테트라할로디보란
Tetrahalodiboranes테트라할로디보란(Tetrahalodiborane)은 이 디보론 화합물의 한 종류입니다. (X = F, Cl, Br I이 화합물들은 1920년대에 [1]처음 발견되었지만, 20세기 중반에 약간의 관심이 있은 후, 연구에서 대부분 무시되었습니다.다른 디보론 화합물에 비해 테트라할로디보란은 상당히 불안정하고 역사적으로 준비하기가 어려웠습니다. 따라서 합성 화학에서의 그들의 사용은 대부분 탐구되지 않았고, 테트라할로디보란에 대한 연구는 그들의 [2]반응성에 대한 근본적인 관심에서 비롯되었습니다.최근, 반도체 [3]장치에 사용하기 위한 B+ {\ {의 실리콘 도핑을 촉진하기 위한 시약으로서 테트라할로디보란, 특히 사불화디보론에 대한 관심이 다시 높아지고 있습니다.
구조.
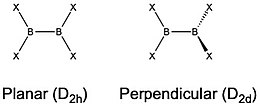
테트라할로디보란의 수직 및 평면 기하학적 구조는 일반적으로 에너지가 매우 가깝기 때문에 이 두 구조 사이의 에너지 차이는 이 분자 기하학에서 가장 많이 조사된 측면입니다.밝혀진 바에 따르면, 그 차이는 화합물 내 할로겐화물의 정체성에 따라 달라집니다.는 고체와 기체 위상 모두에서 평면 기하학( 대칭)을 채택합니다.그러나 회전 장벽은 작습니다(0.42 kcal/mo)l.[4][5] {는 결정화될 때 평면 기하학을 채택하지만 기체 [4][5]단계에서 수직 2d} 대칭)을 합니다.두 컨포머의 상대적 안정성 계산에 따르면 D_}}) 에너지는 ~2kcal/mol 더 낮습니다. 고체의 평면 기하학은 패킹 [5]효과 때문인 것으로 생각됩니다.이러한 추세를 계속하여 계산 모델링 및 실험 결과는 스타일 {와B2I4 스타일 {\})에 일치합니다.은(는) d[4][6] 기하학을 선호합니다.
합성
1925년 Stock et al에 의해 테트라할로디보란의 첫 합성이 보고되었는데, 서 저자들은 액체 에 담근 아연 전극 사이에 전류를 흘려 을 를 했습니다[1]이후의 연구는 [7]전극을 사용하여 을 탐구했습니다의 특징은 °[8]C 이상의 온도에서 분해되는 무색의 발열성 액체라고 는 1958년 핀치와가 삼불화 안티몬과를 하는 데 성공했다고 할 때까지 되지 않았습니다[9] 와 는 상온에서 [9]안정적입니다. 무거운 테트라할로디보란 스타일 와디스플레이 {B2}) 1949년 [10]슐레진저 외 연구진과 슘브가 처음으로 출판했습니다. 4{{은(는) 4 { 및 3 {\을[10]를) 반응하여 처음 액세스했습니다. 4 {은(는) 무전극 무선 주파수 방전을 사용하여 3 {\ce {}}을[10]를 감소시키기 위해 처음 합성되었습니다. Br 4는 -40°C 미만의 온도에서 안정적인 , 디스플레이 ce {})은(는) 0°C 이하에서 안정합니다.은([11]는) 빛에 노출되면 열화되기도 합니다.의 를 은(는) 높은 온도에서 {\과 검은색 고체가 혼합된 것으로 확인되었습니다.BI와9988 BI.[12]
테트라할로디보란에 대한 초기 관심은 주로 근본적이었고, 테트라할로디보란에 대한 더 많은 적용된 고려는 합성의 어려움과 분리된 화합물의 낮은 안정성에 의해 크게 제한되었습니다.최근 테트라할로디보란 합성의 개선으로 { ({B2B4}}), { 4는 보여줍니다[3]1981년 노트 외 연구진이 처음 보고한 의 위상 합성은 개선되지 않았습니다.에서 4를 하기 , 는 3[3]로 처리됩니다.다른 테트라할로디보란은 에서와 에서 할수 또는 3 스타일 {BI3이(가) 스타일 {\ce { 스타일 {\ce { 스타일 {\ {B2를 합니다.[3]개씩입니다.합성 방법의 이러한 개선은 테트라할로디보란의 잠재적인 응용을 탐구할 수 있는 문을 열었습니다. 이러한 관심은 지금까지 상당히 제한되어 있었지만, 연구자들은 합성 구성 요소로서 그리고 산업 [3]응용에 사용하기 위한 테트라할로디보란의 사용을 탐구하기 시작했습니다.특히, 테트라할로디보란에 대한 최근 논문은 붕소 [3]이온이 있는 반도체를 도핑하기 위한 공급 화학 물질로 를하기 위해 하는 것에 대해 주로 논의하고 있습니다
반응성
루이스 염기 부가물 형성
테트라할로디보란의 붕소 원자는 루이스 산성이 강하며 중성 루이스 [11]염기를 가진 부가물을 쉽게 형성합니다.이러한 복합체의 형성은 일반적으로 에너지적으로 유리하지만, 이러한 루이스산 염기 복합체를 형성하려는 초기 시도는 할로겐 [11]치환기의 능력에 의해 방해를 받았습니다. 1992년 3개의 포스판-테트라할로디보란(4) 부가물의 추가 출판 이전에는 3개의 루이스산-루이스 염기 부가물만 [13]보고되었습니다.다른 연구에서는 쉽게 형성되는 루이스 산-루이스 염기 부가물을 더 많이 설명했지만, 안정화된 [11]복합체에서도 테트라할로디보란에 대한 안정성 문제가 어떻게 지속되는지에 대해서도 개략적으로 설명했습니다.이러한 불안정한 테트라할로디보란-루이스 염기 첨가물의 예로는 {로 형성된 비스-디에틸 에테르 첨가물을 들 수 있습니다. 디스플레이 {\ 및 스타일 {\ 또는 3 {의 이중 , 에 의해 형성된 ce { 또는 3과 같은 약한 포스핀 공여체에 의해 형성됩니다[11]
그러나 실온 이상으로 안정적인 일부 부가물이 있습니다. 와 F4는 모두 양성자 질소 [11]공여체와 안정적인 단일 및 이중 부가물을 형성합니다.이러한 안정적인 루이스 염기-환원 할로디보란 부가물 중 첫 번째는 )2}(서IDIP{1,3-bis(2,6-diopropylphenyl)-이미다졸-2-일)가 주변 온도에서 안정적이라는 을 보여준 Braunshweig 등에 의해 2012년에 의해 발표되었습니다.( {{ 디스플레이 스타일은( 2 안정적인 디보렌으로 될 수 .그리고 궁극적으로 [11][14]{로 축소될 수 있습니다.이 발견 이후, 브라운슈바이크 그룹은 일부 단일 부가물과 일부 비대칭 이중 부가물을 포함한 많은 다른 안정적인 테트라할로디보란 부가물을 발표했습니다.이러한 부가물은 일반적으로 {\ NMR을 [11]하여 특징지어집니다.
전이금속과의 반응
전이 금속과 테트라할로디보란의 반응성에 대한 연구가 있었습니다.Norman 등은 와 의 반응성을 보고하여Cis- [ 를 했으며, 여기서2 L=2PPH3, PhP2(CH2)4PPH2[3]BF의24 붕소-할라이드 결합은 무거운 테트라할로디보란보다 상당히 덜 반응하기 때문에, B-B [2]결합에서 Pt와의 반응성이 발생하는 것은 놀라운 일이 아닙니다.
무거운 테트라할로디보란이 더 많은 반응성 붕소-할라이드 결합을 가질 것으로 예상되었기 때문에가 풍부한Pt( 3{{\를 가진 이([2]가) 탐구되었습니다. 의 스타일) 에비해 스타일) 의 높은신뢰성은 보릴 리간드와브리징이 있는 디플라텀 복합체를 형성할 수 있었습니다. [ [2]
보리라닐리덴보란과의 반응
2001년 Seibert 등은 1980년대에 Berndt 등에 의해 처음 합성된 3개의 Boriranylidene Boranes를 테트라할로디보란과 반응시켜 [15]아래의 방식에 표시된 흥미로운 붕소 함유 화합물을 산출할 수 있음을 보여주었습니다.첫 번째 반응에서 염소와 불소 함유 화합물은 모두 양호한 수율로 합성되었지만 불소 화합물은 눈에 띄게 덜 안정적이었습니다.아래에 표시된 모든 화합물은 B,1 H 및 C NMR로 특징지어졌습니다.
불포화 탄화수소에 추가
테트라할로디보란은 불포화 탄화수소에 첨가할 수 있습니다.슐레진저 등은 에틸렌과 아세틸렌에 [16]를 2개 추가한 것을 했습니다.이후 연구에서는 스타일 {\가 알켄, 알킨 및 다이엔과 반응하는 것을 조사했으며 스타일 {\도 [5]유사하게 반응할 수 을 보여주었습니다.도 [5]알켄에 추가할 수 .2015년, 브라운 외 연구진.전자 구조 계산을 사용하여 이러한 (촉매되지 않은) 붕소 첨가물 중 일부에 대한 기계적 정보를 제공했습니다.가장 흥미롭게도, 저자들은 1,2개의 치환된 [5]알켄과의 입체 을 설명하는 기계적 정보를 제공할 수 있었습니다
레퍼런스
- ^ a b Stock, Alfred; Brandt, Arnold; Fischer, Hans (15 April 1925). "Der Zink‐Lichtbogen als Reduktionsmittel". Berichte der Deutschen Chemischen Gesellschaft (A and B Series). 58 (4): 643–657. doi:10.1002/cber.19250580402.
- ^ a b c d Braunschweig, Holger; Dewhurst, Rian D.; Jiménez-Halla, J. Oscar C.; Matito, Eduard; Muessig, Jonas H. (8 January 2018). "Transition-Metal π-Ligation of a Tetrahalodiborane". Angewandte Chemie International Edition. 57 (2): 412–416. doi:10.1002/anie.201709515. PMID 29134749.
- ^ a b c d e f g Arrowsmith, Merle; Böhnke, Julian; Braunschweig, Holger; Deißenberger, Andrea; Dewhurst, Rian D.; Ewing, William C.; Hörl, Christian; Mies, Jan; Muessig, Jonas H. (20 July 2017). "Simple solution-phase syntheses of tetrahalodiboranes(4) and their labile dimethylsulfide adducts". Chemical Communications. 53 (59): 8265–8267. doi:10.1039/c7cc03148c. PMID 28656182.
- ^ a b c Clark, Timothy; von Ragué Schleyer, Paul (1981). "Conformational preferences of 34 valence electron A2X4 molecules: Anab initio Study of B2F4, B2Cl4, N2O4, and C2O42−". Journal of Computational Chemistry. 2: 20–29. doi:10.1002/jcc.540020106. S2CID 98744097.
- ^ a b c d e f Pubill-Ulldemolins, Cristina; Fernánez, Elena; Bo, Carles; Brown, John M. (16 September 2015). "Origins of observed reactivity and specificity in the addition of B2Cl4 and analogues to unsaturated compounds". Organic & Biomolecular Chemistry. 13 (37): 9619–9628. doi:10.1039/C5OB01280E. PMID 26260922.
- ^ Mackie, Iain D.; Hinchley, Sarah L.; Robertson, Heather E.; Rankin, David W. H.; Pardoe, Jennifer A. J.; Timms, Peter L. (12 November 2002). "The structures of borane carbonyl compounds B4X6CO (X = F, Cl, Br and I) by gas-phase electron diffraction and ab initio calculations". Journal of the Chemical Society, Dalton Transactions (22): 4162–4167. doi:10.1039/B207192D.
- ^ Wartik, Thomas.; Moore, R.; Schlesinger, H. I. (September 1949). "Derivatives of Diborine". Journal of the American Chemical Society. 71 (9): 3265–3266. doi:10.1021/ja01177a538.
- ^ Urry, Grant; Wartik, Thomas; Moore, R. E.; Schlesinger, H. I. (1954). "The Preparation and Some of the Properties of Diboron Tetrachloride, B2Cl41". Journal of the American Chemical Society. 76 (21): 5293–5298. doi:10.1021/ja01650a010.
- ^ a b Finch, Arthur; Schlesinger, H. I. (July 1958). "Diboron Tetrafluoride". Journal of the American Chemical Society. 80 (14): 3573–3574. doi:10.1021/ja01547a020.
- ^ a b c Neeve, Emily C.; Geier, Stephen J.; Mkhalid, Ibraheem A. I.; Westcott, Stephen A.; Marder, Todd B. (2016). "Diboron(4) Compounds: From Structural Curiosity to Synthetic Workhorse". Chemical Reviews. 116 (16): 9091–9161. doi:10.1021/acs.chemrev.6b00193. PMID 27434758.
- ^ a b c d e f g h Englert, Lukas; Stoy, Andreas; Arrowsmith, Merle; Muessig, Jonas H.; Thaler, Melanie; Deißenberger, Andrea; Häfner, Alena; Böhnke, Julian; Hupp, Florian; Seufert, Jens; Mies, Jan; Damme, Alexander; Dellermann, Theresa; Hammond, Kai; Kupfer, Thomas; Radacki, Krzysztof; Thiess, Torsten; Braunschweig, Holger (26 June 2019). "Stable Lewis Base Adducts of Tetrahalodiboranes: Synthetic Methods and Structural Diversity". Chemistry – A European Journal. 25 (36): 8612–8622. doi:10.1002/chem.201901437. PMID 30974025. S2CID 109939253.
- ^ Massey, A.G.; Portal, P.J. (January 1982). "Diboron tetraiodide and its decomposition". Polyhedron. 1 (3): 319. doi:10.1016/S0277-5387(00)87173-9.
- ^ Keller, Willi; Sneddon, Larry G.; Einholz, Wolfgang; Gemmler, Armin (November 1992). "Phosphane – Tetrahalodiborane(4) Adducts: Formation of closo ‐3,4,5,6‐Tetrabromo‐1,2‐diphosphahexaborane(4)". Chemische Berichte. 125 (11): 2343–2346. doi:10.1002/cber.19921251102.
- ^ Braunschweig, Holger; Dewhurst, Rian D.; Hammond, Kai; Mies, Jan; Radacki, Krzysztof; Vargas, Alfredo (15 June 2012). "Ambient-Temperature Isolation of a Compound with a Boron-Boron Triple Bond". Science. 336 (6087): 1420–1422. doi:10.1126/science.1221138. PMID 22700924. S2CID 206540959.
- ^ Ziegler, Andreas; Pritzkow, Hans; Siebert, Walter (2001). "Reactions of Diboratetrahalides(4) with Boriranylideneboranes − Formation, Reactivity, and Structures of Cyclic Tetraborylmethanes and Isomeric Diborylmethyleneborane Derivatives". European Journal of Inorganic Chemistry. 2001 (2): 387–391. doi:10.1002/1099-0682(200102)2001:2<387::AID-EJIC387>3.0.CO;2-N.
- ^ Urry, Grant; Kerrigan, James; Parsons, Theran D.; Schlesinger, H. I. (November 1954). "Diboron Tetrachloride, B 2 Cl 4 , as a Reagent for the Synthesis of Organo-boron Compounds. I. The Reaction of Diboron Tetrachloride with Ethylene 1". Journal of the American Chemical Society. 76 (21): 5299–5301. doi:10.1021/ja01650a011.



 고체와 기체 위상 모두에서 평면 기하학(
고체와 기체 위상 모두에서 평면 기하학(


 일치합니다.
일치합니다. (는)
(는) 








 이중
이중 




 축소될 수 있습니다.이 발견 이후, 브라운슈바이크 그룹은 일부 단일 부가물과 일부 비대칭 이중 부가물을 포함한 많은 다른 안정적인 테트라할로디보란 부가물을 발표했습니다.이러한 부가물은 일반적으로
축소될 수 있습니다.이 발견 이후, 브라운슈바이크 그룹은 일부 단일 부가물과 일부 비대칭 이중 부가물을 포함한 많은 다른 안정적인 테트라할로디보란 부가물을 발표했습니다.이러한 부가물은 일반적으로 
 반응성을 보고하여
반응성을 보고하여![{\displaystyle {\ce {cis-[Pt(BF2)2L2]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2a8a85677f65d4f2229446797925840ad6a8fc38)




![{\displaystyle {\ce {[B2I4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d8bf240a0a73b8c7f2fea10d37b14d8a68aa993d)





