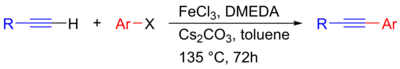소노가시라 결합
Sonogashira coupling| 소노가시라 결합 | |
|---|---|
| 의 이름을 따서 명명됨 | 소노가시라 겐키치 |
| 반응형 | 결합 반응 |
| 식별자 | |
| 유기화학 포털 | 소노가시라 매개체 |
| RSC 온톨로지 ID | RXNO:0000137 |
| 예 및 관련 반응 | |
| 유사한 반응 | 무동 소노가시라 커플링 |
소노가시라 반응은 탄소-탄소 결합을 형성하기 위해 유기 합성에 사용되는 교차 결합 반응이다.팔라듐 촉매와 구리 공동 촉매를 사용하여 말단 알킨과 아릴 또는 할로겐화 [1]비닐 사이에 탄소-탄소 결합을 형성합니다.
| 소노가시라 반응 |
|---|
- R1: 아릴 또는 비닐
- R2: 임의
- X: I, Br, Cl 또는 OTF
Sonogashira 교차 결합 반응은 탄소-탄소 결합 형성에 유용하기 때문에 다양한 영역에서 사용되어 왔다.이 반응은 상온, 수성 매체, 그리고 복합 분자의 합성에 Sonogashira 교차 결합 반응을 사용할 수 있는 약한 염기와 같은 조건에서 수행될 수 있습니다.의약품, 천연제품, 유기물,[1] 나노물질 등이 해당된다.구체적인 예로는 건선과 여드름 치료제인 타자로틴의 [2]합성 및 니코틴 수용체 [3]작용제인 SIB-1508Y의 제조가 포함된다.
역사
방향족 아세틸렌을 사용한 할로겐화 아릴의 알킬화 반응은 1975년 카사르,[4] 디옥 및[5] 헥과 소노가시라, 토흐다 및 [6]하기하라의 세 가지 독립적인 기여로 보고되었다.모든 반응은 팔라듐 촉매를 사용하여 동일한 반응 생성물을 생성한다.그러나 Cassar와 Heck의 프로토콜은 팔라듐 사용만으로 수행되며, 엄격한 반응 조건(즉, 높은 반응 온도)이 요구됩니다.Sonogashira의 시술에서 팔라듐 착체와 더불어 구리-촉매를 사용함으로써 반응이 경미한 조건에서 우수한 수율로 진행될 수 있었다.PD/Cu 시스템의 급속한 발전은 수많은 합성 응용 프로그램을 가능하게 했고, Cassar-Heck의 상태는 부당하게 거의 잊혀졌습니다.[7]이 반응의 주목할 만한 효용성은 합성, 의약품 또는 물질/산업적 [7]중요성의 다양한 화합물을 준비하기 위한 절차를 사용하는 것뿐만 아니라 합성 능력을 이해하고 최적화하기 위해 여전히 수행되고 있는 많은 양의 연구로 입증될 수 있다.스즈키와 헥의[8] 반응 직후의 출판물 수나 Scifinder의 「Sonogashira」의 검색에서는, 2007년부터 [7]2010년까지의 저널 출판물에 1500건 이상의 레퍼런스를 제공하고 있습니다.
Sonogashira 반응은 매우 잘 알려져 있으며, 이러한 반응이 진정한 Sonogashira 반응 [7]조건 하에서 수행되지 않음에도 불구하고 종종 현대 유기 금속 촉매를 사용하여 알킨 모티브를 결합하는 모든 반응은 "Sonogashira 반응"의 변형으로 불린다.
메커니즘
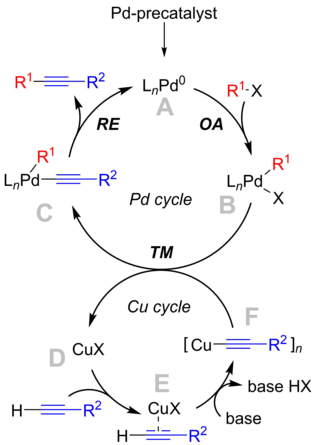
반응 메커니즘은 명확하게 이해되지 않지만 교과서 메커니즘은 "고전적" 교차 결합 메커니즘과 일치하는 팔라듐 사이클과 잘 [9]알려지지 않은 구리 사이클을 중심으로 회전합니다.
팔라듐 사이클
- 팔라듐 전촉매종은 반응조건 하에서 활성화되어 반응성0 Pd화합물 A를 형성한다.촉매종의 정확한 정체는 반응 조건에 따라 크게 달라진다.PPh3(n=2)와 같은 단순 포스핀과 부피가 큰 포스핀(즉, P(o-Tol))
3의 경우 단일화 종(n=1)이 [10]형성되는 것으로 입증되었다.또한 음이온과 할로겐화물의 [11]존재 하에서 실제 촉매가 될 수 있는 음이온성 팔라듐 종인 [LPdCl20]−의 형성을 지적하는 결과도 있다. - 활성 Pd0 촉매는 아릴 또는 할로겐화비닐 기질과의 산화 첨가 단계에 관여하여 Pd 종 B를 생성한다II.위의 설명과 마찬가지로, 그 구조는 사용된 배위자에 따라 달라진다.이 단계는 반응의 속도 제한 단계라고 생각됩니다.
- 착체 B는 금속 투과 공정에서 구리 아세틸리드, 착체 F와 반응하여 착체 C를 생성하고 구리 촉매를 재생한다.
- 복합체 C의 구조는 배위자의 특성에 따라 달라집니다.촉진성 환원 제거가 일어나려면 기질 모티브가 가까운 곳에 있어야 한다. 즉, 시스 배향에 따라서 트랜스-시즈 이성화가 수반될 수 있다.환원 제거에서 생성물 톨란은 복합체로부터 배출되고 활성 Pd 촉매종은 재생된다.
구리 사이클
- 구리 사이클은 완전히 잘 설명되지 않았습니다.염기가 존재하면 γ-알킨 착화체 E가 형성되는 것이 바람직하다.이것은 말단 양성자의 산도를 증가시키고 탈양성자 시 복합체 F인 구리 아세틸리드를 형성하게 한다.
- 그런 다음 아세틸라이드 F는 팔라듐 중간체 B와의 전이 반응에 관여한다.
무동 소노가시라 변종 메커니즘
반응의 효과에는 유익하지만, "고전적" Sonogashira 반응에 구리 소금을 사용하는 것은 환경 친화적인 시약의 적용, 바람직하지 않은 알킨 호모커플링(글레이저 측 제품)의 형성, 그리고 재생 물질에서 엄격한 산소 배제의 필요성과 같은 몇 가지 단점을 동반한다.작용 혼합물.따라서 구리를 반응에서 제외하기 위해 Cu-free Sonogashira 반응 개발에 많은 노력을 기울였다.새로운 반응 조건의 개발에 따라 많은 실험 및 계산 연구가 반응 [12]메커니즘의 설명에 초점을 맞췄다.최근까지, cu-free 반응이 일어나는 정확한 메커니즘은 중요한 기계적 질문에 [7]답하지 않은 채 논의되었다.2018년 Koshmrlj 등에 의해 상호 연결된0 두 가지 Pd/PdII 촉매 [13][14]주기를 따라 반응이 진행된다는 것이 입증되었다.
| Cu-free Sonogashira [13][14]반응 메커니즘. |
|---|
- 원래 메커니즘과 마찬가지로, Pd0 회로는 할로겐화 아릴 또는 트리플라이트를 Pd 촉매에0 산화적으로 첨가하여 복합체 B를 형성하고 반응을 위해 할로겐화 아릴 기질을 활성화하는 것으로 시작된다.
- 아세틸렌은 두 번째 PdII 매개 사이클에서 활성화된다.페닐아세틸렌은 경미한 반응 조건에서 Pd 모노아세틸라이드 복합체 D와 Pd 비스아세틸라이드 복합체 F를 형성하는 것으로 입증되었다.
- 활성종, 즉 착체 B와 F는 모두 투과공정에서 관여하여 착체 C를 형성하고 D를 재생한다.
- 환원 제거의 결과 생성물, 이치환된 알킨 생성물 및 재생된0 Pd 촉매종이 Pd 촉매 사이클을 완료합니다0.
아민은 포스핀에 대해 경쟁력이 있으며 기술된 반응 종에서 리간드 L로 참여할 수 있다는 것이 입증되었다.아민과 포스핀의 경쟁률에 따라 다른 배위 [15][16][13][14]염기를 사용할 때 역동적이고 복잡한 상호작용이 예상된다.
반응 조건
Sonogashira 반응은 보통 가벼운 [17]조건에서 실행됩니다.교차 결합은 상온에서 디에틸아민과 같은 염기(일반적으로 용매 역할을 하는 [6]아민)와 함께 수행됩니다.이 결합 반응의 부산물로 생성된 할로겐화수소를 중화시키기 위해서는 반응 매개체가 기본이어야 하므로 트리에틸아민, 디에틸아민 등의 알킬아민 화합물이 용매로 사용되기도 하지만 DMF 또는 에테르도 용매로 사용될 수 있다.때때로 탄산칼륨이나 탄산세슘과 같은 다른 염기가 사용된다.또한 팔라듐(0) 착체는 공기 중에 불안정하고 산소는 호모커플 아세틸렌의 형성을 촉진하기 때문에 Sonogashira 결합 반응에 탈기 조건이 정식으로 필요하다.최근에는 공기안정형 유기팔라듐 촉매의 개발로 대기중에서도 이러한 반응을 할 수 있게 되었다.또한 R.M Al-Zoubi 및 공동작업은 환경조건 [18]하에서 양호한 수율에서 높은 수율로 1,2,3-트리할로아렌 유도체에 대한 높은 위치선택성을 가진 방법을 성공적으로 개발하였다.
촉매
일반적으로 이 반응에는 0가 팔라듐 복합체와 할로겐화 구리(I) 소금이라는 두 가지 촉매가 필요합니다.팔라듐 촉매의 일반적인 예로는 [Pd(PPH3)]4와 같은 포스핀 배위자를 포함하는 촉매가 있다.팔라듐원으로는 [Pd(PPH3)2Cl2]을 들 수 있지만 [Pd(dpp2)Cl], [Pd(dppp2)Cl], [Pd(dppf2)Cl]와 같은 이인성 포스핀 배위자를 함유하는 착화체도 [9]이용되고 있다.이러한 촉매의 단점은 더 많은 양의 구리 [9]공동 촉매와 함께 팔라듐(최대 5mol%)의 높은 부하가 필요하다는 것입니다.촉매II 작용을 시작하기 전에 Pd(0)로 환원되어야 하므로, Pd 복합체는 사실 전촉매이다.일반적으로II PD 복합체는 PD 복합체보다0 안정성이 뛰어나며 일반 실험실 조건에서 [19]수개월 동안 보관할 수 있습니다.반응II 혼합물의 아민, 포스핀 배위자 또는 다른 반응물에 의해 반응 혼합물의 Pd 촉매가0 환원되어 반응이 [20]진행된다.예를 들어 [Pd(PPH3)2Cl2]을 사용할 때 트리페닐포스핀을 산화트리페닐포스핀으로 산화시키면 현장에서 Pd가0 형성될 수 있다.
CuI와 같은 구리(I) 소금은 말단 알킨과 반응하여 구리(I) 아세틸리드를 생성하며, 구리(I) 아세틸리드는 결합 반응에서 활성화된 종으로 작용합니다.Cu(I)는 반응의 공동 촉매이며 [7]반응 속도를 증가시키는 데 사용됩니다.
할로겐화 아릴 및 의사할라이드
할로겐화 아릴 또는 의사할라이드 기질(sp-탄소2)의 선택은 Sonogashira 촉매 시스템의 반응성에 주로 영향을 미치는 요인 중 하나입니다.할로겐화물의 반응성은 요오드에 대해 더 높으며, 할로겐화 비닐은 유사한 할로겐화 아릴보다 반응성이 더 높습니다.
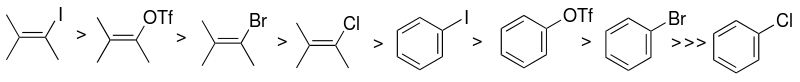
할로겐화 아릴 대신 삼산아릴을 사용할 수도 있다.
아레네디아조늄 전구체
아레네디아조늄염은 소노가시라 결합 반응에 대한 할로겐화 아릴의 대안으로 보고되었다.염화금(I)은 팔라듐(Paladium)과 결합된 촉매로 사용되어 왔다.(II) 아레디아조늄염과 말단 알킨의 결합 중 염화물(bis-2,6-diisopropylphenyl dihydroimidazolium chloride(IPr NHC)(5mol%)의 존재 하에서 NHC-팔라듐 착체를 생성하는 과정 및 2,6-t-t-butyl-4MP-mpridine)이 결합은 디아조늄 염의 형성에 의해 아닐린에서 시작하여 현장에서 소노가시라 결합에 의해 이루어질 수 있으며, 여기에서 아닐린은 디아조늄 염으로 변환되고 페닐아세틸렌과 결합함으로써 알킨으로 더욱 전환된다.
알킨즈
다양한 방향족 알킨을 사용하여 양호한 수율로 원하는 이치환 제품을 만들 수 있다.지방족 알킨은 일반적으로 반응성이 낮다.
베이스
염기의 중요한 역할 때문에 특정 아민을 과잉 또는 용매로 첨가해야 반응이 진행된다.특히 피페리딘, 모르포린 또는 디이소프로필아민과 같은 2차 아민은 하나의 PPH3 배위자를 치환함으로써 트랜스-RPDX(PPH3)2 복합체와 효율적이고 가역적으로 반응할 수 있는 것으로 밝혀졌다.이 반응의 평형 상수는 염기성 요인인 R, X 및 아민의 입체 [22]장애에 따라 달라집니다.그 결과 이 배위자 교환을 위한 아민과 알킨기 간의 경쟁이 일어나며, 이것이 일반적으로 선호 치환을 촉진하기 위해 아민이 과도하게 첨가되는 이유이다.
반응의 변화
무동 소노가시라 커플링
구리 공동 촉매는 반응성을 높이기 위해 반응에 추가되지만 구리가 있으면 알킨 이합체가 형성될 수 있습니다.이는 글레이저 결합 반응으로 알려져 있는데, 이는 산화 시 아세틸렌 유도체의 호모커플링 생성물이 바람직하지 않은 형태로 형성되는 것이다.그 결과, 구리 코촉매에 의한 소노가시라 반응을 실시할 때는 불활성 분위기 속에서 반응시켜 불필요한 이량화를 회피할 필요가 있다.호모커플링 [19][23]생성물의 형성을 피하기 위해 소노가시라 반응의 무동변형이 개발되었습니다.구리 사용을 피해야 하는 다른 경우가 있는데, 예를 들어 프리베이스 포르피린과 [9]같은 잠재적 구리 배위자를 포함하는 기질을 포함하는 결합 반응이다.
역소노가시라 결합
역소노가시라 결합에서 반응물은 아릴 또는 비닐 화합물과 할로겐화 [24]알키닐이다.
촉매의 종류
은 공동 촉매
경우에 따라 구리가 없는 Sonogashira [9]커플링에 CuI 대신 화학량론적 산화은을 사용할 수 있습니다.
니켈 촉매
최근에는 구리 공동 촉매가 [25]필요하지만 팔라듐을 사용하지 않고 불활성 할로겐화 알킬을 아세틸렌에 결합할 수 있는 니켈 촉매 소노가시라 커플링이 개발되었습니다.또한 금을 이종 촉매로 사용할 수 있다고 보고되었으며, 이는 페닐아세틸렌과 요오드벤젠이 Au/CeO2 [26][27]촉매와 결합하는 것으로 입증되었다.이때 촉매작용은 Au(0)를 [29]활성부위로 하여 Au 나노입자에서 [27][28]불균일하게 일어난다.바람직한 교차 결합 제품에 대한 선택성도 CeO2 및 [29]LaO와23 같은 지지대에 의해 향상되는 것으로 확인되었습니다.또한, 철 촉매의 Sonogashira 커플링은 팔라듐에 대한 비교적 저렴하고 독성이 없는 대안으로 조사되었다.여기서 FeCl은3 전이금속 촉매로서23, CsCO는 베이스로서 기능하는 것을 제안하고, 따라서 이론적으로는 팔라듐 프리 및 구리 프리 메커니즘을 [30]통해 진행됩니다.
| 철에 의해 촉매되는 팔라듐 프리[30] 소노가시라 반응 |
|---|
구리가 없는 메커니즘이 실행 가능한 것으로 나타났지만, 팔라듐 촉매의 저렴한 대안으로 위에 언급된 다양한 전이 금속을 통합하려는 시도는 극미량의 팔라듐으로 시약 오염으로 인해 낮은 성공 기록을 보여주었고, 이는 이론화된 경로가 극단적임을 시사한다.불가능하지는 않더라도 [31]달성할 가능성이 낮다.
연구에 따르면 유기 및 무기 시작 재료는 [32]커플링에 충분한 (ppb 레벨) 팔라듐을 포함할 수 있습니다.
금과 팔라듐의 공동 촉매
전자 및 구조적으로 다양한 아릴 및 헤테로아릴 할로겐화물의 Sonogashira 결합을 위한 매우 효율적인 금 및 팔라듐 결합 방법론이 [33]보고되었다.두 금속의 직교 반응성은 Sonogashira 결합에서 높은 선택성과 극도의 관능기 내성을 나타낸다.간단한 기계적 연구에 따르면 금-아세틸라이드 중간체는 금속 변환 단계에서 팔라듐 촉매 사이클에 들어갑니다.
수지상 팔라듐 착화체
제품 형성 후 종종 비용이 많이 드는 촉매의 회수에 관한 문제는 [9]균질 촉매의 대규모 적용에 심각한 단점이 됩니다.금속강화물질로 알려진 구조는 균질 촉매와 이종 촉매의 장점을 결합하는데, 이는 균질 촉매가 용해되고 분자 수준에서 잘 정의되기 때문입니다. 그러나 그것들은 강수, 초여과 또는 초원심 침지에 [34]의해 회복될 수 있습니다.구리가 없는 Sonogashira 반응에 덴드라이트 팔라듐 복합 촉매의 사용에 대한 최근의 예를 볼 수 있습니다.따라서 이인산 포스핀 팔라듐은 여러 세대에 걸쳐 존재한다.II) 폴리아미노 덴드라이트 촉매는 25~120°C에서 요오드화 아릴과 브롬화 아릴의 결합을 위해 트리에틸아민에서 가용화되었지만 매우 낮은 [35]수율로 사용되었습니다.덴드리머 촉매는 보통 단순 침전 및 여과로 회수하여 최대 5회 재사용할 수 있으며 팔라듐 침출이 아닌 덴드리머 분해로 생성된 활성 감소가 관찰되었다.이러한 덴드리머 촉매는 덴드리머 생성 증가에 따라 촉매 효율이 감소하는 음의 덴드리미터 효과를 보였다.아래 표시된 재활용 가능한 고분자 포스핀 배위자는 노르보르넨 유도체의 고리 개방 메타세시스 중합에서 얻은 것으로, 피오도벤조산메틸과 페닐아세틸렌의 구리 공동 촉매 Sonogashira 반응에서 Pd(dba)·2팔라듐 [36]소스로서의 CHCl3.여과에 의한 회수에도 불구하고, 각 재활용 실험에서 폴리머 촉매 활성은 약 4-8% 감소했습니다.
질소배위자
피리딘과 피리미딘은 팔라듐의 착화 특성이 우수하며 Sonogashira 커플링에 적합한 촉매의 형성에 사용되어 왔다.아래와 같은 디피리미딜-팔라듐 복합체는 65 °C에서 N-부틸아민을 베이스로 하는 페닐아세틸렌과 iodo-, bromo-, 클로로벤젠의 무동 결합에 이용되었다.또한 이 복합체의 모든 구조적 특성은 광범위한 X선 분석을 통해 관찰된 반응성을 [37]검증한다.
최근에는 테트라-n-부틸암모늄아세테이트(TBAA)를 상온으로 하여 NMP(Nmethylpyrolidone)에서 요오드화 아릴과 브롬화물의 구리 프리 소노가시라 결합 반응에 이용되고 있다.이 복합체는 또한 용매로서 N-메틸피롤리디논(NMP)에서 효율이 더 높았지만 피롤리딘을 베이스로 하고 TBAB를 [38]첨가제로 하여 환류수에서 요오드화 아릴과 브롬화물의 결합에 사용되어 왔다.

N-헤테로사이클릭카르벤(NHC)팔라듐 착화체
N-헤테로사이클릭 카벤(NHCs)은 전이 금속 촉매 작용에서 가장 중요한 리간드 중 하나가 되었다.정상적인 NHC의 성공은 포스핀에 비해 우수한 γ기증 능력에 크게 기인하며, 이는 비정상적인 NHC의 경우 더욱 크다.팔라듐 복합체에서 배위자로 사용되는 NHC는 전촉매의 안정화와 활성화에 크게 기여했으며, 따라서 소노가시라 [9][40][41]커플링을 포함한 유기 금속 균질 촉매의 많은 영역에서 적용되고 있다.
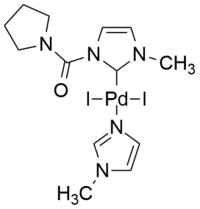
| 팔라듐의 예(II) 정상 NHC 배위자를 [42]가진 유도 복합체. | 물에서 [40]Cu-free Sonogashira 반응을 위한 효율적인 iPEPSI 촉매. |
이상 NHC의 흥미로운 예는 메소이온성 1,2,3-트리아졸-5-일리덴 구조에 기초한다.PEPSI형의 효율적인 양이온성 팔라듐 촉매, 즉 iPEPSI(내부 피리딘 강화 전촉매제 안정화 및 개시)는 구리, 아민, 포스핀 및 기타 첨가물이 없는 상태에서 유일한 용매로서 물에서 구리 없는 소노가시라 반응을 효율적으로 촉매하기 위해 입증되었다.ives.[40]
통합 응용 프로그램
Sonogashira 커플링은 주로 다음과 같은 까다로운 변환을 촉진하는 데 성공했기 때문에 광범위한 합성 반응에 사용됩니다.
알킬화 반응
구리 촉진 또는 무동 Sonogashira 반응의 적용에 대해 이야기할 때 말단 알킨과 방향족 고리의 결합은 중추적인 반응이다.할로겐화 아릴을 이용한 전형적인 소노가시라 반응을 채용한 사례는 매우 많아 예시적인 예를 선택하기가 어렵다.이 방법론의 최근 사용은 생체분석 응용을 [43]위한 알킬알라닌 유도체를 제조할 수 있었던 현장 발생 Pd(0)종을 촉매로 하여 요오드화 페닐알라닌과 d-비오틴 유래 말단 알킨의 결합에 대해 아래에 제시된다.또한 결합 파트너가 알릴 수지에 부착되어 있는 예도 있으며, Pd(0) 촉매는 기판의 분할에 영향을 미치고 후속 Sonogashira 결합은 [44]용액에 있습니다.

천연물
자연에서 발견되는 많은 대사물은 알킨 또는 에닌 부분을 포함하고 있기 때문에,[45] 소노가시라 반응은 그들의 합성에서 빈번한 효용성을 발견했다.천연물의 전체 합성에 대한 이 결합 방법론의 가장 최근 유망한 몇몇 응용 분야는 전형적인 구리-코 촉매 반응을 독점적으로 사용했다.
요오드화 아릴아세틸렌과 요오드화 아릴아세틸렌의 결합 예는 요오드화 알코올과 벤젠데노아제핀 알칼로이드 불가라민의 전합성 중간물질인 트리스(이소프로필)실릴아세틸렌의 반응에서 볼 수 있다.
전형적인 Sonogashira 조건 하에서 중간체 조제를 위해 요오드화 아릴을 사용한 최근의 사례가 있으며, 이는 환산 후 벤질리오퀴놀린 또는 인돌 알칼로이드와[47] 같은 천연물을 산출한다. 예를 들어 벤질리오퀴놀린 알칼로이드(+)와 (S)-라우다노신(S)의 합성이다.이러한 천연물의 합성은 각 [46]분자의 탄소 골격을 만들기 위해 Sonogashira 교차 결합을 사용하는 것을 포함했다.

에니스와 에네디네스
1,3-에닌 부분은 생물학적으로 활성 및 천연 [citation needed]화합물에 대한 중요한 구조 단위입니다.Sonogashira 반응과 같은 구성-유지 입체특이적 절차를 사용하여 비닐계 및 말단 아세틸렌으로부터 유도할 수 있다.요오드화비닐은 산화성 첨가물에 가장0 반응성이 높은 할로겐화비닐이며, 따라서 일반적으로 사용되는 조건이 더 온화하기 때문에 Sonogashira 교차 결합 반응에 가장 자주 사용됩니다.예를 들어 다음과 같습니다.

제약
Sonogashira 반응의 다양성은 다양한 화합물의 합성에 널리 사용되는 반응이다.그러한 의약품 적용 중 하나는 일반적으로 알티니클린으로 알려진 SIB-1508Y의 합성이다.알티니클린은 파킨슨병, 알츠하이머병, 투렛증후군, 정신분열증, 주의력결핍 과잉행동장애(ADHD)[3][50] 치료에서 가능성을 보인 니코틴성 아세틸콜린 수용체 작용제다.2008년 현재 Altinicline은 제2상 임상시험을 [51][52]거쳤다.

Sonogashira 교차 결합 반응은 이미다조피리딘 [53]유도체의 합성에 사용될 수 있다.

관련 반응
레퍼런스
- ^ a b Sonogashira, K. (2002), "Development of Pd-Cu catalyzed cross-coupling of terminal acetylenes with sp2-carbon halides", J. Organomet. Chem., 653 (1–2): 46–49, doi:10.1016/s0022-328x(02)01158-0
- ^ King, A.O.; Yasuda, N. (2005), "A Practical and Efficient Process for the Preparation of Tazarotene", Org. Process Res. Dev., 9 (5): 646–650, doi:10.1021/op050080x
- ^ a b c King, A. O.; Yasuda, N. (2004), Palladium-Catalyzed Cross-Coupling Reactions in the Synthesis of Pharmaceuticals Organometallics in Process Chemistry, Top. Organomet. Chem., vol. 6, pp. 205–245, doi:10.1007/b94551, ISBN 978-3-540-01603-8
- ^ Cassar, L. (1975), "Synthesis of aryl- and vinyl-substituted acetylene derivatives by the use of nickel and palladium complexes", J. Organomet. Chem., 93 (2): 253–257, doi:10.1016/S0022-328X(00)94048-8
- ^ Dieck, H.A.; Heck, R.F. (1975), "Palladium catalyzed synthesis of aryl, heterocyclic and vinylic acetylene derivatives", J. Organomet. Chem., 93 (2): 259–263, doi:10.1016/S0022-328X(00)94049-X
- ^ a b Sonogashira, K.; Tohda, Y.; Hagihara, N. (1975), "A convenient synthesis of acetylenes: catalytic substitutions of acetylenic hydrogen with bromoalkenes, iodoarenes and bromopyridines", Tetrahedron Lett., 16 (50): 4467–4470, doi:10.1016/s0040-4039(00)91094-3
- ^ a b c d e f g Chinchilla, R.; Nájera, C. (2011), "Recent advances in Sonogashira reactions", Chem. Soc. Rev., 40 (10): 5084–5121, doi:10.1039/c1cs15071e, PMID 21655588
- ^ Seechurn, C. C. C.; Kitching, M. O.; Colacot, T. J.; Snieckus, V. (2012), "Palladium-Catalyzed Cross-Coupling: A Historical Contextual Perspective to the 2010 Nobel Prize", Angew. Chem. Int. Ed., 51 (21): 5062–5085, doi:10.1002/anie.201107017, PMID 22573393
- ^ a b c d e f g h Chinchilla, R.; Nájera, C. (2007), "The Sonogashira Reaction: A Booming Methodology in Synthetic Organic Chemistry", Chem. Rev., 107 (3): 874–922, doi:10.1021/cr050992x, PMID 17305399
- ^ Stambuli, J. P.; Buhl, M.; Hartwig, J. F. (2002), "Synthesis, Characterization, and Reactivity of Monomeric, Arylpalladium Halide Complexes with a Hindered Phosphine as the Only Dative Ligand", J. Am. Chem. Soc., 124 (32): 9346–9347, doi:10.1021/ja0264394, PMID 12167009
- ^ Amatore, C.; Jutand, A. (2000), "Anionic Pd(0) and Pd(II) Intermediates in Palladium-Catalyzed Heck and Cross-Coupling Reactions", Acc. Chem. Res., 33 (5): 314–321, CiteSeerX 10.1.1.612.7347, doi:10.1021/ar980063a, PMID 10813876
- ^ Soheili, A.; Albaneze-Walker, J.; Murry, J. A.; Dormer, P. G.; Hughes, D. L. (2003), "Efficient and General Protocol for the Copper-Free Sonogashira Coupling of Aryl Bromides at Room Temp", Org. Lett., 5 (22): 4191–4194, doi:10.1021/ol035632f, PMID 14572282
- ^ a b c d Gazvoda, M.; Virant, M.; Pinter, B.; Košmrlj, J. (2018). "Mechanism of copper-free Sonogashira reaction operates through palladium-palladium transmetallation". Nat. Commun. 9 (1): 4814. Bibcode:2018NatCo...9.4814G. doi:10.1038/s41467-018-07081-5. PMC 6240041. PMID 30446654.
- ^ a b c d Virant, Miha (2019). Development of homogeneous palladium catalytic systems for selected transformations of terminal acetylenes (PhD). University of Ljubljana.
- ^ Tougerti, A.; Negri, S.; Jutand, A. (2007), "Mechanism of the Copper-Free Palladium-Catalyzed Sonogashira Reactions: Multiple Role of Amines", Chem. Eur. J., 13 (2): 666–676, doi:10.1002/chem.200600574, PMID 16991183
- ^ Plenio, H. (2008), "Catalysts for the Sonogashira Coupling—The Crownless Again Shall Be King", Angew. Chem. Int. Ed., 47 (37): 6954–6956, doi:10.1002/anie.200802270, PMID 18683173
- ^ Kohnen, A. L; Danheiser, R. L.; Denmark S. E.; Liu X. (2007), "Synthesis of Terminal 1,3-Diynes Via Sonogashira Coupling of Vinylidene Chloride Followed by Elimination. Preparation of 1,3-Decadiyne", Org. Synth., 84: 77–87, doi:10.15227/orgsyn.084.0077, PMC 2901882, PMID 20628544
- ^ Al-Zoubi, Raed (16 April 2020). "Palladium-catalyzed highly regioselective mono and double Sonogashira cross-coupling reactions of 5-substituted-1,2,3-triiodobenzene under ambient conditions†". RSC Adv. 10 (28): 16376. Bibcode:2020RSCAd..1016366A. doi:10.1039/d0ra01569e.
- ^ a b Bohm, V. P. W.; Herrmann, W. A. (2000), "A Copper-Free Procedure for the Palladium-Catalyzed Sonogashira Reaction of Aryl Bromides with Terminal Alkynes at Room Temperature", Eur. J. Org. Chem., 200 (22): 3679–3681, doi:10.1002/1099-0690(200011)2000:22<3679::aid-ejoc3679>3.0.co;2-x
- ^ Yin, L.; Liebscher, J. (2006), "Carbon-Carbon Coupling Reactions Catalyzed by Heterogeneous Palladium Catalysts", Chem. Rev., 107 (1): 133–173, doi:10.1021/cr0505674, PMID 17212474
- ^ Panda B., Sarkar T. K. (2010). "Gold and palladium combined for the Sonogashira-type cross-coupling of arenediazonium salts". Chem. Commun. 46 (18): 3131–3133. doi:10.1039/c001277g. PMID 20361097.
- ^ Jutand, A.; Négri, S.; Principaud; A. (2005), "Formation of ArPdXL(amine) Complexes by Substitution of One Phosphane Ligand by an Amine in trans-ArPdX(PPh3)2 Complexes", Eur. J. Inorg. Chem., 2005 (4): 631–635, doi:10.1002/ejic.200400413
- ^ Mery, D.; Heuze, K.; Astruc, D. (2003), "A very efficient, copper-free palladium catalyst for the Sonogashira reaction with aryl halides", Chem. Commun., 15 (15): 1934–1935, doi:10.1039/B305391C, PMID 12932040
- ^ Dudnik, A.; Gevorgyan, V. (2010). "Formal Inverse Sonogashira Reaction: Direct Alkynylation of Arenes and Heterocycles with Alkynyl Halides". Angew. Chem. Int. Ed. 49 (12): 2096–2098. doi:10.1002/anie.200906755. PMC 3132814. PMID 20191647.
- ^ Vechorkin, O.; Barmaz, D.; Proust, V.; Hu, X. (2009), "Ni-Catalyzed Sonogashira Coupling of Nonactivated Alkyl Halides: Orthogonal Functionalization of Alkyl Iodides, Bromides, and Chlorides", J. Am. Chem. Soc., 131 (34): 12078–12079, doi:10.1021/ja906040t, PMID 19670863
- ^ Gonzalez-Arallano, C.; Abad, A.; Corma, A.; Garcia, H.; Iglesias, M.; Sanchez, F. (2007), "Catalysis by Gold(I) and Gold(III): A Parallelism between Homo- and Heterogeneous Catalysts for Copper-Free Sonogashira Cross-Coupling Reactions", Angew. Chem. Int. Ed., 46 (9): 1536–1538, doi:10.1002/anie.200604746, PMID 17226890
- ^ a b Corma, A.; Juarez, R.; Boronat, M.; Sanchez, F.; Iglesias, M.; Garcia, H. (2011), "Gold catalyzes the Sonogashira coupling reaction without the requirement of palladium impurities", Chem. Commun., 47 (5): 1446–1448, doi:10.1039/C0CC04564K, PMID 21183985
- ^ Kyriakou, G.; Beaumont, S. K.; Humphrey, S. M.; Antonetti, C.; Lambert, R. M. (2010), "Sonogashira Coupling Catalyzed by Gold Nanoparticles: Does Homogeneous or Heterogeneous Catalysis Dominate?", ChemCatChem, 2 (11): 1444–1449, doi:10.1002/cctc.201000154, S2CID 96700925
- ^ a b Beaumont, S. K.; Kyriakou, G.; Lambert, R. M. (2010), "Identity of the active site in gold nanoparticle-catalyzed Sonogashira coupling of phenylacetylene and iodobenzene." (PDF), J. Am. Chem. Soc., 132 (35): 12246–12248, doi:10.1021/ja1063179, PMID 20715838
- ^ a b M. Carril; A. Correa; C. Bolm (2008), "Iron-Catalyzed Sonogashira Reaction", Angew. Chem., 120 (26): 4940–4943, Bibcode:2008AngCh.120.4940C, doi:10.1002/ange.200801539
- ^ Thorsten Lauterbach; Madeleine Livendahl; Antonio Rosellon; Pablo Espinet; Antonio M. Echavarren (2010), "Unlikeliness of Pd-Free Gold(I)-Catalyzed Sonogashira Coupling Reactions", Org. Lett., 12 (13): 3006–3009, doi:10.1021/ol101012n, PMID 20515017
- ^ Tolnai, L. G.; Gonda, ZS.; Novák, Z. (2010). "Dramatic Impact of ppb Levels of Palladium on the "Copper-Catalyzed" Sonogashira Coupling". Chem. Eur. J. 16 (39): 11822–11826. doi:10.1002/chem.201001880. PMID 20821769.
- ^ Panda, B.; Sarkar, T. K. (2013), "Gold and Palladium Combined for the Sonogashira Coupling of Aryl and Heteroaryl Halides", Synthesis, 45 (6): 817–829, doi:10.1055/s-0032-1318119
- ^ Astruc, Didier; Heuzé, Karine; Gatard, Sylvain; Méry, Denise; Nlate, Sylvain; Plault, Lauriane (February 2005). "Metallodendritic Catalysis for Redox and Carbon—Carbon Bond Formation Reactions: A Step towards Green Chemistry". Adv. Synth. Catal. 347 (2–3): 329–338. doi:10.1002/adsc.200404247.
- ^ Heuzé, Karine; Méry, Denise; Gauss, Dominik; Astruc, Didier (2003). "Copper-free, recoverable dendritic Pd catalysts for the Sonogashira reaction". Chem. Commun. (18): 2274–2275. doi:10.1039/B307116M. PMID 14518871.
- ^ Yang, Yun-Chin; Luh, Tien-Yau (December 2003). "Polymeric Phosphine Ligand from Ring-Opening Metathesis Polymerization of a Norbornene Derivative. Applications in the Heck, Sonogashira, and Negishi Reactions" (PDF). J. Org. Chem. 68 (25): 9870–9873. doi:10.1021/jo035318z. PMID 14656129.
- ^ Buchmeiser, Michael R.; Schareina, Thomas; Kempe, Rhett; Wurst, Klaus (2001). "Bis(pyrimidine)-based palladium catalysts: Synthesis, X-ray structure and applications in Heck–, Suzuki–, Sonogashira–Hagihara couplings and amination reactions". J. Organomet. Chem. 634: 39–46. doi:10.1016/S0022-328X(01)01083-X.
- ^ Gil-Moltó, J.; Karström, S.; Nájera, C. (2005), "Di(2-pyridyl)methylamine–palladium dichloride complex covalently anchored to a styrene-maleic anhydride co-polymer as recoverable catalyst for C–C cross-coupling reactions in water", Tetrahedron, 61 (51): 12168–12176, doi:10.1016/j.tet.2005.08.122
- ^ Gil-Moltó, J.; Nájera, C. (2005), "Palladium(II) Chloride and a (Dipyridin-2-ylmethyl)amine-DerivedPalladium(II) Chloride Complex as Highly Efficient Catalysts for the Synthesisof Alkynes in Water or in NMP and of Diynes in the Absence of Reoxidant", Eur. J. Org. Chem., 2005 (19): 4073–4081, doi:10.1002/ejoc.200500319
- ^ a b c Gazvoda, M.; Virant, M; Pevec, A.; Urankar, D.; Bolje, A.; Kočevar, M.; Košmrlj, J. (2016), "A mesoionic bis(Py-tzNHC) palladium(II) complex catalyses green Sonogashira reaction through an unprecedented mechanism", Chem. Commun., 52 (8): 1571–1574, doi:10.1039/c5cc08717a, PMID 26575368
- ^ Crudden, Cathleen M.; Allen, Daryl P. (December 2004). "Stability and reactivity of N-heterocyclic carbene complexes". Coord. Chem. Rev. 248 (21–24): 2247–2273. doi:10.1016/j.ccr.2004.05.013.
- ^ Batey, R. A.; Shen, M.; Lough, A. J. (2002), "Carbamoyl-Substituted N-Heterocyclic Carbene Complexes of Palladium(II): Application to Sonogashira Cross-Coupling Reactions", Org. Lett., 4 (9): 1411–1414, doi:10.1021/ol017245g, PMID 11975591
- ^ a b Corona C.; Bryant B.K.; Arterburn J.B. (2006). "Synthesis of a Biotin-Derived Alkyne for Pd-Catalyzed Coupling Reactions". Org. Lett. 8 (9): 1883–1886. doi:10.1021/ol060458r. PMC 2523258. PMID 16623575.
- ^ Tulla-Puche J.; Barany G (2005). "Development of resin-to-resin transfer reactions (RRTR) using Sonogashira chemistry". Tetrahedron. 61 (8): 2195. doi:10.1016/j.tet.2004.12.029.
- ^ Hong, B.-C.; Nimje, R. Y. (2006). "Catalytic C-C Bond Formation in Natural Products Synthesis: Highlights From The Years 2000-2005". Curr. Org. Chem. 10 (17): 2191-2225. doi:10.2174/138527206778742605.
- ^ a b c Mujahidin, Didin; Doye, Sven (1 July 2005). "Enantioselective Synthesis of (+)-(S)-Laudanosine and (−)-(S)-Xylopinine". Eur. J. Org. Chem. 2005 (13): 2689–2693. doi:10.1002/ejoc.200500095.
- ^ Pedersen, J. M.; Bowman, W. R.; Elsegood, M. R. J.; Fletcher, A. J.; Lovell, P. J (2005). "Synthesis of Ellipticine: A Radical Cascade Protocol to Aryl- and Heteroaryl-Annulated[b]carbazoles". J. Org. Chem. 70 (25): 10615–10618. doi:10.1021/jo0519920. PMID 16323886.
- ^ Thongsornkleeb, C.; Danheiser, R.L. (2005). "The coupling of 2-iodo-prop-2-enol with a wide range of acetylenes such as TMSA to give enynyl alcohol, which can be oxidized to the corresponding R-alkynylated acroleins". J. Org. Chem. 70 (6): 2364–2367. doi:10.1021/jo047869a. PMC 2897060. PMID 15760233.
- ^ a b Shao, L.-X.; Shi, M. (2005), "Facile Synthesis of 2-Alkynyl Buta-1,3-dienes via Sonogashira Cross-Coupling Methodology", J. Org. Chem., 70 (21): 8635–8637, doi:10.1021/jo051434l, PMID 16209628
- ^ Bleicher, L.S.; Cosford, N.D.P.; Herbaut, A.; McCallum, J. S.; McDonald, I. A. (1998), "A Practical and Efficient Synthesis of the Selective Neuronal Acetylcholine-Gated Ion Channel Agonist (S)-(−)-5-Ethynyl-3-(1-methyl-2-pyrrolidinyl)pyridine Maleate (SIB-1508Y)", J. Org. Chem., 63 (4): 1109–1118, doi:10.1021/jo971572d
- ^ Wang, David X.; Booth, Heather; Lerner-Marmarosh, Nicole; Osdene, Thomas S.; Abood, Leo G. (1 September 1998). "Structure-activity relationships for nicotine analogs comparing competition for [3H]nicotine binding and psychotropic potency". Drug Dev. Res. 45 (1): 10–16. doi:10.1002/(SICI)1098-2299(199809)45:1<10::AID-DDR2>3.0.CO;2-G.
- ^ Parkinson Study, Group (14 February 2006). "Randomized placebo-controlled study of the nicotinic agonist SIB-1508Y in Parkinson disease". Neurology. 66 (3): 408–410. doi:10.1212/01.wnl.0000196466.99381.5c. PMID 16476941. S2CID 31720763.
- ^ a b Bakherad, M.; Nasr-Isfahani, H.; Keivanloo, A.; Doostmohammadi, N. (2008), "Pd–Cu catalyzed heterocyclization during Sonogashira coupling: synthesis of 2-benzylimidazo[1,2-a]pyridine", J. Organomet. Chem., 49 (23): 3819–3822, doi:10.1016/j.tetlet.2008.03.141
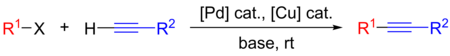
![Mechanism for the Cu-free Sonogashira reaction.[13][14]](https://upload.wikimedia.org/wikipedia/commons/thumb/9/90/Cu-free-mechanism.png/642px-Cu-free-mechanism.png)