시몬스-스미스 반응
Simmons–Smith reaction 시몬스-스미스 반응 진행 중 |
| 시몬스-스미스 반응 | |
|---|---|
| 이름을 따서 명명됨 | 하워드 엔시그 시몬스 주니어 로널드 D. 스미스 |
| 반응형 | 링 형성 반응 |
| 식별자 | |
| 유기화학포털 | 시몬스-스미스-스미스-스미스-스파이프 |
| RSC 온톨로지 ID | RXNO:0000258 |
시몬스-스미스 반응(Simmons-Smith reaction)은 알켄(또는 알킨)과 반응하여 사이클로프로판(Cyclopropane)[1][2][3]을 형성하는 오르간오진크 카보노이드(Organozincarnode)를 수반하는 유기적인 체 그것은 하워드 엔사인 시몬스 주니어와 로널드 D의 이름을 따서 지어졌다. 스미스. 알켄의 양쪽 탄소에 동시에 전달되는 메틸렌 프리 래디컬 중간을 사용하므로 이중 결합의 구성은 제품에 보존되며 반응은 입체적이다.[4]
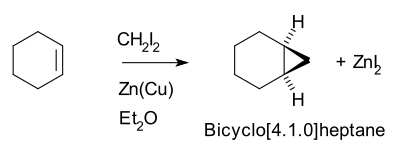
따라서, 사이클로헥센, 다이오도메탄, 아연-코퍼 커플(요오드메틸진크요오드화합물, IHZn2)I) 항복 노르카레인 (비시클로[4.1.0]헵탄).[5][6]
시몬스-스미스 반응은 일반적으로 다른 사이클로프로판화 방법보다 선호되지만,[7] 다이오도메탄의 높은 비용으로 인해 비용이 많이 들 수 있다. 디브로메탄이나[8] 디아조메탄, 요오드화 아연과 같은 값싼 대안이 포함된 수정이 개발되었다.[9] 후루카와 수정을 사용하여 아연-코퍼 부부를 디에틸진크로 교환함으로써 시스템의 반응성도 높일 수 있다.[10]
시몬스-스미스 반응은 일반적으로 강직 효과를 받기 때문에 보통 덜 방해받는 얼굴에서 사이클로프로판화가 일어난다.[11][12] 단, 히드록시 대체물이 이중 결합에 근접하여 기질에 존재하는 경우, 아연은 히드록시 대체물과 좌표를 이루며, 사이클로프로판화 시스를 히드록실 그룹으로 유도한다(이중 결합의 가장 접근하기 쉬운 면의 사이클로프로판화와 일치하지 않을 수 있음).[13] 이 반응의 대화형 3D 모델은 ChemTube3D에서 볼 수 있다.
비대칭 시몬스-스미스 반응
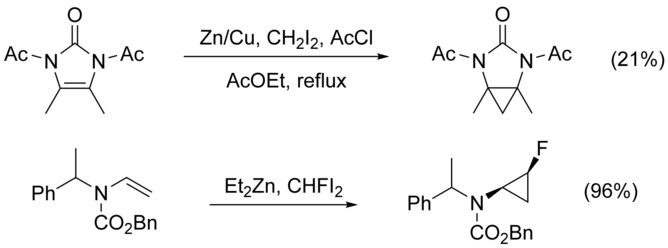
다이아조 화합물에 기초한 비대칭 사이클로프로판화 방법(비소사졸린 리간드 참조)이 1966년부터 존재하지만, 디클로로메탄에 디에틸진크, 디시오도메탄, 치랄 이설폰아미드 등을 첨가한 시나몬스-스미스 반응이 1992년에 도입되었다.
히드록실 그룹은 아연의 닻 역할을 하는 필수 조건이다. 유사한 반응의[15] 대화형 3D 모델을 여기서 볼 수 있다(자바 필요). 이 반응의 다른 버전에서 리간드는 살렌에 기초하고 루이스산 DIBAL은 다음과 같이 추가된다.[16]
범위 및 제한
아치랄 알케네스
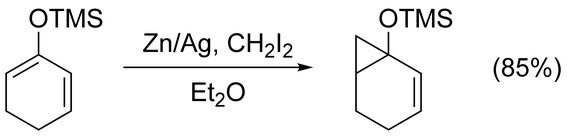
시몬스-스미스 반응은 합병증 없이 단순한 연골을 사이클로프로판화하는데 사용될 수 있다. 작동되지 않은 아치랄 알케인은 후루카와 수정(아래 참조)으로 가장 잘 사이클로프로판화되며, 1,2-디클로로에탄에 EtZn과2 CI를22 사용한다.[17] 전자 기증 그룹에 의해 활성화되는 알케인의 사이클로프로판화는 빠르고 쉽게 진행된다. 예를 들어, 트리메틸릴록시 대체 올레핀과 같은 에놀 에테르들은 높은 수확량 때문에 종종 사용된다.[18]
할로겐화물의 전자 유출 특성에도 불구하고 많은 비닐 할로겐화물은 쉽게 사이클로프로판화되며 플루오로, 브로모, 이오도 대체 사이클로프로판도 생성된다.[19][20]
N 대체 알케인의 사이클로프로판화는 N-alkylation에 의해 경쟁 경로로 복잡하게 만들어진다. 이는 질소에 보호 그룹을 추가하면 우회할 수 있지만 전자 배출 그룹을 추가하면 알켄의 핵 친화성이 감소하여 수율이 낮아진다. 이러한 경우22 CHI 대신 CHFI와2 같은 고전기생성 시약을 사용하는 것이 수율을 높이는 것으로 나타났다.[21]
폴리에네
올레핀에 감독 집단이 없으면 화학적 강인성이 거의 관찰되지 않는다.[22] 그러나, 다른 어떤 것보다 훨씬 더 많은 핵포화성을 가진 알켄은 매우 선호될 것이다. 예를 들어, 사이클로프로판화는 에놀에테르에서 고도로 선택적으로 발생한다.[23]
기능 그룹 호환성
시몬스-스미스 반응의 넓은 용도에 기여하는 중요한 측면은 많은 기능 그룹이 있는 곳에서 사용될 수 있는 능력이다. 그 중에서도 할로알킬진크 매개 반응은 알키네스, 알코올, 에테르, 알데히드, 케톤, 카복실산 및 파생상품, 탄산염, 설폰산, 설폰산, 사일레인, 스타나네와 호환된다. 그러나 일부 부작용은 흔히 관찰된다.
대부분의 부작용은 부산물 ZnI의2 Lewis-acidity 때문에 일어난다. 산성에 민감한 제품을 생산하는 반응에서 과잉 EtZn을2 첨가해 형성된 ZnI를2 파내 산도가 낮은 EtZnI를 형성할 수 있다. 이 반응은 또한 피리딘으로 가라앉힐 수 있는데, 이것은 ZnI와2 과다한 시약을 쓸어버릴 것이다.[24]
아연 카보노이드의 전기적 특성에 의한 시몬스-스미스 반응에서도 이질화 메틸화가 관찰된다. 예를 들어, 긴 반응 시간 동안 초과 시약을 사용하는 것은 거의 항상 알코올의 메틸화로 이어진다.[25] 또한, EtZn과2 CHI는22 아군 티오이더와 반응하여 유황 이라이드를 생성하며, 이후 2,3-시방성 재배열을 겪을 수 있으며, 초과 시몬스-스미스 시약을 사용하지 않는 한 동일한 분자 내 알켄을 사이클로프로판화하지 않는다.[26]
수정
시몬스-스미스 반응은 종종 기본적인 형태로 논의되지만, 아연 촉매와 첨가된 탄소 모두에 대한 많은 수정이 제안되었다.
후루카와 수정
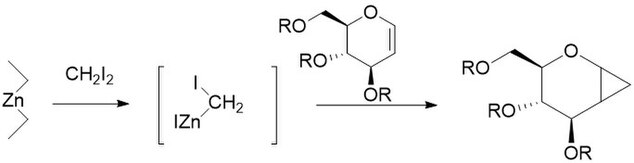
후루카와 개조에는 아연-코퍼 부부를 다이얼킬 아연으로 대체하는 작업이 포함되는데, 이 중 가장 활발한 것이 에트진인2 것으로 밝혀졌다. 1968년 비닐에테르와 같은 계통 중합성이 가능한 올레핀을 각각의 사이클로프로페인으로 바꾸는 방법으로 개정이 제안되었다.[27] 또한 탄수화물의 사이클로프로판화에 특히 유용한 것으로 밝혀져 다른 방법보다 훨씬 재현 가능하다.[28] 수정되지 않은 반응과 마찬가지로 후루카와 수정 반응은 입체적이며, 수정되지 않은 반응보다 훨씬 빠른 경우가 많다. 단, EtZn2 시약은 파이로포린성이므로 주의하여 취급해야 한다.[29]
챠레트 개조
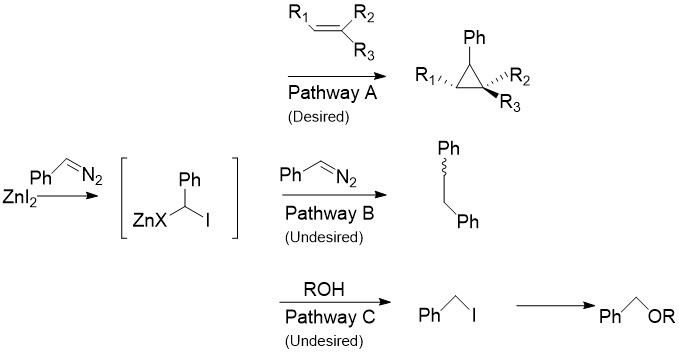
차렛 수정은 일반적으로 시몬스-스미스 반응에서 발견되는 CHI를22 경로 A의 페닐디아조메탄과 같은 아릴디아조 화합물로 대체한다.[30] 아연 할로겐화물의 계량학적 양으로 처리하면 위에서 논의한 카브노이드와 유사한 오르간오진화 화합물이 생성된다. 이것은 스타일렌과 알코올을 포함한 거의 모든 알케인과 알케인에 반응할 수 있다. 이것은 수정되지 않은 시몬스-스미스가 알코올을 분해하는 것으로 알려져 있기 때문에 특히 유용하다. 불행하게도, Pathway B에서 보듯이, 중간은 또한 시스 또는 트랜스 1.2-디페닐테네를 주면서 시작 디아조 화합물과 반응할 수 있다. 또한 중간은 알코올과 반응하여 요오드페닐메탄(요오드페닐메탄)을 생산할 수 있으며, 이는 경로 C에서와 같이 ROCHPh를 생성하기 위해 S2N 반응을 더 겪을 수 있다.
비진크 시약.
일반적으로는 사용되지 않지만 아연의 반응성과 유사한 특성을 보이는 시몬스-스미스 시약은 CHIX가2 존재하는 알루미늄 및 사마륨 화합물로부터 준비되었다.[31] 이러한 시약을 사용하면, 동맹 알코올과 격리된 올레핀은 서로 있는 곳에서 선택적으로 사이클로프로판화 될 수 있다. THF의 이오도- 또는 클로로-메틸사마륨 요오드화물은 히드록실 그룹에 대한 킬레이트화에 의해 지시된 것으로 추측되는 동맹성 알코올을 선택적으로 사이클로프로판화하는데 훌륭한 시약이다.[32] 이와는 대조적으로 CHCl에서22 dialkyl(iodomethyl)alum 시약을 사용하면 격리된 올레핀을 선택적으로 사이클로프로판화한다.[33] 이러한 시약의 특수성은 아연 기반 시약이 완전하고 선택적이지 않게 시클로파네이트가 되는 다불포화 시스템에 시클로프로팬을 배치할 수 있게 한다. 예를 들어 i-BuAl은3 6 위치에서 사이클로프로파나이트 제라니올을, Sm/Hg는 아래와 같이 2 위치에서 사이클로파나이트를 한다.
단, 두 반응 모두 시동 금속 화합물의 거의 기압계가 필요하며, Sm/Hg는 독성이 강한 HgCl로2 활성화해야 한다.
합성에서의 사용
시몬스-스미스 반응의 대부분의 현대적 적용은 후루카와 수정법을 사용한다. 특히 목적 적합하고 신뢰할 수 있는 응용프로그램은 아래에 열거되어 있다.
γ-케토 에스테르 양식에 삽입
후루카와 변형 시몬스-스미스 생성 사이클로프로판 중간체는 β-케토 에스테르에서 γ-케토 에스테르 합성에 형성된다. 시몬스-스미스 시약은 먼저 카보닐 그룹에 결합하고 그 후 첫 번째 반응이 형성되는 사이비 에놀의 α 탄소에 결합한다. 이 두 번째 시약은 시클로프로필 중간을 형성하며, 이 중간은 제품 속으로 빠르게 분해된다.[34][35]
알라나미드로부터의 아미도스피로[2.2] 펜탄의 형성
후루카와가 수정한 시몬스-스미스 반응 시클로프로판스는 알렌아마이드에서 두 개의 결합을 이루어 한 개의 탄소를 공유하는 두 개의 시클로프로필 링이 있는 [2.2] 펜타인을 형성한다. 모노사이클로프로판화의 산물 또한 형성된다.[36][37]
천연제품합성
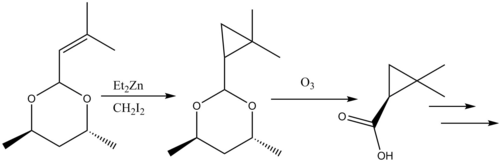
천연물 합성에서의 사이클로프로판화 반응이 검토되었다.[38] β-락타마제 억제제 실라스타틴은 천연물 합성에 있어 시몬스-스미스 반응성의 교훈적인 예를 제공한다. 시몬스-스미스 사이클로프로판화(Simmons-Smith cyclopropanated)가 시몬스-스미스 사이클로프로판화(Anlil)되어 카복실산은 이후 오조놀리분해(Ozonolyisisis)를 통해 분해되어 전구체가 된다.
약물 합성
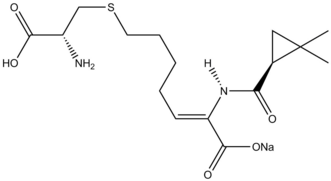
시몬스-스미스 반응은 GSK1360707F와 로파니칸트의 합성에 사용된다.[39]
참조
- ^ Howard Ensign Simmons Jr.; Smith, R.D. (1958). "A New Synthesis of Cyclopropanes from Olefins". J. Am. Chem. Soc. 80 (19): 5323–5324. doi:10.1021/ja01552a080.
- ^ Simmons, H.E.; Smith, R.D. (1959). "A New Synthesis of Cyclopropanes". J. Am. Chem. Soc. 81 (16): 4256–4264. doi:10.1021/ja01525a036.
- ^ Denis, J.M.; Girard, J.M.; Conia, J.M (1972). "Improved Simmons–Smith Reactions". Synthesis. 1972 (10): 549–551. doi:10.1055/s-1972-21919.
- ^ Charette, A. B.; Beauchemin, A. (2001). Simmons-Smith Cyclopropanation Reaction. Org. React. 58. p. 1. doi:10.1002/0471264180.or058.01. ISBN 978-0471264187.
- ^ Smith, R. D.; Simmons, H. E. "Norcarane". Organic Syntheses.CS1 maint: 복수 이름: 저자 목록(링크);
- ^ Ito, Y.; Fujii, S.; Nakatuska, M.; Kawamoto, F.; Saegusa, T. (1988). "One-Carbon Ring Expansion Of Cycloalkanones To Conjugated Cycloalkenones: 2-Cyclohepten-1-one". Organic Syntheses.CS1 maint: 복수 이름: 저자 목록(링크);
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (1st ed.). Oxford University Press. ISBN 978-0-19-850346-0.1067페이지
- ^ Fabisch, Bodo; Mitchell, Terence N. (1984). "An inexpensive modification of the Simmons-Smith reaction: The formation of bromomethylzinc bromide as studied by NMR spectroscopy". Journal of Organometallic Chemistry. 269 (3): 219–221. doi:10.1016/0022-328X(84)80305-8.
- ^ Wittig, Georg; Wingler, Frank (1 August 1964). "Über methylenierte Metallhalogenide, IV. Cyclopropan-Bildung aus Olefinen mit Bis-halogenmethyl-zink". Chemische Berichte. 97 (8): 2146–2164. doi:10.1002/cber.19640970808.
- ^ Furukawa, J.; Kawabata, N.; Nishimura, J. (1968). "Synthesis of cyclopropanes by the reaction of olefins with dialkylzinc and methylene iodide". Tetrahedron. 24 (1): 53–58. doi:10.1016/0040-4020(68)89007-6.
- ^ Simmons, H. E.; et al. (1973). Org. React. (Review). 20: 1. 누락 또는 비어 있음
title=(도움말) - ^ Girard, C.; Conia, J. M. (1978). J. Chem. Res. (S) (Review): 182. 누락 또는 비어 있음
title=(도움말) - ^ Paul A. Grieco; Tomei Oguri; Chia-Lin J. Wang & Eric Williams (1977). "Stereochemistry and total synthesis of (±)-ivangulin". J. Org. Chem. 42 (25): 4113–4118. doi:10.1021/jo00445a027.
- ^ Hideyo Takahashi, Masato Yoshioka, Masaji Ohno and Susumu Kobayashi (1992). "A catalytic enantioselective reaction using a C2-symmetric disulfonamide as a chiral ligand: cyclopropanation of allylic alcohols by the Et2Zn-CH2I2-disulfonamide system". Tetrahedron Letters. 33 (18): 2575–2578. doi:10.1016/S0040-4039(00)92246-9.CS1 maint: 여러 이름: 작성자 목록(링크)
- ^ Wang, Tao; Liang, Yong; Yu, Zhi-Xiang (2011). "Density Functional Theory Study of the Mechanism and Origins of Stereoselectivity in the Asymmetric Simmons–Smith Cyclopropanation with Charette Chiral Dioxaborolane Ligand". Journal of the American Chemical Society. 133 (24): 9343–9353. doi:10.1021/ja111330z. PMID 21627114.
- ^ Hiroaki Shitama & Tsutomu Katsuki (2008). "Asymmetric Simmons–Smith Reaction of Allylic Alcohols with Al Lewis Acid/N Lewis Base Bifunctional Al(Salalen) Catalyst". Angew. Chem. Int. Ed. 47 (13): 2450–2453. doi:10.1002/anie.200705641. PMID 18288666.
- ^ Denmark, S. E.; Edwards, J. P. (1991). "A Comparison of (Chloromethyl)- and (Iodomethyl)zinc Cyclopropanation Reagents". J. Org. Chem. 56 (25): 6974–6981. doi:10.1021/jo00025a007.
- ^ Rubottom, G. M.; Lopez, M. I. (1973). "Reaction of Trimethysilyl Enol Ethers with Simmons-Smith Reagent. Facile Synthesis of Trimethylsilyl Cyclopropyl Ethers and Cyclopropanols". J. Org. Chem. 38 (11): 2097–2099. doi:10.1021/jo00951a032.
- ^ 모리카와 T.; 사사키 H.; 모리 K.; 시로 M.; 다구치 T.; 모리카와 T.; 사사키 H. 모리 K.; 시로 M.; 다구치 T. 시몬스미스- 플루오롤 알코올 파생상품의 반응. 화학. 제약. 불. (도쿄) 1992, 40 (12), 3189.
- ^ 교각, E.; Coish, P. D. 준비 및 2-Ioodalk-2-En-1-Ols의 사이클로프로판화: 기능화된 스테레오디프 요오드클로프로판의 합성. 종합 1995, 1995 (1), 47–55.
- ^ 개그논, J. L. 주니어, W. W. Z. Cis-1,5-Dimethyl-2,4-Dinitro-2,4-diazyclo[3.1.0]hexan-3-One 및 Cis-1,5-Dimethyl-2,4-Dinitro-2,4-diazabyclo[3.2.0]헵탄-3-1의 합성 신스. 1996, 26 (4), 837–845.
- ^ Friedrich, E. C.; Niyati-Shirkhodaee, F. (1991). "Regioselectivity and Solvent Effects in Cyclopropanation of Alkadienes". J. Org. Chem. 56 (6): 2202–2205. doi:10.1021/jo00006a044.
- ^ Lee, J.; Kim, H.; Cha, J. K. (1995). "Diastereoselective Synthesis of Cis-1,2-Dialkenylcyclopropanols and Subsequent Oxy-Cope Rearrangement". J. Am. Chem. Soc. 117 (39): 9919–9920. doi:10.1021/ja00144a022.
- ^ 데니스, J. M.; 지라드, C.; 코니아, J. M. 시몬스-스미스 반응 개선. 합성 1972, 1972(10), 549–551.
- ^ Takakis, I. M.; Rhodes, Y. E. (1978). "Cyclopropanation of Some Simple Olefinic Compounds. By-Product Formation in Excess Simmons-Smith Reagent". J. Org. Chem. 43 (18): 3496–3500. doi:10.1021/jo00412a017.
- ^ Cohen, T.; Kosarych, Z. (1982). "Complete regio- and stereospecificity in the Lewis acid catalyzed Diels-Alder reactions of (Z)-2-methoxy-1-(phenylthio)-1,3-butadienes. Conversion of the CS configuration of an adduct to the CC configuration at the allylic position by a [2,3] sigmatropic rearrangement". J. Org. Chem. 47 (20): 4005–4008. doi:10.1021/jo00141a047.
- ^ Furukawa, J; Kawabata, N; Nishimura, J (1968). "Synthesis of cyclopropanes by the reaction of olefins with dialkylzinc and methylene iodide". Tetrahedron. 24 (1): 53–58. doi:10.1016/0040-4020(68)89007-6.
- ^ Halton, B (2000). Advances in Strained and Interesting Organic Molecules, Volume 8. Stamford, Ct: Press Inc. p. 115. ISBN 978-0-7623-0631-2.
- ^ "Diethyl Zinc MSDS" (PDF). Retrieved 10 May 2017.
- ^ Lévesque, Éric; Goudreau, Sébastien R.; B. Charette, André B. (2014). "Improved Zinc-Catalyzed Simmons–Smith Reaction: Access to Various 1,2,3-Trisubstituted Cyclopropanes". Organic Letters. 16 (5): 1490–1493. doi:10.1021/ol500267w. PMID 24555697.
- ^ Roger, Adams (2001). Organic Reactions Vol 58. New York: Wiley, J. pp. 9–10. ISBN 978-0-471-10590-9.
- ^ Molander, G. A.; Harring, L. S. (1989). "Samarium-Promoted Cyclopropanation of Allylic Alcohols". J. Org. Chem. 54 (15): 3525–3532. doi:10.1021/jo00276a008.
- ^ Maruoka, K.; Fukutani, Y.; Yamamoto, H. (1985). "Trialkylaluminum-Alkylidene Iodide. A Powerful Cyclopropanation Agent with Unique Selectivity". J. Org. Chem. 50 (22): 4412–4414. doi:10.1021/jo00222a051.
- ^ Bhogadhi, Yashoda; Zercher, Charles (2014). "Discussion Addendum for: Formation of γ-Keto Esters from β-Keto Esters: Methyl 5,5-dimethyl-4-oxohexanoate". Organic Syntheses. 91: 248–259. doi:10.15227/orgsyn.091.0248.
- ^ Ronsheim, Matthew; Hilgenkamp, Ramona; Zercher, Charles (2002). Formation of γ-Keto Esters from β-Keto Esters: Methyl 5,5-dimethyl-4-oxohexanoate (PDF). Organic Syntheses. 79. p. 146. doi:10.1002/0471264180.os079.18. ISBN 978-0471264224.
- ^ Teo, Yong-Chua; Hsung, Richard (2014). "Discussion Addendum for: Practical Synthesis of Novel Chiral Allenamides: (R)-4- Phenyl-3-(1,2-propadienyl)oxazolidin-2-one". Organic Syntheses. 91: 12–26. doi:10.15227/orgsyn.091.0012.
- ^ Xiong, H; Tracey, M; Grebe, T; Mulder, J; Hsung, R (2005). "PRACTICAL SYNTHESIS OF NOVEL CHIRAL ALLENAMIDES: (R)-4-PHENYL-3-(1,2-PROPADIENYL)OXAZOLIDIN-2-ONE (2-Oxazolidinone, 4-phenyl-3-(1,2-propadienyl)–, (4R)–)". Organic Syntheses. 81: 147–156. doi:10.15227/orgsyn.081.0147.
- ^ Donaldson, William (October 8, 2001). "Synthesis of cyclopropane containing natural products". Tetrahedron. 57 (41): 8589. doi:10.1016/s0040-4020(01)00777-3.
- ^ "Synthesis of SUVN-911". Synfacts. 16 (06): 0626. 2020. doi:10.1055/s-0040-1707534. ISSN 1861-1958.
외부 링크
| 위키미디어 커먼스는 시몬스-스미스 반응과 관련된 미디어를 보유하고 있다. |