염화옥사일
Oxalyl chloride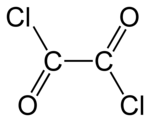 | |||
| | |||
 | |||
| 이름 | |||
|---|---|---|---|
| 선호 IUPAC 이름 옥살릴 디클로로이드[1] | |||
| 체계적 IUPAC 이름 이타네딜 디클로로이드[1] | |||
| 기타 이름 염화 옥살산 옥살산디클로로이드 옥살성 이클로로이드 염화 옥살로일 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 켐스파이더 | |||
| ECHA InfoCard | 100.001.092 | ||
| EC 번호 |
| ||
펍켐 CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| C2O2Cl2 | |||
| 어금질량 | 126.93 g/190 | ||
| 외관 | 무색액 | ||
| 밀도 | 1.4785 g/mL | ||
| 녹는점 | -16°C(3°F, 257K) | ||
| 비등점 | 1.017bar에서 63~64°C(145~147°F, 336~337K) | ||
| 반응하다 | |||
굴절률(nD) | 1.429 | ||
| 위험 | |||
| 산업안전보건(OHS/OSH): | |||
주요 위험 | 독성, 부식성, 라크리메이터[2] | ||
| GHS 라벨 표시: | |||
  [2] [2] | |||
| 위험[2] | |||
| H314, H331[2] | |||
| P261, P280, P305+P351+P338, P310[2] | |||
| NFPA 704(화재 다이아몬드) | |||
| 안전 데이터 시트(SDS) | 외부 MSDS | ||
| 관련 화합물 | |||
| 염화말론 숙염화비닐 포스겐 | |||
관련 화합물 | 옥살산 디틸옥살산염 옥사미드 옥살릴수화물 큐프리존 1호 | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
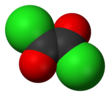
염화 옥살리는 화학적 화합물로서, COCl (Corcl)이라는 공식을 가지고 있다.2이 무색, 날카로운 냄새가 나는 액체, 옥살산의 디아실 염화물은 유기합성에 유용한 시약이다.[3]
준비
염화 옥살리는 1892년 프랑스의 화학자 Adrien Fauconnier에 의해 처음 준비되었는데, 그는 디에틸 옥살레이드에 인 펜타클로라이드를 반응시켰다.[4]옥살산을 인 펜타클로라이드로 치료함으로써도 준비할 수 있다.[5]
염화 옥살리는 에틸렌 탄산염으로부터 상업적으로 생산된다.광염소화물은 사염화물을 공급하며, 이후 분해된다.[6]
- 초코242 + 4 Cl2 → CCLOCO242 + 4 HCl
- CClOCO242 → COCl222 + COCl2
반응
염화 옥살리는 물과 반응하여 염화수소(HCl), 이산화탄소(CO2), 일산화탄소(CO) 등 기체 제품만 배출한다.
- (COCl)2 + H2O → 2 HCl + CO2 + CO
이 점에서 염화수소의 형성과 함께 가수분해하는 다른 아틸염화물과 원래의 카르복실산과는 사뭇 다르다.
유기합성에서의 응용
알코올의 산화
DMSO와 염화 옥살리로 구성된 용액과 트리에틸아민으로 이루어진 quenching은 스웨른 산화로 알려진 과정을 통해 알코올을 해당 알데히드 및 케톤으로 변환한다.[7][8][9]
아킬 염소화합성
염화 옥살릴은 주로 유기합성에 N,N-디메틸포름아미드 촉매와 함께 사용되어 해당 카르복실산으로부터 아킬염소화물을 준비한다.이 애플리케이션에서는 염화 티오닐과 마찬가지로 시약이 휘발성 측면 제품으로 분해되어 작업을 단순화한다.N, N-디메틸포름아미드 촉매 반응에서 나오는 경미한 부산물 중 하나는 N,N-디메틸포름아미드 분해에서 기인하는 강력한 발암물질이다.[10]염화 티오닐에 비해, 염화 옥살리는 더 부드럽고 선택적인 시약인 경향이 있다.또한 염화 티오닐보다 더 비싸기 때문에 작은 규모로 사용하는 경향이 있다.
이 반응에는 DMF를 이미도일 염화물 유도체(MeN2=CHCl+)로 변환하는 것이 포함되며, 이는 빌스메이어-하크 반응의 1단계와 유사하다.염화 이미도일(imidoyl)은 활성염소화제다.
아렌즈 형성
염화 옥살리는 염화알루미늄이 있는 곳에서 방향성 화합물과 반응하여 프리델-크래프트 아틸화라고 알려진 공정에서 해당 염화 아킬화물을 제공한다.[11][12]그 결과 염화 아킬은 해당 카르복실산을 형성하기 위해 가수 분해될 수 있다.
옥살산염 소멸자 준비
다른 아실염화염소화물과 마찬가지로 염화산소도 알코올과 반응하여 에스테르를 발생시킨다.
- 2 RCHOH2 + (COCl)2 → RCOC2(O)C(O)OC2(O)OCR + 2 HCl
전형적으로 그러한 반응은 피리딘과 같은 기지가 있는 곳에서 행해진다.페놀, 페닐 옥살레이트 에스테르에서 파생된 다이터는 야광 스틱의 활성 성분인 시알루메이다.
기타
소염화 옥살리는 탄소의 산화물인 다이옥산 테트라케톤(CO46)의 1차 합성에 사용된 것으로 알려졌다.[13]
주의사항
2000년 3월 말레이시아 항공의 에어버스 A330-300은 금지된 옥살리 염화물(허위판 히드록시퀴놀린) 화물이 화물칸으로 유출돼 수리할 수 없을 정도로 파손됐다.[14]관련 화합물 포스겐보다 덜 급성 독성의 정도 이상이지만 흡입에 의한 독성이 있다.[15]
참고 항목
참조
- ^ a b Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 797. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ a b c d e 염화 옥살릴 MSDS
- ^ Salmon, R. (2001). "Oxalyl Chloride". Encyclopedia of Reagents for Organic Synthesis. New York: John Wiley & Sons. doi:10.1002/047084289X.ro015. ISBN 0471936235.
- ^ Fauconnier, Adrien (1892). "Action du perchlorure de phosphore sur l'oxalate d'éthyle" [The action of phosphorus pentachloride on diethyl oxalate]. Comptes rendus hebdomadaires des séances de l'Académie des Sciences (in French). 114: 122–123.
- ^ DE 특허 2840435, 보겔, A.; 스테판, G.; 마네스, K.; 트레셔, V.는 바이엘에게 할당된 1980-03-27, "염화 옥살리알 준비 과정"을 발행했다.
- ^ Pfoertner, Karl-Heinz (2000). "Photochemistry". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_573.
- ^ Dondoni, A.; Perrone, D. (2004). "Synthesis of 1,1-Dimethyl Ethyl-(S)-4-formyl-2,2-dimethyl-3-oxazolidinecarboxylate by Oxidation of the Alcohol". Organic Syntheses.; Collective Volume, vol. 10, p. 320
- ^ Bishop, R. (1998). "9-Thiabicyclo[3.3.1]nonane-2,6-dione". Organic Syntheses.; Collective Volume, vol. 9, p. 692
- ^ Leopold, E. J. (1990). "Selective hydroboration of a 1,3,7-triene: Homogeraniol". Organic Syntheses.; Collective Volume, vol. 7, p. 258
- ^ Clayden, Jonathan (2005). Organic chemistry (Reprinted(with corrections) ed.). Oxford [u.a.]: Oxford Univ. Press. pp. 296. ISBN 978-0-19-850346-0.
- ^ Neubert, M. E.; Fishel, D. L. (1983). "Preparation of 4-Alkyl- and 4-Halobenzoyl Chlorides: 4-Pentylbenzoyl Chloride". Organic Syntheses. 61: 8.; Collective Volume, vol. 7, p. 420
- ^ Sokol, P. E. (1964). "Mesitoic Acid". Organic Syntheses. 44: 69.; Collective Volume, vol. 5, p. 706
- ^ Strazzolini, P.; Gambi, A.; Giumanini, A. G.; Vancik, H. (1998). "The reaction between ethanedioyl (oxalyl) dihalides and Ag2C2O4: a route to Staudinger's elusive ethanedioic (oxalic) acid anhydride". Journal of the Chemical Society, Perkin Transactions 1. 1998 (16): 2553–2558. doi:10.1039/a803430c.
- ^ "Firm told to pay $65 mln for ruining plane". Reuters. 2007-12-06. Retrieved 2007-12-06.
- ^ Barbee, S.J.; Stone, J.J.; Hilaski, R.J. (January 1995). "Acute Inhalation Toxicology of Oxalyl Chloride". American Industrial Hygiene Association Journal. 56 (1): 74–76. doi:10.1080/15428119591017358. ISSN 0002-8894. PMID 7872205.