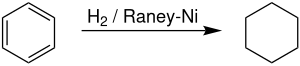사이클로헥산
Cyclohexane| | |||
| | |||
| 이름 | |||
|---|---|---|---|
| 선호 IUPAC 이름 사이클로헥산[2] | |||
| 기타 이름 헥사나프테네(고풍)[1] | |||
| 식별자 | |||
| |||
3D 모델(JSmol) | |||
| 3DMET | |||
| 1900225 | |||
| 체비 | |||
| 켐벨 | |||
| 켐스파이더 | |||
| 드러그뱅크 | |||
| ECHA InfoCard | 100.003.461 | ||
| 1662 | |||
| 케그 | |||
펍켐 CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
| UN 번호 | 1145 | ||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| C6H12 | |||
| 어금질량 | 84.1987 g·message−1 | ||
| 외관 | 무색액 | ||
| 냄새 | 달콤하고, 가솔린 같은 | ||
| 밀도 | 0.7739 g/mL, 액체, 밀도 = 0.996 g/mL, 고체 | ||
| 녹는점 | 6.47°C(43.65°F, 279.62K) | ||
| 비등점 | 80.74°C(177.33°F, 353.89K) | ||
| 불변의 | |||
| 용해성 | 에테르, 알코올, 아세톤에 용해성 | ||
| 증기압 | 78 mmHg(20°C)[3] | ||
자기 감수성(magnetic susibility) | -68.13·10cm−63/190cm | ||
굴절률(nD) | 1.42662 | ||
| 점도 | 17 °C에서 1.02 cP | ||
| 열화학 | |||
의 성 엔탈피 대형화 (ΔfH⦵298) | −156 kJ/mol | ||
의 성 엔탈피 연소시키다 (ΔcH⦵298) | −3920 kJ/mol | ||
| 위험 | |||
| GHS 라벨 표시: | |||
    | |||
| 위험 | |||
| H225, H302, H305, H315, H336 | |||
| P210, P233, P240, P241, P242, P243, P261, P264, P271, P273, P280, P301+P310, P302+P352, P303+P361+P353, P304+P340, P312, P321, P331, P332+P313, P362, P370+P378, P391, P403+P233, P403+P235, P405, P501 | |||
| NFPA 704(화재 다이아몬드) | |||
| 플래시 포인트 | -20°C(-4°F, 253K) | ||
| 245°C(473°F, 518K) | |||
| 폭발 한계 | 1.3–8%[3] | ||
| 치사량 또는 농도(LD, LC): | |||
LD50(중간 선량) | 12705mg/kg(랫드, 구강) 813mg/kg(구강, 구강)[4] | ||
LCLo(최저공표) | 17,190ppm(mouse, 2시간) 26,600ppm( (, 1시간)[4] | ||
| NIOSH(미국 건강 노출 제한): | |||
PEL(허용) | TWA 300ppm(1050mg/m3)[3] | ||
REL(권장) | TWA 300ppm(1050mg/m3)[3] | ||
IDLH(즉시 위험) | 1300ppm[3] | ||
| 관련 화합물 | |||
관련 사이클로알카인 | 사이클로펜테인 사이클로헵탄 | ||
관련 화합물 | 사이클로헥센 벤젠 | ||
| 부가자료페이지 | |||
| 사이클로헥산(데이터 페이지) | |||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
사이클로헥산(Cyclohexane)은 분자식 CH를612 가진 사이클로알카인이다. 사이클로헥산느는 비극성이다. 사이클로헥산(Cyclohexane)은 세제와 같은 독특한 냄새가 나는 무색의 인화성 액체로, 청소 제품(때로는 사용되기도 한다)을 연상시킨다. 사이클로헥산(Cyclohexane)은 나일론의 전구체인 아디프산(adipic acid)과 카프로락탐(caprolactam)의 공업 생산에 주로 쓰인다.[5]
사이클로헥실(Cyclohexyl, CH611)은 사이클로헥산(Cyclohexane)의 알킬 대체물이며, 약칭은 키이다.[6]
생산
모던
산업적 규모에서 사이클로헥산은 래니 니켈 촉매가 있는 곳에서 벤젠의 수소화에 의해 생산된다.[7] 사이클로헥산 생산자는 벤젠에 대한 전 세계 수요의 약 11.4%를 차지한다.[8] 반응은 ΔH(500 K) = -216.37 kJ/mol)로 발열성이 매우 높다. 탈수 현상은 300 °C 이상에서 눈에 띄게 시작되어 탈수화에 유리한 엔트로피를 반영한다.[9]
일찍
시클로헥산은 벤젠과 달리 석탄 등 천연자원에서는 찾아볼 수 없다. 이 때문에 초기 조사관들은 사이클로헥산 샘플을 합성했다.[10]
실패
- 1867년 마르첼린 베르테로트는 높은 온도에서 하이드로이드로이드산을 함유한 벤젠을 감소시켰다.[11][12]
- 1870년 아돌프 폰 배이어는 그 반응을[13] 반복하여 같은 반응 제품인 "헥사하이드로벤젠"을 발음하였다.
- 1890년 블라디미르 마르코브니코프는 코카서스 석유에서 같은 화합물을 증류할 수 있다고 믿었고, 그의 혼합물을 "헥사나프테네"라고 불렀다.
Surprisingly, their cyclohexanes boiled higher by 10 °C than either hexahydrobenzene or hexanaphtene, but this riddle was solved in 1895 by Markovnikov, N.M. Kishner, and Nikolay Zelinsky when they reassigned "hexahydrobenzene" and "hexanaphtene" as methylcyclopentane, the result of an unexpected rearrangement reaction.
성공
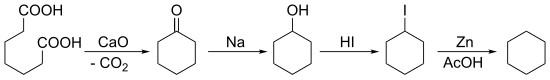
1894년 배이어는 피멜산의 케톤화로부터 시작하여 시클로헥산을 합성하여 다음과 같은 다량의 감소를 하였다.
같은 해에 E. Haworth와 W.H. Perkin Jr. (1860–1929)는 1,6-dibromohexane의 우르츠 반응을 통해 그것을 준비했다.
반응 및 사용
사이클로헥산은 다소 비활성화되기는 하지만 촉매 산화를 통해 사이클로헥사논과 사이클로헥사놀을 생성한다. 사이클로헥사논-사이클로헥사놀 혼합물인 'KA 오일'은 아디프산과 카프로락탐의 원료로 나일론의 전구체다. 매년 수백만 킬로그램의 사이클로헥사논과 사이클로헥산올이 생산된다.[9]
그것은 일부 수정액 브랜드에서 용매로 사용된다. 사이클로헥산(Cyclohexane)은 이러한 목적을 위해 n-헥산(n-hexane)이 더 널리 사용되기는 하지만 때로는 비극성 유기 용매로 사용된다. 많은 유기화합물이 고온 사이클로헥산에서는 용해성이 좋고 저온에서는 용해성이 좋지 않아 재분해용제로 자주 사용된다.
사이클로헥산(Cyclohexane)은 -87.1°C에서 크리스털 전환이 편리하기 때문에 차동 스캐닝 칼로리(DSC) 계측기의 교정에도 사용된다.[14]
사이클로헥산 증기는 진공 화로, 열처리 장비 제조에 사용된다.
순응
6베르텍스 엣지 링은 완벽한 육각형의 모양과 맞지 않는다. 평평한 2D 평면 6각형의 순응은 결합이 109.5도가 아니기 때문에 상당한 각도 스트레인을 가지고 있다. 모든 결합이 비클립 결합이기 때문에 비틀림 스트레인 또한 상당할 것이다. 따라서 비틀림 긴장을 줄이기 위해 사이클로헥산은 의자 순응이라고 알려진 3차원 구조를 채택하는데, 이것은 의자 플립이라고 알려진 과정을 통해 상온에서 빠르게 상호 변환된다. 의자를 뒤집는 동안, 가장 불안정한 순응인 하프 의자, 더 안정적인 보트 순응인 배, 그리고 보트보다 더 안정적이지만 의자보다 훨씬 안정성이 떨어지는 트위스트 보트 등 세 가지 중간 순응이 있다. 의자와 트위스트 보트는 에너지 미니마(minima)이므로 컨포머(conformer)인 반면, 하프 체어와 보트는 전환 상태(transition state)이며 에너지 최대치를 나타낸다. 의자 순응이 사이클로헥산에게 가장 안정된 구조라는 생각은 헤르만 삭세에 의해 1890년 초에 처음 제안되었으나 훨씬 후에야 널리 받아들여졌다. 새로운 순응은 탄소를 109.5° 각도로 만든다. 하이드로겐의 절반은 링의 평면(동등)에 있고 나머지 절반은 평면(축)에 수직이다. 이 순응은 사이클로헥산의 가장 안정적인 구조를 가능하게 한다. 시클로헥산(Cyclohexane)의 또 다른 순응은 보트 순응이라고 알려져 있지만, 그것은 약간 더 안정된 의자 형성과 상호 작용한다. 만약 사이클로헥산이 큰 대체물로 단분 대체된다면, 대체물은 적도의 위치에 부착된 채로 발견될 가능성이 가장 높을 것이다. 이것이 조금 더 안정적인 순응이기 때문이다.
사이클로헥산느는 모든 사이클로알카인 중에서 가장 낮은 각도와 비틀림 스트레인을 가지고 있다. 그 결과 사이클로헥산느는 총 링 스트레인에서 0으로 간주되었다.
솔리드 페이즈
사이클로헥산느는 두 개의 결정 단계를 가지고 있다. 186K와 녹는점 280K 사이에서 안정된 고온 1단계는 플라스틱 결정으로 분자가 어느 정도 회전하는 자유도를 유지한다는 것을 의미한다. 저온(186K 이하) 단계 II를 주문한다. 다른 두 개의 저온(측정 가능한) 단계 3과 IV는 30 MPa 이상의 중간 압력을 적용하여 얻었으며, 여기서 단계 4는 탈수 사이클로헥산에만 나타난다(압력의 적용은 모든 전환 온도의 값을 증가시킨다).[15]
| 아니요. | 대칭 | 스페이스 그룹 | A(A) | b (å) | c (å) | Z | T(K) | P(MPa) |
|---|---|---|---|---|---|---|---|---|
| I | 큐빅 | Fm3m | 8.61 | 4 | 195 | 0.1 | ||
| II | 단음이의 | C2/c | 11.23 | 6.44 | 8.20 | 4 | 115 | 0.1 |
| III. | 정형외과 | Pmn | 6.54 | 7.95 | 5.29 | 2 | 235 | 30 |
| IV | 단음이의 | P12(1)/n1 | 6.50 | 7.64 | 5.51 | 4 | 160 | 37 |
여기서 Z는 단위 셀당 수 구조 단위로서, 단위 셀 상수 a, b, c는 주어진 온도 T와 압력 P에서 측정되었다.
참고 항목
- 사이클로헥산 폭발로 인한 대형 산업재해인 플렉스버러 참사.
- 헥산
- 링 플립
- 사이클로헥산(데이터 페이지)
참조
- ^ Hexanapthene Archived 2018-02-12 Wayback Machine, dictionary.com
- ^ "Front Matter". Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. pp. P001–P004. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ a b c d e NIOSH Pocket Guide to Chemical Hazards. "#0163". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b "Cyclohexane". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Campbell, M. Larry (2011). "Cyclohexane". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a08_209.pub2. ISBN 978-3527306732.
- ^ "Standard Abbreviations and Acronyms" (PDF). The Journal of Organic Chemistry.
- ^ 프레드 판 장, 토마스 판 리엔만, 김수 김, 앨런 청 "향기 화합물의 수소화 현재 방법, 1945년부터 현재에 이르기까지" 룬드 테니스카 호그스콜라 2008
- ^ Ceresana. "Benzene - Study: Market, Analysis, Trends 2021 - Ceresana". www.ceresana.com. Archived from the original on 21 December 2017. Retrieved 4 May 2018.
- ^ a b Michael Tuttle Musser (2005). "Cyclohexanol and Cyclohexanone". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a08_217. ISBN 978-3527306732.
- ^ Warnhoff, E. W. (1996). "The Curiously Intertwined Histories of Benzene and Cyclohexane". J. Chem. Educ. 73 (6): 494. Bibcode:1996JChEd..73..494W. doi:10.1021/ed073p494.
- ^ 베스토레(1867년) "Nouvelles applications des methodd de réruction en chimie orgique"(유기화학에서의 감소 방법의 새로운 적용), Bulletin de la Societété chimique de Paris, 시리즈 2, 7: 53-65.
- ^ 베스토레(1868년) "메토드 유니버셀레 붓 레듀아르 등 시처러 드 하이드로젠 레 콤포지크 오르가니크"(수소로 유기화합물을 줄이고 포화시키는 보편적 방법), 프랑스 파리 번지 드 라 소시에테 치미크 드 파리 시리즈 2, 9: 8-31 17쪽:"앙 effet, 라 benzine,chauffée à부터 280° 펜던트 24heures 80fois 아들saturée àfroid d'acide iodhydrique aqueused'une 해결책 poids avec, 땅이 변화fixant 4fois 아들 볼륨 d'hydrogène:C12H6+4H2한 계란)C12H14 … 르 누보 carbureformé 파(벤진.un 군단 독특한(défprès entièrement 앙 hydrure d'hexylène, C12H14, peu à.ini:il b아웃 à 69°,(offre toutes propriétés les 것은 라 작문 드 l'hydrure d'hexylène extrait 데 pétroles."(사실상, 벤젠, 280°에 24시간 동안 찬 포화hydroiodic 산성의 수용액의 80번의 체중과의 격심한, 거의 전체적으로 hexylene의 수소화, C12H14,-LSB- 참고:로 헥산에 이 공식이 변경되었습니다(C6H14)은 잘못된 것이 아니다. 때문에 당시 화학자들은 [즉, 결합]을 4배의 수소 부피인 CH126 + 4H2 = CH1214 …벤젠에 의해 형성된 새로운 탄소 화합물은 독특하고 잘 정의된 물질이다: 69°에서 끓어오르며 기름에서 추출한 헥실렌의 모든 특성과 하이드라이드 성분을 나타낸다.
- ^ 아돌프 배이어(1870) "Uber die Reductionatischer Kholenwasserstoffe durch Jodphosphosphonium"(요오드화4 인산염[HIP]에 의한 방향성 화합물 감소에 대하여), Annalen der Chemie und Pharmicie, 155 : 266-281. 279페이지부터: "Bei der Reduction mit Natriumamalgam oder Jodphosphonium addiren sich im Höchsten Palle sech Atome Wasserstoff, und es es es es es es es es es esche esignhenstehentententhe hon Aben aven aven aven aven aven aven aven aven Kohen Ko612. Dieser Kohlenwasserstoff ist aller Wahrscheinlichkeit nach ein geschlossener Ring, da seine Derivate, das Hexahydromesitylen und Hexahydromellithsäure, mit Leichtigkeit wieder in Benzolabkömmlinge übergeführt werden können." (During the reduction [of benzene] with sodium amalgam or phosphonium iodide, six atoms of hydrogen are added in the extre내 경우, 그리고 탄화수소612 CH에서 파생되는 파생상품이 발생한다. 이 탄화수소는 헥사히드로미아닐렌[1,3,5 - 트리메틸 시클로헥산]과 헥사히드로멜리스산[사이클로헥산-1,2,3,4,5,6-헥사카르복실산]이 쉽게 벤젠 유도체로 변환될 수 있기 때문에 닫힌 링일 가능성이 전혀 없다.
- ^ Price, D. M. (1995). "Temperature Calibration of Differential Scanning Calorimeters". Journal of Thermal Analysis. 45 (6): 1285–1296. doi:10.1007/BF02547423.
- ^ a b Mayer, J.; Urban, S.; Habrylo, S.; Holderna, K.; Natkaniec, I.; Würflinger, A.; Zajac, W. (1991). "Neutron Scattering Studies of C6H12 and C6D12 Cyclohexane under High Pressure". Physica Status Solidi B. 166 (2): 381. Bibcode:1991PSSBR.166..381M. doi:10.1002/pssb.2221660207.
외부 링크
| 위키미디어 커먼즈에는 사이클로헥산과 관련된 미디어가 있다. |
- 국제 화학 안전 카드 0242
- 국가 오염 물질 목록 – 사이클로헥산 팩트 시트
- 화학적 위험에 대한 NIOSH 포켓 가이드
- 사이클로헥산@3Dchem
- 헤르만 삭스와 의자의 순응의 첫 번째 제안.
- NLM 위험 물질 데이터 뱅크 – 사이클로헥산
- 우주에서 발견된 메탄올
- 사이클로헥산의 증기압력, 액체밀도, 동적 액체점도, 표면장력 계산
- 사이클로헥산 생산 공정 플로우시트, 벤젠 수소화 기법