클라이센 재배열
Claisen rearrangement
| 클라이센 재배열 | |
|---|---|
| 이름을 따서 명명됨 | 레이너 루드비히 클라이센 |
| 반응형 | 재배열반응 |
| 식별자 | |
| 유기화학포털 | 클라젠화. |
| RSC 온톨로지 ID | RXNO:0000148 |
클라이센 재배열은 레이너 루드비히 클라이센이 발견한 강력한 탄소-탄소 결합형 화학반응이다. 아릴 비닐에테르를 가열하면 Δ, Δ-불포화 카보닐을 주기 위해 [3,3]-sigmatious 재배열이 시작된다.
1912년에 발견된 클라이센 재배열은 [3,3]-시그문성 재배열의 첫 번째 기록 사례다.[1][2][3] 많은 후기가 쓰여졌다.[4][5][6][7]
메커니즘
클라이센 재배열은 발열성, 결합성(본드 갈라짐과 재결합) 순환성 순환반응이다. 우드워드-호프만 규칙은 초선형의 입체적인 반응 경로를 보여준다. 운동학은 첫 번째 순서이고 전체 변환은 고도로 순서가 정해진 순환 전환 상태를 통해 진행되며 근육 내이다. 교차 실험은 분자간 반응 메커니즘을 통해 재배치가 발생할 가능성을 제거하며 분자 내 과정과 일치한다.[8][9]
클라이센 재배열에서 상당한 용제 효과가 관찰되며, 극성 용제는 반응을 더 크게 가속화시키는 경향이 있다. 수소결합용제는 가장 높은 비율 상수를 제공했다. 예를 들어, 에탄올/물 용제 혼합물은 설폴레인보다 10배 높은 비율 상수를 제공한다.[10][11] 트리메틸알루미늄과 같은 3가성 유기알루미늄 시약이 이러한 반응을 가속화하는 것으로 나타났다.[12][13]
변형
방향족 클라이센 재배열
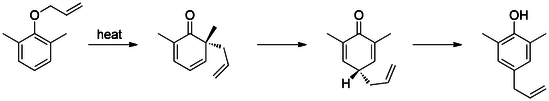
Claisen의 재배열은 아군 페닐 에테르를 중간 1로 [3,3]-시그마티방성 재배열로, 2-알릴페놀로 빠르게 tautomomerize한다.
메타 하위조직은 이 재배치의 섭외성에 영향을 미친다.[14][15] 예를 들어 메타 위치의 전자 인출 그룹(브로마이드 등)은 정형 위치(71% 정형 제품)로 재배치를 지시하고, 전자 기부 그룹(메톡시 등)은 파라 위치(69% 파라 제품)로 직접 재배치를 지시한다. 또한 정형외과 대체물의 존재는 파라 대체 재배열 제품(Tandem Claisen 및 Cope 재배열)을 독점적으로 이끈다.[16]
알데히드나 카복실산이 정형 또는 파라 위치를 차지하면 아릴 사이드 체인이 그룹을 대체해 각각 일산화탄소 또는 이산화탄소로 방출된다.[17][18]
벨루스-클라이센 재배열
벨루스-클라이센 재배열은 동맹 에테르, 아민, 티오에테르가 케테네와 반응하여 γ, Δ-불포화 에스테르, 아미드, 테오테스터를 주는 것이다.[19][20][21] 이러한 변형은 1979년 벨루스에 의해 살충제인 피레스트로이드의 중간합성을 통해 우연히 관찰되었다. 할로겐 대체 케텐(R1, R2)은 높은 전기영양성으로 인해 이 반응에 자주 사용된다. 결과 α-할로스터, 아미드 및 티오스터의 제거를 위한 수많은 환원 방법이 개발되었다.[22][23] 벨루스-클라이센은 합성 화학자들에게 링 확장 전략을 위한 독특한 기회를 제공한다.
에스첸모저-클라이센 재배열
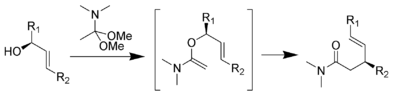
에셴모저-클라이센 재배열은 동맹 알코올을 N,N-디메틸아세타미드 디메틸아세탈이 있는 곳에서 가열하여 Δ-불포화 아미드를 형성함으로써 진행된다. 이것은 1964년 알버트 에셴모저에 의해 개발되었다.[24][25] 모르핀 총합성의 핵심 단계로 에스첸모저-클라이센 재배치가 사용되었다.[26]
메커니즘:[16]
아일랜드-클라이센 재정비
아일랜드-클라이센 재배열은 강한 염기(리튬디이소프로필아미드 등)를 가진 아군 카복시산(Aliglic Carboxylic acid)이 Δ, Δ-불포화 카복실산을 주기 위한 반응이다.[27][28][29] 이 재배치는 클로로트리메틸실레인으로 에놀레이트 리튬을 가두어 형성된 실릴케틴 아세트(Silylketene acetal)를 통해 진행된다. 벨루스-클라이센(위)처럼 아일랜드-클라이센 재배치는 상온 이상에서 이뤄질 수 있다. E-와 Z가 구성한 실릴케텐 아세탈은 각각 안티 및 동기화 제품으로 이어진다.[30] 치랄 붕소 시약과 치랄 보조제의 사용을 포함하기 위해 문헌에서 발견된 항항억제 아일랜드-클라이센 재배열에는 수많은 예가 있다.[31][32]
존슨-클라이센 재배열
존슨-클라이센 재배열은 Δ 불포화 에스테르를 생산하기 위해 정형외과 전문의와 동맹하는 알코올의 반응이다.[33] 프로피온산과 같은 약한 산은 이러한 반응을 촉진하기 위해 사용되어 왔다. 이러한 재배열은 종종 고온(100~200°C)을 필요로 하며, 완성하는 데 10~120시간이 걸릴 수 있다.[34] 그러나 KSF-클레이 또는 프로피온산이 존재하는 마이크로파 보조 난방은 반응률과 수율의 급격한 증가를 보여주었다.[35][36]
메커니즘:[16]
포토 클라이센 재배열
아릴 에테르들의 클라이센 재배열도 광화학반응으로 수행할 수 있다. 열조건([3,3] 재배열 제품)에서 얻은 기존의 정형외과 제품 외에 광화학 변형은 파라 제품([3,5] 제품), 아군 그룹의 대체 이소머(예: [1,3] 및 [1,5] 제품), 에테르 그룹의 단순 손실도 제공하며, 알킬 에테르를 재배열할 수도 있다. 에테르와 동맹을 맺다 광화학 반응은 결합한 순환 순환 반응보다는 결합 형성에 따른 급진적-회전의 단계적 과정을 통해 발생하며, 따라서 가능한 기판과 제품 이소머의 더 다양한 기회를 제공한다.[37] 광-클라이센 재배열 [1,3] 및 [1,5] 결과는 아릴 에스테르 및 관련 아킬 화합물의 광-Fries 재배열과 유사하다.[38]
헤테로클라이센스
아자-클라이센
이미늄은 재배열에서 파이 본드 모이에티 중 하나로 작용할 수 있다.[39]
첸-맵 반응
[3,3]-인산염 재배열 또는 Staudinger-Claisen 반응이라고도 하는 Chen-Mapp 반응은 알코올 대신 인산염을 설치하고 Staudinger 감소를 이용하여 이것을 이미인으로 전환한다. 그 후의 클라이센은 P=O 더블 본드가 P=N 더블 본드보다 더 정력적으로 유리하다는 사실에 의해 추진된다.[40]
오버맨 재배열
오버맨 재배열(Larry Overman의 이름을 따서 명명)은 동맹인 트리클로아세티미드(trichloroacetimidate)를 동맹인 트리클로아세타미드(trichloroacetamides)로 하는 클라이센 재배열이다.[41][42][43]
오버맨 재배치는 1,2-바이실릭 디올의 비시놀 디아미노 화합물 합성에 적용할 수 있다.
즈비테리오닉 클라이센 재배열
난방이 필요한 일반적인 클라이센 재배열과 달리 zwitterionic Claisen 재배열은 상온 이하에서 이루어진다. 아킬암모늄 이온은 경미한 조건에서 Z-에놀레이트의 선택성이 높다.[44][45]
자연에서
효소 chorismate mutase (EC 5.4.99.5)는 penylalanine과 tyrosine의 합성을 향한 생합성 경로의 중간인 chorismate의 Claisen 재배열을 촉진한다.[46]
참고 항목
참조
- ^ Claisen, L. (1912). "Über Umlagerung von Phenol-allyläthern in C-Allyl-phenole". Chemische Berichte. 45 (3): 3157–3166. doi:10.1002/cber.19120450348.
- ^ Claisen, L.; Tietze, E. (1925). "Über den Mechanismus der Umlagerung der Phenol-allyläther". Chemische Berichte. 58 (2): 275. doi:10.1002/cber.19250580207.
- ^ Claisen, L.; Tietze, E. (1926). "Über den Mechanismus der Umlagerung der Phenol-allyläther. (2. Mitteilung)". Chemische Berichte. 59 (9): 2344. doi:10.1002/cber.19260590927.
- ^ 히에레스만, M.; 누브베메이어, U. (2007) 클라이센 재배열. 와일리-VCH ISBN 3-527-30825-3
- ^ Rhoads, S. J.; Raulins, N. R. (1975). The Claisen and Cope Rearrangements. Org. React. 22. pp. 1–252. doi:10.1002/0471264180.or022.01. ISBN 978-0471264187.
- ^ Ziegler, F. E. (1988). "The thermal, aliphatic Claisen rearrangement". Chem. Rev. 88 (8): 1423–1452. doi:10.1021/cr00090a001.
- ^ Wipf, P. (1991). "Claisen Rearrangements". Comprehensive Organic Synthesis. Compr. Org. Synth. 5. pp. 827–873. doi:10.1016/B978-0-08-052349-1.00140-2. ISBN 978-0-08-052349-1.
- ^ Hurd, C. D.; Schmerling, L. (1937). "Observations on the Rearrangement of Allyl Aryl Ethers". J. Am. Chem. Soc. 59: 107. doi:10.1021/ja01280a024.
- ^ Francis A. Carey; Richard J. Sundberg (2007). Advanced Organic Chemistry: Part A: Structure and Mechanisms. Springer. pp. 934–935. ISBN 978-0-387-44897-8.
- ^ Claisen, L. (1912). "Über Umlagerung von Phenol-allyläthern in C-Allyl-phenole". Chemische Berichte. 45 (3): 3157–3166. doi:10.1002/cber.19120450348.
- ^ Claisen, L.; Tietze, E. (1925). "Über den Mechanismus der Umlagerung der Phenol-allyläther". Chemische Berichte. 58 (2): 275. doi:10.1002/cber.19250580207.
- ^ Goering, H. L.; Jacobson, R. R. (1958). "A Kinetic Study of the ortho-Claisen Rearrangement1". J. Am. Chem. Soc. 80 (13): 3277. doi:10.1021/ja01546a024.
- ^ White, W. N.; Wolfarth, E. F. (1970). "The o-Claisen rearrangement. VIII. Solvent effects". J. Org. Chem. 35 (7): 2196. doi:10.1021/jo00832a019.
- ^ White, William; and Slater, Carl, William N.; Slater, Carl D. (1961). "The ortho-Claisen Rearrangement. V. The Products of Rearrangement of Allyl m-X-Phenyl Ethers". The Journal of Organic Chemistry. 26 (10): 3631–3638. doi:10.1021/jo01068a004.CS1 maint: 여러 이름: 작성자 목록(링크)
- ^ Gozzo, Fábio; Fernandes, Sergio; Rodrigues, Denise; Eberlin, Marcos; and Marsaioli, Anita, Fábio Cesar; Fernandes, Sergio Antonio; Rodrigues, Denise Cristina; Eberlin, Marcos Nogueira; Marsaioli, Anita Jocelyne (2003). "Regioselectivity in Aromatic Claisen Rearrangements". The Journal of Organic Chemistry. 68 (14): 5493–5499. doi:10.1021/jo026385g. PMID 12839439.CS1 maint: 여러 이름: 작성자 목록(링크)
- ^ a b c László Kürti; Barbara Czakó (2005). Strategic Applications Of Named Reactions In Organic Synthesis: Background And Detailed Mechanics: 250 Named Reactions. Academic Press. ISBN 978-0-12-429785-2. Retrieved 27 March 2013.
- ^ Adams, Rodger (1944). Organic Reactions, Volume II. New York: John Wiley & Sons, Inc. pp. 11–12.
- ^ Claisen, L.; Eisleb, O. (1913). "Über die Umlagerung von Phenolallyläthern in die isomeren Allylphenole". Justus Liebigs Annalen der Chemie. 401 (1): 90. doi:10.1002/jlac.19134010103.
- ^ Malherbe, R.; Bellus, D. (1978). "A New Type of Claisen Rearrangement Involving 1,3-Dipolar Intermediates. Preliminary communication". Helv. Chim. Acta. 61 (8): 3096–3099. doi:10.1002/hlca.19780610836.
- ^ Malherbe, R.; Rist, G.; Bellus, D. (1983). "Reactions of haloketenes with allyl ethers and thioethers: A new type of Claisen rearrangement". J. Org. Chem. 48 (6): 860–869. doi:10.1021/jo00154a023.
- ^ Gonda, J. (2004). "The Belluš–Claisen Rearrangement". Angew. Chem. Int. Ed. 43 (27): 3516–3524. doi:10.1002/anie.200301718. PMID 15293240.
- ^ Edstrom, E (1991). "An unexpected reversal in the stereochemistry of transannular cyclizations. A stereoselective synthesis of (±)-epilupinine". Tetrahedron Letters. 32 (41): 5709–5712. doi:10.1016/S0040-4039(00)93536-6.
- ^ Bellus (1983). "Reactions of haloketenes with allyl ethers and thioethers: a new type of Claisen rearrangement". The Journal of Organic Chemistry. 48 (6): 860–869. doi:10.1021/jo00154a023.
- ^ Wick, A. E.; Felix, D.; Steen, K.; Eschenmoser, A. (1964). "CLAISEN'sche Umlagerungen bei Allyl- und Benzylalkoholen mit Hilfe von Acetalen des N, N-Dimethylacetamids. Vorläufige Mitteilung". Helv. Chim. Acta. 47 (8): 2425–2429. doi:10.1002/hlca.19640470835.
- ^ Wick, A. E.; Felix, D.; Gschwend-Steen, K.; Eschenmoser, A. (1969). "CLAISEN'sche Umlagerungen bei Allyl- und Benzylalkoholen mit 1-Dimethylamino-1-methoxy-äthen". Helv. Chim. Acta. 52 (4): 1030–1042. doi:10.1002/hlca.19690520418.
- ^ Guillou, C (2008). "Diastereoselective Total Synthesis of (±)-Codeine". Chem. Eur. J. 14 (22): 6606–6608. doi:10.1002/chem.200800744. PMID 18561354.
- ^ Ireland, R. E.; Mueller, R. H. (1972). "Claisen rearrangement of allyl esters". Journal of the American Chemical Society. 94 (16): 5897. doi:10.1021/ja00771a062.
- ^ Ireland, R. E.; Willard, A. K. (1975). "The stereoselective generation of ester enolates". Tetrahedron Lett. 16 (46): 3975–3978. doi:10.1016/S0040-4039(00)91213-9.
- ^ Ireland, R. E.; Mueller, R. H.; Willard, A. K. (1976). "The ester enolate Claisen rearrangement. Stereochemical control through stereoselective enolate formation". Journal of the American Chemical Society. 98 (10): 2868. doi:10.1021/ja00426a033.
- ^ Ireland, R. E. (1991). "Stereochemical control in the ester enolate Claisen rearrangement". 56 (2): 650–657. doi:10.1021/jo00002a030. Cite 저널은 필요로 한다.
journal=(도움말) - ^ Enders, E (1996). "Asymmetric [3,3]-sigmatropic rearrangements in organic synthesis". Tetrahedron: Asymmetry. 7 (7): 1847–1882. doi:10.1016/0957-4166(96)00220-0.
- ^ Corey, E (1991). "Highly enantioselective and diastereoselective Ireland-Claisen rearrangement of achiral allylic esters". Journal of the American Chemical Society. 113 (10): 4026–4028. doi:10.1021/ja00010a074.
- ^ Johnson, William Summer; Werthemann, Lucius; Bartlett, William R.; Brocksom, Timothy J.; Li, Tsung-Tee; Faulkner, D. John; Petersen, Michael R. (1 February 1970). "Simple stereoselective version of the Claisen rearrangement leading to trans-trisubstituted olefinic bonds. Synthesis of squalene". Journal of the American Chemical Society. 92 (3): 741–743. doi:10.1021/ja00706a074. ISSN 0002-7863.
- ^ Fernandes, R. A. (2013). "The Orthoester Johnson–Claisen Rearrangement in the Synthesis of Bioactive Molecules, Natural Products, and Synthetic Intermediates – Recent Advances". European Journal of Organic Chemistry. 2014 (14): 2833–2871. doi:10.1002/ejoc.201301033.
- ^ Huber, R. S. (1992). "Acceleration of the orthoester Claisen rearrangement by clay catalyzed microwave thermolysis: expeditious route to bicyclic lactones". The Journal of Organic Chemistry. 57 (21): 5778–5780. doi:10.1021/jo00047a041.
- ^ Srikrishna, A (1995). "Application of microwave heating technique for rapid synthesis of γ,δ-unsaturated esters". Tetrahedron. 51 (6): 1809–1816. doi:10.1016/0040-4020(94)01058-8.
- ^ Galindo, Francisco (2005). "The photochemical rearrangement of aromatic ethers: A review of the Photo-Claisen reaction". Journal of Photochemistry and Photobiology C: Photochemistry Reviews. 6: 123–138. doi:10.1016/j.jphotochemrev.2005.08.001.
- ^ IUPAC, 화학용어 종합편찬, 제2편. ("금책")(1997년). 온라인 수정 버전: (2006–) "사진-Fries 재배열". doi:10.1351/골드북.P04614
- ^ Kurth, M. J.; Decker, O. H. W. (1985). "Enantioselective preparation of 3-substituted 4-pentenoic acids via the Claisen rearrangement". J. Org. Chem. 50 (26): 5769–5775. doi:10.1021/jo00350a067.
- ^ Chen, B.; Mapp, A. (2005). "Thermal and catalyzed [3,3]-phosphorimidate rearrangements". Journal of the American Chemical Society. 127 (18): 6712–6718. doi:10.1021/ja050759g. PMID 15869293.
- ^ Overman, L. E. (1974). "Thermal and mercuric ion catalyzed [3,3]-sigmatropic rearrangement of allylic trichloroacetimidates. 1,3-Transposition of alcohol and amine functions". Journal of the American Chemical Society. 96 (2): 597–599. doi:10.1021/ja00809a054.
- ^ Overman, L. E. (1976). "A general method for the synthesis of amines by the rearrangement of allylic trichloroacetimidates. 1,3-Transposition of alcohol and amine functions". Journal of the American Chemical Society. 98 (10): 2901–2910. doi:10.1021/ja00426a038.
- ^ "Allylically Transposed Amines from Allylic Alcohols: 3,7-Dimethyl-1,6-Octadien-3-Amine". Organic Syntheses. 58: 4. 1978. doi:10.15227/orgsyn.058.0004.
- ^ Yu, C.-M.; Choi, H.-S.; Lee, J.; Jung, W.-H.; Kim, H.-J. (1996). "Self-regulated molecular rearrangement: Diastereoselective zwitterionic aza-Claisen protocol". J. Chem. Soc., Perkin Trans. 1 (2): 115–116. doi:10.1039/p19960000115.
- ^ Nubbemeyer, U. (1995). "1,2-Asymmetric Induction in the Zwitterionic Claisen Rearrangement of Allylamines". J. Org. Chem. 60 (12): 3773–3780. doi:10.1021/jo00117a032.
- ^ Ganem, B. (1996). "The Mechanism of the Claisen Rearrangement: Déjà Vu All over Again". Angew. Chem. Int. Ed. Engl. 35 (9): 936–945. doi:10.1002/anie.199609361.