베릴륨
Beryllium | |||||||||||||||||||||||||||||||
| 베릴륨 | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 발음 | /b əˈr ɪli əm/ | ||||||||||||||||||||||||||||||
| 외모 | 화이트 gray 메탈릭 | ||||||||||||||||||||||||||||||
| 표준원자량 Ar°(Be) | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| 주기율표의 베릴륨 | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| 원자 번호 (Z) | 4 | ||||||||||||||||||||||||||||||
| 그룹. | group 2 (토금속 alkaline) | ||||||||||||||||||||||||||||||
| 기간 | 2교시 | ||||||||||||||||||||||||||||||
| 블록 | s-block | ||||||||||||||||||||||||||||||
| 전자배치 | [그] 2s2 | ||||||||||||||||||||||||||||||
| 쉘당 전자 수 | 2, 2 | ||||||||||||||||||||||||||||||
| 물리적 특성 | |||||||||||||||||||||||||||||||
| 단계 STP에서 | 단단한 | ||||||||||||||||||||||||||||||
| 융점 | 1560K(1287°C, 2349°F) | ||||||||||||||||||||||||||||||
| 비등점 | 2742K (2469°C, 4476°F) | ||||||||||||||||||||||||||||||
| 밀도 (근처) | 1.85g/cm3 | ||||||||||||||||||||||||||||||
| 액체 상태일 때(에) | 1.690g/cm3 | ||||||||||||||||||||||||||||||
| 임계점 | 5205K, MPa (외삽) | ||||||||||||||||||||||||||||||
| 핵융합열 | 12.2 kJ/mol | ||||||||||||||||||||||||||||||
| 기화열 | 292 kJ/mol | ||||||||||||||||||||||||||||||
| 몰열용량 | 16.443 J/(mol·K) | ||||||||||||||||||||||||||||||
증기압
| |||||||||||||||||||||||||||||||
| 원자 특성 | |||||||||||||||||||||||||||||||
| 산화상태 | 0,[2] +1,[3] +2 (양광성 산화물) | ||||||||||||||||||||||||||||||
| 전기 음성도 | 폴링 눈금: 1.57 | ||||||||||||||||||||||||||||||
| 이온화 에너지 |
| ||||||||||||||||||||||||||||||
| 원자 반지름 | 경험 : 오후 112시 | ||||||||||||||||||||||||||||||
| 공유반경 | 96±3pm | ||||||||||||||||||||||||||||||
| 반데르발스 반지름 | 오후 153시 | ||||||||||||||||||||||||||||||
| 기타속성 | |||||||||||||||||||||||||||||||
| 자연발생 | 태고의 | ||||||||||||||||||||||||||||||
| 결정구조 | 육각밀폐(hcp) | ||||||||||||||||||||||||||||||
| 음속 얇은 막대 | 12,890 m/s (에서)[4] | ||||||||||||||||||||||||||||||
| 열팽창 | 11.3 µm/(m ⋅K)(25°C일 때) | ||||||||||||||||||||||||||||||
| 열전도율 | 200W/(m⋅K) | ||||||||||||||||||||||||||||||
| 전기저항 | 36 N ω ⋅m (20°C에서) | ||||||||||||||||||||||||||||||
| 자기순서 | 반자성의 | ||||||||||||||||||||||||||||||
| 어금니 자기 민감도 | -9.0x10cm−63/mol[5] | ||||||||||||||||||||||||||||||
| 영률 | 287 GPa | ||||||||||||||||||||||||||||||
| 전단 탄성 계수 | 132 GPa | ||||||||||||||||||||||||||||||
| 벌크 모듈러스 | 130 GPa | ||||||||||||||||||||||||||||||
| 포아송 비율 | 0.032 | ||||||||||||||||||||||||||||||
| 모스경도 | 5.5 | ||||||||||||||||||||||||||||||
| 비커스 경도 | 1670 MPa | ||||||||||||||||||||||||||||||
| 브리넬 경도 | 590–1320 MPa | ||||||||||||||||||||||||||||||
| CAS 번호 | 7440-41-7 | ||||||||||||||||||||||||||||||
| 역사 | |||||||||||||||||||||||||||||||
| 디스커버리 | 루이 니콜라 보켈린(1798) | ||||||||||||||||||||||||||||||
| 1차 격리 | 프리드리히 뵐러 & 앙투안 부시 (1828) | ||||||||||||||||||||||||||||||
| 베릴륨 동위 원소 | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
베릴륨은 화학 원소로 기호는 Be, 원자 번호는 4입니다.강철 회색이며 튼튼하고 가볍고 부서지기 쉬운 알칼리 토금속입니다.다른 원소들과 결합해서 광물을 형성할 때만 자연적으로 발생하는 2가 원소입니다.베릴륨이 많이 함유된 원석으로는 베릴 (아쿠아마린, 에메랄드, 레드 베릴)과 크리소베릴이 있습니다.그것은 우주에서 상대적으로 드문 원소이며, 보통 우주 광선과 충돌한 더 큰 원자핵의 폭발의 결과로 발생합니다.별의 중심핵 안에서 베릴륨은 더 무거운 원소로 융합되면서 고갈됩니다.베릴륨은 지각의 질량으로 약 0.0004 퍼센트를 구성하고 있습니다.세계의 연간 220톤의 베릴륨 생산량은 보통 광물 베릴로부터 추출에 의해 제조되는데, 베릴륨은 산소와 강하게 결합하기 때문에 어려운 과정입니다.
구조적 응용 분야에서, 높은 굴곡 강성, 열 안정성, 열 전도율 및 낮은 밀도(물의 1.85배)의 조합은 베릴륨 금속을 항공기 부품, 미사일, 우주선 및 위성에 적합한 항공우주 재료로 만듭니다.[7]베릴륨은 밀도와 원자 질량이 낮기 때문에 X선과 다른 형태의 전리방사선에 상대적으로 투명하기 때문에 X선 장비와 입자 검출기의 부품에 가장 일반적인 창 재료입니다.[7]알루미늄, 구리(특히 합금 베릴륨 구리), 철 또는 니켈에 합금 원소로 첨가되면 베릴륨은 많은 물리적 특성을 향상시킵니다.[7]예를 들어, 베릴륨 구리 합금으로 만들어진 도구와 부품들은 강하고 단단하며 강철 표면에 부딪혔을 때 불꽃이 생기지 않습니다.공기 중에서 베릴륨의 표면은 실온에서 쉽게 산화되어 추가적인 산화와 부식으로부터 보호하는 1-10 nm 두께의 패시베이션 층을 형성합니다.금속은 500°C(932°F) 이상으로 가열하면 대량(패시베이션 층 너머)으로 산화되고 약 2,500°C(4,530°F)로 가열하면 눈부시게 연소됩니다.
베릴륨의 상업적 사용은 베릴륨증이라고 불리는 일부 사람들에게 만성적인 생명을 위협하는 알레르기 질환을 일으킬 수 있는 흡입된 베릴륨 함유 먼지의 독성 때문에 항상 적절한 먼지 제어 장비와 산업용 제어 장치를 사용해야 합니다.[8]베릴리증은 폐렴과 다른 관련 호흡기 질환을 일으킵니다.
특성.
물리적 특성
베릴륨은 강철로 된 회색과 단단한 금속으로 상온에서 부서지기 쉽고 촘촘한 육각형 결정 구조를 가지고 있습니다.[7]1287°C의 녹는점과 영률 287 GPa(영률 287 GPa)라는 뛰어난 강성을 가지고 있습니다.베릴륨의 탄성 계수는 강철의 탄성 계수보다 약 35% 더 큽니다.이 모듈러스와 비교적 낮은 밀도의 조합은 베릴륨의 음전도 속도가 비정상적으로 빨라져 주변 조건에서 약 12.9km/s에 이릅니다.다른 중요한 특성으로는 높은 비열(1925 J·kg−1·K−1)과 열전도율(216 W·m−1·K−1)이 있으며, 이는 베릴륨을 단위 중량당 방열 특성이 가장 우수한 금속으로 만듭니다.비교적 낮은 선형 열팽창 계수(11.4×10−6 K−1)와 결합하여 이러한 특성은 열 부하 조건에서 고유한 안정성을 갖습니다.[9]
핵속성
우주 생성 방사성 동위원소에 의한 약간의 오염을 제외하고 자연적으로 발생하는 베릴륨은 동위원소적으로 순수한 베릴륨-9이며, 핵 스핀은 다음과 같습니다.3/2. 베릴륨은 고에너지 중성자를 위한 큰 산란 단면을 가지고 있으며, 대략 10 keV 이상의 에너지를 위한 약 6개의 반이 있습니다.따라서 중성자 반사기 및 중성자 감속기로 작동하여 중성자를 효과적으로 0.03 eV 미만의 열에너지 범위까지 감속시킵니다. 여기서 총 단면은 최소 크기 이상이며 정확한 값은 물질 내 결정자의 순도와 크기에 따라 크게 달라집니다.
단일 원시 베릴륨 동위 원소 Be는 또한 약 1.9 MeV 이상의 중성자 에너지와 (n,2n) 중성자 반응을 일으켜 거의 즉시 두 개의 알파 입자로 분해되는 Be를 생성합니다.따라서 고에너지 중성자의 경우 베릴륨은 중성자 승수이며 흡수하는 중성자보다 더 많은 중성자를 방출합니다.이 핵반응은 다음과 같습니다.[10]
- + n → 2 He + 2 n 이 됩니다.
중성자들은 핵반응을 일으키는[9] 에너지가 넘치는 알파 입자들에 의해 베릴륨 핵이 부딪힐 때 자유로워집니다.
- Be + He → C + n
여기서 그는
알파 입자이고 C는
탄소-12 핵입니다.[10]베릴륨은 감마선의 충격을 받아 중성자를 방출하기도 합니다.따라서 적합한 방사성 동위원소에서 알파 또는 감마에 의해 폭격되는 천연 베릴륨은 자유 중성자의 실험실 생산을 위한 대부분의 방사성 동위원소 동력 핵반응 중성자 소스의 핵심 구성요소입니다.
Be
핵이 3단계 핵반응에서 저에너지 중성자를 흡수할 때 소량의 삼중수소가 방출됩니다.
- +n → He + He, He → Li + β, Li + n → He + H
6
2그는
0.8초의 반감기를 가지고 있고, β는− 전자이며, Li는
높은 중성자 흡수 단면을 가지고 있습니다.삼중수소는 원자로 폐기물 흐름에서 우려되는 방사성 동위원소입니다.[11]
광학 특성
베릴륨은 금속으로서 대부분의 X선 및 감마선 파장에 대해 투명하거나 반투명하므로 X선 튜브 및 기타 장치의 출력 윈도우에 유용합니다.[12]
동위원소와 핵합성
베릴륨의 안정 동위원소와 불안정 동위원소는 모두 별에서 생성되지만, 방사성 동위원소는 오래가지 못합니다.우주의 안정된 베릴륨의 대부분은 원래 우주 광선이 성간 가스와 먼지에서 발견되는 더 무거운 원소에서 핵분열을 유도했을 때 성간 매질에서 생성되었다고 믿어집니다.[13]원시 베릴륨은 안정 동위 원소인 Be 하나만 포함하고 있기 때문에 베릴륨은 단핵 원소이자 단핵 원소입니다.

방사성 우주생성 Be는 산소의 우주선 폭발에 의해 지구 대기권에서 생성됩니다.[14]10Be는 비교적 긴 반감기(136만 년)가 붕소-10으로 붕괴되기 전까지 긴 거주 시간을 허용하는 토양 표면에 축적됩니다.따라서 Be와 그 딸의 생성물은 자연 토양 침식, 토양 형성 및 라테라이트 토양의 발달을 조사하고 태양 활동의 변화와 빙핵의 나이를 측정하기 위한 대용물로 사용됩니다.[15]Be의 생성은 태양 활동에 반비례하는데, 태양 활동이 왕성한 시기에 태양풍이 증가하면 지구에 도달하는 은하 우주선의 흐름이 줄어들기 때문입니다.[14]핵폭발은 공기중의 이산화탄소에서 빠른 중성자와 C의 반응에 의해서도 Be를 형성합니다.과거 핵무기 실험장에서의 활동을 보여주는 지표 중 하나입니다.[16]동위 원소 Be (반생 53일) 또한 우주 생성성이며 Be와 같이 흑점과 연관된 대기의 풍부함을 보여줍니다.
8베릴륨보다 무거운 원소가 빅뱅의 핵융합으로 생성되지 못했기 때문에 Be는 약 8×10초의−17 매우 짧은 반감기를 가지고 있어 우주론적으로 중요한 역할을 합니다.[17]이것은 빅뱅의 핵합성 단계에서 He 핵의 융합으로 탄소를 생성할 수 있는 충분한 시간이 부족하고 사용 가능한 베릴륨-8의 농도가 매우 낮기 때문입니다.영국 천문학자 프레드 호일 경은 Be와 C의 에너지 준위가 더 많은 핵합성 시간이 있는 헬륨 연료 별에서 소위 삼중 알파 과정에 의한 탄소 생성을 가능하게 한다는 것을 처음으로 보여주었습니다.이 과정은 별에서 탄소가 생성되지만 빅뱅에서는 생성되지 않습니다.별에서 생성된 탄소(탄소 기반 생명체의 기초)는 AGB 별과 초신성(빅뱅 핵합성 참조)에 의해 방출되는 가스와 먼지의 구성 요소이며, 탄소보다 더 큰 원자 번호를 가진 다른 모든 원소를 생성합니다.[18]
베릴륨의 2s 전자는 화학적 결합에 기여할 수 있습니다.따라서, 전자 포획에 의해 Be가 붕괴될 때, 그것은 결합에 참여하고 있을지도 모르는 그것의 원자 궤도로부터 전자를 빼앗아 그렇게 합니다.이로 인해 붕괴 속도는 화학적 환경에 따라 측정 가능한 정도에 따라 달라지는데, 이는 핵붕괴에서는 드문 현상입니다.[19]
베릴륨의 동위 원소 중 가장 수명이 짧은 것은 Be로 반감기가 6.5×10초인−22 중성자 방출을 통해 붕괴됩니다.[20]이국적인 동위 원소 Be와 Be는 핵 후광을 나타내는 것으로 알려져 있습니다.[21]이 현상은 Be와 Be의 핵이 각각 핵의 고전적 페르미 '물방울' 모델 밖에서 실질적으로 공전하는 1 중성자와 4 중성자로 이해될 수 있습니다.
발생


태양의 농도는 베릴륨 10억 pb 당 0.1 pb입니다.[22]베릴륨은 지구의 지각에서 2에서 6 ppm의 농도를 가지고 있습니다.[23]토양에 6ppm으로 가장 많이 농축되어 있습니다.[24]지구의 대기에서 미량의 Be가 발견됩니다.[24]바닷물의 베릴륨 농도는 1조 당 0.2~0.6ppm입니다.[24][25]그러나 하천수에서는 베릴륨이 0.1ppb의 농도로 더 풍부합니다.[26]
베릴륨은 100개가 넘는 광물에서 발견되지만,[27] 대부분은 희귀한 것이 아닙니다.광물을 함유하고 있는 더 일반적인 베릴륨은 베르트란타이트(BeSiO427(OH)),2 베릴(AlBeSiO23618), 크리소베릴(AlBeO24) 및 페나카이트(BeSiO24)를 포함합니다.베릴의 귀중한 형태는 아쿠아마린, 레드 베릴 그리고 에메랄드입니다.[9][28][29]보석 품질의 베릴 형태의 녹색은 다양한 양의 크롬(에메랄드의 경우 약 2%)에서 나옵니다.[30]
베릴륨의 두 주요 광석인 베릴과 베르트란타이트는 아르헨티나, 브라질, 인도, 마다가스카르, 러시아 그리고 미국에서 발견됩니다.[30]베릴륨 광석의 세계 총 매장량은 400,000톤 이상입니다.[30]
생산.
베릴륨 화합물로부터 베릴륨을 추출하는 것은 높은 온도에서 산소에 대한 높은 친화성과 산화막을 제거할 때 물을 감소시킬 수 있는 능력 때문에 어려운 과정입니다.현재 베릴륨의 산업 규모 추출에 관련된 국가는 미국, 중국, 카자흐스탄 3개국뿐입니다.[31]카자흐스탄은 1991년 전후 소련이 붕괴되기 전까지 비축된 농축액에서 베릴륨을 생산합니다.이 자원은 2010년대 중반에 이르러 거의 고갈되었습니다.[32]
러시아의 베릴륨 생산은 1997년에 중단되었고, 2020년대에 재개될 계획입니다.[33][34]
베릴륨은 가장 일반적으로 광물 베릴로부터 추출되는데, 베릴륨은 추출제를 사용하여 소결되거나 용해성 혼합물로 용융됩니다.소결 공정은 베릴과 플루오로규산나트륨 및 탄산음료를 770°C(1,420°F)에서 혼합하여 플루오로규산나트륨, 산화알루미늄 및 이산화규소를 형성합니다.[7]수산화 베릴륨은 플루오로베릴산나트륨과 수산화나트륨의 용액으로부터 물에 침전됩니다.용융법을 이용한 베릴륨의 추출은 베릴을 분말로 분쇄하여 1,650 °C(3,000 °F)로 가열하는 것을 포함합니다.[7]용융물은 물로 빠르게 냉각된 후 250~300°C(482~572°F)의 농축 황산에서 재가열되며, 대부분 황산 베릴륨과 황산 알루미늄을 생성합니다.[7]그런 다음 암모니아수를 사용하여 수산화 베릴륨을 남기면서 알루미늄과 황을 제거합니다.
이후, 소결법 또는 용융법 중 하나를 이용하여 생성된 수산화 베릴륨은 플루오르화 베릴륨 또는 염화 베릴륨으로 변환됩니다.플루오린화를 형성하기 위해 수성 플루오린화 암모늄을 수산화 베릴륨에 첨가하여 테트라플루오베릴레이트의 침전물을 생성하고, 이를 1000 °C(1,830 °F)로 가열하여 플루오린화 베릴륨을 형성합니다.[7]마그네슘으로 불소를 900 °C (1,650 °F)로 가열하면 미세하게 나뉘어진 베릴륨이 형성되고, 1,300 °C (2,370 °F)로 추가 가열하면 콤팩트 금속이 생성됩니다.[7]수산화 베릴륨을 가열하면 산화물이 형성되며, 이 산화물은 탄소와 염소와 결합하면 염화 베릴륨이 됩니다.용융된 염화 베릴륨을 전기분해하여 금속을 얻습니다.[7]
화학적 성질
베릴륨 원자는 전자 구성 [He2] 2s를 가지고 있습니다.베릴륨의 주요 산화 상태는 +2입니다. 베릴륨 원자는 원자가 전자를 모두 잃었습니다.베릴륨의 낮은 산화 상태 복합체는 매우 희귀합니다.예를 들어, 베릴륨을 0- 및 +1-산화 상태로 포함하도록 제안된 비스(카르벤) 화합물이 보고되었지만, 이러한 주장은 논란의 여지가 있습니다.[35][36]베릴륨이 +1 산화 상태인 것을 공식적으로 특징으로 하는 Be-Be 결합을 갖는 안정한 복합체가 기재되어 있습니다.[37]베릴륨의 화학적 거동은 주로 작은 원자와 이온 반경의 결과입니다.따라서 이온화 전위가 매우 높고, 다른 원자와 결합하면서 강한 분극을 가지고 있으며, 이 때문에 모든 화합물이 공유결합을 하고 있습니다.화학적 성질은 대각선 관계의 한 예인 알루미늄과 유사합니다.
실온에서 베릴륨의 표면은 1-10 nm 두께의 산화물 패시베이션 층을 형성하며, 약 25 nm까지의 산화물의 점진적인 비후를 제외하고는 공기와의 추가적인 반응을 방지합니다.500°C 이상으로 가열하면 벌크 금속으로 산화가 결정립계를 따라 진행됩니다.[38]금속이 2500°C 부근의 산화물 녹는점 이상으로 가열되어 공기 중에서 점화되면 베릴륨은 훌륭하게 연소하여 산화 베릴륨과 질화물 베릴륨의 혼합물을 형성합니다.베릴륨은 HCl이나 희석된 HSO와24 같은 비산화성 산에는 쉽게 용해되지만, 산화물을 형성하기 때문에 질산이나 물에는 용해되지 않습니다.이러한 동작은 알루미늄 금속의 동작과 유사합니다.베릴륨은 알칼리 용액에도 녹습니다.[7][39]
베릴륨의 이성분 화합물(II)는 고체 상태에서 고분자입니다.BeF는2 코너-공유 BeF4 테트라헤드라를 갖는 실리카-유사 구조를 갖습니다.BeCl과2 BeBr은2 에지 공유 테트라헤다를 갖는 사슬 구조를 갖습니다.베릴륨 산화물인 BeO는 백색의 내화성 고체로, 워자이트 결정 구조와 일부 금속만큼 높은 열전도율을 가지고 있습니다.BeO는 양성입니다.황화 베릴륨, 셀레나이드, 텔루라이드 등이 알려져 있으며, 모두 아연 혼합 구조를 가지고 있습니다.[40]질화 베릴륨, BeN은32 가수분해가 용이한 고융점 화합물입니다.베릴륨 아지드, BeN이6 알려져 있고, 인산 베릴륨, BeP는32 BeN과32 유사한 구조를 가지고 있습니다.BeB5, BeB, BeB4, BeB2, BeB2, BeB6 및 BeB와12 같은 다수의 베릴륨 붕화물이 알려져 있습니다.베릴륨 카바이드인 BeC는2 물과 반응하여 메탄을 생성하는 내화성 벽돌-적색 화합물입니다.[40]베릴륨 실리사이드는 [39]확인되지 않았습니다
할로겐화물 BeX(X = F, Cl, Br, I)는 기체상에서 선형 모노머 분자 구조를 갖습니다.할로겐화물의 복합체는 하나 이상의 리간드가 총 두 쌍의 전자를 기부하는 형태로 형성됩니다.그러한 화합물은 옥텟 규칙을 따릅니다.아쿠아 이온 [Be(HO2)]42+과 같은 다른 4좌표 복합체들도 옥텟 규칙을 따릅니다.
수용액
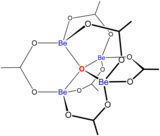
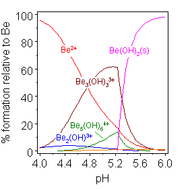
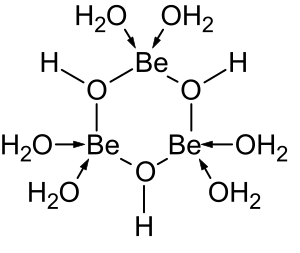
황산 베릴륨 및 질산 베릴륨과 같은 베릴륨 염의 용액은 [Be(HO2)]42+ 이온의 가수분해로 인해 산성입니다.첫 번째 가수분해 생성물인 [Be(HO2)(3OH)]+의 농도는 베릴륨 농도의 1% 미만입니다.가장 안정적인 가수분해 생성물은 삼량체 이온 [Be3(OH)(3HO2)]63+입니다.수산화 베릴륨, Be(OH)2는 pH 5 이상의 물에 불용성입니다.따라서, 베릴륨 화합물은 일반적으로 생물학적 pH에서 불용성입니다.이 때문에 사람이 베릴륨 금속 먼지를 흡입하면 베릴륨증이라는 치명적인 질환이 생깁니다.Be(OH)2는 강알칼리성 용액에 녹습니다.[41]
베릴륨()II)는 물 분자인 [Be(HO2)]42+가 베릴륨 이온에 매우 강하게 결합되어 있기 때문에 모노덴테이트 리간드와 거의 복합체를 형성하지 않습니다.주목할 만한 예외는 플루오르화 이온을 가진 일련의 수용성 복합체입니다.[42]
베릴륨()II)는 산소-기증자 원자를 포함하는 이중 리간드와 많은 복합체를 형성합니다.[41][BeO3(HPO24)]62-라는 종은 중심에 3좌표 산화물이 있는 것으로 유명합니다.기본 베릴륨 아세테이트인 BeO4(OAc)는 6베릴륨 원자의 사면체로 둘러싸인 산화 이온을 가지고 있습니다.
말론산 이온과 같은 유기 리간드를 사용하면 복합체를 형성할 때 산이 탈양성자화됩니다.기증자 원자는 두 개의 산소입니다.
글리콜산과 같은 지방족 히드록시카르복실산은 하이드록실기가 그대로 남아있는 용액에서 다소 약한 모노덴테이트 복합체를 형성합니다.고체 상태에서 하이드록실기는 탈양성자화할 수 있습니다: 헥사머, [ ( 2( ) O ] ] (( O ) O ) 6는 오래 전에 분리되었습니다.[43][44]방향족 히드록시 리간드(즉, 페놀)는 비교적 강한 복합체를 형성합니다.예를 들어, 철이 있는 복합체에 대해 로그 K1 및 로그 K2 값이 12.2 및 9.3으로 보고되었습니다.[43][45]
베릴륨은 일반적으로 아민 리간드에 대한 친화력이 다소 떨어집니다.[43][46]EDTA와 같은 리간드는 디카르복실산으로 작용합니다.[citation needed]아미노산을 갖는 복합체들에 대한 초기 보고들이 많지만, 불행히도 그들은 발표 당시 동반된 가수분해 반응에 대해 이해하지 못했기 때문에 신뢰할 수 없습니다.ca. 6~7의 로그 β 값이 보고되었습니다.가수분해 반응과의 경쟁 때문에 형성 정도가 작습니다.[43][46]
유기화학
유기질 화학은 염화베릴륨과 같은 베릴륨의 도입에 필요한 베릴륨, 베릴륨 유도체 및 시약의 비용과 독성으로 인해 학술 연구에 제한되어 있습니다.유기금속 베릴륨 화합물은 매우 반응성이[47] 높은 것으로 알려져 있습니다. 알려진 유기금속 베릴륨 화합물의 예는 디노펜틸 베릴륨,[48] 베릴로센(CpBe2),[49][50][51][52] 디알릴륨(디에틸 베릴륨과 트리알릴 붕소의 교환 반응에 의해),[53] 비스(1,3-트리메틸실릴릴) 베릴륨,[54] Be(메스) 2[47]및 (베릴륨(I) 복합체) 디베릴로센입니다.[37]리간드는 또한 아릴과[55] 알키닐이 될 수 있습니다.[56]
역사
베릴륨을 함유하고 있는 광물 베릴은 적어도 이집트 프톨레마이오스 왕조 때부터 사용되어 왔습니다.[57]1세기에 로마의 박물학자 대 플리니우스는 그의 백과사전 자연사에서 베릴과 에메랄드가 비슷하다고 언급했습니다.[58]서기 3세기 또는 4세기에 쓰여진 파피루스 그레쿠스 홀미엔시스에는 인공 에메랄드와 베릴을 준비하는 방법에 대한 메모가 들어 있습니다.[58]

마르틴 하인리히 클라프로트, 토르베른 올로프 베르그만, 프란츠 카를 아카드, 요한 야콥 빈드하임에 의한 에메랄드와 베릴의 초기 분석은 항상 비슷한 원소를 산출했고, 두 물질이 모두 알루미늄 규산염이라는 잘못된 결론에 이르게 했습니다.[59]광물학자 르네 쥐스트 하우이는 두 결정이 기하학적으로 동일하다는 것을 발견하고 화학자 루이 니콜라스 보켈린에게 화학 분석을 요청했습니다.[57]
1798년 프랑스 연구소 앞에서 읽은 논문에서 보켈린은 에메랄드와 베릴로부터 수산화 알루미늄을 추가적인 알칼리에 용해시켜 새로운 "지구"를 발견했다고 보고했습니다.[60]아날레스 드 치미에 드 피시크지의 편집자들은 이 새로운 지구를 몇몇 화합물들의 달콤한 맛에 "글루신"이라고 이름 지었습니다.[61]클라프로트는 이트리아가 또한 달콤한 소금을 형성하기 때문에 "베릴리나"라는 이름을 선호했습니다.[62][63]베릴륨이라는 이름은 1828년 뵐러(Wöhler)에 의해 처음 사용되었습니다.[64]

프리드리히 뵐러와[65] 앙투안 부시는 1828년 금속[66] 칼륨과 염화 베릴륨의 화학 반응으로 베릴륨을 독립적으로 분리해냈습니다.
- BeCl + 2K → 2KCl + Be
알코올 램프를 사용하여, 뵐러는 철사로 닫힌 백금 도가니에서 염화 베릴륨과 칼륨의 교대 층을 가열했습니다.위의 반응은 즉시 일어났고 도가니가 하얗게 뜨거워지는 원인이 되었습니다.냉각 및 세척 과정에서 생성된 회흑색 가루가 어두운 금속 광택을 가진 미세한 입자로 만들어진 것을 확인했습니다.[67]반응성이 높은 칼륨은 21년 전에 발견된 화합물의 전기 분해에 의해 생성되었습니다.칼륨을 사용한 화학적 방법은 어떤 금속 잉곳도 주조하거나 망치로 만들 수 없는 베릴륨의 작은 알갱이만 산출했습니다.
1898년 폴 르보(Paul Lebeau)가 플루오르화 베릴륨과 플루오르화 나트륨의 용융 혼합물을 직접 전기분해함으로써 베릴륨의 첫 순수(99.5~99.8%) 샘플이 만들어졌습니다.[67]하지만, 산업 생산은 1차 세계대전 이후에야 시작되었습니다.원래의 산업적 관여에는 오하이오주 클리블랜드에 있는 Union Carbide and Carbon Corporation과 베를린에 있는 Siemens & Halske AG와 관련된 자회사와 과학자들이 포함되었습니다.미국에서는 Hugh S가 그 과정을 지배했습니다.쿠퍼, 케멧 연구소 회사의 이사입니다.독일에서는 1921년 알프레드 스톡(Alfred Stock)과 한스 골드슈미트(Hans Goldschmidt)에 의해 베릴륨을 생산하는 상업적으로 성공적인 첫 공정이 개발되었습니다.[68]
1932년 제임스 채드윅이 중성자의 존재를 밝혀낸 실험에서 라듐의 붕괴로 인한 알파선이 베릴륨의 샘플에 폭격을 가했습니다.[30]이와 같은 방법은 α 입자 백만 개당 30개의 중성자를 생성하는 방사성 동위원소 기반 실험실 중성자 소스의 한 종류에 사용됩니다.[23]
베릴륨 생산량은 제2차 세계 대전 동안 급속한 증가를 보였는데, 이는 경질 베릴륨 구리 합금과 형광등용 형광체에 대한 수요 증가 때문입니다.대부분의 초기 형광등은 녹색 빛을 내기 위해 베릴륨의 함량이 다양한 오르토실리케이트 아연을 사용했습니다.텅스텐산 마그네슘을 약간 첨가하면 스펙트럼의 청색 부분이 개선되어 허용 가능한 백색광을 생성할 수 있었습니다.베릴륨이 독성이 있는 것으로 밝혀진 후, 할로포스페이트계 인광이 베릴륨계 인광을 대체했습니다.[69]
19세기 동안 플루오르화 베릴륨과 플루오르화 나트륨의 혼합물의 전기분해는 베릴륨을 분리하는 데 사용되었습니다.이 공정은 금속의 높은 융점으로 인해 알칼리 금속에 사용되는 해당 공정보다 에너지 소모가 큽니다.20세기 초, 요오드화 베릴륨의 열분해에 의한 베릴륨의 생성은 지르코늄의 생산을 위한 유사한 공정의 성공에 따라 조사되었지만, 이 공정은 대량 생산에 경제적이지 않음이 증명되었습니다.[70]
순수한 베릴륨 금속은 1957년까지 쉽게 구할 수 없었지만, 구리를 굳히고 강화하는 합금 금속으로 사용되었습니다.[30]베릴륨은 염화 베릴륨과 같은 베릴륨 화합물을 금속 칼륨 또는 나트륨으로 환원시킴으로써 생성될 수 있습니다.현재 대부분의 베릴륨은 불화 베릴륨을 마그네슘으로 환원하여 생산되고 있습니다.[71]2001년 진공 주조 베릴륨 잉곳의 미국 시장 가격은 파운드당 약 338달러(kg당 745달러)였습니다.[72]
1998년과 2008년 사이에 세계의 베릴륨 생산량은 343톤에서 약 200톤으로 감소했습니다.그 후 2018년까지 230톤으로 증가했고, 그 중 170톤은 미국에서 왔습니다.[73][74]
어원
반귀한 광물인 베릴의 이름을 따서 지었습니다. 처음에 이 광물이 분리된 것입니다.[75][76][77]
적용들
방사선창


원자 번호가 낮고 X선에 대한 흡수가 매우 낮기 때문에 베릴륨의 가장 오래되고 여전히 가장 중요한 응용 중 하나는 X선 튜브를 위한 방사선 창에 있습니다.[30]X선 영상의 아티팩트를 방지하기 위해 베릴륨의 순수성과 청결성을 극도로 요구합니다.얇은 베릴륨 포일은 X선 검출기의 방사선 창으로 사용되며, 극도로 낮은 흡수율은 싱크로트론 방사선의 전형적인 고강도 저에너지 X선에 의한 가열 효과를 최소화합니다.싱크로트론에 대한 방사선 실험을 위한 진공밀폐 윈도우 및 빔 튜브는 베릴륨에서만 제조됩니다.다양한 X선 방출 연구(예: 에너지 분산형 X선 분광법)를 위한 과학적 설정에서 샘플 홀더는 대개 베릴륨으로 만들어지는데, 이는 방출된 X선이 대부분의 연구 재료에서 나오는 X선보다 훨씬 낮은 에너지( ≈100 eV)를 갖기 때문입니다.
낮은 원자 번호는 또한 베릴륨을 에너지 입자에 상대적으로 투명하게 만듭니다.따라서 Large Hadron Collider(ALICE, ATLAS, CMS, LHCb), [78]Tevatron 및 SLAC에서의 4가지 주요 검출기 실험과 같은 입자 물리학 설정에서 충돌 영역 주위에 빔 파이프를 구축하는 데 사용됩니다.베릴륨의 밀도가 낮아서 충돌 생성물이 큰 상호작용 없이 주변 탐지기에 도달할 수 있고, 강성으로 인해 파이프 내에서 강력한 진공이 생성되어 기체와의 상호작용을 최소화할 수 있으며, 열 안정성으로 인해 절대영도보다 불과 몇 도 높은 온도에서도 정확하게 작동할 수 있습니다.그리고 그것의 반자성은 입자 빔을 조종하고 초점을 맞추는 데 사용되는 복잡한 다극 자석 시스템을 방해하는 것을 막습니다.[79]
기계적 응용
베릴륨 금속은 강성, 가벼운 무게 및 넓은 온도 범위에서의 치수 안정성 때문에 제임스 웹 우주 망원경을 포함한 고속 항공기, 유도 미사일, 우주선 및 위성의 국방 및 항공 우주 산업에서 경량 구조 부품으로 사용됩니다.몇몇 액체 연료 로켓은 순수한 베릴륨으로 만들어진 로켓 노즐을 사용해왔습니다.[80][81]베릴륨 분말은 그 자체로 로켓 연료로 연구되었지만, 이 사용은 결코 실현되지 않았습니다.[30]소수의 최고급 자전거 프레임이 베릴륨으로 만들어졌습니다.[82]1998년부터 2000년까지 맥라렌 포뮬러 원 팀은 베릴륨-알루미늄-합금 피스톤이 장착된 메르세데스-벤츠 엔진을 사용했습니다.[83]스쿠데리아 페라리의 항의로 베릴륨 엔진 부품의 사용이 금지되었습니다.[84]
구리에 약 2.0%의 베릴륨을 섞으면 베릴륨 구리라고 불리는 합금이 형성되는데, 이 합금은 구리 단독보다 6배나 더 강합니다.[85]베릴륨 합금은 탄성, 높은 전기 전도도 및 열 전도도, 높은 강도 및 경도, 비자성 특성뿐만 아니라 양호한 부식 및 피로 저항성을 결합하기 때문에 많은 응용 분야에 사용됩니다.[30][7]이러한 용도에는 인화성 가스(베릴륨 니켈) 근처, 스프링 및 수술 기구 및 고온 장치에 사용되는 막(베릴륨 니켈 및 베릴륨 철)에 사용되는 비점화 공구가 포함됩니다.[30][7]액체 마그네슘과 합금화된 베릴륨은 100만분의 50 parts 정도만이 산화 저항성을 크게 증가시키고 가연성을 감소시킵니다.[7]

베릴륨의 높은 탄성 강성은 관성 유도 시스템 및 광학 시스템의 지지 메커니즘과 같은 정밀 계측에 광범위하게 사용되도록 만들었습니다.[9]베릴륨 구리 합금은 배의 선체에서 페인트를 벗겨내는 데 사용된 "제이슨 권총"에도 경화제로 적용되었습니다.[86]
베릴륨은 또한 고성능 축음기 카트리지 스타일리시의 캔틸레버에 사용되었는데, 극도의 강성과 낮은 밀도로 추적 중량을 1그램으로 줄이면서도 왜곡을 최소화하면서 고주파 통로를 추적할 수 있었습니다.[87]
베릴륨의 초기 주요 용도는 경도, 높은 용융점, 그리고 열을 방출하는 특출난 능력 때문에 군용 비행기에 제동이 걸렸습니다.환경적인 고려가 다른 물질로 대체되는 결과를 가져왔습니다.[9]
베릴륨은 비용 절감을 위해 상당한 양의 알루미늄과 합금화되어 AlBeMet 합금(상표명)을 얻을 수 있습니다.이 혼합물은 순수한 베릴륨보다 저렴하면서도 많은 바람직한 특성을 유지합니다.
거울들
베릴륨 거울은 특히 흥미로운 것입니다.예를 들어, 저중량 및 장기 치수 안정성이 중요한 기상 위성에서는, 종종 벌집 지지 구조를 갖는 대면적 거울이 사용됩니다.더 작은 베릴륨 거울은 광학 유도 시스템과 독일제 레오파드 1과 레오파드 2 주전차와 같은 화기 제어 시스템에서 사용됩니다.이러한 시스템에서는 미러의 매우 빠른 이동이 필요하며, 이는 다시 낮은 질량과 높은 강성을 요구합니다.일반적으로 베릴륨 미러는 단단한 무전해 니켈 도금으로 코팅되어 있어 베릴륨보다 더 미세한 광학 마감으로 더 쉽게 연마할 수 있습니다.그러나 일부 용도에서는 베릴륨 블랭크가 코팅 없이 연마됩니다.이는 특히 열 팽창 불일치로 코팅이 버클링될 수 있는 극저온 작동에 적용됩니다.[9]
제임스 웹 우주 망원경에는 거울을 위한 18개의 육각형 베릴륨 섹션이 있고, 각각은 얇은 금층으로 도금되어 있습니다.[88]JWST는 33K의 온도에 직면하기 때문에 거울은 금도금 베릴륨으로 만들어져 있어 유리보다 극한의 추위를 더 잘 다룰 수 있습니다.베릴륨은 그러한 온도에서 유리보다 더 적게 수축하고 변형되며, 더 균일하게 유지됩니다.[89]같은 이유로, 스피처 우주 망원경의 광학계는 모두 베릴륨 금속으로 만들어졌습니다.[90]
자기 응용
베릴륨은 비자성체입니다.따라서 베릴륨 기반 재료로 제작된 도구는 해군 또는 군 폭발물 처리 팀이 해군 지뢰 또는 인근에서 작업할 때 사용합니다. 이들 지뢰는 일반적으로 자기 융제를 가지고 있기 때문입니다.[92]자기공명영상장치(MRI) 기계 근처의 유지보수나 건설 자재에서도 발견되는데, 이는 자기장이 많이 발생하기 때문입니다.[93]무선 통신 및 강력한 (보통 군사용) 레이더 분야에서, 베릴륨으로 만든 수공구는 송신기에서 높은 수준의 마이크로파 전력을 생성하는 데 사용되는 매우 자성이 강한 클라이스트론, 마그네트론, 진행파관 등을 조정하는 데 사용됩니다.[94]
원자력 응용
베릴륨의 얇은 판 또는 포일은 핵분열 물질을 둘러싸기 위해 배치되는 열핵폭탄의 주요 단계에서 플루토늄 구덩이의 바로 바깥 층으로 핵무기 설계에 사용되기도 합니다.이 베릴륨 층들은 플루토늄-239의 내폭을 위한 좋은 "밀어기"이며, 베릴륨 감속 원자로에서와 마찬가지로 좋은 중성자 반사체입니다.[95]
베릴륨은 (원자로나 입자 가속기로 작동하는 중성자 발생기를 사용하는 것보다) 상대적으로 적은 중성자가 필요한 실험실 장치의 일부 중성자 공급원에서도 일반적으로 사용됩니다.이를 위해 베릴륨-9의 표적은 폴로늄-210, 라듐-226, 플루토늄-238, 아메리슘-241과 같은 방사성 동위원소에서 나오는 에너지가 강한 알파 입자로 폭격됩니다.발생하는 핵반응에서 베릴륨 핵은 탄소-12로 변환되고, 자유 중성자 1개가 방출되어 알파 입자가 향하던 방향과 거의 같은 방향으로 진행합니다.일부 초기 원자폭탄에는 알파붕괴로 인한 베릴륨 중성자 공급원이 사용되었는데, 이를 "성체" 중성자 개시제라고 합니다.[95]베릴륨이 감마 붕괴 방사성 동위원소에서 감마선으로 폭격되는 중성자 소스는 실험실 중성자를 생성하는 데도 사용됩니다.[96]

베릴륨은 CANDU 원자로의 연료 제작에도 사용됩니다.연료 요소에는 브레이징 필러 재료로 Be를 사용하는 유도 브레이징 프로세스를 사용하여 연료 클래딩에 브레이징되는 작은 부속물이 있습니다.연료 번들과 이를 포함하는 압력 튜브 사이의 접촉을 방지하기 위해 베어링 패드가 브레이징 처리되고, 요소간 스페이서 패드가 브레이징 처리되어 요소간 접촉을 방지합니다.
베릴륨은 유럽 공동 토러스 핵융합 연구소에서도 사용되며, 플라즈마를 마주하는 구성 요소를 조정하기 위해 더 발전된 ITER에서 사용될 것입니다.[97]베릴륨은 기계적, 화학적, 핵적 성질의 좋은 조합 때문에 핵연료봉의 피복재로도 제안되어 왔습니다.[9]플루오르화 베릴륨은 공융 염 혼합물 FLiBe의 구성 염 중 하나로, 액체 플루오르화 토륨 반응기(LFTR)를 포함한 많은 가상 용융 염 반응기 설계에서 용매, 감속제 및 냉각제로 사용됩니다.[98]
음향학
베릴륨은 중량이 낮고 강성이 높아 고주파 스피커 드라이버의 소재로 유용합니다.베릴륨 트위터는 값이 비싸고(티타늄보다 몇 배 이상) 취성 때문에 모양을 잡기 어렵고 잘못 다루면 독성이 있기 때문에 고급 가정용,[99][100][101] 프로 오디오용, 공용 주소용으로 제한됩니다.[102][103]일부 충실도가 높은 제품들이 이 소재로 만들어졌다고 거짓 주장을 해왔습니다.[104]
몇몇 고급 축음기 카트리지는 질량을 줄임으로써 추적을 개선하기 위해 베릴륨 캔틸레버를 사용했습니다.[105]
전자의
베릴륨은 III-V 화합물 반도체의 p형 도펀트입니다.분자빔 에피택시(MBE)에 의해 성장된 GaAs, AlGaAs, InGaAs 및 InAlAs와 같은 재료에 널리 사용됩니다.[106]교차 압연된 베릴륨 시트는 표면 실장 기술에 있어서 인쇄 회로 기판의 우수한 구조적 지지력입니다.중요한 전자 응용 분야에서 베릴륨은 구조적 지지체이자 방열판입니다.또한 알루미나 및 폴리이미드 유리 기판과 잘 일치하는 열팽창 계수가 필요합니다.베릴륨-베릴륨 산화물 복합체 "E-Materials"는 이러한 전자적 응용을 위해 특별히 설계되었으며 열팽창 계수가 다양한 기판 재료에 맞게 조정될 수 있다는 추가적인 이점을 가지고 있습니다.[9]
산화 베릴륨은 높은 강도와 경도, 그리고 매우 높은 융점을 가진 전기 절연체와 우수한 열전도체의 결합된 특성을 필요로 하는 많은 용도에 유용합니다.베릴륨 산화물은 전기통신용 무선 주파수 송신기에서 고출력 트랜지스터에서 절연체 베이스 플레이트로 자주 사용됩니다.산화 베릴륨은 또한 이산화우라늄 핵연료 펠릿의 열전도율을 증가시키기 위한 용도로 연구되고 있습니다.[107]베릴륨 화합물은 형광 조명 튜브에 사용되었지만, 튜브를 만드는 작업자들에게 발병한 베릴륨증 때문에 이 사용은 중단되었습니다.[108]
헬스케어
베릴륨은 여러 치과용 합금의 성분입니다.[109][110]
독성 및 안전성
| 유해성 | |
|---|---|
| GHS 라벨링:[111] | |
  | |
| 위험 | |
| H301, H315, H317, H319, H330, H335, H350i, H372 | |
| P201, P202, P280, P302, P304, P305+P351+P338, P310, P340, P352 | |
| NFPA 704 (파이어다이아몬드) | |
생물학적 효과
약 35 마이크로그램의 베릴륨이 인체에 평균적으로 발견되는데, 이 양은 유해하다고 간주되지 않습니다.[112]베릴륨은 화학적으로 마그네슘과 비슷하기 때문에 효소로부터 그것을 대체할 수 있고, 이것은 베릴륨이 오작동을 일으키게 합니다.[112]Be는2+ 전하량이 높고 작은 이온이기 때문에 많은 조직과 세포에 쉽게 들어갈 수 있으며, 특히 세포핵을 표적으로 하여 DNA 합성에 사용되는 효소들을 포함한 많은 효소들을 억제합니다.독성은 몸이 베릴륨 수치를 조절할 수단이 없어 일단 몸 안에 들어가면 베릴륨을 제거할 수 없기 때문에 악화됩니다.[113]
흡입
만성 베릴륨 질환(CBD) 또는 베릴리증은 베릴륨에 오염된 먼지나 연기를 흡입하여 발생하는 폐 및 전신 육아종성 질환입니다. 짧은 시간 동안의 많은 양 또는 긴 시간 동안의 적은 양이 이러한 질병을 초래할 수 있습니다.이 병의 증상은 5년까지 걸릴 수 있습니다; 이 병에 걸린 환자의 약 3분의 1이 사망하고 생존자들은 장애인 상태로 남겨집니다.[112]국제암연구기관(IARC)은 베릴륨과 베릴륨 화합물을 카테고리 1 발암물질로 분류하고 있습니다.[114]
직업노출
미국 산업안전보건국(OSHA)은 0.2 µg/m의 베릴륨 및 베릴륨 화합물에 대한 허용 노출 한도(PEL)를 8시간 시간 가중치 평균(TWA)으로, 2.0 µg/m을 샘플링 기간 15분 이상의 단기 노출 한도로 지정했습니다.국립산업안전보건원(NIOSH)은 권장 노출 한도(REL) 상한 임계값을 0.5 µg/m로 설정했습니다.IDLH(생명과 건강에 즉시 위험) 값은 4mg/m입니다3.[115]베릴륨의 독성은 비소나 수은과 같은 다른 독성 메탈로이드/금속과 동등합니다.[116][117]
직장에서 베릴륨에 노출되면 감작 면역 반응을 일으킬 수 있고 시간이 지남에 따라 만성 베릴륨 질환이 발생할 수 있습니다.[118]미국 국립산업안전보건원(NIOSH)은 베릴륨 제품의 주요 제조업체와 협력하여 이러한 효과를 연구하고 있습니다.NIOSH는 이번 협업과 별도로 감작 및 CBD 유전자 연구도 진행하고 있습니다.[118]
화학적 폐렴 형태의 급성 베릴륨 질환은 1933년 유럽에서, 1943년 미국에서 처음 보고되었습니다.한 조사에 따르면 1949년 미국에서 형광등을 제조하는 공장에서 일하는 근로자의 약 5%가 베릴륨 관련 폐 질환을 앓고 있는 것으로 나타났습니다.[119]만성 베릴리증은 여러 면에서 녹농증과 비슷하고, 감별 진단이 어려운 경우가 많습니다.그것은 Herbert L과 같은 핵무기 설계의 초기 노동자들을 죽였습니다. 앤더슨.[120]
베릴륨은 석탄 슬래그에서 발견될 수 있습니다.슬래그가 단단한 표면에서 페인트와 녹을 분출하기 위한 연마제로 제형화되면 베릴륨은 공기 중에 떠다니며 노출의 원인이 될 수 있습니다.[121]
형광 조명관에서 베릴륨 화합물의 사용은 1949년에 중단되었지만, 원자력 산업과 항공우주 산업에서 베릴륨에 노출될 가능성이 존재하며, 베릴륨 금속의 정제 및 베릴륨 함유 합금의 용융, 전자 장치의 제조,다른 베릴륨을 함유한 물질의 취급.[122]
탐지
초기 연구원들은 달콤한 맛으로부터 베릴륨과 그 다양한 화합물을 식별하는 매우 위험한 관행에 착수했습니다.이제 안전한 최신 진단 기술을 사용하여 식별이 수행됩니다.[7]공기와 표면에서 베릴륨에 대한 성공적인 테스트가 국제 자발적 합의 표준 ASTM D7202로 개발되어 발표되었습니다.이 절차는 설폰화 하이드록시벤조퀴놀린에 결합된 베릴륨과 용해 및 형광 검출을 위해 희석된 이불화암모늄을 사용하여 작업장에서 베릴륨 농도에 대한 권장 한계보다 최대 100배 더 민감한 검출을 허용합니다.형광은 베릴륨 농도가 증가함에 따라 증가합니다.새로운 절차는 다양한 표면에서 성공적으로 테스트되었으며 미세 농도(ASTM D7458)에서 내화성 베릴륨 산화물 및 규질 베릴륨의 용해 및 검출에 효과적입니다.[123][124]NIOSH Manual of Analytical Methods에는 베릴륨에 대한 직업적 노출 측정 방법이 포함되어 있습니다.[125]
참고문헌
- ^ "Standard Atomic Weights: Beryllium". CIAAW. 2013.
- ^ Be(0)이(가) 관찰되었습니다.
- ^ "Beryllium: Beryllium(I) Hydride compound data" (PDF). bernath.uwaterloo.ca. Retrieved 10 December 2007.
- ^ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 14.48. ISBN 1-4398-5511-0.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). "The NUBASE2020 evaluation of nuclear properties" (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ a b c d e f g h i j k l m n o Jakubke, Hans-Dieter; Jeschkeit, Hans, eds. (1994). Concise Encyclopedia Chemistry. trans. rev. Eagleson, Mary. Berlin: Walter de Gruyter.
- ^ Puchta, Ralph (2011). "A brighter beryllium". Nature Chemistry. 3 (5): 416. Bibcode:2011NatCh...3..416P. doi:10.1038/nchem.1033. PMID 21505503.
- ^ a b c d e f g h i Behrens, V. (2003). "11 Beryllium". In Beiss, P. (ed.). Landolt-Börnstein – Group VIII Advanced Materials and Technologies: Powder Metallurgy Data. Refractory, Hard and Intermetallic Materials. Landolt-Börnstein - Group VIII Advanced Materials and Technologies. Vol. 2A1. Berlin: Springer. pp. 667–677. doi:10.1007/10689123_36. ISBN 978-3-540-42942-5.
- ^ a b Hausner, Henry H. (1965). "Nuclear Properties". Beryllium its Metallurgy and Properties. University of California Press. p. 239. Archived from the original on 27 July 2020. Retrieved 30 October 2021.
- ^ Tomberlin, T. A. (15 November 2004). "Beryllium – A Unique Material in Nuclear Applications" (PDF). Idaho National Laboratory. Idaho National Engineering and Environmental Laboratory. Archived from the original (PDF) on 22 December 2015.
- ^ "About Beryllium". US Department of Energy. Archived from the original on 22 December 2021. Retrieved 22 December 2021.
- ^ Ekspong, G. (1992). Physics: 1981–1990. World Scientific. pp. 172 ff. ISBN 978-981-02-0729-8. Archived from the original on 27 July 2020. Retrieved 30 October 2021.
- ^ a b 엠슬리 2001, 페이지 56.
- ^ "Beryllium: Isotopes and Hydrology". University of Arizona, Tucson. Archived from the original on 26 May 2013. Retrieved 10 April 2011.
- ^ Whitehead, N; Endo, S; Tanaka, K; Takatsuji, T; Hoshi, M; Fukutani, S; Ditchburn, Rg; Zondervan, A (February 2008). "A preliminary study on the use of (10)Be in forensic radioecology of nuclear explosion sites". Journal of Environmental Radioactivity. 99 (2): 260–70. doi:10.1016/j.jenvrad.2007.07.016. PMID 17904707.
- ^ Boyd, R. N.; Kajino, T. (1989). "Can Be-9 provide a test of cosmological theories?". The Astrophysical Journal. 336: L55. Bibcode:1989ApJ...336L..55B. doi:10.1086/185360.
- ^ Arnett, David (1996). Supernovae and nucleosynthesis. Princeton University Press. p. 223. ISBN 978-0-691-01147-9. Archived from the original on 27 July 2020. Retrieved 30 October 2021.
- ^ Johnson, Bill (1993). "How to Change Nuclear Decay Rates". University of California, Riverside. Archived from the original on 29 June 2013. Retrieved 30 March 2008.
- ^ 해먼드, C.R. "Elements" in
- ^ Hansen, P. G.; Jensen, A. S.; Jonson, B. (1995). "Nuclear Halos". Annual Review of Nuclear and Particle Science. 45 (45): 591–634. Bibcode:1995ARNPS..45..591H. doi:10.1146/annurev.ns.45.120195.003111.
- ^ "Abundance in the sun". Mark Winter, The University of Sheffield and WebElements Ltd, UK. WebElements. Archived from the original on 27 August 2011. Retrieved 6 August 2011.
- ^ a b O'Neil, Marydale J.; Heckelman, Patricia E.; Roman, Cherie B., eds. (2006). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (14th ed.). Whitehouse Station, NJ, USA: Merck Research Laboratories, Merck & Co., Inc. ISBN 978-0-911910-00-1.
- ^ a b c 엠슬리 2001, 59쪽.
- ^ "Abundance in oceans". Mark Winter, The University of Sheffield and WebElements Ltd, UK. WebElements. Archived from the original on 5 August 2011. Retrieved 6 August 2011.
- ^ "Abundance in stream water". Mark Winter, The University of Sheffield and WebElements Ltd, UK. WebElements. Archived from the original on 4 August 2011. Retrieved 6 August 2011.
- ^ "Search Minerals By Chemistry". www.mindat.org. Archived from the original on 6 August 2021. Retrieved 30 October 2021.
- ^ Walsh, Kenneth A (2009). "Sources of Beryllium". Beryllium chemistry and processing. ASM International. pp. 20–26. ISBN 978-0-87170-721-5. Archived from the original on 13 May 2016. Retrieved 5 January 2016.
- ^ Phillip Sabey (5 March 2006). "Distribution of major deposits". In Jessica Elzea Kogel; Nikhil C. Trivedi; James M. Barker; Stanley T. Krukowski (eds.). Industrial minerals & rocks: commodities, markets, and uses. pp. 265–269. ISBN 978-0-87335-233-8. Retrieved 5 January 2016.
- ^ a b c d e f g h i Emsley 2001, 페이지 58. 58.
- ^ "Sources of Beryllium". Materion Corporation. Archived from the original on 24 December 2016. Retrieved 23 December 2016.
- ^ "베릴림" 2021년 7월 3일 2016년 미네랄 연감 웨이백 머신에서 보관.USGS (2018년 9월).
- ^ Уральский производитель изумрудов планирует выпускать стратегический металл бериллий Archived 11 October 2021 at the Wayback Machine.TASS.ru (2019년 5월 15일)
- ^ "Russia restarts beryllium production after 20 years". Eurasian Business Briefing. 20 February 2015. Archived from the original on 31 July 2017. Retrieved 22 February 2018.
- ^ Arrowsmith, Merle; Braunschweig, Holger; Celik, Mehmet Ali; Dellermann, Theresa; Dewhurst, Rian D.; Ewing, William C.; Hammond, Kai; Kramer, Thomas; Krummenacher, Ivo (2016). "Neutral zero-valent s-block complexes with strong multiple bonding". Nature Chemistry. 8 (9): 890–894. Bibcode:2016NatCh...8..890A. doi:10.1038/nchem.2542. PMID 27334631.
- ^ Gimferrer, Martí; Danés, Sergi; Vos, Eva; Yildiz, Cem B.; Corral, Inés; Jana, Anukul; Salvador, Pedro; Andrada, Diego M. (7 June 2022). "The oxidation state in low-valent beryllium and magnesium compounds". Chemical Science. 13 (22): 6583–6591. doi:10.1039/D2SC01401G. ISSN 2041-6539. PMC 9172369. PMID 35756523.
- ^ a b Boronski, Josef T.; Crumpton, Agamemnon E.; Wales, Lewis L.; Aldridge, Simon (16 June 2023). "Diberyllocene, a stable compound of Be(I) with a Be–Be bond". Science. 380 (6650): 1147–1149. Bibcode:2023Sci...380.1147B. doi:10.1126/science.adh4419. ISSN 0036-8075. PMID 37319227. S2CID 259166086.
- ^ Tomastik, C.; Werner, W.; Stori, H. (2005). "Oxidation of beryllium—a scanning Auger investigation". Nucl. Fusion. 45 (9): 1061. Bibcode:2005NucFu..45.1061T. doi:10.1088/0029-5515/45/9/005. S2CID 111381179.
- ^ a b c Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ a b Wiberg, Egon; Holleman, Arnold Frederick (2001). Inorganic Chemistry. Elsevier. ISBN 978-0-12-352651-9.
- ^ a b Alderghi, Lucia; Gans, Peter; Midollini, Stefano; Vacca, Alberto (2000). Sykes, A.G; Cowley, Alan, H. (eds.). "Aqueous Solution Chemistry of Beryllium". Advances in Inorganic Chemistry. San Diego: Academic Press. 50: 109–172. doi:10.1016/S0898-8838(00)50003-8. ISBN 978-0-12-023650-3.
{{cite journal}}: CS1 maint: 여러 이름: 편집자 목록 (링크) - ^ Bell, N.A. (1972). Advances in Inorganic Chemistry and Radiochemistry. Vol. 14. New York: Academic Press. pp. 256–277. doi:10.1016/S0065-2792(08)60008-4. ISBN 978-0-12-023614-5.
- ^ a b c d e Kumberger, Otto; Schmidbaur, Hubert (December 1993). "Warum ist Beryllium so toxisch?". Chemie in unserer Zeit (in German). 27 (6): 310–316. doi:10.1002/ciuz.19930270611. ISSN 0009-2851.
- ^ Rosenheim, Arthur; Lehmann, Fritz (1924). "Über innerkomplexe Beryllate". Liebigs Ann. Chem. 440: 153–166. doi:10.1002/jlac.19244400115.
- ^ Schmidt, M.; Bauer, A.; Schier, A.; Schmidtbauer, H (1997). "Beryllium Chelation by Dicarboxylic Acids in Aqueous Solution". Inorganic Chemistry. 53b (10): 2040–2043. doi:10.1021/ic961410k. PMID 11669821.
- ^ a b Mederos, A.; Dominguez, S.; Chinea, E.; Brito, F.; Middolini, S.; Vacca, A. (1997). "Recent aspects of the coordination chemistry of the very toxic cation beryllium(II): The search for sequestering agents". Bol. Soc. Chil. Quim. 42: 281.
- ^ a b Naglav, D.; Buchner, M. R.; Bendt, G.; Kraus, F.; Schulz, S. (2016). "Off the Beaten Track—A Hitchhiker's Guide to Beryllium Chemistry". Angew. Chem. Int. Ed. 55 (36): 10562–10576. doi:10.1002/anie.201601809. PMID 27364901.
- ^ Coates, G. E.; Francis, B. R. (1971). "Preparation of base-free beryllium alkyls from trialkylboranes. Dineopentylberyllium, bis((trimethylsilyl)methyl)beryllium, and an ethylberyllium hydride". Journal of the Chemical Society A: Inorganic, Physical, Theoretical: 1308. doi:10.1039/J19710001308.
- ^ Fischer, Ernst Otto; Hofmann, Hermann P. (1959). "Über Aromatenkomplexe von Metallen, XXV. Di-cyclopentadienyl-beryllium". Chemische Berichte. 92 (2): 482. doi:10.1002/cber.19590920233.
- ^ Nugent, K. W.; Beattie, J. K.; Hambley, T. W.; Snow, M. R. (1984). "A precise low-temperature crystal structure of Bis(cyclopentadienyl)beryllium". Australian Journal of Chemistry. 37 (8): 1601. doi:10.1071/CH9841601. S2CID 94408686.
- ^ Almenningen, A.; Haaland, Arne; Lusztyk, Janusz (1979). "The molecular structure of beryllocene, (C5H5)2Be. A reinvestigation by gas phase electron diffraction". Journal of Organometallic Chemistry. 170 (3): 271. doi:10.1016/S0022-328X(00)92065-5.
- ^ Wong, C. H.; Lee, T. Y.; Chao, K. J.; Lee, S. (1972). "Crystal structure of bis(cyclopentadienyl)beryllium at −120 °C". Acta Crystallographica Section B. 28 (6): 1662. doi:10.1107/S0567740872004820.
- ^ Wiegand, G.; Thiele, K.-H. (1974). "Ein Beitrag zur Existenz von Allylberyllium- und Allylaluminiumverbindungen". Zeitschrift für Anorganische und Allgemeine Chemie (in German). 405: 101–108. doi:10.1002/zaac.19744050111.
- ^ Chmely, Stephen C.; Hanusa, Timothy P.; Brennessel, William W. (2010). "Bis(1,3-trimethylsilylallyl)beryllium". Angewandte Chemie International Edition. 49 (34): 5870–5874. doi:10.1002/anie.201001866. PMID 20575128.
- ^ Ruhlandt-Senge, Karin; Bartlett, Ruth A.; Olmstead, Marilyn M.; Power, Philip P. (1993). "Synthesis and structural characterization of the beryllium compounds [Be(2,4,6-Me3C6H2)2(OEt2)], [Be{O(2,4,6-tert-Bu3C6H2)}2(OEt2)], and [Be{S(2,4,6-tert-Bu3C6H2)}2(THF)]⋅PhMe and determination of the structure of [BeCl2(OEt2)2]". Inorganic Chemistry. 32 (9): 1724–1728. doi:10.1021/ic00061a031.
- ^ Morosin, B.; Howatson, J. (1971). "The crystal structure of dimeric methyl-1-propynyl- beryllium-trimethylamine". Journal of Organometallic Chemistry. 29: 7–14. doi:10.1016/S0022-328X(00)87485-9.
- ^ a b 1968년 주, 페이지 535.
- ^ a b 1968년 주, 페이지 536.
- ^ 1968년 537쪽
- ^ Vauquelin, Louis-Nicolas (1798). "De l'Aiguemarine, ou Béril; et découverie d'une terre nouvelle dans cette pierre" [Aquamarine or beryl; and discovery of a new earth in this stone]. Annales de Chimie. 26: 155–169. Archived from the original on 27 April 2016. Retrieved 5 January 2016.
- ^ 2016년 6월 23일 Wayback Machine of (Vauquelin, 1798)에서 보관된 169페이지의 각주에서, 편집자들은 다음과 같이 적습니다: "(1) La propriétéla plus caractéristique de decetterre, confirmée pares dernières experience de notle collègue, ét de former des d'une saveur sucrée, l'apeller glucine, de γλυκυς, doux, γλυκύ, vin doux, γλυκύ.α ιτω, rendre doux … Rédacteurs를 참고하세요." ((1) 동료 [Vauquelin]의 최근 실험에서 확인된 이 지구의 가장 특징적인 특성은, 달콤한 맛을 가진 소금을 만들기 위해서, 우리는 그것을 γλυκυς, 달콤한, γλυκύ, 달콤한 와인, γλυκα ιτω에서 추출한 글루킨이라고 부를 것을 제안합니다. 편집자들의 주의.)
- ^ Claproth, Martin Heinrich, Beitrage zur Chemischen Kennniss der Mineralkörper(광물물질의 화학적 지식에 대한 기여), vol. 3, (Berlin, (독일):Heinrich August Rottmann, 1802), 78-79페이지 2016년 4월 26일 웨이백 머신에서 보관: "Als Vauquelin der von im Berryll und Smaragdentdeckten Neuen Erde, Wegenrher Eigenschaft, sussse Mittelsalze zu bilden, den Namen Glykine, Süsserde, Beilegte, erwarteterer wohl nicht, dassich bald nachereine anderweitige Erde finden würde,웰체미트 볼리그 글리켐 레흐테 안스프루칸 다이센 나멘 마헨 쾨넨.움 다허케인 베르베흐셀룽 더 셀벤 미트 데 이트레르데 주 베란라센, 뷔르데 비엘리히 게라텐센, 젠 나멘 글리킨 아우프주게벤, 운트 뒤흐 베릴르데(베릴리나) 주에르세첸, 웰체 나멘스베른더룽 아우흐 베레츠 봄 Hrn.링크 교수, weil schone in Pflanzengeschlecht Glycine vorhandenist." (보켈린이 그가 베릴과 스마라그드에서 발견한 새로운 지구에 단염을 형성하는 특성 때문에 glycine, 단토라는 이름을 부여했을 때,그는 완전히 동등한 권리로 이 이름을 주장할 수 있는 또 다른 지구가 곧 발견될 것이라고 확실히 예상하지 못했습니다.따라서 이트리아-토류와의 혼동을 피하기 위해서는 글리신이라는 이름을 버리고 베릴-토류(베릴리나)로 대체하는 것이 좋을 것입니다.링크, 그리고 글리신이라는 식물 속이 이미 존재하는 이유.)
- ^ 1968년 주, 페이지 538.
- ^ Wöhler, F. (1828). "Ueber das Beryllium und Yttrium" [On beryllium and yttrium]. Annalen der Physik und Chemie. 13 (89): 577–582. Bibcode:1828AnP....89..577W. doi:10.1002/andp.18280890805. Archived from the original on 26 April 2016. Retrieved 5 January 2016.
- ^ Wöhler, Friedrich (1828). "Ueber das Beryllium und Yttrium". Annalen der Physik und Chemie. 89 (8): 577–582. Bibcode:1828AnP....89..577W. doi:10.1002/andp.18280890805. Archived from the original on 27 May 2016. Retrieved 5 January 2016.
- ^ Bussy, Antoine (1828). "D'une travail qu'il a entrepris sur le glucinium". Journal de Chimie Médicale (4): 456–457. Archived from the original on 22 May 2016. Retrieved 5 January 2016.
- ^ a b 1968년 주, 페이지 539.
- ^ Boillat, Johann (27 August 2016). From Raw Material to Strategic Alloys. The Case of the International Beryllium Industry (1919–1939). 1st World Congress on Business History, At Bergen – Norway. doi:10.13140/rg.2.2.35545.11363. Archived from the original on 30 October 2021. Retrieved 30 October 2021.
- ^ Kane, Raymond; Sell, Heinz (2001). "A Review of Early Inorganic Phosphors". Revolution in lamps: a chronicle of 50 years of progress. Fairmont Press. p. 98. ISBN 978-0-88173-378-5. Archived from the original on 7 May 2016. Retrieved 5 January 2016.
- ^ Babu, R. S.; Gupta, C. K. (1988). "Beryllium Extraction – A Review". Mineral Processing and Extractive Metallurgy Review. 4: 39–94. doi:10.1080/08827508808952633.
- ^ Hammond, C.R. (2003). "The Elements". CRC handbook of chemistry and physics (84th ed.). Boca Raton, FL: CRC Press. pp. 4–5. ISBN 978-0-8493-0595-5. Archived from the original on 13 March 2020. Retrieved 18 July 2019.
- ^ "Beryllium Statistics and Information". United States Geological Survey. Archived from the original on 16 September 2008. Retrieved 18 September 2008.
- ^ "Commodity Summary: Beryllium" (PDF). United States Geological Survey. Archived (PDF) from the original on 1 June 2010. Retrieved 16 May 2010.
- ^ "Commodity Summary 2000: Beryllium" (PDF). United States Geological Survey. Archived (PDF) from the original on 16 July 2010. Retrieved 16 May 2010.
- ^ "etymology online". Archived from the original on 30 October 2020. Retrieved 30 October 2021.
- ^ "Encyclopædia Britannica". Archived from the original on 23 October 2021. Retrieved 30 October 2021.
- ^ "Elemental Matter". Archived from the original on 29 November 2020. Retrieved 30 October 2021.
- ^ Veness, R.; Ramos, D.; Lepeule, P.; Rossi, A.; Schneider, G.; Blanchard, S. "Installation and commissioning of vacuum systems for the LHC particle detectors" (PDF). CERN. Archived (PDF) from the original on 14 November 2011. Retrieved 13 January 2012.
- ^ Wieman, H; Bieser, F.; Kleinfelder, S.; Matis, H. S.; Nevski, P.; Rai, G.; Smirnov, N. (2001). "A new inner vertex detector for STAR" (PDF). Nuclear Instruments and Methods in Physics Research Section A. 473 (1–2): 205. Bibcode:2001NIMPA.473..205W. doi:10.1016/S0168-9002(01)01149-4. S2CID 39909027. Archived (PDF) from the original on 17 October 2020. Retrieved 30 October 2021.
- ^ Davis, Joseph R. (1998). "Beryllium". Metals handbook. ASM International. pp. 690–691. ISBN 978-0-87170-654-6. Archived from the original on 27 July 2020. Retrieved 30 October 2021.
- ^ Schwartz, Mel M. (2002). Encyclopedia of materials, parts, and finishes. CRC Press. p. 62. ISBN 978-1-56676-661-6. Archived from the original on 27 July 2020. Retrieved 30 October 2021.
- ^ "Museum of Mountain Bike Art & Technology: American Bicycle Manufacturing". Archived from the original on 20 July 2011. Retrieved 26 September 2011.
- ^ Ward, Wayne. "Aluminium-Beryllium". Ret-Monitor. Archived from the original on 1 August 2010. Retrieved 18 July 2012.
- ^ Collantine, Keith (8 February 2007). "Banned! – Beryllium". Archived from the original on 21 July 2012. Retrieved 18 July 2012.
- ^ Geller, Elizabeth, ed. (2004). Concise Encyclopedia of Chemistry. New York City: McGraw-Hill. ISBN 978-0-07-143953-4.
- ^ "Defence forces face rare toxic metal exposure risk". The Sydney Morning Herald. 1 February 2005. Archived from the original on 30 December 2007. Retrieved 8 August 2009.
- ^ Shure V15VxMR 사용설명서 2페이지
- ^ "The Webb Space Telescope Will Rewrite Cosmic History. If It Works". Quanta Magazine. 3 December 2021. Archived from the original on 5 December 2021. Retrieved 5 December 2021.
- ^ Gardner, Jonathan P. (2007). "The James Webb Space Telescope" (PDF). Proceedings of Science: 5. Bibcode:2007mru..confE...5G. doi:10.22323/1.052.0005. Archived (PDF) from the original on 4 June 2016. Retrieved 15 January 2009.
- ^ Werner, M. W.; Roellig, T. L.; Low, F. J.; Rieke, G. H.; Rieke, M.; Hoffmann, W. F.; Young, E.; Houck, J. R.; et al. (2004). "The Spitzer Space Telescope Mission". Astrophysical Journal Supplement. 154 (1): 1–9. arXiv:astro-ph/0406223. Bibcode:2004ApJS..154....1W. doi:10.1086/422992. S2CID 119379934.
- ^ 그레이, 시어도어.자이로스코프 구. Wayback Machine에서 2021년 4월 14일 Berylium Archived 요소의 예.periodictable.com
- ^ Kojola, Kenneth; Lurie, William (9 August 1961). "The selection of low-magnetic alloys for EOD tools". Naval Weapons Plant Washington DC. Archived from the original on 23 August 2011. Retrieved 28 February 2010.
- ^ Dorsch, Jerry A. & Dorsch, Susan E. (2007). Understanding anesthesia equipment. Lippincott Williams & Wilkins. p. 891. ISBN 978-0-7817-7603-5. Archived from the original on 27 July 2020. Retrieved 30 October 2021.
- ^ Ropp, Richard C. (31 December 2012). Encyclopedia of the Alkaline Earth Compounds. Newnes. p. 7. ISBN 978-0-444-59553-9. Archived from the original on 11 May 2016. Retrieved 5 January 2016.
- ^ a b Barnaby, Frank (1993). How nuclear weapons spread. Routledge. p. 35. ISBN 978-0-415-07674-6. Archived from the original on 27 July 2020. Retrieved 30 October 2021.
- ^ Byrne, J. Neutrons, Nucleus, and Matter, Dover Publications, Minola, NY, 2011, ISBN 0-486-48238-3, pp. 32-33
- ^ Clark, R. E. H.; Reiter, D. (2005). Nuclear fusion research. Springer. p. 15. ISBN 978-3-540-23038-0. Archived from the original on 27 July 2020. Retrieved 30 October 2021.
- ^ Petti, D.; Smolik, G.; Simpson, M.; Sharpe, J.; Anderl, R.; Fukada, S.; Hatano, Y.; Hara, M.; et al. (2006). "JUPITER-II molten salt Flibe research: An update on tritium, mobilization and redox chemistry experiments". Fusion Engineering and Design. 81 (8–14): 1439. doi:10.1016/j.fusengdes.2005.08.101. OSTI 911741. Archived from the original on 26 April 2021. Retrieved 30 October 2021.
- ^ "Scan Speak offers Be tweeters to OEMs and Do-It-Yourselfers" (PDF). Scan Speak. May 2010. Archived from the original (PDF) on 3 March 2016.
- ^ Johnson, John E. Jr. (12 November 2007). "Usher Be-718 Bookshelf Speakers with Beryllium Tweeters". Archived from the original on 13 June 2011. Retrieved 18 September 2008.
- ^ "Exposé E8B studio monitor". KRK Systems. Archived from the original on 10 April 2011. Retrieved 12 February 2009.
- ^ "Beryllium use in pro audio Focal speakers". Archived from the original on 31 December 2012.
- ^ "VUE Audio announces use of Be in Pro Audio loudspeakers". VUE Audiotechnik. Archived from the original on 10 May 2012. Retrieved 21 May 2012.
- ^ Svilar, Mark (8 January 2004). "Analysis of "Beryllium" Speaker Dome and Cone Obtained from China". Archived from the original on 17 May 2013. Retrieved 13 February 2009.
- ^ "Shure V15 VXmR User Guide" (PDF). Archived from the original (PDF) on 10 January 2017. Retrieved 31 May 2017.
- ^ Diehl, Roland (2000). High-power diode lasers. Springer. p. 104. ISBN 978-3-540-66693-6. Archived from the original on 27 July 2020. Retrieved 30 October 2021.
- ^ "Purdue engineers create safer, more efficient nuclear fuel, model its performance". Purdue University. 27 September 2005. Archived from the original on 27 May 2012. Retrieved 18 September 2008.
- ^ Breslin AJ (1966). "Ch. 3. Exposures and Patterns of Disease in the Beryllium Industry". In Stokinger, HE (ed.). Beryllium: Its Industrial Hygiene Aspects. Academic Press, New York. pp. 30–33. ISBN 978-0-12-671850-8.
- ^ OSHA 유해성 정보 게시판 HIB 02-04-19 (rev. 05-14-02) 치과 실험실의 베릴륨 노출로 인한 건강 악영향 방지
- ^ Elshahawy, W.; Watanabe, I. (2014). "Biocompatibility of dental alloys used in dental fixed prosthodontics". Tanta Dental Journal. 11 (2): 150–159. doi:10.1016/j.tdj.2014.07.005.
- ^ "Beryllium 265063". Sigma-Aldrich. 24 July 2021. Archived from the original on 11 April 2021. Retrieved 21 December 2021.
- ^ a b c 엠슬리 2001, 57쪽.
- ^ Venugopal, B. (14 March 2013). Physiologic and Chemical Basis for Metal Toxicity. Springer. pp. 167–8. ISBN 978-1-4684-2952-7.
- ^ "Beryllium and Beryllium Compounds". IARC Monograph. Vol. 58. International Agency for Research on Cancer. 1993. Archived from the original on 31 July 2012. Retrieved 18 September 2008.
- ^ NIOSH Pocket Guide to Chemical Hazards. "#0054". National Institute for Occupational Safety and Health (NIOSH).
- ^ "CDC - NIOSH Pocket Guide to Chemical Hazards - Arsenic (inorganic compounds, as As)". Archived from the original on 11 May 2017. Retrieved 30 October 2021.
- ^ NIOSH Pocket Guide to Chemical Hazards - Mercury compounds.국립산업안전보건연구소(NIOSH).2021년 5월 7일 웨이백 머신(Wayback Machine)에서 보관
- ^ a b "CDC – Beryllium Research- NIOSH Workplace Safety and Health Topic". www.cdc.gov. Archived from the original on 16 December 2016. Retrieved 30 January 2017.
- ^ Emsley 2001, p. 5.
- ^ "Photograph of Chicago Pile One Scientists 1946". Office of Public Affairs, Argonne National Laboratory. 19 June 2006. Archived from the original on 11 December 2008. Retrieved 18 September 2008.
- ^ Newport News 조선 노동자들, 숨겨진 독소와 마주하다 2014년 1월 13일 Wayback Machine, Daily Press (버지니아), Michael Welles Shapiro, 2013년 8월 31일
- ^ International Programme on Chemical Safety (1990). "Beryllium: ENVIRONMENTAL HEALTH CRITERIA 106". World Health Organization. Archived from the original on 9 June 2011. Retrieved 10 April 2011.
- ^ "ASTM D7458 –08". American Society for Testing and Materials. Archived from the original on 12 July 2010. Retrieved 8 August 2009.
- ^ Minogue, E. M.; Ehler, D. S.; Burrell, A. K.; McCleskey, T. M.; Taylor, T. P. (2005). "Development of a New Fluorescence Method for the Detection of Beryllium on Surfaces". Journal of ASTM International. 2 (9): 13168. doi:10.1520/JAI13168.
- ^ "CDC – NIOSH Publications and Products – NIOSH Manual of Analytical Methods (2003–154) – Alpha List B". www.cdc.gov. Archived from the original on 16 December 2016. Retrieved 30 January 2017.
인용 출처
- Emsley, John (2001). Nature's Building Blocks: An A–Z Guide to the Elements. Oxford, England, UK: Oxford University Press. ISBN 978-0-19-850340-8.
- Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. (2002). Introduction to modern inorganic chemistry (6th ed.). CRC Press. ISBN 978-0-7487-6420-4.
- Weeks, Mary Elvira; Leichester, Henry M. (1968). Discovery of the Elements. Easton, PA: Journal of Chemical Education. LCCCN 68-15217.
추가열람
- Newman LS (2003). "Beryllium". Chemical & Engineering News. 81 (36): 38. doi:10.1021/cen-v081n036.p038.
- Mroz MM, Balkisoon R, Newman LS. "Berylium"Bingham E, Cohrsen B, Powell C (eds.)패티의 독성학, 5판뉴욕: 존 와일리 & 선즈 2001, 177–220.
- 월시, 케이에이, 베릴륨 화학 및 처리.비달, EE 등.Eds. 2009, 머티리얼즈 파크, 오하이오:ASM 인터내셔널.
- 베릴륨 림프구 증식 검사(BeLPT).DOE 규격 1142–2001.워싱턴 DC: 미국 에너지부, 2001.
- 2007, 에릭 세리,주기율표: 그 이야기와 의의, 옥스포드 대학 출판부, 뉴욕, ISBN 978-0-19-530573-9

![{\displaystyle {\ce {[Be(H2O)4]^{2}+{}+{\mathit {n}}\,F^{-}<=>Be[(H2O)_{2\!-{\mathit {n}}}F_{\mathit {n}}]^{2\!-{\mathit {n}}}{}+{\mathit {n}}\,H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9b4cabb9c4f8dd2cd76b67ae2b7338b0df72eab6)
![{\displaystyle {\ce {H2A + [Be(H2O)4]^2+ <=> [BeA(H2O)2] + 2H+ + 2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7cfee182a6f6d66479ed4ea44f318b60bc531733)
![{\displaystyle {\ce {H2A + [BeA(H2O)2] <=> [BeA2]^2- + 2H+ + 2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4e584fca5d0eed9a46d5cdcb9b3540ff77d40af2)
![{\displaystyle {\ce {Na_4[Be_6(OCH_2(O)O)_6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb11d9d4fdbfc6972b29c3f0da2932c7af31f59a)



