デュシェンヌ型筋ジストロフィー
a.病因、病態、病理
本症はX連鎖(性染色体)劣性遺伝をとるため、患者は男児に限られます。同じ様な遺伝形式をとる病気に血友病や色盲があります。母親が遺伝子に異常(変異)をもっていて、それが男の子に伝わることが多いのです。しかし、母親が遺伝子変異をもっているとは限りません。この病気は突然変異率が高いので、お子さんの遺伝子に突然変異があり、お母さんには変異がないことがまれではありません。お母さんの約1/3は変異がありません。
まれに染色体異常(X染色体と常染色体の相互転座、Turner症候群)があると、女性も同様な症状をとります。また女性保因者(女性で遺伝子の異常を持っている人)も、まれですが血液のCK値が高かったり、軽い筋肉の力が弱かったりします。
この病気を起こす遺伝子はどこにあって、その遺伝子に変異があるとどのような蛋白が欠損するか明らかになっています。遺伝子のある場所はX染色体短腕(Xp21)にあります。この遺伝子は分子量427kDの蛋白(ジストロフィンと命名されています)をコードしています。ジストロフィン遺伝子はクローニングされ、それはcDNAで14kbあって、79のエクソンからなっています。患者さんではこのジストロフィン遺伝子に変異があり、ジストロフィン蛋白が生成されないのです。患者さんの50ー60%はジストロフィkン遺伝子の欠失(遺伝子が欠けていて短い)、約10%は重複(遺伝子が重なって長くなっている)です。残りの30ー40%は多分点変異(DNAの一個が間違っているような一塩基置換など)と考えられています。 最も多い欠失は、3塩基づつの読みにずれがある(out of frame)欠失(正常では塩基3個で一つのアミノ酸ができます。3個の組み合わせがずれるので、めちゃくちゃなアミノ酸ができるのです)です。それだけでなく、欠失部以下にもう蛋白を作るのを止めなさいというストップ命令(コドン)が働き、不完全な蛋白が生成されます。それは不安定で、すぐに分解されると考えられています。ですからデュシェンヌ型ではジストロフィン蛋白はまったく作られません。
ジストロフィン蛋白は筋細胞膜直下に局在していて、ジストロフィン結合蛋白と結合しています。ジストロフィンは細長い棒状構造をしていると考えられています(図6)。
5’側(ジストロフィンの頭の部分)は細胞膜をしっかりと強固に保つ、アクチンという細い糸と結合する部位(actin binding domain)で、それに続いて3重らせん構造をとる桿状部分(rod domain)が続いています。それはさらにシスティンに富む部分(cysteine-rich domain)、C端(carboxyl terminal)へと続いています。図6のようにジストロフィン分子はcysteine-rich domainのところでジストロフィン結合蛋白のβジストログリカン(β-dystroglycan)と結合しています。ジストロフィンはアクチンという細い線維と一緒になって膜を補強するものです(細胞膜をしっかりと裏打ち構造をするもので細胞骨格といいます)。
患者さんではこのジストロフィンは全く欠損しています。それは抗ジストロフィン抗体で免疫染色をすると、正常では筋細胞膜に局在するジストロフィンが全く染色されないことから容易に判定でき(図7)、本症の診断用に使用されています。細胞膜をしっかりと安定させているジストロフィン蛋白がないので、細胞膜は弱く、すぐにシャボン玉のようにこわれるのでしょう。
患者さんの骨格筋を生検してみますと、筋線維の活発な壊死と活発な再生をみます(図8)。筋細胞膜がひ弱なため、細胞の外にある高濃度のカルシウム(Ca)が細胞内に逆流して、線維の変性を起こすと考えられています。高濃度のカルシウムが細胞内に入ると、筋線維はぎゅうっと縮みあがり、特殊な酵素(たとえばカルパイン)、で溶かされどろどろになるのです。でもその「どろどろ」を食べてきれいにする細胞(貪食細胞:マクロファージ)が細胞内をきれいにしてくれます。
b.臨床症状
本症の頻度は男児出生3、300人に1人、人口10万人に3ー5人くらいの患者さんがいるといわれています。人種差はなく、あらあゆる国に患者さんがいます。
従来は3ー5歳頃、走れない、転びやすい、階段の昇降困難で気付かれることが多かったのです。しかし最近では、乳児期に他の疾患(たとえば風邪をひいたとか)での検査中に偶然高CK血症で見いだされることが多くなりましたた。乳児期から追跡すると歩行開始遅延(1歳6カ月以降に歩行開始)が30ー50%いること、歩行開始時にはすでに筋力低下(立ち上がり方の異常)がみられることから、乳児期にもすでに異常があるお子さんがいるようです。
病初期は上記のように転びやすい、走れないなど歩行に関する異常が最も多くみられます。また筋肉の力が明らかに弱くなると、そん居の姿勢から立ち上がるとき、床に手をつき、臀部を高く挙げて立つようになります。健康なお子さんは、しゃがんだ位置からすっと垂直に立ち上がります。さらに筋肉の力が弱くなると、手を床に着き、つぎに膝に手を交互にあてて立つ、いわゆる登はん性起立(Gowers徴候)をみるようになります
(図10)。
さらに進行すると、何かものにつかまらないと立てなくなり、10歳前後で歩行不能となり、車椅子生活となります。次第に寝返りにも人の介助が必要となり、20歳前後で、呼吸筋の力が弱くなるため、人工呼吸器の助けが必要となります。むかしは人工呼吸器がなかったので、患者さんは20歳以前に死亡していました。でも今は40歳まで生きる方がでてきました。医療機器の進歩で、患者さんの生命はもっともっと伸びるでしょう。
筋萎縮(見た目に筋肉が細くなる)は病初期にはあまり目立たちません。むしろふくらはぎが異常に太いのが特徴的で、これは仮(偽)性肥大(pseudohypertrophy)とよばれています。この筋の肥大は肩や、頬筋、舌筋にもみられます。ふくらはぎの肥大はデュシェンヌ型や次に述べるベッカー型では、ほとんどの患者さんが経験する病気に特徴的所見です。
病気が進行すると、筋萎縮は躯幹近位筋(大腿、上腕、躯幹筋)に著明にみられるようになります。歩行時には関節拘縮(関節の伸展が悪くなることです)はアキレス腱の短縮による尖足のみですが、歩行不能となった時点から、股関節、膝関節などに広がっていきます。脊柱変形、手指、顎関節など全身の関節の拘縮をみるようになるのです。腱反射はアキレス腱反射を除いて減弱ないし消失します(図11)。
c.治療
現在のところ病気の進行をとめたり、筋力が回復するような根本的治療法はみつかっていません。でも、病気の進行を遅らせるさまざまな試みがなされています。
その一つとして副腎皮質ホルモン投与が試みられています。副作用が出ない少量投与でよい結果が出ています。 わたしはデュボビッツ(Dubowitz)先生の方法(毎月10日間だけプレドニゾロン0.75mg/Kg/日投与、20日間休薬)をとっています。 これですと副作用が出る人はごくまれです。副作用もほっぺがふっくらとする程度です。 中にはとても効果があって、5年くらい病気の進行がなくなる人もいます。 でも、効果がはっきりしない人もいます。アメリカの調査では副腎皮質ホルモン治療を受けた人は歩行期間が2年も延長するとのことです。
最近、アメリカの神経学会、小児神経学会では多くの患者で治験をしたところ、最初はプレドニソン0.75mg/Kg/日の連日投与から開始することがもっとも有効であったとして、推薦しています。副作用が出てきたら、0.3mg/Kg/日に減量します。(http://www.aan.com/professionals/practice/pdfs/DMD_Guideline_Physicians.pdf)。 この量ですと、日本人には量が多すぎて、副作用が出る可能性が強いと思います。日本人用のスタンダードが欲しいです。
デュシェンヌ型では筋力低下、関節拘縮が進行するので、それを少しでも防ぐためのリハビリテーションが行われ、効果をあげています。 また呼吸不全をみるようになった場合は鼻マスクによる人工呼吸器(nasal:noninvasive intermittent positive pressure: NIPP)の使用、あるいは気管切開による人工呼吸器の使用が行われ、患者さんの延命効果に大きく寄与しています。 心不全徴候がみられるようになった患者さんには、アンジオテンシン変換酵素阻害剤(ACE阻害剤)、ベーターブロッカー、ジギタリス剤、利尿剤を組み合わせた治療が行われていて、とてもよい結果をえています。 いろいろな薬物治療、呼吸管理などで、患者さんの生命予後は飛躍的によくなっています。
遺伝子治療はmdxマウス(ジストロフィンが欠損している筋ジストロフィーマウス)を使用して行われています。 現在アデノウィルスDNAをベクター(DNAの細胞内への運びやさん)にして、ジストロフィン遺伝子の一部あるいは全長が挿入され、筋内投与が行われています。 投与部にはジストロフィン陽性線維が増加し、筋線維の壊死の抑制がみられています。ただし、1回投与での効果の持続性が短く、再投与での効果に乏しいことが欠点とされています。 でもアデノウィルスベクターに変わるベクター(たとえばアデノウィルス随伴ウィルスベクター)なども開発されています。 遺伝子治療はよいベクターの開発にかかっています。科学の進歩はすばらしいです。原因がまったく分からなかったデュシェンヌ型筋ジストロフィーの遺伝子がクローニングされたのが1986年です。 最近の学問の進歩には目を見張るものがあります。根本治療、遺伝子治療への時代に突入したのです。
遺伝子治療については別に、国立精神・神経センター神経研究所 遺伝子治療研究部 武田伸一部長に解説いただいています。
→デュシェンヌ型筋ジストロフィーに対する分子治療のこころみ
本症はX連鎖(性染色体)劣性遺伝をとるため、患者は男児に限られます。同じ様な遺伝形式をとる病気に血友病や色盲があります。母親が遺伝子に異常(変異)をもっていて、それが男の子に伝わることが多いのです。しかし、母親が遺伝子変異をもっているとは限りません。この病気は突然変異率が高いので、お子さんの遺伝子に突然変異があり、お母さんには変異がないことがまれではありません。お母さんの約1/3は変異がありません。
まれに染色体異常(X染色体と常染色体の相互転座、Turner症候群)があると、女性も同様な症状をとります。また女性保因者(女性で遺伝子の異常を持っている人)も、まれですが血液のCK値が高かったり、軽い筋肉の力が弱かったりします。
この病気を起こす遺伝子はどこにあって、その遺伝子に変異があるとどのような蛋白が欠損するか明らかになっています。遺伝子のある場所はX染色体短腕(Xp21)にあります。この遺伝子は分子量427kDの蛋白(ジストロフィンと命名されています)をコードしています。ジストロフィン遺伝子はクローニングされ、それはcDNAで14kbあって、79のエクソンからなっています。患者さんではこのジストロフィン遺伝子に変異があり、ジストロフィン蛋白が生成されないのです。患者さんの50ー60%はジストロフィkン遺伝子の欠失(遺伝子が欠けていて短い)、約10%は重複(遺伝子が重なって長くなっている)です。残りの30ー40%は多分点変異(DNAの一個が間違っているような一塩基置換など)と考えられています。 最も多い欠失は、3塩基づつの読みにずれがある(out of frame)欠失(正常では塩基3個で一つのアミノ酸ができます。3個の組み合わせがずれるので、めちゃくちゃなアミノ酸ができるのです)です。それだけでなく、欠失部以下にもう蛋白を作るのを止めなさいというストップ命令(コドン)が働き、不完全な蛋白が生成されます。それは不安定で、すぐに分解されると考えられています。ですからデュシェンヌ型ではジストロフィン蛋白はまったく作られません。
ジストロフィン蛋白は筋細胞膜直下に局在していて、ジストロフィン結合蛋白と結合しています。ジストロフィンは細長い棒状構造をしていると考えられています(図6)。
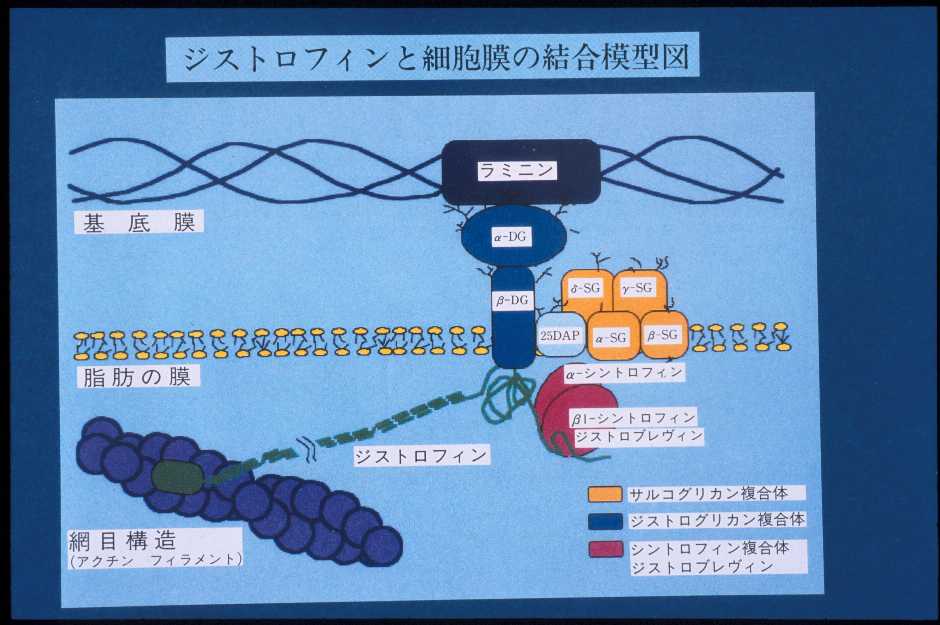 |
| 図6:ジストロフィンとジストロフィン結合蛋白の関係 この図は筋細胞膜(基底膜と形質膜の2重膜からなる)の一部を拡大した分子モデルの図である。 20DAPはサルコスパンとよばれている。DG:ジストログリカン、SG:サルコグリカン |
5’側(ジストロフィンの頭の部分)は細胞膜をしっかりと強固に保つ、アクチンという細い糸と結合する部位(actin binding domain)で、それに続いて3重らせん構造をとる桿状部分(rod domain)が続いています。それはさらにシスティンに富む部分(cysteine-rich domain)、C端(carboxyl terminal)へと続いています。図6のようにジストロフィン分子はcysteine-rich domainのところでジストロフィン結合蛋白のβジストログリカン(β-dystroglycan)と結合しています。ジストロフィンはアクチンという細い線維と一緒になって膜を補強するものです(細胞膜をしっかりと裏打ち構造をするもので細胞骨格といいます)。
患者さんではこのジストロフィンは全く欠損しています。それは抗ジストロフィン抗体で免疫染色をすると、正常では筋細胞膜に局在するジストロフィンが全く染色されないことから容易に判定でき(図7)、本症の診断用に使用されています。細胞膜をしっかりと安定させているジストロフィン蛋白がないので、細胞膜は弱く、すぐにシャボン玉のようにこわれるのでしょう。
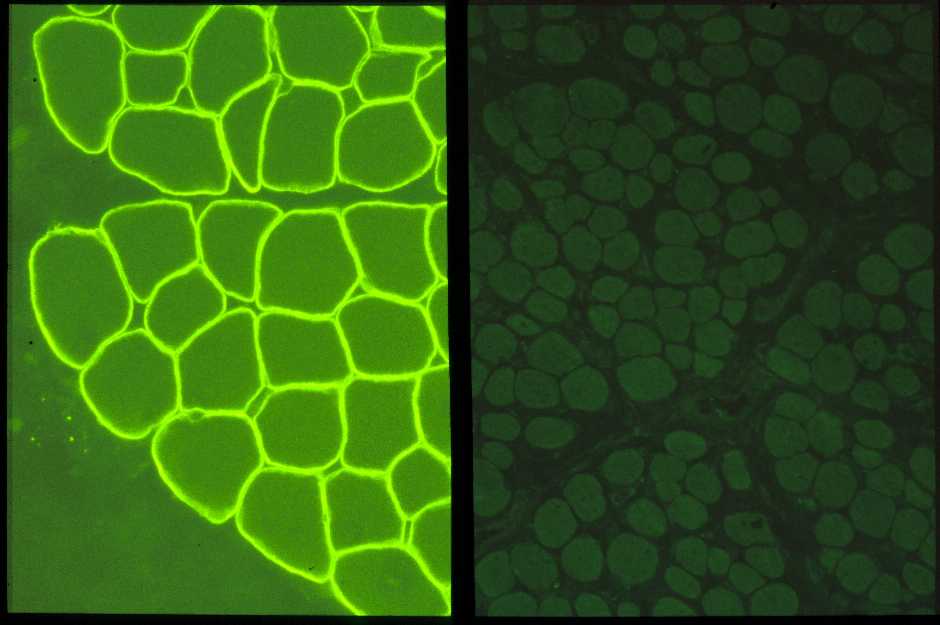 | 正常筋(左)では筋細胞膜にジストロフィンが存在するので、膜の部分が蛍光を発し、染色されている。 デュシェンヌ型(右)ではジストロフィンがないので、まったく染色されていない。 |
| 図7:ジストロフィン抗体による免疫染色 | |
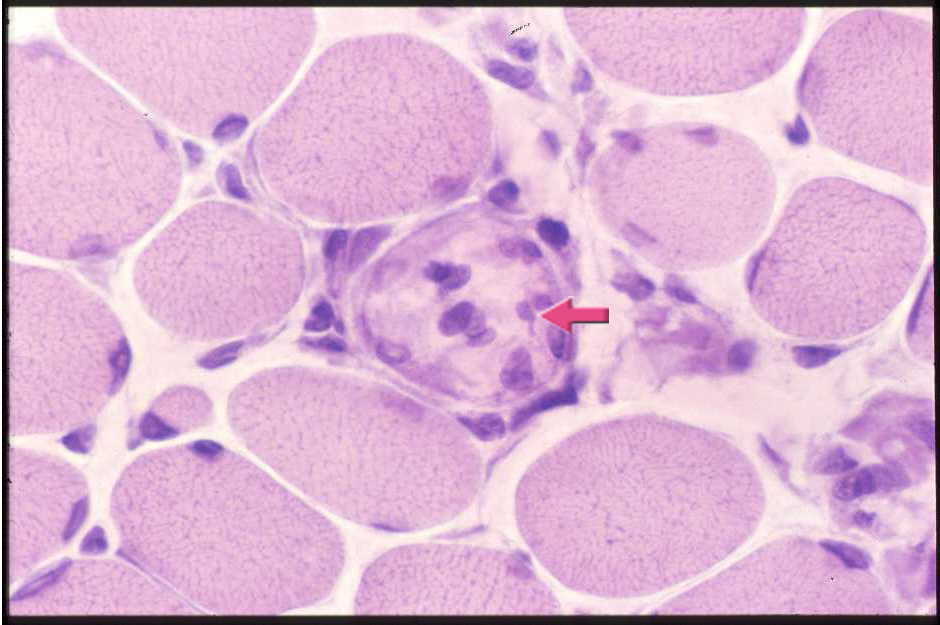 | 筋線維の大小不同と壊死線維(この図の中央にあって、溶けたような胞体をもっている)(矢印)をみる。 壊死線維には大型の核をもつマクロファージが侵入している。 |
| 図8:デュシェンヌ型筋ジストロフィーの筋病理-1 | |
| 筋ジストロフィーにみられる沢山の再生線維。中央にみえる青みを帯びた小さな線維(→) で、デュシェンヌ型では筋線維の平均15%は再生途上筋である。 マクロファージで掃除され、きれいになった壊死細胞には続いて再生が起こる。病気が進むと筋線維は著明に減少し、結合織と脂肪織で置換されてしまう。こうなると力は弱く、関節が硬くなり、伸びなくなってしまう。 | 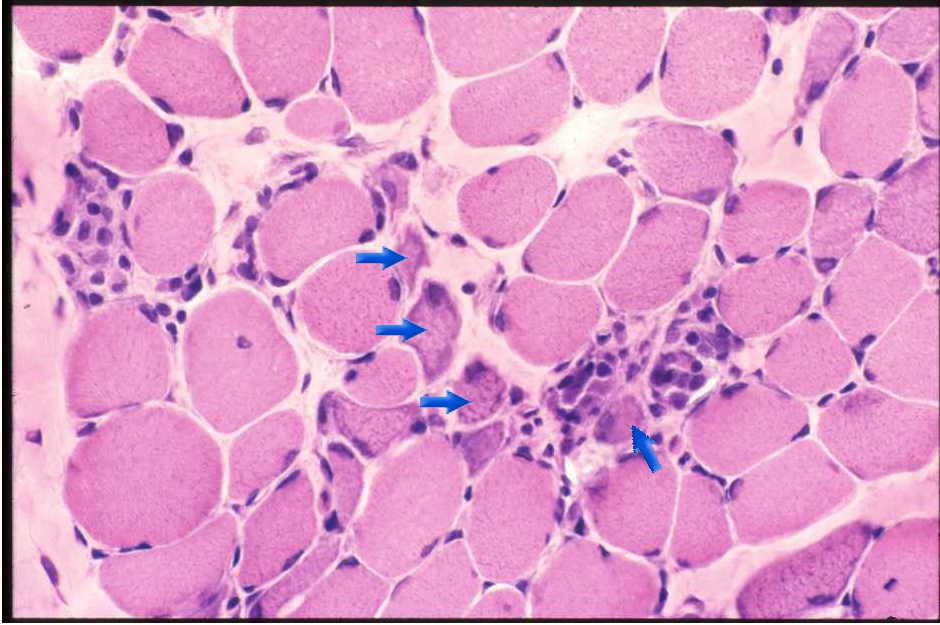 |
| 図9:デュシェンヌ型筋ジストロフィーの筋病理-2 | |
b.臨床症状
本症の頻度は男児出生3、300人に1人、人口10万人に3ー5人くらいの患者さんがいるといわれています。人種差はなく、あらあゆる国に患者さんがいます。
従来は3ー5歳頃、走れない、転びやすい、階段の昇降困難で気付かれることが多かったのです。しかし最近では、乳児期に他の疾患(たとえば風邪をひいたとか)での検査中に偶然高CK血症で見いだされることが多くなりましたた。乳児期から追跡すると歩行開始遅延(1歳6カ月以降に歩行開始)が30ー50%いること、歩行開始時にはすでに筋力低下(立ち上がり方の異常)がみられることから、乳児期にもすでに異常があるお子さんがいるようです。
病初期は上記のように転びやすい、走れないなど歩行に関する異常が最も多くみられます。また筋肉の力が明らかに弱くなると、そん居の姿勢から立ち上がるとき、床に手をつき、臀部を高く挙げて立つようになります。健康なお子さんは、しゃがんだ位置からすっと垂直に立ち上がります。さらに筋肉の力が弱くなると、手を床に着き、つぎに膝に手を交互にあてて立つ、いわゆる登はん性起立(Gowers徴候)をみるようになります
(図10)。
| 腰の筋力低下があるため、床から起立する時、まず床に手をついて、お尻を高くあげる(a)。 次にひざに手をあてて、手の力を借りて立ち上がる(b)。 ふくらはぎは太く偽性肥大を示している。 この偽性肥大はデュシェンヌ型、ベッカー型に特徴的である。 | 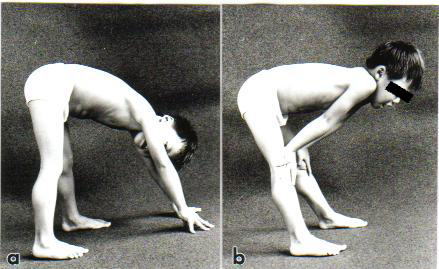 |
| 図10: 登はん性起立(Gowers徴候) | |
さらに進行すると、何かものにつかまらないと立てなくなり、10歳前後で歩行不能となり、車椅子生活となります。次第に寝返りにも人の介助が必要となり、20歳前後で、呼吸筋の力が弱くなるため、人工呼吸器の助けが必要となります。むかしは人工呼吸器がなかったので、患者さんは20歳以前に死亡していました。でも今は40歳まで生きる方がでてきました。医療機器の進歩で、患者さんの生命はもっともっと伸びるでしょう。
筋萎縮(見た目に筋肉が細くなる)は病初期にはあまり目立たちません。むしろふくらはぎが異常に太いのが特徴的で、これは仮(偽)性肥大(pseudohypertrophy)とよばれています。この筋の肥大は肩や、頬筋、舌筋にもみられます。ふくらはぎの肥大はデュシェンヌ型や次に述べるベッカー型では、ほとんどの患者さんが経験する病気に特徴的所見です。
病気が進行すると、筋萎縮は躯幹近位筋(大腿、上腕、躯幹筋)に著明にみられるようになります。歩行時には関節拘縮(関節の伸展が悪くなることです)はアキレス腱の短縮による尖足のみですが、歩行不能となった時点から、股関節、膝関節などに広がっていきます。脊柱変形、手指、顎関節など全身の関節の拘縮をみるようになるのです。腱反射はアキレス腱反射を除いて減弱ないし消失します(図11)。
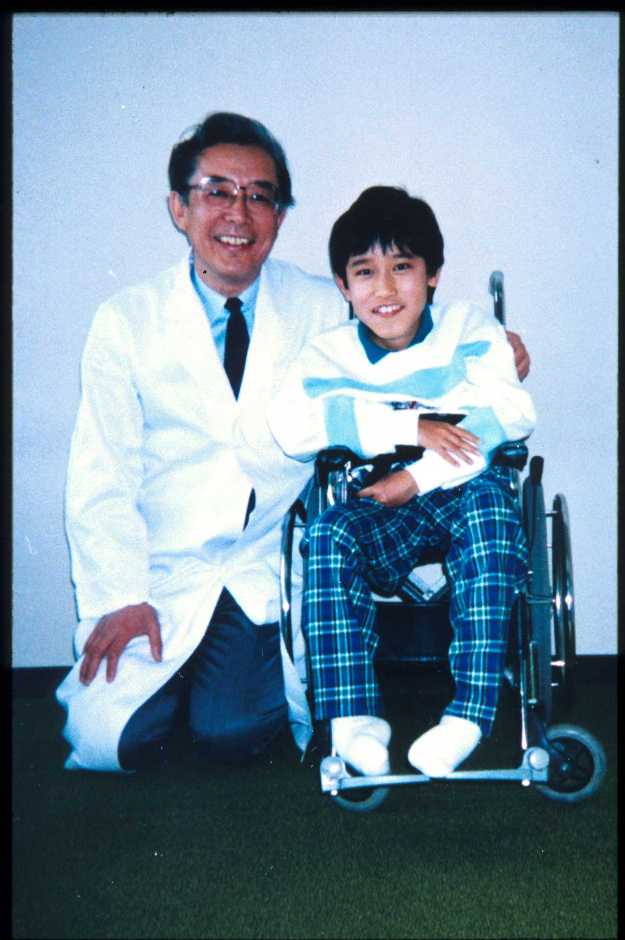 | 足の関節が拘縮している。 T君は今人工呼吸器をつけているが、亜細亜大学法学部に通学し、勉強しているファイトあふれる青年(この写真の掲載はT君の許可を得たものです)。 |
| 図11:車イス生活になったデュシェンヌ型筋ジストロフィーのT君と筆者 | |
現在のところ病気の進行をとめたり、筋力が回復するような根本的治療法はみつかっていません。でも、病気の進行を遅らせるさまざまな試みがなされています。
その一つとして副腎皮質ホルモン投与が試みられています。副作用が出ない少量投与でよい結果が出ています。 わたしはデュボビッツ(Dubowitz)先生の方法(毎月10日間だけプレドニゾロン0.75mg/Kg/日投与、20日間休薬)をとっています。 これですと副作用が出る人はごくまれです。副作用もほっぺがふっくらとする程度です。 中にはとても効果があって、5年くらい病気の進行がなくなる人もいます。 でも、効果がはっきりしない人もいます。アメリカの調査では副腎皮質ホルモン治療を受けた人は歩行期間が2年も延長するとのことです。
最近、アメリカの神経学会、小児神経学会では多くの患者で治験をしたところ、最初はプレドニソン0.75mg/Kg/日の連日投与から開始することがもっとも有効であったとして、推薦しています。副作用が出てきたら、0.3mg/Kg/日に減量します。(http://www.aan.com/professionals/practice/pdfs/DMD_Guideline_Physicians.pdf)。 この量ですと、日本人には量が多すぎて、副作用が出る可能性が強いと思います。日本人用のスタンダードが欲しいです。
デュシェンヌ型では筋力低下、関節拘縮が進行するので、それを少しでも防ぐためのリハビリテーションが行われ、効果をあげています。 また呼吸不全をみるようになった場合は鼻マスクによる人工呼吸器(nasal:noninvasive intermittent positive pressure: NIPP)の使用、あるいは気管切開による人工呼吸器の使用が行われ、患者さんの延命効果に大きく寄与しています。 心不全徴候がみられるようになった患者さんには、アンジオテンシン変換酵素阻害剤(ACE阻害剤)、ベーターブロッカー、ジギタリス剤、利尿剤を組み合わせた治療が行われていて、とてもよい結果をえています。 いろいろな薬物治療、呼吸管理などで、患者さんの生命予後は飛躍的によくなっています。
遺伝子治療はmdxマウス(ジストロフィンが欠損している筋ジストロフィーマウス)を使用して行われています。 現在アデノウィルスDNAをベクター(DNAの細胞内への運びやさん)にして、ジストロフィン遺伝子の一部あるいは全長が挿入され、筋内投与が行われています。 投与部にはジストロフィン陽性線維が増加し、筋線維の壊死の抑制がみられています。ただし、1回投与での効果の持続性が短く、再投与での効果に乏しいことが欠点とされています。 でもアデノウィルスベクターに変わるベクター(たとえばアデノウィルス随伴ウィルスベクター)なども開発されています。 遺伝子治療はよいベクターの開発にかかっています。科学の進歩はすばらしいです。原因がまったく分からなかったデュシェンヌ型筋ジストロフィーの遺伝子がクローニングされたのが1986年です。 最近の学問の進歩には目を見張るものがあります。根本治療、遺伝子治療への時代に突入したのです。
遺伝子治療については別に、国立精神・神経センター神経研究所 遺伝子治療研究部 武田伸一部長に解説いただいています。
→デュシェンヌ型筋ジストロフィーに対する分子治療のこころみ
このページでは「筋疾患百科事典」からdm~dを検索した結果を表示しています。
Weblioに収録されているすべての辞書からdm~dを検索する場合は、下記のリンクをクリックしてください。
 全ての辞書からdm~d を検索
全ての辞書からdm~d を検索
Weblioに収録されているすべての辞書からdm~dを検索する場合は、下記のリンクをクリックしてください。
 全ての辞書からdm~d を検索
全ての辞書からdm~d を検索 - dm~dのページへのリンク
