Подоцит
| Подоцит | ||
|---|---|---|
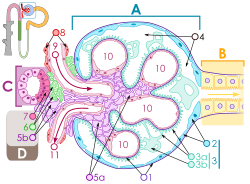 Будова ниркового тільця
Кров тече в приносну артеріолу ( 9 ) вгорі , і з виносної артеріоли ( 11 ) внизу. Кров протікає через капіляри клубочка ( 10 ) , де вона фільтрується за рахунок тиску . Подоцити ( 3b ) вкривають капіляри. Кров фільтрується через фільтраційні щілини між «ніжками» подоцитів ( 3а). Відфільтрована сеча проходить через проксимальний каналець (В) справа.
| ||
| Деталі | ||
| Ідентифікатори | ||
| Латина | podocytus | |
| MeSH | D050199 | |
| FMA | 70967 | |
| Анатомічна термінологія | ||
Подоцит (лат. podocytus; грец. podion — ніжка + гіст. cytus — клітина) — це найбільш диференційовані епітеліальні клітини у капсулах Шумлянського-Боумена в нирках, які вкривають капіляри клубочків. Стінки капсули Шумлянського-Боумена фільтрують плазму крові з капілярів клубочка, не пропускаючи великі молекули, такі як білки. У процесі такої фільтрації утворюється первинна сеча, яка за складом відображає ультрафільтрат плазми крові.
Подоцит є високо диференційованою клітиною овальної форми з ядром, мітохондріями, добре розвиненим ендоплазматичним ретикулумом та апаратом Гольджі. Подоцит складається з трьох частин: тіло клітини, первинні відростки — трабекули, вторинні відростки, або педікули, за допомогою яких клітини прикріплюються до базальної мембрани, у результаті утворюється підподоцитарний простір. У підподоцитарному просторі педікули сусідніх клітин утворюють між собою щілинні контакти за допомогою білка нефрина, який заякорений у мембрані педікул за допомогою білків подоцину і CD2AP. Простір між сусідніми відростками називається щілиною фільтрації та її діаметр може регулюватися в залежності від потреб.
Нефрин — білок, який утворює фільтраційні щілини.[1] Ідентифікація нефрину у фільтраційній щілині дала розуміння пристрою клубочкового фільтру і ролі фільтраійної щілини як заключного селективного бар'єру для проходження білка. Нефрин є трансмембранним білком з молекулярною масою 185 кДа (1241 аміноксилотний залишок), що відноситься до імуноглобулінів з адгезивними функціями.[2] Нефрин є обов'язковим компонентом фільтраційної щілини. Також нефрин бере участь у передачі клітинних сигналів.[3] У фільтраційній щілині нефрин і розташовані поблизу нього білки формують функціональний комплекс, що зв'язує фільтраційну щілину з актиновою частиною цитоскелету.[4][5]
Подоцин — інтегральний мембранний білок з молекулярною масою 42 кДа. Його ген NPHS2 розташований на хромосомі 1 людини у локусі q25-q31.[6] В основному експресується у гломерулярних подоцитах і менше — в тканині яєчок, фетальних тканинах серця і печінки. Подоцин «замикає» нефрин в подоцитах, і подібно до нефрину і білку CD2AP пов'язаний з фільтраційною щілиною ліпідними містками.[7]
CD2AP (СD2-асоційований білок) був названий так у зв'язку з його асоціацією з CD2 — рецепторним білком Т -лімфоцитів. В Т — клітинах CD2AP стабілізує взаємодію з антиген-презентуючими клітинами. Його молекулярна маса — 80 кДа. Білок CD2AP регулює цитоскелет подоцитів і стабілізує фільтраційні щілини.[8][9]
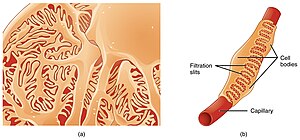
Тіло подоцита формується з проміжних філаментів, які складаються з віментину[10] і десміну. Центральна частина подоцита містить мікротрубочки, а цитозольна частина внутрішньої мембрани клітини вкрита мікрофіламентами. Від тіла клітини відходять великі відростки — трабекули, що охоплюють значну поверхню капіляра. Первинні відростки заповнені мікротрубочками змішаної полярності і руховим білком — CHO1/MKLP1.[11]
Малі відростки — педікули, відходять від великих майже перпендикулярно. Переплітаючись між собою, вони закривають весь вільний від великих відростків простір базальної мембрани капіляра. Педікули містять актинові нитки, що здатні скорочуватися. Один кінець цих ниток розташовується в первинних відростках, інший — в «ніжках» подоцитів. Актинові нитки пов'язані з мікротрубочками первинних відростків і складаються з актину, міозину і α-актиніну.[12]
Цитоскелет подоцита зв'язується з базальною мембраною за допомогою інтегринів.[13] Інтегринові комплекси представлені 31-інтегрином,[14] вінкуліном, таліном.[12]
Подоцитарна мембрана — плазмалема — розділена на базальну та апікальну частини, що переходять у фільтраційну щілину. Товстий шар апікальної частини плазмолеми вкритий глікокаліксом, що має негативний заряд. У глікокаліксі багато сіалопротеїнів, серед яких головними є подокаліксин і подоендин.[15][16]
Подокаліксин — білок з молекулярною масою 150 кДа, що експресується в клітинах ендотелію, мегакаріоцитів і тромбоцитах.[17] Близько 80% негативного заряду глікокаліксу забезпечується подокаліксином. Подокаліксин пов'язаний з цитоскелетом за рахунок взаємодії його цитоплазматичної частини з езрином і бере участь у формуванні та збереженні архітектури подоцита.[18]
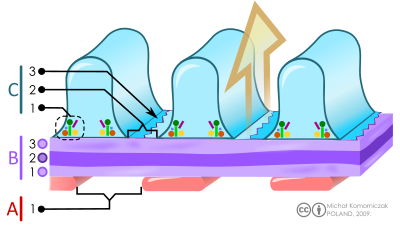
В - гломерулярна базальна мембрана:1. lamina rara interna 2. щільна ламіна 3. lamina rara externa)
C - подоцити: 1. ферменти і структурні білки 2. фільтраційна щілина 3. діафрагма)
Фільтраційні щілини складаються з декількох клітинних поверхневих білків, які блокують фільтрацію молекул розміром більших за 4,5 нм. Тому через мембрану вільно або частково можуть проходити молекули, діаметр яких менше 3,2 нм, наприклад, інсулін — діаметр 1,48 нм, яєчний альбумін — 2,85 нм, гемоглобін — 3,25 нм, сироватковий альбумін — 3,55 нм.
Проникненню білків через мембрану також заважають негативно заряджені молекули — поліаніони і сіалоглікопротеїди, що знаходяться у складі чи на поверхні подоцитів, їхніх мембран. Маючи негативний заряд, вони відштовхують негативно заряджені білки плазми крові, що фільтрується. Таким чином, у нормі через мембрану проникає ультрафільтрат.
Подоцити також беруть участь в регуляції клубочкової фільтрації. Коли подоцити скорочуються, вони викликають закриття фільтраційних щілин, що призводить до зменшення фільтрації клубочків за рахунок зменшення площі поверхні, яка використовується при фільтрації.
Фізіологічна проникність капілярів клубочку залежить від нормальної будови та функції відростків подоцитів, що формують фільтрувальну щілину. Наразі відомі певні мутації декількох генів, які визначають етіологію й патогенез прогресивної ниркової недостатності зі значною протеїнурією.
Нефротичний синдром — патологія, яка часто зустрічається серед гломерулярних захворювань нирок у дитячому віці.
У 1998 році було виявлено ген, відповідальний за розвиток вродженого нефротичного синдрому фінського типу, — NPHS1 — ген нефрину, що розташований на 19-й хромосомі[2]. Він складається з 29 екзонів. Серед фінської популяції відзначаються дві мутації: делеція в 2-му екзоні — Fin-major і нонсенс-мутація в 26-м екзоні — Fin-minor. Обидві мутації призводять до порушення синтезу нефрину.
У представників інших популяцій окрім фінської описані більше 60 різних мутацій, такі як: делеції, міссенс- і нонсенс-мутації в інших екзонах.[19][20] З поліморфізмом гена NPHS1 в 3-му екзоні (G349A) і 26-му екзоні (G3315A) A. Landenkari і співавтори (2004) пов'язали виникнення стероїд-залежних і стероїд-резистентних форм синдрому, які часто рецидивують.[21]
Вроджений нефротичний синдром фінського типу характеризується аутосомно-рецесивним типом успадкування. Велика кількість немовлят народжується передчасно з низькою масою тіла. Плацента збільшена, вага її перевищує масу новонародженого більш ніж на 25%. Синдром набряку в новонародженого спостерігається вже при народженні або розвивається протягом кількох наступних днів внаслідок важкого НС. Масивна протеїнурія супроводжується вираженою гіпоальбумінемією і значної гіпогаммаглобулінемією.[22][23] При морфологічному дослідженні нирок виявляються мікроцисти в тубулярному апараті у поєднанні з подоцитарною патологією — дифузним згладжуванням «ніжок» подоцитів.[24]
Порушення в структурі як самого нефрину, так і асоційованого з ним білкового комплексу призводять до змін архітектоніки подоциту — згладжування «ніжок» і протеїнурії.[7][25] Аналогічний стан спостерігається у хворих при діабетичній нефропатії.[26] Діабетична нефропатія пов'язана з порушенням контролю глікемії.[27] Посилення експресії нефрину встановлено в ранній фазі розвитку діабетичної нефропатії.[28] На пізніших стадіях діабетичної нефропатії експресія нефрину знижується, внаслідок зморщування і втрати функції подоцитів.[29]
Описано понад 30 патологічних мутацій у гені подоцину, що призводять до змін структури білка: міссенс-мутації, нонсенс-мутації, делеції.[30] При мутації P20L, як і при багатьох інших (P118L, R138Q, D160G, R168C, R168H, R168S, V180M і V260E), подоцин збережений в ендоплазматичному ретикулумі, але втрачається його здатність утримувати нефрин в ліпідних містках.[31] [1]
- Шевчук, В. Г. ; В. М. Мороз, С. М. Бєлан (2012). Фізіологія: підручник для студ. вищ. мед. навч. закладів. Вінниця: Нова Книга. с. 448.
- Вандер, А. (2000). Физиология почек (вид. 5-е). СПб: Питер. с. 256.
- Role of podocyte slit diaphragm as a filtration barrier. Nephrology. 11: 274—281. 2006.
- Smoyer, William E.; Peter Mundel (1998). Regulation of podocyte structure during the development of nephrotic syndrome. Springer-Verlag.
- HERMANN PAVENSTA; WILHELM KRIZ, AND MATTHIAS KRETZLER (2003). Cell Biology of the Glomerular Podocyte. Physiol Rev. 83: 253—307. doi:10.1152/physrev.00020.2002.
- HIROSHI KAWACHI, NAOKO MIYAUCHI, KOICHI SUZUKI, GI DONG HAN, MICHIAKI ORIKASA, FUJIO SHIMIZU (2006). Role of podocyte slit diaphragm as a filtration barrier. Nephrology. 11: 274—281.
- ↑ Holzman L.B., St John P.L., Kovari I.A., Verma R., Holthofer H., Abrahamson D.R. Nephrin localizes to the slit pore of the glomerular epithelial cell. Kidney Int 1999; 56: 1481–1491.
- ↑ а б Kestila M., Lenkkeri U., Mannikko M., Lamerdin J., McCready P., Putaala H., Ruotsalainen V., Morita T., Nissinen M., Herva R., Kashtan C.E., Peltonen L., Holmberg C., Olsen A., Tryggvason K. Positionally cloned gene for a novel glomerular protein — nephrin — is mutated in congenital nephrotic syndrome. Mol Cell 1998; 1: 575–582.
- ↑ Huber T.B., Kottgen M., Schilling B., Walz G., Benzing T. Interaction with podocin facilitates nephrin signaling. J Biol Chem 2001; 276: 41 543-41 546.
- ↑ Khoshnoodi J., Tryggvason K. Unraveling the molecular make-up of the glomerular podocyte slit diaphragm. Exp Nephrol 2001; 9: 355–359.
- ↑ Khoshnoodi J., Tryggvason K. Congenital nephrotic syndromes. Curr Opin Genet Dev 2001; 11: 322–327.
- ↑ Huber T.B., Simons M., Hartleben B., Sernetz L., Schmidts M., Gundlech E., Saleem M.A., Walz G., Benzing T. Molecular basis of the functional podocin-nephrin complex: mutations in the NPHS2 gene disrupt nephrin targeting to the lipid raft microdomains. Hum Mol Genet 2003; 12: 3397-3405.
- ↑ а б Boute N., Gribouval O., Roselli S., Benessy F., Lee H., Fuchshuber A., Dahan K., Gubler M.C., Niaudet P., Antignac C. NPHS2, encoding2 the glomerular protein podocin, is mutated in autosomal recessive steroid-resistant nephrotic syndrome. Nat Genet 2000; 24: 349–354.
- ↑ Dustin M.L., Olszowy M.W., Holdorf A.D., Li J., Bromley S., Desai N., Widder P., Rosenberger F., van der Merwe P.A., Allen P.M., Shaw A.S. A novel adaptor protein orchestrates receptor patterning and cytoskeletal polarity in T-cell contacts. Cell 1998; 94: 667–677.
- ↑ Kirsch K.H., Georgescu M.M., Ishimaru S., Hanafusa H. CMS: an adapter molecule involved in cytoskeletal rearrangements. Proc Natl Acad Sci USA 1999; 96: 6211-6216.
- ↑ Bachmann S., Kriz W., Kuhn C., Franke W.W. Differentiation of cell types in the mammalian kidney by immunofluorescence microscopy using antibodies to intermediate filament proteins and desmoplakins. Histochemistry 1983; 77: 365–394.
- ↑ Kobayashi N., Reiser J., Kriz W., Kuriyama R., Mundel P. Nonuniform microtubular polarity established by CHO1/MKLP1 motor protein is necessary for process formation of podocytes. J Cell Biol 1998; 143: 1961–1970.
- ↑ а б Drenckhahn D., Franke R.P. Ultrastructural organization of contractile and cytoskeletal proteins in glomerular podocytes of chicken, rat, and man. Lab Invest 1988; 59: 673–682.
- ↑ Adler S. Characterization of glomerular epithelial cell matrix receptors. Am J Pathol 1992; 141: 571–578.
- ↑ Korhonen M., Ylanne J., Laitinen L., Virtanen I. The alpha 1-alpha 6 subunits of integrins are characteristically expressed in distinct segments of developing and adult human nephron. J Cell Biol 1990; 111: 1245–1254.
- ↑ Huang T.W., Langlois J.C. Podoendin. A new cell surface protein of the podocyte and endothelium. J Exp Med 1985; 162: 245–267.
- ↑ Kerjaschki D., Sharkey D.J., Farquhar M.G. Identification and characterization of podocalyxin — the major sialoprotein of the renal glomerular epithelial cell. J Cell Biol 1984; 98: 1591–1596.
- ↑ Mendrick D.L., Rennke H.G. Induction of proteinuria in the rat by a monoclonal antibody against SGP-115/107. Kidney Int 1988; 33: 818–830.
- ↑ Orlando R.A., Takeda T., Zak B., Schmieder S., Benoit V.M., McQuistan T., Furthmayr H., Farquhar M. The glomerular epithelial cell anti-adhesin podocalyxin associates with the actin cytoskeleton through interactions with ezrin. J Am Soc Nephrol 2001; 12: 1589–1598.
- ↑ Beltcheva O., Martin P., Lenkkeri U., Tryggvason K. Mutation spectrum in the nephrin gene (NPHS1) in congenital nephrotic syndrome. Hum Mutat 2001; 17: 368–373.
- ↑ Fuchshuber A., Niaudet P., Gribouval O., Jean G., Gubler M.C., Broyer M., Antignac C. Congenital nephrotic syndrome of the Finnish type: linkage to the locus in a non-Finnish population. Pediatr Nephrol 1996; 10: 135–138.
- ↑ Lahdenkari A.T., Kestila M., Holmberg C., Koskimies O., Jalanko H. Nephrin gene (NPHS1) in patients with minimal change nephrotic syndrome (MCNS). Kidney Int 2004; 65: 1856–1863.
- ↑ Hallman N., Hjelt L., Ahvenainen E.K. Nephrotic syndrome in newborn and young infants. Ann Pediatr Fenn 1956; 2: 227–241.
- ↑ Huttunen N.-P. Congenital nephrotic syndrome of Finnish type. Study of 75 cases. Arch Dis Child 1976; 51: 344–348.
- ↑ Huttunen N.-P., Rapola J., Vilska J., Hallman N. Renal pathology in congenital nephrotic syndrome of Finnish type: a quantitative light microscopic study of 50 patients. Int J Pediatr Nephrol 1980; 1: 10-16.
- ↑ Donoviel D.B., Freed D.D., Vogel H., Potter D.G., Hawkins E., Barrish J.P., Mathur B.N., Turner C.A., Geske R., Montgomery C.A., Starbuck M., Brandt M., Gupta A., Ramirez-Solis R., Zambrowicz B.P., Powell D.R. Proteinuria and perinatal lethality in mice lacking NEPH1, a novel protein with homology to NEPHRIN. Mol Cell Biol 2001; 21: 4829-4836.
- ↑ Langham R.G., Kelly D.J., Cox A.J., Thomson N.M., Holthofer H., Zaoui P., Pinel N., Cordonnier D.J., Gilbert R.E. Proteinuria and the expression of the podocyte slit diaphragm protein, nephrin, in diabetic nephropathy: effects of angiotensin converting enzyme inhibition. Diabetologia 2002; 45: 1572–1576.
- ↑ Odoni G., Ritz E. Diabetic nephropathy — what have we learned in the last three decades? J Nephrol 1999; 2 (Suppl. 12): S120-S124.
- ↑ Aaltonen P., Luimula P., Astrom E., Palmen T., Gronholm T., Palojoki E., Jaakkola I., Ahola H., Tikkanen I., Holthofer H. Changes in the expression of nephrin gene and protein in experimental diabetic nephropathy. Lab Invest 2001; 81: 1185–1190.
- ↑ Doublier S., Salvidio G., Lupia E., Ruotsalainen V., Verzola D., Deferrari G., Camussi G. Nephrin Expression Is Reduced in Human Diabetic Nephropathy: Evidence for a Distinct Role for Glycated Albumin and Angiotensin II. Diabetes 2003; 52: 1023–1030.
- ↑ Caridi G., Bertelli R., Di Duca M., Dagnino M., Emma F., Onetti Muda A., Scolari F., Miglietti N., Mazzucco G., Murer L., Carrea A., Massella L., Rizzoni G., Perfumo F., Ghiggeri G.M. Broadening the spectrum of diseases related to podocin mutations. J Am Soc Nephrol 2003; 14: 1278–1286.
- ↑ Huber T.B., Simons M., Hartleben B., Sernetz L., Schmidts M., Gundlech E., Saleem M.A., Walz G., Benzing T. Molecular basis of the functional podocin-nephrin complex: mutations in the NPHS2 gene disrupt nephrin targeting to the lipid raft microdomains. Hum Mol Genet 2003; 12: 3397-3405..
- Подоцит: строение и роль в развитии нефротического синдрома(рос.)
- Исследование ассоциации ряда генов-кандидатов с хроническим гломерулонефритом (рос.)
- Нефрин и ассоциированный с ним белковый комплекс в почках и поджелудочной железе. Tuula Palmen (Helsinki University Biomedical Dissertation No 29. Helsinki 2003) Перевод Л.М. Константиновой(рос.)
- Greka, A., & Mundel, P. (2011). Balancing calcium signals through TRPC5 and TRPC6 in podocytes. Journal of the American Society of Nephrology, 22(11), 1969-1980.