Empirisk formel
En empirisk formel anger förhållandet (med minsta möjliga heltal) mellan antal atomer av de olika slagen i en kemisk förening. En molekylformel anger det verkliga antalet atomer av olika slag i en molekyl av ämnet.[1] Ett enkelt exempel på detta koncept är att den empiriska formeln för svavelmonoxid, eller SO, helt enkelt skulle vara SO, lika som den empiriska formeln för disulfurdioxid, S2O2. Sålunda har svavelmonoxid och disulfurdioxid, båda föreningar av svavel och syre, samma empiriska formel. Men deras molekylformler, som uttrycker antalet atomer i varje molekyl av en kemisk förening, är inte desamma.
En empirisk formel nämner inget om arrangemanget eller antalet atomer. Det är standard för många joniska föreningar, som kalciumklorid (CaCl2), och för makromolekyler, såsom kiseldioxid (SiO2).
Molekylformeln, å andra sidan, visar antalet av varje typ av atom i en molekyl.[2] Strukturformeln visar arrangemanget av molekylen. Det är således möjligt för olika typer av föreningar att ha lika empiriska formler.
I kemins tidiga dagar kom information om sammansättningen av föreningar från elementaranalys, som ger information om de relativa mängderna av grundämnen som finns i en förening, vilket kan skrivas som procent eller molförhållanden. Men kemister kunde inte bestämma de exakta mängderna av dessa grundämnen och kunde bara känna till deras förhållanden, därav namnet "empirisk formel". Eftersom joniska föreningar är utökade nätverk av anjoner och katjoner, är alla formler för joniska föreningar empiriska.[3]
Exempel
[redigera | redigera wikitext]Glukos (C6H12O6), ribos (C5H10O5), ättiksyra (C2H4O2) och formaldehyd (CH2O) har alla olika molekylformler men samma empiriska formel: CH2O. Detta är den faktiska molekylformeln för formaldehyd, men ättiksyra har dubbelt så många atomer, ribos har fem gånger antalet atomer och glukos har sex gånger antalet atomer.
Andra exempel är:
| Ämne | Molekylformel | Empirisk formel |
|---|---|---|
| Vatten | H2O | H2O |
| Metan | CH4 | CH4 |
| Bensen | C6H6 | CH |
| Svavel | S8 | S |
Beräkningsexempel
[redigera | redigera wikitext]En kemisk analys av ett prov av metylacetat ger följande elementära data: 48,64 procent kol (C), 8,16 procent väte (H) och 43,20 procent syre (O). För att bestämma empiriska formler antas det att vi har 100 gram av föreningen. Om så är fallet kommer procenttalen att vara lika med massan av varje grundämne i gram.
- Steg 1: Ändra varje procent till ett uttryck för massan av varje element i gram. Det vill säga, 48,64 procent C blir 48,64 g C, 8,16 procent H blir 8,16 g H och 43,20 procent O blir 43,20 g O.
- Steg 2: Konvertera mängden av varje element i gram till dess mängd i mol
- Steg 3: Dividera vart och ett av de resulterande värdena med det minsta av dessa värden (2,7)
- Steg 4: Om det behövs, multiplicera dessa tal med heltal för att få heltal. om en operation görs på ett av talen måste den göras på dem alla.
Således är den empiriska formeln för metylacetat C3H6O2. Denna formel råkar också vara metylacetats molekylformel.
| Strukturformler | Andra framställningar | ||||||
|---|---|---|---|---|---|---|---|
| Elektronformel | Valensformel | Nattaprojektion | Skelettformel | Konstitutionsformel | Summaformel | Empirisk formel | |
| Metan | 
|

|

|
existerar inte | CH4 | CH4 | CH4 |
| Propan | 
|

|
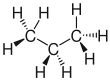
|
CH3–CH2–CH3 | C3H8 | C3H8 | |
| Ättiksyra | 
|

|
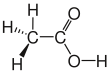
|

|
CH3–COOH | C2H4O2 | CH2O |
| Vatten | 
|
existerar inte | existerar inte | H2O | H2O | ||
Referenser
[redigera | redigera wikitext]- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Empirical formula, 16 februari 2024.
Noter
[redigera | redigera wikitext]- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Empirical formula". doi:10.1351/goldbook.E02063
- ^ MONITOR., WHOLE SKY, URL., OCLC 796720402, https://worldcat.org/oclc/796720402, läst 31 december 2022
- ^ ”10.12: Determining Empirical Formulas” (på engelska). Chemistry LibreTexts. 27 juni 2016. https://chem.libretexts.org/Bookshelves/Introductory_Chemistry/Introductory_Chemistry_(CK-12)/10%3A_The_Mole/10.12%3A_Determining_Empirical_Formulas. Läst 14 augusti 2023.
Externa länkar
[redigera | redigera wikitext]









