Neutron
 | |
| Klasifikacija: | Barion |
| Kompozicija: | 1 gornji kvark, 2 donja kvarka |
| Čestična statistika: | Fermion |
| Grupa: | Hadron |
| Međudjelovanje: | Gravitacijsko, slabo, jako, elektromagnetsko |
| Simbol(i): | n, n0, N0 |
| Antičestica: | Antineutron |
| Teoretiziran: | Ernest Rutherford (1920.) |
| Otkriven: | James Chadwick (1932.) |
| Masa: | 1,674927471(21)× −27 kg |
| Vrijeme poluraspada: | 881,5(15) s |
| Električni naboj: | 0 e |
| Electric dipole moment: | < 2,9×10−26 e⋅cm (gornja granica pokusa) |
| Electrična polarizabilnost: | 1,16(15)×10−3 fm3 |
| Magnetski moment: | −0,96623650(23)×10−26 J·T−1 −1,04187563(25)×10−3 μB |
| Magnetska polarizabilnost: | 3,7(20)×10−4 fm3 |
| Spin: | 1⁄2 |
| Izospin: | -1⁄2 |
| Paritet: | +1 |
U fizici, neutron je subatomska čestica, simbol n ili n0
, bez naelektrisanja i sa masom od 940 MeV/c 2 (1.6749 h 10−27 kg, malo većom od mase protona). Njegov spin je 1/2. Neutron je sastavni deo jezgra svakog atoma osim najrasprostranjenijeg izotopa vodonika, čije se jezgro sastoji samo od jednog protona. Kako se protoni i neutroni slično ponašaju unutar jezgra, i svaki ima masu od aproksimativno jedne jedinice atomske mase, oni se nazivaju nukleonima.[3] Njiova svojstva i interakcije opisuje nuklearna fizika.
Hemijska i nuklearna svojstva nukleusa su određena brojem protona, koji se naziva atomski broj, i brojem neutrona, zvanim neutronski broj. Atomski maseni broj je ukupni broj nukleona. Na primer, ugljenik ima atomski broj 6, i njegov široko zastupljeni izotop ugljenik-12 ima 6 neutrona,[4] dok njegov retki izotop ugljenik-13 ima 7 neutrona. Neki elementi se javljaju u prirodi sa samo jednim stabilnim izotopom, kao što je fluor. Drugi elementi imaju više stabilnih izotopa, kao što je kalaj sa deset stabilnih izotopa.
Unutar nukleusa, protoni i neutroni su međusobno vezani putem nuklearne sile. Neutroni su neophodni za stabilizaciju jezgra. Jedini izuzetak je jednoprotonski atom vodonika. Neutroni se izobilno formiraju u nuklearnoj fisiji i fuziji. Oni su primarni doprinosilac nukleosintezi hemijskih elemenata unutar zvezda putem fisije, fuzije i procesa neutronskog zarobljavanja.
Neutron je esencijalan u produkciji nuklearnog goriva. U deceniji nakon što je neutron otkrio Džejms Čedvik 1932. godine,[5] neutroni su korišteni za uvođenje raznih tipova nuklearnih transmutacija. Sa otkrićem nuklearne fuzije 1938. godine,[6] brzo je shvaćeno da, ako događaj fisije proizvodi neutrone, svaki od tih neutrona može da izazove dalje događaje fisije, itd., u kaskadi poznatoj kao nuklearna lančana reakcija.[7] Ovi događaji i nalazi su doveli do prvog samoodrživog nuklearnog reaktora (Čikaška kamara-1, 1942) i prvog nuklearnog oružja (Triniti, 1945).
Slobodni neutroni, mada direktno ne jonizuju atome, uzrokuju jonizujuću radijaciju. Kao takvi oni mogu da budu biološki hazard, u zavisnosti od doze.[7] Mali prirodni fluks „neutronske pozadine” slobodnih neutrona postoji na Zemlji, uzrokovan zasipanjem kosmičkim zračenjem, i prirodnom radioaktivnošću spontano fizionih elemenata u Zemljinoj kori.[8] Namenski neutronski izvori kao što su neutronski generatori, istraživački reaktori i spalacioni izvori uzrokuju oslobađanje slobodnih neutrona za upotrebu u iradijaciji i u eksperimentima neutronskog rasejavanja.
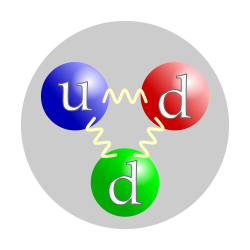
Van jezgra neutroni su nestabilni i imaju vreme polu-raspada od oko 15 minuta. Raspadaju se na proton, elektron i antineutrino. Isti raspad, beta raspad, se odigrava u nekim jezgrima. Unutar jezgra neutron i proton razmenom piona preobraćaju se jedan u drugoga. Neutron je klasifikovan kao barion, i sastoji se od dva down kvarka i jednog up kvarka. Antimaterijski ekvivalent neutrona je antineutron.[7]
Izotopi hemijskih elementa određuju se brojem neutrona u atomskom jezgru. Na primer, izotop ugljenika, ugljenik-12, 12C, ima 6 protona i 6 neutrona, ugljenik-13, 13C, 6 protona i 7 neutrona a ugljenik-14, 14C, 6 protona i 8 neutrona.
Masa neutrona se ne može direktno odrediti pomoću masene spektrometrije usled nedostatka električnog naboja. Međutim, pošto se mase protona i deuterona mogu meriti pomoću masenog spektrometra, masa neutrona se može izvesti putem oduzimanja mase protona od deuteronske mase, pri čemu je razlika masa neutrona plus energija vezivanja deuterijuma (izražena kao pozitivno emitovana energija). Ova kasnija se može direktno meriti putem merenja energije () pojedinačnog Šablon:FormattingError gama fotona emitovanog kad su neutroni zarobljeni protonima (to je egzotermni proces koji se odvija sa neutronima nulte energije), plus mala količina odskočne kinetičke energije () deuterona (oko 0,06% ukupne energije).
Energija gama zraka se može meriti sa velikom preciznošću pomoću tehnika difrakcije X-zraka, što su prvi put izveli Bel i Eliot 1948. godine. Najbolje moderne (1986) vrednosti za masu neutrona pomoću ove tehnike su proizveli Grin, et al.[9] Na ovaj način je određena masa neutrona od:
- mneutron= Šablon:FormattingError
Vrednost mase neutrona u MeV je manje precizno poznata, usled manje preciznosti konverzije u u MeV:[10]
- mneutron= Šablon:FormattingError.
Još jedan metod za određivanje mase neutrona je baziran na beta raspadu neutrona. U tom metodu se meri memenat rezultirajućeg protona i elektrona.
Ukupan električni naboj neutrona je Šablon:FormattingError. Ova nulta vrednost je eksperimentalno testirana, i sadašnji eksperimentalni limit za naboj neutrona je Šablon:FormattingError,[11] ili Šablon:FormattingError. Ova vrednost je konzistentna sa nulom, imajući u vidu eksperimentalne neizvesnosti (navedene u zagradama). U poređenju s tim, naelektrisanje protona je Šablon:FormattingError.
Mada je neutron neutralna čestica, magnetni momenat neutrona nije jednak nuli. Na neutron ne utiču električna polja, ali on podleže uticaju magnetnih polja. Magnetni momenat neutrona je indikacija njegove kvarkne podstrukture i unutrašnje distribucije naboja.[12] Vrednost neutronskog magnetnog momenta su prvi put direktno merili Luis Alvarez i Feliks Bloh u Berkliju (Kalifornija), 1940. godine,[13] koristeći proširenu verziju metoda magnetne rezonance koji je razvio Rabi. Alvarez i Bloh su odredili da je magnetni momenat neutrona μn= Šablon:FormattingError, gde je μN nuklearni magneton.
Energija neutrona, često nazivana i temperatura neutrona, određuje kinetičku energiju slobodnog neutrona, obično u jedinici Elektronvolt. Termin temperatura potiče od principa na koji se neutron usporava, tj. vrući, termički i hladni neutroni se moderiraju u sredini određene temperature.
Sa povećanjem temperature, povećava se i kinetička energija slobodnog neutrona. Kinetička energija, brzina i talasna dužina neutrona vezani su de Brojevom jednačinom.
- Brzi neutroni imaju energiju veću od 1 eV, 0,1 MeV ili 1 MeV, u zavisnosti od definicije.
- Spori neutroni imaju energiju ispod 1 eV.
- Epitermički neutroni imaju energiju između 0,025 do 1 eV.
- Vrući neutroni imaju energiju oko 2 eV.
- Termički neutroni imaju prosečnu energiju oko 0,025 eV.
- Hladni neutroni imaju energiju između 5x10−5 eV do 0.025 eV.
- Veoma hladni neutroni imaju energiju od 2x10−7 eV do 5x10−5 eV.
- Ultra hladni neutroni imaju energije manje od 2x10−7 eV.
Neutron učestvuje u svim oblicima interakcija: elektromagnetnoj, nuklearnoj slaboj, nuklearnoj jakoj i gravitacionoj interakciji.
Mada je, izdaleka gledano, neutron neutralna čestica u njegovoj unutrašnjosti postoji raspodela pozitivnog i negativnog naelektrisanja što se ispo Karakteristika neutrona koja ga najviše razlikuje od ostalih običnih subatomskih čestica je njegova elektroneutralnost. Ovo svojstvo neutrona je odložilo njihovo ottkrivanje, čini ih veoma prodornim, čini da ih nije moguće direktno posmatrati, i čini ih veoma važnim činiocima nuklearnih promena.
Kada se kaže detekcija čestice, misli se na traženje traga jonizacije ali to ne funkcioniše kod neutrona direktno, s obzirom da spada u čestice koje se ne mogu detektovati direktno. Neutroni koji se u elastičnom sudaru odbiju od atom nekog elementa mogu da prouzrokuju stvaranje tragova jonizacije koji se zatim detekuju, ali iskustvo pokazuje da ovi eksperimenti nisu jednostavni za izvođenje. Drugi način detkovanja neutrona, koji se češće koristi, je kada se dopusti da neutron interaguje sa jezgrom atoma.
Detekcija se sastoji u transformaciji energije oslobođene u reakciji u električni impuls. Za ovu svrhu su korisni elementi Helijum-3, Litijum-6, Bor-10, Uranijum-233, Uranijum-235, Neptunijum-237 i Plutonijum-239.
Neutron je veoma važan faktor u većini nuklearnih reakcija. Na primer, apsorpcija neutrona često dovodi do neutronove aktivacije, uključujući radioaktivnost. Znanja o neutronima i njihovom ponašanju igra bitnu ulogu u razvoju nuklearne tehnologije, nuklearnih reaktora i oružja.
Hladni, termalni i vrući neutroni odnosno ozračivanje pomoću njih, je primenjeno u ispitivanju čvrste materiju, gde se koristi odbijanje neutrona o elemente. Neutroni mogu dubinski da reaguju sa materijom s kojom dolaze u dodir. Brzi neutroni se koriste za detekciju vode u čvrstim telima. Kada dođe do reakcije između neutrona i molekula vode, neutron izgubi skoro celu svoju energiju. Merenjem ove energije, s kojom se usporeni neutron vraća do čvrste materije nakon reakcije sa vodonikom, može se ustanoviti gde se tačno voda nalazi u čvrstoj materiji.
Izloženost neutronima može da bude hazardan tj. opasan, s obzirom da interakicja neutrona sa molekulama u organizmu može da dovede do razaranja i oštećenja molekula i atoma, a takođe može izazvati nastanak drugih oblika radijacije. Treba, znači, izbegavati izlaganje snopu neutrona, držati se što dalje od izvora neutrona, i svesti izlaganje na minimum. Kada su u pitanju drugi tipovi radijacije, kao što su alfa čestice, beta čestice i gama zraci, materijali sa višim atomskim brojevima i većom gustinom su dovoljni da nas zaštite. Obično se koristi olovo. Ovakav pristup, naravno, ne važi i za neutrone. Kao što je već napomenuto, neutron veći deo energije gubi u reakciji sa vodonikom, pa je ta osobina iskorišćena za zaštitu pred zračenjem snopom neutrona.
- ↑ Mohr, P.J.; Taylor, B.N. and Newell, D.B. (2014), "The 2014 CODATA Recommended Values of the Fundamental Physical Constants" (Web Version 7.0). The database was developed by J. Baker, M. Douma, and S. Kotochigova. (2014). National Institute of Standards and Technology, Gaithersburg, Maryland 20899.
- ↑ Olive, K.A.; (Particle Data Group); et al. (2014). "Review of Particle Physics" [1]
- ↑ The Structure of the Nucleon, Wiley-WCH, Berlin, 2001, ISBN 978-3-527-40297-7
- ↑ „Table of Isotopic Masses and Natural Abundances” (PDF). 1999.
- ↑ Chadwick, James (1932). „Possible Existence of a Neutron”. Nature 129 (3252): 312. Bibcode 1932Natur.129Q.312C. DOI:10.1038/129312a0.
- ↑ Hahn, O. & Strassmann, F. (1939). „Über den Nachweis und das Verhalten der bei der Bestrahlung des Urans mittels Neutronen entstehenden Erdalkalimetalle ("On the detection and characteristics of the alkaline earth metals formed by irradiation of uranium with neutrons")”. Naturwissenschaften 27 (1): 11-15. Bibcode 1939NW.....27...11H. DOI:10.1007/BF01488241.. The authors were identified as being at the Kaiser-Wilhelm-Institut für Chemie, Berlin-Dahlem. Received 22 December 1938.
- ↑ 7,0 7,1 7,2 Glasstone, Samuel; Dolan, Philip J., ur. (1977), The Effects of Nuclear Weapons, Third Edition, U.S. Dept. of Defense and Energy Research and Development Administration, U.S. Government Printing Office, ISBN 978-1-60322-016-3
- ↑ Carson, M. J. (2004). „Neutron background in large-scale xenon detectors for dark matter searches”. Astroparticle Physics 21 (6): 667-687. arXiv:hep-ex/0404042. Bibcode 2004APh....21..667C. DOI:10.1016/j.astropartphys.2004.05.001.
- ↑ Greene, GL (1986). „New determination of the deuteron binding energy and the neutron mass”. Phys. Rev. Lett. 56 (8): 819-822. Bibcode 1986PhRvL..56..819G. DOI:10.1103/PhysRevLett.56.819. PMID 10033294.
- ↑ Byrne, J. Neutrons, Nuclei, and Matter, Dover Publications, Mineola. Šablon:Page1
- ↑ Olive, K.A.Greška u izrazu: Nepoznata riječ „etal”. (2014). „Review of Particle Physics”. Chin. Phys. C 38 (9): 090001. Bibcode 2014ChPhC..38i0001O. DOI:10.1088/1674-1137/38/9/090001.
- ↑ Gell, Y.; Lichtenberg, D. B. (1969). „Quark model and the magnetic moments of proton and neutron”. Il Nuovo Cimento A. Series 10 61: 27-40. Bibcode 1969NCimA..61...27G. DOI:10.1007/BF02760010.
- ↑ Alvarez, L. W; Bloch, F. (1940). „A quantitative determination of the neutron magnetic moment in absolute nuclear magnetons”. Physical Review 57 (2): 111-122. Bibcode 1940PhRv...57..111A. DOI:10.1103/physrev.57.111.
- Macura, Slobodan; Radić-Perić, Jelena (2004). Atomistika. Beograd: Fakultet za fizičku hemiju Univerziteta u Beogradu/Službeni list. str. 504..
- James Byrne, Neutrons, Nuclei and Matter: An Exploration of the Physics of Slow Neutrons. Mineola, New York. Šablon:Page1.
- Abraham Pais, Inward Bound, Oxford. Šablon:Page1.
- Sin-Itiro Tomonaga (1997). The Story of Spin. The University of Chicago Press.
- Herwig Schopper, Weak interactions and nuclear beta decay, Publisher, North-Holland Pub. Co., 1966.




