Hem

Hemul este o porfirină ce are ca heteroatom ionul de Fe (fier), legat prin valențe secundare de 2 atomi de N (azotul dintr-un heterociclu bazat pe pirol) în timp ce cu ceilați 2 atomi de N sunt legati covalent.
Tipuri de hem
[modificare | modificare sursă]Hemul B
[modificare | modificare sursă]Este cel mai des întâlnit tip de hem, fiind întâlnit atât în structura proteinelor transportoare de O (hemoglobina, mioglobina), cât și în structura enzimelor de tipul peroxidazelor. Enzimele COX1 și COX2 ciclooxigenazele care intervin în sinteza prostaglandinelor, conțin și ele o grupare hemică în unul din cele 2 site-uri active. În general hemul B este atașat de helixul proteic prin intermediul unei legături coordinative între ionul de Fe și lanțul proteic. În cazul hemoglobinei legătura coordinativă este realizată cu histidina, în timp ce NOS (sintaza oxidului de azot) și citocromul P450 realizează legătura cu cisteina.Datorită existenței unui singur electron la atomul de Fe, care poate fi legat printr-o legătura coordinativă cu proteina, fierul adoptă o stare de pentacoordinare, în timp ce în cazul legării oxigenului sau monoxidului de carbon , fierul este hexacoordinat.
Hemul A
[modificare | modificare sursă]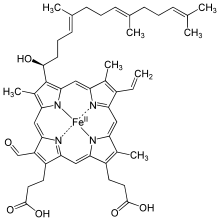
Diferența față de hemul B este oxidarea lanțului metilic din poziția 8 la o grupare formil, iar substituentul din poziția 2 este un lanț izoprenoid.Hemul A este atașat de proteină tot prin legătură coordinativă, și intră în structura citocromului c oxidazei.Separe că atît gruparea formil cît și radicalul izopreonoid joacă un rol important în conservarea oxigenului redus de către citocrom c oxidazei.
Hemul C
[modificare | modificare sursă]Hemul diferă de hemul B , prin legăturile disulfurice stabilite între cele 2 lanțuri vinilice le formează cu matricea proteică.Datorită acestui fapt fierul este legat de 2 lanțuri de aminoacizi, fiind hexacoordinat.Citocromul C conține o grupare hemică de tip C legată la ambele capete cu histidină și cu metionină.Primul care a identificat structura hemului C eset biochimistul suedez K.G.Paul.
Hemul O
[modificare | modificare sursă]Hemul O diferă față de hemul A prin înlocuirea radicalului formil din poziția 8 cu un radical metil, lanțul izoprenoidic ramîne neschimbat;hemul O este implicat în reducerea oxigenului la nivel tisular, oarecum asemănător cu hemul A.
Hemul L
[modificare | modificare sursă]Hemul L este un derivat al hemului B, atașat prin legături covalente de lactoperoxidază, peroxidaza eosinofilelor, și tiroid peroxidaza.Diferă de hemul B prin esterificarea la nivelul C1 și C5 cu o grupare[1] Arhivat în , la Wayback Machine. glutamat respectiv aspartat.Hemul L este cel mai important constituent al peroxidazelor animale:
- Lactoperoxidaza și eosonofil peroxidaza sunt enzime de protecție , responsabile de distrugerea bacteriilor și virusurilor
- Tiroid peroxidaza este o enzimă ce catalizează biosinteza a numeroși hormoni tiroidieni.
Hemul M
[modificare | modificare sursă]Hemul M este asemănător cu hemul B, fiind esterificat la C1 și la C5.Este legat de situsul activ la mieloperoxidazei.Gruparea vinilică este legată de un rest metionil,formînd un ion sulfoniu ceea ce îi permite să oxideze cu ușurință ionii bromură și clorură.
Hemul S
[modificare | modificare sursă]Hemul S se deosebește de hemul B prin prezența unei grupe formil la C2 în locul grupării vinil.A fost identificat la viermii de mare, structura sa fiind stabilită de chimistul Hans Fischer.
Biosinteza hemului
[modificare | modificare sursă]
Calea de sinteză are drept precursori acidul D aminolevulinic format din glicină și succinil CoA provenite din ciclul Krebs.
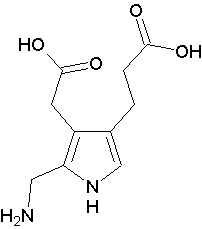
Transformarea porfibilinogenului în porfirină nu este un proces cunoscut în plante.are loc condensarea a 3 molecule de porfobilinogen (eliminare de amoniac, si dehidrogenare), formîndu-se un tripirol.Acesta se poate scinda fien în dipirol A fie în dipirol B.Prin condensarea a 2 molecule de dipirol A se formează porfirina de tip I, iar condensarea unei molecule de dipirol A cu o moleculă de dipirol B se formează protoporfirina(porfirina de tip III).În procesul de biosinteză se formează la început uroporfirinogenul III, format dintr-o moleculă de dipirol A și o molecula de dipirol B sun influența uroporfirinogen sintetazei.are loc eliminarea de amoniac și a unei grupări formil.Din uroporfirinogen III, prin decarboxilarea acidului acetic de la C1, C3, C5, C8 formează coproporfirinogenul III, cu grupări metilice la acești carboni.Acesta eet supus decarboxilării și dehidrogenării la C6 și C4, formîndu-se protoporfirinogenul IX, care prin dehidrogenare trece în protoporfirina IX.Sub acțiunea ferochelatazei asupra protoporfirinei IX, are loc încorporarea fierului, formîndu-se astfel hemul
Tabel ce prezintă intermediarii și cu enzimele implicate în sinteza hemului[2] Arhivat în , la Wayback Machine. [3] Arhivat în , la Wayback Machine.
| Enzimă | Substrat | Produs | Cromozom | EC | OMIM | Tipul de porfirie | Transmiterea |
| ALA sintaze | Glicină, succinil CoA | Acidul D-Aminolevulinic | 3p21.1 | 2.3.1.37 | 125290 | Anemie sideroblastică legată de cromozomul X | Recesivă, legată de cromozomul X |
| ALA dehidrataza | Acidul D-Aminolevulinic | Porfobilinogen | 9q34 | 4.2.1.24 | 125270 | Porfirie cu deficit de acid delta aminolevulinic dehidratază(apare la fecțiuni hepatice induse de expuneri la substanțe chimice plumb stiren) | Autosomal recesivă |
| PBG dezaminază | Porfobilinogen | Hidroximetil bilan | 11q23.3 | 2.5.1.61 | 176000 | Intermitent acută | Autosomal dominantă |
| Uroporfirinogen III sintază | Hidroximetil bilan | Uroporfirinogen III | 10q25.2-q26.3 | 4.2.1.75 | 606938 | eritropietică congenitală | Autosomal recesivă |
| Uroporfirinogen III decarboxilază | Uroporfirinogen III | Coproporfirinogen III | 1q34 | 4.1.1.37 | 176100 | cutanată tardivă (deficitul se pare că este la nivelul ficatului, deficit care se pare că se dobîndește)
Hepatoeritropoietică |
Autosomal dominantă
Autosomal recesivă |
| Coproporfirinogen III oxidază | Coproporfirinogen III | Protoporfirinogen IX | 3q12 | 1.3.3.3 | 121300 | Coproporfiria ereditară | Autosomal dominantă |
| Protoporfirinogen oxidază | Protoporfirinogen IX | Protoporfirin IX | 1q22 | 1.3.3.4 | 600923 | variegata | Autosomal dominantă |
| Ferochelataza | Protoporfirin IX | Hem | 18q21.3 | 4.99.1.1 | 177000 | Protoporfirie eritropietică | Autosomal dominantă |
Vezi și
[modificare | modificare sursă]
| |||||||||||
