Polimerização aniônica

Polimerização aniônica ou polimerização por adição aniônica é uma forma de polimerização em cadeia ou polimerização por adição de monômeros iniciados por ânions. Esse tipo de reação tem muitas variações, mas tradicionalmente os monômeros de vinila são utilizados.[1][2] Frequentemente a polimerização aniônica envolve polimerizações vivas, o que permite o controle da estrutura e composição do polímero formado.
História
[editar | editar código-fonte]Em 1936, Karl Ziegler propôs que a polimerização aniônica de estireno e butadieno por adição consecutiva de monômero a um iniciador de alquil lítio ocorria sem transferência ou terminação de cadeia. Vinte anos depois, a polimerização viva foi demonstrada por Michael Szwarc e colegas de trabalho. Em um dos eventos inovadores no campo da ciência dos polímeros, Szwarc elucidou que a transferência de elétrons ocorreu do ânion radical naftaleno de sódio para o estireno. Os resultados na formação de uma espécie organossódica, que rapidamente adicionou estireno para formar um "polímero vivo de duas extremidades". Um aspecto importante de seu trabalho, Szwarc empregou o solvente aprótico tetrahidrofurano. Sendo físico-químico, Szwarc elucidou a cinética e a termodinâmica do processo em detalhes consideráveis. Ao mesmo tempo, ele explorou a relação de propriedades estruturais dos vários pares de íons e íons radicais envolvidos. Este trabalho forneceu as bases para a síntese de polímeros com melhor controle sobre peso molecular, distribuição de peso molecular e arquitetura.
O uso de metais alcalinos para iniciar a polimerização de 1,3- dienos levou à descoberta por Stavely e colegas de trabalho da empresa Firestone Tire and Rubber do cis-1,4- poliisopreno. Isso desencadeou o desenvolvimento de processos comerciais de polimerização aniônica que utilizam iniciadores de alquil-lítio.
Roderic Quirk ganhou a Medalha Charles Goodyear em 2019 em reconhecimento por suas contribuições à tecnologia de polimerização aniônica. Ele foi apresentado ao assunto enquanto trabalhava em um laboratório da Philips com Henry Hsieh.
Características do monômero
[editar | editar código-fonte]Há duas grandes classes de monômeros que são suscetíveis à polimerização aniônica. [2]
Os monômeros de vinila têm a fórmula CH2=CHR, os mais importantes são o estireno (R = C6H5), o butadieno (CH=CH2) e o isopreno (R = C(Me)=CH2). Uma segunda classe principal de monômeros são os ésteres de acrilato, como acrilonitrila, metacrilato, cianoacrilato e acroleína. Outros monômeros de vinil incluem vinilpiridina, vinil sulfona, vinil sulfóxido e vinil silanos. [2]


Monômeros cíclicos
[editar | editar código-fonte]
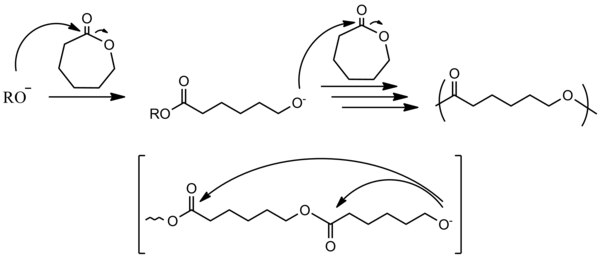
Muitos compostos cíclicos são suscetíveis à polimerização por abertura de anel. Epóxidos, trissiloxanos cíclicos, algumas lactonas, lactídeos, carbonatos cíclicos e aminoácidos N-carboxianidridos.
Para que a polimerização ocorra com monômeros vinílicos, os substituintes na ligação dupla devem ser capazes de estabilizar uma carga negativa. A estabilização ocorre através da deslocalização da carga negativa. Devido à natureza do centro de propagação do carbânion, os substituintes que reagem com bases ou nucleófilos não devem estar presentes ou estar protegidos. [2]
Iniciação e propagação
[editar | editar código-fonte]Os iniciadores são selecionados com base na reatividade dos monômeros. Monômeros altamente eletrofílicos, como o cianoacrilato, requerem apenas iniciadores fracamente nucleofílicos, como aminas , fosfinas ou mesmo haletos. Monômeros menos reativos, como o estireno, requerem nucleófilos fortes, como o butil-lítio. Reações de força intermediária são usadas para monômeros de reatividade intermediária, como a vinilpiridina.[2]
Os solventes utilizados nas polimerizações por adição aniônica são determinados pela reatividade do iniciador e pela natureza da extremidade da cadeia de propagação. Espécies aniônicas com baixa reatividade, como monômeros heterocíclicos, podem usar uma ampla gama de solventes. [1]
Iniciação por transferência de elétrons
[editar | editar código-fonte]O início da polimerização do estireno com naftaleno sódico ocorre pela transferência de elétrons do ânion radical naftaleno para o monômero. O radical resultante dimeriza para dar um composto dissódico, que então funciona como iniciador. Solventes polares são necessários para este tipo de iniciação, tanto para a estabilidade do radical ânion, quanto para solvatar as espécies de cátions formadas. O radical ânion pode então transferir um elétron para o monômero. A iniciação também pode envolver a transferência de um elétron do metal alcalino para o monômero para formar um radical ânion. A iniciação ocorre na superfície do metal, com a transferência reversível de um elétron para o monômero adsorvido. [1]
Iniciação por ânions fortes
[editar | editar código-fonte]Os iniciadores nucleofílicos incluem amidas covalentes ou iônicas, alcóxidos, hidróxidos, cianetos, fosfinas, aminas e compostos organometálicos (compostos de alquillítio e Reagentes de Grignard). O processo de iniciação envolve a adição de um nucleófilo neutro (B:) ou negativo (:B−) ao monômero. [3] O alquillítio tem sido o mais comercialmente útil destes iniciadores. Eles são usados principalmente para a polimerização de estirenos e dienos. [1]
Os monômeros ativados por grupos eletronegativos fortes podem ser iniciados mesmo por nucleófilos aniônicos fracos ou neutros (como aminas e fosfinas). O exemplo mais proeminente é a cura do cianoacrilato, que constitui a base da supercola, onde apenas vestígios de impurezas básicas são suficientes para induzir uma polimerização por adição aniônica ou uma polimerização por adição zwitterioniônica. [3]
Propagação
[editar | editar código-fonte]
A propagação na polimerização por adição aniônica resulta no consumo completo do monômero. Este estágio costuma ser rápido, mesmo em baixas temperaturas. [1]
Terminação
[editar | editar código-fonte]Em reações de polimerização viva, a propagação ocorre até o consumo completo do monômero. Elas podem ser finalizadas pela adição deliberada de um agente de transferência de cadeia, como água ou álcool, ao meio reacional. Mas na ausência de agentes terminadores, a concentração de carbânion decai com o tempo, este tipo de terminação é conhecido como terminação espontânea.[3]
A maioria das polimerizações aniônicas são realizadas em atmosfera inerte com reagentes e vidrarias rigorosamente limpos, pois vestígios de impurezas levam à reação de terminação. Qualquer umidade presente interrompe a propagação de carbânions por transferência de prótons.
Polimerizações sem Terminação
[editar | editar código-fonte]Muitas polimerizações aniônicas, especialmente de monômeros não polares como estireno e 1,3-butadieno, ocorrem sob condições nas quais não há reações de terminação efetivas. A propagação ocorre com o consumo completo do monômero para formar polímeros vivos. Os centros aniônicos de propagação permanecem intactos porque não ocorre transferência de prótons ou outras espécies positivas do solvente. Polímeros vivos são produzidos desde que se utilizem solventes, como benzeno, tetrahidrofurano e 1,2-dimetoxietano, que são relativamente inativos na transferência de cadeia com carbânions.
Uma vantagem da polimerização aniônica viva (LAP da sigla em inglês living anionic polymerization) é que após atingir 100% de conversão, uma polimerização adicional pode ser efetuada, adicionando-se mais monômero, seja o mesmo monômero ou um monômero diferente.
Polimerização Aniônica Viva
[editar | editar código-fonte]A polimerização aniônica viva é uma técnica de polimerização viva envolvendo uma espécie de propagação aniônica.
A polimerização aniônica viva foi demonstrada por Szwarc e colaboradores em 1956. Seu trabalho inicial foi baseado na polimerização de estireno e dienos. Uma das características notáveis da polimerização aniônica viva é que o mecanismo não envolve nenhuma etapa formal de terminação. Na ausência de impurezas, o carbânion ainda estaria ativo e capaz de adicionar outro monômero. As cadeias permanecerão ativas indefinidamente, a menos que haja encerramento inadvertido ou deliberado ou transferência da cadeia. Isto deu origem a duas consequências importantes:
- O peso molecular médio numérico, Mn, do polímero resultante de tal sistema poderia ser calculado pela quantidade de monômero consumido e pelo iniciador usado para a polimerização, já que o grau de polimerização seria a razão entre os mols do monômero consumido e os mols do iniciador que foram adicionados.
- Todas as cadeias são iniciadas aproximadamente ao mesmo tempo. O resultado final é que a síntese do polímero pode ser feita de forma muito mais controlada em termos de peso molecular e distribuição de peso molecular (Distribuição de Poisson).
Os seguintes critérios experimentais foram propostos como uma ferramenta para identificar um sistema como sistema de polimerização vivo.
- Polimerização até que o monômero seja completamente consumido e até que mais monômero seja adicionado.
- Número constante de centros ativos ou espécies em propagação.
- Distribuição de Poisson de peso molecular
- A funcionalização final da cadeia pode ser realizada quantitativamente.
Contudo, na prática, mesmo na ausência de agentes de terminação, a concentração dos ânions vivos diminuirá com o tempo devido a um mecanismo de decaimento denominado terminação espontânea. [1]
Consequências da Polimerização Viva
[editar | editar código-fonte]Copolímeros em bloco
[editar | editar código-fonte]A síntese de copolímeros em bloco é uma das aplicações mais importantes da polimerização viva, pois oferece o melhor controle sobre a estrutura. A nucleofilicidade do carbânion resultante governará a ordem de adição do monômero, uma vez que o monômero que forma as espécies de propagação menos nucleofílicas pode inibir a adição do monômero mais nucleofílico à cadeia. Uma extensão do conceito acima é a formação de copolímeros tribloco onde cada etapa de tal sequência visa preparar um segmento de bloco com peso molecular conhecido e previsível e distribuição estreita de peso molecular sem terminação ou transferência de cadeia. [1]
A adição sequencial de monômeros é o método dominante, mas esta abordagem simples sofre algumas limitações. Além disso, esta estratégia permite a síntese de estruturas lineares de copolímero em bloco que não são acessíveis através da adição sequencial de monômeros. Para estruturas A-b-B comuns, a copolimerização em bloco sequencial dá acesso a copolímeros em bloco bem definidos somente se a constante de taxa de reação cruzada for significativamente maior que a constante de taxa da homopolimerização do segundo monômero, isto é, kAA >> kBB. [4]
Funcionalização/terminação do grupo terminal
[editar | editar código-fonte]Uma das características notáveis da polimerização aniônica viva é a ausência de uma etapa formal de terminação. Na ausência de impurezas, o carbânion permaneceria ativo, aguardando a adição de novo monômero. A terminação pode ocorrer através da extinção não intencional por impurezas, muitas vezes presentes em pequenas quantidades. As impurezas típicas incluem oxigênio, dióxido de carbono ou água. A terminação permite intencionalmente a introdução de grupos terminais personalizados.
A polimerização aniônica viva permite a incorporação de grupos finais funcionais, geralmente adicionados para extinguir a polimerização. Os grupos finais que têm sido utilizados na funcionalização de α-haloalcanos incluem Hidróxidos, -NH2, -OH, -SH, -CHO, -COCH3, -COOH e epóxidos.

Uma abordagem alternativa para funcionalizar grupos terminais é começar a polimerização com um iniciador aniônico funcional. [1] Neste caso, os grupos funcionais estão protegidos uma vez que as extremidades da cadeia polimérica aniônica são uma base forte. Este método leva a polímeros com pesos moleculares controlados e distribuições estreitas de pesos moleculares. [5]
Cinética de polimerizações vivas
[editar | editar código-fonte]A taxa de polimerização em sistemas não-terminais pode ser expressa como Rp da seguinte forma:
Rp = Kapp.[M][M-] (1)
onde [M-] é a concentração total de todos os tipos de centros de propagação aniônicos vivos (íons livres e pares de íons). [M] pode ser determinado pela reação do polímero vivo com um agente terminal eletrofílico, como iodeto de metila, dióxido de carbono ou outra substância eletrofílica, seguido por análise da quantidade de agente de terminação incorporado no polímero.
UV/Vis e RMN são úteis para determinar a concentração total de espécies propagantes. Como os íons livres constituem uma porcentagem muito pequena de [M] para a maioria dos sistemas, igualar a concentração de pares de íons com [M] pode não introduzir erro significativo no cálculo. Em suma, a expressão de Rp pode ser aproximada com relativa precisão para Rp = Kp.[M]2.
As extremidades vivas são monoânions em polimerizações iniciadas por butil-lítio ou outro iniciador similar e diânions em polimerizações iniciadas por transferência de elétrons. Os dois tipos de ânions são referidos como ânions vivos de uma extremidade (monofuncional) e de duas extremidades (bifuncionais).
A Equação (1) se aplica ao caso em que a iniciação é rápida em relação à propagação. Esse condição é atendida para polimerizações em solventes polares. No entanto, polimerizações em solventes apolares possuem uma taxa de iniciação que é da mesma ordem de grandeza ou inferior à de propagação. Expressões cinéticas mais complexas análogas àquelas desenvolvidas para polimerizações catiônicas radicais e não vivas se aplicam a tais sistemas.
Tal como acontece com certos sistemas catiônicos, muitas polimerizações vivas aniônicas também ocorrem rapidamente. A técnica de fluxo interrompido é útil para estudar essas polimerizações rápidas. A taxa de polimerização utilizando essa técnica pode ser obtida inserindo, no meio reacional onde a polimerização é realizada, um tubo capilar contendo um solvente e um agente de terminação. O tempo de reação é dado pela razão entre o volume capilar e a vazão.
A conversão e, portanto, Rp e a constante aparente da taxa de propagação são obtidas analisando a mistura de reação do polímero final ou o monômero que não reagiu.
É importante compreender as razões para as taxas de reação mais rápidas serem encontradas em muitos polimerizações aniônicas em comparação com suas análagos radicais. Isto pode ser feito comparando os parâmetros cinéticos em equações de taxa apropriadas.
Os valores de kp na polimerização radical são semelhantes para os valores de Kapp na polimerização aniônica. Valores de Kapp aniônico podem ser 10–100 vezes mais baixos do que na polimerização radical em solventes hidrocarbonetos, embora possam ser 10–100 vezes maiores em solventes de éter. A principal diferença nas taxas de polimerizações aniônicas e radicais reside na falta de terminação na polimerização aniônica e a grande diferença nas concentrações das espécies propagadoras. A propagação de radicais em propagação é 10-9 a 10-7 M, enquanto a propagação de ânions é frequentemente tão alta como 10-4 a 10-2 M. Assim, as taxas de polimerização aniônica são muito mais altas do que as taxas de radicais com base apenas nas concentrações de espécies em propagação.[3]
Efeitos do Meio Reacional
[editar | editar código-fonte]A constante de taxa de propagação e a taxa de polimerização para polimerização aniônica são dramaticamente afetados pela natureza do solvente e do contra-íon. A polimerização é muito mais rápido nos solventes mais polares. Um exemplo claro é a polimerização do estireno por naftaleno de sódio na presença de tetrahidrofurano e 1,2-dimetoxietano como solventes (polares) em comparação a mesma reação processada em benzeno e dioxano como solventes (apolares). O Rp possui um aumento em três ordem de grandeza quando comparamos a mesma reação em solventes polares e apolares.
O aumento do Kapp com o aumento do poder de solvência do meio de reação é devido principalmente à fração aumentada de íons livres presentes em relação aos pares de íons. Portanto, é de maior valia obter as constantes de taxa de propagação individuais para os íons livres e pares de íons, bem como as quantidades relativas dos dois tipos de espécies em propagação.
Avaliação de Constantes de Taxa de Propagação Individual para Íons Livres e Pares de Íons
[editar | editar código-fonte]A taxa de polimerização é expressa apropriadamente como a soma das taxas para o ânion de propagação livre [P-] e o seu par íon [P-(C+)]:
Rp = [Kp-][P-]+{(Kp)+-[P-(C+)][M]} (1)
onde [kp-] e [kp+-] são as constantes de taxa de propagação para o íon livre e o par de íons, respectivamente, [P-] e [P-(C+)] são as concentrações do íon livre e do par de íons, e [M] é a concentração de monômero. [C+] na notação acima é o contra-íon positivo.
Com alguns algebrismos matemáticos que não serão abordados com ênfase aqui, pode-se reduzir o Kapp como:
Kapp = {[kp-][P-]+[kp+-][P-(C+)]}/[M-] (2)
Considerando-se que as duas espécies propagadoras estão em equilíbrio, temos que:
[P]-(C+) ⇌ [P-] + [C+] (3)
Para o caso em que [P-]= [C+] , ou seja, não há fonte de nenhum dos íons além de [P-][C+], a concentração de íons livres é:
[P-]=(k[P-][C+])1/2 (4)
E a concentração dos pares de íons é:
[P-(C+)] = [M-] - (K[M-])1/2 (5)
Combinando a equação acima com as equações (1), (2) e (4) chegamos finalmente em:
Kapp = [kp+-] +{[kp-] - [kp]K1/2}/[M-]1/2(6), sendo K a constante de equilíbrio da reação entre [P-] e [C+].[3]
Reatividade em polimerizações aniônicas
[editar | editar código-fonte]O aumento do poder de solvatação afeta a taxa de reação principalmente através de um aumento na concentração de íons livres. Como os íons livres são muito mais reativos que os pares de íons, uma pequena concentração tem um efeito muito grande na taxa de polimerização observada. A maioria parte da propagação é realizada por íons livres; cerca de apenas 10% da taxa de reação observada é devida aos pares de íons.[3]
A constante de dissociação para um par de íons qualquer cresce de baixo para cima nas famílias da tabela periódica. A ordem de aumento de K é proporcional a ordem )de aumento do poder de solvatação do contra-íon. Dessa forma, quanto menor o contra-íon, menor também o seu poder de solvatação. A mudança considerável na concentração de íons livres altamente reativos no meio reacional tem reflexo na diminuição de K, que posteriormente terá efeito nas taxas de polimerização global.[3]
As reatividades dos vários pares de íons também aumentam na mesma ordem que os valores de K: de baixo para cima na tabela periódica. A fração dos pares de íons que são do tipo separado por solvente aumenta com o aumento do poder de solvatação do contra-íon. Pares de íons separados por solvente são muito mais reativos do que pares de íons de contato.[3]
Grau de polimerização
[editar | editar código-fonte]O grau médio de polimerização para uma polimerização aniônica viva é a razão da concentração do monômero reagido à concentração das extremidades vivas.[3]
Para a situação usual onde todo o iniciador I é convertido em extremidades de cadeia de propagação, tem-se que:
Xn = (2p[M]0)/[I]0 (7) ou Xn = (p[M]0)/[I]0 (8) dependendo do modo de iniciação. A equação 7 é aplicada a polimerizações iniciadas por transferência de elétrons, uma vez que cada molécula final do polímero se origina de duas moléculas iniciadoras.
A equação 8, por sua vez, é aplicável a outros processos de iniciação que não envolvem apenas a transferência de elétrons. Para reações envolvendo espécies dormentes em equilíbrio, com íons e pares de íons, [I]0 é a soma das concentrações de íons, pares de íons e espécies dormentes.[3]
A ocorrência de qualquer terminação, transferência ou reações colaterais resulta na ampliação do distribuição de peso molecular. Embora a maior parte da propagação seja transportada por uma pequena fração das espécies propagadoras (ou seja, os íons livres), isso não amplia significativamente a distribuição de peso molecular, uma vez que os íons livres e os pares de íons estão em equilíbrio dinâmico. Cada cadeia polimérica propaga íons livres e pares de íons ao longo de sua vida e as frações médias de seu tempo de vida gasto como íons livres e pares de íons não é muito diferente do que para qualquer outra propagação corrente.[3]
Energia: pares de íons separados por solvente e de contato
Os dados disponíveis sobre a dependência da temperatura das taxas de polimerização viva mostram que a energia de ativação experimental ER é geralmente relativamente baixa e positiva. Deve-se reparar que a ER para polimerização viva é basicamente a energia de ativação para propagação. As taxas de polimerização são relativamente insensíveis a temperatura, mas aumentam levemente com o aumento da temperatura. Além disso, a energia de ativação varia consideravelmente dependendo do solvente empregado na polimerização.[3]
O peso molecular do polímero produzido em uma forma não-terminal denota que a polimerização não é afetada pela temperatura se os agentes de transferência estiverem ausentes. A situação será diferente se os agentes de transferência estiverem inicialmente presentes.[3]
O efeito da temperatura nas taxas de propagação é complexa - a temperatura afeta simultaneamente as concentrações relativas de íons livres e pares de íons e as constantes de taxa individuais para os íons livres e pares de íons. A temperatura afeta todas as constantes reacionais (k-, kp+-). [3]
No entanto, o efeito da temperatura na concentração de íons livres em relação aos pares de íons segue uma direção oposta. A mudança com a temperatura da constante de equilíbrio para dissociação de íons pares em íons livres é dado pela relação:
lnK = -ΔH/RT + ΔS/R (9)
Valores opostos da temperatura em relação a K e as constantes de taxa de propagação resultam em energias de ativação que geralmente são baixas. Energias de ativação aparentes para propagação em meios de solvatação mais pobres serão maiores do que aqueles em meios de solvatação melhores.[3]
O efeito de T sobre K em solventes mais polares é maior para os íons menores e mais mal solvatados em comparação com os íons maiores e mais fracamente íons solvatados.[3]
A menor energia de ativação para propagação é razoável, uma vez que a interação entre ânion e monômero deve gerar forças atrativas (devido à polarização) que reduzem a barreira de energia potencial à adição.[3]
O cálculo de kp e dos parâmetros de ativação correspondentes segue uma maneira razoavelmente similar para polimerizações em solventes de baixa polaridade.
Aplicações comerciais da polimerização aniônica
[editar | editar código-fonte]As polimerização aniônicas estão presentes na produção industrial de diversos polímeros, como borracha de polidieno, borrachas de estireno/butadieno em solução (SBRO, elastômeros termoplásticos, entre outros que possuem vasta aplicação comercial).
As empresas Shell e Firestone começaram a produção de cis-poliisopreno por processo aniônico em 1950. Na mesma época Philips começou a fabricar polibutadienos pela rota aniônica e seu uso não parou de crescer. Em 1962, Philips produziu, pela primeira vez de forma comercial, um copolímero de butadieno e estireno que possui excelentes características de extrusão, baixo teor de cinzas, baixa absorção de água e boas propriedades elétricas. Como resultado, esse polímero possui diversas aplicações, como revestimento de fios e cabos, revestimento de piso e solas de sapatos, por exemplo.
A polimerização aniônica também é utilizada para formação de polímeros em bloco de butadieno-estireno com grupos terminais funcionais, que foram desenvolvidos como modificadores de impacto em compostos para moldagem de folha. Na cura, essas misturas apresentam melhor equilíbrio de propriedades mecânicas, melhor resistência ao impacto, melhor pigmentabilidade e baixo encolhimento.
Também foram desenvolvidas modificações no asfalto por polímeros em bloco de butadieno e estireno, que ajudam a reduzir a fragilidade em baixas temperaturas e a resistência ao impacto no fluxo em temperaturas elevadas.
As aplicações das polimerização aniônica já têm sua importância no processo industrial estabelecida. Milhares de toneladas de elastômeros, elastômeros termoplásticos, resinas termoplásticas, polímeros especiais como melhoradores de índice de viscosidade para lubrificantes, aglutinantes de combustíveis para foguetes, entre outro materiais, são fabricados em todo o mundo.
Referências[6]
[editar | editar código-fonte]- ↑ a b c d e f g h Hsieh, H.;Quirk, R. Anionic Polymerization: Principles and practical applications; Marcel Dekker, Inc.: New York, 1996
- ↑ a b c d e Quirk, R. Anionic Polymerization. In Encyclopedia of Polymer Science and Technology; John Wiley and Sons: New York, 2003.
- ↑ a b c d e f g h i j k l m n o p q Odian, George (2004). Principles of Polymerization. Hoboken, New Jersey: John Wiley & Sons, Inc. p. 374. ISBN 9780471478751
- ↑ Bellas, Vasilios; Rehahn, Matthias (5 de março de 2009). «Block Copolymer Synthesis via Chemoselective Stepwise Coupling Reactions». Macromolecular Chemistry and Physics (em inglês) (5): 320–330. ISSN 1022-1352. doi:10.1002/macp.200800463. Consultado em 17 de janeiro de 2024
- ↑ Quirk, Roderic (25 de fevereiro de 2013). Saldívar‐Guerra, Enrique; Vivaldo‐Lima, Eduardo, eds. «Anionic Polymerization». Wiley (em inglês): 127–162. ISBN 978-0-470-63032-7. doi:10.1002/9781118480793.ch7. Consultado em 17 de janeiro de 2024
- ↑ Hsieh, Henry; Quirk, Roderic P. (15 de março de 1996). Anionic Polymerization. [S.l.]: CRC Press
