Bico
O bico é uma estrutura anatômica presente nas aves modernas e é constituído pelos ossos das maxilas superior e inferior, conhecidas respectivamente como maxilar e mandíbula, e pela ranfoteca, a qual designa a camada de queratina que recobre ambas as partes do bico. Essa estrutura apresenta adaptações específicas nas diversas espécies de aves existentes atualmente, sendo muitas dessas adaptações decorrentes do ambiente e também de fatores genéticos, tais como: adaptação ao hábito alimentar, ao canto, às estratégias de defesa e aos hábitos comportamentais. Atualmente, muitos especialistas classificam as aves de acordo com sua dieta alimentar, sendo esta constituída por aves insectívoras, frugívoras, piscívoras, carnívoras, carniceiras, nectarívoras e herbívoras. O surgimento do bico ocorreu mais de uma vez na história evolutiva, sendo que a hipótese mais bem aceita é a de que este decorre do processo de perda dos dentes em algumas linhagens de dinossauros não-avianos ascendentes das aves.
Anatomia
[editar | editar código-fonte]
O bico das aves é conhecido anatomicamente como rostro. Apesar de sua anatomia poder apresentar adaptações específicas para grupos de espécies de acordo com o nicho que ocupam,[1] suas estruturas internas apresentam padrões similares. Os bicos são constituídos pelos ossos das maxilas superior e inferior e pela bainha córnea que os recobre, conhecida como ranfoteca.[2]
Maxila superior (maxilar)
[editar | editar código-fonte]O maxilar é formado principalmente pelo ossos pré-maxilar e nasal, sendo a maxila normalmente pequena.[2] O método de movimentação do maxilar influencia na cinética cranial das aves, podendo ser do tipo “prokinesis” ou “rhynchokinesis”. Em um crânio procinético, presente na maioria das aves, o movimento da maxila superior depende da movimentação de outras estruturas cranianas, ocorrendo através da rotação em torno da articulação entre o bico e o neurocrânio. No crânio do tipo “rhynchokinesis”, a maxila superior movimenta-se para cima ou para baixo independentemente de outras estruturas cranianas.[2][3] Esse tipo de movimentação do maxilar está presente nas aves conhecidas popularmente como grous, aves limícolas, andorinhões e beija-flores.[1]
Maxila Inferior (mandíbula)
[editar | editar código-fonte]O bico inferior é composto por dois ramos mandibulares que se fundem na linha média da porção rostral das aves, denominada região sinfisiária. A primeira ligação entre a mandíbula e o crânio se dá por intermédio do osso quadrado.[2][4]
Ranfoteca
[editar | editar código-fonte]
A ranfoteca é histologicamente parecida com a pele, sendo constituída pela derme e pela epiderme. A epiderme, neste caso, apresenta duas modificações importantes quando comparada à da pele: o estrato córneo (camada de queratina) é bastante espesso e suas células contém fosfato de cálcio livre e cristais de hidroxiapatita orientados. A soma dessas características conferem à ranfoteca sua típica rigidez.[2][5]

A queratina é majoritariamente produzida por células epidérmicas e distribuem-se rostralmente ao longo da superfície do bico. A camada queratinosa que recobre o bico superior é conhecida como rinoteca e a que recobre o bico inferior como gnatoteca. É na rinoteca que se encontra o par de narinas.[2]
A superfície queratinosa de ambas as maxilas são constituídas por um tipo de queratina de cobertura (mais fina) e um tipo de queratina de suporte de pressão (mais espessa). A queratina do tipo cobertura é encontrada nas superfícies externas e laterais dos bicos superior e inferior. A queratina do tipo suporte de pressão é encontrada na parte inferior do bico superior, no ponto de corte do bico superior e nas bordas cortantes do bico superior e inferior (tomia).[5]

O comprimento de toda a linha média dorsal da rinoteca é denominado culmen, enquanto que o comprimento de toda a linha média ventral da gnatoteca é denominado gonys. A base do culmen em algumas aves é aumentada formando estruturas ornamentais. Exemplos desses casos são o escudo frontal de galeirões e o ornamento massivo dos calaus (bicos-de-corno). A rinoteca possui uma borda cortante presente nos lados direito e esquerdo, conhecida como tomium, a qual se encaixa com o tomium de cada lado da mandíbula.[2]
Apesar de sua rigidez característica, a ranfoteca é normalmente desgastada pelo seu uso e exposição e está sendo constantemente reposta.[2] Um exemplo da sua constante reposição pode ser visto em papagaios-do-mar, em que as ranhuras da ranfoteca podem ser utilizadas como forma para se estimar a idade da ave.[6]
“Dente de ovo”
[editar | editar código-fonte]O dente de ovo é o nome dado a um pequeno processo queratinizado e pontudo, presente na parte rostral do bico superior de filhotes recém nascidos de aves. Ele é usado na eclosão para quebrar a casca do ovo e é perdido logo depois. A perfuração é alcançada através de fortes movimentos com a cabeça e é posteriormente ampliada pelo bico.[2]
Termorregulação
[editar | editar código-fonte]Recentemente, foi demonstrado que o bico do tucano-toco tem a notável capacidade de desempenhar a função de um radiador térmico transitório, ao passo que pode regular a distribuição de calor modificando o fluxo sanguíneo dos vasos presentes no bico.[7]
Adaptação Alimentar
[editar | editar código-fonte]As adaptações para o hábito alimentar concentram-se no bico, uma vez que os membros anteriores das aves estão comprometidos com modificações para o voo, estando assim impedida a sua utilização na captura do alimento.[8] O caso alimentar é consagrado na literatura científica principalmente pelo exemplo dos Tentilhões de Darwin, o qual teve grande importância na disseminação do conceito de evolução. Neste, é ilustrado como a seleção natural conduz às mudanças fenotípicas, já que esses pássaros apresentam variações morfológicas impressionantes na estrutura do bico que relacionam-se com o contexto de diferentes nichos alimentares ocupados.[9] A dieta alimentar como fator adaptativo do bico, portanto, pode ser abordada por seu aspecto relacionado a fatores bióticos, que corresponde ao tipo de alimento consumido pelas aves, mas também por fatores abióticos e pela sazonalidade, como será abordado adiante.
Adaptação ao tipo de alimento
[editar | editar código-fonte]Devido às suas especializações comportamentais, como o voo, e principalmente morfológicas, como o bico e as asas, as aves são capazes de explorar diversos tipos de ambiente, resultando na apresentação de uma ampla variedade de alimentação[10] e permitindo sua classificação em dois grandes grupos que refletem seus hábitos: aves generalistas e aves especialistas. As espécies de aves generalistas, ou também chamadas de onívoras ou eurifágicas, são capazes de utilizar uma ampla gama de recursos, se alimentando do que é sazonalmente abundante. As aves especialistas ou estenofágicas, por sua vez, são aquelas que usam apenas uma quantidade estreita de algum tipo de recurso, não tão variado.[11]

A diversidade de dietas e comportamentos das aves é evidente quando se analisa aspectos de sua anatomia, como os pés, asas, cauda e principalmente seus bicos. As diferentes adaptações, principalmente anatômicas supracitadas, são importantes para lidar com os diversos itens alimentares, resultando, dessa forma, em uma ampla variedade no formato de bicos.[12][13]
Neste aspecto, tem-se que algumas espécies se especializaram em sondar vegetação como folhas, troncos de árvore e solo enquanto outras se restringem ao consumo de pequenos lagartos, anelídeos, moluscos, crustáceos, sapos, répteis, mamíferos, peixes, néctar e até mesmo outras aves.[11][12] Assim, uma outra subdivisão mais específicas das aves ocorre de acordo com o tipo de alimento que compreende sua dieta principal (pelo menos 50% de um alimento em particular), mas não única, como por exemplo:[14]
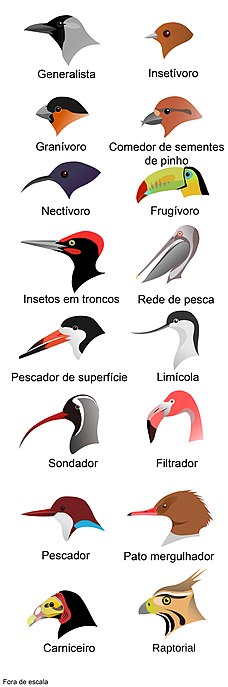
- Insetívoros: são aves que se alimentam de insetos, como por exemplo, andorinhões e andorinhas. A maioria dos grupos com essa dieta têm o bico achatado e largo na sua base, sendo relativamente longo. Isso facilita no alcance dos insetos no momento da captura. Contudo, outros grupos com essa mesma alimentação, capturam presas com bicos curtos e semelhantes a pinças. Podem ser observadas em volta do bico grande número de vibrissas que atuam auxiliando na captura de insetos. Algumas espécies insetívoras possuem um pequeno gancho na ponta do bico, que ajuda na quebra da carapaça quitinosa de artrópodes.[15]
- Frugívoros: são aves que comem frutos e frutas. Os papagaios possuem o bico bastante curvado e forte, de forma que esse bico o possibilita quebrar frutos e sementes duras. Essas aves podem possuir um bico cônico, onde as bordas cortantes descascam as sementes. Este é o tipo de bico encontrado, por exemplo, no canário doméstico.[15]
- Piscívoros: aves que comem peixes, como martim-pescadores, garças, pinguins e gaivotas. Diversas adaptações são necessárias para capturar peixes. Geralmente, essas aves possuem pescoços longos com bicos retos e pontiagudos para “esfaquear” a presa. Outras aves, como papagaios-do-mar, possuem serrilhas em seu bico conseguindo agarrar os peixes de forma que essa ave possa abrir a boca logo após uma pescaria para coletar mais peixes, já que os que estão na sua boca não conseguem escapar.[11][15]
- Carnívoros: alimentam-se de vertebrados. Essas aves possuem o bico adaptado para rasgar a carne de suas presas. Alguns exemplos são falcões, águias, garças e gaviões.[11][15]
- Carniceiros: se alimentam de material em decomposição, como o exemplo de abutres e urubus.[15]
- Nectarívoros: tem o hábito de consumir néctar. Exemplo de aves nectarívoras são os beija-flores. Eles possuem uma variedade de modificações para a exploração do néctar, como diversos comprimentos e curvatura de bico, adaptados a diferentes tamanhos e formas de flores, permitindo que estas aves alcancem o nectário.[15]
- Herbívoros: são as espécies comedoras de material vegetal.[15]
Ademais, algumas espécies de aves podem usar seu bico como “pinças”, manobrando pequenos galhos para extrair as larvas de madeira em decomposição ou para remover suas presas de substratos resistentes, como o exemplo do pica-pau (Camarhynchus pallidus).[13][14] Os tucanos, por sua vez, possuem um bico grande, porém leve que é usado com muita eficiência para coletar frutos nas pontas dos galhos que não suportariam o peso da ave. Além disso, os tucanos podem também se alimentar de pequenos vertebrados.[15] Os bicos dos pelicanos e flamingos são altamente especializados e adaptados para separar os alimentos que constituem a sua dieta da água, possuindo um bico filtrador. Os flamingos alimentam-se em águas rasas com o pescoço curvado para baixo, de modo que a maxila superior fique voltada para o fundo lodoso.[11][15]
Adaptação à forma de obtenção do alimento
[editar | editar código-fonte]Novas pesquisas têm se debruçado sobre novos pontos de vista acerca das variáveis que influenciam a adaptação para a dieta das diferentes espécies de aves. Em uma pesquisa conduzida por Korzoun et al.,[16] analisou-se, sob a óptica morfofuncional do bico, aspectos ecológicos e etiológicos (do comportamento social) que levaram à irradiação de algumas famílias do grupo polifilético de aves denominado “Gobe-Mouches”, o qual inclui rouxinóis e tordos. Neste, foi demonstrado que a condição mais derivada dos bicos das famílias Platysteiridae e Monarchidae, comparando-se a família Muscicapidae, deve-se principalmente à luminosidade e densidade do ambiente que habitam. Essas condições, em mata fechada, selecionaram aves com maior globo ocular, o que altera grande parte da anatomia e cinética de seus bicos. Outra mudança nessas duas últimas famílias foi a aquisição de uma protuberância frontal ondulada e rígida com inserção de penas acima do bico, desempenhando o papel de proteção contra choques mecânicos em colisões acidentais comuns no ambiente de mata fechada. Assim, foi possível compreender melhor a relação entre a estrutura anatômica dos diferentes tipos de bico nessas espécies e as restrições ambientais que a ela conduziram, identificando as adaptações tróficas mais significativas.[16]

Um outro aspecto que também vem sendo alvo de análise sobre a variação morfológica do bico, ecológica e a dieta alimentar das aves é a variação sazonal.[17] Visto que o bico das aves é o principal contato com o alimento e que passa por um constante balanço entre desgaste e crescimento da camada ranfoteca (camada de queratina), a variação entre dietas alimentares ao longo do ano para uma mesma espécie de ave pode explicar a mudança morfológica do bico sazonalmente.[17] Isto é o que ocorre, por exemplo, para a espécie de aves conhecida como trepadeiras (Sitta europaea). Nesse caso, durante o inverno, quando esses pássaros se alimentam de sementes, ocorre maior abrasão do bico justamente pela manipulação desse alimento, caracterizando os bicos menores, mais forte e robustos que permitem melhor manipulação das sementes. No verão, por outro lado, quando as trepadeiras se alimentam majoritariamente de invertebrados, a taxa de abrasão diminui e observa-se bicos mais compridos e finos, visto que esse alimento não causa tanto desgaste do bico, o que permite o seu crescimento.[17] Essas informações ainda explicam o porquê de ocorrer maior diferenciação nos formatos e tamanhos do bico entre machos e fêmeas das trepadeiras em determinadas estações do ano, causando dimorfismo. Nesse sentido, deduz-se que na época reprodutiva, quando as fêmeas ficam em função de chocar os ovos e são alimentadas pelos machos, o bico delas sofre menos abrasão, ao contrário do deles, o que causa uma disparidade morfológica. E, na época em que os filhotes precisam ser alimentados, o tamanho dos bicos dos adultos diminui consideravelmente, pelo maior esforço de forrageio dos pais.[17]
Há também casos mais complexos que evocam conjuntamente fatores bióticos, abióticos e o quesito da sazonalidade para explicar a variação entre os padrões de bico e a alimentação. Isso ocorre, por exemplo, nas aves do gênero Loxia. Nessas aves, há a correspondência entre a morfologia do bico, representada pelo seu tamanho e sua curvatura, com o tipo de alimento consumido (o tipo de conífera da qual retiram as sementes), a temperatura do ambiente em que vivem, sua sazonalidade e a dificuldade de acesso ao alimento.[18]
Adaptações para a Comunicação
[editar | editar código-fonte]O bico exerce importante papel sobre a comunicação, intermediando o canto emitido pelos pássaros. As vocalizações podem sofrer influência da morfologia e função desse órgão, assim como do comportamento da ave. Desse modo, gera-se particularidades na composição musical, o que a torna única para cada uma das espécies e até mesmo indivíduos.
Evocando os tentilhões de Darwin, novas pesquisas sobre esse caso clássico têm abordado um novo aspecto das implicações morfológicas da diferenciação do bico para dietas distintas, procurando-se compreender as consequências dessas adaptações para o sistema acústico dos tentilhões. Dessa forma, as diferenças nos formatos e funções dos bicos conduzem para uma diferença nas habilidades vocais e na estrutura acústica desses pássaros.[9]
Sabe-se que o bico, juntamente com a laringe e a traqueia, altera a estrutura espectral do som produzido pela siringe das aves. Assim, o bico atua como um filtro que seleciona frequências e permite a concentração em uma única. Esse aparelho funciona por ressonância, sendo análogo a instrumentos de sopro. Assim, uma forma de ajustar esse aparelho, ocasionando mudanças na frequência acústica, é a alteração na abertura do bico. Abrindo-o ou fechando-o pode-se selecionar as frequências emitidas, propagando sons mais agudos em aberturas mais amplas, por exemplo.[9]
Padrões da evolução vocal também podem ser moldados pela variação na função do bico, dado o papel ativo dos movimentos dele na produção do som, pelas mudanças dinâmicas na configuração do trato vocal. Assim, espécies especialistas em sementes duras, por exemplo, podem possuir mudanças na biomecânica e no controle neural da função da mandíbula, podendo limitar a capacidade dela de realizar mudanças rápidas na abertura-fechamento do bico. Tais adaptações, ao longo do tempo evolutivo, podem estabelecer limites na evolução de parâmetros específicos da música. Em um outro lado do espectro, contudo, aves com bicos delgados evoluídos para a apreensão devem enfrentar restrições mecânicas menos severas na dinâmica das canções.[9]
Existem dietas mais específicas para as quais foram selecionadas aves com bicos adaptados, sendo que essas modificações do bico podem apresentar influência sobre a determinação das habilidades vocais dessas aves. No clássico dos tentilhões, acredita-se que a tendência de combinar a abertura do bico com as frequências da fonte estava presente no seu ancestral comum e a correlação foi conservada durante a irradiação desses pássaros, apesar da variação substancial na evolução da morfologia do bico e tamanho do corpo. Isso sugere que é provável que as adaptações para a alimentação e seus efeitos resultantes sobre a versatilidade do bico tenham influenciado a estrutura musical do canto, secundariamente. Desse modo, os pássaros que tiveram aumento do bico sofreram uma troca entre força e rapidez em seu uso, diminuindo a velocidade de abertura, a qual é acompanhada de mudanças na arquitetura muscular. Eles possuem, portanto, menor mobilidade e emitem menos sílabas por tempo e sons menos elaborados, em termos de fatores motores na produção vocal.[9]

Existem muitas variações na forma de utilização do bico, sendo que esta pode influenciar até mesmo no comportamento de algumas espécies, como ocorre com alguns pinguins. Neste exemplo, o bico é usado como instrumento para canalizar ou onidirecionar sinais sonoros, além de proporcionar sinalização visual para reconhecimento de parceiros ou filhotes. Esses sinais sonoros apresentam características específicas, como se fossem a “assinatura” de cada indivíduo. Diante disso, em espécies de pinguim que localizam os parceiros e/ou filhotes por pontos de referência geográfica e visual, o sinal sonoro é emitido, de modo geral, com a postura do bico voltada para o céu, com a emissão onidirecional da frequência sonora e a postura visual ajudando na orientação de reconhecimento, como ocorre com as espécies do Pinguim-Rei (Aptenodytes patagonicus), Pinguim-de-Adélia (Pygoscelis adeliae), Pinguim-gentoo (Pygoscelis papua), Pinguim-macaroni (Eudyptes chrysolophus), Pinguim-de-olho-amarelo (Megadyptes antipodes), Pinguim-africano (Spheniscus demersus) e Pinguim-azul (Eudyptula minor) . Em espécies que não usam pontos de referência geográficos, é comum a postura do bico voltada para baixo a fim de canalizar a frequência e permitir um sentido de marcha para os parceiros, sem grandes influências na comunicação visual, como ocorre na espécie do Pinguim-Imperador (Aptenodytes forsteri).[19]
Adaptações e consequências diretas para a reprodução
[editar | editar código-fonte]A variação dos bicos, também causada por pressões seletivas alimentares e/ou de canto, pode ter grande impacto no comportamento reprodutivo das espécies. Assim, tem-se verificado como a mudança morfológica e comportamental envolvendo essa estrutura têm impacto sobre aspectos não tão diretamente relacionados a ela.
Em relação a adaptações para o nicho alimentar, no caso das aves do grupo Loxia, existem grandes desdobramentos da variação morfológica do bico no hábito reprodutivo. Nelas ocorre importante diversidade no período e duração da reprodução, podendo ser sazonal e curta, contemporânea à maturação dos cones (sua fonte alimentar principal) ou bem ampla.[18]
Isso acontece, pois há duas características que se relacionam nesse gênero de aves. São elas o tamanho e curvatura do bico - relacionados à alimentação por meio de diferentes espécies de coníferas, e a determinação da reprodução desses pássaros - ligada à disponibilidade de alimento, que se diversifica também em função das condições físicas ambientais, como a temperatura e o fotoperíodo, variando de acordo com a espécie de conífera explorada.[18]
O prolongamento da duração da reprodução ao longo do ciclo anual é oportunista sobre situações de sazonalidade favoráveis em relação à maturidade e deiscência dos cones. Um longo período de reprodução tem muitas vantagens: aumento do número de jovens elevados e independência juvenil no momento da deiscência, quando o acesso a sementes é o mais fácil e ocorre a possibilidade de várias reproduções sucessivas para o mesmo casal, além da reprodução para jovens nascidos no início da mesma estação. Essas vantagens e a correlação do bico com estrutura do cone são testemunhos, assim, de uma adaptação ótima (no nível individual e da população) ao uso dos recursos disponíveis em cada contexto climático: montanha, mediterrâneo, tropical.[18]

Para algumas espécies do gênero Loxia, o tamanho do bico não é um problema para romper o cone, a grande limitação seria portanto o balanço entre a disponibilidade de recursos alimentares e o gasto energético para os obter, causando um período reprodutivo reduzido. Exemplos disso são as espécies do norte da Europa em que o grande fator limitante para elas é a deiscência tardia das sementes, que ocorre no final do inverno, tornando o gasto energético para a abertura do cone extremamente desfavorável, já que essas aves estão em um período de frio que ocasiona um grande gasto energético. No caso dos Loxia das Filipinas, a situação é contrária: o bico é muito pequeno, o que impossibilita a abertura do cone. Diante disso, como as sementes são a principal fonte de energia que supre as necessidades para a reprodução, esses pássaros têm como estratégia a busca de alimento alternativo, que corresponde a invertebrados que são abundantes na região tropical, até que as sementes sejam disponibilizadas pela deiscência e eles possam se reproduzir, assim em um período também mais curto.[18]
Ademais, referindo-se ao caso de como adaptações vocais podem interferir na reprodução, podemos analisar os tentilhões.
As adaptações do bico para o canto, justamente por alterarem a forma como esses pássaros interagem, pode repercutir sobre os nichos de reprodução deles. Isso faz com que surjam grupos que acabem se diferindo e ocasionando diminuição do fluxo gênico entre populações diferentes de tentilhões. Com isso, pode haver diferenciações em espécies novas.[9]
Esse processo se dá, pois, como é o caso de muitos pássaros cantores, as canções desse grupo são produzidas exclusivamente pelos machos e são usadas em dois contextos principais: defesa de território e atração de parceiro. Assim, os padrões de diversidade musical influenciam diretamente a dinâmica de acasalamento interespecífica, as probabilidades de hibridização e finalmente o processo de especiação. A partir disso e à medida que as canções evoluem, espera-se que as preferências das fêmeas evoluam em conjunto, não tanto por meio de mudanças genéticas, mas devido à plasticidade nas escolhas delas possibilitadas pelo aprendizado.[9]
Desse modo, pode-se perceber que tanto variações na dieta alimentar, como na estrutura vocal entre os indivíduos são passíveis de gerar diferenciações na ecologia da reprodução das aves.
Variação na forma de bicos
[editar | editar código-fonte]A aparência externa do bico é específica de espécie e gênero.[20] Contudo, é interessante notar que pássaros individuais da mesma espécie, ou seja que possuem a mesma morfologia típica, se alimentam de maneira diferente um do outro, ou apresentam diferenças sutis no formato do bico.[11] Algumas variações de formato e cor de bico estão representadas a seguir:
Evolução do bico
[editar | editar código-fonte]O bico é atualmente conhecido por muitos como uma característica exclusiva do grupo das aves modernas, sendo considerado uma estrutura anatômica rígida, de superfície queratinizada, sem dentes e que possui uma enorme quantidade de funções.[21] No entanto, a realidade é que o bico está presente em vários clados de tetrápodes, não apenas nas aves modernas.[22] O estudo da origem e evolução dos bicos tem chamado a atenção de muitos pesquisadores, dessa forma surgindo frequentemente novas hipóteses que se baseiam principalmente em análises de fósseis.
Levando-se em consideração a linhagem evolutiva das aves modernas e reconhecendo-se a sua descendência do grande grupo dos dinossauros, um importante processo assumido para o surgimento dos bicos é o edentulismo, que consiste na perda de dentes ao longo da vida e ocorreu de forma independente várias vezes na história dos tetrápodes.[23] Essa perda de dentes no decorrer da evolução não ocorreu apenas na linhagem de dinossauros que deu origem às aves, mas também em linhagens de dinossauros não-aviários.[24]

Um dos melhores exemplos de edentulismo que agrega novas e relevantes considerações sobre a origem dos bicos é a recente descoberta de 19 espécimes de Limusaurus inextricabilis (um dinossauro, terópode ceratosauriano jurássico) em diferentes estágios de desenvolvimento, que revelou um caso de edentulismo em que os jovens dessa espécie apresentam mandíbulas totalmente dentadas e seus indivíduos maduros apresentam mandíbulas completamente sem dentes,[22] assemelhando-se muito a um bico desdentado.[21] Essa ausência de dentes possivelmente pode estar relacionada a perda dos dentes das extremidades da mandíbula e também pela diminuição e até mesmo falta de reposição dos mesmos. Essa alteração da dentição ao longo da vida desses animais pode ter levado também a uma alteração de seus hábitos alimentares, sendo que segundo análises de isótopos estáveis e presença de gastrólitos nos adultos, os Limusaurus inextricabilis passaram de uma possível dieta onívora para uma dieta herbívora por conta da ausência de dentes no seu estágio mais maduro.[22]
Durante muito tempo, o bico sem dentes das aves modernas foi considerado apenas como uma adaptação ecológica para a alimentação, porém atualmente, com os novos estudos realizados, sabe-se que os fatores de desenvolvimento genéticos também são responsáveis por essa ausência de dentes.[24] Algumas pesquisas de biologia do desenvolvimento recentes utilizaram-se da manipulação genética de embriões de galinhas para comprovar que ajustes genéticos podem ter levado ao desenvolvimento dos bicos das aves. Os genes Fgf8 e Lef1, que atuam na determinação facial, estão presentes em linhagens de répteis e aves modernas, porém apresentam aplicações distintas em cada grupo no início do desenvolvimento embrionário. No presente estudo, através da manipulação laboratorial, as proteínas sintetizadas por esses genes foram inibidas no embrião da galinha, resultando em embriões com focinhos parecidos com os de dinossauros (Velociraptor) e sendo que a ausência de dentes persiste mesmo com modificações tão extremas da forma de bico para focinho.[25]
As informações disponíveis até o momento sobre a evolução e o surgimento do bico em aves permitem concluir que este evento aconteceu mais de uma vez e que os fatores que levaram a essa adaptação foram tanto relacionados às necessidades ecológicas quanto resultantes de determinação genética.[24]
Referências
[editar | editar código-fonte]- ↑ a b Speer, B. et al. Anatomy and Disorders of Beak and Oral Cavity of Birds. Vet Clin Exot Anim. 2016. 707-736.
- ↑ a b c d e f g h i King AS, McLelland J. Birds–their structure and function. 2nd edition. London: Baillière Tindall; 1984.
- ↑ Bock WJ. Kinetics of the avian skull. J Morphol. 1964.114(1):1–41.
- ↑ Costa TVV & Donatelli RJ. Osteologia craniana de Nyctibiidae (Aves, Caprimulgiformes). Pap. Avulsos Zool. 2009. 49(21).
- ↑ a b Carril J, Degrange FJ, Tambussi CP. Jaw myology and bite force of the monk parakeet (Aves, Psittaciformes). J Anat. 2015. 227(1):34–44.
- ↑ Harris MP. Aging Atlantic Puffins Fratercula arctica in summer and winter. SEABIRD. 2014. 27:22-40.
- ↑ Tattersall GJ, Andrade DV & Abe AS. Heat Exchange from the Toucan Bill Reveals a Controllable Vascular Thermal Radiator. Science. 2009. 325:468-470.
- ↑ SILVEIRA, LUÍS FÁBIO. "Pescadores habilidosos."
- ↑ a b c d e f g Podos, Jeffrey, and Stephen Nowicki. "Beaks, adaptation, and vocal evolution in Darwin's finches." AIBS Bulletin 54.6 (2004): 501-510.
- ↑ Gill FB. Ornithology. New York: Freeman; 2007.
- ↑ a b c d e f LOVETTE, Irby J.; FITZPATRICK, John W. The Handbook of Bird Biology. 3. ed. Wiley-Blackwell, 2016.
- ↑ a b JR, Cleveland P. Hickman et al. Princípios integrados de zoologia. 15. ed. Rio de Janeiro: Guanabara Koogan, 2013.
- ↑ a b Kissling, W. D., Sekercioglu, C. H. & Jetz, W. Bird dietary guild richness across latitudes, environments and biogeographic regions. Global Ecol. Biogeogr. 21, 328–340 (2012a).
- ↑ a b Burin, G., Kissling, W. D., Guimarães, P. R., SekercioGlu, Ç. H., & Quental, T. B. (2016). Omnivory in birds is a macroevolutionary sink. Nature Communications, 7, 11250. doi:10.1038/ncomms11250
- ↑ a b c d e f g h i SILVEIRA, L. F. Apostila de Ornitologia Básica. Museu de Zoologia da USP;. Disponível em :https://www.ib.usp.br/~lfsilveira/pdf/d_2012_ornitologiabasica.pdf
- ↑ a b Korzoun, Léonide P., Christian Érard, and Jean-Pierre Gasc. "Analyse morphofonctionnelle et adaptations trophiques: le cas de l’appareil du bec des gobe-mouches de l'Ancien Monde." Comptes Rendus de l'Académie des Sciences-Series III-Sciences de la Vie 323.10 (2000): 867-876.
- ↑ a b c d Matthysen, E. R. I. K. "Seasonal variation in bill morphology of nuthatches Sitta europaea: dietary adaptations or consequences." Ardea 77.1 (1989): 117-125. 4 - Podos, Jeffrey, and Stephen Nowicki. "Beaks, adaptation, and vocal evolution in Darwin's finches." AIBS Bulletin 54.6 (2004): 501-510.
- ↑ a b c d e CLOUET, Michel. "Taille du bec et période de reproduction chez les beccroisés des forêts de pins." (2003).
- ↑ ROBISSON, Patrice. "Adaptation du transfert de l'information individuelle au milieu colonial chez les manchots." Revue d'écologie, 1993, N° 2, Symposium" Ecologie, comportement et évolution", Société française d'écologie et Société française pour l'étude du comportement animal. Réunion commune, Chizé, France, 17-19 Mars 1992. Société nationale de protection de la nature et d'acclimatation de France, Paris (FRA), 1993.
- ↑ BAUMEL, Julian J. et al. Handbook of Avian Anatomy: NOMINA ANATOMICA AVIUM. 2. ed. MASSACHUSETTS: Published By The Club, 1993. 779 p.
- ↑ a b OLIVEIRA U., AYROLLA D. Dinossauros e a origem dos bicos das aves. Papo de primata. (2017) Disponível em https://papodeprimata.com.br/dinossauros-e-a-origem-dos-bicos-das-aves/
- ↑ a b c WANG S., STIEGLER J., AMIOT R. et al. Extreme Ontogenetic Changes in a Ceratosaurian Theropod. Current Biology, vol 27, 144–148. (2017). Disponível em https://www.sciencedirect.com/science/article/pii/S0960982216312696
- ↑ LAUTENSCHLAGER S., WITMER L.M., et al. Edentulism, beaks, and biomechanical innovations in the evolution of theropod dinosaurs. Proceedings of the National Academy of Sciences of the United States of America. (2013). Disponível em https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3870693/
- ↑ a b c YANG TR., SANDER PM. The origin of the bird's beak: new insights from dinosaur incubation periods. The Royal Society, Biology letters. 2018. Disponível em: https://rsbl.royalsocietypublishing.org/content/14/5/20180090
- ↑ BHULLAR BA. , MORRIS ZS. ET AL. A molecular mechanism for the origin of a key evolutionary innovation, the bird beak and palate, revealed by an integrative approach to major transitions in vertebrate history. Evolution, The Society for the Study of Evolution. (2015). Disponível em https://onlinelibrary.wiley.com/doi/full/10.1111/evo.12684










