Zerowa zasada termodynamiki
Wygląd
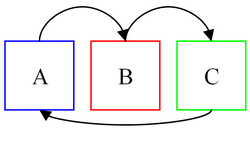
Zerowa zasada termodynamiki głosi, że[1]:
- Jeśli układy A i B mogące ze sobą wymieniać ciepło są ze sobą w równowadze termicznej, i to samo jest prawdą dla układów B i C, to układy A i C również są ze sobą w równowadze termicznej.
Z zerowej zasady wynika istnienie temperatury empirycznej. Istnieje mianowicie taka wielkość fizyczna która jest równa dla układów A i B, będących ze sobą w równowadze termicznej. W rzeczywistości takie określenie nie oznacza jeszcze znanej temperatury ponieważ może być dowolną funkcją
Zerowa zasada termodynamiki stwierdza także, że ciało w równowadze termodynamicznej ma wszędzie tę samą temperaturę.
Zobacz też
[edytuj | edytuj kod]- termodynamika
- zasady termodynamiki
Przypisy
[edytuj | edytuj kod]- ↑ termodynamiki zasady, [w:] Encyklopedia PWN [online], Wydawnictwo Naukowe PWN [dostęp 2021-10-02].
Linki zewnętrzne
[edytuj | edytuj kod] Carlo Rovelli, Death and Resurrection of the Zero-th Principle of Thermodynamics, kanał FQxI na YouTube, 26 lutego 2014 [dostęp 2023-05-21].
Carlo Rovelli, Death and Resurrection of the Zero-th Principle of Thermodynamics, kanał FQxI na YouTube, 26 lutego 2014 [dostęp 2023-05-21].




