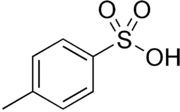
Kwas p-toluenosulfonowy
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C7H8O3S | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
CH3C6H4SO3H | ||||||||||||||||||||||||||||||||||||||||||
| Masa molowa |
172,20 g/mol | ||||||||||||||||||||||||||||||||||||||||||
| Wygląd |
biały lub prawie biały, krystaliczny proszek lub kryształy[1] | ||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||
Kwas p-toluenosulfonowy, kwas tosylowy – organiczny związek chemiczny z grupy aromatycznych kwasów sulfonowych. Jest kwasem mocnym (pKa = −2,8), o mocy porównywalnej z kwasem siarkowym (pKa1 = −3).
Otrzymywanie
[edytuj | edytuj kod]Otrzymywany w reakcji sulfonowania toluenu stężonym kwasem siarkowym[7] lub kwasem chlorosulfonowym (w tym przypadku powstaje głównie chlorek tosylu). Bardzo dobrze rozpuszczalny w wodzie, krystalizuje jako monohydrat. Z zasadami tworzy sole, np. p-toluenosulfonian sodu.
Właściwości i zastosowanie
[edytuj | edytuj kod]Stosowany jako katalizator kwasowy rozpuszczalny w rozpuszczalnikach organicznych, np. w reakcjach estryfikacji[8] lub do eliminacji grupy hydroksylowej.
Przypisy
[edytuj | edytuj kod]- ↑ a b Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.
- ↑ V.A. Kozlov, I.A. Popkova, B.D. Berezin, The Solubility of Sulphonic Acid Hydrates in Aqueous Acid Systems, „Russian Journal of Physical Chemistry”, 55 (6), 1981, s. 827–830.
- ↑ Ikchoon Lee i inni, Cross-interaction constants as a measure of the transition state structure. Part 11. Solvolyses of 1-phenyl-2-propyl benzenesulphonates, „Journal of the Chemical Society, Perkin Transactions 2”, 5, 1991, s. 785–791, DOI: 10.1039/P29910000785 (ang.).
- ↑ a b c Kwas p-toluenosulfonowy, monohydrat (nr 402885) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2012-04-27]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Julius v. Braun, Ernst Anton, Karl Weißbach, Die Methylierung des alkoholischen Hydroxyls vom Standpunkt der Elektronen-Theorie, „Berichte der deutschen chemischen Gesellschaft”, 63 (10), 1930, s. 2847–2861, DOI: 10.1002/cber.19300631027 (niem.).
- ↑ Kwas p-toluenosulfonowy (nr 402885) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2012-04-27]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ J.D. Roberts, M.C. Caserio, Chemia organiczna, Warszawa: Państwowe Wydawnictwo Naukowe, 1969, s. 807.
- ↑ Kyoji Furuta, Qing-Zhi Gao, Hisashi Yamamoto, Chiral (Acyloxy)borane Complex-catalyzed Asymmetric Diels-Alder Reaction: (1R)-1,3,4-Trimethyl-3-cyclohexene-1-carboxaldehyde, „Organic Syntheses”, 72, 1995, s. 86, DOI: 10.15227/orgsyn.072.0086 (ang.).