CD3
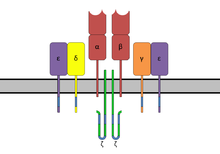
CD3 (ang. cluster of differentiation 3) – główny marker limfocytów T. Jest to złożony z kilku cząsteczek białkowych koreceptor tych komórek, składający się z czterech różnych łańcuchów peptydowych. U ssaków w skład kompleksu CD3 wchodzą: łańcuch CD3γ, łańcuch CD3δ, dwa łańcuchy CD3ζ i dwa łańcuchy CD3ε[1]. Razem z receptorem limfocytu T tworzą one kompleks TCR (ang. T-cell receptor), który jest odpowiedzialny za dostarczenie aktywującego sygnału do limfocytów T[2]. Mimo że w literaturze naukowej łańcuch ζ jest wciąż nazywany jako CD3ζ, oficjalna nazwa tego peptydu w nomenklaturze CD to CD247[3].
Historia
[edytuj | edytuj kod]W roku 1979, w wyniku prac nad izolacją przeciwciał monoklonalnych produkowanych na bazie limfocytów B uzyskiwanych od zwierząt immunizowanych ludzkimi leukocytami, zidentyfikowano przeciwciało oznaczone jako OKT3, które wiązało się z ludzkimi limfocytami T, ale nie z limfocytami B, granulocytami, monocytami i komórkami NK[4]. Przeciwciało OKT3 okazało się istotne nie tylko ze względu na reaktywność względem określonej grupy leukocytów, ale także ze względu na wywoływanie aktywacji limfocytów T[5]. W roku 1980 wykazano, że przeciwciało OKT3 reaguje swoiście z limfocytami T wykrywanymi standardowo wówczas stosowanym testem rozetkowym[6]. Rok później Chang i wsp.[7] opisali antygen reagujący z przeciwciałem OKT3 jako element kompleksu odpowiedzialnego za rozpoznawanie antygenów przez komórki T. Na podstawie tych i innych badań przeciwciało OKT3 zostało uznane za cząsteczkę reagującą z molekułą swoistą dla limfocytów T i w ramach prac konferencji Human Leukocyte Differentiation Antigens (HLDA), która ustala nomenklaturę CD, antygen rozpoznawany przez przeciwciało OKT3 uzyskał oficjalną nazwę CD3[8].
Ekspresja
[edytuj | edytuj kod]Każdy z łańcuchów CD3 jest kodowany przez osobny gen:
- łańcuch CD3γ jest kodowany przez gen CD3G, u człowieka zlokalizowany na chromosomie 11q23[9],
- łańcuch CD3δ jest kodowany przez gen CD3D, również zlokalizowany na chromosomie 11q23[10],
- łańcuch CD3ζ jest kodowany przez gen CD247 (dawniej CD3Z), znajdujący się na chromosomie 1q22-q25[3]. W wyniku alternatywnego splicingu łańcuch CD3ζ może być wytwarzany w formie zawierającej mniej motywów aktywujących limfocyty i jest wtedy określany jako CD3η. Ta forma białka jest produkowana głównie w tymocytach i zastępuje częściowo CD3ζ w kompleksach TCR. mRNA dla CD3η wykrywany jest także w dojrzałych limfocytach T, jednak jego zawartość jest znacznie mniejsza (10 razy i więcej), niż mRNA dla CD3ζ, stąd też uważa się, iż CD3η pełni swe funkcje głównie w trakcie rozwoju limfocytów T[11].
W trakcie rozwoju limfocytów T w grasicy ekspresję białek CD3 stwierdzić można na etapie protymocytu, jednak tylko w cytoplazmie komórki. Podobna sytuacja występuje na etapie pretymocytu, jednak z chwilą zapoczątkowania ekspresji łańcuchów TCRα i TCRβ cząsteczki CD3 pojawiają się również w błonie komórkowej. Błonowa (powierzchniowa) ekspresja CD3 jest charakterystyczna dla każdego dalszego stadium rozwojowego limfocytów T i utrzymuje się do końca życia komórki[12].
Poza limfocytami T słabą ekspresję CD3, zlokalizowaną jedynie w cytoplazmie, stwierdzono w komórkach Purkiniego[13].
Struktura
[edytuj | edytuj kod]Łańcuchy peptydowe CD3γ, CD3δ i CD3ε należą do tej samej nadrodziny immunoglobulin i wykazują silne podobieństwo w sekwencji aminokwasowej i strukturze. Wszystkie one posiadają zewnątrzkomórkową domenę immunoglobulinopodobną, następnie helikalny fragment przechodzący przez błonę komórkową oraz ogon cytoplazmatyczny, zawierający aktywujące sekwencje ITAM. Każdy z łańcuchów γ,δ i ε zawiera dwa motywy ITAM. Z kolei łańcuch CD3ζ nie posiada zewnątrzkomórkowej domeny immunoglobulinowej, zawiera natomiast cztery motywy ITAM w części cytoplazmatycznej. Wariant CD3η posiada trzy motywy ITAM[14]. Region transbłonowy każdej z cząsteczek CD3 jest ujemnie naładowany, co w rezultacie prowadzi do tworzenia kompleksu z dodatnio naładowanymi łańcuchami TCR. W ten sposób dochodzi do tworzenia kompleksów: TCRα-CD3γ-CD3ε-CD3ζ-CD3ζ oraz TCRβ-CD3δ-CD3ε, które razem tworzą pełny kompleks TCR[15].
Funkcja
[edytuj | edytuj kod]Same łańcuchy TCR posiadają jedynie krótką sekwencję cytoplazmatyczną, która nie przekazuje sygnału. Funkcję tę spełniają właśnie łańcuchy CD3, które po związaniu antygenu przez TCR zapoczątkowują kaskadę sygnałową w limfocytach T poprzez rekrutację kinazy ZAP70 na skutek fosforylacji reszt tyrozyny w motywach ITAM[16].
CD3 jako cel terapeutyczny
[edytuj | edytuj kod]Limfocyty T są komórkami, które w znacznej mierze odpowiadają za rozwój zapalenia. Z tego względu czynniki, których działanie w założeniu miałoby hamować aktywację CD3 (a w związku z tym limfocytów T), są testowane pod kątem właściwości przeciwzapalnych w chorobach autoimmunizacyjnych[17] i cukrzycy typu 1[18][19].
Zastosowanie w badaniach naukowych i diagnostyce
[edytuj | edytuj kod]Ze względu na fakt, że białko CD3 jest charakterystyczne dla limfocytów T, jego oznaczanie znajduje szerokie zastosowanie w badaniach naukowych. Przeciwciała monoklonalne skierowane przeciwko CD3 i koniugowane z barwnikami fluorescencyjnymi lub enzymami umożliwiają oznaczenie frekwencji lub liczby tych komórek we krwi i tkankach przy użyciu metod cytometrycznych oraz immunohistochemicznych.
W diagnostyce oznaczanie CD3 jest szczególnie użyteczne w przypadku białaczek[20].
Zobacz też
[edytuj | edytuj kod]Przypisy
[edytuj | edytuj kod]- ↑ MS. Kuhns, HB. Badgandi. Piecing together the family portrait of TCR-CD3 complexes.. „Immunol Rev”. 250 (1), s. 120-43, Nov 2012. DOI: 10.1111/imr.12000. PMID: 23046126.
- ↑ CS. Guy, DA. Vignali. Organization of proximal signal initiation at the TCR:CD3 complex.. „Immunol Rev”. 232 (1), s. 7-21, Nov 2009. DOI: 10.1111/j.1600-065X.2009.00843.x. PMID: 19909352.
- ↑ a b CD247 CD247 molecule [Homo sapiens (human) - Gene - NCBI]. [dostęp 2013-05-25].
- ↑ P. Kung, G. Goldstein, EL. Reinherz, SF. Schlossman. Monoclonal antibodies defining distinctive human T cell surface antigens.. „Science”. 206 (4416), s. 347-9, Oct 1979. PMID: 314668.
- ↑ JP. Van Wauwe, JR. De Mey, JG. Goossens. OKT3: a monoclonal anti-human T lymphocyte antibody with potent mitogenic properties.. „J Immunol”. 124 (6), s. 2708-13, Jun 1980. PMID: 6966296.
- ↑ W. de Cock, J. de Cree, H. Verhaegen. Enumeration of human peripheral T lymphocytes with E-rosettes and OKT3. PAN monoclonal antibody: a close correlation.. „Thymus”. 2 (3), s. 133-7, Dec 1980. PMID: 7008282.
- ↑ TW. Chang, PC. Kung, SP. Gingras, G. Goldstein. Does OKT3 monoclonal antibody react with an antigen-recognition structure on human T cells?. „Proc Natl Acad Sci U S A”. 78 (3), s. 1805-8, Mar 1981. PMID: 6165018.
- ↑ ML. Dustin. Opening the frontier of the T cell surface: schlossman and goldstein.. „J Immunol”. 190 (11), s. 5343-5, Jun 2013. DOI: 10.4049/jimmunol.1300951. PMID: 23687190.
- ↑ CD3G CD3g molecule, gamma (CD3-TCR complex) [Homo sapiens (human) - Gene - NCBI]. [dostęp 2013-05-25].
- ↑ CD3D CD3d molecule, delta (CD3-TCR complex) [Homo sapiens (human) - Gene - NCBI]. [dostęp 2013-05-25].
- ↑ LK. Clayton, L. D'Adamio, FD. Howard, M. Sieh i inni. CD3 eta and CD3 zeta are alternatively spliced products of a common genetic locus and are transcriptionally and/or post-transcriptionally regulated during T-cell development.. „Proc Natl Acad Sci U S A”. 88 (12), s. 5202-6, Jun 1991. PMID: 1828894.
- ↑ Fetal tissue transplants in medicine. Cambridge: Cambridge University Press, 1992, s. 115-118. ISBN 978-0-521-41075-5.
- ↑ C. Gerloff, R. Knoth, B. Volk. Cytoplasmic expression of the leu-4 (CD3) antigen in developing Purkinje cells in the rat cerebellum.. „Neuropathol Appl Neurobiol”. 19 (4), s. 313-23, Aug 1993. PMID: 8232751.
- ↑ Marie-Paule Lefranc, Gerard Lefranc: The T Cell Receptor FactsBook. Burlington: Elsevier, 2001, s. 18. ISBN 978-0-08-054264-5.
- ↑ Daisuke Kitamura: How the Immune System Recognizes Self and Nonself: Immunoreceptors and Their Signaling. Springer, 2008, s. 138. ISBN 978-4-431-73884-8.
- ↑ BB. Au-Yeung, S. Deindl, LY. Hsu, EH. Palacios i inni. The structure, regulation, and function of ZAP-70.. „Immunol Rev”. 228 (1), s. 41-57, Mar 2009. DOI: 10.1111/j.1600-065X.2008.00753.x. PMID: 19290920.
- ↑ Y. Dean, F. Dépis, M. Kosco-Vilbois. Combination therapies in the context of anti-CD3 antibodies for the treatment of autoimmune diseases.. „Swiss Med Wkly”. 142, s. w13711, 2012. DOI: 10.4414/smw.2012.13711. PMID: 23254986.
- ↑ A. Kaufman, KC. Herold. Anti-CD3 mAbs for treatment of type 1 diabetes.. „Diabetes Metab Res Rev”. 25 (4), s. 302-6, May 2009. DOI: 10.1002/dmrr.933. PMID: 19319985.
- ↑ C. Penaranda, Q. Tang, JA. Bluestone. Anti-CD3 therapy promotes tolerance by selectively depleting pathogenic cells while preserving regulatory T cells.. „J Immunol”. 187 (4), s. 2015-22, Aug 2011. DOI: 10.4049/jimmunol.1100713. PMID: 21742976.
- ↑ JJ. van Dongen, GW. Krissansen, IL. Wolvers-Tettero, WM. Comans-Bitter i inni. Cytoplasmic expression of the CD3 antigen as a diagnostic marker for immature T-cell malignancies.. „Blood”. 71 (3), s. 603-12, Mar 1988. PMID: 3278747.
