WO2021239191A1 - Perimidin-derivate und deren verwendung - Google Patents
Perimidin-derivate und deren verwendung Download PDFInfo
- Publication number
- WO2021239191A1 WO2021239191A1 PCT/DE2021/100469 DE2021100469W WO2021239191A1 WO 2021239191 A1 WO2021239191 A1 WO 2021239191A1 DE 2021100469 W DE2021100469 W DE 2021100469W WO 2021239191 A1 WO2021239191 A1 WO 2021239191A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- perimidine
- organic
- compound
- unsaturated
- formulas
- Prior art date
Links
- 125000005327 perimidinyl group Chemical class N1C(=NC2=CC=CC3=CC=CC1=C23)* 0.000 title claims abstract description 16
- 239000004065 semiconductor Substances 0.000 claims abstract description 13
- 239000000539 dimer Substances 0.000 claims abstract description 9
- 230000005693 optoelectronics Effects 0.000 claims abstract description 7
- 150000001768 cations Chemical class 0.000 claims abstract description 6
- 239000002800 charge carrier Substances 0.000 claims abstract description 6
- 238000002347 injection Methods 0.000 claims abstract description 5
- 239000007924 injection Substances 0.000 claims abstract description 5
- 239000003990 capacitor Substances 0.000 claims abstract description 4
- 239000007772 electrode material Substances 0.000 claims abstract description 4
- -1 morpholino thiomorpholino groups Chemical group 0.000 claims description 37
- 150000001875 compounds Chemical class 0.000 claims description 33
- 239000002019 doping agent Substances 0.000 claims description 28
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 claims description 20
- 229920006395 saturated elastomer Polymers 0.000 claims description 18
- 150000003839 salts Chemical class 0.000 claims description 15
- 125000001424 substituent group Chemical group 0.000 claims description 13
- 125000001072 heteroaryl group Chemical group 0.000 claims description 12
- 239000002243 precursor Substances 0.000 claims description 11
- 125000000217 alkyl group Chemical group 0.000 claims description 10
- 125000005418 aryl aryl group Chemical group 0.000 claims description 10
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 10
- 125000003545 alkoxy group Chemical group 0.000 claims description 8
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 8
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 8
- 125000004171 alkoxy aryl group Chemical group 0.000 claims description 6
- 150000001450 anions Chemical class 0.000 claims description 6
- 150000002390 heteroarenes Chemical class 0.000 claims description 6
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 5
- 238000001704 evaporation Methods 0.000 claims description 4
- 230000008020 evaporation Effects 0.000 claims description 4
- 125000004665 trialkylsilyl group Chemical group 0.000 claims description 4
- 230000005669 field effect Effects 0.000 claims description 3
- 230000015654 memory Effects 0.000 claims description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 claims description 2
- 125000002947 alkylene group Chemical group 0.000 claims description 2
- 150000001540 azides Chemical class 0.000 claims description 2
- 150000007942 carboxylates Chemical class 0.000 claims description 2
- 125000004663 dialkyl amino group Chemical group 0.000 claims description 2
- 150000002170 ethers Chemical class 0.000 claims description 2
- 150000004820 halides Chemical class 0.000 claims description 2
- 125000005842 heteroatom Chemical group 0.000 claims description 2
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 claims description 2
- 125000004430 oxygen atom Chemical group O* 0.000 claims description 2
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 claims description 2
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 2
- 125000005936 piperidyl group Chemical group 0.000 claims description 2
- 125000000719 pyrrolidinyl group Chemical group 0.000 claims description 2
- LSNNMFCWUKXFEE-UHFFFAOYSA-L sulfite Chemical compound [O-]S([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-L 0.000 claims description 2
- 229910052717 sulfur Inorganic materials 0.000 claims description 2
- 125000004434 sulfur atom Chemical group 0.000 claims description 2
- 150000001449 anionic compounds Chemical class 0.000 claims 1
- 150000002891 organic anions Chemical class 0.000 claims 1
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 36
- 239000000047 product Substances 0.000 description 22
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 20
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 15
- 150000005052 perimidines Chemical class 0.000 description 15
- 239000000243 solution Substances 0.000 description 12
- 238000004949 mass spectrometry Methods 0.000 description 10
- 239000000463 material Substances 0.000 description 10
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 9
- 238000004768 lowest unoccupied molecular orbital Methods 0.000 description 9
- 239000000203 mixture Substances 0.000 description 9
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 8
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 8
- 229940126214 compound 3 Drugs 0.000 description 7
- 238000001816 cooling Methods 0.000 description 7
- 238000003756 stirring Methods 0.000 description 7
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 6
- 238000005160 1H NMR spectroscopy Methods 0.000 description 6
- XMWRBQBLMFGWIX-UHFFFAOYSA-N C60 fullerene Chemical class C12=C3C(C4=C56)=C7C8=C5C5=C9C%10=C6C6=C4C1=C1C4=C6C6=C%10C%10=C9C9=C%11C5=C8C5=C8C7=C3C3=C7C2=C1C1=C2C4=C6C4=C%10C6=C9C9=C%11C5=C5C8=C3C3=C7C1=C1C2=C4C6=C2C9=C5C3=C12 XMWRBQBLMFGWIX-UHFFFAOYSA-N 0.000 description 6
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 6
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 6
- 229910003472 fullerene Inorganic materials 0.000 description 6
- 239000011159 matrix material Substances 0.000 description 6
- 239000000370 acceptor Substances 0.000 description 5
- 239000000975 dye Substances 0.000 description 5
- JUJWROOIHBZHMG-QYKNYGDISA-N 2-deuteriopyridine Chemical compound [2H]C1=CC=CC=N1 JUJWROOIHBZHMG-QYKNYGDISA-N 0.000 description 4
- HJXMORWPPSSVMF-UHFFFAOYSA-N 2-methyl-1h-perimidine Chemical compound C1=CC(NC(C)=N2)=C3C2=CC=CC3=C1 HJXMORWPPSSVMF-UHFFFAOYSA-N 0.000 description 4
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 4
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 4
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 4
- 229910052786 argon Inorganic materials 0.000 description 4
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 4
- 239000000706 filtrate Substances 0.000 description 4
- 238000004770 highest occupied molecular orbital Methods 0.000 description 4
- 239000001301 oxygen Substances 0.000 description 4
- 229910052760 oxygen Inorganic materials 0.000 description 4
- 229940072033 potash Drugs 0.000 description 4
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Substances [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 4
- 235000015320 potassium carbonate Nutrition 0.000 description 4
- 230000027756 respiratory electron transport chain Effects 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 238000003786 synthesis reaction Methods 0.000 description 4
- SZUVGFMDDVSKSI-WIFOCOSTSA-N (1s,2s,3s,5r)-1-(carboxymethyl)-3,5-bis[(4-phenoxyphenyl)methyl-propylcarbamoyl]cyclopentane-1,2-dicarboxylic acid Chemical compound O=C([C@@H]1[C@@H]([C@](CC(O)=O)([C@H](C(=O)N(CCC)CC=2C=CC(OC=3C=CC=CC=3)=CC=2)C1)C(O)=O)C(O)=O)N(CCC)CC(C=C1)=CC=C1OC1=CC=CC=C1 SZUVGFMDDVSKSI-WIFOCOSTSA-N 0.000 description 3
- GHYOCDFICYLMRF-UTIIJYGPSA-N (2S,3R)-N-[(2S)-3-(cyclopenten-1-yl)-1-[(2R)-2-methyloxiran-2-yl]-1-oxopropan-2-yl]-3-hydroxy-3-(4-methoxyphenyl)-2-[[(2S)-2-[(2-morpholin-4-ylacetyl)amino]propanoyl]amino]propanamide Chemical compound C1(=CCCC1)C[C@@H](C(=O)[C@@]1(OC1)C)NC([C@H]([C@@H](C1=CC=C(C=C1)OC)O)NC([C@H](C)NC(CN1CCOCC1)=O)=O)=O GHYOCDFICYLMRF-UTIIJYGPSA-N 0.000 description 3
- YFOOEYJGMMJJLS-UHFFFAOYSA-N 1,8-diaminonaphthalene Chemical compound C1=CC(N)=C2C(N)=CC=CC2=C1 YFOOEYJGMMJJLS-UHFFFAOYSA-N 0.000 description 3
- AAQTWLBJPNLKHT-UHFFFAOYSA-N 1H-perimidine Chemical compound N1C=NC2=CC=CC3=CC=CC1=C32 AAQTWLBJPNLKHT-UHFFFAOYSA-N 0.000 description 3
- HAZRBKOAALAECO-UHFFFAOYSA-M 2-ethyl-1,3-dimethylperimidin-3-ium;iodide Chemical compound [I-].C1=CC([N+](=C(CC)N2C)C)=C3C2=CC=CC3=C1 HAZRBKOAALAECO-UHFFFAOYSA-M 0.000 description 3
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
- 239000012300 argon atmosphere Substances 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 229940125797 compound 12 Drugs 0.000 description 3
- 229940126543 compound 14 Drugs 0.000 description 3
- 150000002391 heterocyclic compounds Chemical class 0.000 description 3
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 3
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 3
- 235000019341 magnesium sulphate Nutrition 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- KPQNHJKRZKOLGW-UHFFFAOYSA-N prop-1-ene-1,1,3,3-tetracarbonitrile Chemical compound N#CC(C#N)C=C(C#N)C#N KPQNHJKRZKOLGW-UHFFFAOYSA-N 0.000 description 3
- 150000003254 radicals Chemical class 0.000 description 3
- AOSZTAHDEDLTLQ-AZKQZHLXSA-N (1S,2S,4R,8S,9S,11S,12R,13S,19S)-6-[(3-chlorophenyl)methyl]-12,19-difluoro-11-hydroxy-8-(2-hydroxyacetyl)-9,13-dimethyl-6-azapentacyclo[10.8.0.02,9.04,8.013,18]icosa-14,17-dien-16-one Chemical compound C([C@@H]1C[C@H]2[C@H]3[C@]([C@]4(C=CC(=O)C=C4[C@@H](F)C3)C)(F)[C@@H](O)C[C@@]2([C@@]1(C1)C(=O)CO)C)N1CC1=CC=CC(Cl)=C1 AOSZTAHDEDLTLQ-AZKQZHLXSA-N 0.000 description 2
- ONBQEOIKXPHGMB-VBSBHUPXSA-N 1-[2-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]oxy-4,6-dihydroxyphenyl]-3-(4-hydroxyphenyl)propan-1-one Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1OC1=CC(O)=CC(O)=C1C(=O)CCC1=CC=C(O)C=C1 ONBQEOIKXPHGMB-VBSBHUPXSA-N 0.000 description 2
- UNILWMWFPHPYOR-KXEYIPSPSA-M 1-[6-[2-[3-[3-[3-[2-[2-[3-[[2-[2-[[(2r)-1-[[2-[[(2r)-1-[3-[2-[2-[3-[[2-(2-amino-2-oxoethoxy)acetyl]amino]propoxy]ethoxy]ethoxy]propylamino]-3-hydroxy-1-oxopropan-2-yl]amino]-2-oxoethyl]amino]-3-[(2r)-2,3-di(hexadecanoyloxy)propyl]sulfanyl-1-oxopropan-2-yl Chemical compound O=C1C(SCCC(=O)NCCCOCCOCCOCCCNC(=O)COCC(=O)N[C@@H](CSC[C@@H](COC(=O)CCCCCCCCCCCCCCC)OC(=O)CCCCCCCCCCCCCCC)C(=O)NCC(=O)N[C@H](CO)C(=O)NCCCOCCOCCOCCCNC(=O)COCC(N)=O)CC(=O)N1CCNC(=O)CCCCCN\1C2=CC=C(S([O-])(=O)=O)C=C2CC/1=C/C=C/C=C/C1=[N+](CC)C2=CC=C(S([O-])(=O)=O)C=C2C1 UNILWMWFPHPYOR-KXEYIPSPSA-M 0.000 description 2
- STTGYIUESPWXOW-UHFFFAOYSA-N 2,9-dimethyl-4,7-diphenyl-1,10-phenanthroline Chemical compound C=12C=CC3=C(C=4C=CC=CC=4)C=C(C)N=C3C2=NC(C)=CC=1C1=CC=CC=C1 STTGYIUESPWXOW-UHFFFAOYSA-N 0.000 description 2
- PKZJLOCLABXVMC-UHFFFAOYSA-N 2-Methoxybenzaldehyde Chemical compound COC1=CC=CC=C1C=O PKZJLOCLABXVMC-UHFFFAOYSA-N 0.000 description 2
- OJRUSAPKCPIVBY-KQYNXXCUSA-N C1=NC2=C(N=C(N=C2N1[C@H]3[C@@H]([C@@H]([C@H](O3)COP(=O)(CP(=O)(O)O)O)O)O)I)N Chemical compound C1=NC2=C(N=C(N=C2N1[C@H]3[C@@H]([C@@H]([C@H](O3)COP(=O)(CP(=O)(O)O)O)O)O)I)N OJRUSAPKCPIVBY-KQYNXXCUSA-N 0.000 description 2
- HQOWCDPFDSRYRO-CDKVKFQUSA-N CCCCCCc1ccc(cc1)C1(c2cc3-c4sc5cc(\C=C6/C(=O)c7ccccc7C6=C(C#N)C#N)sc5c4C(c3cc2-c2sc3cc(C=C4C(=O)c5ccccc5C4=C(C#N)C#N)sc3c12)(c1ccc(CCCCCC)cc1)c1ccc(CCCCCC)cc1)c1ccc(CCCCCC)cc1 Chemical compound CCCCCCc1ccc(cc1)C1(c2cc3-c4sc5cc(\C=C6/C(=O)c7ccccc7C6=C(C#N)C#N)sc5c4C(c3cc2-c2sc3cc(C=C4C(=O)c5ccccc5C4=C(C#N)C#N)sc3c12)(c1ccc(CCCCCC)cc1)c1ccc(CCCCCC)cc1)c1ccc(CCCCCC)cc1 HQOWCDPFDSRYRO-CDKVKFQUSA-N 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 229940126657 Compound 17 Drugs 0.000 description 2
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 2
- 238000007126 N-alkylation reaction Methods 0.000 description 2
- 229910052783 alkali metal Inorganic materials 0.000 description 2
- 150000001340 alkali metals Chemical class 0.000 description 2
- 125000003118 aryl group Chemical group 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- XZCJVWCMJYNSQO-UHFFFAOYSA-N butyl pbd Chemical compound C1=CC(C(C)(C)C)=CC=C1C1=NN=C(C=2C=CC(=CC=2)C=2C=CC=CC=2)O1 XZCJVWCMJYNSQO-UHFFFAOYSA-N 0.000 description 2
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 2
- 229940125758 compound 15 Drugs 0.000 description 2
- 229940126142 compound 16 Drugs 0.000 description 2
- 229940125782 compound 2 Drugs 0.000 description 2
- 238000011109 contamination Methods 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 238000000113 differential scanning calorimetry Methods 0.000 description 2
- 238000009792 diffusion process Methods 0.000 description 2
- 230000005670 electromagnetic radiation Effects 0.000 description 2
- 238000000132 electrospray ionisation Methods 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- 239000005457 ice water Substances 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 238000002844 melting Methods 0.000 description 2
- 230000008018 melting Effects 0.000 description 2
- 238000000034 method Methods 0.000 description 2
- 238000004776 molecular orbital Methods 0.000 description 2
- 239000012074 organic phase Substances 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 2
- 230000001681 protective effect Effects 0.000 description 2
- 239000011541 reaction mixture Substances 0.000 description 2
- 238000006456 reductive dimerization reaction Methods 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- RFDGVZHLJCKEPT-UHFFFAOYSA-N tris(2,4,6-trimethyl-3-pyridin-3-ylphenyl)borane Chemical compound CC1=C(B(C=2C(=C(C=3C=NC=CC=3)C(C)=CC=2C)C)C=2C(=C(C=3C=NC=CC=3)C(C)=CC=2C)C)C(C)=CC(C)=C1C1=CC=CN=C1 RFDGVZHLJCKEPT-UHFFFAOYSA-N 0.000 description 2
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 1
- IWZSHWBGHQBIML-ZGGLMWTQSA-N (3S,8S,10R,13S,14S,17S)-17-isoquinolin-7-yl-N,N,10,13-tetramethyl-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1H-cyclopenta[a]phenanthren-3-amine Chemical compound CN(C)[C@H]1CC[C@]2(C)C3CC[C@@]4(C)[C@@H](CC[C@@H]4c4ccc5ccncc5c4)[C@@H]3CC=C2C1 IWZSHWBGHQBIML-ZGGLMWTQSA-N 0.000 description 1
- 150000005045 1,10-phenanthrolines Chemical class 0.000 description 1
- VVDJSWJPDAJENP-UHFFFAOYSA-N 1,3,5-tris(3-diphenylphosphorylphenyl)benzene Chemical compound C=1C=CC=CC=1P(C=1C=C(C=CC=1)C=1C=C(C=C(C=1)C=1C=C(C=CC=1)P(=O)(C=1C=CC=CC=1)C=1C=CC=CC=1)C=1C=C(C=CC=1)P(=O)(C=1C=CC=CC=1)C=1C=CC=CC=1)(=O)C1=CC=CC=C1 VVDJSWJPDAJENP-UHFFFAOYSA-N 0.000 description 1
- VEFLKXRACNJHOV-UHFFFAOYSA-N 1,3-dibromopropane Chemical compound BrCCCBr VEFLKXRACNJHOV-UHFFFAOYSA-N 0.000 description 1
- JITPQYBZBLIATE-UHFFFAOYSA-N 2-(2-methoxyphenyl)-1h-perimidine Chemical compound COC1=CC=CC=C1C(N1)=NC2=CC=CC3=CC=CC1=C23 JITPQYBZBLIATE-UHFFFAOYSA-N 0.000 description 1
- QNVKZKOSAXYVFZ-UHFFFAOYSA-N 2-(3-oxoinden-1-ylidene)propanedinitrile Chemical compound C1=CC=C2C(=O)CC(=C(C#N)C#N)C2=C1 QNVKZKOSAXYVFZ-UHFFFAOYSA-N 0.000 description 1
- VQHBDGIIHYIOAB-UHFFFAOYSA-N 2-(4-methylphenyl)-1h-perimidine Chemical compound C1=CC(C)=CC=C1C(N1)=NC2=CC=CC3=CC=CC1=C23 VQHBDGIIHYIOAB-UHFFFAOYSA-N 0.000 description 1
- HRDXQADAMQKCQZ-UHFFFAOYSA-N 2-ethyl-1h-perimidine Chemical compound C1=CC(NC(CC)=N2)=C3C2=CC=CC3=C1 HRDXQADAMQKCQZ-UHFFFAOYSA-N 0.000 description 1
- RYNTXOSYMIOQJA-UHFFFAOYSA-N 2-propan-2-yl-1h-perimidine Chemical compound C1=CC(NC(C(C)C)=N2)=C3C2=CC=CC3=C1 RYNTXOSYMIOQJA-UHFFFAOYSA-N 0.000 description 1
- GSOFREOFMHUMMZ-UHFFFAOYSA-N 3,4-dicarbamoylnaphthalene-1,2-dicarboxylic acid Chemical compound C1=CC=CC2=C(C(O)=N)C(C(=N)O)=C(C(O)=O)C(C(O)=O)=C21 GSOFREOFMHUMMZ-UHFFFAOYSA-N 0.000 description 1
- 239000005725 8-Hydroxyquinoline Substances 0.000 description 1
- ROFVEXUMMXZLPA-UHFFFAOYSA-N Bipyridyl Chemical group N1=CC=CC=C1C1=CC=CC=N1 ROFVEXUMMXZLPA-UHFFFAOYSA-N 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 229910021607 Silver chloride Inorganic materials 0.000 description 1
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical group C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 1
- OKJPEAGHQZHRQV-UHFFFAOYSA-N Triiodomethane Natural products IC(I)I OKJPEAGHQZHRQV-UHFFFAOYSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- LNUFLCYMSVYYNW-ZPJMAFJPSA-N [(2r,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[[(3s,5s,8r,9s,10s,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-3-yl]oxy]-4,5-disulfo Chemical compound O([C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1C[C@@H]2CC[C@H]3[C@@H]4CC[C@@H]([C@]4(CC[C@@H]3[C@@]2(C)CC1)C)[C@H](C)CCCC(C)C)[C@H]1O[C@H](COS(O)(=O)=O)[C@@H](OS(O)(=O)=O)[C@H](OS(O)(=O)=O)[C@H]1OS(O)(=O)=O LNUFLCYMSVYYNW-ZPJMAFJPSA-N 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 150000001339 alkali metal compounds Chemical class 0.000 description 1
- 150000001350 alkyl halides Chemical class 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 230000029936 alkylation Effects 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 150000001556 benzimidazoles Chemical class 0.000 description 1
- UFVXQDWNSAGPHN-UHFFFAOYSA-K bis[(2-methylquinolin-8-yl)oxy]-(4-phenylphenoxy)alumane Chemical compound [Al+3].C1=CC=C([O-])C2=NC(C)=CC=C21.C1=CC=C([O-])C2=NC(C)=CC=C21.C1=CC([O-])=CC=C1C1=CC=CC=C1 UFVXQDWNSAGPHN-UHFFFAOYSA-K 0.000 description 1
- 159000000006 cesium salts Chemical class 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 238000011097 chromatography purification Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 229940125904 compound 1 Drugs 0.000 description 1
- 229940125773 compound 10 Drugs 0.000 description 1
- 229940125898 compound 5 Drugs 0.000 description 1
- 239000007859 condensation product Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 150000008050 dialkyl sulfates Chemical class 0.000 description 1
- 150000004985 diamines Chemical class 0.000 description 1
- 230000006203 ethylation Effects 0.000 description 1
- 238000006200 ethylation reaction Methods 0.000 description 1
- 239000003574 free electron Substances 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 229910021389 graphene Inorganic materials 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- HFZUTZWRTHBWPV-UHFFFAOYSA-N hydron;1h-perimidin-2-amine;bromide Chemical compound Br.C1=CC(NC(N)=N2)=C3C2=CC=CC3=C1 HFZUTZWRTHBWPV-UHFFFAOYSA-N 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 239000000543 intermediate Substances 0.000 description 1
- ZLVXBBHTMQJRSX-VMGNSXQWSA-N jdtic Chemical compound C1([C@]2(C)CCN(C[C@@H]2C)C[C@H](C(C)C)NC(=O)[C@@H]2NCC3=CC(O)=CC=C3C2)=CC=CC(O)=C1 ZLVXBBHTMQJRSX-VMGNSXQWSA-N 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- CUONGYYJJVDODC-UHFFFAOYSA-N malononitrile Chemical compound N#CCC#N CUONGYYJJVDODC-UHFFFAOYSA-N 0.000 description 1
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 1
- 229910052753 mercury Inorganic materials 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 125000001434 methanylylidene group Chemical group [H]C#[*] 0.000 description 1
- 230000011987 methylation Effects 0.000 description 1
- 238000007069 methylation reaction Methods 0.000 description 1
- 125000001442 methylidyne group Chemical group [H]C#[*] 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- PVWOIHVRPOBWPI-UHFFFAOYSA-N n-propyl iodide Chemical compound CCCI PVWOIHVRPOBWPI-UHFFFAOYSA-N 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 229940045681 other alkylating agent in atc Drugs 0.000 description 1
- WCPAKWJPBJAGKN-UHFFFAOYSA-N oxadiazole Chemical compound C1=CON=N1 WCPAKWJPBJAGKN-UHFFFAOYSA-N 0.000 description 1
- 229960003540 oxyquinoline Drugs 0.000 description 1
- 125000005499 phosphonyl group Chemical group 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- IUBQJLUDMLPAGT-UHFFFAOYSA-N potassium bis(trimethylsilyl)amide Chemical compound C[Si](C)(C)N([K])[Si](C)(C)C IUBQJLUDMLPAGT-UHFFFAOYSA-N 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- RQGPLDBZHMVWCH-UHFFFAOYSA-N pyrrolo[3,2-b]pyrrole Chemical class C1=NC2=CC=NC2=C1 RQGPLDBZHMVWCH-UHFFFAOYSA-N 0.000 description 1
- MCJGNVYPOGVAJF-UHFFFAOYSA-N quinolin-8-ol Chemical compound C1=CN=C2C(O)=CC=CC2=C1 MCJGNVYPOGVAJF-UHFFFAOYSA-N 0.000 description 1
- 238000004904 shortening Methods 0.000 description 1
- HKZLPVFGJNLROG-UHFFFAOYSA-M silver monochloride Chemical compound [Cl-].[Ag+] HKZLPVFGJNLROG-UHFFFAOYSA-M 0.000 description 1
- HRZFUMHJMZEROT-UHFFFAOYSA-L sodium disulfite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])(=O)=O HRZFUMHJMZEROT-UHFFFAOYSA-L 0.000 description 1
- 235000010262 sodium metabisulphite Nutrition 0.000 description 1
- 239000002195 soluble material Substances 0.000 description 1
- 238000004611 spectroscopical analysis Methods 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 238000004528 spin coating Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 238000002207 thermal evaporation Methods 0.000 description 1
- VLLMWSRANPNYQX-UHFFFAOYSA-N thiadiazole Chemical compound C1=CSN=N1.C1=CSN=N1 VLLMWSRANPNYQX-UHFFFAOYSA-N 0.000 description 1
- 150000003918 triazines Chemical class 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 238000001947 vapour-phase growth Methods 0.000 description 1
Classifications
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/633—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising polycyclic condensed aromatic hydrocarbons as substituents on the nitrogen atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/14—Carrier transporting layers
- H10K50/16—Electron transporting layers
- H10K50/165—Electron transporting layers comprising dopants
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/17—Carrier injection layers
- H10K50/171—Electron injection layers
Definitions
- the present invention relates to perimidine derivatives and their use, inter alia, in organic electronics, in particular for n-doping an organic electrically semiconducting material, for example an electron transport layer (ETL), or as a charge carrier injection layer in electronic or optoelectronic components.
- organic electronics in particular for n-doping an organic electrically semiconducting material, for example an electron transport layer (ETL), or as a charge carrier injection layer in electronic or optoelectronic components.
- ETL electron transport layer
- organic electronic components such as light emitting diodes, solar cells, field effect transistors and optical sensors is usually limited by the low conductivity or charge carrier mobility of organic semiconductor materials.
- the structure-related poor conductivity of the organic materials can be partially compensated by very thin layer thicknesses, whereby the risk of short circuits increases drastically at a layer thickness of less than 10 nm.
- the conductivity of organic semiconductor materials can, however, also be improved by several orders of magnitude by means of dopants.
- LMO Lowest Unoccupied Molecular Orbitals
- n-dopants Due to the energetic position of the LUMO level in the electron transport layers (ETLs) used industrially, n-dopants are unstable to atmospheric oxygen and water. However, the industry needs stable dopants.
- the precursor itself absorbs electromagnetic radiation of a suitable wavelength and is split into the doping radicals. An electron is transferred from the singly occupied molecular orbital (SOMO) of the radical to the LUMO of the ETL or matrix material.
- SOMO singly occupied molecular orbital
- ETM electron-conducting transport material
- HOMO Highest Occupied Molecular Orbital
- the dopant is stimulated photochemically, then an electron transfer takes place from the single occupied LUMO of the dopant into the LUMO of the ETM or matrix material.
- the electron transfer can also be realized simultaneously by different mechanisms.
- the electron transfer can also take place according to another mechanism that is not mentioned here.
- the n-dopants are often subject to diffusion into neighboring layers because of their charge and their low molar mass, which significantly reduces the service life of the components.
- these dopants ensure effective charge transport between the layers and a long service life for the components.
- EP 2 2009014 A1 describes the use of various organic compounds as precursors of an n-dopant for doping an organic semiconducting material.
- WO 2017/169972 A1 discloses heterocyclic compounds which can each be contained as a doping material in an electron transport layer of a light-emitting device.
- a light-emitting device comprises, in addition to the electron transport layer, an anode, a light-emitting layer and a cathode.
- the electron transport layer contains, besides the heterocyclic compound, an electrode transport material (ETL), the lowest unoccupied molecular orbital (LUMO) level of which is -3.0 eV or more, with the singly occupied molecular orbital (SOMO) level of the heterocyclic compound - 2.2 to -1.5 eV.
- ETL electrode transport material
- LUMO lowest unoccupied molecular orbital
- SOMO singly occupied molecular orbital
- EP 1 837926 B1 discloses heterocyclic radicals or diradicals and their dimers, oligomers, polymers, dispiro compounds and polycycles which are used as dopants for doping an organic semiconducting matrix material. In this way, an organic semiconducting material can be obtained which contains organic semiconducting matrix material and one of the dopants mentioned.
- EP 1 837 926 B1 describes an electronic or optoelectronic component with an electronically active area which contains at least one of the above-mentioned compounds.
- the object of the invention is to provide materials for doping organic semiconductor materials which, on the one hand, have sufficient stability to atmospheric oxygen and water and are also not subject to strong diffusion in electronic components.
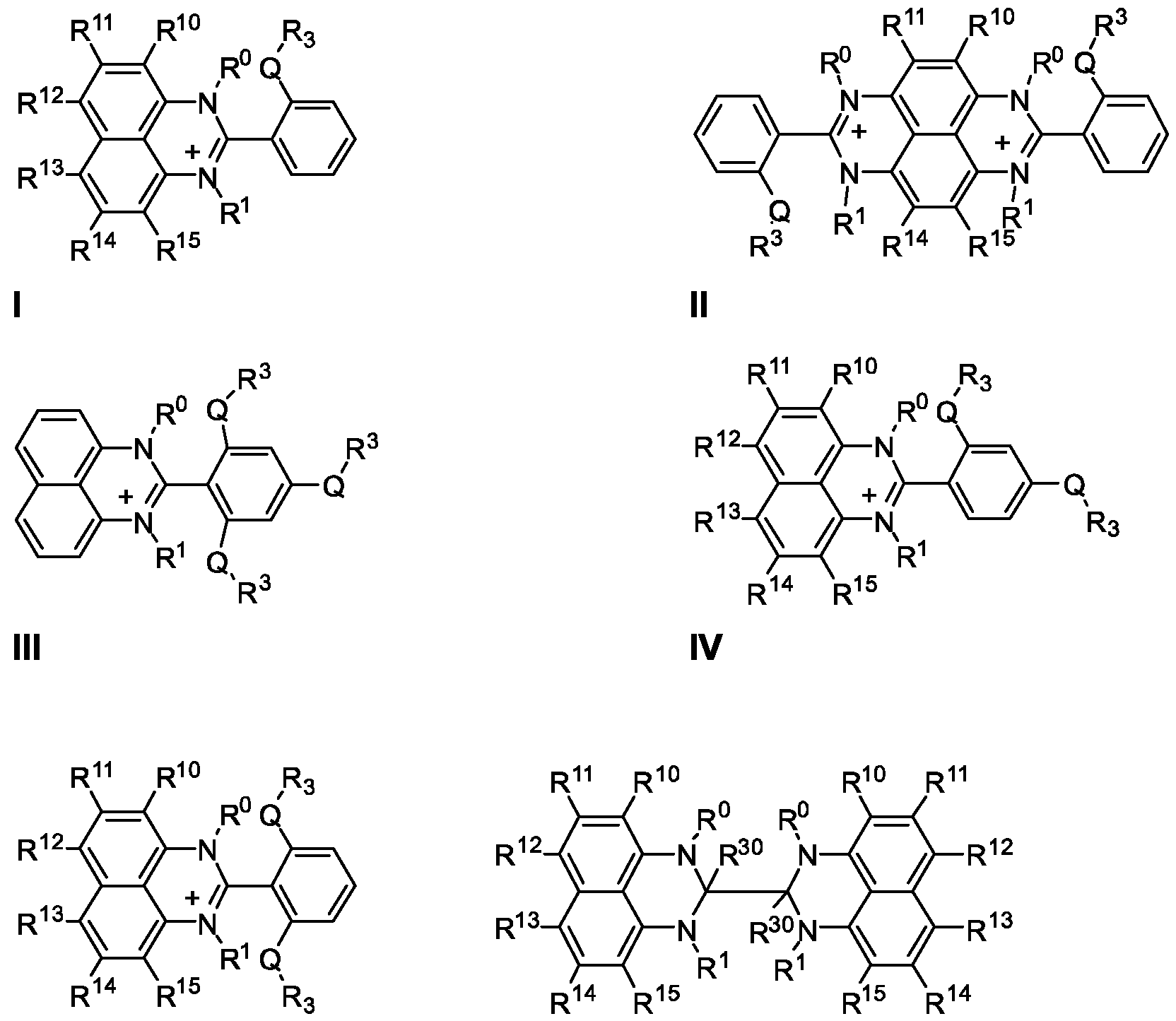
- a permidine derivative according to the invention is suitable for use in organic electronics and can be selected from cations, zwitterions and their dimers, or dications and their dimers or oligomers, with structures according to the formulas:
- each individual phenyl ring to which R40-R43 are assigned as hydrogen atoms or substituents can be replaced by a heteroaryl ring, which can be substituted or unsubstituted.
- R 0-4 in each case corresponds to a hydrogen atom (H) or a substituent selected from straight-chain or branched alkyl, cycloalkyl, trialkylsilyl, benzyl, alkoxy, alkoxyaryl, alkoxyhetaryl, completely or partially saturated and unsaturated aryl or hetaryl groups.
- R 10'15 corresponds in each case to a hydrogen atom (H) or a substituent selected from straight-chain or branched alkyl, alkoxy, phenoxy, dialkylamino, piperidyl, pyrrolidinyl, morpholino, thiomorpholino groups, fully or partially saturated and unsaturated aryl or hetaryl groups.
- Adjacent groups R can also occur as orthocondensed cycles.
- R 30'31 corresponds in each case to a hydrogen atom (H) or a substituent selected from straight-chain or branched alkyl, cycloalkyl, benzyl, trialkylsilyl, diarylboronyl, fully or partially saturated and unsaturated aryl and hetaryl groups.
- R 40-43 each corresponds to a hydrogen atom (H) or a substituent selected from straight-chain or branched alkyl, cycloalkyl, benzyl, alkoxy, alkoxyaryl, alkoxyhetaryl, fully or partially saturated and unsaturated aryl or hetaryl groups .
- R 50'55 corresponds in each case to a hydrogen atom (H) or a substituent selected from straight-chain or branched alkyl, cycloalkyl, benzyl, alkoxy, alkoxyaryl, alkoxyhetaryl, fully or partially saturated and unsaturated aryl or hetaryl groups .
- the letter Q corresponds in each case to an oxygen atom or a sulfur atom or a nitrogen-containing group, for example an NR 3 group.
- At least some of the substituents which are denoted by R 0-55 in the formulas I to XXI, in particular R ° and R 1 , are bridged with one another, with saturated or unsaturated carbon chains, saturated or heteroatom-bearing carbon chains as bridges unsaturated carbon chains, fully or partially saturated and unsaturated aromatics and heteroaromatics can serve.
- the bridges represented by arcs in formulas VIII and IX can be saturated or unsaturated substituted or unsubstituted alkylenes, ethers, aromatics or heteroaromatics, ortho-substituted aromatics or ortho-substituted heteroaromatics or combinations of two or more of these structures.
- the cations of the formulas I to V are present within salts which they form together with anions, the anions provided being preferably oxidizable anions, in particular carboxylate, oxalate, halide, azide or sulfite ions.
- the perimidine derivative is selected from compounds which form n-dopant precursors that are stable to atmospheric oxygen or water and only decompose into the actual n-dopants during doping, for example in an evaporation step or on the layer to be doped .
- Perimidine derivatives with the structural formulas I to VII mentioned above have proven to be particularly advantageous.
- the preferred perimidine dimers achieve unique stability Dopant precursors through close intramolecular tt-tt interactions of the two conjugated perimidine residues, as could be shown by corresponding structural analyzes.
- these perimidine derivatives have a very high doping efficiency, since two dopants are formed from each dimer. No leaving groups are split off and thus no additional contamination is caused, which can lead to a shortening of the service life and losses in the efficiency of the electronic or optoelectronic components.
- Another aspect of the invention relates to the use of the perimidine derivatives according to the invention in organic electronics, in particular in organic semiconductors (OSC), organic light-emitting diodes (OLED), dye solar cells (DSSC), organic field effect transistors (OFET) and / or thermoelectric generators.
- OSC organic semiconductors
- OLED organic light-emitting diodes
- DSSC dye solar cells
- OFET organic field effect transistors
- thermoelectric generators thermoelectric generators
- the perimidine derivative can be used for n-doping an organic electrically semiconducting material, in particular an electron transport layer (ETL), or as a charge carrier injection layer in electronic or optoelectronic components.
- organic solar cells whose acceptors of the active layer are fullerenes, in particular C6o fullerenes, a LUMO energy level of the n-dopant of -3.8 eV and higher is sufficient to realize an electron transfer.
- ETMs are usually spiked with a concentration of 0.1-10%, in exceptional cases 0.01-50%.
- ETMs all known materials can be used here as ETMs, such as fullerenes and their derivatives, graphenes, benzimidazoles, oxadiazole, thiadiazole and triazole compounds, phentanthrolines, in particular 1,10-phenanthrolines, bipyridyl compounds, preferably 2,2'-bipyridyls, pyrimidine compounds, phosphonyls , Aryl or hetarylboranes, pyrimidine and triazine derivatives, 8-hydroxyquinoline metal complexes, preferably the light elements of the second and third main as well as Subgroup elements.
- ETMs such as fullerenes and their derivatives, graphenes, benzimidazoles, oxadiazole, thiadiazole and triazole compounds, phentanthrolines, in particular 1,10-phenanthrolines, bipyridyl compounds, preferably 2,2'-bipyridyls, pyrimidine
- the acceptor dyes of the active layer itself can also be doped with a very low concentration of 0.01-0.1%, better 0.02-0.06% to increase the efficiency of the solar cells.
- Perylenedicarboxydiimides, subphthalocyanines, electron-poor phthalocyanines, C6o derivatives, pyrrolopyrroles, ITIC, NTCDI, INIC, INIC1-3, FBM, CBM, CDTBM, Y6, BtPt-4F and / BTPTT-4F can be used as acceptor dyes in organic solar cells.
- thermoelectric generators should also be mentioned as a further field of application for the perimidine derivatives according to the invention.
- a perimidine derivative can be used as an n-dopant, that is to say for doping an electrically semiconducting material in a thermoelectric generator.
- the perimidine derivatives can also be used as electrode material, preferably in electronic, including optoelectronic components, in accumulators, in batteries, in capacitors, in sensors, in circuits, in data memories or in switches.
- electrode material preferably in electronic, including optoelectronic components, in accumulators, in batteries, in capacitors, in sensors, in circuits, in data memories or in switches.
- accumulators in batteries, in capacitors, in sensors, in circuits, in data memories or in switches.
- Fig. 1 The diode characteristic of a vapor-deposited mixed layer with a
- Fig. 2 the transverse conductivity of this mixed layer as a function of the
- Perimidine compounds were already intensively investigated at the beginning of the 20th century. According to the publications NM Starschikov, AF Poscharsky, Khim. Heterocyclic Soedin., 1980, 1, 96; Yuan Lin et al., Chin. J. Appl. Chem., 2017, 36, 6, 685; and Meijun Feng et al., Tetrahedron Lett. 2012, 53, 6292; known, somewhat modified syntheses, the perimidinium salts E were shown, as can be seen in the following equations. It is based on 1,8-diaminonaphthalene A.
- perimidinium salts E can be reductively dimerized, with radicals being formed as intermediates.
- the compound (3) was presented in a three-chamber cell, the chambers of which are separated by frits, chrono-amperiometrically in acetonitrile and tetrabutylammonium hexafluorophosphate as conductive salt at -1.9 V over a period of 2 hours.
- the electrodes used were: a silver chloride electrode as a reference electrode, a platinum sheet electrode as a counter electrode, and a mercury electrode as a working electrode.
- a melting point (Mp.) Of 235 ° C. was determined for the product by means of differential scanning calorimetry (DSC).
- the doubly charged ion (M / 2 + ) of the molecule could be detected at half of its actual mass.
- Deutero-pyridine was used as the solvent for proton nuclear resonance spectroscopy.
- the numerical values show the (downfield) shift in ppm, the number of protons (H) per molecule indicated by the signal and the shape of the signals in the spectrum either as singlet (s), doublet (d), triplet ( t), multiplet (m).
- Triethyloxonium tetrafluoroborate was used as an alkylating agent.
- 1.82 g (0.01 mol) of compound (1), 2-methylperimidine, are dissolved in 20 ml of 1,2-dichloroethane with stirring under an argon atmosphere.
- 1.3 g (0.01 mol) of diisopropylethylamine are added dropwise at room temperature and the solution is stirred for 30 minutes.
- 3.4 g (0.023 mol) of trimethyloxonium tetrafluoroborate are added in portions and the mixture is stirred at room temperature for 3 hours and refluxed for one hour.
- the single charged ion of the molecule (MH + ) could also be identified with a relative frequency of 3%.
- This compound also serves as a precursor for the synthesis of a further compound with the general formula VI.
- This compound serves as a precursor to a bridged compound with the general formula VII.
- Example 10 2- (p-TolvD-1,3-dimethylperimidine
- the compound 10, 2- (p-tolyl) -1, 3-dimethylperimidine, is obtained analogously to the compound (2), but from 2- (p-tolyl) -perimidine, trimethyl oxonium tetrafluoroborate and Hünig base in 1, 2-dichloroethane.
- Compound 12 was analogous to compound 3 in a three-chamber cell, the chambers of which are separated by frits, chrono-amperiometrically in acetonitrile and tetrabutylammonium hexafluorophosphate as conductive salt at ⁇ 2.0 V.
- 1.26 g of compound (5), 1,3-dimethyl-2-ethylperimidinium iodide and 5 g of conductive salt were dissolved in 70 ml of acetonitrile and subjected to electrosynthesis in the working electrode chamber. The precipitated product is filtered off with suction and recrystallized. It was thus possible to obtain a yield of 91% 2,2‘-bis- (1,3-dimethyl) - [2-ethyl] -dihydro-1H-perimidine).
- Compound 13 was obtained similarly to Compound 2.
- 0.65 g of perimidine are stirred in 15 ml of 1,2-dichloroethane (DCE) under argon at room temperature.
- 0.66 ml of A /, A / -diisopropylethylamine (DIPEA) are added dropwise at room temperature and the solution is stirred for 30 minutes.
- 1.71 g of trimethyloxoniometrafluoroborate are slowly added while cooling with ice add, the solution is stirred at room temperature for 3 hours and finally heated under reflux for a further 10 min. After cooling overnight in the refrigerator, a solid obtained is filtered off with suction and washed with a large amount of ether.
- Compound 14 was analogous to compound 3 in a three-chamber cell, the chambers of which are separated by frits, chrono-amperiometrically in acetonitrile and tetrabutylammonium hexafluorophosphate as conductive salt at ⁇ 2.0 V.
- 1.12 g of compound 12, 1,3-dimethyl-2H-perimidinium tetrafluoroborate and 5 g of conductive salt were dissolved in 70 ml of acetonitrile and subjected to electrosynthesis in the working electrode chamber. The precipitated product is filtered off with suction and recrystallized.
- Compound 16 was analogous to compound 3 in a three-chamber cell, the chambers of which are separated by frits, chrono-amperiometrically in acetonitrile and tetrabutylammonium hexafluorophosphate as conductive salt at ⁇ 2.0 V.
- 1.26 g of compound 14, 1,3-dipropyl-1H-perimidinium iodide and 5 g of conductive salt were dissolved in 70 ml of acetonitrile and subjected to electrosynthesis in the working electrode chamber. The precipitated product is filtered off with suction and recrystallized.
- the melting point (Mp) was determined by DSC and was 259 ° C.
- 1,8-naphthalenediamine (0.0015 mol), 2-methoxybenzaldehyde (0.0015) mol and sodium pyrosulfite (0.0015 mol) were refluxed with stirring in a mixture of 30 ml of ethanol and 10 ml of water overnight. Chromatographic purification gave a white solid.
- the low molecular weight layers are usually deposited using a vacuum process, such as VTE (Vacuum Thermal Evaporation) or OVPD (Organic Vapor Phase Deposition).
- VTE Vauum Thermal Evaporation
- OVPD Organic Vapor Phase Deposition
- Doped layers are typically produced in a vacuum by means of mixed evaporation, for example from the matrix material (C60) and dopant.
- the desired mixing ratio can be set using oscillating crystals and masks.
- spin coating In the case of rotation coating, soluble materials with appropriate stability in the appropriate solvents can be used to produce homogeneous (mixed) layers.
- 1 shows the diode characteristic of the vapor-deposited mixed layer of OQO fullerene and compound 3 at various doping concentrations of 0.1 to 10% by volume.
- FIG. 2 shows the transverse conductivity of the mixed layer composed of the Ceo fullerene and compound 3 as a function of the doping concentration.
- CDTBM 2,2 - (4,4-dioctyl-4H-cyclo-penta [2,1-b: 3,4-b , ] dithiophene-diyl) bis (benzo [c] [1,2,5] thiadi -azol-7,4-diyl)) bis (methan-1 -yl-1-ylidene) dimalononitrile
Landscapes
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
Die Erfindung betrifft ein Perimidin-Derivat für eine Anwendung in der Organischen Elektronik, ausgewählt aus Kationen, Zwitterionen und deren Dimeren, oder Dikationen und deren Dimeren oder Oligomeren. Darüber hinaus betrifft die Erfindung die Verwendung eines entsprechenden Perimidin-Derivats in der Organischen Elektronik, insbesondere zum n-Dotieren eines organischen elektrisch halbleitenden Materials, insbesondere einer Elektronentransportschicht (ETL), oder als Ladungsträgerinjektionsschicht in elektronischen oder optoelektronischen Bauelementen. Des Weiteren betrifft die Erfindung die Verwendung der Perimidin-Derivate in Akkumulatoren, Batterien, Elektrodenmaterial, Kondensatoren, Sensoren, Schaltkreisen und Datenspeichern.
Description
Perimidin-Derivate und deren Verwendung
Die vorliegende Erfindung betrifft Perimidin-Derivate und deren Verwendung unter anderem in der Organischen Elektronik, insbesondere zum n-Dotieren eines organischen elektrisch halbleitenden Materials, zum Beispiel einer Elektronentransportschicht (ETL), oder als Ladungsträgerinjektionsschicht in elektronischen oder optoelektronischen Bauelementen.
Die Leistungsfähigkeit von organischen elektronischen Bauelementen, wie Leuchtdioden, Solarzellen, Feldeffekttransistoren und optischen Sensoren, wird meist durch die geringe Leitfähigkeit beziehungsweise Ladungsträgermobilität der organischen Halbleitermaterialien begrenzt. Die strukturbedingte schlechte Leitfähigkeit der organischen Materialien kann teilweise durch sehr dünne Schichtdicken kompensiert werden, wobei die Kurzschlussgefahr bei unter 10 nm Schichtdicke drastisch steigt. Die Leitfähigkeit von organischen Halbleitermaterialien kann aber auch mittels Dotanden um mehrere Größenordnungen verbessert werden. In der Organischen Elektronik werden für eine Dotierung zirka 1 bis 10 Massen- oder Volumen-% eines verdampfbaren sehr starken Reduktionsmittels benötigt, das Elektronen in das Leitungsband (LUMO = Lowest Unoccupied Molecular Orbitals) der Elektronentransportschicht (ETL) gibt und somit freie Elektronen für den Ladungstransport generiert.
Aufgrund der energetischen Lage des LUMO-Niveaus in den industriell verwendeten Elektronentransportschichten (ETLs) sind n-Dotanden instabil gegenüber Luftsauerstoff und Wasser. Die Industrie benötigt aber stabile Dotanden.
Eine Möglichkeit, diesen Widerspruch zu lösen, besteht darin, besondere Maßnahmen zur Verhinderung der Reaktion mit Luftsauerstoff und/oder Wasser zu treffen, beispielsweise durch Schaffung einer Inertgas-Atmosphäre, was mit einem hohen Aufwand verbunden ist. Eine Alternative besteht darin, dass zunächst stabile n-Dotandenvorstufen dargestellt werden, die während eines
Verdampfungsprozesses oder erst auf der zu dotierenden Schicht in die eigentlichen Dotanden zerfallen.
Hierbei sind die folgenden drei Mechanismen denkbar:
> Die Vorstufe selbst absorbiert elektromagnetische Strahlung geeigneter Wellenlänge und wird hierbei in die dotierenden Radikale gespalten. Es wird ein Elektron aus dem einfach besetzten Molekülorbital (SOMO = Singly Occupied Molecular Orbital) des Radikals in das LUMO des ETLs beziehungsweise Matrixmaterials übertragen.
> Das Elektronen-Ieitende Transportmaterial (ETM) beziehungsweise Matrixmaterial wird durch die elektromagnetische Bestrahlung angeregt, so dass nun in das einstige jetzt einfach besetzte höchste besetzte Molekülorbital (HOMO = Highest Occupied Molecular Orbital) ein Elektron aus dem HOMO des Dotanden aufgenommen werden kann. Der Dotand wird anschließend irreversibel thermodynamisch stabilisiert.
> Der Dotand wird photochemisch angeregt, anschließend findet ein Elektronentransfer vom einfach besetzten LUMO des Dotanden in das LUMO des ETMs beziehungsweise Matrixmaterials statt.
Der Elektronentransfer kann auch durch verschiedene Mechanismen gleichzeitig realisiert werden. Außerdem kann der Elektronentransfer auch nach einem anderen, hier nicht genannten Mechanismus ablaufen.
In elektronischen Bauelementen unterliegen die n-Dotanden wegen ihrer Ladung und ihrer geringen Molmasse oft einer Diffusion in benachbarte Schichten, was die Lebensdauer der Bauelemente deutlich vermindert. Als Ladungsträgerinjektionsschicht an Elektroden sorgen diese Dotanden für einen effektiven Ladungstransport zwischen den Schichten sowie für eine lange Lebensdauer der Bauelemente.
Die EP 2 2009014 A1 beschreibt die Verwendung von verschiedenen organischen Verbindungen jeweils als Precursor eines n-Dotanden zur Dotierung
eines organischen halbleitenden Materials.
In der WO 2017/169972 A1 sind heterocyclische Verbindungen offenbart, die jeweils als Dotierungsmaterial in einer Elektronentransportschicht einer lichtemittierenden Vorrichtung enthalten sein können. Eine solche lichtemittierende Vorrichtung umfasst neben der Elektronentransportschicht eine Anode, eine lichtemittierende Schicht und eine Kathode. Die Elektronentransportschicht enthält außer der heterocyclischen Verbindung ein Elektrodentransportmaterial (ETL), dessen niedrigstes unbesetztes Molekülorbital-(LUMO)-Niveau -3,0 eV oder mehr ist, wobei das einfach besetzte Molekülorbital-(SOMO)-Niveau der heterocyclischen Verbindung - 2,2 bis -1 ,5 eV ist.
Aus der EP 1 837926 B1 sind heterocyclische Radikale oder Diradikale sowie deren Dimere, Oligomere, Polymere, Dispiroverbindungen und Polycyclen bekannt, die als Dotanden zur Dotierung eines organischen halbleitenden Matrixmaterials verwendet werden. Damit kann ein organisches halbleitendes Material erhalten werden, das organisches halbleitendes Matrixmaterial und einen der genannten Dotanden enthält. Darüber hinaus beschreibt die EP 1 837 926 B1 ein elektronisches oder optoelektronisches Bauelement mit einem elektronisch wirksamen Bereich, der zumindest eine der oben genannten Verbindungen enthält.
Bisher sind noch keine organischen n-Dotanden in der industriellen Anwendung. Sie sind nicht ausreichend stabil oder zu leicht flüchtig, was zur Kontamination der Verdampferanlagen führen würde. Gegenwärtig werden häufig Alkalimetallverbindungen, insbesondere thermisch labile Cäsiumsalze eingesetzt.
Der Markt der Organischen Elektronik entwickelt sich rasant. Im Bereich der druckbaren Elektronik werden immer mehr neue Anwendungen zur Marktreife geführt. Die Displayproduktion wird ständig ausgebaut. Mit einem exorbitant
wachsenden Materialbedarf wird auch durch den Markteintritt der Organischen Solarzellen gerechnet.
Die Aufgabe der Erfindung besteht darin, Materialien zur Dotierung von organischen Halbleitermaterialien bereitzustellen, die einerseits gegenüber Luftsauerstoff und Wasser eine ausreichende Stabilität aufweisen und auch in elektronischen Bauelementen keiner starken Diffusion unterliegen.
Die Aufgabe wird durch Perimidin-Derivate gemäß Anspruch 1 gelöst. Bevorzugte Ausführungsformen und Ausgestaltungen sind in den abhängigen Patentansprüchen angegeben.
Ein erfindungsgemäßes Permidin-Derivat ist für eine Anwendung in der organischen Elektronik geeignet und kann ausgewählt werden aus Kationen, Zwitterionen und deren Dimeren, oder Dikationen und deren Dimeren oder Oligomeren, mit Strukturen gemäß den Formeln:
III IV
IX X
Eingeschlossen sind dabei auch Verbindungen, die anstelle der Dimere VII mit den gleichen Monomeren als Oligomere gebildet werden können. In der Struktur XVIII kann jeder einzelne Phenylring, dem R40-R43 als Wasserstoffatome oder Substituenten zugeordnet sind, durch einen Heteroarylring, der substituiert oder unsubstituiert vorliegen kann, ersetzt werden.
R0-4 entspricht jeweils einem Wasserstoffatom (H) oder einem Substituenten, ausgewählt aus geradkettigen oder verzweigten Alkyl-, Cycloalkyl-, Trialkylsilyl-, Benzyl-, Alkoxy-, Alkoxyaryl-, Alkoxyhetaryl-, vollständig oder teilweise
gesättigten und ungesättigten Aryl- oder Hetaryl-Gruppen.
R10'15 entspricht jeweils einem Wasserstoffatom (H) oder einem Substituenten, ausgewählt aus geradkettigen oder verzweigten Alkyl-, Alkoxy-, Phenoxy-, Dialkylamino-, Piperidyl-, Pyrrolidinyl-, Morpholino-, Thiomorpholino- Gruppen, vollständig oder teilweise gesättigten und ungesättigten Aryl- oder Hetaryl- Gruppen. Benachbarte Gruppen R können dabei auch als orthokondensierte Cyclen Vorkommen.
R30'31 entspricht jeweils einem Wasserstoffatom (H) oder einem Substituenten, ausgewählt aus geradkettigen oder verzweigten Alkyl-, Cycloalkyl-, Benzyl-, Trialkylsilyl-, Diarylboronyl-, vollständig oder teilweise gesättigten und ungesättigten Aryl- und Hetaryl-Gruppen.
R 40-43 entspricht jeweils einem Wasserstoffatom (H) oder einem Substituenten, ausgewählt aus geradkettigen oder verzweigten Alkyl-, Cycloalkyl-, Benzyl-, Alkoxy-, Alkoxyaryl-, Alkoxyhetaryl-, vollständig oder teilweise gesättigten und ungesättigten Aryl- oder Hetaryl-Gruppen.
R50'55 entspricht jeweils einem Wasserstoffatom (H) oder einem Substituenten, ausgewählt aus geradkettigen oder verzweigten Alkyl-, Cycloalkyl-, Benzyl-, Alkoxy-, Alkoxyaryl-, Alkoxyhetaryl-, vollständig oder teilweise gesättigten und ungesättigten Aryl- oder Hetaryl-Gruppen.
Der Buchstabe Q entspricht jeweils einem Sauerstoffatom oder einem Schwefelatom oder einer stickstoffhaltigen Gruppe, zum Beispiel einer NR3- Gruppe.
Gemäß einer Ausgestaltung der Erfindung ist zumindest ein Teil der Substituenten, die in den Formeln I bis XXI mit R0-55 bezeichnet sind, insbesondere R° und R1, untereinander verbrückt, wobei als Brücken gesättigte oder ungesättigte Kohlenstoffketten, heteroatomtragende gesättigte oder
ungesättigte Kohlenstoffketten, vollständig oder teilweise gesättigte und ungesättigte Aromaten und Heteroaromaten dienen können.
Die durch Kreisbögen dargestellten Verbrückungen in den Formeln VIII und IX können gesättigte oder ungesättigte substituierte oder unsubstituierte Alkylene, Ether, Aromaten oder Heteroaromaten, ortho-substituierte Aromaten oder ortho- substituierte Heteroaromaten oder Kombinationen von zwei oder mehreren dieser Strukturen sein.
Die Kationen der Formeln I bis V liegen innerhalb von Salzen vor, die sie zusammen mit Anionen bilden, wobei als Anionen vorzugsweise oxidierbare Anionen, insbesondere Carboxylat-, Oxalat-, Halogenid-, Azid- oder Sulfit-Ionen vorgesehen sind.
Strukturformeln für bevorzugte Ausführungsformen einer Verbindung der allgemeinen Strukturformel IX lassen sich mit den Formeln IXa und IXb beschreiben:
IXa IXb.
Gemäß einer vorteilhaften Ausführungsform der Erfindung wird das Perimidin- Derivat aus Verbindungen ausgewählt, die gegenüber Luftsauerstoff oder Wasser stabile n-Dotandenvorstufen bilden, und erst beim Dotieren, zum Beispiel bei einem Verdampfungsschritt oder auf der zu dotierenden Schicht, in die eigentlichen n-Dotanden zerfallen. Als besonders vorteilhaft haben sich dabei Perimidin-Derivate mit den oben genannten Strukturformeln I bis VII erwiesen.
Einzigartige Stabilität erreichen die Perimidindimere als bevorzugte
Dotandenvorstufen durch enge intramolekulare tt-tt-Wechselwirkungen der beiden konjugierten Perimidinreste, wie durch entsprechende Strukturanalysen gezeigt werden konnte. Außerdem haben diese Perimidinderivate eine sehr hohe Dotiereffizienz, da aus jedem Dimer zwei Dotanden entstehen. Es werden keine Abgangsgruppen abgespalten und damit auch keine zusätzliche Kontamination verursacht, was zu einer Verkürzung der Lebensdauer und Verlusten im Wirkungsgrad der elektronischen beziehungsweise optoelektronischen Bauelemente führen kann.
Ein weiterer Aspekt der Erfindung betrifft die Verwendung der erfindungsgemäßen Perimidin-Derivate in der Organischen Elektronik, insbesondere in organischen Halbleitern (OSC), organischen Leuchtdioden (OLED), Farbstoffsolarzellen (DSSC), Organischen Feldeffekttransistoren (OFET) und/oder Thermoelektrischen Generatoren.
So kann das Perimidin-Derivat zum n-Dotieren eines organischen elektrisch halbleitenden Materials, insbesondere einer Elektronentransportschicht (ETL), oder als Ladungsträgerinjektionsschicht in elektronischen oder optoelektronischen Bauelementen verwendet werden. In Organischen Solarzellen, deren Akzeptor der aktiven Schicht Fullerene, insbesondere C6o- Fullerene sind, reicht ein LUMO-Energieniveau des n-Dotanden von -3,8 eV und höher aus, um einen Elektronentransfer zu realisieren. Bei der Verwendung anderer Akzeptorfarbstoffe muss das energetische Niveau der angrenzenden ETL und damit auch der n-Dotanden angepasst werden. Üblicherweise werden ETMs mit einer Konzentration von 0,1 - 10%, in Ausnahmefällen von 0,01 - 50 % dotiert. Als ETMs können hierbei alle bekannten Materialien zum Einsatz kommen, wie Fullerene sowie deren Derivate, Graphene, Benzimidazole, Oxadiazol-, Thiadiazol- und Triazolverbindungen, Phentanthroline insbesondere 1,10-Phenanthroline, Bipyridylverbindungen, vorzugsweise 2,2‘-Bipyridyle, Pyrimidinverbindungen, Phosphonyle, Aryl- beziehungsweise Hetarylborane, Pyrimidin- und Triazinederivate, 8-Hydroxyquinolinmetallkomplexe, vorzugsweise der leichten Elemente der zweiten und dritten Haupt- sowie
Nebengruppenelemente. Einige bekannte Vertreter dieser ETMs sind im Folgenden strukturell aufgeführt.
Bis(8-hydroxy-2-methylquinolin)-(4-phenylphenoxy)aluminum (BAIQ) nanthroline (Bphen)
2,9-Dimethyl-4,7-diphenyl-1 ,10-phenanthrolin (Bathocuproin = BCP)
2-(4-Biphenyl)-5-(4-tert-butylphenyl)-1 ,3,4-oxadiazol (BPD)
Tris(2,4,6-trimethyl-3-(pyridin-3-yl)phenyl)boran (3TPYMB)
1,3,5-Tri(diphenylphosphoryl-phen-3-yl)benzen (TP3PO)
4,6-Bis(3,5-di(pyridin-4-yl)phenyl)-2-(3-(pyridin-3-yl)phenyl)pyrinnidin
(B4PYPPYPM)
Es können auch die Akzeptorfarbstoffe der aktiven Schicht selbst mit einer sehr geringen Konzentration von 0,01-0,1 %, besser 0,02 - 0,06 %, dotiert werden, um
die Effizienz der Solarzellen zu steigern. Als Akzeptorfarbstoffe in Organischen Solarzellen können Perylendicarboxydiimide, Subphthalocyanine, elektronenarme Phthalocyanine, C6o-Derivate, Pyrrolopyrrole, ITIC, NTCDI, INIC, INIC1-3, FBM, CBM, CDTBM, Y6, BtPt-4F und/ BTPTT-4F zum Einsatz kommen.
Als weiteres Anwendungsfeld für die erfindungsgemäßen Perimidin-Derivate sind auch thermoelektrische Generatoren zu nennen. So kann ein Perimidin-Derivat beispielsweise als n-Dotand, das heißt zum Dotieren eines elektrisch halbleitenden Materials in einem thermoelektrischen Generator verwendet werden.
Darüber hinaus können die Perimidin-Derivate auch als Elektrodenmaterial vorzugsweise in elektronischen, einschließlich optoelektronischen Bauelementen, in Akkumulatoren, in Batterien, in Kondensatoren, in Sensoren, in Schaltkreisen, in Datenspeichern oder in Schaltern zum Einsatz kommen. Über die Verwendung als Elektrodenmaterial hinaus sind auch weitere Verwendungsmöglichkeiten in Akkumulatoren, in Batterien, in Kondensatoren, in Sensoren, in Schaltkreisen, in Datenspeichern oder in Schaltern gegeben.
Weitere Einzelheiten, Merkmale und Vorteile von Ausgestaltungen der Erfindung ergeben sich den Figuren und aus der nachfolgenden Beschreibung von Ausführungsbeispielen. Es zeigen:
Fig. 1: die Diodenkennlinie einer aufgedampften Mischschicht mit einem
Perimidin-Derivat bei verschiedenen Dotierkonzentrationen und
Fig. 2: die Querleitfähigkeit dieser Mischschicht in Abhängigkeit von der
Dotierkonzentration.
Perimidin-Verbindungen sind bereits Anfang des 20. Jahrhunderts intensiv untersucht worden. Nach den unter anderem aus den Druckschriften N.M. Starschikov, A.F. Poscharsky, Khim. Geterozykl. Soedin., 1980, 1, 96; Yuan Lin et al., Chin. J. Appl. Chem., 2017, 36, 6, 685; und Meijun Feng et al.,
Tetrahedron Lett. 2012, 53, 6292; bekannten, etwas modifizierten Synthesen wurden die Perimidiniumsalze E dargestellt, wie in den folgenden Gleichungen zu erkennen ist. Es wird von 1 ,8-Diaminonaphthalen A ausgegangen. Die Umsetzung dieses Diamins mit Carbonsäuren- bzw. Carbonsäurederivaten B oder Aldehyden führt zu Perimidinen C, deren Alkylierung mit Halogenalkanen D, Trialkyloxoniumsalzen, Dialkylsulfaten oder sonstigen Alkylierungsmitteln zu Perimidiniumsalzen E führt, was unter anderem durch J.M. Herbert, P.D. Woodgate, W.A. Denny, J. Med. Chem. 1987, 30, 2081; sowie M.M. Baradarani, R.C. Beddoes, O.S. Mills, J.A. Joule, Acta Cryst. 1995 C51 1345; bekannt ist.
C D E
Diese Perimidiniumsalze E lassen sich reduktiv dimerisieren, wobei Radikale als Zwischenstufen gebildet werden.
E F
Svnthesebeispiele:
Es werden 1 ,58 g (0,01 Mol) 1 ,8-Diaminonaphthalen unter Rühren und Argonatmosphäre in 25 ml Dichlormethan gelöst und anschließend im Eisbad gekühlt. Dann werden 1,02 g (0,01 Mol) Acetanhydrid in 5 ml Dichlormethan langsam zur Reaktionslösung zugetropft. Die Reaktionslösung wird über Nacht, das heißt mindestens 14 h, bei Raumtemperatur gerührt. Am Ende wird die Reaktionslösung noch 1 Stunde lang am Rückfluss erhitzt. Nach dem Abkühlen wird das Reaktionsgemisch unter Vakuum eingeengt, danach im Kühlschrank gekühlt. Das ausgefallene kristallin braune Produkt wird schließlich in Methanol umkristallisiert.
Auf diese Weise wurden 1,34 g 2-Methylperimidin erhalten, was einer Ausbeute von 74 % entspricht.
Verbindung 2: 1.2.3-Trimethyl-1H-perimidiniumtetrafluoroborat
F
B-F
Es folgt eine N-Alkylierung in Form einer Methylierung. Dabei werden 1 ,82 g (0,01 Mol) Verbindung (1), 2-Methylperimidin, in 20 ml 1 ,2-Dichlorethan unter Rühren und Argonatmosphäre gelöst. Danach werden 1 ,3 g (0,01 Mol) Diisopropylethylamin bei Raumtemperatur zugetropft und die Lösung 30 Minuten
lang gerührt. Schließlich werden 3,4 g (0,023 Mol) Trimethyloxoniumtetrafluoroborat portionsweise zugegeben und 3 Stunden bei Raumtemperatur gerührt und eine Stunde lang am Rückfluss erhitzt. Nach dem Abkühlen der Reaktionslösung wird 1 ml Methanol zugegeben und die Reaktionslösung 30 Minuten lang gerührt, anschließend wird mit Ether das Produkt ausgefällt. Das gelbe Produkt wird abgesaugt und mit reichlich Ether gewaschen.
Es konnten 2,23 g 1,2,3-Trimethylperimidiniumtetrafluoroborat gewonnen werden, was einer Ausbeute von 75% entspricht.
Die Verbindung (3) wurde in einer Dreikammerzelle, deren Kammern über Fritten getrennt sind, chrono-amperiometrisch in Acetonitril und Tetrabutylammoniumhexafluorophosphat als Leitsalz bei - 1 ,9 V über einen Zeitraum von 2 Stunden dargestellt. Als Elektroden wurden verwendet: eine Silberchloridelektrode als Referenzelektrode, eine Platinblechelektrode als Gegenelektrode, eine Quecksilberelektrode als Arbeitselektrode.
Es wurden 0,8 g Verbindung (2), 1,2,3-Trimethylperimidiniumtetrafluoroborat, und 6 g Leitsalz in 70 ml Acetonitril gelöst und in der Arbeitselektrodenkammer der Elektrosynthese unterworfen. Das ausgefallene Produkt wird abgesaugt und umkristallisiert.
So konnten 0,48 g l .r^^'.a.S'-Hexamethyl^^'^.S'-tetrahydro-I H 'H^^'- biperimidin gewonnen werden, was einer Ausbeute von 85 % entspricht.
Für das Produkt wurde ein Schmelzpunkt (Mp.) von 235 °C mittels Dynamischer Differenzkalorimetrie (DSC = Differential Scanning Calorimetry) ermittelt.
Das Produkt wurde mittels Massenspektrometrie (MS) in Kombination mit Elektrospray-Ionisation als Detektionsmethode (MS/ESI) untersucht, wobei folgende Daten erhalten wurden:
MS/ESI: M/2+ = 211 ,25.
Es konnte das zweifach geladene Ion (M/2+) des Moleküls bei der Hälfte seiner eigentlichen Masse detektiert werden.
Die Verbindung wurde mittels Protonenkernresonanzspektroskopie (1HNMR) untersucht, wobei die folgenden Daten erhalten wurden:
1H-NMR (Deutero-Pyridin): 7,25 (2H, d), 7,2 (2H, t), 5,94 (2H, d), 2,6 (6H, s), 1 ,45 (1 ,5H, s).
Als Lösungsmittel für die Protonenkernresonanzspektroskopie wurde Deutero- Pyridin verwendet. Die Zahlenwerte zeigen die (Tieffeld-)Verschiebung in ppm an, ebenfalls angegeben ist die Anzahl der durch das Signal angezeigten Protonen (H) pro Molekül sowie die Form der Signale im Spektrum entweder als Singulett (s), Duplett (d), Triplett (t), Multiplett (m).
Die oben beschriebene reduktive Dimerisierung lässt sich auch in guten bis sehr gutes Ausbeuten rein chemisch bewerkstelligen, zum Beispiel mit Alkalimetallamalganen oder mit Alkalimetall-/Aromaten-Gemischen.
Verbindung 4: 1 .3-Diethyl-2-methyl-1 H-perimidiniumtetrafluoroborat
Ausgehend von Verbindung (1) erfolgt eine N-Alkylierung in Form einer Ethylierung. Dabei wurde Triethyloxoniumtetrafluoroborat als Alkylierungsmittel verwandt. Es werden 1 ,82 g (0,01 Mol) Verbindung (1 ), 2-Methylperimidin, in 20 ml 1 ,2-Dichlorethan unter Rühren und Argon-Atmosphäre gelöst. Danach werden 1 ,3 g (0,01 Mol) Diisopropylethylamin bei Raumtemperatur zugetropft und die Lösung 30 Minuten lang gerührt. Schließlich werden 3,4 g (0,023 Mol) Trimethyloxoniumtetrafluoroborat portionsweise zugegeben und 3 Stunden bei Raumtemperatur gerührt und eine Stunde lang am Rückfluss erhitzt. Nach dem Abkühlen der Reaktionslösung wird 1 ml Methanol zugegeben und die Reaktionslösung 30 Minuten lang gerührt, anschließend wird mit Ether das Produkt ausgefällt. Das gelbe Produkt wird abgesaugt und mit reichlich Ether gewaschen. Es konnten 2,23 g 1 ,2,3-Trimethylperimidiniumtetrafluoroborat gewonnen werden, was einer Ausbeute von 75 % entspricht.
Verbindung 5: l .r.S.S'- tetrahvdro-
biperimidin
Die Synthese erfolgt wie bei Verbindung (3) durch reduktive Dimerisierung. Nur wurde anstelle von Verbindung (2) die Verbindung (4) verwandt.
Die Ausbeute betrug 78 %.
Das Produkt wurde mittels Massenspektrometrie (MS) in Kombination mit Elektrospray-Ionisation als Detektionsmethode (MS/ESI) untersucht, wobei folgende Daten erhalten wurden:
MS/ESI: MH+ = 479,43 (3%), M/2+ = 239,33 (100%);
Hierbei konnte auch das einfach geladene Ion des Moleküls (MH+) mit einer relativen Häufigkeit von 3 % identifiziert werden.
Es werden 4,65 g (0,0237 Mol) 2-Ethylperimidin, 3,27 g (0,0237 Mol) Pottasche, 13,4g (0.0946 Mol) Methyljodid langsam für 24 Stunden bei 90°C in 40 ml Acetonitril im Druckrohr erhitzt. Nach dem Abkühlen wird auf Eiswasser gegossen, mit Dichlormethan extrahiert, 24 Stunden über Magnesiumsulfat getrocknet und filtriert. Das Filtrat wird eingeengt und über Nacht im Kühlschrank aufbewahrt. Es fällt 1 ,3-Dimethyl-2-ethylperimidiniumjodid als Produkt aus, wobei das ausgefallene Produkt abgesaugt und mit wenig Ether gewaschen wird.
Es konnte eine Ausbeute von 83% erreicht werden.
Diese Verbindung dient als Vorstufe für die Synthese einer weiteren Verbindung mit der allgemeinen Formel VI.
Verbindung 7: 1.3-Dimethyl-2-isopropylperimidiniumiodid
Es werden 2,1 g (0,01 Mol) 2-lsopropylperimidin, 1 ,4 g (0,01 Mol) Pottasche, 5,7g Methyljodid langsam für 24 Stunden auf 90°C in 15 ml Acetonitril im Druckrohr erhitzt. Nach dem Abkühlen wird auf Eiswasser gegossen, mit Dichlormethan extrahiert, 24 Stunden lang über Magnesiumsulfat getrocknet und filtriert. Das Filtrat wird eingeengt und über Nacht in den Kühlschrank gestellt. Das ausgefallene Produkt wird abgesaugt und mit wenig Ether gewaschen.
Es konnte eine Ausbeute an 1 ,3-Dimethyl-2-isopropylperimidiniumjodid von 78 % erreicht werden.
Auch diese Verbindung dient als Vorstufe für die Synthese einer weiteren Verbindung mit der allgemeinen Formel VI.
Es werden 3,0 g (0,00793 Mol) Propan-1 ,3-bis-(perimidin) unter Schutzgas in 60
ml 1 ,2-Dichlorethan gelöst, mit 5,4 ml (0,0317 Mol) Diisopropylethylamin versetzt und 30 Minuten lang bei Raumtemperatur gerührt. Danach werden 7,04 g (0,0476 Mol) Trimethyloxoniumtetrafluoroborat portionsweise zugeführt, folgend 6 Stunden lang bei Raumtemperatur und 2 Stunden lang am Rückfluss gerührt. Nach dem Abkühlen auf Raumtemperatur werden 10 ml Methanol addiert und 30 Minuten lang gerührt. Nach dem Einengen im Vakuum und dem Ausfällen mit Ether wird das Produkt abfiltriert und mit Ether gewaschen.
Es konnte eine Ausbeute von 66 % erreicht werden.
Diese Verbindung dient als Vorstufe zu einer verbrückten Verbindung mit der allgemeinen Formel VII.
Es werden 2,37 g (0,00897 Mol) 2-Aminoperimidiniumhydrobromid, 3,62 g (0,0179 Mol) 1 ,3-Dibrompropan und 3,72 g 0,0269 Mol) Pottasche 12 Stunden lang unter Argon auf 135°C erhitzt, abgekühlt und filtriert. Das Filtrat wird im Vakuum eingeengt, das Produkt mit Ether ausgefällt, abgesaugt und mit wenig kaltem Methanol gewaschen.
Es konnten 2,84 g Salz erhalten werden, was 91 % Ausbeute entspricht.
Diese Verbindung dient als Vorstufe zu einer Verbindung gemäß der allgemeinen Formel VIII.
Beispiel 10: 2-(p-TolvD-1.3-dimethylperimidin
Die Verbindung 10, 2-(p-Tolyl)-1 ,3-dimethylperimidin, wird analog der Verbindung (2) gewonnen, dabei jedoch aus 2-(p-Tolyl)-perimidin, Trimethyl- oxoniumtetrafluoroborat und Hünig-Base in 1 ,2-Dichlorethan.
Die Verbindung 11 wurde ebenfalls elektrochemisch bei -2,1V in Acetonitril reduktiv dimerisiert. Die Ausbeute lag bei 80%. Das Produkt wurde massenspektrometrisch untersucht: MS/ESI: MH+ = 519,36 (6%), M/2+ = 259,34 (100%)
Verbindung 12: 1 1' 3 3,-Tetramethyl-2 2‘-diethyl-2 2, 3 3,-tetrahvdro-1 H 1Ή-2 2,- biperimidin
Die Verbindung 12 wurde analog der Verbindung 3 in einer Dreikammerzelle, deren Kammern über Fritten getrennt sind, chrono-amperiometrisch in Acetonitril und Tetrabutylammoniumhexafluorophosphat als Leitsalz bei - 2,0 V dargestellt. Es wurden 1 ,26 g Verbindung (5), 1 ,3-Dimethyl-2-ethylperimidiniumjodid und 5 g Leitsalz in 70 ml Acetonitril gelöst und in der Arbeitselektrodenkammer der Elektrosynthese unterworfen. Das ausgefallene Produkt wird abgesaugt und umkristallisiert. So konnte eine Ausbeute von 91% 2,2‘-Bis-(1 ,3-dimethyl)-[2- ethyl]-dihydro-1 H-perimidin), gewonnen werden.
Die Verbindung wurde mittels Protonenkernresonanzspektroskopie (1HNMR) untersucht, wobei die folgenden Daten erhalten wurden:
1H-NMR (Deutero-Pyridin): 7,18 (2H, m), 5,82 (2H, d), 4,92 (2H, s), 2,63 (6H, s), 2,12 (2H, q), 0,69 (1,5H, t)
Verbindung 13 wurde ähnlich wie die Verbindung 2 gewonnen. 0,65 g Perimidin werden in 15 ml 1 , 2-Dichlorethan (DCE) unter Argon bei Raumtemperatur gerührt. Danach werden 0,66 ml A/,A/-Diisopropylethylamin (DIPEA) bei Raumtemperatur zugetropft und die Lösung 30 Minuten lang gerührt. Schließlich werden 1,71 g Trimethyloxoniomtetrafluoroborat langsam unter Eiskühlung
zugeben, die Lösung wird bei Raumtemperatur 3 Stunden lang gerührt und zuletzt am Rückfluss noch 10 min erhitzt. Nach dem Abkühlen über Nacht in den Kühlschrank wird ein erhaltener Feststoff abgesaugt und mit viel Ether gewaschen.
Es konnte eine Ausbeute von 81 % erhalten werden.
Die Verbindung 14 wurde analog der Verbindung 3 in einer Dreikammerzelle, deren Kammern über Fritten getrennt sind, chrono-amperiometrisch in Acetonitril und Tetrabutylammoniumhexafluorophosphat als Leitsalz bei - 2,0 V dargestellt. Es wurden 1 ,12 g Verbindung 12, 1 ,3-Dimethyl-2H-perimidiniumtetrafluoroborat und 5 g Leitsalz in 70 ml Acetonitril gelöst und in der Arbeitselektrodenkammer der Elektrosynthese unterworfen. Das ausgefallene Produkt wird abgesaugt und umkristallisiert.
So konnten 0,55 g Produkt gewonnen werden, was einer Ausbeute von 71% entspricht.
Verbindung 15: 1.3-Dipropyl-1H-perimidiniumiodid
Es wurden 0,5 g Perimidin bei Raumtemperatur unter Rühren und Argon als Schutzgas zu einer Suspension von 0,11 g NaH in 20 ml Dimethylformamid (DMF) gegeben und weiter 1 Stunde lang gerührt. Danach wurden 0,9 ml Propyljodid zugetropft und über Nacht am Rückfluss erhitzt. Nach Zugabe von 10 ml Wasser wurde die Mischung 5-mal mit 10 ml Chloroform extrahiert, über MgS04 getrocknet, filtriert und im Vakuum vollständig eingeengt. Nach der chromatographischen Reinigung wurden 0,97g Produkt 14 (86%) erhalten.
Die Verbindung 16 wurde analog der Verbindung 3 in einer Dreikammerzelle, deren Kammern über Fritten getrennt sind, chrono-amperiometrisch in Acetonitril und Tetrabutylammoniumhexafluorophosphat als Leitsalz bei - 2,0 V dargestellt. Dafür wurden 1,26 g Verbindung 14, 1 ,3-Dipropyl-1 H-perimidiniumiodid und 5 g Leitsalz in 70 ml Acetonitril gelöst und in der Arbeitselektrodenkammer der Elektrosynthese unterworfen. Das ausgefallene Produkt wird abgesaugt und umkristallisiert.
So konnten 0,56 g Produkt gewonnen werden, was einer Ausbeute von 67 % entspricht.
Der Schmelzpunkt (Mp) wurde mit DSC ermittelt und lag bei 259°C.
Das Produkt wurde mittels MS/ESI und mittels 1HNMR untersucht, wobei die folgenden Daten erhalten wurden:
MS/ESI: MH+= 507,4 (18%); M/2+= 253,14 (100%);
Die Verbindung wurde mittels Protonenkernresonanzspektroskopie (1HNMR) untersucht, wobei die folgenden Daten erhalten wurden:
1H-NMR (Deutero-Pyridin): 7,28 (2H, t), 7,26 (2H, d), 6,64 (2H, d), 4,44 (1 H, s), 3,77 (2H, m), 2,97 (2H, m), 1 ,38 (4H, m), 0,63 (6H, m).
1,8-Naphthalendiamin (0,0015 mol), 2-Methoxybenzaldehyd (0,0015) mol und Natriumpyrosulfit (0,0015 mol) wurden in einem Gemisch aus 30 ml Ethanol und 10 ml Wasser unter Rühren am Rückfluss über Nacht erhitzt. Chromatographische Reinigung ergab einen weißen Feststoff.
Die Verbindung 17 (1mmol), 4,5 mmol Jodmethan, 1 mmol Pottasche werden in 30 ml Acetonitril über Nacht im Druckrohr bei 120 °C unter Rühren erhitzt. Nach dem Abkühlen wurde das Reaktionsgemisch eingeengt, in Dichlormethan (DCM) aufgenommen und mit Wasser gewaschen. Die organische Phase wurde mit MgS04 getrocknet. Anschließend wird die organische Phase filtriert, eingeengt und in n-Propanol aufgenommen. Bei Zugabe von Eis fällt ein gelber Feststoff aus, der mit Wasser/Ethanol umkristallisiert wird. Es konnte eine Ausbeute von 77% erhalten werden.
Verbindung 19: 2-Carboxv-1 ,3-dipropvl-1 H-perimidin-3-ium
Eine Lösung aus 0,011 mol Verbindung 15 (1 ,3-Dipropyl-1H-perimidiniumiodid) in 50 ml trockenen Tetrahydrofuran wurde unter Argon mit 0,013 mol Kaliumbis(trimethylsilyl)amid behandelt. Die Mischung wurde 16 Stunden bei Raumtemperatur (RT) gerührt und anschließend filtriert. Das Filtrat wurde 16 Stunden in einer C02-Ätmosphäre gerührt, der ausgefallene weiße Feststoff abfiltriert und mit THF gewaschen. Die Ausbeute betrug 85%.
Herstellung dotierter Schichten
Die niedrig molekularen Schichten werden üblicherweise durch ein Vakuumverfahren aufgedampft, wie zum Beispiel VTE (Vacuum Thermal Evaporation) oder OVPD (Organic Vapour Phase Deposition).
Dotierte Schichten werden im Vakuum typischerweise mittels Mischverdampfung zum Beispiel aus dem Matrixmaterial (C6o) und Dotand hergestellt. Über Schwingquarze und Masken kann das gewünschte Mischungsverhältnis eingestellt werden.
Eine alternative Variante ist die Rotationsbeschichtung (Spin Coating). Bei der Rotationsbeschichtung können lösliche Materialien mit entsprechender Stabilität in den entsprechenden Lösungsmitteln zur Fertigung homogener (Misch-)Schichten verwendet werden.
Leitfähigkeitsuntersuchungen Leitfähigkeitsuntersuchungen, die eine Erhöhung um mehr als acht Zehnerpotenzen offenbarten, konnten eine vielversprechende Eignung dieser
Verbindungen als n-Dotanden in organischen Halbleitermaterialien zeigen. Bei der Dotierung einer aufgedampften Mischschicht aus einem C6o- Fulleren und der Verbindung 3 als Dotand konnte eine Querleitfähigkeit auf einem Glassubstrat von bis zu 0,7 S/cm erreicht werden, wobei Leitfähigkeiten von mindestens 0,001 S/cm in elektronischen Bauelementen erreicht werden sollten, je nach Schichtdicke. Der verwendete n-Dotand wurde vor der Leitfähigkeitsuntersuchung 12 Wochen an Luft gelagert.
Die Fig. 1 zeigt Diodenkennlinie der aufgedampften Mischschicht aus OQO- Fulleren und Verbindung 3 bei verschiedenen Dotierkonzentrationen von 0,1 bis 10 Volumen- %.
Die Fig. 2 zeigt die Querleitfähigkeit der Mischschicht aus dem Ceo-Fulleren und Verbindung 3 in Abhängigkeit von der Dotierkonzentration.
Abkürzungen von n-dotierbaren Akzeptorfarbstoffen für Solarzellen
BTPTT-4F 2,2'-((2Z,2,Z)-((12, 13-Bis(2-ethylhexyl)-3,9-diundecyl-12,13- dihydro-[1 ,2,5]thiadiazolo[3,4- e]thieno[2",3’,:4’,5']thieno[2,,3,:4,5]pyrrolo[3,2- g]thieno[2',3':4,5]thieno[3,2-b]indol-2, 10- diyl)bis(methanylyliden))bis(5,6-difluoro-3-oxo-2,3-dihydro-1 H- inden-2, 1 -diyliden))dimalononitrile
CBM 2,2'-(7,7'-(9-(Heptadecan-9-yl)-9H-carbazol-2,7- diyl)bis(benzo[c][1 ,2,5]thiadiazol-7,4-diyl))bis(methan-1 -yl-1 - yliden)dimalononitril
CDTBM 2,2,-(4,4-Dioctyl-4H-cyclo-penta[2,1-b:3,4-b,]dithiophen- diyl)bis(benzo[c][1 ,2,5]thiadi-azol-7,4-diyl))bis(methan-1 -yl-1 - ylidene)dimalononitril
FBM 2,2'-(7,7,-(9,9-Dioctyl-9H-fluoren-2,7- diyl)bis(benzo[c][1 ,2,5]thiadiazol-7,4-diyl))bis(methan-1 -yl-1 - yliden)dimalononitril
IN IC 1-3 Kondensationsprodukte aus der 6,6, 12,12-Tetrakis(4- hexylphenyl)-indacenobis(dithieno[3,2-b;2',3'-c/]thiophen)-Einheit und eines 0-2-fach fluorierten 1 ,1-Dicyanomethylen-3-indanon- Bausteins
ITIC 2,2'-[[6,6, 12, 12-Tetrakis(4-hexylphenyl)-6, 12- dihydrodithieno[2,3-d:2',3'-d^-s-indaceno[1,2-b:5,6-b^dithiophen- 2,8-diyl]bis[methylidyn(3-oxo-1 H-inden-2, 1 (3H)- diyliden)]]bis[propandinitril]
NTCDI Naphthalentetracarboxyldiimid
Claims
1. Perimidin-Derivate für eine Anwendung in der Organischen Elektronik, ausgewählt aus Kationen, Zwitterionen und deren Dimeren, oder Dikationen und deren Dimeren oder Oligomeren, mit Strukturen gemäß einer der Formeln:
V VI
XI XII
XVII XVIII, wobei in XVIII jeder einzelne Phenylring mit R40 bis R43 durch einen substituierten oder unsubstituierten Heteroarylring ersetzt werden kann,
wobei
R0-4 jeweils ein Wasserstoffatom (H) oder ein Substituent, ausgewählt aus geradkettigen oder verzweigten Alkyl-, Cycloalkyl-, Trialkylsilyl-, Benzyl-, Alkoxy-, Alkoxyaryl-, Alkoxyhetaryl-, vollständig oder teilweise gesättigten und ungesättigten Aryl- oder Hetaryl-Gruppen,
R10 15 jeweils ein Wasserstoffatom (H) oder ein Substituent, ausgewählt aus geradkettigen oder verzweigten Alkyl-, Alkoxy-, Phenoxy-, Dialkylamino-, Piperidyl-, Pyrrolidinyl-, Morpholino- Thiomorpholino- Gruppen, vollständig oder teilweise gesättigten und ungesättigten Aryl- oder Hetaryl-Gruppen, wobei benachbarte Gruppen R auch als orthokondensierte Cyclen
Vorkommen können,
R30 31 jeweils ein Substituent, ausgewählt aus geradkettigen oder verzweigten Alkyl-, Cycloalkyl-, Benzyl-, Trialkylsilyl-, Diarylboronyl-, vollständig oder teilweise gesättigten und ungesättigten Aryl- und Hetaryl-Gruppen,
R4043 jeweils ein Wasserstoffatom (H) oder ein Substituent, ausgewählt aus geradkettigen oder verzweigten Alkyl-, Cycloalkyl-, Benzyl-, Alkoxy-,
Alkoxyaryl-, Alkoxyhetaryl-, vollständig oder teilweise gesättigten und ungesättigten Aryl- oder Hetaryl-Gruppen,
R50-55 jeweils ein Wasserstoffatom (H) oder ein Substituent, ausgewählt aus geradkettigen oder verzweigten Alkyl-, Cycloalkyl-, Benzyl-, Alkoxy-,
Alkoxyaryl-, Alkoxyhetaryl-, vollständig oder teilweise gesättigten und ungesättigten Aryl- oder Hetaryl-Gruppen, und
Q jeweils ein Sauerstoffatom oder ein Schwefelatom oder eine stickstoffhaltige Gruppe, zum Beispiel eine NR3-Gruppe, ist.
2. Perimidin-Derivat nach Anspruch 1, dadurch gekennzeichnet, dass zumindest ein Teil der Substituenten, die in den Formeln I bis XXI mit R0-55 bezeichnet sind, insbesondere Ro und Ri, untereinander verbrückt, wobei als Brücken gesättigte oder ungesättigte Kohlenstoffketten, heteroatomtragende gesättigte oder ungesättigte Kohlenstoffketten, vollständig oder teilweise gesättigte und ungesättigte Aromaten und Heteroaromaten dienen.
3. Perimidin-Derivat nach Anspruch 1 oder 2, dadurch gekennzeichnet, dass die durch Kreisbögen dargestellten Verbrückungen in den Formeln VIII und IX gesättigte oder ungesättigte substituierte oder unsubstituierte Alkylene, Ether, Aromaten oder Heteroaromaten, ortho-substituierte Aromaten oder ortho- substituierte Heteroaromaten oder Kombinationen von zwei oder mehreren dieser Strukturen sind.
4. Perimidin-Derivat nach Anspruch 3, dadurch gekennzeichnet, dass das Perimidin-Derivat eine Verbindung der Strukturformel IX ist, die aus Verbindungen der Formeln IXa oder IXb ausgewählt ist:
IXa IXb.
5. Perimidin-Derivat nach Anspruch 1 oder 2, dadurch gekennzeichnet, dass die Kationen der Formeln I bis V innerhalb von Salzen vorliegen, die sie
zusammen mit Anionen bilden, wobei die Perimidinium-Kationen und Dikationen jeweils zusammen mit beliebigen anorganischen oder organischen Anionen als Gegenion Vorkommen können.
6. Perimidin-Derivat nach Anspruch 5, dadurch gekennzeichnet, dass als Anionen oxidierbare Anionen, insbesondere Carboxylat-, Oxalat-, Halogenid-, Azid- oder Sulfit-Ionen vorgesehen sind.
7. Verwendung eines Perimidin-Derivats nach einem der Ansprüche 1 bis 6 in der Organischen Elektronik, insbesondere in organischen Halbleitern (OSC), organischen Leuchtdioden (OLED), Farbstoffsolarzellen (DSSC), Organischen Feldeffekttransistoren (OFET) und/oder Thermoelektrischen Generatoren.
8. Verwendung nach Anspruch 7, dadurch gekennzeichnet, dass das Perimidin-Derivat zum n-Dotieren eines organischen elektrisch halbleitenden Materials, insbesondere einer Elektronentransportschicht (ETL), oder als Ladungsträgerinjektionsschicht in elektronischen oder optoelektronischen Bauelementen verwendet wird.
9. Verwendung nach Anspruch 8, dadurch gekennzeichnet, dass das Perimidin-Derivat ausgewählt wird aus Verbindungen, die den Formeln l-VII entsprechen, wobei diese n-Dotandenvorstufen bilden und erst beim Dotieren, zum Beispiel bei einem Verdampfungsschritt oder auf der zu dotierenden Schicht, in die eigentlichen n-Dotanden zerfallen.
10. Verwendung von einem Perimidin-Derivat nach einem der Ansprüche 1 bis 6 in Akkumulatoren, Batterien, Elektrodenmaterial, Kondensatoren, Sensoren, Schaltkreisen und Datenspeichern.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE112021003032.9T DE112021003032A5 (de) | 2020-05-29 | 2021-05-31 | Perimidin-Derivate und deren Verwendung |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102020114469 | 2020-05-29 | ||
| DE102020114469.5 | 2020-05-29 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2021239191A1 true WO2021239191A1 (de) | 2021-12-02 |
Family
ID=76502641
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/DE2021/100469 WO2021239191A1 (de) | 2020-05-29 | 2021-05-31 | Perimidin-derivate und deren verwendung |
Country Status (2)
| Country | Link |
|---|---|
| DE (1) | DE112021003032A5 (de) |
| WO (1) | WO2021239191A1 (de) |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4427802A (en) * | 1981-07-27 | 1984-01-24 | Hexcel Corporation | Heterocyclic multifunctional amine adducts and curable compositions containing the same |
| EP1837926B1 (de) | 2006-03-21 | 2008-05-07 | Novaled AG | Heterocyclisches Radikal oder Diradikal, deren Dimere, Oligomere, Polymere, Dispiroverbindungen und Polycyclen, deren Verwendung, organisches halbleitendes Material sowie elektronisches Bauelement |
| EP2009014A1 (de) | 2007-06-22 | 2008-12-31 | Novaled AG | Verwendung eines Precursors eines n-Dotanden zur Dotierung eines organischen halbleitenden Materials, Precursor und elektronisches oder optoelektronisches Bauelement |
| CN106543231A (zh) * | 2015-09-21 | 2017-03-29 | 上海和辉光电有限公司 | 伯啶配合物及采用该伯啶配合物的有机电致发光器件 |
| WO2017169972A1 (ja) | 2016-03-29 | 2017-10-05 | 住友化学株式会社 | 発光素子及びその製造方法 |
| CN108822114A (zh) * | 2018-08-21 | 2018-11-16 | 中节能万润股份有限公司 | 一种oled电子传输材料及其应用 |
-
2021
- 2021-05-31 WO PCT/DE2021/100469 patent/WO2021239191A1/de active Application Filing
- 2021-05-31 DE DE112021003032.9T patent/DE112021003032A5/de not_active Withdrawn
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4427802A (en) * | 1981-07-27 | 1984-01-24 | Hexcel Corporation | Heterocyclic multifunctional amine adducts and curable compositions containing the same |
| EP1837926B1 (de) | 2006-03-21 | 2008-05-07 | Novaled AG | Heterocyclisches Radikal oder Diradikal, deren Dimere, Oligomere, Polymere, Dispiroverbindungen und Polycyclen, deren Verwendung, organisches halbleitendes Material sowie elektronisches Bauelement |
| EP2009014A1 (de) | 2007-06-22 | 2008-12-31 | Novaled AG | Verwendung eines Precursors eines n-Dotanden zur Dotierung eines organischen halbleitenden Materials, Precursor und elektronisches oder optoelektronisches Bauelement |
| CN106543231A (zh) * | 2015-09-21 | 2017-03-29 | 上海和辉光电有限公司 | 伯啶配合物及采用该伯啶配合物的有机电致发光器件 |
| WO2017169972A1 (ja) | 2016-03-29 | 2017-10-05 | 住友化学株式会社 | 発光素子及びその製造方法 |
| CN108822114A (zh) * | 2018-08-21 | 2018-11-16 | 中节能万润股份有限公司 | 一种oled电子传输材料及其应用 |
Non-Patent Citations (5)
| Title |
|---|
| J.M. HERBERTP.D. WOODGATEW.A. DENNY, J. MED. CHEM., vol. 30, 1987, pages 2081 |
| M.M. BARADARANIR.C. BEDDOESO.S. MILLSJ.A.JOULE, ACTA CRYST, vol. C51, 1995, pages 1345 |
| MEIJUN FENG ET AL., TETRAHEDRON LETT, vol. 53, 2012, pages 6292 |
| N.M. STARSCHIKOVA.F. POSCHARSKYKHIM. GETEROZYKL, SOEDIN., vol. 1, 1980, pages 96 |
| YUAN LIN ET AL., CHIN. J. APPL. CHEM., vol. 36, no. 6, 2017, pages 685 |
Also Published As
| Publication number | Publication date |
|---|---|
| DE112021003032A5 (de) | 2023-03-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE102008061843B4 (de) | Heterocyclische Verbindungen und deren Verwendung in elektronischen und optoelektronischen Bauelementen | |
| EP1624500B1 (de) | Spiro-Bifluoren Verbindungen als organisches Halbleiter-Matrixmaterial | |
| EP2493906B1 (de) | Heteroleptische carben-komplexe und deren verwendung in der organischen elektronik | |
| EP2513125B1 (de) | Metallkomplexe, enthaltend diazabenzimidazolcarben-liganden und deren verwendung in oleds | |
| KR102051360B1 (ko) | 유기 전자 소자 | |
| EP2433317B1 (de) | Halbleitendes bauelement | |
| WO2013153025A1 (de) | Organisch elektronische bauelemente mit organischen superdonoren mit mindestens zwei gekoppelten carben-gruppen und deren verwendung als n-dotierstoffe | |
| EP1837926B1 (de) | Heterocyclisches Radikal oder Diradikal, deren Dimere, Oligomere, Polymere, Dispiroverbindungen und Polycyclen, deren Verwendung, organisches halbleitendes Material sowie elektronisches Bauelement | |
| EP2498315B1 (de) | Organische Solarzelle | |
| WO2008138580A1 (de) | Imidazolderivate und deren verwendung als dotand zur dotierung eines organischen halbleitenden matrixmaterials | |
| EP1538684A1 (de) | Verfahren zur Dotierung von organischen Halbleitern mit Diiminoquinonderivaten | |
| EP1717291A2 (de) | Mischungen von organischen, zur Emission befähigten Halbleitern und Maxtrixmaterialien, deren Verwendung und diese Mischungen enthaltende Elektronikbauteile | |
| WO2009000237A1 (de) | Verwendung eines precursors eines n-dotanden zur dotierung eines organischen halbleitenden materials, precursor und elektronisches oder optoelektronisches bauelement | |
| DE102010030500A1 (de) | Verdampfbares organisch halbleitendes Material und dessen Verwendung in einem optoelektronischen Bauelement | |
| EP3512848B1 (de) | Verbindungen mit carbazol-strukturen | |
| EP3259786B1 (de) | Halbleitermaterial und naphtofuranverbindungsmatrix dafür | |
| EP2207865A1 (de) | Verwendung von substituierten tris(diphenylamino)-triazinverbindungen in oleds | |
| DE102015110091A1 (de) | Phosphepinmatrixverbindung für ein Halbleitermaterial | |
| WO2009083197A2 (de) | Asymmetrische phenanthroline, deren herstellungsverfahren und diese enthaltendes dotiertes organisches halbleitermaterial | |
| WO2021239191A1 (de) | Perimidin-derivate und deren verwendung | |
| EP4271677A1 (de) | Verbindung für ein optoelektronisches bauelement und optoelektronisches bauelement enthaltend die verbindung | |
| WO2022101343A1 (de) | Cer-ethylendiaminketonartige - und cer-salenartige-komplexe und deren verwendung in der organischen elektronik | |
| DE102021118308A1 (de) | Elektronenreiche heterocyclische Dimere und deren Verwendung | |
| DE102009021881B4 (de) | Organisches halbleitendes Bauelement | |
| EP3059776B1 (de) | Halbleitermaterial und Naphtofuranverbindungsmatrix |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 21733052 Country of ref document: EP Kind code of ref document: A1 |
|
| REG | Reference to national code |
Ref country code: DE Ref legal event code: R225 Ref document number: 112021003032 Country of ref document: DE |
|
| 122 | Ep: pct application non-entry in european phase |
Ref document number: 21733052 Country of ref document: EP Kind code of ref document: A1 |