Substituierte 3-Heteroaryloxy-lH-pyrazole sowie deren Salze und ihre Verwendung als herbizide Wirkstoffe
Beschreibung
Die Erfindung betrifft das technische Gebiet der Pflanzenschutzmittel, insbesondere das der Herbizide zur selektiven Bekämpfung von Unkräutern und Ungräsern in Nutzpflanzenkulturen.
Speziell betrifft diese Erfindung substituierte 3-Heteroaryloxy-lH-pyrazole sowie deren Salze,
Verfahren zu ihrer Herstellung und ihre Verwendung als Herbizide.
Bisher bekannte Pflanzenschutzmittel zur selektiven Bekämpfung von Schadpflanzen in
Nutzpflanzenkulturen oder Wirkstoffe zur Bekämpfung von unerwünschtem Pflanzenwuchs weisen bei ihrer Anwendung teilweise Nachteile auf, sei es, dass sie (a) keine oder aber eine unzureichende herbizide Wirkung gegen bestimmte Schadpflanzen, (b) ein zu geringes Spektrum der Schadpflanzen, das mit einem Wirkstoff bekämpft werden kann, (c) zu geringe Selektivität in Nutzpflanzenkulturen und/oder (d) ein toxikologisch ungünstiges Profil besitzen. Weiterhin führen manche Wirkstoffe, die als Pflanzenwachstumsregulatoren bei einigen Nutzpflanzen eingesetzt werden können, bei anderen
Nutzpflanzen zu unerwünscht verminderten Ernteerträgen oder sind mit der Kulturpflanze nicht oder nur in einem engen Aufwandmengenbereich verträglich. Einige der bekannten Wirkstoffe lassen sich wegen schwer zugänglicher Vorprodukte und Reagenzien im industriellen Maßstab nicht wirtschaftlich herstellen oder besitzen nur unzureichende chemische Stabilitäten. Bei anderen Wirkstoffen hängt die Wirkung zu stark von Umweltbedingungen, wie Wetter- und Bodenverhältnissen ab.
Die herbizide Wirkung dieser bekannten Verbindungen, insbesondere bei niedrigen Aufwandmengen, bzw. deren Verträglichkeit gegenüber Kulturpflanzen bleiben verbesserungswürdig. Verschiedene Schriften beschreiben substituierte Heteroaryloxypyrazole. In JP2002/348280 und J. Pestic. Sei. 2004, 29, 96-104 sind Heteroaryloxypyrazole als Herbizide beschrieben, die in der 4- Position des Pyrazols mit Carbamoyl- oder Acylaminoresten substituiert sind. In JP07285962 werden Heteroaryloxypyrazole benannt, die in der 3 -Position des Pyrazols spezifisch mit Wasserstoff oder Halogen substituiert sind und als Herbicide beansprucht werden. In WO2002/066439 werden
Heteroaryloxypyrazole benannt, die in der 1 -Position des Pyrazols spezifisch mit Carbamoylresten substituiert sind und als Herbicide beansprucht werden. In WO2016/124769 werden
Heteroaryloxypyrazole benannt, die in der 1 -Position des Pyrazols spezifisch mit Alkinylresten
substituiert sind und als Nitrification Inhibitors beansprucht werden. In WO2003/144309 werden Heteroaryloxypyrazole benannt, die in der 4-Position des Pyrazols spezifisch mit Aminopyridine oder Aminopyrimidine substituiert sind und als Proteinkinase-Inhibitoren mit pharmazeutischen Nutzen beansprucht werden. In JP2000/095778 werden Heteroaryloxypyrazole benannt, die in der 4-Position des Pyrazols spezifisch mit Imidazole und 1 ,2,4-Triazole substituiert sind und als Fungicide beansprucht werden.
Substituierte 3-Heteroaryloxy-lH-pyrazole oder deren Salze als herbizide Wirkstoffe sind dagegen bisher noch nicht beschrieben.
Überraschenderweise wurde nun gefunden, dass substituierte 3-Heteroaryloxy-lH-pyrazole oder deren Salze als herbizide Wirkstoffe besonders gut geeignet sind.
Gegenstand der vorliegenden Erfindung sind damit substituierte 3-Heteroaryloxy-lH-pyrazole der allgemeinen Formel (I) oder deren Salze
worin
A für Sauerstoff, -S(0)„-, -C(R3)(R4) -, -NR5- oder eine einfache Bindung steht
mit n gleich 0, 1 oder 2,
Q1 für ein gegebenenfalls substituiertes Aryl, Heteroaryl, (C3-Cio)-Cycloalkyl oder (C3-C10)-
Cycloalkenyl steht, wobei jeder Ring oder jedes Ringsystem optional mit bis zu 5 Substituenten aus der Gruppe R6 substituiert ist;
oder für einen gegebenenfalls substituierten 5-7-gliedrigen heterocyclischen Ring oder für ein gegebenenfalls substituiertes 8-10-gliedriges bicyclisches, heterocyclisches Ringsystem, in dem jeder Ring oder jedes Ringsystem aus Kohlenstoffatomen und 1-5 Heteroatomen besteht, die unabhängig voneinander bis zu 2 O-, bis zu 2 S- und bis zu 5 N-Atome enthalten können, wobei bis zu drei Kohlenstoffringatome unabhängig voneinander aus den Gruppen C(=0) und C(=S) gewählt werden können; und die Schwefelringatome zusätzlich aus den Gruppen S, S(=0), S(=0)2, S(=NR8) und S(=NR8)(=0) gewählt werden können; jeder Ring oder jedes Ringsystem
ist optional mit bis zu 5 Substituenten aus der Gruppe R6 substituiert;
oder für ein 8-10-gliedriges bicyclisches, carbocyclisches Ringsystem steht, das ungesättigt, teilweise gesättigt oder vollständig gesättigt ist, und das mit bis zu 5 Substituenten aus der Gruppe R6 substituiert sein kann,
und wobei für den Fall, dass A eine einfache Bindung representiert, der Rest Q1 ungleich Imidazol oder 1 ,2,4-Triazol ist, für ein gegebenenfalls substituiertes Heteroaryl steht, wobei jeder Ring optional mit bis zu 4 Substituenten aus der Gruppe R7 substituiert ist, für Wasserstoff, (Ci-C8)-Alkyl, (Ci-C8)-Haloalkyl, (Ci-C8)-Cyanoalkyl, (Ci-C8)-Hydroxyalkyl, (Ci-C6)-Alkoxy-(Ci-C6)-alkyl, (Ci-C6)-Haloalkoxy-(Ci-C6)-alkyl, (Ci-C6)-Alkylthio-(Ci-C6)- alkyl, (Ci-C6)-Alkylsulfmyl-(Ci-C6)-alkyl, (Ci-C6)-Alkylsulfonyl-(Ci-C6)-alkyl, (Ci-C6)- Cycloalkylthio-(Ci-C6)-alkyl, (Ci-C6)-Cycloalkylsulfmyl-(Ci-C6)-alkyl, (Ci-C6)- Cycloalkylsulfonyl-(Ci-C6)-alkyl, Aryl-(Ci-C6)-alkyl, Heteroaryl-(Ci-C6)-alkyl, Heterocyclyl- (Ci-C6)-alkyl, (C3-C8)-Cycloalkyl, (C3-C6)-Cycloalkyl-(Ci-C6)-alkyl, (C3-C6)-Halocycloalkyl, (C3-C6)-Halocycloalkyl-(Ci-C6)-alkyl, (C2-C6)-Alkenyl, (C2-C6)-Haloalkenyl, Tris-[(Ci-C6)- alkyl]silyl-(C2-C6)-alkinyl, Carboxyl, Carboxyl-(Ci-C6)-alkyl, (Ci-C8)-Alkylcarbonyl, (Ci-C8)- Haloalkylcarbonyl, (C3-C8)-Cycloalkylcarbonyl, (Ci-C8)-Alkoxycarbonyl, (C2-C8)- Haloalkoxycarbonyl, (C3-C8)-Cycloalkoxycarbonyl, (C2-C8)-Alkylaminocarbonyl, (C3-C10)- Dialkylaminocarbonyl, (C3-Cio)-Cycloalkylaminocarbonyl, (Ci-C8)-Alkoxycarbonyl-(Ci-C6)- alkyl, (C2-C8)- Haloalkoxycarbonyl-(Ci-C6)-alkyl, (C3-C8)-Cycloalkoxycarbonyl-(Ci-C6)-alkyl, (C2-C8)-Alkylaminocarbonyl-(Ci-C6)-alkyl, (C3-Cio)-Dialkylaminocarbonyl-(Ci-C6)-alkyl, (C3-Cio)-Cycloalkylaminocarbonyl-(Ci-C6)-alkyl, (Ci-C8)-Alkylcarbonyloxy-(Ci-C4)-alkyl, (Ci-C8)-Alkoxycarbonyloxy-(Ci-C4)-alkyl, (C3-C6)-Cycloalkoxycarbonyloxy-(Ci-C4)-alkyl, (Ci-C6)-Alkylsulfonyl, (Ci-C6)-Haloalkylsulfonyl, Arylsulfonyl, Phthalimidomethyl steht, für Wasserstoff, Halogen, Cyano, (Ci-C6)-Alkyl, (Ci-C6)-Haloalkyl, (Ci-C6)-Cyanoalkyl, (Ci- C6)-Hydroxyalkyl, (Ci-C6)-Alkoxy, (Ci-C6)-Haloalkoxy, (Ci-C6)-Alkoxy-(Ci-C6)-alkyl, (Ci-C6)- Haloalkoxy-(Ci-C6)-alkyl, Aryl-(Ci-C6)-alkyl, Heteroaryl-(Ci-C6)-alkyl, Heterocyclyl-(Ci-C6)- alkyl, (C3-C6)-Cycloalkyl, (C3-C6)-Cycloalkyl-(Ci-C6)-alkyl, (C3-C6)-Halocycloalkyl, (C3-C6)- Halocycloalkyl-(Ci-C6)-alkyl, (C2-C6)-Alkenyl, (C2-C6)-Alkinyl, (C2-C6)-Haloalkenyl, (C2-C6)- Haloalkinyl, Tris-[(Ci-C6)-alkyl]silyl-(C2-C6)-alkinyl, Carboxyl, Carboxyl-(Ci-C6)-alkyl, (Ci-C8)-Alkylcarbonyl, (Ci-C8)-Haloalkylcarbonyl, (C3-C8)-Cycloalkylcarbonyl, (Ci-Cg)- Alkoxycarbonyl, (Ci-C6)-Alkenyloxycarbonyl, (C2-C8)- Haloalkoxycarbonyl, (C3-C8)- Cycloalkoxycarbonyl, (C2-C8)-Alkylaminocarbonyl, (C3-Cio)-Dialkylaminocarbonyl, (C3-C10)- Cycloalkylaminocarbonyl, (Ci-C8)-Alkoxycarbonyl-(Ci-C6)-alkyl, (C2-C8)-
Haloalkoxycarbonyl-(Ci-C6)-alkyl, (C3-C8)-Cycloalkoxycarbonyl-(Ci-C6)-alkyl, (C2-Cg)- Alkylaminocarbonyl-(Ci-C6)-alkyl, (C3-Cio)-Dialkylaminocarbonyl-(Ci-C6)-alkyl, (C3-C10)- Cycloalkylaminocarbonyl-(Ci-C6)-alkyl, Amino, (Ci-C6)-Alkylamino, (C2-Cio)-Dialkylamino, (Ci-C6)-Haloalkylamino, (C3-C8)-Cycloalkylamino, (C2-C8)-Alkenylamino, (C4-C10)- Dialkenylamino, (Ci-C6)-Alkylcarbonylamino, (C2-Cio)-(Dialkylcarbonyl)amino, (CI-CÖ)- Haloalkylcarbonylamino, (C3-C8)-Cycloalkylcarbonylamino, (N-(Ci-C6)-Alkylcarbonyl)-(Ci- C6)-alkylamino, (Ci-C6)-Alkyl-S(0)x steht,
wobei x gleich 0, 1 oder 2 ist, oder
R1 und R2 zusammen einen Alkyl-(CH2)m-Ring bilden, wobei m gleich 3, 4 oder 5 ist,
R3 und R4 unabhängig voneinander für Wasserstoff, Hydroxy, Halogen, (Ci-Cg)-Alkyl, (Ci-Cg)- Haloalkyl, (C2-C8)-Alkenyl, (C2-C8)-Alkinyl, (Ci-C6)-Alkoxy-(Ci-C6)-alkyl, (Ci-C6)- Haloalkoxy-(Ci-C6)-alkyl, (Ci-C8)-Alkylthio-(Ci-C8)-alkyl, (Ci-C8)-Alkylsulfmyl-(Ci-C8)-alkyl, (Ci-C8)-Alkylsulfonyl-(Ci-C8)-alkyl, (Ci-C8)-Alkylcarbonyl, (Ci-C8)-Haloalkylcarbonyl, (C3-C8)-Cycloalkylcarbonyl, (Ci-C8)-Alkoxycarbonyl, (C2-C8)- Haloalkoxycarbonyl, (C4-Cg)- Cycloalkoxycarbonyl, (C2-C8)-Alkylaminocarbonyl, (C3-Cio)-Dialkylaminocarbonyl, (C3-C10)- Cycloalkylaminocarbonyl, (Ci-Cg)-Alkoxy, (Ci-Cg)-Alkylthio, (Ci-Cg)-Haloalkylthio, (C3-Cg)- Cycloalkylthio, stehen, oder
R3 und R4 gemeinsam einen 3- bis 6-gliedrigen carbocyclischen Ring oder einen 3- bis 6-gliedrigen gesättigten heterocyclischen Ring mit bis zu 2 Sauerstoffatomen bilden, oder
R3 und R4 gemeinsam einen (Ci-C3)-Alkylidenrest oder (Ci-C3)-Haloalkylidenrest bilden,
R5 für Wasserstoff, (Ci-Cg)-Alkyl, (Ci-Cg)-Haloalkyl, Aryl-(Ci-C6)-alkyl, Heteroaryl-(Ci-C6)-alkyl, (C3-C6)-Cycloalkyl, (C3-C6)-Cycloalkyl-(Ci-C6)-alkyl, (C3-C6)-Halocycloalkyl, (C3-C6)- Halocycloalkyl-(Ci-C6)-alkyl, (C2-C8)-Alkenyl, (C2-C8)-Alkinyl, (Ci-C8)-Alkoxy-(Ci-C8)-alkyl, (Ci-C8)-Haloalkoxy-(Ci-C8)-alkyl, (Ci-C8)-Alkylthio-(Ci-C8)-alkyl, (Ci-Cg)-Alkylsulfmyl- (Ci-Cg)-alkyl, (Ci-C8)-Alkylsulfonyl-(Ci-C8)-alkyl, (Ci-Cg)-Alkylcarbonyl, (Ci-Cg)- Haloalkylcarbonyl, (C3-C8)-Cycloalkylcarbonyl, Formyl, (Ci-C8)-Alkoxycarbonyl, (C2-C8)-
Haloalkoxycarbonyl, (C4-C8)-Cycloalkoxycarbonyl, (C2-C8)-Alkylaminocarbonyl, (C3-C10)- Dialkylaminocarbonyl, (C3-Cio)-Cycloalkylaminocarbonyl steht, für Wasserstoff, Halogen, Cyano, Nitro, Formyl, (Ci-Cg)-Alkyl, (Ci-C8)-Haloalkyl, (C2-C8)- Alkenyl, (C2-C8)-Alkinyl, (C2-C4)-Haloalkenyl, (C2-C5)-Haloalkinyl, (Ci-C4)-Alkoxy-(Ci-C4)- alkyl, (Ci-C4)-Haloalkoxy-(Ci-C4)-alkyl, (Ci-C8)-Alkylthio-(Ci-C8)-alkyl, (Ci-C8)-Alkylsulfinyl- (Ci-C8)-alkyl, (Ci-C8)-Alkylsulfonyl-(Ci-C8)-alkyl, (Ci-C8)-Alkylcarbonyl, (Ci-C8)- Haloalkylcarbonyl, (C3-C8)-Cycloalkylcarbonyl, Carboxyl, (Ci-C8)-Alkoxycarbonyl, (C2-C8)- Haloalkoxycarbonyl, (C4-C8)-Cycloalkoxycarbonyl, (C2-C8)-Alkylaminocarbonyl, (C3-C10)- Dialkylaminocarbonyl, (C3-Cio)-Cycloalkylaminocarbonyl, (Ci-C8)-Alkoxy, (Ci-C8)-Haloalkoxy, (Ci-C8)-Alkylthio, (Ci-C8)-Haloalkylthio, (C3-C8)-Cycloalkylthio, (Ci-C8)-Alkylsulfmyl, (Ci-C8)- Haloalkylsulfmyl, (C3-C8)-Cycloalkylsulfmyl, (Ci-C8)-Alkylsulfonyl, (Ci-C8)-Haloalkylsulfonyl, (C3-C8)-cycloalkylsulfonyl, (Ci-C8)-Alkylaminosulfonyl, (C2-C8)-Dialkylaminosulfonyl oder (C3-C8)-Trialkylsilyl steht, für Wasserstoff, Halogen, Cyano, Nitro, Formyl, (Ci-C8)-Alkyl, (Ci-C8)-Haloalkyl, (C2-C8)- Alkenyl, (C2-C4)-Haloalkenyl, (C2-C5)-Haloalkinyl, (Ci-C4)-Alkoxy-(Ci-C4)-alkyl, (C1-C4)- Haloalkoxy-(Ci-C4)-alkyl, (Ci-C8)-Alkylthio-(Ci-C8)-alkyl, (Ci-C8)-Alkylsulfmyl-(Ci-C8)-alkyl, (Ci-C8)-Alkylsulfonyl-(Ci-C8)-alkyl, (Ci-C8)-Alkylcarbonyl, (Ci-C8)-Haloalkylcarbonyl, (C3-C8)- Cycloalkylcarbonyl, Carboxyl, (Ci-C8)-Alkoxycarbonyl, (C2-C8)- Haloalkoxycarbonyl, (C4-C8)- Cycloalkoxycarbonyl, (C2-C8)-Alkylaminocarbonyl, (C3-Cio)-Dialkylaminocarbonyl, (C3-C10)- Cycloalkylaminocarbonyl, (Ci-C8)-Alkoxy, (Ci-C8)-Alkylthio, (Ci-C8)-Haloalkylthio, (C3-C8)- Cycloalkylthio, (Ci-C8)-Alkylsulfmyl, (Ci-C8)-Haloalkylsulfmyl, (C3-C8)-Cycloalkylsulfmyl, (Ci-C8)-Alkylsulfonyl, (Ci-C8)-Haloalkylsulfonyl, (C3-C8)-cycloalkylsulfonyl, (Ci-C8)- Alkylaminosulfonyl, (C2-C8)-Dialkylaminosulfonyl oder (C3-C8)-Trialkylsilyl steht, und für Wasserstoff, Amino, Hydroxy, Cyano, Formyl, (Ci-C8)-Alkyl, (Ci-C8)-Haloalkyl, (Ci-Cs)- Cyanoalkyl, (Ci-C8)-Hydroxyalkyl, (Ci-C8)-Alkoxy-(Ci-C8)-alkyl, Aryl-(Ci-C8)-alkyl,
Heteroaryl-(Ci-C8)-alkyl, Heterocyclyl-(Ci-C8)-alkyl, (C3-Cio)-Cycloalkyl, (C3-Cio)-Cycloalkyl- (Ci-C8)-alkyl, (C3-C8)-Halocycloalkyl, (C3-C8)-Halocycloalkyl-(Ci-C8)-alkyl, (Ci-C8)- Alkylcarbonyl, (Ci-C8)-Alkoxycarbonyl, (C2-C8)-Alkenyl, (C2-C8)-Alkinyl, Tris-[(Ci-C8)- alkyl]silyl-(C2-C8)-alkinyl, Tris-[(Ci-C8)-alkyl]silyl steht.
Die Verbindungen der allgemeinen Formel (I) können durch Anlagerung einer geeigneten anorganischen oder organischen Säure, wie beispielsweise Mineralsäuren, wie beispielsweise HCl, HBr, H2SO4, HsPO i oder HNO3, oder organische Säuren, z. B. Carbonsäuren, wie Ameisensäure, Essigsäure, Propionsäure, Oxalsäure, Milchsäure oder Salicylsäure oder Sulfonsäuren, wie zum Beispiel p- Toluolsulfonsäure, an eine basische Gruppe, wie z.B. Amino, Alkylamino, Dialkylamino, Piperidino, Morpholino oder Pyridino, Salze bilden. Diese Salze enthalten dann die konjugierte Base der Säure als Anion. Geeignete Substituenten, die in deprotonierter Form, wie z.B. Sulfonsäuren, bestimmte
Sulfonsäureamide oder Carbonsäuren, vorliegen, können innere Salze mit ihrerseits protonierbaren Gruppen, wie Aminogruppen bilden. Salzbildung kann auch durch Einwirkung einer Base auf
Verbindungen der allgemeinen Formel (I) erfolgen. Geeignete Basen sind beispielsweise organische Amine, wie Trialkylamine, Morpholin, Piperidin und Pyridin sowie Ammonium-, Alkali- oder
Erdalkalimetallhydroxide, -carbonate und -hydrogencarbonate, insbesondere Natrium- und
Kaliumhydroxid, Natrium- und Kaliumcarbonat und Natrium- und Kaliumhydrogencarbonat. Diese Salze sind Verbindungen, in denen der azide Wasserstoff durch ein für die Landwirtschaft geeignetes Kation ersetzt wird, beispielsweise Metallsalze, insbesondere Alkalimetallsalze oder
Erdalkalimetallsalze, insbesondere Natrium- und Kaliumsalze, oder auch Ammoniumsalze, Salze mit organischen Aminen oder quartäre Ammoniumsalze, zum Beispiel mit Kationen der Formel
[NRaRbRcRd]+ worin Ra bis Rd jeweils unabhängig voneinander einen organischen Rest, insbesondere Alkyl, Aryl, Arylalkyl oder Alkylaryl darstellen. Infrage kommen auch Alkylsulfonium- und
Alkylsulfoxoniumsalze, wie (Ci-C4)-Trialkylsulfonium- und (Ci-C4)-Trialkylsulfoxoniumsalze.
Die erfindungsgemäßen substituierten Arylpyrazole der allgemeinenFormel (I) können in Abhängigkeit von äußeren Bedingungen, wie pH- Wert, Lösungsmittel und Temperatur in verschiedenen tautomeren Strukturen vorliegen, die alle von der allgemeinen Formel (I) umfasst sein sollen.
Im Folgenden werden die erfindungsgemäß verwendeten Verbindungen der Formel (I) und ihre Salze "Verbindungen der allgemeinen Formel (I)" bezeichnet.
Bevorzugter Erfindungsgegenstand sind Verbindungen der allgemeinen Formel (I), worin
A für Sauerstoff, -S(0)„-, -C(R3)(R4) -, -NR5- oder eine einfache Bindung steht,
wobei n gleich 0, 1 oder 2 ist,
Q1 für ein gebenenfalls substituiertes Aryl, Heteroaryl, (C3-Cio)-Cycloalkyl oder (C3-C10)- Cycloalkenyl steht, wobei jeder Ring oder jedes Ringsystem optional mit bis zu 5 Substituenten aus der Gruppe R6 substituiert ist,
oder für einen gegebenenfalls substituierten 5-7-gliedrigen heterocyclischen Ring,
oder für ein gegebenenfalls substituiertes 8-10-gliedriges bicyclisches, heterocyclisches Ringsystem, in dem jeder Ring oder jedes Ringsystem aus Kohlenstoffatomen und 1 -5
Heteroatomen besteht, die unabhängig voneinander bis zu 2 O-, bis zu 2 S- und bis zu 5 N- Atome enthalten können, besteht und wobei bis zu drei Kohlenstoffringatome unabhängig voneinander aus den Gruppen C(=0) und C(=S) gewählt werden können und die
Schwefelringatome zusätzlich aus den Gruppen S, S(=0), S(=0)2, S(=NR8) und S(=NR8)(=0) gewählt werden können,
jeder Ring oder jedes Ringsystem optional mit bis zu 5 Substituenten aus der Gruppe R6 substituiert ist,
oder für ein 8-10-gliedriges bicyclisches, carbocyclisches Ringsystem steht, das ungesättigt, teilweise gesättigt oder vollständig gesättigt ist, und das mit bis zu 5 Substituenten aus der Gruppe R6 substituiert sein kann,
und wobei für den Fall, dass A eine einfache Bindung ist, der Rest Q1 ungleich Imidazol oder 1 ,2,4-Triazol ist, für die Gruppen Q-l bis Q-10 steht
Q-l Q-2 Q-3 Q-4 Q-5
Q-7 Q-8 Q-9 Q-10 für Wasserstoff, (Ci-C8)-Alkyl, (Ci-C8)-Haloalkyl, (Ci-C8)-Cyanoalkyl, (Ci-C8)-Hydroxyalkyl, (Ci-C6)-Alkoxy-(Ci-C6)-alkyl, (Ci-C6)-Haloalkoxy-(Ci-C6)-alkyl, (Ci-C6)-Alkylthio-(Ci-C6)- alkyl, (Ci-C6)-Alkylsulfmyl-(Ci-C6)-alkyl, (Ci-C6)-Alkylsulfonyl-(Ci-C6)-alkyl, (Ci-C6)- Cycloalkylthio-(Ci-C6)-alkyl, (Ci-C6)-Cycloalkylsulfmyl-(Ci-C6)-alkyl, (Ci-C6)- Cycloalkylsulfonyl-(Ci-C6)-alkyl, Aryl-(Ci-C6)-alkyl, Heteroaryl-(Ci-C6)-alkyl, Heterocyclyl- (Ci-C6)-alkyl, (C3-C8)-Cycloalkyl, (C3-C6)-Cycloalkyl-(Ci-C6)-alkyl, (C3-C6)-Halocycloalkyl, (C3-C6)-Halocycloalkyl-(Ci-C6)-alkyl, (C2-C6)-Alkenyl, (C2-C6)-Haloalkenyl, Tris-[(Ci-C6)- alkyl]silyl-(C2-C6)-alkinyl, Carboxyl, Carboxyl-(Ci-C6)-alkyl, (Ci-C8)-Alkylcarbonyl, (Ci-C8)- Haloalkylcarbonyl, (C3-C8)-Cycloalkylcarbonyl, (Ci-C8)-Alkoxycarbonyl, (C2-C8)-
Haloalkoxycarbonyl, (C3-Cg)-Cycloalkoxycarbonyl, (C2-C8)-Alkylaminocarbonyl, (C3-C10)- Dialkylaminocarbonyl, (C3-Cio)-Cycloalkylaminocarbonyl, (Ci-Cg)-Alkoxycarbonyl-(Ci-C6)- alkyl, (C2-Cg)- Haloalkoxycarbonyl-(Ci-C6)-alkyl, (C3-Cg)-Cycloalkoxycarbonyl-(Ci-C6)-alkyl, (C2-Cg)-Alkylaminocarbonyl-(Ci-C6)-alkyl, (C3-Cio)-Dialkylaminocarbonyl-(Ci-C6)-alkyl, (C3-Cio)-Cycloalkylaminocarbonyl-(Ci-C6)-alkyl, (Ci-Cg)-Alkylcarbonyloxy-(Ci-C4)-alkyl, (Ci-Cg)-Alkoxycarbonyloxy-(Ci-C4)-alkyl, (C3-C6)-Cycloalkoxycarbonyloxy-(Ci-C4)-alkyl, (Ci-C6)-Alkylsulfonyl, (Ci-C6)-Haloalkylsulfonyl, Arylsulfonyl, Phthalimidomethyl steht, R2 für Wasserstoff, Halogen, Cyano, (Ci-C6)-Alkyl, (Ci-C6)-Haloalkyl, (Ci-C6)-Cyanoalkyl, (Ci- C6)-Hydroxyalkyl, (Ci-C6)-Alkoxy, (Ci-C6)-Haloalkoxy, (Ci-C6)-Alkoxy-(Ci-C6)-alkyl, (Ci-C6)- Haloalkoxy-(Ci-C6)-alkyl, Aryl-(Ci-C6)-alkyl, Heteroaryl-(Ci-C6)-alkyl, Heterocyclyl-(Ci-C6)- alkyl, (C3-C6)-Cycloalkyl, (C3-C6)-Cycloalkyl-(Ci-C6)-alkyl, (C3-C6)-Halocycloalkyl, (C3-C6)- Halocycloalkyl-(Ci-C6)-alkyl, (C2-C6)-Alkenyl, (C2-C6)-Alkinyl, (C2-C6)-Haloalkenyl, (C2-C6)- Haloalkinyl, Tris-[(Ci-C6)-alkyl]silyl-(C2-C6)-alkinyl, Carboxyl, Carboxyl-(Ci-C6)-alkyl, (Ci-Cg)-Alkylcarbonyl, (Ci-Cg)-Haloalkylcarbonyl, (C3-Cg)-Cycloalkylcarbonyl, (Ci-Cg)- Alkoxycarbonyl, (Ci-C6)-Alkenyloxycarbonyl, (C2-Cg)- Haloalkoxycarbonyl, (C3-Cg)- Cycloalkoxycarbonyl, (C2-Cg)-Alkylaminocarbonyl, (C3-Cio)-Dialkylaminocarbonyl, (C3-C10)- Cycloalkylaminocarbonyl, (Ci-Cg)-Alkoxycarbonyl-(Ci-C6)-alkyl, (C2-Cg)- Haloalkoxycarbonyl-(Ci-C6)-alkyl, (C3-Cg)-Cycloalkoxycarbonyl-(Ci-C6)-alkyl, (C2-Cg)- Alkylaminocarbonyl-(Ci-C6)-alkyl, (C3-Cio)-Dialkylaminocarbonyl-(Ci-C6)-alkyl, (C3-C10)- Cycloalkylaminocarbonyl-(Ci-C6)-alkyl, Amino, (Ci-C6)-Alkylamino, (C2-Cio)-Dialkylamino, (Ci-C6)-Haloalkylamino, (C3-Cg)-Cycloalkylamino, (C2-Cg)-Alkenylamino, (C4-C10)- Dialkenylamino, (Ci-C6)-Alkylcarbonylamino, (C2-Cio)-(Dialkylcarbonyl)amino, (Ci-Ce)- Haloalkylcarbonylamino, (C3-Cg)-Cycloalkylcarbonylamino, (N-(Ci-C6)-Alkylcarbonyl)-(Ci- C6)-alkylamino, (Ci-C6)-Alkyl-S(0)x steht,
wobei x gleich 0, 1 oder 2 ist, oder
R1 und R2 zusammen einen Alkyl-(CH2)m-Ring bilden, wobei m gleich 3, 4 oder 5 ist,
R3 und R4 unabhängig voneinander für Wasserstoff, Hydroxy, Halogen, (Ci-Cg)-Alkyl, (Ci-Cg)- Haloalkyl, (C2-Cg)-Alkenyl, (C2-Cg)-Alkinyl, (Ci-C6)-Alkoxy-(Ci-C6)-alkyl, (Ci-C6)- Haloalkoxy-(Ci-C6)-alkyl, (Ci-Cg)-Alkylthio-(Ci-Cg)-alkyl, (Ci-Cg)-Alkylsulfmyl-(Ci-Cg)-alkyl, (Ci-Cg)-Alkylsulfonyl-(Ci-Cg)-alkyl, (Ci-Cg)-Alkylcarbonyl, (Ci-Cg)-Haloalkylcarbonyl, (C3-Cg)-Cycloalkylcarbonyl, (Ci-Cg)-Alkoxycarbonyl, (C2-Cg)- Haloalkoxycarbonyl, (C4-Cg)- Cycloalkoxycarbonyl, (C2-Cg)-Alkylaminocarbonyl, (C3-Cio)-Dialkylaminocarbonyl, (C3-C10)-
Cycloalkylaminocarbonyl, (Ci-Cg)-Alkoxy, (Ci-Cg)-Alkylthio, (Ci-Cg)-Haloalkylthio, (C3-Cg)- Cycloalkylthio, stehen, oder
R3 und R4 zusammen einen 3- bis 6-gliedrigen carbocyclischen Ring oder einen 3- bis 6-gliedrigen gesättigten heterocyclischen Ring mit bis zu 2 Sauerstoffatomen bilden,
oder
R3 und R4 zusammen einen (Ci-C3)-Alkylidenrest oder (Ci-C3)-Haloalkylidenrest bilden,
R5 für Wasserstoff, (Ci-C8)-Alkyl, (Ci-C8)-Haloalkyl, Aryl-(Ci-C6)-alkyl, Heteroaryl-(Ci-C6)-alkyl, (C3-C6)-Cycloalkyl, (C3-C6)-Cycloalkyl-(Ci-C6)-alkyl, (C3-C6)-Halocycloalkyl, (C3-C6)- Halocycloalkyl-(Ci-C6)-alkyl, (C2-C8)-Alkenyl, (C2-C8)-Alkinyl, (Ci-C8)-Alkoxy-(Ci-C8)-alkyl, (Ci-C8)-Haloalkoxy-(Ci-C8)-alkyl, (Ci-C8)-Alkylthio-(Ci-C8)-alkyl, (Ci-C8)-Alkylsulfinyl- (Ci-C8)-alkyl, (Ci-C8)-Alkylsulfonyl-(Ci-C8)-alkyl, (Ci-C8)-Alkylcarbonyl, (Ci-C8)- Haloalkylcarbonyl, (C3-C8)-Cycloalkylcarbonyl, Formyl, (Ci-C8)-Alkoxycarbonyl, (C2-C8)- Haloalkoxycarbonyl, (C4-C8)-Cycloalkoxycarbonyl, (C2-C8)-Alkylaminocarbonyl, (C3-C10)- Dialkylaminocarbonyl, (C3-Cio)-Cycloalkylaminocarbonyl steht,
R6 für Wasserstoff, Halogen, Cyano, Nitro, Formyl, (Ci-C8)-Alkyl, (Ci-C8)-Haloalkyl, (C2-C8)- Alkenyl, (C2-C8)-Alkinyl, (C2-C4)-Haloalkenyl, (C2-C5)-Haloalkinyl, (Ci-C4)-Alkoxy-(Ci-C4)- alkyl, (Ci-C4)-Haloalkoxy-(Ci-C4)-alkyl, (Ci-C8)-Alkylthio-(Ci-C8)-alkyl, (Ci-C8)- Alkylsulfmyl-(Ci-C8)-alkyl, (Ci-C8)-Alkylsulfonyl-(Ci-C8)-alkyl, (Ci-C8)-Alkylcarbonyl, (Ci-C8)-Haloalkylcarbonyl, (C3-C8)-Cycloalkylcarbonyl, Carboxyl, (Ci-C8)-Alkoxycarbonyl, (C2-C8)- Haloalkoxycarbonyl, (C4-C8)-Cycloalkoxycarbonyl, (C2-C8)-Alkylaminocarbonyl, (C3-Cio)-Dialkylaminocarbonyl, (C3-Cio)-Cycloalkylaminocarbonyl, (Ci-C8)-Alkoxy, (Ci-Cg)- Haloalkoxy, (Ci-C8)-Alkylthio, (Ci-C8)-Haloalkylthio, (C3-C8)-Cycloalkylthio, (Ci-C8)- Alkylsulfmyl, (Ci-C8)-Haloalkylsulfinyl, (C3-C8)-Cycloalkylsulfmyl, (Ci-C8)-Alkylsulfonyl, (Ci-C8)-Haloalkylsulfonyl, (C3-C8)-Cycloalkylsulfonyl, (Ci-C8)-Alkylaminosulfonyl, (C2-C8)- Dialkylaminosulfonyl oder (C3-C8)-Trialkylsilyl steht,
R8 für Wasserstoff, Amino, Hydroxy, Cyano, Formyl, (Ci-C8)-Alkyl, (Ci-C8)-Haloalkyl, (Ci-Cg)- Cyanoalkyl, (Ci-C8)-Hydroxyalkyl, (Ci-C8)-Alkoxy-(Ci-C8)-alkyl, Aryl-(Ci-C8)-alkyl,
Heteroaryl-(Ci-C8)-alkyl, Heterocyclyl-(Ci-C8)-alkyl, (C3-Cio)-Cycloalkyl, (C3-Cio)-Cycloalkyl- (Ci-C8)-alkyl, (C3-C8)-Halocycloalkyl, (C3-C8)-Halocycloalkyl-(Ci-C8)-alkyl, (Ci-C8)- Alkylcarbonyl, (Ci-C8)-Alkoxycarbonyl, (C2-C8)-Alkenyl, (C2-C8)-Alkinyl, Tris-[(Ci-C8)- alkyl]silyl-(C2-C8)-alkinyl, Tris-[(Ci-C8)-alkyl]silyl steht.
R9, R10, R11 und R12 unabhängig voneinander für Wasserstoff, Halogen, Cyano, Nitro, Formyl,
(Ci-C8)-Alkyl, (Ci-C8)-Haloalkyl, (C2-C8)-Alkenyl, (C2-C4)-Haloalkenyl, (C2-C5)-Haloalkinyl, (Ci-C4)-Alkoxy-(Ci-C4)-alkyl, (Ci-C4)-Haloalkoxy-(Ci-C4)-alkyl, (Ci-C8)-Alkylthio-(Ci-C8)- alkyl, (Ci-C8)-Alkylsulfmyl-(Ci-C8)-alkyl, (Ci-C8)-Alkylsulfonyl-(Ci-C8)-alkyl, (Ci-C8)- Alkylcarbonyl, (Ci-C8)-Haloalkylcarbonyl, (C3-C8)-Cycloalkylcarbonyl, Carboxyl, (Ci-Cs)- Alkoxycarbonyl, (C2-C8)- Haloalkoxycarbonyl, (C4-C8)-Cycloalkoxycarbonyl, (C2-C8)- Alkylaminocarbonyl, (C3-Cio)-Dialkylaminocarbonyl, (C3-Cio)-Cycloalkylaminocarbonyl, (Ci-C8)-Alkoxy, (Ci-C8)-Alkylthio, (Ci-C8)-Haloalkylthio, (C3-C8)-Cycloalkylthio, (Ci-C8)- Alkylsulfmyl, (Ci-C8)-Haloalkylsulfmyl, (C3-C8)-Cycloalkylsulfmyl, (Ci-C8)-Alkylsulfonyl, (Ci-C8)-Haloalkylsulfonyl, (C3-C8)-cycloalkylsulfonyl, (Ci-C8)-Alkylaminosulfonyl, (C2-C8)- Dialkylaminosulfonyl oder (C3-C8)-Trialkylsilyl steht,
Besonders bevorzugter Erfindungsgegenstand sind Verbindungen der allgemeinen Formel (I), worin A für Sauerstoff, Schwefel, -C(R3)(R4) -, -NR5- oder eine einfache Bindung steht,
Q1 für ein gegebenenfalls substituiertes Aryl oder Heteroaryl steht, wobei jeder Ring optional mit bis zu 5 Substituenten aus der Gruppe R6 substituiert ist,
und wobei für den Fall, dass A eine einfache Bindung ist, der Rest Q1 ungleich Imidazol oder 1 ,2,4-Triazol ist;
Q2 für die in der oben stehenden Tabelle spezifisch genannten Gruppierungen Q-l bis Q-4 steht,
R1 für Wasserstoff, (Ci-C3)-Alkyl, (Ci-C3)-Haloalkyl, (Ci-C3)-Cyanoalkyl, (Ci-C4)-Alkoxy-(Ci- C3)-alkyl, (Ci-C4)-Haloalkoxy-(Ci-C3)-alkyl, (Ci-C4)-Alkylthio-(Ci-C3)-alkyl, (Ci-C4)- Alkylsulfmyl-(Ci-C3)-alkyl, (Ci-C4)-Alkylsulfonyl-(Ci-C3)-alkyl, (Ci-C6)-Cycloalkylthio-(Ci- C3)-alkyl, (Ci-C6)-Cycloalkylsulfmyl-(Ci-C3)-alkyl, (Ci-C6)-Cycloalkylsulfonyl-(Ci-C3)-alkyl, Aryl-(Ci-C3)-alkyl, Heteroaryl-(Ci-C3)-alkyl, Heterocyclyl-(Ci-C3)-alkyl, (C3-C6)-Cycloalkyl, (C3-C6)-Cycloalkyl-(Ci-C3)-alkyl, (C2-C6)-Alkenyl, (C2-C6)-Haloalkenyl, (Ci-C4)- Alkylcarbonyl, (Ci-C4)-Haloalkylcarbonyl, (C3-C6)-Cycloalkylcarbonyl, (Ci-Ce)- Alkoxycarbonyl, (C2-C6)-Haloalkoxycarbonyl, (C3-C6)-Cycloalkoxycarbonyl, (C2-Ce)- Alkylaminocarbonyl, (C3-C6)-Dialkylaminocarbonyl, (C3-C6)-Cycloalkylaminocarbonyl, (Ci-C6)-Alkoxycarbonyl-(Ci-C3)-alkyl, (C2-C6)-Alkylammocarbonyl-(Ci-C3)-alkyl, (C3-C8)- Dialkylaminocarbonyl-(Ci-C3)-alkyl, (Ci-C6)-Alkylcarbonyloxy-(Ci-C3)-alkyl, (Ci-Ce)-
Alkoxycarbonyloxy-(Ci-C3)-alkyl, (C3-C6)-Cycloalkoxycarbonyloxy-(Ci-C3)-alkyl, (Ci-C4)- Alkylsulfonyl, (Ci-C4)-Haloalkylsulfonyl, Arylsulfonyl, Phthalimidomethyl steht,
R2 für Wasserstoff, Halogen, Cyano, (Ci-Cs)-Alkyl, (Ci-C5)-Haloalkyl, (Ci-C5)-Cyanoalkyl, (Ci- C5)-Hydroxyalkyl, (Ci-C4)-Alkoxy, (Ci-C4)-Haloalkoxy, (Ci-C4)-Alkoxy-(Ci-C5)-alkyl, (C1-C4)- Haloalkoxy-(Ci-C5)-alkyl, Aryl-(Ci-C4)-alkyl, Heteroaryl-(Ci-C4)-alkyl, Heterocyclyl-(Ci-C4)- alkyl, (C3-C6)-Cycloalkyl, (C3-C6)-Cycloalkyl-(Ci-C5)-alkyl, (C3-C6)-Halocycloalkyl, (C3-C6)- Halocycloalkyl-(Ci-C5)-alkyl, (C2-C5)-Alkenyl, (C2-C5)-Alkinyl, (C2-C5)-Haloalkenyl, (C2-C5)- Haloalkinyl, Tris-[(Ci-C6)-alkyl]silyl-(C2-C5)-alkinyl, Carboxyl, Carboxyl-(Ci-C5)-alkyl, (Ci-C6)-Alkylcarbonyl, (Ci-C6)-Haloalkylcarbonyl, (C3-C6)-Cycloalkylcarbonyl, (Ci-Ce)- Alkoxycarbonyl, (Ci-C6)-Alkenyloxycarbonyl, (C2-C6)-Haloalkoxycarbonyl, (C3-C6)- Cycloalkoxycarbonyl, (Ci-C6)-Alkoxycarbonyl-(Ci-C5)-alkyl, (C2-C6)-Haloalkoxycarbonyl-(Ci- C5)-alkyl, (C3-C6)-Cycloalkoxycarbonyl-(Ci-C5)-alkyl, Amino, (Ci-C5)-Alkylamino, (d-Ce)- Dialkylamino, (Ci-C5)-Haloalkylamino, (C2-C8)-Cycloalkylamino, (C2-C5)-Alkenylamino, (C4- C8)-Dialkenylamino, (Ci-C5)-Alkylcarbonylamino, (C2-C8)-(Dialkylcarbonyl)amino, (C1-C5)- Haloalkylcarbonylamino, (C2-C8)-Cycloalkylcarbonylamino, (N-(Ci-C5)-Alkylcarbonyl)-(Ci- C5)-alkylamino, (Ci-C5)-Alkyl-S(0)x steht, und wobei x gleich 0, 1 oder 2 ist, oder
R1 und R2 gemeinsam einen Alkyl-(CH2)m-Ring bilden, wobei m gleich 3, 4 oder 5 ist,
R3 und R4 unabhängig voneinander für Wasserstoff, Halogen, (Ci-C4)-Alkyl, (Ci-C4)-Haloalkyl stehen,
R5 für Wasserstoff, (Ci-C4)-Alkyl, (Ci-C4)-Haloalkyl, Aryl-(Ci-C3)-alkyl, Heteroaryl-(Ci-C3)-alkyl, (C2-C4)-Alkenyl, (C2-C4)-Alkinyl, (Ci-C4)-Alkylcarbonyl, (Ci-C4)-Haloalkylcarbonyl, Formyl, (Ci-C4)-Alkoxycarbonyl, (C2-C4)-Haloalkoxycarbonyl, (C2-C4)-Alkylaminocarbonyl, (C3-C6)- Dialkylaminocarbonyl steht,
R6 für Wasserstoff, Halogen, Cyano, Nitro, Formyl, (Ci-C8)-Alkyl, (Ci-C4)-Haloalkyl, (C2-C4)- Alkenyl, (C2-C4)-Alkinyl, (C2-C4)-Haloalkenyl, (C2-C4)-Haloalkinyl, (Ci-C4)-Alkoxy-(Ci-C4)- alkyl, (Ci-C4)-Haloalkoxy-(Ci-C4)-alkyl, (Ci-C4)-Alkylthio-(Ci-C4)-alkyl, (C1-C4)- Alkylsulfmyl-(Ci-C4)-alkyl, (Ci-C4)-Alkylsulfonyl-(Ci-C4)-alkyl, (Ci-C4)-Alkylcarbonyl, (Ci-C4)-Haloalkylcarbonyl, (C3-C6)-Cycloalkylcarbonyl, (Ci-C4)-Alkoxy, (Ci-C4)-Haloalkoxy, (Ci-C4)-Alkylthio, (Ci-C4)-Haloalkylthio, (C3-C6)-Cycloalkylthio, (Ci-C4)-Alkylsulfmyl, (Ci-C4)-Haloalkylsulfmyl, (C3-C6)-Cycloalkylsulfinyl, (Ci-C4)-Alkylsulfonyl, (C1-C4)-
Haloalkylsulfonyl, (C3-C6)-Cycloalkylsulfonyl, (Ci-C4)-Alkylaminosulfonyl, (C2-C4)- Dialkylaminosulfonyl oder (C3-C6)-Trialkylsilyl steht, und
R9, R10, R11 und R12 unabhängig voneinander für Wasserstoff, Halogen, Cyano, (Ci-C4)-Alkyl,
(Ci- C4)-Haloalkyl, (Ci-C3)-Alkoxy, (Ci-C3)-Haloalkoxy steht.
Ebenfalls weiter bevorzugter Erfindungsgegenstand sind Verbindungen der allgemeinen Formel (I), worin
A für Sauerstoff, Schwefel, -C(R3)(R4) -, -NR5- oder eine einfache Bindung steht,
Q1 für ein gegebnenfalls substituiertes Aryl oder Heteroaryl steht, wobei jeder Ring optional mit bis zu 5 Substituenten aus der Gruppe R6 substituiert ist,
und wobei für den Fall, dass A eine einfache Bindung ist, der Rest Q1 ungleich Imidazol oder 1 ,2,4-Triazol ist, für die Gruppen Q-11 bis Q-14 steht;
Q-11 Q-12 Q-13 Q-14
R1 für Wasserstoff, Methyl, Ethyl, Isopropyl, (Ci-C2)-Haloalkyl, Cyanomethyl, (Ci-C4)-Alkoxy- (Ci-C2)-alkyl, (Ci-C4)-Alkylthio-(Ci-C2)-alkyl, (Ci-C4)-Alkylsulfmyl-(Ci-C2)-alkyl, (C1-C4)- Alkylsulfonyl-(Ci-C2)-alkyl, Arylmethyl, (C2-C6)-Alkenyl, (Ci-C6)-Alkoxycarbonyl, (C3-C6)- Cycloalkoxycarbonyl, (Ci-C6)-Alkoxycarbonyloxy-(Ci-C2)-alkyl, (Ci-C6)-Alkylcarbonyloxy- (Ci-C2)-alkyl steht,
R für Wasserstoff, Halogen, Cyano, (Ci-C4)-Alkyl, (Ci-C4)-Haloalkyl, (Ci-C4)-Cyanoalkyl, (Ci- C4)-Hydroxyalkyl, (Ci-C3)-Alkoxy-(Ci-C4)-alkyl, (C3-C6)-Cycloalkyl, (C3-C6)-Cycloalkyl-(Ci- C4)-alkyl, (C2-C4)-Alkenyl, (C2-C4)-Alkinyl, (C2-C4)-Haloalkenyl, (C2-C4)-Haloalkinyl, (Ci-C6)- Alkoxycarbonyl, (Ci-C6)-Alkenyloxycarbonyl, (C2-C6)-Haloalkoxycarbonyl, (CI-CÖ)-
Alkoxycarbonyl-(Ci-C4)-alkyl, (C2-C6)-Haloalkoxycarbonyl-(Ci-C4)-alkyl, Amino, (C1-C4)- Alkylamino, (C2-C6)-Dialkylamino, (C2-C4)-Alkenylamino, (Ci-C4)-Alkylcarbonylamino steht, oder
R1 und R2 gemeinsam einen Alkyl-(CH2)m-ring bilden, wobei m gleich 3 oder 4 ist,
R3 und R4 unabhängig voneinander für Wasserstoff, Halogen, Methyl oder Ethyl steht, R5 für Wasserstoff, Methyl, Ethyl, Formyl oder Acetyl steht,
R6 für Wasserstoff, Halogen, Cyano, (Ci-C4)-Alkyl, (Ci-C4)-Haloalkyl, (Ci-C3)-Alkoxy, (C1-C3)- Haloalkoxy, Methyl-S(0)n steht, wobei n gleich 0, 1 oder 2 ist, R10 für Wasserstoff, Halogen, Cyano, Methyl, Trifluormethyl, Methoxy steht.
Äußerst bevorzugter Erfindungsgegenstand sind Verbindungen der allgemeinen Formel (I), worin A für Sauerstoff, Schwefel, -CH2-, -NR5- oder eine einfache Bindung steht,
Q1 für ein gegebnenfalls substituiertes Aryl oder Heteroaryl steht, wobei jeder Ring optional mit bis zu 5 Substituenten aus der Gruppe R6 substituiert ist; und wobei für den Fall, dass A eine einfache Bindung ist, der Rest Q1 ungleich Imidazol oder 1 ,2,4-Triazol ist;
Q2 für die Gruppen Q- 11 bis Q- 13 steht
Q-l l Q-12 Q-13
R1 für Wasserstoff, Methyl, Ethyl, Isopropyl, Difluormethyl, 2-Methoxyethyl, 2-Methylsulfanylethyl, Benzyl, Vinyl, Allyl, tert-Butoxycarbonyl steht,
R für Wasserstoff, Cyano, Methyl, Ethyl, Propyl, Trifluormethyl, Cyanomethyl, Cyclopropyl, Methoxycarbonyl, Ethoxycarbonyl, Methoxycarbonylmethyl, Amino, Acetylaminosteht, oder R1 und R2 gemeinsam einen Alkyl-(CH2)3-ring bilden, R5 für Wasserstoff oder Methyl steht,
R6 für Wasserstoff, Fluor, Chlor, Cyano, Methyl, Trifluormethyl, Methoxy, Trifluormethoxy steht,
R10 für Wasserstoff, Fluor, Chlor, Cyano, Methyl, Trifluormethyl, Methoxy steht.
Die oben aufgeführten allgemeinen oder in Vorzugsbereichen aufgeführten Restedefinitionen gelten sowohl für die Endprodukte der allgemeinenFormel (I) als auch entsprechend für die jeweils zur Herstellung benötigten Ausgangs- oder Zwischenprodukte. Diese Restedefinitionen können
untereinander, also auch zwischen den angegebenen bevorzugten Bereichen beliebig kombiniert werden.
Vor allem aus den Gründen der höheren herbiziden Wirkung, besseren Selektivität und/oder besseren Herstellbarkeit sind erfindungsgemäße Verbindungen der genannten allgemeinen Formel (I) oder deren Salze bzw. deren erfindungsgemäße Verwendung von besonderem Interesse, worin einzelne Reste eine der bereits genannten oder im folgenden genannten bevorzugten Bedeutungen haben, oder insbesondere solche, worin eine oder mehrere der bereits genannten oder im Folgenden genannten bevorzugten Bedeutungen kombiniert auftreten. Im Hinblick auf die erfindungsgemäßen Verbindungen werden die vorstehend und weiter unten verwendeten Bezeichnungen erläutert. Diese sind dem Fachmann geläufig und haben insbesondere die im Folgenden erläuterten Bedeutungen:
Sofern nicht anders definiert, gilt generell für die Bezeichnung von chemischen Gruppen, dass die Anbindung an das Gerüst bzw. den Rest des Moleküls über das zuletzt genannte Strukturelement der betreffenden chemischen Gruppe erfolgt, d.h. beispielsweise im Falle von (C2-Cg)-Alkenyloxy über das Sauerstoffatom, und im Falle von Heterocyclyl-(Ci-Cg)-alkyl oder R120(0)C-(Ci-Cg)-Alkyl jeweils über das C-Atom der Alkylgruppe. Erfindungsgemäß steht "Alkylsulfonyl" - in Alleinstellung oder als Bestandteil einer chemischen Gruppe - für geradkettiges oder verzweigtes Alkylsulfonyl, vorzugsweise mit 1 bis 8, oder mit 1 bis 6
Kohlenstoffatomen, z.B. (aber nicht beschränkt auf) (Ci-C6)-Alkylsulfonyl wie Methylsulfonyl, Ethyl-
sulfonyl, Propylsulfonyl, 1 -Methylethylsulfonyl, Butylsulfonyl, 1 -Methylpropylsulfonyl, 2-Methyl- propylsulfonyl, 1 , 1 -Dimethylethylsulfonyl, Pentylsulfonyl, 1 -Methylbutylsulfonyl, 2-Methylbutyl- sulfonyl, 3 -Methylbutylsulfonyl, 1 ,1 -Dimethylpropylsulfonyl, 1 ,2-Dimethylpropylsulfonyl, 2,2-Di- methylpropylsulfonyl, 1 -Ethylpropylsulfonyl, Hexylsulfonyl, 1 -Methylpentylsulfonyl, 2-Methyl- pentylsulfonyl, 3 -Methylpentylsulfonyl, 4-Methylpentylsulfonyl, 1 ,1 -Dimethylbutylsulfonyl, 1 ,2-Di- methylbutylsulfonyl, 1 ,3 -Dimethylbutylsulfonyl, 2,2-Dimethylbutylsulfonyl, 2,3-Dimethylbutylsulfonyl, 3 ,3 -Dimethylbutylsulfonyl, 1 -Ethylbutylsulfonyl, 2-Ethylbutylsulfonyl, 1 , 1 ,2-Trimethylpropylsulfonyl, 1 ,2,2-Trimethylpropylsulfonyl, 1 -Ethyl- 1 -methylpropylsulfonyl und 1 -Ethyl-2-methylpropylsulfonyl. Erfindungsgemäß steht "Heteroarylsulfonyl" für gegebenenfalls substituiertes Pyridylsulfonyl,
Pyrimidinylsulfonyl, Pyrazinylsulfonyl oder gegebenenfalls substituiertes polycyclisches
Heteroarylsulfonyl, hier insbesondere gegebenenfalls substituiertes Chinolinylsulfonyl, beispielsweise substituiert durch Fluor, Chlor, Brom, Iod, Cyano, Nitro, Alkyl-, Haloalkyl-, Haloalkoxy-, Amino-, Alkylamino-, Alkylcarbonylamino-, Dialkylamino- oder Alkoxygruppen.
Erfindungsgemäß steht "Alkylthio" - in Alleinstellung oder als Bestandteil einer chemischen Gruppe - für geradkettiges oder verzweigtes S-Alkyl, vorzugsweise mit 1 bis 8, oder mit 1 bis 6
Kohlenstoffatomen, wie (Ci-Cio)-, (CI-CÖ)- oder (Ci-C4)-Alkylthio, z.B. (aber nicht beschränkt auf) (Ci- Ce)-Alkylthio wie Methylthio, Ethylthio, Propylthio, 1 -Methylethylthio, Butylthio, 1 -Methylpropylthio, 2-Methylpropylthio, 1 , 1 -Dimethylethylthio, Pentylthio, 1 -Methylbutylthio, 2-Methylbutylthio, 3 - Methylbutylthio, 1 ,1 -Dimethylpropylthio, 1 ,2-Dimethylpropylthio, 2,2-Dimethylpropylthio, 1 - Ethylpropylthio, Hexylthio, 1 -Methylpentylthio, 2-Methylpentylthio, 3-Methylpentylthio, 4-Methyl- pentylthio, 1 ,1 -Dimethylbutylthio, 1 ,2-Dimethylbutylthio, 1 ,3-Dimethylbutylthio, 2,2-Dimethylbutyl- thio, 2,3-Dimethylbutylthio, 3,3-Dimethylbutylthio, 1 -Ethylbutylthio, 2-Ethylbutylthio, 1 , 1 ,2-Tri- methylpropylthio, 1 ,2,2-Trimethylpropylthio, 1 -Ethyl- 1 -methylpropylthio und 1 -Ethyl-2-methyl- propylthio.
„Alkenylthio" bedeutet erfindungsgemäßt ein über ein Schwefelatom gebundenen Alkenylrest,
Alkinylthio bedeutet ein über ein Schwefelatom gebundenen Alkinylrest, Cycloalkylthio bedeutet ein über ein Schwefelatom gebundenen Cycloalkylrest und Cycloalkenylthio bedeutet ein über ein
Schwefelatom gebundenen Cycloalkenylrest.
„Alkylsulfinyl (Alkyl-S(=0)-)", soweit nicht an anderer Stelle anders definiert steht erfindungsgemäß für Alkylreste, die über -S(=0)- an das Gerüst gebunden sind, wie (Ci-Cio)-, (CI-CÖ)- oder (C1-C4)- Alkylsulfinyl, z. B. (aber nicht beschränkt auf) (Ci-C6)-Alkylsulfinyl wie Methylsulfinyl, Ethylsulfinyl, Propylsulfinyl, 1 -Methylethylsulfinyl, Butylsulfinyl, 1 -Methylpropylsulfinyl, 2-Methylpropylsulfinyl, 1 , 1 -Dimethylethylsulfinyl, Pentylsulfinyl, 1 -Methylbutylsulfinyl, 2-Methylbutylsulfinyl, 3-
Methylbutylsulfinyl, 1 ,1 -Dimethylpropylsulfmyl, 1 ,2-Dimethylpropylsulfinyl, 2,2-Di- methylpropylsulfinyl, 1 -Ethylpropylsulfinyl, Hexylsulfinyl, 1 -Methylpentylsulfinyl, 2-Methylpentyl- sulfinyl, 3 -Methylpentylsulfinyl, 4-Methylpentylsulfinyl, 1 ,1 -Dimethylbutylsulfinyl, 1 ,2-Dimethyl- butylsulfmyl, 1 ,3-Dimethylbutylsulfinyl, 2,2-Dimethylbutylsulfinyl, 2,3-Dimethylbutylsulfinyl, 3,3- Dimethylbutylsulfmyl, 1 -Ethylbutylsulfinyl, 2-Ethylbutylsulfinyl, 1 ,1 ,2-Trimethylpropylsulfinyl, 1 ,2,2- Trimethylpropylsulfinyl, l -Ethyl-l -methylpropylsulfinyl und l -Ethyl-2-methylpropylsulfinyl.
Analog sind„Alkenylsulfinyl" und„Alkinylsulfinyl", erfindungsgemäß definiert als Alkenyl- bzw. Alkinylreste, die über -S(=0)- an das Gerüst gebunden sind, wie (C2-C10)-, (C2-C6)- oder (C2-C4)- Alkenylsulfinyl bzw. (C3-C10)-, (C3-C6)- oder (C3-C4)-Alkinylsulfmyl.
Analog sind„Alkenylsulfonyl" und„Alkinylsulfonyl" erfindungsgemäß definiert als Alkenyl- bzw. Alkinylreste, die über -S(=0)2- an das Gerüst gebunden sind, wie (C2-C10)-, (C2-C6)- oder (C2-C4)- Alkenylsulfonyl bzw. (C3-C10)-, (C3-C6)- oder (C3-C4)-Alkinylsulfonyl.
„Alkoxy" bedeutet ein über ein Sauerstoffatom gebundenen Alkylrest, z. B. (aber nicht beschränkt auf) (Ci-Ce)-Alkoxy wie Methoxy, Ethoxy, Propoxy, 1 -Methylethoxy, Butoxy, 1 -Methylpropoxy, 2- Methylpropoxy, 1 ,1 -Dimethylethoxy, Pentoxy, 1 -Methylbutoxy, 2-Methylbutoxy, 3-Methylbutoxy, 1 , 1 - Dimethylpropoxy, 1 ,2-Dimethylpropoxy, 2,2-Dimethylpropoxy, 1 -Ethylpropoxy, Hexoxy, 1 - Methylpentoxy, 2-Methylpentoxy, 3-Methylpentoxy, 4-Methylpentoxy, 1 ,1 -Dimethylbutoxy, 1 ,2-Di- methylbutoxy, 1 ,3-Dimethylbutoxy, 2,2-Dimethylbutoxy, 2,3-Dimethylbutoxy, 3,3-Dimethylbutoxy, 1 - Ethylbutoxy, 2-Ethylbutoxy, 1 ,1 ,2-Trimethylpropoxy, 1 ,2,2-Trimethylpropoxy, 1 -Ethyl-l -methylpropoxy und 1 -Ethyl-2-methylpropoxy. Alkenyloxy bedeutet ein über ein Sauerstoffatom gebundenen Alkenylrest, Alkinyloxy bedeutet ein über ein Sauerstoffatom gebundenen Alkinylrest wie (C2-C10)-, (C2-C6)- oder (C2-C4)-Alkenoxy bzw. (C3-C10)-, (C3-C6)- oder (C3-C4)-Alkmoxy.
„Cycloalkyloxy" bedeutet ein über ein Sauerstoffatom gebundenen Cycloalkylrest und Cycloalkenyloxy bedeutet ein über ein Sauerstoffatom gebundenen Cycloalkenylrest. „Alkylcarbonyl" (Alkyl-C(=0)-), soweit nicht an anderer Stelle anders definiert, steht erfindungsgemäß für Alkylreste, die über -C(=0)- an das Gerüst gebunden sind, wie (C1-C10)-, (Ci-Ce)- oder (C1-C4)- Alkylcarbonyl. Die Anzahl der C-Atome bezieht sich dabei auf den Alkylrest in der
Alkylcarbonylgruppe. Analog stehen„Alkenylcarbonyl" und„Alkinylcarbonyl", soweit nicht an anderer Stelle anders definiert, erfindungsgemäß für Alkenyl- bzw. Alkinylreste, die über -C(=0)- an das Gerüst gebunden sind, wie (C2-C10)-, (C2-C6)- oder (C2-C4)-Alkenylcarbonyl bzw. (C2-C10)-, (C2-C6)- oder (C2-C4)-
Alkinylcarbonyl. Die Anzahl der C-Atome bezieht sich dabei auf den Alkenyl- bzw. Alkinylrest in der Alkenyl- bzw. Alkinylcarbonylgruppe.
„Alkoxycarbonyl (Alkyl-0-C(=0)-)", soweit nicht an anderer Stelle anders definiert: Alkylreste, die über -0-C(=0)- an das Gerüst gebunden sind, wie (Ci-Cio)-, (CI-CÖ)- oder (Ci-C i)-Alkoxycarbonyl. Die Anzahl der C-Atome bezieht sich dabei auf den Alkylrest in der Alkoxycarbonylgruppe. Analog stehen „Alkenyloxycarbonyl" und„Alkinyloxycarbonyl", soweit nicht an anderer Stelle anders definiert, erfindungsgemäß für Alkenyl- bzw. Alkinylreste, die über -0-C(=0)- an das Gerüst gebunden sind, wie (C2-C10)-, (C2-C6)- oder (C2-C4)-Alkenyloxycarbonyl bzw. (C3-C10)-, (C3-C6)- oder (C3-C4)- Alkinyloxycarbonyl. Die Anzahl der C-Atome bezieht sich dabei auf den Alkenyl- bzw. Alkinylrest in der Alken- bzw. Alkinyloxycarbonylgruppe.
Der Begriff„Alkylcarbonyloxy" (Alkyl-C(=0)-0-) steht erfindungsgemäß, soweit nicht an anderer Stelle anders definiert, für Alkylreste, die über eine Carbonyloxygruppe (-C(=0)-0-) mit dem Sauerstoff an das Gerüst gebunden sind, wie (C1-C10)-, (CI-CÖ)- oder (Ci-C i)-Alkylcarbonyloxy. Die Anzahl der C- Atome bezieht sich dabei auf den Alkylrest in der Alkylcarbonyloxygruppe.
Analog sind„Alkenylcarbonyloxy" und„Alkinylcarbonyloxy" erfindungsgemäß definiert als Alkenyl- bzw. Alkinylreste, die über (-C(=0)-0-) mit dem Sauerstoff an das Gerüst gebunden sind, wie (C2-C10)-, (C2-C6)- oder (C2-C4)-Alkenylcarbonyloxy bzw. (C2-C10)-, (C2-C6)- oder (C2-C4)-Alkinylcarbonyloxy. Die Anzahl der C-Atome bezieht sich dabei auf den Alkenyl- bzw. Alkinylrest in der Alkenyl- bzw. Alkinylcarbonyloxygruppe.
In Kurzformen wie z.B. C(0)R12, C(0)OR12, OC(O)NR10Ru, oder C(O)NR10Ru steht die in Klammern aufgeführte Kurzform O für ein über eine Doppelbindung an das benachbarte Kohlenstoffatom gebundenes Sauerstoffatom.
In Kurzformen wie z.B. OC(S)OR12, OC(S)SR13, OC(S)NR10RU, steht die in Klammern aufgeführte Kurzform S für ein über eine Doppelbindung an das benachbarte Kohlenstoffatom gebundenes
Schwefelatom.
Der Begriff„Aryl" bedeutet ein gegebenenfalls substituiertes mono-, bi- oder polycyclisches aromatisches System mit vorzugsweise 6 bis 14, insbesondere 6 bis 10 Ring-C- Atomen, beispielsweise Phenyl, Naphthyl, Anthryl, Phenanthrenyl, und ähnliches, vorzugsweise Phenyl. Vom Begriff„gegebenenfalls substituiertes Aryl" sind auch mehrcyclische Systeme, wie
Tetrahydronaphtyl, Indenyl, Indanyl, Fluorenyl, Biphenylyl, umfasst, wobei die Bindungsstelle am aromatischen System ist. Von der Systematik her ist„Aryl" in der Regel auch von dem Begriff
„gegebenenfalls substituiertes Phenyl" umfasst. Bevorzugte Aryl-Substituenten sind hier zum Beispiel Wasserstoff, Halogen, Alkyl, Cycloalkyl, Cycloalkylalkyl, Cycloalkenyl, Halocycloalkyl, Alkenyl, Alkinyl, Aryl, Arylalkyl, Arylalkenyl, Heteroaryl, Heteroarylalkyl, Heterocyclyl, Heterocyclylalkyl, Alkoxyalkyl, Alkylthio, Haloalkylthio, Haloalkyl, Alkoxy, Haloalkoxy, Cycloalkoxy, Cycloalkylalkoxy, Aryloxy, Heteroraryloxy, Alkoxyalkoxy, Alkinylalkoxy, Alkenyloxy, Bis-alkylaminoalkoxy, Tris- [alkyljsilyl, Bis- [alkyl] arylsilyl, Bis- [alkyl] alkylsilyl, Tris- [alkyl] silylalkinyl, Arylalkinyl,
Heteroarylalkinyl, Alkylalkinyl, Cycloalkylalkinyl, Haloalkylalkinyl, Heterocyclyl-N-alkoxy, Nitro, Cyano, Amino, Alkylamino, Bis-alkylamino, Alkylcarbonylamino, Cycloalkylcarbonylamino,
Arylcarbonylamino, Alkoxycarbonylamino, Alkoxycarbonylalkylamino,
Arylalkoxycarbonylalkylamino, Hydroxycarbonyl, Alkoxycarbonyl, Aminocarbonyl,
Alkylaminocarbonyl, Cycloalkylaminocarbonyl, Bis-Alkylaminocarbonyl, Heteroarylalkoxy,
Arylalkoxy
Ein heterocyclischer Rest (Heterocyclyl) enthält mindestens einen heterocyclischen Ring
(=carbocyclischer Ring, in dem mindestens ein C-Atom durch ein Heteroatom ersetzt ist, vorzugsweise durch ein Heteroatom aus der Gruppe N, O, S, P) der gesättigt, ungesättigt, teilgesättigt oder heteroaromatisch ist und dabei unsubstituiert oder substituiert sein kann, wobei die Bindungsstelle an einem Ringatom lokalisiert ist. Ist der Heterocyclylrest oder der heterocyclische Ring gegebenenfalls substituiert, kann er mit anderen carbocyclischen oder heterocyclischen Ringen annelliert sein. Im Falle von gegebenenfalls substituiertem Heterocyclyl werden auch mehrcyclische Systeme umfasst, wie beispielsweise 8-Aza-bicyclo[3.2.1]octanyl, 8-Aza-bicyclo[2.2.2]octanyl oder 1-Aza- bicyclo[2.2.1]heptyl. Im Falle von gegebenenfalls substituiertem Heterocyclyl werden auch
spirocyclische Systeme umfasst, wie beispielsweise l-Oxa-5-aza-spiro[2.3]hexyl. Wenn nicht anders definiert, enthält der heterocyclische Ring vorzugsweise 3 bis 9 Ringatome, insbesondere 3 bis 6 Ringatome, und ein oder mehrere, vorzugsweise 1 bis 4, insbesondere 1 , 2 oder 3 Heteroatome im heterocyclischen Ring, vorzugsweise aus der Gruppe N, O, und S, wobei jedoch nicht zwei
Sauerstoffatome direkt benachbart sein sollen, wie beispielsweise mit einem Heteroatom aus der Gruppe N, O und S 1- oder 2- oder 3-Pyrrolidinyl, 3,4-Dihydro-2H-pyrrol-2- oder 3-yl, 2,3-Dihydro-lH-pyrrol-
1- oder 2- oder 3- oder 4- oder 5-yl; 2,5-Dihydro-lH-pyrrol-l - oder 2- oder 3-yl, 1- oder 2- oder 3- oder 4-Piperidinyl; 2,3,4,5-Tetrahydropyridin-2- oder 3- oder 4- oder 5-yl oder 6-yl; 1,2,3,6-
Tetrahydropyridin-1- oder 2- oder 3- oder 4- oder 5- oder 6-yl; 1,2,3,4-Tetrahydropyridin-l- oder 2- oder 3- oder 4- oder 5- oder 6-yl; 1,4-Dihydropyridin-l - oder 2- oder 3- oder 4-yl; 2,3-Dihydropyridin-
2- oder 3- oder 4- oder 5- oder 6-yl; 2,5-Dihydropyridin-2- oder 3- oder 4- oder 5- oder 6-yl, 1- oder 2- oder 3- oder 4-Azepanyl; 2,3,4,5-Tetrahydro-lH-azepin-l- oder 2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 2,3,4,7-Tetrahydro-lH-azepin-l- oder 2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 2,3,6,7-
Tetrahydro-lH-azepin-1- oder 2- oder 3- oder 4-yl; 3,4,5,6-Tetrahydro-2H-azepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 4,5-Dihydro-lH-azepin-l- oder 2- oder 3- oder 4-yl; 2,5-Dihydro-lH-azepin-
1- oder -2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 2,7-Dihydro-lH-azepin-l- oder -2- oder 3- oder 4- yl; 2,3-Dihydro-lH-azepin-l - oder -2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 3,4-Dihydro-2H-azepin-
2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 3,6-Dihydro-2H-azepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 5,6-Dihydro-2H-azepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 4,5-Dihydro-3H-azepin- 2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 1H-Azepin-1- oder -2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 2H-Azepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 3H-Azepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 4H-Azepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl, 2- oder 3-Oxolanyl (= 2- oder 3- Tetrahydrofuranyl); 2,3-Dihydrofüran-2- oder 3- oder 4- oder 5-yl; 2,5-Dihydrofüran-2- oder 3-yl, 2- oder 3- oder 4-Oxanyl (= 2- oder 3- oder 4-Tetrahydropyranyl); 3,4-Dihydro-2H-pyran-2- oder 3- oder 4- oder 5- oder 6-yl; 3,6-Dihydro-2H-pyran-2- oder 3-oder 4- oder 5- oder 6-yl; 2H-Pyran-2- oder 3- oder 4- oder 5- oder 6-yl; 4H-Pyran-2- oder 3- oder 4-yl, 2- oder 3- oder 4-Oxepanyl; 2,3,4,5- Tetrahydrooxepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 2,3,4,7-Tetrahydrooxepin-2- oder 3- oder
4- oder 5- oder 6- oder 7-yl; 2,3,6,7-Tetrahydrooxepin-2- oder 3- oder 4-yl; 2,3-Dihydrooxepin-2- oder
3- oder 4- oder 5- oder 6- oder 7-yl; 4,5-Dihydrooxepin-2- oder 3- oder 4-yl; 2,5-Dihydrooxepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; Oxepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 2- oder 3-
Tetrahydrothiophenyl; 2,3-Dihydrothiophen-2- oder 3- oder 4- oder 5-yl; 2,5-Dihydrothiophen-2- oder 3-yl; Tetrahydro-2H-thiopyran-2- oder 3- oder 4-yl; 3,4-Dihydro-2H-thiopyran-2- oder 3- oder 4- oder
5- oder 6-yl; 3,6-Dihydro-2H-thiopyran-2- oder 3- oder 4- oder 5- oder 6-yl; 2H-Thiopyran-2- oder 3- oder 4- oder 5- oder 6-yl; 4H-Thiopyran-2- oder 3- oder 4-yl. Bevorzugte 3-Ring und 4-Ring- Heterocyclen sind beispielsweise 1- oder 2-Aziridinyl, Oxiranyl, Thiiranyl, 1- oder 2- oder 3-Azetidinyl,
2- oder 3-Oxetanyl, 2- oder 3-Thietanyl, l,3-Dioxetan-2-yl. Weitere Beispiele für "Heterocyclyl" sind ein partiell oder vollständig hydrierter heterocyclischer Rest mit zwei Heteroatomen aus der Gruppe N, O und S, wie beispielsweise 1- oder 2- oder 3- oder 4-Pyrazolidinyl; 4,5-Dihydro-3H-pyrazol- 3- oder 4- oder 5-yl; 4,5-Dihydro-lH-pyrazol-l - oder 3- oder 4- oder 5-yl; 2,3-Dihydro-lH-pyrazol-l - oder 2- oder 3- oder 4- oder 5-yl; 1- oder 2- oder 3- oder 4- Imidazolidinyl; 2,3-Dihydro-lH-imidazol-l- oder 2- oder
3- oder 4-yl; 2,5-Dihydro-lH-imidazol-l- oder 2- oder 4- oder 5-yl; 4,5-Dihydro-lH-imidazol-l- oder 2- oder 4- oder 5-yl; Hexahydropyridazin-1- oder 2- oder 3- oder 4-yl; 1,2,3,4-Tetrahydropyridazin-l- oder 2- oder 3- oder 4- oder 5- oder 6-yl; 1,2,3, 6-Tetrahydropyridazin-l- oder 2- oder 3- oder 4- oder 5- oder
6- yl; 1,4,5, 6-Tetrahydropyridazin-l- oder 3- oder 4- oder 5- oder 6-yl; 3,4,5, 6-Tetrahydropyridazin-3- oder 4- oder 5-yl; 4,5-Dihydropyridazin-3- oder 4-yl; 3,4-Dihydropyridazin-3- oder 4- oder 5- oder 6-yl;
3,6-Dihydropyridazin-3- oder 4-yl; 1,6-Dihydropyriazin-l- oder 3- oder 4- oder 5- oder 6-yl;
Hexahydropyrimidin-1- oder 2- oder 3- oder 4-yl; 1,4,5,6-Tetrahydropyrimidin-l- oder 2- oder 4- oder 5- oder 6-yl; 1,2,5,6-Tetrahydropyrimidin-l - oder 2- oder 4- oder 5- oder 6-yl; 1,2,3,4- Tetrahydropyrimidin-1- oder 2- oder 3- oder 4- oder 5- oder 6-yl; 1,6-Dihydropyrimidin-l- oder 2- oder 4- oder 5- oder 6-yl; 1,2-Dihydropyrimidin-l - oder 2- oder 4- oder 5- oder 6-yl; 2,5-Dihydropyrimidin- 2- oder 4- oder 5-yl; 4,5-Dihydropyrimidin- 4- oder 5- oder 6-yl; 1,4-Dihydropyrimidin-l- oder 2- oder
4- oder 5- oder 6-yl; 1- oder 2- oder 3-Piperazinyl; 1,2,3,6-Tetrahydropyrazin-l- oder 2- oder 3- oder 5-
oder 6-yl; 1,2,3,4-Tetrahydropyrazin-l - oder 2- oder 3- oder 4- oder 5- oder 6-yl; 1,2-Dihydropyrazin-l- oder 2- oder 3- oder 5- oder 6-yl; 1,4-Dihydropyrazin-l - oder 2- oder 3-yl; 2,3-Dihydropyrazin-2- oder
3- oder 5- oder 6-yl; 2,5-Dihydropyrazin-2- oder 3-yl; l,3-Dioxolan-2- oder 4- oder 5-yl; l,3-Dioxol-2- oder 4-yl; l,3-Dioxan-2- oder 4- oder 5-yl; 4H-l,3-Dioxin-2- oder 4- oder 5- oder 6-yl; l,4-Dioxan-2- oder 3- oder 5- oder 6-yl; 2,3-Dihydro-l,4-dioxin-2- oder 3- oder 5- oder 6-yl; l,4-Dioxin-2- oder 3-yl; l,2-Dithiolan-3- oder 4-yl; 3H-l,2-Dithiol-3- oder 4- oder 5-yl; l,3-Dithiolan-2- oder 4-yl; 1,3-Dithiol- 2- oder 4-yl; l,2-Dithian-3- oder 4-yl; 3,4-Dihydro-l,2-dithiin-3- oder 4- oder 5- oder 6-yl; 3,6-Dihydro-
1.2- dithiin-3- oder 4-yl; l,2-Dithiin-3- oder 4-yl; l,3-Dithian-2- oder 4- oder 5-yl; 4H-l,3-Dithiin-2- oder 4- oder 5- oder 6-yl; Isoxazolidin-2- oder 3- oder 4- oder 5-yl; 2,3-Dihydroisoxazol-2- oder 3- oder 4- oder 5-yl; 2,5-Dihydroisoxazol-2- oder 3- oder 4- oder 5-yl; 4,5-Dihydroisoxazol-3- oder 4- oder 5-yl;
1.3- Oxazolidin-2- oder 3- oder 4- oder 5-yl; 2,3-Dihydro-l,3-oxazol-2- oder 3- oder 4- oder 5-yl; 2,5- Dihydro-l,3-oxazol-2- oder 4- oder 5-yl; 4,5-Dihydro-l,3-oxazol-2- oder 4- oder 5-yl; l,2-Oxazinan-2- oder 3- oder 4- oder 5- oder 6-yl; 3,4-Dihydro-2H-l,2-oxazin-2- oder 3- oder 4- oder 5- oder 6-yl; 3,6- Dihydro-2H-l,2-oxazin-2- oder 3- oder 4- oder 5- oder 6-yl; 5,6-Dihydro-2H-l,2-oxazin-2- oder 3- oder 4- oder 5- oder 6-yl; 5,6-Dihydro-4H-l,2-oxazin-3- oder 4- oder 5- oder 6-yl; 2H-l,2-Oxazin-2- oder 3- oder 4- oder 5- oder 6-yl; 6H-l,2-Oxazin-3- oder 4- oder 5- oder 6-yl; 4H-l,2-Oxazin-3- oder 4- oder 5- oder 6-yl; l,3-Oxazinan-2- oder 3- oder 4- oder 5- oder 6-yl; 3,4-Dihydro-2H-l,3-oxazin-2- oder 3- oder
4- oder 5- oder 6-yl; 3,6-Dihydro-2H-l,3-oxazin-2- oder 3- oder 4- oder 5- oder 6-yl; 5,6-Dihydro-2H- l,3-oxazin-2- oder 4- oder 5- oder 6-yl; 5,6-Dihydro-4H-l,3-oxazin-2- oder 4- oder 5- oder 6-yl; 2H- l,3-Oxazin-2- oder 4- oder 5- oder 6-yl; 6H-l,3-Oxazin-2- oder 4- oder 5- oder 6-yl; 4H-l,3-Oxazin-2- oder 4- oder 5- oder 6-yl; Morpholin-2- oder 3- oder 4-yl; 3,4-Dihydro-2H-l,4-oxazin-2- oder 3- oder 4- oder 5- oder 6-yl; 3,6-Dihydro-2H-l,4-oxazin-2- oder 3- oder 5- oder 6-yl; 2H-l,4-oxazin-2- oder 3- oder 5- oder 6-yl; 4H-l,4-oxazin-2- oder 3-yl; 1 ,2-Oxazepan-2- oder 3- oder 4- oder 5- oder 6- oder 7- yl; 2,3,4,5-Tetrahydro-l,2-oxazepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 2,3,4,7-Tetrahydro-l,2- oxazepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 2,3,6,7-Tetrahydro-l,2-oxazepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 2,5,6,7-Tetrahydro-l,2-oxazepin-2- oder 3- oder 4- oder 5- oder 6- oder 7- yl; 4,5,6,7-Tetrahydro-l,2-oxazepin-3- oder 4- oder 5- oder 6- oder 7-yl; 2,3-Dihydro-l,2-oxazepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 2,5-Dihydro-l,2-oxazepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 2,7-Dihydro-l,2-oxazepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 4,5-Dihydro-l,2- oxazepin-3- oder 4- oder 5- oder 6- oder 7-yl; 4,7-Dihydro-l,2-oxazepin-3- oder 4- oder 5- oder 6- oder 7-yl; 6,7-Dihydro-l,2-oxazepin-3- oder 4- oder 5- oder 6- oder 7-yl; l,2-Oxazepin-3- oder 4- oder 5- oder 6- oder 7-yl; l,3-Oxazepan-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 2,3,4,5-Tetrahydro-l,3- oxazepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 2,3,4,7-Tetrahydro-l,3-oxazepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 2,3,6,7-Tetrahydro-l,3-oxazepin-2- oder 3- oder 4- oder 5- oder 6- oder 7- yl; 2,5,6,7-Tetrahydro-l,3-oxazepin-2- oder 4- oder 5- oder 6- oder 7-yl; 4,5,6,7-Tetrahydro-l,3- oxazepin-2- oder 4- oder 5- oder 6- oder 7-yl; 2,3-Dihydro-l,3-oxazepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 2,5-Dihydro-l,3-oxazepin-2- oder 4- oder 5- oder 6- oder 7-yl; 2,7-Dihydro-l,3-oxazepin-
2- oder 4- oder 5- oder 6- oder 7-yl; 4,5-Dihydro-l,3-oxazepin-2- oder 4- oder 5- oder 6- oder 7-yl; 4,7- Dihydro-l,3-oxazepin-2- oder 4- oder 5- oder 6- oder 7-yl; 6,7-Dihydro-l,3-oxazepin-2- oder 4- oder 5- oder 6- oder 7-yl; l,3-Oxazepin-2- oder 4- oder 5- oder 6- oder 7-yl; 1 ,4-Oxazepan-2- oder 3- oder 5- oder 6- oder 7-yl; 2,3,4,5-Tetrahydro-l,4-oxazepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 2,3,4,7- Tetrahydro-l,4-oxazepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 2,3,6,7-Tetrahydro-l,4-oxazepin- 2- oder 3- oder 5- oder 6- oder 7-yl; 2,5,6,7-Tetrahydro-l,4-oxazepin-2- oder 3- oder 5- oder 6- oder 7- yl; 4,5,6,7-Tetrahydro-l,4-oxazepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 2,3-Dihydro-l,4- oxazepin-2- oder 3- oder 5- oder 6- oder 7-yl; 2,5-Dihydro-l,4-oxazepin-2- oder 3- oder 5- oder 6- oder 7-yl; 2,7-Dihydro-l,4-oxazepin-2- oder 3- oder 5- oder 6- oder 7-yl; 4,5-Dihydro-l,4-oxazepin-2- oder 3- oder 4- oder 5- oder 6- oder 7-yl; 4,7-Dihydro-l,4-oxazepin-2- oder 3- oder 4- oder 5- oder 6- oder 7- yl; 6,7-Dihydro-l,4-oxazepin-2- oder 3- oder 5- oder 6- oder 7-yl; 1 ,4-Oxazepin-2- oder 3- oder 5- oder 6- oder 7-yl; Isothiazolidin-2- oder 3- oder 4- oder 5-yl; 2,3-Dihydroisothiazol-2- oder 3- oder 4- oder 5- yl; 2,5-Dihydroisothiazol-2- oder 3- oder 4- oder 5-yl; 4,5-Dihydroisothiazol-3- oder 4- oder 5-yl; 1,3- Thiazolidin-2- oder 3- oder 4- oder 5-yl; 2,3-Dihydro-l ,3-thiazol-2- oder 3- oder 4- oder 5-yl; 2,5- Dihydro-l,3-thiazol-2- oder 4- oder 5-yl; 4,5-Dihydro-l,3-thiazol-2- oder 4- oder 5-yl; l,3-Thiazinan-2- oder 3- oder 4- oder 5- oder 6-yl; 3,4-Dihydro-2H-l,3-thiazin-2- oder 3- oder 4- oder 5- oder 6-yl; 3,6- Dihydro-2H-l,3-thiazin-2- oder 3- oder 4- oder 5- oder 6-yl; 5,6-Dihydro-2H-l,3-thiazin-2- oder 4- oder 5- oder 6-yl; 5,6-Dihydro-4H-l,3-thiazin-2- oder 4- oder 5- oder 6-yl; 2H-l,3-Thiazin-2- oder 4- oder 5- oder 6-yl; 6H-l,3-Thiazin-2- oder 4- oder 5- oder 6-yl; 4H-l,3-Thiazin-2- oder 4- oder 5- oder 6-yl. Weitere Beispiele für "Heterocyclyl" sind ein partiell oder vollständig hydrierter heterocyclischer Rest mit 3 Heteroatomen aus der Gruppe N, O und S, wie beispielsweise l,4,2-Dioxazolidin-2- oder 3- oder 5-yl; l,4,2-Dioxazol-3- oder 5-yl; 1 ,4,2-Dioxazinan-2- oder -3- oder 5- oder 6-yl; 5,6-Dihydro-l,4,2- dioxazin-3- oder 5- oder 6-yl; l,4,2-Dioxazin-3- oder 5- oder 6-yl; l,4,2-Dioxazepan-2- oder 3- oder 5- oder 6- oder 7-yl; 6,7-Dihydro-5H-l,4,2-Dioxazepin-3- oder 5- oder 6- oder 7-yl; 2,3-Dihydro-7H-l,4,2- Dioxazepin-2- oder 3- oder 5- oder 6- oder 7-yl; 2,3-Dihydro-5H-l,4,2-Dioxazepin-2- oder 3- oder 5- oder 6- oder 7-yl; 5H-l,4,2-Dioxazepin-3- oder 5- oder 6- oder 7-yl; 7H-l,4,2-Dioxazepin-3- oder 5- oder 6- oder 7-yl. Strukturbeispiele für gegebenenfalls weiter substituierte Heterocyclen sind auch im Folgenden aufgeführt:
X)
22
Die oben aufgeführten Heterocyclen sind bevorzugt beispielsweise durch Wasserstoff, Halogen, Alkyl, Haloalkyl, Hydroxy, Alkoxy, Cycloalkoxy, Aryloxy, Alkoxyalkyl, Alkoxyalkoxy, Cycloalkyl,
Halocycloalkyl, Aryl, Arylalkyl, Heteroaryl, Heterocyclyl, Alkenyl, Alkylcarbonyl, Cycloalkylcarbonyl, Arylcarbonyl, Heteroarylcarbonyl, Alkoxycarbonyl, Hydroxycarbonyl, Cycloalkoxycarbonyl,
Cycloalkylalkoxycarbonyl, Alkoxycarbonylalkyl, Arylalkoxycarbonyl, Arylalkoxycarbonylalkyl, Alkinyl, Alkinylalkyl, Alkylalkinyl, Tris-alkylsilylalkinyl, Nitro, Amino, Cyano, Haloalkoxy,
Haloalkylthio, Alkylthio, Hydrothio, Hydroxyalkyl, Oxo, Heteroarylalkoxy, Arylalkoxy, Heterocyclylalkoxy, Heterocyclylalkylthio, Heterocyclyloxy, Heterocyclylthio, Heteroaryloxy, Bis- alkylamino, Alkylamino, Cycloalkylamino, Hydroxycarbonylalkylamino, Alkoxycarbonylalkylamino, Arylalkoxycarbonylalkylamino, Alkoxycarbonylalkyl(alkyl)amino, Aminocarbonyl,
Alkylaminocarbonyl, Bis-alkylaminocarbonyl, Cycloalkylaminocarbonyl,
Hydroxycarbonylalkylaminocarbonyl, Alkoxycarbonylalkylaminocarbonyl,
Arylalkoxycarbonylalkylaminocarbonyl substituiert.
Wenn ein Grundkörper "durch einen oder mehrere Reste" aus einer Aufzählung von Resten (= Gruppe) oder einer generisch definierten Gruppe von Resten substituiert ist, so schließt dies jeweils die gleichzeitige Substitution durch mehrere gleiche und/oder strukturell unterschiedliche Reste ein.
Handelt es sich es sich um einen teilweise oder vollständig gesättigten Stickstoff-Heterocyclus, so kann dieser sowohl über Kohlenstoff als auch über den Stickstoff mit dem Rest des Moleküls verknüpft sein.
Als Substituenten für einen substituierten heterocyclischen Rest kommen die weiter unten genannten Substituenten in Frage, zusätzlich auch Oxo und Thioxo. Die Oxogruppe als Substituent an einem Ring- C-Atom bedeutet dann beispielsweise eine Carbonylgruppe im heterocyclischen Ring. Dadurch sind vorzugsweise auch Lactone und Lactame umfasst. Die Oxogruppe kann auch an den Heteroringatomen, die in verschiedenen Oxidationsstufen existieren können, z.B. bei N und S, auftreten und bilden dann beispielsweise die divalenten Gruppen N(O) , S(O) (auch kurz SO) und S(0)2 (auch kurz SO2) im heterocyclischen Ring. Im Fall von -N(O)- und -S(0)-Gruppen sind jeweils beide Enantiomere umfasst. Erfindungsgemäß steht der Ausdruck„Heteroaryl" für heteroaromatische Verbindungen, d. h.
vollständig ungesättigte aromatische heterocyclische Verbindungen, vorzugsweise für 5- bis 7-gliedrige Ringe mit 1 bis 4, vorzugsweise 1 oder 2 gleichen oder verschiedenen Heteroatomen, vorzugsweise O, S oder N. Erfindungsgemäße Heteroaryle sind beispielsweise lH-Pyrrol-l-yl; lH-Pyrrol-2-yl; lH-Pyrrol- 3-yl; Furan-2-yl; Furan-3-yl; Thien-2-yl; Thien-3-yl, lH-Imidazol-l-yl; lH-Imidazol-2-yl; lH-Imidazol- 4-yl; lH-Imidazol-5-yl; lH-Pyrazol-l-yl; lH-Pyrazol-3-yl; lH-Pyrazol-4-yl; lH-Pyrazol-5-yl, 1H-1,2,3- Triazol-l-yl, lH-l,2,3-Triazol-4-yl, lH-l,2,3-Triazol-5-yl, 2H-l,2,3-Triazol-2-yl, 2H-l,2,3-Triazol-4-yl, lH-l,2,4-Triazol-l-yl, lH-l,2,4-Triazol-3-yl, 4H-l,2,4-Triazol-4-yl, l,2,4-Oxadiazol-3-yl, 1,2,4- Oxadiazol-5-yl, l,3,4-Oxadiazol-2-yl, l,2,3-Oxadiazol-4-yl, l,2,3-Oxadiazol-5-yl, l,2,5-Oxadiazol-3-yl, Azepinyl, Pyridin-2-yl, Pyridin-3-yl, Pyridin-4-yl, Pyrazin-2-yl, Pyrazin-3-yl, Pyrimidin-2-yl,
Pyrimidin-4-yl, Pyrimidin-5-yl, Pyridazin-3-yl, Pyridazin-4-yl, l,3,5-Triazin-2-yl, l,2,4-Triazin-3-yl, l,2,4-Triazin-5-yl, 1 ,2,4-Triazin-6-yl, l,2,3-Triazin-4-yl, l,2,3-Triazin-5-yl, 1,2,4-, 1,3,2-, 1,3,6- und 1,2,6-Oxazinyl, Isoxazol-3-yl, Isoxazol-4-yl, Isoxazol-5-yl, l,3-Oxazol-2-yl, l,3-Oxazol-4-yl, 1,3-
Oxazol-5-yl, Isothiazol-3-yl, Isothiazol-4-yl, Isothiazol-5-yl, l,3-Thiazol-2-yl, l,3-Thiazol-4-yl, 1,3- Thiazol-5-yl, Oxepinyl, Thiepinyl, 1 ,2,4-Triazolonyl und 1 ,2,4-Diazepinyl, 2H-l,2,3,4-Tetrazol-5-yl, lH-l,2,3,4-Tetrazol-5-yl, l,2,3,4-Oxatriazol-5-yl, l,2,3,4-Thiatriazol-5-yl, l,2,3,5-Oxatriazol-4-yl, l,2,3,5-Thiatriazol-4-yl. Die erfindungsgemäßen Heteroarylgruppen können ferner mit einem oder mehreren, gleichen oder verschiedenen Resten substituiert sein. Sind zwei benachbarte
Kohlenstoffatome Bestandteil eines weiteren aromatischen Rings, so handelt es sich um annellierte heteroaromatische Systeme, wie benzokondensierte oder mehrfach annellierte Heteroaromaten.
Bevorzugt sind beispielsweise Chinoline (z. B. Chinolin-2-yl, Chinolin-3-yl, Chinolin-4-yl, Chinolin-5- yl, Chinolin-6-yl, Chinolin-7-yl, Chinolin-8-yl); Isochinoline (z. B. Isochinolin-l -yl, Isochinolin-3-yl, Isochinolin-4-yl, Isochinolin-5-yl, Isochinolin-6-yl, Isochinolin-7-yl, Isochinolin-8-yl); Chinoxalin; Chinazolin; Cinnolin; 1,5-Naphthyridin; 1 ,6-Naphthyridin; 1 ,7-Naphthyridin; 1,8-Naphthyridin; 2,6- Naphthyridin; 2,7-Naphthyridin; Phthalazin; Pyridopyrazine; Pyridopyrimidine; Pyridopyridazine; Pteridine; Pyrimidopyrimidine. Beispiele für Heteroaryl sind auch 5- oder 6-gliedrige benzokondensierte Ringe aus der Gruppe lH-Indol-l-yl, lH-Indol-2-yl, lH-Indol-3-yl, lH-Indol-4-yl, lH-Indol-5-yl, 1H- Indol-6-yl, lH-Indol-7-yl, l-Benzofuran-2-yl, l-Benzofuran-3-yl, l-Benzofuran-4-yl, l-Benzofuran-5- yl, l-Benzofuran-6-yl, l-Benzofuran-7-yl, l-Benzothiophen-2-yl, l-Benzothiophen-3-yl, 1- Benzothiophen-4-yl, l-Benzothiophen-5-yl, l-Benzothiophen-6-yl, l-Benzothiophen-7-yl, lH-Indazol-
1- yl, lH-Indazol-3-yl, lH-Indazol-4-yl, lH-Indazol-5-yl, lH-Indazol-6-yl, lH-Indazol-7-yl, 2H-Indazol-
2- yl, 2H-Indazol-3-yl, 2H-Indazol-4-yl, 2H-Indazol-5-yl, 2H-Indazol-6-yl, 2H-Indazol-7-yl, 2H- Isoindol-2-yl, 2H-Isoindol-l-yl, 2H-Isoindol-3-yl, 2H-Isoindol-4-yl, 2H-Isoindol-5-yl, 2H-Isoindol-6-yl; 2H-Isoindol-7-yl, lH-Benzimidazol-l-yl, lH-Benzimidazol-2-yl, lH-Benzimidazol-4-yl, 1H- Benzimidazol-5-yl, lH-Benzimidazol-6-yl, lH-Benzimidazol-7-yl, l,3-Benzoxazol-2-yl, 1,3- Benzoxazol-4-yl, l,3-Benzoxazol-5-yl, l,3-Benzoxazol-6-yl, l,3-Benzoxazol-7-yl, l,3-Benzthiazol-2-yl, l,3-Benzthiazol-4-yl, l,3-Benzthiazol-5-yl, l,3-Benzthiazol-6-yl, l,3-Benzthiazol-7-yl, 1,2- Benzisoxazol-3-yl, l,2-Benzisoxazol-4-yl, l,2-Benzisoxazol-5-yl, l,2-Benzisoxazol-6-yl, 1,2-
Benzisoxazol-7-yl, l,2-Benzisothiazol-3-yl, l,2-Benzisothiazol-4-yl, l,2-Benzisothiazol-5-yl, 1,2- Benzisothiazol-6-yl, 1 ,2-Benzisothiazol-7-yl.
Die Bezeichnung "Halogen" bedeutet beispielsweise Fluor, Chlor, Brom oder Iod. Wird die
Bezeichnung für einen Rest verwendet, dann bedeutet "Halogen" beispielsweise ein Fluor-, Chlor-, Brom- oder Iodatom.
Erfindungsgemäß bedeutet„Alkyl" einen geradkettigen oder verzweigten offenkettigen, gesättigten Kohlenwasserstoffrest, der gegebenenfalls ein- oder mehrfach substituiert ist und im letzteren Falle als „substituiertes Alkyl" bezeichnet wird. Bevorzugte Substituenten sind Halogenatome, Alkoxy-,
Haloalkoxy-, Cyano-, Alkylthio, Haloalkylthio-, Amino- oder Nitrogruppen, besonders bevorzugt sind Methoxy, Methyl, Fluoralkyl, Cyano, Nitro, Fluor, Chlor, Brom oder Iod. Die Vorsilbe„Bis" schließt
auch die Kombination unterschiedlicher Alkylreste ein, z. B. Methyl(Ethyl) oder Ethyl(Methyl).
„Haloalkyl", ,,-alkenyl" und ,,-alkinyl" bedeuten durch gleiche oder verschiedene Halogenatome, teilweise oder vollständig substituiertes Alkyl, Alkenyl bzw. Alkinyl, z.B. Monohaloalkyl
(= Monohalogenalkyl) wie z. B. CH2CH2C1, CH2CH2Br, CHC1CH3, CH2C1, CH2F; Perhaloalkyl wie z. B. CCI3, CC1F2, CFC12,CF2CC1F2, CF2CC1FCF3; Polyhaloalkyl wie z. B. CH2CHFC1, CF2CC1FH, CF2CBrFH, CH2CF3; Der Begriff Perhaloalkyl umfasst dabei auch den Begriff Perfluoralkyl.
„Teilfluoriertes Alkyl" bedeutet einen geradkettigen oder verzweigten, gesättigten Kohlenwasserstoff, der einfach oder mehrfach durch Fluor substituiert ist, wobei sich die entsprechenden Fluoratome als Substituenten an einem oder mehreren verschiedenen Kohlenstoffatomen der geradkettigen oder verzweigten Kohlenwasserstoffkette befinden können, wie z. B. CHFCH3, CH2CH2F, CH2CH2CF3, CHF2, CH2F, CHFCF2CF3 „Teilfluoriertes Haloalkyl" bedeutet einen geradkettigen oder verzweigten, gesättigten
Kohlenwasserstoff, der durch verschiedenene Halogenatomen mit mindestens einem Fluoratom substituiert ist, wobei alle anderen gegebenenfalls vorhandenen Halogenatome ausgewählt sind aus der Gruppe Fluor, Chlor oder Brom, Iod. Die entsprechenden Halogenatome können sich dabei als Substituenten an einem oder mehreren verschiedenen Kohlenstoffatomen der geradkettigen oder verzweigten Kohlenwasserstoffkette befinden. Teilfluoriertes Haloalkyl schließt auch die vollständige Substitution der geradkettigen oder verzweigten Kette durch Halogen unter Beteiligung von mindestens einem Fluoratom ein.
„Haloalkoxy" ist z.B. OCF3, OCHF2, OCH2F, OCF2CF3, OCH2CF3 und 0CH2CH2C1; Entsprechendes gilt für Haloalkenyl und andere durch Halogen substituierten Reste.
Der hier beispielhaft genannte Ausdruck "(Ci-C4)-Alkyl" bedeutet eine Kurzschreibweise für geradkettiges oder verzweigtes Alkyl mit einem bis 4 Kohlenstoffatomen entsprechend der
Bereichsangabe für C-Atome, d. h. umfasst die Reste Methyl, Ethyl, 1 -Propyl, 2-Propyl, 1 -Butyl, 2-Butyl, 2-Methylpropyl oder tert-Butyl. Allgemeine Alkylreste mit einem größeren angegebenen Bereich von C-Atomen, z. B. "(Ci-C6)-Alkyl", umfassen entsprechend auch geradkettige oder verzweigte Alkylreste mit einer größeren Zahl von C-Atomen, d. h. gemäß Beispiel auch die Alkylreste mit 5 und 6 C-Atomen. Wenn nicht speziell angegeben, sind bei den Kohlenwasserstoffresten wie Alkyl-, Alkenyl- und
Alkinylresten, auch in zusammengesetzten Resten, die niederen Kohlenstoffgerüste, z.B. mit 1 bis 6 C-Atomen bzw. bei ungesättigten Gruppen mit 2 bis 6 C-Atomen, bevorzugt. Alkylreste, auch in den
zusammengesetzten Resten wie Alkoxy, Haloalkyl usw., bedeuten z.B. Methyl, Ethyl, n- oder i-Propyl, n-, i-, t- oder 2-Butyl, Pentyle, Hexyle, wie n-Hexyl, i-Hexyl und 1,3-Dimethylbutyl, Heptyle, wie n-Heptyl, 1 -Methylhexyl und 1 ,4-Dimethylpentyl; Alkenyl- und Alkinylreste haben die Bedeutung der den Alkylresten entsprechenden möglichen ungesättigten Reste, wobei mindestens eine Doppelbindung bzw. Dreifachbindung enthalten ist. Bevorzugt sind Reste mit einer Doppelbindung bzw.
Dreifachbindung.
Der Begriff„Alkenyl" schließt insbesondere auch geradkettige oder verzweigte offenkettige
Kohlenwasserstoffreste mit mehr als einer Doppelbindung ein, wie 1,3-Butadienyl und 1 ,4-Pentadienyl, aber auch Allenyl- oder Kumulenyl-reste mit einer bzw. mehreren kumulierten Doppelbindungen, wie beispielsweise Allenyl (1,2-Propadienyl), 1 ,2-Butadienyl und 1,2,3-Pentatrienyl. Alkenyl bedeutet z.B. Vinyl, welches ggf. durch weitere Alkylreste substituiert sein kann, z B. (aber nicht beschränkt auf) (C2-C6)- Alkenyl wie Ethenyl, 1-Propenyl, 2-Propenyl, 1 -Methylethenyl, 1 -Butenyl, 2-Butenyl, 3- Butenyl, 1 -Methyl- 1-propenyl, 2-Methyl-l-propenyl, 1 -Methyl-2-propenyl, 2-Methyl-2-propenyl, 1- Pentenyl, 2-Pentenyl, 3 -Pentenyl, 4-Pentenyl, 1 -Methyl- 1 -butenyl, 2-Methyl- 1 -butenyl, 3 -Methyl- 1 - butenyl, 1 -Methyl-2-butenyl, 2-Methyl-2-butenyl, 3-Methyl-2-butenyl, l-Methyl-3 -butenyl, 2-Methyl-3- butenyl, 3 -Methyl-3 -butenyl, 1 , 1 -Dimethyl-2-propenyl, 1 ,2-Dimethyl- 1 -propenyl, 1 ,2-Dimethyl-2- propenyl, 1 -Ethyl- 1-propenyl, 1 -Ethyl-2-propenyl, 1-Hexenyl, 2-Hexenyl, 3-Hexenyl, 4-Hexenyl, 5- Hexenyl, 1 -Methyl- 1 -pentenyl, 2-Methyl- 1 -pentenyl, 3-Methyl-l -pentenyl, 4-Methyl-l -pentenyl, 1- Methyl-2-pentenyl, 2-Methyl-2-pentenyl, 3-Methyl-2-pentenyl, 4-Methyl-2-pentenyl, l-Methyl-3- pentenyl, 2-Methyl-3 -pentenyl, 3 -Methyl-3 -pentenyl, 4-Methyl-3 -pentenyl, 1 -Methyl-4-pentenyl, 2- Methyl-4-pentenyl, 3-Methyl-4-pentenyl, 4-Methyl-4-pentenyl, 1 , 1 -Dimethyl-2-butenyl, 1 , 1 -Dimethyl- 3 -butenyl, 1 ,2-Dimethyl- 1 -butenyl, 1 ,2-Dimethyl-2-butenyl, 1 ,2-Dimethyl-3 -butenyl, 1,3-Dimethyl-l- butenyl, l,3-Dimethyl-2-butenyl, l,3-Dimethyl-3-butenyl, 2,2-Dimethyl-3 -butenyl, 2,3-Dimethyl-l- butenyl, 2,3-Dimethyl-2-butenyl, 2,3-Dimethyl-3-butenyl, 3,3-Dimethyl-l -butenyl, 3,3-Dimethyl-2- butenyl, l-Ethyl-l-butenyl, 1-Ethy 1-2 -butenyl, 1 -Ethyl- 3 -butenyl, 2-Ethyl-l -butenyl, 2-Ethyl-2-butenyl, 2-Ethyl-3 -butenyl, 1 , 1 ,2-Trimethyl-2-propenyl, 1 -Ethyl- 1 -methyl-2-propenyl, 1 -Ethyl-2-methyl- 1 - propenyl und 1 -Ethyl-2-methyl-2-propenyl. Der Begriff„Alkinyl" schließt insbesondere auch geradkettige oder verzweigte offenkettige
Kohlenwasserstoffreste mit mehr als einer Dreifachbindung oder auch mit einer oder mehreren
Dreifachbindungen und einer oder mehreren Doppelbindungen ein, wie beispielsweise 1,3-Butatrienyl bzw. 3-Penten-l -in-l -yl. (C2-C6)-Alkinyl bedeutet z.B. Ethinyl, 1-Propinyl, 2-Propinyl, 1-Butinyl, 2- Butinyl, 3-Butinyl, 1 -Methyl-2-propinyl, 1-Pentinyl, 2-Pentinyl, 3-Pentinyl, 4-Pentinyl, l-Methyl-2- butinyl, 1 -Methyl-3 -butinyl, 2-Methyl-3 -butinyl, 3 -Methyl- 1 -butinyl, 1 , 1 -Dimethyl-2-propinyl, 1 -Ethyl- 2-propinyl, 1-Hexinyl, 2-Hexinyl, 3-Hexinyl, 4-Hexinyl, 5-Hexinyl, 1 -Methyl-2-pentinyl, l-Methyl-3- pentinyl, 1 -Methyl-4-pentinyl, 2-Methyl-3-pentinyl, 2-Methyl-4-pentinyl, 3 -Methyl- 1-pentinyl, 3-
Methyl-4-pentinyl, 4-Methyl-l -pentinyl, 4-Methyl-2-pentinyl, 1 , 1 -Di-methyl-2-butinyl, 1 , 1 -Dimethyl-3 - butinyl, l ,2-Dimethyl-3-butinyl, 2,2-Dimethyl-3-butinyl, 3,3-Dimethyl-l -butinyl, 1 -Ethyl-2-butinyl, 1 - Ethyl-3-butinyl, 2-Ethyl-3 -butinyl und l -Ethyl-l -methyl-2-propinyl. Der Begriff„Cycloalkyl" bedeutet ein carbocyclisches, gesättigtes Ringsystem mit vorzugsweise 3-8 Ring-C-Atomen, z.B. Cyclopropyl, Cyclobutyl, Cyclopentyl oder Cyclohexyl, das gegebenenfalls weiter substituiert ist, bevorzugt durch Wasserstoff, Alkyl, Alkoxy, Cyano, Nitro, Alkylthio, Haloalkylthio, Halogen, Alkenyl, Alkinyl, Haloalkyl, AMino, Alkylamino, Bisalkylamino, Alkocycarbonyl,
Hydroxycarbonyl, Arylalkoxycarbonyl, Aminocarbonyl, Alkylaminocarbonyl,
Cycloalkylaminocarbonyl. Im Falle von gegebenenfalls substituiertem Cycloalkyl werden cyclische Systeme mit Substituenten umfasst, wobei auch Substituenten mit einer Doppelbindung am
Cycloalkylrest, z. B. eine Alkylidengruppe wie Methyliden, umfasst sind. Im Falle von gegebenenfalls substituiertem Cycloalkyl werden auch mehrcyclische aliphatische Systeme umfasst, wie beispielsweise Bicyclo[l .1.0]butan-l -yl, Bicyclo[l .1.0]butan-2-yl, Bicyclo[2.1.0]pentan-l -yl, Bicyclo[l .1.1 ]pentan-l - yl, Bicyclo[2.1.0]pentan-2-yl, Bicyclo[2.1.0]pentan-5-yl, Bicyclo[2.1.1 ]hexyl, Bicyclo[2.2.1 ]hept-2-yl, Bicyclo[2.2.2]octan-2-yl, Bicyclo[3.2.1 ]octan-2-yl, Bicyclo[3.2.2]nonan-2-yl, Adamantan-l -yl und Adamantan-2-yl, aber auch Systeme wie z. B. l ,l '-Bi(cyclopropyl)-l -yl, l , l '-Bi(cyclopropyl)-2-yl. Der Ausdruck "(C3-C7)-Cycloalkyl" bedeutet eine Kurzschreibweise für Cycloalkyl mit drei bis 7
Kohlenstoffatomen entsprechend der Bereichsangabe für C-Atome.
Im Falle von substituiertem Cycloalkyl werden auch spirocyclische aliphatische Systeme umfasst, wie beispielsweise Spiro[2.2]pent-l -yl, Spiro[2.3]hex-l -yl, Spiro[2.3]hex-4-yl, 3-Spiro[2.3]hex-5-yl, Spiro[3.3]hept-l -yl, Spiro[3.3]hept-2-yl. „Cycloalkenyl" bedeutet ein carbocyclisches, nicht aromatisches, partiell ungesättigtes Ringsystem mit vorzugsweise 4-8 C-Atomen, z.B. 1 -Cyclobutenyl, 2-Cyclobutenyl, 1 -Cyclopentenyl, 2-Cyclopentenyl, 3 -Cyclopentenyl, oder 1 -Cyclohexenyl, 2-Cyclohexenyl, 3-Cyclohexenyl, 1 ,3-Cyclohexadienyl oder 1 ,4-Cyclohexadienyl, wobei auch Substituenten mit einer Doppelbindung am Cycloalkenylrest, z. B. eine Alkylidengruppe wie Methyliden, umfasst sind. Im Falle von gegebenenfalls substituiertem Cycloalkenyl gelten die Erläuterungen für substituiertes Cycloalkyl entsprechend.
Der Begriff„Alkyliden", z. B. auch in der Form (Ci-Cio)-Alkyliden, bedeutet den Rest eines geradkettigen oder verzweigten offenkettigen Kohlenwasserstoffrests, der über eine Zweifachbindung gebunden ist. Als Bindungsstelle für Alkyliden kommen naturgemäß nur Positionen am Grundkörper in Frage, an denen zwei H- Atome durch die Doppelbindung ersetzt werden können; Reste sind z. B. =CH2, =CH-CH3, =C(CH3)-CH3, =C(CH3)-C2H5 oder =C(C2H5)-C2H5. Cycloalkyliden bedeutet ein
carbocyclischer Rest, der über eine Zweifachbindung gebunden ist.
„Cycloalkylalkyloxy" bedeutet ein über ein Sauerstoffatom gebundenen Cycloalkylalkylrest und „Arylalkyloxy" bedeutet ein über ein Sauerstoffatom gebundenen Arylalkylrest. „Alkoxyalkyl" steht für einen über eine Alkylgruppe gebundenen Alkoxyrest und„Alkoxyalkoxy" bedeutet einen über ein Sauerstoffatom gebundenen Alkoxyalkylrest, z.B. (aber nicht beschränkt auf) Methoxymethoxy, Methoxyethoxy, Ethoxyethoxy, Methoxy-n-propyloxy.
„Alkylthioalkyl" steht für einen über eine Alkylgruppe gebundenen Alkylthiorest und
„Alkylthioalkylthio" bedeutet einen über ein Sauerstoffatom gebundenen Alkylthioalkylrest.
„Arylalkoxyalkyl" steht für einen über eine Alkylgruppe gebundenen Aryloxyrest und
„Heteroaryloxyalkyl" bedeutet einen über eine Alkylgruppe gebundenen Heteroaryloxyrest. „Haloalkoxyalkyl" steht für einen gebundenen Haloalkoxyrest und„Haloalkylthioalkyl" bedeutet einen über eine Alkylgruppe gebundenen Haloalkylthiorest.
„Arylalkyl" steht für einen über eine Alkylgruppe gebundenen Arylrest,„Heteroarylalkyl" bedeutet einen über eine Alkylgruppe gebundenen Heteroarylrest, und„Heterocyclylalkyl" bedeutet einen über eine Alkylgruppe gebundenen Heterocyclylrest.
„Cycloalkylalkyl" steht für einen über eine Alkylgruppe gebundenen Cycloalkylrest, z. B. (aber nicht beschränkt auf) Cyclopropylmethyl, Cyclobutylmethyl, Cyclopentylmethyl, Cyclohexylmethyl, 1 - Cyclopropyleth-l -yl, 2-Cyclopropyleth-l -yl, 1 -Cyclopropylprop-l -yl, 3-Cyclopropylprop-l -yl.
„Arylalkenyl" steht für einen über eine Alkenylgruppe gebundenen Arylrest,„Heteroarylalkenyl" bedeutet einen über eine Alkenylgruppe gebundenen Heteroarylrest, und„Heterocyclylalkenyl" bedeutet einen über eine Alkenylgruppe gebundenen Heterocyclylrest. „Arylalkinyl" steht für einen über eine Alkinylgruppe gebundenen Arylrest,„Heteroarylalkinyl" bedeutet einen über eine Alkinylgruppe gebundenen Heteroarylrest, und„Heterocyclylalkinyl" bedeutet einen über eine Alkinylgruppe gebundenen Heterocyclylrest.
Erfindungsgemäß steht "Haloalkylthio" - in Alleinstellung oder als Bestandteil einer chemischen Gruppe - für geradkettiges oder verzweigtes S-Halogenalkyl, vorzugsweise mit 1 bis 8, oder mit 1 bis 6
Kohlenstoffatomen, wie (Ci-Cs)-, (CI-CÖ)- oder (Ci-C4)-Haloalkylthio, z.B. (aber nicht beschränkt auf)
Trifluormethylthio, Pentafluorethylthio, Difluormethyl, 2,2-Difluoreth-l -ylthio, 2,2,2-Difluoreth-l - ylthio, 3,3,3-prop-l -ylthio.
„Halocycloalkyl" und„Halocycloalkenyl" bedeuten durch gleiche oder verschiedene Halogenatome, wie z. B. F, Cl und Br, oder durch Haloalkyl, wie z. B. Trifluormethyl oder Difluormethyl teilweise oder vollständig substituiertes Cycloalkyl oder Cycloalkenyl , z.B. 1 -Fluorcycloprop-l -yl, 2-Fluorcycloprop- 1 -yl, 2,2-Difluorcycloprop-l -yl, 1 -Fluorcyclobut-l -yl, 1 -Trifluormethylcycloprop-l -yl, 2- Trifluormethylcycloprop- 1 -yl, 1 -Chlor-cycloprop- 1 -yl, 2-Chlorcycloprop- 1 -yl, 2,2-Dichlorcycloprop- 1 - yl, 3,3-Difluorcyclobutyl,
Erfindungsgemäß steht "Trialkylsilyl" - in Alleinstellung oder als Bestandteil einer chemischen Gruppe - für geradkettiges oder verzweigtes Si-Alkyl, vorzugsweise mit 1 bis 8, oder mit 1 bis 6
Kohlenstoffatomen, wie Tri-[(Ci-Cg)-, (Ci-Ce)- oder (Ci-C4)-alkyl]silyl, z.B. (aber nicht beschränkt auf) Trimethylsilyl, Triethylsilyl, Tri-(n-propyl)silyl, Tri-(iso-propyl)silyl, Tri-(n-butyl)silyl, Tri-(1 - methylprop- 1 -yl)silyl, Tri-(2-methylprop- 1 -yl)silyl, Tri( 1 , 1 -Dimethyleth- 1 -yl)silyl, Tri(2,2- Dimethyleth- 1 -yl)silyl.
„Trialkylsilylalkinyl" steht für einen über eine Alkinylgruppe gebundenen Trialkylsilylrest. Wenn die Verbindungen durch Wasserstoffverschiebung Tautomere bilden können, welche strukturell formal nicht durch die allgemeine Formel (I) erfasst würden, so sind diese Tautomere gleichwohl von der Definition der erfindungsgemäßen Verbindungen der allgemeinen Formel (I) umfasst, sofern nicht ein bestimmtes Tautomer Gegenstand der Betrachtung ist. So können beispielsweise viele
Carbonylverbindungen sowohl in der Ketoform wie auch in der Enolform vorliegen, wobei beide Formen durch die Definition der Verbindung der allgemeinen Formel (I) umfasst werden.
Die Verbindungen der allgemeinen Formel (I) können je nach Art und Verknüpfung der Substituenten als Stereoisomere vorliegen. Die durch ihre spezifische Raumform definierten möglichen Stereoisomere, wie Enantiomere, Diastereomere, Z- und E-Isomere sind alle von der allgmeinen Formel (I) umfasst. Sind beispielsweise eine oder mehrere Alkenylgruppen vorhanden, so können Diastereomere (Z- und E- Isomere) auftreten. Sind beispielsweise ein oder mehrere asymmetrische Kohlenstoffatome vorhanden, so können Enantiomere und Diastereomere auftreten. Stereoisomere lassen sich aus den bei der
Herstellung anfallenden Gemischen nach üblichen Trennmethoden erhalten. Die chromatographische Trennung kann sowohl im analytischen Maßstab zur Feststellung des Enantiomerenüberschusses bzw. des Diastereomerenüberschusses, wie auch im präparativen Maßstab zur Herstellung von Prüfmustern für die biologische Ausprüfung erfolgen. Ebenso können Stereoisomere durch Einsatz stereoselektiver Reaktionen unter Verwendung optisch aktiver Ausgangs- und/oder Hilfsstoffe selektiv hergestellt
werden. Die Erfindung betrifft somit auch alle Stereoisomeren, die von der allgemeinen Formel (I) umfasst, jedoch nicht mit ihrer spezifischen Stereoform angegeben sind, sowie deren Gemische.
Sofern die Verbindungen als Feststoffe erhalten werden, kann die Reinigung auch durch
Umkristallisieren oder Digerieren erfolgen. Sofern einzelne Verbindungen (I) nicht auf den nachstehend beschriebenen Wegen zufriedenstellend zugänglich sind, können sie durch Derivatisierung anderer Verbindungen (I) hergestellt werden.
Als Isolierungs-, Reinigungs- und Stereoisomerenauftrennungsverfahren von Verbindungen der allgemeinen Formel (I) kommen Methoden in Frage, die dem Fachmann aus analogen Fällen allgemein bekannt sind, z.B. durch physikalische Verfahren wie Kristallisation, Chromatographieverfahren, vor allem Säulenchromatographie und HPLC (Hochdruckflüssigchromatographie), Destillation, gegebenenfalls unter reduziertem Druck, Extraktion und andere Verfahren, können gegebenfalls verbleibende Gemische in der Regel durch chromatographische Trennung, z.B. an chiralen Festphasen, getrennt werden. Für präparative Mengen oder im industriellen Maßstab kommen Verfahren in Frage wie Kristallisation, z.B. diastereomerer Salze, die aus den Diastereomerengemischen mit optisch aktiven Säuren und gegebenenfalls bei vorhandenen sauren Gruppen mit optisch aktiven Basen erhalten werden können. Die vorliegende Erfindung beansprucht auch Verfahren zur Herstellung der erfindungsgemäßen Verbindungen der allgemeinen Formel (I).
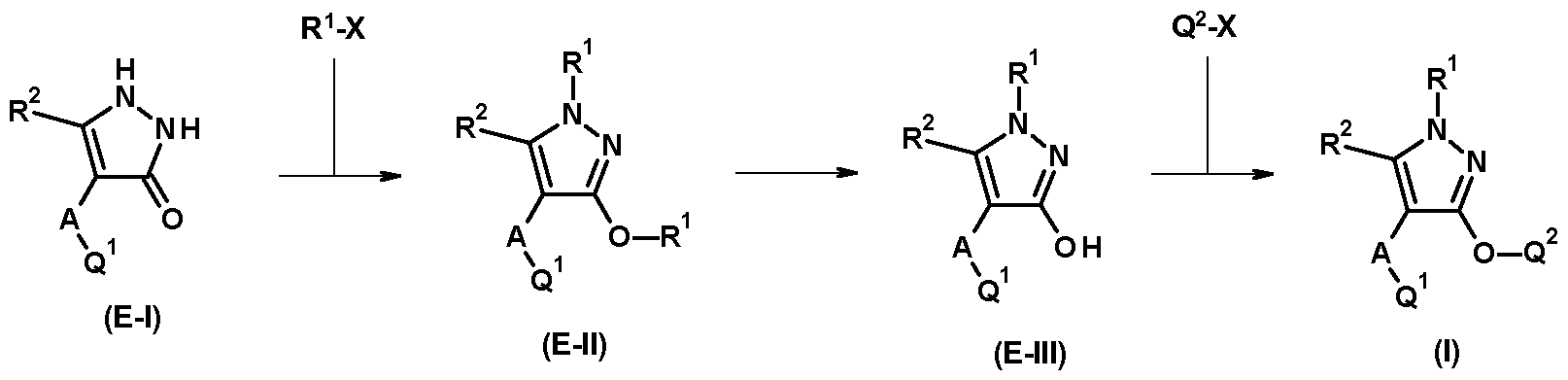
Die erfindungsgemäßen Verbindungen der allgemeinen Formel (I) können unter anderem ausgehend von bekannten Verfahren hergestellt werden. Die eingesetzten und untersuchten Syntheserouten gehen dabei von kommerziell erhältlichen oder leicht herstellbaren Bausteinen aus. Die Gruppierungen Q1, Q2, A, R1, R2, n der all gemeinen Formel (I) haben in den nachfolgenden Schemata die zuvor definierten Bedeutungen, sofern nicht beispielhafte, aber nicht einschränkende, Definitionen erfolgen.
Erfindungsgemäße Verbindungen mit R1 für Methyl und A für O, S(0)n und CR3R4 können beispielsweise nach der in Schema 1 angegebenen Methode hergestellt werden.
Schema 1
Die Pyrazole der allgemeinen Formel (I) können über eine Alkyierung der Pyrazolone (E-III) in
Gegenwart von Basen, Alkyierungsmitteln wie zum Beispiel Q2-X, wobei X eine Abgangsgruppe ist, und Kupfer(I)-Salze, hergestellt werden. Die Base kann ein Carbonat-Salz von einem Alkali-Metall (wie zum Beispiel Natrium, Kalium oder Cäsium) sein. Die Kupfersalze können Kupferhalogenide, wie zum Beispiel Kupfer(I)-Iodid, sein. Die Reaktionen werden im Allgemeinen in einem organischen
Lösungsmittel, wie zum Beispiel Acetonitril oder Dimethylformamid, bei Temperaturen zwischen 0°C und dem Siedepunkt des Lösemittels, durchgeführt. Die Pyrazole der allgemeinen Formel (E-III) können über eine Dealkyierung der Pyrazole (E-II) in Gegenwart von Säuren wie zum Beispiel Bromwasserstoffsäure, hergestellt werden. Die Reaktionen werden im Allgemeinen in einem organischen Lösungsmittel, wie zum Beispiel Essigsäure, bei
Temperaturen zwischen 0°C und dem Siedepunkt des Lösemittels, durchgeführt. Die Pyrazole der allgemeinen Formel (E-II) können über eine Bisalkyierung der Pyrazolone (E-I) in
Gegenwart von Basen und Alkyierungsmitteln wie zum Beispiel R'-X, wobei X eine Abgangsgruppe ist, hergestellt werden. Die Base kann ein Carbonat-Salz von einem Alkali-Metall (wie zum Beispiel Natrium, Kalium oder Cäsium) sein. Die Reaktionen werden im Allgemeinen in einem organischen Lösungsmittel, wie zum Beispiel Acetonitril oder Tetrahydrofuran, bei Temperaturen zwischen 0°C und dem Siedepunkt des Lösemittels, durchgeführt.
Pyrazolone der allgemeinen Formel (E-I) sind literaturbekannt und können beispielsweise gemäß den in Eur. J. Med. Chem. 2009, 44, 3852-7, J. Heterocyclic Chem. 2011, 48, 323-330, Org. Lett. 2016, 18, 6388-91, WO 2016/066664 AI, WO 2011/039338 A2 und ähnlich beschriebenen Methoden hergestellt werden.
Erfindungsgemäße Verbindungen mit A für O, S(0)n und CR3R4 können auch beispielsweise nach der in Schema 2 angegebenen Methode hergestellt werden.
NH2NH-PG
(E-Vl) (la)
Schema 2.
Die Pyrazole der allgemeinen Formel (I) können über eine Alkyierung der Pyrazolone (Ia) in Gegenwart von Basen und Alkyierungsmitteln wie zum Beispiel R'-X, wobei X eine Abgangsgruppe ist, hergestellt werden. Die Base kann ein Carbonat-Salz von einem Alkali-Metall (wie zum Beispiel Natrium, Kalium oder Cäsium), oder ein Amin (wie zum Beispiel Triethylamin) sein. Die Reaktionen werden im
Allgemeinen in einem organischen Lösungsmittel, wie zum Beispiel Acetonitril, Tetrahydrof ran oder Dimethylformamid, bei Temperaturen zwischen 0°C und dem Siedepunkt des Lösemittels, durchgeführt.
Die Pyrazole der allgemeinen Formel (Ia) können über eine Entschützung der Pyrazole (E-VI) in Gegenwart von Säuren wie zum Beispiel Trifluoressigsäure, hergestellt werden. Die Reaktionen werden im Allgemeinen in einem organischen Lösungsmittel, wie zum Beispiel Dichlormethan, oder in
Substanz bei Temperaturen zwischen 0°C und dem Siedepunkt des Lösemittels, durchgeführt. Wie dem Fachmann bekannt ist, können die NH-Pyrazole Ia auch in ihrer entsprechenden anderen tautomeren Form vorliegen.
Die Pyrazole der allgemeinen Formel (E-VI) können über eine Alkyierung der Pyrazolone (E-V) in Gegenwart von Basen und Alkyierungsmitteln wie zum Beispiel Q2-X, wobei X eine Abgangsgruppe ist, hergestellt werden. Die Base kann ein Carbonat-Salz von einem Alkali-Metall (wie zum Beispiel Natrium, Kalium oder Cäsium) sein. Die Reaktionen werden im Allgemeinen in einem organischen Lösungsmittel, wie zum Beispiel Butyronitril, Acetonitril oder Dimethylformamid, bei Temperaturen zwischen 0°C und dem Siedepunkt des Lösemittels, durchgeführt. Die Verbindungen der allgemeinen Formel (E-V) können durch Reaktion der Bausteine (E-IV) mit
Hydrazinen wie zum Beispiel NF NH-PG, wobei PG eine Schützgruppe ist, erhalten werden. Die dabei verwendeten Hydrazine können in freier Form oder als Salze vorliegen, beispielsweise als
Hydrochloride. Im Fall der Verwendung von Salzen kann es vorteilhaft sein, dem Reaktionsgemisch eine organische oder anorganische Base zuzusetzen, wie zum Beispiel Triethylamin. Die Schützgruppe PG kann zum Beispiel Benzyl oder 4-Methoxybenzyl sein. Die Reaktion wird im Allgemeinen in einem organischen Lösungsmittel, wie zum Beispiel Ethanol, bei Temperaturen zwischen 0°C und dem Siedepunkt des Lösemittels durchgeführt.
Ketoester der allgemeinen Formel (E-IV) sind literaturbekannt und können beispielsweise gemäß den in Tetrahedron, 1982, 38, 85-91, J. Am. Chem. Soc. 2013, 135, 14556-14559 und ähnlich beschriebenen Methoden hergestellt werden. Wie dem Fachmann bekannt ist, können die Ketoester E-IV auch in ihrer entsprechenden anderen tautomeren Form vorliegen.
Erfindungsgemäße Verbindungen können auch beispielsweise nach der in Schema 3 angegebenen Methode hergestellt werden.
(E-Vll) (E-VIII) (E-IX) (Ib)
Schema 3.
Die Pyrazole der allgemeinen Formel (Ib) können über eine Substitutionsreaktion der Pyrazole (E-IX) mit Schwefelnucleophilen wie zum Beispiel Q2-SH in Gegenwart von Basen und Kupfer(I)-Salze hergestellt werden. Die Base kann ein Hydrid-Salz von einem Alkali-Metall (wie zum Beispiel Natrium) sein. Die Kupfersalze können Kupferhalogenide, wie zum Beispiel Kupfer(I)-Iodid, sein. Die
Reaktionen werden im Allgemeinen in einem organischen Lösungsmittel, wie zum Beispiel
Dimethylformamid, bei Temperaturen zwischen 0°C und dem Siedepunkt des Lösemittels, durchgeführt. Die Pyrazole der allgemeinen Formel (E-IX) können über eine Iodierung der Pyrazole (E-VIII) mit einem geeigneten Iodierungsmittel, wie zum Beispiel Jod, im Gegenwart von Cerammoniumnitrat hergestellt werden. Die Reaktionen werden im Allgemeinen in einem organischen Lösungsmittel, wie zum Beispiel Acetonitril, bei Temperaturen zwischen 0°C und dem Siedepunkt des Lösemittels, durchgeführt.
Die Pyrazole der allgemeinen Formel (E-VIII) können über eine Alkyierung der Pyrazolone (E-VII) in Gegenwart von Basen, Alkyierungsmitteln wie zum Beispiel Q2-X, wobei X eine Abgangsgruppe ist, und Kupfer(I)-Salze, hergestellt werden. Die Base kann ein Carbonat-Salz von einem Alkali-Metall (wie
zum Beispiel Natrium, Kalium oder Cäsium) sein. Die Kupfersalze können Kupferhalogenide, wie zum Beispiel Kupfer(I)-Iodid, sein. Die Reaktionen werden im Allgemeinen in einem organischen
Lösungsmittel, wie zum Beispiel Acetonitril oder Dimethylformamid, bei Temperaturen zwischen 0°C und dem Siedepunkt des Lösemittels, durchgeführt.
Pyrazole der allgemeinen Formel (E-VII) sind literaturbekannt und können beispielsweise gemäß den in J. Org. Chem. 2015, 80, 6001-6011, WO2013/110643 AI, US5663365 A, WO2015/50989 A2, WO2015/095788 und ähnlich beschriebenen Methoden hergestellt werden. Wie dem Fachmann bekannt ist, können die Pyrazole (E-VII) auch in ihrer entsprechenden anderen tautomeren Form vorliegen.
Erfindungsgemäße Verbindungen können auch beispielsweise nach der in Schema 4 angegebenen Methode hergestellt werden.
(E-IX) (Ic)
Schema 4.
Die Pyrazole der allgemeinen Formel (Ic) können über eine Suzuki-Reaktion der Pyrazole (E-IX) mit Boronsäuren wie zum Beispiel Q2-B(OH)2 in Gegenwart von Basen und Palladium-Katalysatoren (wie zum Beispiel PdC ^dppfXCFhCL)) hergestellt werden. Die Base kann ein Carbonat-Salz von einem Alkali-Metall (wie zum Beispiel Natrium, Kalium oder Cäsium) sein. Die Reaktionen werden im Allgemeinen in einem organischen Lösungsmittel, wie zum Beispiel Dioxane, bei Temperaturen zwischen 0°C und dem Siedepunkt des Lösemittels, durchgeführt.
Erfindungsgemäße Verbindungen können auch beispielsweise nach der in Schema 5 angegebenen Methode hergestellt werden.
(E-VIII) (E-X) (E-Xl) (Id) (le)
Schema 5
Die Pyrazole der allgemeinen Formel (Ie) können über eine Alkyierung der Pyrazolone (Id) in
Gegenwart von Basen und Alkyierungsmitteln wie zum Beispiel R5-X, wobei X eine Abgangsgruppe ist, hergestellt werden. Die Base kann ein Hydrid-Salz von einem Alkali-Metall (wie zum Beispiel Natrium) sein. Die Reaktionen werden im Allgemeinen in einem organischen Lösungsmittel, wie zum Beispiel Acetonitril, Tetrahydrofuran oder Dimethylformamid, bei Temperaturen zwischen 0°C und dem
Siedepunkt des Lösemittels, durchgeführt.
Die Pyrazole der allgemeinen Formel (Id) können über eine Buckwald-Hartwig-Kupplung der Pyrazole (E-XI) mit Arylhalogenids oder Aryltriflats wie zum Beispiel Ql-X in Gegenwart von Basen, Palladium- Katalysatoren (wie zum Beispiel Tris(dibenzylidenaceton)dipalladium(0)) und Liganden (wie zum
Beispiel Xantphos) hergestellt werden. Die Base kann ein Phosphat-Salz von einem Alkali-Metall (wie zum Beispiel Natrium, Kalium oder Cäsium) sein. Die Reaktionen werden im Allgemeinen in einem organischen Lösungsmittel, wie zum Beispiel Toluol, bei Temperaturen zwischen 0°C und dem
Siedepunkt des Lösemittels, durchgeführt.
Die Pyrazole der allgemeinen Formel (E-XI) können über eine Reduktion der Pyrazole (E-X) hergestellt werden. Solche Reaktionen sind dem Fachmann bekannt und beispielsweise in WO2008/8375 A2 und WO201 1/3065 A2 beschrieben. Die Pyrazole der allgemeinen Formel (E-X) können über eine Nitrierung der Pyrazole (E-VIII) hergestellt werden. Solche Reaktionen sind dem Fachmann bekannt und beispielsweise in
WO2005/99688 A2 und US2014/194452 AI beschrieben.
Erfindungsgemäße Verbindungen mit n für 1 und 2 können beispielsweise nach der in Schema 6 an egebenen Methode hergestellt werden.
Schema 6
Die Sulfone und Sulfoxide der allgemeinen Formel (If) können über eine Oxidation der Pyrazole (Ib) hergestellt werden. Solche Reaktionen sind dem Fachmann bekannt und beispielsweise in Eur. J. Med. Chem. 2014, 71 , 168-184 und Org. Lett. 2013, 15, 3994-3997 beschrieben.
Ausgewählte detaillierte Synthesebeispiele für die erfindungsgemäßen Verbindungen der allgemeinen Formel (I) sind im Folgenden aufgeführt. Die 'H-NMR-, 13C-NMR- und 19F-NMR-spektroskopischen Daten, die für die in den nachfolgenden Abschnitten beschriebenen chemischen Beispiele angegeben sind, (400 MHz bei 'H-NMR und 150 MHz bei 13C-NMR und 375 MHz bei "F-NMR, Lösungsmittel CDCb, CD3OD oder d6-DMSO, interner Standard: Tetramethylsilan δ = 0.00 ppm), wurden mit einem Gerät der Firma Bruker erhalten, und die bezeichneten Signale haben die nachfolgend aufgeführten Bedeutungen: br = breit(es); s = Singulett, d = Dublett, t = Triplett, dd = Doppeldublett, ddd = Dublett eines Doppeldubletts, m = Multiplett, q = Quartett, quint = Quintett, sext = Sextett, sept = Septett, dq = Doppelquartett, dt = Doppeltriplett. Bei Diastereomerengemischen werden entweder die jeweils signifikanten Signale beider Diastereomere oder das charakteristische Signal des Hauptdiastereomers angegeben. Die verwendeten Abkürzungen für chemische Gruppen haben beispielsweise die nachfolgenden Bedeutungen: Me = CH3, Et = CH2CH3, t-Hex = C(CH3)2CH(CH3)2, t-Bu = C(CH3)3, n- Bu = unverzweigtes Butyl, n-Pr = unverzweigtes Propyl, i-Pr = verzweigtes Propyl, c-Pr = Cyclopropyl, c-Hex = Cyclohexyl.
Synthesebeispiele:
Synthesebeispiel No. 1-076: Synthesestufe 1 : 3-Methoxy-l,5-dimethyl-4-phenylsulfanyl-pyrazol (Intermediate No. A-28)
5-Methyl-4-phenylsulfanyl-l,2-dihydropyrazol-3-on (7.46 g, 36.2 mmol, 1.0 equiv) wurde in Acetonitril (485 ml) gelöst und mit Kaliumcarbonat (15.0 g, 109 mmol, 3.0 equiv) versetzt. Das resultierende Reaktionsgemisch wurde bei 0 °C mit Dimethylsulfat (3.4 ml, 36.2 mmol, 1.0 equiv) versetzt, für 15 Minuten bei 0 °C und anschließend bei 70 °C für 45 Minuten gerührt. Das resultierende
Reaktionsgemisch wurde nochmals mit Dimethylsulfat (6.8 ml, 72.4 mmol, 2.0 equiv) versetzt und bei 70 °C für weitere 3 Stunden gerührt und anschließend wurde auf Raumtemperatur abgekühlt, Wasser und Dichlormethan zugegeben und nachfolgend die Phasen getrennt. Die wäßrige Phase wurde mehrfach mit Dichlormethan extrahiert, und die vereinigten organischen Phasen wurden danach mit Wasser und ges. Natriumchloridlösung gewaschen, über Magnesiumsulfat getrocknet, filtriert und eingeengt. Durch abschließende säulenchromatographische Reinigung (Gradient Essigester/Heptan) des resultierenden Rohproduktes konnte 3-Methoxy-l,5-dimethyl-4-phenylsulfanyl-pyrazol in Form eines farblosen Feststoffs isoliert werden (6.80 g, 80% der Theorie).
'H-NMR (400 MHz, CDC13 δ, ppm) 7.22-7.18 (m, 2H), 7.10-7.05 (m, 3H), 3.93 (s, 3H), 3.72 (s, 3H), 2.23 (s, 3H).
Synthesestufe 2: l,5-Dimethyl-4-phenylsulfanyl-pyrazol-3-ol (Intermediat No. A-24)
3-Methoxy-l,5-dimethyl-4-phenylsulfanyl-pyrazol (6.80 g, 29.0 mmol, 1.0 equiv) wurde in Essigsäure (95 ml) gelöst und mit einer Lösung von 45% Bromwasserstoffsäure in Essigsäure (35.0 ml, 290 mmol, 10 equiv) versetzt. Das resultierende Reaktionsgemisch wurde bei 90 °C für 18 Stunden gerührt und anschließend auf Raumtemperatur abgekühlt und eingeengt. Der resultierende Feststoff wurde in Essigester gelöst, die Lösung mit Wasser und ges. Natriumchloridlösung gewaschen, über
Magnesiumsulfat getrocknet, filtriert und eingeengt. Durch abschließende Urnkristallisierung (1 :1 Essigester:Methanol) des resultierenden Rohproduktes konnte l,5-Dimethyl-4-phenylsulfanyl-pyrazol- 3-ol in Form eines farblosen Feststoffs isoliert werden (3.12 g, 49% der Theorie).
'H-NMR (400 MHz, de-DMSO δ, ppm) 10.04 (s, 1H), 7.26-7.22 (m, 2H), 7.10-7.06 (m, 1H), 7.00-6.98 (m, 2H), 3.60 (s, 3H), 2.15 (s, 3H).
Synthesestufe 3: 2-(l,5-Dimethyl-4-phenylsulfanyl-pyrazol-3-yl)oxypyrimidin (Synthesebeispiel No. I- 076):
Unter Argon wurden l,5-Dimethyl-4-phenylsulfanyl-pyrazol-3-ol (300 mg, 1.36 mmol, 1.0 equiv) und 2-Chlorpyrimidin (156 mg, 1.36 mmol, 1.0 equiv) in wasserfreiem Dimethylformamid (5 ml) gelöst und mit Cäsiumcarbonat (890 mg, 2.72 mmol, 2.0 equiv) und Kupfer(I)-Iodid (25.9 mg, 0.136 mmol, 0.1 equiv) versetzt. Das resultierende Reaktionsgemisch wurde bei 100 °C für 6 Stunden gerührt und anschließend auf Raumtemperatur abgekühlt, Essigester und Wasser zugegeben und nachfolgend die Phasen getrennt. Die wäßrige Phase wurde mehrfach mit Essigester extrahiert, und die vereinigten organischen Phasen wurden danach mit Wasser (x3) und ges. Natriumchloridlösung (xl) gewaschen, über Magnesiumsulfat getrocknet, filtriert und eingeengt. Durch abschließende
säulenchromatographische Reinigung (Gradient Essigester/Heptan) des resultierenden Rohproduktes konnte 2-(l,5-Dimethyl-4-phenylsulfanyl-pyrazol-3-yl)oxypyrimidin in Form eines gelben Öls isoliert werden (170 mg, 43% der Theorie).
'H-NMR (400 MHz, CDC13 δ, ppm) 8.44 (d, 2H), 7.17-7.13 (m, 2H), 7.09-7.04 (m, 3H), 6.96 (t, 1H), 3.83 (s, 3H), 2.30 (s, 3H).
Synthesebeispiel No. 1-028:
Synthesestufe 1 : 4-(2,4-Difluorphenoxy)-3-methoxy-l ,5-dimethylpyrazol (Intermediat No. A-33)
Analog zur Synthese von 3-Methoxy-l,5-dimethyl-4-phenylsulfanyl-pyrazol wurden aus 5.37 g 4-(2,4- Difluorphenoxy)-5-methyl-l,2-dihydropyrazol-3-on 2.35 g (39%) 4-(2,4-Difluorphenoxy)-3-methoxy- 1,5-dimethylpyrazol erhalten.
'H-NMR (400 MHz, CDC13 δ, ppm) 7.11-7.05 (m, 1H), 6.88-6.83 (m, 1H), 6.76-6.70 (m, 1H), 3.34 (s, 3H), 3.17 (s, 3H), 2.14 (s, 3H).
Synthesestufe 2: 4-(2,4-Difluorphenoxy)-l,5-dimethyl-pyrazol-3-ol (Intermediat No. A-23)
Analog zur Synthese von l,5-Dimethyl-4-phenylsulfanyl-pyrazol-3-ol wurden aus 2.35 g 4-(2,4- Difluorphenoxy)-3-methoxy-l,5-dimethylpyrazol 2.93 g 4-(2,4-Difluorphenoxy)-l,5-dimethyl-pyrazol- 3-ol mit etwas Essigsäure erhalten.
'H-NMR (400 MHz, CDCI3 δ, ppm) 6.98-6.84 (m, 2H), 6.77-6.70 (m, 1H), 3.56 (s, 3H), 2.12 (s, 3H).
Synthesestufe 3: 2-[4-(2,4-Difluorphenoxy)-l,5-dimethyl-pyrazol-3-yl]oxy-5-fluorpyrimidin
(Synthesebeispiel No. 1-028):
Analog zur Synthese von 2-(l,5-Dimethyl-4-phenylsulfanyl-pyrazol-3-yl)oxypyrimidin wurden aus 150 mg 4-(2,4-Difluorphenoxy)-l,5-dimethyl-pyrazol-3-ol 97 mg (46%>) 2-[4-(2,4-Difluorphenoxy)-l,5- dimethyl-pyrazol-3-yl]oxy-5-fluorpyrimidin erhalten.
'H-NMR (400 MHz, CDCI3 δ, ppm) 8.34 (s, 2H), 6.97-6.93 (m, 1H), 6.80-6.77 (m, 1H), 6.69-6.66 (m, 1H), 3.76 (s, 3H), 2.21 (s, 3H).
Synthesebeispiel No. 1-016:
Synthesestufe 1 : 4-[(4-Fluorphenyl)methyl]-3-methoxy-l,5-dimethylpyrazol (Intermediat No. A-22)
4-[(4-Fluorphenyl)methyl]-5-methyl-l,2-dihydropyrazol-3-on (7.60 g, 37.0 mmol, 1.0 equiv) wurde in Acetonitril (220 ml) gelöst und mit Kaliumcarbonat (12.8 g, 92.9 mmol, 2.4 equiv) versetzt. Das resultierende Reaktionsgemisch wurde auf eine Temperatur von 0 °C abgekühlt, mit Dimethylsulfat (5.49 ml, 58.1 mmol, 1.5 equiv) versetzt und anschließend für 30 Minuten bei 0 °C und danach bei Raumtemperatur für 18 Stunden gerührt. Wasser wurde zugegeben, die wäßrige Phase mehrfach mit Dichlormethan extrahiert, und die vereinigten organischen Phasen wurden danach über
Magnesiumsulfat getrocknet, filtriert und eingeengt. Durch abschließende säulenchromatographische Reinigung (Gradient Essigester/Heptan) des resultierenden Rohproduktes konnte 4-[(4- Fluorphenyl)methyl]-3-methoxy-l,5-dimethylpyrazol isoliert werden (720 mg, 8% der Theorie). 'H-NMR (400 MHz, CDC13 δ, ppm) 7.13-7.10 (m, 2H), 6.94-6.90 (m, 2H), 3.88 (s, 3H), 3.62 (s, 3H), 3.60 (s, 2H), 2.06 (s, 3H).
Synthesestufe 2: 4-[(4-Fluorphenyl)methyl]-l,5-dimethylpyrazol-3-ol (Intermediat No. A-21)
4-[(4-Fluorphenyl)methyl]-3-methoxy-l,5-dimethylpyrazol (710 mg, 3.03 mmol, 1.0 equiv) wurde in Essigsäure (9 ml) gelöst und mit einer Lösung von 45% Bromwasserstoffsäure in Essigsäure (3.7 ml, 30.3 mmol, 10 equiv) versetzt. Das resultierende Reaktionsgemisch wurde bei 140 °C für 8 Stunden gerührt und anschließend auf Raumtemperatur abgekühlt und eingeengt. Der resultierende Feststoff wurde in Essigester gelöst, die Lösung mit Wasser und ges. Natriumchloridlösung gewaschen, über Magnesiumsulfat getrocknet, filtriert und eingeengt. Auf diese Weise erhält man 4-[(4- Fluorphenyl)methyl]-l,5-dimethylpyrazol-3-ol (450 mg, 67% der Theorie).
'H-NMR (400 MHz, CDC13 δ, ppm) 7.18-7.15 (m, 2H), 6.96-6.91 (m, 2H), 3.65 (s, 2H), 3.62 (s, 3H), 2.07 (s, 3H).
Synthesestufe 3: 5-Fluor-2-[4-[(4-fluorphenyl)methyl]-l,5-dimethylpyrazol-3-yl]oxypyrimidin
(Synthesebeispiel No. 1-016):
Analog zur Synthese von 2-(l,5-Dimethyl-4-phenylsulfanyl-pyrazol-3-yl)oxypyrimidin wurden aus 145 mg 4-[(4-Fluorphenyl)methyl]-l,5-dimethylpyrazol-3-ol 93 mg (45%) 5-Fluor-2-[4-[(4- fluorphenyl)methyl]-l,5-dimethylpyrazol-3-yl]oxypyrimidin erhalten.
'H-NMR (400 MHz, CDCI3 δ, ppm) 8.32 (s, 2H), 7.06-7.03 (m, 2H), 6.87-6.82 (m, 2H), 3.74 (s, 3H), 3.59 (s, 2H), 2.16 (s, 3H).
Synthesebeispiel No. 1-198:
Synthesestufe 1 : 2-[(4-Methoxyphenyl)methyl]-5-methyl-4-phenylsulfanyl-pyrazol-3-ol (Intermediat No. A-20
Ethyl (£)-3-hydroxy-2-phenylsulfanyl-but-2-enoat (9.16 g, 38.4 mmol, 1.0 equiv) wurde in Ethanol (65 ml) gelöst und mit (4-Methoxyphenyl)hydrazin (7.96 g, 57.6 mmol, 1.5 equiv) versetzt. Das resultierende Reaktionsgemisch wurde für 2 Stunden bei 90 °C gerührt und anschließend auf
Raumtemperatur abgekühlt, eingeengt und Wasser und Essigester zugegeben. Der resultierende Feststoff wurde ab filtriert und mit Wasser und Essigester gewaschen. Auf diese Weise erhält man 2-[(4- Methoxyphenyl)methyl]-5-methyl-4-phenylsulfanyl-pyrazol-3-ol (9.30 g, 74% der Theorie) in Form eines farblosen Feststoffs.
'H-NMR (400 MHz, de-DMSO δ, ppm) 7.27-7.23 (m, 2H), 7.16-7.07 (m, 3H), 6.99-6.89 (m, 4H), 4.99 (s, 2H), 3.73 (s, 3H), 1.98 (s, 3H).
Synthesestufe 2 : 2- [2- [(4-Methoxyphenyl)methyl] -5-methyl-4-phenylsulfanyl-pyrazol-3 - yl]oxypyrimidin (Intermediat No. A-18)
2-[(4-Methoxyphenyl)methyl]-5-methyl-4-phenylsulfanyl-pyrazol-3-ol (4.45 g, 13.6 mmol, 1.0 equiv) wurde in Butyronitril (45 ml) gelöst und mit 2-Chlorpyrimidin (3.12 g, 27.3 mmol, 2.0 equiv) und Caesiumcarbonat (7.55 g, 23.2 mmol, 1.7 equiv) versetzt. Das resultierende Reaktionsgemisch wurde für 8 Stunden bei 160 °C gerührt und anschließend auf Raumtemperatur abgekühlt, eingeengt und Wasser zugegeben. Die wäßrige Phase wurde mehrfach mit Essigester extrahiert, und die vereinigten organischen Phasen wurden danach über Magnesiumsulfat getrocknet, filtriert und eingeengt. Durch abschließende säulenchromatographische Reinigung (Gradient Essigester/Heptan) des resultierenden Rohproduktes konnte 2-[2-[(4-Methoxyphenyl)methyl]-5-methyl-4-phenylsulfanyl-pyrazol-3- yl]oxypyrimidin isoliert werden (5.23 g, 95% der Theorie).
'H-NMR (400 MHz, CDC13 δ, ppm) 8.37 (d, 2H), 7.20-7.12 (m, 4H), 7.06-6.98 (m, 4H), 6.77-6.75 (m, 2H), 5.15 (s, 2H), 3.75 (s, 3H), 2.22 (s, 3H).
Synthesestufe 3: 2-[(5-Methyl-4-phenylsulfanyl-lH-pyrazol-3-yl)oxy]pyrimidin
2- [2- [(4-Methoxyphenyl)methyl] -5-methyl-4-phenylsulfanyl-pyrazol-3 -yl] oxypyrimidin (5.59 g, 13.8 mmol, 1.0 equiv) wurde in Trifluoressigsaeure (37 ml) gelöst, für 2 Stunden bei 50 °C gerührt und anschließend auf Raumtemperatur abgekühlt und eingeengt. Durch abschließende
säulenchromatographische Reinigung (Gradient Essigester/Heptan) des resultierenden Rohproduktes konnte 2-[(5-Methyl-4-phenylsulfanyl-lH-pyrazol-3-yl)oxy]pyrimidin isoliert werden (3.61 g, 90% der Theorie).
'H-NMR (400 MHz, CDCI3 δ, ppm) 8.45 (d, 2H), 7.17-7.13 (m, 2H), 7.07-7.03 (m, 3H), 6.98 (t, 1H), 2.29 (s, 3H).
Synthesestufe 4: 2-(l -Ethyl-5-methyl-4-phenylsulfanyl-pyrazol-3-yl)oxypyrimidin (Synthesebeispiel No. 1-198):
2-[(5-Methyl-4-phenylsulfanyl-lH-pyrazol-3-yl)oxy]pyrimidin (150 mg, 0.53 mmol, 1.0 equiv) wurde in Acetonitril (3 ml) gelöst und mit Caesiumcarbonat (206 mg, 0.63 mmol, 1.2 equiv) und Iodethan (166 mg, 1.06 mmol, 2.0 equiv) versetzt. Das resultierende Reaktionsgemisch wurde für 1 Stunde bei Raumtemperatur gerührt und anschließend 2M Ammoniakwasser gegeben. Die wäßrige Phase wurde mehrfach mit Essigester extrahiert, und die vereinigten organischen Phasen wurden danach mit ges. Natriumchloridlösung gewaschen, über Magnesiumsulfat getrocknet, filtriert und eingeengt. Durch abschließende säulenchromatographische Reinigung (Gradient Essigester/Heptan) des resultierenden Rohproduktes konnte 2-(l-Ethyl-5-methyl-4-phenylsulfanyl-pyrazol-3-yl)oxypyrimidin isoliert werden (106 mg, 64% der Theorie).
'H-NMR (400 MHz, CDC13 δ, ppm) 8.43 (d, 2H), 7.17-7.13 (m, 2H), 7.08-7.03 (m, 3H), 6.95 (t, 1H), 4.13 (q, 2H), 2.31 (s, 3H), 1.48 (t, 3H).
Synthesebeispiel No. 1-053: Tert-butyl-5-methyl-4-phenylsulfanyl-3-pyrimidin-2-yloxy-pyrazole-l-carboxylat
2-[(5-Methyl-4-phenylsulfanyl-lH-pyrazol-3-yl)oxy]pyrimidin (150 mg, 0.53 mmol, 1.0 equiv) wurde in Tetrahydrofuran (3 ml) gelöst und mit Di-tert-butyldicarbonat (138 mg, 0.63 mmol, 1.2 equiv) und Triethylamin (0.11 ml, 0.79 mmol, 1.5 equiv) versetzt. Das resultierende Reaktionsgemisch wurde für 18 Stunden bei Raumtemperatur gerührt und anschließend mit Essigester verdünnt, mit ges.
Natriumchloridlösung gewaschen, über Magnesiumsulfat getrocknet, filtriert und eingeengt. Durch abschließende säulenchromatographische Reinigung (Gradient Essigester/Heptan) des resultierenden
Rohproduktes konnte Tert-butyl-5-methyl-4-phenylsulfanyl-3-pyrimidin-2-yloxy-pyrazole-l-carboxylat isoliert werden (171 mg, 84% der Theorie).
'H-NMR (400 MHz, CDC13 δ, ppm) 8.42 (d, 2H), 7.19-7.15 (m, 2H), 7.11-7.06 (m, 3H), 6.98 (t, 1H), 2.63 (s, 3H), 1.65 (s, 9H).
Synthesebeispiel No. 1-129:
2- [ 1 -(Difluormethyl)-5-methyl-4-phenylsulfanyl-pyrazol-3 -yl] oxypyrimidin
Unter Argon wurde 2-[(5-Methyl-4-phenylsulfanyl-lH-pyrazol-3-yl)oxy]pyrimidin (150 mg, 0.53 mmol, 1.0 equiv) in wasserfreiem Dimethylformamid (2 ml) gelöst und mit Ethyl 2-chloro-2,2- difluoracetat (100 mg, 0.63 mmol, 1.2 equiv) und Kaliumcarbonat (146 mg, 1.06 mmol, 2.0 equiv) versetzt. Das resultierende Reaktionsgemisch wurde für 12 Stunden bei 60 °C und danach für 6 Stunden bei 140 °C gerührt und anschließend auf Raumtemperatur abgekühlt und Wasser zugegeben. Die wäßrige Phase wurde mehrfach mit Dichlormethan extrahiert, und die vereinigten organischen Phasen wurden danach über Magnesiumsulfat getrocknet, filtriert und eingeengt. Durch abschließende säulenchromatographische Reinigung (Gradient Essigester/Heptan) des resultierenden Rohproduktes konnte 2-[l-(Difluormethyl)-5-methyl-4-phenylsulfanyl-pyrazol-3-yl]oxypyrimidin isoliert werden (17 mg, 10% der Theorie).
'H-NMR (400 MHz, CDCI3 δ, ppm) 8.43 (d, 2H), 7.21-7.07 (m, 6H), 7.00 (t, 1H), 2.52 (s, 3H).
Synthesebeispiel No. 1-044:
S nthesestufe 1 : 2-(l,5-Dimethylpyrazol-3-yl)oxypyrimidin (Intermediat No. A-01)
l,5-Dimethyl-lH-pyrazol-3-olhydrochlorid (3.68 g, 24.8 mmol, 1.0 equiv) wurde in Acetonitril (100 ml) gelöst und mit 2-Chlorpyrimidin (2.84 g, 24.8 mmol, 1.0 equiv), Caesiumcarbonat (28.2 g, 86.7 mmol,
3.5 equiv) und Kupfer(I)-iodid (0.36 g, 4.95 mmol, 0.2 equiv) versetzt. Das resultierende Reaktionsgemisch wurde bei 80 °C für 3 Stunden gerührt und anschließend auf Raumtemperatur abgekühlt, filtriert und eingeengt. Durch abschließende säulenchromatographische Reinigung (Gradient Essigester/Heptan) des resultierenden Rohproduktes konnte 2-(l,5-Dimethylpyrazol-3-yl)oxypyrimidin in Form eines braunen Öls isoliert werden (2.68 g, 55% der Theorie).
'H-NMR (400 MHz, CDC13 δ, ppm) 8.59 (d, 2H), 7.04 (t, 1H), 5.83 (s, 1H), 3.74 (s, 3H), 2.29 (s, 3H).
S nthesestufe 2: 2-(4-Iod-l,5-dimethyl-pyrazol-3-yl)oxypyrimidin (Intermediat No. A-08)
2-(l,5-Dimethylpyrazol-3-yl)oxypyrimidin (4.00 g, 21.0 mmol, 1.0 equiv) wurde in Acetonitril (120 ml) gelöst und mit lod (3.20 g, 12.6 mmol, 0.6 equiv) und Ammoniumcer(IV)-nitrat (6.92 g, 12.6 mmol, 0.6 equiv) versetzt. Das resultierende Reaktionsgemisch wurde bei Raumtemperatur für 3 Stunden gerührt und anschließend eingeengt. Der resultierende Öl wurde in Dichlormethan gelöst, die Lösung mit 10% wassrigem Natriumthiosulfat gewaschen, über Magnesiumsulfat getrocknet, filtriert und eingeengt. Auf diese Weise erhält man 2-(4-Iod-l,5-dimethyl-pyrazol-3-yl)oxypyrimidin
(5.92 g, 85%o der Theorie) in Form eines braunen Öls.
'H-NMR (400 MHz, CDCI3 δ, ppm) 8.60 (d, 2H), 7.07 (t, 1H), 3.83 (s, 3H), 2.33 (s, 3H).
Synthesestufe 3: 2-[4-(2,4-Difluorphenyl)sulfanyl-l,5-dimethyl-pyrazol-3-yl]oxypyrimidin
(S nthesebeispiel No. 1-044):
Unter Argon wurde 2,4-Difluorthiophenol (104 mg, 0.71 mmol, 1.5 equiv) in wasserfreiem
Dimethylformamid (4 ml) gelöst, auf eine Temperatur von 0 °C abgekühlt und mit Natriumhydrid (60%> in Öl, 28 mg, 0.71 mmol, 1.5 equiv) versetzt. Das resultierende Reaktionsgemisch wurde bei 0 °C für 10 Minuten gerührt und anschließend mit 2-(4-Iod-l,5-dimethyl-pyrazol-3-yl)oxypyrimidin (150 mg, 0.48 mmol, 1.0 equiv) und Kupfer(I)-iodid (90 mg, 0.48 mmol, 1.0 equiv) versetzt. Das resultierende Reaktionsgemisch wurde bei 80 °C für 6 Stunden gerührt und anschließend auf Raumtemperatur
abgekühlt und mit Wasser versetzt. Die wäßrige Phase wurde mehrfach mit Dichlormethan extrahiert, und die vereinigten organischen Phasen wurden danach über Magnesiumsulfat getrocknet, filtriert und eingeengt. Durch abschließende säulenchromatographische Reinigung (Gradient Essigester/Heptan) des resultierenden Rohproduktes konnte 2-[4-(2,4-Difluorphenyl)sulfanyl-l,5-dimethyl-pyrazol-3- yl]oxypyrimidin in Form eines gelben Öls isoliert werden (124 mg, 74% der Theorie).
'H-NMR (400 MHz, CDC13 δ, ppm) 8.50 (d, 2H), 7.09-7.01 (m, 2H), 6.74-6.67 (m, 2H), 3.82 (s, 3H), 2.35 (s, 3H).
Synthesebeispiel No. 1-077:
Synthesestufe 1 : Methyl- l-methyl-3-(pyrimidin-2-yloxy)-lH-pyrazo 1-5 -carboxylat (Intermediat No. A- 02
Methyl-3-hydroxy-l-methyl-lH-pyrazo 1-5 -carboxylat (1.50 g, 9.61 mmol, 1.0 equiv) wurde in Dimethylformamid (48 ml) gelöst und mit 2-Chlorpyrimidin (1.10 g, 9.61 mmol, 1.0 equiv),
Caesiumcarbonat (6.26 g, 19.2 mmol, 2.0 equiv) und Kupfer(I)-iodid (140 mg, 1.92 mmol, 0.2 equiv) versetzt. Das resultierende Reaktionsgemisch wurde bei 80 °C für 3 Stunden gerührt und anschließend auf Raumtemperatur abgekühlt und Essigester zugegeben. Die organische Phase wurde mit Wasser gewachen, über Magnesiumsulfat getrocknet, filtriert und eingeengt. Der resultierende Feststoff wurde in Heptan suspendiert, gerührt und anschließend ab filtriert. Auf diese Weise erhält man Methyl- 1- methyl-3-(pyrimidin-2-yloxy)-lH-pyrazol-5-carboxylat (1.00 g, 44% der Theorie).
'H-NMR (400 MHz, CDCI3 δ, ppm) 8.60 (d, 2H), 7.09 (t, 1H), 6.65 (s, 1H), 4.16 (s, 3H), 3.89 (s, 3H).
Synthesestufe 2 : Methyl-4-iod- 1 -methyl-3 -(pyrimidin-2-yloxy)- 1 H-pyrazol-5-carboxylat (Intermediat No. A-09
Analog zur Synthese von 2-(4-Iod-l,5-dimethyl-pyrazol-3-yl)oxypyrimidin wurden aus 1.00 g Methyl- l-methyl-3-(pyrimidin-2-yloxy)-lH-pyrazol-5-carboxylat 1.55 g (100%) Methyl-4-iod-l -methyl-3 - (pyrimidin-2-yloxy)- 1 H-pyrazol-5-carboxylat erhalten.
H-NMR (400 MHz, CDC13 δ, ppm) 8.60 (d, 2H), 7.11 (t, 1H), 4.20 (s, 3H), 3.95 (s, 3H).
Synthesestufe 3: Methyl-4-[(4-fluorphenyl)sulfanyl]-l-methyl-3-(pyrimidin-2-yloxy)-lH-pyrazol-5- carbox lat (Synthesebeispiel No. 1-077):
Analog zur Synthese von 2-[4-(2,4-Difluorphenyl)sulfanyl-l,5-dimethyl-pyrazol-3-yl]oxypyrimidin wurden aus 150 mg Methyl-4-iod-l-methyl-3-(pyrimidin-2-yloxy)-lH-pyrazol-5-carboxylat 45 mg (28%) Methyl-4-[(4-fluorphenyl)sulfanyl] - 1 -methyl-3 -(pyrimidin-2-yloxy)- 1 H-pyrazol-5-carboxylat erhalten.
'H-NMR (400 MHz, CDCI3 δ, ppm) 8.47 (d, 2H), 7.22-7.19 (m, 2H), 7.02 (t, 1H), 6.86-6.82 (m, 2H), 4.17 (s, 3H), 3.86 (s, 3H).
Synthesebeispiel No. 1-005:
2- 4-(3,5-Difluorphenyl)-l,5-dimethyl-pyrazol-3-yl]oxypyrimidin
Unter Argon wurde 2-(4-Iod-l,5-dimethyl-pyrazol-3-yl)oxypyrimidin (150 mg, 0.48 mmol, 1.0 equiv) in Dioxan (4 ml) gelöst und nacheinander mit 3,5-Difluorphenylboronsäure (165 mg, 1.04 mmol, 2.2 equiv), PdCl2(dppf)(CH2Cl2) (58 mg, 0.071 mmol, 0.15 equiv), Caesiumcarbonat (464 mg, 1.42 mmol, 3.0 equiv) und Wasser (1 ml) versetzt. Das resultierende Reaktionsgemisch wurde bei 130 °C für 1 Stunde in der Mikrowelle gerührt und anschließend auf Raumtemperatur abgekühlt und mit ges.
Natriumhydrogencarbonatlösung versetzt. Die wäßrige Phase wurde mehrfach mit Dichlormethan extrahiert, und die vereinigten organischen Phasen wurden danach über Magnesiumsulfat getrocknet, filtriert und eingeengt. Durch abschließende säulenchromatographische Reinigung (Gradient
Essigester/Heptan) des resultierenden Rohproduktes konnte 2-[4-(3,5-Difluorphenyl)-l,5-dimethyl- pyrazol-3-yl]oxypyrimidin in Form eines gelben Feststoffs isoliert werden (111 mg, 74% der Theorie).
'H-NMR (400 MHz, CDC13 δ, ppm) 8.53 (d, 2H), 7.00 (t, 1H), 6.88-6.86 (m, 2H), 6.64-6.60 (i
3.82 (s, 3H), 2.38 (s, 3H).
Synthesebeispiel No. 1-229:
Synthesestufe 1 : 2-(l,5-Dimethyl-4-nitro-pyrazol-3-yl)oxypyrimidin (Intermediat No. A-15)
2-(l,5-Dimethylpyrazol-3-yl)oxypyrimidin (1.20 g, 6.30 mmol, 1.0 equiv) wurde in Trifluoressigsäure (10 ml) gelöst, mit Trifluoressigsäureanhydrid (6.24 ml, 9.28 mmol, 7.0 equiv) versetzt. Das resultierende Reaktionsgemisch wurde auf eine Temperatur von 0 °C abgekühlt, mit Ammoniumnitrat (530 mg, 6.62 mmol, 1.05 equiv) portionweise versetzt und anschließend für 2.5 Stunden bei Raumtemperatur gerührt. Wasser wurde zugegeben, die wäßrige Phase mehrfach mit Dichlormethan extrahiert, und die vereinigten organischen Phasen wurden danach über Magnesiumsulfat getrocknet, filtriert und eingeengt. Durch abschließende säulenchromatographische Reinigung (Gradient Essigester/Heptan) des resultierenden Rohproduktes konnte 2-(l,5-Dimethyl-4-nitro-pyrazol-3- yl)oxypyrimidin isoliert werden (980 mg, 66% der Theorie).
'H-NMR (400 MHz, CDCI3 δ, ppm) 8.57 (d, 2H), 7.11 (t, 1H), 3.84 (s, 3H), 2.69 (s, 3H).
S nthesestufe 2: 1 ,5-Dimethyl-3-pyrimidin-2-yloxy-pyrazol-4-amin
2-(l,5-Dimethyl-4-nitro-pyrazol-3-yl)oxypyrimidin (5.00 g, 21.3 mmol, 1.0 equiv) wurde in Ethanol (200 ml) und Wasser (50 ml) gelöst und mit Eisen (3.56 g, 63.8 mmol, 3.0 equiv) und
Ammoniumchlorid (1.14 g, 21.3 mmol, 1.0 equiv) versetz. Das resultierende Reaktionsgemisch wurde für 6 Stunden bei 80 °C gerührt und anschließend auf Raumtemperatur abgekühlt, über Kieseiguhr filtriert und eingeengt. Auf diese Weise erhält man l,5-Dimethyl-3-pyrimidin-2-yloxy-pyrazol-4-amin (4.07 g, 93% der Theorie) in Form eines braunen Feststoffs.
'H-NMR (400 MHz, CDCI3 δ, ppm) 8.60 (d, 2H), 7.05 (t, 1H), 3.70 (s, 3H), 2.21 (s, 3H).
S nthesestufe 3 : N-(2,4-Difluorphenyl)- 1 ,5-dimethyl-3 -(pyrimidin-2-yloxy)- 1 H-pyrazol-4-amin
l,5-Dimethyl-3-pyrimidin-2-yloxy-pyrazol-4-amin (220 mg, 1.07 mmol, 1.0 equiv) und l-Brom-2,4- difluorbenzol (290 mg, 1.50 mmol, 1.4 equiv) wurden in Toluol (6 ml) gelöst und mit
Tris(dibenzylidenaceton)dipalladium(0) (49 mg, 0.054 mmol, 0.05 equiv), Xantphos (62 mg, 0.11 mmol, 0.1 equiv) und Kalliumphosphat (455 mg, 2.14 mmol, 2.0 equiv) versetzt. Das resultierende Reaktionsgemisch wurde mit Argon entgast und für 2 Stunden bei 120 °C gerührt und anschließend auf Raumtemperatur abgekühlt, mit Dichlormethan verdünnt, filtriert und eingeengt. Durch abschließende säulenchromatographische Reinigung (Gradient Essigester/Heptan) des resultierenden Rohproduktes konnte N-(2,4-Difluorphenyl)-l,5-dimethyl-3-(pyrimidin-2-yloxy)-lH-pyrazol-4-amin isoliert werden (120 mg, 34% der Theorie).
'H-NMR (400 MHz, CDC13 δ, ppm) 8.50 (d, 2H), 7.00 (t, 1H), 6.70-6.61 (m, 2H), 6.57-6.53 (m, 1H), 3.78 (s, 3H), 2.18 (s, 3H).
Synthesestufe 4: N-(2,4-Difluo^henyl)-N,l,5-trimethyl-3-(pyrimidin-2-yloxy)-lH-pyrazol-4-amin (Synthesebeispiel No. 1-229):
Unter Argon wurde N-(2,4-Difluo^henyl)-l,5-dimethyl-3-(pyrimidin-2-yloxy)-lH-pyrazol-4-amin (60 mg, 0.19 mmol, 1.0 equiv) in wasserfreiem Dimethylformamid (3 ml) gelöst, auf eine Temperatur von 0 °C abgekühlt und mit Natriumhydrid (60% in Öl, 9 mg, 0.23 mmol, 1.2 equiv) versetzt. Das resultierende Reaktionsgemisch wurde bei 0 °C für 10 Minuten gerührt und anschließend mit lodmethan (13 μΐ, 0.21 mmol, 1.1 equiv) versetzt. Das resultierende Reaktionsgemisch wurde bei Raumtemperatur für 6 Stunden gerührt und anschließend mit Wasser versetzt. Die wäßrige Phase wurde mehrfach mit Dichlormethan extrahiert, und die vereinigten organischen Phasen wurden danach über
Magnesiumsulfat getrocknet, filtriert und eingeengt. Durch abschließende säulenchromatographische Reinigung (Gradient Essigester/Heptan) des resultierenden Rohproduktes konnte N-(2,4-Difluorphenyl)- N,l,5-trimethyl-3-(pyrimidin-2-yloxy)-lH-pyrazol-4-amin isoliert werden (42 mg, 67%> der Theorie).
'H-NMR (400 MHz, CDC13 δ, ppm) 8.43 (d, 2H), 6.93 (t, 1H), 6.79-6.75 (m, 1H), 6.65-6.59 (m, 1H), 6.54-6.53 (m, 1H), 3.74 (s, 3H), 3.10 (s, 3H), 2.17 (s, 3H).
In Analogie zu den oben angeführten und an entsprechender Stelle rezitierten Herstellungsbeispielen und unter Berücksichtigung der allgemeinen Angaben zur Herstellung von substituierten
(Het-)Arylpyrazolamiden erhält man die nachfolgend genannten und in Tabelle I dargestellten
Verbindungen der allgemeinen Formel (I)
Tabelle I
Beispiel1 R2 A-Q1 Q2 nummer
1-001 Methyl Methyl Pyridin-4-yl 5-Fluorpyrimidin-2-yl
1-002 Methyl Methyl Pyridin-4-yl Pyrimidin-2-yl
1-003 Methyl Methyl 3,4-Difluorphenyl 5-Fluorpyrimidin-2-yl
1-004 Methyl Methyl 3- Pyrimidin-2-yl
(Trifluormethyl)phenyl
1-005 Methyl Methyl 3,5-Difluorphenyl Pyrimidin-2-yl
1-006 Methyl Methyl Phenyl Pyrimidin-2-yl
1-007 Methyl Methyl 3- 5-Fluorpyrimidin-2-yl
(Trifluormethyl)phenyl
1-008 Methyl Methyl Pyridin-3-yl Pyrimidin-2-yl
1-009 Methyl Methyl Pyrimidin-5-yl 5-Fluorpyrimidin-2-yl
1-010 Methyl Methyl Phenyl 5-Fluorpyrimidin-2-yl
1-011 Methyl Methyl 3,5-Difluorphenyl 5-Fluorpyrimidin-2-yl
1-012 Methyl Methyl Pyridin-3-yl 5-Fluorpyrimidin-2-yl
1-013 Methyl Methyl 3,4-Difluorphenyl Pyrimidin-2-yl
1-014 Methyl Methyl Pyrimidin-5-yl Pyrimidin-2-yl
1-015 Methyl Methoxycarbonyl 4-Fluorphenyl 5-Chlorpyrimidin-2-yl
1-016 Methyl Methyl (4-Fluorphenyl)methyl 5-Fluorpyrimidin-2-yl
1-017 Methyl Methyl (4-Fluorphenyl)methyl 5-Methoxypyrimidin-2-yl
1-018 Methyl Methyl Benzyl Pyrimidin-2-yl
1-019 Methyl Methyl (4-Fluorphenyl)methyl Pyrimidin-2-yl
1-020 Methyl Methyl Phenoxy Pyrimidin-2-yl
1-021 Methyl Ethoxycarbonyl 3,4-Difluorphenoxy Pyrimidin-2-yl
1-022 Methyl cyano 4-Fluorphenoxy 5-Chlorpyrimidin-2-yl
1-023 Methyl Methyl Phenoxy 5-Fluorpyrimidin-2-yl
1-024 Methyl Ethoxycarbonyl 3,4-Difluorphenoxy 5-Fluorpyrimidin-2-yl
1-025 Methyl Aminocarbonyl 4-Fluorphenoxy 5-Chlorpyrimidin-2-yl
Beispiel1 R2 A-Q1 Q2 nummer
1-026 Methyl Methyl 2,4-Difluorophenoxy Pyrimidin-2-yl
1-027 Methyl Methyl 2,4-Difluorophenoxy 2-Chlorpyrimidin-5-yl
1-028 Methyl Methyl 2,4-Difluorophenoxy 5-Fluorpyrimidin-2-yl
1-029 Methyl Ethoxycarbonyl 3,4-Difluorphenoxy 5-Chlorpyrimidin-2-yl
1-030 Methyl Methyl 2,4-Difluorophenoxy 5-Brompyrimidin-2-yl
1-031 Methyl Methyl 2,4-Difluorophenoxy Pyrazin-2-yl
1-032 Methyl H (4-Fluorphenyl)thio Pyrimidin-2-yl
1-033 Methyl H (4-Chlorphenyl)sulfonyl 5-Fluorpyrimidin-2-yl
1-034 Methyl Ethyl (3-Chlorphenyl)thio 5-Fluorpyrimidin-2-yl
1-035 Methyl Ethyl (3-Chlorphenyl)thio Pyrimidin-2-yl
1-036 Methyl Methyl (3,4-Difluorphenyl)thio Pyrimidin-2-yl
1-037 Methyl Ethyl (3,4-Difluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-038 Ethyl H (4-Fluorphenyl)thio Pyrimidin-2-yl
1-039 Isopropyl H (4-Fluorphenyl)thio Pyrimidin-2-yl
1-040 Isopropyl H (4-Chlorophenyl)thio 5-Chlorpyrimidin-2-yl
1-041 Ethyl H (4-Chlorophenyl)thio Pyrimidin-2-yl
1-042 Ethyl H Phenylsulfanyl Pyrimidin-2-yl
1-043 Isopropyl H (4-Fluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-044 Methyl Methyl (2,4-Difluorphenyl)thio Pyrimidin-2-yl
1-045 Methyl Methyl (3,5- Pyrimidin-2-yl difluorophenyl)thio
1-046 Methyl Methyl Pyrimidin-2-ylthio Pyrimidin-2-yl
1-047 Methyl Methyl (2,4-Difluorphenyl)thio 4,6-Dichlor-l,3,5-triazin- 2-yl
1-048 Methyl Methyl (4-Fluorphenyl)thio 4-
(Methoxycarbonyl)pyridin
-2-yl
1-049 Methyl Methoxycarbonyl Phenylsulfanyl Pyrimidin-2-yl
1-050 Methyl Methoxycarbonyl (3,4-Difluorphenyl)thio Pyrimidin-2-yl
1-051 Methyl Methyl Phenylsulfanyl l,3-Thiazol-2-yl
1-052 Methyl Methyl (5-fluoropyridin-2- Pyrimidin-2-yl yl)thio
1-053 tert- Methyl Phenylsulfanyl Pyrimidin-2-yl
Butoxycarbonyl
1-054 Methyl Methyl [2,4- Pyrimidin-2-yl bis(trifluoromethyl)phe
nyl]thio
1-055 Benzyl Methyl Phenylsulfanyl Pyrimidin-2-yl
1-056 2- Methyl Phenylsulfanyl 5-Fluorpyrimidin-2-yl
Methylsulfanyle
thyl
1-057 Methyl Methyl (2,4-Difluorphenyl)thio 5-(Trifluormethyl)pyridin- 2-yl
1-058 Methyl Ethyl (4-Chlorophenyl)thio Pyrimidin-2-yl
1-059 Methyl H (4-chlorophenyl)sulfinyl 5-Fluorpyrimidin-2-yl
1-060 Methyl Methyl (4-Fluorphenyl)thio 5-Chlorpyrimidin-2-yl
Beispiel1 R2 A-Q1 Q2 nummer
1-061 Methyl Ethyl (3-Chlorphenyl)thio 5-Methoxypyrimidin-2-yl
1-062 Methyl Ethyl (3,4-Difluorphenyl)thio Pyrimidin-2-yl
1-063 Methyl Ethyl Phenylsulfanyl Pyrimidin-2-yl
1-064 Methyl Ethyl (4-Fluorphenyl)thio Pyrimidin-2-yl
1-065 Methyl Methyl (2-Chlor-4- 5-Fluorpyrimidin-2-yl fluorphenyl)thio
1-066 Methyl Methyl (4-Chlorophenyl)thio 5-Methoxypyrimidin-2-yl
1-067 Methyl H Phenylsulfanyl Pyrimidin-2-yl
1-068 Methyl Methyl [3- Pyrazin-2-yl
(Trifluormethyl)phenyl]
thio
1-069 Methyl Methyl (3-Chlorphenyl)thio Pyrimidin-2-yl
1-070 -CH2CH2CH2- (4-Fluorphenyl)thio Pyridin-2-yl
1-071 Methyl Methyl (2-Fluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-072 Methyl Methyl [3- 5-Fluorpyrimidin-2-yl
(Trifluormethyl)phenyl]
thio
1-073 Methyl Methyl Pyridin-2-ylthio 5-Fluorpyrimidin-2-yl
1-074 Methyl Methyl (4-Fluorphenyl)thio 4,6-Dichlor-l,3,5-triazin- 2-yl
1-075 Methyl Phenylmethoxyca Phenylsulfanyl Pyrimidin-2-yl rbonyl
1-076 Methyl Methyl Phenylsulfonyl 5-Fluorpyrimidin-2-yl
1-077 Methyl Methoxycarbonyl (4-Fluorphenyl)thio Pyrimidin-2-yl
1-078 Methyl Methyl (2,6- 5-Fluorpyrimidin-2-yl difluorophenyl)thio
1-079 Methyl Methyl Phenylsulfanyl 5-
Phenylmethoxycarbonylp yrimidin-2-yl
1-080 Methyl Methyl Phenylsulfanyl 5-
(Methoxycarbonyl)pyrimi din-2-yl
1-081 3-Methoxy-3- Methyl Phenylsulfanyl Pyrimidin-2-yl oxopropyl
1-082 2-Methoxyethyl Methyl Phenylsulfanyl Pyrimidin-2-yl
1-083 2-Benzyloxy-2- Methyl Phenylsulfanyl Pyrimidin-2-yl oxoethyl
1-084 vinyl Methyl Phenylsulfanyl Pyrimidin-2-yl
1-085 Methyl cyano (4-Fluorphenyl)thio 5-Chlorpyrimidin-2-yl
1-086 Methyl Methyl (4-Fluorphenyl)thio 5-(Trifluormethyl)pyridin- 2-yl
1-087 Methyl Methyl (4-Fluorphenyl)thio Pyrimidin-2-yl
1-088 Methyl Ethyl Phenylsulfanyl 5-Methoxypyrimidin-2-yl
1-089 Methyl Methyl (4-Fluorphenyl)thio 5-Methoxypyrimidin-2-yl
1-090 Methyl Methyl (4-Fluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-091 Methyl Methyl (3-Chlorphenyl)thio 5-Fluorpyrimidin-2-yl
1-092 Methyl Methyl (3-fluorophenyl)thio Pyrimidin-2-yl
Beispiel1 R2 A-Q1 Q2 nummer
1-093 Methyl Methyl (3,4-Difluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-094 Methyl Ethyl (2,4-Difluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-095 Methyl H (4-Fluorphenyl)thio 5-Chlorpyrimidin-2-yl
1-096 Methyl Methyl (3-Chlorphenyl)thio 4-Methylpyrimidin-2-yl
1-097 -CH2CH2CH2- (4-Fluorphenyl)thio Pyrimidin-2-yl
1-098 Methyl Trifluormethyl Phenylsulfanyl Pyrimidin-2-yl
1-099 Methyl Methyl (3,5- 5-Fluorpyrimidin-2-yl dichlorophenyl)thio
1-100 Methyl Methyl (3,5- 5-Fluorpyrimidin-2-yl difluorophenyl)thio
1-101 Methyl Methyl (4-Fluorphenyl)thio Pyrazin-2-yl
1-102 Methyl Methyl (2,4-Difluorphenyl)thio Pyrazin-2-yl
1-103 Methyl Methyl (4-Fluorphenyl)thio 5-
(Methoxycarbonyl)pyridin
-2-yl
1-104 Methyl Cyclopropyl (3,4-Difluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-105 Methyl Methoxycarbonyl (2,4-Difluorphenyl)thio Pyrimidin-2-yl
1-106 Methyl Methyl pyridin-4-ylthio Pyrimidin-2-yl
1-107 Methyl Methyl (2,4,6- 5-Fluorpyrimidin-2-yl trifluorophenyl)thio
1-108 Methyl Methyl pyridin-4-ylthio 5-Fluorpyrimidin-2-yl
1-109 Methyl Cyanomethyl 4-Fluorphenoxy 5-Fluorpyrimidin-2-yl
1-110 2-Methylpropyl Methyl Phenylsulfanyl Pyrimidin-2-yl
1-111 2-Methoxy-2- Methyl Phenylsulfanyl Pyrimidin-2-yl oxoethyl
1-112 Ethyl Methyl Phenylsulfanyl 5-Fluorpyrimidin-2-yl
1-113 tert- Methyl Phenylsulfanyl 5-Fluorpyrimidin-2-yl
Butoxycarbonyl
1-114 Methyl Methyl (2,4-Difluorphenyl)thio 5-
(Trifluormethyl)pyrimidin- 2-yl
1-115 Methyl Methyl (2,4-Difluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-116 Methyl Methyl (4-Chlorophenyl)thio Pyrimidin-2-yl
1-117 Methyl Ethyl (2-chloro-4- Pyrimidin-2-yl fluorophenyl)thio
1-118 Methyl Ethyl (2-chloro-4- 5-Methoxypyrimidin-2-yl fluorophenyl)thio
1-119 Isopropyl H (4-Chlorophenyl)thio Pyrimidin-2-yl
1-120 Methyl H Phenylsulfanyl 5-Chlorpyrimidin-2-yl
1-121 Ethyl H (4-Fluorphenyl)thio 5-Chlorpyrimidin-2-yl
1-122 -CH2CH2CH2- (4-Fluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-123 Methyl Methyl [4- Pyrimidin-2-yl
(trifluormethyl)phenyl]
thio
1-124 Methyl Methyl [4- 5-Fluorpyrimidin-2-yl
(trifluormethyl)phenyl]
thio
Beispiel1 R2 A-Q1 Q2 nummer
1-125 Methyl phenyl Phenylsulfanyl 5-Brompyrimidin-2-yl
1-126 Methyl Methyl Phenylsulfanyl Pyrimidin-2-yl
1-127 Methyl Methyl Phenylsulfinyl Pyrimidin-2-yl
1-128 Methyl Methyl Phenylsulfanyl 5-Carboxypyrimidin-2-yl
1-129 Difluormethyl Methyl Phenylsulfanyl Pyrimidin-2-yl
1-130 Methyl Aminocarbonyl (4-Fluorphenyl)thio 5-Chlorpyrimidin-2-yl
1-131 Isopropyl Methyl Phenylsulfanyl 5-Fluorpyrimidin-2-yl
1-132 Methyl H (4-Chlorophenyl)thio Pyrimidin-2-yl
1-133 Methyl Methyl Phenylsulfanyl 5-Fluorpyrimidin-2-yl
1-134 Methyl Methyl (3-Chlorphenyl)thio 5-Methoxypyrimidin-2-yl
1-135 Methyl Methyl (2-chloro-4- Pyrimidin-2-yl fluorophenyl)thio
1-136 Methyl Ethyl (2,4-Difluorphenyl)thio Pyrimidin-2-yl
1-137 Isopropyl H (4-Fluorphenyl)thio 5-Chlorpyrimidin-2-yl
1-138 Ethyl H Phenylsulfanyl 5-Chlorpyrimidin-2-yl
1-139 Isopropyl H (4-Chlorophenyl)thio 5-Fluorpyrimidin-2-yl
1-126 Methyl Methyl Phenylsulfanyl Pyrimidin-2-yl
1-140 Methyl Methyl Phenylsulfanyl 5-Methoxypyrimidin-2-yl
1-141 Methyl Methyl (3,4-Difluorphenyl)thio Pyrazin-2-yl
1-093 Methyl Methyl (3,4-Difluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-142 Methyl Methyl [3- Pyrimidin-2-yl
(Trifluormethyl)phenyl]
thio
1-142 Methyl Methyl [3- Pyrimidin-2-yl
(Trifluormethyl)phenyl]
thio
1-143 Methyl Methyl (4-methoxyphenyl)thio Pyrimidin-2-yl
1-144 Methyl Methyl Pyrimidin-2-ylthio 5-Fluorpyrimidin-2-yl
1-145 Methyl Cyclopropyl (3,4-Difluorphenyl)thio Pyrimidin-2-yl
1-146 Methyl Cyclopropyl Phenylsulfanyl 5-Fluorpyrimidin-2-yl
1-147 Methyl Propyl Phenylsulfanyl 5-Fluorpyrimidin-2-yl
1-148 Methyl Methyl (4-Cyanphenyl)thio Pyrimidin-2-yl
1-149 Methyl Methyl Phenylsulfanyl 4,6-Dimethylpyrimidin-2- yi
1-150 Methyl Methyl (2,6- Pyrimidin-2-yl difluorophenyl)thio
1-151 2- Methyl Phenylsulfanyl Pyrimidin-2-yl
Methylsulfanyle
thyl
1-152 2- Methyl Phenylsulfanyl Pyrimidin-2-yl
(Methanesulfon
amido)ethyl
1-153 Methyl Carboxy (4-Fluorphenyl)thio 5-Chlorpyrimidin-2-yl
1-154 Methyl H (4-Chlorophenyl)thio 5-Fluorpyrimidin-2-yl
1-155 Methyl Ethyl Phenylsulfanyl 5-Fluorpyrimidin-2-yl
Beispiel1 R2 A-Q1 Q2 nummer
1-156 Methyl Methyl (2-chloro-4- 5-Methoxypyrimidin-2-yl fluorophenyl)thio
1-157 Methyl Methyl (3,4-Difluorphenyl)thio 5-Methoxypyrimidin-2-yl
1-158 Methyl Methyl (3-fluorophenyl)thio 5-Fluorpyrimidin-2-yl
1-159 Methyl Ethyl (3,4-Difluorphenyl)thio 5-Methoxypyrimidin-2-yl
1-160 Ethyl H (4-Chlorophenyl)thio 5-Fluorpyrimidin-2-yl
1-161 Methyl Methyl (2,4- Pyrimidin-2-yl difluorophenyl)sulfonyl
1-162 Methyl Methyl (3-Chlorphenyl)thio 5-
(Methoxycarbonyl)pyridin
-2-yl
1-163 -CH2CH2CH2- (2,4-Difluorphenyl)thio Pyrimidin-2-yl
1-164 Methyl Trifluoromethyl Phenylsulfanyl 5-Fluorpyrimidin-2-yl
1-165 Methyl Cyclopropyl Phenylsulfanyl Pyrimidin-2-yl
1-166 Methyl Cyclopropyl (3-Chlorphenyl)thio 5-Fluorpyrimidin-2-yl
1-167 Methyl Methyl (3,5- Pyrimidin-2-yl dichlorophenyl)thio
1-168 Methyl Methyl (2-Fluorphenyl)thio Pyrimidin-2-yl
1-169 Methyl Methyl (4-methoxyphenyl)thio 5-Fluorpyrimidin-2-yl
1-170 Methyl Methyl Pyridin-2-ylthio Pyrimidin-2-yl
1-171 Methyl Methyl (2,4-Difluorphenyl)thio 3-Fluoropyridin-2-yl
1-172 Methyl phenyl Phenylsulfanyl 5-Fluorpyrimidin-2-yl
1-173 Methyl carboxy Phenylsulfanyl Pyrimidin-2-yl
1-174 Methyl Methyl carbamoyl Phenylsulfanyl Pyrimidin-2-yl
1-175 Methyl Dimethylaminocar Phenylsulfanyl Pyrimidin-2-yl bonyl
1-176 Methyl Methyl (4-Cyanphenyl)thio 5-Fluorpyrimidin-2-yl
1-177 Methyl Methyl (5-Fluorpyridin-2- 5-Fluorpyrimidin-2-yl yl)thio
1-178 phenyl Methyl Phenylsulfanyl Pyrimidin-2-yl
1-179 2-Methoxyethyl Methyl Phenylsulfanyl 5-Fluorpyrimidin-2-yl
1-180 Methyl Methyl (3,4-Difluorphenyl)thio 5-
(Trifluoromethyl)pyrimidi η-2-yl
1-181 Methyl Ethyl (4-Chlorophenyl)thio 5-Fluorpyrimidin-2-yl
1-182 Methyl H (4-Fluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-183 Methyl Ethyl (4-Fluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-184 Methyl Ethyl (3-fluorophenyl)thio Pyrimidin-2-yl
1-185 Methyl Ethyl (3-fluorophenyl)thio 5-Methoxypyrimidin-2-yl
1-186 Methyl Ethyl (4-Fluorphenyl)thio 5-Methoxypyrimidin-2-yl
1-187 Methyl Ethyl (4-Chlorophenyl)thio 5-Methoxypyrimidin-2-yl
1-188 Methyl H (4-Chlorophenyl)thio 5-Chlorpyrimidin-2-yl
1-189 Ethyl H Phenylsulfanyl 5-Fluorpyrimidin-2-yl
1-190 Isopropyl H Phenylsulfanyl 5-Chlorpyrimidin-2-yl
1-191 Isopropyl H Phenylsulfanyl 5-Fluorpyrimidin-2-yl
1-192 -CH2CH2CH2- (2,4-Difluorphenyl)thio 5-Fluorpyrimidin-2-yl
Beispiel1 R2 A-Q1 Q2 nummer
1-193 Methyl Methyl (4-Methylphenyl)thio Pyrimidin-2-yl
1-194 Methyl Methyl (4-Fluorphenyl)thio 3-Fluorpyridin-2-yl
1-195 -CH2CH2CH2- (2,4-Difluorphenyl)thio Pyridin-2-yl
1-196 Methyl Methyl (2,4,6- Pyrimidin-2-yl
Trifluorphenyl)thio
1-197 Methyl Methyl Phenylsulfanyl 4,6-Dimethoxypyrimidin- 2-yl
1-198 Ethyl Methyl Phenylsulfanyl Pyrimidin-2-yl
1-199 Isopropyl Methyl Phenylsulfanyl Pyrimidin-2-yl
1-200 Methyl Methyl [2- Pyrimidin-2-yl
(Trifluormethyl)phenyl]
thio
1-201 allyl Methyl Phenylsulfanyl Pyrimidin-2-yl
1-202 Methyl Methyl Phenylsulfanyl 5-
(Trifluormethyl)pyrimidin- 2-yl
1-203 Methyl Ethyl (3-Fluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-204 Methyl Methyl (4-Chlorphenyl)thio 5-Fluorpyrimidin-2-yl
1-205 Methyl Methyl (2,4-Difluorphenyl)thio 5-Methoxypyrimidin-2-yl
1-206 Methyl Methyl (3-Fluorphenyl)thio 5-Methoxypyrimidin-2-yl
1-207 Methyl Ethyl (2,4-Difluorphenyl)thio 5-Methoxypyrimidin-2-yl
1-208 Methyl Ethyl (2-Chloro-4- 5-Fluorpyrimidin-2-yl fluorphenyl)thio
1-209 Ethyl H (4-Chlorphenyl)thio 5-Chlorpyrimidin-2-yl
1-210 Methyl H Phenylsulfanyl 5-Fluorpyrimidin-2-yl
1-211 Ethyl H (4-Fluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-212 Methyl Methyl (4-Methylphenyl)thio 5-Fluorpyrimidin-2-yl
1-213 Methyl Methyl (2,4-Difluorphenyl)thio Pyridin-2-yl
1-214 Methyl Methyl (4-Fluorphenyl)thio Pyridin-2-yl
1-215 Methyl Methyl (2,4-Difluorphenyl)thio 5-
(Methoxycarbonyl)pyridin
-2-yl
1-216 Methyl Methyl (2,4-Difluorphenyl)thio 4-
(Methoxycarbonyl)pyridin
-2-yl
1-217 Methyl Methyl [4- Pyrimidin-2-yl
(Methoxycarbonyl)phe
nyl]thio
1-218 Methyl Methyl [4- 5-Fluorpyrimidin-2-yl
(Methoxycarbonyl)phe
nyl]thio
1-219 Methyl Cyclopropyl (3-Chlorphenyl)thio Pyrimidin-2-yl
1-220 Methyl Phenyl Phenylsulfanyl Pyrimidin-2-yl
1-221 Methyl Propyl Phenylsulfanyl Pyrimidin-2-yl
1-222 Methyl Methyl Phenylsulfonyl Pyrimidin-2-yl
1-223 Methyl Methyl Phenylsulfinyl 5-Fluorpyrimidin-2-yl
1-224 Methyl Methyl Phenylsulfanyl 5-Methylpyrimidin-2-yl
Beispiel1 R2 A-Q1 Q2 nummer
1-225 Carboxymethyl Methyl Phenylsulfanyl Pyrimidin-2-yl
1-226 Methyl Methyl (4-Fluorphenyl)thio 5-
(Trifluormethyl)pyrimidin- 2-yl
1-227 H Methyl Phenylsulfanyl 5-Fluorpyrimidin-2-yl
1-228 H Methyl Phenylsulfanyl Pyrimidin-2-yl
1-228 H Methyl Phenylsulfanyl Pyrimidin-2-yl
1-229 Methyl Methyl 2,4-Difluor-N- Pyrimidin-2-yl methylanilin
1-230 Methyl H (4-Chlorphenyl)thio 2-Chlorpyrimidin-5-yl
1-231 Methyl H (4-Fluorphenyl)thio 2-Chlorpyrimidin-5-yl
1-232 Methyl Methyl Phenylsulfanyl Pyridin-3-yl
1-233 Methyl Methyl Phenylsulfanyl Pyrimidin-5-yl
1-234 Methyl Methyl anilino Pyrimidin-2-yl
1-235 Methyl Methyl 2,4-difluoranilino Pyrimidin-2-yl
1-236 Methyl Methyl 4-Fluoranilino Pyrimidin-2-yl
1-236 Methyl Methyl 4-Fluoranilino Pyrimidin-2-yl
1-237 Methyl Methyl 3,4-difluoranilino Pyrimidin-2-yl
1-238 Methyl Methyl 3-Fluoranilino Pyrimidin-2-yl
1-239 Methyl Methyl 3,5-difluoranilino Pyrimidin-2-yl
1-240 Methyl Methyl 3-Chloranilino Pyrimidin-2-yl
1-241 Methyl Methyl 3- Pyrimidin-2-yl
(Trifluormethyl)anilino
1-242 Methyl Methyl (3,4-Difluorphenyl)thio 5-(Trifluormethyl)pyridin- 2-yl
1-243 Methyl Methyl Phenylsulfanyl 5-(Trifluormethyl)pyridin- 2-yl
1-244 Methyl Methyl N-methyl-3- Pyrimidin-2-yl
(trifluormethyl)anilino
1-245 Methyl Methyl N-methylanilino Pyrimidin-2-yl
1-246 Methyl Methyl 4-Fluor-N- Pyrimidin-2-yl methylanilino
1-247 Methyl Methyl 3-Chlor-N- Pyrimidin-2-yl methylanilino
1-248 Methyl Methyl pyrimidin-2-ylamino Pyrimidin-2-yl
1-249 Methyl Methyl 4-Chloranilino Pyrimidin-2-yl
1-250 Methyl Methyl 3-Fluor-N- Pyrimidin-2-yl methylanilino
1-251 Methyl Methyl 3,5-difluor-N- Pyrimidin-2-yl methylanilino
1-252 Methyl Methyl methyl(pyrimidin-2- Pyrimidin-2-yl yl)amino
1-253 Methyl Methyl 4-Chlor-N- Pyrimidin-2-yl methylanilino
1-254 Methyl Methyl 3,4-difluor-N- Pyrimidin-2-yl methylanilino
Beispiel1 R2 A-Q1 Q2 nummer
1-255 Methyl Methyl [5- Pyrimidin-2-yl
(trifluormethyl)pyridin- 2-yl]amino
1-256 Methyl Brom (4-Fluorphenyl)thio 5-Chlorpyrimidin-2-yl
1-257 Methyl Methyl 4-methylanilino Pyrimidin-2-yl
1-258 Methyl Chlor (4-Fluorphenyl)thio 5-Chlorpyrimidin-2-yl
1-259 Methyl Methyl Phenylsulfanyl 2-Chlorpyrimidin-5-yl
1-260 Methyl Methyl methyl-[5- Pyrimidin-2-yl
(Trifluormethyl)pyridin- 2-yl]amino
1-261 Methyl Methyl 2,4-difluoranilino 5-Fluorpyrimidin-2-yl
1-262 Methyl Methyl anilino 5-Fluorpyrimidin-2-yl
1-263 Methyl Methyl Phenylsulfanyl Pyridin-4-yl
1-264 Methyl Diacetylamino (4-Fluorphenyl)thio 5-Chlorpyrimidin-2-yl
1-265 Methyl Amino (4-Fluorphenyl)thio 5-Chlorpyrimidin-2-yl
1-266 Methyl Acetylamino (4-Fluorphenyl)thio 5-Chlorpyrimidin-2-yl
1-267 Methyl Methyl 3- 5-Fluorpyrimidin-2-yl
(Trifluormethyl)anilino
1-268 Methyl Methyl 3-Fluoranilino 5-Fluorpyrimidin-2-yl
1-269 Methyl Methyl 3-Chloranilino 5-Fluorpyrimidin-2-yl
1-270 Methyl Methyl (4-Fluorphenyl)thio 2-Chlorpyrimidin-5-yl
1-271 Methyl Methyl N-methylanilino 5-Fluorpyrimidin-2-yl
1-272 Methyl Methyl (3,4-Difluorphenyl)thio 2-Chlorpyrimidin-5-yl
1-273 Methyl Methyl 3-Fluor-N- 5-Fluorpyrimidin-2-yl methylanilino
1-274 Methyl Methyl pyrazin-2-ylthio 5-Fluorpyrimidin-2-yl
1-275 Methyl Methyl [2- 5-Fluorpyrimidin-2-yl
(methoxycarbonyl)phe
nyl]thio
1-276 Methyl Methyl 3,5-difluoranilino 5-Fluorpyrimidin-2-yl
1-277 Methyl Methyl (4-nitrophenyl)thio 5-Fluorpyrimidin-2-yl
1-278 Methyl Methyl (3-methoxyphenyl)thio 5-Fluorpyrimidin-2-yl
1-279 Methyl Methyl (2-methylphenyl)thio 5-Fluorpyrimidin-2-yl
1-280 Methyl Methyl (4- Pyrimidin-2-yl methylphenyl)methyl
1-281 Methyl Methyl (2,4- Pyrimidin-2-yl difluorphenyl)methyl
1-282 Methyl Methyl (2,5- Pyrimidin-2-yl difluorphenyl)methyl
1-283 Methyl Methyl (3,4- Pyrimidin-2-yl
Difluorphenyl)methyl
1-284 Methyl Methyl (2-Chlorpyridin-4- Pyrimidin-2-yl yl)methyl
1-285 Methyl Methyl [3- Pyrimidin-2-yl
(Trifluormethyl)phenyl]
methyl
Beispiel1 R2 A-Q1 Q2 nummer
1-286 Methyl Methyl (3,5- Pyrimidin-2-yl difluorphenyl)methyl
1-287 Methyl Methyl (3,4- 5-Fluorpyrimidin-2-yl
Difluorphenyl)methyl
1-288 Methyl Methyl (3,5- 5-Fluorpyrimidin-2-yl difluorphenyl)methyl
1-289 Methyl Methyl (2,5- 5-Fluorpyrimidin-2-yl difluorphenyl)methyl
1-290 Methyl Methyl (2,4- 5-Fluorpyrimidin-2-yl difluorphenyl)methyl
1-291 Methyl Methyl [3- 5-Fluorpyrimidin-2-yl
(trifluormethyl)phenyl]
methyl
1-291 Methyl Methyl [3- 5-Fluorpyrimidin-2-yl
(Trifluormethyl)phenyl]
methyl
1-292 Methyl Methyl (3-methoxyphenyl)thio Pyrimidin-2-yl
1-293 Methyl Methyl (4-Chlorphenyl)methyl 5-Fluorpyrimidin-2-yl
1-293 Methyl Methyl (4-Chlorphenyl)methyl 5-Fluorpyrimidin-2-yl
1-294 Methyl Methyl (2-methylphenyl)thio Pyrimidin-2-yl
1-295 Methyl Methyl (2-carboxyphenyl)thio 5-Fluorpyrimidin-2-yl
1-296 Methyl Methyl 4-Fluoranilino 5-Fluorpyrimidin-2-yl
1-297 Methyl Methyl 3,5-difluor-N- 5-Fluorpyrimidin-2-yl methylanilino
1-298 Methyl Methyl [3- Pyrimidin-2-yl
(methoxycarbonyl)phe
nyl]thio
1-299 Methyl Methyl [3- 5-Fluorpyrimidin-2-yl
(methoxycarbonyl)phe
nyl]thio
1-300 Methyl Methyl [2- Pyrimidin-2-yl
(methoxycarbonyl)phe
nyl]thio
1-301 Methyl Methyl (3-carboxyphenyl)thio 5-Fluorpyrimidin-2-yl
1-302 Methyl Methyl (3-carboxyphenyl)thio Pyrimidin-2-yl
1-303 Methyl Methyl (2-carboxyphenyl)thio Pyrimidin-2-yl
1-304 Methyl Methyl Pyrimidin-2-yloxy Pyrimidin-2-yl
1-305 Methyl Methyl 4-Chloranilino 5-Fluorpyrimidin-2-yl
1-306 Methyl Methyl 3,4-difluoranilino 5-Fluorpyrimidin-2-yl
1-307 Methyl Methyl 4-methylanilino 5-Fluorpyrimidin-2-yl
1-308 Methyl Methyl N-methyl-3- 5-Fluorpyrimidin-2-yl
(trifluormethyl)anilino
1-309 Methyl Methyl [5- 5-Fluorpyrimidin-2-yl
(Trifluormethyl)pyridin- 2-yl]amino
1-310 Methyl Methyl pyrimidin-2-ylamino 5-Fluorpyrimidin-2-yl
1-311 Methyl Methyl (5-cyanopyrimidin-2- 5-Fluorpyrimidin-2-yl yl)oxy
Beispiel1 R2 A-Q1 Q2 nummer
1-312 Methyl Methyl (5-Chlorpyrimidin-2- 5-Fluorpyrimidin-2-yl yl)oxy
1-313 Methyl Methyl (5-Fluorpyrimidin-2- 5-Fluorpyrimidin-2-yl yl)oxy
1-314 Methyl Methyl Pyrimidin-2-yloxy 5-Fluorpyrimidin-2-yl
1-315 Methyl Methyl [5- Pyrimidin-2-yl
(Trifluormethyl)pyridin- 2-yl]oxy
1-316 Methyl Methyl (5-Fluorpyrimidin-2- Pyrimidin-2-yl yl)oxy
1-317 Methyl Methyl 3,4-difluor-N- 5-Fluorpyrimidin-2-yl methylanilino
1-318 Methyl Methyl 4-Chlor-N- 5-Fluorpyrimidin-2-yl methylanilino
1-319 Methyl Methyl (5-cyanopyrimidin-2- Pyrimidin-2-yl yl)oxy
1-320 Methyl Methyl (5-methylpyrimidin-2- 5-Fluorpyrimidin-2-yl yl)oxy
1-321 Methyl Methyl pyrazin-2-yloxy 5-Fluorpyrimidin-2-yl
1-322 Methyl Methyl [5- 5-Fluorpyrimidin-2-yl
(Trifluormethyl)pyridin- 2-yl]oxy
1-323 Methyl Methyl cyclopentylthio Pyrimidin-2-yl
1-323 Methyl Methyl cyclopentylthio Pyrimidin-2-yl
1-324 Methyl Methyl cyclopentylthio 5-Fluorpyrimidin-2-yl
1-325 Methyl Methyl (2,4,6- Pyrimidin-2-yl
Trimethylphenyl)thio
1-326 Methyl Methyl (2,6- Pyrimidin-2-yl dimethylphenyl)thio
1-327 Methyl Methyl (2-methoxyphenyl)thio Pyrimidin-2-yl
1-328 Methyl Methyl cyclohexylthio 5-Fluorpyrimidin-2-yl
1-329 Methyl Methyl cyclohexylthio Pyrimidin-2-yl
1-330 Methyl Methyl (4-nitrophenyl)thio Pyrimidin-2-yl
1-331 Methyl Methyl (2-methoxyphenyl)thio 5-Fluorpyrimidin-2-yl
1-332 Methyl Methyl (2,4,6- 5-Fluorpyrimidin-2-yl
Trimethylphenyl)thio
1-333 Methyl Methoxycarbonyl (3,4- Pyrimidin-2-yl
Difluorphenyl)methyl
1-333 Methyl Methoxycarbonyl (3,4- Pyrimidin-2-yl
Difluorphenyl)methyl
1-334 Methyl Methoxycarbonyl (3,5-difluorphenyl)thio Pyrimidin-2-yl
1-335 H Methyl 3-(Trifluormethyl) Pyrimidin-2-yl phenoxy
1-336 Methyl Methoxycarbonyl (5-Fluorpyridin-2- 5-Fluorpyrimidin-2-yl yl)thio
1-337 H Ethoxycarbonyl (4-Fluorphenyl)thio 5-Chlorpyrimidin-2-yl
Beispiel1 R2 A-Q1 Q2 nummer
1-338 Methyl Methoxycarbonyl (3,4- 5-Fluorpyrimidin-2-yl
Difluorphenyl)methyl
1-339 Methyl Methoxycarbonyl benzyl Pyrimidin-2-yl
1-340 Methyl Methoxycarbonyl benzyl 5-Fluorpyrimidin-2-yl
1-341 Methyl Methoxycarbonyl (3,5-difluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-342 Methyl Methoxycarbonyl (4-cyanophenyl)thio 5-Fluorpyrimidin-2-yl
1-343 Methyl Methoxycarbonyl (4-cyanophenyl)thio Pyrimidin-2-yl
1-343 Methyl Methoxycarbonyl (4-cyanophenyl)thio Pyrimidin-2-yl
1-344 Methyl Methoxycarbonyl [3- 5-Fluorpyrimidin-2-yl
(Trifluormethyl)phenyl]
thio
1-345 Methyl Methoxycarbonyl [3- Pyrimidin-2-yl
(Trifluormethyl)phenyl]
thio
1-346 Methyl Methoxycarbonyl pyridin-2-ylthio 5-Fluorpyrimidin-2-yl
1-347 Methyl Methoxycarbonyl pyridin-2-ylthio Pyrimidin-2-yl
1-348 Methyl Methoxycarbonyl [3- 5-Fluorpyrimidin-2-yl
(Trifluormethyl)phenyl]
methyl
1-349 Methyl Methoxycarbonyl [3- Pyrimidin-2-yl
(Trifluormethyl)phenyl]
methyl
1-350 Methyl Methoxycarbonyl (2,4- 5-Fluorpyrimidin-2-yl difluorphenyl)methyl
1-351 Methyl Methoxycarbonyl (2,4- Pyrimidin-2-yl difluorphenyl)methyl
1-352 Methyl Methoxycarbonyl Phenylsulfanyl 5-Fluorpyrimidin-2-yl
1-353 Methyl Methoxycarbonyl (4-Fluorphenyl)methyl 5-Fluorpyrimidin-2-yl
1-354 Methyl Methoxycarbonyl (4-Fluorphenyl)methyl Pyrimidin-2-yl
1-354 Methyl Methoxycarbonyl (4-Fluorphenyl)methyl Pyrimidin-2-yl
1-355 Methyl Methoxycarbonyl (2-Fluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-356 Methyl Methoxycarbonyl (2-Fluorphenyl)thio Pyrimidin-2-yl
1-357 Methyl Methoxycarbonyl (4-Fluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-358 Methyl Methoxycarbonyl (3,4-Difluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-359 Methyl Methoxycarbonyl (3-Chlorphenyl)thio Pyrimidin-2-yl
1-360 Methyl Methoxycarbonyl (3-Chlorphenyl)thio 5-Fluorpyrimidin-2-yl
1-361 Methyl Methoxycarbonyl (4-methylphenyl)thio Pyrimidin-2-yl
1-362 Methyl Methoxycarbonyl (4-methylphenyl)thio 5-Fluorpyrimidin-2-yl
1-363 Methyl Methoxycarbonyl (2,4,6- Pyrimidin-2-yl
Trifluorphenyl)thio
1-364 Methyl Methoxycarbonyl (2,4,6- 5-Fluorpyrimidin-2-yl
Trifluorphenyl)thio
1-365 Methyl Methyl 3-Chlor-N- 5-Fluorpyrimidin-2-yl methylanilino
1-366 Methyl Methyl (2,6- 5-Fluorpyrimidin-2-yl dimethylphenyl)thio
Beispiel1 R2 A-Q1 Q2 nummer
1-367 Methyl Methoxycarbonyl (5-Fluorpyridin-2- Pyrimidin-2-yl yl)thio
1-368 Methyl Methyl 2,4-Difluorphenoxy 5-Chlorpyrimidin-2-yl
1-369 Methyl Methyl 2,4-Difluorphenoxy 5-(Trifluormethyl)pyridin- 2-yl
1-370 H Ethoxycarbonyl Phenylsulfanyl Pyrimidin-2-yl
1-371 H Ethoxycarbonyl (3,4-Difluorphenyl)thio Pyrimidin-2-yl
1-372 Methyl Methyl 3- Pyrimidin-2-yl
(Trifluormethyl)phenox
y
1-373 Methyl Methyl 4-Fluorphenoxy 5-Fluorpyrimidin-2-yl
1-374 Methyl Methyl 4-Fluorphenoxy 5-(Trifluormethyl)pyridin- 2-yl
1-375 Methyl Methyl 4-Fluorphenoxy Pyrimidin-2-yl
1-376 Methyl Methyl 4-Fluorphenoxy 5-Chlorpyrimidin-2-yl
1-377 Methyl Methyl 3,4-difluorphenoxy 5-Fluorpyrimidin-2-yl
1-378 Methyl Methyl 3,4-difluorphenoxy Pyrimidin-2-yl
1-379 Methyl Methyl 3-methoxyphenoxy Pyrimidin-2-yl
1-380 Methyl Methyl 3-methoxyphenoxy 5-Fluorpyrimidin-2-yl
1-381 H Ethoxycarbonyl (4-cyanophenyl)thio Pyrimidin-2-yl
1-382 Methyl Methyl 3,4-difluorphenoxy 5-Chlorpyrimidin-2-yl
1-383 Methyl Methyl 3-methoxyphenoxy 5-(Trifluormethyl)pyridin- 2-yl
1-384 Methyl Methyl 4-methylphenoxy Pyrimidin-2-yl
1-385 Methyl Methyl 4-methylphenoxy 5-Fluorpyrimidin-2-yl
1-386 Methyl Methyl 3,4-difluorphenoxy 5-(Trifluormethyl)pyridin- 2-yl
1-387 Methyl Methyl 3-(Trifluormethyl) 5-Chlorpyrimidin-2-yl phenoxy
1-388 Methyl Methyl 3-(Trifluormethyl) 5-Fluorpyrimidin-2-yl phenoxy
1-389 Methyl Methyl 4-cyanophenoxy Pyrimidin-2-yl
1-390 Methyl Methyl 3-(Trifluormethyl) 5-(Trifluormethyl)pyridin- phenoxy 2-yl
1-391 Allyl Methyl 4-Cyanophenoxy Pyrimidin-2-yl
1-392 Methyl Methyl [3-(Trifluormethoxy) Pyrimidin-2-yl phenyl]thio
1-393 Methyl Methyl (3- Pyrimidin-2-yl methylsulfanylphenyl)
thio
1-394 Methyl Methyl (3-ethoxyphenyl)thio Pyrimidin-2-yl
1-395 Methyl Methyl (3-methylphenyl)thio Pyrimidin-2-yl
1-396 Methyl Methyl (3-methylphenyl)thio 5-Fluorpyrimidin-2-yl
1-397 Methyl Methyl [3-(Trifluormethoxy) 5-Fluorpyrimidin-2-yl phenyl]thio
Beispiel1 R2 A-Q1 Q2 nummer
1-398 Methyl Methoxycarbonyl (3- Pyrimidin-2-yl methylsulfanylphenyl)
thio
1-399 Methyl Methoxycarbonyl (3-ethoxyphenyl)thio Pyrimidin-2-yl
1-400 Methyl Methoxycarbonyl [3-(Trifluormethoxy) Pyrimidin-2-yl phenyl]thio
1-401 Methyl Methyl (3,5- Pyrimidin-2-yl dimethylphenyl)thio
1-402 Methyl Methoxycarbonyl (3-methylphenyl)thio Pyrimidin-2-yl
1-403 Methyl Methoxycarbonyl [3-(Trifluormethoxy) 5-Fluorpyrimidin-2-yl phenyl]thio
1-404 Methyl Methoxycarbonyl (3,5- Pyrimidin-2-yl dimethylphenyl)thio
1-405 Methyl Methyl (3- 5-Fluorpyrimidin-2-yl methylsulfanylphenyl)
thio
1-406 Methyl Methyl (3- 5-Fluorpyrimidin-2-yl methoxyphenyl)methyl
1-407 Methyl Methyl (3,5- 5-Fluorpyrimidin-2-yl dimethylphenyl)thio
1-408 Methyl Methyl (3,5- 5-Fluorpyrimidin-2-yl dimethoxyphenyl)thio
1-409 Methyl Methyl (3,5- Pyrimidin-2-yl dimethoxyphenyl)thio
1-410 Methyl Methoxycarbonyl (3,5- 5-Fluorpyrimidin-2-yl dimethylphenyl)thio
1-411 Methyl Methoxycarbonyl (3-methylphenyl)thio 5-Fluorpyrimidin-2-yl
1-412 Methyl Methoxycarbonyl (3- 5-Fluorpyrimidin-2-yl methylsulfanylphenyl)
thio
1-413 Methyl Methoxycarbonyl (3-ethoxyphenyl)thio 5-Fluorpyrimidin-2-yl
1-414 Methyl Methyl (3,5-dimethoxyphenyl) Pyrimidin-2-yl methyl
1-415 Methyl Methoxycarbonyl (3-methoxyphenyl)thio 5-Fluorpyrimidin-2-yl
1-416 Methyl Methyl (3- Pyrimidin-2-yl methoxyphenyl)methyl
1-417 Methyl Methoxycarbonyl (3,5-dimethoxyphenyl) Pyrimidin-2-yl methyl
1-418 Methyl Methyl (3,5-dimethoxyphenyl) 5-Fluorpyrimidin-2-yl methyl
1-419 Methyl Methoxycarbonyl (3- Pyrimidin-2-yl methoxyphenyl)methyl
1-420 Methyl Methoxycarbonyl (3- 5-Fluorpyrimidin-2-yl methoxyphenyl)methyl
1-421 Methyl Methoxycarbonyl (3,5-dimethoxyphenyl) 5-Fluorpyrimidin-2-yl methyl
1-422 Methyl Methoxycarbonyl (3-methoxyphenyl)thio Pyrimidin-2-yl
1-423 Methyl Methyl (3-ethoxyphenyl)thio 5-Fluorpyrimidin-2-yl
Beispiel1 R2 A-Q1 Q2 nummer
1-424 Methyl Methoxycarbonyl (3,5- Pyrimidin-2-yl dimethoxyphenyl)thio
1-425 Methyl Methoxycarbonyl (3,5- 5-Fluorpyrimidin-2-yl dimethoxyphenyl)thio
1-426 Methyl Methyl (4-Fluor-3- Pyrimidin-2-yl methoxyphenyl)thio
1-427 Methyl Methoxycarbonyl (5-Chlorpyrimidin-2- 5-Fluorpyrimidin-2-yl yl)oxy
1-428 Methyl Ethoxycarbonyl (4-Fluorphenyl)thio 5-Chlorpyrimidin-2-yl
1-429 Methyl Methyl (2,3,4- Pyrimidin-2-yl
Trifluorphenyl)thio
1-430 Methyl Methyl (4-Fluor-3- 5-Fluorpyrimidin-2-yl methoxyphenyl)thio
1-431 Methyl Methoxycarbonyl (2,3,4- Pyrimidin-2-yl
Trifluorphenyl)thio
1-431 Methyl Methoxycarbonyl (2,3,4- Pyrimidin-2-yl
Trifluorphenyl)thio
1-432 Methyl Methoxycarbonyl (5-Fluorpyrimidin-2- 5-Fluorpyrimidin-2-yl yl)oxy
1-433 Methyl Methoxycarbonyl (4-Fluor-3- 5-Fluorpyrimidin-2-yl methoxyphenyl)thio
1-434 Methyl carboxy (4-Fluorphenyl)methyl 5-Fluorpyrimidin-2-yl
1-435 Methyl Methoxycarbonyl [5- 5-Fluorpyrimidin-2-yl
(Trifluormethyl)pyridin- 2-yl]oxy
1-436 Methyl Methoxycarbonyl (5-Chlorpyrimidin-2- Pyrimidin-2-yl yl)oxy
1-437 Methyl Methoxycarbonyl (5-Fluorpyrimidin-2- Pyrimidin-2-yl yl)oxy
1-438 Methyl Methoxycarbonyl [5- Pyrimidin-2-yl
(Trifluormethyl)pyridin- 2-yl]oxy
1-439 Methyl Carboxy (4-Fluorphenyl)thio 5-Fluorpyrimidin-2-yl
1-440 H Methyl 2-phenylpropan-2-yl Pyrimidin-2-yl
1-441 H Methyl 2-phenylpropan-2-yl 5-Fluorpyrimidin-2-yl
1-442 Methyl Methyl 2-phenylpropan-2-yl 5-Fluorpyrimidin-2-yl
1-443 Methyl Methyl 2-phenylpropan-2-yl Pyrimidin-2-yl
1-444 H Methyl 1-Phenylethyl Pyrimidin-2-yl
1-445 H Methyl l-(3,4- Pyrimidin-2-yl
Difluorphenyl)ethyl
1-446 H Methyl l-Pyridin-2-ylethyl Pyrimidin-2-yl
1-447 Methyl Methyl l-Pyridin-2-ylethyl Pyrimidin-2-yl
1-448 Methyl Methyl l-(3,4- Pyrimidin-2-yl
Difluorphenyl)ethyl
1-449 Methyl Methyl 1-Phenylethyl Pyrimidin-2-yl
1-450 Methyl Methyl 1-Phenylethyl 5-Fluorpyrimidin-2-yl
Beispiel1 R2 A-Q1 Q2 nummer
1-451 Methyl Methyl l-(3,4- 5-Fluorpyrimidin-2-yl
Difluorphenyl)ethyl
1-452 Methyl Methyl l-Pyridin-2-ylethyl 5-Fluorpyrimidin-2-yl
1-453 H Methyl l-Pyridin-2-ylethyl 5-Fluorpyrimidin-2-yl
1-454 H Methyl l-(3,4- 5-Fluorpyrimidin-2-yl
Difluorphenyl)ethyl
1-455 H Methyl 1-Phenylethyl 5-Fluorpyrimidin-2-yl
1-456 Methyl Methyl (2,3,4- 5-Fluorpyrimidin-2-yl
Trifluorphenyl)thio
1-457 Methyl Methoxycarbonyl (4-Fluor-3- Pyrimidin-2-yl methoxyphenyl)thio
1-458 Methyl Methoxycarbonyl (2,3,4- 5-Fluorpyrimidin-2-yl
Trifluorphenyl)thio
1-459 Methyl Cyclohexyloxycarb (4-Fluorphenyl)methyl 5-Fluorpyrimidin-2-yl onyl
1-460 Methyl Cyclohexyloxycarb (4-Fluorphenyl)thio 5-Fluorpyrimidin-2-yl onyl
1-461 H Methyl (2,4- 5-Fluorpyrimidin-2-yl
Difluorphenyl)methyl
1-462 Methyl Methyl 2,4-Difluorphenoxy 6-
(Trifluormethyl)pyridazin- 3-yl
1-463 Methyl Methyl (3-Fluorphenyl)methyl 5-Fluorpyrimidin-2-yl
1-464 Methyl Methyl 2,4-Difluorphenoxy 6-Cyanopyridazin-3-yl
1-465 Methyl Methyl 2,4-Difluorphenoxy 6-Chlorpyridazin-3-yl
1-466 Methyl Ethoxycarbonyl 4-Fluorphenoxy 5-Chlorpyrimidin-2-yl
1-467 H Methyl 2,4-Difluorphenoxy 5-Fluorpyrimidin-2-yl
1-468 Methyl Methyl 2,4-Difluoranilin Pyrimidin-2-yl
1-469 Methyl Methoxycarbonyl (4-Fluorphenyl)thio Pyrimidin-2-yl methyl
1-470 Methyl Methoxycarbonyl 4-Fluorphenoxy Pyrimidin-2-yl methyl
1-471 Methyl Methoxycarbonyl (4-Fluorphenyl)thio 5-Fluorpyrimidin-2-yl methyl
1-472 Methyl Methoxycarbonyl 4-Fluorphenoxy 5-Fluorpyrimidin-2-yl methyl
1-473 Methyl Cyanomethyl (4-Fluorphenyl)thio Pyrimidin-2-yl
1-474 Methyl Cyanomethyl 4-Fluorphenoxy Pyrimidin-2-yl
1-475 Methyl Cyanomethyl (4-Fluorphenyl)thio 5-Fluorpyrimidin-2-yl
In Analogie zu den oben angeführten und an entsprechender Stelle rezitierten Herstellungsbeispielen und unter Berücksichtigung der allgemeinen Angaben zur Herstellung von substituierten
(Het-)Arylpyrazolamiden erhält man die nachfolgend genannten und in Tabelle II dargestellten
Intermediate der allgemeinen Formel (II)
Tabelle II
BeispielXI X2 X3 X4 nummer
A-39 Hydroxy (3 -Chlorphenyl)thio Methyl Methyl
A-40 Hydroxy (3,4- Methyl Methyl
Difluorphenyl)thio
A-41 Hydroxy Phenylsulfanyl Cyclopropyl Methyl
A-42 Hydroxy (3 -Chlorphenyl)thio Cyclopropyl Methyl
A-43 Hydroxy (3,4- Cyclopropyl Methyl
Difluorphenyl)thio
A-44 Methoxy (3- Methyl Methyl
Trifluorphenyl)thio
A-45 Methoxy (3,4- Methyl Methyl
Difluorphenyl)thio
A-46 Methoxy (3 -Chlorphenyl)thio Methyl Methyl
A-47 Methoxy (2,4- Methyl Methyl
Difluorphenyl)thio
A-48 Methoxy Phenylsulfanyl Cyclopropyl Methyl
A-49 (5-Chlorpyrimidin-2- lod Methoxycarbonyl Methyl yl)oxy
NMR-Daten ausgewählter Beispiele (Endprodukte und Intermediate) NMR-Peak-Listenverfahren
Die 1H-NMR-Daten ausgewählter Beispiele werden in Form von 1H-NMR-Peaklisten notiert. Zu jedem Signalpeak wird erst der δ-Wert in ppm und dann die Signalintensität in runden Klammern aufgeführt. Die δ-Wert - Signalintensitäts- Zahlenpaare von verschiedenen Signalpeaks werden durch Semikolons voneinander getrennt aufgelistet.
Die Peakliste eines Beispieles hat daher die Form: δι (Intensität^; 82 (Intensität2); ; δ; (Intensität^; ; δη (Intensitätn)
Die Intensität scharfer Signale korreliert mit der Höhe der Signale in einem gedruckten Beispiel eines NMR-Spektrums in cm und zeigt die wirklichen Verhältnisse der Signalintensitäten. Bei breiten
Signalen können mehrere Peaks oder die Mitte des Signals und ihre relative Intensität im Vergleich zum intensivsten Signal im Spektrum gezeigt werden.
Zur Kalibrierung der chemischen Verschiebung von 1H-NMR-Spektren benutzen wir Tetramethylsilan und/oder die chemische Verschiebung des Lösungsmittels, besondern im Falle von Spektren, die in DMSO gemessen werden. Daher kann in NMR-Peaklisten der Tetramethylsilan-Peak vorkommen, muss es aber nicht.
Die Listen der IH-NMR-Peaks sind ähnlich den klassischen IH-NMR- Ausdrucken und enthalten somit gewöhnlich alle Peaks, die bei einer klassischen NMR-Interpretation aufgeführt werden.
Darüber hinaus können sie wie klassische IH-NMR- Ausdrucke Lösungsmittelsignale, Signale von Stereoisomeren der Zielverbindungen, die ebenfalls Gegenstand der Erfindung sind, und/oder Peaks von Verunreinigungen zeigen.
Bei der Angabe von Verbindungssignalen im Delta-Bereich von Lösungsmitteln und/oder Wasser sind in unseren Listen von IH-NMR-Peaks die gewöhnlichen Lösungsmittelpeaks, zum Beispiel Peaks von DMSO in DMSO-D6 und der Peak von Wasser, gezeigt, die gewöhnlich im Durchschnitt eine hohe Intensität aufweisen.
Die Peaks von Stereoisomeren der Targetverbindungen und/oder Peaks von Verunreinigungen haben gewöhnlich im Durchschnitt eine geringere Intensität als die Peaks der Zielverbindungen (zum Beispiel mit einer Reinheit von >90 %). Solche Stereoisomere und/oder Verunreinigungen können typisch für das jeweilige
Herstellungsverfahren sein. Ihre Peaks können somit dabei helfen, die Reproduktion unseres
Herstellungsverfahrens anhand von "Nebenprodukt-Fingerabdrucken" zu erkennen.
Einem Experten, der die Peaks der Zielverbindungen mit bekannten Verfahren (MestreC, ACD- Simulation, aber auch mit empirisch ausgewerteten Erwartungswerten) berechnet, kann je nach Bedarf die Peaks der Zielverbindungen isolieren, wobei gegebenenfalls zusätzliche Intensitätsfilter eingesetzt werden. Diese Isolierung wäre ähnlich dem betreffenden Peak-Picking bei der klassischen 1H-NMR- Interpretation.
Weitere Details zu 1H-NMR-Peaklisten können der Research Disclosure Database Number 564025 entnommen werden.
NMR-Daten der Endprodukte (Peakliste)
1-004: 'H-NMR^OO.O MHz, CDC13):
δ= 8.5000 (6.2); 8.4880 (6.3); 7.5525 (2.2); 7.5507 (2.3); 7.5484 (2.1); 7.5342 (0.7); 7.5304 (1.1); 7.4231 (1.1); 7.4192 (1.7); 7.4138 (1.9); 7.3961 (1.1); 7.3946 (1.0); 7.2608 (24.6); 6.9801 (1.9); 6.9681 (3.6); 6.9561 (1.8); 3.8339 (16.0); 2.3769 (15.6); -
0.0002 (9.3)
1-005: Ή-ΝΜϋ^ΟΟ.Ο MHz, CDC13):
δ= 8.5276 (6.0); 8.5156 (6.1); 7.2615 (21.5); 7.0129 (1.8); 7.0010 (3.5); 6.9890 (1.7); 6.8824 (1.6); 6.8766 (1.9); 6.8735 (1.0); 6.8640 (1.0); 6.8609 (1.9); 6.8551 (1.7); 6.6446 (0.8); 6.6279 (0.8); 6.6220 (1.5); 6.6162 (0.8); 6.5994 (0.8); 3.8183 (16.0);
2.3836 (15.8); 1.5709 (0.8); -0.0002 (7.9)
1-006: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4972 (4.3); 8.4852 (4.4); 7.3528 (1.3); 7.3492 (1.7); 7.3441 (0.6); 7.3365 (0.8); 7.3340 (1.4); 7.3318 (3.0); 7.3285 (2.4); 7.3010 (1.9); 7.2960 (0.6); 7.2839 (1.9); 7.2825 (2.9); 7.2787 (1.0); 7.2670 (0.8); 7.2599 (24.9); 7.1929 (0.6); 7.1893 (1.1); 7.1856 (0.6); 7.1711 (1.2); 7.1530 (0.6); 6.9605 (1.6); 6.9485 (3.1); 6.9365 (1.6); 3.8241 (16.0); 2.3705 (15.3); -0.0002 (9.6) 1-007: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4304 (1.5); 8.3345 (11.0); 8.0764 (1.1); 7.5535 (1.2); 7.5518 (1.5); 7.5500 (1.3); 7.5476 (1.0); 7.5420 (0.5); 7.5406 (0.5); 7.5379 (0.7); 7.5365 (0.6); 7.5229 (0.6); 7.5198 (1.0); 7.4431 (0.9); 7.4400 (1.3); 7.4312 (1.3); 7.4132 (1.0); 7.2613 (15.9); 7.1569 (0.5); 5.2981 (1.1); 3.8366 (0.6); 3.8297 (16.0); 3.7910 (1.3); 3.7317 (2.5); 2.3778 (15.3); 2.3394 (1.2); 2.2894 (1.5);
2.2880 (1.4); 1.5639 (1.8); -0.0002 (9.5)
1-009: 1H-NMR(400.0 MHz, CDC13):
δ= 9.3469 (0.5); 9.0618 (3.3); 8.9992 (1.6); 8.7305 (8.8); 8.3723 (12.0); 7.2638 (20.7); 5.2995 (2.8); 3.8455 (16.0); 2.4051 (15.0);
-0.0002 (8.9)
1-011 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.4353 (0.6); 8.3629 (11.0); 7.2619 (12.0); 6.8750 (1.5); 6.8717 (1.0); 6.8692 (1.7); 6.8661 (0.9); 6.8578 (0.8); 6.8567 (0.8); 6.8536 (1.7); 6.8479 (1.5); 6.6636 (0.7); 6.6469 (0.8); 6.6411 (1.4); 6.6352 (0.6); 6.6185 (0.7); 5.2983 (2.3); 3.8152 (16.0);
3.7542 (1.1); 2.3844 (15.4); 2.2973 (0.7); 2.2961 (0.6); -0.0002 (5.1)
1-013: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5247 (4.6); 8.5127 (4.6); 7.2609 (24.8); 7.1611 (0.5); 7.1560 (0.5); 7.1375 (0.5); 7.1105 (0.6); 7.1079 (0.6); 7.0873 (0.8); 7.0702 (1.1); 7.0685 (2.1); 7.0637 (1.8); 7.0562 (0.8); 7.0513 (1.9); 7.0481 (1.5); 7.0156 (1.7); 7.0036 (3.3); 6.9916 (1.7); 3.8187
(16.0); 2.3518 (15.0); -0.0002 (9.3)
1-015: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.7223 (15.3); 7.3057 (1.8); 7.3002 (0.7); 7.2919 (2.0); 7.2834 (2.5); 7.2754 (0.9); 7.2696 (2.2); 7.1508 (2.3); 7.1452 (0.7); 7.1340 (0.8); 7.1284 (4.0); 7.1227 (0.8); 7.1114 (0.6); 7.1059 (1.8); 5.7535 (1.6); 4.0666 (15.8); 3.7053 (16.0); 3.3134 (4.2); 2.5234 (1.2); 2.5187 (1.6); 2.5100 (14.9); 2.5055 (30.3); 2.5009 (41.0); 2.4964 (28.4); 2.4919 (12.9); 0.0080 (0.9); -0.0002 (24.6);
-0.0085 (0.8)
1-016: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3241 (11.0); 7.2596 (81.0); 7.0649 (1.1); 7.0513 (1.2); 7.0430 (1.5); 7.0351 (0.6); 7.0295 (1.4); 6.8684 (1.8); 6.8631 (0.5); 6.8520 (0.6); 6.8466 (3.3); 6.8412 (0.6); 6.8248 (1.4); 3.7397 (16.0); 3.5939 (4.4); 2.1584 (14.0); 1.5420 (2.5); 0.0079 (0.9); -
0.0002 (28.1); -0.0085 (0.8)
1-017: 1H-NMR(400.0 MHz, CDC13):
δ= 8.1334 (5.0); 7.2619 (14.8); 7.0711 (1.0); 7.0575 (1.1); 7.0493 (1.3); 7.0358 (1.2); 6.8608 (1.6); 6.8555 (0.5); 6.8443 (0.5); 6.8389 (2.9); 6.8335 (0.5); 6.8171 (1.3); 3.8812 (0.9); 3.8371 (16.0); 3.7287 (12.6); 3.5879 (3.7); 2.1439 (12.0); -0.0002 (5.2) 1-018: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4938 (1.3); 7.2600 (42.1); 7.1788 (0.7); 7.1759 (1.1); 7.1719 (0.5); 7.1604 (1.9); 7.1578 (2.8); 7.1550 (2.1); 7.1455 (1.0); 7.1402 (3.5); 7.1160 (4.2); 7.1099 (0.9); 7.0993 (2.4); 7.0898 (0.7); 7.0837 (1.5); 6.9786 (0.7); 6.9671 (1.1); 6.9554 (0.6); 4.1302 (1.5); 4.1124 (1.5); 4.0945 (0.5); 3.7359 (16.0); 3.6277 (7.5); 2.1519 (15.9); 2.0432 (6.8); 1.2762 (1.9); 1.2583 (4.4); 1.2404
(1.8); 0.0080 (0.5); -0.0002 (16.0); -0.0085 (0.5)
1-019: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4949 (5.8); 8.4830 (5.9); 7.5184 (0.8); 7.2694 (0.8); 7.2595 (152.1); 7.0774 (1.1); 7.0637 (1.2); 7.0555 (1.5); 7.0419 (1.4); 6.9955 (0.8); 6.9899 (1.7); 6.9780 (3.2); 6.9660 (1.6); 6.8540 (1.8); 6.8486 (0.6); 6.8375 (0.6); 6.8320 (3.2); 6.8264 (0.6); 6.8102
(1.4); 3.7419 (16.0); 3.5964 (4.3); 2.1523 (13.8); 1.5451 (3.6); 0.0080 (1.6); -0.0002 (52.8); -0.0085 (1.6)
1-020: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4799 (4.7); 8.4680 (4.8); 7.2612 (12.5); 7.2065 (1.5); 7.2012 (0.6); 7.1878 (2.2); 7.1847 (2.3); 7.1713 (0.7); 7.1663 (2.0); 6.9766 (1.5); 6.9646 (2.9); 6.9528 (2.3); 6.9346 (1.6); 6.9323 (1.5); 6.9270 (2.4); 6.9242 (2.6); 6.9188 (0.9); 6.9163 (0.8); 6.9135
(0.6); 6.9050 (2.3); 6.9031 (1.8); 5.2970 (1.8); 3.7696 (16.0); 2.1549 (15.6); 1.5793 (1.5); -0.0002 (4.6)
1-023: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3048 (10.6); 7.2596 (46.5); 7.2170 (1.5); 7.2116 (0.6); 7.1984 (2.2); 7.1952 (2.2); 7.1817 (0.7); 7.1768 (2.0); 6.9683 (0.9); 6.9658 (0.6); 6.9499 (1.6); 6.9315 (0.7); 6.9128 (2.1); 6.9101 (2.6); 6.9048 (0.7); 6.8934 (1.2); 6.8907 (2.2); 6.8884 (1.8); 4.1305 (0.6); 4.1126 (0.7); 3.7669 (16.0); 2.1569 (15.6); 2.0434 (3.0); 1.5403 (8.5); 1.2763 (1.0); 1.2585 (2.0); 1.2406 (0.8); 0.8819
(1.0); 0.0079 (0.5); -0.0002 (16.3); -0.0084 (0.5)
1-028: 'H-NMR(599.8 MHz, CDC13):
δ= 8.3588 (0.5); 8.3395 (10.4); 7.2604 (25.4); 6.9696 (0.5); 6.9608 (0.6); 6.9542 (1.1); 6.9454 (1.1); 6.9388 (0.6); 6.9300 (0.6); 6.8020 (0.6); 6.7971 (0.6); 6.7882 (0.6); 6.7837 (1.0); 6.7792 (0.6); 6.7703 (0.6); 6.7654 (0.6); 6.6924 (0.4); 6.6893 (0.4); 6.6876 (0.4); 6.6845 (0.4); 6.6794 (0.5); 6.6769 (0.7); 6.6744 (0.7); 6.6720 (0.6); 6.6694 (0.4); 6.6642 (0.4); 6.6612 (0.4); 6.6594 (0.4); 3.7592 (15.5); 3.6681 (0.7); 2.2079 (14.9); 2.1351 (0.6); 1.5449 (12.9); 0.1574 (0.4); 0.0053 (1.9); -0.0001 (50.0); -0.0056 (1.7)
1-026: 'H-NMR^OO.O MHz, CDC13):
δ= 8.4981 (3.7); 8.4862 (3.8); 7.2607 (40.9); 7.0138 (1.6); 7.0052 (0.7); 7.0018 (3.1); 6.9917 (0.8); 6.9898 (1.7); 6.9823 (1.2); 6.9689 (1.1); 6.9592 (0.6); 6.9458 (0.6); 6.7864 (0.5); 6.7789 (0.6); 6.7654 (0.6); 6.7587 (0.9); 6.7521 (0.6); 6.7386 (0.5); 6.7313 (0.6); 6.6610 (0.5); 6.6575 (0.6); 6.6565 (0.6); 6.6533 (0.8); 6.6491 (0.5); 3.7619 (16.0); 2.9550 (1.2); 2.8839 (1.1); 2.8825 (1.1);
2.2102 (14.5); 1.5552 (0.7); 1.2585 (0.5); -0.0002 (14.5); -0.0085 (0.6)
1-030: Ή-ΝΜϋ^ΟΟ.Ο MHz, CDC13):
δ= 8.4963 (12.2); 7.2603 (38.0); 6.9750 (0.5); 6.9617 (0.6); 6.9520 (1.1); 6.9386 (1.1); 6.9289 (0.7); 6.9156 (0.6); 6.8169 (0.6); 6.8095 (0.6); 6.7961 (0.6); 6.7893 (0.9); 6.7826 (0.7); 6.7692 (0.6); 6.7618 (0.6); 6.6777 (0.6); 6.6743 (0.7); 6.6703 (0.6); 3.7573
(16.0); 2.2050 (14.8); 1.5439 (5.6); -0.0002 (13.0); -0.0085 (0.5)
1-031 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.3314 (2.8); 8.3292 (3.0); 8.2347 (2.4); 8.2282 (2.7); 8.0288 (1.6); 8.0255 (2.0); 8.0225 (2.0); 8.0190 (1.8); 7.2614 (15.9); 6.9550 (0.6); 6.9417 (0.6); 6.9319 (1.2); 6.9187 (1.3); 6.9089 (0.8); 6.8957 (0.7); 6.7986 (0.6); 6.7913 (0.7); 6.7777 (0.7); 6.7709 (1.3); 6.7645 (0.9); 6.7509 (0.6); 6.7437 (0.7); 6.6867 (0.6); 6.6813 (0.5); 6.6692 (0.9); 6.6661 (1.0); 6.6625 (0.9); 6.6449 (0.5);
3.7566 (16.0); 3.6595 (1.1); 2.2104 (15.5); 2.1383 (1.1); 1.5666 (2.6); 1.2559 (0.7); -0.0002 (5.6)
1-033: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3763 (13.5); 7.8789 (0.6); 7.8726 (4.5); 7.8676 (1.8); 7.8631 (4.8); 7.8558 (1.6); 7.8508 (4.9); 7.8447 (0.6); 7.4500 (0.7); 7.4439 (4.9); 7.4388 (1.6); 7.4270 (1.4); 7.4220 (4.4); 7.4159 (0.5); 7.2605 (35.5); 5.2982 (1.0); 3.8895 (16.0); 1.5512 (11.2); -
0.0002 (13.5)
1-034: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.7790 (0.3); 8.6436 (10.8); 8.6231 (0.4); 7.2775 (1.0); 7.2578 (2.4); 7.2384 (1.6); 7.1797 (1.6); 7.1578 (1.0); 7.0302 (1.4); 7.0264 (2.9); 7.0221 (3.7); 7.0029 (1.2); 7.0004 (1.3); 3.9030 (2.7); 3.8392 (0.7); 3.8282 (16.0); 3.3296 (143.7); 2.7403 (0.9); 2.7214 (2.9); 2.7024 (3.0); 2.6833 (1.0); 2.6761 (0.5); 2.6713 (0.6); 2.6669 (0.4); 2.5245 (1.4); 2.5108 (36.5); 2.5067 (73.5); 2.5023 (96.2); 2.4978 (68.4); 2.3336 (0.4); 2.3290 (0.5); 2.3246 (0.4); 1.0785 (3.3); 1.0596 (7.5); 1.0406 (3.2); -0.0002 (1.5) 1-035: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5613 (6.3); 8.5493 (6.4); 7.2683 (1.1); 7.2543 (1.8); 7.2485 (2.9); 7.2425 (3.3); 7.2297 (3.0); 7.1649 (1.5); 7.1625 (1.5); 7.1425 (1.0); 7.0590 (1.6); 7.0544 (3.1); 7.0497 (1.9); 7.0342 (1.6); 7.0144 (1.3); 3.9032 (2.3); 3.8317 (16.0); 3.3290 (131.3); 2.7323 (0.9); 2.7135 (2.9); 2.6944 (3.0); 2.6756 (1.3); 2.5241 (1.3); 2.5065 (67.6); 2.5022 (87.2); 2.4978 (62.1); 2.3290 (0.5);
2.3247 (0.4); 1.0715 (3.3); 1.0526 (7.2); 1.0336 (3.1); -0.0001 (1.6)
1-036: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5495 (2.2); 8.5425 (7.0); 8.5306 (6.5); 7.3437 (0.7); 7.3225 (1.5); 7.3172 (0.8); 7.3011 (1.2); 7.2959 (1.4); 7.2743 (0.7); 7.2593 (0.6); 7.2523 (2.0); 7.2474 (1.2); 7.2404 (3.4); 7.2284 (1.6); 7.0947 (0.9); 7.0888 (0.8); 7.0759 (1.1); 7.0698 (1.2); 7.0607 (0.9); 7.0479 (0.9); 7.0422 (0.7); 6.8734 (1.1); 6.8675 (1.2); 6.8629 (1.0); 6.8570 (1.0); 6.8516 (1.0); 6.8454 (1.0); 3.9102 (0.4); 3.9033 (1.1); 3.7909 (5.7); 3.7840 (16.0); 3.3317 (26.2); 3.3249 (72.6); 3.1753 (0.4); 3.1623 (0.4); 2.6756 (0.5); 2.6712 (0.5);
2.5066 (89.6); 2.5023 (95.2); 2.4980 (62.5); 2.3294 (0.6); 2.2839 (5.7); 2.2770 (15.7); 0.0070 (0.6); -0.0002 (1.9)
1-037: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6609 (10.8); 7.3618 (0.6); 7.3404 (1.2); 7.3355 (0.7); 7.3188 (0.7); 7.3139 (1.2); 7.2924 (0.6); 7.1158 (0.6); 7.1100 (0.7); 7.0973 (0.6); 7.0914 (0.8); 7.0882 (0.8); 7.0823 (0.7); 7.0696 (0.6); 7.0637 (0.6); 6.8874 (0.4); 6.8835 (0.6); 6.8777 (0.8); 6.8735 (0.6); 6.8673 (0.6); 6.8615 (0.6); 6.8560 (0.7); 6.8516 (0.6); 3.9033 (1.0); 3.8159 (16.0); 3.3245 (68.2); 2.7376 (0.8); 2.7186 (2.8); 2.6995 (2.9); 2.6805 (1.0); 2.6712 (0.5); 2.6667 (0.4); 2.5244 (1.1); 2.5110 (29.9); 2.5066 (61.8); 2.5021 (81.7); 2.4976
(57.9); 2.4933 (27.4); 2.3331 (0.3); 2.3287 (0.4); 2.3244 (0.3); 1.0794 (3.2); 1.0605 (7.3); 1.0415 (3.0); -0.0002 (1.2)
1-038: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5467 (11.9); 8.5347 (12.1); 8.1653 (10.4); 7.2528 (3.1); 7.2408 (6.0); 7.2289 (3.0); 7.1287 (0.4); 7.1141 (1.2); 7.1055 (11.3); 7.1037 (11.1); 7.0912 (6.8); 7.0870 (3.2); 7.0828 (7.0); 7.0754 (0.8); 7.0671 (0.5); 7.0598 (0.8); 4.1446 (1.9); 4.1264 (6.1); 4.1083 (6.2); 4.0901 (2.0); 3.9031 (1.6); 3.3268 (159.2); 2.6753 (0.5); 2.6711 (0.7); 2.6665 (0.5); 2.5243 (1.7); 2.5108 (45.1); 2.5064 (93.1); 2.5019 (122.7); 2.4974 (86.3); 2.4929 (40.2); 2.3331 (0.5); 2.3286 (0.7); 2.3240 (0.5); 1.4210 (7.3); 1.4028 (16.0);
1.3847 (7.1); -0.0002 (1.0)
1-039: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5467 (6.6); 8.5347 (6.8); 8.1978 (6.2); 7.2502 (1.7); 7.2382 (3.3); 7.2263 (1.7); 7.1023 (12.6); 7.0848 (7.5); 4.4916 (0.4); 4.4750 (1.0); 4.4584 (1.4); 4.4419 (1.0); 4.4253 (0.4); 3.9030 (0.8); 3.3252 (70.8); 2.6708 (0.4); 2.5241 (1.0); 2.5107 (27.6);
2.5063 (57.3); 2.5018 (75.8); 2.4973 (53.6); 2.4928 (25.3); 2.3286 (0.4); 1.4474 (16.0); 1.4308 (15.8); -0.0002 (1.3)
1-040: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6398 (13.0); 8.2403 (5.8); 7.3084 (4.0); 7.2869 (4.9); 7.0675 (0.6); 7.0607 (4.9); 7.0559 (1.6); 7.0392 (4.2); 7.0322 (0.5); 4.5056 (0.4); 4.4890 (1.0); 4.4724 (1.4); 4.4557 (1.1); 4.4393 (0.4); 3.9031 (0.9); 3.3230 (45.1); 2.6749 (0.4); 2.6707 (0.5); 2.5061 (73.6); 2.5018 (94.5); 2.4974 (68.4); 2.3329 (0.4); 2.3286 (0.5); 2.3238 (0.4); 1.4516 (16.0); 1.4350 (15.8); -0.0002 (1.5) 1-041 : 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5516 (11.1); 8.5397 (11.4); 8.1831 (10.3); 7.3052 (7.5); 7.3007 (2.6); 7.2884 (2.8); 7.2838 (9.2); 7.2769 (1.2); 7.2571 (2.9); 7.2452 (5.5); 7.2332 (2.8); 7.0869 (1.1); 7.0800 (9.3); 7.0753 (2.9); 7.0631 (2.5); 7.0585 (7.7); 7.0513 (0.8); 4.1563 (2.1); 4.1382
(6.5) ; 4.1200 (6.7); 4.1019 (2.2); 3.9032 (1.5); 3.3233 (69.8); 2.6748 (0.6); 2.6708 (0.9); 2.5061 (122.1); 2.5018 (159.6); 2.4975
(116.0); 2.3325 (0.7); 2.3285 (0.9); 2.3241 (0.7); 1.4273 (7.6); 1.4091 (16.0); 1.3910 (7.4); 1.2349 (0.3); -0.0001 (2.5)
1-042: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5492 (11.0); 8.5372 (11.4); 8.1576 (10.0); 7.2480 (4.8); 7.2356 (6.8); 7.2306 (6.6); 7.2240 (3.7); 7.2111 (4.6); 7.1268 (2.2); 7.1083 (3.3); 7.0900 (1.3); 7.0680 (5.2); 7.0650 (6.4); 7.0469 (5.1); 4.1550 (2.0); 4.1369 (6.5); 4.1188 (6.6); 4.1006 (2.2); 3.9030
(1.6) ; 3.3278 (167.9); 2.6709 (0.8); 2.6665 (0.6); 2.5237 (1.9); 2.5061 (108.9); 2.5017 (144.3); 2.4973 (104.4); 2.3328 (0.6); 2.3283 (0.8); 2.3243 (0.6); 1.4283 (7.5); 1.4101 (16.0); 1.3920 (7.3); 1.2341 (0.4); -0.0002 (1.9)
1-043: 'H-NMR^O.O MHz, de-DMSO):
δ= 8.6259 (10.5); 8.2111 (5.6); 7.1021 (10.7); 7.0845 (11.8); 4.4901 (0.4); 4.4737 (1.0); 4.4570 (1.4); 4.4405 (1.0); 4.4239 (0.4); 3.9031 (0.8); 3.3270 (67.1); 2.6710 (0.4); 2.5241 (1.1); 2.5107 (28.6); 2.5064 (58.5); 2.5020 (77.3); 2.4975 (55.1); 2.4932 (26.3);
2.3286 (0.4); 1.4436 (16.0); 1.4270 (15.8); -0.0002 (1.2)
1-044: Ή-ΝΜϋ^ΟΟ.Ο MHz, CDC13):
δ= 8.4791 (4.4); 8.4672 (4.4); 7.2620 (29.1); 7.0803 (0.6); 7.0647 (0.7); 7.0589 (1.1); 7.0433 (1.1); 7.0385 (0.6); 7.0367 (0.5); 7.0210 (0.6); 7.0171 (1.8); 7.0051 (3.3); 6.9931 (1.7); 6.7384 (0.6); 6.7320 (0.8); 6.7166 (0.7); 6.7144 (0.5); 6.7097 (1.7); 6.7078 (1.6); 6.6872 (2.0); 6.6802 (0.7); 6.6779 (0.5); 6.6669 (0.6); 6.6642 (0.5); 3.8131 (16.0); 3.7879 (1.3); 2.9554 (3.2); 2.8837 (2.8);
2.8824 (2.7); 2.3430 (13.4); 2.2935 (1.1); 1.5777 (1.1); -0.0002 (9.9)
1-045: 1H-NMR(400.1 MHz, de-DMSO):
δ= 8.5522 (6.2); 8.5403 (6.3); 7.2614 (1.7); 7.2495 (3.2); 7.2375 (1.6); 6.9957 (0.4); 6.9904 (0.8); 6.9850 (0.5); 6.9727 (0.8); 6.9673 (1.5); 6.9619 (0.9); 6.9496 (0.5); 6.9441 (0.8); 6.9387 (0.4); 6.7559 (0.4); 6.7393 (2.5); 6.7239 (2.5); 6.7193 (2.0); 6.7070
(0.4); 3.9756 (0.3); 3.8019 (16.0); 2.5019 (13.6); 2.2743 (15.7); -0.0010 (2.4)
1-046: 1H-NMR(400.1 MHz, de-DMSO):
δ= 8.5854 (4.1); 8.5745 (6.6); 8.5639 (4.2); 7.2802 (1.1); 7.2682 (2.1); 7.2563 (1.1); 7.2374 (1.1); 7.2253 (2.1); 7.2132 (1.0);
3.7911 (10.6); 3.6170 (16.0); 2.5099 (20.0); 2.2592 (10.3); 1.2423 (1.2)
1-047: 1H-NMR(400.1 MHz, de-DMSO):
δ= 11.2495 (3.0); 7.2917 (0.8); 7.2853 (0.9); 7.2674 (1.4); 7.2615 (1.4); 7.2437 (0.8); 7.2373 (0.8); 7.1535 (0.7); 7.1373 (0.8); 7.1315 (1.5); 7.1156 (1.5); 7.1098 (1.0); 7.0937 (0.8); 7.0006 (0.9); 6.9949 (0.8); 6.9792 (1.4); 6.9735 (1.4); 6.9579 (0.6); 6.9518
(0.6); 3.7716 (16.0); 2.5058 (15.9); 2.3047 (15.2); 1.2332 (1.4); -0.0012 (2.1)
1-048: 1H-NMR(400.1 MHz, de-DMSO):
δ= 8.2040 (2.6); 8.1912 (2.6); 7.5036 (2.1); 7.4909 (2.0); 7.2987 (3.9); 7.0775 (0.7); 7.0706 (0.5); 7.0547 (4.5); 7.0471 (4.6);
7.0332 (8.6); 3.8728 (16.0); 3.7731 (15.2); 2.5017 (19.0); 2.2902 (14.8); -0.0011 (2.9)
1-049: 1H-NMR(400.0 MHz, CDC13):
δ= 8.6013 (0.7); 8.5893 (0.7); 8.4459 (5.2); 8.4339 (5.3); 7.2605 (23.7); 7.1881 (0.9); 7.1836 (1.4); 7.1779 (0.6); 7.1690 (1.4); 7.1664 (3.1); 7.1628 (2.6); 7.1573 (1.8); 7.1546 (2.1); 7.1492 (0.6); 7.1424 (0.8); 7.1394 (1.8); 7.1373 (2.8); 7.1328 (1.0); 7.1223 (0.8); 7.1184 (1.2); 7.0984 (0.9); 7.0942 (1.4); 7.0895 (0.7); 7.0837 (0.6); 7.0785 (0.9); 7.0766 (1.0); 6.9990 (1.6); 6.9871 (3.0); 6.9751 (1.5); 4.2019 (1.7); 4.1821 (15.9); 4.1596 (1.2); 3.9473 (1.7); 3.8882 (1.0); 3.8105 (16.0); 1.5506 (1.7); -0.0002 (8.9) 1-050: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4834 (5.2); 8.4714 (5.3); 7.2608 (22.8); 7.0491 (1.6); 7.0461 (0.7); 7.0371 (2.9); 7.0336 (0.6); 7.0252 (1.8); 6.9629 (0.9); 6.9487 (1.6); 6.9449 (1.4); 6.9379 (0.9); 6.9325 (1.2); 6.9282 (1.3); 4.1879 (16.0); 4.1350 (0.5); 3.9048 (0.5); 3.8617 (16.0);
1.5457 (3.4); -0.0002 (8.6)
1-051 : 1H-NMR(400.0 MHz, CDC13):
δ= 7.2593 (50.1); 7.2069 (1.0); 7.2048 (1.4); 7.2006 (0.6); 7.1942 (0.6); 7.1858 (2.4); 7.1838 (3.0); 7.1810 (1.6); 7.1781 (2.0); 7.1731 (1.7); 7.1676 (4.0); 7.1043 (4.6); 7.1026 (4.7); 7.0982 (1.3); 7.0875 (2.6); 7.0846 (3.6); 7.0828 (3.0); 7.0687 (0.6); 7.0655 (0.8); 6.8002 (2.1); 6.7908 (2.0); 3.8079 (16.0); 2.2935 (13.9); 2.0433 (0.6); 1.5420 (9.1); 1.2585 (0.6); 0.8819 (0.7); 0.0079
(0.7); -0.0002 (18.0); -0.0085 (0.8)
1-052: 1H-NMR(400.0 MHz, CDC13):
δ= 8.6145 (0.6); 8.6026 (0.7); 8.5019 (5.2); 8.4899 (5.4); 8.2274 (1.9); 8.2207 (2.0); 7.2634 (14.5); 7.2348 (0.7); 7.2274 (0.7); 7.2130 (1.3); 7.2057 (1.3); 7.1925 (0.9); 7.1852 (0.8); 7.0346 (1.6); 7.0226 (3.0); 7.0107 (1.6); 6.9977 (1.4); 6.9874 (1.4); 6.9755
(1.1); 6.9653 (1.1); 5.2988 (2.5); 3.8651 (16.0); 3.8394 (2.2); 2.3293 (2.6); 2.3215 (15.9); 1.5884 (1.0); -0.0002 (5.2)
1-053: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4263 (2.3); 8.4143 (2.4); 7.2615 (5.5); 7.1701 (0.8); 7.1667 (0.5); 7.1513 (0.9); 7.1492 (0.6); 7.0913 (0.6); 7.0873 (1.2); 7.0836 (1.2); 7.0663 (0.8); 7.0632 (0.5); 6.9930 (0.6); 6.9811 (1.3); 6.9691 (0.6); 5.2976 (1.4); 2.6258 (6.3); 1.6537 (16.0);
1.5730 (0.7); -0.0002 (2.5)
1-054: 'H-NMR(601.6 MHz, CD3CN):
δ= 8.4096 (0.5); 8.4016 (0.5); 8.3814 (5.4); 8.3734 (5.4); 7.8590 (1.7); 7.7525 (1.0); 7.7379 (0.9); 7.3919 (1.3); 7.3778 (1.1); 7.0824 (0.4); 7.0793 (1.6); 7.0714 (3.1); 7.0634 (1.5); 3.8437 (16.0); 3.8369 (1.7); 2.5350 (0.7); 2.3033 (15.7); 2.3000 (2.2); 2.2428 (0.4); 2.2304 (0.4); 2.1907 (14.6); 2.1459 (0.4); 1.9925 (2.6); 1.9844 (1.3); 1.9802 (1.5); 1.9764 (5.9); 1.9723 (9.5);
1.9682 (13.6); 1.9641 (9.3); 1.9600 (4.7)
1-058: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4615 (5.6); 8.4495 (5.8); 7.2648 (9.5); 7.1222 (2.5); 7.1169 (1.0); 7.1057 (1.2); 7.1002 (4.4); 7.0940 (0.6); 7.0522 (0.7); 7.0461 (4.6); 7.0405 (1.2); 7.0293 (0.9); 7.0240 (2.5); 6.9940 (1.6); 6.9820 (3.1); 6.9700 (1.6); 3.8549 (16.0); 2.7521 (0.8);
2.7330 (2.8); 2.7139 (2.8); 2.6949 (0.9); 2.1684 (2.6); 1.1401 (3.0); 1.1211 (6.7); 1.1020 (2.9); -0.0002 (3.6)
1-059: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3768 (1.5); 8.3672 (13.2); 7.5844 (0.6); 7.5783 (4.0); 7.5735 (1.4); 7.5617 (1.6); 7.5563 (8.3); 7.3959 (0.7); 7.3899 (5.0); 7.3849 (1.6); 7.3732 (1.3); 7.3683 (4.0); 7.3622 (0.6); 7.2604 (68.4); 3.8899 (1.6); 3.8598 (16.0); 1.5546 (6.6); 1.3331 (1.4);
1.2843 (1.9); 1.2555 (3.3); 0.8801 (0.6); 0.0080 (0.8); -0.0002 (25.4); -0.0084 (1.0)
1-060: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3685 (14.0); 7.2678 (0.6); 7.2670 (0.6); 7.2662 (0.7); 7.2654 (0.9); 7.2645 (1.2); 7.2605 (65.2); 7.2564 (0.7); 7.0798 (1.9); 7.0743 (0.7); 7.0671 (2.0); 7.0630 (0.8); 7.0616 (0.8); 7.0573 (2.4); 7.0501 (0.8); 7.0446 (2.4); 6.8984 (2.4); 6.8927 (0.7); 6.8815 (0.7); 6.8770 (3.3); 6.8761 (3.0); 6.8714 (0.7); 6.8601 (0.6); 6.8546 (1.9); 3.8188 (16.0); 2.3152 (15.5); 1.5434 (8.9); 1.1902
(0.5); 0.0080 (0.8); -0.0002 (30.2); -0.0085 (0.8)
1-061 : 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.2727 (6.1); 7.2699 (0.5); 7.2503 (1.1); 7.2307 (0.8); 7.1683 (0.8); 7.1490 (0.5); 7.1464 (0.5); 7.0237 (1.5); 7.0197 (1.8); 7.0007 (0.6); 6.9985 (0.6); 3.9031 (0.4); 3.8155 (16.0); 3.3244 (32.3); 2.7285 (0.4); 2.7093 (1.4); 2.6904 (1.4); 2.6711 (0.6); 2.5061 (32.6); 2.5018 (42.0); 2.4974 (30.4); 1.0717 (1.6); 1.0529 (3.4); 1.0338 (1.5); -0.0002 (0.4)
1-062: 'H-NMR^O.O MHz, de-DMSO):
δ= 8.5628 (6.2); 8.5508 (6.4); 7.3539 (0.6); 7.3325 (1.2); 7.3275 (0.7); 7.3110 (0.8); 7.3059 (1.2); 7.2844 (0.6); 7.2592 (1.6); 7.2473 (3.1); 7.2353 (1.6); 7.1248 (0.7); 7.1190 (0.7); 7.1062 (0.7); 7.1003 (0.8); 7.0969 (0.8); 7.0910 (0.7); 7.0781 (0.7); 7.0725 (0.7); 6.8985 (0.6); 6.8935 (0.8); 6.8891 (0.7); 6.8824 (0.6); 6.8774 (0.6); 6.8715 (0.7); 6.8665 (0.6); 3.9031 (1.8); 3.8195 (16.0); 3.3267 (96.9); 2.7331 (0.9); 2.7139 (2.9); 2.6949 (3.0); 2.6759 (1.3); 2.5243 (1.2); 2.5064 (63.3); 2.5021 (83.5); 2.4977 (60.2);
2.3330 (0.3); 2.3290 (0.5); 1.0763 (3.2); 1.0574 (7.3); 1.0383 (3.1); -0.0002 (1.8)
1-063: Ή-ΝΜϋ^ΟΟ.Ο MHz, de-DMSO):
δ= 8.5581 (6.1); 8.5462 (6.2); 7.2413 (3.0); 7.2292 (3.4); 7.2225 (3.4); 7.2177 (2.4); 7.2031 (2.4); 7.1140 (1.1); 7.0956 (1.8); 7.0774 (0.6); 7.0472 (2.7); 7.0443 (3.3); 7.0260 (2.7); 3.9030 (1.3); 3.8127 (16.0); 3.3245 (55.9); 2.7237 (0.8); 2.7047 (2.9); 2.6856 (3.0); 2.6666 (1.2); 2.5240 (1.0); 2.5102 (26.6); 2.5061 (54.5); 2.5017 (72.1); 2.4972 (51.5); 2.4930 (24.7); 2.3284 (0.4);
1.0584 (3.2); 1.0395 (7.3); 1.0205 (3.1); -0.0002 (1.9)
1-064: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5594 (6.2); 8.5475 (6.3); 7.2486 (1.6); 7.2367 (3.1); 7.2248 (1.6); 7.0931 (12.1); 7.0756 (9.5); 3.9031 (1.8); 3.8028 (16.0); 3.3269 (84.2); 2.7317 (0.9); 2.7127 (2.9); 2.6937 (3.0); 2.6749 (1.3); 2.5063 (61.2); 2.5020 (78.5); 2.4976 (55.8); 2.3288 (0.4);
1.0590 (3.3); 1.0401 (7.4); 1.0211 (3.2); -0.0002 (1.4)
1-065: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6280 (11.5); 7.4363 (1.4); 7.4295 (1.5); 7.4148 (1.5); 7.4080 (1.5); 7.1713 (0.7); 7.1645 (0.7); 7.1494 (1.4); 7.1428 (1.3); 7.1281 (0.9); 7.1213 (0.8); 6.8922 (1.6); 6.8776 (1.6); 6.8698 (1.4); 6.8553 (1.4); 3.9033 (1.0); 3.7932 (16.0); 3.3241 (62.4);
2.6710 (0.5); 2.5240 (1.5); 2.5063 (71.0); 2.5020 (93.7); 2.4977 (68.8); 2.3286 (0.5); 2.2642 (15.8); -0.0002 (1.3)
1-066: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.2478 (10.8); 7.2973 (0.4); 7.2907 (3.6); 7.2862 (1.2); 7.2692 (4.3); 7.2623 (0.5); 7.0256 (0.5); 7.0185 (4.3); 7.0138 (1.3); 7.0016 (1.2); 6.9971 (3.7); 6.9900 (0.4); 3.9035 (0.8); 3.8120 (16.0); 3.7656 (13.1); 3.3251 (40.8); 2.6707 (0.4); 2.5063 (56.4);
2.5021 (73.2); 2.4979 (53.3); 2.3329 (0.3); 2.3285 (0.4); 2.2585 (13.0); 0.0001 (1.0)
1-067: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5487 (6.5); 8.5368 (6.7); 8.1029 (5.4); 7.2496 (2.6); 7.2380 (3.5); 7.2280 (4.0); 7.2266 (4.0); 7.2094 (2.7); 7.1276 (1.3); 7.1093 (1.9); 7.0908 (0.7); 7.0722 (3.1); 7.0692 (3.7); 7.0511 (3.0); 3.9029 (0.9); 3.8481 (16.0); 3.3281 (83.8); 2.6708 (0.4);
2.5061 (53.5); 2.5018 (69.3); 2.4974 (49.8); 2.3287 (0.4); -0.0002 (0.9)
1-069: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4705 (3.8); 8.4586 (3.9); 7.2620 (15.4); 7.0943 (0.7); 7.0747 (2.1); 7.0552 (1.8); 7.0473 (1.0); 7.0428 (2.4); 7.0388 (1.7); 7.0303 (1.3); 7.0270 (1.8); 7.0221 (1.0); 7.0107 (0.7); 7.0075 (0.7); 7.0058 (0.6); 6.9897 (1.6); 6.9777 (3.1); 6.9717 (1.3); 6.9659
(2.0) ; 6.9526 (0.8); 6.9493 (0.9); 6.9483 (0.9); 6.9450 (0.7); 3.8472 (16.0); 2.3036 (15.6); 1.5771 (2.4); -0.0002 (5.4)
1-070: 1H-NMR(400.2 MHz, de-DMSO):
δ= 8.4737 (4.7); 8.4713 (4.8); 8.4693 (4.4); 8.4633 (4.4); 8.4614 (4.9); 8.4590 (4.6); 8.0291 (5.4); 8.0083 (9.2); 7.9628 (4.1); 7.9581 (4.2); 7.9446 (4.7); 7.9401 (5.0); 7.9376 (3.1); 7.9238 (2.6); 7.9191 (2.6); 7.3011 (4.0); 7.2984 (4.1); 7.2887 (4.1); 7.2861 (4.6); 7.2830 (4.4); 7.2805 (4.0); 7.2707 (4.4); 7.2679 (4.6); 7.2642 (7.1); 7.2589 (3.3); 7.2511 (7.6); 7.2474 (4.8); 7.2456 (4.7); 7.2419 (10.3); 7.2343 (4.2); 7.2288 (9.5); 7.2210 (1.2); 7.1611 (1.4); 7.1533 (9.9); 7.1478 (3.1); 7.1362 (3.6); 7.1311 (16.0); 7.1257 (3.4); 7.1142 (2.8); 7.1089 (6.7); 7.1010 (0.7); 5.7570 (1.6); 4.0846 (7.0); 4.0674 (14.5); 4.0502 (7.2); 3.3218 (68.7); 2.9148 (5.7); 2.8970 (10.0); 2.8777 (6.6); 2.7047 (0.5); 2.6694 (0.4); 2.6645 (0.3); 2.5090 (25.5); 2.5047 (50.2); 2.5003 (66.2); 2.4958 (47.6); 2.4915 (22.5); 2.3965 (1.8); 2.3790 (5.5); 2.3608 (7.4); 2.3426 (4.9); 2.3250 (1.6); 2.0738 (3.1); 1.2331 (1.4);
0.0066 (2.0); -0.0014 (40.2); -0.0096 (1.6)
1-071 : 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5998 (11.3); 7.2003 (0.7); 7.1976 (0.7); 7.1801 (1.2); 7.1761 (0.8); 7.1663 (0.7); 7.1621 (0.8); 7.1571 (1.1); 7.1537 (1.3); 7.1363 (0.7); 7.1319 (1.3); 7.1285 (1.3); 7.1110 (0.6); 7.1082 (0.6); 7.0977 (1.0); 7.0942 (0.9); 7.0781 (1.7); 7.0604 (0.9); 7.0567 (0.8); 6.9099 (0.9); 6.9061 (0.9); 6.8901 (1.6); 6.8863 (1.6); 6.8704 (0.8); 6.8667 (0.7); 3.9032 (1.5); 3.7819 (16.0); 3.3287 (120.4); 3.1746 (0.4); 3.1616 (0.4); 2.6757 (0.4); 2.6712 (0.5); 2.6668 (0.4); 2.5065 (65.0); 2.5021 (84.6); 2.4978 (61.2); 2.3291
(0.5); 2.2923 (15.6); -0.0002 (1.0)
1-072: 1H-NMR(400.1 MHz, de-DMSO):
δ= 8.7797 (0.5); 8.5882 (11.7); 7.4866 (3.0); 7.4738 (4.5); 7.3187 (3.8); 7.3078 (1.7); 7.2961 (1.0); 3.8069 (16.0); 3.7363 (0.8);
3.3416 (12.4); 2.5092 (3.7); 2.2988 (15.8); 2.2662 (0.8)
1-073: 1H-NMR(400.1 MHz, de-DMSO):
δ= 8.6328 (11.5); 8.3124 (1.5); 8.3026 (1.5); 8.3006 (1.5); 7.6464 (0.8); 7.6419 (0.9); 7.6267 (1.6); 7.6224 (1.6); 7.6076 (1.0); 7.6030 (0.9); 7.1156 (1.3); 7.1034 (1.3); 7.0974 (1.3); 7.0851 (1.2); 6.9120 (2.2); 6.8918 (2.1); 3.7976 (16.0); 3.3369 (66.8); 3.3119 (0.5); 2.8900 (0.8); 2.7306 (0.7); 2.5064 (10.0); 2.5023 (13.2); 2.4982 (9.8); 2.2686 (15.7); 1.2982 (0.4); 1.2575 (0.6);
1.2336 (1.7); -0.0010 (0.7)
1-074: 1H-NMR(400.1 MHz, de-DMSO):
δ= 11.2511 (3.0); 8.5750 (1.8); 7.1747 (1.6); 7.1612 (2.0); 7.1527 (3.4); 7.1396 (3.1); 7.1085 (3.2); 7.0865 (4.7); 7.0645 (1.8);
3.7767 (16.0); 2.5018 (45.6); 2.2687 (15.4); 1.2335 (2.0); -0.0013 (7.9)
1-075: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4359 (5.5); 8.4240 (5.6); 7.2981 (1.8); 7.2918 (1.6); 7.2888 (2.1); 7.2801 (3.4); 7.2787 (3.7); 7.2749 (2.3); 7.2708 (3.4); 7.2646 (2.0); 7.2588 (27.0); 7.2487 (0.6); 7.0941 (0.5); 7.0887 (1.3); 7.0852 (1.4); 7.0839 (1.3); 7.0754 (9.7); 7.0667 (1.9); 7.0633 (1.2); 7.0591 (0.6); 7.0562 (0.6); 7.0464 (0.6); 6.9890 (1.5); 6.9770 (3.0); 6.9651 (1.5); 5.2965 (1.2); 5.2605 (7.8); 4.1856
(1.1) ; 4.1778 (16.0); 1.5440 (3.6); -0.0002 (5.6)
1-076: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3902 (12.8); 7.9423 (1.9); 7.9406 (2.0); 7.9394 (2.3); 7.9356 (1.2); 7.9268 (0.7); 7.9217 (3.3); 7.9181 (2.2); 7.5637 (0.5); 7.5454 (1.5); 7.5398 (0.5); 7.5302 (0.8); 7.5268 (1.5); 7.5235 (0.8); 7.4885 (2.1); 7.4849 (1.0); 7.4728 (1.6); 7.4691 (3.1); 7.4655 (0.7); 7.4513 (1.2); 7.4484 (0.8); 7.2602 (38.1); 5.2982 (0.6); 3.7846 (0.6); 3.7571 (16.0); 3.7027 (1.9); 2.5616 (15.8); 2.2933 (0.6); -0.0002 (15.1)
1-077: 'H-NMR(400.0 MHz, CDC13):
δ= 8.4682 (3.6); 8.4563 (3.7); 7.2615 (14.5); 7.2209 (1.8); 7.2157 (0.8); 7.2080 (1.9); 7.2040 (1.1); 7.2026 (1.0); 7.1987 (2.1); 7.1912 (0.9); 7.1858 (1.9); 7.0321 (1.4); 7.0202 (2.7); 7.0082 (1.4); 6.8597 (2.0); 6.8542 (0.8); 6.8427 (0.7); 6.8381 (3.5); 6.8329
(1.0) ; 6.8215 (0.6); 6.8160 (1.7); 5.2983 (0.8); 4.1668 (16.0); 3.8611 (16.0); -0.0002 (5.3)
1-079: Ή-ΝΜϋ^ΟΟ.Ο MHz, CDC13):
δ= 8.9655 (14.8); 7.4126 (2.1); 7.4090 (3.4); 7.4069 (3.0); 7.4018 (3.3); 7.3985 (2.2); 7.3964 (3.5); 7.3944 (3.3); 7.3881 (0.6); 7.3821 (0.8); 7.3801 (1.2); 7.3754 (1.2); 7.3734 (1.0); 7.3700 (0.7); 7.3583 (0.6); 7.2586 (38.7); 7.1467 (0.7); 7.1446 (1.2); 7.1284 (1.9); 7.1252 (1.9); 7.1234 (1.8); 7.1209 (0.7); 7.1124 (0.8); 7.1072 (2.2); 7.1022 (0.6); 7.0460 (3.4); 7.0419 (1.8); 7.0404 (1.6); 7.0373 (0.5); 7.0318 (0.7); 7.0293 (1.0); 7.0274 (2.3); 7.0265 (2.1); 7.0244 (2.2); 7.0219 (1.5); 7.0040 (0.6); 5.3576 (8.8);
5.2967 (1.9); 3.8365 (16.0); 2.3161 (15.3); 1.5424 (1.2); -0.0002 (14.7)
1-080: 1H-NMR(400.0 MHz, CDC13):
δ= 8.9595 (11.4); 7.2596 (44.5); 7.1740 (0.6); 7.1718 (0.8); 7.1582 (0.7); 7.1558 (1.2); 7.1524 (1.9); 7.1488 (0.9); 7.1400 (0.6); 7.1347 (1.6); 7.1328 (1.5); 7.0823 (0.8); 7.0797 (1.0); 7.0701 (0.8); 7.0660 (3.1); 7.0614 (1.9); 7.0497 (0.8); 7.0457 (2.3); 7.0436
(1.3) ; 5.2979 (0.7); 3.9261 (16.0); 3.8426 (13.5); 2.3191 (12.9); 0.0079 (0.5); -0.0002 (17.1); -0.0085 (0.5)
1-081 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.4246 (6.0); 8.4126 (6.2); 7.2616 (13.1); 7.1696 (0.7); 7.1677 (0.9); 7.1537 (0.7); 7.1514 (1.3); 7.1484 (1.8); 7.1475 (1.7); 7.1450 (1.1); 7.1358 (0.6); 7.1303 (1.6); 7.1286 (1.7); 7.0687 (0.8); 7.0661 (1.0); 7.0567 (0.8); 7.0538 (2.6); 7.0523 (3.0); 7.0478
(2.1) ; 7.0375 (0.8); 7.0363 (0.8); 7.0321 (2.8); 7.0306 (1.4); 6.9612 (1.7); 6.9492 (3.3); 6.9373 (1.7); 5.2968 (2.0); 4.3645 (1.9); 4.3475 (4.2); 4.3305 (2.0); 3.6936 (15.2); 3.0004 (1.8); 2.9834 (3.8); 2.9664 (1.7); 2.3574 (16.0); 2.0425 (1.0); 1.5885 (0.7);
1.2577 (0.6); -0.0002 (5.2)
1-082: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4268 (3.9); 8.4149 (3.9); 7.2600 (33.1); 7.1689 (0.6); 7.1670 (0.9); 7.1527 (0.5); 7.1505 (0.9); 7.1487 (1.3); 7.1458 (2.1); 7.1357 (0.5); 7.1295 (1.8); 7.1282 (1.5); 7.0647 (3.3); 7.0592 (0.8); 7.0511 (0.6); 7.0467 (2.6); 7.0436 (1.4); 6.9568 (1.3); 6.9448
(2.4) ; 6.9329 (1.2); 4.2472 (1.6); 4.2338 (3.1); 4.2201 (1.8); 3.7964 (1.7); 3.7828 (3.0); 3.7694 (1.5); 3.3373 (16.0); 2.3317
(13.8); -0.0002 (12.4)
1-083: !H-NMR^OCO MHZ, CDC13):
δ= 8.4279 (5.8); 8.4160 (6.0); 7.3599 (1.4); 7.3563 (1.7); 7.3514 (6.0); 7.3459 (5.6); 7.3350 (0.8); 7.3238 (0.5); 7.2593 (45.7); 7.1554 (0.6); 7.1531 (1.0); 7.1405 (0.5); 7.1367 (1.0); 7.1340 (1.9); 7.1316 (1.6); 7.1161 (2.3); 7.0658 (2.8); 7.0628 (3.3); 7.0555 (0.9); 7.0529 (0.7); 7.0473 (2.3); 7.0430 (1.9); 7.0400 (1.4); 7.0302 (0.6); 6.9678 (1.6); 6.9559 (3.1); 6.9439 (1.6); 5.2337 (7.2);
4.9171 (8.1); 2.2524 (16.0); 1.5530 (1.6); 0.0080 (0.7); -0.0002 (22.8); -0.0084 (0.8)
1-086: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2407 (1.2); 8.2387 (1.2); 7.8571 (0.8); 7.8519 (0.8); 7.8509 (0.8); 7.8365 (0.9); 7.8354 (0.9); 7.8303 (0.8); 7.2597 (21.4); 7.0628 (1.5); 7.0460 (2.0); 7.0409 (2.0); 7.0333 (2.0); 7.0293 (1.0); 7.0280 (1.0); 7.0237 (2.4); 7.0164 (0.9); 7.0110 (2.3); 6.8825 (2.4); 6.8769 (0.7); 6.8656 (0.8); 6.8610 (3.4); 6.8557 (0.8); 6.8444 (0.6); 6.8389 (1.8); 3.8259 (1.2); 3.8199 (16.0); 2.3341 (0.9);
2.3225 (15.4); -0.0002 (9.4)
1-087: 1H-NMR(400.6 MHz, CDC13):
δ= 8.4702 (5.8); 8.4582 (6.0); 7.2629 (7.0); 7.1007 (1.9); 7.0953 (0.8); 7.0879 (2.0); 7.0838 (1.0); 7.0826 (0.9); 7.0784 (2.4); 7.0710 (0.8); 7.0656 (2.2); 7.0000 (1.9); 6.9881 (3.6); 6.9762 (1.8); 6.8815 (2.3); 6.8759 (0.7); 6.8646 (0.8); 6.8598 (3.6); 6.8546
(0.7); 6.8432 (0.6); 6.8378 (1.8); 3.8198 (16.0); 2.3090 (15.9); -0.0002 (5.9)
1-088: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.2704 (11.2); 7.2412 (1.2); 7.2371 (0.5); 7.2225 (2.6); 7.2030 (2.0); 7.1160 (1.0); 7.0976 (1.4); 7.0792 (0.6); 7.0314 (2.2); 7.0283 (2.7); 7.0102 (2.2); 3.9029 (1.1); 3.8116 (16.0); 3.7967 (13.4); 3.3249 (54.5); 2.7182 (0.7); 2.6992 (2.3); 2.6802 (2.5); 2.6707 (0.5); 2.6614 (0.8); 2.5240 (0.9); 2.5105 (22.6); 2.5061 (47.0); 2.5016 (62.2); 2.4971 (43.9); 2.4927 (20.6); 2.3284 (0.4);
1.0583 (2.6); 1.0394 (5.9); 1.0204 (2.5); -0.0002 (0.7)
1-089: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.2488 (11.0); 7.0998 (0.8); 7.0937 (0.4); 7.0773 (3.2); 7.0622 (1.0); 7.0560 (5.6); 7.0427 (3.2); 7.0343 (1.1); 7.0270 (0.4); 7.0200 (0.6); 3.9031 (1.1); 3.8133 (16.0); 3.7546 (13.4); 3.3245 (61.4); 3.1747 (0.4); 3.1617 (0.4); 2.6705 (0.4); 2.5237 (1.0);
2.5060 (53.9); 2.5017 (70.8); 2.4973 (51.1); 2.3285 (0.4); 2.2712 (13.2); -0.0002 (1.8)
1-090: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6184 (11.4); 7.1054 (0.9); 7.0993 (0.4); 7.0828 (3.9); 7.0646 (4.3); 7.0616 (4.7); 7.0513 (4.1); 7.0432 (1.3); 7.0356 (0.4); 7.0287 (0.6); 3.9031 (1.2); 3.7669 (16.0); 3.3257 (76.8); 3.1748 (0.3); 2.6711 (0.4); 2.5062 (63.9); 2.5019 (82.6); 2.4977 (59.9);
2.3286 (0.5); 2.2833 (15.8); -0.0002 (1.9)
1-091 : 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6241 (11.7); 7.2753 (1.1); 7.2556 (2.6); 7.2361 (1.9); 7.1841 (1.6); 7.1820 (1.6); 7.1797 (1.4); 7.1667 (0.8); 7.1619 (1.0); 7.0102 (1.4); 7.0059 (3.1); 7.0012 (2.3); 6.9956 (1.9); 6.9761 (1.3); 3.9030 (1.6); 3.7914 (16.0); 3.3264 (100.9); 2.6756 (0.3); 2.6707 (0.5); 2.6663 (0.4); 2.5241 (1.2); 2.5105 (32.6); 2.5064 (66.1); 2.5020 (87.1); 2.4975 (62.7); 2.3331 (0.4); 2.3287 (0.5);
2.3239 (0.4); 2.2850 (15.7); -0.0002 (1.6)
1-092: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5420 (6.7); 8.5301 (6.9); 7.2947 (0.6); 7.2791 (0.7); 7.2745 (1.3); 7.2590 (1.4); 7.2543 (0.9); 7.2474 (1.8); 7.2354 (3.5); 7.2235 (1.7); 6.9528 (0.6); 6.9466 (0.6); 6.9319 (1.0); 6.9259 (1.1); 6.9100 (0.5); 6.9052 (0.5); 6.8697 (1.3); 6.8676 (1.4); 6.8479 (1.4); 6.8229 (0.9); 6.8176 (1.1); 6.8126 (0.7); 6.7985 (0.9); 6.7935 (1.2); 6.7880 (0.7); 3.9031 (1.4); 3.7934 (16.0); 3.3273 (94.1); 2.6711 (0.4); 2.5243 (1.0); 2.5107 (27.4); 2.5064 (56.5); 2.5020 (74.8); 2.4975 (53.5); 2.4932 (25.7); 2.3287 (0.4); 2.2712 (15.7); -0.0002 (1.7)
1-094: 'H-NMR^O.O MHz, de-DMSO):
δ= 8.6378 (10.8); 7.2513 (0.6); 7.2285 (1.1); 7.2047 (0.6); 7.2007 (0.6); 7.0196 (1.7); 7.0154 (1.7); 7.0010 (1.8); 6.9951 (1.4); 6.9891 (1.6); 3.9033 (0.9); 3.8121 (0.4); 3.8010 (16.0); 3.3247 (71.6); 2.7650 (0.8); 2.7460 (2.8); 2.7269 (2.8); 2.7080 (0.9); 2.6756 (0.4); 2.6712 (0.5); 2.6666 (0.4); 2.5243 (1.3); 2.5109 (31.1); 2.5066 (63.4); 2.5021 (83.1); 2.4976 (59.0); 2.4933 (28.0);
2.3333 (0.3); 2.3288 (0.5); 2.3245 (0.4); 1.0844 (3.1); 1.0655 (7.1); 1.0465 (3.0); -0.0002 (1.0)
1-095: Ή-ΝΜϋ^ΟΟ.Ο MHz, de-DMSO):
δ= 8.6309 (13.8); 8.1363 (5.5); 7.0990 (9.5); 7.0846 (4.7); 7.0779 (4.6); 7.0554 (0.4); 3.9031 (0.9); 3.8396 (16.0); 3.3268 (92.3); 2.6709 (0.4); 2.5241 (1.4); 2.5064 (63.3); 2.5020 (82.1); 2.4976 (58.7); 2.3333 (0.4); 2.3286 (0.5); 2.3244 (0.3); -0.0002 (1.1) 1-097: !Η-ΝΜΚ(400.2 MHz, de-DMSO):
δ= 8.5490 (15.6); 8.5371 (16.0); 7.2524 (4.2); 7.2405 (8.0); 7.2285 (4.1); 7.1214 (1.1); 7.1068 (2.9); 7.0985 (12.4); 7.0932 (13.0); 7.0845 (10.2); 7.0721 (10.0); 7.0559 (1.1); 7.0494 (1.8); 4.1789 (4.2); 4.1609 (6.9); 4.1428 (4.4); 3.3237 (372.2); 2.8974 (3.8); 2.8793 (6.5); 2.8606 (4.6); 2.5527 (1.4); 2.5340 (4.1); 2.5068 (38.1); 2.5025 (50.3); 2.4983 (39.2); 2.4801 (1.6); 1.2362 (2.4);
0.8545 (0.4); 0.0008 (2.2)
1-098: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4430 (11.7); 8.4311 (11.8); 7.2602 (41.9); 7.1633 (15.0); 7.1524 (21.4); 7.1423 (1.0); 7.1330 (0.6); 7.1302 (1.3); 7.1201 (2.2); 7.1108 (2.7); 7.1086 (1.5); 7.0992 (2.4); 7.0960 (0.7); 7.0900 (1.0); 7.0868 (0.8); 7.0101 (3.7); 6.9982 (7.2); 6.9862 (3.6);
5.2973 (1.4); 4.0401 (16.0); 4.0371 (16.0); 4.0343 (6.4); 1.5553 (4.2); -0.0002 (15.7)
1-099: 1H-NMR(400.1 MHz, de-DMSO):
δ= 8.6448 (11.9); 7.3509 (1.8); 7.3466 (3.4); 7.3424 (2.0); 7.0350 (7.0); 7.0307 (7.0); 3.8007 (16.0); 3.3169 (19.5); 2.5052 (15.0);
2.5011 (19.9); 2.4970 (15.0); 2.2908 (15.8); -0.0010 (4.6)
1-100: 1H-NMR(400.1 MHz, de-DMSO):
δ= 8.6521 (11.5); 7.0160 (0.5); 7.0111 (0.8); 7.0059 (0.6); 6.9933 (1.0); 6.9880 (1.6); 6.9828 (1.0); 6.9703 (0.5); 6.9648 (0.8); 6.7421 (0.6); 6.7254 (2.8); 6.7101 (2.8); 6.6930 (0.4); 3.7968 (16.0); 3.3442 (3.8); 2.5049 (26.4); 2.5010 (33.7); 2.4970 (25.5);
2.2773 (15.7); -0.0012 (7.4)
1-101 : 1H-NMR(400.1 MHz, de-DMSO):
δ= 8.5126 (3.6); 8.3434 (2.9); 8.3368 (3.1); 8.0548 (2.4); 7.0953 (0.9); 7.0893 (0.5); 7.0730 (4.1); 7.0588 (4.2); 7.0518 (5.2); 7.0449 (4.9); 7.0367 (1.5); 7.0218 (0.6); 3.7683 (16.0); 3.3169 (45.8); 2.5003 (26.2); 2.2843 (15.8); 1.2327 (0.8); -0.0013 (3.7) 1-102: 1H-NMR(400.1 MHz, de-DMSO):
δ= 8.5305 (3.6); 8.3468 (3.0); 8.3402 (3.2); 8.0156 (2.3); 7.2358 (0.7); 7.2301 (0.8); 7.2118 (1.1); 7.2075 (1.6); 7.1848 (0.8); 7.0050 (1.2); 6.9892 (3.4); 6.9702 (2.4); 3.7670 (16.0); 3.3271 (56.6); 2.5017 (18.4); 2.3098 (15.6); 2.0746 (1.2); 1.2331 (0.7); -
0.0012 (1.6)
1-103: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.4903 (2.5); 8.4845 (2.6); 8.2537 (1.6); 8.2478 (1.6); 8.2322 (1.7); 8.2262 (1.6); 7.1391 (2.6); 7.1175 (2.5); 7.0855 (0.7); 7.0789 (0.4); 7.0627 (3.8); 7.0578 (1.1); 7.0493 (3.8); 7.0416 (4.7); 7.0352 (4.4); 7.0268 (1.0); 7.0199 (0.4); 7.0124 (0.4); 3.9032 (1.2); 3.8384 (15.9); 3.7859 (0.8); 3.7756 (16.0); 3.3282 (149.2); 3.1751 (0.9); 3.1619 (0.8); 3.0988 (0.5); 3.0475 (0.7); 2.8382 (0.5); 2.6757 (0.4); 2.6711 (0.5); 2.6669 (0.4); 2.5243 (1.2); 2.5106 (33.7); 2.5065 (68.8); 2.5021 (91.0); 2.4976 (65.2); 2.4935
(31.5); 2.3332 (0.4); 2.3288 (0.5); 2.3247 (0.4); 2.2872 (14.9); 2.2691 (0.3); -0.0002 (1.0)
1-104: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3198 (9.0); 7.2611 (16.8); 7.0052 (0.6); 6.9840 (1.0); 6.9802 (0.6); 6.9634 (0.8); 6.9590 (1.0); 6.9384 (0.7); 6.9224 (0.6); 6.9166 (0.7); 6.9041 (0.6); 6.8983 (0.7); 6.8955 (0.7); 6.8897 (0.7); 6.8772 (0.6); 6.8715 (0.7); 6.8169 (0.5); 6.8109 (0.8); 6.8069 (0.6); 6.7893 (0.6); 5.2984 (0.9); 3.9311 (16.0); 1.6860 (0.6); 1.6690 (0.9); 1.6514 (0.6); 1.5522 (1.6); 0.9889 (4.7); 0.9834 (1.2);
0.9716 (10.9); -0.0002 (6.3)
1-105: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4840 (5.0); 8.4721 (5.1); 7.2620 (12.4); 7.2321 (0.6); 7.2165 (0.6); 7.2107 (1.0); 7.1950 (1.0); 7.1905 (0.6); 7.0527 (1.5); 7.0407 (2.9); 7.0287 (1.4); 6.7230 (0.5); 6.7165 (0.7); 6.7011 (0.7); 6.6944 (1.8); 6.6930 (1.6); 6.6723 (1.9); 6.6652 (0.8); 6.6519
(0.5); 5.2986 (1.3); 4.1615 (16.0); 3.8956 (15.9); -0.0002 (4.5)
1-106: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5163 (0.5); 8.5043 (0.6); 8.4520 (5.4); 8.4400 (6.1); 8.4281 (0.9); 8.3118 (1.9); 7.2645 (14.4); 6.9965 (1.7); 6.9845 (3.2); 6.9723 (2.1); 6.9628 (3.3); 6.9484 (3.0); 5.2988 (3.0); 3.8713 (16.0); 3.8498 (1.7); 3.6740 (0.8); 2.3298 (0.8); 2.2916 (15.8);
2.2412 (1.4); 1.2560 (1.3); -0.0002 (5.2)
1-107: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4490 (0.8); 8.3474 (2.3); 7.5183 (0.7); 7.3098 (0.5); 7.2594 (125.4); 6.9954 (0.7); 6.5861 (2.0); 6.5700 (2.2); 6.5643 (2.3); 6.5482 (2.0); 4.1306 (0.6); 4.1127 (0.6); 3.8270 (5.1); 3.7504 (16.0); 2.4451 (8.5); 2.3329 (3.6); 2.0434 (2.6); 1.5333 (12.8);
1.2765 (0.8); 1.2586 (1.6); 1.2408 (0.7); 0.0079 (1.5); -0.0002 (46.6); -0.0085 (1.3)
1-108: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3673 (0.8); 8.3390 (0.7); 8.2982 (0.6); 8.2919 (12.7); 8.2687 (0.7); 7.2632 (21.6); 6.9473 (1.3); 6.9330 (1.3); 5.2986 (3.0);
3.8658 (16.0); 3.8513 (0.8); 2.2905 (15.6); 2.2504 (0.8); -0.0002 (8.2)
1-110: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4293 (5.5); 8.4173 (5.6); 7.2606 (13.3); 7.1722 (0.6); 7.1704 (1.0); 7.1567 (0.6); 7.1540 (0.9); 7.1515 (1.7); 7.1490 (2.0); 7.1327 (2.0); 7.0631 (3.8); 7.0564 (0.8); 7.0499 (0.5); 7.0462 (2.6); 7.0437 (2.2); 7.0406 (1.6); 7.0273 (0.5); 6.9529 (1.6); 6.9410 (3.0); 6.9290 (1.5); 3.8757 (3.8); 3.8571 (3.9); 2.3118 (0.5); 2.2943 (16.0); 2.2779 (0.5); 1.5766 (1.1); 0.9692 (12.2); 0.9524
(11.9); -0.0002 (4.9)
1-111 : !H-NMR^OCO MHZ, CDC13):
δ= 8.4379 (5.7); 8.4259 (5.8); 7.2608 (14.1); 7.1854 (0.7); 7.1835 (1.0); 7.1693 (0.7); 7.1670 (1.0); 7.1650 (1.5); 7.1622 (2.3); 7.1597 (0.5); 7.1522 (0.6); 7.1459 (2.0); 7.1447 (1.7); 7.0815 (0.7); 7.0775 (3.7); 7.0711 (0.9); 7.0631 (0.7); 7.0604 (2.1); 7.0584
(2.7) ; 7.0553 (1.7); 7.0406 (0.6); 6.9785 (1.6); 6.9665 (3.1); 6.9545 (1.6); 4.8905 (7.2); 3.8119 (14.5); 2.2909 (16.0); -0.0002
(8.8)
1-113: 'H-NMR^OO.O MHz, CDC13):
δ= 8.2306 (4.3); 7.2595 (16.2); 7.1787 (1.0); 7.1750 (0.6); 7.1598 (0.9); 7.1083 (0.5); 7.0700 (0.8); 7.0663 (1.2); 7.0487 (0.7);
7.0460 (0.6); 2.6341 (6.1); 1.6561 (16.0); 1.5402 (0.6); -0.0002 (7.7)
1-114: 'H-NMR^OO.O MHz, CDC13):
δ= 8.7123 (1.9); 7.2610 (29.5); 7.0538 (1.2); 7.0383 (1.3); 7.0322 (2.3); 7.0167 (2.3); 7.0109 (1.3); 6.9955 (1.2); 6.7497 (1.2); 6.7432 (1.4); 6.7279 (1.5); 6.7202 (1.9); 6.7054 (1.8); 6.6984 (2.0); 6.6855 (1.4); 6.6837 (1.7); 6.6815 (1.2); 6.6771 (1.2); 6.6642
(0.9); 6.6614 (0.9); 6.6576 (0.6); 6.6549 (0.6); 5.2983 (1.4); 3.8222 (16.0); 2.3926 (15.0); -0.0002 (12.0)
1-115: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6123 (11.6); 7.2479 (0.6); 7.2232 (1.2); 7.2203 (1.1); 7.2002 (0.6); 7.1973 (0.6); 7.0023 (1.8); 6.9973 (1.6); 6.9836 (1.7); 6.9770 (1.6); 6.9721 (1.8); 3.9033 (0.9); 3.7643 (16.0); 3.3253 (78.1); 2.6756 (0.4); 2.6711 (0.5); 2.5242 (1.3); 2.5064 (65.4);
2.5020 (84.7); 2.4976 (60.6); 2.3286 (0.5); 2.3242 (0.5); 2.3075 (15.3); -0.0002 (0.8)
1-116: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.9022 (6.0); 8.8902 (6.1); 7.4960 (1.6); 7.4839 (3.0); 7.4718 (1.5); 7.3646 (0.4); 7.3582 (4.1); 7.3537 (1.4); 7.3413 (1.5); 7.3366 (4.9); 7.1146 (0.6); 7.1079 (4.8); 7.0909 (1.4); 7.0864 (4.1); 3.9133 (16.0); 3.9036 (1.7); 3.3266 (72.3); 3.1753 (0.6); 3.1622 (0.5); 2.6717 (0.5); 2.6401 (15.4); 2.5243 (1.2); 2.5067 (60.6); 2.5025 (78.0); 2.4983 (56.8); 2.3291 (0.4); 0.0000 (1.6) 1-117: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5539 (6.5); 8.5420 (6.6); 7.4198 (1.4); 7.4130 (1.4); 7.3983 (1.4); 7.3916 (1.4); 7.2538 (1.7); 7.2419 (3.2); 7.2299 (1.6); 7.1925 (0.7); 7.1856 (0.7); 7.1708 (1.3); 7.1640 (1.2); 7.1493 (0.8); 7.1425 (0.8); 6.9392 (1.6); 6.9246 (1.7); 6.9168 (1.4); 6.9022 (1.3); 3.9033 (0.8); 3.8339 (16.0); 3.3254 (74.2); 2.7140 (0.8); 2.6949 (2.8); 2.6758 (3.2); 2.6570 (0.9); 2.5244 (1.2); 2.5109 (29.5); 2.5065 (60.8); 2.5020 (80.3); 2.4975 (56.8); 2.4931 (26.7); 2.3330 (0.3); 2.3288 (0.4); 2.3242 (0.3); 1.0727 (3.2); 1.0538
(7.3); 1.0348 (3.0); -0.0003 (1.2)
1-118: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.2775 (7.9); 7.4258 (0.9); 7.4191 (1.0); 7.4044 (1.0); 7.3976 (0.9); 7.1919 (0.4); 7.1852 (0.4); 7.1702 (0.8); 7.1634 (0.8); 7.1488 (0.6); 7.1420 (0.5); 6.9076 (0.9); 6.8929 (0.9); 6.8853 (0.8); 6.8707 (0.7); 3.9031 (0.7); 3.8152 (16.0); 3.3265 (61.2); 2.7075 (0.5); 2.6884 (1.7); 2.6695 (2.0); 2.6506 (0.5); 2.5063 (43.4); 2.5020 (55.4); 2.4976 (39.7); 1.0683 (1.9); 1.0494 (4.2);
1.0304 (1.8); -0.0004 (0.7)
1-119: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5515 (5.8); 8.5396 (6.0); 8.2137 (6.0); 7.3079 (4.1); 7.2864 (4.9); 7.2546 (1.5); 7.2427 (2.8); 7.2308 (1.4); 7.0798 (0.6); 7.0730 (4.8); 7.0515 (4.0); 4.5029 (0.4); 4.4865 (1.0); 4.4700 (1.4); 4.4532 (1.0); 4.4367 (0.4); 3.9032 (1.1); 3.6232 (0.4); 3.6096 (0.4); 3.6010 (0.6); 3.3245 (51.0); 2.6708 (0.6); 2.5061 (83.7); 2.5018 (108.6); 2.4975 (78.7); 2.3286 (0.6); 1.4536 (16.0); 1.4370
(15.9); 1.3001 (0.3); -0.0002 (1.7)
1-120: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6215 (14.1); 8.1319 (5.5); 7.2462 (1.4); 7.2278 (3.5); 7.2084 (2.7); 7.1414 (1.3); 7.1232 (1.9); 7.1046 (0.7); 7.0591 (2.9); 7.0560 (3.7); 7.0379 (2.9); 3.9029 (1.1); 3.8508 (16.0); 3.7059 (0.5); 3.3262 (82.9); 2.6709 (0.4); 2.5241 (1.2); 2.5107 (29.2);
2.5064 (60.0); 2.5019 (79.0); 2.4975 (56.2); 2.4934 (27.0); 2.3332 (0.3); 2.3288 (0.4); -0.0002 (1.3)
1-121 : 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.7748 (0.4); 8.6326 (16.0); 8.1916 (6.8); 7.0990 (14.2); 7.0813 (8.6); 4.1468 (1.3); 4.1286 (4.2); 4.1105 (4.2); 4.0922 (1.4); 3.9030 (1.1); 3.3274 (110.0); 2.6755 (0.4); 2.6710 (0.5); 2.6667 (0.4); 2.5241 (1.3); 2.5064 (71.0); 2.5020 (93.0); 2.4976 (66.6);
2.3331 (0.4); 2.3286 (0.5); 2.3243 (0.4); 1.4194 (4.8); 1.4012 (10.4); 1.3830 (4.7); 1.3515 (0.4); -0.0003 (0.6)
1-122: 1H-NMR(400.2 MHz, de-DMSO):
δ= 8.6282 (16.0); 7.0940 (16.0); 7.0788 (6.9); 7.0740 (7.1); 7.0588 (0.4); 7.0513 (0.5); 4.1753 (2.2); 4.1572 (3.5); 4.1391 (2.3); 3.3225 (11.2); 2.9086 (2.0); 2.8907 (3.3); 2.8719 (2.4); 2.5490 (0.7); 2.5305 (2.1); 2.5095 (8.0); 2.5049 (13.9); 2.5005 (18.5);
2.4960 (14.4); 2.4761 (0.6); 0.0066 (0.4); -0.0016 (10.7); -0.0097 (0.4)
1-123: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5337 (6.6); 8.5217 (6.7); 7.5823 (3.0); 7.5614 (3.3); 7.2384 (1.7); 7.2265 (3.4); 7.2144 (4.8); 7.1935 (2.9); 3.9033 (1.0); 3.8028 (16.0); 3.7306 (0.6); 3.3295 (137.4); 2.6758 (0.4); 2.6716 (0.5); 2.6672 (0.4); 2.5247 (1.3); 2.5110 (32.9); 2.5069 (67.3);
2.5025 (89.2); 2.4981 (64.0); 2.3337 (0.4); 2.3291 (0.5); 2.3249 (0.4); 2.2658 (16.0); -0.0001 (0.4)
1-124: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.7733 (0.8); 8.6134 (11.9); 7.5833 (3.0); 7.5623 (3.4); 7.2030 (3.3); 7.1823 (3.0); 3.9031 (1.8); 3.7997 (16.0); 3.7597 (0.4); 3.7281 (1.2); 3.6361 (0.3); 3.6214 (0.4); 3.3283 (140.2); 3.1618 (0.6); 2.6758 (0.4); 2.6711 (0.6); 2.6667 (0.4); 2.5065 (77.9); 2.5022 (101.2); 2.4977 (72.6); 2.3334 (0.4); 2.3286 (0.6); 2.3247 (0.4); 2.2751 (15.8); 2.2601 (1.3); 1.7249 (0.5); 1.3909 (0.5); -
0.0003 (1.2)
1-125: 1H-NMR(400.0 MHz, CDC13):
δ= 8.6167 (0.8); 8.4264 (10.3); 7.4647 (1.2); 7.4590 (0.5); 7.4513 (2.0); 7.4462 (1.5); 7.4414 (3.5); 7.4347 (5.0); 7.4260 (0.7); 7.3993 (2.2); 7.3900 (2.0); 7.3811 (1.3); 7.3747 (1.1); 7.2592 (33.5); 7.1396 (0.5); 7.1364 (0.9); 7.1235 (0.5); 7.1192 (2.6); 7.1152 (1.5); 7.1037 (0.9); 7.1002 (2.5); 7.0688 (1.1); 7.0653 (0.9); 7.0508 (1.4); 7.0439 (0.5); 7.0390 (2.6); 7.0352 (3.3); 7.0295
(0.8); 7.0216 (1.0); 7.0177 (1.9); 5.2973 (3.2); 3.8547 (16.0); 1.5411 (1.5); 1.2561 (1.2); -0.0002 (12.6)
1-127: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5297 (5.5); 8.5178 (5.8); 7.6347 (2.2); 7.6311 (2.9); 7.6140 (3.4); 7.6131 (3.4); 7.4075 (1.2); 7.3909 (3.5); 7.3716 (2.8); 7.3597 (2.0); 7.3489 (0.7); 7.3422 (1.6); 7.2641 (11.4); 7.0580 (1.6); 7.0461 (3.0); 7.0342 (1.6); 5.2983 (0.6); 3.7323 (16.0);
2.2644 (15.8); 1.2567 (0.6); -0.0002 (4.2)
1-128: 1H-NMR(400.0 MHz, CDC13):
δ= 7.5181 (0.9); 7.3164 (0.5); 7.2589 (161.2); 7.2160 (4.1); 7.1975 (3.3); 7.1130 (5.2); 7.0927 (4.5); 7.0692 (1.0); 6.9944 (1.0); 3.6744 (16.0); 2.2217 (15.2); 2.0437 (0.6); 1.5399 (0.7); 1.2584 (1.0); -0.0002 (58.6)
1-129: 'H-NMR(400.0 MHz, CDC13):
δ= 8.4365 (11.0); 8.4245 (11.2); 8.4152 (0.5); 7.5182 (0.9); 7.2859 (2.6); 7.2594 (170.4); 7.2088 (0.9); 7.2014 (1.2); 7.1987 (1.9); 7.1946 (0.9); 7.1852 (1.2); 7.1811 (4.9); 7.1776 (2.7); 7.1656 (2.0); 7.1620 (4.6); 7.1602 (3.2); 7.1562 (1.1); 7.1473 (0.5); 7.1388 (5.1); 7.1217 (1.0); 7.1184 (2.1); 7.1151 (1.9); 7.1055 (0.7); 7.1000 (3.0); 7.0928 (5.3); 7.0890 (5.9); 7.0835 (1.4); 7.0755 (1.7); 7.0716 (3.7); 7.0688 (2.9); 7.0096 (3.2); 6.9977 (6.3); 6.9919 (2.8); 6.9857 (3.2); 2.7310 (0.7); 2.5223 (8.8); 2.5198 (16.0); 2.5172 (8.9); 2.3525 (0.7); 2.3060 (0.6); 2.2011 (1.0); 1.5372 (6.5); 1.2843 (0.7); 1.2558 (6.0); 0.8803 (1.0); 0.0080 (2.0); -0.0002
(69.5); -0.0085 (2.4)
1-130: !H-NMR^OCO MHZ, de-DMSO):
δ= 8.6080 (16.0); 8.1033 (0.6); 8.0135 (0.7); 7.0987 (0.8); 7.0910 (3.2); 7.0870 (1.5); 7.0830 (3.6); 7.0770 (2.9); 7.0717 (0.7); 7.0672 (0.8); 7.0617 (3.1); 7.0551 (0.6); 7.0386 (0.6); 3.9371 (14.0); 3.3100 (63.5); 2.5231 (1.5); 2.5184 (2.3); 2.5097 (27.1);
2.5051 (56.9); 2.5005 (78.8); 2.4959 (54.4); 2.4914 (24.6); 2.0724 (1.1); 1.1517 (0.6); -0.0002 (3.1)
1-132: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4584 (7.6); 8.4465 (7.7); 7.5484 (4.5); 7.5478 (4.5); 7.2604 (40.0); 7.1313 (2.4); 7.1300 (1.6); 7.1255 (1.1); 7.1149 (1.6); 7.1092 (6.4); 7.1038 (1.2); 7.0898 (1.3); 7.0844 (6.4); 7.0787 (1.6); 7.0681 (1.1); 7.0637 (1.6); 7.0623 (2.4); 7.0089 (2.3); 6.9969 (4.5); 6.9850 (2.2); 5.2977 (1.9); 4.1301 (0.7); 4.1123 (0.7); 3.9148 (16.0); 2.0427 (3.3); 1.5546 (2.4); 1.2759 (1.0); 1.2580 (2.3);
1.2401 (1.0); -0.0002 (15.2)
1-134: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.2508 (11.0); 7.2684 (0.9); 7.2488 (2.1); 7.2294 (1.5); 7.1714 (1.3); 7.1510 (0.8); 7.0031 (1.2); 6.9991 (2.5); 6.9942 (2.8); 6.9720 (1.1); 3.9031 (1.3); 3.8137 (16.0); 3.7796 (13.2); 3.3263 (84.3); 2.6711 (0.4); 2.5240 (1.0); 2.5063 (56.5); 2.5019 (73.8);
2.4975 (52.6); 2.3288 (0.4); 2.2733 (12.9); -0.0002 (1.4)
1-135: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5317 (6.6); 8.5198 (6.8); 7.4191 (1.5); 7.4124 (1.6); 7.3976 (1.6); 7.3909 (1.6); 7.2480 (1.7); 7.2360 (3.3); 7.2240 (1.7); 7.1745 (0.8); 7.1676 (0.7); 7.1528 (1.4); 7.1460 (1.3); 7.1312 (0.9); 7.1245 (0.8); 6.9134 (1.6); 6.8988 (1.7); 6.8911 (1.4); 6.8765 (1.4); 3.9033 (1.0); 3.7972 (16.0); 3.3253 (64.4); 2.6753 (0.4); 2.6710 (0.5); 2.6666 (0.4); 2.5241 (1.3); 2.5105 (31.9); 2.5064
(64.0); 2.5020 (83.9); 2.4976 (60.0); 2.3328 (0.3); 2.3289 (0.5); 2.3246 (0.4); 2.2580 (15.9); -0.0002 (0.8)
1-136: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5470 (6.2); 8.5350 (6.4); 7.2514 (1.7); 7.2394 (3.8); 7.2275 (1.7); 7.2155 (1.0); 7.2109 (1.3); 7.1881 (0.8); 7.0290 (1.1); 7.0247 (1.0); 7.0178 (1.9); 7.0138 (2.3); 7.0043 (0.9); 6.9989 (2.3); 3.9035 (0.8); 3.8061 (16.0); 3.3255 (68.3); 2.7569 (0.9); 2.7380 (2.9); 2.7190 (3.0); 2.7000 (1.0); 2.6755 (0.4); 2.6716 (0.5); 2.5243 (1.3); 2.5066 (62.1); 2.5023 (80.6); 2.4979 (57.7);
2.3331 (0.3); 2.3290 (0.4); 2.3247 (0.3); 1.0803 (3.2); 1.0614 (7.2); 1.0424 (3.1); -0.0001 (1.1)
1-137: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.7769 (0.3); 8.6337 (12.8); 8.2249 (5.8); 7.0978 (10.7); 7.0801 (11.7); 4.4950 (0.4); 4.4784 (1.0); 4.4617 (1.4); 4.4452 (1.1); 4.4286 (0.4); 3.9031 (0.8); 3.3246 (67.8); 2.6753 (0.3); 2.6709 (0.4); 2.6667 (0.3); 2.5242 (1.2); 2.5105 (31.2); 2.5064 (63.2); 2.5020 (82.7); 2.4976 (58.8); 2.3330 (0.4); 2.3285 (0.5); 2.3241 (0.4); 1.4460 (16.0); 1.4294 (15.8); 1.3982 (0.6); 1.3816 (0.5); -
0.0002 (1.2)
1-138: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6227 (16.0); 8.1868 (6.7); 7.2491 (1.6); 7.2305 (3.9); 7.2112 (2.9); 7.1411 (1.4); 7.1227 (2.1); 7.1044 (0.8); 7.0554 (3.1); 7.0522 (4.1); 7.0342 (3.2); 4.1581 (1.3); 4.1399 (4.2); 4.1218 (4.2); 4.1036 (1.4); 3.9030 (1.1); 3.3287 (147.3); 2.6755 (0.4); 2.6709 (0.5); 2.6663 (0.4); 2.5242 (1.3); 2.5107 (35.5); 2.5064 (73.5); 2.5019 (97.5); 2.4974 (69.4); 2.4931 (33.1); 2.3331 (0.4);
2.3286 (0.6); 2.3243 (0.4); 1.4272 (5.0); 1.4091 (10.8); 1.3909 (4.8); -0.0002 (0.8)
1-139: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6323 (11.0); 8.2260 (5.8); 7.3115 (4.1); 7.3070 (1.5); 7.2900 (5.0); 7.0726 (0.6); 7.0656 (4.9); 7.0441 (4.2); 4.5009 (0.4); 4.4844 (1.1); 4.4678 (1.5); 4.4513 (1.1); 4.4347 (0.4); 3.9031 (0.8); 3.3235 (64.8); 2.6708 (0.5); 2.6665 (0.4); 2.5059 (69.5);
2.5017 (91.0); 2.4974 (67.6); 2.3281 (0.5); 2.3239 (0.4); 1.4494 (16.0); 1.4328 (15.9); -0.0001 (1.3)
1-126: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4500 (3.2); 8.4380 (3.3); 8.0172 (1.7); 7.2640 (20.2); 7.1723 (0.8); 7.1557 (1.3); 7.1530 (1.6); 7.1511 (1.3); 7.1398 (0.6); 7.1350 (1.7); 7.0886 (1.4); 7.0849 (2.5); 7.0793 (0.6); 7.0748 (0.9); 7.0704 (1.0); 7.0670 (1.5); 7.0639 (1.1); 7.0590 (0.6); 7.0541
(1.0) ; 6.9718 (1.2); 6.9598 (2.3); 6.9479 (1.2); 3.8308 (11.3); 2.9548 (16.0); 2.8831 (14.0); 2.8818 (13.4); 2.3025 (11.0); 2.0431
(2.1) ; 1.6233 (1.6); 1.2761 (0.6); 1.2582 (1.3); 1.2404 (0.6); -0.0002 (7.0)
1-140: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3815 (0.8); 8.1903 (0.8); 8.0781 (8.9); 7.2603 (27.4); 7.1746 (0.6); 7.1727 (0.9); 7.1582 (0.7); 7.1545 (1.4); 7.1516 (2.0); 7.1414 (0.6); 7.1352 (1.9); 7.0736 (3.6); 7.0683 (0.8); 7.0557 (2.8); 7.0527 (1.4); 7.0374 (0.5); 3.8913 (1.3); 3.8761 (0.8); 3.8716 (0.6); 3.8334 (1.1); 3.8198 (12.6); 3.8054 (16.0); 3.7757 (0.6); 2.3111 (1.0); 2.2959 (12.4); 2.2819 (0.7); 1.5610 (0.6); -0.0002
(10-5)
1-141 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.4505 (2.6); 8.4471 (2.7); 8.2437 (2.5); 8.2370 (2.6); 7.9822 (1.6); 7.9787 (1.6); 7.9755 (1.6); 7.9720 (1.5); 7.2603 (31.2); 7.0045 (0.6); 6.9834 (1.0); 6.9795 (0.7); 6.9628 (0.8); 6.9585 (1.0); 6.9377 (0.7); 6.8994 (0.6); 6.8936 (0.7); 6.8812 (0.6); 6.8754 (0.8); 6.8727 (0.7); 6.8668 (0.7); 6.8544 (0.6); 6.8486 (0.7); 6.8016 (0.5); 6.7959 (0.8); 6.7918 (0.6); 6.7743 (0.6); 3.8325 (16.0);
2.3102 (15.7); 1.5488 (2.2); -0.0002 (10.8)
1-093: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3249 (7.1); 7.2599 (57.3); 7.0078 (0.6); 6.9866 (1.0); 6.9828 (0.7); 6.9661 (0.8); 6.9617 (1.0); 6.9411 (0.8); 6.9205 (0.6); 6.9147 (0.7); 6.9023 (0.7); 6.8964 (0.8); 6.8938 (0.7); 6.8879 (0.8); 6.8755 (0.6); 6.8698 (0.7); 6.8256 (0.6); 6.8195 (0.9); 6.8156
(0.6); 6.7979 (0.7); 3.8347 (16.0); 2.3045 (14.4); 1.5362 (9.7); 0.0079 (0.7); -0.0002 (20.6); -0.0084 (0.6)
1-142: 1H-NMR(400.0 MHz, CDC13):
δ= 8.6029 (0.5); 8.5910 (0.5); 8.4387 (6.0); 8.4267 (6.1); 7.3159 (2.0); 7.3139 (1.8); 7.3120 (1.8); 7.2983 (0.8); 7.2941 (1.5); 7.2905 (1.3); 7.2707 (1.7); 7.2622 (16.9); 7.2535 (1.8); 7.2485 (1.6); 7.2439 (0.7); 6.9757 (1.8); 6.9638 (3.4); 6.9518 (1.7); 3.8548 (16.0); 3.7874 (1.6); 2.3041 (15.7); 2.2930 (1.6); 1.5800 (0.9); -0.0002 (5.6)
1-143: 'H-NMR^O.l MHz, de-DMSO):
δ= 8.6258 (5.8); 8.6138 (6.0); 7.2633 (1.6); 7.2513 (3.1); 7.2394 (1.6); 7.1094 (2.7); 7.1042 (1.2); 7.0928 (1.5); 7.0875 (5.6); 7.0814 (1.0); 7.0535 (1.0); 7.0474 (5.6); 7.0421 (1.6); 7.0306 (1.1); 7.0255 (2.7); 3.7914 (16.0); 3.6787 (14.6); 3.3279 (31.5);
2.5054 (18.1); 2.5011 (24.0); 2.4969 (17.9); 2.2312 (14.6); 2.0748 (0.4); 1.2347 (0.5); -0.0009 (3.6)
1-144: Ή-ΝΜϋ^ΟΟ.Ι MHz, de-DMSO):
δ= 8.6688 (11.4); 8.5695 (6.1); 8.5574 (6.2); 7.2356 (1.7); 7.2235 (3.2); 7.2114 (1.6); 3.7799 (16.0); 3.4461 (28.4); 2.5401 (1.0);
2.5007 (34.2); 2.2499 (15.7); 2.0069 (0.3); 1.9876 (0.4); 1.2334 (2.6); 0.8523 (0.4); -0.0012 (2.0)
1-145: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4804 (5.6); 8.4684 (5.7); 7.2600 (55.5); 7.0066 (1.7); 6.9946 (3.3); 6.9865 (0.6); 6.9826 (1.6); 6.9651 (0.9); 6.9614 (0.6); 6.9447 (0.8); 6.9399 (1.5); 6.9341 (0.7); 6.9198 (0.9); 6.9159 (0.7); 6.9129 (0.7); 6.9071 (0.6); 6.8945 (0.5); 6.8888 (0.6); 6.8216 (0.7); 6.8177 (0.5); 6.8000 (0.5); 3.9360 (16.0); 1.6872 (0.5); 1.6705 (1.0); 1.6529 (0.6); 1.5403 (3.2); 0.9875 (11.6); 0.9767
(1.0); 0.9710 (3.3); 0.9692 (3.5); 0.9634 (1.0); 0.0080 (0.6); -0.0002 (20.2); -0.0085 (0.6)
1-146: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2496 (10.4); 7.2605 (11.8); 7.1711 (0.9); 7.1558 (1.2); 7.1512 (2.8); 7.1380 (0.7); 7.1337 (2.0); 7.0736 (1.0); 7.0708 (1.0); 7.0558 (4.7); 7.0517 (3.0); 7.0389 (1.1); 7.0346 (2.9); 5.2968 (1.3); 3.9277 (16.0); 1.6975 (0.6); 1.6902 (0.6); 1.6799 (0.6); 1.6767 (1.0); 1.6628 (0.6); 1.6555 (0.6); 1.5636 (0.7); 1.0302 (0.5); 1.0159 (1.3); 1.0117 (1.6); 1.0024 (2.6); 0.9976 (1.4); 0.9889
(1.0); 0.9839 (0.6); 0.9740 (1.6); 0.9646 (1.5); 0.9616 (1.1); 0.9530 (1.1); 0.9453 (1.6); 0.9393 (1.1); -0.0002 (4.3)
1-147: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2497 (10.4); 7.2596 (41.6); 7.1656 (1.2); 7.1448 (3.1); 7.1272 (3.1); 7.0774 (5.4); 7.0572 (4.1); 7.0379 (0.8); 5.2981 (1.4); 3.8438 (16.0); 3.7979 (0.8); 2.7006 (2.2); 2.6813 (3.0); 2.6614 (2.5); 1.5872 (1.2); 1.5678 (2.1); 1.5416 (9.7); 1.5115 (0.5);
1.2552 (0.9); 0.9439 (3.9); 0.9256 (7.6); 0.9072 (3.6); -0.0002 (13.9)
1-148: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4635 (6.2); 8.4515 (6.2); 7.4399 (0.8); 7.4351 (3.9); 7.4302 (1.5); 7.4183 (1.6); 7.4133 (4.5); 7.4086 (0.8); 7.2604 (45.6); 7.1364 (0.9); 7.1317 (4.4); 7.1268 (1.6); 7.1148 (1.5); 7.1099 (3.9); 7.1051 (0.7); 7.0144 (2.0); 7.0025 (3.7); 6.9905 (1.9); 5.2985
(1.2); 3.8668 (16.0); 2.9551 (1.0); 2.8838 (0.9); 2.8825 (0.9); 2.2904 (15.7); 1.5441 (5.0); -0.0002 (10.3)
1-149: 1H-NMR(400.0 MHz, CDC13):
δ= 7.2615 (5.5); 7.1629 (0.6); 7.1433 (1.6); 7.1250 (1.6); 7.0934 (2.3); 7.0760 (1.2); 7.0489 (0.6); 7.0314 (0.9); 6.6503 (2.2);
3.8191 (8.3); 2.2837 (16.0); 2.2551 (8.4); 1.6068 (0.5); -0.0002 (2.1)
1-150: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4929 (3.7); 8.4809 (3.8); 7.2617 (25.3); 7.1664 (0.9); 7.1610 (0.7); 7.1454 (1.7); 7.1402 (0.6); 7.1297 (0.7); 7.1245 (1.0); 7.1089 (0.5); 7.0144 (1.3); 7.0025 (2.6); 6.9905 (1.3); 6.7778 (2.8); 6.7609 (2.9); 6.7569 (2.5); 6.7527 (0.6); 6.7399 (2.3); 5.2982
(1.5); 3.8529 (1.2); 3.7785 (16.0); 2.4456 (11.0); 2.3317 (1.4); -0.0002 (9.6)
1-151 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.4261 (4.9); 8.4142 (5.0); 7.2601 (20.9); 7.1714 (0.8); 7.1552 (1.4); 7.1521 (1.4); 7.1501 (1.3); 7.1393 (0.6); 7.1341 (1.7); 7.1326 (1.3); 7.0842 (1.0); 7.0801 (2.5); 7.0746 (1.4); 7.0660 (0.6); 7.0636 (0.8); 7.0618 (1.5); 7.0591 (1.5); 7.0545 (1.0); 6.9642
(1.4) ; 6.9522 (2.7); 6.9403 (1.4); 4.2824 (1.6); 4.2654 (2.1); 4.2478 (1.7); 3.0127 (1.7); 2.9952 (2.2); 2.9782 (1.6); 2.3673 (13.8);
2.0831 (16.0); 1.5561 (2.6); -0.0002 (7.6)
1-152: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4519 (3.7); 8.4400 (3.9); 7.5182 (1.4); 7.2594 (247.3); 7.1814 (1.0); 7.1624 (1.9); 7.1601 (1.5); 7.1442 (2.1); 7.0872 (2.5); 7.0841 (3.0); 7.0688 (2.2); 7.0643 (1.9); 7.0516 (0.6); 7.0013 (1.2); 6.9953 (1.4); 6.9893 (2.2); 6.9773 (1.1); 5.2985 (1.2); 4.2609
(1.5) ; 4.2477 (1.8); 4.2437 (1.2); 4.2339 (1.7); 3.6819 (0.7); 3.6668 (1.2); 3.6555 (1.1); 3.6395 (0.6); 2.9472 (16.0); 2.3577
(14.3); 1.6779 (1.5); 0.0080 (2.4); -0.0002 (88.1); -0.0085 (2.6)
1-069: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4708 (2.7); 8.4589 (2.7); 7.2622 (12.6); 7.0946 (0.8); 7.0747 (2.2); 7.0551 (1.9); 7.0472 (1.1); 7.0428 (2.4); 7.0388 (1.9); 7.0302 (1.4); 7.0269 (1.9); 7.0220 (1.1); 7.0106 (0.8); 7.0074 (0.8); 7.0056 (0.7); 7.0025 (0.6); 6.9902 (1.1); 6.9783 (2.0); 6.9716 (1.4); 6.9672 (2.2); 6.9642 (1.3); 6.9525 (0.9); 6.9493 (1.0); 6.9481 (1.0); 6.9449 (0.8); 5.2977 (1.7); 3.8473 (15.0); 2.3036
(16.0); -0.0002 (7.2)
1-154: 'H-NMR(400.0 MHz, CDC13):
δ= 8.2916 (13.9); 7.5476 (4.4); 7.5470 (4.3); 7.2603 (42.8); 7.1489 (3.3); 7.1435 (1.3); 7.1324 (1.7); 7.1269 (5.9); 7.1206 (0.8); 7.0777 (0.9); 7.0715 (6.0); 7.0660 (1.6); 7.0549 (1.3); 7.0495 (3.4); 4.1303 (1.3); 4.1124 (1.3); 3.9118 (16.0); 2.0431 (5.9);
1.5470 (14.5); 1.2761 (1.7); 1.2583 (3.5); 1.2404 (1.7); 0.0079 (0.6); -0.0002 (17.3)
1-155: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6287 (10.9); 7.2440 (1.5); 7.2250 (3.5); 7.2056 (2.5); 7.1243 (1.2); 7.1057 (1.8); 7.0876 (0.7); 7.0304 (3.5); 7.0120 (2.9); 3.9030 (1.0); 3.8108 (16.0); 3.3245 (54.0); 2.7319 (0.9); 2.7130 (3.0); 2.6940 (3.1); 2.6750 (1.3); 2.5059 (59.4); 2.5016 (77.6);
2.4973 (56.8); 2.3286 (0.4); 2.3245 (0.3); 1.0666 (3.3); 1.0477 (7.4); 1.0287 (3.2); -0.0001 (0.8)
1-156: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.2509 (11.1); 7.4247 (1.3); 7.4179 (1.3); 7.4032 (1.3); 7.3965 (1.3); 7.1731 (0.6); 7.1663 (0.6); 7.1514 (1.2); 7.1447 (1.1); 7.1298 (0.7); 7.1231 (0.7); 6.8870 (1.3); 6.8724 (1.4); 6.8647 (1.2); 6.8501 (1.1); 3.9032 (0.8); 3.8115 (16.0); 3.7811 (13.0); 3.3263 (62.6); 2.6712 (0.4); 2.5065 (57.9); 2.5022 (75.5); 2.4978 (54.7); 2.3288 (0.4); 2.3243 (0.3); 2.2531 (12.9); -0.0002 (0.7) 1-044: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5219 (6.2); 8.5100 (6.3); 7.2446 (1.6); 7.2327 (3.8); 7.2207 (1.7); 7.2072 (1.3); 7.1835 (0.8); 7.0042 (1.8); 6.9983 (1.6); 6.9922 (2.0); 6.9775 (2.0); 3.9032 (1.2); 3.7697 (16.0); 3.3259 (71.9); 2.6709 (0.5); 2.5063 (66.4); 2.5022 (84.7); 2.4984 (62.4);
2.3292 (0.5); 2.2995 (15.6); -0.0002 (1.8)
1-069: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5440 (6.5); 8.5320 (6.6); 7.2678 (1.1); 7.2487 (3.7); 7.2379 (3.3); 7.2277 (2.6); 7.1690 (1.6); 7.1665 (1.6); 7.1490 (1.0); 7.1466 (1.1); 7.0313 (1.7); 7.0269 (3.2); 7.0223 (2.0); 7.0058 (1.7); 6.9863 (1.4); 3.9031 (1.4); 3.7954 (16.0); 3.3264 (75.4); 2.6709 (0.4); 2.5062 (61.7); 2.5019 (79.1); 2.4975 (56.5); 2.3324 (0.3); 2.3289 (0.4); 2.2754 (15.9); -0.0003 (1.7)
1-157: 'H-NMR(400.0 MHz, de-DMSO):
δ= 8.2617 (10.8); 7.3452 (0.5); 7.3237 (1.0); 7.3187 (0.6); 7.3020 (0.7); 7.2971 (1.0); 7.2758 (0.5); 7.0739 (0.6); 7.0682 (0.6); 7.0554 (0.6); 7.0494 (0.7); 7.0464 (0.7); 7.0404 (0.6); 7.0276 (0.6); 7.0219 (0.6); 6.8623 (0.4); 6.8563 (0.5); 6.8527 (0.7); 6.8485 (0.6); 6.8409 (0.5); 6.8355 (0.5); 6.8309 (0.6); 6.8261 (0.5); 3.9033 (1.2); 3.8699 (0.4); 3.8166 (16.0); 3.7902 (0.3); 3.7676 (12.9); 3.3244 (47.4); 2.6711 (0.4); 2.5241 (1.1); 2.5104 (27.6); 2.5064 (54.9); 2.5020 (71.3); 2.4975 (51.0); 2.3288 (0.4); 2.2885
(0.4); 2.2732 (12.7); -0.0002 (1.9)
1-159: 'H-NMR(400.0 MHz, de-DMSO):
δ= 8.2854 (11.0); 7.3570 (0.5); 7.3354 (1.2); 7.3308 (0.7); 7.3091 (1.1); 7.2875 (0.6); 7.1025 (0.6); 7.0971 (0.6); 7.0839 (0.6); 7.0754 (0.8); 7.0691 (0.7); 7.0562 (0.6); 7.0507 (0.6); 6.8764 (0.8); 6.8662 (0.6); 6.8550 (0.7); 3.9034 (0.8); 3.8203 (16.0); 3.8025 (14.0); 3.3257 (73.4); 2.7281 (0.8); 2.7091 (2.6); 2.6901 (2.7); 2.6712 (1.3); 2.5062 (64.9); 2.5022 (83.2); 2.3289 (0.5);
1.0744 (2.9); 1.0555 (6.4); 1.0365 (2.8); -0.0001 (0.8)
1-160: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6320 (16.0); 8.1946 (8.2); 7.3157 (0.7); 7.3090 (5.8); 7.2876 (7.1); 7.2807 (0.9); 7.0790 (0.9); 7.0722 (7.0); 7.0507 (5.9); 4.1537 (1.6); 4.1355 (5.1); 4.1173 (5.2); 4.0991 (1.8); 3.9030 (1.4); 3.3265 (143.9); 2.6711 (0.7); 2.6669 (0.6); 2.5063 (101.4);
2.5020 (131.7); 2.4976 (96.0); 2.3329 (0.6); 2.3287 (0.7); 1.4229 (5.9); 1.4047 (12.5); 1.3866 (5.8); -0.0002 (1.6)
1-161 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.4846 (7.3); 8.4726 (7.4); 7.9059 (0.5); 7.8904 (0.6); 7.8849 (1.1); 7.8693 (1.0); 7.8631 (0.7); 7.8476 (0.6); 7.2618 (25.9); 7.0520 (2.2); 7.0401 (4.2); 7.0281 (2.1); 6.8932 (0.6); 6.8907 (0.6); 6.8798 (0.5); 6.8772 (0.8); 6.8737 (0.7); 6.8711 (1.2); 6.8693 (1.0); 6.8672 (0.9); 6.8660 (0.9); 6.8578 (0.5); 6.8516 (0.6); 6.8496 (0.8); 6.8448 (0.9); 6.8420 (0.9); 6.8361 (0.6); 6.8208 (0.8);
6.8148 (0.6); 3.8071 (16.0); 3.7880 (0.9); 2.6383 (8.8); 2.6361 (8.7); 2.2936 (0.9); 1.5661 (1.3); -0.0002 (10.0)
1-162: 1H-NMR(400.0 MHz, CDC13):
δ= 8.6567 (1.4); 8.6519 (1.4); 8.2384 (1.5); 8.2325 (1.4); 8.2169 (1.5); 8.2110 (1.5); 7.2600 (36.1); 7.0999 (0.6); 7.0986 (0.6); 7.0807 (1.6); 7.0794 (1.6); 7.0614 (1.5); 7.0601 (1.5); 7.0399 (1.0); 7.0367 (1.3); 7.0350 (1.4); 7.0319 (1.4); 7.0155 (1.4); 7.0123
(2.3) ; 7.0090 (2.2); 7.0078 (2.1); 7.0039 (2.4); 6.9821 (1.6); 6.9808 (1.5); 6.9466 (1.1); 6.9434 (1.2); 6.9423 (1.2); 6.9391 (0.9); 6.9276 (0.9); 6.9240 (1.0); 6.9199 (0.7); 5.2981 (2.7); 3.8959 (16.0); 3.8422 (13.2); 2.3077 (12.4); 1.5474 (5.9); 0.0079 (0.7); -
0.0002 (13.1); -0.0085 (0.5)
1-163: !H-NMR^OCl MHz, de-DMSO):
δ= 8.5366 (15.6); 8.5207 (16.0); 7.2604 (4.2); 7.2445 (9.3); 7.2362 (1.9); 7.2285 (4.1); 7.2141 (1.9); 7.2111 (1.9); 7.2054 (2.1); 7.2029 (1.9); 7.1804 (1.5); 7.1720 (1.5); 7.1188 (1.1); 7.0976 (1.2); 7.0896 (2.7); 7.0684 (2.8); 7.0609 (2.1); 7.0396 (2.0); 7.0206 (1.6); 7.0183 (1.6); 7.0119 (1.4); 7.0098 (1.4); 6.9904 (2.2); 6.9822 (2.0); 6.9635 (0.8); 6.9609 (0.8); 6.9548 (0.8); 6.9524 (0.8); 4.1848 (2.9); 4.1606 (4.6); 4.1365 (3.0); 3.3234 (10.7); 2.9341 (2.4); 2.9104 (4.3); 2.8850 (3.2); 2.5686 (0.9); 2.5439 (2.6);
2.5147 (7.9); 2.5086 (13.6); 2.5025 (18.0); 2.4965 (13.6); 2.4713 (0.8); 0.0108 (0.4); -0.0001 (12.7); -0.0112 (0.4)
1-164: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2459 (16.0); 7.2596 (19.8); 7.1861 (0.7); 7.1724 (1.0); 7.1691 (1.6); 7.1635 (1.8); 7.1597 (1.1); 7.1514 (4.7); 7.1502 (4.6); 7.1421 (6.5); 7.1361 (2.5); 7.1342 (1.9); 7.1290 (1.7); 7.1247 (2.0); 7.1194 (1.1); 7.1164 (2.0); 7.1003 (0.5); 4.0382 (9.6); 4.0352
(9.9); 4.0323 (4.1); 1.5449 (3.3); -0.0002 (7.8)
1-165: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4442 (4.4); 8.4323 (4.5); 7.2605 (24.4); 7.1662 (0.7); 7.1642 (1.0); 7.1600 (0.5); 7.1475 (1.7); 7.1449 (2.1); 7.1430 (1.8); 7.1315 (0.9); 7.1268 (2.2); 7.1255 (1.8); 7.1219 (0.6); 7.0790 (2.0); 7.0751 (3.0); 7.0698 (0.9); 7.0606 (1.6); 7.0574 (2.5); 7.0543 (2.0); 7.0446 (0.7); 7.0398 (1.5); 7.0348 (0.5); 7.0219 (0.7); 6.9580 (1.6); 6.9460 (3.1); 6.9341 (1.6); 5.2974 (0.7); 3.9312 (16.0); 3.8529 (0.5); 1.6833 (0.5); 1.6698 (0.9); 1.6561 (0.6); 1.6486 (0.6); 1.5624 (1.1); 1.0092 (1.1); 1.0047 (1.4); 0.9961 (2.0); 0.9926
(1.6) ; 0.9826 (1.0); 0.9735 (0.6); 0.9656 (0.7); 0.9620 (1.1); 0.9549 (1.1); 0.9529 (1.3); 0.9519 (1.3); 0.9495 (1.3); 0.9475 (1.0);
0.9410 (1.2); 0.9374 (0.6); 0.9334 (1.4); 0.9304 (1.2); 0.9275 (1.2); 0.9194 (0.6); 0.9132 (0.6); -0.0002 (8.7)
1-166: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2891 (10.9); 7.2595 (66.3); 7.0999 (0.5); 7.0810 (1.0); 7.0788 (1.4); 7.0620 (1.0); 7.0598 (1.3); 7.0365 (0.8); 7.0319 (1.4); 7.0288 (1.5); 7.0166 (1.2); 7.0138 (3.0); 7.0100 (2.6); 7.0076 (0.9); 6.9958 (0.8); 6.9706 (0.6); 6.9496 (1.0); 6.9454 (1.2); 6.9421 (0.9); 6.9305 (0.8); 6.9266 (1.3); 6.9229 (0.7); 5.9352 (0.8); 3.9498 (0.8); 3.9430 (16.0); 3.7263 (2.8); 1.6976 (0.5); 1.6825 (1.1); 1.2263 (1.5); 1.2090 (1.5); 1.1474 (0.6); 1.1301 (0.6); 0.9873 (6.3); 0.9792 (1.4); 0.9745 (2.4); 0.9719 (1.8); 0.9682 (1.9); 0.9654
(2.4) ; 0.9608 (1.2); 0.0079 (0.7); -0.0002 (25.2); -0.0085 (0.8)
1-167: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5546 (6.8); 8.5426 (7.0); 7.3339 (1.9); 7.3294 (3.6); 7.3249 (2.0); 7.2658 (1.8); 7.2538 (3.4); 7.2419 (1.7); 7.0569 (7.7); 7.0524 (7.5); 3.9032 (0.9); 3.8059 (16.0); 3.3274 (94.6); 2.6750 (0.4); 2.6712 (0.5); 2.6664 (0.4); 2.5244 (1.3); 2.5107 (34.5); 2.5066 (70.1); 2.5021 (92.4); 2.4977 (66.0); 2.4934 (31.6); 2.3332 (0.4); 2.3289 (0.5); 2.3243 (0.4); 2.2834 (15.9); -0.0002 (0.8) 1-168: 1H-NMR(400.1 MHz, de-DMSO):
δ= 8.5248 (6.2); 8.5128 (6.3); 7.2386 (1.7); 7.2267 (3.2); 7.2148 (1.7); 7.1824 (0.8); 7.1653 (1.3); 7.1464 (1.8); 7.1234 (1.3); 7.1201 (1.4); 7.1005 (1.6); 7.0809 (1.7); 7.0635 (0.9); 7.0599 (0.8); 6.9223 (0.9); 6.9190 (1.0); 6.9025 (1.6); 6.8993 (1.6); 6.8831 (0.8); 6.8796 (0.7); 3.7872 (16.0); 3.5111 (2.3); 2.5061 (7.7); 2.5021 (10.2); 2.4982 (7.8); 2.2825 (15.6); 1.2329 (0.4); -0.0012
(1 -3)
1-169: 1H-NMR(400.1 MHz, de-DMSO):
δ= 8.7129 (10.2); 7.1178 (2.9); 7.1128 (1.2); 7.1011 (1.6); 7.0960 (5.5); 7.0896 (0.9); 7.0555 (0.9); 7.0492 (5.4); 7.0439 (1.5); 7.0323 (1.2); 7.0273 (2.9); 3.7895 (16.0); 3.6782 (14.6); 3.3496 (3.1); 2.5060 (7.0); 2.5018 (9.2); 2.4975 (6.8); 2.2272 (14.5);
2.0754 (0.4); -0.0009 (0.9)
1-170: 1H-NMR(400.1 MHz, de-DMSO):
δ= 8.5421 (6.2); 8.5301 (6.4); 8.3055 (1.6); 8.2956 (1.6); 8.2937 (1.6); 7.6455 (0.8); 7.6411 (0.8); 7.6257 (1.6); 7.6217 (1.5); 7.6067 (0.9); 7.6022 (0.9); 7.2459 (1.7); 7.2340 (3.2); 7.2221 (1.6); 7.1056 (1.3); 7.0934 (1.4); 7.0872 (1.3); 7.0750 (1.2); 6.9259 (2.3); 6.9056 (2.1); 3.8015 (16.0); 3.6439 (0.4); 3.3439 (25.5); 2.5030 (11.0); 2.4992 (8.4); 2.2672 (15.7); 2.1749 (0.4); 1.2348
(1.7) ; 0.9397 (0.3); -0.0002 (0.8)
1-171 : 'H-NMR(400.1 MHz, de-DMSO):
δ= 7.8328 (0.9); 7.8298 (0.9); 7.8126 (1.0); 7.8086 (1.3); 7.8035 (1.1); 7.7864 (0.9); 7.7833 (1.0); 7.7420 (1.8); 7.7395 (1.8); 7.7301 (2.0); 7.2316 (0.8); 7.2272 (0.8); 7.2038 (1.5); 7.1811 (0.9); 7.1715 (1.0); 7.1629 (1.1); 7.1597 (1.1); 7.1513 (1.7); 7.1429 (1.0); 7.1397 (1.0); 7.1312 (0.8); 7.0083 (1.8); 7.0011 (1.9); 6.9956 (2.4); 6.9874 (1.3); 6.9809 (2.5); 3.7564 (16.0); 3.5956 (0.7); 3.3631 (11.1); 2.5069 (10.3); 2.5029 (13.2); 2.4989 (10.1); 2.2952 (15.6); 2.1212 (0.8); 2.0761 (0.4); 1.2336 (0.4); -0.0009 (1.2) 1-172: Ή-ΝΜϋ^ΟΟ.Ο MHz, CDC13):
δ= 8.4580 (0.7); 8.2809 (10.7); 7.4644 (0.8); 7.4465 (2.1); 7.4413 (1.5); 7.4367 (3.4); 7.4299 (4.7); 7.4211 (0.7); 7.3938 (2.2); 7.3911 (1.2); 7.3845 (1.9); 7.3758 (1.2); 7.3693 (1.1); 7.2593 (18.2); 7.1378 (0.8); 7.1213 (1.4); 7.1184 (1.7); 7.1157 (1.3); 7.1004 (2.1); 7.0582 (0.9); 7.0562 (1.2); 7.0471 (2.6); 7.0445 (3.6); 7.0394 (2.3); 7.0305 (0.9); 7.0261 (2.0); 7.0236 (1.7); 5.2961
(4.0); 3.8543 (16.0); 3.8147 (0.5); 1.5537 (0.8); 1.2576 (0.5); -0.0002 (6.6)
1-173: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5542 (7.3); 8.5422 (7.6); 7.2652 (1.9); 7.2532 (3.6); 7.2412 (1.9); 7.2184 (0.9); 7.2166 (1.3); 7.2123 (0.6); 7.1982 (3.1); 7.1955 (1.8); 7.1828 (1.0); 7.1790 (2.4); 7.1183 (0.6); 7.1153 (1.3); 7.1122 (0.9); 7.1015 (0.6); 7.0969 (1.7); 7.0920 (0.6); 7.0785 (0.7); 7.0531 (2.8); 7.0499 (3.4); 7.0447 (0.9); 7.0343 (1.4); 7.0320 (2.6); 7.0292 (2.1); 4.0836 (16.0); 4.0625 (0.9); 4.0208 (0.5); 3.3208 (0.5); 2.5192 (0.6); 2.5105 (6.1); 2.5060 (12.5); 2.5015 (16.9); 2.4970 (11.9); 2.4924 (5.6); 1.9882 (2.2); 1.3568 (0.8);
1.1922 (0.6); 1.1744 (1.2); 1.1566 (0.6); -0.0002 (0.8)
1-174: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4363 (5.6); 8.4243 (5.7); 7.2624 (13.7); 7.2189 (0.6); 7.2153 (0.8); 7.2027 (0.9); 7.1980 (1.9); 7.1946 (1.4); 7.1898 (0.6); 7.1833 (1.2); 7.1796 (2.4); 7.1775 (1.7); 7.1735 (0.7); 7.1556 (0.6); 7.1515 (1.1); 7.1484 (1.2); 7.1341 (2.2); 7.1317 (3.5); 7.1274
(3.6) ; 7.1216 (0.7); 7.1190 (0.7); 7.1149 (1.4); 7.1108 (2.1); 7.1074 (1.4); 6.9991 (1.7); 6.9871 (3.1); 6.9752 (1.6); 5.2976 (4.3);
4.2748 (16.0); 2.9119 (7.4); 2.8996 (7.3); 1.5781 (0.8); -0.0002 (5.2)
1-175: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4142 (5.5); 8.4022 (5.6); 7.2624 (16.6); 7.1794 (0.7); 7.1745 (1.0); 7.1686 (0.5); 7.1634 (0.6); 7.1577 (3.7); 7.1533 (5.2); 7.1492 (1.0); 7.1380 (2.0); 7.1361 (2.7); 7.1312 (0.8); 7.1210 (0.5); 7.1164 (0.8); 7.0870 (0.7); 7.0823 (1.0); 7.0769 (0.6); 7.0679 (0.7); 7.0655 (0.9); 6.9753 (1.6); 6.9634 (3.0); 6.9515 (1.5); 5.2977 (3.9); 3.8953 (1.2); 3.8868 (16.0); 3.1056 (0.5); 3.0504
(12.3); 2.9799 (12.4); 1.5829 (0.6); -0.0002 (6.1)
1-177: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4353 (0.7); 8.3220 (0.5); 8.3171 (11.8); 8.2232 (1.8); 8.2159 (1.8); 7.2627 (17.0); 7.2329 (0.8); 7.2256 (0.7); 7.2126 (1.0); 7.2109 (1.0); 7.2052 (0.9); 7.2035 (1.0); 7.1906 (0.9); 7.1832 (0.9); 6.9524 (1.1); 6.9512 (1.0); 6.9422 (1.1); 6.9409 (1.0); 6.9303 (0.9); 6.9290 (0.9); 6.9201 (0.9); 6.9189 (0.8); 5.2987 (1.2); 3.8494 (16.0); 3.8278 (0.6); 3.7355 (1.2); 2.3282 (0.9); 2.3209
(15.7); 2.2902 (0.7); 2.2889 (0.7); 1.5771 (1.6); -0.0002 (6.2)
1-082: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4566 (1.7); 8.4447 (1.7); 8.4259 (5.0); 8.4140 (5.0); 7.2604 (24.5); 7.1686 (0.9); 7.1665 (0.9); 7.1558 (0.6); 7.1518 (1.0); 7.1482 (1.6); 7.1454 (2.1); 7.1351 (0.6); 7.1291 (2.0); 7.0642 (3.5); 7.0590 (1.0); 7.0556 (0.9); 7.0511 (1.2); 7.0462 (2.9); 7.0435
(1.7) ; 7.0393 (1.3); 7.0351 (0.6); 7.0318 (0.7); 7.0275 (0.9); 6.9558 (1.4); 6.9438 (2.7); 6.9319 (1.4); 4.2470 (1.6); 4.2335 (3.1); 4.2200 (2.0); 4.2071 (1.1); 4.1925 (0.6); 3.7961 (1.8); 3.7825 (3.3); 3.7690 (1.6); 3.7522 (0.6); 3.7376 (1.3); 3.7228 (0.5); 3.3367
(16.0); 3.2396 (5.1); 2.3373 (2.4); 2.3312 (13.9); 2.2270 (4.2); -0.0002 (9.1)
1-178: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4667 (5.2); 8.4547 (5.3); 7.5637 (1.4); 7.5602 (2.0); 7.5550 (0.7); 7.5419 (3.0); 7.5398 (3.1); 7.5335 (0.6); 7.5024 (1.8); 7.4972 (0.7); 7.4840 (2.9); 7.4801 (1.5); 7.4680 (0.9); 7.4639 (1.6); 7.4135 (0.8); 7.4103 (1.2); 7.4069 (0.7); 7.3970 (0.6); 7.3919 (1.4); 7.3867 (0.5); 7.3738 (0.6); 7.2598 (19.9); 7.2130 (0.9); 7.2088 (0.5); 7.1969 (1.4); 7.1934 (2.5); 7.1818 (1.0); 7.1764 (3.1); 7.1667 (3.4); 7.1620 (4.2); 7.1559 (0.9); 7.1453 (1.6); 7.1411 (1.0); 7.1106 (0.8); 7.1067 (1.0); 7.1021 (0.6); 7.0946 (0.7); 7.0921 (0.8); 7.0893 (1.6); 7.0833 (0.5); 7.0721 (0.6); 6.9954 (1.7); 6.9834 (3.0); 6.9714 (1.6); 5.2971 (1.2); 2.4132 (16.0); 2.0877 (0.6);
2.0434 (0.6); 1.5602 (0.8); 1.2581 (0.7); -0.0002 (8.5)
1-179: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2575 (0.6); 8.2308 (8.9); 7.5182 (0.8); 7.2593 (150.7); 7.1766 (0.8); 7.1744 (1.2); 7.1702 (0.6); 7.1603 (0.8); 7.1562 (2.9); 7.1533 (1.7); 7.1410 (1.1); 7.1372 (2.5); 7.1356 (1.8); 7.0845 (0.6); 7.0812 (1.3); 7.0781 (1.0); 7.0679 (0.5); 7.0629 (1.6); 7.0576 (0.6); 7.0461 (3.2); 7.0427 (3.6); 7.0373 (0.8); 7.0250 (2.4); 7.0220 (1.9); 6.9953 (0.9); 4.2436 (2.0); 4.2302 (3.9); 4.2167 (2.2); 3.7904 (2.0); 3.7769 (3.4); 3.7636 (1.7); 3.3366 (16.0); 3.3158 (0.8); 3.2386 (0.8); 2.3385 (14.3); 2.3055 (0.8); 2.2327 (0.6);
1.5665 (1.7); 0.0079 (2.2); -0.0002 (61.8); -0.0085 (1.7)
1-180: 1H-NMR(400.0 MHz, CDC13):
δ= 8.6970 (3.8); 7.2661 (0.5); 7.2653 (0.6); 7.2644 (0.8); 7.2636 (1.0); 7.2603 (30.9); 7.0057 (0.7); 6.9842 (1.0); 6.9807 (0.7); 6.9640 (0.9); 6.9593 (1.0); 6.9390 (0.8); 6.9112 (0.7); 6.9055 (0.8); 6.8931 (0.7); 6.8873 (0.8); 6.8846 (0.7); 6.8788 (0.8); 6.8664 (0.6); 6.8607 (0.8); 6.8223 (0.6); 6.8186 (0.6); 6.8165 (0.6); 6.8124 (0.9); 6.8086 (0.6); 6.8064 (0.5); 6.8028 (0.6); 6.8007 (0.5);
6.7909 (0.7); 5.2985 (0.6); 3.8519 (16.0); 2.3313 (15.0); -0.0002 (13.2)
1-181 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.2956 (10.4); 7.2614 (15.5); 7.1386 (2.8); 7.1334 (1.0); 7.1220 (1.2); 7.1167 (4.1); 7.1102 (0.5); 7.0357 (0.6); 7.0292 (4.3); 7.0238 (1.2); 7.0125 (1.0); 7.0072 (2.8); 3.8513 (16.0); 2.7512 (0.8); 2.7320 (2.7); 2.7129 (2.8); 2.6939 (0.8); 1.1453 (3.0);
1.1263 (6.7); 1.1072 (2.8); -0.0002 (5.7)
1-182: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2965 (11.6); 7.5380 (4.3); 7.2606 (22.8); 7.1544 (2.0); 7.1491 (0.8); 7.1417 (2.0); 7.1374 (1.0); 7.1321 (2.3); 7.1248 (0.9); 7.1194 (2.3); 6.9001 (2.4); 6.8945 (0.7); 6.8832 (0.8); 6.8785 (3.7); 6.8732 (0.8); 6.8619 (0.6); 6.8564 (1.9); 4.1302 (1.2); 4.1124 (1.2); 3.8980 (16.0); 2.0427 (5.5); 1.5607 (1.2); 1.2758 (1.6); 1.2580 (3.2); 1.2401 (1.5); -0.0002 (9.0)
1-087: 'H-NMR(400.0 MHz, CDC13):
δ= 8.4682 (5.6); 8.4562 (5.7); 7.2614 (22.1); 7.1014 (1.8); 7.0960 (0.8); 7.0886 (1.9); 7.0845 (0.9); 7.0832 (0.9); 7.0790 (2.4); 7.0716 (0.9); 7.0662 (2.3); 6.9973 (1.8); 6.9853 (3.3); 6.9733 (1.7); 6.8804 (2.3); 6.8748 (0.7); 6.8635 (0.7); 6.8586 (3.4); 6.8534 (0.8); 6.8421 (0.6); 6.8366 (1.8); 3.8181 (15.8); 3.7871 (0.6); 3.7435 (0.7); 2.3079 (16.0); 2.2929 (0.6); 1.3334 (0.5); 1.2843
(0.7); 1.2558 (0.6); -0.0002 (8.4)
1-183: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6420 (11.0); 7.0915 (5.4); 7.0883 (5.4); 7.0724 (11.4); 3.9031 (1.9); 3.8003 (16.0); 3.3251 (72.5); 2.7391 (0.9); 2.7202 (3.0); 2.7011 (3.1); 2.6822 (1.0); 2.6755 (0.5); 2.6712 (0.6); 2.5061 (70.0); 2.5019 (89.8); 2.4975 (64.5); 2.3327 (0.4); 2.3285 (0.5);
2.3244 (0.4); 1.0655 (3.4); 1.0466 (7.5); 1.0276 (3.2); -0.0002 (2.4)
1-184: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5609 (6.1); 8.5489 (6.2); 7.2972 (0.6); 7.2817 (0.7); 7.2769 (1.3); 7.2615 (1.4); 7.2530 (1.8); 7.2411 (3.8); 7.2291 (1.6); 6.9503 (0.6); 6.9443 (0.6); 6.9287 (1.0); 6.9231 (1.1); 6.9079 (0.6); 6.8935 (1.5); 6.8738 (1.4); 6.8514 (0.9); 6.8462 (1.2); 6.8412 (0.7); 6.8268 (0.9); 6.8219 (1.2); 6.8164 (0.7); 3.9033 (1.5); 3.8286 (16.0); 3.3251 (62.9); 2.7286 (0.9); 2.7096 (3.0); 2.6906 (3.1); 2.6714 (1.4); 2.5240 (1.3); 2.5063 (61.2); 2.5020 (79.6); 2.4976 (57.6); 2.3329 (0.3); 2.3288 (0.5); 2.3243 (0.3); 1.0741
(3.3); 1.0552 (7.4); 1.0362 (3.2); -0.0002 (2.0)
1-185: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.2785 (10.3); 7.2991 (0.5); 7.2835 (0.6); 7.2791 (1.0); 7.2636 (1.0); 7.2590 (0.7); 7.2434 (0.6); 6.9549 (0.4); 6.9489 (0.5); 6.9340 (0.8); 6.9280 (0.8); 6.9123 (0.4); 6.9071 (0.4); 6.8776 (1.1); 6.8578 (1.1); 6.8269 (0.7); 6.8218 (0.9); 6.8165 (0.6); 6.8023 (0.7); 6.7975 (0.9); 6.7920 (0.5); 3.9032 (1.4); 3.8160 (16.0); 3.8116 (13.4); 3.3238 (47.9); 2.7226 (0.6); 2.7036 (2.2); 2.6846 (2.3); 2.6756 (0.5); 2.6659 (0.9); 2.5240 (1.1); 2.5104 (25.1); 2.5062 (51.1); 2.5018 (67.1); 2.4973 (48.0); 2.4932 (23.1); 2.3285
(0.4); 1.0723 (2.4); 1.0534 (5.6); 1.0344 (2.4); -0.0002 (1.8)
1-186: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.2749 (10.8); 7.0869 (4.2); 7.0827 (4.2); 7.0672 (9.3); 3.9031 (1.3); 3.8166 (16.0); 3.7868 (13.4); 3.3278 (87.7); 2.7272 (0.7); 2.7083 (2.4); 2.6893 (2.5); 2.6706 (1.1); 2.5062 (54.8); 2.5019 (71.4); 2.4975 (51.4); 2.3286 (0.4); 1.0588 (2.7); 1.0400 (6.2);
1.0209 (2.6); -0.0002 (0.9)
1-187: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.2717 (11.5); 7.3043 (0.4); 7.2973 (3.6); 7.2926 (1.2); 7.2806 (1.3); 7.2758 (4.3); 7.2688 (0.5); 7.0503 (0.5); 7.0435 (4.2); 7.0388 (1.2); 7.0267 (1.2); 7.0220 (3.6); 7.0151 (0.3); 3.9031 (0.9); 3.8144 (16.0); 3.7988 (13.5); 3.3258 (70.4); 2.7159 (0.7); 2.6970 (2.4); 2.6779 (2.6); 2.6664 (0.5); 2.6592 (0.8); 2.5238 (1.1); 2.5062 (56.7); 2.5018 (73.4); 2.4974 (52.2); 2.3286 (0.4);
1.0642 (2.7); 1.0453 (6.0); 1.0263 (2.6); -0.0002 (0.6)
1-188: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6365 (14.2); 8.1539 (5.5); 7.3088 (0.4); 7.3016 (4.3); 7.2969 (1.4); 7.2850 (1.5); 7.2801 (5.3); 7.2732 (0.6); 7.0764 (0.6); 7.0695 (5.4); 7.0646 (1.6); 7.0529 (1.4); 7.0480 (4.5); 7.0409 (0.5); 3.9030 (1.0); 3.8509 (16.0); 3.3263 (98.9); 2.6756 (0.4); 2.6709 (0.5); 2.6664 (0.4); 2.5241 (1.2); 2.5103 (31.8); 2.5062 (65.4); 2.5018 (86.8); 2.4974 (62.4); 2.3332 (0.4); 2.3285 (0.5);
2.3238 (0.4); -0.0002 (0.5)
1-189: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6141 (16.0); 8.1734 (8.3); 7.2510 (2.1); 7.2324 (4.9); 7.2129 (3.6); 7.1371 (1.8); 7.1187 (2.6); 7.1003 (1.0); 7.0587 (4.0); 7.0556 (5.1); 7.0375 (4.0); 4.1533 (1.6); 4.1352 (5.2); 4.1170 (5.3); 4.0989 (1.7); 3.9030 (1.2); 3.3249 (102.5); 2.6752 (0.4); 2.6708 (0.6); 2.6662 (0.4); 2.5237 (1.6); 2.5101 (41.8); 2.5061 (83.5); 2.5016 (109.0); 2.4972 (77.8); 2.4930 (37.4); 2.3326 (0.4);
2.3283 (0.6); 2.3237 (0.4); 1.4248 (6.0); 1.4066 (12.7); 1.3884 (5.8); -0.0002 (1.4)
1-190: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6233 (14.4); 8.2193 (6.1); 7.2515 (1.3); 7.2473 (0.6); 7.2330 (3.2); 7.2135 (2.4); 7.1400 (1.2); 7.1373 (0.8); 7.1216 (1.7); 7.1032 (0.6); 7.0486 (2.6); 7.0454 (3.3); 7.0274 (2.7); 4.5067 (0.4); 4.4900 (1.0); 4.4734 (1.4); 4.4568 (1.0); 4.4403 (0.4); 3.9029 (1.0); 3.3224 (47.3); 2.6751 (0.4); 2.6705 (0.5); 2.6660 (0.3); 2.5238 (1.2); 2.5103 (31.6); 2.5059 (65.0); 2.5015 (85.5); 2.4969
(60.2); 2.4925 (28.1); 2.3325 (0.3); 2.3282 (0.5); 2.3237 (0.4); 1.4538 (16.0); 1.4372 (15.8); 0.9360 (0.4); -0.0002 (1.7)
1-191 : 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6139 (10.8); 8.2056 (6.0); 7.2530 (1.4); 7.2345 (3.3); 7.2150 (2.4); 7.1360 (1.2); 7.1176 (1.8); 7.0992 (0.6); 7.0515 (2.8); 7.0485 (3.4); 7.0304 (2.8); 4.5023 (0.4); 4.4856 (1.0); 4.4690 (1.4); 4.4524 (1.1); 4.4359 (0.4); 3.9030 (1.1); 3.3245 (61.0); 2.6752 (0.3); 2.6707 (0.5); 2.6662 (0.3); 2.5239 (1.2); 2.5104 (32.3); 2.5061 (65.1); 2.5017 (84.6); 2.4972 (59.8); 2.4930 (28.3);
2.3330 (0.4); 2.3282 (0.5); 2.3236 (0.3); 2.2494 (0.3); 1.4519 (16.0); 1.4353 (15.8); 1.1750 (0.3); -0.0001 (1.5)
1-192: !H-NMR^OCl MHz, de-DMSO):
δ= 8.6225 (16.0); 7.2592 (1.1); 7.2504 (1.2); 7.2285 (1.4); 7.2198 (1.5); 7.1949 (1.1); 7.1864 (1.1); 7.1149 (0.8); 7.0936 (0.9); 7.0858 (2.0); 7.0645 (2.0); 7.0572 (1.6); 7.0358 (1.4); 7.0203 (1.2); 7.0117 (1.1); 6.9905 (1.7); 6.9820 (1.4); 6.9610 (0.6); 6.9527 (0.6); 4.1792 (2.1); 4.1554 (3.3); 4.1311 (2.1); 3.3217 (41.2); 2.9427 (1.8); 2.9190 (3.1); 2.8935 (2.3); 2.5661 (0.7); 2.5407 (2.0); 2.5137 (13.5); 2.5077 (24.1); 2.5017 (31.5); 2.4957 (22.2); 2.4899 (10.8); 2.4688 (0.7); 2.0751 (1.8); 0.0108 (0.7); -0.0001 (20.7);
-0.0111 (0.7)
1-193: 1H-NMR(400.1 MHz, de-DMSO):
δ= 8.5484 (6.3); 8.5365 (6.4); 7.2460 (1.7); 7.2340 (3.3); 7.2221 (1.7); 7.0420 (3.0); 7.0217 (4.2); 6.9238 (4.9); 6.9034 (3.6); 3.7647 (16.0); 3.3281 (35.1); 3.3043 (0.5); 2.8899 (0.3); 2.5059 (16.2); 2.5018 (21.4); 2.4978 (16.0); 2.2747 (0.4); 2.2529 (15.9);
2.2124 (12.5); 1.2578 (0.4); 1.2349 (3.2); 0.9394 (0.4); 0.9227 (0.4); 0.8534 (0.4); -0.0002 (3.9)
1-194: 1H-NMR(400.1 MHz, de-DMSO):
δ= 7.8206 (1.3); 7.7913 (3.7); 7.7763 (3.9); 7.1727 (1.2); 7.1633 (1.7); 7.1528 (1.9); 7.1419 (1.6); 7.1334 (1.2); 7.1260 (0.9); 7.1021 (1.3); 7.0779 (7.7); 7.0594 (11.3); 3.7547 (16.0); 3.6980 (0.9); 3.3212 (12.8); 2.5023 (20.9); 2.2884 (1.8); 2.2684 (15.9); 2.0750 (0.7); 1.2985 (0.4); 1.2575 (0.5); 1.2339 (1.2); -0.0002 (2.6)
1-195: Ή-ΝΜϋ^ΟΟ.Ι MHz, de-DMSO):
δ= 8.4815 (4.3); 8.4784 (5.4); 8.4756 (5.4); 8.4725 (4.8); 8.4652 (4.8); 8.4622 (5.7); 8.4590 (5.3); 8.4561 (4.6); 8.0260 (4.8); 8.0228 (3.4); 8.0020 (7.3); 7.9985 (11.1); 7.9951 (6.8); 7.9717 (5.9); 7.9657 (5.9); 7.9481 (6.3); 7.9421 (6.2); 7.9203 (2.9); 7.9140 (2.8); 7.8128 (0.4); 7.8054 (0.4); 7.7883 (0.6); 7.7607 (0.5); 7.7540 (0.3); 7.3407 (3.2); 7.3320 (3.4); 7.3083 (7.8); 7.3016 (4.7); 7.2966 (6.9); 7.2919 (5.7); 7.2891 (5.2); 7.2847 (4.5); 7.2760 (4.1); 7.2724 (5.1); 7.2681 (7.0); 7.2424 (2.7); 7.2212 (3.0); 7.2129 (6.1); 7.1919 (6.4); 7.1835 (3.9); 7.1624 (3.8); 7.0894 (0.8); 7.0743 (3.2); 7.0713 (3.0); 7.0655 (3.0); 7.0430 (4.2); 7.0364
(4.0) ; 7.0138 (2.8); 7.0084 (2.1); 6.9878 (1.1); 4.1675 (0.6); 4.1434 (1.1); 4.1169 (7.9); 4.0939 (16.0); 4.0709 (7.8); 3.3174 (132.1); 3.1773 (0.4); 3.1599 (0.4); 2.9325 (6.0); 2.9088 (11.0); 2.8831 (7.6); 2.8632 (0.9); 2.8529 (0.4); 2.7276 (0.7); 2.5132 (38.2); 2.5073 (74.5); 2.5013 (98.1); 2.4953 (66.2); 2.4894 (29.7); 2.4162 (1.9); 2.3929 (5.7); 2.3680 (7.8); 2.3439 (5.0); 2.3205 (1.4); 2.2715 (0.6); 2.0743 (0.7); 1.2344 (5.0); 1.1939 (0.3); 0.8718 (0.4); 0.8523 (0.6); 0.8296 (0.4); 0.1958 (0.4); 0.0108 (2.8);
0.0000 (69.9); -0.0111 (2.0); -0.0626 (0.8)
1-196: Ή-ΝΜϋ^ΟΟ.Ο MHz, CDC13):
δ= 8.6235 (0.7); 8.6115 (0.7); 8.5141 (5.2); 8.5021 (5.4); 7.2613 (22.6); 7.0413 (1.6); 7.0294 (3.0); 7.0174 (1.5); 6.5666 (0.7); 6.5635 (1.8); 6.5475 (2.1); 6.5448 (1.3); 6.5416 (2.0); 6.5256 (1.7); 5.2985 (2.6); 3.8477 (2.3); 3.7688 (16.0); 2.4435 (10.5);
2.3316 (2.3); 1.5607 (1.4); -0.0002 (8.5)
1-197: 1H-NMR(400.0 MHz, CDC13):
δ= 7.2598 (10.0); 7.2587 (10.0); 7.2154 (0.8); 7.1947 (1.9); 7.1762 (1.6); 7.1532 (1.6); 7.1343 (1.6); 7.0926 (2.3); 7.0876 (1.3); 7.0680 (3.2); 7.0542 (1.4); 7.0464 (2.2); 5.7213 (2.5); 5.7203 (2.5); 5.2962 (0.6); 5.2952 (0.6); 3.9205 (8.3); 3.9196 (8.3); 3.8106
(16.0); 3.8099 (16.0); 3.8050 (10.0); 3.7144 (8.2); 2.2746 (7.4); 2.2209 (8.1); 1.5682 (0.6); -0.0002 (3.8); -0.0013 (3.8)
1-126: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4534 (2.2); 8.4416 (2.2); 7.2602 (29.2); 7.1739 (0.7); 7.1717 (1.1); 7.1676 (0.5); 7.1552 (1.9); 7.1525 (2.2); 7.1505 (1.8); 7.1393 (0.9); 7.1345 (2.4); 7.1331 (1.8); 7.1296 (0.5); 7.0890 (2.0); 7.0851 (3.3); 7.0797 (0.9); 7.0742 (1.2); 7.0718 (1.5); 7.0701 (1.4); 7.0674 (2.3); 7.0659 (1.4); 7.0642 (1.6); 7.0584 (0.8); 7.0535 (1.4); 7.0356 (0.6); 6.9708 (1.4); 6.9588 (2.7); 6.9469 (1.4); 4.1301 (1.1); 4.1122 (1.1); 3.8299 (16.0); 2.3032 (14.6); 2.2938 (0.5); 2.2890 (0.7); 2.0428 (5.2); 1.5570 (3.2); 1.2760 (1.5);
1.2581 (3.1); 1.2403 (1.5); -0.0002 (10.4)
1-198: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4349 (5.2); 8.4229 (5.2); 7.2607 (13.7); 7.1747 (0.6); 7.1725 (1.0); 7.1563 (1.6); 7.1531 (1.5); 7.1513 (1.5); 7.1490 (0.5); 7.1403 (0.6); 7.1351 (1.9); 7.1338 (1.4); 7.0794 (0.9); 7.0752 (2.8); 7.0706 (1.5); 7.0693 (1.4); 7.0611 (0.6); 7.0587 (0.8); 7.0568 (1.7); 7.0553 (1.8); 7.0537 (1.6); 7.0505 (1.2); 7.0327 (0.5); 6.9578 (1.6); 6.9458 (3.2); 6.9339 (1.6); 4.1529 (1.0); 4.1347 (3.3);
4.1165 (3.4); 4.0984 (1.0); 2.3092 (16.0); 1.5793 (0.8); 1.4972 (3.6); 1.4791 (7.8); 1.4609 (3.5); -0.0002 (5.2)
1-199: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4175 (5.5); 8.4055 (5.6); 7.2603 (14.2); 7.1769 (0.6); 7.1752 (1.1); 7.1613 (0.7); 7.1579 (1.5); 7.1560 (1.9); 7.1537 (1.4); 7.1511 (0.7); 7.1373 (1.8); 7.0695 (0.5); 7.0679 (0.8); 7.0658 (1.1); 7.0583 (2.4); 7.0553 (2.8); 7.0508 (1.6); 7.0490 (1.6); 7.0417 (0.8); 7.0405 (0.8); 7.0376 (1.6); 7.0347 (2.2); 7.0314 (0.6); 6.9467 (1.6); 6.9348 (3.1); 6.9228 (1.6); 4.4957 (0.9); 4.4792 (1.2);
4.4626 (0.9); 2.3130 (16.0); 1.5762 (1.1); 1.5357 (13.8); 1.5191 (13.7); -0.0002 (5.3)
1-200: 'H-NMR(601.6 MHz, CD3CN):
δ= 8.4143 (4.4); 8.4063 (4.4); 7.6053 (1.0); 7.5924 (1.0); 7.4798 (0.5); 7.4787 (0.5); 7.4674 (1.0); 7.4664 (1.0); 7.4540 (0.6); 7.4530 (0.6); 7.2922 (0.7); 7.2909 (0.5); 7.2796 (1.1); 7.2669 (0.5); 7.2023 (1.2); 7.1888 (1.1); 7.1062 (1.5); 7.0982 (2.9); 7.0903 (1.4); 3.8453 (15.5); 2.5381 (2.2); 2.3109 (16.0); 2.3052 (0.3); 2.1923 (4.0); 1.9925 (2.2); 1.9844 (1.1); 1.9803 (1.3); 1.9764
(5.1) ; 1.9723 (8.4); 1.9682 (12.2); 1.9641 (8.3); 1.9600 (4.1)
1-203: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6483 (11.3); 7.3042 (0.7); 7.2883 (1.5); 7.2847 (1.5); 7.2688 (1.8); 7.2485 (0.7); 6.9659 (1.0); 6.9437 (1.7); 6.9229 (0.8); 6.9188 (0.7); 6.8816 (2.2); 6.8619 (2.0); 6.8330 (1.6); 6.8285 (1.6); 6.8085 (1.6); 6.8042 (1.6); 3.9063 (1.0); 3.9024 (1.5); 3.8253 (16.0); 3.3235 (62.5); 2.7337 (1.3); 2.7154 (3.5); 2.6964 (3.5); 2.6774 (1.6); 2.5056 (113.1); 2.5016 (113.6); 2.3326 (0.6); 2.3282
(0.7); 1.0789 (4.0); 1.0599 (7.9); 1.0410 (3.4); 0.0030 (1.3); 0.0001 (1.9); -0.0010 (1.9)
1-204: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.9909 (10.0); 7.3664 (0.4); 7.3592 (3.9); 7.3542 (1.2); 7.3426 (1.4); 7.3376 (4.7); 7.3306 (0.5); 7.1122 (0.5); 7.1052 (4.7); 7.1001 (1.4); 7.0885 (1.2); 7.0835 (3.9); 7.0764 (0.4); 3.9078 (16.0); 3.9034 (3.5); 3.3260 (66.1); 2.6757 (0.3); 2.6712 (0.4); 2.6667 (0.3); 2.6038 (15.1); 2.5246 (1.1); 2.5111 (28.8); 2.5067 (59.4); 2.5022 (78.3); 2.4977 (55.3); 2.4933 (26.0); 2.3334 (0.3);
2.3289 (0.4); -0.0002 (2.3)
1-205: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.2362 (11.4); 7.2352 (0.5); 7.2136 (1.1); 7.2083 (0.7); 7.1908 (0.5); 7.1853 (0.5); 6.9920 (1.3); 6.9870 (1.6); 6.9710 (2.1); 6.9538 (0.8); 3.9032 (1.3); 3.8160 (16.0); 3.7546 (12.6); 3.3253 (63.6); 2.6711 (0.4); 2.5243 (0.9); 2.5108 (24.5); 2.5064 (50.8);
2.5020 (67.3); 2.4974 (47.6); 2.4930 (22.5); 2.3287 (0.4); 2.2949 (11.9); -0.0002 (1.8)
1-206: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.2553 (11.3); 7.2953 (0.5); 7.2797 (0.6); 7.2752 (1.1); 7.2597 (1.2); 7.2550 (0.8); 7.2394 (0.7); 6.9579 (0.5); 6.9522 (0.5); 6.9370 (0.9); 6.9309 (1.0); 6.9150 (0.4); 6.9101 (0.5); 6.8533 (1.2); 6.8334 (1.2); 6.8009 (0.8); 6.7955 (1.0); 6.7905 (0.6); 6.7764 (0.8); 6.7713 (1.0); 6.7660 (0.6); 3.9030 (1.3); 3.8128 (16.0); 3.7772 (13.2); 3.3242 (49.3); 2.6710 (0.4); 2.5237 (1.1); 2.5101
(26.2); 2.5060 (52.0); 2.5016 (67.7); 2.4972 (48.3); 2.4931 (23.2); 2.3285 (0.4); 2.2668 (12.9); -0.0002 (1.8)
1-207: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.2657 (11.2); 7.2404 (0.5); 7.2183 (1.1); 7.2132 (0.7); 7.1957 (0.5); 7.1897 (0.5); 7.0128 (1.4); 7.0084 (1.6); 6.9921 (2.3); 6.9757 (0.8); 3.9032 (0.9); 3.8192 (16.0); 3.7901 (13.3); 3.3259 (73.7); 2.7516 (0.7); 2.7326 (2.3); 2.7136 (2.4); 2.6949 (0.7); 2.6712 (0.4); 2.5244 (1.1); 2.5108 (27.8); 2.5065 (57.1); 2.5021 (75.5); 2.4976 (54.0); 2.4933 (25.8); 2.3289 (0.4); 1.0785 (2.6); 1.0596 (5.9); 1.0406 (2.5); -0.0002 (1.1)
1-208: 'H-NMR^O.O MHz, de-DMSO):
δ= 8.6515 (11.4); 7.4375 (1.4); 7.4307 (1.5); 7.4161 (1.4); 7.4093 (1.4); 7.1898 (0.7); 7.1830 (0.7); 7.1682 (1.3); 7.1614 (1.2); 7.1466 (0.8); 7.1398 (0.8); 6.9076 (1.5); 6.8930 (1.6); 6.8853 (1.3); 6.8707 (1.3); 3.9032 (1.1); 3.8304 (16.0); 3.3255 (91.7); 2.7191 (0.8); 2.7000 (2.8); 2.6809 (3.0); 2.6715 (0.7); 2.6622 (1.0); 2.5244 (1.3); 2.5109 (32.6); 2.5066 (67.0); 2.5022 (88.5); 2.4977 (63.3); 2.4935 (30.4); 2.3336 (0.4); 2.3291 (0.5); 2.3244 (0.4); 1.0736 (3.1); 1.0547 (7.2); 1.0357 (3.0); -0.0002 (0.9) 1-209: Ή-ΝΜϋ^ΟΟ.Ο MHz, de-DMSO):
δ= 8.6385 (16.0); 8.2086 (6.7); 7.3123 (0.5); 7.3052 (4.8); 7.3004 (1.6); 7.2885 (1.7); 7.2837 (5.7); 7.2768 (0.7); 7.0737 (0.6); 7.0667 (5.7); 7.0617 (1.7); 7.0500 (1.5); 7.0451 (4.8); 7.0382 (0.5); 4.1584 (1.3); 4.1401 (4.0); 4.1220 (4.1); 4.1038 (1.4); 3.9031 (1.4); 3.3261 (113.8); 2.6756 (0.4); 2.6710 (0.6); 2.6664 (0.4); 2.5240 (1.6); 2.5105 (41.1); 2.5064 (83.2); 2.5020 (109.3); 2.4975
(78.1); 2.4934 (37.5); 2.3330 (0.4); 2.3290 (0.6); 2.3242 (0.5); 1.4255 (4.8); 1.4073 (10.4); 1.3891 (4.7); -0.0002 (1.5)
1-210: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6139 (11.5); 8.1186 (5.5); 7.2490 (1.5); 7.2303 (3.7); 7.2110 (2.8); 7.1378 (1.3); 7.1197 (2.0); 7.1012 (0.7); 7.0625 (3.2); 7.0598 (3.8); 7.0415 (3.2); 3.9030 (0.8); 3.8460 (16.0); 3.3247 (61.1); 2.6707 (0.4); 2.5059 (63.0); 2.5018 (80.7); 2.4976 (58.3);
2.3283 (0.5); -0.0002 (1.2)
1-211 : 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.7491 (0.4); 8.6263 (14.7); 8.1786 (7.6); 7.1044 (16.0); 7.0865 (10.5); 4.1420 (1.6); 4.1240 (4.9); 4.1058 (4.9); 4.0876 (1.6);
3.9032 (1.1); 3.3242 (79.4); 2.6710 (0.6); 2.5061 (88.8); 2.5019 (116.0); 2.4976 (84.8); 2.3284 (0.6); 1.4169 (5.6); 1.3988 (11.8);
1.3806 (5.5); 1.3682 (0.3); 1.3501 (0.5); 1.2372 (0.3); -0.0002 (1.7)
1-212: 1H-NMR(400.1 MHz, de-DMSO):
δ= 8.6073 (11.4); 7.0394 (3.1); 7.0191 (4.2); 6.9112 (4.9); 6.8908 (3.6); 3.7604 (16.0); 3.3152 (19.6); 2.5042 (23.0); 2.5001
(30.9); 2.4960 (23.5); 2.2654 (15.8); 2.2144 (12.8); -0.0009 (6.4)
1-213: 1H-NMR(400.0 MHz, de-DMSO):
δ= 7.9516 (1.4); 7.9481 (1.5); 7.9393 (1.5); 7.9359 (1.5); 7.7974 (0.8); 7.7926 (0.8); 7.7752 (1.4); 7.7588 (0.9); 7.7538 (0.9); 7.2244 (0.7); 7.1984 (1.3); 7.1735 (0.7); 7.0746 (1.4); 7.0622 (1.4); 7.0572 (1.4); 7.0446 (1.2); 7.0064 (2.5); 6.9957 (2.0); 6.9846 (3.9); 6.9699 (1.8); 6.9659 (1.9); 4.2219 (0.4); 3.9032 (0.8); 3.7554 (16.0); 3.3268 (62.9); 2.6709 (0.5); 2.5056 (78.0); 2.5018 (99.5); 2.4980 (74.7); 2.3284 (0.6); 2.2818 (15.7); 2.2632 (0.4); 1.2971 (0.4); 1.2836 (0.6); 1.2585 (0.4); 1.2352 (0.6); 0.9303
(0.3); 0.9121 (0.6); 0.8936 (0.6); 0.8753 (0.8); 0.8615 (0.8); 0.8431 (0.4); -0.0002 (1.3)
1-214: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.0008 (1.3); 7.9969 (1.4); 7.9887 (1.4); 7.9846 (1.4); 7.7926 (0.8); 7.7877 (0.8); 7.7714 (1.3); 7.7539 (0.9); 7.7490 (0.9); 7.0736 (6.1); 7.0707 (6.5); 7.0613 (2.0); 7.0547 (12.4); 6.9963 (2.2); 6.9755 (2.1); 3.9029 (0.8); 3.7531 (16.0); 3.3285 (97.6); 2.6708 (0.4); 2.6665 (0.3); 2.5062 (59.3); 2.5019 (77.6); 2.4975 (56.7); 2.3330 (0.3); 2.3285 (0.4); 2.3241 (0.4); 2.2609 (16.0); -
0.0003 (1.0)
1-215: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6154 (0.5); 8.6096 (0.5); 8.4346 (2.6); 8.4288 (2.6); 8.2600 (1.6); 8.2541 (1.5); 8.2385 (1.7); 8.2325 (1.6); 7.9037 (0.3); 7.8977 (0.3); 7.8810 (0.3); 7.8751 (0.4); 7.2055 (0.6); 7.1996 (0.6); 7.1819 (0.9); 7.1771 (1.4); 7.1521 (3.0); 7.1305 (2.4); 6.9964 (1.0); 6.9801 (2.7); 6.9642 (2.0); 6.9611 (1.9); 3.9034 (1.0); 3.8405 (15.6); 3.8223 (1.0); 3.7744 (16.0); 3.3248 (77.1); 3.0477 (2.6); 2.6710 (0.5); 2.6667 (0.4); 2.5241 (1.4); 2.5064 (71.6); 2.5021 (94.3); 2.4977 (67.9); 2.3284 (0.6); 2.3134 (14.1); -0.0002
(1 -4)
1-216: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.1640 (2.2); 8.1513 (2.3); 7.5079 (1.8); 7.5048 (1.8); 7.4951 (1.8); 7.4920 (1.8); 7.3056 (3.3); 7.2105 (0.6); 7.2043 (0.6); 7.1870 (0.9); 7.1816 (1.2); 7.1611 (0.6); 7.1569 (0.6); 7.0021 (0.4); 6.9964 (1.0); 6.9792 (2.6); 6.9735 (1.4); 6.9591 (1.9); 6.9530 (1.3); 3.9034 (1.1); 3.8803 (16.0); 3.7713 (14.4); 3.3234 (50.6); 2.6756 (0.4); 2.6712 (0.5); 2.6666 (0.4); 2.5244 (1.4); 2.5107 (34.8); 2.5065 (69.7); 2.5021 (90.9); 2.4977 (64.6); 2.4934 (31.0); 2.3337 (0.4); 2.3286 (0.6); 2.3124 (13.8); -0.0002 (1.6) 1-217: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.5328 (6.2); 8.5208 (6.3); 7.8053 (4.2); 7.7840 (4.3); 7.2326 (1.6); 7.2206 (3.0); 7.2086 (1.6); 7.1372 (4.2); 7.1159 (4.1);
3.9033 (1.9); 3.8123 (16.0); 3.8032 (14.8); 3.6235 (1.1); 3.3401 (29.1); 3.1684 (0.5); 2.6752 (0.4); 2.6711 (0.6); 2.6666 (0.4); 2.5241 (1.5); 2.5104 (37.6); 2.5064 (75.4); 2.5020 (98.4); 2.4975 (70.1); 2.4932 (33.3); 2.3330 (0.4); 2.3287 (0.6); 2.3239 (0.4);
2.2546 (14.3); 2.1474 (1.0); -0.0002 (1.4)
1-218: 1H-NMR(400.0 MHz, de-DMSO):
δ= 8.6283 (11.2); 7.8115 (4.2); 7.7902 (4.5); 7.1304 (4.5); 7.1092 (4.2); 3.9032 (2.4); 3.8149 (16.0); 3.8001 (15.3); 3.3310
(116.2); 2.6760 (0.4); 2.6715 (0.5); 2.6672 (0.4); 2.5417 (0.6); 2.5247 (1.2); 2.5111 (33.3); 2.5070 (68.4); 2.5026 (90.5); 2.4982
(65.0); 2.3338 (0.4); 2.3292 (0.5); 2.2597 (15.0); -0.0002 (0.7)
1-219: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4654 (5.5); 8.4534 (5.6); 7.2605 (34.9); 7.0879 (0.7); 7.0684 (2.0); 7.0489 (1.7); 7.0401 (1.0); 7.0356 (2.1); 7.0316 (1.5); 7.0184 (1.2); 7.0153 (1.6); 7.0135 (1.0); 7.0103 (1.0); 6.9987 (0.7); 6.9958 (0.8); 6.9937 (0.7); 6.9908 (0.5); 6.9778 (1.6); 6.9658 (3.2); 6.9613 (1.2); 6.9580 (1.4); 6.9570 (1.4); 6.9538 (2.5); 6.9421 (0.8); 6.9390 (0.9); 6.9376 (0.9); 6.9346 (0.7); 5.2983 (3.1); 3.9473 (16.0); 1.6946 (0.5); 1.6802 (1.1); 1.6600 (0.5); 1.5509 (4.4); 1.2559 (0.5); 0.9895 (1.0); 0.9861 (2.2); 0.9831 (2.0);
0.9791 (2.4); 0.9762 (3.2); 0.9719 (3.0); 0.9681 (1.5); 0.9600 (1.4); 0.9561 (2.1); 0.9518 (1.1); -0.0002 (12.4)
1-220: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4787 (2.4); 8.4668 (2.4); 7.4370 (1.9); 7.4317 (1.4); 7.4270 (3.2); 7.4239 (1.7); 7.4203 (4.7); 7.4153 (0.9); 7.4119 (0.8); 7.4004 (0.5); 7.3899 (2.2); 7.3868 (1.3); 7.3830 (1.1); 7.3804 (1.9); 7.3778 (1.0); 7.3760 (0.8); 7.3719 (1.2); 7.3652 (1.1); 7.2603 (15.3); 7.1310 (0.8); 7.1149 (1.4); 7.1122 (2.0); 7.1099 (1.6); 7.0993 (0.8); 7.0945 (2.4); 7.0899 (0.8); 7.0708 (2.5); 7.0664 (3.4); 7.0608 (0.8); 7.0524 (0.8); 7.0492 (1.6); 7.0473 (1.2); 7.0454 (1.7); 7.0420 (1.0); 7.0377 (0.6); 7.0294 (0.6); 7.0241 (1.4); 7.0065 (0.6); 6.9910 (1.3); 6.9790 (2.5); 6.9671 (1.3); 5.2956 (2.8); 3.8575 (16.0); 2.9519 (0.9); 2.8815 (0.7); 2.0423 (1.9); 1.5756 (1.1); 1.2754 (0.6); 1.2575 (1.4); 1.2396 (0.6); -0.0002 (5.8)
1-221 : 'H-NMR^OO.O MHz, CDC13):
δ= 8.4426 (5.1); 8.4307 (5.4); 7.2607 (16.0); 7.2488 (1.1); 7.1583 (1.0); 7.1386 (3.0); 7.1210 (3.5); 7.1014 (4.8); 7.0833 (2.0); 7.0570 (1.2); 7.0394 (1.7); 7.0220 (0.6); 6.9589 (1.4); 6.9469 (2.8); 6.9350 (1.6); 3.8464 (16.0); 3.8021 (0.6); 2.6963 (2.2); 2.6769 (2.8); 2.6572 (2.5); 1.5685 (4.8); 1.5557 (2.4); 1.5363 (2.2); 1.5174 (1.4); 1.2566 (0.8); 0.9364 (3.8); 0.9180 (7.6); 0.8996
(3.6); -0.0002 (5.6)
1-222: Ή-ΝΜϋ^ΟΟ.Ο MHz, CDC13):
δ= 8.5551 (5.4); 8.5432 (5.6); 7.9485 (3.1); 7.9298 (3.5); 7.9262 (2.8); 7.5421 (0.6); 7.5238 (2.0); 7.5053 (1.6); 7.4705 (2.6); 7.4508 (3.7); 7.4330 (1.5); 7.2627 (11.6); 7.0815 (1.5); 7.0696 (3.0); 7.0576 (1.6); 5.2977 (1.4); 3.7862 (0.5); 3.7578 (16.0);
3.6055 (0.7); 2.5639 (15.8); 2.2906 (0.9); 2.0429 (1.6); 1.5850 (0.7); 1.2578 (1.1); -0.0002 (4.4)
1-223: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3499 (11.0); 7.6054 (2.1); 7.6013 (2.5); 7.5847 (3.1); 7.5817 (2.9); 7.4202 (0.7); 7.4141 (1.0); 7.4101 (0.6); 7.3985 (3.1); 7.3797 (3.7); 7.3750 (2.7); 7.3712 (1.6); 7.3659 (0.8); 7.3593 (1.2); 7.2637 (11.0); 5.2984 (0.6); 3.7350 (16.0); 2.2982 (15.7);
1.6162 (0.9); -0.0002 (4.2)
1-224: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2413 (7.3); 7.2597 (42.4); 7.2119 (0.6); 7.1687 (1.2); 7.1493 (2.9); 7.1314 (3.0); 7.0802 (4.4); 7.0737 (2.6); 7.0615 (2.9); 7.0535 (2.3); 7.0354 (0.9); 4.1304 (1.6); 4.1126 (1.6); 4.0948 (0.6); 3.8202 (16.0); 2.2936 (15.7); 2.1895 (12.6); 2.0432 (6.8);
1.5438 (5.3); 1.2762 (1.8); 1.2584 (3.7); 1.2405 (1.9); -0.0002 (16.3)
1-225: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4475 (3.3); 8.4355 (3.7); 7.5181 (9.8); 7.2988 (2.2); 7.2593 (1718.1); 7.2233 (1.4); 7.2091 (4.8); 7.1901 (1.5); 7.1693 (2.5); 7.1501 (2.4); 7.1395 (1.6); 7.0865 (3.5); 7.0663 (2.2); 6.9952 (9.7); 6.9888 (2.5); 4.9107 (7.8); 2.3279 (16.0); 1.5497 (7.2); 1.4320 (6.4); 1.2549 (7.4); 0.8801 (1.4); 0.1461 (3.0); 0.0689 (20.5); 0.0080 (25.6); -0.0002 (777.8); -0.0084 (25.8); -0.0502
(2.2); -0.1496 (3.0)
1-044: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4980 (2.0); 8.4865 (2.1); 7.2618 (25.8); 7.0894 (0.8); 7.0738 (0.8); 7.0678 (1.4); 7.0523 (1.4); 7.0476 (0.8); 7.0458 (0.7); 7.0301 (1.7); 7.0179 (2.2); 7.0060 (1.1); 6.7414 (0.8); 6.7349 (1.0); 6.7195 (0.9); 6.7174 (0.7); 6.7127 (2.2); 6.7110 (2.1); 6.7029 (0.6); 6.6956 (0.6); 6.6906 (2.6); 6.6833 (0.8); 6.6702 (0.7); 6.6676 (0.6); 5.2982 (4.4); 3.8212 (16.0); 2.3475 (15.4); 2.3260
(1.1) ; -0.0002 (10.8)
1-226: 1H-NMR(400.0 MHz, CDC13):
δ= 8.6581 (4.5); 8.6564 (4.6); 7.2600 (27.7); 7.0727 (1.8); 7.0673 (0.8); 7.0600 (1.9); 7.0559 (1.0); 7.0547 (0.9); 7.0503 (2.5); 7.0431 (0.8); 7.0376 (2.4); 6.8892 (2.4); 6.8836 (0.7); 6.8723 (0.8); 6.8678 (3.4); 6.8624 (0.8); 6.8511 (0.6); 6.8456 (1.9); 3.8342
(16.0); 2.3403 (15.3); -0.0002 (11.4)
1-228: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4556 (4.8); 8.4438 (4.9); 7.2601 (15.6); 7.1689 (2.0); 7.1484 (4.6); 7.1308 (4.5); 7.0736 (8.5); 7.0543 (6.5); 7.0348 (1.0); 6.9907 (1.8); 6.9788 (3.3); 6.9669 (1.8); 4.1310 (0.8); 4.1131 (0.8); 2.2914 (16.0); 2.0447 (3.5); 1.2757 (0.9); 1.2579 (1.9);
1.2400 (0.9); -0.0002 (5.8)
1-228: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4768 (4.7); 8.4649 (4.9); 7.2595 (48.7); 7.1728 (1.7); 7.1688 (0.8); 7.1564 (2.9); 7.1536 (3.4); 7.1407 (1.2); 7.1354 (3.7); 7.0810 (5.9); 7.0767 (3.4); 7.0620 (4.3); 7.0572 (3.0); 7.0519 (0.9); 7.0423 (0.7); 7.0391 (1.0); 7.0360 (0.6); 7.0048 (1.6); 6.9928
(3.2) ; 6.9808 (1.6); 5.2972 (1.7); 4.1301 (0.9); 4.1123 (0.9); 2.3096 (16.0); 2.0436 (4.0); 1.2753 (1.2); 1.2575 (3.0); 1.2396 (1.1);
0.0079 (0.6); -0.0002 (18.4); -0.0085 (0.5)
1-229: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4299 (5.7); 8.4180 (5.8); 7.5187 (0.6); 7.2598 (94.3); 6.9958 (0.6); 6.9453 (1.7); 6.9334 (3.2); 6.9214 (1.6); 6.7923 (0.5); 6.7841 (0.7); 6.7694 (0.7); 6.7596 (0.6); 6.7452 (0.6); 6.6528 (0.6); 6.6455 (0.6); 6.6313 (0.6); 6.6238 (0.8); 6.6149 (0.6); 6.6006 (0.6); 6.5934 (0.6); 6.5358 (0.5); 6.5325 (0.7); 6.5290 (0.7); 6.5253 (0.6); 3.7436 (16.0); 3.0996 (7.6); 3.0956 (7.8); 2.9551 (1.3);
2.8841 (1.1); 2.8828 (1.1); 2.1741 (13.4); 1.5407 (24.5); 0.0079 (1.3); -0.0002 (40.1); -0.0085 (1.2)
1-230: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4947 (12.5); 7.5091 (4.5); 7.2612 (17.8); 7.2078 (3.8); 7.2027 (1.4); 7.1913 (1.6); 7.1861 (5.2); 7.1794 (0.6); 7.0571 (0.7);
7.0504 (5.1); 7.0452 (1.5); 7.0338 (1.3); 7.0287 (3.9); 3.8489 (16.0); 3.8377 (0.5); 1.5643 (7.7); -0.0002 (6.7)
1-231 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.4770 (11.8); 8.3984 (0.5); 7.4994 (4.3); 7.2603 (35.9); 7.1398 (2.0); 7.1344 (0.8); 7.1271 (2.1); 7.1229 (1.0); 7.1174 (2.5); 7.1103 (0.9); 7.1048 (2.4); 6.9596 (2.6); 6.9540 (0.8); 6.9427 (0.9); 6.9383 (3.6); 6.9329 (0.8); 6.9216 (0.7); 6.9161 (1.9); 3.8378
(16.0); 1.5493 (1.8); 1.2562 (0.7); -0.0002 (14.0)
1-232: 1H-NMR(400.0 MHz, CDC13):
δ= 7.8858 (0.9); 7.8652 (0.9); 7.2844 (1.1); 7.2805 (1.5); 7.2606 (45.8); 7.2459 (2.6); 7.2276 (3.1); 7.2077 (1.4); 7.1471 (0.6); 7.1439 (1.1); 7.1402 (0.6); 7.1310 (0.5); 7.1261 (1.4); 7.1086 (0.6); 3.2472 (10.2); 2.4166 (16.0); 1.2555 (0.9); -0.0002 (16.6); -
0.0085 (0.5)
1-233: 1H-NMR(400.0 MHz, CDC13):
δ= 9.1463 (0.6); 8.8940 (0.7); 7.2869 (0.7); 7.2823 (1.1); 7.2767 (0.5); 7.2649 (4.3); 7.2612 (21.8); 7.2523 (1.0); 7.2404 (2.7); 7.2358 (1.1); 7.2249 (0.6); 7.2203 (1.0); 7.1713 (0.6); 7.1670 (0.9); 7.1621 (0.6); 7.1497 (1.0); 3.2564 (15.2); 2.4458 (16.0); -
0.0002 (10.5); -0.0085 (0.6)
1-234: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4789 (6.4); 8.4669 (6.7); 7.2598 (29.2); 7.0891 (1.7); 7.0840 (0.7); 7.0707 (2.3); 7.0676 (2.4); 7.0624 (0.5); 7.0542 (0.7); 7.0493 (2.1); 6.9765 (1.9); 6.9646 (3.7); 6.9526 (1.9); 6.6884 (0.9); 6.6857 (0.6); 6.6701 (1.6); 6.6677 (0.9); 6.6518 (0.8); 6.5345 (2.1); 6.5318 (2.7); 6.5298 (1.5); 6.5266 (0.8); 6.5178 (0.8); 6.5153 (1.3); 6.5128 (2.5); 6.5103 (2.1); 5.2971 (1.2); 3.7811 (16.0); 2.1640 (15.4); 2.0429 (0.6); -0.0002 (13.3); -0.0085 (0.6)
1-235: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4970 (5.4); 8.4850 (5.4); 7.2609 (24.2); 7.0124 (1.6); 7.0005 (3.0); 6.9885 (1.5); 6.6997 (0.6); 6.6930 (0.8); 6.6784 (0.8); 6.6717 (1.2); 6.6646 (0.8); 6.6504 (1.0); 6.6436 (1.1); 6.6287 (1.0); 6.6053 (0.6); 6.5675 (0.8); 6.5535 (0.8); 6.5438 (1.0); 6.5299
(1.0); 5.2982 (1.4); 4.7539 (0.9); 3.8003 (0.6); 3.7846 (16.0); 3.5929 (0.8); 2.1785 (15.2); 1.9193 (0.7); -0.0002 (10.4)
1-237: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5002 (5.8); 8.4882 (5.8); 7.2621 (13.6); 7.0153 (1.8); 7.0033 (3.4); 6.9913 (1.6); 6.8793 (0.6); 6.8572 (1.2); 6.8540 (0.7); 6.8351 (0.7); 6.8319 (1.2); 6.8098 (0.6); 6.3554 (0.6); 6.3483 (0.6); 6.3386 (0.6); 6.3316 (0.6); 6.3240 (0.6); 6.3170 (0.6); 6.3072 (0.6); 6.3002 (0.6); 6.2165 (0.6); 6.2137 (0.6); 6.1943 (0.5); 6.1915 (0.5); 5.2983 (1.1); 3.7844 (16.0); 2.1630 (15.5); -0.0002
(5-6)
1-238: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4947 (5.6); 8.4827 (5.7); 8.4784 (0.9); 8.4663 (0.7); 7.2612 (15.0); 7.0219 (0.6); 7.0053 (0.8); 7.0013 (1.5); 6.9993 (2.0); 6.9872 (3.4); 6.9813 (0.9); 6.9753 (1.7); 6.9646 (1.0); 6.3560 (0.8); 6.3501 (0.8); 6.3141 (0.9); 6.3121 (0.9); 6.3086 (1.0); 6.3066 (1.0); 6.2938 (0.8); 6.2917 (0.8); 6.2882 (1.0); 6.2862 (0.9); 6.2446 (0.8); 6.2388 (1.2); 6.2331 (0.6); 6.2160 (0.7); 6.2103 (1.2);
6.2045 (0.6); 5.2973 (2.2); 3.7850 (16.0); 3.7806 (2.7); 2.1665 (15.4); 2.0428 (0.6); -0.0002 (6.4)
1-239: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5107 (6.0); 8.4988 (6.1); 7.2621 (12.7); 7.0236 (1.8); 7.0117 (3.4); 6.9997 (1.7); 6.1274 (0.7); 6.1103 (0.6); 6.1047 (1.4); 6.0990 (0.8); 6.0819 (0.7); 6.0762 (0.5); 6.0563 (1.7); 6.0534 (0.9); 6.0508 (1.8); 6.0366 (0.6); 6.0318 (2.0); 6.0288 (0.7); 6.0263
(1.3) ; 5.2979 (0.8); 4.9139 (1.0); 3.7877 (16.0); 2.1682 (11.9); -0.0002 (5.5)
1-240: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4969 (6.1); 8.4849 (6.1); 8.4791 (0.6); 8.4671 (0.6); 7.2608 (22.9); 6.9992 (1.8); 6.9915 (1.3); 6.9872 (3.5); 6.9753 (1.9); 6.9715 (2.4); 6.9514 (1.4); 6.6435 (0.9); 6.6413 (1.0); 6.6386 (1.0); 6.6364 (1.0); 6.6239 (0.8); 6.6216 (0.9); 6.6189 (1.0); 6.6167 (0.9); 6.5222 (1.3); 6.5168 (2.4); 6.5116 (1.4); 6.4248 (1.0); 6.4226 (1.0); 6.4191 (0.9); 6.4169 (0.9); 6.4043 (0.9); 6.4022 (0.9); 6.3986 (0.8); 6.3964 (0.8); 5.2978 (3.7); 4.7570 (1.2); 3.7890 (16.0); 3.7810 (1.6); 2.1638 (12.8); 2.0431 (0.9); 1.5726 (0.6);
1.2582 (0.6); -0.0002 (9.8)
1-241 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.4789 (1.7); 8.4673 (1.6); 7.2604 (32.3); 7.1802 (0.6); 7.1607 (1.3); 7.1408 (0.8); 6.9882 (1.2); 6.9763 (2.3); 6.9643 (1.1); 6.9161 (1.1); 6.8970 (0.9); 6.7410 (1.6); 6.7076 (0.9); 6.6874 (0.8); 6.6816 (0.7); 5.2980 (1.2); 3.8006 (16.0); 3.7809 (1.0);
2.1647 (15.7); 2.0432 (0.7); 1.2583 (0.5); -0.0002 (13.7)
1-242: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2797 (0.8); 8.2776 (1.1); 8.2754 (1.1); 8.2735 (1.1); 8.2714 (1.2); 8.2692 (0.8); 7.8770 (0.8); 7.8757 (0.8); 7.8707 (0.8); 7.8695 (0.8); 7.8554 (0.8); 7.8541 (0.8); 7.8491 (0.8); 7.8478 (0.8); 7.2600 (22.4); 7.0813 (1.1); 7.0797 (1.5); 7.0780 (1.1); 7.0596 (1.0); 7.0581 (1.4); 7.0565 (1.0); 6.9942 (0.6); 6.9727 (0.9); 6.9692 (0.7); 6.9525 (0.8); 6.9477 (0.9); 6.9275 (0.7); 6.9015 (0.6); 6.8957 (0.7); 6.8833 (0.6); 6.8775 (0.8); 6.8747 (0.7); 6.8689 (0.7); 6.8564 (0.6); 6.8507 (0.7); 6.8021 (0.5); 6.7984 (0.6);
6.7923 (0.8); 6.7884 (0.6); 6.7707 (0.6); 3.8361 (16.0); 2.3155 (15.6); -0.0002 (9.8)
1-243: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2209 (0.8); 8.2188 (1.1); 8.2167 (1.1); 8.2147 (1.1); 8.2126 (1.2); 8.2105 (0.8); 7.8306 (0.8); 7.8293 (0.8); 7.8243 (0.8); 7.8230 (0.8); 7.8090 (0.8); 7.8077 (0.8); 7.8027 (0.8); 7.8014 (0.8); 7.2590 (16.4); 7.1737 (0.6); 7.1711 (1.1); 7.1670 (0.5); 7.1573 (0.6); 7.1531 (2.7); 7.1499 (1.6); 7.1379 (0.9); 7.1342 (2.3); 7.1325 (1.6); 7.0890 (0.6); 7.0857 (1.2); 7.0825 (0.9); 7.0672
(1.4) ; 7.0490 (0.8); 7.0427 (3.6); 7.0392 (3.3); 7.0338 (0.7); 7.0236 (1.8); 7.0217 (3.1); 7.0186 (2.0); 3.8309 (16.0); 2.3211
(15.6); 1.5498 (1.9); -0.0002 (7.2)
1-244: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3918 (5.3); 8.3799 (5.3); 7.6323 (0.6); 7.6283 (1.0); 7.6269 (1.1); 7.6229 (0.7); 7.5612 (0.5); 7.5431 (0.6); 7.5417 (0.7); 7.4438 (1.0); 7.4244 (0.7); 7.4229 (0.6); 7.4100 (0.9); 7.2597 (16.3); 6.7220 (1.5); 6.7100 (2.8); 6.6981 (1.4); 3.8573 (16.0);
3.6640 (13.2); 2.0496 (13.3); 1.5768 (1.8); -0.0002 (7.6)
1-245: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4325 (4.4); 8.4206 (4.4); 7.2597 (47.6); 7.1281 (1.7); 7.1228 (0.6); 7.1099 (2.2); 7.1061 (2.3); 7.0931 (0.7); 7.0879 (2.0); 6.9337 (1.5); 6.9217 (2.8); 6.9097 (1.4); 6.6767 (0.9); 6.6742 (0.6); 6.6585 (1.6); 6.6562 (1.0); 6.6403 (0.8); 6.6376 (0.6); 6.6304 (2.0); 6.6279 (2.4); 6.6109 (1.2); 6.6083 (2.3); 6.6060 (1.8); 3.7817 (12.2); 3.0751 (16.0); 3.0462 (0.6); 2.0797 (12.2); 0.0080
(0.8); -0.0002 (21.5); -0.0085 (0.6)
1-246: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4476 (4.3); 8.4356 (4.3); 7.2601 (37.8); 6.9629 (1.6); 6.9509 (2.9); 6.9389 (1.5); 6.8229 (1.8); 6.8170 (0.6); 6.8057 (0.8); 6.8000 (2.8); 6.7848 (0.6); 6.7789 (2.2); 6.5538 (2.1); 6.5479 (0.7); 6.5428 (2.2); 6.5368 (1.1); 6.5308 (1.8); 6.5257 (0.6); 6.5198
(1.7); 3.7791 (15.2); 3.0747 (0.5); 3.0460 (16.0); 2.0836 (15.0); 0.0080 (0.6); -0.0002 (16.6); -0.0084 (0.5)
1-247: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4512 (5.8); 8.4392 (5.9); 8.4262 (0.6); 8.4142 (0.5); 7.2616 (14.1); 7.0277 (0.9); 7.0105 (0.6); 7.0068 (1.7); 6.9879 (0.9); 6.9864 (1.0); 6.9531 (1.7); 6.9411 (3.2); 6.9291 (1.6); 6.6310 (0.9); 6.6289 (1.1); 6.6262 (1.3); 6.6242 (1.3); 6.6122 (1.2); 6.6091 (3.3); 6.6054 (3.1); 6.5137 (0.9); 6.5119 (1.0); 6.5077 (0.9); 6.5058 (0.9); 6.4930 (0.8); 6.4888 (1.0); 6.4846 (0.7); 3.7889 (16.0);
3.7794 (1.6); 3.0748 (1.7); 3.0655 (15.9); 2.0850 (15.6); 2.0770 (1.7); 1.5822 (1.7); -0.0002 (5.8)
1-248: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5991 (0.6); 8.5872 (0.6); 8.5271 (5.8); 8.5151 (5.8); 8.2624 (4.4); 8.2504 (4.5); 7.2657 (13.5); 7.0260 (1.7); 7.0140 (3.2); 7.0020 (1.7); 6.5994 (1.7); 6.5874 (3.2); 6.5754 (1.6); 6.1471 (1.0); 5.2988 (4.7); 3.7733 (16.0); 3.7664 (1.0); 3.6968 (1.8);
2.2173 (12.8); 2.2129 (2.9); 2.0431 (1.2); 1.2580 (0.9); -0.0002 (5.8)
1-249: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4856 (5.8); 8.4737 (5.9); 7.2606 (22.8); 7.0242 (4.0); 7.0187 (1.3); 7.0074 (1.3); 7.0019 (4.5); 6.9990 (2.2); 6.9939 (0.6); 6.9870 (3.3); 6.9750 (1.7); 6.4698 (4.5); 6.4643 (1.4); 6.4530 (1.2); 6.4475 (4.1); 3.7794 (16.0); 2.1508 (15.6); -0.0002 (10.2)
1-250: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4798 (0.6); 8.4678 (0.6); 8.4484 (6.2); 8.4365 (6.3); 7.2607 (25.5); 7.0427 (0.6); 7.0393 (1.0); 7.0221 (1.1); 7.0191 (0.6); 7.0016 (0.6); 6.9535 (2.1); 6.9416 (3.7); 6.9296 (1.8); 6.3948 (0.6); 6.3928 (0.8); 6.3889 (0.8); 6.3869 (0.9); 6.3739 (0.6); 6.3716 (0.8); 6.3682 (1.0); 6.3658 (1.0); 6.3495 (0.5); 6.3478 (0.5); 6.3445 (0.8); 6.3424 (0.7); 6.3351 (0.7); 6.3295 (1.2); 6.3234 (0.8); 6.3042 (0.7); 6.2983 (1.0); 5.2978 (0.6); 3.7859 (16.0); 3.7818 (2.4); 3.0751 (0.9); 3.0643 (15.6); 2.1645 (1.6); 2.0876 (15.2);
2.0773 (0.8); -0.0002 (11.1)
1-251 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.4721 (5.9); 8.4602 (6.0); 7.2610 (25.8); 6.9830 (1.8); 6.9710 (3.4); 6.9590 (1.7); 6.1327 (0.7); 6.1287 (1.8); 6.1239 (1.4); 6.1200 (0.5); 6.1067 (1.6); 6.1012 (1.9); 6.0976 (1.0); 6.0800 (0.5); 3.7916 (15.3); 3.0550 (16.0); 2.0967 (14.8); -0.0002 (10.5) 1-252: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4641 (5.5); 8.4522 (5.6); 8.2925 (3.9); 8.2806 (4.0); 7.2625 (27.5); 6.9669 (1.6); 6.9550 (3.0); 6.9430 (1.5); 6.5282 (1.4);
6.5163 (2.6); 6.5044 (1.3); 5.2988 (2.1); 3.7818 (14.0); 3.7187 (0.5); 3.2814 (16.0); 2.1560 (13.6); -0.0002 (10.9)
1-253: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4379 (5.9); 8.4260 (6.0); 7.3017 (0.5); 7.2622 (12.7); 7.0509 (3.8); 7.0452 (1.2); 7.0338 (1.2); 7.0281 (4.2); 6.9541 (1.7); 6.9422 (3.3); 6.9302 (1.7); 6.5516 (3.8); 6.5460 (1.1); 6.5345 (1.0); 6.5289 (3.5); 5.2975 (2.2); 3.7773 (16.0); 3.0532 (15.8);
2.9538 (2.0); 2.8826 (1.6); 2.8814 (1.7); 2.0697 (15.6); -0.0002 (5.3)
1-254: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4582 (6.2); 8.4462 (6.3); 7.2615 (22.4); 6.9725 (1.8); 6.9606 (3.6); 6.9486 (1.8); 6.9107 (0.6); 6.8881 (1.2); 6.8854 (0.7); 6.8654 (0.7); 6.8627 (1.2); 6.8400 (0.6); 6.4401 (0.5); 6.4326 (0.6); 6.4232 (0.5); 6.4157 (0.6); 6.4061 (0.5); 6.3986 (0.6); 6.3817 (0.5); 6.2808 (0.6); 6.2770 (0.6); 6.2580 (0.5); 6.2542 (0.5); 5.2985 (2.9); 3.7828 (16.0); 3.0370 (14.5); 2.0877 (15.3); -0.0002
(8.9)
1-255: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5074 (6.2); 8.4954 (6.3); 8.2592 (0.8); 8.2570 (1.2); 8.2534 (1.2); 8.2511 (1.2); 7.5882 (0.8); 7.5821 (0.8); 7.5662 (0.8); 7.5600 (0.8); 7.2628 (23.8); 7.0370 (1.8); 7.0250 (3.5); 7.0130 (1.7); 6.4531 (1.4); 6.4310 (1.3); 5.9675 (1.0); 5.2985 (5.0);
3.7997 (16.0); 3.7926 (0.5); 2.1897 (11.2); 2.0433 (0.5); 1.2583 (0.6); -0.0002 (9.0)
1-256: lH-NMR(400.0 MHz, d6-DMSO):
δ= 8.6562 (16.0); 7.1115 (4.1); 7.1092 (4.3); 7.0929 (11.4); 3.8833 (13.8); 3.3584 (1.1); 3.3084 (215.5); 3.2595 (1.5); 2.6694 (2.0); 2.5500 (2.5); 2.5454 (2.1); 2.5228 (7.4); 2.5181 (10.3); 2.5094 (114.7); 2.5049 (238.6); 2.5002 (329.8); 2.4957 (222.6); 2.4911 (99.0); 2.4553 (1.7); 2.4505 (1.8); 2.3270 (1.9); 2.3225 (1.3); 0.0080 (5.8); -0.0002 (164.4); -0.0085 (4.0); -0.0499 (1.1) 1-257: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4894 (6.6); 8.4774 (6.7); 7.2598 (20.0); 6.9875 (1.9); 6.9755 (3.6); 6.9635 (1.8); 6.8896 (1.7); 6.8879 (2.0); 6.8846 (0.8); 6.8827 (0.6); 6.8734 (0.6); 6.8715 (0.8); 6.8681 (2.2); 6.8665 (1.9); 6.4484 (3.0); 6.4434 (0.9); 6.4324 (0.8); 6.4273 (2.7); 5.2964
(1.2); 3.7848 (0.5); 3.7753 (16.0); 2.1886 (8.1); 2.1618 (0.7); 2.1541 (15.4); -0.0002 (7.1)
1-258: lH-NMR(400.0 MHz, d6-DMSO):
δ= 8.6633 (16.0); 7.1234 (9.8); 7.1079 (3.4); 7.1039 (3.6); 5.7537 (2.2); 3.8627 (14.3); 3.3103 (35.3); 2.5234 (1.3); 2.5187 (1.8);
2.5100 (20.7); 2.5054 (43.3); 2.5008 (59.8); 2.4962 (40.8); 2.4916 (18.2); 0.0081 (0.6); -0.0002 (15.4)
1-259: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5671 (0.7); 8.5536 (1.1); 8.4799 (12.0); 7.2597 (39.4); 7.2314 (0.7); 7.2290 (1.1); 7.2247 (0.5); 7.2147 (0.6); 7.2109 (2.6); 7.2076 (1.5); 7.1955 (0.9); 7.1917 (2.1); 7.1902 (1.5); 7.1422 (0.6); 7.1390 (1.2); 7.1359 (0.8); 7.1204 (1.3); 7.1023 (0.6); 7.0449 (0.7); 7.0425 (2.3); 7.0392 (2.8); 7.0339 (0.7); 7.0255 (0.7); 7.0237 (0.9); 7.0214 (2.1); 7.0200 (1.3); 7.0184 (1.8); 5.2981 (0.7); 3.7698 (16.0); 3.6816 (1.8); 2.3232 (15.3); 2.3161 (1.1); 2.2691 (1.0); 2.2676 (1.0); 1.5429 (5.0); 0.0079 (0.5); -0.0002 (18.0) 1-260: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4550 (6.5); 8.4430 (6.6); 8.3423 (0.9); 8.3399 (1.1); 8.3362 (1.0); 8.3338 (1.1); 8.3315 (0.8); 7.4934 (0.7); 7.4923 (0.8); 7.4872 (0.7); 7.4861 (0.7); 7.4709 (0.8); 7.4698 (0.8); 7.4646 (0.8); 7.4636 (0.8); 7.2605 (48.9); 6.9929 (1.9); 6.9810 (3.6); 6.9690 (1.8); 6.5553 (1.3); 6.5538 (1.0); 6.5328 (1.3); 6.5313 (1.0); 5.2984 (1.0); 3.8328 (0.9); 3.8085 (16.0); 3.6854 (0.7);
3.2703 (13.7); 2.1255 (15.7); 2.0217 (0.7); 1.5538 (1.3); 1.2558 (0.6); 0.0079 (0.6); -0.0002 (19.1); -0.0085 (0.6)
1-261 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.4480 (0.8); 8.3277 (11.4); 7.2600 (42.6); 6.7242 (0.5); 6.7174 (0.6); 6.7031 (0.6); 6.6960 (1.0); 6.6886 (0.8); 6.6678 (0.6); 6.6362 (0.6); 6.6328 (0.6); 6.5563 (0.7); 6.5424 (0.7); 6.5321 (0.7); 6.5181 (0.8); 5.2980 (2.2); 4.7225 (0.7); 4.7168 (0.7); 3.7974
(0.7); 3.7811 (16.0); 3.5959 (1.0); 2.1763 (11.7); 1.9362 (0.7); 1.5458 (2.7); -0.0002 (16.4); -0.0085 (0.6)
1-262: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2924 (11.0); 7.2594 (12.3); 7.0953 (1.6); 7.0934 (0.6); 7.0902 (0.6); 7.0769 (2.2); 7.0739 (2.2); 7.0605 (0.6); 7.0555 (1.9); 6.7009 (0.9); 6.6982 (0.5); 6.6853 (0.7); 6.6826 (1.6); 6.6801 (0.8); 6.6643 (0.7); 6.5317 (2.1); 6.5289 (2.6); 6.5269 (1.3); 6.5238 (0.7); 6.5149 (0.6); 6.5125 (1.1); 6.5100 (2.4); 6.5074 (2.0); 5.2955 (0.8); 4.6388 (1.0); 3.7768 (16.0); 2.1630 (13.6); -0.0002
(4.7)
1-263: 1H-NMR(400.0 MHz, CDC13):
δ= 7.5181 (1.0); 7.2592 (177.3); 7.2097 (0.7); 7.2002 (1.0); 7.1821 (2.3); 7.1633 (1.8); 7.1138 (0.9); 7.0963 (1.3); 7.0783 (0.6); 7.0470 (2.3); 7.0282 (1.9); 6.9952 (1.1); 3.8093 (14.1); 2.3336 (16.0); 1.2551 (0.7); 0.0080 (2.1); -0.0002 (66.3); -0.0085 (1.8) 1-265: lH-NMR(400.0 MHz, d6-DMSO):
δ= 8.5950 (16.0); 7.0963 (0.9); 7.0796 (0.6); 7.0736 (2.8); 7.0683 (0.6); 7.0581 (0.5); 7.0517 (2.4); 7.0434 (2.4); 7.0368 (0.7); 7.0298 (2.5); 7.0206 (1.0); 7.0069 (0.8); 5.9434 (2.4); 3.5426 (12.8); 3.3090 (39.7); 2.8904 (1.5); 2.7315 (1.3); 2.7300 (1.4); 2.5230 (1.4); 2.5183 (2.0); 2.5096 (25.5); 2.5050 (54.1); 2.5004 (75.1); 2.4959 (51.5); 2.4913 (23.3); 2.0723 (1.8); 0.0080 (0.9); - 0.0002 (33.9); -0.0085 (1.0)
1-266: lH-NMR(400.0 MHz, d6-DMSO):
δ= 8.7013 (9.9); 8.6078 (1.0); 7.2677 (0.8); 7.2494 (1.9); 7.2357 (0.6); 7.2311 (1.8); 7.1863 (1.3); 7.1815 (2.1); 7.1652 (1.6); 7.1637 (1.9); 7.1619 (1.8); 7.1579 (1.3); 7.1444 (1.6); 7.1351 (1.5); 7.1278 (0.8); 7.1220 (1.5); 7.0879 (1.4); 7.0657 (2.1); 7.0433 (0.8); 3.7021 (8.0); 3.6290 (0.7); 3.3094 (30.9); 2.5232 (1.7); 2.5186 (2.4); 2.5098 (25.5); 2.5053 (52.8); 2.5007 (72.5); 2.4961
(49.4); 2.4916 (22.1); 2.2998 (7.6); 2.2166 (1.3); 2.2067 (16.0); 2.0587 (0.6); 0.0080 (1.6); -0.0002 (45.5); -0.0086 (1.2)
1-267: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2970 (11.7); 8.2942 (1.3); 7.2605 (23.5); 7.1719 (1.0); 7.1520 (0.6); 6.9344 (0.7); 6.9325 (0.8); 6.9305 (0.7); 6.9153 (0.6); 6.9134 (0.7); 6.9115 (0.6); 6.7496 (0.7); 6.7481 (0.7); 6.7451 (1.1); 6.7438 (1.2); 6.7410 (0.9); 6.7395 (0.8); 6.7130 (0.7); 6.7117 (0.6); 6.7076 (0.5); 6.6927 (0.6); 6.6868 (0.5); 5.2978 (1.4); 4.8525 (0.8); 3.7978 (16.0); 3.7783 (1.0); 2.1634 (12.9); 2.0431
(0.6); 1.5604 (1.8); -0.0002 (9.8); -0.0027 (0.6)
1-268: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3200 (11.0); 8.2942 (1.4); 7.2604 (21.6); 7.0335 (0.6); 7.0170 (0.6); 7.0131 (1.2); 6.9965 (1.3); 6.9927 (0.7); 6.9762 (0.6); 6.3734 (0.6); 6.3720 (0.6); 6.3674 (0.6); 6.3660 (0.7); 6.3186 (0.8); 6.3164 (0.8); 6.3130 (1.0); 6.3109 (0.9); 6.2982 (0.8); 6.2961 (0.8); 6.2926 (1.0); 6.2905 (0.9); 6.2456 (0.7); 6.2398 (1.1); 6.2341 (0.5); 6.2172 (0.7); 6.2113 (1.1); 6.2056 (0.6); 3.7831 (16.0);
3.7791 (2.6); 2.1663 (15.8); -0.0002 (8.8)
1-269: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3220 (11.8); 8.2940 (1.0); 7.2602 (27.7); 7.0021 (1.1); 6.9820 (2.2); 6.9620 (1.4); 6.6590 (0.9); 6.6567 (1.0); 6.6540 (1.0); 6.6518 (1.0); 6.6393 (0.8); 6.6370 (0.9); 6.6343 (1.0); 6.6321 (0.9); 6.5200 (1.3); 6.5147 (2.3); 6.5095 (1.4); 6.4302 (1.0); 6.4280
(1.0) ; 6.4244 (0.9); 6.4222 (0.9); 6.4097 (0.9); 6.4075 (0.9); 6.4039 (0.8); 6.4017 (0.8); 4.7234 (1.0); 3.7867 (16.0); 3.7784 (1.5);
2.1644 (11.5); 2.0431 (0.9); 1.5546 (6.5); 1.2583 (0.6); -0.0002 (12.3)
1-270: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5538 (0.6); 8.4985 (11.9); 7.2602 (37.6); 7.0589 (1.6); 7.0534 (0.7); 7.0462 (1.7); 7.0421 (0.9); 7.0407 (0.8); 7.0364 (2.5); 7.0293 (0.9); 7.0238 (2.4); 6.9480 (2.6); 6.9423 (0.7); 6.9311 (0.7); 6.9268 (3.3); 6.9258 (2.6); 6.9212 (0.8); 6.9100 (0.6); 6.9044
(1.7); 3.7568 (16.0); 3.6819 (1.0); 2.3260 (15.4); 2.2694 (0.5); 2.2678 (0.6); 1.5436 (11.0); 0.0080 (0.5); -0.0002 (17.0)
1-271 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.2948 (0.7); 8.2436 (10.2); 7.2594 (31.5); 7.1338 (1.7); 7.1315 (0.6); 7.1285 (0.6); 7.1156 (2.1); 7.1117 (2.1); 7.0987 (0.6); 7.0959 (0.7); 7.0936 (2.0); 6.6908 (0.8); 6.6882 (0.5); 6.6752 (0.6); 6.6727 (1.5); 6.6702 (0.8); 6.6544 (0.7); 6.6172 (1.8); 6.6145 (2.2); 6.6123 (1.1); 6.6092 (0.6); 6.6001 (0.6); 6.5977 (1.0); 6.5950 (2.1); 6.5925 (1.7); 3.7763 (16.0); 3.0717 (15.6); 2.1651
(1.1) ; 2.0839 (15.4); -0.0002 (13.2)
1-272: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5538 (1.0); 8.5425 (11.8); 7.2607 (30.3); 7.0663 (0.6); 7.0450 (0.9); 7.0414 (0.7); 7.0247 (0.7); 7.0201 (0.9); 6.9999 (0.6); 6.8681 (0.6); 6.8624 (0.7); 6.8501 (0.6); 6.8444 (0.8); 6.8419 (0.6); 6.8361 (0.7); 6.8183 (0.7); 6.8155 (0.6); 6.8119 (0.6); 6.8056 (0.8); 6.8019 (0.6); 6.7842 (0.7); 5.2987 (0.7); 3.7681 (16.0); 3.6820 (1.6); 2.6817 (1.2); 2.3180 (15.2); 2.2695 (0.9); 2.2680
(0.9); 1.5480 (4.5); -0.0002 (13.7)
1-273: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2942 (0.6); 8.2765 (11.4); 8.2430 (1.4); 7.2603 (24.3); 7.0700 (0.6); 7.0528 (0.6); 7.0494 (1.1); 7.0322 (1.1); 7.0289 (0.7); 7.0116 (0.6); 6.3864 (0.7); 6.3848 (0.9); 6.3830 (0.8); 6.3807 (0.9); 6.3787 (1.0); 6.3642 (0.9); 6.3617 (1.2); 6.3582 (1.1); 6.3564 (0.7); 6.3271 (0.7); 6.3212 (1.0); 6.2961 (0.6); 6.2901 (1.0); 5.2977 (0.9); 3.7811 (16.0); 3.7758 (2.4); 3.0713 (2.3); 3.0658
(15.7); 2.1647 (0.8); 2.0899 (15.2); 2.0837 (2.2); 1.5587 (3.6); -0.0002 (10.0)
1-274: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3030 (11.5); 8.2746 (1.0); 8.2709 (0.9); 8.2433 (0.8); 8.2220 (0.8); 7.2611 (42.4); 3.8623 (16.0); 2.3389 (15.8); 1.5598 (4.7);
-0.0002 (18.4); -0.0085 (0.5)
1-275: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4515 (0.6); 8.2806 (10.2); 7.9522 (1.2); 7.9484 (1.2); 7.9327 (1.2); 7.9288 (1.2); 7.3248 (0.6); 7.3209 (0.6); 7.3064 (0.8); 7.3037 (1.0); 7.3007 (0.8); 7.2862 (0.9); 7.2823 (0.8); 7.2626 (11.4); 7.1244 (0.8); 7.1217 (0.9); 7.1044 (1.2); 7.1029 (1.2); 7.0867 (0.6); 7.0839 (0.7); 7.0169 (1.4); 7.0143 (1.4); 6.9966 (1.2); 6.9939 (1.2); 5.2979 (1.1); 3.8947 (16.0); 3.8651 (14.0);
3.7484 (1.0); 2.2912 (0.7); 2.2679 (13.8); 1.5677 (2.4); -0.0002 (5.0)
1-276: lH-NMR(400.0 MHz, CDC13):
δ= 8.3423 (11.9); 7.2611 (19.0); 6.1450 (0.7); 6.1279 (0.7); 6.1223 (1.4); 6.1167 (0.8); 6.0995 (0.7); 6.0619 (1.6); 6.0592 (0.8); 6.0564 (1.7); 6.0424 (0.6); 6.0401 (0.7); 6.0375 (2.0); 6.0345 (0.6); 6.0320 (1.3); 4.8770 (0.9); 3.7853 (16.0); 2.1679 (10.9);
2.0431 (0.5); 1.5634 (5.1); -0.0002 (8.0)
1-277: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4435 (0.7); 8.3111 (10.4); 8.0515 (4.3); 8.0292 (4.1); 7.2618 (15.5); 7.1619 (4.6); 7.1397 (4.0); 5.2990 (1.4); 3.8729 (16.0);
3.8298 (1.2); 2.3292 (1.3); 2.2978 (15.7); 1.5545 (5.0); -0.0002 (6.9)
1-278: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2824 (7.6); 7.2609 (9.9); 7.0986 (1.0); 7.0787 (1.8); 7.0570 (1.2); 6.6555 (1.8); 6.6348 (1.7); 6.6219 (2.0); 6.6142 (2.4);
6.6090 (3.6); 6.6057 (3.5); 5.2973 (0.7); 3.8271 (14.6); 3.7321 (16.0); 2.3082 (14.8); 1.5634 (1.5); -0.0002 (4.4)
1-279: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2453 (11.3); 7.2600 (20.2); 7.0283 (0.5); 7.0181 (0.7); 7.0141 (1.2); 7.0123 (1.6); 7.0103 (1.8); 7.0089 (1.5); 7.0048 (0.6); 7.0036 (0.5); 6.9948 (2.0); 6.9936 (1.8); 6.9892 (2.3); 6.9858 (0.9); 6.9736 (0.8); 6.8945 (1.2); 6.8890 (1.2); 6.8771 (0.5); 6.8748 (0.6); 6.8736 (0.6); 6.8724 (0.6); 6.8717 (0.6); 3.8416 (16.0); 2.2910 (15.8); 2.2618 (9.6); 2.0434 (1.0); 1.5537 (1.9); 1.2584
(0.8); 0.8817 (0.6); -0.0002 (11.8)
1-280: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4985 (6.1); 8.4865 (6.3); 7.2671 (0.6); 7.2597 (67.2); 7.0107 (1.0); 6.9957 (1.1); 6.9901 (3.3); 6.9798 (2.0); 6.9679 (5.2); 6.9559 (2.1); 6.9501 (1.0); 3.7279 (16.0); 3.5797 (4.3); 3.5200 (1.0); 2.3425 (0.5); 2.2492 (7.7); 2.1399 (13.5); 1.5484 (1.3); 0.0079 (1.1); -0.0002 (34.6); -0.0085 (0.9)
1-281 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.4942 (5.0); 8.4822 (5.1); 7.2611 (25.0); 7.0527 (0.8); 7.0364 (0.8); 6.9967 (1.9); 6.9847 (3.5); 6.9727 (1.7); 6.6774 (0.6); 6.6613 (0.6); 6.6549 (0.7); 6.6527 (0.8); 6.6416 (0.5); 6.6392 (0.5); 6.6359 (0.6); 6.6303 (0.7); 6.6208 (0.8); 6.6187 (0.7); 6.6141
(0.5); 6.6121 (0.6); 3.7453 (16.0); 3.6002 (3.7); 2.2055 (12.6); -0.0002 (13.6)
1-282: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5000 (6.0); 8.4881 (6.2); 7.2617 (16.0); 6.9953 (1.8); 6.9833 (3.5); 6.9713 (1.7); 6.8585 (0.9); 6.8472 (0.9); 6.8359 (0.5); 6.8247 (0.5); 6.7724 (0.7); 6.7643 (0.8); 6.7562 (0.6); 6.7547 (0.6); 6.7452 (0.5); 6.7352 (0.6); 3.7579 (16.0); 3.6243 (3.3);
2.2044 (11.4); -0.0002 (8.5)
1-283: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5075 (6.2); 8.4955 (6.5); 7.2654 (0.6); 7.2605 (37.6); 7.0070 (1.8); 6.9950 (3.5); 6.9831 (1.8); 6.9435 (1.0); 6.9386 (0.5); 6.9229 (0.7); 6.9178 (1.0); 6.8974 (0.9); 3.7534 (16.0); 3.7482 (0.7); 3.5879 (3.7); 2.1591 (13.4); 1.5564 (0.9); 0.0079 (0.6); -
0.0002 (20.2); -0.0085 (0.6)
1-284: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5029 (6.2); 8.4909 (6.2); 8.1195 (1.2); 8.1130 (1.2); 7.5186 (1.2); 7.4493 (0.9); 7.4430 (1.0); 7.4288 (1.1); 7.4224 (1.0); 7.2598 (181.8); 7.2101 (0.6); 7.1352 (1.6); 7.1159 (1.3); 7.0233 (1.9); 7.0114 (3.6); 6.9994 (1.8); 6.9958 (1.0); 3.7521 (16.0); 3.6382 (0.7); 3.6163 (5.0); 3.5745 (2.3); 2.1746 (13.7); 2.0757 (1.7); 1.5410 (1.7); 0.0080 (3.1); -0.0002 (97.8); -0.0085 (2.7) 1-285: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4689 (5.9); 8.4569 (6.0); 7.3323 (1.8); 7.3309 (1.8); 7.3281 (1.8); 7.3120 (0.9); 7.3083 (1.1); 7.2951 (1.0); 7.2766 (0.8);
7.2621 (11.9); 6.9711 (1.8); 6.9592 (3.5); 6.9472 (1.7); 3.7591 (16.0); 3.6938 (4.8); 2.1699 (13.7); -0.0002 (6.2)
1-286: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5139 (6.0); 8.5019 (6.2); 7.2612 (21.8); 7.0083 (1.8); 6.9963 (3.6); 6.9843 (1.8); 6.6454 (0.9); 6.6430 (0.8); 6.6411 (1.0); 6.6396 (1.2); 6.6356 (0.6); 6.6287 (0.5); 6.6244 (1.1); 6.6229 (1.0); 6.6211 (0.8); 6.6186 (1.0); 6.5383 (0.5); 6.5325 (0.9); 3.7607
(16.0); 3.6121 (4.6); 2.1667 (13.6); -0.0002 (12.0)
1-287: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3454 (11.0); 7.2658 (0.6); 7.2608 (32.4); 6.9627 (1.0); 6.9579 (0.5); 6.9421 (0.7); 6.9371 (1.0); 6.9165 (0.7); 6.8216 (0.5); 5.7616 (0.5); 5.7598 (0.6); 3.7482 (16.0); 3.7188 (3.0); 3.7098 (0.7); 3.6341 (0.9); 3.5886 (4.1); 2.2817 (1.7); 2.2802 (1.7);
2.2704 (0.8); 2.2196 (1.0); 2.1943 (0.6); 2.1932 (0.6); 2.1596 (13.6); 0.0080 (0.5); -0.0002 (17.2)
1-288: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3420 (11.1); 8.3056 (0.7); 8.3028 (0.7); 7.2670 (0.6); 7.2662 (0.7); 7.2604 (50.5); 6.6345 (0.9); 6.6321 (0.8); 6.6302 (1.0); 6.6288 (1.2); 6.6179 (0.6); 6.6136 (1.1); 6.6121 (1.0); 6.6104 (0.9); 6.6078 (1.0); 6.5562 (0.6); 6.5504 (0.9); 5.7688 (0.7); 5.7670 (0.8); 4.0674 (0.7); 4.0623 (0.7); 3.7566 (16.0); 3.7211 (4.0); 3.7153 (1.1); 3.6385 (1.8); 3.6117 (4.6); 3.5885 (1.5); 2.2831 (2.2); 2.2817 (2.3); 2.2724 (0.9); 2.2226 (1.6); 2.1930 (1.0); 2.1917 (1.0); 2.1728 (13.7); 0.0079 (0.9); -0.0002 (27.5); -0.0085 (0.7) 1-289: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3214 (10.8); 7.2607 (21.6); 6.8654 (0.7); 6.8541 (0.6); 6.7767 (0.6); 6.7747 (0.6); 6.7731 (0.6); 6.7667 (0.8); 6.7585 (0.9);
6.7523 (0.8); 6.7509 (0.9); 6.7494 (0.8); 6.7305 (0.6); 3.7547 (16.0); 3.6208 (3.3); 2.2149 (11.4); -0.0002 (11.8)
1-290: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3287 (10.8); 7.2603 (43.9); 7.0380 (0.7); 7.0218 (0.7); 6.6925 (0.6); 6.6685 (0.7); 6.6642 (0.6); 6.6437 (1.1); 3.7408 (16.0); 3.7000 (1.8); 3.6919 (0.7); 3.6303 (2.0); 3.5985 (3.4); 2.2602 (1.0); 2.2587 (1.0); 2.2505 (0.7); 2.2091 (11.3); 2.2011 (0.7);
0.0080 (0.7); -0.0002 (24.5); -0.0085 (0.7)
1-291 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.2862 (11.2); 7.3599 (0.6); 7.3555 (0.8); 7.3131 (2.0); 7.3019 (2.7); 7.2995 (3.0); 7.2861 (1.0); 7.2624 (33.9); 3.7619 (16.0);
3.6948 (5.2); 2.1888 (13.8); 1.5655 (3.1); -0.0002 (11.8)
1-292: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4906 (5.0); 8.4787 (5.0); 7.2607 (20.2); 7.0950 (0.8); 7.0942 (0.9); 7.0747 (1.8); 7.0552 (1.0); 7.0545 (1.0); 7.0021 (1.5); 6.9901 (2.9); 6.9781 (1.4); 6.6802 (0.7); 6.6780 (0.9); 6.6758 (1.0); 6.6737 (1.0); 6.6608 (0.6); 6.6586 (0.7); 6.6565 (1.0); 6.6542 (1.0); 6.6416 (1.0); 6.6363 (1.5); 6.6317 (1.0); 6.6197 (1.0); 6.6176 (1.0); 6.6135 (0.6); 6.6113 (0.5); 6.5994 (0.8); 6.5972 (0.8);
6.5931 (0.6); 6.5910 (0.6); 3.8414 (12.9); 3.7278 (16.0); 2.3050 (12.8); 1.5607 (3.6); -0.0002 (10.6)
1-293: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3194 (10.6); 7.2602 (17.9); 7.1349 (2.7); 7.1300 (1.0); 7.1188 (1.2); 7.1138 (4.2); 7.1078 (0.6); 7.0353 (3.3); 7.0140 (2.1);
3.7399 (16.0); 3.5934 (6.0); 2.1565 (14.4); -0.0002 (10.0)
1-294: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4547 (5.8); 8.4427 (5.8); 7.2611 (16.6); 7.0277 (0.7); 7.0264 (0.6); 7.0244 (0.6); 7.0226 (0.9); 7.0209 (0.7); 7.0072 (2.5); 7.0058 (2.3); 7.0043 (1.6); 6.9896 (1.3); 6.9836 (1.7); 6.9788 (1.8); 6.9709 (2.1); 6.9618 (1.3); 6.9590 (3.7); 6.9470 (2.0); 6.9197 (1.5); 6.9157 (0.8); 6.9134 (0.6); 6.9003 (0.9); 6.8965 (0.5); 5.2968 (0.9); 3.8532 (16.0); 2.2847 (15.8); 2.2660 (9.9); 1.5865
(1.4); -0.0002 (6.2)
1-295: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2907 (11.9); 8.0446 (1.4); 8.0410 (1.4); 8.0250 (1.5); 8.0214 (1.4); 7.3676 (0.8); 7.3637 (0.8); 7.3494 (1.1); 7.3470 (1.2); 7.3457 (1.2); 7.3433 (1.0); 7.3290 (1.1); 7.3251 (1.1); 7.2608 (43.9); 7.1543 (1.0); 7.1515 (1.1); 7.1347 (1.4); 7.1333 (1.4); 7.1166 (0.9); 7.1138 (0.9); 7.0425 (1.7); 7.0403 (1.6); 7.0220 (1.6); 7.0198 (1.4); 4.1319 (0.5); 4.1141 (0.6); 3.8727 (15.4);
2.2761 (16.0); 2.0458 (2.0); 1.2769 (0.8); 1.2590 (1.8); 1.2412 (1.0); 0.0080 (0.6); -0.0002 (16.8)
1-296: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3124 (11.2); 8.2974 (0.6); 7.2650 (0.6); 7.2642 (0.7); 7.2634 (1.0); 7.2601 (40.2); 7.2561 (0.8); 7.2553 (0.6); 6.8051 (1.8); 6.7992 (0.6); 6.7882 (0.7); 6.7830 (2.5); 6.7824 (2.6); 6.7782 (0.7); 6.7672 (0.7); 6.7612 (2.1); 6.4742 (2.1); 6.4682 (0.7); 6.4630 (2.2); 6.4571 (1.2); 6.4513 (1.9); 6.4461 (0.6); 6.4402 (1.8); 5.2980 (0.9); 3.7840 (1.2); 3.7790 (16.0); 2.1676 (1.1); 2.1609 (15.5); -0.0002 (16.3)
1-315: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4863 (5.3); 8.4744 (5.4); 8.3443 (1.4); 7.8122 (0.9); 7.8068 (0.9); 7.7905 (0.9); 7.7843 (0.9); 7.2625 (17.4); 7.0041 (1.6);
6.9922 (3.1); 6.9802 (1.6); 6.9344 (1.6); 6.9127 (1.5); 3.7922 (16.0); 2.1976 (15.6); 1.5971 (1.5); -0.0002 (5.2)
1-316: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5032 (5.8); 8.4912 (6.2); 8.4782 (0.9); 8.3516 (1.5); 8.3250 (10.7); 7.2646 (17.9); 7.0150 (1.8); 7.0031 (3.4); 6.9911 (1.7); 5.2994 (1.4); 3.7945 (2.2); 3.7837 (16.0); 3.7362 (0.8); 3.6729 (0.5); 2.2324 (0.6); 2.2149 (15.6); 2.1977 (2.2); 1.2677 (1.6);
1.2405 (9.1); -0.0002 (7.0)
1-317: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2968 (10.8); 8.2444 (1.1); 7.2617 (14.3); 6.9269 (0.6); 6.9041 (1.3); 6.8790 (1.2); 6.8563 (0.6); 6.4364 (0.6); 6.4289 (0.6); 6.4196 (0.6); 6.4121 (0.6); 6.4025 (0.6); 6.3950 (0.6); 6.3857 (0.5); 6.3782 (0.6); 6.2767 (0.7); 6.2730 (0.6); 6.2540 (0.6); 6.2502 (0.6); 5.2983 (2.5); 3.8636 (2.2); 3.7773 (16.0); 3.6565 (2.0); 3.0397 (15.3); 2.0868 (15.6); 2.0502 (2.0); 1.5733 (0.5); 1.2407
(0.8); -0.0002 (5.5)
1-318: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2735 (11.1); 7.2606 (19.7); 7.0660 (3.8); 7.0604 (1.2); 7.0489 (1.2); 7.0432 (4.1); 6.5452 (3.8); 6.5396 (1.2); 6.5281 (1.1); 6.5225 (3.5); 5.2980 (2.4); 3.8585 (0.8); 3.7729 (16.0); 3.6480 (0.7); 3.0538 (15.8); 2.0715 (15.5); 2.0361 (0.7); 1.5588 (0.9); -
0.0002 (7.7)
1-319: 1H-NMR(400.0 MHz, CDC13):
δ= 8.7441 (12.3); 8.5089 (5.8); 8.4970 (5.9); 7.2639 (18.7); 7.0441 (1.7); 7.0321 (3.2); 7.0201 (1.6); 5.2995 (4.3); 3.7976 (16.0);
2.9561 (1.7); 2.8832 (1.4); 2.2196 (15.8); 2.0435 (0.8); 1.2585 (0.6); -0.0002 (6.6)
1-320: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3333 (10.2); 8.3293 (1.1); 8.3206 (0.8); 8.3122 (0.8); 8.2919 (4.9); 8.2903 (4.9); 7.2614 (43.4); 5.2989 (1.4); 3.7730 (16.0); 3.5687 (1.4); 2.9557 (1.2); 2.8841 (1.0); 2.8829 (1.0); 2.2629 (0.6); 2.2275 (9.5); 2.2177 (1.0); 2.2037 (16.0); 1.5618 (0.9);
1.2560 (0.8); 0.0080 (0.6); -0.0002 (19.3); -0.0085 (0.6)
1-321 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.3353 (0.8); 8.3307 (10.6); 8.3233 (2.2); 8.3199 (2.2); 8.2212 (2.2); 8.2145 (2.3); 8.0384 (1.6); 8.0349 (1.6); 8.0317 (1.5); 8.0281 (1.4); 7.2633 (15.0); 5.2990 (1.9); 3.7857 (16.0); 3.7799 (0.8); 3.7746 (0.9); 2.2147 (1.0); 2.2111 (0.6); 2.2013 (15.8);
1.5858 (3.0); 1.2560 (0.5); -0.0002 (6.4)
1-322: lH-NMR(400.0 MHz, CDC13):
δ= 8.3625 (1.1); 8.3604 (1.1); 8.3586 (1.1); 8.3564 (1.1); 8.3346 (11.0); 7.8359 (0.8); 7.8297 (0.8); 7.8142 (0.8); 7.8088 (0.8);
7.2626 (13.4); 6.9501 (1.4); 6.9285 (1.3); 5.2986 (3.1); 3.7874 (16.0); 2.1924 (15.8); 1.5760 (1.5); -0.0002 (5.5)
1-323: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5935 (1.3); 8.5841 (1.3); 7.2636 (18.4); 7.0628 (1.1); 7.0509 (2.1); 7.0390 (1.1); 3.7898 (0.9); 3.7763 (16.0); 3.1740 (0.6); 3.1583 (0.9); 3.1404 (0.6); 2.3489 (14.0); 2.3124 (0.8); 1.8239 (0.6); 1.8199 (0.5); 1.8115 (0.9); 1.8084 (0.8); 1.8027 (0.7); 1.7935 (0.9); 1.7807 (0.7); 1.7669 (0.5); 1.7636 (0.5); 1.7110 (0.6); 1.7034 (0.7); 1.6945 (1.2); 1.6855 (1.5); 1.6813 (1.2); 1.6734
(1.2) ; 1.6665 (0.8); 1.5191 (0.7); 1.5157 (0.8); 1.5079 (0.8); 1.5046 (0.9); 1.5006 (1.2); 1.4904 (1.9); 1.4839 (2.1); 1.4756 (1.9);
1.4706 (1.1); 1.4603 (1.0); 1.4561 (0.8); 1.4493 (0.5); 1.4447 (0.6); -0.0002 (7.2)
1-324: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4410 (2.0); 8.4081 (0.8); 7.2626 (23.4); 3.7858 (3.6); 3.7720 (16.0); 3.1606 (0.9); 3.1446 (1.2); 3.1282 (0.8); 2.3526 (13.5); 2.3136 (3.2); 2.2719 (0.5); 2.2531 (0.6); 1.8599 (0.5); 1.8257 (0.7); 1.8137 (1.0); 1.7941 (1.0); 1.7832 (1.0); 1.7638 (0.6); 1.7140 (0.6); 1.7057 (0.8); 1.6973 (1.1); 1.6916 (1.1); 1.6882 (1.2); 1.6752 (1.1); 1.6682 (0.6); 1.5998 (0.9); 1.5249 (0.8); 1.5143 (0.9); 1.5089 (1.2); 1.4990 (1.7); 1.4921 (1.8); 1.4841 (2.0); 1.4712 (1.3); 1.4647 (1.0); 1.4539 (1.0); 1.4380 (0.7); -0.0002 (9.0) 1-325: 1H-NMR(400.0 MHz, CDC13):
δ= 7.2607 (12.2); 6.8908 (0.6); 6.6302 (3.6); 3.7285 (4.5); 2.3547 (16.0); 2.3157 (2.6); 2.1194 (7.5); 1.5869 (0.9); -0.0002 (4.7) 1-326: 1H-NMR(400.0 MHz, CDC13):
δ= 7.2610 (12.2); 6.8984 (0.8); 6.8910 (0.6); 6.8836 (1.0); 6.8768 (1.0); 6.8619 (1.7); 6.8345 (2.7); 6.8182 (0.9); 6.8146 (0.8);
3.7342 (4.3); 2.3916 (16.0); 2.3036 (2.9); 1.5889 (0.6); -0.0002 (4.6)
1-327: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4634 (2.2); 8.4515 (2.3); 7.2619 (14.0); 7.0638 (0.7); 7.0590 (0.8); 7.0459 (0.9); 7.0436 (1.0); 7.0412 (1.0); 7.0389 (1.0); 7.0257 (0.9); 7.0210 (1.0); 6.9704 (1.4); 6.9585 (2.7); 6.9465 (1.4); 6.8419 (0.7); 6.8373 (0.9); 6.8225 (2.0); 6.8179 (1.8); 6.8024
(1.3) ; 6.7995 (1.5); 6.7845 (1.2); 6.7816 (1.4); 6.7624 (1.9); 6.7427 (1.3); 6.7401 (1.1); 3.8419 (14.6); 3.8251 (16.0); 2.2870
(14.0); 1.6115 (0.5); -0.0002 (5.7)
1-328: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4686 (1.4); 7.2623 (39.3); 3.7744 (16.0); 2.6305 (0.6); 2.6241 (0.6); 2.6139 (0.9); 2.6049 (0.8); 2.5876 (0.5); 2.3535 (13.1); 1.8485 (0.9); 1.8387 (1.4); 1.8172 (2.0); 1.7085 (1.7); 1.6993 (1.8); 1.6243 (1.2); 1.5602 (0.9); 1.5378 (0.8); 1.2342 (1.3); 1.2172 (2.0); 1.2072 (3.2); 1.1972 (2.4); 1.1895 (2.2); 1.1743 (2.6); 1.1548 (1.2); 1.1466 (1.2); 0.0080 (0.5); -0.0002 (15.2); -0.0085 (0.5) 1-329: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5802 (5.9); 8.5682 (6.1); 7.2616 (29.4); 7.0561 (1.9); 7.0441 (3.6); 7.0321 (1.8); 3.7822 (16.0); 2.3336 (15.3); 1.8431 (0.7); 1.8187 (1.0); 1.7020 (0.8); 1.6880 (0.8); 1.6785 (0.7); 1.6336 (1.8); 1.2366 (0.6); 1.2161 (1.1); 1.1953 (1.1); 1.1892 (1.2); 1.1669
(1.3); 1.1423 (0.6); -0.0002 (11.7)
1-330: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4646 (6.1); 8.4527 (6.2); 8.0342 (4.2); 8.0290 (1.4); 8.0167 (1.3); 8.0115 (4.5); 8.0050 (0.6); 7.2624 (20.6); 7.1795 (0.5); 7.1729 (4.5); 7.1677 (1.4); 7.1555 (1.3); 7.1503 (4.4); 7.1438 (0.6); 7.0117 (1.8); 6.9997 (3.5); 6.9877 (1.8); 3.8769 (16.0);
3.4882 (0.7); 2.2986 (15.6); 1.5717 (0.8); -0.0002 (8.0)
1-331 : 1H-NMR(400.0 MHz, CDC13):
δ= 7.2599 (54.6); 7.0706 (0.6); 7.0585 (0.7); 7.0563 (0.7); 7.0510 (0.6); 7.0437 (0.6); 7.0361 (0.7); 6.7962 (2.9); 6.7891 (1.6); 6.7832 (1.2); 6.7807 (1.2); 6.7714 (1.6); 6.7517 (1.3); 3.8317 (16.0); 2.3942 (1.2); 1.5421 (3.5); 0.0080 (0.7); -0.0002 (21.5); - 0.0085 (0.8)
1-332: 1H-NMR(400.0 MHz, CDC13):
δ= 8.1230 (0.5); 7.2597 (28.9); 6.6172 (2.8); 6.6162 (2.8); 3.7416 (6.0); 2.3406 (16.0); 2.1356 (5.9); 1.5540 (1.2); -0.0002 (11.3) 1-333: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5012 (1.9); 8.4893 (1.9); 7.2601 (65.0); 7.0472 (1.2); 7.0352 (2.2); 7.0232 (1.1); 6.9411 (0.8); 6.9364 (0.5); 6.9199 (1.0); 6.9148 (0.6); 6.8995 (0.7); 6.8943 (0.9); 6.8742 (0.7); 6.8449 (0.5); 6.6772 (0.5); 5.2565 (0.7); 4.1584 (2.2); 4.1474 (14.6);
3.9099 (4.2); 3.8709 (16.0); 1.5776 (2.6); 0.0080 (0.8); -0.0002 (24.4); -0.0084 (0.9)
1-334: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4871 (4.4); 8.4751 (4.5); 8.0193 (0.7); 7.2605 (53.1); 7.0475 (1.5); 7.0356 (2.8); 7.0236 (1.4); 6.6787 (1.3); 6.6763 (0.8); 6.6731 (1.5); 6.6707 (0.8); 6.6614 (0.7); 6.6591 (1.4); 6.6535 (1.3); 6.5370 (0.6); 6.5206 (0.7); 6.5149 (1.2); 6.5092 (0.6); 6.4927 (0.6); 4.2188 (15.8); 4.2024 (1.0); 3.9480 (1.0); 3.8362 (16.0); 2.9558 (7.0); 2.8843 (5.8); 2.8833 (5.7); 2.0436 (0.6); 1.5505
(4.0); 1.2586 (0.6); 0.0080 (0.7); -0.0002 (22.0); -0.0085 (0.7)
1-336: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4394 (4.2); 8.3246 (10.2); 8.2152 (1.5); 8.2078 (1.6); 7.2604 (61.0); 7.2432 (1.2); 7.2411 (1.3); 7.2357 (1.1); 7.2337 (1.2); 7.2211 (1.0); 7.2138 (0.9); 7.0477 (0.9); 7.0464 (0.9); 7.0376 (0.9); 7.0363 (0.9); 7.0257 (0.7); 7.0244 (0.8); 7.0155 (0.8); 7.0142
(0.7); 4.2113 (15.7); 4.1963 (7.5); 3.9515 (7.3); 3.7949 (16.0); 1.9499 (0.6); 0.0079 (0.7); -0.0002 (23.7); -0.0085 (1.1)
1-337: lH-NMR(400.6 MHz, d6-DMSO):
δ= 8.6660 (16.0); 7.2686 (1.7); 7.2649 (0.7); 7.2503 (4.2); 7.2366 (1.3); 7.2318 (4.2); 7.1884 (1.2); 7.1868 (2.8); 7.1850 (3.4); 7.1836 (4.2); 7.1821 (4.8); 7.1758 (1.0); 7.1701 (0.8); 7.1658 (3.5); 7.1642 (4.4); 7.1626 (4.0); 7.1611 (2.9); 7.1475 (2.9); 7.1451 (2.2); 7.1440 (2.2); 7.1427 (2.3); 7.1376 (0.7); 7.1341 (2.5); 7.1307 (1.4); 7.1283 (1.6); 7.1248 (4.9); 7.1175 (1.6); 7.1116 (4.0); 7.1041 (0.7); 7.0878 (1.0); 7.0805 (4.4); 7.0745 (1.2); 7.0659 (0.8); 7.0637 (1.0); 7.0584 (6.0); 7.0526 (1.3); 7.0417 (1.0); 7.0359
(2.5) ; 4.3035 (1.4); 4.2858 (4.9); 4.2680 (4.9); 4.2503 (1.5); 3.7448 (1.6); 3.7385 (0.8); 3.7328 (0.7); 3.7287 (0.7); 3.7239 (1.0); 3.7167 (0.9); 3.7113 (0.8); 3.7014 (1.5); 3.6980 (1.1); 3.6921 (1.4); 3.6853 (1.1); 3.6809 (1.0); 3.6733 (1.2); 3.6642 (1.6); 3.6345
(1.6) ; 3.6198 (1.7); 3.5644 (1.2); 2.6748 (0.7); 2.6702 (1.1); 2.6656 (0.8); 2.5240 (2.7); 2.5193 (3.8); 2.5105 (57.8); 2.5060 (126.3); 2.5014 (176.4); 2.4968 (121.0); 2.4922 (54.1); 2.3331 (0.8); 2.3284 (1.1); 2.3238 (0.8); 2.2998 (18.7); 1.2014 (6.3);
1.1836 (14.2); 1.1659 (6.1); 0.0081 (1.8); -0.0002 (71.3); -0.0085 (2.1)
1-338: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3394 (9.4); 8.3241 (0.9); 7.5186 (0.7); 7.2597 (125.9); 7.1194 (1.0); 6.9956 (0.8); 6.9422 (1.0); 6.9378 (0.8); 6.9335 (0.5); 6.9219 (0.9); 6.9167 (1.0); 6.8963 (0.6); 6.8387 (0.6); 6.8331 (0.5); 4.1522 (0.6); 4.1448 (2.1); 4.1404 (14.9); 3.9479 (0.6);
3.9071 (3.9); 3.8715 (16.0); 3.8613 (1.6); 3.8505 (1.8); 1.5831 (5.4); 0.0080 (1.6); -0.0002 (46.4); -0.0084 (1.7)
1-339: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4719 (4.4); 8.4600 (4.5); 7.2603 (15.2); 7.1318 (2.7); 7.1298 (3.0); 7.1194 (9.6); 7.0861 (0.6); 7.0786 (0.5); 7.0751 (0.6);
7.0647 (0.6); 7.0054 (1.5); 6.9935 (2.8); 6.9815 (1.4); 4.1372 (14.8); 3.9480 (5.9); 3.8499 (16.0); -0.0002 (5.8)
1-340: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2687 (8.7); 7.2596 (33.2); 7.1276 (1.3); 7.1225 (1.3); 7.1176 (0.6); 7.1101 (2.8); 7.1086 (2.5); 7.0955 (3.7); 7.0829 (1.0);
7.0790 (1.3); 7.0734 (1.3); 4.1356 (14.9); 3.9525 (5.5); 3.8637 (16.0); -0.0002 (12.5); -0.0085 (0.5)
1-341 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.3220 (5.6); 7.2596 (56.2); 6.6653 (0.8); 6.6599 (1.0); 6.6459 (0.9); 6.6404 (0.8); 6.5354 (0.7); 4.2123 (9.0); 3.8402 (9.1);
1.5372 (16.0); 0.0079 (0.8); -0.0002 (20.7); -0.0084 (0.8)
1-342: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3011 (9.0); 7.4565 (2.9); 7.4516 (1.2); 7.4397 (1.1); 7.4346 (3.7); 7.4300 (0.7); 7.2605 (39.4); 7.1838 (0.6); 7.1791 (3.5); 7.1741 (1.3); 7.1622 (1.1); 7.1572 (3.2); 7.1524 (0.6); 4.2181 (15.2); 3.8019 (16.0); 2.0052 (0.9); 1.7079 (0.6); -0.0002 (15.1); -
0.0085 (0.7)
1-343: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4561 (2.6); 8.4441 (2.6); 7.4333 (3.0); 7.4284 (1.1); 7.4165 (1.2); 7.4115 (3.6); 7.4068 (0.6); 7.2601 (69.6); 7.1955 (0.6); 7.1908 (3.6); 7.1859 (1.2); 7.1739 (1.1); 7.1690 (3.0); 7.1642 (0.5); 7.0430 (1.2); 7.0310 (2.4); 7.0191 (1.2); 4.2243 (15.0);
3.8015 (16.0); 1.6145 (1.7); 0.0080 (0.8); -0.0002 (26.9); -0.0085 (1.0)
1-344: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2676 (9.1); 7.4010 (1.4); 7.3654 (0.8); 7.3627 (0.8); 7.3448 (1.8); 7.3110 (1.1); 7.2914 (0.7); 7.2612 (13.2); 4.1998 (15.5);
3.8221 (16.0); -0.0002 (5.0)
1-345: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4419 (2.8); 8.4299 (2.9); 7.4115 (1.4); 7.3730 (0.7); 7.3536 (1.1); 7.3500 (1.0); 7.3277 (1.1); 7.2981 (1.1); 7.2788 (1.2);
7.2606 (25.8); 7.0098 (1.2); 6.9978 (2.4); 6.9859 (1.2); 4.2051 (15.2); 3.8135 (16.0); 1.6276 (0.6); -0.0002 (9.9)
1-346: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3779 (0.6); 8.3673 (0.7); 8.3066 (8.2); 7.5419 (0.5); 7.5374 (0.6); 7.5215 (0.9); 7.5190 (0.9); 7.5030 (0.7); 7.4985 (0.6); 7.2611 (29.7); 7.0592 (1.1); 7.0527 (0.9); 7.0387 (1.6); 7.0218 (0.7); 4.2195 (15.6); 3.7772 (16.0); 2.9274 (0.5); -0.0002 (11.0); -
0.0085 (0.5)
1-347: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4765 (2.4); 8.4645 (2.4); 8.3428 (0.6); 8.3327 (0.6); 7.5038 (0.6); 7.4993 (0.5); 7.4836 (0.9); 7.4806 (0.8); 7.4649 (0.6); 7.4604 (0.6); 7.2614 (29.3); 7.0455 (0.9); 7.0362 (1.3); 7.0243 (2.9); 7.0123 (1.3); 6.9972 (0.8); 6.9908 (0.6); 4.2257 (15.5);
3.7664 (16.0); 2.4324 (0.5); -0.0002 (10.9)
1-348: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2802 (8.1); 7.3624 (0.5); 7.3422 (2.7); 7.3259 (1.0); 7.3247 (1.0); 7.2942 (0.8); 7.2743 (0.8); 7.2601 (29.2); 4.1601 (0.6);
4.1482 (14.6); 4.0159 (4.6); 3.8609 (16.0); 1.6491 (0.7); -0.0002 (11.2)
1-349: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4668 (2.6); 8.4549 (2.7); 7.3569 (2.0); 7.3370 (1.1); 7.3319 (1.2); 7.2834 (0.9); 7.2603 (38.9); 7.0121 (1.2); 7.0001 (2.4); 6.9881 (1.2); 6.6952 (0.6); 5.3652 (0.9); 4.1661 (2.5); 4.1532 (14.4); 4.0104 (4.7); 3.8493 (16.0); 1.5933 (0.8); -0.0002 (14.4)
1-350: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3301 (8.0); 7.2606 (23.5); 7.0566 (0.6); 7.0401 (0.6); 6.6760 (0.8); 6.6550 (2.5); 6.6339 (1.2); 4.1402 (14.7); 3.9408 (3.7);
3.8559 (16.0); 1.5697 (1.2); -0.0002 (9.0)
1-351 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.4966 (2.2); 8.4847 (2.3); 7.2619 (14.4); 7.0725 (0.7); 7.0557 (0.7); 7.0385 (1.3); 7.0266 (2.2); 7.0146 (1.1); 6.6603 (0.9);
6.6555 (0.6); 6.6357 (2.0); 6.6182 (0.5); 6.6147 (1.4); 4.1474 (14.4); 3.9437 (4.0); 3.8498 (16.0); -0.0002 (5.6)
1-352: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2554 (8.0); 7.2649 (0.6); 7.2599 (34.1); 7.2488 (0.5); 7.1573 (3.9); 7.1561 (4.0); 7.1471 (4.8); 7.1453 (5.1); 7.1261 (0.7); 7.1158 (0.9); 7.1079 (0.7); 7.1058 (1.0); 7.0947 (0.9); 4.1779 (15.6); 3.8245 (16.0); 1.6162 (1.6); -0.0002 (13.1); -0.0084 (0.6) 1-353: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3101 (9.4); 7.2601 (26.7); 7.0858 (1.1); 7.0803 (0.5); 7.0722 (1.2); 7.0637 (1.4); 7.0558 (0.6); 7.0502 (1.3); 6.8466 (1.6); 6.8412 (0.5); 6.8300 (0.6); 6.8248 (2.9); 6.8194 (0.6); 6.8029 (1.3); 4.1483 (0.6); 4.1320 (14.9); 3.9186 (4.0); 3.8671 (16.0); -
0.0002 (10.2)
1-354: lH-NMR(400.0 MHz, CDC13):
δ= 8.4805 (4.9); 8.4686 (5.0); 7.2604 (18.8); 7.0991 (1.3); 7.0939 (0.6); 7.0855 (1.5); 7.0774 (1.6); 7.0638 (1.5); 7.0247 (1.5); 7.0128 (2.8); 7.0008 (1.4); 6.8287 (1.8); 6.8234 (0.6); 6.8068 (3.3); 6.8015 (0.7); 6.7900 (0.6); 6.7849 (1.5); 4.1373 (15.3);
3.9203 (5.4); 3.8636 (16.0); -0.0002 (10.6)
1-355: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2774 (9.0); 7.2600 (43.5); 7.1343 (0.6); 7.1299 (0.8); 7.1252 (0.6); 7.1205 (0.8); 7.1151 (1.1); 7.1107 (1.4); 7.1043 (0.6); 7.1027 (0.7); 7.0947 (0.5); 7.0924 (0.9); 7.0895 (0.8); 6.9621 (0.5); 6.9594 (1.0); 6.9535 (0.8); 6.9517 (0.7); 6.9408 (0.6); 6.9366 (1.7); 6.9340 (1.6); 6.9320 (1.1); 6.9157 (1.2); 6.9127 (0.6); 4.1752 (16.0); 3.8569 (16.0); 1.5484 (3.0); 0.0080 (0.5); -0.0002
(17.0); -0.0085 (0.6)
1-356: lH-NMR(400.0 MHz, CDC13):
δ= 8.4660 (2.4); 8.4540 (2.5); 7.2600 (50.1); 7.1466 (0.6); 7.1320 (0.8); 7.1275 (1.3); 7.1086 (1.0); 7.1037 (0.7); 7.1005 (0.6); 7.0893 (0.6); 7.0826 (0.6); 7.0253 (1.2); 7.0133 (2.3); 7.0013 (1.2); 6.9459 (1.0); 6.9421 (1.0); 6.9225 (2.5); 6.9030 (1.3); 4.1807
(15.2); 3.8470 (16.0); 1.7916 (0.5); 0.0078 (0.6); -0.0002 (17.6); -0.0083 (0.8)
1-357: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2987 (8.4); 7.2600 (55.7); 7.2059 (1.6); 7.2005 (0.7); 7.1930 (1.7); 7.1890 (0.8); 7.1875 (0.8); 7.1835 (2.0); 7.1762 (0.8); 7.1707 (1.9); 6.8844 (1.9); 6.8789 (0.6); 6.8675 (0.7); 6.8630 (2.8); 6.8576 (0.7); 6.8463 (0.6); 6.8408 (1.6); 4.1623 (15.5);
3.8633 (16.0); 1.5858 (2.5); 0.0080 (0.6); -0.0002 (19.7); -0.0084 (0.7)
1-358: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3259 (8.9); 7.2599 (67.2); 7.0390 (0.6); 7.0333 (0.6); 7.0207 (0.5); 7.0150 (0.6); 7.0125 (0.6); 7.0069 (1.0); 6.9954 (0.6); 6.9884 (0.7); 6.9853 (0.9); 6.9657 (0.8); 6.9604 (0.8); 6.9408 (1.1); 6.9375 (0.6); 6.9350 (0.6); 6.9319 (0.5); 6.9291 (0.7); 6.9270
(0.7); 6.9238 (0.6); 6.9214 (0.5); 4.1823 (15.5); 3.8625 (16.0); 1.6157 (0.7); 0.0079 (0.8); -0.0002 (23.8); -0.0085 (0.8)
1-359: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4693 (3.4); 8.4573 (3.4); 7.2603 (36.6); 7.1349 (0.9); 7.1317 (1.5); 7.1299 (1.5); 7.1259 (0.9); 7.0836 (0.7); 7.0821 (0.7); 7.0725 (0.8); 7.0674 (3.0); 7.0652 (4.2); 7.0618 (2.1); 7.0548 (1.8); 7.0500 (1.6); 7.0479 (0.8); 7.0438 (0.6); 7.0213 (1.4); 7.0094
(2.6); 6.9974 (1.4); 4.2010 (15.5); 3.8325 (16.0); 1.5495 (2.2); -0.0002 (14.0); -0.0085 (0.5)
1-360: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2925 (9.8); 7.2601 (33.7); 7.1173 (0.8); 7.1162 (0.8); 7.1114 (1.8); 7.1089 (1.0); 7.1069 (1.0); 7.0943 (0.9); 7.0815 (0.5); 7.0770 (2.5); 7.0752 (2.0); 7.0709 (2.5); 7.0665 (1.8); 7.0622 (1.7); 7.0577 (2.0); 7.0526 (1.0); 7.0398 (0.6); 4.1958 (15.7);
3.8425 (16.0); 2.0046 (0.6); 1.5463 (1.1); -0.0002 (12.6)
1-361 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.4643 (2.1); 8.4524 (2.1); 7.2600 (33.4); 7.1127 (2.3); 7.1082 (0.8); 7.0968 (0.9); 7.0922 (3.0); 7.0167 (1.1); 7.0047 (2.2);
6.9928 (1.1); 6.9475 (2.2); 6.9277 (1.8); 4.1607 (14.8); 3.8404 (16.0); 2.2406 (8.0); -0.0002 (12.3)
1-362: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2598 (9.2); 7.2599 (28.5); 7.0904 (2.2); 7.0859 (0.8); 7.0746 (0.9); 7.0699 (3.0); 6.9563 (2.3); 6.9365 (1.7); 4.1578 (15.7);
3.8505 (16.0); 2.2527 (8.0); 1.5722 (1.7); -0.0002 (10.7)
1-363: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4945 (3.3); 8.4825 (3.4); 7.2607 (35.4); 7.0538 (1.2); 7.0418 (2.4); 7.0299 (1.2); 6.5510 (1.6); 6.5346 (1.8); 6.5292 (1.9);
6.5128 (1.6); 6.5088 (0.5); 4.1263 (15.6); 3.9589 (16.0); 2.0050 (0.6); -0.0002 (13.6); -0.0085 (0.6)
1-364: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3474 (9.5); 7.2604 (33.2); 6.5879 (1.6); 6.5714 (1.9); 6.5662 (1.9); 6.5498 (1.6); 4.1204 (15.9); 3.9599 (16.0); 2.0055 (0.7);
-0.0002 (12.7)
1-365: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3300 (5.4); 8.3181 (5.6); 7.2609 (17.5); 7.1896 (2.4); 7.1843 (0.8); 7.1729 (0.9); 7.1676 (2.6); 7.1377 (0.5); 7.1236 (0.7); 7.1189 (1.9); 7.1163 (1.5); 7.1030 (5.4); 7.0975 (4.2); 7.0857 (0.6); 7.0812 (1.0); 7.0663 (0.8); 7.0619 (0.7); 7.0598 (0.5); 7.0449 (0.9); 6.9942 (1.6); 6.9822 (3.0); 6.9703 (1.5); 6.7224 (3.1); 6.7171 (1.0); 6.7058 (0.9); 6.7006 (2.8); 5.2965 (2.5); 5.2909 (5.2); 4.3385 (1.1); 4.3207 (3.6); 4.3029 (3.6); 4.2851 (1.1); 3.7304 (16.0); 1.2246 (3.7); 1.2068 (8.0); 1.1890 (3.6); -0.0002 (6.8) 1-366: 1H-NMR(400.0 MHz, CDC13):
δ= 8.1096 (8.8); 7.2605 (11.1); 6.9007 (0.8); 6.8968 (0.8); 6.8802 (1.2); 6.8208 (2.3); 6.8196 (2.3); 6.8014 (1.3); 3.7468 (12.9);
2.3816 (16.0); 2.3109 (12.7); -0.0002 (4.4)
1-367: 1H-NMR(400.0 MHz, CDC13):
δ= 8.6063 (1.1); 8.5944 (1.2); 8.4888 (2.1); 8.4769 (2.2); 8.1944 (0.9); 8.1880 (0.9); 7.2611 (39.5); 7.2409 (0.6); 7.2336 (0.6); 7.2207 (0.7); 7.2189 (0.8); 7.2134 (0.7); 7.2116 (0.8); 7.1988 (0.7); 7.1915 (0.7); 7.1117 (0.9); 7.0528 (1.8); 7.0409 (2.6); 7.0289 (1.4); 7.0210 (0.6); 4.2179 (15.1); 4.2022 (6.1); 3.9482 (6.2); 3.7912 (16.0); -0.0002 (14.8); -0.0085 (0.6)
1-368: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4163 (12.0); 7.3102 (0.5); 7.2602 (52.4); 6.9765 (0.6); 6.9632 (0.6); 6.9535 (1.2); 6.9402 (1.2); 6.9304 (0.7); 6.9171 (0.6); 6.8157 (0.6); 6.8081 (0.6); 6.7949 (0.6); 6.7880 (1.0); 6.7814 (0.7); 6.7680 (0.6); 6.7606 (0.8); 6.6823 (0.5); 6.6781 (0.6); 6.6747
(0.7); 6.6708 (0.6); 5.2987 (0.6); 3.7587 (16.0); 2.2061 (15.0); 1.5426 (10.7); 0.0079 (0.5); -0.0002 (18.4); -0.0085 (0.7)
1-369: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3336 (1.2); 8.3296 (1.2); 8.3275 (1.2); 7.8342 (0.8); 7.8291 (0.8); 7.8127 (0.8); 7.8075 (0.8); 7.2602 (31.3); 6.9640 (1.7); 6.9519 (0.6); 6.9422 (2.5); 6.9289 (1.2); 6.9192 (0.7); 6.9059 (0.6); 6.7820 (0.6); 6.7746 (0.7); 6.7612 (0.6); 6.7544 (1.0); 6.7477 (0.7); 6.7343 (0.6); 6.7269 (0.7); 6.6677 (0.5); 6.6635 (0.7); 6.6600 (0.8); 6.6564 (0.6); 3.7592 (16.0); 2.2122 (15.0); 1.5447 (2.3); -0.0002 (11.1)
1-370: 1H-NMR(400.0 MHz, CDC13):
δ= 8.6139 (0.6); 8.6019 (0.6); 8.4643 (8.9); 8.4524 (9.2); 7.2611 (35.9); 7.2596 (29.3); 7.2051 (2.5); 7.2010 (3.5); 7.1957 (1.4); 7.1824 (6.6); 7.1808 (6.7); 7.1629 (2.4); 7.1601 (3.5); 7.1548 (1.2); 7.1428 (6.7); 7.1386 (2.6); 7.1231 (3.3); 7.1059 (1.8); 7.1021 (3.0); 7.0986 (1.7); 7.0910 (1.2); 7.0843 (3.1); 7.0774 (0.8); 7.0670 (0.9); 7.0267 (2.8); 7.0147 (5.3); 7.0028 (2.7); 5.2978 (5.8); 5.2964 (4.6); 4.4552 (0.5); 4.4374 (0.5); 4.3627 (2.4); 4.3449 (7.4); 4.3270 (7.6); 4.3091 (2.6); 3.8026 (0.7); 2.0456 (1.2); 1.4446 (0.6); 1.4269 (1.1); 1.4080 (0.7); 1.3898 (0.5); 1.2749 (0.6); 1.2515 (8.2); 1.2337 (16.0); 1.2158 (7.6); -0.0002 (12.9); -0.0017
(10-1)
1-371 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.4985 (9.6); 8.4865 (9.8); 8.3901 (0.6); 8.3782 (0.6); 7.5189 (0.8); 7.2600 (138.3); 7.0749 (3.6); 7.0715 (1.0); 7.0629 (5.5); 7.0571 (1.2); 7.0552 (1.2); 7.0510 (3.6); 7.0464 (1.2); 7.0329 (1.0); 7.0274 (1.1); 6.9961 (1.0); 6.9848 (0.6); 6.9793 (3.0); 6.9753 (2.7); 6.9702 (1.5); 6.9670 (1.9); 6.9657 (1.9); 6.9631 (2.9); 6.9584 (3.3); 6.9434 (1.7); 5.2565 (0.6); 4.4081 (2.3); 4.3903 (7.3); 4.3724 (7.4); 4.3664 (0.8); 4.3546 (2.4); 4.3485 (0.6); 3.8089 (1.4); 3.7898 (0.7); 2.0443 (2.1); 1.3244 (7.7); 1.3066 (16.0); 1.2977 (1.0); 1.2888 (7.7); 1.2798 (1.4); 1.2767 (1.5); 1.2620 (1.4); 1.2588 (2.1); 1.2409 (0.7); 0.8818 (1.5); 0.8641 (0.6); 0.0079
(1.7); -0.0002 (53.4); -0.0085 (2.0)
1-372: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4709 (5.0); 8.4590 (5.1); 7.3357 (0.5); 7.3165 (1.2); 7.2960 (0.9); 7.2605 (39.8); 7.2107 (1.3); 7.1867 (1.3); 7.1803 (1.5); 7.1412 (0.9); 7.1353 (0.7); 7.1207 (0.7); 6.9873 (1.6); 6.9753 (3.1); 6.9634 (1.6); 3.7925 (16.0); 2.1622 (15.5); 1.5489 (9.3); -
0.0002 (15.1); -0.0085 (0.8)
1-373: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3257 (10.2); 7.2613 (15.2); 6.8919 (0.6); 6.8846 (2.9); 6.8808 (0.7); 6.8783 (1.1); 6.8721 (3.0); 6.8656 (3.8); 6.8599 (3.6);
6.8563 (0.7); 6.8501 (0.5); 5.2982 (0.6); 3.7615 (16.0); 2.1569 (15.5); 1.5624 (1.6); -0.0002 (9.2)
1-374: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3583 (1.2); 8.3545 (1.2); 8.3524 (1.2); 7.8195 (0.8); 7.8133 (0.8); 7.7978 (0.8); 7.7917 (0.8); 7.2602 (18.2); 6.9522 (1.5); 6.9404 (0.5); 6.9307 (1.4); 6.8973 (0.9); 6.8910 (0.6); 6.8807 (1.1); 6.8781 (0.9); 6.8738 (2.9); 6.8662 (0.6); 6.8614 (0.6); 6.8542 (3.0); 6.8480 (3.2); 6.8434 (0.8); 6.8414 (0.9); 6.8367 (3.0); 6.8312 (0.7); 6.8297 (0.7); 6.8246 (0.9); 6.8128 (0.6); 5.2978 (1.2); 3.8696 (2.8); 3.7620 (16.0); 3.6386 (2.6); 3.1475 (0.7); 2.3930 (0.6); 2.1662 (14.0); 2.1572 (0.5); 2.0751 (2.6); 1.5536 (2.8); -
0.0002 (10.4)
1-375: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4973 (5.5); 8.4853 (5.6); 7.2610 (27.5); 7.0032 (1.7); 6.9912 (3.2); 6.9793 (1.6); 6.8765 (12.3); 6.8609 (9.1); 3.7712 (16.0);
2.1609 (15.4); 1.5570 (4.0); 0.0080 (0.5); -0.0002 (15.3); -0.0085 (0.5)
1-376: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4283 (0.7); 8.4057 (11.9); 7.2608 (23.6); 6.8952 (0.7); 6.8882 (2.8); 6.8817 (0.8); 6.8796 (0.8); 6.8732 (3.2); 6.8691 (3.6); 6.8659 (1.8); 6.8612 (3.4); 6.8573 (0.7); 6.8510 (0.6); 3.7625 (16.0); 3.6680 (0.7); 2.1559 (15.6); 2.0929 (0.6); 1.5531 (7.4); -
0.0002 (13.1)
1-377: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3450 (10.7); 7.2622 (13.4); 7.0233 (0.5); 7.0008 (1.1); 6.9763 (1.1); 6.9539 (0.6); 6.7964 (0.5); 6.7889 (0.6); 6.7800 (0.6); 6.7725 (0.6); 6.7675 (0.6); 6.7600 (0.6); 6.7511 (0.5); 6.7436 (0.6); 6.6592 (0.7); 6.6548 (0.6); 6.6365 (0.6); 6.6321 (0.6); 5.2987
(0.9); 3.7697 (16.0); 2.1583 (15.5); 1.5658 (3.1); -0.0002 (7.7)
1-378: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5053 (4.1); 8.4933 (4.2); 7.2631 (11.1); 7.0196 (1.6); 7.0077 (3.2); 6.9957 (1.6); 6.9828 (1.1); 6.9582 (1.1); 6.9358 (0.6); 6.8050 (0.5); 6.7974 (0.6); 6.7885 (0.6); 6.7810 (0.6); 6.7759 (0.6); 6.7684 (0.6); 6.7595 (0.5); 6.7520 (0.6); 6.6665 (0.6); 6.6621
(0.6); 6.6438 (0.6); 6.6394 (0.6); 5.2986 (1.0); 3.7740 (16.0); 2.1613 (15.6); 1.5816 (2.6); -0.0002 (6.2)
1-379: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4962 (3.4); 8.4843 (3.4); 7.2621 (12.8); 7.1012 (0.8); 7.0980 (0.5); 7.0828 (0.8); 7.0796 (1.4); 7.0612 (0.8); 7.0594 (0.9); 6.9893 (1.4); 6.9773 (2.7); 6.9654 (1.4); 6.5266 (0.7); 6.5245 (0.9); 6.5209 (0.9); 6.5187 (1.2); 6.5115 (0.8); 6.5093 (0.8); 6.5056 (1.6); 6.5029 (1.7); 6.4983 (1.2); 6.4901 (1.6); 6.4871 (3.6); 6.4841 (2.4); 6.4786 (0.7); 5.2975 (1.1); 3.7647 (14.7); 3.7263
(16.0) ; 2.1556 (14.3); 1.5916 (0.5); -0.0002 (6.9)
1-380: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3215 (9.7); 7.2600 (29.3); 7.1098 (1.0); 7.0895 (2.2); 7.0690 (1.2); 6.5221 (0.6); 6.5202 (0.9); 6.5162 (0.8); 6.5143 (1.2); 6.5110 (0.9); 6.5090 (0.8); 6.5049 (1.3); 6.5025 (1.1); 6.4995 (0.8); 6.4959 (0.9); 6.4937 (1.1); 6.4909 (0.7); 6.4886 (0.7); 6.4847 (1.3); 6.4826 (0.9); 6.4740 (1.6); 6.4683 (2.0); 6.4626 (0.8); 3.7615 (15.2); 3.7345 (16.0); 2.1753 (0.5); 2.1562 (14.8); 1.5457
(5.6); 0.0691 (0.5); 0.0079 (0.6); -0.0002 (16.7); -0.0084 (0.6)
1-392: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4671 (4.6); 8.4552 (4.8); 7.2608 (46.7); 7.1978 (1.3); 7.1931 (0.5); 7.1778 (1.8); 7.1764 (1.9); 7.1602 (0.9); 7.1565 (1.7); 7.0033 (1.2); 6.9967 (3.0); 6.9843 (3.2); 6.9804 (2.3); 6.9769 (1.6); 6.9727 (1.6); 6.9251 (0.6); 6.9224 (1.0); 6.9196 (1.4); 6.9167 (1.5); 6.9141 (1.1); 6.9021 (3.2); 6.8995 (3.9); 6.8967 (3.0); 3.8617 (16.0); 2.2979 (14.7); 1.5544 (9.5); 0.0080 (0.5); -0.0002
(17.1) ; -0.0084 (0.8)
1-394: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4852 (5.4); 8.4733 (5.5); 7.2611 (17.9); 7.0767 (1.3); 7.0568 (2.5); 7.0369 (1.5); 6.9965 (1.6); 6.9845 (2.9); 6.9726 (1.5); 6.6616 (1.4); 6.6424 (1.4); 6.6277 (1.5); 6.6221 (2.5); 6.6177 (1.7); 6.6039 (1.4); 6.5982 (0.9); 6.5834 (1.2); 6.5778 (0.9); 5.2975 (3.8); 3.9678 (1.3); 3.9503 (3.9); 3.9328 (4.0); 3.9154 (1.3); 3.8382 (16.0); 2.3014 (15.6); 1.5683 (4.4); 1.3825 (4.1); 1.3651
(8.2) ; 1.3476 (3.9); -0.0002 (6.4)
1-408: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4545 (0.6); 8.4455 (0.6); 8.3125 (4.8); 8.3035 (4.8); 7.3215 (0.6); 7.2693 (11.6); 7.2604 (11.7); 6.2263 (4.6); 6.2231 (4.5); 6.1812 (2.5); 3.8881 (0.6); 3.8319 (8.0); 3.8229 (8.0); 3.7753 (1.3); 3.7520 (1.9); 3.7212 (15.9); 3.7122 (16.0); 2.3151 (7.7);
2.3060 (8.1); 1.5582 (2.4); 0.0086 (4.5); -0.0002 (4.6)
1-409: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4929 (4.0); 7.2700 (9.0); 7.2611 (9.1); 7.0007 (1.8); 6.9906 (1.8); 6.9791 (0.8); 6.2501 (4.8); 6.2468 (4.6); 6.1737 (2.3); 3.8911 (0.6); 3.8358 (7.9); 3.8268 (7.8); 3.7160 (16.0); 3.7070 (16.0); 2.3115 (7.7); 2.3025 (7.7); 2.2353 (0.5); 1.5732 (1.2);
0.0087 (3.5); -0.0002 (3.5)
1-410: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2578 (10.8); 7.2619 (39.0); 6.7663 (3.3); 6.7647 (3.1); 6.7169 (1.4); 6.7152 (1.4); 4.1782 (15.6); 3.8604 (16.0); 2.1803
(16.0); 2.1790 (15.2); 1.5543 (10.9); -0.0002 (14.2)
1-411 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.2581 (10.3); 7.2622 (21.1); 7.0574 (0.5); 7.0389 (0.8); 7.0360 (1.2); 7.0212 (0.6); 7.0176 (1.0); 6.9723 (1.0); 6.9709 (1.0); 6.9694 (1.0); 6.9551 (2.1); 6.9537 (2.3); 6.9522 (2.1); 6.9125 (0.9); 6.8947 (0.7); 6.8931 (0.7); 4.1793 (15.7); 3.8443 (16.0);
2.2236 (8.1); 1.5593 (5.4); -0.0002 (7.9)
1-412: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2724 (10.1); 7.2623 (30.5); 7.0887 (0.8); 7.0693 (1.9); 7.0497 (1.4); 7.0127 (0.9); 7.0083 (1.9); 7.0041 (1.2); 6.9671 (0.8); 6.9644 (1.2); 6.9598 (1.0); 6.9501 (1.2); 6.9474 (1.6); 6.9456 (1.6); 6.9430 (1.4); 6.9402 (0.7); 6.9310 (0.8); 6.9283 (0.7); 6.9266
(0.8); 6.9239 (0.6); 4.1842 (15.3); 3.8526 (15.4); 2.4078 (16.0); 1.5563 (8.3); -0.0002 (11.2)
1-413: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2662 (10.6); 7.2627 (19.9); 7.0691 (1.0); 7.0491 (1.9); 7.0292 (1.2); 6.7411 (0.8); 6.7388 (0.9); 6.7368 (1.0); 6.7346 (0.9); 6.7217 (0.7); 6.7194 (0.8); 6.7174 (0.9); 6.7151 (0.8); 6.6756 (1.1); 6.6699 (1.6); 6.6653 (1.2); 6.6328 (0.9); 6.6306 (0.9); 6.6266 (0.7); 6.6245 (0.7); 6.6122 (0.8); 6.6101 (0.8); 6.6060 (0.7); 6.6039 (0.6); 4.1808 (15.7); 3.9544 (1.0); 3.9369 (3.3); 3.9194 (3.3);
3.9020 (1.0); 3.8391 (16.0); 1.5639 (4.6); 1.3903 (3.6); 1.3729 (7.5); 1.3554 (3.5); -0.0002 (7.4)
1-414: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5127 (2.7); 8.5008 (2.7); 7.2632 (9.1); 6.9942 (0.8); 6.9822 (1.5); 6.9702 (0.7); 6.2802 (1.8); 6.2745 (2.1); 6.2100 (0.6);
6.2044 (1.0); 6.1987 (0.5); 3.7367 (7.3); 3.7034 (16.0); 3.5603 (2.9); 2.1622 (6.6); -0.0002 (3.4)
1-415: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2693 (10.4); 7.2623 (28.0); 7.0871 (1.0); 7.0671 (2.0); 7.0471 (1.3); 6.7560 (0.8); 6.7538 (1.0); 6.7518 (1.0); 6.7496 (1.0); 6.7366 (0.7); 6.7344 (0.8); 6.7323 (0.9); 6.7302 (0.8); 6.6950 (1.1); 6.6892 (1.6); 6.6847 (1.2); 6.6486 (0.9); 6.6465 (0.9); 6.6423 (0.8); 6.6402 (0.7); 6.6280 (0.8); 6.6259 (0.8); 6.6217 (0.7); 6.6196 (0.6); 4.1804 (15.8); 3.8409 (16.0); 3.7249 (15.8); 1.5580
(8.0); -0.0002 (10.5)
1-416: 1H-NMR(400.0 MHz, CDC13):
δ= 8.5007 (5.0); 8.4887 (5.1); 7.2634 (12.6); 7.1002 (0.7); 7.0802 (1.5); 7.0605 (0.8); 6.9851 (1.5); 6.9731 (3.0); 6.9612 (1.5); 6.7200 (0.9); 6.7185 (0.9); 6.7166 (0.7); 6.7012 (0.8); 6.6996 (0.8); 6.6597 (0.6); 6.6548 (1.4); 6.6534 (1.4); 6.6494 (1.8); 6.6289
(0.7); 6.6225 (0.5); 3.7369 (14.4); 3.7214 (16.0); 3.5995 (4.8); 2.1572 (12.5); -0.0002 (4.6)
1-417: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4983 (0.7); 8.4902 (2.3); 8.4870 (3.3); 8.4784 (2.1); 8.4750 (2.8); 7.2732 (7.9); 7.2652 (24.2); 7.2618 (32.9); 7.0166 (1.1); 7.0079 (1.2); 7.0047 (1.6); 6.9970 (0.7); 6.9928 (0.8); 6.2902 (3.2); 6.1857 (1.3); 6.1806 (1.4); 4.1500 (2.1); 4.1426 (6.1); 4.1394 (7.7); 3.8910 (4.0); 3.8837 (2.5); 3.8754 (6.4); 3.8721 (8.1); 3.6977 (4.2); 3.6901 (12.5); 3.6869 (16.0); 1.5652 (2.4); 1.5576
(7.3) ; 1.5543 (10.6); 0.0112 (3.1); 0.0032 (9.0); -0.0002 (12.2); -0.0084 (0.8)
1-418: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3112 (5.1); 7.2616 (67.2); 6.2386 (1.5); 6.2329 (2.1); 6.2070 (0.7); 6.2014 (0.9); 3.7382 (7.3); 3.7085 (16.0); 3.5503 (2.6);
2.1835 (6.5); 1.5511 (15.8); 0.0079 (0.8); -0.0002 (24.8); -0.0084 (1.0)
1-419: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4776 (5.4); 8.4657 (5.5); 7.2622 (26.7); 7.0704 (1.0); 7.0507 (1.6); 7.0310 (1.2); 7.0107 (1.5); 6.9987 (3.0); 6.9868 (1.4); 6.7285 (0.9); 6.7095 (0.8); 6.6771 (0.9); 6.6714 (1.3); 6.6675 (1.0); 6.6290 (0.8); 6.6273 (0.8); 6.6226 (0.6); 6.6085 (0.7); 6.6021
(0.6); 4.1390 (15.0); 3.9258 (5.0); 3.8619 (15.7); 3.7070 (16.0); 1.5662 (6.1); -0.0002 (10.2)
1-420: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2674 (10.4); 7.2622 (17.6); 7.0691 (0.6); 7.0503 (0.9); 7.0474 (0.8); 7.0282 (0.9); 6.6996 (1.0); 6.6812 (0.8); 6.6799 (0.8); 6.6267 (2.3); 6.6243 (2.3); 6.6180 (0.8); 6.6100 (0.9); 4.1360 (15.0); 3.9272 (4.9); 3.8760 (16.0); 3.7124 (15.8); 1.5684 (4.3); -
0.0002 (6.5)
1-421 : 1H-NMR(400.0 MHz, CDC13):
δ= 8.2782 (5.4); 7.2626 (9.4); 6.2452 (1.7); 6.2395 (2.1); 6.1848 (0.6); 6.1791 (1.0); 4.1358 (7.6); 3.8867 (9.3); 3.6934 (16.0);
1.5687 (2.7); -0.0002 (3.5)
1-422: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4607 (5.3); 8.4488 (5.5); 7.2622 (45.7); 7.2604 (29.1); 7.0790 (1.1); 7.0589 (2.3); 7.0389 (1.4); 7.0133 (1.5); 7.0014 (3.0); 6.9894 (1.5); 6.7710 (1.4); 6.7689 (1.5); 6.7668 (1.4); 6.7515 (1.2); 6.7496 (1.3); 6.7474 (1.3); 6.7184 (1.4); 6.7125 (2.2); 6.7085 (1.5); 6.6336 (1.3); 6.6295 (1.0); 6.6274 (1.1); 6.6130 (1.2); 6.6089 (0.9); 6.6068 (1.0); 4.1852 (15.8); 3.8271 (16.0); 3.7179 (15.9); 1.5570 (12.8); -0.0002 (16.6); -0.0022 (10.7); -0.0083 (0.9)
1-441 : 1H-NMR(400.1 MHz, d6-DMSO):
δ= 12.1042 (1.2); 8.6572 (4.8); 7.2599 (1.7); 7.2412 (3.6); 7.2202 (2.1); 7.2020 (2.8); 7.1826 (1.4); 7.1151 (0.9); 7.0976 (1.2);
7.0815 (0.6); 3.3313 (34.2); 2.6750 (0.5); 2.5075 (75.8); 2.3335 (0.7); 1.7809 (8.1); 1.4901 (16.0); 1.2418 (1.7)
1-442: 1H-NMR(400.1 MHz, d6-DMSO):
δ= 8.8108 (0.5); 8.7249 (5.4); 7.3005 (1.9); 7.2824 (3.7); 7.2653 (2.6); 7.2471 (3.1); 7.2304 (1.8); 7.1529 (1.1); 7.1354 (1.4); 7.1181 (0.8); 3.5813 (9.3); 3.4326 (0.9); 3.3214 (26.2); 2.6772 (1.1); 2.5085 (95.5); 2.3350 (1.3); 1.7461 (0.4); 1.7037 (9.3);
1.6299 (1.0); 1.5790 (0.5); 1.4663 (16.0); 1.3439 (0.7); 1.3264 (0.4); 1.3036 (0.4); 1.2430 (2.7); 0.8607 (0.3)
1-443: 1H-NMR(400.1 MHz, d6-DMSO):
δ= 8.6614 (3.5); 8.6496 (3.5); 7.3214 (1.6); 7.3029 (3.0); 7.2752 (1.9); 7.2650 (1.8); 7.2537 (3.6); 7.2412 (1.9); 7.2377 (1.5); 7.1572 (0.8); 7.1394 (1.2); 7.1215 (0.5); 3.7248 (0.5); 3.5782 (10.0); 3.3191 (13.0); 3.2994 (0.4); 3.2960 (0.4); 2.5105 (39.6); 2.5070 (47.9); 2.4338 (1.0); 2.3337 (0.5); 2.2919 (0.4); 1.6677 (9.9); 1.4475 (16.0); 1.2413 (0.6)
1-444: 1H-NMR(400.1 MHz, d6-DMSO):
δ= 12.0791 (2.6); 8.5723 (5.8); 8.5606 (5.6); 7.2238 (2.3); 7.2121 (3.9); 7.2004 (3.0); 7.1839 (5.8); 7.1693 (14.1); 7.1044 (1.5); 7.0953 (1.7); 7.0894 (1.8); 7.0745 (0.9); 5.7597 (0.9); 3.8939 (0.8); 3.8760 (2.1); 3.8577 (2.1); 3.8397 (0.8); 3.3193 (20.3); 2.6754 (0.4); 2.5066 (52.5); 2.3334 (0.5); 2.0626 (16.0); 2.0068 (0.5); 1.9939 (1.0); 1.4073 (8.9); 1.3890 (8.8); 1.3428 (1.0);
1.3040 (0.3); 1.2417 (4.2); 1.1980 (0.4); 1.1802 (0.5); 0.8593 (0.5)
1-445: 1H-NMR(400.1 MHz, d6-DMSO):
δ= 12.1429 (2.3); 8.5482 (5.8); 8.5363 (5.8); 7.2269 (1.0); 7.2174 (2.1); 7.2056 (4.9); 7.1938 (2.1); 7.1839 (1.4); 7.1788 (1.8); 7.1571 (1.1); 7.1500 (1.1); 7.1451 (1.0); 7.1300 (1.0); 7.1248 (1.2); 7.1196 (1.1); 7.1145 (1.0); 7.0993 (0.9); 7.0947 (0.9); 6.9896 (1.3); 6.9851 (1.3); 6.9801 (1.3); 6.9691 (1.1); 3.9438 (0.6); 3.9259 (1.8); 3.9078 (1.8); 3.8897 (0.6); 3.3121 (13.5); 3.2884 (0.4);
2.5088 (42.6); 2.5052 (51.5); 2.3321 (0.4); 2.1167 (16.0); 1.4056 (8.4); 1.3874 (8.5); 1.3413 (0.5); 1.2393 (1.9)
1-446: 1H-NMR(400.1 MHz, d6-DMSO):
δ= 12.0933 (2.6); 8.5409 (5.7); 8.5292 (5.6); 8.3487 (2.0); 8.3381 (2.0); 7.5883 (1.1); 7.5850 (1.1); 7.5693 (2.2); 7.5503 (1.3); 7.2137 (1.9); 7.2020 (3.3); 7.1903 (1.8); 7.1123 (1.8); 7.0977 (4.5); 7.0794 (3.3); 5.7603 (0.8); 3.9763 (0.7); 3.9582 (2.0); 3.9401 (2.1); 3.9220 (0.8); 3.3191 (15.0); 2.6760 (0.4); 2.5071 (48.8); 2.3341 (0.8); 2.2799 (0.5); 2.1850 (0.4); 2.1211 (16.0); 2.0423 (0.4); 2.0175 (0.4); 1.9999 (0.4); 1.9595 (0.3); 1.4629 (9.1); 1.4447 (9.1); 1.3426 (1.2); 1.3041 (0.8); 1.2418 (6.3); 1.1937 (0.5);
0.8594 (0.8); 0.8423 (0.5)
1-447: 1H-NMR(400.1 MHz, d6-DMSO):
δ= 8.5462 (5.4); 8.5344 (5.5); 8.3423 (1.7); 8.3316 (1.7); 7.5832 (0.9); 7.5796 (0.9); 7.5639 (1.8); 7.5604 (1.8); 7.5451 (1.1); 7.5412 (1.0); 7.2180 (1.6); 7.2062 (3.0); 7.1944 (1.7); 7.1096 (3.7); 7.0906 (3.9); 7.0794 (1.5); 3.9969 (0.6); 3.9789 (1.8); 3.9606
(1.8) ; 3.9423 (0.7); 3.6246 (15.9); 3.3108 (18.6); 2.6759 (0.6); 2.5071 (118.8); 2.3340 (0.9); 2.1553 (16.0); 1.4575 (7.7); 1.4393
(7.9) ; 1.2414 (0.5)
1-448: 1H-NMR(400.1 MHz, d6-DMSO):
δ= 8.5579 (5.5); 8.5461 (5.6); 7.2273 (2.2); 7.2152 (3.4); 7.2070 (2.1); 7.2034 (2.4); 7.1854 (1.1); 7.1802 (1.5); 7.1660 (1.0); 7.1595 (1.3); 7.1464 (0.9); 7.1410 (1.0); 7.1359 (0.9); 7.1306 (0.9); 7.1157 (0.8); 7.1108 (0.8); 7.0057 (1.0); 7.0007 (1.0); 6.9960
(1.0) ; 6.9852 (0.9); 3.9688 (0.5); 3.9507 (1.4); 3.9325 (1.5); 3.9146 (0.5); 3.6324 (16.0); 3.6060 (0.4); 3.4561 (0.4); 3.3189 (14.1); 3.2958 (0.4); 2.5109 (29.6); 2.5069 (35.6); 2.3338 (0.4); 2.1474 (16.0); 2.1212 (0.4); 2.0382 (0.4); 1.3952 (7.0); 1.3769
(7.1) ; 1.2407 (0.7)
1-449: 1H-NMR(400.1 MHz, d6-DMSO):
δ= 8.5807 (5.3); 8.5689 (5.3); 7.2307 (1.8); 7.2188 (3.3); 7.2070 (2.0); 7.1880 (10.0); 7.1774 (10.0); 7.1190 (0.3); 7.1087 (0.8); 7.0981 (1.3); 7.0876 (1.4); 7.0771 (0.9); 7.0663 (0.4); 3.9180 (0.6); 3.8998 (1.7); 3.8815 (1.8); 3.8632 (0.6); 3.6192 (15.9); 3.3111 (15.1); 3.2915 (0.5); 2.6761 (0.4); 2.5073 (49.8); 2.3339 (0.4); 2.0952 (16.0); 1.3977 (7.4); 1.3793 (7.5); 1.3456 (0.4);
1.2424 (0.9)
1-450: 1H-NMR(400.1 MHz, d6-DMSO):
δ= 8.6756 (4.0); 7.2431 (0.4); 7.2232 (2.0); 7.2091 (5.6); 7.1547 (0.4); 7.1484 (0.5); 7.1398 (0.6); 7.1338 (0.6); 3.9739 (0.8);
3.9556 (0.8); 3.6737 (7.2); 3.3747 (5.6); 2.5609 (16.0); 2.1786 (7.2); 1.4661 (3.4); 1.4477 (3.4); 1.2949 (0.5)
1-451 : 1H-NMR(400.1 MHz, d6-DMSO):
δ= 8.6355 (9.2); 7.2361 (0.6); 7.2145 (1.4); 7.2099 (1.0); 7.1927 (1.1); 7.1878 (1.5); 7.1662 (0.8); 7.1473 (0.8); 7.1427 (0.9); 7.1273 (0.9); 7.1224 (1.0); 7.1173 (1.0); 7.1123 (1.0); 7.0970 (0.9); 7.0926 (0.8); 6.9813 (1.2); 3.9851 (0.5); 3.9671 (1.5); 3.9490 (1.6); 3.9313 (0.6); 3.6308 (16.0); 3.4394 (0.4); 3.3164 (10.9); 3.2932 (0.4); 2.5069 (39.3); 2.3338 (0.4); 2.1640 (16.0); 2.0132
(0.4); 1.4048 (7.2); 1.3866 (7.3); 1.2408 (0.3)
1-452: 1H-NMR(400.1 MHz, d6-DMSO):
δ= 8.6020 (8.8); 8.3193 (1.7); 8.3110 (1.6); 7.5847 (0.9); 7.5807 (0.9); 7.5655 (1.8); 7.5618 (1.7); 7.5465 (1.1); 7.5425 (1.0); 7.1004 (3.0); 7.0806 (2.8); 4.0219 (0.6); 4.0037 (1.8); 3.9855 (1.8); 3.9672 (0.6); 3.6238 (15.8); 3.3144 (19.3); 3.2747 (0.3); 2.6762 (0.6); 2.5074 (59.2); 2.3347 (0.9); 2.1767 (16.0); 2.0791 (0.6); 2.0278 (0.3); 2.0186 (0.4); 1.4687 (7.9); 1.4504 (7.8) 1-453: 1H-NMR(400.1 MHz, d6-DMSO):
δ= 12.1175 (2.6); 8.5979 (9.4); 8.3290 (2.1); 8.3187 (2.1); 7.5883 (1.2); 7.5698 (2.3); 7.5513 (1.3); 7.1135 (1.7); 7.0936 (4.2); 7.0734 (2.8); 5.7606 (0.5); 3.9998 (0.8); 3.9819 (2.1); 3.9638 (2.1); 3.9460 (0.8); 3.3200 (16.4); 2.6760 (0.5); 2.5075 (51.0); 2.3335 (0.9); 2.3011 (0.6); 2.2664 (0.5); 2.1794 (0.7); 2.1425 (16.0); 2.0917 (1.1); 2.0426 (0.9); 2.0180 (0.5); 2.0006 (0.4); 1.9818 (0.4); 1.4731 (8.8); 1.4550 (8.8); 1.3622 (0.5); 1.3429 (0.9); 1.3040 (0.7); 1.2423 (6.8); 0.8598 (0.9); 0.8428 (0.5) 1-454: 1H-NMR(400.1 MHz, d6-DMSO):
δ= 12.1712 (2.6); 8.6262 (9.8); 7.2365 (0.7); 7.2150 (1.5); 7.1883 (1.6); 7.1668 (0.8); 7.1306 (1.0); 7.1102 (1.2); 7.1054 (1.2); 7.1004 (1.1); 7.0847 (1.0); 7.0806 (0.9); 6.9688 (1.4); 3.9600 (0.6); 3.9420 (1.7); 3.9239 (1.8); 3.9058 (0.7); 3.3165 (13.6); 3.2890 (0.5); 2.6756 (0.3); 2.5067 (49.3); 2.3336 (0.5); 2.1358 (16.0); 2.0911 (0.4); 2.0507 (0.4); 1.9937 (0.6); 1.4148 (7.8); 1.3966 (7.9); 1.2407 (0.9); 1.1804 (0.3)
1-455: 1H-NMR(400.1 MHz, d6-DMSO):
δ= 12.1057 (2.5); 8.6121 (9.8); 7.1908 (1.3); 7.1716 (4.0); 7.1539 (6.4); 7.1449 (7.2); 7.1284 (2.5); 7.1005 (1.5); 7.0836 (2.0); 7.0720 (0.8); 7.0668 (0.9); 3.9137 (0.6); 3.8957 (1.9); 3.8774 (1.9); 3.8592 (0.7); 3.3475 (0.4); 3.3443 (0.6); 3.3412 (0.7); 3.3213 (39.0); 3.2984 (1.0); 3.2950 (0.8); 3.2918 (0.7); 3.2853 (0.4); 2.6759 (0.4); 2.5071 (69.2); 2.3337 (0.5); 2.0942 (16.0); 1.4222
(8.3); 1.4039 (8.4); 1.3429 (0.4); 1.2415 (2.4)
1-456: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3352 (11.2); 7.2610 (15.3); 6.8082 (0.9); 6.8064 (1.0); 6.8023 (0.9); 6.7996 (1.0); 6.7977 (1.0); 6.7940 (0.8); 6.7895 (1.0);
6.7857 (2.4); 6.7757 (1.0); 6.7730 (1.7); 3.8136 (16.0); 2.3463 (13.6); 2.0047 (1.3); 1.5517 (1.7); -0.0002 (8.6)
1-457: 1H-NMR(400.0 MHz, CDC13):
δ= 8.4596 (5.2); 8.4477 (5.3); 7.2617 (13.0); 7.0291 (1.5); 7.0172 (2.9); 7.0052 (1.4); 6.8887 (1.0); 6.8833 (1.1); 6.8689 (1.0); 6.8635 (1.2); 6.8607 (1.1); 6.8395 (1.6); 6.8333 (0.9); 6.8122 (1.6); 6.7873 (0.9); 6.7819 (0.8); 6.7764 (1.0); 6.7711 (0.9); 6.7662 (0.5); 6.7608 (0.5); 4.1673 (15.8); 3.8841 (16.0); 3.7929 (14.6); -0.0002 (7.5)
1-458: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3407 (10.3); 7.2609 (13.7); 6.9343 (0.5); 6.8089 (0.8); 6.8035 (0.6); 6.7911 (0.5); 6.7858 (0.8); 4.1628 (16.0); 3.9072 (16.0);
-0.0002 (7.9)
1-459: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2854 (11.2); 7.2607 (14.2); 7.0775 (1.2); 7.0721 (0.5); 7.0639 (1.3); 7.0556 (1.5); 7.0476 (0.6); 7.0420 (1.4); 6.8365 (1.8); 6.8311 (0.6); 6.8199 (0.6); 6.8147 (3.3); 6.8093 (0.7); 6.7981 (0.5); 6.7928 (1.5); 5.0014 (0.5); 4.1474 (16.0); 3.9576 (4.2); 2.0043 (0.9); 1.9019 (0.5); 1.8867 (0.7); 1.8767 (0.8); 1.7119 (0.6); 1.7040 (0.7); 1.6892 (0.6); 1.6799 (0.5); 1.4460 (0.6); 1.4402
(0.6); 1.4162 (1.5); 1.3954 (1.4); 1.3726 (0.5); 1.3650 (0.7); -0.0002 (8.1)
1-460: 1H-NMR(400.0 MHz, CDC13):
δ= 8.2737 (10.8); 7.2599 (28.2); 7.1473 (1.7); 7.1421 (0.7); 7.1345 (1.8); 7.1301 (0.9); 7.1251 (2.0); 7.1176 (0.8); 7.1123 (1.9); 6.8763 (2.0); 6.8708 (0.6); 6.8594 (0.7); 6.8547 (3.3); 6.8496 (0.7); 6.8382 (0.6); 6.8328 (1.6); 5.0137 (0.7); 4.1763 (16.0); 1.8439 (0.5); 1.8309 (0.6); 1.8147 (0.6); 1.8059 (0.7); 1.7129 (0.6); 1.7048 (0.6); 1.6969 (0.6); 1.6890 (0.7); 1.6818 (0.6); 1.4843 (0.5); 1.4597 (0.6); 1.4516 (0.7); 1.4286 (0.9); 1.4018 (0.7); 1.3983 (0.7); 1.3706 (0.9); 1.3628 (0.6); 1.3463 (0.7); 1.3382 (0.8);
0.0080 (0.6); -0.0002 (16.0); -0.0085 (0.5)
1-461 : lH-NMR(400.0 MHz, d6-DMSO):
δ= 9.3888 (2.8); 8.6067 (6.2); 7.0468 (0.6); 7.0279 (2.2); 7.0235 (1.3); 7.0069 (2.4); 6.9971 (0.5); 6.9900 (0.6); 6.8376 (0.5); 6.8353 (0.6); 6.8311 (0.5); 6.8291 (0.5); 6.7282 (2.5); 6.7231 (0.8); 6.7118 (0.7); 6.7068 (2.2); 5.0703 (3.1); 3.5123 (2.4); 3.3129 (16.0); 2.5188 (0.6); 2.5101 (6.6); 2.5056 (13.6); 2.5010 (18.5); 2.4965 (13.1); 2.4920 (6.1); 2.2069 (7.1); 1.9879 (1.0); 1.1747
(0.6); -0.0002 (0.8)
1-462: lH-NMR(400.0 MHz, CDC13):
δ= 7.7391 (1.6); 7.7162 (1.8); 7.2846 (1.0); 7.2619 (7.9); 6.9960 (0.7); 6.9827 (0.7); 6.7694 (0.6); 5.2984 (16.0); 3.7581 (9.1);
2.2023 (9.2); 1.5669 (0.6); -0.0002 (3.8)
1-463: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3257 (13.0); 7.2603 (24.9); 7.1238 (0.5); 7.1086 (0.6); 7.1041 (1.1); 7.0889 (1.1); 7.0844 (0.8); 7.0692 (0.7); 6.8524 (1.1); 6.8509 (1.1); 6.8334 (1.0); 6.8318 (1.0); 6.7744 (0.7); 6.7688 (0.9); 6.7470 (1.2); 6.7259 (0.6); 6.7219 (0.8); 3.6139 (16.0);
3.6057 (6.5); 2.1592 (15.2); 1.5732 (0.9); -0.0002 (14.2); -0.0085 (0.5)
1-464: 1H-NMR(400.0 MHz, CDC13):
δ= 7.7435 (3.1); 7.7208 (3.4); 7.2715 (3.3); 7.2598 (52.4); 7.2487 (3.3); 7.0126 (0.6); 6.9994 (0.6); 6.9895 (1.2); 6.9762 (1.2); 6.9665 (0.7); 6.9533 (0.7); 6.8200 (0.6); 6.8126 (0.7); 6.7994 (0.6); 6.7924 (1.1); 6.7858 (0.7); 6.7725 (0.6); 6.7651 (0.7); 6.7108 (0.5); 6.6960 (0.5); 6.6922 (0.7); 6.6884 (0.8); 6.6848 (0.6); 5.2983 (0.6); 3.7627 (15.9); 2.1975 (16.0); 1.5366 (11.4); 0.0079
(0.9); -0.0002 (29.0); -0.0085 (1.2)
1-465: 1H-NMR(400.0 MHz, CDC13):
δ= 7.4203 (2.8); 7.3975 (3.3); 7.2608 (19.2); 7.1262 (3.3); 7.1034 (2.8); 7.0320 (0.6); 7.0186 (0.6); 7.0088 (1.2); 6.9955 (1.2); 6.9857 (0.7); 6.9723 (0.6); 6.8184 (0.6); 6.8110 (0.7); 6.7977 (0.6); 6.7909 (1.0); 6.7841 (0.7); 6.7708 (0.6); 6.7634 (0.6); 6.6898
(0.7); 6.6862 (0.8); 6.6825 (0.6); 5.2983 (1.1); 3.7449 (16.0); 2.1783 (15.3); 1.5539 (5.5); -0.0002 (10.1)
1-466: lH-NMR(400.0 MHz, d6-DMSO):
δ= 8.7158 (13.8); 7.1183 (0.7); 7.0971 (0.6); 7.0914 (1.8); 7.0854 (0.6); 7.0743 (0.8); 7.0685 (2.8); 7.0646 (0.8); 7.0535 (0.7); 7.0473 (2.4); 6.9210 (2.6); 6.9130 (1.1); 6.9100 (2.7); 6.9039 (1.4); 6.9008 (0.9); 6.8979 (1.9); 6.8929 (0.8); 6.8870 (1.8); 5.7522 (4.2); 4.1638 (1.2); 4.1460 (4.3); 4.1283 (5.0); 4.1106 (2.2); 4.0546 (16.0); 3.9481 (4.0); 3.8259 (4.3); 3.4990 (1.3); 2.5239 (0.6); 2.5192 (0.8); 2.5105 (10.5); 2.5060 (21.9); 2.5014 (30.0); 2.4968 (21.2); 2.4923 (9.9); 0.9948 (4.4); 0.9771 (9.4); 0.9593 (4.2); -
0.0002 (4.1)
1-467: 1H-NMR(400.0 MHz, CDC13):
δ= 8.3578 (1.3); 8.3500 (4.0); 7.2601 (44.8); 6.9805 (0.7); 6.9672 (0.7); 6.9575 (1.4); 6.9442 (1.4); 6.9345 (0.8); 6.9212 (0.8); 6.8214 (0.8); 6.8140 (0.9); 6.8006 (0.9); 6.7938 (1.4); 6.7871 (1.0); 6.7738 (0.8); 6.7664 (0.9); 6.7127 (0.6); 6.7082 (0.6); 6.7053 (0.6); 6.7008 (0.5); 6.6932 (0.7); 6.6889 (0.9); 6.6856 (1.0); 6.6818 (0.8); 6.6780 (0.5); 6.6705 (0.5); 6.6659 (0.6); 5.2981 (1.0); 3.8966 (0.6); 3.6676 (0.6); 2.5008 (0.8); 2.2491 (16.0); 2.1351 (0.6); 2.0444 (0.5); 1.2588 (1.0); 0.0080 (0.8); -0.0002 (25.6); - 0.0085 (0.9)
NMR-Daten ausgewählter Intermediate (Peakliste)
NMR-Daten ausgewählter Intermediate (manuelle Auswertung)
Beispielnummer
A-07 'H-NMR (400 MHz, CDC13): δ = 8.26 (s, 2H), 5.81 (s, 1H), 3.87 (s, 3H), 3.72 (s, 3H), 2.28 (s, 3H)
A-l l 'H-NMR (400 MHz, CDCI3): δ = 8.46 (d, 1H), 7.93 (dd, 1H), 7.13 (d, 1H), 3.83 (s, 3H), 2.33 (s, 3H)
A-12 'H-NMR (400 MHz, CDCI3): δ = 8.83 (s, 2H), 3.84 (s, 3H), 2.35 (s, 3H)
A-13 'H-NMR (400 MHz, CDCI3): δ = 8.25 (s, 2H), 3.88 (s, 3H), 3.82 (s, 3H), 2.32 (s, 3H)
A-34 'H-NMR (400 MHz, CDCI3): δ = 7.26-7.14 (m, 5H), 3.88 (s, 3H), 3.64 (s, 2H), 3.62 (s, 3H), 2.06 (s, 3H)
A-35 'H-NMR (400 MHz, CDCI3): δ = 7.29-7.24 (m, 2H), 7.01-6.92 (m, 3H), 3.87 (s, 3H), 3.64 (s, 3H), 2.07 (s, 3H)
A-36 'H-NMR (400 MHz, CDCI3): δ = 7.30-7.26 (m, 2H), 7.01-6.98 (m, 3H), 3.57 (s, 3H), 2.07 (s, 3H)
A-37 'H-NMR (400 MHz, de-DMSO): δ = 7.28-7.24 (m, 1H), 7.04-7.00 (m, 1H), 6.84-6.78 (m, 1H), 3.60 (s, 3H), 2.17 (s, 3H)
A-38 'H-NMR (400 MHz, de-DMSO): δ = 7.49-7.46 (m, 2H), 7.31-7.29 (m, 2H), 3.62 (s, 3H), 2.17 (s, 3H)
A-39 'H-NMR (400 MHz, de-DMSO): δ = 7.28-7.26 (m, 1H), 7.16-7.14 (m, 1H), 7.00-6.95 (m, 2H), 3.62 (s, 3H), 2.16 (s, 3H)
A-40 'H-NMR (400 MHz, de-DMSO): δ = 7.42-7.38 (m, 1H), 7.09-7.05 (m, 1H), 6.91-6.87 (m, 1H), 3.67 (s, 3H), 2.23 (s, 3H)
A-41 'H-NMR (400 MHz, CDCI3): δ = 7.26-6.99 (m, 5H), 3.83 (s, 3H), 1.64-1.60 (m, 1H), 0.99- 0.95 (m, 4H)
A-42 'H-NMR (400 MHz, de-DMSO): δ = 7.29-7.25 (m, 1H), 7.14 (d, 1H), 6.96-6.92 (m, 2H), 3.71 (s, 3H), 1.79-1.75 (m, 1H), 0.91-0.86 (m, 2H), 0.81-0.77 (m, 2H)
A-43 'H-NMR (400 MHz, de-DMSO): δ = 7.37-7.30 (m, 1H), 7.01-6.96 (m, 1H), 6.81-6.78 (m, 2H), 3.70 (s, 3H), 1.79-1.74 (m, 1H), 0.91-0.86 (m, 2H), 0.81-0.78 (m, 2H)
A-44 'H-NMR (400 MHz, CDCI3): δ = 7.32-7.30 (m, 3H), 7.20-7.19 (m, 1H), 3.92 (s, 3H), 3.73 (s, 3H), 2.23 (s, 3H)
A-45 'H-NMR (400 MHz, CDCI3): δ = 7.01-6.99 (m, 1H), 6.85-6.79 (m, 2H), 3.92 (s, 3H), 3.72 (s, 3H), 2.22 (s, 3H)
A-46 'H-NMR (400 MHz, CDCI3): δ = 7.14-7.10 (m, 1H), 7.05-7.02 (m, 1H), 6.99-6.93 (m, 2H), 3.92 (s, 3H), 3.72 (s, 3H), 2.22 (s, 3H)
A-47 'H-NMR (400 MHz, CDCI3): δ = 6.89-6.86 (m, 1H), 6.79-6.73 (m, 2H), 3.92 (s, 3H), 3.70 (s, 3H), 2.24 (s, 3H)
A-48 'H-NMR (400 MHz, CDCI3): δ = 7.21-7.18 (m, 2H), 7.08-7.03 (m, 3H), 3.90 (s, 3H), 3.82 (s, 3H), 1.61 (quintet, 1H), 0.92 (d, 4H)
A-49 'H-NMR (400 MHz, de-DMSO): δ = 8.83 (s, 2H), 4.07 (s, 3H), 3.88 (s, 3H)
Gegenstand der vorliegenden Erfindung ist weiterhin die Verwendung einer oder mehrerer
Verbindungen der allgemeinen Formel (I) und/oder deren Salzen, wie oben definiert, vorzugsweise in einer der als bevorzugt bzw. besonders bevorzugt gekennzeichneten Ausgestaltung, insbesondere einer
oder mehrerer Verbindungen der Formeln (1-001) bis (1-240) und/oder deren Salze, jeweils wie oben definiert, als Herbizid und/oder Pflanzenwachstumsregulator, vorzugsweise in Kulturen von Nutz- und/oder Zierpflanzen. Gegenstand der vorliegenden Erfindung ist ferner ein Verfahren zur Bekämpfung von Schadpflanzen und/oder zur Wachstumsregulierung von Pflanzen, dadurch gekennzeichnet, dass eine wirksame Menge einer oder mehrerer Verbindungen der allgemeinen Formel (I) und/oder deren Salzen, wie oben definiert, vorzugsweise in einer der als bevorzugt bzw. besonders bevorzugt gekennzeichneten Ausgestaltung, insbesondere einer oder mehrerer Verbindungen der Formeln (1-001) bis (1-240) und/oder deren Salze, jeweils wie oben definiert, oder eines erfindungsgemäßen Mittels, wie nachstehend definiert,
auf die (Schad)Pflanzen, (Schad)Pflanzensamen, den Boden, in dem oder auf dem die
(Schad)Pflanzen wachsen, oder die Anbaufläche appliziert wird.
Gegenstand der vorliegenden Erfindung ist auch ein Verfahren zur Bekämpfung von unerwünschten Pflanzen, vorzugsweise in Nutzpflanzenkulturen, dadurch gekennzeichnet, dass eine wirksame Menge einer oder mehrerer Verbindungen der allgemeinen Formel (I) und/oder deren Salzen, wie oben definiert, vorzugsweise in einer der als bevorzugt bzw. besonders bevorzugt gekennzeichneten
Ausgestaltung, insbesondere einer oder mehrerer Verbindungen der Formeln (1-001) bis (1-240) und/oder deren Salze, jeweils wie oben definiert, oder eines erfindungsgemäßen Mittels, wie nachstehend definiert,
auf unerwünschte Pflanzen (z.B. Schadpflanzen wie mono- oder dikotyle Unkräuter oder unerwünschte Kulturpflanzen), das Saatgut der unerwünschten Pflanzen (d.h. Pflanzensamen, z.B. Körner, Samen oder vegetative Vermehrungsorgane wie Knollen oder Sprossteile mit Knospen), den Boden, in dem oder auf dem die unerwünschte Pflanzen wachsen, (z.B. den Boden von Kulturland oder Nicht-Kulturland) oder die Anbaufläche (d.h. Fläche, auf der die unerwünschte Pflanzen wachsen werden) appliziert wird.
Gegenstand der vorliegenden Erfindung ist ferner auch Verfahren zur Bekämpfung zur
Wachstumsregulierung von Pflanzen, vorzugsweise von Nutzpflanzen, dadurch gekennzeichnet, dass eine wirksame Menge einer oder mehrerer Verbindungen der allgemeinen Formel (I) und/oder deren Salzen, wie oben definiert, vorzugsweise in einer der als bevorzugt bzw. besonders bevorzugt gekennzeichneten
Ausgestaltung, insbesondere einer oder mehrerer Verbindungen der Formeln (1-001) bis (1-240) und/oder deren Salze, jeweils wie oben definiert, oder eines erfindungsgemäßen Mittels, wie nachstehend definiert,
die Pflanze, das Saatgut der Pflanze (d.h. Pflanzensamen, z.B. Körner, Samen oder vegetative
Vermehrungsorgane wie Knollen oder Sprossteile mit Knospen), den Boden, in dem oder auf dem die Pflanzen wachsen, (z.B. den Boden von Kulturland oder Nicht-Kulturland) oder die Anbaufläche (d.h. Fläche, auf der die Pflanzen wachsen werden) appliziert wird. Dabei können die erfindungsgemäßen Verbindungen bzw. die erfindungsgemäßen Mittel z.B. im Vorsaat- (gegebenenfalls auch durch Einarbeitung in den Boden), Vorauflauf- und/oder
Nachauflaufverfahren ausgebracht werden. Im einzelnen seien beispielhaft einige Vertreter der mono- und dikotylen Unkrautflora genannt, die durch die die erfindungsgemäßen Verbindungen kontrolliert werden können, ohne dass durch die Nennung eine Beschränkung auf bestimmte Arten erfolgen soll.
Vorzugsweise werden in einem erfindungsgemäßen Verfahren zur Bekämpfung von Schadpflanzen oder zur Wachstumsregulierung von Pflanzen eine oder mehrere Verbindungen der allgemeinen Formel (I) und/oder deren Salze zur Bekämpfung von Schadpflanzen oder zur Wachstumsregulierung in Kulturen von Nutzpflanzen oder Zierpflanzen eingesetzt, wobei die Nutzpflanzen oder Zierpflanzen in einer bevorzugten Ausgestaltung transgene Pflanzen sind.
Die erfindungsgemäßen Verbindungen der allgemeinen Formel (I) und/oder deren Salze eignen sich zur Bekämpfung der folgenden Gattungen von monokotylen und dikotylen Schadpflanzen:
Monokotyle Schadpflanzen der Gattungen: Aegilops, Agropyron, Agrostis, Alopecurus, Apera, Avena, Brachiaria, Bromus, Cenchrus, Commelina, Cynodon, Cyperus, Dactyloctenium, Digitaria, Echinochloa, Eleocharis, Eleusine, Eragrostis, Eriochloa, Festuca, Fimbristylis, Heteranthera, Imperata, Ischaemum, Leptochloa, Lolium, Monochoria, Panicum, Paspalum, Phalaris, Phleum, Poa, Rottboellia, Sagittaria, Scirpus, Setaria, Sorghum. Dikotyle Schadpflanzen der Gattungen: Abutilon, Amaranthus, Ambrosia, Anoda, Anthemis, Aphanes, Artemisia, Atriplex, Bellis, Bidens, Capsella, Carduus, Cassia, Centaurea, Chenopodium, Cirsium, Convolvulus, Datura, Desmodium, Emex, Erysimum, Euphorbia, Galeopsis, Galinsoga, Galium, Hibiscus, Ipomoea, Kochia, Lamium, Lepidium, Lindernia, Matricaria, Mentha, Mercurialis, Mullugo, Myosotis, Papaver, Pharbitis, Plantago, Polygonum, Portulaca, Ranunculus, Raphanus, Rorippa, Rotala, Rumex, Salsola, Senecio, Sesbania, Sida, Sinapis, Solanum, Sonchus, Sphenoclea, Stellaria, Taraxacum, Thlaspi, Trifolium, Urtica, Veronica, Viola, Xanthium.
Werden die erfindungsgemäßen Verbindungen der allgemeinen Formel (I) vor dem Keimen der Schadpflanzen (Ungräser und/oder Unkräuter) auf die Erdoberfläche appliziert (VorauflaufVerfahren), so wird entweder das Auflaufen der Ungras- bzw. Unkrautkeimlinge vollständig verhindert oder diese wachsen bis zum Keimblattstadium heran, stellen jedoch dann ihr Wachstum ein und sterben schließlich nach Ablauf von drei bis vier Wochen vollkommen ab.
Bei Applikation der Wirkstoffe der allgemeinen Formel (I) auf die grünen Pflanzenteile im
Nachauflaufverfahren tritt nach der Behandlung Wachstumsstop ein und die Schadpflanzen bleiben in dem zum Applikationszeitpunkt vorhandenen Wachstumsstadium stehen oder sterben nach einer gewissen Zeit ganz ab, so dass auf diese Weise eine für die Kulturpflanzen schädliche
Unkrautkonkurrenz sehr früh und nachhaltig beseitigt wird.
Obgleich die erfindungsgemäßen Verbindungen der allgemeinnen Formel (I) eine ausgezeichnete herbizide Aktivität gegenüber mono- und dikotylen Unkräutern aufweisen, werden Kulturpflanzen wirtschaftlich bedeutender Kulturen z.B. dikotyler Kulturen der Gattungen Arachis, Beta, Brassica, Cucumis, Cucurbita, Helianthus, Daucus, Glycine, Gossypium, Ipomoea, Lactuca, Linum,
Lycopersicon, Miscanthus, Nicotiana, Phaseolus, Pisum, Solanum, Vicia, oder monokotyler Kulturen der Gattungen Allium, Ananas, Asparagus, Avena, Hordeum, Oryza, Panicum, Saccharum, Seeale, Sorghum, Triticale, Triticum, Zea, abhängig von der Struktur der jeweiligen erfindungsgemäßen Verbindung und deren Aufwandmenge nur unwesentlich oder gar nicht geschädigt. Die vorliegenden Verbindungen eignen sich aus diesen Gründen sehr gut zur selektiven Bekämpfung von unerwünschtem Pflanzenwuchs in Pflanzenkulturen wie landwirtschaftlichen Nutzpflanzungen oder Zierpflanzungen.
Darüberhinaus weisen die erfindungsgemäßen Verbindungen der allgemeinen Formel (I) (abhängig von ihrer jeweiligen Struktur und der ausgebrachten Aufwandmenge) hervorragende
wachstumsregulatorische Eigenschaften bei Kulturpflanzen auf. Sie greifen regulierend in den pflanzeneigenen Stoffwechsel ein und können damit zur gezielten Beeinflussung von
Pflanzeninhaltsstoffen und zur Ernteerleichterung wie z.B. durch Auslösen von Desikkation und Wuchsstauchung eingesetzt werden. Desweiteren eignen sie sich auch zur generellen Steuerung und Hemmung von unerwünschtem vegetativem Wachstum, ohne dabei die Pflanzen abzutöten. Eine
Hemmung des vegetativen Wachstums spielt bei vielen mono- und dikotylen Kulturen eine große Rolle, da beispielsweise die Lagerbildung hierdurch verringert oder völlig verhindert werden kann.
Aufgrund ihrer herbiziden und pflanzenwachstumsregulatorischen Eigenschaften können die Wirkstoffe der allgemeinen Formel (I) auch zur Bekämpfung von Schadpflanzen in Kulturen von gentechnisch oder durch konventionelle Mutagenese veränderten Pflanzen eingesetzt werden. Die transgenen Pflanzen zeichnen sich in der Regel durch besondere vorteilhafte Eigenschaften aus, beispielsweise durch
Resistenzen gegenüber bestimmten Pestiziden, vor allem bestimmten Herbiziden, Resistenzen gegenüber Pflanzenkrankheiten oder Erregern von Pflanzenkrankheiten wie bestimmten Insekten oder Mikroorganismen wie Pilzen, Bakterien oder Viren. Andere besondere Eigenschaften betreffen z.B. das Erntegut hinsichtlich Menge, Qualität, Lagerfähigkeit, Zusammensetzung und spezieller Inhaltsstoffe. So sind transgene Pflanzen mit erhöhtem Stärkegehalt oder veränderter Qualität der Stärke oder solche mit anderer Fettsäurezusammensetzung des Ernteguts bekannt.
Bevorzugt bezüglich transgener Kulturen ist die Anwendung der erfindungsgemäßen Verbindungen der allgemeinen Formel (I) und/oder deren Salze in wirtschaftlich bedeutenden transgenen Kulturen von Nutz und Zierpflanzen, z.B. von Getreide wie Weizen, Gerste, Roggen, Hafer, Hirse, Reis und Mais oder auch Kulturen von Zuckerrübe, Baumwolle, Soja, Raps, Kartoffel, Tomate, Erbse und anderen Gemüsesorten.
Vorzugsweise können die erfindungsgemäßen Verbindungen der allgemeinen Formel (I) auch als Herbizide in Nutzpflanzenkulturen eingesetzt werden, welche gegenüber den phytotoxischen Wirkungen der Herbizide resistent sind bzw. gentechnisch resistent gemacht worden sind.
Aufgrund ihrer herbiziden und pflanzenwachstumsregulatorischen Eigenschaften können die erfindungsgemäßen Verbindungen der allgemeinen Formel (I) auch zur Bekämpfung von Schadpflanzen in Kulturen von bekannten oder noch zu entwickelnden gentechnisch veränderten Pflanzen eingesetzt werden. Die transgenen Pflanzen zeichnen sich in der Regel durch besondere vorteilhafte Eigenschaften aus, beispielsweise durch Resistenzen gegenüber bestimmten Pestiziden, vor allem bestimmten
Herbiziden, Resistenzen gegenüber Pflanzenkrankheiten oder Erregern von Pflanzenkrankheiten wie bestimmten Insekten oder Mikroorganismen wie Pilzen, Bakterien oder Viren. Andere besondere Eigenschaften betreffen z.B. das Erntegut hinsichtlich Menge, Qualität, Lagerfähigkeit,
Zusammensetzung und spezieller Inhaltsstoffe. So sind transgene Pflanzen mit erhöhtem Stärkegehalt oder veränderter Qualität der Stärke oder solche mit anderer Fettsäurezusammensetzung des Ernteguts bekannt. Weitere besondere Eigenschaften können in einer Toleranz oder Resistenz gegen abiotische Stressoren z.B. Hitze, Kälte, Trockenheit, Salz und ultraviolette Strahlung liegen.
Bevorzugt ist die Anwendung der erfindungsgemäßen Verbindungen der allgemeinen Formel (I) oder deren Salze in wirtschaftlich bedeutenden transgenen Kulturen von Nutz-und Zierpflanzen, z.B. von Getreide wie Weizen, Gerste, Roggen, Hafer, Triticale, Hirse, Reis, Maniok und Mais oder auch Kulturen von Zuckerrübe, Baumwolle, Soja, Raps, Kartoffel, Tomate, Erbse und anderen Gemüsesorten.
Vorzugsweise können die Verbindungen der allgemeinen Formel (I) als Herbizide in Nutzpflanzenkulturen eingesetzt werden, welche gegenüber den phytotoxischen Wirkungen der Herbizide resistent sind bzw. gentechnisch resistent gemacht worden sind. Herkömmliche Wege zur Herstellung neuer Pflanzen, die im Vergleich zu bisher vorkommenden Pflanzen modifizierte Eigenschaften aufweisen, bestehen beispielsweise in klassischen
Züchtungsverfahren und der Erzeugung von Mutanten. Alternativ können neue Pflanzen mit veränderten Eigenschaften mit Hilfe gentechnischer Verfahren erzeugt werden. Zahlreiche molekularbiologische Techniken, mit denen neue transgene Pflanzen mit veränderten
Eigenschaften hergestellt werden können, sind dem Fachmann bekannt. Für derartige gentechnische Manipulationen können Nucleinsäuremoleküle in Plasmide eingebracht werden, die eine Mutagenese oder eine Sequenzveränderung durch Rekombination von DNA-Sequenzen erlauben. Mit Hilfe von Standardverfahren können z.B. Basenaustausche vorgenommen, Teilsequenzen entfernt oder natürliche oder synthetische Sequenzen hinzugefügt werden. Für die Verbindung der DNA-Fragmente untereinander können an die Fragmente Adaptoren oder Linker angesetzt werden.
Die Herstellung von Pflanzenzellen mit einer verringerten Aktivität eines Genprodukts kann beispielsweise erzielt werden durch die Expression mindestens einer entsprechenden antisense-RNA, einer sense-RNA zur Erzielung eines Cosuppressionseffektes oder die Expression mindestens eines entsprechend konstruierten Ribozyms, das spezifisch Transkripte des obengenannten Genprodukts spaltet.
Hierzu können zum einen DNA-Moleküle verwendet werden, die die gesamte codierende Sequenz eines Genprodukts einschließlich eventuell vorhandener flankierender Sequenzen umfassen, als auch DNA- Moleküle, die nur Teile der codierenden Sequenz umfassen, wobei diese Teile lang genug sein müssen, um in den Zellen einen antisense-Effekt zu bewirken. Möglich ist auch die Verwendung von DNA- Sequenzen, die einen hohen Grad an Homologie zu den codiereden Sequenzen eines Genprodukts aufweisen, aber nicht vollkommen identisch sind.
Bei der Expression von Nucleinsäuremolekülen in Pflanzen kann das synthetisierte Protein in jedem beliebigen Kompartiment der pflanzlichen Zelle lokalisiert sein. Um aber die Lokalisation in einem bestimmten Kompartiment zu erreichen, kann z.B. die codierende Region mit DNA-Sequenzen verknüpft werden, die die Lokalisierung in einem bestimmten Kompartiment gewährleisten. Derartige Sequenzen sind dem Fachmann bekannt (siehe beispielsweise Braun et al., EMBO J. 11 (1992), 3219- 3227). Die Expression der Nukleinsäuremoleküle kann auch in den Organellen der Pflanzenzellen stattfinden.
Die transgenen Pflanzenzellen können nach bekannten Techniken zu ganzen Pflanzen regeneriert werden. Bei den transgenen Pflanzen kann es sich prinzipiell um Pflanzen jeder beliebigen
Pflanzenspezies handeln, d.h. sowohl monokotyle als auch dikotyle Pflanzen.
So sind transgene Pflanzen erhältlich, die veränderte Eigenschaften durch Überexpression, Suppression oder Inhibierung homologer (= natürlicher) Gene oder Gensequenzen oder Expression heterologer (= fremder) Gene oder Gensequenzen aufweisen. Vorzugsweise können die erfindungsgemäßen Verbindungen der allgemeinen Formel (I) in transgenen Kulturen eingesetzt werden, welche gegen Wuchsstoffe, wie z.B. Dicamba oder gegen Herbizide, die essentielle Pflanzenenzyme, z.B. Acetolactatsynthasen (ALS), EPSP Synthasen, Glutaminsynthasen (GS) oder Hydoxyphenylpyruvat Dioxygenasen (HPPD) hemmen, respektive gegen Herbizide aus der Gruppe der Sulfonylharnstoffe, der Glyphosate, Glufosinate oder Benzoylisoxazole und analogen Wirkstoffe, resistent sind.
Bei der Anwendung der erfindungsgemäßen Verbindungen der allgemeinen Formel (I) in transgenen Kulturen treten neben den in anderen Kulturen zu beobachtenden Wirkungen gegenüber Schadpflanzen oftmals Wirkungen auf, die für die Applikation in der jeweiligen transgenen Kultur spezifisch sind, beispielsweise ein verändertes oder speziell erweitertes Unkrautspektrum, das bekämpft werden kann, veränderte Aufwandmengen, die für die Applikation eingesetzt werden können, vorzugsweise gute Kombinierbarkeit mit den Herbiziden, gegenüber denen die transgene Kultur resistent ist, sowie Beeinflussung von Wuchs und Ertrag der transgenen Kulturpflanzen. Gegenstand der Erfindung ist deshalb auch die Verwendung der erfindungsgemäßen Verbindungen der allgemeinen Formel (I) und/oder deren Salze als Herbizide zur Bekämpfung von Schadpflanzen in Kulturen von Nutz- oder Zierpflanzen, gegebenenfalls in transgenen Kulturpflanzen.
Bevorzugt ist die Verwendung von Verbindungen der allgemeinen Formel (I) in Getreide, dabei vorzugsweise Mais, Weizen, Gerste, Roggen, Hafer, Hirse, oder Reis, im Vor- oder Nachauflauf.
Bevorzugt ist auch die Verwendung von Verbindungen der allgemeinene Formel (I) in Soja im Voroder Nachauflauf.
Die Verwendung erfindungsgemäßer Verbindungen der Formel (I) zur Bekämpfung von Schadpflanzen oder zur Wachstumsregulierung von Pflanzen schließt auch den Fall ein, bei dem einer Verbindung der
allgemeinen Formel (I) oder deren Salz erst nach der Ausbringung auf der Pflanze, in der Pflanze oder im Boden aus einer Vorläufersubstanz ("Prodrug") gebildet wird.
Gegenstand der Erfindung ist auch die Verwendung einer oder mehrerer Verbindungen der allgemeinen Formel (I) oder deren Salzen bzw. eines erfindungsgemäßen Mittels (wie nachstehend definiert) (in einem Verfahren) zur Bekämpfung von Schadpflanzen oder zur Wachstumsregulierung von Pflanzen, dadurch gekennzeichnet, dass man eine wirksame Menge einer oder mehreren Verbindungen der allgemeinen Formel (I) oder deren Salzen auf die Pflanzen (Schadpflanzen, gegebenenfalls zusammen mit den Nutzpflanzen) Pflanzensamen, den Boden, in dem oder auf dem die Pflanzen wachsen, oder die Anbaufläche appliziert.
Gegenstand der Erfindung ist auch ein herbizides und/oder pfianzenwachstumsregulierendes Mittel, dadurch gekennzeichnet, dass das Mittel (a) eine oder mehrere Verbindungen der allgemeinen Formel (I) und/oder deren Salze enthält wie oben definiert, vorzugsweise in einer der als bevorzugt bzw. besonders bevorzugt gekennzeichneten
Ausgestaltung, insbesondere eine oder mehrere Verbindungen der Formeln
(1-001) bis (1-240) und/oder deren Salze, jeweils wie oben definiert,
und
(b) ein oder mehrere weitere Stoffe ausgewählt aus den Gruppen (i) und/oder (ii):
(i) ein oder mehrere weitere agrochemisch wirksame Stoffe, vorzugsweise ausgewählt aus der Gruppe bestehend aus Insektiziden, Akariziden, Nematiziden, weiteren Herbiziden (d.h. solche, die nicht der oben definierten allgemeinen Formel (I) entsprechen), Fungiziden, Safenern,
Düngemitteln und/oder weiteren Wachstumsregulatoren,
(ii) ein oder mehrere im Pflanzenschutz übliche Formulierungshilfsmittel. Die weiteren agrochemischen wirksamen Stoffe des Bestandteils (i) eines erfindungsgemäßen Mittels sind dabei vorzugsweise ausgewählt aus der Gruppe der Stoffe, die in "The Pesticide Manual", 16th edition, The British Crop Protection Council und the Royal Soc. of Chemistry, 2012 genannt sind.
Ein erfindungsgemäßes herbizides oder pfianzenwachstumsregulierendes Mittel, umfasst vorzugsweise ein, zwei, drei oder mehr im Pflanzenschutz übliche Formulierungshilfsmittel (ii) ausgewählt aus der Gruppe bestehend aus Tensiden, Emulgatoren, Dispergiermitteln, Filmbildnern, Verdickungsmitteln, anorganischen Salzen, Stäubemitteln, bei 25 °C und 1013 mbar festen Trägerstoffen, vorzugsweise
adsorptionsfähigen, granulierten Inertmaterialien, Netzmitteln, Antioxidationsmitteln, Stabilisatoren, Puffersubstanzen, Antischaummitteln, Wasser, organischen Lösungsmitteln, vorzugsweise bei 25 °C und 1013 mbar mit Wasser in jedem beliebigen Verhältnis mischbare organische Lösungsmittel. Die erfindungsgemäßen Verbindungen der allgemeinen Formel (I) können in Form von Spritzpulvern, emulgierbaren Konzentraten, versprühbaren Lösungen, Stäubemitteln oder Granulaten in den üblichen Zubereitungen angewendet werden. Gegenstand der Erfindung sind deshalb auch herbizide und pflanzenwachstumsregulierende Mittel, die Verbindungen der allgemeinen Formel (I) und/oder deren Salze enthalten.
Die erfindungsgemäßen Verbindungen der allgemeinen Formel (I) und/oder deren Salze können auf verschiedene Art formuliert werden, je nachdem welche biologischen und/oder chemisch-physikalischen Parameter vorgegeben sind. Als Formulierungsmöglichkeiten kommen beispielsweise in Frage:
Spritzpulver (WP), wasserlösliche Pulver (SP), wasserlösliche Konzentrate, emulgierbare Konzentrate (EC), Emulsionen (EW), wie Öl-in- Wasser- und Wasser-in-Öl-Emulsionen, versprühbare Lösungen, Suspensionskonzentrate (SC), Dispersionen auf Öl- oder Wasserbasis, ölmischbare Lösungen,
Kapselsuspensionen (CS), Stäubemittel (DP), Beizmittel, Granulate für die Streu- und
Bodenapplikation, Granulate (GR) in Form von Mikro-, Sprüh-, Aufzugs- und Adsorptionsgranulaten, wasserdispergierbare Granulate (WG), wasserlösliche Granulate (SG), ULV-Formulierungen,
Mikrokapseln und Wachse.
Diese einzelnen Formulierungstypen und die Formulierungshilfsmittel wie Inertmaterialien, Tenside, Lösungsmittel und weitere Zusatzstoffe sind dem Fachmann bekannt, und werden beispielsweise beschrieben in: Watkins, "Handbook of Insecticide Dust Diluents and Carriers", 2nd Ed., Darland Books, Caldwell N.J., H.v. Olphen, "Introduction to Clay Colloid Chemistry"; 2nd Ed., J. Wiley & Sons, N.Y.; C. Marsden, "Solvents Guide"; 2nd Ed., Interscience, N.Y. 1963; McCutcheon's "Detergents and Emulsifiers Annual", MC Publ. Corp., Ridgewood N.J.; Sisley and Wood, "Encyclopedia of Surface Active Agents", Chem. Publ. Co. Inc., N.Y. 1964; Schönfeldt, "Grenzflächenaktive
Äthylenoxidaddukte", Wiss. Verlagsgesellschaft, Stuttgart 1976; Winnacker-Küchler, "Chemische Technologie", Band 7, C. Hanser Verlag München, 4. Aufl. 1986.
Spritzpulver sind in Wasser gleichmäßig dispergierbare Präparate, die neben dem Wirkstoff außer einem Verdünnungs- oder Inertstoff noch Tenside ionischer und/oder nichtionischer Art (Netzmittel,
Dispergiermittel), z.B. polyoxyethylierte Alkylphenole, polyoxethylierte Fettalkohole, polyoxethylierte Fettamine, Fettalkoholpolyglykolethersulfate, Alkansulfonate, Alkylbenzolsulfonate, ligninsulfonsaures Natrium, 2,2'-dinaphthylmethan-6,6'-disulfonsaures Natrium, dibutylnaphthalin-sulfonsaures Natrium oder auch oleoylmethyltaurinsaures Natrium enthalten. Zur Herstellung der Spritzpulver werden die
herbiziden Wirkstoffe beispielsweise in üblichen Apparaturen wie Hammermühlen, Gebläsemühlen und Luftstrahlmühlen feingemahlen und gleichzeitig oder anschließend mit den Formulierungshilfsmitteln vermischt. Emulgierbare Konzentrate werden durch Auflösen des Wirkstoffes in einem organischen Lösungsmittel z.B. Butanol, Cyclohexanon, Dimethylformamid, Xylol oder auch höhersiedenden Aromaten oder Kohlenwasserstoffen oder Mischungen der organischen Lösungsmittel unter Zusatz von einem oder mehreren Tensiden ionischer und/oder nichtionischer Art (Emulgatoren) hergestellt. Als Emulgatoren können beispielsweise verwendet werden: Alkylarylsulfonsaure Calcium-Salze wie
Ca-dodecylbenzolsulfonat oder nichtionische Emulgatoren wie Fettsäurepolyglykolester,
Alkylarylpolyglykolether, Fettalkoholpolyglykolether, Propylenoxid-Ethylenoxid- Kondensationsprodukte, Alkylpolyether, Sorbitanester wie z.B. Sorbitanfettsäureester oder
Polyoxethylensorbitanester wie z.B. Polyoxyethylensorbitanfettsäureester. Stäubemittel erhält man durch Vermählen des Wirkstoffes mit fein verteilten festen Stoffen, z.B.
Talkum, natürlichen Tonen, wie Kaolin, Bentonit und Pyrophyllit, oder Diatomeenerde.
Suspensionskonzentrate können auf Wasser- oder Ölbasis sein. Sie können beispielsweise durch Naß-Vermahlung mittels handelsüblicher Perlmühlen und gegebenenfalls Zusatz von Tensiden, wie sie z.B. oben bei den anderen Formulierungstypen bereits aufgeführt sind, hergestellt werden.
Emulsionen, z.B. Öl-in- Wasser-Emulsionen (EW), lassen sich beispielsweise mittels Rührern,
Kolloidmühlen und/oder statischen Mischern unter Verwendung von wäßrigen organischen
Lösungsmitteln und gegebenenfalls Tensiden, wie sie z.B. oben bei den anderen Formulierungstypen bereits aufgeführt sind, herstellen.
Granulate können entweder durch Verdüsen des Wirkstoffes auf adsorptionsfähiges, granuliertes Inertmaterial hergestellt werden oder durch Aufbringen von Wirkstoffkonzentraten mittels Klebemitteln, z.B. Polyvinylalkohol, polyacrylsaurem Natrium oder auch Mineralölen, auf die Oberfläche von Trägerstoffen wie Sand, Kaolinite oder von granuliertem Inertmaterial. Auch können geeignete
Wirkstoffe in der für die Herstellung von Düngemittelgranulaten üblichen Weise - gewünschtenfalls in Mischung mit Düngemitteln - granuliert werden.
Wasserdispergierbare Granulate werden in der Regel nach den üblichen Verfahren wie Sprühtrocknung, Wirbelbett-Granulierung, Teller-Granulierung, Mischung mit Hochgeschwindigkeitsmischern und Extrusion ohne festes Inertmaterial hergestellt.
Zur Herstellung von Teller-, Fließbett-, Extruder- und Sprühgranulaten siehe z.B. Verfahren in "Spray- Drying Handbook" 3rd ed. 1979, G. Goodwin Ltd., London; J.E. Browning, "Agglomeration", Chemical and Engineering 1967, Seiten 147 ff; "Perry's Chemical Engineer's Handbook", 5th Ed., McGraw-Hill, New York 1973, S. 8-57.
Für weitere Einzelheiten zur Formulierung von Pflanzenschutzmitteln siehe z.B. G.C. Klingman, "Weed Control as a Science", John Wiley and Sons, Inc., New York, 1961, Seiten 81-96 und J.D. Freyer, S.A. Evans, "Weed Control Handbook", 5th Ed., Blackwell Scientific Publications, Oxford, 1968, Seiten 101-103.
Die agrochemischen Zubereitungen, vorzugsweise herbizide oder pflanzenwachstumsregulierende Mittel der vorliegenden Erfindung enthalten vorzugsweise eine Gesamtmenge von 0,1 bis 99 Gew.-%, bevorzugt 0,5 bis 95 Gew.- %, weiter bevorzugt 1 bis 90 Gew.- %, insbesondere bevorzugt 2 bis 80 Gew.-%, an Wirkstoffen der allgemeinen Formel (I) und deren Salzen.
In Spritzpulvern beträgt die Wirkstoffkonzentration z.B. etwa 10 bis 90 Gew.-%, der Rest zu 100 Gew.-% besteht aus üblichen Formulierungsbestandteilen. Bei emulgierbaren Konzentraten kann die Wirkstoffkonzentration etwa 1 bis 90, vorzugsweise 5 bis 80 Gew.-% betragen. Staubförmige
Formulierungen enthalten 1 bis 30 Gew.-% Wirkstoff, vorzugsweise meistens 5 bis 20 Gew.-% an Wirkstoff, versprühbare Lösungen enthalten etwa 0,05 bis 80, vorzugsweise 2 bis 50 Gew.-% Wirkstoff. Bei wasserdispergierbaren Granulaten hängt der Wirkstoffgehalt zum Teil davon ab, ob die wirksame Verbindung flüssig oder fest vorliegt und welche Granulierhilfsmittel, Füllstoffe usw. verwendet werden. Bei den in Wasser dispergierbaren Granulaten liegt der Gehalt an Wirkstoff beispielsweise zwischen 1 und 95 Gew.-%, vorzugsweise zwischen 10 und 80 Gew.-%.
Daneben enthalten die genannten Wirkstofformulierungen gegebenenfalls die jeweils üblichen Haft-, Netz-, Dispergier-, Emulgier-, Penetrations-, Konservierungs-, Frostschutz- und Lösungsmittel, Füll-, Träger- und Farbstoffe, Entschäumer, Verdunstungshemmer und den pH- Wert und die Viskosität beeinflussende Mittel. Beispiele für Formulierungshilfsmittel sind unter anderem in "Chemistry and Technology of Agrochemical Formulations", ed. D. A. Knowles, Kluwer Academic Publishers (1998) beschrieben.
Die erfindungsgemäßen Verbindungen der allgemeinen Formel (I) oder deren Salze können als solche oder in Form ihrer Zubereitungen (Formulierungen) mit anderen pestizid wirksamen Stoffen, wie z.B. Insektiziden, Akariziden, Nematiziden, Herbiziden, Fungiziden, Safenern, Düngemitteln und/oder Wachstumsregulatoren kombiniert eingesetzt werden, z.B. als Fertigformulierung oder als
Tankmischungen. Die Kombinationsformulierungen können dabei auf Basis der obengenannten
Formulierangen hergestellt werden, wobei die physikalischen Eigenschaften und Stabilitäten der zu kombinierenden Wirkstoffe zu berücksichtigen sind.
Als Kombinationspartner für die erfindungsgemäßen Verbindungen der allgemeinen Formel (I) in Mischungsformulierangen oder im Tank-Mix sind beispielsweise bekannte Wirkstoffe, die auf einer Inhibition von beispielsweise Acetolactat-Synthase, Acetyl-CoA-Carboxylase, Cellulose-Synthase, Enolpyravylshikimat-3-phosphat-Synthase, Glutamin-Synthetase, p-Hydroxyphenylpyravat- Dioxygenase, Phytoendesaturase, Photosystem I, Photosystem II, Protoporphyrinogen-Oxidase berahen, einsetzbar, wie sie z.B. in Weed Research 26 (1986) 441-445 oder "The Pesticide Manual", 16th edition, The British Crop Protection Council and the Royal Soc. of Chemistry, 2012 und der dort zitierten Literatur beschrieben sind.
Von besonderem Interesse ist die selektive Bekämpfung von Schadpflanzen in Kulturen von Nutz- und Zierpflanzen. Obgleich die erfindungsgemäßen Verbindungen der allgemeinen Formel (I) bereits in vielen Kulturen sehr gute bis ausreichende Selektivität aufweisen, können prinzipiell in einigen Kulturen und vor allem auch im Falle von Mischungen mit anderen Herbiziden, die weniger selektiv sind, Phytotoxizitäten an den Kulturpflanzen auftreten. Diesbezüglich sind Kombinationen
erfindungsgemäßer Verbindungen (I) von besonderem Interesse, welche die Verbindungen der allgemeinen Formel (I) bzw. deren Kombinationen mit anderen Herbiziden oder Pestiziden und Safenern enthalten. Die Safener, welche in einem antidotisch wirksamen Gehalt eingesetzt werden, reduzieren die phytotoxischen Nebenwirkungen der eingesetzten Herbizide/Pestizide, z.B. in wirtschaftlich bedeutenden Kulturen wie Getreide (Weizen, Gerste, Roggen, Mais, Reis, Hirse), Zuckerrübe, Zuckerrohr, Raps, Baumwolle und Soja, vorzugsweise Getreide. Die Gewichtsverhältnisse von Herbizid(mischung) zu Safener hängt im Allgemeinen von der
Aufwandmenge an Herbizid und der Wirksamkeit des jeweiligen Safeners ab und kann innerhalb weiter Grenzen variieren, beispielsweise im Bereich von 200: 1 bis 1 :200, vorzugsweise 100: 1 bis 1 : 100, insbesondere 20: 1 bis 1 :20. Die Safener können analog den Verbindungen der allgemeinen Formel (I) oder deren Mischungen mit weiteren Herbiziden/Pestiziden formuliert werden und als
Fertigformulierang oder Tankmischung mit den Herbiziden bereitgestellt und angewendet werden.
Zur Anwendung werden die in handelsüblicher Form vorliegenden Herbizid- oder Herbizid- Safener- Formulierangen gegebenenfalls in üblicher Weise verdünnt z.B. bei Spritzpulvern, emulgierbaren Konzentraten, Dispersionen und wasserdispergierbaren Granulaten mittels Wasser. Staubförmige Zubereitungen, Boden- bzw. Streugranulate sowie versprühbare Lösungen werden vor der Anwendung üblicherweise nicht mehr mit weiteren inerten Stoffen verdünnt.
Äußere Bedingungen wie Temperatur, Feuchtigkeit etc. beeinflussen zu einem gewissen Teil die Aufwandmenge der Verbindungen der allgemeinen Formel (I) und/oder deren Salze. Die
Aufwandmenge kann dabei innerhalb weiter Grenzen variieren. Für die Anwendung als Herbizid zur Bekämpfung von Schadpflanzen liegt die Gesamtmenge an Verbindungen der allgemeinen Formel (I) und deren Salze vorzugsweise im Bereich von 0,001 bis 10,0 kg/ha, bevorzugt im Bereich von 0,005 bis 5 kg/ha, weiter bevorzugt im Bereich von 0,01 bis 1,5 kg/ha, insbesondere bevorzugt im Bereich von 0,05 bis 1 kg/ha. Dies gilt sowohl für die Anwendung im Vorauflauf oder im Nachauflauf.
Bei der Anwendung von erfindungsgemäßen Verbindungen der allgemeinen Formel (I) und/oder deren Salzen als Pflanzenwachstumsregulator, beispielsweise als Halmverkürzer bei Kulturpflanzen, wie sie oben genannt worden sind, vorzugsweise bei Getreidepflanzen wie Weizen, Gerste, Roggen, Triticale, Hirse, Reis oder Mais, liegt die Gesamt- Aufwandmenge vorzugsweise im Bereich von 0,001 bis 2 kg/ha, vorzugsweise im Bereich von 0,005 bis 1 kg/ha, insbesondere im Bereich von 10 bis 500 g/ha, ganz besonders bevorzugt im Bereich von 20 bis 250 g/ha. Dies gilt sowohl für die Anwendung im
Vorauflauf oder im Nachauflauf.
Die Applikation als Halmverkürzer kann in verschiedenen Stadien des Wachstums der Pflanzen erfolgen. Bevorzugt ist beispielsweise die Anwendung nach der Bestückung am Beginn des
Längenwachstums .
Alternativ kommt bei der Anwendung als Pflanzenwachstumsregulator auch die Behandlung des Saatguts in Frage, welche die unterschiedlichen Saatgutbeiz- und Beschichtungstechniken einschließt. Die Aufwandmenge hängt dabei von den einzelnen Techniken ab und kann in Vorversuchen ermittelt werden.
Als Kombinationspartner für die erfindungsgemäßen Verbindungen der allgemeinen Formel (I) in erfindungsgemäßen Mitteln (z.B. Mischungsformulierungen oder im Tank-Mix) sind beispielsweise bekannte Wirkstoffe, die auf einer Inhibition von beispielsweise Acetolactat-Synthase, Acetyl-CoA- Carboxylase, Cellulose-Synthase, Enolpyruvylshikimat-3-phosphat-Synthase, Glutamin-Synthetase, p- Hydroxyphenylpyruvat-Dioxygenase, Phytoendesaturase, Photosystem I, Photosystem II oder
Protoporphyrinogen-Oxidase beruhen, einsetzbar, wie sie z.B. aus Weed Research 26 (1986) 441-445 oder "The Pesticide Manual", 16th edition, The British Crop Protection Council und the Royal Soc. of Chemistry, 2012 und dort zitierter Literatur beschrieben sind. Nachfolgend werden beispielhaft bekannte Herbizide oder Pflanzenwachstumsregulatoren genannt, die mit den erfindungsgemäßen Verbindungen kombiniert werden können, wobei diese Wirkstoffe entweder mit ihrem "common name" in der englischsprachigen Variante gemäß International Organization for Standardization (ISO) oder mit dem chemischen Namen bzw. mit der Codenummer bezeichnet sind. Dabei sind stets sämtliche
Anwendungsformen wie beispielsweise Säuren, Salze, Ester sowie auch alle isomeren Formen wie Stereoisomere und optische Isomere umfaßt, auch wenn diese nicht explizit erwähnt sind.
Beispiele für solche herbiziden Mischungspartner sind:
Acetochlor, acifluorfen, acifluorfen-sodium, aclonifen, alachlor, allidochlor, alloxydim, alloxydim- sodium, ametryn, amicarbazone, amidochlor, amidosulfuron, 4-amino-3-chloro-6-(4-chloro-2-fluoro-3- methylphenyl)-5-fluoropyridine-2-carboxylic acid, aminocyclopyrachlor, aminocyclopyrachlor- potassium, aminocyclopyrachlor-methyl, aminopyralid, amitrole, ammoniumsulfamate, anilofos, asulam, atrazine, azafenidin, azimsulfuron, beflubutamid, benazolin, benazolin-ethyl, benfluralin, benfuresate, bensulfuron, bensulfuron-methyl, bensulide, bentazone, benzobicyclon, benzofenap, bicyclopyron, bifenox, bilanafos, bilanafos-sodium, bispyribac, bispyribac-sodium, bromacil, bromobutide, bromofenoxim, bromoxynil, bromoxynil-butyrate, -potassium, -heptanoate und -octanoate, busoxinone, butachlor, butafenacil, butamifos, butenachlor, butralin, butroxydim, butylate, cafenstrole, carbetamide, carfentrazone, carfentrazone-ethyl, chloramben, chlorbromuron, chlorfenac, chlorfenac- sodium, chlorfenprop, chlorflurenol, chlorflurenol-methyl, chloridazon, chlorimuron, chlorimuron-ethyl, chlorophthalim, chlorotoluron, chlorthal-dimethyl, chlorsulfuron, cinidon, cinidon-ethyl, cinmethylin, cinosulfuron, clacyfos, clethodim, clodinafop, clodinafop-propargyl, clomazone, clomeprop, clopyralid, cloransulam, cloransulam-methyl, cumyluron, cyanamide, cyanazine, cycloate, cyclopyrimorate, cyclosulfamuron, cycloxydim, cyhalofop, cyhalofop-butyl, cyprazine, 2,4-D, 2,4-D-butotyl, -butyl, - dimethylammonium, -diolamin, -ethyl, 2-ethylhexyl, -isobutyl, -isooctyl, -isopropylammonium, - potassium, -triisopropanolammonium und -trolamine, 2,4-DB, 2,4-DB-butyl, -dimethylammonium, isooctyl, -potassium und -sodium, daimuron (dymron), dalapon, dazomet, n-decanol, desmedipham, detosyl-pyrazolate (DTP), dicamba, dichlobenil, 2-(2,4-dichlorobenzyl)-4,4-dimethyl-l,2-oxazolidin-3- one, 2-(2,5-dichlorobenzyl)-4,4-dimethyl-l,2-oxazolidin-3-one, dichlorprop, dichlorprop-P, diclofop, diclofop-methyl, diclofop-P-methyl, diclosulam, difenzoquat, diflufenican, diflufenzopyr, diflufenzopyr- sodium, dimefuron, dimepiperate, dimethachlor, dimethametryn, dimethenamid, dimethenamid-P, dimetrasulfuron, dinitramine, dinoterb, diphenamid, diquat, diquat-dibromid, dithiopyr, diuron, DNOC, endothal, EPTC, esprocarb, ethalfluralin, ethametsulfuron, ethametsulfuron-methyl, ethiozin, ethofumesate, ethoxyfen, ethoxyfen- ethyl, ethoxysulfuron, etobenzanid, F-9600, F-5231, i.e. N-[2- Chlor-4-fluor-5-[4-(3-fluorpropyl)-4,5-dihydro-5-oxo-lH-tetrazol-l-yl]-phenyl]-ethansulfonamid, F- 7967, i.e. 3-[7-Chlor-5-fluor-2-(trifluormethyl)-lH-benzimidazol-4-yl]-l-methyl-6- (trifluormethyl)pyrimidin-2,4(lH,3H)-dion, fenoxaprop, fenoxaprop-P, fenoxaprop-ethyl, fenoxaprop-P- ethyl, fenoxasulfone, fenquinotrione, fentrazamide, flamprop, flamprop-M-isopropyl, flamprop-M- methyl, flazasulfuron, florasulam, fluazifop, fluazifop-P, fluazifop-butyl, fluazifop-P-butyl,
flucarbazone, flucarbazone-sodium, flucetosulfuron, fluchloralin, flufenacet, flufenpyr, flufenpyr-ethyl, flumetsulam, flumiclorac, flumiclorac-pentyl, flumioxazin, fluometuron, flurenol, flurenol-butyl, - dimethylammonium und -methyl, fluoroglycofen, fluoroglycofen-ethyl, flupropanate, flupyrsulfuron,
flupyrsulfüron-methyl-sodium, fluridone, flurochloridone, fluroxypyr, fluroxypyr-meptyl, flurtamone, fluthiacet, fluthiacet-methyl, fomesafen, fomesafen-sodium, forarnsulfuron, fosamine, glufosinate, glufosinate-ammonium, glufosinate-P-sodium, glufosinate-P-ammonium, glufosinate-P-sodium, glyphosate, glyphosate-ammonium, -isopropylammonium, -diammonium, -dimethylammonium, - potassium, -sodium und -trimesium, H-9201, i.e. 0-(2,4-Dimethyl-6-nitrophenyl)-0-ethyl- isopropylphosphoramidothioat, halauxifen, halauxifen-methyl, halosafen, halosulfuron, halosulfuron- methyl, haloxyfop, haloxyfop-P, haloxyfop-ethoxyethyl, haloxyfop-P-ethoxyethyl, haloxyfop-methyl, haloxyfop-P-methyl, hexazinone, HW-02, i.e. l-(Dimethoxyphosphoryl)-ethyl-(2,4- dichlorphenoxy)acetat, imazamethabenz, Imazamethabenz-methyl, imazamox, imazamox-ammonium, imazapic, imazapic-ammonium, imazapyr, imazapyr-isopropylammonium, imazaquin, imazaquin- ammonium, imazethapyr, imazethapyr-immonium, imazosulfuron, indanofan, indaziflam, iodosulfuron, iodosulfuron-methyl-sodium, ioxynil, ioxynil-octanoate, -potassium und sodium, ipfencarbazone, isoproturon, isouron, isoxaben, isoxaflutole, karbutilate, KUH-043, i.e. 3-({[5-(Difluormethyl)-l - methyl-3-(trifluormethyl)- 1 H-pyrazol-4-yl]methyl} sulfonyl)-5,5-dimethyl-4,5-dihydro- 1 ,2-oxazol, ketospiradox, lactofen, lenacil, linuron, MCPA, MCPA-butotyl, -dimethylammonium, -2-ethylhexyl, - isopropylammonium, -potassium und -sodium, MCPB, MCPB-methyl, -ethyl und -sodium, mecoprop, mecoprop-sodium, und -butotyl, mecoprop-P, mecoprop-P-butotyl, -dimethylammonium, -2-ethylhexyl und -potassium, mefenacet, mefluidide, mesosulfuron, mesosulfuron-methyl, mesotrione,
methabenzthiazuron, metam, metamifop, metamitron, metazachlor, metazosulfuron,
methabenzthiazuron, methiopyrsulfuron, methiozolin, methyl isothiocyanate, metobromuron, metolachlor, S-metolachlor, metosulam, metoxuron, metribuzin, metsulfuron, metsulfuron-methyl, molinat, monolinuron, monosulfuron, monosulfuron-ester, MT-5950, i.e. N-[3-chlor-4-(l-methylethyl)- phenyl]-2-methylpentanamid, NGGC-011, napropamide, NC-310, i.e. 4-(2,4-Dichlorbenzoyl)-l-methyl- 5-benzyloxypyrazol, neburon, nicosulfuron, nonanoic acid (Pelargonsäure), norflurazon, oleic acid (fatty acids), orbencarb, orthosulfamuron, oryzalin, oxadiargyl, oxadiazon, oxasulfuron, oxaziclomefon, oxyfluorfen, paraquat, paraquat dichloride, pebulate, pendimethalin, penoxsulam, pentachlorphenol, pentoxazone, pethoxamid, petroleum oils, phenmedipham, picloram, picolinafen, pinoxaden, piperophos, pretilachlor, primisulfuron, primisulfuron-methyl, prodiamine, profoxydim, prometon, prometryn, propachlor, propanil, propaquizafop, propazine, propham, propisochlor, propoxycarbazone, propoxycarbazone-sodium, propyrisulfuron, propyzamide, prosulfocarb, prosulfuron, pyraclonil, pyraflufen, pyraflufen- ethyl, pyrasulfotole, pyrazolynate (pyrazolate), pyrazosulfuron, pyrazosulfuron- ethyl, pyrazoxyfen, pyribambenz, pyribambenz-isopropyl, pyribambenz-propyl, pyribenzoxim, pyributicarb, pyridafol, pyridate, pyriftalid, pyriminobac, pyriminobac-methyl, pyrimisulfan, pyrithiobac, pyrithiobac-sodium, pyroxasulfone, pyroxsulam, quinclorac, quinmerac, quinoclamine, quizalofop, quizalofop-ethyl, quizalofop-P, quizalofop-P-ethyl, quizalofop-P-tefuryl, rimsulfuron, saflufenacil, sethoxydim, siduron, simazine, simetryn, SL-261, sulcotrion, sulfentrazone, sulfometuron, sulfometuron-methyl, sulfosulfuron, , SYN-523, SYP-249, i.e. l-Ethoxy-3-methyl-l-oxobut-3-en-2-yl-
5-[2-chlor-4-(trifluormethyl)phenoxy]-2-nitrobenzoat, SYP-300, i.e. l-[7-Fluor-3-oxo-4-(prop-2-in-l- yl)-3,4-dihydro-2H-l,4-benzoxazin-6-yl]-3-propyl-2-thioxoimidazolidin-4,5-dion, 2,3,6-TBA, TCA (Trifluoressigsäure), TCA-sodium, tebuthiuron, tefuryltrione, tembotrione, tepraloxydim, terbacil, terbucarb, terbumeton, terbuthylazin, terbutryn, thenylchlor, thiazopyr, thiencarbazone, thiencarbazone- methyl, thifensulfuron, thifensulfuron-methyl, thiobencarb, tiafenacil, tolpyralate, topramezone, tralkoxydim, triafamone, tri-allate, triasulfuron, triaziflam, tribenuron, tribenuron-methyl, triclopyr, trietazine, trifloxysulfuron, trifloxysulfuron-sodium, trifludimoxazin, trifluralin, triflusulfuron, triflusulfuron-methyl, tritosulfuron, urea sulfate, vemolate, XDE-848, ZJ-0862, i.e. 3,4-Dichlor-N- {2- [(4,6-dimethoxypyrimidin-2-yl)oxy]benzyl}anilin, sowie die folgenden Verbindungen:
Beispiele für Pflanzenwachstumsregulatoren als mögliche Mischungspartner sind:
Acibenzolar, acibenzolar-S-methyl, 5-Aminolävulinsäure, ancymidol, 6-benzylaminopurine,
Brassinolid, Catechin, chlormequat chloride, cloprop, cyclanilide, 3-(Cycloprop-l-enyl)propionsäure, daminozide, dazomet, n-decanol, dikegulac, dikegulac-sodium, endothal, endothal- dipotassium, -disodium, und mono(N,N-dimethylalkylammonium), ethephon, flumetralin, flurenol, flurenol-butyl, flurprimidol, forchlorfenuron, gibberellic acid, inabenfide, indol-3-acetic acid (IAA), 4- indol-3-ylbutyric acid, isoprothiolane, probenazole, Jasmonsäure, Jasmonsäuremethylester, maleic hydrazide, mepiquat chloride, 1 -methylcyclopropene, 2-(l-naphthyl)acetamide, 1 -naphthylacetic acid, 2- naphthyloxyacetic acid, nitrophenolate-mixture, 4-0x0-4 [(2 -phenylethyl)amino]buttersäure, paclobutrazol, N-phenylphthalamic acid, prohexadione, prohexadione-calcium, prohydrojasmone, Salicylsäure, Strigolacton, tecnazene, thidiazuron, triacontanol, trinexapac, trinexapac-ethyl, tsitodef, uniconazole, uniconazole-P.
Ebenfalls als Kombinationspartner für die erfindungsgemäßen Verbindungen der allgemeinen Formel (I) kommen beispielsweise die folgenden Safener in Frage:
Verbindungen aus der Gruppe heterocyclischer Carbonsäurederivate:
Verbindungen vom Typ der Dichlorphenylpyrazolin-3-carbonsäure (Sla), vorzugsweise
Verbindungen wie
l-(2,4-Dichlorphenyl)-5-(ethoxycarbonyl)-5-methyl-2-pyrazolin-3-carbonsäure,
1 -(2,4-Dichlorphenyl)-5-(ethoxycarbonyl)-5-methyl-2-pyrazolin-3-carbonsäureethylester (S 1 - 1 ) ("Mefenpyr-diethyl"), und verwandte Verbindungen, wie sie in der WO-A-91/07874 beschrieben sind;
Derivate der Dichlorphenylpyrazolcarbonsäure (Slb), vorzugsweise Verbindungen wie 1 -(2,4-Dichlorphenyl)-5-methylpyrazol-3 -carbonsäureethylester (S 1 -2),
l-(2,4-Dichlorphenyl)-5-isopropylpyrazol-3-carbonsäureethylester (Sl-3),
1 -(2,4-Dichlorphenyl)-5-(l , 1 -dimethyl-ethyl)pyrazol-3-carbonsäureethylester (Sl -4) und verwandte Verbindungen, wie sie in EP-A-333131 und EP-A-269806 beschrieben sind;
Derivate der l,5-Diphenylpyrazol-3-carbonsäure (Slc), vorzugsweise Verbindungen wie 1 -(2,4-Dichlorphenyl)-5-phenylpyrazol-3-carbonsäureethylester (S 1 -5),
l-(2-Chlorphenyl)-5-phenylpyrazol-3-carbonsäuremethylester (Sl-6) und verwandte
Verbindungen wie sie beispielsweise in der EP-A-268554 beschrieben sind;
Verbindungen vom Typ der Triazolcarbonsäuren (Sld), vorzugsweise Verbindungen wie Fenchlorazol(-ethylester), d.h. l-(2,4-Dichlorphenyl)-5-trichlormethyl-(lH)-l,2,4-triazol-3- carbonsäureethylester (Sl-7), und verwandte Verbindungen, wie sie in EP-A- 174562 und EP-A-346620 beschrieben sind;
Verbindungen vom Typ der 5-Benzyl- oder 5-Phenyl-2-isoxazolin-3- carbonsäure, oder der 5,5- Diphenyl-2-isoxazolin-3-carbonsäure(Sle), vorzugsweise Verbindungen wie
5-(2,4-Dichlorbenzyl)-2-isoxazolin-3 -carbonsäureethylester (Sl-8) oder
5-Phenyl-2-isoxazolin-3-carbonsäureethylester (Sl-9) und verwandte Verbindungen, wie sie in WO-A-91/08202 beschrieben sind, bzw. 5,5-Diphenyl-2-isoxazolin-carbonsäure (Sl-10) oder 5,5-Diphenyl-2-isoxazolin-3-carbonsäureethylester (Sl-11) ("Isoxadifen-ethyl")
oder -n-propylester (Sl-12) oder 5-(4-Fluorphenyl)-5-phenyl-2-isoxazolin-3-carbon- säureethylester (Sl-13), wie sie in der Patentanmeldung WO-A-95/07897 beschrieben sind. Verbindungen aus der Gruppe der 8-Chinolinoxyderivate (S2):
Verbindungen vom Typ der 8-Chinolinoxyessigsäure (S2a), vorzugsweise
(5 -Chlort ^-chinolinoxy)essij *säure-(l-methylhexyl)-ester ("Cloquintocet-mexyl") (S2-1),
(5 -Chlort ^-chinolinoxy)essij *säure-(l,3-dimethyl-but-l -yl)-ester (S2-2),
(5 -Chlort ^-chinolinoxy)essij *säure-4-allyl-oxy-butylester (S2-3),
(5 -Chlort ^-chinolinoxy)essij ^säure- 1 -allyloxy-prop-2-ylester (S2-4),
(5 -Chlort ^-chinolinoxy)essij jsäureethylester (S2-5),
(5 -Chlort ^-chinolinoxy)essij *säuremethylester (S2-6),
(5 -Chlort ^-chinolinoxy)essij jsäureallylester (S2-7),
(5-Chlor-8-chinolinoxy)essigsäure-2-(2-propyliden-iminoxy)-l-ethylester (S2-8),
(5-Chlor-8-chinolinoxy)essigsäure-2-oxo-prop-l -ylester (S2-9) und verwandte Verbindungen, wie sie in EP-A-86750, EP-A-94349 und EP-A-191736 oder EP-A-0 492 366 beschrieben sind, sowie (5-Chlor-8-chinolinoxy)essigsäure (S2-10), deren Hydrate und Salze, beispielsweise deren Lithium-, Natrium- Kalium-, Kalzium-, Magnesium-, Aluminium-, Eisen-, Ammonium-, quartäre Ammonium-, Sulfonium-, oder Phosphoniumsalze wie sie in der WO-A-2002/34048 beschrieben sind;
Verbindungen vom Typ der (5-Chlor-8-chinolinoxy)malonsäure (S2b), vorzugsweise
Verbindungen wie (5-Chlor-8-chinolinoxy)malonsäurediethylester,
(5-Chlor-8-chinolinoxy)malonsäurediallylester,
(5-Chlor-8-chinolinoxy)malonsäure-methyl-ethylester und verwandte Verbindungen, wie sie in EP-A-0 582 198 beschrieben sind.
S3) Wirkstoffe vom Typ der Dichloracetamide (S3), die häufig als Vorauflaufsafener
(bodenwirksame Safener) angewendet werden, wie z. B.
"Dichlormid" (N,N-Diallyl-2,2-dichloracetamid) (S3-1),
"R-29148" (3-Dichloracetyl-2,2,5-trimethyl-l,3-oxazolidin) der Firma Stauffer (S3-2), "R-28725" (3-Dichloracetyl-2,2,-dimethyl-l,3-oxazolidin) der Firma Stauffer (S3-3),
"Benoxacor" (4-Dichloracetyl-3,4-dihydro-3-methyl-2H-l,4-benzoxazin) (S3-4),
"PPG-1292" (N-Allyl-N-[(l,3-dioxolan-2-yl)-methyl]-dichloracetamid) der Firma PPG
Industries (S3-5),
"DKA-24" (N-Allyl-N-[(allylaminocarbonyl)methyl]-dichloracetamid) der Firma Sagro-Chem (S3-6),
"AD-67" oder "MON 4660" (3-Dichloracetyl-l-oxa-3-aza-spiro[4,5]decan) der Firma
Nitrokemia bzw. Monsanto (S3-7),
"TI-35" (1-Dichloracetyl-azepan) der Firma TRI-Chemical RT (S3-8),
"Diclonon" (Dicyclonon) oder "BAS145138" oder "LAB145138" (S3-9)
((RS)-l-Dichloracetyl-3,3,8a-trimethylperhydropyrrolo[l,2-a]pyrimidin-6-on) der Firma BASF, "Furilazol" oder "MON 13900" ((RS)-3-Dichloracetyl-5-(2-furyl)-2,2-dimethyloxazolidin) (S3-10), sowie dessen (R)-Isomer (S3-11).
S4) Verbindungen aus der Klasse der Acylsulfonamide (S4):
S4a) N-Acylsulfonamide der Formel (S4a) und deren Salze wie sie in der WO-A-97/45016
worin
RA1 (Ci-C6)Alkyl, (C3-C6)Cycloalkyl, wobei die 2 letztgenannten Reste durch VA
Substituenten aus der Gruppe Halogen, (Ci-C4)Alkoxy, (Ci-C6)Haloalkoxy und (Ci- C4)Alkylthio und im Falle cyclischer Reste auch durch (Ci-C4)Alkyl und
(Ci-C4)Haloalkyl substituiert sind;
RA2 Halogen, (Ci-C4)Alkyl, (Ci-C4)Alkoxy, CF3;
niA 1 oder 2;
VA ist 0, 1 , 2 oder 3 bedeuten;
Verbindungen vom Typ der 4-(Benzoylsulfamoyl)benzamide der Formel (S4b) und deren Salze,
worin
RB1, RB2 unabhängig voneinander Wasserstoff, (Ci-C6)Alkyl, (C3-C6)Cycloalkyl, (C3-
C6)Alkenyl, (C3-C6)Alkinyl,
RB 3 Halogen, (Ci-C4)Alkyl, (Ci-C4)Haloalkyl oder (Ci-C4)Alkoxy und
ms 1 oder 2 bedeuten,
z.B. solche worin
RB1 = Cyclopropyl, RB 2 = Wasserstoff und (RB3) = 2-OMe ist ("Cyprosulfamide", S4-1),
RB1 = Cyclopropyl, RB 2 = Wasserstoff und (RB3) = 5-Cl-2-OMe ist (S4-2),
RB1 = Ethyl, RB 2 = Wasserstoff und (RB3) = 2-OMe ist (S4-3),
RB1 = Isopropyl, RB 2 = Wasserstoff und (RB3) = 5-Cl-2-OMe ist (S4-4) und
RB1 = Isopropyl, RB 2 = Wasserstoff und (RB3) = 2-OMe ist (S4-5);
S4C) Verbindungen aus der Klasse der Benzoylsulfamoylphenylharnstoffe der Formel (S4C), wie sie
worin
Rc1, Rc unabhängig voneinander Wasserstoff, (Ci-Cg)Alkyl, (C3-Cg)Cycloalkyl, (C3-
C6)Alkenyl, (C3-C6)Alkinyl,
Rc Halogen, (Ci-C4)Alkyl, (Ci-C4)Alkoxy, CF3 und
1 oder 2 bedeuten;
beispielsweise
1 - [4-(N-2-Methoxybenzoylsulfamoyl)phenyl] -3 -methylharnstoff,
1 - [4-(N-2-Methoxybenzoylsulfamoyl)phenyl] -3 ,3 -dimethylharnstoff,
l-[4-(N-4,5-Dimethylbenzoylsulfamoyl)phenyl]-3-methylharnstoff;
Verbindungen vom Typ der N-Phenylsulfonylterephthalamide der Formel (S4d) und deren Salze,
worin
RD 4 Halogen, (Ci-C4)Alkyl, (Ci-C4)Alkoxy, CF3;
mD 1 oder 2;
RD 5 Wasserstoff, (Ci-C6)Alkyl, (C3-C6)Cycloalkyl, (C2-C6)Alkenyl, (C2-C6)Alkinyl, (C5-
Ce)Cycloalkenyl bedeutet.
S5) Wirkstoffe aus der Klasse der Hydroxyaromaten und der aromatisch-aliphatischen
Carbonsäurederivate (S5), z.B.
3,4,5-Triacetoxybenzoesäureethylester, 3,5-Dimethoxy-4-hydroxybenzoesäure, 3,5- Dihydroxybenzoesäure, 4-Hydroxysalicylsäure, 4-Fluorsalicyclsäure, 2-Hydroxyzimtsäure, 2,4- Dichlorzimtsäure, wie sie in der WO-A-2004/084631, WO-A-2005/015994, WO-A- 2005/016001 beschrieben sind.
S6) Wirkstoffe aus der Klasse der l,2-Dihydrochinoxalin-2-one (S6), z.B.
l-Methyl-3-(2-thienyl)-l,2-dihydrochinoxalin-2-on, l-Methyl-3-(2-thienyl)-l,2-dihydro- chinoxalin-2-thion, l-(2-Aminoethyl)-3-(2-thienyl)-l,2-dihydro-chinoxalin-2-on-hydrochlorid, l-(2-Methylsulfonylaminoethyl)-3-(2-thienyl)-l,2-dihydro-chinoxalin-2-on, wie sie in der WO- A-2005/112630 beschrieben sind.
S7) Verbindungen aus der Klasse der Diphenylmethoxyessigsäurederivate (S7), z.B.
Diphenylmethoxyessigsäuremethylester (CAS-Reg.Nr. 41858-19-9) (S7-1),
Diphenylmethoxyessigsäureethylester oder Diphenylmethoxyessigsäure wie sie in der WO-A- 98/38856 beschrieben sind.
S8) Verbindungen der Formel (S8), wie sie in der WO-A-98/27049 beschrieben sind,
worin die Symbole und Indizes folgende Bedeutungen haben:
RD
1 ist Halogen, (Ci-C
4)Alkyl, (Ci-C
4)Haloalkyl, (Ci-C
4)Alkoxy, (Ci-C
4)Haloalkoxy, RD
2 ist Wasserstoff oder (Ci-C
4)Alkyl,
3
R D ist Wasserstoff, (Ci-Cg)Alkyl, (C2-C4)Alkenyl, (C2-C4)Alkinyl, oder Aryl, wobei jeder der vorgenannten C-haltigen Reste unsubstituiert oder durch einen oder mehrere, vorzugsweise bis zu drei gleiche oder verschiedene Reste aus der Gruppe, bestehend aus Halogen und Alkoxy substituiert ist; oder deren Salze,
nD ist eine ganze Zahl von 0 bis 2.
S9) Wirkstoffe aus der Klasse der 3-(5-Tetrazolylcarbonyl)-2-chinolone (S9), z.B.
1 ,2-Dihydro-4-hydroxy- 1 -ethyl-3-(5-tetrazolylcarbonyl)-2-chinolon (CAS-Reg.Nr. : 219479- 18-
2), l,2-Dihydro-4-hydroxy-l-methyl-3-(5-tetrazolyl-carbonyl)-2-chinolon (CAS-Reg.Nr.
95855-00-8), wie sie in der WO-A- 1999/000020 beschrieben sind.
S10) Verbindungen der Formeln (S10a) oder (S10b),
wie sie in der WO-A-2007/023719 und WO-A-2007/023764 beschrieben sind,
(S10A) (S10B)
worin
RE1 Halogen, (Ci-C4)Alkyl, Methoxy, Nitro, Cyano, CF3, OCF3
YE, ZE unabhängig voneinander O oder S,
nE eine ganze Zahl von 0 bis 4,
RE2 (Ci-Ci6)Alkyl, (C2-C6)Alkenyl, (C3-C6)Cycloalkyl, Aryl; Benzyl, Halogenbenzyl,
RE3 Wasserstoff oder (Ci-Ce)Alkyl bedeuten.
Si l) Wirkstoffe vom Typ der Oxyimino- Verbindungen (Si l), die als Saatbeizmittel bekannt sind, wie z. B.
"Oxabetrinil" ((Z)-l,3-Dioxolan-2-ylmethoxyimino(phenyl)acetonitril) (Sl 1-1), das als Saatbeiz-Safener für Hirse gegen Schäden von Metolachlor bekannt ist,
"Fluxofenim" (l-(4-Chlorphenyl)-2,2,2-trifluor-l-ethanon-0-(l,3-dioxolan-2-ylmethyl)-oxim) (Sl 1-2), das als Saatbeiz-Safener für Hirse gegen Schäden von Metolachlor bekannt ist, und "Cyometrinil" oder "CGA-43089" ((Z)-Cyanomethoxyimino(phenyl)acetonitril) (Sl l-3), das als Saatbeiz-Safener für Hirse gegen Schäden von Metolachlor bekannt ist.
S12) Wirkstoffe aus der Klasse der Isothiochromanone (S12), wie z.B. Methyl- [(3 -oxo-lH-2- benzothiopyran-4(3H)-yliden)methoxy]acetat (CAS-Reg.Nr. 205121-04-6) (S12-1) und verwandte Verbindungen aus WO-A-1998/13361.
Eine oder mehrere Verbindungen aus Gruppe (S13):
"Naphthalic anhydrid" (1 ,8-Naphthalindicarbonsäureanhydrid) (S13-1), das als Saatbeiz-Safener für Mais gegen Schäden von Thiocarbamatherbiziden bekannt ist,
"Fenclorim" (4,6-Dichlor-2-phenylpyrimidin) (S13-2), das als Safener für Pretilachlor in gesätem Reis bekannt ist,
"Flurazole" (Benzyl-2-chlor-4-trifluormethyl-l ,3-thiazol-5-carboxylat) (S 13-3), das als Saatbeiz-Safener für Hirse gegen Schäden von Alachlor und Metolachlor bekannt ist,
"CL 304415" (CAS-Reg.Nr. 31541 -57-8)
(4-Carboxy-3,4-dihydro-2H-l -benzopyran-4-essigsäure) (S13-4) der Firma American
Cyanamid, das als Safener für Mais gegen Schäden von Imidazolinonen bekannt ist,
"MG 191 " (CAS-Reg.Nr. 96420-72-3) (2-Dichlormethyl-2-methyl-l ,3-dioxolan) (S13-5) der Firma Nitrokemia, das als Safener für Mais bekannt ist,
"MG 838" (CAS-Reg.Nr. 133993-74-5)
(2-propenyl l -oxa-4-azaspiro[4.5]decan-4-carbodithioat) (S13-6) der Firma Nitrokemia "Disulfoton" (0,0-Diethyl S-2-ethylthioethyl phosphordithioat) (S13-7),
"Dietholate" (0,0-Diethyl-O-phenylphosphorothioat) (S 13-8),
"Mephenate" (4-Chlorphenyl-methylcarbamat) (S 13-9).
S 14) Wirkstoffe, die neben einer herbiziden Wirkung gegen Schadpflanzen auch Safenerwirkung an Kulturpflanzen wie Reis aufweisen, wie z. B.
"Dimepiperate" oder "MY-93" (S-\ -Methyl- 1 -phenylethyl-piperidin-l -carbothioat), das als Safener für Reis gegen Schäden des Herbizids Molinate bekannt ist,
"Daimuron" oder "SK 23" (l -(l -Methyl-l -phenylethyl)-3-p-tolyl-harnstoff), das als Safener für Reis gegen Schäden des Herbizids Imazosulfuron bekannt ist,
"Cumyluron" = "JC-940" (3-(2-Chlorphenylmethyl)-l -(l -methyl-l -phenyl-ethyl)harnstoff, siehe JP-A-60087270), das als Safener für Reis gegen Schäden einiger Herbizide bekannt ist, "Methoxyphenon" oder "NK 049" (3,3'-Dimethyl-4-methoxy-benzophenon), das als Safener für Reis gegen Schäden einiger Herbizide bekannt ist,
"CSB" (l -Brom-4-(chlormethylsulfonyl)benzol) von Kumiai, (CAS-Reg.Nr. 54091 -06-4), das als Safener gegen Schäden einiger Herbizide in Reis bekannt ist.
S 15) Verbindungen der Formel (S 15) oder deren Tautomere,
wie sie in der WO-A-2008/131861 und WO-A-2008/131860 beschrieben sind,
worin
einen (Ci-C6)Haloalkylrest bedeutet und
Wasserstoff oder Halogen bedeutet und
, RH4 unabhängig voneinander Wasserstoff, (Ci-Ci6)Alkyl, (C2-Ci6)Alkenyl oder
(C2-Ci6)Alkinyl,
wobei jeder der letztgenannten 3 Reste unsubstituiert oder durch einen oder mehrere Reste aus der Gruppe Halogen, Hydroxy, Cyano, (Ci-C i)Alkoxy, (Ci-C i)Haloalkoxy, (Ci-C4)Alkylthio, (Ci-C4)Alkylamino, Di[(Ci-C4)alkyl]-amino, [(Ci-C4)Alkoxy]- carbonyl, [(Ci-C4)Haloalkoxy]-carbonyl, (C3-C6)Cycloalkyl, das unsubstituiert oder substituiert ist, Phenyl, das unsubstituiert oder substituiert ist, und Heterocyclyl, das unsubstituiert oder substituiert ist, substituiert ist,
oder (C3-C6)Cycloalkyl, (C4-C6)Cycloalkenyl, (C3-C6)Cycloalkyl, das an einer Seite des Rings mit einem 4 bis 6-gliedrigen gesättigten oder ungesättigten carbocyclischen Ring kondensiert ist, oder (C4-C6)Cycloalkenyl, das an einer Seite des Rings mit einem 4 bis 6-gliedrigen gesättigten oder ungesättigten carbocyclischen Ring kondensiert ist,
wobei jeder der letztgenannten 4 Reste unsubstituiert oder durch einen oder mehrere Reste aus der Gruppe Halogen, Hydroxy, Cyano, (Ci-C4)Alkyl, (Ci-C4)Haloalkyl, (Ci-C4)Alkoxy, (Ci-C4)Haloalkoxy, (Ci-C4)Alkylthio, (Ci-C4)Alkylamino, Di[(Ci- C4)alkyl]-amino, [(Ci-C4)Alkoxy]-carbonyl, [(Ci-C4)Haloalkoxy]-carbonyl, (C3-C6)Cycloalkyl, das unsubstituiert oder substituiert ist, Phenyl, das unsubstituiert oder substituiert ist, und Heterocyclyl, das unsubstituiert oder substituiert ist, substituiert ist,
bedeutet oder
(Ci-C4)-Alkoxy, (C2-C4)Alkenyloxy, (C2-C6)Alkinyloxy oder (C2-C4)Haloalkoxy bedeutet und
Wasserstoff oder (Ci-C4)-Alkyl bedeutet oder
und RH4 zusammen mit dem direkt gebundenen N-Atom einen vier- bis achtgliedrigen
heterocyclischen Ring, der neben dem N-Atom auch weitere Heteroringatome, vorzugsweise bis zu zwei weitere Heteroringatome aus der Gruppe N, O und S enthalten kann und der unsubstituiert oder durch einen oder mehrere Reste aus der Gruppe Halogen, Cyano, Nitro, (Ci-
C4)Alkyl, (Ci-C4)Haloalkyl, (Ci-C4)Alkoxy, (Ci-C4)Haloalkoxy und (Ci-C4)Alkylthio substituiert ist, bedeutet.
) Wirkstoffe, die vorrangig als Herbizide eingesetzt werden, jedoch auch Safenerwirkung auf
Kulturpflanzen aufweisen, z. B.
(2,4-Dichlorphenoxy)essigsäure (2,4-D),
(4-Chlorphenoxy)essigsäure,
(R,S)-2-(4-Chlor-o-tolyloxy)propionsäure (Mecoprop),
4-(2,4-Dichlorphenoxy)buttersäure (2,4-DB),
(4-Chlor-o-tolyloxy)essigsäure (MCPA),
4-(4-Chlor-o-tolyloxy)buttersäure,
4-(4-Chlorphenoxy)buttersäure,
3,6-Dichlor-2-methoxybenzoesäure (Dicamba),
1 -(Ethoxycarbonyl)ethyl-3,6-dichlor-2-methoxybenzoat (Lactidichlor- ethyl).
Bevorzugte Safener in Kombination mit den erfindungsgemäßen Verbindungend der allgemeinen Formel (I) und/oder deren Salze, insbesondere mit den Verbindungen der Formeln (1-1) bis (1-240) und/oder deren Salze sind: Cloquintocet-mexyl, Cyprosulfamid, Fenchlorazol-ethylester, Isoxadifen- ethyl, Mefenpyr-diethyl, Fenclorim, Cumyluron, S4-1 und S4-5, und besonders bevorzugte Safener sind: Cloquintocet-mexyl, Cyprosulfamid, Isoxadifen-ethyl und Mefenpyr-diethyl.
Biologische Beispiele A. Herbizide Wirkung und Kulturverträglichkeit im Nachauflauf
Samen von mono- bzw. dikotylen Unkraut- bzw. Kulturpflanzen wurden in Kunststoff- oder
Holzfasertöpfen in sandigem Lehmboden ausgelegt, mit Erde abgedeckt und im Gewächshaus unter kontrollierten Wachstumsbedingungen angezogen. 2 bis 3 Wochen nach der Aussaat wurden die Versuchspflanzen im Einblattstadium behandelt. Die in Form von benetzbaren Pulvern (WP) oder als Emulsionskonzentrate (EC) formulierten erfindungsgemäßen Verbindungen wurden dann als wässrige Suspension bzw. Emulsion unter Zusatz von 0,5% Additiv mit einer Wasseraufwandmenge von umgerechnet 600 1/ha auf die grünen Pflanzenteile gesprüht. Nach ca. 3 Wochen Standzeit der
Versuchspflanzen im Gewächshaus, unter optimalen Wachstumsbedingungen, wurde die Wirkung der Präparate visuell im Vergleich zu unbehandelten Kontrollen bonitiert. Beispielsweise bedeutet 100% Wirkung = Pflanzen sind abgestorben, 0%> Wirkung = wie Kontrollpflanzen.
In den nachstehenden Tabllen Bl bis B15 sind die Wirkungen ausgewählter Verbindungen der allgemeinen Formel (I) gemäß Tabelle I auf verschiedene Schadpflanzen und einer Aufwandmenge entsprechend 1280 g/ha, die gemäß zuvor genannter Versuchvorschrift erhalten wurden, dargestellt.
Tabelle Bl
Verbindung
Alopecurus myosuroides Beispiel Nr.
1-140 100
1-133 100
1-093 100
1-158 100
1-141 80
1-126 100
1-060 90
1-036 90
1-183 90
1-044 90
1-087 90
1-163 90
1-122 90
1-092 90
1-069 100
1-157 100
1-155 90
1-090 100
1-120 90
1-097 90
1-091 80
1-134 90
1-062 80
1-192 80
1-063 100
1-089 90
Tabelle B2
Verbindung
Echinochloa crus-galli Beispiel Nr.
1-140 100
1-133 100
1-093 100
1-158 100
1-141 100
1-126 100
1-060 90
1-036 90
1-183 90
1-044 100
1-163 90
1-122 90
1-092 100
1-069 80
1-157 100
1-090 80
1-094 80
1-097 100
1-091 80
1-134 80
1-192 80
1-095 80
1-066 80
Tabelle B3
Verbindung
Setaria viridis Beispiel Nr.
1-140 100
1-133 100
1-093 100
1-158 100
1-141 90
1-126 100
1-060 80
1-036 90
1-183 100
1-044 100
1-087 90
1-163 90
1-122 100
1-092 100
1-069 80
1-157 80
1-155 80
1-090 100
1-120 80
1-097 90
1-091 100
1-037 100
1-203 90
1-064 100
1-115 100
1-063 80
1-089 80
1-205 80
1-211 90
Tabelle B4
Verbindung
Abutilon theophrasti Beispiel Nr.
1-140 100
1-133 100
1-093 90
1-158 90
1-141 90
1-126 100
1-060 80
1-036 90
1-183 90
1-044 100
1-087 80
1-163 90
1-122 100
1-092 100
1-069 80
1-157 90
1-155 80
1-090 100
1-094 90
1-065 80
1-097 90
1-091 80
1-037 90
1-134 90
1-203 100
1-064 80
1-115 100
1-062 100
1-136 90
1-192 80
1-063 100
1-034 80
Verbindung
Abutilon theophrasti Beispiel Nr.
1-035 100
1-205 90
1-142 80
1-096 80
Tabelle B5
Verbindung
Amaranthus retroflexus Beispiel Nr.
1-140 100
1-133 100
1-093 100
1-158 100
1-141 100
1-126 100
1-060 100
1-036 100
1-183 100
1-044 100
1-087 100
1-092 100
1-069 100
1-157 100
1-155 100
1-090 100
1-094 100
1-120 80
1-065 100
1-097 80
1-091 80
1-037 100
1-134 100
1-203 100
Verbindung
Amaranthus retroflexus Beispiel Nr.
1-064 100
1-115 100
1-062 100
1-136 100
1-063 100
1-034 100
1-095 100
1-205 90
1-135 100
1-066 80
1-032 90
1-186 100
1-156 100
1-207 90
1-058 80
1-142 90
1-121 80
1-137 80
1-188 100
Tabelle B6
Verbindung
Polygonum convolvulus Beispiel Nr.
1-140 100
1-133 100
1-093 100
1-158 100
1-141 100
1-126 100
1-060 80
1-036 100
Verbindung
Polygonum convolvulus Beispiel Nr.
1-183 90
1-044 100
1-087 100
1-163 100
1-122 100
1-092 100
1-069 100
1-157 80
1-090 100
1-094 90
1-120 100
1-065 100
1-037 80
1-134 80
1-064 100
1-115 90
1-062 90
1-192 100
1-035 100
1-089 90
1-067 90
1-211 100
1-032 90
1-156 80
1-121 80
1-042 80
Tabelle B7
Verbindung
Stellaria media Beispiel Nr.
1-140 90
1-133 100
Verbindung
Stellaria media Beispiel Nr.
1-093 100
1-158 90
1-141 100
1-126 100
1-060 100
1-036 90
1-183 90
1-044 100
1-087 100
1-163 80
1-122 90
1-092 100
1-155 90
1-090 100
1-094 100
1-120 90
1-065 90
1-037 100
1-203 90
1-064 100
1-115 100
1-062 90
1-136 90
1-035 80
1-067 90
1-135 90
1-211 100
1-032 100
1-058 100
Tabelle B8
Verbindung
Viola tricolor Beispiel Nr.
1-140 100
1-133 100
1-093 100
1-158 100
1-141 90
1-126 100
1-060 100
1-036 100
1-183 100
1-044 100
1-087 100
1-163 90
1-122 90
1-092 100
1-069 100
1-157 100
1-155 100
1-090 100
1-094 100
1-120 100
1-065 100
1-097 80
1-091 100
1-037 100
1-134 100
1-203 100
1-064 100
1-115 100
1-062 100
1-136 100
1-192 80
1-063 100
Verbindung
Viola tricolor Beispiel Nr.
1-034 100
1-035 100
1-095 100
1-067 80
1-205 90
1-135 100
1-066 100
1-211 80
1-186 100
1-156 100
1-207 80
1-121 80
1-137 100
1-038 90
1-039 100
1-138 80
1-160 100
1-230 80
Tabelle B9
Verbindung
Ipomoea purpurea Beispiel Nr.
1-095 80
1-135 80
1-066 80
1-186 80
1-207 90
Tabelle BIO
Verbindung
Lolium rigidum Beispiel Nr.
1-140 80
1-133 90
1-093 100
1-158 100
1-036 90
1-157 80
Tabelle Bl 3
Verbindung
Matricaria inodora Beispiel Nr.
1-140 100
1-126 80
1-060 80
1-065 80
Tabelle B14
Verbindung
Pharbitis purpurea Beispiel Nr.
1-140 100
1-133 100
1-093 90
1-158 80
1-141 80
1-126 100
1-183 100
1-044 100
1-087 80
1-163 90
1-122 90
1-092 80
1-155 80
1-094 100
Verbindung
Pharbitis purpurea
Beispiel Nr.
1-065 100
1-097 90
1-091 80
1-037 100
1-134 80
1-203 90
1-034 90
1-095 80
1-135 80
1-066 80
1-186 80
1-207 90
Tabelle Bl 5
Verbindung
Hordeum murinum
Beispiel Nr.
1-140 80
1-133 90
1-093 90
1-126 80
1-069 80
Die Versuchsergebnisse belegen, dass erfindungsgemäße Verbindungen der allgemeinen Formel (I) bei Behandlung im Nachauflauf eine gute herbizide Wirksamkeit gegen ausgewählte Schadpflanzen wie z.B. Alopecurus myosuroides, Echinochloa crus-galli, Setaria viridis, Abutilon theophrasti, Amaranthus retroflexus, Polygonum convolvulus, Stellaria media, Viola tricolor, Ipomoea purpurea, Vcronica persica, Avena fatua, Hordeum murinum, Lolium rigidum, Matricaria inodora, Pharbitis purpurea bei einer jweiligen Aufwandmenge von 1280 g Aktivsubstanz pro Hektar aufweisen.
Herbizide Wirkung und Kulturverträglichkeit im Vorauflauf
Samen von mono- bzw. dikotylen Unkraut und Kulturpflanzen wurden in Kunststoff- oder
Holzfasertöpfen ausgelegt und mit Erde abgedeckt. Die in Form von benetzbaren Pulvern (WP) oder als Emulsionskonzentrate (EC) formulierten erfindungsgemäßen Verbindungen wurden dann als wässrige Suspension bzw. Emulsion unter Zusatz von 0,5% Additiv mit einer Wasseraufwandmenge von umgerechnet 600 1/ha auf die Oberfläche der Abdeckerde appliziert. Nach der Behandlung wurden die Töpfe im Gewächshaus aufgestellt und unter guten Wachstumsbedingungen für die Testpflanzen gehalten. Nach ca. 3 Wochen wurde die Wirkung der Präparate visuell im Vergleich zu unbehandelten Kontrollen in Prozentwerten bonitiert. Beispielsweise bedeutet 100% Wirkung = Pflanzen sind abgestorben, 0%> Wirkung = wie Kontrollpflanzen.
In nachstehenden Tabllen Cl bis C 14 sind die Wirkungen ausgewählter Verbindungen der allgemeinen Formel (I) gemäß Tabelle I auf verschiedene Schadpflanzen und einer Aufwandmenge entsprechend 1280 g/ha, die gemäß zuvor genannter Versuchvorschrift erhalten wurden, dargestellt.
Tabelle Cl
Verbindung
Alopecurus myosuroides
Beispiel Nr.
1-205 100
1-126 100
1-093 100
1-091 100
1-158 100
1-094 100
1-095 100
1-044 100
1-133 100
1-069 100
1-134 100
1-135 100
1-062 100
1-092 100
1-036 90
1-140 100
Verbindung
Alopecurus myosuroides Beispiel Nr.
1-157 100
1-141 90
1-089 90
1-097 100
1-090 100
1-037 100
1-211 90
1-066 80
1-122 100
1-155 100
1-192 100
1-163 90
1-183 100
1-136 100
1-039 100
1-063 100
1-067 90
1-038 80
1-115 90
1-064 90
1-203 90
1-096 100
1-120 90
1-142 80
Tabelle C2
Verbindung
Setaria viridis Beispiel Nr.
1-205 100
1-126 100
1-093 100
Verbindung
Setaria viridis Beispiel Nr.
1-091 100
1-158 100
1-094 100
1-095 100
1-044 100
1-133 100
1-069 100
1-134 100
1-135 100
1-062 100
1-092 100
1-036 100
1-140 100
1-157 100
1-141 100
1-089 100
1-097 100
1-090 100
1-037 100
1-211 100
1-066 100
1-122 100
1-155 100
1-192 100
1-163 100
1-183 100
1-136 100
1-039 90
1-063 100
1-067 100
1-038 100
1-115 100
1-064 100
Verbindung
Setaria viridis Beispiel Nr.
1-203 100
1-096 100
1-087 100
1-156 100
1-060 90
1-065 100
1-207 100
1-142 100
1-121 90
1-138 100
1-186 100
1-042 80
1-188 100
1-137 100
1-034 100
1-035 90
Tabelle C3
Verbindung
Abutilon theophrasti Beispiel Nr.
1-205 100
1-126 100
1-093 100
1-091 100
1-158 100
1-094 100
1-095 100
1-044 100
1-133 100
1-069 100
1-134 100
1-135 100
1-062 100
1-092 100
1-036 100
1-140 100
1-157 100
1-141 100
1-089 100
1-097 100
1-090 100
1-037 100
1-211 90
1-066 90
1-122 100
1-155 100
1-192 100
1-163 100
1-183 100
1-136 100
1-039 100
1-063 100
Verbindung
Abutilon theophrasti Beispiel Nr.
1-067 90
1-038 80
1-115 100
1-064 100
1-203 90
1-096 100
1-087 100
1-120 100
1-156 90
1-060 80
1-065 80
1-207 80
1-138 80
1-034 80
Tabelle C4
Verbindung
Amaranthus retroflexus Beispiel Nr.
1-205 100
1-126 100
1-093 100
1-091 100
1-158 100
1-094 100
1-095 100
1-044 100
1-133 100
1-069 100
1-134 100
1-135 100
1-062 100
Verbindung
Amaranthus retroflexus Beispiel Nr.
1-092 100
1-036 90
1-140 100
1-157 100
1-141 100
1-089 100
1-097 90
1-090 100
1-037 100
1-211 100
1-066 100
1-122 100
1-155 100
1-192 80
1-163 90
1-183 100
1-136 100
1-039 100
1-063 100
1-067 100
1-038 100
1-115 100
1-064 100
1-203 100
1-096 100
1-087 100
1-120 80
1-156 100
1-060 100
1-065 100
1-207 100
1-142 90
1-121 100
Verbindung
Amaranthus retroflexus Beispiel Nr.
1-186 100
1-042 80
1-188 100
1-137 100
1-034 100
1-035 90
1-058 100
1-032 80
Tabelle C5
Verbindung
Matricaria inodora Beispiel Nr.
1-205 100
1-126 100
1-093 100
1-091 100
1-158 100
1-094 100
1-095 100
1-044 100
1-133 100
1-069 100
1-134 100
1-135 90
1-062 100
1-092 100
1-036 90
1-140 100
1-157 100
1-141 100
1-089 100
Verbindung
Matricaria inodora Beispiel Nr.
1-097 100
1-090 100
1-037 90
1-211 90
1-066 100
1-122 100
1-155 100
1-192 100
1-163 100
1-183 100
1-136 100
1-039 90
1-063 100
1-067 100
1-038 90
1-115 90
1-064 90
1-203 80
1-096 100
1-087 90
1-156 100
1-065 90
1-186 90
1-042 90
1-032 90
Tabelle C6
Verbindung
Stellaria media Beispiel Nr.
1-205 100
1-126 100
Verbindung
Stellaria media Beispiel Nr.
1-093 100
1-091 100
1-158 100
1-094 100
1-095 100
1-044 100
1-133 100
1-069 100
1-134 100
1-135 100
1-062 100
1-092 90
1-036 100
1-140 100
1-157 100
1-141 90
1-089 100
1-097 100
1-090 100
1-037 100
1-211 100
1-066 100
1-122 100
1-155 100
1-192 90
1-163 90
1-183 100
1-136 100
1-039 100
1-063 90
1-067 90
1-038 100
1-115 90
Verbindung
Stellaria media Beispiel Nr.
1-064 100
1-203 80
1-096 90
1-120 100
1-156 100
1-065 100
1-207 100
1-142 90
1-121 80
1-186 100
1-042 100
1-188 90
1-137 100
1-034 90
1-058 90
Tabelle C7
Verbindung
Viola tricolor Beispiel Nr.
1-205 100
1-126 100
1-093 100
1-091 100
1-158 100
1-094 100
1-095 100
1-044 100
1-133 100
1-069 100
1-134 100
1-135 100
Verbindung
Viola tricolor Beispiel Nr.
1-062 100
1-092 90
1-036 100
1-140 100
1-157 100
1-141 100
1-089 100
1-097 100
1-090 100
1-037 100
1-211 100
1-066 100
1-122 100
1-155 100
1-192 100
1-163 100
1-183 100
1-136 100
1-039 100
1-063 100
1-067 100
1-038 100
1-115 100
1-064 100
1-203 90
1-096 100
1-087 100
1-120 100
1-156 100
1-060 100
1-065 100
1-207 100
1-142 100
Verbindung
Viola tricolor Beispiel Nr.
1-121 100
1-138 90
1-186 100
1-042 90
1-188 100
1-137 100
1-034 100
1-035 100
1-058 80
1-160 100
Tabelle C8
Verbindung
Polygonum convolvulus Beispiel Nr.
1-205 100
1-126 100
1-093 100
1-091 100
1-158 100
1-094 90
1-095 90
1-044 90
1-133 100
1-069 100
1-134 100
1-135 90
1-062 100
1-092 90
1-140 100
1-157 100
Verbindung
Polygonum convolvulus Beispiel Nr.
1-141 100
1-089 90
1-097 100
1-090 90
1-037 100
1-211 90
1-066 90
1-122 100
1-192 100
1-163 100
1-183 100
1-136 100
1-039 90
1-063 100
1-067 90
1-038 80
1-115 90
1-064 100
1-203 80
1-096 100
1-087 90
1-120 80
1-156 100
1-060 100
1-065 100
1-207 80
1-142 100
1-121 90
1-138 80
1-186 80
1-137 100
1-160 80
Tabelle C9
Verbindung
Veronica persica Beispiel Nr.
1-205 100
1-093 100
1-091 100
1-158 100
1-094 100
1-095 100
1-044 100
1-069 100
1-134 100
1-135 100
1-092 100
1-036 100
1-157 100
1-141 100
1-089 100
1-097 90
1-090 100
1-037 100
1-211 100
1-066 100
1-122 100
1-192 100
1-163 90
1-039 100
1-067 100
1-115 100
1-064 100
1-203 100
1-096 100
1-087 100
1-120 100
1-060 100
Verbindung
Veronica persica Beispiel Nr.
1-207 100
1-142 90
1-121 100
1-138 100
1-042 100
1-160 100
1-032 90
Tabelle CIO
Verbindung
Avena fatua Beispiel Nr.
1-205 100
1-126 100
1-093 100
1-091 90
1-158 100
1-095 100
1-044 100
1-133 100
1-069 100
1-134 80
1-135 80
1-062 80
1-092 90
1-036 90
1-140 100
1-157 100
1-141 80
1-089 80
1-097 80
1-090 100
1-122 80
1-155 100
1-136 90
Verbindung
Avena fatua Beispiel Nr.
1-039 90
1-063 100
1-087 80
Tabelle Cl l
Verbindung
Echinochloa crus-galli Beispiel Nr.
1-205 100
1-126 100
1-093 100
1-091 100
1-158 100
1-094 100
1-095 100
1-044 100
1-133 100
1-069 100
1-134 90
1-135 100
1-062 100
1-092 100
1-036 100
1-140 100
1-157 100
1-141 100
1-089 100
1-097 100
1-090 100
1-037 100
1-211 90
1-066 100
1-122 100
1-155 90
1-192 100
Verbindung
Echinochloa crus-galli Beispiel Nr.
1-163 100
1-183 100
1-136 90
1-063 100
1-067 90
1-038 80
1-115 100
1-064 90
1-203 80
1-096 80
1-087 80
1-120 100
1-156 80
1-060 80
1-188 80
Tabelle C12
Verbindung
Lolium rigidum Beispiel Nr.
1-205 100
1-126 100
1-093 100
1-091 90
1-158 100
1-094 80
1-095 100
1-044 90
1-133 100
1-069 100
1-134 100
1-135 90
1-062 80
1-092 100
1-036 100
Verbindung
Lolium rigidum Beispiel Nr.
1-140 100
1-157 100
1-141 90
1-089 90
1-090 90
1-037 100
1-211 100
1-155 80
1-183 100
1-136 100
1-115 80
Tabelle Cl 3
Tabelle C14
Verbindung
Hordeum murinum Beispiel Nr.
1-205 100
1-126 100
1-093 100
1-091 100
1-158 100
1-094 100
Verbindung
Hordeum murinum
Beispiel Nr.
1-095 100
1-044 90
1-133 100
1-069 100
1-134 90
1-135 80
1-062 100
1-092 100
1-036 100
1-140 100
1-157 100
1-141 80
1-089 90
1-097 90
1-090 100
1-037 90
1-066 100
1-122 90
1-155 100
1-192 90
1-163 90
1-183 100
1-063 100
Die Versuchsergebnisse belegen, dass erfindungsgemäße Verbindungen der allgemeinen Formel (I) bei Behandlung im Vorauflauf eine gute herbizide Wirksamkeit gegen ausgewählte Schadpflanzen wie z.B. Alopecurus myosuroides, Setaria viridis, Abutilon theophrasti, Amaranthus retroflexus, Matricaria inodora, Stellaria media, Viola tricolor, Polygonum convolvulus, Veronica persica, Avena fatua, Echinochloa crus-galli, Hordeum murinum, Lolium rigidum, Pharbitis purpurea bei einer
Aufwandmenge von 1280 g Aktivsubstanz pro Hektar aufweisen.