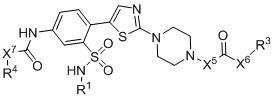
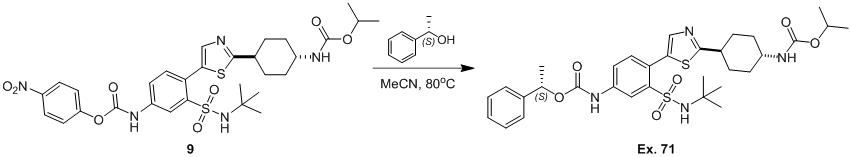
TWI791608B - Rad51抑制劑 - Google Patents
Rad51抑制劑 Download PDFInfo
- Publication number
- TWI791608B TWI791608B TW107131953A TW107131953A TWI791608B TW I791608 B TWI791608 B TW I791608B TW 107131953 A TW107131953 A TW 107131953A TW 107131953 A TW107131953 A TW 107131953A TW I791608 B TWI791608 B TW I791608B
- Authority
- TW
- Taiwan
- Prior art keywords
- group
- monocyclic
- halogen
- represented
- cycloalkyl
- Prior art date
Links
- 239000003112 inhibitor Substances 0.000 title claims abstract description 29
- 101100300807 Drosophila melanogaster spn-A gene Proteins 0.000 title description 2
- 238000000034 method Methods 0.000 claims abstract description 193
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 68
- 201000011510 cancer Diseases 0.000 claims abstract description 55
- 208000023275 Autoimmune disease Diseases 0.000 claims abstract description 16
- 230000004770 neurodegeneration Effects 0.000 claims abstract description 12
- 208000015122 neurodegenerative disease Diseases 0.000 claims abstract description 12
- 230000007812 deficiency Effects 0.000 claims abstract description 11
- 150000001875 compounds Chemical class 0.000 claims description 287
- -1 -OH Chemical group 0.000 claims description 163
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 157
- 229910052736 halogen Inorganic materials 0.000 claims description 106
- 125000002950 monocyclic group Chemical group 0.000 claims description 106
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 105
- 150000002367 halogens Chemical class 0.000 claims description 96
- 150000003839 salts Chemical class 0.000 claims description 96
- 238000002360 preparation method Methods 0.000 claims description 95
- 102100022433 Single-stranded DNA cytosine deaminase Human genes 0.000 claims description 86
- 210000004027 cell Anatomy 0.000 claims description 84
- 101710143275 Single-stranded DNA cytosine deaminase Proteins 0.000 claims description 82
- 108090000623 proteins and genes Proteins 0.000 claims description 55
- 125000000623 heterocyclic group Chemical group 0.000 claims description 52
- 125000003341 7 membered heterocyclic group Chemical group 0.000 claims description 50
- 125000001072 heteroaryl group Chemical group 0.000 claims description 47
- 125000000217 alkyl group Chemical group 0.000 claims description 46
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 claims description 44
- 125000004970 halomethyl group Chemical group 0.000 claims description 39
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 claims description 38
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims description 36
- 102000004190 Enzymes Human genes 0.000 claims description 32
- 108090000790 Enzymes Proteins 0.000 claims description 32
- 108020004414 DNA Proteins 0.000 claims description 28
- 238000010442 DNA editing Methods 0.000 claims description 28
- 230000035772 mutation Effects 0.000 claims description 28
- 210000003719 b-lymphocyte Anatomy 0.000 claims description 25
- 230000001965 increasing effect Effects 0.000 claims description 25
- 229910052760 oxygen Inorganic materials 0.000 claims description 24
- 238000006467 substitution reaction Methods 0.000 claims description 21
- 230000005778 DNA damage Effects 0.000 claims description 20
- 231100000277 DNA damage Toxicity 0.000 claims description 20
- 102100021147 DNA mismatch repair protein Msh6 Human genes 0.000 claims description 20
- 101000968658 Homo sapiens DNA mismatch repair protein Msh6 Proteins 0.000 claims description 20
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical group C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 claims description 20
- 125000005843 halogen group Chemical group 0.000 claims description 20
- 201000009030 Carcinoma Diseases 0.000 claims description 16
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 16
- 230000000694 effects Effects 0.000 claims description 16
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 16
- 239000008194 pharmaceutical composition Substances 0.000 claims description 16
- 206010025323 Lymphomas Diseases 0.000 claims description 15
- 208000009415 Spinocerebellar Ataxias Diseases 0.000 claims description 15
- 208000029462 Immunodeficiency disease Diseases 0.000 claims description 12
- 239000003814 drug Substances 0.000 claims description 12
- 230000007813 immunodeficiency Effects 0.000 claims description 12
- 208000032839 leukemia Diseases 0.000 claims description 12
- 101710183280 Topoisomerase Proteins 0.000 claims description 11
- 230000001363 autoimmune Effects 0.000 claims description 11
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 11
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 claims description 11
- 201000010099 disease Diseases 0.000 claims description 11
- 125000001400 nonyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 11
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 11
- 125000004399 C1-C4 alkenyl group Chemical group 0.000 claims description 10
- 230000033616 DNA repair Effects 0.000 claims description 10
- 206010039491 Sarcoma Diseases 0.000 claims description 10
- 206010009944 Colon cancer Diseases 0.000 claims description 9
- 102000002689 Toll-like receptor Human genes 0.000 claims description 9
- 108020000411 Toll-like receptor Proteins 0.000 claims description 9
- 125000003566 oxetanyl group Chemical group 0.000 claims description 9
- 125000000168 pyrrolyl group Chemical group 0.000 claims description 9
- 208000011580 syndromic disease Diseases 0.000 claims description 9
- 206010006187 Breast cancer Diseases 0.000 claims description 8
- 208000026310 Breast neoplasm Diseases 0.000 claims description 8
- 206010061598 Immunodeficiency Diseases 0.000 claims description 8
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims description 8
- 230000008569 process Effects 0.000 claims description 8
- 125000000719 pyrrolidinyl group Chemical group 0.000 claims description 8
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 claims description 7
- 239000002246 antineoplastic agent Substances 0.000 claims description 7
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 7
- 208000029742 colonic neoplasm Diseases 0.000 claims description 7
- 239000003085 diluting agent Substances 0.000 claims description 7
- 125000004076 pyridyl group Chemical group 0.000 claims description 7
- 230000028617 response to DNA damage stimulus Effects 0.000 claims description 7
- 208000000659 Autoimmune lymphoproliferative syndrome Diseases 0.000 claims description 6
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 6
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 6
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 6
- 208000006990 cholangiocarcinoma Diseases 0.000 claims description 6
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 claims description 6
- 239000003937 drug carrier Substances 0.000 claims description 6
- 206010017758 gastric cancer Diseases 0.000 claims description 6
- 230000002757 inflammatory effect Effects 0.000 claims description 6
- 201000002313 intestinal cancer Diseases 0.000 claims description 6
- 201000007270 liver cancer Diseases 0.000 claims description 6
- 208000014018 liver neoplasm Diseases 0.000 claims description 6
- 125000003386 piperidinyl group Chemical group 0.000 claims description 6
- 201000011549 stomach cancer Diseases 0.000 claims description 6
- 125000000229 (C1-C4)alkoxy group Chemical group 0.000 claims description 5
- 208000008190 Agammaglobulinemia Diseases 0.000 claims description 5
- 102100025621 Cytochrome b-245 heavy chain Human genes 0.000 claims description 5
- 239000012623 DNA damaging agent Substances 0.000 claims description 5
- 206010020983 Hypogammaglobulinaemia Diseases 0.000 claims description 5
- 208000034578 Multiple myelomas Diseases 0.000 claims description 5
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 claims description 5
- 206010033128 Ovarian cancer Diseases 0.000 claims description 5
- 206010035226 Plasma cell myeloma Diseases 0.000 claims description 5
- 208000029052 T-cell acute lymphoblastic leukemia Diseases 0.000 claims description 5
- 208000024770 Thyroid neoplasm Diseases 0.000 claims description 5
- 125000003118 aryl group Chemical group 0.000 claims description 5
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 5
- 125000002393 azetidinyl group Chemical group 0.000 claims description 5
- 208000016532 chronic granulomatous disease Diseases 0.000 claims description 5
- 229940127089 cytotoxic agent Drugs 0.000 claims description 5
- 125000005043 dihydropyranyl group Chemical group O1C(CCC=C1)* 0.000 claims description 5
- 125000004925 dihydropyridyl group Chemical group N1(CC=CC=C1)* 0.000 claims description 5
- 125000005053 dihydropyrimidinyl group Chemical group N1(CN=CC=C1)* 0.000 claims description 5
- 125000005072 dihydrothiopyranyl group Chemical group S1C(CCC=C1)* 0.000 claims description 5
- 125000005842 heteroatom Chemical group 0.000 claims description 5
- 239000002955 immunomodulating agent Substances 0.000 claims description 5
- 229940121354 immunomodulator Drugs 0.000 claims description 5
- 210000004185 liver Anatomy 0.000 claims description 5
- 206010025135 lupus erythematosus Diseases 0.000 claims description 5
- 125000002911 monocyclic heterocycle group Chemical group 0.000 claims description 5
- 125000002757 morpholinyl group Chemical group 0.000 claims description 5
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 claims description 5
- 239000001301 oxygen Substances 0.000 claims description 5
- 125000004193 piperazinyl group Chemical group 0.000 claims description 5
- 208000010626 plasma cell neoplasm Diseases 0.000 claims description 5
- 230000006798 recombination Effects 0.000 claims description 5
- 238000005215 recombination Methods 0.000 claims description 5
- 125000001412 tetrahydropyranyl group Chemical group 0.000 claims description 5
- 125000005942 tetrahydropyridyl group Chemical group 0.000 claims description 5
- 125000004568 thiomorpholinyl group Chemical group 0.000 claims description 5
- 201000002510 thyroid cancer Diseases 0.000 claims description 5
- LWTIGYSPAXKMDG-UHFFFAOYSA-N 2,3-dihydro-1h-imidazole Chemical compound C1NC=CN1 LWTIGYSPAXKMDG-UHFFFAOYSA-N 0.000 claims description 4
- 208000031261 Acute myeloid leukaemia Diseases 0.000 claims description 4
- 208000024827 Alzheimer disease Diseases 0.000 claims description 4
- 206010003591 Ataxia Diseases 0.000 claims description 4
- 102000007370 Ataxin2 Human genes 0.000 claims description 4
- 108010032951 Ataxin2 Proteins 0.000 claims description 4
- 208000004736 B-Cell Leukemia Diseases 0.000 claims description 4
- 208000003174 Brain Neoplasms Diseases 0.000 claims description 4
- 208000011691 Burkitt lymphomas Diseases 0.000 claims description 4
- 201000003874 Common Variable Immunodeficiency Diseases 0.000 claims description 4
- 102100040261 DNA dC->dU-editing enzyme APOBEC-3C Human genes 0.000 claims description 4
- 201000003741 Gastrointestinal carcinoma Diseases 0.000 claims description 4
- 108010044091 Globulins Proteins 0.000 claims description 4
- 102000006395 Globulins Human genes 0.000 claims description 4
- 208000009329 Graft vs Host Disease Diseases 0.000 claims description 4
- 101000964383 Homo sapiens DNA dC->dU-editing enzyme APOBEC-3C Proteins 0.000 claims description 4
- 208000023105 Huntington disease Diseases 0.000 claims description 4
- WRYCSMQKUKOKBP-UHFFFAOYSA-N Imidazolidine Chemical compound C1CNCN1 WRYCSMQKUKOKBP-UHFFFAOYSA-N 0.000 claims description 4
- 208000027747 Kennedy disease Diseases 0.000 claims description 4
- 201000001779 Leukocyte adhesion deficiency Diseases 0.000 claims description 4
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 4
- 208000002569 Machado-Joseph Disease Diseases 0.000 claims description 4
- 208000018737 Parkinson disease Diseases 0.000 claims description 4
- 208000007452 Plasmacytoma Diseases 0.000 claims description 4
- 206010060862 Prostate cancer Diseases 0.000 claims description 4
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 4
- 208000000453 Skin Neoplasms Diseases 0.000 claims description 4
- 201000003622 Spinocerebellar ataxia type 2 Diseases 0.000 claims description 4
- 208000036834 Spinocerebellar ataxia type 3 Diseases 0.000 claims description 4
- 201000003620 Spinocerebellar ataxia type 6 Diseases 0.000 claims description 4
- 201000003629 Spinocerebellar ataxia type 8 Diseases 0.000 claims description 4
- 208000004921 cutaneous lupus erythematosus Diseases 0.000 claims description 4
- 125000004852 dihydrofuranyl group Chemical group O1C(CC=C1)* 0.000 claims description 4
- 125000005057 dihydrothienyl group Chemical group S1C(CC=C1)* 0.000 claims description 4
- 201000003444 follicular lymphoma Diseases 0.000 claims description 4
- 208000024908 graft versus host disease Diseases 0.000 claims description 4
- 210000003734 kidney Anatomy 0.000 claims description 4
- 201000005202 lung cancer Diseases 0.000 claims description 4
- 208000020816 lung neoplasm Diseases 0.000 claims description 4
- 201000008383 nephritis Diseases 0.000 claims description 4
- 125000003518 norbornenyl group Chemical group C12(C=CC(CC1)C2)* 0.000 claims description 4
- 125000002868 norbornyl group Chemical group C12(CCC(CC1)C2)* 0.000 claims description 4
- 230000005855 radiation Effects 0.000 claims description 4
- 201000003624 spinocerebellar ataxia type 1 Diseases 0.000 claims description 4
- 201000003594 spinocerebellar ataxia type 12 Diseases 0.000 claims description 4
- 201000003570 spinocerebellar ataxia type 17 Diseases 0.000 claims description 4
- 201000003632 spinocerebellar ataxia type 7 Diseases 0.000 claims description 4
- 239000000126 substance Substances 0.000 claims description 4
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 claims description 4
- 125000004632 tetrahydrothiopyranyl group Chemical group S1C(CCCC1)* 0.000 claims description 4
- DTGKSKDOIYIVQL-WEDXCCLWSA-N (+)-borneol Chemical group C1C[C@@]2(C)[C@@H](O)C[C@@H]1C2(C)C DTGKSKDOIYIVQL-WEDXCCLWSA-N 0.000 claims description 3
- HXFLZWAZSSPLCO-UHFFFAOYSA-N 6,6-dimethylbicyclo[3.1.1]heptyl Chemical group C1[C-]2C([CH2+])([CH2-])[C+]1CCC2 HXFLZWAZSSPLCO-UHFFFAOYSA-N 0.000 claims description 3
- 108010004483 APOBEC-3G Deaminase Proteins 0.000 claims description 3
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 claims description 3
- 208000031212 Autoimmune polyendocrinopathy Diseases 0.000 claims description 3
- 208000025324 B-cell acute lymphoblastic leukemia Diseases 0.000 claims description 3
- 208000023611 Burkitt leukaemia Diseases 0.000 claims description 3
- 102100040399 C->U-editing enzyme APOBEC-2 Human genes 0.000 claims description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 3
- 102100040263 DNA dC->dU-editing enzyme APOBEC-3A Human genes 0.000 claims description 3
- 102100040264 DNA dC->dU-editing enzyme APOBEC-3D Human genes 0.000 claims description 3
- 102100040266 DNA dC->dU-editing enzyme APOBEC-3F Human genes 0.000 claims description 3
- 102100038076 DNA dC->dU-editing enzyme APOBEC-3G Human genes 0.000 claims description 3
- 102100038050 DNA dC->dU-editing enzyme APOBEC-3H Human genes 0.000 claims description 3
- 101710082737 DNA dC->dU-editing enzyme APOBEC-3H Proteins 0.000 claims description 3
- 206010014733 Endometrial cancer Diseases 0.000 claims description 3
- 206010014759 Endometrial neoplasm Diseases 0.000 claims description 3
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 3
- 206010017993 Gastrointestinal neoplasms Diseases 0.000 claims description 3
- 101000964322 Homo sapiens C->U-editing enzyme APOBEC-2 Proteins 0.000 claims description 3
- 101000964378 Homo sapiens DNA dC->dU-editing enzyme APOBEC-3A Proteins 0.000 claims description 3
- 101000964382 Homo sapiens DNA dC->dU-editing enzyme APOBEC-3D Proteins 0.000 claims description 3
- 101000964377 Homo sapiens DNA dC->dU-editing enzyme APOBEC-3F Proteins 0.000 claims description 3
- 101000800426 Homo sapiens Putative C->U-editing enzyme APOBEC-4 Proteins 0.000 claims description 3
- 208000008839 Kidney Neoplasms Diseases 0.000 claims description 3
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 claims description 3
- 208000030289 Lymphoproliferative disease Diseases 0.000 claims description 3
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 claims description 3
- 206010030155 Oesophageal carcinoma Diseases 0.000 claims description 3
- 102100033091 Putative C->U-editing enzyme APOBEC-4 Human genes 0.000 claims description 3
- 206010038389 Renal cancer Diseases 0.000 claims description 3
- 208000023915 Ureteral Neoplasms Diseases 0.000 claims description 3
- 239000000556 agonist Substances 0.000 claims description 3
- 206010003246 arthritis Diseases 0.000 claims description 3
- 201000009201 autoimmune lymphoproliferative syndrome type 2B Diseases 0.000 claims description 3
- 210000000601 blood cell Anatomy 0.000 claims description 3
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 claims description 3
- 210000001096 cystic duct Anatomy 0.000 claims description 3
- 208000035475 disorder Diseases 0.000 claims description 3
- 201000004101 esophageal cancer Diseases 0.000 claims description 3
- 201000010536 head and neck cancer Diseases 0.000 claims description 3
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 3
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 3
- 230000000521 hyperimmunizing effect Effects 0.000 claims description 3
- 210000002865 immune cell Anatomy 0.000 claims description 3
- 230000002584 immunomodulator Effects 0.000 claims description 3
- 208000015181 infectious disease Diseases 0.000 claims description 3
- 201000010982 kidney cancer Diseases 0.000 claims description 3
- 230000001404 mediated effect Effects 0.000 claims description 3
- 208000025113 myeloid leukemia Diseases 0.000 claims description 3
- 125000000466 oxiranyl group Chemical group 0.000 claims description 3
- 208000031223 plasma cell leukemia Diseases 0.000 claims description 3
- 206010039073 rheumatoid arthritis Diseases 0.000 claims description 3
- 201000000849 skin cancer Diseases 0.000 claims description 3
- 238000002560 therapeutic procedure Methods 0.000 claims description 3
- 125000006272 (C3-C7) cycloalkyl group Chemical group 0.000 claims description 2
- 102100026210 1-phosphatidylinositol 4,5-bisphosphate phosphodiesterase gamma-2 Human genes 0.000 claims description 2
- 108010029988 AICDA (activation-induced cytidine deaminase) Proteins 0.000 claims description 2
- 208000030767 Autoimmune encephalitis Diseases 0.000 claims description 2
- 206010003827 Autoimmune hepatitis Diseases 0.000 claims description 2
- 208000036170 B-Cell Marginal Zone Lymphoma Diseases 0.000 claims description 2
- 208000017392 BENTA disease Diseases 0.000 claims description 2
- 208000023514 Barrett esophagus Diseases 0.000 claims description 2
- 208000023665 Barrett oesophagus Diseases 0.000 claims description 2
- 206010004593 Bile duct cancer Diseases 0.000 claims description 2
- 208000029402 Bulbospinal muscular atrophy Diseases 0.000 claims description 2
- 206010068597 Bulbospinal muscular atrophy congenital Diseases 0.000 claims description 2
- 206010062746 Carditis Diseases 0.000 claims description 2
- 201000003762 Chilblain lupus Diseases 0.000 claims description 2
- 206010009137 Chronic sinusitis Diseases 0.000 claims description 2
- 208000015943 Coeliac disease Diseases 0.000 claims description 2
- 206010010099 Combined immunodeficiency Diseases 0.000 claims description 2
- 208000025212 Constitutional neutropenia Diseases 0.000 claims description 2
- 108090000695 Cytokines Proteins 0.000 claims description 2
- 102000004127 Cytokines Human genes 0.000 claims description 2
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 claims description 2
- 102100024350 Dedicator of cytokinesis protein 8 Human genes 0.000 claims description 2
- 206010061850 Extranodal marginal zone B-cell lymphoma (MALT type) Diseases 0.000 claims description 2
- 208000001914 Fragile X syndrome Diseases 0.000 claims description 2
- 208000000259 GATA2 Deficiency Diseases 0.000 claims description 2
- 208000022140 GATA2 deficiency with susceptibility to MDS/AML Diseases 0.000 claims description 2
- 208000007882 Gastritis Diseases 0.000 claims description 2
- 101000691589 Homo sapiens 1-phosphatidylinositol 4,5-bisphosphate phosphodiesterase gamma-2 Proteins 0.000 claims description 2
- 101000889276 Homo sapiens Cytotoxic T-lymphocyte protein 4 Proteins 0.000 claims description 2
- 101001052946 Homo sapiens Dedicator of cytokinesis protein 8 Proteins 0.000 claims description 2
- 101001017764 Homo sapiens Lipopolysaccharide-responsive and beige-like anchor protein Proteins 0.000 claims description 2
- 101000828537 Homo sapiens Synaptic functional regulator FMR1 Proteins 0.000 claims description 2
- 108091008036 Immune checkpoint proteins Proteins 0.000 claims description 2
- 102000037982 Immune checkpoint proteins Human genes 0.000 claims description 2
- 206010052210 Infantile genetic agranulocytosis Diseases 0.000 claims description 2
- 208000022559 Inflammatory bowel disease Diseases 0.000 claims description 2
- 208000005016 Intestinal Neoplasms Diseases 0.000 claims description 2
- 208000031671 Large B-Cell Diffuse Lymphoma Diseases 0.000 claims description 2
- 102100033353 Lipopolysaccharide-responsive and beige-like anchor protein Human genes 0.000 claims description 2
- 201000003791 MALT lymphoma Diseases 0.000 claims description 2
- 208000036626 Mental retardation Diseases 0.000 claims description 2
- 208000009525 Myocarditis Diseases 0.000 claims description 2
- 206010068871 Myotonic dystrophy Diseases 0.000 claims description 2
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 2
- 108090000430 Phosphatidylinositol 3-kinases Proteins 0.000 claims description 2
- 102000003993 Phosphatidylinositol 3-kinases Human genes 0.000 claims description 2
- 201000004681 Psoriasis Diseases 0.000 claims description 2
- 108010017324 STAT3 Transcription Factor Proteins 0.000 claims description 2
- 102100024040 Signal transducer and activator of transcription 3 Human genes 0.000 claims description 2
- 208000021386 Sjogren Syndrome Diseases 0.000 claims description 2
- 102100023532 Synaptic functional regulator FMR1 Human genes 0.000 claims description 2
- 206010042971 T-cell lymphoma Diseases 0.000 claims description 2
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 claims description 2
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 claims description 2
- 206010046392 Ureteric cancer Diseases 0.000 claims description 2
- 208000000260 Warts Diseases 0.000 claims description 2
- 208000006269 X-Linked Bulbo-Spinal Atrophy Diseases 0.000 claims description 2
- 208000026309 X-linked immunodeficiency with magnesium defect, Epstein-Barr virus infection and neoplasia Diseases 0.000 claims description 2
- 201000006722 X-linked immunodeficiency with magnesium defect, Epstein-Barr virus infection, and neoplasia Diseases 0.000 claims description 2
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 claims description 2
- 201000009771 autoimmune polyendocrine syndrome type 1 Diseases 0.000 claims description 2
- 201000004988 autoimmune vasculitis Diseases 0.000 claims description 2
- 125000003725 azepanyl group Chemical group 0.000 claims description 2
- 208000026900 bile duct neoplasm Diseases 0.000 claims description 2
- 229940022399 cancer vaccine Drugs 0.000 claims description 2
- 238000009566 cancer vaccine Methods 0.000 claims description 2
- 230000001684 chronic effect Effects 0.000 claims description 2
- 208000027157 chronic rhinosinusitis Diseases 0.000 claims description 2
- 206010009887 colitis Diseases 0.000 claims description 2
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 2
- 206010012601 diabetes mellitus Diseases 0.000 claims description 2
- 125000005959 diazepanyl group Chemical group 0.000 claims description 2
- 206010012818 diffuse large B-cell lymphoma Diseases 0.000 claims description 2
- ZZUFCTLCJUWOSV-UHFFFAOYSA-N furosemide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC(C(O)=O)=C1NCC1=CC=CO1 ZZUFCTLCJUWOSV-UHFFFAOYSA-N 0.000 claims description 2
- 230000013595 glycosylation Effects 0.000 claims description 2
- 238000006206 glycosylation reaction Methods 0.000 claims description 2
- 208000014951 hematologic disease Diseases 0.000 claims description 2
- 208000003669 immune deficiency disease Diseases 0.000 claims description 2
- 208000014165 immunodeficiency 21 Diseases 0.000 claims description 2
- 208000021646 inflammation of heart layer Diseases 0.000 claims description 2
- 125000004594 isoindolinyl group Chemical group C1(NCC2=CC=CC=C12)* 0.000 claims description 2
- 201000007919 lymphoplasmacytic lymphoma Diseases 0.000 claims description 2
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 2
- 201000006417 multiple sclerosis Diseases 0.000 claims description 2
- 230000003387 muscular Effects 0.000 claims description 2
- 206010028417 myasthenia gravis Diseases 0.000 claims description 2
- 201000002528 pancreatic cancer Diseases 0.000 claims description 2
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 2
- 201000010153 skin papilloma Diseases 0.000 claims description 2
- 208000011834 subacute cutaneous lupus erythematosus Diseases 0.000 claims description 2
- 201000000596 systemic lupus erythematosus Diseases 0.000 claims description 2
- 201000011294 ureter cancer Diseases 0.000 claims description 2
- 201000010717 Bruton-type agammaglobulinemia Diseases 0.000 claims 2
- 208000033014 Plasma cell tumor Diseases 0.000 claims 2
- 208000016349 X-linked agammaglobulinemia Diseases 0.000 claims 2
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 claims 1
- 208000005777 Lupus Nephritis Diseases 0.000 claims 1
- 208000024558 digestive system cancer Diseases 0.000 claims 1
- 201000010231 gastrointestinal system cancer Diseases 0.000 claims 1
- 230000001434 glomerular Effects 0.000 claims 1
- 150000004820 halides Chemical class 0.000 claims 1
- 150000002390 heteroarenes Chemical class 0.000 claims 1
- 208000026278 immune system disease Diseases 0.000 claims 1
- 201000000585 muscular atrophy Diseases 0.000 claims 1
- 238000011127 radiochemotherapy Methods 0.000 claims 1
- 210000000463 red nucleus Anatomy 0.000 claims 1
- 125000005888 tetrahydroindolyl group Chemical group 0.000 claims 1
- 125000005958 tetrahydrothienyl group Chemical group 0.000 claims 1
- 108010068097 Rad51 Recombinase Proteins 0.000 abstract description 33
- 102000001195 RAD51 Human genes 0.000 abstract 1
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 147
- 239000000203 mixture Substances 0.000 description 140
- OKKJLVBELUTLKV-MZCSYVLQSA-N Deuterated methanol Chemical compound [2H]OC([2H])([2H])[2H] OKKJLVBELUTLKV-MZCSYVLQSA-N 0.000 description 88
- 230000015572 biosynthetic process Effects 0.000 description 74
- 238000003786 synthesis reaction Methods 0.000 description 72
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 66
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 62
- 235000019439 ethyl acetate Nutrition 0.000 description 59
- 125000000437 thiazol-2-yl group Chemical group [H]C1=C([H])N=C(*)S1 0.000 description 57
- OVPLZYJGTGDFNB-UHFFFAOYSA-N propan-2-yl carbamate Chemical compound CC(C)OC(N)=O OVPLZYJGTGDFNB-UHFFFAOYSA-N 0.000 description 49
- 239000000543 intermediate Substances 0.000 description 41
- 239000000243 solution Substances 0.000 description 39
- 239000007787 solid Substances 0.000 description 36
- 125000004496 thiazol-5-yl group Chemical group S1C=NC=C1* 0.000 description 35
- 239000003208 petroleum Substances 0.000 description 33
- 102000002490 Rad51 Recombinase Human genes 0.000 description 32
- YMWUJEATGCHHMB-UHFFFAOYSA-N dichloromethane Natural products ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 31
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 30
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 30
- 239000011734 sodium Substances 0.000 description 29
- 239000002585 base Substances 0.000 description 28
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 26
- 239000007832 Na2SO4 Substances 0.000 description 24
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 24
- 238000006243 chemical reaction Methods 0.000 description 24
- 229910052938 sodium sulfate Inorganic materials 0.000 description 24
- 235000011152 sodium sulphate Nutrition 0.000 description 24
- 239000012044 organic layer Substances 0.000 description 23
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 23
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 21
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 21
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 21
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 20
- 229910004298 SiO 2 Inorganic materials 0.000 description 19
- 239000003795 chemical substances by application Substances 0.000 description 19
- 125000001424 substituent group Chemical group 0.000 description 19
- 229920006395 saturated elastomer Polymers 0.000 description 18
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 17
- 230000005782 double-strand break Effects 0.000 description 17
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 16
- 230000003211 malignant effect Effects 0.000 description 16
- 102000004169 proteins and genes Human genes 0.000 description 16
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 15
- 238000004440 column chromatography Methods 0.000 description 15
- 239000012074 organic phase Substances 0.000 description 15
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 14
- 239000002609 medium Substances 0.000 description 14
- 230000033607 mismatch repair Effects 0.000 description 14
- 238000002953 preparative HPLC Methods 0.000 description 14
- 238000011282 treatment Methods 0.000 description 14
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 13
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 13
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 13
- WYURNTSHIVDZCO-UHFFFAOYSA-N tetrahydrofuran Substances C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 13
- 108700031745 MutS Homolog 2 Proteins 0.000 description 12
- 230000030833 cell death Effects 0.000 description 12
- 239000012071 phase Substances 0.000 description 12
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 11
- 208000008051 Hereditary Nonpolyposis Colorectal Neoplasms Diseases 0.000 description 11
- 241000282414 Homo sapiens Species 0.000 description 11
- 102000053129 MutS Homolog 2 Human genes 0.000 description 11
- 239000000460 chlorine Substances 0.000 description 11
- 230000014509 gene expression Effects 0.000 description 11
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 11
- VYPYMYPTXKWEEN-UHFFFAOYSA-N oxetan-3-ylcarbamic acid Chemical compound OC(=O)NC1COC1 VYPYMYPTXKWEEN-UHFFFAOYSA-N 0.000 description 11
- 230000008439 repair process Effects 0.000 description 11
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 10
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 10
- 239000000427 antigen Substances 0.000 description 10
- 108091007433 antigens Proteins 0.000 description 10
- 102000036639 antigens Human genes 0.000 description 10
- 238000003556 assay Methods 0.000 description 10
- 150000002148 esters Chemical class 0.000 description 10
- 239000003921 oil Substances 0.000 description 10
- 238000003756 stirring Methods 0.000 description 10
- 201000005027 Lynch syndrome Diseases 0.000 description 9
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical class OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 9
- 125000004397 aminosulfonyl group Chemical group NS(=O)(=O)* 0.000 description 9
- 238000012746 preparative thin layer chromatography Methods 0.000 description 9
- 238000004808 supercritical fluid chromatography Methods 0.000 description 9
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 8
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 8
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-dimethylformamide Substances CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 8
- 125000004432 carbon atom Chemical group C* 0.000 description 8
- 125000004093 cyano group Chemical group *C#N 0.000 description 8
- 206010051922 Hereditary non-polyposis colorectal cancer syndrome Diseases 0.000 description 7
- 241000282412 Homo Species 0.000 description 7
- 208000009956 adenocarcinoma Diseases 0.000 description 7
- 238000012217 deletion Methods 0.000 description 7
- 230000037430 deletion Effects 0.000 description 7
- 239000007788 liquid Substances 0.000 description 7
- 239000011541 reaction mixture Substances 0.000 description 7
- 230000000405 serological effect Effects 0.000 description 7
- 235000017550 sodium carbonate Nutrition 0.000 description 7
- 229910000029 sodium carbonate Inorganic materials 0.000 description 7
- 229940124530 sulfonamide Drugs 0.000 description 7
- 150000003456 sulfonamides Chemical class 0.000 description 7
- 238000004809 thin layer chromatography Methods 0.000 description 7
- QHFKWIKCUHNXAU-UHFFFAOYSA-N (4-nitrophenyl) carbamate Chemical compound NC(=O)OC1=CC=C([N+]([O-])=O)C=C1 QHFKWIKCUHNXAU-UHFFFAOYSA-N 0.000 description 6
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 6
- 102100037700 DNA mismatch repair protein Msh3 Human genes 0.000 description 6
- 241001465754 Metazoa Species 0.000 description 6
- 102100038895 Myc proto-oncogene protein Human genes 0.000 description 6
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 150000001412 amines Chemical class 0.000 description 6
- 239000008346 aqueous phase Substances 0.000 description 6
- 239000012267 brine Substances 0.000 description 6
- 238000002474 experimental method Methods 0.000 description 6
- 239000012065 filter cake Substances 0.000 description 6
- 238000002744 homologous recombination Methods 0.000 description 6
- 238000003780 insertion Methods 0.000 description 6
- 230000037431 insertion Effects 0.000 description 6
- 239000000546 pharmaceutical excipient Substances 0.000 description 6
- 230000002829 reductive effect Effects 0.000 description 6
- 230000005783 single-strand break Effects 0.000 description 6
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 6
- LFKDJXLFVYVEFG-UHFFFAOYSA-N tert-butyl carbamate Chemical compound CC(C)(C)OC(N)=O LFKDJXLFVYVEFG-UHFFFAOYSA-N 0.000 description 6
- 101001027762 Homo sapiens DNA mismatch repair protein Msh3 Proteins 0.000 description 5
- 101100395211 Trichoderma harzianum his3 gene Proteins 0.000 description 5
- 125000003545 alkoxy group Chemical group 0.000 description 5
- 239000000872 buffer Substances 0.000 description 5
- 230000007547 defect Effects 0.000 description 5
- 230000012361 double-strand break repair Effects 0.000 description 5
- 230000037433 frameshift Effects 0.000 description 5
- 238000007429 general method Methods 0.000 description 5
- 230000006801 homologous recombination Effects 0.000 description 5
- 230000005764 inhibitory process Effects 0.000 description 5
- 229910052757 nitrogen Inorganic materials 0.000 description 5
- 125000001981 tert-butyldimethylsilyl group Chemical group [H]C([H])([H])[Si]([H])(C([H])([H])[H])[*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 5
- 229940124597 therapeutic agent Drugs 0.000 description 5
- RKEYKDXXZCICFZ-UHFFFAOYSA-N 5-hydroxypipecolic acid Chemical compound OC1CCC(C(O)=O)NC1 RKEYKDXXZCICFZ-UHFFFAOYSA-N 0.000 description 4
- WNLCRBMIFGIKSW-LJGSYFOKSA-N BrC1=CN=C(S1)[C@@H]1CC[C@H](CC1)N Chemical compound BrC1=CN=C(S1)[C@@H]1CC[C@H](CC1)N WNLCRBMIFGIKSW-LJGSYFOKSA-N 0.000 description 4
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 4
- 208000017095 Hereditary nonpolyposis colon cancer Diseases 0.000 description 4
- 101000601724 Homo sapiens Paired box protein Pax-5 Proteins 0.000 description 4
- 102000008071 Mismatch Repair Endonuclease PMS2 Human genes 0.000 description 4
- 108010074346 Mismatch Repair Endonuclease PMS2 Proteins 0.000 description 4
- 102100037504 Paired box protein Pax-5 Human genes 0.000 description 4
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 4
- 241000700605 Viruses Species 0.000 description 4
- 125000002619 bicyclic group Chemical group 0.000 description 4
- GTCAXTIRRLKXRU-UHFFFAOYSA-N carbamic acid methyl ester Natural products COC(N)=O GTCAXTIRRLKXRU-UHFFFAOYSA-N 0.000 description 4
- 229960004316 cisplatin Drugs 0.000 description 4
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 4
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 4
- 150000002430 hydrocarbons Chemical group 0.000 description 4
- 150000003840 hydrochlorides Chemical class 0.000 description 4
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 4
- 230000002401 inhibitory effect Effects 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 238000001990 intravenous administration Methods 0.000 description 4
- 201000001441 melanoma Diseases 0.000 description 4
- 230000000869 mutational effect Effects 0.000 description 4
- XBXCNNQPRYLIDE-UHFFFAOYSA-M n-tert-butylcarbamate Chemical compound CC(C)(C)NC([O-])=O XBXCNNQPRYLIDE-UHFFFAOYSA-M 0.000 description 4
- 239000012299 nitrogen atmosphere Substances 0.000 description 4
- 108020004707 nucleic acids Proteins 0.000 description 4
- 102000039446 nucleic acids Human genes 0.000 description 4
- 150000007523 nucleic acids Chemical class 0.000 description 4
- 230000035699 permeability Effects 0.000 description 4
- 238000000746 purification Methods 0.000 description 4
- 125000006413 ring segment Chemical group 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- 230000005945 translocation Effects 0.000 description 4
- YQOLEILXOBUDMU-KRWDZBQOSA-N (4R)-5-[(6-bromo-3-methyl-2-pyrrolidin-1-ylquinoline-4-carbonyl)amino]-4-(2-chlorophenyl)pentanoic acid Chemical compound CC1=C(C2=C(C=CC(=C2)Br)N=C1N3CCCC3)C(=O)NC[C@H](CCC(=O)O)C4=CC=CC=C4Cl YQOLEILXOBUDMU-KRWDZBQOSA-N 0.000 description 3
- OGKGGBNPVRGQQN-UHFFFAOYSA-N 2-bromo-5-nitrobenzenesulfonyl chloride Chemical compound [O-][N+](=O)C1=CC=C(Br)C(S(Cl)(=O)=O)=C1 OGKGGBNPVRGQQN-UHFFFAOYSA-N 0.000 description 3
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 3
- OTLNPYWUJOZPPA-UHFFFAOYSA-N 4-nitrobenzoic acid Chemical compound OC(=O)C1=CC=C([N+]([O-])=O)C=C1 OTLNPYWUJOZPPA-UHFFFAOYSA-N 0.000 description 3
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 3
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 3
- 102000012758 APOBEC-1 Deaminase Human genes 0.000 description 3
- 108010079649 APOBEC-1 Deaminase Proteins 0.000 description 3
- 102100021631 B-cell lymphoma 6 protein Human genes 0.000 description 3
- 102100022976 B-cell lymphoma/leukemia 11A Human genes 0.000 description 3
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 3
- KHBQMWCZKVMBLN-UHFFFAOYSA-N Benzenesulfonamide Chemical compound NS(=O)(=O)C1=CC=CC=C1 KHBQMWCZKVMBLN-UHFFFAOYSA-N 0.000 description 3
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 3
- 208000005243 Chondrosarcoma Diseases 0.000 description 3
- 208000037051 Chromosomal Instability Diseases 0.000 description 3
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 3
- 102100025877 Complement component C1q receptor Human genes 0.000 description 3
- 102100028843 DNA mismatch repair protein Mlh1 Human genes 0.000 description 3
- 102100027829 DNA repair protein XRCC3 Human genes 0.000 description 3
- 238000011346 DNA-damaging therapy Methods 0.000 description 3
- 201000008808 Fibrosarcoma Diseases 0.000 description 3
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 101000971234 Homo sapiens B-cell lymphoma 6 protein Proteins 0.000 description 3
- 101000903703 Homo sapiens B-cell lymphoma/leukemia 11A Proteins 0.000 description 3
- 101000933665 Homo sapiens Complement component C1q receptor Proteins 0.000 description 3
- 101001064870 Homo sapiens Lon protease homolog, mitochondrial Proteins 0.000 description 3
- 101001030211 Homo sapiens Myc proto-oncogene protein Proteins 0.000 description 3
- 101000595531 Homo sapiens Serine/threonine-protein kinase pim-1 Proteins 0.000 description 3
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 3
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 3
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 3
- 241000699670 Mus sp. Species 0.000 description 3
- 108010026664 MutL Protein Homolog 1 Proteins 0.000 description 3
- 101710135898 Myc proto-oncogene protein Proteins 0.000 description 3
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 3
- 238000003559 RNA-seq method Methods 0.000 description 3
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 3
- 102100036077 Serine/threonine-protein kinase pim-1 Human genes 0.000 description 3
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 3
- DHXVGJBLRPWPCS-UHFFFAOYSA-N Tetrahydropyran Chemical compound C1CCOCC1 DHXVGJBLRPWPCS-UHFFFAOYSA-N 0.000 description 3
- 101710150448 Transcriptional regulator Myc Proteins 0.000 description 3
- 108010074310 X-ray repair cross complementing protein 3 Proteins 0.000 description 3
- 125000003342 alkenyl group Chemical group 0.000 description 3
- 125000002947 alkylene group Chemical group 0.000 description 3
- 238000003491 array Methods 0.000 description 3
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 235000013877 carbamide Nutrition 0.000 description 3
- 230000003197 catalytic effect Effects 0.000 description 3
- 238000004113 cell culture Methods 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 210000001072 colon Anatomy 0.000 description 3
- 229940127573 compound 38 Drugs 0.000 description 3
- 229940125844 compound 46 Drugs 0.000 description 3
- 230000002950 deficient Effects 0.000 description 3
- WVYXNIXAMZOZFK-UHFFFAOYSA-N diaziquone Chemical compound O=C1C(NC(=O)OCC)=C(N2CC2)C(=O)C(NC(=O)OCC)=C1N1CC1 WVYXNIXAMZOZFK-UHFFFAOYSA-N 0.000 description 3
- 239000006185 dispersion Substances 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 238000001704 evaporation Methods 0.000 description 3
- 230000008020 evaporation Effects 0.000 description 3
- 238000002509 fluorescent in situ hybridization Methods 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 230000002496 gastric effect Effects 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- 229910052739 hydrogen Inorganic materials 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 230000028993 immune response Effects 0.000 description 3
- 210000000987 immune system Anatomy 0.000 description 3
- 230000000415 inactivating effect Effects 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 231100000518 lethal Toxicity 0.000 description 3
- 230000001665 lethal effect Effects 0.000 description 3
- 210000001853 liver microsome Anatomy 0.000 description 3
- 208000003747 lymphoid leukemia Diseases 0.000 description 3
- 108020004999 messenger RNA Proteins 0.000 description 3
- 125000006626 methoxycarbonylamino group Chemical group 0.000 description 3
- RRIWSQXXBIFKQM-UHFFFAOYSA-M n-benzylcarbamate Chemical compound [O-]C(=O)NCC1=CC=CC=C1 RRIWSQXXBIFKQM-UHFFFAOYSA-M 0.000 description 3
- 239000002773 nucleotide Substances 0.000 description 3
- 125000003729 nucleotide group Chemical group 0.000 description 3
- PIDFDZJZLOTZTM-KHVQSSSXSA-N ombitasvir Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@H]1C(=O)NC1=CC=C([C@H]2N([C@@H](CC2)C=2C=CC(NC(=O)[C@H]3N(CCC3)C(=O)[C@@H](NC(=O)OC)C(C)C)=CC=2)C=2C=CC(=CC=2)C(C)(C)C)C=C1 PIDFDZJZLOTZTM-KHVQSSSXSA-N 0.000 description 3
- 238000007911 parenteral administration Methods 0.000 description 3
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 3
- JMIDSOKOEHWPQW-UHFFFAOYSA-N piperidin-4-ylmethyl carbamate Chemical compound NC(=O)OCC1CCNCC1 JMIDSOKOEHWPQW-UHFFFAOYSA-N 0.000 description 3
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 3
- 230000003389 potentiating effect Effects 0.000 description 3
- 239000003755 preservative agent Substances 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 3
- 239000000523 sample Substances 0.000 description 3
- 238000010898 silica gel chromatography Methods 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 3
- 125000003507 tetrahydrothiofenyl group Chemical group 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- ASGMFNBUXDJWJJ-JLCFBVMHSA-N (1R,3R)-3-[[3-bromo-1-[4-(5-methyl-1,3,4-thiadiazol-2-yl)phenyl]pyrazolo[3,4-d]pyrimidin-6-yl]amino]-N,1-dimethylcyclopentane-1-carboxamide Chemical compound BrC1=NN(C2=NC(=NC=C21)N[C@H]1C[C@@](CC1)(C(=O)NC)C)C1=CC=C(C=C1)C=1SC(=NN=1)C ASGMFNBUXDJWJJ-JLCFBVMHSA-N 0.000 description 2
- AOSZTAHDEDLTLQ-AZKQZHLXSA-N (1S,2S,4R,8S,9S,11S,12R,13S,19S)-6-[(3-chlorophenyl)methyl]-12,19-difluoro-11-hydroxy-8-(2-hydroxyacetyl)-9,13-dimethyl-6-azapentacyclo[10.8.0.02,9.04,8.013,18]icosa-14,17-dien-16-one Chemical compound C([C@@H]1C[C@H]2[C@H]3[C@]([C@]4(C=CC(=O)C=C4[C@@H](F)C3)C)(F)[C@@H](O)C[C@@]2([C@@]1(C1)C(=O)CO)C)N1CC1=CC=CC(Cl)=C1 AOSZTAHDEDLTLQ-AZKQZHLXSA-N 0.000 description 2
- GHYOCDFICYLMRF-UTIIJYGPSA-N (2S,3R)-N-[(2S)-3-(cyclopenten-1-yl)-1-[(2R)-2-methyloxiran-2-yl]-1-oxopropan-2-yl]-3-hydroxy-3-(4-methoxyphenyl)-2-[[(2S)-2-[(2-morpholin-4-ylacetyl)amino]propanoyl]amino]propanamide Chemical compound C1(=CCCC1)C[C@@H](C(=O)[C@@]1(OC1)C)NC([C@H]([C@@H](C1=CC=C(C=C1)OC)O)NC([C@H](C)NC(CN1CCOCC1)=O)=O)=O GHYOCDFICYLMRF-UTIIJYGPSA-N 0.000 description 2
- IUSARDYWEPUTPN-OZBXUNDUSA-N (2r)-n-[(2s,3r)-4-[[(4s)-6-(2,2-dimethylpropyl)spiro[3,4-dihydropyrano[2,3-b]pyridine-2,1'-cyclobutane]-4-yl]amino]-3-hydroxy-1-[3-(1,3-thiazol-2-yl)phenyl]butan-2-yl]-2-methoxypropanamide Chemical compound C([C@H](NC(=O)[C@@H](C)OC)[C@H](O)CN[C@@H]1C2=CC(CC(C)(C)C)=CN=C2OC2(CCC2)C1)C(C=1)=CC=CC=1C1=NC=CS1 IUSARDYWEPUTPN-OZBXUNDUSA-N 0.000 description 2
- OWALAMKTKVXDJL-LTHGFNDWSA-N (3R,4R,5R)-2-(6-amino-7H-purin-2-yl)-3-fluorooxane-3,4,5-triol Chemical compound N=1C=2N=CNC=2C(N)=NC=1C1OC[C@@H](O)[C@@H](O)[C@@]1(O)F OWALAMKTKVXDJL-LTHGFNDWSA-N 0.000 description 2
- NXLNNXIXOYSCMB-UHFFFAOYSA-N (4-nitrophenyl) carbonochloridate Chemical compound [O-][N+](=O)C1=CC=C(OC(Cl)=O)C=C1 NXLNNXIXOYSCMB-UHFFFAOYSA-N 0.000 description 2
- 125000006274 (C1-C3)alkoxy group Chemical group 0.000 description 2
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 2
- KNTZCGBYFGEMFR-UHFFFAOYSA-N (propan-2-ylazaniumyl)formate Chemical compound CC(C)NC(O)=O KNTZCGBYFGEMFR-UHFFFAOYSA-N 0.000 description 2
- HUCDRECCONJQHA-UHFFFAOYSA-N 1-[3-(tert-butylsulfamoyl)-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)phenyl]-3-(pyridin-2-ylmethyl)urea Chemical compound C(C)(C)(C)NS(=O)(=O)C=1C=C(C=CC=1B1OC(C(O1)(C)C)(C)C)NC(=O)NCC1=NC=CC=C1 HUCDRECCONJQHA-UHFFFAOYSA-N 0.000 description 2
- UNILWMWFPHPYOR-KXEYIPSPSA-M 1-[6-[2-[3-[3-[3-[2-[2-[3-[[2-[2-[[(2r)-1-[[2-[[(2r)-1-[3-[2-[2-[3-[[2-(2-amino-2-oxoethoxy)acetyl]amino]propoxy]ethoxy]ethoxy]propylamino]-3-hydroxy-1-oxopropan-2-yl]amino]-2-oxoethyl]amino]-3-[(2r)-2,3-di(hexadecanoyloxy)propyl]sulfanyl-1-oxopropan-2-yl Chemical compound O=C1C(SCCC(=O)NCCCOCCOCCOCCCNC(=O)COCC(=O)N[C@@H](CSC[C@@H](COC(=O)CCCCCCCCCCCCCCC)OC(=O)CCCCCCCCCCCCCCC)C(=O)NCC(=O)N[C@H](CO)C(=O)NCCCOCCOCCOCCCNC(=O)COCC(N)=O)CC(=O)N1CCNC(=O)CCCCCN\1C2=CC=C(S([O-])(=O)=O)C=C2CC/1=C/C=C/C=C/C1=[N+](CC)C2=CC=C(S([O-])(=O)=O)C=C2C1 UNILWMWFPHPYOR-KXEYIPSPSA-M 0.000 description 2
- LWWGTPJWGYWBSY-UHFFFAOYSA-N 1-benzyl-3-[4-(2-bromo-1,3-thiazol-5-yl)-3-(tert-butylsulfamoyl)phenyl]urea Chemical compound C(C1=CC=CC=C1)NC(=O)NC1=CC(=C(C=C1)C1=CN=C(S1)Br)S(NC(C)(C)C)(=O)=O LWWGTPJWGYWBSY-UHFFFAOYSA-N 0.000 description 2
- SBQITYFGDYPTTI-UHFFFAOYSA-N 2-(3,6-dihydro-2H-pyran-2-yl)-1,3-thiazole Chemical compound O1C(CC=CC1)C=1SC=CN=1 SBQITYFGDYPTTI-UHFFFAOYSA-N 0.000 description 2
- NJDQOHQIXKZDPU-UHFFFAOYSA-N 2-(5-azidooxan-2-yl)-1,3-thiazole Chemical compound N(=[N+]=[N-])C1CCC(OC1)C=1SC=CN=1 NJDQOHQIXKZDPU-UHFFFAOYSA-N 0.000 description 2
- LDTHXGVTMLBBER-UHFFFAOYSA-N 2-O-benzyl 1-O-tert-butyl 5-hydroxypiperidine-1,2-dicarboxylate Chemical compound C(C1=CC=CC=C1)OC(=O)C1N(CC(CC1)O)C(=O)OC(C)(C)C LDTHXGVTMLBBER-UHFFFAOYSA-N 0.000 description 2
- IQHSSYROJYPFDV-UHFFFAOYSA-N 2-bromo-1,3-dichloro-5-(trifluoromethyl)benzene Chemical group FC(F)(F)C1=CC(Cl)=C(Br)C(Cl)=C1 IQHSSYROJYPFDV-UHFFFAOYSA-N 0.000 description 2
- FYYYQOOJNNIWOI-UHFFFAOYSA-N 2-bromo-N-(1-hydroxy-2-methylpropan-2-yl)-5-nitrobenzenesulfonamide Chemical compound BrC1=C(C=C(C=C1)[N+](=O)[O-])S(=O)(=O)NC(CO)(C)C FYYYQOOJNNIWOI-UHFFFAOYSA-N 0.000 description 2
- 125000004198 2-fluorophenyl group Chemical group [H]C1=C([H])C(F)=C(*)C([H])=C1[H] 0.000 description 2
- GSLTVFIVJMCNBH-UHFFFAOYSA-N 2-isocyanatopropane Chemical compound CC(C)N=C=O GSLTVFIVJMCNBH-UHFFFAOYSA-N 0.000 description 2
- MSXVEPNJUHWQHW-UHFFFAOYSA-N 2-methylbutan-2-ol Chemical compound CCC(C)(C)O MSXVEPNJUHWQHW-UHFFFAOYSA-N 0.000 description 2
- BEETZOYEGNNBAS-UHFFFAOYSA-N 3-methoxypyridine-2-carbonitrile Chemical compound COC1=CC=CN=C1C#N BEETZOYEGNNBAS-UHFFFAOYSA-N 0.000 description 2
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 2
- RQJDUEKERVZLLU-UHFFFAOYSA-N 4-Hydroxybenzylamine Chemical compound NCC1=CC=C(O)C=C1 RQJDUEKERVZLLU-UHFFFAOYSA-N 0.000 description 2
- 125000004203 4-hydroxyphenyl group Chemical group [H]OC1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 2
- NMUSYJAQQFHJEW-UHFFFAOYSA-N 5-Azacytidine Natural products O=C1N=C(N)N=CN1C1C(O)C(O)C(CO)O1 NMUSYJAQQFHJEW-UHFFFAOYSA-N 0.000 description 2
- RYYCJUAHISIHTL-UHFFFAOYSA-N 5-azaorotic acid Chemical compound OC(=O)C1=NC(=O)NC(=O)N1 RYYCJUAHISIHTL-UHFFFAOYSA-N 0.000 description 2
- GDUANFXPOZTYKS-UHFFFAOYSA-N 6-bromo-8-[(2,6-difluoro-4-methoxybenzoyl)amino]-4-oxochromene-2-carboxylic acid Chemical compound FC1=CC(OC)=CC(F)=C1C(=O)NC1=CC(Br)=CC2=C1OC(C(O)=O)=CC2=O GDUANFXPOZTYKS-UHFFFAOYSA-N 0.000 description 2
- 241001251200 Agelas Species 0.000 description 2
- 206010003571 Astrocytoma Diseases 0.000 description 2
- 208000003950 B-cell lymphoma Diseases 0.000 description 2
- 108010006654 Bleomycin Proteins 0.000 description 2
- DTYKAKQJMQUIEV-MXVIHJGJSA-N BrC1=CN=C(S1)[C@@H]1CC[C@H](CC1)O[Si](C1=CC=CC=C1)(C1=CC=CC=C1)C(C)(C)C Chemical compound BrC1=CN=C(S1)[C@@H]1CC[C@H](CC1)O[Si](C1=CC=CC=C1)(C1=CC=CC=C1)C(C)(C)C DTYKAKQJMQUIEV-MXVIHJGJSA-N 0.000 description 2
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 2
- KAKZBPTYRLMSJV-UHFFFAOYSA-N Butadiene Chemical compound C=CC=C KAKZBPTYRLMSJV-UHFFFAOYSA-N 0.000 description 2
- QFOHBWFCKVYLES-UHFFFAOYSA-N Butylparaben Chemical compound CCCCOC(=O)C1=CC=C(O)C=C1 QFOHBWFCKVYLES-UHFFFAOYSA-N 0.000 description 2
- OJRUSAPKCPIVBY-KQYNXXCUSA-N C1=NC2=C(N=C(N=C2N1[C@H]3[C@@H]([C@@H]([C@H](O3)COP(=O)(CP(=O)(O)O)O)O)O)I)N Chemical compound C1=NC2=C(N=C(N=C2N1[C@H]3[C@@H]([C@@H]([C@H](O3)COP(=O)(CP(=O)(O)O)O)O)O)I)N OJRUSAPKCPIVBY-KQYNXXCUSA-N 0.000 description 2
- TWDLJMNABUOJEN-UHFFFAOYSA-N CCCCC1=CC=C([N+]([O-])=O)C=C1S(N)(=O)=O Chemical compound CCCCC1=CC=C([N+]([O-])=O)C=C1S(N)(=O)=O TWDLJMNABUOJEN-UHFFFAOYSA-N 0.000 description 2
- 201000000274 Carcinosarcoma Diseases 0.000 description 2
- 229940126657 Compound 17 Drugs 0.000 description 2
- 229940127007 Compound 39 Drugs 0.000 description 2
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 2
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 2
- 108010031325 Cytidine deaminase Proteins 0.000 description 2
- 102000053602 DNA Human genes 0.000 description 2
- 244000166102 Eucalyptus leucoxylon Species 0.000 description 2
- 235000004694 Eucalyptus leucoxylon Nutrition 0.000 description 2
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 208000005234 Granulosa Cell Tumor Diseases 0.000 description 2
- 208000017604 Hodgkin disease Diseases 0.000 description 2
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 2
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 2
- 108060003951 Immunoglobulin Proteins 0.000 description 2
- RMOUBSOVHSONPZ-UHFFFAOYSA-N Isopropyl formate Chemical compound CC(C)OC=O RMOUBSOVHSONPZ-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 2
- 208000028018 Lymphocytic leukaemia Diseases 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 2
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 2
- 241000699660 Mus musculus Species 0.000 description 2
- ZRKWMRDKSOPRRS-UHFFFAOYSA-N N-Methyl-N-nitrosourea Chemical compound O=NN(C)C(N)=O ZRKWMRDKSOPRRS-UHFFFAOYSA-N 0.000 description 2
- XSQDAFWQWINGDK-UHFFFAOYSA-N N-[4-(2-bromo-1,3-thiazol-5-yl)-3-(tert-butylsulfamoyl)phenyl]acetamide Chemical compound BrC=1SC(=CN=1)C1=C(C=C(C=C1)NC(C)=O)S(NC(C)(C)C)(=O)=O XSQDAFWQWINGDK-UHFFFAOYSA-N 0.000 description 2
- 201000010133 Oligodendroglioma Diseases 0.000 description 2
- 206010061332 Paraganglion neoplasm Diseases 0.000 description 2
- 108010057150 Peplomycin Proteins 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 206010070834 Sensitisation Diseases 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- FOCVUCIESVLUNU-UHFFFAOYSA-N Thiotepa Chemical compound C1CN1P(N1CC1)(=S)N1CC1 FOCVUCIESVLUNU-UHFFFAOYSA-N 0.000 description 2
- 241000009298 Trigla lyra Species 0.000 description 2
- PSLUFJFHTBIXMW-WYEYVKMPSA-N [(3r,4ar,5s,6s,6as,10s,10ar,10bs)-3-ethenyl-10,10b-dihydroxy-3,4a,7,7,10a-pentamethyl-1-oxo-6-(2-pyridin-2-ylethylcarbamoyloxy)-5,6,6a,8,9,10-hexahydro-2h-benzo[f]chromen-5-yl] acetate Chemical compound O([C@@H]1[C@@H]([C@]2(O[C@](C)(CC(=O)[C@]2(O)[C@@]2(C)[C@@H](O)CCC(C)(C)[C@@H]21)C=C)C)OC(=O)C)C(=O)NCCC1=CC=CC=N1 PSLUFJFHTBIXMW-WYEYVKMPSA-N 0.000 description 2
- RZBCLYNNBGMPFP-UHFFFAOYSA-N [1-[5-[4-(benzylcarbamoylamino)-2-(tert-butylsulfamoyl)phenyl]-1,3-thiazol-2-yl]piperidin-4-yl] N-propan-2-ylcarbamate Chemical compound C(C)(C)NC(OC1CCN(CC1)C=1SC(=CN=1)C1=C(C=C(C=C1)NC(NCC1=CC=CC=C1)=O)S(NC(C)(C)C)(=O)=O)=O RZBCLYNNBGMPFP-UHFFFAOYSA-N 0.000 description 2
- IBDWZOSBKPETLX-UHFFFAOYSA-N [6-(1,3-thiazol-2-yl)oxan-3-yl] methanesulfonate Chemical compound CS(=O)(=O)OC1COC(CC1)C=1SC=CN=1 IBDWZOSBKPETLX-UHFFFAOYSA-N 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- ORILYTVJVMAKLC-UHFFFAOYSA-N adamantane Chemical compound C1C(C2)CC3CC1CC2C3 ORILYTVJVMAKLC-UHFFFAOYSA-N 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 125000001931 aliphatic group Chemical group 0.000 description 2
- 230000002707 ameloblastic effect Effects 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 229940045799 anthracyclines and related substance Drugs 0.000 description 2
- 230000000340 anti-metabolite Effects 0.000 description 2
- 229940100197 antimetabolite Drugs 0.000 description 2
- 239000002256 antimetabolite Substances 0.000 description 2
- 229940045719 antineoplastic alkylating agent nitrosoureas Drugs 0.000 description 2
- 125000004566 azetidin-1-yl group Chemical group N1(CCC1)* 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- 230000002457 bidirectional effect Effects 0.000 description 2
- QKSKPIVNLNLAAV-UHFFFAOYSA-N bis(2-chloroethyl) sulfide Chemical compound ClCCSCCCl QKSKPIVNLNLAAV-UHFFFAOYSA-N 0.000 description 2
- 229960001561 bleomycin Drugs 0.000 description 2
- 210000000988 bone and bone Anatomy 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- 210000000481 breast Anatomy 0.000 description 2
- 229960002092 busulfan Drugs 0.000 description 2
- 239000004202 carbamide Substances 0.000 description 2
- 125000006297 carbonyl amino group Chemical group [H]N([*:2])C([*:1])=O 0.000 description 2
- 230000004663 cell proliferation Effects 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 2
- 229960004630 chlorambucil Drugs 0.000 description 2
- 210000000349 chromosome Anatomy 0.000 description 2
- 229940125797 compound 12 Drugs 0.000 description 2
- 229940125758 compound 15 Drugs 0.000 description 2
- 229940125807 compound 37 Drugs 0.000 description 2
- 229940126540 compound 41 Drugs 0.000 description 2
- 238000002425 crystallisation Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 2
- 125000004122 cyclic group Chemical group 0.000 description 2
- 229960004397 cyclophosphamide Drugs 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 239000008121 dextrose Substances 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 230000002327 eosinophilic effect Effects 0.000 description 2
- YJGVMLPVUAXIQN-UHFFFAOYSA-N epipodophyllotoxin Natural products COC1=C(OC)C(OC)=CC(C2C3=CC=4OCOC=4C=C3C(O)C3C2C(OC3)=O)=C1 YJGVMLPVUAXIQN-UHFFFAOYSA-N 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 2
- 229960005420 etoposide Drugs 0.000 description 2
- 230000001747 exhibiting effect Effects 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 239000000796 flavoring agent Substances 0.000 description 2
- 125000001153 fluoro group Chemical group F* 0.000 description 2
- 229960002949 fluorouracil Drugs 0.000 description 2
- 235000013355 food flavoring agent Nutrition 0.000 description 2
- 235000003599 food sweetener Nutrition 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 125000001188 haloalkyl group Chemical group 0.000 description 2
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 2
- 239000000833 heterodimer Substances 0.000 description 2
- ZSIAUFGUXNUGDI-UHFFFAOYSA-N hexan-1-ol Chemical compound CCCCCCO ZSIAUFGUXNUGDI-UHFFFAOYSA-N 0.000 description 2
- 238000012165 high-throughput sequencing Methods 0.000 description 2
- 238000009396 hybridization Methods 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 229960001101 ifosfamide Drugs 0.000 description 2
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 2
- 102000018358 immunoglobulin Human genes 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 238000007913 intrathecal administration Methods 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- CFHGBZLNZZVTAY-UHFFFAOYSA-N lawesson's reagent Chemical compound C1=CC(OC)=CC=C1P1(=S)SP(=S)(C=2C=CC(OC)=CC=2)S1 CFHGBZLNZZVTAY-UHFFFAOYSA-N 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 238000001294 liquid chromatography-tandem mass spectrometry Methods 0.000 description 2
- RENRQMCACQEWFC-UGKGYDQZSA-N lnp023 Chemical compound C1([C@H]2N(CC=3C=4C=CNC=4C(C)=CC=3OC)CC[C@@H](C2)OCC)=CC=C(C(O)=O)C=C1 RENRQMCACQEWFC-UGKGYDQZSA-N 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- 201000009020 malignant peripheral nerve sheath tumor Diseases 0.000 description 2
- 229960004961 mechlorethamine Drugs 0.000 description 2
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical compound ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 2
- 229960001924 melphalan Drugs 0.000 description 2
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Natural products C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 description 2
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 229960001156 mitoxantrone Drugs 0.000 description 2
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 208000029974 neurofibrosarcoma Diseases 0.000 description 2
- 201000008968 osteosarcoma Diseases 0.000 description 2
- 229950000193 oteracil Drugs 0.000 description 2
- 230000002611 ovarian Effects 0.000 description 2
- 210000001672 ovary Anatomy 0.000 description 2
- 229960001756 oxaliplatin Drugs 0.000 description 2
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 2
- 125000000636 p-nitrophenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)[N+]([O-])=O 0.000 description 2
- 208000007312 paraganglioma Diseases 0.000 description 2
- QIMGFXOHTOXMQP-GFAGFCTOSA-N peplomycin Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCCN[C@@H](C)C=1C=CC=CC=1)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1NC=NC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C QIMGFXOHTOXMQP-GFAGFCTOSA-N 0.000 description 2
- 229950003180 peplomycin Drugs 0.000 description 2
- 229940124531 pharmaceutical excipient Drugs 0.000 description 2
- 210000004180 plasmocyte Anatomy 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- XOJVVFBFDXDTEG-UHFFFAOYSA-N pristane Chemical compound CC(C)CCCC(C)CCCC(C)CCCC(C)C XOJVVFBFDXDTEG-UHFFFAOYSA-N 0.000 description 2
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 2
- 229960000624 procarbazine Drugs 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- LYMGWQBDAZOXDB-UHFFFAOYSA-N propan-2-yl 4-[5-[2-(tert-butylsulfamoyl)-4-(phenylmethoxycarbonylamino)phenyl]-1,3-thiazol-2-yl]piperazine-1-carboxylate Chemical compound C(C1=CC=CC=C1)OC(=O)NC1=CC(=C(C=C1)C1=CN=C(S1)N1CCN(CC1)C(=O)OC(C)C)S(NC(C)(C)C)(=O)=O LYMGWQBDAZOXDB-UHFFFAOYSA-N 0.000 description 2
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 2
- 230000008707 rearrangement Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 230000008313 sensitization Effects 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 230000003007 single stranded DNA break Effects 0.000 description 2
- 210000003491 skin Anatomy 0.000 description 2
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 2
- 235000010265 sodium sulphite Nutrition 0.000 description 2
- 230000000392 somatic effect Effects 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-N succinic acid Chemical compound OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 2
- 229910052717 sulfur Inorganic materials 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 239000003765 sweetening agent Substances 0.000 description 2
- 229960001278 teniposide Drugs 0.000 description 2
- CKXZPVPIDOJLLM-UHFFFAOYSA-N tert-butyl n-piperidin-4-ylcarbamate Chemical compound CC(C)(C)OC(=O)NC1CCNCC1 CKXZPVPIDOJLLM-UHFFFAOYSA-N 0.000 description 2
- 125000000037 tert-butyldiphenylsilyl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1[Si]([H])([*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 2
- 125000003831 tetrazolyl group Chemical group 0.000 description 2
- 229960001196 thiotepa Drugs 0.000 description 2
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- 238000011830 transgenic mouse model Methods 0.000 description 2
- QAEDZJGFFMLHHQ-UHFFFAOYSA-N trifluoroacetic anhydride Chemical compound FC(F)(F)C(=O)OC(=O)C(F)(F)F QAEDZJGFFMLHHQ-UHFFFAOYSA-N 0.000 description 2
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 2
- 238000010792 warming Methods 0.000 description 2
- 239000003643 water by type Substances 0.000 description 2
- CXNIUSPIQKWYAI-UHFFFAOYSA-N xantphos Chemical compound C=12OC3=C(P(C=4C=CC=CC=4)C=4C=CC=CC=4)C=CC=C3C(C)(C)C2=CC=CC=1P(C=1C=CC=CC=1)C1=CC=CC=C1 CXNIUSPIQKWYAI-UHFFFAOYSA-N 0.000 description 2
- UAOUIVVJBYDFKD-XKCDOFEDSA-N (1R,9R,10S,11R,12R,15S,18S,21R)-10,11,21-trihydroxy-8,8-dimethyl-14-methylidene-4-(prop-2-enylamino)-20-oxa-5-thia-3-azahexacyclo[9.7.2.112,15.01,9.02,6.012,18]henicosa-2(6),3-dien-13-one Chemical compound C([C@@H]1[C@@H](O)[C@@]23C(C1=C)=O)C[C@H]2[C@]12C(N=C(NCC=C)S4)=C4CC(C)(C)[C@H]1[C@H](O)[C@]3(O)OC2 UAOUIVVJBYDFKD-XKCDOFEDSA-N 0.000 description 1
- AILYJCHMDSZEOL-VGMFFHCQSA-N (1S)-1-phenylethanol Chemical compound C1(=CC=CC=C1)[C@H](C)O.C1(=CC=CC=C1)[C@H](C)O AILYJCHMDSZEOL-VGMFFHCQSA-N 0.000 description 1
- ABJSOROVZZKJGI-OCYUSGCXSA-N (1r,2r,4r)-2-(4-bromophenyl)-n-[(4-chlorophenyl)-(2-fluoropyridin-4-yl)methyl]-4-morpholin-4-ylcyclohexane-1-carboxamide Chemical compound C1=NC(F)=CC(C(NC(=O)[C@H]2[C@@H](C[C@@H](CC2)N2CCOCC2)C=2C=CC(Br)=CC=2)C=2C=CC(Cl)=CC=2)=C1 ABJSOROVZZKJGI-OCYUSGCXSA-N 0.000 description 1
- AAFJXZWCNVJTMK-GUCUJZIJSA-N (1s,2r)-1-[(2s)-oxiran-2-yl]-2-[(2r)-oxiran-2-yl]ethane-1,2-diol Chemical compound C([C@@H]1[C@H](O)[C@H](O)[C@H]2OC2)O1 AAFJXZWCNVJTMK-GUCUJZIJSA-N 0.000 description 1
- SZUVGFMDDVSKSI-WIFOCOSTSA-N (1s,2s,3s,5r)-1-(carboxymethyl)-3,5-bis[(4-phenoxyphenyl)methyl-propylcarbamoyl]cyclopentane-1,2-dicarboxylic acid Chemical compound O=C([C@@H]1[C@@H]([C@](CC(O)=O)([C@H](C(=O)N(CCC)CC=2C=CC(OC=3C=CC=CC=3)=CC=2)C1)C(O)=O)C(O)=O)N(CCC)CC(C=C1)=CC=C1OC1=CC=CC=C1 SZUVGFMDDVSKSI-WIFOCOSTSA-N 0.000 description 1
- QEHXDOJPVIHUDO-UHFFFAOYSA-N (2-fluorophenyl)methanol Chemical compound OCC1=CC=CC=C1F QEHXDOJPVIHUDO-UHFFFAOYSA-N 0.000 description 1
- GCTFTMWXZFLTRR-GFCCVEGCSA-N (2r)-2-amino-n-[3-(difluoromethoxy)-4-(1,3-oxazol-5-yl)phenyl]-4-methylpentanamide Chemical compound FC(F)OC1=CC(NC(=O)[C@H](N)CC(C)C)=CC=C1C1=CN=CO1 GCTFTMWXZFLTRR-GFCCVEGCSA-N 0.000 description 1
- STBLNCCBQMHSRC-BATDWUPUSA-N (2s)-n-[(3s,4s)-5-acetyl-7-cyano-4-methyl-1-[(2-methylnaphthalen-1-yl)methyl]-2-oxo-3,4-dihydro-1,5-benzodiazepin-3-yl]-2-(methylamino)propanamide Chemical compound O=C1[C@@H](NC(=O)[C@H](C)NC)[C@H](C)N(C(C)=O)C2=CC(C#N)=CC=C2N1CC1=C(C)C=CC2=CC=CC=C12 STBLNCCBQMHSRC-BATDWUPUSA-N 0.000 description 1
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 1
- UDQTXCHQKHIQMH-KYGLGHNPSA-N (3ar,5s,6s,7r,7ar)-5-(difluoromethyl)-2-(ethylamino)-5,6,7,7a-tetrahydro-3ah-pyrano[3,2-d][1,3]thiazole-6,7-diol Chemical compound S1C(NCC)=N[C@H]2[C@@H]1O[C@H](C(F)F)[C@@H](O)[C@@H]2O UDQTXCHQKHIQMH-KYGLGHNPSA-N 0.000 description 1
- HUWSZNZAROKDRZ-RRLWZMAJSA-N (3r,4r)-3-azaniumyl-5-[[(2s,3r)-1-[(2s)-2,3-dicarboxypyrrolidin-1-yl]-3-methyl-1-oxopentan-2-yl]amino]-5-oxo-4-sulfanylpentane-1-sulfonate Chemical compound OS(=O)(=O)CC[C@@H](N)[C@@H](S)C(=O)N[C@@H]([C@H](C)CC)C(=O)N1CCC(C(O)=O)[C@H]1C(O)=O HUWSZNZAROKDRZ-RRLWZMAJSA-N 0.000 description 1
- ZEPBRCCLUJOLFB-UHFFFAOYSA-N (4-carbamoyl-1-bicyclo[2.2.2]octanyl) N-propan-2-ylcarbamate Chemical compound C(C)(C)NC(OC12CCC(CC1)(CC2)C(N)=O)=O ZEPBRCCLUJOLFB-UHFFFAOYSA-N 0.000 description 1
- GMCGGPBQDKOUCV-UHFFFAOYSA-N (4-methyl-1-bicyclo[2.2.2]octanyl) N-propan-2-ylcarbamate Chemical compound CC(C)NC(=O)OC12CCC(C)(CC1)CC2 GMCGGPBQDKOUCV-UHFFFAOYSA-N 0.000 description 1
- OIIOPWHTJZYKIL-PMACEKPBSA-N (5S)-5-[[[5-[2-chloro-3-[2-chloro-3-[6-methoxy-5-[[[(2S)-5-oxopyrrolidin-2-yl]methylamino]methyl]pyrazin-2-yl]phenyl]phenyl]-3-methoxypyrazin-2-yl]methylamino]methyl]pyrrolidin-2-one Chemical compound C1(=C(N=C(C2=C(C(C3=CC=CC(=C3Cl)C3=NC(OC)=C(N=C3)CNC[C@H]3NC(=O)CC3)=CC=C2)Cl)C=N1)OC)CNC[C@H]1NC(=O)CC1 OIIOPWHTJZYKIL-PMACEKPBSA-N 0.000 description 1
- YJGVMLPVUAXIQN-LGWHJFRWSA-N (5s,5ar,8ar,9r)-5-hydroxy-9-(3,4,5-trimethoxyphenyl)-5a,6,8a,9-tetrahydro-5h-[2]benzofuro[5,6-f][1,3]benzodioxol-8-one Chemical compound COC1=C(OC)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O)[C@@H]3[C@@H]2C(OC3)=O)=C1 YJGVMLPVUAXIQN-LGWHJFRWSA-N 0.000 description 1
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 1
- ZCZVGQCBSJLDDS-UHFFFAOYSA-N 1,2,3,4-tetrahydro-1,8-naphthyridine Chemical compound C1=CC=C2CCCNC2=N1 ZCZVGQCBSJLDDS-UHFFFAOYSA-N 0.000 description 1
- KQZLRWGGWXJPOS-NLFPWZOASA-N 1-[(1R)-1-(2,4-dichlorophenyl)ethyl]-6-[(4S,5R)-4-[(2S)-2-(hydroxymethyl)pyrrolidin-1-yl]-5-methylcyclohexen-1-yl]pyrazolo[3,4-b]pyrazine-3-carbonitrile Chemical compound ClC1=C(C=CC(=C1)Cl)[C@@H](C)N1N=C(C=2C1=NC(=CN=2)C1=CC[C@@H]([C@@H](C1)C)N1[C@@H](CCC1)CO)C#N KQZLRWGGWXJPOS-NLFPWZOASA-N 0.000 description 1
- OXGVEGCNBSOKCY-UHFFFAOYSA-N 1-[(2-methylpropan-2-yl)oxycarbonyl]-5-(propan-2-yloxycarbonylamino)piperidine-2-carboxylic acid Chemical compound C(C)(C)(C)OC(=O)N1C(CCC(C1)NC(=O)OC(C)C)C(=O)O OXGVEGCNBSOKCY-UHFFFAOYSA-N 0.000 description 1
- RMPQAVQRJOJFKF-UHFFFAOYSA-N 1-[(2-methylpropan-2-yl)oxycarbonyl]-5-propan-2-yloxycarbonyloxypiperidine-2-carboxylic acid Chemical compound C(C)(C)(C)OC(=O)N1C(CCC(C1)OC(=O)OC(C)C)C(=O)O RMPQAVQRJOJFKF-UHFFFAOYSA-N 0.000 description 1
- ONBQEOIKXPHGMB-VBSBHUPXSA-N 1-[2-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]oxy-4,6-dihydroxyphenyl]-3-(4-hydroxyphenyl)propan-1-one Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1OC1=CC(O)=CC(O)=C1C(=O)CCC1=CC=C(O)C=C1 ONBQEOIKXPHGMB-VBSBHUPXSA-N 0.000 description 1
- YOQILGBVPQSEGU-UHFFFAOYSA-N 1-[4-[2-(4-aminocyclohexyl)-1,3-thiazol-5-yl]-3-(tert-butylsulfamoyl)phenyl]-3-benzylurea Chemical compound NC1CCC(CC1)C=1SC(=CN=1)C1=C(C=C(C=C1)NC(=O)NCC1=CC=CC=C1)S(NC(C)(C)C)(=O)=O YOQILGBVPQSEGU-UHFFFAOYSA-N 0.000 description 1
- DHCDEHAEADDPQH-UHFFFAOYSA-N 1-[4-bromo-3-(tert-butylsulfamoyl)phenyl]-3-(pyridin-2-ylmethyl)urea Chemical compound BrC1=C(C=C(C=C1)NC(=O)NCC1=NC=CC=C1)S(NC(C)(C)C)(=O)=O DHCDEHAEADDPQH-UHFFFAOYSA-N 0.000 description 1
- LHHJUWUPIWPGAR-UHFFFAOYSA-N 1-benzyl-3-[3-(tert-butylsulfamoyl)-4-[2-(4-hydroxypiperidin-1-yl)-1,3-thiazol-5-yl]phenyl]urea Chemical compound C(C1=CC=CC=C1)NC(=O)NC1=CC(=C(C=C1)C1=CN=C(S1)N1CCC(CC1)O)S(NC(C)(C)C)(=O)=O LHHJUWUPIWPGAR-UHFFFAOYSA-N 0.000 description 1
- MICMHFIQSAMEJG-UHFFFAOYSA-N 1-bromopyrrolidine-2,5-dione Chemical compound BrN1C(=O)CCC1=O.BrN1C(=O)CCC1=O MICMHFIQSAMEJG-UHFFFAOYSA-N 0.000 description 1
- NNZVKALEGZPYKL-UHFFFAOYSA-N 1-isocyanato-2-methylpropane Chemical compound CC(C)CN=C=O NNZVKALEGZPYKL-UHFFFAOYSA-N 0.000 description 1
- VSNHCAURESNICA-NJFSPNSNSA-N 1-oxidanylurea Chemical compound N[14C](=O)NO VSNHCAURESNICA-NJFSPNSNSA-N 0.000 description 1
- 125000001462 1-pyrrolyl group Chemical group [*]N1C([H])=C([H])C([H])=C1[H] 0.000 description 1
- DUHBLGCXLOJNDU-UHFFFAOYSA-M 13-dodecyl-13-methyl-1,4,7,10-tetraoxa-13-azoniacyclopentadecane;bromide Chemical compound [Br-].CCCCCCCCCCCC[N+]1(C)CCOCCOCCOCCOCC1 DUHBLGCXLOJNDU-UHFFFAOYSA-M 0.000 description 1
- FRUWMYWEARDNTC-UHFFFAOYSA-N 2,3,3a,4-tetrahydro-1h-indole Chemical compound C1C=CC=C2NCCC21 FRUWMYWEARDNTC-UHFFFAOYSA-N 0.000 description 1
- PNJUXCNBOXMPEY-UHFFFAOYSA-N 2,4-dihydropyrrolo[2,3-d]triazole Chemical compound N1N=NC2=C1C=CN2 PNJUXCNBOXMPEY-UHFFFAOYSA-N 0.000 description 1
- FQMZXMVHHKXGTM-UHFFFAOYSA-N 2-(1-adamantyl)-n-[2-[2-(2-hydroxyethylamino)ethylamino]quinolin-5-yl]acetamide Chemical compound C1C(C2)CC(C3)CC2CC13CC(=O)NC1=CC=CC2=NC(NCCNCCO)=CC=C21 FQMZXMVHHKXGTM-UHFFFAOYSA-N 0.000 description 1
- YZUCHNQXRGQMQB-UHFFFAOYSA-N 2-(2-bromo-1,3-thiazol-5-yl)-N-tert-butyl-5-nitrobenzenesulfonamide Chemical compound BrC=1SC(=CN=1)C1=C(C=C(C=C1)[N+](=O)[O-])S(=O)(=O)NC(C)(C)C YZUCHNQXRGQMQB-UHFFFAOYSA-N 0.000 description 1
- QEBYEVQKHRUYPE-UHFFFAOYSA-N 2-(2-chlorophenyl)-5-[(1-methylpyrazol-3-yl)methyl]-4-[[methyl(pyridin-3-ylmethyl)amino]methyl]-1h-pyrazolo[4,3-c]pyridine-3,6-dione Chemical compound C1=CN(C)N=C1CN1C(=O)C=C2NN(C=3C(=CC=CC=3)Cl)C(=O)C2=C1CN(C)CC1=CC=CN=C1 QEBYEVQKHRUYPE-UHFFFAOYSA-N 0.000 description 1
- WOXFMYVTSLAQMO-UHFFFAOYSA-N 2-Pyridinemethanamine Chemical compound NCC1=CC=CC=N1 WOXFMYVTSLAQMO-UHFFFAOYSA-N 0.000 description 1
- QTMAZYGAVHCKKX-UHFFFAOYSA-N 2-[(4-amino-5-bromopyrrolo[2,3-d]pyrimidin-7-yl)methoxy]propane-1,3-diol Chemical compound NC1=NC=NC2=C1C(Br)=CN2COC(CO)CO QTMAZYGAVHCKKX-UHFFFAOYSA-N 0.000 description 1
- PYRKKGOKRMZEIT-UHFFFAOYSA-N 2-[6-(2-cyclopropylethoxy)-9-(2-hydroxy-2-methylpropyl)-1h-phenanthro[9,10-d]imidazol-2-yl]-5-fluorobenzene-1,3-dicarbonitrile Chemical compound C1=C2C3=CC(CC(C)(O)C)=CC=C3C=3NC(C=4C(=CC(F)=CC=4C#N)C#N)=NC=3C2=CC=C1OCCC1CC1 PYRKKGOKRMZEIT-UHFFFAOYSA-N 0.000 description 1
- FMKGJQHNYMWDFJ-CVEARBPZSA-N 2-[[4-(2,2-difluoropropoxy)pyrimidin-5-yl]methylamino]-4-[[(1R,4S)-4-hydroxy-3,3-dimethylcyclohexyl]amino]pyrimidine-5-carbonitrile Chemical compound FC(COC1=NC=NC=C1CNC1=NC=C(C(=N1)N[C@H]1CC([C@H](CC1)O)(C)C)C#N)(C)F FMKGJQHNYMWDFJ-CVEARBPZSA-N 0.000 description 1
- YSUIQYOGTINQIN-UZFYAQMZSA-N 2-amino-9-[(1S,6R,8R,9S,10R,15R,17R,18R)-8-(6-aminopurin-9-yl)-9,18-difluoro-3,12-dihydroxy-3,12-bis(sulfanylidene)-2,4,7,11,13,16-hexaoxa-3lambda5,12lambda5-diphosphatricyclo[13.2.1.06,10]octadecan-17-yl]-1H-purin-6-one Chemical compound NC1=NC2=C(N=CN2[C@@H]2O[C@@H]3COP(S)(=O)O[C@@H]4[C@@H](COP(S)(=O)O[C@@H]2[C@@H]3F)O[C@H]([C@H]4F)N2C=NC3=C2N=CN=C3N)C(=O)N1 YSUIQYOGTINQIN-UZFYAQMZSA-N 0.000 description 1
- TVTJUIAKQFIXCE-HUKYDQBMSA-N 2-amino-9-[(2R,3S,4S,5R)-4-fluoro-3-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-7-prop-2-ynyl-1H-purine-6,8-dione Chemical compound NC=1NC(C=2N(C(N(C=2N=1)[C@@H]1O[C@@H]([C@H]([C@H]1O)F)CO)=O)CC#C)=O TVTJUIAKQFIXCE-HUKYDQBMSA-N 0.000 description 1
- 125000000022 2-aminoethyl group Chemical group [H]C([*])([H])C([H])([H])N([H])[H] 0.000 description 1
- VFPWGZNNRSQPBT-UHFFFAOYSA-N 2-bromobenzenesulfonyl chloride Chemical compound ClS(=O)(=O)C1=CC=CC=C1Br VFPWGZNNRSQPBT-UHFFFAOYSA-N 0.000 description 1
- FZZMTSNZRBFGGU-UHFFFAOYSA-N 2-chloro-7-fluoroquinazolin-4-amine Chemical compound FC1=CC=C2C(N)=NC(Cl)=NC2=C1 FZZMTSNZRBFGGU-UHFFFAOYSA-N 0.000 description 1
- QSKPIOLLBIHNAC-UHFFFAOYSA-N 2-chloro-acetaldehyde Chemical compound ClCC=O QSKPIOLLBIHNAC-UHFFFAOYSA-N 0.000 description 1
- 125000002941 2-furyl group Chemical group O1C([*])=C([H])C([H])=C1[H] 0.000 description 1
- 125000006479 2-pyridyl methyl group Chemical group [H]C1=C([H])C([H])=C([H])C(=N1)C([H])([H])* 0.000 description 1
- 125000000389 2-pyrrolyl group Chemical group [H]N1C([*])=C([H])C([H])=C1[H] 0.000 description 1
- IWKIGCQJGKYIMC-UHFFFAOYSA-N 2-tert-butyl-5-nitrobenzenesulfonamide Chemical compound CC(C)(C)C1=CC=C([N+]([O-])=O)C=C1S(N)(=O)=O IWKIGCQJGKYIMC-UHFFFAOYSA-N 0.000 description 1
- CEKMRJVRIRSIFF-UHFFFAOYSA-N 2-tert-butylbenzenesulfonamide Chemical compound CC(C)(C)C1=CC=CC=C1S(N)(=O)=O CEKMRJVRIRSIFF-UHFFFAOYSA-N 0.000 description 1
- 125000000175 2-thienyl group Chemical group S1C([*])=C([H])C([H])=C1[H] 0.000 description 1
- HSBWROPSDPNMTM-UHFFFAOYSA-N 3,6-dihydro-2h-pyran-2-carboxamide Chemical compound NC(=O)C1CC=CCO1 HSBWROPSDPNMTM-UHFFFAOYSA-N 0.000 description 1
- OWRKSSDYRPRYGL-UHFFFAOYSA-N 3,6-dihydro-2h-pyran-2-carboxylic acid Chemical compound OC(=O)C1CC=CCO1 OWRKSSDYRPRYGL-UHFFFAOYSA-N 0.000 description 1
- DFRAKBCRUYUFNT-UHFFFAOYSA-N 3,8-dicyclohexyl-2,4,7,9-tetrahydro-[1,3]oxazino[5,6-h][1,3]benzoxazine Chemical compound C1CCCCC1N1CC(C=CC2=C3OCN(C2)C2CCCCC2)=C3OC1 DFRAKBCRUYUFNT-UHFFFAOYSA-N 0.000 description 1
- QBWKPGNFQQJGFY-QLFBSQMISA-N 3-[(1r)-1-[(2r,6s)-2,6-dimethylmorpholin-4-yl]ethyl]-n-[6-methyl-3-(1h-pyrazol-4-yl)imidazo[1,2-a]pyrazin-8-yl]-1,2-thiazol-5-amine Chemical compound N1([C@H](C)C2=NSC(NC=3C4=NC=C(N4C=C(C)N=3)C3=CNN=C3)=C2)C[C@H](C)O[C@H](C)C1 QBWKPGNFQQJGFY-QLFBSQMISA-N 0.000 description 1
- KLCYDBAYYYVNFM-UHFFFAOYSA-N 3-[(2-methylpropan-2-yl)oxycarbonylamino]cyclobutane-1-carboxylic acid Chemical compound CC(C)(C)OC(=O)NC1CC(C(O)=O)C1 KLCYDBAYYYVNFM-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- YDPLFBIGFQFIDB-UHFFFAOYSA-N 3-chloropyridine-2-carbonitrile Chemical compound ClC1=CC=CN=C1C#N YDPLFBIGFQFIDB-UHFFFAOYSA-N 0.000 description 1
- 125000003682 3-furyl group Chemical group O1C([H])=C([*])C([H])=C1[H] 0.000 description 1
- GOAONOKEEWITAN-UHFFFAOYSA-N 3-methoxy-5-nitropyridine Chemical compound COC1=CN=CC([N+]([O-])=O)=C1 GOAONOKEEWITAN-UHFFFAOYSA-N 0.000 description 1
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 description 1
- 125000001397 3-pyrrolyl group Chemical group [H]N1C([H])=C([*])C([H])=C1[H] 0.000 description 1
- 125000001541 3-thienyl group Chemical group S1C([H])=C([*])C([H])=C1[H] 0.000 description 1
- MUGSKSNNEORSJG-UHFFFAOYSA-N 3174-74-1 Chemical compound C1CC=CCO1 MUGSKSNNEORSJG-UHFFFAOYSA-N 0.000 description 1
- IKHFDKLVBCRBHG-UHFFFAOYSA-N 4-(propan-2-ylcarbamoyloxy)bicyclo[2.2.2]octane-1-carboxylic acid Chemical compound C(C)(C)NC(=O)OC12CCC(CC1)(CC2)C(=O)O IKHFDKLVBCRBHG-UHFFFAOYSA-N 0.000 description 1
- JQOIGFNJFBTVKO-UHFFFAOYSA-N 4-(propan-2-yloxycarbonylamino)bicyclo[2.2.2]octane-1-carboxylic acid Chemical compound C(C)(C)OC(=O)NC12CCC(CC1)(CC2)C(=O)O JQOIGFNJFBTVKO-UHFFFAOYSA-N 0.000 description 1
- HCFRWBBJISAZNK-UHFFFAOYSA-N 4-Hydroxycyclohexylcarboxylic acid Chemical compound OC1CCC(C(O)=O)CC1 HCFRWBBJISAZNK-UHFFFAOYSA-N 0.000 description 1
- KXMRDHPZQHAXML-UHFFFAOYSA-N 4-[(2-methylpropan-2-yl)oxycarbonylamino]cyclohexane-1-carboxylic acid Chemical compound CC(C)(C)OC(=O)NC1CCC(C(O)=O)CC1 KXMRDHPZQHAXML-UHFFFAOYSA-N 0.000 description 1
- GSDQYSSLIKJJOG-UHFFFAOYSA-N 4-chloro-2-(3-chloroanilino)benzoic acid Chemical compound OC(=O)C1=CC=C(Cl)C=C1NC1=CC=CC(Cl)=C1 GSDQYSSLIKJJOG-UHFFFAOYSA-N 0.000 description 1
- LXQJPKMORWPZGM-UHFFFAOYSA-N 4-hydroxybicyclo[2.2.2]octane-1-carboxylic acid Chemical compound C1CC2(O)CCC1(C(=O)O)CC2 LXQJPKMORWPZGM-UHFFFAOYSA-N 0.000 description 1
- UCUHQXIAXJMZRI-UHFFFAOYSA-N 4-hydroxycyclohexane-1-carboxamide Chemical compound NC(=O)C1CCC(O)CC1 UCUHQXIAXJMZRI-UHFFFAOYSA-N 0.000 description 1
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 1
- KDDQRKBRJSGMQE-UHFFFAOYSA-N 4-thiazolyl Chemical group [C]1=CSC=N1 KDDQRKBRJSGMQE-UHFFFAOYSA-N 0.000 description 1
- VKLKXFOZNHEBSW-UHFFFAOYSA-N 5-[[3-[(4-morpholin-4-ylbenzoyl)amino]phenyl]methoxy]pyridine-3-carboxamide Chemical compound O1CCN(CC1)C1=CC=C(C(=O)NC=2C=C(COC=3C=NC=C(C(=O)N)C=3)C=CC=2)C=C1 VKLKXFOZNHEBSW-UHFFFAOYSA-N 0.000 description 1
- IZDQVUOBMKKPRO-UHFFFAOYSA-N 5-amino-2-(2-bromo-1,3-thiazol-5-yl)-N-tert-butylbenzenesulfonamide Chemical compound NC=1C=CC(=C(C=1)S(=O)(=O)NC(C)(C)C)C1=CN=C(S1)Br IZDQVUOBMKKPRO-UHFFFAOYSA-N 0.000 description 1
- MHSHJIDNQVCZFL-UHFFFAOYSA-N 5-amino-2-[2-(3-aminoazetidin-1-yl)-1,3-thiazol-5-yl]-N-tert-butylbenzenesulfonamide Chemical compound NC=1C=CC(=C(C=1)S(=O)(=O)NC(C)(C)C)C1=CN=C(S1)N1CC(C1)N MHSHJIDNQVCZFL-UHFFFAOYSA-N 0.000 description 1
- GNNQMMWVGAJOCT-UHFFFAOYSA-N 5-amino-3-methoxypyridine-2-carbonitrile Chemical compound COC1=CC(N)=CN=C1C#N GNNQMMWVGAJOCT-UHFFFAOYSA-N 0.000 description 1
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 1
- XFJBGINZIMNZBW-CRAIPNDOSA-N 5-chloro-2-[4-[(1r,2s)-2-[2-(5-methylsulfonylpyridin-2-yl)oxyethyl]cyclopropyl]piperidin-1-yl]pyrimidine Chemical compound N1=CC(S(=O)(=O)C)=CC=C1OCC[C@H]1[C@@H](C2CCN(CC2)C=2N=CC(Cl)=CN=2)C1 XFJBGINZIMNZBW-CRAIPNDOSA-N 0.000 description 1
- DKOIPAZERNXIHU-UHFFFAOYSA-N 5-hydroxy-1-[(2-methylpropan-2-yl)oxycarbonyl]piperidine-2-carboxylic acid Chemical compound CC(C)(C)OC(=O)N1CC(O)CCC1C(O)=O DKOIPAZERNXIHU-UHFFFAOYSA-N 0.000 description 1
- CGRRUFNHHQCLDZ-UHFFFAOYSA-N 5-hydroxypyridine-2-carboxylic acid Natural products OC(=O)C1=CC=C(O)C=N1 CGRRUFNHHQCLDZ-UHFFFAOYSA-N 0.000 description 1
- IJRKLHTZAIFUTB-UHFFFAOYSA-N 5-nitro-2-(2-phenylethylamino)benzoic acid Chemical compound OC(=O)C1=CC([N+]([O-])=O)=CC=C1NCCC1=CC=CC=C1 IJRKLHTZAIFUTB-UHFFFAOYSA-N 0.000 description 1
- CWDWFSXUQODZGW-UHFFFAOYSA-N 5-thiazolyl Chemical group [C]1=CN=CS1 CWDWFSXUQODZGW-UHFFFAOYSA-N 0.000 description 1
- FALMDFKWGXBTNQ-UHFFFAOYSA-N 6-(1,3-thiazol-2-yl)oxan-3-amine Chemical compound S1C(=NC=C1)C1CCC(CO1)N FALMDFKWGXBTNQ-UHFFFAOYSA-N 0.000 description 1
- UXPLZIGNUAKISI-UHFFFAOYSA-N 6-(1,3-thiazol-2-yl)oxan-3-ol Chemical compound S1C(=NC=C1)C1CCC(CO1)O UXPLZIGNUAKISI-UHFFFAOYSA-N 0.000 description 1
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 101150079657 AICDA gene Proteins 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- 206010069754 Acquired gene mutation Diseases 0.000 description 1
- 108090000963 Actin-related protein 2 Proteins 0.000 description 1
- 208000016557 Acute basophilic leukemia Diseases 0.000 description 1
- 208000004804 Adenomatous Polyps Diseases 0.000 description 1
- 208000009746 Adult T-Cell Leukemia-Lymphoma Diseases 0.000 description 1
- 208000016683 Adult T-cell leukemia/lymphoma Diseases 0.000 description 1
- 229930195730 Aflatoxin Natural products 0.000 description 1
- XWIYFDMXXLINPU-UHFFFAOYSA-N Aflatoxin G Chemical compound O=C1OCCC2=C1C(=O)OC1=C2C(OC)=CC2=C1C1C=COC1O2 XWIYFDMXXLINPU-UHFFFAOYSA-N 0.000 description 1
- ZGCSNRKSJLVANE-UHFFFAOYSA-N Aglycone-Rebeccamycin Natural products N1C2=C3NC4=C(Cl)C=CC=C4C3=C(C(=O)NC3=O)C3=C2C2=C1C(Cl)=CC=C2 ZGCSNRKSJLVANE-UHFFFAOYSA-N 0.000 description 1
- 201000010000 Agranulocytosis Diseases 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 229920000856 Amylose Polymers 0.000 description 1
- 206010053622 Asplenia Diseases 0.000 description 1
- 206010003694 Atrophy Diseases 0.000 description 1
- 208000035900 Autoimmune polyendocrinopathy type 1 Diseases 0.000 description 1
- 108091008875 B cell receptors Proteins 0.000 description 1
- 208000012526 B-cell neoplasm Diseases 0.000 description 1
- KZKNWJNMPADDRY-UHFFFAOYSA-N B1CCCO1 Chemical compound B1CCCO1 KZKNWJNMPADDRY-UHFFFAOYSA-N 0.000 description 1
- IYHHRZBKXXKDDY-UHFFFAOYSA-N BI-605906 Chemical compound N=1C=2SC(C(N)=O)=C(N)C=2C(C(F)(F)CC)=CC=1N1CCC(S(C)(=O)=O)CC1 IYHHRZBKXXKDDY-UHFFFAOYSA-N 0.000 description 1
- 102000052609 BRCA2 Human genes 0.000 description 1
- 108700020462 BRCA2 Proteins 0.000 description 1
- 206010004146 Basal cell carcinoma Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 208000019838 Blood disease Diseases 0.000 description 1
- 101150008921 Brca2 gene Proteins 0.000 description 1
- 208000007690 Brenner tumor Diseases 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 1
- ULMKNHYMJWIJBM-MEMLXQNLSA-N C(C)(C)(C)[Si](O[C@@H]1CC[C@H](CC1)C=1SC=CN=1)(C1=CC=CC=C1)C1=CC=CC=C1 Chemical compound C(C)(C)(C)[Si](O[C@@H]1CC[C@H](CC1)C=1SC=CN=1)(C1=CC=CC=C1)C1=CC=CC=C1 ULMKNHYMJWIJBM-MEMLXQNLSA-N 0.000 description 1
- IPIDQVHFAAEBAS-MGCOHNPYSA-N C(C)(C)NC(O[C@@H]1CC[C@H](CC1)C=1SC(=CN=1)Br)=O Chemical compound C(C)(C)NC(O[C@@H]1CC[C@H](CC1)C=1SC(=CN=1)Br)=O IPIDQVHFAAEBAS-MGCOHNPYSA-N 0.000 description 1
- BGGALFIXXQOTPY-NRFANRHFSA-N C1(=C(C2=C(C=C1)N(C(C#N)=C2)C[C@@H](N1CCN(CC1)S(=O)(=O)C)C)C)CN1CCC(CC1)NC1=NC(=NC2=C1C=C(S2)CC(F)(F)F)NC Chemical compound C1(=C(C2=C(C=C1)N(C(C#N)=C2)C[C@@H](N1CCN(CC1)S(=O)(=O)C)C)C)CN1CCC(CC1)NC1=NC(=NC2=C1C=C(S2)CC(F)(F)F)NC BGGALFIXXQOTPY-NRFANRHFSA-N 0.000 description 1
- IYGJNPNWQKXUEY-UHFFFAOYSA-N C1C(C(=O)OCC2=CC=CC=C2)N(CC(C1)N)C(=O)OC(C)(C)C Chemical compound C1C(C(=O)OCC2=CC=CC=C2)N(CC(C1)N)C(=O)OC(C)(C)C IYGJNPNWQKXUEY-UHFFFAOYSA-N 0.000 description 1
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 1
- JPWHSYNHWPMKEB-UHFFFAOYSA-N CC(C)(C)OC(=O)N1CC(CCC1C(=O)OCC1=CC=CC=C1)OS(C)(=O)=O Chemical compound CC(C)(C)OC(=O)N1CC(CCC1C(=O)OCC1=CC=CC=C1)OS(C)(=O)=O JPWHSYNHWPMKEB-UHFFFAOYSA-N 0.000 description 1
- ZHADZGDUZZOXRR-UHFFFAOYSA-N CC(C)OC(NC(CCC1C(O)=O)CN1C(O)=O)=O Chemical compound CC(C)OC(NC(CCC1C(O)=O)CN1C(O)=O)=O ZHADZGDUZZOXRR-UHFFFAOYSA-N 0.000 description 1
- LGULJOCYVVOMME-UHFFFAOYSA-N CC(C)OC(NC1=CN=C(C2=NC=C(C(C=CC(NC(O)=O)=C3)=C3S(NC(C)(C)C)(=O)=O)S2)C(OC)=C1)=O Chemical compound CC(C)OC(NC1=CN=C(C2=NC=C(C(C=CC(NC(O)=O)=C3)=C3S(NC(C)(C)C)(=O)=O)S2)C(OC)=C1)=O LGULJOCYVVOMME-UHFFFAOYSA-N 0.000 description 1
- UHNRLQRZRNKOKU-UHFFFAOYSA-N CCN(CC1=NC2=C(N1)C1=CC=C(C=C1N=C2N)C1=NNC=C1)C(C)=O Chemical compound CCN(CC1=NC2=C(N1)C1=CC=C(C=C1N=C2N)C1=NNC=C1)C(C)=O UHNRLQRZRNKOKU-UHFFFAOYSA-N 0.000 description 1
- BQXUPNKLZNSUMC-YUQWMIPFSA-N CCN(CCCCCOCC(=O)N[C@H](C(=O)N1C[C@H](O)C[C@H]1C(=O)N[C@@H](C)c1ccc(cc1)-c1scnc1C)C(C)(C)C)CCOc1ccc(cc1)C(=O)c1c(sc2cc(O)ccc12)-c1ccc(O)cc1 Chemical compound CCN(CCCCCOCC(=O)N[C@H](C(=O)N1C[C@H](O)C[C@H]1C(=O)N[C@@H](C)c1ccc(cc1)-c1scnc1C)C(C)(C)C)CCOc1ccc(cc1)C(=O)c1c(sc2cc(O)ccc12)-c1ccc(O)cc1 BQXUPNKLZNSUMC-YUQWMIPFSA-N 0.000 description 1
- 108010029697 CD40 Ligand Proteins 0.000 description 1
- 102100032937 CD40 ligand Human genes 0.000 description 1
- FVLVBPDQNARYJU-XAHDHGMMSA-N C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O Chemical compound C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O FVLVBPDQNARYJU-XAHDHGMMSA-N 0.000 description 1
- 101100452003 Caenorhabditis elegans ape-1 gene Proteins 0.000 description 1
- KLWPJMFMVPTNCC-UHFFFAOYSA-N Camptothecin Natural products CCC1(O)C(=O)OCC2=C1C=C3C4Nc5ccccc5C=C4CN3C2=O KLWPJMFMVPTNCC-UHFFFAOYSA-N 0.000 description 1
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- 208000005623 Carcinogenesis Diseases 0.000 description 1
- 208000010667 Carcinoma of liver and intrahepatic biliary tract Diseases 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 201000009047 Chordoma Diseases 0.000 description 1
- 208000006332 Choriocarcinoma Diseases 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- 208000005443 Circulating Neoplastic Cells Diseases 0.000 description 1
- 108020004705 Codon Proteins 0.000 description 1
- 229940126639 Compound 33 Drugs 0.000 description 1
- 241000699802 Cricetulus griseus Species 0.000 description 1
- PMPVIKIVABFJJI-UHFFFAOYSA-N Cyclobutane Chemical compound C1CCC1 PMPVIKIVABFJJI-UHFFFAOYSA-N 0.000 description 1
- 102000005381 Cytidine Deaminase Human genes 0.000 description 1
- 102100026846 Cytidine deaminase Human genes 0.000 description 1
- 102000012410 DNA Ligases Human genes 0.000 description 1
- 108010061982 DNA Ligases Proteins 0.000 description 1
- 229940127399 DNA Polymerase Inhibitors Drugs 0.000 description 1
- 102000003915 DNA Topoisomerases Human genes 0.000 description 1
- 108090000323 DNA Topoisomerases Proteins 0.000 description 1
- 230000000970 DNA cross-linking effect Effects 0.000 description 1
- 231100000280 DNA damage induction Toxicity 0.000 description 1
- 230000005971 DNA damage repair Effects 0.000 description 1
- 230000008265 DNA repair mechanism Effects 0.000 description 1
- 102100027830 DNA repair protein XRCC2 Human genes 0.000 description 1
- 238000001712 DNA sequencing Methods 0.000 description 1
- 230000006820 DNA synthesis Effects 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- 241000702421 Dependoparvovirus Species 0.000 description 1
- 208000007033 Dysgerminoma Diseases 0.000 description 1
- 201000009051 Embryonal Carcinoma Diseases 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 208000005431 Endometrioid Carcinoma Diseases 0.000 description 1
- 206010014958 Eosinophilic leukaemia Diseases 0.000 description 1
- 206010014967 Ependymoma Diseases 0.000 description 1
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 1
- 208000031637 Erythroblastic Acute Leukemia Diseases 0.000 description 1
- 208000036566 Erythroleukaemia Diseases 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 241000206602 Eukaryota Species 0.000 description 1
- 208000006168 Ewing Sarcoma Diseases 0.000 description 1
- 108700024394 Exon Proteins 0.000 description 1
- 206010073306 Exposure to radiation Diseases 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 208000004463 Follicular Adenocarcinoma Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 208000031448 Genomic Instability Diseases 0.000 description 1
- 208000008999 Giant Cell Carcinoma Diseases 0.000 description 1
- 208000002966 Giant Cell Tumor of Bone Diseases 0.000 description 1
- ZPLQIPFOCGIIHV-UHFFFAOYSA-N Gimeracil Chemical compound OC1=CC(=O)C(Cl)=CN1 ZPLQIPFOCGIIHV-UHFFFAOYSA-N 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- 241000235503 Glomus Species 0.000 description 1
- 206010018498 Goitre Diseases 0.000 description 1
- 208000006050 Hemangiopericytoma Diseases 0.000 description 1
- 102100031573 Hematopoietic progenitor cell antigen CD34 Human genes 0.000 description 1
- 206010073069 Hepatic cancer Diseases 0.000 description 1
- 241000700721 Hepatitis B virus Species 0.000 description 1
- 206010073073 Hepatobiliary cancer Diseases 0.000 description 1
- 208000028523 Hereditary Complement Deficiency disease Diseases 0.000 description 1
- 108010068250 Herpes Simplex Virus Protein Vmw65 Proteins 0.000 description 1
- 208000002291 Histiocytic Sarcoma Diseases 0.000 description 1
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 1
- 101001134036 Homo sapiens DNA mismatch repair protein Msh2 Proteins 0.000 description 1
- 101000649306 Homo sapiens DNA repair protein XRCC2 Proteins 0.000 description 1
- 101000777663 Homo sapiens Hematopoietic progenitor cell antigen CD34 Proteins 0.000 description 1
- 101000581326 Homo sapiens Mediator of DNA damage checkpoint protein 1 Proteins 0.000 description 1
- 101000825217 Homo sapiens Meiotic recombination protein SPO11 Proteins 0.000 description 1
- 101000738911 Homo sapiens Mismatch repair endonuclease PMS2 Proteins 0.000 description 1
- 101000755690 Homo sapiens Single-stranded DNA cytosine deaminase Proteins 0.000 description 1
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 1
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 1
- 206010048643 Hypereosinophilic syndrome Diseases 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 206010020843 Hyperthermia Diseases 0.000 description 1
- XDXDZDZNSLXDNA-UHFFFAOYSA-N Idarubicin Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XDXDZDZNSLXDNA-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 229940076838 Immune checkpoint inhibitor Drugs 0.000 description 1
- 108010038486 Interleukin-4 Receptors Proteins 0.000 description 1
- 102000010787 Interleukin-4 Receptors Human genes 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 201000008869 Juxtacortical Osteosarcoma Diseases 0.000 description 1
- 208000007766 Kaposi sarcoma Diseases 0.000 description 1
- 208000018142 Leiomyosarcoma Diseases 0.000 description 1
- 206010024305 Leukaemia monocytic Diseases 0.000 description 1
- 208000000265 Lobular Carcinoma Diseases 0.000 description 1
- 101150110531 MLH1 gene Proteins 0.000 description 1
- 229910015837 MSH2 Inorganic materials 0.000 description 1
- 101150102506 MSH3 gene Proteins 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 208000006644 Malignant Fibrous Histiocytoma Diseases 0.000 description 1
- 208000007369 Malignant Mixed Tumor Diseases 0.000 description 1
- 206010072448 Malignant blue naevus Diseases 0.000 description 1
- 206010025566 Malignant haemangiopericytoma Diseases 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 102100027643 Mediator of DNA damage checkpoint protein 1 Human genes 0.000 description 1
- 208000007054 Medullary Carcinoma Diseases 0.000 description 1
- 208000035490 Megakaryoblastic Acute Leukemia Diseases 0.000 description 1
- 102100022253 Meiotic recombination protein SPO11 Human genes 0.000 description 1
- 206010027145 Melanocytic naevus Diseases 0.000 description 1
- 208000002030 Merkel cell carcinoma Diseases 0.000 description 1
- 201000009574 Mesenchymal Chondrosarcoma Diseases 0.000 description 1
- UEZVMMHDMIWARA-UHFFFAOYSA-N Metaphosphoric acid Chemical compound OP(=O)=O UEZVMMHDMIWARA-UHFFFAOYSA-N 0.000 description 1
- 108091092878 Microsatellite Proteins 0.000 description 1
- 101150033433 Msh2 gene Proteins 0.000 description 1
- 206010057269 Mucoepidermoid carcinoma Diseases 0.000 description 1
- 208000010357 Mullerian Mixed Tumor Diseases 0.000 description 1
- 101100381525 Mus musculus Bcl6 gene Proteins 0.000 description 1
- 102000016077 MutL Proteins Human genes 0.000 description 1
- 108010010712 MutL Proteins Proteins 0.000 description 1
- 108700024836 MutS Homolog 3 Proteins 0.000 description 1
- 102000010645 MutS Proteins Human genes 0.000 description 1
- 108010038272 MutS Proteins Proteins 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- NBUHNHAIHXXZOK-UHFFFAOYSA-N N(=[N+]=[N-])C1CCC(N(C1)C(=O)OC(C)(C)C)C(=O)OCC1=CC=CC=C1 Chemical compound N(=[N+]=[N-])C1CCC(N(C1)C(=O)OC(C)(C)C)C(=O)OCC1=CC=CC=C1 NBUHNHAIHXXZOK-UHFFFAOYSA-N 0.000 description 1
- KWYHDKDOAIKMQN-UHFFFAOYSA-N N,N,N',N'-tetramethylethylenediamine Chemical compound CN(C)CCN(C)C KWYHDKDOAIKMQN-UHFFFAOYSA-N 0.000 description 1
- ZKGNPQKYVKXMGJ-UHFFFAOYSA-N N,N-dimethylacetamide Chemical compound CN(C)C(C)=O.CN(C)C(C)=O ZKGNPQKYVKXMGJ-UHFFFAOYSA-N 0.000 description 1
- LIMFPAAAIVQRRD-BCGVJQADSA-N N-[2-[(3S,4R)-3-fluoro-4-methoxypiperidin-1-yl]pyrimidin-4-yl]-8-[(2R,3S)-2-methyl-3-(methylsulfonylmethyl)azetidin-1-yl]-5-propan-2-ylisoquinolin-3-amine Chemical compound F[C@H]1CN(CC[C@H]1OC)C1=NC=CC(=N1)NC=1N=CC2=C(C=CC(=C2C=1)C(C)C)N1[C@@H]([C@H](C1)CS(=O)(=O)C)C LIMFPAAAIVQRRD-BCGVJQADSA-N 0.000 description 1
- NJFQKSJHHIOZJR-UHFFFAOYSA-N N-[3-(tert-butylsulfamoyl)-4-(2-piperazin-1-yl-1,3-thiazol-5-yl)phenyl]acetamide Chemical compound C(C)(C)(C)NS(=O)(=O)C=1C=C(C=CC=1C1=CN=C(S1)N1CCNCC1)NC(C)=O NJFQKSJHHIOZJR-UHFFFAOYSA-N 0.000 description 1
- RDCVZBXRVABOLI-UHFFFAOYSA-N N-[3-(tert-butylsulfamoyl)-4-[2-(4-hydroxypiperidin-1-yl)-1,3-thiazol-5-yl]phenyl]acetamide Chemical compound C(C)(C)(C)NS(=O)(=O)C=1C=C(C=CC=1C1=CN=C(S1)N1CCC(CC1)O)NC(C)=O RDCVZBXRVABOLI-UHFFFAOYSA-N 0.000 description 1
- AVYVHIKSFXVDBG-UHFFFAOYSA-N N-benzyl-N-hydroxy-2,2-dimethylbutanamide Chemical compound C(C1=CC=CC=C1)N(C(C(CC)(C)C)=O)O AVYVHIKSFXVDBG-UHFFFAOYSA-N 0.000 description 1
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Substances BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 1
- POFVJRKJJBFPII-UHFFFAOYSA-N N-cyclopentyl-5-[2-[[5-[(4-ethylpiperazin-1-yl)methyl]pyridin-2-yl]amino]-5-fluoropyrimidin-4-yl]-4-methyl-1,3-thiazol-2-amine Chemical compound C1(CCCC1)NC=1SC(=C(N=1)C)C1=NC(=NC=C1F)NC1=NC=C(C=C1)CN1CCN(CC1)CC POFVJRKJJBFPII-UHFFFAOYSA-N 0.000 description 1
- MAXOESZLDBUFPF-UHFFFAOYSA-N N-tert-butyl-5-nitro-2-(1,3-thiazol-5-yl)benzenesulfonamide Chemical compound C(C)(C)(C)NS(=O)(=O)C1=C(C=CC(=C1)[N+](=O)[O-])C1=CN=CS1 MAXOESZLDBUFPF-UHFFFAOYSA-N 0.000 description 1
- MWMUNJCUEVGCMF-UMSPYCQHSA-N NC=1C=CC(=C(C=1)S(=O)(=O)NC(C)(C)C)C1=CN=C(S1)[C@@H]1C[C@H](C1)N Chemical compound NC=1C=CC(=C(C=1)S(=O)(=O)NC(C)(C)C)C1=CN=C(S1)[C@@H]1C[C@H](C1)N MWMUNJCUEVGCMF-UMSPYCQHSA-N 0.000 description 1
- 229910017906 NH3H2O Inorganic materials 0.000 description 1
- YOQILGBVPQSEGU-MXVIHJGJSA-N N[C@@H]1CC[C@H](CC1)C=1SC(=CN=1)C1=C(C=C(C=C1)NC(=O)NCC1=CC=CC=C1)S(NC(C)(C)C)(=O)=O Chemical compound N[C@@H]1CC[C@H](CC1)C=1SC(=CN=1)C1=C(C=C(C=C1)NC(=O)NCC1=CC=CC=C1)S(NC(C)(C)C)(=O)=O YOQILGBVPQSEGU-MXVIHJGJSA-N 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 208000007256 Nevus Diseases 0.000 description 1
- 244000061176 Nicotiana tabacum Species 0.000 description 1
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 108020004485 Nonsense Codon Proteins 0.000 description 1
- 238000000636 Northern blotting Methods 0.000 description 1
- 101710163270 Nuclease Proteins 0.000 description 1
- 108700020796 Oncogene Proteins 0.000 description 1
- 239000012661 PARP inhibitor Substances 0.000 description 1
- 208000025618 Paget disease of nipple Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 108010033276 Peptide Fragments Proteins 0.000 description 1
- 102000007079 Peptide Fragments Human genes 0.000 description 1
- 244000146510 Pereskia bleo Species 0.000 description 1
- 208000019262 Pilomatrix carcinoma Diseases 0.000 description 1
- 208000007641 Pinealoma Diseases 0.000 description 1
- 229940121906 Poly ADP ribose polymerase inhibitor Drugs 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 102000001183 RAG-1 Human genes 0.000 description 1
- 108060006897 RAG1 Proteins 0.000 description 1
- QEHOIJJIZXRMAN-UHFFFAOYSA-N Rebeccamycin Natural products OC1C(O)C(OC)C(CO)OC1N1C2=C3NC4=C(Cl)C=CC=C4C3=C3C(=O)NC(=O)C3=C2C2=CC=CC(Cl)=C21 QEHOIJJIZXRMAN-UHFFFAOYSA-N 0.000 description 1
- 102000001218 Rec A Recombinases Human genes 0.000 description 1
- 108010055016 Rec A Recombinases Proteins 0.000 description 1
- 102000018120 Recombinases Human genes 0.000 description 1
- 108010091086 Recombinases Proteins 0.000 description 1
- 201000000582 Retinoblastoma Diseases 0.000 description 1
- 101000825209 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) Meiosis-specific protein SPO11 Proteins 0.000 description 1
- 208000034189 Sclerosis Diseases 0.000 description 1
- 208000003252 Signet Ring Cell Carcinoma Diseases 0.000 description 1
- PNUZDKCDAWUEGK-CYZMBNFOSA-N Sitafloxacin Chemical compound C([C@H]1N)N(C=2C(=C3C(C(C(C(O)=O)=CN3[C@H]3[C@H](C3)F)=O)=CC=2F)Cl)CC11CC1 PNUZDKCDAWUEGK-CYZMBNFOSA-N 0.000 description 1
- ZSJLQEPLLKMAKR-UHFFFAOYSA-N Streptozotocin Natural products O=NN(C)C(=O)NC1C(O)OC(CO)C(O)C1O ZSJLQEPLLKMAKR-UHFFFAOYSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 206010042553 Superficial spreading melanoma stage unspecified Diseases 0.000 description 1
- 238000006069 Suzuki reaction reaction Methods 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 1
- 206010043276 Teratoma Diseases 0.000 description 1
- 201000009365 Thymic carcinoma Diseases 0.000 description 1
- 108700025716 Tumor Suppressor Genes Proteins 0.000 description 1
- 102000044209 Tumor Suppressor Genes Human genes 0.000 description 1
- 102000007537 Type II DNA Topoisomerases Human genes 0.000 description 1
- 108010046308 Type II DNA Topoisomerases Proteins 0.000 description 1
- 208000015778 Undifferentiated pleomorphic sarcoma Diseases 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 208000008383 Wilms tumor Diseases 0.000 description 1
- 208000006110 Wiskott-Aldrich syndrome Diseases 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical group [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- HLRAZPBRONOBEX-SSDOTTSWSA-N [(1r)-1-phenylethyl] carbamate Chemical compound NC(=O)O[C@H](C)C1=CC=CC=C1 HLRAZPBRONOBEX-SSDOTTSWSA-N 0.000 description 1
- HLRAZPBRONOBEX-ZETCQYMHSA-N [(1s)-1-phenylethyl] carbamate Chemical compound NC(=O)O[C@@H](C)C1=CC=CC=C1 HLRAZPBRONOBEX-ZETCQYMHSA-N 0.000 description 1
- VCOJPHPOVDIRJK-LURJTMIESA-N [(2s)-1-methylpyrrolidin-2-yl]methanol Chemical compound CN1CCC[C@H]1CO VCOJPHPOVDIRJK-LURJTMIESA-N 0.000 description 1
- AVARVUJNXCATDS-UHFFFAOYSA-N [1-[5-[2-(tert-butylsulfamoyl)-4-[(4-nitrophenoxy)carbonylamino]phenyl]-1,3-thiazol-2-yl]piperidin-4-yl] N-benzylcarbamate Chemical compound C(C1=CC=CC=C1)NC(OC1CCN(CC1)C=1SC(=CN=1)C1=C(C=C(C=C1)NC(=O)OC1=CC=C(C=C1)[N+](=O)[O-])S(NC(C)(C)C)(=O)=O)=O AVARVUJNXCATDS-UHFFFAOYSA-N 0.000 description 1
- AHJSZYNCYTWAQL-RUZDIDTESA-N [1-[5-[2-(tert-butylsulfamoyl)-4-[[(2R)-1-methylpyrrolidin-2-yl]methoxycarbonylamino]phenyl]-1,3-thiazol-2-yl]piperidin-4-yl] N-benzylcarbamate Chemical compound C(C1=CC=CC=C1)NC(OC1CCN(CC1)C=1SC(=CN=1)C1=C(C=C(C=C1)NC(=O)OC[C@@H]1N(CCC1)C)S(NC(C)(C)C)(=O)=O)=O AHJSZYNCYTWAQL-RUZDIDTESA-N 0.000 description 1
- ZACGWYXHUDLXRS-UHFFFAOYSA-N [4-(1,3-thiazol-2-yl)-1-bicyclo[2.2.2]octanyl] N-propan-2-ylcarbamate Chemical compound C(C)(C)NC(OC12CCC(CC1)(CC2)C=1SC=CN=1)=O ZACGWYXHUDLXRS-UHFFFAOYSA-N 0.000 description 1
- HDZQOBQDNSPOFA-UHFFFAOYSA-N [4-(5-bromo-1,3-thiazol-2-yl)-1-bicyclo[2.2.2]octanyl] N-propan-2-ylcarbamate Chemical compound C(C)(C)NC(OC12CCC(CC1)(CC2)C=1SC(=CN=1)Br)=O HDZQOBQDNSPOFA-UHFFFAOYSA-N 0.000 description 1
- DKHVWZAPUAYXAY-UHFFFAOYSA-N [4-[5-[4-(benzylcarbamoylamino)-2-(tert-butylsulfamoyl)phenyl]-1,3-thiazol-2-yl]-1-bicyclo[2.2.2]octanyl] N-propan-2-ylcarbamate Chemical compound C(C)(C)NC(OC12CCC(CC1)(CC2)C=1SC(=CN=1)C1=C(C=C(C=C1)NC(NCC1=CC=CC=C1)=O)S(NC(C)(C)C)(=O)=O)=O DKHVWZAPUAYXAY-UHFFFAOYSA-N 0.000 description 1
- SMNRFWMNPDABKZ-WVALLCKVSA-N [[(2R,3S,4R,5S)-5-(2,6-dioxo-3H-pyridin-3-yl)-3,4-dihydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl] [[[(2R,3S,4S,5R,6R)-4-fluoro-3,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-hydroxyphosphoryl]oxy-hydroxyphosphoryl] hydrogen phosphate Chemical compound OC[C@H]1O[C@H](OP(O)(=O)OP(O)(=O)OP(O)(=O)OP(O)(=O)OC[C@H]2O[C@H]([C@H](O)[C@@H]2O)C2C=CC(=O)NC2=O)[C@H](O)[C@@H](F)[C@@H]1O SMNRFWMNPDABKZ-WVALLCKVSA-N 0.000 description 1
- 210000001015 abdomen Anatomy 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 125000000218 acetic acid group Chemical group C(C)(=O)* 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 208000006336 acinar cell carcinoma Diseases 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 208000021841 acute erythroid leukemia Diseases 0.000 description 1
- 208000020700 acute megakaryocytic leukemia Diseases 0.000 description 1
- 230000004721 adaptive immunity Effects 0.000 description 1
- 208000002517 adenoid cystic carcinoma Diseases 0.000 description 1
- 201000000452 adenoid squamous cell carcinoma Diseases 0.000 description 1
- 201000008395 adenosquamous carcinoma Diseases 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 210000004100 adrenal gland Anatomy 0.000 description 1
- 229940009456 adriamycin Drugs 0.000 description 1
- 201000006966 adult T-cell leukemia Diseases 0.000 description 1
- 239000005409 aflatoxin Substances 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- QBYJBZPUGVGKQQ-SJJAEHHWSA-N aldrin Chemical compound C1[C@H]2C=C[C@@H]1[C@H]1[C@@](C3(Cl)Cl)(Cl)C(Cl)=C(Cl)[C@@]3(Cl)[C@H]12 QBYJBZPUGVGKQQ-SJJAEHHWSA-N 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001447 alkali salts Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 229930013930 alkaloid Natural products 0.000 description 1
- 229940045714 alkyl sulfonate alkylating agent Drugs 0.000 description 1
- 150000008052 alkyl sulfonates Chemical class 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229960000473 altretamine Drugs 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 206010065867 alveolar rhabdomyosarcoma Diseases 0.000 description 1
- 208000006431 amelanotic melanoma Diseases 0.000 description 1
- 230000001668 ameliorated effect Effects 0.000 description 1
- 208000010029 ameloblastoma Diseases 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- CBTVGIZVANVGBH-UHFFFAOYSA-N aminomethyl propanol Chemical compound CC(C)(N)CO CBTVGIZVANVGBH-UHFFFAOYSA-N 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- SMWDFEZZVXVKRB-UHFFFAOYSA-N anhydrous quinoline Natural products N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 201000007436 apocrine adenocarcinoma Diseases 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 108700028529 archaeal RadA Proteins 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical group 0.000 description 1
- 201000005476 astroblastoma Diseases 0.000 description 1
- XRWSZZJLZRKHHD-WVWIJVSJSA-N asunaprevir Chemical compound O=C([C@@H]1C[C@H](CN1C(=O)[C@@H](NC(=O)OC(C)(C)C)C(C)(C)C)OC1=NC=C(C2=CC=C(Cl)C=C21)OC)N[C@]1(C(=O)NS(=O)(=O)C2CC2)C[C@H]1C=C XRWSZZJLZRKHHD-WVWIJVSJSA-N 0.000 description 1
- METKIMKYRPQLGS-UHFFFAOYSA-N atenolol Chemical compound CC(C)NCC(O)COC1=CC=C(CC(N)=O)C=C1 METKIMKYRPQLGS-UHFFFAOYSA-N 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- 230000037444 atrophy Effects 0.000 description 1
- 208000019493 atypical carcinoid tumor Diseases 0.000 description 1
- 230000005784 autoimmunity Effects 0.000 description 1
- 239000012752 auxiliary agent Substances 0.000 description 1
- 229960002756 azacitidine Drugs 0.000 description 1
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 1
- 229960002170 azathioprine Drugs 0.000 description 1
- LMEKQMALGUDUQG-UHFFFAOYSA-N azathioprine Chemical compound CN1C=NC([N+]([O-])=O)=C1SC1=NC=NC2=C1NC=N2 LMEKQMALGUDUQG-UHFFFAOYSA-N 0.000 description 1
- 125000004567 azetidin-3-yl group Chemical group N1CC(C1)* 0.000 description 1
- 230000033590 base-excision repair Effects 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- HFACYLZERDEVSX-UHFFFAOYSA-N benzidine Chemical compound C1=CC(N)=CC=C1C1=CC=C(N)C=C1 HFACYLZERDEVSX-UHFFFAOYSA-N 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- KGNDCEVUMONOKF-UGPLYTSKSA-N benzyl n-[(2r)-1-[(2s,4r)-2-[[(2s)-6-amino-1-(1,3-benzoxazol-2-yl)-1,1-dihydroxyhexan-2-yl]carbamoyl]-4-[(4-methylphenyl)methoxy]pyrrolidin-1-yl]-1-oxo-4-phenylbutan-2-yl]carbamate Chemical compound C1=CC(C)=CC=C1CO[C@H]1CN(C(=O)[C@@H](CCC=2C=CC=CC=2)NC(=O)OCC=2C=CC=CC=2)[C@H](C(=O)N[C@@H](CCCCN)C(O)(O)C=2OC3=CC=CC=C3N=2)C1 KGNDCEVUMONOKF-UGPLYTSKSA-N 0.000 description 1
- WGQKYBSKWIADBV-UHFFFAOYSA-N benzylamine Chemical compound NCC1=CC=CC=C1 WGQKYBSKWIADBV-UHFFFAOYSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 238000002306 biochemical method Methods 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- IPWKHHSGDUIRAH-UHFFFAOYSA-N bis(pinacolato)diboron Chemical compound O1C(C)(C)C(C)(C)OB1B1OC(C)(C)C(C)(C)O1 IPWKHHSGDUIRAH-UHFFFAOYSA-N 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 201000011143 bone giant cell tumor Diseases 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 201000003714 breast lobular carcinoma Diseases 0.000 description 1
- 201000011054 breast malignant phyllodes tumor Diseases 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 125000004106 butoxy group Chemical group [*]OC([H])([H])C([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- 125000006630 butoxycarbonylamino group Chemical group 0.000 description 1
- BZTLBVUBTRSJCL-UHFFFAOYSA-N butyl sulfamate Chemical group CCCCOS(N)(=O)=O BZTLBVUBTRSJCL-UHFFFAOYSA-N 0.000 description 1
- 235000010354 butylated hydroxytoluene Nutrition 0.000 description 1
- 229940067596 butylparaben Drugs 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- BPKIGYQJPYCAOW-FFJTTWKXSA-I calcium;potassium;disodium;(2s)-2-hydroxypropanoate;dichloride;dihydroxide;hydrate Chemical compound O.[OH-].[OH-].[Na+].[Na+].[Cl-].[Cl-].[K+].[Ca+2].C[C@H](O)C([O-])=O BPKIGYQJPYCAOW-FFJTTWKXSA-I 0.000 description 1
- 229940127093 camptothecin Drugs 0.000 description 1
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical compound C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 description 1
- 230000036952 cancer formation Effects 0.000 description 1
- 208000035269 cancer or benign tumor Diseases 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- ZGCRYQYOBQICBM-UHFFFAOYSA-N carbamic acid oxetane Chemical compound C(N)(O)=O.O1CCC1 ZGCRYQYOBQICBM-UHFFFAOYSA-N 0.000 description 1
- 125000001951 carbamoylamino group Chemical group C(N)(=O)N* 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-N carbonic acid monoamide Natural products NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 229960004562 carboplatin Drugs 0.000 description 1
- 150000001735 carboxylic acids Chemical group 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- 229960005243 carmustine Drugs 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000022534 cell killing Effects 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 238000012054 celltiter-glo Methods 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 231100000481 chemical toxicant Toxicity 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 229940044683 chemotherapy drug Drugs 0.000 description 1
- 238000004296 chiral HPLC Methods 0.000 description 1
- 238000000633 chiral stationary phase gas chromatography Methods 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- IJOOHPMOJXWVHK-UHFFFAOYSA-N chlorotrimethylsilane Chemical compound C[Si](C)(C)Cl IJOOHPMOJXWVHK-UHFFFAOYSA-N 0.000 description 1
- 201000005217 chondroblastoma Diseases 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 208000021668 chronic eosinophilic leukemia Diseases 0.000 description 1
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 1
- 208000029664 classic familial adenomatous polyposis Diseases 0.000 description 1
- 208000009060 clear cell adenocarcinoma Diseases 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000003927 comet assay Methods 0.000 description 1
- 231100000170 comet assay Toxicity 0.000 description 1
- 201000002388 complement deficiency Diseases 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 238000010668 complexation reaction Methods 0.000 description 1
- 229940126543 compound 14 Drugs 0.000 description 1
- 229940126142 compound 16 Drugs 0.000 description 1
- 229940125782 compound 2 Drugs 0.000 description 1
- 229940125833 compound 23 Drugs 0.000 description 1
- 229940125961 compound 24 Drugs 0.000 description 1
- 229940125846 compound 25 Drugs 0.000 description 1
- 229940125851 compound 27 Drugs 0.000 description 1
- 229940126214 compound 3 Drugs 0.000 description 1
- 229940125877 compound 31 Drugs 0.000 description 1
- 229940125878 compound 36 Drugs 0.000 description 1
- 229940125936 compound 42 Drugs 0.000 description 1
- 229940125898 compound 5 Drugs 0.000 description 1
- 229940127113 compound 57 Drugs 0.000 description 1
- 229940125900 compound 59 Drugs 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000012937 correction Methods 0.000 description 1
- 230000001054 cortical effect Effects 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- 150000001923 cyclic compounds Chemical class 0.000 description 1
- 150000001924 cycloalkanes Chemical class 0.000 description 1
- 208000002445 cystadenocarcinoma Diseases 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 229960003901 dacarbazine Drugs 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- 238000007405 data analysis Methods 0.000 description 1
- 229960000975 daunorubicin Drugs 0.000 description 1
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 1
- DEZRYPDIMOWBDS-UHFFFAOYSA-N dcm dichloromethane Chemical compound ClCCl.ClCCl DEZRYPDIMOWBDS-UHFFFAOYSA-N 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 230000000779 depleting effect Effects 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 229950000758 dianhydrogalactitol Drugs 0.000 description 1
- 229950002389 diaziquone Drugs 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- UXGNZZKBCMGWAZ-UHFFFAOYSA-N dimethylformamide dmf Chemical compound CN(C)C=O.CN(C)C=O UXGNZZKBCMGWAZ-UHFFFAOYSA-N 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- SACNIGZYDTUHKB-UHFFFAOYSA-N ditert-butyl-[2-[2,4,6-tri(propan-2-yl)phenyl]phenyl]phosphane Chemical compound CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1C1=CC=CC=C1P(C(C)(C)C)C(C)(C)C SACNIGZYDTUHKB-UHFFFAOYSA-N 0.000 description 1
- VSJKWCGYPAHWDS-UHFFFAOYSA-N dl-camptothecin Natural products C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-UHFFFAOYSA-N 0.000 description 1
- CETRZFQIITUQQL-UHFFFAOYSA-N dmso dimethylsulfoxide Chemical compound CS(C)=O.CS(C)=O CETRZFQIITUQQL-UHFFFAOYSA-N 0.000 description 1
- 239000003534 dna topoisomerase inhibitor Substances 0.000 description 1
- 230000034431 double-strand break repair via homologous recombination Effects 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 238000000132 electrospray ionisation Methods 0.000 description 1
- 238000002330 electrospray ionisation mass spectrometry Methods 0.000 description 1
- 229940087477 ellence Drugs 0.000 description 1
- 201000009409 embryonal rhabdomyosarcoma Diseases 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 201000003914 endometrial carcinoma Diseases 0.000 description 1
- 230000002357 endometrial effect Effects 0.000 description 1
- 208000028730 endometrioid adenocarcinoma Diseases 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- JOZGNYDSEBIJDH-UHFFFAOYSA-N eniluracil Chemical compound O=C1NC=C(C#C)C(=O)N1 JOZGNYDSEBIJDH-UHFFFAOYSA-N 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 229960001904 epirubicin Drugs 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 201000010877 epithelioid cell melanoma Diseases 0.000 description 1
- 210000003238 esophagus Anatomy 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- 235000019441 ethanol Nutrition 0.000 description 1
- LVSGIRALGRTDAN-UHFFFAOYSA-N ethyl 3,6-dihydro-2h-pyran-2-carboxylate Chemical compound CCOC(=O)C1CC=CCO1 LVSGIRALGRTDAN-UHFFFAOYSA-N 0.000 description 1
- RIFGWPKJUGCATF-UHFFFAOYSA-N ethyl chloroformate Chemical compound CCOC(Cl)=O RIFGWPKJUGCATF-UHFFFAOYSA-N 0.000 description 1
- 229960001617 ethyl hydroxybenzoate Drugs 0.000 description 1
- 235000010228 ethyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004403 ethyl p-hydroxybenzoate Substances 0.000 description 1
- NUVBSKCKDOMJSU-UHFFFAOYSA-N ethylparaben Chemical compound CCOC(=O)C1=CC=C(O)C=C1 NUVBSKCKDOMJSU-UHFFFAOYSA-N 0.000 description 1
- OJCSPXHYDFONPU-UHFFFAOYSA-N etoac etoac Chemical compound CCOC(C)=O.CCOC(C)=O OJCSPXHYDFONPU-UHFFFAOYSA-N 0.000 description 1
- 210000001808 exosome Anatomy 0.000 description 1
- 201000008815 extraosseous osteosarcoma Diseases 0.000 description 1
- 239000003925 fat Substances 0.000 description 1
- 201000008825 fibrosarcoma of bone Diseases 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 229960004783 fotemustine Drugs 0.000 description 1
- YAKWPXVTIGTRJH-UHFFFAOYSA-N fotemustine Chemical compound CCOP(=O)(OCC)C(C)NC(=O)N(CCCl)N=O YAKWPXVTIGTRJH-UHFFFAOYSA-N 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 238000013467 fragmentation Methods 0.000 description 1
- 238000006062 fragmentation reaction Methods 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 231100000221 frame shift mutation induction Toxicity 0.000 description 1
- 239000012737 fresh medium Substances 0.000 description 1
- 238000002825 functional assay Methods 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 208000015419 gastrin-producing neuroendocrine tumor Diseases 0.000 description 1
- 201000000052 gastrinoma Diseases 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- 229940020967 gemzar Drugs 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 208000005017 glioblastoma Diseases 0.000 description 1
- 201000003872 goiter Diseases 0.000 description 1
- 210000002503 granulosa cell Anatomy 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 201000009277 hairy cell leukemia Diseases 0.000 description 1
- 125000004438 haloalkoxy group Chemical group 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 201000011066 hemangioma Diseases 0.000 description 1
- 208000018706 hematopoietic system disease Diseases 0.000 description 1
- 230000002440 hepatic effect Effects 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 208000006359 hepatoblastoma Diseases 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- 125000004475 heteroaralkyl group Chemical group 0.000 description 1
- UUVWYPNAQBNQJQ-UHFFFAOYSA-N hexamethylmelamine Chemical compound CN(C)C1=NC(N(C)C)=NC(N(C)C)=N1 UUVWYPNAQBNQJQ-UHFFFAOYSA-N 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 208000029824 high grade glioma Diseases 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 102000057079 human MSH2 Human genes 0.000 description 1
- 102000050929 human PMS2 Human genes 0.000 description 1
- 229920003063 hydroxymethyl cellulose Polymers 0.000 description 1
- 229940031574 hydroxymethyl cellulose Drugs 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 1
- 208000018949 hyper-IgM syndrome type 2 Diseases 0.000 description 1
- 230000036031 hyperthermia Effects 0.000 description 1
- 239000005457 ice water Substances 0.000 description 1
- 229940099279 idamycin Drugs 0.000 description 1
- 229960000908 idarubicin Drugs 0.000 description 1
- 125000002962 imidazol-1-yl group Chemical group [*]N1C([H])=NC([H])=C1[H] 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 230000008076 immune mechanism Effects 0.000 description 1
- 239000012274 immune-checkpoint protein inhibitor Substances 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 238000003365 immunocytochemistry Methods 0.000 description 1
- 201000001373 immunodeficiency with hyper-IgM type 2 Diseases 0.000 description 1
- 238000003364 immunohistochemistry Methods 0.000 description 1
- 229960001438 immunostimulant agent Drugs 0.000 description 1
- 239000003022 immunostimulating agent Substances 0.000 description 1
- 230000003308 immunostimulating effect Effects 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- JYGFTBXVXVMTGB-UHFFFAOYSA-N indolin-2-one Chemical compound C1=CC=C2NC(=O)CC2=C1 JYGFTBXVXVMTGB-UHFFFAOYSA-N 0.000 description 1
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000009830 intercalation Methods 0.000 description 1
- 230000002601 intratumoral effect Effects 0.000 description 1
- 206010073095 invasive ductal breast carcinoma Diseases 0.000 description 1
- 201000010985 invasive ductal carcinoma Diseases 0.000 description 1
- 206010073096 invasive lobular breast carcinoma Diseases 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 230000005865 ionizing radiation Effects 0.000 description 1
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 210000002332 leydig cell Anatomy 0.000 description 1
- 239000000436 ligase inhibitor Substances 0.000 description 1
- 238000012417 linear regression Methods 0.000 description 1
- 206010024627 liposarcoma Diseases 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 201000002250 liver carcinoma Diseases 0.000 description 1
- 229960002247 lomustine Drugs 0.000 description 1
- 201000000014 lung giant cell carcinoma Diseases 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 208000012804 lymphangiosarcoma Diseases 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 230000000527 lymphocytic effect Effects 0.000 description 1
- 201000010953 lymphoepithelioma-like carcinoma Diseases 0.000 description 1
- 208000025036 lymphosarcoma Diseases 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 201000007054 malignant Sertoli cell tumor Diseases 0.000 description 1
- 201000011614 malignant glioma Diseases 0.000 description 1
- 201000006812 malignant histiocytosis Diseases 0.000 description 1
- 208000006178 malignant mesothelioma Diseases 0.000 description 1
- 208000021810 malignant mixed neoplasm Diseases 0.000 description 1
- 208000026267 malignant phyllodes tumor Diseases 0.000 description 1
- 201000000289 malignant teratoma Diseases 0.000 description 1
- 208000027202 mammary Paget disease Diseases 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 208000000516 mast-cell leukemia Diseases 0.000 description 1
- 201000008749 mast-cell sarcoma Diseases 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000008774 maternal effect Effects 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 208000023356 medullary thyroid gland carcinoma Diseases 0.000 description 1
- 206010027191 meningioma Diseases 0.000 description 1
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 150000004702 methyl esters Chemical class 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 238000002493 microarray Methods 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 230000003228 microsomal effect Effects 0.000 description 1
- 210000001589 microsome Anatomy 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 208000022499 mismatch repair cancer syndrome Diseases 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- QXYYYPFGTSJXNS-UHFFFAOYSA-N mitozolomide Chemical compound N1=NN(CCCl)C(=O)N2C1=C(C(=O)N)N=C2 QXYYYPFGTSJXNS-UHFFFAOYSA-N 0.000 description 1
- 229950005967 mitozolomide Drugs 0.000 description 1
- 238000001823 molecular biology technique Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 201000006894 monocytic leukemia Diseases 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 201000010879 mucinous adenocarcinoma Diseases 0.000 description 1
- 208000010492 mucinous cystadenocarcinoma Diseases 0.000 description 1
- 238000007838 multiplex ligation-dependent probe amplification Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- 239000003471 mutagenic agent Substances 0.000 description 1
- 231100000707 mutagenic chemical Toxicity 0.000 description 1
- 231100000243 mutagenic effect Toxicity 0.000 description 1
- 230000003505 mutagenic effect Effects 0.000 description 1
- 201000005962 mycosis fungoides Diseases 0.000 description 1
- 208000001611 myxosarcoma Diseases 0.000 description 1
- PEECTLLHENGOKU-UHFFFAOYSA-N n,n-dimethylpyridin-4-amine Chemical compound CN(C)C1=CC=NC=C1.CN(C)C1=CC=NC=C1 PEECTLLHENGOKU-UHFFFAOYSA-N 0.000 description 1
- LPOIGVZLNWEGJG-UHFFFAOYSA-N n-benzyl-5-(4-methylpiperazin-1-yl)-2-nitroaniline Chemical compound C1CN(C)CCN1C1=CC=C([N+]([O-])=O)C(NCC=2C=CC=CC=2)=C1 LPOIGVZLNWEGJG-UHFFFAOYSA-N 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 208000014761 nasopharyngeal type undifferentiated carcinoma Diseases 0.000 description 1
- 210000001989 nasopharynx Anatomy 0.000 description 1
- IOMMMLWIABWRKL-WUTDNEBXSA-N nazartinib Chemical compound C1N(C(=O)/C=C/CN(C)C)CCCC[C@H]1N1C2=C(Cl)C=CC=C2N=C1NC(=O)C1=CC=NC(C)=C1 IOMMMLWIABWRKL-WUTDNEBXSA-N 0.000 description 1
- 210000003739 neck Anatomy 0.000 description 1
- 201000008026 nephroblastoma Diseases 0.000 description 1
- 210000000653 nervous system Anatomy 0.000 description 1
- 210000001020 neural plate Anatomy 0.000 description 1
- 208000027831 neuroepithelial neoplasm Diseases 0.000 description 1
- 230000001272 neurogenic effect Effects 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- KPMKNHGAPDCYLP-UHFFFAOYSA-N nimustine hydrochloride Chemical compound Cl.CC1=NC=C(CNC(=O)N(CCCl)N=O)C(N)=N1 KPMKNHGAPDCYLP-UHFFFAOYSA-N 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 150000004005 nitrosamines Chemical class 0.000 description 1
- GQPLMRYTRLFLPF-UHFFFAOYSA-N nitrous oxide Inorganic materials [O-][N+]#N GQPLMRYTRLFLPF-UHFFFAOYSA-N 0.000 description 1
- 125000006574 non-aromatic ring group Chemical group 0.000 description 1
- 201000009804 nonencapsulated sclerosing carcinoma Diseases 0.000 description 1
- 230000037434 nonsense mutation Effects 0.000 description 1
- TVMXDCGIABBOFY-UHFFFAOYSA-N octane Chemical compound CCCCCCCC TVMXDCGIABBOFY-UHFFFAOYSA-N 0.000 description 1
- 208000027825 odontogenic neoplasm Diseases 0.000 description 1
- 230000009437 off-target effect Effects 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 238000002966 oligonucleotide array Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 231100000822 oral exposure Toxicity 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- QMLWSAXEQSBAAQ-UHFFFAOYSA-N oxetan-3-ol Chemical compound OC1COC1 QMLWSAXEQSBAAQ-UHFFFAOYSA-N 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 208000004019 papillary adenocarcinoma Diseases 0.000 description 1
- 201000010198 papillary carcinoma Diseases 0.000 description 1
- 201000010210 papillary cystadenocarcinoma Diseases 0.000 description 1
- 208000024641 papillary serous cystadenocarcinoma Diseases 0.000 description 1
- 201000001494 papillary transitional carcinoma Diseases 0.000 description 1
- 208000031101 papillary transitional cell carcinoma Diseases 0.000 description 1
- 230000007918 pathogenicity Effects 0.000 description 1
- 229960002340 pentostatin Drugs 0.000 description 1
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- RLZZZVKAURTHCP-UHFFFAOYSA-N phenanthrene-3,4-diol Chemical compound C1=CC=C2C3=C(O)C(O)=CC=C3C=CC2=C1 RLZZZVKAURTHCP-UHFFFAOYSA-N 0.000 description 1
- 208000028591 pheochromocytoma Diseases 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 208000024724 pineal body neoplasm Diseases 0.000 description 1
- 125000004483 piperidin-3-yl group Chemical group N1CC(CCC1)* 0.000 description 1
- NBFIAMNDAAXUFC-UHFFFAOYSA-N piperidin-3-yl methanesulfonate Chemical compound CS(=O)(=O)OC1CCCNC1 NBFIAMNDAAXUFC-UHFFFAOYSA-N 0.000 description 1
- HDOWRFHMPULYOA-UHFFFAOYSA-N piperidin-4-ol Chemical compound OC1CCNCC1 HDOWRFHMPULYOA-UHFFFAOYSA-N 0.000 description 1
- LZJOBCQSXGWBFP-UHFFFAOYSA-N piperidin-4-ylmethyl N-[3-(tert-butylsulfamoyl)-4-[2-[3-methoxy-5-(propan-2-yloxycarbonylamino)pyridin-2-yl]-1,3-thiazol-5-yl]phenyl]carbamate Chemical compound C(C)(C)(C)NS(=O)(=O)C=1C=C(C=CC=1C1=CN=C(S1)C1=NC=C(C=C1OC)NC(=O)OC(C)C)NC(OCC1CCNCC1)=O LZJOBCQSXGWBFP-UHFFFAOYSA-N 0.000 description 1
- DNUTZBZXLPWRJG-UHFFFAOYSA-M piperidine-1-carboxylate Chemical compound [O-]C(=O)N1CCCCC1 DNUTZBZXLPWRJG-UHFFFAOYSA-M 0.000 description 1
- 239000000419 plant extract Substances 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 150000003057 platinum Chemical class 0.000 description 1
- YJGVMLPVUAXIQN-XVVDYKMHSA-N podophyllotoxin Chemical compound COC1=C(OC)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@H](O)[C@@H]3[C@@H]2C(OC3)=O)=C1 YJGVMLPVUAXIQN-XVVDYKMHSA-N 0.000 description 1
- 229960001237 podophyllotoxin Drugs 0.000 description 1
- YVCVYCSAAZQOJI-UHFFFAOYSA-N podophyllotoxin Natural products COC1=C(O)C(OC)=CC(C2C3=CC=4OCOC=4C=C3C(O)C3C2C(OC3)=O)=C1 YVCVYCSAAZQOJI-UHFFFAOYSA-N 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 125000003367 polycyclic group Chemical group 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920006316 polyvinylpyrrolidine Polymers 0.000 description 1
- 238000010837 poor prognosis Methods 0.000 description 1
- 159000000001 potassium salts Chemical class 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- LOCAUIUYQHSGLN-UHFFFAOYSA-N propan-2-yl 4-[5-[2-(tert-butylsulfamoyl)-4-(pyridin-2-ylmethylcarbamoylamino)phenyl]-1,3-thiazol-2-yl]piperidine-1-carboxylate Chemical compound C(C)(C)(C)NS(=O)(=O)C1=C(C=CC(=C1)NC(NCC1=NC=CC=C1)=O)C1=CN=C(S1)C1CCN(CC1)C(=O)OC(C)C LOCAUIUYQHSGLN-UHFFFAOYSA-N 0.000 description 1
- FEUUVOWZDUCLFB-UHFFFAOYSA-N propan-2-yl 4-[5-[4-amino-2-(tert-butylsulfamoyl)phenyl]-1,3-thiazol-2-yl]piperazine-1-carboxylate Chemical compound NC1=CC(=C(C=C1)C1=CN=C(S1)N1CCN(CC1)C(=O)OC(C)C)S(NC(C)(C)C)(=O)=O FEUUVOWZDUCLFB-UHFFFAOYSA-N 0.000 description 1
- HOQOGPXYBPLINP-UHFFFAOYSA-N propan-2-yl N-(4-methyl-1-bicyclo[2.2.2]octanyl)carbamate Chemical compound CC(C)OC(=O)NC12CCC(C)(CC1)CC2 HOQOGPXYBPLINP-UHFFFAOYSA-N 0.000 description 1
- IVRIRQXJSNCSPQ-UHFFFAOYSA-N propan-2-yl carbonochloridate Chemical compound CC(C)OC(Cl)=O IVRIRQXJSNCSPQ-UHFFFAOYSA-N 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 201000008520 protoplasmic astrocytoma Diseases 0.000 description 1
- 208000013368 pseudoglandular squamous cell carcinoma Diseases 0.000 description 1
- 125000004307 pyrazin-2-yl group Chemical group [H]C1=C([H])N=C(*)C([H])=N1 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000002206 pyridazin-3-yl group Chemical group [H]C1=C([H])C([H])=C(*)N=N1 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- SHNUBALDGXWUJI-UHFFFAOYSA-N pyridin-2-ylmethanol Chemical compound OCC1=CC=CC=N1 SHNUBALDGXWUJI-UHFFFAOYSA-N 0.000 description 1
- HGKZQJZJYQCPCB-UHFFFAOYSA-N pyridin-2-ylmethyl carbamate Chemical compound NC(=O)OCC1=CC=CC=N1 HGKZQJZJYQCPCB-UHFFFAOYSA-N 0.000 description 1
- 125000000246 pyrimidin-2-yl group Chemical group [H]C1=NC(*)=NC([H])=C1[H] 0.000 description 1
- 125000004527 pyrimidin-4-yl group Chemical group N1=CN=C(C=C1)* 0.000 description 1
- 125000004528 pyrimidin-5-yl group Chemical group N1=CN=CC(=C1)* 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 238000003753 real-time PCR Methods 0.000 description 1
- 229960005567 rebeccamycin Drugs 0.000 description 1
- INSACQSBHKIWNS-QZQSLCQPSA-N rebeccamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](OC)[C@@H](CO)O[C@H]1N1C2=C3N=C4[C](Cl)C=CC=C4C3=C3C(=O)NC(=O)C3=C2C2=CC=CC(Cl)=C21 INSACQSBHKIWNS-QZQSLCQPSA-N 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000013120 recombinational repair Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 238000003757 reverse transcription PCR Methods 0.000 description 1
- 201000007416 salivary gland adenoid cystic carcinoma Diseases 0.000 description 1
- 239000012266 salt solution Substances 0.000 description 1
- 208000014212 sarcomatoid carcinoma Diseases 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 238000001963 scanning near-field photolithography Methods 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 201000008407 sebaceous adenocarcinoma Diseases 0.000 description 1
- DCKVNWZUADLDEH-UHFFFAOYSA-N sec-butyl acetate Chemical compound CCC(C)OC(C)=O DCKVNWZUADLDEH-UHFFFAOYSA-N 0.000 description 1
- FVLVBPDQNARYJU-UHFFFAOYSA-N semustine Chemical compound CC1CCC(NC(=O)N(CCCl)N=O)CC1 FVLVBPDQNARYJU-UHFFFAOYSA-N 0.000 description 1
- 229960003440 semustine Drugs 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 210000000717 sertoli cell Anatomy 0.000 description 1
- 208000002491 severe combined immunodeficiency Diseases 0.000 description 1
- 230000035939 shock Effects 0.000 description 1
- 208000007056 sickle cell anemia Diseases 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 201000008123 signet ring cell adenocarcinoma Diseases 0.000 description 1
- 230000018381 sister chromatid cohesion Effects 0.000 description 1
- 201000002078 skin pilomatrix carcinoma Diseases 0.000 description 1
- 208000000649 small cell carcinoma Diseases 0.000 description 1
- 201000002314 small intestine cancer Diseases 0.000 description 1
- 239000000779 smoke Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- HYHCSLBZRBJJCH-UHFFFAOYSA-M sodium hydrosulfide Chemical compound [Na+].[SH-] HYHCSLBZRBJJCH-UHFFFAOYSA-M 0.000 description 1
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 230000037439 somatic mutation Effects 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 230000035892 strand transfer Effects 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 208000028210 stromal sarcoma Diseases 0.000 description 1
- 201000005211 struma ovarii Diseases 0.000 description 1
- 125000000547 substituted alkyl group Chemical group 0.000 description 1
- 239000001384 succinic acid Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- NVBFHJWHLNUMCV-UHFFFAOYSA-N sulfamide Chemical compound NS(N)(=O)=O NVBFHJWHLNUMCV-UHFFFAOYSA-N 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 208000030457 superficial spreading melanoma Diseases 0.000 description 1
- 201000008205 supratentorial primitive neuroectodermal tumor Diseases 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 206010042863 synovial sarcoma Diseases 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 229960001674 tegafur Drugs 0.000 description 1
- WFWLQNSHRPWKFK-ZCFIWIBFSA-N tegafur Chemical compound O=C1NC(=O)C(F)=CN1[C@@H]1OCCC1 WFWLQNSHRPWKFK-ZCFIWIBFSA-N 0.000 description 1
- 229960004964 temozolomide Drugs 0.000 description 1
- WLZRWMXLHNAASA-QWHCGFSZSA-N tert-butyl (2R,5S)-5-(propan-2-yloxycarbonylamino)-2-(1,3-thiazol-2-yl)piperidine-1-carboxylate Chemical compound C(C)(C)OC(=O)N[C@H]1CC[C@@H](N(C1)C(=O)OC(C)(C)C)C=1SC=CN=1 WLZRWMXLHNAASA-QWHCGFSZSA-N 0.000 description 1
- MHYGQXWCZAYSLJ-UHFFFAOYSA-N tert-butyl-chloro-diphenylsilane Chemical compound C=1C=CC=CC=1[Si](Cl)(C(C)(C)C)C1=CC=CC=C1 MHYGQXWCZAYSLJ-UHFFFAOYSA-N 0.000 description 1
- YBRBMKDOPFTVDT-UHFFFAOYSA-N tert-butylamine Chemical compound CC(C)(C)N YBRBMKDOPFTVDT-UHFFFAOYSA-N 0.000 description 1
- BCNZYOJHNLTNEZ-UHFFFAOYSA-N tert-butyldimethylsilyl chloride Chemical compound CC(C)(C)[Si](C)(C)Cl BCNZYOJHNLTNEZ-UHFFFAOYSA-N 0.000 description 1
- 210000001550 testis Anatomy 0.000 description 1
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 1
- WHRNULOCNSKMGB-UHFFFAOYSA-N tetrahydrofuran thf Chemical compound C1CCOC1.C1CCOC1 WHRNULOCNSKMGB-UHFFFAOYSA-N 0.000 description 1
- 150000004905 tetrazines Chemical class 0.000 description 1
- WROMPOXWARCANT-UHFFFAOYSA-N tfa trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.OC(=O)C(F)(F)F WROMPOXWARCANT-UHFFFAOYSA-N 0.000 description 1
- 238000010257 thawing Methods 0.000 description 1
- 238000011285 therapeutic regimen Methods 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 208000026308 thyroid gland diffuse sclerosing papillary carcinoma Diseases 0.000 description 1
- 208000030901 thyroid gland follicular carcinoma Diseases 0.000 description 1
- 208000015191 thyroid gland papillary and follicular carcinoma Diseases 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- KJAMZCVTJDTESW-UHFFFAOYSA-N tiracizine Chemical compound C1CC2=CC=CC=C2N(C(=O)CN(C)C)C2=CC(NC(=O)OCC)=CC=C21 KJAMZCVTJDTESW-UHFFFAOYSA-N 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 210000002105 tongue Anatomy 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 229940044693 topoisomerase inhibitor Drugs 0.000 description 1
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 1
- 229960000303 topotecan Drugs 0.000 description 1
- 239000003440 toxic substance Substances 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 230000002110 toxicologic effect Effects 0.000 description 1
- 231100000759 toxicological effect Toxicity 0.000 description 1
- 208000029335 trabecular adenocarcinoma Diseases 0.000 description 1
- 230000033587 transcription-coupled nucleotide-excision repair Effects 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 206010044412 transitional cell carcinoma Diseases 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- UCPYLLCMEDAXFR-UHFFFAOYSA-N triphosgene Chemical compound ClC(Cl)(Cl)OC(=O)OC(Cl)(Cl)Cl UCPYLLCMEDAXFR-UHFFFAOYSA-N 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 230000005748 tumor development Effects 0.000 description 1
- 208000010576 undifferentiated carcinoma Diseases 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 150000003672 ureas Chemical class 0.000 description 1
- 210000000626 ureter Anatomy 0.000 description 1
- 210000003932 urinary bladder Anatomy 0.000 description 1
- 125000005500 uronium group Chemical group 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 238000007482 whole exome sequencing Methods 0.000 description 1
- 238000012070 whole genome sequencing analysis Methods 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/426—1,3-Thiazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/454—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. pimozide, domperidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene or sparfloxacin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/02—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings
- C07D277/20—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D277/22—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
- C07D277/28—Radicals substituted by nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/02—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings
- C07D277/20—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D277/22—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
- C07D277/30—Radicals substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/02—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings
- C07D277/20—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D277/32—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D277/38—Nitrogen atoms
- C07D277/42—Amino or imino radicals substituted by hydrocarbon or substituted hydrocarbon radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Immunology (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Hospice & Palliative Care (AREA)
- Psychiatry (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Thiazole And Isothizaole Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
本申請案係關於由以下結構式表示之RAD51抑制劑,
Description
本申請案係關於RAD51抑制劑及其使用方法,諸如用於治療包括癌症、自體免疫疾病、免疫缺乏及神經退化性疾病之病狀。
RAD51為真核生物基因。由此基因所編碼之蛋白質為RAD51蛋白家族之成員,其有助於修復DNA雙股斷裂。RAD51家族成員係與細菌RecA、古細菌RadA及酵母RAD51同源。該蛋白質在大多數真核生物(從酵母到人類)中高度保守。在人類中,RAD51係一種339個胺基酸之蛋白質,其在雙股斷裂(DSB)修復期間在DNA之同源重組中起主要作用。RAD51催化斷裂序列與其未受損同源物之間之鏈轉移,以允許重新合成受損區域(參見同源重組模型)。
研究已證實,對某些DNA損傷療法的敏化與促進HR DNA修復之蛋白質中的細胞缺陷相關聯。此敏化係對DNA交聯化療藥物(30至100倍)及電離輻射(3至5倍)特別劇烈(Godthelp等人,「Mammalian Rad51C contributes to DNA cross-link resistance, sister chromatid cohesion and genomic stability」,Nucleic Acids Res., 30:2172-2182, 2002;Tebbs等人,「Correction of chromosomal instability and sensitivity to diverse mutagens by a cloned cDNA of the XRCC3 DNA repair gene」,Proc. Natl. Acad. Sci. USA, 92:6354-6358, 1995;Takata等人,「Chromosome instability and defective recombinational repair in knockout mutants of the five Rad51 paralogs」,Mol. Cell Biol., 21:2858-2866, 2001;Liu等人,「XRCC2 and XRCC3, new human Rad51-family members, promote chromosome stability and protect against DNA cross-links and other damages」,Mol. Cell, 1:783-793, 1998)。
最近數個研究小組已證實,HR可經部分抑制以使細胞對DNA損傷療法敏感。已證實XRCC3 (RAD51旁系同源蛋白)之抑制作用,該證實使用對應於另一種旁系同源蛋白之合成肽。此肽使中國倉鼠卵巢(CHO)細胞對順鉑敏感,並抑制亞核RAD51變異區回應於DNA損傷而形成(Connell等人,Cancer Res., 64:3002-3005, 2004)。其他研究者已抑制RAD51蛋白本身之表現(Russell等人,Cancer Res., 63:7377-7383, 2003;Hansen等人,Int. J. Cancer, 105:472-479, 2003;Ohnishi等人,Biochem. Biophys. Res. Commun., 245:319-324, 1998;Ito等人,J. Gene Med., 7(8):1044-1052, 2005;Collins等人,Nucleic Acids Res., 29:1534-1538, 2001)或藉由過度表現源自BRCA2之顯性陰性BRC肽片段來阻斷其功能(Chen等人,J. Biol. Chem., 274:32931-32935, 1999)。鑑於對某些DNA損傷療法之敏感性增加與HR DNA修復相關蛋白中之細胞缺陷之間的關聯,需要抑制RAD51之額外化合物。
申請人現已發現新穎化合物,其等為RAD51之有效抑制劑(參見實例1至75)。本發明RAD51抑制劑藉由在DNA損傷誘導後改變RAD51之核質細胞質分佈來抑制同源重組。本發明RAD51抑制劑減少AID誘導之DNA雙股斷裂的修復,導致正常及惡性B淋巴細胞兩者中之AID依賴性細胞毒性。如在Caco-2細胞中所量測,此等RAD51抑制劑中的某些具有優異細胞滲透性(參見實例76)。在具有良好細胞滲透性之RAD51抑制劑中,若干種具有優異代謝穩定性(如藉由肝臟微粒體檢定所量測,參見實例77)及曝露,包括口服曝露(參見實例79)。
本發明亦提供包含如本文所述之化合物或其醫藥上可接受之鹽及醫藥上可接受之載劑或稀釋劑的醫藥組合物。
本發明進一步提供治療癌症、自體免疫疾病、免疫缺乏或神經退化性疾病之方法。該方法包括向有需要之個體投與有效量之本文所揭示之化合物或其醫藥上可接受之鹽或本文所揭示之醫藥組合物。
亦提供本文所揭示之化合物或其醫藥上可接受之鹽、或本文所揭示之醫藥組合物之用途,其用於製備用於治療癌症、自體免疫疾病、免疫缺乏或神經退化性疾病之藥物。
亦提供本文所揭示之化合物或其醫藥上可接受之鹽、或本文所揭示之醫藥組合物,其用於治療癌症、自體免疫疾病、免疫缺乏或神經退化性疾病。
雖然申請人不希望受任何機制束縛,但據信本發明化合物藉由與MDC1結合併導致形成RAD51活性複合體之能力降低而抑制RAD51。
相關申請案之交互參照
本申請案主張2017年9月11日申請之美國臨時申請案第62/556,763號;及2018年7月30日申請之美國臨時申請案第62/711,959號之權利。前述申請案之全部教示係以引用之方式併入本文中。
在第一實施例中,本發明提供由結構式I
表示之化合物: I
;
或其醫藥上可接受之鹽,其中:
該噻唑環係視情況經–F或–Cl取代;
Cy為-(C3
–C7
)環烷基、橋聯(C6
–C12
)環烷基或4至12員雜環,其等各係視情況經一或多個選自由鹵素、-OH、(C1
-C4
)烷基及(C1
-C4
)烷氧基組成之群的基團取代;
當X5
係與Cy之氮環原子連接時,X5
不存在;
當X5
係與Cy之碳環原子連接時,X5
為NRa
或O;
X6
為NRa
或O;
R1
為(C1
–C5
)烷基;
R3
為(C1
–C5
)烷基、-CH2
-苯基、-(C3
–C7
)環烷基、-CH2
-(C3
–C7
)環烷基、-CH2
-單環3至7員雜環或單環3至7員雜環,其中由R3
表示或在由R3
表示之基團中的該(C1
–C5
)烷基、-(C3
–C7
)環烷基、苯基或單環3至7員雜環係視情況經一或多個選自由鹵素、-OH、(C1
-C4
)烷基、鹵甲基、鹵甲氧基、-CN及(C1
-C4
)烷氧基組成之群的基團取代;
R2
為-NRa
C(O)O(C1
-C4
)烷基;-NRa
C(O)NRa
(C1
-C4
)烷基;-NRa
C(O)O(C2
-C4
)烯基;-NRa
C(O)NRa
(C2
-C4
)烯基;-NRa
C(O)O-(C3
-C6
)環烷基;-NRa
C(O)NRa
-(C3
-C7
)環烷基;-NRa
C(O)O-苯基;-NRa
C(O)NRa
-苯基;-NRa
C(O)O-單環3至7員雜環;-NRa
C(O)NRa
-單環3至7員雜環;-NRa
C(O)O-單環5至6員雜芳族環;-NRa
C(O)NRa
-單環5至6員雜芳族環;
其中在由R2
表示之基團中的該(C1
–C4
)烷基及(C2
-C4
)烯基各係視情況且獨立地經一或多個選自由鹵素、N3
、–ORa
、-NRa
Ra
、-(C3
–C6
)環烷基、苯基、單環3至7員雜環及單環5至6員雜芳族環組成之群的基團取代;
其中在由R2
表示之基團中的該(C3
–C7
)環烷基係視情況經一或多個選自由鹵素、-CH3
、=O、-ORa
及-NRa
Ra
組成之群的基團取代;
其中在由R2
表示之基團中的該苯基係視情況經一或多個選自由鹵素、-CH3
、鹵甲基、鹵甲氧基、-CN、-ORa
及-N3
組成之群的基團取代;
其中在由R2
表示之基團中的該雜環係視情況經一或多個選自由=O、鹵素、–ORa
、-CH3
、鹵甲基及鹵甲氧基組成之群的基團取代;
其中在由R2
表示之基團中的該雜芳族環係視情況經一或多個選自由鹵素、-CN、-CH3
、鹵甲基、鹵甲氧基、-ORa
及-NRa
Ra
組成之群的基團取代;且
各Ra
係獨立地為–H或-CH3
。
在第二實施例中,本發明提供由結構式II
表示之化合物: II
;
或其醫藥上可接受之鹽,其中
該噻唑環係視情況經-F或–Cl取代;
Cy為環己基或6員單環雜環;
X5
及X6
各係獨立地為NRa
或O;
R1
為(C1
–C5
)烷基;
R3
為(C1
–C5
)烷基或單環3至7員雜環;
R2
為-NRa
C(O)O(C1
-C4
)烷基;-NRa
C(O)NRa
(C1
-C4
)烷基;-NRa
C(O)O(C2
-C4
)烯基;-NRa
C(O)NRa
(C2
-C4
)烯基;-NRa
C(O)-O(C3
-C6
)環烷基;-NRa
C(O)NRa
-(C3
-C6
)環烷基;-NRa
C(O)O-苯基;-NRa
C(O)NRa
-苯基;-NRa
C(O)O-單環3至7員雜環;-NRa
C(O)NRa
-單環3至7員雜環;-NRa
C(O)O-單環5至6員雜芳族環;-NRa
C(O)NRa
-單環5至6員雜芳族環;
其中在由R2
表示之基團中的該(C1
–C4
)烷基及(C2
-C4
)烯基各係視情況且獨立地經一或多個鹵素、N3
、–ORa
、-NRa
Ra
、-(C3
–C6
)環烷基、苯基、單環3至7員雜環或單環5至6員雜芳族環取代;
其中在由R2
表示之基團中的該-(C3
–C6
)環烷基係視情況經一或多個鹵素、-CH3
、-ORa
或-NRa
Ra
取代;
其中在由R2
表示之基團中的該苯基係視情況經一或多個鹵素、-CH3
、鹵甲基、鹵甲氧基、-ORa
或-N3
取代;
其中在由R2
表示之基團中的該雜環係視情況經一或多個=O、鹵素、-CH3
、鹵甲基或鹵甲氧基取代;
其中在由R2
表示之基團中的該雜芳族環係視情況經一或多個鹵素、-CH3
、鹵甲基、鹵甲氧基、-ORa
或-NRa
Ra
取代;且
各Ra
係獨立地為–H或-CH3
。
在第三實施例中,本發明提供根據結構式I
之化合物或其醫藥上可接受之鹽,其中Cy為環丙基、環丁基、環戊基、環己基、環庚基;氮雜環丁基、氮雜環庚基、二氮雜螺[4.4]壬基、二氮雜螺[3.5]壬基、二氮雜環庚基、二氫咪唑、二氫呋喃基、二氫哌喃基、二氫吡啶基、二氫嘧啶基、二氫噻吩基、二氫苯硫基、二氫硫哌喃基、六氫噠嗪基、六氫嘧啶基、乙內醯脲基、吲哚啉基、異吲哚啉基、嗎啉基、環氧乙基、氧雜環丁基、哌啶基、哌嗪基、吡咯啶酮基、吡咯啶基、四氫呋喃基、四氫咪唑、四氫吲哚基、四氫哌喃基、四氫噻吩基、四氫吡啶基、四氫嘧啶基、四氫苯硫基、四氫硫哌喃基、硫嗎啉基、莨菪烷基、戊內醯胺基;雙環[2.1.1]己基、雙環[2.2.1]庚基、雙環[2.2.2]辛基、雙環[3.2.1]辛基、雙環[4.3.1]癸基、雙環[3.3.1]壬基、冰片基、冰片烯基、降莰基、降莰烯基(norbornenyl)、6,6-二甲基雙環[3.1.1]庚基、三環丁基、金剛烷基;氮雜降莰基、啶基、異啶基、莨菪烷基、氮雜雙環[2.2.1]庚基、2-氮雜雙環[3.2.1]辛基、氮雜雙環[3.2.1]辛基、氮雜雙環[3.2.2]壬基、氮雜雙環[3.3.0]壬基、氮雜雙環[3.3.1]壬基、二氮雜雙環[2.2.1]庚基、二氮雜雙環[3.2.1]辛基、八氫吡咯并[3,4-b]吡咯基、八氫吡咯并[3,4-c]吡咯基;且其餘變量係如第一實施例中所定義。
在第四實施例中,本發明提供根據結構式I
或II
之化合物或其醫藥上可接受之鹽,其中Cy為環己基、嗎啉基、硫嗎啉基、哌啶基、哌嗪基、六氫噠嗪基、六氫嘧啶基、戊內醯胺基、二氫哌喃基、二氫吡啶基、二氫嘧啶基、二氫硫哌喃基、四氫哌喃基、四氫吡啶基、四氫嘧啶基或四氫硫哌喃基;且其餘變量係如第一、第二及/或第三實施例中所定義。
在第五實施例中,本發明提供由結構式III
表示之化合物, III
,
或其醫藥上可接受之鹽,其中:
X7
為NH或O;
R4
為(C1
–C4
)烷基、(C3
-C6
)環烷基或單環3至7員雜環;
其中由R4
表示之(C1
–C4
)烷基係視情況經一或多個選自由鹵素、N3
、–ORa
、-NRa
Ra
、-(C3
–C6
)環烷基、苯基、單環3至7員雜環及單環5至6員雜芳族環組成之群的基團取代,
其中由R4
表示之(C3
-C6
)環烷基或單環3至7員雜環、在由R4
表示之基團中的該(C3
-C6
)環烷基或單環3至7員雜環係視情況經一或多個選自由鹵素、-ORa
、=O及-CH3
組成之群的基團取代,
其中在由R4
表示之基團中的該苯基係視情況經一或多個選自由鹵素、-CH3
、鹵甲基、鹵甲氧基、-ORa
及-N3
組成之群的基團取代;
其中在由R4
表示之基團中的該雜芳族環係視情況經一或多個選自由鹵素及-CH3
組成之群的基團取代;且其餘變量係如第一、第二、第三及/或第四實施例中所定義。
在第六實施例中,本發明提供根據結構式III
之化合物或其醫藥上可接受之鹽,其中X7
為NH或O;R3
為(C1
–C5
)烷基;且R4
為(C1
–C4
)烷基,其中由R4
表示之(C1
–C4
)烷基係視情況經一或多個鹵素、–ORa
、-NRa
Ra
、-(C3
–C6
)環烷基、苯基(視情況經一或多個鹵素、-CH3
、鹵甲基、鹵甲氧基、ORa
或N3
取代)、單環3至7員雜環(視情況經=O、鹵素或–CH3
取代)或單環5至6員雜芳族環(視情況經鹵素或–CH3
取代)取代;且其餘變量係如第一、第二、第三、第四及/或第五實施例中所定義。
在第十三實施例中,本發明提供根據結構式I
、II
或III
之化合物或其醫藥上可接受之鹽,其中Cy為氮雜環丁基或吡咯啶基,且氮環原子係與噻唑環連接;且其餘變量係如第一、第二、第三、第四、第五及/或第六實施例中所定義。
在第十四實施例中,本發明提供根據結構式I
、II
或III
之化合物或其醫藥上可接受之鹽,其中Cy為1,7-二氮雜螺[4.4]壬基、2,7-二氮雜螺[4.4]壬基、2,7-二氮雜螺[3.5]壬基、1,4-二氮雜環庚基、2,5-二氮雜雙環[2.2.1]庚基、3,8-二氮雜雙環[3.2.1]辛基、八氫吡咯并[3,4-b]吡咯基或八氫吡咯并[3,4-c]吡咯基,且兩個氮環原子係各自與噻唑環及-X5
C(O)X6
R3
部分連接;且其餘變量係如第一、第二、第三、第四、第五及/或第六實施例中所定義。
在第十五實施例中,本發明提供根據結構式III
、IV
、V
、VI
、VII
、VIII
或IX
之化合物或其醫藥上可接受之鹽,其中R4
為-(C1
–C3
)烷基、(C3
-C6
)環烷基或單環3至7員雜環,其中-(C1
–C3
)烷基係視情況經以下取代:(i)視情況經一或多個鹵素或-CH3
取代之苯基;(ii)視情況經一或多個鹵素或–CH3
取代之單環5至6員雜芳族環;或(iii)視情況經一或多個選自由鹵素及-CH3
組成之群的基團取代之單環3至7員雜環;且其餘變量係如第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二、第十三及/或第十四實施例中所定義。
在第十六實施例中,本發明提供根據結構式III
、IV
、V
、VI
、VII
、VIII
或IX
之化合物或其醫藥上可接受之鹽,其中R4
為-(C1
–C3
)烷基、-CHRa
-苯基、-CHRa
-5至6員雜芳族環或-CHRa
-3至7員單環雜環,其中在由R4
表示之基團中的該苯基、5至6員雜芳族環或3至7員單環雜環係視情況經一或多個選自由鹵素及–CH3
組成之群的基團取代;且其餘變量係如第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二、第十三及/或第十四實施例中所定義。
在第十七實施例中,本發明提供根據結構式III
、IV
、V
、VI
、VII
、VIII
或IX
之化合物或其醫藥上可接受之鹽,其中R4
為-(C1
–C3
)烷基,其視情況經以下取代:(i)視情況經一或多個鹵素、-CH3
、鹵甲基、鹵甲氧基、ORa
或N3
取代之苯基;(ii)視情況經一或多個鹵素或-CH3
取代之單環5至6員雜芳族環;或(iii)視情況經一或多個=O或–CH3
取代之單環3至7員雜環;且其餘變量係如第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二、第十三及/或第十四實施例中所定義。
在第十八實施例中,本發明提供根據結構式III
、IV
、V
、VI
、VII
、VIII
或IX
之化合物或其醫藥上可接受之鹽,其中R4
為-(C1
–C3
)烷基,其視情況經(i)視情況經一或多個鹵素、-CH3
、鹵甲基、鹵甲氧基、ORa
或N3
取代之苯基;(ii)視情況經一或多個鹵素或-CH3
取代之單環5至6員雜芳族環;或(iii)視情況經一或多個=O或–CH3
取代之單環3至7員雜環取代;且其餘變量係如第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二、第十三、第十四及/或第十七實施例中所定義。
在第十九實施例中,本發明提供根據結構式I
、III
、IV
、V
、VI
、VII
、VIII
或IX
之化合物或其醫藥上可接受之鹽,其中R3
為(C1
–C4
)烷基、-(C4
–C6
)環烷基、-CH2
-苯基、-CH2
-單環4至6員雜環或單環4至6員雜環,其中由R3
表示或在由R3
表示之基團中的該苯基或單環4至6員雜環係視情況經一或多個選自由鹵素、-ORa
及–CH3
組成之群的基團取代;且其餘變量係如第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二、第十三、第十四、第十五、第十六、第十七及/或第十八實施例中所定義。
在第二十實施例中,本發明提供由結構式X
表示之化合物: X
;
或其醫藥上可接受之鹽;且該等變量係如第一、第二、第三、第四、第五、第六、第七、第十五、第十六、第十七、第十八及/或第十九實施例中所定義。
在第二十一實施例中,本發明提供由結構式XI
表示之化合物: XI
;
或其醫藥上可接受之鹽;且該等變量係如第一、第二、第三、第四、第五、第六、第七、第十五、第十六、第十七、第十八及/或第十九實施例中所定義。
在第二十二實施例中,本發明提供由結構式XII
表示之化合物: XII
;
或其醫藥上可接受之鹽;且該等變量係如第一、第二、第三、第四、第五、第六、第八、第十五、第十六、第十七、第十八及/或第十九實施例中所定義。
在第二十三實施例中,本發明提供由結構式XIII(a)
或XIII(b)
表示之化合物:XIII(a)或XIII(b);
或其醫藥上可接受之鹽;且該等變量係如第一、第二、第三、第四、第五、第六、第八、第十五、第十六、第十七、第十八及/或第十九實施例中所定義。
在第二十三實施例中,本發明提供由結構式XIV
表示之化合物: XIV
;
或其醫藥上可接受之鹽;且該等變量係如第一、第二、第三、第四、第五、第六、第十、第十五、第十六、第十七、第十八及/或第十九實施例中所定義。
在第二十五實施例中,本發明提供根據結構式I
、II
、III
、IV
、V
、VI
、VII
、VIII
、IX
、X
、XI
、XII
、XIII(a)
、XIII(b)
、XIV
之化合物或其醫藥上可接受之鹽,其中R3
為異丙基、第三丁基、環丁基、環戊基、苄基、氧雜環丁基、四氫-2H-哌喃基或;且其餘變量係如第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二、第十三、第十四、第十五、第十六、第十七、第十八、第十九、第二十、第二十一、第二十二、第二十三及/或第二十四實施例中所定義。在一替代實施例中,R3
為異丙基或氧雜環丁基。在另一替代實施例中,R3
為異丙基。
在第二十六實施例中,本發明提供根據結構式I
、II
、III
、IV
、V
、VI
、VII
、VIII
、IX
、X
、XI
、XII
、XIII(a)
、XIII(b)
、XIV
之化合物或其醫藥上可接受之鹽,其中R1
為第三丁基;且其餘變量係如第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二、第十三、第十四、第十五、第十六、第十七、第十八、第十九、第二十、第二十一、第二十二、第二十三、第二十四及/或第二十五實施例中所定義。
在第二十七實施例中,本發明提供根據結構式III
、IV
、V
、VI
、VII
、VIII
、IX
、X
、XI
、XII
、XIII(a)
、XIII(b)
、XIV
之化合物或其醫藥上可接受之鹽,其中R4
為、、、、、、、、、、、、、、、、或;且其餘變量係如第一、第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二、第十三、第十四、第十五、第十六、第十七、第十八、第十九、第二十、第二十一、第二十二、第二十三、第二十四、第二十五及/或第二十六實施例中所定義。在一替代實施例中,R4
為、、、、、、或。在另一替代實施例中,R4
為、、、、、、、、或。在另一替代實施例中,R4
為、、、、或。在又另一替代實施例中,R4
為、、、、或。在又另一替代實施例中,R4
為或。
本發明提供一種由結構式I'
表示之化合物。
在第一實施例中,本發明提供由結構式I'
表示之化合物: I'
;
或其醫藥上可接受之鹽,其中:
該噻唑環係視情況經-F或–Cl取代;
X4
為NRa
或O;
X5
及X6
各係獨立地為NRb
或O;
R1
為(C1
–C5
)烷基;
R3
為(C1
–C5
)烷基、-(C3
–C7
)環烷基或–(CH2
)q
雜環基(其中該雜環基為單環3至7員雜環視情況經一或多個甲基取代)或苄基(其中該苄基環係視情況經一或多個鹵素、甲氧基、鹵甲氧基、甲基、鹵甲基或氰基取代);
Ra
、Rb
及Rc
中的每一個均獨立地為氫或甲基;
Rd
係獨立地為鹵素、甲氧基、鹵甲氧基、甲基、鹵甲基或氰基;
m為0、1、2或3;
n為0、1或2;且
q為0或1。
在第六實施例中,本發明提供根據結構式I'
、I'-1
、I'-2
、I'-3
或I'-4
之化合物或其醫藥上可接受之鹽,其中X4
為NH,且其餘變量係如第一實施例中所定義。
在第七實施例中,本發明提供根據結構式I'
、I'-1
、I'-2
、I'-3
或I'-4
之化合物或其醫藥上可接受之鹽,其中R3
為(C1
–C4
)烷基、-(C4
–C6
)環烷基、–(CH2
)q
雜環基(其中該雜環基為視情況經一個甲基取代之單環4至6員雜環)或苄基,且其餘變量係如第一及/或第六實施例中所定義。在一特定實施例中,R3
為異丙基、第三丁基、環丁基、環戊基、氧雜環丁基、苄基、四氫-2H-哌喃基或。在另一特定實施例中,R3
為異丙基或氧雜環丁基。
在第八實施例中,本發明提供根據結構式I'
、I'-1
、I'-2
、I'-3
或I'-4
之化合物或其醫藥上可接受之鹽,其中Rd
為鹵素,且m為0或1,且其餘變量係如第一、第六及/或第七實施例中所定義。在一特定實施例中,為、、或。
在第九實施例中,本發明提供根據結構式I'
、I'-1
、I'-2
、I'-3
或I'-4
之化合物或其醫藥上可接受之鹽,其中R1
為第三丁基,且其餘變量係如第一、第六、第七及/或第八實施例中所定義。
在第十一實施例中,本發明提供由結構式II'
表示之化合物: II'
;
或其醫藥上可接受之鹽,其中:
該噻唑環係視情況經-F或–Cl取代;
X4
為NRa
或O;
X5
及X6
各係獨立地為NRb
或O;
R1
為(C1
–C5
)烷基;
R4
為(C1
–C4
)烷基、-(C3
–C7
)環烷基、–(CH(Rc
))q
-雜環基(其中該雜環基為視情況經一或多個甲基取代之單環3至7員雜環)、–(CH(Rc
))q
-苯基(其中該苯基環係視情況經一或多個鹵素、甲氧基、鹵甲氧基、甲基、鹵甲基或氰基取代)或–(CH(Rc
))q
-2-吡啶基(其中該2-吡啶基環係視情況經一或多個鹵素、甲氧基、鹵甲氧基、甲基、鹵甲基或氰基取代);
Ra
、Rb
及Rc
中的每一個均獨立地為氫或甲基;
n為0、1或2;且
q為0或1。
在第十四實施例中,本發明提供根據結構式II'
、II'-1
或II'-2
之化合物或其醫藥上可接受之鹽,其中R4
為異丙基、氧雜環丁基、環丁基、–CH2
-2-吡咯啶基、–CH2
-N
-甲基-2-吡咯啶基、–CH2
-3-哌啶基、–CH2
-2-吡嗪基、–CH2
-2-嘧啶基、–CH(Rc
)-苯基或–CH(Rc
)-2-吡啶基,且其中該苯基及2-吡啶基環各係獨立且視情況地經一或多個鹵素取代,且其餘變量係如第十一實施例中所定義。在一特定實施例中,R4
為、、、、、或。在另一特定實施例中,R4
為或。
在第十五實施例中,本發明提供根據結構式II'
、II'-1
或II'-2
之化合物或其醫藥上可接受之鹽,其中X4
為NH,且其餘變量係如第十一及/或第十四實施例中所定義。
在第十六實施例中,本發明提供根據結構式II'
、II'-1
或II'-2
之化合物或其醫藥上可接受之鹽,其中R1
為第三丁基,且其餘變量係如第十一、第十四及第十五實施例中所定義。
亦包括在範例中所揭示之化合物,包括醫藥上可接受之鹽形式及中性形式兩者。
術語「醫藥上可接受之鹽」係指在合理範圍的醫學判斷下適用於與人類及低等動物之組織接觸而無異常毒性、刺激及過敏反應,且係符合合理效益/風險比的醫藥用鹽(pharmaceutical salt)。醫藥上可接受之鹽係此項技術中所熟知。例如,S. M. Berge等人在J. Pharm. Sci.
, 1977, 66, 1–19中描述醫藥上可接受之鹽。
本教示包括本文所揭示之化合物的醫藥上可接受之鹽。具有鹼性基團之化合物可與醫藥上可接受之酸形成醫藥上可接受之鹽。本文所述化合物之合適醫藥上可接受之酸加成鹽包括無機酸(諸如鹽酸、氫溴酸、磷酸、偏磷酸、硝酸及硫酸)鹽及有機酸(諸如乙酸、苯磺酸、苯甲酸、乙磺酸、甲磺酸、琥珀酸及三氟乙酸)鹽。具有酸性基團(諸如羧酸)之本教示化合物可與醫藥上可接受之鹼形成醫藥上可接受之鹽。合適醫藥上可接受之鹼性鹽包括銨鹽、鹼金屬鹽(諸如鈉鹽及鉀鹽)及鹼土金屬鹽(諸如鎂鹽及鈣鹽)。
定義
如本文所用,術語「鹵基」意指鹵素且包括氯、氟、溴及碘。
單獨使用或作為較大部分(諸如「烷氧基」或「鹵烷基」等)之一部分使用的術語「烷基」意指飽和脂族直鏈或分支鏈單價烴基。除非另有說明,否則烷基基團通常具有1至5個碳原子,即(C1
-C5
)烷基。如本文所用,「(C1
-C5
)烷基」基團意指具有1至5個碳原子以直鏈或分支鏈排列之基團。實例包括甲基、乙基、正丙基、異丙基等。
術語「烷氧基」意指通過氧連接原子連接之烷基,由-O-烷基表示。例如,「(C1
-C4
)烷氧基」包括甲氧基、乙氧基、丙氧基及丁氧基。
術語「鹵烷基」及「鹵烷氧基」意指視情況而定經一或多個鹵素原子取代之烷基或烷氧基。
「伸烷基」為飽和脂族分支鏈或直鏈二價烴基。除非另有說明,否則伸烷基通常具有2至6個碳原子,例如,(C2
-C6
)伸烷基。
術語「烯基」意指含有至少一個雙鍵之分支鏈或直鏈單價烴基。烯基可為單不飽和或多不飽和,且可呈E或Z構型存在。除非另有說明,否則烯基通常具有2至6個碳原子,即(C2
-C6
)烯基。例如,「(C2
-C4
)烯基」意指具有2至4個碳原子以直鏈或分支鏈排列之基團。
術語「環烷基」意指單環飽和烴環系。例如,C3
-C6
環烷基包括環丙基、環丁基、環戊基及環己基。除非另有說明,否則「環烷基」具有三至七個環碳原子。
橋聯環烷基意指雙環非芳族烴環系,其中該等兩個環共享至少三個相鄰環碳原子。橋聯環烷基通常具有6至12個環碳原子。實例包括(但不限於)雙環[2.1.1]己基、雙環[2.2.1]庚基、雙環[2.2.2]辛基、雙環[3.2.1]辛基、雙環[4.3.1]癸基、雙環[3.3.1]壬基、冰片基、冰片烯基、降莰基、降莰烯基、6,6-二甲基雙環[3.1.1]庚基、三環丁基及金鋼烷基。
術語「雜環基」、「雜環」及「雜環基團」在本文中可互換使用,且意指含有1至4個可為相同或者不同之選自N、O或S的環雜原子之飽和或不飽和非芳族4至10員環基。其可為單環、雙環或三環(例如,稠合或橋聯雙環或三環)。實例包括(但不限於)氮雜環丁基、嗎啉基、硫嗎啉基、吡咯啶酮基、吡咯啶基、哌啶基、哌嗪基、乙內醯脲基、戊內醯胺基、環氧乙基、氧雜環丁基、二氫咪唑、二氫呋喃基、二氫哌喃基、二氫吡啶基、二氫嘧啶基、二氫噻吩基、二氫苯硫基、二氫硫哌喃基、四氫咪唑、四氫呋喃基、四氫哌喃基、四氫噻吩基、四氫吡啶基、四氫嘧啶基、四氫苯硫基及四氫硫哌喃基。雜環視情況含有一或多個雙鍵及/或視情況與一或多個芳環稠合(例如,四氫萘啶、吲哚啉酮、二氫吡咯并三唑、咪唑并嘧啶、喹啉酮、二氧雜螺癸烷)。
3至7員單環雜環之實例包括(但不限於)氮雜環丁基、嗎啉基、硫嗎啉基、吡咯啶酮基、吡咯啶基、哌啶基、哌嗪基、乙內醯脲基、戊內醯胺基、環氧乙基、氧雜環丁基、二氫咪唑、二氫呋喃基、二氫哌喃基、二氫吡啶基、二氫嘧啶基、二氫噻吩基、二氫苯硫基、二氫硫哌喃基、四氫咪唑、四氫呋喃基、四氫哌喃基、四氫噻吩基、四氫吡啶基、四氫嘧啶基、四氫苯硫基及四氫硫哌喃基。
橋聯雜環基意指含有1至4個環雜原子之雙環非芳族環系,其中該等兩個環共享至少三個相鄰環原子。橋聯雜環基通常具有6至12個環原子。實例包括(但不限於)氮雜降莰基、啶基、異啶基、莨菪烷基、氮雜雙環[3.2.1]辛基、氮雜雙環[2.2.1]庚基、2-氮雜雙環[3.2.1]辛基、氮雜雙環[3.2.1]辛基、氮雜雙環[3.2.2]壬基、氮雜雙環[3.3.0]壬基及氮雜雙環[3.3.1]壬基。
術語「雜芳基」、「雜芳族」、「雜芳基環」、「雜芳基基團」、「雜芳族環」及「雜芳族基」在本文中可互換使用。當單獨使用或作為較大部分(如「雜芳烷基」或「雜芳烷氧基」)中之一部分使用時,「雜芳基」係指具有五至十個選自碳及至少一個(通常1至4個,更通常1或2個)雜原子(例如,氧、氮或硫)之環原子的芳族環基團。「雜芳基」包括單環及多環,其中單環雜芳族環與一或多個其他芳族或雜芳族環稠合。「雜芳基」包括單環及雙環系。
「單環5至6員雜芳族環(或雜芳基)」意指具有五個或六個選自碳及至少一個(通常1至3個,更通常1或2個)雜原子(例如,氧、氮或硫)之環原子的單環雜芳族環。單環5至6員雜芳族環基團之實例包括呋喃基(例如,2-呋喃基、3-呋喃基)、咪唑基(例如,N-咪唑基、2-咪唑基、4-咪唑基、5-咪唑基)、異噁唑基(例如,3-異噁唑基、4-異噁唑基、5-異噁唑基)、噁二唑基(例如,2-噁二唑基、5-噁二唑基)、噁唑基(例如,2-噁唑基、4-噁唑基、5-噁唑基)、吡唑基(例如,3-吡唑基、4-吡唑基)、吡咯基(例如,1-吡咯基、2-吡咯基、3-吡咯基)、吡啶基(例如,2-吡啶基、3-吡啶基、4-吡啶基)、嘧啶基(例如,2-嘧啶基、4-嘧啶基、5-嘧啶基)、噠嗪基(例如,3-噠嗪基)、噻唑基(例如,2-噻唑基、4-噻唑基、5-噻唑基)、異噻唑基、三唑基(例如,2-三唑基、5-三唑基)、四唑基(例如,四唑基)及噻吩基(例如,2-噻吩基、3-噻吩基)。
若基團係描述為「經取代之」,則非氫取代基將取代該取代基之碳或氮上的氫。因此,例如,經取代之烷基為其中至少一個非氫取代基代替該烷基取代基上之氫取代基的烷基。為了說明,單氟烷基為經一個氟取代基取代之烷基,且二氟烷基為經兩個氟取代基取代之烷基。應瞭解,若取代基上存在一個以上取代,則每個非氫取代基可為相同或不同(除非另有說明)。如本文所用,許多部分(例如,烷基、環烷基或雜環)被稱為「經取代」或「視情況經取代」。當部分經此等術語中之一者修飾時,除非另有說明,否則其表示熟習此項技術者已知可用於取代的該部分之任何一部分可經取代,其包括一或多個取代基。若存在一個以上取代基,則各取代基係經獨立選擇。此等取代方法係此項技術所熟知及/或由本發明教示。可選取代基可為適於與該部分連接之任何取代基。一般技術者將認識到,所提供之化合物及定義不包括不允許之取代基模式(例如,經5個不同基團取代之甲基及類似者)。一般技術者將清楚知曉此類不允許之取代模式。當基團係描述為視情況經「一或多個」取代基取代時,其表示該基團視情況經一個、兩個、三個、四個、五個或六個取代基取代。在一實施例中,基團係視情況經1至3個取代基取代。在一實施例中,基團係視情況經1至2個取代基取代。在一實施例中,基團係視情況經一個取代基取代。
合適取代基為彼等對該化合物抑制RAD51之能力無顯著不利影響之取代基。在未具體列舉合適取代基的情況下,例示性取代基包括(但不限於)鹵基、-CN、烷基、烷氧基、鹵甲基、鹵甲氧基、(C1
-C5
)烷基、鹵基(C1
-C5
)烷基、(C1
-C5
)烷氧基、-NO2
、-ORc'
、-NRa'
Rb'
、-S(O)i
Ra'
、-NRa
S(O)i
Rb'
、-S(O)i
NRa'
Rb'
、-C(=O)ORa'
、-OC(=O)ORa'
、-C(=S)ORa'
、-O(C=S)Ra'
、-C(=O)NRa'
Rb'
、-NRa'
C(=O)Rb'
、-C(=S)NRa'
Rb'
、-NRa'
C(=S)Rb'
、-NRa'
(C=O)ORb'
、-O(C=O)NRa'
Rb'
、-NRa'
(C=S)ORb'
、-O(C=S)NRa'
Rb'
、-NRa'
(C=O)NRa'
Rb'
、-NRa'
(C=S)NRa'
Rb'
、-C(=S)Ra'
、-C(=O)Ra'
、(C3
-C6
)環烷基、單環雜芳基及苯基,其中(C3
-C6
)環烷基、單環雜芳基及苯基取代基係視情況且獨立地經–CH3
、鹵甲基、鹵基、甲氧基或鹵甲氧基取代。各Ra'
及各Rb'
係獨立地選自–H及(C1
–C5
)烷基,其中由Ra'
或Rb'
表示之(C1
–C5
)烷基係視情況經羥基或(C1
–C3
)烷氧基取代;Rc'
為–H、鹵(C1
–C5
)烷基或(C1
–C5
)烷基,其中由Rc
表示之(C1
–C5
)烷基係視情況經羥基或(C1
–C3
)烷氧基取代;且i為0、1或2。=O亦為針對烷基、環烷基及雜環之合適取代基。
具有一或多個對掌性中心之化合物可呈各種立體異構形式存在。立體異構體為僅在其空間排列上不同之化合物。立體異構體包括所有非對映異構、對映異構及差向異構形式以及其外消旋體及混合物。
術語「幾何異構體」係指具有至少兩個取代基之環狀化合物,其中該等兩個取代基均位於該環之同一側(順式)或其中該等取代基係各自位於該環之相對側(反式)。當藉由結構命名或描繪所揭示化合物而未指示立體化學時,應理解,該名稱或結構涵蓋一或多種可能之立體異構體或幾何異構體、或該等所涵蓋之立體異構體或幾何異構體之混合物。
當藉由名稱或結構描繪幾何異構體時,應理解,所命名或所描繪之異構體係以比另一種異構體更大之程度存在,即該所命名或所描繪之幾何異構體之幾何異構體純度係大於以重量計之50%,諸如至少60%、70%、80%、90%、99%或99.9%純度。幾何異構體純度係藉由將混合物中之所命名或所描繪幾何異構體的重量除以混合物中所有幾何異構體之總重量來確定。
外消旋混合物意指50%為一種對映異構體,且50%為對應之對映異構體。當命名或描繪具有一個對掌性中心之化合物而未指示該對掌性中心之立體化學時,應理解,該名稱或結構涵蓋該化合物之兩種可能對映異構形式(例如,兩種對映異構體純、對映異構體富集或外消旋)。當命名或描繪具有兩個或更多個對掌性中心之化合物而未指示對掌性中心之立體化學時,應理解,該名稱或結構涵蓋該化合物之所有可能非對映異構形式(例如,非對映異構體純、非對映異構體富集及一或多種非對映異構體之等莫耳混合物(例如,外消旋混合物))。
可藉由熟知方法將對映異構體及非對映異構體混合物解析成其組分對映異構體或立體異構體,該等熟知方法諸如對掌性相氣相層析法、對掌性相高效液相層析法、將化合物結晶成對掌性鹽錯合物、或使化合物在對掌性溶劑中結晶。亦可藉由熟知之不對稱合成方法自非對映異構體純或對映異構體純之中間體、試劑及催化劑獲得對映異構體及非對映異構體。
當化合物係由指示單一對映異構體之名稱或結構指定時,除非另有說明,否則該化合物為至少60%、70%、80%、90%、99%或99.9%光學純(亦稱為「對映異構體純」)。光學純度為所命名或所描繪對映異構體在混合物中之重量除以兩種對映異構體在混合物中之總重量。
當藉由結構命名或描繪所揭示化合物之立體化學,且該所命名或所描繪結構涵蓋一種以上立體異構體(例如,如呈非對映異構體對)時,應理解,所涵蓋立體異構體中的一種或所涵蓋立體異構體之任何混合物包括在內。應進一步理解,所命名或所描繪立體異構體之立體異構體純度為以重量計之至少60%、70%、80%、90%、99%或99.9%。在此情況下,立體異構體純度係藉由將由該名稱或結構所涵蓋之立體異構體在混合物中之總重量除以所有立體異構體在混合物中之總重量來確定。
醫藥組合物
本文所揭示之化合物為RAD51抑制劑。本發明醫藥組合物包含一或多種RAD51抑制劑或其醫藥上可接受之鹽,及醫藥上可接受之載劑或稀釋劑。
「醫藥上可接受之載劑」及「醫藥上可接受之稀釋劑」係指有助於活性劑調配及/或投與至個體及/或由個體吸收,且可包含於本發明組合物中而不會導致顯著之對該個體的不良毒理作用。醫藥上可接受之載劑及/或稀釋劑之非限制性實例包括水、NaCl、生理鹽水溶液、乳酸化林格氏液(lactated Ringer's)、正常蔗糖、正常葡萄糖、黏合劑、填充劑、崩解劑、潤滑劑、包衣、甜味劑、調味劑、鹽溶液(例如林格氏溶液(Ringer's solution))、醇、油、明膠、碳水化合物(諸如乳糖、直鏈澱粉或澱粉)、脂肪酸酯、羥甲基纖維素、聚乙烯吡咯啶及顏料等。此等製劑可係經滅菌,且若需要,可與輔助劑混合,諸如潤滑劑、防腐劑、穩定劑、潤濕劑、乳化劑、影響滲透壓之鹽、緩衝劑、著色劑及/或芳香物質等,其等不會與本文所提供之化合物發生有害反應或干擾其活性。一般技術者將認識到,其他醫藥賦形劑係適用於與所揭示化合物一起使用。
本教示醫藥組合物視情況包含一或多種其醫藥上可接受之載劑及/或稀釋劑,諸如乳糖、澱粉、纖維素及右旋糖。亦可包含其他賦形劑,諸如調味劑;甜味劑;及防腐劑,諸如對羥基苯甲酸甲酯、對羥基苯甲酸乙酯、對羥基苯甲酸丙酯及對羥基苯甲酸丁酯。合適賦形劑之更完整列表可見於醫藥賦形劑手冊(Handbook of Pharmaceutical Excipients) (第5版,Pharmaceutical Press (2005))。熟習此項技術者將知曉如何製備適用於各種投與途徑之調配物。用於選擇及製備合適調配物之習知方法及成分係描述於(例如) Remington's Pharmaceutical Sciences (2003-第20版)及1999年出版之The United States Pharmacopeia: The National Formulary (USP 24 NF19)中。載劑、稀釋劑及/或賦形劑係在與醫藥組合物之其他成分相容且對其接受者無害之意義上為「可接受的」。
治療方法
本發明提供治療患有可藉由抑制RAD51而改善之疾病之個體的方法,其藉由向該個體投與有效量之一或多種所揭示化合物或其醫藥上可接受之鹽或對應醫藥組合物。可藉由抑制RAD51而改善之疾病包括癌症、自體免疫疾病、免疫缺乏或神經退化性疾病。
在一態樣中,本文描述治療癌症、自體免疫疾病、免疫缺乏或神經退化性疾病之方法,該方法包括向對治療癌症、自體免疫疾病、免疫缺乏或神經退化性疾病有需要之個體投與治療有效劑量之如本文所述的組合物,例如,包含本發明化合物之組合物。
在一些實施例中,該個體可為經測定為相對於參考水平在一或多種細胞類型中具有增加之DNA損傷水平的個體。如本文所用,「DNA損傷」係指細胞中存在之DNA斷裂、缺口及突變。在一些實施例中,DNA損傷可包括單股斷裂(例如「缺口」)、雙股斷裂(DSB)及突變中之一或多種。在一些實施例中,DNA損傷可為一或多種DSB。如本文所用,「突變」係指與參考野生型細胞相比,細胞遺傳物質之變化或差異,例如缺失、插入、SNP、基因重排及/或外源基因或序列之引入。
在一些實施例中,若個體經測定為具有增加之DNA損傷過程或DNA編輯酶水平及/或活性,則可確定該個體具有增加之DNA損傷水平。如本文所用,「DNA損傷過程」係指細胞中引起一或多種類型DNA損傷發生之任何活動或過程。
在一些實施例中,增加之DNA損傷水平可為增加之突變水平,例如藉由測定細胞之全部或部分基因組中的整體突變狀態。整體突變狀態比參考細胞中之整體突變狀態高至少2%,例如高2%或更多、高3%或更多、高5%或更多、高10%或更多或高20%或更多可指示增加、升高及/或顯著之DNA編輯酶活性水平。在一些實施例中,可測定超突變之水平。在一些實施例中,可使用FISH、全基因組定序、高通量定序、外顯子組定序、雜交及/或PCR來測定全基因組或其部分中之整體突變狀態。在一些實施例中,DNA編輯酶之活性可藉由測定特定靶基因中之超突變水平進行量測,該等特定靶基因包括但不限於IGH、BCL6、MYC、BCLl 1A、CD93、PIMl及/或PAX5。在某些實施例中,DNA編輯酶為AID。在一些實施例中,包括IGH、BCL6、MYC、BCLl 1A、CD93、PIMl及/或PAX5之特定靶基因中之突變水平比參考細胞中之IGH、BCL6、MYC、BCLl 1A、CD93、PIMl及/或PAX5中之突變水平高至少2%,例如高2%或更多、高3%或更多、高5%或更多、高10%或更多或高20%或更多可指示增加、升高及/或顯著之AID活性水平。
在一些實施例中,增加之DNA損傷水平可為增加之雙股斷裂(DSB)水平。作為非限制性實例,可藉由核型分析、藉由γ-H2c變異區形成及/或藉由使用FISH分析來檢測DNA雙股斷裂(例如,DNA斷裂檢測魚(DBD-FISH))來測定DSB之水平(Volpi及Bridger,BioTechniques,第45卷,第4期,2008年10月,第385至409頁)。
在一些實施例中,增加之DNA損傷水平可為增加之單股斷裂水平。作為非限制性實例,可藉由COMET檢定、FISH、或使用單股斷裂特異性探針測定DNA中之單股斷裂水平。單股及雙股DNA斷裂兩者之檢測係此項技術中已知,且在(例如) Kumari等人EXCLI Journal 2009 7:44-62及Motalleb等人Research Journal of Applied Sciences, Engineering and Technology. 2012 4: 1888-1894中進一步描述;其等各係以全文引用之方式併入本文中。
在一些實施例中,增加之DNA損傷過程的活性水平可包括增加之DNA編輯酶水平及/或活性。在一些實施例中,本文所述技術涉及用本發明化合物處理具有活性DNA編輯酶之細胞。在一些實施例中,本文所述技術涉及用本發明化合物處理具有增加之DNA編輯酶水平及/或活性的細胞。如本文所用,「DNA編輯酶」係指通常催化DNA片段之突變、交換或切除的酶,特定言之可產生點突變、DNA單股斷裂、DNA雙股斷裂或蛋白質-DNA加合物或促進其等產生之酶。如本文所提及之DNA編輯酶在其作用中不一定具有位點特異性。同樣,其不一定具有細胞特異性。在一些實施例中,該細胞為表現可檢測量之此類酶的B細胞。
DNA編輯酶之非限制性實例包括但不限於重組活化基因1 (RAG1;NCBI基因ID:5896)、重組活化基因2 (RAG2;NCBI基因ID:5897)、孢子形成特異性蛋白11 (SPOl 1;NCBI基因ID:23626)、APOBEC家族成員1型拓撲異構酶;2型拓撲異構酶;及/或AID。在一些實施例中,DNA編輯酶可為AID。
在一些實施例中,DNA編輯酶可為APOBEC (載脂蛋白B mRNA編輯酶,催化多肽樣)家族之成員。如本文所用,「APOBEC家族」係指具有N-末端鋅依賴性胞苷脫胺酶催化結構域及C-末端假催化結構域之胞苷脫胺酶家族。APOBEC家族成員之非限制性實例包括AID、APOBEC 1 (例如,NCBI基因ID:339)、APOBEC2 (例如,NCBI基因ID:10930)、APOBEC3A (例如,NCBI基因ID:200315)、APOBEC3C (例如,NCBI基因ID:27350)、APOBEC3E (例如,NCBI基因ID:140564)、APOBEC3F (例如,NCBI Gene ID:200316)、APOBEC3G (例如,NCBI基因ID:60489)、APOBEC3H (例如,NCBI基因ID:164668)及APOBEC4 (例如,NCBI基因ID:403314)。
在一些實施例中,DNA編輯酶可為1型拓撲異構酶。在一些實施例中,DNA編輯酶可為2型拓撲異構酶。拓撲異構酶在DNA中產生斷裂以幫助開卷或放鬆鏈。II型拓撲異構酶水解ATP以產生DSB切口,而I型拓撲異構酶產生單股斷裂。II型拓撲異構酶之非限制性實例可包括拓撲異構酶II (例如,NCBI基因ID:7153及7155)。I型拓撲異構酶之非限制性實例可包括拓撲異構酶I (例如,NCBI基因ID:7150)。
本文所述技術之實施例係基於本文所述化合物可抑制DNA修復機制(例如,同源修復)之發現。作為載脂蛋白B mRNA編輯酶,催化多肽樣(APOBEC)之成員,活化誘導之胞苷脫胺酶(AID或AICDA,亦稱為ARP2、CDA2或HIGM2)將在同源重組能力降低之細胞(例如DNA雙股斷裂修復能力降低之細胞)中引起廣泛的基因組斷裂及細胞死亡。因此,本文提供一種引起細胞死亡之方法,其包括檢測細胞中之DNA編輯酶(例如AID)表現的增加並此後使該細胞與本發明化合物接觸;藉此導致細胞死亡。因此,本文提供一種引起細胞死亡之方法,其包括增加細胞中之DNA編輯酶(例如AID)表現並此後使該細胞與本發明化合物接觸;藉此導致細胞死亡。因此,本文提供一種引起細胞死亡之方法,其包括向細胞投與治療有效量之DNA編輯酶(例如AID)並此後使該細胞與本發明化合物接觸;藉此導致細胞死亡。
由AICDA基因(NCBI基因ID:57379)編碼之AID係正常B細胞功能所必需,且係在中心母細胞B細胞中最突出地表現。該蛋白質參與體細胞超突變、基因轉換及免疫球蛋白基因之類別轉換重組。AID通常幾乎僅在抗原活化之發生中心B細胞中表現,其中其啟動免疫球蛋白同型類別轉換(Manis等人,2002, Trends Immunol, 23, 31-39;Chaudhuri及Alt,Nat Rev Immunol, 2004, 4, 541-552;Longerich等人,Curr Opin Immunol, 2006, 18, 164-174;Chaudhuri等人,Adv Immunol 2007, 94, 157-214)。AID係活化B細胞中之體細胞超突變及免疫球蛋白類別轉換所必需的。AID表現係由CD40配位體、B細胞受體、IL4R或類鐸受體刺激進行調節(Crouch等人,J Exp Med 2007 204: 1145-1156;Muramatsu等人,J Biol Chem 1999 274: 18470-6)。AID在活化後瞬時上調,在免疫球蛋白基因內以序列非特異性方式誘導點突變或DNA雙股斷裂,並隨後下調(Longerich等人,Curr Opin Immunol, 2006, 18, 164-176;Chaudhuri等人,Adv Immunol 2007, 94, 157-214)。總而言之,AID在任何給定時間僅在一小部分正常細胞(抗原活化之B細胞)中具有活性。由AID控制之基因組重排及突變導致功能性適應性免疫所需之抗原識別多樣性、受體編輯及淋巴效應子功能的發展(Mills等人,Immunol Rev 2003 194:77-95)。最近已報告,AID具有脫靶點突變活性(Liu, M.等人,Nature 2008, 451, 841-845;Liu及Schatz,Trends Immunol. 2009, 30, 173-181;Perez-Duran等人,Carcinogenesis. 2007, 28(12):2427-33)。Robbiani等人已報告AID在B細胞中之脫靶活性,特別是c-myc/IgH易位(Robbiani等人,Mol Cell 2009, 36(4):631-41)。AID表現加速Bcl6轉殖基因小鼠中腫瘤發展之速率(Pasqualucci等人,2008, Nat. Genet. 40, 108-112)。然而,失調的AID不一定在B細胞中獨自引起惡性腫瘤或易位相關的癌症 (Muto等人,2006, Proc. Natl. Acad. Sci. USA 103, 2752-2757;Okazaki等人,2003, J. Exp. Med. 197, 1173-1181;Shen等人,2008, Mol. Immunol. 45, 1883-1892)。此外,儘管其在c-myc/IgH易位中具有專性作用,但AID不為IL-6轉殖基因小鼠或經朴日斯烷(pristane)處理之小鼠中之漿細胞增生或漿細胞瘤之發展各自所必需(Kovalchuk等人,2007, J. Exp. Med. 204, 2989-3001;Ramiro等人,2004, J. Exp. Med. 200, 1103-1110)。然而,大多數人類B細胞淋巴瘤相關易位不涉及c-myc,且許多不涉及Ig基因(Kuppers,2005, Oncogene 20, 5580-5594)。
已報告AID在慢性淋巴球性白血病(CLL)中過度表現(Hancer等人,Leuk Lymphoma. 2011年1月; 52(l):79-84;Heintel等人,Leukemia. 2004年4月; 18(4):756-62)。此外,已顯示AID表現係與骨髓性白血病中之急性轉化期B譜系白血病及治療抗性相關,且係與慢性B淋巴球性白血病中之一般不良預後相關聯(Mao等人,Br J Dermatol 2001, 145: 117-122;Chaudhuri等人,Nature 2004, 430:992-8)。已報告AID在來自多種癌症之腫瘤細胞中進一步表現,該等癌症包括但不限於肺癌、乳癌、胃癌、結腸癌、腸癌、肝癌及膽管癌(Greeve等人,Blood 2003, 1010, 3574-3580;Feldhahn等人,J Exp Med 2007, 204, 1157-1166;Kotani等人,PNAS USA 2007, 104, 1616-1620;Engels等人,2008, Appl Immunohistochem Mol Morphol 16, 521-529;Klemm等人,2009, Cancer Cell 6, 232-245;Palacios等人,2010, Blood 115(22), 4488-4496;Leuenberger等人,2009, Mod Pathol 32, 177-186;Gruber等人,2010, Cancer Res 70, 7411-7420);發炎性癌症(Marusawa 2008, Int J Biochem Cell Biol.40, 399-402);濾泡性淋巴瘤(Hardianti等人,2004, Leukemia 18, 826-831;Shikata等人,2012, Cancer Sci. 103(3):415-21);甲狀腺癌(Qiu等人2012, Mod Pathol 25(l),36-45);乳癌(Borchert等人2011, BMC Cancer 11:347);Marusawa等人,2011, Adv Immunol 111 : 109-41;Zhang等人2012, Hum Pathol 43(3):423-34;Komori等人,2008, Hepatology 47(3):888-896;Hockley 2010, Leukemia 24(5): 1084-6;成人T細胞白血病(Nakamura等人,2011, Br J Dermatol. 165(2):437-9)。前述段落中之所有參考文獻均係以全文引用之方式併入本文中。
已報告AID水平在關節炎(Xu等人Scand. J. Immunol. 2009, 296, 2033-6)及MRL/Fas (lpr/lpr)小鼠狼瘡模型中升高(White等人2011, Autoimmunity 44(8), 585-98)。前述段落中之所有參考文獻均係以全文引用之方式併入本文中。
當DSB修復受到抑制時,AID產生之DSB之程度係遠高於先前所懷疑之程度,且基因組損傷之程度非常嚴重以至於導致細胞死亡。因此,在本文所述技術之一實施例中,提供一種治療方法,其包括:(a)選擇具有表現升高之活化誘導之胞苷脫胺酶(AID)水平之細胞的個體;(b)向該個體投與治療有效量之雙股斷裂修復的抑制劑(例如本發明化合物);其中升高之AID水平為高於來自健康個體之相同類型細胞中之AID水平的AID水平。在一些實施例中,表現升高之AID水平的細胞為B細胞。在一些實施例中,表現升高之AID水平的B細胞為癌性B細胞或與自體免疫疾病相關聯之B細胞。在一些實施例中,該個體可為人類個體。
本文所提供之方法係藉由抑制DNA雙股斷裂修復來治療癌症及/或自體免疫病症。此抑制證明對表現AID之細胞係致命的,因為AID產生廣泛之基因組斷裂,而用雙股斷裂修復抑制劑進行治療阻止由細胞自身產生之此等病灶的修復。此導致該個體中之細胞死亡,其特異性針對表現AID之細胞,例如癌性B細胞及/或自體免疫細胞。因此,如本文所述,在一實施例中,提供一種治療範例,其選擇性地誘導某些患病細胞之自我破壞,同時減少健康組織中之非預期副作用。
在一些實施例中,增加之DNA編輯酶水平及/或活性可為增加之DNA編輯酶mRNA水平。可使用(例如)生物化學及分子生物學技術,諸如北方墨點法或其他雜交檢定、核酸酶保護檢定、逆轉錄(定量RT-PCR)技術、RNA-Seq、高通量定序及其類似者來評估mRNA水平。此類檢定為熟習此項技術者所熟知。在一實施例中,使用核「繼續運轉(run-on)」(或「運轉關閉(run-off)」)轉錄檢定(參見例如Methods in Molecular Biology,第49卷,1995年9月27日,頁數範圍:229-238)。亦可使用陣列;前人已在例如EP0834575、EP0834576、W096/31622、美國專利第5,837,832號或WO98/30883中描述陣列及使用此類陣列分析mRNA之方法。WO97/10365提供使用高密度寡核苷酸陣列監測多種基因之表現水平的方法。
在一些實施例中,若個體已曝露至已知會引起此類DNA損傷之試劑,則可確定該個體相對於參考水平在一或多種細胞類型中具有增加之DNA損傷水平。此類試劑之非限制性實例可包括DNA整合病毒(例如腺相關病毒、逆轉錄病毒、人類嗜T細胞病毒、HIV-1、腫瘤病毒、肝炎病毒、B型肝炎病毒)之病毒感染;DNA損傷性化學品(例如乙醛、多環芳族烴、苯、亞硝胺、菸草煙霧、黃曲霉毒素(aflatoxin)等);DNA損傷化學治療劑(例如博萊黴素(bleomycin)、絲裂黴素、氮芥類(例如氮芥(mechlorethamine)、環磷醯胺、美法侖(melphalan)、苯丁酸氮芥(chlorambucil)、異環磷醯胺及白消安(busulfan))、亞硝基脲類(例如,N-亞硝基-N-甲基脲(MNU)、卡莫司汀(carmustine)(BCNU)、洛莫司汀(lomustine)(CCNU)及司莫司汀(semustine) (MeCCNU)、福莫司汀(fotemustine)及鏈尿黴素(streptozotocin))、四嗪類(例如,達卡巴嗪(dacarbazine)、米托唑胺(mitozolomide)及替莫唑胺(temozolomide))、氮丙啶類(例如,塞替派(thiotepa)、絲裂黴素(mytomycin)及地吖醌(diaziquone)(AZQ))、順鉑類(例如順鉑、卡鉑及奧沙利鉑)、丙卡巴肼(procarbazine)及六甲基三聚氰胺);及電離或紫外線輻射。曝露至此類藥劑可係事故、感染及/或環境曝露之結果或此類藥劑之治療性投與的結果。
在一些實施例中,增加之DNA損傷水平可在受癌症、自體免疫疾病及/或神經退化性疾病影響之細胞類型中發生。在一些實施例中,該個體係經確定為在選自由以下組成之群的細胞中具有增加之DNA損傷水平:癌細胞;免疫系統細胞;或神經系統細胞。
在一些實施例中,DNA編輯酶可為AID。在一些實施例中,AID水平可為血液細胞中之AID水平。在一些實施例中,AID水平可為B細胞中之AID水平。
在一些實施例中,增加之AID水平可為可檢測之AID水平,例如,如下文所述。
在一些實施例中,該個體可為人類個體。
本文所提供之方法係藉由抑制DNA雙股斷裂修復來治療癌症及/或自體免疫病症。此抑制證明對表現AID之細胞係致命的,因為AID產生廣泛之基因組斷裂,而用雙股斷裂修復抑制劑進行治療阻止由細胞自身產生之此等病灶的修復。此導致個體中之細胞死亡,其特異性針對表現AID之細胞,例如癌性B細胞及/或自體免疫細胞。因此,如本文所述,在一實施例中,提供一種治療範例,其選擇性地誘導某些患病細胞之自我破壞,同時減少健康組織中之非預期副作用。
WO2016/094897中揭示在DNA損傷水平升高或DNA編輯酶水平增加之患者中使癌症缺損之方法,其以引用之方式併入本文中。
在某些實施例中,待治療之癌症為具有高DNA編輯酶表現之類型。在某些實施例中,待治療之癌症為B細胞腫瘤。
另一實施例為治療癌症之方法,其藉由向個體投與有效量之一或多種所揭示化合物或其醫藥上可接受之鹽或對應醫藥組合物。在一態樣中,癌症係選自由淋巴瘤、白血病及漿細胞腫瘤組成之群。在另一態樣中,癌症係選自由癌及肉瘤組成之群。
在某些實施例中,待治療之癌症為淋巴瘤。可藉由所揭示之方法進行治療的淋巴瘤包括非霍奇金氏淋巴瘤(Non-Hodgkin's lymphoma);伯基特氏(Burkitt)淋巴瘤;小淋巴球性淋巴瘤;淋巴漿細胞性淋巴瘤;MALT淋巴瘤;濾泡性淋巴瘤;瀰漫性大B細胞淋巴瘤;及T細胞淋巴瘤。
淋巴瘤係免疫系統之淋巴細胞(例如B細胞、T細胞或自然殺手(NK)細胞)中的惡性疾病。淋巴瘤通常起源於淋巴結並呈實體腫瘤形式存在。其等可轉移至其他器官,諸如大腦、骨骼或皮膚。結節外(Extranodal)部位通常位於腹部。淋巴瘤係與淋巴白血病密切相關,且在某些情況下,特定形式之癌症可同時歸類為淋巴瘤及白血病。
可藉由所揭示之方法進行治療的白血病包括急性淋巴母細胞白血病(ALL);伯基特氏白血病;B細胞白血病;B細胞急性淋巴母細胞白血病;慢性淋巴球性白血病(CLL);急性骨髓性白血病(AML);慢性骨髓性白血病(CML);及T細胞急性淋巴母細胞白血病(T-ALL)。
在某些實施例中,待治療之癌症為B細胞腫瘤、B細胞白血病、B細胞急性淋巴母細胞白血病、慢性淋巴球性白血病、慢性骨髓性白血病、伯基特氏白血病、急性骨髓性白血病及/或T-ALL。當外來抗原被中和時,B細胞之成熟最通常停止或實質上減少。然而,特定B細胞之增殖偶爾將繼續不減;此類增殖可導致稱為「B細胞淋巴瘤」或「B細胞白血病」之癌症。在某些實施例中,待治療之癌症為慢性淋巴球性白血病(CLL)或慢性骨髓性白血病(CML)。
在某些實施例中,待治療之癌症為漿細胞腫瘤。漿細胞腫瘤之實例包括多發性骨髓瘤;漿細胞骨髓瘤;漿細胞白血病及漿細胞瘤。
可藉由所揭示之方法進行治療的癌包括結腸癌;肝癌;胃癌;腸癌;食道癌;乳癌;卵巢癌;頭頸癌;肺癌;及甲狀腺癌。
可藉由所揭示之方法進行治療的肉瘤包括軟組織肉瘤及骨肉瘤。
任何以高DNA損傷及/或DNA編輯酶表現水平為特徵之癌症可用本文所述之化合物(例如本發明化合物)進行治療。例如,肉瘤、上皮細胞癌、結腸癌、胃癌、腸癌、肝癌、肝細胞癌、乳癌、甲狀腺癌、食道癌、肺癌、腦癌、頭頸癌、黑色素瘤、腎癌、前列腺癌、血管瘤、橫紋肌肉瘤、軟骨肉瘤、骨肉瘤、纖維肉瘤及膽管癌可藉由高DNA編輯酶表現(例如AID)水平為特徵。在某些實施例中,待治療之癌症為結腸癌、肝癌、胃癌、腸癌、乳癌、肺癌、甲狀腺癌及/或膽管癌。
可藉由所揭示之方法進行治療的具體癌症包括膀胱、血液、骨、骨髓、腦、乳房、結腸、食道、胃腸、牙齦、頭、腎、肝、肺、鼻咽、頸、卵巢、前列腺、皮膚、胃、睾丸、舌頭或子宮之癌症。此外,該癌症可具體地為以下組織學類型,但不限於此等:惡性腫瘤;癌;未分化癌;巨細胞及梭形細胞癌;肉瘤;小細胞癌;乳頭狀癌;鱗狀細胞癌;淋巴上皮癌;基底細胞癌;毛母質(pilomatrix)癌;移行細胞癌;乳頭狀移行細胞癌;腺癌;胃泌素瘤,惡性;膽管癌;肝細胞癌;合併肝細胞癌及膽管癌;小梁腺癌;腺樣囊性癌;腺瘤性息肉中之腺癌;腺癌,家族性結腸息肉;實體癌;惡性類癌瘤;支氣管肺泡腺癌;乳頭狀腺癌;嫌色細胞癌;嗜酸性球癌;嗜酸性腺癌;嗜鹼性球癌;透明細胞腺癌;顆粒細胞癌;濾泡性腺癌;乳頭狀及濾泡狀腺癌;非包膜性硬化癌;腎上腺皮質癌;子宮內膜樣癌;皮膚附屬癌;大汗腺癌;皮脂腺癌;琥珀酸腺癌;黏液表皮樣癌;囊腺癌;乳頭狀囊腺癌;乳頭狀漿液性囊腺癌;黏液性囊腺癌;黏液腺癌;印戒細胞癌;浸潤性導管癌;髓樣癌;小葉癌;炎性癌;乳腺佩吉特病(paget's disease);腺泡細胞癌;腺鱗癌;腺癌伴鱗狀化生;惡性胸腺瘤;惡性卵巢間質瘤;惡性肉瘤;惡性顆粒細胞瘤;惡性男性母細胞瘤(androblastoma);史托利(sertoli)細胞癌;惡性雷迪格(leydig)細胞瘤;惡性脂質細胞瘤;惡性副神經節瘤;惡性乳腺外副神經節瘤;嗜鉻細胞瘤;血管球肉瘤;惡性黑色素瘤;無黑色素性黑色素瘤;淺表擴散性黑色素瘤;巨大色素痣中之惡性黑色素瘤;上皮樣細胞黑色素瘤;惡性藍色痣;肉瘤;纖維肉瘤;惡性纖維組織細胞瘤;黏液肉瘤;脂肪肉瘤;平滑肌肉瘤;橫紋肌肉瘤;胚胎性橫紋肌肉瘤;肺泡橫紋肌肉瘤;間質肉瘤;惡性混合瘤;穆勒(mullerian)混合瘤;腎母細胞瘤;肝母細胞瘤;癌肉瘤;惡性間質瘤;惡性布倫納(brenner)腫瘤;惡性葉狀腫瘤;滑膜肉瘤;惡性間皮瘤;無性細胞瘤;胚胎癌;惡性畸胎瘤;惡性卵巢甲狀腺腫(struma ovarii);絨毛膜癌;惡性中腎瘤;血管肉瘤;惡性血管內皮瘤;卡波西肉瘤(Kaposi's sarcoma);惡性血管外皮細胞瘤;淋巴管肉瘤;骨肉瘤;近皮質骨肉瘤;軟骨肉瘤;惡性軟骨母細胞瘤;間充質軟骨肉瘤;骨之巨細胞瘤;尤文氏肉瘤(Ewing's sarcoma);牙源性腫瘤,惡性;成釉細胞牙肉瘤(ameloblastic odontosarcoma);成釉細胞瘤,惡性;成釉細胞纖維肉瘤;惡性松果體瘤;脊索瘤;惡性膠質瘤;室管膜瘤;星形細胞瘤;原生質星形細胞瘤;原纖維星形細胞瘤;星形母細胞瘤;膠質母細胞瘤;少突膠質細胞瘤;少突神經母細胞瘤;原始神經外胚層;小腦肉瘤;神經節神經母細胞瘤;神經母細胞瘤;視網膜母細胞瘤;嗅神經源性腫瘤;腦膜瘤,惡性;神經纖維肉瘤;惡性神經鞘瘤;惡性顆粒細胞瘤;惡性淋巴瘤;霍奇金氏病;霍奇金氏;副肉芽腫(paragranuloma);小淋巴球性惡性淋巴瘤;大細胞瀰漫性惡性淋巴瘤;濾泡性惡性淋巴瘤;蕈狀肉芽腫;其他指定非霍奇金氏淋巴瘤;惡性組織細胞病;多發性骨髓瘤;肥大細胞肉瘤;免疫增殖性小腸疾病;白血病;淋巴樣白血病;漿細胞白血病;紅白血病;淋巴肉瘤細胞白血病;髓樣白血病;嗜鹼性球白血病;嗜酸性球白血病;單核細胞白血病;肥大細胞白血病;巨核細胞白血病;骨髓肉瘤;及毛細胞白血病。
在所揭示方法之另一實施例中,該癌症之特徵在於mutS
同源物(例如,MSH2、MSH3及MSH6)、mutL
同源物(例如MLH1)或錯配修復核酸內切酶PMS2中之突變。突變為遺傳密碼中之變化。其等包括點突變及讀框移位突變。在點突變中,一個核苷酸被換出另一個核苷酸。因此,該突變發生在DNA鏈內之單個點或位置。讀框移位突變係歸因於核苷酸之插入或缺失。此導致整個DNA鏈在尺寸方面伸長或收縮。因此,讀框移位突變可改變在缺失或插入後所發生之所有密碼子。本文所提及之突變包括(但不限於)插入、缺失、重複、倒位或其他公認之點突變。現已發現RAD51抑制劑在治療具有MSH (例如MSH6
)、MLH或PMS2突變之癌症中特別有效。
MutS同源物2 (MSH2
)為一種蛋白質,其在人類中係由位於2號染色體上之MSH2
基因編碼。MSH2
為腫瘤抑制基因,且更具體言之為編碼DNA錯配修復(MMR)蛋白之看護基因MSH2
,其與MSH6
形成異二聚體以製成人類MutSα錯配修復複合體。其亦與MSH3
二聚化以形成MutSβ DNA修復複合體。MSH2
參與許多不同形式的DNA修復,包括轉錄偶聯修復、同源重組及鹼基切除修復。MSH2
中之突變的實例包括(但不限於) g.47630253_47630254del、g.47702411_47702421del、g.47709913_47709915inv、g.47635629_47635634del、g.47637227_47637236dup、g.47639550_47639561del、g.(?_47630206)_(47710367_?)del、g.(?_47630206)_(47643569_47656880)del、g.47630263_47643568del、g.(?_47630206)_(47657081_47672686)del、g.47630263_47657080del、g.(?_47630206)_(47672797_47690169)del、g.47630263_47672796del、g.(?_47630206)_(47672797_47690169)del、g.(?_47630206)_(47693948_47698103)del、g.47630263_47693947del、g.(?_47630206)_(47698202_47702163)del、g.(?_47630206)_(47630542_47635539)del、g.(?_47630206)_(47708011_47709917)del、g.(?_47630206)_(47635695_47637232)del、g.(?_47630206)_(47635695_47637232)del、g.(?_47630206)_(47637512_47639552)del、g.(?_47630206)_(47639700_47641407)del、g.(?_47630206)_(47641558_47643434)del、g.47618487_47650860delins(155)、g.47628578_47638433del、g.47595033_47662777del、g.47583175_47667707del、g.47625602_47636880del、g.47554933_47699909del、g.47629508_47649552del、g.47629375_47651274del、g.(?_47630206)_(47630542_47635539)del、g.(?_47630206)_(47635695_47637232)del、g.47643509_47643510del、g.47643529_47643530dup、g.47656746_47657199dup、g.47656661_47663325del、g.(47643569_47656880)_(47710367_?)del、g.(47643569_47656880)_(47710367_?)del、g.47656881_47657080del、g.(47643569_47656880)_(47657081_47672686)del、g.(47643569_47656880)_(47657081_47672686)del、g.(47643569_47656880)_(47657081_47672686)del、g.(47643569_47656880)_(47657081_47672686)dup、g.(47643569_47656880)_(47657081_47672686)dup、g.(47643569_47656880)_(47672797_47690169)del、g.(47643569_47656880)_(47693948_47698103)del、g.47656881_47693947del、g.(47643569_47656880)_(47702410_47703505)del、g.47656881_47656882ins(173)、g.47656901_47656902insA、g.47656903del、g.47656912del、g.47630440del、g.47656923del、g.47656931_47656932dup、g.47656943del、g.47656943_47656949delinsCCCAGA、g.47656948dup、g.47656996dup、g.47657000_47657001dup、g.47630449del、g.47657007dup、g.47657008del、g.47657020_47657023dup、g.47657025_47657026del、g.47657026dup、g.47657030_47657031del、g.47657047_47657050del、g.47657053del、g.47657053_47657057del、g.47657064del、g.47657073dup、g.47657312_47676594del、g.47668611_47674615del、g.47672116_47675123del、g.47666463_47677632del、g.47666403_47677572del、g.(47657081_47672686)_(47710367_?)del、g.(47657081_47672686)_(47710367_?)inv、g.47671507_47675022delinsCATTCTCTTTGAAAA、g.47657278_47676557del、g.47672687_47672796del、g.(47657081_47672686)_(47672797_47690169)del、g.(47657081_47672686)_(47672797_47690169)del、g.(47657081_47672686)_(47693948_47698103)del、g.(47657081_47672686)_(47698202_47702163)del、g.(47657081_47672686)_(47708011_47709917)del、g.47672691dup、g.47672697dup、g.47672721_47672744delins47672748_47672771inv、g.47672728_47672729del、g.47672731dup、g.47672750_47672751insGG、g.47672755_47672758del、g.47672762_47672763del、g.47630466_47630494del、g.47686194_47697740del、g.(47672797_47690169)_(47710367_?)del、g.(47672797_47690169)_(47690294_47693796)del、g.(47672797_47690169)_(47693948_47698103)del、g.47690170_47693947del、g.(47672797_47690169)_(47693948_47698103)del、g.(47672797_47690169)_(47693948_47698103)dup、g.(47672797_47690169)_(47705659_47707834)del、g.47690173del、g.47690191del、g.47690216_47690217dup、g.47690227del、g.47690227dup、g.47690228_47690232del、g.47690230_47690231del、g.47690240del、g.47690240_47690243del、g.47630475del、g.47630475_47630476del、g.47690259_47690260delinsCT、g.47690277dup、g.47690280del、g.47690283dup、g.(47690294_47693796)_(47702410_47703505)del、g.47630484_47630485insG、g.47693838_47693839del、g.47693862del、g.47693864del、g.47693873del、g.47693880dup、g.47693913del、g.47693924_47693925dup、g.47630493del、g.47697730_47706125del、g.(47693948_47698103)_(47710367_?)del、g.(47693948_47698103)_(47698202_47702163)del、g.(47693948_47698103)_(47705659_47707834)del、g.47698107del、g.47698109del、g.47698109_47698110insA、g.47630496del、g.47698118del、g.47698125del,g.47698129dup、g.47698138_47698139del、g.47698142_47698146del、g.47698144dup、g.47698147_47698148del、g.47698147_47698148dup、g.47698147_47698148insT、g.47698159del、g.47698162del、g.47698506_47703472del、g.47701803_47708848del、g.(47698202_47702163)_(47710367_?)del、g.(47698202_47702163)_(47702410_47703505)del、g.(47698202_47702163)_(47703711_47705410)del、g.(47698202_47702163)_(47705659_47707834)del、g.47702164del、g.47702175_47702176insA、g.47702183_47702186del、g.47702185_47702186insCT、g.47702190_47702192del、g.47702191dup、g.47702192_47702193del、g.47702213del、g.47702231del、g.47702242dup、g.47702257del、g.47702262_47702263dup、g.47630516_47630517dup、g.47630517del、g.47630517dup、g.47702289_47702290inv、g.47702293_47702296del、g.47702301dup、g.47702315del、g.47702315del、g.47702328_47702329del、g.47630522dup、g.47702339del、g.47702371_47702374dup、g.47702384_47702385del、g.47702386_47702389del、g.47702388del、g.47702388_47702389del、g.47702390del、g.47702390_47702391del、g.47702400_47702401del、g.47703506_47703710del、g.47703506_47708010del、g.47703510del、g.47703515del、g.47703521_47703522del、g.47703535_47703536del、g.47703546_47703547del、g.47703548_47703611dup、g.47630534del、g.47703571dup、g.47703574_47703581del、g.47703585dup、g.47630350del、g.47632107_47668733del、g.47703613del、g.(47630542_47635539)_(47643569_47656880)del、g.(47630542_47635539)_(47643569_47656880)inv、g.(47630542_47635539)_(47657081_47672686)del、g.47635540_47657080del、g.(47630542_47635539)_(47672797_47690169)del、g.(47630542_47635539)_(47690294_47693796)del、g.(47630542_47635539)_(47705659_47707834)del、g.47635540_47635694del、g.(47630542_47635539)_(47635695_47637232)del、g.(47630542_47635539)_(47635695_47637232)del、g.(47630542_47635539)_(47637512_47639552)del、g.47703635dup、g.47703641dup、g.47635542_47635549del、g.47703660_47703663del、g.47703667dup、g.47630351dup、g.47703704del、g.47703826_47707938del、g.(47703711_47705410)_(47705659_47707834)del、g.47705428_47705431del、g.47705437_47705438insA、g.47635551_47635552del、g.47705440_47705441del、g.47705461del、g.47705490del、g.47705494del、g.47705495del、g.47635557_47635558del、g.47705505del、g.47705535dup、g.47705547del、g.47705560_47705561dup、g.47705561dup、g.47705562dup、g.47705588del、g.47705608_47705609del、g.47705618dup、g.47705627dup、g.47635571_47635601delins(217)、g.(47705659_47707834)_(47710367_?)del、g.(47705659_47707834)_(47708011_47709917)del、g.47707842_47707843del、g.47707861del、g.47707861_47707874dup、g.47707878_47707884del、g.47707878_47707884del、g.47707883del、g.47707895_47707905del、g.47707897del、g.47707901_47707902del、g.47707905_47707906del、g.47707921del、g.47635583dup、g.47635583_47635584del、g.47707969_47707973del、g.47707996_47707997ins(115)、g.47708009_47708010del、g.(47708011_47709917)_(47710367_?)del、g.47635591_47635592del、g.47635597_47635618dup、g.47635606_47635607del、g.47630359dup、g.47635672del、g.47635675_47635678del、g.47630364dup、g.47635680dup、g.47636862_47639040del、g.47636781_47638831del、g.47636753_47638155del、g.47636552_47638597del、g.(47635695_47637232)_(47643569_47656880)del、g.(47635695_47637232)_(47643569_47656880)del、g.(47635695_47637232)_(47657081_47672686)del、g.(47635695_47637232)_(47672797_47690169)del、g.(47635695_47637232)_(47698202_47702163)del、g.(47635695_47637232)_(47637512_47639552)del、g.(47635695_47637232)_(47641558_47643434)del、g.47637234del、g.47637246_47637247del、g.47637253_47637254del、g.47637254_47637255del、g.47637254_47637255del、g.47637265del、g.47637274del、g.47637282del、g.47637320del、g.47637372_47637375del、g.47637377_47637449dup、g.47637379del、g.47637384del、g.47637394_47637395del、g.47637396_47637397del、g.47637417del、g.47637427_47637435del、g.47637437_47637439del、g.47637453del、g.47637458dup、g.47637479_47637482dup、g.47637482dup、g.47637504_47637505del、g.47637508_47637511del、g.47638050_47653430del、g.47638302_47648462del、g.47638478_47648643del、g.(47637512_47639552)_(47710367_?)del、g.(47637512_47639552)_(47643569_47656880)del、g.47639553_47643568del、g.(47637512_47639552)_(47657081_47672686)del、g.(47637512_47639552)_(47657081_47672686)del、g.(47637512_47639552)_(47672797_47690169)del、g.(47637512_47639552)_(47639700_47641407)del、g.(47637512_47639552)_(47641558_47643434)del、g.47639557_47639561del、g.47639582_47639586delinsTAAT、g.47639583_47639584del、g.47639594del、g.47639594dup、g.47639598del、g.47639603_47639604del、g.47639611_47639612del、g.47639612del、g.47639618_47639621del、g.47639624_47639628delinsTTA、g.47630401dup、g.47639632dup、g.47639638_47639641dup、g.47639638_47639641dup、g.47639639del、g.47639639del、g.47639642dup、g.47630403_47630404insC、g.47639653del、g.47639666del、g.47639666_47639669del、g.47639668del、g.47639670_47639673delinsTT、g.47639674_47639675dup、g.47639695_47639696del、g.47639707_47642985del、g.47641402_47642007del、g.(47639700_47641407)_(47643569_47656880)del、g.47641408_47643568del、g.(47639700_47641407)_(47657081_47672686)del、g.(47639700_47641407)_(47672797_47690169)del、g.(47639700_47641407)_(47641558_47643434)del、g.(47639700_47641407)_(47641558_47643434)del、g.47641410del、g.47641425_47641426del、g.47641426_47641429del、g.47630412del、g.47641451del、g.47641454dup、g.47641455dup、g.47641469del、g.47641478del、g.47641488_47641491del、g.47641496_47641497del、g.47641503del、g.47641513_47641514dup、g.47641530_47641537dup、g.47642509_47655432del、g.(47641558_47643434)_(47643569_47656880)del、g.(47641558_47643434)_(47693948_47698103)del、g.47630424_47630433del、g.47643450dup、g.47643462_47643463del、g.47643462_47643463ins(4)、g.47643464_47643465insNC_000022.10:35788169_35788352、g.47643465dup。
MutS同源物3 (MSH3
)為參與錯配修復(MMR)系統之細菌錯配修復蛋白MutS的人類同源物。MSH3通常與MSH2形成異二聚體MutSβ,以在DNA合成期間校正微衛星中之長插入/缺失環及鹼基錯配。在大約15%的結腸直腸癌中發現針對MMR之能力缺陷,且在近50%的MMR缺陷型結腸直腸癌中發現MSH3基因中之體細胞突變。MSH3
中之突變的實例包括(但不限於) g.79970809del。
MSH6
編碼MutS同源物6 (MSH6),其為參與DNA錯配修復(MMR)之突變基因S (MutS)蛋白家族的成員。MSH6蛋白在人類及酵母中均與MutS同源物2 (MSH2)形成異二聚體。人類MSH2/6識別單個鹼基-鹼基錯配及短插入/缺失環。在識別出錯配後,MSH2/6複合體結合ADP並將其交換成ATP,導致在鹼基對溶解、鹼基切除及修復之前複合體的構象改變。
MSH6
突變包括讀框移位及/或無義突變,且可導致非功能性MSH6
及蛋白質表現之喪失。實例包括MSH6胺基酸殘基290處之讀框移位突變及復合錯義T1189I。
藉由常規診斷方法可在癌症中檢測到失活MSH6
突變。此等方法包括(但不限於)藉由活組織檢查及血液檢查及藉由獲得淋巴或其他體液來獲得癌細胞及其他診斷指標,諸如外周血液單核細胞(PBMC)、PBMC亞群、循環母細胞(CD34+細胞)、循環腫瘤細胞及循環外泌體癌(exosomescancer)細胞。隨後藉由此項技術已知之方法從癌細胞或其他診斷指標確定癌症是否顯示失活MSH6
突變,例如,直接DNA定序及多重連接依賴性探針擴增、RNA定序(RNA-Seq)、微陣列、定量PCR或NanoStringTM
基因表現組,或藉由免疫組織化學、流式細胞儀、免疫細胞化學或西方墨點法確定MSH6蛋白。在Houlleberghs H、Goverde A、Lusseveld J、Dekker M、Bruno MJ等人,(2017) Suspected Lynch syndrome associated MSH6 variants: A functional assay to determine their pathogenicity. PLOS Genetics 13(5): e1006765. https://doi.org/10.1371/journal.pgen.1006765中揭示用於鑑定失活MSH6
突變之方法。
MSH6
中之突變的實例包括(但不限於) g.48032846_48032849del、g.48032846_48032849del、g.48032846_48032849del、g.48033337_48033342del、g.48033420_48033422del、g.(?_48010221)_(48034092)del、g.(?_48010221)_(48018263_48023032)del、g.47998510_48020183del、g.48007276_48020272del、g.48026207del、g.48026223del、g.48026223del、g.48026257_48026261del、g.48026261_48026265del、g.48026312_48026313del、g.48026398del、g.48026543_48026544dup、g.48026693dup、g.48026702del、g.48026712del、g.48026718dup、g.48026736_48026737delinsAG、g.48026736_48026737delinsG、g.48026750_48026751del、g.48026754_48026757del、g.48026756_48026759del、g.48026759_48026760del、g.48026906del、g.48026928_48026931del、g.48026941dup、g.48026991del、g.48027023_48027024del、g.48027079del、g.48027079_48027082dup、g.48027167_48027168del、g.48027172_48027173dup、g.48027178_48027185del、g.48027184_48027185del、g.48027272_48027275del、g.48027470_48027471del、g.48027501_48027502del、g.48027501_48027502delTG、g.48027657dup、g.48027691_48027694del、g.48027733_48027736dup、g.48027794_48027796delinsC、g.48027841_48027842del、g.48027887del、g.48027890dup、g.48027973_48027980del、g.48028067del、g.48028098del、g.48028106del、g.48028175_48028176del、g.48028241_48028242del、g.48028241_48028242delTT、g.48028272_48028284dup、g.48028277_48028278del、g.48030558_48030559del、g.48030126_48032394del、g.48030568del、g.48030581_48030584del、g.48030584_48030585dup、g.48030607del、g.48030645_48030646insT、g.48030647del、g.48030647dup、g.48030649dup、g.48030654_48030660del、g.48030659dup、g.48030697_48030698del、g.48030698del、g.48030706del、g.48030710dup、g.48030727_48030728insC、g.48030765_48030829del、c.3438+797_3438+798insTATins1839_3439-428、c.3438+797_3438+798insTATins1839_3439-428、g.48032121_48032122del、g.48032123_48032124del、g.48032124dup、g.48032126_48032129del、g.48032129_48032130insA、g.48032129_48032132dup、g.(48032167_48032756)_(48034092_?)del、g.48032809_48032812del、g.48032835dup、g.48032846_48032849del、g.48033374_48033402dup、g.48033395_48033398del、g.48033421_48033433del、g.48033425_48033428dup、g.48033453_48033454insA、g.48033494_48033523del、g.48033495_48033496del、g.48033593dup、g.48033610_48033613dup、g.48033629_48033635del、g.48033636_48033639dup、g.48033676_48033682del、g.48033707dup、g.48033709_48033716dup、g.48033721_48033724dup、g.48033727_48033730dup、g.48033728_48033746dup、g.(48033742_48033743)_(48033742_48033743)ins(32)、g.48033746dup、g.48033748_48033751del、g.48033758_48033768del、g.48033773_48033774insATCA、g.48033773_48033776dup、g.48033785_48033789dup、g.48033887_48033910inv、g.(48018263_48023032)_(48032167_48032756)del、g.(48018263_48023032)_(48023203_48025749)del、g.48023097_48023098del、g.48025773dup、g.48025832del、g.48025860_48025861insT、g.48025884_48025885del、g.48025967dup。
MutL同源物1,結腸癌,非息肉病性2型(大腸桿菌)為一種蛋白質,其在人類中係由位於3號染色體上之MLH1基因編碼。其為一種通常與遺傳性非息肉病性結腸直腸癌相關聯之基因。
MSH6
中之突變的實例包括(但不限於) g.37089113_37089115del、g.37089175del、g.37090379_37090393del、g.37038201_37038202del、g.37042531_37042542del、g.37053339_37053355del、g.37053354del、g.37053590_37053591insT、g.37034841_37092337del、g.(?_37034841)_(37092337_?)del、g.(?_37034841)_(37061955_37067127)del、g.(?_37034841)_(37035155_37038109)del、g.(?_37034841)_(37035155_37038109)del、g.(?_37034841)_(37070424_37081676)del、g.(?_37034841)_(37083823_37089009)del、g.37034841_37083822del、g.(?_37034841)_(37038201_37042445)del、g.(?_37034841)_(37042545_37045891)del、g.37034841_37042544del、g.(?_37034841)_(37042545_37045891)del、g.(?_37034841)_(37042545_37045891)del、g.(?_37034841)_(37045966_37048481)del、g.(?_37034841)_(37050397_37053310)del、g.(?_37034841)_(37059091_37061800)del、g.37034658_37038806del、g.36961079_37138741del、g.37061923del、g.37061927del、g.37061933del、g.37061939del、g.37061942dup、g.37035140_37035141del、g.37070417del、g.37070417_37070418insT、g.37070419dup、g.37070422_37070423insT、g.37080355_37083368del、g.(37070424_37081676)_(37092337_?)del、g.(37070424_37081676)_(37081786_37083758)del、g.(37070424_37081676)_(37083823_37089009)del、g.37038148_37038151del、g.37038149del、g.37038149dup、g.37081690_37081691del、g.37081691_37081692del、g.37081706_37081708del、g.37081710_37081711del、g.37035053_37035066del、g.37038154del、g.37038154_37038157del、g.37081738_37081739del、g.37081740del、g.37081753dup、g.37081757_37081761dup、g.37081782_37081783insAAGT、g.37081787_37081793delinsATTT、g.(37081786_37083758)_(37083823_37089009)del、g.(37081786_37083758)_(37089175_37090007)del、g.37083759del、g.37083780dup、g.37083781_37083784del、g.37083781_37083784delCTCA、g.37083808_37083809del、g.37083816del、g.37086069_37089606del、g.37084092_37089247del、g.37084590_37089786del、g.(37083823_37089009)_(37092337_?)del、g.(37083823_37089009)_(37089175_37090007)del、g.37089010_37089174del、g.(37083823_37089009)_(37090509_37091976)del、g.37089023del、g.37089026_37089027del、g.37089027del、g.37089036del、g.37089036dup、g.37038168dup、g.37089042del、g.37089047del、g.37089050_37089053del、g.37089056_37089057del、g.37089061_37089062del、g.37089078_37089096del、g.37089090dup、g.37089099dup、g.37089107_37089110dup、g.37089109_37089110del、g.37089130_37089132del、g.37089130_37089132delAAG、g.37089131delinsTTCTT、g.37089133del、g.37089133delG、g.37089144del、g.37089155del、g.37089155_37089161del、g.37089158_37089161del、g.37089162_37089166del、g.37089171del、g.(37089175_37090007)_(37090101_37090394)del、g.37035056_37035072del、g.37090013del、g.37090015dup、g.37038183_37038184del、g.37090024_37090037dup、g.37090025_37090053dup、g.37090027dup、g.37038184dup、g.37090031_37090032insT、g.37090041del、g.37090057del、g.37090064_37090067del、g.37038188del、g.37090082del、g.37090086_37090087del、g.37090087_37090088del、g.37090097_37090101delinsC、g.37090099del、g.37038191dup、g.(37090101_37090394)_(37092337_?)del、g.37035057_37035073del、g.37090405dup、g.37090411_37090415del、g.37090414del、g.37038194del、g.37038198del、g.37090472_37090478del、g.37039445_37059613dup、g.37039760_37052440del、g.37090481_37090482del、g.37090483_37090484del、g.37090483_37092045del、g.37040732_37043185delinsACATAGTA、g.37042445_37042446del、g.(37038201_37042445)_(37042545_37045891)del、g.(37038201_37042445)_(37048555_37050304)del、g.(37038201_37042445)_(37050397_37053310)del、g.(37038201_37042445)_(37053591_37055922)del、g.37090497_37090498del、g.37090497_37090498delTC、g.37090504_37090507del、g.(37090509_37091976)_(37092337_?)del、g.(37090509_37091976)_(37092337_?)dup、g.37091977_37091978del、g.37091978_37091987del、g.37042448_37042451del、g.37091984_37091990del、g.37042451_37042453del、g.37092020_37092021del、g.37092022_37092068dup、g.37092027_37092028del、g.37092027_37092028dup、g.37092030dup、g.37092052_37092055del、g.37092054_37092055del、g.37092068_37092071dup、g.37092091dup、g.37092094_37092097delins(30)、g.37092096_37092106del、g.37092097del、g.37092125_37092126delAA、g.37092125_37092126del、g.37092139_37092142dup、g.37092142dup、g.37035060dup、g.37042469_37042470del、g.37042470del、g.37042482dup、g.37042485del、g.37042499del、g.37042546dup、g.37044472_37046589del、g.37045648_37049941del、g.37045095_37054651del、g.37045072_37046861del、g.(37042545_37045891)_(37045966_37048481)del、g.(37042545_37045891)_(37092337_?)del、g.(37042545_37045891)_(37048555_37050304)del、g.(37042545_37045891)_(37050397_37053310)del、g.37045892_37050396del、g.37035069del、g.37045926del、g.37045931del、g.37045939_37045940dup、g.37045957_37045958del、g.37045963del、g.37035075del、g.37048067_37049287del、g.(37045966_37048481)_(37048555_37050304)del、g.(37045966_37048481)_(37050397_37053310)del、g.37048483del、g.37048483_37048503delinsT、g.37048486_37048487delinsGTT、g.37048489del、g.37048490del、g.37035076_37035077insCCCA、g.37035077_37035078dup、g.37048505_37048508del、g.37048521del、g.37048529dup、g.37035082dup、g.37049873_37052281del、g.37049839_37052249del、g.37049800_37052209del、g.37049640_37050445del、g.37050305_37050396del、g.(37048555_37050304)_(37050397_37053310)del、g.37050305_37050396del、g.37050319_37050320del、g.37050339del、g.37050348del、g.37050353_37050354del、g.37050354dup、g.37050364del、g.37050375_37050376insGA、g.37035090del、g.37050382_37050383delinsAT、g.37050382_37050383delinsCT、g.37050390_37050396del、g.37052950_37060990del、g.(37050397_37053310)_(37067499_37070274)dup、g.(37050397_37053310)_(37053591_37055922)del、g.(37050397_37053310)_(37056036_37058996)del、g.37053353del、g.37053510_37053511del、g.37035099del、g.37053545_37053546insT、g.37053562del、g.37053578del、g.37053578dup、g.37053585del、g.37053586_37053589del、g.37053591del、g.37053590_37053591delinsAT、g.37055920_37055921del、g.37055914_37055938del、g.(37053591_37055922)_(37070424_37081676)del、g.(37053591_37055922)_(37083823_37089009)del、g.(37053591_37055922)_(37059091_37061800)del、g.37035105del、g.37055928dup、g.37035106_37035116del、g.37055938del、g.37035108del、g.37055972_37055975del、g.37055976_37055979del、g.37035111del、g.37055990dup、g.37035114del、g.37035116del、g.37056036del、g.37056037dup、g.37058993_37059001del、g.(37056036_37058996)_(37070424_37081676)del、g.(37056036_37058996)_(37059091_37061800)del、g.37058997_37059000del、g.37059014_37059017del、g.37059017_37059021del、g.37059027_37059030dup、g.37035122del、g.37059062_37059063insT、g.37059065_37059066del、g.37059066del、g.37059066dup、g.37059072_37059073del、g.37059072_37059073dup、g.37059090_37059093del、g.37061595_37061913del、g.37061308_37066756del、g.37061207_37063077del、g.(37059091_37061800)_(37092337_?)del、g.(37059091_37061800)_(37061955_37067127)del、g.37061801_37061954del、g.(37059091_37061800)_(37083823_37089009)del、g.37061803dup、g.37061804del、g.37061817del、g.37061837_37061838dup、g.37061844del、g.37061851dup、g.37061855dup、g.37061870del、g.37061904_37061906del、g.37061910del、g.37035047del、g.[37049179_37051317delinsTG;37051667_37054327delinsCA]。
人類PMS2
相關基因係位於條帶7p12、7p13、7q11及7q22。此等同源物之外顯子1至5與人類PMS2
具有高度同一性。此基因之產物參與DNA錯配修復。該蛋白質與MLH1
形成異二聚體,且此複合體與結合錯配鹼基之MSH2
相互作用。此基因中之缺陷係與遺傳性非息肉性結腸直腸癌、塔可特氏症候群(Turcot syndrome)相關聯,且係小腦幕上原始神經外胚層腫瘤之病因。
PMS2
中之突變的實例包括(但不限於) g.(?_6012870)_(6048737_?)del、g.6012870_6048737del、g.(6027252_6029430)_(6048737_?)del、g.(6045663_6048627)_(6048737_?)del、g.6029554del、g.6029499dup、g.6029495_6029496del、g.6029462_6029463delinsTAAA、g.5992485_6028601del、g.(6018328_6022454)_(6027252_6029430)del、g.(6013174_6017218)_(6027252_6029430)del、g.6027226_6027227ins(20)、g.6027175del、g.6027090dup、g.6036705_6044207delinsCG、g.6026666dup、g.6026628del、g.6043671del、g.6026565dup、g.6026565dupT、g.6018315_6018316del、g.6018306_6018310del、g.6018306_6018310delAGTTA、g.6043633_6043634dup、g.6018256_6018259del、g.6015623_6017501del、g.6016429_6017479del、g.6017300_6017303del、g.6045579_6045674delinsATTT、g.(6043690_6045522)_(6045663_6048627)del、g.(?_6012870)_(6042268_6043320)del、g.(6035265_6036956)_(6042268_6043320)del、g.6038283_6039384del、g.6038901del、g.6038851dup、g.(6035265_6036956)_(6037055_6038738)del、g.6037019_6037024delinsCTTCACACACA、g.6036980del、g.6036958dup、g.6035323_6035324insJN866832.1、g.(6022623_6026389)_(6035265_6036956)del、g.(6031689_6035164)_(6035265_6036956)del、g.6035204_6035207del、g.6035205_6035206del、g.(?_6012870)_(6031689_6035164)del、g.(6027252_6029430)_(6031689_6035164)del、g.(6029587_6031603)_(6031689_6035164)del、g.6028725_6029882del、g.(?_6012870)_(6029587_6031603)del。
本發明提供一種治療患有林奇氏(Lynch)症候群之患者以降低發展源自林奇氏症候群之癌症的可能性或對其進行治療的方法,該方法藉由向該個體投與有效量之一或多種所揭示化合物或其醫藥上可接受之鹽或對應醫藥組合物。
林奇氏症候群係由錯配修復基因中之突變所引起的遺傳性病症,其中受影響之個體(通常在年輕時)發展結腸直腸癌、子宮內膜癌及各種其他類型之侵襲性癌症的機會高於正常,亦稱為遺傳性非息肉病性結腸癌(HNPCC)。
特異性錯配修復(MMR)基因之突變(包括但不限於MLH1、MSH2、MSH6、PMS2及EPCAM-TACSTD1缺失)係林奇氏症候群之原因。此等基因在修復為準備細胞分裂而複製DNA時所犯之錯誤起作用。基因中之缺陷不允許修復DNA錯誤,且隨著細胞分裂,錯誤堆疊及不可控之細胞生長可導致癌症。
患有林奇氏症候群之彼等患者具有高達85%之感染結腸癌的風險,以及高於平均之感染子宮內膜癌、胃癌、胰臟癌、腎/輸尿管癌、肝膽管癌、胃腸道癌、前列腺癌、卵巢癌、膽囊管癌、腦癌、小腸癌、乳癌及皮膚癌的風險。
因此,在所揭示方法之一實施例中,該方法為治療源自林奇氏症候群之癌症的方法,該等癌症係選自由結腸癌、子宮內膜癌、胃癌、胰臟癌、腎/輸尿管癌、肝膽管癌、胃腸道癌、前列腺癌、卵巢癌、膽囊管癌、腦癌、小腸癌、乳癌及皮膚癌組成之群。
在又另一實施例中,該方法為治療自體免疫疾病之方法。例示性自體免疫疾病包括紅斑狼瘡;偉-爾二氏(Wiskott-Aldrich)症候群;自體免疫性淋巴細胞增生症候群;重症肌無力;類風濕性關節炎(RA);狼瘡性腎炎;多發性硬化;全身性紅斑狼瘡;盤狀狼瘡;亞急性皮膚紅斑狼瘡;皮膚紅斑狼瘡,包括凍瘡狀紅斑狼瘡;慢性關節炎;修格蘭氏症候群(Sjogren's syndrome);發炎性慢性鼻竇炎;結腸炎;乳糜瀉;發炎性腸病;巴雷特氏食道症(Barrett's esophagus);發炎性胃炎;自體免疫性腎炎;自體免疫性血管炎;自體免疫性肝炎;自體免疫性心臟炎;自體免疫性腦炎;自體免疫性糖尿病;自體免疫性糖尿病腎炎;牛皮癬;移植物抗宿主病(GvHD);及自體免疫介導之血液病。
在此實施例之一態樣中,該方法為治療選自由以下組成之群之免疫缺乏的方法:自體免疫性淋巴細胞增生症候群(ALPS)、1型自體免疫性多腺症候群(APS-1)、BENTA病、卡斯蛋白酶八缺乏狀態(CEDS)、慢性肉芽腫病(CGD)、常見變異性免疫缺乏(CVID)、先天性嗜中性球減少症候群、CTLA4缺乏、DOCK8缺乏、GATA2缺乏、伴有免疫缺乏之糖基化病症、超免疫球蛋白E症候群(HIES)、超免疫球蛋白M (Hyper-IgM)症候群、白血球黏附缺乏(LAD)、LRBA缺乏、PI3激酶疾病、PLCG2相關抗體缺乏及免疫失調(PLAID)、嚴重複合型免疫缺乏(SCID)、STAT3功能獲得型疾病、疣、低γ球蛋白血症、感染及無效生成性慢性粒細胞缺乏(Myelokathexis)症候群(WHIMS)、X性聯無γ球蛋白血症(XLA)、X性聯淋巴細胞增生性疾病(XLP)及XMEN病。
如本文所用,術語「免疫缺乏」係指一種病狀,其中構成免疫系統之細胞組分的一部分或一些部分具有缺陷或功能障礙,使得正常免疫機制受損。換言之,「免疫缺乏」意指一種病狀,在該病狀下:先天性免疫及/或獲得性免疫受到抑制及/或減少。在一些實施例中,免疫缺乏個體為免疫功能不全個體。免疫缺乏之非限制性實例可包括AIDS、低γ球蛋白血症、無γ球蛋白血症、粒細胞缺乏、慢性肉芽腫病、無脾、SCID、補體缺乏及/或鐮狀細胞性貧血。
在此實施例之另一態樣中,該方法為治療選自由以下組成之群之神經退化性疾病的方法:多發性硬化、帕金森氏病(Parkinson's disease) (PD)、阿茲海默氏症(Alzheimer's disease) (AD)、齒狀紅核蒼白球肌萎縮症(DRPLA)、亨廷頓氏症(Huntington's Disease) (HD)、1型脊髓小腦性共濟失調(SCA1)、2型脊髓小腦性共濟失調(SCA2)、3型脊髓小腦性共濟失調(SCA3)、脊髓小腦性共濟失調6 (SCA6)、7型脊髓小腦性共濟失調(SCA7)、8型脊髓小腦性共濟失調(SCA8)、12型脊髓小腦性共濟失調(SCA12)、17型脊髓小腦性共濟失調(SCA17)、脊髓性肌肉共濟失調/肯尼迪病(Kennedy Disease) (SBMA)、脆性X症候群(FRAXA)、脆性XE智力遲鈍(FRAXE)及肌強直性營養不良(DM)。
「個體」為哺乳動物,較佳人類,但亦可為需要獸醫治療之動物,例如伴侶動物(例如,狗、貓及其類似動物)、農場動物(例如,牛、羊、豬、馬及其類似動物)及實驗室動物(例如,大鼠、小鼠、豚鼠及其類似動物)。
在某些實施例中,本文所揭示之方法進一步包括除投與有效量之所揭示RAD51抑制劑外,向待治療癌症之個體共同投與有效量之DNA修復抑制劑、DNA損傷反應(DDR)抑制劑、DNA損傷劑或免疫調節劑。
術語「DNA修復抑制劑」係指靶向細胞用以修復DNA中之突變或變化並將DNA恢復至其初始狀態並防止DNA修復之組分/過程的任何試劑。DNA修復抑制劑之實例包括:RPA抑制劑、APE1抑制劑、DNA連接酶抑制劑、DNA聚合酶抑制劑、Parp抑制劑等。
術語「DNA損傷反應抑制劑」係指靶向參與檢測DNA病灶、傳訊DNA損傷之存在及/或促進DNA損傷修復之組分/過程的任何試劑。DNA損傷反應抑制劑之實例包括檢查點抑制劑、ATM及ATR抑制劑、DNA-PK抑制劑等。
術語「DNA損傷劑」係指直接或間接地使DNA損傷之任何試劑,同源重組可對該DNA損傷進行修復。DNA損傷劑係選自由以下組成之群:曝露至DNA損傷性化學品;曝露至化學治療劑;曝露至放射化學療法,及曝露至電離或紫外線輻射。DNA損傷性化學治療劑之具體實例包括烷化劑、亞硝基脲、抗代謝物、植物生物鹼、植物萃取物及放射性同位素。化學治療劑之具體實例亦包括DNA損傷藥物,例如5-氟尿嘧啶(5-FU)、卡培他濱(capecitabine)、S-1 (替加氟(Tegafur)、5-氯-2,4-二羥基吡啶及氧嗪酸(oxonic acid))、5-乙炔基尿嘧啶、阿拉伯糖基胞嘧啶(ara-C)、5-氮胞苷(5-AC)、2',2'-二氟-2'-脫氧胞苷(dFdC)、嘌呤抗代謝物(巰基嘌呤、硫唑嘌呤、硫鳥嘌呤)、吉西他濱鹽酸鹽(gemcitabine hydrochlorine)(Gemzar)、噴司他汀(pentostatin)、異嘌呤醇、2-氟-阿拉伯糖基-腺嘌呤(2F-ara-A)、羥基脲、硫芥(雙氯乙基硫醚)、氮芥、美法侖、苯丁酸氮芥、環磷醯胺、異環磷醯胺、塞替派、AZQ、絲裂黴素C、二脫水半乳糖醇、二溴甜醇(dibromoducitol)、烷基磺酸鹽(白消安)、亞硝基脲(BCNU、CCNU、4-甲基CCNU或ACNU)、丙卡巴肼、癸巴肼(decarbazine)、瑞貝卡黴素(rebeccamycin)、蒽環黴素諸如多柔比星(doxorubicin) (阿黴素(adriamycin);ADR)、柔紅黴素(daunorubicin) (塞魯比星(Cerubicine))、伊達比星(idarubicin)(伊達黴素)及表柔比星(epirubicin)(Ellence)、蒽環黴素類似物諸如米托蒽醌(mitoxantrone)、放線菌素D、非插入拓撲異構酶抑制劑諸如表鬼臼毒素(依託泊苷(etoposide)或VP16、替尼泊苷(teniposide)或VM-26)、鬼臼毒素、博萊黴素(Bleo)、培坡黴素(pepleomycin)、與核酸形成加合物之化合物,包括鉑衍生物(例如順鉑(CDDP)、順鉑之反式類似物、卡鉑、異丙鉑、四鉑及奧沙利鉑)以及喜樹鹼(camptothecin)、拓撲替康(topotecan)、伊立替康(irinotecan) (CPT-11)及SN-38。核酸損傷處理之具體實例包括輻射(例如紫外線(UV)、紅外線(IR)或α-、β-或γ-輻射)以及環境休克(例如體溫過高)。
「免疫調節劑」意指調節對抗原之免疫反應但不為抗原或衍生自抗原之試劑。如本文所用,「調節」係指誘導、增強、抑制、引導或重新引導免疫反應。此等試劑包括免疫刺激劑,諸如刺激(或增強)對抗原之免疫反應但不為抗原或衍生自抗原之佐劑。存在若干種不同類型之免疫調節劑,其包括(但不限於)類鐸受體(TLR)促效劑及類鐸受體(TLR)拮抗劑。此等藥劑亦包括免疫抑制劑。免疫調節劑係選自由免疫檢查點調節劑、類鐸受體(TLR)促效劑、基於細胞之療法、細胞激素及癌症疫苗組成之群。
在某些實施例中,個體係經確定為具有增加之DNA損傷過程或DNA編輯酶水平及/或活性。在此實施例之一態樣中,DNA編輯酶係選自由活化誘導之胞苷脫胺酶(AID或AICDA)、APOBEC2、APOBEC3A、APOBEC3C、APOBEC3D、APOBEC3F、APOBEC3G、APOBEC3H、APOBEC4、1型拓撲異構酶、2型拓撲異構酶、重組活化基因1 (RAG 1)及重組活化基因2 (RAG2)組成之群。
在某些實施例中,已確定從個體獲得之血細胞具有可檢測之活化誘導之胞苷脫胺酶(AID)水平。
在某些實施例中,已確定從個體獲得之B細胞具有可檢測之活化誘導之胞苷脫胺酶(AID)水平。
在某些實施例中,該可檢測之活化誘導之胞苷脫胺酶(AID)水平係在統計學上顯著高於來自健康個體之未活化B細胞或正常非免疫細胞中表現的AID水平。
投與方法及劑型
爲了向個體提供「有效量」所投與之化合物的精確量將取決於投與方式、疾病之類型及嚴重程度及個體之特徵,諸如一般健康狀況、年齡、性別、體重及對藥物之耐受性。熟習此項技術者將能夠根據此等及其他因素確定合適之劑量。當與其他治療劑組合投與時,例如,當與抗癌劑組合投與時,任何額外治療劑之「有效量」將取決於所用藥物之類型。合適劑量對於已批准之治療劑而言係已知的,且可由熟習此項技術者根據個體之狀況、所治療之病狀類型及藉由遵循(例如)在文獻中報告並在Physician’s Desk Reference
(第57版,2003)中推薦之劑量進行使用之本發明化合物的量來調節。
術語「有效量」意指當投與至個體時產生有益或所需結果(包括臨床結果),例如,與對照相比,抑制(inhibit/suppress)或減輕個體中待治療病症之症狀之量。例如,治療有效量可呈單位劑型給予(例如,每天0.1 mg至約50 g,或者每天1 mg至約5 g)。
如本文所用,術語「投與(administer/administering/administration)」及類似者係指可用於將組合物遞送至所需之生物作用位點的方法。此等方法包括(但不限於)關節內(在關節內)、靜脈內、肌肉內、瘤內、皮內、腹膜內、皮下、經口、局部、鞘內、吸入、經皮、經直腸等。可與本文所述之藥劑及方法一起使用之投與技術見於例如,Goodman及Gilman,The Pharmacological Basis of Therapeutics
,當前版本;Pergamon及Remington's,Pharmaceutical Sciences
(當前版本), Mack Publishing Co., Easton, Pa。
此外,所揭示RAD51抑制劑可與其他治療劑共同投與。如本文所用,術語「共同投與」、「與...組合投與」及其語法等同物意在涵蓋向單一個體投與兩種或更多種治療劑,且旨在包括其中該等藥劑係通過相同或不同之投與途徑或在相同或不同之時間進行投與之治療方案。在一些實施例中,本文所述之一或多種化合物將與其他藥劑共同投與。此等術語涵蓋向個體投與兩種或更多種藥劑,使得該等藥劑及/或其等之代謝物同時存在於該個體中。其等包括以分開組合物同時投與、以分開組合物在不同時間投與或以兩種藥劑皆存在於其中之組合物進行投與。因此,在一些實施例中,本文所述化合物及其他藥劑係呈單一組合物進行投與。在一些實施例中,將本文所述化合物及其他藥劑混合於組合物中。
考慮到病例之特定情況(例如,個體、疾病、所涉及之疾病狀態、特定治療),主治醫師將選擇特定之投與方式及給藥方案。治療可涉及每日或每日多次或少於每日(例如每週或每月等)劑量,持續數天至數月,或甚至數年。然而,藉由觀察使用已揭示之RAD51抑制劑用於治療RAD51介導疾病之批准組合物的劑量作為指導,一般技術者將立即確認適當及/或等效劑量。
如熟習此項技術者所理解,視所選之投與途徑而定,本文所教示之化合物或對應醫藥組合物可呈多種形式投與至患者。本教示化合物可(例如)藉由經口、非經腸、頰內、舌下、鼻、直腸、貼片、泵或經皮投與進行投與,並相應地調配醫藥組合物。非經腸投與包括靜脈內、腹膜內、皮下、肌肉內、經上皮、鼻、肺內、鞘內、直腸及局部投與方式。非經腸投與可藉由在選定之一段時間內連續輸注。
本發明醫藥組合物係經調配以與其預期之投與途徑相容。在一實例中,根據常規步驟將該組合物調配成適應於靜脈內、皮下、肌肉內、經口、鼻內或局部投與至人類之醫藥組合物。在較佳實施例中,調配該醫藥組合物用於靜脈內投與。
通常,對於口服治療投與而言,本教示化合物可與賦形劑合併並呈可攝取之錠劑、頰含錠、片劑、膠囊、酏劑、懸浮劑、糖漿、片劑與類似物形式進行使用。
通常,對於非經腸投與而言,本教示化合物之溶液通常可在水中適當地與界面活性劑(諸如羥丙基纖維素)混合來製備。分散液亦可在甘油、液體聚乙二醇、DMSO及其混合物(有醇或無醇)及在油中進行製備。在儲存及使用之一般條件下,此等製劑包含防腐劑以預防微生物之生長。
通常,對於可注射使用而言,用於臨時製備無菌可注射溶液或分散液的本文所述化合物之無菌水溶液或分散液及無菌粉末係合適的。
實例 縮寫詞:
Ac 乙醯基
ACN 乙腈
aq 水性
Bn 苄基
Boc 第三丁氧基羰基
br. 寬
d 雙重峰(僅在1
H NMR光譜內使用時)
DCM 二氯甲烷
DIEA(DIPEA) 二異丙基乙胺
DMA 二甲基乙醯胺
DMAP 4-二甲基胺基吡啶
DMF N,N-二甲基甲醯胺
DMSO 二甲基亞碸
dppf 1,1'-雙(二苯基膦基)二茂鐵
eq 當量
EtOAc 乙酸乙酯
hr 小時
HBTU 六氟磷酸N,N,N',N',
-四甲基-O-(1H
-苯并三唑-1-基)脲鎓
HPLC 高效液相層析法
LC-MS 液相層析與質譜分析聯用
m 多重峰
MS ESI 質譜,電噴霧離子化
NBSN
-溴代琥珀醯亞胺
NMR 核磁共振
prep 製備型
Py 吡啶
s 單峰
sat 飽和
SFC 超臨界流體層析法
t 三重峰
TEA 三乙胺
TFA 三氟乙酸
THF 四氫呋喃
TLC 薄層層析法
Tol 甲苯
實例
1.
合成
(S)-(4-(2-(4-((
苄基胺甲醯基
)
氧基
)
哌啶
-1-
基
)
噻唑
-5-
基
)-3-(N-(
第三丁基
)
胺磺醯基
)
苯基
)
胺基甲酸
(1-
甲基吡咯啶
-2-
基
)
甲酯
反應圖
1
:
用於製備磺醯胺化合物 12 之一般方法 D 。
將DMAP (156 mg,1.3 mmol,0.1eq.
)及Ac2
O (1.96 g,19.2 mmol,1.5eq.
)添加至 5- 胺基 -2-(2- 溴噻唑 -5- 基 )-N- 第三丁基 - 苯磺醯胺
(5 g,12.8 mmol,1eq.
)含於DCM (30 mL)之溶液。在20℃下攪拌混合物1小時,並隨後用1M HCl (50 mL)及飽和Na2
CO3
水溶液(50 mL)洗滌。通過Na2
SO4
乾燥有機層,過濾並濃縮。藉由管柱層析法(SiO2
,石油醚:乙酸乙酯 = 5:1至2:1)純化殘餘物以獲得呈黃色固體之 N-[4-(2- 溴噻唑 -5- 基 )-3-( 第三丁基胺磺醯基 ) 苯基 ] 乙醯胺
(1.5 g,3.5 mmol,27%產率)。ESI [M+H] = 433.9/431.9
用於製備磺醯胺化合物 13 之一般方法 A 。
將K2
CO3
(448 mg,3.3 mmol,2eq.
)及哌啶-4-醇(246 mg,2.4 mmol,1.5eq.
)添加至 N-[4-(2- 溴噻唑 -5- 基 )-3-( 第三丁基胺磺醯基 ) 苯基 ] 乙醯胺
(700 mg,1.6 mmol,1eq.
)含於DMF (20 mL)之溶液。在100℃下攪拌混合物12小時並隨後倒入H2
O (100 mL)中。用EtOAc (50 mL x 3)萃取水相,用鹽水(100 mL)洗滌經合併之有機層,通過Na2
SO4
乾燥,過濾並濃縮。藉由管柱層析法(SiO2
,石油醚:乙酸乙酯 = 1:2)純化殘餘物以獲得呈黃色固體之 N-[3-( 第三丁基胺磺醯基 )-4-[2-(4- 羥基 -1- 哌啶基 ) 噻唑 -5- 基 ] 苯基 ] 乙醯胺
(550 mg,1.2 mmol,13.2%產率)。1
H NMR (400 MHz, 氯仿-d) δ = 8.26 (dd, J=2.2, 8.6 Hz, 2H), 7.93 (d, J=2.4 Hz, 1H), 7.37 (d, J=8.4 Hz, 1H), 7.31 (s, 1H), 4.02 - 3.94 (m, 1H), 3.88 - 3.80 (m, 2H), 3.30 (ddd, J=3.5, 9.2, 13.1 Hz, 2H), 2.21 (s, 3H), 2.03 - 1.95 (m, 2H), 1.67 (dtd, J=4.0, 8.7, 13.0 Hz, 2H), 1.09 (s, 9H)。ESI [M+H] = 453.1
用於製備磺醯胺化合物 15 之一般方法 F 。
將 N- 苄基胺基甲酸 [1-[5-[4- 乙醯胺基 -2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ]-4- 哌啶基 ] 酯
(380 mg,649 μmol,1eq.
)溶解於HCl/MeOH (4M,20 mL)中並在20℃下攪拌混合物1小時。濃縮混合物,用飽和Na2
CO3
水溶液(20 mL)稀釋並用EtOAc (20 mL x 3)萃取。用鹽水(20 mL)洗滌經合併之有機層,通過Na2
SO4
乾燥,過濾並濃縮。藉由管柱層析法(SiO2
,石油醚:乙酸乙酯 = 10:1至1:1)純化殘餘物以獲得呈黃色固體之 N- 苄基胺基甲酸 [1-[5-[4- 胺基 -2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ]-4- 哌啶基 ] 酯
(300 mg,552 μmol,85%產率)。ESI [M+H] = 544.2
用於製備實例 1 之一般方法 H 。
將 N- 苄基胺基甲酸 [1-[5-[2-( 第三丁基胺磺醯基 )-4-[(4- 硝基苯氧基 ) 羰基胺基 ] 苯基 ] 噻唑 -2- 基 ]-4- 哌啶基 ] 酯
(130 mg,184 μmol,1eq.
)含於DCM (2 mL)之溶液添加至[(2S)-1-甲基吡咯啶-2-基]甲醇(42 mg,367 μmol,2eq.
)及DIEA (71.11 mg,550 μmol,3eq.
)含於MeCN (5 mL)之溶液並使混合物回流1小時。濃縮混合物並藉由製備型HPLC純化殘餘物以獲得呈淺黃色固體之 (S)-(4-(2-(4-(( 苄基胺甲醯基 ) 氧基 ) 哌啶 -1- 基 ) 噻唑 -5- 基 )-3-(N-( 第三丁基 ) 胺磺醯基 ) 苯基 ) 胺基甲酸 (1- 甲基吡咯啶 -2- 基 ) 甲酯
(19.87 mg,28.8 μmol,15.7%產率,99.3%純度)。1
H NMR (400 MHz, DMSO-d6) δ = 10.06 (s, 1H), 8.26 (d, J=2.0 Hz, 1H), 7.71 (t, J=6.2 Hz, 1H), 7.60 (dd, J=2.3, 8.5 Hz, 1H), 7.37 - 7.14 (m, 7H), 6.94 (s, 1H), 4.81 - 4.71 (m, 1H), 4.16 (br d, J=6.2 Hz, 2H), 4.10 - 4.03 (m, 1H), 4.02 - 3.96 (m, 1H), 3.73 - 3.63 (m, 2H), 3.28 (br s, 2H), 2.94 - 2.87 (m, 1H), 2.44 - 2.37 (m, 1H), 2.30 (s, 3H), 2.18 - 2.05 (m, 1H), 1.99 - 1.82 (m, 3H), 1.68 - 1.52 (m, 5H), 1.12 - 1.03 (m, 9H)。ESI [M+H] = 685.2
實例 2. 合成 N- 苄基胺基甲酸 [1-[5-[2-( 第三丁基胺磺醯基 )-4-[[(2R)-1- 甲基吡咯啶 -2- 基 ] 甲氧基羰基胺基 ] 苯基 ] 噻唑 -2- 基 ]-4- 哌啶基 ] 酯 。 以下化合物係經由相同方法藉由關鍵中間體 16 進行合成。 N- 苄基胺基甲酸 [1-[5-[2-( 第三丁基胺磺醯基 )-4-[[(2R)-1- 甲基吡咯啶 -2- 基 ] 甲氧基羰基胺基 ] 苯基 ] 噻唑 -2- 基 ]-4- 哌啶基 ] 酯
。1
H NMR (400 MHz, DMSO-d6) δ = 10.07 (s, 1H), 8.29 (d, J=2.2 Hz, 1H), 7.73 (t, J=6.2 Hz, 1H), 7.63 (dd, J=2.3, 8.5 Hz, 1H), 7.39 - 7.19 (m, 7H), 6.94 (s, 1H), 4.80 (td, J=4.1, 8.0 Hz, 1H), 4.20 (br d, J=6.1 Hz, 2H), 4.14 - 4.07 (m, 1H), 4.06 - 3.99 (m, 1H), 3.72 (br d, J=13.6 Hz, 2H), 3.29 - 3.22 (m, 2H), 2.98 - 2.92 (m, 1H), 2.45 - 2.41 (m, 1H), 2.33 (s, 3H), 2.22 - 2.13 (m, 1H), 2.02 - 1.79 (m, 3H), 1.72 - 1.56 (m, 5H), 1.20 - 1.03 (m, 9H)。ESI [M+H] = 685.2
實例 3. 合成 N- 異丙基胺基甲酸 [1-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ]-4- 哌啶基 ] 酯。 反應圖 2 : 製備化合物 23 。
一般方法A, 1- 苄基 -3-[3-( 第三丁基胺磺醯基 )-4-[2-(4- 羥基 -1- 哌啶基 ) 噻唑 -5- 基 ] 苯基 ] 脲。
ESI [M+H] = 544.1
製備實例 3 。
將DMAP (22.47 mg,183.92 μmol,2eq.
)及[異丙基(甲基)-亞氮烷基(azanylidene)]甲酮(78.26 mg,919.62 μmol,10eq.
)添加至 1- 苄基 -3-[3-( 第三丁基胺磺醯基 )-4-[2-(4- 羥基 -1- 哌啶基 ) 噻唑 -5- 基 ] 苯基 ] 脲
(50 mg,91.96 μmol,1eq.
)含於甲苯(2 mL)之溶液。在100℃下攪拌混合物4小時並隨後濃縮。藉由製備型TLC (石油醚/EtOAc=1:3)並隨後進行酸性製備型HPLC來純化殘餘物以獲得呈黃色固體之 N- 異丙基胺基甲酸 [1-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ]-4- 哌啶基 ] 酯
(28.31 mg,99.2%純度)。1
H NMR (400 MHz, 甲醇-d4) δ = 8.29 (d, J=2.0 Hz, 1H), 7.71 (dd, J=2.0, 8.3 Hz, 1H), 7.43 (d, J=8.8 Hz, 1H), 7.35 (d, J=3.9 Hz, 5H), 7.27 (dt, J=2.7, 5.7 Hz, 1H), 4.98 - 4.93 (m, 1H), 4.43 (s, 2H), 3.90 - 3.59 (m, 5H), 2.19 - 2.07 (m, 2H), 1.99 - 1.86 (m, 2H), 1.22 (s, 9H), 1.16 (d, J=6.8 Hz, 6H)。ESI [M+H] = 629.1
實例 4. 合成 4-[5-[2-( 第三丁基胺磺醯基 )-4-(2- 吡啶基甲基胺甲醯基胺基 ) 苯基 ] 噻唑 -2- 基 ] 哌啶 -1- 甲酸異丙酯。 反應圖 3 : 製備化合物 45
一般方法D, 胺基甲酸 4- 硝基苯基 (4- 溴 -3-(N-( 第三丁基 ) 胺磺醯基 ) 苯基 ) 酯
。ESI [M+H] =474.1
用於製備磺醯胺化合物 46 之一般方法 E 。
將 N-[4- 溴 -3-( 第三丁基胺磺醯基 ) 苯基 ] 胺基甲酸 (4- 硝基苯基 ) 酯
(307 mg,650 μmol,1eq.
)含於DCM (3 mL)之溶液添加至2-吡啶基甲胺(352 mg,3.3 mmol,5eq.
)及DIEA (84 mg,650 μmol,1eq.
)含於DCM (3 mL)之溶液。在25℃下攪拌混合物1小時,隨後用DCM (30 mL)稀釋並用H2
O (20 mL x 2)洗滌。濃縮有機層並藉由製備型TLC (SiO2
,石油醚:乙酸乙酯 = 0:1)純化殘餘物以獲得呈黃色固體之 1-[4- 溴 -3-( 第三丁基胺磺醯基 ) 苯基 ]-3-(2- 吡啶基甲基 ) 脲
(180 mg,粗製物)。ESI [M+H] =441.2/443.2
製備化合物 47
使 1-[4- 溴 -3-( 第三丁基胺磺醯基 ) 苯基 ]-3-(2- 吡啶基甲基 ) 脲
(140 mg,317.21 μmol,1eq.
)、4,4,5,5-四甲基-2-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊-2-基)-1,3,2-二氧雜硼雜環戊烷(322.21 mg,1.27 mmol,4eq.
)、Pd(dppf)Cl2
(116.05 mg,158.61 μmol,0.5eq.
)及KOAc (93.39 mg,951.64 μmol,3eq.
)含於二噁烷(4 mL)之混合物脫氣並用N2
淨化3次,並隨後在80℃下在N2
氣氛下攪拌混合物12小時。濃縮混合物並藉由管柱層析法(SiO2
,石油醚/乙酸乙酯=1/0至1:1)純化殘餘物以獲得 1-[3-( 第三丁基胺磺醯基 )-4-(4,4,5,5- 四甲基 -1,3,2- 二氧雜硼雜環戊 -2- 基 ) 苯基 ]-3-(2- 吡啶基甲基 ) 脲
(50 mg,89.37 μmol,28.17%產率,87.3%純度)。ESI [M+H] =489.4
用於製備化合物實例 4 之一般方法 K
使 1-[3-( 第三丁基胺磺醯基 )-4-(4,4,5,5- 四甲基 -1,3,2- 二氧雜硼雜環戊 -2- 基 ) 苯基 ]-3-(2- 吡啶基甲基 ) 脲
(26.38 mg,54.01 μmol,1.2eq.
)、 4-(5- 溴噻唑 -2- 基 ) 哌啶 -1- 甲酸異丙酯
(15 mg,45.01 μmol,1eq.
)、Na2
CO3
(9.54 mg,90.02 μmol,2eq.
)、KF (7.85 mg,135.04 μmol,3eq.
)及Pd(PPh3
)4
(5.20 mg,4.50 μmol,0.1eq.
)含於H2
O (0.1 mL)/EtOH (0.3 mL)/甲苯(0.3 mL)之混合物脫氣並用N2
淨化3次,並隨後在85℃下在N2
氣氛下攪拌混合物12小時。過濾反應混合物並濃縮。藉由製備型TLC (SiO2
,石油醚/乙酸乙酯=1/2)並隨後進行製備型HPLC (TFA條件)來純化殘餘物以獲得呈淺黃色固體之 4-[5-[2-( 第三丁基胺磺醯基 )-4-(2- 吡啶基甲基胺甲醯基胺基 ) 苯基 ] 噻唑 -2- 基 ] 哌啶 -1- 甲酸異丙酯
(6.36 mg,8.21 μmol,18.24%產率,94.07%純度,TFA)。1
H NMR (400 MHz, 甲醇-d4) δ = 8.75 (br d, J=5.6 Hz, 1H), 8.53 (br t, J=7.9 Hz, 1H), 8.34 (d, J=2.0 Hz, 1H), 8.04 (br d, J=8.1 Hz, 1H), 7.92 (br t, J=6.5 Hz, 1H), 7.75 (s, 1H), 7.69 (dd, J=2.3, 8.4 Hz, 1H), 7.39 (d, J=8.3 Hz, 1H), 4.94 - 4.92 (m, 1H), 4.77 (s, 2H), 4.24 (br d, J=13.4 Hz, 2H), 3.31 - 3.25 (m, 1H), 3.02 (br s, 2H), 2.15 (br d, J=11.5 Hz, 2H), 1.76 (dq, J=4.2, 12.3 Hz, 2H), 1.28 (d, J=6.2 Hz, 6H), 1.11 (s, 9H)。ESI [M+H] = 615.2
實例 5. 合成 4-[5-[2-( 第三丁基胺磺醯基 )-4-( 異丙氧基羰基胺基 ) 苯基 ] 噻唑 -2- 基 ] 哌嗪 -1- 甲酸異丙酯 。 反應圖 4 : 製備化合物 56
一般方法A, 4-[5-[4- 乙醯胺基 -2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 哌嗪 -1- 甲酸第三丁酯
。ESI [M+H] = 538.2
用於製備磺醯胺化合物 57 之一般方法 C 。
將TFA (1 mL)添加至 4-[5-[4- 乙醯胺基 -2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 哌嗪 -1- 甲酸第三丁酯
(110 mg,205 μmol,1eq.
)含於DCM (2 mL)之溶液並在25℃下攪拌混合物30分鐘。濃縮混合物以獲得呈黃色固體之 N-[3-( 第三丁基胺磺醯基 )-4-(2- 哌嗪 -1- 基噻唑 -5- 基 ) 苯基 ] 乙醯胺
(80 mg,183 μmol,89.4%產率)。ESI [M+H] = 438.2
製備化合物實例 5
一般方法D, 4-[5-[2-( 第三丁基胺磺醯基 )-4-( 異丙氧基羰基胺基 ) 苯基 ] 噻唑 -2- 基 ] 哌嗪 -1- 甲酸異丙酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.22 (d, J=2.1 Hz, 1H), 7.56 (dd, J=2.2, 8.3 Hz, 1H), 7.30 (d, J=8.3 Hz, 1H), 7.20 (s, 1H), 4.94 - 4.81 (m, 2H), 3.61 - 3.43 (m, 8H), 1.20 (dd, J=6.2, 14.5 Hz, 12H), 1.07 (s, 9H)。ESI [M+H] = 568.3
實例 6. 合成 4-[5-[4-( 苄氧基羰基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 哌嗪 -1- 甲酸異丙酯 反應圖 5 : 製備化合物實例 6
一般方法D, 4-[5-[4-( 苄氧基羰基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 哌嗪 -1- 甲酸異丙酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.33 (d, J=2.0 Hz, 1H), 7.68 (dd, J=2.2, 8.4 Hz, 1H), 7.45 - 7.27 (m, 7H), 5.21 (s, 2H), 4.94 - 4.88 (m, 1H), 3.68 - 3.51 (m, 8H), 1.27 (d, J=6.4 Hz, 6H), 1.19 - 1.11 (m, 9H)。ESI [M+H] = 616.3
實例 7. 合成反式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 環戊氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸異丙酯。 反應圖 6 : 用於製備磺醯胺化合物 83 之一般方法 B 。
將Na2
CO3
(579 mg,5.5 mmol,3eq.
)及Pd(dppf)Cl2
(133 mg,182 μmol,0.1eq.
)添加至 ( 反式 -4-(5- 溴噻唑 -2- 基 ) 環己基 ) 胺基甲酸第三丁酯
(1.3 g,3.6 mmol,2eq.
)及 N-[3-( 第三丁基胺磺醯基 )-4-(4,4,5,5- 四甲基 -1,3,2- 二氧雜硼雜環戊 -2- 基 ) 苯基 ] 胺基甲酸異丙酯
(800 mg,1.8 mmol,1eq.
)含於二噁烷(12 mL)及H2
O (2 mL)之混合物。在80℃下在N2
氣氛下攪拌混合物12小時並隨後濃縮。用H2
O (5 mL)稀釋殘餘物並用乙酸乙酯(5 mL x 3)萃取,通過Na2
SO4
乾燥,過濾並濃縮。藉由管柱層析法(SiO2
,石油醚:乙酸乙酯 = 1:0至3:1)純化殘餘物以獲得 反式 -N-[4-[2-[4-( 第三丁氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ]-3-( 第三丁基胺磺醯基 ) 苯基 ] 胺基甲酸異丙酯
(660 mg,粗製物),其中60 mg係藉由製備型HPLC (管柱:Agela Durashell C18 150X25 5u;流動相:[水(0.04% NH3
H2
O)-ACN];B%:60%-90%,10分鐘)進行純化以獲得呈白色固體用於遞送之純 化合物 83
(40.92 mg,99.64%純度)。1
H NMR (400 MHz, DMSO-d6) δ = 10.06 (s, 1H), 8.32 (d, J=2.1 Hz, 1H), 7.70 - 7.60 (m, 2H), 7.38 (d, J=8.4 Hz, 1H), 6.96 (s, 1H), 6.81 (br d, J=7.9 Hz, 1H), 4.99 - 4.87 (m, 1H), 3.27 (br s, 1H), 2.94 - 2.84 (m, 1H), 2.13 (br d, J=11.7 Hz, 2H), 1.90 (br d, J=11.1 Hz, 2H), 1.63 - 1.49 (m, 2H), 1.39 (s, 9H), 1.33 (br d, J=14.4 Hz, 2H), 1.28 (d, J=6.4 Hz, 6H), 1.07 (s, 9H)。ESI [M+H] =595.3
製備實例 7
一般方法D, 反式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 環戊氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸異丙酯
。1
H NMR (400 MHz, DMSO-d6) δ = 10.04 (s, 1H), 8.29 (d, J=2.2 Hz, 1H), 7.61 - 7.59 (m, 2H),7.35 (d, J=8.8 Hz, 1H), 7.00 (br d, J=7.9 Hz, 1H), 6.96 - 6.93 (m, 1H), 4.96 - 4.87 (m, 2H), 3.29 - 3.22 (m, 1H), 2.87 (br t, J=11.8 Hz, 1H), 2.10 (br d, J=12.7 Hz, 2H), 1.88 (br d, J=12.7 Hz, 2H), 1.75 (br s, 2H), 1.61 - 1.48 (m, 8H), 1.36 - 1.27 (m, 2H), 1.25 (d, J=6.1 Hz, 6H), 1.04 (s, 9H)。ESI [M+Na] = 629.3
實例 8. 合成 N-[4-[5-[2-( 第三丁基胺磺醯基 )-4-( 異丙氧基羰基胺基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸 [(2R)-1- 甲基吡咯啶 -2- 基 ] 甲酯。 反應圖 7 : 製備化合物 85
一般方法D, 反式 -N-[4-[5-[2-( 第三丁基胺磺醯基 )-4-( 異丙氧基羰基胺基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸 (4- 硝基苯基 ) 酯
。ESI [M+H] = 660.2
製備化合物實例 8
一般方法H, N-[4-[5-[2-( 第三丁基胺磺醯基 )-4-( 異丙氧基羰基胺基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸 [(2R)-1- 甲基吡咯啶 -2- 基 ] 甲酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.38 (s, 1H), 7.80 - 7.73 (m, 1H), 7.69 (dd, J=2.2, 8.4 Hz, 1H), 7.40 (d, J=8.3 Hz, 1H), 5.05 - 5.00 (m, 1H), 4.48 (br dd, J=3.0, 12.8 Hz, 1H), 4.21 (br dd, J=7.2, 12.6 Hz, 1H), 3.78 - 3.66 (m, 2H), 3.57 - 3.46 (m, 1H), 3.22 (td, J=8.3, 11.2 Hz, 1H), 3.07 - 3.01 (m, 3H), 2.43 - 1.99 (m, 8H), 1.98 - 1.88 (m, 1H), 1.80 - 1.66 (m, 2H), 1.47 (q, J=12.5 Hz, 2H), 1.34 (d, J=6.2 Hz, 6H), 1.20 - 1.12 (m, 9H)。ESI [M+H] = 636.2
實例 9. 合成 (3-(N-( 第三丁基 ) 胺磺醯基 )-4-(2-((1S,4r)-4-(((((S)-1- 甲基吡咯啶 -2- 基 ) 甲氧基 ) 羰基 ) 胺基 ) 環己基 ) 噻唑 -5- 基 ) 苯基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 85 進行合成。 1
H NMR (甲醇-d4, 400 MHz): δ = 8.34 (d, J=2.2 Hz, 1H), 7.71 (s, 1H), 7.66 (dd, J=8.5, 2.1 Hz, 1H), 7.36 (d, J=8.4 Hz, 1H), 4.93-5.04 (m, 1H), 4.46 (dd, J=13.0, 2.9 Hz, 1H), 4.18 (dd, J=13.0, 7.1 Hz, 1H), 3.64-3.75 (m, 2H), 3.42-3.58 (m, 1H), 3.12-3.25 (m, 1H), 3.00-3.06 (m, 3H), 1.97-2.39 (m, 8H), 1.84-1.96 (m, 1H), 1.64-1.77 (m, 2H), 1.44 (q, J=12.6 Hz, 2H), 1.31 (d, J=6.2 Hz, 6H), 1.13 (s, 9H)。ESI [M+H] = 636.3
實例 10. 合成反式 -N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸第三丁酯。
一般方法B, 反式 -N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸第三丁酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.24 (d, J=2.4 Hz, 1H), 7.72 - 7.66 (m, 2H), 7.37 - 7.29 (m, 5H), 7.28 - 7.21 (m, 1H), 4.40 (s, 2H), 3.39 (br t, J=11.6 Hz, 1H), 2.98 (tt, J=3.4, 12.1 Hz, 1H), 2.25 - 2.17 (m, 2H), 2.04 (br d, J=11.5 Hz, 2H), 1.67 (dq, J=2.9, 12.9 Hz, 2H), 1.44 (s, 9H), 1.41 - 1.32 (m, 2H), 1.10 (s, 9H)。ESI [M+H] = 642.3
實例 11. 合成 N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸 [(2R)-1- 甲基吡咯啶 -2- 基 ] 甲酯
。反應圖 8 : 製備化合物 86
一般方法F, 反式 -1-[4-[2-(4- 胺基環己基 ) 噻唑 -5- 基 ]-3-( 第三丁基胺磺醯基 ) 苯基 ]-3- 苄基 - 脲
。ESI [M+H] = 542.3
製備化合物 87
一般方法D, 反式 -N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸 (4- 硝基苯基 ) 酯
。
製備實例 11
一般方法H, N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸 [(2R)-1- 甲基吡咯啶 -2- 基 ] 甲酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.30 (d, J=2.2 Hz, 1H), 7.79 (s, 1H), 7.70 (dd, J=2.3, 8.4 Hz, 1H), 7.42 - 7.31 (m, 5H), 7.27 (dt, J=2.6, 5.7 Hz, 1H), 4.54 - 4.41 (m, 3H), 4.21 (dd, J=7.1, 12.7 Hz, 1H), 3.79 - 3.66 (m, 2H), 3.52 (br t, J=11.6 Hz, 1H), 3.26 - 3.17 (m, 1H), 3.04 (s, 3H), 2.42 - 1.98 (m, 8H), 1.97 - 1.87 (m, 1H), 1.80 - 1.65 (m, 2H), 1.54 - 1.40 (m, 2H), 1.15 (s, 9H)。ESI [M+H] = 683.3
實例 12. 合成 ((1r,4S)-4-(5-(4-(3- 苄基脲基 )-2-(N-( 第三丁基 ) 胺磺醯基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸 ((S)-1- 甲基吡咯啶 -2- 基 ) 甲酯 以下化合物係經由相同方法藉由關鍵中間體 87 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.29 (d, J=2.3 Hz, 1H), 7.83 - 7.74 (m, 1H), 7.73 - 7.65 (m, 1H), 7.43 - 7.31 (m, 5H), 7.30 - 7.22 (m, 1H), 4.55 - 4.35 (m, 3H), 4.21 (br dd, J=7.1, 12.7 Hz, 1H), 3.79 - 3.61 (m, 2H), 3.58 - 3.42 (m, 1H), 3.23 (br s, 1H), 3.08 - 3.02 (m, 3H), 2.43 - 1.98 (m, 8H), 1.97 - 1.86 (m, 1H), 1.80 - 1.65 (m, 2H), 1.54 - 1.39 (m, 2H), 1.19 - 1.07 (m, 9H)。ESI [M+H] = 683.3
實例 13. 合成 (S)-(4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-(1- 苯基乙基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 雙環 [2.2.2] 辛 -1- 基 ) 胺基甲酸異丙酯。 反應圖 9 : 製備化合物 89
一般方法D, 4-( 異丙氧基羰基胺基 ) 雙環 [2.2.2] 辛烷 -1- 甲酸甲酯
。
用於製備化合物 90 之一般方法 O
將含於H2
O (5 mL)中之LiOH (106.70 mg,4.46 mmol,3eq.
)添加至 4-( 異丙氧基羰基胺基 ) 雙環 [2.2.2] 辛烷 -1- 甲酸甲酯
(400 mg,1.49 mmol,1eq.
)含於MeOH (5 mL)之溶液並在50℃下攪拌混合物1小時。濃縮混合物以移除MeOH並隨後用MTBE (10 mL*2)萃取。藉由添加4N HCl溶液將水相之pH調整至1-2並隨後用EtOAc (10 mL*3)萃取。通過Na2
SO4
乾燥經合併之有機相,過濾並濃縮以獲得呈黃色固體之 4-( 異丙氧基羰基胺基 ) 雙環 [2.2.2] 辛烷 -1- 甲酸
(270 mg,粗製物)。1
H NMR (400 MHz, 氯仿-d) δ = 4.86 (br d, J=6.4 Hz, 1H), 4.46 (br s, 1H), 2.00 - 1.80 (m, 12H), 1.23 (br d, J=5.9 Hz, 6H)。
用於製備化合物 91 之一般方法 N
將DMF (7.73 mg,105.75 μmol,0.1eq.
)及(COCl)2
(201.34 mg,1.59 mmol,1.5eq.
)添加至 4-( 異丙氧基羰基胺基 ) 雙環 [2.2.2] 辛烷 -1- 甲酸
(270 mg,1.06 mmol,1eq.
)含於DCM (5 mL)之溶液。在26℃下攪拌混合物0.2小時並隨後濃縮。將殘餘物溶解於THF (5 mL)中並逐滴添加至含於二噁烷(5 mL)中之NH3
.H2
O (741.24 mg,5.29 mmol,5eq.
)。隨後在26℃下攪拌混合物0.3小時。濃縮混合物並用EtOAc (20 mL)稀釋並用H2
O (10 mL)洗滌。通過Na2
SO4
乾燥有機相,過濾並濃縮以獲得呈黃色固體之 N-(1- 胺甲醯基 -4- 雙環 [2.2.2] 辛基 ) 胺基甲酸異丙酯
。1
H NMR (400 MHz, 氯仿-d) δ = 5.43 (br s, 1H), 5.17 (br s, 1H), 4.85 - 4.71 (m, 1H), 4.35 (br s, 1H), 1.82 (s, 12H), 1.13 (d, J=6.2 Hz, 6H)。ESI[M+H]=255.2
用於製備化合物 92 之一般方法 L
將2,4-雙(4-甲氧基苯基)-2,4-二側硫基-1,3,2,4-二硫二磷雜環丁烷(95.42 mg,235.92 μmol,1eq.
)添加至 N-(1- 胺甲醯基 -4- 雙環 [2.2.2] 辛基 ) 胺基甲酸異丙酯
(60 mg,235.92 μmol,1eq.
)含於2-Me-THF (2 mL)之溶液並在80℃下攪拌混合物0.5小時。將混合物倒入至飽和Na2
CO3
水溶液(10 mL)中並用EtOAc (10 mL*3)萃取。通過Na2
SO4
乾燥經合併之有機相,過濾並濃縮。藉由製備型TLC (石油醚/乙酸乙酯=2:3)純化殘餘物以獲得呈黃色固體之 N-(1- 胺甲醯硫基 -4- 雙環 [2.2.2] 辛基 ) 胺基甲酸異丙酯
(30 mg,粗製物)。ESI [M+H]=271.1
用於製備化合物 93 之一般方法 M
將TsOH.H2
O (119.59 mg,628.72 μmol,2eq.
)及2-溴-1,1-二乙氧基-乙烷(123.90 mg,628.72 μmol,2eq.
)添加至 N-(1- 胺甲醯硫基 -4- 雙環 [2.2.2] 辛基 ) 胺基甲酸異丙酯
(85 mg,314.36 μmol,1eq.
)含於EtOH (2 mL)之溶液。在80℃下攪拌混合物1小時並隨後濃縮並用EtOAc (30 mL)稀釋。用飽和Na2
CO3
水溶液(10 mL*2)洗滌混合物並通過Na2
SO4
乾燥經合併之有機相,過濾並濃縮。藉由製備型TLC (石油醚/乙酸乙酯 = 3:1)純化殘餘物以獲得呈黃色固體之 N-(1- 噻唑 -2- 基 -4- 雙環 [2.2.2] 辛基 ) 胺基甲酸異丙酯
(80 mg,粗製物)。ESI [M+H]=295.3
製備化合物 95
一般方法B, N-[1-[5-[4- 胺基 -2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ]-4- 雙環 [2.2.2] 辛基 ] 胺基甲酸異丙酯
。ESI [M+H] = 521.2
製備化合物 96
一般方法D, N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 )-1- 雙環 [2.2.2] 辛基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸 (4- 硝基苯基 ) 酯
。ESI [M+H] = 686.4
製備實例 13
一般方法E, N-[1-[5-[2-( 第三丁基胺磺醯基 )-4-[[(1S)-1- 苯基乙基 ] 胺甲醯基胺基 ] 苯基 ] 噻唑 -2- 基 ]-4- 雙環 [2.2.2] 辛基 ] 胺基甲酸異丙酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.21 (d, J=2.3 Hz, 1H), 7.75 (s, 1H), 7.67 (dd, J=2.3, 8.3 Hz, 1H), 7.41 - 7.32 (m, 5H), 7.29 - 7.23 (m, 1H), 4.99 - 4.93 (m, 1H), 4.83 - 4.76 (m, 1H), 2.17 - 2.08 (m, 6H), 2.07 - 1.99 (m, 6H), 1.51 (d, J=7.0 Hz, 3H), 1.22 (br d, J=6.0 Hz, 6H), 1.12 (s, 9H)。ESI [M+H] = 668.3
實例 14. 合成 (R)-(4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-(1- 苯基乙基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 雙環 [2.2.2] 辛 -1- 基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 96 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.18 (d, J=2.6 Hz, 1H), 7.74 - 7.69 (m, 1H), 7.64 (dd, J=2.2, 8.3 Hz, 1H), 7.38 - 7.29 (m, 5H), 7.26 - 7.19 (m, 1H), 4.92 (q, J=7.0 Hz, 1H), 4.82 - 4.71 (m, 1H), 2.15 - 2.05 (m, 6H), 2.04 - 1.95 (m, 6H), 1.48 (d, J=7.0 Hz, 3H), 1.20 (br d, J=6.1 Hz, 6H), 1.09 (s, 9H)。ESI [M+H] = 668.3
實例 15. 合成 (S)-(4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-(1-( 吡啶 -2- 基 ) 乙基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 雙環 [2.2.2] 辛 -1- 基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 96 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.72 (d, J=5.6 Hz, 1H), 8.46 (t, J=7.9 Hz, 1H), 8.28 (d, J=2.3 Hz, 1H), 8.02 (d, J=7.9 Hz, 1H), 7.85 (t, J=6.6 Hz, 1H), 7.72 (s, 1H), 7.63 (dd, J=2.3, 8.4 Hz, 1H), 7.35 (d, J=8.4 Hz, 1H), 5.13 (q, J=7.1 Hz, 1H), 4.84 - 4.74 (m, 1H), 2.15 - 2.07 (m, 6H), 2.07 - 1.98 (m, 6H), 1.65 (d, J=7.1 Hz, 3H), 1.22 (br d, J=6.1 Hz, 6H), 1.09 (s, 9H)。ESI [M+H] = 669.2
實例 16. 合成 (R)-(4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-(1-( 吡啶 -2- 基 ) 乙基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 雙環 [2.2.2] 辛 -1- 基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 96 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.75 (d, J=5.1 Hz, 1H), 8.57 (dt, J=1.5, 7.9 Hz, 1H), 8.29 (d, J=2.2 Hz, 1H), 8.11 (d, J=8.1 Hz, 1H), 7.98 - 7.90 (m, 1H), 7.75 (s, 1H), 7.62 (dd, J=2.3, 8.3 Hz, 1H), 7.36 (d, J=8.4 Hz, 1H), 5.15 (q, J=7.1 Hz, 1H), 4.84 - 4.75 (m, 1H), 2.16 - 2.07 (m, 6H), 2.06 - 1.97 (m, 6H), 1.67 (d, J=7.2 Hz, 3H), 1.22 (br d, J=6.1 Hz, 6H), 1.09 (s, 9H)。ESI [M+H] = 669.2
實例 17. 合成 N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 )-1- 雙環 [2.2.2] 辛基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸異丙酯
。反應圖 10 : 製備化合物實例 17
一般方法B, N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 )-1- 雙環 [2.2.2] 辛基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸異丙酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.33 (d, J=2.0 Hz, 1H), 7.74 (s, 1H), 7.66 (dd, J=2.2, 8.4 Hz, 1H), 7.36 (d, J=8.4 Hz, 1H), 5.03 - 4.91 (m, 1H), 4.78 (br d, J=6.4 Hz, 1H), 2.16 - 2.05 (m, 6H), 2.04 - 1.95 (m, 6H), 1.31 (d, J=6.4 Hz, 6H), 1.20 (br d, J=6.0 Hz, 6H), 1.11 (s, 9H)。ESI [M+H] =607.3
實例 18. 合成 (4-(5-(4-(3- 苄基脲基 )-2-(N-( 第三丁基 ) 胺磺醯基 ) 苯基 ) 噻唑 -2- 基 ) 雙環 [2.2.2] 辛 -1- 基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 94 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.26 (d, J=2.2 Hz, 1H), 7.77 (s, 1H), 7.72 (dd, J=2.4, 8.4 Hz, 1H), 7.38 - 7.33 (m, 5H), 7.27 (td, J=2.6, 8.6 Hz, 1H), 4.80 (br d, J=5.7 Hz, 1H), 4.43 (s, 2H), 2.17 - 2.10 (m, 6H), 2.06 - 2.00 (m, 6H), 1.25 - 1.20 (m, 6H), 1.13 (s, 9H)。ESI [M+H] =654.1
實例 19. 合成 (4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-( 吡啶 -2- 基甲基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 雙環 [2.2.2] 辛 -1- 基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 94 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.73 (d, J=5.7 Hz, 1H), 8.51 (dt, J=1.3, 7.9 Hz, 1H), 8.31 (d, J=2.2 Hz, 1H), 8.02 (d, J=8.3 Hz, 1H), 7.90 (t, J=6.8 Hz, 1H), 7.72 (s, 1H), 7.66 (dd, J=2.2, 8.3 Hz, 1H), 7.35 (d, J=8.3 Hz, 1H), 4.75 (s, 3H), 2.15 - 1.93 (m, 12H), 1.20 (br d, J=6.1 Hz, 6H), 1.07 (s, 9H)。ESI [M+H] =655.3
實例 20. 合成反式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙基胺甲醯基氧基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸異丙酯
。反應圖 11 : 製備化合物 111 。
將HBTU (2.89 g,7.63 mmol,1.1eq.
)及TEA (2.11 g,20.81 mmol,2.90 mL,3eq.
)添加至 反式 -4- 羥基環己烷甲酸
(1 g,6.94 mmol,1eq.
)含於MeCN (10 mL)之溶液,其後接著添加NH4
Cl (742.07 mg,13.87 mmol,2eq.
)並在26℃下攪拌混合物1小時。隨後過濾混合物並乾燥以獲得呈白色固體之 反式 -4- 羥基環己烷甲醯胺
(1 g,粗製物),其無需進行任何純化即可使用。
製備化合物 112 。
將咪唑(11.41 g,167.62 mmol,2eq.
)及第三丁基-氯-二苯基-矽烷(27.64 g,100.57 mmol,25.83 mL,1.2eq.
)添加至 反式 -4- 羥基環己烷甲醯胺
(12 g,83.81 mmol,1eq.
)含於DCM (150 mL)之溶液。在26℃下攪拌混合物12小時並隨後倒入至1N HCl (200 mL)中並用飽和Na2
CO3
水溶液(100 mL)洗滌有機相。通過Na2
SO4
乾燥有機相,過濾並濃縮。用溶液(石油醚:EtOAc=10:1,100 mL)洗滌殘餘物並隨後過濾。乾燥濾餅以獲得 反式 4-[ 第三丁基 ( 二苯基 ) 甲矽烷基 ] 氧基環己烷甲醯胺
(31.5 g,粗製物)。1
H NMR (400 MHz, 甲醇-d4) δ = 7.72 - 7.64 (m, 4H), 7.49 - 7.36 (m, 6H), 3.69 - 3.55 (m, 1H), 2.21 - 2.08 (m, 1H), 1.96 - 1.83 (m, 2H), 1.82 - 1.69 (m, 2H), 1.50 - 1.23 (m, 4H), 1.12 - 0.98 (m, 9H)。
製備化合物 113 。
一般方法L, 反式 -4-[ 第三丁基 ( 二苯基 ) 甲矽烷基 ] 氧基環己烷硫代甲醯胺。 1
H NMR (400 MHz, 甲醇-d4) δ = 7.73 - 7.64 (m, 4H), 7.52 - 7.36 (m, 6H), 3.73 - 3.59 (m, 1H), 2.59 - 2.44 (m, 1H), 1.91 (br d, J=8.3 Hz, 2H), 1.80 - 1.66 (m, 2H), 1.57 - 1.35 (m, 4H), 1.08 - 1.04 (m, 9H)。ESI [M+H] =398.1
製備化合物 114 。
一般方法M, 反式 - 第三丁基 - 二苯基 -(4- 噻唑 -2- 基環己氧基 ) 矽烷
。1
H NMR (400 MHz, 甲醇-d4) δ = 7.63 - 7.55 (m, 5H), 7.42 - 7.25 (m, 7H), 4.05 - 3.96 (m, 1H), 2.97 (tt, J=3.7, 11.7 Hz, 1H), 2.05 (dq, J=3.2, 12.5 Hz, 2H), 1.84 - 1.62 (m, 4H), 1.44 (tt, J=2.9, 13.5 Hz, 2H), 1.01 - 0.98 (m, 9H)。ESI [M+H] =422.2
製備化合物 115 。
將TBAF (1M,4.49 mL,1.5eq.
)添加至 反式 -[4-(5- 溴噻唑 -2- 基 ) 環己氧基 ]- 第三丁基 - 二苯基 - 矽烷
(1.5 g,3.00 mmol,1eq.
)含於THF (10 mL)之溶液並在26℃下攪拌混合物12小時並隨後濃縮。藉由矽膠管柱層析法(石油醚/乙酸乙酯=20:1-1:1)純化殘餘物以獲得呈黃色固體之 反式 -4-(5- 溴噻唑 -2- 基 ) 環己醇
(500 mg,1.91 mmol,63.64%產率)。
製備化合物 116 。
將2-異氰酸根基丙烷(486.93 mg,5.72 mmol,3eq.
)及DIEA (739.47 mg,5.72 mmol,3eq.
)添加至 反式 -4-(5- 溴噻唑 -2- 基 ) 環己醇
(500 mg,1.91 mmol,1eq.
)含於DMF (5 mL)之溶液。在100℃下攪拌混合物40小時並隨後倒入至H2
O (50 mL)中並用EtOAc (10 mL*3)萃取。通過Na2
SO4
乾燥經合併之有機相,過濾並濃縮。藉由矽膠管柱層析法(石油醚/乙酸乙酯=10:1-1:1)純化殘餘物以獲得呈黃色固體之 反式 -N- 異丙基胺基甲酸 [4-(5- 溴噻唑 -2- 基 ) 環己基 ] 酯
(180 mg,518.33 μmol,27.18%產率)。1
H NMR (400 MHz, 甲醇-d4) δ = 7.61 (s, 1H), 3.85 - 3.64 (m, 2H), 3.15 - 2.99 (m, 1H), 1.98 - 1.83 (m, 6H), 1.73 (br d, J=13.5 Hz, 2H), 1.14 - 1.12 (m, 6H)。ESI [M+H] =347.1/349.1
製備實例 20 。
一般方法B, 反式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙基胺甲醯基氧基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸異丙酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.34 (d, J=2.0 Hz, 1H), 7.75 (s, 1H), 7.67 (dd, J=2.0, 8.4 Hz, 1H), 7.37 (d, J=8.4 Hz, 1H), 5.05 - 4.93 (m, 1H), 4.89 (br s, 1H), 3.83 - 3.64 (m, 1H), 3.15 (br s, 1H), 2.12 - 1.88 (m, 6H), 1.84 - 1.64 (m, 2H), 1.31 (d, J=6.2 Hz, 6H), 1.19 - 1.04 (m, 15H)。ESI [M+H] =581.4
實例 21. 合成 (1r,4r)- 異丙基胺基甲酸 4-(5-(4-(3- 苄基脲基 )-2-(N-( 第三丁基 ) 胺磺醯基 ) 苯基 ) 噻唑 -2- 基 ) 環己酯 以下化合物係經由相同方法藉由關鍵中間體 116 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.24 (d, J=2.2 Hz, 1H), 7.74 (s, 1H), 7.69 (dd, J=2.4, 8.4 Hz, 1H), 7.40 - 7.28 (m, 5H), 7.28 - 7.17 (m, 1H), 4.89 (br s, 1H), 4.41 (s, 2H), 3.79 - 3.64 (m, 1H), 3.14 (br s, 1H), 2.04 - 1.94 (m, 6H), 1.84 - 1.65 (m, 2H), 1.16 - 1.08 (m, 15H)。ESI [M+H] = 628.4
實例 22. 合成反式 -N-[4-[5-[2-( 第三丁基胺磺醯基 )-4-(4 - 吡啶基甲基胺甲醯基胺基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯。 反應圖 12 : 製備化合物 117 。
一般方法K, 反式 -N-[4-[5-[4- 胺基 -2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 7.68 - 7.57 (s, 1H), 7.43 (d, J=2.4 Hz, 1H), 7.13 (d, J=8.2 Hz, 1H), 6.82 (dd, J=2.4, 8.2 Hz, 1H), 4.84 - 4.77 (m, 1H), 3.44 (tt, J=3.9, 11.5 Hz, 1H), 2.97 (tt, J=3.6, 12.1 Hz, 1H), 2.26 - 2.13 (m, 2H), 2.11 - 2.02 (m, 2H), 1.67 (dq, J=3.0, 12.9 Hz, 2H), 1.49 - 1.32 (m, 2H), 1.22 (dd, J=2.5, 6.7 Hz, 6H), 1.09 (s, 9H)。ESI [M+H] =495.2
製備化合物 118 。
一般方法D, 反式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸 (4- 硝基苯基 ) 酯
。ESI [M+H] =660.1
製備實例 22.
一般方法E, 反式 -N-[4-[5-[2-( 第三丁基胺磺醯基 )-4-(4 - 吡啶基甲基胺甲醯基胺基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.79 (d, J=6.7 Hz, 2H), 8.34 (d, J=2.3 Hz, 1H), 8.07 (d, J=6.6 Hz, 2H), 7.76 (s, 1H), 7.69 (dd, J=2.3, 8.4 Hz, 1H), 7.39 (d, J=8.3 Hz, 1H), 4.85 - 4.83 (m, 1H), 4.73 (s, 2H), 3.47 (tt, J=3.6, 11.5 Hz, 1H), 3.04 (tt, J=3.4, 12.0 Hz, 1H), 2.30 - 2.19 (m, 2H), 2.09 (br d, J=10.1 Hz, 2H), 1.71 (dq, J=3.0, 12.9 Hz, 2H), 1.43 (dq, J=3.3, 12.6 Hz, 2H), 1.24 (br d, J=6.1 Hz, 6H), 1.12 (s, 9H)。ESI [M+H] =629.2
實例 23. 合成 ((1r,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-(4- 氟苄基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸異丙酯 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.27 (d, J=2.3 Hz, 1H), 7.77 (s, 1H), 7.71 (dd, J=2.4, 8.4 Hz, 1H), 7.38 (td, J=2.7, 8.6 Hz, 3H), 7.12 - 7.04 (m, 2H), 5.00 - 4.92 (m, 1H), 4.41 (s, 2H), 3.54 - 3.41 (m, 1H), 3.05 (tt, J=3.5, 12.0 Hz, 1H),2.13 - 2.05 (m, 2H), 2.05 - 2.04 (m, 2H), 1.72 (dq, J=3.0, 12.8 Hz, 2H), 1.43 (dq, J=3.2, 12.5 Hz, 2H), 1.24 (br d, J=6.1 Hz, 6H), 1.14 (s, 9H)。ESI [M+H] =646.2
實例 24. 合成 ((1R,4r)-4-(5-(2-(N- 異丙基胺磺醯基 )-4-(3-((R)-1- 苯基乙基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸異丙酯 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.20 (d, J=2.2 Hz, 1H), 7.73 (s, 1H), 7.64 (dd, J=2.4, 8.4 Hz, 1H), 7.38 - 7.29 (m, 5H), 7.26 - 7.19 (m, 1H), 4.94 - 4.89 (m, 1H), 4.81 (br d, J=6.2 Hz, 1H), 3.44 (tt, J=3.9, 11.6 Hz, 1H), 3.01 (tt, J=3.5, 12.0 Hz, 1H), 2.26 - 2.17 (m, 2H), 2.10 - 2.01 (m, 2H), 1.68 (dq, J=2.9, 12.8 Hz, 2H), 1.48 (d, J=7.1 Hz, 3H), 1.43 - 1.33 (m, 2H), 1.21 (br d, J=6.2 Hz, 6H), 1.10 (s, 9H)。ESI [M+H] =642.3
實例 25. 合成 ((1r,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-( 吡啶 -3- 基甲基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.84 (s, 1H), 8.74 (d, J=5.7 Hz, 1H), 8.60 (d, J=8.2 Hz, 1H), 8.30 (d, J=2.2 Hz, 1H), 8.04 (dd, J=5.8, 7.8 Hz, 1H), 7.72 (s, 1H), 7.65 (dd, J=2.4, 8.4 Hz, 1H), 7.36 (d, J=8.4 Hz, 1H), 4.85 - 4.77 (m, 1H), 4.60 (s, 2H), 3.44 (tt, J=3.9, 11.5 Hz, 1H), 3.10 - 2.93 (m, 1H), 2.28 - 2.17 (m, 2H), 2.13 - 2.01 (m, 2H), 1.69 (dq, J=3.0, 12.8 Hz, 2H), 1.50 - 1.33 (m, 2H), 1.22 (br d, J=6.2 Hz, 6H), 1.09 (s, 9H)。ESI [M+H] =629.3
實例 26. 合成 ((1S,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-((S)-1- 苯基乙基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.19 (d, J=2.4 Hz, 1H), 7.70 (s, 1H), 7.65 (dd, J=2.4, 8.4 Hz, 1H), 7.39 - 7.30 (m, 5H), 7.26 - 7.21 (m, 1H), 4.93 (q, J=6.5 Hz, 1H), 4.83 - 4.81 (m, 1H), 3.49 - 3.40 (m, 1H), 3.05 - 2.96 (m, 1H), 2.22 (br d, J=11.7 Hz, 2H), 2.06 (br d, J=11.5 Hz, 2H), 1.73 - 1.62 (m, 2H), 1.49 (d, J=6.8 Hz, 3H), 1.43 - 1.36 (m, 2H), 1.22 (br d, J=6.0 Hz, 6H), 1.10 (s, 9H)。ESI[M+H] =642.3
實例 27. 合成 ((1r,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-(3- 氟苄基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.27 (d, J=2.2 Hz, 1H), 7.74 (s, 1H), 7.71 (dd, J=2.3, 8.3 Hz, 1H), 7.40 - 7.32 (m, 2H), 7.18 (d, J=7.7 Hz, 1H), 7.10 (br d, J=9.9 Hz, 1H), 6.99 (dt, J=2.2, 8.5 Hz, 1H), 4.87 (br s, 1H), 4.44 (s, 2H), 3.47 (tt, J=3.8, 11.6 Hz, 1H), 3.02 (tt, J=3.5, 12.0 Hz, 1H), 2.24 (br d, J=12.2 Hz, 2H), 2.14 - 2.04 (m, 2H), 1.71 (dq, J=3.0, 12.9 Hz, 2H), 1.50 - 1.36 (m, 2H), 1.24 (br d, J=6.1 Hz, 6H), 1.14 (s, 9H)。ESI [M+H] =646.2
實例 28. 合成 ((1r,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-(2- 氟苄基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.23 (d, J=2.2 Hz, 1H), 7.71 (s, 1H), 7.68 (dd, J=2.4, 8.4 Hz, 1H), 7.41 (dt, J=1.5, 7.6 Hz, 1H), 7.35 (d, J=8.4 Hz, 1H), 7.29 (ddt, J=1.8, 5.5, 7.7 Hz, 1H), 7.15 (dt, J=1.0, 7.6 Hz, 1H), 7.11 - 7.05 (m, 1H), 4.81 (br s, 1H), 4.46 (s, 2H), 3.45 (tt, J=3.7, 11.6 Hz, 1H), 3.00 (tt, J=3.5, 12.0 Hz, 1H), 2.27 - 2.18 (m, 2H), 2.06 (br d, J=10.1 Hz, 2H), 1.69 (dq, J=3.1, 12.9 Hz, 2H), 1.46 - 1.34 (m, 2H), 1.22 (br d, J=6.2 Hz, 6H), 1.11 (s, 9H)。ESI [M+H] =646.2
實例 29. 合成 ((1r,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-( 吡啶 -2- 基甲基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.79 - 8.73 (m, 1H), 8.56 (dt, J=1.5, 7.9 Hz, 1H), 8.35 (d, J=2.2 Hz, 1H), 8.06 (d, J=8.1 Hz, 1H), 7.94 (t, J=6.4 Hz, 1H), 7.77 (s, 1H), 7.69 (dd, J=2.3, 8.4 Hz, 1H), 7.39 (d, J=8.3 Hz, 1H), 4.86 - 4.83 (m, 1H), 4.79 (s, 2H), 3.47 (tt, J=3.9, 11.6 Hz, 1H), 3.05 (tt, J=3.5, 12.0 Hz, 1H), 2.29 - 2.21 (m, 2H), 2.09 (br d, J=10.1 Hz, 2H), 1.71 (dq, J=2.9, 12.8 Hz, 2H), 1.43 (dq, J=3.3, 12.6 Hz, 2H), 1.24 (br d, J=6.2 Hz, 6H), 1.11 (s, 9H)。ESI [M+H] =629.3
實例 30. 合成 ((1R,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-((R)-1-( 吡啶 -2- 基 ) 乙基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.73 (d, J=5.7 Hz, 1H), 8.53 (dt, J=1.8, 7.9 Hz, 1H), 8.28 (d, J=2.2 Hz, 1H), 8.08 (d, J=8.3 Hz, 1H), 7.94 - 7.85 (m, 1H), 7.80 - 7.68 (m, 1H), 7.61 (dd, J=2.2, 8.3 Hz, 1H), 7.35 (d, J=8.3 Hz, 1H), 5.13 (q, J=7.0 Hz, 1H), 4.85 - 4.78 (m, 1H), 3.49 - 3.39 (m, 1H), 3.08 - 2.96 (m, 1H), 2.22 (br d, J=12.3 Hz, 2H), 2.06 (br d, J=10.1 Hz, 2H), 1.76 - 1.61 (m, 5H), 1.49 - 1.34 (m, 2H), 1.22 (br d, J=6.1 Hz, 6H), 1.14 - 1.02 (m, 9H)。ESI [M+H] =643.3
實例 31. 合成 ((1r,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-((3- 氟吡啶 -2- 基 ) 甲基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.42 (d, J=4.8 Hz, 1H), 8.28 (d, J=2.2 Hz, 1H), 7.78 - 7.62 (m, 3H), 7.44 (td, J=4.4, 8.5 Hz, 1H), 7.38 (d, J=8.4 Hz, 1H), 4.86 - 4.81 (m, 1H), 4.65 (s, 2H), 3.47 (ddd, J=4.0, 7.7, 11.4 Hz, 1H), 3.10 - 3.00 (m, 1H), 2.25 (br d, J=12.1 Hz, 2H), 2.09 (br d, J=10.5 Hz, 2H), 1.72 (dq, J=3.0, 12.9 Hz, 2H), 1.43 (dq, J=3.2, 12.6 Hz, 2H), 1.24 (br d, J=6.1 Hz, 6H), 1.14 (s, 9H)。ESI [M+H] =647.2
實例 32. 合成 ((1S,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-((S)-1-( 吡啶 -2- 基 ) 乙基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.72 (d, J=5.3 Hz, 1H), 8.50 (dt, J=1.8, 7.9 Hz, 1H), 8.27 (d, J=2.2 Hz, 1H), 8.05 (d, J=8.3 Hz, 1H), 7.88 (t, J=6.6 Hz, 1H), 7.72 (s, 1H), 7.61 (dd, J=2.6, 8.3 Hz, 1H), 7.34 (d, J=8.8 Hz, 1H), 5.12 (q, J=7.0 Hz, 1H), 4.87 - 4.68 (m, 1H), 3.51 - 3.38 (m, 1H), 3.01 (tt, J=3.3, 12.0 Hz, 1H), 2.21 (br d, J=11.8 Hz, 2H), 2.10 - 1.97 (m, 2H), 1.76 - 1.57 (m, 5H), 1.48 - 1.33 (m, 2H), 1.22 (d, J=6.1 Hz, 6H), 1.13 - 1.00 (m, 9H)。ESI [M+H] =643.3
實例 33. 合成反式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸 4- 哌啶基甲酯
。反應圖 13 : 製備化合物 119 。
一般方法H, 反式 -4-[[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺甲醯基氧基甲基 ] 哌啶 -1- 甲酸第三丁酯
。ESI [M+H] =736.5
製備實例 33.
一般方法C, 反式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸 4- 哌啶基甲酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.37 (d, J=2.2 Hz, 1H), 7.78 (s, 1H), 7.68 (br d, J=7.9 Hz, 1H), 7.40 (d, J=8.4 Hz, 1H), 4.86 - 4.78 (m, 1H), 4.11 (d, J=6.2 Hz, 2H), 3.50 - 3.39 (m, 3H), 3.11 - 2.96 (m, 3H), 2.23 (br d, J=12.3 Hz, 2H), 2.13 - 1.98 (m, 5H), 1.70 (dq, J=2.8, 12.8 Hz, 2H), 1.60 - 1.34 (m, 4H), 1.22 (br d, J=6.2 Hz, 6H), 1.11 (s, 9H)。ESI [M/2+H] = 318.6
實例 34. 合成 ((1R,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(((((R)-1- 甲基吡咯啶 -2- 基 ) 甲氧基 ) 羰基 ) 胺基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.41 (d, J=2.2 Hz, 1H), 7.80 - 7.73 (m, 2H), 7.45 (d, J=8.4 Hz, 1H), 4.86 - 4.81 (m, 1H), 4.67 (dd, J=3.2, 12.8 Hz, 1H), 4.35 (dd, J=7.1, 12.8 Hz, 1H), 3.85 - 3.71 (m, 2H), 3.47 (tt, J=3.9, 11.6 Hz, 1H), 3.26 (td, J=8.1, 11.5 Hz, 1H), 3.10 (s, 3H), 3.08 - 2.98 (m, 1H), 2.46 - 2.35 (m, 1H), 2.30 - 2.18 (m, 3H), 2.15 - 1.95 (m, 4H), 1.72 (dq, J=3.1, 12.9 Hz, 2H), 1.43 (dq, J=3.3, 12.6 Hz, 2H), 1.25 (br d, J=6.2 Hz, 6H), 1.13 (s, 9H)。ESI [M+H] = 636.3
實例 35. 合成 ((1S,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(((((S)-1- 甲基吡咯啶 -2- 基 ) 甲氧基 ) 羰基 ) 胺基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.41 (d, J=2.0 Hz, 1H), 7.80 - 7.71 (m, 2H), 7.44 (d, J=8.3 Hz, 1H), 4.86 - 4.79 (m, 1H), 4.67 (dd, J=3.2, 13.0 Hz, 1H), 4.40 - 4.31 (m, 1H), 3.87 - 3.66 (m, 2H), 3.47 (tt, J=3.8, 11.6 Hz, 1H), 3.26 (td, J=8.3, 11.4 Hz, 1H), 3.10 (s, 3H), 3.04 (tt, J=3.4, 12.0 Hz, 1H), 2.48 - 2.33 (m, 1H), 2.30 - 2.16 (m, 3H), 2.15 - 1.92 (m, 4H), 1.72 (dq, J=2.7, 12.8 Hz, 2H), 1.51 - 1.36 (m, 2H), 1.25 (br d, J=6.4 Hz, 6H), 1.13 (s, 9H)。ESI [M/2+H] = 318.6
實例 36. 合成 ((1R,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(((((R)- 吡咯啶 -2- 基 ) 甲氧基 ) 羰基 ) 胺基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.38 (br d, J=2.2 Hz, 1H), 7.75 - 7.66 (m, 2H), 7.41 (d, J=8.4 Hz, 1H), 4.81 (br s, 1H), 4.48 (br dd, J=3.4, 12.5 Hz, 1H), 4.33 (dd, J=7.8, 12.5 Hz, 1H), 3.93 (dq, J=3.6, 8.0 Hz, 1H), 3.49 - 3.33 (m, 3H), 3.00 (ddd, J=3.5, 8.5, 12.0 Hz, 1H), 2.30 - 2.18 (m, 3H), 2.10 - 2.00 (m, 3H), 1.85 (qd, J=8.5, 12.9 Hz, 2H), 1.74 - 1.61 (m, 2H), 1.46 - 1.34 (m, 2H), 1.22 (br d, J=6.2 Hz, 6H), 1.09 (s, 9H)。ESI [M/2+H] = 311.6
實例 37. 合成 ((1S,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(((((S)- 吡咯啶 -2- 基 ) 甲氧基 ) 羰基 ) 胺基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.38 (d, J=1.8 Hz, 1H), 7.79 - 7.68 (m, 2H), 7.41 (d, J=8.2 Hz, 1H), 4.85 - 4.78 (m, 1H), 4.49 (dd, J=3.4, 12.5 Hz, 1H), 4.33 (dd, J=7.9, 12.3 Hz, 1H), 3.94 (dq, J=3.4, 8.0 Hz, 1H), 3.49 - 3.40 (m, 1H), 3.40 - 3.33 (m, 2H), 3.08 - 2.97 (m, 1H), 2.31 - 2.19 (m, 3H), 2.17 - 2.00 (m, 4H), 1.85 (qd, J=8.5, 13.0 Hz, 1H), 1.75 - 1.62 (m, 2H), 1.46 - 1.35 (m, 2H), 1.22 (br d, J=6.2 Hz, 6H), 1.10 (s, 9H)。ESI [M/2+H] = 311.6
實例 38. 合成 ((1r,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-((( 氧雜環丁 -3- 基氧基 ) 羰基 ) 胺基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (甲醇-d4, 400 MHz): δ = 8.33 (s, 1H), 7.63-7.72 (m, 2H), 7.38 (d, J=8.4 Hz, 1H), 5.50 (br t, J=5.5 Hz, 1H), 4.92 (t, J=6.9 Hz, 2H), 4.81-4.83 (m, 1H), 4.64-4.73 (m, 2H), 3.44 (br t, J=11.7 Hz, 1H), 2.99 (br t, J=11.8 Hz, 1H), 2.21 (br d, J=12.3 Hz, 2H), 2.06 (br d, J=11.7 Hz, 2H), 1.59-1.75 (m, 2H), 1.30-1.47 (m, 2H), 1.21 (br d, J=6.0 Hz, 6H), 1.10 ppm (s, 9H)。ESI [M+H] = 595.1
實例 39. 合成 (3-(N-( 第三丁基 ) 胺磺醯基 )-4-(2-((1r,4r)-4-(( 異丙氧基羰基 ) 胺基 ) 環己基 ) 噻唑 -5- 基 ) 苯基 ) 胺基甲酸苄酯。 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.36 (s, 1H), 7.75 - 7.67 (m, 2H), 7.46 - 7.28 (m, 6H), 5.28 - 5.14 (m, 2H), 4.85 - 4.76 (m, 1H), 3.47 (br d, J=11.8 Hz, 1H), 3.01 (br s, 1H), 2.23 (br d, J=12.7 Hz, 2H), 2.07 (br d, J=14.5 Hz, 2H), 1.70 (br d, J=11.0 Hz, 2H), 1.40 (br d, J=12.7 Hz, 2H), 1.22 (br d, J=6.1 Hz, 6H), 1.12 (s, 9H)。ESI [M+H] = 629.2
實例 40. 合成 (3-(N-( 第三丁基 ) 胺磺醯基 )-4-(2-((1r,4r)-4-(( 異丙氧基羰基 ) 胺基 ) 環己基 ) 噻唑 -5- 基 ) 苯基 ) 胺基甲酸 2- 氟苄酯。 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.36 (s, 1H), 7.77 - 7.63 (m, 2H), 7.52 (t, J=7.0 Hz, 1H), 7.44 - 7.31 (m, 2H), 7.23 - 7.08 (m, 2H), 5.29 (s, 2H), 4.83 (br s, 1H), 3.46 (br d, J=11.8 Hz, 1H), 3.00 (br t, J=11.8 Hz, 1H), 2.22 (br d, J=12.7 Hz, 2H), 2.07 (br d, J=11.4 Hz, 2H), 1.76 - 1.62 (m, 2H), 1.47 - 1.35 (m, 2H), 1.22 (br d, J=6.1 Hz, 6H), 1.12 (s, 9H)。ESI [M+H] = 647.2
實例 41. 合成 (3-(N-( 第三丁基 ) 胺磺醯基 )-4-(2-((1r,4S)-4-(( 異丙氧基羰基 ) 胺基 ) 環己基 ) 噻唑 -5- 基 ) 苯基 ) 胺基甲酸 (S)-1- 苯基乙酯。 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.35 (br s, 1H), 7.81 - 7.65 (m, 2H), 7.48 - 7.36 (m, 5H), 7.31 (br d, J=6.8 Hz, 1H), 5.89 (br d, J=6.2 Hz, 1H), 4.85 (br d, J=5.5 Hz, 1H), 3.47 (br s, 1H), 3.03 (br s, 1H), 2.24 (br d, J=11.2 Hz, 2H), 2.08 (br d, J=11.0 Hz, 2H), 1.71 (q, J=11.9 Hz, 2H), 1.61 (br d, J=6.4 Hz, 3H), 1.49 - 1.37 (m, 2H), 1.24 (br d, J=5.4 Hz, 6H), 1.13 (s, 9H)。ESI [M+H] =643.2
實例 42. 合成 (3-(N-( 第三丁基 ) 胺磺醯基 )-4-(2-((1r,4r)-4-(( 異丙氧基羰基 ) 胺基 ) 環己基 ) 噻唑 -5- 基 ) 苯基 ) 胺基甲酸吡啶 -2- 基甲酯。 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.56 (br d, J=4.5 Hz, 1H), 8.38 (d, J=1.8 Hz, 1H), 7.94 - 7.87 (m, 1H), 7.78 - 7.72 (m, 2H), 7.59 (br d, J=7.8 Hz, 1H), 7.44 - 7.38 (m, 2H), 5.32 (s, 2H), 4.85 (td, J=5.9, 12.0 Hz, 1H), 3.47 (br t, J=11.8 Hz, 1H), 3.07 - 2.96 (m, 1H), 2.24 (br d, J=12.3 Hz, 2H), 2.13 - 2.04 (m, 2H), 1.77 - 1.65 (m, 2H), 1.48 - 1.37 (m, 2H), 1.24 (br d, J=6.1 Hz, 6H), 1.14 (s, 9H)。ESI [M+H] =630.2
實例 43. 合成 (3-(N-( 第三丁基 ) 胺磺醯基 )-4-(2-((1r,4R)-4-(( 異丙氧基羰基 ) 胺基 ) 環己基 ) 噻唑 -5- 基 ) 苯基 ) 胺基甲酸 (R)-1- 苯基乙酯。 以下化合物係經由相同方法藉由關鍵中間體 118 進行合成。 1
H NMR (400 MHz, DMSO-d6) δ = 8.28 (d, J=2.2 Hz, 1H), 7.70 - 7.57 (m, 2H), 7.47 - 7.24 (m, 7H), 7.05 - 6.84 (m, 2H), 5.82 (q, J=6.6 Hz, 1H), 4.79 - 4.65 (m, 1H), 3.35 - 3.24 (m, 1H), 2.88 (tt, J=3.4, 11.9 Hz, 1H), 2.11 (br d, J=11.7 Hz, 2H), 1.89 (br d, J=9.9 Hz, 2H), 1.54 (d, J=6.6 Hz, 5H), 1.30 (br s, 2H), 1.14 (d, J=6.2 Hz, 6H), 1.08 - 0.99 (m, 9H)。ESI [M+H] = 643.3
實例 44. 合成反式 -N-[4-[2-[4-( 第三丁氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ]-3-( 第三丁基胺磺醯基 ) 苯基 ] 胺基甲酸異丙酯 。 反應圖 14 :
一般方法B, 反式 -N-[4-[2-[4-( 第三丁氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ]-3-( 第三丁基胺磺醯基 ) 苯基 ] 胺基甲酸異丙酯
。1
H NMR (400 MHz, DMSO-d6) δ = 10.06 (s, 1H), 8.32 (d, J=2.1 Hz, 1H), 7.70 - 7.60 (m, 2H), 7.38 (d, J=8.4 Hz, 1H), 6.96 (s, 1H), 6.81 (br d, J=7.9 Hz, 1H), 4.99 - 4.87 (m, 1H), 3.27 (br s, 1H), 2.94 - 2.84 (m, 1H), 2.13 (br d, J=11.7 Hz, 2H), 1.90 (br d, J=11.1 Hz, 2H), 1.63 - 1.49 (m, 2H), 1.39 (s, 9H), 1.33 (br d, J=14.4 Hz, 2H), 1.28 (d, J=6.4 Hz, 6H), 1.07 (s, 9H)。ESI [M+H] =595.1
實例 45. 合成 ((1r,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-( 吡啶 -2- 基甲基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸第三丁酯。 以下化合物係經由相同方法藉由關鍵中間體 82 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.17 (d, J=2.2 Hz, 1H), 7.75 - 7.59 (m, 2H), 7.43 - 7.22 (m, 3H), 7.21 - 7.03 (m, 2H), 4.53 (m, 2H), 3.43 (br t, J=11.8 Hz, 1H), 2.99 (br t, J=12.1 Hz, 1H), 2.22 (br d, J=12.7 Hz, 2H), 2.06 (br d, J=10.5 Hz, 2H), 1.77 - 1.60 (m, 2H), 1.58 - 1.34 (m, 11H), 1.09 (s, 9H)。ESI [M+H] =643.3
實例 46. 合成 N-[3-( 第三丁基胺磺醯基 )-4-[2-[3-( 異丙氧基羰基胺基 ) 氮雜環丁 -1- 基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸異丙酯。 反應圖 15 : 製備化合物 129 。
使N-(氮雜環丁-3-基)胺基甲酸第三丁酯;鹽酸鹽(72.40 mg,346.94 μmol,1.50eq.
)、 N-[4-(2- 溴噻唑 -5- 基 )-3-( 第三丁基胺磺醯基 ) 苯基 ] 乙醯胺
(100 mg,231.29 μmol,1eq.
)、t-BuONa (66.68 mg,693.87 μmol,3eq.
)、[2-(2-胺基乙基)苯基]-氯-鈀;二第三丁基-[2-(2,4,6-三異丙基苯基)苯基]膦(15.88 mg,23.13 μmol,0.1eq.
)含於第三戊醇(2 mL)之混合物脫氣並用N2
淨化3次,並隨後在100℃下在N2
氣氛下攪拌混合物12小時並隨後濃縮。用乙酸乙酯(20 mL)稀釋殘餘物並用H2
O (20 mL)洗滌。乾燥有機層並濃縮並藉由製備型TLC (EtOAc)純化殘餘物以獲得呈黃色固體之 N-[1-[5-[4- 乙醯胺基 -2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 氮雜環丁 -3- 基 ] 胺基甲酸第三丁酯
(46 mg,粗製物)。ESI [M+H] =524.3
製備實例 46
一般方法D, N-[3-( 第三丁基胺磺醯基 )-4-[2-[3-( 異丙氧基羰基胺基 ) 氮雜環丁 -1- 基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸異丙酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.35 (d, J=2.0 Hz, 1H), 7.67 (dd, J=2.2, 8.4 Hz, 1H), 7.45 - 7.32 (m, 2H), 5.04 - 4.94 (m, 1H), 4.92 - 4.88 (m, 1H), 4.73 - 4.63 (m, 1H), 4.56 (br t, J=8.5 Hz, 2H), 4.27 (br s, 2H), 1.31 (d, J=6.2 Hz, 6H), 1.27 - 1.19 (m, 15H)。ESI [M+H] =554.2
實例 47. 合成反式 -N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸氧雜環丁 -3- 酯 反應圖 16 : 製備化合物 131 。
一般方法F, 反式 -4-(5- 溴噻唑 -2- 基 ) 環己胺
。ESI [M+H] =260.9/262.9
製備化合物 132 。
將DIEA (3.34 g,25.84 mmol,4.50 mL,5eq.
)及三光氣(1.53 g,5.17 mmol,1eq.
)添加至氧雜環丁-3-醇(1.15 g,15.51 mmol,3eq.
)含於DCE (10 mL)之溶液。在25至50℃下攪拌混合物1小時並隨後添加 反式 -4-(5- 溴噻唑 -2- 基 ) 環己胺
(1.35 g,5.17 mmol,1eq.
)、DIEA (3.34 g,25.84 mmol,4.50 mL,5eq.
)含於DCE (10 mL)之溶液。在25℃下攪拌混合物0.5小時。濃縮混合物並藉由管柱層析法(SiO2
,石油醚/乙酸乙酯=30/1至5:1)純化殘餘物以獲得呈白色固體之 反式 -N-[4-(5- 溴噻唑 -2- 基 ) 環己基 ] 胺基甲酸氧雜環丁 -3- 酯
(1.5 g,粗製物)。ESI [M+H] =363.1/361.1
製備實例 47
一般方法K, 反式 -N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸氧雜環丁 -3- 酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.23 (d, J=2.2 Hz, 1H), 7.71 - 7.66 (m, 2H), 7.37 - 7.29 (m, 5H), 7.24 (br s, 1H), 5.40 - 5.27 (m, 2H), 4.66 - 4.55 (m, 3H), 4.40 (s, 2H), 3.45 (br d, J=11.0 Hz, 1H), 3.00 (br t, J=11.8 Hz, 1H), 2.22 (br d, J=13.0 Hz, 2H), 2.07 (br d, J=11.2 Hz, 2H), 1.74 - 1.63 (m, 2H), 1.47 - 1.37 (m, 2H), 1.10 (s, 9H)。ESI [M+H] =642.3
實例 48. 合成 ((1r,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(( 異丙氧基羰基 ) 胺基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸氧雜環丁 -3- 酯。 以下化合物係經由相同方法藉由關鍵中間體 132 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.33 (d, J=2.0 Hz, 1H), 7.71 - 7.64 (m, 2H), 7.36 (d, J=8.4 Hz, 1H), 5.41 - 5.27 (m, 2H), 4.98 (td, J=6.4, 12.6 Hz, 1H), 4.87 (br s, 1H), 4.63 - 4.56 (m, 2H), 3.45 (br d, J=12.3 Hz, 1H), 3.00 (br t, J=12.0 Hz, 1H), 2.22 (br d, J=13.0 Hz, 2H), 2.11 - 2.02 (m, 2H), 1.74 - 1.63 (m, 2H), 1.42 (q, J=12.7 Hz, 2H), 1.31 (d, J=6.2 Hz, 6H), 1.11 (s, 9H)。ESI [M+H] =595.3
實例 49. 合成反式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 氧雜環丁 -3- 基氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸氧雜環丁 -3- 酯 反應圖 17 : 製備化合物 133 。
一般方法K, 反式 -N-[4-[5-[4- 胺基 -2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸氧雜環丁 -3- 酯
。ESI [M+H] =509.0
製備化合物 134 。
一般方法D, 反式 -N-[4-[5-[2-( 第三丁基胺磺醯基 )-4- [(4- 硝基苯氧基 ) 羰基胺基 ] 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸氧雜環丁 -3- 酯
。ESI [M+H] =674.2
製備實例 49.
一般方法H, 反式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 氧雜環丁 -3- 基氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸氧雜環丁 -3- 酯
。1
H NMR (400 MHz, DMSO-d6) δ = 10.39 (s, 1H), 8.28 (d, J=2.2 Hz, 1H), 7.71 - 7.58 (m, 2H), 7.48 - 7.34 (m, 2H), 6.97 (s, 1H), 5.50 - 5.39 (m, 1H), 5.32 - 5.20 (m, 1H), 4.87 - 4.68 (m, 4H), 4.61 - 4.36 (m, 4H), 3.30 - 3.23 (m, 1H), 3.01 - 2.82 (m, 1H), 2.12 (br d, J=11.7 Hz, 2H), 1.90 (br d, J=10.4 Hz, 2H), 1.66 - 1.47 (m, 2H), 1.43 - 1.26 (m, 2H), 1.04 (s, 9H)。ESI [M+H] =609.2
實例 50. 合成 ((1r,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-( 吡啶 -2- 基甲基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸氧雜環丁 -3- 酯。 以下化合物係經由相同方法藉由關鍵中間體 134 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.49 (d, J=4.8 Hz, 1H), 8.25 (d, J=2.2 Hz, 1H), 7.82 (dt, J=1.8, 7.7 Hz, 1H), 7.73 - 7.63 (m, 2H), 7.45 (d, J=7.9 Hz, 1H), 7.38 - 7.26 (m, 2H), 5.39 - 5.28 (m, 1H), 4.84 (br s, 1H), 4.70 - 4.56 (m, 3H), 4.53 (s, 2H), 3.44 (br t, J=12.1 Hz, 1H), 3.06 - 2.92 (m, 1H), 2.22 (br d, J=13.2 Hz, 2H), 2.07 (br d, J=11.0 Hz, 2H), 1.79 - 1.60 (m, 2H), 1.50 - 1.35 (m, 2H), 1.10 (s, 9H)。ESI [M+H] =643.2
實例 51. 合成 ((1S,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-((S)-1- 苯基乙基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸氧雜環丁 -3- 酯。 以下化合物係經由相同方法藉由關鍵中間體 134 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.19 (d, J=2.2 Hz, 1H), 7.70 - 7.63 (m, 2H), 7.39 - 7.30 (m, 5H), 7.27 - 7.20 (m, 1H), 5.35 (t, J=5.7 Hz, 1H), 4.92 (q, J=6.8 Hz, 2H), 4.84 (br s, 1H), 4.60 (t, J=6.4 Hz, 2H), 3.49 - 3.38 (m, 1H), 3.05 - 2.95 (m, 1H), 2.22 (br d, J=12.3 Hz, 2H), 2.10 - 2.02 (m, 2H), 1.74 - 1.61 (m, 2H), 1.49 (d, J=7.1 Hz, 3H), 1.45 - 1.34 (m, 2H), 1.09 (s, 9H)。ESI [M+H] =656.3
實例 52. 合成 ((1R,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-((R)-1- 苯基乙基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸氧雜環丁 -3- 酯。 以下化合物係經由相同方法藉由關鍵中間體 134 進行合成。 1
HNMR (400 MHz, 甲醇-d4) δ = 8.19 (d, J=2.2 Hz, 1H), 7.75 - 7.61 (m, 2H), 7.42 - 7.18 (m, 6H), 5.35 (quin, J=5.7 Hz, 1H), 5.01 - 4.87 (m, 3H), 4.70 - 4.52 (m, 2H), 3.51 - 3.38 (m, 1H), 3.06 - 2.92 (m, 1H), 2.22 (br d, J=11.9 Hz, 2H), 2.07 (br d, J=11.7 Hz, 2H), 1.77 - 1.62 (m, 2H), 1.54 - 1.35 (m, 5H), 1.10 (s, 9H)。ESI [M+H] =656.2
實例 53. 合成 ((1r,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-(2- 氟苄基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸氧雜環丁 -3- 酯。 以下化合物係經由相同方法藉由關鍵中間體 134 進行合成。 1
HNMR (400 MHz, 甲醇-d4) δ = 8.23 (d, J=2.4 Hz, 1H), 7.75 - 7.63 (m, 2H), 7.46 - 7.24 (m, 3H), 7.20 - 7.03 (m, 2H), 5.43 - 5.28 (m, 1H), 4.85 (br s, 2H), 4.67 - 4.56 (m, 2H), 4.47 (s, 2H), 3.53 - 3.37 (m, 1H), 3.08 - 2.93 (m, 1H), 2.29 - 1.99 (m, 4H), 1.78 - 1.61 (m, 2H), 1.53 - 1.35 (m, 2H), 1.11 (s, 9H)。ESI [M+H] =660.2
實例 54. 合成 ((1R,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-((R)-1-(2- 氟苯基 ) 乙基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸氧雜環丁 -3- 酯。 以下化合物係經由相同方法藉由關鍵中間體 134 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.20 (d, J=2.3 Hz, 1H), 7.73 - 7.65 (m, 2H), 7.45 - 7.39 (m, 1H), 7.38 - 7.26 (m, 2H), 7.21 - 7.04 (m, 2H), 5.37 (quin, J=5.7 Hz, 1H), 5.20 (q, J=7.0 Hz, 1H), 4.89 - 4.86 (m, 2H), 4.65 - 4.59 (m, 2H), 3.52 - 3.41 (m, 1H), 3.08 - 2.96 (m, 1H), 2.24 (br d, J=12.2 Hz, 2H), 2.13 - 2.05 (m, 2H), 1.76 - 1.64 (m, 2H), 1.52 (d, J=7.0 Hz, 3H), 1.47 - 1.39 (m, 2H), 1.12 (s, 9H)。ESI [M+H] =674.2
實例 55. 合成 ((1S,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-((S)-1-(2- 氟苯基 ) 乙基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 環己基 ) 胺基甲酸氧雜環丁 -3- 酯。 以下化合物係經由相同方法藉由關鍵中間體 134 進行合成。 1
HNMR (400 MHz, 甲醇-d4) δ = 8.17 (d, J=2.2 Hz, 1H), 7.75 - 7.59 (m, 2H), 7.43 - 7.22 (m, 3H), 7.21 - 7.03 (m, 2H), 5.39 - 5.28 (m, 1H), 5.17 (q, J=7.0 Hz, 1H), 4.90 - 4.87 (m, 1H), 4.84 (s, 1H), 4.66 - 4.54 (m, 2H), 3.43 (br t, J=11.8 Hz, 1H), 2.99 (br t, J=12.1 Hz, 1H), 2.22 (br d, J=12.7 Hz, 2H), 2.06 (br d, J=10.5 Hz, 2H), 1.77 - 1.60 (m, 2H), 1.58 - 1.34 (m, 5H), 1.09 (s, 9H)。ESI [M+H] =674.2
實例 56. 合成 N-[3-( 第三丁基胺磺醯基 )-4-[2-[5-( 異丙氧基羰基胺基 )-3- 甲氧基 -2- 吡啶基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸 4- 哌啶基甲酯 反應圖 18 : 製備化合物 136 。
將Na (8.75 g,380.60 mmol,9.02 mL,1.51eq.
)逐份添加至MeOH (300 mL)中,並在Na溶解後濃縮混合物至乾。將所得灰色固體(NaOMe)添加至DMF (300 mL)中並在0℃下添加 3- 氯吡啶 -2- 甲腈
(35 g,252.61 mmol,1eq.
)。在20℃下攪拌反應混合物12小時並隨後用H2
O (800 mL)稀釋並過濾。乾燥濾餅以獲得呈白色固體之 3- 甲氧基吡啶 -2- 甲腈
(25 g,粗製物)。ESI [M+H] =135.1
製備化合物 137
在0℃下將Bu4
NNO3
(83.30 g,273.59 mmol,1.5eq.
)及TFAA (57.54 g,273.98 mmol,38.11 mL,1.5eq.
)含於DCM (150 mL)之混合物逐滴添加至 3- 甲氧基吡啶 -2- 甲腈
(24.5 g,182.65 mmol,1eq.
)含於DCM (450 mL)之溶液。在20℃下攪拌混合物12小時並隨後在0℃下倒入至飽和NaHCO3
水溶液(300 mL)中並通過Na2
SO4
乾燥有機層,過濾並濃縮。藉由管柱層析法(SiO2
,石油醚/乙酸乙酯=20/1至10:1)純化殘餘物以獲得呈白色固體之 3- 甲氧基 -5- 硝基 - 吡啶 -2- 甲腈
(27 g,粗製物)。1
H NMR (400 MHz, 氯仿-d) δ = 9.06 (d, J=2.2 Hz, 1H), 8.13 (d, J=2.2 Hz, 1H), 4.16 - 4.08 (m, 3H)。ESI [M+H] =180.1
用於製備化合物 138 之一般方法 G 。
將Fe (4 g,754 mmol,5eq.
)及NH4
Cl (24.2 g,452 mmol,3eq.
)含於H2
O (50 mL)之溶液添加至 3- 甲氧基 -5- 硝基 - 吡啶 -2- 甲腈
(27 g,151 mmol,1eq.
)含於THF (100 mL)/EtOH (500 mL)之溶液。在80℃攪拌混合物下30分鐘,隨後用THF (500 mL)稀釋並過濾。濃縮濾液,用H2
O (500 mL)稀釋並隨後用DCM (400 mL x 3)萃取。通過Na2
SO4
乾燥經合併之有機層,過濾並濃縮以獲得呈淺黃色固體之 5- 胺基 -3- 甲氧基 - 吡啶 -2- 甲腈
(14.5 g,粗製物)。ESI [M+H] =150.1
製備化合物 139 。
一般方法D, N-(6- 氰基 -5- 甲氧基 -3- 吡啶基 ) 胺基甲酸異丙酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.13 (d, J=2.2 Hz, 1H), 7.95 (d, J=1.8 Hz, 1H), 5.04 - 4.95 (m, 1H), 3.96 (s, 3H), 1.31 (d, J=6.2 Hz, 6H)。ESI [M+H] =236.1
製備化合物 140 。
將NaHS (19.06 g,340.08 mmol,5eq.
)添加至 N-(6- 氰基 -5- 甲氧基 -3- 吡啶基 ) 胺基甲酸異丙酯
(16 g,68.02 mmol,1eq.
)含於DMF (200 mL)之溶液並隨後添加MgCl2
(19.43 g,204.05 mmol,8.37 mL,3eq.
)。在25℃下攪拌混合物12小時並隨後倒入至H2
O (500ml)中並用DCM (40 mL * 3)萃取。通過Na2
SO4
乾燥經合併之有機層,過濾並濃縮。用溶液(石油醚:EtOAc= 8:1)洗滌殘餘物,過濾並乾燥濾餅以獲得呈黃色固體之 N-(6- 胺甲醯硫基 -5- 甲氧基 -3- 吡啶基 ) 胺基甲酸異丙酯
(21 g,粗製物)。1
H NMR (400 MHz, DMSO-d6) δ = 9.92 - 9.84 (m, 2H), 9.38 (br s, 1H), 8.08 (d, J=1.8 Hz, 1H), 7.66 (s, 1H), 4.89 (spt, J=6.3 Hz, 1H), 3.74 (s, 3H), 1.24 (d, J=6.1 Hz, 6H)。ESI [M+H] =270.0
製備化合物 141 。
一般方法M, N-(5- 甲氧基 -6- 噻唑 -2- 基 -3- 吡啶基 ) 胺基甲酸異丙酯。 1
H NMR (400 MHz, DMSO-d6) δ = 10.07 (s, 1H), 8.26 (d, J=2.0 Hz, 1H), 7.88 (d, J=3.1 Hz, 1H), 7.85 (d, J=1.3 Hz, 1H), 7.71 (d, J=3.3 Hz, 1H), 4.91 (spt, J=6.2 Hz, 1H), 3.88 (s, 3H), 1.26 (d, J=6.4 Hz, 6H)。ESI [M+H] =294.1
製備化合物 142 。
一般方法J, N-[6-(5- 溴噻唑 -2- 基 )-5- 甲氧基 -3- 吡啶基 ] 胺基甲酸異丙酯
。1
H NMR (400 MHz, DMSO-d6) δ = 10.17 (s, 1H), 8.28 (d, J=1.8 Hz, 1H), 8.08 - 7.86 (m, 2H), 4.99 (br s, 1H), 3.93 (s, 3H), 1.29 (d, J=6.4 Hz, 6H)。ESI [M+H] =371.8/373.8
製備化合物 143 。
一般方法B, N-[6-[5-[4- 乙醯胺基 -2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ]-5- 甲氧基 -3- 吡啶基 ] 胺基甲酸異丙酯
。ESI [M+H] =562.0
製備化合物 144 。
一般方法F, N-[6-[5-[4- 胺基 -2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ]-5- 甲氧基 -3- 吡啶基 ] 胺基甲酸異丙酯。
ESI [M+H] =520.2
製備化合物 145 。
一般方法D, N-[3-( 第三丁基胺磺醯基 )-4-[2-[5-( 異丙氧基羰基胺基 )-3- 甲氧基 -2- 吡啶基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸 (4- 硝基苯基 ) 酯
。ESI [M+H] =685.1
製備化合物 146 。
一般方法H, 4-[[3-( 第三丁基胺磺醯基 )-4-[2-[5-( 異丙氧基羰基胺基 )-3- 甲氧基 -2- 吡啶基 ] 噻唑 -5- 基 ] 苯基 ] 胺甲醯基氧基甲基 ] 哌啶 -1- 甲酸第三丁酯。
ESI [M+H] =761.4
製備實例 56
一般方法C, N-[3-( 第三丁基胺磺醯基 )-4-[2-[5-( 異丙氧基羰基胺基 )-3- 甲氧基 -2- 吡啶基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸 4- 哌啶基甲酯
。1
H NMR (400 MHz, DMSO-d6) δ = 10.19 - 10.10 (m, 2H), 8.35 (d, J=2.1 Hz, 1H), 8.30 (d, J=1.8 Hz, 1H), 7.89 (s, 2H), 7.68 (dd, J=2.0, 8.4 Hz, 1H), 7.46 (d, J=8.4 Hz, 1H), 7.12 (br s, 1H), 4.95 (td, J=6.2, 12.5 Hz, 1H), 3.98 (d, J=6.5 Hz, 2H), 3.93 (s, 3H), 3.00 (br d, J=12.1 Hz, 2H), 2.70 - 2.56 (m, 2H), 1.77 (br d, J=4.0 Hz, 1H), 1.67 (br d, J=12.1 Hz, 2H), 1.30 (d, J=6.2 Hz, 6H), 1.16 (br dd, J=3.4, 12.0 Hz, 2H), 1.09 (s, 9H)。ESI [M+H] =661.3
實例 57 合成反式 -N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ]-4- 氟 - 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯。 反應圖 19 : 製備化合物 147
將1-(氯甲基)-4-氟-1,4-二氮鎓雙環[2.2.2]辛烷;二四氟硼酸鹽(3.06 g,8.64 mmol,2eq.
)添加至 反式 -N-[4-(5- 溴噻唑 -2- 基 ) 環己基 ] 胺基甲酸異丙酯
(1.50 g,4.32 mmol,1eq.
)含於ACN (20 mL)之溶液並在80℃下攪拌混合物12小時。隨後濃縮混合物並藉由管柱層析法(SiO2
,石油醚/乙酸乙酯=3/1至3:1)純化殘餘物以獲得呈黃色膠之 反式 -N-[4-(5- 溴 -4- 氟 - 噻唑 -2- 基 ) 環己基 ] 胺基甲酸異丙酯
(0.2 g,547.55 μmol,12.68%產率)。ESI [M+H] =365.1/367.1
製備實例 57
一般方法B, 反式 -N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ]-4- 氟 - 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.24 (d, J=2.0 Hz, 1H), 7.67 (dd, J=2.0, 8.4 Hz, 1H), 7.37 - 7.29 (m, 5H), 7.24 (br d, J=2.6 Hz, 1H), 4.82 - 4.77 (m, 1H), 4.40 (s, 2H), 3.42 (br t, J=11.6 Hz, 1H), 2.87 (br t, J=12.0 Hz, 1H), 2.20 (br d, J=12.3 Hz, 2H), 2.05 (br d, J=11.0 Hz, 2H), 1.69 - 1.57 (m, 2H), 1.43 - 1.30 (m, 2H), 1.21 (br d, J=5.7 Hz, 6H), 1.15 (s, 9H)。ESI [M+H] =646.2
實例 58 合成 ((1r,4r)-4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(( 異丙氧基羰基 ) 胺基 ) 苯基 )-4- 氟噻唑 -2- 基 ) 環己基 ) 胺基甲酸異丙酯 以下化合物係經由相同方法藉由關鍵中間體 147 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.35 (s, 1H), 7.69 (br d, J=8.1 Hz, 1H), 7.37 (d, J=8.3 Hz, 1H), 5.01 (td, J=6.1, 12.4 Hz, 1H), 4.83 (br s, 1H), 3.53 - 3.39 (m, 1H), 2.96 - 2.85 (m, 1H), 2.23 (br d, J=12.3 Hz, 2H), 2.08 (br d, J=10.5 Hz, 2H), 1.75 - 1.60 (m, 2H), 1.47 - 1.38 (m, 2H), 1.34 (d, J=6.2 Hz, 6H), 1.24 (br d, J=6.0 Hz, 6H), 1.18 (s, 9H)。ESI [M+H] =599.2
實例 59 合成反式 -N-[6-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 四氫哌喃 -3- 基 ] 胺基甲酸異丙酯 反應圖 20 : 製備化合物 149
將 丁 -1,3- 二烯
(92.72 g,1.71 mol,149.55 mL,1.4eq.
)及2,6-二第三丁基-4-甲基-苯酚(5.40 g,24.49 mmol,0.02eq.
)添加至 2- 側氧基乙酸乙酯
(250 g,1.22 mol,1eq.
)含於甲苯(1.5 L)之溶液。在高壓管中在170℃ 1 MPa下攪拌混合物8小時並隨後濃縮。藉由矽膠管柱層析法(石油醚/乙酸乙酯=100:1-10:1)純化殘餘物以獲得呈黃色油之 3,6- 二氫 -2H- 哌喃 -2- 甲酸乙酯
(26 g,166.48 mmol,13.60%產率)。1
H NMR (400 MHz, 氯仿-d) δ = 5.82 - 5.74 (m, 1H), 5.71 - 5.64 (m, 1H), 4.36 - 4.27 (m, 1H), 4.23 - 4.12 (m, 4H), 2.39 - 2.23 (m, 2H), 1.24 (t, J=7.1 Hz, 3H)。
製備化合物 150
一般方法O, 3,6- 二氫 -2H- 哌喃 -2- 甲酸
。1
H NMR (400 MHz, 氯仿-d) δ = 5.88 (qdd, J=2.3, 5.1, 10.2 Hz, 1H), 5.80 - 5.71 (m, 1H), 4.43 - 4.19 (m, 3H), 2.53 - 2.31 (m, 2H)
製備化合物 151
一般方法N, 3,6- 二氫 -2H- 哌喃 -2- 甲醯胺
。1
H NMR (400 MHz, 氯仿-d) δ = 6.50 (br s, 1H), 5.89 - 5.76 (m, 1H), 5.67 (br d, J=9.8 Hz, 1H), 5.50 (br s, 1H), 4.22 (br s, 2H), 3.97 (dd, J=3.9, 10.8 Hz, 1H), 2.49 - 2.35 (m, 1H), 2.28 - 2.09 (m, 1H)
製備化合物 153
一般方法M, 2-(3,6- 二氫 -2H- 哌喃 -2- 基 ) 噻唑
。1
H NMR (400 MHz, 氯仿-d) δ = 7.69 (d, J=2.9 Hz, 1H), 7.26 (d, J=2.9 Hz, 1H), 5.93 - 5.83 (m, 1H), 5.70 - 5.63 (m, 1H), 4.86 (dd, J=3.9, 9.8 Hz, 1H), 4.33 (br s, 2H), 2.61 - 2.37 (m, 2H)。ESI [M+H]=168.1
製備化合物 154
在0℃下,將BH3
-Me2
S (10 M,15.55 mL,2eq.
)逐滴添加至 2-(3,6- 二氫 -2H- 哌喃 -2- 基 ) 噻唑
(13 g,77.74 mmol,1eq.
)含於THF (150 mL)之溶液並在26℃下攪拌混合物2小時。隨後在0℃下藉由NaOH (62.19 g,1.55 mol,20eq.
)含於H2
O (150 mL)緩慢中止混合物,其後接著添加H2
O2
(264.42 g,2.33 mol,224.09 mL,30%純度,30eq.
)。再在26℃下攪拌混合物12小時。藉由飽和Na2
SO3
水溶液(1 L)中止混合物並用EtOAc (1 L*2)萃取。通過Na2
SO4
乾燥經合併之有機相,過濾並濃縮。藉由管柱(石油醚 : EtOAc= 5:1至1:1)純化殘餘物以獲得呈黃色固體之 6- 噻唑 -2- 基四氫哌喃 -3- 醇
(7 g,粗製物)。ESI [M+H]=186.2
製備化合物 155
在0℃下,將TEA (7.65 g,75.58 mmol,10.52 mL,2eq.
)及甲磺醯氯(6.49 g,56.68 mmol,4.39 mL,1.5eq.
)逐滴添加至 6- 噻唑 -2- 基四氫哌喃 -3- 醇
(7 g,37.79 mmol,1eq.
)含於DCM (100 mL)之溶液並在26℃下攪拌混合物2小時。用DCM (100 mL)稀釋混合物並用水(200 mL)洗滌。通過Na2
SO4
乾燥有機相,過濾並濃縮以獲得呈黃色油之粗製 甲磺酸 (6- 噻唑 -2- 基四氫哌喃 -3- 基 ) 酯
(7 g,粗製物),其可直接進行使用。
將疊氮鈉(8.64 g,132.91 mmol,5eq.
)添加至 甲磺酸 (6- 噻唑 -2- 基四氫哌喃 -3- 基 ) 酯
(7 g,26.58 mmol,1eq.
)含於DMF (60 mL)之溶液並在80℃下攪拌混合物12小時並隨後倒入至飽和Na2
CO3
水溶液(500 mL)中並用EtOAc (200 mL*3)萃取。用鹽水(200 mL)洗滌經合併之有機相並通過Na2
SO4
乾燥,過濾並濃縮以獲得呈黃色油之粗製 2-(5- 疊氮基四氫哌喃 -2- 基 ) 噻唑
(5 g,粗製物),其無需進行任何純化即可使用。
製備化合物 156
將PPh3
(9.36 g,35.67 mmol,1.5eq.
)添加至 2-(5- 疊氮基四氫哌喃 -2- 基 ) 噻唑
(5 g,23.78 mmol,1eq.
)含於THF (80 mL)及H2
O (40 mL)之溶液。在50℃下攪拌混合物12小時並隨後倒入至4N HCl溶液 (100 mL)中並用EtOAc (50 mL*2)萃取。隨後藉由飽和Na2
CO3
水溶液鹼化水相直至pH>12並用溶液(DCM/MeOH = 5:1) (100 mL*3)萃取。通過Na2
SO4
乾燥經合併之有機相,過濾並濃縮以獲得呈黃色油之粗製 6- 噻唑 -2- 基四氫哌喃 -3- 胺
(3 g,粗製物)。ESI [M+H] =185.2
製備化合物 157
一般方法D, 反式 -N-(6- 噻唑 -2- 基四氫哌喃 -3- 基 ) 胺基甲酸異丙酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 7.74 (d, J=3.3 Hz, 1H), 7.55 (d, J=3.3 Hz, 1H), 4.86 - 4.77 (m, 2H), 4.64 (dd, J=2.4, 10.8 Hz, 1H), 4.12 (ddd, J=2.0, 4.6, 10.8 Hz, 1H), 3.75 - 3.55 (m, 1H), 2.32 - 2.20 (m, 1H), 2.16 - 2.03 (m, 1H), 1.81 - 1.54 (m, 2H), 1.22 (br d, J=6.2 Hz, 6H)。ESI [M+H] = 271.2
註釋:
化合物157係藉由製備型TLC其後接著製備型HPLC進行純化以分離出其他異構體。
製備化合物實例 59
一般方法B, 反式 -N-[6-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 四氫哌喃 -3- 基 ] 胺基甲酸異丙酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.24 (d, J=2.2 Hz, 1H), 7.74 (s, 1H), 7.68 (dd, J=2.2, 8.4 Hz, 1H), 7.37 - 7.29 (m, 5H), 7.27 - 7.19 (m, 1H), 4.84 - 4.78 (m, 2H), 4.64 (dd, J=2.0, 11.0 Hz, 1H), 4.40 (s, 2H), 4.12 (br dd, J=3.2, 10.7 Hz, 1H), 3.69 - 3.58 (m, 1H), 2.33 - 2.26 (m, 1H), 2.13 (br d, J=10.4 Hz, 1H), 1.82 - 1.71 (m, 1H), 1.69 - 1.57 (m, 1H), 1.26 - 1.19 (m, 6H), 1.10 (s, 9H)。ESI [M+H] =630.3
製備化合物實例 59A 及實例 59B
實例59係藉由SFC (條件:儀器:Thar SFC80製備型SFC;管柱:Chiralpak IC-H 250*30 mm i.d. 5u;流動相:A為CO2
及B為MeOH (0.1% NH3
.H2
O);梯度:B%=42%;流速:70 g/min;波長:220 nm;管柱溫度:40℃;系統背壓:100巴)進行進一步分離以獲得實例 59A
。1
H NMR (400 MHz,甲醇-d4) δ = 8.27 (d, J=2.2 Hz, 1H), 7.77 (s, 1H), 7.72 (dd, J=2.3, 8.3 Hz, 1H), 7.40 - 7.33 (m, 5H), 7.30 - 7.23 (m, 1H), 4.89 - 4.79 (m, 2H), 4.67 (dd, J=2.3, 11.0 Hz, 1H), 4.43 (s, 2H), 4.16 (br dd, J=3.0, 10.9 Hz, 1H), 3.67 (br t, J=10.9 Hz, 1H), 2.33 (br dd, J=2.6, 13.1 Hz, 1H), 2.16 (br d, J=10.6 Hz, 1H), 1.88 - 1.58 (m, 2H), 1.31 - 1.22 (m, 6H), 1.13 (s, 9H)。ESI [M+H] =630.2
實例 59B
:1
H NMR (400 MHz, 甲醇-d4) δ = 8.25 (d, J=2.2 Hz, 1H), 7.76 (s, 1H), 7.70 (dd, J=2.2, 8.3 Hz, 1H), 7.37 (s, 1H), 7.36 - 7.31 (m, 4H), 7.28 - 7.18 (m, 1H), 4.87 - 4.74 (m, 1H), 4.65 (br d, J=9.2 Hz, 1H), 4.41 (s, 2H), 4.19 - 4.04 (m, 1H), 3.63 (br d, J=10.5 Hz, 1H), 3.34 (br s, 1H), 2.31 (br d, J=13.2 Hz, 1H), 2.13 (br d, J=10.1 Hz, 1H), 1.84 - 1.72 (m, 1H), 1.71 - 1.58 (m, 1H), 1.22 (d, J=6.1 Hz, 6H), 1.11 (s, 9H)。ESI [M+H] =630.3
實例 60 合成反式 -N-[6-[5-[2-( 第三丁基胺磺醯基 )-4-( 異丙氧基羰基胺基 ) 苯基 ] 噻唑 -2- 基 ] 四氫哌喃 -3- 基 ] 胺基甲酸異丙酯 反應圖 21 : 製備實例 60
一般方法B, 反式 -N-[6-[5-[2-( 第三丁基胺磺醯基 )-4-( 異丙氧基羰基胺基 ) 苯基 ] 噻唑 -2- 基 ] 四氫哌喃 -3- 基 ] 胺基甲酸異丙酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.37 (d, J=2.0 Hz, 1H), 7.79 (s, 1H), 7.70 (dd, J=2.4, 8.3 Hz, 1H), 7.40 (d, J=8.3 Hz, 1H), 5.01 (spt, J=6.3 Hz, 1H), 4.87 - 4.79 (m, 1H), 4.68 (dd, J=2.4, 11.2 Hz, 1H), 4.16 (dd, J=2.9, 10.8 Hz, 1H), 3.72 - 3.60 (m, 1H), 3.38 - 3.34 (m, 1H), 2.39 - 2.29 (m, 1H), 2.16 (br d, J=12.2 Hz, 1H), 1.89 - 1.74 (m, 1H), 1.72 - 1.59 (m, 1H), 1.39 - 1.21 (m, 12H), 1.14 (s, 9H)。ESI [M+H] =583.3
製備化合物實例 60A 及實例 60B
實例60係藉由SFC (條件:
儀器:Thar SFC80製備型SFC;管柱:Chiralpak IC-H 250*30mm i.d. 5u;流動相:A為CO2
及B為MeOH (0.1% NH3
.H2
O);梯度:B%=38%;流速:65 g/min;波長:220 nm;管柱溫度:40℃;系統背壓:100巴)進行進一步分離以獲得 實例 60A
:1
H NMR (400 MHz, 甲醇-d4) δ = 8.37 (d, J=2.2 Hz, 1H), 7.78 (s, 1H), 7.70 (dd, J=2.0, 8.4 Hz, 1H), 7.40 (d, J=8.3 Hz, 1H), 5.05 - 4.95 (m, 1H), 4.90 - 4.81 (m, 1H), 4.67 (dd, J=2.4, 11.1 Hz, 1H), 4.70 - 4.64 (m, 1H), 4.16 (br dd, J=2.9, 10.9 Hz, 1H), 3.73 - 3.62 (m, 1H), 2.33 (br dd, J=2.8, 13.2 Hz, 1H), 2.16 (br d, J=11.9 Hz, 1H), 1.86 - 1.74 (m, 1H), 1.70 - 1.61 (m, 1H), 1.34 (d, J=6.2 Hz, 6H), 1.25 (br d, J=6.1 Hz, 6H), 1.14 (s, 9H)。ESI [M+H] =583.3
實例 60B
:1
H NMR (400 MHz, 甲醇-d4) δ = 8.34 (d, J=2.2 Hz, 1H), 7.80 - 7.72 (m, 1H), 7.67 (dd, J=2.0, 8.6 Hz, 1H), 7.36 (d, J=8.3 Hz, 1H), 4.98 (spt, J=6.2 Hz, 1H), 4.85 - 4.75 (m, 1H), 4.65 (dd, J=2.4, 11.2 Hz, 1H), 4.13 (br dd, J=3.1, 11.0 Hz, 1H), 3.72 - 3.56 (m, 1H), 3.33 (s, 1H), 2.30 (br dd, J=2.6, 13.2 Hz, 1H), 2.13 (br d, J=11.4 Hz, 1H), 1.85 - 1.71 (m, 1H), 1.69 - 1.57 (m, 1H), 1.31 (d, J=6.1 Hz, 6H), 1.27 - 1.17 (m, 6H), 1.11 (s, 9H)。ESI [M+H] =583.2
實例 61 合成 N- 異丙基胺基甲酸 [1-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ]-4- 雙環 [2.2.2] 辛基 ] 酯。 反應圖 22 : 製備化合物 160 。
將TMSCl (23.59 mg,217.12 μmol,0.1eq.
)及2-異氰酸根基丙烷(554.33 mg,6.51 mmol,3eq.
)添加至 4- 羥基雙環 [2.2.2] 辛烷 -1- 甲酸甲酯
(0.4 g,2.17 mmol,1eq.
)含於DCM (10 mL)之溶液。在25℃下攪拌混合物12小時並隨後用1N HCl (20 mL)及飽和Na2
CO3
水溶液(20 mL)洗滌。通過Na2
SO4
乾燥有機層,過濾並濃縮以獲得呈黃色膠之 4-( 異丙基胺甲醯基氧基 ) 雙環 [2.2.2] 辛烷 -1- 甲酸甲酯
(0.45 g,粗製物)。1
H NMR (400 MHz, 氯仿-d) δ = 4.34 (br s, 1H), 3.72 - 3.61 (m, 1H), 3.56 (s, 3H), 1.94 (br d, J=7.7 Hz, 6H), 1.90 - 1.81 (m, 6H), 1.08 - 1.00 (m, 6H)。ESI [M+H] =269.9
製備化合物 161 。
一般方法O, 4-( 異丙基胺甲醯基氧基 ) 雙環 [2.2.2] 辛烷 -1- 甲酸
。1
H NMR (400 MHz, 氯仿-d) δ = 4.32 (br s, 1H), 3.71 - 3.60 (m, 1H), 1.93 (br s, 6H), 1.88 (br d, J=9.3 Hz, 6H), 1.05 (d, J=6.5 Hz, 6H)。ESI [M+H] =256.0
製備化合物 162 。
一般方法N, N- 異丙基胺基甲酸 (1- 胺甲醯基 -4- 雙環 [2.2.2] 辛基 ) 酯
。1
H NMR (400 MHz, 氯仿-d) δ = 5.56 - 5.31 (m, 2H), 4.34 (br s, 1H), 3.72 - 3.57 (m, 1H), 1.96 (br s, 6H), 1.97 - 1.93 (m, 1H), 1.92 - 1.80 (m, 6H), 1.05 (d, J=6.6 Hz, 6H)。ESI [M+H] =255.3
製備實例 61 。
一般方法K, N- 異丙基胺基甲酸 [1-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ]-4- 雙環 [2.2.2] 辛基 ] 酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.26 (d, J=2.2 Hz, 1H), 7.74 - 7.68 (m, 2H), 7.38 - 7.32 (m, 4H), 7.30 - 7.23 (m, 1H), 4.43 (s, 2H), 3.71 - 3.61 (m, 1H), 2.18 (s, 12H), 1.16 - 1.09 (m, 15H)。ESI [M+H] =654.3
實例 62 合成異丙基胺基甲酸 4-(5-(2-(N-( 第三丁基 ) 胺磺醯基 )-4-(3-( 吡啶 -2- 基甲基 ) 脲基 ) 苯基 ) 噻唑 -2- 基 ) 雙環 [2.2.2] 辛 -1- 酯。 以下化合物係經由相同方法藉由關鍵中間體 165 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.77 (br s, 1H), 8.62 - 8.52 (m, 1H), 8.34 (br s, 1H), 8.12 - 8.03 (m, 1H), 7.96 (br d, J=5.5 Hz, 1H), 7.79 - 7.66 (m, 2H), 7.43 - 7.35 (m, 1H), 4.78 (br s, 2H), 3.67 (br dd, J=6.2, 13.0 Hz, 1H), 2.19 (br s, 12H), 1.17 - 1.09 (m, 15H)。ESI [M/2+H] = 328.2
實例 63 合成反式 -N-[6-[5-[2-( 第三丁基胺磺醯基 )-4-( 異丙氧基羰基胺基 ) 苯基 ] 噻唑 -2- 基 ]-3- 哌啶基 ] 胺基甲酸異丙酯 反應圖 23 : 用於製備化合物 167 之一般方法 I 。
在N2
下,將濕Pd/C (2 g,10%含量)添加至 5- 羥基吡啶 -2- 甲酸
(60 g,431 mmol,1eq.
)含於AcOH (200 mL)/H2
O (600 mL)之溶液。使懸浮液在真空下脫氣並用H2
淨化若干次。在50℃ H2
(50 psi)下攪拌混合物12小時,隨後過濾並濃縮以獲得呈黃色油之 5- 羥基哌啶 -2- 甲酸
(62.61 g,粗製物)。ESI [M+H] =146.5
製備化合物 168
將NaOH (34.17 g,854.25 mmol,2eq.
)添加至 5- 羥基哌啶 -2- 甲酸
(62 g,427.13 mmol,1eq.
)及Boc2
O (102.54 g,469.84 mmol,107.94 mL,1.1eq.
)含於二噁烷(500 mL)之混合物並在25℃下攪拌混合物18小時。隨後濃縮混合物以移除二噁烷並藉由添加1N HCl溶液將pH值調整至2-3。用2-Me-THF (500 mL * 3)萃取水相。通過Na2
SO4
乾燥經合併之有機層,過濾並濃縮以獲得呈黃色油之 1- 第三丁氧基羰基 -5- 羥基 - 哌啶 -2- 甲酸
(40 g,粗製物)。ESI [M+Na] =267.9
製備化合物 170
在0℃下,將甲磺醯氯(4.10 g,35.78 mmol,2.77 mL,1.2eq.
)添加至 5- 羥基哌啶 -1,2- 二甲酸 O2
- 苄酯 O1
- 第三丁酯
(10 g,29.82 mmol,1eq.
)、TEA (3.62 g,35.78 mmol,4.98 mL,1.2eq.
)含於DCM (100 mL)之混合物並在25℃下攪拌混合物1小時。隨後用H2
O (50 mL)洗滌混合物並乾燥有機層並濃縮。藉由管柱層析法(SiO2
,石油醚/乙酸乙酯=40/1至5:1)純化殘餘物以獲得呈黃色油之 5- 甲基磺醯基氧基哌啶 -1,2- 二甲酸 O2
- 苄酯 O1
- 第三丁酯
(9.5 g,18.98 mmol,63.65%產率,82.6%純度)。
在100℃下攪拌 5- 甲基磺醯基氧基哌啶 -1,2- 二甲酸 O2
- 苄酯 O1
- 第三丁酯
(9.5 g,22.98 mmol,1eq.
)、NaN3
(8.96 g,137.85 mmol,6eq.
)含於DMF (20 mL)之混合物4小時。隨後用飽和Na2
SO3
水溶液(30 mL)中止混合物並用EtOAc (100 mL * 3)萃取。用鹽水(40 mL * 3)洗滌經合併之有機層,通過Na2
SO4
乾燥,過濾並濃縮以獲得呈黃色油之 5- 疊氮基哌啶 -1,2- 二甲酸 O2
- 苄酯 O1
- 第三丁酯
(8.82 g,粗製物)。
製備化合物 171
在45℃下攪拌 5- 疊氮基哌啶 -1,2- 二甲酸 O2
- 苄酯 O1
- 第三丁酯
(8 g,22.20 mmol,1eq.
)、三苯基膦(8.73 g,33.30 mmol,1.5eq.
)含於H2
O (50 mL)及THF (50 mL)之混合物4小時。濃縮混合物以移除THF並藉由添加1N HCl溶液將pH值調整至2-3。用MTBE (30 mL)萃取水相並隨後鹼化水相以將pH調整至9並用EtOAc (50 mL * 3)萃取。通過Na2
SO4
乾燥經合併之有機層,過濾並濃縮以獲得呈黃色油之 5- 胺基哌啶 -1,2- 二甲酸 O2
- 苄酯 O1
- 第三丁酯
(6 g,粗製物)。ESI [M+H]=335.2
製備化合物 174
在25℃下攪拌 1- 第三丁氧基羰基 -5-( 異丙氧基羰基胺基 ) 哌啶 -2- 甲酸
(1.3 g,3.93 mmol,1eq.
)、NH4
Cl (315.73 mg,5.90 mmol,1.5eq.
)、TEA (1.19 g,11.80 mmol,1.64 mL,3eq.
)及HBTU (1.64 g,4.33 mmol,1.1eq.
)含於ACN (10 mL)之混合物2小時並隨後濃縮。隨後將混合物倒入至H2
O (20 mL)中並用EtOAc (20 ml*3)萃取。通過Na2
SO4
乾燥經合併之有機層,過濾並濃縮。藉由製備型HPLC(管柱:Phenomenex Gemini C18 250*50 10u;流動相:[水(0.05%氫氧化銨v/v)-ACN];B%:10%-40%,20分鐘)純化混合物以獲得呈白色固體之 2- 胺甲醯基 -5-( 異丙氧基羰基胺基 ) 哌啶 -1- 甲酸第三丁酯
(1 g,3.01 mmol,76.38%產率,99%純度)。ESI [M+H] =330.2
製備化合物 176
將緩衝劑(784.76 mg,2.82 mmol,1.5eq.
)及2-氯乙醛(3.69 g,18.82 mmol,3.03 mL,10eq.
)添加至 反式 -2- 胺甲醯硫基 -5-( 異丙氧基羰基胺基 ) 哌啶 -1- 甲酸第三丁酯
(650 mg,1.88 mmol,1.0eq.
)含於甲苯(20 mL)之溶液。在100℃下攪拌混合物1.5小時並隨後倒入至水(20 mL)中並用EtOAc (10 mL x 3)萃取。通過Na2
SO4
乾燥經合併之有機相,過濾並濃縮。藉由鹼性製備型HPLC純化殘餘物以獲得呈黃色固體之 反式 -5-( 異丙氧基羰基胺基 )-2- 噻唑 -2- 基 - 哌啶 -1- 甲酸第三丁酯
(80 mg,216.52 μmol,11.51%產率)。1
H NMR (400 MHz, 甲醇-d4) δ = 7.75 (d, J=3.4 Hz, 1H), 7.58 (d, J=2.9 Hz, 1H), 5.60 (br s, 1H), 4.95 - 4.90 (m, 1H), 4.23 (br d, J=14.7 Hz, 1H), 3.68 (br s, 1H), 3.11 - 2.94 (m, 1H), 2.42 - 2.31 (m, 1H), 2.30 - 2.17 (m, 1H), 1.93 - 1.79 (m, 1H), 1.75 - 1.64 (m, 1H), 1.50 (s, 9H), 1.30 - 1.23 (m, 6H)
製備化合物 178
一般方法B, 反式 -2-[5-[2-( 第三丁基胺磺醯基 )-4-( 異丙氧基羰基胺基 ) 苯基 ] 噻唑 -2- 基 ]-5-( 異丙氧基羰基胺基 ) 哌啶 -1- 甲酸第三丁酯
。ESI [M+H] =682.3
製備實例 63
一般方法C, 反式 -N-[6-[5-[2-( 第三丁基胺磺醯基 )-4-( 異丙氧基羰基胺基 ) 苯基 ] 噻唑 -2- 基 ]-3- 哌啶基 ] 胺基甲酸異丙酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.40 (d, J=2.0 Hz, 1H), 7.86 (s, 1H), 7.65 (dd, J=2.2, 8.4 Hz, 1H), 7.38 (d, J=8.4 Hz, 1H), 5.05 - 4.94 (m, 1H), 4.85 - 4.81 (m, 1H), 4.67 (dd, J=2.9, 11.9 Hz, 1H), 3.92 - 3.82 (m, 1H), 3.60 (br dd, J=3.6, 11.8 Hz, 1H), 2.92 (t, J=11.9 Hz, 1H), 2.48 (br dd, J=3.2, 14.2 Hz, 1H), 2.22 - 2.03 (m, 2H), 1.82 - 1.70 (m, 1H), 1.32 (d, J=6.4 Hz, 6H), 1.24 (br d, J=6.2 Hz, 6H), 1.19 (s, 9H)。ESI [M+H] =582.2
實例 64 合成 ((3R,6S)-6-(5-(4-(3- 苄基脲基 )-2-(N-( 第三丁基 ) 胺磺醯基 ) 苯基 ) 噻唑 -2- 基 ) 哌啶 -3- 基 ) 胺基甲酸異丙酯。 以下化合物係經由相同方法藉由關鍵中間體 178 進行合成。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.30 (d, J=2.2 Hz, 1H), 7.86 (s, 1H), 7.66 (dd, J=2.2, 8.4 Hz, 1H), 7.38 - 7.20 (m, 6H), 4.85 - 4.82 (m, 1H), 4.70 (dd, J=3.2, 12.0 Hz, 1H), 4.42 (s, 2H), 3.93 - 3.82 (m, 1H), 3.62 (br dd, J=3.5, 11.7 Hz, 1H), 3.00 - 2.90 (m, 1H), 2.52 - 2.44 (m, 1H), 2.23 - 2.04 (m, 2H), 1.84 - 1.70 (m, 1H), 1.26 - 1.21 (m, 6H), 1.18 (s, 9H)。ESI [M+H] =629.2
實例 65 合成 N-[3-( 第三丁基胺磺醯基 )-4-[2-[3-( 異丙氧基羰基胺基 ) 環丁基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸異丙酯 反應圖 24 : 製備化合物 180
將氯甲酸乙酯(277.29 mg,2.56 mmol,1.1eq.
)添加至 反式 -3-( 第三丁氧基羰基胺基 ) 環丁烷甲酸
(500 mg,2.32 mmol,1eq.
)、DIEA (750.54 mg,5.81 mmol,1.01 mL,2.5eq.
)含於THF (10 mL)之溶液並在0℃下攪拌混合物1小時。隨後將其添加至NH3
.H2
O (1.30 g,9.29 mmol,1.43 mL,25%純度,4eq.
)含於THF (10 mL)及二噁烷 (10 mL)中並在25℃下攪拌混合物1小時。用1N HCl (20 mL)、飽和Na2
CO3
水溶液(20 mL)洗滌混合物並通過Na2
SO4
乾燥有機相,過濾並濃縮以獲得呈白色固體之 反式 -N-(3- 胺甲醯基環丁基 ) 胺基甲酸第三丁酯
(0.39 g,粗製物)。1
H NMR (400 MHz, DMSO-d6) δ = 7.20 - 7.07 (m, 2H), 6.71 (br s, 1H), 4.09 - 4.00 (m, 1H), 2.72 (br t, J=9.3 Hz, 1H), 2.23 (br t, J=8.7 Hz, 2H), 2.01 (q, J=9.8 Hz, 2H), 1.34 (s, 9H.ESI [M+Na]=237.1
製備化合物 181
一般方法L, 反式 -N-(3- 胺甲醯硫基環丁基 ) 胺基甲酸第三丁酯
。1
H NMR (400 MHz, DMSO-d6) δ = 9.33 (br s, 1H), 9.02 (br s, 1H), 7.18 (br d, J=5.5 Hz, 1H), 4.16 - 4.03 (m, 1H), 3.33 (br s, 1H), 2.45 (br d, J=12.2 Hz, 2H), 2.15 (br d, J=6.5 Hz, 2H), 1.37 (br s, 9H)
製備化合物 182
一般方法M, 反式 -N-(3- 噻唑 -2- 基環丁基 ) 胺基甲酸第三丁酯
。1
H NMR (400 MHz, 氯仿-d) δ = 7.62 (d, J=3.2 Hz, 1H), 7.14 (dd, J=3.3, 8.3 Hz, 1H), 4.79 (br s, 1H), 4.34 (br s, 1H), 3.47 - 3.36 (m, 1H), 2.81 (br d, J=8.8 Hz, 1H), 2.66 (ddd, J=4.5, 7.9, 12.8 Hz, 1H), 2.46 - 2.34 (m, 1H), 2.17 - 2.09 (m, 1H), 1.38 (s, 9H)。ESI[M+H]=255.3
製備實例 65
一般方法D, N-[3-( 第三丁基胺磺醯基 )-4-[2-[3-( 異丙氧基羰基胺基 ) 環丁基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸異丙酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.34 (d, J=1.5 Hz, 1H), 7.76 - 7.65 (m, 2H), 7.38 (t, J=8.5 Hz, 1H), 5.04 - 4.94 (m, 1H), 4.82 (br d, J=6.4 Hz, 1H), 4.42 - 4.32 (m, 0.5H), 4.13 (br t, J=8.0 Hz, 0.5H), 3.87 - 3.78 (m, 0.5H), 3.58 - 3.48 (m, 0.5H), 2.82 (dq, J=2.6, 7.9 Hz, 1H), 2.72 - 2.64 (m, 1H), 2.60 - 2.50 (m, 1H), 2.34 - 2.23 (m, 1H), 1.31 (d, J=6.2 Hz, 6H), 1.22 (br d, J=6.0 Hz, 6H), 1.13 (s, 9H)。ESI [M+H] =553.4
實例 66A 及 66B 反應圖 25 : 製備化合物 31 。
在0℃下,將HNO3
(79.95 g,1.21 mol,57.11 mL,95%純度,3.08eq.
)含於H2
SO4
(0.50 L)之溶液逐滴添加至 2- 溴苯磺醯氯
(100.00 g,391.36 mmol,1.00eq.
)含於H2
SO4
(1.0 L)之溶液。在26℃下攪拌混合物2小時。TLC (石油醚:EtOAc =10:1,Rf
=0.40)顯示反應完成。伴隨劇烈攪拌將混合物緩慢添加至冰水(5 L)中並隨後過濾。用H2
O (1 L X 3)洗滌濾餅並乾燥以獲得呈黃色固體之 2- 溴 -5- 硝基 - 苯磺醯氯
(105.00 g,粗製物)。1
H NMR (400 MHz, 氯仿-d) δ = 8.98 (d, J=2.4 Hz, 1H), 8.37 (dd, J=2.5, 8.7 Hz, 1H), 8.09 (d, J=8.6 Hz, 1H)。
製備化合物 32 。
在0℃下,將 2- 溴 -5- 硝基 - 苯磺醯基氯
(250 g,831.91 mmol,1eq.
)逐份添加至 2- 甲基丙 -2- 胺
(200 g,2.73 mol,287.36 mL,3.29eq.
)及DMAP (10 g,81.85 mmol,0.1eq.
)含於DCM (2 L)之混合物。將混合物加熱至15℃並攪拌1小時。LCMS顯示反應完成。用HCl (1N,2 L)、飽和NaHCO3
水溶液(500 mL)及鹽水(500 mL)洗滌混合物,通過Na2
SO4
乾燥,過濾並濃縮以獲得呈灰色固體之 2- 溴 -N- 第三丁基 -5- 硝基 - 苯磺醯胺
(240 g,粗製物)。ESI [M+H] = 336.9/338.9。
製備化合物 33 。
將噻唑(26.51 g,311.40 mmol,3eq
.)、Pd(OAc)2
(2.33 g,10.38 mmol,0.1eq
.)及KOAc (30.56 g,311.40 mmol,3eq
.)添加至 2- 溴 -N- 第三丁基 -5- 硝基 - 苯磺醯胺
(35 g,103.80 mmol,1eq
.)含於DMA (300 mL)之溶液。在140℃下在N2
下攪拌混合物16小時。LCMS顯示反應完成,將混合物倒入至水(3 L)中並過濾。用水(200 mL x 3)洗滌濾餅並隨後乾燥以獲得呈黑棕色固體之 N- 第三丁基 -5- 硝基 -2- 噻唑 -5- 基 - 苯磺醯胺
(25.1 g,粗製物)。1
H NMR (400 MHz, DMSO-d6) δ = 9.30 (s, 1H), 8.81 (d, J=2.4 Hz, 1H), 8.46 (dd, J=2.4, 8.3 Hz, 1H), 8.12 (s, 1H), 7.83 (d, J=8.3 Hz, 1H), 7.60 (s, 1H), 1.07 (s, 9H)。ESI [M+H] = 342.0。
製備化合物 34 。
將KOAc (21.56 g,219.68 mmol,5eq
.)及Br2
(35.11 g,219.68 mmol,5eq
.)添加至 N- 第三丁基 -5- 硝基 -2- 噻唑 -5- 基 - 苯磺醯胺
(15 g,43.94 mmol,1eq
.)含於AcOH (200 mL)之溶液。在80℃下攪拌混合物3小時。LCMS顯示反應完成,藉由飽和Na2
CO3
水溶液(1 L)中止混合物並用EtOAc (300 mL x 3)萃取。通過Na2
SO4
乾燥經合併之有機相,過濾並濃縮以獲得呈綠色固體之 2-(2- 溴噻唑 -5- 基 )-N- 第三丁基 -5- 硝基 - 苯磺醯胺
(18 g,粗製物),其無需進行任何純化即可使用。
製備化合物 35 。
將Fe (3.39 g,60.67 mmol,3eq
.)及NH4
Cl (3.25 g,60.67 mmol,2.12 mL,3eq
.)添加至 2-(2- 溴噻唑 -5- 基 )-N- 第三丁基 -5- 硝基 - 苯磺醯胺
(8.5 g,20.22 mmol,1eq
.)含於EtOH (70 mL)、THF (40 mL)及H 2
O (20 mL)之溶液。在90℃下攪拌混合物1小時。LCMS顯示反應完成。過濾混合物,濃縮濾液以移除有機溶劑並用DCM (200 mL x 2)萃取。通過Na2
SO4
乾燥有機相,過濾並濃縮以獲得呈黃色固體之 5- 胺基 -2-(2- 溴噻唑 -5- 基 )-N- 第三丁基 - 苯磺醯胺
(6 g,粗製物)。1
HNMR顯示結構正確。1
H NMR (400 MHz, DMSO-d6) δ = 7.58 - 7.52 (m, 1H), 7.30 (d, J=2.4 Hz, 1H), 7.11 (d, J=8.3 Hz, 1H), 6.99 (s, 1H), 6.73 (dd, J=2.4, 8.3 Hz, 1H), 5.94 (s, 2H), 1.07 (s, 9H)。ESI [M+H] = 390.0/392.0。
製備化合物 36 。
一般方法D,呈DCM溶液之 N-[4-(2- 溴噻唑 -5- 基 )-3-( 第三丁基胺磺醯基 ) 苯基 ] 胺基甲酸 (4- 硝基苯基 ) 酯
。ESI [M+H] = 555.0/557.0。
製備化合物 38 。 一般方法 B
( 鈴木反應 )
, N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 環己 -3- 烯 -1- 基 ] 胺基甲酸第三丁酯 ( 化合物 38) 。
將Pd(dppf)Cl2
(0.1eq
.)、 化合物 37
(0.9eq
.)及Na2
CO3
(3eq
.)添加至 化合物 17
(1eq
.)含於二噁烷及H2
O之溶液。在80℃下在N2
下攪拌混合物12小時。LCMS顯示反應完成。濃縮混合物並藉由製備型TLC(PE/EtOAc=1:1)純化殘餘物以獲得產物38
。ESI [M+H] = 640.5。
製備化合物 39 。 N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸第三丁酯
。
將Pd/C (10%純度,1.00eq
.)添加至 化合物 38
(1eq
.)及AcOH (0.1eq
.)含於EtOAc之溶液。在40℃下在H2
(15 psi)下攪拌混合物1小時。LCMS顯示反應完成並隨後過濾混合物並濃縮。藉由管柱層析法(SiO2
,石油醚/乙酸乙酯=10/1至1:1)純化殘餘物以獲得 化合物 39 。
ESI [M+H] = 642.5。
製備化合物 41
一般方法D, N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯
,ESI [M+H] = 628.3。
製備化合物實例 66A 及實例 66B 。
化合物41係藉由SFC (儀器:Thar SFC80製備型SFC;管柱:Chiralpak AD-H 250*30 mm i.d. 5u;流動相:A為CO2
及B為IPA (0.1% NH3
H2
O);梯度:B%=42%;流速:70 g/min;波長:220 nm;管柱溫度:40℃;系統背壓:100巴;循環時間:20分鐘;注射量:每次注射4 mg)進行分離,並隨後藉由製備型HPLC (管柱:Luna C18 100*30 5u;流動相:[水(0.1%TFA)-ACN];B%:35%-75%,5分鐘)進行純化。獲得 反式 -N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯實例 66A
(11.54 mg,18.38 μmol,5.53%產率,100%純度)及 順式 -N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯實例 66B
(9.38 mg,14.94 μmol,4.50%產率,100%純度)。
反式 -N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯
,1
H NMR (400 MHz, 甲醇-d4) δ = 8.24 (d, J=2.2 Hz, 1H), 7.72 (s, 1H), 7.69 (dd, J=2.6, 8.3 Hz, 1H), 7.37 - 7.30 (m, 5H), 7.27 - 7.22 (m, 1H), 4.85 - 4.78 (m, 1H), 4.41 (s, 2H), 3.50 - 3.39 (m, 1H), 3.06 - 2.96 (m, 1H), 2.22 (br d, J=11.8 Hz, 2H), 2.07 (br d, J=10.1 Hz, 2H), 1.76 - 1.62 (m, 2H), 1.41 (dq, J=3.1, 12.7 Hz, 2H), 1.22 (br d, J=6.1 Hz, 6H), 1.11 (s, 9H)。ESI [M+H] = 628.2。
順式 -N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.25 (d, J=2.2 Hz, 1H), 7.74 (s, 1H), 7.70 (dd, J=2.2, 8.3 Hz, 1H), 7.38 - 7.30 (m, 5H), 7.28 - 7.22 (m, 1H), 4.82 (br d, J=6.1 Hz, 1H), 4.41 (s, 2H), 3.74 (br s, 1H), 3.20 - 3.13 (m, 1H), 2.03 - 1.95 (m, 4H), 1.86 - 1.72 (m, 4H), 1.23 (d, J=6.1 Hz, 6H), 1.12 (s, 9H)。ESI [M+H] = 628.2。
實例 67A 及 67B 反應圖 26 : 製備化合物 42 。
一般方法D, N-[4-(2- 溴噻唑 -5- 基 )-3-( 第三丁基胺磺醯基 ) 苯基 ] 胺基甲酸異丙酯。
ESI [M+H] =476.0/478.0。
製備化合物 43
一般方法B, N-[4-[2-[4-( 第三丁氧基羰基胺基 ) 環己烯 -1- 基 ] 噻唑 -5- 基 ]-3-( 第三丁基胺磺醯基 ) 苯基 ] 胺基甲酸異丙酯
。ESI [M+H] =593.3。
製備化合物 44 。
一般方法I, N-[4-[2-[4-( 第三丁氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ]-3-( 第三丁基胺磺醯基 ) 苯基 ] 胺基甲酸異丙酯
。ESI [M+H] =595.3。
製備化合物 46 。
一般方法D, N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸異丙酯
。ESI [M+H] =581.2。
製備實例 67A 及實例 67B 。
化合物46係藉由SFC (儀器:Thar SFC80製備型SFC;管柱:ChiralpakAD-H 250*30mm i.d. 5u;流動相:A為CO2
及B為IPA (0.1% NH3
H2
O);梯度:B%=30%;流速:70 g/min;波長:220 nm;管柱溫度:40℃;系統背壓:100巴;循環時間:8分鐘;注射量:每次注射3 mg)進行分離;並隨後藉由製備型HPLC (管柱:Agela Durashell C18 150*25 5u;流動相:[水(0.1%TFA)-ACN];B%: 55%-85%,12分鐘)進行純化, 獲得呈淺黃色固體之反式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸異丙酯實例 67A
(5.76 mg,100%純度)及 順式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸異丙酯實例 67B
(3.95 mg,100%純度) 。
反式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸異丙酯 ( 化合物 S12) 。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.37 (d, J=2.3 Hz, 1H), 7.75 (s, 1H), 7.69 (dd, J=2.2, 8.4 Hz, 1H), 7.40 (d, J=8.3 Hz, 1H), 5.01 (td, J=6.3, 12.5 Hz, 1H), 4.86 - 4.82 (m, 1H), 3.52 - 3.42 (m, 1H), 3.04 (tt, J=3.5, 12.0 Hz, 1H), 2.35 - 2.19 (m, 2H), 2.15 - 1.99 (m, 2H), 1.72 (dq, J=3.0, 12.9 Hz, 2H), 1.43 (dq, J=3.3, 12.6 Hz, 2H), 1.34 (d, J=6.2 Hz, 6H), 1.25 (br d, J=6.1 Hz, 6H), 1.14 (s, 9H)。ESI [M+H] = 581.2。
順式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸異丙酯 ( 化合物 S13) 。 1
H NMR (400 MHz, 甲醇-d4) δ = 8.37 (d, J=2.2 Hz, 1H), 7.76 (s, 1H), 7.70 (dd, J=2.2, 8.3 Hz, 1H), 7.40 (d, J=8.3 Hz, 1H), 5.01 (td, J=6.3, 12.5 Hz, 1H), 4.84 (br s, 1H), 3.77 (br s, 1H), 3.23 - 3.15 (m, 1H), 2.05 - 1.98 (m, 4H), 1.89 - 1.72 (m, 4H), 1.34 (d, J=6.2 Hz, 6H), 1.25 (d, J=6.1 Hz, 6H), 1.16 (s, 9H)。ESI [M+H] = 581.2。
實例 68 合成 N-[1-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ]-4- 哌啶基 ] 胺基甲酸異丙酯。 反應圖 27 : 製備化合物 24 。
在N2
下,將 1- 苄基 -3-[4-(2- 溴噻唑 -5- 基 )-3-( 第三丁基胺磺醯基 ) 苯基 ] 脲
(0.06 g,114.62 μmol,1.0 eq.)、N-(4-哌啶基)胺基甲酸第三丁酯(40 mg,199.72 μmol,1.74 eq.)、Xantphos (6.63 mg,11.46 μmol,0.1 eq.)、Pd(OAc)2
(2.57 mg,11.46 μmol,0.1 eq.)及Cs2
CO3
(112.04 mg,343.86 μmol,3.0 eq.)含於ACN (3 mL)之混合物加熱至80℃持續12小時。LCMS顯示反應完成並濃縮混合物。藉由製備型TLC (石油醚:乙酸乙酯 = 1:1)純化殘餘物以獲得呈黃色固體之 N-[1-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ]-4- 哌啶基 ] 胺基甲酸第三丁酯
(0.03 g,粗製物)。ESI [M+H] = 643.1。
製備化合物 25 。
將 N-[1-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ]-4- 哌啶基 ] 胺基甲酸第三丁酯
(30 mg,46.67 μmol,1.0 eq.)溶解於HCl/MeOH (4M, 1 mL)中並在20℃下攪拌混合物0.5小時。LCMS顯示反應完成並濃縮混合物以獲得呈黃色固體之 1-[4-[2-(4- 胺基 -1- 哌啶基 ) 噻唑 -5- 基 ]-3-( 第三丁基胺磺醯基 ) 苯基 ]-3- 苄基 - 脲
(27 mg,粗製物,HCl鹽)。ESI [M+H] = 543.2。
製備實例 68 。
一般方法D, N-[1-[5-[4-( 苄基胺甲醯基胺基 )-2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ]-4- 哌啶基 ] 胺基甲酸異丙酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.24 (d, J=2.2 Hz, 1H), 7.69 (dd, J=2.4, 8.4 Hz, 1H), 7.39 (d, J=8.4 Hz, 1H), 7.36 - 7.19 (m, 6H), 4.82 - 4.73 (m, 1H), 4.40 (s, 2H), 3.92 (br d, J=13.7 Hz, 2H), 3.75 - 3.68 (m, 1H), 3.43 (br t, J=11.0 Hz, 2H), 2.10 - 2.02 (m, 2H), 1.71 - 1.60 (m, 2H), 1.22 (br d, J=6.2 Hz, 6H), 1.18 (s, 9H)。ESI [M+H] = 629.2。
實例 69 合成 N-[1-[5-[2-( 第三丁基胺磺醯基 )-4-( 異丙氧基羰基胺基 ) 苯基 ] 噻唑 -2- 基 ]-4- 哌啶基 ] 胺基甲酸異丙酯 。 反應圖 28 : 製備化合物 26 。
一般方法D, N-[4-(2- 溴噻唑 -5- 基 )-3-( 第三丁基胺磺醯基 ) 苯基 ] 胺基甲酸異丙酯
。ESI [M+H] = 478.0/476.0。
製備化合物 27 。
將Cs2
CO3
(102.59 mg,314.86 μmol,3.0 eq.)、KI (17.42 mg,104.95 μmol,1.0 eq.)及N-(4-哌啶基)胺基甲酸第三丁酯(105.10 mg,524.76 μmol,5.0 eq.)添加至 N-[4-(2- 溴噻唑 -5- 基 )-3-( 第三丁基胺磺醯基 ) 苯基 ] 胺基甲酸異丙酯
(0.05 g,104.95 μmol,1.0 eq.)含於MeCN (2 mL)之溶液。在95℃下攪拌混合物12小時並隨後濃縮。藉由製備型TLC純化殘餘物(SiO2
,石油醚:乙酸乙酯 = 4:3)以獲得呈白色固體之 N-[4-[2-[4-( 第三丁氧基羰基胺基 )-1- 哌啶基 ] 噻唑 -5- 基 ]-3-( 第三丁基胺磺醯基 ) 苯基 ] 胺基甲酸 異丙 酯
(0.025 g,粗製物)。ESI [M+H] = 596.2。
製備化合物 28 。
將 N-[4-[2-[4-( 第三丁氧基羰基胺基 )-1- 哌啶基 ] 噻唑 -5- 基 ]-3-( 第三丁基胺磺醯基 ) 苯基 ] 胺基甲酸異丙酯
(0.025 g,41.96 μmol,1.0 eq.)溶解於HCl/MeOH (4M,1.5 mL)中並在20℃下攪拌混合物0.5小時。LCMS顯示反應完成並濃縮混合物以獲得呈白色固體之 N-[4-[2-(4- 胺基 -1- 哌啶基 ) 噻唑 -5- 基 ]-3-( 第三丁基胺磺醯基 ) 苯基 ] 胺基甲酸 異丙 酯
(0.02 g,粗製物,HCl鹽)。ESI [M+H] = 496.2。
製備實例 69 。
一般方法D, N-[1-[5-[2-( 第三丁基胺磺醯基 )-4-( 異丙氧基羰基胺基 ) 苯基 ] 噻唑 -2- 基 ]-4- 哌啶基 ] 胺基甲酸異丙酯
。1
H NMR (400 MHz, 甲醇-d4) δ = 8.35 (s, 1H), 7.66 (br d, J=8.4 Hz, 1H), 7.42 (d, J=8.4 Hz, 1H), 7.31 (s, 1H), 4.98 (td, J=6.2, 12.5 Hz, 1H), 4.84 - 4.77 (m, 1H), 3.93 (br d, J=13.5 Hz, 2H), 3.77 - 3.67 (m, 1H), 3.44 (br t, J=12.3 Hz, 2H), 2.06 (br dd, J=3.1, 13.2 Hz, 2H), 1.71 - 1.61 (m, 2H), 1.31 (d, J=6.4 Hz, 6H), 1.23 (br d, J=6.2 Hz, 6H), 1.19 (s, 9H)。ESI [M+H] = 582.2。實例 70 合成反式 -N-[4-[5-[2-( 第三丁基胺磺醯基 )-4-[(2- 氟苯基 ) 甲氧基羰基胺基 ] 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯。 反應圖 29 : 製備化合物 2 。
將HBTU (111.5 g,293.9 mmol,1.1eq.
)添加至 反式 -4-( 第三丁氧基羰基胺基 ) 環己烷甲酸
(65.0 g,267.2 mmol,1.0eq.
)、NH4
Cl (21.4 g,400.7 mmol,1.5eq.
)及TEA (801.5 mmol,111.6 mL,3eq.
)含於MeCN (1.3 L)之混合物並在25℃下攪拌混合物3小時。過濾混合物並隨後用石油醚 (200 mL)洗滌濾餅並乾燥以獲得呈白色固體之 反式 -N-(4- 胺甲醯基環己基 ) 胺基甲酸第三丁酯
(140 g,粗製,2批)。1
H NMR (甲醇-d4, 400 MHz) δ = 3.25-3.34 (m, 1H), 2.14 (tt, J=12.3, 3.5 Hz, 1H), 1.83-1.99 (m, 4H), 1.52 (qd, J=13.1, 2.9 Hz, 2H), 1.42 (s, 9H), 1.21 (qd, J=12.7, 3.5 Hz, 2H)
製備化合物 3 。
在80℃下攪拌 反式 -N-(4- 胺甲醯基環己基 ) 胺基甲酸第三丁酯
(90.0 g,371.4 mmol,1.0eq.
)、Na2
CO3
(39.4 g,371.4 mmol,1.0eq.
)及勞森試劑(Lawesson's reagent) (82.6 g,204.3 mmol,0.55eq.
)含於2-Me-THF (600 mL)之混合物2小時並隨後將反應混合物倒入至H2
O (200 mL)中。用EtOAc (500 mL x 2)萃取水相。通過Na2
SO4
乾燥經合併之有機層,過濾並濃縮以獲得呈白色固體之 反式 -N-(4- 胺甲醯硫基環己基 ) 胺基甲酸第三丁酯
(180 g,粗製物,2批)。1
H NMR (甲醇-d4, 400 MHz) δ = 3.35-3.46 (m, 1H), 2.87-3.00 (m, 1H), 2.09-2.20 (m, 2H), 1.99-2.09 (m, 2H), 1.54-1.68 (m, 2H), 1.26-1.45 (m, 2H), 1.14-1.25 (m, 9H)。
製備化合物 4 。
在80℃下攪拌 反式 -N-(4- 胺甲醯硫基環己基 ) 胺基甲酸第三丁酯
(180.0 g,696.7 mmol,1.0eq.
)、2-溴-1,1-二乙氧基-乙烷(137.3 g,696.7 mmol,1.0eq.
)及TsOH.H2
O (265 g,1.4 mol,2eq.
)含於EtOH (2.0 L)之混合物6小時。隨後使混合物冷卻至RT並用飽和Na2
CO3
水溶液調整至PH=9並添加Boc2
O (152 g,696.7 mmol,1eq.
)。在30℃下攪拌混合物3小時,隨後濃縮並用H2
O (2 L)稀釋。用EtOAc (800 mL x 3)萃取混合物並通過Na2
SO4
乾燥經合併之有機層,過濾並濃縮。用石油醚 (1.5 L)研磨殘餘物以獲得呈白色固體之 反式 -N-(4- 噻唑 -2- 基環己基 ) 胺基甲酸第三丁酯
(70 g,247.87 mmol,35.58%產率)。1
H NMR (甲醇-d4, 400 MHz) δ = 7.67 (d, J=3.1 Hz, 1H), 7.44 (d, J=3.5 Hz, 1H), 3.33-3.44 (m, 1H), 2.93-3.06 (m, 1H), 2.12-2.21 (m, 2H), 2.00-2.09 (m, 2H), 1.57-1.71 (m, 2H), 1.41-1.48 (m, 9H), 1.29-1.38 (m, 1H), 1.13-1.28 (m, 1H)。
製備化合物 5 。
在25℃下攪拌 反式 -N-(4- 噻唑 -2- 基環己基 ) 胺基甲酸第三丁酯
(68 g,240.8 mmol,1eq.
)及NBS (47.1 g,264.9 mmol,1.1eq.
)含於DMF (500 mL)之混合物10小時並隨後倒入至H2
O (2 L)中並用EtOAc (500 mL x 3)萃取。用鹽水(300 mL x 5)洗滌經合併之有機層,通過Na2
SO4
乾燥,過濾並濃縮。藉由管柱層析法(SiO2
,石油醚:乙酸乙酯 = 20:1至10:1)純化殘餘物以獲得呈黃色固體之 反式 -N-[4-(5- 溴噻唑 -2- 基 ) 環己基 ] 胺基甲酸第三丁酯
(78 g,粗製物)。ESI [M+H] = 363.0/361.0。
製備化合物 6 。
在25℃下攪拌 反式 - 第三丁基 N-[4-(5- 溴噻唑 -2- 基 ) 環己基 ] 胺基甲酸酯
(50 g,138.4 mmol,1eq.
)含於HCl/MeOH (4 M,700 mL)之混合物0.5小時並隨後濃縮以獲得呈黃色固體之 反式 -4-(5- 溴噻唑 -2- 基 ) 環己胺
(45 g,粗製,HCl鹽)。ESI [M+H] = 263.0/261.0。
製備化合物 7 。
在0℃下,將氯甲酸異丙酯(258.5 mmol,35.9 mL,1.5eq.
)逐滴添加至 反式 -4-(5- 溴噻唑 -2- 基 ) 環己胺
(45 g,HCl 鹽,172.3 mmol,1eq.
)、吡啶(61.5 mmol,69.5 mL,5eq.
)及DMAP (4.2 g,34.5 mmol,0.2eq.
)含於DCM (300 mL)之溶液。在25℃下攪拌混合物0.5小時並隨後用HCl (1N,1 L)及飽和Na2
CO3
水溶液(1 L)洗滌。通過Na2
SO4
乾燥有機層,過濾並濃縮。藉由管柱層析法(SiO2
,石油醚:乙酸乙酯=15:1至10:1)純化殘餘物以獲得呈黃色固體之 反式 -N-[4-(5- 溴噻唑 -2- 基 ) 環己基 ] 胺基甲酸異丙酯
(37 g,106.55 mmol,61.84%產率)。1
H NMR (甲醇-d4, 400 MHz) δ = 7.60 (s, 1H), 4.81 (dt, J=12.2, 6.2 Hz, 1H), 3.41 (tt, J=11.6, 4.0 Hz, 1H), 2.88-3.00 (m, 1H), 2.10-2.20 (m, 2H), 1.98-2.07 (m, 2H), 1.55-1.68 (m, 2H), 1.30-1.43 (m, 2H), 1.21 (br d, J=6.2 Hz, 6H)。
製備化合物 8 。
在80℃下,在N2
氣氛下攪拌 反式 -N-[4-(5- 溴噻唑 -2- 基 ) 環己基 ] 胺基甲酸異丙酯
(16.2 g,46.7 mmol,1eq.
)、 5- 胺基 -N- 第三丁基 -2-(4,4,5,5- 四甲基 -1,3,2- 二氧雜硼雜環戊 -2- 基 ) 苯磺醯胺
(19.9 g,56.1 mmol,1.2eq.
)、KF (4.1 g,70.1 mmol,1.5eq.
)、Na2
CO3
(14.9 g,140.2 mmol,3eq.
)及Pd(PPh3
)4
(1.6 g,1.4 mmol,0.03eq.
)含於甲苯 (150 mL)、EtOH (150 mL)及H2
O (50 mL)之混合物6小時。濃縮反應混合物並用H2
O (100 mL)稀釋殘餘物並用EtOAc (100 mL x 2)萃取。通過Na2
SO4
乾燥經合併之有機層,過濾並濃縮。藉由管柱層析法(SiO2
,石油醚:乙酸乙酯 = 20:1至1:1)純化殘餘物以獲得呈白色固體之 反式 -N-[4-[5-[4- 胺基 -2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯
(13 g,26.3 mmol,56.2%產率)。1
H NMR (400 MHz, 甲醇-d4) δ = 7.65 - 7.60 (m, 1H), 7.43 (d, J=2.2 Hz, 1H), 7.13 (d, J=8.3 Hz, 1H), 6.83 (dd, J=2.6, 8.3 Hz, 1H), 4.81 (br s, 1H), 3.76 - 3.71 (m, 1H), 3.05 - 2.86 (m, 1H), 2.20 (br d, J=12.3 Hz, 2H), 2.06 (br d, J=10.5 Hz, 2H), 1.75 - 1.60 (m, 2H), 1.47 - 1.34 (m, 2H), 1.22 (br d, J=6.1 Hz, 6H), 1.09 (s, 9H)。
製備化合物 9 。
將DMAP (6.2 mg,50.5 μmol,0.1eq.
)、吡啶(120 mg,1.5 mmol,3eq.
)及氯甲酸(4-硝基苯基)酯(153 mg,758 μmol,1.5eq.
)添加至 反式 -N-[4-[5-[4- 胺基 -2-( 第三丁基胺磺醯基 ) 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯
(250 mg,505.4 μmol,1eq.
)含於DCM (4 mL)之溶液。在25℃下攪拌混合物0.5小時並直接用於下一步驟。ESI [M+H] = 660.2
製備化合物實例 70 。
將上述溶液(1 mL)添加至(2-氟苯基)甲醇(45.9 mg,363.8 μmol,3eq.
)及DIEA (47 mg,363.8 μmol,3eq.
)含於MeCN (1 mL)之溶液。在80℃下攪拌混合物1小時,隨後濃縮並藉由製備型HPLC (管柱:Waters Xbridge 150*25 5u;流動相:[水(10 mM NH4
HCO3
)-ACN];B%:42%-72%,12分鐘)純化殘餘物以獲得呈黃色固體之 反式 -N-[4-[5-[2-( 第三丁基胺磺醯基 )-4-[(2- 氟苯基 ) 甲氧基羰基胺基 ] 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯
(16.34 mg,25.26 μmol,20.83%產率,100%純度)。1
H NMR (400 MHz, 甲醇-d4) δ = 8.36 (s, 1H), 7.77 - 7.63 (m, 2H), 7.52 (t, J=7.0 Hz, 1H), 7.44 - 7.31 (m, 2H), 7.23 - 7.08 (m, 2H), 5.29 (s, 2H), 4.83 (br s, 1H), 3.46 (br d, J=11.8 Hz, 1H), 3.00 (br t, J=11.8 Hz, 1H), 2.22 (br d, J=12.7 Hz, 2H), 2.07 (br d, J=11.4 Hz, 2H), 1.76 - 1.62 (m, 2H), 1.47 - 1.35 (m, 2H), 1.22 (br d, J=6.1 Hz, 6H), 1.12 (s, 9H)。ESI [M+H] = 647.2
實例 71 合成反式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸 [(1S)-1- 苯基乙基 ] 酯。 反應圖 30 : 製備實例 71 。
將 反式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸 (4- 硝基苯基 ) 酯
(80 mg,121.25 μmol,1eq.
)含於DCM (1 mL)之溶液添加至(1S)-1-苯基乙醇(29.6 mg,242.5 μmol,2eq.
)及DIEA (47 mg,363.8 μmol,3eq.
)含於MeCN (2 mL)之溶液。在80℃下攪拌混合物1小時,隨後濃縮並藉由製備型HPLC (管柱:Nano-Micro UniSil 5-100 C18 ULTRA 100*250mm 5um;流動相:[水(0.1% TFA)-ACN];B%:55%-80%,11分鐘)純化殘餘物以獲得呈白色固體之 反式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸 [(1S)-1- 苯基乙基 ] 酯
(12.19 mg,18.77 μmol,15.48%產率,99%純度)。1
H NMR (400 MHz, 甲醇-d4) δ = 8.35 (br s, 1H), 7.81 - 7.65 (m, 2H), 7.48 - 7.36 (m, 5H), 7.31 (br d, J=6.8 Hz, 1H), 5.89 (br d, J=6.2 Hz, 1H), 4.85 (br d, J=5.5 Hz, 1H), 3.47 (br s, 1H), 3.03 (br s, 1H), 2.24 (br d, J=11.2 Hz, 2H), 2.08 (br d, J=11.0 Hz, 2H), 1.71 (q, J=11.9 Hz, 2H), 1.61 (br d, J=6.4 Hz, 3H), 1.49 - 1.37 (m, 2H), 1.24 (br d, J=5.4 Hz, 6H), 1.13 (s, 9H)。ESI [M+H] = 643.2
實例 72 合成 N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸酯。 反應圖 31 : 製備實例 72 。
將 反式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸 (4- 硝基苯基 ) 酯
(80 mg,121.3 μmol,1eq.
)含於DCM (1 mL)之溶液添加至2-吡啶基甲醇(26.5 mg,242.5 μmol,2eq.
)及DIEA (47 mg,363.8 μmol,3eq.
)含於MeCN (2 mL)之溶液。在80℃下攪拌混合物1小時,隨後濃縮並藉由製備型HPLC (管柱:Waters Xbridge 150*25 5u;流動相:[水(0.04% NH3
H2
O + 10 mM NH4
HCO3
)-ACN];B%:35%-65%,10分鐘)純化殘餘物以獲得呈淺黃色固體之 反式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸 2- 吡啶基甲酯
(18.59 mg,28.82 μmol,23.77%產率,97.65%純度)。1
H NMR (400 MHz, 甲醇-d4) δ = 8.56 (br d, J=4.5 Hz, 1H), 8.38 (d, J=1.8 Hz, 1H), 7.94 - 7.87 (m, 1H), 7.78 - 7.72 (m, 2H), 7.59 (br d, J=7.8 Hz, 1H), 7.44 - 7.38 (m, 2H), 5.32 (s, 2H), 4.85 (td, J=5.9, 12.0 Hz, 1H), 3.47 (br t, J=11.8 Hz, 1H), 3.07 - 2.96 (m, 1H), 2.24 (br d, J=12.3 Hz, 2H), 2.13 - 2.04 (m, 2H), 1.77 - 1.65 (m, 2H), 1.48 - 1.37 (m, 2H), 1.24 (br d, J=6.1 Hz, 6H), 1.14 (s, 9H)。ESI [M+H] = 630.2。
實例 73 合成反式 -N-[4-[5-[2-( 第三丁基胺磺醯基 )-4-[(4- 羥基苯基 ) 甲基胺甲醯基胺基 ] 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯。 反應圖 32 : 製備實例 73 。
將 反式 -N-[3-( 第三丁基胺磺醯基 )-4-[2-[4-( 異丙氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸 (4- 硝基苯基 ) 酯
(133.4 mg,202.2 μmol,1eq.
)含於DCM (2 mL)添加至4-(胺基甲基)苯酚(74.7 mg,606.5 μmol,3eq.
)及DIEA (78.4 mg,606.5 μmol,3eq.
)含於DCM (2 mL)之溶液。在25℃下攪拌混合物1小時,隨後濃縮並藉由製備型HPLC (TFA條件)純化殘餘物以獲得呈白色固體之 反式 -N-[4-[5-[2-( 第三丁基胺磺醯基 )-4-[(4- 羥基苯基 ) 甲基胺甲醯基胺基 ] 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯
(23.56 mg,35.99 μmol,17.80%產率,98.357%純度)。1
H NMR (400 MHz, 甲醇-d4) δ = 8.24 (d, J=2.2 Hz, 1H), 7.77 (s, 1H), 7.69 (dd, J=2.2, 8.3 Hz, 1H), 7.36 (d, J=8.3 Hz, 1H), 7.16 (d, J=8.8 Hz, 2H), 6.75 (d, J=8.3 Hz, 2H), 4.85 - 4.74 (m, 1H), 4.30 (s, 2H), 3.45 (s, 1H), 3.15 - 2.97 (m, 1H), 2.23 (br d, J=12.3 Hz, 2H), 2.08 (br d, J=13.2 Hz, 2H), 1.79 - 1.63 (m, 2H), 1.48 - 1.34 (m, 2H), 1.22 (br d, J=6.1 Hz, 6H), 1.12 (s, 9H)。ESI [M+H] = 644.2。
實例 74 合成反式 -N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-[(2- 羥基 -1,1- 二甲基 - 乙基 ) 胺磺醯基 ] 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯。 反應圖 33 : 製備化合物 11 。
將 2- 溴 -5- 硝基 - 苯磺醯氯
(2 g,6.66 mmol,1eq.
)添加至 2- 胺基 -2- 甲基 - 丙 -1- 醇
(3 g,33.7 mmol,5.1eq.
)及DMAP (80 mg,654.8 μmol,0.98eq.
)含於DCM (50 mL)之混合物。在20℃下攪拌混合物30分鐘,隨後用1N HCl (20 mL)及飽和NaHCO3
水溶液(20 mL)洗滌。通過Na2
SO4
乾燥有機層,過濾並濃縮以獲得呈黃色膠之 2- 溴 -N-(2- 羥基 -1,1- 二甲基 - 乙基 )-5- 硝基 - 苯磺醯胺
(1.7 g,4.8 mmol,72.3%產率)。ESI [M+H] = 355.0/353.0
製備化合物 12 。
在80℃下攪拌 2- 溴 -N-(2- 羥基 -1,1- 二甲基 - 乙基 )-5- 硝基 - 苯磺醯胺
(1.7 g,4.8 mmol,1eq.
)、Fe (1.5 g,26.9 mmol,5.6eq.
)及NH4
Cl (800 mg,14.9 mmol,3.1eq.
)含於EtOH (15 mL)/H2
O (7.5 mL)/THF (7.5 mL)之混合物2小時。濃縮反應混合物以移除EtOH,用H2
O (100 mL)稀釋並用EtOAc (100 mL x 3)萃取。通過Na2
SO4
乾燥經合併之有機層,過濾並濃縮。藉由管柱層析法(SiO2
,石油醚:乙酸乙酯 = 100:1至1:1)純化殘餘物以獲得呈淺黃色固體之 5- 胺基 -2- 溴 -N-(2- 羥基 -1,1- 二甲基 - 乙基 ) 苯磺醯胺
(1.1 g,3.4 mmol,70.7%產率)。ESI [M+H] = 325.0/323.0
製備化合物 13 。
在80℃下在N2
氣氛下攪拌 5- 胺基 -2- 溴 -N-(2- 羥基 -1,1- 二甲基 - 乙基 ) 苯磺醯胺
(400 mg,1.24 mmol,1eq.
)、4,4,5,5-四甲基-2-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊-2-基)-1,3,2-二氧雜硼雜環戊烷(942.8 mg,3.7 mmol,3eq.
)、Pd(dppf)Cl2
(90.6 mg,123.8 μmol,0.1eq.
)及KOAc (364.4 mg,3.7 mmol,3eq.
)含於二噁烷(4 mL)之混合物12小時並隨後濃縮。藉由管柱層析法(SiO2
,石油醚:乙酸乙酯 = 50:1至3:1)純化殘餘物以獲得呈白色固體之 5- 胺基 -N-(2- 羥基 -1,1- 二甲基 - 乙基 )-2-(4,4,5,5- 四甲基 -1,3,2- 二氧雜硼雜環戊 -2- 基 ) 苯磺醯胺
(201 mg,粗製物)。1
H NMR (400 MHz, 甲醇-d4) δ = 7.53 (d, J=8.0 Hz, 1H), 7.28 (d, J=2.4 Hz, 1H), 6.75 (dd, J=6.4 Hz, 1H), 3.35 (s, 2H), 1.36 (s, 12H), 1.10 (s, 6H)。
製備化合物 14 。
在80℃下,在N2
氣氛下攪拌 5- 胺基 -N-(2- 羥基 -1,1- 二甲基 - 乙基 )-2-(4,4,5,5- 四甲基 -1,3,2- 二氧雜硼雜環戊 -2- 基 ) 苯磺醯胺
(140.7 mg,380.1 μmol,1.2eq.
)、 反式 -N-[4-(5- 溴噻唑 -2- 基 ) 環己基 ] 胺基甲酸異丙酯
(110 mg,316.7 μmol,1eq.
)、Na2
CO3
(100.7 mg,950.3 μmol,3eq.
)、KF (27.6 mg,475.1 μmol,1.5eq.
)及Pd(PPh3
)4
(36.6 mg,31.7 μmol,0.1eq.
)含於甲苯(1 mL)/EtOH (1 mL)/H2
O (0.3 mL)之混合物12小時。濃縮反應混合物,用H2
O (10 mL)稀釋並用EtOAc (10 mL x 2)萃取。通過Na2
SO4
乾燥經合併之有機層,過濾並濃縮。藉由製備型TLC (SiO2
,乙酸乙酯)純化殘餘物以獲得呈黃色固體之 反式 -N-[4-[5-[4- 胺基 -2-[(2- 羥基 -1,1- 二甲基 - 乙基 ) 胺磺醯基 ] 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯
(117 mg,粗製物)。1
H NMR (400 MHz, 甲醇-d4) δ = 7.63 (d, J=7.0 Hz, 1H), 7.44 (d, J=2.2 Hz, 1H), 7.15 (d, J=8.3 Hz, 1H), 6.83 (dd, J=2.4, 8.1 Hz, 1H), 4.85 - 4.78 (m, 1H), 3.50 - 3.39 (m, 1H), 3.25 (s, 2H), 3.03 - 2.91 (m, 1H), 2.21 (br t, J=6.1 Hz, 2H), 2.12 - 2.00 (m, 2H), 1.75 - 1.60 (m, 2H), 1.45 - 1.33 (m, 2H), 1.28 - 1.19 (s, 6H), 1.03 (s, 6H)。
製備化合物 15 。
將TEA (53.5 mg,528.7 μmol,3eq.
)、DMAP (2.2 mg,17.6 μmol,0.1eq.
)及TBSCl (66.4 mg,440.6 μmol,2.5eq.
)添加至 反式 -N-[4-[5-[4- 胺基 -2-[(2- 羥基 -1,1- 二甲基 - 乙基 ) 胺磺醯基 ] 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯
(90 mg,176.3 μmol,1eq.
)含於DCM (1 mL)之溶液。在30℃下攪拌混合物12小時並隨後濃縮。藉由製備型TLC (SiO2
,石油醚:乙酸乙酯 = 2:1)純化殘餘物以獲得呈淺黃色固體之 反式 -N-[4-[5-[4- 胺基 -2-[[2-[ 第三丁基 ( 二甲基 ) 甲矽烷基 ] 氧基 -1,1- 二甲基 - 乙基 ] 胺磺醯基 ] 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯
(120 mg,粗製物)。ESI [M+H] = 625.2。
製備化合物 16 。
將DMAP (1.8 mg,14.4 μmol,0.1eq.
)、吡啶(34.2 mg,432 μmol,3eq.
)及氯甲酸(4-硝基苯基)酯(43.5 mg,216 μmol,1.5eq.
)添加至 反式 -N-[4-[5-[4- 胺基 -2-[[2-[ 第三丁基 ( 二甲基 ) 甲矽烷基 ] 氧基 -1,1- 二甲基 - 乙基 ] 胺磺醯基 ] 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯
(90 mg,144 μmol,1eq.
)含於DCM (1 mL)之溶液。在25℃下攪拌混合物0.5小時並直接用於下一步驟而無需進一步純化。ESI [M+H] = 790.3
製備化合物 17 。
將 反式 -N-[3-[[2-[ 第三丁基 ( 二甲基 ) 甲矽烷基 ] 氧基 -1,1- 二甲基 - 乙基 ] 胺磺醯基 ]-4-[2-[4-( 異丙氧基羰基胺基 ) 環己基 ] 噻唑 -5- 基 ] 苯基 ] 胺基甲酸 (4- 硝基苯基 ) 酯
(88.5 mg,112 μmol,1eq.
)含於DCM (1 mL)之溶液添加至苯基甲胺(36 mg,336 μmol,3eq.
)含於DCM (1 mL)之溶液並在25℃下攪拌混合物0.5小時。用H2
O (10 mL)稀釋反應混合物並用EtOAc (10 mL x 2)萃取。通過Na2
SO4
乾燥經合併之有機層,過濾並濃縮。藉由製備型TLC (SiO2
,石油醚:乙酸乙酯 = 1:1)純化殘餘物以獲得呈黃色膠之 反式 -N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-[[2-[ 第三丁基 ( 二甲基 ) 甲矽烷基 ] 氧基 -1,1- 二甲基 - 乙基 ] 胺磺醯基 ] 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯
(93 mg,粗製物)。ESI [M+H] = 758.4。
製備實例 74 。
在80℃下攪拌 反式 -N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-[[2-[ 第三丁基 ( 二甲基 ) 甲矽烷基 ] 氧基 -1,1- 二甲基 - 乙基 ] 胺磺醯基 ] 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯
(84.9 mg,112 μmol,1eq.
)含於AcOH (0.5 mL)/THF (0.5 mL)/H2
O (0.5 mL)之混合物0.5小時。隨後濃縮混合物並藉由製備型HPLC (TFA條件)純化殘餘物以獲得呈黃色固體之 反式 -N-[4-[5-[4-( 苄基胺甲醯基胺基 )-2-[(2- 羥基 -1,1- 二甲基 - 乙基 ) 胺磺醯基 ] 苯基 ] 噻唑 -2- 基 ] 環己基 ] 胺基甲酸異丙酯
(5.86 mg,9.10 μmol,8.13%產率,100%純度)。1
H NMR (400 MHz, 甲醇-d4) δ = 8.25 (d, J=2.6 Hz, 1H), 7.81 - 7.66 (m, 2H), 7.40 - 7.30 (m, 5H), 7.28 - 7.22 (m, 1H), 4.82 (td, J=6.0, 12.5 Hz, 1H), 4.41 (s, 2H), 3.45 (br t, J=11.6 Hz, 1H), 3.28 (s, 2H), 3.00 (br t, J=11.8 Hz, 1H), 2.23 (br d, J=13.2 Hz, 2H), 2.11 - 2.00 (m, 2H), 1.77 - 1.60 (m, 2H), 1.48 - 1.32 (m, 2H), 1.22 (br d, J=6.1 Hz, 6H), 1.05 (s, 6H)。ESI [M+H] = 644.3
實例 75 化合物初步篩選 1. 背景
初步篩選為一種表型篩選,其利用AID與RAD51之間之合成致死相互作用來鑑定既強效又在目標上之化合物。表現AID之細胞的存活取決於RAD51;在AID陽性細胞中抑制RAD51導致細胞毒性作用。基於此種作用,鑑定出在AID陽性細胞中強效且在AID陰性細胞中顯著降低效力之化合物。
2. 材料及供應
此實驗所需之塑料製品及消耗品包括:細胞培養基;蒸發緩衝介質;100% DMSO;96孔U-底無菌培養板;250 mL瓶;1.5 mL不透明琥珀色epi管;Epi管支架;300 mL儲液器;25 mL儲液器;25 mL血清吸量管吸頭;5 mL血清吸量管吸頭;P1000吸量管吸頭;及P200吸量管吸頭。
此實驗所需之設備包括:Viaflo 384液體處理器;Eppendorf血清吸量管;Eppendorf P1000吸量管;及Eppendorf P200吸量管
此實驗亦需要Daudi細胞培養物及WI-38細胞培養物。
最後,需要待測試之化合物(例如,本發明化合物)。
3.
程序
所有步驟均在生物安全櫃內之無菌環境中進行。
第一步為在Daudi細胞系(AID陽性)中設置細胞殺傷檢定。藉由在板蓋之右上角寫下實驗編號、板號、日期及首字母來製備96孔u-底板。使用無菌300 ml儲液器及25 ml血清吸量管,將蒸發緩衝介質以25 ml之增量吸量至儲液器中。使用液體處理器,將150 μl蒸發緩衝介質從儲液器吸量至96孔u-底板之行A至H,及列1至12。計數細胞培養物以獲得每毫升細胞密度及培養物存活率。細胞密度資訊係用於使用5mL血清吸量管從培養物中獲得1,000,000個細胞至epi管中。來自培養物之細胞密度資訊係用於計算測定在96孔u-底板之每個可用培養孔的130 μL培養基中接種1250個細胞所需之細胞數目及培養基體積。行B至F用於細胞(總共50個孔),行G留下用於空白培養基對照。考慮300 mL儲液器中之死體積,將高估計算10 mL。計算得到培養基體積後,使用25 mL血清吸量管將適當體積之培養基以25 mL增量吸量至250 mL瓶中。將250 mL瓶蓋緊,並置於37℃水浴中2分鐘。在培養基升溫的同時,將10 mL新鮮培養基從500 mL培養基瓶中吸量至無菌25 mL儲液器中。使用Eppendorf多通道吸量管,將130 μL培養基從25 mL儲液器中吸量至96孔u-底板之行G。在加熱250 mL培養基瓶後,將所需體積之培養物吸量至瓶中,並用25 mL血清吸量管輕輕混合,不至於產生氣泡,並隨後將瓶中之內容物吸量至新的300 mL儲液器中。使用液體處理器,將130 μl培養物從300 mL儲液器吸量至96孔u-底板之行B至F中。在加入培養物後,將板置於37℃培養箱中直至製備可供使用的化合物樣板(master plate)。
藉由將樣板名稱寫在板蓋之右上角來製備兩個96孔u-底板。將其中一個標記為DMSO樣板並將另一個標記為培養基樣板。從實驗室冷凍器中獲得受關注之化合物,並放入具有蓋子之25孔儲存盒中,並將盒子放在一邊。解凍後使用前,將化合物渦旋。使用自動多通道吸量管,將20 μl 100% DMSO吸量至DMSO樣板之孔B3-B11至G3-G11中。對於樣板上之每種化合物而言,將50 μL化合物吸量至第2行之適當孔中(參考板圖以確定適當孔)。藉由從第2行吸出20 μL並與第3行混合開始製備連續稀釋,重複直至到達第11行。使用液體處理器,將194 μL Daudi培養基分配至培養基樣板之孔B2-B11至G2-G11中。使用液體處理器,將DMSO樣板中的6 μl吸出並分配至培養基樣板中,混合100 μL兩次。
隨後將來自樣板之化合物添加至培養板中。將培養板從培養箱中取出,並置於生物安全櫃內。使用液體處理器,吸出來自樣板之孔B2-B11至G2-G11的20 μL,並分配至培養板之孔B2-B11至G2-G11中。對每個培養板繼續此組步驟。在培養板獲得其等之20 μl化合物稀釋液後,將其等放回至培養箱中,直至在實驗第7天讀取其等。在實驗第7天使用Cell-Titer Glo及Promega板讀器量測細胞死亡。
藉由比較經化合物處理之孔與未經處理之孔的細胞存活率來計算細胞死亡百分比及EC50
值。藉由將同一列中之每個孔減去培養基孔值,並隨後將該值除以經DMSO處理之細胞值,獲得標準化RLU值。隨後藉由將1減去該標準化RLU值並乘以100來計算殺傷百分比。隨後計算平均標準化殺傷百分比值及平均值之標準誤差。隨後將殺傷值與對應標準誤差輸入至Prism中。在Prism中,使用半對數標度用數據點繪製非線性回歸線,並計算EC50
值。對於在Daudi細胞系中顯示出良好效力之化合物而言,使用WI-38細胞(AID陰性)重複該檢定。
實例 76. 雙向 Caco-2 滲透性
測定雙向Caco-2滲透性。將Caco-2細胞接種至可滲透之聚碳酸酯載體上,並允許在用於檢定之前分化約3週。隨後將細胞從頂側或底側曝露至該等化合物,並在輕微攪拌下在37℃下培育至多90分鐘。隨後在第30、60及90分鐘時使用LC/MS/MS分析量測化合物轉運。表 2
實例 77. 人類肝臟微粒體穩定性
在人類肝臟微粒體存在下測定所主張化合物之穩定性。將該等化合物與微粒體在37℃下培育45分鐘。使用LC-MS/MS分析樣品。數據分析包括每種化合物在不同物質中之半衰期、清除率及肝血流百分比(% QH)。以下為代表性化合物之肝臟微粒體檢定數據,其顯示所主張化合物具有優異之代謝穩定性。表 3
Claims (51)
- 一種由以下結構式表示之化合物或其醫藥上可接受之鹽,
- 如請求項1之化合物或或其醫藥上可接受之鹽,其中:Cy為環己基或6員單環雜環;X5及X6各獨立地為NRa或O;R1為(C1-C5)烷基; R3為(C1-C5)烷基或單環3至7員雜環;其中在由R2表示之基團中的該-(C3-C6)環烷基係視情況經一或多個鹵素、-CH3、-ORa或-NRaRa取代;其中在由R2表示之基團中的該苯基係視情況經一或多個鹵素、-CH3、鹵甲基、鹵甲氧基、-ORa或-N3取代;其中在由R2表示之基團中的該雜環係視情況經一或多個=O、鹵素、-CH3、鹵甲基或鹵甲氧基取代;且其中在由R2表示之基團中的該雜芳族環係視情況經一或多個鹵素、-CH3、鹵甲基、鹵甲氧基、-ORa或-NRaRa取代。
- 如請求項1之化合物或其醫藥上可接受之鹽,其中Cy為環丙基、環丁基、環戊基、環己基、環庚基;氮雜環丁基、氮雜環庚基、二氮雜螺[4.4]壬基、二氮雜螺[3.5]壬基、二氮雜環庚基、二氫咪唑、二氫呋喃基、二氫哌喃基、二氫吡啶基、二氫嘧啶基、二氫噻吩基、二氫苯硫基、二氫硫哌喃基、六氫噠嗪基、六氫嘧啶基、乙內醯脲基、吲哚啉基、異吲哚啉基、嗎啉基、環氧乙基、氧雜環丁基、哌啶基、哌嗪基、吡咯啶酮基、吡咯啶基、四氫呋喃基、四氫咪唑、四氫吲哚基、四氫哌喃基、四氫噻吩基、四氫吡啶基、四氫嘧啶基、四氫苯硫基、四氫硫哌喃基、硫嗎啉基、莨菪烷基、戊內醯胺基;雙環[2.1.1]己基、雙環[2.2.1]庚基、雙環[2.2.2]辛基、雙環[3.2.1]辛基、雙環[4.3.1]癸基、雙環[3.3.1]壬基、冰片基、冰片烯基、降莰基、降莰烯基(norbornenyl)、6,6-二甲基雙環[3.1.1]庚基、 三環丁基、金剛烷基;氮雜降莰基、啶基、異啶基、莨菪烷基、氮雜雙環[2.2.1]庚基、2-氮雜雙環[3.2.1]辛基、氮雜雙環[3.2.1]辛基、氮雜雙環[3.2.2]壬基、氮雜雙環[3.3.0]壬基、氮雜雙環[3.3.1]壬基、二氮雜雙環[2.2.1]庚基、二氮雜雙環[3.2.1]辛基、八氫吡咯并[3,4-b]吡咯基、八氫吡咯并[3,4-c]吡咯基。
- 如請求項1之化合物或其醫藥上可接受之鹽,其中該化合物由以下結構式表示:
- 如請求項4之化合物或其醫藥上可接受之鹽,其中X7為NH或O;R3為(C1-C5)烷基;及R4為(C1-C4)烷基,其中由R4表示之該(C1-C4)烷基係視情況經一或多個鹵素、-ORa、-NRaRa、-(C3-C6)環烷基、苯基(視情況經一或多個鹵素、-CH3、鹵甲基、鹵甲氧基、ORa或N3取代)、單環3至7員雜環(視情況經=O、鹵素或-CH3取代)或單環5至6員雜芳族環(視情況經鹵素或-CH3取代)取代。
- 如請求項1之化合物或其醫藥上可接受之鹽,其中該化合物由以下結構式表示:
- 如請求項1之化合物或其醫藥上可接受之鹽,其中Cy為氮雜環丁基或吡咯啶基,且該氮環原子係與該噻唑環連接。
- 如請求項1之化合物或其醫藥上可接受之鹽,其中Cy為1,7-二氮雜螺[4.4]壬基、2,7-二氮雜螺[4.4]壬基、2,7-二氮雜螺[3.5]壬基、1,4-二氮雜環庚基、2,5-二氮雜雙環[2.2.1]庚基、3,8-二氮雜雙環[3.2.1]辛基、八氫吡咯并[3,4-b]吡咯基或八氫吡咯并[3,4-c]吡咯基,且該兩個氮環原子係各自與該噻唑環及該-X5C(O)X6R3部分連接。
- 如請求項4或6之化合物或其醫藥上可接受之鹽,其中R4為-(C1-C3)烷基、(C3-C6)環烷基或單環3至7員雜環,其中該-(C1-C3)烷基係視情況經以下取代:(i)視情況經一或多個鹵素或-CH3取代之苯基;(ii)視情況經一或多個鹵素或-CH3取代之單環5至6員雜芳族環;或(iii)視情況經一或多個選自由鹵素及-CH3組成之群的基團取代之單環3至7員雜環。
- 如請求項4或6之化合物或其醫藥上可接受之鹽,其中R4為-(C1-C3)烷基、-CHRa-苯基、-CHRa-5至6員雜芳族環或-CHRa-3至7員單環雜環,其中在由R4表示之該基團中的該苯基、5至6員雜芳族環或3至7員單環雜環係視情況經一或多個選自由鹵素及-CH3組成之群的基團取代。
- 如請求項4或6之化合物或其醫藥上可接受之鹽,其中R4為-(C1-C3)烷基,其視情況經以下取代:(i)視情況經一或多個鹵素、-CH3、鹵甲基、鹵甲氧基、ORa或N3取代之苯基;(ii)視情況經一或多個鹵素或-CH3 取代之單環5至6員雜芳族環;或(iii)視情況經一或多個=O或-CH3取代之單環3至7員雜環。
- 如請求項11之化合物或其醫藥上可接受之鹽,其中R4為(i)-(C1-C3)烷基;(ii)視情況經鹵素、-CH3、鹵甲基、鹵甲氧基、ORa或N3取代之-CH2-苯基;(iii)視情況經鹵素、-CH3、鹵甲基、鹵甲氧基、ORa或N3取代之-CH(CH3)-苯基;(iv)視情況經鹵素或-CH3取代之-CH2-5至6員雜芳族環;或(v)視情況經=O或-CH3取代之-CH2-3至7員單環雜環。
- 如請求項1至8中任一項之化合或其醫藥上可接受之鹽,其中R3為-(C1-C4)烷基、-(C4-C6)環烷基、-CH2-苯基、-CH2-單環4至6員雜環或單環4至6員雜環,其中由R3表示或在由R3表示之該基團中的該苯基或單環4至6員雜環係視情況經一或多個選自由鹵素、-ORa及-CH3組成之群的基團取代。
- 如請求項1之化合物或其醫藥上可接受之鹽,其中該化合物由以下結構式表示:
- 如請求項14之化合物或其醫藥上可接受之鹽,其中該化合物由以下結構式表示:
- 如請求項1之化合物或其醫藥上可接受之鹽,其中該化合物由以下結構式表示:
- 如請求項16之化合物或其醫藥上可接受之鹽,其中該化合物由以下結構式表示:
- 如請求項1之化合物或其醫藥上可接受之鹽,其中該化合物由以下結構式表示:
- 如請求項1至8及14至18中任一項之化合物或其醫藥上可接受之鹽,其中R1為第三丁基。
- 如請求項1至8及14至18中任一項之化合物或其醫藥上可接受之鹽,其中R3為異丙基或氧雜環丁基。
- 如請求項21之化合物或其醫藥上可接受之鹽,其中R3為異丙基。
- 一種醫藥組合物,其包含醫藥上可接受之載劑或稀釋劑及如請求項1至28中任一項之化合物或其醫藥上可接受之鹽。
- 一種如請求項1至28中任一項之化合物或其醫藥上可接受之鹽之用途,其係用於製備治療個體中之癌症、自體免疫疾病、免疫缺乏或神經退化性疾病之藥物之用途。
- 如請求項30之用途,其中該癌症係選自由淋巴瘤、白血病及漿細胞腫瘤組成之群。
- 如請求項31之用途,其中該淋巴瘤為選自由非霍奇金氏淋巴瘤(Non-Hodgkin's lymphoma)、伯基特氏(Burkitt)淋巴瘤、小淋巴球性淋巴瘤、淋巴漿細胞性淋巴瘤、MALT淋巴瘤、濾泡性淋巴瘤、瀰漫性大B細胞淋巴瘤及T細胞淋巴瘤組成之群。
- 如請求項31之用途,其中該白血病為選自由急性淋巴母細胞白血病(ALL)、伯基特氏白血病、B細胞白血病、慢性淋巴球性白血病(CLL)、急性骨髓性白血病(AML)及慢性骨髓性白血病(CML)組成之群。
- 如請求項31之用途,其中該漿細胞腫瘤為選自由多發性骨髓瘤、漿細胞骨髓瘤、漿細胞白血病及漿細胞瘤組成之群。
- 如請求項30之用途,其中該癌症係選自由癌及肉瘤組成之群。
- 如請求項35之用途,其中該癌為選自由結腸癌、肝癌、胃癌、腸癌、食道癌、乳癌、卵巢癌、頭頸癌、肺癌及甲狀腺癌組成之群。
- 如請求項30之用途,其中該癌症係選自由結腸癌、子宮內膜癌、胃癌、胰臟癌、腎/輸尿管癌、肝膽管癌、胃腸道癌、前列腺癌、卵巢癌、膽囊管癌、腦癌、小腸癌、乳癌及皮膚癌組成之群。
- 如請求項30之用途,其中該癌症具有在mutS同源物6(MSH6)中之突變。
- 如請求項30之用途,其中該自體免疫疾病選自由紅斑狼瘡、偉-爾二氏(Wiskott-Aldrich)症候群、自體免疫性淋巴細胞增生症候群、重症肌無力、類風濕性關節炎(RA)、狼瘡性腎炎、全身性紅斑狼瘡、盤狀狼瘡、亞急性皮膚紅斑狼瘡、包括凍瘡狀紅斑狼瘡之皮膚紅斑狼瘡、慢性關節炎、修格蘭氏症候群(Sjogren's syndrome)、發炎性慢性鼻竇炎、結腸炎、乳糜瀉、發炎性腸病、巴雷特氏食道症(Barrett's esophagus)、發炎性胃炎、自體免疫性腎炎、自體免疫性血管炎、自體免疫性肝炎、自體免 疫性心臟炎、自體免疫性腦炎、自體免疫性糖尿病、自體免疫性糖尿病腎炎、牛皮癬、移植物抗宿主病(GvHD)及自體免疫介導之血液病組成之群。
- 如請求項30之用途,其中該免疫缺乏選自由自體免疫性淋巴細胞增生症候群(ALPS)、1型自體免疫性多腺症候群(APS-1)、BENTA病、卡斯蛋白酶八缺乏狀態(CEDS)、慢性肉芽腫病(CGD)、常見變異性免疫缺乏(CVID)、先天性嗜中性球減少症候群、CTLA4缺乏、DOCK8缺乏、GATA2缺乏、伴有免疫缺乏之糖基化病症、超免疫球蛋白E症候群(HIES)、超免疫球蛋白M(Hyper-IgM)症候群、白血球黏附缺乏(LAD)、LRBA缺乏、PI3激酶疾病、PLCG2相關抗體缺乏及免疫失調(PLAID)、嚴重複合型免疫缺乏(SCID)、STAT3功能獲得型疾病、疣、低γ球蛋白血症、感染及無效生成性慢性粒細胞缺乏(Myelokathexis)症候群(WHIMS)、X性聯無γ球蛋白血症(XLA)、X性聯淋巴細胞增生性疾病(XLP)及XMEN病組成之群。
- 如請求項30之用途,其中該神經退化性疾病選自由多發性硬化、帕金森氏病(Parkinson's disease)(PD)、阿茲海默氏症(Alzheimer's disease)(AD)、齒狀紅核蒼白球肌萎縮症(DRPLA)、亨廷頓氏症(Huntington's Disease)(HD)、1型脊髓小腦性共濟失調(SCA1)、2型脊髓小腦性共濟失調(SCA2)、3型脊髓小腦性共濟失調(SCA3)、脊髓小腦性共濟失調6(SCA6)、7型脊髓小腦性共濟失調(SCA7)、8型脊髓小腦性共濟失調(SCA8)、12型脊髓小腦性共濟失調(SCA12)、17型脊髓小腦性共濟失調 (SCA17)、脊髓性肌肉共濟失調/肯尼迪病(Kennedy Disease)(SBMA)、脆性X症候群(FRAXA)、脆性XE智力遲鈍(FRAXE)及肌強直性營養不良(DM)組成之群。
- 如請求項30之用途,其進一步包括共同投與DNA修復抑制劑、DNA損傷反應(DDR)抑制劑、DNA損傷劑或免疫調節劑。
- 如請求項42之用途,其中該DNA損傷劑係選自由以下組成之群:曝露至DNA損傷性化學品、曝露至化學治療劑、曝露至放射化學療法及曝露至電離或紫外線輻射。
- 如請求項30之用途,其中該個體係經確定為具有增加之DNA損傷過程或DNA編輯酶水平及/或活性。
- 如請求項42之用途,其中該免疫調節劑係選自由免疫檢查點調節劑、類鐸受體(TLR)促效劑、基於細胞之療法、細胞激素及癌症疫苗組成之群。
- 如請求項44之用途,其中該DNA編輯酶係選自由活化誘導之胞苷脫胺酶(AID或AICDA)、APOBEC2、APOBEC3A、APOBEC3C、APOBEC3D、APOBEC3F、APOBEC3G、APOBEC3H、APOBEC4、1型拓撲異構酶、2型拓撲異構酶、重組活化基因1(RAG1)及重組活化基因2(RAG2)組成之群。
- 如請求項30之用途,其中已確定從該個體獲得之血細胞具有可檢測之活化誘導之胞苷脫胺酶(AID)水平。
- 如請求項30之用途,其中已確定從該個體獲得之B細胞具有可檢測之活化誘導之胞苷脫胺酶(AID)水平。
- 如請求項47之用途,其中該可檢測之活化誘導之胞苷脫胺酶(AID)水平係在統計學上顯著高於來自健康個體之未活化B細胞或正常非免疫細胞中表現的AID水平。
- 如請求項48之用途,其中該可檢測之活化誘導之胞苷脫胺酶(AID)水平係在統計學上顯著高於來自健康個體之未活化B細胞或正常非免疫細胞中表現的AID水平。
- 如請求項33之用途,其中該急性淋巴母細胞白血病(ALL)為選自由B細胞急性淋巴母細胞白血病及T細胞急性淋巴母細胞白血病(T-ALL)組成之群。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762556763P | 2017-09-11 | 2017-09-11 | |
| US62/556,763 | 2017-09-11 | ||
| US201862711959P | 2018-07-30 | 2018-07-30 | |
| US62/711,959 | 2018-07-30 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| TW201917121A TW201917121A (zh) | 2019-05-01 |
| TWI791608B true TWI791608B (zh) | 2023-02-11 |
Family
ID=63722779
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| TW107131953A TWI791608B (zh) | 2017-09-11 | 2018-09-11 | Rad51抑制劑 |
Country Status (20)
| Country | Link |
|---|---|
| US (4) | US10590122B2 (zh) |
| EP (2) | EP3681884B1 (zh) |
| JP (1) | JP7265537B2 (zh) |
| CN (1) | CN111542521B (zh) |
| AU (1) | AU2018328818C1 (zh) |
| BR (1) | BR112020004828A2 (zh) |
| CA (1) | CA3075062A1 (zh) |
| DK (1) | DK3681884T3 (zh) |
| ES (1) | ES2925218T3 (zh) |
| HU (1) | HUE059969T2 (zh) |
| IL (2) | IL273156B (zh) |
| MX (2) | MX2020002745A (zh) |
| PH (1) | PH12020550079A1 (zh) |
| PL (1) | PL3681884T3 (zh) |
| PT (1) | PT3681884T (zh) |
| SG (2) | SG10202107087YA (zh) |
| SI (1) | SI3681884T1 (zh) |
| TW (1) | TWI791608B (zh) |
| WO (1) | WO2019051465A1 (zh) |
| ZA (1) | ZA202104029B (zh) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA3069003A1 (en) | 2017-07-11 | 2019-01-17 | Cyteir Therapeutics, Inc. | Rad51 inhibitors |
| EP3681884B1 (en) * | 2017-09-11 | 2022-06-01 | Cyteir Therapeutics, Inc. | Rad51 inhibitors |
| MX2021010916A (es) * | 2019-03-12 | 2021-10-01 | Cyteir Therapeutics Inc | Inhibidores rad51. |
| KR20210143257A (ko) * | 2019-03-25 | 2021-11-26 | 사이티어 테라퓨틱스, 인크. | Rad51 억제제와 parp 억제제의 조합 |
| BR112021025491A2 (pt) * | 2019-06-21 | 2022-04-26 | Cyteir Therapeutics Inc | Métodos para uso de inibidores de rad51 para tratamento de câncer pancreático |
| WO2021164746A1 (zh) | 2020-02-19 | 2021-08-26 | 江苏先声药业有限公司 | 取代芳基类化合物 |
| MX2022010963A (es) * | 2020-03-03 | 2022-12-08 | Cyteir Therapeutics Inc | El compuesto 67a (2301085-06-1) inhibidor de rad51 en una dosificación específica para el tratamiento de cáncer. |
| JP2022151436A (ja) * | 2021-03-26 | 2022-10-07 | 均 石井 | 髄膜炎と脳炎の治療薬。 |
| CN116063243A (zh) * | 2021-11-02 | 2023-05-05 | 上海旭成医药科技有限公司 | 芳香化合物、其制备方法、中间体、药物组合物和应用 |
| CN116196314B (zh) * | 2023-05-04 | 2023-08-15 | 广州市妇女儿童医疗中心 | Ri-1或其盐在制备防治胃肠道疾病的药物中的应用 |
| CN117603097B (zh) * | 2023-11-29 | 2024-06-18 | 安徽泽升科技股份有限公司 | 一种快速制备2-溴-5-硝基苯磺酰氯的方法 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016196955A1 (en) * | 2015-06-04 | 2016-12-08 | Drexel University | Inhibitors of RAD52 Recombination Protein and Methods Using Same |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6040138A (en) | 1995-09-15 | 2000-03-21 | Affymetrix, Inc. | Expression monitoring by hybridization to high density oligonucleotide arrays |
| WO1992010588A1 (en) | 1990-12-06 | 1992-06-25 | Affymax Technologies N.V. | Sequencing by hybridization of a target nucleic acid to a matrix of defined oligonucleotides |
| US5837832A (en) | 1993-06-25 | 1998-11-17 | Affymetrix, Inc. | Arrays of nucleic acid probes on biological chips |
| US6309823B1 (en) | 1993-10-26 | 2001-10-30 | Affymetrix, Inc. | Arrays of nucleic acid probes for analyzing biotransformation genes and methods of using the same |
| GB9507238D0 (en) | 1995-04-07 | 1995-05-31 | Isis Innovation | Detecting dna sequence variations |
| PT2099442E (pt) * | 2006-12-26 | 2015-02-10 | Pharmacyclics Inc | Métodos de utilização de inibidores de histona desacetilase e monitorização de biomarcadores em terapia de combinação |
| US8551984B2 (en) | 2009-12-17 | 2013-10-08 | Merck Sharp & Dohme Corp. | Aminopyrimidines as SYK inhibitors |
| US10912761B2 (en) * | 2012-11-30 | 2021-02-09 | The University Of Chicago | Methods and compositions involving RAD51 inhibitors |
| TW201702218A (zh) | 2014-12-12 | 2017-01-16 | 美國杰克森實驗室 | 關於治療癌症、自體免疫疾病及神經退化性疾病之組合物及方法 |
| US10421753B2 (en) * | 2015-03-02 | 2019-09-24 | The Regents Of The University Of California | RAD51 inhibitors and uses thereof |
| CA3069003A1 (en) | 2017-07-11 | 2019-01-17 | Cyteir Therapeutics, Inc. | Rad51 inhibitors |
| EP3681884B1 (en) | 2017-09-11 | 2022-06-01 | Cyteir Therapeutics, Inc. | Rad51 inhibitors |
| MX2021010916A (es) | 2019-03-12 | 2021-10-01 | Cyteir Therapeutics Inc | Inhibidores rad51. |
| KR20210143257A (ko) * | 2019-03-25 | 2021-11-26 | 사이티어 테라퓨틱스, 인크. | Rad51 억제제와 parp 억제제의 조합 |
-
2018
- 2018-09-11 EP EP18782257.2A patent/EP3681884B1/en active Active
- 2018-09-11 ES ES18782257T patent/ES2925218T3/es active Active
- 2018-09-11 IL IL273156A patent/IL273156B/en unknown
- 2018-09-11 EP EP22175891.5A patent/EP4112616A1/en active Pending
- 2018-09-11 SI SI201830740T patent/SI3681884T1/sl unknown
- 2018-09-11 TW TW107131953A patent/TWI791608B/zh active
- 2018-09-11 JP JP2020514206A patent/JP7265537B2/ja active Active
- 2018-09-11 US US16/127,229 patent/US10590122B2/en active Active
- 2018-09-11 HU HUE18782257A patent/HUE059969T2/hu unknown
- 2018-09-11 CA CA3075062A patent/CA3075062A1/en active Pending
- 2018-09-11 IL IL293332A patent/IL293332B2/en unknown
- 2018-09-11 PT PT187822572T patent/PT3681884T/pt unknown
- 2018-09-11 CN CN201880072664.5A patent/CN111542521B/zh active Active
- 2018-09-11 WO PCT/US2018/050391 patent/WO2019051465A1/en active Application Filing
- 2018-09-11 AU AU2018328818A patent/AU2018328818C1/en active Active
- 2018-09-11 MX MX2020002745A patent/MX2020002745A/es unknown
- 2018-09-11 SG SG10202107087YA patent/SG10202107087YA/en unknown
- 2018-09-11 BR BR112020004828-3A patent/BR112020004828A2/pt unknown
- 2018-09-11 SG SG11202002069WA patent/SG11202002069WA/en unknown
- 2018-09-11 PL PL18782257.2T patent/PL3681884T3/pl unknown
- 2018-09-11 DK DK18782257.2T patent/DK3681884T3/da active
- 2018-12-31 US US16/236,894 patent/US10336746B1/en active Active
-
2020
- 2020-01-06 US US16/734,566 patent/US11084812B2/en active Active
- 2020-03-06 PH PH12020550079A patent/PH12020550079A1/en unknown
- 2020-03-11 MX MX2023004221A patent/MX2023004221A/es unknown
-
2021
- 2021-06-11 ZA ZA2021/04029A patent/ZA202104029B/en unknown
- 2021-06-30 US US17/363,099 patent/US20220056022A1/en not_active Abandoned
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016196955A1 (en) * | 2015-06-04 | 2016-12-08 | Drexel University | Inhibitors of RAD52 Recombination Protein and Methods Using Same |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TWI791608B (zh) | Rad51抑制劑 | |
| US12064419B2 (en) | Methods of using RAD51 inhibitors for treatment of pancreatic cancer | |
| JP7460649B2 (ja) | Rad51インヒビター | |
| KR102718671B1 (ko) | Rad51 억제제 | |
| RU2795882C2 (ru) | Ингибиторы rad51 |