TW202227401A - 用於持續釋放治療劑的前藥及其用途 - Google Patents
用於持續釋放治療劑的前藥及其用途 Download PDFInfo
- Publication number
- TW202227401A TW202227401A TW110138814A TW110138814A TW202227401A TW 202227401 A TW202227401 A TW 202227401A TW 110138814 A TW110138814 A TW 110138814A TW 110138814 A TW110138814 A TW 110138814A TW 202227401 A TW202227401 A TW 202227401A
- Authority
- TW
- Taiwan
- Prior art keywords
- pharmaceutically acceptable
- acceptable salt
- prodrug compound
- group
- alkyl
- Prior art date
Links
- 229940002612 prodrug Drugs 0.000 title claims abstract description 145
- 239000000651 prodrug Substances 0.000 title claims abstract description 145
- 239000003814 drug Substances 0.000 title claims abstract description 113
- 229940124597 therapeutic agent Drugs 0.000 title abstract description 18
- 230000002459 sustained effect Effects 0.000 title abstract description 5
- 238000000034 method Methods 0.000 claims abstract description 31
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 23
- 201000010099 disease Diseases 0.000 claims abstract description 20
- 150000001875 compounds Chemical class 0.000 claims description 185
- -1 amino, hydroxyl Chemical group 0.000 claims description 141
- 150000003839 salts Chemical class 0.000 claims description 101
- 229940079593 drug Drugs 0.000 claims description 95
- 125000000623 heterocyclic group Chemical group 0.000 claims description 94
- 125000000217 alkyl group Chemical group 0.000 claims description 93
- 125000003118 aryl group Chemical group 0.000 claims description 76
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 30
- 125000001072 heteroaryl group Chemical group 0.000 claims description 28
- 239000008194 pharmaceutical composition Substances 0.000 claims description 22
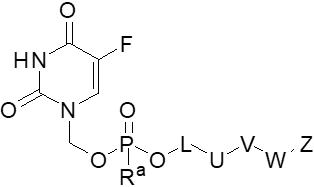
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 claims description 18
- 125000003342 alkenyl group Chemical group 0.000 claims description 18
- 229960002949 fluorouracil Drugs 0.000 claims description 18
- 125000004435 hydrogen atom Chemical class [H]* 0.000 claims description 17
- 125000000304 alkynyl group Chemical group 0.000 claims description 16
- 229910052739 hydrogen Inorganic materials 0.000 claims description 16
- 239000001257 hydrogen Substances 0.000 claims description 16
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 11
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 11
- 229910052720 vanadium Inorganic materials 0.000 claims description 11
- UZFMOKQJFYMBGY-UHFFFAOYSA-N 4-hydroxy-TEMPO Chemical compound CC1(C)CC(O)CC(C)(C)N1[O] UZFMOKQJFYMBGY-UHFFFAOYSA-N 0.000 claims description 9
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 8
- 150000001408 amides Chemical class 0.000 claims description 7
- 125000003386 piperidinyl group Chemical group 0.000 claims description 7
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 6
- 150000001412 amines Chemical class 0.000 claims description 6
- 206010028980 Neoplasm Diseases 0.000 claims description 5
- 229910019142 PO4 Inorganic materials 0.000 claims description 5
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 5
- 239000003242 anti bacterial agent Substances 0.000 claims description 5
- 239000002260 anti-inflammatory agent Substances 0.000 claims description 5
- 229940121375 antifungal agent Drugs 0.000 claims description 5
- 239000002246 antineoplastic agent Substances 0.000 claims description 5
- 201000011510 cancer Diseases 0.000 claims description 5
- 201000004101 esophageal cancer Diseases 0.000 claims description 5
- 150000007857 hydrazones Chemical class 0.000 claims description 5
- 150000002466 imines Chemical class 0.000 claims description 5
- 235000021317 phosphate Nutrition 0.000 claims description 5
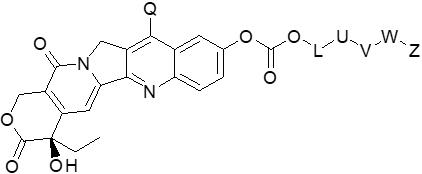
- HAWSQZCWOQZXHI-FQEVSTJZSA-N 10-Hydroxycamptothecin Chemical compound C1=C(O)C=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 HAWSQZCWOQZXHI-FQEVSTJZSA-N 0.000 claims description 4
- HAWSQZCWOQZXHI-UHFFFAOYSA-N CPT-OH Natural products C1=C(O)C=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 HAWSQZCWOQZXHI-UHFFFAOYSA-N 0.000 claims description 4
- 206010030155 Oesophageal carcinoma Diseases 0.000 claims description 4
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 claims description 4
- 150000001241 acetals Chemical class 0.000 claims description 4
- VSJKWCGYPAHWDS-UHFFFAOYSA-N dl-camptothecin Natural products C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-UHFFFAOYSA-N 0.000 claims description 4
- 229960004964 temozolomide Drugs 0.000 claims description 4
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims description 3
- 125000004605 1,2,3,4-tetrahydroisoquinolinyl group Chemical group C1(NCCC2=CC=CC=C12)* 0.000 claims description 3
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 claims description 3
- FJHBVJOVLFPMQE-QFIPXVFZSA-N 7-Ethyl-10-Hydroxy-Camptothecin Chemical compound C1=C(O)C=C2C(CC)=C(CN3C(C4=C([C@@](C(=O)OC4)(O)CC)C=C33)=O)C3=NC2=C1 FJHBVJOVLFPMQE-QFIPXVFZSA-N 0.000 claims description 3
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 claims description 3
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 claims description 3
- 208000031261 Acute myeloid leukaemia Diseases 0.000 claims description 3
- 206010003571 Astrocytoma Diseases 0.000 claims description 3
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 claims description 3
- 206010005003 Bladder cancer Diseases 0.000 claims description 3
- 206010006187 Breast cancer Diseases 0.000 claims description 3
- 208000026310 Breast neoplasm Diseases 0.000 claims description 3
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 claims description 3
- 206010009944 Colon cancer Diseases 0.000 claims description 3
- 201000010915 Glioblastoma multiforme Diseases 0.000 claims description 3
- 229940122245 Janus kinase inhibitor Drugs 0.000 claims description 3
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 claims description 3
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 claims description 3
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 3
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 claims description 3
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 3
- 229940121363 anti-inflammatory agent Drugs 0.000 claims description 3
- 229940088710 antibiotic agent Drugs 0.000 claims description 3
- 239000003429 antifungal agent Substances 0.000 claims description 3
- 150000004657 carbamic acid derivatives Chemical class 0.000 claims description 3
- 150000007942 carboxylates Chemical class 0.000 claims description 3
- 238000003776 cleavage reaction Methods 0.000 claims description 3
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 claims description 3
- 206010017758 gastric cancer Diseases 0.000 claims description 3
- 208000005017 glioblastoma Diseases 0.000 claims description 3
- 201000010536 head and neck cancer Diseases 0.000 claims description 3
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 3
- 201000007270 liver cancer Diseases 0.000 claims description 3
- 208000014018 liver neoplasm Diseases 0.000 claims description 3
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 3
- 201000002528 pancreatic cancer Diseases 0.000 claims description 3
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 3
- 125000000719 pyrrolidinyl group Chemical group 0.000 claims description 3
- 230000007017 scission Effects 0.000 claims description 3
- 201000011549 stomach cancer Diseases 0.000 claims description 3
- 150000003558 thiocarbamic acid derivatives Chemical class 0.000 claims description 3
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 3
- 239000002525 vasculotropin inhibitor Substances 0.000 claims description 3
- 206010061424 Anal cancer Diseases 0.000 claims description 2
- 208000007860 Anus Neoplasms Diseases 0.000 claims description 2
- 208000003174 Brain Neoplasms Diseases 0.000 claims description 2
- 208000001333 Colorectal Neoplasms Diseases 0.000 claims description 2
- 208000007766 Kaposi sarcoma Diseases 0.000 claims description 2
- 206010029260 Neuroblastoma Diseases 0.000 claims description 2
- 206010002224 anaplastic astrocytoma Diseases 0.000 claims description 2
- 229940124599 anti-inflammatory drug Drugs 0.000 claims description 2
- 201000011165 anus cancer Diseases 0.000 claims description 2
- 230000003115 biocidal effect Effects 0.000 claims description 2
- 150000004649 carbonic acid derivatives Chemical class 0.000 claims description 2
- 150000003013 phosphoric acid derivatives Chemical class 0.000 claims description 2
- 125000004193 piperazinyl group Chemical group 0.000 claims description 2
- WEAHRLBPCANXCN-UHFFFAOYSA-N Daunomycin Natural products CCC1(O)CC(OC2CC(N)C(O)C(C)O2)c3cc4C(=O)c5c(OC)cccc5C(=O)c4c(O)c3C1 WEAHRLBPCANXCN-UHFFFAOYSA-N 0.000 claims 1
- 238000011282 treatment Methods 0.000 abstract description 10
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 102
- 239000000203 mixture Substances 0.000 description 79
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 76
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 66
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 65
- 239000000243 solution Substances 0.000 description 62
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 58
- 125000004432 carbon atom Chemical group C* 0.000 description 58
- 238000006243 chemical reaction Methods 0.000 description 51
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 41
- 235000019439 ethyl acetate Nutrition 0.000 description 37
- 239000011541 reaction mixture Substances 0.000 description 33
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 28
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 28
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 27
- 238000005481 NMR spectroscopy Methods 0.000 description 25
- 238000004237 preparative chromatography Methods 0.000 description 24
- 125000001424 substituent group Chemical group 0.000 description 23
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 22
- 239000002904 solvent Substances 0.000 description 21
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 21
- 239000000725 suspension Substances 0.000 description 20
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 18
- 229910052757 nitrogen Inorganic materials 0.000 description 16
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 15
- 238000010898 silica gel chromatography Methods 0.000 description 15
- XPKDPAZHNXWUMF-UHFFFAOYSA-N 5-fluoro-1-(hydroxymethyl)pyrimidine-2,4-dione Chemical compound OCN1C=C(F)C(=O)NC1=O XPKDPAZHNXWUMF-UHFFFAOYSA-N 0.000 description 14
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 14
- 229910052799 carbon Inorganic materials 0.000 description 14
- 239000012044 organic layer Substances 0.000 description 14
- 239000000706 filtrate Substances 0.000 description 13
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 12
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 12
- 239000002552 dosage form Substances 0.000 description 12
- 125000000524 functional group Chemical group 0.000 description 12
- 239000011734 sodium Substances 0.000 description 12
- 239000000126 substance Substances 0.000 description 12
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 12
- UCPYLLCMEDAXFR-UHFFFAOYSA-N triphosgene Chemical compound ClC(Cl)(Cl)OC(=O)OC(Cl)(Cl)Cl UCPYLLCMEDAXFR-UHFFFAOYSA-N 0.000 description 12
- 125000004429 atom Chemical group 0.000 description 11
- 239000010410 layer Substances 0.000 description 11
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 11
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 11
- 235000017557 sodium bicarbonate Nutrition 0.000 description 11
- 238000003786 synthesis reaction Methods 0.000 description 11
- 239000007832 Na2SO4 Substances 0.000 description 10
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 10
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 10
- 239000002585 base Substances 0.000 description 10
- 230000007062 hydrolysis Effects 0.000 description 10
- 238000006460 hydrolysis reaction Methods 0.000 description 10
- 229910052938 sodium sulfate Inorganic materials 0.000 description 10
- 235000011152 sodium sulphate Nutrition 0.000 description 10
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 9
- 125000003545 alkoxy group Chemical group 0.000 description 9
- 239000012043 crude product Substances 0.000 description 9
- 239000000047 product Substances 0.000 description 9
- 230000002829 reductive effect Effects 0.000 description 9
- 238000003756 stirring Methods 0.000 description 9
- 230000009885 systemic effect Effects 0.000 description 9
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 8
- 235000011054 acetic acid Nutrition 0.000 description 8
- 239000002253 acid Substances 0.000 description 8
- 230000015572 biosynthetic process Effects 0.000 description 8
- 230000000694 effects Effects 0.000 description 8
- 239000007924 injection Substances 0.000 description 8
- 238000002347 injection Methods 0.000 description 8
- 125000002950 monocyclic group Chemical group 0.000 description 8
- 125000000962 organic group Chemical group 0.000 description 8
- 229920006395 saturated elastomer Polymers 0.000 description 8
- 238000013268 sustained release Methods 0.000 description 8
- 238000002560 therapeutic procedure Methods 0.000 description 8
- OFPWENIUCJQNPC-INIZCTEOSA-N (2s)-1-benzhydrylpyrrolidine-2-carboxylic acid Chemical compound OC(=O)[C@@H]1CCCN1C(C=1C=CC=CC=1)C1=CC=CC=C1 OFPWENIUCJQNPC-INIZCTEOSA-N 0.000 description 7
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 7
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 7
- 239000012730 sustained-release form Substances 0.000 description 7
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- 239000007821 HATU Substances 0.000 description 6
- UWSNWHGQWDIJEJ-UHFFFAOYSA-N OC(CC1CCN(CC(C2=CC=CC=C2)C2=CC=CC=C2)CC1)=O Chemical compound OC(CC1CCN(CC(C2=CC=CC=C2)C2=CC=CC=C2)CC1)=O UWSNWHGQWDIJEJ-UHFFFAOYSA-N 0.000 description 6
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 239000013078 crystal Substances 0.000 description 6
- 238000009472 formulation Methods 0.000 description 6
- 125000003367 polycyclic group Chemical group 0.000 description 6
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 6
- 239000000843 powder Substances 0.000 description 6
- 239000000376 reactant Substances 0.000 description 6
- 229910052717 sulfur Inorganic materials 0.000 description 6
- 239000011593 sulfur Substances 0.000 description 6
- 230000000699 topical effect Effects 0.000 description 6
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 5
- ZTQSAGDEMFDKMZ-UHFFFAOYSA-N Butyraldehyde Chemical compound CCCC=O ZTQSAGDEMFDKMZ-UHFFFAOYSA-N 0.000 description 5
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 5
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 5
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 5
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 5
- 239000007853 buffer solution Substances 0.000 description 5
- 239000003153 chemical reaction reagent Substances 0.000 description 5
- 238000012377 drug delivery Methods 0.000 description 5
- 238000001990 intravenous administration Methods 0.000 description 5
- 229910052760 oxygen Inorganic materials 0.000 description 5
- 239000001301 oxygen Substances 0.000 description 5
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 5
- 239000012071 phase Substances 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- 230000008569 process Effects 0.000 description 5
- 125000006239 protecting group Chemical group 0.000 description 5
- 239000012453 solvate Substances 0.000 description 5
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 5
- NXLNNXIXOYSCMB-UHFFFAOYSA-N (4-nitrophenyl) carbonochloridate Chemical compound [O-][N+](=O)C1=CC=C(OC(Cl)=O)C=C1 NXLNNXIXOYSCMB-UHFFFAOYSA-N 0.000 description 4
- JJBUINLKXFHHNU-UHFFFAOYSA-N 2-(dicyclohexylazaniumyl)acetate Chemical compound C1CCCCC1N(CC(=O)O)C1CCCCC1 JJBUINLKXFHHNU-UHFFFAOYSA-N 0.000 description 4
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 4
- BSEWCHKPJQZHID-UHFFFAOYSA-N 4-piperidin-4-ylphenol hydrobromide Chemical compound Br.Oc1ccc(cc1)C1CCNCC1 BSEWCHKPJQZHID-UHFFFAOYSA-N 0.000 description 4
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical class N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 4
- GUCJCZQLWTZITG-UHFFFAOYSA-N CCCCN(CCCC)C(C=C1)=CC=C1N1CCC(CCO)CC1 Chemical compound CCCCN(CCCC)C(C=C1)=CC=C1N1CCC(CCO)CC1 GUCJCZQLWTZITG-UHFFFAOYSA-N 0.000 description 4
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 4
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 4
- 229910010082 LiAlH Inorganic materials 0.000 description 4
- MTVAFXCSWINMFZ-UHFFFAOYSA-N OC(C1=CC=C(C2CCN(CC(C3=CC=CC=C3)C3=CC=CC=C3)CC2)C=C1)=O Chemical compound OC(C1=CC=C(C2CCN(CC(C3=CC=CC=C3)C3=CC=CC=C3)CC2)C=C1)=O MTVAFXCSWINMFZ-UHFFFAOYSA-N 0.000 description 4
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 4
- 238000013459 approach Methods 0.000 description 4
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 4
- ILAHWRKJUDSMFH-UHFFFAOYSA-N boron tribromide Chemical compound BrB(Br)Br ILAHWRKJUDSMFH-UHFFFAOYSA-N 0.000 description 4
- 125000004122 cyclic group Chemical group 0.000 description 4
- 238000001704 evaporation Methods 0.000 description 4
- 230000008020 evaporation Effects 0.000 description 4
- 230000002496 gastric effect Effects 0.000 description 4
- 239000000499 gel Substances 0.000 description 4
- 125000005842 heteroatom Chemical group 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- 238000001802 infusion Methods 0.000 description 4
- 239000000543 intermediate Substances 0.000 description 4
- 125000005647 linker group Chemical group 0.000 description 4
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 4
- 238000002844 melting Methods 0.000 description 4
- 230000008018 melting Effects 0.000 description 4
- 150000004702 methyl esters Chemical class 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- 230000004048 modification Effects 0.000 description 4
- 230000037361 pathway Effects 0.000 description 4
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 4
- 238000000746 purification Methods 0.000 description 4
- 125000006413 ring segment Chemical group 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 239000007858 starting material Substances 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 4
- YLWWCGNFSIGQTB-UHFFFAOYSA-N (1-heptylpiperidin-4-yl)methanol Chemical compound CCCCCCCN1CCC(CO)CC1 YLWWCGNFSIGQTB-UHFFFAOYSA-N 0.000 description 3
- QLWJYOLYCKTBQT-UHFFFAOYSA-N 1-benzhydrylpiperidin-4-one Chemical compound C1CC(=O)CCN1C(C=1C=CC=CC=1)C1=CC=CC=C1 QLWJYOLYCKTBQT-UHFFFAOYSA-N 0.000 description 3
- HLLGFGBLKOIZOM-UHFFFAOYSA-N 2,2-diphenylacetaldehyde Chemical compound C=1C=CC=CC=1C(C=O)C1=CC=CC=C1 HLLGFGBLKOIZOM-UHFFFAOYSA-N 0.000 description 3
- LQZZZAFQKXTFKH-UHFFFAOYSA-N 4'-aminobiphenyl-4-ol Chemical compound C1=CC(N)=CC=C1C1=CC=C(O)C=C1 LQZZZAFQKXTFKH-UHFFFAOYSA-N 0.000 description 3
- CEDPZHCTMFYNJD-UHFFFAOYSA-N 4-(1-butylpiperidin-4-yl)phenol Chemical compound C1CN(CCCC)CCC1C1=CC=C(O)C=C1 CEDPZHCTMFYNJD-UHFFFAOYSA-N 0.000 description 3
- LYJUSGNBUCWZAX-UHFFFAOYSA-N 4-(dipentylamino)phenol Chemical compound CCCCCN(CCCCC)C1=CC=C(O)C=C1 LYJUSGNBUCWZAX-UHFFFAOYSA-N 0.000 description 3
- KROSOKJTABNBOQ-UHFFFAOYSA-N 4-[(1-benzhydrylpiperidin-4-yl)methyl]phenol Chemical compound C1CN(CCC1CC2=CC=C(C=C2)O)C(C3=CC=CC=C3)C4=CC=CC=C4 KROSOKJTABNBOQ-UHFFFAOYSA-N 0.000 description 3
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical compound C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- ILWWUQOVBBHSEZ-UHFFFAOYSA-N CC1=CC(C)=CC(N(CC2)CCC2C(C=C2)=CC=C2O)=C1 Chemical compound CC1=CC(C)=CC(N(CC2)CCC2C(C=C2)=CC=C2O)=C1 ILWWUQOVBBHSEZ-UHFFFAOYSA-N 0.000 description 3
- ABYFXZSTEDVGNY-UHFFFAOYSA-N CCCC(C=C1)=CC=C1N(CC1)CCC1C(C(C=C1)=CC=C1OC)=O Chemical compound CCCC(C=C1)=CC=C1N(CC1)CCC1C(C(C=C1)=CC=C1OC)=O ABYFXZSTEDVGNY-UHFFFAOYSA-N 0.000 description 3
- MSMCIKWCCORYJH-UHFFFAOYSA-N CCCC(C=C1)=CC=C1N(CCC1=C2)CC1=CC=C2O Chemical compound CCCC(C=C1)=CC=C1N(CCC1=C2)CC1=CC=C2O MSMCIKWCCORYJH-UHFFFAOYSA-N 0.000 description 3
- HQCLAQXPFRPRIJ-UHFFFAOYSA-N CCCC(C=C1)=CC=C1N1CCC(CC(C=C2)=CC=C2O)CC1 Chemical compound CCCC(C=C1)=CC=C1N1CCC(CC(C=C2)=CC=C2O)CC1 HQCLAQXPFRPRIJ-UHFFFAOYSA-N 0.000 description 3
- BQTRKNSHAWECRB-UHFFFAOYSA-N CCCC(C=C1)=CC=C1N1CCC(CC(C=C2)=CC=C2OC)CC1 Chemical compound CCCC(C=C1)=CC=C1N1CCC(CC(C=C2)=CC=C2OC)CC1 BQTRKNSHAWECRB-UHFFFAOYSA-N 0.000 description 3
- OAXVSWWVOWCRIR-UHFFFAOYSA-N CCCCC(CC1)CCN1C1=CC=C(CCO)C=C1 Chemical compound CCCCC(CC1)CCN1C1=CC=C(CCO)C=C1 OAXVSWWVOWCRIR-UHFFFAOYSA-N 0.000 description 3
- CZJAVJCHTXKOTL-UHFFFAOYSA-N CCCN(CCC)C(C=C1)=CC=C1C(C=C1)=CC=C1O Chemical compound CCCN(CCC)C(C=C1)=CC=C1C(C=C1)=CC=C1O CZJAVJCHTXKOTL-UHFFFAOYSA-N 0.000 description 3
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 3
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 3
- WUJVPQUCLAPDCX-UHFFFAOYSA-N OC1=CC=C(C2CCN(CC(C3=CC=CC=C3)C3=CC=CC=C3)CC2)C=C1 Chemical compound OC1=CC=C(C2CCN(CC(C3=CC=CC=C3)C3=CC=CC=C3)CC2)C=C1 WUJVPQUCLAPDCX-UHFFFAOYSA-N 0.000 description 3
- XDKSJPQLCRDGOM-UHFFFAOYSA-N OC1=CC=C(C2CCN(CC3(CC(C4)C5)CC5CC4C3)CC2)C=C1 Chemical compound OC1=CC=C(C2CCN(CC3(CC(C4)C5)CC5CC4C3)CC2)C=C1 XDKSJPQLCRDGOM-UHFFFAOYSA-N 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 3
- 230000002378 acidificating effect Effects 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 125000003277 amino group Chemical group 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 239000012867 bioactive agent Substances 0.000 description 3
- KXDHJXZQYSOELW-UHFFFAOYSA-N carbonic acid monoamide Natural products NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 238000004587 chromatography analysis Methods 0.000 description 3
- 238000002425 crystallisation Methods 0.000 description 3
- 230000008025 crystallization Effects 0.000 description 3
- 208000035475 disorder Diseases 0.000 description 3
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 3
- YFNGCKXAIRGJTA-UHFFFAOYSA-N ethyl 2-(dicyclohexylamino)acetate Chemical compound C1CCCCC1N(CC(=O)OCC)C1CCCCC1 YFNGCKXAIRGJTA-UHFFFAOYSA-N 0.000 description 3
- WIKWPYFFKLRAIF-UHFFFAOYSA-N ethyl 2-[1-(4-aminophenyl)piperidin-4-yl]acetate Chemical compound C1CC(CC(=O)OCC)CCN1C1=CC=C(N)C=C1 WIKWPYFFKLRAIF-UHFFFAOYSA-N 0.000 description 3
- 150000002430 hydrocarbons Chemical group 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- 125000002971 oxazolyl group Chemical group 0.000 description 3
- 239000010452 phosphate Substances 0.000 description 3
- 229910000027 potassium carbonate Inorganic materials 0.000 description 3
- 235000015320 potassium carbonate Nutrition 0.000 description 3
- 125000004076 pyridyl group Chemical group 0.000 description 3
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 3
- 239000007921 spray Substances 0.000 description 3
- 210000002784 stomach Anatomy 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 238000004809 thin layer chromatography Methods 0.000 description 3
- KJAMZCVTJDTESW-UHFFFAOYSA-N tiracizine Chemical compound C1CC2=CC=CC=C2N(C(=O)CN(C)C)C2=CC(NC(=O)OCC)=CC=C21 KJAMZCVTJDTESW-UHFFFAOYSA-N 0.000 description 3
- UGOMMVLRQDMAQQ-UHFFFAOYSA-N xphos Chemical compound CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 UGOMMVLRQDMAQQ-UHFFFAOYSA-N 0.000 description 3
- OEYAFMGVIFWPQI-UHFFFAOYSA-N (1-benzylpyrrolidin-2-yl)methanamine Chemical compound NCC1CCCN1CC1=CC=CC=C1 OEYAFMGVIFWPQI-UHFFFAOYSA-N 0.000 description 2
- ZAIQBJPTOXDDKA-UHFFFAOYSA-N (1-benzylpyrrolidin-2-yl)methanol Chemical compound OCC1CCCN1CC1=CC=CC=C1 ZAIQBJPTOXDDKA-UHFFFAOYSA-N 0.000 description 2
- BBDTWYQCXXFKDH-UHFFFAOYSA-N (4-methoxyphenyl)-piperidin-4-ylmethanone;hydrochloride Chemical compound Cl.C1=CC(OC)=CC=C1C(=O)C1CCNCC1 BBDTWYQCXXFKDH-UHFFFAOYSA-N 0.000 description 2
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 description 2
- LBUJPTNKIBCYBY-UHFFFAOYSA-N 1,2,3,4-tetrahydroquinoline Chemical compound C1=CC=C2CCCNC2=C1 LBUJPTNKIBCYBY-UHFFFAOYSA-N 0.000 description 2
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 2
- CYUOVQJYCHEQCU-UHFFFAOYSA-N 1-adamantyl-[4-(4-hydroxyphenyl)piperidin-1-yl]methanone Chemical compound C1=CC(O)=CC=C1C1CCN(C(=O)C23CC4CC(CC(C4)C2)C3)CC1 CYUOVQJYCHEQCU-UHFFFAOYSA-N 0.000 description 2
- NUPWGLKBGVNSJX-UHFFFAOYSA-N 1-bromo-4-propylbenzene Chemical compound CCCC1=CC=C(Br)C=C1 NUPWGLKBGVNSJX-UHFFFAOYSA-N 0.000 description 2
- QIALRSFOFFWEKO-UHFFFAOYSA-N 3-methyl-4-oxoimidazo[5,1-d][1,2,3,5]tetrazine-8-carbonyl isocyanate Chemical compound O=C1N(C)N=NC2=C(C(=O)N=C=O)N=CN21 QIALRSFOFFWEKO-UHFFFAOYSA-N 0.000 description 2
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 2
- NXNCSOWZLAPYDI-UHFFFAOYSA-N 4-[(4-methylpiperazin-1-yl)methyl]phenol Chemical compound C1CN(C)CCN1CC1=CC=C(O)C=C1 NXNCSOWZLAPYDI-UHFFFAOYSA-N 0.000 description 2
- RGHHSNMVTDWUBI-UHFFFAOYSA-N 4-hydroxybenzaldehyde Chemical compound OC1=CC=C(C=O)C=C1 RGHHSNMVTDWUBI-UHFFFAOYSA-N 0.000 description 2
- YCIPQJTZJGUXND-UHFFFAOYSA-N Aglaia odorata Alkaloid Natural products C1=CC(OC)=CC=C1C1(C(C=2C(=O)N3CCCC3=NC=22)C=3C=CC=CC=3)C2(O)C2=C(OC)C=C(OC)C=C2O1 YCIPQJTZJGUXND-UHFFFAOYSA-N 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- 229910015845 BBr3 Inorganic materials 0.000 description 2
- PXJKIQNZXWPBAE-BHVANESWSA-N CC[C@](C(C=C1N2CC3=C(CC)C(C=C(C=C4)OC(CN(C5CCCCC5)C5CCCCC5)=O)=C4N=C13)=C(CO1)C2=O)(C1=O)O Chemical compound CC[C@](C(C=C1N2CC3=C(CC)C(C=C(C=C4)OC(CN(C5CCCCC5)C5CCCCC5)=O)=C4N=C13)=C(CO1)C2=O)(C1=O)O PXJKIQNZXWPBAE-BHVANESWSA-N 0.000 description 2
- QIXVFKGGNQVWGJ-UHFFFAOYSA-N COC(C=C1)=CC=C1C(C(CC1)CCN1C(C1=CC=CC=C1)C1=CC=CC=C1)=O Chemical compound COC(C=C1)=CC=C1C(C(CC1)CCN1C(C1=CC=CC=C1)C1=CC=CC=C1)=O QIXVFKGGNQVWGJ-UHFFFAOYSA-N 0.000 description 2
- XZXVZBQGMDPAKV-UHFFFAOYSA-N COC1=CC=C(C(C(CC2)CCN2C(C2=CC=CC=C2)C2=CC=CC=C2)O)C=C1 Chemical compound COC1=CC=C(C(C(CC2)CCN2C(C2=CC=CC=C2)C2=CC=CC=C2)O)C=C1 XZXVZBQGMDPAKV-UHFFFAOYSA-N 0.000 description 2
- RGGVNLVDRTTYSP-UHFFFAOYSA-N COC1=CC=C(CC(CC2)CCN2C(C2=CC=CC=C2)C2=CC=CC=C2)C=C1 Chemical compound COC1=CC=C(CC(CC2)CCN2C(C2=CC=CC=C2)C2=CC=CC=C2)C=C1 RGGVNLVDRTTYSP-UHFFFAOYSA-N 0.000 description 2
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 2
- IAJILQKETJEXLJ-UHFFFAOYSA-N Galacturonsaeure Natural products O=CC(O)C(O)C(O)C(O)C(O)=O IAJILQKETJEXLJ-UHFFFAOYSA-N 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 2
- 238000004566 IR spectroscopy Methods 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 2
- 229910010084 LiAlH4 Inorganic materials 0.000 description 2
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 2
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 2
- UEZVMMHDMIWARA-UHFFFAOYSA-N Metaphosphoric acid Chemical compound OP(=O)=O UEZVMMHDMIWARA-UHFFFAOYSA-N 0.000 description 2
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical class C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- FDZYSROCTYFMDD-UHFFFAOYSA-N N#CC1=CC=C(C=C(CC2)CCN2C(C2=CC=CC=C2)C2=CC=CC=C2)C=C1 Chemical compound N#CC1=CC=C(C=C(CC2)CCN2C(C2=CC=CC=C2)C2=CC=CC=C2)C=C1 FDZYSROCTYFMDD-UHFFFAOYSA-N 0.000 description 2
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical group [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical class C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical class C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 2
- NBBJYMSMWIIQGU-UHFFFAOYSA-N Propionic aldehyde Chemical compound CCC=O NBBJYMSMWIIQGU-UHFFFAOYSA-N 0.000 description 2
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 2
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 2
- 238000002441 X-ray diffraction Methods 0.000 description 2
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 2
- DHKHKXVYLBGOIT-UHFFFAOYSA-N acetaldehyde Diethyl Acetal Natural products CCOC(C)OCC DHKHKXVYLBGOIT-UHFFFAOYSA-N 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 2
- 125000003158 alcohol group Chemical group 0.000 description 2
- 150000001299 aldehydes Chemical class 0.000 description 2
- 229910052782 aluminium Inorganic materials 0.000 description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 235000001014 amino acid Nutrition 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 2
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 2
- 238000009835 boiling Methods 0.000 description 2
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- 239000007894 caplet Substances 0.000 description 2
- 125000002837 carbocyclic group Chemical group 0.000 description 2
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 2
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 2
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 2
- 208000029742 colonic neoplasm Diseases 0.000 description 2
- 238000013270 controlled release Methods 0.000 description 2
- 230000001276 controlling effect Effects 0.000 description 2
- 239000003246 corticosteroid Substances 0.000 description 2
- 229960001334 corticosteroids Drugs 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- 125000006165 cyclic alkyl group Chemical group 0.000 description 2
- HCAJEUSONLESMK-UHFFFAOYSA-N cyclohexylsulfamic acid Chemical compound OS(=O)(=O)NC1CCCCC1 HCAJEUSONLESMK-UHFFFAOYSA-N 0.000 description 2
- 229960000975 daunorubicin Drugs 0.000 description 2
- 238000010511 deprotection reaction Methods 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- TXCDCPKCNAJMEE-UHFFFAOYSA-N dibenzofuran Chemical compound C1=CC=C2C3=CC=CC=C3OC2=C1 TXCDCPKCNAJMEE-UHFFFAOYSA-N 0.000 description 2
- CDPKWOKGVUHZFR-UHFFFAOYSA-N dichloro(methyl)phosphane Chemical compound CP(Cl)Cl CDPKWOKGVUHZFR-UHFFFAOYSA-N 0.000 description 2
- 238000007865 diluting Methods 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 238000000132 electrospray ionisation Methods 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 230000002255 enzymatic effect Effects 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- USGOGXZJPANEHE-UHFFFAOYSA-N ethyl 2-[1-(4-nitrophenyl)piperidin-4-yl]acetate Chemical compound C1CC(CC(=O)OCC)CCN1C1=CC=C([N+]([O-])=O)C=C1 USGOGXZJPANEHE-UHFFFAOYSA-N 0.000 description 2
- 239000012458 free base Substances 0.000 description 2
- 125000002541 furyl group Chemical group 0.000 description 2
- FXHGMKSSBGDXIY-UHFFFAOYSA-N heptanal Chemical compound CCCCCCC=O FXHGMKSSBGDXIY-UHFFFAOYSA-N 0.000 description 2
- VKYKSIONXSXAKP-UHFFFAOYSA-N hexamethylenetetramine Chemical compound C1N(C2)CN3CN1CN2C3 VKYKSIONXSXAKP-UHFFFAOYSA-N 0.000 description 2
- KIWBRXCOTCXSSZ-UHFFFAOYSA-N hexyl carbonochloridate Chemical compound CCCCCCOC(Cl)=O KIWBRXCOTCXSSZ-UHFFFAOYSA-N 0.000 description 2
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 2
- 125000002883 imidazolyl group Chemical group 0.000 description 2
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 2
- 125000001041 indolyl group Chemical group 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 125000000904 isoindolyl group Chemical group C=1(NC=C2C=CC=CC12)* 0.000 description 2
- 150000002576 ketones Chemical class 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000008297 liquid dosage form Substances 0.000 description 2
- 229910052744 lithium Inorganic materials 0.000 description 2
- 239000012280 lithium aluminium hydride Substances 0.000 description 2
- 239000011777 magnesium Substances 0.000 description 2
- 229910052749 magnesium Inorganic materials 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 239000002808 molecular sieve Substances 0.000 description 2
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 239000006072 paste Substances 0.000 description 2
- 239000003208 petroleum Substances 0.000 description 2
- 125000001791 phenazinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3N=C12)* 0.000 description 2
- 125000001484 phenothiazinyl group Chemical group C1(=CC=CC=2SC3=CC=CC=C3NC12)* 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 229910052698 phosphorus Inorganic materials 0.000 description 2
- 239000011574 phosphorus Chemical group 0.000 description 2
- 230000000704 physical effect Effects 0.000 description 2
- 230000004962 physiological condition Effects 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 239000011591 potassium Substances 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- 238000002953 preparative HPLC Methods 0.000 description 2
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 230000004224 protection Effects 0.000 description 2
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 2
- 125000003373 pyrazinyl group Chemical group 0.000 description 2
- 125000003226 pyrazolyl group Chemical group 0.000 description 2
- 125000002098 pyridazinyl group Chemical group 0.000 description 2
- VTGOHKSTWXHQJK-UHFFFAOYSA-N pyrimidin-2-ol Chemical compound OC1=NC=CC=N1 VTGOHKSTWXHQJK-UHFFFAOYSA-N 0.000 description 2
- 125000000714 pyrimidinyl group Chemical group 0.000 description 2
- 125000000168 pyrrolyl group Chemical group 0.000 description 2
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 2
- 125000005493 quinolyl group Chemical group 0.000 description 2
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 2
- 230000009257 reactivity Effects 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical compound [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 description 2
- 239000012279 sodium borohydride Substances 0.000 description 2
- 229910000033 sodium borohydride Inorganic materials 0.000 description 2
- BEOOHQFXGBMRKU-UHFFFAOYSA-N sodium cyanoborohydride Chemical compound [Na+].[B-]C#N BEOOHQFXGBMRKU-UHFFFAOYSA-N 0.000 description 2
- AKHNMLFCWUSKQB-UHFFFAOYSA-L sodium thiosulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=S AKHNMLFCWUSKQB-UHFFFAOYSA-L 0.000 description 2
- 235000019345 sodium thiosulphate Nutrition 0.000 description 2
- 239000007909 solid dosage form Substances 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 239000011975 tartaric acid Substances 0.000 description 2
- 235000002906 tartaric acid Nutrition 0.000 description 2
- 125000001544 thienyl group Chemical group 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- 125000001425 triazolyl group Chemical group 0.000 description 2
- AQRLNPVMDITEJU-UHFFFAOYSA-N triethylsilane Chemical compound CC[SiH](CC)CC AQRLNPVMDITEJU-UHFFFAOYSA-N 0.000 description 2
- PYOKUURKVVELLB-UHFFFAOYSA-N trimethyl orthoformate Chemical compound COC(OC)OC PYOKUURKVVELLB-UHFFFAOYSA-N 0.000 description 2
- 238000001851 vibrational circular dichroism spectroscopy Methods 0.000 description 2
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 2
- 229920002554 vinyl polymer Polymers 0.000 description 2
- 239000011701 zinc Substances 0.000 description 2
- 229910052725 zinc Inorganic materials 0.000 description 2
- NLPUSUARSZKOKJ-UHFFFAOYSA-N (1-benzhydrylpyrrolidin-2-yl)methanamine Chemical compound NCC1CCCN1C(c1ccccc1)c1ccccc1 NLPUSUARSZKOKJ-UHFFFAOYSA-N 0.000 description 1
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 1
- AAWZDTNXLSGCEK-LNVDRNJUSA-N (3r,5r)-1,3,4,5-tetrahydroxycyclohexane-1-carboxylic acid Chemical compound O[C@@H]1CC(O)(C(O)=O)C[C@@H](O)C1O AAWZDTNXLSGCEK-LNVDRNJUSA-N 0.000 description 1
- CCFSGQKTSBIIHG-UHFFFAOYSA-N (4-methoxyphenyl) carbonochloridate Chemical compound COC1=CC=C(OC(Cl)=O)C=C1 CCFSGQKTSBIIHG-UHFFFAOYSA-N 0.000 description 1
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 description 1
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 description 1
- 239000001211 (E)-4-phenylbut-3-en-2-one Substances 0.000 description 1
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- SCMZIFSYPJICCV-UHFFFAOYSA-N 1,2,3,4-tetrahydroisoquinolin-6-ol Chemical compound C1NCCC2=CC(O)=CC=C21 SCMZIFSYPJICCV-UHFFFAOYSA-N 0.000 description 1
- PVOAHINGSUIXLS-UHFFFAOYSA-N 1-Methylpiperazine Chemical compound CN1CCNCC1 PVOAHINGSUIXLS-UHFFFAOYSA-N 0.000 description 1
- LLOQMFDCQPKSFB-UHFFFAOYSA-N 1-benzhydrylpiperidine Chemical compound C1CCCCN1C(C=1C=CC=CC=1)C1=CC=CC=C1 LLOQMFDCQPKSFB-UHFFFAOYSA-N 0.000 description 1
- DJMXWKUBTGMKCG-UHFFFAOYSA-N 1-benzhydrylpyrrolidine Chemical compound C1CCCN1C(C=1C=CC=CC=1)C1=CC=CC=C1 DJMXWKUBTGMKCG-UHFFFAOYSA-N 0.000 description 1
- SOZQAONWQPHCPN-UHFFFAOYSA-N 1-benzylpyrrolidine-2-carboxamide Chemical compound NC(=O)C1CCCN1CC1=CC=CC=C1 SOZQAONWQPHCPN-UHFFFAOYSA-N 0.000 description 1
- LMFRTSBQRLSJHC-UHFFFAOYSA-N 1-bromo-3,5-dimethylbenzene Chemical group CC1=CC(C)=CC(Br)=C1 LMFRTSBQRLSJHC-UHFFFAOYSA-N 0.000 description 1
- WFQDTOYDVUWQMS-UHFFFAOYSA-N 1-fluoro-4-nitrobenzene Chemical compound [O-][N+](=O)C1=CC=C(F)C=C1 WFQDTOYDVUWQMS-UHFFFAOYSA-N 0.000 description 1
- BLXSFCHWMBESKV-UHFFFAOYSA-N 1-iodopentane Chemical compound CCCCCI BLXSFCHWMBESKV-UHFFFAOYSA-N 0.000 description 1
- 125000000530 1-propynyl group Chemical group [H]C([H])([H])C#C* 0.000 description 1
- 125000001462 1-pyrrolyl group Chemical group [*]N1C([H])=C([H])C([H])=C1[H] 0.000 description 1
- LFHLEABTNIQIQO-UHFFFAOYSA-N 1H-isoindole Chemical compound C1=CC=C2CN=CC2=C1 LFHLEABTNIQIQO-UHFFFAOYSA-N 0.000 description 1
- HUTNOYOBQPAKIA-UHFFFAOYSA-N 1h-pyrazin-2-one Chemical compound OC1=CN=CC=N1 HUTNOYOBQPAKIA-UHFFFAOYSA-N 0.000 description 1
- AAILEWXSEQLMNI-UHFFFAOYSA-N 1h-pyridazin-6-one Chemical compound OC1=CC=CN=N1 AAILEWXSEQLMNI-UHFFFAOYSA-N 0.000 description 1
- QMNWYGTWTXOQTP-UHFFFAOYSA-N 1h-triazin-6-one Chemical compound O=C1C=CN=NN1 QMNWYGTWTXOQTP-UHFFFAOYSA-N 0.000 description 1
- 125000004398 2-methyl-2-butyl group Chemical group CC(C)(CC)* 0.000 description 1
- 125000004918 2-methyl-2-pentyl group Chemical group CC(C)(CCC)* 0.000 description 1
- 125000004922 2-methyl-3-pentyl group Chemical group CC(C)C(CC)* 0.000 description 1
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 1
- IYDUFJOXYMLYNM-UHFFFAOYSA-N 2-piperidin-1-ium-4-ylacetic acid;chloride Chemical compound [Cl-].OC(=O)CC1CC[NH2+]CC1 IYDUFJOXYMLYNM-UHFFFAOYSA-N 0.000 description 1
- GWWZRSGYYSHXMD-UHFFFAOYSA-N 2-piperidin-4-ylethyl acetate;hydrochloride Chemical compound Cl.CC(=O)OCCC1CCNCC1 GWWZRSGYYSHXMD-UHFFFAOYSA-N 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- VHMICKWLTGFITH-UHFFFAOYSA-N 2H-isoindole Chemical compound C1=CC=CC2=CNC=C21 VHMICKWLTGFITH-UHFFFAOYSA-N 0.000 description 1
- HGWUUOXXAIISDB-UHFFFAOYSA-N 3-azabicyclo[3.1.0]hexane Chemical compound C1NCC2CC21 HGWUUOXXAIISDB-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- 125000004917 3-methyl-2-butyl group Chemical group CC(C(C)*)C 0.000 description 1
- 125000004919 3-methyl-2-pentyl group Chemical group CC(C(C)*)CC 0.000 description 1
- 125000004921 3-methyl-3-pentyl group Chemical group CC(CC)(CC)* 0.000 description 1
- VVTMIOYTNALQAW-UHFFFAOYSA-N 3-methyl-4-oxoimidazo[5,1-d][1,2,3,5]tetrazine-8-carboxylic acid Chemical compound O=C1N(C)N=NC2=C(C(O)=O)N=CN21 VVTMIOYTNALQAW-UHFFFAOYSA-N 0.000 description 1
- 125000001397 3-pyrrolyl group Chemical group [H]N1C([H])=C([*])C([H])=C1[H] 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- ZNDJDQOECGBUNK-UHFFFAOYSA-N 4-(4-nitrophenyl)phenol Chemical compound C1=CC(O)=CC=C1C1=CC=C([N+]([O-])=O)C=C1 ZNDJDQOECGBUNK-UHFFFAOYSA-N 0.000 description 1
- XGBXKFFOFJXZIP-UHFFFAOYSA-N 4-(dimethoxyphosphorylmethyl)benzonitrile Chemical compound COP(=O)(OC)CC1=CC=C(C#N)C=C1 XGBXKFFOFJXZIP-UHFFFAOYSA-N 0.000 description 1
- BZGBBAAWCANEGA-UHFFFAOYSA-N 4-[(1-benzylpiperidin-4-ylidene)methyl]benzonitrile Chemical compound C1=CC(C#N)=CC=C1C=C1CCN(CC=2C=CC=CC=2)CC1 BZGBBAAWCANEGA-UHFFFAOYSA-N 0.000 description 1
- PLIKAWJENQZMHA-UHFFFAOYSA-N 4-aminophenol Chemical compound NC1=CC=C(O)C=C1 PLIKAWJENQZMHA-UHFFFAOYSA-N 0.000 description 1
- PJZNWESBJXCGSK-UHFFFAOYSA-N 4-butylpiperidine;hydrochloride Chemical compound Cl.CCCCC1CCNCC1 PJZNWESBJXCGSK-UHFFFAOYSA-N 0.000 description 1
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 1
- 125000004920 4-methyl-2-pentyl group Chemical group CC(CC(C)*)C 0.000 description 1
- VVWYZHFWAUQTKI-UHFFFAOYSA-N 4-piperidin-4-ylbenzoic acid;hydrochloride Chemical compound Cl.C1=CC(C(=O)O)=CC=C1C1CCNCC1 VVWYZHFWAUQTKI-UHFFFAOYSA-N 0.000 description 1
- 125000006043 5-hexenyl group Chemical group 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- DGGKXQQCVPAUEA-UHFFFAOYSA-N 8-azabicyclo[3.2.1]octane Chemical compound C1CCC2CCC1N2 DGGKXQQCVPAUEA-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 206010000830 Acute leukaemia Diseases 0.000 description 1
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Natural products CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 1
- CQNVELICTBKRON-UHFFFAOYSA-N C(C)C1=C(C(C(NO1)=O)=O)CC Chemical compound C(C)C1=C(C(C(NO1)=O)=O)CC CQNVELICTBKRON-UHFFFAOYSA-N 0.000 description 1
- UCIBLXOLDDPFPR-UHFFFAOYSA-N C1CN(CCC1CC2=CC=C(C=C2)CN)CC3=CC=CC=C3 Chemical compound C1CN(CCC1CC2=CC=C(C=C2)CN)CC3=CC=CC=C3 UCIBLXOLDDPFPR-UHFFFAOYSA-N 0.000 description 1
- NOPFPTZPFKHKEX-UHFFFAOYSA-N CCCCN(CCCC)C(C=C1)=CC=C1N1CCC(CC(OCC)=O)CC1 Chemical compound CCCCN(CCCC)C(C=C1)=CC=C1N1CCC(CC(OCC)=O)CC1 NOPFPTZPFKHKEX-UHFFFAOYSA-N 0.000 description 1
- CIPFEDDFUBQKIH-UHFFFAOYSA-N CCCCN(CCCC)C(C=C1)=CC=C1N1CCC(CCOC(N(C=C(C(N2)=O)F)C2=O)=O)CC1 Chemical compound CCCCN(CCCC)C(C=C1)=CC=C1N1CCC(CCOC(N(C=C(C(N2)=O)F)C2=O)=O)CC1 CIPFEDDFUBQKIH-UHFFFAOYSA-N 0.000 description 1
- FNVHQZRDHFCBKD-QQLMSYFVSA-N CC[C@](C(C=C1N2CC3=C(CC)C(C=C(C=C4)OC([C@H](CCC5)N5C(C5=CC=CC=C5)C5=CC=CC=C5)=O)=C4N=C13)=C(CO1)C2=O)(C1=O)O Chemical compound CC[C@](C(C=C1N2CC3=C(CC)C(C=C(C=C4)OC([C@H](CCC5)N5C(C5=CC=CC=C5)C5=CC=CC=C5)=O)=C4N=C13)=C(CO1)C2=O)(C1=O)O FNVHQZRDHFCBKD-QQLMSYFVSA-N 0.000 description 1
- IVJQGHZBFXYNFM-UHFFFAOYSA-N CN1N=NC2=C(C(NCC3=CC=C(CC(CC4)CCN4C(C4=CC=CC=C4)C4=CC=CC=C4)C=C3)=O)N=CN2C1=O Chemical compound CN1N=NC2=C(C(NCC3=CC=C(CC(CC4)CCN4C(C4=CC=CC=C4)C4=CC=CC=C4)C=C3)=O)N=CN2C1=O IVJQGHZBFXYNFM-UHFFFAOYSA-N 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 208000006332 Choriocarcinoma Diseases 0.000 description 1
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 1
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- AAWZDTNXLSGCEK-UHFFFAOYSA-N Cordycepinsaeure Natural products OC1CC(O)(C(O)=O)CC(O)C1O AAWZDTNXLSGCEK-UHFFFAOYSA-N 0.000 description 1
- GUGHGUXZJWAIAS-QQYBVWGSSA-N Daunorubicin hydrochloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 GUGHGUXZJWAIAS-QQYBVWGSSA-N 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 208000010201 Exanthema Diseases 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 235000019766 L-Lysine Nutrition 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-N L-arginine Chemical compound OC(=O)[C@@H](N)CCCN=C(N)N ODKSFYDXXFIFQN-BYPYZUCNSA-N 0.000 description 1
- 229930064664 L-arginine Natural products 0.000 description 1
- 235000014852 L-arginine Nutrition 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- 150000001204 N-oxides Chemical class 0.000 description 1
- LHOXAYHDXKAWGK-UHFFFAOYSA-N NC(=O)C1CCCN1C(C=1C=CC=CC=1)C1=CC=CC=C1 Chemical compound NC(=O)C1CCCN1C(C=1C=CC=CC=1)C1=CC=CC=C1 LHOXAYHDXKAWGK-UHFFFAOYSA-N 0.000 description 1
- UREHHFVBFZZDNM-UHFFFAOYSA-N NCC1=CC=C(CC(CC2)CCN2C(C2=CC=CC=C2)C2=CC=CC=C2)C=C1 Chemical compound NCC1=CC=C(CC(CC2)CCN2C(C2=CC=CC=C2)C2=CC=CC=C2)C=C1 UREHHFVBFZZDNM-UHFFFAOYSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- YZCKVEUIGOORGS-IGMARMGPSA-N Protium Chemical compound [1H] YZCKVEUIGOORGS-IGMARMGPSA-N 0.000 description 1
- 241000720974 Protium Species 0.000 description 1
- AAWZDTNXLSGCEK-ZHQZDSKASA-N Quinic acid Natural products O[C@H]1CC(O)(C(O)=O)C[C@H](O)C1O AAWZDTNXLSGCEK-ZHQZDSKASA-N 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- 208000006265 Renal cell carcinoma Diseases 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- GNVMUORYQLCPJZ-UHFFFAOYSA-M Thiocarbamate Chemical compound NC([S-])=O GNVMUORYQLCPJZ-UHFFFAOYSA-M 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 208000000208 Wet Macular Degeneration Diseases 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- ZDVDCDLBOLSVGM-UHFFFAOYSA-N [chloro(phenyl)methyl]benzene Chemical compound C=1C=CC=CC=1C(Cl)C1=CC=CC=C1 ZDVDCDLBOLSVGM-UHFFFAOYSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 206010064930 age-related macular degeneration Diseases 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- IAJILQKETJEXLJ-RSJOWCBRSA-N aldehydo-D-galacturonic acid Chemical compound O=C[C@H](O)[C@@H](O)[C@@H](O)[C@H](O)C(O)=O IAJILQKETJEXLJ-RSJOWCBRSA-N 0.000 description 1
- IAJILQKETJEXLJ-QTBDOELSSA-N aldehydo-D-glucuronic acid Chemical compound O=C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)C(O)=O IAJILQKETJEXLJ-QTBDOELSSA-N 0.000 description 1
- 150000001335 aliphatic alkanes Chemical class 0.000 description 1
- 150000008044 alkali metal hydroxides Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 150000003973 alkyl amines Chemical class 0.000 description 1
- 125000002947 alkylene group Chemical group 0.000 description 1
- 229940061720 alpha hydroxy acid Drugs 0.000 description 1
- 150000001280 alpha hydroxy acids Chemical class 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 159000000032 aromatic acids Chemical class 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- JUHORIMYRDESRB-UHFFFAOYSA-N benzathine Chemical compound C=1C=CC=CC=1CNCCNCC1=CC=CC=C1 JUHORIMYRDESRB-UHFFFAOYSA-N 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- HSDAJNMJOMSNEV-UHFFFAOYSA-N benzyl chloroformate Chemical compound ClC(=O)OCC1=CC=CC=C1 HSDAJNMJOMSNEV-UHFFFAOYSA-N 0.000 description 1
- 229930008407 benzylideneacetone Natural products 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 210000003445 biliary tract Anatomy 0.000 description 1
- 208000020790 biliary tract neoplasm Diseases 0.000 description 1
- 230000000975 bioactive effect Effects 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 238000010504 bond cleavage reaction Methods 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 229910000024 caesium carbonate Inorganic materials 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 235000013877 carbamide Nutrition 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 150000001722 carbon compounds Chemical class 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical compound OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 150000001733 carboxylic acid esters Chemical class 0.000 description 1
- 208000002458 carcinoid tumor Diseases 0.000 description 1
- 201000011603 cardia cancer Diseases 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 238000002144 chemical decomposition reaction Methods 0.000 description 1
- 229910052729 chemical element Inorganic materials 0.000 description 1
- 125000003636 chemical group Chemical group 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- VDANGULDQQJODZ-UHFFFAOYSA-N chloroprocaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1Cl VDANGULDQQJODZ-UHFFFAOYSA-N 0.000 description 1
- 229960002023 chloroprocaine Drugs 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- 125000004230 chromenyl group Chemical group O1C(C=CC2=CC=CC=C12)* 0.000 description 1
- 235000013985 cinnamic acid Nutrition 0.000 description 1
- 229930016911 cinnamic acid Natural products 0.000 description 1
- WCZVZNOTHYJIEI-UHFFFAOYSA-N cinnoline Chemical compound N1=NC=CC2=CC=CC=C21 WCZVZNOTHYJIEI-UHFFFAOYSA-N 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 229940109275 cyclamate Drugs 0.000 description 1
- WZHCOOQXZCIUNC-UHFFFAOYSA-N cyclandelate Chemical compound C1C(C)(C)CC(C)CC1OC(=O)C(O)C1=CC=CC=C1 WZHCOOQXZCIUNC-UHFFFAOYSA-N 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000003678 cyclohexadienyl group Chemical group C1(=CC=CCC1)* 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000006547 cyclononyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 230000000593 degrading effect Effects 0.000 description 1
- 238000001212 derivatisation Methods 0.000 description 1
- 239000007933 dermal patch Substances 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 229940043237 diethanolamine Drugs 0.000 description 1
- 125000005045 dihydroisoquinolinyl group Chemical group C1(NC=CC2=CC=CC=C12)* 0.000 description 1
- 125000005044 dihydroquinolinyl group Chemical group N1(CC=CC2=CC=CC=C12)* 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- BDUPRNVPXOHWIL-UHFFFAOYSA-N dimethyl sulfite Chemical compound COS(=O)OC BDUPRNVPXOHWIL-UHFFFAOYSA-N 0.000 description 1
- MGHPNCMVUAKAIE-UHFFFAOYSA-N diphenylmethanamine Chemical compound C=1C=CC=CC=1C(N)C1=CC=CC=C1 MGHPNCMVUAKAIE-UHFFFAOYSA-N 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- XBRDBODLCHKXHI-UHFFFAOYSA-N epolamine Chemical compound OCCN1CCCC1 XBRDBODLCHKXHI-UHFFFAOYSA-N 0.000 description 1
- 230000000925 erythroid effect Effects 0.000 description 1
- 210000003238 esophagus Anatomy 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- 229940031098 ethanolamine Drugs 0.000 description 1
- VFRSADQPWYCXDG-LEUCUCNGSA-N ethyl (2s,5s)-5-methylpyrrolidine-2-carboxylate;2,2,2-trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.CCOC(=O)[C@@H]1CC[C@H](C)N1 VFRSADQPWYCXDG-LEUCUCNGSA-N 0.000 description 1
- PQJJJMRNHATNKG-UHFFFAOYSA-N ethyl bromoacetate Chemical compound CCOC(=O)CBr PQJJJMRNHATNKG-UHFFFAOYSA-N 0.000 description 1
- 229940012017 ethylenediamine Drugs 0.000 description 1
- 125000005469 ethylenyl group Chemical group 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 230000005713 exacerbation Effects 0.000 description 1
- 201000005884 exanthem Diseases 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 239000012065 filter cake Substances 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 229940083124 ganglion-blocking antiadrenergic secondary and tertiary amines Drugs 0.000 description 1
- 229940097043 glucuronic acid Drugs 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000004312 hexamethylene tetramine Substances 0.000 description 1
- 235000010299 hexamethylene tetramine Nutrition 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 239000005457 ice water Substances 0.000 description 1
- UTCSSFWDNNEEBH-UHFFFAOYSA-N imidazo[1,2-a]pyridine Chemical group C1=CC=CC2=NC=CN21 UTCSSFWDNNEEBH-UHFFFAOYSA-N 0.000 description 1
- 125000002962 imidazol-1-yl group Chemical group [*]N1C([H])=NC([H])=C1[H] 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 238000002329 infrared spectrum Methods 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 125000001977 isobenzofuranyl group Chemical group C=1(OC=C2C=CC=CC12)* 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 238000006317 isomerization reaction Methods 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 208000002780 macular degeneration Diseases 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- WPBNNNQJVZRUHP-UHFFFAOYSA-L manganese(2+);methyl n-[[2-(methoxycarbonylcarbamothioylamino)phenyl]carbamothioyl]carbamate;n-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate Chemical compound [Mn+2].[S-]C(=S)NCCNC([S-])=S.COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC WPBNNNQJVZRUHP-UHFFFAOYSA-L 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 229960003194 meglumine Drugs 0.000 description 1
- 230000004630 mental health Effects 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- HQEIPVHJHZTMDP-JEDNCBNOSA-N methyl (2s)-pyrrolidine-2-carboxylate;hydrochloride Chemical compound Cl.COC(=O)[C@@H]1CCCN1 HQEIPVHJHZTMDP-JEDNCBNOSA-N 0.000 description 1
- QHJOWSXZDCTNQX-UHFFFAOYSA-N methyl 2-(4-bromophenyl)acetate Chemical compound COC(=O)CC1=CC=C(Br)C=C1 QHJOWSXZDCTNQX-UHFFFAOYSA-N 0.000 description 1
- CXHHBNMLPJOKQD-UHFFFAOYSA-M methyl carbonate Chemical compound COC([O-])=O CXHHBNMLPJOKQD-UHFFFAOYSA-M 0.000 description 1
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 229910000403 monosodium phosphate Inorganic materials 0.000 description 1
- 235000019799 monosodium phosphate Nutrition 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- LNOPIUAQISRISI-UHFFFAOYSA-N n'-hydroxy-2-propan-2-ylsulfonylethanimidamide Chemical compound CC(C)S(=O)(=O)CC(N)=NO LNOPIUAQISRISI-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- 125000001400 nonyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000002868 norbornyl group Chemical group C12(CCC(CC1)C2)* 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 150000002905 orthoesters Chemical class 0.000 description 1
- 201000008482 osteoarthritis Diseases 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 125000003566 oxetanyl group Chemical group 0.000 description 1
- 238000012856 packing Methods 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 235000019371 penicillin G benzathine Nutrition 0.000 description 1
- 125000003538 pentan-3-yl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 125000001644 phenoxazinyl group Chemical group C1(=CC=CC=2OC3=CC=CC=C3NC12)* 0.000 description 1
- DHHVAGZRUROJKS-UHFFFAOYSA-N phentermine Chemical compound CC(C)(N)CC1=CC=CC=C1 DHHVAGZRUROJKS-UHFFFAOYSA-N 0.000 description 1
- BSCCSDNZEIHXOK-UHFFFAOYSA-N phenyl carbamate Chemical compound NC(=O)OC1=CC=CC=C1 BSCCSDNZEIHXOK-UHFFFAOYSA-N 0.000 description 1
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 1
- PTMHPRAIXMAOOB-UHFFFAOYSA-L phosphoramidate Chemical compound NP([O-])([O-])=O PTMHPRAIXMAOOB-UHFFFAOYSA-L 0.000 description 1
- 150000008298 phosphoramidates Chemical class 0.000 description 1
- 150000003014 phosphoric acid esters Chemical class 0.000 description 1
- 125000004592 phthalazinyl group Chemical group C1(=NN=CC2=CC=CC=C12)* 0.000 description 1
- XKJCHHZQLQNZHY-UHFFFAOYSA-N phthalimide Chemical compound C1=CC=C2C(=O)NC(=O)C2=C1 XKJCHHZQLQNZHY-UHFFFAOYSA-N 0.000 description 1
- 230000001766 physiological effect Effects 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- GJQNVZVOTKFLIU-UHFFFAOYSA-N piperidin-1-ium-4-one;chloride Chemical compound Cl.O=C1CCNCC1 GJQNVZVOTKFLIU-UHFFFAOYSA-N 0.000 description 1
- XBXHCBLBYQEYTI-UHFFFAOYSA-N piperidin-4-ylmethanol Chemical compound OCC1CCNCC1 XBXHCBLBYQEYTI-UHFFFAOYSA-N 0.000 description 1
- 125000005936 piperidyl group Chemical group 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- 230000009862 primary prevention Effects 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 125000003132 pyranosyl group Chemical group 0.000 description 1
- 125000004309 pyranyl group Chemical group O1C(C=CC=C1)* 0.000 description 1
- UBQKCCHYAOITMY-UHFFFAOYSA-N pyridin-2-ol Chemical compound OC1=CC=CC=N1 UBQKCCHYAOITMY-UHFFFAOYSA-N 0.000 description 1
- JUJWROOIHBZHMG-UHFFFAOYSA-N pyridine Substances C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 1
- 238000003908 quality control method Methods 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 230000000171 quenching effect Effects 0.000 description 1
- ZHNFLHYOFXQIOW-LPYZJUEESA-N quinine sulfate dihydrate Chemical compound [H+].[H+].O.O.[O-]S([O-])(=O)=O.C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@@H]2[C@H](O)C1=CC=NC2=CC=C(OC)C=C21.C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@@H]2[C@H](O)C1=CC=NC2=CC=C(OC)C=C21 ZHNFLHYOFXQIOW-LPYZJUEESA-N 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- SBYHFKPVCBCYGV-UHFFFAOYSA-N quinuclidine Chemical compound C1CC2CCN1CC2 SBYHFKPVCBCYGV-UHFFFAOYSA-N 0.000 description 1
- 206010037844 rash Diseases 0.000 description 1
- 238000009790 rate-determining step (RDS) Methods 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 208000023504 respiratory system disease Diseases 0.000 description 1
- 238000007363 ring formation reaction Methods 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 230000009863 secondary prevention Effects 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical compound [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 238000002798 spectrophotometry method Methods 0.000 description 1
- 238000004611 spectroscopical analysis Methods 0.000 description 1
- 125000003003 spiro group Chemical group 0.000 description 1
- 238000013222 sprague-dawley male rat Methods 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 230000000707 stereoselective effect Effects 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- IIACRCGMVDHOTQ-UHFFFAOYSA-M sulfamate Chemical compound NS([O-])(=O)=O IIACRCGMVDHOTQ-UHFFFAOYSA-M 0.000 description 1
- 150000003460 sulfonic acids Chemical class 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 230000001839 systemic circulation Effects 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- YBRBMKDOPFTVDT-UHFFFAOYSA-N tert-butylamine Chemical compound CC(C)(C)N YBRBMKDOPFTVDT-UHFFFAOYSA-N 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000003039 tetrahydroisoquinolinyl group Chemical group C1(NCCC2=CC=CC=C12)* 0.000 description 1
- 125000001712 tetrahydronaphthyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- 125000000147 tetrahydroquinolinyl group Chemical group N1(CCCC2=CC=CC=C12)* 0.000 description 1
- 125000005958 tetrahydrothienyl group Chemical group 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 150000007970 thio esters Chemical class 0.000 description 1
- 150000003585 thioureas Chemical class 0.000 description 1
- 239000012049 topical pharmaceutical composition Substances 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- BWHOZHOGCMHOBV-BQYQJAHWSA-N trans-benzylideneacetone Chemical compound CC(=O)\C=C\C1=CC=CC=C1 BWHOZHOGCMHOBV-BQYQJAHWSA-N 0.000 description 1
- 238000000844 transformation Methods 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- IMNIMPAHZVJRPE-UHFFFAOYSA-N triethylenediamine Chemical compound C1CN2CCN1CC2 IMNIMPAHZVJRPE-UHFFFAOYSA-N 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 150000003672 ureas Chemical class 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/46—Two or more oxygen, sulphur or nitrogen atoms
- C07D239/52—Two oxygen atoms
- C07D239/54—Two oxygen atoms as doubly bound oxygen atoms or as unsubstituted hydroxy radicals
- C07D239/545—Two oxygen atoms as doubly bound oxygen atoms or as unsubstituted hydroxy radicals with other hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/553—Two oxygen atoms as doubly bound oxygen atoms or as unsubstituted hydroxy radicals with other hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms with halogen atoms or nitro radicals directly attached to ring carbon atoms, e.g. fluorouracil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/545—Heterocyclic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D309/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings
- C07D309/02—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings having no double bonds between ring members or between ring members and non-ring members
- C07D309/08—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D309/14—Nitrogen atoms not forming part of a nitro radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/22—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains four or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/645—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having two nitrogen atoms as the only ring hetero atoms
- C07F9/6509—Six-membered rings
- C07F9/6512—Six-membered rings having the nitrogen atoms in positions 1 and 3
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/6561—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom containing systems of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring or ring system, with or without other non-condensed hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H15/00—Compounds containing hydrocarbon or substituted hydrocarbon radicals directly attached to hetero atoms of saccharide radicals
- C07H15/20—Carbocyclic rings
- C07H15/24—Condensed ring systems having three or more rings
- C07H15/252—Naphthacene radicals, e.g. daunomycins, adriamycins
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Engineering & Computer Science (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Biotechnology (AREA)
- Genetics & Genomics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
本揭露內容涉及用於持續釋放治療劑的前藥,以及使用此類前藥治療疾病的方法。
Description
本揭露內容關於用於持續釋放治療劑的前藥,以及使用此類前藥治療疾病的方法。
大多數治療劑通過口服/GI吸收或全身注射全身性地遞送到身體。隨後,治療劑通過血液循環遞送到作用位點,因此,治療劑暴露於整個身體。在一些情況下,治療劑在身體其它部分中的非預期暴露可導致副作用,有時是嚴重的副作用。為了減少全身暴露導致的副作用,開發了許多局部遞送劑型。一個良好實例為治療呼吸系統疾病,如COPD和哮喘的吸入劑型。這些治療劑靶向氣道上的受體,並且使氣道開放以進行更有效的氧氣交換。存在許多局部遞送藥物的其它實例,如用於皮疹的局部皮質類固醇、用於濕性年齡相關性黃斑變性(age-related macular degeneration;AMD)的抗VEGF玻璃體內注射、治療骨關節炎的皮質類固醇關節內注射。這些局部遞送劑型的目的是具有高局部藥物濃度以具有治療性有效性,但減少藥物的全身暴露以具有最小副作用。然而,局部遞送劑型在大多數情況下難以使用,尤其是局部注射劑型。因此,期望一種具有可緩慢釋放藥物以具有延長的持續時間來降低給藥頻率的遞送系統,例如持續或控制釋放劑型。前藥方法是所屬領域中已知人員通常使用的持續釋放機制之一。
全身循環中的藥物通過酶或排泄從系統代謝和消除。為了在所有時間維持高於有效濃度的濃度,需要比有效濃度高得多的峰濃度,使得每次給藥之間的谷將高於有效濃度。然而,在一些情況下,峰濃度可導致不期望的副作用。存在許多方法來降低峰濃度而不按比例降低谷濃度。最流行的方法為使用聚合物來減緩藥物從給藥系統的釋放。許多口服施用的持續釋放/控制釋放系統使用此方法。此方法在一些事件中存在利弊,尤其是對於以在數周或數月的持續時間內進行釋放為目標的局部注射遞送系統。使用聚合物系統來控制藥物釋放還可能在產品的製造工藝和質量控制方面具有挑戰。更精確控制藥物釋放的另一方法為提供可通過化學鍵裂解釋放藥物的前藥。在此情況下,釋放機制本質上為化學反應,更具體來說,其為一級化學反應。歸因於生物系統中環境的一致性,藥物釋放的速率為更加可預測的。此外,通過控制前藥的溶解度,有可能建立一種系統,其可使用溶解度作為限速步驟,以零級或偽零方式釋放藥物。
本揭露內容涉及一種前藥系統,其針對預期位置和適應症,通過前藥部分的化學結構控制藥物釋放速率。
在一個方面,本揭露內容提供一種前藥化合物,其包含母體藥物部分和尾部分,其中
所述母體藥物部分衍生自包含選自下組的反應性基團的母體藥物:胺、氨基、羥基、羧酸酯、酮和醯胺,
所述尾部分與所述母體藥物部分共價連接並且具有式(I):
(I)
其中:
L
1通過所述母體藥物的所述反應性基團與所述母體藥物部分連接以形成可裂解鍵;
L為直接鍵或烷基;
U選自下組:直接鍵、環烷基、雜環基、芳基和雜芳基;
V為直接鍵或烷基;
W選自下組:直接鍵、環烷基、雜環基、芳基和雜芳基;
Z選自下組:直接鍵、烷基、芳基、NR
1R
2和OR
3,其中所述烷基和芳基任選地被一個或多個R
4取代;
R
1、R
2和R
3獨立地為氫、烷基或環烷基;並且
R
4選自下組:烷基、環烷基、雜環基、芳基和雜芳基,
其條件是當U不是直接鍵時,V、W和Z不同時是直接鍵,
或其藥學上可接受的鹽。
在另一方面,本揭露內容提供一種藥物組合物,其包含本文所提供的前藥化合物或其藥學上可接受的鹽和藥學上可接受的賦形劑。
在另一方面,本揭露內容提供一種治療有需要的受試者的疾病的方法,其包括向受試者施用治療有效量的本文所提供的前藥化合物或其藥學上可接受的鹽,或本文所提供的藥物組合物。
現將詳細參考本揭露內容的某些實施方式,其實施例在附隨的結構和式中得以說明。雖然將結合所列舉的實施方式描述本揭露內容,但應理解其並不意圖將本揭露內容限於那些實施方式。相反,本揭露內容旨在涵蓋所有替代方案、修改和等效物,所述替代方案、修改和等效物可以包括在如申請專利範圍所限定的本揭露內容的範圍內。所屬技術領域中具有通常知識者將認識到與本文所描述的那些方法和材料類似或等效的許多方法和材料,所述方法和材料可以用於實踐本揭露內容。本揭露內容決不限於所描述的方法和材料。在所併入的參考文獻和類似材料中的一個或多個(包括但不限於所定義的術語、術語用法、所描述的技術等)與本申請不同或相矛盾的情況下,以本揭露內容為准。本揭露內容中所引用的所有參考文獻、專利、專利申請均以全文引用的方式併入本文中。
應瞭解,為清楚起見而在不同實施方式的上下文中描述的本揭露內容的某些特徵也可組合提供於單一實施方式中。相反,為簡潔起見而在單一實施方式的上下文中描述的本揭露內容的各種特徵也可分開地或以任何合適的子組合形式提供。必須指出,除非上下文另外明確規定,否則如說明書和所附請求項申請專利範圍中所用,單數形式「一(a/an)」和「所述(the)」包括其複數形式。
定義
下文更詳細地描述特定官能團和化學術語的定義。出於本揭露內容的目的,根據元素週期表,CAS版本,《化學和物理學手冊(Handbook of Chemistry and Physics)》,第75版,內封面來識別化學元素,且一般如其中所描述來定義特定官能團。另外,有機化學的一般原理以及特定官能部分和反應性描述於《有機化學(Organic Chemistry)》,Thomas Sorrell,第2版,大學科學書籍(University Science Books),Sausalito,2006;Smith和March《馬奇高等有機化學(March's Advanced Organic Chemistry)》,第6版,約翰·威立父子公司(John Wiley & Sons, Inc.),紐約(New York),2007;Larock,《綜合有機轉化(Comprehensive Organic Transformations)》,第3版,VCH出版公司(VCH Publishers, Inc.),紐約,2018;Carruthers,《一些現代有機合成方法(Some Modern Methods of Organic Synthesis)》,第4版,劍橋大學出版社(Cambridge University Press),劍橋(Cambridge), 2004中,其中的每一個的全部內容以引用的方式併入本文中。
在本揭露內容的多處,描述了連接取代基。尤其希望每個連接取代基均包括連接取代基的正向和反向形式兩者。例如,-NR(CR'R")-包括-NR(CR'R")-和-(CR'R")NR-兩者。在結構明確需要連接基團的情況下,針對該基團所列舉的馬庫什變量(markush variable)應理解為連接基團。舉例來說,如果結構需要連接基團,且該變量的馬庫什組定義列舉「烷基」,那麼應理解所述「烷基」表示連接亞烷基。
當連到取代基的鍵顯示與連接環中的兩個原子的鍵交叉時,那麼該取代基可鍵結到環上的任何原子。當所列取代基未指示該取代基鍵結到給定式化合物的其餘部分的原子時,那麼該取代基可經由該式中的任何原子鍵結。取代基和/或變量的組合是可容許的,但只有在該組合產生穩定化合物時。
當任何變量(例如R
i)在化合物的任何成分或式中出現超過一次時,其在每次出現時的定義獨立於其在其它每次出現時的定義。因此,舉例來說,如果基團顯示為被0-2個R
i部分取代,那麼該基團可任選地被最多兩個R
i部分取代,並且R
i在每次出現時獨立地選自R
i的定義。此外,取代基和/或變量的組合是可容許的,但只有在該組合產生穩定化合物時。
如本文所用,術語「C
i-j」指示碳原子數的範圍,其中i和j為整數,並且碳原子數的範圍包括端點(即i和j)和介於其間的每個整數點,並且其中j大於i。舉例來說,C
1-6指示一至六個碳原子的範圍,包括一個碳原子、兩個碳原子、三個碳原子、四個碳原子、五個碳原子和六個碳原子。在一些實施方式中,術語「C
1-12」指示1至12,尤其是1至10,尤其是1至8,尤其是1至6,尤其是1至5,尤其是1至4,尤其是1至3或尤其是1至2個碳原子。
不論作為另一術語的一部分還是獨立地使用,如本文所用,術語「烷基」均指代飽和的直鏈或支鏈烴基,其可任選獨立地被下文所述的一個或多個取代基取代。術語「C
i-j烷基」是指具有i至j個碳原子的烷基。在一些實施方式中,烷基含有1至10個碳原子。在一些實施方式中,烷基含有1至9個碳原子。在一些實施方式中,烷基含有1至8個碳原子、1至7個碳原子、1至6個碳原子、1至5個碳原子、1至4個碳原子、1至3個碳原子或1至2個碳原子。「C
1-10烷基」的實例包括但不限於甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基和癸基。「C
1-6烷基」的實例為甲基、乙基、丙基、異丙基、正丁基、異丁基、仲丁基、叔丁基、正戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲基-2-丁基、3-甲基-1-丁基、2-甲基-1-丁基、1-己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、2-甲基-3-戊基、2,3-二甲基-2-丁基、3,3-二甲基-2-丁基等。
不論作為另一術語的一部分還是獨立地使用,如本文所用,術語「烯基」均指代具有至少一個碳-碳雙鍵的直鏈或支鏈烴基,其可任選地獨立地被本文所述的一個或多個取代基取代,並且包括具有「順」和「反」取向,或替代地,「E」和「Z」取向的基團。在一些實施方式中,烯基含有2至12個碳原子。在一些實施方式中,烯基含有2至11個碳原子。在一些實施方式中,烯基含有2至11個碳原子、2至10個碳原子、2至9個碳原子、2至8個碳原子、2至7個碳原子、2至6個碳原子、2至5個碳原子、2至4個碳原子、2至3個碳原子,並且在一些實施方式中,烯基含有2個碳原子。烯基的實例包括但不限於乙烯基(ethylenyl/vinyl)、丙烯基(烯丙基)、丁烯基、戊烯基、1-甲基-2-丁-1-基、5-己烯基等。
不論作為另一術語的一部分還是獨立地使用,如本文所用,術語「炔基」均指代具有至少一個碳-碳三鍵的直鏈或支鏈烴基,其可任選地獨立地被本文所述的一個或多個取代基取代。在一些實施方式中,烯基含有2至12個碳原子。在一些實施方式中,炔基含有2至11個碳原子。在一些實施方式中,炔基含有2至11個碳原子、2至10個碳原子、2至9個碳原子、2至8個碳原子、2至7個碳原子、2至6個碳原子、2至5個碳原子、2至4個碳原子、2至3個碳原子,並且在一些實施方式中,炔基含有2個碳原子。炔基的實例包括但不限於乙炔基、1-丙炔基、2-丙炔基等。
如本文所用,術語「醯胺」是指-C(=O)NR'-,其中R'表示氫、N-保護基、烷基、烯基、炔基、烷氧基、環烷基、雜環基、芳基、雜芳基和其它合適的有機基團。
如本文所用,術語「胺」是指氨的衍生物,其中一個或多個氫原子被取代基置換,並且可由N(H)
n(R')
3-n表示,其中n為0、1或2,並且每個R'獨立地為羥基、硝基、N-保護基、烷基、烯基、炔基、烷氧基、環烷基、雜環基、芳基、雜芳基和其它合適的有機基團,或兩個R'與其所連接的氮原子一起形成任選地被取代的雜環基或雜芳基。
如本文所用,術語「氨基」是指-NH
2。
如本文所用,術語「縮醛」是指-O-CH(R')-O-,其中R'表示烷基、烯基、炔基、烷氧基、環烷基、雜環基、芳基、雜芳基和其它合適的有機基團。
不論作為另一術語的一部分還是獨立地使用,如本文所用,術語「芳基」均指代具有總共5至20個環成員的單環和多環環系統,其中系統中的至少一個環為芳香族的,並且其中系統中的每個環含有3至12個環成員。「芳基」的實例包括但不限於苯基、聯苯基、萘基、蒽基等,其可帶有一個或多個取代基。如本文所用,其中芳環與一個或多個另外的環稠合的基團也包括在術語「芳基」的範圍內。在多環環系統的情況下,僅需要一個環為芳香族(例如2,3-二氫吲哚),不過所有環也均可為芳香族(例如喹啉)。第二環也可為稠合或橋聯的。多環芳基的實例包括但不限於苯并呋喃基、茚滿基、鄰苯二甲醯亞胺基、萘醯亞胺基、啡啶基或四氫萘基等。芳基可以在一個或多個環的位置處被如上文所述的取代基取代。
不論作為另一術語的一部分還是獨立地使用,如本文所用,術語「環烷基」均指代單價非芳香族、飽和或部分不飽和的單環和多環環系統,其中所有環原子均為碳,並且其中含有至少三個成環碳原子。在一些實施方式中,環烷基可含有3至12個成環碳原子、3至10個成環碳原子、3至9個成環碳原子、3至8個成環碳原子、3至7個成環碳原子、3至6個成環碳原子、3至5個成環碳原子、4至12個成環碳原子、4至10個成環碳原子、4至9個成環碳原子、4至8個成環碳原子、4至7個成環碳原子、4至6個成環碳原子、4至5個成環碳原子。環烷基可為飽和或部分不飽和的。環烷基可以被取代。在一些實施方式中,環烷基可為飽和的環狀烷基。在一些實施方式中,環烷基可為在其環系統中含有至少一個雙鍵或三鍵的部分不飽和的環狀烷基。在一些實施方式中,環烷基可為單環或多環的。單環環烷基的實例包括但不限於環丙基、環丁基、環戊基、1-環戊-1-烯基、1-環戊-2-烯基、1-環戊-3-烯基、環己基、1-環己-1-烯基、1-環己-2-烯基、1-環己-3-烯基、環己二烯基、環庚基、環辛基、環壬基、環癸基、環十一烷基和環十二烷基。多環環烷基的實例包括但不限於金剛烷基、降冰片烷基、芴基、螺-戊二烯基、螺[3.6]-癸基、雙環[1,1,1]戊烯基、雙環[2,2,1]庚烯基等。
如本文所用,術語「羧酸酯(carboxylate/carboxylate ester)」是指-C(=O)O-。
如本文所用,術語「磷酸酯」是指-OP(=O)(OR')O-,其中R'表示氫、N-保護基、烷基、烯基、炔基、烷氧基、環烷基、雜環基、芳基、雜芳基和其它合適的有機基團。
如本文所用,術語「氨基甲酸酯」是指-NR'(C=O)O-,其中R'表示氫、N-保護基、烷基、烯基、炔基、烷氧基、環烷基、雜環基、芳基、雜芳基和其它合適的有機基團。
如本文所用,術語「硫代氨基甲酸酯」是指-NR'(C=S)O-,其中R'表示氫、N-保護基、烷基、烯基、炔基、烷氧基、環烷基、雜環基、芳基、雜芳基和其它合適的有機基團。
如本文所用,術語「碳酸酯」是指-OC(=O)O-。
如本文所用,術語「硫代碳酸酯」是指-OC(=S)O-。
如本文所用,術語「雜原子」是指氮、氧或硫,並且包括氮或硫的任何氧化形式,以及鹼性氮(包括N-氧化物)的任何季銨化形式。
不論作為另一術語的一部分還是獨立地使用,如本文所用,術語「雜芳基」均指代除碳原子之外,還具有一個或多個雜原子的芳基。雜芳基可為單環的。單環雜芳基的實例包括但不限於噻吩基、呋喃基、吡咯基、咪唑基、吡唑基、三唑基、四唑基、噁唑基、異噁唑基、噁二唑基、噻唑基、異噻唑基、噻二唑基、吡啶基、噠嗪基、嘧啶基、吡嗪基、吲哚嗪基、嘌呤基、萘啶基、苯并呋喃基和蝶啶基。雜芳基還包括雜芳環與一個或多個芳基、環脂肪族基或雜環基環稠合的多環基團,其中連接基團或連接點位於雜芳環上。多環雜芳基的實例包括但不限於吲哚基、異吲哚基、苯并噻吩基、苯并呋喃基、苯并[1,3]間二氧雜環戊烯基、二苯并呋喃基、吲唑基、苯并咪唑基、苯并噻唑基、喹啉基、異喹啉基、二氫喹啉基、二氫異喹啉基、四氫喹啉基、四氫異喹啉基、噌啉基、酞嗪基、喹唑啉基、喹喔啉基、4H-喹嗪基、哢唑基、吖啶基、吩嗪基、吩噻嗪基、吩噁嗪基、四氫喹啉基、四氫異喹啉基等。
如本文所用,術語「雜環基」是指飽和或部分不飽和的碳環基,其中一個或多個環原子為獨立地選自氧、硫、氮、磷等的雜原子,其餘環原子為碳,其中一個或多個環原子可任選獨立地被一個或多個取代基取代。在一些實施方式中,雜環基為飽和雜環基。在一些實施方式中,雜環基為在其環系統中具有一個或多個雙鍵的部分不飽和的雜環基。在一些實施方式中,雜環基可含有碳、氮或硫的任何氧化形式和鹼性氮的任何季銨化形式。「雜環基」還包括其中雜環基與飽和、部分不飽和或完全不飽和(即,芳香族)的碳環或雜環環稠合的基團。在可能的情況下,雜環基可為碳連接的或氮連接的。在一些實施方式中,雜環為碳連接的。在一些實施方式中,雜環為氮連接的。舉例來說,衍生自吡咯的基團可為吡咯-1-基(氮連接)或吡咯-3-基(碳連接)。此外,衍生自咪唑的基團可為咪唑-1-基(氮連接)或咪唑-3-基(碳連接)。
在一些實施方式中,術語「3至12元雜環基」是指具有1至3個獨立地選自氮、氧或硫的雜原子的3至12元飽和或部分不飽和的單環或多環雜環環系統。稠合、螺環和橋接環系統也包括在本定義範圍內。單環雜環基的實例包括(但不限於)氧雜環丁烷基、1,1-二氧代硫雜環丁烷基吡咯烷基、四氫呋喃基、四氫噻吩基、吡咯基、呋喃基、噻吩基、吡唑基、咪唑基、三唑基、噁唑基、噻唑基、哌啶基(piperidyl)、哌嗪基、哌啶基(piperidinyl)、嗎啉基、吡啶基、吡嗪基、嘧啶基、噠嗪基、三嗪基、吡啶酮基、嘧啶酮基、吡嗪酮基、嘧啶酮基、噠嗪酮基、吡咯烷基、三嗪酮基等。稠合雜環基的實例包括但不限於苯基稠環或吡啶基稠環,如喹啉基、異喹啉基、四氫喹啉基、四氫異喹啉基、喹喔啉基、喹嗪基、喹唑啉基、氮雜吲哚嗪基、蝶啶基、色烯基、異色烯基、吲哚基、異吲哚基、吲哚嗪基、吲唑基、嘌呤基、苯并呋喃基、異苯并呋喃基、苯并咪唑基、苯并噻吩基、苯并噻唑基、哢唑基、吩嗪基、吩噻嗪基、啡啶基、咪唑[1,2-a]吡啶基、[1,2,4]三唑並[4,3-a]吡啶基、[1,2,3]三唑並[4,3-a]吡啶基等。螺環雜環基的實例包括但不限於螺環吡喃基、螺環噁嗪基等。橋接雜環基的實例包括但不限於嗎啡烷基(morphanyl)、六亞甲基四胺基、3-氮雜-雙環[3.1.0]己烷、8-氮雜-雙環[3.2.1]辛烷、1-氮雜-雙環[2.2.2]辛烷、1,4-二氮雜雙環[2.2.2]辛烷(DABCO)等。
如本文所用,術語「腙」是指-C(R')=N-NH-,其中R'表示氫、烷基、烯基、炔基、烷氧基、環烷基、雜環基、芳基、雜芳基和其它合適的有機基團。
如本文所用,術語「羥基」是指-OH。
如本文所用,術語「酮」是指-C(=O)-。
如本文所用,術語「膦醯胺酯」是指-OP(=O)(R')(NR'')-,其中R'和R''獨立地為氫、烷基、烯基、炔基、烷氧基、環烷基、雜環基、芳基、雜芳基和其它合適的有機基團。
如本文所用,術語「亞胺」是指-C(R')=N-,其中R'表示氫、烷基、烯基、炔基、烷氧基、環烷基、雜環基、芳基、雜芳基和其它合適的有機基團。
如本文所用,術語「鍵」或「接頭」是指由至少兩個待連接的實體的官能團之間的化學反應形成的鍵或化學部分,從而形成一個分子或維持實體足夠緊密近接的締合。鍵可整合在所得連接的分子或結構中,具有或不具有其已反應的官能團。此類鍵可以是共價或非共價的。水解不穩定或可降解鍵意指鍵能夠在水或水溶液(包括例如體液,如血液)中降解。酶促不穩定或可降解鍵意指鍵可由一種或多種酶降解。此類可降解鍵包括但不限於由一個實體中的羧酸與生物活性劑上的醇基形成的酯鍵,其中此類酯基一般在生理條件下水解以釋放生物活性劑。其它可水解降解鍵包括但不限於碳酸酯鍵、由胺與醛反應產生的亞胺鍵、由磷酸基與醇反應產生的磷酸酯鍵、由醯肼與醛反應產生的腙鍵、由醛與醇反應產生的縮醛鍵、由胺基與羧基反應產生的醯胺鍵。
如本文所用,術語「部分不飽和的」是指包括至少一個雙鍵或三鍵的基團。術語「部分不飽和的」意圖涵蓋具有多個不飽和位點的環,但並不意圖包括芳香族(即,完全不飽和的)部分。
如本文所用,術語「藥學上可接受的」表示物質或組合物在化學和/或毒理學上與構成配製物的其它成分和/或用其治療的受試者相容。
如本文所用,術語「取代的」,無論前面是否有術語「任選地」,都意指指定部分的一個或多個氫被合適的取代基置換。應理解,「取代」或「被取代」包括以下隱含的限制條件:此類取代與被取代的原子的容許價態一致,並且取代產生穩定或化學上可行的化合物,例如不會如通過重排、環化、消除等而自發進行轉化的化合物。除非另外指示,否則「任選地被取代」的基團可在基團的每個可取代位置處具有合適的取代基,並且當任何既定結構中的多於一個位置可被多於一個選自規定基團的取代基取代時,在每一位置處取代基可為相同或不同的。所屬技術領域中具有通常知識者應理解,適當時,取代基本身可以被取代。除非具體陳述為「未被取代的」,否則提及本文中的化學部分應理解為包括被取代的變體。舉例來說,提及「芳基」基團或部分隱含地包括被取代和未被取代的變體兩者。
如本文所用,術語「治療劑」、「藥物」、「生物活性分子」、「生物活性劑」、「活性劑」等是指可影響生物有機體,包括但不限於病毒、細菌、真菌、植物、動物和人的任何物理或生物化學特性的任何物質。特定來說,如本文所用,治療劑包括預期用於診斷、治癒、減輕、治療或預防人或其它動物的疾病,或以其它方式增強人或動物的身體或精神健康的任何物質。
將治療劑藥物遞送到身體內的特定組織或部位帶來多種挑戰,尤其在需要將治療劑局部遞送到特定組織並且持續釋放治療劑時,以及在需要避免導致毒性副作用的治療劑的高全身濃度時。
化合物
因此,本揭露內容提供一種前藥化合物,其能夠局部遞送治療劑並且以受控和持續方式釋放治療劑,且具有減少的全身副作用。這通過有意地設計前藥化合物來實現,所述前藥化合物實現前藥化合物的溶解度與前藥化合物釋放母體藥物的速率的平衡。
在一個方面,本揭露內容提供一種前藥化合物,其包含母體藥物部分和尾部分,其中
所述母體藥物部分衍生自包含選自下組的反應性基團的母體藥物:胺、氨基、羥基和醯胺,
所述尾所述尾部分與所述母體藥物部分共價連接並且具有式(I):
(I)
其中:
L
1通過所述母體藥物的所述反應性基團與所述母體藥物部分連接以形成可裂解鍵;
L為直接鍵或烷基;
U選自下組:直接鍵、環烷基、雜環基、芳基和雜芳基;
V為直接鍵或烷基;
W選自下組:直接鍵、環烷基、雜環基、芳基和雜芳基;
Z選自下組:直接鍵、烷基、芳基、NR
1R
2和OR
3,其中所述烷基和芳基任選地被一個或多個R
4取代;
R
1、R
2和R
3獨立地為氫、烷基或環烷基;並且
R
4選自下組:烷基、環烷基、雜環基、芳基和雜芳基,
其條件是當U不是直接鍵時,V、W和Z不同時是直接鍵,
或其藥學上可接受的鹽。
在一些實施方式中,母體藥物包含至少一個反應性基團,其能夠與第二實體(例如本文所提供的尾部分)的反應性官能團和任選的共反應物反應以形成可裂解鍵,從而將母體藥物部分連接到第二實體(例如尾部分)。
「可裂解鍵」是在生理條件下裂解的相對不穩定鍵。示例性可釋放鍵為在與水反應後裂解(即,水解)的可水解鍵。鍵在水中水解的趨勢可能不僅取決於連接兩個原子的鍵的一般類型,而且取決於連接到這些原子的取代基。適當水解不穩定或弱鍵包括但不限於羧酸酯、磷酸酯、酸酐、縮醛、縮酮、醯胺、醯氧基烷基醚、亞胺、腙、原酸酯、肽、寡核苷酸、硫酯、脲、硫脲、氨基甲酸酯、硫代氨基甲酸酯、氨基磷酸酯、膦醯胺酯、碳酸酯和硫代碳酸酯。某些官能團具有可通過除水解外的工藝進行化學降解的原子。此類別中的示例性可釋放鍵包括某些氨基甲酸酯和Fmoc衍生物。含有適當鍵結的這些類別的官能團的某些分子可在鹼作用後經歷化學降解(釋放)。在此類情況下,「裂解」可在較高pH值下發生或通過含有鹼性部分的生物分子(例如組精酸)的作用發生。另一示例性可裂解鍵為可酶促裂解鍵。「可酶促裂解鍵」意指易由一種或多種酶裂解的鍵。
在某些實施方式中,母體藥物選自下組:抗癌劑、抗炎藥、抗生素、抗真菌劑、JAK抑制劑和VEGF抑制劑。
在一些實施方式中,母體藥物為抗癌劑。
在一些實施方式中,母體藥物為抗炎藥。
在一些實施方式中,母體藥物為抗生素。
在一些實施方式中,母體藥物為抗真菌劑。
在一些實施方式中,母體藥物選自下組:氟尿嘧啶、替莫唑胺(Temozolomide)、道諾黴素(Daunorubicin)、10-羥基-喜樹鹼和7-乙基-10-羥基-喜樹鹼。
在一些實施方式中,母體藥物的反應性基團與尾部分的反應性官能團和任選的共反應物反應,以形成選自下組的可裂解鍵:碳酸酯、硫代碳酸酯、氨基甲酸酯、硫代氨基甲酸酯、羧酸酯、磷酸酯、醯胺、亞胺、腙、膦醯胺酯和縮醛。
在一些實施方式中,L
1選自直接鍵、*-CH
2OC(=O)O-、*-CH
2OC(=S)O-、*-C(=O)O-、*-OC(=S)-、*-C(=O)-、*-C(=O)N(R
a)-、*-C(=S)N(R
a)-、*-CH
2OP(=O)(R
a)O-和*-P(=O)(R
a)N(R
a)-,其中R
a為氫、烷基、烯基或炔基,並且L
1的*端與母體藥物部分連接。
在一些實施方式中,L
1選自下組:直接鍵、*-CH
2OC(=O)O-、*-C(=O)O-、*-C(=O)-、*-C(=O)N(R
a)-、*-CH
2OP(=O)(R
a)O-和*-P(=O)(R
a)N(R
a)-。
在一些實施方式中,母體藥物包含與尾部分的反應性官能團和任選的共反應物反應的胺基,使得形成選自*-CH
2OC(=O)O-、*-C(=O)O-、*-C(=O)-和*-CH
2OP(=O)(R
a)O-的L
1。
在一些實施方式中,母體藥物包含與尾部分的反應性官能團和任選的共反應物反應的氨基,使得形成選自直接鍵和*-C(=O)O-的L
1。
在一些實施方式中,母體藥物包含與尾部分的反應性官能團和任選的共反應物反應的羥基,使得形成選自*-C(=O)-、*-C(=O)O-、*-C(=O)N(R
a)-和*-P(=O)(R
a)N(R
a)-的L
1。
在一些實施方式中,L為直接鍵。
在一些實施方式中,L為烷基。在某些實施方式中,L為C
1-6烷基、C
1-5烷基、C
1-4烷基、C
1-3烷基或C
1-2烷基。
在某些實施方式中,L為甲基、乙基或己基。
在一些實施方式中,U為直接鍵。
在一些實施方式中,U為雜環基。在某些實施方式中,U為飽和雜環基。在某些實施方式中,U為部分不飽和雜環基。
在某些實施方式中,U為5到12元雜環基、5到11元雜環基、5到10元雜環基、5到9元雜環基、5到8元雜環基、5到7元雜環基或5到6元雜環基。
在某些實施方式中,U為5到12元飽和雜環基、5到11元飽和雜環基、5到10元飽和雜環基、5到9元飽和雜環基、5到8元飽和雜環基、5到7元雜環基或5到6元飽和雜環基。
在某些實施方式中,U為哌啶基。
在某些實施方式中,U為5到12元部分不飽和雜環基、5到11元部分不飽和雜環基、5到10元部分不飽和雜環基、5到9元部分不飽和雜環基、5到8元部分不飽和雜環基、5到7元雜環基或5到6元部分不飽和雜環基。
在某些實施方式中,U為1,2,3,4-四氫-異喹啉基。
在一些實施方式中,U為芳基。在某些實施方式中,U為5到12元芳基、5到10元芳基、5到8元芳基或5到6元芳基。
在某些實施方式中,U為苯基。
在一些實施方式中,L為直接鍵,並且U為直接鍵、雜環基或芳基。
在某些實施方式中,L為直接鍵,並且U為直接鍵、5到12元飽和或部分不飽和雜環基或5到12元芳基。
在某些實施方式中,L為直接鍵,並且U選自下組:直接鍵、1,2,3,4-四氫-異喹啉基和苯基。
在一些實施方式中,L為烷基,並且U為直接鍵、雜環基或芳基。
在某些實施方式中,L為C
1-6烷基,並且U為直接鍵、5到12元飽和或部分不飽和雜環基或5到12元芳基。
在某些實施方式中,L為C
1-6烷基,並且U選自下組:直接鍵、哌啶基和苯基。
在一些實施方式中,V為直接鍵。
在一些實施方式中,V為烷基。在某些實施方式中,V為C
1-6烷基、C
1-5烷基、C
1-4烷基、C
1-3烷基或C
1-2烷基。
在某些實施方式中,V為甲基。
在一些實施方式中,W為直接鍵。
在一些實施方式中,W為芳基。在某些實施方式中,W為5到12元芳基、5到10元芳基、5到8元芳基或5到6元芳基。
在某些實施方式中,W為苯基。
在一些實施方式中,W為雜環基。在某些實施方式中,W為飽和雜環基。在某些實施方式中,W為部分不飽和雜環基。
在某些實施方式中,W為5到12元雜環基、5到11元雜環基、5到10元雜環基、5到9元雜環基、5到8元雜環基、5到7元雜環基或5到6元雜環基。
在某些實施方式中,W為5到12元飽和雜環基、5到11元飽和雜環基、5到10元飽和雜環基、5到9元飽和雜環基、5到8元飽和雜環基、5到7元雜環基或5到6元飽和雜環基。
在某些實施方式中,W為吡咯烷基、哌啶基或哌嗪基。
在一些實施方式中,Z為直接鍵。
在一些實施方式中,Z為任選地被一個或多個R
4取代的烷基。在某些實施方式中,Z為任選地被一個或多個R
4取代的C
1-8烷基。
在某些實施方式中,R
4為環烷基或芳基。
在某些實施方式中,Z為C
1-8烷基。
在某些實施方式中,Z為C
1-6烷基、C
1-5烷基、C
1-4烷基、C
1-3烷基或C
1-2烷基,其中的每一者被一個或兩個R
4取代,並且R
4獨立地為環烷基或芳基。
在某些實施方式中,Z為甲基或乙基,其被一個或兩個R
4取代,並且R
4獨立地為金剛烷基或苯基。
在一些實施方式中,Z為任選地被一個或多個R
4取代的芳基。在某些實施方式中,Z為任選地被一個或多個R
4取代的5到12元芳基。
在某些實施方式中,R
4為烷基。
在某些實施方式中,Z為任選地被一個或多個R
4取代的苯基,其中R4為C
1-6烷基、C
1-5烷基、C
1-4烷基、C
1-3烷基或C
1-2烷基。
在某些實施方式中,Z為被一個或多個R
4取代的苯基,其中R
4為甲基或乙基。
在一些實施方式中,Z為NR
1R
2。
在某些實施方式中,R
1和R
2獨立地為烷基或環烷基。
在某些實施方式中,R
1和R
2獨立地為C
1-6烷基、C
1-5烷基、C
1-4烷基、C
1-3烷基或C
1-2烷基。
在某些實施方式中,R
1和R
2獨立地為C
3-6環烷基。
在一些實施方式中,Z為OR
3。
在某些實施方式中,R
3為烷基。在某些實施方式中,R
3為C
1-6烷基、C
1-5烷基、C
1-4烷基、C
1-3烷基或C
1-2烷基。在某些實施方式中,R
3為甲基。
在某些實施方式中,在具有式(II)、(III)、(IV)或(V)的前藥化合物中,
L為直接鍵,
U為雜環基、芳基或雜芳基,
V為直接鍵或烷基,
W為直接鍵、雜環基或芳基;
Z為烷基、芳基、NR
1R
2或OR
3,其中所述烷基和芳基任選地被一個或多個R
4取代,
其中R
1、R
2、R
3和R
4如前述所定義。
在一些實施方式中,本揭露內容提供一種前藥化合物或其藥學上可接受的鹽,其具有選自下組的式:
(VI),
(VII),
(VIII),和
(IX),
其中Q為氫或乙基,並且L、U、V、W、Z和R
a如前述所定義。
在某些實施方式中,在具有式(VI)、(VII)、(VIII)或(IX)的前藥化合物中,
L為直接鍵或烷基,
U為直接鍵或芳基,
V為直接鍵,
W為直接鍵或雜環基;
Z為NR
1R
2或任選地被一個或多個R
4取代的烷基。
其中R
1、R
2和R
4如前述所定義。
在一些實施方式中,在生物pH下,本文所提供的前藥化合物的溶解度低於母體藥物。
本文所提供的前藥化合物參考通式和具體化合物兩者進行描述。另外,本揭露內容的前藥化合物可以許多不同形式或衍生物存在,其全部在本揭露內容的範圍內。這些包括例如互變異構體、立體異構體、外消旋混合物、區位異構體、鹽、溶劑化形式、非晶形式、不同晶體形式或多晶型物。
取決於取代基選擇,本揭露內容的前藥化合物可包含一個或多個不對稱中心,並且因此可以各種立體異構形式,例如對映異構體和/或非對映異構體。舉例來說,本文所提供的前藥化合物可具有不對稱碳中心,並且因此本文所提供的化合物可在碳不對稱中心處具有(R)或(S)立體構型。因此,本揭露內容的前藥化合物可呈個別對映異構體、非對映異構體或幾何異構體形式,或可呈立體異構體的混合物形式。
如本文所用,術語「對映異構體」是指化合物的兩種立體異構體,其互為不可重疊的鏡像。術語「非對映異構體」是指不是彼此鏡像的一對光學異構體。非對映異構體具有不同物理特性,例如熔點、沸點、光譜特性和反應性。
當優選特定對映異構體時,在一些實施方式中其可提供為基本上不含相對的對映異構體,並且還可被稱作「光學富集」。如本文所用,「光學富集」意指化合物由顯著較大比例的一種對映異構體構成。在某些實施方式中,化合物由至少約90重量%的較佳的對映異構體構成。在其它實施方式中,化合物由至少約95重量%、98重量%或99重量%的較佳的對映異構體構成。較佳的對映異構體可以通過所屬技術領域中具有通常知識者已知的任何方法從外消旋混合物中分離出來,例如通過色譜或結晶、通過使用立體化學均一的起始材料進行合成或通過立體選擇性合成。任選地,衍生化可在分離立體異構體之前進行。立體異構體的混合物的分離可在合成本文所提供的化合物期間的中間步驟進行或其可對最終外消旋產物進行。絕對立體化學可以通過結晶產物或結晶中間物的X射線晶體分析來測定,所述結晶產物或結晶中間物在必要時用含有已知構型的立體中心的試劑衍生化。替代地,絕對立體化學可以通過振動圓二色性(VCD)光譜分析來測定。參見例如,Jacques等人,《對映異構體、外消旋體以及拆分(Enantiomers, Racemates and Resolutions)》(威立國際科學(Wiley Interscience),紐約, 1981);Wilen,S.H.等人,《四面體(Tetrahedron)》33:2725 (1977);Eliel,E.L. 《碳化合物的立體化學(Stereochemistry of Carbon Compounds)》(麥格勞-希爾(McGraw-Hill),NY,1962);Wilen,S.H. 《拆分劑和光學拆分的表格(Tables of Resolving Agents and Optical Resolutions)》第268頁(E.L. Eliel編,美國諾特丹大學出版社(Univ. of Notre Dame Press),諾特丹(Notre Dame),印第安納州(IN)1972)。
在一些實施方式中,提供非對映異構體的混合物,例如富集有51%或更多的非對映異構體中的一種的非對映異構體的混合物,包括例如60%或更多、70%或更多、80%或更多或90%或更多的非對映異構體中的一種。
本揭露內容還涵蓋呈基本上不含其它異構體的個別異構體形式和替代地,呈多種異構體的混合物(例如,對映異構體的外消旋混合物)形式的化合物。
本揭露內容的前藥化合物還可以不同互變異構形式存在,並且所有此類形式涵蓋在本揭露內容的範圍內。術語「互變異構體」或「互變異構形式」是指可經由低能壘相互轉化的不同能量的結構異構體。舉例來說,質子互變異構體(也稱為質子轉移互變異構體)包括經由質子遷移而進行的相互轉化,如酮-烯醇、醯胺-亞胺酸、內醯胺-內醯亞胺、亞胺-烯胺異構化和環狀形式,其中質子可佔據雜環系統的兩個或更多個位置(例如1H-咪唑和3H-咪唑、1H-1,2,4-三唑、2H-1,2,4-三唑和4H-1,2,4-三唑、1H-異吲哚和2H-異吲哚以及1H-吡唑和2H-吡唑)。價互變異構體包括通過一些成鍵電子的重組而進行的相互轉化。互變異構體可以處於平衡狀態或通過適當取代而被空間鎖定成一種形式。除非另外說明,否則通過名稱或結構標識為一種特定互變異構形式的本揭露內容的化合物意圖包括其它互變異構形式。
本揭露內容還意圖包括化合物中的原子的所有同位素。原子的同位素包括具有相同原子數但質量數不同的原子。舉例來說,除非另外說明,否則本揭露內容的化合物中的氫、碳、氮、氧、磷、硫、氟、氯、溴或碘還意圖包括其同位素,如但不限於:
1H、
2H、
3H、
11C、
12C、
13C、
14C、
14N、
15N、
16O、
17O、
18O、
31P、
32P、
32S、
33S、
34S、
36S、
17F、
18F、
19F、
35Cl、
37Cl、
79Br、
81Br、
124I、
127I和
131I。在一些實施方式中,氫包括氕、氘和氚。在一些實施方式中,碳包括
12C和
13C。可在無過度實驗的情況下,通過所屬技術領域中具有通常知識者熟知的常規技術或通過與本文中的方案和實施例中所述的工藝類似的工藝,使用適當的同位素富集的試劑和/或中間物,來製備同位素富集的式(I)化合物。
本揭露內容的前藥化合物可被配製成藥學上可接受的鹽或呈藥學上可接受的鹽形式。除非相反地說明,否則本文所提供的前藥化合物包括此類化合物的藥學上可接受的鹽。
如本文所用,術語「藥學上可接受的」指明物質或組合物在化學和/或毒理學上與構成配製物的其它成分和/或用其治療的受試者相容。
如本文所用,除非另外指示,否則術語「藥學上可接受的鹽」包括保留指定化合物的游離酸和鹼的生物有效性並且在生物學上或其它方面並非不合需要的鹽。所考慮的藥學上可接受的鹽形式包括但不限於單鹽、雙鹽、三鹽、四鹽等。藥學上可接受的鹽在其施用的量和濃度下是無毒的。此類鹽的製備可以通過改變化合物的物理特徵而不妨礙其發揮其生理作用來促進藥理學使用。物理特性的有用改變包括降低熔點以促進經黏膜施用和提高溶解度以促進施用更高濃度的藥物。
藥學上可接受的鹽包括酸加成鹽,如含有以下的酸加成鹽:硫酸鹽、氯化物、鹽酸鹽、富馬酸鹽、馬來酸鹽、磷酸鹽、氨基磺酸鹽、乙酸鹽、檸檬酸鹽、乳酸鹽、酒石酸鹽、甲磺酸鹽、乙磺酸鹽、苯磺酸鹽、對甲苯磺酸鹽、環己基氨基磺酸鹽和奎尼酸鹽。藥學上可接受的鹽可以由如以下的酸獲得:鹽酸、馬來酸、硫酸、磷酸、氨基磺酸、乙酸、檸檬酸、乳酸、酒石酸、丙二酸、甲磺酸、乙磺酸、苯磺酸、對甲苯磺酸、環己基氨基磺酸、富馬酸和奎尼酸。
當存在酸性官能團(如羧酸或苯酚)時,藥學上可接受的鹽還包括鹼加成鹽,如含有以下的鹼加成鹽:苄星(benzathine)、氯普魯卡因、膽鹼、二乙醇胺、乙醇胺、叔丁胺、乙二胺、葡甲胺、普魯卡因、鋁、鈣、鋰、鎂、鉀、鈉、銨、烷基胺和鋅。例如參見,《雷明頓氏藥物科學(Remington's Pharmaceutical Sciences)》,第19版,馬克出版公司(Mack Publishing Co.),賓夕法尼亞州伊斯頓(Easton, PA),第2卷,第1457頁,1995;Stahl和Wermuth的「藥用鹽手冊:特性、選擇和用途(Handbook of Pharmaceutical Salts: Properties, Selection, and Use)」,威立-VCH(Wiley-VCH),德國魏因海姆(Weinheim, Germany),2002。此類鹽可以使用適當對應的鹼製備。
藥學上可接受的鹽可以通過標準技術製備。舉例來說,化合物的游離鹼形式可以溶解於合適的溶劑(如含有適當酸的水溶液或水-醇溶液)中,並且接著通過蒸發溶液來加以分離。因此,如果特定化合物為鹼,那麼期望的藥學上可接受的鹽可以通過所屬領域中可用的任何合適方法製備,例如,用無機酸,如鹽酸、氫溴酸、硫酸、硝酸、磷酸等處理游離鹼,或用有機酸,如乙酸、馬來酸、琥珀酸、杏仁酸、富馬酸、丙二酸、丙酮酸、草酸、乙醇酸、水楊酸、吡喃糖基酸(如葡萄糖醛酸或半乳糖醛酸)、α-羥基酸(如檸檬酸或酒石酸)、胺基酸(如天門冬胺酸或麩胺酸)、芳香族酸(如苯甲酸或肉桂酸)、磺酸(如對甲苯磺酸或乙磺酸)等處理游離鹼。
類似地,如果特定化合物為酸,則期望的藥學上可接受的鹽可通過任何合適方法製備,例如,用無機或有機鹼如胺(伯、仲或叔)、鹼金屬氫氧化物或鹼土金屬氫氧化物等處理游離酸。合適鹽的說明性實例包括衍生自胺基酸如L-甘胺酸、L-離胺酸和L-精胺酸,氨,伯胺、仲胺和叔胺以及環胺如羥基乙基吡咯烷、哌啶、嗎啉或哌嗪的有機鹽;和衍生自鈉、鈣、鉀、鎂、錳、鐵、銅、鋅、鋁和鋰的無機鹽。
還應理解,本揭露內容化合物可以非溶劑化形式、溶劑化形式(例如水合形式)和固體形式(例如晶體或多晶形式)存在,並且本揭露內容意圖涵蓋所有此類形式。
如本文所用,術語「溶劑化物」或「溶劑化形式」是指含有化學計量或非化學計量量溶劑的溶劑加成形式。一些化合物傾向於以結晶固體狀態截留固定莫耳比例的溶劑分子,由此形成溶劑化物。如果溶劑為水,那麼所形成的溶劑化物為水合物;並且如果溶劑為醇,那麼所形成的溶劑化物為醇化物。水合物通過一個或多個水分子與一個物質分子的組合形成,其中水保持其分子狀態為H2O。形成溶劑化物的溶劑的實例包括但不限於水、異丙醇、乙醇、甲醇、DMSO、乙酸乙酯、乙酸和乙醇胺。
如本文所用,術語「晶體形式」、「結晶形式」、「多晶形式」和「多晶型物」可互換使用,並且意指化合物(或其鹽或溶劑化物)可以不同的晶體堆積排列方式結晶的晶體結構,所有這些晶體結構具有相同的元素組成。不同的晶體形式通常具有不同的X射線衍射圖、紅外光譜、熔點、密度、硬度、晶體形狀、光學和電學特性、穩定性以及溶解性。再結晶溶劑、結晶速率、儲存溫度和其它因素可使一種晶體形式占主導地位。化合物的多晶型物可以通過在不同條件下結晶來製備。
化合物的合成
本文所提供的前藥化合物的合成在實施例中的合成方案中說明。本文所提供的前藥化合物可使用任何已知的有機合成技術製備且可根據多種可能的合成途徑中的任一種合成,且因此,這些方案只是說明性的且不旨在限制可用於製備本文所提供的化合物的其它可能的方法。此外,方案中的步驟是為了更好地說明且在適當時可以改變。出於研究和可能提交給管理機構的目的來合成實施例中的前藥化合物的實施方式。
用於製備本揭露內容的前藥化合物的反應可在合適的溶劑中進行,所述溶劑可由有機合成領域的通常知識者容易地選擇。合適的溶劑可在反應進行的溫度下,例如在溶劑的冷凍溫度至溶劑的沸騰溫度範圍內的溫度下基本上不與起始材料(反應物)、中間物或產物反應。給定反應可以在一種溶劑或超過一種溶劑的混合物中進行。取決於特定反應步驟,用於特定反應步驟的合適溶劑可以由所屬技術領域中具有通常知識者進行選擇。
本揭露內容的前藥化合物的製備可涉及各種化學基團的保護和脫保護。保護和脫保護的需求和適當保護基的選擇可由所屬技術領域中具有通常知識者容易地確定。保護基的化學性質可見於例如T. W. Greene和P. G. M. Wuts,《有機合成中的保護基團(Protective Groups in Organic Synthesis)》,第3版,威立父子公司(Wiley & Sons, Inc.),紐約(1999);P. Kocienski,《保護基(Protecting Groups)》,格奧爾格蒂梅出版社(Georg Thieme Verlag),2003;和Peter G.M. Wuts,《格林氏有機合成中的保護基團(Greene's Protective Groups in Organic Synthesis)》,第5版,威立(Wiley),2014,所述所有文獻以全文引用的方式併入本文中。
可根據所屬領域中已知的任何合適方法監測反應。例如,可通過波譜手段,如核磁共振波譜法(例如
1H或
13C)、紅外光譜法(IR)、分光光度法(例如UV-可見光)、質譜法,或通過色譜法,如高效液相色譜法(HPLC)、液相色譜-質譜法(LCMS)或薄層色譜法(TLC)來監測產物形成。所屬技術領域中具有通常知識者可通過多種方法,包括高效液相色譜法(HPLC)(「製備型LC-MS純化:改良的化合物特異性方法優化(Preparative LC-MS Purification:Improved Compound Specific Method Optimization)」,Karl F. Blom,Brian Glass,Richard Sparks,Andrew P. Combs,《組合化學雜誌(J. Combi. Chem.)》,2004, 6(6),874-883,其以全文引用的方式併入本文中)和正相二氧化矽色譜法來純化化合物。
本揭露內容的已知起始材料可通過使用所屬領域中的已知方法或根據所屬領域中的已知方法合成,或可從商業供應商購買。除非另外指出,否則分析級溶劑和市售試劑不經進一步純化即使用。
除非另外規定,否則本揭露內容的反應均在氮氣或氬氣的正壓下或在無水溶劑中用乾燥管進行,並且反應燒瓶通常裝配有橡膠隔片以用於經由注射器引入底物和試劑。將玻璃器皿烘乾和/或熱乾燥。
化合物的用途
在一個方面,本揭露內容提供一種前藥化合物,其能夠局部遞送治療劑並且以受控和持續方式釋放治療劑,其中全身暴露和歸因於全身暴露的潛在副作用減少。因此,取決於經選擇以釋放的母體藥物,本揭露內容的前藥化合物或其藥學上可接受的鹽適用作各種疾病的治療或預防劑。
如本文所用,術語「療法」意圖具有其普通含義,即處置疾病,以便完全或部分地緩解其症狀中的一種、一些或全部,或糾正或補償潛在病理,從而實現有益或所需的臨床結果。出於本揭露內容的目的,有益的或所需的臨床結果包括但不限於症狀的緩解、疾病程度的減輕、疾病狀態的穩定(即,未惡化)、疾病進展的延緩或減慢、疾病病況的改善或緩和以及緩解(部分或完全),無論是可檢測的抑或不可檢測的。「療法」還可以意指與未接受療法的情況下的預期存活期相比,存活期延長。需要療法的情況包括已患有病況或病症的情況以及易於患上病況或病症的情況或待預防病況或病症的情況。除非有相反的特定指示,否則術語「療法」還涵蓋預防。術語「治療的(therapeutic)」和「治療性地(therapeutically)」應按對應方式加以解釋。
術語「治療」與「療法」同義使用。類似地,術語「治療」可以被視為「施加療法」,其中「療法」如本文所定義。
如本文所用,術語「預防」意圖具有其通常含義並且包括用於預防疾病發展的一級預防,以及二級預防,其中疾病已經發展並且暫時地或永久地保護患者以防疾病加劇或惡化或罹患疾病相關新症狀。
本揭露內容的前藥化合物或其藥學上可接受的鹽通過控制母體藥物在生物pH下的溶解度和母體藥物在不同pH下的釋放而顯示母體藥物的所需整體釋放率。
在一些實施方式中,在生物pH下,本揭露內容的前藥化合物或其藥學上可接受的鹽的溶解度低於母體藥物。
在某些實施方式中,本揭露內容的前藥化合物或其藥學上可接受的鹽在酸性pH下顯示的溶解度高於在生物pH下顯示的溶解度。在一些實施方式中,本揭露內容的前藥化合物或其藥學上可接受的鹽在酸性pH下的溶解度與在生物pH下的溶解度的比率大於5、大於10、大於20、大於30、大於40、大於50、大於60、大於70、大於80、大於90、大於100、大於200、大於300、大於400、大於500、大於600、大於700、大於800、大於900、大於1000、大於1100、大於1200、大於1300、大於1400、大於1500或甚至更高。
本文所提供的前藥化合物的降低溶解度可避免施用後的高局部濃度,從而提供溶解度受控的零級持續釋放機制。
母體藥物可通過母體藥物部分與尾部分之間的鍵的裂解而從本文所提供的前藥化合物中釋放。母體藥物的釋放可涉及酶促或非酶促工藝。在一些實施方式中,母體藥物通過水解工藝從本文所提供的前藥化合物中釋放。
母體藥物的釋放可受多種因素影響,例如特定母體藥物的選擇、母體藥物部分與尾部分之間的鍵、尾部分以及前藥化合物的施用(例如施用部位、施用途徑)。本揭露內容考慮具有不同反應性基團和與尾部分的鍵的母體藥物。
本揭露內容還設想本文所提供的前藥化合物的不同施用。在一些實施方式中,向有需要的受試者局部施用本文所提供的前藥化合物。在某些實施方式中,通過注射向有需要的受試者局部施用本文所提供的前藥化合物。在某些實施方式中,通過口服劑型向有需要的受試者局部施用本文所提供的前藥化合物。在某些實施方式中,通過吸入向有需要的受試者局部施用本文所提供的前藥化合物。在某些實施例中,通過植入向有需要的受試者局部施用本文所提供的前藥化合物。在某些實施例中,通過局部施加向有需要的受試者局部施用本文所提供的前藥化合物。取決於特定母體藥物、可裂解鍵和尾部分組合,向受試者施用後,母體藥物的釋放可在多個位置發生。
在一些實施方式中,本文所提供的前藥化合物或其藥學上可接受的鹽可通過水解以不同比率釋放母體藥物。
在一些實施方式中,母體藥物從本文所提供的前藥化合物或其藥學上可接受的鹽中的釋放率可由施用後6小時內在pH 7.4下從前藥化合物中釋放的母體藥物的百分比表徵。在一些實施方式中,在pH 7.4下,母體藥物從前藥化合物中的釋放率在施用後6小時內可在約50%至約100%的範圍內變化,例如約55%至約100%、約60%至約100%、約65%至約100%、約70%至約100%、約75%至約100%、約80%至約100%、約85%至約100%、約90%至約100%、約95%至約100%、約96%至約100%、約97%至約100%、約98%至約100%、約99%至約100%或甚至約100%。
在一些實施方式中,母體藥物從本文所提供的前藥化合物或其藥學上可接受的鹽中的釋放率可由施用後0.5小時內在pH 7.4下從前藥化合物中釋放的母體藥物的百分比表徵。在一些實施方式中,在pH 7.4下,母體藥物從前藥化合物中的釋放率在施用後0.5小時內可在約5%至約100%的範圍內變化,例如約10%至約100%、約20%至約100%、約30%至約100%、約40%至約100%、約50%至約100%、約60%至約100%、約70%至約100%、約80%至約100%、約90%至約100%、約95%至約100%、約96%至約100%、約97%至約100%、約98%至約100%、約99%至約100%或甚至約100%。
在一些實施方式中,在pH 2.0下,施用後6小時內母體藥物從前藥化合物中的釋放率不大於70%,例如不大於65%、不大於60%、不大於55%、不大於50%、不大於45%、不大於40%、不大於35%、不大於30%、不大於25%、不大於20%、不大於15%、不大於10%、不大於5%、不大於4%、不大於3%、不大於2%或不大於1%。在某些實施方式中,在pH 2.0下,本文所提供的前藥化合物保持穩定而不通過水解釋放母體藥物。
在一些實施方式中,母體藥物從本文所提供的前藥化合物或其藥學上可接受的鹽中的釋放率可由施用後6小時內前藥化合物的水解常數(K
h)表徵。在一些實施方式中,在pH 7.4下,本文所提供的前藥化合物的K
h值可在約0.1至約15的範圍內,例如約0.1至約14、約0.1至約13、約0.1至約12、約0.1至約11、約0.1至約10、約0.1至約9、約0.1至約8、約0.1至約7、約0.1至約6、約0.1至約5、約0.1至約4、約0.1至約3、約0.1至約2、約0.1至約1、約0.1至約0.5、約0.1至約0.4、約0.1至約0.3或約0.1至約0.2。
在一些實施方式中,在pH 2.0下,本文所提供的前藥化合物的K
h值可不大於0.2,例如不大於不大於0.15、不大於0.1、不大於0.09、不大於0.08、不大於0.07、不大於0.06、不大於0.05、不大於0.04、不大於0.03、不大於0.02或不大於0.01。在某些實施方式中,本文所提供的前藥化合物的K
h值可為0。
在一些實施方式中,與在pH 2.0下相比,在pH 7.4下施用後6小時內本文所提供的前藥化合物釋放更多母體藥物。
在某些實施方式中,在pH 7.4下施用後6小時內從本文所提供的前藥化合物中釋放的母體藥物的百分比與在pH 2.0下的百分比的比率大於1,例如大於1.1、大於1.2、大於1.3、大於1.4、大於1.5、大於2、大於2.5、大於3、大於3.5、大於4、大於4.5、大於5、大於5.5、大於6、大於7、大於8、大於9、大於10等。
在某些實施方式中,本文所提供的前藥化合物在pH 7.4下的K
h值與在pH 2.0下的K
h值的比率大於1,例如大於1.5、大於2、大於3、大於4、大於5、大於10、大於20、大於30、大於40、大於50、大於60、大於70、大於80、大於90、大於100、大於150、大於200、大於250、大於300、大於350、大於400等。
通過有意地選擇合適的母體藥物和尾部分以實現溶解度與釋放曲線的所需組合,本文所提供的前藥化合物可在1-12小時的時間段內提供母體藥物的持續釋放。
藥物組合物
在另一方面,提供一種包含本揭露內容的前藥化合物的藥物組合物。
在另一方面,提供一種包含本揭露內容的前藥化合物和至少一種藥學可接受的賦形劑的藥物組合物。
如本文所用,術語「藥物組合物」是指含有呈適於向受試者施用的形式的本揭露內容的藥物遞送系統的配製物。
如本文所用,術語「藥學上可接受的賦形劑」意指適用於製備通常安全無毒並且在生物學上和其它方面均合乎需要的藥物組合物的賦形劑,並且包括對於獸醫用途以及人類藥物用途可接受的賦形劑。如本文所用,「藥學上可接受的賦形劑」包括一種和多於一種的此類賦形劑。術語「藥學上可接受的賦形劑」還涵蓋「藥學上可接受的載體」和「藥學上可接受的稀釋劑」。
本文所提供的藥物組合物可以呈允許將組合物向受試者(包括但不限於人)施用,並且配製成與預期施用途徑相容的任何形式。
針對本文所提供的藥物組合物考慮多種途徑,並且因此本文所提供的藥物組合物可以取決於預期施用途徑以散裝或單位劑型供應。例如,對於口服、經頰和舌下施用,粉劑、顆粒、片劑、丸劑、膠囊、膠囊錠和囊片作為固體劑型可能為可接受的,並且乳液、糖漿、酏劑、懸浮液和溶液作為液體劑型可能為可接受的。對於注射施用,凝膠、溶液、乳液和懸浮液作為液體劑型可能為可接受的,並且適於用適當溶液復原的粉劑作為固體劑型可能為可接受的。對於吸入施用,溶液、噴霧劑、乾粉和氣霧劑可能為可接受的劑型。對於局部(包括經頰和舌下)或經皮施用,粉劑、噴霧劑、軟膏、糊劑、乳膏、洗劑、凝膠、溶液和貼片可能為可接受的劑型。對於陰道施用,陰道栓劑、棉塞、乳膏、凝膠、糊劑、泡沫和噴霧劑可能為可接受的劑型。對於植入施用,固體、半固體、凝膠可能為可接受的劑型。
在一些實施方式中,本揭露內容的藥物組合物可以呈口服施用配製物形式。
在一些實施方式中,本揭露內容的藥物組合物可以呈注射施用配製物形式。
在一些實施方式中,本揭露內容的藥物組合物可以呈吸入施用配製物形式。
在一些實施方式中,本揭露內容的藥物組合物可以呈局部施用配製物形式。
在某些實施方式中,本文所提供的藥物組合物可以所屬領域的通常知識者所熟知的皮膚貼片形式配製。
除上述那些代表性劑型以外,藥學上可接受的賦形劑和載體通常被所屬技術領域中具有通常知識者已知並且因此包括於本揭露內容中。此類賦形劑和載體描述於例如「雷明頓氏藥物科學(Remingtons Pharmaceutical Sciences)」馬克出版公司,新澤西州(1991),「雷明頓:藥物科學和實踐(Remington: The Science and Practice of Pharmacy)」,費城科學大學(University of the Sciences in Philadelphia)編,第21版,LWW (2005),所述文獻以引用的方式併入本文中。
在一些實施方式中,本揭露內容的藥物組合物可被配製成單次劑量。單次劑量中本文所提供的前藥化合物的量將取決於所治療的受試者和特定施用模式而變化。
在一些實施方式中,本揭露內容的藥物組合物可被配製成以數天、數周、數月或甚至更長的時間間隔向受試者施用。
在另一方面,還提供包含本揭露內容的藥物遞送系統的藥物組合物,作為兩種或更多種組合療法。
治療疾病的方法
在另一方面,提供一種治療有需要的受試者的疾病的方法,其包括向受試者施用治療有效量的本文所提供的前藥化合物或藥物組合物。
待治療的疾病取決於本文所提供的前藥化合物或藥物組合物中的所選母體藥物。在一些實施方式中,疾病可選自下組:肛門癌、乳腺癌、結直腸癌、食道癌、胰腺癌、頭頸癌、腦癌、肝癌、胃癌、膀胱癌、口腔黏膜癌、食道癌、間變性星形細胞瘤、多形性膠質母細胞瘤、急性骨髓性白血病、急性淋巴細胞白血病、慢性髓細胞性白血病、卡波西肉瘤和神經母細胞瘤。
在一些實施方式中,母體藥物選自抗癌劑、抗炎藥、抗生素、抗真菌劑、JAK抑制劑和VEGF抑制劑。
在一些實施方式中,所選母體藥物為氟尿嘧啶,並且因此本文所提供的前藥化合物適用於治療癌症,包括結腸癌、食道癌、胃癌、直腸癌、乳腺癌、膽道癌、胃癌、頭頸癌、宮頸癌、胰腺癌、腎細胞癌和類癌。
在一些實施方式中,所選母體藥物為替莫唑胺,並且因此本文所提供的前藥化合物適用於治療間變性星形細胞瘤和多形性膠質母細胞瘤。
在一些實施方式中,所選母體藥物為道諾黴素,並且因此本文所提供的前藥化合物適用於治療急性非淋巴細胞白血病(髓細胞性、單核細胞性、紅系)和急性淋巴細胞白血病。
在一些實施方式中,所選母體藥物為10-羥基-喜樹鹼和7-乙基-10-羥基-喜樹鹼,並且因此本文所提供的前藥化合物適用於治療癌症,包括胃癌、食道癌、賁門癌、結腸癌、肝癌、肺癌、膀胱癌、急性白血病、慢性髓細胞性白血病和絨毛膜上皮癌。
在此上下文中,術語「治療有效量」是指本文所提供的藥物遞送系統中所選的治療劑或其藥學上可接受的鹽的量,其可有效地在受試者中提供「療法」,或「治療」受試者的病症、疾病或病況。
實施例
出於說明的目的,包括以下實施例。然而,應理解,這些實施例並不限制本揭露內容,並且僅意圖表明實踐本揭露內容的方法。所屬技術領域中具有通常知識者將認識到,所描述的化學反應可容易地適用於製備本揭露內容的許多其它化合物或其藥學上可接受的鹽,並且用於製備本揭露內容的化合物或其藥學上可接受的鹽的替代方法被認為在本揭露內容的範圍內。例如,可通過對於所屬技術領域中具有通常知識者顯而易見的修飾,例如通過適當地保護干擾基團、通過利用除所述試劑和構建塊外,所屬領域中已知的其它合適的試劑和構建塊和/或通過常規地改變反應條件,成功地合成根據本揭露內容的非示例性化合物。替代地,本文所公開或所屬領域中已知的其它反應將被認為適用於製備本揭露內容的其它化合物。
如本文所用,在這些工藝、方案和實施例中使用的符號和慣例與當代科學文獻,例如《美國化學學會雜誌(Journal of the American Chemical Society)》或《生物化學雜誌(the Journal of Biological Chemistry)》中所使用的符號和慣例一致。除非另外指出,否則所有起始材料都從商業供應商獲得並且不經進一步純化即使用。舉例來說,在實施例和整個說明書中可使用以下縮寫:g(克);mg(毫克);L(升);mL(毫升);μL(微升);psi(磅/平方英寸);M(莫耳);mM(毫莫耳);i.v.(靜脈內);Hz(赫茲);MHz(兆赫茲);aq.(水性溶液);mol(莫耳);mmol(毫莫耳);r.t.(室溫);min(分鐘);h(小時);mp(熔點);TLC(薄層色譜法);Rt(滯留時間);RP(反相);AcOH(乙酸);MeOH(甲醇);i-PrOH(異丙醇);TEA(三乙胺);TFA(三氟乙酸);THF(四氫呋喃);DMSO(二甲亞碸);EtOAc(乙酸乙酯);DCM(二氯甲烷);HCHO(甲醛);MeCN(乙腈);DIPEA(N,N-二異丙基乙胺);PE(石油醚);DMF(N,Ν-二甲基甲醯胺);Pd2dba3(三(二苯亞甲基丙酮)二鈀);NMP(1-甲基-2-吡咯烷酮);HATU(2-(7-氮雜苯并三唑-1-基)-N,N,N',N'-四甲基脲鎓六氟磷酸鹽);BOP((苯并三唑-1-基氧基)三(二甲氨基)鏻鎓六氟磷酸鹽)。
除非另外指示,否則所有溫度均以℃(攝氏度)表示。除非另外指出,否則所有反應均在惰性氣氛下在r.t.下進行。
1H NMR波譜在安捷倫(Agilent)400MR NMR波譜儀上記錄。化學位移以百萬分率(ppm)表示。偶合常數以赫茲(Hz)為單位。分裂模式描述顯而易見的多重性並且表示為s(單峰)、d(雙重峰)、t(三重峰)、q(四重峰)、m(多重峰)和br(寬峰)。
在配備有電噴霧電離(ESI)源和UV檢測器(215和254 nm)的安捷倫LC/MS單四極杆系統上獲取低分辨率質譜(MS)和化合物純度數據。
實施例
1
將5-氟尿嘧啶(10 g,76.9 mmol)與37% HCHO(aq.)(100 mL)在密封管中的反應物在60℃下攪拌5小時,並且濃縮混合物,得到粗產物5-氟-1-(羥基甲基)嘧啶-2,4(1
H,3
H)-二酮(
1a),其直接用於下一步驟。MS-ESI (m/z): 161 [M+1]
+。
將1-氟-4-硝基苯(248 mg,1.76 mmol)、2-(哌啶-4-基)乙酸乙酯鹽酸鹽(443 mg,2,13 mmol)和K
2CO
3(738 mg,5,34 mmol)在MeCN(10 mL)中的反應物在密封管中在110℃下攪拌5小時,並且將混合物過濾並濃縮,得到粗產物2-(1-(4-硝基苯基)哌啶-4-基)乙酸乙酯(
1b),其直接用於下一步驟。MS-ESI (m/z): 293 [M+1]
+。
將2-(1-(4-硝基苯基)哌啶-4-基)乙酸乙酯(
1b)(415 mg,1.42 mmol)、Fe粉(1.5 g,26.8 mmol)、(NH
4)
2SO
4(108 mg,0.81 mmol)和1 M HCl(2.5 mL)在EtOH(20 mL)中的混合物回流加熱3小時。將混合物過濾並濃縮,得到粗產物2-(1-(4-氨基苯基)哌啶-4-基)乙酸乙酯(
1c),其直接用於下一步驟。MS-ESI (m/z): 263 [M+1]
+。
向2-(1-(4-氨基苯基)哌啶-4-基)乙酸乙酯(
1c)(370 mg,1.41 mmol)於MeOH(20 mL)中的溶液中添加AcOH(1 mL)、正丁醛(415 μL,4.7 mmol)和NaBH
3CN(820 mg,13.0 mmol)。將混合物攪拌1.5 h,隨後濃縮以去除MeOH,溶解於EtOAc中並用NaHCO
3(aq)洗滌,乾燥並濃縮,得到粗產物2-(1-(4-(二丁氨基)苯基)哌啶-4-基)乙酸乙酯(
1d),其直接用於下一步驟。MS-ESI (m/z): 375 [M+1]
+。
向2-(1-(4-(二丁氨基)苯基)哌啶-4-基)乙酸乙酯(
1d)(2.1 g,5.6 mmol)於THF(24 mL)中的溶液中添加1 M LiAlH
4-THF(35 mL,35 mmol)。將混合物攪拌過夜,並且用水淬滅,用EtOAc萃取,乾燥並濃縮。通過矽膠柱色譜純化殘餘物,用石油醚和EtOAc洗脫,得到304 mg 2-(1-(4-(二丁氨基)苯基)哌啶-4-基)乙-1-醇(
1e)。MS-ESI (m/z): 333 [M+1]
+。
向冷卻到-50℃以下的2-(1-(4-(二丁氨基)苯基)哌啶-4-基)乙-1-醇(
1e)(160 mg,0.48 mmol)於DCM(5 mL)中的溶液中添加DIPEA(850 μL,4.8 mmol)和三光氣(142 mg,0.48 mmol)於DCM(1.4 mL)中的溶液。將混合物在環境溫度下攪拌2 h,並且添加到5-氟-1-(羥基甲基)嘧啶-2,4(1
H,3
H)-二酮(
1a)(310 mg,1.9 mmol)於MeCN(5 mL)中的溶液中。將反應物攪拌過夜,並通過製備型色譜純化,用MeCN和0.1% TFA-H
2O洗脫,得到((5-氟-2,4-二氧代-3,4-二氫嘧啶-1(2
H)-基)甲基)碳酸2-(1-(4-(二丁氨基)苯基)哌啶-4-基)乙酯(
1)(39 mg)。MS-ESI (m/z): 519 [M+1]
+。
1H NMR (400 MHz, DMSO-d
6) δ 12.03 (d, J = 5.0 Hz, 1H), 8.14 (d, J = 6.5 Hz, 1H), 7.38 (brs, 2H), 6.67 (brs, 2H), 5.58 (s, 2H), 4.18 (t, J = 6.2 Hz, 2H), 3.61 - 2.93 (m, 8H), 2.03 - 0.58 (m, 21H)。
實施例
2
將4'-硝基-[1,1'-聯苯]-4-醇(500 mg,2.32 mmol)、Fe粉(2.63 g,47.0 mmol)、NH
4Cl(125 mg,2.32 mmol)、AcOH(500 μL)和1 M HCl(250 μL)在EtOH(40 mL)中的反應物回流加熱3.5 h。將混合物過濾並濃縮,得到粗產物4'-氨基-[1,1'-聯苯]-4-醇(
2a),其直接用於下一步驟。MS-ESI (m/z): 186 [M+1]
+。
將4'-氨基-[1,1'-聯苯]-4-醇(
2a)(400 mg,2.16 mmol)溶解於MeOH(40 mL)中,並且用丙醛(760 μL,10.4 mmol)、AcOH(500 μL)和NaBH
3CN(1.75 g,27.9 mmol)處理。將混合物攪拌過夜。將反應混合物過濾並濃縮,殘餘物用EtOAc稀釋並用NaHCO
3(aq.)洗滌。用EtOAc萃取水層兩次。合併層經Na
2SO
4乾燥,並濃縮至乾。殘餘物通過矽膠柱色譜(PE:EtOAc = 10:1至3:1)純化,得到產物4'-(二丙氨基)-[1,1'-聯苯]-4-醇(
2b)(510 mg)。MS-ESI (m/z): 270 [M+1]
+。
向冷卻到50℃以下的4'-(二丙氨基)-[1,1'-聯苯]-4-醇(
2b)(270 mg,1 mmol)於DCM(5 mL)中的溶液中添加DIPEA(1.8 mL,10 mmol)和三光氣(300 mg,1 mmol)的DCM(3 mL)溶液,將混合物在-50℃以下攪拌2 h。將5-氟-1-(羥基甲基)嘧啶-2,4(1
H,3
H)-二酮(
1a)(640 mg)於MeCN(5 mL)中的懸浮液添加到混合物中並攪拌1 h。將反應混合物過濾並通過製備型色譜純化,用MeCN和0.1% TFA-H
2O洗脫,得到((5-氟-2,4-二氧代-3,4-二氫嘧啶-1(2
H)-基)甲基)碳酸4'-(二丙氨基)-[1,1'-聯苯]-4-基酯(
2)(39 mg)。MS-ESI (m/z): 456 [M+1]
+。
1H NMR (400 MHz, DMSO-d
6) δ 12.06 (d, J = 5.0 Hz, 1H), 8.16 (d, J = 6.5 Hz, 1H), 7.67 - 7.39 (m, 4H), 7.27 (d, J = 8.3 Hz, 2H), 6.72 (brs, 2H), 5.70 (s, 2H), 3.28 (brs, 4H), 1.50 (brs, 4H), 0.87 (t, J = 7.4 Hz, 6H)。
實施例
3
向4-氨基苯酚(4.0 g,36.6 mmol)、1-碘戊烷(17.1 g,86.5 mmol)於DMF(72 mL)中的混合物中添加K
2CO
3(5.2 g,37.4 mmol)。將反應物在75℃下攪拌1.5 h。將反應混合物倒入水(300 mL)中,並用EtOAc萃取3次。將合併的有機層用Na
2S
2O
3(aq.)洗滌,經Na
2SO
4乾燥,並蒸發至乾。殘餘物通過矽膠色譜純化,用PE和EA洗脫,得到4-(二戊氨基)苯酚(
3a)。MS-ESI (m/z): 250 [M+1]
+。
向冷卻到-50℃以下的4-(二戊基氨基)苯酚(
3a)(250 mg,1 mmol)於DCM(5 mL)中的溶液中添加DIPEA(1.8 mL,10 mmol)和三光氣(300 mg,1 mmol),將混合物攪拌1 h。將混合物添加到5-氟-1-(羥基甲基)嘧啶-2,4(1
H,3
H)-二酮(
1a)(800 mg)於MeCN(5 mL)中的懸浮液中,經4Å分子篩乾燥,並攪拌1 h。將反應混合物過濾並通過製備型色譜純化,得到((5-氟-2,4-二氧代-3,4-二氫嘧啶-1(2
H)-基)甲基)碳酸4-(二戊基氨基)苯酯(
3)(95 mg)。MS-ESI (m/z): 436 [M+1]
+。
1H NMR (400 MHz, DMSO-d
6) δ 12.05 (d, J = 5.0 Hz, 1H), 8.14 (d, J = 6.5 Hz, 1H), 7.28 - 6.40 (m, 4H), 5.67 (s, 2H), 3.47 - 3.11 (m, 4H), 1.42 (s, 4H), 1.31 - 1.13 (m, 8H), 0.83 (t, J = 6.8 Hz, 6H)。
實施例
4
將1-溴-3,5-二甲苯(0.74 g,4 mmol)、4-(哌啶-4-基)苯酚氫溴酸鹽(1.04 g,4 mmol)、2-(二叔丁基膦基))-1,1'-聯苯(300 mg,1 mmol)、Pd
2dba
3(370 mg,0.40 mmol)和t-BuONa(0.76 g,7.9 mmol)於二乙惡嗪二酮(40 mL)中的混合物在氮氣下在55℃下攪拌3 h。並且另外將2-(二叔丁基膦基))-1,1'-聯苯(300 mg,1 mmol)、Pd
2dba
3(370 mg,0.40 mmol)和t-BuONa(0.76 g,7.9 mmol)添加到反應中。將反應物在55℃下攪拌5 h。將混合物過濾並用EtOAc洗滌,並濃縮濾液。殘餘物通過矽膠柱色譜純化,得到4-(1-(3,5-二甲基苯基)哌啶-4-基)苯酚(
4a)(638 mg)。MS-ESI (m/z): 282 [M+1]
+。
向冷卻到-50℃以下的4-(1-(3,5-二甲基苯基)哌啶-4-基)苯酚(
4a)(158 mg,0.56 mmol)於DCM(4 mL)中的溶液中添加DIPEA(1.0 mL,5.6 mmol)和三光氣(167 mg,0.56 mmol),將混合物攪拌1 h。將反應混合物添加到5-氟-1-(羥基甲基)嘧啶-2,4(1
H,3
H)-二酮(
1a)(450 mg)於MeCN(5 mL)中的懸浮液中並攪拌1 h。將反應混合物過濾並通過製備型色譜純化,得到((5-氟-2,4-二氧代-3,4-二氫嘧啶-1(2
H)-基)甲基)碳酸4-(1-(3,5-二甲基苯基)哌啶-4-基)苯酯(
4)(40 mg)。MS-ESI (m/z): 468 [M+1]
+。
1H NMR (400 MHz, DMSO-d
6) δ 12.05 (d, J = 5.0 Hz, 1H), 8.14 (d, J = 6.6 Hz, 1H), 7.33 (d, J = 8.4 Hz, 2H), 7.21 (d, J = 8.3 Hz, 2H), 7.07 - 6.60 (m, 3H), 5.69 (s, 2H), 4.57 - 3.59 (m, 4H), 2.83 (brs, 1H), 2.25 (s, 6H), 2.04 - 1.76 (m, 4H)。
實施例
5
將1,2,3,4-四氫異喹啉-6-醇(0.50 g,3.36 mmol)、1-溴-4-丙基苯(0.75 g,3.75 mmol)、Pd
2dba
3(200 mg,0.22 mmol)、二環己基(2',4',6'-三異丙基-[1,1'-聯苯]-2-基)膦(300 mg,0.63 mmol)和Cs
2CO
3(3.0 g,9.2 mmol)於PhMe(15 mL)中的懸浮液在密封管中在110℃下攪拌7 h。將混合物用EtOAc稀釋並過濾。將濾液濃縮並通過矽膠柱色譜純化,得到2-(4-丙基苯基)-1,2,3,4-四氫異喹啉-6-醇(
5a)(109 mg)。MS-ESI (m/z): 268 [M+1]
+。
向
冷卻到-50℃以下的2-(4-丙基苯基)-1,2,3,4-四氫異喹啉-6-醇(
5a)(26.7 mg,0.1 mmol)於DCM(1 mL)中的溶液中添加DIPEA(200 μL,1.1 mmol)和三光氣(30 mg,0.1 mmol),將混合物攪拌1 h。將反應混合物添加到5-氟-1-(羥基甲基)嘧啶-2,4(1
H,3
H)-二酮(
1a)(80 mg)於MeCN(1 mL)中的懸浮液中,經4Å分子篩乾燥,並攪拌1 h。將反應混合物過濾並通過製備型色譜純化,得到(2-(4-丙基苯基)-1,2,3,4-四氫異喹啉-6-基)碳酸(5-氟-2,4-二氧代-3,4-二氫嘧啶-1(2
H)-基)甲酯(
5)(2.0 mg)。MS-ESI (m/z): 454 [M+1]
+。
實施例
6
將(4-甲氧基苯基)(哌啶-4-基)甲酮鹽酸鹽(1.0 g,3.9 mmol)、1-溴-4-丙基苯(0.8 g,4.0 mmol)、Pd
2dba
3(732 mg,0.8 mmol)、二環己基(2',4',6'-三異丙基-[1,1'-聯苯]-2-基)膦(1.15 g,2.4 mmol)和t-BuONa(1.1 g,11.4 mmol)於PhMe(20 mL)中的懸浮液在密封管中在氮氣下在110℃下攪拌4 h。過濾混合物。將濾液濃縮並通過矽膠柱色譜純化,得到(4-甲氧基苯基)(1-(4-丙基苯基)哌啶-4-基)甲酮(
6a)(1.09 g)。MS-ESI (m/z): 338 [M+1]
+。
向(4-甲氧基苯基)(1-(4-丙基苯基)哌啶-4-基)甲酮(
6a)(600 mg,1.78 mmol)於MeOH(20 mL)中的溶液中添加NaBH
4(200 mg,5.33 mmol)。攪拌40 min之後,另外將NaBH
4(200 mg,5.33 mmol)添加到混合物中。將反應物攪拌1.5 h並用NaHCO
3水溶液淬滅。將混合物用EtOAc萃取,經Na
2SO
4乾燥,並蒸發至乾,得到黑色油狀殘餘物。
將殘餘物溶解於TFA(20 mL)中,接著添加三乙基矽烷(3 mL)。將反應物攪拌在80℃下攪拌1 h並用NaHCO
3水溶液淬滅。將混合物用EtOAc萃取,得到粗產物4-(4-甲氧基苯甲基)-1-(4-丙基苯基)哌啶(
6b)(1.87 g),直接用於下一步驟。MS-ESI (m/z): 324 [M+1]
+。
向4-(4-甲氧基苯甲基)-1-(4-丙基苯基)哌啶(
6b)(1.87 g)於DCM(10 mL)中的溶液中添加1 M BBr
3-DCM溶液(6 mL)。將反應物攪拌1 h。用NaHCO
3水溶液淬滅之後,用DCM萃取混合物。粗產物通過矽膠色譜純化,得到4-((1-(4-丙基苯基)哌啶-4-基)甲基)苯酚(
6c)(400 mg)。MS-ESI (m/z): 310 [M+1]
+。
向冷卻到-50℃以下的4-((1-(4-丙基苯基)哌啶-4-基)甲基)苯酚(
6c)(320 mg,1.0 mmol)於DCM(5 mL)中的溶液中添加DIPEA(1.7 mL,10.3mmol)和三光氣(307 mg,1.0 mmol),將混合物攪拌1 h。將反應混合物添加到5-氟-1-(羥基甲基)嘧啶-2,4(1
H,3
H)-二酮(
1a)(830 mg)於MeCN(5 mL)中的懸浮液中並攪拌1 h。將反應混合物過濾並通過製備型色譜純化,得到(4-((1-(4-丙基苯基)哌啶-4-基)甲基)苯基)碳酸(5-氟-2,4-二氧代-3,4-二氫嘧啶-1(2
H)-基)甲酯(
6)(49 mg)。MS-ESI (m/z): 496 [M+1]
+。
1H NMR (400 MHz, DMSO-d
6) δ 12.05 (d, J = 5.0 Hz, 1H), 8.14 (d, J = 6.5 Hz, 1H), 7.43 - 7.09 (m, 8H), 5.69 (s, 2H), 3.85 - 2.96 (m, 4H), 2.60 (d, J = 6.7 Hz, 2H), 2.52 (d, J = 7.6 Hz, 2H), 1.78 (d, J = 14.3 Hz, 3H), 1.53 (dt, J = 16.6, 8.4 Hz, 4H), 0.85 (t, J = 7.3 Hz, 3H)。
實施例
7
向4-(哌啶-4-基)苯酚氫溴酸鹽(500 mg,1.9 mmol)、2,2-二苯乙醛(400 mg,2.0 mmol)和AcOH(0.5 mL)於MeOH(20 mL)中的溶液中添加NaBH
3CN(1.0 g,15.9 mmol)。將反應物在環境溫度下攪拌過夜。通過蒸發去除溶劑之後,將殘餘物在EtOAc與NaHCO
3(aq.)之間分配。分離的有機層經Na
2SO
4乾燥並蒸發至乾。粗產物通過矽膠色譜純化,得到4-(1-(2,2-二苯基乙基)哌啶-4-基)苯酚(
7a)(400 mg)。MS-ESI (m/z): 358 [M+1]
+。
向冷卻到-50℃以下的4-(1-(2,2-二苯基乙基)哌啶-4-基)苯酚(
7a)(380 mg,1.06 mmol)於DCM(5 mL)中的溶液中添加DIPEA(1.8 mL,10.3 mmol)和三光氣(315 mg,1.06 mmol),將混合物攪拌0.5 h。將反應混合物添加到5-氟-1-(羥基甲基)嘧啶-2,4(1
H,3
H)-二酮(
1a)(855 mg)於MeCN(5 mL)中的懸浮液中並攪拌2 h。將反應混合物過濾並通過製備型色譜純化,得到((5-氟-2,4-二氧代-3,4-二氫嘧啶-1(2
H)-基)甲基)碳酸4-(1-(2,2-二苯基乙基)哌啶-4-基)苯酯(
7)(39 mg)。MS-ESI (m/z): 544 [M+1]
+。
實施例
8
向4-(哌啶-4-基)苯酚氫溴酸鹽(520 mg,2 mmol)和金剛烷-1-甲醯氯(400 mg,2 mmol)於DCM(20 mL)中的混合物中添加DIPEA(1 mL,5.7 mmol),將反應物在環境溫度下攪拌4 h,接著蒸發,得到粗產物金剛烷-1-基(4-(4-羥基苯基)哌啶-1-基)甲酮(
8a),其直接用於下一步驟。MS-ESI (m/z): 340 [M+1]
+。
將金剛烷-1-基(4-(4-羥基苯基)哌啶-1-基)甲酮(
8a)(650 mg,1.9 mmol)溶解於THF(20 mL)中,接著在環境溫度下添加1 M LiAlH
4-THF(6 mL,6 mmol)。將反應物攪拌0.5 h並通過添加NaOH溶液淬滅。過濾混合物並濃縮濾液。粗產物通過柱色譜純化,得到4-(1-(金剛烷-1-基甲基)哌啶-4-基)苯酚(
8b)(595 mg)。MS-ESI (m/z): 326 [M+1]
+。
向冷卻到-50℃以下的4-(1-(金剛烷-1-基甲基)哌啶-4-基)苯酚(
8b)(575 mg,1.77 mmol)於DCM(5 mL)中的溶液中添加DIPEA(2.9 mL,16.6 mmol)和三光氣(524 mg,1.77 mmol),將混合物攪拌0.5 h。將反應混合物添加到5-氟-1-(羥基甲基)嘧啶-2,4(1
H,3
H)-二酮(
1a)(1.13g)於MeCN(6 mL)中的懸浮液中並攪拌1 h。將反應混合物過濾並通過製備型色譜純化,得到((5-氟-2,4-二氧代-3,4-二氫嘧啶-1(2H)-基)甲基)碳酸4-(1-(金剛烷-1-基甲基)哌啶-4-基)苯酯(
8)(167 mg)。MS-ESI (m/z): 512 [M+1]
+。
1H NMR (400 MHz, DMSO-d
6) δ 12.05 (d, J = 5.0 Hz, 1H), 8.13 (d, J = 6.6 Hz, 1H), 7.41 - 7.19 (m, 4H), 5.69 (s, 2H), 3.76 - 2.77 (m, 7H), 2.18 - 1.55 (m, 19H)。
實施例
9
將(4-甲氧基苯基)(哌啶-4-基)甲酮鹽酸鹽(520 mg,2.0 mmol)、(溴亞甲基)二苯(520 mg,2.1 mmol)、KI(340 mg,2.0 mmol)和K
2CO
3(820 mg,5.9 mmol)於MeCN(20 mL)中的懸浮液在90℃下攪拌過夜。過濾混合物並將濾液蒸發至乾,得到粗產物(1-二苯甲基哌啶-4-基)(4-甲氧基苯基)甲酮(
9a)。MS-ESI (m/z): 386 [M+1]
+。
將(1-二苯甲基哌啶-4-基)(4-甲氧基苯基)甲酮(
9a)(750 mg,1.94 mmol)溶解於THF(20 mL)中,接著添加1 M LiAlH
4-THF溶液(4 mL,4 mmol)。將反應物攪拌0.5 h並用NaOH(aq.)溶液淬滅。過濾混合物並將濾液蒸發至乾,得到粗產物(1-二苯甲基哌啶-4-基)(4-甲氧基苯基)甲醇(
9b)。MS-ESI (m/z): 388 [M+1]
+。
將(1-二苯甲基哌啶-4-基)(4-甲氧基苯基)甲醇(
9b)(939 mg,2.43 mmol)溶解於TFA(5 mL)中,接著添加HSiEt
3(2.5 mL)。將反應物攪拌1 h並濃縮。將殘餘物溶解於DCM中,用NaHCO
3溶液洗滌。有機層經Na
2SO
4乾燥並濃縮,得到粗產物1-二苯甲基-4-(4-甲氧基苯甲基)哌啶(
9c)。MS-ESI (m/z): 372 [M+1]
+。
將1-二苯甲基-4-(4-甲氧基苯甲基)哌啶(
9c)(1.07 g,2.88 mmol)溶解於DCM(8 mL)中,接著添加1 M BBr
3-DCM溶液(6 mL,6 mmol)。將混合物在室溫下攪拌5 h。將反應物用DCM稀釋並用NaHCO
3(aq.)溶液淬滅。用DCM萃取水層。合併的DCM層經Na
2SO
4乾燥,並濃縮至乾。殘餘物通過矽膠柱色譜(PE:EtOAc = 10:1至3:1)純化,得到產物4-((1-二苯甲基哌啶-4-基)甲基)苯酚(
9d)(504 mg)。MS-ESI (m/z): 358 [M+1]
+。
向冷卻到-50℃以下的4-((1-二苯甲基哌啶-4-基)甲基)苯酚(
9d)(100 mg,0.28 mmol)於DCM(3 mL)中的溶液中添加DIPEA(700 μL,4.2 mmol)和三光氣(100 mg,0.34 mmol),並將混合物攪拌0.5 h。將反應混合物添加到5-氟-1-(羥基甲基)嘧啶-2,4(1
H,3
H)-二酮(
1a)(180 mg)於MeCN(3 mL)中的懸浮液中並攪拌1 h。將反應混合物過濾並通過製備型色譜純化,得到((5-氟-2,4-二氧代-3,4-二氫嘧啶-1(2
H)-基)甲基)碳酸4-((1-二苯甲基哌啶-4-基)甲基)苯酯(
9)(27 mg)。MS-ESI (m/z): 544 [M+1]
+。
1H NMR (400 MHz,氯仿-d) δ 7.61 (d, J = 5.2 Hz, 1H), 7.37 (d, J = 7.5 Hz, 4H), 7.29 - 7.10 (m, 8H), 7.05 (d, J = 8.5 Hz, 2H), 5.74 (s, 2H), 4.21 (s, 1H), 2.84 (d, J = 11.4 Hz, 2H), 2.53 (d, J = 6.6 Hz, 2H), 2.35 (s, 1H), 1.76 (t, J = 11.5 Hz, 2H), 1.61 - 1.42 (m, 3H), 1.38 - 1.24 (m, 2H)。
實施例
10
將2-(4-溴苯基)乙酸甲酯(241.2 mg,1.05 mmol)、4-丁基哌啶鹽酸鹽(207.6 g,1.17 mmol)、Pd
2dba
3(33 mg,0.035 mmol)、二環己基(2',4',6'-三異丙基-[1,1'-聯苯]-2-基)膦(67 mg,0.14 mmol)和Cs
2CO
3(1.14 g,3.51 mmol)於PhMe(10 mL)中的懸浮液在密封管中在110℃下攪拌18 h。將混合物用MeCN稀釋並過濾。濃縮濾液,得到粗產物2-(4-(4-丁基哌啶-1-基)苯基)乙酸甲酯(
10a),其直接用於下一步驟。MS-ESI (m/z): 290 [M+1]
+。
將2-(4-(4-丁基哌啶-1-基)苯基)乙酸甲酯(
10a)(300 mg,1.03 mmol)溶解於THF(11 mL)中,接著添加1 M LiAlH
4-THF(3 mL)。將混合物在室溫下攪拌過夜。用水淬滅反應物。用EtOAc萃取水層3次。合併的EtOAc層經Na
2SO
4乾燥並蒸發至乾。殘餘物通過製備型色譜純化,得到2-(4-(4-丁基哌啶-1-基)苯基)乙-1-醇(
10b)(281 mg)。MS-ESI (m/z): 262 [M+1]
+。
將冷卻到-50℃以下的2-(4-(4-丁基哌啶-1-基)苯基)乙-1-醇(
10b)(94 mg,0.36 mmol)、三光氣(108 mg,0.36 mmol)和DIPEA(650 μL)於DCM(3.5 mL)中的混合物攪拌2 h,接著添加氟尿嘧啶(50 mg,0.38 mmol)於MeCN(3.6 mL)中的懸浮液。將反應物在室溫下攪拌2 h,接著濃縮至乾。粗產物通過製備型色譜純化,得到5-氟-2,4-二氧代-3,4-二氫嘧啶-1(2
H)-羧酸4-(4-丁基哌啶-1-基)苯基乙酯(
10)(35 mg)。MS-ESI (m/z): 418 [M+1]
+。
1H NMR (400 MHz, DMSO-d
6) δ 12.00 (d, J = 4.9 Hz, 1H), 8.12 (d, J = 7.2 Hz, 1H), 7.44 - 7.16 (m, 4H), 4.45 (t, J = 6.6 Hz, 2H), 3.62 - 2.94 (m, 4H), 1.83 (d, J = 13.2 Hz, 2H), 1.58 - 0.96 (m, 11H), 0.90 - 0.77 (m, 3H)。
實施例
11
向冷卻到-50℃以下的2-(1-(4-(二丁氨基)苯基)哌啶-4-基)乙-1-醇(
1e)(278 mg,0.84 mmol)於DCM(7 mL)中的溶液中添加DIPEA(1.4 mL,8.4 mmol)和三光氣(248 mg,0.84 mmol)於DCM(2.5 mL)中的溶液中。將混合物在環境溫度下攪拌1.5 h,並添加到氟尿嘧啶(109 mg,0.84 mmol)於MeCN(10 mL)中的懸浮液中。將反應物攪拌過夜,並通過製備型色譜純化,用MeCN和0.1% TFA-H
2O洗脫,得到5-氟-2,4-二氧代-3,4-二氫嘧啶-1(2
H)-羧酸2-(1-(4-(二丁氨基)苯基)哌啶-4-基)乙酯(
11)(99 mg)。MS-ESI (m/z): 489 [M+1]
+。
1H NMR (400 MHz, DMSO-d
6) δ 12.02 (s, 1H), 8.21 (d, J = 7.2 Hz, 1H), 7.39 (brs, 2H), 6.67 (brs, 2H), 4.37 (t, J = 6.1 Hz, 2H), 3.90 - 3.15 (m, 8H), 2.12 - 1.05 (m, 15H), 0.92 - 0.68 (m, 6H)。
實施例
12
在環境溫度下向4-((1-二苯甲基哌啶-4-基)甲基)苯酚(
9d)(200 mg,0.56 mmol)於DCM(2 mL)中的溶液中添加NEt
3(310 μL,2.24 mmol)和二氯甲基膦(90 mg,0.67 mmol),將混合物攪拌0.5 h。將反應混合物添加到5-氟-1-(羥基甲基)嘧啶-2,4(1
H,3
H)-二酮(
1a)(360 mg)於NMP(2 mL)中的懸浮液中並攪拌3 h。將反應混合物過濾並通過製備型色譜純化,得到((5-氟-2,4-二氧代-3,4-二氫嘧啶-1(2
H)-基)甲基)甲基膦酸4-((1-二苯甲基哌啶-4-基)甲基)苯酯(
12)(90 mg)。MS-ESI (m/z): 578 [M+1]
+.
1H NMR (400 MHz,氯仿-d) δ 7.41 - 7.29 (m, 5H), 7.24 - 7.18 (m, 4H), 7.18 - 7.09 (m, 2H), 7.07 - 6.89 (m, 4H), 5.72 - 5.31 (m, 2H), 4.22 (s, 1H), 2.95 - 2.78 (m, 2H), 2.55 - 2.42 (m, 2H), 1.83 - 1.65 (m, 4H), 1.55 - 1.20 (m, 6H)。
實施例
13
2-(1-(2,2-
二苯基乙基
)
哌啶
-4-
基
)
乙酸
(S)-4-
乙基
-4-
羥基
-3,14-
二氧代
-3,4,12,14-
四氫
-1
H-
吡喃並
[3',4':6,7]
中氮茚並
[1,2-
b]
喹啉
-9-
基酯
(
13
)
向2-(哌啶-4-基)乙酸鹽酸鹽(2.3 g,12.8 mmol)、2,2-二苯基乙醛(2.5 g,12.7 mmol)和AcONa(3.1 g,37.8 mmol)於MeOH(25 mL)中的懸浮液中添加NaBH
3CN(2.0 g,31.8 mmol)。將反應物在環境溫度下攪拌4.5 h。通過蒸發去除溶劑之後,將殘餘物在EtOAc與H
2O之間分配。分離的有機層經Na
2SO
4乾燥,並蒸發至乾。粗產物通過矽膠色譜純化,得到2-(1-(2,2-二苯基乙基)哌啶-4-基)乙酸(
13a)(517 mg)。MS-ESI (m/z): 324 [M+1]
+。
2-(1-(2,2-
二苯基乙基
)
哌啶
-4-
基
)
乙酸
(S)-4-
乙基
-4-
羥基
-3,14-
二氧代
-3,4,12,14-
四氫
-1
H-
吡喃並
[3',4':6,7]
中氮茚並
[1,2-
b]
喹啉
-9-
基酯
(
13
)
將10-羥喜樹鹼(36 mg,0.1 mmol)、2-(1-(2,2-二苯基乙基)哌啶-4-基)乙酸(
13a)(32 mg,0.1 mmol)、HATU(114 mg,0.3 mmol)、DIPEA(105 μL,0.6 mmol)於NMP(2 mL)中的混合物在室溫下攪拌23 h。反應混合物通過製備型色譜純化,得到呈三氟乙酸鹽的2-(1-(2,2-二苯基乙基)哌啶-4-基)乙酸(S)-4-乙基-4-羥基-3,14-二氧代-3,4,12,14-四氫-1
H-吡喃並[3',4':6,7]中氮茚並[1,2-b]喹啉-9-基酯(
13)。MS-ESI (m/z): 670 [M+1]
+。
1H NMR (400 MHz, DMSO-
d 6) δ 8.99 (s, 1H), 8.65 (s, 1H), 8.20 (d,
J= 9.2 Hz, 1H), 7.89 (d,
J= 2.8 Hz, 1H), 7.65 (dd,
J= 9.3, 2.6 Hz, 1H), 7.47 - 7.18 (m, 11H), 6.52 (brs, 1H), 5.41 (s, 2H), 5.28 (s, 2H), 4.60 - 4.53 (m, 1H), 3.95- 3.85 (m, 2H), 3.51 (d,
J= 12.0 Hz, 2H), 3.31 - 2.85 (m, 2H), 2.63 (d,
J= 7.0 Hz, 2H), 2.15 - 1.72 (m, 5H), 1.60 - 1.45(m, 1H), 1.12 - 0.96 (m, 1H), 0.86 (t,
J= 7.3 Hz, 3H)。
實施例
14
二苯甲基脯胺酸
(S)-4,11-
二乙基
-4-
羥基
-3,14-
二氧代
-3,4,12,14-
四氫
-1
H-
吡喃並
[3',4':6,7]
中氮茚並
[1,2-
b]
喹啉
-9-
基酯(
14
)
將脯胺酸甲酯鹽酸鹽(6.0 g,36.2 mmol)、二苯氯甲烷(8.1 g,40.0 mmol)、K
2CO
3(15.0 g,108.5 mmol)和KI(6.0 g,36.1 mmol)於MeCN(120 mL)中的反應混合物在60℃下攪拌24小時。將反應混合物過濾並濃縮,將殘餘物溶解於EtOAc中並用水洗滌。用EtOAc萃取水層。將合併層用Na
2S
2O
3水溶液洗滌,經Na
2SO
4乾燥,並濃縮,得到粗產物二苯甲基脯胺酸甲酯(12.0 g),其直接用於下一步驟。MS-ESI (m/z): 296 [M+1]
+。
向以上粗產物(12.0 g)於MeOH(50 mL)中的溶液中添加NaOH(4.9 g,122.5 mmol)的水(50 mL)溶液。將反應物在50℃下攪拌17小時。將混合物在45℃下減壓濃縮以去除MeOH,並用甲基叔丁基醚洗滌剩餘水溶液。將水相用1 M HCl酸化直到pH = 5-6,並用DCM萃取六次。合併的有機層經Na
2SO
4乾燥並濃縮,得到二苯甲基脯胺酸(
14a)(7.8 g)。MS-ESI (m/z): 282 [M+1]
+。
二苯甲基脯胺酸
(
S)-4,11-
二乙基
-4-
羥基
-3,14-
二氧代
-3,4,12,14-
四氫
-1
H-
吡喃並
[3',4':6,7]
中氮茚並
[1,2-
b]
喹啉
-9-
基酯(
14
)
將(
S)-4,11-二乙基-4,9-二羥基-1,12-二氫-14
H-吡喃並[3',4':6,7]中氮茚並[1,2-
b]喹啉-3,14(4
H)-二酮(50 mg,0.13 mmol)、二苯甲基脯胺酸(
14a)(72 mg,0.26 mmol)、HATU(145 mg,0.38 mmol)和DIPEA(135 μL,0.76 mmol)於NMP(2 mL)中的混合物在室溫下攪拌3.5 h。反應混合物通過製備型色譜純化,得到二苯甲基脯胺酸(
S)-4,11-二乙基-4-羥基-3,14-二氧代-3,4,12,14-四氫-1
H-吡喃並[3',4':6,7]中氮茚並[1,2-
b]喹啉-9-基酯(
14)(31 mg)。MS-ESI (m/z): 656 [M+1]
+。
1H NMR (400 MHz, DMSO-
d 6) δ 8.16 (d,
J= 9.1 Hz, 1H), 7.56 (dd,
J= 5.3, 2.8 Hz, 5H), 7.44 - 7.21 (m, 8H), 5.42 (s, 2H), 5.33 (s, 2H), 5.04 (brs, 1H), 3.92 (brs, 1H), 3.16 (q,
J= 7.6 Hz, 2H), 3.00 (brs., 1H), 2.80 - 2.60 (m, 1H), 2.44 - 2.30 (m, 1H), 2.25 - 2.12 (m, 1H), 2.05 - 1.78 (m, 4H), 1.31 (t,
J= 7.5 Hz, 3H), 0.86 (t,
J= 7.3 Hz, 3H)。
實施例
15
N-
二苯甲基
-P-
甲基
膦醯胺
(S)-4,11-
二乙基
-4-
羥基
-3,14-
二氧代
-3,4,12,14-
四氫
-1
H-
吡喃並
[3',4':6,7]
中
氮茚並
[1,2-
b]
喹啉
-9-
基
酯
(
15
)
N-
二苯甲基
-P-
甲基
膦醯胺
(
S)-4,11-
二乙基
-4-
羥基
-3,14-
二氧代
-3,4,12,14-
四氫
-1
H-
吡喃並
[3',4':6,7]
中
氮茚並
[1,2-
b]
喹啉
-9-
基
酯
(
15
)
向(
S)-4,11-二乙基-4,9-二羥基-1,12-二氫-14
H-吡喃並[3',4':6,7]中氮茚並[1,2-
b]喹啉-3,14(4
H)-二酮(120 mg,0.3 mmol)和DIPEA(280 μL,1.6 mmol)於DCM(4 mL)中的懸浮液中添加二氯甲基膦(60 mg,0.45 mmol)。將反應物在室溫下攪拌45分鐘,接著用氨基二苯甲烷(80 μL,0.46 mmol)和DIPEA(80 μL,0.46 mmol)於DCM(1 mL)中的溶液處理。將混合物攪拌35分鐘並濃縮至乾。殘餘物通過製備型色譜純化,得到N-二苯甲基-P-甲基膦醯胺(
S)-4,11-二乙基-4-羥基-3,14-二氧代-3,4,12,14-四氫-1
H-吡喃並[3',4':6,7]中氮茚並[1,2-
b]喹啉-9-基酯(
15)(34 mg)。MS-ESI (m/z): 636 [M+1]
+。
1H NMR (400 MHz,氯仿-
d) δ 8.10 (d,
J= 9.2 Hz, 1H), 7.81 (s, 1H), 7.66 (s, 1H), 7.50 - 7.43 (m, 1H), 7.35 - 6.98 (m, 10H), 5.80 (brs, 1H), 5.73 (d,
J= 16.3 Hz, 1H), 5.50 (t,
J= 9.75 Hz, 1H), 5.35 - 5.25 (m, 2H), 5.21 (s, 2H), 3.04 - 2.90 (m, 2H), 1.95 - 1.82 (m, 2H), 1.66 (d,
J= 16.7 Hz, 3H), 1.18 (t,
J= 7.0 Hz, 3H), 1.03 (t,
J= 7.3 Hz, 3H)。
實施例
16
((1-
二苯甲基吡咯烷
-2-
基
)
甲基
)
氨基甲酸
(S)-4,11-
二乙基
-4-
羥基
-3,14-
二氧代
-3,4,12,14-
四氫
-1
H-
吡喃並
[3',4':6,7]
中
氮茚並
[1,2-
b]
喹啉
-9-
基酯
(
16
)
向在冰水中冷卻的二苯甲基脯胺酸(
14a)(1.0 g,3.6 mmol)和DIPEA(2 mL,11.5 mmol)於MeCN(20 mL)的混合物中添加氯甲酸苯甲酯(0.8 mL,5.6 mmol)。將反應物攪拌3 h,接著用氫氧化銨(4 mL)處理,且隨後在室溫下保持過夜。去除溶劑之後,獲得呈棕色油狀物的粗產物1-二苯甲基吡咯烷-2-甲醯胺(
16a),其直接用於下一步驟。MS-ESI (m/z): 281 [M+1]
+。
將1-二苯甲基吡咯烷-2-甲醯胺(
16a)(3.6 mmol)溶解於THF(25 mL)中,接著添加1 M LiAlH
4-THF溶液(22 mL,22 mmol)。將反應物攪拌過夜並用NaOH(aq.)溶液淬滅。過濾混合物並將濾液蒸發至乾。殘餘物通過矽膠柱色譜(PE:EtOAc = 10:1至5:1)純化,得到產物(1-二苯甲基吡咯烷-2-基)甲胺(
16b)(600 mg)。MS-ESI (m/z): 267 [M+1]
+。
((1-
二苯甲基吡咯烷
-2-
基
)
甲基
)
氨基甲酸
(S)-4,11-
二乙基
-4-
羥基
-3,14-
二氧
代
-3,4,12,14-
四氫
-1
H-
吡喃並
[3',4':6,7]
中
氮茚並
[1,2-
b]
喹啉
-9-
基酯
(
16
)
在-10℃下將氯甲酸4-硝基苯酯(58 mg,0.29 mmol)於NMP(0.25 mL)中的溶液添加到(
S)-4,11-二乙基-4,9-二羥基-1,12-二氫-14
H-吡喃並[3',4':6,7]中氮茚並[1,2-
b]喹啉-3,14(4
H)-二酮(50 mg,0.13 mmol)和DIPEA(0.2 mL,1.15 mmol)於NMP(1 mL)中的溶液中。將混合物攪拌1.5 h,接著添加(1-二苯甲基吡咯烷-2-基)甲胺(
16b)(77 mg,0.29 mmol)的NMP(0.25 mL)溶液。將反應混合物攪拌2.5 h並通過製備型色譜純化,得到((1-二苯甲基吡咯烷-2-基)甲基)氨基甲酸(S)-4,11-二乙基-4-羥基-3,14-二氧代-3,4,12,14-四氫-1
H-吡喃並[3',4':6,7]中氮茚並[1,2-
b]喹啉-9-基酯(16)(36 mg)。MS-ESI (m/z): 685 [M+1]
+。
1H NMR (400 MHz,氯仿-
d) δ 8.17 (d,
J= 9.2 Hz, 1H), 8.08 (s, 1H), 7.79 - 7.63 (m, 5H), 7.50 - 7.34 (m, 5H), 7.33 - 7.22 (m, 2H), 5.74 (d,
J= 16.3 Hz, 1H), 5.29 (d,
J= 26.2 Hz, 3H), 4.88 (s, 1H), 4.02 (s, 1H), 3.88 - 3.76 (m, 1H), 3.54 (dt,
J= 15.1, 7.2 Hz, 1H), 3.43 - 3.32 (m, 1H), 3.26 - 3.08 (m, 3H), 2.43 - 2.31 (m, 1H), 2.27 - 2.04 (m, 3H), 1.97 - 1.82 (m, 2H), 1.39 (t,
J= 7.6 Hz, 3H), 1.02 (t,
J= 7.3 Hz, 3H)。
實施例
17
(
S)-(4,11-
二乙基
-4-
羥基
-3,14-
二氧代
-3,4,12,14-
四氫
-1
H-
吡喃並
[3',4':6,7]
中
氮茚並
[1,2-
b]
喹啉
-9-
基
)
碳酸
4-(1-
丁基哌啶
-4-
基
)
苯酯(
17
)
向4-(哌啶-4-基)苯酚氫溴酸鹽(500 mg,1.94 mmol)、正丁醛(200 μL,2.17 mmol)和AcOH(2 mL)於MeOH(20 mL)的混合物中添加氰基硼氫化鈉(250 mg,3.98 mmol),並將反應物在室溫下攪拌過夜。將混合物濃縮以去除MeOH,用EtOAc(30 mL)稀釋並用NaHCO
3(aq.)(30 mL)洗滌。將水層用EtOAc(30 mL)萃取並且將合併的有機層經Na
2SO
4乾燥,並蒸發至乾,得到粗產物4-(1-丁基哌啶-4-基)苯酚(
17a),其直接用於下一步驟(380 mg)。MS-ESI (m/z): 234 [M+1]
+。
(
S)-(4,11-
二乙基
-4-
羥基
-3,14-
二氧代
-3,4,12,14-
四氫
-1
H-
吡喃並
[3',4':6,7]
中
氮茚並
[1,2-
b]
喹啉
-9-
基
)
碳酸
4-(1-
丁基哌啶
-4-
基
)
苯酯
(
17
)
向冷卻到-50℃以下的4-(1-丁基哌啶-4-基)苯酚(
17a)(240 mg,1.0 mmol)和DIPEA(1.9 mL,10.9 mmol)於DCM(10 mL)中的溶液中添加三光氣(360 mg,1.2 mmol)於DCM(3.6 mL)中的溶液。將混合物攪拌1 h,接著添加(
S)-4,11-二乙基-4,9-二羥基-1,12-二氫-14
H-吡喃並[3',4':6,7]中氮茚並[1,2-
b]喹啉-3,14(4
H)-二酮(300 mg,0.76 mmol)。使反應物在室溫下攪拌1 h。將反應混合物用MeCN稀釋並通過製備型色譜純化,得到(
S)-(4,11-二乙基-4-羥基-3,14-二氧代-3,4,12,14-四氫-1
H-吡喃並[3',4':6,7]中氮茚並[1,2-
b]喹啉-9-基)碳酸4-(1-丁基哌啶-4-基)苯酯(
17)(5 mg)。MS-ESI (m/z): 652 [M+1]
+。
1H NMR (400 MHz,氯仿-
d) δ 8.27 (d,
J= 9.2 Hz, 1H), 8.04 (d,
J= 2.6 Hz, 1H), 7.72 (dd,
J= 9.4, 2.5 Hz, 1H), 7.65 (s, 1H), 7.36 - 7.09 (m, 4H), 5.75 (d,
J= 16.4 Hz, 1H), 5.35 - 5.24 (m, 3H), 3.80 - 3.69 (m, 2H), 3.17 (q,
J= 7.8 Hz, 2H), 3.05 - 2.65 (m, 4H), 2.43 - 2.22 (m, 1H), 2.08 - 1.65 (m, 8H), 1.48 - 1.16 (m, 5H), 1.08 - 0.86 (m, 6H)。
實施例
18
((1-
庚基哌啶
-4-
基
)
甲基
)
碳酸
(S)-4,11-
二乙基
-4-
羥基
-3,14-
二氧代
-3,4,12,14-
四氫
-1
H-
吡喃並
[3',4':6,7]
中
氮茚並
[1,2-
b]
喹啉
-9-
基酯(
18
)
向哌啶-4-基甲醇(2.0 g,17.4 mmol)、正庚醛(2.0 g,17.4 mmol)和AcOH(6 mL)於MeOH(60 mL)的混合物中添加氰基硼氫化鈉(2.2 g,34.8 mmol),並且將反應物在室溫下攪拌過夜。將混合物蒸餾以去除MeOH並用EtOAc(100 mL)溶解,且用NaHCO
3(aq.)(100 mL)洗滌。將水層用EtOAc(100 mL)萃取並且將合併的有機層經Na
2SO
4乾燥,並蒸發至乾,得到粗產物(1-庚基哌啶-4-基)甲醇(
18a),其直接用於下一步驟(3.8 g)。MS-ESI (m/z): 214 [M+1]
+。
((1-
庚基哌啶
-4-
基
)
甲基
)
碳酸
(
S)-4,11-
二乙基
-4-
羥基
-3,14-
二氧代
-3,4,12,14-
四氫
-1
H-
吡喃並
[3',4':6,7]
中
氮茚並
[1,2-
b]
喹啉
-9-
基酯
(
18
)
在-10℃下將氯甲酸4-硝基苯酯(82 mg,0.41 mmol)於NMP(0.3 mL)中的溶液添加到(
S)-4,11-二乙基-4,9-二羥基-1,12-二氫-14
H-吡喃並[3',4':6,7]中氮茚並[1,2-
b]喹啉-3,14(4
H)-二酮(55 mg,0.14 mmol)和DIPEA(0.2 mL,1.2 mmol)於NMP(1 mL)中的溶液中。將混合物攪拌1 h,接著添加(1-庚基哌啶-4-基)甲醇(
18a)(94 mg,0.43 mmol)的NMP(0.2 mL)溶液。將反應混合物攪拌4.5 h並通過製備型色譜純化,得到((1-庚基哌啶-4-基)甲基)碳酸(
S)-4,11-二乙基-4-羥基-3,14-二氧代-3,4,12,14-四氫-1
H-吡喃並[3',4':6,7]中氮茚並[1,2-
b]喹啉-9-基酯(
18)(4 mg)。MS-ESI (m/z): 632 [M+1]
+。
1H NMR (400 MHz,氯仿-
d) δ 8.23 (d,
J= 9.2 Hz, 1H), 7.91 (s, 1H), 7.65 (s, 1H), 7.62 (d,
J= 9.2 Hz, 1H), 5.74 (d,
J= 16.3 Hz, 1H), 5.29 (d,
J= 24.0 Hz, 3H), 4.22 (d,
J= 5.6 Hz, 2H), 3.77 (d,
J= 11.9 Hz, 2H), 3.15 (q,
J= 7.7 Hz, 2H), 2.99 (s, 2H), 2.74 - 2.59 (m, 2H), 2.14 - 1.62 (m, 3H), 1.44 - 1.14 (m, 14H), 1.03 (t,
J= 7.4 Hz, 3H), 0.95 - 0.70 (m, 6H)。
實施例
19
二環己基
甘胺酸
(S)-4,11-
二乙基
-4-
羥基
-3,14-
二氧代
-3,4,12,14-
四氫
-1
H-
吡喃並
[3',4':6,7]
中
氮茚並
[1,2-
b]
喹啉
-9-
基酯(
19
)
二環己基甘胺酸乙酯(
19a
)
將二環己胺(3.66 g,20.2 mmol)和2-溴乙酸乙酯(1.67 g,10 mmol)於EtOAc(20 mL)中的溶液在70℃下加熱過夜。過濾混合物並將濾液濃縮至乾。殘餘物通過矽膠柱色譜(PE:EtOAc = 10:1至3:1)純化,得到產物二環己基甘胺酸乙酯(
19a)(2.42 g)。MS-ESI (m/z): 268 [M+1]
+。
二環己基甘胺酸(
19b
)
向二環己基甘胺酸乙酯(
19a)(2.42 g,9.1 mmol)於MeOH(5 mL)中的溶液中添加LiOH(650 mg,27.1 mmol)於水(5 mL)中的溶液。將反應混合物在50℃下攪拌過夜並減壓濃縮。將殘餘物用水(30 mL)和EtOAc(60 mL)稀釋,並用甲酸(2 mL)酸化。用EtOAc萃取水層。合併的有機層經Na
2SO
4乾燥並濃縮,得到二環己基甘胺酸(
19b)(870 mg)。MS-ESI (m/z): 240 [M+1]
+。
二環己基
甘胺酸
(S)-4,11-
二乙基
-4-
羥基
-3,14-
二氧代
-3,4,12,14-
四氫
-1
H-
吡喃並
[3',4':6,7]
中
氮茚並
[1,2-
b]
喹啉
-9-
基酯
(
19
)
將二環己基甘胺酸(
19b)(37 mg,0.15 mmol)、(
S)-4,11-二乙基-4,9-二羥基-1,12-二氫-14
H-吡喃並[3',4':6,7]中氮茚並[1,2-
b]喹啉-3,14(4
H)-二酮(42 mg,0.11 mmol)、HATU(113 mg,0.30 mmol)和DIPEA(105 μL,0.60 mmol)於NMP(1 mL)中的混合物在室溫下攪拌過夜。反應混合物通過製備型色譜純化,得到二環己基甘胺酸(
S)-4,11-二乙基-4-羥基-3,14-二氧代-3,4,12,14-四氫-1
H-吡喃並[3',4':6,7]中氮茚並[1,2-
b]喹啉-9-基酯(
19)(6.4 mg)。MS-ESI (m/z): 614 [M+1]
+。
1H NMR (400 MHz, DMSO-
d 6) δ 8.95 (s, 1H), 8.28 (d,
J= 9.1 Hz, 1H), 8.07 (d,
J= 2.5 Hz, 1H), 7.74 (dd,
J= 9.2, 2.5 Hz, 1H), 7.32 (s, 1H), 5.42 (s, 2H), 5.35 (s, 2H), 4.69 (s, 2H), 3.18 (q,
J= 7.7 Hz, 2H), 2.09 - 1.94 (m, 4H), 1.94 - 1.75 (m, 6H), 1.75 - 1.04 (m, 17H), 0.86 (t,
J= 7.3 Hz, 3H)。
實施例
20
((S)-4-
乙基
-4-
羥基
-3,14-
二氧代
-3,4,12,14-
四氫
-1H-
吡喃並
[3',4':6,7]
中氮茚並
[1,2-b]
喹啉
-9-
基
)
碳酸
(1-
二苯甲基吡咯烷
-2-
基
)
甲酯(
20
)
(1-
二苯甲基吡咯烷
-2-
基
)
甲醇
(
20a
)
將1 M LiAlH
4-THF(10 mL,10 mmol)逐滴添加到二苯甲基脯胺酸(
14a)(1.0 g,3.6 mmol)於THF(20 mL)中的溶液中。將反應混合物用NaHCO
3(aq.)淬滅並用EtOAc萃取兩次。將有機層合併,經Na
2SO
4乾燥並減壓濃縮,得到(1-二苯甲基吡咯烷-2-基)甲醇(
20a)(900 mg)。MS-ESI (m/z): 268 [M+1]
+。
((
S)-4-
乙基
-4-
羥基
-3,14-
二氧代
-3,4,12,14-
四氫
-1H-
吡喃並
[3',4':6,7]
中
氮茚並
[1,2-b]
喹啉
-9-
基
)
碳酸
(1-
二苯甲基吡咯烷
-2-
基
)
甲酯
(
20
)
在-10℃下將氯甲酸4-硝基苯酯(150 mg,0.74 mmol)於NMP(0.5 mL)中的溶液添加到(
S)-4-乙基-4,9-二羥基-1,12-二氫-14H-吡喃並[3',4':6,7]中氮茚並[1,2-b]喹啉-3,14(4H)-二酮(100 mg,0.27 mmol)和DIPEA(0.4 mL,2.3 mmol)於NMP(1 mL)中的溶液中。將混合物攪拌2 h,接著添加(1-二苯甲基吡咯烷-2-基)甲醇(
20a)(98 mg,0.37 mmol)和DMAP(54 mg,0.46 mmol)的NMP(0.5 mL)溶液。將反應混合物攪拌1 h並通過製備型色譜純化,得到((
S)-4-乙基-4-羥基-3,14-二氧代-3,4,12,14-四氫-1H-吡喃並[3',4':6,7]中氮茚並[1,2-b]喹啉-9-基)碳酸(1-二苯甲基吡咯烷-2-基)甲酯(
20)(30 mg)。MS-ESI (m/z): 658 [M+1]
+。
1H NMR (400 MHz,氯仿-
d) δ 8.36 (s, 1H), 8.22 (d,
J= 9.2 Hz, 1H), 7.78 (d,
J= 2.6 Hz, 1H), 7.76 - 7.66 (m, 5H), 7.59 (dd,
J= 9.2, 2.5 Hz, 1H), 7.50 - 7.33 (m, 6H), 5.74 (d,
J= 16.4 Hz, 1H), 5.35 - 5.26 (m, 3H), 5.05 (s, 1H), 4.46 - 4.36 (m, 2H), 4.10 (brs, 1H), 4.12 - 3.80 (m, 2H), 3.24 (s, 1H), 2.48 - 2.36 (m, 1H), 2.36 - 2.26 (m, 1H), 2.23 - 2.08 (m, 2H), 1.98 - 1.82 (m, 2H), 1.03 (t,
J= 7.4 Hz, 3H)。
實施例
21
3-
甲基
-4-
氧代
-3,4-
二氫咪唑並
[5,1-d][1,2,3,5]
四嗪
-8-
羰基異氰酸
(
21a
)
將替莫唑胺(200 mg,1.0 mmol)和乙二醯氯(175 μL,2.1 mmol)於1,2-二氯乙烷(25 mL)中的混合物在85℃下攪拌4 h。減壓濃縮反應混合物,得到3-甲基-4-氧代-3,4-二氫咪唑並[5,1-d][1,2,3,5]四嗪-8-羰基異氰酸(
21a),其直接用於下一步驟。MS-ESI (m/z): 275
[M+MeOH+Na]
+(樣品用MeOH淬滅)。
(3-
甲基
-4-
氧代
-3,4-
二氫咪唑並
[5,1-
d][1,2,3,5]
四嗪
-8-
羰基
)
氨基甲酸
4-((1-
二苯甲基哌啶
-4-
基
)
甲基
)
苯
酯(
21
)
將3-甲基-4-氧代-3,4-二氫咪唑並[5,1-d][1,2,3,5]四嗪-8-羰基異氰酸(
21a)(1mmol)於DCM中的混合物添加到4-((1-二苯甲基哌啶-4-基)甲基)苯酚(
9d)(1 mmol)和DIPEA(900 μL,5.2 mmol)於DCM(10 mL)中的溶液中。將反應混合物在室溫下攪拌1.5 h,接著蒸發。殘餘物通過製備型色譜純化,得到(3-甲基-4-氧代-3,4-二氫咪唑並[5,1-
d][1,2,3,5]四嗪-8-羰基)氨基甲酸4-((1-二苯甲基哌啶-4-基)甲基)苯酯(
21)(109 mg)。MS-ESI (m/z): 578 [M+1]
+。
1H NMR (400 MHz,氯仿-
d) δ 9.63 (s, 1H), 8.46 (s, 1H), 7.69 - 7.56 (m, 4H), 7.43 - 7.31 (m, 6H), 7.19 - 7.04 (m, 4H), 4.89 (s, 1H), 4.08 (s, 3H), 3.47 (d,
J= 12.0 Hz, 2H), 2.63 - 2.46 (m, 4H), 1.92 - 1.64 (m, 5H)。
實施例
22
將4-哌啶酮鹽酸鹽(1.0 g,7.4 mmol)、(氯亞甲基)二苯(1.57 g,7.7 mmol)、K
2CO
3(22.1 mmol)和KI(7.4mmol)於MeCN(30 mL)中的懸浮液在60℃下攪拌過夜。過濾混合物並將濾液濃縮至乾。將殘餘物用EtOAc(50 mL)溶解並用水(50 mL)洗滌,並且有機層經Na
2SO
4乾燥,蒸發至乾,得到粗產物1-二苯甲基哌啶-4-酮(
22a)(2.2 g),其直接用於下一步驟。MS-ESI (m/z): 266 [M+1]
+。
向在-50℃下冷卻的(4-氰基苯甲基)膦酸二甲酯(2.2 g,9.8 mmol)於THF(20 mL)中的溶液中逐份添加60% NaH(2.3 g),並且接著添加1-二苯甲基哌啶-4-酮(
22a)(7.7 mmol)的THF(20 mL)溶液。將反應物攪拌4 h並用水(100 mL)淬滅。混合物用EtOAc萃取兩次,並且合併的有機層經Na
2SO
4乾燥並蒸發至乾,得到4-((1-二苯甲基哌啶-4-亞基)甲基)苯甲腈(
22b)。MS-ESI (m/z): 365 [M+1]
+。
將4-((1-二苯甲基哌啶-4-亞基)甲基)苯甲腈(
22b)(1.4 g,3.8 mmol)和10% Pd/C(200 mg)於THF(20 mL)中的懸浮液在真空下脫氣,並用H
2吹掃數次。將混合物在室溫下用H
2氣球攪拌過夜。過濾懸浮液,並向濾液中添加LiAlH
4(50 mmol)的THF(35 mL)溶液。將反應物攪拌3.5 h,接著添加2 mL NaOH(aq.),過濾懸浮液並用EtOAc洗滌濾餅。將合併的濾液濃縮至乾,得到(4-((1-二苯甲基哌啶-4-基)甲基)苯基)甲胺(
22c)(1.26 g),其直接用於下一步驟。MS-ESI (m/z): 371 [M+1]
+。
向3-甲基-4-氧代-3,4-二氫咪唑並[5,1-d][1,2,3,5]四嗪-8-甲酸(200 mg,1.0 mmol)和DIPEA(1 mL,5.7 mmoL)於DCM(20 mL)中的溶液中添加HATU(1.15 g,3.0 mmol)和(4-((1-二苯甲基哌啶-4-基)甲基)苯基)甲胺(
22c)(400 mg,1.1 mmol)。將反應物在室溫下攪拌3 h,接著添加水和DCM。有機層經Na
2SO
4乾燥並蒸發至乾。粗產物通過矽膠色譜和製備型色譜純化,得到
N-(4-((1-二苯甲基哌啶-4-基)甲基)苯甲基)-3-甲基-4-氧代-3,4-二氫咪唑並[5,1-
d][1,2,3,5]四嗪-8-甲醯胺(
22)(43 mg)。MS-ESI (m/z): 548 [M+1]
+。
1H NMR (400 MHz,氯仿-
d) δ 8.37 (s, 1H), 7.68 - 7.57 (m, 4H), 7.43 - 7.31 (m, 6H), 7.22 (d,
J= 7.7 Hz, 2H), 7.02 (d,
J= 7.6 Hz, 2H), 4.69 - 4.60 (m, 2H), 4.02 (s, 3H), 3.55 - 3.42 (m, 4H), 2.56 - 2.46 (m, 3H), 1.96 - 1.55 (m, 5H)。
實施例
23
乙酸
(2S,3S,4S,6R)-6-(((1S,3S)-3-
乙醯基
-3,5,12-
三羥基
-10-
甲氧基
-6,11-
二氧代
-1,2,3,4,6,11-
六氫並四苯
-1-
基
)
氧基
)-2-
甲基
-4-(((4-((4-
甲基哌嗪
-1-
基
)
甲基
)
苯氧基
)
羰基
)
氨基
)
四氫
-2
H-
吡喃
-3-
基酯
(
23
)
將4-羥基苯甲醛(2.0 g,20 mmol)、1-甲基哌嗪(2.44 g,20 mmol)、AcOH(8 mL)和NaBH
3CN(2.51 g,40 mmol)於MeOH(80 mL)中的混合物在室溫下攪拌過夜。將反應混合物蒸發至乾並用EtOAc(50 mL)和NaHCO
3(aq.)(50 mL)溶解。有機層經Na
2SO
4乾燥並蒸發至乾,得到4-((4-甲基哌嗪-1-基)甲基)苯酚(
23a)(2.37 g),其直接用於下一步驟。MS-ESI (m/z): 207 [M+1]
+。
乙酸
(2S,3R,4S,6R)-6-(((1S,3S)-3-
乙醯基
-3,5,12-
三羥基
-10-
甲氧基
-6,11-
二氧代
-1,2,3,4,6,11-
六氫並四苯
-1-
基
)
氧基
)-4-(
λ
2-
氫氯酸基
)-2-
甲基四氫
-2H-
吡喃
-3-
基酯鹽酸鹽
(
23b
)
將道諾黴素鹽酸鹽(656 mg,1.24 mmol)於原甲酸三甲酯(10 mL)中的懸浮液在110℃下加熱3 h。減壓濃縮反應物。將殘餘物用丙酮(40 mL)稀釋,接著添加1 N HCl(4 mL)和HCl(0.1 mL)。將混合物蒸發至乾並從MeOH(4 mL)、EtOAc(40 mL)和PE(40 mL)重結晶,得到乙酸(2S,3R,4S,6R)-6-(((1S,3S)-3-乙醯基-3,5,12-三羥基-10-甲氧基-6,11-二氧代-1,2,3,4,6,11-六氫並四苯-1-基)氧基)-4-(
λ2-氫氯酸基)-2-甲基四氫-2H-吡喃-3-基酯鹽酸鹽(
23b)(622 mg)。MS-ESI (m/z): 570 [M+1]
+。
乙酸
(2S,3S,4S,6R)-6-(((1S,3S)-3-
乙醯基
-3,5,12-
三羥基
-10-
甲氧基
-6,11-
二氧代
-1,2,3,4,6,11-
六氫並四苯
-1-
基
)
氧基
)-2-
甲基
-4-(((4-((4-
甲基哌嗪
-1-
基
)
甲基
)
苯氧基
)
羰基
)
氨基
)
四氫
-2
H-
吡喃
-3-
基酯
(
23
)
在-10℃下將氯甲酸4-硝基苯酯(80 mg,0.2 mmol)於NMP(0.5 mL)中的溶液添加到4-((4-甲基哌嗪-1-基)甲基)苯酚(
23a)(40 mg,0.1 mmol)和DIPEA(90 μL,0.5 mmol)於NMP(1 mL)中的溶液中。將混合物攪拌4 h,接著添加(2S,3R,4S,6R)-6-(((1S,3S)-3-乙醯基-3,5,12-三羥基-10-甲氧基-6,11-二氧代-1,2,3,4,6,11-六氫並四苯-1-基)氧基)-4-(
λ2-氫氯酸基)-2-甲基四氫-2H-吡喃-3-基酯鹽酸鹽(
23b)(50 mg,0.083 mmol)的NMP(0.5 mL)溶液。將反應混合物攪拌1 h並通過製備型色譜純化,得到乙酸(2S,3S,4S,6R)-6-(((1S,3S)-3-乙醯基-3,5,12-三羥基-10-甲氧基-6,11-二氧代-1,2,3,4,6,11-六氫並四苯-1-基)氧基)-2-甲基-4-(((4-((4-甲基哌嗪-1-基)甲基)苯氧基)羰基)氨基)四氫-2
H-吡喃-3-基酯(
23)(25 mg)。MS-ESI (m/z): 802 [M+1]
+。
1H NMR (400 MHz, DMSO-
d 6) δ 13.26 (s, 1H), 7.95 - 7.84 (m, 3H), 7.69 - 7.62 (m, 1H), 7.29 (d,
J= 8.2 Hz, 2H), 7.02 (d,
J= 8.2 Hz, 2H), 5.54 (brs, 1H), 5.33 (s, 1H), 5.02 - 4.92 (m, 2H), 4.39 (q,
J= 5.6 Hz, 1H), 3.97 (s, 3H), 4.15 - 3.55 (m, 10H), 3.35 (brs, 1H), 2.98 (brs, 1H), 2.93 (s, 2H), 2.73 (s, 2H), 2.33 - 2.05 (m, 8H), 1.95 - 1.83 (m, 1H), 1.68 - 1.56 (m, 1H), 1.03 (d,
J= 6.4 Hz, 3H)。
實施例
24
向5-氟-1-(羥基甲基)嘧啶-2,4(1
H,3
H)-二酮(
1a)(640 mg)和氯甲酸己酯(165 μL,1.0 mmol)於MeCN(5 mL)中的溶液中添加DIPEA(1 mL,5.6 mmol)。將反應物在室溫下攪拌2 h,接著進行製備型HPLC純化,得到己基碳酸(5-氟-2,4-二氧代-3,4-二氫嘧啶-1(2
H)-基)甲酯(
24)。MS-ESI (m/z): 289 [M+1]
+。
1H NMR (400 MHz, DMSO-
d 6) δ 12.01 (s, 1H), 8.12 (d,
J= 6.6 Hz, 1H), 5.56 (s, 2H), 4.09 (t,
J= 6.6 Hz, 2H), 1.61 - 1.52 (m, 2H), 1.31 - 1.18 (m, 6H), 0.87 - 0.79 (m, 3H)。
實施例
25
根據實施例24的方法,通過使用氯甲酸4-甲氧基苯酯替代氯甲酸己酯製備標題化合物(
25)。MS-ESI (m/z): 311 [M+1]
+。
實施例
26
向4-(哌啶-4-基)苯甲酸鹽酸鹽(317 mg,1.3 mmol)、2,2-二苯基乙醛(510 mg,2.6 mmol)和AcOH(1.0 mL)於MeOH(13 mL)中的溶液中添加NaBH
3CN(250 mg,3.9 mmol)。將混合物在環境溫度下攪拌2 h。通過蒸發去除溶劑之後,將殘餘物溶解於EtOAc中並洗滌NaHCO
3(aq.)溶液。有機層經Na
2SO
4乾燥,並蒸發至乾。粗產物通過矽膠色譜純化,得到4-(1-(2,2-二苯基乙基)哌啶-4-基)苯甲酸(
26a)(340 mg)。MS-ESI (m/z): 386 [M+1]
+。
向4-(1-(2,2-二苯基乙基)哌啶-4-基)苯甲酸(
26a)(300 mg,0.78 mmol)和1H-苯并三唑-1-基氧基三(二甲氨基)鏻六氟磷酸鹽(BOP)(520 mg,1.2 mmol)於MeCN(8 mL)中的溶液中添加DIPEA(690 μl,3.9 mmol)。將混合物在室溫下攪拌1 h,且隨後添加到5-氟-1-(羥基甲基)嘧啶-2,4(1
H,3
H)-二酮(
1a)(435mg)於MeCN(7 mL)中的懸浮液中並攪拌1 h。過濾懸浮液並將濾液蒸餾為殘餘物。殘餘物通過矽膠柱色譜接著製備型HPLC純化,得到4-(1-(2,2-二苯基乙基)哌啶-4-基)苯甲酸(5-氟-2,4-二氧代-3,4-二氫嘧啶-1(2H)-基)甲酯(
26)(192 mg)。MS-ESI (m/z): 528 [M+1]
+。
1H NMR (400 MHz,氯仿-
d) δ 7.61 (d,
J= 5.2 Hz, 1H), 7.37 (d,
J= 7.4 Hz, 4H), 7.29 - 7.20 (m, 4H), 7.20 - 7.10 (m, 4H), 7.06 (d,
J= 8.6 Hz, 2H), 5.74 (s, 2H), 4.22 (s, 1H), 2.85 (d,
J= 11.5 Hz, 2H), 2.53 (d,
J= 6.7 Hz, 2H), 1.77 (t,
J= 11.3 Hz, 2H), 1.63 - 1.43 (m, 3H), 1.39 - 1.25 (m, 2H)。
實施例
27
藥物釋放分析
方法
pH 2.0
緩衝溶液的製備
通過在200 mL量瓶中添加50 mL 0.1 M磷酸溶液,用0.1 M磷酸二氫鈉溶液將pH值調節到2.0,隨後用水稀釋到200 mL來製備pH 2.0緩衝溶液。
pH 7.4
緩衝溶液的製備
通過在200 mL量瓶中添加50 mL 0.1 M磷酸氫二鈉溶液,用0.1 M磷酸溶液將pH值調節到7.4,隨後用水稀釋到200 mL來製備pH 7.4緩衝溶液。
HPLC
條件
| 柱 | 安捷倫XDB-C18(250mm × 4.6mm)5.0 µm |
| 流動相 | 梯度 A相:H 2O:ACN=9:1(0.05% TFA); B相:H 2O:ACN=1:9(0.05% TFA); |
| 流動速率 | 1.0 mL/min |
| 檢測波長 | 254 nm |
| 樣品注射體積 | 10 µL |
| 柱爐溫 | 40℃ |
| 檢測波長 | 254 nm/215 nm |
| 樣品注射體積 | 10 µL |
水解率測試方法
將化合物溶解於pH 7.4/pH 2.0緩衝溶液中,放置在37℃和200 rpm下的恒溫振盪器中,並且分別在0 h、0.5 h和6 h時取樣。在每個時間點測試相對於0 h的化合物的殘餘含量。
使用以下方程式計算釋放率(%):釋放率(%)= [A(0h)-A(
xh)]/A(0h)×100%,(
x=0, 0.5, 6),A(
xh)為指定時間點處通過HPLC測試的化合物的峰面積。
使用以下方程式計算水解常數(K
h):水解常數K
h= -ln[100%-釋放率(%)]/t
結果
本揭露內容的示例性前藥化合物的母體藥物釋放的結果示於表1中。
表1
| 實施例編號 | 釋放率( % ) | 水解常數 K h | |||
| pH 7.4 ( 0.5 h ) | pH 7.4 ( 6 h ) | pH 2.0 ( 6 h ) | pH 7.4 | pH 2.0 | |
| 實施例1 | 5.4 | 64 | 0 | 0.111 | <0.001 |
| 實施例2 | 69.5 | 89 | 38 | 2.375 | 0.080 |
| 實施例3 | 60.8 | 100 | 60 | 1.873 | 0.153 |
| 實施例4 | 82.7 | 98 | 21 | 3.509 | 0.039 |
| 實施例5 | 94.6 | 95 | 56 | 5.838 | 0.137 |
| 實施例6 | 82.8 | 75 | 18 | 3.521 | 0.033 |
| 實施例7 | 99.3 | 92 | 16 | 9.924 | 0.029 |
| 實施例8 | 99.6 | 99 | 22 | 11.043 | 0.041 |
| 實施例9 | 89.5 | 90 | 15 | 4.508 | 0.027 |
| 實施例10 | 12.0 | 54 | 37 | 0.256 | 0.077 |
| 實施例11 | 5.7 | 83 | 33 | 0.117 | 0.067 |
| 實施例12 | 100.0 | 100.0 | 9.2 | >20 | 0.016 |
| 實施例13 | 2.1 | 23.3 | 0.5 | 0.042 | <0.001 |
| 實施例14 | 85.6 | 84.4 | 8.4 | 3.876 | 0.015 |
| 實施例15 | 20.6 | 78.5 | 4.2 | 0.461 | 0.007 |
| 實施例16 | 96.2 | 100 | 0.4 | 6.540 | <0.001 |
| 實施例17 | 4.7 | 57.4 | 43.6 | 0.096 | 0.095 |
| 實施例18 | 8.8 | 11.9 | 0.3 | 0.184 | <0.001 |
| 實施例19 | 35.1 | 100 | 21.8 | 0.865 | 0.041 |
| 實施例20 | 100 | 100 | 37.2 | >20 | 0.078 |
| 實施例21 | 81.7 | 100 | 0 | 3.397 | <0.001 |
| 實施例22 | 12.5 | 85.4 | 0 | 0.267 | <0.001 |
| 實施例23 | 7.2 | 70.8 | 2.5 | 0.149 | 0.004 |
| 實施例24 | 4.6 | 55.7 | 0 | 0.094 | <0.001 |
| 實施例25 | 20.2 | 61.3 | 40.5 | 0.451 | 0.151 |
如表1所示,本發明所公開的化合物在pH 7.4下的水解常數(K
h)大於在pH 2下的水解常數。
實施例
28
大鼠藥代動力學分析
此研究的目標為評定在向雄性史泊格多利大鼠連續胃內施用本揭露內容的示例性化合物和連續靜脈內輸注或單次口服施用游離氟尿嘧啶之後,游離氟尿嘧啶和本揭露內容的示例性化合物在胃和血漿中的藥代動力學。
在以相同莫耳量施用示例性化合物和游離氟尿嘧啶之後,測試氟尿嘧啶的血漿和胃濃度並且分別示於圖1和圖2中。
根據圖1,可見與通過連續靜脈內輸注或單次口服施用游離氟尿嘧啶所實現的濃度相比,血漿中從示例性化合物釋放的氟尿嘧啶的濃度較低。此表明與母體藥物相比,本揭露內容的前藥具有較低的全身暴露以及減少的氟尿嘧啶的全身副作用。根據圖2,可見與通過連續靜脈內輸注或單次口服施用游離氟尿嘧啶所實現的濃度相比,胃組織中從示例性化合物釋放的氟尿嘧啶的濃度較高。此表明本揭露內容的前藥實現氟尿嘧啶在胃組織處的持續釋放。
上述描述僅被視為本揭露內容的原理的說明。此外,由於許多修改和變化對於所屬技術領域中具有通常知識者來說是顯而易見地,所以並不期望將所請發明限於如上文所述的所示確切構造和過程。因此,所有合適的修改和等效方案可以被視為落入由所附申請專利範圍限定的所請發明的範圍內。
無
圖1和2分別描繪向雄性史泊格多利大鼠(Sprague Dawley rat)連續胃內施用本揭露內容的示例性化合物和連續靜脈內輸注或單次口服施用游離氟尿嘧啶之後,氟尿嘧啶的血漿和胃濃度。
無
Claims (55)
- 一種前藥化合物,其包含母體藥物部分及尾部分,其中 所述母體藥物部分衍生自包含選自下組的反應性基團的母體藥物:胺、氨基、羥基和醯胺, 所述尾部分與所述母體藥物部分共價連接並且具有式(I): (I) 其中: L 1通過所述母體藥物的所述反應性基團與所述母體藥物部分連接以形成可裂解鍵; L為直接鍵或烷基; U選自下組:直接鍵、環烷基、雜環基、芳基和雜芳基; V為直接鍵或烷基; W選自下組:直接鍵、環烷基、雜環基、芳基和雜芳基; Z選自下組:直接鍵、烷基、芳基、NR 1R 2和OR 3,其中所述烷基和芳基任選地被一個或多個R 4取代; R 1、R 2和R 3獨立地為氫、烷基或環烷基;並且 R 4選自下組:烷基、環烷基、雜環基、芳基和雜芳基, 其條件是當U不是直接鍵時,V、W和Z不同時是直接鍵, 或其藥學上可接受的鹽。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中所述母體藥物選自下組:抗癌劑、抗炎藥、抗生素、抗真菌劑、JAK抑制劑和VEGF抑制劑。
- 根據請求項2所述的前藥化合物或其藥學上可接受的鹽,其中所述母體藥物是抗癌劑。
- 根據請求項2所述的前藥化合物或其藥學上可接受的鹽,其中所述母體藥物是抗炎藥。
- 根據請求項2所述的前藥化合物或其藥學上可接受的鹽,其中所述母體藥物是抗生素。
- 根據請求項2所述的前藥化合物或其藥學上可接受的鹽,其中所述母體藥物是抗真菌劑。
- 根據請求項2所述的前藥化合物或其藥學上可接受的鹽,其中所述母體藥物選自下組:氟尿嘧啶、替莫唑胺、道諾黴素、10-羥基-喜樹鹼和7-乙基-10-羥基-喜樹鹼。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中L 1通過所述母體藥物部分的所述反應性基團與所述母體藥物部分連接以形成選自下組的可裂解鍵:碳酸酯、硫代碳酸酯、氨基甲酸酯、硫代氨基甲酸酯、羧酸酯、磷酸酯、醯胺、亞胺、腙、膦醯胺酯和縮醛。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中L 1選自直接鍵、*-CH 2OC(=O)O-、*-CH 2OC(=S)O-、*-C(=O)O-、*-OC(=S)-、*-C(=O)-、*-C(=O)N(R a)-、*-C(=S)N(R a)-、*-CH 2OP(=O)(R a)O-和*-P(=O)(R a)N(R a)-,其中R a為氫、烷基、烯基或炔基,並且L 1的*端與所述母體藥物部分連接。
- 根據請求項9所述的前藥化合物或其藥學上可接受的鹽,其中L 1選自下組:直接鍵、*-CH 2OC(=O)O-、*-C(=O)O-、*-C(=O)-、*-C(=O)N(R a)-、*-CH 2OP(=O)(R a)O-和*-P(=O)(R a)N(R a)-。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中L為直接鍵。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中L為烷基。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中L為C 1-6烷基。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中U為直接鍵。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中U為雜環基。
- 根據請求項15所述的前藥化合物或其藥學上可接受的鹽,其中U為5到12元雜環基。
- 根據請求項16所述的前藥化合物或其藥學上可接受的鹽,其中U為哌啶基或1,2,3,4-四氫-異喹啉基。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中U為芳基。
- 根據請求項18所述的前藥化合物或其藥學上可接受的鹽,其中U為5到12元芳基。
- 根據請求項19所述的前藥化合物或其藥學上可接受的鹽,其中U為苯基。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中L為直接鍵,並且U為直接鍵、雜環基或芳基。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中L為烷基,並且U為直接鍵、雜環基或芳基。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中V為直接鍵。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中V為烷基。
- 根據請求項24所述的前藥化合物或其藥學上可接受的鹽,其中V為C 1-6烷基。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中W為直接鍵。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中W為芳基。
- 根據請求項27所述的前藥化合物或其藥學上可接受的鹽,其中W為5到12元芳基。
- 根據請求項28所述的前藥化合物或其藥學上可接受的鹽,其中W為苯基。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中W為雜環基。
- 根據請求項30所述的前藥化合物或其藥學上可接受的鹽,其中W為5到12元雜環基。
- 根據請求項31所述的前藥化合物或其藥學上可接受的鹽,其中W為吡咯烷基、哌啶基或哌嗪基。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中Z為直接鍵。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中Z為任選地被一個或多個R 4取代的烷基。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中Z為任選地被一個或多個R 4取代的C 1-8烷基。
- 根據請求項34或35所述的前藥化合物或其藥學上可接受的鹽,其中R 4為環烷基或芳基。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中Z為任選地被一個或多個R 4取代的芳基。
- 根據請求項37所述的前藥化合物或其藥學上可接受的鹽,其中Z為任選地被一個或多個R 4取代的5到12元芳基。
- 根據請求項38所述的前藥化合物或其藥學上可接受的鹽,其中Z為任選地被一個或多個R 4取代的苯基。
- 根據請求項37至39中任一項所述的前藥化合物或其藥學上可接受的鹽,其中R 4為烷基。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中Z為NR 1R 2。
- 根據請求項41所述的前藥化合物或其藥學上可接受的鹽,其中R 1和R 2獨立地為烷基或環烷基。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中Z為OR 3。
- 根據請求項43所述的前藥化合物或其藥學上可接受的鹽,其中R 3為烷基。
- 根據請求項45所述的前藥化合物或其藥學上可接受的鹽,其中 L為直接鍵, U為雜環基、芳基或雜芳基, V為直接鍵或烷基, W為直接鍵、雜環基或芳基; Z為烷基、芳基、NR 1R 2或OR 3,其中所述烷基和芳基任選地被一個或多個R 4取代。
- 根據請求項47所述的前藥化合物或其藥學上可接受的鹽,其中 L為直接鍵或烷基, U為直接鍵或芳基, V為直接鍵, W為直接鍵或雜環基; Z為NR 1R 2或任選地被一個或多個R 4取代的烷基。
- 根據請求項1所述的前藥化合物或其藥學上可接受的鹽,其中在生物pH下,所述前藥化合物的溶解度低於所述母體藥物。
- 一種藥物組合物,其包含根據請求項1至52中任一項所述的前藥化合物或其藥學上可接受的鹽和藥學上可接受的賦形劑。
- 一種治療有需要的受試者的疾病的方法,其包括向所述受試者施用治療有效量的根據請求項1至52中任一項所述的前藥化合物或其藥學上可接受的鹽,或根據請求項53所述的藥物組合物。
- 根據請求項54所述的方法,其中所述疾病選自下組:肛門癌、乳腺癌、結直腸癌、食道癌、胰腺癌、頭頸癌、腦癌、肝癌、胃癌、膀胱癌、口腔黏膜癌、食道癌、間變性星形細胞瘤、多形性膠質母細胞瘤、急性骨髓性白血病、急性淋巴細胞白血病、慢性髓細胞性白血病、卡波西肉瘤和神經母細胞瘤。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN2020123167 | 2020-10-23 | ||
| WOPCT/CN2020/123167 | 2020-10-23 | ||
| CN2021117394 | 2021-09-09 | ||
| WOPCT/CN2021/117394 | 2021-09-09 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| TW202227401A true TW202227401A (zh) | 2022-07-16 |
Family
ID=81289697
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| TW110138814A TW202227401A (zh) | 2020-10-23 | 2021-10-20 | 用於持續釋放治療劑的前藥及其用途 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US20230391731A1 (zh) |
| EP (1) | EP4232437A1 (zh) |
| CN (1) | CN116529252A (zh) |
| TW (1) | TW202227401A (zh) |
| WO (1) | WO2022083679A1 (zh) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2024124092A2 (en) * | 2022-12-09 | 2024-06-13 | H. Lee Moffitt Cancer Center And Research Institute, Inc. | Prodrugs of temozolomide to facilitate delivery into brain tumors |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2065083A1 (en) * | 1991-04-05 | 1992-10-06 | Kenneth B. Sloan | Topical 5-fluorouracil prodrug composition and method |
| US7700612B2 (en) * | 2003-12-23 | 2010-04-20 | Abraxis Bioscience, Llc | Di-ester prodrugs of camptothecin, process for their preparation and their therapeutical applications |
| WO2012083178A1 (en) * | 2010-12-17 | 2012-06-21 | Neo Oncology Inc. | Methods and devices for using isoperillyl alcohol |
| CN105315294B (zh) * | 2014-06-26 | 2018-05-01 | 王杭祥 | 7-乙基-10-羟基喜树碱药物前体及其制备方法和应用 |
| CN112724088B (zh) * | 2021-01-15 | 2022-04-29 | 中国医学科学院医药生物技术研究所 | 尿嘧啶类化合物及其抗肿瘤用途 |
| CN112618550A (zh) * | 2021-01-15 | 2021-04-09 | 中国医学科学院医药生物技术研究所 | 抗肿瘤的尿嘧啶类化合物及其脂质组合物 |
-
2021
- 2021-10-20 TW TW110138814A patent/TW202227401A/zh unknown
- 2021-10-21 CN CN202180072494.2A patent/CN116529252A/zh active Pending
- 2021-10-21 US US18/033,210 patent/US20230391731A1/en active Pending
- 2021-10-21 WO PCT/CN2021/125237 patent/WO2022083679A1/en active Application Filing
- 2021-10-21 EP EP21882094.2A patent/EP4232437A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| CN116529252A (zh) | 2023-08-01 |
| EP4232437A1 (en) | 2023-08-30 |
| US20230391731A1 (en) | 2023-12-07 |
| WO2022083679A1 (en) | 2022-04-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN113767103B (zh) | 新型螺环类K-Ras G12C抑制剂 | |
| US8541408B2 (en) | Aminodihydrothiazine derivatives substituted with a cyclic group | |
| EP3461821B1 (en) | Indole carboxamide compounds useful as kinase inhibitors | |
| JP2022547014A (ja) | ヘテロ環式rip1キナーゼ阻害剤 | |
| AU2015335703B2 (en) | Carbazole derivatives | |
| JP2019521082A (ja) | Lsd1/hdac二重阻害剤としてのシクロプロピル−アミド化合物 | |
| EP3209652B1 (en) | Tricyclic atropisomer compounds | |
| WO1997037989A1 (en) | Indole derivatives as 5-ht receptor antagonist | |
| KR102142797B1 (ko) | 피리디닐아미노피리미딘 유도체의 메실레이트 염의 결정질 형태, 그의 제조 방법, 및 그의 용도 | |
| US20210198261A1 (en) | Aurora kinase inhibitors and uses thereof | |
| JPH10504820A (ja) | N−置換されたフェノチアジン類の使用 | |
| TW202227401A (zh) | 用於持續釋放治療劑的前藥及其用途 | |
| US20090143380A1 (en) | 2h- or 3h-benzo[e]indazol-1-yl carbamate derivatives, the preparation and therapeutic use thereof | |
| TW202345836A (zh) | 可用作NLRP3衍生物之吡啶并-〔3,4-d〕噠嗪胺衍生物 | |
| WO2022076662A1 (en) | Acetamido-phenylbenzamide derivatives and methods of using the same | |
| JPS63166876A (ja) | ピリドンカルボン酸誘導体 | |
| RU2822464C2 (ru) | Ингибиторы аврора-киназы и их применение | |
| CN115960109B (zh) | 稠环类shp2磷酸酶抑制剂的制备及其应用 | |
| CN106045966B (zh) | 取代杂环化合物及其在药物上的应用 | |
| TW202402269A (zh) | ROCK(Rho相關激酶)抑制劑及其用途 | |
| WO2023179567A1 (zh) | 作为Toll样受体激动剂的嘧啶并哒嗪酮类化合物 | |
| RU2128178C1 (ru) | Пиперидинилзамещенные метаноантрацены и их фармацевтически приемлемые соли, фармацевтическая композиция на их основе и способы их получения | |
| JP2023524935A (ja) | 新規なピリミジン誘導体及びこれを含む神経退行性疾患及び癌の予防又は治療用組成物 | |
| CN116283764A (zh) | 硝羟喹啉前药及其制备方法和用途 |