TW202219037A - 作為免疫調節劑之雜環化合物 - Google Patents
作為免疫調節劑之雜環化合物 Download PDFInfo
- Publication number
- TW202219037A TW202219037A TW111105165A TW111105165A TW202219037A TW 202219037 A TW202219037 A TW 202219037A TW 111105165 A TW111105165 A TW 111105165A TW 111105165 A TW111105165 A TW 111105165A TW 202219037 A TW202219037 A TW 202219037A
- Authority
- TW
- Taiwan
- Prior art keywords
- alkyl
- cancer
- cycloalkyl
- aryl
- membered heterocycloalkyl
- Prior art date
Links
- 239000002955 immunomodulating agent Substances 0.000 title abstract 2
- 229940121354 immunomodulator Drugs 0.000 title abstract 2
- 150000002391 heterocyclic compounds Chemical class 0.000 title 1
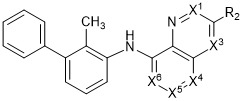
- 150000001875 compounds Chemical class 0.000 claims abstract description 337
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 75
- 201000011510 cancer Diseases 0.000 claims abstract description 47
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 38
- 201000010099 disease Diseases 0.000 claims abstract description 26
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 16
- 208000035475 disorder Diseases 0.000 claims abstract description 12
- 125000000217 alkyl group Chemical group 0.000 claims description 470
- 125000000592 heterocycloalkyl group Chemical group 0.000 claims description 249
- 125000001424 substituent group Chemical group 0.000 claims description 179
- -1 NH 2 Chemical group 0.000 claims description 144
- 125000003118 aryl group Chemical group 0.000 claims description 137
- 125000006376 (C3-C10) cycloalkyl group Chemical group 0.000 claims description 119
- 125000001313 C5-C10 heteroaryl group Chemical group 0.000 claims description 106
- 125000005843 halogen group Chemical group 0.000 claims description 94
- 150000003839 salts Chemical class 0.000 claims description 92
- 229910052757 nitrogen Inorganic materials 0.000 claims description 84
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 claims description 76
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 claims description 76
- 125000004765 (C1-C4) haloalkyl group Chemical group 0.000 claims description 64
- 125000006570 (C5-C6) heteroaryl group Chemical group 0.000 claims description 61
- 229910052799 carbon Inorganic materials 0.000 claims description 61
- 125000001072 heteroaryl group Chemical group 0.000 claims description 47
- 229910052739 hydrogen Inorganic materials 0.000 claims description 43
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 40
- 108010074708 B7-H1 Antigen Proteins 0.000 claims description 39
- 102000008096 B7-H1 Antigen Human genes 0.000 claims description 39
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 claims description 38
- 125000003545 alkoxy group Chemical group 0.000 claims description 38
- 125000003342 alkenyl group Chemical group 0.000 claims description 34
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 34
- 125000000304 alkynyl group Chemical group 0.000 claims description 33
- 125000004432 carbon atom Chemical group C* 0.000 claims description 28
- 125000004767 (C1-C4) haloalkoxy group Chemical group 0.000 claims description 26
- 125000000171 (C1-C6) haloalkyl group Chemical group 0.000 claims description 26
- 229910052717 sulfur Inorganic materials 0.000 claims description 22
- 125000005842 heteroatom Chemical group 0.000 claims description 20
- 229910052760 oxygen Inorganic materials 0.000 claims description 20
- 239000003795 chemical substances by application Substances 0.000 claims description 18
- 229910052702 rhenium Inorganic materials 0.000 claims description 18
- 238000006467 substitution reaction Methods 0.000 claims description 18
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 15
- 125000004737 (C1-C6) haloalkoxy group Chemical group 0.000 claims description 14
- 230000002401 inhibitory effect Effects 0.000 claims description 12
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 11
- 150000001335 aliphatic alkanes Chemical class 0.000 claims description 10
- 210000004027 cell Anatomy 0.000 claims description 10
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 claims description 10
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims description 9
- 229910052736 halogen Inorganic materials 0.000 claims description 9
- 150000002367 halogens Chemical class 0.000 claims description 9
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 claims description 8
- 125000004414 alkyl thio group Chemical group 0.000 claims description 8
- 238000002360 preparation method Methods 0.000 claims description 8
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims description 7
- 208000008839 Kidney Neoplasms Diseases 0.000 claims description 7
- 206010038389 Renal cancer Diseases 0.000 claims description 7
- 208000036142 Viral infection Diseases 0.000 claims description 7
- 239000003937 drug carrier Substances 0.000 claims description 7
- 201000010982 kidney cancer Diseases 0.000 claims description 7
- 230000001225 therapeutic effect Effects 0.000 claims description 7
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 6
- 210000003169 central nervous system Anatomy 0.000 claims description 6
- 239000003814 drug Substances 0.000 claims description 6
- 201000005202 lung cancer Diseases 0.000 claims description 6
- 208000020816 lung neoplasm Diseases 0.000 claims description 6
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 claims description 5
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 claims description 5
- 206010014733 Endometrial cancer Diseases 0.000 claims description 5
- 206010014759 Endometrial neoplasm Diseases 0.000 claims description 5
- 206010025323 Lymphomas Diseases 0.000 claims description 5
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 claims description 5
- 206010039491 Sarcoma Diseases 0.000 claims description 5
- 230000003993 interaction Effects 0.000 claims description 5
- 201000001441 melanoma Diseases 0.000 claims description 5
- 206010041823 squamous cell carcinoma Diseases 0.000 claims description 5
- 206010005003 Bladder cancer Diseases 0.000 claims description 4
- 206010046431 Urethral cancer Diseases 0.000 claims description 4
- 206010046458 Urethral neoplasms Diseases 0.000 claims description 4
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 4
- 208000002495 Uterine Neoplasms Diseases 0.000 claims description 4
- 150000001924 cycloalkanes Chemical class 0.000 claims description 4
- 230000028993 immune response Effects 0.000 claims description 4
- 201000007270 liver cancer Diseases 0.000 claims description 4
- 208000014018 liver neoplasm Diseases 0.000 claims description 4
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 4
- 206010046766 uterine cancer Diseases 0.000 claims description 4
- 230000009385 viral infection Effects 0.000 claims description 4
- FCJKNDFGNLPNLK-UHFFFAOYSA-N 1-[[4-(2-methyl-3-phenylanilino)pyrido[3,2-d]pyrimidin-7-yl]methyl]piperidine-2-carboxylic acid Chemical compound CC1=C(C=CC=C1NC1=C2N=CC(CN3CCCCC3C(O)=O)=CC2=NC=N1)C1=CC=CC=C1 FCJKNDFGNLPNLK-UHFFFAOYSA-N 0.000 claims description 3
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 claims description 3
- 208000031261 Acute myeloid leukaemia Diseases 0.000 claims description 3
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 claims description 3
- 206010006187 Breast cancer Diseases 0.000 claims description 3
- 208000026310 Breast neoplasm Diseases 0.000 claims description 3
- 206010009944 Colon cancer Diseases 0.000 claims description 3
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 3
- 208000017604 Hodgkin disease Diseases 0.000 claims description 3
- 208000010747 Hodgkins lymphoma Diseases 0.000 claims description 3
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 claims description 3
- 206010033128 Ovarian cancer Diseases 0.000 claims description 3
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 3
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 3
- 206010060862 Prostate cancer Diseases 0.000 claims description 3
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 3
- 208000000453 Skin Neoplasms Diseases 0.000 claims description 3
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 3
- 208000009060 clear cell adenocarcinoma Diseases 0.000 claims description 3
- 208000029742 colonic neoplasm Diseases 0.000 claims description 3
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 claims description 3
- 206010012818 diffuse large B-cell lymphoma Diseases 0.000 claims description 3
- 229940079593 drug Drugs 0.000 claims description 3
- 201000004101 esophageal cancer Diseases 0.000 claims description 3
- 206010017758 gastric cancer Diseases 0.000 claims description 3
- 201000005787 hematologic cancer Diseases 0.000 claims description 3
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 claims description 3
- 125000005349 heteroarylcycloalkyl group Chemical group 0.000 claims description 3
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 3
- 208000037819 metastatic cancer Diseases 0.000 claims description 3
- 208000011575 metastatic malignant neoplasm Diseases 0.000 claims description 3
- 208000002154 non-small cell lung carcinoma Diseases 0.000 claims description 3
- 201000002528 pancreatic cancer Diseases 0.000 claims description 3
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 3
- 201000000849 skin cancer Diseases 0.000 claims description 3
- 201000011549 stomach cancer Diseases 0.000 claims description 3
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 claims description 3
- 125000006650 (C2-C4) alkynyl group Chemical group 0.000 claims description 2
- 206010000830 Acute leukaemia Diseases 0.000 claims description 2
- 206010061424 Anal cancer Diseases 0.000 claims description 2
- 208000007860 Anus Neoplasms Diseases 0.000 claims description 2
- 206010005949 Bone cancer Diseases 0.000 claims description 2
- 208000018084 Bone neoplasm Diseases 0.000 claims description 2
- 206010006143 Brain stem glioma Diseases 0.000 claims description 2
- 206010008342 Cervix carcinoma Diseases 0.000 claims description 2
- 201000001342 Fallopian tube cancer Diseases 0.000 claims description 2
- 208000013452 Fallopian tube neoplasm Diseases 0.000 claims description 2
- 201000003741 Gastrointestinal carcinoma Diseases 0.000 claims description 2
- 208000021519 Hodgkin lymphoma Diseases 0.000 claims description 2
- 208000007766 Kaposi sarcoma Diseases 0.000 claims description 2
- 206010052178 Lymphocytic lymphoma Diseases 0.000 claims description 2
- 208000032271 Malignant tumor of penis Diseases 0.000 claims description 2
- 206010027480 Metastatic malignant melanoma Diseases 0.000 claims description 2
- 208000034578 Multiple myelomas Diseases 0.000 claims description 2
- 208000000821 Parathyroid Neoplasms Diseases 0.000 claims description 2
- 208000002471 Penile Neoplasms Diseases 0.000 claims description 2
- 206010034299 Penile cancer Diseases 0.000 claims description 2
- 208000007913 Pituitary Neoplasms Diseases 0.000 claims description 2
- 206010035226 Plasma cell myeloma Diseases 0.000 claims description 2
- 208000015634 Rectal Neoplasms Diseases 0.000 claims description 2
- 208000021712 Soft tissue sarcoma Diseases 0.000 claims description 2
- 206010042971 T-cell lymphoma Diseases 0.000 claims description 2
- 208000024313 Testicular Neoplasms Diseases 0.000 claims description 2
- 206010057644 Testis cancer Diseases 0.000 claims description 2
- 208000024770 Thyroid neoplasm Diseases 0.000 claims description 2
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 claims description 2
- 206010047741 Vulval cancer Diseases 0.000 claims description 2
- 208000004354 Vulvar Neoplasms Diseases 0.000 claims description 2
- 201000005188 adrenal gland cancer Diseases 0.000 claims description 2
- 208000024447 adrenal gland neoplasm Diseases 0.000 claims description 2
- 210000002945 adventitial reticular cell Anatomy 0.000 claims description 2
- 201000011165 anus cancer Diseases 0.000 claims description 2
- 201000010881 cervical cancer Diseases 0.000 claims description 2
- 208000024207 chronic leukemia Diseases 0.000 claims description 2
- 210000000750 endocrine system Anatomy 0.000 claims description 2
- 201000003444 follicular lymphoma Diseases 0.000 claims description 2
- 208000005017 glioblastoma Diseases 0.000 claims description 2
- 201000010536 head and neck cancer Diseases 0.000 claims description 2
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 2
- 201000002313 intestinal cancer Diseases 0.000 claims description 2
- 208000032839 leukemia Diseases 0.000 claims description 2
- 208000020984 malignant renal pelvis neoplasm Diseases 0.000 claims description 2
- 208000026045 malignant tumor of parathyroid gland Diseases 0.000 claims description 2
- 208000021039 metastatic melanoma Diseases 0.000 claims description 2
- 201000005825 prostate adenocarcinoma Diseases 0.000 claims description 2
- 206010038038 rectal cancer Diseases 0.000 claims description 2
- 201000001275 rectum cancer Diseases 0.000 claims description 2
- 201000007444 renal pelvis carcinoma Diseases 0.000 claims description 2
- 208000037959 spinal tumor Diseases 0.000 claims description 2
- 201000003120 testicular cancer Diseases 0.000 claims description 2
- 201000002510 thyroid cancer Diseases 0.000 claims description 2
- 206010046885 vaginal cancer Diseases 0.000 claims description 2
- 208000013139 vaginal neoplasm Diseases 0.000 claims description 2
- 201000005102 vulva cancer Diseases 0.000 claims description 2
- 208000031671 Large B-Cell Diffuse Lymphoma Diseases 0.000 claims 2
- 201000005746 Pituitary adenoma Diseases 0.000 claims 1
- 206010061538 Pituitary tumour benign Diseases 0.000 claims 1
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 claims 1
- 208000030381 cutaneous melanoma Diseases 0.000 claims 1
- 208000021310 pituitary gland adenoma Diseases 0.000 claims 1
- 201000003708 skin melanoma Diseases 0.000 claims 1
- 230000000638 stimulation Effects 0.000 claims 1
- 238000000034 method Methods 0.000 abstract description 74
- 208000015181 infectious disease Diseases 0.000 abstract description 18
- 239000000203 mixture Substances 0.000 description 123
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 94
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 63
- 239000003112 inhibitor Substances 0.000 description 59
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 58
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 58
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 55
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical class CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 46
- 125000006708 (C5-C14) heteroaryl group Chemical group 0.000 description 43
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 40
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 37
- 235000019439 ethyl acetate Nutrition 0.000 description 36
- 238000006243 chemical reaction Methods 0.000 description 32
- 102000037982 Immune checkpoint proteins Human genes 0.000 description 26
- 108091008036 Immune checkpoint proteins Proteins 0.000 description 26
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 26
- 125000000753 cycloalkyl group Chemical group 0.000 description 25
- JFDZBHWFFUWGJE-UHFFFAOYSA-N benzonitrile Chemical compound N#CC1=CC=CC=C1 JFDZBHWFFUWGJE-UHFFFAOYSA-N 0.000 description 24
- 238000000746 purification Methods 0.000 description 23
- 239000011541 reaction mixture Substances 0.000 description 23
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 21
- 238000002953 preparative HPLC Methods 0.000 description 21
- 239000000047 product Substances 0.000 description 21
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 20
- 229940126546 immune checkpoint molecule Drugs 0.000 description 20
- 239000012044 organic layer Substances 0.000 description 20
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 19
- 239000000243 solution Substances 0.000 description 19
- 241000700605 Viruses Species 0.000 description 18
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 17
- 239000012267 brine Substances 0.000 description 17
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 17
- 229910052938 sodium sulfate Inorganic materials 0.000 description 17
- 235000011152 sodium sulphate Nutrition 0.000 description 17
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 17
- 239000007787 solid Substances 0.000 description 17
- 125000006568 (C4-C7) heterocycloalkyl group Chemical group 0.000 description 16
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 16
- 150000001412 amines Chemical class 0.000 description 15
- 125000004429 atom Chemical group 0.000 description 14
- 229940045513 CTLA4 antagonist Drugs 0.000 description 13
- 102100040678 Programmed cell death protein 1 Human genes 0.000 description 13
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical class [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 13
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 13
- 239000002253 acid Substances 0.000 description 13
- 150000004982 aromatic amines Chemical class 0.000 description 13
- 239000012043 crude product Substances 0.000 description 13
- 239000010410 layer Substances 0.000 description 13
- 238000011282 treatment Methods 0.000 description 13
- 238000005859 coupling reaction Methods 0.000 description 12
- 238000009472 formulation Methods 0.000 description 12
- 229910052763 palladium Inorganic materials 0.000 description 12
- 229920006395 saturated elastomer Polymers 0.000 description 12
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 11
- 101710089372 Programmed cell death protein 1 Proteins 0.000 description 11
- 239000004480 active ingredient Substances 0.000 description 11
- 125000002947 alkylene group Chemical group 0.000 description 11
- 150000001721 carbon Chemical group 0.000 description 11
- 239000003054 catalyst Substances 0.000 description 11
- 238000004440 column chromatography Methods 0.000 description 11
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 11
- 125000006413 ring segment Chemical group 0.000 description 11
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 10
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 10
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 10
- 125000002950 monocyclic group Chemical group 0.000 description 10
- 230000006916 protein interaction Effects 0.000 description 10
- 239000002904 solvent Substances 0.000 description 10
- 238000003756 stirring Methods 0.000 description 10
- 238000005481 NMR spectroscopy Methods 0.000 description 9
- 229960002621 pembrolizumab Drugs 0.000 description 9
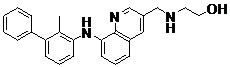
- WXVGZIZBMFJASZ-UHFFFAOYSA-N 2-methyl-3-phenylaniline Chemical compound CC1=C(N)C=CC=C1C1=CC=CC=C1 WXVGZIZBMFJASZ-UHFFFAOYSA-N 0.000 description 8
- DPGSPRJLAZGUBQ-UHFFFAOYSA-N 4,4,5,5-tetramethyl-2-vinyl-1,3,2-dioxaborolane Substances CC1(C)OB(C=C)OC1(C)C DPGSPRJLAZGUBQ-UHFFFAOYSA-N 0.000 description 8
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 8
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 8
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 8
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 8
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 8
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 7
- 102000008203 CTLA-4 Antigen Human genes 0.000 description 7
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 7
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 description 7
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 description 7
- 239000002552 dosage form Substances 0.000 description 7
- 230000000694 effects Effects 0.000 description 7
- 125000001188 haloalkyl group Chemical group 0.000 description 7
- LPVKPDICSWYIRC-UHFFFAOYSA-N 4-chloro-8-(2-methyl-3-phenylanilino)-1,7-naphthyridine-3-carbaldehyde Chemical compound CC1=C(C=CC=C1NC1=NC=CC2=C(Cl)C(C=O)=CN=C12)C1=CC=CC=C1 LPVKPDICSWYIRC-UHFFFAOYSA-N 0.000 description 6
- MQQKUZKSLHBPEV-UHFFFAOYSA-N 8-(2-methyl-3-phenylanilino)-1,7-naphthyridine-3-carbaldehyde Chemical compound CC1=C(C=CC=C1NC1=NC=CC2=CC(C=O)=CN=C12)C1=CC=CC=C1 MQQKUZKSLHBPEV-UHFFFAOYSA-N 0.000 description 6
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 241000282414 Homo sapiens Species 0.000 description 6
- 101001137987 Homo sapiens Lymphocyte activation gene 3 protein Proteins 0.000 description 6
- 101000801234 Homo sapiens Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 description 6
- 102000017578 LAG3 Human genes 0.000 description 6
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 6
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 6
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 6
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 6
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 6
- 102100033728 Tumor necrosis factor receptor superfamily member 18 Human genes 0.000 description 6
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 description 6
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 6
- 150000001299 aldehydes Chemical class 0.000 description 6
- 238000003556 assay Methods 0.000 description 6
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 6
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 6
- 229910000024 caesium carbonate Inorganic materials 0.000 description 6
- 239000000284 extract Substances 0.000 description 6
- 238000002868 homogeneous time resolved fluorescence Methods 0.000 description 6
- 125000005647 linker group Chemical group 0.000 description 6
- 239000007937 lozenge Substances 0.000 description 6
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 6
- 239000008108 microcrystalline cellulose Substances 0.000 description 6
- 229940016286 microcrystalline cellulose Drugs 0.000 description 6
- 239000001301 oxygen Substances 0.000 description 6
- PIBWKRNGBLPSSY-UHFFFAOYSA-L palladium(II) chloride Chemical compound Cl[Pd]Cl PIBWKRNGBLPSSY-UHFFFAOYSA-L 0.000 description 6
- 239000000843 powder Substances 0.000 description 6
- 239000002244 precipitate Substances 0.000 description 6
- 125000006239 protecting group Chemical group 0.000 description 6
- 108090000623 proteins and genes Proteins 0.000 description 6
- 230000002829 reductive effect Effects 0.000 description 6
- JQWHASGSAFIOCM-UHFFFAOYSA-M sodium periodate Chemical compound [Na+].[O-]I(=O)(=O)=O JQWHASGSAFIOCM-UHFFFAOYSA-M 0.000 description 6
- 239000011593 sulfur Substances 0.000 description 6
- 239000000725 suspension Substances 0.000 description 6
- 238000003786 synthesis reaction Methods 0.000 description 6
- 210000004881 tumor cell Anatomy 0.000 description 6
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 5
- 238000006443 Buchwald-Hartwig cross coupling reaction Methods 0.000 description 5
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 5
- 241000712079 Measles morbillivirus Species 0.000 description 5
- 101100407308 Mus musculus Pdcd1lg2 gene Proteins 0.000 description 5
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 5
- 108700030875 Programmed Cell Death 1 Ligand 2 Proteins 0.000 description 5
- 102100024213 Programmed cell death 1 ligand 2 Human genes 0.000 description 5
- 210000001744 T-lymphocyte Anatomy 0.000 description 5
- 235000011114 ammonium hydroxide Nutrition 0.000 description 5
- 239000007864 aqueous solution Substances 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 239000003153 chemical reaction reagent Substances 0.000 description 5
- 238000001816 cooling Methods 0.000 description 5
- 230000008878 coupling Effects 0.000 description 5
- 238000010168 coupling process Methods 0.000 description 5
- 229960004397 cyclophosphamide Drugs 0.000 description 5
- NKLCNNUWBJBICK-UHFFFAOYSA-N dess–martin periodinane Chemical compound C1=CC=C2I(OC(=O)C)(OC(C)=O)(OC(C)=O)OC(=O)C2=C1 NKLCNNUWBJBICK-UHFFFAOYSA-N 0.000 description 5
- 229950009791 durvalumab Drugs 0.000 description 5
- KTWOOEGAPBSYNW-UHFFFAOYSA-N ferrocene Chemical compound [Fe+2].C=1C=C[CH-]C=1.C=1C=C[CH-]C=1 KTWOOEGAPBSYNW-UHFFFAOYSA-N 0.000 description 5
- 239000000706 filtrate Substances 0.000 description 5
- 125000004438 haloalkoxy group Chemical group 0.000 description 5
- 230000002519 immonomodulatory effect Effects 0.000 description 5
- 229960004942 lenalidomide Drugs 0.000 description 5
- GOTYRUGSSMKFNF-UHFFFAOYSA-N lenalidomide Chemical group C1C=2C(N)=CC=CC=2C(=O)N1C1CCC(=O)NC1=O GOTYRUGSSMKFNF-UHFFFAOYSA-N 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 5
- 229960001924 melphalan Drugs 0.000 description 5
- 229960003301 nivolumab Drugs 0.000 description 5
- 125000001820 oxy group Chemical group [*:1]O[*:2] 0.000 description 5
- 244000052769 pathogen Species 0.000 description 5
- 239000006187 pill Substances 0.000 description 5
- 102000004196 processed proteins & peptides Human genes 0.000 description 5
- 108090000765 processed proteins & peptides Proteins 0.000 description 5
- 102000004169 proteins and genes Human genes 0.000 description 5
- 125000003226 pyrazolyl group Chemical group 0.000 description 5
- 125000004076 pyridyl group Chemical group 0.000 description 5
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 5
- 235000017557 sodium bicarbonate Nutrition 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- 125000000335 thiazolyl group Chemical group 0.000 description 5
- 125000001544 thienyl group Chemical group 0.000 description 5
- 210000001519 tissue Anatomy 0.000 description 5
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 5
- KWGRBVOPPLSCSI-WPRPVWTQSA-N (-)-ephedrine Chemical compound CN[C@@H](C)[C@H](O)C1=CC=CC=C1 KWGRBVOPPLSCSI-WPRPVWTQSA-N 0.000 description 4
- 102000010400 1-phosphatidylinositol-3-kinase activity proteins Human genes 0.000 description 4
- IQUASGWDOYAKKG-UHFFFAOYSA-N 2-[(8-chloro-1,7-naphthyridin-3-yl)methylamino]ethanol Chemical compound OCCNCC1=CN=C2C(Cl)=NC=CC2=C1 IQUASGWDOYAKKG-UHFFFAOYSA-N 0.000 description 4
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 4
- OYLKUSGEAUGWGE-UHFFFAOYSA-N 3-bromo-N-(2-methyl-3-phenylphenyl)-1,7-naphthyridin-8-amine Chemical compound CC1=C(C=CC=C1NC1=NC=CC2=CC(Br)=CN=C12)C1=CC=CC=C1 OYLKUSGEAUGWGE-UHFFFAOYSA-N 0.000 description 4
- JYSHQHSYWWVDRS-UHFFFAOYSA-N 3-ethenyl-N-(2-methyl-3-phenylphenyl)-1,7-naphthyridin-8-amine Chemical compound CC1=C(C=CC=C1NC1=NC=CC2=CC(C=C)=CN=C12)C1=CC=CC=C1 JYSHQHSYWWVDRS-UHFFFAOYSA-N 0.000 description 4
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 description 4
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 4
- SAGXMMIBMUJIHQ-UHFFFAOYSA-N 8-(2-methyl-3-phenylanilino)quinoline-3-carbaldehyde Chemical compound CC1=C(C=CC=C1NC=1C=CC=C2C=C(C=NC=12)C=O)C1=CC=CC=C1 SAGXMMIBMUJIHQ-UHFFFAOYSA-N 0.000 description 4
- WSVLPVUVIUVCRA-KPKNDVKVSA-N Alpha-lactose monohydrate Chemical compound O.O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O WSVLPVUVIUVCRA-KPKNDVKVSA-N 0.000 description 4
- 102100029822 B- and T-lymphocyte attenuator Human genes 0.000 description 4
- 208000035143 Bacterial infection Diseases 0.000 description 4
- 102100027207 CD27 antigen Human genes 0.000 description 4
- 102100038078 CD276 antigen Human genes 0.000 description 4
- 101710185679 CD276 antigen Proteins 0.000 description 4
- 101150013553 CD40 gene Proteins 0.000 description 4
- 206010017533 Fungal infection Diseases 0.000 description 4
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 4
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 4
- 102100034458 Hepatitis A virus cellular receptor 2 Human genes 0.000 description 4
- 101000864344 Homo sapiens B- and T-lymphocyte attenuator Proteins 0.000 description 4
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 description 4
- 101001068133 Homo sapiens Hepatitis A virus cellular receptor 2 Proteins 0.000 description 4
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 4
- 101000666896 Homo sapiens V-type immunoglobulin domain-containing suppressor of T-cell activation Proteins 0.000 description 4
- 241000701806 Human papillomavirus Species 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- 241000235395 Mucor Species 0.000 description 4
- 208000031888 Mycoses Diseases 0.000 description 4
- 239000007832 Na2SO4 Substances 0.000 description 4
- 102000004473 OX40 Ligand Human genes 0.000 description 4
- 108010042215 OX40 Ligand Proteins 0.000 description 4
- 108091007960 PI3Ks Proteins 0.000 description 4
- 208000030852 Parasitic disease Diseases 0.000 description 4
- 229940079156 Proteasome inhibitor Drugs 0.000 description 4
- 101100215487 Sus scrofa ADRA2A gene Proteins 0.000 description 4
- 238000006069 Suzuki reaction reaction Methods 0.000 description 4
- 108091008874 T cell receptors Proteins 0.000 description 4
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 4
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 4
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 4
- 108010079206 V-Set Domain-Containing T-Cell Activation Inhibitor 1 Proteins 0.000 description 4
- 102100038929 V-set domain-containing T-cell activation inhibitor 1 Human genes 0.000 description 4
- 102100038282 V-type immunoglobulin domain-containing suppressor of T-cell activation Human genes 0.000 description 4
- 239000012369 [(2-Di-cyclohexylphosphino-3,6-dimethoxy-2',4',6'-triisopropyl-1,1'-biphenyl)-2-(2'-amino-1,1'-biphenyl)]palladium(II) methanesulfonate Substances 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 229940100198 alkylating agent Drugs 0.000 description 4
- 239000002168 alkylating agent Substances 0.000 description 4
- 239000000427 antigen Substances 0.000 description 4
- 108091007433 antigens Proteins 0.000 description 4
- 102000036639 antigens Human genes 0.000 description 4
- 239000002246 antineoplastic agent Substances 0.000 description 4
- 125000002393 azetidinyl group Chemical group 0.000 description 4
- 208000022362 bacterial infectious disease Diseases 0.000 description 4
- 230000037396 body weight Effects 0.000 description 4
- 239000000460 chlorine Substances 0.000 description 4
- 239000003246 corticosteroid Substances 0.000 description 4
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 4
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 4
- NXQGGXCHGDYOHB-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloropalladium;iron(2+) Chemical compound [Fe+2].Cl[Pd]Cl.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 NXQGGXCHGDYOHB-UHFFFAOYSA-L 0.000 description 4
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 4
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 4
- 229960003957 dexamethasone Drugs 0.000 description 4
- IJJVMEJXYNJXOJ-UHFFFAOYSA-N fluquinconazole Chemical compound C=1C=C(Cl)C=C(Cl)C=1N1C(=O)C2=CC(F)=CC=C2N=C1N1C=NC=N1 IJJVMEJXYNJXOJ-UHFFFAOYSA-N 0.000 description 4
- 125000002541 furyl group Chemical group 0.000 description 4
- 108020001507 fusion proteins Proteins 0.000 description 4
- 102000037865 fusion proteins Human genes 0.000 description 4
- 230000014509 gene expression Effects 0.000 description 4
- 230000012010 growth Effects 0.000 description 4
- 230000036541 health Effects 0.000 description 4
- 125000000623 heterocyclic group Chemical group 0.000 description 4
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 4
- 125000002883 imidazolyl group Chemical group 0.000 description 4
- 238000009169 immunotherapy Methods 0.000 description 4
- 229960001021 lactose monohydrate Drugs 0.000 description 4
- 239000003446 ligand Substances 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 4
- 235000019341 magnesium sulphate Nutrition 0.000 description 4
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Chemical compound C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 description 4
- 229910000489 osmium tetroxide Inorganic materials 0.000 description 4
- 125000002971 oxazolyl group Chemical group 0.000 description 4
- 238000007911 parenteral administration Methods 0.000 description 4
- 239000002245 particle Substances 0.000 description 4
- 230000007170 pathology Effects 0.000 description 4
- 230000037361 pathway Effects 0.000 description 4
- HXITXNWTGFUOAU-UHFFFAOYSA-N phenylboronic acid Chemical compound OB(O)C1=CC=CC=C1 HXITXNWTGFUOAU-UHFFFAOYSA-N 0.000 description 4
- 229960000688 pomalidomide Drugs 0.000 description 4
- UVSMNLNDYGZFPF-UHFFFAOYSA-N pomalidomide Chemical compound O=C1C=2C(N)=CC=CC=2C(=O)N1C1CCC(=O)NC1=O UVSMNLNDYGZFPF-UHFFFAOYSA-N 0.000 description 4
- 229910000027 potassium carbonate Inorganic materials 0.000 description 4
- 239000003207 proteasome inhibitor Substances 0.000 description 4
- 125000000168 pyrrolyl group Chemical group 0.000 description 4
- 230000019491 signal transduction Effects 0.000 description 4
- 230000011664 signaling Effects 0.000 description 4
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 4
- 238000002560 therapeutic procedure Methods 0.000 description 4
- 241000712461 unidentified influenza virus Species 0.000 description 4
- 229960005486 vaccine Drugs 0.000 description 4
- GUBGYTABKSRVRQ-UHFFFAOYSA-N 2-(hydroxymethyl)-6-[4,5,6-trihydroxy-2-(hydroxymethyl)oxan-3-yl]oxyoxane-3,4,5-triol Chemical compound OCC1OC(OC2C(O)C(O)C(O)OC2CO)C(O)C(O)C1O GUBGYTABKSRVRQ-UHFFFAOYSA-N 0.000 description 3
- TZYSPRRGYIRZIZ-UHFFFAOYSA-N 2-amino-6-(cyclohexen-1-yl)benzonitrile Chemical compound NC1=C(C#N)C(=CC=C1)C1=CCCCC1 TZYSPRRGYIRZIZ-UHFFFAOYSA-N 0.000 description 3
- IILVSKMKMOJHMA-UHFFFAOYSA-N 3-bromo-2-methylaniline Chemical compound CC1=C(N)C=CC=C1Br IILVSKMKMOJHMA-UHFFFAOYSA-N 0.000 description 3
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical compound C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 description 3
- KUPVUSGTEKUCOF-UHFFFAOYSA-N 5-(2-methyl-3-phenylanilino)pyrido[3,4-b]pyrazine-2-carbaldehyde Chemical compound CC1=C(C=CC=C1NC1=NC=CC=2C1=NC=C(N=2)C=O)C1=CC=CC=C1 KUPVUSGTEKUCOF-UHFFFAOYSA-N 0.000 description 3
- 125000006163 5-membered heteroaryl group Chemical group 0.000 description 3
- ZCRLDIUDZQZTLR-UHFFFAOYSA-N 8-(2-methyl-3-phenylanilino)-1,7-naphthyridine-4-carbaldehyde Chemical compound CC1=C(C=CC=C1NC1=NC=CC2=C(C=O)C=CN=C12)C1=CC=CC=C1 ZCRLDIUDZQZTLR-UHFFFAOYSA-N 0.000 description 3
- QYFVNFUBUIBKBL-UHFFFAOYSA-N 8-(2-methyl-3-phenylanilino)quinoline-4-carbaldehyde Chemical compound CC1=C(C=CC=C1NC=1C=CC=C2C(=CC=NC=12)C=O)C1=CC=CC=C1 QYFVNFUBUIBKBL-UHFFFAOYSA-N 0.000 description 3
- 208000035473 Communicable disease Diseases 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 101000916644 Homo sapiens Macrophage colony-stimulating factor 1 receptor Proteins 0.000 description 3
- 101000611936 Homo sapiens Programmed cell death protein 1 Proteins 0.000 description 3
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 3
- 229940076838 Immune checkpoint inhibitor Drugs 0.000 description 3
- 102100040061 Indoleamine 2,3-dioxygenase 1 Human genes 0.000 description 3
- 102000037984 Inhibitory immune checkpoint proteins Human genes 0.000 description 3
- 108091008026 Inhibitory immune checkpoint proteins Proteins 0.000 description 3
- 102100037850 Interferon gamma Human genes 0.000 description 3
- 108010074328 Interferon-gamma Proteins 0.000 description 3
- 108010050904 Interferons Proteins 0.000 description 3
- 102000014150 Interferons Human genes 0.000 description 3
- 108010002350 Interleukin-2 Proteins 0.000 description 3
- 102000000588 Interleukin-2 Human genes 0.000 description 3
- 102000042838 JAK family Human genes 0.000 description 3
- 108091082332 JAK family Proteins 0.000 description 3
- 241000222722 Leishmania <genus> Species 0.000 description 3
- 102100028198 Macrophage colony-stimulating factor 1 receptor Human genes 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 241000588769 Proteus <enterobacteria> Species 0.000 description 3
- 241000589516 Pseudomonas Species 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 241000295644 Staphylococcaceae Species 0.000 description 3
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- 230000001580 bacterial effect Effects 0.000 description 3
- 125000002619 bicyclic group Chemical group 0.000 description 3
- 230000000903 blocking effect Effects 0.000 description 3
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 3
- 238000006555 catalytic reaction Methods 0.000 description 3
- 239000003638 chemical reducing agent Substances 0.000 description 3
- 229910052801 chlorine Inorganic materials 0.000 description 3
- USJRLGNYCQWLPF-UHFFFAOYSA-N chlorophosphane Chemical compound ClP USJRLGNYCQWLPF-UHFFFAOYSA-N 0.000 description 3
- 125000004093 cyano group Chemical group *C#N 0.000 description 3
- 229910052805 deuterium Inorganic materials 0.000 description 3
- 239000006196 drop Substances 0.000 description 3
- 230000002538 fungal effect Effects 0.000 description 3
- 208000006454 hepatitis Diseases 0.000 description 3
- 231100000283 hepatitis Toxicity 0.000 description 3
- 150000002430 hydrocarbons Chemical group 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 3
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 3
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 3
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 3
- 239000012274 immune-checkpoint protein inhibitor Substances 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 229960005386 ipilimumab Drugs 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- OKKJLVBELUTLKV-VMNATFBRSA-N methanol-d1 Chemical compound [2H]OC OKKJLVBELUTLKV-VMNATFBRSA-N 0.000 description 3
- CXQTTWVBUDFUNO-UHFFFAOYSA-N methyl piperidine-2-carboxylate Chemical compound COC(=O)C1CCCCN1 CXQTTWVBUDFUNO-UHFFFAOYSA-N 0.000 description 3
- 125000001624 naphthyl group Chemical group 0.000 description 3
- 239000002674 ointment Substances 0.000 description 3
- 230000026731 phosphorylation Effects 0.000 description 3
- 238000006366 phosphorylation reaction Methods 0.000 description 3
- HXEACLLIILLPRG-UHFFFAOYSA-N pipecolic acid Chemical compound OC(=O)C1CCCCN1 HXEACLLIILLPRG-UHFFFAOYSA-N 0.000 description 3
- 125000003386 piperidinyl group Chemical group 0.000 description 3
- 125000003367 polycyclic group Chemical group 0.000 description 3
- 238000000159 protein binding assay Methods 0.000 description 3
- 125000003373 pyrazinyl group Chemical group 0.000 description 3
- 125000002098 pyridazinyl group Chemical group 0.000 description 3
- 125000000714 pyrimidinyl group Chemical group 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 238000010898 silica gel chromatography Methods 0.000 description 3
- 239000012279 sodium borohydride Substances 0.000 description 3
- 229910000033 sodium borohydride Inorganic materials 0.000 description 3
- 229910000029 sodium carbonate Inorganic materials 0.000 description 3
- AKHNMLFCWUSKQB-UHFFFAOYSA-L sodium thiosulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=S AKHNMLFCWUSKQB-UHFFFAOYSA-L 0.000 description 3
- 235000019345 sodium thiosulphate Nutrition 0.000 description 3
- 239000012453 solvate Substances 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 3
- NQRYJNQNLNOLGT-UHFFFAOYSA-N tetrahydropyridine hydrochloride Natural products C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 3
- 239000012049 topical pharmaceutical composition Substances 0.000 description 3
- 238000012546 transfer Methods 0.000 description 3
- 229960000575 trastuzumab Drugs 0.000 description 3
- 241000701161 unidentified adenovirus Species 0.000 description 3
- 241001529453 unidentified herpesvirus Species 0.000 description 3
- 229920002554 vinyl polymer Polymers 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 2
- 125000000229 (C1-C4)alkoxy group Chemical group 0.000 description 2
- 125000006700 (C1-C6) alkylthio group Chemical group 0.000 description 2
- 125000006582 (C5-C6) heterocycloalkyl group Chemical group 0.000 description 2
- 125000004607 1,2,3,4-tetrahydroquinolinyl group Chemical group N1(CCCC2=CC=CC=C12)* 0.000 description 2
- 125000004502 1,2,3-oxadiazolyl group Chemical group 0.000 description 2
- 125000004511 1,2,3-thiadiazolyl group Chemical group 0.000 description 2
- 125000001399 1,2,3-triazolyl group Chemical group N1N=NC(=C1)* 0.000 description 2
- 125000004504 1,2,4-oxadiazolyl group Chemical group 0.000 description 2
- 125000004514 1,2,4-thiadiazolyl group Chemical group 0.000 description 2
- 125000001376 1,2,4-triazolyl group Chemical group N1N=C(N=C1)* 0.000 description 2
- 125000001781 1,3,4-oxadiazolyl group Chemical group 0.000 description 2
- 125000004520 1,3,4-thiadiazolyl group Chemical group 0.000 description 2
- VDJUOHRFRUIXDD-UHFFFAOYSA-N 1-[[4-chloro-8-(2-methyl-3-phenylanilino)-1,7-naphthyridin-3-yl]methyl]piperidine-2-carboxylic acid Chemical compound CC1=C(C=CC=C1NC1=NC=CC2=C(Cl)C(CN3CCCCC3C(O)=O)=CN=C12)C1=CC=CC=C1 VDJUOHRFRUIXDD-UHFFFAOYSA-N 0.000 description 2
- OTQIANDCURZNJU-UHFFFAOYSA-N 1-[[8-(2-methyl-3-phenylanilino)-1,7-naphthyridin-3-yl]methyl]piperidine-2-carboxylic acid Chemical compound CC1=C(C=CC=C1NC1=NC=CC2=CC(CN3CCCCC3C(O)=O)=CN=C12)C1=CC=CC=C1 OTQIANDCURZNJU-UHFFFAOYSA-N 0.000 description 2
- PDWPVFMFNAKOIU-UHFFFAOYSA-N 1-[[8-(2-methyl-3-phenylanilino)-1,7-naphthyridin-4-yl]methyl]piperidine-2-carboxylic acid Chemical compound CC1=C(C=CC=C1NC1=NC=CC2=C(CN3CCCCC3C(O)=O)C=CN=C12)C1=CC=CC=C1 PDWPVFMFNAKOIU-UHFFFAOYSA-N 0.000 description 2
- OSRRQUWJQWECFR-UHFFFAOYSA-N 1-[[8-(2-methyl-3-phenylanilino)quinolin-4-yl]methyl]piperidine-2-carboxylic acid Chemical compound CC1=C(C=CC=C1NC=1C=CC=C2C(=CC=NC=12)CN1C(CCCC1)C(=O)O)C1=CC=CC=C1 OSRRQUWJQWECFR-UHFFFAOYSA-N 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- RAXXELZNTBOGNW-UHFFFAOYSA-N 1H-imidazole Chemical compound C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 2
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 2
- UEJJHQNACJXSKW-UHFFFAOYSA-N 2-(2,6-dioxopiperidin-3-yl)-1H-isoindole-1,3(2H)-dione Chemical compound O=C1C2=CC=CC=C2C(=O)N1C1CCC(=O)NC1=O UEJJHQNACJXSKW-UHFFFAOYSA-N 0.000 description 2
- JUQSDLWOYKZYCB-UHFFFAOYSA-N 2-[[3-[(2-hydroxyethylamino)methyl]-1,7-naphthyridin-8-yl]amino]-6-phenylbenzonitrile Chemical compound OCCNCC1=CN=C2C(NC3=CC=CC(C4=CC=CC=C4)=C3C#N)=NC=CC2=C1 JUQSDLWOYKZYCB-UHFFFAOYSA-N 0.000 description 2
- LJTPFZPYMAAJOC-UHFFFAOYSA-N 2-[[4-chloro-8-(2-methyl-3-phenylanilino)-1,7-naphthyridin-3-yl]methylamino]ethanol Chemical compound CC1=C(C=CC=C1NC1=NC=CC2=C(Cl)C(CNCCO)=CN=C12)C1=CC=CC=C1 LJTPFZPYMAAJOC-UHFFFAOYSA-N 0.000 description 2
- OGQKKMFECOENRK-UHFFFAOYSA-N 2-[[4-methoxy-8-(2-methyl-3-phenylanilino)-1,7-naphthyridin-3-yl]methylamino]ethanol Chemical compound COC1=C2C=CN=C(NC3=CC=CC(=C3C)C3=CC=CC=C3)C2=NC=C1CNCCO OGQKKMFECOENRK-UHFFFAOYSA-N 0.000 description 2
- PISXMONKQHOZNA-UHFFFAOYSA-N 2-[[5-(2-methyl-3-phenylanilino)pyrido[3,4-b]pyrazin-2-yl]methylamino]ethanol Chemical compound CC1=C(C=CC=C1NC1=NC=CC=2C1=NC=C(N=2)CNCCO)C1=CC=CC=C1 PISXMONKQHOZNA-UHFFFAOYSA-N 0.000 description 2
- BGWSCKXNHVXXJI-UHFFFAOYSA-N 2-[[8-(2-methyl-3-phenylanilino)-1,7-naphthyridin-3-yl]methylamino]ethanol Chemical compound CC1=C(C=CC=C1NC1=NC=CC2=CC(CNCCO)=CN=C12)C1=CC=CC=C1 BGWSCKXNHVXXJI-UHFFFAOYSA-N 0.000 description 2
- NHGZPWFRCNWOMB-UHFFFAOYSA-N 2-[[8-(2-methyl-3-phenylanilino)quinolin-3-yl]methylamino]ethanol Chemical compound CC1=C(C=CC=C1NC=1C=CC=C2C=C(C=NC=12)CNCCO)C1=CC=CC=C1 NHGZPWFRCNWOMB-UHFFFAOYSA-N 0.000 description 2
- KQDZTYCYGBEXKI-UHFFFAOYSA-N 2-[[8-(2-methyl-3-phenylanilino)quinolin-4-yl]methylamino]ethanol Chemical compound CC1=C(C=CC=C1NC=1C=CC=C2C(=CC=NC=12)CNCCO)C1=CC=CC=C1 KQDZTYCYGBEXKI-UHFFFAOYSA-N 0.000 description 2
- PPQKPUYWWQXCHT-UHFFFAOYSA-N 2-[[8-(3-bromo-2-methylanilino)-1,7-naphthyridin-3-yl]methylamino]ethanol Chemical compound CC1=C(NC2=NC=CC3=CC(CNCCO)=CN=C23)C=CC=C1Br PPQKPUYWWQXCHT-UHFFFAOYSA-N 0.000 description 2
- ZALMCYSOPAIMMK-UHFFFAOYSA-N 2-amino-6-cyclohexylbenzonitrile Chemical compound NC1=C(C#N)C(=CC=C1)C1CCCCC1 ZALMCYSOPAIMMK-UHFFFAOYSA-N 0.000 description 2
- LMAIDQDTPOQJBC-UHFFFAOYSA-N 2-amino-6-phenylbenzonitrile Chemical compound NC1=CC=CC(C=2C=CC=CC=2)=C1C#N LMAIDQDTPOQJBC-UHFFFAOYSA-N 0.000 description 2
- WFJHXMHKPJWSIA-UHFFFAOYSA-N 2-chloro-N-(2-methyl-3-phenylphenyl)pyrido[3,4-b]pyrazin-5-amine Chemical compound ClC=1N=C2C(=NC=1)C(=NC=C2)NC=1C(=C(C=CC=1)C1=CC=CC=C1)C WFJHXMHKPJWSIA-UHFFFAOYSA-N 0.000 description 2
- ORWPNVRZTNXBIE-UHFFFAOYSA-N 2-cyclohexyl-6-[[3-[(2-hydroxyethylamino)methyl]-1,7-naphthyridin-8-yl]amino]benzonitrile Chemical compound C1(CCCCC1)C1=C(C#N)C(=CC=C1)NC=1N=CC=C2C=C(C=NC=12)CNCCO ORWPNVRZTNXBIE-UHFFFAOYSA-N 0.000 description 2
- UKNPLLPHRIAASA-UHFFFAOYSA-N 2-ethenyl-N-(2-methyl-3-phenylphenyl)pyrido[3,4-b]pyrazin-5-amine Chemical compound CC1=C(C=CC=C1NC1=NC=CC=2C1=NC=C(N=2)C=C)C1=CC=CC=C1 UKNPLLPHRIAASA-UHFFFAOYSA-N 0.000 description 2
- DSPVDMUXVYEYPP-UHFFFAOYSA-N 3-bromo-8-chloro-1,7-naphthyridine Chemical compound BrC1=CN=C2C(Cl)=NC=CC2=C1 DSPVDMUXVYEYPP-UHFFFAOYSA-N 0.000 description 2
- WHJPXKCFKJMNKT-UHFFFAOYSA-N 4,8-dichloro-1,7-naphthyridine Chemical compound N1=CC=C2C(Cl)=CC=NC2=C1Cl WHJPXKCFKJMNKT-UHFFFAOYSA-N 0.000 description 2
- FRLHWPHQQYNLMT-UHFFFAOYSA-N 4-(2-methyl-3-phenylanilino)pyrido[3,2-d]pyrimidine-7-carbaldehyde Chemical compound CC1=C(C=CC=C1NC=1C2=C(N=CN=1)C=C(C=N2)C=O)C1=CC=CC=C1 FRLHWPHQQYNLMT-UHFFFAOYSA-N 0.000 description 2
- PMMKGGOJFZLMLJ-UHFFFAOYSA-N 4-chloro-N-(2-methyl-3-phenylphenyl)-1,7-naphthyridin-8-amine Chemical compound CC1=C(C=CC=C1NC1=NC=CC2=C(Cl)C=CN=C12)C1=CC=CC=C1 PMMKGGOJFZLMLJ-UHFFFAOYSA-N 0.000 description 2
- XICJQUUUKOYCMI-UHFFFAOYSA-N 4-ethenyl-N-(2-methyl-3-phenylphenyl)-1,7-naphthyridin-8-amine Chemical compound CC1=C(C=CC=C1NC1=NC=CC2=C(C=C)C=CN=C12)C1=CC=CC=C1 XICJQUUUKOYCMI-UHFFFAOYSA-N 0.000 description 2
- JLPMDLXAIWGZPH-UHFFFAOYSA-N 4-methoxy-8-(2-methyl-3-phenylanilino)-1,7-naphthyridine-3-carbaldehyde Chemical compound COC1=C2C=CN=C(NC3=CC=CC(=C3C)C3=CC=CC=C3)C2=NC=C1C=O JLPMDLXAIWGZPH-UHFFFAOYSA-N 0.000 description 2
- 102100022464 5'-nucleotidase Human genes 0.000 description 2
- ONMGBDHAWFBDGU-UHFFFAOYSA-N 5-(2-methyl-3-phenylanilino)-1H-pyrido[3,4-b]pyrazin-2-one Chemical compound CC1=C(C=CC=C1NC1=NC=CC=2C1=NC=C(N=2)O)C1=CC=CC=C1 ONMGBDHAWFBDGU-UHFFFAOYSA-N 0.000 description 2
- OGZGLIYUABJKDY-UHFFFAOYSA-N 7-bromo-N-(2-methyl-3-phenylphenyl)pyrido[3,2-d]pyrimidin-4-amine Chemical compound BrC1=CC=2N=CN=C(C=2N=C1)NC=1C(=C(C=CC=1)C1=CC=CC=C1)C OGZGLIYUABJKDY-UHFFFAOYSA-N 0.000 description 2
- MJRMWQPAXNMPLU-UHFFFAOYSA-N 8-(2-methyl-3-phenylanilino)quinoline-3-carboxylic acid Chemical compound CC1=C(C=CC=C1NC=1C=CC=C2C=C(C=NC=12)C(=O)O)C1=CC=CC=C1 MJRMWQPAXNMPLU-UHFFFAOYSA-N 0.000 description 2
- WYJWDDNBYNHNPQ-UHFFFAOYSA-N 8-chloro-1,7-naphthyridine-3-carbaldehyde Chemical compound ClC1=NC=CC2=CC(C=O)=CN=C12 WYJWDDNBYNHNPQ-UHFFFAOYSA-N 0.000 description 2
- RUBAKWSVGRTJBW-UHFFFAOYSA-N 8-chloro-3-ethenyl-1,7-naphthyridine Chemical compound ClC1=NC=CC2=CC(C=C)=CN=C12 RUBAKWSVGRTJBW-UHFFFAOYSA-N 0.000 description 2
- 229930000680 A04AD01 - Scopolamine Natural products 0.000 description 2
- 241000235389 Absidia Species 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- 208000006400 Arbovirus Encephalitis Diseases 0.000 description 2
- 102000004452 Arginase Human genes 0.000 description 2
- 108700024123 Arginases Proteins 0.000 description 2
- 229940125565 BMS-986016 Drugs 0.000 description 2
- 241000193830 Bacillus <bacterium> Species 0.000 description 2
- 241000193738 Bacillus anthracis Species 0.000 description 2
- 101000840545 Bacillus thuringiensis L-isoleucine-4-hydroxylase Proteins 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 2
- 239000012388 BrettPhos 3rd generation precatalyst Substances 0.000 description 2
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 2
- 125000000041 C6-C10 aryl group Chemical group 0.000 description 2
- 241000222120 Candida <Saccharomycetales> Species 0.000 description 2
- 241000222122 Candida albicans Species 0.000 description 2
- 241000222178 Candida tropicalis Species 0.000 description 2
- ZEOWTGPWHLSLOG-UHFFFAOYSA-N Cc1ccc(cc1-c1ccc2c(n[nH]c2c1)-c1cnn(c1)C1CC1)C(=O)Nc1cccc(c1)C(F)(F)F Chemical compound Cc1ccc(cc1-c1ccc2c(n[nH]c2c1)-c1cnn(c1)C1CC1)C(=O)Nc1cccc(c1)C(F)(F)F ZEOWTGPWHLSLOG-UHFFFAOYSA-N 0.000 description 2
- 241000606161 Chlamydia Species 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 206010008631 Cholera Diseases 0.000 description 2
- 241000711573 Coronaviridae Species 0.000 description 2
- 241000709687 Coxsackievirus Species 0.000 description 2
- 201000007336 Cryptococcosis Diseases 0.000 description 2
- 241000221204 Cryptococcus neoformans Species 0.000 description 2
- RGSFGYAAUTVSQA-UHFFFAOYSA-N Cyclopentane Chemical compound C1CCCC1 RGSFGYAAUTVSQA-UHFFFAOYSA-N 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- ZBNZXTGUTAYRHI-UHFFFAOYSA-N Dasatinib Chemical compound C=1C(N2CCN(CCO)CC2)=NC(C)=NC=1NC(S1)=NC=C1C(=O)NC1=C(C)C=CC=C1Cl ZBNZXTGUTAYRHI-UHFFFAOYSA-N 0.000 description 2
- 241000725619 Dengue virus Species 0.000 description 2
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- 241001115402 Ebolavirus Species 0.000 description 2
- 241001466953 Echovirus Species 0.000 description 2
- 241000224432 Entamoeba histolytica Species 0.000 description 2
- 241000709661 Enterovirus Species 0.000 description 2
- 241000991587 Enterovirus C Species 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 102100031968 Ephrin type-B receptor 2 Human genes 0.000 description 2
- 102100023593 Fibroblast growth factor receptor 1 Human genes 0.000 description 2
- 101710182386 Fibroblast growth factor receptor 1 Proteins 0.000 description 2
- 102100023600 Fibroblast growth factor receptor 2 Human genes 0.000 description 2
- 101710182389 Fibroblast growth factor receptor 2 Proteins 0.000 description 2
- 102100027842 Fibroblast growth factor receptor 3 Human genes 0.000 description 2
- 101710182396 Fibroblast growth factor receptor 3 Proteins 0.000 description 2
- 102100027844 Fibroblast growth factor receptor 4 Human genes 0.000 description 2
- 241000710831 Flavivirus Species 0.000 description 2
- 102100039619 Granulocyte colony-stimulating factor Human genes 0.000 description 2
- 208000005176 Hepatitis C Diseases 0.000 description 2
- 208000005331 Hepatitis D Diseases 0.000 description 2
- 101000678236 Homo sapiens 5'-nucleotidase Proteins 0.000 description 2
- 101000917134 Homo sapiens Fibroblast growth factor receptor 4 Proteins 0.000 description 2
- 101001037256 Homo sapiens Indoleamine 2,3-dioxygenase 1 Proteins 0.000 description 2
- 101001055145 Homo sapiens Interleukin-2 receptor subunit beta Proteins 0.000 description 2
- 101000868279 Homo sapiens Leukocyte surface antigen CD47 Proteins 0.000 description 2
- 101001138062 Homo sapiens Leukocyte-associated immunoglobulin-like receptor 1 Proteins 0.000 description 2
- 101000831007 Homo sapiens T-cell immunoreceptor with Ig and ITIM domains Proteins 0.000 description 2
- 101000596234 Homo sapiens T-cell surface protein tactile Proteins 0.000 description 2
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 2
- 101000997835 Homo sapiens Tyrosine-protein kinase JAK1 Proteins 0.000 description 2
- 241000598436 Human T-cell lymphotropic virus Species 0.000 description 2
- 241000700588 Human alphaherpesvirus 1 Species 0.000 description 2
- 241000701024 Human betaherpesvirus 5 Species 0.000 description 2
- 241000725303 Human immunodeficiency virus Species 0.000 description 2
- STECJAGHUSJQJN-GAUPFVANSA-N Hyoscine Natural products C1([C@H](CO)C(=O)OC2C[C@@H]3N([C@H](C2)[C@@H]2[C@H]3O2)C)=CC=CC=C1 STECJAGHUSJQJN-GAUPFVANSA-N 0.000 description 2
- 102100026879 Interleukin-2 receptor subunit beta Human genes 0.000 description 2
- 241000701460 JC polyomavirus Species 0.000 description 2
- 102000002698 KIR Receptors Human genes 0.000 description 2
- 108010043610 KIR Receptors Proteins 0.000 description 2
- 241000588748 Klebsiella Species 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- 239000002067 L01XE06 - Dasatinib Substances 0.000 description 2
- 239000002144 L01XE18 - Ruxolitinib Substances 0.000 description 2
- 241000589248 Legionella Species 0.000 description 2
- 208000007764 Legionnaires' Disease Diseases 0.000 description 2
- 206010024238 Leptospirosis Diseases 0.000 description 2
- 102100032913 Leukocyte surface antigen CD47 Human genes 0.000 description 2
- 102100020943 Leukocyte-associated immunoglobulin-like receptor 1 Human genes 0.000 description 2
- 208000016604 Lyme disease Diseases 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- 241000711386 Mumps virus Species 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- STECJAGHUSJQJN-UHFFFAOYSA-N N-Methyl-scopolamin Natural products C1C(C2C3O2)N(C)C3CC1OC(=O)C(CO)C1=CC=CC=C1 STECJAGHUSJQJN-UHFFFAOYSA-N 0.000 description 2
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 2
- 125000000815 N-oxide group Chemical group 0.000 description 2
- 241000588653 Neisseria Species 0.000 description 2
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 2
- 241001631646 Papillomaviridae Species 0.000 description 2
- 208000037581 Persistent Infection Diseases 0.000 description 2
- 102100036052 Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit gamma isoform Human genes 0.000 description 2
- 101710096503 Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit gamma isoform Proteins 0.000 description 2
- 241000235645 Pichia kudriavzevii Species 0.000 description 2
- 206010035148 Plague Diseases 0.000 description 2
- 241000223810 Plasmodium vivax Species 0.000 description 2
- 241000233872 Pneumocystis carinii Species 0.000 description 2
- 241000125945 Protoparvovirus Species 0.000 description 2
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 2
- 241000711798 Rabies lyssavirus Species 0.000 description 2
- 241000235527 Rhizopus Species 0.000 description 2
- 241000606651 Rickettsiales Species 0.000 description 2
- 241000702670 Rotavirus Species 0.000 description 2
- 241000315672 SARS coronavirus Species 0.000 description 2
- 101001037255 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) Indoleamine 2,3-dioxygenase Proteins 0.000 description 2
- 241000607142 Salmonella Species 0.000 description 2
- 241000607720 Serratia Species 0.000 description 2
- 241000700584 Simplexvirus Species 0.000 description 2
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 2
- 230000005867 T cell response Effects 0.000 description 2
- 102100024834 T-cell immunoreceptor with Ig and ITIM domains Human genes 0.000 description 2
- 102100035268 T-cell surface protein tactile Human genes 0.000 description 2
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 2
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 2
- MUMGGOZAMZWBJJ-DYKIIFRCSA-N Testostosterone Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 MUMGGOZAMZWBJJ-DYKIIFRCSA-N 0.000 description 2
- 206010043376 Tetanus Diseases 0.000 description 2
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 2
- 241000223105 Trypanosoma brucei Species 0.000 description 2
- 241000223109 Trypanosoma cruzi Species 0.000 description 2
- 102100033438 Tyrosine-protein kinase JAK1 Human genes 0.000 description 2
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 2
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 description 2
- 241000607479 Yersinia pestis Species 0.000 description 2
- KQLUDRQROKPOBY-UHFFFAOYSA-N [4-chloro-8-(2-methyl-3-phenylanilino)-1,7-naphthyridin-3-yl]methanol Chemical compound CC1=C(C=CC=C1NC1=NC=CC2=C(Cl)C(CO)=CN=C12)C1=CC=CC=C1 KQLUDRQROKPOBY-UHFFFAOYSA-N 0.000 description 2
- DNEQEMMVFAGFOY-UHFFFAOYSA-N [8-(2-methyl-3-phenylanilino)quinolin-3-yl]methanol Chemical compound CC1=C(C=CC=C1NC=1C=CC=C2C=C(C=NC=12)CO)C1=CC=CC=C1 DNEQEMMVFAGFOY-UHFFFAOYSA-N 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 238000009098 adjuvant therapy Methods 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 150000001336 alkenes Chemical class 0.000 description 2
- 150000001350 alkyl halides Chemical class 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 description 2
- 125000003710 aryl alkyl group Chemical group 0.000 description 2
- 125000003725 azepanyl group Chemical group 0.000 description 2
- 210000003719 b-lymphocyte Anatomy 0.000 description 2
- 244000052616 bacterial pathogen Species 0.000 description 2
- YTKUWDBFDASYHO-UHFFFAOYSA-N bendamustine Chemical compound ClCCN(CCCl)C1=CC=C2N(C)C(CCCC(O)=O)=NC2=C1 YTKUWDBFDASYHO-UHFFFAOYSA-N 0.000 description 2
- 229960002707 bendamustine Drugs 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 125000004603 benzisoxazolyl group Chemical group O1N=C(C2=C1C=CC=C2)* 0.000 description 2
- 125000005605 benzo group Chemical group 0.000 description 2
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 2
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 2
- AKGGYBADQZYZPD-UHFFFAOYSA-N benzylacetone Chemical compound CC(=O)CCC1=CC=CC=C1 AKGGYBADQZYZPD-UHFFFAOYSA-N 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 229960002092 busulfan Drugs 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 235000014633 carbohydrates Nutrition 0.000 description 2
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 2
- YAYRGNWWLMLWJE-UHFFFAOYSA-L carboplatin Chemical compound O=C1O[Pt](N)(N)OC(=O)C11CCC1 YAYRGNWWLMLWJE-UHFFFAOYSA-L 0.000 description 2
- 229960004562 carboplatin Drugs 0.000 description 2
- BLMPQMFVWMYDKT-NZTKNTHTSA-N carfilzomib Chemical group C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)[C@]1(C)OC1)NC(=O)CN1CCOCC1)CC1=CC=CC=C1 BLMPQMFVWMYDKT-NZTKNTHTSA-N 0.000 description 2
- 229960002438 carfilzomib Drugs 0.000 description 2
- 108010021331 carfilzomib Proteins 0.000 description 2
- 125000003636 chemical group Chemical group 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- 125000004122 cyclic group Chemical group 0.000 description 2
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 description 2
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 229940127089 cytotoxic agent Drugs 0.000 description 2
- KWGRBVOPPLSCSI-UHFFFAOYSA-N d-ephedrine Natural products CNC(C)C(O)C1=CC=CC=C1 KWGRBVOPPLSCSI-UHFFFAOYSA-N 0.000 description 2
- 229960002448 dasatinib Drugs 0.000 description 2
- 230000003111 delayed effect Effects 0.000 description 2
- 210000004443 dendritic cell Anatomy 0.000 description 2
- 238000010511 deprotection reaction Methods 0.000 description 2
- 125000004431 deuterium atom Chemical group 0.000 description 2
- YVKBXDQXBUYRTM-UHFFFAOYSA-L dicyclohexyl(cyclopentyl)phosphane;iron;palladium(2+);dichloride Chemical compound [Cl-].[Cl-].[Fe].[Pd+2].C1CCCC1P(C1CCCCC1)C1CCCCC1.C1CCCC1P(C1CCCCC1)C1CCCCC1 YVKBXDQXBUYRTM-UHFFFAOYSA-L 0.000 description 2
- 125000000723 dihydrobenzofuranyl group Chemical group O1C(CC2=C1C=CC=C2)* 0.000 description 2
- 125000004852 dihydrofuranyl group Chemical group O1C(CC=C1)* 0.000 description 2
- 125000005043 dihydropyranyl group Chemical group O1C(CCC=C1)* 0.000 description 2
- USIUVYZYUHIAEV-UHFFFAOYSA-N diphenyl ether Chemical compound C=1C=CC=CC=1OC1=CC=CC=C1 USIUVYZYUHIAEV-UHFFFAOYSA-N 0.000 description 2
- 206010013023 diphtheria Diseases 0.000 description 2
- 208000037765 diseases and disorders Diseases 0.000 description 2
- 229960003668 docetaxel Drugs 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 239000012636 effector Substances 0.000 description 2
- 229940007078 entamoeba histolytica Drugs 0.000 description 2
- 239000012055 enteric layer Substances 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- 229960002179 ephedrine Drugs 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- MIXOXIZJLMWLFT-UHFFFAOYSA-N ethyl 4-chloro-8-(2-methyl-3-phenylanilino)-1,7-naphthyridine-3-carboxylate Chemical compound CCOC(=O)C1=CN=C2C(NC3=CC=CC(=C3C)C3=CC=CC=C3)=NC=CC2=C1Cl MIXOXIZJLMWLFT-UHFFFAOYSA-N 0.000 description 2
- VDIBEFAECLBGKD-UHFFFAOYSA-N ethyl 8-chloro-4-oxo-1h-1,7-naphthyridine-3-carboxylate Chemical compound ClC1=NC=CC2=C(O)C(C(=O)OCC)=CN=C21 VDIBEFAECLBGKD-UHFFFAOYSA-N 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 238000003818 flash chromatography Methods 0.000 description 2
- 229960000961 floxuridine Drugs 0.000 description 2
- ODKNJVUHOIMIIZ-RRKCRQDMSA-N floxuridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(F)=C1 ODKNJVUHOIMIIZ-RRKCRQDMSA-N 0.000 description 2
- 229910052731 fluorine Inorganic materials 0.000 description 2
- 244000053095 fungal pathogen Species 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 238000011194 good manufacturing practice Methods 0.000 description 2
- 208000005252 hepatitis A Diseases 0.000 description 2
- 208000002672 hepatitis B Diseases 0.000 description 2
- 125000004446 heteroarylalkyl group Chemical group 0.000 description 2
- 125000005885 heterocycloalkylalkyl group Chemical group 0.000 description 2
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 2
- 150000004677 hydrates Chemical class 0.000 description 2
- 229940031702 hydroxypropyl methylcellulose 2208 Drugs 0.000 description 2
- 229940121569 ieramilimab Drugs 0.000 description 2
- 238000003384 imaging method Methods 0.000 description 2
- 229960003685 imatinib mesylate Drugs 0.000 description 2
- YLMAHDNUQAMNNX-UHFFFAOYSA-N imatinib methanesulfonate Chemical compound CS(O)(=O)=O.C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 YLMAHDNUQAMNNX-UHFFFAOYSA-N 0.000 description 2
- 150000002466 imines Chemical class 0.000 description 2
- 210000000987 immune system Anatomy 0.000 description 2
- 230000036039 immunity Effects 0.000 description 2
- 238000010874 in vitro model Methods 0.000 description 2
- 230000001965 increasing effect Effects 0.000 description 2
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 2
- 125000001041 indolyl group Chemical group 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 229940079322 interferon Drugs 0.000 description 2
- 239000000543 intermediate Substances 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 2
- 229960004768 irinotecan Drugs 0.000 description 2
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 2
- 125000001786 isothiazolyl group Chemical group 0.000 description 2
- 125000000842 isoxazolyl group Chemical group 0.000 description 2
- HXEACLLIILLPRG-RXMQYKEDSA-N l-pipecolic acid Natural products OC(=O)[C@H]1CCCCN1 HXEACLLIILLPRG-RXMQYKEDSA-N 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 229960001320 lapatinib ditosylate Drugs 0.000 description 2
- 229960003881 letrozole Drugs 0.000 description 2
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 description 2
- 210000002540 macrophage Anatomy 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- QPJVMBTYPHYUOC-UHFFFAOYSA-N methyl benzoate Chemical compound COC(=O)C1=CC=CC=C1 QPJVMBTYPHYUOC-UHFFFAOYSA-N 0.000 description 2
- 238000003801 milling Methods 0.000 description 2
- 150000007522 mineralic acids Chemical class 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 125000002757 morpholinyl group Chemical group 0.000 description 2
- AZBFJBJXUQUQLF-UHFFFAOYSA-N n-(1,5-dimethylpyrrolidin-3-yl)pyrrolidine-1-carboxamide Chemical compound C1N(C)C(C)CC1NC(=O)N1CCCC1 AZBFJBJXUQUQLF-UHFFFAOYSA-N 0.000 description 2
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 150000002894 organic compounds Chemical class 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 239000012285 osmium tetroxide Substances 0.000 description 2
- 244000045947 parasite Species 0.000 description 2
- 230000001717 pathogenic effect Effects 0.000 description 2
- 239000008177 pharmaceutical agent Substances 0.000 description 2
- 229940124531 pharmaceutical excipient Drugs 0.000 description 2
- 229950010773 pidilizumab Drugs 0.000 description 2
- 125000004193 piperazinyl group Chemical group 0.000 description 2
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 2
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 2
- 108091006082 receptor inhibitors Proteins 0.000 description 2
- 238000001953 recrystallisation Methods 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 230000000241 respiratory effect Effects 0.000 description 2
- HFNKQEVNSGCOJV-OAHLLOKOSA-N ruxolitinib Chemical compound C1([C@@H](CC#N)N2N=CC(=C2)C=2C=3C=CNC=3N=CN=2)CCCC1 HFNKQEVNSGCOJV-OAHLLOKOSA-N 0.000 description 2
- 229960000215 ruxolitinib Drugs 0.000 description 2
- STECJAGHUSJQJN-FWXGHANASA-N scopolamine Chemical compound C1([C@@H](CO)C(=O)O[C@H]2C[C@@H]3N([C@H](C2)[C@@H]2[C@H]3O2)C)=CC=CC=C1 STECJAGHUSJQJN-FWXGHANASA-N 0.000 description 2
- 229960002646 scopolamine Drugs 0.000 description 2
- 238000007423 screening assay Methods 0.000 description 2
- 239000000741 silica gel Substances 0.000 description 2
- 229910002027 silica gel Inorganic materials 0.000 description 2
- 239000000377 silicon dioxide Substances 0.000 description 2
- 239000008247 solid mixture Substances 0.000 description 2
- 229950007213 spartalizumab Drugs 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 238000010189 synthetic method Methods 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 229940126625 tavolimab Drugs 0.000 description 2
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 2
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 2
- CXWXQJXEFPUFDZ-UHFFFAOYSA-N tetralin Chemical compound C1=CC=C2CCCCC2=C1 CXWXQJXEFPUFDZ-UHFFFAOYSA-N 0.000 description 2
- 125000003831 tetrazolyl group Chemical group 0.000 description 2
- 229960003433 thalidomide Drugs 0.000 description 2
- 238000011287 therapeutic dose Methods 0.000 description 2
- 238000004809 thin layer chromatography Methods 0.000 description 2
- 125000000101 thioether group Chemical group 0.000 description 2
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 2
- 238000011200 topical administration Methods 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 125000004306 triazinyl group Chemical group 0.000 description 2
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 2
- 229910052722 tritium Inorganic materials 0.000 description 2
- 230000004614 tumor growth Effects 0.000 description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 2
- 238000002255 vaccination Methods 0.000 description 2
- CXNIUSPIQKWYAI-UHFFFAOYSA-N xantphos Chemical compound C=12OC3=C(P(C=4C=CC=CC=4)C=4C=CC=CC=4)C=CC=C3C(C)(C)C2=CC=CC=1P(C=1C=CC=CC=1)C1=CC=CC=C1 CXNIUSPIQKWYAI-UHFFFAOYSA-N 0.000 description 2
- XRASPMIURGNCCH-UHFFFAOYSA-N zoledronic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CN1C=CN=C1 XRASPMIURGNCCH-UHFFFAOYSA-N 0.000 description 2
- 229960004276 zoledronic acid Drugs 0.000 description 2
- BMKDZUISNHGIBY-ZETCQYMHSA-N (+)-dexrazoxane Chemical compound C([C@H](C)N1CC(=O)NC(=O)C1)N1CC(=O)NC(=O)C1 BMKDZUISNHGIBY-ZETCQYMHSA-N 0.000 description 1
- XYLPKCDRAAYATL-OAHLLOKOSA-N (11S)-7-(3,5-dimethyl-1,2-oxazol-4-yl)-11-pyridin-2-yl-9-oxa-1,3-diazatricyclo[6.3.1.04,12]dodeca-4(12),5,7-trien-2-one Chemical compound CC1=NOC(C)=C1C1=CC=C2C3=C1OC[C@H](C=1N=CC=CC=1)N3C(=O)N2 XYLPKCDRAAYATL-OAHLLOKOSA-N 0.000 description 1
- FMCGSUUBYTWNDP-ONGXEEELSA-N (1R,2S)-2-(dimethylamino)-1-phenyl-1-propanol Chemical compound CN(C)[C@@H](C)[C@H](O)C1=CC=CC=C1 FMCGSUUBYTWNDP-ONGXEEELSA-N 0.000 description 1
- BXSMSABDFNJYGN-MNZWIYERSA-N (1R,5S,6R)-5-[2,6-difluoro-3-[(2-methoxypyrido[3,4-b]pyrazin-5-yl)amino]phenyl]-5-(fluoromethyl)-2-oxa-4-azabicyclo[4.1.0]hept-3-en-3-amine Chemical compound FC1=C(C(=CC=C1NC1=NC=CC=2C1=NC=C(N2)OC)F)[C@]2(N=C(O[C@@H]1C[C@H]21)N)CF BXSMSABDFNJYGN-MNZWIYERSA-N 0.000 description 1
- UKSZBOKPHAQOMP-SVLSSHOZSA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 UKSZBOKPHAQOMP-SVLSSHOZSA-N 0.000 description 1
- BXSMSABDFNJYGN-OUWCAGMASA-N (1s,2r,6s)-2-[2,6-difluoro-3-[(2-methoxypyrido[3,4-b]pyrazin-5-yl)amino]phenyl]-2-(fluoromethyl)-5-oxa-3-azabicyclo[4.1.0]hept-3-en-4-amine Chemical compound N1=C(N)O[C@H]2C[C@H]2[C@]1(CF)C1=C(F)C(NC=2C3=NC=C(N=C3C=CN=2)OC)=CC=C1F BXSMSABDFNJYGN-OUWCAGMASA-N 0.000 description 1
- SZUVGFMDDVSKSI-WIFOCOSTSA-N (1s,2s,3s,5r)-1-(carboxymethyl)-3,5-bis[(4-phenoxyphenyl)methyl-propylcarbamoyl]cyclopentane-1,2-dicarboxylic acid Chemical compound O=C([C@@H]1[C@@H]([C@](CC(O)=O)([C@H](C(=O)N(CCC)CC=2C=CC(OC=3C=CC=CC=3)=CC=2)C1)C(O)=O)C(O)=O)N(CCC)CC(C=C1)=CC=C1OC1=CC=CC=C1 SZUVGFMDDVSKSI-WIFOCOSTSA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- HUWCLPQJYLGZLG-DEOSSOPVSA-N (2S)-1-[[5-(2-methyl-3-phenylanilino)pyrido[3,4-b]pyrazin-2-yl]methyl]piperidine-2-carboxylic acid Chemical compound CC1=C(C=CC=C1NC1=NC=CC=2C1=NC=C(N=2)CN1[C@@H](CCCC1)C(=O)O)C1=CC=CC=C1 HUWCLPQJYLGZLG-DEOSSOPVSA-N 0.000 description 1
- GHYOCDFICYLMRF-UTIIJYGPSA-N (2S,3R)-N-[(2S)-3-(cyclopenten-1-yl)-1-[(2R)-2-methyloxiran-2-yl]-1-oxopropan-2-yl]-3-hydroxy-3-(4-methoxyphenyl)-2-[[(2S)-2-[(2-morpholin-4-ylacetyl)amino]propanoyl]amino]propanamide Chemical compound C1(=CCCC1)C[C@@H](C(=O)[C@@]1(OC1)C)NC([C@H]([C@@H](C1=CC=C(C=C1)OC)O)NC([C@H](C)NC(CN1CCOCC1)=O)=O)=O GHYOCDFICYLMRF-UTIIJYGPSA-N 0.000 description 1
- DNISEZBAYYIQFB-PHDIDXHHSA-N (2r,3r)-2,3-diacetyloxybutanedioic acid Chemical compound CC(=O)O[C@@H](C(O)=O)[C@H](C(O)=O)OC(C)=O DNISEZBAYYIQFB-PHDIDXHHSA-N 0.000 description 1
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 1
- YPBKTZBXSBLTDK-PKNBQFBNSA-N (3e)-3-[(3-bromo-4-fluoroanilino)-nitrosomethylidene]-4-[2-(sulfamoylamino)ethylamino]-1,2,5-oxadiazole Chemical compound NS(=O)(=O)NCCNC1=NON\C1=C(N=O)/NC1=CC=C(F)C(Br)=C1 YPBKTZBXSBLTDK-PKNBQFBNSA-N 0.000 description 1
- OMJKFYKNWZZKTK-POHAHGRESA-N (5z)-5-(dimethylaminohydrazinylidene)imidazole-4-carboxamide Chemical compound CN(C)N\N=C1/N=CN=C1C(N)=O OMJKFYKNWZZKTK-POHAHGRESA-N 0.000 description 1
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- XGQXULJHBWKUJY-LYIKAWCPSA-N (z)-but-2-enedioic acid;n-[2-(diethylamino)ethyl]-5-[(z)-(5-fluoro-2-oxo-1h-indol-3-ylidene)methyl]-2,4-dimethyl-1h-pyrrole-3-carboxamide Chemical compound OC(=O)\C=C/C(O)=O.CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C XGQXULJHBWKUJY-LYIKAWCPSA-N 0.000 description 1
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 1
- 125000005919 1,2,2-trimethylpropyl group Chemical group 0.000 description 1
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 1
- HJTAZXHBEBIQQX-UHFFFAOYSA-N 1,5-bis(chloromethyl)naphthalene Chemical compound C1=CC=C2C(CCl)=CC=CC2=C1CCl HJTAZXHBEBIQQX-UHFFFAOYSA-N 0.000 description 1
- VMLKTERJLVWEJJ-UHFFFAOYSA-N 1,5-naphthyridine Chemical compound C1=CC=NC2=CC=CN=C21 VMLKTERJLVWEJJ-UHFFFAOYSA-N 0.000 description 1
- VSOSXKMEQPYESP-UHFFFAOYSA-N 1,6-naphthyridine Chemical compound C1=CN=CC2=CC=CN=C21 VSOSXKMEQPYESP-UHFFFAOYSA-N 0.000 description 1
- MXBVNILGVJVVMH-UHFFFAOYSA-N 1,7-naphthyridine Chemical compound C1=NC=CC2=CC=CN=C21 MXBVNILGVJVVMH-UHFFFAOYSA-N 0.000 description 1
- FLBAYUMRQUHISI-UHFFFAOYSA-N 1,8-naphthyridine Chemical compound N1=CC=CC2=CC=CN=C21 FLBAYUMRQUHISI-UHFFFAOYSA-N 0.000 description 1
- UNILWMWFPHPYOR-KXEYIPSPSA-M 1-[6-[2-[3-[3-[3-[2-[2-[3-[[2-[2-[[(2r)-1-[[2-[[(2r)-1-[3-[2-[2-[3-[[2-(2-amino-2-oxoethoxy)acetyl]amino]propoxy]ethoxy]ethoxy]propylamino]-3-hydroxy-1-oxopropan-2-yl]amino]-2-oxoethyl]amino]-3-[(2r)-2,3-di(hexadecanoyloxy)propyl]sulfanyl-1-oxopropan-2-yl Chemical compound O=C1C(SCCC(=O)NCCCOCCOCCOCCCNC(=O)COCC(=O)N[C@@H](CSC[C@@H](COC(=O)CCCCCCCCCCCCCCC)OC(=O)CCCCCCCCCCCCCCC)C(=O)NCC(=O)N[C@H](CO)C(=O)NCCCOCCOCCOCCCNC(=O)COCC(N)=O)CC(=O)N1CCNC(=O)CCCCCN\1C2=CC=C(S([O-])(=O)=O)C=C2CC/1=C/C=C/C=C/C1=[N+](CC)C2=CC=C(S([O-])(=O)=O)C=C2C1 UNILWMWFPHPYOR-KXEYIPSPSA-M 0.000 description 1
- WBPWDDPSYSUQJA-VQTJNVASSA-N 1-[[4-(methoxymethyl)-4-[[[(1R,2S)-2-phenylcyclopropyl]amino]methyl]piperidin-1-yl]methyl]cyclobutane-1-carboxylic acid Chemical compound COCC1(CCN(CC1)CC1(CCC1)C(=O)O)CN[C@H]1[C@@H](C1)C1=CC=CC=C1 WBPWDDPSYSUQJA-VQTJNVASSA-N 0.000 description 1
- KKVYYGGCHJGEFJ-UHFFFAOYSA-N 1-n-(4-chlorophenyl)-6-methyl-5-n-[3-(7h-purin-6-yl)pyridin-2-yl]isoquinoline-1,5-diamine Chemical compound N=1C=CC2=C(NC=3C(=CC=CN=3)C=3C=4N=CNC=4N=CN=3)C(C)=CC=C2C=1NC1=CC=C(Cl)C=C1 KKVYYGGCHJGEFJ-UHFFFAOYSA-N 0.000 description 1
- RQEUFEKYXDPUSK-UHFFFAOYSA-N 1-phenylethylamine Chemical compound CC(N)C1=CC=CC=C1 RQEUFEKYXDPUSK-UHFFFAOYSA-N 0.000 description 1
- LFHLEABTNIQIQO-UHFFFAOYSA-N 1H-isoindole Chemical compound C1=CC=C2CN=CC2=C1 LFHLEABTNIQIQO-UHFFFAOYSA-N 0.000 description 1
- OBHCCORLMBZISY-UHFFFAOYSA-N 2,3-dimethylbutane-2,3-diol;ethenylboronic acid Chemical compound OB(O)C=C.CC(C)(O)C(C)(C)O OBHCCORLMBZISY-UHFFFAOYSA-N 0.000 description 1
- SSNMISUJOQAFRR-UHFFFAOYSA-N 2,6-naphthyridine Chemical compound N1=CC=C2C=NC=CC2=C1 SSNMISUJOQAFRR-UHFFFAOYSA-N 0.000 description 1
- ZHBPUONKWDNQRX-UHFFFAOYSA-N 2-(3-ethoxyprop-2-enyl)-2-ethylpropanedioic acid Chemical compound CCC(CC=COCC)(C(=O)O)C(=O)O ZHBPUONKWDNQRX-UHFFFAOYSA-N 0.000 description 1
- QNZFUMVTUFOLRT-UHFFFAOYSA-N 2-(cyclohexen-1-yl)-4,4,5,5-tetramethyl-1,3,2-dioxaborolane Chemical compound O1C(C)(C)C(C)(C)OB1C1=CCCCC1 QNZFUMVTUFOLRT-UHFFFAOYSA-N 0.000 description 1
- TVSSJSQXPQYVJM-UHFFFAOYSA-N 2-(cyclohexen-1-yl)-6-[[3-[(2-hydroxyethylamino)methyl]-1,7-naphthyridin-8-yl]amino]benzonitrile Chemical compound OCCNCC1=CN=C2C(C=CN=C2NC2=CC=CC(C3=CCCCC3)=C2C#N)=C1 TVSSJSQXPQYVJM-UHFFFAOYSA-N 0.000 description 1
- IFIPBXHQYNXVIU-UHFFFAOYSA-N 2-(n-benzylanilino)-2,2-dinitroacetic acid Chemical compound C=1C=CC=CC=1N(C(C(=O)O)([N+]([O-])=O)[N+]([O-])=O)CC1=CC=CC=C1 IFIPBXHQYNXVIU-UHFFFAOYSA-N 0.000 description 1
- QXLQZLBNPTZMRK-UHFFFAOYSA-N 2-[(dimethylamino)methyl]-1-(2,4-dimethylphenyl)prop-2-en-1-one Chemical compound CN(C)CC(=C)C(=O)C1=CC=C(C)C=C1C QXLQZLBNPTZMRK-UHFFFAOYSA-N 0.000 description 1
- KTBSXLIQKWEBRB-UHFFFAOYSA-N 2-[1-[1-[3-fluoro-2-(trifluoromethyl)pyridine-4-carbonyl]piperidin-4-yl]-3-[4-(7h-pyrrolo[2,3-d]pyrimidin-4-yl)pyrazol-1-yl]azetidin-3-yl]acetonitrile Chemical compound C1=CN=C(C(F)(F)F)C(F)=C1C(=O)N1CCC(N2CC(CC#N)(C2)N2N=CC(=C2)C=2C=3C=CNC=3N=CN=2)CC1 KTBSXLIQKWEBRB-UHFFFAOYSA-N 0.000 description 1
- RTQWWZBSTRGEAV-PKHIMPSTSA-N 2-[[(2s)-2-[bis(carboxymethyl)amino]-3-[4-(methylcarbamoylamino)phenyl]propyl]-[2-[bis(carboxymethyl)amino]propyl]amino]acetic acid Chemical compound CNC(=O)NC1=CC=C(C[C@@H](CN(CC(C)N(CC(O)=O)CC(O)=O)CC(O)=O)N(CC(O)=O)CC(O)=O)C=C1 RTQWWZBSTRGEAV-PKHIMPSTSA-N 0.000 description 1
- YMQKWYXWKRFGHG-UHFFFAOYSA-N 2-[[8-(2-methyl-3-phenylanilino)-1,7-naphthyridin-4-yl]methylamino]ethanol Chemical compound CC1=C(C=CC=C1NC1=NC=CC2=C(CNCCO)C=CN=C12)C1=CC=CC=C1 YMQKWYXWKRFGHG-UHFFFAOYSA-N 0.000 description 1
- LJLVJVZWMANIBX-UHFFFAOYSA-N 2-[[8-[3-(cyclohexen-1-yl)-2-methylanilino]-1,7-naphthyridin-3-yl]methylamino]ethanol Chemical compound CC1=C(NC2=NC=CC3=CC(CNCCO)=CN=C23)C=CC=C1C1=CCCCC1 LJLVJVZWMANIBX-UHFFFAOYSA-N 0.000 description 1
- IJXJGQCXFSSHNL-UHFFFAOYSA-N 2-amino-2-phenylethanol Chemical compound OCC(N)C1=CC=CC=C1 IJXJGQCXFSSHNL-UHFFFAOYSA-N 0.000 description 1
- GOJUJUVQIVIZAV-UHFFFAOYSA-N 2-amino-4,6-dichloropyrimidine-5-carbaldehyde Chemical group NC1=NC(Cl)=C(C=O)C(Cl)=N1 GOJUJUVQIVIZAV-UHFFFAOYSA-N 0.000 description 1
- ZKZYTSGUONPOPF-UHFFFAOYSA-N 2-amino-6-bromobenzonitrile Chemical compound NC1=CC=CC(Br)=C1C#N ZKZYTSGUONPOPF-UHFFFAOYSA-N 0.000 description 1
- KMGUEILFFWDGFV-UHFFFAOYSA-N 2-benzoyl-2-benzoyloxy-3-hydroxybutanedioic acid Chemical compound C=1C=CC=CC=1C(=O)C(C(C(O)=O)O)(C(O)=O)OC(=O)C1=CC=CC=C1 KMGUEILFFWDGFV-UHFFFAOYSA-N 0.000 description 1
- MEQBJJUWDCYIAB-UHFFFAOYSA-N 2-chloropyridin-3-amine Chemical compound NC1=CC=CN=C1Cl MEQBJJUWDCYIAB-UHFFFAOYSA-N 0.000 description 1
- PWOIYBVEDIFBEO-UHFFFAOYSA-N 2-chloropyridine-3,4-diamine Chemical compound NC1=CC=NC(Cl)=C1N PWOIYBVEDIFBEO-UHFFFAOYSA-N 0.000 description 1
- 125000000954 2-hydroxyethyl group Chemical group [H]C([*])([H])C([H])([H])O[H] 0.000 description 1
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 1
- TYEYBOSBBBHJIV-UHFFFAOYSA-M 2-oxobutanoate Chemical compound CCC(=O)C([O-])=O TYEYBOSBBBHJIV-UHFFFAOYSA-M 0.000 description 1
- VHMICKWLTGFITH-UHFFFAOYSA-N 2H-isoindole Chemical compound C1=CC=CC2=CNC=C21 VHMICKWLTGFITH-UHFFFAOYSA-N 0.000 description 1
- HCDMJFOHIXMBOV-UHFFFAOYSA-N 3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-ethyl-8-(morpholin-4-ylmethyl)-4,7-dihydropyrrolo[4,5]pyrido[1,2-d]pyrimidin-2-one Chemical compound C=1C2=C3N(CC)C(=O)N(C=4C(=C(OC)C=C(OC)C=4F)F)CC3=CN=C2NC=1CN1CCOCC1 HCDMJFOHIXMBOV-UHFFFAOYSA-N 0.000 description 1
- LKKMLIBUAXYLOY-UHFFFAOYSA-N 3-Amino-1-methyl-5H-pyrido[4,3-b]indole Chemical compound N1C2=CC=CC=C2C2=C1C=C(N)N=C2C LKKMLIBUAXYLOY-UHFFFAOYSA-N 0.000 description 1
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 1
- XAUDJQYHKZQPEU-KVQBGUIXSA-N 5-aza-2'-deoxycytidine Chemical compound O=C1N=C(N)N=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 XAUDJQYHKZQPEU-KVQBGUIXSA-N 0.000 description 1
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 1
- XKNAEESNEWODPQ-UHFFFAOYSA-N 5-chloro-1h-pyrido[3,4-b]pyrazin-2-one Chemical compound N1C(=O)C=NC2=C1C=CN=C2Cl XKNAEESNEWODPQ-UHFFFAOYSA-N 0.000 description 1
- WYWHKKSPHMUBEB-UHFFFAOYSA-N 6-Mercaptoguanine Natural products N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 1
- 125000006164 6-membered heteroaryl group Chemical group 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- VVIAGPKUTFNRDU-UHFFFAOYSA-N 6S-folinic acid Natural products C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-UHFFFAOYSA-N 0.000 description 1
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 1
- POZFSLLRNAMHBC-UHFFFAOYSA-N 7-bromo-4-chloropyrido[3,2-d]pyrimidine Chemical compound BrC1=CN=C2C(Cl)=NC=NC2=C1 POZFSLLRNAMHBC-UHFFFAOYSA-N 0.000 description 1
- JFQCWDLGMGABCH-UHFFFAOYSA-N 7-ethenyl-N-(2-methyl-3-phenylphenyl)pyrido[3,2-d]pyrimidin-4-amine Chemical compound CC1=C(C=CC=C1NC=1C2=C(N=CN=1)C=C(C=N2)C=C)C1=CC=CC=C1 JFQCWDLGMGABCH-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- JRKLRIAIMIKGHT-UHFFFAOYSA-N 8-bromoquinoline-4-carbaldehyde Chemical compound C1=CN=C2C(Br)=CC=CC2=C1C=O JRKLRIAIMIKGHT-UHFFFAOYSA-N 0.000 description 1
- SHGAZHPCJJPHSC-ZVCIMWCZSA-N 9-cis-retinoic acid Chemical compound OC(=O)/C=C(\C)/C=C/C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-ZVCIMWCZSA-N 0.000 description 1
- 101150107888 AKT2 gene Proteins 0.000 description 1
- ZKHQWZAMYRWXGA-KQYNXXCUSA-J ATP(4-) Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP([O-])(=O)OP([O-])(=O)OP([O-])([O-])=O)[C@@H](O)[C@H]1O ZKHQWZAMYRWXGA-KQYNXXCUSA-J 0.000 description 1
- 241000224424 Acanthamoeba sp. Species 0.000 description 1
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 1
- ZKHQWZAMYRWXGA-UHFFFAOYSA-N Adenosine triphosphate Natural products C1=NC=2C(N)=NC=NC=2N1C1OC(COP(O)(=O)OP(O)(=O)OP(O)(O)=O)C(O)C1O ZKHQWZAMYRWXGA-UHFFFAOYSA-N 0.000 description 1
- 101150051155 Akt3 gene Proteins 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 208000008822 Ankylosis Diseases 0.000 description 1
- BFYIZQONLCFLEV-DAELLWKTSA-N Aromasine Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC(=C)C2=C1 BFYIZQONLCFLEV-DAELLWKTSA-N 0.000 description 1
- 108010024976 Asparaginase Proteins 0.000 description 1
- 102000015790 Asparaginase Human genes 0.000 description 1
- 241000228212 Aspergillus Species 0.000 description 1
- 241001225321 Aspergillus fumigatus Species 0.000 description 1
- 241000228245 Aspergillus niger Species 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 108091008875 B cell receptors Proteins 0.000 description 1
- MLDQJTXFUGDVEO-UHFFFAOYSA-N BAY-43-9006 Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 MLDQJTXFUGDVEO-UHFFFAOYSA-N 0.000 description 1
- 102100035080 BDNF/NT-3 growth factors receptor Human genes 0.000 description 1
- 241000223848 Babesia microti Species 0.000 description 1
- 241000606125 Bacteroides Species 0.000 description 1
- 241001235572 Balantioides coli Species 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 1
- 241000335423 Blastomyces Species 0.000 description 1
- 241000228405 Blastomyces dermatitidis Species 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- 102000001805 Bromodomains Human genes 0.000 description 1
- 108050009021 Bromodomains Proteins 0.000 description 1
- JTLNMBDFXCKXBF-UHFFFAOYSA-N CC1=C(C=CC=C1NC2=CC=CC3=C(C=CN=C32)CN4CCCCC4)C5=CC=CC=C5 Chemical compound CC1=C(C=CC=C1NC2=CC=CC3=C(C=CN=C32)CN4CCCCC4)C5=CC=CC=C5 JTLNMBDFXCKXBF-UHFFFAOYSA-N 0.000 description 1
- SARGRRSVZHRXRZ-UHFFFAOYSA-N CCC(CC=CNC1=CC=CN=C1Cl)(C(O)=O)C(O)=O Chemical compound CCC(CC=CNC1=CC=CN=C1Cl)(C(O)=O)C(O)=O SARGRRSVZHRXRZ-UHFFFAOYSA-N 0.000 description 1
- 101100381481 Caenorhabditis elegans baz-2 gene Proteins 0.000 description 1
- 244000197813 Camelina sativa Species 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- 102000000844 Cell Surface Receptors Human genes 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 206010007953 Central nervous system lymphoma Diseases 0.000 description 1
- JWBOIMRXGHLCPP-UHFFFAOYSA-N Chloditan Chemical compound C=1C=CC=C(Cl)C=1C(C(Cl)Cl)C1=CC=C(Cl)C=C1 JWBOIMRXGHLCPP-UHFFFAOYSA-N 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 235000001258 Cinchona calisaya Nutrition 0.000 description 1
- 241000723346 Cinnamomum camphora Species 0.000 description 1
- PTOAARAWEBMLNO-KVQBGUIXSA-N Cladribine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PTOAARAWEBMLNO-KVQBGUIXSA-N 0.000 description 1
- 241000223205 Coccidioides immitis Species 0.000 description 1
- 241001478240 Coccus Species 0.000 description 1
- 244000060011 Cocos nucifera Species 0.000 description 1
- 206010056370 Congestive cardiomyopathy Diseases 0.000 description 1
- 241000223935 Cryptosporidium Species 0.000 description 1
- 241000295636 Cryptosporidium sp. Species 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- 101100481408 Danio rerio tie2 gene Proteins 0.000 description 1
- 201000004624 Dermatitis Diseases 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 201000010046 Dilated cardiomyopathy Diseases 0.000 description 1
- 241000199914 Dinophyceae Species 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 108010055196 EphA2 Receptor Proteins 0.000 description 1
- 108010055191 EphA3 Receptor Proteins 0.000 description 1
- 108010055334 EphB2 Receptor Proteins 0.000 description 1
- 102100030322 Ephrin type-A receptor 1 Human genes 0.000 description 1
- 102100030340 Ephrin type-A receptor 2 Human genes 0.000 description 1
- 102100030324 Ephrin type-A receptor 3 Human genes 0.000 description 1
- 102100031983 Ephrin type-B receptor 4 Human genes 0.000 description 1
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 229910052693 Europium Inorganic materials 0.000 description 1
- 108010007457 Extracellular Signal-Regulated MAP Kinases Proteins 0.000 description 1
- 108091008794 FGF receptors Proteins 0.000 description 1
- 101150009958 FLT4 gene Proteins 0.000 description 1
- JNCMHMUGTWEVOZ-UHFFFAOYSA-N F[CH]F Chemical compound F[CH]F JNCMHMUGTWEVOZ-UHFFFAOYSA-N 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 108010029961 Filgrastim Proteins 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 1
- VWUXBMIQPBEWFH-WCCTWKNTSA-N Fulvestrant Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3[C@H](CCCCCCCCCS(=O)CCCC(F)(F)C(F)(F)F)CC2=C1 VWUXBMIQPBEWFH-WCCTWKNTSA-N 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 241000224466 Giardia Species 0.000 description 1
- 241000224467 Giardia intestinalis Species 0.000 description 1
- 206010018364 Glomerulonephritis Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 108010069236 Goserelin Proteins 0.000 description 1
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 1
- 241000759872 Griselinia lucida Species 0.000 description 1
- 108010081348 HRT1 protein Hairy Proteins 0.000 description 1
- 102100021881 Hairy/enhancer-of-split related with YRPW motif protein 1 Human genes 0.000 description 1
- 102000002812 Heat-Shock Proteins Human genes 0.000 description 1
- 108010004889 Heat-Shock Proteins Proteins 0.000 description 1
- 102100035108 High affinity nerve growth factor receptor Human genes 0.000 description 1
- 241000228402 Histoplasma Species 0.000 description 1
- 241000228404 Histoplasma capsulatum Species 0.000 description 1
- 101000596896 Homo sapiens BDNF/NT-3 growth factors receptor Proteins 0.000 description 1
- 101000938354 Homo sapiens Ephrin type-A receptor 1 Proteins 0.000 description 1
- 101000596894 Homo sapiens High affinity nerve growth factor receptor Proteins 0.000 description 1
- 101001117317 Homo sapiens Programmed cell death 1 ligand 1 Proteins 0.000 description 1
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 1
- 101000932478 Homo sapiens Receptor-type tyrosine-protein kinase FLT3 Proteins 0.000 description 1
- 101000611183 Homo sapiens Tumor necrosis factor Proteins 0.000 description 1
- 101000997832 Homo sapiens Tyrosine-protein kinase JAK2 Proteins 0.000 description 1
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 1
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 1
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- XQFRJNBWHJMXHO-RRKCRQDMSA-N IDUR Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(I)=C1 XQFRJNBWHJMXHO-RRKCRQDMSA-N 0.000 description 1
- 238000004566 IR spectroscopy Methods 0.000 description 1
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 1
- XDXDZDZNSLXDNA-UHFFFAOYSA-N Idarubicin Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XDXDZDZNSLXDNA-UHFFFAOYSA-N 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 229940122245 Janus kinase inhibitor Drugs 0.000 description 1
- 206010023198 Joint ankylosis Diseases 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- HXEACLLIILLPRG-YFKPBYRVSA-N L-pipecolic acid Chemical compound [O-]C(=O)[C@@H]1CCCC[NH2+]1 HXEACLLIILLPRG-YFKPBYRVSA-N 0.000 description 1
- 239000005411 L01XE02 - Gefitinib Substances 0.000 description 1
- 239000005551 L01XE03 - Erlotinib Substances 0.000 description 1
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 1
- 239000005511 L01XE05 - Sorafenib Substances 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 241000222727 Leishmania donovani Species 0.000 description 1
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 1
- 240000007472 Leucaena leucocephala Species 0.000 description 1
- 108010000817 Leuprolide Proteins 0.000 description 1
- HLFSDGLLUJUHTE-SNVBAGLBSA-N Levamisole Chemical compound C1([C@H]2CN3CCSC3=N2)=CC=CC=C1 HLFSDGLLUJUHTE-SNVBAGLBSA-N 0.000 description 1
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 1
- 241000712899 Lymphocytic choriomeningitis mammarenavirus Species 0.000 description 1
- 229940123628 Lysine (K)-specific demethylase 1A inhibitor Drugs 0.000 description 1
- 102000001291 MAP Kinase Kinase Kinase Human genes 0.000 description 1
- 102000043136 MAP kinase family Human genes 0.000 description 1
- 108091054455 MAP kinase family Proteins 0.000 description 1
- 108060006687 MAP kinase kinase kinase Proteins 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 102000007557 Melanoma-Specific Antigens Human genes 0.000 description 1
- 108010071463 Melanoma-Specific Antigens Proteins 0.000 description 1
- 102000000440 Melanoma-associated antigen Human genes 0.000 description 1
- 108050008953 Melanoma-associated antigen Proteins 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- 229920003091 Methocel™ Polymers 0.000 description 1
- 229920003094 Methocel™ K4M Polymers 0.000 description 1
- QXKHYNVANLEOEG-UHFFFAOYSA-N Methoxsalen Chemical compound C1=CC(=O)OC2=C1C=C1C=COC1=C2OC QXKHYNVANLEOEG-UHFFFAOYSA-N 0.000 description 1
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 1
- 241000235388 Mucorales Species 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 101100381978 Mus musculus Braf gene Proteins 0.000 description 1
- 101100481410 Mus musculus Tek gene Proteins 0.000 description 1
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 1
- FMCGSUUBYTWNDP-UHFFFAOYSA-N N-Methylephedrine Natural products CN(C)C(C)C(O)C1=CC=CC=C1 FMCGSUUBYTWNDP-UHFFFAOYSA-N 0.000 description 1
- 150000001204 N-oxides Chemical class 0.000 description 1
- 102000003945 NF-kappa B Human genes 0.000 description 1
- 108010057466 NF-kappa B Proteins 0.000 description 1
- 102100029166 NT-3 growth factor receptor Human genes 0.000 description 1
- 101150117329 NTRK3 gene Proteins 0.000 description 1
- 241000224438 Naegleria fowleri Species 0.000 description 1
- 238000006411 Negishi coupling reaction Methods 0.000 description 1
- 235000007413 Nigella arvensis Nutrition 0.000 description 1
- 244000090896 Nigella sativa Species 0.000 description 1
- 235000016698 Nigella sativa Nutrition 0.000 description 1
- 241001126259 Nippostrongylus brasiliensis Species 0.000 description 1
- 102000007607 Non-Receptor Type 11 Protein Tyrosine Phosphatase Human genes 0.000 description 1
- 108010032107 Non-Receptor Type 11 Protein Tyrosine Phosphatase Proteins 0.000 description 1
- 102000002001 Non-Receptor Type 6 Protein Tyrosine Phosphatase Human genes 0.000 description 1
- 108010015793 Non-Receptor Type 6 Protein Tyrosine Phosphatase Proteins 0.000 description 1
- YGACXVRLDHEXKY-WXRXAMBDSA-N O[C@H](C[C@H]1c2c(cccc2F)-c2cncn12)[C@H]1CC[C@H](O)CC1 Chemical compound O[C@H](C[C@H]1c2c(cccc2F)-c2cncn12)[C@H]1CC[C@H](O)CC1 YGACXVRLDHEXKY-WXRXAMBDSA-N 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 229940124780 PI3K delta inhibitor Drugs 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 241001537205 Paracoccidioides Species 0.000 description 1
- 241000526686 Paracoccidioides brasiliensis Species 0.000 description 1
- 241001057811 Paracoccus <mealybug> Species 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical group [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 102000014750 Phosphorylase Kinase Human genes 0.000 description 1
- 108010064071 Phosphorylase Kinase Proteins 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 102000003923 Protein Kinase C Human genes 0.000 description 1
- 108090000315 Protein Kinase C Proteins 0.000 description 1
- 102000001892 Protein Kinase C-theta Human genes 0.000 description 1
- 108010015499 Protein Kinase C-theta Proteins 0.000 description 1
- 241000589517 Pseudomonas aeruginosa Species 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical group C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 1
- LOUPRKONTZGTKE-WZBLMQSHSA-N Quinine Natural products C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@@H]2[C@H](O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-WZBLMQSHSA-N 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 101100372762 Rattus norvegicus Flt1 gene Proteins 0.000 description 1
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 1
- 102100029986 Receptor tyrosine-protein kinase erbB-3 Human genes 0.000 description 1
- 101710100969 Receptor tyrosine-protein kinase erbB-3 Proteins 0.000 description 1
- 102100029981 Receptor tyrosine-protein kinase erbB-4 Human genes 0.000 description 1
- 101710100963 Receptor tyrosine-protein kinase erbB-4 Proteins 0.000 description 1
- 102100020718 Receptor-type tyrosine-protein kinase FLT3 Human genes 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 241000725643 Respiratory syncytial virus Species 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 241000710799 Rubella virus Species 0.000 description 1
- 229940124639 Selective inhibitor Drugs 0.000 description 1
- 244000000231 Sesamum indicum Species 0.000 description 1
- 229920001800 Shellac Polymers 0.000 description 1
- 241001149962 Sporothrix Species 0.000 description 1
- 241001149963 Sporothrix schenckii Species 0.000 description 1
- 241000191967 Staphylococcus aureus Species 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 238000006619 Stille reaction Methods 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 230000006044 T cell activation Effects 0.000 description 1
- 108091005729 TAM receptors Proteins 0.000 description 1
- 102000013530 TOR Serine-Threonine Kinases Human genes 0.000 description 1
- 108010065917 TOR Serine-Threonine Kinases Proteins 0.000 description 1
- NAVMQTYZDKMPEU-UHFFFAOYSA-N Targretin Chemical compound CC1=CC(C(CCC2(C)C)(C)C)=C2C=C1C(=C)C1=CC=C(C(O)=O)C=C1 NAVMQTYZDKMPEU-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 1
- FOCVUCIESVLUNU-UHFFFAOYSA-N Thiotepa Chemical compound C1CN1P(N1CC1)(=S)N1CC1 FOCVUCIESVLUNU-UHFFFAOYSA-N 0.000 description 1
- 241000223996 Toxoplasma Species 0.000 description 1
- 241000223997 Toxoplasma gondii Species 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 102100039094 Tyrosinase Human genes 0.000 description 1
- 108060008724 Tyrosinase Proteins 0.000 description 1
- 102100033444 Tyrosine-protein kinase JAK2 Human genes 0.000 description 1
- 108091008605 VEGF receptors Proteins 0.000 description 1
- 102000016663 Vascular Endothelial Growth Factor Receptor-3 Human genes 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- 206010047505 Visceral leishmaniasis Diseases 0.000 description 1
- PCWZKQSKUXXDDJ-UHFFFAOYSA-N Xanthotoxin Natural products COCc1c2OC(=O)C=Cc2cc3ccoc13 PCWZKQSKUXXDDJ-UHFFFAOYSA-N 0.000 description 1
- LNUFLCYMSVYYNW-ZPJMAFJPSA-N [(2r,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[[(3s,5s,8r,9s,10s,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-3-yl]oxy]-4,5-disulfo Chemical compound O([C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1C[C@@H]2CC[C@H]3[C@@H]4CC[C@@H]([C@]4(CC[C@@H]3[C@@]2(C)CC1)C)[C@H](C)CCCC(C)C)[C@H]1O[C@H](COS(O)(=O)=O)[C@@H](OS(O)(=O)=O)[C@H](OS(O)(=O)=O)[C@H]1OS(O)(=O)=O LNUFLCYMSVYYNW-ZPJMAFJPSA-N 0.000 description 1
- 241000222126 [Candida] glabrata Species 0.000 description 1
- XOCUXOWLYLLJLV-UHFFFAOYSA-N [O].[S] Chemical group [O].[S] XOCUXOWLYLLJLV-UHFFFAOYSA-N 0.000 description 1
- AIWRTTMUVOZGPW-HSPKUQOVSA-N abarelix Chemical compound C([C@@H](C(=O)N[C@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCNC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@H](C)C(N)=O)N(C)C(=O)[C@H](CO)NC(=O)[C@@H](CC=1C=NC=CC=1)NC(=O)[C@@H](CC=1C=CC(Cl)=CC=1)NC(=O)[C@@H](CC=1C=C2C=CC=CC2=CC=1)NC(C)=O)C1=CC=C(O)C=C1 AIWRTTMUVOZGPW-HSPKUQOVSA-N 0.000 description 1
- 229960002184 abarelix Drugs 0.000 description 1
- 108010023617 abarelix Proteins 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 229940081735 acetylcellulose Drugs 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000011149 active material Substances 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 125000003158 alcohol group Chemical group 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 108700025316 aldesleukin Proteins 0.000 description 1
- 229960005310 aldesleukin Drugs 0.000 description 1
- 229960000548 alemtuzumab Drugs 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001445 alitretinoin Drugs 0.000 description 1
- 125000004450 alkenylene group Chemical group 0.000 description 1
- 150000001345 alkine derivatives Chemical class 0.000 description 1
- 150000005215 alkyl ethers Chemical class 0.000 description 1
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 1
- 229960003459 allopurinol Drugs 0.000 description 1
- OFCNXPDARWKPPY-UHFFFAOYSA-N allopurinol Chemical compound OC1=NC=NC2=C1C=NN2 OFCNXPDARWKPPY-UHFFFAOYSA-N 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229960000473 altretamine Drugs 0.000 description 1
- 238000005576 amination reaction Methods 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 229960002932 anastrozole Drugs 0.000 description 1
- YBBLVLTVTVSKRW-UHFFFAOYSA-N anastrozole Chemical compound N#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1 YBBLVLTVTVSKRW-UHFFFAOYSA-N 0.000 description 1
- 239000004037 angiogenesis inhibitor Substances 0.000 description 1
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 1
- TZIHFWKZFHZASV-UHFFFAOYSA-N anhydrous methyl formate Natural products COC=O TZIHFWKZFHZASV-UHFFFAOYSA-N 0.000 description 1
- 229940121363 anti-inflammatory agent Drugs 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 230000006023 anti-tumor response Effects 0.000 description 1
- 229940124691 antibody therapeutics Drugs 0.000 description 1
- 229940041181 antineoplastic drug Drugs 0.000 description 1
- 238000003782 apoptosis assay Methods 0.000 description 1
- 239000008365 aqueous carrier Substances 0.000 description 1
- 239000012736 aqueous medium Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- GOLCXWYRSKYTSP-UHFFFAOYSA-N arsenic trioxide Inorganic materials O1[As]2O[As]1O2 GOLCXWYRSKYTSP-UHFFFAOYSA-N 0.000 description 1
- 229960002594 arsenic trioxide Drugs 0.000 description 1
- 150000001502 aryl halides Chemical class 0.000 description 1
- 125000000732 arylene group Chemical group 0.000 description 1
- 239000010425 asbestos Substances 0.000 description 1
- 229960003272 asparaginase Drugs 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-M asparaginate Chemical compound [O-]C(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-M 0.000 description 1
- 229940091771 aspergillus fumigatus Drugs 0.000 description 1
- 239000012131 assay buffer Substances 0.000 description 1
- 230000005784 autoimmunity Effects 0.000 description 1
- 229960002756 azacitidine Drugs 0.000 description 1
- 229960002170 azathioprine Drugs 0.000 description 1
- LMEKQMALGUDUQG-UHFFFAOYSA-N azathioprine Chemical compound CN1C=NC([N+]([O-])=O)=C1SC1=NC=NC2=C1NC=N2 LMEKQMALGUDUQG-UHFFFAOYSA-N 0.000 description 1
- 125000004567 azetidin-3-yl group Chemical group N1CC(C1)* 0.000 description 1
- 208000007456 balantidiasis Diseases 0.000 description 1
- 229950000971 baricitinib Drugs 0.000 description 1
- XUZMWHLSFXCVMG-UHFFFAOYSA-N baricitinib Chemical compound C1N(S(=O)(=O)CC)CC1(CC#N)N1N=CC(C=2C=3C=CNC=3N=CN=2)=C1 XUZMWHLSFXCVMG-UHFFFAOYSA-N 0.000 description 1
- WDIHJSXYQDMJHN-UHFFFAOYSA-L barium chloride Chemical compound [Cl-].[Cl-].[Ba+2] WDIHJSXYQDMJHN-UHFFFAOYSA-L 0.000 description 1
- 230000037429 base substitution Effects 0.000 description 1
- UHOVQNZJYSORNB-UHFFFAOYSA-N benzene Substances C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 229960000397 bevacizumab Drugs 0.000 description 1
- 229960002938 bexarotene Drugs 0.000 description 1
- MUALRAIOVNYAIW-UHFFFAOYSA-N binap Chemical group C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 MUALRAIOVNYAIW-UHFFFAOYSA-N 0.000 description 1
- 238000010170 biological method Methods 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- IFVTZJHWGZSXFD-UHFFFAOYSA-N biphenylene Chemical group C1=CC=C2C3=CC=CC=C3C2=C1 IFVTZJHWGZSXFD-UHFFFAOYSA-N 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 238000010322 bone marrow transplantation Methods 0.000 description 1
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 1
- 125000005620 boronic acid group Chemical group 0.000 description 1
- 229960001467 bortezomib Drugs 0.000 description 1
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 230000005587 bubbling Effects 0.000 description 1
- BTANRVKWQNVYAZ-UHFFFAOYSA-N butan-2-ol Chemical compound CCC(C)O BTANRVKWQNVYAZ-UHFFFAOYSA-N 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 229960001714 calcium phosphate Drugs 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 239000000378 calcium silicate Substances 0.000 description 1
- 229910052918 calcium silicate Inorganic materials 0.000 description 1
- 229960003340 calcium silicate Drugs 0.000 description 1
- 235000012241 calcium silicate Nutrition 0.000 description 1
- OYACROKNLOSFPA-UHFFFAOYSA-N calcium;dioxido(oxo)silane Chemical compound [Ca+2].[O-][Si]([O-])=O OYACROKNLOSFPA-UHFFFAOYSA-N 0.000 description 1
- IVFYLRMMHVYGJH-PVPPCFLZSA-N calusterone Chemical compound C1C[C@]2(C)[C@](O)(C)CC[C@H]2[C@@H]2[C@@H](C)CC3=CC(=O)CC[C@]3(C)[C@H]21 IVFYLRMMHVYGJH-PVPPCFLZSA-N 0.000 description 1
- 229950009823 calusterone Drugs 0.000 description 1
- 229930008380 camphor Natural products 0.000 description 1
- 238000009566 cancer vaccine Methods 0.000 description 1
- 229940022399 cancer vaccine Drugs 0.000 description 1
- 229940095731 candida albicans Drugs 0.000 description 1
- 208000032343 candida glabrata infection Diseases 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- 125000002837 carbocyclic group Chemical group 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical compound OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 229940081733 cetearyl alcohol Drugs 0.000 description 1
- 229960005395 cetuximab Drugs 0.000 description 1
- 229960000541 cetyl alcohol Drugs 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 229960004630 chlorambucil Drugs 0.000 description 1
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 1
- LOUPRKONTZGTKE-UHFFFAOYSA-N cinchonine Natural products C1C(C(C2)C=C)CCN2C1C(O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-UHFFFAOYSA-N 0.000 description 1
- WCZVZNOTHYJIEI-UHFFFAOYSA-N cinnoline Chemical compound N1=NC=CC2=CC=CC=C21 WCZVZNOTHYJIEI-UHFFFAOYSA-N 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 229960002436 cladribine Drugs 0.000 description 1
- WDDPHFBMKLOVOX-AYQXTPAHSA-N clofarabine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@@H]1F WDDPHFBMKLOVOX-AYQXTPAHSA-N 0.000 description 1
- 229960000928 clofarabine Drugs 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 229940125773 compound 10 Drugs 0.000 description 1
- 229940125797 compound 12 Drugs 0.000 description 1
- 229940126543 compound 14 Drugs 0.000 description 1
- 229940126214 compound 3 Drugs 0.000 description 1
- 229940125898 compound 5 Drugs 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 239000012050 conventional carrier Substances 0.000 description 1
- 239000012059 conventional drug carrier Substances 0.000 description 1
- 229940028617 conventional vaccine Drugs 0.000 description 1
- 230000000139 costimulatory effect Effects 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- 238000006880 cross-coupling reaction Methods 0.000 description 1
- 125000002188 cycloheptatrienyl group Chemical group C1(=CC=CC=CC1)* 0.000 description 1
- 125000003678 cyclohexadienyl group Chemical group C1(=CC=CCC1)* 0.000 description 1
- SSJXIUAHEKJCMH-UHFFFAOYSA-N cyclohexane-1,2-diamine Chemical compound NC1CCCCC1N SSJXIUAHEKJCMH-UHFFFAOYSA-N 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000004186 cyclopropylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C1([H])[H] 0.000 description 1
- 229960000684 cytarabine Drugs 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 229960003901 dacarbazine Drugs 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- 229940018872 dalteparin sodium Drugs 0.000 description 1
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 1
- 229960000975 daunorubicin Drugs 0.000 description 1
- 229960003603 decitabine Drugs 0.000 description 1
- 210000001787 dendrite Anatomy 0.000 description 1
- 108010017271 denileukin diftitox Proteins 0.000 description 1
- 229960002923 denileukin diftitox Drugs 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 150000001975 deuterium Chemical group 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 229960000605 dexrazoxane Drugs 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- ZJULYDCRWUEPTK-UHFFFAOYSA-N dichloromethyl Chemical compound Cl[CH]Cl ZJULYDCRWUEPTK-UHFFFAOYSA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 125000000532 dioxanyl group Chemical group 0.000 description 1
- 230000006806 disease prevention Effects 0.000 description 1
- NYDXNILOWQXUOF-UHFFFAOYSA-L disodium;2-[[4-[2-(2-amino-4-oxo-1,7-dihydropyrrolo[2,3-d]pyrimidin-5-yl)ethyl]benzoyl]amino]pentanedioate Chemical compound [Na+].[Na+].C=1NC=2NC(N)=NC(=O)C=2C=1CCC1=CC=C(C(=O)NC(CCC([O-])=O)C([O-])=O)C=C1 NYDXNILOWQXUOF-UHFFFAOYSA-L 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- NOTIQUSPUUHHEH-UXOVVSIBSA-N dromostanolone propionate Chemical compound C([C@@H]1CC2)C(=O)[C@H](C)C[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H](OC(=O)CC)[C@@]2(C)CC1 NOTIQUSPUUHHEH-UXOVVSIBSA-N 0.000 description 1
- 229950004683 drostanolone propionate Drugs 0.000 description 1
- 238000007908 dry granulation Methods 0.000 description 1
- 210000001198 duodenum Anatomy 0.000 description 1
- 229960002224 eculizumab Drugs 0.000 description 1
- 239000008157 edible vegetable oil Substances 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 239000012156 elution solvent Substances 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 239000002702 enteric coating Substances 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 229950006370 epacadostat Drugs 0.000 description 1
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 1
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 1
- 229960001904 epirubicin Drugs 0.000 description 1
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 description 1
- 229960001433 erlotinib Drugs 0.000 description 1
- 229960001842 estramustine Drugs 0.000 description 1
- FRPJXPJMRWBBIH-RBRWEJTLSA-N estramustine Chemical compound ClCCN(CCCl)C(=O)OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 FRPJXPJMRWBBIH-RBRWEJTLSA-N 0.000 description 1
- GTEFIYMEQZHVDD-UHFFFAOYSA-N ethyl 8-bromoquinoline-3-carboxylate Chemical compound BrC1=CC=CC2=CC(C(=O)OCC)=CN=C21 GTEFIYMEQZHVDD-UHFFFAOYSA-N 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- LIQODXNTTZAGID-OCBXBXKTSA-N etoposide phosphate Chemical compound COC1=C(OP(O)(O)=O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 LIQODXNTTZAGID-OCBXBXKTSA-N 0.000 description 1
- 229960000752 etoposide phosphate Drugs 0.000 description 1
- OGPBJKLSAFTDLK-UHFFFAOYSA-N europium atom Chemical compound [Eu] OGPBJKLSAFTDLK-UHFFFAOYSA-N 0.000 description 1
- GWQVMPWSEVRGPY-UHFFFAOYSA-N europium cryptate Chemical compound [Eu+3].N=1C2=CC=CC=1CN(CC=1N=C(C=CC=1)C=1N=C(C3)C=CC=1)CC(N=1)=CC(C(=O)NCCN)=CC=1C(N=1)=CC(C(=O)NCCN)=CC=1CN3CC1=CC=CC2=N1 GWQVMPWSEVRGPY-UHFFFAOYSA-N 0.000 description 1
- 229960000255 exemestane Drugs 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- IVLVTNPOHDFFCJ-UHFFFAOYSA-N fentanyl citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C=1C=CC=CC=1N(C(=O)CC)C(CC1)CCN1CCC1=CC=CC=C1 IVLVTNPOHDFFCJ-UHFFFAOYSA-N 0.000 description 1
- 229960004207 fentanyl citrate Drugs 0.000 description 1
- 102000052178 fibroblast growth factor receptor activity proteins Human genes 0.000 description 1
- 229960004177 filgrastim Drugs 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000012054 flavored emulsion Substances 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000020375 flavoured syrup Nutrition 0.000 description 1
- 229960000390 fludarabine Drugs 0.000 description 1
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 125000003709 fluoroalkyl group Chemical group 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- VVIAGPKUTFNRDU-ABLWVSNPSA-N folinic acid Chemical compound C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-ABLWVSNPSA-N 0.000 description 1
- 235000008191 folinic acid Nutrition 0.000 description 1
- 239000011672 folinic acid Substances 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- WBJINCZRORDGAQ-UHFFFAOYSA-N formic acid ethyl ester Natural products CCOC=O WBJINCZRORDGAQ-UHFFFAOYSA-N 0.000 description 1
- 238000001640 fractional crystallisation Methods 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 229960002258 fulvestrant Drugs 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 description 1
- 229960002584 gefitinib Drugs 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 229940014259 gelatin Drugs 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 229960003297 gemtuzumab ozogamicin Drugs 0.000 description 1
- 229940085435 giardia lamblia Drugs 0.000 description 1
- YQEMORVAKMFKLG-UHFFFAOYSA-N glycerine monostearate Natural products CCCCCCCCCCCCCCCCCC(=O)OC(CO)CO YQEMORVAKMFKLG-UHFFFAOYSA-N 0.000 description 1
- SVUQHVRAGMNPLW-UHFFFAOYSA-N glycerol monostearate Natural products CCCCCCCCCCCCCCCCC(=O)OCC(O)CO SVUQHVRAGMNPLW-UHFFFAOYSA-N 0.000 description 1
- 229960003690 goserelin acetate Drugs 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- DMEGYFMYUHOHGS-UHFFFAOYSA-N heptamethylene Natural products C1CCCCCC1 DMEGYFMYUHOHGS-UHFFFAOYSA-N 0.000 description 1
- 229940022353 herceptin Drugs 0.000 description 1
- UBHWBODXJBSFLH-UHFFFAOYSA-N hexadecan-1-ol;octadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO.CCCCCCCCCCCCCCCCCCO UBHWBODXJBSFLH-UHFFFAOYSA-N 0.000 description 1
- UUVWYPNAQBNQJQ-UHFFFAOYSA-N hexamethylmelamine Chemical compound CN(C)C1=NC(N(C)C)=NC(N(C)C)=N1 UUVWYPNAQBNQJQ-UHFFFAOYSA-N 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- BKEMVGVBBDMHKL-VYFXDUNUSA-N histrelin acetate Chemical compound CC(O)=O.CC(O)=O.CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC(N=C1)=CN1CC1=CC=CC=C1 BKEMVGVBBDMHKL-VYFXDUNUSA-N 0.000 description 1
- 229960003911 histrelin acetate Drugs 0.000 description 1
- 239000008240 homogeneous mixture Substances 0.000 description 1
- 102000048776 human CD274 Human genes 0.000 description 1
- 102000048362 human PDCD1 Human genes 0.000 description 1
- 239000012051 hydrophobic carrier Substances 0.000 description 1
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 1
- 229960001001 ibritumomab tiuxetan Drugs 0.000 description 1
- 229960000908 idarubicin Drugs 0.000 description 1
- 229960001101 ifosfamide Drugs 0.000 description 1
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 1
- 159000000029 imidazo[1,2-b]thiazoles Chemical class 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 230000003308 immunostimulating effect Effects 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 238000005462 in vivo assay Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 229940047124 interferons Drugs 0.000 description 1
- 108010093036 interleukin receptors Proteins 0.000 description 1
- 102000002467 interleukin receptors Human genes 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000007914 intraventricular administration Methods 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000000555 isopropenyl group Chemical group [H]\C([H])=C(\*)C([H])([H])[H] 0.000 description 1
- 125000003253 isopropoxy group Chemical group [H]C([H])([H])C([H])(O*)C([H])([H])[H] 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- ZLVXBBHTMQJRSX-VMGNSXQWSA-N jdtic Chemical compound C1([C@]2(C)CCN(C[C@@H]2C)C[C@H](C(C)C)NC(=O)[C@@H]2NCC3=CC(O)=CC=C3C2)=CC=CC(O)=C1 ZLVXBBHTMQJRSX-VMGNSXQWSA-N 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 229960001375 lactose Drugs 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 229960001691 leucovorin Drugs 0.000 description 1
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 description 1
- 229960004338 leuprorelin Drugs 0.000 description 1
- 229960001614 levamisole Drugs 0.000 description 1
- 229920006008 lipopolysaccharide Polymers 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 239000011344 liquid material Substances 0.000 description 1
- 229940057995 liquid paraffin Drugs 0.000 description 1
- 239000012280 lithium aluminium hydride Substances 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 229960002247 lomustine Drugs 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 206010025135 lupus erythematosus Diseases 0.000 description 1
- 201000004792 malaria Diseases 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- RQZAXGRLVPAYTJ-GQFGMJRRSA-N megestrol acetate Chemical compound C1=C(C)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 RQZAXGRLVPAYTJ-GQFGMJRRSA-N 0.000 description 1
- 229960004296 megestrol acetate Drugs 0.000 description 1
- 229960000901 mepacrine Drugs 0.000 description 1
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- 229960004469 methoxsalen Drugs 0.000 description 1
- VSOVJRPUFDFCBO-UHFFFAOYSA-N methyl 1-[[4-(2-methyl-3-phenylanilino)pyrido[3,2-d]pyrimidin-7-yl]methyl]piperidine-2-carboxylate Chemical compound CC1=C(C=CC=C1NC=1C2=C(N=CN=1)C=C(C=N2)CN1C(CCCC1)C(=O)OC)C1=CC=CC=C1 VSOVJRPUFDFCBO-UHFFFAOYSA-N 0.000 description 1
- FGCKPNVPGHDOSD-UHFFFAOYSA-N methyl 1-[[4-chloro-8-(2-methyl-3-phenylanilino)-1,7-naphthyridin-3-yl]methyl]piperidine-2-carboxylate Chemical compound ClC1=C(C=NC2=C(N=CC=C12)NC=1C(=C(C=CC=1)C1=CC=CC=C1)C)CN1C(CCCC1)C(=O)OC FGCKPNVPGHDOSD-UHFFFAOYSA-N 0.000 description 1
- UNKSJPRPXQDRTL-UHFFFAOYSA-N methyl 1-[[8-(2-methyl-3-phenylanilino)-1,7-naphthyridin-3-yl]methyl]piperidine-2-carboxylate Chemical compound CC1=C(C=CC=C1NC=1N=CC=C2C=C(C=NC=12)CN1C(CCCC1)C(=O)OC)C1=CC=CC=C1 UNKSJPRPXQDRTL-UHFFFAOYSA-N 0.000 description 1
- DACDJQYZEFYJOG-UHFFFAOYSA-N methyl 1-[[8-(2-methyl-3-phenylanilino)-1,7-naphthyridin-4-yl]methyl]piperidine-2-carboxylate Chemical compound CC1=C(C=CC=C1NC=1N=CC=C2C(=CC=NC=12)CN1C(CCCC1)C(=O)OC)C1=CC=CC=C1 DACDJQYZEFYJOG-UHFFFAOYSA-N 0.000 description 1
- 229940095102 methyl benzoate Drugs 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- APCHKWZTSCBBJX-UHFFFAOYSA-N methyl piperidine-2-carboxylate;hydrochloride Chemical compound Cl.COC(=O)C1CCCCN1 APCHKWZTSCBBJX-UHFFFAOYSA-N 0.000 description 1
- URJDHFWXGWLHIZ-UHFFFAOYSA-N methyl pyridine-2-carboxylate;hydrochloride Chemical compound [Cl-].COC(=O)C1=CC=CC=[NH+]1 URJDHFWXGWLHIZ-UHFFFAOYSA-N 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 238000012737 microarray-based gene expression Methods 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 229960000350 mitotane Drugs 0.000 description 1
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 1
- 229960001156 mitoxantrone Drugs 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000012243 multiplex automated genomic engineering Methods 0.000 description 1
- BLCLNMBMMGCOAS-UHFFFAOYSA-N n-[1-[[1-[[1-[[1-[[1-[[1-[[1-[2-[(carbamoylamino)carbamoyl]pyrrolidin-1-yl]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-3-[(2-methylpropan-2-yl)oxy]-1-oxopropan-2-yl]amino]-3-(4-hydroxyphenyl)-1-oxopropan-2-yl]amin Chemical compound C1CCC(C(=O)NNC(N)=O)N1C(=O)C(CCCN=C(N)N)NC(=O)C(CC(C)C)NC(=O)C(COC(C)(C)C)NC(=O)C(NC(=O)C(CO)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C(CC=1NC=NC=1)NC(=O)C1NC(=O)CC1)CC1=CC=C(O)C=C1 BLCLNMBMMGCOAS-UHFFFAOYSA-N 0.000 description 1
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 1
- 125000004370 n-butenyl group Chemical group [H]\C([H])=C(/[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- AGVKXDPPPSLISR-UHFFFAOYSA-N n-ethylcyclohexanamine Chemical compound CCNC1CCCCC1 AGVKXDPPPSLISR-UHFFFAOYSA-N 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 229940073569 n-methylephedrine Drugs 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003506 n-propoxy group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])O* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 229960001133 nandrolone phenpropionate Drugs 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 210000000581 natural killer T-cell Anatomy 0.000 description 1
- 239000006199 nebulizer Substances 0.000 description 1
- IXOXBSCIXZEQEQ-UHTZMRCNSA-N nelarabine Chemical compound C1=NC=2C(OC)=NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@@H]1O IXOXBSCIXZEQEQ-UHTZMRCNSA-N 0.000 description 1
- 229960000801 nelarabine Drugs 0.000 description 1
- 238000009099 neoadjuvant therapy Methods 0.000 description 1
- 150000002825 nitriles Chemical class 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 125000006574 non-aromatic ring group Chemical group 0.000 description 1
- 125000002868 norbornyl group Chemical group C12(CCC(CC1)C2)* 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 244000309459 oncolytic virus Species 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 229940127084 other anti-cancer agent Drugs 0.000 description 1
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 1
- 229960001756 oxaliplatin Drugs 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- MUJIDPITZJWBSW-UHFFFAOYSA-N palladium(2+) Chemical compound [Pd+2] MUJIDPITZJWBSW-UHFFFAOYSA-N 0.000 description 1
- 229940046231 pamidronate Drugs 0.000 description 1
- WRUUGTRCQOWXEG-UHFFFAOYSA-N pamidronate Chemical compound NCCC(O)(P(O)(O)=O)P(O)(O)=O WRUUGTRCQOWXEG-UHFFFAOYSA-N 0.000 description 1
- 229960001972 panitumumab Drugs 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- HQQSBEDKMRHYME-UHFFFAOYSA-N pefloxacin mesylate Chemical compound [H+].CS([O-])(=O)=O.C1=C2N(CC)C=C(C(O)=O)C(=O)C2=CC(F)=C1N1CCN(C)CC1 HQQSBEDKMRHYME-UHFFFAOYSA-N 0.000 description 1
- 229960001744 pegaspargase Drugs 0.000 description 1
- 108010001564 pegaspargase Proteins 0.000 description 1
- 229960001373 pegfilgrastim Drugs 0.000 description 1
- 108010044644 pegfilgrastim Proteins 0.000 description 1
- 229960003349 pemetrexed disodium Drugs 0.000 description 1
- 125000003538 pentan-3-yl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 229960002340 pentostatin Drugs 0.000 description 1
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 1
- 238000003359 percent control normalization Methods 0.000 description 1
- 125000005004 perfluoroethyl group Chemical group FC(F)(F)C(F)(F)* 0.000 description 1
- 235000019271 petrolatum Nutrition 0.000 description 1
- 229930015704 phenylpropanoid Natural products 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- LFSXCDWNBUNEEM-UHFFFAOYSA-N phthalazine Chemical compound C1=NN=CC2=CC=CC=C21 LFSXCDWNBUNEEM-UHFFFAOYSA-N 0.000 description 1
- NJBFOOCLYDNZJN-UHFFFAOYSA-N pipobroman Chemical compound BrCCC(=O)N1CCN(C(=O)CCBr)CC1 NJBFOOCLYDNZJN-UHFFFAOYSA-N 0.000 description 1
- 229960000952 pipobroman Drugs 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 229910000160 potassium phosphate Inorganic materials 0.000 description 1
- 235000011009 potassium phosphates Nutrition 0.000 description 1
- LJCNRYVRMXRIQR-OLXYHTOASA-L potassium sodium L-tartrate Chemical compound [Na+].[K+].[O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O LJCNRYVRMXRIQR-OLXYHTOASA-L 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 208000016800 primary central nervous system lymphoma Diseases 0.000 description 1
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 1
- 229960000624 procarbazine Drugs 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000005522 programmed cell death Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 230000005588 protonation Effects 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- QJZUKDFHGGYHMC-UHFFFAOYSA-N pyridine-3-carbaldehyde Chemical compound O=CC1=CC=CN=C1 QJZUKDFHGGYHMC-UHFFFAOYSA-N 0.000 description 1
- 125000005344 pyridylmethyl group Chemical group [H]C1=C([H])C([H])=C([H])C(=N1)C([H])([H])* 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- GPKJTRJOBQGKQK-UHFFFAOYSA-N quinacrine Chemical compound C1=C(OC)C=C2C(NC(C)CCCN(CC)CC)=C(C=CC(Cl)=C3)C3=NC2=C1 GPKJTRJOBQGKQK-UHFFFAOYSA-N 0.000 description 1
- JWVCLYRUEFBMGU-UHFFFAOYSA-N quinazoline Chemical compound N1=CN=CC2=CC=CC=C21 JWVCLYRUEFBMGU-UHFFFAOYSA-N 0.000 description 1
- 229960000948 quinine Drugs 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- XSCHRSMBECNVNS-UHFFFAOYSA-N quinoxaline Chemical compound N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 description 1
- 125000004621 quinuclidinyl group Chemical group N12C(CC(CC1)CC2)* 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 229960000424 rasburicase Drugs 0.000 description 1
- 108010084837 rasburicase Proteins 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 229940044551 receptor antagonist Drugs 0.000 description 1
- 239000002464 receptor antagonist Substances 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000029058 respiratory gaseous exchange Effects 0.000 description 1
- 229910052895 riebeckite Inorganic materials 0.000 description 1
- 229960004641 rituximab Drugs 0.000 description 1
- 201000005404 rubella Diseases 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 239000012056 semi-solid material Substances 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 239000004208 shellac Substances 0.000 description 1
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 1
- 229940113147 shellac Drugs 0.000 description 1
- 235000013874 shellac Nutrition 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- BEOOHQFXGBMRKU-UHFFFAOYSA-N sodium cyanoborohydride Chemical compound [Na+].[B-]C#N BEOOHQFXGBMRKU-UHFFFAOYSA-N 0.000 description 1
- 235000011006 sodium potassium tartrate Nutrition 0.000 description 1
- 239000011343 solid material Substances 0.000 description 1
- 229960003787 sorafenib Drugs 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 238000002798 spectrophotometry method Methods 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 230000000707 stereoselective effect Effects 0.000 description 1
- 239000012058 sterile packaged powder Substances 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- 229960001796 sunitinib Drugs 0.000 description 1
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 229960001603 tamoxifen Drugs 0.000 description 1
- 238000002626 targeted therapy Methods 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- 229960004964 temozolomide Drugs 0.000 description 1
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 1
- 229960001278 teniposide Drugs 0.000 description 1
- 125000004213 tert-butoxy group Chemical group [H]C([H])([H])C(O*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- BPEWUONYVDABNZ-DZBHQSCQSA-N testolactone Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(OC(=O)CC4)[C@@H]4[C@@H]3CCC2=C1 BPEWUONYVDABNZ-DZBHQSCQSA-N 0.000 description 1
- 229960005353 testolactone Drugs 0.000 description 1
- 229960003604 testosterone Drugs 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 125000002813 thiocarbonyl group Chemical group *C(*)=S 0.000 description 1
- 229960001196 thiotepa Drugs 0.000 description 1
- 208000013077 thyroid gland carcinoma Diseases 0.000 description 1
- MNRILEROXIRVNJ-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=NC=N[C]21 MNRILEROXIRVNJ-UHFFFAOYSA-N 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 1
- 229960000303 topotecan Drugs 0.000 description 1
- 229960005026 toremifene Drugs 0.000 description 1
- XFCLJVABOIYOMF-QPLCGJKRSA-N toremifene Chemical compound C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 XFCLJVABOIYOMF-QPLCGJKRSA-N 0.000 description 1
- 229960005267 tositumomab Drugs 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- 229960001727 tretinoin Drugs 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- ZBZJXHCVGLJWFG-UHFFFAOYSA-N trichloromethyl(.) Chemical compound Cl[C](Cl)Cl ZBZJXHCVGLJWFG-UHFFFAOYSA-N 0.000 description 1
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- GBXQPDCOMJJCMJ-UHFFFAOYSA-M trimethyl-[6-(trimethylazaniumyl)hexyl]azanium;bromide Chemical compound [Br-].C[N+](C)(C)CCCCCC[N+](C)(C)C GBXQPDCOMJJCMJ-UHFFFAOYSA-M 0.000 description 1
- 230000005747 tumor angiogenesis Effects 0.000 description 1
- 230000004565 tumor cell growth Effects 0.000 description 1
- 238000009827 uniform distribution Methods 0.000 description 1
- 229940035893 uracil Drugs 0.000 description 1
- ZOCKGBMQLCSHFP-KQRAQHLDSA-N valrubicin Chemical compound O([C@H]1C[C@](CC2=C(O)C=3C(=O)C4=CC=CC(OC)=C4C(=O)C=3C(O)=C21)(O)C(=O)COC(=O)CCCC)[C@H]1C[C@H](NC(=O)C(F)(F)F)[C@H](O)[C@H](C)O1 ZOCKGBMQLCSHFP-KQRAQHLDSA-N 0.000 description 1
- 229960000653 valrubicin Drugs 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- GBABOYUKABKIAF-GHYRFKGUSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-GHYRFKGUSA-N 0.000 description 1
- 229960002066 vinorelbine Drugs 0.000 description 1
- WAEXFXRVDQXREF-UHFFFAOYSA-N vorinostat Chemical compound ONC(=O)CCCCCCC(=O)NC1=CC=CC=C1 WAEXFXRVDQXREF-UHFFFAOYSA-N 0.000 description 1
- 229960000237 vorinostat Drugs 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
- 238000005550 wet granulation Methods 0.000 description 1
- 238000001238 wet grinding Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 239000003871 white petrolatum Substances 0.000 description 1
- 238000010626 work up procedure Methods 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/38—Nitrogen atoms
- C07D215/40—Nitrogen atoms attached in position 8
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/4375—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a six-membered ring having nitrogen as a ring heteroatom, e.g. quinolizines, naphthyridines, berberine, vincamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/4985—Pyrazines or piperazines ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/10—Antimycotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
- A61P31/22—Antivirals for DNA viruses for herpes viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
- A61P33/06—Antimalarials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oncology (AREA)
- Virology (AREA)
- Communicable Diseases (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- Pulmonology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Hematology (AREA)
- Biotechnology (AREA)
- Cardiology (AREA)
- Diabetes (AREA)
- Obesity (AREA)
- Vascular Medicine (AREA)
- Urology & Nephrology (AREA)
- Heart & Thoracic Surgery (AREA)
- AIDS & HIV (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Quinoline Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
Abstract
本發明揭示式(I’)化合物、使用該等化合物作為免疫調節劑之方法及包含該等化合物之醫藥組合物。該等化合物可用於治療、預防或改善諸如癌症或感染等疾病或病症。
Description
本申請案係關於醫藥活性化合物。本發明提供化合物以及其組合物及使用方法。該等化合物調節PD-1/PD-L1蛋白/蛋白相互作用且可用於治療多種疾病,包括傳染病及癌症。
免疫系統在控制及消除諸如癌症等疾病方面起著重要作用。然而,癌症細胞通常形成多項策略來避開或阻抑免疫系統以有利於其生長。一種此類機制改變在免疫細胞上表現之共刺激及共抑制分子之表現(Postow等人,J. Clinical Oncology 2015, 1-9)。阻斷抑制性免疫檢查點(例如PD-1)之信號傳導已證實為有前景且有效之治療形式。
程序性細胞死亡受體-1 (PD-1) (亦稱為CD279)為在活化T細胞、自然殺手T細胞、B細胞及巨噬細胞上表現之細胞表面受體(Greenwald等人,Annu. Rev. Immunol 2005, 23:515-548;Okazaki及Honjo, Trends Immunol 2006, (4):195-201)。其充當固有負反饋系統以防止T細胞活化,進而降低自體免疫性且提高自我耐受性。此外,亦已知PD-1在阻抑如癌症及病毒感染等疾病中之抗原特異性T細胞反應方面起著關鍵作用(Sharpe等人,
Nat Immunol2007 8, 239-245;Postow等人,J. Clinical Oncol 2015, 1-9)。
PD-1之結構由以下各項組成:細胞外免疫球蛋白可變樣結構域,其後為跨膜區及細胞內結構域(Parry等人,Mol Cell Biol 2005, 9543-9553)。細胞內結構域含有兩個位於基於免疫受體酪胺酸之抑制基序及基於免疫受體酪胺酸之切換基序中之磷酸化位點,此表明PD-1負調控T細胞受體介導之信號。PD-1具有兩個配位體,即PD-L1及PD-L2 (Parry等人,Mol Cell Biol 2005, 9543-9553;Latchman等人,Nat Immunol 2001, 2, 261-268),且其表現模式不同。PD-L1蛋白在巨噬細胞及樹突狀細胞上因應脂多醣及GM-CSF處理以及在T細胞及B細胞上在T細胞受體及B細胞受體信號傳導時發生上調。PD-L1亦在幾乎所有的腫瘤細胞上高度表現,且該表現在IFN-γ處理後進一步增加(Iwai等人,PNAS2002, 99(19):12293-7;Blank等人,Cancer Res 2004, 64(3):1140-5)。實際上,已顯示腫瘤PD-L1表現狀況可預測多個腫瘤類型(Wang等人,Eur J Surg Oncol 2015;Huang等人,Oncol Rep 2015;Sabatier等人,Oncotarget 2015, 6(7): 5449-5464)。相比之下,PD-L2表現更受限且主要由樹突狀細胞表現(Nakae等人,J Immunol 2006, 177:566-73)。PD-1與其在T細胞上之配位體PD-L1及PD-L2之接合遞送某一信號,該信號抑制IL-2及IFN-γ產生以及在T細胞受體活化時誘導之細胞增殖(Carter等人,Eur J Immunol 2002, 32(3):634-43;Freeman等人,J Exp Med 2000, 192(7):1027-34)。該機制涉及募集SHP-2或SHP-1磷酸酶以抑制T細胞受體信號傳導,例如Syk及Lck磷酸化(Sharpe等人,Nat Immunol 2007, 8, 239-245)。PD-1信號傳導軸之活化亦減弱PKC-θ活化圈磷酸化,該PKC-θ活化圈磷酸化為活化NF-κB及AP1路徑及諸如IL-2、IFN-γ及TNF等細胞介素產生所必需(Sharpe等人,Nat Immunol 2007, 8, 239-245;Carter等人,Eur J Immunol 2002, 32(3):634-43;Freeman等人,J Exp Med 2000, 192(7):1027-34)。
來自臨床前動物研究之若干證據線索指示,PD-1及其配位體負調控免疫反應。已顯示PD-1缺失小鼠罹患狼瘡樣腎小球性腎炎及擴張型心肌病變(Nishimura等人,Immunity 1999, 11:141-151;Nishimura等人,Science 2001, 291:319-322)。使用LCMV慢性感染模型已顯示,PD-1/PD-L1相互作用抑制病毒特異性CD8 T細胞之效應物功能之活化、擴大及獲取(Barber等人,Nature 2006, 439, 682-7)。總而言之,該等資料支持旨在阻斷PD-1介導之抑制性信號傳導級聯以增大或「挽救」T細胞反應的治療方式之研發。因此,業內需要能阻斷PD-1/PD-L1蛋白/蛋白相互作用之新穎化合物。
本發明另外提供醫藥組合物,其包含本發明化合物或其醫藥學上可接受之鹽或立體異構物及至少一種醫藥學上可接受之載劑或賦形劑。
本發明另外提供調節或抑制PD-1/PD-L1蛋白/蛋白相互作用之方法,其包括向個體投與本發明化合物或其醫藥學上可接受之鹽或立體異構物。
本發明另外提供治療患者之疾病或病症之方法,其包括向患者投與治療有效量之本發明化合物或其醫藥學上可接受之鹽或立體異構物。
I.
化合物
本發明尤其提供式(I’)化合物:
(I’)
或其醫藥學上可接受之鹽或立體異構物,其中:
X
1為N或CR
1;
X
2為N或CR
2;
X
3為N或CR
3;
X
4為N或CR
4;
X
5為N或CR
5;
X
6為N或CR
6其中X
1、X
2及X
3不會同時為N;
其中X
4、X
5及X
6不會同時為N;
X
7為N或CR
8a;
X
8為N或CR
8b;
X
9為N或CR
8c;
Cy為C
6-10芳基、C
3-10環烷基、5至14員雜芳基或4至10員雜環烷基,其各自視情況經1至4個經獨立選擇之R
9取代基取代;
R
1、R
2、R
3、R
4、R
5、R
6及R
9各自獨立地選自H、鹵基、C
1-6烷基、C
2-6烯基、C
2-6炔基、C
1-6鹵烷基、C
1-6鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、CN、NO
2、OR
a、SR
a、NHOR
a、C(O)R
a、C(O)NR
aR
a、C(O)OR
a、OC(O)R
a、OC(O)NR
aR
a、NHR
a、NR
aR
a、NR
aC(O)R
a、NR
aC(O)OR
a、NR
aC(O)NR
aR
a、C(=NR
a)R
a、C(=NR
a)NR
aR
a、NR
aC(=NR
a)NR
aR
a、NR
aS(O)R
a、NR
aS(O)
2R
a、NR
aS(O)
2NR
aR
a、S(O)R
a、S(O)NR
aR
a、S(O)
2R
a及S(O)
2NR
aR
a,其中R
1、R
2、R
3、R
4、R
5、R
6及R
9之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個或4個R
b取代基取代;
R
7為鹵基、C
1-6烷基、C
2-6烯基、C
2-6炔基、C
1-6鹵烷基、C
1-6鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、CN、OR
11、SR
11、NH
2、NHR
11、NR
11R
11、NHOR
11、C(O)R
11、C(O)NR
11R
11、C(O)OR
11、OC(O)R
11、OC(O)NR
11R
11、NR
11C(O)R
11、NR
11C(O)OR
11、NR
11C(O)NR
11R
11、C(=NR
11)R
11、C(=NR
11)NR
11R
11、NR
11C(=NR
11)NR
11R
11、NR
11S(O)R
11、NR
11S(O)
2R
11、NR
11S(O)
2NR
11R
11、S(O)R
11、S(O)NR
11R
11、S(O)
2R
11及S(O)
2NR
11R
11,其中R
9及R
11之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
1-6鹵烷基、C
1-6鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個或3個R
b取代基取代;
每一R
11獨立地選自H、C
1-6烷基、C
1-6鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-,其中R
11之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個或3個經獨立選擇之R
b取代基取代;
R
8a、R
8b及R
8c各自獨立地選自H、C
1-4烷基、C
3-6環烷基、C
3-6環烷基-C
1-4烷基-、C
6-10芳基、C
6-10芳基-C
1-4烷基-、5-10員雜芳基、4-10員雜環烷基、(5-10員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、C
2-4烯基、C
2-4炔基、鹵基、CN、OR
10、C
1-4鹵烷基、C
1-4鹵烷氧基、NH
2、-NHR
10、-NR
10R
10、NHOR
10、C(O)R
10、C(O)NR
10R
10、C(O)OR
10、OC(O)R
10、OC(O)NR
10R
10、NR
10C(O)R
10、NR
10C(O)OR
10、NR
10C(O)NR
10R
10、C(=NR
10)R
10、C(=NR
10)NR
10R
10、NR
10C(=NR
10)NR
10R
10、NR
10S(O)R
10、NR
10S(O)
2R
10、NR
10S(O)
2NR
10R
10、S(O)R
10、S(O)NR
10R
10、S(O)
2R
10及S(O)
2NR
10R
10,其中每一R
10獨立地選自H、C
1-4烷基、C
2-4烯基、C
2-4炔基、C
1-4烷氧基、C
3-6環烷基、C
3-6環烷基-C
1-4烷基-、C
6-10芳基、C
6-10芳基-C
1-4烷基、5-10員雜芳基、4-10員雜環烷基、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-,其中R
8a、R
8b、R
8c及R
10之C
1-4烷基、C
2-4烯基、C
2-4炔基、C
1-4烷氧基、C
3-6環烷基、C
3-6環烷基-C
1-4烷基-、C
6-10芳基、C
6-10芳基-C
1-4烷基-、5-10員雜芳基、4-10員雜環烷基、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個或3個經獨立選擇之R
d取代基取代;
或兩個毗鄰R
9取代基與其所連接之原子一起形成稠合苯基環、稠合5至7員雜環烷基環、稠合5員或6員雜芳基環或稠合C
3-10環烷基環,其中稠合5至7員雜環烷基環及稠合5員或6員雜芳基環各自具有1-4個選自N、O及S之雜原子作為環成員,且其中稠合苯基環、稠合5至7員雜環烷基環、稠合5員或6員雜芳基環及稠合C
3-10環烷基環各自視情況經1個、2個或3個經獨立選擇之R
b取代基取代;
每一R
a獨立地選自H、CN、C
1-6烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-,其中R
a之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個、4個或5個R
d取代基取代;
每一R
d獨立地選自C
1-6烷基、C
1-6鹵烷基、鹵基、C
6-10芳基、5-10員雜芳基、C
3-10環烷基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、CN、NH
2、NHOR
e、OR
e、SR
e、C(O)R
e、C(O)NR
eR
e、C(O)OR
e、OC(O)R
e、OC(O)NR
eR
e、NHR
e、NR
eR
e、NR
eC(O)R
e、NR
eC(O)NR
eR
e、NR
eC(O)OR
e、C(=NR
e)NR
eR
e、NR
eC(=NR
e)NR
eR
e、NR
eC(=NOH)NR
eR
e、NR
eC(=NCN)NR
eR
e、S(O)R
e、S(O)NR
eR
e、S(O)
2R
e、NR
eS(O)
2R
e、NR
eS(O)
2NR
eR
e及S(O)
2NR
eR
e,其中R
d之C
1-6烷基、C
1-6鹵烷基、C
6-10芳基、5-10員雜芳基、C
3-10環烷基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1-3個經獨立選擇之R
h取代基取代;
每一R
b取代基獨立地選自鹵基、C
1-4烷基、C
1-4鹵烷基、C
1-4鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、CN、OH、NH
2、NO
2、NHOR
c、OR
c、SR
c、C(O)R
c、C(O)NR
cR
c、C(O)OR
c、OC(O)R
c、OC(O)NR
cR
c、C(=NR
c)NR
cR
c、NR
cC(=NR
c)NR
cR
c、NHR
c、NR
cR
c、NR
cC(O)R
c、NR
cC(O)OR
c、NR
cC(O)NR
cR
c、NR
cS(O)R
c、NR
cS(O)
2R
c、NR
cS(O)
2NR
cR
c、S(O)R
c、S(O)NR
cR
c、S(O)
2R
c或S(O)
2NR
cR
c;其中R
b之C
1-4烷基、C
1-4鹵烷基、C
1-4鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自進一步視情況經1-3個經獨立選擇之R
d取代基取代;
每一R
c獨立地選自H、C
1-6烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-,其中R
c之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個、4個或5個獨立地選自以下之R
f取代基取代:C
1-4烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、鹵基、CN、NHOR
g、OR
g、SR
g、C(O)R
g、C(O)NR
gR
g、C(O)OR
g、OC(O)R
g、OC(O)NR
gR
g、NHR
g、NR
gR
g、NR
gC(O)R
g、NR
gC(O)NR
gR
g、NR
gC(O)OR
g、C(=NR
g)NR
gR
g、NR
gC(=NR
g)NR
gR
g、S(O)R
g、S(O)NR
gR
g、S(O)
2R
g、NR
gS(O)
2R
g、NR
gS(O)
2NR
gR
g及S(O)
2NR
gR
g;其中R
f之C
1-4烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個、4個或5個獨立地選自以下之R
n取代基取代:C
1-4烷基、C
1-4鹵烷基、鹵基、CN、R
o、NHOR
o、OR
o、SR
o、C(O)R
o、C(O)NR
oR
o、C(O)OR
o、OC(O)R
o、OC(O)NR
oR
o、NHR
o、NR
oR
o、NR
oC(O)R
o、NR
oC(O)NR
oR
o、NR
oC(O)OR
o、C(=NR
o)NR
oR
o、NR
oC(=NR
o)NR
oR
o、S(O)R
o、S(O)NR
oR
o、S(O)
2R
o、NR
oS(O)
2R
o、NR
oS(O)
2NR
oR
o及S(O)
2NR
oR
o;
每一R
g獨立地選自H、C
1-6烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-,其中R
g之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1-3個獨立地選自以下之R
p取代基取代:C
1-6烷基、C
1-6鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、鹵基、CN、NHOR
r、OR
r、SR
r、C(O)R
r、C(O)NR
rR
r、C(O)OR
r、OC(O)R
r、OC(O)NR
rR
r、NHR
r、NR
rR
r、NR
rC(O)R
r、NR
rC(O)NR
rR
r、NR
rC(O)OR
r、C(=NR
r)NR
rR
r、NR
rC(=NR
r)NR
rR
r、NR
rC(=NOH)NR
rR
r、NR
rC(=NCN)NR
rR
r、S(O)R
r、S(O)NR
rR
r、S(O)
2R
r、NR
rS(O)
2R
r、NR
rS(O)
2NR
rR
r及S(O)
2NR
rR
r,其中R
p之C
1-6烷基、C
1-6鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-視情況經1個、2個或3個R
q取代基取代;
或任兩個R
a取代基與其所連接之氮原子一起形成4員、5員、6員、7員、8員、9員或10員雜環烷基,其視情況經1個、2個或3個獨立地選自以下之R
h取代基取代:C
1-6烷基、C
3-10環烷基、4-7員雜環烷基、C
6-10芳基、5-6員雜芳基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-6員雜芳基)-C
1-4烷基-、(4-7員雜環烷基)-C
1-4烷基-、C
1-6鹵烷基、C
2-6烯基、C
2-6炔基、鹵基、CN、OR
i、SR
i、NHOR
i、C(O)R
i、C(O)NR
iR
i、C(O)OR
i、OC(O)R
i、OC(O)NR
iR
i、NHR
i、NR
iR
i、NR
iC(O)R
i、NR
iC(O)NR
iR
i、NR
iC(O)OR
i、C(=NR
i)NR
iR
i、NR
iC(=NR
i)NR
iR
i、S(O)R
i、S(O)NR
iR
i、S(O)
2R
i、NR
iS(O)
2R
i、NR
iS(O)
2NR
iR
i及S(O)
2NR
iR
i,其中R
h之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
3-10環烷基、4-7員雜環烷基、C
6-10芳基、5-6員雜芳基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-6員雜芳基)-C
1-4烷基-及(4-7員雜環烷基)-C
1-4烷基-各自進一步視情況經1個、2個或3個獨立地選自以下之R
j取代基取代:C
3-6環烷基、C
6-10芳基、5或6員雜芳基、4-7員雜環烷基、C
2-4烯基、C
2-4炔基、鹵基、C
1-4烷基、C
1-4鹵烷基、CN、NHOR
k、OR
k、SR
k、C(O)R
k、C(O)NR
kR
k、C(O)OR
k、OC(O)R
k、OC(O)NR
kR
k、NHR
k、NR
kR
k、NR
kC(O)R
k、NR
kC(O)NR
kR
k、NR
kC(O)OR
k、C(=NR
k)NR
kR
k、NR
kC(=NR
k)NR
kR
k、S(O)R
k、S(O)NR
kR
k、S(O)
2R
k、NR
kS(O)
2R
k、NR
kS(O)
2NR
kR
k及S(O)
2NR
kR
k,其中R
j之C
1-4烷基、C
3-6環烷基、C
6-10芳基、5員或6員雜芳基、4-6員雜環烷基、C
2-4烯基、C
2-4炔基、C
1-4鹵烷基及C
1-4鹵烷氧基各自視情況經1個、2個或3個經獨立選擇之R
q取代基取代;或連接至4至10員雜環烷基之同一碳原子之兩個R
h基團與其所連接之碳原子一起形成C
3-6環烷基或具有1-2個選自O、N或S之雜原子作為環成員之4至6員雜環烷基;
或任兩個R
c取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
e取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
g取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
i取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
k取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
o取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;且
每一R
e、R
i、R
k、R
o或R
r獨立地選自H、C
1-4烷基、C
3-6環烷基、C
6-10芳基、5或6員雜芳基、4-7員雜環烷基、C
1-4鹵烷基、C
2-4烯基及C
2-4炔基,其中R
e、R
i、R
k、R
o或R
p之C
1-4烷基、C
3-6環烷基、C
6-10芳基、5或6員雜芳基、4-7員雜環烷基、C
2-4烯基及C
2-4炔基各自視情況經1個、2個或3個R
q取代基取代;
每一R
q獨立地選自OH、CN、-COOH、NH
2、鹵基、C
1-6鹵烷基、C
1-6烷基、C
1-6烷氧基、C
1-6烷基硫基、苯基、5-6員雜芳基、4-6員雜環烷基、C
3-6環烷基、NHR
12、NR
12R
12及C
1-4鹵烷氧基,其中R
q之C
1-6烷基、苯基、C
3-6環烷基、4-6員雜環烷基及5-6員雜芳基各自視情況經以下基團取代:鹵基、OH、CN、-COOH、NH
2、C
1-4烷基、C
1-4烷氧基、C
1-4鹵烷基、C
1-4鹵烷氧基、苯基、C
3-10環烷基、5-6員雜芳基及4-6員雜環烷基,且每一R
12獨立地為C
1-6烷基;
其限制條件為當X
8為CR
8b且X
7及X
9各自為N時,R
7不為NH
2;且
化合物不為(1R,5S,6R)-5-(2,6-二氟-3-((2-甲氧基吡啶并[3,4-b]吡嗪-5-基)胺基)苯基)-5-(氟甲基)-2-氧雜-4-氮雜二環[4.1.0]庚-3-烯-3-胺或(1S,5R,6S)-5-(2,6-二氟-3-((2-甲氧基吡啶并[3,4-b]吡嗪-5-基)胺基)苯基)-5-(氟甲基)-2-氧雜-4-氮雜二環[4.1.0]庚-3-烯-3-胺。
本發明提供式(I’)化合物或其醫藥學上可接受之鹽或立體異構物,其中:
X
1為N或CR
1;
X
2為N或CR
2;
X
3為N或CR
3;
X
4為N或CR
4;
X
5為N或CR
5;
X
6為N或CR
6其中X
1、X
2及X
3不會同時為N;
其中X
4、X
5及X
6不會同時為N;
X
7為N或CR
8a;
X
8為N或CR
8b;
X
9為N或CR
8c;
Cy為C
6-10芳基、C
3-10環烷基、5至14員雜芳基或4至10員雜環烷基,其各自視情況經1至4個經獨立選擇之R
9取代基取代;
R
1、R
2、R
3、R
4、R
5、R
6及R
9各自獨立地選自H、鹵基、C
1-6烷基、C
2-6烯基、C
2-6炔基、C
1-6鹵烷基、C
1-6鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、CN、NO
2、OR
a、SR
a、NHOR
a、C(O)R
a、C(O)NR
aR
a、C(O)OR
a、OC(O)R
a、OC(O)NR
aR
a、NHR
a、NR
aR
a、NR
aC(O)R
a、NR
aC(O)OR
a、NR
aC(O)NR
aR
a、C(=NR
a)R
a、C(=NR
a)NR
aR
a、NR
aC(=NR
a)NR
aR
a、NR
aS(O)R
a、NR
aS(O)
2R
a、NR
aS(O)
2NR
aR
a、S(O)R
a、S(O)NR
aR
a、S(O)
2R
a及S(O)
2NR
aR
a,其中R
1、R
2、R
3、R
4、R
5、R
6及R
9之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個或4個R
b取代基取代;
R
7為C
1-4烷基、鹵基、CN、OH、環丙基、C
2-4炔基、C
1-4烷氧基、C
1-4鹵烷基、C
1-4鹵烷氧基、NH
2、-NH-C
1-4烷基、-N(C
1-4烷基)
2、OR
11、NHOR
11、C(O)R
11、C(O)NR
11R
11、C(O)OR
11、OC(O)R
11、OC(O)NR
11R
11、NR
11C(O)R
11、NR
11C(O)OR
11、NR
11C(O)NR
11R
11、C(=NR
11)R
11、C(=NR
11)NR
11R
11、NR
11C(=NR
11)NR
11R
11、NR
11S(O)R
11、NR
11S(O)
2R
11、NR
11S(O)
2NR
11R
11、S(O)R
11、S(O)NR
11R
11、S(O)
2R
11及S(O)
2NR
11R
11,其中R
7之C
1-4烷基、環丙基、C
2-4炔基及C
1-4烷氧基各自視情況經1或2個鹵基、OH、CN或OCH
3取代基取代,且每一R
11獨立地選自H及視情況經1或2個鹵基、OH、CN或OCH
3取代之C
1-4烷基;
R
8a、R
8b及R
8c各自獨立地選自H、C
1-4烷基、C
3-6環烷基、C
2-4烯基、C
2-4炔基、鹵基、CN、OH、C
1-4烷氧基、C
1-4鹵烷基、C
1-4鹵烷氧基、NH
2、-NH-C
1-4烷基、-N(C
1-4烷基)
2、OR
10、NHOR
10、C(O)R
10、C(O)NR
10R
10、C(O)OR
10、OC(O)R
10、OC(O)NR
10R
10、NR
10C(O)R
10、NR
10C(O)OR
10、NR
10C(O)NR
10R
10、C(=NR
10)R
10、C(=NR
10)NR
10R
10、NR
10C(=NR
10)NR
10R
10、NR
10S(O)R
10、NR
10S(O)
2R
10、NR
10S(O)
2NR
10R
10、S(O)R
10、S(O)NR
10R
10、S(O)
2R
10及S(O)
2NR
10R
10,其中每一R
10獨立地為H或視情況經1或2個獨立地選自鹵基、OH、CN及C
1-4烷氧基之基團取代之C
1-4烷基,且其中R
8之C
1-4烷基、C
3-6環烷基、C
2-4烯基及C
2-4炔基各自視情況經1或2個獨立地選自以下之取代基取代:鹵基、OH、CN、C
1-4烷基及C
1-4烷氧基;
或兩個毗鄰R
9取代基與其所連接之碳原子一起形成稠合苯基環、稠合5至7員雜環烷基環、稠合5員或6員雜芳基環或稠合C
3-10環烷基環,其中稠合5至7員雜環烷基環及稠合5員或6員雜芳基環各自具有1-4個選自N、O及S之雜原子作為環成員,且其中稠合苯基環、稠合5至7員雜環烷基環、稠合5員或6員雜芳基環及稠合C
3-10環烷基環各自視情況經1或2個經獨立選擇之R
b取代基或1或2個經獨立選擇之R
q取代基取代;
每一R
a獨立地選自H、CN、C
1-6烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-,其中R
a之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個、4個或5個R
d取代基取代;
每一R
d獨立地選自C
1-4烷基、C
1-4鹵烷基、鹵基、C
3-10環烷基、4-10員雜環烷基、苯基、5員或6員雜芳基、CN、NH
2、NHOR
e、OR
e、SR
e、C(O)R
e、C(O)NR
eR
e、C(O)OR
e、OC(O)R
e、OC(O)NR
eR
e、NHR
e、NR
eR
e、NR
eC(O)R
e、NR
eC(O)NR
eR
e、NR
eC(O)OR
e、C(=NR
e)NR
eR
e、NR
eC(=NR
e)NR
eR
e、S(O)R
e、S(O)NR
eR
e、S(O)
2R
e、NR
eS(O)
2R
e、NR
eS(O)
2NR
eR
e及S(O)
2NR
eR
e,其中R
d之C
1-4烷基、C
3-10環烷基、苯基、5員或6員雜芳基及4-10員雜環烷基各自進一步視情況經1-3個經獨立選擇之R
q取代基取代;
每一R
b取代基獨立地選自鹵基、C
1-4烷基、C
1-4鹵烷基、C
1-4鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、CN、OH、NH
2、NO
2、NHOR
c、OR
c、SR
c、C(O)R
c、C(O)NR
cR
c、C(O)OR
c、OC(O)R
c、OC(O)NR
cR
c、C(=NR
c)NR
cR
c、NR
cC(=NR
c)NR
cR
c、NHR
c、NR
cR
c、NR
cC(O)R
c、NR
cC(O)OR
c、NR
cC(O)NR
cR
c、NR
cS(O)R
c、NR
cS(O)
2R
c、NR
cS(O)
2NR
cR
c、S(O)R
c、S(O)NR
cR
c、S(O)
2R
c或S(O)
2NR
cR
c;其中R
b之C
1-4烷基、C
1-4鹵烷基、C
1-4鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自進一步視情況經1-3個經獨立選擇之R
d取代基取代;
每一R
c獨立地選自H、C
1-6烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-,其中R
c之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個、4個或5個獨立地選自以下之R
f取代基取代:C
1-4烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、鹵基、CN、NHOR
g、OR
g、SR
g、C(O)R
g、C(O)NR
gR
g、C(O)OR
g、OC(O)R
g、OC(O)NR
gR
g、NHR
g、NR
gR
g、NR
gC(O)R
g、NR
gC(O)NR
gR
g、NR
gC(O)OR
g、C(=NR
g)NR
gR
g、NR
gC(=NR
g)NR
gR
g、S(O)R
g、S(O)NR
gR
g、S(O)
2R
g、NR
gS(O)
2R
g、NR
gS(O)
2NR
gR
g及S(O)
2NR
gR
g;其中R
f之C
1-4烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個、4個或5個獨立地選自以下之R
n取代基取代:C
1-4烷基、C
1-4鹵烷基、鹵基、CN、R
o、NHOR
o、OR
o、SR
o、C(O)R
o、C(O)NR
oR
o、C(O)OR
o、OC(O)R
o、OC(O)NR
oR
o、NHR
o、NR
oR
o、NR
oC(O)R
o、NR
oC(O)NR
oR
o、NR
oC(O)OR
o、C(=NR
o)NR
oR
o、NR
oC(=NR
o)NR
oR
o、S(O)R
o、S(O)NR
oR
o、S(O)
2R
o、NR
oS(O)
2R
o、NR
oS(O)
2NR
oR
o及S(O)
2NR
oR
o;
每一R
g獨立地選自H、C
1-6烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-,其中R
g之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1-3個經獨立選擇之R
p取代基取代;
或任兩個R
a取代基與其所連接之氮原子一起形成4員、5員、6員、7員、8員、9員或10員雜環烷基,其視情況經1個、2個或3個獨立地選自以下之R
h取代基取代:C
1-6烷基、C
3-10環烷基、4-7員雜環烷基、C
6-10芳基、5-6員雜芳基、C
3-10環烷基-C
1-4烷基-、(5-6員雜芳基)-C
1-4烷基-、(4-7員雜環烷基)-C
1-4烷基-、C
1-6鹵烷基、C
2-6烯基、C
2-6炔基、鹵基、CN、OR
i、SR
i、NHOR
i、C(O)R
i、C(O)NR
iR
i、C(O)OR
i、OC(O)R
i、OC(O)NR
iR
i、NHR
i、NR
iR
i、NR
iC(O)R
i、NR
iC(O)NR
iR
i、NR
iC(O)OR
i、C(=NR
i)NR
iR
i、NR
iC(=NR
i)NR
iR
i、S(O)R
i、S(O)NR
iR
i、S(O)
2R
i、NR
iS(O)
2R
i、NR
iS(O)
2NR
iR
i及S(O)
2NR
iR
i,其中R
h之C
1-6烷基、C
3-10環烷基、4-7員雜環烷基、C
6-10芳基、5-6員雜芳基、C
3-10環烷基-C
1-4烷基-、(5-6員雜芳基)-C
1-4烷基-及(4-7員雜環烷基)-C
1-4烷基-各自進一步視情況經1個、2個或3個獨立地選自以下之R
j取代基取代:C
3-6環烷基、C
6-10芳基、5或6員雜芳基、C
2-4烯基、C
2-4炔基、鹵基、C
1-4烷基、C
1-4鹵烷基、CN、NHOR
k、OR
k、SR
k、C(O)R
k、C(O)NR
kR
k、C(O)OR
k、OC(O)R
k、OC(O)NR
kR
k、NHR
k、NR
kR
k、NR
kC(O)R
k、NR
kC(O)NR
kR
k、NR
kC(O)OR
k、C(=NR
k)NR
kR
k、NR
kC(=NR
k)NR
kR
k、S(O)R
k、S(O)NR
kR
k、S(O)
2R
k、NR
kS(O)
2R
k、NR
kS(O)
2NR
kR
k及S(O)
2NR
kR
k;或連接至4至10員雜環烷基之同一碳原子之兩個R
h基團與其所連接之碳原子一起形成C
3-6環烷基或具有1-2個選自O、N或S之雜原子作為環成員之4至6員雜環烷基;
或任兩個R
c取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
e取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
g取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
i取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
k取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
o取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;且
每一R
e、R
i、R
k、R
o或R
p獨立地選自H、C
1-4烷基、C
3-6環烷基、C
6-10芳基、5或6員雜芳基、C
1-4鹵烷基、C
2-4烯基及C
2-4炔基,其中R
e、R
i、R
k、R
o或R
p之C
1-4烷基、C
3-6環烷基、C
6-10芳基、5或6員雜芳基、C
2-4烯基及C
2-4炔基各自視情況經1個、2個或3個R
q取代基取代;
每一R
q獨立地選自OH、CN、-COOH、NH
2、鹵基、C
1-6鹵烷基、C
1-6烷基、C
1-6烷氧基、C
1-6烷基硫基、苯基、5-6員雜芳基、4-6員雜環烷基、C
3-6環烷基、NHR
12、NR
12R
12及C
1-4鹵烷氧基,其中R
q之C
1-6烷基、苯基、C
3-6環烷基、4-6員雜環烷基及5-6員雜芳基各自視情況經以下基團取代:鹵基、OH、CN、-COOH、NH
2、C
1-4烷氧基、C
1-4鹵烷基、C
1-4鹵烷氧基、苯基、C
3-10環烷基及4-6員雜環烷基,且每一R
12獨立地為C
1-6烷基;
其限制條件為當X
8為CR
8b且X
7及X
9各自為N時,R
7不為NH
2;且
化合物不為(1R,5S,6R)-5-(2,6-二氟-3-((2-甲氧基吡啶并[3,4-b]吡嗪-5-基)胺基)苯基)-5-(氟甲基)-2-氧雜-4-氮雜二環[4.1.0]庚-3-烯-3-胺或(1S,5R,6S)-5-(2,6-二氟-3-((2-甲氧基吡啶并[3,4-b]吡嗪-5-基)胺基)苯基)-5-(氟甲基)-2-氧雜-4-氮雜二環[4.1.0]庚-3-烯-3-胺。
在式(I’)化合物之一些實施例中,Cy不為3-胺基-1-氟甲基-2-氧雜-4-氮雜二環[4.1.0]庚-3-烯-1-基。在一些情況下,當R
8a、R
8b或R
8c中之任一者為F時,Cy不為3-胺基-1-氟甲基-2-氧雜-4-氮雜二環[4.1.0]庚-3-烯-1-基。在一些情況下,當R
8a、R
8b或R
8c中之任一者為鹵基時,Cy不為3-胺基-1-氟甲基-2-氧雜-4-氮雜二環[4.1.0]庚-3-烯-1-基。在一些情況下,當R
7為F時,Cy不為3-胺基-1-氟甲基-2-氧雜-4-氮雜二環[4.1.0]庚-3-烯-1-基。在一些情況下,當R
7為鹵基時,Cy不為3-胺基-1-氟甲基-2-氧雜-4-氮雜二環[4.1.0]庚-3-烯-1-基。
在式(I’)化合物之一些實施例中,Cy為C
6-10芳基,其視情況經1至4個經獨立選擇之R
9取代基取代。在某些實施例中,Cy為苯基或萘基,其各自視情況經1至4個經獨立選擇之R
9取代基取代。在某些實施例中,Cy為苯基,其視情況經1至4個經獨立選擇之R
9取代基取代。在某些實施例中,Cy為未經取代之苯基。
在式(I’)化合物之一些實施例中,Cy為C
3-10環烷基,其視情況經1至4個經獨立選擇之R
9取代基取代。在某些實施例中,Cy為環丙基、環丁基、環戊基、環己基、環庚基或環辛基,其各自視情況經1至4個經獨立選擇之R
9取代基取代。
在式(I’)化合物之一些實施例中,Cy為5至14員雜芳基,其視情況經1至4個經獨立選擇之R
9取代基取代。在某些實施例中,Cy為吡啶基、嘧啶基、吡嗪基、嗒嗪基、三嗪基、吡咯基、吡唑基、吖唑基、噁唑基、噻唑基、咪唑基、呋喃基、苯硫基、喹啉基、異喹啉基、萘啶基、吲哚基、苯并苯硫基、苯并呋喃基、苯并異噁唑基、咪唑并[1,2-
b]噻唑基、嘌呤基、噻吩基、呋喃基、吡咯基、咪唑基、噻唑基、噁唑基、吡唑基、異噻唑基、異噁唑基、1,2,3-三唑基、四唑基、1,2,3-噻二唑基、1,2,3-噁二唑基、1,2,4-三唑基、1,2,4-噻二唑基、1,2,4-噁二唑基、1,3,4-三唑基、1,3,4-噻二唑基及1,3,4-噁二唑基,其各自視情況經1至4個經獨立選擇之R
9取代基取代。
在式(I’)化合物之一些實施例中,Cy為4至10員雜環烷基,其視情況經1至4個經獨立選擇之R
9取代基取代。在某些實施例中,Cy為氮雜環丁基、氮雜環庚基、二氫苯并呋喃基、二氫呋喃基、二氫哌喃基、嗎啉基、3-氧雜-9-氮雜螺[5.5]十一烷基、1-氧雜-8-氮雜螺[4.5]癸烷基、哌啶基、哌嗪基、側氧基哌嗪基、哌喃基、吡咯啶基、奎寧環基、四氫呋喃基、四氫哌喃基、1,2,3,4-四氫喹啉基、莨菪烷基、2,3-二氫-1,4-苯并二氧雜環己烯-6-基及硫嗎啉基,其各自視情況經1至4個經獨立選擇之R
9取代基取代。在一些實施例中,Cy為2,3-二氫-1,4-苯并二氧雜環己烯-6-基,其視情況經1至4個經獨立選擇之R
9取代基取代。在一些實施例中,Cy為未經取代之2,3-二氫-1,4-苯并二氧雜環己烯-6-基。
在式(I’)化合物之一些實施例中,X
7為CR
8a,X
8為CR
8b且X
9為CR
8c。在一些情況下,R
8a、R
8b及R
8c各自為H。
在式(I’)化合物之一些實施例中,X
7為CR
8a,X
8為N且X
9為N。在一些情況下,R
8a為H。
在式(I’)化合物之一些實施例中,X
7為CR
8a,X
8為N且X
9為CR
8c。在一些情況下,R
8a及R
8c各自為H。
在式(I’)化合物之一些實施例中,X
7為CR
8a,X
8為CR
8b且X
9為N。在一些情況下,R
8a及R
8c各自為H。
在式(I’)化合物之一些實施例中,X
7為N,X
8為CR
8b且X
9為CR
8c。在一些情況下,R
8a及R
8c各自為H。
在式(I’)化合物之一些實施例中,X
7為N,X
8為N且X
9為CR
8c。在一些情況下,R
8c為H。
在式(I’)化合物之一些實施例中,X
7為N,X
8為CR
8b且X
9為N。在一些情況下,R
8b為H。
在式(I’)化合物之一些實施例中,X
7、X
8及X
9各自為N。
在一些實施例中,本發明提供式(I)化合物:
(I)
或其醫藥學上可接受之鹽或立體異構物,其中:
X
1為N或CR
1;
X
2為N或CR
2;
X
3為N或CR
3;
X
4為N或CR
4;
X
5為N或CR
5;
X
6為N或CR
6其中X
1、X
2及X
3不會同時為N;
其中X
4、X
5及X
6不會同時為N;
R
1、R
2、R
3、R
4、R
5、R
6及R
9各自獨立地選自H、鹵基、C
1-6烷基、C
2-6烯基、C
2-6炔基、C
1-6鹵烷基、C
1-6鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、CN、NO
2、OR
a、SR
a、NHOR
a、C(O)R
a、C(O)NR
aR
a、C(O)OR
a、OC(O)R
a、OC(O)NR
aR
a、NHR
a、NR
aR
a、NR
aC(O)R
a、NR
aC(O)OR
a、NR
aC(O)NR
aR
a、C(=NR
a)R
a、C(=NR
a)NR
aR
a、NR
aC(=NR
a)NR
aR
a、NR
aS(O)R
a、NR
aS(O)
2R
a、NR
aS(O)
2NR
aR
a、S(O)R
a、S(O)NR
aR
a、S(O)
2R
a及S(O)
2NR
aR
a,其中R
1、R
2、R
3、R
4、R
5、R
6及R
9之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個或4個R
b取代基取代;
R
7為C
1-4烷基、鹵基、CN、OH、環丙基、C
2-4炔基、C
1-4烷氧基、C
1-4鹵烷基、C
1-4鹵烷氧基、NH
2、-NH-C
1-4烷基、-N(C
1-4烷基)
2、OR
11、NHOR
11、C(O)R
11、C(O)NR
11R
11、C(O)OR
11、OC(O)R
11、OC(O)NR
11R
11、NR
11C(O)R
11、NR
11C(O)OR
11、NR
11C(O)NR
11R
11、C(=NR
11)R
11、C(=NR
11)NR
11R
11、NR
11C(=NR
11)NR
11R
11、NR
11S(O)R
11、NR
11S(O)
2R
11、NR
11S(O)
2NR
11R
11、S(O)R
11、S(O)NR
11R
11、S(O)
2R
11及S(O)
2NR
11R
11,其中R
7之C
1-4烷基、環丙基、C
2-4炔基及C
1-4烷氧基各自視情況經1或2個鹵基、OH、CN或OCH
3取代基取代,且每一R
11獨立地選自H及視情況經1或2個鹵基、OH、CN或OCH
3取代之C
1-4烷基;
每一R
8獨立地選自H、C
1-4烷基、C
3-6環烷基、C
2-4烯基、C
2-4炔基、鹵基、CN、OH、C
1-4烷氧基、C
1-4鹵烷基、C
1-4鹵烷氧基、NH
2、-NH-C
1-4烷基、-N(C
1-4烷基)
2、OR
10、NHOR
10、C(O)R
10、C(O)NR
10R
10、C(O)OR
10、OC(O)R
10、OC(O)NR
10R
10、NR
10C(O)R
10、NR
10C(O)OR
10、NR
10C(O)NR
10R
10、C(=NR
10)R
10、C(=NR
10)NR
10R
10、NR
10C(=NR
10)NR
10R
10、NR
10S(O)R
10、NR
10S(O)
2R
10、NR
10S(O)
2NR
10R
10、S(O)R
10、S(O)NR
10R
10、S(O)
2R
10及S(O)
2NR
10R
10,其中每一R
10獨立地為H或視情況經1或2個獨立地選自鹵基、OH、CN及C
1-4烷氧基之基團取代之C
1-4烷基,且其中R
8之C
1-4烷基、C
3-6環烷基、C
2-4烯基及C
2-4炔基各自視情況經1或2個獨立地選自以下之取代基取代:鹵基、OH、CN、C
1-4烷基及C
1-4烷氧基;
或兩個毗鄰R
9取代基與其所連接之碳原子一起形成稠合苯基環、稠合5至7員雜環烷基環、稠合5員或6員雜芳基環或稠合C
3-10環烷基環,其中稠合5至7員雜環烷基環及稠合5員或6員雜芳基環各自具有1-4個選自N、O及S之雜原子作為環成員,且其中稠合苯基環、稠合5至7員雜環烷基環、稠合5員或6員雜芳基環及稠合C
3-10環烷基環各自視情況經1或2個經獨立選擇之R
q取代基或1或2個經獨立選擇之R
b取代基取代;
每一R
a獨立地選自H、CN、C
1-6烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-,其中R
a之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個、4個或5個R
d取代基取代;
每一R
d獨立地選自C
1-4烷基、C
1-4鹵烷基、鹵基、C
3-10環烷基、4-10員雜環烷基、苯基、5員或6員雜芳基、CN、NH
2、NHOR
e、OR
e、SR
e、C(O)R
e、C(O)NR
eR
e、C(O)OR
e、OC(O)R
e、OC(O)NR
eR
e、NHR
e、NR
eR
e、NR
eC(O)R
e、NR
eC(O)NR
eR
e、NR
eC(O)OR
e、C(=NR
e)NR
eR
e、NR
eC(=NR
e)NR
eR
e、S(O)R
e、S(O)NR
eR
e、S(O)
2R
e、NR
eS(O)
2R
e、NR
eS(O)
2NR
eR
e及S(O)
2NR
eR
e,其中R
d之C
1-4烷基、C
3-10環烷基、苯基、5員或6員雜芳基及4-10員雜環烷基各自進一步視情況經1-3個經獨立選擇之R
q取代基取代;
每一R
b取代基獨立地選自鹵基、C
1-4烷基、C
1-4鹵烷基、C
1-4鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、CN、OH、NH
2、NO
2、NHOR
c、OR
c、SR
c、C(O)R
c、C(O)NR
cR
c、C(O)OR
c、OC(O)R
c、OC(O)NR
cR
c、C(=NR
c)NR
cR
c、NR
cC(=NR
c)NR
cR
c、NHR
c、NR
cR
c、NR
cC(O)R
c、NR
cC(O)OR
c、NR
cC(O)NR
cR
c、NR
cS(O)R
c、NR
cS(O)
2R
c、NR
cS(O)
2NR
cR
c、S(O)R
c、S(O)NR
cR
c、S(O)
2R
c或S(O)
2NR
cR
c;其中R
b之C
1-4烷基、C
1-4鹵烷基、C
1-4鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自進一步視情況經1-3個經獨立選擇之R
d取代基取代;
每一R
c獨立地選自H、C
1-6烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-,其中R
c之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個、4個或5個獨立地選自以下之R
f取代基取代:C
1-4烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、鹵基、CN、NHOR
g、OR
g、SR
g、C(O)R
g、C(O)NR
gR
g、C(O)OR
g、OC(O)R
g、OC(O)NR
gR
g、NHR
g、NR
gR
g、NR
gC(O)R
g、NR
gC(O)NR
gR
g、NR
gC(O)OR
g、C(=NR
g)NR
gR
g、NR
gC(=NR
g)NR
gR
g、S(O)R
g、S(O)NR
gR
g、S(O)
2R
g、NR
gS(O)
2R
g、NR
gS(O)
2NR
gR
g及S(O)
2NR
gR
g;其中R
f之C
1-4烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個、4個或5個獨立地選自以下之R
n取代基取代:C
1-4烷基、C
1-4鹵烷基、鹵基、CN、R
o、NHOR
o、OR
o、SR
o、C(O)R
o、C(O)NR
oR
o、C(O)OR
o、OC(O)R
o、OC(O)NR
oR
o、NHR
o、NR
oR
o、NR
oC(O)R
o、NR
oC(O)NR
oR
o、NR
oC(O)OR
o、C(=NR
o)NR
oR
o、NR
oC(=NR
o)NR
oR
o、S(O)R
o、S(O)NR
oR
o、S(O)
2R
o、NR
oS(O)
2R
o、NR
oS(O)
2NR
oR
o及S(O)
2NR
oR
o;
每一R
g獨立地選自H、C
1-6烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-,其中R
g之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1-3個經獨立選擇之R
p取代基取代;
或任兩個R
a取代基與其所連接之氮原子一起形成4員、5員、6員、7員、8員、9員或10員雜環烷基,其視情況經1個、2個或3個獨立地選自以下之R
h取代基取代:C
1-6烷基、C
3-10環烷基、4-7員雜環烷基、C
6-10芳基、5-6員雜芳基、C
3-10環烷基-C
1-4烷基-、(5-6員雜芳基)-C
1-4烷基-、(4-7員雜環烷基)-C
1-4烷基-、C
1-6鹵烷基、C
2-6烯基、C
2-6炔基、鹵基、CN、OR
i、SR
i、NHOR
i、C(O)R
i、C(O)NR
iR
i、C(O)OR
i、OC(O)R
i、OC(O)NR
iR
i、NHR
i、NR
iR
i、NR
iC(O)R
i、NR
iC(O)NR
iR
i、NR
iC(O)OR
i、C(=NR
i)NR
iR
i、NR
iC(=NR
i)NR
iR
i、S(O)R
i、S(O)NR
iR
i、S(O)
2R
i、NR
iS(O)
2R
i、NR
iS(O)
2NR
iR
i及S(O)
2NR
iR
i,其中R
h之C
1-6烷基、C
3-10環烷基、4-7員雜環烷基、C
6-10芳基、5-6員雜芳基、C
3-10環烷基-C
1-4烷基-、(5-6員雜芳基)-C
1-4烷基-及(4-7員雜環烷基)-C
1-4烷基-各自進一步視情況經1個、2個或3個獨立地選自以下之R
j取代基取代:C
3-6環烷基、C
6-10芳基、5或6員雜芳基、C
2-4烯基、C
2-4炔基、鹵基、C
1-4烷基、C
1-4鹵烷基、CN、NHOR
k、OR
k、SR
k、C(O)R
k、C(O)NR
kR
k、C(O)OR
k、OC(O)R
k、OC(O)NR
kR
k、NHR
k、NR
kR
k、NR
kC(O)R
k、NR
kC(O)NR
kR
k、NR
kC(O)OR
k、C(=NR
k)NR
kR
k、NR
kC(=NR
k)NR
kR
k、S(O)R
k、S(O)NR
kR
k、S(O)
2R
k、NR
kS(O)
2R
k、NR
kS(O)
2NR
kR
k及S(O)
2NR
kR
k;或連接至4至10員雜環烷基之同一碳原子之兩個R
h基團與其所連接之碳原子一起形成C
3-6環烷基或具有1-2個選自O、N或S之雜原子作為環成員之4至6員雜環烷基;
或任兩個R
c取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
e取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
g取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
i取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
k取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
o取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;且
每一R
e、R
i、R
k、R
o或R
p獨立地選自H、C
1-4烷基、C
3-6環烷基、C
6-10芳基、5或6員雜芳基、C
1-4鹵烷基、C
2-4烯基及C
2-4炔基,其中R
e、R
i、R
k、R
o或R
p之C
1-4烷基、C
3-6環烷基、C
6-10芳基、5或6員雜芳基、C
2-4烯基及C
2-4炔基各自視情況經1個、2個或3個R
q取代基取代;
每一R
q獨立地選自OH、CN、-COOH、NH
2、鹵基、C
1-4烷基、C
1-4烷氧基、C
1-4烷基硫基、苯基、4至6員雜環烷基、5員或6員雜芳基、C
3-6環烷基、NHR
12、NR
12R
12及C
1-4鹵烷氧基,其中R
q之C
1-4烷基、苯基、4至6員雜環烷基及5員或6員雜芳基各自視情況經1或2個獨立地選自以下之取代基取代:鹵基、OH、CN、-COOH、NH
2、C
1-4烷基、C
1-4烷氧基、C
3-10環烷基及4員、5員或6員雜環烷基,且每一R
12獨立地為C
1-6烷基;
下標n為整數1、2、3、4或5;且
下標m為整數1、2或3。
在一些實施例中,本發明提供式(I)化合物:
(I)
或其醫藥學上可接受之鹽或立體異構物,其中:
X
1為N或CR
1;
X
2為N或CR
2;
X
3為N或CR
3;
X
4為N或CR
4;
X
5為N或CR
5;
X
6為N或CR
6其中X
1、X
2及X
3不會同時為N;
其中X
4、X
5及X
6不會同時為N;
R
1、R
2、R
3、R
4、R
5、R
6及R
9各自獨立地選自H、鹵基、C
1-6烷基、C
2-6烯基、C
2-6炔基、C
1-6鹵烷基、C
1-6鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、CN、NO
2、OR
a、SR
a、NHOR
a、C(O)R
a、C(O)NR
aR
a、C(O)OR
a、OC(O)R
a、OC(O)NR
aR
a、NHR
a、NR
aR
a、NR
aC(O)R
a、NR
aC(O)OR
a、NR
aC(O)NR
aR
a、C(=NR
a)R
a、C(=NR
a)NR
aR
a、NR
aC(=NR
a)NR
aR
a、NR
aS(O)R
a、NR
aS(O)
2R
a、NR
aS(O)
2NR
aR
a、S(O)R
a、S(O)NR
aR
a、S(O)
2R
a及S(O)
2NR
aR
a,其中R
1、R
2、R
3、R
4、R
5、R
6及R
9之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個或4個R
b取代基取代;
R
7為C
1-4烷基、鹵基、CN、OH、環丙基、C
2-4炔基、C
1-4烷氧基、C
1-4鹵烷基、C
1-4鹵烷氧基、NH
2、-NH-C
1-4烷基、-N(C
1-4烷基)
2、OR
11、NHOR
11、C(O)R
11、C(O)NR
11R
11、C(O)OR
11、OC(O)R
11、OC(O)NR
11R
11、NR
11C(O)R
11、NR
11C(O)OR
11、NR
11C(O)NR
11R
11、C(=NR
11)R
11、C(=NR
11)NR
11R
11、NR
11C(=NR
11)NR
11R
11、NR
11S(O)R
11、NR
11S(O)
2R
11、NR
11S(O)
2NR
11R
11、S(O)R
11、S(O)NR
11R
11、S(O)
2R
11及S(O)
2NR
11R
11,其中每一R
11獨立地選自H及視情況經1或2個鹵基、OH、CN或OCH
3取代之C
1-4烷基;
每一R
8獨立地選自H、C
1-4烷基、C
3-6環烷基、C
2-4烯基、C
2-4炔基、鹵基、CN、OH、C
1-4烷氧基、C
1-4鹵烷基、C
1-4鹵烷氧基、NH
2、-NH-C
1-4烷基、-N(C
1-4烷基)
2、OR
10、NHOR
10、C(O)R
10、C(O)NR
10R
10、C(O)OR
10、OC(O)R
10、OC(O)NR
10R
10、NR
10C(O)R
10、NR
10C(O)OR
10、NR
10C(O)NR
10R
10、C(=NR
10)R
10、C(=NR
10)NR
10R
10、NR
10C(=NR
10)NR
10R
10、NR
10S(O)R
10、NR
10S(O)
2R
10、NR
10S(O)
2NR
10R
10、S(O)R
10、S(O)NR
10R
10、S(O)
2R
10及S(O)
2NR
10R
10,其中每一R
10獨立地為H或視情況經1或2個獨立地選自鹵基、OH、CN及C
1-4烷氧基之基團取代之C
1-4烷基,且其中R
8之C
1-4烷基、C
3-6環烷基、C
2-4烯基及C
2-4炔基各自視情況經1或2個獨立地選自以下之取代基取代:鹵基、OH、CN、C
1-4烷基及C
1-4烷氧基;
或兩個毗鄰R
9取代基與其所連接之碳原子一起形成稠合苯基環、稠合5至7員雜環烷基環、稠合5員或6員雜芳基環或稠合C
3-10環烷基環,其中稠合5至7員雜環烷基環及稠合5員或6員雜芳基環各自具有1-4個選自N、O及S之雜原子作為環成員,且其中稠合苯基環、稠合5至7員雜環烷基環、稠合5員或6員雜芳基環及稠合C
3-10環烷基環各自視情況經1或2個經獨立選擇之R
q取代基取代;
每一R
a獨立地選自H、CN、C
1-6烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-,其中R
a之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個、4個或5個R
d取代基取代;
每一R
d獨立地選自C
1-4烷基、C
1-4鹵烷基、鹵基、C
3-10環烷基、4-10員雜環烷基、苯基、5員或6員雜芳基、CN、NH
2、NHOR
e、OR
e、SR
e、C(O)R
e、C(O)NR
eR
e、C(O)OR
e、OC(O)R
e、OC(O)NR
eR
e、NHR
e、NR
eR
e、NR
eC(O)R
e、NR
eC(O)NR
eR
e、NR
eC(O)OR
e、C(=NR
e)NR
eR
e、NR
eC(=NR
e)NR
eR
e、S(O)R
e、S(O)NR
eR
e、S(O)
2R
e、NR
eS(O)
2R
e、NR
eS(O)
2NR
eR
e及S(O)
2NR
eR
e,其中R
d之C
1-4烷基、C
3-10環烷基、苯基、5員或6員雜芳基及4-10員雜環烷基各自進一步視情況經1-3個經獨立選擇之R
q取代基取代;
每一R
b取代基獨立地選自鹵基、C
1-4烷基、C
1-4鹵烷基、C
1-4鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、CN、OH、NH
2、NO
2、NHOR
c、OR
c、SR
c、C(O)R
c、C(O)NR
cR
c、C(O)OR
c、OC(O)R
c、OC(O)NR
cR
c、C(=NR
c)NR
cR
c、NR
cC(=NR
c)NR
cR
c、NHR
c、NR
cR
c、NR
cC(O)R
c、NR
cC(O)OR
c、NR
cC(O)NR
cR
c、NR
cS(O)R
c、NR
cS(O)
2R
c、NR
cS(O)
2NR
cR
c、S(O)R
c、S(O)NR
cR
c、S(O)
2R
c或S(O)
2NR
cR
c;其中R
b之C
1-4烷基、C
1-4鹵烷基、C
1-4鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自進一步視情況經1-3個經獨立選擇之R
d取代基取代;
每一R
c獨立地選自H、C
1-6烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-,其中R
c之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個、4個或5個獨立地選自以下之R
f取代基取代:C
1-4烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、鹵基、CN、NHOR
g、OR
g、SR
g、C(O)R
g、C(O)NR
gR
g、C(O)OR
g、OC(O)R
g、OC(O)NR
gR
g、NHR
g、NR
gR
g、NR
gC(O)R
g、NR
gC(O)NR
gR
g、NR
gC(O)OR
g、C(=NR
g)NR
gR
g、NR
gC(=NR
g)NR
gR
g、S(O)R
g、S(O)NR
gR
g、S(O)
2R
g、NR
gS(O)
2R
g、NR
gS(O)
2NR
gR
g及S(O)
2NR
gR
g;其中R
f之C
1-4烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個、4個或5個獨立地選自以下之R
n取代基取代:C
1-4烷基、C
1-4鹵烷基、鹵基、CN、R
o、NHOR
o、OR
o、SR
o、C(O)R
o、C(O)NR
oR
o、C(O)OR
o、OC(O)R
o、OC(O)NR
oR
o、NHR
o、NR
oR
o、NR
oC(O)R
o、NR
oC(O)NR
oR
o、NR
oC(O)OR
o、C(=NR
o)NR
oR
o、NR
oC(=NR
o)NR
oR
o、S(O)R
o、S(O)NR
oR
o、S(O)
2R
o、NR
oS(O)
2R
o、NR
oS(O)
2NR
oR
o及S(O)
2NR
oR
o;
每一R
g獨立地選自H、C
1-6烷基、C
1-4鹵烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-,其中R
g之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-10員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-10員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1-3個經獨立選擇之R
p取代基取代;
或任兩個R
a取代基與其所連接之氮原子一起形成4員、5員、6員、7員、8員、9員或10員雜環烷基,其視情況經1個、2個或3個獨立地選自以下之R
h取代基取代:C
1-6烷基、C
3-10環烷基、4-7員雜環烷基、C
6-10芳基、5-6員雜芳基、C
3-10環烷基-C
1-4烷基-、(5-6員雜芳基)-C
1-4烷基-、(4-7員雜環烷基)-C
1-4烷基-、C
1-6鹵烷基、C
2-6烯基、C
2-6炔基、鹵基、CN、OR
i、SR
i、NHOR
i、C(O)R
i、C(O)NR
iR
i、C(O)OR
i、OC(O)R
i、OC(O)NR
iR
i、NHR
i、NR
iR
i、NR
iC(O)R
i、NR
iC(O)NR
iR
i、NR
iC(O)OR
i、C(=NR
i)NR
iR
i、NR
iC(=NR
i)NR
iR
i、S(O)R
i、S(O)NR
iR
i、S(O)
2R
i、NR
iS(O)
2R
i、NR
iS(O)
2NR
iR
i及S(O)
2NR
iR
i,其中R
h之C
1-6烷基、C
3-10環烷基、4-7員雜環烷基、C
6-10芳基、5-6員雜芳基、C
3-10環烷基-C
1-4烷基-、(5-6員雜芳基)-C
1-4烷基-及(4-7員雜環烷基)-C
1-4烷基-各自進一步視情況經1個、2個或3個獨立地選自以下之R
j取代基取代:C
3-6環烷基、C
6-10芳基、5或6員雜芳基、C
2-4烯基、C
2-4炔基、鹵基、C
1-4烷基、C
1-4鹵烷基、CN、NHOR
k、OR
k、SR
k、C(O)R
k、C(O)NR
kR
k、C(O)OR
k、OC(O)R
k、OC(O)NR
kR
k、NHR
k、NR
kR
k、NR
kC(O)R
k、NR
kC(O)NR
kR
k、NR
kC(O)OR
k、C(=NR
k)NR
kR
k、NR
kC(=NR
k)NR
kR
k、S(O)R
k、S(O)NR
kR
k、S(O)
2R
k、NR
kS(O)
2R
k、NR
kS(O)
2NR
kR
k及S(O)
2NR
kR
k;或連接至4至10員雜環烷基之同一碳原子之兩個R
h基團與其所連接之碳原子一起形成C
3-6環烷基或具有1-2個選自O、N或S之雜原子作為環成員之4至6員雜環烷基;
或任兩個R
c取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
e取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
g取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
i取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
k取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;
或任兩個R
o取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R
h取代基取代;且
每一R
e、R
i、R
k、R
o或R
p獨立地選自H、C
1-4烷基、C
3-6環烷基、C
6-10芳基、5或6員雜芳基、C
1-4鹵烷基、C
2-4烯基及C
2-4炔基,其中R
e、R
i、R
k、R
o或R
p之C
1-4烷基、C
3-6環烷基、C
6-10芳基、5或6員雜芳基、C
2-4烯基及C
2-4炔基各自視情況經1個、2個或3個R
q取代基取代;
每一R
q獨立地選自OH、CN、-COOH、NH
2、鹵基、C
1-4烷基、C
1-4烷氧基、C
1-4烷基硫基、苯基、4至6員雜環烷基、5員或6員雜芳基、C
3-6環烷基、NHR
12、NR
12R
12及C
1-4鹵烷氧基,其中R
q之C
1-4烷基、苯基、4至6員雜環烷基及5員或6員雜芳基各自視情況經1或2個獨立地選自以下之取代基取代:鹵基、OH、CN、-COOH、NH
2、C
1-4烷基、C
1-4烷氧基、C
3-10環烷基及4員、5員或6員雜環烷基,且每一R
12獨立地為C
1-6烷基;
下標n為整數1、2、3、4或5;且
下標m為整數1、2或3。
如本文所描述之化合物或其醫藥學上可接受之鹽或立體異構物可用作PD-1/PD-L1蛋白/蛋白相互作用之抑制劑。舉例而言,如本文所描述之化合物或其醫藥學上可接受之鹽或立體異構物可破壞PD-1路徑中之PD-1/PD-L1蛋白/蛋白相互作用。
在一些實施例中,本發明提供具有式(II)之化合物:
(II)
或其醫藥學上可接受之鹽或立體異構物。在式(II)化合物之某些實施例中,R
2為鹵基、C
1-6烷基、C
2-6烯基、C
2-6炔基、C
1-6鹵烷基、C
1-6鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、CN、NO
2、OR
a、SR
a、NHOR
a、C(O)R
a、C(O)NR
aR
a、C(O)OR
a、OC(O)R
a、OC(O)NR
aR
a、NHR
a、NR
aR
a、NR
aC(O)R
a、NR
aC(O)OR
a、NR
aC(O)NR
aR
a、C(=NR
a)R
a、C(=NR
a)NR
aR
a、NR
aC(=NR
a)NR
aR
a、NR
aS(O)R
a、NR
aS(O)
2R
a、NR
aS(O)
2NR
aR
a、S(O)R
a、S(O)NR
aR
a、S(O)
2R
a及S(O)
2NR
aR
a,其中R
2之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個或4個R
b取代基取代。式(II)之其他變量如本文所描述之式(I)或式(I)化合物之任一實施例中所定義。在式(II)化合物之一實施例中,R
7為CN或視情況經R
q取代之C
1-4烷基。在另一實施例中,R
7為CH
3或CN。
在一些實施例中,本發明提供具有式(III)之化合物:
(III)
或其醫藥學上可接受之鹽或立體異構物。在式(III)化合物之某些實施例中,R
2為鹵基、C
1-6烷基、C
2-6烯基、C
2-6炔基、C
1-6鹵烷基、C
1-6鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、CN、NO
2、OR
a、SR
a、NHOR
a、C(O)R
a、C(O)NR
aR
a、C(O)OR
a、OC(O)R
a、OC(O)NR
aR
a、NHR
a、NR
aR
a、NR
aC(O)R
a、NR
aC(O)OR
a、NR
aC(O)NR
aR
a、C(=NR
a)R
a、C(=NR
a)NR
aR
a、NR
aC(=NR
a)NR
aR
a、NR
aS(O)R
a、NR
aS(O)
2R
a、NR
aS(O)
2NR
aR
a、S(O)R
a、S(O)NR
aR
a、S(O)
2R
a及S(O)
2NR
aR
a,其中R
2之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個或4個R
b取代基取代。式(III)之其他變量如本文所描述之式(I)或式(I)化合物之任一實施例中所定義。
在一些實施例中,本發明提供具有式(IV)之化合物:
(IV)
或其醫藥學上可接受之鹽或立體異構物,其中式(IV)之變量如本文所描述之式(I)或式(I)化合物之任一實施例中所定義。在式(II)化合物之某些實施例中,R
2為鹵基、C
1-6烷基、C
2-6烯基、C
2-6炔基、C
1-6鹵烷基、C
1-6鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、CN、NO
2、OR
a、SR
a、NHOR
a、C(O)R
a、C(O)NR
aR
a、C(O)OR
a、OC(O)R
a、OC(O)NR
aR
a、NHR
a、NR
aR
a、NR
aC(O)R
a、NR
aC(O)OR
a、NR
aC(O)NR
aR
a、C(=NR
a)R
a、C(=NR
a)NR
aR
a、NR
aC(=NR
a)NR
aR
a、NR
aS(O)R
a、NR
aS(O)
2R
a、NR
aS(O)
2NR
aR
a、S(O)R
a、S(O)NR
aR
a、S(O)
2R
a及S(O)
2NR
aR
a,其中R
2之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個或4個R
b取代基取代。
在一些實施例中,本發明提供具有式(V)之化合物:
(V)
或其醫藥學上可接受之鹽或立體異構物,其中式(V)之變量如本文所描述之式(I)或式(I)化合物之任一實施例中所定義。在式(V)化合物之某些實施例中,R
2為鹵基、C
1-6烷基、C
2-6烯基、C
2-6炔基、C
1-6鹵烷基、C
1-6鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、CN、NO
2、OR
a、SR
a、NHOR
a、C(O)R
a、C(O)NR
aR
a、C(O)OR
a、OC(O)R
a、OC(O)NR
aR
a、NHR
a、NR
aR
a、NR
aC(O)R
a、NR
aC(O)OR
a、NR
aC(O)NR
aR
a、C(=NR
a)R
a、C(=NR
a)NR
aR
a、NR
aC(=NR
a)NR
aR
a、NR
aS(O)R
a、NR
aS(O)
2R
a、NR
aS(O)
2NR
aR
a、S(O)R
a、S(O)NR
aR
a、S(O)
2R
a及S(O)
2NR
aR
a,其中R
2之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個或4個R
b取代基取代。
在一些實施例中,本發明提供具有式(VI)之化合物:
(VI)
或其醫藥學上可接受之鹽或立體異構物,其中式(VI)之變量如本文所描述之式(I)或式(I)化合物之任一實施例中所定義。在式(VI)化合物之某些實施例中,R
2為鹵基、C
1-6烷基、C
2-6烯基、C
2-6炔基、C
1-6鹵烷基、C
1-6鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、CN、NO
2、OR
a、SR
a、NHOR
a、C(O)R
a、C(O)NR
aR
a、C(O)OR
a、OC(O)R
a、OC(O)NR
aR
a、NHR
a、NR
aR
a、NR
aC(O)R
a、NR
aC(O)OR
a、NR
aC(O)NR
aR
a、C(=NR
a)R
a、C(=NR
a)NR
aR
a、NR
aC(=NR
a)NR
aR
a、NR
aS(O)R
a、NR
aS(O)
2R
a、NR
aS(O)
2NR
aR
a、S(O)R
a、S(O)NR
aR
a、S(O)
2R
a及S(O)
2NR
aR
a,其中R
2之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個或4個R
b取代基取代。
在一些實施例中,本發明提供具有式(VII)之化合物:
(VII)
或其醫藥學上可接受之鹽或立體異構物,其中式(VII)之變量如本文所描述之式(I’)或(I)或式(I’)或(I)化合物之任一實施例中所定義。在式(VII)化合物之某些實施例中,為鹵基、C
1-6烷基、C
2-6烯基、C
2-6炔基、C
1-6鹵烷基、C
1-6鹵烷氧基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-、(4-10員雜環烷基)-C
1-4烷基-、CN、NO
2、OR
a、SR
a、NHOR
a、C(O)R
a、C(O)NR
aR
a、C(O)OR
a、OC(O)R
a、OC(O)NR
aR
a、NHR
a、NR
aR
a、NR
aC(O)R
a、NR
aC(O)OR
a、NR
aC(O)NR
aR
a、C(=NR
a)R
a、C(=NR
a)NR
aR
a、NR
aC(=NR
a)NR
aR
a、NR
aS(O)R
a、NR
aS(O)
2R
a、NR
aS(O)
2NR
aR
a、S(O)R
a、S(O)NR
aR
a、S(O)
2R
a及S(O)
2NR
aR
a,其中R
1之C
1-6烷基、C
2-6烯基、C
2-6炔基、C
6-10芳基、C
3-10環烷基、5-14員雜芳基、4-10員雜環烷基、C
6-10芳基-C
1-4烷基-、C
3-10環烷基-C
1-4烷基-、(5-14員雜芳基)-C
1-4烷基-及(4-10員雜環烷基)-C
1-4烷基-各自視情況經1個、2個、3個或4個R
b取代基取代。
在一些實施例中,本發明提供具有式(VIII)之化合物:
(VIII)
或其醫藥學上可接受之鹽或立體異構物,其中式(VIII)之變量如本文所描述之式(I’)或(I)或式(I’)或(I)化合物之任一實施例中所定義。在一些情況下,R
9為H,n為1,X
7為CR
8a,X
8為CR
8b且X
9為CR
8c。在一些情況下,X
7、X
8及X
9各自為CH。
在一些實施例中,本發明提供具有式(IX)之化合物:
(IX)
或其醫藥學上可接受之鹽或立體異構物,其中式(IX)之變量如本文所描述之式(I’)或(I)或式(I’)或(I)化合物之任一實施例中所定義。在一些情況下,R
9為H,n為1,X
7為CR
8a,X
8為CR
8b且X
9為CR
8c。在一些情況下,X
7、X
8及X
9各自為CH。
在式I’、I、II、III、IV、V或VI化合物或其醫藥學上可接受之鹽或立體異構物之一些實施例中,部分
或
選自:
、
、
、
、
、
、
、
、
、
、
、
、
、
、
、
、
、
、
、
及
,其中取代基R
1、R
2、R
3、R
4、R
5及R
6如本文所描述之式(I’)、(I)或式(I’)或(I)化合物之任一實施例中所定義。在某些實施例中,在每次出現時,R
1、R
3、R
4、R
5及R
6各自為H。
在式I’、I、VII、VIII或IX化合物或其醫藥學上可接受之鹽或立體異構物之一些實施例中,部分
或
選自:
、
、
、
、
、
、
、
、
、
、
、
、
、
、
、
、
、
、
、
及
,其中取代基R
1、R
2、R
3、R
4、R
5及R
6如本文所描述之式(I’)、(I)或式(I’)、(I)化合物之任一實施例中所定義。在某些實施例中,在每次出現時,R
1、R
2、R
4、R
5及R
6各自為H。
在式I’、I、II、III、IV、V或VI化合物或其醫藥學上可接受之鹽或立體異構物之一些實施例中,X
1為CR
1,X
3為CR
3,X
4為CR
4,X
5為CR
5且X
6為CR
6。在一些情況下,X
1、X
3、X
4、X
5及X
6各自為CH。在一實施例中,X
2為CR
2。
在式I’、I、II、III、IV、V或VI化合物或其醫藥學上可接受之鹽或立體異構物之一些實施例中,X
1為CR
1,X
3為CR
3,X
4為CR
4,X
5為CR
5且X
6為N。在一些情況下,X
1、X
3、X
4及X
5各自為CH。在一實施例中,X
2為CR
2。
在式I’、I、II、III、IV、V或VI化合物或其醫藥學上可接受之鹽或立體異構物之一些實施例中,X
1為CR
1,X
3為CR
3,X
4為N,X
5為CR
5且X
6為N。在一些情況下,X
1、X
3及X
5各自為CH。在一實施例中,X
2為CR
2。
在式I’、I、II、III、IV、V或VI化合物或其醫藥學上可接受之鹽或立體異構物之一些實施例中,X
1為CR
1,X
3為N,X
4為CR
4,X
5為CR
5且X
6為N。在一些情況下,X
1、X
4及X
5各自為CH。在一實施例中,X
2為CR
2。
在式I’、I、VII、VIII或IX化合物或其醫藥學上可接受之鹽或立體異構物之一些實施例中,X
1為CR
1,X
2為N,X
4為CR
4,X
5為CR
5且X
6為CR
6。在一些情況下,X
1、X
4、X
5及X
6各自為CH。在一實施例中,X
2為CR
2。
在式I’、I、VII、VIII或IX化合物或其醫藥學上可接受之鹽或立體異構物之一些實施例中,X
1為CR
1,X
2為CR
2,X
4為CR
4,X
5為CR
5且X
6為CR
6。在一些情況下,X
1、X
2、X
4、X
5及X
6各自為CH。在一實施例中,X
3為CR
3。
在式I’、I、VII、VIII或IX化合物或其醫藥學上可接受之鹽或立體異構物之一些實施例中,X
1為CR
1,X
2為CR
2,X
4為CR
4,X
5為CR
5且X
6為N。在一些情況下,X
1、X
2、X
4及X
5各自為CH。在一實施例中,X
3為CR
3。
在式I’、I、VII、VIII或IX化合物或其醫藥學上可接受之鹽或立體異構物之一些實施例中,X
1為CR
1,X
2為CR
2,X
4為N,X
5為CR
5且X
6為N。在一些情況下,X
1、X
2及X
5各自為CH。在一實施例中,X
3為CR
3。
在式I’、I、VII、VIII或IX化合物或其醫藥學上可接受之鹽或立體異構物之一些實施例中,X
1為CR
1,X
2為N,X
4為CR
4,X
5為CR
5且X
6為N。在一些情況下,X
1、X
4及X
5各自為CH。在一實施例中,X
3為CR
3。
在式I’、I、VII、VIII或IX化合物或其醫藥學上可接受之鹽或立體異構物之一些實施例中,X
1為CR
1,X
2為N,X
4為CR
4,X
5為CR
5且X
6為CR
6。在一些情況下,X
1、X
4、X
5及X
6各自為CH。在一實施例中,X
3為CR
3。
在一些實施例中,R
1、R
3、R
4、R
5及R
6各自獨立地選自H、C
1-6烷基、CN、-N(C
1-6烷基)
2及鹵基。
在一些實施例中,R
1、R
3、R
4、R
5及R
6各自獨立地選自H、CN、C
1-6烷基及鹵基。
在一些實施例中,R
1、R
2、R
4、R
5及R
6各自獨立地選自H、C
1-6烷基、CN、-N(C
1-6烷基)
2及鹵基。
在一些實施例中,R
1、R
2、R
4、R
5及R
6各自獨立地選自H、CN、C
1-6烷基及鹵基。
在一些實施例中,R
1、R
2、R
3、R
4、R
5、R
8及R
9各自為H。
在一些實施例中,R
1、R
3、R
4、R
5、R
6、R
8及R
9各自為H。
在一些實施例中,R
1、R
2、R
4、R
5、R
6、R
8及R
9各自為H。
在一些實施例中,R
2為-CH
2-R
b。
在一些實施例中,R
3為-CH
2-R
b。
在一些實施例中,R
3為H、鹵基或C
1-6烷基。
在一些實施例中,R
3為H、Cl或OCH
3。
在一些實施例中,苯基環上之兩個毗鄰R
9取代基與其所連接之碳原子一起形成5員、6員或7員稠合雜環烷基,其視情況經1或2個R
q取代基取代。在一些情況下,稠合雜環烷基為稠合二氧雜環己基,其視情況經1或2個R
q取代基取代。在一些情況下,稠合雜環烷基具有碳及1或2個選自O、N或S之雜原子作為環成員,其中碳環原子視情況經氧化形成羰基,N環原子視情況經氧化形成NO且S環原子視情況經氧化形成SO或SO
2。
在一些實施例中,下標n為2且下標m為1。
在一些實施例中,R
7為C
1-4烷基或CN。
在一些實施例中,R
7為CH
3或CN。
在一些實施例中,R
8及R
9各自為H。
在式I’、I、II、III、III、IV、V、VI、VII、VIII或IX化合物之一些實施例中,R
2為經R
b取代之C
1-4烷基。在某些實施例中,R
b為NHR
c或NR
cR
c。在某些實施例中,R
b為NR
cR
c。在其他實施例中,R
b為2-羥基乙基胺基、2-羥基乙基(甲基)胺基、2-羧基哌啶-1-基、(氰基甲基)胺基、(S)-2-羧基哌啶-1-基、(R)-2-羧基哌啶-1-基或2-羧基哌啶-1-基,其各自視情況經1個、2個或3個R
q取代基取代。在其他實施例中,R
b為2-羥基乙基胺基、2-羥基乙基(甲基)胺基、2-羧基哌啶-1-基、(氰基甲基)胺基、(S)-2-羧基哌啶-1-基、(R)-2-羧基哌啶-1-基或2-羧基哌啶-1-基。在其他實施例中,R
b為2-羥基乙基胺基。在其他實施例中,R
b為2-羧基哌啶-1-基。在其他實施例中,R
2為經R
q取代之C
1-4烷基。
在式I’、I、II、III、III、IV、V、VI、VII、VIII或IX化合物之一些實施例中,R
2為經R
d取代之C
1-4烷氧基。在某些實施例中,R
d為苯基、3-氰基苯基、3-吡啶基、2-吡啶基、4-吡啶基,其各自視情況經1個、2個或3個R
q取代基取代。
在式I’、I、II、III、III、IV、V、VI、VII、VIII或IX化合物之一些實施例中,R
2為-OCH
2R
d。在某些實施例中,R
d為苯基、3-氰基苯基、3-吡啶基、2-吡啶基、4-吡啶基,其各自視情況經1個、2個或3個R
q取代基取代。
在式I’、I、II、III、III、IV、V、或VI、VII、VIII或IX化合物之一些實施例中,R
3為經R
b取代之C
1-4烷基。在某些實施例中,R
b為NHR
c或NR
cR
c。在某些實施例中,R
b為NR
cR
c。在其他實施例中,R
b為2-羥基乙基胺基、2-羥基乙基(甲基)胺基、2-羧基哌啶-1-基、(氰基甲基)胺基、(S)-2-羧基哌啶-1-基、(R)-2-羧基哌啶-1-基或2-羧基哌啶-1-基,其各自視情況經1個、2個或3個R
q取代基取代。在其他實施例中,R
b為2-羥基乙基胺基、2-羥基乙基(甲基)胺基、2-羧基哌啶-1-基、(氰基甲基)胺基、(S)-2-羧基哌啶-1-基、(R)-2-羧基哌啶-1-基或2-羧基哌啶-1-基。在其他實施例中,R
b為2-羥基乙基胺基。在其他實施例中,R
b為2-羧基哌啶-1-基。在其他實施例中,R
3為經R
q取代之C
1-4烷基。
在式I’、I、II、III、III、IV、V、VI、VII、VIII或IX化合物之一些實施例中,R
3為經R
d取代之C
1-4烷氧基。在某些實施例中,R
d為苯基、3-氰基苯基、3-吡啶基、2-吡啶基、4-吡啶基,其各自視情況經1個、2個或3個R
q取代基取代。
在式I’、I、II、III、III、IV、V、VI、VII、VIII或IX化合物之一些實施例中,R
3為-OCH
2R
d。在某些實施例中,R
d為苯基、3-氰基苯基、3-吡啶基、2-吡啶基、4-吡啶基,其各自視情況經1個、2個或3個R
q取代基取代。
在式I’、I、II、III、III、IV、V、VI、VII、VIII或IX化合物之一些實施例中,R
3為2-羥基乙基胺基甲基、2-羥基乙基(甲基)胺基甲基、2-羧基哌啶-1-基甲基、(氰基甲基)胺基甲基、(S)-2-羧基哌啶-1-基甲基、(R)-2-羧基哌啶-1-基甲基、2-羧基哌啶-1-基甲基、苄基氧基、2-氰基苄基氧基、3-氰基苄基氧基、4-氰基苄基氧基、2-吡啶基甲氧基、3-吡啶基甲氧基或4-吡啶基甲氧基,其各自視情況經1個、2個或3個R
q取代基取代。在某些實施例中,R
3為2-羥基乙基胺基甲基、2-羧基哌啶-1-基甲基、(S)-2-羧基哌啶-1-基甲基、(R)-2-羧基哌啶-1-基甲基或(3-氰基苄基)氧基,其各自視情況經1個、2個或3個R
q取代基取代。
在式I、II、III、V或VII化合物之一些實施例中,R
8為H、鹵基、CN、N(C
1-6烷基)
2、C
1-6烷基或C
1-6烷氧基,其中C
1-6烷基及C
1-6烷氧基各自視情況經1-3個R
q取代基取代。在式I’、VIII或IX化合物之一些實施例中,R
8a、R
8b及R
8c各自獨立地選自H、鹵基、CN、N(C
1-6烷基)
2、C
1-6烷基及C
1-6烷氧基,其中C
1-6烷基及C
1-6烷氧基各自視情況經1-3個R
q取代基取代。
在式I、II、III、V或VII化合物之一些實施例中,R
8為H、鹵基、CN、N(CH
3)
2或CH
3。在式I’、VIII或IX化合物之一些實施例中,R
8a、R
8b及R
8c各自獨立地選自H、鹵基、CN、N(CH
3)
2及CH
3。
應進一步瞭解,為清晰起見描述於單獨實施例上下文中之某些本發明特徵亦可以組合形式提供於單一實施例中(儘管意欲組合該等實施例如同以多種附屬形式書寫一般)。反之,為簡便起見描述於單一實施例上下文中之多個本發明特徵亦可單獨提供或以任一適宜子組合提供。因此,預期描述為式(I’)或(I)化合物之實施例之特徵可組合於任一適宜組合中。
在本說明書各處,某些化合物特徵以群或以範圍來揭示。此類揭示內容意欲明確包括此類群及範圍之成員之每一及每個個別子組合。舉例而言,術語「C
1-6烷基」意欲明確個別地揭示(但不限於)甲基、乙基、C
3烷基、C
4烷基、C
5烷基及C
6烷基。
術語「n員」在n為整數時通常描述成環原子數為n之部分中之成環原子數。舉例而言,哌啶基為6員雜環烷基環之實例,吡唑基為5員雜芳基環之實例,吡啶基為6員雜芳基環之實例,且1,2,3,4-四氫-萘為10員環烷基之實例。
在本說明書各處,可描述定義二價連接基團之變量。每一連接取代基意欲明確包括該連接取代基之前置及後置形式二者。舉例而言,-NR(CR'R'')
n-包括-NR(CR'R'')
n-及-(CR'R'')
nNR-二者且意欲個別地揭示每一形式。當結構需要連接基團時,針對該基團列示之馬庫什變量(Markush variable)應理解為連接基團。舉例而言,若結構需要連接基團且該變量之馬庫什基團定義列示「烷基」或「芳基」,則應理解「烷基」或「芳基」分別代表伸烷基連接基團或伸芳基連接基團。
術語「經取代」意指原子或原子之基團在形式上替代氫作為連接至另一基團之「取代基」。除非另有指示,否則術語「經取代」指任一取代度,例如單取代、二取代、三取代、四取代或五取代,其中此類取代為容許的。取代基經獨立地選擇,且取代可處於任一化學上可及之位置。應理解,給定原子之取代受化合價之限制。應理解,給定原子之取代產生化學上穩定之分子。片語「視情況經取代」意指未經取代或經取代。術語「經取代」意指移除氫原子且由取代基替代。單一二價取代基(例如側氧基)可替代兩個氫原子。
術語「C
n-m」指示包括終點之範圍,其中n及m為整數且指示碳數。實例包括C
1-4、C
1-6及諸如此類。
術語「烷基」單獨或與其他術語組合使用且指可為直鏈或具支鏈之飽和烴基團。術語「C
n-m烷基」指具有n至m個碳原子之烷基。烷基在形式上對應於一個C-H鍵經烷基與化合物其餘部分之連接點替代之烷烴。在一些實施例中,烷基含有1至6個碳原子、1至4個碳原子、1至3個碳原子或1至2個碳原子。烷基部分之實例包括(但不限於)化學基團,例如甲基、乙基、正丙基、異丙基、正丁基、第三丁基、異丁基、第二丁基;高碳數同系物,例如2-甲基-1-丁基、正戊基、3-戊基、正己基、1,2,2-三甲基丙基及諸如此類。
術語「烯基」單獨或與其他術語組合使用且指對應於具有一或多個碳-碳雙鍵之烷基之直鏈或具支鏈烴基團。烯基在形式上對應於一個C-H鍵經烯基與化合物其餘部分之連接點替代之烯烴。術語「C
n-m烯基」指具有n至m個碳之烯基。在一些實施例中,烯基部分含有2至6個、2至4個或2至3個碳原子。實例性烯基包括(但不限於)乙烯基、正丙烯基、異丙烯基、正丁烯基、第二丁烯基及諸如此類。
術語「炔基」單獨或與其他術語組合使用且指對應於具有一或多個碳-碳三鍵之烷基之直鏈或具支鏈烴基團。炔基在形式上對應於一個C-H鍵經烷基與化合物其餘部分之連接點替代之炔烴。術語「C
n-m炔基」指具有n至m個碳之炔基。實例性炔基包括(但不限於)乙炔基、丙炔-1-基、丙炔-2-基及諸如此類。在一些實施例中,炔基部分含有2至6個、2至4個或2至3個碳原子。
術語「伸烷基」單獨或與其他術語組合使用且指二價烷基連接基團。伸烷基在形式上對應於兩個C-H鍵經伸烷基與化合物其餘部分之連接點替代之烷烴。術語「C
n-m伸烷基」指具有n至m個碳原子之伸烷基。伸烷基之實例包括(但不限於)乙-1,2-二基、丙-1,3-二基、丙-1,2-二基、丁-1,4-二基、丁-1,3-二基、丁-1,2-二基、2-甲基-丙-1,3-二基及諸如此類。
術語「烷氧基」單獨或與其他術語組合使用且指式-O-烷基,其中烷基如上文所定義。術語「C
n-m烷氧基」指烷氧基,其中之烷基具有n至m個碳。實例性烷氧基包括甲氧基、乙氧基、丙氧基(例如正丙氧基及異丙氧基)、第三丁氧基及諸如此類。在一些實施例中,烷基具有1至6個、1至4個或1至3個碳原子。
術語「烷基硫基」單獨或與其他術語組合使用且指式-S-烷基,其中烷基如上文所定義。術語「C
n-m烷基硫基」指烷基硫基,其中之烷基具有n至m個碳。實例性烷基硫基包括甲基硫基、乙基硫基等。在一些實施例中,烷基硫基之烷基具有1至6個、1至4個或1至3個碳原子。
術語「胺基」單獨或與其他術語組合使用且指式-NH
2基團。
術語「羰基」單獨或與其他術語組合使用且指-C(=O)-基團,其亦可寫為C(O)。
術語「氰基」或「腈」指式-C≡N基團,其亦可寫為-CN。
術語「鹵基」或「鹵素」單獨或與其他術語組合使用且指氟、氯、溴及碘。在一些實施例中,「鹵基」指選自F、Cl或Br之鹵素原子。在一些實施例中,鹵基為F。
術語「鹵烷基」單獨或與其他術語組合使用且指其中一或多個氫原子已經鹵素原子替代之烷基。術語「C
n-m鹵烷基」指具有n至m個碳原子及至少一個至多達{2(n至m)+1}個鹵素原子之C
n-m烷基,該等鹵素原子可相同或不同。在一些實施例中,鹵素原子為氟原子。在一些實施例中,鹵烷基具有1至6個或1至4個碳原子。實例性鹵烷基包括CF
3、C
2F
5、CHF
2、CCl
3、CHCl
2、C
2Cl
5及諸如此類。在一些實施例中,鹵烷基為氟烷基。
術語「鹵烷氧基」單獨或與其他術語組合使用且指式-O-鹵烷基,其中鹵烷基如上文所定義。術語「C
n-m鹵烷氧基」指鹵烷氧基,其中之鹵烷基具有n至m個碳。實例性鹵烷氧基包括三氟甲氧基及諸如此類。在一些實施例中,鹵烷氧基具有1至6個、1至4個或1至3個碳原子。
術語「側氧基」指氧原子作為二價取代基在連接至碳時形成羰基,或在連接至雜原子時形成亞碸或碸基團,或
N-氧化物基團。在一些實施例中,雜環基團可視情況經1或2個側氧基(=O)取代基取代。
術語「硫離子基」指硫原子作為二價取代基在連接至碳時形成硫代羰基(C=S)。
術語「芳族」指具有一或多個具有芳族特徵(即當n為整數時具有(4n + 2)個非定域π (pi)電子)之多不飽和環之碳環或雜環。
術語「芳基」單獨或與其他術語組合使用且指芳族烴基團,其可為單環或多環(例如具有2個稠合環)。術語「C
n-m芳基」指具有n至m個環碳原子之芳基。芳基包括例如苯基、萘基、二氫茚基、茚基及諸如此類。在一些實施例中,芳基具有6至約10個碳原子。在一些實施例中,芳基具有6個碳原子。在一些實施例中,芳基具有10個碳原子。在一些實施例中,芳基為苯基。在一些實施例中,芳基為萘基。
術語「雜芳基」或「雜芳族」單獨或與其他術語組合使用且指具有至少一個選自硫、氧及氮之雜原子環成員之單環或多環芳族雜環。在一些實施例中,雜芳基環具有1個、2個、3個或4個獨立地選自氮、硫及氧之雜原子環成員。在一些實施例中,雜芳基部分中之任一成環N可為N-氧化物。在一些實施例中,雜芳基具有5-14個環原子,包括碳原子及1個、2個、3個或4個獨立地選自氮、硫及氧之雜原子環成員。在一些實施例中,雜芳基具有5-10個環原子,包括碳原子及1個、2個、3個或4個獨立地選自氮、硫及氧之雜原子環成員。在一些實施例中,雜芳基具有5-6個環原子及1或2個獨立地選自氮、硫及氧之雜原子環成員。在一些實施例中,雜芳基為5員或6員雜芳基環。在其他實施例中,雜芳基為8員、9員或10員稠合雙環雜芳基環。實例性雜芳基包括(但不限於)吡啶基(pyridinyl) (吡啶基(pyridyl))、嘧啶基、吡嗪基、嗒嗪基、吡咯基、吡唑基、吖唑基、噁唑基、噻唑基、咪唑基、呋喃基、硫苯基、喹啉基、異喹啉基、萘啶基(包括1,2-萘啶、1,3-萘啶、1,4-萘啶、1,5-萘啶、1,6-萘啶、1,7-萘啶、1,8-萘啶、2,3-萘啶及2,6-萘啶)、吲哚基、苯并硫苯基、苯并呋喃基、苯并異噁唑基、咪唑并[1,2-
b]噻唑基、嘌呤基及諸如此類。
5員雜芳基環為具有5個環原子之雜芳基,其中一或多個(例如1個、2個或3個)環原子獨立地選自N、O及S。實例性5員環雜芳基包括噻吩基、呋喃基、吡咯基、咪唑基、噻唑基、噁唑基、吡唑基、異噻唑基、異噁唑基、1,2,3-三唑基、四唑基、1,2,3-噻二唑基、1,2,3-噁二唑基、1,2,4-三唑基、1,2,4-噻二唑基、1,2,4-噁二唑基、1,3,4-三唑基、1,3,4-噻二唑基及1,3,4-噁二唑基。
6員雜芳基環為具有6個環原子之雜芳基,其中一或多個(例如1個、2個或3個)環原子獨立地選自N、O及S。實例性6員環雜芳基為吡啶基、吡嗪基、嘧啶基、三嗪基及嗒嗪基。
術語「環烷基」單獨或與其他術語組合使用且指非芳族烴環系統(單環、雙環或多環),包括環化烷基及烯基。術語「C
n-m環烷基」指具有n至m個環成員碳原子之環烷基。環烷基可包括單環或多環(例如具有2個、3個或4個稠合環)基團及螺環。環烷基可具有3個、4個、5個、6個或7個成環碳(C
3-7)。在一些實施例中,環烷基具有3至6個環成員、3至5個環成員或3至4個環成員。在一些實施例中,環烷基為單環。在一些實施例中,環烷基為單環或雙環。在一些實施例中,環烷基為C
3-6單環環烷基。環烷基之成環碳原子可視情況經氧化以形成側氧基或硫離子基。環烷基亦包括伸環烷基。在一些實施例中,環烷基為環丙基、環丁基、環戊基或環己基。具有一或多個稠合(即具有共同鍵)至環烷基環之芳族環(例如環戊烷、環己烷及諸如此類之苯并或噻吩基衍生物)之部分亦包括在環烷基之定義中。含有稠合芳族環之環烷基可經由任一成環原子(包括稠合芳族環之成環原子)連接。環烷基之實例包括環丙基、環丁基、環戊基、環己基、環庚基、環戊烯基、環己烯基、環己二烯基、環庚三烯基、降莰基、降菔基、降蒈基、雙環[1.1.1]戊基、雙環[2.1.1]己基及諸如此類。在一些實施例中,環烷基為環丙基、環丁基、環戊基或環己基。
術語「雜環烷基」單獨或與其他術語組合使用且指非芳族環或環系統,其可視情況含有一或多個伸烯基作為環結構之一部分,其具有至少一個獨立地選自氮、硫氧及磷之雜原子環成員,且其具有4-10個環成員、4-7個環成員或4-6個環成員。單環4員、5員、6員及7員雜環烷基包括在術語「雜環烷基」內。雜環烷基可包括單環或雙環(例如具有兩個稠合或橋接環)環系統。在一些實施例中,雜環烷基為具有1個、2個或3個獨立地選自氮、硫及氧之雜原子之單環基團。雜環烷基之成環碳原子及雜原子可視情況經氧化以形成側氧基或硫離子基或其他氧化連接(例如C(O)、S(O)、C(S)或S(O)
2、
N-氧化物等)或氮原子可經四級銨化。雜環烷基可經由成環碳原子或成環雜原子連接。在一些實施例中,雜環烷基含有0至3個雙鍵。在一些實施例中,雜環烷基含有0至2個雙鍵。具有一或多個稠合(即具有共同鍵)至雜環烷基環之芳族環(例如哌啶、嗎啉、氮呯等之苯并或噻吩基衍生物)之部分亦包括在雜環烷基之定義中。含有稠合芳族環之雜環烷基可經由任一成環原子(包括稠合芳族環之成環原子)連接。雜環烷基之實例包括氮雜環丁基、氮雜環庚基、二氫苯并呋喃基、二氫呋喃基、二氫哌喃基、嗎啉基、3-氧雜-9-氮雜螺[5.5]十一烷基、1-氧雜-8-氮雜螺[4.5]癸基、哌啶基、哌嗪基、側氧基哌嗪基、哌喃基、吡咯啶基、奎寧環基、四氫呋喃基、四氫哌喃基、1,2,3,4-四氫喹啉基、莨菪烷基及硫嗎啉基。
術語「芳基烷基」單獨或與其他術語組合使用且指芳基-(伸烷基)-基團,其中芳基及伸烷基如本文所定義。實例性芳基烷基為苄基。
術語「雜芳基烷基」單獨或與其他術語組合使用且指雜芳基-(伸烷基)-基團,其中雜芳基及伸烷基如本文所定義。實例性雜芳基烷基為吡啶基甲基。
術語「環烷基烷基」單獨或與其他術語組合使用且指環烷基-(伸烷基)-基團,其中環烷基及伸烷基如本文所定義。實例性環烷基烷基為環丙基甲基。
術語「雜環烷基烷基」單獨或與其他術語組合使用且指雜環烷基-(伸烷基)-基團,其中雜環烷基及伸烷基如本文所定義。實例性雜環烷基烷基為氮雜環丁基甲基。
在某些地方,該等定義或實施例係關於特定環(例如氮雜環丁烷環、吡啶環等)。除非另有指示,否則該等環可連接至任一環成員,其限制條件為不超過該原子之化合價。舉例而言,氮雜環丁烷環可連接在環之任一位置,而氮雜環丁-3-基環連接在3位。
本文所述化合物可為不對稱的(例如具有一或多個立體中心)。除非另有指示,否則意欲針對所有立體異構物,例如鏡像異構物及非鏡像異構物。含有經不對稱取代之碳原子之本發明化合物可以光學活性或外消旋形式來分離。關於如何自光學無活性起始材料製備光學活性形式之方法為業內已知,例如藉由解析外消旋混合物或藉由立體選擇性合成。烯烴之許多幾何異構物、C=N雙鍵及諸如此類亦可存在於本文所述化合物中,且所有此類穩定異構物皆涵蓋於本發明中。本發明化合物之順式及反式幾何異構物描述為異構物混合物或分開的異構形式且可以該等形式來分離。
化合物之外消旋混合物之解析可藉由業內已知之多種方法中之任一者來實施。一方法包括使用手性解析酸分段再結晶,該酸為光學活性鹽形成有機酸。適用於分段再結晶方法之解析劑為例如光學活性酸,例如D及L形式之酒石酸、二乙醯基酒石酸、二苯甲醯基酒石酸、苦杏仁酸、蘋果酸、乳酸或各種光學活性樟腦磺酸(例如β-樟腦磺酸)。適於分段結晶方法之其他解析劑包括α-甲基-苄基-胺之立體異構純形式(例如
S及
R形式或非鏡像異構純形式)、2-苯基甘胺醇、降麻黃鹼、麻黃鹼、
N-甲基麻黃鹼、環己基乙基胺、1,2-二胺基環己烷及諸如此類。
外消旋混合物之解析亦可藉由經光學活性解析劑(例如二硝基苯甲醯基苯基甘胺酸)封裝之管柱上之溶析來實施。適宜溶析溶劑組合物可藉由熟習此項技術者來確定。
在一些實施例中,本發明化合物具有(
R)-構形。在其他實施例中,化合物具有(
S)-構形。除非另有指示,否則在具有一個以上手性中心之化合物中,化合物中之每一手性中心可獨立地為(
R)或(
S)。
本發明化合物亦包括互變異構形式。互變異構形式源自單鍵與毗鄰雙鍵之交換以及質子之伴隨遷移。互變異構形式包括質子轉移互變異構物,其為具有相同經驗式及總電荷之異構質子化狀態。實例性質子轉移互變異構物包括酮-烯醇對、醯胺-醯亞胺酸對、內醯胺-內醯亞胺對、烯胺-亞胺對及質子可佔據雜環系統之兩個或更多個位置之環形式,例如1
H-咪唑及3
H-咪唑、1
H-1,2,4-三唑、2
H-1,2,4-三唑及4
H-1,2,4-三唑、1
H-異吲哚及2
H-異吲哚及1
H-吡唑及2
H-吡唑。互變異構形式可處於平衡或藉由適當取代立體鎖定於一種形式。
本發明化合物亦可包括在中間體或最終化合物中出現之原子之所有同位素。同位素包括彼等具有相同原子序但不同質量數之原子。舉例而言,氫之同位素包括氚及氘。本發明化合物之一或多個構成原子可經原子之天然或非天然豐度之同位素替代或取代。在一些實施例中,化合物包括至少一個氘原子。舉例而言,本發明化合物中之一或多個氫原子可經氘替代或取代。在一些實施例中,化合物包括兩個或更多個氘原子。在一些實施例中,化合物包括1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個或12個氘原子。將同位素納入有機化合物中之合成方法為業內已知。
如本文所用術語「化合物」意欲包括所繪示結構之所有立體異構物、幾何異構物、互變異構物及同位素。該術語亦欲指本發明化合物而與其製備方式(例如合成、經由生物方法(例如代謝或酶轉化)或其組合)無關。
所有化合物及其醫藥學上可接受之鹽可與其他物質(例如水及溶劑)一起存在(例如水合物及溶劑合物)或可經分離。當呈固態時,本文所述化合物及其鹽可以多種形式存在且可例如呈溶劑合物(包括水合物)形式。化合物可呈任何固態形式,例如多形體或溶劑合物,因此除非另外明確指示,否則本說明書中對化合物及其鹽之提及應理解為涵蓋化合物之任何固態形式。
在一些實施例中,本發明化合物或其鹽實質上為經分離的。「實質上經分離」意指化合物至少部分地或實質上自形成或檢測到其之環境分離。部分分離物可包括例如富含本發明化合物之組合物。實質分離物可包括含有至少約50重量%、至少約60重量%、至少約70重量%、至少約80重量%、至少約90重量%、至少約95重量%、至少約97重量%或至少約99重量%之本發明化合物或其鹽之組合物。
片語「醫藥學上可接受」在本文中用於指在合理醫學判斷範疇內適於與人類及動物之組織接觸使用且無過度毒性、刺激性、過敏反應或其他問題或併發症且與合理益處/風險比相當之彼等化合物、材料、組合物及/或劑型。
業內應理解如本文所用表述「環境溫度」及「室溫」通常指為實施反應之房間之大致溫度的溫度,例如反應溫度,例如約20℃至約30℃之溫度。
本發明亦包括本文所述化合物之醫藥學上可接受之鹽。術語「醫藥學上可接受之鹽」指所揭示化合物之衍生物,其中母體化合物藉由將現有酸或鹼部分轉化成其鹽形式而經修飾。醫藥學上可接受之鹽之實例包括(但不限於)鹼性殘基(例如胺)之礦物酸或有機酸鹽;酸性殘基(例如羧酸)之鹼性或有機鹽;及諸如此類。本發明之醫藥學上可接受之鹽包括母體化合物之例如自無毒無機或有機酸形成之無毒鹽。本發明之醫藥學上可接受之鹽可藉由習用化學方法自含有鹼性或酸性部分之母體化合物合成。通常,此類鹽可藉由使該等化合物之游離酸或鹼形式與化學計量量之適宜鹼或酸於水中或於有機溶劑中或於兩者之混合物中反應來製備;通常,非水性介質(如醚、乙酸乙酯、醇(例如甲醇、乙醇、異丙醇或丁醇)或乙腈(MeCN))較佳。適宜鹽之列表參見
Remington's Pharmaceutical Sciences,第17版(Mack Publishing Company, Easton, 1985),第1418頁;Berge等人,
J. Pharm. Sci.,
1977,
66(1), 1-19及Stahl等人,
Handbook of Pharmaceutical Salts: Properties, Selection, and Use, (Wiley, 2002)。在一些實施例中,本文所述化合物包括N-氧化物形式。
II. 合成
本發明化合物(包括其鹽)可使用已知有機合成技術來製備且可根據多種可能合成途徑(例如下文方案中之彼等)中之任一者來合成。
用於製備本發明化合物之反應可在可由熟習有機合成技術者容易選擇之適宜溶劑中實施。適宜溶劑在實施反應之溫度(例如,可介於溶劑之冰點至溶劑之沸點之間的溫度)下可實質上不與起始材料(反應物)、中間體或產物反應。給定反應可在一種溶劑或一種以上溶劑之混合物中實施。端視具體反應步驟,可由熟習此項技術者選擇適用於具體反應步驟之溶劑。
本發明化合物之製備可涉及多個化學基團之保護及去保護。對保護及去保護之需要及適宜保護基團之選擇可容易地由熟習此項技術者確定。保護基團之化學法描述於例如以下文獻中:Kocienski,
Protecting Groups, (Thieme, 2007);Robertson,
Protecting Groups Chemistry, (Oxford University Press, 2000);Smith等人,
March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure,第6版(Wiley, 2007);Peturssion等人,「Protecting Groups in Carbohydrate Chemistry」,
J. Chem. Educ., 1997,
74(11), 1297;及Wuts等人,
Protective Groups in Organic Synthesis,第4版(Wiley, 2006)。
可根據業內已知之任何適宜方法來監測反應。舉例而言,可藉由光譜手段(例如核磁共振光譜法(例如
1H或
13C)、紅外光譜法、分光亮度法(例如UV-可見光)、質譜法)或藉由層析方法(例如高效液相層析(HPLC)或薄層層析(TLC))來監測產物形成。
下文方案提供與製備本發明化合物相關之一般指導方針。熟習此項技術者應理解,方案中所顯示之製備可使用一般有機化學知識來修改或優化以製備各種本發明化合物。
本發明式
8化合物可使用
方案 1中所顯示之方法來合成。在
方案 1中,在標準金屬催化之交叉偶合反應條件(例如鈴木(Suzuki)偶合反應,例如在鈀觸媒(例如1,1'-雙(二苯基膦基)二茂鐵]二氯鈀(II))及鹼(例如碳酸氫鹼或碳酸鹼)存在下)下,經鹵基(Hal
1)取代之適宜族胺
1可與適宜偶合試劑
2(其中M為例如-B(OH)
2)反應以產生化合物
3。然後,在適宜S
NAr條件(例如酸催化,例如在HCl存在下;或不經催化)或標準偶合反應條件(例如布赫瓦爾德-哈特維希(Buchwald-Hartwig)胺化,例如在鈀觸媒(例如[(2-二-環己基膦基-3,6-二甲氧基-2′,4′,6′-三異丙基-1,1′-聯苯)-2-(2′-胺基-1,1′-聯苯)]鈀(II)甲烷磺酸鹽)及鹼(例如碳酸鹼或丁醇鹼)存在下)下,芳族胺
3可與化合物
4之鹵基(Hal
2)選擇性反應,形成化合物
5。可藉由在標準偶合反應條件(例如鈴木偶合反應,例如在鈀觸媒(例如1,1'-雙(二環己基膦基)二茂鐵]二氯鈀(II))及鹼(例如碳酸氫鹼或碳酸鹼)存在下)下,偶合
5之鹵基(Hal
3)與乙烯基試劑(例如乙烯基硼酸頻哪醇酯)來合成式
6化合物。可在適宜試劑(例如但不限於OsO
4及NaIO
4)存在下氧化裂解化合物
6中之乙烯基以提供式
7之醛。然後可藉由在適宜溶劑(例如THF或DCM)中使用還原劑(例如但不限於三乙氧基硼氫化鈉)、視情況在鹼(例如DIPEA)存在下式
7化合物與胺HN(R
c)
2之間之還原性胺化來獲得式
8化合物。
或者,本發明式
8化合物可使用
方案 2中所顯示之方法來合成。在標準偶合反應條件(例如布赫瓦爾德-哈特維希胺化,例如在鈀觸媒(例如[(2-二-環己基膦基-3,6-二甲氧基-2′,4′,6′-三異丙基-1,1′-聯苯)-2-(2′-胺基-1,1′-聯苯)]鈀(II)甲烷磺酸鹽)及鹼(例如碳酸鹼或丁醇鹼)存在下)下,芳族胺
3可與式
9之鹵基(Hal
4)反應。隨後使用適宜還原劑(例如但不限於氫化鋰鋁)還原化合物
10中之羧基可給出式
11醇。可用適宜氧化劑(例如但不限於戴斯-馬丁過碘烷(Dess-Martin periodinane))氧化化合物
11中之醇單元以獲得醛
7。然後可使用與
方案 1中所顯示類似之條件自化合物
7獲得式
8化合物。
本發明式
16化合物可使用
方案 3中所顯示之方法來合成。在
方案 3中,在適宜S
NAr條件(酸催化,例如在HCl存在下;或不經催化)或標準偶合反應條件(例如布赫瓦爾德-哈特維希胺化,例如在鈀觸媒(例如[(2-二-環己基膦基-3,6-二甲氧基-2′,4′,6′-三異丙基-1,1′-聯苯)-2-(2′-胺基-1,1′-聯苯)]鈀(II)甲烷磺酸鹽)及鹼(例如碳酸鹼或丁醇鹼)存在下)下,芳族胺
3可與化合物
12之鹵基(Hal
5)選擇性反應以獲得化合物
13。式
14化合物可藉由在標準偶合反應條件(例如鈴木偶合反應,例如在鈀觸媒(例如1,1'-雙(二環己基膦基)二茂鐵]二氯鈀(II))及鹼(例如碳酸氫鹼或碳酸鹼)存在下)下偶合
13之鹵基(Hal
6)與乙烯基試劑(例如乙烯基硼酸頻哪醇酯)來合成。可在適宜試劑(例如但不限於OsO
4及NaIO
4)存在下氧化裂解化合物
14中之乙烯基以提供式
15醛。然後可藉由在適當溶劑(例如THF或DCM)中使用還原劑(例如但不限於三乙氧基硼氫化鈉)、視情況在鹼(例如DIPEA)存在下式
15化合物與胺HN(R
c)
2之間之還原性胺化來獲得式
16化合物。
式
21化合物可使用如方案
4中所概述之程序來製備。在適宜S
NAr條件(酸催化,例如在HCl存在下;或不經催化)或適宜選擇性偶合反應條件(例如布赫瓦爾德-哈特維希胺化,例如在鈀觸媒(例如[(2-二-環己基膦基-3,6-二甲氧基-2′,4′,6′-三異丙基-1,1′-聯苯)-2-(2′-胺基-1,1′-聯苯)]鈀(II)甲烷磺酸鹽)及鹼(例如碳酸鹼或丁醇鹼)存在下)下,式
17芳族胺可與化合物
18之鹵基(Hal
7)選擇性反應以獲得式
19化合物。在鈴木偶合條件(例如在鈀觸媒及適宜鹼存在下)或施蒂勒(Stille)偶合條件(例如在鈀觸媒存在下)或根岸(Negishi)偶合條件(例如在鈀觸媒存在下)下,式
19化合物中之鹵化物(Hal
8)可偶合至式
20化合物,其中M為硼酸、硼酸酯或經適當取代之金屬[例如M為B(OR)
2、Sn(烷基)
4或Zn-Hal],以獲得式
21衍生物。或者,式
20化合物可為環胺(其中M為H且連接至環Cy中之胺氮),且可在適宜布赫瓦爾德-哈特維希胺化條件(例如在鈀觸媒及鹼(例如第三丁醇鈉)存在下)下實施式
19芳基鹵化物與式
18環胺之偶合。
或者,式
21化合物可使用如方案
5中所概述之反應序列來製備。可使用與方案
4中所述類似之條件(例如用於偶合式
19化合物與式
20化合物之條件)來達成式
17芳族鹵化物與式
20化合物之偶合,以獲得式
22芳族胺,該芳族胺可在如方案
4中所述之適宜S
NAr條件或適宜選擇性偶合反應條件下與式
18化合物之鹵基(Hal
7)反應,以獲得式
21化合物。
III. 化合物之用途
本發明化合物可抑制PD-1/PD-L1蛋白/蛋白相互作用之活性,且因此可用於治療與PD-1活性相關之疾病及病症及與PD-L1 (包括其與諸如PD-1及B7-1 (CD80)等其他蛋白質之相互作用)相關之疾病及病症。在某些實施例中,本發明化合物或其醫藥學上可接受之鹽或立體異構物可用於治療性投與以在癌症或慢性感染中增強免疫性,包括增強對疫苗接種之反應。在一些實施例中,本發明提供抑制PD-1/PD-L1蛋白/蛋白相互作用之方法。該方法包括向個體或患者投與式(I’)、(I)或如本文所述之任一式之化合物或如申請專利範圍中之任一者所列舉及本文所述之化合物或其醫藥學上可接受之鹽或立體異構物。本發明化合物可單獨使用、與其他藥劑或療法組合使用或作為輔助或新輔助療法使用來治療疾病或病症,包括癌症或傳染病。關於本文所述之用途,可使用任一本發明化合物,包括其任一實施例。
本發明化合物抑制PD-1/PD-L1蛋白/蛋白相互作用,從而阻斷PD-1路徑。阻斷PD-1可增強哺乳動物(包括人類)對癌性細胞及傳染病之免疫反應。在一些實施例中,本發明提供在活體內使用式(I’)、(I)化合物或其鹽或立體異構物治療個體或患者使得抑制癌性腫瘤之生長。可使用式(I’)、(I)或如本文所述任一式之化合物或如申請專利範圍中之任一者中所列舉及本文所述之化合物或其鹽或立體異構物來抑制癌性腫瘤之生長。或者,式(I’)、(I)或如本文所述任一式之化合物或如申請專利範圍中之任一者中所列舉及本文所述之化合物或其鹽或立體異構物可與其他藥劑或標準癌症治療結合使用,如下文所述。在一實施例中,本發明提供抑制活體內腫瘤細胞生長之方法。該方法包括使腫瘤細胞在活體內與式(I’)、(I)或如本文所述任一式之化合物或如申請專利範圍中之任一者中所列舉及本文所述之化合物或其鹽或立體異構物接觸。在另一實施例中,本發明提供抑制個體或患者之腫瘤細胞生長之方法。該方法包括向有需要之個體或患者投與治療有效量之式(I’)、(I)或如本文所述任一式之化合物或如申請專利範圍中之任一者中所列舉及本文所述之化合物或其鹽或立體異構物。
在一些實施例中,本文提供治療癌症之方法。該方法包括向有需要之患者投與治療有效量之式(I’)、(I)或如本文所述任一式之化合物、如申請專利範圍中之任一者中所列舉及本文所述之化合物或其鹽。癌症之實例包括可使用本發明化合物抑制其生長之彼等及通常對免疫療法有反應之癌症。
可使用本發明化合物治療之癌症之實例包括(但不限於)骨癌、胰臟癌、皮膚癌、頭頸癌、皮膚或眼內惡性黑色素瘤、子宮癌、卵巢癌、直腸癌、肛區癌、胃癌、睪丸癌、子宮癌、輸卵管癌、子宮內膜之癌、子宮內膜癌、子宮頸癌、陰道癌、陰戶癌、霍奇金氏病(Hodgkin's Disease)、非霍奇金氏淋巴瘤、食道癌、小腸癌、內分泌系統癌、甲狀腺癌、副甲狀腺癌、腎上腺癌、軟組織肉瘤、尿道癌、陰莖癌、慢性或急性白血病(包括急性骨髓樣白血病、慢性骨髓樣白血病、急性淋巴母細胞性白血病、慢性淋巴球性白血病)、兒童實體腫瘤、淋巴球性淋巴瘤、膀胱癌、腎或尿道癌、腎盂癌、中樞神經系統(CNS)贅瘤、原發性CNS淋巴瘤、腫瘤血管生成、脊軸腫瘤、腦幹膠質瘤、垂體腺瘤、卡波西氏肉瘤(Kaposi's sarcoma)、表皮樣癌、鱗狀細胞癌、T細胞淋巴瘤、環境誘導之癌症(包括由石棉誘導之彼等)及該等癌症之組合。本發明化合物亦可用於治療轉移性癌症、尤其表現PD-L1之轉移性癌症。
在一些實施例中,可使用本發明化合物治療之癌症包括黑色素瘤(例如轉移性惡性黑色素瘤)、腎癌(例如透明細胞癌)、前列腺癌(例如激素難治性前列腺腺癌)、乳癌、結腸癌及肺癌(例如非小細胞肺癌)。另外,本發明包括難治性或復發性惡性腫瘤,其生長可使用本發明化合物來抑制。
在一些實施例中,可使用本發明化合物治療之癌症包括(但不限於)實體腫瘤(例如,前列腺癌、結腸癌、食道癌、子宮內膜癌、卵巢癌、子宮癌、腎癌、肝癌、胰臟癌、胃癌、乳癌、肺癌、頭頸癌、甲狀腺癌、神經膠質母細胞瘤、肉瘤、膀胱癌等)、血液癌症(例如淋巴瘤、白血病,例如急性淋巴母細胞性白血病(ALL)、急性髓性白血病(AML)、慢性淋巴球性白血病(CLL)、慢性髓性白血病(CML)、DLBCL、外膜細胞淋巴瘤、非霍奇金氏淋巴瘤(包括復發性或難治性NHL及復發性濾泡性淋巴瘤)、霍奇金氏淋巴瘤或多發性骨髓瘤)及該等癌症之組合。
用本發明化合物阻斷PD-1路徑亦可用於治療感染,例如病毒、細菌、真菌及寄生蟲感染。本發明提供治療感染(例如病毒感染)之方法。該方法包括向有需要之患者投與治療有效量之式(I’)、(I)或如本文所述任一式之化合物、如申請專利範圍中之任一者中所列舉及本文所述之化合物、其鹽。引起可藉由本發明方法治療之感染之病毒的實例包括(但不限於)人類免疫缺陷病毒、人類乳頭瘤病毒、流行性感冒病毒、A型、B型、C型或D型肝炎病毒、腺病毒、痘病毒、單純疱疹病毒、人類巨細胞病毒、嚴重急性呼吸道症候群病毒、伊波拉病毒(ebola virus)及麻疹病毒。在一些實施例中,引起可藉由本發明方法治療之感染之病毒包括(但不限於)肝炎(A型、B型或C型)病毒、疱疹病毒(例如VZV、HSV-1、HAV-6、HSV-II及CMV、艾司坦-巴爾病毒(Epstein Barr virus))、腺病毒、流行性感冒病毒、黃病毒、埃柯病毒(echovirus)、鼻病毒、柯薩奇病毒(coxsackie virus)、冠狀病毒、呼吸道融合病毒、腮腺炎病毒、輪狀病毒、麻疹病毒、德國麻疹病毒、小病毒、痘瘡病毒、HTLV病毒、登革熱病毒(dengue virus)、乳頭瘤病毒、軟疣病毒、脊髓灰白質炎病毒、狂犬病病毒、JC病毒及蟲媒病毒性腦炎病毒。
本發明提供治療細菌感染之方法。該方法包括向有需要之患者投與治療有效量之式(I’)、(I)或如本文所述任一式之化合物、如申請專利範圍中之任一者中所列舉及本文所述之化合物或其鹽。引起可藉由本發明方法治療之感染之致病性細菌之非限制性實例包括披衣菌(chlamydia)、立克次體細菌、分枝桿菌(staphylococci)、葡萄球菌(staphylococci)、鏈球菌(streptococci)、肺炎球菌(pneumonococci)、腦膜炎球菌(meningococci)及淋球菌(conococci)、克留氏菌屬(klebsiella)、變形桿菌屬(proteus)、鋸桿菌屬(serratia)、假單胞菌屬(pseudomonas)、退伍軍人菌屬(legionella)、白喉、沙氏桿菌屬(salmonella)、桿菌、霍亂、破傷風、臘腸菌病、炭疽、瘟疫、鉤端螺旋體病及萊姆病(Lyme's disease)細菌。
本發明提供治療真菌感染之方法。該方法包括向有需要之患者投與治療有效量之式(I’)、(I)或如本文所述任一式之化合物、如申請專利範圍中之任一者中所列舉及本文所述之化合物或其鹽。引起可藉由本發明方法治療之感染之致病性真菌之非限制性實例包括念珠菌屬(Candida) (白色念珠菌(Candida albicans)、克魯斯念珠菌(Candida krusei)、光滑念珠菌(Candida glabrata)、熱帶念珠菌(Candida tropicalis)等)、新型隱球菌(Cryptococcus neoformans)、麴菌屬(Aspergillus) (熏煙色麴菌(Aspergillus fumigatus)、黑麴菌(Aspergillus niger)等)、毛黴屬(Genus Mucorales) (毛黴菌屬(mucor)、犁頭黴屬(absidia)、根黴菌屬(rhizopus))、申克氏孢子絲菌(Sporothrix schenkii)、皮炎芽生菌(Blastomyces dermatitidis)、巴西副球孢子菌(Paracoccidioides brasiliensis)、粗球黴菌(Coccidioides immitis)及莢膜組織漿菌(Histoplasma capsulatum)。
本發明提供治療寄生蟲感染之方法。該方法包括向有需要之患者投與治療有效量之式(I’)、(I)或如本文所述任一式之化合物、如申請專利範圍中之任一者中所列舉及本文所述之化合物或其鹽。引起可藉由本發明方法治療之感染之致病性寄生蟲之非限制性實例包括溶組織內阿米巴(Entamoeba histolytica)、大腸絨毛蟲(Balantidium coli)、福氏耐格里變形蟲(Naegleriafowleri)、棘狀變形蟲屬(Acanthamoeba sp.)、梨形鞭毛蟲(Giardia lamblia)、隱孢子蟲屬(Cryptosporidium sp.)、卡氏肺囊蟲(Pneumocystis carinii)、間日瘧原蟲(Plasmodium vivax)、小鼠焦蟲(Babesia microti)、布氏錐蟲(Trypanosoma brucei)、克氏錐蟲(Trypanosoma cruzi)、黑熱病利什曼原蟲(Leishmania donovani)、弓蟲(Toxoplasma gondii)及巴西鼠鉤蟲(Nippostrongylus brasiliensis)。
術語「個體」或「患者」可互換使用且指任何動物,包括哺乳動物,較佳小鼠、大鼠、其他囓齒類動物、兔、狗、貓、豬、牛、綿羊、馬或靈長類動物,且最佳人類。
片語「治療有效量」指活性化合物或醫藥劑在組織、系統、動物、個體或人類中引發研究者、獸醫師、醫師或其他臨床醫師所尋求之生物或醫學反應之量。
如本文所用,術語「治療(treating)」或「治療(treatment)」指以下中之一或多者:(1) 抑制疾病;例如,抑制正經歷或顯示疾病、病況或病症之病理學或症狀學之個體之疾病、病況或病症(即阻止病理學及/或症狀學之進一步發展);及(2) 改善疾病;例如,改善正經歷或顯示疾病、病況或病症之病理學或症狀學之個體之疾病、病況或病症(即逆轉病理學及/或症狀學),例如減輕疾病之嚴重程度。
在一些實施例中,本發明化合物可用於預防或降低罹患本文所提及之任一疾病之風險;例如,預防或降低可能易患疾病、病況或病症但尚未經歷或顯示該疾病之病理學或症狀學之個體罹患該疾病、病況或病症之風險。
組合療法
癌症細胞生長及存活可受多個信號傳導路徑之影響。因此,組合不同的酶/蛋白質/受體抑制劑,從而在活性受其調節之靶中展現不同偏好可用於治療此類病況。靶向一個以上之信號傳導路徑(或一個以上之參與給定信號傳導路徑之生物分子)可降低細胞群中出現之抗藥性之可能性及/或降低治療之毒性。
本發明化合物可與一或多種其他酶/蛋白質/受體抑制劑組合使用來治療疾病,例如癌症或感染。癌症之實例包括實體腫瘤及液體腫瘤,例如血液癌症。感染之實例包括病毒感染、細菌感染、真菌感染或寄生蟲感染。舉例而言,本發明化合物可與一或多種以下激酶之抑制劑組合來治療癌症:Akt1、Akt2、Akt3、TGF-βR、PKA、PKG、PKC、CaM激酶、磷酸化酶激酶、MEKK、ERK、MAPK、mTOR、EGFR、HER2、HER3、HER4、INS-R、IGF-1R、IR-R、PDGFαR、PDGFβR、CSFIR、KIT、FLK-II、KDR/FLK-1、FLK-4、flt-1、FGFR1、FGFR2、FGFR3、FGFR4、c-Met、Ron、Sea、TRKA、TRKB、TRKC、FLT3、VEGFR/Flt2、Flt4、EphA1、EphA2、EphA3、EphB2、EphB4、Tie2、Src、Fyn、Lck、Fgr、Btk、Fak、SYK、FRK、JAK、ABL、ALK及B-Raf。在一些實施例中,本發明化合物可與以下抑制劑中之一或多者組合來治療癌症或感染。可與本發明化合物組合來治療癌症及感染之抑制劑之非限制性實例包括FGFR抑制劑(FGFR1、FGFR2、FGFR3或FGFR4,例如INCB54828、INCB62079及INCB63904)、JAK抑制劑(JAK1及/或JAK2,例如魯索替尼(ruxolitinib)、白瑞西替尼(baricitinib)或INCB39110)、IDO抑制劑(例如依波斯他(epacadostat)及NLG919)、LSD1抑制劑(例如INCB59872及INCB60003)、TDO抑制劑、PI3K-δ抑制劑、PI3K-γ抑制劑(例如PI3K-γ選擇性抑制劑,例如INCB50797)、Pim抑制劑、CSF1R抑制劑、TAM受體酪胺酸激酶(Tyro-3、Axl及Mer)、血管生成抑制劑、介白素受體抑制劑、含溴及額外末端結構域家族成員抑制劑(例如溴結構域抑制劑或BET抑制劑,例如INCB54329及INCB57643)及三磷酸腺苷受體拮抗劑或其組合。
本發明化合物可與一或多種免疫檢查點抑制劑組合使用。實例性免疫檢查點抑制劑包括針對諸如以下等免疫檢查點分子之抑制劑:CD27、CD28、CD40、CD122、CD96、CD73、CD47、OX40、GITR、CSF1R、JAK、PI3K δ、PI3K γ、TAM、精胺酸酶、CD137 (亦稱為4-1BB)、ICOS、A2AR、B7-H3、B7-H4、BTLA、CTLA-4、LAG3、TIM3、VISTA、PD-1、PD-L1及PD-L2。在一些實施例中,免疫檢查點分子為選自以下之刺激性檢查點分子:CD27、CD28、CD40、ICOS、OX40、GITR及CD137。在一些實施例中,免疫檢查點分子為選自以下之抑制性檢查點分子:A2AR、B7-H3、B7-H4、BTLA、CTLA-4、IDO、KIR、LAG3、PD-1、TIM3及VISTA。在一些實施例中,本文所提供之化合物可與一或多種選自以下之藥劑組合使用:KIR抑制劑、TIGIT抑制劑、LAIR1抑制劑、CD160抑制劑、2B4抑制劑及TGFR β抑制劑。
在一些實施例中,免疫檢查點分子之抑制劑為抗PD1抗體、抗PD-L1抗體或抗CTLA-4抗體。
在一些實施例中,免疫檢查點分子之抑制劑為PD-1之抑制劑,例如抗PD-1單株抗體。在一些實施例中,抗PD-1單株抗體為尼沃魯單抗(nivolumab)、派姆單抗(pembrolizumab) (亦稱為MK-3475)、皮地珠單抗(pidilizumab)、SHR-1210、PDR001或AMP-224。在一些實施例中,抗PD-1單株抗體為尼沃魯單抗或派姆單抗。在一些實施例中,抗PD1抗體為派姆單抗。在一些實施例中,抗PD-1抗體為SHR-1210。
在一些實施例中,免疫檢查點分子之抑制劑為PD-L1之抑制劑,例如抗PD-L1單株抗體。在一些實施例中,抗PD-L1單株抗體為BMS-935559、MEDI4736、MPDL3280A (亦稱為RG7446)或MSB0010718C。在一些實施例中,抗PD-L1單株抗體為MPDL3280A或MEDI4736。
在一些實施例中,免疫檢查點分子之抑制劑為CTLA-4之抑制劑,例如抗CTLA-4抗體。在一些實施例中,抗CTLA-4抗體為伊匹單抗(ipilimumab)。
在一些實施例中,免疫檢查點分子之抑制劑為LAG3之抑制劑,例如抗LAG3抗體。在一些實施例中,抗LAG3抗體為BMS-986016或LAG525。
在一些實施例中,免疫檢查點分子之抑制劑為GITR之抑制劑,例如抗GITR抗體。在一些實施例中,抗GITR抗體為TRX518或MK-4166。
在一些實施例中,免疫檢查點分子之抑制劑為OX40之抑制劑,例如抗OX40抗體或OX40L融合蛋白。在一些實施例中,抗OX40抗體為MEDI0562。在一些實施例中,OX40L融合蛋白為MEDI6383。
本發明化合物可與一或多種治療諸如癌症等疾病之藥劑組合使用。在一些實施例中,藥劑為烷基化劑、蛋白酶體抑制劑、皮質類固醇或免疫調節劑。烷基化劑之實例包括環磷醯胺(CY)、美法侖(melphalan) (MEL)及苯達莫斯汀(bendamustine)。在一些實施例中,蛋白酶體抑制劑為卡非左米(carfilzomib)。在一些實施例中,皮質類固醇為地塞米松(dexamethasone) (DEX)。在一些實施例中,免疫調節劑為來那度胺(lenalidomide) (LEN)或泊馬度胺(pomalidomide) (POM)。
本發明化合物可另外與治療癌症之其他方法(例如藉由化學療法、照射療法、腫瘤靶向療法、輔助療法、免疫療法或手術)組合使用。免疫療法之實例包括細胞介素治療(例如干擾素、GM-CSF、G-CSF、IL-2)、CRS-207免疫療法、癌症疫苗、單株抗體、授受性T細胞轉移、溶瘤病毒療法及免疫調節小分子(包括沙利度胺(thalidomide)或JAK1/2抑制劑)及諸如此類。化合物可與一或多種抗癌藥物(例如化學治療劑)組合投與。實例性化學治療劑包括以下中之任一者:阿巴瑞克(abarelix)、阿地白介素(aldesleukin)、阿倫珠單抗(alemtuzumab)、阿利維A酸(alitretinoin)、異嘌呤醇(allopurinol)、六甲蜜胺(altretamine)、阿那曲唑(anastrozole)、三氧化砷、天冬醯胺酶、阿紮胞苷(azacitidine)、貝伐珠單抗(bevacizumab)、貝沙羅汀(bexarotene)、白瑞西替尼、博來黴素(bleomycin)、硼替佐米(bortezombi)、硼替佐米(bortezomib)、靜脈內白消安(busulfan)、口服白消安、卡普睪酮(calusterone)、卡培他濱(capecitabine)、卡鉑(carboplatin)、卡莫司汀(carboplatin)、西妥昔單抗(cetuximab)、苯丁酸氮芥(chlorambucil)、順鉑(cisplatin)、克拉屈濱(cladribine)、氯法拉濱(clofarabine)、環磷醯胺、阿糖胞苷(cytarabine)、達喀爾巴嗪(dacarbazine)、放線菌素D (dactinomycin)、達肝素鈉(dalteparin sodium)、達沙替尼(dasatinib)、道諾黴素(daunorubicin)、地西他濱(decitabine)、地尼介白素(denileukin)、地尼介白素毒素連接物(denileukin diftitox)、右雷佐生(dexrazoxane)、多西他賽(docetaxel)、多柔比星(doxorubicin)、丙酸屈他雄酮(dromostanolone propionate)、依庫珠單抗(eculizumab)、表柔比星(epirubicin)、厄洛替尼(erlotinib)、雌莫司汀(estramustine)、磷酸依託泊苷(etoposide phosphate)、依託泊苷、依西美坦(exemestane)、檸檬酸芬太尼(fentanylcitrate)、非格司亭(filgrastim)、氟尿苷(floxuridine)、氟達拉濱(fludarabine)、氟尿嘧啶、氟韋司群(fulvestrant)、吉非替尼(gefitinib)、吉西他濱(gemcitabine)、吉妥單抗奧佐米星(gemtuzumab ozogamicin)、乙酸戈舍瑞林(goserelin acetate)、乙酸組胺瑞林(histrelin acetate)、替伊莫單抗(ibritumomab tiuxetan)、埃達黴素(idarubicin)、異環磷醯胺(ifosfamide)、甲磺酸伊馬替尼(imatinib mesylate)、干擾素α 2a、伊立替康(irinotecan)、二甲苯磺酸拉帕替尼(lapatinib ditosylate)、來那度胺、來曲唑(letrozole)、若克瘤(leucovorin)、乙酸亮丙瑞林(leuprolide acetate)、左旋咪唑(levamisole)、洛莫司汀(lomustine)、二氯甲基二乙胺(meclorethamine)、乙酸甲地孕酮(megestrol acetate)、美法侖、巰基嘌呤、胺甲喋呤(methotrexate)、甲氧沙林(methoxsalen)、絲裂黴素C (mitomycin C)、米托坦(mitotane)、米托蒽醌(mitoxantrone)、苯丙酸諾龍(nandrolone phenpropionate)、奈拉濱(nelarabine)、諾非單抗(nofetumomab)、奧沙利鉑(oxaliplatin)、紫杉醇(paclitaxel)、帕米膦酸(pamidronate)、帕尼單抗(panitumumab)、培門冬酶(pegaspargase)、聚乙二醇化非格司亭(pegfilgrastim)、培美曲塞二鈉(pemetrexed disodium)、噴司他丁(pentostatin)、哌血生(pipobroman)、普卡黴素(plicamycin)、丙卡巴肼(procarbazine)、奎那克林(quinacrine)、拉布立酶(rasburicase)、利妥昔單抗(rituximab)、魯索替尼、索拉菲尼(sorafenib)、脲鏈黴素(streptozocin)、舒尼替尼(sunitinib)、馬來酸舒尼替尼、他莫昔芬(tamoxifen)、替莫唑胺(temozolomide)、替尼泊苷(teniposide)、睪內酯(testolactone)、沙利度胺、硫鳥嘌呤、塞替派(thiotepa)、托泊替康(topotecan)、托瑞米芬(toremifene)、托西莫單抗(tositumomab)、曲妥珠單抗(trastuzumab)、維A酸(tretinoin)、尿嘧啶氮芥、戊柔比星(valrubicin)、長春鹼(vinblastine)、長春新鹼(vincristine)、長春瑞濱(vinorelbine)、弗利諾他(vorinostat)及唑來膦酸(zoledronate)。
其他抗癌劑包括抗體治療劑,例如曲妥珠單抗(Herceptin)、針對共刺激分子(例如CTLA-4)之抗體(例如伊匹單抗)、4-1BB、針對PD-1及PD-L1之抗體或針對細胞介素(IL-10、TGF-β等)之抗體。可與本發明化合物組合來治療癌症或感染(例如病毒、細菌、真菌及寄生蟲感染)之針對PD-1及/或PD-L1之抗體的實例包括(但不限於)尼沃魯單抗、派姆單抗、MPDL3280A、MEDI-4736及SHR-1210。
在一些實施例中,抗癌劑為烷基化劑、蛋白酶體抑制劑、皮質類固醇或免疫調節劑。烷基化劑之實例包括環磷醯胺(CY)、美法侖(MEL)及苯達莫斯汀。在一些實施例中,蛋白酶體抑制劑為卡非左米。在一些實施例中,皮質類固醇為地塞米松(DEX)。在一些實施例中,免疫調節劑為來那度胺(LEN)或泊馬度胺(POM)。
式(I’)或(I)或如本文所述任一式之化合物、如申請專利範圍中之任一者中所列舉及本文所述之化合物或其鹽、立體異構物可與免疫檢查點抑制劑組合使用來治療癌症及病毒感染。
實例性免疫檢查點抑制劑包括針對諸如以下等免疫檢查點分子之抑制劑:CD27、CD28、CD40、CD122、CD96、CD73、CD47、OX40、GITR、CSF1R、JAK、PI3K δ、PI3K γ、TAM、精胺酸酶、CD137 (亦稱為4-1BB)、ICOS、A2AR、B7-H3、B7-H4、BTLA、CTLA-4、LAG3、TIM3、VISTA、PD-1、PD-L1及PD-L2。在一些實施例中,免疫檢查點分子為選自以下之刺激性檢查點分子:CD27、CD28、CD40、ICOS、OX40、GITR及CD137。在一些實施例中,免疫檢查點分子為選自以下之抑制性檢查點分子:A2AR、B7-H3、B7-H4、BTLA、CTLA-4、IDO、KIR、LAG3、PD-1、TIM3及VISTA。在一些實施例中,本文所提供之化合物可與一或多種選自以下之藥劑組合使用:KIR抑制劑、TIGIT抑制劑、LAIR1抑制劑、CD160抑制劑、2B4抑制劑及TGFRβ抑制劑。
在一些實施例中,免疫檢查點分子之抑制劑為抗PD1抗體、抗PD-L1抗體或抗CTLA-4抗體。
在一些實施例中,免疫檢查點分子之抑制劑為PD-1之抑制劑,例如抗PD-1單株抗體。在一些實施例中,抗PD-1單株抗體為尼沃魯單抗、派姆單抗(亦稱為MK-3475)、皮地珠單抗、SHR-1210、PDR001或AMP-224。在一些實施例中,抗PD-1單株抗體為尼沃魯單抗或派姆單抗。在一些實施例中,抗PD1抗體為派姆單抗。
在一些實施例中,免疫檢查點分子之抑制劑為PD-L1之抑制劑,例如抗PD-L1單株抗體。在一些實施例中,抗PD-L1單株抗體為BMS-935559、MEDI4736、MPDL3280A (亦稱為RG7446)或MSB0010718C。在一些實施例中,抗PD-L1單株抗體為MPDL3280A或MEDI4736。
在一些實施例中,免疫檢查點分子之抑制劑為CTLA-4之抑制劑,例如抗CTLA-4抗體。在一些實施例中,抗CTLA-4抗體為伊匹單抗。
在一些實施例中,免疫檢查點分子之抑制劑為LAG3之抑制劑,例如抗LAG3抗體。在一些實施例中,抗LAG3抗體為BMS-986016或LAG525
。
在一些實施例中,免疫檢查點分子之抑制劑為GITR之抑制劑,例如抗GITR抗體。在一些實施例中,抗GITR抗體為TRX518或MK-4166。
在一些實施例中,免疫檢查點分子之抑制劑為OX40之抑制劑,例如抗OX40抗體或OX40L融合蛋白。在一些實施例中,抗OX40抗體為MEDI0562。在一些實施例中,OX40L融合蛋白為MEDI6383。
本發明化合物可進一步與一或多種抗發炎劑、類固醇、免疫阻抑劑或治療性抗體組合使用。
式(I’)、(I)或如本文所述任一式之化合物、如申請專利範圍中之任一者中所列舉及本文所述之化合物或其鹽可與諸如以下等另一免疫原性劑組合:癌性細胞、經純化之腫瘤抗原(包括重組蛋白質、肽及碳水化合物分子)、細胞及經編碼免疫刺激性細胞介素之基因轉染之細胞。可用腫瘤疫苗之非限制性實例包括黑色素瘤抗原之肽,例如gp100、MAGE抗原、Trp-2、MARTI及/或酪胺酸酶之肽或經轉染以表現細胞介素GM-CSF之腫瘤細胞。
式(I’)、(I)或如本文所述任一式之化合物、如申請專利範圍中之任一者中所列舉及本文所述之化合物或其鹽可與疫苗接種方案組合使用來治療癌症。在一些實施例中,腫瘤細胞經轉導以表現GM-CSF。在一些實施例中,腫瘤疫苗包括參與諸如以下等人類癌症之病毒之蛋白質:人類乳頭瘤病毒(HPV)、肝炎病毒(HBV及HCV)及卡波西氏疱疹肉瘤病毒(KHSV)。在一些實施例中,本發明化合物可與腫瘤特異性抗原(例如自腫瘤組織自身分離之熱休克蛋白)組合使用。在一些實施例中,式(I’)、(I)或如本文所述任一式之化合物、如申請專利範圍中之任一者中所列舉及本文所述之化合物或其鹽可與樹突狀細胞免疫組合來活化強效抗腫瘤反應。
本發明化合物可與使表現Fe α或Fe γ受體之效應細胞靶向腫瘤細胞之雙特異性大環肽組合使用。本發明化合物亦可與活化宿主免疫反應性之大環肽組合。
本發明化合物可與骨髓移植組合使用來治療多種造血來源之腫瘤。
式(I’)、(I)或如本文所述任一式之化合物、如申請專利範圍中之任一者中所列舉及本文所述之化合物或其鹽可與疫苗組合使用來刺激針對病原體、毒素及自體抗原之免疫反應。此治療方法可尤其有用之病原體之實例包括當前無有效疫苗之病原體或習用疫苗不夠完全有效之病原體。該等病原體包括(但不限於) HIV、肝炎病毒(A型、B型及C型)、流行性感冒病毒、疱疹病毒、梨形鞭毛蟲屬(Giardia)、瘧疾、利什曼原蟲屬(Leishmania)、金黃色葡萄球菌(Staphylococcus aureus)、綠膿桿菌(Pseudomonas Aeruginosa)。
引起可藉由本發明方法治療之感染之病毒包括(但不限於)人類乳頭瘤病毒、流行性感冒病毒、A型、B型、C型或D型肝炎病毒、腺病毒、痘病毒、單純疱疹病毒、人類巨細胞病毒、嚴重急性呼吸道症候群病毒、伊波拉病毒、麻疹病毒、疱疹病毒(例如VZV、HSV-1、HAV-6、HSV-II及CMV、艾司坦-巴爾病毒)、黃病毒、埃柯病毒、鼻病毒、柯薩奇病毒、冠狀病毒、呼吸道融合病毒、腮腺炎病毒、輪狀病毒、麻疹病毒、德國麻疹病毒、小病毒、痘瘡病毒、HTLV病毒、登革熱病毒、乳頭瘤病毒、軟疣病毒、脊髓灰白質炎病毒、狂犬病病毒、JC病毒及蟲媒病毒性腦炎病毒。
引起可藉由本發明方法治療之感染之致病性細菌包括(但不限於)披衣菌、立克次體細菌、分枝桿菌、葡萄球菌、鏈球菌、肺炎球菌、腦膜炎球菌及淋球菌、克留氏菌屬、變形桿菌屬、鋸桿菌屬、假單胞菌屬、退伍軍人菌屬、白喉、沙氏桿菌屬、桿菌、霍亂、破傷風、臘腸菌病、炭疽、瘟疫、鉤端螺旋體病及萊姆病細菌。
引起可藉由本發明方法治療之感染之致病性真菌包括(但不限於)念珠菌屬(白色念珠菌、克魯斯念珠菌、光滑念珠菌、熱帶念珠菌等)、新型隱球菌、麴菌屬(熏煙色麴菌、黑麴菌等)、毛黴屬(毛黴菌屬、犁頭黴屬、根黴菌屬)、申克氏孢子絲菌、皮炎芽生菌、巴西副球孢子菌、粗球黴菌及莢膜組織漿菌。
引起可藉由本發明方法治療之感染之致病性寄生蟲包括(但不限於)溶組織內阿米巴、大腸絨毛蟲、福氏耐格里變形蟲、棘狀變形蟲屬、梨形鞭毛蟲、隱孢子蟲屬、卡氏肺囊蟲、間日瘧原蟲、小鼠焦蟲、布氏錐蟲、克氏錐蟲、黑熱病利什曼原蟲、弓蟲及巴西鼠鉤蟲。
當向患者投與一種以上之醫藥劑時,其可同時、分開、依序或以組合形式(例如針對兩種以上之藥劑)投與。
IV. 調配物、劑型及投與
當用作醫藥時,本發明化合物可以醫藥組合物形式來投與。因此,本發明提供組合物,其包含式(I’)、(I)或如本文所述任一式之化合物、如申請專利範圍中之任一者中所列舉及本文所述之化合物或其醫藥學上可接受之鹽或其任一實施例,及至少一種醫藥學上可接受之載劑或賦形劑。該等組合物可以醫藥業內所熟知之方式製備,且可藉由多個途徑來投與,此端視指示局部抑或全身性治療及欲治療區域而定。投與可為局部(包括經皮、表皮、眼部及至黏膜,包括鼻內、陰道及直腸遞送)、肺(例如藉由吸入或吹入粉劑或氣溶膠,包括藉由噴霧器;氣管內或鼻內)、經口或非經腸。非經腸投與包括靜脈內、動脈內、皮下、腹膜內、肌內或注射或輸注;或顱內,例如鞘內或心室內投與。非經腸投與可呈單次濃注劑量形式,或可例如藉由連續灌注幫浦。用於局部投與之醫藥組合物及調配物可包括經皮貼片、軟膏、洗劑、乳霜、凝膠、滴劑、栓劑、噴霧劑、液體及粉劑。可需要或期望習用醫藥載劑、水溶液、粉劑或油性基底、增稠劑及諸如此類。
本發明亦包括醫藥組合物,其含有本發明化合物或其醫藥學上可接受之鹽作為活性成份與一或多種醫藥學上可接受之載劑或賦形劑之組合。在一些實施例中,組合物適於局部投與。在製備本發明組合物時,活性成份通常與賦形劑混合、經賦形劑稀釋或裝入呈例如膠囊、藥囊、紙或其他容器形式之此類載劑內。當賦形劑充當稀釋劑時,其可為固體、半固體或液體材料,該等材料用作媒劑、載劑或活性成份之介質。因此,組合物可呈以下形式:錠劑、丸劑、粉劑、菱形錠劑、藥囊、藥丸、酏劑、懸浮液、乳液、溶液、糖漿、氣溶膠(呈固體形式或於液體介質中)、含有例如至多10重量%之活性化合物之軟膏、軟及硬明膠膠囊、栓劑、無菌可注射溶液及無菌包裝粉劑。
在製備調配物時,可將活性化合物研磨以在與其他成份組合之前提供適宜粒徑。若活性化合物實質上為不可溶的,則可將其研磨至小於200目之粒徑。若活性化合物實質上為水溶性的,則可藉由研磨調節粒徑以提供在調配物中實質上均勻之分佈,例如約40目。
本發明化合物可使用已知研磨程序(例如濕式研磨)來研磨以獲得適於錠劑形成及適於其他調配物類型之粒徑。本發明化合物之精細(奈米微粒)製劑可藉由業內已知之方法來製備,參見例如WO 2002/000196。
適宜賦形劑之一些實例包括乳糖、右旋糖、蔗糖、山梨醇、甘露醇、澱粉、阿拉伯樹膠、磷酸鈣、海藻酸鹽、黃蓍膠、明膠、矽酸鈣、微晶纖維素、聚乙烯基吡咯啶酮、纖維素、水、糖漿及甲基纖維素。調配物可另外包括:潤滑劑,例如滑石、硬脂酸鎂及礦物油;潤濕劑;乳化及懸浮劑;防腐劑,例如苯甲酸甲基酯及苯甲酸丙基羥基酯;甜味劑;及矯味劑。本發明組合物可經調配以在藉由採用業內已知之程序投與患者後提供活性成份之快速、持續或延遲釋放。
在一些實施例中,醫藥組合物包含矽化微晶纖維素(SMCC)及至少一種本文所述化合物或其醫藥學上可接受之鹽。在一些實施例中,矽化微晶纖維素包含約98%微晶纖維素及約2%二氧化矽w/w。
在一些實施例中,組合物為持續釋放組合物,其包含至少一種本文所述化合物或其醫藥學上可接受之鹽及至少一種醫藥學上可接受之載劑或賦形劑。在一些實施例中,組合物包含至少一種本文所述化合物或其醫藥學上可接受之鹽及至少一種選自微晶纖維素、乳糖單水合物、羥丙基甲基纖維素及聚氧化乙烯之組分。在一些實施例中,組合物包含至少一種本文所述化合物或其醫藥學上可接受之鹽及微晶纖維素、乳糖單水合物及羥丙基甲基纖維素。在一些實施例中,組合物包含至少一種本文所述化合物或其醫藥學上可接受之鹽及微晶纖維素、乳糖單水合物及聚氧化乙烯。在一些實施例中,組合物另外包含硬脂酸鎂或二氧化矽。在一些實施例中,微晶纖維素為Avicel PH102™。在一些實施例中,乳糖單水合物為Fast-flo 316™。在一些實施例中,羥丙基甲基纖維素為羥丙基甲基纖維素2208 K4M (例如Methocel K4 M Premier™)及/或羥丙基甲基纖維素2208 K100LV (例如Methocel K00LV™)。在一些實施例中,聚氧化乙烯為聚氧化乙烯WSR 1105 (例如Polyox WSR 1105™)。
在一些實施例中,使用濕式粒化方法來產生組合物。在一些實施例中,使用乾式粒化方法來產生組合物。
組合物可以單位劑型來調配,每一劑量含有約5 mg至約1,000 mg (1 g)、更通常而言約100 mg至約500 mg活性成份。在一些實施例中,每一劑量含有約10 mg活性成份。在一些實施例中,每一劑量含有約50 mg活性成份。在一些實施例中,每一劑量含有約25 mg活性成份。術語「單位劑型」指適於作為單一劑量用於人類個體及其他哺乳動物之物理離散單位,各單位含有經計算可產生期望治療效應之預定量的活性材料以及適宜醫藥賦形劑。
用於調配醫藥組合物之組分具有高質量且實質上不含可能有害之污染物(例如,至少國家食品級,通常至少分析級,且更通常至少醫藥級)。具體而言對於人類消耗,組合物較佳根據如美國食品藥品管理局(U.S. Food and Drug Administration)之適用規則所定義之良好製造實踐(Good Manufacturing Practice)標準來製造或調配。舉例而言,適宜調配物可為無菌及/或實質上等滲及/或完全順從美國食品藥品管理局之所有良好製造實踐規則。
活性化合物可在寬劑量範圍內有效且通常以治療有效量來投與。然而,應理解,實際上投與之化合物之量通常將由醫師根據相關情況來確定,該等情況包括欲治療病況、所選投與途徑、所投與之實際化合物、個體患者之年齡、體重及反應、患者症狀之嚴重程度及諸如此類)。
本發明化合物之治療劑量可根據例如以下等因素而變化:進行治療之具體使用、化合物之投與方式、患者之健康狀況及病況以及主治醫師之判斷。醫藥組合物中本發明化合物之比例或濃度可端視多個因素而變化,包括劑量、化學特徵(例如疏水性)及投與途徑。舉例而言,本發明化合物可以含有約0.1%至約10% w/v化合物之生理緩衝水溶液形式提供用於非經腸投與。一些典型劑量範圍為約1 μg/kg至約1 g/kg體重/天。在一些實施例中,劑量範圍為約0.01 mg/kg至約100 mg/kg體重/天。劑量可能端視諸如以下等變量而定:疾病或病症之類型及其進展程度、特定患者之總體健康狀況、所選化合物之相對生物效能、賦形劑之調配及其投與途徑。可根據得自活體外或動物模型測試系統之劑量-反應曲線來推斷有效劑量。
為製備諸如錠劑等固體組合物,將主要活性成份與醫藥賦形劑混合以形成含有本發明化合物之均質混合物之固體預調配組合物。當提及該等均質預調配組合物時,活性成份通常均勻分散於整個組合物中,以使得可容易地將組合物細分成同樣有效之單位劑型,例如錠劑、丸劑及膠囊。然後將此固體預調配物細分成含有例如約0.1 mg至約1000 mg本發明活性成份之上述類型之單位劑型。
本發明之錠劑或丸劑可經塗覆或以其他方式化合以提供提供延長作用的優點之劑型。舉例而言,錠劑或丸劑可包含內部劑量組分及外部劑量組分,後者呈前者上之包膜形式。兩種組分可藉由用於抵抗胃中之崩解且容許內部組分完整進入十二指腸中或容許延遲釋放之腸溶層分離。多種材料可用於此類腸溶層或包衣,此類材料包括多種聚合酸及聚合酸與諸如蟲膠、鯨蠟醇及乙酸纖維素等材料之混合物。
可納入本發明化合物及組合物以經口或藉由注射投與之液體形式包括水溶液、經適宜矯味之糖漿、水性或油性懸浮液及經食用油(例如棉籽油、芝麻油、椰子油或花生油)矯味之乳液以及酏劑及類似醫藥媒劑。
用於吸入或吹入之組合物包括醫藥學上可接受之水性或有機溶劑中之溶液及懸浮液或其混合物及粉劑。液體或固體組合物可含有如上文所述之適宜醫藥學上可接受之賦形劑。在一些實施例中,組合物藉由經口或鼻呼吸途徑來投與用於局部或全身效應。組合物可藉由使用惰性氣體來霧化。霧化溶液可直接自霧化裝置來呼吸或霧化裝置可連接至面罩、塞條或間歇性正壓呼吸機。溶液、懸浮液或粉劑組合物可自以適當方式遞送調配物之裝置經口或經鼻投與。
局部調配物可含有一或多種習用載劑。在一些實施例中,軟膏可含有水及一或多種選自例如以下等疏水性載劑:液體石蠟、聚氧乙烯烷基醚、丙二醇、白凡士林及諸如此類。乳霜之載劑組合物可基於水與甘油及一或多種其他組分(例如甘油單硬脂酸酯、PEG-甘油單硬脂酸酯及鯨蠟硬脂醇)之組合。凝膠可使用異丙基醇及水適宜地與其他組分(例如甘油、羥乙基纖維素及諸如此類)之組合來調配。在一些實施例中,局部調配物含有至少約0.1 wt %、至少約0.25 wt %、至少約0.5 wt %、至少約1 wt %、至少約2 wt %或至少約5 wt %之本發明化合物。局部調配物可適宜地包裝於例如100 g管中,該等管視情況附有用於治療所選適應症(例如牛皮癬或其他皮膚病況)之說明書。
投與患者之化合物或組合物之量將端視以下因素而變化:被投與者、投與目的(例如預防或治療)、患者之狀態、投與方式及諸如此類。在治療應用中,組合物可以足以治癒或至少部分地阻止疾病之症狀及其併發症之量投與已患有疾病之患者。有效劑量將端視所治療之疾病病況以及主治醫師端視諸如疾病之嚴重程度、患者之年齡、體重及一般狀況及諸如此類等因素之判斷而定。
投與患者之組合物可呈上述醫藥組合物形式。該等組合物可藉由習用除菌技術來除菌,或可經過濾除菌。水溶液可經包裝以原樣或凍乾形式使用,在投與之前將凍乾製劑與無菌水性載劑組合。化合物製劑之pH通常將介於3與11之間,更佳為5至9且最佳為7至8。應理解,使用某些前述賦形劑、載劑或穩定劑將可形成醫藥鹽。
本發明化合物之治療劑量可根據例如以下等因素而變化:進行治療之具體使用、化合物之投與方式、患者之健康狀況及病況以及主治醫師之判斷。醫藥組合物中本發明化合物之比例或濃度可端視多種因素而變化,包括劑量、化學特徵(例如疏水性)及投與途徑。舉例而言,本發明化合物可以含有約0.1%至約10% w/v化合物之生理緩衝水溶液形式提供用於非經腸投與。一些典型劑量範圍為約1 µg/kg至約1 g/kg體重/天。在一些實施例中,劑量範圍為約0.01 mg/kg至約100 mg/kg體重/天。劑量可能端視諸如以下等變量而定:疾病或病症之類型及其進展程度、特定患者之總體健康狀況、所選化合物之相對生物效能、賦形劑之調配及其投與途徑。可根據得自活體外或動物模型測試系統之劑量-反應曲線來推斷有效劑量。
V. 經標記化合物及分析方法
本發明化合物可進一步用於研究正常及異常組織中之生物過程。因此,本發明之另一態樣係關於本發明之經標記化合物(經放射性標記、經螢光標記等),其不僅可用於成像技術中亦可用於活體外及活體內分析中,用於定位及量化組織樣品(包括人類)中之PD-1或PD-L1蛋白,及用於藉由抑制經標記化合物之結合鑑別PD-L1配位體。因此,本發明包括含有此類經標記化合物之PD-1/PD-L1結合分析。
本發明另外包括本發明之經同位素取代之化合物。「經同位素取代」之化合物為其中一或多個原子經原子質量或質量數不同於通常在自然界中發現(即天然)之原子質量或質量數之原子替代或取代的本發明化合物。應理解,「經放射性標記」之化合物為納入至少一種放射活性同位素(例如放射性核種)之化合物。可納入本發明化合物中之適宜放射性核種包括(但不限於)
3H (對於氚亦寫為T)、
11C、
13C、
14C、
13N、
15N、
15O、
17O、
18O、
18F、
35S、
36Cl、
82Br、
75Br、
76Br、
77Br、
123I、
124I、
125I及
131I。納入本發明放射性標記化合物中之放射性核種將端視該放射性標記化合物之特定應用而定。舉例而言,對於活體外PD-L1蛋白標記及競爭分析,納入
3H、
14C、
82Br、
125I、
131I、
35S或之化合物通常將最有用。對於放射性成像應用,
11C、
18F、
125I、
123I、
124I、
131I、
75Br、
76Br或
77Br通常將最有用。在一些實施例中,放射性核種選自由
3H、
14C、
125I、
35S及
82Br組成之群。將放射性同位素納入有機化合物中之合成方法為業內已知。
特定而言,本發明之經標記化合物可於篩選分析中用以鑑別及/或評估化合物。舉例而言,經標記之新合成或鑑別之化合物(即測試化合物)結合PD-L1蛋白之能力可經由追蹤標記監測其與PD-L1蛋白接觸時之濃度變化來評估。舉例而言,可評估測試化合物(經標記)減少已知結合至PD-L1蛋白之另一化合物(即標準化合物)之結合之能力。因此,測試化合物與標準化合物競爭結合至PD-L1蛋白之能力與其結合親和力直接相關。相反,在一些其他篩選分析中,標準化合物經標記且測試化合物未經標記。因此,監測經標記標準化合物之濃度以評估標準化合物與測試化合物之間之競爭,且因此確定測試化合物之相對結合親和力。
VI. 套組
本發明亦包括醫藥套組,其可用於例如治療或預防與PD-L1活性(包括其與諸如PD-1及B7-1 (CD80)等其他蛋白質之相互作用)相關之疾病或病症(例如癌症或感染),該等套組包括一或多個容器,該等容器含有包含治療有效量之式(I’)、(I)化合物或其任一實施例之醫藥組合物。此類套組可另外包括多種習用醫藥套組組分中之一或多者,例如含有一或多種醫藥學上可接受之載劑之容器、其他容器等,如熟習此項技術者將容易明瞭。在套組中亦可包括呈插頁或呈標記形式指示欲投與組分之量、投與指南及/或混合組分指南之說明書。
本發明將藉助特定實例進行更詳細描述。以下實例出於說明性目的提供,且不欲以任何方式限制本發明。熟習此項技術者將容易地認識到,可改變或修改多個非關鍵參數以產生基本上相同之結果。已發現根據本文所述之至少一個分析,各實例之化合物抑制PD-1/PD-L1蛋白/蛋白相互作用之活性。
實例
本發明化合物之實驗程序提供於下文中。所製備之一些化合物之開放式存取製備型LCMS純化在Waters質量導向分級系統上實施。用於操作該等系統之基本設備設定、方案及控制軟件已詳細描述於文獻中。參見例如Blom, 「Two-Pump At Column Dilution Configuration for Preparative LC-MS」, K. Blom,
J. Combi. Chem.,
2002,
4, 295-301;Blom等人,「Optimizing Preparative LC-MS Configurations and Methods for Parallel Synthesis Purification」,
J. Combi. Chem.,
2003,
5, 670-83;及Blom等人,「Preparative LC-MS Purification: Improved Compound Specific Method Optimization」,
J. Combi. Chem.,
2004,
6, 874-883。
實例 1 2-[({8-[(2- 甲基聯苯 -3- 基 ) 胺基 ] 喹啉 -3- 基 } 甲基 ) 胺基 ] 乙醇 步驟 1 : 2- 甲基聯苯 -3- 胺
向3-溴-2-甲基苯胺(Aldrich,目錄號530018: 0.39 mL, 3.2 mmol)、苯基硼酸(Aldrich,目錄號P20009: 0.50 g, 4.1 mmol)、[1,1'-雙(二苯基膦基)二茂鐵]二氯鈀(II) (Aldrich,目錄號697230: 0.13 g, 0.16 mmol)及碳酸鉀(1.32 g, 9.57 mmol)於1,4-二噁烷(20.0 mL)及水(7 mL)中之混合物通氮氣5 min。然後將混合物加熱且在110℃下攪拌1.5 h。將反應混合物冷卻至室溫,用飽和NaHCO
3水溶液驟冷,且用乙酸乙酯(3 × 10 mL)萃取。用鹽水洗滌合併之有機層,經MgSO
4乾燥,過濾並在減壓下濃縮。藉由矽膠管柱上之急速層析用己烷中之乙酸乙酯(0 → 15%)溶析來純化殘餘物,以提供期望產物。C
13H
14N (M+H)
+之LC-MS計算值: m/z = 184.1;實驗值184.1。
1H NMR (400 MHz, DMSO) δ 7.40 (dd,
J= 7.6, 6.8 Hz, 2H), 7.32 (dd,
J= 7.6, 7.2 Hz, 1H), 7.29 - 7.14 (m, 2H), 6.92 (dd,
J= 7.6, 7.6 Hz, 1H), 6.64 (d,
J= 7.2 Hz, 1H), 6.40 (d,
J= 7.2 Hz, 1H), 4.89 (s, 2H), 1.92 (s, 3H)。
步驟 2 : 8-[(2- 甲基聯苯 -3- 基 ) 胺基 ] 喹啉 -3- 甲酸
向小瓶中添加外消旋2,2'-雙(二苯基膦基)-1,1'-聯萘(Aldrich,目錄號481084: 30 mg, 0.05 mmol)、2-甲基聯苯-3-胺(262 mg, 1.43 mmol)、8-溴喹啉-3-甲酸乙酯(Ark Pharm,目錄號AK-47201: 0.200 g, 0.714 mmol)、雙(二亞苄基丙酮)鈀(0) (Aldrich,目錄號227994: 0.012 g, 0.021 mmol)及第三丁醇鈉(Aldrich,目錄號359270: 96.7 mg, 1.01 mmol)。添加甲苯(3.6 mL)且向反應混合物通氮氣5 min,然後密封並在130℃下加熱18 h。將反應混合物冷卻,且在真空中濃縮。所得殘餘物不經進一步純化即直接用於下一步驟中。C
23H
19N
2O
2(M+H)
+之LC-MS計算值: m/z = 355.1;實驗值355.4。
步驟 3 : {8-[(2- 甲基聯苯 -3- 基 ) 胺基 ] 喹啉 -3- 基 } 甲醇
在-78℃下,向8-[(2-甲基聯苯-3-基)胺基]喹啉-3-甲酸(253 mg, 0.714 mmol)於THF (3.6 mL)中之溶液中添加THF中之1.0 M四氫鋁酸鋰(2.14 mL, 2.14 mmol)。將所得混合物升溫至室溫,且攪拌18 h。將混合物冷卻至0℃且使用費雪處理(Fieser workup)驟冷:添加水(80 μL),然後添加1 N NaOH (240 μL),且然後再添加水(80 μL),且然後在室溫下將混合物攪拌1 h。用乙酸乙酯(10 mL)稀釋所得漿液,經矽藻土過濾,且用水洗滌。然後用鹽水洗滌有機萃取物,經硫酸鈉乾燥,過濾,然後在真空中濃縮。藉由矽膠層析(0 → 40%乙酸乙酯/己烷)純化所得殘餘物。C
23H
21N
2O (M+H)
+之LC-MS計算值: m/z = 341.1;實驗值341.2。
步驟 4 : 8-[(2- 甲基聯苯 -3- 基 ) 胺基 ] 喹啉 -3- 甲醛
在0℃下,向{8-[(2-甲基聯苯-3-基)胺基]喹啉-3-基}甲醇(83.0 mg, 0.244 mmol)於二氯甲烷(1.0 mL)中之溶液中添加戴斯-馬丁過碘烷(Aldrich,目錄號274623: 103 mg, 0.244 mmol)。在0℃下將混合物攪拌10 min,然後在0℃下用飽和硫代硫酸鈉水溶液驟冷。用二氯甲烷(3 × 10 mL)萃取混合物。然後用飽和碳酸氫鈉水溶液、水、然後鹽水洗滌有機萃取物。經硫酸鈉乾燥有機萃取物且在真空中濃縮。藉由管柱層析(0至20% EtOAc/己烷)純化期望醛。C
23H
19N
2O (M+H)
+之LC-MS計算值: m/z = 339.1;實驗值339.3。
步驟 5 : 2-[({8-[(2- 甲基聯苯 -3- 基 ) 胺基 ] 喹啉 -3- 基 } 甲基 ) 胺基 ] 乙醇
在室溫下,將8-[(2-甲基聯苯-3-基)胺基]喹啉-3-甲醛(19 mg, 0.056 mmol)及乙醇胺(Aldrich,目錄號398136: 10 μL, 0.167 mmol)於二氯甲烷(0.4 mL)及N,N-二異丙基乙基胺(58.1 μL, 0.333 mmol)中之混合物攪拌1 h,然後小心地添加三乙氧基硼氫化鈉(0.0353 g, 0.167 mmol)。在室溫下將反應混合物攪拌24 h。將混合物濃縮,溶解於甲醇中,然後藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,以獲得呈TFA鹽形式之期望產物。C
25H
26N
3O (M+H)
+之LC-MS計算值: m/z = 384.2;實驗值384.2。
1H NMR (400 MHz, DMSO) δ 9.06 (s, 2H), 8.94 (d,
J= 2.0 Hz, 1H), 8.43 (d,
J= 2.0 Hz, 1H), 8.33 (s, 1H), 7.54 - 7.22 (m, 8H), 7.06 (d,
J= 7.6 Hz, 1H), 7.00 (d,
J= 7.6 Hz, 1 H), 5.18 (brs, 1H), 4.43 (t,
J= 5.2 Hz, 2H), 3.70 (t,
J= 5.2 Hz, 2H), 3.08 (brs, 2H), 2.14 (s, 3H)。
實例 2 2-[({8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -3- 基 } 甲基 ) 胺基 ] 乙醇 步驟 1 : 3- 溴 -N-(2- 甲基聯苯 -3- 基 )-1,7- 萘啶 -8- 胺
向微波小瓶中添加2-甲基聯苯-3-胺(實例1、步驟1:0.1 g, 0.546 mmol)、3-溴-8-氯-1,7-萘啶(PharmaBlock,目錄號PBLJ2743: 140 mg, 0.55 mmol)、第三丁醇(2.5 mL)及二噁烷中之4.0 M氯化氫(0.136 mL, 0.546 mmol)。在微波中將所得混合物照射至100℃並保持1 h。濃縮所得混合物,且期望產物直接用於下一步驟中。C
21H
17N
3Br (M+H)
+之LC-MS計算值: m/z = 390.1;實驗值390.1。
步驟 2 : N-(2- 甲基聯苯 -3- 基 )-3- 乙烯基 -1,7- 萘啶 -8- 胺
向3-溴-N-(2-甲基聯苯-3-基)-1,7-萘啶-8-胺(213 mg, 0.546 mmol)、4,4,5,5-四甲基-2-乙烯基-1,3,2-二氧硼戊環(Aldrich,目錄號633348: 0.185 mL, 1.09 mmol)及[1,1′-雙(二-環己基膦基)二茂鐵]二氯鈀(II) (Aldrich,目錄號701998: 4 mg, 0.005 mmol)於第三丁醇(3.93 mL)及水(4 mL)中之混合物通氮氣,然後密封。在110℃下將其攪拌2 h。將反應混合物冷卻,然後用乙酸乙酯(3 × 10 mL)萃取。用鹽水洗滌合併之有機層,經MgSO
4乾燥,過濾並在減壓下濃縮。粗產物不經純化即直接用於下一步驟中。C
23H
20N
3(M+H)
+之LC-MS計算值: m/z = 338.2;實驗值338.1。
步驟 3 : 8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -3- 甲醛
向N-(2-甲基聯苯-3-基)-3-乙烯基-1,7-萘啶-8-胺(184 mg, 0.55 mmol)於1,4-二噁烷(11 mL)及水(11 mL)中之溶液中添加四氧化鋨於水中之4 wt%溶液(0.52 mL, 0.082 mmol)。將混合物攪拌5 min,然後添加高碘酸鈉(467 mg, 2.18 mmol)且攪拌1 h。用乙酸乙酯(10 mL)稀釋混合物,且分離各相。用乙酸乙酯(10 mL)萃取水層且用水、然後用鹽水洗滌合併之有機層並經硫酸鈉乾燥。過濾萃取物,然後在真空中濃縮。藉由矽膠層析(0 → 40% EtOAc/己烷)純化期望醛。C
22H
18N
3O (M+H)
+之LC-MS計算值: m/z = 340.1;實驗值340.1。
步驟 4 : 2-[({8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -3- 基 } 甲基 ) 胺基 ] 乙醇
此化合物係使用與針對實例1、步驟5所述類似之程序、用8-[(2-甲基聯苯-3-基)胺基]-1,7-萘啶-3-甲醛(步驟3)替代8-[(2-甲基聯苯-3-基)胺基]喹啉-3-甲醛來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,以獲得呈TFA鹽形式之期望產物。C
24H
25N
4O (M+H)
+之LC-MS計算值: m/z = 385.2;實驗值385.2。
1H NMR (400 MHz, DMSO) δ 9.24 (s, 2H), 9.10 (s, 1H), 8.50 (s, 1H), 7.88 (d,
J= 2.8 Hz, 2H), 7.52 - 7.35 (m, 6H), 7.28 - 7.18 (m, 2H), 5.02 (brs, 1H), 4.49 (s, 2H), 3.71 (t,
J= 5.2 Hz, 2H), 3.11 (s, 2H), 2.18 (s, 3H)。
實例 3 1-({8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -3- 基 } 甲基 ) 哌啶 -2- 甲酸 步驟 1 : 1-((8-(2- 甲基聯苯 -3- 基胺基 )-1,7- 萘啶 -3- 基 ) 甲基 ) 哌啶 -2- 甲酸甲酯
在室溫下,將8-[(2-甲基聯苯-3-基)胺基]-1,7-萘啶-3-甲醛(實例2、步驟3:65 mg, 0.19 mmol)及哌啶甲酸甲酯鹽酸鹽(Aldrich,目錄號391204: 100 mg, 0.574 mmol)於二氯甲烷(2 mL)及N,N-二異丙基乙胺(200 μL, 1.15 mmol)中之混合物攪拌1 h。小心地添加三乙氧基硼氫化鈉(0.0353 g, 0.167 mmol)且在室溫下將混合物攪拌24 h。用飽和碳酸氫鈉溶液驟冷反應混合物,且分離出有機層。用二氯甲烷(2 × 10 mL)再萃取水層。經硫酸鈉乾燥合併之有機層,過濾,且在真空中濃縮。獲得油狀期望產物且其不經進一步純化即用於下一步驟中。C
29H
31N
4O
2(M+H)
+之LC-MS計算值: m/z = 467.2;實驗值467.2。
步驟 2 : 1-({8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -3- 基 } 甲基 ) 哌啶 -2- 甲酸
向1-((8-(2-甲基聯苯-3-基胺基)-1,7-萘啶-3-基)甲基)哌啶-2-甲酸甲酯(88 mg, 0.19 mmol)、四氫呋喃(0.66 mL)、甲醇(0.66 mL)及水(0.33 mL)中之混合物中添加氫氧化鋰(275 mg, 11.5 mmol)。在65℃下將所得混合物加熱過夜。將混合物冷卻至室溫,然後用1N HCl調節至pH = 1-2且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,以獲得呈TFA鹽形式之期望產物。C
28H
29N
4O
2(M+H)
+之LC-MS計算值: m/z = 453.2;實驗值453.2。
1H NMR (400 MHz, MeOD) δ 9.21 (d,
J= 1.8 Hz, 1H), 8.55 (d,
J= 1.8 Hz, 1H), 7.61 (d,
J= 7.0 Hz, 1H), 7.57 - 7.36 (m, 8H), 7.33 (d,
J= 7.0 Hz, 1H), 4.80 (m, 1H), 4.39 (d,
J= 13.4 Hz, 1H), 3.90 (d, J = 10.4 Hz, 1H), 3.48 (m, 1H), 3.16 - 3.00 (m, 1H), 2.34 (d, J = 13.4 Hz, 1H), 2.22 (s, 3H), 1.96 - 1.55 (m, 6H)。
實例 4 1-({4-[(2- 甲基聯苯 -3- 基 ) 胺基 ] 吡啶并 [3,2-d] 嘧啶 -7- 基 } 甲基 ) 哌啶 -2- 甲酸 步驟 1 : 7- 溴 -N-(2- 甲基聯苯 -3- 基 ) 吡啶并 [3,2-d] 嘧啶 -4- 胺
向小瓶中添加2-甲基聯苯-3-胺(實例1、步驟1:0.4 g, 2.18 mmol)、7-溴-4-氯吡啶并[3,2-d]嘧啶(Ark Pharm,目錄號AK-27560: 540 mg, 2.2 mmol)及異丙醇(10. mL)。將混合物加熱至110℃並保持4 h。將混合物冷卻至室溫,濃縮,且粗產物不經進一步純化即直接用於下一步驟中。C
20H
16BrN
4(M+1)
+之LC-MS計算值: m/z = 391.1;實驗值391.1。
步驟 2 : N-(2- 甲基聯苯 -3- 基 )-7- 乙烯基吡啶并 [3,2-d] 嘧啶 -4- 胺
此化合物係使用與針對實例2、步驟2所述類似之程序、用7-溴-N-(2-甲基聯苯-3-基)吡啶并[3,2-d]嘧啶-4-胺(步驟1)替代3-溴-N-(2-甲基聯苯-3-基)-1,7-萘啶-8-胺來製備。粗產物不經進一步純化即直接用於下一步驟中。C
22H
19N
4(M+1)
+之LC-MS計算值: m/z = 339.2;實驗值339.2。
步驟 3 : 4-[(2- 甲基聯苯 -3- 基 ) 胺基 ] 吡啶并 [3,2-d] 嘧啶 -7- 甲醛
此化合物係使用與針對實例2、步驟3所述類似之程序、用N-(2-甲基聯苯-3-基)-7-乙烯基吡啶并[3,2-d]嘧啶-4-胺替代N-(2-甲基聯苯-3-基)-3-乙烯基-1,7-萘啶-8-胺來製備。在室溫下將反應混合物攪拌18 h,且然後用乙酸乙酯(10 mL)稀釋。分離出有機層且用乙酸乙酯(2 × 10 mL)再萃取水層。用鹽水洗滌合併之有機層,經硫酸鈉乾燥,過濾,且在真空中濃縮。粗產物不經進一步純化即直接用於下一步驟中。C
21H
17N
4O (M+1)
+之LC-MS計算值: m/z = 341.1;實驗值341.1。
步驟 4 : 1-((4-(2- 甲基聯苯 -3- 基胺基 ) 吡啶并 [3,2-d] 嘧啶 -7- 基 ) 甲基 ) 哌啶 -2- 甲酸甲酯
此化合物係使用與針對實例3、步驟1所述類似之程序、用4-[(2-甲基聯苯-3-基)胺基]吡啶并[3,2-d]嘧啶-7-甲醛(步驟3)替代8-[(2-甲基聯苯-3-基)胺基]-1,7-萘啶-3-甲醛來製備。粗產物不經進一步純化即直接用於下一步驟中。C
28H
30N
5O
2(M+1)
+之LC-MS計算值: m/z = 468.2;實驗值468.2。
步驟 5 : 1-({4-[(2- 甲基聯苯 -3- 基 ) 胺基 ] 吡啶并 [3,2-d] 嘧啶 -7- 基 } 甲基 ) 哌啶 -2- 甲酸
此化合物係使用與針對實例3、步驟2所述類似之程序、用1-((4-(2-甲基聯苯-3-基胺基)吡啶并[3,2-d]嘧啶-7-基)甲基)哌啶-2-甲酸甲酯(步驟4)替代1-((8-(2-甲基聯苯-3-基胺基)-1,7-萘啶-3-基)甲基)哌啶-2-甲酸甲酯來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化粗產物,以獲得呈TFA鹽形式之期望產物。C
27H
28N
5O
2(M+H)
+之LC-MS計算值: m/z = 454.2;實驗值454.3。
實例 5 1-({8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -4- 基 } 甲基 ) 哌啶 -2- 甲酸 步驟 1 : 4- 氯 -N-(2- 甲基聯苯 -3- 基 )-1,7- 萘啶 -8- 胺
向小瓶中添加2-甲基聯苯-3-胺(實例1、步驟1:0.2 g, 1.09 mmol)、4,8-二氯-1,7-萘啶(Synthonix,目錄號D7291: 180 mg, 0.91 mmol)及異丙醇(4 mL)。將混合物加熱至100℃並保持4 h。將混合物濃縮,且粗產物直接用於下一步驟中。C
21H
17ClN
3(M+1)
+之LC-MS計算值: m/z = 346.1;實驗值346.1。
步驟 2 : N-(2- 甲基聯苯 -3- 基 )-4- 乙烯基 -1,7- 萘啶 -8- 胺
此化合物係使用與針對實例2、步驟2所述類似之程序、用4-氯-N-(2-甲基聯苯-3-基)-1,7-萘啶-8-胺(步驟1)替代3-溴-N-(2-甲基聯苯-3-基)-1,7-萘啶-8-胺來製備。粗產物不經進一步純化即直接用於下一步驟中。C
23H
20N
3(M+1)
+之LC-MS計算值: m/z = 338.2;實驗值338.2。
步驟 3 : 8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -4- 甲醛
此化合物係使用與針對實例2、步驟3所述類似之程序、用N-(2-甲基聯苯-3-基)-4-乙烯基-1,7-萘啶-8-胺(步驟2)替代N-(2-甲基聯苯-3-基)-3-乙烯基-1,7-萘啶-8-胺來製備。在室溫下將反應混合物攪拌18 h,且然後用乙酸乙酯(10 mL)稀釋。分離出有機層且用乙酸乙酯(2 × 10 mL)再萃取水層。用鹽水洗滌合併之有機層,經硫酸鈉乾燥,過濾,且在真空中濃縮。藉由矽膠層析(0 → 50% EtOAc/己烷)純化粗產物。C
22H
18N
3O (M+1)
+之LC-MS計算值: m/z = 340.1;實驗值340.2。
步驟 4 : 1-((8-(2- 甲基聯苯 -3- 基胺基 )-1,7- 萘啶 -4- 基 ) 甲基 ) 哌啶 -2- 甲酸甲酯
此化合物係使用與針對實例3、步驟1所述類似之程序、用8-[(2-甲基聯苯-3-基)胺基]-1,7-萘啶-4-甲醛(步驟3)替代8-[(2-甲基聯苯-3-基)胺基]-1,7-萘啶-3-甲醛來製備。粗產物不經進一步純化即直接用於下一步驟中。C
29H
31N
4O
2(M+1)
+之LC-MS計算值: m/z = 467.2;實驗值467.2。
步驟 5 : 1-({8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -4- 基 } 甲基 ) 哌啶 -2- 甲酸
此化合物係使用與針對實例3、步驟2所述類似之程序、用1-((8-(2-甲基聯苯-3-基胺基)-1,7-萘啶-4-基)甲基)哌啶-2-甲酸甲酯替代1-((8-(2-甲基聯苯-3-基胺基)-1,7-萘啶-3-基)甲基)哌啶-2-甲酸甲酯來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化粗產物,以獲得呈TFA鹽形式之期望產物。C
28H
29N
4O
2(M+H)
+之LC-MS計算值: m/z = 453.2;實驗值453.2。
1H NMR (400 MHz, MeOD) δ 9.11 (d,
J= 4.4 Hz, 1H), 8.09 (d,
J= 4.4 Hz, 1H), 7.94 (d,
J= 7.2 Hz, 1H), 7.62 (d,
J= 7.2 Hz, 1H), 7.55 - 7.37 (m, 8H), 4.73 (d,
J= 13.8 Hz, 1H), 4.16 (d,
J= 13.8 Hz, 1H), 3.66 - 3.48 (m, 1H), 3.12 (m, 1H), 2.71 (m, 1H), 2.24 (s, 3H), 2.20 (m, 1H) 1.94 - 1.52 (m, 6H)。
實例 6 2-[({8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -4- 基 } 甲基 ) 胺基 ] 乙醇
在50℃下,將8-[(2-甲基聯苯-3-基)胺基]-1,7-萘啶-4-甲醛(實例5、步驟3:0.022 g, 0.065 mmol)及乙醇胺於二氯甲烷(1.00 mL)及N,N-二異丙基乙胺(67.7 μL, 0.389 mmol)中之混合物攪拌1 h,然後小心地添加三乙氧基硼氫化鈉(0.0412 g, 0.194 mmol)。在50℃下將反應物攪拌12 h。將混合物冷卻至室溫,且然後在真空中濃縮。將殘餘物溶解於甲醇中且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,以獲得呈TFA鹽形式之期望產物。C
24H
25N
4O (M+H)
+之LC-MS計算值: m/z = 385.2;實驗值385.2。
1H NMR (400 MHz, DMSO) δ 9.19 (s, 2H), 9.05 (d,
J= 4.8 Hz, 1H), 8.20 - 8.02 (m, 2H), 7.97 (d,
J= 3.6 Hz, 1H), 7.48 (dd,
J= 7.6, 7.2 Hz, 2H), 7.44 - 7.32 (m, 4H), 7.09 (m, 1H), 5.32 (brs, 1H), 4.69 (m, 2H), 3.86 - 3.67 (m, 2H), 3.19 (m, 2H), 2.21 (s, 3H)。
實例 7 2-[({8-[(2- 甲基聯苯 -3- 基 ) 胺基 ] 喹啉 -4- 基 } 甲基 ) 胺基 ] 乙醇 步驟 1 : 8-[(2- 甲基聯苯 -3- 基 ) 胺基 ] 喹啉 -4- 甲醛
用氮吹掃8-溴喹啉-4-甲醛(Oakwood Chemical,目錄號042977: 100.0 mg, 0.4236 mmol)、2-甲基聯苯-3-胺(實例1、步驟1:77.6 mg, 0.424 mmol)、[(2-二-環己基膦基-3,6-二甲氧基-2′,4′,6′- 三異丙基-1,1′-聯苯)-2-(2′-胺基-1,1′-聯苯)]鈀(II)甲烷磺酸鹽(Aldrich,目錄號761605: 58 mg, 0.064 mmol)及碳酸銫(0.690 g, 2.12 mmol)於第三丁醇(10.0 mL)中之混合物,且然後在100℃下攪拌2 h。將混合物冷卻至室溫,用乙酸乙酯及水稀釋。分離各層且用鹽水洗滌有機層,經硫酸鈉乾燥,過濾,且在真空中濃縮。藉由管柱層析(0 → 50% EtOAc/己烷)純化殘餘物。C
23H
19N
2O (M+H)
+之LC-MS計算值: m/z = 339.1;實驗值339.2。
步驟 2 : 2-[({8-[(2- 甲基聯苯 -3- 基 ) 胺基 ] 喹啉 -4- 基 } 甲基 ) 胺基 ] 乙醇
此化合物係使用與針對實例1、步驟5所述類似之程序、用8-[(2-甲基聯苯-3-基)胺基]喹啉-4-甲醛(步驟1)替代8-[(2-甲基聯苯-3-基)胺基]喹啉-3-甲醛來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,以獲得呈TFA鹽形式之期望產物。C
25H
26N
3O (M+H)
+之LC-MS計算值: m/z = 384.2;實驗值384.2。
1H NMR (400 MHz, DMSO) δ 9.13 (s, 2H), 8.94 (d, J = 4.4 Hz, 1H), 8.43 (s, 1H), 7.73 (d, J = 4.4 Hz, 1H), 7.60 - 7.43 (m, 4H), 7.44 - 7.23 (m, 4H), 7.10 - 6.99 (m, 2H), 5.32 (brs, 1H), 4.73 (m, 2H), 3.76 (t, J = 5.2 Hz, 2H), 3.21 (s, 2H), 2.15 (s, 3H)。
實例 8 1-({8-[(2- 甲基聯苯 -3- 基 ) 胺基 ] 喹啉 -4- 基 } 甲基 ) 哌啶 -2- 甲酸 步驟 1 : 1-((8-(2- 甲基聯苯 -3- 基胺基 ) 喹啉 -4- 基 ) 甲基 ) 哌啶 -2- 甲酸甲酯
此化合物係使用與針對實例3、步驟1所述類似之程序、用8-[(2-甲基聯苯-3-基)胺基]喹啉-4-甲醛(實例7、步驟1)替代8-[(2-甲基聯苯-3-基)胺基]-1,7-萘啶-3-甲醛來製備。粗產物不經進一步純化即直接用於下一步驟中。C
30H
32N
3O
2(M+H)
+之LC-MS計算值: m/z = 466.2;實驗值466.2。
步驟 2 : 1-({8-[(2- 甲基聯苯 -3- 基 ) 胺基 ] 喹啉 -4- 基 } 甲基 ) 哌啶 -2- 甲酸
此化合物係使用與針對實例3、步驟2所述類似之程序、用1-((8-(2-甲基聯苯-3-基胺基)喹啉-4-基)甲基)哌啶-2-甲酸甲酯(步驟1)替代1-((8-(2-甲基聯苯-3-基胺基)-1,7-萘啶-3-基)甲基)哌啶-2-甲酸甲酯來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化粗產物,以獲得呈TFA鹽形式之期望產物。C
29H
30N
3O
2(M+H)
+之LC-MS計算值: m/z = 452.2;實驗值452.3。
1H NMR (400 MHz, MeOD) δ 8.93 (d,
J= 4.4 Hz, 1H), 7.77 (d,
J= 4.4 Hz, 1H), 7.71 (d, J = 8.4 Hz, 1H), 7.58 (dd,
J= 8.0, 7.8 Hz, 1H), 7.50 - 7.43 (m, 4H), 7.40 - 7.30 (m, 4H), 7.11 (dd,
J= 15.2, 7.8 Hz, 2H), 5.14 (d,
J= 12.8 Hz, 1H), 4.65 (m, 1H), 4.16 (d,
J= 11.2 Hz, 1H), 3.25 - 3.13 (m, 1H), 2.42 (d,
J= 11.2 Hz, 1H), 2.20 (s, 3H), 2.02 - 1.62 (m, 6H)。
實例 9 2-[({4- 氯 -8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -3- 基 } 甲基 ) 胺基 ] 乙醇 步驟 1 : {[(2- 氯吡啶 -3- 基 ) 胺基 ] 亞甲基 } 丙二酸二乙酯
將3-胺基-2-氯吡啶(
Aldrich ,目錄號 A46900: 5.71 g, 44.4 mmol)及(乙氧基亞甲基)丙二酸二乙酯(
Alfa Aesar ,目錄號 A13776: 9.013 mL, 44.6 mmol)合併於具有攪拌棒之小瓶中且在120℃下加熱5 h。濃縮所得混合物且用己烷洗滌以提供米色固體狀期望化合物。C
13H
16ClN
2O
4(M+H)
+之LC-MS計算值: m/z = 299.1;實驗值299.1。
步驟 2 : 8- 氯 -4- 側氧基 -1,4- 二氫 -1,7- 萘啶 -3- 甲酸乙酯
向三頸燒瓶中裝填{[(2-氯吡啶-3-基)胺基]亞甲基}丙二酸二乙酯(6.39 g, 21.4 mmol)、攪拌棒及二苯基醚(
Aldrich ,目錄號 240834: 102 mL)。藉由使氮鼓泡通過溶液將混合物脫氣10 min。然後配備Vigreux回流冷凝器及溫度探針且將反應物之內部溫度加熱至240℃-250℃並保持1 h。然後將反應物冷卻,且添加己烷以使產物沈澱。然後過濾混合物並用己烷洗滌沈澱。使用高真空再乾燥固體且其不經進一步純化即直接用於下一步驟中。C
11H
10ClN
2O
3(M+H)
+之LC-MS計算值: m/z = 253.0;實驗值253.1。
步驟 3 : 8-(2- 甲基聯苯 -3- 基胺基 )-4- 側氧基 -1,4- 二氫 -1,7- 萘啶 -3- 甲酸乙酯
向小瓶中添加2-甲基聯苯-3-胺(
實例 1 、步驟 1:0.457 g, 2.49 mmol)、8-氯-4-羥基-1,7-萘啶-3-甲酸乙酯(630 mg, 2.5 mmol)、碳酸銫(2.44 g, 7.48 mmol)、Brettphos-Pd-G3前觸媒(
Aldrich ,目錄號 761605:
339 mg, 0.374 mmol),然後添加第三丁醇(21 mL)。向混合物通氮氣2 min,然後密封且在100℃下加熱2 h。冷卻至室溫後,過濾混合物並用乙酸乙酯洗滌固體。在真空中濃縮濾液且藉由管柱層析(0 → 20% MeOH/DCM)純化。C
24H
22N
3O
3(M+H)+之LC-MS計算值: m/z = 400.2;實驗值400.2。
步驟 4 : 4- 氯 -8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -3- 甲酸乙酯
向配備有Vigreux回流冷凝器之燒瓶中裝填8-(2-甲基聯苯-3-基胺基)-4-側氧基-1,4-二氫-1,7-萘啶-3-甲酸乙酯(0.480 g, 1.20 mmol)、攪拌棒及磷醯氯(13 mL, 140 mmol)。在110℃下將混合物攪拌1 h。在真空中濃縮混合物且用冰驟冷剩餘磷醯氯並緩慢添加飽和碳酸氫鈉溶液。將DCM添加至混合物中,且分離各層。用DCM再萃取水層,且經硫酸鈉乾燥合併之有機萃取物,過濾,且在真空中濃縮。藉由管柱層析(0 → 40% EtOAc/己烷)純化粗殘餘物。C
24H
21ClN
3O
2(M+H)
+之LC-MS計算值: m/z = 418.1;實驗值418.2。
步驟 5 : {4- 氯 -8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -3- 基 } 甲醇
在-78℃下,向4-氯-8-[(2-甲基聯苯-3-基)胺基]-1,7-萘啶-3-甲酸乙酯(0.550 g, 1.32 mmol)於四氫呋喃(13.8 mL, 1.70E2 mmol)中之溶液中逐滴添加THF中之1.0 M四氫鋁酸鋰(1.32 mL, 1.32 mmol)。添加後,在此溫度下將反應物攪拌30 min。藉由添加飽和氯化銨水溶液小心地驟冷反應物,然後添加飽和羅謝爾鹽(Rochelle's salt)水溶液且攪拌1 h。用EtOAc稀釋混合物,且分離各層。用EtOAc再萃取水層,且經硫酸鈉乾燥合併之有機萃取物,過濾,且在真空中濃縮。粗固體以標題化合物及相應醛之混合物形式直接用於下一步驟中。C
22H
19ClN
3O (M+H)
+之LC-MS計算值: m/z = 376.1;實驗值376.2。
步驟 6 : 4- 氯 -8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -3- 甲醛
在0℃下,向{4-氯-8-[(2-甲基聯苯-3-基)胺基]-1,7-萘啶-3-基}甲醇(464.0 mg, 1.234 mmol)於二氯甲烷(11 mL)中之溶液中添加戴斯-馬丁過碘烷(549.8 mg, 1.296 mmol)。在0℃下將混合物攪拌1 h。在此溫度下用飽和硫代硫酸鈉水溶液驟冷反應物,且分離各層。用二氯甲烷再萃取水層。用碳酸氫鈉、水及鹽水洗滌合併之有機層並經硫酸鈉乾燥,過濾,且在真空中濃縮。藉由層析使用矽膠墊(0 → 1:1 EtOAc/己烷)純化粗殘餘物。C
22H
17ClN
3O (M+H)
+之LC-MS計算值: m/z = 374.1;實驗值374.2。
步驟 7 : 2-[({4- 氯 -8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -3- 基 } 甲基 ) 胺基 ] 乙醇
在室溫下,將4-氯-8-[(2-甲基聯苯-3-基)胺基]-1,7-萘啶-3-甲醛(0.008 g, 0.02 mmol)及乙醇胺(
Aldrich ,目錄號 398136: 3.87 μL, 0.0642 mmol)於二氯甲烷(0.2 mL)及N,N-二異丙基乙胺(22.4 μL, 0.128 mmol)中之混合物攪拌1 h。小心地逐份添加三乙氧基硼氫化鈉(0.0136 g, 0.0642 mmol)。在室溫下將反應物攪拌12 h。使用LC-MS (pH = 10,水+NH
4OH)觀察亞胺,且向混合物中添加硼氫化鈉(4.05 mg, 0.107 mmol)及幾滴甲醇。在室溫下將反應物攪拌2 h,然後用甲醇稀釋且藉由製備型HPLC (pH = 2,水+TFA)純化,以提供呈TFA鹽形式之期望產物。C
24H
24ClN
4O (M+H)+之LC-MS計算值: m/z = 419.2;實驗值419.1。
實例 10 2-[({4- 甲氧基 -8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -3- 基 } 甲基 ) 胺基 ] 乙醇 步驟 1 : 4- 甲氧基 -8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -3- 甲醛
將4-氯-8-[(2-
甲基聯苯-3-基)胺基]-1,7-萘啶-3-甲醛(
實例 9 、步驟 6: 20.0 mg, 0.0535 mmol)、甲醇(1.0 mL)及碳酸鉀(8.87 mg, 0.0642 mmol)合併於小瓶中且在攪拌的同時在60℃下加熱1 h。用乙酸乙酯稀釋混合物,過濾,且在真空中濃縮。所得黃色殘餘物直接用於下一步驟中。C
23H
20N
3O
2(M+H)
+之LC-MS計算值: m/z = 370.1;實驗值370.2。
步驟 2 : 2-[({4- 甲氧基 -8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -3- 基 } 甲基 ) 胺基 ] 乙醇
此化合物係使用與針對
實例 9 、步驟 7所述類似之程序、用4-甲氧基-8-[(2-甲基聯苯-3-基)胺基]-1,7-萘啶-3-甲醛替代4-氯-8-[(2-甲基聯苯-3-基)胺基]-1,7-萘啶-3-甲醛來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,以獲得呈TFA鹽形式之期望產物。C
25H
27N
4O
2(M+H)
+之LC-MS計算值: m/z = 415.2;實驗值415.2。
實例 11 1-({4- 氯 -8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -3- 基 } 甲基 ) 哌啶 -2- 甲酸 步驟 1 : 1-({4- 氯 -8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -3- 基 } 甲基 ) 哌啶 -2- 甲酸甲酯
在室溫下,將4-氯-8-[(2-甲基聯苯-3-基)胺基]-1,7-萘啶-3-甲醛(
實例 9 、步驟 6: 0.020 g, 0.053 mmol)及甲基哌啶-2-甲酸酯鹽酸鹽(
Aldrich ,目錄號 391204:
28.8 mg, 0.160 mmol)於二氯甲烷(0.4 mL)及N,N-二異丙基乙胺(55.9 μL, 0.321 mmol)中之混合物攪拌1 h。小心地逐份添加三乙氧基硼氫化鈉(0.0340 g, 0.160 mmol)。在室溫下將反應物攪拌2 h。藉由LC-MS (pH = 10,水+NH
4OH)觀察所得亞胺且向反應混合物中添加幾滴甲醇及四氫硼酸鈉(10.1 mg, 0.267 mmol)。將混合物攪拌1 h,然後用飽和碳酸氫鈉水溶液驟冷。分離出有機層且用DCM再萃取水層。經Na
2SO
4乾燥合併之有機層,過濾,且在真空中濃縮。粗殘餘物直接用於下一步驟中。C
29H
30ClN
4O
2(M+H)
+之LC-MS計算值: m/z = 501.2;實驗值501.2。
步驟 2 : 1-({4- 氯 -8-[(2- 甲基聯苯 -3- 基 ) 胺基 ]-1,7- 萘啶 -3- 基 } 甲基 ) 哌啶 -2- 甲酸
向裝填1-({4-氯-8-[(2-甲基聯苯-3-基)胺基]-1,7-萘啶-3-基}甲基)哌啶-2-甲酸甲酯(26.8 mg, 0.0535 mmol)之小瓶中添加氫氧化鋰(12.81 mg, 0.5350 mmol)、甲醇(0.5 mL)、THF (0.5 mL)及水(0.5 mL)。在攪拌的同時將混合物加熱至60℃並保持2 h。冷卻至室溫後,使用1 N HCl水溶液酸化混合物,用甲醇稀釋,且藉由製備型HPLC (pH = 2,水+TFA)純化,以提供呈TFA鹽形式之期望化合物。C
28H
28ClN
4O
2(M+H)
+之LC-MS計算值: m/z = 487.2;實驗值487.2。
實例 12 2-{[(8-{[3-(2,3- 二氫 -1,4- 苯并二氧雜環己烯 -6- 基 )-2- 甲基苯基 ] 胺基 }-1,7- 萘啶 -4- 基 ) 甲基 ] 胺基 } 乙醇 步驟 1 : 3-(2,3- 二氫 -1,4- 苯并二氧雜環己烯 -6- 基 )-2- 甲基苯胺
將3-溴-2-甲基苯胺(
Aldrich ,目錄號 530018: 1.00 mL, 8.12 mmol)、2,3-二氫-1,4-苯并二氧雜環己烯-6-基硼酸(
Combi-Blocks ,目錄號 BB-8311: 1.9 g, 10. mmol)、[1,1'-雙(二苯基膦基)二茂鐵]二氯鈀(II)與二氯甲烷之複合物(1:1) (
Aldrich ,目錄號 379670:
0.05 g, 0.06 mmol)及碳酸鉀(2.72 g, 19.7 mmol)於1,4-二噁烷(41.2 mL)及水(20 mL)中之混合物脫氣且再裝填氮三次。然後將混合物加熱且在110℃下攪拌1.5 h。用飽和NaHCO
3水溶液驟冷反應混合物,且用乙酸乙酯(3×10 mL)萃取。用鹽水洗滌合併之有機層,經Na
2SO
4乾燥,過濾並在減壓下濃縮。藉由管柱層析(0 → 30% EtOAc/己烷)純化所得殘餘物。C
15H
16NO
2(M+H)
+之LC-MS計算值: m/z = 242.1;實驗值242.2。
步驟 2 : 4- 氯 -N-[3-(2,3- 二氫 -1,4- 苯并二氧雜環己烯 -6- 基 )-2- 甲基苯基 ]-1,7- 萘啶 -8- 胺
向小瓶中添加3-(2,3-二氫-1,4-苯并二氧雜環己烯-6-基)-2-甲基苯胺(0.263 g, 1.09 mmol)、4,8-二氯-1,7-萘啶(
Synthonix ,目錄號 D7291:
180 mg, 0.91 mmol)及乙腈(10.0 mL)。將反應物加熱至100℃並保持4 h。冷卻至室溫後,添加碳酸銫(0.296 g, 0.910 mmol)且然後將混合物回流4 h。冷卻至室溫後,用乙酸乙酯稀釋混合物,過濾,且在真空中濃縮。C
23H
19ClN
3O
2(M+H)
+之LC-MS計算值: m/z = 404.1;實驗值404.1。
步驟 3 : N-[3-(2,3- 二氫 -1,4- 苯并二氧雜環己烯 -6- 基 )-2- 甲基苯基 ]-4- 乙烯基 -1,7- 萘啶 -8- 胺
將N-[3-(2,3-二氫-1,4-苯并二氧雜環己烯-6-基)-2-甲基苯基]-4-乙烯基-1,7-萘啶-8-胺(0.370 g, 0.936 mmol)、4,4,5,5-四甲基-2-乙烯基-1,3,2-二氧硼戊環(
Aldrich ,目錄號 633348:
1.59 mL, 9.36 mmol)、碳酸鈉(0.198 g, 1.87 mmol)及[1,1′-雙(二-環己基膦基)二茂鐵]二氯鈀(II) (
Aldrich ,目錄號 701998: 7.1 mg, 0.0094 mmol)於第三丁醇(6.73 mL)及水(6 mL)中之混合物脫氣且密封。在110℃下將混合物攪拌2 h。將反應混合物冷卻,然後用乙酸乙酯(3× 20 mL)萃取。用鹽水洗滌合併之有機層,經MgSO
4乾燥,過濾並在減壓下濃縮。粗殘餘物不經進一步純化即直接用於下一步驟中。C
25H
22N
3O
2(M+1)
+之LC-MS計算值: m/z = 396.2;實驗值396.2。
步驟 4 : 8-{[3-(2,3- 二氫 -1,4- 苯并二氧雜環己烯 -6- 基 )-2- 甲基苯基 ] 胺基 }-1,7- 萘啶 -4- 甲醛
向燒瓶中裝填N-[3-(2,3-二氫-1,4-苯并二氧雜環己烯-6-基)-2-甲基苯基]-4-乙烯基-1,7-萘啶-8-胺(370. mg, 0.936 mmol)、1,4-二噁烷(20. mL)、攪拌棒及水(20. mL)。向此懸浮液中添加四氧化鋨於水中之4% w/w混合物(0.89 mL, 0.14 mmol)。將反應物攪拌5 min,然後添加高碘酸鈉(2001 mg, 9.356 mmol)。在室溫下攪拌1 h後,用飽和硫代硫酸鈉水溶液驟冷反應物。然後用乙酸乙酯(2 × 10 mL)萃取混合物,且分離合併之有機層,用鹽水洗滌,經Na
2SO
4乾燥,過濾,且在真空中濃縮。藉由管柱層析(0 → 60% EtOAc/己烷)純化粗殘餘物。C
24H
20N
3O
3(M+H)+之LC-MS計算值: m/z = 398.1;實驗值398.2。
步驟 5 : 2-{[(8-{[3-(2,3- 二氫 -1,4- 苯并二氧雜環己烯 -6- 基 )-2- 甲基苯基 ] 胺基 }-1,7- 萘啶 -4- 基 ) 甲基 ] 胺基 } 乙醇
此化合物係使用與針對
實例 9 、步驟 7所述類似之程序、用8-{[3-(2,3-二氫-1,4-苯并二氧雜環己烯-6-基)-2-甲基苯基]胺基}-1,7-萘啶-4-甲醛替代4-氯-8-[(2-甲基聯苯-3-基)胺基]-1,7-萘啶-3-甲醛來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,以獲得呈TFA鹽形式之期望產物。C
26H
27N
4O
3(M+H)
+之LC-MS計算值: m/z = 443.2;實驗值443.3。
實例 13 1-[(8-{[3-(2,3- 二氫 -1,4- 苯并二氧雜環己烯 -6- 基 )-2- 甲基苯基 ] 胺基 }-1,7- 萘啶 -4- 基 ) 甲基 ] 哌啶 -2- 甲酸 步驟 1 : 1-((8-(3-(2,3- 二氫苯并 [b][1,4] 二噁烷 -6- 基 )-2- 甲基苯基胺基 )-1,7- 萘啶 -4- 基 ) 甲基 ) 哌啶 -2- 甲酸甲酯
此化合物係使用與針對
實例 11 、步驟 1所述類似之程序、用8-{[3-(2,3-二氫-1,4-苯并二氧雜環己烯-6-基)-2-甲基苯基]胺基}-1,7-萘啶-4-甲醛(實例12, 步驟4)替代4-氯-8-[(2-甲基聯苯-3-基)胺基]-1,7-萘啶-3-甲醛來製備。粗化合物不經進一步純化即直接用於下一步驟中。C
31H
33N
4O
4(M+H)
+之LC-MS計算值: m/z = 525.2;實驗值525.2。
步驟 2 : 1-[(8-{[3-(2,3- 二氫 -1,4- 苯并二氧雜環己烯 -6- 基 )-2- 甲基苯基 ] 胺基 }-1,7- 萘啶 -4- 基 ) 甲基 ] 哌啶 -2- 甲酸
此化合物係使用與針對
實例 11 、步驟 2所述類似之程序、用1-((8-(3-(2,3-二氫苯并[b][1,4]二噁烷-6-基)-2-甲基苯基胺基)-1,7-萘啶-4-基)甲基)哌啶-2-甲酸甲酯替代1-({4-氯-8-[(2-甲基聯苯-3-基)胺基]-1,7-萘啶-3-基}甲基)哌啶-2-甲酸甲酯來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,以獲得呈TFA鹽形式之期望產物。C
30H
31N
4O
4(M+H)
+之LC-MS計算值: m/z = 511.2;實驗值511.3。
實例 14 2-[({5-[(2- 甲基聯苯 -3- 基 ) 胺基 ] 吡啶并 [3,4-b] 吡嗪 -2- 基 } 甲基 ) 胺基 ] 乙醇 步驟 1 : 5- 氯吡啶并 [3,4-b] 吡嗪 -2(1H)- 酮
在90℃下,將2-氯吡啶-3,4-二胺(
Aldrich ,目錄號 736376: 0.5 g, 3 mmol)及乙醛酸乙酯(1:1 w/v於甲苯中,
Alfa Aesar ,目錄號 L19207: 0.73 mL, 3.6 mmol)於乙醇(5.0 mL)中之懸浮液加熱過夜。然後在-20℃下將混合物冷卻2天。過濾沈澱,用冷乙醇洗滌,收集,且不經進一步純化即直接用於下一步驟中。C
7H
5ClN
3O (M+H)
+之LC-MS計算值: m/z = 182.0;實驗值182.1。
步驟 2 : 5-[(2- 甲基聯苯 -3- 基 ) 胺基 ] 吡啶并 [3,4-b] 吡嗪 -2- 醇
在100℃下,將2-甲基聯苯-3-胺(
實例 1 、步驟 1 :0.020 g, 0.11 mmol)、5-氯吡啶并[3,4-b]吡嗪-2(1H)-酮(0.020 g, 0.11 mmol)、碳酸銫(0.107 g, 0.327 mmol)及Brettphos Pd G3前觸媒(
Aldrich ,目錄號 761605: 7.9 mg, 0.0087 mmol)於第三丁醇(0.3 mL)中之脫氣混合物加熱2 h。添加水中之1.0 M氯化氫直至pH為約5。攪拌過夜後,過濾沈澱,且將固體乾燥並直接用於下一步驟中。C
20H
17N
4O (M+H)
+之LC-MS計算值: m/z = 329.1;實驗值329.2。
步驟 3 : 2- 氯 -N-(2- 甲基聯苯 -3- 基 ) 吡啶并 [3,4-b] 吡嗪 -5- 胺
在120℃下在密封瓶中,將5-[(2-甲基聯苯-3-基)胺基]吡啶并[3,4-b]吡嗪-2-醇(0.25 g, 0.76 mmol)於磷醯氯(2.5 mL, 27 mmol)中之混合物加熱1.5 h。冷卻反應物且在真空中濃縮。將所得黑色殘餘物溶解於1,2-二氯乙烷中且冷卻至0℃。添加飽和碳酸氫鈉水溶液且在室溫下攪拌1 h。過濾沈澱並用鹽水洗滌濾液,經硫酸鈉乾燥,過濾,且濃縮。然後將黑色固體與第三丁基甲基醚(3 mL)一起研磨,且過濾所得沈澱並洗滌,以獲得深棕色固體狀期望產物。然後使用管柱層析(0 → 30% EtOAc/己烷)純化濾液,以提供深棕色固體狀期望產物。C
20H
16ClN
4(M+H)
+之LC-MS計算值: m/z = 347.1;實驗值347.1。
步驟 4 : N-(2- 甲基聯苯 -3- 基 )-2- 乙烯基吡啶并 [3,4-b] 吡嗪 -5- 胺
在120℃下,將2-氯-N-(2-甲基聯苯-3-基)吡啶并[3,4-b]吡嗪-5-胺(0.25 g, 0.72 mmol)、二環己基(2',4',6'-三異丙基聯苯-2-基)膦-(2'-胺基聯苯-2-基)(氯)鈀(1:1) (
Aldrich ,目錄號 741825: 0.063 g, 0.080 mmol)、磷酸鉀(0.47 g, 2.2 mmol)及4,4,5,5-四甲基-2-乙烯基-1,3,2-二氧硼戊環(
Aldrich ,目錄號 663348: 0.18 mL, 1.1 mmol)於1,4-二噁烷(2.5 mL)及水(0.8 mL)中之脫氣混合物回流2.5 h。將混合物冷卻至室溫,且添加乙酸乙酯及水。將所得混合物攪拌1 h,且過濾沈澱並洗滌。用鹽水洗滌有機濾液,經硫酸鈉乾燥,過濾並在真空中濃縮。使用急速層析(0 → 30% EtOAc/己烷)純化粗殘餘物,以提供橙色固體狀期望化合物。C
22H
19N
4(M+H)
+之LC-MS計算值: m/z = 339.2;實驗值339.2。
步驟 5 : 5-[(2- 甲基聯苯 -3- 基 ) 胺基 ] 吡啶并 [3,4-b] 吡嗪 -2- 甲醛
此化合物係使用與針對
實例 12 、步驟 4所述類似之程序、用N-(2-甲基聯苯-3-基)-2-乙烯基吡啶并[3,4-b]吡嗪-5-胺替代N-[3-(2,3-二氫-1,4-苯并二氧雜環己烯-6-基)-2-甲基苯基]-4-乙烯基-1,7-萘啶-8-胺來製備。粗化合物不經進一步純化即直接用於下一步驟中。C
21H
17N
4O
2(M+H
2O)
+之LC-MS計算值: m/z = 359.1;實驗值359.2。
步驟 6 : 2-[({5-[(2- 甲基聯苯 -3- 基 ) 胺基 ] 吡啶并 [3,4-b] 吡嗪 -2- 基 } 甲基 ) 胺基 ] 乙醇
向5-[(2-甲基聯苯-3-基)胺基]吡啶并[3,4-b]吡嗪-2-甲醛(3.0 mg, 0.0088 mmol)於二氯甲烷(1 mL)中之溶液中添加乙醇胺(
Aldrich ,目錄號 398136: 10.0 μL, 0.166 mmol)及乙酸(10.0 μL, 0.176 mmol)。在室溫下將混合物攪拌20 min,然後添加三乙氧基硼氫化鈉(31 mg, 0.15 mmol)且在室溫下攪拌1 h。添加水及飽和NaHCO
3溶液。分離各層且濃縮有機層並溶解於THF/MeOH中。藉由製備型HPLC (pH = 10,水+NH
4OH,然後使用pH = 2,水+TFA進行第二次純化)純化期望產物,以提供呈TFA鹽形式之化合物。C
23H
24N
5O (M+H)
+之LC-MS計算值: m/z = 386.2;實驗值386.2。
實例 15 (2S)-1-({5-[(2- 甲基聯苯 -3- 基 ) 胺基 ] 吡啶并 [3,4-b] 吡嗪 -2- 基 } 甲基 ) 哌啶 -2- 甲酸
將5-[(2-甲基聯苯-3-基)胺基]吡啶并[3,4-b]吡嗪-2-甲醛(
實例 14 、步驟 5 :0.022 g, 0.065 mmol)、(2S)-哌啶-2-甲酸(
Alfa Aesar ,目錄號 L15373: 15 mg, 0.12 mmol)及乙酸(10.0 μL, 0.176 mmol)於甲醇(1 mL)及四氫呋喃(1 mL)中之懸浮液攪拌2 min。添加氰基硼氫化鈉(9.0 mg, 0.14 mmol)且在室溫下攪拌4.5 h。用甲醇稀釋混合物且藉由製備型HPLC (pH = 10,水+NH
4OH,然後使用pH = 2,水+TFA進行第二次純化)純化,以提供呈TFA鹽形式之期望化合物。C
27H
28N
5O
2(M+H)
+之LC-MS計算值: m/z = 454.2;實驗值454.3。
實例 16 2-(2,3- 二氫 -1,4- 苯并二氧雜環己烯 -6- 基 )-6-[(3-{[(2- 羥基乙基 ) 胺基 ] 甲基 }-1,7- 萘啶 -8- 基 ) 胺基 ] 苯甲腈 步驟 1 : 2- 胺基 -6-(2,3- 二氫 -1,4- 苯并二氧雜環己烯 -6- 基 ) 苯甲腈
將2-胺基-6-溴苯甲腈(
Combi-blocks ,目錄號 SS-7081: 3.0 g, 15 mmol)、2,3-二氫-1,4-苯并二氧雜環己烯-6-基硼酸(
Combi-Blocks ,目錄號 BB-8311:
3.6 g, 20. mmol)、[1,1'-雙(二苯基膦基)二茂鐵]二氯鈀(II)與二氯甲烷之複合物(1:1) (
Aldrich ,目錄號 379670:
0.1 g, 0.1 mmol)及碳酸鉀(5.11 g, 36.9 mmol)於1,4-二噁烷(77 mL)及水(30 mL)中之混合物脫氣且再裝填氮三次。然後將混合物加熱且在120℃下攪拌1.5 h。用飽和NaHCO
3水溶液驟冷反應混合物,且用乙酸乙酯(3× 10 mL)萃取。用鹽水洗滌合併之有機層,經Na
2SO
4乾燥,過濾並在減壓下濃縮。米色固體直接用於下一步驟中。C
15H
13N
2O
2(M+H)
+之LC-MS計算值: m/z = 253.1;實驗值253.2。
步驟 2 : 8- 氯 -3- 乙烯基 -1,7- 萘啶
將3-溴-8-氯-1,7-萘啶(
PharmaBlock ,目錄號 PBLJ2743:
0.200 g, 0.821 mmol)、4,4,5,5-四甲基-2-乙烯基-1,3,2-二氧硼戊環(
Aldrich ,目錄號 663348: 153 μL, 0.904 mmol)、碳酸鈉(0.174 g, 1.64 mmol)及[1,1′-雙(二-環己基膦基)二茂鐵]二氯鈀(II) (
Aldrich ,目錄號 701998: 6.2 mg, 0.0082 mmol)於第三丁醇(5.91 mL)及水(6 mL)中之混合物脫氣且密封。在110℃下將其攪拌2 h。將反應混合物冷卻,然後用乙酸乙酯(3× 20 mL)萃取。用鹽水洗滌合併之有機層,經MgSO
4乾燥,過濾並在減壓下濃縮。粗殘餘物不經進一步純化即直接用於下一步驟中。C
10H
8ClN
2(M+H)
+之LC-MS計算值: m/z = 191.0;實驗值191.0。
步驟 3 : 8- 氯 -1,7- 萘啶 -3- 甲醛
此化合物係使用與針對
實例 12 、步驟 4所述類似之程序、用8-氯-3-乙烯基-1,7-萘啶替代N-[3-(2,3-二氫-1,4-苯并二氧雜環己烯-6-基)-2-甲基苯基]-4-乙烯基-1,7-萘啶-8-胺來製備。粗化合物不經進一步純化即直接用於下一步驟中。C
9H
6ClN
2O (M+H)
+之LC-MS計算值: m/z = 193.0;實驗值192.9。
步驟 4 : 2-{[(8- 氯 -1,7- 萘啶 -3- 基 ) 甲基 ] 胺基 } 乙醇
在室溫下,將8-氯-1,7-萘啶-3-甲醛(0.160 g, 0.831 mmol)及乙醇胺(
Aldrich ,目錄號 398136: 251 μL, 4.15 mmol)於二氯甲烷(6 mL)及N,N-二異丙基乙胺(868 μL, 4.98 mmol)中之混合物攪拌1 h。小心地逐份添加三乙氧基硼氫化鈉(0.528 g, 2.49 mmol)。在室溫下將反應物攪拌2 h。然後向混合物中小心地添加四氫硼酸鈉(157 mg, 4.15 mmol)及甲醇(1 mL),且在氮下將反應混合物攪拌過夜。用飽和碳酸氫鈉水溶液驟冷反應物。然後用氯仿/異丙醇之3:1混合物萃取混合物。用鹽水洗滌合併之有機層,經硫酸鈉乾燥,然後在真空中濃縮。藉由管柱層析(0 → 50%甲醇/DCM)純化粗殘餘物且獲得灰白色固體。C
11H
13ClN
3O (M+H)
+之LC-MS計算值: m/z = 238.1;實驗值238.1。
步驟 5 : 2-(2,3- 二氫 -1,4- 苯并二氧雜環己烯 -6- 基 )-6-[(3-{[(2- 羥基乙基 ) 胺基 ] 甲基 }-1,7- 萘啶 -8- 基 ) 胺基 ] 苯甲腈
向小瓶中添加2-胺基-6-(2,3-二氫-1,4-苯并二氧雜環己烯-6-基)苯甲腈(0.0106 g, 0.0421 mmol)、2-{[(8-氯-1,7-萘啶-3-基)甲基]胺基}乙醇(10.00 mg, 0.04207 mmol)、碳酸銫(0.0274 g, 0.0841 mmol)、1,4-二噁烷(1 mL)、(9,9-二甲基-9H-呫噸-4,5-二基)雙(二苯基膦) (
Aldrich ,目錄號 526460: 4.9 mg, 0.0084 mmol)及叁(二亞苄基丙酮)二鈀(0) (
Aldrich ,目錄號 328774: 4.4 mg, 0.0042 mmol)。向混合物通氮氣20 s,然後將小瓶密封且在攪拌的同時加熱至110℃並保持2 h。將混合物冷卻至室溫,用甲醇稀釋,且藉由製備型HPLC (pH = 2,水+TFA)純化,以提供呈TFA鹽形式之化合物。C
26H
24N
5O
3(M+H)
+之LC-MS計算值: m/z = 454.2;實驗值454.2。
實例 17 2-{[(8-{[3-(2,3- 二氫 -1,4- 苯并二氧雜環己烯 -6- 基 )-2- 甲基苯基 ] 胺基 }-1,7- 萘啶 -3- 基 ) 甲基 ] 胺基 } 乙醇
向小瓶中添加3-(2,3-二氫-1,4-苯并二氧雜環己烯-6-基)-2-甲基苯胺(
實例 12 、步驟 1 :0.0102 g, 0.0421 mmol)、2-{[(8-氯-1,7-萘啶-3-基)甲基]胺基}乙醇(
實例 16 、步驟 4 :10.00 mg, 0.04207 mmol)、碳酸銫(0.0274 g, 0.0841 mmol)、1,4-二噁烷(1.00 mL)、(9,9-二甲基-9H-呫噸-4,5-二基)雙(二苯基膦) (
Aldrich ,目錄號 526460: 4.9 mg, 0.0084 mmol)及叁(二亞苄基丙酮)二鈀(0) (
Aldrich ,目錄號 328774: 4.4 mg, 0.0042 mmol)。向混合物通氮氣20 s且將小瓶密封且在攪拌的同時加熱至110℃並保持2 h。冷卻反應物,用甲醇稀釋,然後藉由製備型HPLC (pH = 2,水+TFA)純化,以提供呈TFA鹽形式之化合物。C
26H
27N
4O
3(M+H)
+之LC-MS計算值: m/z = 443.2;實驗值443.2。
實例 18 2-[({8-[(3- 環己 -1- 烯 -1- 基 -2- 甲基苯基 ) 胺基 ]-1,7- 萘啶 -3- 基 } 甲基 ) 胺基 ] 乙醇 步驟 1 : 2-[({8-[(3- 溴 -2- 甲基苯基 ) 胺基 ]-1,7- 萘啶 -3- 基 } 甲基 ) 胺基 ] 乙醇
向微波瓶中添加3-溴-2-甲基苯胺(
Aldrich ,目錄號 530018: 29.5 μL, 0.240 mmol)、2-{[(8-氯-1,7-萘啶-3-基)甲基]胺基}乙醇(
實例 16 、步驟 4 :57.00 mg, 0.2398 mmol)、第三丁醇(1.1 mL)及二噁烷中之4.0 M氯化氫(59.0 μL, 0.236 mmol)。在微波中將反應物照射至100℃並保持1 h。冷卻至室溫後,在真空中濃縮混合物,且藉由管柱層析(0 → 50%甲醇/DCM)純化期望化合物。C
18H
20BrN
4O (M+H)
+之LC-MS計算值: m/z = 387.1;實驗值387.1。
步驟 2 : 2-[({8-[(3- 環己 -1- 烯 -1- 基 -2- 甲基苯基 ) 胺基 ]-1,7- 萘啶 -3- 基 } 甲基 ) 胺基 ] 乙醇
將2-[({8-[(3-溴-2-甲基苯基)胺基]-1,7-萘啶-3-基}甲基)胺基]乙醇(0.0150 g, 0.0387 mmol)、2-環己-1-烯-1-基-4,4,5,5-四甲基-1,3,2-二氧硼戊環(
Aldrich ,目錄號 650277: 0.0242 g, 0.116 mmol)、碳酸鈉(0.00821 g, 0.0775 mmol)及[1,1′-雙(二-環己基膦基)二茂鐵]二氯鈀(II) (
Aldrich ,目錄號 701998: 0.29 mg, 0.00039 mmol)於第三丁醇(0.279 mL)及水(0.3 mL)中之混合物脫氣且密封。在90℃下將混合物攪拌2 h。冷卻反應物,用甲醇稀釋,然後藉由製備型HPLC (pH = 10,水+NH
4OH)純化。C
24H
29N
4O (M+H)
+之LC-MS計算值: m/z = 389.2;實驗值389.3。
實例 19 3-[(3-{[(2- 羥基乙基 ) 胺基 ] 甲基 }-1,7- 萘啶 -8- 基 ) 胺基 ] 聯苯 -2- 甲腈 步驟 1 : 3- 胺基聯苯 -2- 甲腈
此化合物係使用與針對
實例 16 、步驟 1所述類似之程序、用苯基硼酸(Aldrich,目錄號P20009)替代2,3-二氫-1,4-苯并二氧雜環己烯-6-基硼酸來製備。使用管柱層析(0 → 50% EtOAc/己烷)純化粗化合物。C
13H
11N
2(M+H)
+之LC-MS計算值: m/z = 195.1;實驗值195.2。
步驟 2 : 3-[(3-{[(2- 羥基乙基 ) 胺基 ] 甲基 }-1,7- 萘啶 -8- 基 ) 胺基 ] 聯苯 -2- 甲腈
此化合物係使用與針對
實例 16 、步驟 5所述類似之程序、用3-胺基聯苯-2-甲腈替代2-胺基-6-(2,3-二氫-1,4-苯并二氧雜環己烯-6-基)苯甲腈來製備。使用製備型HPLC (pH = 2,水+TFA)純化反應混合物,以提供呈TFA鹽形式之化合物。C
24H
22N
5O (M+H)
+之LC-MS計算值: m/z = 396.2;實驗值396.3。
實例 20 2- 環己 -1- 烯 -1- 基 -6-[(3-{[(2- 羥基乙基 ) 胺基 ] 甲基 }-1,7- 萘啶 -8- 基 ) 胺基 ] 苯甲腈 步驟 1 : 2- 胺基 -6- 環己 -1- 烯 -1- 基苯甲腈
此化合物係使用與針對
實例 16 、步驟 1所述類似之程序、用2-環己-1-烯-1-基-4,4,5,5-四甲基-1,3,2-二氧硼戊環(Aldrich,目錄號650277)替代2,3-二氫-1,4-苯并二氧雜環己烯-6-基硼酸來製備。使用管柱層析(0 → 50% EtOAc/己烷)純化粗化合物。C
13H
15N
2(M+H)
+之LC-MS計算值: m/z = 199.1;實驗值199.1。
步驟 2 : 2- 環己 -1- 烯 -1- 基 -6-[(3-{[(2- 羥基乙基 ) 胺基 ] 甲基 }-1,7- 萘啶 -8- 基 ) 胺基 ] 苯甲腈
此化合物係使用與針對
實例 16 、步驟 5所述類似之程序、用2-胺基-6-環己-1-烯-1-基苯甲腈替代2-胺基-6-(2,3-二氫-1,4-苯并二氧雜環己烯-6-基)苯甲腈來製備。使用製備型HPLC (pH = 2,水+TFA)純化反應混合物,以提供呈TFA鹽形式之化合物。C
24H
26N
5O (M+H)
+之LC-MS計算值: m/z = 400.2;實驗值400.3。
實例 21 2- 環己基 -6-[(3-{[(2- 羥基乙基 ) 胺基 ] 甲基 }-1,7- 萘啶 -8- 基 ) 胺基 ] 苯甲腈 步驟 1 : 2- 胺基 -6- 環己基苯甲腈
在氫氣氛圍下在室溫下,將2-胺基-6-環己-1-烯-1-基苯甲腈(
實例 20 、步驟 1 :100 mg, 0.5 mmol)及碳載10%鈀(53 mg, 0.050 mmol)於甲醇(5 mL)中之混合物攪拌1.5 h。經由矽藻土過濾反應混合物且在真空中濃縮濾液。期望化合物不經進一步純化即直接用於下一步驟中。C
13H
17N
2(M+H)
+之LC-MS計算值: m/z = 201.1;實驗值201.2。
步驟 2 : 2- 環己基 -6-[(3-{[(2- 羥基乙基 ) 胺基 ] 甲基 }-1,7- 萘啶 -8- 基 ) 胺基 ] 苯甲腈
此化合物係使用與針對
實例 16 、步驟 5所述類似之程序、用2-胺基-6-環己基苯甲腈替代2-胺基-6-(2,3-二氫-1,4-苯并二氧雜環己烯-6-基)苯甲腈來製備。使用製備型HPLC (pH = 2,水+TFA)純化反應混合物,以提供呈TFA鹽形式之化合物。C
24H
28N
5O (M+H)
+之LC-MS計算值: m/z = 402.2;實驗值402.3。
實例 A. PD-1/PD-L1 同質時間解析螢光 (HTRF) 結合分析
在標準黑色384孔聚苯乙烯板中以20 μL之最終體積來實施該等分析。首先將抑制劑連續稀釋於DMSO中,且然後添加至板孔中,隨後添加其他反應組分。分析中DMSO之最終濃度為1%。在25℃下在含有0.05% Tween-20及0.1% BSA之PBS緩衝液(pH 7.4)中實施分析。在C末端帶有His標籤之重組人類PD-L1蛋白(19-238)購自AcroBiosystems (PD1-H5229)。在C末端帶有Fc標籤之重組人類PD-1蛋白(25-167)亦購自AcroBiosystems (PD1-H5257)。將PD-L1及PD-1蛋白稀釋於分析緩衝液中且將10 μL添加至板孔中。將板離心且將蛋白質與抑制劑一起預培育40分鐘。培育後添加10 μL HTRF檢測緩衝液,其補充有特異性針對Fc之經銪穴狀化合物標記之抗人類IgG (PerkinElmer-AD0212)及結合至SureLight®-別藻藍蛋白(APC, PerkinElmer-AD0059H)之抗His抗體。離心後,在25℃下將板培育60 min.,然後在PHERAstar FS板讀數器(665 nm/620 nm比率)上讀數。分析中之最終濃度為3 nM PD1、10 nM PD-L1、1 nM銪抗人類IgG及20 nM抗His-別藻藍蛋白。藉由使用GraphPad Prism 5.0軟件擬合控制活性%與抑制劑濃度對數之關係曲線來實施IC
50測定。
如實例中所例示之本發明化合物顯示在以下範圍內之IC
50值:+ = IC
50≤ 10 nM;++ = 10 nM < IC
50≤ 100 nM;+++ = 100 nM < IC
50≤ 1000 nM。
使用實例A中所述之PD-1/PD-L1同質時間解析螢光(HTRF)結合分析對實例性化合物獲得之資料提供於表1中。
表 1
| 實例 | PD-1/PD-L1 HTRF IC 50(nM) |
| 1 | ++ |
| 2 | + |
| 3 | ++ |
| 4 | ++ |
| 5 | + |
| 6 | ++ |
| 7 | ++ |
| 8 | ++ |
| 9 | ++ |
| 10 | + |
| 11 | ++ |
| 12 | + |
| 13 | ++ |
| 14 | + |
| 15 | ++ |
| 16 | + |
| 17 | + |
| 18 | + |
| 19 | + |
| 20 | + |
| 21 | ++ |
除本文所述者外,熟習此項技術者根據前述描述將明瞭本發明之多種修改。此類修改亦意欲屬於隨附申請專利範圍之範疇。本申請案中所引用之每一參考文獻(包括但不限於所有專利、專利申請案及公開案)皆以全文引用方式併入本文中。
Claims (38)
- 一種具有式(I)之化合物或其醫藥學上可接受之鹽或立體異構物: (I) ,其中: X 1為CR 1、X 2為CR 2、X 3為CR 3、X 4為N、X 5為CR 5及X 6為N; R 1、R 2、R 3、R 5及R 9各自獨立地選自H、鹵基、C 1-6烷基、C 2-6烯基、C 2-6炔基、C 1-6鹵烷基、C 1-6鹵烷氧基、C 6-10芳基、C 3-10環烷基、5至14員雜芳基、4至10員雜環烷基、C 6-10芳基-C 1-4烷基-、C 3-10環烷基-C 1-4烷基-、(5至14員雜芳基)-C 1-4烷基-、(4至10員雜環烷基)-C 1-4烷基-、CN、NO 2、OR a、SR a、NHOR a、C(O)R a、C(O)NR aR a、C(O)OR a、OC(O)R a、OC(O)NR aR a、NHR a、NR aR a、NR aC(O)R a、NR aC(O)OR a、NR aC(O)NR aR a、C(=NR a)R a、C(=NR a)NR aR a、NR aC(=NR a)NR aR a、NR aS(O)R a、NR aS(O) 2R a、NR aS(O) 2NR aR a、S(O)R a、S(O)NR aR a、S(O) 2R a及S(O) 2NR aR a,其中R 1、R 2、R 3、R 5及R 9之該C 1-6烷基、C 2-6烯基、C 2-6炔基、C 6-10芳基、C 3-10環烷基、5至14員雜芳基、4至10員雜環烷基、C 6-10芳基-C 1-4烷基-、C 3-10環烷基-C 1-4烷基-、(5至14員雜芳基)-C 1-4烷基-及(4至10員雜環烷基)-C 1-4烷基-各自視情況經1個、2個、3個或4個R b取代基取代; R 7為C 1-4烷基、鹵基、CN、OH、環丙基、C 2-4炔基、C 1-4烷氧基、C 1-4鹵烷基、C 1-4鹵烷氧基、NH 2、-NH-C 1-4烷基、-N(C 1-4烷基) 2、OR 11、NHOR 11、C(O)R 11、C(O)NR 11R 11、C(O)OR 11、OC(O)R 11、OC(O)NR 11R 11、NR 11C(O)R 11、NR 11C(O)OR 11、NR 11C(O)NR 11R 11、C(=NR 11)R 11、C(=NR 11)NR 11R 11、NR 11C(=NR 11)NR 11R 11、NR 11S(O)R 11、NR 11S(O) 2R 11、NR 11S(O) 2NR 11R 11、S(O)R 11、S(O)NR 11R 11、S(O) 2R 11及S(O) 2NR 11R 11,其中每一R 11獨立地選自H及視情況經1或2個鹵基、OH、CN或OCH 3取代之C 1-4烷基; 每一R 8獨立地選自H、C 1-4烷基、C 3-6環烷基、C 2-4烯基、C 2-4炔基、鹵基、CN、OH、C 1-4烷氧基、C 1-4鹵烷基、C 1-4鹵烷氧基、NH 2、-NH-C 1-4烷基、-N(C 1-4烷基) 2、OR 10、NHOR 10、C(O)R 10、C(O)NR 10R 10、C(O)OR 10、OC(O)R 10、OC(O)NR 10R 10、NR 10C(O)R 10、NR 10C(O)OR 10、NR 10C(O)NR 10R 10、C(=NR 10)R 10、C(=NR 10)NR 10R 10、NR 10C(=NR 10)NR 10R 10、NR 10S(O)R 10、NR 10S(O) 2R 10、NR 10S(O) 2NR 10R 10、S(O)R 10、S(O)NR 10R 10、S(O) 2R 10及S(O) 2NR 10R 10,其中每一R 10獨立地為H或視情況經1或2個獨立地選自鹵基、OH、CN及C 1-4烷氧基之基團取代之C 1-4烷基且其中R 8之該C 1-4烷基、C 3-6環烷基、C 2-4烯基及C 2-4炔基各自視情況經1或2個獨立地選自以下之取代基取代:鹵基、OH、CN、C 1-4烷基及C 1-4烷氧基; 或兩個毗鄰R 9取代基與其所連接之碳原子一起形成稠合苯基環、稠合5至7員雜環烷基環、稠合5員或6員雜芳基環或稠合C 3-10環烷基環,其中該稠合5至7員雜環烷基環及稠合5員或6員雜芳基環各自具有1至4個選自N、O及S之雜原子作為環成員,且其中該稠合苯基環、稠合5至7員雜環烷基環、稠合5員或6員雜芳基環及稠合C 3-10環烷基環各自視情況經1或2個經獨立選擇之R q取代基取代; 每一R a獨立地選自H、CN、C 1-6烷基、C 1-4鹵烷基、C 2-6烯基、C 2-6炔基、C 6-10芳基、C 3-10環烷基、5至10員雜芳基、4至10員雜環烷基、C 6-10芳基-C 1-4烷基-、C 3-10環烷基-C 1-4烷基-、(5至10員雜芳基)-C 1-4烷基-及(4至10員雜環烷基)-C 1-4烷基-,其中R a之該C 1-6烷基、C 2-6烯基、C 2-6炔基、C 6-10芳基、C 3-10環烷基、5至10員雜芳基、4至10員雜環烷基、C 6-10芳基-C 1-4烷基-、C 3-10環烷基-C 1-4烷基-、(5至10員雜芳基)-C 1-4烷基-及(4至10員雜環烷基)-C 1-4烷基-各自視情況經1個、2個、3個、4個或5個R d取代基取代; 每一R d獨立地選自C 1-4烷基、C 1-4鹵烷基、鹵基、C 3-10環烷基、4至10員雜環烷基、苯基、5員或6員雜芳基、CN、NH 2、NHOR e、OR e、SR e、C(O)R e、C(O)NR eR e、C(O)OR e、OC(O)R e、OC(O)NR eR e、NHR e、NR eR e、NR eC(O)R e、NR eC(O)NR eR e、NR eC(O)OR e、C(=NR e)NR eR e、NR eC(=NR e)NR eR e、S(O)R e、S(O)NR eR e、S(O) 2R e、NR eS(O) 2R e、NR eS(O) 2NR eR e及S(O) 2NR eR e,其中R d之該C 1-4烷基、C 3-10環烷基、苯基、5員或6員雜芳基及4至10員雜環烷基各自進一步視情況經1至3個經獨立選擇之R q取代基取代; 每一R b取代基獨立地選自鹵基、C 1-4烷基、C 1-4鹵烷基、C 1-4鹵烷氧基、C 6-10芳基、C 3-10環烷基、5至10員雜芳基、4至10員雜環烷基、C 6-10芳基-C 1-4烷基-、C 3-10環烷基-C 1-4烷基-、(5至10員雜芳基)-C 1-4烷基-、(4至10員雜環烷基)-C 1-4烷基-、CN、OH、NH 2、NO 2、NHOR c、OR c、SR c、C(O)R c、C(O)NR cR c、C(O)OR c、OC(O)R c、OC(O)NR cR c、C(=NR c)NR cR c、NR cC(=NR c)NR cR c、NHR c、NR cR c、NR cC(O)R c、NR cC(O)OR c、NR cC(O)NR cR c、NR cS(O)R c、NR cS(O) 2R c、NR cS(O) 2NR cR c、S(O)R c、S(O)NR cR c、S(O) 2R c或S(O) 2NR cR c;其中R b之該C 1-4烷基、C 1-4鹵烷基、C 1-4鹵烷氧基、C 6-10芳基、C 3-10環烷基、5至10員雜芳基、4至10員雜環烷基、C 6-10芳基-C 1-4烷基-、C 3-10環烷基-C 1-4烷基-、(5至10員雜芳基)-C 1-4烷基-及(4至10員雜環烷基)-C 1-4烷基-各自進一步視情況經1至3個經獨立選擇之R d取代基取代; 每一R c獨立地選自H、C 1-6烷基、C 1-4鹵烷基、C 2-6烯基、C 2-6炔基、C 6-10芳基、C 3-10環烷基、5至10員雜芳基、4至10員雜環烷基、C 6-10芳基-C 1-4烷基-、C 3-10環烷基-C 1-4烷基-、(5至10員雜芳基)-C 1-4烷基-及(4至10員雜環烷基)-C 1-4烷基-,其中R c之該C 1-6烷基、C 2-6烯基、C 2-6炔基、C 6-10芳基、C 3-10環烷基、5至10員雜芳基、4至10員雜環烷基、C 6-10芳基-C 1-4烷基-、C 3-10環烷基-C 1-4烷基-、(5至10員雜芳基)-C 1-4烷基-及(4至10員雜環烷基)-C 1-4烷基-各自視情況經1個、2個、3個、4個或5個獨立地選自以下之R f取代基取代:C 1-4烷基、C 1-4鹵烷基、C 2-6烯基、C 2-6炔基、C 6-10芳基、C 3-10環烷基、5至10員雜芳基、4至10員雜環烷基、C 6-10芳基-C 1-4烷基-、C 3-10環烷基-C 1-4烷基-、(5至10員雜芳基)-C 1-4烷基-、(4至10員雜環烷基)-C 1-4烷基-、鹵基、CN、NHOR g、OR g、SR g、C(O)R g、C(O)NR gR g、C(O)OR g、OC(O)R g、OC(O)NR gR g、NHR g、NR gR g、NR gC(O)R g、NR gC(O)NR gR g、NR gC(O)OR g、C(=NR g)NR gR g、NR gC(=NR g)NR gR g、S(O)R g、S(O)NR gR g、S(O) 2R g、NR gS(O) 2R g、NR gS(O) 2NR gR g及S(O) 2NR gR g;其中R f之該C 1-4烷基、C 1-4鹵烷基、C 2-6烯基、C 2-6炔基、C 6-10芳基、C 3-10環烷基、5至10員雜芳基、4至10員雜環烷基、C 6-10芳基-C 1-4烷基-、C 3-10環烷基-C 1-4烷基-、(5至10員雜芳基)-C 1-4烷基-及(4至10員雜環烷基)-C 1-4烷基-各自視情況經1個、2個、3個、4個或5個獨立地選自以下之R n取代基取代:C 1-4烷基、C 1-4鹵烷基、鹵基、CN、R o、NHOR o、OR o、SR o、C(O)R o、C(O)NR oR o、C(O)OR o、OC(O)R o、OC(O)NR oR o、NHR o、NR oR o、NR oC(O)R o、NR oC(O)NR oR o、NR oC(O)OR o、C(=NR o)NR oR o、NR oC(=NR o)NR oR o、S(O)R o、S(O)NR oR o、S(O) 2R o、NR oS(O) 2R o、NR oS(O) 2NR oR o及S(O) 2NR oR o; 每一R g獨立地選自H、C 1-6烷基、C 1-4鹵烷基、C 2-6烯基、C 2-6炔基、C 6-10芳基、C 3-10環烷基、5至10員雜芳基、4至10員雜環烷基、C 6-10芳基-C 1-4烷基-、C 3-10環烷基-C 1-4烷基-、(5至10員雜芳基)-C 1-4烷基-及(4至10員雜環烷基)-C 1-4烷基-,其中R g之該C 1-6烷基、C 2-6烯基、C 2-6炔基、C 6-10芳基、C 3-10環烷基、5至10員雜芳基、4至10員雜環烷基、C 6-10芳基-C 1-4烷基-、C 3-10環烷基-C 1-4烷基-、(5至10員雜芳基)-C 1-4烷基-及(4至10員雜環烷基)-C 1-4烷基-各自視情況經1至3個經獨立選擇之R p取代基取代; 或任兩個R a取代基與其所連接之氮原子一起形成4員、5員、6員、7員、8員、9員或10員雜環烷基,其視情況經1個、2個或3個獨立地選自以下之R h取代基取代:C 1-6烷基、C 3-10環烷基、4至7員雜環烷基、C 6-10芳基、5至6員雜芳基、C 3-10環烷基-C 1-4烷基-、(5至6員雜芳基)-C 1-4烷基-、(4至7員雜環烷基)-C 1-4烷基-、C 1-6鹵烷基、C 2-6烯基、C 2-6炔基、鹵基、CN、OR i、SR i、NHOR i、C(O)R i、C(O)NR iR i、C(O)OR i、OC(O)R i、OC(O)NR iR i、NHR i、NR iR i、NR iC(O)R i、NR iC(O)NR iR i、NR iC(O)OR i、C(=NR i)NR iR i、NR iC(=NR i)NR iR i、S(O)R i、S(O)NR iR i、S(O) 2R i、NR iS(O) 2R i、NR iS(O) 2NR iR i及S(O) 2NR iR i,其中R h之該C 1-6烷基、C 3-10環烷基、4至7員雜環烷基、C 6-10芳基、5至6員雜芳基、C 3-10環烷基-C 1-4烷基-、(5至6員雜芳基)-C 1-4烷基-及(4至7員雜環烷基)-C 1-4烷基-各自進一步視情況經1個、2個或3個獨立地選自以下之R j取代基取代:C 3-6環烷基、C 6-10芳基、5或6員雜芳基、C 2-4烯基、C 2-4炔基、鹵基、C 1-4烷基、C 1-4鹵烷基、CN、NHOR k、OR k、SR k、C(O)R k、C(O)NR kR k、C(O)OR k、OC(O)R k、OC(O)NR kR k、NHR k、NR kR k、NR kC(O)R k、NR kC(O)NR kR k、NR kC(O)OR k、C(=NR k)NR kR k、NR kC(=NR k)NR kR k、S(O)R k、S(O)NR kR k、S(O) 2R k、NR kS(O) 2R k、NR kS(O) 2NR kR k及S(O) 2NR kR k;或連接至該4至10員雜環烷基之同一碳原子之兩個R h基團與其所連接之碳原子一起形成C 3-6環烷基或具有1至2個選自O、N或S之雜原子作為環成員之4至6員雜環烷基; 或任兩個R c取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R h取代基取代; 或任兩個R e取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R h取代基取代; 或任兩個R g取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R h取代基取代; 或任兩個R o取代基與其所連接之氮原子一起形成4員、5員、6員或7員雜環烷基,其視情況經1個、2個或3個經獨立選擇之R h取代基取代;且 每一R e、R i、R k、R o或R p獨立地選自H、C 1-4烷基、C 3-6環烷基、C 6-10芳基、5或6員雜芳基、C 1-4鹵烷基、C 2-4烯基及C 2-4炔基,其中R e、R i、R k、R o或R p之該C 1-4烷基、C 3-6環烷基、C 6-10芳基、5或6員雜芳基、C 2-4烯基及C 2-4炔基各自視情況經1個、2個或3個R q取代基取代; 每一R q獨立地選自OH、CN、-COOH、NH 2、鹵基、C 1-4烷基、C 1-4烷氧基、C 1-4烷基硫基、苯基、4至6員雜環烷基、5員或6員雜芳基、C 3-6環烷基、NHR 12、NR 12R 12及C 1-4鹵烷氧基,其中R q之該C 1-4烷基、苯基、4至6員雜環烷基及5員或6員雜芳基各自視情況經1或2個獨立地選自以下之取代基取代:鹵基、OH、CN、-COOH、NH 2、C 1-4烷基、C 1-4烷氧基、C 3-10環烷基及4員、5員或6員雜環烷基,且每一R 12獨立地為C 1-6烷基; 下標n為整數1、2、3、4或5;且 下標m為整數1、2或3。
- 如請求項1之化合物或其醫藥學上可接受之鹽或立體異構物, 其中R 2為鹵基、C 1-6烷基、C 2-6烯基、C 2-6炔基、C 1-6鹵烷基、C 1-6鹵烷氧基、C 6-10芳基、C 3-10環烷基、5至14員雜芳基、4至10員雜環烷基、C 6-10芳基-C 1-4烷基-、C 3-10環烷基-C 1-4烷基-、(5至14員雜芳基)-C 1-4烷基-、(4至10員雜環烷基)-C 1-4烷基-、CN、NO 2、OR a、SR a、NHOR a、C(O)R a、C(O)NR aR a、C(O)OR a、OC(O)R a、OC(O)NR aR a、NHR a、NR aR a、NR aC(O)R a、NR aC(O)OR a、NR aC(O)NR aR a、C(=NR a)R a、C(=NR a)NR aR a、NR aC(=NR a)NR aR a、NR aS(O)R a、NR aS(O) 2R a、NR aS(O) 2NR aR a、S(O)R a、S(O)NR aR a、S(O) 2R a及S(O) 2NR aR a,其中R 2之該C 1-6烷基、C 2-6烯基、C 2-6炔基、C 6-10芳基、C 3-10環烷基、5至14員雜芳基、4至10員雜環烷基、C 6-10芳基-C 1-4烷基-、C 3-10環烷基-C 1-4烷基-、(5至14員雜芳基)-C 1-4烷基-及(4至10員雜環烷基)-C 1-4烷基-各自視情況經1個、2個、3個或4個R b取代基取代。
- 如請求項1之化合物或其醫藥學上可接受之鹽或立體異構物,其中R 1、R 3及R 5各自獨立地選自H、CN、C 1-6烷基及鹵基。
- 如請求項1之化合物或其醫藥學上可接受之鹽或立體異構物,其中R 2為-CH 2-R b。
- 如請求項5之化合物或其醫藥學上可接受之鹽或立體異構物,其中R b為-NR cR c。
- 如請求項1之化合物或其醫藥學上可接受之鹽或立體異構物,其中R 3為-CH 2-R b。
- 如請求項7之化合物或其醫藥學上可接受之鹽或立體異構物,其中R b為-NR cR c。
- 如請求項1之化合物或其醫藥學上可接受之鹽或立體異構物,其中R 2為2-羥基乙基胺基甲基、2-羧基哌啶-1-基甲基、(S)-2-羧基哌啶-1-基甲基、(R)-2-羧基哌啶-1-基甲基或(3-氰基苄基)氧基。
- 如請求項1之化合物或其醫藥學上可接受之鹽或立體異構物,其中R 3為2-羥基乙基胺基甲基、2-羧基哌啶-1-基甲基、(S)-2-羧基哌啶-1-基甲基、(R)-2-羧基哌啶-1-基甲基或(3-氰基苄基)氧基。
- 如請求項1之化合物或其醫藥學上可接受之鹽或立體異構物,其中﹕ R 1、R 3及R 5各自獨立地選自H、CN、C 1-6烷基及鹵基; R 2為–CH 2-R b;及 R b為–NR cR c。
- 如請求項1之化合物或其醫藥學上可接受之鹽或立體異構物,其係 1-({4-[(2-甲基聯苯-3-基)胺基]吡啶并[3,2-d]嘧啶-7-基}甲基)哌啶-2-甲酸, 或其醫藥學上可接受之鹽。
- 一種醫藥組合物,其包含如請求項 1至12中任一項之化合物或其醫藥學上可接受之鹽或立體異構物,及醫藥學上可接受之載劑或賦形劑。
- 一種如請求項1至12中任一項之化合物或其醫藥學上可接受之鹽或立體異構物之用途,其係用於製備抑制PD-1/PD-L1相互作用之藥劑。
- 一種如請求項1至12中任一項之化合物或其醫藥學上可接受之鹽或立體異構物或如請求項13之醫藥組合物之用途,其係用於製備治療與PD-1/PD-L1相互作用相關之疾病或病症之藥劑。
- 如請求項15之用途,其中該疾病或病症為病毒感染。
- 如請求項15之用途,其中該疾病或病症為癌症。
- 如請求項17之用途,其中該癌症係選自實體腫瘤、皮膚癌、鱗狀細胞癌、腎癌、黑色素瘤、肝癌、及肺癌。
- 如請求項17之用途,其中該癌症係選自骨癌、胰臟癌、皮膚癌、頭頸癌、子宮癌、卵巢癌、直腸癌、肛區癌、胃癌、睪丸癌、輸卵管癌、子宮內膜癌、子宮頸癌、陰道癌、陰戶癌、食道癌、小腸癌、內分泌系統癌、尿道癌、陰莖癌、兒童實體腫瘤、膀胱癌、腎盂癌、中樞神經系統(CNS)贅瘤、脊軸腫瘤、腦幹膠質瘤、垂體腺瘤、表皮樣癌、鱗狀細胞癌、腎癌(renal cancer)、透明細胞癌、前列腺癌、乳癌、結腸癌、肺癌、實體腫瘤、肝癌、神經膠質母細胞瘤、肉瘤、血液癌症、淋巴瘤、白血病及多發性骨髓瘤。
- 如請求項17之用途,其中該癌症為子宮內膜癌。
- 如請求項17之用途,其中該癌症係選自甲狀腺癌、副甲狀腺癌及腎上腺癌。
- 如請求項17之用途,其中該癌症係選自慢性白血病及急性白血病。
- 如請求項17之用途,其中該癌症係選自急性淋巴母細胞性白血病(ALL)、急性髓性白血病(AML)、慢性淋巴球性白血病(CLL)及慢性髓性白血病(CML)。
- 如請求項17之用途,其中該癌症係選自非霍奇金氏淋巴瘤、霍奇金氏淋巴瘤、淋巴球性淋巴瘤、原發性中樞神經系統(CNS)淋巴瘤、T細胞淋巴瘤、外膜細胞淋巴瘤、復發性濾泡性淋巴瘤及瀰漫性大B細胞淋巴瘤(DLBCL)、復發性非霍奇金氏淋巴瘤(NHL)及難治性非霍奇金氏淋巴瘤(NHL)。
- 如請求項17之用途,其中該癌症係激素難治性前列腺腺癌。
- 如請求項17之用途,其中該癌症係選自皮膚黑色素瘤、轉移性惡性黑色素瘤、皮膚惡性黑色素瘤及眼內惡性黑色素瘤。
- 如請求項17之用途,其中該癌症係選自軟組織肉瘤及卡波西氏肉瘤(Kaposi's sarcoma)。
- 如請求項17之用途,其中該癌症為表現PD-L1之轉移性癌症。
- 如請求項17之用途,其中該癌症為肺癌。
- 如請求項29之用途,其中該肺癌為非小細胞肺癌(NSCLC)。
- 如請求項17之用途,其中該癌症為肝癌。
- 如請求項17之用途,其中該癌症為黑色素瘤。
- 如請求項17之用途,其中該癌症為膀胱癌。
- 如請求項17之用途,其中該癌症為尿道癌。
- 如請求項17之用途,其中該癌症為腎癌(renal cancer)。
- 如請求項35之用途,其中該腎癌為透明細胞癌。
- 一種如請求項1至12中任一項之化合物或其醫藥學上可接受之鹽或立體異構物或如請求項13之醫藥組合物之用途,其係用於製備增強、刺激、調節及/或增加患者之免疫反應之藥劑。
- 一種如請求項1至12中任一項之化合物或其醫藥學上可接受之鹽或立體異構物或如請求項13之醫藥組合物之用途,其係用於製備抑制患者中癌症細胞之生長、增殖或轉移之藥劑。
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562270931P | 2015-12-22 | 2015-12-22 | |
| US62/270,931 | 2015-12-22 | ||
| US201662324502P | 2016-04-19 | 2016-04-19 | |
| US62/324,502 | 2016-04-19 | ||
| US201662385341P | 2016-09-09 | 2016-09-09 | |
| US62/385,341 | 2016-09-09 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| TW202219037A true TW202219037A (zh) | 2022-05-16 |
| TWI850624B TWI850624B (zh) | 2024-08-01 |
Family
ID=
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TWI767896B (zh) | 作為免疫調節劑之雜環化合物 | |
| US11407749B2 (en) | Heterocyclic compounds as immunomodulators | |
| EP3452476B1 (en) | Heterocyclic compounds as immunomodulators | |
| TWI771305B (zh) | 作為免疫調節劑之雜環化合物 | |
| JP7148401B2 (ja) | 免疫調節剤としての複素環化合物 | |
| US20200181126A1 (en) | Heterocyclic compounds as immunomodulators | |
| EP3558989A1 (en) | Triazolo[1,5-a]pyridine derivatives as immunomodulators | |
| TWI850624B (zh) | 作為免疫調節劑之雜環化合物 | |
| NZ788114A (en) | Heterocyclic compounds as immunomodulators |