RU2776204C1 - Слитый белок, содержащий рецептор tgf-бета, и его фармацевтическое применение - Google Patents
Слитый белок, содержащий рецептор tgf-бета, и его фармацевтическое применение Download PDFInfo
- Publication number
- RU2776204C1 RU2776204C1 RU2019136157A RU2019136157A RU2776204C1 RU 2776204 C1 RU2776204 C1 RU 2776204C1 RU 2019136157 A RU2019136157 A RU 2019136157A RU 2019136157 A RU2019136157 A RU 2019136157A RU 2776204 C1 RU2776204 C1 RU 2776204C1
- Authority
- RU
- Russia
- Prior art keywords
- ser
- tgf
- val
- thr
- antibody
- Prior art date
Links
- 102000004169 proteins and genes Human genes 0.000 title abstract 5
- 108090000623 proteins and genes Proteins 0.000 title abstract 5
- 108091005711 TGF-beta receptors Proteins 0.000 title abstract 2
- 102000016715 Transforming Growth Factor beta Receptors Human genes 0.000 title abstract 2
- 102100007290 CD274 Human genes 0.000 abstract 3
- 101710012053 CD274 Proteins 0.000 abstract 3
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N Tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 abstract 2
- 108090001012 Transforming Growth Factor beta Proteins 0.000 abstract 2
- 102000004887 Transforming Growth Factor beta Human genes 0.000 abstract 2
- 230000000694 effects Effects 0.000 abstract 2
- 206010063836 Atrioventricular septal defect Diseases 0.000 abstract 1
- 206010028980 Neoplasm Diseases 0.000 abstract 1
- 102000004965 antibodies Human genes 0.000 abstract 1
- 108090001123 antibodies Proteins 0.000 abstract 1
- 230000001588 bifunctional Effects 0.000 abstract 1
- 239000003814 drug Substances 0.000 abstract 1
- 101500018149 human Transforming growth factor beta-1 Proteins 0.000 abstract 1
- 230000001404 mediated Effects 0.000 abstract 1
- 239000000126 substance Substances 0.000 abstract 1
Images
Abstract
Изобретение относится к области биотехнологии, конкретно к слитым белкам на основе рецептора TGF-бета, и может быть использовано в медицине для лечения PD-L1-опосредованной опухоли. Предложен бифункциональный слитый белок, содержащий нацеливающую часть - антитело против PD-L1 и внеклеточный домен TGF-бета RII. Изобретение обеспечивает получение слитых белков, которые являются специфичными в отношении связывания с человеческими TGF-бета1 и PD-L1, блокируют связывание с PD-1 и ингибируют TGF-бета - индуцируемую активность pSMAD3, а также демонстрируют более высокий уровень экспрессии и стабильную структуру по сравнению со слитым белком аналогичной конструкции на основе неусеченного ECD TGF-бета RII. 7 н. и 12 з.п. ф-лы, 8 ил., 10 табл., 12 пр.
Description
Область техники, к которой относится изобретение
Настоящее изобретение относится к области лекарственных средств для противоопухолевой иммунотерапии. В частности, изобретение относится к слитым белкам для лечения рака, включая слитый белок, содержащий нацеливающую молекулу и иммуномодулирующий фактор (такой как TGF-βRII (от англ. transforming growth factor beta receptor - рецептор трансформирующего фактора роста бета)). Более конкретно, настоящее изобретение относится к слитому белку, образованному нацеливающей молекулой - антителом против PD-L1 (от англ. programmed cell death ligand 1 - лиганд запрограммированной гибели клеток) и иммуномодулирующим фактором (TGF-βRII), содержащей его фармацевтической композиции и ее применению в качестве противоракового лекарственного средства.
Предшествующий уровень техники
В лечении рака люди признали высокую токсичность, вызываемую химиотерапией, и отрицательные воздействия, которые могут приводить к образованию устойчивых к лекарственным средствам раковых клеток. Даже если лечение было нацелено на сверхэкспрессируемые или активированные белки, которые ассоциированы с опухолевой выживаемостью, раковые клетки будут все еще полагаться на мутации для уменьшения или избегания зависимости от путей, на которые нацелена таргетная терапия, и будут также выживать посредством других путей. Противоопухолевая иммунотерапия в последние годы привлекла большое внимание и находится в центре лечения рака. При ней трудно развивается устойчивость к лекарственным средствам, и это является выдающимся преимуществом данной терапии. Исходя из иммунологической теории и способа, противоопухолевая иммунотерапия главным образом усиливает иммуногенность опухолевых клеток и чувствительность к уничтожению на основе эффекторных клеток, стимулирует и усиливает противоопухолевый иммунный ответ, и вводит иммунные клетки и эффекторные молекулы в хозяина, координируя свое действие с иммунной системой, с уничтожением опухолевой клетки и ингибированием роста опухоли.
Белок запрограммированной гибели клетки 1 (PD-1 - от англ. Programmed cell death 1) представляет собой член суперсемейства CD28. PD-1 экспрессируется на активированных Т-клетках, В-клетках и миелоидных клетках, которые имеют два лиганда, PD-L1 (лиганд запрограммированной гибели клетки 1) и PD-L2. PD-L1 взаимодействует с PD-1 на Т-клетках и играет важную роль в негативной регуляции иммунных ответов. Экспрессию белка PD-L1 можно выявлять во многих опухолевых тканях человека. Микроокружение опухоли может индуцировать экспрессию PD-L1 на опухолевых клетках. Экспрессия PD-L1 благотворно влияет на распространение и рост опухолей, и вызывает апоптоз противоопухолевой Т-клетки. Ингибитор пути PD-1/PD-L1 может блокировать связывание PD-1 с PD-L1 и блокировать данный негативный регуляторный сигнал, и восстанавливать активность Т-клеток с усилением иммунного ответа. Таким образом, иммунорегуляция, нацеленная на PD-1/PD-L1, важна для подавления опухоли.
Трансформирующий фактор роста бета (TGF-β) принадлежит к суперсемейству TGF-β, которое регулирует рост и дифференциацию клеток. TGF-β передает сигнал через гетеротетрамерный рецепторный комплекс, которые состоит из двух трансмембранных рецепторных серин-треониновых киназ типа I и двух трансмембранных рецепторных серин-треониновых киназ типа II.
TGF-β представляет собой многофункциональный цитокин, который оказывает действие, подавляющее опухоль, или действие, стимулирующее опухоль, зависимым от клетки или зависимым от происхождения образом. Эффект TGF-β-сигнального пути, заключающийся в подавлении опухоли, обусловлен способностью индуцировать экспрессию множества генов. Когда во время развития опухоли происходит мутация или эпигенетическая модификация, раковые клетки постепенно становятся толерантными к ингибированию TGF-β-сигнального пути, что в конечном итоге приводит к развитию опухолей.
Во время исследований было обнаружено, что блокирование TGF-β-сигнального пути может уменьшать опухолевый метастаз. Доминантно-негативный мутант с усеченным Smad2/3 использовали для ингибирования TGF-β-сигнального пути линии опухолевых клеток молочной железы, и было обнаружено, что способность опухолевых клеток к метастазированию ингибировалась. В исследованиях рака толстой кишки в отношении микросателлитной нестабильности обнаружили, что неактивные мутации TGF-βRII уменьшали метастаз и увеличивали послеоперационную выживаемость. Однако, в общем, применение ингибитора TGF-β-сигнального пути в отдельности оказывает слабое действие в клиническом лечении, которое может быть связано с высоким уровнем экспрессии TGF-β главным образом в опухолевых клетках и биодоступностью ингибиторов сигнальных путей.
Таким образом, ингибирование пути PD-1/PD-L1 на основе блокирования и нейтрализации TGF-β в микроокружении опухоли может восстанавливать активность Т-клеток, усиливать иммунный ответ и улучшать эффект ингибирования развития распространения опухоли. Антитело против PD-L1 предложено предшествующей РСТ заявкой заявителя PCT/CN2016/104320.
На сегодняшний день существуют слитые белки антитела/рецептора TGF-β, раскрытые в WO 2006074451 А2, WO 2009152610 A1, WO 2011109789 А2, WO 2013164694 A1, WO 2014164427 A1, WO 2015077540 А2, WO 9309228 A1, WO 9409815 A1, WO 2015077540 A2, WO 2015118175 А2. Однако, некоторые слитые белки все еще имеют проблемы нестабильности или низкого уровня экспрессии. Все еще существует необходимость в дальнейшей разработке продуктов с лучшей эффективностью, как в получении, так и клинической практике. Согласно настоящему изобретению предложено техническое решение, которое благоприятствует получению и обладает более стабильными рабочими характеристиками.
Краткое изложение сущности изобретения
Согласно настоящему изобретению предложен слитый белок, содержащий рецептор TGF-β, содержащий нацеливающую группировку и группировку рецептора TGF-β, где группировка рецептора TGF-β представляет собой N-концевую усеченную форму внеклеточного домена TGF-βRII.
В предпочтительном воплощении настоящего изобретения, в котором N-концевая усеченная форма внеклеточного домена TGF-βRII включает делецию 26 или меньшего числа соседних аминокислот на N-конце внеклеточного домена TGF-βRII, предпочтительно делецию 14-26 соседних аминокислот, более предпочтительно делецию 14-21 соседних аминокислот, наиболее предпочтительно делецию 14-21 соседних аминокислот; В качестве неограничивающих примеров N-концевая усеченная форма внеклеточного домена TGF-βRII содержит последовательность SEQ ID NO: 14 или SEQ ID NO: 15.
В предпочтительном воплощении настоящего изобретения последовательность внеклеточного домена TGF-βRII показана в виде SEQ ID NO: 13.
В предпочтительном воплощении настоящего изобретения нацеливающая группировка представляет собой специфичную в отношении клетки нацеливающую группировку; предпочтительно, нацеливающая группировка представляет собой специфичную в отношении раковой клетки нацеливающую группировку.
В предпочтительном воплощении настоящего изобретения специфичная в отношении раковой клетки нацеливающая группировка выбрана из группы, состоящей из антитела или его антигенсвязывающего фрагмента, фактора роста, гормона, пептида, рецептора и цитокина.
В предпочтительном воплощении настоящего изобретения антитело или его антигенсвязывающий фрагмент выбраны из группы, состоящей из полноразмерного антитела, химерного антитела, Fab', Fab, F(ab')2, однодоменного антител (DAB), Fv, scFv, маленького антитела, биспецифичного антитела и триспецифичного антитела или их смеси.
В предпочтительном воплощении настоящего изобретения антитело или его антигенсвязывающий фрагмент связывается с одним или более следующими полипептидами или белками, выбранными из группы, состоящей из HER2 (рецептор 2 эпидермального фактора роста человека, от англ. "human epidermal growth factor receptor 2"), HER3 (рецептор 3 эпидермального фактора роста человека, от англ. "human epidermal growth factor receptor 3"), молекулы иммунной контрольной точки, CD33, VEGF (фактор роста эндотелия сосудов, от англ. "vascular endothelial growth factor"), VEGFR (рецептор фактора роста эндотелия сосудов, от англ. "vascular endothelial growth factor receptor"), VEGFR-2 (рецептор 2 фактора роста эндотелия сосудов, от англ. "vascular endothelial growth factor receptor-2"), CD152, TNF (фактор некроза опухоли, от англ. "tumour necrosis factor"), IL-1, IL-5, IL-17, IL-6R, IL-1, IL-2R, BLYS, PCSK9 (пропротеин конвертаза субтилизин/кексин тип 9, от англ. "proprotein convertase subtilisin/kexin type 9"), EGFR (рецептор эпидермального фактора роста, от англ. "epidermal growth factor receptor"), c-Met (рецептор фактора роста гепатоцитов), CD2, CD3, CD11a, CD19, CD30, CD38, CD20, CD52, CD60, CD80, CD86, TNF-α (фактор некроза опухоли альфа, от англ. "tumour necrosis factor alpha"), IL-12, IL-17, IL-23, IL-6, IL-1β, RSVF, IgE, RANK (рецептор-активатор ядерного фактора каппа-В, от англ. " receptor activator of nuclear factor-kappa В"), BLyS (стимулятор В-лимфоцитов, от англ. "В Lymphocyte Stimulator"), α4β7, PD-1CCR4 (рецептор СС хемокинов 4, от англ. "СС chemokine receptor 4"), SLAMF7 (7-й член семейства сигнальных молекул активации лимфоцитов, от англ. "Signaling Lymphocytic Activation Molecule Family member 7"), GD2, CD21, CD79b, IL20Rα, CD22, CD79a, CD72, IGF-1 R (рецептор инсулино-подобного фактора роста 1, от англ. " insulin-like growth factor 1 receptor") и RANKL (лиганд рецептора-активатора ядерного фактора каппа-В, от англ. "receptor activator of nuclear factor kappa-B ligand"); предпочтительно в котором антитело или его антигенсвязывающий фрагмент связывается с молекулой иммунной контрольной точки.
В предпочтительном воплощении настоящего изобретения антитело представляет собой антитело против PD-L1; предпочтительно антитело против PD-L1 выбрано из группы, состоящей из: MSB0010718C, MEDI4736, BMS-936559 и MPDL3280A; или антитело против PD-L1 содержит одну или более CDR (от англ. complementarity determining region - гипервариабельная область), выбранных из группы, состоящей из приведенных ниже CDR или их мутантов:
где X1 представляет собой Н или G, предпочтительно G; Х2 представляет собой G или F, предпочтительно F.
В предпочтительном воплощении настоящего изобретения антитело или его антигенсвязывающий фрагмент представляет собой химерное антитело или его функциональный фрагмент, гуманизированное антитело или его функциональный фрагмент, или человеческое антитело или его функциональный фрагмент.
В предпочтительном воплощении настоящего изобретения гуманизированное антитело содержит вариабельную область тяжелой цепи SEQ ID NO: 7, предпочтительно содержит вариабельную область тяжелой цепи SEQ ID NO: 9.
В предпочтительном воплощении настоящего изобретения гуманизированное антитело дополнительно содержит тяжелую цепь SEQ ID NO: 11.
В предпочтительном воплощении настоящего изобретения гуманизированное антитело содержит вариабельную область легкой цепи SEQ ID NO: 8 или 10 или ее мутант.
В предпочтительном воплощении настоящего изобретения гуманизированное антитело содержит легкую цепь SEQ ID NO: 12.
В предпочтительном воплощении настоящего изобретения, в котором слитый белок, содержащий рецептор TGF-β, представляет собой такой, как показано в общей формуле (I):
где TGF-βRII ECD представляет собой усеченную форму внеклеточного домена TGF-βRII;
Ab представляет собой антитело;
L представляет собой линкер.
В предпочтительном воплощении настоящего изобретения линкер представляет собой (G4S)xG, где х представляет собой 3-6, предпочтительно представляет собой 4-5.
Согласно настоящему изобретению дополнительно предложена фармацевтическая композиция, содержащая терапевтически эффективное количество слитого белка, содержащего рецептор TGF-β, как описано выше, и один или более фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ.
Согласно настоящему изобретению предложена молекула ДНК, кодирующая слитый белок, содержащий рецептор TGF-β, как описано выше.
Согласно настоящему изобретению дополнительно предложен экспрессионный вектор, содержащий молекулу ДНК, как описано выше.
Согласно настоящему изобретению дополнительно предложена клетка-хозяин, трансформированная данным экспрессионным вектором, как описано выше, где клетка-хозяин выбрана из группы, состоящей из бактериальной, дрожжевой клетки и клетки млекопитающего; предпочтительно клетки млекопитающего.
Согласно настоящему изобретению дополнительно предложено применение слитого белка, содержащего рецептор TGF-β, как описано выше, или его фармацевтической композиции для получения лекарственного средства для лечения опухолей; предпочтительно для получения лекарственного средства для лечения PD-L1-опосредованной опухоли; более предпочтительно рака, при котором экспрессируется PD-L1.
Согласно настоящему изобретению дополнительно предложен способ лечения или предупреждения опухоли, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества слитого белка, содержащего рецептор TGF-β, как описано выше.
Согласно настоящему изобретению дополнительно предложен усеченный внеклеточный домен TGF-βRII, где усеченный внеклеточный домен TGF-βRII включает делецию 26 или меньшего числа соседних аминокислот на N-конце SEQ ID NO: 13, предпочтительно делецию 14-26 соседних аминокислот на N-конце, более предпочтительно делецию 14-21 соседних аминокислот на N-конце; неограничивающие примеры усеченного внеклеточного домена TGF-βRII включают последовательность, показанную в виде SEQ ID NO: 14 или SEQ ID NO: 15.
Согласно настоящему изобретению дополнительно предложена фармацевтическая композиция, содержащая терапевтически эффективное количество усеченного внеклеточного домена TGF-βRII по настоящему изобретению и один или более фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ.
Согласно настоящему изобретению дополнительно предложено применение усеченного внеклеточного домена TGF-βRII по настоящему изобретению или его фармацевтически приемлемой композиции для получения лекарственного средства для лечения или ингибирования заболеваний или расстройств, ассоциированных с пролиферацией или метастазом раковых клеток.
Согласно настоящему изобретению дополнительно предложен способ лечения или предупреждения опухоли, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества усеченного внеклеточного домена TGF-βRII по настоящему изобретению или его фармацевтической композиции.
Опухоль или рак, описанные в настоящем раскрытии, выбраны из группы, состоящей из колоректального рак, рака молочной железы, яичника, поджелудочной железы, желудка, предстательной железы, почки, шейки матки, миеломы, лимфомы, лейкоза, рака щитовидной железы, эндометрия, матки, мочевого пузыря, нейроэндокринного рака, рака головы и шеи, печени, носоглотки, яичка, мелкоклеточного рака легкого, немелкоклеточного рака легкого, меланомы, базально-клеточного рака кожи, плоскоклеточного рака кожи, выбухающей дерматофибросаркомы, карциномы Меркеля, глиобластомы, глиомы, саркомы, мезотелиомы и миелодиспластического синдрома.
Описание графических материалов
Фиг. 1. Схематичное изображение структуры слитого белка.
Фиг. 2. Результаты, показывающие связывание слитого белка с человеческим TGF-β1 in vitro.
Фиг. 3. Результаты, показывающие связывание слитого белка с человеческим TGF-β1 in vitro.
Фиг. 4. Результаты, показывающие связывание слитого белка с человеческим PD-L1 in vitro.
Фиг. 5. Результаты, показывающие выявление блокирования пути PD-1/PD-L1 слитым белком in vitro.
Фиг. 6. Слитый белок ингибирует TGFβ-индуцируемую активность репортера pSMAD3 дозозависимым образом.
Фиг. 7. Все образцы слитых белков усиливают секрецию цитокина IFN-γ (от англ. interferon gamma - интерферон гамма) активированными Т-лимфоцитами.
Фиг. 8. Воздействие слитого белка на массу опухоли мышей, несущих опухоль.
Подробное описание изобретения
Термины
Для более легкого понимания изобретения определенные технические и научные термины конкретно определены ниже. Если где-либо в другом месте данного документа конкретно не определено иное, все другие технические и научные термины, используемые в данном документе, имеют значение, обычно понятное обычному специалисту в данной области, к которой принадлежит данное изобретение.
В том виде, в котором он используется в данном документе, однобуквенный код и трехбуквенный код для аминокислот представляет собой такой, как описано в J. Biol. Chem, 243, (1968) р. 3558.
В том виде, в котором он используется в данном документе, термин «антитело» относится к иммуноглобулину, структуре четырех пептидных цепей, образованной двумя идентичными тяжелыми цепями и двумя идентичными легкими цепями, соединенными межцепочечной дисульфидной связью. Разные константные области тяжелой цепи иммуноглобулина демонстрируют разные аминокислотные составы и последовательности, следовательно, представляют разную антигенность. Соответственно, иммуноглобулины могут быть подразделены на пять категорий, также называемых изотипами иммуноглобулинов, а именно IgM, IgD, IgG, IgA и IgE; их соответствующие тяжелые цепи представляют собой цепь μ, цепь δ, цепь γ, цепь α и цепь ε, соответственно. В соответствии с аминокислотным составом шарнирной области и числом и локализацией дисульфидных связей тяжелой цепи, иммуноглобулины могут быть подразделены на разные подкатегории, например, IgG может быть подразделен на IgG1, IgG2, IgG3 и IgG4. Легкую цепь можно подразделить на цепь κ или λ, с учетом различной константной области. Каждая категория Ig из данных пяти категорий включает цепь κ или λ.
В настоящем изобретении легкая цепь антитела, упомянутая в данном документе, дополнительно содержит константную область легкой цепи, которая содержит цепь κ, λ человека или мыши, или ее вариант.
В настоящем изобретении тяжелая цепь антитела, упомянутая в данном документе, дополнительно содержит константную область тяжелой цепи, которая содержит IgG1, IgG2, IgG3, IgG4 человека или мыши, или ее вариант.
На N-конце тяжелой и легкой цепей антитела, примерно 110 аминокислот сильно варьируют, которые известны как вариабельная область (область FV); аминокислотная последовательность на С-конце относительно стабильна, которая известна как константная область. Вариабельная область содержит три гипервариабельные области (HVR - от англ. hypervariable region) и четыре FR области (FR - от англ. framework region - константная область) с относительно консервативной последовательностью. Три гипервариабельные области определяют специфичность антитела, также известные как область, определяющая комплементарность (CDR). Каждая вариабельная область легкой цепи (LCVR - от англ. light chain variable region) и каждая вариабельная область тяжелой цепи (HCVR - от англ. heavy chain variable region) состоит из трех областей CDR и четырех областей FR, расположенных от N-конца до С-конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Три области CDR легкой цепи относятся к LCDR1, LCDR2 и LCDR3; три области CDR тяжелой цепи относятся к HCDR1, HCDR2 и HCDR3. Число и положение аминокислотных остатков области CDR в областях LCVR и HCVR антитела или антигенсвязывающего фрагмента в данном документе соответствуют известным критериям нумерации Kabat (LCDR1-3, HCDE2-3) или соответствуют критериям нумерации Kabat и Chothia (HCDR1).
Антитело по настоящему изобретению включает полноразмерное антитело, выбранное из группы, состоящей из мышиного антитела, химерного антитела и гуманизированного антитела, предпочтительно представляет собой гуманизированное антитело.
Термин «мышиное антитело» в настоящем изобретении относится к моноклональному антителу против человеческого PD-L1, полученному в соответствии со знанием и с умениями данной области. Во время получения тестируемому субъекту инъецировали антиген PD-L1, и затем выделяли гибридому, экспрессирующую антитело, которое имеет желаемую последовательность или функциональные характеристики. В предпочтительном воплощении настоящего изобретения мышиное антитело против PD-L1 или его антигенсвязывающий фрагмент дополнительно сдержит константную область легкой цепи мышиной цепи κ, λ или ее вариант, или дополнительно содержит константную область тяжелой цепи мышиного IgG1, IgG2, IgG3 или ее вариант.
Термин «химерное антитело» представляет собой антитело, которое образовано слиянием вариабельной области мышиного антитела с константной областью человеческого антитела, таким образом, чтобы облегчать иммунный ответ, вызываемый мышиным антителом. Для создания химерного антитела сначала создают гибридому, секретирующую специфичное мышиное моноклональное антитело, затем гены вариабельных областей клонируют из клеток гибридомы мыши, и затем при желании клонируют гены константных областей человеческого антитела, гены вариабельных областей мыши лигируют с генами константных областей человека с образованием химерного гена, который может быть вставлен в человеческий вектор, и, наконец, молекула химерного антитела экспрессируется в эукариотической или прокариотической промышленной системе. В предпочтительном воплощении настоящего изобретения легкая цепь химерного антитела против PD-L1 дополнительно содержит константные области легкой цепи, происходящие из цепи κ, λ человека, или их вариант. Тяжелая цепь химерного антитела против PD-L1 дополнительно содержит константную(ые) область(ти) тяжелой цепи, происходящую(ие) из человеческого IgG1, IgG2, IgG3, IgG4, или их вариант. Константная(ые) область(ти) человеческого антитела может(гут) быть выбрана(ы) из константной(ых) области(ей) тяжелой цепи, происходящей(их) из человеческого IgG1, IgG2, IgG3, IgG4, или их варианта, предпочтительно содержит константную область тяжелой цепи, происходящую из человеческого IgG2 или IgG4, или IgG4 без ADCC (от англ. antibody-dependent cell-mediated cytotoxicity -антителозависимая клеточная цитотоксичность) после аминокислотной мутации.
Термин «гуманизированное антитело», также известное как антитело с привитыми CDR, относится к антителу, созданному посредством прививания мышиных последовательностей CDR в каркас вариабельной области человеческого антитела, а именно, антитело, образованное из разных типов последовательностей каркаса антитела зародышевой линии человека. Гуманизированное антитело преодолевает неблагоприятно сильный ответ на антитела, вызываемый химерным антителом, которое несет большое количество мышиных компонентов. Такие последовательности каркаса могут быть получены из общедоступной базы данных ДНК, охватывающей последовательности генов антител зародышевой линии, или из опубликованных референсных последовательностей. Например, ДНК-последовательности зародышевой линии генов вариабельных областей тяжелой и легкой цепи человека могут быть найдены в базе данных последовательностей зародышевой линии человека «VBase» (доступна на веб-сайте www.mrccpe.com.ac.uk/vbase), а также могут быть найдены в Kabat, ЕА, et al, 1991 Sequences of Proteins of Immunological Interest, 5th Ed. Для того, чтобы избежать снижения активности, вызываемого уменьшением иммуногенности, каркас вариабельной области человеческого антитела подвергают минимальной обратной мутации для сохранения активности. Гуманизированное антитело по настоящему изобретению также включает гуманизированное антитело, которое дополнительно получают посредством фагового дисплея, в целях созревания аффинности CDR.
Термины «человеческое антитело» и «антитело человеческого происхождения» используются взаимозаменяемо для обозначения того, что одна или более вариабельных и константных областей происходят из последовательности человеческого иммуноглобулина. В предпочтительном воплощении все вариабельные и константные области происходят из последовательностей человеческого иммуноглобулина, то есть «антитела, полностью происходящие из человека» или «полностью человеческие антитела». Данные антитела могут быть получены различными путями, включая технологию фагового дисплея; выделение В-клеток из человеческих РВМС (от англ. peripheral blood mononuclear cells - мононуклеарные клетки периферической крови), селезенки или лимфатических узлов; конструирование библиотеки фаговых нативных одноцепочечных человеческих антител; или посредством иммунизации трансгенных мышей, которые экспрессируют легкую и тяжелую цепи человеческого антитела; и осуществление скрининга антител, полученных таким образом.
В том виде, в котором он используется в данном документе, термин «антигенсвязывающий фрагмент» или «функциональный фрагмент» относится к Fab фрагменту, Fab' фрагменту, F(ab')2 фрагменту с антиген связывающей активностью, а также scFv фрагменту Fv фрагмента, связывающемуся с человеческим PD-L1. Fv фрагмент представляет собой минимальный фрагмент антитела, который включает все антигенсвязывающие сайты, Fv фрагмент содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, но без константной области. Обычно антитело Fv дополнительно содержит полипептидный линкер между доменами VH и VL с образованием структуры, требуемой для связывания антигена. Также, разные линкеры могут быть использованы для соединения вариабельных областей двух антител с образованием полипептида, называемого одноцепочечным антителом или одноцепочечным Fv (scFv). В том виде, в котором он используется в данном документе, термин «связывание с PD-L1» означает способность взаимодействовать с человеческим PD-L1. В том виде, в котором он используется в данном документе, термин «антигенсвязывающий сайт» по настоящему изобретению относится к дискретным, трехмерным сайтам на антигене, распознаваемом антителом или антигенсвязывающим фрагментом по настоящему изобретению.
В том виде, в котором он используется в данном документе, термин «ADCC», а именно антителозависимая клеточная цитотоксичность, относится к клеткам, экспрессирующим рецепторы Fc, которые непосредственно уничтожают клетки-мишени, покрытые антителом, в результате распознавания сегмента Fc антитела. ADCC эффекторная функция антитела может быть ослаблена или устранена посредством модификации сегмента Fc в IgG. Модификация относится к мутациям в константной области тяжелой цепи антитела, таким как мутации, выбранные из N297A, L234A, L235A в IgG1; химера IgG2/4; или мутации F234A/L235A в IgG4.
«Мутация» в «мутантной последовательности» по настоящему изобретению включает «обратную мутацию», «консервативную модификацию» или «консервативное замещение или замену», но не ограничивается ими. «Консервативная модификация» или «консервативное замещение или замена» в настоящем раскрытии относится к заменам аминокислот в белке другими аминокислотами, имеющими похожие характеристики (например, заряд, размер боковой цепи, гидрофобность/гидрофильность, конформация главной цепи и жесткость и т.п.), таким образом, что данные изменения могут быть часто сделаны без изменения биологической активности данного белка. Специалисты в данной области признают, что, в общем, единичная аминокислотная замена в заменимой области полипептида по существу не меняет биологическую активность (см., например, Watson et al. (1987) Molecular Biology of the Gene, The Benjamin/Cummings Pub. Co., p. 224 (4th edition)). Кроме того, замены структурно или функционально похожих аминокислот маловероятно нарушат биологическую активность.
Термин «мутантная последовательность», в том виде, в котором он используется в настоящем изобретении, означает, что нуклеотидная последовательность и аминокислотная последовательность по настоящему изобретению подвергаются замене, вставке или делеции, таким образом, полученная нуклеотидная последовательность и аминокислотная последовательность разделяют варьирующий процент идентичности с нуклеотидной последовательностью и аминокислотной последовательностью по настоящему изобретению.
В том виде, в котором он используется в данном документе, термин «идентичность» указывает на степень сходства между двумя нуклеиновыми кислотами или двумя аминокислотными последовательностями. Идентичность последовательностей в настоящем изобретении составляет по меньшей мере 85%, 90% или 95%, предпочтительно по меньшей мере 95%. Репрезентативные примеры включают, но не ограничиваются 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 100%. Сравнение последовательностей и определение идентичности в процентах двух последовательностей можно выполнять с использованием установок по умолчанию алгоритма BLASTN/BLASTP, доступного на веб-сайте национального центра биотехнологического института.
Фраза «антитело против PD-L1 или его антигенсвязывающий белок» по настоящему изобретению могла бы включать любое из антител против PD-L1 или их антигенсвязывающие фрагменты, описанные в данной области. Антитело против PD-L1 может представлять собой антитело против PD-L1, которое имеется в продаже или было раскрыто в литературе, включая, но, не ограничиваясь антителом против PD-L1 BMS-936559, MPDL3280A, MEDI4736, MSB0010718C (см. US 2014341917, US 20130034559, US 8779108) и т.п. Антитело может представлять собой моноклональное антитело, химерное антитело, гуманизированное антитело или человеческое антитело. Фрагмент антитела включает Fab фрагмент, Fab' фрагмент, F(ab')2 фрагмент, обладающий антигенсвязывающей активностью, и Fv фрагмент и scFv фрагмент, который связывается с антигеном.
В качестве иллюстративного способа получения антитела против PD-L1 по настоящему изобретению, см. PCT/CN2016/104320, антитело против PD-L1 содержит CDR вариабельных областей тяжелой цепи, как описано ниже:
В альтернативном воплощении X1 выбран из Н или G; и Х2 выбран из G или F.
В другом воплощении иллюстративное антитело против PD-L1 по настоящему изобретению дополнительно содержит последовательности CDR вариабельной области легкой цепи, как описано ниже:
В другом воплощении осуществляют гуманизацию приведенных выше областей CDR посредством прививки CDR, и FR матриц гуманизированной легкой цепи представляют собой IGKV7-3*01 и hjk2.1, FR матриц гуманизированной тяжелой цепи представляют собой IGHV1-46*01 и hjh6.1, и последовательности гуманизированных вариабельных областей выглядят следующим образом:
Гуманизированная вариабельная область тяжелой цепи:
Гуманизированная вариабельная область легкой цепи:
Примечание. Порядок выглядит следующим образом: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, фрагмент, выделенный курсивом, представляет последовательность FR, и подчеркнутый фрагмент представляет последовательность CDR.
В другом воплощении реализовывали схему обратных: мутаций на гуманизированном антителе по настоящему изобретению, см. приведенную ниже таблицу:
Новое гуманизированное антитело может быть получено посредством отличающейся комбинации мутаций в тяжелой цепи и легкой цепи, показанных в приведенной выше таблице.
В другом аспекте изобретения предложено воплощение для конструирования гуманизированного клона, как указано ниже:
Конструировали праймеры, и фрагменты гена VH/VK каждого гуманизированного антитела конструировали посредством ПЦР и затем вставляли в экспрессионный вектор pHr (с сигнальным пептидом и фрагментом гена константной области (CH1-Fc/CL)) с осуществлением гомологичной рекомбинации для конструирования экспрессионного вектора полноразмерного антитела: VH-CH1-Fc-pHr/VL-CL-pHr.
1. Дизайн праймеров
Программное обеспечение online DNAWorks (v3.2.2)
(http: //helixweb.nih.gov/dnaworks/) использовали для конструирования множества праймеров для синтеза VH/VK содержащих фрагментов гена, требуемых для рекомбинации: 5'-30 п.о. (пара оснований) сигнальный пептид плюс VH/VK плюс 30 п.о. CH1/CL-3'.
2. Сплайсинг фрагментов
В соответствии с инструкциями по эксплуатации для ДНК-полимеразы Primer STAR GXL от компании TaKaRa с использованием праймеров, сконструированных выше, VH/VK содержащие фрагменты гена, требуемые для рекомбинации, получали в результате двух стадийной ПЦР-амплификации.
3. Конструирование экспрессионного вектора pHr (с сигнальным пептидом и фрагментом гена константной области (CH1-FC/CL)) и ферментативное расщепление
Осуществляли дизайн экспрессионного вектора pHr (с сигнальным пептидом и фрагментом гена константной области (CH1-FC/CL)) и его конструировали посредством использования специфичной эндонуклеазы рестрикции, такой как BsmBI, которая распознает отличительный признак между последовательностью и сайтом рестрикции. BsmBI расщепляла вектор, и затем расщепленные фрагменты выделяли посредством геля и хранили для применения.
4. Рекомбинантное конструирование экспрессионного вектора VH-CH1-Fc-pHr/VK-CL-pHr
VH/VK содержащие фрагменты гена, требуемые для рекомбинации, и экспрессионный вектор pHr (с сигнальным пептидом и фрагментом гена константной области (CH1-FC/CL)), который расщепляли посредством BsmBI, добавляли в компетентные клетки DH5H в соотношении 3:1, инкубировали при 0°С на льду в течение 30 мин, подвергали тепловому шоку при 42°С на протяжении 90 с, объединяли с 5 объемами среды LB, инкубировали при 37°С в течение 45 мин, помещали на чашку с LB-Amp и культивировали при 37°С в течение ночи. Единственный клон отбирали для секвенирования, и получали исследуемый клон.
5. Плазмиду конструировали в соответствии со схемой настоящего примера, затем очищали белок, и аффинность полученного белка измеряли посредством выявления, описанного в Примере SPR (от англ. surface plasmon resonance -поверхностный плазмонный резонанс).
6. Наконец, аффинность гуманизированного мутанта с обратной мутацией или антител гибридомы в отношении человеческого PD-L1-His измеряли посредством BIACORE, полученные гуманизированные сайты с обратной мутацией и комбинирование последовательностей посредством скрининга выглядят следующим образом:
вариабельная область тяжелой цепи:
где CDR2 представляет собой последовательность, в которой X1 SEQ ID NO: 7 представляет собой G и Х2 представляет собой F.
вариабельная область легкой цепи:
Примечание. Порядок выглядит следующим образом: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, фрагмент, выделенный курсивом, представляет последовательность FR, и подчеркнутый фрагмент представляет последовательность CDR.
В другом аспекте настоящего изобретения предложено воплощение для конструирования и экспрессии антитела против PD-L1 типа человеческого IgG4, и дополнительно предложено антитело против PD-L1, используемое для конструирования слитого белка. Антитело против PD-L1 можно также использовать в качестве контрольной молекулы в примерах анализов настоящего изобретения.
Поскольку PD-L1 также экспрессируется в активированных Т-клетках, вследствие этого, применение константных областей IgG1 дикого типа может вызывать Fc-опосредованное действие, такое как ADCC и CDC, которое могло бы приводить к уменьшению активированных Т-клеток. Согласно настоящему изобретению осуществляется отбор мутированного IgG4 с получением антител без ADCC и CDC. Клон, полученный в результате созревания аффинности, превращали в тип IgG4, и коровая шарнирная область IgG4 содержала мутацию S228P, и дополнительно вводили мутации F234A и L235A(mAb 4:3, 310-318; Май/Июнь 2012).
В то же время, для того, чтобы избежать того, чтобы происходил разрыв на С-конце тяжелой цепи антитела при введении линкерного пептида (который используется для связывания внеклеточного домена TGF-βRII), последнюю аминокислоту K тяжелой цепи антитела против PD-L1 дополнительно мутировали с получением А, таким образом, чтобы увеличить стабильность слитого белка. Последовательность антитела против PD-L1 по настоящему изобретению, используемая для конструирования слитого белка, выглядит следующим образом:
Тяжелая цепь антитела против PD-L1: IgG4(AA) (S228P)
Легкая цепь антитела против PD-L1:
Примечание. Подчеркнутый фрагмент представляет собой последовательность вариабельной области тяжелой или легкой цепи антитела или ее кодирующую нуклеотидную последовательность. Остальной фрагмент представляет собой последовательность константной области антитела и ее кодирующую нуклеотидную последовательность.
В том виде, в котором он используется в данном документе, слитый белок, описанный в настоящем изобретении, представляет собой белковый продукт, полученный в результате совместной экспрессии двух генов посредством технологии рекомбинантных ДНК. Способы получения и очистки антител и антигенсвязывающих фрагментов хорошо известны в данной области и могут быть найдены, например, в руководстве по экспериментальным технологиям с антителами Колд-Спринг-Харбор, главы 5-8 и 15. Например, мышей можно иммунизировать человеческим PD-L1 или его фрагментами, и полученные антитела могут быть затем ренатурированы, очищены и секвенированы в отношении аминокислотных последовательностей, используя традиционные способы, хорошо известные в данной области. Антигенсвязывающие фрагменты можно также получать традиционными способами. Антитело или антигенсвязывающие фрагменты по настоящему изобретению конструируют с прививкой CDR, происходящих из антитела, не являющегося человеческим, в одну или более человеческих FR. Посредством выравнивания в сравнении с базой данных вариабельных областей антител зародышевой линии человека IMGT, используя программное обеспечение МОЕ, последовательности каркаса зародышевой линии человека можно получать с веб-сайта ImMunoGeneTics (IMGT) https://imgt.cines.fr или из «The Immunoglobulin Facts Book, 2001, ISBN 012441351».
Сконструированные антитела или антигенсвязывающие фрагменты по настоящему изобретению могут быть получены и очищены, используя известные способы. Например, последовательности кДНК, кодирующие тяжелую цепь и легкую цепь, можно клонировать и конструировать в экспрессионный вектор GS. Сконструированным экспрессионным вектором иммуноглобулина можно затем стабильно трансфицировать клетки СНО (от англ. Chinese hamster ovary cell - клетка яичника китайского хомяка). В качестве более рекомендованного способа, известного в данной области, экспрессионная система млекопитающего будет приводить к гликозилированию антитела, обычно в высоко консервативных N-концевых сайтах в области Fc. Стабильные клоны могут быть получены посредством экспрессии антитела, специфично связывающегося с человеческим PD-L1. Позитивные клоны могут быть размножены в культуральной среде, не содержащей сыворотку, для получения антител в биореакторах.
Культуральную среду, в которую секретировалось антитело, можно очищать традиционными методиками. Например, данную среду можно загружать на колонку на основе сефарозы FF с белком А или G, которую уравновешивали совместимым буфером. Колонку промывают для удаления неспецифичных связывающих компонентов. Связанное антитело элюируют посредством градиента рН, и фрагменты антитела выявляют посредством SDS-PAGE (от англ. sodium dodecyl sulphate-polyacrylamide gel electrophoresis - электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия) и затем собирают. Антитело можно фильтровать и концентрировать с использованием обычных методик. Растворимый агрегат и мультимеры можно эффективно удалять обычными методиками, включая гель-фильтрацию или ионный обмен. Продукт может быть сразу же заморожен, например, при -70°С, или может быть лиофилизирован.
«Иммуномодуляторная молекула» по настоящему изобретению может быть использована для ослабления иммунной толерантности раковых клеток. В настоящем изобретении применяется усеченная форма внеклеточного домена TGF-βRII в качестве иммуномодуляторной молекулы в слитом белке. «Рецептор II TGF-β (TGF-βRII)» связывается с лигандами TGF-β1 и 3 с высокой аффинностью. Комплекс TGF-β RII/TGF-β усиливает TGF-β RI с образованием комплекса передачи сигнала (Won et al, Cancer Res. 1999; 59: 1273-7). Внеклеточный домен TGF-βRII представляет собой пептид из 136 аминокислотных остатков с N-конца TGF-βRII, иллюстративный пример которого показан в SEQ ID NO: 13. Другие варианты примерно 136 аминокислот в длину и происходящие из человеческого внеклеточного домена TGF-βRII, которые способны связываться с TGF-β1 и 3, также принадлежат к внеклеточному домену TGF-βRII по изобретению. В настоящем изобретении обнаружилось, что структура и функция N-концевой прилегающей усеченной формы внеклеточного домена TGF-βRII являются более стабильными, чем структура и функция неусеченной молекулы. Слитый белок, содержащий N-концевую неусеченную форму внеклеточного домена TGF-βRII (полипептид, показанный как а.к. 1-136 SEQ ID NO: 13), чувствителен к расщеплению. В частности, усеченная форма, содержащая делецию максимум 26 аминокислот на своем N-конце, является более стабильной, предпочтительно усечение 14-26 аминокислот, более предпочтительно усечение 14-21 аминокислоты на N-конце с более высоким уровнем экспрессии, наиболее предпочтительно усечение 19 или 21 соседних аминокислот на N-конце.
Термин «введение» и «обработка», в том виде, в котором он применяется к животному, человеку, экспериментальному субъекту, клетке, ткани, органу или биологической жидкости, относится к приведению экзогенного фармацевтического, терапевтического, диагностического средства или композиции в контакт с животным, человеком, субъектом, клеткой, тканью, органом или биологической жидкостью. Термин «введение» и «обработка» может относиться, например, к терапевтическим, фармакокинетическим, диагностическим, исследовательским и экспериментальным способам. Обработка клетки охватывает приведение реагента в контакт с клеткой, а также приведение реагента в контакт с жидкостью, где данная жидкость находится в контакте с клеткой. Термин «введение» и «обработка» также означает обработки in vitro или ex vivo, например, клетки реагентом, диагностическим, связывающим соединением или другой клеткой. Термин «лечение», в том виде, в котором он применяется к субъекту-человеку, субъекту ветеринарии или исследования, относится к терапевтическому лечению, профилактическим или превентивным мерам, к исследовательским и диагностическим применениям.
Термин «лечить» означает вводить терапевтическое средство, такое как композиция, содержащая любое из связывающих соединений по настоящему изобретению, внутрь или наружно пациенту, имеющему один или более симптомов заболевания, в отношении которого данное средство обладает известной терапевтической активностью. Типично средство вводят в количестве, эффективном для облегчения одного или более симптомов заболевания у пациента или популяции, подлежащих лечению, вызывая регрессию или предотвращая развитие такого(их) симптома(ов) до какой-либо клинически измеряемой степени. Количество терапевтического средства, которое является эффективным для облегчения какого-либо определенного симптома заболевания (также называемое «терапевтически эффективным количеством»), может варьировать в соответствии с факторами, такими как течение заболевания, возраст и масса пациента, и способностью лекарственного средства вызывать желаемый ответ у пациента. Был ли облегчен симптом заболевания можно оценить посредством любого клинического измерения, обычно используемого лечащими врачами или другими квалифицированными медицинскими работниками, для оценки тяжести или статуса прогрессирования данного симптома. В то время как воплощение настоящего изобретения (например, способ лечения или изделие производства) может не быть эффективным в облегчении целевого(ых) симптома(ов) заболевания у каждого пациента, оно должно облегчать целевой(ые) симптом(ы) заболевания у статистически значимого числа пациентов, как определено любым статистическим критерием, известным в данной области, таким как t-критерий Стьюдента, критерий хи-квадрат, U-критерий Манна и Уитни, критерий Краскела - Уоллиса (Н-критерий), критерий Джонкхира-Терпстры и критерий Уилкоксона.
«Консервативные модификации» или «консервативная замена» относится к заменам аминокислот в белке другими аминокислотами, имеющими похожие характеристики (например, заряд, размер боковой цепи, гидрофобность/гидрофильность, конформация главной цепи и жесткость и т.п.), таким образом, что данные изменения часто могут быть сделаны без изменения биологической активности белка. Специалисты в данной области признают, что, в общем, единичная аминокислотная замена в заменимой области полипептида по существу не меняют биологическую активность (см., например, Watson et al. (1987) Molecular Biology of the Gene, The Benjamin/Cummings Pub. Co., p. 224 (4.sup.th Ed.)) Кроме того, замены структурно или функционально похожих аминокислот с меньшей вероятностью нарушат биологическую активность.
Термин «эффективное количество» охватывает количество, достаточное для смягчения или предупреждения симптома или признака медицинского состояния. Эффективное количество также означает количество, достаточное для обеспечения возможности или облегчения диагностирования. Эффективное количество для конкретного пациента или субъекта ветеринарии может варьировать в зависимости от факторов, таких как состояние, подлежащее лечению, общее состояние здоровья пациента, путь и доза введения и тяжесть побочных эффектов. Эффективное количество может представлять собой максимальную дозу или протокол дозирования, который позволяет избежать значительных побочных эффектов или токсичных действий.
Термин «экзогенный» относится к веществам, которые образуются вне организма, клетки или организма человека, в зависимости от контекста. Термин «эндогенный» относится к веществам, которые образуются в пределах клетки, организма или организма человека, в зависимости от контекста.
Термин «гомология» относится к сходству последовательностей между двумя полинуклеотидными последовательностями или между двумя полипептидными последовательностями. Молекулы считаются гомологичными в одном положении, когда данное положение в обеих последовательностях, подлежащих сравнению, занято одним и тем же основанием или аминокислотной мономерной субъединицей, например, когда положение в каждой из двух молекул ДНК занято аденином. Процент гомологии двух последовательностей является функцией числа совпадающих или гомологичных положений, являющихся общими у двух последовательностей, деленного на число всех сравниваемых положений и затем с умножением на 100. Например, при возможном выравнивании, если 6 из 10 положений в двух последовательностях совпадают или являются гомологичными, тогда данные две последовательности являются гомологичными на 60%. В общем, сравнение осуществляют при выравнивании двух последовательностей с получением максимального процента гомологии.
Термин «молекулы иммунных контрольных точек» включают молекулу стимулирующей иммунной контрольной точки и молекулу ингибиторной иммунной контрольной точки, и иллюстративные молекулы включают CD27, CD28, CD40, CD40L, CD122, ОХ40, OX40L, GITR, ICOS, A2AR, В7-Н3, В7-Н4, BTLA, CTLA-4, IDO, KIR (от англ. Killer-cell Immunoglobulin-like Receptor - рецептор, содержащий иммуноглобулин-подобные домены), LAG3, PD-1, PD-L1, PD-L2, TIM-3, VISTA, и т.д.
В том виде, в котором они используются в данном документе, выражения «клетка», «клеточная линия» и «клеточная культура» используются взаимозаменяемо, и все такие обозначения включают их потомство. Таким образом, слова «трансформант» и «трансформированная клетка» включают первичные исследуемые клетки и полученные из них культуры без учета числа переносов. Также следует понимать, что все потомство не может быть с точностью идентичным по содержанию ДНК вследствие целенаправленных или случайных мутаций. Потомство с мутациями, которое обладает такой же функцией или биологической активностью, что и функция и биологическая активность исходно трансформированных клеток, получают посредством скрининга и будет включено в изобретение. В случае, когда предполагаются отличные обозначения, это будет отчетливо понятно из контекста.
В том виде, в которой она используется в данном документе, фраза «полимеразная цепная реакция» или «ПЦР» относится к способу или методике, в которой маленькое количество конкретных фрагментов нуклеиновой кислоты, РНК и/или ДНК, амплифицируют, как описано, например, в патенте США №4683195. Обычно существует необходимость в информации о последовательности на концах или за пределами исследуемой области, таким образом, чтобы можно было сконструировать олигонуклеотидные праймеры; последовательность данных праймеров будет идентичной или сходной с обратной нитью матрицы, подлежащей амплификации. 5'-Концевые нуклеотиды данных двух праймеров совпадают с концами материала, подлежащего амплификации. ПЦР можно использовать для амплификации конкретных последовательностей РНК, конкретных последовательностей ДНК из тотальной геномной ДНК и кДНК, транскрибируемой с тотальной РНК клетки, последовательностей бактериофагов или плазмид и т.д. Обычно см. Mullis et al. (1987) Cold Spring Harbor Symp. Ouant.Biol. 51:263; Erlich, ed., (1989) PCR TECHNOLOGY (Stockton Press, N.Y.). ПЦР, используемая в настоящем изобретении, считается одним, но не единственным примером способа амплификации анализируемого образца нуклеиновой кислоты на основе полимеразной реакции. Данный способ включает применение известных нуклеиновых кислот в качестве праймеров и полимеразы нуклеиновой кислоты для амплификации или продукции конкретного фрагмента нуклеиновой кислоты.
Термин «возможный» или «возможно» означает, что событие или ситуация, описанная впоследствии, может происходить (но не обязательно происходит), и данное описание включает примеры, в которых событие или ситуация происходит или не происходит. Например, фраза «возможно содержит 1-3 вариабельную(ые) область(ти) тяжелой цепи антитела» означает, что вариабельная область тяжелой цепи антитела с конкретной последовательностью может присутствовать, но не обязательно присутствует.
Термин «фармацевтическая композиция» относится к смеси, содержащей одно или более соединений согласно настоящему изобретению или их физиологически/фармацевтически приемлемую соль или пролекарство и другие химические компоненты, причем указанные химические компоненты представляют собой такие, как физиологически/фармацевтически приемлемый(ые) носитель(и) и вспомогательное(ые) вещество(ва). Целью фармацевтической композиции является содействие введению в организм, облегчение поглощения активного вещества и оказание, таким образом, биологического эффекта.
Примеры и примеры анализов
Далее в данном документе настоящее изобретение дополнительно описано со ссылкой на примеры. Однако объем настоящего изобретения не ограничивается ими.
В примерах настоящего изобретения, в которых не описаны конкретные условия, эксперименты обычно проводят в традиционных условиях или в условиях, предложенных производителями материала или продукта. См. Sambrook et al., Molecular Cloning, Laboratory Manual, Cold Spring Harbor Laboratory; Modern Molecular Biology Methods, Ausubel et al., Greene Publishing Association, Wiley Interscience, NY. Когда источник реагентов конкретным образом не указан, реагенты представляют собой имеющиеся в продаже традиционные реагенты.
Примеры
Пример 1. Клонирование и экспрессия слитого белка PD-L1/ловушка TGF-β
Внеклеточный домен TGF-βRII (полноразмерную или усеченную форму SEQ ID NO: 13) использовали в качестве фрагмента для иммуномодуляторной молекулы в слитом белке, и антитело против PD-L1 используют в качестве нацеливающего фрагмента слитого белка с образованием слитого белка антитело против PD-L1/внеклеточный домен TGF-βRII (PD-L1/ловушка TGF-β). При исследованиях обнаружили, что усеченная форма внеклеточного домена TGF-βRII является относительно стабильной, в особенности усеченная форма включает делецию меньше чем 26 аминокислот на своем N-конце, предпочтительно делецию 14-26 аминокислот, более предпочтительно делецию 14-21 соседних аминокислот, которая демонстрирует более высокий уровень экспрессии и стабильную структуру; более предпочтительно делецию 14, 19 или 21 соседних аминокислот. Последовательности неограничивающих примеров внеклеточного домена TGF-βRII и его усеченной формы по изобретению выглядят следующим образом:
Последовательность внеклеточного домена TGF-βRII: ECD (1-136)
Последовательность усеченного внеклеточного домена TGF-βRII, которая включает делецию размером 19 соседних аминокислот на N-конце: ECD (20-136)
Последовательность усеченного внеклеточного домена TGF-βRII, которая включает делецию размером 21 соседних аминокислот на N-конце: ECD (22-136):
Последовательность усеченного внеклеточного домена TGF-βRII, которая включает делецию размером 14 соседних аминокислот на N-конце: ECD (15-136):
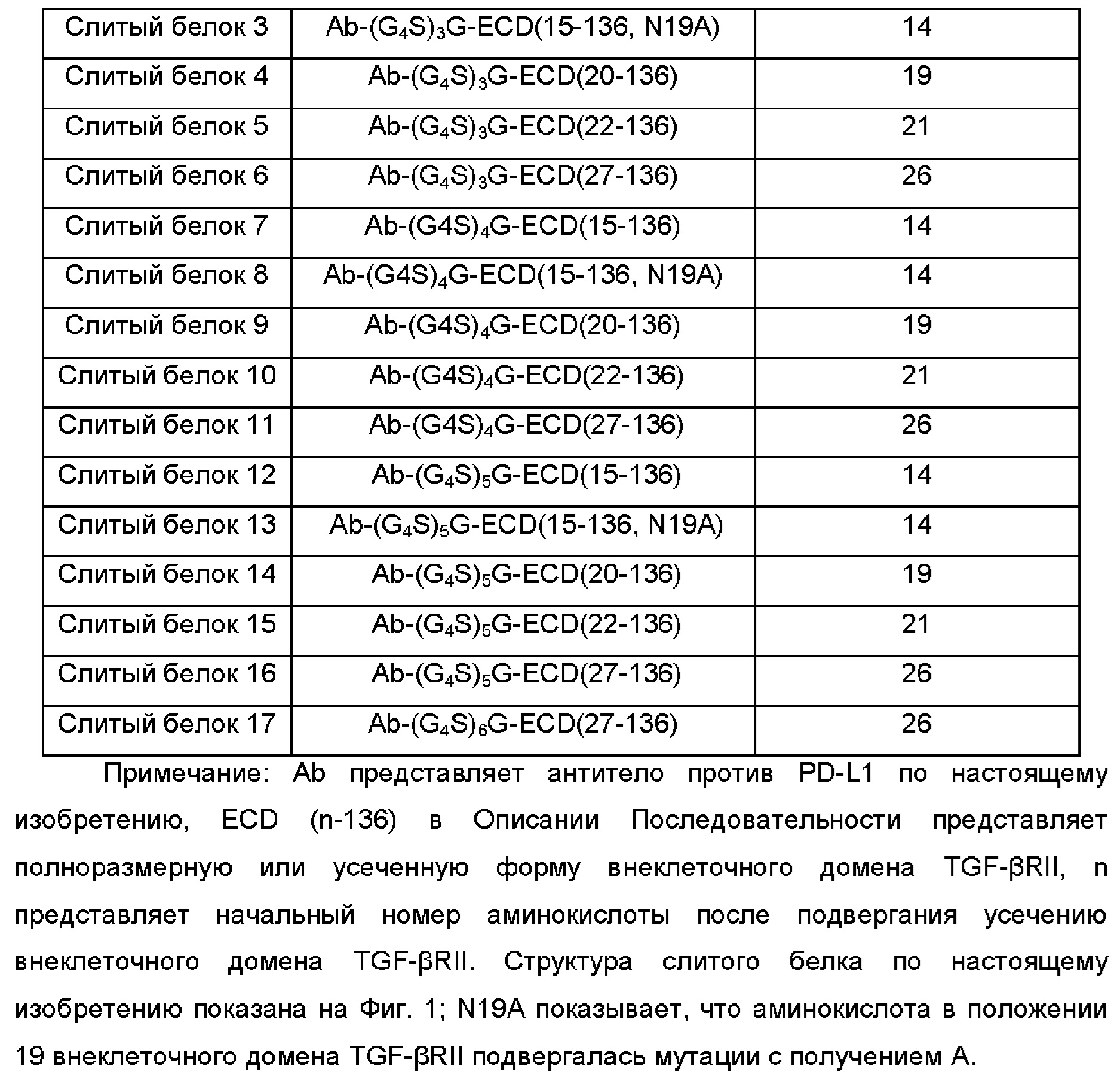
С-концевую аминокислоту тяжелой цепи антитела против PD-L1 по настоящему изобретению лигировали посредством линкера (G4S)xG с внеклеточным доменом TGF-βRII с варьированием длин посредством методики гомологичной рекомбинации, и обычным способом экспрессировали посредством экспрессионной системы 293 вместе с легкой цепью, и полученные слитые белки показаны в Таблице 2:
Нуклеотидную последовательность, кодирующую антитело против PD-L1, нуклеотидную последовательность, кодирующую внеклеточный домен TGF-βRII, и нуклеотидную последовательность фрагмента линкерного белка ((G4S)xG) получали посредством традиционной методики в данной области. С-концевой нуклеотид антитела против PD-L1 лигировали посредством линкерного белка с N-концевым нуклеотидом внеклеточного домена TGF-βRII с разной длиной посредством методики гомологичной рекомбинации, и затем клонировали в вектор Phr-BsmbI. Рекомбинантный слитый белок PD-L1/ловушка TGF-β экспрессировали в клетках 293 и очищали, как описано в Примере 2. Очищенный белок можно использовать в экспериментах следующих примеров.
Пример 2. Очистка слитого белка PD-L1/ловушка TGF-β
Среду для клеточной культуры центрифугировали с высокой скоростью, и супернатант собирали, и первую стадию очистки проводили посредством аффинной хроматографии. Хроматографическая среда представляет собой Белок А или производный наполнитель, который взаимодействует с Fc, как например Mabselect GE. Уравновешивающий буфер представлял собой 1×PBS (от англ. Phosphate buffered saline - фосфатно-солевой буферный раствор) (137 ммоль/л NaCl, 2,7 ммоль/л KCl, 10 ммоль/л Na2HPO4, 2 ммоль/л KH2PO4, рН 7,4). После уравновешивания 5 объемов колонки, клеточный супернатант загружали для связывания, и скорость потока контролировали таким образом, чтобы обеспечить образцу возможность остаться на колонке, на протяжении больше 1 мин или на протяжении 1 мин. После загрузки образца колонку промывали 1×PBS (рН 7,4) до тех пор, пока считываемое значение А280 не уменьшалось до исходного уровня. Затем, колонку промывали 0,1 М содержащим глицин (рН 3,0) элюирующим буфером, и элюируемый пик собирали в соответствии с пиком поглощения в ультрафиолетовой области А280, и собранный элюируемый образец нейтрализовали посредством 1 М Tris (рН 8,5).
Нейтрализованный элюируемый образец концентрировали посредством ультрафильтрации, и затем подвергали эксклюзионной хроматографии, буфер представлял собой 1×PBS, и колонка представляла собой XK26/60 Superdex 200 (GE). Скорость потока контролировали на уровне 4 мл/мин, объем загрузки составлял меньше чем 5 мл, и пик целевого белка объединяли в соответствии с поглощением в ультрафиолетовой области А280. Чистота собранного белка составляла больше, чем 95%, как идентифицировано посредством эксклюзионной ВЭЖХ (Высокоэффективная жидкостная хроматография), и ее проверяли посредством ЖХ-МС (жидкостная хроматография/масс-спектрометрия). Проверенный образец разделяли на аликвоты для применения. Получали слитый белок PD-L1/ловушка TGF-β.
Эффективность и преимущества настоящего изобретения проверяли биохимическими аналитическими способами, как указанно ниже.
Оценивание биологической активности in vitro
Пример анализа 1. In vitro выявление связывания слитого белка PD-L1/ловушка TGF-β с TGF-β1 на основе ELISA
Способ выявления описан ниже:
а. 96-луночные планшеты покрывали 100 мкл/лунка человеческого TGF-β1 (8915LC, CST) при концентрации 1 мкг/мл при 4°С в течение ночи.
б. Промывка, 3 раза, 250 мкл 1×PBST, 250 мкл 5% молока в PBS добавляли для блокирования при 37°С на протяжении 2 часов.
в. Промывка, 3 раза, 250 мкл 1×PBST, градиентное разведение слитого белка PD-L1/ловушка TGF-β, ловушку TGF-p и положительный контроль добавляли и инкубировали в течение 1 часа при 37°С.
г. Промывка, 3 раза, 250 мкл 1×PBST.
д. 100 мкл антитела против человеческого Fc, конъюгированного с HRP (от англ. horseradish peroxidase - пероксидаза хрена) (1:4000), добавляли в каждую лунку и инкубировали в течение 40 минут при 37°С.
е. 100 мкл ТМВ (от англ. tetramethylbenzidine - тетраметилбензидин) добавляли в каждую лунку, инкубировали в течение 10 минут при комнатной температуре, и реакцию останавливали посредством добавления 100 мкл 1 М H2SO4.
ж. Поглощение при 450 нм измеряли на микропланшете-ридере, и данные анализировали посредством Graphpad Prism5.
Результаты связывания слитого белка с человеческим TGF-β1 in vitro показаны на Фиг. 2 и 3. ELISA показал, что слитый белок 1 в Таблице 2 не сохранял активности связывания с человеческим TGF-β1. Масс-спектрометрический анализ показал, что слитый белок 1 (то есть, неусеченная форма внеклеточного домена TGF-βRII (1-136)) была нестабильной, и она легко разрушалась в тяжелой цепи TGF-βRII, и положительный контроль имел такой же дефект. Слитые белки, содержащие N-концевую усеченную форму внеклеточного домена TGFβRII, такие как слитые белки 7, 9, 10, 12-15, являются специфичными в отношении связывания с человеческим TGF-β1.
Пример анализа 2. In vitro выявление связывания слитого белка PD-L1/ловушка TGF-β с PD-L1 на основе ELISA
Антиген, используемый для выявления: PD-L1-His
Способ выявления описан ниже:
а. 96-луночные планшеты покрывали 100 мкл/лунка человеческого PD-L1-His (SEQ ID NO: 17) при концентрации 5 мкг/мл при 4°С в течение ночи.
б. Промывка, 3 раза, 250 мкл 1×PBST, 250 мкл 5% молока в PBS добавляли для блокирования при 37°С в течение 2 часов.
в. Промывка, 3 раза, 250 мкл 1×PBST, градиентное разведение слитого белка PD-L1/ловушка TGF-β, антитело против PD-L1 в качестве положительного контроля добавляли и инкубировали в течение 1 часа при 37°С.
г. Промывка, 3 раза, 250 мкл 1×PBST.
д. 100 мкл антитела против человеческого Fc, конъюгированного с HRP (1:4000), добавляли в каждую лунку и инкубировали в течение 40 минут при 37°С.
е. 100 мкл ТМВ добавляли в каждую лунку, инкубировали в течение 10 минут при комнатной температуре, и реакцию останавливали посредством добавления 100 мкл 1 М H2SO4.
ж. Поглощение при 450 нм измеряли на микропланшете-ридере, и данные анализировали посредством Graphpad Prism5.
Результаты связывания слитого белка по настоящему изобретению с человеческим PD-L1 in vitro показаны на ФИГ.4. ELISA показал, что все слитые белки сохраняли активность связывания с человеческим PD-L1.
Пример анализа 3. Выявление блокирования PD-1/PD-L1 in vitro
1. Цель анализа
Для исследования блокирующего действия слитого белка PD-L1/ловушка TGF-β на сигнальный путь PD-1/PD-L1, эксперимент по блокированию антителом на клетках проводили на клетках, несущих рецепторные молекулы PD-1 и PD-L1 человека, которые конструировали посредством Promaga, соответственно.
2. Анализируемые образцы
Контроль 1 (20T-Fc): ECD(20-136)-Fc, слитый белок, содержащий фрагмент усеченного внеклеточного домена TGF-βRII ECD (20-136) и Fc
Последовательность выглядит следующим образом:
Контроль 2 (22T-Fc): ECD(22-136)-Fc, слитый белок, содержащий фрагмент усеченного внеклеточного домена TGF-βRII ECD (22-136) и Fc
Последовательность выглядит следующим образом:
Человеческий IgG: холостой контроль, человеческий иммуноглобулин, полученный из смешанной нормальной сыворотки человека, посредством очистки, используя традиционный метод аффинной хроматографии, как например Белок А;
Положительный контроль (М7824, полученный посредством патента, на который делается ссылка, WO 2015118175): слитый белок антитело против PD-L1/внеклеточный домен TGF-βRII;
Аминокислотная последовательность легкой цепи антитела против PD-L1:
Аминокислотная последовательность тяжелой цепи антитела против PD-L1/внеклеточного домена TGF-βRII (1-136):
3. Процесс проведения анализа
Клетки CHO/PD-L1 (CS187108, Promega) расщепляли и ресуспендировали в полной среде F-12 Nutrient Mixture (Ham). Плотность клеток доводили до 4×105/мл с использованием полной среды в соответствии с результатами подсчета клеток. Клеточную суспензию переносили в бак загрузки, добавляли в 96-луночный планшет в количестве 100 мкл/лунка с использованием многоканальной пипетки и инкубировали при 37°С, в инкубаторе с 5% CO2 в течение 20-24 ч; На следующий день получали клеточную суспензию Jurkat/PD-1 (CS187102, Promega), и клетки ресуспендировали в соответствии с результатами подсчета клеток с использованием аналитической среды, и плотность клеток доводили до 1,25×106/мл; Планшеты с клеточной культурой, содержащие клетки CHO/PD-L1, вынимали из инкубатора, на лунку отбирали 95 мкл раствора культуры с использованием многоканальной пипетки, и градиентно разведенный слитый белок, антитело против PD-L1 и положительный контроль (М7824) соответственно добавляли в количестве 40 мкл/лунка. Затем, клеточную суспензию Jurkat/PD-1 переносили в бак загрузки, добавляли в планшет с клеточной культурой в количестве 40 мкл/лунка и инкубировали при 37°С, 5% CO2 в течение 5-6 ч. Во время инкубации с белком реагент Bio-Glo™ вынимали и оставляли при комнатной температуре. Планшеты с клеточной культурой вынимали и помещали их в комнатную температуру на 5-10 мин. Затем 40 мкл реагента Bio-Glo™ добавляли в каждую лунку, инкубировали в ламинарном боксе в течение 5-10 мин, и значение сигнала хемилюминесценции считывали, используя многофункциональный микропланшет-ридер.
4. Результаты
Как показано на Фиг. 5, равно как и молекула положительного контроля, слитый белок 9 по настоящему изобретению мог эффективно блокировать связывание PD-1-экспрессирующих клеток Jurkat с клетками CHO/PD-L1 и оказывать действие дозозависимым образом наряду с концентрацией лекарственного средства. Слитый белок 15 обладает такой же блокирующей способностью, как и блокирующая способность слитого белка 9.
Пример анализа 4: Выявление аффинности и кинетики связывания in vitro посредством Biacore
Аффинность тестируемой молекулы в отношении человеческого или мышиного TGF-β1 или человеческого белка PD-L1 определяли посредством Biacore Т200 (GE). Экспериментальный способ описан ниже:
Определенное количество слитого белка PD-LI/ловушка TGF-β захватывалось чипом на основе белка А, и затем человеческий или мышиный TGF-β1 (8915LC, CST) или человеческий PD-L1 (Sino Biological) пропускали через поверхность данного чипа. Реакционный сигнал выявляли в реальном времени, используя Biacore, с получением кривых ассоциации и диссоциации. Затем биочип промывали и регенерировали глицин гидрохлоридом (рН 1,5, GE). Буферный раствор, используемый в эксперименте, представлял собой буфер HBS-EP (GE). Экспериментальные данные подгоняли под (1:1) модель Ленгмюра с использованием ознакомительной версии 4.1 программного обеспечения BIA(GE), и получали значения аффинности, как показано в Таблице 3.
Связывающая активность слитых белков показана в Таблице 3. Результаты указывают на то, что слитые белки 9 и 15 по настоящему изобретению обладают чрезвычайно высокой аффинностью в отношении человеческого, мышиного TGF-β1 и человеческого PD-L1.
Пример анализа 5. Анализ ингибирования репортерного гена SMAD3
1. Цель анализа
В данном эксперименте Smad3 связывающий элемент (SBE - от англ. Smad3 binding element) с репортерным геном люциферазы экспрессировали в клетках HepG2 для изучения ингибиторного действия слитого белка PD-L1/ловушка TGF-β на TGF-β1-индуцируемую активацию Smad3, и активность слитого белка PD-L1/ловушка TGF-β in virto оценивали в соответствии со значением IC50.
2. Образец для анализа: слитый белок 9, положительный контроль (М7824)
3. Способ анализа
Клетки HepG2 культивировали в полной среде MEM (от англ. minimal essential medium - минимальная питательная среда) (GE, SH30243.01), содержащей 10% FBS (от англ. Fetal Bovine Serum - фетальная телячья сыворотка), и пересевали каждые 3 дня. В первые сутки эксперимента 25000 клеток на лунку инокулировали в 96-луночные планшеты (Corning, 3903) и культивировали при 37°С, 5% CO2 в течение 24 часов. На следующие сутки среду в планшетах для клеточной культуры отбрасывали, и осуществляли трансфекцию 100 нг плазмиды 3ТР-Lux на лунку. Клетки дополнительно культивировали при 37°С, 5% CO2 в течение 24 часов. За шесть часов до добавления анализируемого образца, полную среду в 96-луночном планшете отбрасывали, и в каждую лунку добавляли 80 мкл неполной среды (MEM + 0,5% FBS). После 6 часов 10 мкл раствора человеческого TGF-β1 (R&D, 240-В-010), приготовленного в неполной среде (конечная концентрация 2 нг/мл), и добавляли 10 мкл анализируемого образца (конечная концентрация составляет 500, 50, 5, 0,5, 0,05, 0,005, 0,0005 и 0 нМ), растворитель человеческого TGF-β1 использовали в качестве контроля, и клетки культивировали при 37°С, 5% CO2 на протяжении еще 18 ч. Затем 100 мкл полученного субстрата люциферазы системы анализа люциферазы ONE-Glo™ (promega, Е6110) добавляли в каждую лунку и инкубировали при комнатной температуре в течение 10 минут в темноте, и затем значение люминесцентного сигнала считывали, используя минипланшет-ридер Victor3 (Perkin Elmer). Значение IC50 анализируемого образца получали посредством расчета с использованием программного обеспечения для обработки данных Graphpad Prism 5.0.
На Фиг. 6 показано, как слитый белок 9 ингибирует TGFβ-индуцируемую активность pSMAD3 дозозависимым образом, и имеет эффективность и IC50 (концентрацию, требуемую для ингибирования 50% максимальной активности) сопоставимую с эффективностью и IC50 положительного контроля М7824. Результаты анализа по антителу против PD-L1 показали, что оно не оказывает ингибирующего действия (IC50 больше 500 нМ).
Пример анализа 6. In vitro выявление секреции IFNγ РВМС за счет стимуляции туберкулином (ТВ)
1. Цель анализа
Для исследования активации Т-лимфоцитов слитым белком PD-L1/ловушка TGF-β мононуклеарные клетки периферической крови человека (РВМС) собирали и очищали, и секрецию IFNγ выявляли после стимуляции туберкулином (ТВ - от англ. tuberculin) в течение 5 суток.
2. Образец для анализа
Человеческий IgG; антитело против PD-L1; Слитый белок 9 Контроль 1 (20T-Fc): ECD(20-136)-Fc; антитело против PD-L1 + контроль 1 (20Т-Fc).
3. Способ анализа
К указанным выше образцам добавляли 15 мл очищенных свежих РВМС, примерно 3×107 клеток, и 20 мкл туберкулина и культивировали в инкубаторе в течение 5 суток при 37°С, 5% CO2. В сутки 6, культивируемые клетки собирали и центрифугировали, промывали один раз PBS и ресуспендировали в свежей среде с плотностью, доведенной до 1×106 клеток/мл, 90 мкл ресуспендированных клеток добавляли в 96-луночный планшет.10 мкл/лунка разных концентраций антител по отдельности добавляли в соответствующие лунки указанного выше 96-луночного планшета для культуры клеток, 10 мкл PBS добавляли в контроль и холостую группу, соответственно. Затем, планшет с клеточной культурой инкубировали в инкубаторе в течение трех суток при 37°С, 5% CO2. Планшет с клеточной культурой вынимали, и супернатант отбирали из каждой лунки после центрифугирования (4000 об/мин, 10 мин). После 10-кратного разведения секрецию IFN-γ выявляли посредством ELISA (набор для выявления человеческого IFN-γ, Xinbosheng, ЕНС 102g.96), обращаясь к инструкциям к реагентам для конкретных операций. Как показано на фигуре, образцы слитого белка PD-L1/ловушка TGF-β были способны усиливать секрецию цитокина IFN-γ активированными Т-лимфоцитами, и имели дозовый эффект концентрации лекарственного средства.
4. Результаты
Как показано на Фиг. 7 и в Таблице 4, слитый белок 9 мог усиливать секрецию активированным Т-лимфоцитом цитокина IFN-γ дозозависимым образом, и имел более сильный эффект активации, чем эффект активации антитела против PD-L1 и 20T-FC.
Фармакокинетическая оценка
Пример анализа 7
Трех крыс SD (от англ. Sprague Dawley - Спрег-Доули), самок, приобретали в Jiesijie Experimental Animal Co., Ltd. и содержали в условиях 12/12-часового цикла свет/темнота (температура составляет 24 плюс/минус 3°С, относительная влажность составляет 50-60%), крысы имели свободный доступ к воде и пище. В день эксперимента крысам SD инъецировали слитый белок в хвостовую вену в дозе 6 мг/кг и объеме инъекции 5 мл/кг.
Забор крови осуществляли в момент времени: 15 мин, 7 ч (в первые сутки), 24 ч (2ые сутки), 3ьи сутки, 4ые сутки, 6ые сутки, 8ые сутки, 10ые сутки и 15ые сутки после введения, 200 мкл крови (эквивалентно 100 мкл сыворотки) отбирали из вены глазного дна крысы. Образец крови помещали в условия комнатной температуры на 30 мин для обеспечения агглютинации и затем центрифугировали при 10000 g в течение 10 минут при 4°С. Супернатант отбирали и сразу же помещали на хранение при -80°С. Концентрацию слитого белка в сыворотке измеряли посредством ELISA.
Способ измерения описан ниже:
а. 96-луночные планшеты покрывали 100 мкл/лунка человеческого PD-L1-His в концентрации 2 мкг/мл, в течение ночи при 4°С.
б. Промывка, 4 раза, 250 мкл 1×PBST, 250 мкл 5% молока в PBS добавляли для блокирования при 37°С в течение 3 часов.
в. Промывка, 4 раза, 250 мкл 1×PBST, добавляли 100 мкл градиентно разведенного образца сыворотки и инкубировали при 37°С в течение 1 часа со слитым белком 9 в качестве положительного контроля.
г. Промывка, 5 раз, 250 мкл 1×PBST.
д. Добавляли 100 мкл/лунка биотинилированного антитела против человеческого TGF-pRII (R&D) и инкубировали в течение 1 часа при 37°С.
е. Промывка, 5 раз, 250 мкл 1×PBST.
ж. Добавляли 100 мкл/лунка ТМВ, инкубировали в течение 10 минут при комнатной температуре и реакцию останавливали добавлением 100 мкл 1 М H2SO4.
з. Поглощение при 450 нм измеряли на микропланшете-ридере, и данные анализировали посредством Graphpad Prism5.
Результаты PK анализа показали, что период полужизни слитого белка 9 по настоящему изобретению у крыс составлял приблизительно 236 ч (9,8 суток), см. Таблицу 5.
Оценивание биологической активности in vivo
Пример анализа 8: Воздействие слитого белка PD-L1/ловушка TGF-β на подкожный ксенотрансплантат опухоли молочной железы человека MDA-MB-231, пересаживаемый мыши
Мышиная линия, используемая в данном эксперименте, представляла собой самку мыши NOD/SCID (Cavens). Мононуклеарные клетки периферической крови человека, используемые в эксперименте, выделяли из свежесобранной крови, и способ выделения выглядел следующим образом: венозную кровь, подвергнутую обработке гепарином, препятствующей свертыванию, смешивали с PBS, содержащим 2% FBS в таком же объеме, и после смешивания 25 мл разведенной крови медленно добавляли в центрифужную пробирку, содержащую 15 мл раствора для отделения лимфоцитов, и центрифугировали при 1200 g в течение 10 минут при комнатной температуре. Слой лимфоцитов отбирали пипеткой в другую центрифужную пробирку, клетки промывали PBS и центрифугировали при 300 g в течение 8 минут при комнатной температуре. После одного повторения клетки ресуспендировали в среде RPMI-1640, содержащей 10% FBS, и клетки добавляли в 6-луночный планшет, предварительно покрытый антителом против CD3 (ОКТ3, 40 нг/мл), в количестве 2×106 клеток/лунка (2 мл), и затем помещали в инкубатор при 37°С на 4 суток.
Анализируемый образец
холостой контроль: PBS; слитый белок 9-4,8 мг/кг; слитый белок 9-24 мг/кг; антитело против PD-L1-4 мг/кг; антитело против PD-L1-20 мг/кг; антитело против PD-L1 -4 мг/кг + контроль 1 (20T-Fc)-2,14 мг/кг; контроль 1 (20Т-Fc)-2,14 мг/кг.
Клетки MDA-MB-231 ресуспендировали в бессывороточной среде RPMI-1640 и смешивали с равным объемом матригеля, 100 мкг (2,3×106) инокулировали подкожно в правую боковую поверхность мышей NOD/SCID. 11 Дней спустя, животных, несущих слишком большую или недостаточно большую опухоль, исключали, мышей случайным образом распределяли на группы, по 9 животных в каждой группе. 5×105 Стимулированных РВМС (60 мкл) инъецировали в опухолевые ткани, и оставшиеся РВМС дополнительно культивировали без стимуляции. Одну неделю спустя, 5×106 РВМС (100 мкл) внутрибрюшинно инъецировали мышам, несущим опухоль, в качестве первого раунда инъекции. На протяжении экспериментального периода, за 2 с половиной раунда, в общей сложности обеспечивали 5 инъекций РВМС. В день первой внутриопухолевой инъекции проводили внутрибрюшинное введение, три раза в неделю, в общей сложности 14 введений. Схема введения показана в Таблице 6. Объем и массу опухоли измеряли дважды в неделю. Результаты эксперимента показаны в Таблице 7.
Результаты показаны на Фиг. 8, слитый белок, содержащий антитело, 9 (4,8, 24 мг/кг) может значимо ингибировать рост мышиного подкожного ксенотрансплантата опухоли молочной железы человека MDA-MB-231. Имело место дозозависимая взаимосвязь между высокой и низкой дозами, и он превосходил антитело против PD-L1, используемое в качестве референсного лекарственного средства (4, 20 мг/кг), контрольную молекулу TGF-pRII 20T-FC (2,14 мг/кг) и комбинированную группу (антитело против PD-L1-4 мг/кг + 20 T-FC - 2,14 мг/кг) в эквивалентной молярной дозе, соответственно. Каждая доза слитого белка 9 сохраняла идеальный противоопухолевый эффект с 14ых суток после введения; при сравнении с антителом против PD-L1-20 мг/кг, слитый белок 9 в высокой дозе обладал очевидным преимуществом (р меньше 0,05). На 25ые сутки после введения, противоопухолевое действие каждого антитела достигало оптимального уровня. Степени ингибирования, достигаемые группой слитого белка 9 в комбинации с антителом против PDL-1 (как при высокой, так и при низкой дозе), составляли 37,24%, 52,38%, 30,24%, 28,01% и 31,38%, соответственно. На 32ые сутки после введения противоопухолевое действие слитого белка 9 было все еще очень значимым. %, TGI (от англ. tumor growth inhibition - ингибирование роста опухоли) группы низкой и высокой дозы составляло 36,68% и 50,76%, соответственно, и объем опухоли статистически отличался, по сравнению с контрольной группой (р меньше 0,05).
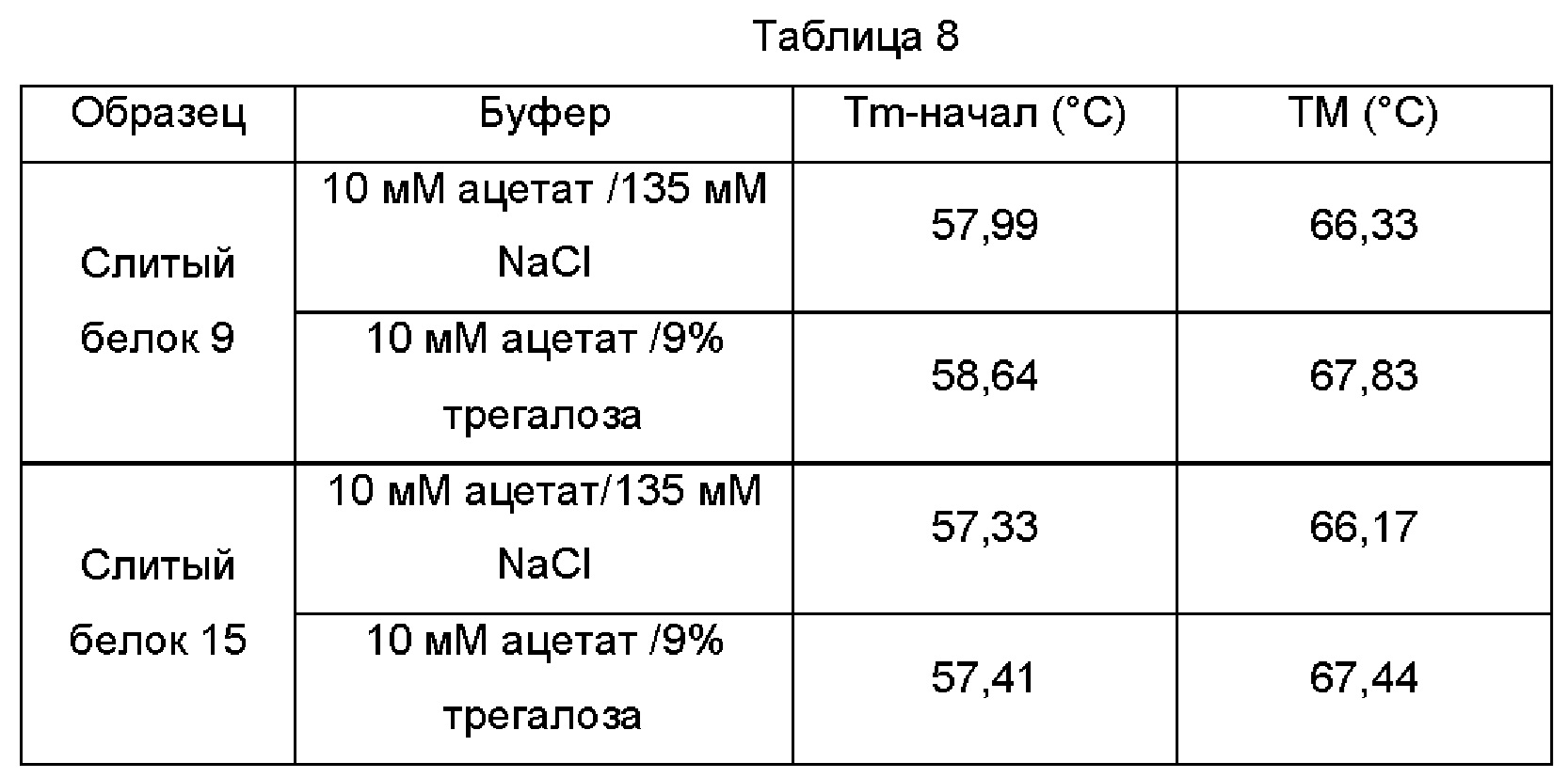
Пример анализа 9. Физическая стабильность слитого белка PD-L1/ловушка TGF-β
Данный пример анализа использовали для выявления стабильности слитого белка 9 и слитого белка 15.
ДСК (дифференциальная сканирующая колориметрия) использовали для выявления термостабильности разных антител, и сравнивали стабильность в разных буферных системах. Буферные системы включают такие, как 10 мМ ацетат /135 мМ NaCl (рН 5,5) и 10 мМ ацетат / 9% трегалоза (рН 5,5).
Образец растворяли в соответствующих буферах, и концентрацию контролировали на уровне примерно 50 мг/мл. Выявление проводили посредством капиллярного дифференциального сканирующего калориметра (ДСК) MicroCal* VP (Malvern). Перед анализом каждый образец и холостой буфер дегазировали с помощью вакуумного дегазирующего устройства в течение 1-2 мин. В каждую лунку планшета добавляли 400 мкл образца или холостого буфера (загружаемое количество составляло 300 мкл). Наконец, в две пары луночных планшетов добавляли 14% Decon 90 и ddH2O, соответственно, и они были готовы для промывки. Образец загружали в планшет, и затем планшет герметично закрывали пластиковой крышкой. Сканирование начиналось с температуры 25°С и заканчивалось при 100°С, и скорость сканирования составляет 60°С/ч. Результаты показаны в Таблице 8, указывая на то, что как слитый белок 9, так и слитый белок 15 демонстрируют хорошую термостабильность в данных двух тест-системах.
Периодическую стабильность при определенной концентрации исследовали посредством отслеживания чистоты с помощью эксклюзионной ВЭЖХ, иллюстративные условия, например, концентрацию образца контролировали на уровне примерно 50 мг/мл. Стабильность разных антител в 10 мМ ацетате/135 мМ NaCl (рН 5,5) сравнивали в условиях, таких как 5 циклов замораживания и оттаивания при -80°С, и хранили при 40°С в течение одного месяца. Для выявления использовали колонку для ВЭЖХ с белком Xbridge ВЕН SEC 200А (Waters). Результат показан ниже в Таблице 9, данные два слитых белка демонстрировали хорошую стабильность.
Пример анализа 10. Химическая стабильность слитого белка
Дезамидирование представляет собой обычную химическую модификацию, которая будет влиять на стабильность антитела на более поздней стадии. В особенности, сверхдезамидирования аминокислот в областях CDR будут избегать, или уменьшение мутаций в данных областях является предпочтительным. 1600 мкг антитела, подлежащего тестированию, растворяли в 200 мкл 10 мМ ацетата/135 мМ NaCl (рН5,5) и помещали в инкубатор при 40°С. Образцы отбирали в сутки 0, 14 и 28 для анализа на основе ферментативного гидролиза. 100 мкг каждого образца, отобранного в разные моменты времени, растворяли в 100 мкл 0,2 М His-HCl, 8 М раствора Gua-HCl, рН 6,0; добавляли 3 мкл 0,1 г/мл DTT (от англ. dithiothreitol -дитиотреитол), и затем образец инкубировали на водяной бани 50°С в течение 1 часа. Затем, два раза осуществляли ультрафильтрацию образца 0,02 М His-HCl (рН 6,0) и расщепляли в течение ночи при 37°С на водяной бани посредством добавления 3 мкл 0,25 мг/мл трипсина. Модификацию - дезамидирование исследовали, используя времяпролетный жидкостный хромато-масс-спектрометр Agilent 6530, и результаты показаны ниже в Таблице 10.
Результаты масс-спектрометрии показали, что эти два слитых белка не имеют очевидных сайтов модификации-дезамидирования, что указывает на то, что данные слитые белки обладают хорошей химической стабильностью.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> JIANGSU HENGRUI MEDICINE CO.,LTD., SHANGHAI HENGRUI PHARMACEUTICAL CO.,
LTD.
<120> СЛИТЫЙ БЕЛОК, СОДЕРЖАЩИЙ РЕЦЕПТОР TGF-b, И ЕГО ФАРМАЦЕВТИЧЕСКОЕ
ПРИМЕНЕНИЕ
<130> 780027CPCT
<160> 21
<170> PatentIn version 3.3
<210> 1
<211> 5
<212> ПРТ
<213> Mus musculus
<400> 1
Ser Tyr Trp Met His
1 5
<210> 2
<211> 17
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Мутант HCDR2 антитела против PD-L1
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> Xaa представляет собой His или Gly.
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> Xaa представляет собой Gly или Phe.
<400> 2
Arg Ile Xaa Pro Asn Ser Gly Xaa Thr Ser Tyr Asn Glu Lys Phe Lys
1 5 10 15
Asn
<210> 3
<211> 10
<212> ПРТ
<213> Mus musculus
<400> 3
Gly Gly Ser Ser Tyr Asp Tyr Phe Asp Tyr
1 5 10
<210> 4
<211> 15
<212> ПРТ
<213> Mus musculus
<400> 4
Arg Ala Ser Glu Ser Val Ser Ile His Gly Thr His Leu Met His
1 5 10 15
<210> 5
<211> 7
<212> ПРТ
<213> Mus musculus
<400> 5
Ala Ala Ser Asn Leu Glu Ser
1 5
<210> 6
<211> 9
<212> ПРТ
<213> Mus musculus
<400> 6
Gln Gln Ser Phe Glu Asp Pro Leu Thr
1 5
<210> 7
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Мутант вариабельной области тяжелой цепи гуманизированного антитела
против PD-L1
<220>
<221> MISC_FEATURE
<222> (52)..(52)
<223> Xaa представляет собой His или Gly.
<220>
<221> MISC_FEATURE
<222> (57)..(57)
<223> Xaa представляет собой Gly или Phe.
<400> 7
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Xaa Pro Asn Ser Gly Xaa Thr Ser Tyr Asn Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Ser Ser Tyr Asp Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 8
<211> 111
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела против PD-L1
<400> 8
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Gln Arg Ala Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Ser Ile His
20 25 30
Gly Thr His Leu Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Asn Asp Thr Ala Asn Tyr Tyr Cys Gln Gln Ser Phe
85 90 95
Glu Asp Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 9
<211> 119
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи антитела против PD-L1 с созревшей
аффинностью
<400> 9
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Gly Pro Asn Ser Gly Phe Thr Ser Tyr Asn Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Ser Ser Tyr Asp Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 10
<211> 111
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи антитела против PD-L1 с созревшей
аффинностью
<400> 10
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Gln Arg Ala Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Ser Ile His
20 25 30
Gly Thr His Leu Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Glu Asp Thr Ala Asn Tyr Tyr Cys Gln Gln Ser Phe
85 90 95
Glu Asp Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 11
<211> 446
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь антитела против PD-L1
<400> 11
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Gly Pro Asn Ser Gly Phe Thr Ser Tyr Asn Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Ser Ser Tyr Asp Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val
260 265 270
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Ala
435 440 445
<210> 12
<211> 218
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Легкая цепь антитела против PD-L1
<400> 12
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Gln Arg Ala Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Ser Ile His
20 25 30
Gly Thr His Leu Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Glu Asp Thr Ala Asn Tyr Tyr Cys Gln Gln Ser Phe
85 90 95
Glu Asp Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 13
<211> 136
<212> ПРТ
<213> Homo sapiens
<220>
<223> Последовательность внеклеточного домена TGF-бета RII: ECD(1-136)
<400> 13
Ile Pro Pro His Val Gln Lys Ser Val Asn Asn Asp Met Ile Val Thr
1 5 10 15
Asp Asn Asn Gly Ala Val Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp
20 25 30
Val Arg Phe Ser Thr Cys Asp Asn Gln Lys Ser Cys Met Ser Asn Cys
35 40 45
Ser Ile Thr Ser Ile Cys Glu Lys Pro Gln Glu Val Cys Val Ala Val
50 55 60
Trp Arg Lys Asn Asp Glu Asn Ile Thr Leu Glu Thr Val Cys His Asp
65 70 75 80
Pro Lys Leu Pro Tyr His Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro
85 90 95
Lys Cys Ile Met Lys Glu Lys Lys Lys Pro Gly Glu Thr Phe Phe Met
100 105 110
Cys Ser Cys Ser Ser Asp Glu Cys Asn Asp Asn Ile Ile Phe Ser Glu
115 120 125
Glu Tyr Asn Thr Ser Asn Pro Asp
130 135
<210> 14
<211> 117
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Последовательность усеченного внеклеточного домена TGF-бета RII, который
включает делецию 19 соседних аминокислот на N-конце: ECD(20-136)
<400> 14
Gly Ala Val Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp Val Arg Phe
1 5 10 15
Ser Thr Cys Asp Asn Gln Lys Ser Cys Met Ser Asn Cys Ser Ile Thr
20 25 30
Ser Ile Cys Glu Lys Pro Gln Glu Val Cys Val Ala Val Trp Arg Lys
35 40 45
Asn Asp Glu Asn Ile Thr Leu Glu Thr Val Cys His Asp Pro Lys Leu
50 55 60
Pro Tyr His Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro Lys Cys Ile
65 70 75 80
Met Lys Glu Lys Lys Lys Pro Gly Glu Thr Phe Phe Met Cys Ser Cys
85 90 95
Ser Ser Asp Glu Cys Asn Asp Asn Ile Ile Phe Ser Glu Glu Tyr Asn
100 105 110
Thr Ser Asn Pro Asp
115
<210> 15
<211> 115
<212> PRT
<213> Artificial sequence
<220>
<223> Последовательность усеченного внеклеточного домена TGF-бета RII, который
включает делецию 21 соседней аминокислоты на N-конце:ECD(22-136)
<400> 15
Val Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp Val Arg Phe Ser Thr
1 5 10 15
Cys Asp Asn Gln Lys Ser Cys Met Ser Asn Cys Ser Ile Thr Ser Ile
20 25 30
Cys Glu Lys Pro Gln Glu Val Cys Val Ala Val Trp Arg Lys Asn Asp
35 40 45
Glu Asn Ile Thr Leu Glu Thr Val Cys His Asp Pro Lys Leu Pro Tyr
50 55 60
His Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro Lys Cys Ile Met Lys
65 70 75 80
Glu Lys Lys Lys Pro Gly Glu Thr Phe Phe Met Cys Ser Cys Ser Ser
85 90 95
Asp Glu Cys Asn Asp Asn Ile Ile Phe Ser Glu Glu Tyr Asn Thr Ser
100 105 110
Asn Pro Asp
115
<210> 16
<211> 122
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Последовательность усеченного внеклеточного домена TGF-бета RII, который
включает делецию 14 соседних аминокислот на N-конце: ECD(15-136)
<400> 16
Val Thr Asp Asn Asn Gly Ala Val Lys Phe Pro Gln Leu Cys Lys Phe
1 5 10 15
Cys Asp Val Arg Phe Ser Thr Cys Asp Asn Gln Lys Ser Cys Met Ser
20 25 30
Asn Cys Ser Ile Thr Ser Ile Cys Glu Lys Pro Gln Glu Val Cys Val
35 40 45
Ala Val Trp Arg Lys Asn Asp Glu Asn Ile Thr Leu Glu Thr Val Cys
50 55 60
His Asp Pro Lys Leu Pro Tyr His Asp Phe Ile Leu Glu Asp Ala Ala
65 70 75 80
Ser Pro Lys Cys Ile Met Lys Glu Lys Lys Lys Pro Gly Glu Thr Phe
85 90 95
Phe Met Cys Ser Cys Ser Ser Asp Glu Cys Asn Asp Asn Ile Ile Phe
100 105 110
Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp
115 120
<210> 17
<211> 236
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Антиген, используемый для детекции: PD-L1-His
<400> 17
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Arg Cys
85 90 95
Met Ile Ser Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Glu Gln Lys Leu
210 215 220
Ile Ser Glu Glu Asp Leu His His His His His His
225 230 235
<210> 18
<211> 346
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Контроль 1 (20T-Fc): ECD(20-136)-Fc, слитый белок, содержащий фрагмент
усеченного внеклеточного домена TGF-beta RII ECD (20-136) и Fc
<400> 18
Gly Ala Val Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp Val Arg Phe
1 5 10 15
Ser Thr Cys Asp Asn Gln Lys Ser Cys Met Ser Asn Cys Ser Ile Thr
20 25 30
Ser Ile Cys Glu Lys Pro Gln Glu Val Cys Val Ala Val Trp Arg Lys
35 40 45
Asn Asp Glu Asn Ile Thr Leu Glu Thr Val Cys His Asp Pro Lys Leu
50 55 60
Pro Tyr His Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro Lys Cys Ile
65 70 75 80
Met Lys Glu Lys Lys Lys Pro Gly Glu Thr Phe Phe Met Cys Ser Cys
85 90 95
Ser Ser Asp Glu Cys Asn Asp Asn Ile Ile Phe Ser Glu Glu Tyr Asn
100 105 110
Thr Ser Asn Pro Asp Ala Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
115 120 125
Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro
130 135 140
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
145 150 155 160
Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn
165 170 175
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
180 185 190
Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
195 200 205
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
210 215 220
Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys
225 230 235 240
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu
245 250 255
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
260 265 270
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
275 280 285
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
290 295 300
Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly
305 310 315 320
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
325 330 335
Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
340 345
<210> 19
<211> 344
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Контроль 2 (22T-Fc): ECD(22-136)-Fc, слитый белок, содержащий фрагмент
усеченного внеклеточного домена TGF-beta RII ECD(22-136) и Fc
<400> 19
Val Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp Val Arg Phe Ser Thr
1 5 10 15
Cys Asp Asn Gln Lys Ser Cys Met Ser Asn Cys Ser Ile Thr Ser Ile
20 25 30
Cys Glu Lys Pro Gln Glu Val Cys Val Ala Val Trp Arg Lys Asn Asp
35 40 45
Glu Asn Ile Thr Leu Glu Thr Val Cys His Asp Pro Lys Leu Pro Tyr
50 55 60
His Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro Lys Cys Ile Met Lys
65 70 75 80
Glu Lys Lys Lys Pro Gly Glu Thr Phe Phe Met Cys Ser Cys Ser Ser
85 90 95
Asp Glu Cys Asn Asp Asn Ile Ile Phe Ser Glu Glu Tyr Asn Thr Ser
100 105 110
Asn Pro Asp Ala Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
115 120 125
Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
130 135 140
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
145 150 155 160
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
165 170 175
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
180 185 190
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
195 200 205
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
210 215 220
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
225 230 235 240
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
245 250 255
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
260 265 270
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
275 280 285
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
290 295 300
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
305 310 315 320
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
325 330 335
Lys Ser Leu Ser Leu Ser Leu Gly
340
<210> 20
<211> 216
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность легкой цепи антитела против PD-L1
<400> 20
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Asp Val Ser Asn Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Thr Ser Ser
85 90 95
Ser Thr Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly Gln
100 105 110
Pro Lys Ala Asn Pro Thr Val Thr Leu Phe Pro Pro Ser Ser Glu Glu
115 120 125
Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr
130 135 140
Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro Val Lys
145 150 155 160
Ala Gly Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn Lys Tyr
165 170 175
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
180 185 190
Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
195 200 205
Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 21
<211> 607
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность тяжелой цепи антитела против PD-
L1/внеклеточный домен TGF-бета RII
<400> 21
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ile Met Met Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Tyr Pro Ser Gly Gly Ile Thr Phe Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ile Lys Leu Gly Thr Val Thr Thr Val Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Ala Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
450 455 460
Ser Gly Gly Gly Gly Ser Gly Ile Pro Pro His Val Gln Lys Ser Val
465 470 475 480
Asn Asn Asp Met Ile Val Thr Asp Asn Asn Gly Ala Val Lys Phe Pro
485 490 495
Gln Leu Cys Lys Phe Cys Asp Val Arg Phe Ser Thr Cys Asp Asn Gln
500 505 510
Lys Ser Cys Met Ser Asn Cys Ser Ile Thr Ser Ile Cys Glu Lys Pro
515 520 525
Gln Glu Val Cys Val Ala Val Trp Arg Lys Asn Asp Glu Asn Ile Thr
530 535 540
Leu Glu Thr Val Cys His Asp Pro Lys Leu Pro Tyr His Asp Phe Ile
545 550 555 560
Leu Glu Asp Ala Ala Ser Pro Lys Cys Ile Met Lys Glu Lys Lys Lys
565 570 575
Pro Gly Glu Thr Phe Phe Met Cys Ser Cys Ser Ser Asp Glu Cys Asn
580 585 590
Asp Asn Ile Ile Phe Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp
595 600 605
<---
Claims (19)
1. Слитый белок, содержащий рецептор TGF-β, для лечения PD-L1-опосредованной опухоли, где слитый белок имеет общую формулу (I): Ab-L- TGF-βRII ECD (I), где TGF-βRII ECD представляет собой N-концевую усеченную форму внеклеточного домена TGF-βRII, имеющую делецию 14, 19 или 21 соседних аминокислот на N-конце внеклеточного домена TGF-βRII, где внеклеточный домен TGF-βRII содержит аминокислотную последовательность SEQ ID NO: 13; Ab представляет собой антитело против PD-L1 или его антигенсвязывающий фрагмент, содержащий: HCDR1 последовательности SEQ ID NO: 1; HCDR2 последовательности SEQ ID NO: 2; HCDR3 последовательности SEQ ID NO: 3; LCDR1 последовательности SEQ ID NO: 4; LCDR2 последовательности SEQ ID NO: 5; и LCDR3 последовательности SEQ ID NO: 6; L представляет собой линкер; и TGF-βRII ECD связан с С-концом тяжелой цепи антитела против PD-L1 через линкер.
2. Слитый белок, содержащий рецептор TGF-β, по п. 1, в котором TGF-βRII ECD содержит последовательность SEQ ID NO: 14, 15 или 16.
3. Слитый белок, содержащий рецептор TGF-β, по п. 2, в котором антитело против PD-L1 или его антигенсвязывающий фрагмент выбран из группы, состоящей из полноразмерного антитела, химерного антитела, биспецифичного антитела и триспецифичного антитела.
4. Слитый белок, содержащий рецептор TGF-β, по п. 1, в котором антитело против PD-L1 или его антигенсвязывающий фрагмент представляет собой химерное антитело или его функциональный фрагмент, гуманизированное антитело или его функциональный фрагмент или человеческое антитело или его функциональный фрагмент.
5. Слитый белок, содержащий рецептор TGF-β, по п. 4, в котором гуманизированное антитело содержит вариабельную область тяжелой цепи SEQ ID NO: 7.
6. Слитый белок, содержащий рецептор TGF-β, по п. 4, в котором гуманизированное антитело содержит вариабельную область тяжелой цепи SEQ ID NO: 9.
7. Слитый белок, содержащий рецептор TGF-β, по п. 4, в котором гуманизированное антитело дополнительно содержит тяжелую цепь SEQ ID NO: 11.
8. Слитый белок, содержащий рецептор TGF-β, по п. 4, в котором гуманизированное антитело содержит вариабельную область легкой цепи SEQ ID NO: 8 или SEQ ID NO: 10.
9. Слитый белок, содержащий рецептор TGF-β, по п. 4, в котором гуманизированное антитело содержит легкую цепь SEQ ID NO: 12.
10. Слитый белок, содержащий рецептор TGF-β, по п. 1, в котором линкер представляет собой (G4S)xG, где x равен 3-6.
11. Слитый белок, содержащий рецептор TGF-β, по п. 1, в котором линкер представляет собой (G4S)xG, где x равен 4-5.
12. Фармацевтическая композиция для лечения PD-L1-опосредованной опухоли, содержащая терапевтически эффективное количество слитого белка, содержащего рецептор TGF-β, по любому из пп. 1-11, и один или более фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ.
13. Молекула ДНК, кодирующая слитый белок, содержащий рецептор TGF-β по любому из пп. 1-11.
14. Экспрессионный вектор, содержащий молекулу ДНК по п. 13.
15. Клетка-хозяин, содержащая экспрессионный вектор по п. 14, где клетка-хозяин выбрана из группы, состоящей из бактериальной клетки, дрожжевой клетки и клетки млекопитающего.
16. Клетка-хозяин по п. 15, где клетка-хозяин представляет собой клетку млекопитающего.
17. Применение слитого белка, содержащего рецептор TGF-β, по любому из пп. 1-11, или фармацевтической композиции по п. 12 для получения лекарственного средства для лечения PD-L1-опосредованной опухоли.
18. Применение по п. 17, где PD-L1-опосредованная опухоль представляет собой рак, при котором экспрессируется PD-L1.
19. Способ лечения или профилактики PD-L1-опосредованной опухоли, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества слитого белка, содержащего рецептор TGF-β, по любому из пп. 1-11, или фармацевтической композиции по п. 12.
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201710334292.6 | 2017-05-12 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2776204C1 true RU2776204C1 (ru) | 2022-07-14 |
Family
ID=
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2011109789A2 (en) * | 2010-03-05 | 2011-09-09 | The Johns Hopkins University | Compositions and methods for targeted immunomodulatory antibodies and fusion proteins |
| WO2015118175A2 (en) * | 2014-02-10 | 2015-08-13 | Merck Patent Gmbh | TARGETED TGFβ INHIBITION |
| RU2014145158A (ru) * | 2012-04-30 | 2016-06-20 | Биокон Лимитед | Нацеленные/иммуномодулирующие слитные белки и способы их получения |
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2011109789A2 (en) * | 2010-03-05 | 2011-09-09 | The Johns Hopkins University | Compositions and methods for targeted immunomodulatory antibodies and fusion proteins |
| RU2014145158A (ru) * | 2012-04-30 | 2016-06-20 | Биокон Лимитед | Нацеленные/иммуномодулирующие слитные белки и способы их получения |
| WO2015118175A2 (en) * | 2014-02-10 | 2015-08-13 | Merck Patent Gmbh | TARGETED TGFβ INHIBITION |
Non-Patent Citations (1)
| Title |
|---|
| LIN H.Y. et al., Expression cloning of the TGF-beta type II receptor, a functional transmembrane serine/threonine kinase, Cell, 1992, v. 68, n. 4, p. 775-785, PAKULA A.A. et al., Genetic analysis of protein stability and function. Anna. Rev. Genet. 1989, v. 23, p. 289-310, TOKURIKI N. et al., Stability effects of mutations and protein evolvability, Curr. Opin. Struct. Biol., 2009, v. 19, n. 5, p. 596-604, GUIMOND A. et al., Mapping of putative binding sites on the ectodomain of the type II TGF-β receptor by scanning-deletion mutagenesis and knowledge-based modeling, FEBS letters, 1999, v. 456, n. 1, p. 79-84, ORLANDO M., Modification of proteins and low molecular weight substances with hydroxyethyl starch (HES), Inauguraldissertation, Giesen, 2003, p. 166, KONTERMANN R.E. et al., Bispecific antibodies, Drug Discovery Today, 2015, v. 7, n. 20, p. 838-847, CHEN X. et al., Fusion protein linkers: property, design and functionality, Advanced drug delivery reviews, 2013, v. 65, n. 10, p. 13 * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11274142B2 (en) | Fusion protein containing TGF-β receptor and medicinal uses thereof | |
| US11365255B2 (en) | PD-1 antibody, antigen-binding fragment thereof, and medical application thereof | |
| KR102503084B1 (ko) | 항-ctla4 및 항-pd-1 이작용성 항체, 이의 약제학적 조성물 및 이의 용도 | |
| RU2693661C2 (ru) | Антитело против pdl-1, его фармацевтическая композиция и применение | |
| JP6983371B2 (ja) | 抗pd−l1抗体、その抗原結合フラグメントおよびその医療用途 | |
| KR20200119846A (ko) | 항 비7 에이치4 항체, 그의 항원 결합 단편 및 그의 약학적 용도 | |
| CA3089260A1 (en) | Anti-4-1bb antibody, antigen-binding fragment thereof and medical use thereof | |
| JP2021532801A (ja) | 抗btla抗体 | |
| CN112513088B (zh) | 抗ox40抗体、其抗原结合片段及其医药用途 | |
| CN112625130A (zh) | 抗-tigit抗体及使用之方法 | |
| KR20210121102A (ko) | 항-cd79b 항체, 이의 항원-결합 단편, 및 이의 약학적 용도 | |
| EP4155318A1 (en) | Bispecific antibody and use thereof | |
| CN114008077A (zh) | 抗体和使用方法 | |
| WO2022247826A1 (zh) | 靶向pd-l1和cd73的特异性结合蛋白 | |
| RU2776204C1 (ru) | Слитый белок, содержащий рецептор tgf-бета, и его фармацевтическое применение | |
| CN116925222A (zh) | 抗pvrig抗体、其药物组合物及用途 | |
| KR20230126713A (ko) | Cea6 결합 분자 및 이의 사용 | |
| CA3209827A1 (en) | Anti-tnfr2 antibody and use thereof | |
| TW202305007A (zh) | 靶向pd-l1和cd73的特異性結合蛋白 | |
| CN116323658A (zh) | 靶向PD-1或PD-L1和TGF-β的双功能蛋白及其医药用途 | |
| JP2021523688A (ja) | 抗cd27抗体およびその使用 |