RU2740996C2 - КОНЪЮГАТЫ АНТИТЕЛА К cMet И ЛЕКАРСТВЕННОГО СРЕДСТВА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ - Google Patents
КОНЪЮГАТЫ АНТИТЕЛА К cMet И ЛЕКАРСТВЕННОГО СРЕДСТВА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ Download PDFInfo
- Publication number
- RU2740996C2 RU2740996C2 RU2018144315A RU2018144315A RU2740996C2 RU 2740996 C2 RU2740996 C2 RU 2740996C2 RU 2018144315 A RU2018144315 A RU 2018144315A RU 2018144315 A RU2018144315 A RU 2018144315A RU 2740996 C2 RU2740996 C2 RU 2740996C2
- Authority
- RU
- Russia
- Prior art keywords
- cmet
- antibody
- antibodies
- adc
- adcs
- Prior art date
Links
- 239000003814 drug Substances 0.000 title claims abstract description 85
- 229940079593 drug Drugs 0.000 title claims abstract description 73
- 238000000034 method Methods 0.000 title abstract description 84
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 111
- 201000011510 cancer Diseases 0.000 claims abstract description 37
- 229940049595 antibody-drug conjugate Drugs 0.000 claims description 372
- 239000000611 antibody drug conjugate Substances 0.000 claims description 363
- 239000000203 mixture Substances 0.000 claims description 65
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 36
- 238000011282 treatment Methods 0.000 claims description 34
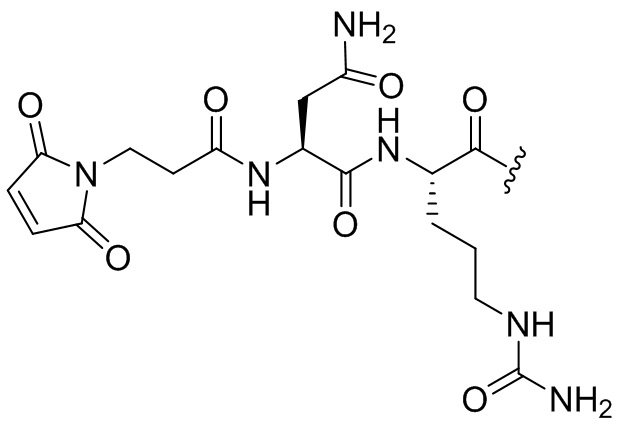
- IEDXPSOJFSVCKU-HOKPPMCLSA-N [4-[[(2S)-5-(carbamoylamino)-2-[[(2S)-2-[6-(2,5-dioxopyrrolidin-1-yl)hexanoylamino]-3-methylbutanoyl]amino]pentanoyl]amino]phenyl]methyl N-[(2S)-1-[[(2S)-1-[[(3R,4S,5S)-1-[(2S)-2-[(1R,2R)-3-[[(1S,2R)-1-hydroxy-1-phenylpropan-2-yl]amino]-1-methoxy-2-methyl-3-oxopropyl]pyrrolidin-1-yl]-3-methoxy-5-methyl-1-oxoheptan-4-yl]-methylamino]-3-methyl-1-oxobutan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]-N-methylcarbamate Chemical compound CC[C@H](C)[C@@H]([C@@H](CC(=O)N1CCC[C@H]1[C@H](OC)[C@@H](C)C(=O)N[C@H](C)[C@@H](O)c1ccccc1)OC)N(C)C(=O)[C@@H](NC(=O)[C@H](C(C)C)N(C)C(=O)OCc1ccc(NC(=O)[C@H](CCCNC(N)=O)NC(=O)[C@@H](NC(=O)CCCCCN2C(=O)CCC2=O)C(C)C)cc1)C(C)C IEDXPSOJFSVCKU-HOKPPMCLSA-N 0.000 claims description 19
- 125000003396 thiol group Chemical group [H]S* 0.000 claims description 15
- 230000021615 conjugation Effects 0.000 claims description 12
- 239000000562 conjugate Substances 0.000 claims description 9
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 claims description 7
- 241000282414 Homo sapiens Species 0.000 abstract description 55
- 239000003795 chemical substances by application Substances 0.000 abstract description 43
- 230000000694 effects Effects 0.000 abstract description 30
- 239000000126 substance Substances 0.000 abstract description 20
- 230000008685 targeting Effects 0.000 description 201
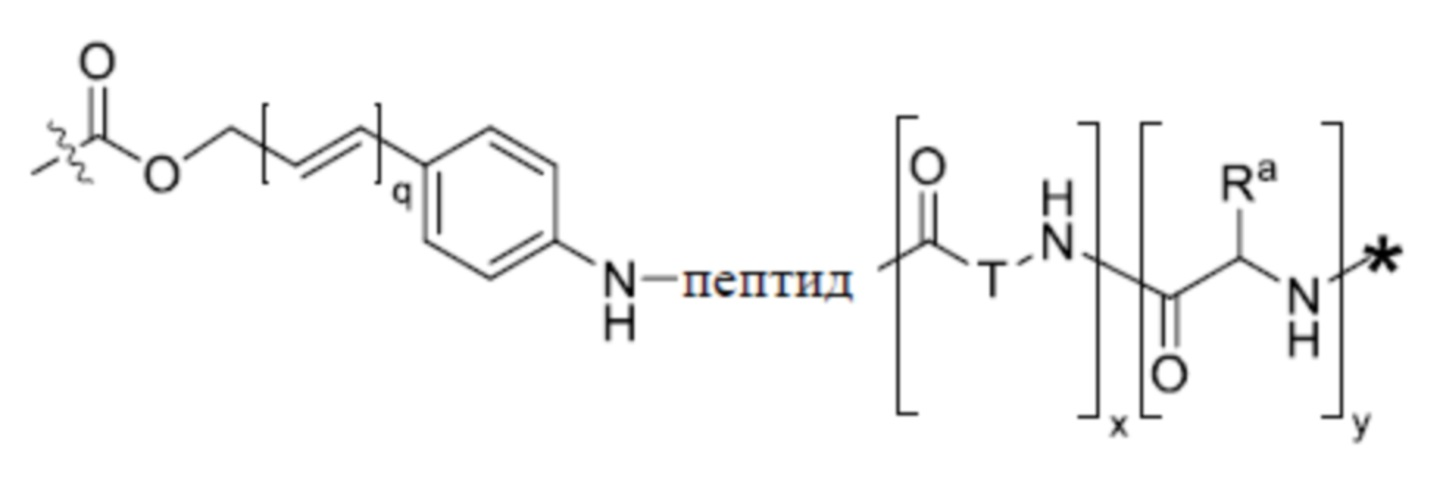
- 125000005647 linker group Chemical group 0.000 description 180
- 230000027455 binding Effects 0.000 description 140
- 210000004027 cell Anatomy 0.000 description 101
- 239000000824 cytostatic agent Substances 0.000 description 70
- 239000002254 cytotoxic agent Substances 0.000 description 70
- 239000012634 fragment Substances 0.000 description 67
- 108090000623 proteins and genes Proteins 0.000 description 66
- 231100000433 cytotoxic Toxicity 0.000 description 65
- 230000001472 cytotoxic effect Effects 0.000 description 65
- 239000000427 antigen Substances 0.000 description 58
- 108091007433 antigens Proteins 0.000 description 58
- 102000036639 antigens Human genes 0.000 description 58
- 239000003112 inhibitor Substances 0.000 description 50
- -1 1-aziridinyl Chemical group 0.000 description 47
- 238000001802 infusion Methods 0.000 description 44
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 42
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 42
- 201000010099 disease Diseases 0.000 description 37
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 37
- 108020004414 DNA Proteins 0.000 description 36
- 238000001990 intravenous administration Methods 0.000 description 36
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 34
- 238000003364 immunohistochemistry Methods 0.000 description 32
- 102100024952 Protein CBFA2T1 Human genes 0.000 description 31
- 230000001225 therapeutic effect Effects 0.000 description 31
- 108090000765 processed proteins & peptides Proteins 0.000 description 30
- YUOCYTRGANSSRY-UHFFFAOYSA-N pyrrolo[2,3-i][1,2]benzodiazepine Chemical class C1=CN=NC2=C3C=CN=C3C=CC2=C1 YUOCYTRGANSSRY-UHFFFAOYSA-N 0.000 description 28
- 102000004169 proteins and genes Human genes 0.000 description 27
- 238000003776 cleavage reaction Methods 0.000 description 26
- 235000018102 proteins Nutrition 0.000 description 25
- 230000014509 gene expression Effects 0.000 description 24
- 230000004044 response Effects 0.000 description 24
- 238000010186 staining Methods 0.000 description 24
- 108060003951 Immunoglobulin Proteins 0.000 description 22
- 102000018358 immunoglobulin Human genes 0.000 description 22
- 230000007017 scission Effects 0.000 description 22
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 19
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 19
- 235000001014 amino acid Nutrition 0.000 description 19
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 19
- 102000004196 processed proteins & peptides Human genes 0.000 description 19
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 18
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 description 18
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 18
- 238000012360 testing method Methods 0.000 description 18
- 239000005551 L01XE03 - Erlotinib Substances 0.000 description 17
- 229940024606 amino acid Drugs 0.000 description 17
- 150000001413 amino acids Chemical class 0.000 description 17
- 229920001184 polypeptide Polymers 0.000 description 17
- 125000000539 amino acid group Chemical group 0.000 description 16
- 229960005277 gemcitabine Drugs 0.000 description 16
- 238000002360 preparation method Methods 0.000 description 16
- 229940127089 cytotoxic agent Drugs 0.000 description 15
- 239000013604 expression vector Substances 0.000 description 15
- 125000000524 functional group Chemical group 0.000 description 15
- 229960001592 paclitaxel Drugs 0.000 description 15
- 150000003839 salts Chemical class 0.000 description 15
- 239000013598 vector Substances 0.000 description 15
- 238000011360 adjunctive therapy Methods 0.000 description 14
- 230000001085 cytostatic effect Effects 0.000 description 14
- 231100000599 cytotoxic agent Toxicity 0.000 description 14
- 238000005516 engineering process Methods 0.000 description 14
- 229960001433 erlotinib Drugs 0.000 description 14
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 14
- 230000009467 reduction Effects 0.000 description 14
- 238000002560 therapeutic procedure Methods 0.000 description 14
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 13
- 238000003556 assay Methods 0.000 description 13
- 229910052739 hydrogen Inorganic materials 0.000 description 13
- 108010093470 monomethyl auristatin E Proteins 0.000 description 13
- 230000035772 mutation Effects 0.000 description 13
- 238000009097 single-agent therapy Methods 0.000 description 13
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 12
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 12
- 229930012538 Paclitaxel Natural products 0.000 description 12
- 238000009472 formulation Methods 0.000 description 12
- 230000001965 increasing effect Effects 0.000 description 12
- 102000004190 Enzymes Human genes 0.000 description 11
- 108090000790 Enzymes Proteins 0.000 description 11
- 229940088598 enzyme Drugs 0.000 description 11
- 230000003902 lesion Effects 0.000 description 11
- 239000012528 membrane Substances 0.000 description 11
- 229920002857 polybutadiene Polymers 0.000 description 11
- 102100021866 Hepatocyte growth factor Human genes 0.000 description 10
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 10
- 230000002776 aggregation Effects 0.000 description 10
- 238000004220 aggregation Methods 0.000 description 10
- 150000001875 compounds Chemical class 0.000 description 10
- 235000018417 cysteine Nutrition 0.000 description 10
- 125000002228 disulfide group Chemical group 0.000 description 10
- 229940043355 kinase inhibitor Drugs 0.000 description 10
- 230000002018 overexpression Effects 0.000 description 10
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 10
- 230000002829 reductive effect Effects 0.000 description 10
- 230000004083 survival effect Effects 0.000 description 10
- 210000001519 tissue Anatomy 0.000 description 10
- 102000014914 Carrier Proteins Human genes 0.000 description 9
- 108010016626 Dipeptides Proteins 0.000 description 9
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 9
- 108091008324 binding proteins Proteins 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 9
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 9
- 210000004379 membrane Anatomy 0.000 description 9
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 9
- 238000003259 recombinant expression Methods 0.000 description 9
- 230000001105 regulatory effect Effects 0.000 description 9
- 210000004881 tumor cell Anatomy 0.000 description 9
- 229910052720 vanadium Inorganic materials 0.000 description 9
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 8
- 102000001301 EGF receptor Human genes 0.000 description 8
- 108060006698 EGF receptor Proteins 0.000 description 8
- 108010076504 Protein Sorting Signals Proteins 0.000 description 8
- QTBSBXVTEAMEQO-UHFFFAOYSA-N acetic acid Substances CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 8
- 230000002378 acidificating effect Effects 0.000 description 8
- 239000003080 antimitotic agent Substances 0.000 description 8
- 239000000872 buffer Substances 0.000 description 8
- 229960004316 cisplatin Drugs 0.000 description 8
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 8
- 230000006870 function Effects 0.000 description 8
- BCFGMOOMADDAQU-UHFFFAOYSA-N lapatinib Chemical compound O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 BCFGMOOMADDAQU-UHFFFAOYSA-N 0.000 description 8
- 230000002132 lysosomal effect Effects 0.000 description 8
- 230000004048 modification Effects 0.000 description 8
- 238000012986 modification Methods 0.000 description 8
- 239000008194 pharmaceutical composition Substances 0.000 description 8
- 229920000642 polymer Polymers 0.000 description 8
- 102000005962 receptors Human genes 0.000 description 8
- 108020003175 receptors Proteins 0.000 description 8
- MLDQJTXFUGDVEO-UHFFFAOYSA-N BAY-43-9006 Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 MLDQJTXFUGDVEO-UHFFFAOYSA-N 0.000 description 7
- 206010009944 Colon cancer Diseases 0.000 description 7
- 230000000970 DNA cross-linking effect Effects 0.000 description 7
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 7
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 7
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 7
- 239000002136 L01XE07 - Lapatinib Substances 0.000 description 7
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 7
- 239000004472 Lysine Substances 0.000 description 7
- 239000002202 Polyethylene glycol Substances 0.000 description 7
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 7
- 208000009956 adenocarcinoma Diseases 0.000 description 7
- 229960001686 afatinib Drugs 0.000 description 7
- ULXXDDBFHOBEHA-CWDCEQMOSA-N afatinib Chemical compound N1=CN=C2C=C(O[C@@H]3COCC3)C(NC(=O)/C=C/CN(C)C)=CC2=C1NC1=CC=C(F)C(Cl)=C1 ULXXDDBFHOBEHA-CWDCEQMOSA-N 0.000 description 7
- 229940100198 alkylating agent Drugs 0.000 description 7
- 239000002168 alkylating agent Substances 0.000 description 7
- 230000008901 benefit Effects 0.000 description 7
- 229960004562 carboplatin Drugs 0.000 description 7
- 230000000875 corresponding effect Effects 0.000 description 7
- 239000003431 cross linking reagent Substances 0.000 description 7
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 description 7
- 229940020967 gemzar Drugs 0.000 description 7
- 229960003180 glutathione Drugs 0.000 description 7
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 7
- 229960002885 histidine Drugs 0.000 description 7
- 235000014304 histidine Nutrition 0.000 description 7
- 230000002209 hydrophobic effect Effects 0.000 description 7
- 238000001727 in vivo Methods 0.000 description 7
- 201000005202 lung cancer Diseases 0.000 description 7
- 208000020816 lung neoplasm Diseases 0.000 description 7
- 229960003646 lysine Drugs 0.000 description 7
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 7
- 229960003301 nivolumab Drugs 0.000 description 7
- 229920001223 polyethylene glycol Polymers 0.000 description 7
- 238000003860 storage Methods 0.000 description 7
- 229960005486 vaccine Drugs 0.000 description 7
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 6
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 6
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 6
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 6
- RGHNJXZEOKUKBD-SQOUGZDYSA-N D-gluconic acid Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O RGHNJXZEOKUKBD-SQOUGZDYSA-N 0.000 description 6
- IAJILQKETJEXLJ-UHFFFAOYSA-N Galacturonsaeure Natural products O=CC(O)C(O)C(O)C(O)C(O)=O IAJILQKETJEXLJ-UHFFFAOYSA-N 0.000 description 6
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 6
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 6
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 6
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 6
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 6
- 241001529936 Murinae Species 0.000 description 6
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 6
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 6
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 6
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 6
- 229940124650 anti-cancer therapies Drugs 0.000 description 6
- 230000000340 anti-metabolite Effects 0.000 description 6
- 230000000259 anti-tumor effect Effects 0.000 description 6
- 238000011319 anticancer therapy Methods 0.000 description 6
- 229940100197 antimetabolite Drugs 0.000 description 6
- 239000002256 antimetabolite Substances 0.000 description 6
- 239000002246 antineoplastic agent Substances 0.000 description 6
- 230000006907 apoptotic process Effects 0.000 description 6
- 238000013459 approach Methods 0.000 description 6
- 229960005261 aspartic acid Drugs 0.000 description 6
- 108010044540 auristatin Proteins 0.000 description 6
- 210000000170 cell membrane Anatomy 0.000 description 6
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 6
- 229960002433 cysteine Drugs 0.000 description 6
- 210000000805 cytoplasm Anatomy 0.000 description 6
- 229960002989 glutamic acid Drugs 0.000 description 6
- 210000004408 hybridoma Anatomy 0.000 description 6
- 230000001900 immune effect Effects 0.000 description 6
- 229940072221 immunoglobulins Drugs 0.000 description 6
- 230000005764 inhibitory process Effects 0.000 description 6
- 238000002347 injection Methods 0.000 description 6
- 239000007924 injection Substances 0.000 description 6
- 229960005386 ipilimumab Drugs 0.000 description 6
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 6
- 210000003712 lysosome Anatomy 0.000 description 6
- 230000001868 lysosomic effect Effects 0.000 description 6
- 239000003550 marker Substances 0.000 description 6
- 125000003729 nucleotide group Chemical group 0.000 description 6
- FDLYAMZZIXQODN-UHFFFAOYSA-N olaparib Chemical compound FC1=CC=C(CC=2C3=CC=CC=C3C(=O)NN=2)C=C1C(=O)N(CC1)CCN1C(=O)C1CC1 FDLYAMZZIXQODN-UHFFFAOYSA-N 0.000 description 6
- 238000011275 oncology therapy Methods 0.000 description 6
- 230000036961 partial effect Effects 0.000 description 6
- 229960003787 sorafenib Drugs 0.000 description 6
- 239000003381 stabilizer Substances 0.000 description 6
- 231100000402 unacceptable toxicity Toxicity 0.000 description 6
- 239000004474 valine Substances 0.000 description 6
- 229960004295 valine Drugs 0.000 description 6
- 229960000241 vandetanib Drugs 0.000 description 6
- UHTHHESEBZOYNR-UHFFFAOYSA-N vandetanib Chemical compound COC1=CC(C(/N=CN2)=N/C=3C(=CC(Br)=CC=3)F)=C2C=C1OCC1CCN(C)CC1 UHTHHESEBZOYNR-UHFFFAOYSA-N 0.000 description 6
- YCOYDOIWSSHVCK-UHFFFAOYSA-N vatalanib Chemical compound C1=CC(Cl)=CC=C1NC(C1=CC=CC=C11)=NN=C1CC1=CC=NC=C1 YCOYDOIWSSHVCK-UHFFFAOYSA-N 0.000 description 6
- CVCLJVVBHYOXDC-IAZSKANUSA-N (2z)-2-[(5z)-5-[(3,5-dimethyl-1h-pyrrol-2-yl)methylidene]-4-methoxypyrrol-2-ylidene]indole Chemical compound COC1=C\C(=C/2N=C3C=CC=CC3=C\2)N\C1=C/C=1NC(C)=CC=1C CVCLJVVBHYOXDC-IAZSKANUSA-N 0.000 description 5
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 5
- IAKHMKGGTNLKSZ-INIZCTEOSA-N (S)-colchicine Chemical compound C1([C@@H](NC(C)=O)CC2)=CC(=O)C(OC)=CC=C1C1=C2C=C(OC)C(OC)=C1OC IAKHMKGGTNLKSZ-INIZCTEOSA-N 0.000 description 5
- ULXXDDBFHOBEHA-ONEGZZNKSA-N Afatinib Chemical compound N1=CN=C2C=C(OC3COCC3)C(NC(=O)/C=C/CN(C)C)=CC2=C1NC1=CC=C(F)C(Cl)=C1 ULXXDDBFHOBEHA-ONEGZZNKSA-N 0.000 description 5
- 108010012934 Albumin-Bound Paclitaxel Proteins 0.000 description 5
- 239000004475 Arginine Substances 0.000 description 5
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 5
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 5
- 206010061818 Disease progression Diseases 0.000 description 5
- OFDNQWIFNXBECV-UHFFFAOYSA-N Dolastatin 10 Natural products CC(C)C(N(C)C)C(=O)NC(C(C)C)C(=O)N(C)C(C(C)CC)C(OC)CC(=O)N1CCCC1C(OC)C(C)C(=O)NC(C=1SC=CN=1)CC1=CC=CC=C1 OFDNQWIFNXBECV-UHFFFAOYSA-N 0.000 description 5
- 239000004471 Glycine Substances 0.000 description 5
- 241000282412 Homo Species 0.000 description 5
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 5
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 5
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 5
- RHGKLRLOHDJJDR-BYPYZUCNSA-N L-citrulline Chemical compound NC(=O)NCCC[C@H]([NH3+])C([O-])=O RHGKLRLOHDJJDR-BYPYZUCNSA-N 0.000 description 5
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 5
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 5
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 5
- 239000005511 L01XE05 - Sorafenib Substances 0.000 description 5
- 239000005536 L01XE08 - Nilotinib Substances 0.000 description 5
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 5
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 5
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 5
- 102000035195 Peptidases Human genes 0.000 description 5
- 108091005804 Peptidases Proteins 0.000 description 5
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 5
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 5
- 108010022394 Threonine synthase Proteins 0.000 description 5
- 239000002253 acid Substances 0.000 description 5
- 239000002671 adjuvant Substances 0.000 description 5
- 125000000217 alkyl group Chemical group 0.000 description 5
- 150000001412 amines Chemical class 0.000 description 5
- 238000004458 analytical method Methods 0.000 description 5
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 5
- 229960003121 arginine Drugs 0.000 description 5
- 229960001230 asparagine Drugs 0.000 description 5
- 235000009582 asparagine Nutrition 0.000 description 5
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 5
- 229960000397 bevacizumab Drugs 0.000 description 5
- 239000011230 binding agent Substances 0.000 description 5
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical compound C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 description 5
- 229960005395 cetuximab Drugs 0.000 description 5
- 230000008859 change Effects 0.000 description 5
- 230000000295 complement effect Effects 0.000 description 5
- 229960003901 dacarbazine Drugs 0.000 description 5
- 230000034994 death Effects 0.000 description 5
- 231100000517 death Toxicity 0.000 description 5
- 102000004419 dihydrofolate reductase Human genes 0.000 description 5
- 230000005750 disease progression Effects 0.000 description 5
- OFDNQWIFNXBECV-VFSYNPLYSA-N dolastatin 10 Chemical compound CC(C)[C@H](N(C)C)C(=O)N[C@@H](C(C)C)C(=O)N(C)[C@@H]([C@@H](C)CC)[C@H](OC)CC(=O)N1CCC[C@H]1[C@H](OC)[C@@H](C)C(=O)N[C@H](C=1SC=CN=1)CC1=CC=CC=C1 OFDNQWIFNXBECV-VFSYNPLYSA-N 0.000 description 5
- 108010045524 dolastatin 10 Proteins 0.000 description 5
- 125000004185 ester group Chemical group 0.000 description 5
- 235000013922 glutamic acid Nutrition 0.000 description 5
- 239000004220 glutamic acid Substances 0.000 description 5
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 5
- 235000004554 glutamine Nutrition 0.000 description 5
- 229960002743 glutamine Drugs 0.000 description 5
- 229960002449 glycine Drugs 0.000 description 5
- 230000012010 growth Effects 0.000 description 5
- 230000036541 health Effects 0.000 description 5
- 125000005597 hydrazone group Chemical group 0.000 description 5
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 5
- 229940127121 immunoconjugate Drugs 0.000 description 5
- 229960004891 lapatinib Drugs 0.000 description 5
- 229960003136 leucine Drugs 0.000 description 5
- 230000000670 limiting effect Effects 0.000 description 5
- 125000005439 maleimidyl group Chemical group C1(C=CC(N1*)=O)=O 0.000 description 5
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 5
- 230000007246 mechanism Effects 0.000 description 5
- 230000001404 mediated effect Effects 0.000 description 5
- 239000002609 medium Substances 0.000 description 5
- 229930182817 methionine Natural products 0.000 description 5
- 235000006109 methionine Nutrition 0.000 description 5
- HHZIURLSWUIHRB-UHFFFAOYSA-N nilotinib Chemical compound C1=NC(C)=CN1C1=CC(NC(=O)C=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)=CC(C(F)(F)F)=C1 HHZIURLSWUIHRB-UHFFFAOYSA-N 0.000 description 5
- 229910052757 nitrogen Inorganic materials 0.000 description 5
- 239000002773 nucleotide Substances 0.000 description 5
- 229960000435 oblimersen Drugs 0.000 description 5
- MIMNFCVQODTQDP-NDLVEFNKSA-N oblimersen Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](COP(S)(=O)O[C@@H]2[C@H](O[C@H](C2)N2C3=NC=NC(N)=C3N=C2)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(NC(=O)C(C)=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C3=NC=NC(N)=C3N=C2)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(NC(=O)C(C)=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(NC(=O)C(C)=C2)=O)CO)[C@@H](O)C1 MIMNFCVQODTQDP-NDLVEFNKSA-N 0.000 description 5
- 229950000846 onartuzumab Drugs 0.000 description 5
- 201000002528 pancreatic cancer Diseases 0.000 description 5
- 208000008443 pancreatic carcinoma Diseases 0.000 description 5
- 230000037361 pathway Effects 0.000 description 5
- CUIHSIWYWATEQL-UHFFFAOYSA-N pazopanib Chemical compound C1=CC2=C(C)N(C)N=C2C=C1N(C)C(N=1)=CC=NC=1NC1=CC=C(C)C(S(N)(=O)=O)=C1 CUIHSIWYWATEQL-UHFFFAOYSA-N 0.000 description 5
- WBXPDJSOTKVWSJ-ZDUSSCGKSA-N pemetrexed Chemical compound C=1NC=2NC(N)=NC(=O)C=2C=1CCC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 WBXPDJSOTKVWSJ-ZDUSSCGKSA-N 0.000 description 5
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 5
- 229960002429 proline Drugs 0.000 description 5
- 239000000243 solution Substances 0.000 description 5
- 229940124597 therapeutic agent Drugs 0.000 description 5
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 5
- KVJXBPDAXMEYOA-CXANFOAXSA-N trilostane Chemical compound OC1=C(C#N)C[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CC[C@@]32O[C@@H]31 KVJXBPDAXMEYOA-CXANFOAXSA-N 0.000 description 5
- 229950011257 veliparib Drugs 0.000 description 5
- JNAHVYVRKWKWKQ-CYBMUJFWSA-N veliparib Chemical compound N=1C2=CC=CC(C(N)=O)=C2NC=1[C@@]1(C)CCCN1 JNAHVYVRKWKWKQ-CYBMUJFWSA-N 0.000 description 5
- 206010006187 Breast cancer Diseases 0.000 description 4
- 208000026310 Breast neoplasm Diseases 0.000 description 4
- 206010057248 Cell death Diseases 0.000 description 4
- 102000009058 Death Domain Receptors Human genes 0.000 description 4
- 108010049207 Death Domain Receptors Proteins 0.000 description 4
- 238000002965 ELISA Methods 0.000 description 4
- HKVAMNSJSFKALM-GKUWKFKPSA-N Everolimus Chemical compound C1C[C@@H](OCCO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 HKVAMNSJSFKALM-GKUWKFKPSA-N 0.000 description 4
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 4
- 108010024636 Glutathione Proteins 0.000 description 4
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 4
- 102100026120 IgG receptor FcRn large subunit p51 Human genes 0.000 description 4
- 102000009786 Immunoglobulin Constant Regions Human genes 0.000 description 4
- 108010009817 Immunoglobulin Constant Regions Proteins 0.000 description 4
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 4
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 4
- 108010047761 Interferon-alpha Proteins 0.000 description 4
- 102000006992 Interferon-alpha Human genes 0.000 description 4
- 108010050904 Interferons Proteins 0.000 description 4
- 102000014150 Interferons Human genes 0.000 description 4
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 4
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 4
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 4
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 4
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 4
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 4
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 4
- 239000002146 L01XE16 - Crizotinib Substances 0.000 description 4
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 4
- 206010033128 Ovarian cancer Diseases 0.000 description 4
- 206010061535 Ovarian neoplasm Diseases 0.000 description 4
- 108091007960 PI3Ks Proteins 0.000 description 4
- 108090000430 Phosphatidylinositol 3-kinases Proteins 0.000 description 4
- 102000003993 Phosphatidylinositol 3-kinases Human genes 0.000 description 4
- 239000004365 Protease Substances 0.000 description 4
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 4
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 4
- 206010041067 Small cell lung cancer Diseases 0.000 description 4
- NAVMQTYZDKMPEU-UHFFFAOYSA-N Targretin Chemical compound CC1=CC(C(CCC2(C)C)(C)C)=C2C=C1C(=C)C1=CC=C(C(O)=O)C=C1 NAVMQTYZDKMPEU-UHFFFAOYSA-N 0.000 description 4
- CBPNZQVSJQDFBE-FUXHJELOSA-N Temsirolimus Chemical compound C1C[C@@H](OC(=O)C(C)(CO)CO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 CBPNZQVSJQDFBE-FUXHJELOSA-N 0.000 description 4
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 4
- 239000004473 Threonine Substances 0.000 description 4
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 4
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 4
- 229940028652 abraxane Drugs 0.000 description 4
- 229960003767 alanine Drugs 0.000 description 4
- 235000004279 alanine Nutrition 0.000 description 4
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 4
- 235000003704 aspartic acid Nutrition 0.000 description 4
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 4
- 239000000969 carrier Substances 0.000 description 4
- KTEIFNKAUNYNJU-GFCCVEGCSA-N crizotinib Chemical compound O([C@H](C)C=1C(=C(F)C=CC=1Cl)Cl)C(C(=NC=1)N)=CC=1C(=C1)C=NN1C1CCNCC1 KTEIFNKAUNYNJU-GFCCVEGCSA-N 0.000 description 4
- 150000001945 cysteines Chemical class 0.000 description 4
- 229960000684 cytarabine Drugs 0.000 description 4
- 230000009089 cytolysis Effects 0.000 description 4
- 230000001086 cytosolic effect Effects 0.000 description 4
- 238000010586 diagram Methods 0.000 description 4
- 239000000539 dimer Substances 0.000 description 4
- VSJKWCGYPAHWDS-UHFFFAOYSA-N dl-camptothecin Natural products C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-UHFFFAOYSA-N 0.000 description 4
- 229960003668 docetaxel Drugs 0.000 description 4
- 239000003623 enhancer Substances 0.000 description 4
- 230000002255 enzymatic effect Effects 0.000 description 4
- MNJVRJDLRVPLFE-UHFFFAOYSA-N etoricoxib Chemical compound C1=NC(C)=CC=C1C1=NC=C(Cl)C=C1C1=CC=C(S(C)(=O)=O)C=C1 MNJVRJDLRVPLFE-UHFFFAOYSA-N 0.000 description 4
- 238000000684 flow cytometry Methods 0.000 description 4
- 229960002949 fluorouracil Drugs 0.000 description 4
- 206010017758 gastric cancer Diseases 0.000 description 4
- 229940087158 gilotrif Drugs 0.000 description 4
- 150000007857 hydrazones Chemical class 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- 230000003834 intracellular effect Effects 0.000 description 4
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 4
- 229960000310 isoleucine Drugs 0.000 description 4
- 238000000111 isothermal titration calorimetry Methods 0.000 description 4
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 4
- 230000001394 metastastic effect Effects 0.000 description 4
- 206010061289 metastatic neoplasm Diseases 0.000 description 4
- 229960000485 methotrexate Drugs 0.000 description 4
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 4
- 229960004857 mitomycin Drugs 0.000 description 4
- 239000002105 nanoparticle Substances 0.000 description 4
- 210000004940 nucleus Anatomy 0.000 description 4
- 229960003278 osimertinib Drugs 0.000 description 4
- DUYJMQONPNNFPI-UHFFFAOYSA-N osimertinib Chemical compound COC1=CC(N(C)CCN(C)C)=C(NC(=O)C=C)C=C1NC1=NC=CC(C=2C3=CC=CC=C3N(C)C=2)=N1 DUYJMQONPNNFPI-UHFFFAOYSA-N 0.000 description 4
- 235000006408 oxalic acid Nutrition 0.000 description 4
- 229960001972 panitumumab Drugs 0.000 description 4
- 229960002621 pembrolizumab Drugs 0.000 description 4
- 239000012071 phase Substances 0.000 description 4
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N phenol group Chemical group C1(=CC=CC=C1)O ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 4
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 4
- 229960005190 phenylalanine Drugs 0.000 description 4
- 235000008729 phenylalanine Nutrition 0.000 description 4
- 210000002381 plasma Anatomy 0.000 description 4
- 102000040430 polynucleotide Human genes 0.000 description 4
- 108091033319 polynucleotide Proteins 0.000 description 4
- 239000002157 polynucleotide Substances 0.000 description 4
- 230000003389 potentiating effect Effects 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 238000001959 radiotherapy Methods 0.000 description 4
- 230000010076 replication Effects 0.000 description 4
- 239000000523 sample Substances 0.000 description 4
- 230000028327 secretion Effects 0.000 description 4
- 229960001153 serine Drugs 0.000 description 4
- 238000001542 size-exclusion chromatography Methods 0.000 description 4
- 238000006467 substitution reaction Methods 0.000 description 4
- 150000005846 sugar alcohols Chemical class 0.000 description 4
- AYUNIORJHRXIBJ-TXHRRWQRSA-N tanespimycin Chemical compound N1C(=O)\C(C)=C\C=C/[C@H](OC)[C@@H](OC(N)=O)\C(C)=C\[C@H](C)[C@@H](O)[C@@H](OC)C[C@H](C)CC2=C(NCC=C)C(=O)C=C1C2=O AYUNIORJHRXIBJ-TXHRRWQRSA-N 0.000 description 4
- 229940120982 tarceva Drugs 0.000 description 4
- 229960004964 temozolomide Drugs 0.000 description 4
- 229960000235 temsirolimus Drugs 0.000 description 4
- 229960002898 threonine Drugs 0.000 description 4
- 230000014616 translation Effects 0.000 description 4
- 238000013519 translation Methods 0.000 description 4
- 229960001670 trilostane Drugs 0.000 description 4
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 4
- 229960004441 tyrosine Drugs 0.000 description 4
- 229950000578 vatalanib Drugs 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- BMKDZUISNHGIBY-ZETCQYMHSA-N (+)-dexrazoxane Chemical compound C([C@H](C)N1CC(=O)NC(=O)C1)N1CC(=O)NC(=O)C1 BMKDZUISNHGIBY-ZETCQYMHSA-N 0.000 description 3
- AGGWFDNPHKLBBV-YUMQZZPRSA-N (2s)-2-[[(2s)-2-amino-3-methylbutanoyl]amino]-5-(carbamoylamino)pentanoic acid Chemical compound CC(C)[C@H](N)C(=O)N[C@H](C(O)=O)CCCNC(N)=O AGGWFDNPHKLBBV-YUMQZZPRSA-N 0.000 description 3
- MYBLAOJMRYYKMS-RTRLPJTCSA-N 1-(2-chloroethyl)-1-nitroso-3-[(3r,4r,5s,6r)-2,4,5-trihydroxy-6-(hydroxymethyl)oxan-3-yl]urea Chemical compound OC[C@H]1OC(O)[C@H](NC(=O)N(CCCl)N=O)[C@@H](O)[C@@H]1O MYBLAOJMRYYKMS-RTRLPJTCSA-N 0.000 description 3
- PVCULFYROUOVGJ-UHFFFAOYSA-N 1-[2-chloroethyl(methylsulfonyl)amino]-3-methyl-1-methylsulfonylurea Chemical compound CNC(=O)N(S(C)(=O)=O)N(S(C)(=O)=O)CCCl PVCULFYROUOVGJ-UHFFFAOYSA-N 0.000 description 3
- TVZGACDUOSZQKY-LBPRGKRZSA-N 4-aminofolic acid Chemical class C1=NC2=NC(N)=NC(N)=C2N=C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 TVZGACDUOSZQKY-LBPRGKRZSA-N 0.000 description 3
- BFYIZQONLCFLEV-DAELLWKTSA-N Aromasine Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC(=C)C2=C1 BFYIZQONLCFLEV-DAELLWKTSA-N 0.000 description 3
- 108010006654 Bleomycin Proteins 0.000 description 3
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 3
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 3
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 3
- 101150013553 CD40 gene Proteins 0.000 description 3
- KLWPJMFMVPTNCC-UHFFFAOYSA-N Camptothecin Natural products CCC1(O)C(=O)OCC2=C1C=C3C4Nc5ccccc5C=C4CN3C2=O KLWPJMFMVPTNCC-UHFFFAOYSA-N 0.000 description 3
- 102000000844 Cell Surface Receptors Human genes 0.000 description 3
- 108010001857 Cell Surface Receptors Proteins 0.000 description 3
- 241000282693 Cercopithecidae Species 0.000 description 3
- 108020004705 Codon Proteins 0.000 description 3
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 3
- 241000701022 Cytomegalovirus Species 0.000 description 3
- RGHNJXZEOKUKBD-UHFFFAOYSA-N D-gluconic acid Natural products OCC(O)C(O)C(O)C(O)C(O)=O RGHNJXZEOKUKBD-UHFFFAOYSA-N 0.000 description 3
- 102000053602 DNA Human genes 0.000 description 3
- 229940123780 DNA topoisomerase I inhibitor Drugs 0.000 description 3
- 229940124087 DNA topoisomerase II inhibitor Drugs 0.000 description 3
- 108010092160 Dactinomycin Proteins 0.000 description 3
- ZBNZXTGUTAYRHI-UHFFFAOYSA-N Dasatinib Chemical compound C=1C(N2CCN(CCO)CC2)=NC(C)=NC=1NC(S1)=NC=C1C(=O)NC1=C(C)C=CC=C1Cl ZBNZXTGUTAYRHI-UHFFFAOYSA-N 0.000 description 3
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- VWUXBMIQPBEWFH-WCCTWKNTSA-N Fulvestrant Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3[C@H](CCCCCCCCCS(=O)CCCC(F)(F)C(F)(F)F)CC2=C1 VWUXBMIQPBEWFH-WCCTWKNTSA-N 0.000 description 3
- BLCLNMBMMGCOAS-URPVMXJPSA-N Goserelin Chemical compound C([C@@H](C(=O)N[C@H](COC(C)(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1[C@@H](CCC1)C(=O)NNC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 BLCLNMBMMGCOAS-URPVMXJPSA-N 0.000 description 3
- 108010069236 Goserelin Proteins 0.000 description 3
- 101710177940 IgG receptor FcRn large subunit p51 Proteins 0.000 description 3
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 3
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 3
- UGQMRVRMYYASKQ-KQYNXXCUSA-N Inosine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C2=NC=NC(O)=C2N=C1 UGQMRVRMYYASKQ-KQYNXXCUSA-N 0.000 description 3
- 239000002067 L01XE06 - Dasatinib Substances 0.000 description 3
- 239000003798 L01XE11 - Pazopanib Substances 0.000 description 3
- 239000002118 L01XE12 - Vandetanib Substances 0.000 description 3
- 239000002145 L01XE14 - Bosutinib Substances 0.000 description 3
- 239000002144 L01XE18 - Ruxolitinib Substances 0.000 description 3
- 241000829100 Macaca mulatta polyomavirus 1 Species 0.000 description 3
- 241000699666 Mus <mouse, genus> Species 0.000 description 3
- 108091007491 NSP3 Papain-like protease domains Proteins 0.000 description 3
- RHGKLRLOHDJJDR-UHFFFAOYSA-N Ndelta-carbamoyl-DL-ornithine Natural products OC(=O)C(N)CCCNC(N)=O RHGKLRLOHDJJDR-UHFFFAOYSA-N 0.000 description 3
- 108091034117 Oligonucleotide Proteins 0.000 description 3
- 108091008606 PDGF receptors Proteins 0.000 description 3
- 206010035226 Plasma cell myeloma Diseases 0.000 description 3
- 102000011653 Platelet-Derived Growth Factor Receptors Human genes 0.000 description 3
- 229940123573 Protein synthesis inhibitor Drugs 0.000 description 3
- 108020004511 Recombinant DNA Proteins 0.000 description 3
- 208000006265 Renal cell carcinoma Diseases 0.000 description 3
- 208000005718 Stomach Neoplasms Diseases 0.000 description 3
- 210000001744 T-lymphocyte Anatomy 0.000 description 3
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 3
- 239000000365 Topoisomerase I Inhibitor Substances 0.000 description 3
- 239000000317 Topoisomerase II Inhibitor Substances 0.000 description 3
- 108091023040 Transcription factor Proteins 0.000 description 3
- 102000040945 Transcription factor Human genes 0.000 description 3
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 3
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 3
- HSRXSKHRSXRCFC-WDSKDSINSA-N Val-Ala Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C)C(O)=O HSRXSKHRSXRCFC-WDSKDSINSA-N 0.000 description 3
- 108010023617 abarelix Proteins 0.000 description 3
- AIWRTTMUVOZGPW-HSPKUQOVSA-N abarelix Chemical compound C([C@@H](C(=O)N[C@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCNC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@H](C)C(N)=O)N(C)C(=O)[C@H](CO)NC(=O)[C@@H](CC=1C=NC=CC=1)NC(=O)[C@@H](CC=1C=CC(Cl)=CC=1)NC(=O)[C@@H](CC=1C=C2C=CC=CC2=CC=1)NC(C)=O)C1=CC=C(O)C=C1 AIWRTTMUVOZGPW-HSPKUQOVSA-N 0.000 description 3
- 229960002184 abarelix Drugs 0.000 description 3
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 3
- 239000000654 additive Substances 0.000 description 3
- 229930013930 alkaloid Natural products 0.000 description 3
- 125000002947 alkylene group Chemical group 0.000 description 3
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 3
- 229960000473 altretamine Drugs 0.000 description 3
- XCPGHVQEEXUHNC-UHFFFAOYSA-N amsacrine Chemical compound COC1=CC(NS(C)(=O)=O)=CC=C1NC1=C(C=CC=C2)C2=NC2=CC=CC=C12 XCPGHVQEEXUHNC-UHFFFAOYSA-N 0.000 description 3
- YBBLVLTVTVSKRW-UHFFFAOYSA-N anastrozole Chemical compound N#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1 YBBLVLTVTVSKRW-UHFFFAOYSA-N 0.000 description 3
- 239000004037 angiogenesis inhibitor Substances 0.000 description 3
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 3
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 description 3
- 239000003719 aurora kinase inhibitor Substances 0.000 description 3
- 229940120638 avastin Drugs 0.000 description 3
- 229960003005 axitinib Drugs 0.000 description 3
- RITAVMQDGBJQJZ-FMIVXFBMSA-N axitinib Chemical compound CNC(=O)C1=CC=CC=C1SC1=CC=C(C(\C=C\C=2N=CC=CC=2)=NN2)C2=C1 RITAVMQDGBJQJZ-FMIVXFBMSA-N 0.000 description 3
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 description 3
- ACWZRVQXLIRSDF-UHFFFAOYSA-N binimetinib Chemical compound OCCONC(=O)C=1C=C2N(C)C=NC2=C(F)C=1NC1=CC=C(Br)C=C1F ACWZRVQXLIRSDF-UHFFFAOYSA-N 0.000 description 3
- 238000001574 biopsy Methods 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 3
- UBPYILGKFZZVDX-UHFFFAOYSA-N bosutinib Chemical compound C1=C(Cl)C(OC)=CC(NC=2C3=CC(OC)=C(OCCCN4CCN(C)CC4)C=C3N=CC=2C#N)=C1Cl UBPYILGKFZZVDX-UHFFFAOYSA-N 0.000 description 3
- 210000000481 breast Anatomy 0.000 description 3
- 229960000455 brentuximab vedotin Drugs 0.000 description 3
- 239000006172 buffering agent Substances 0.000 description 3
- 229940127093 camptothecin Drugs 0.000 description 3
- BLMPQMFVWMYDKT-NZTKNTHTSA-N carfilzomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)[C@]1(C)OC1)NC(=O)CN1CCOCC1)CC1=CC=CC=C1 BLMPQMFVWMYDKT-NZTKNTHTSA-N 0.000 description 3
- 229960002438 carfilzomib Drugs 0.000 description 3
- 229940076006 cell cycle modulator Drugs 0.000 description 3
- 108700008462 cetrorelix Proteins 0.000 description 3
- SBNPWPIBESPSIF-MHWMIDJBSA-N cetrorelix Chemical compound C([C@@H](C(=O)N[C@H](CCCNC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@H](C)C(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](CC=1C=NC=CC=1)NC(=O)[C@@H](CC=1C=CC(Cl)=CC=1)NC(=O)[C@@H](CC=1C=C2C=CC=CC2=CC=1)NC(C)=O)C1=CC=C(O)C=C1 SBNPWPIBESPSIF-MHWMIDJBSA-N 0.000 description 3
- 238000007385 chemical modification Methods 0.000 description 3
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 3
- 238000004587 chromatography analysis Methods 0.000 description 3
- 229960002173 citrulline Drugs 0.000 description 3
- 235000013477 citrulline Nutrition 0.000 description 3
- 230000002860 competitive effect Effects 0.000 description 3
- 238000007822 cytometric assay Methods 0.000 description 3
- 210000000172 cytosol Anatomy 0.000 description 3
- GVJHHUAWPYXKBD-UHFFFAOYSA-N d-alpha-tocopherol Natural products OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 3
- 229960000640 dactinomycin Drugs 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 229960002448 dasatinib Drugs 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 229960003957 dexamethasone Drugs 0.000 description 3
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 239000002552 dosage form Substances 0.000 description 3
- 229960004679 doxorubicin Drugs 0.000 description 3
- 239000012636 effector Substances 0.000 description 3
- 229950004255 emibetuzumab Drugs 0.000 description 3
- QXRSDHAAWVKZLJ-PVYNADRNSA-N epothilone B Chemical compound C/C([C@@H]1C[C@@H]2O[C@]2(C)CCC[C@@H]([C@@H]([C@@H](C)C(=O)C(C)(C)[C@@H](O)CC(=O)O1)O)C)=C\C1=CSC(C)=N1 QXRSDHAAWVKZLJ-PVYNADRNSA-N 0.000 description 3
- 229960004945 etoricoxib Drugs 0.000 description 3
- 238000002710 external beam radiation therapy Methods 0.000 description 3
- DBEPLOCGEIEOCV-WSBQPABSSA-N finasteride Chemical compound N([C@@H]1CC2)C(=O)C=C[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H](C(=O)NC(C)(C)C)[C@@]2(C)CC1 DBEPLOCGEIEOCV-WSBQPABSSA-N 0.000 description 3
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 3
- 210000004602 germ cell Anatomy 0.000 description 3
- 239000000174 gluconic acid Substances 0.000 description 3
- 235000012208 gluconic acid Nutrition 0.000 description 3
- 150000004820 halides Chemical class 0.000 description 3
- 239000008241 heterogeneous mixture Substances 0.000 description 3
- UUVWYPNAQBNQJQ-UHFFFAOYSA-N hexamethylmelamine Chemical compound CN(C)C1=NC(N(C)C)=NC(N(C)C)=N1 UUVWYPNAQBNQJQ-UHFFFAOYSA-N 0.000 description 3
- HHXHVIJIIXKSOE-QILQGKCVSA-N histrelin Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC(N=C1)=CN1CC1=CC=CC=C1 HHXHVIJIIXKSOE-QILQGKCVSA-N 0.000 description 3
- 238000001794 hormone therapy Methods 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- 230000007062 hydrolysis Effects 0.000 description 3
- 238000006460 hydrolysis reaction Methods 0.000 description 3
- 229960002411 imatinib Drugs 0.000 description 3
- CGIGDMFJXJATDK-UHFFFAOYSA-N indomethacin Chemical compound CC1=C(CC(O)=O)C2=CC(OC)=CC=C2N1C(=O)C1=CC=C(Cl)C=C1 CGIGDMFJXJATDK-UHFFFAOYSA-N 0.000 description 3
- 239000000138 intercalating agent Substances 0.000 description 3
- 229940084651 iressa Drugs 0.000 description 3
- GURKHSYORGJETM-WAQYZQTGSA-N irinotecan hydrochloride (anhydrous) Chemical compound Cl.C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 GURKHSYORGJETM-WAQYZQTGSA-N 0.000 description 3
- 210000003734 kidney Anatomy 0.000 description 3
- 239000004310 lactic acid Substances 0.000 description 3
- 235000014655 lactic acid Nutrition 0.000 description 3
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 description 3
- 229950002884 lexatumumab Drugs 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- PCZOHLXUXFIOCF-BXMDZJJMSA-N lovastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 PCZOHLXUXFIOCF-BXMDZJJMSA-N 0.000 description 3
- 239000008176 lyophilized powder Substances 0.000 description 3
- 229960001924 melphalan Drugs 0.000 description 3
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 3
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 3
- 239000002207 metabolite Substances 0.000 description 3
- 229960004452 methionine Drugs 0.000 description 3
- 229960003248 mifepristone Drugs 0.000 description 3
- VKHAHZOOUSRJNA-GCNJZUOMSA-N mifepristone Chemical compound C1([C@@H]2C3=C4CCC(=O)C=C4CC[C@H]3[C@@H]3CC[C@@]([C@]3(C2)C)(O)C#CC)=CC=C(N(C)C)C=C1 VKHAHZOOUSRJNA-GCNJZUOMSA-N 0.000 description 3
- 150000007522 mineralic acids Chemical class 0.000 description 3
- 230000002438 mitochondrial effect Effects 0.000 description 3
- 229950003063 mitumomab Drugs 0.000 description 3
- AARXZCZYLAFQQU-UHFFFAOYSA-N motexafin gadolinium Chemical compound [Gd].CC(O)=O.CC(O)=O.C1=C([N-]2)C(CC)=C(CC)C2=CC(C(=C2C)CCCO)=NC2=CN=C2C=C(OCCOCCOCCOC)C(OCCOCCOCCOC)=CC2=NC=C2C(C)=C(CCCO)C1=N2 AARXZCZYLAFQQU-UHFFFAOYSA-N 0.000 description 3
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 3
- 201000000050 myeloid neoplasm Diseases 0.000 description 3
- LBWFXVZLPYTWQI-IPOVEDGCSA-N n-[2-(diethylamino)ethyl]-5-[(z)-(5-fluoro-2-oxo-1h-indol-3-ylidene)methyl]-2,4-dimethyl-1h-pyrrole-3-carboxamide;(2s)-2-hydroxybutanedioic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O.CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C LBWFXVZLPYTWQI-IPOVEDGCSA-N 0.000 description 3
- CMWTZPSULFXXJA-VIFPVBQESA-N naproxen Chemical compound C1=C([C@H](C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-VIFPVBQESA-N 0.000 description 3
- 229960001346 nilotinib Drugs 0.000 description 3
- XWXYUMMDTVBTOU-UHFFFAOYSA-N nilutamide Chemical compound O=C1C(C)(C)NC(=O)N1C1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 XWXYUMMDTVBTOU-UHFFFAOYSA-N 0.000 description 3
- 239000002736 nonionic surfactant Substances 0.000 description 3
- 230000030147 nuclear export Effects 0.000 description 3
- 102000039446 nucleic acids Human genes 0.000 description 3
- 108020004707 nucleic acids Proteins 0.000 description 3
- 150000007523 nucleic acids Chemical class 0.000 description 3
- 229950006584 obatoclax Drugs 0.000 description 3
- 150000007524 organic acids Chemical class 0.000 description 3
- 229960005079 pemetrexed Drugs 0.000 description 3
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 3
- 229960002087 pertuzumab Drugs 0.000 description 3
- 229910052697 platinum Inorganic materials 0.000 description 3
- 238000003752 polymerase chain reaction Methods 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 3
- 229960004618 prednisone Drugs 0.000 description 3
- 239000003755 preservative agent Substances 0.000 description 3
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 3
- 229960000624 procarbazine Drugs 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 239000000007 protein synthesis inhibitor Substances 0.000 description 3
- GZUITABIAKMVPG-UHFFFAOYSA-N raloxifene Chemical compound C1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 GZUITABIAKMVPG-UHFFFAOYSA-N 0.000 description 3
- 230000000306 recurrent effect Effects 0.000 description 3
- 239000002336 ribonucleotide Substances 0.000 description 3
- VHXNKPBCCMUMSW-FQEVSTJZSA-N rubitecan Chemical compound C1=CC([N+]([O-])=O)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VHXNKPBCCMUMSW-FQEVSTJZSA-N 0.000 description 3
- 229950009213 rubitecan Drugs 0.000 description 3
- HFNKQEVNSGCOJV-OAHLLOKOSA-N ruxolitinib Chemical compound C1([C@@H](CC#N)N2N=CC(=C2)C=2C=3C=CNC=3N=CN=2)CCCC1 HFNKQEVNSGCOJV-OAHLLOKOSA-N 0.000 description 3
- 229960000215 ruxolitinib Drugs 0.000 description 3
- BTIHMVBBUGXLCJ-OAHLLOKOSA-N seliciclib Chemical compound C=12N=CN(C(C)C)C2=NC(N[C@@H](CO)CC)=NC=1NCC1=CC=CC=C1 BTIHMVBBUGXLCJ-OAHLLOKOSA-N 0.000 description 3
- 208000000587 small cell lung carcinoma Diseases 0.000 description 3
- 125000006850 spacer group Chemical group 0.000 description 3
- 206010041823 squamous cell carcinoma Diseases 0.000 description 3
- 230000006641 stabilisation Effects 0.000 description 3
- 238000011105 stabilization Methods 0.000 description 3
- 238000010561 standard procedure Methods 0.000 description 3
- 201000011549 stomach cancer Diseases 0.000 description 3
- 239000001384 succinic acid Substances 0.000 description 3
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 3
- 229960001796 sunitinib Drugs 0.000 description 3
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 3
- FQZYTYWMLGAPFJ-OQKDUQJOSA-N tamoxifen citrate Chemical compound [H+].[H+].[H+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O.C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 FQZYTYWMLGAPFJ-OQKDUQJOSA-N 0.000 description 3
- 235000002906 tartaric acid Nutrition 0.000 description 3
- 150000003573 thiols Chemical class 0.000 description 3
- 230000001988 toxicity Effects 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 3
- 229960000575 trastuzumab Drugs 0.000 description 3
- 229960004799 tryptophan Drugs 0.000 description 3
- 229960003048 vinblastine Drugs 0.000 description 3
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- 230000003442 weekly effect Effects 0.000 description 3
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 2
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- LVLLALCJVJNGQQ-SEODYNFXSA-N (1r,3s,5z)-5-[(2e)-2-[(1r,3as,7ar)-1-[(2r,3e,5e)-7-ethyl-7-hydroxynona-3,5-dien-2-yl]-7a-methyl-2,3,3a,5,6,7-hexahydro-1h-inden-4-ylidene]ethylidene]-4-methylidenecyclohexane-1,3-diol Chemical compound C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)/C=C/C=C/C(O)(CC)CC)=C\C=C1\C[C@@H](O)C[C@H](O)C1=C LVLLALCJVJNGQQ-SEODYNFXSA-N 0.000 description 2
- WZRFLSDVFPIXOV-LRQRDZAKSA-N (2s)-1-[(2s)-2-cyclohexyl-2-[[(2s)-2-(methylamino)propanoyl]amino]acetyl]-n-(4-phenylthiadiazol-5-yl)pyrrolidine-2-carboxamide Chemical compound C1([C@H](NC(=O)[C@H](C)NC)C(=O)N2[C@@H](CCC2)C(=O)NC2=C(N=NS2)C=2C=CC=CC=2)CCCCC1 WZRFLSDVFPIXOV-LRQRDZAKSA-N 0.000 description 2
- MHFUWOIXNMZFIW-WNQIDUERSA-N (2s)-2-hydroxypropanoic acid;n-[4-[4-(4-methylpiperazin-1-yl)-6-[(5-methyl-1h-pyrazol-3-yl)amino]pyrimidin-2-yl]sulfanylphenyl]cyclopropanecarboxamide Chemical compound C[C@H](O)C(O)=O.C1CN(C)CCN1C1=CC(NC2=NNC(C)=C2)=NC(SC=2C=CC(NC(=O)C3CC3)=CC=2)=N1 MHFUWOIXNMZFIW-WNQIDUERSA-N 0.000 description 2
- UFPFGVNKHCLJJO-SSKFGXFMSA-N (2s)-n-[(1s)-1-cyclohexyl-2-[(2s)-2-[4-(4-fluorobenzoyl)-1,3-thiazol-2-yl]pyrrolidin-1-yl]-2-oxoethyl]-2-(methylamino)propanamide Chemical compound C1([C@H](NC(=O)[C@H](C)NC)C(=O)N2[C@@H](CCC2)C=2SC=C(N=2)C(=O)C=2C=CC(F)=CC=2)CCCCC1 UFPFGVNKHCLJJO-SSKFGXFMSA-N 0.000 description 2
- HCSMRSHIIKPNAK-LSAVBLLPSA-N (2s)-n-[(1s)-2-[(3ar,7as)-6-(2-phenylethyl)-3,3a,4,5,7,7a-hexahydro-2h-pyrrolo[2,3-c]pyridin-1-yl]-1-cyclohexyl-2-oxoethyl]-2-(methylamino)propanamide Chemical compound C1([C@H](NC(=O)[C@H](C)NC)C(=O)N2[C@@H]3CN(CCC=4C=CC=CC=4)CC[C@@H]3CC2)CCCCC1 HCSMRSHIIKPNAK-LSAVBLLPSA-N 0.000 description 2
- OMRPLUKQNWNZAV-CONSDPRKSA-N (6as)-3-[3-[[(6as)-2-methoxy-8-(4-methoxyphenyl)-11-oxo-6a,7-dihydropyrrolo[2,1-c][1,4]benzodiazepin-3-yl]oxy]propoxy]-8-(4-aminophenyl)-2-methoxy-6a,7-dihydropyrrolo[2,1-c][1,4]benzodiazepin-11-one Chemical compound C1=CC(OC)=CC=C1C1=CN2C(=O)C3=CC(OC)=C(OCCCOC=4C(=CC=5C(=O)N6C=C(C[C@H]6C=NC=5C=4)C=4C=CC(N)=CC=4)OC)C=C3N=C[C@@H]2C1 OMRPLUKQNWNZAV-CONSDPRKSA-N 0.000 description 2
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 2
- LKJPYSCBVHEWIU-KRWDZBQOSA-N (R)-bicalutamide Chemical compound C([C@@](O)(C)C(=O)NC=1C=C(C(C#N)=CC=1)C(F)(F)F)S(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-KRWDZBQOSA-N 0.000 description 2
- OPAKEJZFFCECPN-XQRVVYSFSA-N (z)-3-[3-[3,5-bis(trifluoromethyl)phenyl]-1,2,4-triazol-1-yl]-n'-pyridin-2-ylprop-2-enehydrazide Chemical compound FC(F)(F)C1=CC(C(F)(F)F)=CC(C2=NN(\C=C/C(=O)NNC=3N=CC=CC=3)C=N2)=C1 OPAKEJZFFCECPN-XQRVVYSFSA-N 0.000 description 2
- KHWIRCOLWPNBJP-UHFFFAOYSA-N 1-(2-chloroethyl)-3-(2,6-dioxopiperidin-3-yl)-1-nitrosourea Chemical compound ClCCN(N=O)C(=O)NC1CCC(=O)NC1=O KHWIRCOLWPNBJP-UHFFFAOYSA-N 0.000 description 2
- SWQQELWGJDXCFT-PNHWDRBUSA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-ethynylimidazole-4-carboxamide Chemical compound C#CC1=C(C(=O)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 SWQQELWGJDXCFT-PNHWDRBUSA-N 0.000 description 2
- WPHKIQPVPYJNAX-UHFFFAOYSA-N 1-[4-[4-amino-7-[1-(2-hydroxyethyl)pyrazol-4-yl]thieno[3,2-c]pyridin-3-yl]phenyl]-3-(3-fluorophenyl)urea Chemical compound C1=2SC=C(C=3C=CC(NC(=O)NC=4C=C(F)C=CC=4)=CC=3)C=2C(N)=NC=C1C=1C=NN(CCO)C=1 WPHKIQPVPYJNAX-UHFFFAOYSA-N 0.000 description 2
- CZDWSKBKCZWXFI-UHFFFAOYSA-N 1-morpholin-4-yl-3-[4-oxo-3-[4-[2-oxo-2-(4-propan-2-ylpiperazin-1-yl)ethoxy]phenyl]-1h-indeno[1,2-c]pyrazol-5-yl]urea Chemical compound C1CN(C(C)C)CCN1C(=O)COC1=CC=C(C=2C=3C(=O)C4=C(NC(=O)NN5CCOCC5)C=CC=C4C=3NN=2)C=C1 CZDWSKBKCZWXFI-UHFFFAOYSA-N 0.000 description 2
- HAWSQZCWOQZXHI-FQEVSTJZSA-N 10-Hydroxycamptothecin Chemical compound C1=C(O)C=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 HAWSQZCWOQZXHI-FQEVSTJZSA-N 0.000 description 2
- QFWCYNPOPKQOKV-UHFFFAOYSA-N 2-(2-amino-3-methoxyphenyl)chromen-4-one Chemical compound COC1=CC=CC(C=2OC3=CC=CC=C3C(=O)C=2)=C1N QFWCYNPOPKQOKV-UHFFFAOYSA-N 0.000 description 2
- JNAHVYVRKWKWKQ-UHFFFAOYSA-N 2-(2-methyl-2-pyrrolidinyl)-1H-benzimidazole-4-carboxamide Chemical compound N=1C2=C(C(N)=O)C=CC=C2NC=1C1(C)CCCN1 JNAHVYVRKWKWKQ-UHFFFAOYSA-N 0.000 description 2
- QINPEPAQOBZPOF-UHFFFAOYSA-N 2-amino-n-[3-[[3-(2-chloro-5-methoxyanilino)quinoxalin-2-yl]sulfamoyl]phenyl]-2-methylpropanamide Chemical compound COC1=CC=C(Cl)C(NC=2C(=NC3=CC=CC=C3N=2)NS(=O)(=O)C=2C=C(NC(=O)C(C)(C)N)C=CC=2)=C1 QINPEPAQOBZPOF-UHFFFAOYSA-N 0.000 description 2
- BJVRNXSHJLDZJR-UHFFFAOYSA-N 3-(1-methyl-4-morpholin-4-ylpyrazolo[3,4-d]pyrimidin-6-yl)phenol Chemical compound N1=C2N(C)N=CC2=C(N2CCOCC2)N=C1C1=CC=CC(O)=C1 BJVRNXSHJLDZJR-UHFFFAOYSA-N 0.000 description 2
- ZZUBHVMHNVYXRR-UHFFFAOYSA-N 3-(4-hydroxyphenyl)-2h-chromen-7-ol Chemical compound C1=CC(O)=CC=C1C1=CC2=CC=C(O)C=C2OC1 ZZUBHVMHNVYXRR-UHFFFAOYSA-N 0.000 description 2
- HXHAJRMTJXHJJZ-UHFFFAOYSA-N 3-[(4-bromo-2,6-difluorophenyl)methoxy]-5-(4-pyrrolidin-1-ylbutylcarbamoylamino)-1,2-thiazole-4-carboxamide Chemical compound S1N=C(OCC=2C(=CC(Br)=CC=2F)F)C(C(=O)N)=C1NC(=O)NCCCCN1CCCC1 HXHAJRMTJXHJJZ-UHFFFAOYSA-N 0.000 description 2
- WEVYNIUIFUYDGI-UHFFFAOYSA-N 3-[6-[4-(trifluoromethoxy)anilino]-4-pyrimidinyl]benzamide Chemical compound NC(=O)C1=CC=CC(C=2N=CN=C(NC=3C=CC(OC(F)(F)F)=CC=3)C=2)=C1 WEVYNIUIFUYDGI-UHFFFAOYSA-N 0.000 description 2
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 2
- WJRRGYBTGDJBFX-UHFFFAOYSA-N 4-(2-methyl-3-propan-2-yl-4-imidazolyl)-N-(4-methylsulfonylphenyl)-2-pyrimidinamine Chemical compound CC(C)N1C(C)=NC=C1C1=CC=NC(NC=2C=CC(=CC=2)S(C)(=O)=O)=N1 WJRRGYBTGDJBFX-UHFFFAOYSA-N 0.000 description 2
- CLPFFLWZZBQMAO-UHFFFAOYSA-N 4-(5,6,7,8-tetrahydroimidazo[1,5-a]pyridin-5-yl)benzonitrile Chemical compound C1=CC(C#N)=CC=C1C1N2C=NC=C2CCC1 CLPFFLWZZBQMAO-UHFFFAOYSA-N 0.000 description 2
- XXJWYDDUDKYVKI-UHFFFAOYSA-N 4-[(4-fluoro-2-methyl-1H-indol-5-yl)oxy]-6-methoxy-7-[3-(1-pyrrolidinyl)propoxy]quinazoline Chemical compound COC1=CC2=C(OC=3C(=C4C=C(C)NC4=CC=3)F)N=CN=C2C=C1OCCCN1CCCC1 XXJWYDDUDKYVKI-UHFFFAOYSA-N 0.000 description 2
- HHFBDROWDBDFBR-UHFFFAOYSA-N 4-[[9-chloro-7-(2,6-difluorophenyl)-5H-pyrimido[5,4-d][2]benzazepin-2-yl]amino]benzoic acid Chemical compound C1=CC(C(=O)O)=CC=C1NC1=NC=C(CN=C(C=2C3=CC=C(Cl)C=2)C=2C(=CC=CC=2F)F)C3=N1 HHFBDROWDBDFBR-UHFFFAOYSA-N 0.000 description 2
- MDOJTZQKHMAPBK-UHFFFAOYSA-N 4-iodo-3-nitrobenzamide Chemical compound NC(=O)C1=CC=C(I)C([N+]([O-])=O)=C1 MDOJTZQKHMAPBK-UHFFFAOYSA-N 0.000 description 2
- NMUSYJAQQFHJEW-UHFFFAOYSA-N 5-Azacytidine Natural products O=C1N=C(N)N=CN1C1C(O)C(O)C(CO)O1 NMUSYJAQQFHJEW-UHFFFAOYSA-N 0.000 description 2
- SRSGVKWWVXWSJT-ATVHPVEESA-N 5-[(z)-(5-fluoro-2-oxo-1h-indol-3-ylidene)methyl]-2,4-dimethyl-n-(2-pyrrolidin-1-ylethyl)-1h-pyrrole-3-carboxamide Chemical compound CC=1NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C(C)C=1C(=O)NCCN1CCCC1 SRSGVKWWVXWSJT-ATVHPVEESA-N 0.000 description 2
- ODACNRQBNVVGAI-UHFFFAOYSA-N 5-[2-chloroethyl(2-fluoroethyl)amino]-6-methyl-1h-pyrimidine-2,4-dione Chemical compound CC=1NC(=O)NC(=O)C=1N(CCF)CCCl ODACNRQBNVVGAI-UHFFFAOYSA-N 0.000 description 2
- UPALIKSFLSVKIS-UHFFFAOYSA-N 5-amino-2-[2-(dimethylamino)ethyl]benzo[de]isoquinoline-1,3-dione Chemical compound NC1=CC(C(N(CCN(C)C)C2=O)=O)=C3C2=CC=CC3=C1 UPALIKSFLSVKIS-UHFFFAOYSA-N 0.000 description 2
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 2
- DUUGKQCEGZLZNO-UHFFFAOYSA-N 5-hydroxyindoleacetic acid Chemical compound C1=C(O)C=C2C(CC(=O)O)=CNC2=C1 DUUGKQCEGZLZNO-UHFFFAOYSA-N 0.000 description 2
- DOCINCLJNAXZQF-LBPRGKRZSA-N 6-fluoro-3-phenyl-2-[(1s)-1-(7h-purin-6-ylamino)ethyl]quinazolin-4-one Chemical compound C1([C@@H](NC=2C=3N=CNC=3N=CN=2)C)=NC2=CC=C(F)C=C2C(=O)N1C1=CC=CC=C1 DOCINCLJNAXZQF-LBPRGKRZSA-N 0.000 description 2
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 2
- FJHBVJOVLFPMQE-QFIPXVFZSA-N 7-Ethyl-10-Hydroxy-Camptothecin Chemical compound C1=C(O)C=C2C(CC)=C(CN3C(C4=C([C@@](C(=O)OC4)(O)CC)C=C33)=O)C3=NC2=C1 FJHBVJOVLFPMQE-QFIPXVFZSA-N 0.000 description 2
- WLCZTRVUXYALDD-IBGZPJMESA-N 7-[[(2s)-2,6-bis(2-methoxyethoxycarbonylamino)hexanoyl]amino]heptoxy-methylphosphinic acid Chemical compound COCCOC(=O)NCCCC[C@H](NC(=O)OCCOC)C(=O)NCCCCCCCOP(C)(O)=O WLCZTRVUXYALDD-IBGZPJMESA-N 0.000 description 2
- FUXVKZWTXQUGMW-FQEVSTJZSA-N 9-Aminocamptothecin Chemical compound C1=CC(N)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 FUXVKZWTXQUGMW-FQEVSTJZSA-N 0.000 description 2
- OONFNUWBHFSNBT-HXUWFJFHSA-N AEE788 Chemical compound C1CN(CC)CCN1CC1=CC=C(C=2NC3=NC=NC(N[C@H](C)C=4C=CC=CC=4)=C3C=2)C=C1 OONFNUWBHFSNBT-HXUWFJFHSA-N 0.000 description 2
- 102100033793 ALK tyrosine kinase receptor Human genes 0.000 description 2
- 101150054149 ANGPTL4 gene Proteins 0.000 description 2
- BUROJSBIWGDYCN-GAUTUEMISA-N AP 23573 Chemical compound C1C[C@@H](OP(C)(C)=O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 BUROJSBIWGDYCN-GAUTUEMISA-N 0.000 description 2
- GBJVVSCPOBPEIT-UHFFFAOYSA-N AZT-1152 Chemical compound N=1C=NC2=CC(OCCCN(CC)CCOP(O)(O)=O)=CC=C2C=1NC(=NN1)C=C1CC(=O)NC1=CC=CC(F)=C1 GBJVVSCPOBPEIT-UHFFFAOYSA-N 0.000 description 2
- 102100026439 Adhesion G protein-coupled receptor E1 Human genes 0.000 description 2
- LIWMQSWFLXEGMA-WDSKDSINSA-N Ala-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H](C)N LIWMQSWFLXEGMA-WDSKDSINSA-N 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- 206010073478 Anaplastic large-cell lymphoma Diseases 0.000 description 2
- 102000045205 Angiopoietin-Like Protein 4 Human genes 0.000 description 2
- 108700042530 Angiopoietin-Like Protein 4 Proteins 0.000 description 2
- 102100021569 Apoptosis regulator Bcl-2 Human genes 0.000 description 2
- 101100330725 Arabidopsis thaliana DAR4 gene Proteins 0.000 description 2
- GOLCXWYRSKYTSP-UHFFFAOYSA-N Arsenious Acid Chemical compound O1[As]2O[As]1O2 GOLCXWYRSKYTSP-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 241000271566 Aves Species 0.000 description 2
- YUXMAKUNSXIEKN-BTJKTKAUSA-N BGT226 Chemical compound OC(=O)\C=C/C(O)=O.C1=NC(OC)=CC=C1C1=CC=C(N=CC2=C3N(C=4C=C(C(N5CCNCC5)=CC=4)C(F)(F)F)C(=O)N2C)C3=C1 YUXMAKUNSXIEKN-BTJKTKAUSA-N 0.000 description 2
- 102000051485 Bcl-2 family Human genes 0.000 description 2
- 108700038897 Bcl-2 family Proteins 0.000 description 2
- KHBQMWCZKVMBLN-UHFFFAOYSA-N Benzenesulfonamide Chemical compound NS(=O)(=O)C1=CC=CC=C1 KHBQMWCZKVMBLN-UHFFFAOYSA-N 0.000 description 2
- VGGGPCQERPFHOB-MCIONIFRSA-N Bestatin Chemical compound CC(C)C[C@H](C(O)=O)NC(=O)[C@@H](O)[C@H](N)CC1=CC=CC=C1 VGGGPCQERPFHOB-MCIONIFRSA-N 0.000 description 2
- 206010065553 Bone marrow failure Diseases 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 2
- 108010037003 Buserelin Proteins 0.000 description 2
- 102100032367 C-C motif chemokine 5 Human genes 0.000 description 2
- 102100025248 C-X-C motif chemokine 10 Human genes 0.000 description 2
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 2
- 102000008203 CTLA-4 Antigen Human genes 0.000 description 2
- 229940045513 CTLA4 antagonist Drugs 0.000 description 2
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- SHHKQEUPHAENFK-UHFFFAOYSA-N Carboquone Chemical compound O=C1C(C)=C(N2CC2)C(=O)C(C(COC(N)=O)OC)=C1N1CC1 SHHKQEUPHAENFK-UHFFFAOYSA-N 0.000 description 2
- 102000011727 Caspases Human genes 0.000 description 2
- 108010076667 Caspases Proteins 0.000 description 2
- 108090000994 Catalytic RNA Proteins 0.000 description 2
- 102000053642 Catalytic RNA Human genes 0.000 description 2
- 206010008342 Cervix carcinoma Diseases 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 2
- 102100021906 Cyclin-O Human genes 0.000 description 2
- 101710112752 Cytotoxin Proteins 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 2
- SRBFZHDQGSBBOR-IOVATXLUSA-N D-xylopyranose Chemical compound O[C@@H]1COC(O)[C@H](O)[C@H]1O SRBFZHDQGSBBOR-IOVATXLUSA-N 0.000 description 2
- GJKXGJCSJWBJEZ-XRSSZCMZSA-N Deslorelin Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CNC2=CC=CC=C12 GJKXGJCSJWBJEZ-XRSSZCMZSA-N 0.000 description 2
- 229920002307 Dextran Polymers 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 2
- LQKSHSFQQRCAFW-UHFFFAOYSA-N Dolastatin 15 Natural products COC1=CC(=O)N(C(=O)C(OC(=O)C2N(CCC2)C(=O)C2N(CCC2)C(=O)C(C(C)C)N(C)C(=O)C(NC(=O)C(C(C)C)N(C)C)C(C)C)C(C)C)C1CC1=CC=CC=C1 LQKSHSFQQRCAFW-UHFFFAOYSA-N 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 2
- ULGZDMOVFRHVEP-RWJQBGPGSA-N Erythromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 ULGZDMOVFRHVEP-RWJQBGPGSA-N 0.000 description 2
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 2
- 102100038595 Estrogen receptor Human genes 0.000 description 2
- 108010087819 Fc receptors Proteins 0.000 description 2
- 102000009109 Fc receptors Human genes 0.000 description 2
- 108010029961 Filgrastim Proteins 0.000 description 2
- 108700000266 GSK923295 Proteins 0.000 description 2
- 241000287828 Gallus gallus Species 0.000 description 2
- LLEUXCDZPQOJMY-AAEUAGOBSA-N Glu-Trp Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@H](CCC(O)=O)N)C(O)=O)=CNC2=C1 LLEUXCDZPQOJMY-AAEUAGOBSA-N 0.000 description 2
- SITLTJHOQZFJGG-XPUUQOCRSA-N Glu-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@@H](N)CCC(O)=O SITLTJHOQZFJGG-XPUUQOCRSA-N 0.000 description 2
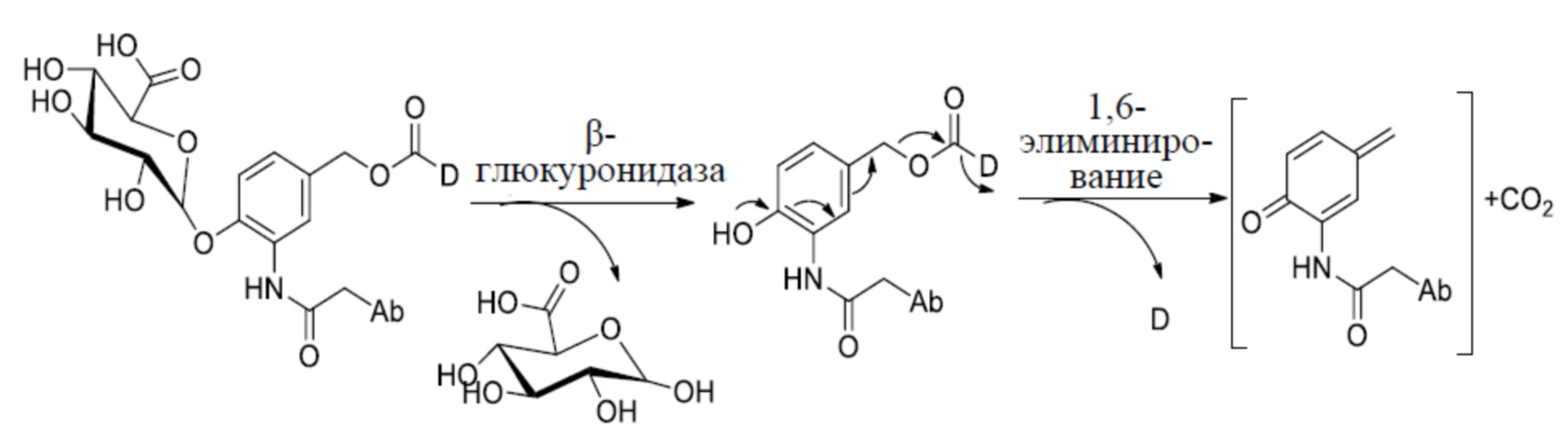
- 108010060309 Glucuronidase Proteins 0.000 description 2
- 102000053187 Glucuronidase Human genes 0.000 description 2
- 102000003886 Glycoproteins Human genes 0.000 description 2
- 108090000288 Glycoproteins Proteins 0.000 description 2
- 102100039619 Granulocyte colony-stimulating factor Human genes 0.000 description 2
- 102000006354 HLA-DR Antigens Human genes 0.000 description 2
- 108010058597 HLA-DR Antigens Proteins 0.000 description 2
- 108010004889 Heat-Shock Proteins Proteins 0.000 description 2
- 102000002812 Heat-Shock Proteins Human genes 0.000 description 2
- 102000003745 Hepatocyte Growth Factor Human genes 0.000 description 2
- 108090000100 Hepatocyte Growth Factor Proteins 0.000 description 2
- 108090000353 Histone deacetylase Proteins 0.000 description 2
- 102000003964 Histone deacetylase Human genes 0.000 description 2
- 101000718225 Homo sapiens Adhesion G protein-coupled receptor E1 Proteins 0.000 description 2
- 101000971171 Homo sapiens Apoptosis regulator Bcl-2 Proteins 0.000 description 2
- 101000797762 Homo sapiens C-C motif chemokine 5 Proteins 0.000 description 2
- 101000858088 Homo sapiens C-X-C motif chemokine 10 Proteins 0.000 description 2
- 101000897441 Homo sapiens Cyclin-O Proteins 0.000 description 2
- 101000994375 Homo sapiens Integrin alpha-4 Proteins 0.000 description 2
- 101000916644 Homo sapiens Macrophage colony-stimulating factor 1 receptor Proteins 0.000 description 2
- 101000904173 Homo sapiens Progonadoliberin-1 Proteins 0.000 description 2
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 2
- 101000654674 Homo sapiens Semaphorin-6A Proteins 0.000 description 2
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 2
- 101000666896 Homo sapiens V-type immunoglobulin domain-containing suppressor of T-cell activation Proteins 0.000 description 2
- VSNHCAURESNICA-UHFFFAOYSA-N Hydroxyurea Chemical compound NC(=O)NO VSNHCAURESNICA-UHFFFAOYSA-N 0.000 description 2
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 2
- 229940076838 Immune checkpoint inhibitor Drugs 0.000 description 2
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 2
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 2
- 102000037984 Inhibitory immune checkpoint proteins Human genes 0.000 description 2
- 108091008026 Inhibitory immune checkpoint proteins Proteins 0.000 description 2
- 102100032818 Integrin alpha-4 Human genes 0.000 description 2
- 108010078049 Interferon alpha-2 Proteins 0.000 description 2
- 229940121730 Janus kinase 2 inhibitor Drugs 0.000 description 2
- 102000010638 Kinesin Human genes 0.000 description 2
- 108010063296 Kinesin Proteins 0.000 description 2
- FADYJNXDPBKVCA-UHFFFAOYSA-N L-Phenylalanyl-L-lysin Natural products NCCCCC(C(O)=O)NC(=O)C(N)CC1=CC=CC=C1 FADYJNXDPBKVCA-UHFFFAOYSA-N 0.000 description 2
- DEFJQIDDEAULHB-IMJSIDKUSA-N L-alanyl-L-alanine Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(O)=O DEFJQIDDEAULHB-IMJSIDKUSA-N 0.000 description 2
- 239000002137 L01XE24 - Ponatinib Substances 0.000 description 2
- UIARLYUEJFELEN-LROUJFHJSA-N LSM-1231 Chemical compound C12=C3N4C5=CC=CC=C5C3=C3C(=O)NCC3=C2C2=CC=CC=C2N1[C@]1(C)[C@](CO)(O)C[C@H]4O1 UIARLYUEJFELEN-LROUJFHJSA-N 0.000 description 2
- CZQHHVNHHHRRDU-UHFFFAOYSA-N LY294002 Chemical compound C1=CC=C2C(=O)C=C(N3CCOCC3)OC2=C1C1=CC=CC=C1 CZQHHVNHHHRRDU-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 208000032004 Large-Cell Anaplastic Lymphoma Diseases 0.000 description 2
- 229920001491 Lentinan Polymers 0.000 description 2
- 108010000817 Leuprolide Proteins 0.000 description 2
- 102100028198 Macrophage colony-stimulating factor 1 receptor Human genes 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- 102100030412 Matrix metalloproteinase-9 Human genes 0.000 description 2
- 108010015302 Matrix metalloproteinase-9 Proteins 0.000 description 2
- 102000008135 Mechanistic Target of Rapamycin Complex 1 Human genes 0.000 description 2
- 108010035196 Mechanistic Target of Rapamycin Complex 1 Proteins 0.000 description 2
- 102000009308 Mechanistic Target of Rapamycin Complex 2 Human genes 0.000 description 2
- 108010034057 Mechanistic Target of Rapamycin Complex 2 Proteins 0.000 description 2
- 102000018697 Membrane Proteins Human genes 0.000 description 2
- 108010052285 Membrane Proteins Proteins 0.000 description 2
- 206010027476 Metastases Diseases 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-M Methanesulfonate Chemical compound CS([O-])(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-M 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- VFKZTMPDYBFSTM-KVTDHHQDSA-N Mitobronitol Chemical compound BrC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CBr VFKZTMPDYBFSTM-KVTDHHQDSA-N 0.000 description 2
- 229930192392 Mitomycin Natural products 0.000 description 2
- PCZOHLXUXFIOCF-UHFFFAOYSA-N Monacolin X Natural products C12C(OC(=O)C(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 PCZOHLXUXFIOCF-UHFFFAOYSA-N 0.000 description 2
- SITLTJHOQZFJGG-UHFFFAOYSA-N N-L-alpha-glutamyl-L-valine Natural products CC(C)C(C(O)=O)NC(=O)C(N)CCC(O)=O SITLTJHOQZFJGG-UHFFFAOYSA-N 0.000 description 2
- MVTQIFVKRXBCHS-SMMNFGSLSA-N N-[(3S,6S,12R,15S,16R,19S,22S)-3-benzyl-12-ethyl-4,16-dimethyl-2,5,11,14,18,21,24-heptaoxo-19-phenyl-17-oxa-1,4,10,13,20-pentazatricyclo[20.4.0.06,10]hexacosan-15-yl]-3-hydroxypyridine-2-carboxamide (10R,11R,12E,17E,19E,21S)-21-hydroxy-11,19-dimethyl-10-propan-2-yl-9,26-dioxa-3,15,28-triazatricyclo[23.2.1.03,7]octacosa-1(27),6,12,17,19,25(28)-hexaene-2,8,14,23-tetrone Chemical compound CC(C)[C@H]1OC(=O)C2=CCCN2C(=O)c2coc(CC(=O)C[C@H](O)\C=C(/C)\C=C\CNC(=O)\C=C\[C@H]1C)n2.CC[C@H]1NC(=O)[C@@H](NC(=O)c2ncccc2O)[C@@H](C)OC(=O)[C@@H](NC(=O)[C@@H]2CC(=O)CCN2C(=O)[C@H](Cc2ccccc2)N(C)C(=O)[C@@H]2CCCN2C1=O)c1ccccc1 MVTQIFVKRXBCHS-SMMNFGSLSA-N 0.000 description 2
- QGZYDVAGYRLSKP-UHFFFAOYSA-N N-[7-(hydroxyamino)-7-oxoheptyl]-2-(N-phenylanilino)-5-pyrimidinecarboxamide Chemical compound N1=CC(C(=O)NCCCCCCC(=O)NO)=CN=C1N(C=1C=CC=CC=1)C1=CC=CC=C1 QGZYDVAGYRLSKP-UHFFFAOYSA-N 0.000 description 2
- BLXXJMDCKKHMKV-UHFFFAOYSA-N Nabumetone Chemical compound C1=C(CCC(C)=O)C=CC2=CC(OC)=CC=C21 BLXXJMDCKKHMKV-UHFFFAOYSA-N 0.000 description 2
- CMWTZPSULFXXJA-UHFFFAOYSA-N Naproxen Natural products C1=C(C(C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-UHFFFAOYSA-N 0.000 description 2
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 2
- 241000283973 Oryctolagus cuniculus Species 0.000 description 2
- SUDAHWBOROXANE-SECBINFHSA-N PD 0325901 Chemical compound OC[C@@H](O)CONC(=O)C1=CC=C(F)C(F)=C1NC1=CC=C(I)C=C1F SUDAHWBOROXANE-SECBINFHSA-N 0.000 description 2
- QIUASFSNWYMDFS-NILGECQDSA-N PX-866 Chemical compound CC(=O)O[C@@H]1C[C@]2(C)C(=O)CC[C@H]2C2=C1[C@@]1(C)[C@@H](COC)OC(=O)\C(=C\N(CC=C)CC=C)C1=C(O)C2=O QIUASFSNWYMDFS-NILGECQDSA-N 0.000 description 2
- SHGAZHPCJJPHSC-UHFFFAOYSA-N Panrexin Chemical compound OC(=O)C=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-UHFFFAOYSA-N 0.000 description 2
- UOZODPSAJZTQNH-UHFFFAOYSA-N Paromomycin II Natural products NC1C(O)C(O)C(CN)OC1OC1C(O)C(OC2C(C(N)CC(N)C2O)OC2C(C(O)C(O)C(CO)O2)N)OC1CO UOZODPSAJZTQNH-UHFFFAOYSA-N 0.000 description 2
- FADYJNXDPBKVCA-STQMWFEESA-N Phe-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@@H](N)CC1=CC=CC=C1 FADYJNXDPBKVCA-STQMWFEESA-N 0.000 description 2
- 102000012288 Phosphopyruvate Hydratase Human genes 0.000 description 2
- 108010022181 Phosphopyruvate Hydratase Proteins 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- HRHKSTOGXBBQCB-UHFFFAOYSA-N Porfiromycine Chemical compound O=C1C(N)=C(C)C(=O)C2=C1C(COC(N)=O)C1(OC)C3N(C)C3CN12 HRHKSTOGXBBQCB-UHFFFAOYSA-N 0.000 description 2
- 102100033237 Pro-epidermal growth factor Human genes 0.000 description 2
- 101100528525 Prochlorococcus marinus (strain SARG / CCMP1375 / SS120) rnc gene Proteins 0.000 description 2
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 2
- 102100024028 Progonadoliberin-1 Human genes 0.000 description 2
- 102100024216 Programmed cell death 1 ligand 1 Human genes 0.000 description 2
- 101710089372 Programmed cell death protein 1 Proteins 0.000 description 2
- 102100040678 Programmed cell death protein 1 Human genes 0.000 description 2
- 206010060862 Prostate cancer Diseases 0.000 description 2
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 2
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 2
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 2
- 239000005464 Radotinib Substances 0.000 description 2
- AHHFEZNOXOZZQA-ZEBDFXRSSA-N Ranimustine Chemical compound CO[C@H]1O[C@H](CNC(=O)N(CCCl)N=O)[C@@H](O)[C@H](O)[C@H]1O AHHFEZNOXOZZQA-ZEBDFXRSSA-N 0.000 description 2
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 2
- IWUCXVSUMQZMFG-AFCXAGJDSA-N Ribavirin Chemical compound N1=C(C(=O)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 IWUCXVSUMQZMFG-AFCXAGJDSA-N 0.000 description 2
- 108091028664 Ribonucleotide Proteins 0.000 description 2
- 241000283984 Rodentia Species 0.000 description 2
- 102000009203 Sema domains Human genes 0.000 description 2
- 108050000099 Sema domains Proteins 0.000 description 2
- 102100032795 Semaphorin-6A Human genes 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 102000002663 Surrogate Immunoglobulin Light Chains Human genes 0.000 description 2
- 108010018324 Surrogate Immunoglobulin Light Chains Proteins 0.000 description 2
- 101000996723 Sus scrofa Gonadotropin-releasing hormone receptor Proteins 0.000 description 2
- 102100024834 T-cell immunoreceptor with Ig and ITIM domains Human genes 0.000 description 2
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 2
- 108010000449 TNF-Related Apoptosis-Inducing Ligand Receptors Proteins 0.000 description 2
- 102000002259 TNF-Related Apoptosis-Inducing Ligand Receptors Human genes 0.000 description 2
- 239000004098 Tetracycline Substances 0.000 description 2
- FOCVUCIESVLUNU-UHFFFAOYSA-N Thiotepa Chemical compound C1CN1P(N1CC1)(=S)N1CC1 FOCVUCIESVLUNU-UHFFFAOYSA-N 0.000 description 2
- 102000002938 Thrombospondin Human genes 0.000 description 2
- 108060008245 Thrombospondin Proteins 0.000 description 2
- 108010078233 Thymalfasin Proteins 0.000 description 2
- 239000003819 Toceranib Substances 0.000 description 2
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 2
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 2
- 102100038282 V-type immunoglobulin domain-containing suppressor of T-cell activation Human genes 0.000 description 2
- 108091008605 VEGF receptors Proteins 0.000 description 2
- UPJONISHZRADBH-XPUUQOCRSA-N Val-Glu Chemical compound CC(C)[C@H](N)C(=O)N[C@H](C(O)=O)CCC(O)=O UPJONISHZRADBH-XPUUQOCRSA-N 0.000 description 2
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 2
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 2
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 2
- OGQICQVSFDPSEI-UHFFFAOYSA-N Zorac Chemical compound N1=CC(C(=O)OCC)=CC=C1C#CC1=CC=C(SCCC2(C)C)C2=C1 OGQICQVSFDPSEI-UHFFFAOYSA-N 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 108010052004 acetyl-2-naphthylalanyl-3-chlorophenylalanyl-1-oxohexadecyl-seryl-4-aminophenylalanyl(hydroorotyl)-4-aminophenylalanyl(carbamoyl)-leucyl-ILys-prolyl-alaninamide Proteins 0.000 description 2
- 230000021736 acetylation Effects 0.000 description 2
- 238000006640 acetylation reaction Methods 0.000 description 2
- USZYSDMBJDPRIF-SVEJIMAYSA-N aclacinomycin A Chemical compound O([C@H]1[C@@H](O)C[C@@H](O[C@H]1C)O[C@H]1[C@H](C[C@@H](O[C@H]1C)O[C@H]1C[C@]([C@@H](C2=CC=3C(=O)C4=CC=CC(O)=C4C(=O)C=3C(O)=C21)C(=O)OC)(O)CC)N(C)C)[C@H]1CCC(=O)[C@H](C)O1 USZYSDMBJDPRIF-SVEJIMAYSA-N 0.000 description 2
- 229960004176 aclarubicin Drugs 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 239000012190 activator Substances 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 238000011374 additional therapy Methods 0.000 description 2
- 229950009084 adecatumumab Drugs 0.000 description 2
- 201000008395 adenosquamous carcinoma Diseases 0.000 description 2
- 229940009456 adriamycin Drugs 0.000 description 2
- 108010056243 alanylalanine Proteins 0.000 description 2
- 150000001299 aldehydes Chemical class 0.000 description 2
- 108700025316 aldesleukin Proteins 0.000 description 2
- KDGFLJKFZUIJMX-UHFFFAOYSA-N alectinib Chemical compound CCC1=CC=2C(=O)C(C3=CC=C(C=C3N3)C#N)=C3C(C)(C)C=2C=C1N(CC1)CCC1N1CCOCC1 KDGFLJKFZUIJMX-UHFFFAOYSA-N 0.000 description 2
- 125000001931 aliphatic group Chemical group 0.000 description 2
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 2
- IHUNBGSDBOWDMA-AQFIFDHZSA-N all-trans-acitretin Chemical compound COC1=CC(C)=C(\C=C\C(\C)=C\C=C\C(\C)=C\C(O)=O)C(C)=C1C IHUNBGSDBOWDMA-AQFIFDHZSA-N 0.000 description 2
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 2
- BIIVYFLTOXDAOV-YVEFUNNKSA-N alvocidib Chemical compound O[C@@H]1CN(C)CC[C@@H]1C1=C(O)C=C(O)C2=C1OC(C=1C(=CC=CC=1)Cl)=CC2=O BIIVYFLTOXDAOV-YVEFUNNKSA-N 0.000 description 2
- 150000001408 amides Chemical class 0.000 description 2
- 229960002932 anastrozole Drugs 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 230000003042 antagnostic effect Effects 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 235000006708 antioxidants Nutrition 0.000 description 2
- 239000000074 antisense oligonucleotide Substances 0.000 description 2
- 238000012230 antisense oligonucleotides Methods 0.000 description 2
- 239000003443 antiviral agent Substances 0.000 description 2
- MCGDSOGUHLTADD-UHFFFAOYSA-N arzoxifene Chemical compound C1=CC(OC)=CC=C1C1=C(OC=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 MCGDSOGUHLTADD-UHFFFAOYSA-N 0.000 description 2
- 229950005529 arzoxifene Drugs 0.000 description 2
- 239000005441 aurora Substances 0.000 description 2
- 229960002756 azacitidine Drugs 0.000 description 2
- KLNFSAOEKUDMFA-UHFFFAOYSA-N azanide;2-hydroxyacetic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OCC(O)=O KLNFSAOEKUDMFA-UHFFFAOYSA-N 0.000 description 2
- 239000002585 base Substances 0.000 description 2
- PYXFVCFISTUSOO-UHFFFAOYSA-N betulafolienetriol Natural products C1CC(O)C(C)(C)C2CCC3(C)C4(C)CCC(C(C)(O)CCC=C(C)C)C4C(O)CC3C21C PYXFVCFISTUSOO-UHFFFAOYSA-N 0.000 description 2
- 229960002938 bexarotene Drugs 0.000 description 2
- 229960000997 bicalutamide Drugs 0.000 description 2
- 229960001561 bleomycin Drugs 0.000 description 2
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 2
- 230000000903 blocking effect Effects 0.000 description 2
- 230000017531 blood circulation Effects 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 229960001467 bortezomib Drugs 0.000 description 2
- GJPICJJJRGTNOD-UHFFFAOYSA-N bosentan Chemical compound COC1=CC=CC=C1OC(C(=NC(=N1)C=2N=CC=CN=2)OCCO)=C1NS(=O)(=O)C1=CC=C(C(C)(C)C)C=C1 GJPICJJJRGTNOD-UHFFFAOYSA-N 0.000 description 2
- 229960003736 bosutinib Drugs 0.000 description 2
- 239000004067 bulking agent Substances 0.000 description 2
- CUWODFFVMXJOKD-UVLQAERKSA-N buserelin Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](COC(C)(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 CUWODFFVMXJOKD-UVLQAERKSA-N 0.000 description 2
- 229960002092 busulfan Drugs 0.000 description 2
- 229940022399 cancer vaccine Drugs 0.000 description 2
- 238000009566 cancer vaccine Methods 0.000 description 2
- OJLHWPALWODJPQ-QNWVGRARSA-N canfosfamide Chemical compound ClCCN(CCCl)P(=O)(N(CCCl)CCCl)OCCS(=O)(=O)C[C@H](NC(=O)CC[C@H](N)C(O)=O)C(=O)N[C@@H](C(O)=O)C1=CC=CC=C1 OJLHWPALWODJPQ-QNWVGRARSA-N 0.000 description 2
- 229950000772 canfosfamide Drugs 0.000 description 2
- 229960002115 carboquone Drugs 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- 150000001735 carboxylic acids Chemical class 0.000 description 2
- 108010021331 carfilzomib Proteins 0.000 description 2
- 229960005243 carmustine Drugs 0.000 description 2
- 229960002412 cediranib Drugs 0.000 description 2
- RZEKVGVHFLEQIL-UHFFFAOYSA-N celecoxib Chemical compound C1=CC(C)=CC=C1C1=CC(C(F)(F)F)=NN1C1=CC=C(S(N)(=O)=O)C=C1 RZEKVGVHFLEQIL-UHFFFAOYSA-N 0.000 description 2
- 230000030833 cell death Effects 0.000 description 2
- VERWOWGGCGHDQE-UHFFFAOYSA-N ceritinib Chemical compound CC=1C=C(NC=2N=C(NC=3C(=CC=CC=3)S(=O)(=O)C(C)C)C(Cl)=CN=2)C(OC(C)C)=CC=1C1CCNCC1 VERWOWGGCGHDQE-UHFFFAOYSA-N 0.000 description 2
- 201000010881 cervical cancer Diseases 0.000 description 2
- 229960003230 cetrorelix Drugs 0.000 description 2
- 238000002512 chemotherapy Methods 0.000 description 2
- 235000013330 chicken meat Nutrition 0.000 description 2
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 2
- 229960004630 chlorambucil Drugs 0.000 description 2
- 230000007012 clinical effect Effects 0.000 description 2
- 229960000928 clofarabine Drugs 0.000 description 2
- WDDPHFBMKLOVOX-AYQXTPAHSA-N clofarabine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@@H]1F WDDPHFBMKLOVOX-AYQXTPAHSA-N 0.000 description 2
- 229960001338 colchicine Drugs 0.000 description 2
- 238000004440 column chromatography Methods 0.000 description 2
- 230000001268 conjugating effect Effects 0.000 description 2
- 229960005061 crizotinib Drugs 0.000 description 2
- 239000003255 cyclooxygenase 2 inhibitor Substances 0.000 description 2
- GLNWREBYRLDPQP-MHZLTWQESA-N cyclopentyl (2s)-2-[[4-[[8-(hydroxyamino)-8-oxooctanoyl]amino]phenyl]methylamino]-2-phenylacetate Chemical compound C1=CC(NC(=O)CCCCCCC(=O)NO)=CC=C1CN[C@@H](C=1C=CC=CC=1)C(=O)OC1CCCC1 GLNWREBYRLDPQP-MHZLTWQESA-N 0.000 description 2
- 229960004397 cyclophosphamide Drugs 0.000 description 2
- 230000001461 cytolytic effect Effects 0.000 description 2
- 239000002619 cytotoxin Substances 0.000 description 2
- 229950006418 dactolisib Drugs 0.000 description 2
- JOGKUKXHTYWRGZ-UHFFFAOYSA-N dactolisib Chemical compound O=C1N(C)C2=CN=C3C=CC(C=4C=C5C=CC=CC5=NC=4)=CC3=C2N1C1=CC=C(C(C)(C)C#N)C=C1 JOGKUKXHTYWRGZ-UHFFFAOYSA-N 0.000 description 2
- 230000002354 daily effect Effects 0.000 description 2
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 2
- 229960000975 daunorubicin Drugs 0.000 description 2
- 229960002272 degarelix Drugs 0.000 description 2
- MEUCPCLKGZSHTA-XYAYPHGZSA-N degarelix Chemical compound C([C@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCNC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@H](C)C(N)=O)NC(=O)[C@H](CC=1C=CC(NC(=O)[C@H]2NC(=O)NC(=O)C2)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](CC=1C=NC=CC=1)NC(=O)[C@@H](CC=1C=CC(Cl)=CC=1)NC(=O)[C@@H](CC=1C=C2C=CC=CC2=CC=1)NC(C)=O)C1=CC=C(NC(N)=O)C=C1 MEUCPCLKGZSHTA-XYAYPHGZSA-N 0.000 description 2
- 238000012217 deletion Methods 0.000 description 2
- 230000037430 deletion Effects 0.000 description 2
- 238000004925 denaturation Methods 0.000 description 2
- 230000036425 denaturation Effects 0.000 description 2
- WAZQAZKAZLXFMK-UHFFFAOYSA-N deracoxib Chemical compound C1=C(F)C(OC)=CC=C1C1=CC(C(F)F)=NN1C1=CC=C(S(N)(=O)=O)C=C1 WAZQAZKAZLXFMK-UHFFFAOYSA-N 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 108700025485 deslorelin Proteins 0.000 description 2
- 229960005408 deslorelin Drugs 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 239000003599 detergent Substances 0.000 description 2
- 229960000605 dexrazoxane Drugs 0.000 description 2
- NIJJYAXOARWZEE-UHFFFAOYSA-N di-n-propyl-acetic acid Natural products CCCC(C(O)=O)CCC NIJJYAXOARWZEE-UHFFFAOYSA-N 0.000 description 2
- 238000002405 diagnostic procedure Methods 0.000 description 2
- DCOPUUMXTXDBNB-UHFFFAOYSA-N diclofenac Chemical compound OC(=O)CC1=CC=CC=C1NC1=C(Cl)C=CC=C1Cl DCOPUUMXTXDBNB-UHFFFAOYSA-N 0.000 description 2
- 238000009792 diffusion process Methods 0.000 description 2
- HUPFGZXOMWLGNK-UHFFFAOYSA-N diflunisal Chemical compound C1=C(O)C(C(=O)O)=CC(C=2C(=CC(F)=CC=2)F)=C1 HUPFGZXOMWLGNK-UHFFFAOYSA-N 0.000 description 2
- 230000008034 disappearance Effects 0.000 description 2
- DCSRPHQBFSYJNN-UHFFFAOYSA-L disodium 4-[(2-arsonophenyl)diazenyl]-3-hydroxynaphthalene-2,7-disulfonate Chemical compound [Na+].[Na+].Oc1c(N=Nc2ccccc2[As](O)(O)=O)c2ccc(cc2cc1S([O-])(=O)=O)S([O-])(=O)=O DCSRPHQBFSYJNN-UHFFFAOYSA-L 0.000 description 2
- MSJMDZAOKORVFC-SEPHDYHBSA-L disodium fumarate Chemical compound [Na+].[Na+].[O-]C(=O)\C=C\C([O-])=O MSJMDZAOKORVFC-SEPHDYHBSA-L 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 239000003534 dna topoisomerase inhibitor Substances 0.000 description 2
- HKXBNHCUPKIYDM-CGMHZMFXSA-N doxercalciferol Chemical compound C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)/C=C/[C@H](C)C(C)C)=C\C=C1\C[C@@H](O)C[C@H](O)C1=C HKXBNHCUPKIYDM-CGMHZMFXSA-N 0.000 description 2
- ZWAOHEXOSAUJHY-ZIYNGMLESA-N doxifluridine Chemical compound O[C@@H]1[C@H](O)[C@@H](C)O[C@H]1N1C(=O)NC(=O)C(F)=C1 ZWAOHEXOSAUJHY-ZIYNGMLESA-N 0.000 description 2
- 229950005454 doxifluridine Drugs 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 238000012377 drug delivery Methods 0.000 description 2
- 230000009977 dual effect Effects 0.000 description 2
- 229950009791 durvalumab Drugs 0.000 description 2
- BNFRJXLZYUTIII-UHFFFAOYSA-N efaproxiral Chemical compound CC1=CC(C)=CC(NC(=O)CC=2C=CC(OC(C)(C)C(O)=O)=CC=2)=C1 BNFRJXLZYUTIII-UHFFFAOYSA-N 0.000 description 2
- CTSPAMFJBXKSOY-UHFFFAOYSA-N ellipticine Chemical compound N1=CC=C2C(C)=C(NC=3C4=CC=CC=3)C4=C(C)C2=C1 CTSPAMFJBXKSOY-UHFFFAOYSA-N 0.000 description 2
- INVTYAOGFAGBOE-UHFFFAOYSA-N entinostat Chemical compound NC1=CC=CC=C1NC(=O)C(C=C1)=CC=C1CNC(=O)OCC1=CC=CN=C1 INVTYAOGFAGBOE-UHFFFAOYSA-N 0.000 description 2
- WXCXUHSOUPDCQV-UHFFFAOYSA-N enzalutamide Chemical compound C1=C(F)C(C(=O)NC)=CC=C1N1C(C)(C)C(=O)N(C=2C=C(C(C#N)=CC=2)C(F)(F)F)C1=S WXCXUHSOUPDCQV-UHFFFAOYSA-N 0.000 description 2
- 229960001904 epirubicin Drugs 0.000 description 2
- HESCAJZNRMSMJG-HGYUPSKWSA-N epothilone A Natural products O=C1[C@H](C)[C@H](O)[C@H](C)CCC[C@H]2O[C@H]2C[C@@H](/C(=C\c2nc(C)sc2)/C)OC(=O)C[C@H](O)C1(C)C HESCAJZNRMSMJG-HGYUPSKWSA-N 0.000 description 2
- XOZIUKBZLSUILX-GIQCAXHBSA-N epothilone D Chemical compound O1C(=O)C[C@H](O)C(C)(C)C(=O)[C@H](C)[C@@H](O)[C@@H](C)CCC\C(C)=C/C[C@H]1C(\C)=C\C1=CSC(C)=N1 XOZIUKBZLSUILX-GIQCAXHBSA-N 0.000 description 2
- 229940082789 erbitux Drugs 0.000 description 2
- 201000004101 esophageal cancer Diseases 0.000 description 2
- NNYBQONXHNTVIJ-UHFFFAOYSA-N etodolac Chemical compound C1COC(CC)(CC(O)=O)C2=C1C(C=CC=C1CC)=C1N2 NNYBQONXHNTVIJ-UHFFFAOYSA-N 0.000 description 2
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 229960005167 everolimus Drugs 0.000 description 2
- ZVYVPGLRVWUPMP-FYSMJZIKSA-N exatecan Chemical compound C1C[C@H](N)C2=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC3=CC(F)=C(C)C1=C32 ZVYVPGLRVWUPMP-FYSMJZIKSA-N 0.000 description 2
- 229950009429 exatecan Drugs 0.000 description 2
- 229960000255 exemestane Drugs 0.000 description 2
- 229950000484 exisulind Drugs 0.000 description 2
- 229950011548 fadrozole Drugs 0.000 description 2
- 229950000133 filanesib Drugs 0.000 description 2
- LLXISKGBWFTGEI-FQEVSTJZSA-N filanesib Chemical compound C1([C@]2(CCCN)SC(=NN2C(=O)N(C)OC)C=2C(=CC=C(F)C=2)F)=CC=CC=C1 LLXISKGBWFTGEI-FQEVSTJZSA-N 0.000 description 2
- 229960004039 finasteride Drugs 0.000 description 2
- ODKNJVUHOIMIIZ-RRKCRQDMSA-N floxuridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(F)=C1 ODKNJVUHOIMIIZ-RRKCRQDMSA-N 0.000 description 2
- 229960000390 fludarabine Drugs 0.000 description 2
- 238000002875 fluorescence polarization Methods 0.000 description 2
- 229960002074 flutamide Drugs 0.000 description 2
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 2
- YAKWPXVTIGTRJH-UHFFFAOYSA-N fotemustine Chemical compound CCOP(=O)(OCC)C(C)NC(=O)N(CCCl)N=O YAKWPXVTIGTRJH-UHFFFAOYSA-N 0.000 description 2
- 229960004783 fotemustine Drugs 0.000 description 2
- 229960002258 fulvestrant Drugs 0.000 description 2
- 239000001530 fumaric acid Substances 0.000 description 2
- 208000010749 gastric carcinoma Diseases 0.000 description 2
- 229960003297 gemtuzumab ozogamicin Drugs 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 229940080856 gleevec Drugs 0.000 description 2
- 239000003862 glucocorticoid Substances 0.000 description 2
- XLXSAKCOAKORKW-UHFFFAOYSA-N gonadorelin Chemical compound C1CCC(C(=O)NCC(N)=O)N1C(=O)C(CCCN=C(N)N)NC(=O)C(CC(C)C)NC(=O)CNC(=O)C(NC(=O)C(CO)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C(CC=1NC=NC=1)NC(=O)C1NC(=O)CC1)CC1=CC=C(O)C=C1 XLXSAKCOAKORKW-UHFFFAOYSA-N 0.000 description 2
- XLXSAKCOAKORKW-AQJXLSMYSA-N gonadorelin Chemical compound C([C@@H](C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 XLXSAKCOAKORKW-AQJXLSMYSA-N 0.000 description 2
- 229960002913 goserelin Drugs 0.000 description 2
- QBKSWRVVCFFDOT-UHFFFAOYSA-N gossypol Chemical compound CC(C)C1=C(O)C(O)=C(C=O)C2=C(O)C(C=3C(O)=C4C(C=O)=C(O)C(O)=C(C4=CC=3C)C(C)C)=C(C)C=C21 QBKSWRVVCFFDOT-UHFFFAOYSA-N 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 229940093915 gynecological organic acid Drugs 0.000 description 2
- 201000010536 head and neck cancer Diseases 0.000 description 2
- 208000014829 head and neck neoplasm Diseases 0.000 description 2
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 2
- PPZMYIBUHIPZOS-UHFFFAOYSA-N histamine dihydrochloride Chemical compound Cl.Cl.NCCC1=CN=CN1 PPZMYIBUHIPZOS-UHFFFAOYSA-N 0.000 description 2
- 108700020746 histrelin Proteins 0.000 description 2
- 229960002193 histrelin Drugs 0.000 description 2
- 229940124866 human papillomavirus vaccine Drugs 0.000 description 2
- 150000002431 hydrogen Chemical class 0.000 description 2
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 2
- 238000004191 hydrophobic interaction chromatography Methods 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 229960001330 hydroxycarbamide Drugs 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 239000012274 immune-checkpoint protein inhibitor Substances 0.000 description 2
- 239000000367 immunologic factor Substances 0.000 description 2
- 239000002955 immunomodulating agent Substances 0.000 description 2
- DBIGHPPNXATHOF-UHFFFAOYSA-N improsulfan Chemical compound CS(=O)(=O)OCCCNCCCOS(C)(=O)=O DBIGHPPNXATHOF-UHFFFAOYSA-N 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 230000005917 in vivo anti-tumor Effects 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 150000007529 inorganic bases Chemical class 0.000 description 2
- 229960000367 inositol Drugs 0.000 description 2
- CDAISMWEOUEBRE-GPIVLXJGSA-N inositol Chemical compound O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](O)[C@@H]1O CDAISMWEOUEBRE-GPIVLXJGSA-N 0.000 description 2
- 239000012444 intercalating antibiotic Substances 0.000 description 2
- 229940079322 interferon Drugs 0.000 description 2
- 108010042414 interferon gamma-1b Proteins 0.000 description 2
- 229940047124 interferons Drugs 0.000 description 2
- DKYWVDODHFEZIM-UHFFFAOYSA-N ketoprofen Chemical compound OC(=O)C(C)C1=CC=CC(C(=O)C=2C=CC=CC=2)=C1 DKYWVDODHFEZIM-UHFFFAOYSA-N 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 108010021336 lanreotide Proteins 0.000 description 2
- 201000003445 large cell neuroendocrine carcinoma Diseases 0.000 description 2
- DXOJIXGRFSHVKA-BZVZGCBYSA-N larotaxel Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@@]23[C@H]1[C@@]1(CO[C@@H]1C[C@@H]2C3)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 DXOJIXGRFSHVKA-BZVZGCBYSA-N 0.000 description 2
- 229960002367 lasofoxifene Drugs 0.000 description 2
- GXESHMAMLJKROZ-IAPPQJPRSA-N lasofoxifene Chemical compound C1([C@@H]2[C@@H](C3=CC=C(C=C3CC2)O)C=2C=CC(OCCN3CCCC3)=CC=2)=CC=CC=C1 GXESHMAMLJKROZ-IAPPQJPRSA-N 0.000 description 2
- 229940115286 lentinan Drugs 0.000 description 2
- 229960003881 letrozole Drugs 0.000 description 2
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 description 2
- 229960004338 leuprorelin Drugs 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- MPVGZUGXCQEXTM-UHFFFAOYSA-N linifanib Chemical compound CC1=CC=C(F)C(NC(=O)NC=2C=CC(=CC=2)C=2C=3C(N)=NNC=3C=CC=2)=C1 MPVGZUGXCQEXTM-UHFFFAOYSA-N 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 239000012669 liquid formulation Substances 0.000 description 2
- 229960002247 lomustine Drugs 0.000 description 2
- KHPKQFYUPIUARC-UHFFFAOYSA-N lumiracoxib Chemical compound OC(=O)CC1=CC(C)=CC=C1NC1=C(F)C=CC=C1Cl KHPKQFYUPIUARC-UHFFFAOYSA-N 0.000 description 2
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 2
- 238000007726 management method Methods 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 229950002736 marizomib Drugs 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 229960001428 mercaptopurine Drugs 0.000 description 2
- ANZJBCHSOXCCRQ-FKUXLPTCSA-N mertansine Chemical compound CO[C@@H]([C@@]1(O)C[C@H](OC(=O)N1)[C@@H](C)[C@@H]1O[C@@]1(C)[C@@H](OC(=O)[C@H](C)N(C)C(=O)CCS)CC(=O)N1C)\C=C\C=C(C)\CC2=CC(OC)=C(Cl)C1=C2 ANZJBCHSOXCCRQ-FKUXLPTCSA-N 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 2
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 2
- 229960002216 methylparaben Drugs 0.000 description 2
- 238000002493 microarray Methods 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- 229960005225 mifamurtide Drugs 0.000 description 2
- JMUHBNWAORSSBD-WKYWBUFDSA-N mifamurtide Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@@H](OC(=O)CCCCCCCCCCCCCCC)COP(O)(=O)OCCNC(=O)[C@H](C)NC(=O)CC[C@H](C(N)=O)NC(=O)[C@H](C)NC(=O)[C@@H](C)O[C@H]1[C@H](O)[C@@H](CO)OC(O)[C@@H]1NC(C)=O JMUHBNWAORSSBD-WKYWBUFDSA-N 0.000 description 2
- 229960005485 mitobronitol Drugs 0.000 description 2
- 229960001156 mitoxantrone Drugs 0.000 description 2
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 2
- QXYYYPFGTSJXNS-UHFFFAOYSA-N mitozolomide Chemical compound N1=NN(CCCl)C(=O)N2C1=C(C(=O)N)N=C2 QXYYYPFGTSJXNS-UHFFFAOYSA-N 0.000 description 2
- VOWOEBADKMXUBU-UHFFFAOYSA-J molecular oxygen;tetrachlorite;hydrate Chemical compound O.O=O.[O-]Cl=O.[O-]Cl=O.[O-]Cl=O.[O-]Cl=O VOWOEBADKMXUBU-UHFFFAOYSA-J 0.000 description 2
- HWPKGOGLCKPRLZ-UHFFFAOYSA-M monosodium citrate Chemical compound [Na+].OC(=O)CC(O)(C([O-])=O)CC(O)=O HWPKGOGLCKPRLZ-UHFFFAOYSA-M 0.000 description 2
- 239000002524 monosodium citrate Substances 0.000 description 2
- 235000018342 monosodium citrate Nutrition 0.000 description 2
- PJUIMOJAAPLTRJ-UHFFFAOYSA-N monothioglycerol Chemical compound OCC(O)CS PJUIMOJAAPLTRJ-UHFFFAOYSA-N 0.000 description 2
- ISGGVCWFTPTHIX-UHFFFAOYSA-N n'-(2-hydroxy-3-piperidin-1-ylpropoxy)pyridine-3-carboximidamide;dihydrochloride Chemical compound Cl.Cl.C1CCCCN1CC(O)CONC(=N)C1=CC=CN=C1 ISGGVCWFTPTHIX-UHFFFAOYSA-N 0.000 description 2
- SMFXSYMLJDHGIE-UHFFFAOYSA-N n-(3-aminopropyl)-n-[1-(5-benzyl-3-methyl-4-oxo-[1,2]thiazolo[5,4-d]pyrimidin-6-yl)-2-methylpropyl]-4-methylbenzamide Chemical compound N=1C=2SN=C(C)C=2C(=O)N(CC=2C=CC=CC=2)C=1C(C(C)C)N(CCCN)C(=O)C1=CC=C(C)C=C1 SMFXSYMLJDHGIE-UHFFFAOYSA-N 0.000 description 2
- 229960002009 naproxen Drugs 0.000 description 2
- 229950007221 nedaplatin Drugs 0.000 description 2
- QZGIWPZCWHMVQL-UIYAJPBUSA-N neocarzinostatin chromophore Chemical compound O1[C@H](C)[C@H](O)[C@H](O)[C@@H](NC)[C@H]1O[C@@H]1C/2=C/C#C[C@H]3O[C@@]3([C@@H]3OC(=O)OC3)C#CC\2=C[C@H]1OC(=O)C1=C(O)C=CC2=C(C)C=C(OC)C=C12 QZGIWPZCWHMVQL-UIYAJPBUSA-N 0.000 description 2
- 229960002653 nilutamide Drugs 0.000 description 2
- VFEDRRNHLBGPNN-UHFFFAOYSA-N nimustine Chemical compound CC1=NC=C(CNC(=O)N(CCCl)N=O)C(N)=N1 VFEDRRNHLBGPNN-UHFFFAOYSA-N 0.000 description 2
- 229960000572 olaparib Drugs 0.000 description 2
- 235000005985 organic acids Nutrition 0.000 description 2
- 229960003104 ornithine Drugs 0.000 description 2
- 229960001756 oxaliplatin Drugs 0.000 description 2
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 2
- OFPXSFXSNFPTHF-UHFFFAOYSA-N oxaprozin Chemical compound O1C(CCC(=O)O)=NC(C=2C=CC=CC=2)=C1C1=CC=CC=C1 OFPXSFXSNFPTHF-UHFFFAOYSA-N 0.000 description 2
- 125000003854 p-chlorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Cl 0.000 description 2
- WRUUGTRCQOWXEG-UHFFFAOYSA-N pamidronate Chemical compound NCCC(O)(P(O)(O)=O)P(O)(O)=O WRUUGTRCQOWXEG-UHFFFAOYSA-N 0.000 description 2
- UOZODPSAJZTQNH-LSWIJEOBSA-N paromomycin Chemical compound N[C@@H]1[C@@H](O)[C@H](O)[C@H](CN)O[C@@H]1O[C@H]1[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](N)C[C@@H](N)[C@@H]2O)O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)N)O[C@@H]1CO UOZODPSAJZTQNH-LSWIJEOBSA-N 0.000 description 2
- 229960001914 paromomycin Drugs 0.000 description 2
- 229960000639 pazopanib Drugs 0.000 description 2
- AQIXEPGDORPWBJ-UHFFFAOYSA-N pentan-3-ol Chemical compound CCC(O)CC AQIXEPGDORPWBJ-UHFFFAOYSA-N 0.000 description 2
- 229960002340 pentostatin Drugs 0.000 description 2
- 238000003359 percent control normalization Methods 0.000 description 2
- 239000012466 permeate Substances 0.000 description 2
- 238000002823 phage display Methods 0.000 description 2
- ZJAOAACCNHFJAH-UHFFFAOYSA-N phosphonoformic acid Chemical compound OC(=O)P(O)(O)=O ZJAOAACCNHFJAH-UHFFFAOYSA-N 0.000 description 2
- IIMIOEBMYPRQGU-UHFFFAOYSA-L picoplatin Chemical compound N.[Cl-].[Cl-].[Pt+2].CC1=CC=CC=N1 IIMIOEBMYPRQGU-UHFFFAOYSA-L 0.000 description 2
- LHNIIDJUOCFXAP-UHFFFAOYSA-N pictrelisib Chemical compound C1CN(S(=O)(=O)C)CCN1CC1=CC2=NC(C=3C=4C=NNC=4C=CC=3)=NC(N3CCOCC3)=C2S1 LHNIIDJUOCFXAP-UHFFFAOYSA-N 0.000 description 2
- 125000004194 piperazin-1-yl group Chemical group [H]N1C([H])([H])C([H])([H])N(*)C([H])([H])C1([H])[H] 0.000 description 2
- NJBFOOCLYDNZJN-UHFFFAOYSA-N pipobroman Chemical compound BrCCC(=O)N1CCN(C(=O)CCBr)CC1 NJBFOOCLYDNZJN-UHFFFAOYSA-N 0.000 description 2
- QYSPLQLAKJAUJT-UHFFFAOYSA-N piroxicam Chemical compound OC=1C2=CC=CC=C2S(=O)(=O)N(C)C=1C(=O)NC1=CC=CC=N1 QYSPLQLAKJAUJT-UHFFFAOYSA-N 0.000 description 2
- 229920001983 poloxamer Polymers 0.000 description 2
- 229920001515 polyalkylene glycol Polymers 0.000 description 2
- PHXJVRSECIGDHY-UHFFFAOYSA-N ponatinib Chemical compound C1CN(C)CCN1CC(C(=C1)C(F)(F)F)=CC=C1NC(=O)C1=CC=C(C)C(C#CC=2N3N=CC=CC3=NC=2)=C1 PHXJVRSECIGDHY-UHFFFAOYSA-N 0.000 description 2
- 229940002612 prodrug Drugs 0.000 description 2
- 239000000651 prodrug Substances 0.000 description 2
- NLNGWFLRRRYNIL-PLNGDYQASA-N propan-2-yl (z)-3-[3-[3-methoxy-5-(trifluoromethyl)phenyl]-1,2,4-triazol-1-yl]prop-2-enoate Chemical compound FC(F)(F)C1=CC(OC)=CC(C2=NN(\C=C/C(=O)OC(C)C)C=N2)=C1 NLNGWFLRRRYNIL-PLNGDYQASA-N 0.000 description 2
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 2
- 238000001742 protein purification Methods 0.000 description 2
- 150000003212 purines Chemical class 0.000 description 2
- 150000003230 pyrimidines Chemical class 0.000 description 2
- 229950004043 radotinib Drugs 0.000 description 2
- DUPWHXBITIZIKZ-UHFFFAOYSA-N radotinib Chemical compound C1=NC(C)=CN1C1=CC(NC(=O)C=2C=C(NC=3N=C(C=CN=3)C=3N=CC=NC=3)C(C)=CC=2)=CC(C(F)(F)F)=C1 DUPWHXBITIZIKZ-UHFFFAOYSA-N 0.000 description 2
- 229960004622 raloxifene Drugs 0.000 description 2
- 229960002185 ranimustine Drugs 0.000 description 2
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 2
- FNHKPVJBJVTLMP-UHFFFAOYSA-N regorafenib Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=C(F)C(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 FNHKPVJBJVTLMP-UHFFFAOYSA-N 0.000 description 2
- 229960000329 ribavirin Drugs 0.000 description 2
- HZCAHMRRMINHDJ-DBRKOABJSA-N ribavirin Natural products O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1N=CN=C1 HZCAHMRRMINHDJ-DBRKOABJSA-N 0.000 description 2
- 125000002652 ribonucleotide group Chemical group 0.000 description 2
- 108091092562 ribozyme Proteins 0.000 description 2
- 229960004641 rituximab Drugs 0.000 description 2
- RZJQGNCSTQAWON-UHFFFAOYSA-N rofecoxib Chemical compound C1=CC(S(=O)(=O)C)=CC=C1C1=C(C=2C=CC=CC=2)C(=O)OC1 RZJQGNCSTQAWON-UHFFFAOYSA-N 0.000 description 2
- OHRURASPPZQGQM-GCCNXGTGSA-N romidepsin Chemical compound O1C(=O)[C@H](C(C)C)NC(=O)C(=C/C)/NC(=O)[C@H]2CSSCC\C=C\[C@@H]1CC(=O)N[C@H](C(C)C)C(=O)N2 OHRURASPPZQGQM-GCCNXGTGSA-N 0.000 description 2
- NGWSFRIPKNWYAO-SHTIJGAHSA-N salinosporamide A Chemical compound C([C@@H]1[C@H](O)[C@]23C(=O)O[C@]2([C@H](C(=O)N3)CCCl)C)CCC=C1 NGWSFRIPKNWYAO-SHTIJGAHSA-N 0.000 description 2
- WVYADZUPLLSGPU-UHFFFAOYSA-N salsalate Chemical compound OC(=O)C1=CC=CC=C1OC(=O)C1=CC=CC=C1O WVYADZUPLLSGPU-UHFFFAOYSA-N 0.000 description 2
- 229960005399 satraplatin Drugs 0.000 description 2
- 190014017285 satraplatin Chemical compound 0.000 description 2
- CDAISMWEOUEBRE-UHFFFAOYSA-N scyllo-inosotol Natural products OC1C(O)C(O)C(O)C(O)C1O CDAISMWEOUEBRE-UHFFFAOYSA-N 0.000 description 2
- CYOHGALHFOKKQC-UHFFFAOYSA-N selumetinib Chemical compound OCCONC(=O)C=1C=C2N(C)C=NC2=C(F)C=1NC1=CC=C(Br)C=C1Cl CYOHGALHFOKKQC-UHFFFAOYSA-N 0.000 description 2
- 230000011664 signaling Effects 0.000 description 2
- 229960002930 sirolimus Drugs 0.000 description 2
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 235000019294 sodium fumarate Nutrition 0.000 description 2
- 239000007790 solid phase Substances 0.000 description 2
- 239000000600 sorbitol Substances 0.000 description 2
- 235000010356 sorbitol Nutrition 0.000 description 2
- 238000012409 standard PCR amplification Methods 0.000 description 2
- 238000011301 standard therapy Methods 0.000 description 2
- 239000008227 sterile water for injection Substances 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 229960001052 streptozocin Drugs 0.000 description 2
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 2
- SUVMJBTUFCVSAD-UHFFFAOYSA-N sulforaphane Chemical compound CS(=O)CCCCN=C=S SUVMJBTUFCVSAD-UHFFFAOYSA-N 0.000 description 2
- 229960000894 sulindac Drugs 0.000 description 2
- MLKXDPUZXIRXEP-MFOYZWKCSA-N sulindac Chemical compound CC1=C(CC(O)=O)C2=CC(F)=CC=C2\C1=C/C1=CC=C(S(C)=O)C=C1 MLKXDPUZXIRXEP-MFOYZWKCSA-N 0.000 description 2
- MVGSNCBCUWPVDA-MFOYZWKCSA-N sulindac sulfone Chemical compound CC1=C(CC(O)=O)C2=CC(F)=CC=C2\C1=C/C1=CC=C(S(C)(=O)=O)C=C1 MVGSNCBCUWPVDA-MFOYZWKCSA-N 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 229940037128 systemic glucocorticoids Drugs 0.000 description 2
- 229960003454 tamoxifen citrate Drugs 0.000 description 2
- 229940099419 targretin Drugs 0.000 description 2
- 239000011975 tartaric acid Substances 0.000 description 2
- 229940069905 tasigna Drugs 0.000 description 2
- QFJCIRLUMZQUOT-UHFFFAOYSA-N temsirolimus Natural products C1CC(O)C(OC)CC1CC(C)C1OC(=O)C2CCCCN2C(=O)C(=O)C(O)(O2)C(C)CCC2CC(OC)C(C)=CC=CC=CC(C)CC(C)C(=O)C(OC)C(O)C(C)=CC(C)C(=O)C1 QFJCIRLUMZQUOT-UHFFFAOYSA-N 0.000 description 2
- 229960002180 tetracycline Drugs 0.000 description 2
- 229930101283 tetracycline Natural products 0.000 description 2
- 235000019364 tetracycline Nutrition 0.000 description 2
- 150000003522 tetracyclines Chemical class 0.000 description 2
- 229960001196 thiotepa Drugs 0.000 description 2
- NZVYCXVTEHPMHE-ZSUJOUNUSA-N thymalfasin Chemical compound CC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O NZVYCXVTEHPMHE-ZSUJOUNUSA-N 0.000 description 2
- 229960004231 thymalfasin Drugs 0.000 description 2
- 229960004089 tigecycline Drugs 0.000 description 2
- FPZLLRFZJZRHSY-HJYUBDRYSA-N tigecycline Chemical class C([C@H]1C2)C3=C(N(C)C)C=C(NC(=O)CNC(C)(C)C)C(O)=C3C(=O)C1=C(O)[C@@]1(O)[C@@H]2[C@H](N(C)C)C(O)=C(C(N)=O)C1=O FPZLLRFZJZRHSY-HJYUBDRYSA-N 0.000 description 2
- 229960003087 tioguanine Drugs 0.000 description 2
- UPSPUYADGBWSHF-UHFFFAOYSA-N tolmetin Chemical compound C1=CC(C)=CC=C1C(=O)C1=CC=C(CC(O)=O)N1C UPSPUYADGBWSHF-UHFFFAOYSA-N 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 229940044693 topoisomerase inhibitor Drugs 0.000 description 2
- 229960005026 toremifene Drugs 0.000 description 2
- XFCLJVABOIYOMF-QPLCGJKRSA-N toremifene Chemical compound C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 XFCLJVABOIYOMF-QPLCGJKRSA-N 0.000 description 2
- 229960005267 tositumomab Drugs 0.000 description 2
- 238000013518 transcription Methods 0.000 description 2
- 230000035897 transcription Effects 0.000 description 2
- 230000002103 transcriptional effect Effects 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- 229960001727 tretinoin Drugs 0.000 description 2
- 229950010147 troxacitabine Drugs 0.000 description 2
- RXRGZNYSEHTMHC-BQBZGAKWSA-N troxacitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1O[C@@H](CO)OC1 RXRGZNYSEHTMHC-BQBZGAKWSA-N 0.000 description 2
- 229940094060 tykerb Drugs 0.000 description 2
- 229950009811 ubenimex Drugs 0.000 description 2
- 241000701161 unidentified adenovirus Species 0.000 description 2
- LNPDTQAFDNKSHK-UHFFFAOYSA-N valdecoxib Chemical compound CC=1ON=C(C=2C=CC=CC=2)C=1C1=CC=C(S(N)(=O)=O)C=C1 LNPDTQAFDNKSHK-UHFFFAOYSA-N 0.000 description 2
- MSRILKIQRXUYCT-UHFFFAOYSA-M valproate semisodium Chemical compound [Na+].CCCC(C(O)=O)CCC.CCCC(C([O-])=O)CCC MSRILKIQRXUYCT-UHFFFAOYSA-M 0.000 description 2
- 229960000604 valproic acid Drugs 0.000 description 2
- ZOCKGBMQLCSHFP-KQRAQHLDSA-N valrubicin Chemical compound O([C@H]1C[C@](CC2=C(O)C=3C(=O)C4=CC=CC(OC)=C4C(=O)C=3C(O)=C21)(O)C(=O)COC(=O)CCCC)[C@H]1C[C@H](NC(=O)C(F)(F)F)[C@H](O)[C@H](C)O1 ZOCKGBMQLCSHFP-KQRAQHLDSA-N 0.000 description 2
- 229960003862 vemurafenib Drugs 0.000 description 2
- GPXBXXGIAQBQNI-UHFFFAOYSA-N vemurafenib Chemical compound CCCS(=O)(=O)NC1=CC=C(F)C(C(=O)C=2C3=CC(=CN=C3NC=2)C=2C=CC(Cl)=CC=2)=C1F GPXBXXGIAQBQNI-UHFFFAOYSA-N 0.000 description 2
- LQBVNQSMGBZMKD-UHFFFAOYSA-N venetoclax Chemical compound C=1C=C(Cl)C=CC=1C=1CC(C)(C)CCC=1CN(CC1)CCN1C(C=C1OC=2C=C3C=CNC3=NC=2)=CC=C1C(=O)NS(=O)(=O)C(C=C1[N+]([O-])=O)=CC=C1NCC1CCOCC1 LQBVNQSMGBZMKD-UHFFFAOYSA-N 0.000 description 2
- 229960001183 venetoclax Drugs 0.000 description 2
- 229960004528 vincristine Drugs 0.000 description 2
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 2
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 2
- 230000002618 waking effect Effects 0.000 description 2
- 229940049068 xalkori Drugs 0.000 description 2
- 239000000811 xylitol Substances 0.000 description 2
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 2
- 235000010447 xylitol Nutrition 0.000 description 2
- 229960002675 xylitol Drugs 0.000 description 2
- 229940055760 yervoy Drugs 0.000 description 2
- 229950009268 zinostatin Drugs 0.000 description 2
- XRASPMIURGNCCH-UHFFFAOYSA-N zoledronic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CN1C=CN=C1 XRASPMIURGNCCH-UHFFFAOYSA-N 0.000 description 2
- FBTUMDXHSRTGRV-ALTNURHMSA-N zorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(\C)=N\NC(=O)C=1C=CC=CC=1)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 FBTUMDXHSRTGRV-ALTNURHMSA-N 0.000 description 2
- 229960000641 zorubicin Drugs 0.000 description 2
- AADVCYNFEREWOS-UHFFFAOYSA-N (+)-DDM Natural products C=CC=CC(C)C(OC(N)=O)C(C)C(O)C(C)CC(C)=CC(C)C(O)C(C)C=CC(O)CC1OC(=O)C(C)C(O)C1C AADVCYNFEREWOS-UHFFFAOYSA-N 0.000 description 1
- WVTKBKWTSCPRNU-KYJUHHDHSA-N (+)-Tetrandrine Chemical compound C([C@H]1C=2C=C(C(=CC=2CCN1C)OC)O1)C(C=C2)=CC=C2OC(=C2)C(OC)=CC=C2C[C@@H]2N(C)CCC3=CC(OC)=C(OC)C1=C23 WVTKBKWTSCPRNU-KYJUHHDHSA-N 0.000 description 1
- AYIRNRDRBQJXIF-NXEZZACHSA-N (-)-Florfenicol Chemical compound CS(=O)(=O)C1=CC=C([C@@H](O)[C@@H](CF)NC(=O)C(Cl)Cl)C=C1 AYIRNRDRBQJXIF-NXEZZACHSA-N 0.000 description 1
- NNJPGOLRFBJNIW-HNNXBMFYSA-N (-)-demecolcine Chemical compound C1=C(OC)C(=O)C=C2[C@@H](NC)CCC3=CC(OC)=C(OC)C(OC)=C3C2=C1 NNJPGOLRFBJNIW-HNNXBMFYSA-N 0.000 description 1
- DOKWDOLZCMETIJ-ZAQUEYBZSA-N (12as)-9-[[3-[[(12as)-8-methoxy-6-oxo-11,12,12a,13-tetrahydroindolo[2,1-c][1,4]benzodiazepin-9-yl]oxymethyl]-5-[2-[2-(2-methoxyethoxy)ethoxy]ethyl-(2-methyl-2-sulfanylpropyl)amino]phenyl]methoxy]-8-methoxy-12a,13-dihydroindolo[2,1-c][1,4]benzodiazepin-6-o Chemical compound N1=C[C@@H]2CC3=CC=CC=C3N2C(=O)C(C=C2OC)=C1C=C2OCC1=CC(N(CC(C)(C)S)CCOCCOCCOC)=CC(COC=2C(=CC=3C(=O)N4C5=CC=CC=C5C[C@H]4CNC=3C=2)OC)=C1 DOKWDOLZCMETIJ-ZAQUEYBZSA-N 0.000 description 1
- IXXFZUPTQVDPPK-ZAWHAJPISA-N (1r,2r,4r,6r,7r,8r,10s,13r,14s)-17-[4-[4-(3-aminophenyl)triazol-1-yl]butyl]-7-[(2s,3r,4s,6r)-4-(dimethylamino)-3-hydroxy-6-methyloxan-2-yl]oxy-13-ethyl-10-fluoro-6-methoxy-2,4,6,8,10,14-hexamethyl-12,15-dioxa-17-azabicyclo[12.3.0]heptadecane-3,9,11,16-tet Chemical compound O([C@@H]1[C@@H](C)C(=O)[C@](C)(F)C(=O)O[C@@H]([C@]2(OC(=O)N(CCCCN3N=NC(=C3)C=3C=C(N)C=CC=3)[C@@H]2[C@@H](C)C(=O)[C@H](C)C[C@@]1(C)OC)C)CC)[C@@H]1O[C@H](C)C[C@H](N(C)C)[C@H]1O IXXFZUPTQVDPPK-ZAWHAJPISA-N 0.000 description 1
- PYXFVCFISTUSOO-HKUCOEKDSA-N (20S)-protopanaxadiol Chemical compound C1C[C@H](O)C(C)(C)[C@@H]2CC[C@@]3(C)[C@]4(C)CC[C@H]([C@@](C)(O)CCC=C(C)C)[C@H]4[C@H](O)C[C@@H]3[C@]21C PYXFVCFISTUSOO-HKUCOEKDSA-N 0.000 description 1
- DLMYFMLKORXJPO-FQEVSTJZSA-N (2R)-2-amino-3-[(triphenylmethyl)thio]propanoic acid Chemical compound C=1C=CC=CC=1C(C=1C=CC=CC=1)(SC[C@H](N)C(O)=O)C1=CC=CC=C1 DLMYFMLKORXJPO-FQEVSTJZSA-N 0.000 description 1
- JMPZTWDLOGTBPM-OUQSKUGOSA-N (2e,4e,6e)-7-(3,5-ditert-butylphenyl)-3-methylocta-2,4,6-trienoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)C1=CC(C(C)(C)C)=CC(C(C)(C)C)=C1 JMPZTWDLOGTBPM-OUQSKUGOSA-N 0.000 description 1
- CAYGMWMWJUFODP-AYFTZVAISA-N (2r)-2-[(1e,3z,5r,7e,9e,11r)-11-hydroxy-11-[(2s,4r,5s,6s)-4-hydroxy-5-methyl-6-[(e)-prop-1-enyl]oxan-2-yl]-3,5,7-trimethylundeca-1,3,7,9-tetraenyl]-2,3-dihydropyran-6-one Chemical compound C1[C@@H](O)[C@H](C)[C@H](/C=C/C)O[C@@H]1[C@H](O)\C=C\C=C(/C)C[C@@H](C)\C=C(\C)/C=C/[C@@H]1OC(=O)C=CC1 CAYGMWMWJUFODP-AYFTZVAISA-N 0.000 description 1
- XUSXOPRDIDWMFO-CTMSJIKGSA-N (2r,3r,4r,5r)-2-[(1s,2s,3r,4s,6r)-4,6-diamino-3-[[(2s,3r)-3-amino-6-[(1s)-1-aminoethyl]-3,4-dihydro-2h-pyran-2-yl]oxy]-2-hydroxycyclohexyl]oxy-5-methyl-4-(methylamino)oxane-3,5-diol Chemical compound O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H](CC=C(O2)[C@H](C)N)N)[C@@H](N)C[C@H]1N XUSXOPRDIDWMFO-CTMSJIKGSA-N 0.000 description 1
- WDQLRUYAYXDIFW-RWKIJVEZSA-N (2r,3r,4s,5r,6r)-4-[(2s,3r,4s,5r,6r)-3,5-dihydroxy-4-[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-6-[[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxymethyl]oxan-2-yl]oxy-6-(hydroxymethyl)oxane-2,3,5-triol Chemical compound O[C@@H]1[C@@H](CO)O[C@@H](O)[C@H](O)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)[C@H](O)[C@@H](CO[C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)O1 WDQLRUYAYXDIFW-RWKIJVEZSA-N 0.000 description 1
- RIWLPSIAFBLILR-WVNGMBSFSA-N (2s)-1-[(2s)-2-[[(2s,3s)-2-[[(2s)-2-[[(2s,3r)-2-[[(2r,3s)-2-[[(2s)-2-[[2-[[2-[acetyl(methyl)amino]acetyl]amino]acetyl]amino]-3-methylbutanoyl]amino]-3-methylpentanoyl]amino]-3-hydroxybutanoyl]amino]pentanoyl]amino]-3-methylpentanoyl]amino]-5-(diaminomethy Chemical compound CC(=O)N(C)CC(=O)NCC(=O)N[C@@H](C(C)C)C(=O)N[C@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1CCC[C@H]1C(=O)NCC RIWLPSIAFBLILR-WVNGMBSFSA-N 0.000 description 1
- ZZKNRXZVGOYGJT-VKHMYHEASA-N (2s)-2-[(2-phosphonoacetyl)amino]butanedioic acid Chemical compound OC(=O)C[C@@H](C(O)=O)NC(=O)CP(O)(O)=O ZZKNRXZVGOYGJT-VKHMYHEASA-N 0.000 description 1
- BXTJCSYMGFJEID-XMTADJHZSA-N (2s)-2-[[(2r,3r)-3-[(2s)-1-[(3r,4s,5s)-4-[[(2s)-2-[[(2s)-2-[6-[3-[(2r)-2-amino-2-carboxyethyl]sulfanyl-2,5-dioxopyrrolidin-1-yl]hexanoyl-methylamino]-3-methylbutanoyl]amino]-3-methylbutanoyl]-methylamino]-3-methoxy-5-methylheptanoyl]pyrrolidin-2-yl]-3-met Chemical compound C([C@H](NC(=O)[C@H](C)[C@@H](OC)[C@@H]1CCCN1C(=O)C[C@H]([C@H]([C@@H](C)CC)N(C)C(=O)[C@@H](NC(=O)[C@H](C(C)C)N(C)C(=O)CCCCCN1C(C(SC[C@H](N)C(O)=O)CC1=O)=O)C(C)C)OC)C(O)=O)C1=CC=CC=C1 BXTJCSYMGFJEID-XMTADJHZSA-N 0.000 description 1
- KQRHTCDQWJLLME-XUXIUFHCSA-N (2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-aminopropanoyl]amino]-4-methylpentanoyl]amino]propanoyl]amino]-4-methylpentanoic acid Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)N KQRHTCDQWJLLME-XUXIUFHCSA-N 0.000 description 1
- QXOPTIPQEVJERB-JQWIXIFHSA-N (2s)-2-[[5-[2-[(6s)-2-amino-4-oxo-5,6,7,8-tetrahydro-1h-pyrido[2,3-d]pyrimidin-6-yl]ethyl]-4-methylthiophene-2-carbonyl]amino]pentanedioic acid Chemical compound C1=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)SC(CC[C@H]2CC=3C(=O)N=C(N)NC=3NC2)=C1C QXOPTIPQEVJERB-JQWIXIFHSA-N 0.000 description 1
- ZFKBWSREWJOSSJ-VIFPVBQESA-N (2s)-6,8-dichloro-2-(trifluoromethyl)-2h-chromene-3-carboxylic acid Chemical compound ClC1=CC(Cl)=C2O[C@H](C(F)(F)F)C(C(=O)O)=CC2=C1 ZFKBWSREWJOSSJ-VIFPVBQESA-N 0.000 description 1
- ZBVJFYPGLGEMIN-OYLNGHKZSA-N (2s)-n-[(2s)-1-[[(2s)-1-[[(2s)-1-[[(2s)-1-[[(2r)-1-[[(2s)-1-[[(2s)-1-[(2s)-2-[(2-amino-2-oxoethyl)carbamoyl]pyrrolidin-1-yl]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-3-(1h-indol-3-yl)-1-oxopropan-2-yl]amino]-3-( Chemical compound C1=CC=C2C(CC=3C4=CC=CC=C4C=C(C=3O)C(=O)O)=C(O)C(C(O)=O)=CC2=C1.C([C@@H](C(=O)N[C@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 ZBVJFYPGLGEMIN-OYLNGHKZSA-N 0.000 description 1
- GTXSRFUZSLTDFX-HRCADAONSA-N (2s)-n-[(2s)-3,3-dimethyl-1-(methylamino)-1-oxobutan-2-yl]-4-methyl-2-[[(2s)-2-sulfanyl-4-(3,4,4-trimethyl-2,5-dioxoimidazolidin-1-yl)butanoyl]amino]pentanamide Chemical compound CNC(=O)[C@H](C(C)(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](S)CCN1C(=O)N(C)C(C)(C)C1=O GTXSRFUZSLTDFX-HRCADAONSA-N 0.000 description 1
- XSAKVDNHFRWJKS-IIZANFQQSA-N (2s)-n-benzyl-1-[(2s)-1-[(2s)-2-[[(2s)-2-[[(2s)-2-(dimethylamino)-3-methylbutanoyl]amino]-3-methylbutanoyl]-methylamino]-3-methylbutanoyl]pyrrolidine-2-carbonyl]pyrrolidine-2-carboxamide Chemical compound CC(C)[C@H](N(C)C)C(=O)N[C@@H](C(C)C)C(=O)N(C)[C@@H](C(C)C)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(=O)NCC=2C=CC=CC=2)CCC1 XSAKVDNHFRWJKS-IIZANFQQSA-N 0.000 description 1
- PSVUJBVBCOISSP-SPFKKGSWSA-N (2s,3r,4s,5s,6r)-2-bis(2-chloroethylamino)phosphoryloxy-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound OC[C@H]1O[C@@H](OP(=O)(NCCCl)NCCCl)[C@H](O)[C@@H](O)[C@@H]1O PSVUJBVBCOISSP-SPFKKGSWSA-N 0.000 description 1
- HBJOXQRURQPDEX-MHXMMLMNSA-N (2s,4r)-n-[(1s,2s)-2-chloro-1-[(2r,3r,4s,5r,6r)-3,4,5-trihydroxy-6-methylsulfanyloxan-2-yl]propyl]-4-ethylpiperidine-2-carboxamide Chemical compound C1[C@H](CC)CCN[C@@H]1C(=O)N[C@H]([C@H](C)Cl)[C@@H]1[C@H](O)[C@H](O)[C@@H](O)[C@@H](SC)O1 HBJOXQRURQPDEX-MHXMMLMNSA-N 0.000 description 1
- PUDHBTGHUJUUFI-SCTWWAJVSA-N (4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-n-[(2s,3r)-1-amino-3-hydroxy-1-oxobutan-2-yl]-19-[[(2r)-2-amino-3-naphthalen-2-ylpropanoyl]amino]-16-[(4-hydroxyphenyl)methyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-7-propan-2-yl-1,2-dithia-5,8,11,14,17-p Chemical compound C([C@H]1C(=O)N[C@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](N)CC=1C=C2C=CC=CC2=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(N)=O)=O)C(C)C)C1=CC=C(O)C=C1 PUDHBTGHUJUUFI-SCTWWAJVSA-N 0.000 description 1
- RNIADBXQDMCFEN-IWVLMIASSA-N (4s,4ar,5s,5ar,12ar)-7-chloro-4-(dimethylamino)-1,5,10,11,12a-pentahydroxy-6-methylidene-3,12-dioxo-4,4a,5,5a-tetrahydrotetracene-2-carboxamide Chemical compound C=C1C2=C(Cl)C=CC(O)=C2C(O)=C2[C@@H]1[C@H](O)[C@H]1[C@H](N(C)C)C(=O)C(C(N)=O)=C(O)[C@@]1(O)C2=O RNIADBXQDMCFEN-IWVLMIASSA-N 0.000 description 1
- SGKRLCUYIXIAHR-AKNGSSGZSA-N (4s,4ar,5s,5ar,6r,12ar)-4-(dimethylamino)-1,5,10,11,12a-pentahydroxy-6-methyl-3,12-dioxo-4a,5,5a,6-tetrahydro-4h-tetracene-2-carboxamide Chemical compound C1=CC=C2[C@H](C)[C@@H]([C@H](O)[C@@H]3[C@](C(O)=C(C(N)=O)C(=O)[C@H]3N(C)C)(O)C3=O)C3=C(O)C2=C1O SGKRLCUYIXIAHR-AKNGSSGZSA-N 0.000 description 1
- FFTVPQUHLQBXQZ-KVUCHLLUSA-N (4s,4as,5ar,12ar)-4,7-bis(dimethylamino)-1,10,11,12a-tetrahydroxy-3,12-dioxo-4a,5,5a,6-tetrahydro-4h-tetracene-2-carboxamide Chemical compound C1C2=C(N(C)C)C=CC(O)=C2C(O)=C2[C@@H]1C[C@H]1[C@H](N(C)C)C(=O)C(C(N)=O)=C(O)[C@@]1(O)C2=O FFTVPQUHLQBXQZ-KVUCHLLUSA-N 0.000 description 1
- GUXHBMASAHGULD-SEYHBJAFSA-N (4s,4as,5as,6s,12ar)-7-chloro-4-(dimethylamino)-1,6,10,11,12a-pentahydroxy-3,12-dioxo-4a,5,5a,6-tetrahydro-4h-tetracene-2-carboxamide Chemical compound C1([C@H]2O)=C(Cl)C=CC(O)=C1C(O)=C1[C@@H]2C[C@H]2[C@H](N(C)C)C(=O)C(C(N)=O)=C(O)[C@@]2(O)C1=O GUXHBMASAHGULD-SEYHBJAFSA-N 0.000 description 1
- HBUJYEUPIIJJOS-PBHICJAKSA-N (5r)-3-[4-[1-[(2s)-2,3-dihydroxypropanoyl]-3,6-dihydro-2h-pyridin-4-yl]-3,5-difluorophenyl]-5-(1,2-oxazol-3-yloxymethyl)-1,3-oxazolidin-2-one Chemical compound C1N(C(=O)[C@@H](O)CO)CCC(C=2C(=CC(=CC=2F)N2C(O[C@@H](COC3=NOC=C3)C2)=O)F)=C1 HBUJYEUPIIJJOS-PBHICJAKSA-N 0.000 description 1
- QYNUQALWYRSVHF-OLZOCXBDSA-N (6R)-5,10-methylenetetrahydrofolic acid Chemical compound C([C@H]1CNC=2N=C(NC(=O)C=2N1C1)N)N1C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 QYNUQALWYRSVHF-OLZOCXBDSA-N 0.000 description 1
- RWZVMMQNDHPRQD-SFTDATJTSA-N (6as)-3-[3-[[(6as)-2-methoxy-8-methylidene-11-oxo-7,9-dihydro-6ah-pyrrolo[2,1-c][1,4]benzodiazepin-3-yl]oxy]propoxy]-2-methoxy-8-methylidene-7,9-dihydro-6ah-pyrrolo[2,1-c][1,4]benzodiazepin-11-one Chemical compound N1=C[C@@H]2CC(=C)CN2C(=O)C(C=C2OC)=C1C=C2OCCCOC1=CC(N=C[C@H]2N(CC(=C)C2)C2=O)=C2C=C1OC RWZVMMQNDHPRQD-SFTDATJTSA-N 0.000 description 1
- KQJSQWZMSAGSHN-UHFFFAOYSA-N (9beta,13alpha,14beta,20alpha)-3-hydroxy-9,13-dimethyl-2-oxo-24,25,26-trinoroleana-1(10),3,5,7-tetraen-29-oic acid Natural products CC12CCC3(C)C4CC(C)(C(O)=O)CCC4(C)CCC3(C)C2=CC=C2C1=CC(=O)C(O)=C2C KQJSQWZMSAGSHN-UHFFFAOYSA-N 0.000 description 1
- RXZBMPWDPOLZGW-XMRMVWPWSA-N (E)-roxithromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=N/OCOCCOC)/[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 RXZBMPWDPOLZGW-XMRMVWPWSA-N 0.000 description 1
- MHFRGQHAERHWKZ-HHHXNRCGSA-N (R)-edelfosine Chemical compound CCCCCCCCCCCCCCCCCCOC[C@@H](OC)COP([O-])(=O)OCC[N+](C)(C)C MHFRGQHAERHWKZ-HHHXNRCGSA-N 0.000 description 1
- AGBQKNBQESQNJD-SSDOTTSWSA-N (R)-lipoic acid Chemical compound OC(=O)CCCC[C@@H]1CCSS1 AGBQKNBQESQNJD-SSDOTTSWSA-N 0.000 description 1
- ZGNLFUXWZJGETL-YUSKDDKASA-N (Z)-[(2S)-2-amino-2-carboxyethyl]-hydroxyimino-oxidoazanium Chemical compound N[C@@H](C\[N+]([O-])=N\O)C(O)=O ZGNLFUXWZJGETL-YUSKDDKASA-N 0.000 description 1
- VYEWZWBILJHHCU-OMQUDAQFSA-N (e)-n-[(2s,3r,4r,5r,6r)-2-[(2r,3r,4s,5s,6s)-3-acetamido-5-amino-4-hydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-6-[2-[(2r,3s,4r,5r)-5-(2,4-dioxopyrimidin-1-yl)-3,4-dihydroxyoxolan-2-yl]-2-hydroxyethyl]-4,5-dihydroxyoxan-3-yl]-5-methylhex-2-enamide Chemical compound N1([C@@H]2O[C@@H]([C@H]([C@H]2O)O)C(O)C[C@@H]2[C@H](O)[C@H](O)[C@H]([C@@H](O2)O[C@@H]2[C@@H]([C@@H](O)[C@H](N)[C@@H](CO)O2)NC(C)=O)NC(=O)/C=C/CC(C)C)C=CC(=O)NC1=O VYEWZWBILJHHCU-OMQUDAQFSA-N 0.000 description 1
- BWDQBBCUWLSASG-MDZDMXLPSA-N (e)-n-hydroxy-3-[4-[[2-hydroxyethyl-[2-(1h-indol-3-yl)ethyl]amino]methyl]phenyl]prop-2-enamide Chemical compound C=1NC2=CC=CC=C2C=1CCN(CCO)CC1=CC=C(\C=C\C(=O)NO)C=C1 BWDQBBCUWLSASG-MDZDMXLPSA-N 0.000 description 1
- OUPZKGBUJRBPGC-UHFFFAOYSA-N 1,3,5-tris(oxiran-2-ylmethyl)-1,3,5-triazinane-2,4,6-trione Chemical compound O=C1N(CC2OC2)C(=O)N(CC2OC2)C(=O)N1CC1CO1 OUPZKGBUJRBPGC-UHFFFAOYSA-N 0.000 description 1
- HJTAZXHBEBIQQX-UHFFFAOYSA-N 1,5-bis(chloromethyl)naphthalene Chemical compound C1=CC=C2C(CCl)=CC=CC2=C1CCl HJTAZXHBEBIQQX-UHFFFAOYSA-N 0.000 description 1
- VENAWWNQXLXMHX-UHFFFAOYSA-N 1-(2-chloroethyl)-4-(3-chloropropyl)piperazine;hydrochloride Chemical compound Cl.ClCCCN1CCN(CCCl)CC1 VENAWWNQXLXMHX-UHFFFAOYSA-N 0.000 description 1
- QBPISWMTLKTKMK-UHFFFAOYSA-N 1-[(4-aminophenyl)methyl]pyridin-2-one Chemical compound C1=CC(N)=CC=C1CN1C(=O)C=CC=C1 QBPISWMTLKTKMK-UHFFFAOYSA-N 0.000 description 1
- 102100025573 1-alkyl-2-acetylglycerophosphocholine esterase Human genes 0.000 description 1
- GZCWLCBFPRFLKL-UHFFFAOYSA-N 1-prop-2-ynoxypropan-2-ol Chemical compound CC(O)COCC#C GZCWLCBFPRFLKL-UHFFFAOYSA-N 0.000 description 1
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 1
- AMDHQGZVCWWZCS-UHFFFAOYSA-N 109466-93-5 Chemical compound O=CC1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 AMDHQGZVCWWZCS-UHFFFAOYSA-N 0.000 description 1
- 108010058566 130-nm albumin-bound paclitaxel Proteins 0.000 description 1
- GVEZIHKRYBHEFX-MNOVXSKESA-N 13C-Cerulenin Natural products CC=CCC=CCCC(=O)[C@H]1O[C@@H]1C(N)=O GVEZIHKRYBHEFX-MNOVXSKESA-N 0.000 description 1
- KUFRQPKVAWMTJO-QSTRRNJOSA-N 17-dmag Chemical compound N1C(=O)\C(C)=C/C=C\[C@@H](OC)[C@H](OC(N)=O)\C(C)=C/[C@@H](C)[C@@H](O)[C@H](OC)C[C@@H](C)CC2=C(NCCN(C)C)C(=O)C=C1C2=O KUFRQPKVAWMTJO-QSTRRNJOSA-N 0.000 description 1
- ROZCIVXTLACYNY-UHFFFAOYSA-N 2,3,4,5,6-pentafluoro-n-(3-fluoro-4-methoxyphenyl)benzenesulfonamide Chemical compound C1=C(F)C(OC)=CC=C1NS(=O)(=O)C1=C(F)C(F)=C(F)C(F)=C1F ROZCIVXTLACYNY-UHFFFAOYSA-N 0.000 description 1
- AEQDJSLRWYMAQI-UHFFFAOYSA-N 2,3,9,10-tetramethoxy-6,8,13,13a-tetrahydro-5H-isoquinolino[2,1-b]isoquinoline Chemical compound C1CN2CC(C(=C(OC)C=C3)OC)=C3CC2C2=C1C=C(OC)C(OC)=C2 AEQDJSLRWYMAQI-UHFFFAOYSA-N 0.000 description 1
- 150000003923 2,5-pyrrolediones Chemical class 0.000 description 1
- UEJJHQNACJXSKW-UHFFFAOYSA-N 2-(2,6-dioxopiperidin-3-yl)-1H-isoindole-1,3(2H)-dione Chemical compound O=C1C2=CC=CC=C2C(=O)N1C1CCC(=O)NC1=O UEJJHQNACJXSKW-UHFFFAOYSA-N 0.000 description 1
- XNTLXAUHLBBEKP-UHFFFAOYSA-N 2-(3,4-difluorophenyl)-4-(3-hydroxy-3-methylbutoxy)-5-(4-methylsulfonylphenyl)pyridazin-3-one Chemical compound O=C1C(OCCC(C)(O)C)=C(C=2C=CC(=CC=2)S(C)(=O)=O)C=NN1C1=CC=C(F)C(F)=C1 XNTLXAUHLBBEKP-UHFFFAOYSA-N 0.000 description 1
- PADGNZFOVSZIKZ-UHFFFAOYSA-N 2-(chloromethyl)oxirane;hydrogen carbonate;prop-2-enylazanium Chemical compound NCC=C.OC(O)=O.ClCC1CO1 PADGNZFOVSZIKZ-UHFFFAOYSA-N 0.000 description 1
- IZXIZTKNFFYFOF-UHFFFAOYSA-N 2-Oxazolidone Chemical compound O=C1NCCO1 IZXIZTKNFFYFOF-UHFFFAOYSA-N 0.000 description 1
- ACTOXUHEUCPTEW-BWHGAVFKSA-N 2-[(4r,5s,6s,7r,9r,10r,11e,13e,16r)-6-[(2s,3r,4r,5s,6r)-5-[(2s,4r,5s,6s)-4,5-dihydroxy-4,6-dimethyloxan-2-yl]oxy-4-(dimethylamino)-3-hydroxy-6-methyloxan-2-yl]oxy-10-[(2s,5s,6r)-5-(dimethylamino)-6-methyloxan-2-yl]oxy-4-hydroxy-5-methoxy-9,16-dimethyl-2-o Chemical compound O([C@H]1/C=C/C=C/C[C@@H](C)OC(=O)C[C@@H](O)[C@@H]([C@H]([C@@H](CC=O)C[C@H]1C)O[C@H]1[C@@H]([C@H]([C@H](O[C@@H]2O[C@@H](C)[C@H](O)[C@](C)(O)C2)[C@@H](C)O1)N(C)C)O)OC)[C@@H]1CC[C@H](N(C)C)[C@@H](C)O1 ACTOXUHEUCPTEW-BWHGAVFKSA-N 0.000 description 1
- QXLQZLBNPTZMRK-UHFFFAOYSA-N 2-[(dimethylamino)methyl]-1-(2,4-dimethylphenyl)prop-2-en-1-one Chemical compound CN(C)CC(=C)C(=O)C1=CC=C(C)C=C1C QXLQZLBNPTZMRK-UHFFFAOYSA-N 0.000 description 1
- AWVHFDOHKFRHKQ-UHFFFAOYSA-N 2-[10-(3-aminopropylimino)-6,8-dihydroxy-3-oxo-14,15-diazatetracyclo[7.6.1.02,7.013,16]hexadeca-1,4,6,8,11,13(16)-hexaen-14-yl]ethyl-(2-hydroxyethyl)azanium chloride Chemical compound C1=CC(=NCCCN)C2=C(C3=C(C=CC(=O)C3=C4C2=C1N(N4)CC[NH2+]CCO)O)O.[Cl-] AWVHFDOHKFRHKQ-UHFFFAOYSA-N 0.000 description 1
- OTLLEIBWKHEHGU-UHFFFAOYSA-N 2-[5-[[5-(6-aminopurin-9-yl)-3,4-dihydroxyoxolan-2-yl]methoxy]-3,4-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-3,5-dihydroxy-4-phosphonooxyhexanedioic acid Chemical compound C1=NC=2C(N)=NC=NC=2N1C(C(C1O)O)OC1COC1C(CO)OC(OC(C(O)C(OP(O)(O)=O)C(O)C(O)=O)C(O)=O)C(O)C1O OTLLEIBWKHEHGU-UHFFFAOYSA-N 0.000 description 1
- PBUUPFTVAPUWDE-UGZDLDLSSA-N 2-[[(2S,4S)-2-[bis(2-chloroethyl)amino]-2-oxo-1,3,2lambda5-oxazaphosphinan-4-yl]sulfanyl]ethanesulfonic acid Chemical compound OS(=O)(=O)CCS[C@H]1CCO[P@](=O)(N(CCCl)CCCl)N1 PBUUPFTVAPUWDE-UGZDLDLSSA-N 0.000 description 1
- WEZDRVHTDXTVLT-GJZGRUSLSA-N 2-[[(2s)-2-[[(2s)-2-[(2-aminoacetyl)amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]acetic acid Chemical compound OC(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)CN)CC1=CC=CC=C1 WEZDRVHTDXTVLT-GJZGRUSLSA-N 0.000 description 1
- RTQWWZBSTRGEAV-PKHIMPSTSA-N 2-[[(2s)-2-[bis(carboxymethyl)amino]-3-[4-(methylcarbamoylamino)phenyl]propyl]-[2-[bis(carboxymethyl)amino]propyl]amino]acetic acid Chemical compound CNC(=O)NC1=CC=C(C[C@@H](CN(CC(C)N(CC(O)=O)CC(O)=O)CC(O)=O)N(CC(O)=O)CC(O)=O)C=C1 RTQWWZBSTRGEAV-PKHIMPSTSA-N 0.000 description 1
- SGUMXALIXOMJSH-UHFFFAOYSA-N 2-[[2-chloro-5-[(2,4-diamino-5-methylquinazolin-6-yl)methylamino]benzoyl]amino]butanedioic acid Chemical compound C1=CC2=NC(N)=NC(N)=C2C(C)=C1CNC1=CC=C(Cl)C(C(=O)NC(CC(O)=O)C(O)=O)=C1 SGUMXALIXOMJSH-UHFFFAOYSA-N 0.000 description 1
- PJKVJJYMWOCLIJ-UHFFFAOYSA-N 2-amino-6-methyl-5-pyridin-4-ylsulfanyl-1h-quinazolin-4-one;hydron;dichloride Chemical compound Cl.Cl.CC1=CC=C2NC(N)=NC(=O)C2=C1SC1=CC=NC=C1 PJKVJJYMWOCLIJ-UHFFFAOYSA-N 0.000 description 1
- RGHYDLZMTYDBDT-UHFFFAOYSA-N 2-amino-8-ethyl-4-methyl-6-(1H-pyrazol-5-yl)-7-pyrido[2,3-d]pyrimidinone Chemical compound O=C1N(CC)C2=NC(N)=NC(C)=C2C=C1C=1C=CNN=1 RGHYDLZMTYDBDT-UHFFFAOYSA-N 0.000 description 1
- SCVJRXQHFJXZFZ-JKUQZMGJSA-N 2-amino-9-[(2s,4s,5r)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-3h-purine-6-thione Chemical compound C1=2NC(N)=NC(=S)C=2N=CN1[C@@H]1C[C@H](O)[C@@H](CO)O1 SCVJRXQHFJXZFZ-JKUQZMGJSA-N 0.000 description 1
- HTCSFFGLRQDZDE-UHFFFAOYSA-N 2-azaniumyl-2-phenylpropanoate Chemical compound OC(=O)C(N)(C)C1=CC=CC=C1 HTCSFFGLRQDZDE-UHFFFAOYSA-N 0.000 description 1
- 125000001340 2-chloroethyl group Chemical group [H]C([H])(Cl)C([H])([H])* 0.000 description 1
- NEAQRZUHTPSBBM-UHFFFAOYSA-N 2-hydroxy-3,3-dimethyl-7-nitro-4h-isoquinolin-1-one Chemical compound C1=C([N+]([O-])=O)C=C2C(=O)N(O)C(C)(C)CC2=C1 NEAQRZUHTPSBBM-UHFFFAOYSA-N 0.000 description 1
- GHWSMQHJFMAATF-DSHMRAQASA-N 20(S)-protopanaxadiol Natural products CC(=CCC[C@@](O)(CO)[C@H]1CC[C@]2(C)[C@@H]1CC[C@H]3[C@@]2(C)CC[C@H]4C(C)(C)[C@@H](O)CC[C@]34CO)C GHWSMQHJFMAATF-DSHMRAQASA-N 0.000 description 1
- YIMDLWDNDGKDTJ-QLKYHASDSA-N 3'-deamino-3'-(3-cyanomorpholin-4-yl)doxorubicin Chemical compound N1([C@H]2C[C@@H](O[C@@H](C)[C@H]2O)O[C@H]2C[C@@](O)(CC=3C(O)=C4C(=O)C=5C=CC=C(C=5C(=O)C4=C(O)C=32)OC)C(=O)CO)CCOCC1C#N YIMDLWDNDGKDTJ-QLKYHASDSA-N 0.000 description 1
- NDMPLJNOPCLANR-UHFFFAOYSA-N 3,4-dihydroxy-15-(4-hydroxy-18-methoxycarbonyl-5,18-seco-ibogamin-18-yl)-16-methoxy-1-methyl-6,7-didehydro-aspidospermidine-3-carboxylic acid methyl ester Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 NDMPLJNOPCLANR-UHFFFAOYSA-N 0.000 description 1
- HDBQZGJWHMCXIL-UHFFFAOYSA-N 3,7-dihydropurine-2-thione Chemical compound SC1=NC=C2NC=NC2=N1 HDBQZGJWHMCXIL-UHFFFAOYSA-N 0.000 description 1
- AXRCEOKUDYDWLF-UHFFFAOYSA-N 3-(1-methyl-3-indolyl)-4-[1-[1-(2-pyridinylmethyl)-4-piperidinyl]-3-indolyl]pyrrole-2,5-dione Chemical compound C12=CC=CC=C2N(C)C=C1C(C(NC1=O)=O)=C1C(C1=CC=CC=C11)=CN1C(CC1)CCN1CC1=CC=CC=N1 AXRCEOKUDYDWLF-UHFFFAOYSA-N 0.000 description 1
- MAUCONCHVWBMHK-UHFFFAOYSA-N 3-[(dimethylamino)methyl]-N-[2-[4-[(hydroxyamino)-oxomethyl]phenoxy]ethyl]-2-benzofurancarboxamide Chemical compound O1C2=CC=CC=C2C(CN(C)C)=C1C(=O)NCCOC1=CC=C(C(=O)NO)C=C1 MAUCONCHVWBMHK-UHFFFAOYSA-N 0.000 description 1
- QNKJFXARIMSDBR-UHFFFAOYSA-N 3-[2-[bis(2-chloroethyl)amino]ethyl]-1,3-diazaspiro[4.5]decane-2,4-dione Chemical compound O=C1N(CCN(CCCl)CCCl)C(=O)NC11CCCCC1 QNKJFXARIMSDBR-UHFFFAOYSA-N 0.000 description 1
- WUIABRMSWOKTOF-OYALTWQYSA-N 3-[[2-[2-[2-[[(2s,3r)-2-[[(2s,3s,4r)-4-[[(2s,3r)-2-[[6-amino-2-[(1s)-3-amino-1-[[(2s)-2,3-diamino-3-oxopropyl]amino]-3-oxopropyl]-5-methylpyrimidine-4-carbonyl]amino]-3-[(2r,3s,4s,5s,6s)-3-[(2r,3s,4s,5r,6r)-4-carbamoyloxy-3,5-dihydroxy-6-(hydroxymethyl)ox Chemical compound OS([O-])(=O)=O.N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1NC=NC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C WUIABRMSWOKTOF-OYALTWQYSA-N 0.000 description 1
- HKPVIFTWECXNPY-UHFFFAOYSA-N 3-[[2-chloro-4-(4,6-diamino-2,2-dimethyl-1,3,5-triazin-1-yl)phenoxy]methyl]-n,n-dimethylbenzamide;ethanesulfonic acid Chemical compound CCS(O)(=O)=O.CN(C)C(=O)C1=CC=CC(COC=2C(=CC(=CC=2)N2C(N=C(N)N=C2N)(C)C)Cl)=C1 HKPVIFTWECXNPY-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- PRDJGNVQBVXXEO-UHFFFAOYSA-N 3-cyanopropyl carbamimidothioate Chemical compound NC(=N)SCCCC#N PRDJGNVQBVXXEO-UHFFFAOYSA-N 0.000 description 1
- VOUAQYXWVJDEQY-QENPJCQMSA-N 33017-11-7 Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)NCC(=O)NCC(=O)N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N1[C@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O)CCC1 VOUAQYXWVJDEQY-QENPJCQMSA-N 0.000 description 1
- CYDQOEWLBCCFJZ-UHFFFAOYSA-N 4-(4-fluorophenyl)oxane-4-carboxylic acid Chemical compound C=1C=C(F)C=CC=1C1(C(=O)O)CCOCC1 CYDQOEWLBCCFJZ-UHFFFAOYSA-N 0.000 description 1
- AKJHMTWEGVYYSE-AIRMAKDCSA-N 4-HPR Chemical compound C=1C=C(O)C=CC=1NC(=O)/C=C(\C)/C=C/C=C(C)C=CC1=C(C)CCCC1(C)C AKJHMTWEGVYYSE-AIRMAKDCSA-N 0.000 description 1
- SUVMJBTUFCVSAD-JTQLQIEISA-N 4-Methylsulfinylbutyl isothiocyanate Natural products C[S@](=O)CCCCN=C=S SUVMJBTUFCVSAD-JTQLQIEISA-N 0.000 description 1
- HEUVRFNVTLGKMZ-SANMLTNESA-N 4-[(2s)-2-(4-cyanophenyl)-2-hydroxy-2-(3-methylimidazol-4-yl)ethoxy]-3-[4-(trifluoromethoxy)phenyl]benzonitrile Chemical compound CN1C=NC=C1[C@@](O)(C=1C=CC(=CC=1)C#N)COC1=CC=C(C#N)C=C1C1=CC=C(OC(F)(F)F)C=C1 HEUVRFNVTLGKMZ-SANMLTNESA-N 0.000 description 1
- BQMGBEHGBILFLB-YUPPHXPYSA-N 4-[2-[4-[[2-(4-chlorophenyl)phenyl]methyl]piperazin-1-yl]benzoyl]-4-[[(2R)-4-(dimethylamino)-1-phenylsulfanylbutan-2-yl]amino]-3-nitrocyclohexa-1,5-diene-1-sulfonamide Chemical compound ClC1=CC=C(C=C1)C1=C(C=CC=C1)CN1CCN(CC1)C1=C(C(=O)C2(C(C=C(C=C2)S(=O)(=O)N)[N+](=O)[O-])N[C@H](CCN(C)C)CSC2=CC=CC=C2)C=CC=C1 BQMGBEHGBILFLB-YUPPHXPYSA-N 0.000 description 1
- ZHSKUOZOLHMKEA-UHFFFAOYSA-N 4-[5-[bis(2-chloroethyl)amino]-1-methylbenzimidazol-2-yl]butanoic acid;hydron;chloride Chemical compound Cl.ClCCN(CCCl)C1=CC=C2N(C)C(CCCC(O)=O)=NC2=C1 ZHSKUOZOLHMKEA-UHFFFAOYSA-N 0.000 description 1
- PXACTUVBBMDKRW-UHFFFAOYSA-N 4-bromobenzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=C(Br)C=C1 PXACTUVBBMDKRW-UHFFFAOYSA-N 0.000 description 1
- HEROWGICZZJWKP-UHFFFAOYSA-N 4-pyrrol-1-ylbenzenesulfonamide Chemical compound C1=CC(S(=O)(=O)N)=CC=C1N1C=CC=C1 HEROWGICZZJWKP-UHFFFAOYSA-N 0.000 description 1
- WUUGFSXJNOTRMR-IOSLPCCCSA-N 5'-S-methyl-5'-thioadenosine Chemical compound O[C@@H]1[C@H](O)[C@@H](CSC)O[C@H]1N1C2=NC=NC(N)=C2N=C1 WUUGFSXJNOTRMR-IOSLPCCCSA-N 0.000 description 1
- XTWYTFMLZFPYCI-KQYNXXCUSA-N 5'-adenylphosphoric acid Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP(O)(=O)OP(O)(O)=O)[C@@H](O)[C@H]1O XTWYTFMLZFPYCI-KQYNXXCUSA-N 0.000 description 1
- 102100022464 5'-nucleotidase Human genes 0.000 description 1
- HUNAOTXNHVALTN-UHFFFAOYSA-N 5-(5-chloro-2,4-dihydroxyphenyl)-N-ethyl-4-(4-methoxyphenyl)pyrazole-3-carboxamide Chemical compound CCNC(=O)C1=NNC(C=2C(=CC(O)=C(Cl)C=2)O)=C1C1=CC=C(OC)C=C1 HUNAOTXNHVALTN-UHFFFAOYSA-N 0.000 description 1
- XAUDJQYHKZQPEU-KVQBGUIXSA-N 5-aza-2'-deoxycytidine Chemical compound O=C1N=C(N)N=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 XAUDJQYHKZQPEU-KVQBGUIXSA-N 0.000 description 1
- ODHCTXKNWHHXJC-VKHMYHEASA-N 5-oxo-L-proline Chemical group OC(=O)[C@@H]1CCC(=O)N1 ODHCTXKNWHHXJC-VKHMYHEASA-N 0.000 description 1
- LJIRBXZDQGQUOO-KVTDHHQDSA-N 6-amino-3-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-1,4-dihydro-1,3,5-triazin-2-one Chemical compound C1NC(N)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 LJIRBXZDQGQUOO-KVTDHHQDSA-N 0.000 description 1
- VVIAGPKUTFNRDU-UHFFFAOYSA-N 6S-folinic acid Natural products C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-UHFFFAOYSA-N 0.000 description 1
- KUAKYFCHUDSMNU-UHFFFAOYSA-N 7-chlorocamptothecin Chemical compound C1=CC=C2C(Cl)=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 KUAKYFCHUDSMNU-UHFFFAOYSA-N 0.000 description 1
- HFDKKNHCYWNNNQ-YOGANYHLSA-N 75976-10-2 Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CCSC)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@@H](NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](C)N)C(C)C)[C@@H](C)O)C1=CC=C(O)C=C1 HFDKKNHCYWNNNQ-YOGANYHLSA-N 0.000 description 1
- KCIOVTSUEXGUFJ-UHFFFAOYSA-N 8-(2-chloro-3,4,5-trimethoxybenzyl)-2-fluoro-9-pent-4-yn-1-yl-9H-purin-6-amine Chemical compound COC1=C(OC)C(OC)=CC(CC=2N(C3=NC(F)=NC(N)=C3N=2)CCCC#C)=C1Cl KCIOVTSUEXGUFJ-UHFFFAOYSA-N 0.000 description 1
- NKGPJODWTZCHGF-UHFFFAOYSA-N 9-[3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-3h-purine-6-thione Chemical compound OC1C(O)C(CO)OC1N1C(NC=NC2=S)=C2N=C1 NKGPJODWTZCHGF-UHFFFAOYSA-N 0.000 description 1
- FUXVKZWTXQUGMW-UHFFFAOYSA-N 9-amino-20-(r,s)-camptothecin Chemical compound C1=CC(N)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 FUXVKZWTXQUGMW-UHFFFAOYSA-N 0.000 description 1
- TUOSCZDRWRYPRS-UHFFFAOYSA-N 9-butyl-8-(3,4,5-trimethoxybenzyl)-9h-purin-6-amine Chemical compound N=1C2=C(N)N=CN=C2N(CCCC)C=1CC1=CC(OC)=C(OC)C(OC)=C1 TUOSCZDRWRYPRS-UHFFFAOYSA-N 0.000 description 1
- XVMZDZFTCKLZTF-NRFANRHFSA-N 9-methoxycamptothecin Chemical compound C1=CC(OC)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 XVMZDZFTCKLZTF-NRFANRHFSA-N 0.000 description 1
- HPLNQCPCUACXLM-PGUFJCEWSA-N ABT-737 Chemical compound C([C@@H](CCN(C)C)NC=1C(=CC(=CC=1)S(=O)(=O)NC(=O)C=1C=CC(=CC=1)N1CCN(CC=2C(=CC=CC=2)C=2C=CC(Cl)=CC=2)CC1)[N+]([O-])=O)SC1=CC=CC=C1 HPLNQCPCUACXLM-PGUFJCEWSA-N 0.000 description 1
- 101150005096 AKR1 gene Proteins 0.000 description 1
- 101710168331 ALK tyrosine kinase receptor Proteins 0.000 description 1
- 102000013563 Acid Phosphatase Human genes 0.000 description 1
- 108010051457 Acid Phosphatase Proteins 0.000 description 1
- 102100036732 Actin, aortic smooth muscle Human genes 0.000 description 1
- XTWYTFMLZFPYCI-UHFFFAOYSA-N Adenosine diphosphate Natural products C1=NC=2C(N)=NC=NC=2N1C1OC(COP(O)(=O)OP(O)(O)=O)C(O)C1O XTWYTFMLZFPYCI-UHFFFAOYSA-N 0.000 description 1
- TWCMVXMQHSVIOJ-UHFFFAOYSA-N Aglycone of yadanzioside D Natural products COC(=O)C12OCC34C(CC5C(=CC(O)C(O)C5(C)C3C(O)C1O)C)OC(=O)C(OC(=O)C)C24 TWCMVXMQHSVIOJ-UHFFFAOYSA-N 0.000 description 1
- ZGCSNRKSJLVANE-UHFFFAOYSA-N Aglycone-Rebeccamycin Natural products N1C2=C3NC4=C(Cl)C=CC=C4C3=C(C(=O)NC3=O)C3=C2C2=C1C(Cl)=CC=C2 ZGCSNRKSJLVANE-UHFFFAOYSA-N 0.000 description 1
- QXRNAOYBCYVZCD-BQBZGAKWSA-N Ala-Lys Chemical compound C[C@H](N)C(=O)N[C@H](C(O)=O)CCCCN QXRNAOYBCYVZCD-BQBZGAKWSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-UHFFFAOYSA-N Alanine Chemical compound CC([NH3+])C([O-])=O QNAYBMKLOCPYGJ-UHFFFAOYSA-N 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 108010003133 Aldo-Keto Reductase Family 1 Member C2 Proteins 0.000 description 1
- 102100024089 Aldo-keto reductase family 1 member C2 Human genes 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- NMKUAEKKJQYLHK-UHFFFAOYSA-N Allocolchicine Natural products CC(=O)NC1CCC2=CC(OC)=C(OC)C(OC)=C2C2=CC=C(C(=O)OC)C=C21 NMKUAEKKJQYLHK-UHFFFAOYSA-N 0.000 description 1
- 102100040121 Allograft inflammatory factor 1 Human genes 0.000 description 1
- 102100021266 Alpha-(1,6)-fucosyltransferase Human genes 0.000 description 1
- 102100023635 Alpha-fetoprotein Human genes 0.000 description 1
- ATRRKUHOCOJYRX-UHFFFAOYSA-N Ammonium bicarbonate Chemical class [NH4+].OC([O-])=O ATRRKUHOCOJYRX-UHFFFAOYSA-N 0.000 description 1
- 108090000644 Angiozyme Proteins 0.000 description 1
- 102000013918 Apolipoproteins E Human genes 0.000 description 1
- 108010025628 Apolipoproteins E Proteins 0.000 description 1
- 229940085659 Apoptosis stimulant Drugs 0.000 description 1
- 206010073360 Appendix cancer Diseases 0.000 description 1
- 101100330723 Arabidopsis thaliana DAR2 gene Proteins 0.000 description 1
- QJMCHPGWFZZRID-BQBZGAKWSA-N Asn-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@@H](N)CC(N)=O QJMCHPGWFZZRID-BQBZGAKWSA-N 0.000 description 1
- CPMKYMGGYUFOHS-FSPLSTOPSA-N Asp-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@@H](N)CC(O)=O CPMKYMGGYUFOHS-FSPLSTOPSA-N 0.000 description 1
- 108010024976 Asparaginase Proteins 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- PLMKQQMDOMTZGG-UHFFFAOYSA-N Astrantiagenin E-methylester Natural products CC12CCC(O)C(C)(CO)C1CCC1(C)C2CC=C2C3CC(C)(C)CCC3(C(=O)OC)CCC21C PLMKQQMDOMTZGG-UHFFFAOYSA-N 0.000 description 1
- 102000004000 Aurora Kinase A Human genes 0.000 description 1
- 108090000461 Aurora Kinase A Proteins 0.000 description 1
- 102000003989 Aurora kinases Human genes 0.000 description 1
- 108090000433 Aurora kinases Proteins 0.000 description 1
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 1
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 description 1
- 108010074708 B7-H1 Antigen Proteins 0.000 description 1
- 102100035656 BCL2/adenovirus E1B 19 kDa protein-interacting protein 3 Human genes 0.000 description 1
- QULDDKSCVCJTPV-UHFFFAOYSA-N BIIB021 Chemical compound COC1=C(C)C=NC(CN2C3=NC(N)=NC(Cl)=C3N=C2)=C1C QULDDKSCVCJTPV-UHFFFAOYSA-N 0.000 description 1
- 108010077805 Bacterial Proteins Proteins 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 102100035875 C-C chemokine receptor type 5 Human genes 0.000 description 1
- 101710149870 C-C chemokine receptor type 5 Proteins 0.000 description 1
- 108010075254 C-Peptide Proteins 0.000 description 1
- 102100025279 C-X-C motif chemokine 11 Human genes 0.000 description 1
- 125000001433 C-terminal amino-acid group Chemical group 0.000 description 1
- 102100027207 CD27 antigen Human genes 0.000 description 1
- 102100038078 CD276 antigen Human genes 0.000 description 1
- 101710185679 CD276 antigen Proteins 0.000 description 1
- 108010029697 CD40 Ligand Proteins 0.000 description 1
- 102100032937 CD40 ligand Human genes 0.000 description 1
- 102100025221 CD70 antigen Human genes 0.000 description 1
- 108091007914 CDKs Proteins 0.000 description 1
- HAWSQZCWOQZXHI-UHFFFAOYSA-N CPT-OH Natural products C1=C(O)C=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 HAWSQZCWOQZXHI-UHFFFAOYSA-N 0.000 description 1
- 102100035350 CUB domain-containing protein 1 Human genes 0.000 description 1
- FVLVBPDQNARYJU-XAHDHGMMSA-N C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O Chemical compound C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O FVLVBPDQNARYJU-XAHDHGMMSA-N 0.000 description 1
- 101100463133 Caenorhabditis elegans pdl-1 gene Proteins 0.000 description 1
- 102400000113 Calcitonin Human genes 0.000 description 1
- 108060001064 Calcitonin Proteins 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- 101710132601 Capsid protein Proteins 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-N Carbamic acid Chemical group NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 102000004225 Cathepsin B Human genes 0.000 description 1
- 108090000712 Cathepsin B Proteins 0.000 description 1
- 102000003908 Cathepsin D Human genes 0.000 description 1
- 102100032219 Cathepsin D Human genes 0.000 description 1
- 108090000258 Cathepsin D Proteins 0.000 description 1
- 102000005600 Cathepsins Human genes 0.000 description 1
- 108010084457 Cathepsins Proteins 0.000 description 1
- AQKDBFWJOPNOKZ-UHFFFAOYSA-N Celastrol Natural products CC12CCC3(C)C4CC(C)(C(O)=O)CCC4(C)CCC3(C)C2=CC=C2C1=CC(=O)C(=O)C2C AQKDBFWJOPNOKZ-UHFFFAOYSA-N 0.000 description 1
- 229940123587 Cell cycle inhibitor Drugs 0.000 description 1
- 102100025064 Cellular tumor antigen p53 Human genes 0.000 description 1
- 102100025832 Centromere-associated protein E Human genes 0.000 description 1
- 229940124957 Cervarix Drugs 0.000 description 1
- 241001233914 Chelidonium majus Species 0.000 description 1
- 241001227713 Chiron Species 0.000 description 1
- 239000004099 Chlortetracycline Substances 0.000 description 1
- VWFCHDSQECPREK-LURJTMIESA-N Cidofovir Chemical compound NC=1C=CN(C[C@@H](CO)OCP(O)(O)=O)C(=O)N=1 VWFCHDSQECPREK-LURJTMIESA-N 0.000 description 1
- PTOAARAWEBMLNO-KVQBGUIXSA-N Cladribine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PTOAARAWEBMLNO-KVQBGUIXSA-N 0.000 description 1
- 101710094648 Coat protein Proteins 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 102100024335 Collagen alpha-1(VII) chain Human genes 0.000 description 1
- 102100037085 Complement C1q subcomponent subunit B Human genes 0.000 description 1
- 108010060123 Conjugate Vaccines Proteins 0.000 description 1
- 108091035707 Consensus sequence Proteins 0.000 description 1
- 101800000414 Corticotropin Proteins 0.000 description 1
- 239000000055 Corticotropin-Releasing Hormone Substances 0.000 description 1
- 239000004971 Cross linker Substances 0.000 description 1
- 229930188224 Cryptophycin Natural products 0.000 description 1
- 102000003903 Cyclin-dependent kinases Human genes 0.000 description 1
- 108090000266 Cyclin-dependent kinases Proteins 0.000 description 1
- IELOKBJPULMYRW-NJQVLOCASA-N D-alpha-Tocopheryl Acid Succinate Chemical compound OC(=O)CCC(=O)OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C IELOKBJPULMYRW-NJQVLOCASA-N 0.000 description 1
- HEBKCHPVOIAQTA-QWWZWVQMSA-N D-arabinitol Chemical compound OC[C@@H](O)C(O)[C@H](O)CO HEBKCHPVOIAQTA-QWWZWVQMSA-N 0.000 description 1
- RGHNJXZEOKUKBD-SQOUGZDYSA-M D-gluconate Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O RGHNJXZEOKUKBD-SQOUGZDYSA-M 0.000 description 1
- SHZGCJCMOBCMKK-UHFFFAOYSA-N D-mannomethylose Natural products CC1OC(O)C(O)C(O)C1O SHZGCJCMOBCMKK-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 1
- 239000012624 DNA alkylating agent Substances 0.000 description 1
- 102100026139 DNA damage-inducible transcript 4 protein Human genes 0.000 description 1
- 230000004543 DNA replication Effects 0.000 description 1
- 238000001712 DNA sequencing Methods 0.000 description 1
- 101100481408 Danio rerio tie2 gene Proteins 0.000 description 1
- 102000010170 Death domains Human genes 0.000 description 1
- 108050001718 Death domains Proteins 0.000 description 1
- 102100033553 Delta-like protein 4 Human genes 0.000 description 1
- NNJPGOLRFBJNIW-UHFFFAOYSA-N Demecolcine Natural products C1=C(OC)C(=O)C=C2C(NC)CCC3=CC(OC)=C(OC)C(OC)=C3C2=C1 NNJPGOLRFBJNIW-UHFFFAOYSA-N 0.000 description 1
- FMTDIUIBLCQGJB-UHFFFAOYSA-N Demethylchlortetracyclin Natural products C1C2C(O)C3=C(Cl)C=CC(O)=C3C(=O)C2=C(O)C2(O)C1C(N(C)C)C(O)=C(C(N)=O)C2=O FMTDIUIBLCQGJB-UHFFFAOYSA-N 0.000 description 1
- 108010002156 Depsipeptides Proteins 0.000 description 1
- 101000582926 Dictyostelium discoideum Probable serine/threonine-protein kinase PLK Proteins 0.000 description 1
- ASXBYYWOLISCLQ-UHFFFAOYSA-N Dihydrostreptomycin Natural products O1C(CO)C(O)C(O)C(NC)C1OC1C(CO)(O)C(C)OC1OC1C(N=C(N)N)C(O)C(N=C(N)N)C(O)C1O ASXBYYWOLISCLQ-UHFFFAOYSA-N 0.000 description 1
- 102000016607 Diphtheria Toxin Human genes 0.000 description 1
- 108010053187 Diphtheria Toxin Proteins 0.000 description 1
- AADVCYNFEREWOS-OBRABYBLSA-N Discodermolide Chemical compound C=C\C=C/[C@H](C)[C@H](OC(N)=O)[C@@H](C)[C@H](O)[C@@H](C)C\C(C)=C/[C@H](C)[C@@H](O)[C@@H](C)\C=C/[C@@H](O)C[C@@H]1OC(=O)[C@H](C)[C@@H](O)[C@H]1C AADVCYNFEREWOS-OBRABYBLSA-N 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- XXPXYPLPSDPERN-UHFFFAOYSA-N Ecteinascidin 743 Natural products COc1cc2C(NCCc2cc1O)C(=O)OCC3N4C(O)C5Cc6cc(C)c(OC)c(O)c6C(C4C(S)c7c(OC(=O)C)c(C)c8OCOc8c37)N5C XXPXYPLPSDPERN-UHFFFAOYSA-N 0.000 description 1
- 102100029722 Ectonucleoside triphosphate diphosphohydrolase 1 Human genes 0.000 description 1
- 206010014733 Endometrial cancer Diseases 0.000 description 1
- 206010014759 Endometrial neoplasm Diseases 0.000 description 1
- SAMRUMKYXPVKPA-VFKOLLTISA-N Enocitabine Chemical compound O=C1N=C(NC(=O)CCCCCCCCCCCCCCCCCCCCC)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 SAMRUMKYXPVKPA-VFKOLLTISA-N 0.000 description 1
- 101000877447 Enterobacteria phage T4 Endonuclease V Proteins 0.000 description 1
- YQYJSBFKSSDGFO-UHFFFAOYSA-N Epihygromycin Natural products OC1C(O)C(C(=O)C)OC1OC(C(=C1)O)=CC=C1C=C(C)C(=O)NC1C(O)C(O)C2OCOC2C1O YQYJSBFKSSDGFO-UHFFFAOYSA-N 0.000 description 1
- 206010073064 Epithelioid mesothelioma Diseases 0.000 description 1
- QXRSDHAAWVKZLJ-OXZHEXMSSA-N Epothilone B Natural products O=C1[C@H](C)[C@H](O)[C@@H](C)CCC[C@@]2(C)O[C@H]2C[C@@H](/C(=C\c2nc(C)sc2)/C)OC(=O)C[C@H](O)C1(C)C QXRSDHAAWVKZLJ-OXZHEXMSSA-N 0.000 description 1
- XOZIUKBZLSUILX-SDMHVBBESA-N Epothilone D Natural products O=C1[C@H](C)[C@@H](O)[C@@H](C)CCC/C(/C)=C/C[C@@H](/C(=C\c2nc(C)sc2)/C)OC(=O)C[C@H](O)C1(C)C XOZIUKBZLSUILX-SDMHVBBESA-N 0.000 description 1
- 239000004386 Erythritol Substances 0.000 description 1
- UNXHWFMMPAWVPI-UHFFFAOYSA-N Erythritol Natural products OCC(O)C(O)CO UNXHWFMMPAWVPI-UHFFFAOYSA-N 0.000 description 1
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical group OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 108091029865 Exogenous DNA Proteins 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- UKCVAQGKEOJTSR-UHFFFAOYSA-N Fadrozole hydrochloride Chemical compound Cl.C1=CC(C#N)=CC=C1C1N2C=NC=C2CCC1 UKCVAQGKEOJTSR-UHFFFAOYSA-N 0.000 description 1
- 229940124226 Farnesyltransferase inhibitor Drugs 0.000 description 1
- 102000008857 Ferritin Human genes 0.000 description 1
- 108050000784 Ferritin Proteins 0.000 description 1
- 238000008416 Ferritin Methods 0.000 description 1
- KRHYYFGTRYWZRS-UHFFFAOYSA-M Fluoride anion Chemical compound [F-] KRHYYFGTRYWZRS-UHFFFAOYSA-M 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- 102100022629 Fructose-2,6-bisphosphatase Human genes 0.000 description 1
- PNNNRSAQSRJVSB-SLPGGIOYSA-N Fucose Natural products C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)C=O PNNNRSAQSRJVSB-SLPGGIOYSA-N 0.000 description 1
- 229940032072 GVAX vaccine Drugs 0.000 description 1
- 229910052688 Gadolinium Inorganic materials 0.000 description 1
- RVAQIUULWULRNW-UHFFFAOYSA-N Ganetespib Chemical compound C1=C(O)C(C(C)C)=CC(C=2N(C(O)=NN=2)C=2C=C3C=CN(C)C3=CC=2)=C1O RVAQIUULWULRNW-UHFFFAOYSA-N 0.000 description 1
- 229940124897 Gardasil Drugs 0.000 description 1
- 102400000921 Gastrin Human genes 0.000 description 1
- 108010052343 Gastrins Proteins 0.000 description 1
- 206010017993 Gastrointestinal neoplasms Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- JRZJKWGQFNTSRN-UHFFFAOYSA-N Geldanamycin Natural products C1C(C)CC(OC)C(O)C(C)C=C(C)C(OC(N)=O)C(OC)CCC=C(C)C(=O)NC2=CC(=O)C(OC)=C1C2=O JRZJKWGQFNTSRN-UHFFFAOYSA-N 0.000 description 1
- 229930182566 Gentamicin Natural products 0.000 description 1
- CEAZRRDELHUEMR-URQXQFDESA-N Gentamicin Chemical compound O1[C@H](C(C)NC)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](NC)[C@@](C)(O)CO2)O)[C@H](N)C[C@@H]1N CEAZRRDELHUEMR-URQXQFDESA-N 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 108010053070 Glutathione Disulfide Proteins 0.000 description 1
- 108010009504 Gly-Phe-Leu-Gly Proteins 0.000 description 1
- 102100021181 Golgi phosphoprotein 3 Human genes 0.000 description 1
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 1
- 102000001398 Granzyme Human genes 0.000 description 1
- 108060005986 Granzyme Proteins 0.000 description 1
- 102100030385 Granzyme B Human genes 0.000 description 1
- 244000041633 Grewia tenax Species 0.000 description 1
- 235000005612 Grewia tenax Nutrition 0.000 description 1
- 102100030595 HLA class II histocompatibility antigen gamma chain Human genes 0.000 description 1
- 102100034458 Hepatitis A virus cellular receptor 2 Human genes 0.000 description 1
- 102100022623 Hepatocyte growth factor receptor Human genes 0.000 description 1
- SQUHHTBVTRBESD-UHFFFAOYSA-N Hexa-Ac-myo-Inositol Natural products CC(=O)OC1C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C1OC(C)=O SQUHHTBVTRBESD-UHFFFAOYSA-N 0.000 description 1
- FRJIAZKQGSCKPQ-FSPLSTOPSA-N His-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@@H](N)CC1=CN=CN1 FRJIAZKQGSCKPQ-FSPLSTOPSA-N 0.000 description 1
- VLDVBZICYBVQHB-IUCAKERBSA-N His-Val Chemical compound CC(C)[C@@H](C([O-])=O)NC(=O)[C@@H]([NH3+])CC1=CN=CN1 VLDVBZICYBVQHB-IUCAKERBSA-N 0.000 description 1
- 101000600756 Homo sapiens 3-phosphoinositide-dependent protein kinase 1 Proteins 0.000 description 1
- 101000678236 Homo sapiens 5'-nucleotidase Proteins 0.000 description 1
- 101000929319 Homo sapiens Actin, aortic smooth muscle Proteins 0.000 description 1
- 101000890626 Homo sapiens Allograft inflammatory factor 1 Proteins 0.000 description 1
- 101000819490 Homo sapiens Alpha-(1,6)-fucosyltransferase Proteins 0.000 description 1
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 1
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 description 1
- 101000803294 Homo sapiens BCL2/adenovirus E1B 19 kDa protein-interacting protein 3 Proteins 0.000 description 1
- 101000858060 Homo sapiens C-X-C motif chemokine 11 Proteins 0.000 description 1
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 description 1
- 101000934356 Homo sapiens CD70 antigen Proteins 0.000 description 1
- 101000737742 Homo sapiens CUB domain-containing protein 1 Proteins 0.000 description 1
- 101000914324 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 5 Proteins 0.000 description 1
- 101000914321 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 7 Proteins 0.000 description 1
- 101000869010 Homo sapiens Cathepsin D Proteins 0.000 description 1
- 101000721661 Homo sapiens Cellular tumor antigen p53 Proteins 0.000 description 1
- 101000914247 Homo sapiens Centromere-associated protein E Proteins 0.000 description 1
- 101000909498 Homo sapiens Collagen alpha-1(VII) chain Proteins 0.000 description 1
- 101000740680 Homo sapiens Complement C1q subcomponent subunit B Proteins 0.000 description 1
- 101000912753 Homo sapiens DNA damage-inducible transcript 4 protein Proteins 0.000 description 1
- 101000872077 Homo sapiens Delta-like protein 4 Proteins 0.000 description 1
- 101001012447 Homo sapiens Ectonucleoside triphosphate diphosphohydrolase 1 Proteins 0.000 description 1
- 101500025419 Homo sapiens Epidermal growth factor Proteins 0.000 description 1
- 101000823463 Homo sapiens Fructose-2,6-bisphosphatase Proteins 0.000 description 1
- 101001009603 Homo sapiens Granzyme B Proteins 0.000 description 1
- 101001082627 Homo sapiens HLA class II histocompatibility antigen gamma chain Proteins 0.000 description 1
- 101001068133 Homo sapiens Hepatitis A virus cellular receptor 2 Proteins 0.000 description 1
- 101000972946 Homo sapiens Hepatocyte growth factor receptor Proteins 0.000 description 1
- 101001034652 Homo sapiens Insulin-like growth factor 1 receptor Proteins 0.000 description 1
- 101001044927 Homo sapiens Insulin-like growth factor-binding protein 3 Proteins 0.000 description 1
- 101001046686 Homo sapiens Integrin alpha-M Proteins 0.000 description 1
- 101001082070 Homo sapiens Interferon alpha-inducible protein 6 Proteins 0.000 description 1
- 101000599940 Homo sapiens Interferon gamma Proteins 0.000 description 1
- 101000604590 Homo sapiens Keratin, type I cuticular Ha3-I Proteins 0.000 description 1
- 101001039113 Homo sapiens Leucine-rich repeat-containing protein 15 Proteins 0.000 description 1
- 101000868279 Homo sapiens Leukocyte surface antigen CD47 Proteins 0.000 description 1
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 description 1
- 101000917839 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-B Proteins 0.000 description 1
- 101001065609 Homo sapiens Lumican Proteins 0.000 description 1
- 101000934372 Homo sapiens Macrosialin Proteins 0.000 description 1
- 101001011906 Homo sapiens Matrix metalloproteinase-14 Proteins 0.000 description 1
- 101000956317 Homo sapiens Membrane-spanning 4-domains subfamily A member 4A Proteins 0.000 description 1
- 101001014567 Homo sapiens Membrane-spanning 4-domains subfamily A member 7 Proteins 0.000 description 1
- 101000623901 Homo sapiens Mucin-16 Proteins 0.000 description 1
- 101000604123 Homo sapiens Noggin Proteins 0.000 description 1
- 101000595746 Homo sapiens Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit delta isoform Proteins 0.000 description 1
- 101000579123 Homo sapiens Phosphoglycerate kinase 1 Proteins 0.000 description 1
- 101000935642 Homo sapiens Phosphoinositide 3-kinase adapter protein 1 Proteins 0.000 description 1
- 101001126417 Homo sapiens Platelet-derived growth factor receptor alpha Proteins 0.000 description 1
- 101000617725 Homo sapiens Pregnancy-specific beta-1-glycoprotein 2 Proteins 0.000 description 1
- 101000595907 Homo sapiens Procollagen-lysine,2-oxoglutarate 5-dioxygenase 2 Proteins 0.000 description 1
- 101001117317 Homo sapiens Programmed cell death 1 ligand 1 Proteins 0.000 description 1
- 101000881678 Homo sapiens Prolyl hydroxylase EGLN3 Proteins 0.000 description 1
- 101000804792 Homo sapiens Protein Wnt-5a Proteins 0.000 description 1
- 101000984753 Homo sapiens Serine/threonine-protein kinase B-raf Proteins 0.000 description 1
- 101000701446 Homo sapiens Stanniocalcin-2 Proteins 0.000 description 1
- 101000577874 Homo sapiens Stromelysin-2 Proteins 0.000 description 1
- 101000831007 Homo sapiens T-cell immunoreceptor with Ig and ITIM domains Proteins 0.000 description 1
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 1
- 101000976959 Homo sapiens Transcription factor 4 Proteins 0.000 description 1
- 101000596771 Homo sapiens Transcription factor 7-like 2 Proteins 0.000 description 1
- 101000635938 Homo sapiens Transforming growth factor beta-1 proprotein Proteins 0.000 description 1
- 101000635958 Homo sapiens Transforming growth factor beta-2 proprotein Proteins 0.000 description 1
- 101000801234 Homo sapiens Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 description 1
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 description 1
- 101000851007 Homo sapiens Vascular endothelial growth factor receptor 2 Proteins 0.000 description 1
- 101001117146 Homo sapiens [Pyruvate dehydrogenase (acetyl-transferring)] kinase isozyme 1, mitochondrial Proteins 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- GRRNUXAQVGOGFE-UHFFFAOYSA-N Hygromycin-B Natural products OC1C(NC)CC(N)C(O)C1OC1C2OC3(C(C(O)C(O)C(C(N)CO)O3)O)OC2C(O)C(CO)O1 GRRNUXAQVGOGFE-UHFFFAOYSA-N 0.000 description 1
- 206010021143 Hypoxia Diseases 0.000 description 1
- 108010023610 IL13-PE38 Proteins 0.000 description 1
- MPBVHIBUJCELCL-UHFFFAOYSA-N Ibandronate Chemical compound CCCCCN(C)CCC(O)(P(O)(O)=O)P(O)(O)=O MPBVHIBUJCELCL-UHFFFAOYSA-N 0.000 description 1
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 1
- BBIXOODYWPFNDT-CIUDSAMLSA-N Ile-Pro Chemical compound CC[C@H](C)[C@H](N)C(=O)N1CCC[C@H]1C(O)=O BBIXOODYWPFNDT-CIUDSAMLSA-N 0.000 description 1
- BCXBIONYYJCSDF-CIUDSAMLSA-N Ile-Val Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](C(C)C)C(O)=O BCXBIONYYJCSDF-CIUDSAMLSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000018071 Immunoglobulin Fc Fragments Human genes 0.000 description 1
- 108010091135 Immunoglobulin Fc Fragments Proteins 0.000 description 1
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 1
- 229930010555 Inosine Natural products 0.000 description 1
- 102100039688 Insulin-like growth factor 1 receptor Human genes 0.000 description 1
- 102100022708 Insulin-like growth factor-binding protein 3 Human genes 0.000 description 1
- 102100022338 Integrin alpha-M Human genes 0.000 description 1
- 102100022297 Integrin alpha-X Human genes 0.000 description 1
- 102100027354 Interferon alpha-inducible protein 6 Human genes 0.000 description 1
- 102100037850 Interferon gamma Human genes 0.000 description 1
- 108090000467 Interferon-beta Proteins 0.000 description 1
- 102000003996 Interferon-beta Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 102000004889 Interleukin-6 Human genes 0.000 description 1
- 102000002698 KIR Receptors Human genes 0.000 description 1
- 108010043610 KIR Receptors Proteins 0.000 description 1
- 101150069255 KLRC1 gene Proteins 0.000 description 1
- 102100038185 Keratin, type I cuticular Ha3-I Human genes 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- 102000011743 Kisspeptin-1 Receptors Human genes 0.000 description 1
- 108010076800 Kisspeptin-1 Receptors Proteins 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- MLFKVJCWGUZWNV-UHFFFAOYSA-N L-alanosine Natural products OC(=O)C(N)CN(O)N=O MLFKVJCWGUZWNV-UHFFFAOYSA-N 0.000 description 1
- SHZGCJCMOBCMKK-DHVFOXMCSA-N L-fucopyranose Chemical compound C[C@@H]1OC(O)[C@@H](O)[C@H](O)[C@@H]1O SHZGCJCMOBCMKK-DHVFOXMCSA-N 0.000 description 1
- 101710159002 L-lactate oxidase Proteins 0.000 description 1
- 239000004395 L-leucine Substances 0.000 description 1
- 235000019454 L-leucine Nutrition 0.000 description 1
- 239000005411 L01XE02 - Gefitinib Substances 0.000 description 1
- 239000002138 L01XE21 - Regorafenib Substances 0.000 description 1
- 239000002176 L01XE26 - Cabozantinib Substances 0.000 description 1
- 239000002177 L01XE27 - Ibrutinib Substances 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- 108010062867 Lenograstim Proteins 0.000 description 1
- LMVRPBWWHMVLPC-KBPJCXPTSA-N Leptolstatin Natural products CC(CC=CC(=CC(C)C(=O)C(C)C(O)C(C)CC(=CCO)C)C)C=C(C)/C=C/C1CC=CC(=O)O1 LMVRPBWWHMVLPC-KBPJCXPTSA-N 0.000 description 1
- YACHGFWEQXFSBS-UHFFFAOYSA-N Leptomycin B Natural products OC(=O)C=C(C)CC(C)C(O)C(C)C(=O)C(C)C=C(C)C=CCC(C)C=C(CC)C=CC1OC(=O)C=CC1C YACHGFWEQXFSBS-UHFFFAOYSA-N 0.000 description 1
- 102100040645 Leucine-rich repeat-containing protein 15 Human genes 0.000 description 1
- 102100032913 Leukocyte surface antigen CD47 Human genes 0.000 description 1
- OJMMVQQUTAEWLP-UHFFFAOYSA-N Lincomycin Natural products CN1CC(CCC)CC1C(=O)NC(C(C)O)C1C(O)C(O)C(O)C(SC)O1 OJMMVQQUTAEWLP-UHFFFAOYSA-N 0.000 description 1
- 239000000232 Lipid Bilayer Substances 0.000 description 1
- 102100029185 Low affinity immunoglobulin gamma Fc region receptor III-B Human genes 0.000 description 1
- 102100032114 Lumican Human genes 0.000 description 1
- 239000012819 MDM2-Inhibitor Substances 0.000 description 1
- 101100404845 Macaca mulatta NKG2A gene Proteins 0.000 description 1
- 102100025136 Macrosialin Human genes 0.000 description 1
- 101710125418 Major capsid protein Proteins 0.000 description 1
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 102100030216 Matrix metalloproteinase-14 Human genes 0.000 description 1
- 229930126263 Maytansine Natural products 0.000 description 1
- 101150031009 Mcpt8 gene Proteins 0.000 description 1
- 208000000172 Medulloblastoma Diseases 0.000 description 1
- 102100032512 Membrane-spanning 4-domains subfamily A member 7 Human genes 0.000 description 1
- IMTUWVJPCQPJEE-IUCAKERBSA-N Met-Lys Chemical compound CSCC[C@H](N)C(=O)N[C@H](C(O)=O)CCCCN IMTUWVJPCQPJEE-IUCAKERBSA-N 0.000 description 1
- 108700011259 MicroRNAs Proteins 0.000 description 1
- 102000029749 Microtubule Human genes 0.000 description 1
- 108091022875 Microtubule Proteins 0.000 description 1
- DMUAPQTXSSNEDD-QALJCMCCSA-N Midecamycin Chemical compound C1[C@](O)(C)[C@@H](OC(=O)CC)[C@H](C)O[C@H]1O[C@H]1[C@H](N(C)C)[C@@H](O)[C@H](O[C@@H]2[C@H]([C@H](OC(=O)CC)CC(=O)O[C@H](C)C/C=C/C=C/[C@H](O)[C@H](C)C[C@@H]2CC=O)OC)O[C@@H]1C DMUAPQTXSSNEDD-QALJCMCCSA-N 0.000 description 1
- 102100023123 Mucin-16 Human genes 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 101100481410 Mus musculus Tek gene Proteins 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 102100038895 Myc proto-oncogene protein Human genes 0.000 description 1
- 101710135898 Myc proto-oncogene protein Proteins 0.000 description 1
- 241001467552 Mycobacterium bovis BCG Species 0.000 description 1
- 206010073137 Myxoid liposarcoma Diseases 0.000 description 1
- HRNLUBSXIHFDHP-UHFFFAOYSA-N N-(2-aminophenyl)-4-[[[4-(3-pyridinyl)-2-pyrimidinyl]amino]methyl]benzamide Chemical compound NC1=CC=CC=C1NC(=O)C(C=C1)=CC=C1CNC1=NC=CC(C=2C=NC=CC=2)=N1 HRNLUBSXIHFDHP-UHFFFAOYSA-N 0.000 description 1
- URCVCIZFVQDVPM-UHFFFAOYSA-N N-[2-(4-hydroxyanilino)-3-pyridinyl]-4-methoxybenzenesulfonamide Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)NC1=CC=CN=C1NC1=CC=C(O)C=C1 URCVCIZFVQDVPM-UHFFFAOYSA-N 0.000 description 1
- YALNUENQHAQXEA-UHFFFAOYSA-N N-[4-[(hydroxyamino)-oxomethyl]phenyl]carbamic acid [6-(diethylaminomethyl)-2-naphthalenyl]methyl ester Chemical compound C1=CC2=CC(CN(CC)CC)=CC=C2C=C1COC(=O)NC1=CC=C(C(=O)NO)C=C1 YALNUENQHAQXEA-UHFFFAOYSA-N 0.000 description 1
- LKJPYSCBVHEWIU-UHFFFAOYSA-N N-[4-cyano-3-(trifluoromethyl)phenyl]-3-[(4-fluorophenyl)sulfonyl]-2-hydroxy-2-methylpropanamide Chemical compound C=1C=C(C#N)C(C(F)(F)F)=CC=1NC(=O)C(O)(C)CS(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-UHFFFAOYSA-N 0.000 description 1
- TZYWCYJVHRLUCT-VABKMULXSA-N N-benzyloxycarbonyl-L-leucyl-L-leucyl-L-leucinal Chemical compound CC(C)C[C@@H](C=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(C)C)NC(=O)OCC1=CC=CC=C1 TZYWCYJVHRLUCT-VABKMULXSA-N 0.000 description 1
- 108010072915 NAc-Sar-Gly-Val-(d-allo-Ile)-Thr-Nva-Ile-Arg-ProNEt Proteins 0.000 description 1
- 102100031911 NEDD8 Human genes 0.000 description 1
- 108700004934 NEDD8 Proteins 0.000 description 1
- 101150107958 NEDD8 gene Proteins 0.000 description 1
- 108010057466 NF-kappa B Proteins 0.000 description 1
- 102000003945 NF-kappa B Human genes 0.000 description 1
- 102100022682 NKG2-A/NKG2-B type II integral membrane protein Human genes 0.000 description 1
- 241001045988 Neogene Species 0.000 description 1
- 229930193140 Neomycin Natural products 0.000 description 1
- 206010061309 Neoplasm progression Diseases 0.000 description 1
- 101100215778 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) ptr-1 gene Proteins 0.000 description 1
- AFLXUQUGROGEFA-UHFFFAOYSA-N Nitrogen mustard N-oxide Chemical compound ClCC[N+]([O-])(C)CCCl AFLXUQUGROGEFA-UHFFFAOYSA-N 0.000 description 1
- KYRVNWMVYQXFEU-UHFFFAOYSA-N Nocodazole Chemical compound C1=C2NC(NC(=O)OC)=NC2=CC=C1C(=O)C1=CC=CS1 KYRVNWMVYQXFEU-UHFFFAOYSA-N 0.000 description 1
- 102100038454 Noggin Human genes 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 101710141454 Nucleoprotein Proteins 0.000 description 1
- 102000004473 OX40 Ligand Human genes 0.000 description 1
- 108010042215 OX40 Ligand Proteins 0.000 description 1
- 239000004104 Oleandomycin Substances 0.000 description 1
- RZPAKFUAFGMUPI-UHFFFAOYSA-N Oleandomycin Natural products O1C(C)C(O)C(OC)CC1OC1C(C)C(=O)OC(C)C(C)C(O)C(C)C(=O)C2(OC2)CC(C)C(OC2C(C(CC(C)O2)N(C)C)O)C1C RZPAKFUAFGMUPI-UHFFFAOYSA-N 0.000 description 1
- 108700020796 Oncogene Proteins 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- 101100532088 Oryza sativa subsp. japonica RUB2 gene Proteins 0.000 description 1
- 101100532090 Oryza sativa subsp. japonica RUB3 gene Proteins 0.000 description 1
- 239000004100 Oxytetracycline Substances 0.000 description 1
- 229940029536 PANVAC Drugs 0.000 description 1
- 239000012661 PARP inhibitor Substances 0.000 description 1
- KJWZYMMLVHIVSU-IYCNHOCDSA-N PGK1 Chemical compound CCCCC[C@H](O)\C=C\[C@@H]1[C@@H](CCCCCCC(O)=O)C(=O)CC1=O KJWZYMMLVHIVSU-IYCNHOCDSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 108010025700 PR-171 Proteins 0.000 description 1
- 244000131316 Panax pseudoginseng Species 0.000 description 1
- 235000005035 Panax pseudoginseng ssp. pseudoginseng Nutrition 0.000 description 1
- 235000003140 Panax quinquefolius Nutrition 0.000 description 1
- 102000018886 Pancreatic Polypeptide Human genes 0.000 description 1
- 208000037273 Pathologic Processes Diseases 0.000 description 1
- 108010057150 Peplomycin Proteins 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 108090000279 Peptidyltransferases Proteins 0.000 description 1
- KHGNFPUMBJSZSM-UHFFFAOYSA-N Perforine Natural products COC1=C2CCC(O)C(CCC(C)(C)O)(OC)C2=NC2=C1C=CO2 KHGNFPUMBJSZSM-UHFFFAOYSA-N 0.000 description 1
- 206010057249 Phagocytosis Diseases 0.000 description 1
- OZILORBBPKKGRI-RYUDHWBXSA-N Phe-Arg Chemical compound NC(N)=NCCC[C@@H](C(O)=O)NC(=O)[C@@H](N)CC1=CC=CC=C1 OZILORBBPKKGRI-RYUDHWBXSA-N 0.000 description 1
- 102100036056 Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit delta isoform Human genes 0.000 description 1
- 102100028251 Phosphoglycerate kinase 1 Human genes 0.000 description 1
- 102100028238 Phosphoinositide 3-kinase adapter protein 1 Human genes 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 108010022233 Plasminogen Activator Inhibitor 1 Proteins 0.000 description 1
- 102100039418 Plasminogen activator inhibitor 1 Human genes 0.000 description 1
- 102100030485 Platelet-derived growth factor receptor alpha Human genes 0.000 description 1
- 229940121906 Poly ADP ribose polymerase inhibitor Drugs 0.000 description 1
- 229920000776 Poly(Adenosine diphosphate-ribose) polymerase Polymers 0.000 description 1
- 229930182556 Polyacetal Natural products 0.000 description 1
- 241001505332 Polyomavirus sp. Species 0.000 description 1
- HLCFGWHYROZGBI-JJKGCWMISA-M Potassium gluconate Chemical compound [K+].OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O HLCFGWHYROZGBI-JJKGCWMISA-M 0.000 description 1
- 102100025067 Potassium voltage-gated channel subfamily H member 4 Human genes 0.000 description 1
- 101710163352 Potassium voltage-gated channel subfamily H member 4 Proteins 0.000 description 1
- 102100022019 Pregnancy-specific beta-1-glycoprotein 2 Human genes 0.000 description 1
- 108010079780 Pristinamycin Proteins 0.000 description 1
- RLNUPSVMIYRZSM-UHFFFAOYSA-N Pristinamycin Natural products CC1OC(=O)C(C=2C=CC=CC=2)NC(=O)C2CC(=O)CCN2C(=O)C(CC=2C=CC(=CC=2)N(C)C)CCN(C)C(=O)C2CCCN2C(=O)C(CC)NC(=O)C1NC(=O)C1=NC=CC=C1O RLNUPSVMIYRZSM-UHFFFAOYSA-N 0.000 description 1
- 102100027467 Pro-opiomelanocortin Human genes 0.000 description 1
- 101710083689 Probable capsid protein Proteins 0.000 description 1
- 102100035198 Procollagen-lysine,2-oxoglutarate 5-dioxygenase 2 Human genes 0.000 description 1
- 102100037247 Prolyl hydroxylase EGLN3 Human genes 0.000 description 1
- 229940079156 Proteasome inhibitor Drugs 0.000 description 1
- 102000006010 Protein Disulfide-Isomerase Human genes 0.000 description 1
- 102000001253 Protein Kinase Human genes 0.000 description 1
- 102100026858 Protein-lysine 6-oxidase Human genes 0.000 description 1
- 108010090931 Proto-Oncogene Proteins c-bcl-2 Proteins 0.000 description 1
- 102000013535 Proto-Oncogene Proteins c-bcl-2 Human genes 0.000 description 1
- XESARGFCSKSFID-UHFFFAOYSA-N Pyrazofurin Natural products OC1=C(C(=O)N)NN=C1C1C(O)C(O)C(CO)O1 XESARGFCSKSFID-UHFFFAOYSA-N 0.000 description 1
- 241000219492 Quercus Species 0.000 description 1
- 238000003559 RNA-seq method Methods 0.000 description 1
- MUPFEKGTMRGPLJ-RMMQSMQOSA-N Raffinose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 MUPFEKGTMRGPLJ-RMMQSMQOSA-N 0.000 description 1
- CAYGMWMWJUFODP-UWQYKGISSA-N Ratjadone Natural products CC=CC1OC(CC(O)C1C)C(O)C=CC=C(/C)CC(C)C=C(C)/C=C/C2CC=CC(=O)O2 CAYGMWMWJUFODP-UWQYKGISSA-N 0.000 description 1
- QEHOIJJIZXRMAN-UHFFFAOYSA-N Rebeccamycin Natural products OC1C(O)C(OC)C(CO)OC1N1C2=C3NC4=C(Cl)C=CC=C4C3=C3C(=O)NC(=O)C3=C2C2=CC=CC(Cl)=C21 QEHOIJJIZXRMAN-UHFFFAOYSA-N 0.000 description 1
- 101710100968 Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- JVWLUVNSQYXYBE-UHFFFAOYSA-N Ribitol Natural products OCC(C)C(O)C(O)CO JVWLUVNSQYXYBE-UHFFFAOYSA-N 0.000 description 1
- 108010083644 Ribonucleases Proteins 0.000 description 1
- 102000006382 Ribonucleases Human genes 0.000 description 1
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 1
- URWAJWIAIPFPJE-UHFFFAOYSA-N Rickamicin Natural products O1CC(O)(C)C(NC)C(O)C1OC1C(O)C(OC2C(CC=C(CN)O2)N)C(N)CC1N URWAJWIAIPFPJE-UHFFFAOYSA-N 0.000 description 1
- NCDNCNXCDXHOMX-UHFFFAOYSA-N Ritonavir Natural products C=1C=CC=CC=1CC(NC(=O)OCC=1SC=NC=1)C(O)CC(CC=1C=CC=CC=1)NC(=O)C(C(C)C)NC(=O)N(C)CC1=CSC(C(C)C)=N1 NCDNCNXCDXHOMX-UHFFFAOYSA-N 0.000 description 1
- 108010044012 STAT1 Transcription Factor Proteins 0.000 description 1
- BFZKMNSQCNVFGM-UCEYFQQTSA-N Sagopilone Chemical compound O1C(=O)C[C@H](O)C(C)(C)C(=O)[C@H](CC=C)[C@@H](O)[C@@H](C)CCC[C@@]2(C)O[C@H]2C[C@H]1C1=CC=C(SC(C)=N2)C2=C1 BFZKMNSQCNVFGM-UCEYFQQTSA-N 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- 102100027103 Serine/threonine-protein kinase B-raf Human genes 0.000 description 1
- 102100029904 Signal transducer and activator of transcription 1-alpha/beta Human genes 0.000 description 1
- 229920000519 Sizofiran Polymers 0.000 description 1
- 108020004459 Small interfering RNA Proteins 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 108010017622 Somatomedin Receptors Proteins 0.000 description 1
- 102000004584 Somatomedin Receptors Human genes 0.000 description 1
- 239000004187 Spiramycin Substances 0.000 description 1
- UQZIYBXSHAGNOE-USOSMYMVSA-N Stachyose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@H](CO[C@@H]2[C@@H](O)[C@@H](O)[C@@H](O)[C@H](CO)O2)O1 UQZIYBXSHAGNOE-USOSMYMVSA-N 0.000 description 1
- 102100030510 Stanniocalcin-2 Human genes 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 108010034396 Streptogramins Proteins 0.000 description 1
- 241000187747 Streptomyces Species 0.000 description 1
- ZSJLQEPLLKMAKR-UHFFFAOYSA-N Streptozotocin Natural products O=NN(C)C(=O)NC1C(O)OC(CO)C(O)C1O ZSJLQEPLLKMAKR-UHFFFAOYSA-N 0.000 description 1
- 102100028848 Stromelysin-2 Human genes 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 239000012505 Superdex™ Substances 0.000 description 1
- 101100215487 Sus scrofa ADRA2A gene Proteins 0.000 description 1
- 101000983124 Sus scrofa Pancreatic prohormone precursor Proteins 0.000 description 1
- 229940126530 T cell activator Drugs 0.000 description 1
- 101710090983 T-cell immunoreceptor with Ig and ITIM domains Proteins 0.000 description 1
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 1
- 108700011582 TER 286 Proteins 0.000 description 1
- 102100033456 TGF-beta receptor type-1 Human genes 0.000 description 1
- 102000013530 TOR Serine-Threonine Kinases Human genes 0.000 description 1
- 108010065917 TOR Serine-Threonine Kinases Proteins 0.000 description 1
- 229940123237 Taxane Drugs 0.000 description 1
- WFWLQNSHRPWKFK-UHFFFAOYSA-N Tegafur Chemical compound O=C1NC(=O)C(F)=CN1C1OCCC1 WFWLQNSHRPWKFK-UHFFFAOYSA-N 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-N Thiophosphoric acid Chemical group OP(O)(S)=O RYYWUUFWQRZTIU-UHFFFAOYSA-N 0.000 description 1
- 102100033504 Thyroglobulin Human genes 0.000 description 1
- 108010034949 Thyroglobulin Proteins 0.000 description 1
- IVTVGDXNLFLDRM-HNNXBMFYSA-N Tomudex Chemical compound C=1C=C2NC(C)=NC(=O)C2=CC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)S1 IVTVGDXNLFLDRM-HNNXBMFYSA-N 0.000 description 1
- IWEQQRMGNVVKQW-OQKDUQJOSA-N Toremifene citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 IWEQQRMGNVVKQW-OQKDUQJOSA-N 0.000 description 1
- 102100023489 Transcription factor 4 Human genes 0.000 description 1
- 101710150448 Transcriptional regulator Myc Proteins 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 108010011702 Transforming Growth Factor-beta Type I Receptor Proteins 0.000 description 1
- 102000009618 Transforming Growth Factors Human genes 0.000 description 1
- 108010009583 Transforming Growth Factors Proteins 0.000 description 1
- 102100030742 Transforming growth factor beta-1 proprotein Human genes 0.000 description 1
- 102100030737 Transforming growth factor beta-2 proprotein Human genes 0.000 description 1
- 229930189037 Trapoxin Natural products 0.000 description 1
- YCPOZVAOBBQLRI-WDSKDSINSA-N Treosulfan Chemical compound CS(=O)(=O)OC[C@H](O)[C@@H](O)COS(C)(=O)=O YCPOZVAOBBQLRI-WDSKDSINSA-N 0.000 description 1
- 108010050144 Triptorelin Pamoate Proteins 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 102100040247 Tumor necrosis factor Human genes 0.000 description 1
- 102100033728 Tumor necrosis factor receptor superfamily member 18 Human genes 0.000 description 1
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 description 1
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 1
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 description 1
- YJQCOFNZVFGCAF-UHFFFAOYSA-N Tunicamycin II Natural products O1C(CC(O)C2C(C(O)C(O2)N2C(NC(=O)C=C2)=O)O)C(O)C(O)C(NC(=O)C=CCCCCCCCCC(C)C)C1OC1OC(CO)C(O)C(O)C1NC(C)=O YJQCOFNZVFGCAF-UHFFFAOYSA-N 0.000 description 1
- 239000004182 Tylosin Substances 0.000 description 1
- 229930194936 Tylosin Natural products 0.000 description 1
- MUPFEKGTMRGPLJ-UHFFFAOYSA-N UNPD196149 Natural products OC1C(O)C(CO)OC1(CO)OC1C(O)C(O)C(O)C(COC2C(C(O)C(O)C(CO)O2)O)O1 MUPFEKGTMRGPLJ-UHFFFAOYSA-N 0.000 description 1
- VGQOVCHZGQWAOI-UHFFFAOYSA-N UNPD55612 Natural products N1C(O)C2CC(C=CC(N)=O)=CN2C(=O)C2=CC=C(C)C(O)=C12 VGQOVCHZGQWAOI-UHFFFAOYSA-N 0.000 description 1
- 229940127507 Ubiquitin Ligase Inhibitors Drugs 0.000 description 1
- 102000006275 Ubiquitin-Protein Ligases Human genes 0.000 description 1
- 108010083111 Ubiquitin-Protein Ligases Proteins 0.000 description 1
- 108010079206 V-Set Domain-Containing T-Cell Activation Inhibitor 1 Proteins 0.000 description 1
- 102100038929 V-set domain-containing T-cell activation inhibitor 1 Human genes 0.000 description 1
- JKHXYJKMNSSFFL-IUCAKERBSA-N Val-Lys Chemical compound CC(C)[C@H](N)C(=O)N[C@H](C(O)=O)CCCCN JKHXYJKMNSSFFL-IUCAKERBSA-N 0.000 description 1
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 description 1
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 1
- 108010067390 Viral Proteins Proteins 0.000 description 1
- 108010080702 Virginiamycin Proteins 0.000 description 1
- 239000004188 Virginiamycin Substances 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- 102000043366 Wnt-5a Human genes 0.000 description 1
- FKCMADOPPWWGNZ-YUMQZZPRSA-N [(2r)-1-[(2s)-2-amino-3-methylbutanoyl]pyrrolidin-2-yl]boronic acid Chemical compound CC(C)[C@H](N)C(=O)N1CCC[C@H]1B(O)O FKCMADOPPWWGNZ-YUMQZZPRSA-N 0.000 description 1
- RTJVUHUGTUDWRK-CSLCKUBZSA-N [(2r,4ar,6r,7r,8s,8ar)-6-[[(5s,5ar,8ar,9r)-9-(3,5-dimethoxy-4-phosphonooxyphenyl)-8-oxo-5a,6,8a,9-tetrahydro-5h-[2]benzofuro[6,5-f][1,3]benzodioxol-5-yl]oxy]-2-methyl-7-[2-(2,3,4,5,6-pentafluorophenoxy)acetyl]oxy-4,4a,6,7,8,8a-hexahydropyrano[3,2-d][1,3]d Chemical compound COC1=C(OP(O)(O)=O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](OC(=O)COC=4C(=C(F)C(F)=C(F)C=4F)F)[C@@H]4O[C@H](C)OC[C@H]4O3)OC(=O)COC=3C(=C(F)C(F)=C(F)C=3F)F)[C@@H]3[C@@H]2C(OC3)=O)=C1 RTJVUHUGTUDWRK-CSLCKUBZSA-N 0.000 description 1
- LQKSHSFQQRCAFW-CCVNJFHASA-N [(2s)-1-[(2s)-2-benzyl-3-methoxy-5-oxo-2h-pyrrol-1-yl]-3-methyl-1-oxobutan-2-yl] (2s)-1-[(2s)-1-[(2s)-2-[[(2s)-2-[[(2s)-2-(dimethylamino)-3-methylbutanoyl]amino]-3-methylbutanoyl]-methylamino]-3-methylbutanoyl]pyrrolidine-2-carbonyl]pyrrolidine-2-carboxyl Chemical compound C([C@@H]1N(C(=O)C=C1OC)C(=O)[C@@H](OC(=O)[C@H]1N(CCC1)C(=O)[C@H]1N(CCC1)C(=O)[C@H](C(C)C)N(C)C(=O)[C@@H](NC(=O)[C@H](C(C)C)N(C)C)C(C)C)C(C)C)C1=CC=CC=C1 LQKSHSFQQRCAFW-CCVNJFHASA-N 0.000 description 1
- JMNXSNUXDHHTKQ-QVMSTPCGSA-N [(3r,6r)-6-[(3s,5r,7r,8r,9s,10s,13r,14s,17r)-3-[3-(4-aminobutylamino)propylamino]-7-hydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]-2-methylheptan-3-yl] hydrogen sulfate;(2s)-2-hydroxypropanoic ac Chemical compound C[C@H](O)C(O)=O.C([C@@H]1C[C@H]2O)[C@@H](NCCCNCCCCN)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@H](C)CC[C@H](C(C)C)OS(O)(=O)=O)[C@@]2(C)CC1 JMNXSNUXDHHTKQ-QVMSTPCGSA-N 0.000 description 1
- XJXKGUZINMNEDK-GPJOBVNKSA-L [(4r,5r)-5-(aminomethyl)-2-propan-2-yl-1,3-dioxolan-4-yl]methanamine;platinum(2+);propanedioate Chemical compound [Pt+2].[O-]C(=O)CC([O-])=O.CC(C)C1O[C@H](CN)[C@@H](CN)O1 XJXKGUZINMNEDK-GPJOBVNKSA-L 0.000 description 1
- XMYKNCNAZKMVQN-NYYWCZLTSA-N [(e)-(3-aminopyridin-2-yl)methylideneamino]thiourea Chemical compound NC(=S)N\N=C\C1=NC=CC=C1N XMYKNCNAZKMVQN-NYYWCZLTSA-N 0.000 description 1
- XSMVECZRZBFTIZ-UHFFFAOYSA-M [2-(aminomethyl)cyclobutyl]methanamine;2-oxidopropanoate;platinum(4+) Chemical compound [Pt+4].CC([O-])C([O-])=O.NCC1CCC1CN XSMVECZRZBFTIZ-UHFFFAOYSA-M 0.000 description 1
- INKDAKMSOSCDGL-UHFFFAOYSA-N [O].OC1=CC=CC=C1 Chemical group [O].OC1=CC=CC=C1 INKDAKMSOSCDGL-UHFFFAOYSA-N 0.000 description 1
- 102100024148 [Pyruvate dehydrogenase (acetyl-transferring)] kinase isozyme 1, mitochondrial Human genes 0.000 description 1
- 229950008805 abexinostat Drugs 0.000 description 1
- GZOSMCIZMLWJML-VJLLXTKPSA-N abiraterone Chemical compound C([C@H]1[C@H]2[C@@H]([C@]3(CC[C@H](O)CC3=CC2)C)CC[C@@]11C)C=C1C1=CC=CN=C1 GZOSMCIZMLWJML-VJLLXTKPSA-N 0.000 description 1
- DHKHKXVYLBGOIT-UHFFFAOYSA-N acetaldehyde Diethyl Acetal Chemical group CCOC(C)OCC DHKHKXVYLBGOIT-UHFFFAOYSA-N 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- DEXPIBGCLCPUHE-UISHROKMSA-N acetic acid;(4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-n-[(2s,3r)-1-amino-3-hydroxy-1-oxobutan-2-yl]-19-[[(2r)-2-amino-3-naphthalen-2-ylpropanoyl]amino]-16-[(4-hydroxyphenyl)methyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-7-propan-2-yl-1,2-dithia-5, Chemical compound CC(O)=O.C([C@H]1C(=O)N[C@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](N)CC=1C=C2C=CC=CC2=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(N)=O)=O)C(C)C)C1=CC=C(O)C=C1 DEXPIBGCLCPUHE-UISHROKMSA-N 0.000 description 1
- 108010014659 acetyl-glycyl-valyl-allo-isoleucyl-seryl-glutaminyl-isoleucyl-arginyl-prolyl-cysteinamide Proteins 0.000 description 1
- 229960001138 acetylsalicylic acid Drugs 0.000 description 1
- 229960004150 aciclovir Drugs 0.000 description 1
- MKUXAQIIEYXACX-UHFFFAOYSA-N aciclovir Chemical compound N1C(N)=NC(=O)C2=C1N(COCCO)C=N2 MKUXAQIIEYXACX-UHFFFAOYSA-N 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 229960005339 acitretin Drugs 0.000 description 1
- QAWIHIJWNYOLBE-OKKQSCSOSA-N acivicin Chemical compound OC(=O)[C@@H](N)[C@@H]1CC(Cl)=NO1 QAWIHIJWNYOLBE-OKKQSCSOSA-N 0.000 description 1
- 229950008427 acivicin Drugs 0.000 description 1
- 229940099550 actimmune Drugs 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 201000005188 adrenal gland cancer Diseases 0.000 description 1
- 208000024447 adrenal gland neoplasm Diseases 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 230000001270 agonistic effect Effects 0.000 description 1
- 108010054982 alanyl-leucyl-alanyl-leucine Proteins 0.000 description 1
- 125000003158 alcohol group Chemical group 0.000 description 1
- 229960005310 aldesleukin Drugs 0.000 description 1
- 229940083773 alecensa Drugs 0.000 description 1
- 229960001611 alectinib Drugs 0.000 description 1
- 229960000548 alemtuzumab Drugs 0.000 description 1
- 229940110282 alimta Drugs 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 239000002295 alkylating antineoplastic agent Substances 0.000 description 1
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 1
- 108010026331 alpha-Fetoproteins Proteins 0.000 description 1
- AGBQKNBQESQNJD-UHFFFAOYSA-N alpha-Lipoic acid Natural products OC(=O)CCCCC1CCSS1 AGBQKNBQESQNJD-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 229960004821 amikacin Drugs 0.000 description 1
- LKCWBDHBTVXHDL-RMDFUYIESA-N amikacin Chemical compound O([C@@H]1[C@@H](N)C[C@H]([C@@H]([C@H]1O)O[C@@H]1[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O1)O)NC(=O)[C@@H](O)CCN)[C@H]1O[C@H](CN)[C@@H](O)[C@H](O)[C@H]1O LKCWBDHBTVXHDL-RMDFUYIESA-N 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 235000012538 ammonium bicarbonate Nutrition 0.000 description 1
- 229960004701 amonafide Drugs 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 229960002550 amrubicin Drugs 0.000 description 1
- VJZITPJGSQKZMX-XDPRQOKASA-N amrubicin Chemical compound O([C@H]1C[C@](CC2=C(O)C=3C(=O)C4=CC=CC=C4C(=O)C=3C(O)=C21)(N)C(=O)C)[C@H]1C[C@H](O)[C@H](O)CO1 VJZITPJGSQKZMX-XDPRQOKASA-N 0.000 description 1
- 229960001220 amsacrine Drugs 0.000 description 1
- 229950000242 ancitabine Drugs 0.000 description 1
- KZOWNALBTMILAP-JBMRGDGGSA-N ancitabine hydrochloride Chemical compound Cl.N=C1C=CN2[C@@H]3O[C@H](CO)[C@@H](O)[C@@H]3OC2=N1 KZOWNALBTMILAP-JBMRGDGGSA-N 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- CIDNKDMVSINJCG-GKXONYSUSA-N annamycin Chemical compound I[C@@H]1[C@H](O)[C@@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(=O)CO)C1 CIDNKDMVSINJCG-GKXONYSUSA-N 0.000 description 1
- VGQOVCHZGQWAOI-HYUHUPJXSA-N anthramycin Chemical compound N1[C@@H](O)[C@@H]2CC(\C=C\C(N)=O)=CN2C(=O)C2=CC=C(C)C(O)=C12 VGQOVCHZGQWAOI-HYUHUPJXSA-N 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000003432 anti-folate effect Effects 0.000 description 1
- 229940124599 anti-inflammatory drug Drugs 0.000 description 1
- 230000001028 anti-proliverative effect Effects 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 238000009175 antibody therapy Methods 0.000 description 1
- 229940127074 antifolate Drugs 0.000 description 1
- IOASYARYEYRREA-LQAJYKIKSA-N aphidicolin glycinate Chemical compound C1[C@]23[C@]4(C)CC[C@H](O)[C@](C)(CO)[C@H]4CC[C@@H]3C[C@@H]1[C@@](COC(=O)CN)(O)CC2 IOASYARYEYRREA-LQAJYKIKSA-N 0.000 description 1
- 201000007580 appendix carcinoma Diseases 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- UVJYAKBJSGRTHA-ZCRGAIPPSA-N arglabin Chemical compound C1C[C@H]2C(=C)C(=O)O[C@@H]2[C@@H]2C(C)=CC[C@]32O[C@]31C UVJYAKBJSGRTHA-ZCRGAIPPSA-N 0.000 description 1
- UVJYAKBJSGRTHA-UHFFFAOYSA-N arglabin Natural products C1CC2C(=C)C(=O)OC2C2C(C)=CCC32OC31C UVJYAKBJSGRTHA-UHFFFAOYSA-N 0.000 description 1
- 229940078010 arimidex Drugs 0.000 description 1
- 229940087620 aromasin Drugs 0.000 description 1
- 210000004436 artificial bacterial chromosome Anatomy 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- BIDUPMYXGFNAEJ-APGVDKLISA-N astromicin Chemical compound O[C@@H]1[C@H](N(C)C(=O)CN)[C@@H](OC)[C@@H](O)[C@H](N)[C@H]1O[C@@H]1[C@H](N)CC[C@@H]([C@H](C)N)O1 BIDUPMYXGFNAEJ-APGVDKLISA-N 0.000 description 1
- 229960003852 atezolizumab Drugs 0.000 description 1
- MOTJMGVDPWRKOC-QPVYNBJUSA-N atrasentan Chemical compound C1([C@H]2[C@@H]([C@H](CN2CC(=O)N(CCCC)CCCC)C=2C=C3OCOC3=CC=2)C(O)=O)=CC=C(OC)C=C1 MOTJMGVDPWRKOC-QPVYNBJUSA-N 0.000 description 1
- 229940054720 avage Drugs 0.000 description 1
- 229950002916 avelumab Drugs 0.000 description 1
- 229960002278 azidamfenicol Drugs 0.000 description 1
- SGRUZFCHLOFYHZ-MWLCHTKSSA-N azidamfenicol Chemical compound [N-]=[N+]=NCC(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 SGRUZFCHLOFYHZ-MWLCHTKSSA-N 0.000 description 1
- 229960004099 azithromycin Drugs 0.000 description 1
- MQTOSJVFKKJCRP-BICOPXKESA-N azithromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)N(C)C[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 MQTOSJVFKKJCRP-BICOPXKESA-N 0.000 description 1
- 229960000190 bacillus calmette–guérin vaccine Drugs 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 229950001429 batabulin Drugs 0.000 description 1
- 229950008356 becatecarin Drugs 0.000 description 1
- 229960001192 bekanamycin Drugs 0.000 description 1
- 229960003094 belinostat Drugs 0.000 description 1
- NCNRHFGMJRPRSK-MDZDMXLPSA-N belinostat Chemical compound ONC(=O)\C=C\C1=CC=CC(S(=O)(=O)NC=2C=CC=CC=2)=C1 NCNRHFGMJRPRSK-MDZDMXLPSA-N 0.000 description 1
- LNHWXBUNXOXMRL-VWLOTQADSA-N belotecan Chemical compound C1=CC=C2C(CCNC(C)C)=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 LNHWXBUNXOXMRL-VWLOTQADSA-N 0.000 description 1
- 229950011276 belotecan Drugs 0.000 description 1
- 229960002707 bendamustine Drugs 0.000 description 1
- YTKUWDBFDASYHO-UHFFFAOYSA-N bendamustine Chemical compound ClCCN(CCCl)C1=CC=C2N(C)C(CCCC(O)=O)=NC2=C1 YTKUWDBFDASYHO-UHFFFAOYSA-N 0.000 description 1
- 229960001716 benzalkonium Drugs 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- YBHILYKTIRIUTE-UHFFFAOYSA-N berberine Chemical compound C1=C2CC[N+]3=CC4=C(OC)C(OC)=CC=C4C=C3C2=CC2=C1OCO2 YBHILYKTIRIUTE-UHFFFAOYSA-N 0.000 description 1
- 229940093265 berberine Drugs 0.000 description 1
- QISXPYZVZJBNDM-UHFFFAOYSA-N berberine Natural products COc1ccc2C=C3N(Cc2c1OC)C=Cc4cc5OCOc5cc34 QISXPYZVZJBNDM-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- AEMOLEFTQBMNLQ-QIUUJYRFSA-N beta-D-glucuronic acid Chemical compound O[C@@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O AEMOLEFTQBMNLQ-QIUUJYRFSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 1
- 229940110331 bextra Drugs 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 229950003054 binimetinib Drugs 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000008512 biological response Effects 0.000 description 1
- 239000012472 biological sample Substances 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- HUTDDBSSHVOYJR-UHFFFAOYSA-H bis[(2-oxo-1,3,2$l^{5},4$l^{2}-dioxaphosphaplumbetan-2-yl)oxy]lead Chemical compound [Pb+2].[Pb+2].[Pb+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O HUTDDBSSHVOYJR-UHFFFAOYSA-H 0.000 description 1
- 229960003008 blinatumomab Drugs 0.000 description 1
- 229940101815 blincyto Drugs 0.000 description 1
- JSKFWUPVIZYJMR-UDOAKELVSA-N bmy-27557 Chemical compound O=C1N(CCN(CC)CC)C(=O)C(C2=C3[CH]C=CC(Cl)=C3NC2=C23)=C1C2=C1C=CC=C(Cl)[C]1N3[C@@H]1O[C@H](CO)[C@@H](OC)[C@H](O)[C@H]1O JSKFWUPVIZYJMR-UDOAKELVSA-N 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 229960003065 bosentan Drugs 0.000 description 1
- 229940083476 bosulif Drugs 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 238000002725 brachytherapy Methods 0.000 description 1
- PHEZJEYUWHETKO-UHFFFAOYSA-N brequinar Chemical compound N1=C2C=CC(F)=CC2=C(C(O)=O)C(C)=C1C(C=C1)=CC=C1C1=CC=CC=C1F PHEZJEYUWHETKO-UHFFFAOYSA-N 0.000 description 1
- 229950010231 brequinar Drugs 0.000 description 1
- 229960001506 brilliant green Drugs 0.000 description 1
- HXCILVUBKWANLN-UHFFFAOYSA-N brilliant green cation Chemical compound C1=CC(N(CC)CC)=CC=C1C(C=1C=CC=CC=1)=C1C=CC(=[N+](CC)CC)C=C1 HXCILVUBKWANLN-UHFFFAOYSA-N 0.000 description 1
- 229960002719 buserelin Drugs 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- PPKJUHVNTMYXOD-PZGPJMECSA-N c49ws9n75l Chemical compound O=C([C@@H]1N(C2=O)CC[C@H]1S(=O)(=O)CCN(CC)CC)O[C@H](C(C)C)[C@H](C)\C=C\C(=O)NC\C=C\C(\C)=C\[C@@H](O)CC(=O)CC1=NC2=CO1.N([C@@H]1C(=O)N[C@@H](C(N2CCC[C@H]2C(=O)N(C)[C@@H](CC=2C=CC(=CC=2)N(C)C)C(=O)N2C[C@@H](CS[C@H]3C4CCN(CC4)C3)C(=O)C[C@H]2C(=O)N[C@H](C(=O)O[C@@H]1C)C=1C=CC=CC=1)=O)CC)C(=O)C1=NC=CC=C1O PPKJUHVNTMYXOD-PZGPJMECSA-N 0.000 description 1
- BMQGVNUXMIRLCK-OAGWZNDDSA-N cabazitaxel Chemical compound O([C@H]1[C@@H]2[C@]3(OC(C)=O)CO[C@@H]3C[C@@H]([C@]2(C(=O)[C@H](OC)C2=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=3C=CC=CC=3)C[C@]1(O)C2(C)C)C)OC)C(=O)C1=CC=CC=C1 BMQGVNUXMIRLCK-OAGWZNDDSA-N 0.000 description 1
- 229960001573 cabazitaxel Drugs 0.000 description 1
- 229960001292 cabozantinib Drugs 0.000 description 1
- ONIQOQHATWINJY-UHFFFAOYSA-N cabozantinib Chemical compound C=12C=C(OC)C(OC)=CC2=NC=CC=1OC(C=C1)=CC=C1NC(=O)C1(C(=O)NC=2C=CC(F)=CC=2)CC1 ONIQOQHATWINJY-UHFFFAOYSA-N 0.000 description 1
- GVEZIHKRYBHEFX-UHFFFAOYSA-N caerulein A Natural products CC=CCC=CCCC(=O)C1OC1C(N)=O GVEZIHKRYBHEFX-UHFFFAOYSA-N 0.000 description 1
- BBBFJLBPOGFECG-VJVYQDLKSA-N calcitonin Chemical compound N([C@H](C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(N)=O)C(C)C)C(=O)[C@@H]1CSSC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1 BBBFJLBPOGFECG-VJVYQDLKSA-N 0.000 description 1
- 229960004015 calcitonin Drugs 0.000 description 1
- KVUAALJSMIVURS-ZEDZUCNESA-L calcium folinate Chemical compound [Ca+2].C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC([O-])=O)C([O-])=O)C=C1 KVUAALJSMIVURS-ZEDZUCNESA-L 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- BPKIGYQJPYCAOW-FFJTTWKXSA-I calcium;potassium;disodium;(2s)-2-hydroxypropanoate;dichloride;dihydroxide;hydrate Chemical compound O.[OH-].[OH-].[Na+].[Na+].[Cl-].[Cl-].[K+].[Ca+2].C[C@H](O)C([O-])=O BPKIGYQJPYCAOW-FFJTTWKXSA-I 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 229940112129 campath Drugs 0.000 description 1
- 229940088954 camptosar Drugs 0.000 description 1
- OMZCMEYTWSXEPZ-UHFFFAOYSA-N canertinib Chemical compound C1=C(Cl)C(F)=CC=C1NC1=NC=NC2=CC(OCCCN3CCOCC3)=C(NC(=O)C=C)C=C12 OMZCMEYTWSXEPZ-UHFFFAOYSA-N 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 125000005587 carbonate group Chemical group 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical compound OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 150000007942 carboxylates Chemical class 0.000 description 1
- 125000002843 carboxylic acid group Chemical group 0.000 description 1
- 229940097647 casodex Drugs 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 150000003943 catecholamines Chemical class 0.000 description 1
- KQJSQWZMSAGSHN-JJWQIEBTSA-N celastrol Chemical compound C([C@H]1[C@]2(C)CC[C@@]34C)[C@](C)(C(O)=O)CC[C@]1(C)CC[C@]2(C)C4=CC=C1C3=CC(=O)C(O)=C1C KQJSQWZMSAGSHN-JJWQIEBTSA-N 0.000 description 1
- 229940047495 celebrex Drugs 0.000 description 1
- 229960000590 celecoxib Drugs 0.000 description 1
- 230000007910 cell fusion Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 230000005889 cellular cytotoxicity Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 229950001357 celmoleukin Drugs 0.000 description 1
- 108010046713 cemadotin Proteins 0.000 description 1
- 229950009017 cemadotin Drugs 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 229960001602 ceritinib Drugs 0.000 description 1
- GVEZIHKRYBHEFX-NQQPLRFYSA-N cerulenin Chemical compound C\C=C\C\C=C\CCC(=O)[C@H]1O[C@H]1C(N)=O GVEZIHKRYBHEFX-NQQPLRFYSA-N 0.000 description 1
- 229950005984 cerulenin Drugs 0.000 description 1
- 229940112106 cetrotide Drugs 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- IQCIQDNWBGEGRL-UHFFFAOYSA-N chembl1614651 Chemical compound O=C1C2=C(O)C=CC(O)=C2N2N=C(CNCCO)C3=CC=C(NCCCN)C1=C32 IQCIQDNWBGEGRL-UHFFFAOYSA-N 0.000 description 1
- KPMVHELZNRNSMN-UHFFFAOYSA-N chembl1985849 Chemical compound N1=CC=C2NCCN21 KPMVHELZNRNSMN-UHFFFAOYSA-N 0.000 description 1
- AOXOCDRNSPFDPE-UKEONUMOSA-N chembl413654 Chemical compound C([C@H](C(=O)NCC(=O)N[C@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@H](CCSC)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC=1C=CC=CC=1)C(N)=O)NC(=O)[C@@H](C)NC(=O)[C@@H](CCC(O)=O)NC(=O)[C@@H](CCC(O)=O)NC(=O)[C@@H](CCC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H]1N(CCC1)C(=O)CNC(=O)[C@@H](N)CCC(O)=O)C1=CC=C(O)C=C1 AOXOCDRNSPFDPE-UKEONUMOSA-N 0.000 description 1
- ZFVRYNYOPQZKDG-MQMHXKEQSA-N chembl560895 Chemical compound O=C1CC(C)(C)CC2=C1C(C(F)(F)F)=NN2C(C=1)=CC=C(C(N)=O)C=1N[C@H]1CC[C@H](O)CC1 ZFVRYNYOPQZKDG-MQMHXKEQSA-N 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 239000012829 chemotherapy agent Substances 0.000 description 1
- 229950009221 chidamide Drugs 0.000 description 1
- 229960005091 chloramphenicol Drugs 0.000 description 1
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 1
- CYDMQBQPVICBEU-UHFFFAOYSA-N chlorotetracycline Natural products C1=CC(Cl)=C2C(O)(C)C3CC4C(N(C)C)C(O)=C(C(N)=O)C(=O)C4(O)C(O)=C3C(=O)C2=C1O CYDMQBQPVICBEU-UHFFFAOYSA-N 0.000 description 1
- 229960001480 chlorozotocin Drugs 0.000 description 1
- 229960004475 chlortetracycline Drugs 0.000 description 1
- 235000019365 chlortetracycline Nutrition 0.000 description 1
- CYDMQBQPVICBEU-XRNKAMNCSA-N chlortetracycline Chemical compound C1=CC(Cl)=C2[C@](O)(C)[C@H]3C[C@H]4[C@H](N(C)C)C(O)=C(C(N)=O)C(=O)[C@@]4(O)C(O)=C3C(=O)C2=C1O CYDMQBQPVICBEU-XRNKAMNCSA-N 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 229960000724 cidofovir Drugs 0.000 description 1
- 230000004087 circulation Effects 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 229960002626 clarithromycin Drugs 0.000 description 1
- AGOYDEPGAOXOCK-KCBOHYOISA-N clarithromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@](C)([C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)OC)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 AGOYDEPGAOXOCK-KCBOHYOISA-N 0.000 description 1
- 208000009060 clear cell adenocarcinoma Diseases 0.000 description 1
- 229960002227 clindamycin Drugs 0.000 description 1
- KDLRVYVGXIQJDK-AWPVFWJPSA-N clindamycin Chemical compound CN1C[C@H](CCC)C[C@H]1C(=O)N[C@H]([C@H](C)Cl)[C@@H]1[C@H](O)[C@H](O)[C@@H](O)[C@@H](SC)O1 KDLRVYVGXIQJDK-AWPVFWJPSA-N 0.000 description 1
- 101150045189 cmo gene Proteins 0.000 description 1
- 229960002271 cobimetinib Drugs 0.000 description 1
- RESIMIUSNACMNW-BXRWSSRYSA-N cobimetinib fumarate Chemical compound OC(=O)\C=C\C(O)=O.C1C(O)([C@H]2NCCCC2)CN1C(=O)C1=CC=C(F)C(F)=C1NC1=CC=C(I)C=C1F.C1C(O)([C@H]2NCCCC2)CN1C(=O)C1=CC=C(F)C(F)=C1NC1=CC=C(I)C=C1F RESIMIUSNACMNW-BXRWSSRYSA-N 0.000 description 1
- 239000000084 colloidal system Substances 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 238000012875 competitive assay Methods 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 229950007276 conatumumab Drugs 0.000 description 1
- 229940031670 conjugate vaccine Drugs 0.000 description 1
- 239000013068 control sample Substances 0.000 description 1
- 239000000599 controlled substance Substances 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- IDLFZVILOHSSID-OVLDLUHVSA-N corticotropin Chemical compound C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)NC(=O)[C@@H](N)CO)C1=CC=C(O)C=C1 IDLFZVILOHSSID-OVLDLUHVSA-N 0.000 description 1
- 229960000258 corticotropin Drugs 0.000 description 1
- 239000006184 cosolvent Substances 0.000 description 1
- 230000000139 costimulatory effect Effects 0.000 description 1
- 229940111134 coxibs Drugs 0.000 description 1
- CZZLLDDFQKSALH-UHFFFAOYSA-N cpg 8954 Chemical compound O=C1NC(=O)C(C)=CN1C1OC(COP(O)(=O)OC2C(OC(C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=O)OC2C(OC(C2)N2C(N=C(N)C=C2)=O)COP(O)(=O)OC2C(OC(C2)N2C(NC(=O)C(C)=C2)=O)COP(O)(=O)OC2C(OC(C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=O)OC2C(OC(C2)N2C(N=C(N)C=C2)=O)COP(O)(=O)OC2C(OC(C2)N2C3=NC=NC(N)=C3N=C2)COP(O)(=O)OC2C(OC(C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=O)OC2C(OC(C2)N2C(N=C(N)C=C2)=O)COP(O)(=O)OC2C(OC(C2)N2C3=NC=NC(N)=C3N=C2)COP(O)(=O)OC2C(OC(C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=O)OC2C(OC(C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=O)OC2C(OC(C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=O)OC2C(OC(C2)N2C3=C(C(NC(N)=N3)=O)N=C2)CO)C(OP(O)(=O)OCC2C(CC(O2)N2C3=C(C(NC(N)=N3)=O)N=C2)OP(O)(=O)OCC2C(CC(O2)N2C3=C(C(NC(N)=N3)=O)N=C2)OP(O)(=O)OCC2C(CC(O2)N2C3=C(C(NC(N)=N3)=O)N=C2)OP(O)(=O)OCC2C(CC(O2)N2C3=C(C(NC(N)=N3)=O)N=C2)OP(O)(=O)OCC2C(CC(O2)N2C3=C(C(NC(N)=N3)=O)N=C2)OP(O)(=O)OCC2C(CC(O2)N2C3=C(C(NC(N)=N3)=O)N=C2)OP(O)(=O)OCC2C(CC(O2)N2C3=C(C(NC(N)=N3)=O)N=C2)O)C1 CZZLLDDFQKSALH-UHFFFAOYSA-N 0.000 description 1
- 101150054175 cro gene Proteins 0.000 description 1
- 108010006226 cryptophycin Proteins 0.000 description 1
- PSNOPSMXOBPNNV-VVCTWANISA-N cryptophycin 1 Chemical compound C1=C(Cl)C(OC)=CC=C1C[C@@H]1C(=O)NC[C@@H](C)C(=O)O[C@@H](CC(C)C)C(=O)O[C@H]([C@H](C)[C@@H]2[C@H](O2)C=2C=CC=CC=2)C/C=C/C(=O)N1 PSNOPSMXOBPNNV-VVCTWANISA-N 0.000 description 1
- PSNOPSMXOBPNNV-UHFFFAOYSA-N cryptophycin-327 Natural products C1=C(Cl)C(OC)=CC=C1CC1C(=O)NCC(C)C(=O)OC(CC(C)C)C(=O)OC(C(C)C2C(O2)C=2C=CC=CC=2)CC=CC(=O)N1 PSNOPSMXOBPNNV-UHFFFAOYSA-N 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 229940043378 cyclin-dependent kinase inhibitor Drugs 0.000 description 1
- 150000003999 cyclitols Chemical class 0.000 description 1
- UKJLNMAFNRKWGR-UHFFFAOYSA-N cyclohexatrienamine Chemical group NC1=CC=C=C[CH]1 UKJLNMAFNRKWGR-UHFFFAOYSA-N 0.000 description 1
- 229960000978 cyproterone acetate Drugs 0.000 description 1
- UWFYSQMTEOIJJG-FDTZYFLXSA-N cyproterone acetate Chemical compound C1=C(Cl)C2=CC(=O)[C@@H]3C[C@@H]3[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 UWFYSQMTEOIJJG-FDTZYFLXSA-N 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 229940099418 d- alpha-tocopherol succinate Drugs 0.000 description 1
- 229960002465 dabrafenib Drugs 0.000 description 1
- BFSMGDJOXZAERB-UHFFFAOYSA-N dabrafenib Chemical compound S1C(C(C)(C)C)=NC(C=2C(=C(NS(=O)(=O)C=3C(=CC=CC=3F)F)C=CC=2)F)=C1C1=CC=NC(N)=N1 BFSMGDJOXZAERB-UHFFFAOYSA-N 0.000 description 1
- 229960002806 daclizumab Drugs 0.000 description 1
- 229940070230 daypro Drugs 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000008260 defense mechanism Effects 0.000 description 1
- 229960002398 demeclocycline Drugs 0.000 description 1
- 229960001251 denosumab Drugs 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 229960003314 deracoxib Drugs 0.000 description 1
- 229940051427 deramaxx Drugs 0.000 description 1
- 238000001212 derivatisation Methods 0.000 description 1
- XOZIUKBZLSUILX-UHFFFAOYSA-N desoxyepothilone B Natural products O1C(=O)CC(O)C(C)(C)C(=O)C(C)C(O)C(C)CCCC(C)=CCC1C(C)=CC1=CSC(C)=N1 XOZIUKBZLSUILX-UHFFFAOYSA-N 0.000 description 1
- 150000004985 diamines Chemical class 0.000 description 1
- 229910003460 diamond Inorganic materials 0.000 description 1
- 239000010432 diamond Substances 0.000 description 1
- 229960003807 dibekacin Drugs 0.000 description 1
- JJCQSGDBDPYCEO-XVZSLQNASA-N dibekacin Chemical compound O1[C@H](CN)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N JJCQSGDBDPYCEO-XVZSLQNASA-N 0.000 description 1
- 229960001259 diclofenac Drugs 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 208000030315 diffuse gastric adenocarcinoma Diseases 0.000 description 1
- LFQCJSBXBZRMTN-OAQYLSRUSA-N diflomotecan Chemical compound CC[C@@]1(O)CC(=O)OCC(C2=O)=C1C=C1N2CC2=CC3=CC(F)=C(F)C=C3N=C21 LFQCJSBXBZRMTN-OAQYLSRUSA-N 0.000 description 1
- 229960000616 diflunisal Drugs 0.000 description 1
- 229960002222 dihydrostreptomycin Drugs 0.000 description 1
- ASXBYYWOLISCLQ-HZYVHMACSA-N dihydrostreptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](CO)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O ASXBYYWOLISCLQ-HZYVHMACSA-N 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- 230000003292 diminished effect Effects 0.000 description 1
- CITHEXJVPOWHKC-UHFFFAOYSA-N dimyristoyl phosphatidylcholine Chemical compound CCCCCCCCCCCCCC(=O)OCC(COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCCCCCCC CITHEXJVPOWHKC-UHFFFAOYSA-N 0.000 description 1
- 229960003724 dimyristoylphosphatidylcholine Drugs 0.000 description 1
- 206010013023 diphtheria Diseases 0.000 description 1
- IRXRGVFLQOSHOH-UHFFFAOYSA-L dipotassium;oxalate Chemical compound [K+].[K+].[O-]C(=O)C([O-])=O IRXRGVFLQOSHOH-UHFFFAOYSA-L 0.000 description 1
- 230000007646 directional migration Effects 0.000 description 1
- 229960004100 dirithromycin Drugs 0.000 description 1
- WLOHNSSYAXHWNR-NXPDYKKBSA-N dirithromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H]2O[C@H](COCCOC)N[C@H]([C@@H]2C)[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 WLOHNSSYAXHWNR-NXPDYKKBSA-N 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- 235000019262 disodium citrate Nutrition 0.000 description 1
- 239000002526 disodium citrate Substances 0.000 description 1
- CEYULKASIQJZGP-UHFFFAOYSA-L disodium;2-(carboxymethyl)-2-hydroxybutanedioate Chemical compound [Na+].[Na+].[O-]C(=O)CC(O)(C(=O)O)CC([O-])=O CEYULKASIQJZGP-UHFFFAOYSA-L 0.000 description 1
- NYDXNILOWQXUOF-UHFFFAOYSA-L disodium;2-[[4-[2-(2-amino-4-oxo-1,7-dihydropyrrolo[2,3-d]pyrimidin-5-yl)ethyl]benzoyl]amino]pentanedioate Chemical compound [Na+].[Na+].C=1NC=2NC(N)=NC(=O)C=2C=1CCC1=CC=C(C(=O)NC(CCC([O-])=O)C([O-])=O)C=C1 NYDXNILOWQXUOF-UHFFFAOYSA-L 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 150000002019 disulfides Chemical class 0.000 description 1
- 108010045552 dolastatin 15 Proteins 0.000 description 1
- 229940072701 dolobid Drugs 0.000 description 1
- 230000005782 double-strand break Effects 0.000 description 1
- 229960000413 doxercalciferol Drugs 0.000 description 1
- 229960003722 doxycycline Drugs 0.000 description 1
- 229940000406 drug candidate Drugs 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 239000003118 drug derivative Substances 0.000 description 1
- 229940126534 drug product Drugs 0.000 description 1
- 229960005501 duocarmycin Drugs 0.000 description 1
- VQNATVDKACXKTF-XELLLNAOSA-N duocarmycin Chemical compound COC1=C(OC)C(OC)=C2NC(C(=O)N3C4=CC(=O)C5=C([C@@]64C[C@@H]6C3)C=C(N5)C(=O)OC)=CC2=C1 VQNATVDKACXKTF-XELLLNAOSA-N 0.000 description 1
- 229930184221 duocarmycin Natural products 0.000 description 1
- GVGYEFKIHJTNQZ-RFQIPJPRSA-N ecgonine benzoate Chemical compound O([C@@H]1[C@@H]([C@H]2CC[C@@H](C1)N2C)C(O)=O)C(=O)C1=CC=CC=C1 GVGYEFKIHJTNQZ-RFQIPJPRSA-N 0.000 description 1
- 229950011461 edelfosine Drugs 0.000 description 1
- 229960001776 edrecolomab Drugs 0.000 description 1
- 229960000925 efaproxiral Drugs 0.000 description 1
- VLCYCQAOQCDTCN-UHFFFAOYSA-N eflornithine Chemical compound NCCCC(N)(C(F)F)C(O)=O VLCYCQAOQCDTCN-UHFFFAOYSA-N 0.000 description 1
- 229960002759 eflornithine Drugs 0.000 description 1
- 229940121647 egfr inhibitor Drugs 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 229940120655 eloxatin Drugs 0.000 description 1
- 230000013020 embryo development Effects 0.000 description 1
- 230000012202 endocytosis Effects 0.000 description 1
- 210000001163 endosome Anatomy 0.000 description 1
- 210000003038 endothelium Anatomy 0.000 description 1
- 229950011487 enocitabine Drugs 0.000 description 1
- HKSZLNNOFSGOKW-UHFFFAOYSA-N ent-staurosporine Natural products C12=C3N4C5=CC=CC=C5C3=C3CNC(=O)C3=C2C2=CC=CC=C2N1C1CC(NC)C(OC)C4(C)O1 HKSZLNNOFSGOKW-UHFFFAOYSA-N 0.000 description 1
- 229950005837 entinostat Drugs 0.000 description 1
- 229960004671 enzalutamide Drugs 0.000 description 1
- 229950002189 enzastaurin Drugs 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 229930013356 epothilone Natural products 0.000 description 1
- 150000003883 epothilone derivatives Chemical class 0.000 description 1
- 229950009760 epratuzumab Drugs 0.000 description 1
- 229950006835 eptaplatin Drugs 0.000 description 1
- UNXHWFMMPAWVPI-ZXZARUISSA-N erythritol Chemical compound OC[C@H](O)[C@H](O)CO UNXHWFMMPAWVPI-ZXZARUISSA-N 0.000 description 1
- 229940009714 erythritol Drugs 0.000 description 1
- 235000019414 erythritol Nutrition 0.000 description 1
- 229960003276 erythromycin Drugs 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 229960001842 estramustine Drugs 0.000 description 1
- FRPJXPJMRWBBIH-RBRWEJTLSA-N estramustine Chemical compound ClCCN(CCCl)C(=O)OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 FRPJXPJMRWBBIH-RBRWEJTLSA-N 0.000 description 1
- 108010038795 estrogen receptors Proteins 0.000 description 1
- 229960005293 etodolac Drugs 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 230000003203 everyday effect Effects 0.000 description 1
- 229940085363 evista Drugs 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 230000028023 exocytosis Effects 0.000 description 1
- 231100000776 exotoxin Toxicity 0.000 description 1
- 239000002095 exotoxin Substances 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 229940043168 fareston Drugs 0.000 description 1
- 229940087861 faslodex Drugs 0.000 description 1
- 229940065410 feldene Drugs 0.000 description 1
- 229940087476 femara Drugs 0.000 description 1
- 229950003662 fenretinide Drugs 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 229960004177 filgrastim Drugs 0.000 description 1
- 229960003760 florfenicol Drugs 0.000 description 1
- 229960000961 floxuridine Drugs 0.000 description 1
- 229960005304 fludarabine phosphate Drugs 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 229960001398 flurithromycin Drugs 0.000 description 1
- XOEUHCONYHZURQ-HNUBZJOYSA-N flurithromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@@](C)(F)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 XOEUHCONYHZURQ-HNUBZJOYSA-N 0.000 description 1
- JYEFSHLLTQIXIO-SMNQTINBSA-N folfiri regimen Chemical compound FC1=CNC(=O)NC1=O.C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1.C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 JYEFSHLLTQIXIO-SMNQTINBSA-N 0.000 description 1
- 239000004052 folic acid antagonist Substances 0.000 description 1
- 235000008191 folinic acid Nutrition 0.000 description 1
- 239000011672 folinic acid Substances 0.000 description 1
- 230000022244 formylation Effects 0.000 description 1
- 238000006170 formylation reaction Methods 0.000 description 1
- 229960005102 foscarnet Drugs 0.000 description 1
- 229950005309 fostamatinib Drugs 0.000 description 1
- GKDRMWXFWHEQQT-UHFFFAOYSA-N fostamatinib Chemical compound COC1=C(OC)C(OC)=CC(NC=2N=C(NC=3N=C4N(COP(O)(O)=O)C(=O)C(C)(C)OC4=CC=3)C(F)=CN=2)=C1 GKDRMWXFWHEQQT-UHFFFAOYSA-N 0.000 description 1
- 238000013467 fragmentation Methods 0.000 description 1
- 238000006062 fragmentation reaction Methods 0.000 description 1
- 229960003704 framycetin Drugs 0.000 description 1
- PGBHMTALBVVCIT-VCIWKGPPSA-N framycetin Chemical compound N[C@@H]1[C@@H](O)[C@H](O)[C@H](CN)O[C@@H]1O[C@H]1[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](N)C[C@@H](N)[C@@H]2O)O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CN)O2)N)O[C@@H]1CO PGBHMTALBVVCIT-VCIWKGPPSA-N 0.000 description 1
- 229950004003 fresolimumab Drugs 0.000 description 1
- 230000033581 fucosylation Effects 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- UIWYJDYFSGRHKR-UHFFFAOYSA-N gadolinium atom Chemical compound [Gd] UIWYJDYFSGRHKR-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-GUCUJZIJSA-N galactitol Chemical compound OC[C@H](O)[C@@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-GUCUJZIJSA-N 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 229960002963 ganciclovir Drugs 0.000 description 1
- IRSCQMHQWWYFCW-UHFFFAOYSA-N ganciclovir Chemical compound O=C1NC(N)=NC2=C1N=CN2COC(CO)CO IRSCQMHQWWYFCW-UHFFFAOYSA-N 0.000 description 1
- 150000002270 gangliosides Chemical class 0.000 description 1
- 229960002584 gefitinib Drugs 0.000 description 1
- 238000001641 gel filtration chromatography Methods 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- QTQAWLPCGQOSGP-GBTDJJJQSA-N geldanamycin Chemical compound N1C(=O)\C(C)=C/C=C\[C@@H](OC)[C@H](OC(N)=O)\C(C)=C/[C@@H](C)[C@@H](O)[C@H](OC)C[C@@H](C)CC2=C(OC)C(=O)C=C1C2=O QTQAWLPCGQOSGP-GBTDJJJQSA-N 0.000 description 1
- 229960002518 gentamicin Drugs 0.000 description 1
- UIVFUQKYVFCEKJ-OPTOVBNMSA-N gimatecan Chemical compound C1=CC=C2C(\C=N\OC(C)(C)C)=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UIVFUQKYVFCEKJ-OPTOVBNMSA-N 0.000 description 1
- 229950009073 gimatecan Drugs 0.000 description 1
- 235000008434 ginseng Nutrition 0.000 description 1
- 229950010415 givinostat Drugs 0.000 description 1
- 229950000918 glembatumumab Drugs 0.000 description 1
- 229950009672 glembatumumab vedotin Drugs 0.000 description 1
- 208000005017 glioblastoma Diseases 0.000 description 1
- 229940050410 gluconate Drugs 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229950011595 glufosfamide Drugs 0.000 description 1
- 125000000404 glutamine group Chemical group N[C@@H](CCC(N)=O)C(=O)* 0.000 description 1
- YPZRWBKMTBYPTK-BJDJZHNGSA-N glutathione disulfide Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@H](C(=O)NCC(O)=O)CSSC[C@@H](C(=O)NCC(O)=O)NC(=O)CC[C@H](N)C(O)=O YPZRWBKMTBYPTK-BJDJZHNGSA-N 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 208000027124 goblet cell carcinoma Diseases 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- PKWIYNIDEDLDCJ-UHFFFAOYSA-N guanazole Chemical compound NC1=NNC(N)=N1 PKWIYNIDEDLDCJ-UHFFFAOYSA-N 0.000 description 1
- 125000005179 haloacetyl group Chemical group 0.000 description 1
- LVASCWIMLIKXLA-LSDHHAIUSA-N halofuginone Chemical compound O[C@@H]1CCCN[C@H]1CC(=O)CN1C(=O)C2=CC(Cl)=C(Br)C=C2N=C1 LVASCWIMLIKXLA-LSDHHAIUSA-N 0.000 description 1
- 229950010152 halofuginone Drugs 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 239000003481 heat shock protein 90 inhibitor Substances 0.000 description 1
- 229940062743 hectorol Drugs 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- 229940022353 herceptin Drugs 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 229960001340 histamine Drugs 0.000 description 1
- 229960004931 histamine dihydrochloride Drugs 0.000 description 1
- 108010040030 histidinoalanine Proteins 0.000 description 1
- 229940121372 histone deacetylase inhibitor Drugs 0.000 description 1
- 239000003276 histone deacetylase inhibitor Substances 0.000 description 1
- PFOARMALXZGCHY-UHFFFAOYSA-N homoegonol Natural products C1=C(OC)C(OC)=CC=C1C1=CC2=CC(CCCO)=CC(OC)=C2O1 PFOARMALXZGCHY-UHFFFAOYSA-N 0.000 description 1
- 229940116978 human epidermal growth factor Drugs 0.000 description 1
- MFZWMTSUNYWVBU-UHFFFAOYSA-N hycanthone Chemical compound S1C2=CC=CC=C2C(=O)C2=C1C(CO)=CC=C2NCCN(CC)CC MFZWMTSUNYWVBU-UHFFFAOYSA-N 0.000 description 1
- 229950000216 hycanthone Drugs 0.000 description 1
- 229940071870 hydroiodic acid Drugs 0.000 description 1
- 229920001477 hydrophilic polymer Polymers 0.000 description 1
- 150000004679 hydroxides Chemical class 0.000 description 1
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 1
- 229960004171 hydroxychloroquine Drugs 0.000 description 1
- XXSMGPRMXLTPCZ-UHFFFAOYSA-N hydroxychloroquine Chemical compound ClC1=CC=C2C(NC(C)CCCN(CCO)CC)=CC=NC2=C1 XXSMGPRMXLTPCZ-UHFFFAOYSA-N 0.000 description 1
- GRRNUXAQVGOGFE-NZSRVPFOSA-N hygromycin B Chemical compound O[C@@H]1[C@@H](NC)C[C@@H](N)[C@H](O)[C@H]1O[C@H]1[C@H]2O[C@@]3([C@@H]([C@@H](O)[C@@H](O)[C@@H](C(N)CO)O3)O)O[C@H]2[C@@H](O)[C@@H](CO)O1 GRRNUXAQVGOGFE-NZSRVPFOSA-N 0.000 description 1
- 229940097277 hygromycin b Drugs 0.000 description 1
- 230000001146 hypoxic effect Effects 0.000 description 1
- 229960005236 ibandronic acid Drugs 0.000 description 1
- 229960001001 ibritumomab tiuxetan Drugs 0.000 description 1
- 229960001507 ibrutinib Drugs 0.000 description 1
- XYFPWWZEPKGCCK-GOSISDBHSA-N ibrutinib Chemical compound C1=2C(N)=NC=NC=2N([C@H]2CN(CCC2)C(=O)C=C)N=C1C(C=C1)=CC=C1OC1=CC=CC=C1 XYFPWWZEPKGCCK-GOSISDBHSA-N 0.000 description 1
- 229960001680 ibuprofen Drugs 0.000 description 1
- 229940049235 iclusig Drugs 0.000 description 1
- 229960001101 ifosfamide Drugs 0.000 description 1
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 1
- 229960002751 imiquimod Drugs 0.000 description 1
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical compound C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 230000002055 immunohistochemical effect Effects 0.000 description 1
- 238000011532 immunohistochemical staining Methods 0.000 description 1
- 238000012309 immunohistochemistry technique Methods 0.000 description 1
- 239000000677 immunologic agent Substances 0.000 description 1
- 229940124541 immunological agent Drugs 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 229940089536 indocin Drugs 0.000 description 1
- 229960000905 indomethacin Drugs 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 229960003786 inosine Drugs 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 229950000038 interferon alfa Drugs 0.000 description 1
- 229960003521 interferon alfa-2a Drugs 0.000 description 1
- 229960003507 interferon alfa-2b Drugs 0.000 description 1
- 229960003130 interferon gamma Drugs 0.000 description 1
- 229940095009 interferon gamma-1a Drugs 0.000 description 1
- 229940028862 interferon gamma-1b Drugs 0.000 description 1
- 229960001388 interferon-beta Drugs 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 206010073095 invasive ductal breast carcinoma Diseases 0.000 description 1
- 201000010985 invasive ductal carcinoma Diseases 0.000 description 1
- 238000005342 ion exchange Methods 0.000 description 1
- 229950010897 iproplatin Drugs 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- 229960000779 irinotecan hydrochloride Drugs 0.000 description 1
- KLEAIHJJLUAXIQ-JDRGBKBRSA-N irinotecan hydrochloride hydrate Chemical compound O.O.O.Cl.C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 KLEAIHJJLUAXIQ-JDRGBKBRSA-N 0.000 description 1
- 230000001788 irregular Effects 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 108010078274 isoleucylvaline Proteins 0.000 description 1
- ZBKFYXZXZJPWNQ-UHFFFAOYSA-N isothiocyanate group Chemical group [N-]=C=S ZBKFYXZXZJPWNQ-UHFFFAOYSA-N 0.000 description 1
- FABUFPQFXZVHFB-PVYNADRNSA-N ixabepilone Chemical compound C/C([C@@H]1C[C@@H]2O[C@]2(C)CCC[C@@H]([C@@H]([C@@H](C)C(=O)C(C)(C)[C@@H](O)CC(=O)N1)O)C)=C\C1=CSC(C)=N1 FABUFPQFXZVHFB-PVYNADRNSA-N 0.000 description 1
- 229960003648 ixazomib Drugs 0.000 description 1
- MXAYKZJJDUDWDS-LBPRGKRZSA-N ixazomib Chemical compound CC(C)C[C@@H](B(O)O)NC(=O)CNC(=O)C1=CC(Cl)=CC=C1Cl MXAYKZJJDUDWDS-LBPRGKRZSA-N 0.000 description 1
- 229960004144 josamycin Drugs 0.000 description 1
- XJSFLOJWULLJQS-NGVXBBESSA-N josamycin Chemical compound CO[C@H]1[C@H](OC(C)=O)CC(=O)O[C@H](C)C\C=C\C=C\[C@H](O)[C@H](C)C[C@H](CC=O)[C@@H]1O[C@H]1[C@H](O)[C@@H](N(C)C)[C@H](O[C@@H]2O[C@@H](C)[C@H](OC(=O)CC(C)C)[C@](C)(O)C2)[C@@H](C)O1 XJSFLOJWULLJQS-NGVXBBESSA-N 0.000 description 1
- 229960000318 kanamycin Drugs 0.000 description 1
- 229930027917 kanamycin Natural products 0.000 description 1
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 1
- 229930182823 kanamycin A Natural products 0.000 description 1
- SKKLOUVUUNMCJE-FQSMHNGLSA-N kanamycin B Chemical compound N[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SKKLOUVUUNMCJE-FQSMHNGLSA-N 0.000 description 1
- 229930182824 kanamycin B Natural products 0.000 description 1
- SKKLOUVUUNMCJE-UHFFFAOYSA-N kanendomycin Natural products NC1C(O)C(O)C(CN)OC1OC1C(O)C(OC2C(C(N)C(O)C(CO)O2)O)C(N)CC1N SKKLOUVUUNMCJE-UHFFFAOYSA-N 0.000 description 1
- 239000003835 ketolide antibiotic agent Substances 0.000 description 1
- 229960000991 ketoprofen Drugs 0.000 description 1
- 229960004752 ketorolac Drugs 0.000 description 1
- OZWKMVRBQXNZKK-UHFFFAOYSA-N ketorolac Chemical compound OC(=O)C1CCN2C1=CC=C2C(=O)C1=CC=CC=C1 OZWKMVRBQXNZKK-UHFFFAOYSA-N 0.000 description 1
- BWHLPLXXIDYSNW-UHFFFAOYSA-N ketorolac tromethamine Chemical compound OCC(N)(CO)CO.OC(=O)C1CCN2C1=CC=C2C(=O)C1=CC=CC=C1 BWHLPLXXIDYSNW-UHFFFAOYSA-N 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 229940000764 kyprolis Drugs 0.000 description 1
- 238000011005 laboratory method Methods 0.000 description 1
- 229940001447 lactate Drugs 0.000 description 1
- 229960002437 lanreotide Drugs 0.000 description 1
- 208000003849 large cell carcinoma Diseases 0.000 description 1
- 229950005692 larotaxel Drugs 0.000 description 1
- 229960004942 lenalidomide Drugs 0.000 description 1
- GOTYRUGSSMKFNF-UHFFFAOYSA-N lenalidomide Chemical compound C1C=2C(N)=CC=CC=2C(=O)N1C1CCC(=O)NC1=O GOTYRUGSSMKFNF-UHFFFAOYSA-N 0.000 description 1
- 229960002618 lenograstim Drugs 0.000 description 1
- 229960003784 lenvatinib Drugs 0.000 description 1
- WOSKHXYHFSIKNG-UHFFFAOYSA-N lenvatinib Chemical compound C=12C=C(C(N)=O)C(OC)=CC2=NC=CC=1OC(C=C1Cl)=CC=C1NC(=O)NC1CC1 WOSKHXYHFSIKNG-UHFFFAOYSA-N 0.000 description 1
- YACHGFWEQXFSBS-XYERBDPFSA-N leptomycin B Chemical compound OC(=O)/C=C(C)/C[C@H](C)[C@@H](O)[C@H](C)C(=O)[C@H](C)/C=C(\C)/C=C/C[C@@H](C)/C=C(/CC)\C=C\[C@@H]1OC(=O)C=C[C@@H]1C YACHGFWEQXFSBS-XYERBDPFSA-N 0.000 description 1
- 229960001691 leucovorin Drugs 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- OJMMVQQUTAEWLP-KIDUDLJLSA-N lincomycin Chemical compound CN1C[C@H](CCC)C[C@H]1C(=O)N[C@H]([C@@H](C)O)[C@@H]1[C@H](O)[C@H](O)[C@@H](O)[C@@H](SC)O1 OJMMVQQUTAEWLP-KIDUDLJLSA-N 0.000 description 1
- 229960005287 lincomycin Drugs 0.000 description 1
- 229960003907 linezolid Drugs 0.000 description 1
- TYZROVQLWOKYKF-ZDUSSCGKSA-N linezolid Chemical compound O=C1O[C@@H](CNC(=O)C)CN1C(C=C1F)=CC=C1N1CCOCC1 TYZROVQLWOKYKF-ZDUSSCGKSA-N 0.000 description 1
- 229950002950 lintuzumab Drugs 0.000 description 1
- 238000001638 lipofection Methods 0.000 description 1
- 235000019136 lipoic acid Nutrition 0.000 description 1
- 229950011263 lirilumab Drugs 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 229950008991 lobaplatin Drugs 0.000 description 1
- 229940063718 lodine Drugs 0.000 description 1
- DHMTURDWPRKSOA-RUZDIDTESA-N lonafarnib Chemical compound C1CN(C(=O)N)CCC1CC(=O)N1CCC([C@@H]2C3=C(Br)C=C(Cl)C=C3CCC3=CC(Br)=CN=C32)CC1 DHMTURDWPRKSOA-RUZDIDTESA-N 0.000 description 1
- 229950001750 lonafarnib Drugs 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 229960004844 lovastatin Drugs 0.000 description 1
- QLJODMDSTUBWDW-UHFFFAOYSA-N lovastatin hydroxy acid Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(C)C=C21 QLJODMDSTUBWDW-UHFFFAOYSA-N 0.000 description 1
- 210000003141 lower extremity Anatomy 0.000 description 1
- 229960000994 lumiracoxib Drugs 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 201000008443 lung non-squamous non-small cell carcinoma Diseases 0.000 description 1
- 229950002654 lurtotecan Drugs 0.000 description 1
- RVFGKBWWUQOIOU-NDEPHWFRSA-N lurtotecan Chemical compound O=C([C@]1(O)CC)OCC(C(N2CC3=4)=O)=C1C=C2C3=NC1=CC=2OCCOC=2C=C1C=4CN1CCN(C)CC1 RVFGKBWWUQOIOU-NDEPHWFRSA-N 0.000 description 1
- 229960004196 lymecycline Drugs 0.000 description 1
- AHEVKYYGXVEWNO-UEPZRUIBSA-N lymecycline Chemical compound C1=CC=C2[C@](O)(C)[C@H]3C[C@H]4[C@H](N(C)C)C(O)=C(C(=O)NCNCCCC[C@H](N)C(O)=O)C(=O)[C@@]4(O)C(O)=C3C(=O)C2=C1O AHEVKYYGXVEWNO-UEPZRUIBSA-N 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- RLSSMJSEOOYNOY-UHFFFAOYSA-N m-cresol Chemical compound CC1=CC=CC(O)=C1 RLSSMJSEOOYNOY-UHFFFAOYSA-N 0.000 description 1
- 229940124302 mTOR inhibitor Drugs 0.000 description 1
- 229940092110 macugen Drugs 0.000 description 1
- 229950000547 mafosfamide Drugs 0.000 description 1
- 208000014699 malignant epithelioid mesothelioma Diseases 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 1
- 229960000733 mannosulfan Drugs 0.000 description 1
- UUVIQYKKKBJYJT-ZYUZMQFOSA-N mannosulfan Chemical compound CS(=O)(=O)OC[C@@H](OS(C)(=O)=O)[C@@H](O)[C@H](O)[C@H](OS(C)(=O)=O)COS(C)(=O)=O UUVIQYKKKBJYJT-ZYUZMQFOSA-N 0.000 description 1
- WKPWGQKGSOKKOO-RSFHAFMBSA-N maytansine Chemical compound CO[C@@H]([C@@]1(O)C[C@](OC(=O)N1)([C@H]([C@@H]1O[C@@]1(C)[C@@H](OC(=O)[C@H](C)N(C)C(C)=O)CC(=O)N1C)C)[H])\C=C\C=C(C)\CC2=CC(OC)=C(Cl)C1=C2 WKPWGQKGSOKKOO-RSFHAFMBSA-N 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 229960004961 mechlorethamine Drugs 0.000 description 1
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical class ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 1
- 229960000826 meclocycline Drugs 0.000 description 1
- 229940090004 megace Drugs 0.000 description 1
- RQZAXGRLVPAYTJ-GQFGMJRRSA-N megestrol acetate Chemical compound C1=C(C)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 RQZAXGRLVPAYTJ-GQFGMJRRSA-N 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 229940115256 melanoma vaccine Drugs 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 229940100630 metacresol Drugs 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- XZWYZXLIPXDOLR-UHFFFAOYSA-N metformin Chemical compound CN(C)C(=N)NC(N)=N XZWYZXLIPXDOLR-UHFFFAOYSA-N 0.000 description 1
- 229960003105 metformin Drugs 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- NMKUAEKKJQYLHK-KRWDZBQOSA-N methyl (7s)-7-acetamido-1,2,3-trimethoxy-6,7-dihydro-5h-dibenzo[5,3-b:1',2'-e][7]annulene-9-carboxylate Chemical compound CC(=O)N[C@H]1CCC2=CC(OC)=C(OC)C(OC)=C2C2=CC=C(C(=O)OC)C=C21 NMKUAEKKJQYLHK-KRWDZBQOSA-N 0.000 description 1
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 1
- HRHKSTOGXBBQCB-VFWICMBZSA-N methylmitomycin Chemical compound O=C1C(N)=C(C)C(=O)C2=C1[C@@H](COC(N)=O)[C@@]1(OC)[C@H]3N(C)[C@H]3CN12 HRHKSTOGXBBQCB-VFWICMBZSA-N 0.000 description 1
- 229940099246 mevacor Drugs 0.000 description 1
- HPNSFSBZBAHARI-UHFFFAOYSA-N micophenolic acid Natural products OC1=C(CC=C(C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-UHFFFAOYSA-N 0.000 description 1
- 210000004688 microtubule Anatomy 0.000 description 1
- 229960002757 midecamycin Drugs 0.000 description 1
- 108700007621 mifamurtide Proteins 0.000 description 1
- UQRORFVVSGFNRO-UTINFBMNSA-N miglustat Chemical compound CCCCN1C[C@H](O)[C@@H](O)[C@H](O)[C@H]1CO UQRORFVVSGFNRO-UTINFBMNSA-N 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- PQLXHQMOHUQAKB-UHFFFAOYSA-N miltefosine Chemical compound CCCCCCCCCCCCCCCCOP([O-])(=O)OCC[N+](C)(C)C PQLXHQMOHUQAKB-UHFFFAOYSA-N 0.000 description 1
- 229960004023 minocycline Drugs 0.000 description 1
- 239000003226 mitogen Substances 0.000 description 1
- 239000002829 mitogen activated protein kinase inhibitor Substances 0.000 description 1
- VFKZTMPDYBFSTM-GUCUJZIJSA-N mitolactol Chemical compound BrC[C@H](O)[C@@H](O)[C@@H](O)[C@H](O)CBr VFKZTMPDYBFSTM-GUCUJZIJSA-N 0.000 description 1
- 229950010913 mitolactol Drugs 0.000 description 1
- 229950005967 mitozolomide Drugs 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 229950007812 mocetinostat Drugs 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 229960003063 molgramostim Drugs 0.000 description 1
- 108010032806 molgramostim Proteins 0.000 description 1
- DASWEROEPLKSEI-UIJRFTGLSA-N monomethyl auristatin e Chemical compound CN[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N(C)[C@@H]([C@@H](C)CC)[C@H](OC)CC(=O)N1CCC[C@H]1[C@H](OC)[C@@H](C)C(=O)N[C@H](C)[C@@H](O)C1=CC=CC=C1 DASWEROEPLKSEI-UIJRFTGLSA-N 0.000 description 1
- MFRNYXJJRJQHNW-NARUGQRUSA-N monomethyl auristatin f Chemical compound CN[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N(C)C([C@@H](C)CC)[C@H](OC)CC(=O)N1CCC[C@H]1[C@H](OC)[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 MFRNYXJJRJQHNW-NARUGQRUSA-N 0.000 description 1
- VYGYNVZNSSTDLJ-HKCOAVLJSA-N monorden Natural products CC1CC2OC2C=C/C=C/C(=O)CC3C(C(=CC(=C3Cl)O)O)C(=O)O1 VYGYNVZNSSTDLJ-HKCOAVLJSA-N 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 229940072709 motrin Drugs 0.000 description 1
- ZTFBIUXIQYRUNT-MDWZMJQESA-N mubritinib Chemical compound C1=CC(C(F)(F)F)=CC=C1\C=C\C1=NC(COC=2C=CC(CCCCN3N=NC=C3)=CC=2)=CO1 ZTFBIUXIQYRUNT-MDWZMJQESA-N 0.000 description 1
- 201000010879 mucinous adenocarcinoma Diseases 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 229960000951 mycophenolic acid Drugs 0.000 description 1
- HPNSFSBZBAHARI-RUDMXATFSA-N mycophenolic acid Chemical compound OC1=C(C\C=C(/C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-RUDMXATFSA-N 0.000 description 1
- QOSWSNDWUATJBJ-UHFFFAOYSA-N n,n'-diphenyloctanediamide Chemical compound C=1C=CC=CC=1NC(=O)CCCCCCC(=O)NC1=CC=CC=C1 QOSWSNDWUATJBJ-UHFFFAOYSA-N 0.000 description 1
- WXHHICFWKXDFOW-BJMVGYQFSA-N n-(2-amino-5-fluorophenyl)-4-[[[(e)-3-pyridin-3-ylprop-2-enoyl]amino]methyl]benzamide Chemical compound NC1=CC=C(F)C=C1NC(=O)C(C=C1)=CC=C1CNC(=O)\C=C\C1=CC=CN=C1 WXHHICFWKXDFOW-BJMVGYQFSA-N 0.000 description 1
- CMEGANPVAXDBPL-INIZCTEOSA-N n-[(7s)-1,2,3-trimethoxy-10-methylsulfanyl-9-oxo-6,7-dihydro-5h-benzo[a]heptalen-7-yl]acetamide Chemical compound C1([C@@H](NC(C)=O)CC2)=CC(=O)C(SC)=CC=C1C1=C2C=C(OC)C(OC)=C1OC CMEGANPVAXDBPL-INIZCTEOSA-N 0.000 description 1
- OHDXDNUPVVYWOV-UHFFFAOYSA-N n-methyl-1-(2-naphthalen-1-ylsulfanylphenyl)methanamine Chemical compound CNCC1=CC=CC=C1SC1=CC=CC2=CC=CC=C12 OHDXDNUPVVYWOV-UHFFFAOYSA-N 0.000 description 1
- 229960004270 nabumetone Drugs 0.000 description 1
- QRGHOAATPOLDPF-VQFNDLOPSA-N nanatinostat Chemical compound N1=CC(C(=O)NO)=CN=C1N1C[C@@H]([C@@H]2NCC=3N=C4C=CC(F)=CC4=CC=3)[C@@H]2C1 QRGHOAATPOLDPF-VQFNDLOPSA-N 0.000 description 1
- 229940090008 naprosyn Drugs 0.000 description 1
- 229960000513 necitumumab Drugs 0.000 description 1
- IXOXBSCIXZEQEQ-UHTZMRCNSA-N nelarabine Chemical compound C1=NC=2C(OC)=NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@@H]1O IXOXBSCIXZEQEQ-UHTZMRCNSA-N 0.000 description 1
- 229960000801 nelarabine Drugs 0.000 description 1
- CTMCWCONSULRHO-UHQPFXKFSA-N nemorubicin Chemical compound C1CO[C@H](OC)CN1[C@@H]1[C@H](O)[C@H](C)O[C@@H](O[C@@H]2C3=C(O)C=4C(=O)C5=C(OC)C=CC=C5C(=O)C=4C(O)=C3C[C@](O)(C2)C(=O)CO)C1 CTMCWCONSULRHO-UHQPFXKFSA-N 0.000 description 1
- 229950010159 nemorubicin Drugs 0.000 description 1
- 101150091879 neo gene Proteins 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 108010068617 neonatal Fc receptor Proteins 0.000 description 1
- GVUGOAYIVIDWIO-UFWWTJHBSA-N nepidermin Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)NC(=O)CNC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@H](CS)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CS)NC(=O)[C@H](C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C(C)C)C(C)C)C1=CC=C(O)C=C1 GVUGOAYIVIDWIO-UFWWTJHBSA-N 0.000 description 1
- 229960000808 netilmicin Drugs 0.000 description 1
- ZBGPYVZLYBDXKO-HILBYHGXSA-N netilmycin Chemical compound O([C@@H]1[C@@H](N)C[C@H]([C@@H]([C@H]1O)O[C@@H]1[C@]([C@H](NC)[C@@H](O)CO1)(C)O)NCC)[C@H]1OC(CN)=CC[C@H]1N ZBGPYVZLYBDXKO-HILBYHGXSA-N 0.000 description 1
- 229940029345 neupogen Drugs 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 239000002547 new drug Substances 0.000 description 1
- 229940080607 nexavar Drugs 0.000 description 1
- 229940099637 nilandron Drugs 0.000 description 1
- 229960001420 nimustine Drugs 0.000 description 1
- 229940109551 nipent Drugs 0.000 description 1
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 229950006344 nocodazole Drugs 0.000 description 1
- XHWRWCSCBDLOLM-UHFFFAOYSA-N nolatrexed Chemical compound CC1=CC=C2NC(N)=NC(=O)C2=C1SC1=CC=NC=C1 XHWRWCSCBDLOLM-UHFFFAOYSA-N 0.000 description 1
- 229950000891 nolatrexed Drugs 0.000 description 1
- 229940085033 nolvadex Drugs 0.000 description 1
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 1
- 230000000683 nonmetastatic effect Effects 0.000 description 1
- 230000009871 nonspecific binding Effects 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 229960002351 oleandomycin Drugs 0.000 description 1
- 235000019367 oleandomycin Nutrition 0.000 description 1
- RZPAKFUAFGMUPI-KGIGTXTPSA-N oleandomycin Chemical compound O1[C@@H](C)[C@H](O)[C@@H](OC)C[C@@H]1O[C@@H]1[C@@H](C)C(=O)O[C@H](C)[C@H](C)[C@H](O)[C@@H](C)C(=O)[C@]2(OC2)C[C@H](C)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C RZPAKFUAFGMUPI-KGIGTXTPSA-N 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 150000002482 oligosaccharides Chemical class 0.000 description 1
- 229950003600 ombrabulin Drugs 0.000 description 1
- IXWNTLSTOZFSCM-YVACAVLKSA-N ombrabulin Chemical compound C1=C(NC(=O)[C@@H](N)CO)C(OC)=CC=C1\C=C/C1=CC(OC)=C(OC)C(OC)=C1 IXWNTLSTOZFSCM-YVACAVLKSA-N 0.000 description 1
- 102000027450 oncoproteins Human genes 0.000 description 1
- 108091008819 oncoproteins Proteins 0.000 description 1
- 229940048191 onivyde Drugs 0.000 description 1
- 230000014207 opsonization Effects 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 230000033667 organ regeneration Effects 0.000 description 1
- 229940127084 other anti-cancer agent Drugs 0.000 description 1
- 230000002611 ovarian Effects 0.000 description 1
- 229940039748 oxalate Drugs 0.000 description 1
- 229960002739 oxaprozin Drugs 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- YPZRWBKMTBYPTK-UHFFFAOYSA-N oxidized gamma-L-glutamyl-L-cysteinylglycine Natural products OC(=O)C(N)CCC(=O)NC(C(=O)NCC(O)=O)CSSCC(C(=O)NCC(O)=O)NC(=O)CCC(N)C(O)=O YPZRWBKMTBYPTK-UHFFFAOYSA-N 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 229960000625 oxytetracycline Drugs 0.000 description 1
- IWVCMVBTMGNXQD-PXOLEDIWSA-N oxytetracycline Chemical compound C1=CC=C2[C@](O)(C)[C@H]3[C@H](O)[C@H]4[C@H](N(C)C)C(O)=C(C(N)=O)C(=O)[C@@]4(O)C(O)=C3C(=O)C2=C1O IWVCMVBTMGNXQD-PXOLEDIWSA-N 0.000 description 1
- 235000019366 oxytetracycline Nutrition 0.000 description 1
- 101710135378 pH 6 antigen Proteins 0.000 description 1
- 108700027936 paclitaxel poliglumex Proteins 0.000 description 1
- 229940090244 palladia Drugs 0.000 description 1
- 229960003978 pamidronic acid Drugs 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 229960005184 panobinostat Drugs 0.000 description 1
- FWZRWHZDXBDTFK-ZHACJKMWSA-N panobinostat Chemical compound CC1=NC2=CC=C[CH]C2=C1CCNCC1=CC=C(\C=C\C(=O)NO)C=C1 FWZRWHZDXBDTFK-ZHACJKMWSA-N 0.000 description 1
- 229940096763 panretin Drugs 0.000 description 1
- 208000017954 parathyroid gland carcinoma Diseases 0.000 description 1
- 229960004662 parecoxib Drugs 0.000 description 1
- TZRHLKRLEZJVIJ-UHFFFAOYSA-N parecoxib Chemical compound C1=CC(S(=O)(=O)NC(=O)CC)=CC=C1C1=C(C)ON=C1C1=CC=CC=C1 TZRHLKRLEZJVIJ-UHFFFAOYSA-N 0.000 description 1
- 238000005192 partition Methods 0.000 description 1
- 230000009054 pathological process Effects 0.000 description 1
- 229950007460 patupilone Drugs 0.000 description 1
- 229960003407 pegaptanib Drugs 0.000 description 1
- 229960001744 pegaspargase Drugs 0.000 description 1
- 108010001564 pegaspargase Proteins 0.000 description 1
- 230000006320 pegylation Effects 0.000 description 1
- WVUNYSQLFKLYNI-AATRIKPKSA-N pelitinib Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OCC)=CC2=NC=C(C#N)C=1NC1=CC=C(F)C(Cl)=C1 WVUNYSQLFKLYNI-AATRIKPKSA-N 0.000 description 1
- 229950003819 pelitrexol Drugs 0.000 description 1
- 229960003349 pemetrexed disodium Drugs 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- MEGKRPMNPGTIIG-VNYBMUHKSA-N penimepicycline Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)COC1=CC=CC=C1.O=C([C@@]1(O)C(O)=C2[C@@H]([C@](C3=CC=CC(O)=C3C2=O)(C)O)C[C@H]1[C@@H](C=1O)N(C)C)C=1C(=O)NCN1CCN(CCO)CC1 MEGKRPMNPGTIIG-VNYBMUHKSA-N 0.000 description 1
- 229960003187 penimepicycline Drugs 0.000 description 1
- QIMGFXOHTOXMQP-GFAGFCTOSA-N peplomycin Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCCN[C@@H](C)C=1C=CC=CC=1)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1NC=NC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C QIMGFXOHTOXMQP-GFAGFCTOSA-N 0.000 description 1
- 229950003180 peplomycin Drugs 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 238000010647 peptide synthesis reaction Methods 0.000 description 1
- 229930192851 perforin Natural products 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 230000008782 phagocytosis Effects 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 229960003742 phenol Drugs 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- 108010018625 phenylalanylarginine Proteins 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 1
- SXADIBFZNXBEGI-UHFFFAOYSA-N phosphoramidous acid Chemical group NP(O)O SXADIBFZNXBEGI-UHFFFAOYSA-N 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 229950005566 picoplatin Drugs 0.000 description 1
- 229950010773 pidilizumab Drugs 0.000 description 1
- JTHRRMFZHSDGNJ-UHFFFAOYSA-N piperazine-2,3-dione Chemical compound O=C1NCCNC1=O JTHRRMFZHSDGNJ-UHFFFAOYSA-N 0.000 description 1
- 229960000952 pipobroman Drugs 0.000 description 1
- XESARGFCSKSFID-FLLFQEBCSA-N pirazofurin Chemical compound OC1=C(C(=O)N)NN=C1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 XESARGFCSKSFID-FLLFQEBCSA-N 0.000 description 1
- 229960001635 pirlimycin Drugs 0.000 description 1
- 229960002702 piroxicam Drugs 0.000 description 1
- 229960004403 pixantrone Drugs 0.000 description 1
- PEZPMAYDXJQYRV-UHFFFAOYSA-N pixantrone Chemical compound O=C1C2=CN=CC=C2C(=O)C2=C1C(NCCN)=CC=C2NCCN PEZPMAYDXJQYRV-UHFFFAOYSA-N 0.000 description 1
- BLFWHYXWBKKRHI-JYBILGDPSA-N plap Chemical compound N([C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(O)=O)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(=O)[C@@H]1CCCN1C(=O)[C@H](CO)NC(=O)[C@@H](N)CCC(O)=O BLFWHYXWBKKRHI-JYBILGDPSA-N 0.000 description 1
- 229940012957 plasmin Drugs 0.000 description 1
- HRGDZIGMBDGFTC-UHFFFAOYSA-N platinum(2+) Chemical compound [Pt+2] HRGDZIGMBDGFTC-UHFFFAOYSA-N 0.000 description 1
- 238000011518 platinum-based chemotherapy Methods 0.000 description 1
- 239000002770 polo like kinase inhibitor Substances 0.000 description 1
- 229920001481 poly(stearyl methacrylate) Polymers 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229920006324 polyoxymethylene Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229940068965 polysorbates Drugs 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 229960001131 ponatinib Drugs 0.000 description 1
- 229950004447 posizolid Drugs 0.000 description 1
- 231100000683 possible toxicity Toxicity 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- KYKNRZGSIGMXFH-ZVGUSBNCSA-M potassium bitartrate Chemical compound [K+].OC(=O)[C@H](O)[C@@H](O)C([O-])=O KYKNRZGSIGMXFH-ZVGUSBNCSA-M 0.000 description 1
- 239000004224 potassium gluconate Substances 0.000 description 1
- 235000013926 potassium gluconate Nutrition 0.000 description 1
- 229960003189 potassium gluconate Drugs 0.000 description 1
- PHZLMBHDXVLRIX-UHFFFAOYSA-M potassium lactate Chemical compound [K+].CC(O)C([O-])=O PHZLMBHDXVLRIX-UHFFFAOYSA-M 0.000 description 1
- 239000001521 potassium lactate Substances 0.000 description 1
- 235000011085 potassium lactate Nutrition 0.000 description 1
- 229960001304 potassium lactate Drugs 0.000 description 1
- 239000001472 potassium tartrate Substances 0.000 description 1
- 229940111695 potassium tartrate Drugs 0.000 description 1
- 235000011005 potassium tartrates Nutrition 0.000 description 1
- JHDKZFFAIZKUCU-ZRDIBKRKSA-N pracinostat Chemical compound ONC(=O)/C=C/C1=CC=C2N(CCN(CC)CC)C(CCCC)=NC2=C1 JHDKZFFAIZKUCU-ZRDIBKRKSA-N 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 229960003961 pristinamycin Drugs 0.000 description 1
- DAIKHDNSXMZDCU-OUDXUNEISA-N pristinamycin-IIA Natural products CC(C)[C@H]1OC(=O)C2=CCCN2C(=O)c3coc(CC(=O)C[C@H](O)C=C(C)C=CCNC(=O)C=C[C@@H]1C)n3 DAIKHDNSXMZDCU-OUDXUNEISA-N 0.000 description 1
- JOOMGSFOCRDAHL-XKCHLWDXSA-N pristinamycin-IIB Natural products CC(C)[C@@H]1OC(=O)[C@H]2CCCN2C(=O)c3coc(CC(=O)C[C@@H](O)C=C(C)C=CCNC(=O)C=C[C@H]1C)n3 JOOMGSFOCRDAHL-XKCHLWDXSA-N 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 239000000186 progesterone Substances 0.000 description 1
- 229960003387 progesterone Drugs 0.000 description 1
- 229940087463 proleukin Drugs 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 229940117382 propecia Drugs 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 229940030749 prostate cancer vaccine Drugs 0.000 description 1
- 235000019419 proteases Nutrition 0.000 description 1
- 239000003207 proteasome inhibitor Substances 0.000 description 1
- 108020003519 protein disulfide isomerase Proteins 0.000 description 1
- 239000003528 protein farnesyltransferase inhibitor Substances 0.000 description 1
- 108060006633 protein kinase Proteins 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 230000002797 proteolythic effect Effects 0.000 description 1
- 230000006337 proteolytic cleavage Effects 0.000 description 1
- 229940024999 proteolytic enzymes for treatment of wounds and ulcers Drugs 0.000 description 1
- SHCBCKBYTHZQGZ-CJPZEJHVSA-N protopanaxatriol Chemical compound C1C[C@H](O)C(C)(C)[C@@H]2[C@@H](O)C[C@@]3(C)[C@]4(C)CC[C@H]([C@@](C)(O)CCC=C(C)C)[C@H]4[C@H](O)C[C@@H]3[C@]21C SHCBCKBYTHZQGZ-CJPZEJHVSA-N 0.000 description 1
- BBEUDPAEKGPXDG-UHFFFAOYSA-N protopanaxatriol Natural products CC(CCC=C(C)C)C1CCC2(C)C1C(O)CC3C4(C)CCC(O)C(C)(C)C4C(O)CC23C BBEUDPAEKGPXDG-UHFFFAOYSA-N 0.000 description 1
- 229940034080 provenge Drugs 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 229940117820 purinethol Drugs 0.000 description 1
- NGVDGCNFYWLIFO-UHFFFAOYSA-N pyridoxal 5'-phosphate Chemical compound CC1=NC=C(COP(O)(O)=O)C(C=O)=C1O NGVDGCNFYWLIFO-UHFFFAOYSA-N 0.000 description 1
- 229940052337 quinupristin/dalfopristin Drugs 0.000 description 1
- WVTKBKWTSCPRNU-UHFFFAOYSA-N rac-Tetrandrin Natural products O1C(C(=CC=2CCN3C)OC)=CC=2C3CC(C=C2)=CC=C2OC(=C2)C(OC)=CC=C2CC2N(C)CCC3=CC(OC)=C(OC)C1=C23 WVTKBKWTSCPRNU-UHFFFAOYSA-N 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- AECPBJMOGBFQDN-YMYQVXQQSA-N radicicol Chemical compound C1CCCC(=O)C[C@H]2[C@H](Cl)C(=O)CC(=O)[C@H]2C(=O)O[C@H](C)C[C@H]2O[C@@H]21 AECPBJMOGBFQDN-YMYQVXQQSA-N 0.000 description 1
- 229930192524 radicicol Natural products 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- MUPFEKGTMRGPLJ-ZQSKZDJDSA-N raffinose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)O)O1 MUPFEKGTMRGPLJ-ZQSKZDJDSA-N 0.000 description 1
- 229960004432 raltitrexed Drugs 0.000 description 1
- 229960002633 ramucirumab Drugs 0.000 description 1
- PWHNTOQANLCTHN-KRWDZBQOSA-N ranbezolid Chemical compound O=C1O[C@@H](CNC(=O)C)CN1C(C=C1F)=CC=C1N1CCN(CC=2OC(=CC=2)[N+]([O-])=O)CC1 PWHNTOQANLCTHN-KRWDZBQOSA-N 0.000 description 1
- 108010061338 ranpirnase Proteins 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 229960005567 rebeccamycin Drugs 0.000 description 1
- INSACQSBHKIWNS-QZQSLCQPSA-N rebeccamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](OC)[C@@H](CO)O[C@H]1N1C2=C3N=C4[C](Cl)C=CC=C4C3=C3C(=O)NC(=O)C3=C2C2=CC=CC(Cl)=C21 INSACQSBHKIWNS-QZQSLCQPSA-N 0.000 description 1
- 229950005950 rebimastat Drugs 0.000 description 1
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 1
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 1
- 229960004836 regorafenib Drugs 0.000 description 1
- 229940087462 relafen Drugs 0.000 description 1
- 229940020428 renagel Drugs 0.000 description 1
- 230000008439 repair process Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- FECGNJPYVFEKOD-VMPITWQZSA-N resminostat Chemical compound C1=CC(CN(C)C)=CC=C1S(=O)(=O)N1C=C(\C=C\C(=O)NO)C=C1 FECGNJPYVFEKOD-VMPITWQZSA-N 0.000 description 1
- 229950002821 resminostat Drugs 0.000 description 1
- 229960002771 retapamulin Drugs 0.000 description 1
- STZYTFJPGGDRJD-NHUWBDDWSA-N retapamulin Chemical compound C([C@H]([C@@]1(C)[C@@H](C[C@@](C)(C=C)[C@@H](O)[C@@H]2C)OC(=O)CS[C@@H]3C[C@H]4CC[C@H](N4C)C3)C)C[C@]32[C@H]1C(=O)CC3 STZYTFJPGGDRJD-NHUWBDDWSA-N 0.000 description 1
- OAKGNIRUXAZDQF-TXHRRWQRSA-N retaspimycin Chemical compound N1C(=O)\C(C)=C\C=C/[C@H](OC)[C@@H](OC(N)=O)\C(C)=C\[C@H](C)[C@@H](O)[C@@H](OC)C[C@H](C)CC2=C(O)C1=CC(O)=C2NCC=C OAKGNIRUXAZDQF-TXHRRWQRSA-N 0.000 description 1
- 229940002683 retin-a Drugs 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- MYFATKRONKHHQL-UHFFFAOYSA-N rhodamine 123 Chemical compound [Cl-].COC(=O)C1=CC=CC=C1C1=C2C=CC(=[NH2+])C=C2OC2=CC(N)=CC=C21 MYFATKRONKHHQL-UHFFFAOYSA-N 0.000 description 1
- HEBKCHPVOIAQTA-ZXFHETKHSA-N ribitol Chemical compound OC[C@H](O)[C@H](O)[C@H](O)CO HEBKCHPVOIAQTA-ZXFHETKHSA-N 0.000 description 1
- 229960003485 ribostamycin Drugs 0.000 description 1
- NSKGQURZWSPSBC-NLZFXWNVSA-N ribostamycin Chemical compound N[C@H]1[C@H](O)[C@@H](O)[C@H](CN)O[C@@H]1O[C@@H]1[C@@H](O[C@H]2[C@@H]([C@@H](O)[C@H](CO)O2)O)[C@H](O)[C@@H](N)C[C@H]1N NSKGQURZWSPSBC-NLZFXWNVSA-N 0.000 description 1
- 229930190553 ribostamycin Natural products 0.000 description 1
- NSKGQURZWSPSBC-UHFFFAOYSA-N ribostamycin A Natural products NC1C(O)C(O)C(CN)OC1OC1C(OC2C(C(O)C(CO)O2)O)C(O)C(N)CC1N NSKGQURZWSPSBC-UHFFFAOYSA-N 0.000 description 1
- 238000007363 ring formation reaction Methods 0.000 description 1
- 229960000311 ritonavir Drugs 0.000 description 1
- NCDNCNXCDXHOMX-XGKFQTDJSA-N ritonavir Chemical compound N([C@@H](C(C)C)C(=O)N[C@H](C[C@H](O)[C@H](CC=1C=CC=CC=1)NC(=O)OCC=1SC=NC=1)CC=1C=CC=CC=1)C(=O)N(C)CC1=CSC(C(C)C)=N1 NCDNCNXCDXHOMX-XGKFQTDJSA-N 0.000 description 1
- 229920002477 rna polymer Polymers 0.000 description 1
- 229960000371 rofecoxib Drugs 0.000 description 1
- 229960005009 rolitetracycline Drugs 0.000 description 1
- HMEYVGGHISAPJR-IAHYZSEUSA-N rolitetracycline Chemical compound O=C([C@@]1(O)C(O)=C2[C@@H]([C@](C3=CC=CC(O)=C3C2=O)(C)O)C[C@H]1[C@@H](C=1O)N(C)C)C=1C(=O)NCN1CCCC1 HMEYVGGHISAPJR-IAHYZSEUSA-N 0.000 description 1
- 229960003452 romidepsin Drugs 0.000 description 1
- 108010091666 romidepsin Proteins 0.000 description 1
- OHRURASPPZQGQM-UHFFFAOYSA-N romidepsin Natural products O1C(=O)C(C(C)C)NC(=O)C(=CC)NC(=O)C2CSSCCC=CC1CC(=O)NC(C(C)C)C(=O)N2 OHRURASPPZQGQM-UHFFFAOYSA-N 0.000 description 1
- 229960005224 roxithromycin Drugs 0.000 description 1
- 101150024074 rub1 gene Proteins 0.000 description 1
- HMABYWSNWIZPAG-UHFFFAOYSA-N rucaparib Chemical compound C1=CC(CNC)=CC=C1C(N1)=C2CCNC(=O)C3=C2C1=CC(F)=C3 HMABYWSNWIZPAG-UHFFFAOYSA-N 0.000 description 1
- NGWSFRIPKNWYAO-UHFFFAOYSA-N salinosporamide A Natural products N1C(=O)C(CCCl)C2(C)OC(=O)C21C(O)C1CCCC=C1 NGWSFRIPKNWYAO-UHFFFAOYSA-N 0.000 description 1
- 210000003079 salivary gland Anatomy 0.000 description 1
- 229960000953 salsalate Drugs 0.000 description 1
- 238000003118 sandwich ELISA Methods 0.000 description 1
- 229930182490 saponin Natural products 0.000 description 1
- 235000017709 saponins Nutrition 0.000 description 1
- 150000007949 saponins Chemical class 0.000 description 1
- 208000014212 sarcomatoid carcinoma Diseases 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 230000000276 sedentary effect Effects 0.000 description 1
- FVLVBPDQNARYJU-UHFFFAOYSA-N semustine Chemical compound CC1CCC(NC(=O)N(CCCl)N=O)CC1 FVLVBPDQNARYJU-UHFFFAOYSA-N 0.000 description 1
- 229960003440 semustine Drugs 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 229950009921 seocalcitol Drugs 0.000 description 1
- 208000019694 serous adenocarcinoma Diseases 0.000 description 1
- 208000004548 serous cystadenocarcinoma Diseases 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- ZNSIZMQNQCNRBW-UHFFFAOYSA-N sevelamer Chemical compound NCC=C.ClCC1CO1 ZNSIZMQNQCNRBW-UHFFFAOYSA-N 0.000 description 1
- 229960005441 sevelamer carbonate Drugs 0.000 description 1
- RAGFPHFDFVNLCG-INYQBOQCSA-N sibiromycin Chemical compound O[C@@H]1[C@@](O)(C)[C@@H](NC)[C@H](C)O[C@H]1OC(C(=C1O)C)=CC(C2=O)=C1N[C@H](O)[C@H]1N2C=C(\C=C\C)C1 RAGFPHFDFVNLCG-INYQBOQCSA-N 0.000 description 1
- RAGFPHFDFVNLCG-UHFFFAOYSA-N sibiromycin Natural products OC1C(O)(C)C(NC)C(C)OC1OC(C(=C1O)C)=CC(C2=O)=C1NC(O)C1N2C=C(C=CC)C1 RAGFPHFDFVNLCG-UHFFFAOYSA-N 0.000 description 1
- 230000005783 single-strand break Effects 0.000 description 1
- 229960000714 sipuleucel-t Drugs 0.000 description 1
- URWAJWIAIPFPJE-YFMIWBNJSA-N sisomycin Chemical compound O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H](CC=C(CN)O2)N)[C@@H](N)C[C@H]1N URWAJWIAIPFPJE-YFMIWBNJSA-N 0.000 description 1
- 229950001403 sizofiran Drugs 0.000 description 1
- 210000000813 small intestine Anatomy 0.000 description 1
- 229940083542 sodium Drugs 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- HELHAJAZNSDZJO-OLXYHTOASA-L sodium L-tartrate Chemical compound [Na+].[Na+].[O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O HELHAJAZNSDZJO-OLXYHTOASA-L 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- 239000000176 sodium gluconate Substances 0.000 description 1
- 235000012207 sodium gluconate Nutrition 0.000 description 1
- 229940005574 sodium gluconate Drugs 0.000 description 1
- 239000001540 sodium lactate Substances 0.000 description 1
- 235000011088 sodium lactate Nutrition 0.000 description 1
- 229940005581 sodium lactate Drugs 0.000 description 1
- ZNCPFRVNHGOPAG-UHFFFAOYSA-L sodium oxalate Chemical compound [Na+].[Na+].[O-]C(=O)C([O-])=O ZNCPFRVNHGOPAG-UHFFFAOYSA-L 0.000 description 1
- 229940039790 sodium oxalate Drugs 0.000 description 1
- ZDQYSKICYIVCPN-UHFFFAOYSA-L sodium succinate (anhydrous) Chemical compound [Na+].[Na+].[O-]C(=O)CCC([O-])=O ZDQYSKICYIVCPN-UHFFFAOYSA-L 0.000 description 1
- 239000001433 sodium tartrate Substances 0.000 description 1
- 229960002167 sodium tartrate Drugs 0.000 description 1
- 235000011004 sodium tartrates Nutrition 0.000 description 1
- AKHNMLFCWUSKQB-UHFFFAOYSA-L sodium thiosulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=S AKHNMLFCWUSKQB-UHFFFAOYSA-L 0.000 description 1
- 235000019345 sodium thiosulphate Nutrition 0.000 description 1
- KZQSXALQTHVPDQ-UHFFFAOYSA-M sodium;butanedioate;hydron Chemical compound [Na+].OC(=O)CCC([O-])=O KZQSXALQTHVPDQ-UHFFFAOYSA-M 0.000 description 1
- MIXCUJKCXRNYFM-UHFFFAOYSA-M sodium;diiodomethanesulfonate;n-propyl-n-[2-(2,4,6-trichlorophenoxy)ethyl]imidazole-1-carboxamide Chemical compound [Na+].[O-]S(=O)(=O)C(I)I.C1=CN=CN1C(=O)N(CCC)CCOC1=C(Cl)C=C(Cl)C=C1Cl MIXCUJKCXRNYFM-UHFFFAOYSA-M 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 229950008588 solithromycin Drugs 0.000 description 1
- 238000005063 solubilization Methods 0.000 description 1
- 230000007928 solubilization Effects 0.000 description 1
- 229940078986 somatuline Drugs 0.000 description 1
- 229940072291 soriatane Drugs 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 229960000268 spectinomycin Drugs 0.000 description 1
- UNFWWIHTNXNPBV-WXKVUWSESA-N spectinomycin Chemical compound O([C@@H]1[C@@H](NC)[C@@H](O)[C@H]([C@@H]([C@H]1O1)O)NC)[C@]2(O)[C@H]1O[C@H](C)CC2=O UNFWWIHTNXNPBV-WXKVUWSESA-N 0.000 description 1
- 229960001294 spiramycin Drugs 0.000 description 1
- 235000019372 spiramycin Nutrition 0.000 description 1
- 229930191512 spiramycin Natural products 0.000 description 1
- 210000004988 splenocyte Anatomy 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- UQZIYBXSHAGNOE-XNSRJBNMSA-N stachyose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO[C@@H]3[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O3)O)O2)O)O1 UQZIYBXSHAGNOE-XNSRJBNMSA-N 0.000 description 1
- 238000011272 standard treatment Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- HKSZLNNOFSGOKW-FYTWVXJKSA-N staurosporine Chemical compound C12=C3N4C5=CC=CC=C5C3=C3CNC(=O)C3=C2C2=CC=CC=C2N1[C@H]1C[C@@H](NC)[C@@H](OC)[C@]4(C)O1 HKSZLNNOFSGOKW-FYTWVXJKSA-N 0.000 description 1
- SFVFIFLLYFPGHH-UHFFFAOYSA-M stearalkonium chloride Chemical compound [Cl-].CCCCCCCCCCCCCCCCCC[N+](C)(C)CC1=CC=CC=C1 SFVFIFLLYFPGHH-UHFFFAOYSA-M 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 230000003637 steroidlike Effects 0.000 description 1
- 239000000021 stimulant Substances 0.000 description 1
- 229940090374 stivarga Drugs 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 201000000498 stomach carcinoma Diseases 0.000 description 1
- 229940041030 streptogramins Drugs 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000008362 succinate buffer Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- MPUQHZXIXSTTDU-QXGSTGNESA-N sulfamic acid [(1S,2S,4R)-4-[4-[[(1S)-2,3-dihydro-1H-inden-1-yl]amino]-7-pyrrolo[2,3-d]pyrimidinyl]-2-hydroxycyclopentyl]methyl ester Chemical compound C1[C@H](O)[C@H](COS(=O)(=O)N)C[C@H]1N1C2=NC=NC(N[C@@H]3C4=CC=CC=C4CC3)=C2C=C1 MPUQHZXIXSTTDU-QXGSTGNESA-N 0.000 description 1
- 229960005559 sulforaphane Drugs 0.000 description 1
- 235000015487 sulforaphane Nutrition 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 229940034785 sutent Drugs 0.000 description 1
- FNDDDNOJWPQCBZ-ZDUSSCGKSA-N sutezolid Chemical compound O=C1O[C@@H](CNC(=O)C)CN1C(C=C1F)=CC=C1N1CCSCC1 FNDDDNOJWPQCBZ-ZDUSSCGKSA-N 0.000 description 1
- 229950000448 sutezolid Drugs 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 230000001839 systemic circulation Effects 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 229930194539 taccalonolide Natural products 0.000 description 1
- 229950003999 tafluposide Drugs 0.000 description 1
- 108010009573 talabostat Proteins 0.000 description 1
- 229950010637 talabostat Drugs 0.000 description 1
- 229950007866 tanespimycin Drugs 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 229960003102 tasonermin Drugs 0.000 description 1
- DKPFODGZWDEEBT-QFIAKTPHSA-N taxane Chemical class C([C@]1(C)CCC[C@@H](C)[C@H]1C1)C[C@H]2[C@H](C)CC[C@@H]1C2(C)C DKPFODGZWDEEBT-QFIAKTPHSA-N 0.000 description 1
- 150000004579 taxol derivatives Chemical class 0.000 description 1
- RCINICONZNJXQF-XAZOAEDWSA-N taxol® Chemical compound O([C@@H]1[C@@]2(CC(C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3(C21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-XAZOAEDWSA-N 0.000 description 1
- 229940063683 taxotere Drugs 0.000 description 1
- 229960000565 tazarotene Drugs 0.000 description 1
- 229950001699 teceleukin Drugs 0.000 description 1
- 229960003879 tedizolid Drugs 0.000 description 1
- XFALPSLJIHVRKE-GFCCVEGCSA-N tedizolid Chemical compound CN1N=NC(C=2N=CC(=CC=2)C=2C(=CC(=CC=2)N2C(O[C@@H](CO)C2)=O)F)=N1 XFALPSLJIHVRKE-GFCCVEGCSA-N 0.000 description 1
- 229950009112 tefinostat Drugs 0.000 description 1
- 229960003250 telithromycin Drugs 0.000 description 1
- LJVAJPDWBABPEJ-PNUFFHFMSA-N telithromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)[C@@H](C)C(=O)O[C@@H]([C@]2(OC(=O)N(CCCCN3C=C(N=C3)C=3C=NC=CC=3)[C@@H]2[C@@H](C)C(=O)[C@H](C)C[C@@]1(C)OC)C)CC)[C@@H]1O[C@H](C)C[C@H](N(C)C)[C@H]1O LJVAJPDWBABPEJ-PNUFFHFMSA-N 0.000 description 1
- 229940061353 temodar Drugs 0.000 description 1
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 1
- 229960001278 teniposide Drugs 0.000 description 1
- IWVCMVBTMGNXQD-UHFFFAOYSA-N terramycin dehydrate Natural products C1=CC=C2C(O)(C)C3C(O)C4C(N(C)C)C(O)=C(C(N)=O)C(=O)C4(O)C(O)=C3C(=O)C2=C1O IWVCMVBTMGNXQD-UHFFFAOYSA-N 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 229960003433 thalidomide Drugs 0.000 description 1
- 229940110675 theracys Drugs 0.000 description 1
- OTVAEFIXJLOWRX-NXEZZACHSA-N thiamphenicol Chemical compound CS(=O)(=O)C1=CC=C([C@@H](O)[C@@H](CO)NC(=O)C(Cl)Cl)C=C1 OTVAEFIXJLOWRX-NXEZZACHSA-N 0.000 description 1
- 229960003053 thiamphenicol Drugs 0.000 description 1
- 229960002663 thioctic acid Drugs 0.000 description 1
- 229940035024 thioglycerol Drugs 0.000 description 1
- 229960002175 thyroglobulin Drugs 0.000 description 1
- UURAUHCOJAIIRQ-QGLSALSOSA-N tiamulin Chemical compound CCN(CC)CCSCC(=O)O[C@@H]1C[C@@](C)(C=C)[C@@H](O)[C@H](C)[C@@]23CC[C@@H](C)[C@]1(C)[C@@H]2C(=O)CC3 UURAUHCOJAIIRQ-QGLSALSOSA-N 0.000 description 1
- 229960004885 tiamulin Drugs 0.000 description 1
- MIMJSJSRRDZIPW-UHFFFAOYSA-N tilmacoxib Chemical compound C=1C=C(S(N)(=O)=O)C(F)=CC=1C=1OC(C)=NC=1C1CCCCC1 MIMJSJSRRDZIPW-UHFFFAOYSA-N 0.000 description 1
- 230000025934 tissue morphogenesis Effects 0.000 description 1
- 230000007838 tissue remodeling Effects 0.000 description 1
- 229960000707 tobramycin Drugs 0.000 description 1
- NLVFBUXFDBBNBW-PBSUHMDJSA-N tobramycin Chemical compound N[C@@H]1C[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N NLVFBUXFDBBNBW-PBSUHMDJSA-N 0.000 description 1
- 229960005048 toceranib Drugs 0.000 description 1
- 229960001017 tolmetin Drugs 0.000 description 1
- 229960000303 topotecan Drugs 0.000 description 1
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 1
- 229940019127 toradol Drugs 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- PKVRCIRHQMSYJX-AIFWHQITSA-N trabectedin Chemical compound C([C@@]1(C(OC2)=O)NCCC3=C1C=C(C(=C3)O)OC)S[C@@H]1C3=C(OC(C)=O)C(C)=C4OCOC4=C3[C@H]2N2[C@@H](O)[C@H](CC=3C4=C(O)C(OC)=C(C)C=3)N(C)[C@H]4[C@@H]21 PKVRCIRHQMSYJX-AIFWHQITSA-N 0.000 description 1
- 229940118436 tracleer Drugs 0.000 description 1
- 229960004066 trametinib Drugs 0.000 description 1
- LIRYPHYGHXZJBZ-UHFFFAOYSA-N trametinib Chemical compound CC(=O)NC1=CC=CC(N2C(N(C3CC3)C(=O)C3=C(NC=4C(=CC(I)=CC=4)F)N(C)C(=O)C(C)=C32)=O)=C1 LIRYPHYGHXZJBZ-UHFFFAOYSA-N 0.000 description 1
- 239000003558 transferase inhibitor Substances 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 238000011830 transgenic mouse model Methods 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- 108010060597 trapoxin A Proteins 0.000 description 1
- 229940066958 treanda Drugs 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 229940032510 trelstar Drugs 0.000 description 1
- 229960003181 treosulfan Drugs 0.000 description 1
- IUCJMVBFZDHPDX-UHFFFAOYSA-N tretamine Chemical compound C1CN1C1=NC(N2CC2)=NC(N2CC2)=N1 IUCJMVBFZDHPDX-UHFFFAOYSA-N 0.000 description 1
- 229950001353 tretamine Drugs 0.000 description 1
- 229960005526 triapine Drugs 0.000 description 1
- 229960004560 triaziquone Drugs 0.000 description 1
- PXSOHRWMIRDKMP-UHFFFAOYSA-N triaziquone Chemical compound O=C1C(N2CC2)=C(N2CC2)C(=O)C=C1N1CC1 PXSOHRWMIRDKMP-UHFFFAOYSA-N 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical class CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 1
- NOYPYLRCIDNJJB-UHFFFAOYSA-N trimetrexate Chemical compound COC1=C(OC)C(OC)=CC(NCC=2C(=C3C(N)=NC(N)=NC3=CC=2)C)=C1 NOYPYLRCIDNJJB-UHFFFAOYSA-N 0.000 description 1
- 229960001099 trimetrexate Drugs 0.000 description 1
- 190014017283 triplatin tetranitrate Chemical compound 0.000 description 1
- 229950002860 triplatin tetranitrate Drugs 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 150000004043 trisaccharides Chemical class 0.000 description 1
- 229940086984 trisenox Drugs 0.000 description 1
- HRXKRNGNAMMEHJ-UHFFFAOYSA-K trisodium citrate Chemical compound [Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O HRXKRNGNAMMEHJ-UHFFFAOYSA-K 0.000 description 1
- 229940038773 trisodium citrate Drugs 0.000 description 1
- 229960005041 troleandomycin Drugs 0.000 description 1
- LQCLVBQBTUVCEQ-QTFUVMRISA-N troleandomycin Chemical compound O1[C@@H](C)[C@H](OC(C)=O)[C@@H](OC)C[C@@H]1O[C@@H]1[C@@H](C)C(=O)O[C@H](C)[C@H](C)[C@H](OC(C)=O)[C@@H](C)C(=O)[C@@]2(OC2)C[C@H](C)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)OC(C)=O)[C@H]1C LQCLVBQBTUVCEQ-QTFUVMRISA-N 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 230000005751 tumor progression Effects 0.000 description 1
- 229910052721 tungsten Inorganic materials 0.000 description 1
- MEYZYGMYMLNUHJ-UHFFFAOYSA-N tunicamycin Natural products CC(C)CCCCCCCCCC=CC(=O)NC1C(O)C(O)C(CC(O)C2OC(C(O)C2O)N3C=CC(=O)NC3=O)OC1OC4OC(CO)C(O)C(O)C4NC(=O)C MEYZYGMYMLNUHJ-UHFFFAOYSA-N 0.000 description 1
- 229960004059 tylosin Drugs 0.000 description 1
- WBPYTXDJUQJLPQ-VMXQISHHSA-N tylosin Chemical compound O([C@@H]1[C@@H](C)O[C@H]([C@@H]([C@H]1N(C)C)O)O[C@@H]1[C@@H](C)[C@H](O)CC(=O)O[C@@H]([C@H](/C=C(\C)/C=C/C(=O)[C@H](C)C[C@@H]1CC=O)CO[C@H]1[C@@H]([C@H](OC)[C@H](O)[C@@H](C)O1)OC)CC)[C@H]1C[C@@](C)(O)[C@@H](O)[C@H](C)O1 WBPYTXDJUQJLPQ-VMXQISHHSA-N 0.000 description 1
- 235000019375 tylosin Nutrition 0.000 description 1
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 1
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 1
- 210000001364 upper extremity Anatomy 0.000 description 1
- 229940045136 urea Drugs 0.000 description 1
- 229950005972 urelumab Drugs 0.000 description 1
- AUFUWRKPQLGTGF-FMKGYKFTSA-N uridine triacetate Chemical compound CC(=O)O[C@@H]1[C@H](OC(C)=O)[C@@H](COC(=O)C)O[C@H]1N1C(=O)NC(=O)C=C1 AUFUWRKPQLGTGF-FMKGYKFTSA-N 0.000 description 1
- XGOYIMQSIKSOBS-UHFFFAOYSA-N vadimezan Chemical compound C1=CC=C2C(=O)C3=CC=C(C)C(C)=C3OC2=C1CC(O)=O XGOYIMQSIKSOBS-UHFFFAOYSA-N 0.000 description 1
- 229960002004 valdecoxib Drugs 0.000 description 1
- LLYYNOVSVPBRGV-MVNKZKPCSA-N valnemulin Chemical compound CC(C)[C@@H](N)C(=O)NCC(C)(C)SCC(=O)O[C@@H]1C[C@@](C)(C=C)[C@@H](O)[C@H](C)[C@@]23CC[C@@H](C)[C@]1(C)[C@@H]2C(=O)CC3 LLYYNOVSVPBRGV-MVNKZKPCSA-N 0.000 description 1
- 229950008166 valnemulin Drugs 0.000 description 1
- 229960000653 valrubicin Drugs 0.000 description 1
- 229940054937 valstar Drugs 0.000 description 1
- 108010073969 valyllysine Proteins 0.000 description 1
- 229940097704 vantas Drugs 0.000 description 1
- 229940099039 velcade Drugs 0.000 description 1
- 229950001544 verdinexor Drugs 0.000 description 1
- 229940094450 vetoryl Drugs 0.000 description 1
- 229960004982 vinblastine sulfate Drugs 0.000 description 1
- KDQAABAKXDWYSZ-PNYVAJAMSA-N vinblastine sulfate Chemical compound OS(O)(=O)=O.C([C@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 KDQAABAKXDWYSZ-PNYVAJAMSA-N 0.000 description 1
- AQTQHPDCURKLKT-JKDPCDLQSA-N vincristine sulfate Chemical compound OS(O)(=O)=O.C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C=O)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 AQTQHPDCURKLKT-JKDPCDLQSA-N 0.000 description 1
- 229960002110 vincristine sulfate Drugs 0.000 description 1
- 229960004355 vindesine Drugs 0.000 description 1
- UGGWPQSBPIFKDZ-KOTLKJBCSA-N vindesine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(N)=O)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 UGGWPQSBPIFKDZ-KOTLKJBCSA-N 0.000 description 1
- 229960000922 vinflunine Drugs 0.000 description 1
- NMDYYWFGPIMTKO-HBVLKOHWSA-N vinflunine Chemical compound C([C@@](C1=C(C2=CC=CC=C2N1)C1)(C2=C(OC)C=C3N(C)[C@@H]4[C@@]5(C3=C2)CCN2CC=C[C@]([C@@H]52)([C@H]([C@]4(O)C(=O)OC)OC(C)=O)CC)C(=O)OC)[C@H]2C[C@@H](C(C)(F)F)CN1C2 NMDYYWFGPIMTKO-HBVLKOHWSA-N 0.000 description 1
- 229960002066 vinorelbine Drugs 0.000 description 1
- GBABOYUKABKIAF-GHYRFKGUSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-GHYRFKGUSA-N 0.000 description 1
- 229940087652 vioxx Drugs 0.000 description 1
- 229960003842 virginiamycin Drugs 0.000 description 1
- 235000019373 virginiamycin Nutrition 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
- 108010069784 vitespin Proteins 0.000 description 1
- 229940063674 voltaren Drugs 0.000 description 1
- 229960000237 vorinostat Drugs 0.000 description 1
- WAEXFXRVDQXREF-UHFFFAOYSA-N vorinostat Chemical compound ONC(=O)CCCCCCC(=O)NC1=CC=CC=C1 WAEXFXRVDQXREF-UHFFFAOYSA-N 0.000 description 1
- 229940069559 votrient Drugs 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- QDLHCMPXEPAAMD-QAIWCSMKSA-N wortmannin Chemical compound C1([C@]2(C)C3=C(C4=O)OC=C3C(=O)O[C@@H]2COC)=C4[C@@H]2CCC(=O)[C@@]2(C)C[C@H]1OC(C)=O QDLHCMPXEPAAMD-QAIWCSMKSA-N 0.000 description 1
- QDLHCMPXEPAAMD-UHFFFAOYSA-N wortmannin Natural products COCC1OC(=O)C2=COC(C3=O)=C2C1(C)C1=C3C2CCC(=O)C2(C)CC1OC(C)=O QDLHCMPXEPAAMD-UHFFFAOYSA-N 0.000 description 1
- 229940053867 xeloda Drugs 0.000 description 1
- 229940085728 xtandi Drugs 0.000 description 1
- ZPUHVPYXSITYDI-HEUWMMRCSA-N xyotax Chemical compound OC(=O)[C@@H](N)CCC(O)=O.O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 ZPUHVPYXSITYDI-HEUWMMRCSA-N 0.000 description 1
- 229940004212 yondelis Drugs 0.000 description 1
- 229910052727 yttrium Inorganic materials 0.000 description 1
- 229950009002 zanolimumab Drugs 0.000 description 1
- 229940099072 zavesca Drugs 0.000 description 1
- 229960002555 zidovudine Drugs 0.000 description 1
- HBOMLICNUCNMMY-XLPZGREQSA-N zidovudine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](N=[N+]=[N-])C1 HBOMLICNUCNMMY-XLPZGREQSA-N 0.000 description 1
- 229940106067 zinbryta Drugs 0.000 description 1
- 229940033942 zoladex Drugs 0.000 description 1
- 229960004276 zoledronic acid Drugs 0.000 description 1
- 229940002005 zometa Drugs 0.000 description 1
- 229940052129 zykadia Drugs 0.000 description 1
- 229940051084 zytiga Drugs 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6849—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a receptor, a cell surface antigen or a cell surface determinant
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6871—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting an enzyme
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/517—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with carbocyclic ring systems, e.g. quinazoline, perimidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/68031—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being an auristatin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/68035—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a pyrrolobenzodiazepine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6811—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a protein or peptide, e.g. transferrin or bleomycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
- A61K47/6857—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell the tumour determinant being from lung cancer cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2863—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for growth factors, growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Cell Biology (AREA)
- Organic Chemistry (AREA)
- Molecular Biology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biochemistry (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Oncology (AREA)
- Pulmonology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Oil, Petroleum & Natural Gas (AREA)
Abstract
Изобретение относится к конъюгатам антитела и лекарственного средства, которые связывают человеческий cMET и предназначены для их применения для лечения пациентов, у которых имеется рак. 3 н. и 1 з.п. ф-лы, 21 ил., 9 табл., 20 пр.
Description
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[001] Настоящая заявка испрашивает преимущество приоритета в соответствии с предварительной заявкой на выдачу патента США № 62/337796, поданной 17 мая 2016 года, содержание которой включено в данный документ посредством ссылки во всей своей полноте.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[002] Настоящая заявка содержит перечень последовательностей, который был подан в электронном виде в формате ASCII и настоящим включен посредством ссылки во всей своей полноте. Указанная ASCII-копия, созданная 17 мая 2017 года, имеет название 12252_0206-00304_SL.TXT и размер 98306 байт.
1. ОБЛАСТЬ ТЕХНИКИ
[003] Настоящая заявка относится, среди прочего, к конъюгатам антитела к cMet и лекарственного средства ("ADC"), композициям, содержащим ADC, способам получения ADC, способам отбора конкретных популяций пациентов для лечения рака с помощью ADC, нацеливающегося на cMet, и способам применения ADC для лечения определенных форм рака.
2. ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[004] Онкогенные протеинкиназы, как например cMet, представляют класс важных с биологической точки зрения мишеней для вмешательства в отношении рака. cMet, хорошо изученная рецепторная тирозинкиназа, кодируемая протоонкогеном MET, представляет собой рецептор клеточной поверхности для фактора роста гепатоцитов (HGF; Gherardi E, Birchmeier W, Birchmeier C et al. Targeting MET in cancer: rationale and progress. Nat Rev Can. 2012;12:89-103). Сверхэкспрессия cMet наблюдается в примерно 30% - 50% случаев солидных опухолей, включая немелкоклеточный рак легкого (NSCLC), колоректальный рак (CRC) и поздние стадии рака желудочно-кишечного тракта (AGEC) (Spigel DR, Ervin TJ, Ramlau RA, et al. Randomized Phase II trial of onartuzumab in combination with erlotinib in patients with advanced non-small-cell lung cancer. J Clin Oncol. 2013;31(32):41054114; Resnick MB, Routhier J, Konkin T et al. Epidermal growth factor receptor, cMET, B-catenin, and p53 expression as prognostic indicators in stage II colon cancer: a tissue microarray study. Clin Can Res. 2004;10:3069-3075; Lee HE, Kim MA, Lee HS, et al. MET in gastric carcinomas: comparison between protein express and gene copy number and impact on outcome. Br J Can. 2012;107(2):325-333).
[005] Сверхэкспрессия cMet была ассоциирована с неблагоприятным исходом у пациентов. Таким образом, остается потребность в средствах противораковой терапии, которые нацелены на формы рака, представляющие собой солидные опухоли, характеризующиеся сверхэкспрессией cMet.
3. КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[006] Описанные в данном документе средства терапии нацелены на формы рака, представляющие собой солидные опухоли, при которых cMet сверхэкспрессируется у по меньшей мере 10% популяции пациентов, у которых имеется рак. cMet (фактор мезенхимально-эпителиального перехода клеток) представляет собой рецепторную тирозинкиназу клеточной поверхности, которая передает сигналы от внеклеточного матрикса в цитоплазму путем связывания с лигандом, представляющим собой фактор роста гепатоцитов/HGF. Этот рецептор клеточной поверхности экспрессируется в эпителиальных клетках многих органов, включая печень, поджелудочную железу, предстательную железу, почку, мышцу и костный мозг, как во время эмбриогенеза, так и во взрослой жизни. cMet регулирует многие физиологические процессы, включая пролиферацию и выживание клеток, миграцию и рассеяние (межклеточное отталкивание), тканевой морфогенез, регенерацию органов и ремоделирование тканей. При раке и других патологических процессах cMet зачастую аберрантно активируется в результате мутации, увеличения численности или сверхэкспрессии белка.
[007] К формам рака, представляющим собой солидные опухоли, при которых cMet сверхэкспрессируется у по меньшей мере 10% популяции пациентов, относятся рак легкого, колоректальный рак, рак головы и шеи, рак поджелудочной железы, рак желудка, глиобластома, рак яичника, рак молочной железы, рак предстательной железы, рак шейки матки и рак пищевода. Представленные в данном документе данные впервые демонстрируют, что конъюгаты антитела и лекарственного средства ("ADC"), которые специфически нацелены на сверхэкспрессию cMet, продемонстрировали противоопухолевую активность у пациентов с диагнозом немелкоклеточный рак легкого. Данные, демонстрирующие противоопухолевую эффективность in vivo ADC, нацеливающихся на cMet, вводимых в виде монотерапии или комбинации, представлены в примерах 10-14 и 16 и на фиг. 8-12 и 14-18.
[008] Сверхэкспрессия cMet может быть определена по иммуногистохимическому (IHC) H-показателю, большему или равному 150, при измерении согласно анализу из примера 17. Вкратце, протокол IHC-окрашивания для определения наличия сверхэкспрессии cMet был разработан с помощью набора Ventana cMet CONFIRM (SP44). Образцы тканей окрашивают антителом Ventana, а затем оценивают путем определения процентного содержания целевых клеток ткани, окрашенных с различными уровнями интенсивности: от низкого до высокого. На фиг. 20 изображены репрезентативные H-показатели, полученные с помощью анализа, описанного в примере 17.
[009] Альтернативно, ткань опухоли, характеризующейся сверхэкспрессией cMet, по IHC-показателю от 0 до 3+, как описано в примере 17. На фиг. 19 и 21 изображены репрезентативные IHC-показатели, полученные с помощью анализа, описанного в примере 17.
[010] ADC, нацеливающиеся на cMet, можно вводить как отдельные терапевтические средства (монотерапия) или дополнительно с другими противораковыми средствами лечения и/или терапевтическими средствами или в дополнение к ним, обычно, но не обязательно, применяемым для лечения подлежащих лечению форм рака определенного типа. Действительно, представленные в данном документе данные демонстрируют, что опухоли, которые обладают резистентностью к другим нацеленным или ненацеленным средствам химиотерапии, сохраняют чувствительность к ADC, нацеливающимся на cMet (см., например, пример 14 и фиг. 12А-С). Соответственно, описанные в данном документе ADC, нацеливающиеся на cMet, обеспечивают значительные преимущества по сравнению с существующими нацеленными и ненацеленными подходами к лечению форм рака, представляющих собой солидные опухоли, при которых сверхэкспрессируется cMet. Дополнительные виды терапии и/или терапевтические средства обычно будут применяться в дозе, с помощью пути введения и при частоте введения, одобренных для них, но их можно применять и в более низких дозах и/или с меньшей частотой. При введении в виде монотерапии ADC, нацеливающийся на cMet, обычно будут вводить по схеме, которая обеспечивает терапевтический эффект. Предполагается, что ADC, нацеливающиеся на cMet, вводимые один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель, один раз в шесть недель, один раз в семь недель или один раз в восемь недель, будут обеспечивать терапевтический эффект, хотя эффективным может быть и более или менее частое введение. При введении дополнительно с другой терапией и/или другим средством или в дополнение к ним ADC, нацеливающийся на cMet, можно вводить до, после или одновременно с другой терапией или другим средством.
[011] ADC, нацеливающиеся на cMet, можно вводить с помощью различных путей или способов введения, включая без ограничения внутривенную инфузию и/или инъекцию и подкожную инъекцию. Величина вводимого количества будет зависеть от пути введения, схемы дозирования, типа рака, в отношении которого осуществляется лечение, стадии рака, в отношении которого осуществляется лечение, и других параметров, таких как возраст и вес пациента, что хорошо известно из уровня техники. В подробном описании приведены конкретные иллюстративные схемы дозирования, которые, как ожидается, обеспечивают терапевтический эффект. В целом, ожидается, что терапевтический эффект обеспечивает количество ADC, нацеливающегося на cMet, в диапазоне от приблизительно 0,005 до 15 мг/кг при еженедельном внутривенном введении от одного раза в неделю до одного раза в восемь недель включительно.
[012] Соответственно, в одном аспекте настоящее изобретение предусматривает ADC, которые специфически связывают cMet ("ADC, нацеливающиеся на cMet"). ADC, нацеливающиеся на cMet, содержат цитотоксические и/или цитостатические средства, связанные посредством линкеров с антигенсвязывающей частью, которая специфически связывает cMet. В некоторых вариантах осуществления антигенсвязывающая часть представляет собой антитело и/или антигенсвязывающий фрагмент.
[013] Антитела и/или связывающие фрагменты, входящие в состав ADC, нацеливающихся на cMet, как правило, содержат тяжелую цепь, содержащую вариабельную область (VH), имеющую три определяющие комплементарность области ("CDR"), называемые в данном документе (в порядке N→C) как CDR № 1 VH, CDR № 2 VH и CDR № 3 VH, и легкую цепь, содержащую вариабельную область (VL), имеющую три определяющие комплементарность области, называемые в данном документе (в порядке N→C) как CDR № 1 VL, CDR № 2 VL и CDR № 3 VL. В данном документе приведены аминокислотные последовательности иллюстративных CDR, а также аминокислотная последовательность областей VH и VL тяжелой и легкой цепей иллюстративных антител к cMet и/или связывающих фрагментов, которые могут входить в состав ADC, нацеливающихся на cMet. Конкретные варианты осуществления ADC, нацеливающихся на cMet, включают без ограничения ABT-700 и STI-0602.
[014] Для терапевтических применений целесообразным может быть использование ADC, нацеливающихся на cMet, которые связывают cMet с аффинностью, составляющей по меньшей мере 100 нМ. Соответственно, в некоторых вариантах осуществления ADC, нацеливающиеся на cMet, содержат антитело к cMet и/или связывающий фрагмент антитела к cMet, которые связывают cMet с аффинностью, составляющей по меньшей мере приблизительно 100 нМ или даже больше, например, по меньшей мере приблизительно 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 30 нМ, 25 нМ, 20 нМ, 15 нМ, 10 нМ, 7 нМ, 6 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ, 1 нМ, 0,1 нМ, 0,01 нМ или больше. Аффинность антител к cMet и/или связывающих фрагментов можно определить с помощью методик, хорошо известных из уровня техники или описанных в данном документе, таких как, например, ELISA, изотермическая титрационная калориметрия (ITC), поверхностный плазмонный резонанс, проточная цитометрия или анализ поляризации флуоресценции. В некоторых вариантах осуществления аффинность относится к значениям ЕС50 кажущейся аффинности, измеренным согласно примеру 5. В одном варианте осуществления антитело характеризуется значением EC50 кажущейся аффинности, составляющим от менее приблизительно 10 наномоль/л, предпочтительно от приблизительно 1 пикомоль/л до 10 наномоль/л, предпочтительно приблизительно 0,3 наномоль/л, как определяют согласно примеру 5.
[015] Антитела могут быть представлены в форме полноразмерных антител, биспецифических антител, антител с двойным вариабельным доменом, многоцепочечных или одноцепочечных антител, сурротел (включая конструкцию с суррогатной легкой цепью), однодоменных антител, камелизированных антител, scFv-Fc-антител и т. п. Они могут относится к любому изотипу или происходить от него, включая, например, IgA (например, IgA1 или IgA2), IgD, IgE, IgG (например, IgG1, IgG2, IgG3 или IgG4), IgM, или IgY. В некоторых вариантах осуществления антитело к cMet представляет собой IgG (например, IgG1, IgG2, IgG3 или IgG4). Антитела могут иметь человеческое происхождение или отличное от человеческого происхождение. Примеры отличного от человеческого происхождения включают без ограничения происхождение от млекопитающих (например, обезьян, грызунов, коз и кроликов) или происхождение от птиц (например, куриц). В конкретных вариантах осуществления антитела, входящие в состав ADC, нацеливающихся на cMet, подходят для введения людям, такие как, например, гуманизированные антитела и/или полностью человеческие антитела.
[016] Антигенсвязывающие фрагменты, входящие в состав ADC, нацеливающихся на cMet, могут включать любой фрагмент антитела, способный специфически связывать cMet. Конкретные примеры связывающих фрагментов антитела, которые могут быть включены в ADC, нацеливающиеся на cMet, включают без ограничения Fab, Fab', (Fab')2, Fv и scFv.
[017] Антитела и/или связывающие фрагменты, входящие в состав ADC, нацеливающихся на cMet, могут содержать модификации и/или мутации, которые изменяют свойства антител и/или фрагментов, как, например, таковые, которые увеличивают период полужизни, увеличивают или уменьшают ADCC и т. д., как известно из уровня техники.
[018] Цитотоксические и/или цитостатические средства, входящие в состав ADC, нацеливающихся на cMet, могут быть любыми средствами, о которых известно, что они ингибируют рост и/или репликацию клеток и/или приводят к их гибели. Из литературы известно множество средств, обладающих цитотоксическими и/или цитостатическими свойствами. Неограничивающие примеры классов цитотоксических и/или цитостатических средств включают в качестве примера и без ограничения модуляторы клеточного цикла, регуляторы апоптоза, ингибиторы киназ, ингибиторы синтеза белка, алкилирующие средства, сшивающие ДНК средства, интеркалирующие средства, митохондриальные ингибиторы, ингибиторы ядерного экспорта, ингибиторы топоизомеразы I, ингибиторы топоизомеразы II, антиметаболиты РНК/ДНК и антимитотические средства.
[019] В конкретном варианте осуществления цитотоксическое и/или цитостатическое средство, входящее в состав ADC, нацеливающегося на cMet, представляет собой проникающее в клетки антимитотическое средство, такое как, например, ауристатин. Конкретные примеры проникающих в клетки ауристатинов включают без ограничения доластатин-10 и монометилауристатин E ("MMAE"). В другом конкретном варианте осуществления цитотоксическое и/или цитостатическое средство, входящее в состав ADC, нацеливающегося на cMet, представляет собой проникающее в клетку и сшивающее ДНК средство, такое как проникающее в клетку и связывающееся с малой бороздой ДНК-сшивающее средство. Конкретные примеры проникающих в клетку и связывающихся с малой бороздой ДНК средств включают без ограничения пирролобензодиазепины ("PBD") и димеры PBD.
[020] Линкеры, связывающие цитотоксические и/или цитостатические средства с антигенсвязывающей частью ADC, нацеливающегося на cMet, могут быть длинными, короткими, гибкими, жесткими, гидрофильными или гидрофобными по своей природе или могут содержать сегменты, которые имеют разные характеристики, такие как сегменты гибкости, сегменты жесткости и т. д. Линкер может быть химически устойчивым к внеклеточным средам, например химически устойчивым в кровотоке, или может содержать связи, которые являются неустойчивыми и обеспечивают высвобождение цитотоксических и/или цитостатических средств во внеклеточную среду. В некоторых вариантах осуществления линкеры содержат связи, которые сконструированы с возможностью обеспечения высвобождения цитотоксических и/или цитостатических средств при интернализации ADC, нацеливающегося на cMet, в клетку. В некоторых конкретных вариантах осуществления линкеры содержат связи, выполненные с возможностью специфического или неспецифического расщепления и/или отщепления или разрушения иным образом внутри клеток. Из уровня техники известен широкий спектр линкеров, пригодных для связывания лекарственных средств с антигенсвязывающими частями, такими как антитела, в контексте ADC. Для связывания цитотоксических и/или цитостатических средств с антигенсвязывающей частью описываемых в данном документе ADC, нацеливающихся на cMet, можно применять любой из этих линкеров, а также другие линкеры.
[021] Количество цитотоксических и/или цитостатических средств, связанных с антигенсвязывающей частью ADC, нацеливающегося на cMet, может варьировать (так называемое "соотношение лекарственного средства и антитела" или "DAR") и будет ограничено только количеством доступных участков присоединения на антигенсвязывающей части и количеством средств, связанных с одним линкером. Обычно линкер будет связывать одно цитотоксическое и/или цитостатическое средство с антигенсвязывающей частью ADC, нацеливающегося на cMet. В вариантах осуществления ADC, нацеливающихся на cMet, которые включают более одного цитотоксического и/или цитостатического средства, каждое средство может быть одинаковым или различным. Предполагаются ADC, нацеливающиеся на cMet, с DAR, составляющим двадцать или даже больше, при условии, что ADC, нацеливающийся на cMet, не характеризуется неприемлемыми уровнями агрегации в условиях применения и/или хранения. В некоторых вариантах осуществления описываемые в данном документе ADC, нацеливающиеся на cMet, могут характеризоваться DAR, находящимся в диапазоне приблизительно 1-10, 1-8, 1-6 или 1-4. В определенных конкретных вариантах осуществления ADC, нацеливающиеся на cMet, могут характеризоваться DAR, составляющим 2, 3 или 4. В других конкретных вариантах осуществления ADC, нацеливающиеся на cMet, могут характеризоваться средним DAR, составляющим 3,1.
4. КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Файл патента или заявки содержит по меньшей мере один графический материал, выполненный в цвете. Копии данной публикации патента или патентной заявки с цветным графическим материалом (графическими материалами) будут предоставлены Ведомству по запросу и с оплатой необходимого сбора.
[022] На фиг. 1А-Е показаны аминокислотные последовательности нескольких антител к cMet.
[023] На фиг. 2A-B проиллюстрирован способ 1 для ABBV-399.
[024] На фиг. 3A-B проиллюстрирован способ 2 для ABBV-399.
[025] На фиг. 4A-B изображена цитотоксичность ABBV-399 в линиях клеток, экспрессирующих cMet.
[026] На фиг. 5 приведены результаты по ингибированию пролиферации с помощью ABBV-399 и ABT-700 PBD.
[027] На фиг. 6A-B показана активность in vitro ABT-700 PBD в линиях клеток колоректального рака.
[028] На фиг. 7 показана активность in vitro ABT-700 PBD в линиях клеток рака головного мозга.
[029] На фиг. 8 показана активность ABT-700 PBD в ксенотрансплантатах SW48.
[030] На фиг. 9A-C показана активность ABT-700 PBD и ABBV-399 в ксенотрансплантатах от пациентов с NSCLC.
[031] На фиг. 10A-B показана активность ABBV-399 в ксенотрансплантатах от пациентов с NSCLC с применением диаграмм Каплана-Мейера.
[032] На фиг. 11A-B приведено сравнение активности ABT-700 с ABBV-399 в ксенотрансплантатах опухолей человека; на фиг. 11С показана активность ABBV-339 в отдельности или в комбинации с FOLFIRI.
[033] На фиг. 12A-C показана активность ABBV-399 в моделях ксенотрансплантата человека, резистентных к ABT-700.
[034] На фиг. 13 приведена схема повышения дозы ABBV-399 в ходе испытания фазы I монотерапии.
[035] На фиг. 14 приведена каскадная диаграмма, демонстрирующая наилучшее процентное изменение целевых очагов.
[036] На фиг. 15 приведена каскадная диаграмма, демонстрирующая наилучшее процентное изменение целевых очагов/уровней cMet с помощью ABBV-399 в качестве монотерапии.
[037] На фиг. 16 показано количество недель до клинического прогрессирования у 16 пациентов, получавших лечение с помощью ABBV-399.
[038] На фиг. 17 представлена каскадная диаграмма, демонстрирующая наилучшее процентное изменение целевых очагов с помощью ABBV-399 в комбинации с эрлотинибом.
[039] На фиг. 18 показано количество недель до клинического прогрессирования у 6 пациентов, получавших лечение с помощью ABBV-399 и эрлотиниба.
[040] На фиг. 19 проиллюстрировано руководство по оценке SP44 от Ventana.
[041] На фиг. 20 проиллюстрирован отбор пациентов по сверхэкспрессии cMet.
[042] На фиг. 21 приведены иллюстративные IHC-показатели, полученные с помощью способа из примера 17.
5. ПОДРОБНОЕ ОПИСАНИЕ
5.1. Сокращения
[043] Описываемые в данном документе антитела, связывающие фрагменты, ADC и полинуклеотиды во многих вариантах осуществления описаны с помощью их соответствующих полипептидных или полинуклеотидных последовательностей. Если не указано иное, полипептидные последовательности представлены в ориентации N→C; полинуклеотидные последовательности - в ориентации 5'→3'. Для полипептидных последовательностей можно применять традиционные трех- или однобуквенные сокращения кодируемых генетическим кодом аминокислот, которые указаны в приведенной ниже таблице 1.
| ТАБЛИЦА 1 Сокращения кодируемых аминокислот |
||
| Аминокислота | Трехбуквенное сокращение | Однобуквенное сокращение |
| Аланин | Ala | A |
| Аргинин | Arg | R |
| Аспарагин | Asn | N |
| Аспарагиновая кислота | Asp | D |
| Цистеин | Cys | C |
| Глутаминовая кислота | Glu | E |
| Глутамин | Gln | Q |
| Глицин | Gly | G |
| Гистидин | His | H |
| Изолейцин | Ile | I |
| Лейцин | Leu | L |
| Лизин | Lys | K |
| Метионин | Met | M |
| Фенилаланин | Phe | F |
| Пролин | Pro | P |
| Серин | Ser | S |
| Треонин | Thr | T |
| Триптофан | Trp | W |
| Тирозин | Tyr | Y |
| Валин | Val | V |
[044] Определенные последовательности определяются структурными формулами, указывающими аминокислотные остатки, относящиеся к определенным классам (например, алифатические, гидрофобные и т. д.). Различные классы, к которым относятся кодируемые генетическим кодом аминокислоты, используемые в данном документе, указаны в приведенной ниже таблице 2. Некоторые аминокислоты могут относится более чем к одному классу. Цистеин, который содержит сульфгидрильную группу, и пролин, который является конформационно ограниченным, не принадлежат ни к одному из классов.
| ТАБЛИЦА 2 Классы кодируемых аминокислот |
|
| Класс | Аминокислоты |
| Алифатические | A, I, L,V |
| Ароматические | F, Y, W |
| Неполярные | M, A, I, L, V |
| Полярные | N, Q, S, T |
| Основные | H, K, R |
| Кислые | D, E |
| Малые | A, G |
5.2. Определения
[045] Если в данном документе не определено иное, научные и технические термины, применяемые в связи с настоящим изобретением, будут иметь значения, которые в большинстве случаев понимают специалисты в данной области техники.
5.3. Конъюгаты антитела и лекарственного средства, которые связываются с cMet, и анализ сверхэкспрессии cMet
[046] Настоящее изобретение относится к конъюгатам антитела и лекарственного средства, которые специфически связывают cMet человека, композициям, содержащим ADC, антителам к cMet и/или связывающим фрагментам, которые могут входить в состав ADC, полинуклеотидам, кодирующим антитела к cMet и/или связывающие фрагменты, которые входят в состав ADC, клеткам-хозяевам, способным продуцировать антитела и/или связывающие фрагменты, способам и композициям, пригодным для получения антител, связывающих фрагментов и ADC, и различным способам применения ADC в лечении рака.
[047] Представленные в данном документе данные впервые демонстрируют, что конъюгаты антитела и лекарственного средства ("ADC"), специфически нацеленные на cMet, оказывают сильные противоопухолевые эффекты как в отдельности, так и в комбинации с другими нацеленными и ненацеленными противоопухолевыми средствами терапии в отношении солидных опухолей, при которых сверхэкспрессируется cMet, в частности опухолей с IHC-показателем 2+ и 3+ по результатам измерения с помощью иммуногистохимии с антителом SP44. Данные, демонстрирующие противоопухолевую эффективность in vivo ABBV-399, вводимого в виде монотерапии, представлены в примерах.
[048] Для целей настоящей заявки, включая формулу изобретения, конкретный анализ, применяемый в описанном в данном документе исследовании, называют "протоколом окрашивания с помощью ABBV-ADC, нацеливающегося на cMet". Данный протокол подробно описан в примере 17, и результаты выражены в виде H-показателя, а также они могут быть выражены в виде IHC-показателя или с помощью другой системы оценки, хорошо известной в данной области техники.
[049] Подход с использованием H-показателя обеспечивает оптимальное разрешение данных для определения изменения интенсивности и процента окрашивания опухоли в пределах типа опухоли и среди различных типов опухоли. Он также служит хорошим инструментом для определения пороговых значений для положительного окрашивания. В данном способе процент клеток (0-100) в опухоли предусматривается по значениям интенсивности окрашивания в диапазоне от 0-3+. Данный протокол обеспечивает окрашивание белка cMet как в цитоплазме, так и на клеточной поверхности/мембране. Определяют интенсивность окрашивания для каждой клетки в фиксированном поле (обычно 100 клеток) обработанного биоптата опухоли, и каждой клетке присваивают отдельное значение, как описано далее, в зависимости от окрашивания клеточной поверхности/мембраны:
[050] 0= отсутствие окрашивания,
[051] 1+= слабое окрашивание,
[052] 2+= умеренное окрашивание,
[053] 3+= сильное окрашивание.
[054] Для получения H-показателя процент опухолевых клеток умножают на каждое значение интенсивности и складывают вместе. Максимальный H-показатель составляет 300, если 100% опухолевых клеток помечены с интенсивностью 3+. H-показатель рассчитывают следующим образом:
[055] H-показатель=[1 x (% клеток 1+)+2 x (% клеток 2+)+3 x (% клеток 3+)].
[056] Данный протокол обеспечивает окрашивание cMet как в цитоплазме, так и на мембране. Для упомянутых в данном документе расчетов H-показателя применяли мембранное окрашивание. Итоговый H-показатель опухоли (0-300) дает большее относительное значение для мембранного окрашивания с более высокой интенсивностью (3+ клетка > 2+ клетка > 1+ клетка). На фиг. 20 показаны иллюстративные результаты окрашивания опухолей с различными H-показателями (15, 90, 180 и 290), полученными с помощью "протокола окрашивания с помощью ABBV-ADC, нацеливающегося на cMet".
[057] Каждой опухоли также можно присвоить IHC-показатель, представляющий собой IHC 0, IHC 1+, IHC 2+ или IHC 3+. Хотя как IHC-показатель, так и H-показатель включают значения 0, 1+, 2+ и 3+, их не следует путать. В случае H-показателя, значения 0, 1+, 2+ и 3+ относятся к интенсивности окрашивания отдельной клетки. В случае IHC-показателя, значения 0, 1+, 2+ и 3+ относятся к общему окрашиванию конкретной области образца опухоли. На фиг. 21 показаны иллюстративные результаты окрашивания опухолей с различными IHC-показателями 0/1+/2+/3+, полученными с помощью "протокола окрашивания с помощью ABBV-ADC, нацеливающегося на cMet".
[058] Для целей настоящего изобретения и согласно описанному в данном документе протоколу, если ни одна из клеток в фиксированном поле не окрашена, значение, присваиваемое опухоли, представляет собой IHC 0. Если общий уровень окрашивания в фиксированном поле является низким, значение, присваиваемое опухоли, представляет собой IHC 1+. Если в большей части клеток в фиксированном поле наблюдается умеренное окрашивание, значение, присваиваемое опухоли, представляет собой IHC 2+. Если в большей части клеток в фиксированном поле наблюдается сильное окрашивание, значение, присваиваемое опухоли, представляет собой IHC 3+.
[059] В другом варианте осуществления, и для целей настоящего изобретения, и согласно описанному в данном документе протоколу, если ни одна из клеток в фиксированном поле не окрашена, значение, присваиваемое опухоли, представляет собой IHC 0. Если общий уровень окрашивания в фиксированном поле является низким, значение, присваиваемое опухоли, представляет собой IHC 1+. Если в по меньшей мере 15% клеток в фиксированном поле наблюдается умеренное окрашивание, значение, присваиваемое опухоли, представляет собой IHC 2+. Если в по меньшей мере 15% клеток в фиксированном поле наблюдается сильное окрашивание, значение, присваиваемое опухоли, представляет собой IHC 3+.
[060] Для целей настоящего изобретения H-показатель, составляющий от 150 до 224, эквивалентен IHC-показателю 2+, а H-показатель, составляющий 225 и больше, эквивалентен IHC-показателю 3+.
[061] Соответственно, в одном аспекте настоящее изобретение предусматривает ADC, которые специфически связывают cMet ("ADC, нацеливающиеся на cMet"). ADC, нацеливающиеся на cMet, содержат цитотоксические и/или цитостатические средства, связанные посредством линкеров с антигенсвязывающей частью, которая специфически связывает cMet. В случае ABBV-399, антигенсвязывающая часть (ABT-700) связывает cMet на домене 1 IPT cMet человека. В случае других ADC, нацеливающихся на cMet, антигенсвязывающая часть может представлять собой часть, способную специфически связывать cMet. В некоторых вариантах осуществления антигенсвязывающая часть представляет собой антитело и/или связывающий фрагмент антитела.
[062] В конкретном варианте осуществления цитотоксическое и/или цитостатическое средство, входящее в состав ADC, нацеливающегося на cMet, представляет собой проникающее в клетки антимитотическое средство, такое как, например, ауристатин. Конкретные примеры проникающих в клетки ауристатинов включают без ограничения доластатин-10 и монометилауристатин E ("MMAE"). В другом конкретном варианте осуществления цитотоксическое и/или цитостатическое средство, входящее в состав ADC, нацеливающегося на cMet, представляет собой проникающее в клетку и сшивающее ДНК средство, такое как проникающее в клетку и связывающееся с малой бороздой ДНК-сшивающее средство. Конкретные примеры проникающих в клетку и связывающихся с малой бороздой ДНК средств включают без ограничения пирролобензодиазепины ("PBD") и димеры PBD.
[063] Как будет понятно специалистам в данной области техники, антитела и/или связывающие фрагменты являются "модульными" по своей природе. В настоящем раскрытии описаны различные конкретные варианты осуществления различных "модулей", входящих в состав антител и/или связывающих фрагментов. В качестве конкретных неограничивающих примеров описаны различные конкретные варианты осуществления CDR VH, VH-цепей, CDR VL и VL-цепей. Предполагается, что все конкретные варианты осуществления можно комбинировать друг с другом, как если бы каждая конкретная комбинация была явно описана отдельно.
[064] Раскрытые в данном документе ADC также являются "модульными" по своей природе. В настоящем раскрытии описаны различные конкретные варианты осуществления "модулей", входящих в состав ADC. В качестве неограничивающих примеров описаны конкретные варианты осуществления антител, линкеров и цитотоксических и/или цитостатических средств, которые могут входить в состав ADC. Предполагается, что все описанные конкретные варианты осуществления можно комбинировать друг с другом, как если бы каждая конкретная комбинация была явно описана отдельно.
[065] Специалистам в данной области техники также будет понятно, что различные описанные в данном документе ADC могут быть представлены в форме солей, а в конкретных вариантах осуществления - фармацевтически приемлемых солей. ADC по настоящему раскрытию, которые содержат достаточно кислые, достаточно основные или обе функциональные группы, могут взаимодействовать с любым из ряда неорганических оснований, а также неорганических и органических кислот с образованием соли. Альтернативно, соединения, которые по своей природе являются заряженными, например соединения с четвертичным азотом, могут образовывать соль с соответствующим противоионом, например галогенидом, таким как бромид, хлорид или фторид.
[066] Кислоты, обычно используемые для образования солей присоединения кислоты, представляют собой неорганические кислоты, такие как хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, фосфорная кислота и т. п., и органические кислоты, такие как п-толуолсульфоновая кислота, метансульфоновая кислота, щавелевая кислота, п-бромфенилсульфоновая кислота, угольная кислота, янтарная кислота, лимонная кислота и т. д. К солям присоединения основания относятся соли, полученные из неорганических оснований, таких как гидроксиды, карбонаты, бикарбонаты аммония и щелочных или щелочноземельных металлов и т. п.
5.4. Антитела к cMet
[067] В конкретных иллюстративных вариантах осуществления антигенсвязывающая часть представляет собой антитело или антигенсвязывающий фрагмент.
[068] Используемый в данном документе термин "антитело" (Ab) относится к молекуле иммуноглобулина, которая специфически связывается с определенным антигеном, в данном документе - cMet, или является иммунологически реактивной в отношении него. Антитела содержат определяющие комплементарность области (CDR), также известные как гипервариабельные области, в вариабельных доменах как легкой цепи, так и тяжелой цепи. Более высококонсервативные части вариабельных доменов называют каркасными (FR). Как известно из уровня техники, положение аминокислоты/граница, определяющая гипервариабельную область антитела, может варьировать в зависимости от контекста и различных определений, известных из уровня техники. Некоторые положения в вариабельном домене можно рассматривать как гибридные гипервариабельные положения в том смысле, что эти положения можно считать находящимися в гипервариабельной области по одному набору критериев, в то время как их можно считать находящимися вне гипервариабельной области по другому набору критериев. Одно или несколько из этих положений также можно обнаружить в расширенных гипервариабельных областях. Каждый из вариабельных доменов нативных тяжелых и легких цепей содержит четыре FR-области, в основном в результате принятия конфигурации β-листа, соединенные тремя CDR, которые образуют петли, соединяющие, и в некоторых случаях формирующие часть структуры β-листа. CDR в каждой цепи удерживаются совместно в непосредственной близости посредством FR-областей и вместе с CDR из другой цепи способствуют образованию антигенсвязывающего участка антител. См. Kabat et al., Sequences of Proteins of Immunological Interest (National Institute of Health, Bethesda, Md. 1987). Как используется в данном документе, аминокислотные остатки иммуноглобулина нумеруют согласно системе нумерации аминокислотных остатков иммуноглобулина по Kabat et al., если не указано иное.
[069] Антитела и/или связывающие фрагменты, входящие в состав ADC, нацеливающихся на cMet, как правило, содержат тяжелую цепь, содержащую вариабельную область (VH), имеющую три определяющие комплементарность области ("CDR"), называемые в данном документе (в порядке N→C) как CDR № 1 VH, CDR № 2 VH и CDR № 3 VH, и легкую цепь, содержащую вариабельную область (VL), имеющую три определяющие комплементарность области, называемые в данном документе (в порядке N→C) как CDR № 1 VL, CDR № 2 VL и CDR № 3 VL. В данном документе приведены аминокислотные последовательности иллюстративных CDR, а также аминокислотная последовательность областей VH и VL тяжелой и легкой цепей иллюстративных антител к cMet и/или связывающих фрагментов, которые могут быть включены в антигенсвязывающие части, входящие в состав ADC, нацеливающихся на cMet. Конкретные варианты осуществления ADC, нацеливающихся на cMet, включают без ограничения ADC, которые содержат антитела и/или связывающие фрагменты, которые содержат такие иллюстративные CDR и/или последовательности VH и/или VL, а также антитела и/или связывающие фрагменты, которые конкурируют за связывание cMet с такими антителами и/или связывающими фрагментами.
[070] Антитела могут быть представлены в форме полноразмерных антител, биспецифических антител, антител с двойным вариабельным доменом, многоцепочечных или одноцепочечных антител, сурротел (включая конструкцию с суррогатной легкой цепью), однодоменных антител, камелизированных антител, scFv-Fc-антител и т. п. Они могут относится к любому изотипу или происходить от него, включая, например, IgA (например, IgA1 или IgA2), IgD, IgE, IgG (например, IgG1, IgG2, IgG3 или IgG4), IgM, или IgY. В некоторых вариантах осуществления антитело к cMet представляет собой IgG (например, IgG1, IgG2, IgG3 или IgG4). Антитела могут иметь человеческое происхождение или отличное от человеческого происхождение. Примеры отличного от человеческого происхождения включают без ограничения происхождение от млекопитающих (например, обезьян, грызунов, коз и кроликов) или происхождение от птиц (например, куриц). В конкретных вариантах осуществления антитела, входящие в состав ADC, нацеливающихся на cMet, подходят для введения людям, такие как, например, гуманизированные антитела и/или полностью человеческие антитела.
[071] Антитела, входящие в состав ADC, нацеливающихся на cMet, могут быть поликлональными, моноклональными, полученными методами генной инженерии и/или иным образом модифицированными по своей природе, включая без ограничения химерные антитела, гуманизированные антитела, человеческие антитела, приматизированные антитела, одноцепочечные антитела, биспецифические антитела, антитела с двумя вариабельными доменами и т. д. В различных вариантах осуществления антитела содержат всю константную область антитела или ее часть. В некоторых вариантах осуществления константная область относится к изотипу, выбранному из: IgA (например, IgA1 или IgA2), IgD, IgE, IgG (например, IgG1, IgG2, IgG3 или IgG4), IgM, и IgY. В конкретных вариантах осуществления антитела, входящие в состав ADC, нацеливающегося на cMet, содержат константную область изотипа IgG1.
[072] Используемый в данном документе термин "моноклональное антитело" не ограничивается антителами, полученными посредством гибридомной технологии. Моноклональное антитело получают из одного клона, включая любой эукариотический, прокариотический или фаговый клон, любыми доступными или известными из уровня техники способами. Моноклональные антитела, пригодные в настоящем изобретении, можно получать с применением широкого спектра методик, известных из уровня техники, включая применение гибридомной технологии, рекомбинантной технологии и технологии фагового дисплея или их комбинации. Во многих применениях настоящего изобретения, включая применение in vivo ADC, включающих антитела к cMet, у людей, можно соответствующим образом применять химерные, приматизированные, гуманизированные или человеческие антитела.
[073] Используемый в данном документе термин "химерное" антитело относится к антителу, имеющему вариабельные последовательности, полученные из отличного от человеческого иммуноглобулина, такого как крысиное или мышиное антитело, и константные области человеческого иммуноглобулина, обычно выбранные из матрицы человеческого иммуноглобулина. Способы получения химерных антител известны из уровня техники. См., например, Morrison, 1985, Science 229(4719):1202-7; Oi et al., 1986, BioTechniques 4:214-221; Gillies et al., 1985, J. Immunol. Methods 125:191-202; патенты США №№ 5807715; 4816567 и 4816397, которые включены в данный документ посредством ссылки во всей своей полноте.
[074] "Гуманизированные" формы отличных от человеческих (например, мышиных) антител представляют собой химерные иммуноглобулины, которые содержат минимальные последовательности, полученные из отличного от человеческого иммуноглобулина. В целом, гуманизированное антитело будет содержать практически все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или практически все CDR-области соответствуют таковым из отличного от человеческого иммуноглобулина, и все или практически все FR-области являются таковыми с последовательностью человеческого иммуноглобулина. Гуманизированное антитело также может содержать по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, таковую с консенсусной последовательностью человеческого иммуноглобулина. Способы гуманизации антитела хорошо известны из уровня техники. См, например, Riechmann et al., 1988, Nature 332:323-7; патенты США №№ 5530101, 5585089, 5693761, 5693762 и 6180370 от Queen et al.; EP239400, публикацию согласно PCT WO 91/09967; патент США № 5225539; EP592106, EP519596, Padlan, 1991, Mol. Immunol., 28:489-498; Studnicka et al., 1994, Prot. Eng. 7:805-814; Roguska et al., 1994, Proc. Natl. Acad. Sci. 91:969-973; и патент США № 5565332, все из которых включены в данный документ посредством ссылки во всей своей полноте.
[075] "Человеческие антитела" представляют собой антитела, имеющие аминокислотную последовательность человеческого иммуноглобулина, и включают антитела, выделенные из библиотек человеческих иммуноглобулинов или из животных, которые являются трансгенными по одному или нескольким человеческим иммуноглобулинам и которые не экспрессируют эндогенные иммуноглобулины. Человеческие антитела можно получить различными способами, известными из уровня техники, включая способы фагового дисплея с применением библиотек антител, полученных из последовательностей человеческих иммуноглобулинов. См. патенты США №№ 4444887 и 4716111 и публикации согласно PCT WO 98/46645; WO 98/50433; WO 98/24893; WO 98/16654; WO 96/34096; WO 96/33735 и WO 91/10741, каждое их которых включено в данный документ посредством ссылки во всей своей полноте. Человеческие антитела также можно получить с помощью трансгенных мышей, которые не способны экспрессировать функциональные эндогенные иммуноглобулины, но могут экспрессировать гены человеческого иммуноглобулина. См, например, публикации согласно PCT WO 98/24893; WO 92/01047; WO 96/34096; WO 96/33735; патенты США №№ 5413923; 5625126; 5633425; 5569825; 5661016; 5545806; 5814318; 5885793; 5916771 и 5939598, которые включены в данный документ посредством ссылки во всей своей полноте. Кроме того, можно привлечь такие компании, как Medarex (Принстон, Нью-Джерси), Astellas Pharma (Дирфилд, Иллинойс), Amgen (Таузанд-Окс, Калифорния) и Regeneron (Тарритаун, Нью-Йорк), для создания человеческих антител, направленных против выбранного антигена, с помощью технологии, аналогичной описанной выше. Полностью человеческие антитела, которые распознают выбранный эпитоп, можно создать с помощью методики, называемой "управляемым отбором". В данном подходе выбранное не относящееся к человеческому моноклональное антитело, например мышиное антитело, применяют для управления отбором полностью человеческого антитела, распознающего такой же эпитоп (см., Jespers et al., 1988, Biotechnology 12:899-903).
[076] "Приматизированные антитела" содержат вариабельные области обезьян и константные области человека. Способы получения приматизированных антител известны из уровня техники. См., например, патенты США №№ 5658570; 5681722 и 5693780, которые включены в данный документ посредством ссылки во всей своей полноте.
[077] ADC, нацеливающиеся на cMet, могут содержать полноразмерные (интактные) молекулы антитела, а также антигенсвязывающие фрагменты, которые способны специфически связывать cMet. Примеры связывающих фрагментов антитела включают в качестве примера и без ограничения Fab-, Fab'-, F(ab')2-, Fv-фрагменты, одноцепочечные Fv-фрагменты и однодоменные фрагменты.
[078] Fab-фрагмент содержит константный домен легкой цепи и первый константный домен (CH2) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков на карбоксильном конце CH2-домена тяжелой цепи, включая один или несколько цистеинов из шарнирной области антитела. F(ab')-фрагменты получают путем расщепления дисульфидной связи в цистеинах шарнирной области продукта пепсинового расщепления F(ab ')2. Специалистам в данной области техники известны дополнительные схемы химического связывания фрагментов антител. Fab- и F(ab')2-фрагменты не содержат Fc-фрагмента интактного антитела, быстрее выводятся из кровотока у животных и могут характеризоваться меньшим уровнем неспецифического связывания с тканями, чем интактное антитело (см., например, Wahl et al., 1983, J. Nucl. Med. 24:316).
[079] "Fv"-фрагмент представляет собой минимальный фрагмент антитела, который содержит полный участок распознавания и связывания мишени. Эта область состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи в плотной нековалентной связи (димер VH-VL). Три CDR каждого вариабельного домена взаимодействуют именно в этой конфигурации, определяя антигенсвязывающий участок на поверхности димера VH-VL. Зачастую шесть CDR придают антителу антигенсвязывающую специфичность. Однако в некоторых случаях даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичные к мишени) может обладать способностью распознавать и связывать антиген, хотя и с более низкой аффинностью, чем полный участок связывания.
[080] "Одноцепочечные Fv" или "scFv" связывающие фрагменты антитела содержат VH- и VL-домены антитела, при этом эти домены присутствуют в одной полипептидной цепи. Как правило, полипептид Fv дополнительно содержит полипептидный линкер между VH- и VL-доменами, который позволяет scFv сформировать необходимую структуру для связывания антигена.
[081] Антитела и/или связывающие фрагменты, входящие в состав ADC, нацеливающихся на cMet, могут содержать модификации и/или мутации, которые изменяют свойства антител и/или фрагментов, как, например, таковые, которые увеличивают период полужизни, увеличивают или уменьшают ADCC и т. д., как известно из уровня техники.
[082] "Однодоменные антитела" состоят из одного VH- или VL-доменов, которые обладают достаточной аффинностью к cMet. В конкретном варианте осуществления однодоменное антитело представляет собой камелизированное антитело (см., например, Riechmann, 1999, Journal of Immunological Methods 231:25-38).
[083] Антитела, входящие в состав ADC, нацеливающихся на cMet, также могут быть биспецифическими антителами. Биспецифические антитела состоят из моноклональных, зачастую человеческих или гуманизированных антител, которые характеризуются специфичностями связывания в отношении двух различных эпитопов на одном и том же или различных антигенах. В настоящем изобретении одна из специфичностей связывания может быть направлена в отношении cMet, другая может быть в отношении любого другого антигена, например, в отношении белка клеточной поверхности, рецептора, субъединицы рецептора, тканеспецифического антигена, вирусного белка, кодируемого вирусом белка оболочки, бактериального белка или бактериального поверхностного белка и т. д.
[084] Антитела, входящие в состав ADC, нацеливающихся на cMet, могут быть дериватизированными. Дериватизированные антитела обычно модифицированы путем гликозилирования, ацетилирования, пэгилирования, фосфорилирования, амидирования, дериватизации с помощью известных защитных/блокирующих групп, протеолитического расщепления, связывания с клеточным лигандом или другим белком. С помощью известных методик можно осуществить любую из многочисленных химических модификаций, включая без ограничения специфическое химическое расщепление, ацетилирование, формилирование, метаболический синтез туникамицина и т. д. Кроме того, производное может содержать одну или несколько не встречающихся в природе аминокислот, например, полученных с помощью методики ambrx. См., например, Wolfson, 2006, Chem. Biol. 13(10):1011-2.
[085] Антитела или связывающие фрагменты, входящие в состав ADC, нацеливающихся на cMet, могут представлять собой антитела или фрагменты, последовательности которых были модифицированы для изменения по меньшей мере одной опосредуемой константной областью биологической эффекторной функции. Например, в некоторых вариантах осуществления антитело к cMet может быть модифицировано для уменьшения по меньшей мере одной опосредуемой константной областью биологической эффекторной функции по сравнению с немодифицированным антителом, например, уменьшения связывания с Fc-рецептором (FcγR). Связывание FcγR можно уменьшить путем мутации сегмента константной области иммуноглобулина антитела в определенных областях, необходимых для взаимодействий с FcγR (см., например, Canfϊeld and Morrison, 1991, J. Exp. Med. 173:1483-1491; и Lund et al., 1991, J. Immunol. 147:2657-2662). Уменьшение связывания FcγR может также уменьшать другие эффекторные функции, которые основаны на взаимодействиях с FcγR, таких как опсонизация, фагоцитоз и антигензависимая клеточная цитотоксичность ("ADCC").
[086] Антитела, включенные в ADC, нацеливающиеся на cMet, могут характеризоваться низкими уровнями фукозы или ее отсутствием. Антитела, не содержащие фукозу, коррелировали с повышенной ADCC-активностью, особенно в низких дозах антитела. См. Shields et al., 2002, J. Biol. Chem. 277:26733-26740; Shinkawa et al., 2003, J. Biol. Chem. 278:3466-73. Способы получения не содержащих фукозу антител включают выращивание клеток YB2/0 миеломы крысы (ATCC CRL 1662). Клетки YB2/0 имеют низкий уровень экспрессии мРНК FUT8, которая кодирует α-1,6-фукозилтрансферазу, фермент, необходимый для фукозилирования полипептидов.
[087] Антитела или связывающие фрагменты, входящие в состав ADC, нацеливающихся на cMet, могут включать модификации, которые увеличивают или уменьшают их аффинности связывания с неонатальным Fc-рецептором, FcRn, например, путем мутации сегмента константной области иммуноглобулина в конкретных областях, участвующих во взаимодействиях с FcRn (см., например, WO 2005/123780). В конкретных вариантах осуществления антитело к cMet класса IgG подвергнуто мутации таким образом, чтобы по меньшей мере один из аминокислотных остатков 250, 314 и 428 константной области тяжелой цепи был заменен в отдельности или в любой их комбинации, например, в положениях 250 и 428, или в положениях 250 и 314, или в положениях 314 и 428, или в положениях 250, 314 и 428, причем конкретной комбинацией является замена в положениях 250 и 428. В случае положения 250, заменяющий аминокислотный остаток может представлять собой любой аминокислотный остаток, отличный от треонина, включая без ограничения аланин, цистеин, аспарагиновую кислоту, глутаминовую кислоту, фенилаланин, глицин, гистидин, изолейцин, лизин, лейцин, метионин, аспарагин, пролин, глутамин, аргинин, серин, валин, триптофан или тирозин. В случае положения 314, заменяющий аминокислотный остаток может представлять собой любой аминокислотный остаток, отличный от лейцина, включая без ограничения аланин, цистеин, аспарагиновую кислоту, глутаминовую кислоту, фенилаланин, глицин, гистидин, изолейцин, лизин, метионин, аспарагин, пролин, глутамин, аргинин, серин, треонин, валин, триптофан или тирозин. В случае положения 428, заменяющие аминокислотные остатки могут представлять собой любой аминокислотный остаток, отличный от метионина, включая без ограничения аланин, цистеин, аспарагиновую кислоту, глутаминовую кислоту, фенилаланин, глицин, гистидин, изолейцин, лизин, лейцин, аспарагин, пролин, глутамин, аргинин, серин, треонин, валин, триптофан или тирозин. Конкретные комбинации подходящих аминокислотных замен указаны в таблице 1 патента США № 7217797, который включен в данный документ посредством ссылки. Такие мутации увеличивают связывание с FcRn, который защищает антитело от разрушения и увеличивает период его полужизни.
[088] Антитело к cMet и/или связывающий фрагмент могут иметь одну или несколько аминокислот, вставленных в одну или несколько его гипервариабельных областей, например, как описано в Jung & Plückthun, 1997, Protein Engineering 10:9, 959-966; Yazaki et al., 2004, Protein Eng. Des Sel. 17(5):481-9; и заявке на патент США № 2007/0280931.
[089] Для терапевтических целей могут быть необходимы антитела к cMet и/или связывающие фрагменты с высокой аффинностью к cMet. Следовательно, в настоящем изобретении предполагаются ADC, содержащие антитела к cMet и/или связывающие фрагменты, характеризующиеся высокой аффинностью связывания в отношении cMet. В конкретных вариантах осуществления антитела и/или связывающие фрагменты связывают cMet с аффинностью, составляющей по меньшей мере приблизительно 100 нМ, но могут характеризоваться большей аффинностью, например, по меньшей мере приблизительно 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 30 нМ, 25 нМ, 20 нМ, 15 нМ, 10 нМ, 7 нМ, 6 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ, 1 нМ, 0,1 нМ, 0,01 нМ или даже выше. В некоторых вариантах осуществления антитела связывают cMet с аффинностью, находящейся в диапазоне от приблизительно 1 пМ до приблизительно 100 нМ, или с аффинностью, варьирующей между любыми из вышеперечисленных значений.
[090] Аффинность антител и/или связывающих фрагментов в отношении cMet можно определить с помощью методик, хорошо известных из уровня техники или описанных в данном документе, таких как, например, без ограничения ELISA, изотермическая титрационная калориметрия (ITC), поверхностный плазмонный резонанс, проточная цитометрия или анализы поляризации флуоресценции. В одном варианте осуществления аффинность относится к значениям ЕС50 кажущейся аффинности, измеренным согласно примеру 5.
[091] В контексте настоящего изобретения антитела к cMet могут служить по меньшей мере двум разным целям. В некоторых вариантах осуществления антитела к cMet применяют в диагностических целях, способствуя отбору пациентов и управляя им. Например, такие антитела к cMet можно применять для иммуногистохимических анализов биоптатов опухоли, полученных от пациентов, которые подлежат лечению или уже получают лечение. Специалист в данной области техники хорошо знаком с методиками выбора конкретного антитела в диагностических целях для анализа уровней экспрессии белка cMet в биоптатах опухоли. Обычно образцы оценивают по одному или нескольким руководствам по оценке, включая IHC-показатели 0/1+/2+/3+ или H-показатели. В настоящем раскрытии подробно описан один пример такого диагностического анализа, который коммерчески доступен от Ventana. Антитело SP44 от Ventana и антитела со схожими свойствами можно получить или приобрести у других поставщиков, а протокол скорректировать таким образом, чтобы способ обладал такой же или лучшей диагностической эффективностью, что и анализ Ventana. Кроме того, с этой целью также можно применять антитела к cMet, отличные от SP44. Специалист в данной области техники будет знать, как правильно скорректировать протокол под новое антитело с тем, чтобы получить диагностический тест в отношении уровней экспрессии cMet. Существуют сопутствующие диагностические средства для ряда других одобренных FDA средств лечения рака, и они входят в компетенцию специалиста в данной области техники. FDA ведет перечень одобренных FDA сопутствующих диагностических тестов, например, на www.fda.gov/.
[092] Примеры антител к cMet, которые можно применять, включают, например, диагностические антитела, раскрытые в патенте США № 8673302 (224D10 и 221C9) и патенте США № 9120852 (227D3 и 205A5). Раскрытия каждого из этих патентов полностью включены в данный документ посредством ссылки, включая аминокислотные последовательности для CDR, тяжелых цепей (полной длины и вариабельные области) и легких цепей (полной длины и вариабельные области). В одном варианте осуществления антитело представляет собой 227D3.
[093] 227D3 секретируется гибридомой, депонированной в CNCM 18 ноября 2009 года под номером I-4247.
| Антитело | Нумерация CDR | Тяжелая цепь | Легкая цепь | SEQ ID NO: |
| 227D3 | IMGT | CDR-L1 | 159 | |
| CDR-L2 | 160 | |||
| CDR-L3 | 161 | |||
| CDR-H1 | 162 | |||
| CDR-H2 | 163 | |||
| CDR-H3 | 164 | |||
| Антитело | Нумерация CDR | Тяжелая цепь | Легкая цепь | SEQ ID NO: |
| 227D3 | Kabat | CDR-L1 | 165 | |
| CDR-L2 | 166 | |||
| CDR-L3 | 161 | |||
| CDR-H1 | 167 | |||
| CDR-H2 | 168 | |||
| CDR-H3 | 169 |
[094] В других вариантах осуществления антитела к cMet вводят для целей лечения либо как компоненты конъюгатов антитела и лекарственного средства (ADC), либо до/после/одновременно с введением ADC.
5.6.1 ABT-700 и родственные антитела для целей лечения
[095] В контексте антител, описанных в данном разделе, CDR были указаны согласно системе нумерации IMGT.
[096] ABBV-399 представляет собой ADC, состоящий из нацеленного на cMet антитела ABT-700 (PR-1266688, h224G11), конъюгированного с сильнодействующим цитотоксином MMAE посредством валин-цитруллинового (vc) линкера. ADC связывается с cMet на поверхности опухолевых клеток, интернализируется, а затем высвобождает MMAE, что приводит к ингибированию функции микротрубочек и нарушению критически важных клеточных процессов и гибели. ABBV-399 сильно цитотоксичен для раковых клеток со сверхэкспрессией cMet или увеличенной численностью MET и демонстрирует противоопухолевую активность в ксенотрансплантатах опухоли человека. Также была продемонстрирована активность ABBV-399 в отношении ABT-700-резистентных опухолей (см., например, пример 14).
ABT-700
[097] ABT-700 представляет собой гуманизированный вариант мышиного моноклонального антитела 224G11, которое впервые было раскрыто и реализовано в патенте США № 8329173. ABT-700 представляет собой "гуманизированный" рекомбинантный IgG1κ (раскрытый как 224G11 [TH7 Hz3] в патенте США № 8741290), который нацелен на уникальный эпитоп cMet, расположенный в домене 1 гомологии иммуноглобулин-плексинового фактора транскрипции (IPT), что приводит к блокировке как HGF-зависимой, так и HGF-независимой передачи сигнала от cMet. ABT-700 конкурирует за связывание с cMet с антителами, направленными против лопасти 5 SEMA (и наоборот), но не с антителами, направленными против лопастей 1-3 или IPT 2-3. В отличие от этого, 5D5 (двухвалентный предшественник одноплечевого онартузумаба, обсуждаемый ниже) связывается с лопастью 5 домена SEMA.
[098] ADC, нацеливающиеся на cMet, по настоящему изобретению охватывают любое антитело, которое содержит тяжелую цепь, содержащую CDR-H1, CDR-H2 и CDR-H3, содержащие соответственно аминокислотную последовательность под SEQ ID NO: 1, 2 и 3; и легкую цепь, содержащую CDR-L1, CDR-L2 и CDR-L3, содержащие соответственно аминокислотную последовательность под SEQ ID NO: 5, 6 и 7 согласно патенту США № 8741290. Они представляют собой CDR исходного мышиного антитела 224G11, определенные на основе системы нумерации IMGT.
[099] Как определяет номенклатура IMGT, последовательности CDR ABT-700 включают следующие последовательности:
[0100] CDR-H1: GYIFTAYT (SEQ ID NO: 72)
[0101] CDR-H2: IKPNNGLA (SEQ ID NO: 73)
[0102] CDR-H3: ARSEITTEFDY (SEQ ID NO: 74)
[0103] CDR-L1: ESVDSYANSF (SEQ ID NO: 75)
[0104] CDR-L2: RAS (SEQ ID NO: 76)
[0105] CDR-L3: QQSKEDPLT (SEQ ID NO: 77)
[0106] В одном варианте осуществления вариабельная область тяжелой цепи 224G11 [TH7 Hz3] содержит SEQ ID NO: 4 из патента США № 8741290:
[0107] QVQLVQSGAEVKKPGASVKVSCKASGYIFTAYTMHWVRQAPGQGLEWMG WIKPNNGLANYAQKFQGRVTMTRDTSISTAYMELSRLRSDDTAVYYCARSEITTEFDYWGQGTLVTVSS (SEQ ID NO: 78);
[0108] а вариабельная область легкой цепи содержит SEQ ID NO: 10 из патента США № 8741290: DIVMTQSPDSLAVSLGERATINCKSSESVDSYANSFLHWYQQKPGQPPK LLIYRASTRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQSKED PLTFGGGTKVEIKR (SEQ ID NO: 79)
[0109] В другом варианте осуществления вариабельная область тяжелой цепи 224G11 [TH7 Hz3] содержит:
[0110] QVQLVQSGAEVKKPGASVKVSCKASGYIFTAYTMHWVRQAPGQGLEWMG WIKPNNGLANYAQKFQGRVTMTRDTSISTAYMELSRLRSDDTAVYYCAR SEITTEFDYWGQGTLVTVSS (SEQ ID NO: 80);
[0111] а вариабельная область легкой цепи содержит: DIVMTQSPDSLAVSLGERATINCKSSESVDSYANSFLHWYQQKPGQPPK LLIYRASTRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQSKED PLTFGGGTKVEIK (SEQ ID NO: 81)
[0112] В другом варианте осуществления антитело [224G11] [TH7 Hz3] содержит полную тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 37 из патента США № 8741290, и полную легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 40 из патента США № 8741290. Модифицированная шарнирная область имеет последовательность под SEQ ID NO: 170.
[0113] В некоторых вариантах осуществления антитело к cMet содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 4 из патента США № 8741290:
[0114] QVQLVQSGAEVKKPGASVKVSCKASGYIFTAYTMHWVRQAPGQGLEWMG WIKPNNGLANYAQKFQGRVTMTRDTSISTAYMELSRLRSDDTAVYYCAR SEITTEFDYWGQGTLVTVSS (SEQ ID NO: 78), связанную с любой константной областью тяжелой цепи;
[0115] и вариабельную область легкой цепи, содержащую SEQ ID NO: 10 из патента США № 8741290: DIVMTQSPDSLAVSLGERATINCKSSESVDSYANSFLHWYQQKPGQPPK LLIYRASTRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQSKED PLTFGGGTKVEIKR (SEQ ID NO: 79), связанную с любой константной областью легкой цепи. Ниже приведены примеры подходящих константных областей тяжелой и легкой цепей.
[0116] В некоторых вариантах осуществления антитело к cMet содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 4 из патента США № 8741290:
[0117] QVQLVQSGAEVKKPGASVKVSCKASGYIFTAYTMHWVRQAPGQGLEWMG WIKPNNGLANYAQKFQGRVTMTRDTSISTAYMELSRLRSDDTAVYYCAR SEITTEFDYWGQGTLVTVSS (SEQ ID NO: 80), связанную с любой константной областью тяжелой цепи;
[0118] и вариабельную область легкой цепи, содержащую: DIVMTQSPDSLAVSLGERATINCKSSESVDSYANSFLHWYQQKPGQPPK LLIYRASTRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQSKED PLTFGGGTKVEIK (SEQ ID NO: 81), связанную с любой константной областью легкой цепи. Ниже приведены примеры подходящих константных областей тяжелой и легкой цепей.
[0119] В некоторых вариантах осуществления антитело к cMet и/или связывающий фрагмент, входящие в состав ADC, нацеливающихся на cMet, представляет собой IgG1.
[0120] В некоторых вариантах осуществления антитело к cMet, входящее в состав ADC, нацеливающегося на cMet, содержит тяжелую цепь, имеющую константную область, содержащую или состоящую из:
[0121] ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDCHCPPCPAPELLGGPSVF LFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYR VVSVLTVLHQ DWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKN QVSLTCLVKG FYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGN VFSCSVMHEALHNHYTQKSLSLSPG (SEQ ID NO: 82)
[0122] В некоторых вариантах осуществления антитело к cMet, входящее в состав ADC, нацеливающегося на cMet, содержит легкую цепь, имеющую константную область, содержащую или состоящую из:
[0123] RTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQ DSKDSTYSLS STLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 83)
[0124] В некоторых вариантах осуществления антитело к cMet, входящее в состав ADC, нацеливающегося на cMet, содержит тяжелую цепь, имеющую константную область, содержащую или состоящую из:
[0125] ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDFPEPVTVSWNSGALTSGVHTFPAVLQSSGL YSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDCHCPPCPAPELLGGPSVF LFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO: 84)
[0126] и легкую цепь, имеющую константную область, содержащую или состоящую из:
[0127] TVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQ DSKDSTYSLS STLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 85)
[0128] В некоторых вариантах осуществления тяжелая цепь антитела к cMet (ABT-700), входящего в состав ADC, нацеливающегося на cMet, содержит или состоит из (константные области выделены жирным шрифтом; CDR выделены подчеркнутым шрифтом (пронумерованные по Kabat последовательности CDR, раскрытые соответственно под SEQ ID NO: 112-114 в порядке встречаемости)):
QVQLVQSGAE VKKPGASVKV SCKASGYIFT AYTMHWVRQA PGQGLEWMGW 050
IKPNNGLANY AQKFQGRVTM TRDTSISTAY MELSRLRSDD TAVYYCARSE 100
ITTEFDYWGQ GTLVTVSSAS TKGPSVFPLA PSSKSTSGGT AALGCLVKDY 150
FPEPVTVSWN SGALTSGVHT FPAVLQSSGL YSLSSVVTVP SSSLGTQTYI 200
CNVNHKPSNT KVDKRVEPKS CDCHCPPCPA PELLGGPSVF LFPPKPKDTL 250
MISRTPEVTC VVVDVSHEDP EVKFNWYVDG VEVHNAKTKP REEQYNSTYR 300
VVSVLTVLHQ DWLNGKEYKC KVSNKALPAP IEKTISKAKG QPREPQVYTL 350
PPSREEMTKN QVSLTCLVKG FYPSDIAVEW ESNGQPENNY KTTPPVLDSD 400
GSFFLYSKLT VDKSRWQQGN VFSCSVMHEA LHNHYTQKSL SLSPG 445
[0129] (полноразмерная последовательность, раскрытая под SEQ ID NO: 86),
[0130] а легкая цепь содержит или состоит из (последовательностей CDR, раскрытых соответственно под SEQ ID NO: 115-117 в порядке встречаемости):
DIVMTQSPDS LAVSLGERAT INCKSSESVD SYANSFLHWY QQKPGQPPKL 050
LIYRASTRES GVPDRFSGSG SGTDFTLTIS SLQAEDVAVY YCQQSKEDPL 100
TFGGGTKVEI KRTVAAPSVF IFPPSDEQLK SGTASVVCLL NNFYPREAKV 150
QWKVDNALQS GNSQESVTEQ DSKDSTYSLS STLTLSKADY EKHKVYACEV 200
THQGLSSPVT KSFNRGEC 218
[0131] (полноразмерная последовательность, раскрытая под SEQ ID NO: 87).
[0132] В некоторых вариантах осуществления тяжелая цепь антитела к cMet, входящая в состав ADC, нацеливающегося на cMet, содержит или состоит из вариабельной области (аминокислоты 1-118 из SEQ ID NO: 88), константной области (выделенной жирным шрифтом) и CDR (подчеркнутые; последовательности CDR, раскрытые соответственно под SEQ ID NO: 118-120 в порядке встречаемости):
QVQLVQSGAE VKKPGASVKV SCKASGYIFT AYTMHWVRQA PGQGLEWMGW 050
IKPNNGLANY AQKFQGRVTM TRDTSISTAY MELSRLRSDD TAVYYCARSE 100
ITTEFDYWGQ GTLVTVSSAS TKGPSVFPLA PSSKSTSGGT AALGCLVKDY 150
FPEPVTVSWN SGALTSGVHT FPAVLQSSGL YSLSSVVTVP SSSLGTQTYI 200
CNVNHKPSNT KVDKRVEPKS CDCHCPPCPA PELLGGPSVF LFPPKPKDTL 250
MISRTPEVTC VVVDVSHEDP EVKFNWYVDG VEVHNAKTKP REEQYNSTYR 300
VVSVLTVLHQ DWLNGKEYKC KVSNKALPAP IEKTISKAKG QPREPQVYTL 350
PPSREEMTKN QVSLTCLVKG FYPSDIAVEW ESNGQPENNY KTTPPVLDSD 400
GSFFLYSKLT VDKSRWQQGN VFSCSVMHEA LHNHYTQKSL SLSPGK 446
[0133] (полноразмерная последовательность тяжелой цепи, раскрытая под SEQ ID NO: 88),
[0134] а легкая цепь содержит или состоит из вариабельной области (аминокислоты 1-110 из SEQ ID NO: 89), константной области (выделенной жирным шрифтом) и последовательностей CDR (подчеркнутые и раскрытые соответственно под SEQ ID NO: 121-123 в порядке встречаемости):
DIVMTQSPDS LAVSLGERAT INCKSSESVD SYANSFLHWY QQKPGQPPKL 050
LIYRASTRES GVPDRFSGSG SGTDFTLTIS SLQAEDVAVY YCQQSKEDPL 100
TFGGGTKVEI KRTVAAPSVF IFPPSDEQLK SGTASVVCLL NNFYPREAKV 150
QWKVDNALQS GNSQESVTEQ DSKDSTYSLS STLTLSKADY EKHKVYACEV 200
THQGLSSPVT KSFNRGEC 218
(полноразмерная последовательность легкой цепи, раскрытая под SEQ ID NO: 89).
[0135] В одном варианте осуществления антитело представляет собой ABT-700, и тяжелая цепь кодируется следующей нуклеотидной последовательностью (полноразмерной последовательностью, раскрытой под SEQ ID NO: 90):
atgggatggtcttggatctttctgctgtttctgtctggtactgctggtgtgctgagccaggtccagctggtgcaatccggcgcagaggtgaagaagccaggcgcttccgtgaaggtgagctgtaaggcctctggctacatcttcacagcatacaccatgcactgggtgaggcaagctcctgggcagggactggagtggatgggatggattaaacccaacaatgggctggccaactacgcccagaaattccagggtagggtcactatgacaagggataccagcatcagcaccgcatatatggagctgagcaggctgaggtctgacgacactgctgtctattattgcgccaggagcgaaattacaacagaattcgattactgggggcagggcaccctggtgaccgtgtcctctgccagcaccaagggcccaagcgtgttccccctggcccccagcagcaagagcaccagcggcggcacagccgccctgggctgcctggtgaaggactacttccccgagcccgtgaccgtgtcctggaacagcggagccctcacttctggagttcataccttcccagcagtattgcagagcagtggcctgtattcactgtcttccgtcgtaacagttccatcctccagcctcgggacacagacttacatttgtaacgtgaatcacaagcctagcaacaccaaggtcgacaagagagttgaaccaaagagttgtgattgccactgtcctccctgcccagctcctgagctgcttggcggtcccagtgtcttcttgtttccccctaaacccaaagacaccctgatgatctcaaggactcccgaggtgacatgcgtggtggtggatgtgtctcatgaggacccagaggtgaagttcaactggtacgtggacggcgtggaggtgcacaacgccaagaccaagcccagagaggagcagtacaacagcacctacagggtggtgtccgtgctgaccgtgctgcaccaggactggctgaacggcaaggagtacaagtgtaaggtgtccaacaaggccctgccagccccaatcgaaaagaccatcagcaaggccaagggccagccaagagagccccaggtgtacaccctgccacccagcagggaggagatgaccaagaaccaggtgtccctgacctgtctggtgaagggcttctacccaagcgacatcgccgtggagtgggagagcaacggccagcccgagaacaactacaagaccacccccccagtgctggacagcgacggcagcttcttcctgtacagcaagctgaccgtggacaagagcagatggcagcagggcaacgtgttcagctgctccgtgatgcacgaggccctgcacaaccactacacccagaagagcctgagcctgtccccaggctga
[0136] Сигнальный пептид секреции выделен жирными ЗАГЛАВНЫМИ буквами.
[0137] Включает конечный стоп-кодон (TGA)
[0138] Константная область выделена жирным шрифтом
[0139] CDR подчеркнуты (последовательности CDR, раскрытые соответственно под SEQ ID NO: 124-126 в порядке встречаемости)
[0140] В одном варианте осуществления антитело представляет собой ABT-700, и легкая цепь кодируется следующей нуклеотидной последовательностью (полноразмерной последовательностью, раскрытой под SEQ ID NO: 91):
[0141] atggaaactgatacactgctgctgtgggtcctgctgctgtgggtccctggaagcacaggggacattgtgatgacccagtctcccgatagcctggccgtgtccctgggcgagagggctaccatcaactgt aaaagctccgaatctgtggactcttacgcaaacagctttctgcac tggtatcagcaaaagccaggccaacctccaaagctgctgatttac agggcttctaccagggagagc ggcgtgcccgataggttcagcggatctggcagcggcaccgactttacactgaccatctccagcctgcaggccgaagatgtggcagtctattactgc cagcagtccaaggaggaccccctgact ttcgggggtggtactaaagtggagatcaagcgtacggtggccgctcccagcgtgttcatcttccccccaagcgacgagcagctgaagagcggcaccgccagcgtggtgtgtctgctgaacaacttctaccccagggaggccaaggtgcagtggaaggtggacaacgccctgcagagcggcaacagccaggagagcgtcaccgagcaggacagcaaggactccacctacagcctgagcagcaccctgaccctgagcaaggccgactacgagaagcacaaggtgtacgcctgtgaggtgacccaccagggcctgtccagccccgtgaccaagagcttcaacaggggcgagtgctga
[0142] Сигнальный пептид секреции выделен жирными ЗАГЛАВНЫМИ буквами.
[0143] Включает конечный стоп-кодон (tga)
[0144] Константная область выделена жирным шрифтом
[0145] CDR подчеркнуты (последовательности CDR, раскрытые соответственно под SEQ ID NO: 127-129 в порядке встречаемости)
[0146] В одном варианте осуществления, обозначенном в данном документе как ABBV399, последовательность тяжелой цепи антитела представлена под SEQ ID NO: 88, последовательность легкой цепи представлена под SEQ ID NO: 89, конъюгированной с монометилауристатином E (MMAE) посредством валин-цитруллинового (vc) линкера.
[0147] Последовательность ABT-700 PBD, содержащая последовательность ABT-700, несущую мутацию S238C (также называется в данном документе как ABT-700 (S238C)-PBD) согласно нумерации по Kabat, является следующей (CDR подчеркнуты; системой нумерации является система Kabat; и мутация S238C представлена как C (жирным, курсивом и подчеркнутым шрифтом):
Аминокислотная последовательность (10 AA в группе, 5 групп на строчку)
Тяжелая цепь (SEQ ID NO: 171) (подчеркнутые последовательности CDR, раскрытые соответственно под SEQ ID NO: 173-175 в порядке встречаемости):
QVQLVQSGAE VKKPGASVKV SCKASGYIFT_AYTMHWVRQA PGQGLEWMGW 50
IKPNNGLANY_AQKFQGRVTM TRDTSISTAY MELSRLRSDD TAVYYCARSE 100
ITTEFDYWGQ GTLVTVSSAS TKGPSVFPLA PSSKSTSGGT AALGCLVKDY 150
FPEPVTVSWN SGALTSGVHT FPAVLQSSGL YSLSSVVTVP SSSLGTQTYI 200
CNVNHKPSNT KVDKRVEPKS CDCHCPPCPA PELLGGPCVF LFPPKPKDTL 250
MISRTPEVTC VVVDVSHEDP EVKFNWYVDG VEVHNAKTKP REEQYNSTYR 300
VVSVLTVLHQ DWLNGKEYKC KVSNKALPAP IEKTISKAKG QPREPQVYTL 350
PPSREEMTKN QVSLTCLVKG FYPSDIAVEW ESNGQPENNY KTTPPVLDSD 400
GSFFLYSKLT VDKSRWQQGN VFSCSVMHEA LHNHYTQKSL SLSPG 445
Легкая цепь (SEQ ID NO:172) (подчеркнутые последовательности CDR, раскрытые соответственно под SEQ ID NO: 176-178 в порядке встречаемости):
DIVMTQSPDS LAVSLGERAT INCKSSESVD_SYANSFLHWY QQKPGQPPKL 50
LIYRASTRES GVPDRFSGSG SGTDFTLTIS SLQAEDVAVY YCQQSKEDPL 100
TFGGGTKVEI KRTVAAPSVF IFPPSDEQLK SGTASVVCLL NNFYPREAKV 150
QWKVDNALQS GNSQESVTEQ DSKDSTYSLS STLTLSKADY EKHKVYACEV 200
THQGLSSPVT KSFNRGEC 218
[0148] Соответственно, антитело ABT-700 PBD содержит две молекулы комплекса лекарственное средство PBD-линкер, конъюгированные со сконструированным с cys mAb ABT-700 (S238C), и имеет тяжелую цепь с SEQ ID NO: 171 и легкую цепь с SEQ ID NO:172.
[0149] В одном варианте осуществления C-концевая аминокислота лизин в тяжелой цепи 224G11 [TH7 Hz3] была исключена при конструировании для устранения гетерогенности на C-конце в связи с неполным расщеплением лизина. В ABT-700 тяжелая цепь посттрансляционно модифицируется путем добавления N-связанных гликанов к аспарагину-296. Основными гликанами являются фукозилированные двуантеннарные олигосахариды, содержащие ноль, один или два галактозных остатка. Кроме того, на N-конце тяжелой цепи находится остаток глутамина, который может подвергаться самопроизвольной циклизации с образованием остатка пироглутамата.
[0150] Исходное мышиное антитело 224G11 дополнительно подвергали химеризации и гуманизации. Способы химеризации и гуманизации подробно описаны в патенте США № 8741290, и эти способы включены в данный документ посредством ссылки во всей своей полноте, также как и описания биологических и структурных свойств всех описанных в нем антител. В ходе способа гуманизации мышиного антитела 224G11 химерная форма 224G11 Mab (224G11chim/IgG1), означающая вариабельный домен (VH+VL) из m224G11 в комбинации с человеческим константным доменом IgG1/каппа, давала сильную (17% от максимального эффекта HGF) агонистическую активность, ассоциированную со сниженной антагонистической эффективностью (54% ингибирования от максимального эффекта HGF по сравнению с m224G11, которая дает 75% ингибирование от максимального эффекта HGF). Три гуманизированные формы 224G11 Mab, [224G11]Hz1/IgG1, [224G11]Hz2/IgG1 и [224G11]Hz3/IgG1, также сконструированные на основе человеческого остова IgG1/каппа, также давали сниженную антагонистическую эффективность и значительную агонистическую активность (11-24% от максимального уровня HGF) по сравнению с мышиным 224G11.
[0151] Шарниры некоторых из гуманизированных форм антитела 224G11 были модифицированы, как подробно описано в патенте США № 8741290, и включены в данный документ посредством ссылки. Полученные антитела, ADC с которыми также входят в объем настоящего изобретения, включали 224G11 [TH7Hz3].
[0152] Антитело h224G11/ABT-700 относится к гуманизированной форме 224G11 [TH7 Hz3]. Данное антитело представляет собой антитело ABT-700, которое является частью ABBV-399 по настоящему изобретению. Формы биологической активности антитела ABT-700 или h224G11 широко описаны в патенте США № 8741290. Описанные в нем способы определения биологических характеристик включены в данный документ посредством ссылки во всей своей полноте. Полное описание патента США № 8741290 включено в данный документ посредством ссылки.
[0153] Иллюстративные варианты других химеризированных и гуманизированных вариантов конъюгатов антитела 224G11 и лекарственного средства, которые входят в объем настоящего изобретения, приведены в патенте США № 8741290 в качестве антител [224G11] [IgG2Hz1], [224G11] [IgG2Hz2]; [224G11] [IgG2Hz3]; [224G11] [TH7Hz1]; [224G11] [TH7z2]; [224G11] [TH7Hz3]; [224G11] [IgG2chim]; [224G11] [TH7chim]; [224G11] [C1]; [224G11] [C2]; [224G11] [C3]; [224G11] [C5]; [224G11] [C6]; [224G11] [C7]; [224G11] [C8]; и [224G11] [C9].
[0154] Другие примеры включают антитела [224G11] [Δ1-3]; [224G11] [C7Δ6];[224G11] [C6Δ9];[224G11] [C2Δ5-7]; [224G11] [C5Δ2-6];[224G11] [C9Δ2-7]; [224G11] [Δ5-6-7-8];[224G11] [IgG1/IgG2];[224G11] [IgG2Hz1];[224G11] [IgG2Hz2];[224G11] [IgG2Hz3];[224G11] [TH7Hz1];[224G11] [TH7Hz2];[224G11] [TH7Hz3]; [224G11] [TH7chim]; [224G11] [MHchim];[224G11] [MUP9Hchim]; и [224G11] [MMCHchim].
[0155] В обеих этих сериях антител содержимое первых скобок обозначает название антитела, которое модифицировано (т. е. 224G11), а содержимое вторых скобок указывает конкретную модификацию антитела, большинство из которых соответствуют изменениям в шарнирной области, согласно уникальной нумерации IMGT для C-доменов. Символ Δ означает делецию. Конкретные подробности по каждой модификации можно найти в патенте США № 8741290.
[0156] Соответственно, в некоторых вариантах осуществления антитело к cMet и/или связывающий фрагмент, входящие в состав ADC, нацеливающегося на cMet, подходят для введения людям. В конкретном варианте осуществления антитело к cMet является гуманизированным.
[0157] В некоторых вариантах осуществления антитела к cMet и/или связывающие фрагменты, входящие в состав ADC, нацеливающегося на cMet, конкурируют за связывание cMet на клетках, экспрессирующих cMet, или домена гомологии иммуноглобулин-плексинового фактора транскрипции (IPT) в человеческом cMet или с Met-Fc или сконструированным/рекомбинантным cMet в твердой фазе в анализах in vitro с эталонным антителом. Эталонным антителом может быть любое антитело, которое специфически связывает домен гомологии иммуноглобулин-плексинового фактора транскрипции (IPT) в человеческом cMet. В одном конкретном варианте осуществления эталонное антитело представляет собой мышиное 224G11. В другом конкретном варианте осуществления эталонное антитело представляет собой ABT-700.
[0158] Анализы в отношении конкурирования включают без ограничения иммуноанализ с мечением радиоактивным веществом (RIA), твердофазный иммуноферментный анализ (ELISA), сэндвич-ELISA, анализы методом проточной цитометрии и анализы методом поверхностного плазмонного резонанса. Предпочтительным является способ, который описан у Basilico C, Hultberg A, Blanchetot C, de Jonge N, Festjens E, Hanssens V, Osepa SI, De Boeck G, Mira A, Cazzanti M, Morello V, Dreier T, Saunders M, de Haard H, Michieli P. Four individually druggable MET hotspots mediate HGF-driven tumor progression. J Clin Invest. 2014 Jul;124(7):3172-86. doi: 10.1172/JCI72316. Epub 2014 May 27.
[0159] В одном иллюстративном варианте осуществления проведения конкурентного анализа антител между эталонным антителом и тестируемым антителом (независимо от вида или изотипа) сначала можно пометить эталон выявляемой меткой, такой как флуорофор, биотин или ферментативная или радиоактивная метка, для обеспечения возможности последующего выявления. В данном случае клетки, экспрессирующие cMet или внеклеточный домен cMet (или его подчасть), инкубируют с немеченым тестируемым антителом, добавляют меченое эталонное антитело и измеряют интенсивность проявления связанной метки. Если тестируемое антитело конкурирует с меченым эталонным антителом путем связывания с одним и тем же, близрасположенным или перекрывающимся эпитопом, интенсивность выявляемого сигнала будет уменьшаться по сравнению с контрольной реакцией, проводимой без тестируемого антитела.
[0160] В конкретном варианте осуществления данного анализа сначала определяют концентрацию меченного эталонного антитела, которая приводит к 80% от максимального связывания ("конц.80%") в условиях проведения анализа (например, при определенной плотности клеток или определенной концентрации cMet/внеклеточного домена cMet или его подчасти), и конкурентный анализ проводят с 10X концентрацией80% немеченого тестируемого антитела и конц.80% меченого эталонного антитела.
[0161] В другом иллюстративном варианте осуществления проведения конкурентного анализа методом проточной цитометрии клетки, экспрессирующие cMet, инкубируют с серией титров антител, включающей увеличивающиеся концентрации немеченого тестируемого антитела в отличие от флуоресцентно меченого эталонного антитела к cMet. Меченое эталонное антитело к cMet применяют в фиксированной концентрации X (например, X=1 мкг/мл), а немеченое тестируемое антитело применяют в диапазоне концентраций (например, от 10-4× до 100×). Клетки или cMet/внеклеточный домен cMet или его подчасть одновременно инкубируют как с немеченым тестируемым антителом, так и с меченым эталонным антителом. Данные проточной цитометрии нормализуют относительно флуоресцентно меченого эталонного антитела в отдельности, при этом интенсивность флуоресценции образца, над которым проводили анализ без немеченого тестируемого антитела, принимают за 100% связывание. Если тестируемое антитело конкурирует за связывание cMet с меченым эталонным антителом, анализ, проведенный с равной концентрацией каждого (например, 1 мкг/мл немеченого тестируемого антитела и 1 мкг/мл меченого эталонного антитела), будет приводить к примерно 50% снижению интенсивности флуоресценции по сравнению со 100% контролем, что указывает на примерно 50% связывание. Применение меченого эталонного антитела в концентрации X и немеченого тестируемого антитела, которое конкурирует за связывание cMet, в концентрации 10X будет приводить к примерно 90% уменьшению связывания по сравнению со 100% контролем, что указывает на примерно 10% связывание.
[0162] Ингибирование можно выразить в виде константы ингибирования или Ki, которую рассчитывают по следующей формуле:
[0163] Ki=IC50/ (1+[концентрация эталонного Ab]/Kd),
[0164] где IC50 представляет собой концентрацию тестируемого антитела, которая приводит к 50% снижению связывания эталонного антитела, и Kd представляет собой константу диссоциации эталонного антитела, показатель его аффинности в отношении cMet. Антитела, которые конкурируют с эталонными антителами к cMet, могут иметь Ki от 10 пМ до 100 нМ в условиях анализа, которые описаны в данном документе.
[0165] В различных вариантах осуществления считается, что тестируемое антитело конкурирует с эталонным антителом, если оно уменьшает связывание эталонного антитела с клетками, экспрессирующими cMet или cMet/внеклеточный домен cMet или его подчасть, на по меньшей мере приблизительно 20% или больше, например, на по меньшей мере приблизительно 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или еще больше, или на процент, варьирующий между любыми из вышеприведенных значений, при концентрации эталонного антитела, которая составляет 80% от максимального связывания в конкретных применяемых условиях анализа, и концентрации тестируемого антитела, которая в 10 раз выше, чем концентрация эталонного антитела.
[0166] В различных вариантах осуществления конкурентного анализа методом проточной цитометрии считается, что тестируемое антитело конкурирует с эталонным антителом, если оно уменьшает связывание эталонного антитела с клетками, экспрессирующими cMet, на по меньшей мере приблизительно 20% или больше, например, на по меньшей мере приблизительно 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или еще больше, или на процент, варьирующий между любыми из вышеприведенных значений, при концентрации тестируемого антитела, которая в 10X больше, чем концентрация эталонного антитела.
[0167] Выявление экспрессии cMet, как правило, включает приведение в контакт биологического образца (клеток, ткани или биологической жидкости индивидуума) с одним или несколькими антителами к cMet (необязательно конъюгированными с выявляемой частью) и выявление того, является ли образец положительным по экспрессии cMet или нет, или того, имеет ли образец измененную (например, уменьшенную или увеличенную) экспрессию по сравнению с контрольным образцом. Способы осуществления этого хорошо известны специалистам в данной области техники, включая способы, которые описаны в примерах.
5.6.2. Некоторые другие иллюстративные антитела к cMet
[0168] Другое антитело к cMet, которое можно применять согласно настоящему изобретению, было названо 227H1, при этом оно содержит тяжелую цепь, содержащую CDR-H1, CDR-H2 и CDR-H3, содержащие соответственно аминокислотную последовательность под SEQ ID NO: 4, 5 и 6; и легкую цепь, содержащую CDR-L1, CDR-L2 и CDR-L3, содержащие соответственно аминокислотную последовательность под SEQ ID NO: 13, 11 и 14 из патента США № 8329173 (соответственно SEQ ID NO: 4, 5, 6, 13, 11 и 14 в настоящей заявке). Данные антитела были подробно описаны в патенте США № 8329173, и их описания включены в данный документ посредством ссылки во всей своей полноте. Перечень последовательностей, поданный одновременно с настоящей заявкой, включает SEQ ID NO: 1-71 из патента США 8329173 под SEQ ID NO: 1-71.
[0169] В одном варианте осуществления антитело 227H1 содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 19, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 22 из патента США № 8329173 (соответственно SEQ ID NO: 19 и 20 в настоящей заявке). Данные антитела были подробно описаны в патенте США № 8329173, и их описания включены в данный документ посредством ссылки во всей своей полноте.
[0170] Другое антитело к cMet, которое можно применять согласно настоящему изобретению, было названо 223C4, при этом оно содержит тяжелую цепь, содержащую CDR-H1, CDR-H2 и CDR-H3, содержащие соответственно аминокислотную последовательность под SEQ ID No. 7, 8 и 9; и легкую цепь, содержащую CDR-L1, CDR-L2 и CDR-L3, содержащие соответственно аминокислотную последовательность под SEQ ID NO: 15, 16 и 17 из патента США № 8329173 (соответственно SEQ ID NO 7, 8, 9, 15, 16 и 17 в настоящей заявке). Данные антитела были подробно описаны в патенте США № 8329173, и их описания включены в данный документ посредством ссылки во всей своей полноте.
[0171] В одном варианте осуществления антитело 223C4 содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 20, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 23 из патента США № 8329173 (соответственно SEQ ID NO: 20 и 23). Данные антитела были подробно описаны в патенте США № 8329173, и их описания включены в данный документ посредством ссылки во всей своей полноте.
[0172] Другое антитело к cMet, которое можно применять согласно настоящему изобретению, было названо 11E1, при этом оно содержит тяжелую цепь, содержащую CDR-H1, CDR-H2 и CDR-H3, содержащие соответственно аминокислотную последовательность под SEQ ID NO: 56, 57 и 58; и легкую цепь, содержащую CDR-L1, CDR-L2 и CDR-L3, содержащие соответственно аминокислотную последовательность под SEQ ID NO: 59, 60 и 61 из патента США № 8329173 (соответственно SEQ ID NO 56, 57, 58, 59, 60 и 61). Данные антитела были подробно описаны в патенте США № 8329173, и их описания включены в данный документ посредством ссылки во всей своей полноте.
[0173] В одном варианте осуществления антитело 11E1 содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 62, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 63 из патента США № 8329173 (соответственно SEQ ID NO: 62 и 63). Данные антитела были подробно описаны в патенте США № 8329173, и их описания включены в данный документ посредством ссылки во всей своей полноте.
[0174] Данные первые моноклональные антитела, раскрытые выше, или один из их функциональных фрагментов или производных характеризуются тем, что указанные антитела секретируются гибридомой, депонированной в Национальной коллекции культур микроорганизмов (CNCM, National Collection of Microorganism Cultures) (Институт Пастера, Париж, Франция) от 14.03.2007 под номерами CNCM I-3724 (соответствующий 11E1), I-3731 (соответствующий 224G11), I-3732 (соответствующий 227H1) и от 06.07.2007 под номером I-3786 (соответствующий 223C4). Данные гибридомы предусматривают мышиные гибридомы, полученные в результате клеточного слияния спленоцитов иммунизированных мышей с линией миеломных клеток (Sp20 Ag14).
[0175] Данные первые антитела, все из которых были первоначально раскрыты в патенте США № 8329173 и которые охватываются несколькими патентами, таким образом обобщены следующим образом (SEQ ID NO являются одинаковыми в патенте '173 и в настоящей заявке):
| 224G11 | 227H1 | 223C4 | 11E1 | |||||
| I-3731 | I-3732 | I-3786 | I-3724 | |||||
| SEQ ID NO белк. |
SEQ ID NO нукл. |
SEQ ID NO белк. |
SEQ ID NO нукл. |
SEQ ID NO белк. |
SEQ ID NO нукл. |
SEQ ID NO белк. |
SEQ ID NO нукл. |
|
| CDR-H1 | 1 | 24 | 4 | 27 | 7 | 30 | 56 | 64 |
| CDR-H2 | 2 | 25 | 5 | 28 | 8 | 31 | 57 | 65 |
| CDR-H3 | 3 | 26 | 6 | 29 | 9 | 32 | 58 | 66 |
| H-цепь | 18 | 41 | 19 | 42 | 20 | 43 | 62 | 70 |
| CDR-L1 | 10 | 33 | 13 | 36 | 15 | 38 | 59 | 67 |
| CDR-L2 | 11 | 34 | 11 | 34 | 16 | 39 | 60 | 68 |
| CDR-L3 | 12 | 35 | 14 | 37 | 17 | 40 | 61 | 69 |
| L-цепь | 21 | 44 | 22 | 45 | 23 | 46 | 63 | 71 |
[0176] Антитела 224G11, 227H1 и 223C4 не связывают домен SEMA рецептора cMet. 11E1 способно связывать домен SEMA.
[0177] В одном варианте осуществления антитело к cMet содержит CDR антитела STI-D0602 или STI-0602 (Sorrento Therapeutics). В другом варианте осуществления антитело к cMet представляет собой STI-D0602 или STI-0602, которые описаны в Lingna Li, Cathrine Fells, Julia Guo, Pia Muyot, Edwige Gros, Yanliang Zhang, Yingqing Sun, Hong, Zhang, Yanwen Fu, Tong Zhu, Jian Cao, Gunnar Kaufmann, Gang Chen, Zhenwei Miao, A novel cMet targeting antibody drug conjugate for NSCLC, Abstract No. 3897, AACR Annual Meeting, April 16-20, New Orleans, USA.
[0178] В одном варианте осуществления антитело к cMet содержит CDR антитела 5D5 (Genentech) или одноплечевого (моновалентного) производного онартузумаба. В одном варианте осуществления антитело к cMet представляет собой антитело 5D5 (Genentech) или одноплечевое (моновалентное) производное онартузумаба (фиг. 1В). Далее приведена дополнительная информация по онартузумабу:
| Тяжелая цепь (SEQ ID NO: 92): | |
| EVQLVESGGGLVQPGGSLRLSCAASGYTFTSYWLHWVRQAPGKGL | |
| EWVGMIDPSNSDTRFNPNFKDRFTISADTSKNTAYLQMNSLRAED | |
| TAVYYCATYRSYVTPLDYWGQGTLVTVSSASTKGPSVFPLAPSSK | |
| STSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSG | |
| LYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKT | |
| HTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSH | |
| EDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDW | |
| LNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEM | |
| TKNQVSLSCAVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGS | |
| FFLVSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK | |
| Легкая цепь (SEQ ID NO: 93): | |
| DIQMTQSPSSLSASVGDRVTITCKSSQSLLYTSSQKNYLAWYQQK | |
| PGKAPKLLIYWASTRESGVPSRFSGSGSGTDFTLTISSLQPEDFA | |
| TYYCQQYYAYPWTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGT | |
| ASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYS | |
| LSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC | |
| Шарнир-CH2-CH3 (SEQ ID NO: 94): | |
| DKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVD | |
| VSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLH | |
| QDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSR | |
| EEMTKNQVSLWCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDS | |
| DGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSP | |
| GK |
[0179] В одном варианте осуществления антитело к cMet содержит CDR антитела эмибетузумаб/LY2875358. В одном варианте осуществления антитело к cMet представляет собой эмибетузумаб/LY2875358 (Eli Lilly and Company, номер по CAS 1365287-97-3) (фиг. 1A). Далее приведена дополнительная информация по эмибетузумабу:
| Тяжелая цепь (SEQ ID NO: 95): QVQLVQSGAEVKKPGASVKVSCKASGYTFTDYYMHWVRQAPGQGL |
| EWMGRVNPNRRGTTYNQKFEGRVTMTTDTSTSTAYMELRSLRSDD |
| TAVYYCARANWLDYWGQGTTVTVSSASTKGPSVFPLAPCSRSTSE |
| STAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSL |
| SSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCP |
| APEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQF |
| NWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYK |
| CKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSL |
| TCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRL |
| TVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLG Легкая цепь (SEQ ID NO: 96) |
| DIQMTQSPSSLSASVGDRVTITCSVSSSVSSIYLHWYQQKPGKAP |
| KLLIYSTSNLASGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQ |
| VYSGYPLTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVC |
| LLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTL |
| TLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
[0180] В одном варианте осуществления антитело к cMet содержит CDR антитела AbF46 или SAIT301 (Samsung Electronics). В одном варианте осуществления антитело представляет собой AbF46 (фиг. 1C). В другом варианте осуществления антитело к cMet представляет собой SAIT301 (фиг. 1E).
[0181] В одном варианте осуществления антитело к cMet содержит CDR антитела ARGX-111 (36C4) (arGEN-X BV). В другом варианте осуществления антитело к cMet представляет собой ARGX-111 (фиг. 1D).
[0182] В одном варианте осуществления антитело к cMet содержит CDR одного из антител в Sym015 (Hu9006, Hu9338) (Symphogen A/S). В другом варианте осуществления антитело к cMet представляет собой Hu9006. В другом варианте осуществления антитело к cMet представляет собой Hu9338. Аминокислотные последовательности данных антител, включая их CDR, раскрыты в WO2016042412.
5.5. Системы экспрессии и способы получения антител
[0183] Антитела к cMet можно получить путем рекомбинантной экспрессии генов легкой и тяжелой цепей иммуноглобулина в клетке-хозяине с помощью способов, хорошо известных специалистам в данной области техники. Для того, чтобы рекомбинантно экспрессировать антитело, клетку-хозяина трансфицируют одним или несколькими рекомбинантными векторами экспрессии, несущими фрагменты ДНК, кодирующие иммуноглобулиновые легкие и тяжелые цепи антитела, так, что легкие и тяжелые цепи экспрессируются в клетке-хозяине и, необязательно, секретируются в среду, в которой культивируют клетки-хозяев, при этом из данной среды можно выделить антитела. Стандартные методики рекомбинантной ДНК применяют для получения генов тяжелой и легкой цепей антител, встраивания данных генов в рекомбинантные векторы экспрессии и введения векторов в клетки-хозяева, такие как описанные в Molecular Cloning; A Laboratory Manual, Second Edition (Sambrook, Fritsch and Maniatis (eds), Cold Spring Harbor, N. Y., 1989), Current Protocols in Molecular Biology (Ausubel, F.M. et al., eds., Greene Publishing Associates, 1989) и в патенте США № 4816397.
[0184] Для получения нуклеиновых кислот, кодирующих такие антитела к cMet, сначала получают фрагменты ДНК, кодирующие вариабельные области легкой и тяжелой цепей. Такие ДНК можно получить путем амплификации и модификации ДНК зародышевой линии или cDNA, кодирующей вариабельные последовательности легкой и тяжелой цепей, например, с помощью полимеразной цепной реакции (ПЦР). Из уровня техники известны последовательности ДНК зародышевой линии для человеческих генов вариабельных областей тяжелой и легкой цепей (см., например, базу данных последовательностей зародышевой линии человека "VBASE"; см. также Kabat et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242; Tomlinson et al., 1992, J. Mol. Biol. 22T:116-198; и Cox et al., 1994, Eur. J. Immunol. 24:827-836; содержание каждой из которых включено в данный документ посредством ссылки). Нуклеотиды, кодирующие антитела 224G11, 227H1, 223C4 и 11E11, были подробно описаны в патенте США № 8329173, и их описания включены в данный документ посредством ссылки во всей своей полноте.
[0185] После получения фрагментов ДНК, кодирующих сегменты VH и VL, относящиеся к антителам к cMet, данные фрагменты ДНК можно дополнительно подвергнуть манипуляциям с помощью стандартных методик рекомбинантной ДНК, например, для превращения генов вариабельных областей в гены полноразмерных цепей антитела, в гены Fab-фрагментов или в ген scFv. В случае данных манипуляций фрагмент ДНК, кодирующий VL или VH, функционально связывают с другим фрагментом ДНК, кодирующим другой белок, такой как константная область антитела или гибкий линкер. Подразумевается, что термин "функционально связанный", используемый в данном контексте, означает, что два фрагмента ДНК соединены таким образом, что аминокислотные последовательности, кодируемые этими двумя фрагментами ДНК, остаются в пределах рамки считывания.
[0186] Выделенную ДНК, кодирующую VH-область, можно превращать в ген полноразмерной тяжелой цепи путем функционального связывания ДНК, кодирующей VH, с другой молекулой ДНК, кодирующей константные области тяжелой цепи (CH1, CH2, CH3 и необязательно CH4). Последовательности человеческих генов константных областей тяжелой цепи известны из уровня техники (см., например, Kabat et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), и фрагменты ДНК, охватывающие данные области, можно получить с помощью стандартной ПЦР-амплификации. Константная область тяжелой цепи может представлять собой константную область IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD, но в определенных вариантах осуществления она представляет собой константную область IgG1 или IgG4. В случае гена тяжелой цепи Fab-фрагмента, ДНК, кодирующую VH, можно функционально связать с другой молекулой ДНК, кодирующей только константную область CH1 тяжелой цепи.
[0187] Выделенную ДНК, кодирующую VL-область, можно превращать в ген полноразмерной легкой цепи (а также ген легкой цепи Fab) путем функционального связывания ДНК, кодирующей VL, с другой молекулой ДНК, кодирующей константную область легкой цепи CL. Последовательности человеческих генов константных областей легкой цепи известны из уровня техники (см., например, Kabat et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), и фрагменты ДНК, охватывающие данные области, можно получить с помощью стандартной ПЦР-амплификации. Константная область легкой цепи может представлять собой константную область каппа-цепи или лямбда-цепи, но в определенных вариантах осуществления она представляет собой константную область каппа-цепи. Для создания гена scFv фрагменты ДНК, кодирующие VH и VL, функционально связывают с другим фрагментом, кодирующим гибкий линкер, например, кодирующим аминокислотную последовательность (Gly4~Ser)3 (SEQ ID NO: 97), так, чтобы последовательности VH и VL могли экспрессироваться в виде непрерывного одноцепочечного белка с VL- и VH-областями, соединенными гибким линкером (см., например, Bird et al., 1988, Science 242:423-426; Huston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; McCafferty et al., 1990, Nature 348:552-554).
[0188] Для экспрессии антител к cMet ДНК, кодирующие частичные или полноразмерные легкие и тяжелые цепи, полученные так, как описано выше, вставляют в векторы экспрессии так, чтобы гены были функционально связанными с последовательностями контроля транскрипции и трансляции. В данном контексте подразумевается, что термин "функционально связанный" означает, что ген антитела лигируют в вектор так, чтобы последовательности контроля транскрипции и трансляции внутри вектора выполняли их предполагаемую функцию, заключающуюся в регулировании транскрипции и трансляции гена антитела. Вектор экспрессии и последовательности контроля экспрессии выбирают так, чтобы они были совместимыми с применяемой для экспрессии клеткой-хозяином. Ген легкой цепи антитела и ген тяжелой цепи антитела можно вставить в отдельные векторы или, что чаще, оба гена вставляют в один и тот же вектор экспрессии.
[0189] Гены антитела вставляют в вектор экспрессии с помощью стандартных способов (например, лигирование комплементарных сайтов рестрикции на фрагменте гена антитела и вектора или лигирование "тупых" концов, если отсутствуют сайты рестрикции). Перед вставкой последовательностей легкой или тяжелой цепей, относящихся к антителу к cMet, вектор экспрессии может уже нести последовательности константных областей антитела. Например, один подход к превращению последовательностей VH и VL, относящихся к моноклональному антителу к cMet, в гены полноразмерного антитела заключается во вставке их в векторы экспрессии, которые уже кодируют константные области соответственно легкой и тяжелой цепей, так, чтобы сегмент VH был функционально связан с сегментом(сегментами) СН в векторе, а сегмент VL был функционально связан с сегментом CL в векторе. Дополнительно или альтернативно, рекомбинантный вектор экспрессии может кодировать сигнальный пептид, который способствует секреции цепи антитела из клетки-хозяина. Ген цепи антитела можно клонировать в вектор так, чтобы сигнальный пептид был связан в рамке считывания с аминоконцом цепи антитела, кодируемого геном. Сигнальный пептид может представлять собой сигнальный пептид иммуноглобулина или гетерологичный сигнальный пептид (т. е. сигнальный пептид из отличного от иммуноглобулина белка).
[0190] Помимо генов цепи антитела рекомбинантные векторы экспрессии несут регуляторные последовательности, которые контролируют экспрессию генов цепей антитела в клетке-хозяине. Подразумевается, что термин "регуляторная последовательность" включает промоторы, энхансеры и другие элементы контроля экспрессии (например, сигналы полиаденилирования), которые обеспечивают контроль транскрипции или трансляции генов цепей антитела. Такие регуляторные последовательности описаны, например, в Goeddel, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, CA, 1990. Специалистам в данной области техники будет понятно, что конструирование вектора экспрессии, включая выбор регуляторных последовательностей, может зависеть от таких факторов, как выбор подлежащей трансформации клетки-хозяина, необходимого уровня экспрессии белка и т. д. Подходящие регуляторные последовательности для экспрессии в клетках-хозяевах млекопитающих включают вирусные элементы, которые управляют высокими уровнями экспрессии белка в клетках млекопитающих, такие как промоторы и/или энхансеры, полученные из цитомегаловируса (CMV) (такие как промотор/энхансер CMV), вируса обезьян 40 (SV40) (такие как промотор/энхансер SV40), аденовируса (например, основной поздний промотор аденовируса (AdMLP)) и вируса полиомы. Более подробное описание вирусных регуляторных элементов и их последовательностей см., например, в патенте США № 5168062 от Stinski, патенте США № 4510245 от Bell et al. и патенте США № 4968615 от Schaffner et al.
[0191] Рекомбинантные векторы экспрессии по настоящему изобретению, в дополнение к генам цепей антитела и регуляторным последовательностям, могут нести такие последовательности, как последовательности, которые регулируют репликацию вектора в клетках-хозяевах (например, точки начала репликации) и селектируемые маркерные гены. Селектируемые маркерные гены облегчают отбор клеток-хозяев, в которые был введен вектор (см., например, патенты США №№ 4399216, 4634665 и 5179017, все от Axel et al.). Например, обычно селектируемый маркерный ген придает устойчивость к лекарственным средствам, таким как G418, гигромицин или метотрексат, клетке-хозяину, в которую был введен вектор. Подходящие селектируемые маркерные гены включают ген дигидрофолатредуктазы (DHFR) (для применения в DHFR- клетках-хозяевах с отбором по метотрексату/амплификацией) и ген neo (для отбора по G418). Для экспрессии легкой и тяжелой цепей вектор(векторы) экспрессии, кодирующий(кодирующие) тяжелую и легкую цепи, трансфицируют в клетку-хозяина с помощью стандартных методик. Подразумевается, что различные формы термина "трансфекция" охватывают широкий спектр методик, обычно применяемых для введения экзогенной ДНК в прокариотическую или эукариотическую клетку-хозяина, например, электропорацию, липофекцию, осаждение с помощью фосфата кальция, опосредованную DEAE-декстраном трансфекцию и т. п.
[0192] Антитела к cMet, входящие в состав ADC, нацеливающихся на cMet, можно экспрессировать либо в прокариотических, либо в эукариотических клетках-хозяевах. В определенных вариантах осуществления экспрессию антител обеспечивают в эукариотических клетках, например клетках-хозяевах млекопитающих, с оптимальной секрецией надлежащим образом свернутого и иммунологически активного антитела. Иллюстративные клетки-хозяева млекопитающего, предназначенные для экспрессии рекомбинантных антител по настоящему изобретению, включают клетки яичника китайского хомячка (клетки CHO) (включая DHFR- клетки CHO, описанные в Urlaub and Chasin, 1980, Proc. Natl. Acad. Sci. USA 77:4216-4220, применяемые с селектируемым маркером DHFR, например, как описано в Kaufman and Sharp, 1982, Mol. Biol. 159:601-621), клетки миеломы NS0, клетки COS и клетки SP2. Когда векторы для рекомбинантной экспрессии, кодирующие гены антитела, вводят в клетки-хозяева млекопитающего, антитела получают путем культивирования клеток-хозяев в течение периода времени, достаточного для обеспечения экспрессии антитела в клетках-хозяевах или секреции антитела в среду для культивирования, в которой клетки-хозяева выращиваются. Антитела можно извлекать из среды для культивирования с применением стандартных способов очистки белка. Клетки-хозяева также можно применять для получения частей интактных антител, таких как Fab-фрагменты или молекулы scFv. Понятно, что вариации вышеописанной процедуры находятся в пределах объема настоящего изобретения. Например, может быть необходимо трансфицировать клетку-хозяина с помощью ДНК, кодирующей либо легкую цепь, либо тяжелую цепь (но не обе) антитела к cMet.
[0193] Технологию рекомбинантной ДНК также можно применять для удаления некоторых или всех ДНК, кодирующих какую-либо одну или обе из легкой и тяжелой цепей, которые не являются необходимыми для связывания с cMet. Антитела по настоящему изобретению также охватывают молекулы, экспрессируемые с таких усеченных молекул ДНК.
[0194] В случае рекомбинантной экспрессии антитела к cMet, клетку-хозяина можно котрансфицировать с помощью двух векторов экспрессии, при этом первый вектор кодирует полипептид, полученный из тяжелой цепи, а второй вектор кодирует полипептид, полученный из легкой цепи. Два вектора могут содержать идентичные селектируемые маркеры, или каждый из них может содержать отдельный селектируемый маркер. Альтернативно, можно применять один вектор, который кодирует полипептиды как тяжелой, так и легкой цепей.
[0195] После получения нуклеиновой кислоты, кодирующей одну или несколько частей антитела к cMet, в кодирующую последовательность можно включить дополнительные изменения или мутации, например, для создания нуклеиновых кислот, кодирующих антитела с различными последовательностями CDR, антитела с уменьшенной аффинностью в отношении Fc-рецептора или антитела различных подклассов.
[0196] Антитела и/или связывающие фрагменты, входящие в состав ADC, нацеливающихся на cMet, также можно получить с помощью химического синтеза (например, с помощью способов, описанных в Solid Phase Peptide Synthesis, 2nd ed., 1984 The Pierce Chemical Co., Rockford, Ill.). Варианты антител также можно создать с помощью бесклеточной платформы, см., например, Chu et al., Biochemia No. 2, 2001 (Roche Molecular Biologicals) и Murray et al., 2013, Current Opinion in Chemical Biology, 17:420-426.
[0197] После получения антитела к cMet и/или связывающего фрагмента с помощью рекомбинантной экспрессии их можно очистить с помощью любого известного из уровня техники способа очистки молекулы иммуноглобулина, например, с помощью хроматографии (например, ионообменной, аффинной и эксклюзионной колоночной хроматографии), центрифугирования, методики, основанной на дифференциальной растворимости, или любой другой стандартной методики по очистке белков. Кроме того, антитела к cMet и/или связывающие фрагменты можно слить с описанными в данном документе гетерологичными полипептидными последовательностями или подвергнуть другой методике, известной из уровня техники, для облегчения очистки.
[0198] После выделения, антитело к cMet и/или связывающий фрагмент при необходимости можно дополнительно очистить, например, с помощью колоночной хроматографии (см., например, Fisher, Laboratory Techniques In Biochemistry And Molecular Biology, Work and Burdon, eds., Elsevier, 1980) или с помощью гельфильтрационной хроматографии на колонке SuperdexTM 75 (Pharmacia Biotech AB, Уппсала, Швеция).
5.6. Конкретные конъюгаты антитела к cMet и лекарственного средства
[0199] Как упоминалось, ADC, нацеливающиеся на cMet, в целом содержат антигенсвязывающую часть, нацеливающуюся на cMet, такую как антитело к cMet и/или связывающий фрагмент, имеющую один или несколько цитотоксических и/или цитостатических средств, которые могут быть одинаковыми или различными, связанных с ней с помощью одного или нескольких линкеров, которые также могут быть одинаковыми или различными. Для получения ADC к каждому Ab можно присоединить множество различных цитотоксических/цитостатических средств. Такие средства могут быть нацелены на два или более пути для обеспечения гибели или остановки роста опухолевых клеток, могут быть нацелены на несколько узлов одного и того же пути или могут оказывать двойное воздействие на одну и ту же мишень (т. е. ингибировать рост и/или обеспечивать гибель клеток посредством двух или более различных механизмов).
[0200] В конкретных вариантах осуществления ADC, нацеливающиеся на cMet, представляют собой соединения согласно структурной формуле (I):
[0201] (I) [D-L-XY] n -Ab
[0202] или их соли, где каждый "D" независимо от других представляет собой цитотоксическое и/или цитостатическое средство ("лекарственное средство"); каждый "L" независимо от других представляет собой линкер; "Ab" представляет собой антигенсвязывающую часть, нацеливающуюся на cMet, такую как антитело к cMet или связывающий фрагмент; каждый "XY" представляет собой связь, образованную между функциональной группой Rx на линкере и "комплементарной" функциональной группой Ry на антигенсвязывающей части; и n представляет собой количество лекарственных средств, присоединенных к Ab в ADC.
[0203] Конкретные варианты осуществления различных антител или связывающих фрагментов (Ab), которые могут входить в состав ADC согласно структурной формуле (I), включают различные варианты осуществления описанных выше антител к cMet и/или связывающих фрагментов.
[0204] В некоторых конкретных вариантах осуществления ADC или солей структурной формулы (I) каждый D является одинаковым, и/или каждый L является одинаковым.
[0205] Ниже более подробно описаны конкретные варианты осуществления цитотоксических и/или цитостатических средств (D) и линкеров (L), которые могут входить в состав ADC, нацеливающихся на cMet, а также количество связанных цитотоксических и/или цитостатических средств в ADC, нацеливающихся на cMet.
[0206] В конкретном иллюстративном варианте осуществления ADC, нацеливающиеся на cMet, представляют собой соединения согласно структурной формуле (I), где каждый "D" является одинаковым и представляет собой либо проникающий в клетку ауристатин (например, доластатин-10 или MMAE), либо проникающее в клетку и связывающееся с малой бороздой ДНК-сшивающее средство (например, PBD или димер PBD); каждый "L" является одинаковым и представляет собой линкер, расщепляемый лизосомальным ферментом; каждый "XY" представляет собой связь, образованную между малеимидом и сульфгидрильной группой; "Ab" представляет собой антитело, содержащее шесть CDR, соответствующих шести CDR антитела ABT-700 (224G11), или антитело, которое конкурирует за связывание cMet с таким антителом; и n равняется 2, 3 или 4. В конкретном варианте осуществления данного иллюстративного варианта осуществления или ADC, нацеливающихся на cMet, со структурной формулой (I) "Ab" представляет собой гуманизированное антитело, например, гуманизированное антитело, содержащее VH- и VL-цепи, соответствующие VH- и VL-цепям антитела 5D5. В другом конкретном варианте осуществления ADC, нацеливающихся на cMet, со структурной формулой (I) Ab представляет собой антитело STI-D0602 (Sorrento).
[0207] В конкретном иллюстративном варианте осуществления соединение согласно структурной формуле (I) характеризуется структурой формулы (IIa):
[0208] В одном варианте осуществления Ab в соединении формулы (IIa) представляет собой ABT-700.
[0209] В конкретном иллюстративном варианте осуществления соединение структурной формулы (I) характеризуется следующей структурой:
[0210] или ее фармацевтически приемлемой соли, где n имеет среднее значение, находящееся в диапазоне от 2 до 4, и Ab представляет собой полноразмерное антитело к cMet.
[0211] В конкретном варианте осуществления Ab в соединении данной конкретной формулы представляет собой ABT-700.
[0212] В конкретном варианте осуществления n имеет среднее значение, находящееся в диапазоне от 2 до 4, и Ab представляет собой полноразмерное антитело к cMet.
5.6.1. Цитотоксические и/или цитостатические средства
[0213] Цитотоксические и/или цитостатические средства могут быть любыми средствами, о которых известно, что они ингибируют рост и/или репликацию клеток и/или приводят к их гибели, и в частности раковых и/или опухолевых клеток. Из литературы известно множество средств, обладающих цитотоксическими и/или цитостатическими свойствами. Неограничивающие примеры классов цитотоксических и/или цитостатических средств включают в качестве примера и без ограничения радионуклиды, алкилирующие средства, сшивающие ДНК средства, ДНК-интеркалирующие средства (например, связывающиеся с бороздой средства, такие как связывающиеся с малой бороздой средства), модуляторы клеточного цикла, регуляторы апоптоза, ингибиторы киназ, ингибиторы синтеза белка, митохондриальные ингибиторы, ингибиторы ядерного экспорта, ингибиторы топоизомеразы I, ингибиторы топоизомеразы II, антиметаболиты РНК/ДНК и антимитотические средства.
[0214] Ниже приведены конкретные неограничивающие примеры средств некоторых из этих различных классов.
[0215] Алкилирующие средства : асалей (сложный этиловый эфир N-[N-ацетил-4-[бис-(2-хлорэтил)амино]-DL-фенилаланил]-L-лейцина); AZQ (диэтиловый эфир 2,5-бис(1-азиридинил)-3,6-диоксо-1,4-циклогексадиен-1,4-карбаминовой кислоты); BCNU (N,N'-бис(2-хлорэтил)-N-нитрозомочевина); бусульфан (1,4-бутандиолдиметансульфонат); (карбоксифталато)платина; CBDCA (цис-(1,1-циклобутандикарбоксилато)диаминплатина(II))); CCNU (N-(2-хлорэтил)-N'-циклогексил-N-нитрозомочевина); CHIP (ипроплатин, NSC 256927); хлорамбуцил; хлорозотоцин (2-[[[(2-хлорэтил)нитрозоамино]карбонил]амино]-2-дезокси-D-глюкопираноза); цис-платина (цисплатин); кломезон; цианоморфолинодоксорубицин; циклодизон; диангидрогалактитол-(5,6-диэпоксидульцитол); флуородопан ((5-[(2-хлорэтил)-(2-фторэтил)амино]-6-метилурацил); гепсульфам; гикантон; димер индолинобензодиазепина DGN462; мелфалан; метил-CCNU ((1-(2-хлорэтил)-3-(транс-4-метилциклогексан)-1-нитрозомочевина); митомицин C; митозоламид; азотистый иприт ((бис(2-хлорэтил)метиламина гидрохлорид); PCNU ((1-(2-хлорэтил)-3-(2,6-диоксо-3-пиперидил)-1-нитрозомочевина)); пиперазиновое алкилирующее средство ((1-(2-хлорэтил)-4-(3-хлоропропил)-пиперазина дигидрохлорид)); пиперазиндион; пипоброман (N,N'-бис(3-бромопропионил)пиперазин); порфиромицин (N-метилмитомицин C); спирогидантоиновый иприт; тероксирон (триглицидилизоцианурат); тетраплатин; тиотепа (N,N',N"-три-1,2-этандиилтиофосфорамид); триэтиленмеламин; урацил-азотистый иприт (десметилдопан); Yoshi-864 ((бис(3-мезилоксипропил)амингидрохлорид).
[0216] Подобные ДНК-алкилирующим средства: цисплатин; карбоплатин; недаплатин; оксалиплатин; сатраплатин; тетранитрат триплатина; прокарбазин; алтретамин; дакарбазин; митозоломид; темозоломид.
[0217] Алкилирующие антинеопластические средства: карбоквон; кармустин; хлорнафазин; хлорзотоцин; дуокармицин; эвофосфамид; фотемустин; глюфосфамид; ломустин; манносульфан; нимустин; фенантриплатин; пипоброман; ранимустин; семустин; стрептозотоцин; тиотепа; треосульфан; триазиквон; триэтиленмеламин; триплатины тетранитрат.
[0218] Ингибиторы репликации и репарации ДНК: алтретамин; блеомицин; дакарбазин; дактиномицин; митобронитол; митомицин; пингиангмицин; пликамицин; прокарбазин; темозоломид; ABT-888 (велипариб); олапариб; KU-59436; AZD-2281; AG-014699; BSI-201; BGP-15; INO-1001; ONO-2231.
[0219] Модуляторы клеточного цикла : паклитаксел; наб-паклитаксел; доцетаксел; винкристин; винбластин; ABT-348; AZD-1152; MLN-8054; VX-680; специфические ингибиторы киназы Aurora А; специфические ингибиторы киназы Aurora B и пан-ингибиторы киназ Aurora; AZD-5438; BMI-1040; BMS-032; BMS-387; CVT-2584; флавоперидол; GPC-286199; MCS-5A; PD0332991; PHA-690509; селициклиб (CYC-202, R-росковитин); ZK-304709; AZD4877, ARRY-520; GSK923295A.
[0220] Регуляторы апоптоза : AT-101 ((-)госсипол); G3139 или облимерсен (Bcl-2-нацеленный антисмысловой олигонуклеотид); IPI-194; IPI-565; N-(4-(4-((4′-хлор(1,1′-бифенил)-2-ил)метил)пиперазин-1-илбензоил)-4-(((1R)-3-(диметиламино)-1-((фенилсульфанил)метил)пропил)амино)-3-нитробензолсульфонамид); N-(4-(4-((2-(4-хлорфенил)-5,5-диметил-1-циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)бензоил)-4-(((1R)-3-(морфолин-4-ил)-1-((фенилсульфанил)метил)пропил)амино)-3-((трифторметил)сульфонил)бензолсульфонамид; GX-070 (Obatoclax®; 2-(2-((3,5-диметил-1H-пиррол-2-ил)метилен)-3-метокси-2H-пиррол-5-ил)-1H-индол); HGS1029; GDC-0145; GDC-0152; LCL-161; LBW-242; венетоклакс; средства, которые нацелены на рецепторы TRAIL или смерти (например, DR4 и DR5), такие как ETR2-ST01, GDC0145, HGS-1029, LBY-135, PRO-1762; лекарственные средства, которые нацелены на каспазы, регуляторы каспазы, представителей семейства BCL-2, белки с доменами смерти, представителей семейства TNF, представителей семейства Toll и/или NF-каппа-B белки.
[0221] Ингибиторы ангиогенеза: ABT-869; AEE-788; акситиниб (AG-13736); AZD-2171; CP-547632; IM-862; пегаптамиб; сорафениб; BAY43-9006; пазопаниб (GW-786034); ваталаниб (PTK-787, ZK-222584); сунитиниб; SU-11248; акцептор VEGF; вандетаниб; ABT-165; ZD-6474; ингибиторы DLL4.
[0222] Ингибиторы протеосом: бортезомиб; карфилзомиб; эпоксомицин; иксазомиб; салиноспорамид A.
[0223] Ингибиторы киназ: афатиниб; акситиниб; босутиниб; кризотиниб; дазатиниб; эрлотиниб; фостаматиниб; гефинитиб; ибрутиниб; иматиниб; лапатиниб; ленватиниб; мабритиниб; нилотиниб; пазопаниб; пегаптаниб; сорафениб; сунитиниб; SU6656; вандетаниб; вемурафениб; CEP-701 (лезауртиниб); XL019; INCB018424 (руксолитиниб); ARRY-142886 (селеметиниб); ARRY-438162 (биниметиниб); PD-325901; PD-98059; AP-23573; CCI-779; эверолимус; RAD-001; рапамицин; темсиролимус; АТФ-конкурентные ингибиторы TORC1/TORC2, включая PI-103, PP242, PP30, торин 1; LY294002; XL-147; CAL-120; ONC-21; AEZS-127; ETP-45658; PX-866; GDC-0941; BGT226; BEZ235; XL765.
[0224] Ингибиторы синтеза белка: стрептомицин; дигидрострептомицин; неомицин; фрамицетин; паромомицин; рибостамицин; канамицин; амикацин; арбакацин; бeканамицин; дибекацин; тобрамицин; спектиномицин; гигромицин B; паромомицин; гентамицин; нетилмицин; сизомицин; изепамицин; вердамицин; астромицин; тетрациклин; доксициклин; хлортетрациклин; кломоцеклин; демеклоциклин; лимециклин; меклоциклин; метациклин; миноциклин; окситетрациклин; пенимепициклин; ролитетрациклин; тетрациклин; глицилциклины; тигециклин; оксазолидинон; эперезолид; линезолид; позизолид; радезолид; ранбезолид; сутезолид; тедизолид; ингибиторы пептидилтрансферазы; хлорамфеникол; азидамфеникол; тиамфеникол; флорфеникол; плевромутилины; ретапамулин; тиамулин; валнемулин; азитромицин; кларитромицин; диритромицин; эритромицин; флуритромицин; джозамицин; мидекамицин; миокамицин; олеандомицин; рокитамицин; рокситромицин; спирамицин; тролеандомицин; тилозин; кетолиды; телитромицин; цетромицин; солитромицин; клиндамицин; линкомицин; пирлимицин; стрептограмины; пристинамицин; хинупристин/далфопристин; вирджиниамицин.
[0225] Ингибиторы гистондезацетилазы: вориностат; ромидепсин; хидамид; панобиностат; вальпроевая кислота; белиностат; моцетиностат; абексиностат; энтиностат; SB939 (прациностат); ресминостат; гивиностат; квизиностат; тиоуреидобутиронитрил (KevetrinTM); CUDC-10; CHR-2845 (тефиностат); CHR-3996; 4SC-202; CG200745; ACY-1215 (роцилиностат); ME-344; сульфорафан.
[0226] Ингибиторы топоизомеразы I : камптотецин; различные производные и аналоги камптотецина (например; NSC 100880, NSC 603071, NSC 107124, NSC 643833, NSC 629971, NSC 295500, NSC 249910, NSC 606985, NSC 74028, NSC 176323, NSC 295501, NSC 606172, NSC 606173, NSC 610458, NSC 618939, NSC 610457, NSC 610459, NSC 606499, NSC 610456, NSC 364830, и NSC 606497); морфолинизоксорубицин; SN-38.
[0227] Ингибиторы топоизомеразы II : доксорубицин; амонафид (бензизохинолиндион); m-AMSA (4'-(9-акридиниламино)-3'-метоксиметансульфонанилид); производное антрапиразола ((NSC 355644); этопозид (VP-16); пиразолокридин ((9-метокси-N,N-диметил-5-нитро-пиразоло[3,4,5-kl]акридин-2(6H)-пропанамина монометансульфонат); бисантрена гидрохлорид; даунорубицин; дезоксидоксорубицин; митоксантрон; меногарил; N,N-дибензилдауномицин; оксантразол; рубидазон; тенипозид.
[0228] ДНК-интеркалирующие средства : антрамицин; хикамицин A; томаймицин; DC-81; сибиромицин; производное пирролoбензодиазепина; SGD-1882 ((S)-2-(4-аминофенил)-7-метокси-8-(3-(((S)-7-метокси-2-(4-метоксифенил)-5-оксо-5,11a-дигидро-1H-бензо[e]пирролo[1,2-a][1,4]диазепин-8-ил)окси)пропокси)-1H-бензо[e]пирролo[1,2-a][1,4]диазепин-5(11aH)-он); SG2000 (SJG-136; (11aS,11a'S)-8,8'-(пропан-1,3-диилбис(окси))бис(7-метокси-2-метилен-2,3-дигидро-1H-бензо[e]пирролo[1,2-a][1,4]диазепин-5(11aH)-он)).
[0229] Антиметаболиты РНК/ДНК : L-аланозин; 5-азацитидин; 5-фторурацил; ацивицин; производное аминоптерина N-[2-хлор-5-[[(2,4-диамино-5-метил-6-хиназолинил)метил]амино]бензоил]-L-аспарагиновая кислота (NSC 132483); производное аминоптерина N-[4-[[(2, 4-диамино-5-этил-6-хиназолинил)метил]амино]бензоил]-L-аспарагиновая кислота; производное аминоптерина N-[2-хлор-4-[[(2,4-диамино-6-птеридинил)метил]амино]бензоил]-L-аспарагиновой кислоты моногидрат; антифолат PT523 ((Nα-(4-амино-4-дезоксиптероил)-Nγ-гемифталоил-L-орнитин)); растворимый антифол Бейкера (NSC 139105); дихлораллил лаусон ((2-(3,3-дихлораллил)-3-гидрокси-1,4-нафтохинон); бреквинар; фторафур ((пролекарство, 5-фтор-1-(тетрагидро-2-фурил)-урацил); 5,6-дигидро-5-азацитидин; метотрексат; производное метотрексата (N-[[4-[[(2,4-диамино-6-птеридинил)метил]метиламино]-1-нафталинил]карбонил]-L-глутаминовая кислота); PALA ((N-(фосфоноацетил)-L-аспартат); пиразофурин; триметрексат.
[0230] Антиметаболиты ДНК : 3-HP; 2'-дезокси-5-фторуридин; 5-HP; α-TGDR (α-2'-дезокси-6-тиoгуанозин); афидиколина глицинат; ara C (цитозина арабинозид); 5-аза-2'-дезоксицитидин; β-TGDR (β-2'-дезокси-6-тиoгуанозин); циклоцитидин; гуаназол; гидроксимочевина; инозина гликодиальдегид; макбецин II; пиразолоимидазол; тиoгуанин; тиoпурин.
[0231] Митохондриальные ингибиторы: панкратистатин; фенпанстатин; родамин-123; эдельфозин; d-альфа-токоферола сукцинат; соединение 11β; аспирин; эллиптицин; берберин; церуленин; GX015-070 (Obatoclax®; 2-(2-((3,5-диметил-1H-пиррол-2-ил)метилен)-3-метокси-2H-пиррол-5-ил)-1H-индол); целастрол (триптерин); метформин; бриллиантовый зеленый; ME-344.
[0232] Антимитотические средства : аллоколхицин; ауристатины, такие как MMAE (монометилауристатин E) и MMAF (монометилауристатин F); халихондрин B; цемадотин; колхицин; производное колхицина (N-бензоилдеацетилбензамид); доластатин-10; доластатин-15; майтансин; майтанзиноиды, такие как DM1 (N 2 '-деацетил-N 2 '-(3-меркапто-1-оксопропил)-майтансин); розоксин; паклитаксел; производное паклитаксела ((2'-N-[3-(диметиламино)пропил]глутарамата паклитаксел); доцетаксел; тиoколхицин; тритила цистеин; винбластина сульфат; винкристина сульфат.
[0233] Ингибиторы ядерного экспорта: каллистатин A; делактонмицин; KPT-185 (пропан-2-ил-(Z)-3-[3-[3-метокси-5-(трифторметил)фенил]-1,2,4-триазол-1-ил]проп-2-еноат); казусамицин A; лептолстатин; лептофуранин A; лептомицин B; ратжадон; вердинексор ((Z)-3-[3-[3,5-бис(трифторметил)фенил]-1,2,4-триазол-1-ил]-N'-пиридин-2-илпроп-2-енгидразид).
[0234] Средства гормональной терапии: анастрозол; экземестан; арзоксифен; бикалутамид; цетрореликс; дегареликс; деслорелин; трилостан; дексаметазон; флутамид; ралоксифен; фадрозол; торемифен; фулвестрант; летрозол; форместан; глюкокортикоиды; доксеркальциферол; севеламера карбонат; лазофоксифен; лейпролида ацетат; мегестерол; мифепристон; нилутамид; тамоксифена цитрат; абареликс; преднизон; финастерид; рилостан; бусерелин; рилизинг-фактор лютеинизирующего гормона (LHRH); гистрелин; трилостан или модрастан; фосрелин; гозерелин.
[0235] В ADC, нацеливающийся на cMet, можно включить любое из данных средств, которые включают или могут быть модифицированы для включения участка присоединения к антителу и/или связывающему фрагменту.
[0236] Специалистам в данной области техники также будет понятно, что вышеупомянутые механизмы действия не являются взаимоисключающими и что в некоторых вариантах осуществления может быть необходимым использование ADC, нацеливающихся на cMet, способных проявлять противоопухолевую активность в отношении экспрессирующих cMet (в данном документе называются cMet+ опухоли) или сверхэкспрессирующих cMet опухолей посредством более чем одного механизма действия. В качестве конкретного примера, такой ADC, нацеливающийся на cMet, может включать проникающее в клетку цитотоксическое и/или цитостатическое средство, которое является цитотоксическим и/или цитостатическим в отношении как cMet+/сверхэкспрессирующих опухолей, так и cMet-отрицательных опухолевых клеток, связанное с антителом к cMet посредством расщепляемого линкера.
[0237] Соответственно, в некоторых вариантах осуществления цитотоксические и/или цитостатические средства, включенные в ADC, нацеливающийся на cMet, смогут после расщепления ADC проходить через клеточные мембраны ("способные проникать в клетку цитостатические и/или цитотоксические средства"). Конкретные цитотоксические и/или цитостатические средства, представляющие интерес, и/или продукты расщепления ADC, включающих такие средства, можно тестировать в отношении способности проникать через клеточные мембраны с помощью стандартных способов, известных специалистам в данной области техники. Способность (P) молекул проникать через мембрану может быть выражена как P=KD/Δx, где K представляет собой коэффициент распределения, D представляет собой коэффициент диффузии, Δx представляет собой толщину клеточной мембраны. Коэффициент диффузии (D) является мерой скорости вхождения в цитоплазму в зависимости от молекулярной массы или размера молекулы. K является мерой растворимости вещества в липидах. Низкое значение K описывает подобную воде молекулу, которая не растворяется в липидах. С точки зрения графического представления предполагается, что способность (P) проникать в зависимости от коэффициента распределения (K) будет линейно возрастать, когда D и Δx являются константами. (Walter & Gutknecht, 1986, "Permeability of small nonelectrolytes through lipid bilayer membranes", Journal of Membrane Biology 90:207-217; Diamond & Katz, 1974, "Interpretation of nonelectrolyte partition coefficients between dimyristoyl lecithin and water", Journal of Membrane Biology 17:121-154).
[0238] В конкретном варианте осуществления цитотоксическое и/или цитостатическое средство представляет собой способное проникать в клетку антимитотическое средство.
[0239] В другом конкретном варианте осуществления цитотоксическое и/или цитостатическое средство представляет собой способный проникать в клетку ауристатин, такой как, например, доластатин-10 или MMAE.
[0240] В другом конкретном варианте осуществления цитотоксическое и/или цитостатическое средство представляет собой проникающее в клетку и связывающееся с малой бороздой ДНК-сшивающее средство, такое как, например, димер пирролобензодиазепина ("PBD").
5.6.2. Линкеры
[0241] В описанных в данном документе ADC, нацеливающихся на cMet, цитотоксические и/или цитостатические средства связаны с антигенсвязывающей частью посредством линкеров. Линкеры могут быть короткими, длинными, гидрофобными, гидрофильными, гибкими или жесткими или могут состоять из сегментов, каждый из которых независимо обладает одним или несколькими из вышеупомянутых свойств, так что линкер может включать сегменты, обладающие различными свойствами. Линкеры могут быть поливалентными с тем, чтобы они ковалентно связывали более одного средства с одним сайтом на антителе, или моновалентными с тем, чтобы они ковалентно связывали одно средство с одним сайтом на антителе.
[0242] Специалистам в данной области техники будет понятно, что линкеры связывают цитотоксические и/или цитостатические средства с антигенсвязывающей частью путем образования ковалентной связи с цитотоксическим и/или цитостатическим средством в одном месте и ковалентной связи с антигенсвязывающей частью в другом. Ковалентные связи образуются в результате взаимодействия между функциональными группами на линкере и функциональными группами на средствах и антигенсвязывающей части. Подразумевается, что используемое в данном документе выражение "линкер" включает (i) неконъюгированные формы линкера, который включает функциональную группу, способную ковалентно связывать линкер с цитотоксическим и/или цитостатическим средством, и функциональную группу, способную ковалентно связывать линкер с антигенсвязывающей частью, такой как антитело; (ii) частично конъюгированные формы линкера, который включает функциональную группу, способную ковалентно связывать линкер с антигенсвязывающей частью, такой как антитело, и который ковалентно связан с цитотоксическим и/или цитостатическим средством или наоборот; и (iii) полностью конъюгированные формы линкера, который ковалентно связан как с цитотоксическим и/или цитостатическим средством, так и с антигенсвязывающей частью, такой как антитело. В некоторых конкретных вариантах осуществления описанных в данном документе линкеров и ADC, а также синтонов, применяемых для конъюгации линкер-средств с антителами, части, содержащие функциональные группы на линкере, и ковалентные связи, образованные между линкером и антителом, конкретно проиллюстрированы соответственно в виде Rx и XY.
[0243] Линкеры, связывающие цитотоксические и/или цитостатические средства с антигенсвязывающей частью ADC, нацеливающегося на cMet, могут быть длинными, короткими, гибкими, жесткими, гидрофильными или гидрофобными по своей природе или могут содержать сегменты, которые имеют разные характеристики, такие как сегменты гибкости, сегменты жесткости и т. д. Линкер может быть химически устойчивым к внеклеточным средам, например химически устойчивым в кровотоке, или может содержать связи, которые являются неустойчивыми и обеспечивают высвобождение цитотоксических и/или цитостатических средств во внеклеточную среду. В некоторых вариантах осуществления линкеры содержат связи, которые выполнены с возможностью обеспечения высвобождения цитотоксических и/или цитостатических средств при интернализации ADC, нацеливающегося на cMet, в клетку. В некоторых конкретных вариантах осуществления линкеры содержат связи, выполненные с возможностью специфического или неспецифического расщепления и/или отщепления или разрушения иным образом внутри клеток. Из уровня техники известен широкий спектр линкеров, пригодных для связывания лекарственных средств с антигенсвязывающими частями, такими как антитела, в контексте ADC. Для связывания цитотоксических и/или цитостатических средств с антигенсвязывающей частью описываемых в данном документе ADC, нацеливающихся на cMet, можно применять любой из этих линкеров, а также другие линкеры.
[0244] Количество цитотоксических и/или цитостатических средств, связанных с антигенсвязывающей частью ADC, нацеливающегося на cMet, может варьировать (так называемое "соотношение лекарственного средства и антитела" или "DAR") и будет ограничено только количеством доступных участков присоединения на антигенсвязывающей части и количеством средств, связанных с одним линкером. Обычно линкер будет связывать одно цитотоксическое и/или цитостатическое средство с антигенсвязывающей частью ADC, нацеливающегося на cMet. В вариантах осуществления ADC, нацеливающиеся на cMet, которые включают более одного цитотоксического и/или цитостатического средства, каждое средство может быть одинаковым или различным. Предполагаются ADC, нацеливающиеся на cMet, с DAR, составляющим двадцать или даже больше, при условии, что ADC, нацеливающийся на cMet, не характеризуется неприемлемыми уровнями агрегации в условиях применения и/или хранения. В некоторых вариантах осуществления описываемые в данном документе ADC, нацеливающиеся на cMet, могут характеризоваться DAR, находящимся в диапазоне приблизительно 1-10, 1-8, 1-6 или 1-4. В определенных конкретных вариантах осуществления ADC, нацеливающиеся на cMet, могут характеризоваться DAR, составляющим 2, 3 или 4. В определенных вариантах осуществления ADC, нацеливающийся на cMet, характеризуется средним DAR, составляющим 3,1.
[0245] Линкеры являются предпочтительно, но не обязательно, химически устойчивыми к внеклеточным условиям и могут быть сконструированы с возможностью специфического расщепления, отщепления и/или разрушения иным образом внутри клетки. Альтернативно, можно применять линкеры, которые сконструированы с отсутствием возможности специфического расщепления или разрушения внутри клетки. Выбор устойчивого и неустойчивого линкера может зависеть от токсичности цитотоксического и/или цитостатического средства. Из уровня техники известен широкий спектр линкеров, пригодных для связывания лекарственных средств с антителами в контексте ADC. Для связывания цитотоксических и/или цитостатических средств с антителом описываемых в данном документе ADC можно применять любой из этих линкеров, а также другие линкеры.
[0246] Иллюстративные поливалентные линкеры, которые можно применять для связывания многих цитотоксических и/или цитостатических средств с одной молекулой антитела, описаны, например, в WO 2009/073445; WO 2010/068795; WO 2010/138719; WO 2011/120053; WO 2011/171020; WO 2013/096901; WO 2014/008375; WO 2014/093379; WO 2014/093394; WO 2014/093640; содержание которых включено в данный документ посредством ссылки во всей своей полноте. Например, технология линкера Fleximer, разработанная Mersana et al., обладает потенциалом, позволяющим получать ADC с высоким DAR и с надлежащими физико-химическими свойствами. Как показано ниже, технология Mersana основана на включении молекул лекарственного средства в солюбилизируемый полиацетальный остов с помощью последовательности со сложноэфирными связями. Технология дает высоконагруженные ADC (DAR до 20) при сохранении надлежащих физико-химических свойств.
[0247] Дополнительные примеры линкеров дендритного типа можно найти в US 2006/116422; US 2005/271615; de Groot et al (2003) Angew. Chem. Int. Ed. 42:4490-4494; Amir et al (2003) Angew. Chem. Int. Ed. 42:4494-4499; Shamis et al (2004) J. Am. Chem. Soc. 126:1726-1731; Sun et al (2002) Bioorganic & Medicinal Chemistry Letters 12:2213-2215; Sun et al (2003) Bioorganic & Medicinal Chemistry 11:1761-1768; King et al (2002) Tetrahedron Letters 43:1987-1990, каждый из которых включен в данный документ посредством ссылки.
[0248] Иллюстративные моновалентные линкеры, которые можно применять, описаны, например, в Nolting, 2013, Antibody-Drug Conjugates, Methods in Molecular Biology 1045:71-100; Kitson et al., 2013, CROs/CMOs - Chemica Oggi - Chemistry Today 31(4):30-38; Ducry et al., 2010, Bioconjugate Chem. 21:5-13; Zhao et al., 2011, J. Med. Chem. 54:3606-3623; патенте США № 7223837, патенте США № 8568728, патенте США № 8535678 и WO2004010957, каждый из которых включен в данный документ посредством ссылки.
[0249] В качестве примера и без ограничения в данном документе далее описаны некоторые расщепляемые и нерасщепляемые линкеры, которые могут быть включены в ADC, нацеливающиеся на cMet.
5.6.2.1. Расщепляемые линкеры
[0250] В определенных вариантах осуществления выбранный линкер является расщепляемым in vivo. Расщепляемые линкеры могут включать химически или ферментативно неустойчивые или разрушаемые связи. Расщепляемые линкеры, как правило, зависят от процессов внутри клетки для высвобождения лекарственного средства, таких как восстановление в цитоплазме, воздействие кислых условий в лизосоме или расщепление специфическими протеазами или другими ферментами внутри клетки. Расщепляемые линкеры, как правило, включают одну или несколько химических связей, которые могут быть либо химически, либо ферментативно расщепляемыми, тогда как остальная часть линкера является нерасщепляемой. В определенных вариантах осуществления линкер содержит химически неустойчивую группу, такую как гидразоновая и/или дисульфидная группы. Линкеры, содержащие химически неустойчивые группы, используют отличающиеся свойства плазмы крови и некоторых цитоплазматических компартментов. Внутриклеточными условиями, способствующими высвобождение лекарственного средства в случае линкеров, содержащих гидразоновые группы, являются кислая среда эндосом и лизосом, тогда как линкеры, содержащие дисульфидные группы, восстанавливаются в цитозоле, который содержит высокие концентрации тиолов, например, глутатиона. В определенных вариантах осуществления устойчивость линкера, содержащего химически неустойчивую группу, в плазме крови можно увеличить путем введения стерического затруднения с помощью заместителей вблизи химически неустойчивой группы.
[0251] Кислотно-неустойчивые группы, такие как гидразоновая, остаются интактными во время пребывания в системном кровотоке в среде с нейтральным значением рН (рН 7,3-7,5) и подвергаются гидролизу и высвобождают лекарственное средство после того, как ADC интернализируется в слабокислый эндосомальный (рН 5,0-6,5) и лизосомальный (рН 4,5-5,0) компартменты клетки. Данный рН-зависимый механизм высвобождения был ассоциирован с неспецифическим высвобождением лекарственного средства. Для повышения устойчивости гидразоновой группы в линкере линкер можно изменить путем химической модификации, например замещением, что позволяет добиться достижения более эффективного высвобождения в лизосоме с минимальной потерей в кровотоке.
[0252] Содержащие гидразоновые группы линкеры могут содержать дополнительные сайты расщепления, такие как дополнительные кислотно-неустойчивые сайты расщепления и/или ферментативно неустойчивые сайты расщепления. ADC, включающие иллюстративные линкеры, содержащие гидразоновые группы, включают следующие структуры:
[0253] где D и Ab представляют собой соответственно цитотоксическое и/или цитостатическое средство (лекарственное средство) и антитело, и n представляет собой количество комплексов лекарственное средство-линкер, связанных с антителом. В определенных линкерах, таких как линкер (Ig), линкер содержит две расщепляемые группы - дисульфидную и гидразоновую часть. В случае таких линкеров для эффективного высвобождения немодифицированного свободного лекарственного средства требуется кислое значение рН или восстановление дисульфидной группы и кислое значение рН. Было показано, что такие линкеры, как (Ih) и (Ii), эффективны с одним гидразоновым сайтом расщепления.
[0254] Другие кислотно-неустойчивые группы, которые могут быть включены в линкеры, включают цис-акотитил-содержащие линкеры. Химия цис-аконициловых групп предусматривает использование группы карбоновой кислоты, соединенной амидной связью для ускорения гидролиза амидной группы в кислых условиях.
[0255] Расщепляемые линкеры также могут включать дисульфидную группу. Дисульфиды термодинамически устойчивы при физиологическом значении рН и предназначены для высвобождения лекарственного средства после интернализации внутрь клеток, где цитозоль обеспечивает значительно более восстанавливающую среду по сравнению с внеклеточной средой. Для разрезания дисульфидных связей, как правило, требуется наличие цитоплазматического тиолового кофактора, такого как (восстановленный) глутатион (GSH), с тем, чтобы линкеры, содержащие дисульфидные группы, были достаточно устойчивы в кровотоке, избирательно высвобождая лекарственное средство в цитозоле. Внутриклеточный ферментативный белок дисульфидизомераза или подобные ферменты, способные расщеплять дисульфидные связи, также могут способствовать преимущественному расщеплению дисульфидных связей внутри клеток. Сообщалось, что GSH присутствует в клетках в диапазоне концентраций 0,5-10 мМ по сравнению со значительно более низкой концентрацией GSH или цистеина, наиболее распространенного низкомолекулярного тиола, в кровотоке в количестве примерно 5 мкМ. Опухолевые клетки, где нерегулярный ток крови приводит к гипоксическому состоянию, приводят в результате к повышенной активности восстанавливающих ферментов и, следовательно, к еще более высоким концентрациям глутатиона. В определенных вариантах осуществления устойчивость in vivo линкера, содержащего дисульфидные группы, можно усилить путем химической модификации линкера, например, путем использования стерического затруднения, прилегающего к дисульфидной связи.
[0256] ADC, включающие иллюстративные линкеры, содержащие дисульфидные группы, включают следующие структуры:
[0257] где D и Ab представляют собой соответственно лекарственное средство и антитело, n представляет собой количество комплексов лекарственное средство-линкер, связанных с антителом, и R в каждом случае независимо выбран, например, из водорода или алкила. В определенных вариантах осуществления увеличение стерического затруднения, прилегающего к дисульфидной связи, увеличивает устойчивость линкера. Такие структуры, как (Ij) и (Il), демонстрируют повышенную устойчивость in vivo, когда одна или несколько групп R выбраны из низшего алкила, такого как метил.
[0258] Другим типом расщепляемого линкера, который можно применять, является линкер, который специфически расщепляется ферментом. Такие линкеры обычно имеют пептидную основу или включают пептидные области, которые выступают в роли субстратов для ферментов. Линкеры на основе пептидов, как правило, более устойчивы в плазме крови и внеклеточной среде, чем химически неустойчивые линкеры. Пептидные связи, как правило, имеют хорошую устойчивость в сыворотке крови, так как лизосомальные протеолитические ферменты обладают очень низкой активностью в крови из-за эндогенных ингибиторов и неблагоприятно высокого значения pH крови по сравнению с лизосомами. Высвобождение лекарственного средства от антитела происходит специфически в результате действия лизосомальных протеаз, например, катепсина и плазмина. Данные протеазы могут присутствовать на повышенных уровнях в определенных опухолевых клетках.
[0259] В иллюстративных вариантах осуществления расщепляемый пептид выбран из тетрапептидов, таких как Gly-Phe-Leu-Gly (SEQ ID NO:98), Ala-Leu-Ala-Leu (SEQ ID NO:99) или дипептидов, таких как Val-Cit, Val-Ala, Met-(D)Lys, Asn-(D)Lys, Val-(D)Asp, Phe-Lys, Ile-Val, Asp-Val, His-Val, NorVal-(D)Asp, Ala-(D)Asp, Met-Lys, Asn-Lys, Ile-Pro, Me3Lys-Pro, фенилGly-(D)Lys, Met-(D)Lys, Asn-(D)Lys, Pro-(D)Lys, Met-(D)Lys, Asn-(D)Lys, Met-(D)Lys, Asn-(D)Lys. В определенных вариантах осуществления предпочтительными являются дипептиды, а не более длинные полипептиды, в связи с гидрофобностью более длинных пептидов.
[0260] Были описаны различные расщепляемые линкеры на основе дипептидов, пригодные для связывания лекарственных средств, таких как доксорубицин, митомицин, камототецин, таллисомицин и ауристатин/ представители семейства ауристатинов, с антителами (см., Dubowchik et al., 1998, J. Org. Chem. 67:1866-1872; Dubowchik et al., 1998, Bioorg. Med. Chem. Lett. 8(21):3341-3346; Walker et al., 2002, Bioorg. Med. Chem. Lett. 12:217-219; Walker et al., 2004, Bioorg. Med. Chem. Lett.14:4323-4327; и Francisco et al., 2003, Blood 102:1458-1465, Dornina et al., 2008, Bioconjugate Chemistry 19:1960-1963, каждый из которых включен в данный документ посредством ссылки). Все данные дипептидные линкеры или модифицированные варианты данных дипептидных линкеров можно применять в ADC, описанных в данном документе. Другие дипептидные линкеры, которые можно применять, включают линкеры, которые встречаются в таких ADC, как брентуксимаба вендотин-SGN-35 (Adcetris™) от Seattle Genetics, SGN-75 (антитело к CD-70, Val-Cit-MMAF) от Seattle Genetics, глембатумумаб (CDX-011) (антитело к-NMB, Val-Cit-MMAE) от Celldex Therapeutics и PSMA-ADC (PSMA-ADC-1301) (антитело к PSMA, Val-Cit-MMAE) от Cytogen.
[0261] Ферментативно расщепляемые линкеры могут включать самоотщепляющийся спейсер для пространственного отделения лекарственного средства от сайта ферментативного расщепления. Непосредственное присоединение лекарственного средства к пептидному линкеру может привести к протеолитическому высвобождению аминокислотного аддукта с лекарственным средством, что ухудшает его активность. Применение самоотщепляющегося спейсера обеспечивает возможность удаления полностью активного химически немодифицированного лекарственного средства при гидролизе амидной связи.
[0262] Одним самоотщепляющимся спейсером является бифункциональная группа пара-аминобензилового спирта, которая связана с пептидом посредством аминогруппы, образуя амидную связь, тогда как аминсодержащие лекарственные средства могут быть присоединены посредством карбаматных функциональных групп к бензиловой гидроксильной группе линкера (PABC). Полученные в результате пролекарства активируются при опосредованном протеазой расщеплении, что приводит к 1,6-элиминирующей реакции, обеспечивающей высвобождение немодифицированного лекарственного средства, диоксида углерода и остатков линкерной группы. На следующей схеме изображена фрагментация простого п-амидобензилового эфира и высвобождение лекарственного средства:
[0263] где X-D представляет собой немодифицированное лекарственное средство.
[0264] Также были описаны гетероциклические варианты данной самоотщепляющейся группы. См., например, US 7989434, включенный в данный документ посредством ссылки.
[0265] В некоторых вариантах осуществления ферментативно расщепляемый линкер представляет собой линкер на основе β-глюкуроновой кислоты. Легкое высвобождение лекарственного средства может быть осуществлено посредством расщепления гликозидной связи β-глюкуронида лизосомальным ферментом β-глюкуронидазой. Данный фермент присутствует в избытке в лизосомах и сверхэкспрессируется в некоторых типах опухолей, при этом активность данного фермента вне клеток является низкой. Линкеры на основе β-глюкуроновой кислоты можно применять для того, чтобы обойти тенденцию ADC подвергаться агрегации вследствие гидрофильной природы β-глюкуронидов. В некоторых вариантах осуществления линкеры на основе β-глюкуроновой кислоты предпочтительны в качестве линкеров для ADC, связанных с гидрофобными лекарственными средствами. Следующая схема описывает высвобождение лекарственного средства из ADC, содержащего линкер на основе β-глюкуроновой кислоты:
[0266] Были описаны различные расщепляемые линкеры на основе β-глюкуроновой кислоты, пригодные для связывания лекарственных средств, таких как ауристатины, камптотецин и аналоги доксорубицина, связывающие малую борозду CBI средства и псимберин, с антителами (см. Nolting, Chapter 5 "Linker Technology in Antibody-Drug Conjugates", в: Antibody-Drug Conjugates: Methods in Molecular Biology, vol. 1045, pp. 71-100, Laurent Ducry (Ed.), Springer Science & Business Medica, LLC, 2013; Jeffrey et al., 2006, Bioconjug. Chem. 17:831-840; Jeffrey et al., 2007, Bioorg. Med. Chem. Lett. 17:2278-2280; и Jiang et al., 2005, J. Am. Chem. Soc. 127:11254-11255, каждый из которых включен в данный документ посредством ссылки). Все данные линкеры на основе β-глюкуроновой кислоты можно применять в описанных в данном документе ADC, нацеливающихся на cMet.
[0267] Кроме того, цитотоксические и/или цитостатические средства, содержащие фенольную группу, можно ковалентно связать с линкером посредством атома кислорода фенола. В основе одного такого линкера, описанного в WO 2007/089149, лежит методика, в которой диаминоэтан "SpaceLink" применяют в сочетании с традиционными самоотщепляющимися группами на основе "PABO" для доставки фенолов. Ниже схематически изображено расщепление линкера, где D представляет собой цитотоксическое и/или цитостатическое средство, имеющее фенольную гидроксильную группу.
[0268] Расщепляемые линкеры могут включать нерасщепляемые части или сегменты, и/или расщепляемые сегменты или части могут быть включены в иной нерасщепляемый линкер с тем, чтобы сделать его расщепляемым. Лишь в качестве примера, полиэтиленгликоль (PEG) и родственные ему полимеры могут включать расщепляемые группы в полимерном остове. Например, полиэтиленгликолевый или полимерный линкер может включать одну или несколько расщепляемых групп, таких как дисульфидная, гидразоновая или дипептидная.
[0269] Другие разрушаемые связи, которые можно использовать в линкерах, включают без ограничения сложноэфирные связи, образованные в результате реакции PEG-карбоновых кислот или активированных PEG-карбоновых кислот со спиртовыми группами на биологически активном средстве, при этом такие сложноэфирные группы, как правило, гидролизуются в физиологических условиях с высвобождением биологически активного средства. Гидролитически разрушаемые связи включают без ограничения карбонатные связи; иминовые связи, образованные в результате реакции амина и альдегида; фосфатные сложноэфирные связи, образованные в результате реакции спирта с фосфатной группой; ацетальные связи, которые являются продуктом реакции альдегида и спирта; сложные ортоэфирные связи, которые являются продуктом реакции формата и спирта; и олигонуклеотидные связи, образованные фосфорамидитной группой, в том числе без ограничения, которая находится на конце полимера, и 5'-гидроксильную группу олигонуклеотида.
[0270] В определенных вариантах осуществления линкер содержит ферментативно расщепляемую пептидную часть, например линкер, предусматривающий структурную формулу (IVa), (IVb), (IVc) или (IVd):
или его соль, где
[0271] пептид представляет собой пептид (проиллюстрированный C→N и без демонстрации карбокси- и амино- "концов"), расщепляемый лизосомальным ферментом;
[0272] Т представляет собой полимер, содержащий одно или несколько этиленгликолевых звеньев или алкиленовую цепь или их комбинации;
[0273] Ra выбран из водорода, алкила, сульфоната и метилсульфоната;
[0274] p представляет собой целое число в диапазоне от 0 до 5;
[0275] q равняется 0 или 1;
[0276] x равняется 0 или 1;
[0277] y равняется 0 или 1;
[0278] представляет собой точку присоединения линкера к цитотоксическому и/или цитостатическому средству; и
[0279] * представляет собой точку присоединения линкера к остальной части.
[0280] В определенных вариантах осуществления лизосомальный фермент выбран из катепсина В и β-глюкуронидазы.
[0281] В определенных вариантах осуществления пептид выбран из трипептида или дипептида. В конкретных вариантах осуществления дипептид выбран из Val-Cit; Cit-Val; Ala-Ala; Ala-Cit; Cit-Ala; Asn-Cit; Cit-Asn; Cit-Cit; Val-Glu; Glu-Val; Ser-Cit; Cit-Ser; Lys-Cit; Cit-Lys; Asp-Cit; Cit-Asp; Ala-Val; Val-Ala; Phe-Lys; Val-Lys; Ala-Lys; Phe-Cit; Leu-Cit; Ile-Cit; Phe-Arg; и Trp-Cit. В определенных вариантах осуществления пептид выбран из Val-Cit; Cit-Val; Ala-Ala; Ala-Cit; Cit-Ala; Asn-Cit; Cit-Asn; Cit-Cit; Val-Glu; Glu-Val; Ser-Cit; Cit-Ser; Lys-Cit; Cit-Lys; Asp-Cit; Cit-Asp; Ala-Val; и Val-Ala и их солей.
[0282] Конкретные иллюстративные варианты осуществления линкеров согласно структурной формуле (IVa), которые могут быть включены в описанные в данном документе ADC, включают линкеры, проиллюстрированные ниже (как проиллюстрировано, линкеры включают группу, подходящую для ковалентного связывания линкера с антителом):
[0283] Конкретные иллюстративные варианты осуществления линкеров согласно структурной формуле (IVb), которые могут быть включены в описанные в данном документе ADC, включают линкеры, проиллюстрированные ниже (как проиллюстрировано, линкеры включают группу, подходящую для ковалентного связывания линкера с антителом):
| (IVb.1) | |
| (IVb.2) | |
| (IVb.3) | |
| (IVb.4) | |
| (IVb.5) | |
| (IVb.6) | |
| (IVb.7) | |
| (IVb.8) | |
| (IVb.9) | |
| (IVb.10) | |
| (IVb.11) | |
| (IVb.12) | |
| (IVb.13) | |
| (IVb.14) | |
| (IVb.15) | |
| (IVb.16) | |
| (IVb.17) |
[0284] Конкретные иллюстративные варианты осуществления линкеров согласно структурной формуле (IVc), которые могут быть включены в описанные в данном документе ADC, включают линкеры, проиллюстрированные ниже (как проиллюстрировано, линкеры включают группу, подходящую для ковалентного связывания линкера с антителом):
[0285] Конкретные иллюстративные варианты осуществления линкеров согласно структурной формуле (IVd), которые могут быть включены в описанные в данном документе ADC, включают линкеры, проиллюстрированные ниже (как проиллюстрировано, линкеры включают группу, подходящую для ковалентного связывания линкера с антителом):
| (IVd.1) | |
| (IVd.2) | |
| (IVd.3) | |
| (IVd.4) | |
| (IVd.5) | |
| (IVd.6) | |
| (IVd.7) | |
| (IVd.8) | |
| (IVd.9) | |
| (IVd.10) | |
| (IVd.11) | |
| (IVd.12) | |
| (IVd.13) | |
| (IVd.14) | |
| (IVd.15) | |
| (IVd.16) | |
| (IVd.17) |
[0286] В определенных вариантах осуществления линкер, предусматривающий структурную формулу (IVa), (IVb), (IVc) или (IVd), дополнительно содержит карбонатную часть, расщепляемую под воздействием кислой среды. В конкретных вариантах осуществления линкер присоединен к цитотоксическому и/или цитостатическому средству посредством атома кислорода.
5.6.2.2. Нерасщепляемые линкеры
[0287] Хотя расщепляемые линкеры могут обеспечивать определенные преимущества, линкеры, входящие в состав описанных в данном документе ADC, необязательно должны быть расщепляемыми. В случае нерасщепляемых линкеров высвобождение лекарственного средства не зависит от отличающихся свойств у плазмы крови и некоторых цитоплазматических компартментов. Предполагается, что высвобождение лекарственного средства происходит после интернализации ADC посредством антиген-опосредованного эндоцитоза и доставки в лизосомальный компартмент, при этом антитело разрушается до уровня аминокислот посредством внутриклеточного протеолитического разрушения. Данный процесс обеспечивает высвобождение производного лекарственного средства, которое образовано лекарственным средством, линкером и аминокислотным остатком, к которому был ковалентно присоединен линкер. Аминокислотные метаболиты с лекарственным средством из конъюгатов с нерасщепляемыми линкерами являются более гидрофильными и, как правило, характеризуются меньшей способностью проникать через мембрану, что приводит к меньшему количеству эффектов, оказываемых на близлежащие случайные клетки, и меньшей неспецифической токсичности по сравнению с конъюгатами с расщепляемым линкером. В целом, ADC с нерасщепляемыми линкерами характеризуются большей устойчивостью в кровотоке, чем ADC с расщепляемыми линкерами. Нерасщепляемые линкеры могут представлять собой алкиленовые цепи, или могут быть полимерными по своей природе, как, например, линкеры, в основе которых лежат полиалкиленгликолевые полимеры, амидные полимеры, или могут включать сегменты алкиленовых цепей, полиалкиленгликолей и/или амидных полимеров.
[0288] Было описано множество нерасщепляемых линкеров, применяемых для связывания лекарственных средств с антителами. См., Jeffrey et al., 2006, Bioconjug. Chem. 17;831-840; Jeffrey et al., 2007, Bioorg. Med. Chem. Lett. 17:2278-2280; и Jiang et al., 2005, J. Am. Chem. Soc. 127:11254-11255, каждый из которых включен в данный документ посредством ссылки. Все данные линкеры могут быть включены в описанные в данном документе ADC.
[0289] В некоторых вариантах осуществления, линкер является нерасщепляемым in vivo, например линкер согласно структурной формуле (VIa), (VIb), (VIc) или (VId) (как проиллюстрировано, линкеры включают группу, подходящую для ковалентного связывания линкера с антителом):
[0290] или его соли, где:
[0291] Ra выбран из водорода, алкила, сульфоната и метилсульфоната;
[0292] Rx представляет собой часть, включающую функциональную группу, способную ковалентно связывать линкер с антителом; и
[0293] представляет собой точку присоединения линкера к цитотоксическому и/или цитостатическому средству.
[0294] Конкретные иллюстративные варианты осуществления линкеров согласно структурной формуле (VIa) - (VId), которые могут быть включены в описанные в данном документе ADC, включают линкеры, проиллюстрированные ниже (как проиллюстрировано, линкеры включают группу, подходящую для ковалентного связывания линкера с антителом, и "" представляет собой точку присоединения к цитотоксическому и/или цитостатическому средству):
5.6.2.3. Группы, применяемые для присоединения линкеров к антителам
[0295] Для присоединения синтонов линкер-лекарственное средство к антителам с получением ADC можно применять различные группы. Группы присоединения могут быть электрофильными по своей природе и включают малеимидные группы, активированные дисульфидные группы, активные сложноэфирные группы, такие как сложноэфирные группы NHS и сложноэфирные группы HOBt, галогеноформиатные, галогенангидридные, алкил- и бензилгалогенидные, такие как галогенацетамидные. Как обсуждается ниже, существуют также перспективные технологии, связанные с "самостабилизирующимися" малеимидными группами и "образующими мостиковую связь дисульфидными группами", которые можно применять согласно настоящему изобретению. Конкретная применяемая группа отчасти будет зависеть от участка присоединения к антителу.
[0296] На приведенной ниже схеме изображен один пример "самостабилизирующейся" малеимидной группы, которая самопроизвольно гидролизируется в условиях конъюгации антител с образованием молекул ADC с улучшенной устойчивостью. См. US20130309256 A1; также Lyon et al., Nature Biotech, опубликованная онлайн, doi:10.1038/nbt.2968).
[0297] Polytherics раскрыл способ образования мостиковой связи в паре сульфгидрильных групп, полученных в результате восстановления нативной дисульфидной связи в шарнире. См. Badescu et al., 2014, Bioconjugate Chem. 25:1124-1136. Реакция показана на приведенной ниже схеме. Преимуществом данной методологии является возможность синтезировать гомогенные ADC с DAR4 путем полного восстановления молекул IgG (с получением 4 пар сульфгидрильных групп) с последующей реакцией с 4 эквивалентами алкилирующего средства. ADC, содержащие "образующие мостики дисульфидные группы", также реализованы как имеющие повышенную устойчивость.
[0298] Аналогично, как показано ниже, было разработано производное малеимида (1, ниже), которое способно образовывать мостиковую связь в паре сульфгидрильных групп. См. WO2013/085925.
5.6.2.4. Соображения по выбору линкера
[0299] Как известно специалистам в данной области техники, на линкер, выбранный для конкретного ADC, может влиять множество факторов, включая без ограничения участок присоединения к антителу (например, Lys, Cys или другие аминокислотные остатки), структурные ограничения фармакофора лекарственного средства и липофильность лекарственного средства. Конкретный линкер, выбранный для ADC, должен пытаться сбалансировать эти различные факторы для конкретной комбинации антитело/лекарственное средство. Обзор факторов, на которые влияет выбор линкеров в ADC, см. в Nolting, Chapter 5 "Linker Technology in Antibody-Drug Conjugates" в: Antibody-Drug Conjugates: Methods in Molecular Biology, vol. 1045, pp. 71-100, Laurent Ducry (Ed.), Springer Science & Business Medica, LLC, 2013.
[0300] Например, ADC, нацеливающиеся на cMet, могут осуществлять цитолиз близлежащих случайных cMet-отрицательных опухолевых клеток, присутствующих в непосредственной близости от экспрессирующих cMet раковых клеток. Механизм цитолиза близлежащих случайных клеток с помощью ADC показал, что продукты метаболизма, образующиеся при внутриклеточной обработке ADC, могут играть определенную роль. Проникающие в клетку цитотоксические и/или цитостатические метаболиты, образующиеся в результате метаболизма молекул ADC в клетках, экспрессирующих cMet, по-видимому, играют роль в цитолизе близлежащих случайных клеток, тогда как не проникающие в клетку метаболиты, которые не способны пройти через клеточную мембрану и диффундировать в среду, не могут осуществлять цитолиз близлежащих случайных клеток. В определенных вариантах осуществления линкер выбирают так, чтобы он оказывал влияние, усиливал или увеличивал цитолитический эффект ADC, нацеливающихся на cMet, на близлежащие случайные клетки.
[0301] Свойства линкера могут также влиять на агрегацию ADC в условиях применения и/или хранения. Как правило, упоминаемые в литературе ADC содержат не более 3-4 молекул лекарственного средства на антигенсвязывающую часть, например, на молекулу антитела (см., например, Chari, 2008, Acc Chem Res 41:98-107). Попытки получить более высокие соотношения лекарственного средства и антитела ("DAR") часто были неудачными, особенно если как лекарственное средство, так и линкер были гидрофобными, из-за агрегации молекул ADC (King et al., 2002, J Med Chem 45:4336-4343; Hollander et al., 2008, Bioconjugate Chem 19:358-361; Burke et al., 2009 Bioconjugate Chem 20:1242-1250). Во многих случаях DAR выше 3-4 могут быть полезными в качестве средства увеличения активности. В случаях, когда цитотоксическое и/или цитостатическое средство является гидрофобным по своей природе, целесообразным может быть выбор линкеров, которые являются относительно гидрофильными, в качестве средства уменьшения агрегации ADC, особенно в случаях, когда требуются DAR больше 3-4. Таким образом, в определенных вариантах осуществления линкер включает химические фрагменты, которые уменьшают агрегацию ADC во время хранения и/или применения. Для уменьшения агрегации молекул ADC линкер может содержать полярные или гидрофильные группы, такие как заряженные группы или группы, которые становятся заряженными при физиологическом значении рН. Например, линкер может содержать заряженные группы, такие как соли, или группы, которые депротонируют, например карбоксилатные, или протонируют, например амины, при физиологическом значении рН.
[0302] Иллюстративные поливалентные линкеры, о которых сообщалось, что они обеспечивают получение DAR вплоть до 20, которые можно применять для связывания множества цитотоксических и/или цитостатических средств с антителом, описаны в WO 2009/073445, WO 2010/068795, WO 2010/138719, WO 2011/120053, WO 2011/171020, WO 2013/096901, WO 2014/008375, WO 2014/093379, WO 2014/093394, WO 2014/093640, содержание которых включено в данный документ посредством ссылки во всей своей полноте.
[0303] В конкретных вариантах осуществления агрегация ADC во время хранения или применения составляет менее приблизительно 10%, как определяют с помощью эксклюзионной хроматографии (SEC). В конкретных вариантах осуществления агрегация ADC во время хранения или применения составляет менее 10%, например, менее приблизительно 5%, менее приблизительно 4%, менее приблизительно 3%, менее приблизительно 2%, менее приблизительно 1%, менее приблизительно 0,5%, менее приблизительно 0,1% или даже меньше, как определяют с помощью эксклюзионной хроматографии (SEC).
5.6.3. ABBV-399
[0304] Как описано в данном описании, ABBV-399 представляет собой ADC, состоящий из нацеливающегося на cMet антитела ABT-700 (PR-1266688, h224G11), конъюгированного с сильнодействующим цитотоксином монометилауристатином Е (MMAE) посредством валин-цитруллинового (vc) линкера. ABBV-399 применяли в клиническом испытании фазы 1 (см. пример 16) с DAR, составляющим 3,1.
[0305] В альтернативных вариантах осуществления ABBV-399 можно применять при соотношении E2/E4 1:1, что соответствует среднему значению DAR, составляющему 3,0. Другими словами, ABBV-399 применяют как композицию, характеризующуюся соотношением 1:1 очищенных фракций Е2 и Е4 конъюгата антитела и лекарственного средства.
5.6.4. ABT-700-PBD
[0306] ABT-700 (S238C)-PBD (нумерация по Kabat) является тем же, что и ABT-700 (S239C)-PBD (Eu нумерация) и состоит из двух молекул линкер-лекарственное средство PBD, конъюгированных со сконструированным с включением cys mAb ABT-700. Способ конъюгации заключается в количественном восстановлении сконструированных и межцепочечных дисульфидных связей. Затем смесь после восстановления очищают для удаления избыточного реагента и его побочных продуктов с последующим количественным окислением межцепочечных дисульфидных связей, а затем конъюгацией с избытком молекул линкер-лекарственное средство PBD. После остановки реакции реакционную смесь очищают и заменяют буфер с получением ABT-700 (S238C)-PBD. Были установлены параметры реакции для получения конъюгата с >80% нагрузкой лекарственного средства DAR2.
[0307] Последовательность ABT-700-PBD, которая несет мутацию S238C (нумерация по Kabat) (эквивалентная мутации S239C по Eu нумерации), представляет собой следующую (CDR подчеркнуты, система нумерации по Kabat, и мутация S238C представлена C (жирным, подчеркнутым и курсивным шрифтом):
Аминокислотная последовательность (10 AA в группе, 5 групп на строчку)
Тяжелая цепь (SEQ ID NO: 171) (подчеркнутые последовательности CDR, раскрытые соответственно под SEQ ID NO: 173-175 в порядке встречаемости):
QVQLVQSGAE VKKPGASVKV SCKASGYIFT_AYTMHWVRQA PGQGLEWMGW 50
IKPNNGLANY_AQKFQGRVTM TRDTSISTAY MELSRLRSDD TAVYYCARSE 100
ITTEFDYWGQ GTLVTVSSAS TKGPSVFPLA PSSKSTSGGT AALGCLVKDY 150
FPEPVTVSWN SGALTSGVHT FPAVLQSSGL YSLSSVVTVP SSSLGTQTYI 200
CNVNHKPSNT KVDKRVEPKS CDCHCPPCPA PELLGGPCVF LFPPKPKDTL 250
MISRTPEVTC VVVDVSHEDP EVKFNWYVDG VEVHNAKTKP REEQYNSTYR 300
VVSVLTVLHQ DWLNGKEYKC KVSNKALPAP IEKTISKAKG QPREPQVYTL 350
PPSREEMTKN QVSLTCLVKG FYPSDIAVEW ESNGQPENNY KTTPPVLDSD 400
GSFFLYSKLT VDKSRWQQGN VFSCSVMHEA LHNHYTQKSL SLSPG 445
Легкая цепь (SEQ ID NO: 172) (подчеркнутые последовательности CDR, раскрытые соответственно под SEQ ID NO 176-178 в порядке встречаемости):
DIVMTQSPDS LAVSLGERAT INCKSSESVD_SYANSFLHWY QQKPGQPPKL 50
LIYRASTRES GVPDRFSGSG SGTDFTLTIS SLQAEDVAVY YCQQSKEDPL 100
TFGGGTKVEI KRTVAAPSVF IFPPSDEQLK SGTASVVCLL NNFYPREAKV 150
QWKVDNALQS GNSQESVTEQ DSKDSTYSLS STLTLSKADY EKHKVYACEV 200
THQGLSSPVT KSFNRGEC 218
5.7. Способы получения конъюгатов антитела к cMet и лекарственного средства
[0308] Описанные в данном документе ADC можно синтезировать с помощью хорошо известных химических способов. Выбранные химические способы будут зависеть, среди прочего, от типа цитотоксического и/или цитостатического средства(средств), линкера и групп, применяемых для присоединения линкера к антителу. В целом, ADC согласно формуле (I) можно получить согласно следующей схеме:
[0309] D-L-Rx +Ab-Ry → (I) [D-L-XY] n -Ab,
[0310] где D, L, Ab, XY и n являются такими, как определено ранее, а Rx и Ry представляют собой дополняющие друг друга группы, способные образовывать ковалентные связи друг с другом, как обсуждалось выше.
[0311] Типы групп Rx и Ry будут зависеть от химического способа, применяемого для связывания синтона D-L-Rx с антителом. В целом, применяемый химический способ не должен приводить к изменению целостности антитела, например, его способности связывать свою мишень. Предпочтительно, свойства связывания конъюгированного антитела будут очень напоминать свойства связывания неконъюгированного антитела. Из уровня техники известен ряд химических способов и методик для конъюгации молекул с биологическими молекулами, такими как антитела, и, в частности, с антителами. См., например, Amon et al., "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy", в: Monoclonal Antibodies And Cancer Therapy, Reisfeld et al. Eds., Alan R. Liss, Inc., 1985; Hellstrom et al., "Antibodies For Drug Delivery" в: Controlled Drug Delivery, Robinson et al.Eds., Marcel Dekker, Inc., 2nd Ed. 1987; Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", в: Monoclonal Antibodies '84: Biological And Clinical Applications, Pinchera et al.,Eds., 1985; "Analysis, Results, and Future Prospective of the Therapeutic Use of Radiolabeled Antibody In Cancer Therapy", в: Monoclonal Antibodies For Cancer Detection And Therapy, Baldwin et al., Eds., Academic Press, 1985; Thorpe et al., 1982, Immunol. Rev. 62:119-58; публикацию согласно PCT WO 89/12624. Для связывания синтонов с антителом можно применять любой из данных химических способов.
[0312] Известен ряд функциональных групп Rx и химических способов, пригодных для связывания синтонов с доступными остатками лизина, и в их число входят, в качестве примера, а не ограничения, сложноэфирные группы NHS и изотиоцианатные группы.
[0313] Известен ряд функциональных групп Rx и химических способов, пригодных для связывания синтонов с доступными свободными сульфгидрильными группами, и в их число входят, в качестве примера, а не ограничения, галогенацетильные группы и малеимидные группы.
[0314] Тем не менее химические способы конъюгации не ограничены доступными группами боковых цепей. Боковые цепи, такие как амины, можно преобразовать в другие пригодные группы, такие как гидроксильные, путем связывания соответствующей малой молекулы с амином. Данную стратегию можно применять для увеличения количества доступных сайтов связывания на антителе путем конъюгации многофункциональных малых молекул с боковыми цепями доступных аминокислотных остатков антитела. Затем в синтоны включают функциональные группы Rx, подходящие для ковалентного связывания синтонов с этими "преобразованными" функциональными группами.
[0315] Антитело также можно конструировать так, чтобы оно включало аминокислотные остатки для конъюгации. Подход по конструированию антител так, чтобы они включали аминокислотные остатки, кодируемые не генетическим кодом, пригодные для конъюгации лекарственных средств в контексте ADC, описан у Axup et al., 2012, Proc Natl Acad Sci U S A. 109(40):16101-16106, а также там описаны химические способы и функциональные группы, пригодные для связывания синтонов с не закодированными аминокислотами.
[0316] Обычно синтоны связывают с боковыми цепями аминокислотных остатков антитела, включая, например, первичную аминогруппу доступных лизиновых остатков или сульфгидрильную группу доступных цистеиновых остатков. Свободные сульфгидрильные группы можно получить путем восстановления межцепочечных дисульфидных связей.
[0317] В случае связей, где Ry представляет собой сульфгидрильную группу (например, если Rx представляет собой малеимидную группу), антитело, как правило, сначала полностью или частично восстанавливают для разрушения межцепочечных дисульфидных мостиков между цистеиновыми остатками. Конкретные цистеиновые остатки и межцепочечные дисульфидные мостики, которые можно восстановить для присоединения синтонов лекарственное средство-линкер, включая группу, подходящую для конъюгации с сульфгидрильной группой для иллюстративного антитела ABT-700, включают, в качестве примера, а не ограничения, остатки C221, C223, C225 и C228 тяжелой цепи человеческого IgG1 и остаток C218 легкой цепи каппа человеческого Ig из описанного в данном документе ABT-700.
[0318] Цистеиновые остатки для присоединения синтонов, которые не участвуют в образовании дисульфидных мостиков, могут быть встроены при конструировании в антитело путем мутации одного или нескольких кодонов. Такие неспаренные цистеины обеспечивают подходящую для конъюгации сульфгидрильную группу. Предпочтительные положения для включения сконструированных цистеинов включают, в качестве примера, а не ограничения, положения S112C, S113C, A114C, S115C, A176C, S180C, S252C, V286C, V292C, S357C, A359C, S398C, S428C (нумерация по Kabat) тяжелой цепи человеческого IgG1 и положения V110C, S114C, S121C, S127C, S168C, V205C (нумерация по Kabat) легкой цепи каппа человеческого Ig (см., например, патент США № 7521541, патент США № 7855275 и патент США № 8455622).
[0319] Как будет понятно специалистам в данной области техники, количество цитотоксических и/или цитостатических средств, связанных с молекулой антитела, может варьировать, так что препарат ADC может быть гетерогенным по своей природе, если некоторые антитела в препарате содержат одно связанное средство, некоторые два, некоторые три и т. д. (а некоторые ни одного). Степень гетерогенности будет зависеть, помимо прочего, от химических способов, применяемых для связывания цитотоксических и/или цитостатических средств. Например, если антитела восстанавливают с получением сульфгидрильных групп для присоединения, зачастую образуются гетерогенные смеси антител, имеющих ни одного, 2, 4, 6 или 8 связующих средств на молекулу. Кроме того, при ограничения молярного соотношения присоединяемого соединения зачастую получают антитела, имеющие ни одного, 1, 2, 3, 4, 5, 6, 7 или 8 связанных средств на молекулу. Таким образом, будет понятно, что в зависимости от контекста, указанные соотношения лекарственного средства и антитела (DAR) могут представлять собой средние значения для коллекции антител. Например, "DAR4" обозначает препарат ADC, который не был подвергнут очистке для выделения конкретных пиков DAR и содержит гетерогенную смесь молекул ADC с различными количествами присоединенных цитостатических и/или цитотоксических средств на антитело (например, 0, 2, 4, 6, 8 средств на антитело), но имеет среднее соотношение лекарственного средства и антитела, составляющее 4. Аналогично, "DAR8" обозначает гетерогенный препарат ADC, в котором среднее соотношение лекарственного средства и антитела составляет 8.
[0320] Гетерогенные препараты ADC можно подвергнуть обработке, например, с помощью хроматографии гидрофобного взаимодействия ("HIC"), с получением препаратов, обогащенных ADC с указанным представляющий интерес DAR (или смесь из двух или более указанных DAR). Такие обогащенные препараты в данном документе обозначены "EX", где "E" указывает, что препарат ADC был подвергнут обработке и обогащен ADC с конкретным DAR, а "X" представляет собой количество связанных цитостатических и/или цитотоксических средств на молекулу ADC. Препараты, обогащенные смесью ADC с двумя конкретными DAR, обозначены "EX/EY", тремя конкретными DAR - "EX/EY/EZ" и т. д., где "E" указывает, что препарат ADC был подвергнут обработке для обогащения указанными DAR, а "X", "Y" и "Z" представляют собой обогащенные DAR. В качестве конкретных примеров, "E2" обозначает препарат ADC, который был обогащен так, чтобы он содержал преимущественно ADC с двумя связанными цитостатическими и/или цитотоксическими средствами на молекулу ADC. "E4" обозначает препарат ADC, который был обогащен так, чтобы он содержал преимущественно ADC с четырьмя связанными цитостатическими и/или цитотоксическими средствами на молекулу ADC. "E2/E4" обозначает препарат ADC, который был обогащен так, чтобы он содержал преимущественно две популяции ADC, причем одна из них имеет два связанных цитостатических и/или цитотоксических средства на молекулу ADC, а другая имеет четыре связанных цитостатических и/или цитотоксических средства на молекулу ADC.
[0321] Как используется в данном документе, препараты, обогащенные "Е", как правило, будут по меньшей мере на 80% чистыми по ADC с указанным DAR, хотя могут быть получены и желательны и более высокие уровни чистоты, такие как значения чистоты, составляющие по меньшей мере приблизительно 85%, 90%, 95%, 98% или даже выше. Например, препарат "EX", как правило, будет по меньшей мере на приблизительно 80% чистым по ADC с X связанных цитостатических и/или цитотоксических средств на молекулу ADC. В случае обогащенных препаратов "более высокого порядка", таких как, например, препараты "EX/EY", общая сумма ADC с X и Y связанными цитостатическими и/или цитотоксическими средствами на молекулу ADC, как правило, будет включать по меньшей мере приблизительно 80% всех ADC в препарате. Аналогично, в обогащенном препарате "EX/EY/EZ" общая сумма ADC с X, Y и Z связанными цитостатическими и/или цитотоксическими средствами на молекулу ADC будет включать по меньшей мере приблизительно 80% всех ADC в препарате.
[0322] Степень чистоты можно оценить с помощью множества способов, которые известны из уровня техники. В качестве конкретного примера, препарат ADC можно проанализировать с помощью HPLC или другой хроматографии и оценить степень чистоты путем анализа значений площади под кривыми полученных пиков. Конкретные способы хроматографии, которые можно применять для оценки степени чистоты препаратов ADC, приведены в примере 6.
[0323] На фиг. 2 проиллюстрирован способ I, который применяют для получения DAR, составляющего 3,1. На фиг. 3 проиллюстрирован способ II, который применяли для получения соотношения E2/E4 1:1.
[0324] Конкретные способы получения гетерогенных смесей ADC, содержащих гуманизированное антитело huM25, имеющее среднее DAR, составляющее 4, а также высокоочищенных препаратов, содержащих 2 и 4 связанных средств, приведены в разделе "Примеры". Данные конкретные способы без труда можно модифицировать для получения гетерогенных и/или гомогенных ADC, содержащих другие антитела к cMet, линкеры и/или цитотоксические и/или цитостатические средства.
[0325] После конъюгирования vcMMAE с ABT-700 применяют дополнительную стадию способа для уменьшения среднего соотношения лекарственного средства и антитела (DAR) от примерно 5 до примерно 3, что приводит в результате к получению более гомогенного лекарственного продукта с меньшим количеством конъюгированных с антителом молекул MMAE. Данная стратегия была реализована для уменьшения количества молекул лекарственных средств, присоединенных к ABBV-399, что может улучшить его переносимость, поскольку молекулы лекарственного средства высокого порядка могут вносить непропорциональный вклад в токсичность.
5.8. Композиции
[0326] Описанные в данном документе ADC могут быть представлены в форме композиций, содержащих ADC и один или несколько носителей, вспомогательных средств и/или разбавителей. Композиции могут быть составлены для конкретных применений, как, например, для ветеринарных применений или для фармацевтических применений у людей. Форма композиции (например, сухой порошок, жидкий состав и т. д.) и применяемые вспомогательные средства, разбавители и/или носители будут зависеть от предполагаемых путей применения антитела и/или ADC и, в случае терапевтических применений, способа введения.
[0327] В случае терапевтических применений композиции могут поставляться как часть стерильной фармацевтической композиции, которая включает фармацевтически приемлемый носитель. Такая композиция может иметь любую подходящую форму (в зависимости от требуемого способа ее введения пациенту). Фармацевтическую композицию можно вводить пациенту различными путями, как, например, перорально, трансдермально, подкожно, интраназально, внутривенно, внутримышечно, в опухоль, интратекально, местно или локально. Наиболее подходящий путь введения в любом конкретном случае будет зависеть от конкретного антитела и/или ADC, субъекта, а также природы и тяжести заболевания и физического состояния субъекта. Как правило, фармацевтическую композицию будут вводить внутривенно или подкожно.
[0328] Фармацевтические композиции для удобства могут быть представлены в единичных лекарственных формах, содержащих предварительно определенное количество описанных в данном документе антитела и/или ADC на дозу. Количество антитела и/или ADC, включенное в единичную дозу, будет зависеть от заболевания, в отношении которого осуществляется лечение, а также от других факторов, хорошо известных из уровня техники. Такие единичные дозировки могут быть представлены в форме лиофилизированного сухого порошка, содержащего подходящее для однократного введения количество антитела и/или ADC, или в форме жидкости. Единичные лекарственные формы в виде сухого порошка могут быть упакованы в набор со шприцем, подходящим количеством разбавителя и/или другими компонентами, пригодными для введения. Единичные лекарственные формы в жидкой форме для удобства могут поставляться в форме шприца, предварительно заполненного подходящим для однократного введения количеством антитела и/или ADC.
[0329] Фармацевтические композиции также могут поставляться в бестарной форме, содержащей подходящие для многократных введений количества ADC.
[0330] Фармацевтические композиции можно получать для хранения в виде лиофилизированных составов или водных растворов путем смешивания антитела и/или ADC с необходимой степенью чистоты с необязательными фармацевтически приемлемыми носителями, вспомогательными средствами или стабилизаторами, обычно используемыми в данной области техники (все из которых в данном документе называют "носителями"), т. е. буферными средствами, стабилизирующими средствами, консервантами, изотонирующими добавками, неионогенными детергентами, антиоксидантами и разными другими добавками. См., Remington's Pharmaceutical Sciences, 16th edition (Osol, ed. 1980) и Remington: The Science and Practice of Pharmacy, 22nd Edition (Edited by Allen, Loyd V. Jr., 2012). Такие добавки должны быть нетоксичными для принимающих их лиц в используемых дозировках и концентрациях.
[0331] Буферные средства помогают поддерживать рН в диапазоне, который стабилизирует белок. Они могут присутствовать в широком спектре концентраций, но обычно они будут присутствовать в концентрациях, варьирующих от приблизительно 2 мМ до приблизительно 50 мМ. Подходящие буферные средства для применения по настоящему изобретению включают как органические, так и неорганические кислоты и их соли, такие как цитратные буферы (например, смесь мононатрия цитрата и динатрия цитрата, смесь лимонной кислоты и тринатрия цитрата, смесь лимонной кислоты и мононатрия цитрата и т. д.), сукцинатные буферы (например, смесь янтарной кислоты и мононатрия сукцината, смесь янтарной кислоты и натрия гидроксида, смесь янтарной кислоты и динатрия сукцината и т. д.), тартратные буферы (например, смесь винной кислоты и натрия тартрата, смесь винной кислоты и калия тартрата, смесь винной кислоты и гидроксида натрия и т. д.), фумаратные буферы (например, смесь фумаровой кислоты и мононатрия фумарата, смесь фумаровой кислоты и динатрия фумарата, смесь мононатрия фумарата и динатрия фумарата и т. д.), глюконатные буферы (например, смесь глюконовой кислоты и натрия глюконата, смесь глюконовой кислоты и натрия гидроксида, смесь глюконовой кислоты и калия глюконата и т. д.), оксалатный буфер (например, смесь щавелевой кислоты и натрия оксалата, смесь щавелевой кислоты и натрия гидроксида, смесь щавелевой кислоты и калия оксалата и т. д.), лактатные буферы (например, смесь молочной кислоты и натрия лактата, смесь молочной кислоты и натрия гидроксида, смесь молочной кислоты и калия лактата и т. д.) и ацетатные буферы (например, смесь уксусной кислоты и натрия ацетата, смесь уксусной кислоты и натрия гидроксида и т. д.). Кроме того, можно применять фосфатные буферы, гистидиновые буферы и соли триметиламина, такие как Tris.
[0332] Для замедления роста микроорганизмов можно добавлять консерванты, и их можно добавлять в количествах, варьирующих в диапазоне от приблизительно 0,2% до 1% (вес/объем). Подходящие консерванты для применения в настоящем изобретении включают фенол, бензиловый спирт, метакрезол, метилпарабен, пропилпарабен, октадецилдиметилбензиламмония хлорид, галогениды бензалкония (например, хлорид, бромид и йодид), гексаметония хлорид и алкилпарабены, такие как метил- или пропилпарабен, катехол, резорцин, циклогексанол и 3-пентанол. Для обеспечения изотоничности жидких композиций по настоящему изобретению можно добавить изотонирующие добавки, иногда называемые как "стабилизаторы", и они включают многоатомные сахароспирты, например тригидридные или высшие сахароспирты, такие как глицерин, эритрит, арабит, ксилит, сорбит и маннит. Стабилизаторы относятся к широкой категории вспомогательных средств, которые могут выполнять функцию от наполнителя до добавки, которая солюбилизирует терапевтическое средство или помогает предотвратить денатурацию или прилипание к стенке контейнера. Типичные стабилизаторы могут представлять собой многоатомные сахароспирты (перечисленные выше); аминокислоты, такие как аргинин, лизин, глицин, глутамин, аспарагин, гистидин, аланин, орнитин, L-лейцин, 2-фенилаланин, глутаминовая кислота, иреонин, и т. д., органические сахара или сахароспирты, такие как лактоза, трегалоза, стахиоза, маннит, сорбит, ксилит, рибит, миоинозит, галактит, глицерин и т. п., включая циклитолы, такие как инозит; полиэтиленгликоль; аминокислотные полимеры; серосодержащие восстановители, такие как мочевина, глутатион, тиоктовая кислота, натрия триогликолят, тиoглицерин, α-монотиoглицерин и натрия тиосульфат; низкомолекулярные полипептиды (например, пептиды из 10 остатков или менее); белки, такие как человеческий сывороточный альбумин, бычий сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон, моносахариды, такие как ксилоза, манноза, фруктоза, глюкоза; дисахариды, такие как лактоза, мальтоза, сахароза и трегалоза; и трисахариды, такие как раффиноза; и полисахариды, такие как декстран. Стабилизаторы могут присутствовать в количествах, варьирующих от 0,5 до 10 вес. % в пересчете на вес ADC.
[0333] Неионогенные поверхностно-активные вещества или детергенты (также известные как "смачивающие средства") можно добавить для уменьшения адсорбции к поверхностям и для содействия солюбилизации гликопротеина, а также для защиты гликопротеина от агрегации, вызванной перемешиванием, что также позволяет подвергать состав стрессовому воздействию со сдвигом поверхности, не вызывая денатурации белка. Пригодные неионогенные поверхностно-активные вещества включают полисорбаты (20, 80 и т. д.), полоксамеры (184, 188 и т. д.) и плюроновые полиолы. Неионогенные поверхностно-активные вещества могут присутствовать в диапазоне от приблизительно 0,05 мг/мл до приблизительно 1,0 мг/мл, например, от приблизительно 0,07 мг/мл до приблизительно 0,2 мг/мл.
[0334] К числу различных дополнительных вспомогательных средств относятся объемообразующие средства (например, крахмал), хелатирующие средства (например, ЭДТА), антиоксиданты (например, аскорбиновая кислота, метионин, витамин Е) и сорастворители.
[0335] Конкретный иллюстративный вариант осуществления водной композиции, подходящей для введения посредством внутривенной инфузии, содержит 20 мг/мл ADC, нацеливающегося на cMet, 10 мМ гистидинового буфера, pH 6,0, 7% (вес/объем) сахарозы, 0,03% (вес/объем) полисорбата 80. Композиция может быть представлена в виде лиофилизированного порошка, который при ресуспендировании с 5,2 мл стерильной воды или другого раствора, подходящего для инъекции или инфузии (например, 0,9% солевой раствор, раствор Рингера, раствор Рингера с лактатом и т. д.), приводит к получению вышеуказанной водной композиции. Данный или другие варианты осуществления композиций также могут быть представлены в виде шприца или другого устройства, подходящего для инъекции и/или инфузии, предварительно заполненного количеством композиции, подходящим для однократного введения ADC, нацеливающегося на cMet.
[0336] В одном варианте осуществления композиция содержит ABBV-399 в соотношении 1:1 очищенных фракций E1 и E4. Такие фракции можно получить с помощью любого известного из уровня техники способа очистки ADC, включая способ из примеров 2 и 3. В одном варианте осуществления композиция содержит ABBV-399 с DAR в диапазоне 0-10. В другом варианте осуществления композиция содержит ABBV-399 с DAR в диапазоне 1-4. В другом варианте осуществления композиция содержит ABBV-399 с DAR в диапазоне 2-4. В другом варианте осуществления композиция содержит ABBV-399 с DAR, составляющим приблизительно 3,1. В другом варианте осуществления композиция содержит ABBV-399 с DAR, составляющим приблизительно 3,0.
5.9. Способы применения
[0337] Как обсуждалось ранее, cMet экспрессируется/сверхэкспрессируется в случае ряда солидных опухолей. Представленные в данном документе данные демонстрируют, что ADC, нацеливающиеся на cMet, проявляют сильную противоопухолевую активность в отношении данных экспрессирующих/сверхэкспрессирующих cMet опухолей in vivo. Соответственно, ADC и/или фармацевтические композиции, содержащие ADC, можно применять в терапевтических целях для лечения экспрессирующих cMet (т. е. cMet+ опухолей) и сверхэкспрессирующих cMet опухолей (т. е. cMet+/сверхэкспрессирующих опухолей).
[0338] Как правило, способы включают введение пациенту-человеку, у которого имеется экспрессирующая cMet или сверхэкспрессирующая cMet опухоль, количества ADC, нацеливающегося на cMet, эффективного для обеспечения терапевтического эффекта. Можно применять любой известный специалисту в данной области техники способ оценки наличия и/или уровня экспрессии рецепторного белка cMet в клетке. В одном варианте осуществления уровни cMet являются мембранными. В другом варианте осуществления уровни cMet являются цитоплазматическими. В другом варианте осуществления измеряют общий уровень экспрессии cMet. Предпочтительный способ определения уровней экспрессии cMet подробно описан в примере 17 и называется в данном документе как "протокол окрашивания с помощью ABBV-ADC, нацеливающегося на cMet". H-показатели (0-300) и IHC-показатель (0, 1+, 2+ и 3+) определяют на основании способов, известных специалисту в области патоморфологии. В одном варианте осуществления для лечения выбирают пациентов с H-показателями, составляющими <150, и/или IHC-показателями, составляющими 0 и 1+. В одном варианте осуществления для лечения выбирают пациентов с H-показателями, составляющими ≥150, и/или IHC-показателями, составляющими 2+ и 3+.
[0339] К пациентам, выбранным для лечения посредством ADC по настоящему изобретению, относятся пациенты с экспрессирующими cMet опухолями и пациенты со сверхэкспрессирующими cMet опухолями, которые включают без ограничения любую солидную опухоль (включая также те, которые сверхэкспрессируют HGF и/или характеризуются аномальной активацией сигнального пути HGF/cMet или экспрессией). Более конкретные примеры включают формы рака легкого; формы рака молочной железы (например, инвазивную протоковую карциному); формы рака головы и шеи; формы рака поджелудочной железы; карциномы желудка; формы колоректального рака (включая метастазы колоректального рака в легкие); формы рака яичников (например, серозную аденокарциному); формы рака желудка; формы рака почек (например, почечно-клеточный рак, такой как папиллярный тип почечно-клеточного рака почек, формы светлоклеточного рака, наследственные папиллярные типы почечно-клеточного рака почек); формы рака надпочечников; формы рака желудка/пищевода; медуллобластомы; глиомы; формы рака печени (например, гепатоклеточные карциномы (включая неоперабельные HCC на поздних стадиях)); рак предстательной железы (метастатический или неметастатический); меланомы; опухоли слюнных желез; саркомы; формы рака шейки матки; миксоидные липосаркомы; аденокарциномы паращитовидной железы; формы эндометриального рака; эпителиоидные мезотелиомы; карциномы аппендикса; карциномы из бокаловидных клеток; метастатическую диффузную желудочную аденокарциному с признаками перстневидного; анапластическую крупноклеточную лимфому (ALCL); любое злокачественное новообразование на поздних стадиях, включая без ограничения на поздних стадиях, рецидивирующие, резистентные подтипы перечисленных в данном документе форм рака.
[0340] Рак легкого можно классифицировать с помощью различных систем. По одной системе рак легкого включает аденокарциному (смешанную, ацинарную, папиллярную, солидную, микропапиллярную, лепидическую немуцинозную и лепидическую муцинозную), плоскоклеточную карциному, крупноклеточную карциному (например, формы немелкоклеточного рака легкого или NSCLC (например, на поздних стадиях или не напоздних стадиях, LCNEC, LCNEM, NSCLC без дополнительных уточнений (NOS)/аденосквамозную карциному, саркоматоидную карциному, аденосквамозную карциному и крупноклеточную нейроэндокринную карциному) и мелкоклеточный рак легкого/карциному или SCLC)).
[0341] Альтернативно, по другой системе рак легкого можно классифицировать на преинвазивные очаги, минимально инвазивную аденокарциному и инвазивную аденокарциному (инвазивную муцинозную аденокарциному, муцинозную BAC, коллоидную, фетальную (низкий и высокой степени злокачественности) и тонкого кишечника).
[0342] Чаще рак легкого можно классифицировать как мелкоклеточный рак легкого ("SCLC") или немелкоклеточный рак легкого ("NSCLC"). Формы NSCLC можно дополнительно классифицировать как плоскоклеточный или неплоскоклеточный. Примером неплоскоклеточного NSCLC является аденокарцинома.
[0343] Рак может быть впервые диагностирован и таким, что не подвергался лечению, или может быть рецидивирующим, резистентным или рецидивирующим и резистентным, или метастазом или метастатической формой экспрессирующих cMet или сверхэкспрессирующих cMet опухолей. Как продемонстрировано в примере 14 настоящего изобретения, сверхэкспрессирующие cMet опухоли, которые проявляют резистентность к другим нацеленным или ненацеленным средствам химиотерапии, сохраняют чувствительность к ABBV-399.
[0344] Более того, как показано на фиг. 12C, сверхэкспрессирующая cMet опухоль, которая в конечном итоге восстанавливала рост после обработки антителом ABT-700 к cMet, оставалась чувствительной к повторной обработке ADC, нацеливающимся на cMet, ABBV-399. Соответственно, описанные в данном документе ADC, нацеливающиеся на cMet, обеспечивают значительные преимущества по сравнению с существующими нацеленными и ненацеленными подходами к лечению сверхэкспрессирующих cMet опухолей.
[0345] ADC, нацеливающиеся на cMet, можно вводить в отдельности (монотерапия) или в дополнение к другим средствам противораковой терапии и/или нацеленным или ненацеленным противораковым средствам или совместно с ними. При введении ADC, нацеливающегося на cMet, в качестве монотерапии можно применять один или несколько ADC, нацеливающихся на cMet. В определенных вариантах осуществления ADC, нацеливающийся на cMet, вводят в сочетании с антителом к cMet, которое распознает эпитоп на cMet, отличный от эпитопа, который распознается ADC. Это можно осуществлять, например, для стимулирования интернализации рецептора cMet. Альтернативно, ABT-700 можно давать перед ABBV-399 (или другим ADC, нацеливающимся на cMet) с тем, чтобы "блокировать" эндогенный cMet на нормальных тканях для снижения возможной токсичности, ассоциированной с активностью ABBV-399, на нормальных тканях.
[0346] В другом варианте осуществления ADC, нацеливающийся на cMet, распознает два разных неперекрывающихся эпитопа в cMet. Такие ADC, также известные как ADC, несущие бивалентное бипаратопное антитело, могут обладать несколькими преимуществами по сравнению с моновалентными антителами. Например, они могут индуцировать кластеризацию рецепторов cMet, что, в свою очередь, может стимулировать устойчивую интернализацию, направленную миграцию лизосом и разрушение, тем самым улучшая высвобождение части с лекарственным средством из ADC в цитоплазму, а также ее доступность для эффекта, оказываемого на близлежащие случайные клетки.
[0347] Независимо от того, вводят ли ADC, нацеливающийся на cMet, в виде монотерапии или в дополнение к другим видам терапии или средствам или совместно с ними, его количество вводят таким образом, чтобы общий режим лечения обеспечивал терапевтический эффект. Под терапевтическим эффектом понимают, что применение ADC, нацеливающихся на cMet, для лечения рака у пациента приводит к любому ярко выраженному клиническому эффекту по сравнению с отсутствием терапии (если это необходимо) или с известным стандартом лечения. Клинический эффект можно оценить с помощью любого способа, известного специалисту в данной области техники. В одном варианте осуществления клинический эффект оценивают на основании частоты объективных ответов (ORR) (определяют с помощью RECIST версии 1.1), продолжительности ответа (DOR), выживаемости без прогрессирования (PFS) и/или общей выживаемости (ОS). В некоторых вариантах осуществления на терапевтический эффект указывает полный ответ. В некоторых вариантах осуществления на терапевтический эффект указывает частичный ответ. В некоторых вариантах осуществления на терапевтический эффект указывает стабилизация заболевания. В некоторых вариантах осуществления на терапевтический эффект указывает увеличение общей выживаемости. В некоторых вариантах осуществления терапевтический эффект может представлять собой улучшение в отношении времени до прогрессирования заболевания и/или улучшение в отношении симптомов или качества жизни. В других вариантах осуществления терапевтический эффект не может быть преобразован в увеличенный период контроля заболевания, а скорее в значительно уменьшенное проявление симптомов, что приводит к улучшению качества жизни. Специалистам в данной области техники будет очевидно, что терапевтический эффект может наблюдаться при применении ADC, нацеливающихся на cMet, в отдельности (монотерапия) или в дополнение к другим средствам противораковой терапии и/или нацеленным или ненацеленным противораковым средствам или совместно с ними. Предпочтительные способы оценки терапевтического эффекта подробно описаны в примерах, которые применяются в клиническом испытании фазы 1 с ABBV-399.
[0348] Обычно терапевтический эффект оценивают с помощью стандартных клинических тестов, предназначенных для измерения ответа на новое лечение рака. Для оценки терапевтических эффектов от описанных в данном документе ADC, нацеливающихся на cMet, можно применять один или комбинацию из следующих тестов: (1) критерии оценки ответа солидных опухолей (RECIST) версии 1.1 (подробности см. в примере 16), (2) общее состояние по системе Восточной объединенной онкологической группы (ECOG), (3) критерии иммунного ответа (irRC) (4) заболевание, оцениваемое с помощью оценки опухолевых антигенов, (5) валидированные шкалы сообщаемых пациентами результатов и/или (6) оценки Каплана-Мейера для общей выживаемости и выживаемости без прогрессирования.
[0349] Шкалу ECOG для общего состояния, показанную в таблице 3, применяют для описания уровня функционирования пациента с точки зрения способности заботиться о себе, выполнять повседневную активность и физических возможностей. Шкала была разработана Восточной объединенной онкологической группой (ECOG), которая в настоящее время является частью Онкологической исследовательской группы ECOG-ACRIN, и опубликована в 1982 году.
| ТАБЛИЦА 3 | |
| Степень | Общее состояние по ECOG |
| 0 | Полностью активный, способный без ограничений выполнять все задания, как и до заболевания. |
| 1 | Ограниченный в физически напряженной деятельности, но способный ходить, и способный выполнять работу легкого или сидячего характера, например, работу легкую домашнюю работу, работу в офисе. |
| 2 | Способный ходить и способный к полноценному самообслуживанию, но не способный выполнять какую-либо работу; подвижный более чем приблизительно 50% часов бодрствования. |
| 3 | Способный только к ограниченному самообслуживанию; прикованный к постели или креслу более 50% часов бодрствования. |
| 4 | Полностью недееспособный; не способный к самообслуживанию; полностью прикован к постели или креслу. |
| 5 | Смерть. |
[0350] Оценка изменения опухолевой нагрузки является важной особенностью клинического оценивания терапии рака. Уменьшение размеров опухоли (объективный ответ), а также время до развития прогрессирования заболевания являются важными конечными точками в клинических испытаниях относительно рака. Стандартизированные критерии ответа, известные как RECIST (Критерии оценки ответа солидных опухолей), были опубликованы в 2000. Обновленная версия (RECIST 1.1) была выпущена в 2009 году. Критерии RECIST обычно применяют в клинических испытаниях, где объективный ответ является конечной точкой первичного исследования, а также в тех испытаниях, в которых проводят оценку стабилизации заболевания, прогрессирования опухоли или анализах времени до прогрессирования, поскольку такие критерии эффективности основаны на оценке анатомической опухолевой нагрузки и ее изменении в ходе клинического испытания. В таблице 4 приведены определения критериев ответа, применяемых для определения объективного ответа опухоли на исследуемое лекарственное средство, такое как описанные в данном документе ADC, нацеливающиеся на cMet.
| ТАБЛИЦА 4 | |
| Ответ | Критерии |
| Полный ответ (CR) | Исчезновение всех целевых очагов. Любые патологические лимфатические узлы (либо целевые, либо нецелевые) должны демонстрировать снижение по короткой оси до <10 мм. |
| Частичный ответ (PR) | По меньшей мере на 30% суммы диаметров целевых очагов, при этом эталоном считается исходная сумма диаметров. |
| Прогрессирование заболевания (PD) | По меньшей мере 20%-ное увеличение суммы диаметров целевых очагов, при этом эталоном считается наименьшая сумма в исследовании (она включает в себя исходную сумму, если является наименьшей в исследовании). Кроме относительного увеличения на 20% сумма также должна демонстрировать увеличение по меньшей мере 5 мм. (Примечание: появление одного или нескольких новых очагов также считают прогрессированием). |
| Стабилизация заболевания (SD) | Ни достаточного уменьшения размеров опухоли, чтобы соответствовать требованиям для присвоения PR, ни достаточного увеличения, чтобы соответствовать требованиям для присвоения PD, при этом эталоном считается наименьшая сумма диаметров в исследовании. |
[0351] Вторичные критерии эффективности, которые можно применять для определения терапевтического эффекта от описанных в данном документе ADC, нацеливающихся на cMet, включают частоту объективных ответов (ORR), выживаемость без прогрессирования (PFS), продолжительность общего ответа (DOR) и глубину ответа (DpR). ORR определяют как долю участников, у которых был достигнут полный ответ (CR) или частичный ответ (PR). PFS определяют как время от момента введения первой дозы ADC, нацеливающихся на cMet, до прогрессирования заболевания либо смерти, в зависимости от того, что наступит раньше. DOR определяют как время от первоначального CR или PR участника до момента прогрессирования заболевания. DpR определяют как процент уменьшения размеров опухоли, наблюдаемый в момент максимального ответа, по сравнению с опухолевой нагрузкой на исходном уровне. Клинические конечные точки как для ORR, так и для PFS можно определить на основании критериев RECIST 1.1, описанных выше.
[0352] Еще один набор критериев, который можно применять, чтобы полностью охарактеризовать и определить ответ на иммунотерапевтические средства, такие как средства противораковой терапии на основе антител, представляет собой критерии иммунного ответа (irRC), которые были разработаны для измерения солидных опухолей в 2009 году и обновлены в 2013 году (Wolchok, et al. Clin. Cancer Res. 2009; 15(23): 7412-7420 и Nishino, et al. Clin. Cancer Res. 2013; 19(14): 3936-3943, каждый из которых включен в данный документ посредством ссылки во всей своей полноте). Обновленные критерии irRC обычно применяют для оценки влияния иммунотерапевтического средства (например, антитела к PD1), и они определяют ответ согласно таблице 5.
| ТАБЛИЦА 5 | |
| Ответ | Критерии |
| Полный ответ (CR) | Исчезновение всех целевых очагов за два последовательных осмотра с интервалом не менее чем 4 недели. |
| Частичный ответ (PR) | По меньшей мере на 30% суммы наибольших диаметров целевых очагов, при этом эталоном считается исходная сумма диаметров. |
| Прогрессирование заболевания (PD) | По меньшей мере 20%-ное увеличение суммы диаметров целевых очагов, при этом эталоном считается наименьшая сумма в исследовании (она включает в себя исходную сумму, если является наименьшей в исследовании). (Примечание: появление одного или нескольких новых очагов не считают прогрессированием. Результаты измерения новых очагов включают в сумму результатов измерений). |
| Стабилизация заболевания (SD) |
Ни достаточного уменьшения размеров опухоли, чтобы соответствовать требованиям для присвоения PR, ни достаточного увеличения, чтобы соответствовать требованиям для присвоения PD, при этом эталоном считается наименьшая сумма диаметров в исследовании. |
[0353] Опухолевые антигены, которые можно применять для оценки терапевтического эффекта от описанных в данном документе ADC, нацеливающихся на cMet, включают ApoE, CD11c, CD40, CD45 (PTPRC), CD49D (ITGA4), CD80, CSF1R, CTSD, GZMB, Ly86, MS4A7, PIK3AP1, PIK3CD, CD74, CCL5, CCR5, CXCL10, IFNG, IL10RA1, IL-6, ACTA2, COL7A1, LOX, LRRC15, MCPT8, MMP10, NOG, SERPINE1, STAT1, TGFBR1, CTSS, PGF, VEGFA, C1QA, C1QB, ANGPTL4, EGLN, ANGPTL4, EGLN3, BNIP3, AIF1, CCL5, CXCL10, CXCL11, IFI6, PLOD2, KISS1R, STC2, DDIT4, PFKFB3, PGK1, PDK1, AKR1C1, AKR1C2, CADM1, CDH11, COL6A3, CTGF, HMOX1, KRT33A, LUM, WNT5A, IGFBP3, MMP14, CDCP1, PDGFRA, TCF4, TGF, TGFB1, TGFB2, CD11b, ADGRE1 (EMR1, F4/80), CD86, CD68, MHC-класс II, CD3, HLA-DR, CD4, CD3, CD5, CD19, CD7, CD8, CD16, TCRαβ, TCRγδ, PD-1, PDL-1, CTLA-4, кислую фосфатазу, ACTH, щелочную фосфатазу, альфа-фетопротеин CA-125, CA15-3, CA19-9, CA-195, C-212, CA-549, кальцитонин, катехоламины, катепсин-D, СЕА, ERBB2 (HER2/neu), хромагранин-A, c-Myc, EGFR, ERA (анализ рецепторов эстрогенов), ферритин, гастрин, 5-HIAA, hCG, альфа-HCG, бета-HCG, HVA, LDH1-5, NSE (нейрон-специфическая енолаза), панкреатический полипептид, PLAP, PLP, PRA (рецептор прогестерона A), проинсулиновый C-пептид, PSA, SMA, SCC, тиреоглобулин, TDT, TPA и альфа-TSH. Данные антигены можно оценивать на уровне ДНК, РНК или белка с помощью методик секвенирования ДНК, методик секвенирования РНК, микроматрицы на генном чипе, ПЦР-способов, способов проточной цитометрии или иммуногистохимии, которые известны специалистам в данной области техники.
[0354] Одним иллюстративным терапевтическим эффектом, получаемым в результате применения описанных в данном документе ADC, нацеливающихся на cMet, для лечения экспрессирующих cMet и сверхэкспрессирующих cMet опухолей, независимо от того, вводят ли их в виде монотерапии или в дополнение к другим видам терапии или средствам или совместно с ними, является полный ответ. Другим иллюстративным терапевтическим эффектом, получаемым в результате применения описанных в данном документе ADC, нацеливающихся на cMet, к сверхэкспрессирующим cMet опухолям, независимо от того, вводят ли их в виде монотерапии или в дополнение к другим видам терапии или средствам или совместно с ними, является частичный ответ.
[0355] Для обозначения ответа, предоставляемого каждым пациентом через определенную систему отчетности, также можно применять валидированные шкалы сообщаемых пациентами исходов. Не фокусируясь на заболевании, такие шкалы исходов связаны с сохранением функциональности при ведении пациента с хроническим состоянием. Одним неограничивающим примером валидированной шкалы сообщаемых пациентами исходов является PROMIS® (Информационная система для измерения сообщаемых пациентами результатов), созданная Национальными институтами здравоохранения Соединенных Штатов Америки. Например, инструмент для определения физической функциональности PROMIS® для взрослых пациентов с раком может оценивать самостоятельно сообщаемые характеристики функционирования верхних конечностей (например, ловкость), нижних конечностей (например, ходьбу или подвижность) и центральных областей (например, подвижность шеи, спины), а также включает стандартные повседневные виды активности, такие как выполнение обычных дел.
[0356] Кривые Каплана-Мейера (Kaplan and Meier, J. Am. Stat. Assoc. 1958; 53(282): 457-481) также можно применять для оценки общей выживаемости и выживаемости без прогрессирования для пациентов с раком, проходящих терапию антителом или ADC, нацеливающимися на cMet, по сравнению со стандартом лечения.
5.9.1. Виды дополнительной терапии
[0357] ADC, нацеливающиеся на cMet, можно применять в дополнение к другим средствам или средствам лечения, обладающим противораковыми свойствами, или совместно с ними. При применении в качестве дополнения нацеливающееся на cMet и другое(другие) средство(средства) можно составлять вместе в один фармацевтический состав или можно составлять и вводить отдельно, либо по единому согласованному режиму дозирования, либо по разным режимам дозирования. Средства, вводимые дополнительно с ADC, нацеливающимися на cMet, обычно будут обладать дополняющими ADC, нацеливающиеся на cMet, активностями с тем, чтобы ADC и другие средства не оказывали неблагоприятного воздействия друг на друга.
[0358] Средства, которые можно применять в дополнение к ADC, нацеливающимися на cMet, включают без ограничения алкилирующие средства, ингибиторы ангиогенеза, антитела, антиметаболиты, антимитотические средства, антипролиферативные средства, противовирусные средства, ингибиторы киназы aurora, ингибиторы ALK киназ (например, кризотиниб (XALKORI®), церитиниб (ZYKADIA®) и алектиниб (ALECENSA®), стимуляторы апоптоза (например, ингибиторы семейства Bcl-2), активаторы пути рецептора смерти, ингибиторы Bcr-Abl-киназы, антитела BiTE (биспецифические активаторы Т-клеток), конъюгаты антитела и лекарственного средства, модификаторы биологических ответов, ингибиторы циклин-зависимых киназ, ингибиторы клеточного цикла, ингибиторы циклооксигеназы-2, DVD, ингибиторы рецепторов гомолога вирусного онкогена лейкоза (ErbB2), ингибиторы фактора роста, ингибиторы белка теплового шока (HSP)-90, ингибиторы гистондеацетилазы (HDAC), средства гормональной терапии, иммунологические препараты, ингибиторы ингибиторов белков апоптоза (IAP), интеркалирующие антибиотики, ингибиторы киназ, ингибиторы кинезина, ингибиторы Jak2, ингибиторы мишени рапамицина у млекопитающих, микроРНК, ингибиторы митоген-активируемых регулируемых внеклеточными сигналами киназ, мультивалентные связывающие белки, нестероидные противовоспалительные лекарственные средства (NSAID), ингибиторы polyADP (аденозиндифосфат)-рибозо-полимеразы (PARP), химиотерапевтические средства на основе платины, ингибиторы Polo-подобной киназы (Plk), ингибиторы фосфоинозитид-3-киназы (PI3K), ингибиторы протеосом, аналоги пурина, аналоги пиримидина, ингибиторы рецепторной тирозинкиназы, ретиноиды/дельтоиды, растительные алкалоиды, малые ингибирующие рибонуклеиновые кислоты (siRNA), ингибиторы топоизомераз, ингибиторы убиквитинлигазы и т. п., а также комбинации одного или нескольких данных средств.
[0359] Антитела BiTE представляют собой биспецифические антитела, которые заставляют T-клетки атаковать раковые клетки посредством одновременного связывания с этими двумя клетками. Затем T-клетка атакует целевую раковую клетку. Примеры антител BiTE включают адекатумумаб (Micromet MT201), блинатумомаб (BLINCYTO®, Amgen and Onyx Pharmaceuticals) и т. п. Не ограничиваясь теорией, одним из механизмов, с помощью которых Т-клетки запускают апоптоз у целевой раковой клетки, является экзоцитоз компонентов цитолитической гранулы, которые включают перфорин и гранзим B.
[0360] SiRNA представляют собой молекулы, которые содержат эндогенные РНК-основания или химически модифицированные нуклеотиды. Модификации не приводят к прекращению функционирования клетки, а скорее придают ей повышенную устойчивость и/или повышенную клеточную активность. Примеры химических модификаций включают фосфоротиоатные группы, 2'-дезоксинуклеотид, рибонуклеотиды, содержащие 2'-OCH3, 2'-F-рибонуклеотиды, 2'-метоксиэтил-рибонуклеотиды, их комбинации и т. п. siRNA могут иметь различные значения длины (например, 10-200 пар оснований) и различные структуры (например, шпильки, одиночные/двойные нити, петли, однонитевые разрывы/двухнитевые разрывы, ошибочное спаривание) и подвергаются процессингу в клетках с обеспечением сайленсинга активных генов. Двухнитевая siRNA (dsRNA) может иметь равное количество нуклеотидов на каждой нити (тупые концы), или асимметричные (липкие) концы. Выступ из 1-2 нуклеотидов может присутствовать на смысловой и/или антисмысловой нити, а также присутствовать на 5'- и/или 3'-концах данной нити.
[0361] Мультивалентные связывающие белки представляют собой связывающие белки, содержащие два или более антигенсвязывающих участков. Мультивалентные связывающие белки конструируют так, чтобы они содержали три или более антигенсвязывающих участков, и они, как правило, представляют собой антитела, не встречающиеся в природе. Термин "мультиспецифический связывающий белок" означает связывающий белок, способный связывать две или более родственные или неродственные мишени. Связывающие белки с двойным вариабельным доменом (DVD) представляют собой тетравалентные или мультивалентные связывающие белки, содержащие два или более антигенсвязывающих участков. Такие DVD могут быть моноспецифическими (то есть способными связывать один антиген) или мультиспецифическими (то есть способными связывать два или более антигенов). DVD-связывающие белки, содержащие два DVD-полипептида тяжелой цепи и два DVD-полипептида легкой цепи, обозначаются как DVD-Ig. Каждая половина DVD-Ig содержит DVD-полипептид тяжелой цепи, DVD-полипептид легкой цепи и два антигенсвязывающих участка. Каждый связывающий участок содержит вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, содержащие в общей сложности 6 CDR, вовлеченных в связывание антигена, на антигенсвязывающий участок.
[0362] Алкилирующие средства включают без ограничения алтретамин, AMD-473, AP-5280, апазиквон, бендамустин, бросталлицин, бусульфан, карбоквон, кармустин (BCNU), хлорамбуцил, CLORETAZINE® (ларомустин, VNP 40101M), циклофосфамид, дакарбазин, эстрамустин, фотемустин, глюфосфамид, ифосфамид, KW-2170, ломустин (CCNU), мафосфамид, мелфалан, митобронитол, митолактол, нимустин, N-оксид азотистого иприта, ранимустин, темозоломид, тиотепу, TREANDA® (бендамустин), треосульфан и трофосфамид.
[0363] Ингибиторы ангиогенеза включают без ограничения ингибиторы эндотелий-специфической рецепторной тирозинкиназы (Tie-2), ингибиторы рецепторов эпидермального фактора роста (EGFR), ингибиторы рецепторов инсулиноподобного фактора роста 2 (IGFR-2), ингибиторы матриксной металлопротеиназы-2 (MMP-2), ингибиторы матриксной металлопротеиназы-9 (MMP-9), ингибиторы рецепторов тромбоцитарного фактора роста (PDGFR), аналоги тромбоспондина и ингибиторы рецепторной тирозинкиназы фактора роста эндотелия сосудов (VEGFR).
[0364] Антиметаболиты включают без ограничения ALIMTA® (пеметрексед динатрия, LY231514, MTA), 5-азацитидин, XELODA® (капецитабин), кармофур, LEUSTAT® (кладрибин), клофарабин, цитарабин, цитарабина окфосфат, цитозин арабинозид, децитабин, дефероксамин, доксифлуридин, эфлорнитин, EICAR (5-этинил-1-β-D-рибофуранозилимидазол-4-карбоксамид), эноцитабин, этнилцитидин, флударабин, 5-фтороурацил в отдельности или в комбинации с лейковорином, GEMZAR® (гемцитабин), гидроксимочевину, ALKERAN® (мелфалан), меркаптопурин, 6-меркаптопурина рибозид, метотрексат, микофеноловую кислоту, неларабин, нолатрексед, окфосфат, пелитрексол, пентостатин, ралтитрексед, рибавирин, триапин, триметрексат, S-1, тиазофурин, тегафур, TS-1, видарабин и UFT.
[0365] Противовирусные препараты включают без ограничения ритонавир, ацикловир, цидофовир, ганцикловир, фоскарнет, зидовудин, рибавирин и гидроксихлорохин.
[0366] Ингибиторы киназы Aurora включают без ограничения ABT-348, AZD-1152, MLN-8054, VX-680, специфические ингибиторы киназы Aurora A, специфические ингибиторы киназы Aurora В и пан-ингибиторы киназ Aurora.
[0367] Ингибиторы белков семейства Bcl-2 включают без ограничения AT-101 ((-)госсипол), GENASENSE® (G3139 или облимерсен (Bcl-2-нацеливающийся антисмысловой олигонуклеотид)), IPI-194, IPI-565, N-(4-(4-((4'-хлор(1,1'-бифенил)-2-ил)метил)пиперазин-1-ил)бензоил)-4-(((1R)-3-(диметиламино)-1-((фенилсульфанил)метил)пропил)амино)-3-нитробензолсульфонамид), N-(4-(4-((2-(4-хлорфенил)-5,5-диметил-1-циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)бензоил)-4-(((1R)-3-(морфолин-4-ил)-1-((фенилсульфанил)метил)пропил)амино)-3-((трифторметил)сульфонил)бензолсульфонамид, венетоклакс и GX-070 (обатоклакс).
[0368] Ингибиторы киназ Bcr-Abl включают без ограничения DASATINIB® (BMS-354825) и GLEEVEC® (иматиниб).
[0369] Ингибиторы CDK включают без ограничения AZD-5438, BMI-1040, BMS-032, BMS-387, CVT-2584, флавоперидол, GPC-286199, MCS-5A, PD0332991, PHA-690509, селициклиб (CYC-202, R-росковитин) и ZK-304709.
[0370] Ингибиторы COX-2 включают без ограничения ABT-963, ARCOXIA® (эторикоксиб), BEXTRA® (валдекоксиб), BMS347070, CELEBREX® (целекоксиб), COX-189 (люмиракоксиб), CT-3, DERAMAXX® (деракоксиб), JTE-522, 4-метил-2-(3,4-диметилфенил)-1-(4-сульфамоилфенил-1H-пиррол), MK-663 (эторикоксиб), NS-398, парекоксиб, RS-57067, SC-58125, SD-8381, SVT-2016, S-2474, T-614 и VIOXX® (рофекоксиб).
[0371] Ингибиторы EGFR включают без ограничения афатиниб (GILOTRIF®), ABX-EGF, иммунолипосомы, нацеливающиеся на EGFR, EGF-вакцину, EMD-7200, ERBITUX® (цетуксимаб), HR3, IgA-антитела, IRESSA® (гефинитиб), TARCEVA® (эрлотиниб или OSI-774), TP-38, слитый белок с EGFR, PORTRAZZA® (нецитунунаб), TAGRISSO® (осимертиниб), TYKERB® (лапатиниб), TARCEVA® (эрлотиниб) и TAGRISSO® (осимертиниб).
[0372] Ингибиторы рецептора ErbB2 включают без ограничения CP-724-714, CI-1033 (канертиниб), HERCEPTIN® (трастузумаб), TYKERB® (лапатиниб), OMNITARG® (2C4, пертузумаб), TAK-165, GW-572016 (ионафарниб), GW-282974, EKB-569, PI-166, dHER2 (HER2-вакцина), APC-8024 (HER-2-вакцина), биспецифическое антитело к HER/2neu, B7.her2IgG3, трифункциональные биспецифические антитела AS HER2, mAB AR-209 и mAB 2B-1.
[0373] Ингибиторы гистонадеацетилазы включают без ограничения депсипептид, LAQ-824, MS-275, трапоксин, субероиланилид гидроксамовой кислоты (SAHA), TSA и вальпроевую кислоту.
[0374] Ингибиторы HSP-90 включают без ограничения 17-AAG-nab, 17-AAG, CNF-101, CNF-1010, CNF-2024, 17-DMAG, гелданамицин, IPI-504, KOS-953, MYCOGRAB® (рекомбинантное антитело человека к HSP-90), NCS-683664, PU24FCl, PU-3, радицикол, SNX-2112, STA-9090 и VER49009.
[0375] Ингибиторы белков апоптоза включают без ограничения HGS1029, GDC-0145, GDC-0152, LCL-161 и LBW-242.
[0376] Активаторы пути рецептора смерти включают без ограничения TRAIL, антитела или другие средства, которые нацеливаются на TRAIL или рецепторы смерти (например, DR4 и DR5), такие как апомаб, конатумумаб, ETR2-ST01, GDC0145 (лексатумумаб), HGS-1029, LBY-135, PRO-1762 и трастузумаб.
[0377] Ингибиторы кинезина включают без ограничения ингибиторы Eg5, такие как AZD4877, ARRY-520; и ингибиторы CENPE, такие как GSK923295A.
[0378] Ингибиторы JAK-2 включают без ограничения CEP-701 (лезауртиниб), XL019 и INCB018424.
[0379] Ингибиторы MEK включают без ограничения ARRY-142886, ARRY-438162, PD-325901, PD-98059 и траметиниб.
[0380] Ингибиторы mTOR включают без ограничения AP-23573, CCI-779, эверолимус, RAD-001, рапамицин, темсиролимус, АТФ-конкурентные ингибиторы TORC1/TORC2, включая PI-103, PP242, PP30 и Торин 1.
[0381] Нестероидные противовоспалительные лекарственные средства включают без ограничения AMIGESIC® (салсалат), DOLOBID® (дифлунисал), MOTRIN® (ибупрофен), ORUDIS® (кетопрофен), RELAFEN® (набуметон), FELDENE® (пироксикам), ибупрофен крем, ALEVE® (напроксен) и NAPROSYN® (напроксен), VOLTAREN® (диклофенак), INDOCIN® (индометацин), CLINORIL® (сулиндак), TOLECTIN® (толметин), LODINE® (этодолак), TORADOL® (кеторолак) и DAYPRO® (оксапрозин).
[0382] Ингибиторы PDGFR включают без ограничения C-451, CP-673 и CP-868596.
[0383] Средства химиотерапии на основе платины включают без ограничения цисплатин, ELOXATIN® (оксалиплатин), эптаплатин, лобаплатин, недаплатин, PARAPLATIN® (карбоплатин), сатраплатин и пикоплатин.
[0384] Ингибиторы Polo-подобных киназ включают без ограничения BI-2536.
[0385] Ингибиторы BRAF представляют собой вемурафениб, дабрафениб, кобиметиниб.
[0386] Ингибиторы фосфоинозитид-3-киназы (PI3K) включают без ограничения вортманнин, LY294002, XL-147, CAL-120, ONC-21, AEZS-127, ETP-45658, PX-866, GDC-0941, BGT226, BEZ235, и XL765.
[0387] Аналоги тромбоспондина включают без ограничения ABT-510, ABT-567, ABT-898 и TSP-1.
[0388] Ингибиторы VEGFR включают без ограничения AVASTIN® (бевацизумаб), ABT-869, AEE-788, ANGIOZYME™ (рибозим, который ингибирует ангиогенез (Ribozyme Pharmaceuticals (Боулдер, Колорадо) и Chiron (Эмеривилл, Калифорния)), акситиниб (AG-13736), AZD-2171, CP-547,632, IM-862, MACUGEN® (пегаптамиб), NEXAVAR® (сорафениб, BAY43-9006), пазопаниб (GW-786034), ваталаниб (PTK-787, ZK-222584), SUTENT® (сунитиниб, SU-11248), акцептор VEGF и ZACTIMA™ (вандетаниб, ZD-6474), кабозантиниб (VEGFR2 и ингибитор cMet), рамуцирумаб (ингибиторное mAb к VEGFR2).
[0389] Антибиотики включают без ограничения интеркалирующие антибиотики акларубицин, актиномицин D, амрубицин, аннамицин, адриамицин, BLENOXANE® (блеомицин), даунорубицин, CAELYX® или MYOCET® (липосомальный доксорубицин), элсамитруцин, эпирубицин, гларубицин, ZAVEDOS® (идарубицин), митомицин C, неморубицин, неокарциностатин, пепломицин, пирарубицин, ребеккамицин, стималамер, стрептозоцин, VALSTAR® (валрубицин) и зиностатин.
[0390] Ингибиторы топоизомеразы включают без ограничения акларубицин, 9-аминокамптотецин, амонафид, амсакрин, бекатекарин, белотекан, BN-80915, CAMPTOSAR® (иринотекана гидрохлорид), камптотецин, CARDIOXANE® (дексразоксин), дифломотекан, эдотекарин, ELLENCE® или PHARMORUBICIN® (эпирубицин), этопозид, эксатекан, 10-гидроксикамптотецин, гиматекан, луртотекан, митоксантрон, OnivydeTM (липосомальный иринотекан), оратецин, пирарбуцин, пиксантрон, рубитекан, собузоксан, SN-38, тафлупозид и топотекан.
[0391] Антитела включают без ограничения AVASTIN® (бевацизумаб), CD40-специфические антитела, chTNT-1/B, деносумаб, ERBITUX® (цетуксимаб), HUMAX-CD4® (занолимумаб), IGF1R-специфические антитела, линтузумаб, PANOREX® (эдреколомаб), RENCAREX® (WX G250), RITUXAN® (ритуксимаб), тицилимумаб, трастузумаб, пертузумаб, VECTIBIX® (панитумумаб) и антитела к CD20 типов I и II.
[0392] Средства гормональной терапии включают без ограничения ARIMIDEX® (анастрозол), AROMASIN® (экземестан), арзоксифен, CASODEX® (бикалутамид), CETROTIDE® (цетрореликс), дегареликс, дезлорелин, DESOPAN® (трилостан), дексаметазон, DROGENIL® (флутамид), EVISTA® (ралоксифен), AFEMA™ (фадрозол), FARESTON® (торемифен), FASLODEX® (фулвестрант), FEMARA® (летрозол), форматестан, глюкокортикоиды, HECTOROL® (доксеркальциферол), RENAGEL® (севеламера карбонат), лазофоксифен, лейпролида ацетат, MEGACE® (мегестерол), MIFEPREX® (мифепристон), NILANDRON™ (нилутамид), NOLVADEX® (тамоксифена цитрат), PLENAXIS™ (абареликс), преднизон, PROPECIA® (финастерид), рилостан, SUPREFACT® (бусерелин), TRELSTAR® (рилизинг-фактор лютеинизирующего гормона (LHRH)), VANTAS® (гистрелиновый имплантат), VETORYL® (трилостан или модрастан), XTANDI® (энзалутамид), ZOLADEX® (фосрелин, гозерелин) и ZYTIGA® (абиратенон).
[0393] Дельтоиды и ретиноиды включают без ограничения сеокальцитол (EB1089, CB1093), лексакальцитрол (KH1060), фенретинид, PANRETIN® (алиретиноин), ATRAGEN® (липосомальный третиноин), TARGRETIN® (бексаротен) и LGD-1550.
[0394] Ингибиторы PARP включают без ограничения ABT-888 (велипариб), олапариб, KU-59436, AZD-2281, AG-014699, BSI-201, BGP-15, INO-1001, и ONO-2231.
[0395] Растительные алкалоиды включают без ограничения винкристин, винбластин, виндезин и винорелбин.
[0396] Ингибиторы протеосом включают без ограничения VELCADE® (бортезомиб), KYPROLIS® (карфилзомиб), MG132, NPI-0052 и PR-171.
[0397] Примеры иммунологических средств включают без ограничения интерфероны, ингибиторы иммунных контрольных точек, костимулирующие средства и другие иммуноукрепляющие средства. Интерфероны включают интерферон альфа, интерферон альфа-2a, интерферон альфа-2b, интерферон бета, интерферон гамма-1a, ACTIMMUNE® (интерферон гамма-1b) или интерферон гамма-n1, их комбинации и т. п. Ингибиторы иммунных контрольных точек включают антитела, которые нацеливаются на PD-1 (например, пембролизумаб, ниволумаб и пидилизумаб), PD-L1 (например, дурвалумаб, атезолизумаб, авелумаб, MEDI4736, MSB0010718C и MPDL3280A) и CTLA-4 (антиген 4 цитотоксических лимфоцитов, например, ипилимумаб, тремелимумаб). Костимулирующие средства включают без ограничения антитела к CD3, CD40, CD40L, CD27, CD28, CSF1R, CD137 (например, урелумаб), B7H1, GITR, ICOS, CD80, CD86, OX40, OX40L, CD70, HLA-DR, LIGHT, LIGHT-R, TIM3, A2AR, NKG2A, TIGIT (T-клеточный иммунорецептор с доменами Ig и ITIM), VISTA (V-доменный Ig-супрессор T-клеточной активации), B7-H3, B7-H4, CD47, CD73, CD39, KIR (например, лирилумаб), TGF-β (например, фрезолимумаб) и их комбинации.
[0398] Другие средства включают без ограничения ALFAFERONE® (IFN-α), BAM-002 (окисленный глутатион), BEROMUN® (тасонермин), BEXXAR® (тозитумомаб), CAMPATH® (алемтузумаб), дакарбазин, денилейкин, эпратузумаб, GRANOCYTE® (ленограстим), лентинан, лейкоцитарный альфа-интерферон, имиквимод, вакцину против меланомы, митумомаб, молграмоcтим, MYLOTARG™ (гемтузумаб озогамицин), NEUPOGEN® (филграстим), OncoVAC-CL, OVAREX® (ореговомаб), пемтумомаб (Y-muHMFG1), PROVENGE® (сипулейцел-Т), саргарамостим, сизофиран, тецелейкин, THERACYS® (бацилла Кальметта - Герена), убенимекс, VIRULIZIN® (иммунотерапевтическое средство, Lorus Pharmaceuticals), Z-100 (специфичное вещество Маруяма (SSM)), WF-10 (тетрахлордекаоксид (TCDO)), PROLEUKIN® (альдеслейкин), ZADAXIN® (тималфазин), ZINBRYTA® (даклизумаб, полученный высокопродуктивным способом) и ZEVALIN® (90Y-ибритумомаб тиуксетан).
[0399] Модификаторы биологического ответа представляют собой средства, которые модифицируют защитные механизмы живых организмов или биологические ответы, такие как выживание, рост или дифференцировка клеток ткани, направляя их таким образом, чтобы они проявляли противоопухолевую активность, и включают без ограничения крестин, лентинан, сизофиран, пицибанил, PF-3512676 (CpG-8954) и убенимекс.
[0400] Аналоги пиримидина включают без ограничения цитарабин (ara C или арабинозид C), цитозин-арабинозид, доксифлуридин, FLUDARA® (флударабин), 5-FU (5-фторурацил), флоксуридин, GEMZAR® (гемцитабин), TOMUDEX® (ратитрексед) и TROXATYL™ (триацетилуридин троксацитабин).
[0401] Аналоги пурина включают без ограничения LANVIS® (тиoгуанин) и PURI-NETHOL® (меркаптопурин).
[0402] Антимитотические средства включают без ограничения батабулин, эпотилон D (KOS-862), N-(2-((4-гидроксифенил)амино)пиридин-3-ил)-4-метоксибензолсульфонамид, иксабепилон (BMS-247550), TAXOL® (паклитаксел), TAXOTERE® (доцетаксел), PNU100940 (109881), патупилон, XRP-9881 (ларотаксел), винфлунин и ZK-EPO (синтетический эпотилон).
[0403] Ингибиторы убиквитин-лигаз включают без ограничения ингибиторы MDM2, такие как нутлины, и ингибиторы NEDD8, такие как MLN4924.
[0404] Ингибиторы тирозинкиназ включают иматиниб (GLEEVEC®), дазатиниб (SPRYCE®), нилотиниб (TASIGNA®), босутиниб (BOSULIF®), понатиниб (ICLUSIG®), афатиниб (GIOTRIF®), акситиниб (INLYTA®), кризотиниб (XALKORI®), эрлотиниб (TARCEVA®), гефинитиб (IRESSA®), лапатиниб (TYVERB®), нилотиниб (TASIGNA®), пазопаниб (VOTRIENT®), регорафениб (STIVARGA®), сорафениб (NEXAVAR®), сунитиниб (SUTENT®), тоцераниб (PALLADIA®), ваталаниб и радотиниб (SUPECT®).
[0405] ADC, нацеливающиеся на cMet, также можно применять для повышения эффективности лучевой терапии. Примеры лучевой терапии включают наружную дистанционную лучевую терапию, внутреннюю лучевую терапию (т. е. брахитерапию) и системную лучевую терапию.
[0406] ADC, нацеливающиеся на cMet, можно вводить в дополнение к другим химиотерапевтическим средствам или совместно с ними, такими как ABRAXANE™ (ABI-007), ABT-100 (ингибитор фарнезилтрансферазы), ADVEXIN® (вакцина Ad5CMV-p53), ALTOCOR® или MEVACOR® (ловастатин), AMPLIGEN® (поли-I:поли-C12U, синтетическая РНК), APTOSYN® (эксисулинд), AREDIA® (памидроновая кислота), арглабин, L-аспарагиназа, атаместан (1-метил-3,17-дион-андроста-1,4-диен), AVAGE® (тазаротен), AVE-8062 (производное комбреастатина) BEC2 (митумомаб), кахектин или кахексин (фактор некроза опухоли), канваксин (вакцина), CEAVAC® (противораковая вакцина), CELEUK® (целмолейкин), CEPLENE® (гистамина дигидрохлорид), CERVARIX® (вакцина против вируса папилломы человека), CHOP® (С: CYTOXAN® (циклофосфамид); H: ADRIAMYCIN® (гидроксидоксорубицин); O: винкристин (ONCOVIN®); P: преднизон), CYPAT™ (ципротерона ацетат), комбрестатин A4P, DAB(389)EGF (каталитический и транслокационный домены дифтерийного токсина, слитые посредством линкера His-Ala с эпидермальным фактором роста человека) или TransMID-107R™ (дифтерийные токсины), дакарбазин, дактиномицин, 5,6-диметилксантенон-4-уксусная кислота (DMXAA), энилурацил, EVIZON™ (скваламина лактат), DIMERICINE® (липосомный лосьон T4N5), дискодермолид, DX-8951f (экзатекана мезилат), энзастаурин, EPO906 (эпотилон B), GARDASIL® (квадривалентная рекомбинантная вакцина против вируса папилломы человека (типов 6, 11, 16, 18)), GASTRIMMUNE®, GENASENSE®, GMK (ганглиозид-конъюгированная вакцина), GVAX® (вакцина против рака предстательной железы), галофугинон, гистерелин, гидроксикарбамид, ибандроновая кислота, IGN-101, IL-13-PE38, IL-13-PE38QQR (цинтредекина бесудотокс), IL-13-экзотоксин pseudomonas, интерферон-α, интерферон-γ, JUNOVAN™ или MEPACT™ (мифамуртид), лонафарниб, 5,10-метилентетрагидрофолат, милтефосин (гексадецилфосфохолин), NEOVASTAT® (AE-941), NEUTREXIN® (триметрексата глюкуронат), NIPENT® (пентостатин), ONCONASE® (фермент рибонуклеаза), ONCOPHAGE® (вакцина для лечения меланомы), ONCOVAX® (IL-2 вакцина), ORATHECIN™ (рубитекан), OSIDEM® (клеточный препарат на основе антител), OVAREX® MAb (мышиное моноклональное антитело), паклитаксел, PANDIMEX™ (агликоновые сапонины из женьшеня, включающие 20(S)-протопанаксадиол (aPPD) и 20(S)-протопанаксатриол (aPPT)), панитумумаб, PANVAC®-VF (экспериментальная противораковая вакцина), пэгаспаргаза, PEG интерферон A, феноксодиол, прокарбазин, ребимастат, REMOVAB® (катумаксомаб), REVLIMID® (леналидомид), RSR13 (эфапроксирал), SOMATULINE® LA (ланреотид), SORIATANE® (ацитретин), стауроспорин (Streptomyces staurospores), талабостат (PT100), TARGRETIN® (бексаротен), TAXOPREXIN® (DHA-паклитаксел), TELCYTA® (канфосфамид, TLK286), темилифен, TEMODAR® (темозоломид), тесмилифен, талидомид, THERATOPE® (STn-KLH), тимитак (2-амино-3,4-дигидро-6-метил-4-оксо-5-(4-пиридилтио)хиназолина дигидрохлорид), TNFERADE™ (аденовектор: ДНК-носитель, содержащий ген фактора некроза опухоли α), TRACLEER® или ZAVESCA® (бозентан), третиноин (Retin-A), тетрандрин, TRISENOX® (триоксид мышьяка), VIRULIZIN®, украин (производное алкалоидов из чистотела большого), витаксин (антитело к αvβ3), XCYTRIN ® (мотексафина гадолиний), XINLAY™ (атразентан), XYOTAX™ (паклитаксел полиглюмекс), YONDELIS® (трабектедин), ZD-6126, ZINECARD® (дексразоксан), ZOMETA ® (золедроновая кислота) и зорубицин, а также комбинации любых из этих средств.
[0407] Дополнительные виды терапии и/или терапевтические средства обычно будут применяться в дозе, с помощью пути введения и при частоте введения, одобренных для них, но их можно применять и в более низких дозах и/или с меньшей частотой. При введении в виде монотерапии ADC, нацеливающийся на cMet, обычно будут вводить по схеме, которая обеспечивает получение терапевтического эффекта. Предполагается, что ADC, нацеливающиеся на cMet, вводимые один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель, один раз в шесть недель, один раз в семь недель или один раз в восемь недель, будут обеспечивать терапевтический эффект, хотя эффективным может быть и более или менее частое введение. При введении в дополнение к другим терапии и/или средству ADC, нацеливающийся на cMet, можно вводить до лечения, после лечения или одновременно с лечением с помощью других терапии или средства.
5.10. Дозировки и режимы введения
[0408] Количество вводимого ADC, нацеливающегося на cMet, будет зависеть от ряда факторов, включая без ограничения конкретный тип cMet+/сверхэкспрессирующих опухолей, в отношении которых осуществляется лечение, стадию cMet+/сверхэкспрессирующих опухолей, в отношении которых осуществляется лечение, способ введения, частоту введения, требуемый терапевтический эффект, лекарственный компонент в ADC (например, MMAE или PBD) и другие параметры, такие как возраст, вес и другие характеристики пациента и т. д. Определение дозировок, эффективных для обеспечения терапевтического эффекта для конкретных способов и частоты введения, находится в пределах возможностей специалистов в данной области техники.
[0409] Дозировки, эффективные для обеспечения терапевтического эффекта, можно первоначально оценить на животных моделях in vivo или в клинических условиях. Подходящие животные модели для широкого спектра заболеваний известны из уровня техники.
[0410] ADC, нацеливающиеся на cMet, можно вводить любым путем, который подходит для состояния, в отношении которого осуществляется лечение. ADC, нацеливающийся на cMet, обычно будут вводить парентерально, т. е. с помощью инфузии, подкожной, внутримышечной, внутривенной (IV), внутрикожной, интратекальной, болюсной инъекции, инъекции в опухоль или эпидуральной инъекции ((Shire et al., 2004, J. Pharm. Sciences 93(6):1390-1402)). В одном варианте осуществления ADC, нацеливающийся на cMet, представлен в виде лиофилизированного порошка во флаконе. Флаконы могут содержать, например, 0,5 мг, 1 мг, 5 мг, 10 мг, 50 мг, 100 мг или 200 мг ADC, нацеливающегося на cMet. В одном варианте осуществления перед введением лиофилизированный порошок ресуспендируют стерильной водой для инъекций (SWFI) или другой подходящей средой с получением раствора, содержащего 20 мг/мл ADC, нацеливающегося на cMet. Полученный ресуспендированный раствор дополнительно разводят солевым раствором или другой подходящей средой и вводят посредством IV инфузии один раз в 7 дней, один раз в 14 дней, один раз в 21 день или один раз в 28 дней. В некоторых вариантах осуществления для первого цикла инфузию выполняют в течении 180 минут, последующие инфузии выполняют в течение 90 минут. В других вариантах осуществления инфузию выполняют в течение 60 минут. В некоторых вариантах осуществления все инфузии для каждого цикла выполняют в течение 30 минут.
[0411] В одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, вводят один раз в 14 дней в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,8 мг/кг, 1,9 мг/кг, 2,1 мг/кг, 2,2 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, или 6,0 мг/кг веса тела субъекта. В одном варианте осуществления ADC, нацеливающийся на cMet, вводят один раз в 14 дней в количестве 1,6 мг/кг. В одном варианте осуществления ADC, нацеливающийся на cMet, вводят один раз в 14 дней в количестве 1,9 мг/кг. В одном варианте осуществления ADC, нацеливающийся на cMet, вводят один раз в 14 дней в количестве 2,2 мг/кг. В одном варианте осуществления ADC, нацеливающийся на cMet, вводят один раз в 14 дней в количестве 2,5 мг/кг. В одном варианте осуществления введение продолжают до момента прогрессирования заболевания или неприемлемой токсичности.
[0412] В одном варианте осуществления рак представляет собой NSCLC-аденокарциному, ADC, нацеливающийся на cMet, представляет собой ABBV-399, вводимый в количестве 1,6 или 1,9 мг/кг один раз в 14 дней, и у пациента H-показатель составляет 225 и выше или IHC-показатель составляет 3+. В другом варианте осуществления рак представляет собой плоскоклеточную карциному, представляющую собой NSCLC, ADC, нацеливающийся на cMet, представляет собой ABBV-399, вводимый в количестве 1,6 или 1,9 мг/кг один раз в 14 дней, и у пациента H-показатель составляет от 150 до 224 или IHC-показатель составляет 2+.
[0413] В другом иллюстративном варианте осуществления ADC, нацеливающийся на cMet, вводят один раз в 7 дней в количестве 0,15 мг/кг, 0,3 мг/кг, 0,45 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, или 3,0 мг/кг. В одном варианте осуществления введение продолжают до момента прогрессирования заболевания или неприемлемой токсичности.
[0414] В другом иллюстративном варианте осуществления ADC, нацеливающийся на cMet, вводят один раз в 28 дней в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг. В одном варианте осуществления введение продолжают до момента прогрессирования заболевания или неприемлемой токсичности.
[0415] В другом иллюстративном варианте осуществления ADC, нацеливающийся на cMet, вводят один раз в 28 дней в количестве 2,7 мг/кг. В одном варианте осуществления введение продолжают до момента прогрессирования заболевания или неприемлемой токсичности.
[0416] В другом иллюстративном варианте осуществления ADC, нацеливающийся на cMet, вводят один раз в 21 дней в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг. В одном варианте осуществления введение продолжают до момента прогрессирования заболевания или неприемлемой токсичности.
[0417] В другом иллюстративном варианте осуществления ADC, нацеливающийся на cMet (например, ABBV-399), вводят один раз в 21 день в количестве 2,7 мг/кг. В одном варианте осуществления введение продолжают до момента прогрессирования заболевания или неприемлемой токсичности. В одном варианте осуществления рак представляет собой NSCLC-аденокарциному, ADC, нацеливающийся на cMet, представляет собой ABBV-399, вводимый в количестве 2,7 мг/кг один раз в 21 день, и у пациента H-показатель составляет 225 и выше или IHC-показатель составляет 3+. В другом варианте осуществления рак представляет собой плоскоклеточную карциному, представляющую собой NSCLC, ADC, нацеливающийся на cMet, представляет собой ABBV-399, вводимый в количестве 2,7 мг/кг один раз в 21 день, и у пациента H-показатель составляет по меньшей мере 150 или больше и IHC-показатель составляет по меньшей мере 2+.
[0418] В другом иллюстративном варианте осуществления ADC на основе антитела к cMet и PBD (например, ABT-700 и PBD) вводят один раз в 14 дней, один раз в 21 день или один раз в 28 дней в дозе, составляющей от 1.0 мкг/кг до 1,0 мг/кг, 1,0 мкг/кг до 500,0 мкг/кг, или 5,0 мкг/кг до 200,0 мкг/кг веса тела субъекта. Что касается любого другого ADC, дозировка зависит, например, от частоты введения, состояния пациента и ответа на предшествующее лечение, если таковое имело место. Концентрация ADC в жидком составе может составлять, например, 0,01-10 мг/мл, как например 1,0 мг/мл.
[0419] В одном варианте осуществления ADC на основе антитела к cMet и PBD (например, ABT-700 и PBD) вводят один раз в 14 дней, один раз в 21 день или один раз в 28 дней в количестве 10 мкг/кг, 50 мкг/кг, 75 мкг/кг, 100 мкг/кг, 110 мкг/кг, 120 мкг/кг, 130 мкг/кг, 140 мкг/кг, 150 мкг/кг, 160 мкг/кг, 170 мкг/кг, 180 мкг/кг, 190 мкг/кг, 200 мкг/кг, 250 мкг/кг, 300 мкг/кг, 350 мкг/кг, 400 мкг/кг, 450 мкг/кг, или 500 мкг/кг. В одном варианте осуществления ADC на основе антитела к cMet и PBD (например, ABT-700 и PBD) вводят в количестве 100 мкг/кг. В одном варианте осуществления ADC на основе антитела к cMet и PBD (например, ABT-700 и PBD) вводят в количестве 200 мкг/кг. В одном варианте осуществления ADC на основе антитела к cMet и PBD (например, ABT-700 и PBD) вводят в количестве 300 мкг/кг. В одном варианте осуществления ADC на основе антитела к cMet и PBD (например, ABT-700 и PBD) вводят в количестве 400 мкг/кг.
[0420] При введении дополнительно или совместно с другими средствами, такими как другие химиотерапевтические средства, ADC можно вводить по одной и той же схеме, что и другое(другие) средство(средства), или по другой схеме. При введении по одной схеме ADC можно вводить до, после или одновременно с другим средством. В некоторых вариантах осуществления, где ADC вводят дополнительно или совместно со стандартными видами лечения, ADC можно начинать вводить до начала приема стандартной терапии, например, за день, несколько дней, неделю, несколько недель, месяц или даже за несколько месяцев до начала приема средств стандартной терапии.
[0421] В одной серии иллюстративных вариантов осуществления дополнительное противораковое средство выбрано из группы, состоящей из кабазитаксела, колцемида, колхицина, криптофицина, демоколцина, доцетаксела, нокодазола, паклитаксела, таккалонолида, таксана и винбластина.
[0422] В одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к афатинибу (GILOTRIF®) для лечения NSCLC. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. GILOTRIF® вводят в количестве 40 мг перорально один раз в сутки до момента прогрессирования заболевания или пока пациент переносит его. В одном варианте осуществления пациентов отбирают для лечения первой линии метастатического NSCLC с помощью GILOTRIF® на основании наличия в образцах опухоли делеций в экзоне 19 EGFR или мутаций по типу замены в экзоне 21 (L858R).
[0423] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к TARCEVA® (эрлотинибу) для лечения немелкоклеточного рака легкого (NSCLC). ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Рекомендуемая доза и схема для эрлотиниба представляет собой 150 мг перорально один раз в сутки. Дополнительную терапию ADC, нацеливающимся на cMet/эрлотинибом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0424] В одном варианте осуществления рак представляет собой NSCLC, ADC, нацеливающийся на cMet, представляет собой ABBV-399, вводимый в количестве 2,7 мг/кг один раз в 21 день, и эрлотиниб вводят в количестве 150 мг перорально один раз в сутки. Дополнительную терапию ADC, нацеливающимся на cMet/эрлотинибом продолжают до момента прогрессирования заболевания или пока пациент переносит ее. В одном варианте осуществления рак представляет собой NSCLC-аденокарциному с мутацией в EGFR, ADC, нацеливающийся на cMet, представляет собой ABBV-399, вводимый в количестве 2,7 мг/кг один раз в 21 день, эрлотиниб вводят в количестве 150 мг перорально один раз в сутки, и у пациента H-показатель составляет 225 и выше или IHC-показатель составляет 3+.
[0425] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к IRESSA® (гефинитибу) для лечения немелкоклеточного рака легкого (NSCLC). ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Рекомендуемая доза и схема для гефинитиба представляет собой 250 мг перорально один раз в сутки. Дополнительную терапию ADC, нацеливающимся на cMet/гефитинибом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0426] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к афатинибу для лечения немелкоклеточного рака легкого (NSCLC). ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Рекомендуемая доза и схема для афатиниба представляет собой 40 мг перорально один раз в сутки. Дополнительную терапию ADC, нацеливающимся на cMet/афатинибом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0427] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к OPDIVO® (ниволумабу) для лечения немелкоклеточного рака легкого (NSCLC). ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Ниволумаб вводят посредством внутривенной инфузии в количестве 3 мг/кг в течение 60 минут каждые две недели. Дополнительное лечение ADC, нацеливающимся на cMet/ниволумабом продолжают до момента прогрессирования заболевания или пока пациент переносит его.
[0428] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к OPDIVO® (ниволумабу) и YERVOY® (ипилимумабу) для лечения немелкоклеточного рака легкого (NSCLC). ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг для четырех доз с ипилимумабом, затем один раз в 14 дней в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, без ипилимумаба. Ниволумаб вводят в виде внутривенной инфузии в количестве 3 мг/кг в течение 60 минут каждые две недели. Ипилимумаб вводят внутривенно в количестве 3 мг/кг в течение 90 минут каждые три недели для первых четырех доз. Дополнительное лечение ADC, нацеливающимся на cMet/ниволумабом продолжают до момента прогрессирования заболевания или пока пациент переносит его.
[0429] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, можно применять в дополнение к пембролизумабу (KEYTRUDA®) для лечения NSCLC. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Пембролизумаб вводят в виде внутривенной инфузии в количестве 2 мг/кг в течение 30 минут каждые 3 недели. Дополнительную терапию ADC, нацеливающимся на cMet, и пембролизумабом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0430] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к цисплатину для лечения NSCLC. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Цисплатин вводят в количестве 20 мг/м2 или больше один раз в 3-4 недели. Дополнительную терапию ADC, нацеливающимся на cMet/цисплатином продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0431] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к карбоплатину для лечения NSCLC. ADC, нацеливающийся на cMet, вводят посредством IV инфузии один раз в 14 дней в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг. Карбоплатин вводят в количестве 300 мг/м2 или больше один раз в 4 недели. Дополнительную терапию ADC, нацеливающимся на cMet/карбоплатином продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0432] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к велипарибу для лечения NSCLC. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Велипариб вводят перорально два раза в сутки. Дополнительную терапию ADC, нацеливающимся на cMet/велипарибом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0433] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к велипарибу и пеметрекседу для лечения NSCLC. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Велипариб вводят перорально два раза в сутки. Пеметрексед вводят в количестве 500 мг/м2 внутривенно каждый 21 день. Дополнительную терапию ADC, нацеливающимся на cMet/пеметрекседом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0434] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к цетуксимабу для лечения NSCLC. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Цетуксимаб вводят в начальной дозе, составляющей 400 мг/м2, в течение 120-минутной внутривенной инфузии с последующей еженедельной инфузией в течение 60 минут в дозе 250 мг/м2. Дополнительную терапию ADC, нацеливающимся на cMet/цетуксимабом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0435] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к ипилимумабу (YERVOY®) для лечения NSCLC. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Ипилимумаб вводят в количестве 3 мг/кг внутривенно в течение 90 минут каждые 3 недели в течение 3 месяцев. Терапию ADC, нацеливающимся на cMet, продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0436] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к облучению для лечения NSCLC. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Обычно наружную дистанционную лучевую терапию применяют в течение нескольких минут не более 5 дней в неделю в течение 5-7 недель, но это будет зависеть от типа применяемой наружной дистанционной лучевой терапии. Дополнительную терапию ADC, нацеливающимся на cMet/облучением продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0437] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к AVASTIN® (бевацизумабу) для лечения NSCLC. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Рекомендованная доза и схема для бевацизумаба представляет собой 10 мг/кг один раз в 14 дней или 15 мг/кг один раз в 21 день. Дополнительную терапию ADC, нацеливающимся на cMet/бевацизумабом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0438] В одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к гемцитабину (GEMZAR®) для NSCLC. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Гемцитабин вводят посредством внутривенной инфузии в дозе 1000 мг/м2 в течение 30 минут в дни 1, 8 и 15 по схеме один раз в 4 недели. Введение цисплатина внутривенно в количестве 100 мг/м2 в день 1 осуществляют после инфузии гемцитабина. В другом варианте осуществления гемцитабин вводят посредством внутривенной инфузии в дозе 1250 мг/м2 в течение 30 минут в дни 1 и 8 по схеме один раз в 3 недели. Введение цисплатина внутривенно в количестве 100 мг/м2 в день 1 осуществляют после инфузии гемцитабина. Если наблюдается миелосуппрессия, можно осуществлять модификации доз, как указано в инструкцие-вкладыше для гемцитабина. Дополнительную терапию ADC, нацеливающимся на cMet/гемцитабином продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0439] В одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к гемцитабину (GEMZAR®) для лечения рака поджелудочной железы, яичника, молочной железы или NSCLC. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. При лечении рака поджелудочной железы гемцитабин вводят посредством внутривенной инфузии в дозе 1000 мг/м2 в течение 30 минут один раз в неделю в течение не более 7 недель, после чего следует неделя отдыха от лечения. После недели 8: еженедельное введение дозы в дни 1, 8 и 15 в течение 28-дневных циклов. При лечении рака яичника гемцитабин вводят посредством внутривенной инфузии в дозе 1000 мг/м2 в течение 30 минут в дни 1 и 8 каждого 21-дневного цикла в комбинации с карбоплатином AUC 4 внутривенно после введения GEMZAR в день 1 каждого 21-дневного цикла. Для получения дополнительной информации обратитесь к инструкции-вкладышу для карбоплатина. При лечении рака молочной железы гемцитабин вводят посредством внутривенной инфузии в дозе 1250 мг/м2 внутривенно в течение 30 минут в дни 1 и 8 каждого 21-дневного цикла, который включает паклитаксел. Паклитаксел следует вводить в количестве 175 мг/м2 в день 1 в виде 3-часовой внутривенной инфузии перед введением GEMZAR. Если наблюдается миелосуппрессия, можно осуществлять модификации доз, как указано в инструкции-вкладыше для гемцитабина. Последующие циклы должны состоять из инфузий один раз в неделю в течение 3 последовательных недель из каждых 4 недель. Дополнительную терапию ADC, нацеливающимся на cMet/гемцитабином продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0440] В другом иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к составу стабилизированных альбумином наночастиц паклитаксела (ABRAXANE®) для лечения рака молочной железы или легкого. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Рекомендуемая доза и схема для состава стабилизированных альбумином наночастиц паклитаксела представляет собой 125 мг/м2, вводимая в виде внутривенной инфузии в течение 30-40 минут в дни 1, 8 и 15 каждого 28-дневного цикла. Дополнительную терапию ADC, нацеливающимся на cMet/ABRAXANE® продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0441] В другом иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к составу стабилизированных альбумином наночастиц паклитаксела (ABRAXANE®) и гемцитабину (GEMZAR®) для лечения рака поджелудочной железы. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Рекомендуемая доза и схема для состава стабилизированных альбумином наночастиц паклитаксела представляет собой 125 мг/м2, вводимая в виде внутривенной инфузии в течение 30-40 минут в дни 1, 8 и 15 каждого 28-дневного цикла. Гемцитабин вводят посредством внутривенной инфузии в дозе 1000 мг/м2 в течение 30 минут один раз в неделю в течение не более 7 недель (или до появления токсичности, уменьшая или сохраняя дозу), после чего следует неделя отдыха от лечения. Последующие циклы должны состоять из инфузий один раз в неделю в течение 3 последовательных недель из каждых 4 недель. Дополнительную терапию ADC, нацеливающимся на cMet/ABRAXANE®/GEMZAR® продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0442] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к AVASTIN® (бевацизумабу) для лечения колоректального рака или рака легкого или яичника. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Рекомендованная доза и схема для бевацизумаба представляет собой 10 мг/кг один раз в 14 дней или 15 мг/кг один раз в 21 день. Дополнительную терапию ADC, нацеливающимся на cMet/бевацизумабом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0443] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к FOLFIRINOX (или FOLFIRI, или FOLFOX, или иринотекану, или 5-FU, или капецитабину) для лечения колоректального рака. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. FOLFIRINOX представляет собой комбинацию из четырех химиотерапевтических средств: фторурацила [5-FU], лейковорина, иринотекана и оксалиплатина. В некоторых вариантах осуществления FOLFIRINOX вводят следующим образом: оксалиплатин, 85 мг/м2; иринотекан, 180 мг/м2; лейковорин, 400 мг/м2 и фторурацил, 400 мг/м2, которые дают в виде болюса с последующими 2400 мг/м2, которые дают в виде 46-часовой непрерывной инфузии, каждые 2 недели. Дополнительную терапию ADC, нацеливающимся на cMet/FOLFIRINOX продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0444] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к Onivyde® для лечения рака поджелудочной железы. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Onivyde® представляет собой липосомальный состав иринотекана. В некоторых вариантах осуществления Onivyde® вводят в количестве 70 мг/м2 посредством внутривенной инфузии в течение 90 минут каждые 2 недели. Дополнительную терапию ADC, нацеливающимся на cMet/Onivyde® продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0445] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к Onivyde®, фторурацилу и лейковорину для лечения рака поджелудочной железы. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Onivyde® представляет собой липосомальный состав иринотекана. В некоторых вариантах осуществления Onivyde® вводят в количестве 70 мг/м2 посредством внутривенной инфузии в течение 90 минут каждые 2 недели с лейковорином в количестве 400 мг/м2 и фторурацилом в количестве 2400 мг/м2 в течение 46 часов каждые 2 недели. Дополнительную терапию ADC, нацеливающимся на cMet/Onivyde®/лейковорином/фторурацилом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0446] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к ниволумабу (OPDIVO®) для лечения рака легкого и других форм рака, при которых используют ниволумаб. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Ниволумаб вводят посредством внутривенной инфузии в количестве 3 мг/кг в течение 60 минут каждые две недели. Дополнительную терапию ADC, нацеливающимся на cMet/ниволумабом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0447] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, можно применять в дополнение к пембролизумабу (KEYTRUDA®) для лечения колоректального рака. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Пембролизумаб вводят в виде внутривенной инфузии в количестве 2 мг/кг в течение 30 минут каждые три недели. Дополнительную терапию ADC, нацеливающимся на cMet/пембролизумабом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0448] В одном варианте осуществления рак представляет собой рак поджелудочной железы, ADC, нацеливающийся на cMet, представляет собой ABBV-399, вводимый в количестве 2,7 мг/кг один раз в 21 день, и эрлотиниб вводят в количестве 150 мг перорально один раз в сутки. Дополнительную терапию ADC, нацеливающимся на cMet/эрлотинибом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0449] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к доксорубицину для лечения рака молочной железы. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. При применении дополнительно с другими лекарственными средствами наиболее часто применяемая доза доксорубицина составляет от 40 до 60 мг/м2, которую дают в виде однократной внутривенной инъекции один раз в 21-28 дней. Дополнительную терапию ADC, нацеливающимся на cMet/доксорубицином продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0450] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к AVASTIN® (бевацизумабу) для лечения рака молочной железы. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Рекомендованная доза и схема для бевацизумаба представляет собой 10 мг/кг один раз в 14 дней или 15 мг/кг один раз в 21 день. Дополнительную терапию ADC, нацеливающимся на cMet/бевацизумабом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0451] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к доксорубицину для лечения рака молочной железы. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Гемцитабин вводят посредством внутривенной инфузии в дозе 1000 мг/м2 в течение 30 минут один раз в неделю в течение не более 7 недель (или до появления токсичности, уменьшая или сохраняя дозу), после чего следует неделя отдыха от лечения. Последующие циклы должны состоять из инфузий один раз в неделю в течение 3 последовательных недель из каждых 4 недель. Дополнительную терапию ADC, нацеливающимся на cMet/гемцитабином продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0452] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к трастузумабу (HERCEPTIN®) для лечения рака молочной железы. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Рекомендуемая начальная нагрузочная доза трастузумаба составляет 4 мг/кг, которую вводят в виде 90-минутной инфузии. Рекомендованная еженедельная поддерживающая доза трастузумаба составляет 2 мг/кг, которую можно вводить в виде 30-минутной инфузии, если начальная нагрузочная доза хорошо переносилась. Дополнительную терапию ADC, нацеливающимся на cMet/трастузумабом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0453] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к капецитабину (XELODA®) для лечения рака молочной железы. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Капецитабин можно вводить в количестве 1250 мг/м2 два раза в сутки в течение 2 недель, после чего следует недельный период отдыха в 3-недельных циклах. Дополнительную терапию ADC, нацеливающимся на cMet/капецитабином продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0454] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к ниволумабу (OPDIVO®) для лечения рака молочной железы. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Ниволумаб вводят посредством внутривенной инфузии в количестве 3 мг/кг в течение 60 минут каждые две недели. Дополнительную терапию ADC, нацеливающимся на cMet/ниволумабом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0455] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, можно применять в дополнение к пембролизумабу (KEYTRUDA®) для лечения рака молочной железы. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Пембролизумаб вводят в виде внутривенной инфузии в количестве 2 мг/кг в течение 30 минут каждые 3 недели. Дополнительную терапию ADC, нацеливающимся на cMet/пембролизумабом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0456] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к TARCEVA® (эрлотинибу) для лечения рака головы и шеи. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Рекомендуемая доза и схема для эрлотиниба представляет собой 150 мг перорально один раз в сутки. Дополнительную терапию ADC, нацеливающимся на cMet/эрлотинибом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0457] В одном варианте осуществления рак представляет собой рак головы и шеи, ADC, нацеливающийся на cMet, представляет собой ABBV-399, вводимый в количестве 2,7 мг/кг один раз в 21 день, и эрлотиниб вводят в количестве 150 мг перорально один раз в сутки. Дополнительную терапию ADC, нацеливающимся на cMet/эрлотинибом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0458] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к облучению для лечения рака головы и шеи. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Обычно наружную дистанционную лучевую терапию применяют в течение нескольких минут не более 5 дней в неделю в течение 5-7 недель, но это будет зависеть от типа применяемой наружной дистанционной лучевой терапии. Дополнительную терапию ADC, нацеливающимся на cMet/облучением продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0459] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к AVASTIN® (бевацизумабу) для лечения рака головы и шеи. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Рекомендованная доза и схема для бевацизумаба представляет собой 10 мг/кг один раз в 14 дней или 15 мг/кг один раз в 21 день. Дополнительную терапию ADC, нацеливающимся на cMet/бевацизумабом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0460] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к цетуксимабу для лечения рака головы и шеи. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Цетуксимаб вводят в начальной дозе, составляющей 400 мг/м2, в течение 120-минутной внутривенной инфузии с последующей еженедельной инфузией в течение 60 минут в дозе 250 мг/м2. Дополнительную терапию ADC, нацеливающимся на cMet/цетуксимабом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0461] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к карбоплатину для лечения рака головы и шеи. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Карбоплатин вводят в количестве 300 мг/м2 или больше один раз в 4 недели. Дополнительную терапию ADC, нацеливающимся на cMet/карбоплатином продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0462] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к ниволумабу (OPDIVO®) для лечения рака головы и шеи. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Ниволумаб вводят посредством внутривенной инфузии в количестве 3 мг/кг в течение 60 минут каждые две недели. Дополнительную терапию ADC, нацеливающимся на cMet/ниволумабом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0463] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, можно применять в дополнение к пембролизумабу (KEYTRUDA®) для лечения рака головы и шеи. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Пембролизумаб вводят в виде внутривенной инфузии в количестве 2 мг/кг в течение 30 минут каждые 3 недели. Дополнительную терапию ADC, нацеливающимся на cMet/пембролизумабом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0464] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к цисплатину для лечения рака головы и шеи. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Дополнительную терапию ADC, направленным против LRRC15/цисплатином продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0465] В еще одном иллюстративном варианте осуществления ADC, нацеливающийся на cMet, применяют в дополнение к TARCEVA® (эрлотинибу) для лечения рака головы и шеи. ADC, нацеливающийся на cMet (например, ABBV-399), вводят посредством IV инфузии один раз в 14 дней или один раз в 21 день в количестве 0,15 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,9 мг/кг, 1,2 мг/кг, 1,5 мг/кг, 1,8 мг/кг, 2,1 мг/кг, 2,4 мг/кг, 2,7 мг/кг, 3,0 мг/кг, 3,3 мг/кг, 3,6 мг/кг, 3,9 мг/кг, 4,2 мг/кг, 4,5 мг/кг, 4,8 мг/кг, 5,1 мг/кг, 5,4 мг/кг, 5,7 мг/кг или 6,0 мг/кг, предпочтительно один раз в 21 день в количестве 2,7 мг/кг. Рекомендуемая доза и схема для эрлотиниба представляет собой 150 мг перорально один раз в сутки. Дополнительную терапию ADC, нацеливающимся на cMet/эрлотинибом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0466] В одном варианте осуществления рак представляет собой рак головы и шеи, ADC, нацеливающийся на cMet, представляет собой ABBV-399, вводимый в количестве 2,7 мг/кг один раз в 21 день, и эрлотиниб вводят в количестве 150 мг перорально один раз в сутки. Дополнительную терапию ADC, нацеливающимся на cMet/эрлотинибом продолжают до момента прогрессирования заболевания или пока пациент переносит ее.
[0467] Как будет понятно специалистам в данной области техники, для рекомендуемых дозировок различных вышеописанных средств может потребоваться корректировка для оптимизации ответа у пациента и увеличения до максимума терапевтического эффекта.
[0468] В альтернативных вариантах осуществления все числа, выражающие количества ингредиентов, % чистоты и т. д., применяемые в настоящем изобретении, модифицированы термином "приблизительно".
5.11. Выбор пациентов
[00450] К пациентам, выбранным для лечения посредством ADC по настоящему изобретению, относятся пациенты с экспрессирующими cMet опухолями и пациенты со сверхэкспрессирующими cMet опухолями, которые включают без ограничения любую солидную опухоль (включая также те, которые сверхэкспрессируют HGF и/или характеризуются аномальной активацией сигнального пути HGF/cMet или экспрессией). Пациентов можно выбирать для лечения с помощью средств лечения на основе ADC по настоящему изобретению на основании их уровня cMet, который классифицируют по иммуногистохимическому (IHC) H-показателю. Подробная информация о том, как количественно и качественно оценивать уровень сверхэкспрессии cMet, приведена в подробном описании (раздел 5.3.) и в примере 17. Сверхэкспрессию cMet можно определять по IHC H-показателю, превышающему или равняющемуся 150, при измерении согласно анализу из примера 17 "Протокол окрашивания с помощью ABBV-ADC, нацеливающегося на cMet". Вкратце, протокол IHC-окрашивания для определения наличия сверхэкспрессии cMet был разработан с помощью набора Ventana cMet CONFIRM (SP44). Образцы тканей окрашивают антителом Ventana, а затем оценивают путем определения процентного содержания целевых клеток ткани, окрашенных с различными уровнями интенсивности: от низкого до высокого. На фиг. 20 изображены репрезентативные H-показатели, полученные с помощью анализа, описанного в примере 17. Альтернативно, ткань опухоли, характеризующейся сверхэкспрессией cMet, по IHC-показателю от 0 до 3+, описана в примере 21. На фиг. 19 изображены репрезентативные IHC-показатели, полученные с помощью анализа, описанного в примере 21.
[0469] Для целей настоящего изобретения H-показатель, составляющий от 150 до 224 эквивалентен IHC-показателю 2+, а H-показатель 225 и больше, эквивалентен IHC-показателю 3+. В одном примере пациенты с плоскоклеточной карциномой, представляющей собой NSCLC, могут быть выбраны для лечения, если имеющийся у них рак характеризуется Н-показателем, составляющим по меньшей мере от 150 до 224, или IHC-показателем, составляющим 2+. В другом примере пациенты с аденокарциномой, представляющей собой NSCLC, могут быть выбраны для лечения, если имеющийся у них рак характеризуется Н-показателем, составляющим по меньшей мере 225 и выше, или IHC-показателем, составляющим 3+.
[0470] Рак может быть впервые диагностирован и таким, который не подвергался лечению, или может быть рецидивирующим, резистентным или рецидивирующим и резистентным, или метастазом или метастатической формой экспрессирующей cMet (называемой в данном документе cMet+ опухолями) или сверхэкспрессирующей cMet опухоли, т. е. cMet+/сверхэкспрессирующими опухолями. Как продемонстрировано в примерах настоящего изобретения, cMet+/ сверхэкспрессирующие опухоли, которые проявляют резистентность к другим нацеленным или ненацеленным средствам химиотерапии, сохраняют чувствительность к ABBV-399.
[0471] ADC, нацеливающиеся на cMet, имеют множество применений, и в одном варианте осуществления они пригодны в терапевтических целях для лечения опухолей, характеризующихся сверхэкспрессией cMet, у людей, опухолей, при которых наблюдается амплификация гена MET; и опухолей, несущих мутации в экзоне 14 гена MET или около него, среди прочих. В другом варианте осуществления ADC, нацеливающиеся на cMet, пригодны в терапевтических целях для лечения экспрессирующих cMet опухолей у людей, где cMet не сверхэкспрессируется, но все же экспрессируется.
[0472] Опухоли, несущие делеции в экзоне 19 EGFR или мутации в экзоне 21 (L858R) EGFR, также входят в объем настоящего изобретения. Амплификацию гена MET считают одной из наиболее распространенных причин приобретенной резистентности при NSCLC с мутацией по EGFR.
[0473] Ответ на ABBV-399 и другие раскрытые в данном документе ADC, нацеливающиеся на cMet, может коррелировать с экспрессией cMet как на белковом, так и на геномном уровне (например, амплификация, мутации экзона 14). Предпочтительные способы измерения обоих данных биомаркеров подробно описаны в примерах. Тем не менее, специалист в данной области техники будет знать, как применять другие способы для их оценки, и такие способы входят в объем настоящего изобретения.
[0474] Если с помощью различных способов получают различные результаты, то результаты, полученные с помощью способов, описанных в примерах, являются теми, которые необходимо применять при определении того, подпадает ли конкретный вариант осуществления под объем вариантов осуществления. Например, для оценки экспрессии белка cMet специалист будет применять "протокол окрашивания с помощью ABBV-ADC, нацеливающегося на cMet". Если реагенты от Ventana, применяемые в данном протоколе, больше не доступны, можно применять другой одобренный FDA протокол для оценки уровней экспрессии cMet с помощью IHC. Для оценки количества копий гена MET специалист будет применять "способ амплификации cMET MET/CEP7".
[0475] MET подвергается альтернативному сплайсингу. В клеточных линиях и тканях человека было выявлено множество транскриптов МЕТ различного размера. Были описаны по меньшей мере три варианта размером 8 т.о., и предположительно они образуются в результате альтернативного сплайсинга. Была описана изоформа cMet, у которой отсутствуют 18 аминокислот во внеклеточной области (экзон 10), и она является наиболее распространенной формой в ряде тканей и клеточных линий. В результате альтернативного сплайсинга экзона 14 образуется другой вариант, который имеет делецию внутри рамки считывания из 47 аминокислот в околомембранном цитоплазматическом домене рецептора. Возможный механизм альтернативного сплайсинга может заключаться в образованииукороченной на N-конце формы МЕТ размером 85 кДа, которая встречается в злокачественных мышечно-скелетных опухолях, хотя эта короткая форма также может образовываться в результате альтернативного начала транскрипции или протеолитического расщепления.
[0476] Было продемонстрировано, что мутанты MET, включающие делецию экзона 14, стабилизируют рецептор cMet, что приводит в результате к усилению функциональной активности. Экзон 14 MET содержит сайт Cbl убиквитинлигаз на остатке тирозина 1003 (Y1003), при этом в ином случае убиквинтин обычно присоединяется к остатку тирозина и приводит к лизосомальному разрушению белка cMet. Следовательно, миссенс-мутация остатка Y1003 или "пропускание" белковой области, которая кодируется экзоном 14 MET, приводит в результате к относительной сверхэкспрессии белка MET, усиленной активации cMet и последующему онкогенезу. Ингибирование с помощью ингибиторов тирозинкиназы (TKI) MET может привести к клиническому эффекту по меньшей мере у пациентов с NSCLC, несущих такие изменения экзона 14 MET. Пациенты, несущие любую из данных мутаций, могут получить положительный эффект от раскрытых в данном документе средств лечения.
[0477] Соответственно, пациенты также могут быть выбраны для лечения, если у них присутствуют клетки с мутацией в экзоне 14 гена MET, результатом чего является повышенный уровень белка cMet в таких раковых клетках. В примерах также представлены различные способы оценки данного биомаркера.
[0478] Амплификация MET признана одним из потенциальных молекулярных механизмов приобретенной резистентности к EGFR-TKI при NSCLC с мутацией по EGFR. Решение о том, выбирать ли конкретного пациента для лечения с помощью раскрытых в данном документе ADC или нет, также может охватывать определение того, характеризуется ли имеющийся у пациента рак делецией в экзоне 19 рецептора эпидермального фактора роста (EGFR), заменой в экзоне 21 (L858R) или как первым, так и вторым. Пациентов, у которых рак характеризуется одним или обоими данными геномными изменениями по меньшей мере в некоторых из его клеток, предпочтительно выбирают для лечения с помощью ABBV-399 или любого другого раскрытого в данном документе ADC. Способы оценки данных двух биомаркеров приведены в примерах ниже.
6. Примеры
[0479] Изложенные ниже примеры, которые подчеркивают некоторые признаки и свойства иллюстративных вариантов осуществления ADC, нацеливающихся на cMet, и способов применения данных ADS для лечения пациентов, приведены в целях иллюстрации, а не ограничения.
Пример 1. Получение ABT-700
[0480] ABBV-399 (ABT-700-vcMMAE) представляет собой конъюгат антитела и лекарственного средства (ADC), состоящий из антитела ABT-700, конъюгированного с цитотоксическим ингибитором микротрубочек монометилауристатином E (MMAE) посредством расщепляемого валин-цитруллинового (vc) линкера. ABT-700 представляет собой "гуманизированную" рекомбинантную каппа-цепь иммуноглобулина G (IgG1κ), которая нацеливается на уникальный эпитоп cMet, что приводит к блокировке как HGF-зависимой, так и HGF-независимой передачи сигнала cMet.
[0481] ABT-700 представляет собой гуманизированное рекомбинантное моноклональное антитело, направленное против cMet. Антитело состоит из 2 идентичных тяжелых цепей IgG1 из 445 аминокислот, спаренных с 2 идентичными легкими цепями из 218 аминокислот. Тяжелую цепь конструировали с введением дополнительного цистеина в положении 223, а также с делецией лизинового остатка перед Cys-223 и делецией 2 треониновых остатков, фланкирующих His-224. Кроме того, C-концевая аминокислота лизин в тяжелой цепи была исключена при конструировании для устранения гетерогенности на C-конце в связи с неполным расщеплением лизина. Антитело гликозилировано по аспарагину 296 на каждой тяжелой цепи.
[0482] Тяжелая цепь содержит 12 цистеиновых остатков, а легкая цепь содержит 5 цистеиновых остатков. Каждая тяжелая цепь содержит 4 внутрицепочечных дисульфидных мостика, а каждая легкая цепь содержит 2 внутрицепочечных дисульфидных мостика. Кроме того, 2 тяжелые цепи ковалентно связаны 3 межцепочечными дисульфидными мостиками. Каждая легкая цепь принимает участие в образовании 1 дисульфидной связи с тяжелой цепью.
[0483] ABT-700 для описанных ниже исследований in vitro получали с помощью стандартных методик, которые в общем описаны в патенте США № 8741290. Вкратце, адаптированные к суспензионному культивированию клетки EBNA HEK293 (InVitrogen, США) выращивали по стандартной процедуре в колбах объемом 250 мл в 50 мл бессывороточной среды Excell 293 (SAFC Biosciences), дополненной 6 мM глутамина, на орбитальном шейкере (со скоростью вращения 110 об./мин). Проводили временную трансфекцию с 2×106 клеток/мл с применением линейного полиэтиленимина массой 25 кДа (PEI) (Polysciences), полученного в воде с конечной концентрацией 1 мг/мл, и смешивали с плазмидной ДНК (с конечной концентрацией 1,25 мкг/мл для соотношения плазмид тяжелой цепи и плазмид легкой цепи 1:1). Через 4 часа после трансфекции культуру разводили одним объемом свежей культуральной среды до достижения конечной плотности клеток 106 клеток/мл. Процесс культивирования отслеживали по жизнеспособности клеток и выработке Mab. Как правило, культуры поддерживали в течение 4-5 дней. ABT-700 очищали с помощью традиционного хроматографического подхода на смоле с белком A (GE Healthcare, США).
[0484] ABT-700 для описанных ниже клинических исследований получали по сути так, как описано далее. Сначала конструировали плазмиду pConPlusγ1fΔK/κ-hz224G11[TH7] для экспрессии моноклонального антитела ABT-700 на высоком уровне в клетках CHO с помощью технологии GS-CHO с использованием глутаминсинтетазы. Последовательности тяжелых и легких цепей клонировали соответственно в векторы pConPlusγ1fΔK-hz224G11/TH7VH0 и pConPlusκ2-hz224G11/VL4(4-39-84) с получением векторов с одним геном (SGV). Затем SGV, содержащие гены тяжелой цепи и легкой цепи, объединяли вместе с геном глутаминсинтетазы (GS) для отбора с получением конечного вектора с двумя генами (DGV): pConPlusγ1fΔK/κ-
[0485] hz224G11[TH7]. Основные компоненты pConPlusγ1fΔK/κ-hz224G11[TH7] включают следующие гены или регуляторные элементы в следующем порядке: промотор hCMV-MIE, 5' UTR с интроном, последовательность, кодирующая легкую цепь ABT-700 [224G11 (HzVL)], последовательность полиаденилирования SV40, промотор hCMV-MIE, 5' UTR с интроном, последовательность, кодирующая тяжелую цепь ABT-700 [224G11 (HzVH)], последовательность полиаденилирования SV40, точка начала репликации плазмиды, cDNA беталактамазы и глутаминсинтетазы с ее регуляторными последовательностями.
[0486] Система экспрессии, применяемая для получения лекарственного вещества ABT-700, представляла собой запатентованную систему экспрессии в клетках яичника китайского хомячка (CHO) гена глутаминсинтетазы (GS) от Lonza Biologics. Линия клеток-хозяев была получена из рабочего банка клеток-хозяев CHO-K1SV под обозначением 269-W3 (полученная из мастер-банка клеток-хозяев 269-M).
[0487] Вектор с двумя генами pConPlusγ1fΔK/κ-hz224G11[TH7] трансфицировали в клетки CHO-K1SV с помощью электропорации, а затем распределяли в 96-луночные планшеты. Клетки, экспрессирующие GS, и, следовательно, содержащие вектор экспрессии, отбирали путем выращивания в среде, не содержащей белок и не содержащей глутамин. Планшеты инкубировали до начала появления очагов трансфицированных клеток. Далее забирали только линии клеток, которые были из лунок, содержавших одиночные колонии (что определяли с помощью визуальной оценки). Супернатанты культур из лунок, содержавших одиночные колонии, подвергали скринингу в отношении выработки антител с помощью ELISA по собранному антителу. Было создано несколько линий клональных клеток, и для выработки ABT-700 была отобрана линия, демонстрирующая наиболее соответствующую производительность. Клетки тестировали для подтверждения качества мРНК и точность воспроизведения кодирующих транскриптов.
[0488] Содержимое одной замороженной пробирки клеток размножали либо путем культивирования на шейкере, либо в мешках для культивирования клеток. Размноженные культуры инокулировали в больший объем культуральной среды, и далее культуры размножались в биореакторе (содержащем среду для выращивания, дополненную метионинсульфоксимидом) в инкубаторе с 5% CO2, 36°С. Культуры собирали и фильтровали для удаления клеток и дебриса. ABT-700 очищали с помощью колонки с белком А с последующей анионообменной мембранной хроматографией, катионообменной колоночной хроматографией, вирусной фильтрацией, ультрафильтрацией и конечной фильтрацией в потоке. Все растворы готовили в соответствии с cGMP.
Пример 2. Получение гетерогенных по DAR ADC ABT700-vcMMAE
[0489] ABBV-399 представляет собой ADC, состоящий из ABT-700 (антитело IgG1 к cMet), конъюгированного с MMAE посредством vc-линкера.
[0490] ABBV399 получают в результате конъюгации vcMMAE с межцепочечными дисульфидными связями в ABT-700 после мягкого восстановления до сульфгидрильных групп. После дополнительной стадии способа для удаления молекул с DAR более высокого порядка средний DAR для ABBV-399 составлял примерно 3.
[0491] Для получения композиций ABBV-399, гетерогенных по DAR, использовали два различных способа: способ I (фиг. 2А и 2В) и способ II (фиг. 3А и 3В).
[0492] Композицию ABBV399, гетерогенную по DAR, получали с помощью двухстадийного химического способа: восстановление дисульфидной группы ABT-700 с последующим алкилированием (конъюгацией) с малеимидокапроил валин-цитруллин ("val-cit") парааминобензилового спирта ("PABA") монометилауристатином E (называемым в данном документе "vcMMAE"), который проиллюстрирован ниже:
[0493] На первой стадии ограниченное количество межцепочечных дисульфидных связей ABT700 восстанавливали с помощью трис(2-карбоксиэтил)фосфина ("TCEP") (≥0,8 экв.). Частично восстановленный ABT700 затем конъюгировали с vcMMAE (≥1,8 экв.) в DMSO. Реакцию с оставшимся непрореагировавшим vcMMAE останавливали с помощью N-ацетил-L-цистеина.
[0494] На фиг. 2A и 3A показаны результаты хроматографического разделения полученных неочищенных препаратов ADC, полученных в результате осуществления способа I (фиг. 2A) или способа II (фиг. 3A). Как можно увидеть, полученный препарат ADC представлял собой гетерогенную смесь, содержащую антитела без присоединенных молекул MMAE (пик "E0"), с двумя присоединенными молекулами MMAE (пик "E2"), с четырьмя присоединенными молекулами MMAE (пик "E4"), с шестью присоединенными молекулами MMAE (пик "Е6"), с восемью присоединенными молекулами MMAE (пик "Е8") и с десятью присоединенными молекулами MMAE (пик "E10"). В случае способа I, средний DAR препарата в виде неочищенного продукта составлял примерно 4,3. В случае способа II, средний DAR препарата в виде неочищенного продукта составлял примерно 3,2.
Пример 3. Получение ADC ABT700-vcMMAE, обогащенных в DAR 3.1, и ABBV-399, обогащенных в соотношении E2/E4 1:1
Получение ABBV-399, обогащенного в DAR 3.1, с помощью способа I
[0495] Для получения среднего DAR, составляющего 3,1, как показано на фиг. 2B, применяли способ периодической хроматографии. Раствор неочищенного продукта ABBV-399 (фиг. 2A) разбавляли буфером на основе фосфата калия и обрабатывали смолой для HIC для уменьшения DAR до примерно 3. Смолу для HIC удаляли фильтрованием, промывали фосфатно-солевым буферным раствором и смыв необязательно объединяли с раствором продукта ABBV-399 с DAR 3.1.
[0496] На фиг.2В показана аналитическая хроматограмма HIC конечного продукта, полученного в результате осуществления способа I, после обработки смолой для HIC (как можно увидеть, полученный препарат ADC представлял собой гетерогенную смесь, содержащую антитела без присоединенных молекул MMAE (пик "E0"), с двумя присоединенными молекулами MMAE (пик "E2"), с четырьмя присоединенными молекулами MMAE (пик "E4") и с шестью присоединенными молекулами MMAE (пик "E6"), и имел среднее DAR, составляющее 3,1.
Получение ABBV-399, обогащенного в соотношении E2/E4 1:1
[0497] Для получения соотношения E2/E4 1:1, как показано на фиг. YB, применяли способ колоночной хроматографии. Раствор неочищенного продукта ABBV-399 (фиг. 3A) разбавляли раствором на основе сульфата аммония/фосфата аммония до целевой концентрации связывания. Этот материал загружали на колонку, и он связывался со смолой для HIC. Применяли элюирование со ступенчатым градиентом с применением буфера на основе сульфата аммония/фосфата натрия буфера для обогащения конъюгатов антитела и лекарственного средства и выделяли молекулы ADC с двумя или четырьмя присоединенными молекулами vcMMAE. Они элюировались из колонки в одном пике.
[0498] На фиг. 3В показана аналитическая хроматограмма HIC конечного продукта, полученного в результате осуществления способа II, после обогащения с применением хроматографической колонки для HIC. Как можно увидеть, полученный препарат ADC представлял собой гетерогенную смесь, содержащую антитела без присоединенных молекул MMAE (пик "E0"), с двумя присоединенными молекулами MMAE (пик "E2") и четырьмя присоединенными молекулами MMAE (пик "E4"), и имел среднее DAR, составляющее 3,0.
[0499] Как будет показано ниже в примере 16, ABBV-399 продемонстрировал противораковые эффекты в фазе I клинических испытаний при дозе 2,7 мг/кг Q3W. Также в данном документе предложено повышение дозы до 3 мг/кг для выявления максимальной переносимой дозы для фазы II исследований с учетом того, что брентуксимаба ведотин и DCDT2980S (ADC с MMAE, нацеливающийся на CD22) переносились соответственно в дозе 1,8 и 2,4 мг/кг, но не 2,7 или 3,2 мг/кг. Исходя из соображений соотношения лекарственного средства и антитела (DAR; нагрузка MMAE на молекулу антитела), ABBV-399 с DAR 3,1 может потенциально лучше переноситься, чем брентуксимаба ведотин, который имеет DAR примерно 4.
Пример 4. Получения КОНЪЮГАТА АНТИТЕЛА И ЛЕКАРСТВЕННОГО СРЕДСТВА ABT700-PBD
[0500] ABT-700 (S238C)-PBD состоит из двух молекул линкер-лекарственное средство PBD, конъюгированных со сконструированным с включением cys mAb ABT-700. Синтон PBD vaPBD конъюгировали с ABT-700 (S238C, если использовать систему нумерации по Kabat, S239C, если использовать систему нумерации EU). Способ конъюгации заключается в количественном восстановлении сконструированных и межцепочечных дисульфидных связей. Это происходит в результате восстановления межцепочечных дисульфидных связей, количественного окисления и конъюгации с избытком линкера с лекарственным средством PBD. Затем смесь после восстановления очищают для удаления избыточного реагента и его побочных продуктов с последующим количественным окислением межцепочечных дисульфидных связей, а затем конъюгацией с избытком молекул линкер-лекарственное средство PBD. После остановки реакции реакционную смесь очищают и заменяют буфер с получением ABT-700 (S238C)-PBD. Были установлены параметры реакции для получения конъюгата с >80% нагрузкой лекарственного средства DAR2.
Пример 5. ABBV-399 связывается с рекомбинантным и клеточным cMet
in vitro
Связывание ELISA, клеточный анализ связывания и анализ с применением сортировки флуоресцентно-активированных клеток (FACS)
[0501] 96-луночные планшеты (Costar № 3369) покрывали с помощью 100 мкл/лунка мышиного антитела к His (Invitrogen № 37-2900) в концентрации 1 мкг/мл в PBS, pH 7,4, при 4°C в течение ночи, а затем блокировали с применением Superblock (Pierce, № 37535) в течение одного часа при комнатной температуре. Планшеты промывали 4 раза с помощью PBST, а затем инкубировали со 100 мкл рекомбинантного внеклеточного домена человеческого cMet (rh-cMet ECD-6His) ("6His", который раскрыт под SEQ ID NO: 100) в концентрации 2 мкг/мл в 10% Superblock в PBST в течение 1 ч. при комнатной температуре. Планшеты промывали 4 раза с помощью PBST, а затем инкубировали с ABT-700 или контрольным человеческим IgG в серийных разведениях в 10% Superblock в трех лунках при комнатной температуре в течение 1 ч. Планшеты промывали 4 раза с помощью PBST, а затем инкубировали со 100 мкл 1:15000 конъюгированного с HRP антитела козы к человеческому IgG (Thermo-Scientific Pierce, кат. № 31412) при комнатной температуре в течение 1 ч. Планшеты промывали 4 раза с помощью PBST и 100 мкл TMB (Pierce, № 34028) добавляли в каждую лунку и инкубировали при комнатной температуре до проявления цвета (примерно 10 мин.). Реакции останавливали добавлением 2 н. серной кислоты (Mallinckrodt chemicals, кат. № H381-05) и считывали оптическую плотность (OD) при 450 нм.
[0502] Связывание ABBV-399 с поверхностным cMet панели раковых клеток человека определяли с помощью анализа с применением сортировки флуоресцентно-активированных клеток (FACS). Для клеточных исследований по связыванию cMet клетки собирали из колб при достижении примерно 80% конфлюэнтности с применением буфера для диссоциации клеток (Invitrogen № 13151-014 или № 13150-016). Клетки промывали один раз в PBS/1% FBS (буфер для FACS), ресуспендировали в 1,5-2×106 клеток/мл в буфере для FACS и переносили в круглодонный 96-луночный планшет (BD Falcon № 3910) в количестве 100 мкл/лунка. Добавляли по десять мкл 10x концентрации ABT-700, ABBV-399 или контролей и планшеты инкубировали при 4°C в течение двух часов. Лунки дважды промывали буфером для FACS и ресуспендировали в 50 мкл 1:500 Ab к человеческому IgG (AlexaFluor 488, Invitrogen № 11013), разбавленного в буфере для FACS. Планшеты инкубировали при 4°C в течение одного часа, дважды промывали буфером для FACS. Клетки ресуспендировали в 100 мкл PBS/1% формальдегида и анализировали на проточном цитометре LSRII от Becton Dickinson.
[0503] ABBV-399 является реакционноспособным с рекомбинантной формой внеклеточного домена человеческого cMet (ECD, остатки 25-932), что определяли с помощью твердофазного иммуноферментного анализа (ELISA) с применением стандартного способа для измерения кажущейся аффинности, известного и доступного для специалиста в данной области техники. ABBV-399 связывается с ECD человеческого cMet с кажущейся аффинностью (EC50), составляющей 0,30 нМ (таблица 6), которая сходна с таковой у ABT-700 (EC50 0,22 нM) (таблица 6).
[0504] ABBV-399 демонстрировал аффинность связывания, составляющую 0,2-1,5 нМ (таблица 6), с опухолевыми клетками, в том числе клетками рака легкого NCI-H441, NCI-H292 и NCI-H1650 и линиями клеток рака желудка Hs746T, IM-95 и SNU-5. Данный анализ проводили с помощью стандартного способа для измерения кажущейся аффинности, который известен и доступен специалисту в данной области техники.
ТАБЛИЦА 6. Аффинность связывания ABBV-399 с рекомбинантным и клеточным cMet
| ABBV-399 (EC50 нмоль/л) | ABT-700 (EC50 нмоль/л) | |
| ECDa cMet по результатам ELISAb | 0,30 | 0,22 |
| Клеточный cMet по результатам FACSc | ||
| Hs746T | 0,4 +/- 0,1 | 0,4 +/- 0,1 |
| SNU-5 | 1,4+/- 0,4 | 1,6+/- 1,1 |
| IM-95 | 1,5 +/- 0,9 | 1,8 +/- 0,4 |
| NCI-H820 | 0,2 +/- 0,1 | 0,3 +/- 0,2 |
| NCI-H441 | 1,0 +/- 0,6 | 1,1 +/- 1,1 |
| NCI-H1573 | 0,6 +/- 0,1 | 0,4 +/- 0,1 |
| NCI-H1650 | 0,3 +/- 0,2 | 0,4 +/- 0,2 |
[0505] a Внеклеточный домен (остатки 25-932 cMet)
b Значения EC50, полученные по результатам ELISA, в котором ECD cMet захватывали на планшете посредством His-метки. Значения представляют собой среднее из шести экспериментов.
c Значения EC50, полученные по результатам FACS-анализа ABBV-399 на линиях раковых клеток. Значения представляют собой среднее из по меньшей мере двух экспериментов, +/- стандартное отклонение.
Пример 6. Активность ABBV-399 в отношении линий опухолевых клеток
in vitro
Анализ цитотоксичности
[0506] Опухолевые клетки высевали в количестве 2000-5000 клеток/лунка в 180 мкл среды для выращивания, содержащей 10% FBS, в 96-луночных планшетах и культивировали при 37°C во влажной камере с 5% СО2. На следующий день добавляли различные титры антител или ADC в количестве 20 мкл и клетки инкубировали в течение 6 дней. Жизнеспособность клеток определяли с помощью люминесцентного анализа жизнеспособности клеток CellTiter-Glo (Promega) согласно инструкциям производителя. Также во все анализы включали несвязывающийся нерелевантный ADC отрицательного контроля, конъюгированный с MMAE, чтобы подтвердить, что цитолиз клеток зависел от антигена.
[0507] ABBV-399 ингибировал пролиферацию раковых клеток, которые сверхэкспрессируют cMet, в том числе линии клеток с амплифицированным MET и клетки рака желудка Hs746T и SNU-5 (фиг. 4). Для сравнения, ABT-700 ингибировал пролиферацию клеток с амплификацией МЕТ (фиг. 4А и фиг. 4В), но не линии клеток без амплификации МЕТ, т. е. NCI-H820 и NCI-H441 (фиг. 4С и фиг. 4D).
Определение плотности рецепторов
[0508] Плотность cMet клеточной поверхности (антигенсвязывающая способность на клетку) определяли путем непрямого иммунофлуоресцентного окрашивания антигенов клеточной поверхности на культивируемых клетках с применением QIFIKIT (Dako). Вкратце, клетки собирали из колбы с культурой, как описано выше, для FACS-анализа, добавляли в круглодонный 96-луночный планшет в количестве 100 мкл/лунка и инкубировали при 4°С с 3 мкг/мл антитела cMet m224G11. В качестве контролей включали лунки, обработанные нерелевантным мышиным моноклональным антителом того же изотипа mIgG1 в концентрации 3 мкг/мл. После инкубирования в течение одного часа с первичным антителом клетки центрифугировали в течение 3 минут при 300 x g, дважды промывали буфером для FACS и инкубировали в течение одного часа при 4°C со 100 мкл поставляемого с QIFIT антитела, конъюгированного с FITC, разбавленного 1:50 в буфере для FACS. Клетки центрифугировали в течение 3 минут при 300 x g, дважды промывали буфером для FACS и фиксировали с помощью 100 мкл/лунка 1% формальдегида в PBS. В случае непрямого иммунофлуоресцентного окрашивания микросфер QIFIKIT, добавляли 100 мкл ресуспендированных микросфер из флакона 1 и флакона 2 для разделения лунок, центрифугировали в течение 3 мин. при 300 x g, один раз промывали буфером для FACS и фиксировали с помощью 100 мкл/лунка 1% формальдегида в PBS. Данные снимали на проточном цитометре LSRII от Becton Dickinson, и регистрировали значения Geomean для 5 популяций микросфер, и использовали их для расчета стандартной кривой, основанной на множестве молекул специфических антител на микросферу. Стандартную кривую применяли для присвоения ABC (антигенсвязывающей способности антитела или количества рецепторов) образцам окрашенных клеток.
[0509] ABBV-399 является цитотоксичным для раковых клеток, которые сверхэкспрессируют cMet. Для установления корреляции уровня экспрессии cMet с чувствительностью к ABBV-399 анализ in vitro расширяли с включением панели из 16 линий клеток. Они включали 6 линий NSCLC (A549, NCI-H1573, NCI-H820, NCI-H441 и NCI-H1650), 4 линии клеток рака пищевода (Hs746T, SNU-5, SNU-620 и IM-95), 2 линии клеток CRC (SW-48 и HT-29), 2 линии клеток рака молочной железы (MDA-MB-231 и MCF-7), линию клеток рака поджелудочной железы KP4 и линию раковых клеток глиобластомы U-87 MG. Также тестировали дополнительные линии клеток NSCLC (EBC-1, NCI-H226, SW900, HCC15, SK-MES-1 и NCI-H1702), и результаты показаны в таблице 7A.
Таблица 7A
[0510] FACS-анализ демонстрировал, что данные линии клеток характеризовались варьирующими уровнями экспрессии cMet, как количественно определяли с помощью связывающей способности антитела с cMet, которая представляет собой количество молекул cMet на клеточной поверхности (таблица 7B). Чувствительность к ABBV-399 в анализе клеточной пролиферации количественно определяли как максимальный цитолиз и IC50 (таблица 7B). Эти данные свидетельствуют о существовании порогового уровня экспрессии cMet, необходимого для значительного цитолиза посредством ABBV-399. Исключениями в данном случае были линии клеток, о которых известно, что они имеют аутокринную петлю HGF, такие как IM 95, KP4 и U-87 MG, у которых уровни экспрессии cMet были достаточными для того, чтобы ABBV-399 проявлял значительную цитотоксичность.
ТАБЛИЦА 7B. Экспрессия cMet на опухолевых клетках in vitro и чувствительность к ABBV-399
| Экспрессия cMeta | Максимальны цитолизb | IC50 ABBV-399c | |
| Рак легкого | |||
| A549 | 43000 | 22% | 1,6 +/- 1,1 |
| NCI-H1573 | 115667 | 18% | 18 +/- 14 |
| NCI-H820 | 320000 | 87% | 0,20 +/- 0,07 |
| NCI-H441 | 197000 | 56% | 0,06 +/- 0,05 |
| NCI-H1650 | 4500 | 13% | 47,9 +/- 8,5 |
| EBC-1 | 233231 | 96% | 0,06 +/- 0,03 |
| Рак желудка | |||
| Hs746T | 350000 | 87% | 0,11 +/- 0,06 |
| SNU-620 | 230000 | 80% | 0,17 +/- 0,08 |
| SNU-5 | 291000 | 85% | 0,28 +/- 0,07 |
| IM-95 | 21500 | 53% | 1,7 +/- 0,9 |
| Колоректальный рак | |||
| SW48 | 25500 | 0% | н. о. |
| HT-29 | 161438 | 70% | 9,0 +/- 1,4 |
| Рак молочной железы | |||
| MDA-MB-231 | 30500 | 0% | н. о. |
| MCF-7 | 8300 | 0% | н. о. |
| Рак поджелудочной железы | |||
| KP4 | 15300 | 53% | 2,9 +/- 1,9 |
| Глиобластома | |||
| U-87MG | 22000 | 30% | 1,9 +/- 0,1 |
| Линии клеток, не являющихся опухолевыми | |||
| NHBE (бронхиальный эпителий) | 40085 | 10% | н. о. |
| HUVEC (сосудистый эндотелий) | 15790 | 6% | н. о. |
| HMEC (эпителий молочной железы) | н. д. | 0% | н. о. |
| PrEC (эпителий предстательной железы) | 64853 | 0% | н. о. |
| NHDF (фибробласты кожи) | 1602 | 0% | н. о. |
[0511] a Примерное количество молекул cMet на клеточной поверхности, определенное с помощью FACS-анализа как связывающая способность антитела для m224G11 (мышиного исходного для ABT-700 антитела), связывающегося в концентрации 10 мкг/мл.
[0512] bОтносительно необработанного контроля в концентрации <1 мкг/мл при пролиферации на протяжении шести дней.
Пример 7. ADC ABT700-PBD ингибирует пролиферацию опухолевых клеток в широкой панели линий клеток
[0513] Опухолевые клетки высевали в количестве 2000-5000 клеток/лунка в 180 мкл среды для выращивания, содержащей 10% FBS, в 96-луночных планшетах и культивировали при 37°C во влажной камере с 5% СО2. На следующий день добавляли различные титры ADC в количестве 20 мкл и клетки инкубировали в течение 6 дней. Жизнеспособность клеток определяли с помощью люминесцентного анализа жизнеспособности клеток CellTiter-Glo (Promega) согласно инструкциям производителя. Также во все анализы включали несвязывающийся нерелевантный ADC отрицательного контроля, конъюгированный с MMAE, чтобы подтвердить, что цитолиз клеток зависел от антигена.
[0514] Результаты показаны на фиг. 5. Оба ADC, нацеливающиеся на cMet, были активны в отношении разнообразной панели типов опухолей с различными уровнями экспрессии cMet (высоким/низким) и амплификацией гена (amp). В столбце MMAE/PBD указано, сколько еще было необходимо ADC с MMAE для того, чтобы дать аналогичную цитотоксическую активность, которая достигалась с ADC с PBD. На большинстве линий клеток ADC с PBD был значительно более активен, чем конъюгат с MMAE.
Пример 8. ADC ABT700-PBD является активным
in vitro
в отношении линий клеток колоректального рака человека
[0515] Опухолевые клетки высевали в количестве 2000-5000 клеток/лунка в 180 мкл среды для выращивания, содержащей 10% FBS, в 96-луночных планшетах и культивировали при 37°C во влажной камере с 5% СО2. На следующий день добавляли различные титры ADC и несвязанного лекарственного средства (PBD и MMAE) в количестве 20 мкл и клетки инкубировали в течение 6 дней. Жизнеспособность клеток определяли с помощью люминесцентного анализа жизнеспособности клеток CellTiter-Glo (Promega) согласно инструкциям производителя. Также во все анализы включали несвязывающийся нерелевантный ADC отрицательного контроля, конъюгированный с MMAF (Ab095 MMAF), чтобы подтвердить, что цитолиз клеток зависел от антигена. ADC с цетуксимаб-MMAE выступал в качестве положительного контроля. Уровни плотности рецепторов рассчитывали так, как описано в примере 6.
[0516] Результаты показаны на фиг. 6A и 6B. ABT700-PBD был активен в отношении ряда линий клеток колоректального рака, в том числе линий с низкими уровнями рецепторов cMet на клеточной поверхности (например, SW48, фиг. 6B). Линии клеток с амплифицированным геном cMet в среднем имели 200-300 тыс. рецепторов на клетку. Для сравнения также показана активность ADC ABBV-399. Если результаты не введены, значит активность на наблюдалась. В целом, ABT700-PBD был более активен, чем ABBV-300 на линиях клеток колоректального рака.
Пример 9. ADC ABT700-PBD является активным
in vitro
в отношении линий клеток рака головного мозга человека
[0517] Опухолевые клетки высевали в количестве 2000-5000 клеток/лунка в 180 мкл среды для выращивания, содержащей 10% FBS, в 96-луночных планшетах и культивировали при 37°C во влажной камере с 5% СО2. На следующий день добавляли различные титры ADC и несвязанного лекарственного средства (PBD и MMAE) в количестве 20 мкл и клетки инкубировали в течение 6 дней. Жизнеспособность клеток определяли с помощью люминесцентного анализа жизнеспособности клеток CellTiter-Glo (Promega) согласно инструкциям производителя. Также во все анализы включали несвязывающийся нерелевантный ADC отрицательного контроля, конъюгированный с MMAF (Ab095-MMAF), чтобы подтвердить, что цитолиз клеток зависел от антигена. Уровни плотности рецепторов рассчитывали так, как описано в примере 6. Линии клеток с амплифицированным геном cMet в среднем имели 200-300 тыс. рецепторов на клетку.
[0518] Результаты показаны на фиг. 7. ABT700-PBD был активен в отношении ряда линий клеток рака головного мозга, в том числе линий с низкими уровнями рецепторов cMet на клеточной поверхности (например, SW48, фиг. 6B). Для сравнения также показана активность ADC ABBV-399. Если результаты не введены, значит активность на наблюдалась. В целом, ABT700-PBD был более активен, чем ABBV-300 на линиях клеток рака головного мозга.
Пример 10. ADC ABT700-PBD является активным
in vivo
в отношении ксенотрансплантатов колоректальной опухоли человека
[0519] Эффективность in vivo ABT-700, ABBV-399 и ABT-700-PBD оценивали у мышей, которым были трансплантированы клетки колоректального рака SW-48 (cMet IHC 1+). Эксперименты проводили по сути так, как описано в приведенном ниже примере 13.
[0520] ADC или антитела вводили один раз в семь дней в показанных дозах (мг/кг). ABT-700 PBD превосходил ABBV-399 в ксенотрансплантатах SW-48 с низким уровнем экспрессии cMet. См. фиг. 8.
Пример 11. ADC ABBV-399 и ABT700-PBD являются активными
in vivo
в отношении полученных от пациентов ксенотрансплантатов NSCLC человека
[0521] Эффективность ADC ABBV-399 и ABT700-PBD определяли в ксенотрансплантатах, полученных от пациентов с немелкоклеточным раком легкого и колоректальным раком. Фрагменты опухоли размером 3-5 мм3 на 3-м пассаже 3 (P3) имплантировали подкожно в правый нижний бок мышей NSG (The Jackson Laboratory) с помощью троакара. ABBV-399 и ABT-700 PBD вводили один раз в семь дней в общей сложности в шести дозах. Числа в скобках представляют собой вводимую дозу в мг/кг. Для всех групп значения объема опухолей наносили на график только на протяжении периода, который позволял полному набору животных оставаться в исследовании. Если животных приходилось выводить из исследования, у остальных животных отслеживали рост опухоли, пока они не достигали определенных конечных точек. Результаты задержки роста опухоли (TGD) показаны в таблице 8.
1Задержка роста опухоли (TGD), выраженная в процентах, представляет собой разницу между медианным временем до достижения опухолями в группе обработки тестируемым изделием размера 1 см3 в сравнении с контрольной группой.
[0522] Графики показаны для трех различных ксенотрансплантатов опухоли человека с относительно низкими (CTG-0363), промежуточными (CTG-0159) и высокими (CTG-0170) уровнями экспрессии мРНК cMet, суррогатом для уровней белка cMet на клеточной поверхности (фиг. 9А, 9В и 9С соответственно). Ответ опухоли на каждый ADC зависел от уровней cMet. ADC ABT700-PBD был более активен, чем ABBV-399, приблизительно в количестве 1/10 дозы.
Пример 12. ABBV-399 являются активными
in vivo
в отношении полученных от пациентов ксенотрансплантатов NSCLC человека
[0523] В случае моделей полученных от пациентов ксенотрансплантатов LG0703 и LG1049 (The Jackson Laboratory, Сакраменто, Калифорния) эффективность ABBV-399 определяли на ксенотрансплантатах, полученных от пациентов с немелкоклеточным раком легкого. Фрагменты опухоли размером 3-5 мм3 на 3-м пассаже 3 (P3) имплантировали подкожно в правый нижний бок мышей NSG (The Jackson Laboratory) с помощью троакара. Для всех групп значения объема опухолей наносили на график только на протяжении периода, который позволял полному набору животных оставаться в исследовании. Если животных приходилось выводить из исследования, у остальных животных отслеживали рост опухоли, пока они не достигали определенных конечных точек. Эффективность показана на графике Каплана-Мейера для моделей (A) LG0703 и (B) LG1049 в виде долей достигших указанных объемов опухолей после терапии. В обеих моделях ABBV-399 и контрольные средства вводили один раз в четыре дня в общей сложности в шести дозах. В модели LG1049 ABT-700 вводили один раз в семь дней в общей сложности в шести дозах. Числа в скобках представляют собой вводимую дозу в мг/кг.
[0524] ADC ABBV-399 был более активен, чем ABT-700 в отдельности. См. фиг. 10.
Пример 13. ABBV399 в отдельности и в комбинации ингибирует опухолевый рост у сверхэкспрессирующих cMet опухолей в животных моделях
[0525] ABBV-399 демонстрировал устойчивые и воспроизводимые противоопухолевые эффекты на ряде моделей ксенотрансплантатов, в том числе на моделях рака желудка, NSCLC и мультиформной глиобластомы. Активность в опухолях частично основана на доставке цитотоксической полезной нагрузки MMAE. Кроме того, ABBV-399 может также обладать противоопухолевой активностью посредством ингибирования как HGF-зависимой, так и HGF-независимой передачи сигнала cMet и антителоопосредованной эффекторной функции.
[0526] Эффективность ABBV-399 in vivo оценивали на мышах, которым трансплантировали (фиг. 11A) клетки рака желудка Hs746T, (фиг. 11B) клетки рака легкого NCI-H441 и (фиг. 11C) клетки колоректального рака SW-40. Самок мышей SCID, SCID-Beige и бестимусных мышей приобретали у Charles River (Уилмингтон, Массачусетс) и расселяли по десять мышей на клетку. По прибытии вес тела составлял 20-22 г. Корм и вода были в свободном доступе. Мышей акклиматизировали к местам содержания животных в течение по меньшей мере одной недели до начала экспериментов. Животных тестировали в условиях режима световой фазы 12 ч. свет: 12 ч. темнота (освещение включали в 06:00 часов). Все эксперименты проводили в соответствии с Руководством по содержанию и использованию лабораторных животных от Институционального комитета по содержанию и использованию животных AbbVie и Национальных институтов здравоохранения на объекте, аккредитованном Ассоциацией по оценке и аккредитации содержания лабораторных животных.
[0527] Для создания ксенотрансплантатов в бок 6-8-недельных мышей подкожно вводили суспензию жизнеспособных опухолевых клеток, смешанную с равным количеством матригеля (BD Biosciences). Объем инъекции составлял 0,2 мл, состоящий из 1:1 смеси S-MEM и матригеля (BD Biosciences). Опухоли приводили в соответствие по размеру на уровне примерно 200-250 мм3, если не было указано иное. Терапию начинали в день приведения опухолей в соответствие по размеру или через 24 часа после него. В начале терапии мыши весили примерно 25 г. Каждая экспериментальная группа включала 8-10 животных. Опухоли измеряли два-три раза в неделю. С помощью электронного штангенциркуля получали размеры длины (L) и ширины (W) опухоли, и объем рассчитывали согласно следующему уравнению: V=L x W2/2. Мышей подвергали эвтаназии, когда объем опухоли достигал максимум 3000 мм3 или при появлении изъязвлений на коже или других осложнений, в зависимости от того, что наступало раньше. В случае Hs746T, ABT-700 вводили один раз в семь дней, тогда как ABBV-399 вводили один раз в четыре дня. В случае ксенотрансплантатов NCI-H441, как ABT-700, так и ABBV-399 вводили один раз в четыре дня в общей сложности в шести дозах. Числа в скобках представляют собой вводимую дозу в мг/кг, а стрелками указаны дни введения. При обоих типах рака ADC ABBV-399 был более активен, чем ABT-700 в отдельности, и эффект был дозозависимым (фиг. 11A и 11B).
[0528] (Фиг. 11C) Эффективность комбинации ABBV-399 и FOLFIRI определяли с применением ксенотрансплантатов колоректального рака человека SW-48. 5-Фторурацил (APP Pharmaceuticals, Шаумбург, Иллинойс), иринотекан (Hospira, Лейк-Форест, Иллинойс) приобретали в виде растворов и разбавляли 0,9% хлоридом натрия для инъекций (USP), а кальция лейковорин (Fluka Chemical Corp., Милуоки, Висконсин) приобретали в виде соли и ресуспендировали в солевом растворе перед введением дозы. Стандартные средства лечения 5-фторурацил (50 мг/кг) и иринотекан (30 мг/кг) вводили внутривенно, а лейковорин (25 мг/кг) вводили перорально согласно режиму Q7Dx5 (FOLFIRI). IgG-контроль, Ig MMAE и ABBV-399 вводили внутрибрюшинно один раз в семь дней. Числа в скобках представляют собой вводимую дозу в мг/кг, а стрелками указаны дни введения. Комбинация ABBV-399+FOLFIRI была эффективна в ксенотрансплантатах рака толстой кишки SW-48.
Пример 14. Эффективность ABBV-399 в отношении моделей ксенотрансплантатов опухолей человека, резистентных к ABT-700
[0529] Эффективность ABBV-399 оценивали у мышей, которым подсадили ксенотрансплантаты только исходного Hs746T (фиг. 12B), или после рецидива при лечении посредством ABT-700 (фиг. 12A и 12B). На фиг. 12C приведена оценка эффективности ABBV-399 после рецидива при лечении посредством ABT-700 у мышей, которым трансплантировали ксенотрансплантаты опухолей EBC-1. Числа в скобках представляют собой вводимую дозу в мг/кг, а стрелками указаны дни введения. Объемы опухолей обозначены как среднее значение ± S.E.M.
[0530] Эффективность ABBV-399 оценивали на модели карциномы желудка (Hs746T) и модели плоскоклеточной карциномы легкого (EBC-1), которых сделали резистентными к ABT-700 путем многократного воздействия антителом in vivo (Hs746T ABT-700R и EBC-1 ABT-700R). Первоначально обработка ксенотрансплантатов, полученных от исходного Hs746T, посредством ABT-700 приводила к остановке роста опухоли с последующим рецидивом (фиг. 12A; синяя линия). Обработка данных рецидивировавших опухолей (красная линия) с помощью ABBV-399 приводила к регрессии (фиг. 12A, красная линия). Напротив, ксенотрансплантаты Hs746T ABT-700R были резистентны к обработке посредством ABT-700 с быстрым развитием опухоли при терапии (фиг. 12B; синяя линия). Когда эти резистентные опухоли достигали среднего когортного размера примерно 1000 мм3, обработка посредством ABBV-399 приводила к регрессии опухоли (фиг. 12В; красная линия) с последующим потенциальным разрастанием. Обработка Hs746T ABT-700R размером примерно 300 мм3 посредством ABBV-399 приводила к полной регрессии опухоли (фиг. 12B). Схожие результаты наблюдали после обработки ABT-700-резистентной клеточной линии EBC-1 посредством ABT-700 с последующей обработкой посредством ABBV-399. Эти результаты свидетельствовали, что эффективность ABBV-399 не зависела от ответа на ABT-700, по меньшей мере для клеточных линий с амплифицированным cMet.
Пример 15. Состав ABBV-399 для клинического применения
[0531] Лекарственный продукт ABBV-399 представлен в виде стерильного лиофилизированного порошка для ресуспендирования. Каждый флакон содержит 100 мг ABBV-399. После ресуспендирования с помощью 5,0 мл стерильной воды для инъекций конечная концентрация ABBV-399 составляет 20 мг/мл. Помимо ABBV-399 состав содержит сахарозу, полисорбат 80 и находится в гистидиновом буфере. Перед введением ABBV-399 дополнительно разбавляют нормальным солевым раствором до концентрации 1-10 мг/мл в зависимости от веса субъекта.
Пример 16. Открытое исследование фазы I с увеличением и расширением дозы для ABBV-399, конъюгата антитела и лекарственного средства (ADC), нацеливающегося на cMet, с участием пациентов (пациен.) с солидными опухолями на поздних стадиях
16.1. Краткое описание
[0532] В продолжающемся открытом исследовании фазы 1/1b оценивают безопасность, фармакокинетические параметры (PK) и предварительную эффективность ABBV-399 на субъектах с солидными опухолями на поздних стадиях. Исследование состоит из двух фаз: (1) Фаза увеличения/расширения дозы (монотерапия) и фаза исследования комбинированной терапии. В фазы исследования с расширением дозы и комбинированной терапией могут быть включены субъекты с солидными опухолями на поздних стадиях, характеризующимися сверхэкспрессией cMet, мутацией в экзоне 14 MET или амплификацией MET, в том числе, возможно, но без ограничения, NSCLC, раком пищевода/желудка, CRC или раком головы и шеи.
[0533] В фазе исследования монотерапии оценивали профиль безопасности и фармакокинетики ABBV-399 при внутривенном введении у примерно 24-42 субъектов в соответствии со схемой увеличения дозы, изображенной на фиг. 13. ABBV-399 вводили в увеличивающихся уровнях дозы, начиная с 0,15 мг/мг, в 21-дневных циклах введения доз. Исходя из данных по безопасности и PK, полученных в результате введения дозы один раз в 21 день, ABBV-399 также вводят один раз в 14 дней по 28-дневной схеме. От трех до 6 субъектов включают в каждую когорту и вводят им дозу один раз в 21 (одна доза за 21-дневный цикл) или 14 (2 дозы за 28-дневный цикл) дней до момента прогрессирования заболевания или неприемлемой токсичности для определения максимальной переносимой дозы (MTD) или максимально возможной вводимой дозы (MAD). Для принятия решений касательно увеличения дозы используют определения ограничивающей дозы токсичности (DLT). Исходя из доступных данных по безопасности, PK и фармакодинамике (PDx), включают не более 40 субъектов в когорту расширения, на которой дополнительно оценивают ABBV-399 с уровнем дозы, который соответствует или является ниже MTD или MAD. В ходе расширения дозы включают субъектов с солидными опухолями на поздних стадиях, характеризующимися сверхэкспрессией cMet, мутацией в экзоне 14 MET или амплификацией MET.
[0534] В фазе исследования комбинированной терапии не более 18 субъектов включают в каждую из групп комбинированной терапии, как описано ниже:
Когорта A комбинированной терапии: субъекты, удовлетворяющие критериям приема ABBV-399 плюс эрлотиниб
Когорта В комбинированной терапии: субъекты, удовлетворяющие критериям приема ABBV-399 плюс цетуксимаб
Когорта C комбинированной терапии: субъекты, удовлетворяющие критериям приема ABBV-399 плюс бевацизумаб
Когорта D комбинированной терапии: субъекты, удовлетворяющие критериям приема ABBV-399 плюс ниволумаб
[0535] Всех субъектов оценивают на предмет безопасности и переносимости режима, PK профиля ABBV-399 и предварительных результатов эффективности. В группы комбинированной терапии могли быть включены субъекты с солидными опухолями на поздних стадиях, характеризующимися сверхэкспрессией cMet, мутацией в экзоне 14 MET или амплификацией MET. Субъектам в группах комбинированной терапии A, B или C назначают 14-дневную или 21-дневную схему дозирования ABBV-399, тогда как субъекты в группе D получают ABBV-399 по 14-дневной схеме для соответствия с введением дозы ниволумаба один раз в 14 дней.
[0536] Для включения в данное исследование была необходима архивная опухолевая ткань. Опухолевую ткань анализируют в отношении белка cMet, количества копий MET и других биомаркеров. Экспрессию cMet определяют с помощью иммуногистохимического анализа; амплификацию MET определяют с помощью флуоресцентной гибридизации in situ (FISH) или секвенирования ДНК опухоли или опухолевой ДНК в кровотоке.
16.2. Выбор пациентов: диагностика и основные критерии включения/исключения
[0537] Некоторые из критериев включения для увеличения/расширения дозы в случае монотерапии ABBV-399:
Возраст субъекта должен составлять ≥ 18 лет
Субъект с солидной опухолью на поздних стадиях, в том числе без ограничения с немелкоклеточным раком легкого (NSCLC), колоректальным раком, раком молочной железы, яичника, пищевода/желудка и раком головы и шеи.
У субъекта должна быть солидная опухоль на поздних стадиях, которая не поддавалась хирургическому удалению или другим утвержденным вариантам терапии, которые продемонстрировали клинический результат.
Для расширения дозы: у субъекта должна быть опухоль, характеризующаяся сверхэкспрессией cMet, мутацией в экзоне 14 MET или амплификацией MET.
У субъекта показатель общего состояния по системе Восточной объединенной онкологической группе (ECOG) составляет 0-2.
У субъекта должно быть поддающееся измерению с помощью RECIST версии 1.1 заболевание
[0538] Дополнительные критерии включения для субъектов, включенных в фазу исследования комбинированной терапии
Субъекты в группах комбинированной терапии должны соответствовать вышеуказанным критериям включения и удовлетворять критериям приема эрлотиниба, цетуксимаба, бевацизумаба или ниволумаба по наиболее актуальной информации о назначении препаратов или по усмотрению исследователя.
[0539] Основные критерии исключения:
Для всех когорт:
Субъект получал противораковую терапию, в том числе химиотерапию, иммунотерапию, лучевую терапию, иммунотерапию, биологическую или любую исследуемую терапию в течение периода, составляющего 21 день, или фитотерапию за 7 дней до введения первой дозы ABBV-399.
При паллиативной лучевой терапии в случае болезненных метастаз в костях, кожных или подкожных метастаз в течение 10 процедур или менее отмывочный период не был нужен.
Для одобренных нацеленных малых молекул достаточным был отмывочный период в 5 периодов полувыведения (отмывочный период не требовался для субъектов, которые на тот момент получали эрлотиниб).
У субъекта имеются известные неконтролируемые метастазы в центральной нервной системе (ЦНС). Субъекты с метастазами в головном мозге допускались после радикальной терапии при условии, что они не имели симптомов без приема стероидов и противосудорожных средств в течение по меньшей мере 2 недель до приема первой дозы ABBV-399.
Субъект имел неразрешенные клинически значимые неблагоприятные явления ≥ 2 степени от предыдущей противораковой терапии, за исключением алопеции или анемии.
Субъекта подвергался радикальной хирургии за 21 день до введения первой дозы ABBV-399.
[0540] Дополнительные критерии исключения для субъектов, включенных в фазу исследования комбинированной терапии
Субъекты, включенные в фазу исследования комбинированной терапии, должны были удовлетворять вышеуказанным критериям исключения, а также следующему:
o субъекты не могут принимать ABBV-399 в комбинации с эрлотинибом, цетуксимабом, бевацизумабом или ниволумабом, если у них было какое-либо медицинское состояние, которое, по мнению Исследователя, подвергает субъекта неприемлемо высокому риску токсичности, вызванной приемом комбинации.
Субъекты не могут принимать цетуксимаб, если у них имеется мутация K-ras.
Субъекты не могут принимать бевацизумаб, если у них имеется плоскоклеточный NSCLC.
[0541] Также планировалось, что в некоторых исследованиях и для последующего клинического применения раскрытых в данном документе ADC, нацеливающихся на cMet, пациентов будут отбирать на основании присутствующих у них уровней экспрессии cMet (амплификации гена, мембранного cMet) и мутации в экзоне 14 MET. Ниже приведены способы оценки каждого из данных маркеров.
16.3. Режим введения доз
Фаза увеличения/расширения дозы
[0542] ABBV-399 вводили в виде внутривенной инфузии один раз в 21 день до момента прогрессирования заболевания или непереносимой токсичности. Введение начинали с дозы 0,15 мг/кг и увеличивали до 0,3, 0,6, 1,2, 1,8, 2,4, 3,0 и 3,3 мг/кг в последующих когортах при переносимости. Альтернативные дозы (промежуточные или высокие) или схемы введения доз можно было использовать на основании данных по клинической безопасности и PK. Дозу 2,7 мг/кг также использовали на основании данных по клинической безопасности и PK. Исходя из данных по безопасности и PK, полученных в результате введения дозы один раз в 21 день, ABBV-399 также вводят один раз в 14 дней по 28-дневной схеме (начиная с дозы 1,6 мг/кг). ABBV-399 вводили в течение 30 ± 10 минут. Его не вводят в виде внутривенного струйного или болюсного введения.
Фаза исследования комбинированной терапии
[0543] ABBV-399 комбинируют со стандартными дозами эрлотиниба, цетуксимаба, бевацизумаба или ниволумаба, начиная с уровня дозы ABBV-399 ниже MTD или MAD, а затем увеличивают до уровня MTD или MAD, но не превышая его, который был определен в фазе увеличения/расширения дозы для монотерапии. Ограничивающие дозу определения токсичности применяют к части по увеличению дозы в каждой комбинации.
| Исследуемый продукт: | ABBV-399 |
| Доза: | Текущая доза 2,7 мг/кг ABBV-399 для введения один раз в 21 день 1,6 мг/кг начальная доза ABBV-399 для введения один раз в 14 дней Дозу для субъектов с весом >100 кг следует рассчитывать для 100 кг |
| Способ введения: | IV инфузия |
| Частота введения | Один раз в 21 день (21-дневный цикл) или Один раз в 14 дней (28-дневный цикл) |
| Терапия сравнения: | эрлотиниб |
| Доза: | 150 мг |
| Способ введения: | Перорально |
| Частота введения | Каждый день |
| Терапия сравнения: | Цетуксимаб |
| Доза: | 400 мг/м2 начальная доза в течение 120 минут; затем 250 мг/м2 в течение 60 минут |
| Способ введения: | IV инфузия |
| Частота введения | Один раз в 7 дней |
| Терапия сравнения: | Бевацизумаб |
| Доза: | 10-15 мг/кг |
| Способ введения: | IV инфузия |
| Частота введения | Один раз в 21 день (15 мг/кг) или один раз в 14 дней (10 мг/кг) |
| Терапия сравнения: | Ниволумаб |
| Доза: | 3 мг/кг |
| Способ введения: | IV инфузия |
| Частота введения | Один раз в 14 дней |
| Длительность лечения: Субъектам с клиническим результатом (CR, PR или SD) разрешают продолжать лечение с помощью ABBV-399 до момента прогрессирования заболевания, непереносимых побочных эффектов или в течение не более 24 месяцев. Субъекты, у которых наблюдали клинический результат за 24 месяца и которые способны переносить лекарственное средство, могут продолжать лечение в расширенном исследовании. | |
16.4. Оценки
[0544] Визиты в исследовательские центры и оценки осуществляют на этапе скрининга и по меньшей мере один раз в неделю в течение первого цикла и в день 1 каждого последующего цикла. Оценки включают ограниченное физикальное обследование, гематологические и химические тесты перед введением всех доз исследуемого лекарственного средства и на заключительном визите. ECG снимают на этапе скрининга, в день 1 цикла 1, в день 1 цикла 2 и на заключительном визите. Неблагоприятные явления, лабораторные данные и показатели жизненно важных функций оценивают на протяжении всего исследования.
[0545] Исходные рентгенографические оценки опухолей с помощью CT (или MRI) головы, грудной клетки, брюшной полости и таза получают не более чем за 28 дней до дня 1 цикла 1. Затем CT-сканирование (или MRI) повторяют примерно один раз в 6 недель после начала терапии для оценки степени опухолевой нагрузки. Рентгенографические оценки опухоли продолжают до тех пор, пока не документируют прогрессирование заболевания путем визуализации, до начала новой противораковой терапии, смерти или отзыва согласия. Оценка ответа основывается на RECIST версии 1.1. Кроме того, на каждом визите исследователь оценивает субъекта на предмет свидетельств клинического прогрессирования заболевания.
16.4.1. Оценки биомаркеров
[0546] Для включения в данное исследование необходима архивная опухолевая ткань (предпочтителен наиболее свежий образец). Если у субъекта были данные из локальных или центральных лабораторий, демонстрирующие сверхэкспрессию cMet, мутацию 14 экзона MET или амплификацию MET и не была доступна архивная опухолевая ткань, субъект может быть допущен после обсуждения с медицинским наблюдателем. У вызвавшихся добровольцами субъектов может быть взята необязательная биопсия до и после лечения (в любое время после начала терапии), если это безопасно по мнению Исследователя. Для фиксирования и заливки свежесобранной ткани в парафин необходимо соблюдать установленные процедуры. Опухолевую ткань анализируют в отношении белка cMet, количества копий MET и других биомаркеров.
[0547] Экспрессию cMet определяют с помощью иммуногистохимического анализа (см. пример 17); амплификацию MET определяют с помощью флуоресцентной гибридизации in situ (FISH) или секвенирования ДНК опухоли или опухолевой ДНК в кровотоке (см. пример 18). Биологические образцы собирают в обозначенные моменты времени на протяжении всего исследования для проведения исследования с целью выявления биомаркеров, связанных с исходами, полученными от субъекта, или для того, чтобы лучше охарактеризовать заболевание.
16.4.2 Критерии оценивания
| Эффективность. Конечные точки в отношении эффективности включают частоту объективных ответов (ORR) (определяемую с помощью RECIST версии 1.1), выживаемость без прогрессирования (PFS) и продолжительность общего ответа (DOR). Рентгенографические оценки состоят из CT-сканирований (или MRI у субъектов, которые не переносят контраст) и выполняются примерно один раз в 6 недель после начала терапии для оценки степени опухолевой нагрузки. Рентгенографические оценки опухоли продолжают выполнять до тех пор, пока не документируют прогрессирование заболевания путем визуализации, до начала новой противораковой терапии, смерти или отзыва согласия. Оценивания ответа основываются на критериях оценки ответа солидных опухолей (RECIST) 1.1. Eisenhauer EA, Therasse P, Bogaerts B, et al. New response evaluation criteria in solid tumors: Revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45:228-47. |
| Фармакокинетика. Для оценки РК-параметров использовали образцы крови для анализа уровней лекарственных средств ABBV-399, общего ABT-700 и несвязанного MMAE. Образцы крови для определения антитела к лекарственному средству (ADA) и нейтрализующего ADA (nADA) собирают в заданные моменты времени на протяжении всего исследования, при этом ADA/nADA будут коррелировать с исходами PK и безопасности. |
| Безопасность. Неблагоприятные явления, лабораторные профили, результаты физикальных осмотров и показатели жизненно важных функций оценивают на протяжении всего исследования. Неблагоприятные явления оценивают согласно общим терминологическим критериям по оценке неблагоприятных явлений Национального института онкологии (NCI CTCAE), версии 4.03. |
| Статистические способы |
| Эффективность. Для всех оцениваемых субъектов, которые получали дозы, проводят анализы ORR, PFS и DOR. |
| Фармакокинетика. Концентрации ABBV-399 в сыворотке крови и значения PK-параметров сводят в таблицу для каждого субъекта и каждого режима, и итоговые статистические данные исчисляют для каждого момента времени забора образца и каждого параметра. |
| Безопасность. Безопасность ABBV-399 оценивают путем оценки воздействия исследуемого лекарственного средства, неблагоприятных явлений, серьезных неблагоприятных явлений, всех смертельных исходов, а также изменений результатов лабораторных анализов и показателей жизненно важных функций. |
Эффективность
[0548] Все анализы эффективности имеют исследовательский характер. Конечные точки в отношении исследуемой эффективности включают частоту объективных ответов (ORR) (определяемую с помощью RECIST версии 1.1), выживаемость без прогрессирования (PFS) и продолжительность ответа (DOR).
Частота объективных ответов
[0549] Частоту объективных ответов (ORR) определяют как долю субъектов с подтвержденным частичным или полным ответом на лечение. ORR для каждой когорты лечения оценивают с объединенными данными по всех центрах. 2-сторонние 80% доверительные интервалы ORR, а также значения частоты CR и PR получают на основе (точного) способа Клоппера-Пирсона.
Выживаемость без прогрессирования
[0550] Для каждого субъекта время PFS определяют как время от первого приема дозы ABBV-399 субъектом до прогрессирования заболевания или смерти субъекта, в зависимости от того, что наступает раньше. В ситуации, когда ни одно из событий не происходит, время PFS оценивают по дате последней оценки заболевания. Всех субъектов отслеживают до момента прогрессирования заболевания или не более 24 месяцев в случае тех субъектов, которые продолжают принимать исследуемое лекарственное средство.
[0551] Время PFS для когорт лечения сводят с помощью оценок Каплана-Мейера. Для описания распределения времени до наступления события рассчитывают среднее и медианное время с 2-сторонними 80% доверительными интервалами.
Продолжительность ответа
[0552] Продолжительность ответа (DOR) для субъекта определяют как время от первоначального объективного ответа субъекта на терапию исследуемым лекарственным средством до прогрессирования заболевания или смерти, в зависимости от того, что наступает раньше. Если данные о прогрессировании заболевания или смерти отсутствуют, DOR оценивают по дате последней оценки опухоли. DOR анализируют так же, как и для PFS.
Оценки опухоли
[0553] Исходную рентгенологическую оценку опухоли необходимо проводить за 28 дней до дня 1 цикла 1, и она состоит из CT (или MRI или неконтрастного CT для субъектов, которые не могут переносить контраст) головы, грудной клетки, брюшной полости и таза (и других вовлеченных в развитие опухоли областей, которые были показаны клинически). В целом, визуализацию в ходе терапии с помощью ABBV-399 осуществляют примерно один раз 6 недель (визуализацию можно проводить не более чем за 7 дней до введения следующей дозы лекарственного средства). В случае комбинации ABBV-399 с ниволумабом первую запланированную визуализацию в ходе терапии осуществляют примерно через 9 недель с последующей визуализацией примерно один раз в 6 недель. Визуализацию необходимо проводить до введения следующей запланированной дозы ABBV-399. Субъектов, которые прекращают прием исследуемого лекарственного средства по какой-либо причине, кроме прогрессирования заболевания, демонстрируемого с помощью визуализации, отслеживают до тех пор, пока не появляется задокументированное путем визуализации прогрессирование заболевания, или до начала новой противораковой терапии, смерти или отзыва согласия. Визуализацию также проводят в ходе заключительного визита для субъектов, у которых не было задокументировано рентгенологического прогрессирования по критериям RECIST 1.1, если это было клинически обосновано. Визуализацию также можно проводить в другие моменты времени, если у Исследователя имеются подозрения в отношении прогрессирования опухоли. Визуализацию головного мозга в отношении метастазирующего заболевания повторяют только при клиническом показании. При возможности, в ходе исследования следует применять одинаковую методику визуализации. Оценка опухоли, проводимая при скрининге, выступает в качестве исходного уровня для клинической оценки. Изменения в поддающихся измерению очагах в ходе терапии оценивают с помощью RECIST версии 1.1, как описано ниже.
Критерии RECIST (версии 1.1) для ответа опухоли
[0554] Критерии ответа оценивают с помощью RECIST (версии 1.1). Изменения в поддающихся измерению очагах в ходе терапии необходимо оценивать с помощью перечисленных ниже критериев.
a. Пригодность
[0555] Субъекты с поддающимся измерению заболеванием на исходном уровне могут иметь объективный ответ опухоли, оцениваемый с помощью критериев RECIST. Поддающееся измерению заболевание определяется наличием по меньшей мере одного поддающегося измерению очага. Если поддающееся измерению заболевание ограничено одиночным очагом, его неопластическую природу необходимо подтверждать цитологическим/гистологическим исследованием, если это возможно.
b. Измеряемость
| Поддающиеся измерению очаги | Очаги, точно измеряемые по меньшей мере в одной размерности, с минимальным размером: наибольший диаметр ≥10 мм (толщина среза для CT-сканирования не более 5 мм) измерение 10 мм штангенциркулем, выполняемое клиницистом |
| Не поддающиеся измерению очаги | Все остальные очаги, включая небольшие очаги (наибольший диаметр <10 мм), а также действительно не поддающиеся измерению очаги. К очагам, считающимся действительно не поддающимся измерению, относятся: лептоменингиальное заболевание, асциты, плевральный/перикардиальный выпот, воспалительное заболевание молочной железы, лимфангитное вовлечение кожи или легкого, а также масс брюшной полости, которые не были подтверждены и с последующими методиками визуализации. |
| Поддающиеся измерению злокачественные лимфатические узлы | Для того, чтобы он был оценен как патологически увеличенный и поддающийся измерению, лимфатический узел должен быть ≥15 мм по короткой оси при оценке с помощью СТ-сканирования (рекомендуется, чтобы толщина среза для CT-сканирования не превышала 5 мм). На исходном уровне и при последующем наблюдении измеряют и отслеживают только короткую ось. |
| Не поддающиеся измерению злокачественные лимфатические узлы | Патологические лимфатические узлы с короткой осью от ≥10 до <15 мм. |
[0556] Все измерения необходимо выполнять и регистрировать в метрической записи с использованием штангенциркуля, если он был квалифицирован для клинического применения. Все исходные оценки следует проводить как можно ближе к началу лечения и не более чем за 4 недели до начала лечения.
[0557] Тот же способ оценки и ту же методику следует применять для определения характеристик каждого выявленного и сообщаемого очага на исходном уровне и в ходе последующего наблюдения.
[0558] Клинические очаги считают поддающимися измерению только тогда, когда они являются поверхностными (например, кожные узлы и пальпируемые лимфатические узлы) и имеют диаметр ≥10 мм, как оценивают с помощью штангенциркуля. В случае кожных очагов рекомендуется документирование цветной фотографией с включением линейки для оценки размера очага.
c. Способы измерения
[0559] Традиционную CT следует проводить со срезами размером 5 мм или меньше с приблизительно равной толщиной среза. То же самое применимо к опухолям грудной клетки и брюшной полости. Во все рентгенологические измерения необходимо включать оценку по шкале.
[0560] В редких случаях можно использовать цитологическое и гистологическое исследование для того, чтобы отличить частичный ответ (PR) и полный ответ (CR).
d. Документирование "целевых" и "нецелевых" очагов на исходном уровне
[0561] Все поддающиеся измерению очаги вплоть до максимум 2 очагов на орган и 5 очагов в общей сложности, представляющие все вовлеченные органы, необходимо идентифицировать как целевые очаги и регистрировать и измерять на исходном уровне. Опухолевые очаги, расположенные в ранее облученной зоне или в зоне, подвергнутой другой локорегиональной терапии, обычно не считают поддающимися измерению, если не было продемонстрировано прогрессирование очага.
[0562] Особого упоминания заслуживают лимфатические узлы, поскольку они являются нормальными анатомическими структурами, которые могут быть видны при визуализации, даже если они не вовлечены в развитие опухоли. Патологические узлы, которые определяют как поддающиеся измерению и могут быть идентифицированы как целевые очаги, должны соответствовать критерию короткой оси ≥15 мм по результатам СТ-сканирования. В сумму на исходном уровне вносит вклад только короткая ось этих узлов. Короткая ось узла представляет собой диаметр, обычно используемый рентгенологами для оценки того, вовлечен ли узел в развитие солидной опухоли. Размер узла обычно регистрируют в двух размерностях в плоскости, в которой получено изображение (для СТ это практически всегда осевая плоскость). Наименьшим из этих результатов измерения является коротка ось. Например, брюшной узел, который регистрировали в виде 20 мм × 30 мм, имеет короткую ось 20 мм и классифицируется как злокачественный поддающийся измерению узел. В этом примере 20 мм следует регистрировать в качестве результата измерения узла. Все остальные патологические узлы (узлы с короткой осью ≥10 мм, но <15 мм) следует считать нецелевыми очагами. Узлы, которые имеют короткую ось <10 мм, считают непатологическими, и их не нужно регистрировать или отслеживать.
[0563] Сумму диаметров для всех целевых очагов рассчитывают и регистрируют как сумму диаметров на исходном уровне. Если в сумму необходимо включить лимфатические узлы, то, как указано выше, в сумму добавляют только короткую ось. Суммарные диаметры на исходном уровне используют в качестве эталона, с помощью которого характеризуют объективный ответ опухоли.
[0564] Все остальные очаги (или участки поражения заболеванием), включая патологические лимфатические узлы, следует идентифицировать как нецелевые очаги, а также следует регистрировать на исходном уровне. Измерения этих очагов не требуется, но наличие (стабильное, увеличивающееся или уменьшающееся) или отсутствие каждого следует отмечать в ходе последующего наблюдения.
e. Оценка целевых очагов
Полный ответ (CR):
[0565] Исчезновение всех целевых очагов. Любые патологические лимфатические узлы (как целевые, так и нецелевые) должны иметь уменьшение короткой оси до <10 мм.
Частичный ответ (PR):
[0566] По меньшей мере на 30% суммы диаметров целевых очагов, при этом эталоном считается исходная сумма диаметров.
Прогрессирование заболевания (PD):
[0567] По меньшей мере 20%-ное увеличение суммы диаметров целевых очагов, при этом эталоном считается наименьшая сумма диаметров, зарегистрированная с начала лечения (на исходном уровне или после него) или появления одного или нескольких новых очагов. В дополнение к относительному увеличению на 20% сумма также должна свидетельствовать об абсолютном увеличении, составляющем по меньшей мере 5 мм.
Стабилизация заболевания (SD):
[0568] Ни достаточного уменьшения размеров опухоли, чтобы соответствовать требованиям для присвоения PR, ни достаточного увеличения, чтобы соответствовать требованиям для присвоения PD, при этом эталоном считается наименьшая сумма диаметров с начала лечения (на исходном уровне или после него).
Оценка целевых очагов:
[0569] Лимфатические узлы, идентифицированные как целевые очаги, всегда должны иметь зарегистрированный актуальный результат измерения короткой оси (измеренный в той же анатомической плоскости, что и в ходе обследования на исходном уровне), даже если узлы регрессируют до менее 10 мм при исследовании. Это означает, что если лимфатические узлы включены как целевые очаги, "сумма" очагов может не быть равной нулю, даже если удовлетворяются все критерии ответа, поскольку нормальный лимфатический узел определяют как имеющий короткую ось <10 мм. В случае PR, SD и PD в сумму целевых очагов необходимо включать фактический результат измерения коротких осей узлов.
[0570] Все очаги (узловые и неузловые), регистрируемые на исходном уровне, должны иметь фактические результаты их измерения, зарегистрированные при каждой последующей оценке, даже если они очень маленькие (<5 мм). Однако иногда целевые очаги или лимфатические узлы становятся слишком маленькими для измерения. Если по мнению рентгенолога очаг, по всей видимости, исчез, результат измерения должен быть зарегистрирован как 0 мм. Если полагают, что очаг присутствует, но является слишком маленьким для измерения, следует присвоить ему значение по умолчанию 5 мм (полученное из толщины 5 мм СТ-среза). Измерение этих очагов потенциально является невоспроизводимым; поэтому включение такого значения по умолчанию будет предотвращать ложные ответы или ложное прогрессирование на основе ошибки измерения.
f. Оценка нецелевых очагов
Полный ответ (CR):
[0571] Исчезновение всех нецелевых очагов и нормализация уровня опухолевых маркеров. Все лимфатические узлы должны быть непатологическими по размеру (короткая ось <10 мм).
Отличные от CR/отличные от PD:
[0572] Устойчивость одного или нескольких нецелевых очагов и/или сохранение уровня опухолевого маркера выше нормальных пределов.
Прогрессирование заболевания (PD):
[0573] Явное прогрессирование существующих нецелевых очагов.
[0574] В такой ситуации для достижения "явного прогрессирования" на основе нецелевого заболевания должен иметь место общий уровень значительного ухудшения при нецелевом заболевании такой, что даже при наличии SD или PR целевого заболевания общая опухолевая нагрузка увеличивается достаточно, чтобы прекратить терапию. Умеренное "увеличение" в размере одного или нескольких нецелевых очагов обычно не является достаточным для того, чтобы соответствовать требованиям для присвоения явного статуса прогрессирования. Таким образом, присвоение статуса общего прогрессирования исключительно на основе изменений нецелевого заболевания ввиду SD или PR целевого заболевания имеет место крайне редко.
[0575] Примечание: если субъект прекращает лечение из-за симптоматического ухудшения, необходимо приложить все усилия для документирования объективного прогрессирования даже после прекращения лечения.
Новые очаги
[0576] Появление новых злокачественных очагов обозначает прогрессирование заболевания. Хотя конкретные критерии для выявления новых рентгенологических очагов отсутствуют, обнаружение новых очагов должно быть однозначным, т. е. не быть связанным с различиями в методиках сканирования, времени сканирования, фазе введения контраста, изменении метода визуализации или прихода мысли, что очаг представляет собой нечто иное, а не опухоль (например, некоторые "новые" очаги в костях могли быть просто следом заживления или обострением ранее существовавших очагов). Очаг, выявленный при последующем наблюдении в анатомическом местоположении, которое не было подвергнуто сканированию на исходном уровне, считают новым очагом, и это свидетельствует о прогрессировании заболевания. Примером этого был субъект, у которого было висцеральное заболевание на исходном уровне, и в процессе исследования ему было назначено СТ или MRI головного мозга, которое выявило метастазы. Метастазы головного мозга субъекта считали доказательством прогрессирующего заболевания, даже если ему/ей не проводили визуализацию головного мозга на исходном уровне.
[0577] Если новый очаг не был явным (т. е. слишком малым для измерения), продолженная терапия и последующее наблюдение позволяли уточнить, действительно ли он представлял собой новое заболевание. Если повторные сканирования подтверждали наличие нового очага, то следовало объявить о прогрессировании с использованием даты первоначального сканирования.
16.5. РЕЗУЛЬТАТЫ
16.5.1. Фаза увеличения/расширения дозы для монотерапии ABBV-399 (фаза 1):
[0578] В схеме 3+3 увеличения дозы ABBV-399 вводили в дозах от 0,15 до 3,3 мг/кг один раз в 21 день пациентам с метастатическими солидными опухолями (NCT02099058). Как изображено на фиг. 13, ABBV-399 вводили в виде внутривенной инфузии один раз в 21 день до момента прогрессирования заболевания или непереносимой токсичности. Введение начинали с дозы 0,15 мг/кг и увеличивали до 0,3, 0,6, 1,2, 1,8, 2,4, 3,0 и 3,3 мг/кг в последующих когортах при переносимости. Также оценивали дозу 2,7 мг/кг ABBV-399 один раз в 21 день, и на основании данных по безопасности и PK эта доза была выбрана в качестве дозы для когорты расширения. Исходя из данных по безопасности и PK, полученных в результате введения дозы один раз в 21 день, ABBV-399 также вводят один раз в 14 дней по 28-дневной схеме (начиная с дозы 1,6 мг/кг до 2,5 мг/кг с пошаговыми увеличениями на 0,3 мг/кг, т. е., 1,6, 1,9, 2,2 и 2,5 мг/кг). В случае введения на 14-й или 21-й дни ABBV-399 вводят в течение 30±10 минут. Его не вводят в виде внутривенного струйного или болюсного введения.
[0579] По состоянию на 31 марта 2016 года по меньшей мере 1 дозу ABBV-399 получили 48 пациентов. После однократного введения дозы наблюдали доза-пропорциональное увеличение площади под кривой для ABBV-399 и общего антитела. Периоды полужизни для ABBV-399 и общего антитела составляли примерно 2-4 дня. Ограничивающая дозу токсичность в виде лихорадочной нейтропении имела место у 1 пациента при дозе 3 мг/кг и у 1 пациента (с септическим шоком) при дозе 3,3 мг/кг. Наилучший процент изменения целевых очагов у пациентов по меньшей мере с 1 оценкой опухоли после исходного уровня показан на фиг. 14. Как показано на фиг. 14 (и из данных, которые не показаны на фигурах), наилучшими ответами на монотерапию ABBV-399 у всех проходящих лечение пациентов были: 3/40 (7,5%) пациентов с частичным ответом, 20/40 (50%) пациентов со стабилизацией заболевания и 17/40 (42,5%) пациентов с прогрессированием заболевания. Данные RECIST не были доступны для восьми пациентов в связи с клиническим прогрессированием (4), неблагоприятными явлениями (2), отзывом согласия (1) и смертельным исходом из-за пневмонии (1). У трех пациентов с частичным ответом был немелкоклеточный рак легкого (NSCLC), характеризующийся сверхэкспрессией cMet.
[0580] Доза 2,7 мг/кг была выбрана для расширения дозы, основываясь преимущественно на безопасности и переносимости. Для включение в данную фазу исследования осуществляли скрининг субъектов с NSCLC в отношении сверхэкспрессии cMet с помощью IHC-анализа с использованием набора моноклонального первичного антитела кролика к общему cMet (SP44) под названием CONFIRM, приобретенного у Ventana (кат. № 790-4430). Образцы тканей оценивали путем определения процента окрашивания клеток целевой ткани на различных уровнях интенсивности, от высокой до низкой, т. е. с помощью IHC-показателя, составляющего 0, 1+, 2+ или 3+, или H-показателя, составляющего 0-149, 150-224 или 225-300. Оценку можно было выполнять либо вручную, либо с помощью компьютера. Подробности о IHC-анализе и процедуре оценки описаны в примере 17. В приведенной далее таблицы показано количество пациентов с NSCLC, подвергнутых проспективному скринингу, и H-показатель, используемый для оценивания сверхэкспрессии cMet:
| Подвергнуто скринингу | H-показатель 0-149 N (%) |
H-показатель 150-224 N (%) |
H-показатель 225-300 N (%) |
H-показатель общего cMet ≥ 150 N (%) |
| 91 | 39 (43%) |
35 (38%) |
17 (19%) |
52 (57%) |
[0581] Связанные с лечением смертельные исходы отсутствовали. Связанными с лечением неблагоприятными явлениями у ≥10% пациентов (включая все уровни дозы и все степени) были усталость (22,9%), тошнота (20,8%), невропатия (14,6%), пониженный аппетит (12,5%), рвота (12,5%) и гипоальбуминемия (10,4%). Из 16 пациентов с cMet+ NSCLC, которых лечили посредством ABBV-399, результаты для 11 из них показаны на фиг. 15. На фиг. 15 представлена каскадная диаграмма, демонстрирующая наилучшее процентное изменение целевого очага в ответ на монотерапию ABBV-399, исходя из рентгенографических данных. Как показано на фиг. 15 (и из данных, не показанных на фигуре), 3/16 подвергаемых лечению пациентов с частичным ответом (19%), 6/16 подвергаемых лечению пациентов со стабилизацией заболевания (37,5%), 2/16 подвергаемых лечению пациентов с прогрессирующим по результатам рентгенографии заболеванием (12,5% ) и 5 пациентов без доступной визуализации в связи с клиническим прогрессированием (3), отзывом согласия (1) и смертельным исходом от пневмонии (1).
[0582] На фиг. 16 показано количество недель, в течение которых 16 пациентов участвовали в исследовании до начала клинического прогрессирования.
16.5.2. Фаза исследования комбинированной терапии (фаза 1b):
[0583] Результаты испытания комбинированной терапии в отношении NSCLC с применением ABBV-399 в количестве 2,7 мг/кг один раз в 21 день и 150 мг эрлотиниба, вводимого перорально каждый день, показаны на фиг. 17 и 18. На фиг. 17 представлена каскадная диаграмма, демонстрирующая наилучшее процентное изменение целевых очагов для 6 пациентов, которые получали лечение с помощью ABBV-399 и эрлотиниба. Как показано на фиг. 17, 2/6 пациентов достигали частичного ответа, 1/6 прогрессирования заболевания, о чем свидетельствовали новые очаги. На фиг. 18 показано количество недель, в течение которых 6 пациентов участвовали в исследовании до начала клинического прогрессирования.
16.5.3. Предшествующий лечению отбор пациентов, имеющих cMet+ опухоли с IHC-показателями 2+/3+ или H-показателями ≥150, может значительно улучшать исход лечения
[0584] Доклинические результаты с клеточными линиями и моделями ксенотрансплантатов свидетельствуют, что пациенты с показателем IHC2+/IHC3+ cMet будут иметь лучший ответ, чем пациенты с IHC 0/1+. Применение сопутствующей диагностики для облегчения предшествующего лечению отбора пациентов с формами рака с IHC2/3+ cMet или H-показателем ≥150 значительно улучшило бы общие результаты лечения и избавило бы пациентов от лечения, которое согласно прогнозу будет неэффективным. Используемый в данном документе термин cMet+ охватывает все опухоли, которые экспрессируют cMet, независимо от того, сверхэкспрессируется ли cMet или нет. В некоторых cMet+ вариантах осуществления cMet сверхэкспрессируется. В некоторых cMet+ вариантах осуществления cMet не сверхэкспрессируется.
[0585] Аналогичным образом, результаты данного текущего клинического испытания фазы 1 свидетельствуют, что H-показатели 150 и выше связаны с прогнозируемым ответом на лечение с помощью ADC, нацеливающегося на cMet, в том числе ABBV-399.
[0586] Не ограничиваясь какой-либо теорией, предварительные результаты свидетельствуют о том, что гетерогенность опухолей может быть ограничивающим фактором в эффективности ABBV-399. Среди этих cMet+ опухолей с показателями IHC2+ и IHC3+ были раковые клетки, которые вообще не демонстрировали экспрессии cMet или демонстрировали низкую экспрессию cMet. Среди них по меньшей мере некоторые из клеток, которые не подвергались цитолизу в результате "эффекта, оказываемого на близлежащие случайные клетки", могли восстановить популяцию опухоли и препятствовать ответу опухоли на лечение. ABBV-399 можно комбинировать со стандартными средствами лечения, которые ингибируют или уничтожают опухолевые клетки с низким уровнем экспрессии cMet, не ограничиваясь нацеленными средствами, такими как эрлотиниб, и средствами иммунотерапии, такими как ниволумаб, но также со стандартными средствами химиотерапии, предпочтительно с неперекрывающейся токсичностью.
[0587] В таблице 9 приведены клинические результаты текущего испытания фазы 1, коррелирующие с общим ответом с H-показателем у пациентов с NSCLC, которые получали лечение с помощью ABBV-399 в виде монотерапии один раз в две (Q2W) или три (Q3W) недели или с помощью ABBV-399 в комбинации с эрлотинибом. IHC-показатель получали с помощью протокола, описанного в примере 17.
ТАБЛИЦА 9
| Субъект | Доза (мг/кг) и частота введения | Гистология опухоли | IHC-показатель | Общий ответ |
| 1 | 2,7 Q3W ПЛЮС ЭРЛОТИНИБ (150 мг QD) | Аденокарцинома | 295 | PR |
| 2 | 2,7 Q3W ПЛЮС ЭРЛОТИНИБ (150 мг QD) | аденокарцинома | 250 | PR |
| 3 | 2,7 Q3W ПЛЮС ЭРЛОТИНИБ (150 мг QD) | аденокарцинома | 270 | PR |
| 4 | 1,6 Q2W | аденокарцинома | 280 | PR |
| 5 | 1,9 Q2W | аденокарцинома | 250 | CR |
| 6 | 2,7 Q3W ПЛЮС ЭРЛОТИНИБ (150 мг QD) | аденокарцинома | 250 | PR |
| 7 | 2,7 МГ/КГ Q3W | плоскоклеточная карцинома | 165 | PR |
| 8 | 2,7 МГ/КГ Q3W | плоскоклеточная карцинома | 185 | PR |
| 9 | 2,7 МГ/КГ Q3W | плоскоклеточная карцинома | 170 | PR |
[0588] Как показано в таблице 9, четыре пациента с формами аденокарциномы, представляющими собой NSCLC, которые получали лечение с помощью 2,7 мг/кг ABBV-399 один раз в 3 недели (Q3W) и эрлотиниба, с IHC-показателями, составляющими 225 или больше, достигали частичных ответов (PR). Два пациента с формами аденокарциномы, представляющими собой NSCLC, которые получали лечение один раз в две недели с помощью ABBV-399, с IHC-показателями, составляющими 225 или больше, достигали либо частичного ответа, либо полного ответа. Три пациента с формами плоскоклеточной карциномы, представляющими собой NSCLC, которые получали лечение с помощью 2,7 мг/кг ABBV-399 один раз в 3 недели, с IHC-показателями в диапазоне 150-224, достигали частичных ответов.
Пример 17. Иммуногистохимический анализ по cMet и H-показатель: "протокол окрашивания с помощью ABBV-ADC, нацеливающегося на cMet"
[0589] В данной области техники существуют различные доступные способы оценки уровней экспрессии белка cMet с помощью иммуногистохимии (IHC). Специалисту данной области техники обычно будет понятно, как применять их и как адаптировать их к конкретному исследованию. Некоторые поставщики предоставляют платные услуги по окрашиванию cMet (см., например, Flagship Biosciences L.L.C., ARUP Laboratories, PathGroup Inc.). В данном исследовании фазы I оценивали уровни экспрессии cMet с применением mAb к cMet SP44 от Ventana Medical Systems, более конкретно, моноклонального антитела кролика к общему cMet CONFIRM® от Ventana (Ventana Medical Systems, Inc, кат. № 790-4430) в комбинации с автоматическим устройством для окраски препаратов Ventana® (BenchMark ULTRA®) и универсальным набором для выявления DAB Ventana ultraView® (кат. № 760-500). Окрашивания и результаты анализировали у Flagship Biosciences L.L.C. в сотрудничестве с ARUP Laboratories. Ткани положительного контроля включали формы аденокарциномы толстой кишки и аденокарциному легкого. Ткани отрицательного контроля включали контрольную линию ER100 клеток молочной железы, контрольную линию ER13781 клеток молочной железы и контрольную линию CD15-5 клеток лимфомы Ходжкина. Для целей настоящей заявки, включая формулу изобретения, конкретный анализ, применяемый в данном исследовании фазы 1, в данном документе называют "протоколом окрашивания с помощью ABBV-ADC, нацеливающегося на cMet".
[0590] Биоптаты опухоли пациента фиксировали в формалине в PBS и заливали парафином. Нарезали микроскопические препараты величиной 4 микрона, давали им высохнуть, а затем просушивали в течение 60 минут при 60°C. Микроскопические препараты использовали в пределах 2 недель после нарезки. Микроскопические препараты переносили в устройство BenchMark ULTRA® и выбирали следующие параметры:
[0591] Процедура: ultraView® DAB
[0592] Название: cMet CONFIRM®
[0593] Парафин [выборочно]
[0594] Депарафинизация [выборочно]
[0595] Кондиционирование клеток [выборочно]
[0596] Кондиционер № 1 [выборочно]
[0597] [короткое - 8-мин. кондиционирование]
[0598] Умеренный CC1 [выборочно]
[0599] [жесткое - 95-мин. кондиционирование]
[0600] Температуры инкубирования Ab [выборочно]
[0601] 36°C Ab [выборочно]
[0602] антитело [выборочно]
[0603] Набор для подготовки № [4430] ** 0 ч 16 мин
[0604] Контрастный краситель [выборочно]
[0605] Гематоксилин [2021] 4 минуты
[0606] Реагент после контрастного красителя [выборочно]
[0607] Окрашивающий в синий реагент [2037] 4 минуты
[0608]
[0609] После завершение окрашивания микроскопические препараты забирали из устройства и промывали водопроводной водой. Микроскопические препараты дегидратировали следующим образом:
[0610] Погрузить микроскопические препараты в 70% этанол, 2 смены, 1-2 минуты каждая.
[0611] Погрузить микроскопические препараты в 95% этанол, 1-2 минуты.
[0612] Погрузить микроскопические препараты в 99% (или абсолютный) этанол, 3-5 минут.
[0613] Промыть ксиленом, 3 смены, 3-5 минут каждая.
[0614] После дегидратирования микроскопические препараты покрывали безводной средой для заливки с использованием стеклянных покровных стекол.
[0615] В этой автоматизированной системе применяли следующие реагенты:
Ventana® cMet CONFIRM® кат. № 790-4430 (инкубация примерно 16 минут при 36°C)
[0616] Один 5-мл дозатор антител к общему cMet CONFIRM® содержит примерно 48,75 мкг рекомбинантного моноклонального антитела кролика SP44 (также доступного от других коммерческих поставщиков). Антитело разбавляли в 0,05 M Tris-HCl с 1% белка-носителя и 0,10% ProClin 300® (консерванта). Общая концентрация белка в реагенте составляла примерно 10 мг/мл. Концентрация специфического антитела составляла 9,75 мкг/мл. В этом продукте не было обнаружено никакой неспецифической реактивности антител.
Буфер Ventana Ultra CC1, кат. № 950-224
[0617] Кондиционирование клеток в растворе Ultra CC1 выполняли при 64°C в течение 95 минут.
Универсальный набор для детектирования Ventana
ultraView
®, кат. № 760-500
Гематоксилин II Ventana, кат. № 760-2021
Окрашивающий в синий реагент Ventana, кат. № 760-2037
Определения H-показателя и IHC-показателя
[0618] Обработанные микроскопические препараты анализировал сертифицированный комиссией врач-специалист в области патоморфологии. Применяли руководство по оценке, предложенное производителем (см., например, фиг. 19). Для того, чтобы вывести показатель использовали 10-12 репрезентативных областей. При оценивании окрашивания в отношении cMet было определено, что подход с использованием H-показателя будет наилучшем подходом для количественной оценки экспрессии cMet. Подход с использованием H-показателя обеспечивает оптимальное разрешение данных для определения изменения интенсивности и процента окрашивания опухоли в пределах типа опухоли и среди различных типов опухоли. Он также служит хорошим инструментом для определения пороговых значений для положительного окрашивания. В данном способе процент клеток (0-100) в опухоли предусматривается по значениям интенсивности окрашивания в диапазоне от 0-3+. Данный протокол обеспечивает окрашивание белка cMet как в цитоплазме, так и на клеточной поверхности/мембране. Определяют интенсивность окрашивания для каждой клетки в фиксированном поле обработанного биоптата опухоли, и каждой клетке присваивают отдельное значение, как описано далее, в зависимости от окрашивания клеточной поверхности/мембраны:
[0619] 0= отсутствие окрашивания,
[0620] 1+= слабое окрашивание,
[0621] 2+= умеренное окрашивание,
[0622] 3+= сильное окрашивание.
[0623] Для получения H-показателя процент опухолевых клеток умножают на каждое значение интенсивности и складывают вместе. Максимальный H-показатель составляет 300, если 100% опухолевых клеток помечены с интенсивностью 3+. H-показатель рассчитывают следующим образом:
[0624] H-показатель=[1 x (% клеток 1+)+2 x (% клеток 2+)+3 x (% клеток 3+)].
[0625] Данный протокол обеспечивает окрашивание cMet как в цитоплазме, так и на мембране. Для упомянутых в данном документе расчетов H-показателя применяли мембранное окрашивание. Итоговый H-показатель опухоли (0-300) дает большее относительное значение для мембранного окрашивания с более высокой интенсивностью (3+ клетка > 2+ клетка > 1+ клетка).
[0626] На фиг. 20 показаны иллюстративные результаты окрашивания опухолей с различными H-показателями (15, 90, 180 и 290), полученными с помощью "протокола окрашивания с помощью ABBV-ADC, нацеливающегося на cMet".
[0627] Каждой опухоли также можно присвоить IHC-показатель, представляющий собой IHC 0, IHC 1+, IHC 2+ или IHC 3+. Хотя оба IHC-показателя включают значения 0, 1+, 2+ и 3+, их не следует путать. В случае H-показателя, значения 0, 1+, 2+ и 3+ относятся к интенсивности окрашивания конкретной отдельной клетки. В случае IHC-показателя, значения 0, 1+, 2+ и 3+ относятся к общему окрашиванию конкретной области образца опухоли. На фиг. 21 показаны иллюстративные результаты окрашивания опухолей с различными IHC-показателями 0/1+/2+/3+, полученными с помощью "протокола окрашивания с помощью ABBV-ADC, нацеливающегося на cMet".
[0628] Для целей настоящего изобретения и согласно описанному в данном документе протоколу, если ни одна из клеток в фиксированном поле не окрашена, значение, присваиваемое опухоли, представляет собой IHC 0. Если общий уровень окрашивания в фиксированном поле является низким, значение, присваиваемое опухоли, представляет собой IHC 1+. Если в большей части клеток в фиксированном поле наблюдается умеренное окрашивание, значение, присваиваемое опухоли, представляет собой IHC 2+. Если в большей части клеток в фиксированном поле наблюдается сильное окрашивание, значение, присваиваемое опухоли, представляет собой IHC 3+.
[0629] В другом варианте осуществления, и для целей настоящего изобретения, и согласно описанному в данном документе протоколу, если ни одна из клеток в фиксированном поле не окрашена, значение, присваиваемое опухоли, представляет собой IHC 0. Если общий уровень окрашивания в фиксированном поле является низким, значение, присваиваемое опухоли, представляет собой IHC 1+. Если в по меньшей мере 15% клеток в фиксированном поле наблюдается умеренное окрашивание, значение, присваиваемое опухоли, представляет собой IHC 2+. Если в по меньшей мере 15% клеток в фиксированном поле наблюдается сильное окрашивание, значение, присваиваемое опухоли, представляет собой IHC 3+.
Пример 18. Измерение амплификации количества копий гена
MET
[0630] Амплификация гена MET может улучшать ответ пациента на ингибиторы cMet, в том числе на раскрытые в данном документе средства лечения. В уровне техники был описан ряд способов измерения амплификации гена MET. См., например, Cappuzzo F, Marchetti A, Skokan M, Rossi E, Gajapathy S, Felicioni L, et al. Increased MET gene copy number negatively affects survival of surgically resected non-small-cell lung cancer patients. J Clin Oncol 2009;27:1667-74; Koeppen H, Yu W, Zha J, Pandita A, Penuel E, Rangell L, et al. Biomarker analyses from a placebo-controlled phase II study evaluating erlotinib {+/-} onartuzumab in advanced non-small-cell lung cancer: MET expression levels are predictive of patient benefit. Clin Cancer Res 2014;20:4488-98.
[0631] Предпочтительный способ описан ниже и в данном документе называется "способом амплификации cMET MET/CEP7". Вкратце, фиксированные в формалине, залитые парафином блоки ткани можно использовать в двухцветовых FISH-анализах с применением смеси зондов MET/CEP7, полученной с ДНК-зондом MET (клон BAC RP 11-95I20), или с применением зонда из 319 т. о., сконструированного из 3 клонов бактериальной искусственной хромосомы (BAC), который охватывает весь ген MET на 7q31.1, меченных SpectrumRed и SpectrumGreen CEP7 (Abbott Molecular). FISH-анализы можно проводить, например, в соответствии с ранее описанным протоколом (Cappuzzo F, Hirsch FR, Rossi E, et al. (2005) Epidermal growth factor receptor gene and protein and gefitinib sensitivity in non-small cell lung cancer. J Natl Cancer Inst 97:643-655), предусматривающим предварительную обработку 2× буфером на основе хлорида натрия и цитрата натрия при 75°C и расщепление протеиназой K в течение 7-15 минут каждый раз, совместную денатурацию при 85°C в течение 15 минут, гибридизацию в течение примерно 36 часов и быстрые послегибридизационные промывки 2× буфером на основе хлорида натрия и цитрата натрия/0,4 нонилфеноксилполиэтоксиэтанолом. Регистрируют сигналы по меньшей мере в 50 ядрах опухолей на активную зону с помощью эпифлуоресцентного микроскопа с наборами отдельных интерференционных фильтров для зеленого (FITC), красного (техасский красный) и синего (DAPI) цвета, а также двойным (красный/зеленый) и тройным (синий, красный, зеленый) полосовыми фильтрами. Для каждой активной зоны среднее и стандартное отклонение количества копий на клетку каждой тестируемой последовательности ДНК, процент клеток с ≤2, 3 и ≥4 копий генов MET и соотношение MET/CEP7 (гена, локализованного возле центросомы той же хромосомы). Если среди трех протестированных активных зон были обнаружены гетерогенные результаты, то для представления пациента в статистических анализах использовали активную зону с наивысшим средним количеством копий. Для документирования получали изображения с использованием CCD-камеры и сливали их с помощью специализированного программного обеспечения (CytoVision, Genetix USA, Бостон, Массачусетс). MET можно считать амплифицированным, когда соотношение сигнала MET:CEP7 составляет ≥2,0, или когда это соотношение составляет <2,0, но было >20 копий сигналов MET у более чем 10% подсчитанных ядер опухолевых клеток согласно критериям, установленным MD Anderson Pathology Department на основе предшествующих исследований. Zeng, ZS, Weiser MR, Kuntz E, Chen CT, Khan SA, Forslund A, et al. cMet gene amplification is associated with advanced stage colorectal cancer and liver metastases. Cancer Lett 2008;265:258-69. В некоторых исследованиях сообщалось, что количество копий гена МЕТ относительно CEP7 варьировало от 2,05 до 16,14 (медиана 3,48).
[0632] Другим тестом амплификации cMET является тест на крови. Его можно выполнить с помощью любого из множества коммерчески доступных реагентов, таких как, например, набор для проведения теста на амплификацию МЕТ в жидком биоптате Biocept Liquid Biopsy MET Amplication Test (Biocept), MET Detect-R ® (Personal Genome Diagnostics) и Guardant360® (Guardant Health®).
Пример 19. Оценка наличия мутации/удаления в экзоне 14 гена
MET
[0633] Экзон 14 MET содержит сайт Cbl убиквитинлигаз на остатке тирозина 1003 (Y1003), при этом в ином случае убиквинтин обычно присоединяется к остатку тирозина и приводит к лизосомальному разрушению белка cMet. Следовательно, миссенс-мутация остатка Y1003 или "пропускание" белковой области, которая кодируется экзоном 14 MET, приводит в результате к относительной сверхэкспрессии белка MET, усиленной активации cMet и последующему онкогенезу. Ингибирование с помощью ингибиторов тирозинкиназы (TKI) MET может привести к клиническому эффекту по меньшей мере у пациентов с NSCLC, несущих такие изменения экзона 14 MET. Пациенты, несущие любую из данных мутаций, могут получить положительный эффект от раскрытых в данном документе средств лечения.
[0634] Для детекции мутаций в гене MET специалисту в данной области техники доступно несколько способов. Поскольку мутация либо присутствует, либо нет (т. е. она является абсолютной величиной, а не степенью), ее обнаружение не зависит от типа анализа, и для ее обнаружения в образцах опухоли можно применять любой способ. Было описано множество мутаций в экзоне 14 гена MET, многие из которых были обобщены в Impaired cMet Receptor Degradation Mediated by MET Exon 14 Mutations in Non-Small-Cell Lung Cancer, Mark M. Awad JCO Mar 10, 2016:879-881; опубликованной онлайн 19 января 2016 года; 10.1200/JCO.2015.64.2777. Этот способ и способы, применяемые в упомянутых там источниках, для выявления дополнительных мутаций в экзоне 14 образцов рака, включены в данный документ посредством ссылки во всей своей полноте. Эти способы можно применять для выявления таких конкретных мутаций в образцах рака. Кроме того, настоящее раскрытие относится к любой известной мутации в экзоне 14 гена и не ограничено мутациями, проиллюстрированными в данном документе.
[0635] Было выявлено несколько сплайсинг-мутаций экзона 14 при аденокарциноме легких. Например,
[0636] MET amplification, protein expression, and mutations in pulmonary adenocarcinoma. Park S, Koh J, Kim DW, Kim M, Keam B, Kim TM, Jeon YK, Chung DH, Heo DS. Lung Cancer. 2015 Dec;90(3):381-7. doi: 10.1016/j.lungcan.2015.10.022. Электронная публикация от 27 октября 2015 года. PMID: 26791796. Этот способ и способы, применяемые в упомянутых там источниках, для выявления дополнительных мутаций в экзоне 14 образцов рака, включены в данный документ посредством ссылки во всей своей полноте. Эти способы можно применять для выявления таких конкретных мутаций в образцах рака.
[0637] Responses to the multitargeted MET/ALK/ROS1 inhibitor crizotinib and co-occurring mutations in lung adenocarcinomas with MET amplification or MET exon 14 skipping mutation. Jorge SE, Schulman S, Freed JA, VanderLaan PA, Rangachari D, Kobayashi SS, Huberman MS, Costa DB. Lung Cancer. 2015 Dec;90(3):369-74. doi: 10.1016/j.lungcan.2015.10.028. Электронная публикация от 31 октября 2015 года. Этот способ и способы, применяемые в упомянутых там источниках, для выявления дополнительных мутаций в экзоне 14 образцов рака, включены в данный документ посредством ссылки во всей своей полноте. Эти способы можно применять для выявления таких конкретных мутаций в образцах рака.
[0638] Дополнительные мутации в экзоне 14 при NSCLC можно обнаружить с помощью способов, описанных в следующих ссылках:
[0639] Next-Generation Sequencing of Pulmonary Sarcomatoid Carcinoma Reveals High Frequency of Actionable MET Gene Mutations Exon 14 Xuewen Liu, Yuxia Jia, Mark B. Stoopler, Yufeng Shen, Haiying Cheng, Jinli Chen, Mahesh Mansukhani, Sanjay Koul, Balazs Halmos, and Alain C. Borczuk, JCO Mar 10, 2016:794-802; опубликована онлайн 27 июля 2015 года. Этот способ и способы, применяемые в упомянутых там источниках, для выявления дополнительных мутаций в экзоне 14 образцов рака, включены в данный документ посредством ссылки во всей своей полноте. Эти способы можно применять для выявления таких конкретных мутаций в образцах рака.
[0640] MET Exon 14 Mutations in Non-Small-Cell Lung Cancer Are Associated With Advanced Age and Stage-Dependent MET Genomic Amplification and cMet Overexpression. Awad MM, Oxnard GR, Jackman DM, Savukoski DO, Hall D, Shivdasani P, Heng JC, Dahlberg SE, Jänne PA, Verma S, Christensen J, Hammerman PS, Sholl LM. J Clin Oncol. 2016 Mar 1;34(7):721-30. doi: 10.1200/JCO.2015.63.4600. Электронная публикация от 4 января 2016 года. Этот способ и способы, применяемые в упомянутых там источниках, для выявления дополнительных мутаций в экзоне 14 образцов рака, включены в данный документ посредством ссылки во всей своей полноте. Эти способы можно применять для выявления таких конкретных мутаций в образцах рака.
[0641] Сообщалось о другой делеции в экзоне 14 MET при злокачественных новообразованиях желудочно-кишечного тракта. Oncotarget. 2015 Sep 29;6(29):28211-22. doi: 10.18632/oncotarget.4721. Злокачественные новообразования желудочно-кишечного тракта несут требующие принятия мер делеции в экзоне 14 MET. Lee J, Ou SH3, Lee JM, Kim HC5, Hong M6, Kim SY1, Jang J1, Ahn S6, Kang SY6, Lee S1, Kim ST1, Kim B4, Choi J4, Kim KA4, Lee J, Park C Park SH, Park JO, Lim HY, Kang WK, Park K, Park YS, Kim KM. Этот способ и способы, применяемые в упомянутых там источниках, для выявления дополнительных мутаций в экзоне 14 образцов рака, включены в данный документ посредством ссылки во всей своей полноте. Эти способы можно применять для выявления таких конкретных мутаций в образцах рака.
Пример 20. Оценка наличия делеций в экзоне 19 и замен в экзоне 21 (L858R) в гене
EGFR
у пациентов с раком
[0642] Две наиболее распространенные соматические мутации EGFR, делеции в экзоне 19 и миссенс-мутации L858R, связаны с in vitro и in vivo восприимчивостью к лечению ингибиторами EGFR-тирозинкиназ (EGFR-TKI) гефитинибом и эрлотинибом. Эти два различных типа мутаций ответственны за ∼85% всех соматических мутаций EGFR, выявленных у пациентов с NSCLC. Эффекты от раскрытых в настоящем документе средств лечения можно наблюдать у пациентов с делецией в экзоне 19 и заменой L858R в экзоне 21.
[0643] В уровне техники были описаны несколько способов обнаружения делеций в экзоне 19 в образцах раковой опухоли. Ниже приведены примеры таких способов, которые доступны специалисту в данной области техники. Поскольку мутация либо присутствует, либо нет (т. е. она является абсолютной величиной, а не степенью), ее обнаружение не зависит от типа анализа, и для ее обнаружения в образцах опухоли можно применять любой способ.
[0644] A recent review of the literature reporting on the effect of these mutations in cancer patients is that in EGFR-TKIEGFR-tyrosine kinase inhibitor treatment in a patient with advanced non-small cell lung cancer and concurrent exon 19 and 21 EGFR mutations: A case report and review of the literature.Yang Y, Zhang B, Li R, Liu B, Wang L. Oncol Lett. 2016 May;11(5):3546-3550. Электронная публикация от 5 апреля 2016 года. Способ, применяемый в этой публикации, и способы, применяемые в упомянутых там публикациях, для выявления делеций в экзоне 19 и замен (L858R) в экзоне 21 в гене EGFR в образцах раковой опухоли пациентов включены в данный документ посредством ссылки во всей своей полноте.
[0645] Сообщалось, что пациенты с NSCLC и делециями в экзоне 19 EGFR имеют более длительную выживаемость после лечения гефитинибом или эрлотинибом по сравнению с пациентами с мутацией L858R. Jackman DM, Yeap BY, Sequist LV, et al. (2006) Exon 19 deletion mutations of epidermal growth factor receptor are associated with prolonged survival in non-small cell lung cancer patients treated with gefitinib or erlotinib. Clin Cancer Res 12:3908-3914. В этой публикации приведены два различных способа обнаружения делеций и мутации L858R в экзоне 19 EGFR. Эти способы и способы, применяемые в упомянутых там публикациях, для выявления делеций в экзоне 19 и замен (L858R) в экзоне 21 в гене EGFR в образцах раковой опухоли пациентов включены в данный документ посредством ссылки во всей своей полноте.
[0646] Все публикации, патенты, патентные заявки и другие документы, упомянутые в настоящей заявке, настоящим включены посредством ссылки во всей своей полноте для всех целей в той же степени, как если бы каждая отдельная публикация, патент, патентная заявка или другой документ были указаны отдельно как включенные посредством ссылки для всех целей.
[0647] Несмотря на то, что были проиллюстрированы и описаны различные конкретные варианты осуществления, и некоторые из них представлены ниже, будет понятно, что можно вносить различные изменения без отклонения от сущности и объема настоящего изобретения(изобретений).
[0648] 1. Способ лечения рака, представляющего собой солидную опухоль, при котором сверхэкспрессируется cMet, предусматривающий введение субъекту-человеку, у которого имеется указанный рак, конъюгата антитела к cMet и лекарственного средства ("ADC") в количестве и в течение периода времени, достаточных для обеспечения терапевтического эффекта.
[0649] 2. Способ согласно варианту осуществления 1, где рак, характеризующийся сверхэкспрессией cMet, относится к типу рака, при котором cMet сверхэкспрессируется у по меньшей мере приблизительно 10% популяции пациентов, у которых имеется данный тип рака.
[0650] 3. Способ согласно варианту осуществления 1, где биоптат ткани опухоли, характеризующейся сверхэкспрессией cMet, от субъекта характеризуется IHC-показателем, составляющим 2+, и/или H-показателем, составляющим от 150 до 224, при измерении согласно протоколу окрашивания с помощью ABBV-ADC, нацеливающегося на cMet.
[0651] 4. Способ согласно варианту осуществления 1, где биоптат ткани опухоли, характеризующейся сверхэкспрессией cMet, от субъекта характеризуется IHC-показателем, составляющим 3+, и/или H-показателем, превышающим 225, при измерении согласно протоколу окрашивания с помощью ABBV-ADC, нацеливающегося на cMet.
[0652] 5. Способ согласно любому из вариантов осуществления пп. 1-4, где рак, характеризующийся сверхэкспрессией cMet, представляет собой немелкоклеточный рак легкого ("NSCLC").
[0653] 6. Способ согласно варианту осуществления 5, где NSCLC представляет собой неплоскоклеточный NSCLC.
[0654] 7. Способ согласно варианту осуществления 5, где NSCLC представляет собой плоскоклеточный NSCLC.
[0655] 8. Способ согласно варианту осуществления 5, где гистология NSCLC представляет собой NSCLC без дополнительных уточнений (NSCLC-NOS).
[0656] 9. Способ согласно варианту осуществления 1, где рак представляет собой колоректальный рак ("CRC").
[0657] 10. Способ согласно варианту осуществления 9, где гистология CRC не уточнена.
[0658] 11. Способ согласно варианту осуществления 10, где CRC представляет собой аденокарциному.
[0659] 12. Способ согласно варианту осуществления 1, где рак представляет собой рак головы и шеи ("H&N").
[0660] 13. Способ согласно варианту осуществления 12, где гистология H&N не уточнена.
[0661] 14. Способ согласно варианту осуществления 1, где рак представляет собой рак поджелудочной железы.
[0662] 15. Способ согласно варианту осуществления 14, где рак поджелудочной железы представляет собой аденокарциному.
[0663] 16. Способ согласно варианту осуществления 5, где рак, характеризующийся сверхэкспрессией cMet, характеризуется делециями в экзоне 19 рецептора эпидермального фактора роста ("EGFR") или заменами (L858R) в экзоне 21, которые выявляют с помощью одобренного FDA теста.
[0664] 17. Способ согласно варианту осуществления 1, где рак, характеризующийся сверхэкспрессией cMet, является устойчивым к предшествующему лечению с помощью нацеленной и/или отличной от нацеленной химиотерапии.
[0665] 18. Способ согласно варианту осуществления 1, где рак, характеризующийся сверхэкспрессией cMet, является устойчивым к предшествующему лечению с помощью антитела к cMet.
[0666] 19. Способ согласно варианту осуществления 1, где ADC, нацеливающийся на cMet, вводят в виде монотерапии.
[0667] 20. Способ согласно варианту осуществления 1, где ADC, нацеливающийся на cMet, вводят в дополнение к дополнительному противораковому средству, при этом дополнительное средство вводят согласно его режиму дозирования, одобренному FDA.
[0668] 21. Способ согласно варианту осуществления 20, где дополнительное противораковое средство представляет собой ингибитор рецептора эпидермального фактора роста ("EGFR").
[0669] 22. Способ согласно варианту осуществления 21, где дополнительное противораковое средство представляет собой эрлотиниб.
[0670] 23. Способ согласно варианту осуществления 20, где рак, характеризующийся сверхэкспрессией cMet, характеризуется делециями в экзоне 19 или заменами (L858R) в экзоне 21 EGFR, которые выявляют с помощью одобренного FDA теста, и дополнительное противораковое средство представляет собой ингибитор EGFR, имеющих такие делеции или замены.
[0671] 24. Способ согласно варианту осуществления 23, где дополнительное противораковое средство представляет собой афатиниб.
[0672] 25. Способ согласно варианту осуществления 20, где рак представляет собой NSCLC.
[0673] 26. Способ согласно варианту осуществления 25, где дополнительное противораковое средство выбрано из иматиниба (GLEEVEC®), дазатиниба (SPRYCE®), нилотиниба (TASIGNA®), босутиниба (BOSULIF®), понатиниба (ICLUSIG®), афатиниба (GIOTRIF®), акситиниба (INLYTA®), кризотиниба (XALKORI®), эрлотиниба (TARCEVA®), гефитиниба (IRESSA®), лапатиниба (TYVERB®), нилотиниба (TASIGNA®), пазопаниба (VOTRIENT®), регорафениба (STIVARGA®), сорафениба (NEXAVAR®), сунитиниба (SUTENT®), тоцераниба (PALLADIA®), ваталаниба и радотиниба (SUPECT®).
[0674] 27. Способ согласно варианту осуществления 26, где дополнительное противораковое средство представляет собой ингибитор PD1.
[0675] 28. Способ согласно варианту осуществления 27, где ингибитор PD1 представляет собой антитело к PD1.
[0676] 29. Способ согласно варианту осуществления 28, где антитело к PD1 представляет собой ниволумаб.
[0677] 30. Способ согласно любому из вариантов осуществления 1-29, где ADC, нацеливающийся на cMet, вводят в количестве, находящемся в диапазоне от приблизительно 0,15 мг/кг до приблизительно 3,3 мг/кг, один раз в три недели.
[0678] 31. Способ согласно варианту осуществления 30, где ADC, нацеливающийся на cMet, вводят в количестве, составляющем приблизительно 2,7 мг/кг.
[0679]
[0680] 32. Способ согласно любому из вариантов осуществления 1-29, где ADC, нацеливающийся на cMet, вводят в количестве, находящемся в диапазоне от приблизительно 0,15 мг/кг до приблизительно 3,3 мг/кг, один раз в две недели.
[0681] 33. Способ согласно варианту осуществления 32, где ADC, нацеливающийся на cMet, вводят в количестве, составляющем приблизительно 1,6 мг/кг, один раз в две недели.
[0682] 34. Способ согласно варианту осуществления 32, где ADC, нацеливающийся на cMet, вводят в количестве, составляющем приблизительно 1,9 мг/кг, один раз в две недели.
[0683] 35. Способ согласно любому из вариантов осуществления 1-34, где ADC, нацеливающийся на cMet, содержит антитело к cMet, связанное с цитостатическим и/или цитотоксическим средством посредством линкера.
[0684] 36. Способ согласно варианту осуществления 35, где антитело к cMet представляет собой полноразмерное антитело.
[0685] 37. Способ согласно варианту осуществления 35, где антитело к cMet интернализируется и характеризуется значением кажущейся аффинности EC50, составляющим менее приблизительно 10 наномоль/л, предпочтительно от приблизительно 1 пикомоль/л до 10 наномоль/л.
[0686] 38. Способ согласно варианту осуществления 35, где антитело к cMet связывает человеческий cMet in vitro со значением кажущейся аффинности EC50, составляющим приблизительно 0,3 нмоль/л.
[0687] 39. Способ варианта осуществления согласно любому из вариантов осуществления 35-38, где антитело к cMet содержит VH-цепь, содержащую три CDR, а именно CDR № 1 VH (SEQ ID NO: 112), CDR № 2 VH (SEQ ID NO: 113) и CDR № 3 VH (SEQ ID NO: 114); VL-цепь, содержащую три CDR, а именно CDR № 1 VL (SEQ ID NO: 115), CDR № 2 VL (SEQ ID NO: 116) и CDR № 3 VL (SEQ ID NO: 117); и модифицированную шарнирную область с SEQ ID NO: 170.
[0688] 40. Способ согласно варианту осуществления 39, где антитело к cMet представляет собой IgG1.
[0689] 41. Способ согласно варианту осуществления 38, где антитело к cMet содержит VH-цепь с SEQ ID NO: 78; VL-цепь с SEQ ID NO: 79 и модифицированную шарнирную область с SEQ ID NO: 170.
[0690] 42. Способ согласно варианту осуществления 41, где антитело к cMet представляет собой IgG1.
[0691] 43. Способ согласно варианту осуществления 39, где антитело к cMet содержит тяжелую цепь с SEQ ID NO: 86 и легкую цепь с SEQ ID NO: 87.
[0692] 44. Способ согласно варианту осуществления 39, где антитело к cMet представляет собой ABBV399.
[0693] 45. Способ согласно варианту осуществления 39, где антитело к cMet содержит тяжелую цепь с SEQ ID NO: 171 и легкую цепь с SEQ ID NO: 172.
[0694] 46. Способ согласно варианту осуществления 39, где антитело к cMet представляет собой ABT-700 (S238C)-PBD.
[0695] 47. Способ согласно варианту осуществления 38, где антитело к cMet содержит шесть CDR антитела STI-D0602/STI-0602.
[0696] 48. Способ согласно варианту осуществления 47, где антитело к cMet представляет собой IgG1.
[0697] 49. Способ согласно варианту осуществления 35, где антитело к cMet содержит VH-цепь STI-D0602/STI-0602 и VL-цепь STI-D0602/STI-0602.
[0698] 50. Способ согласно варианту осуществления 49, где антитело к cMet представляет собой IgG1.
[0699] 51. Способ согласно варианту осуществления 35, где линкер является расщепляемым лизосомальным ферментом.
[0700] 52. Способ согласно варианту осуществления 51, где лизосомальный фермент представляет собой катепсин B.
[0701] 53. Способ согласно варианту осуществления 52, где линкер предусматривает сегмент согласно одной или нескольким структурным формулам (IVa), (IVb), (IVc) и (IVd):
[0702] или его соль, где
[0703] пептид представляет собой пептид (проиллюстрированный C→N и без демонстрации карбокси- и амино- "концов"), расщепляемый катепсином В;
[0704] Т представляет собой полимер, содержащий одно или несколько этиленгликолевых звеньев или алкиленовую цепь или их комбинации;
[0705] Ra выбран из водорода, алкила, сульфоната и метилсульфоната;
[0706] p представляет собой целое число в диапазоне от 0 до 5;
[0707] q равняется 0 или 1;
[0708] x равняется 0 или 1;
[0709] y равняется 0 или 1;
[0710] представляет собой точку присоединения линкера к цитотоксическому и/или цитостатическому средству; и
[0711] * представляет собой точку присоединения линкера к остальной части.
[0712] 54. Способ согласно варианту осуществления 53, где пептид выбран из группы, состоящей из Val-Cit; Cit-Val; Ala-Ala; Ala-Cit; Cit-Ala; Asn-Cit; Cit-Asn; Cit-Cit; Val-Glu; Glu-Val; Ser-Cit; Cit-Ser; Lys-Cit; Cit-Lys; Asp-Cit; Cit-Asp; Ala-Val и Val-Ala и их солей.
[0713] 55. Способ согласно варианту осуществления 51, где лизосомальный фермент представляет собой β-глюкуронидазу.
[0714] 56. Способ согласно варианту осуществления 35, где ADC, нацеливающийся на cMet, характеризуется средним соотношением лекарственного средства и антитела ("DAR"), находящимся в диапазоне 0-10.
[0715] 57. Способ согласно варианту осуществления 35, где ADC, нацеливающийся на cMet, характеризуется средним соотношением лекарственного средства и антитела ("DAR"), находящимся в диапазоне 1-4.
[0716] 58. Способ согласно варианту осуществления 57, где ADC, нацеливающийся на cMet, характеризуется DAR, находящимся в диапазоне 2-4.
[0717] 59. Способ согласно варианту осуществления 57, где ADC, нацеливающийся на cMet, характеризуется DAR, составляющим приблизительно 3,1.
[0718] 60. Способ согласно варианту осуществления 57, где ADC, нацеливающийся на cMet, характеризуется соотношением E2 и E4 ADC, составляющим приблизительно 1:1.
[0719] 61. Способ согласно варианту осуществления 57, где ADC, нацеливающийся на cMet, характеризуется DAR, составляющим 3,0.
[0720] 62. Способ согласно варианту осуществления 35, где цитостатическое и/или цитотоксическое средство представляет собой ингибитор микротрубочек.
[0721] 63. Способ согласно варианту осуществления 62, где ингибитор микротрубочек представляет собой ауристатин.
[0722] 64. Способ согласно варианту осуществления 63, где ауристатин представляет собой MMAE или MMAF.
[0723] 65. Способ согласно варианту осуществления 63, где ауристатин представляет собой MMAE.
[0724] 66. Способ согласно варианту осуществления 35, где ADC, нацеливающийся на cMet, представляет собой соединение согласно структурной формуле (I):
| (I) | [D-L-XY-] n -Ab, |
[0725] или его соль, где
[0726] D представляет собой цитотоксическое и/или цитостатическое средство;
[0727] L представляет собой линкер;
[0728] Ab представляет собой антитело к cMet;
[0729] XY представляет собой ковалентную связь, связывающую линкер L с антителом Ab; и
[0730] n имеет значение, находящееся в диапазоне от 2 до 8.
[0731] 67. Способ согласно варианту осуществления 66, где n имеет значение, равняющееся 2, 3 или 4.
[0732] 68. Способ согласно варианту осуществления 66, где XY представляет собой связь, образованную с помощью аминогруппы антитела Ab к cMet.
[0733] 69. Способ согласно варианту осуществления 66, где XY представляет собой амид или тиoмочевину.
[0734] 70. Способ согласно варианту осуществления 66, где XY представляет собой связь, образованную с помощью сульфгидрильной группы антитела Ab к cMet.
[0735] 71. Способ согласно варианту осуществления 66, где XY представляет собой простой тиоэфир.
[0736] 72. Способ согласно варианту осуществления 66, где соединение согласно структурной формуле (I) характеризуется структурой формулы (IIa):
[0738]
[0739] 73. Способ согласно варианту осуществления 72, где антитело Ab к cMet представляет собой ABT-700.
[0740] 74. Способ согласно варианту осуществления 66, где соединение структурной формулы (I) характеризуется следующей структурой: .
[0741] 75. Способ согласно варианту осуществления 74, где антитело Ab к cMet представляет собой ABT-700.
[0742] 76. Способ согласно варианту осуществления 66, где соединение согласно структурной формуле (I) характеризуется структурой формулы (IIb):
[0744] 77. Способ согласно варианту осуществления 76, где антитело Ab к cMet представляет собой ABT-700.
[0745] 78. Способ согласно варианту осуществления 66, где соединение согласно структурной формуле (I) характеризуется следующей структурой:
[0746] 79. Способ согласно варианту осуществления 78, где антитело Ab к cMet представляет собой ABT-700.
[0747] 80. Способ лечения пациента-человека, у которого диагностирован немелкоклеточный рак легкого ("NSCLC"), предусматривающий введение пациенту конъюгата антитела к cMet и лекарственного средства ("ADC") в количестве и в течение периода времени, достаточных для обеспечения терапевтического эффекта.
[0748] 81. Способ согласно варианту осуществления 80, где ткань опухоли, представляющей собой NSCLC, характеризуется иммуногистохимическим ("IHC") H-показателем, превышающим или равным 150, при измерении согласно протоколу окрашивания с помощью ABBV-ADC, нацеливающегося на cMet, или IHC-показателем, составляющим 2+.
[0749] 82. Способ согласно варианту осуществления 80, где ткань опухоли, представляющей собой NSCLC, характеризуется иммуногистохимическим ("IHC") H-показателем, превышающим 225, при измерении согласно протоколу окрашивания с помощью ABBV-ADC, нацеливающегося на cMet, или IHC-показателем, составляющим 3+.
[0750] 83. Способ согласно варианту осуществления 80, где ткань опухоли, представляющей собой NSCLC, характеризуется IHC-показателем, составляющим 2+, и/или H-показателем, составляющим от 150 до 224, при измерении согласно протоколу окрашивания с помощью ABBV-ADC, нацеливающегося на cMet.
[0751] 84. Способ согласно варианту осуществления 80, где ткань опухоли, представляющей собой NSCLC, характеризуется IHC-показателем, составляющим 3+, и/или H-показателем, превышающим 225, при измерении согласно протоколу окрашивания с помощью ABBV-ADC, нацеливающегося на cMet.
[0752] 85. Способ согласно любому из вариантов осуществления 80, 81 и 94, где NSCLC представляет собой неплоскоклеточную карциному.
[0753] 86. Способ согласно любому из вариантов осуществления 80, 81 и 83, где NSCLC представляет собой плоскоклеточную карциному.
[0754] 87. Способ согласно варианту осуществления 80, где гистология NSCLC представляет собой NSCLC без дополнительных уточнений (NSCLC-NOS).
[0755] 88. Способ согласно варианту осуществления 80, где опухоль, представляющая собой NSCLC, характеризуется делециями в экзоне 19 или заменами (L858R) в экзоне 21 рецептора эпителиального фактора роста ("EGFR"), которые выявляют с помощью одобренного FDA теста, такого как cobas® EGFR Mutation Test v2 или therascreen® EGFR RGQ PCR Kit.
[0756] 89. Способ согласно любому из вариантов осуществления 80-88, где опухоль, представляющая собой NSCLC, является устойчивой к предшествующему лечению с помощью ингибитора микротрубочек.
[0757] 90. Способ согласно любому из вариантов осуществления 80-89, где опухоль, представляющая собой NSCLC, является устойчивой к предшествующему лечению с помощью антитела к cMet.
[0758] 91. Способ согласно любому из вариантов осуществления 80-90, где ADC, нацеливающийся на cMet, вводят в виде монотерапии.
[0759] 92. Способ согласно любому из вариантов осуществления 80-91, где ADC, нацеливающийся на cMet, вводят в дополнение к дополнительному противораковому средству, при этом дополнительное средство вводят согласно его режиму дозирования, одобренному FDA.
[0760] 93. Способ согласно варианту осуществления 92, где дополнительное противораковое средство представляет собой ингибитор рецептора эпидермального фактора роста ("EGFR").
[0761] 94. Способ согласно варианту осуществления 93, где дополнительное противораковое средство представляет собой эрлотиниб, вводимый один раз в сутки.
[0762] 95. Способ согласно варианту осуществления 92, где опухоль, представляющая собой NSCLC, характеризуется делециями в экзоне 18 или заменами (L858R) в экзоне 21 EGFR, которые выявляют с помощью одобренного FDA теста, и дополнительное противораковое средство представляет собой ингибитор EGFR, имеющих такие делеции или замены.
[0763] 96. Способ согласно варианту осуществления 95, где дополнительное противораковое средство представляет собой афатиниб.
[0764] 97. Способ согласно варианту осуществления 92, где дополнительное противораковое средство представляет собой ингибитор микротрубочек.
[0765] 98. Способ согласно варианту осуществления 97, где дополнительное противораковое средство выбрано из группы, состоящей из кабазитаксела, колцемида, колхицина, криптофицина, демоколцина, доцетаксела, нокодазола, паклитаксела, таккалонолида, таксана и винбластина.
[0766] 99. Способ согласно варианту осуществления 92, где дополнительное противораковое средство представляет собой ингибитор PD1.
[0767] 100. Способ согласно варианту осуществления 99, где ингибитор PD1 представляет собой антитело к PD1.
[0768] 101. Способ согласно варианту осуществления 100, где антитело к PD1 представляет собой ниволумаб.
[0769] 102. Способ согласно любому из вариантов осуществления 80-101, где ADC, нацеливающийся на cMet, вводят в количестве, находящемся в диапазоне от приблизительно 0,15 мг/кг до приблизительно 3,3 мг/кг, один раз в 3 недели.
[0770] 103. Способ согласно варианту осуществления 102, где ADC, нацеливающийся на cMet, вводят в количестве, составляющем приблизительно 2,7 мг/кг, один раз в 3 недели.
[0771] 104. Способ согласно любому из вариантов осуществления 80-101, где ADC, нацеливающийся на cMet, вводят в количестве, находящемся в диапазоне от приблизительно 0,15 мг/кг до приблизительно 3,3 мг/кг, один раз в 2 недели.
[0772] 105. Способ согласно варианту осуществления 104, где ADC, нацеливающийся на cMet, вводят в количестве, составляющем приблизительно 1,6 мг/кг, один раз в 2 недели. Добавить зависимый для 1,9.
[0773] 106. Способ согласно варианту осуществления 104, где ADC, нацеливающийся на cMet, вводят в количестве, составляющем приблизительно 1,9 мг/кг, один раз в 2 недели.
[0774] 107. Способ согласно любому из вариантов осуществления 80-105, где ADC, нацеливающийся на cMet, содержит антитело к cMet, связанное с цитостатическим и/или цитотоксическим средством посредством линкера.
[0775] 108. Способ согласно варианту осуществления 107, где антитело к cMet представляет собой полноразмерное антитело.
[0776] 109. Способ согласно варианту осуществления 109, где антитело к cMet интернализируется и характеризуется значением кажущейся аффинности EC50, составляющим менее приблизительно 10 наномоль/л, предпочтительно от приблизительно 1 пикомоль/л до 10 наномоль/л.
[0777] 110. Способ согласно варианту осуществления 109, где антитело к cMet связывает человеческий cMet in vitro со значением кажущейся аффинности EC50, составляющим приблизительно 0,3 нмоль/л.
[0778] 111. Способ варианта осуществления согласно любому из вариантов осуществления 107-110, где антитело к cMet содержит VH-цепь, содержащую три CDR, а именно CDR № 1 VH (SEQ ID NO: 112), CDR № 2 VH (SEQ ID NO: 113) и CDR № 3 VH (SEQ ID NO: 114); VL-цепь, содержащую три CDR, а именно CDR № 1 VL (SEQ ID NO: 115), CDR № 2 VL (SEQ ID NO: 116) и CDR № 3 VL (SEQ ID NO: 117); и модифицированную шарнирную область с SEQ ID NO: 170.
[0779] 112. Способ согласно варианту осуществления 111, где антитело к cMet представляет собой IgG1.
[0780] 113. Способ согласно варианту осуществления 111, где антитело к cMet содержит VH-цепь с SEQ ID NO: 78; VL-цепь с SEQ ID NO: 79 и модифицированную шарнирную область с SEQ ID NO: 170.
[0781] 114. Способ согласно варианту осуществления 113, где антитело к cMet представляет собой IgG1.
[0782] 115. Способ согласно варианту осуществления 111, где антитело к cMet содержит тяжелую цепь с SEQ ID NO: 86 и легкую цепь с SEQ ID NO: 87.
[0783] 116. Способ согласно варианту осуществления 111, где антитело к cMet содержит тяжелую цепь с SEQ ID NO: 171 и легкую цепь с SEQ ID NO: 172.
[0784] 117. Способ согласно варианту осуществления 110, где антитело к cMet содержит содержит шесть CDR антитела STI-D0602/STI-0602.
[0785] 118. Способ согласно варианту осуществления 117, где антитело к cMet представляет собой IgG1.
[0786] 119. Способ согласно варианту осуществления 104, где антитело к cMet содержит VH-цепь STI-D0602/STI-0602 и VL-цепь STI-D0602/STI-0602.
[0787] 120. Способ согласно варианту осуществления 119, где антитело к cMet представляет собой IgG1.
[0788] 121. Способ согласно варианту осуществления 107, где линкер является расщепляемым лизосомальным ферментом.
[0789] 122. Способ согласно варианту осуществления 121, где лизосомальный фермент представляет собой катепсин B.
[0790] 123. Способ согласно варианту осуществления 122, где линкер предусматривает сегмент согласно одной или нескольким структурным формулам (IVa), (IVb), (IVc) и (IVd):
[0791] или его соль, где
[0792] пептид представляет собой пептид (проиллюстрированный C→N и без демонстрации карбокси- и амино- "концов"), расщепляемый катепсином В;
[0793] Т представляет собой полимер, содержащий одно или несколько этиленгликолевых звеньев или алкиленовую цепь или их комбинации;
[0794] Ra выбран из водорода, алкила, сульфоната и метилсульфоната;
[0795] p представляет собой целое число в диапазоне от 0 до 5;
[0796] q равняется 0 или 1;
[0797] x равняется 0 или 1;
[0798] y равняется 0 или 1;
[0799] представляет собой точку присоединения линкера к цитотоксическому и/или цитостатическому средству; и
[0800] * представляет собой точку присоединения линкера к остальной части.
[0801] 124. Способ согласно варианту осуществления 123, где пептид выбран из группы, состоящей из Val-Cit; Cit-Val; Ala-Ala; Ala-Cit; Cit-Ala; Asn-Cit; Cit-Asn; Cit-Cit; Val-Glu; Glu-Val; Ser-Cit; Cit-Ser; Lys-Cit; Cit-Lys; Asp-Cit; Cit-Asp; Ala-Val; и Val-Ala и их солей.
[0802] 125. Способ согласно варианту осуществления 121, где лизосомальный фермент представляет собой β-глюкуронидазу.
[0803] 126. Способ согласно варианту осуществления 107, где ADC, нацеливающийся на cMet, характеризуется средним соотношением лекарственного средства и антитела ("DAR"), находящимся в диапазоне 0-10.
[0804] 127. Способ согласно варианту осуществления 107, где ADC, нацеливающийся на cMet, характеризуется средним соотношением лекарственного средства и антитела ("DAR"), находящимся в диапазоне 1-4.
[0805] 128. Способ согласно варианту осуществления 127, где ADC, нацеливающийся на cMet, характеризуется DAR, находящимся в диапазоне 2-4.
[0806] 129. Способ согласно варианту осуществления 127, где ADC, нацеливающийся на cMet, характеризуется DAR, составляющим приблизительно 3,1.
[0807] 130. Способ согласно варианту осуществления 127, где ADC, нацеливающийся на cMet, характеризуется соотношением E2 и E4 ADC, составляющим приблизительно 1:1.
[0808] 131. Способ согласно варианту осуществления 127, где ADC, нацеливающийся на cMet, характеризуется DAR, составляющим 3,0.
[0809] 132. Способ согласно любому из вариантов осуществления 107-131, где цитостатическое и/или цитотоксическое средство представляет собой ингибитор микротрубочек.
[0810] 133. Способ согласно варианту осуществления 132, где ингибитор микротрубочек представляет собой ауристатин.
[0811] 134. Способ согласно варианту осуществления 133, где ауристатин представляет собой MMAE или MMAF.
[0812] 135. Способ согласно варианту осуществления 134, где ауристатин представляет собой MMAE.
[0813] 136. Способ согласно любому из вариантов осуществления 107-135, где ADC, нацеливающийся на cMet, представляет собой соединение согласно структурной формуле (I):
| (I) | [D-L-XY-] n -Ab, |
[0814] или его соль, где
[0815] D представляет собой цитотоксическое и/или цитостатическое средство;
[0816] L представляет собой линкер;
[0817] Ab представляет собой антитело к cMet;
[0818] XY представляет собой ковалентную связь, связывающую линкер L с антителом Ab; и
[0819] n имеет значение, находящееся в диапазоне от 2 до 8.
[0820] 137. Способ согласно варианту осуществления 136, где n имеет значение, равняющееся 2, 3 или 4.
[0821] 138. Способ согласно варианту осуществления 136, где XY представляет собой связь, образованную с помощью аминогруппы антитела Ab к cMet.
[0822] 139. Способ согласно варианту осуществления 136, где XY представляет собой амид или тиoмочевину.
[0823] 140. Способ согласно варианту осуществления 136, где XY представляет собой связь, образованную с помощью сульфгидрильной группы антитела Ab к cMet.
[0824] 141. Способ согласно варианту осуществления 136, где XY представляет собой простой тиоэфир.
[0825] 142. Способ согласно варианту осуществления 136, где соединение согласно структурной формуле (I) характеризуется структурой формулы (IIa):
[0827]
[0828] 143. Способ согласно варианту осуществления 142, где антитело Ab к cMet представляет собой ABT-700.
[0829] 144. Способ согласно варианту осуществления 136, где соединение структурной формулы (I) характеризуется следующей структурой: .
[0830] 145. Способ согласно варианту осуществления 144, где антитело Ab к cMet представляет собой ABT-700.
[0831] 146. Способ согласно варианту осуществления 136, где соединение согласно структурной формуле (I) характеризуется структурой формулы (IIb):
[0833] 147. Способ согласно варианту осуществления 146, где антитело Ab к cMet представляет собой ABT-700.
[0834] 148. Способ согласно варианту осуществления 136, где соединение согласно структурной формуле (I) характеризуется следующей структурой: .
[0835] 149. Способ согласно варианту осуществления 148, где антитело Ab к cMet представляет собой ABT-700.
[0836] 150. Способ лечения субъекта-человека, у которого имеется опухоль, представляющая собой NSCLC, с IHC-показателем, составляющим по меньшей мере 2+, у по меньшей мере одного биоптата опухоли от субъекта, предусматривающий введение субъекту ADC, нацеливающегося на cMet, в количестве, составляющем приблизительно 2,7 мг/кг, один раз в две недели или один раз в 3 недели, где ADC, нацеливающийся на cMet, представляет собой соединение согласно следующей структуре: .
[0837] или его фармацевтически приемлемую соль, где n имеет значение, находящееся в диапазоне от 2 до 4, и Ab представляет собой полноразмерное антитело к cMet.
[0838] 151. Способ согласно варианту осуществления 150, где антитело к cMet представляет собой ABT-700.
[0839] 152. Способ согласно варианту осуществления 151, где ADC, нацеливающийся на cMet, вводят в виде монотерапии.
[0840] 153. Способ согласно варианту осуществления 150, где ADC, нацеливающийся на cMet, вводят в дополнение к дополнительному противораковому средству.
[0841] 154. Способ согласно варианту осуществления 153, где дополнительное противораковое средство представляет собой эрлотиниб.
[0842] 155. Способ согласно варианту осуществления 153, где дополнительное противораковое средство представляет собой ниволумаб.
[0843] 156. Способ согласно варианту осуществления 153, где опухоль, представляющая собой NSCLC, характеризуется делециями в экзоне 19 или заменами (L858R) в экзоне 21 EGFR, которые выявляют с помощью одобренного FDA теста, и дополнительное противораковое средство представляет собой афатиниб.
[0844] 157. Способ согласно любому из вариантов осуществления 1-34, где лекарственное средство представляет собой пирролoбензодиазепин (PBD), предпочтительно PBD ((S)-2-(4-аминофенил)-7-метокси-8-(3-(((S)-7-метокси-2-(4-метоксифенил)-5-оксо-5,11a-дигидро-1H-бензо[e]пирролo[1,2-a][1,4]диазепин-8-ил)окси)пропокси)-1H-бензо[e]пирролo[1,2-a][1,4]диазепин-5(11aH)-он); SG2000 (SJG-136; (11aS,11a'S)-8,8'-(пропан-1,3-диилбис(окси))бис(7-метокси-2-метилен-2,3-дигидро-1H-бензо[e]пирролo[1,2-a][1,4]диазепин-5(11aH)-он)) (или SGD-1882).
[0845] 158. Способ согласно любому из вариантов осуществления 35-56 и 62, где лекарственное средство представляет собой пирролoбензодиазепин (PBD), предпочтительно SGD-1882.
[0846] 159. Способ согласно любому из вариантов осуществления 66-71 и 76-78, где лекарственное средство представляет собой пирролoбензодиазепин (PBD), предпочтительно SGD-1882.
[0847]
[0848] 160. Способ согласно варианту осуществления 66, где соединение формулы I характеризуется следующей структурой:
[0849] где Ab представляет собой антитело, и n равняется 2.
[0850] 161. Способ согласно варианту осуществления 160, где антитело представляет собой ABT-700 или ABT-700 (S238C).
[0851] 162. Способ согласно любому из вариантов осуществления 80-131, где лекарственное средство представляет собой пирролoбензодиазепин (PBD), предпочтительно SGD-1882.
[0852] 163. Способ согласно варианту осуществления 107, где цитостатическое и/или цитотоксическое средство представляет собой связывающееся с малой бороздой ДНК-сшивающее средство.
[0853] 164. Способ согласно варианту осуществления 163, где связывающееся с малой бороздой ДНК-сшивающее средство представляет собой пирролoбензодиазепин (PBD), предпочтительно SGD-1882.
[0854] 165. Способ согласно варианту осуществления 107, где ADC, нацеливающийся на cMet, представляет собой соединение формулы
[0855] где Ab представляет собой ABT-700 или ABT-700 (S238C), и n равняется 2.
[0856] 166. Способ лечения субъекта-человека, у которого имеется опухоль, представляющая собой NSCLC, с IHC-показателем, составляющим по меньшей мере 2+, у по меньшей мере одного биоптата опухоли от субъекта, предусматривающий введение субъекту ADC, нацеливающегося на cMet, в количестве, составляющем приблизительно 2,7 мг/кг, один раз в две недели или один раз в 3 недели, где ADC, нацеливающийся на cMet, представляет собой соединение согласно следующей структуре:
[0857] или его фармацевтически приемлемую соль, где n равняется 2, и Ab представляет собой полноразмерное антитело к cMet.
[0858] 167. Способ согласно варианту осуществления 166, где антитело к cMet представляет собой ABT-700 или ABT-700 (S238C).
[0859] 168. Способ согласно варианту осуществления 167, где ADC, нацеливающийся на cMet, вводят в виде монотерапии.
[0860] 169. Способ согласно варианту осуществления 166, где ADC, нацеливающийся на cMet, вводят в дополнение к дополнительному противораковому средству.
[0861] 170. Способ согласно варианту осуществления 169, где дополнительное противораковое средство представляет собой эрлотиниб.
[0862] 171. Способ согласно варианту осуществления 169, где дополнительное противораковое средство представляет собой ниволумаб.
[0863] 172. Способ согласно варианту осуществления 169, где опухоль, представляющая собой NSCLC, характеризуется делециями в экзоне 19 или заменами (L858R) в экзоне 21 EGFR, которые выявляют с помощью одобренного FDA теста, и дополнительное противораковое средство представляет собой афатиниб.
[0864] 173. Способ лечения субъекта-человека, у которого имеется аденокарцинома, представляющая собой NSCLC, предусматривающий введение субъекту ABBV-399 один раз в 3 недели в количестве, составляющем приблизительно 2,7 мг/кг, где аденокарцинома характеризуется H-показателем, составляющим по меньшей мере 225.
[0865] 174. Способ лечения субъекта-человека, у которого имеется аденокарцинома, представляющая собой NSCLC, предусматривающий введение субъекту ABBV-399 один раз в 3 недели в количестве, составляющем приблизительно 2,7 мг/кг, где аденокарцинома характеризуется IHC-показателем, составляющим 3+.
[0866] 175. Способ согласно любому из вариантов осуществления 173 и 174, где ABBV-399 вводят в дополнение к эрлотинибу, при этом эрлотиниб вводят один раз в сутки в количестве 150 мг.
[0867] 176. Способ лечения субъекта-человека, у которого имеется плоскоклеточная карцинома, представляющая собой NSCLC, предусматривающий введение субъекту ABBV-399 один раз в 2 недели в количестве, составляющем приблизительно 1,6 мг/кг, где плоскоклеточная карцинома характеризуется H-показателем, составляющим от 150 до 224.
[0868] 177. Способ лечения субъекта-человека, у которого имеется аденокарцинома, представляющая собой NSCLC, предусматривающий введение субъекту ABBV-399 один раз в 2 недели в количестве, составляющем приблизительно 1,6 мг/кг, где аденокарцинома характеризуется IHC-показателем, составляющим 2+.
[0869] 178. Способ лечения субъекта-человека, у которого имеется плоскоклеточная карцинома, представляющая собой NSCLC, предусматривающий введение субъекту ABBV-399 один раз в 2 недели в количестве, составляющем приблизительно 1,9 мг/кг, где плоскоклеточная карцинома характеризуется H-показателем, составляющим от 150 до 224.
[0870] 179. Способ лечения субъекта-человека, у которого имеется плоскоклеточная карцинома, представляющая собой NSCLC, предусматривающий введение субъекту ABBV-399 один раз в 2 недели в количестве, составляющем приблизительно 1,9 мг/кг, где плоскоклеточная карцинома характеризуется IHC-показателем, составляющим 2+.
[0871] 180. Способ лечения субъекта-человека, у которого имеется аденокарцинома, представляющая собой NSCLC, предусматривающий введение субъекту ABT-700 (S238C)-PBD один раз в 3 недели в количестве, составляющем приблизительно 2,7 мг/кг, где аденокарцинома характеризуется H-показателем, составляющим по меньшей мере 225.
[0872] 181. Способ лечения субъекта-человека, у которого имеется аденокарцинома, представляющая собой NSCLC, предусматривающий введение субъекту ABT-700 (S238C)-PBD один раз в 3 недели в количестве, составляющем приблизительно 2,7 мг/кг, где аденокарцинома характеризуется IHC-показателем, составляющим 3+.
[0873] 182. Способ согласно любому из вариантов осуществления 180-181, где ABT-700 (S238C)-PBD вводят в дополнение к эрлотинибу, при этом эрлотиниб вводят один раз в сутки в количестве 150 мг.
[0874] 183. Способ лечения субъекта-человека, у которого имеется плоскоклеточная карцинома, представляющая собой NSCLC, предусматривающий введение субъекту ABT-700 (S238C)-PBD один раз в 2 недели в количестве, составляющем приблизительно 1,6 мг/кг, где плоскоклеточная карцинома характеризуется H-показателем, составляющим от 150 до 224.
[0875] 184. Способ лечения субъекта-человека, у которого имеется плоскоклеточная карцинома, представляющая собой NSCLC, предусматривающий введение субъекту ABT-700 (S238C)-PBD один раз в 2 недели в количестве, составляющем приблизительно 1,6 мг/кг, где плоскоклеточная карцинома характеризуется IHC-показателем, составляющим 2+.
[0876] 185. Способ лечения субъекта-человека, у которого имеется плоскоклеточная карцинома, представляющая собой NSCLC, предусматривающий введение субъекту ABT-700 (S238C)-PBD один раз в 2 недели в количестве, составляющем приблизительно 1,6 мг/кг, где плоскоклеточная карцинома характеризуется H-показателем, составляющим от 150 до 224.
186. Способ лечения субъекта-человека, у которого имеется плоскоклеточная карцинома, представляющая собой NSCLC, предусматривающий введение субъекту ABT-700 (S238C)-PBD один раз в 2 недели в количестве, составляющем приблизительно 1,9 мг/кг, где плоскоклеточная карцинома характеризуется IHC-показателем, составляющим 2+.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ABBVIE BIOTHERAPEUTICS INC.
ABBVIE INC.
<120> КОНЪЮГАТЫ АНТИТЕЛА К CMET И ЛЕКАРСТВЕННОГО СРЕДСТВА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
<130> 12252.0206-00304
<140>
<141>
<150> 62/337,796
<151> 2016-05-17
<160> 178
<170> PatentIn версия 3.5
<210> 1
<211> 8
<212> БЕЛОК
<213> Mus musculus
<400> 1
Gly Tyr Ile Phe Thr Ala Tyr Thr
1 5
<210> 2
<211> 8
<212> БЕЛОК
<213> Mus musculus
<400> 2
Ile Lys Pro Asn Asn Gly Leu Ala
1 5
<210> 3
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 3
Ala Arg Ser Glu Ile Thr Thr Glu Phe Asp Tyr
1 5 10
<210> 4
<211> 8
<212> БЕЛОК
<213> Mus musculus
<400> 4
Gly Tyr Ser Phe Thr Asp Tyr Thr
1 5
<210> 5
<211> 8
<212> БЕЛОК
<213> Mus musculus
<400> 5
Ile Asn Pro Tyr Asn Gly Gly Thr
1 5
<210> 6
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 6
Ala Arg Glu Glu Ile Thr Lys Asp Phe Asp Phe
1 5 10
<210> 7
<211> 8
<212> БЕЛОК
<213> Mus musculus
<400> 7
Gly Tyr Thr Phe Thr Asp Tyr Asn
1 5
<210> 8
<211> 8
<212> БЕЛОК
<213> Mus musculus
<400> 8
Ile Asn Pro Asn Asn Gly Gly Thr
1 5
<210> 9
<211> 14
<212> БЕЛОК
<213> Mus musculus
<400> 9
Ala Arg Gly Arg Tyr Val Gly Tyr Tyr Tyr Ala Met Asp Tyr
1 5 10
<210> 10
<211> 10
<212> БЕЛОК
<213> Mus musculus
<400> 10
Glu Ser Val Asp Ser Tyr Ala Asn Ser Phe
1 5 10
<210> 11
<211> 3
<212> БЕЛОК
<213> Mus musculus
<400> 11
Arg Ala Ser
1
<210> 12
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 12
Gln Gln Ser Lys Glu Asp Pro Leu Thr
1 5
<210> 13
<211> 10
<212> БЕЛОК
<213> Mus musculus
<400> 13
Glu Ser Ile Asp Thr Tyr Gly Asn Ser Phe
1 5 10
<210> 14
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 14
Gln Gln Ser Asn Glu Asp Pro Phe Thr
1 5
<210> 15
<211> 6
<212> БЕЛОК
<213> Mus musculus
<400> 15
Glu Asn Ile Tyr Ser Asn
1 5
<210> 16
<211> 3
<212> БЕЛОК
<213> Mus musculus
<400> 16
Ala Ala Thr
1
<210> 17
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 17
Gln His Phe Trp Gly Pro Pro Tyr Thr
1 5
<210> 18
<211> 118
<212> БЕЛОК
<213> Mus musculus
<400> 18
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Thr Ser Gly Tyr Ile Phe Thr Ala Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ser Leu Gly Glu Ser Leu Asp Trp Ile
35 40 45
Gly Gly Ile Lys Pro Asn Asn Gly Leu Ala Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Asp Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Glu Ile Thr Thr Glu Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ala Leu Thr Val Ser Ser
115
<210> 19
<211> 118
<212> БЕЛОК
<213> Mus musculus
<400> 19
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Met Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asp Tyr
20 25 30
Thr Leu Asn Trp Val Lys Gln Ser His Gly Lys Thr Leu Glu Trp Ile
35 40 45
Gly Leu Ile Asn Pro Tyr Asn Gly Gly Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Glu Ile Thr Lys Asp Phe Asp Phe Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 20
<211> 121
<212> БЕЛОК
<213> Mus musculus
<400> 20
Glu Val Leu Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Pro Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Asn Met Asp Trp Val Lys Gln Ser His Gly Met Ser Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asn Gly Gly Thr Ile Phe Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Arg Tyr Val Gly Tyr Tyr Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 21
<211> 111
<212> БЕЛОК
<213> Mus musculus
<400> 21
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Ser Tyr
20 25 30
Ala Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Asp Asp Val Ala Thr Tyr Tyr Cys Gln Gln Ser Lys
85 90 95
Glu Asp Pro Leu Thr Phe Gly Ser Gly Thr Lys Leu Glu Met Lys
100 105 110
<210> 22
<211> 111
<212> БЕЛОК
<213> Mus musculus
<400> 22
Gly Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Val Ser Glu Ser Ile Asp Thr Tyr
20 25 30
Gly Asn Ser Phe Ile His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Asp Asp Ser Ala Thr Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Glu Asp Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Met Lys
100 105 110
<210> 23
<211> 107
<212> БЕЛОК
<213> Mus musculus
<400> 23
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Val Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Ala Ala Thr Asn Leu Val Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Tyr Ser Leu Lys Ile Asn Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Gly Ser Tyr Tyr Cys Gln His Phe Trp Gly Pro Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 24
<211> 24
<212> ДНК
<213> Mus musculus
<400> 24
ggatacatat tcactgcata cacc 24
<210> 25
<211> 24
<212> ДНК
<213> Mus musculus
<400> 25
attaaaccaa acaatggtct tgct 24
<210> 26
<211> 33
<212> ДНК
<213> Mus musculus
<400> 26
gcaagatctg agattacgac ggaatttgac tac 33
<210> 27
<211> 24
<212> ДНК
<213> Mus musculus
<400> 27
ggttattcat tcactgacta cacc 24
<210> 28
<211> 24
<212> ДНК
<213> Mus musculus
<400> 28
attaatcctt acaatggtgg tact 24
<210> 29
<211> 33
<212> ДНК
<213> Mus musculus
<400> 29
gcaagagagg aaattacgaa ggactttgat ttc 33
<210> 30
<211> 24
<212> ДНК
<213> Mus musculus
<400> 30
ggatacacat tcactgacta caac 24
<210> 31
<211> 24
<212> ДНК
<213> Mus musculus
<400> 31
attaatccta acaatggtgg tact 24
<210> 32
<211> 42
<212> ДНК
<213> Mus musculus
<400> 32
gcaagaggga ggtatgttgg ttactactat gctatggact ac 42
<210> 33
<211> 30
<212> ДНК
<213> Mus musculus
<400> 33
gaaagtgttg atagttatgc caatagtttt 30
<210> 34
<211> 9
<212> ДНК
<213> Mus musculus
<400> 34
cgtgcatcc 9
<210> 35
<211> 27
<212> ДНК
<213> Mus musculus
<400> 35
cagcaaagta aggaggatcc tctcacg 27
<210> 36
<211> 30
<212> ДНК
<213> Mus musculus
<400> 36
gaaagtattg atacttatgg caatagtttt 30
<210> 37
<211> 27
<212> ДНК
<213> Mus musculus
<400> 37
cagcaaagta atgaggatcc attcacg 27
<210> 38
<211> 18
<212> ДНК
<213> Mus musculus
<400> 38
gagaatattt acagtaat 18
<210> 39
<211> 9
<212> ДНК
<213> Mus musculus
<400> 39
gctgcaaca 9
<210> 40
<211> 27
<212> ДНК
<213> Mus musculus
<400> 40
caacattttt ggggtcctcc gtacacg 27
<210> 41
<211> 354
<212> ДНК
<213> Mus musculus
<400> 41
gaggtccagc tgcaacagtc tggacctgag ctggtgaagc ctggggcttc agtgaagata 60
tcctgcaaga cttctggata catattcact gcatacacca tgcactgggt gaggcagagc 120
cttggagaga gccttgactg gattggaggt attaaaccaa acaatggtct tgctaactac 180
aaccagaagt tcaagggcaa ggccacattg actgtagaca agtcctccag cacagcctac 240
atggacctcc gcagcctgac atctgaggat tctgcagtct attactgtgc aagatctgag 300
attacgacgg aatttgacta ctggggccaa ggcaccgctc tcacagtctc ctca 354
<210> 42
<211> 354
<212> ДНК
<213> Mus musculus
<400> 42
gaggtccagc tgcaacagtc tggacctgaa ctggtgaagc ctggagcttc aatgaagatt 60
tcctgcaagg cttctggtta ttcattcact gactacaccc tgaactgggt gaagcagagc 120
catggaaaga cccttgagtg gattggactt attaatcctt acaatggtgg tactacctac 180
aaccagaagt tcaagggcaa ggccacatta actgtagaca agtcatccag cacagcctac 240
atggagctcc tcagtctgac atctgaggac tctgcagtct attactgtgc aagagaggaa 300
attacgaagg actttgattt ctggggccaa ggcaccactc tcacagtctc ctca 354
<210> 43
<211> 363
<212> ДНК
<213> Mus musculus
<400> 43
gaggtcctgc tgcaacagtc tggacctgag ctggtgaagc ctggggcttc agtgaagata 60
ccctgcaagg cttctggata cacattcact gactacaaca tggactgggt gaagcagagc 120
catggaatga gccttgagtg gattggagat attaatccta acaatggtgg tactatcttc 180
aaccagaagt tcaagggcaa ggccacattg actgtagaca agtcctccag cacagcctac 240
atggagctcc gcagcctgac atctgaggac actgcagtct attactgtgc aagagggagg 300
tatgttggtt actactatgc tatggactac tggggtcaag gaacctcagt caccgtctcc 360
tca 363
<210> 44
<211> 333
<212> ДНК
<213> Mus musculus
<400> 44
gacattgtgc tgacccaatc tccagcttct ttggctgtgt ctctagggca gagggccacc 60
atatcctgca gagccagtga aagtgttgat agttatgcca atagttttat gcactggtac 120
cagcagaaac caggacagcc acccaaactc ctcatctatc gtgcatccaa cctagaatct 180
gggatccctg ccaggttcag tggcagtggg tctaggacag acttcaccct caccattaat 240
cctgtggagg ctgatgatgt tgcaacctat tactgtcagc aaagtaagga ggatcctctc 300
acgttcggct cggggacaaa attggaaatg aaa 333
<210> 45
<211> 333
<212> ДНК
<213> Mus musculus
<400> 45
ggcattgtgt tgacccaatc tccagcttct ttggctgtgt ctctaggaca gagggccacc 60
atatcctgca gagtcagtga aagtattgat acttatggca atagttttat acactggtac 120
cagcagaaac caggacagcc acccaaactc ctcatctatc gtgcatccaa cctagaatct 180
gggatccctg ccaggttcag tggcagtggg tctaggacag acttcaccct caccattaat 240
cctgtggagg ctgatgattc tgcaacctat tactgtcagc aaagtaatga ggatccattc 300
acgttcggct cggggacaaa gttggaaatg aaa 333
<210> 46
<211> 321
<212> ДНК
<213> Mus musculus
<400> 46
gacatccaga tgactcagtc tccagcctcc ctatctgtat ctgtgggaga aactgtcacc 60
atcacatgtc gagcaagtga gaatatttac agtaatttag catggtatca gcagaaacag 120
ggaaaatctc ctcagctcct ggtctatgct gcaacaaact tagtagatgg tgtgccatca 180
aggttcagtg gcagtggatc aggcacacag tattccctca agatcaacag cctgcagtct 240
gaagattttg ggagttatta ctgtcaacat ttttggggtc ctccgtacac gttcggaggg 300
gggaccaagc tggagataaa g 321
<210> 47
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический праймер для конститутивного гена рибосомного белка, крупного, P0 (RPL0)"
<400> 47
gaaactctgc attctcgctt cctg 24
<210> 48
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический праймер для конститутивного гена рибосомного белка, крупного, P0 (RPL0)"
<400> 48
aggactcgtt tgtacccgtt ga 22
<210> 49
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический праймер для конститутивного гена рибосомного белка, крупного, P0 (RPL0)"
<400> 49
tgcagattgg ctacccaact gttgca 26
<210> 50
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический праймер для HGF"
<400> 50
aacaatgcct ctggttcc 18
<210> 51
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический праймер для HGF"
<400> 51
cttgtagctg cgtcctttac 20
<210> 52
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический зонд для HGF"
<400> 52
ccttcaatag catgtcaagt ggagtga 27
<210> 53
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический праймер для c-Met"
<400> 53
cattaaagga gacctcacca tagctaat 28
<210> 54
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический праймер для c-Met"
<400> 54
cctgatcgag aaaccacaac ct 22
<210> 55
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический зонд для c-Met"
<400> 55
catgaagcga ccctctgatg tccca 25
<210> 56
<211> 8
<212> БЕЛОК
<213> Mus musculus
<400> 56
Gly Tyr Thr Phe Thr Ser Tyr Trp
1 5
<210> 57
<211> 8
<212> БЕЛОК
<213> Mus musculus
<400> 57
Ile Asn Pro Thr Thr Gly Ser Thr
1 5
<210> 58
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 58
Ala Ile Gly Gly Tyr Gly Ser Trp Phe Ala Tyr
1 5 10
<210> 59
<211> 7
<212> БЕЛОК
<213> Mus musculus
<400> 59
Ser Ser Val Ser Ser Thr Tyr
1 5
<210> 60
<211> 3
<212> БЕЛОК
<213> Mus musculus
<400> 60
Thr Thr Ser
1
<210> 61
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 61
His Gln Trp Ser Ser Tyr Pro Phe Thr
1 5
<210> 62
<211> 118
<212> БЕЛОК
<213> Mus musculus
<400> 62
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Thr Thr Gly Ser Thr Asp Tyr Asn Gln Lys Leu
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gly Gly Tyr Gly Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 63
<211> 108
<212> БЕЛОК
<213> Mus musculus
<400> 63
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Leu Thr Cys Ser Ala Ser Ser Ser Val Ser Ser Thr
20 25 30
Tyr Leu Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Leu Trp
35 40 45
Ile Tyr Thr Thr Ser Ile Leu Ala Ser Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu
65 70 75 80
Thr Glu Asp Ala Ala Ser Tyr Phe Cys His Gln Trp Ser Ser Tyr Pro
85 90 95
Phe Thr Phe Gly Ser Gly Thr Lys Leu Asp Ile Lys
100 105
<210> 64
<211> 24
<212> ДНК
<213> Mus musculus
<400> 64
ggctacactt ttacttccta ctgg 24
<210> 65
<211> 24
<212> ДНК
<213> Mus musculus
<400> 65
attaacccta ccactggttc tact 24
<210> 66
<211> 33
<212> ДНК
<213> Mus musculus
<400> 66
gcaataggag gatatgggtc ctggtttgct tac 33
<210> 67
<211> 21
<212> ДНК
<213> Mus musculus
<400> 67
tcaagtgtaa gttccaccta c 21
<210> 68
<211> 9
<212> ДНК
<213> Mus musculus
<400> 68
accacatcc 9
<210> 69
<211> 27
<212> ДНК
<213> Mus musculus
<400> 69
catcagtgga gtagttaccc attcacg 27
<210> 70
<211> 354
<212> ДНК
<213> Mus musculus
<400> 70
caggtccagc ttcagcagtc tggggctgaa ctggcaaaac ctggggcctc agtgaagatg 60
tcctgcaagg cttctggcta cacttttact tcctactgga tgaactgggt gaaacagagg 120
cctggacagg gtctggaatg gattggatac attaacccta ccactggttc tactgactac 180
aatcagaagt taaaggacaa ggccacattg actgcagaca aatcctccaa cacagcctac 240
atgcaactga gcagcctgac atctgaggac tctgcagtct attactgtgc aataggagga 300
tatgggtcct ggtttgctta ctggggccaa gggactctgg tcactgtctc tgca 354
<210> 71
<211> 324
<212> ДНК
<213> Mus musculus
<400> 71
caaattgttc tcacccagtc tccagcaatc atgtctgcat ctcctgggga gaaggtcacc 60
ttgacctgca gtgccagctc aagtgtaagt tccacctact tgtactggta ccagcagaag 120
ccaggatcct cccccaaact ctggatttat accacatcca tcctggcttc tggagtccct 180
gctcgcttca gtggcagtgg gtctgggacc tcttactctc tcacaatcag cagcatggag 240
actgaagatg ctgcctctta tttctgccat cagtggagta gttacccatt cacgttcggc 300
tcggggacaa agttggacat aaaa 324
<210> 72
<211> 8
<212> БЕЛОК
<213> Mus musculus
<400> 72
Gly Tyr Ile Phe Thr Ala Tyr Thr
1 5
<210> 73
<211> 8
<212> БЕЛОК
<213> Mus musculus
<400> 73
Ile Lys Pro Asn Asn Gly Leu Ala
1 5
<210> 74
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 74
Ala Arg Ser Glu Ile Thr Thr Glu Phe Asp Tyr
1 5 10
<210> 75
<211> 10
<212> БЕЛОК
<213> Mus musculus
<400> 75
Glu Ser Val Asp Ser Tyr Ala Asn Ser Phe
1 5 10
<210> 76
<211> 3
<212> БЕЛОК
<213> Mus musculus
<400> 76
Arg Ala Ser
1
<210> 77
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 77
Gln Gln Ser Lys Glu Asp Pro Leu Thr
1 5
<210> 78
<211> 118
<212> БЕЛОК
<213> Mus musculus
<400> 78
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Ala Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Lys Pro Asn Asn Gly Leu Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Glu Ile Thr Thr Glu Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 79
<211> 112
<212> БЕЛОК
<213> Mus musculus
<400> 79
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Glu Ser Val Asp Ser Tyr
20 25 30
Ala Asn Ser Phe Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Thr Arg Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Lys
85 90 95
Glu Asp Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
<210> 80
<211> 118
<212> БЕЛОК
<213> Mus musculus
<400> 80
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Ala Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Lys Pro Asn Asn Gly Leu Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Glu Ile Thr Thr Glu Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 81
<211> 111
<212> БЕЛОК
<213> Mus musculus
<400> 81
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Glu Ser Val Asp Ser Tyr
20 25 30
Ala Asn Ser Phe Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Thr Arg Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Lys
85 90 95
Glu Asp Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 82
<211> 327
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 82
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Cys His Cys Pro Pro Cys Pro Ala
100 105 110
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
115 120 125
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
130 135 140
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
145 150 155 160
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
165 170 175
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
180 185 190
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
195 200 205
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
210 215 220
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
225 230 235 240
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
245 250 255
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
260 265 270
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
275 280 285
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
290 295 300
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
305 310 315 320
Ser Leu Ser Leu Ser Pro Gly
325
<210> 83
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 83
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 84
<211> 327
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 84
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Phe
20 25 30
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
35 40 45
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
50 55 60
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
65 70 75 80
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
85 90 95
Val Glu Pro Lys Ser Cys Asp Cys His Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
195 200 205
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Pro Gly Lys
325
<210> 85
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 85
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
1 5 10 15
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
20 25 30
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
35 40 45
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
50 55 60
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
65 70 75 80
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
85 90 95
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 86
<211> 445
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 86
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Ala Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Lys Pro Asn Asn Gly Leu Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Glu Ile Thr Thr Glu Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Cys His
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 87
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 87
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Glu Ser Val Asp Ser Tyr
20 25 30
Ala Asn Ser Phe Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Thr Arg Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Lys
85 90 95
Glu Asp Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 88
<211> 446
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 88
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Ala Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Lys Pro Asn Asn Gly Leu Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Glu Ile Thr Thr Glu Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Cys His
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 89
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 89
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Glu Ser Val Asp Ser Tyr
20 25 30
Ala Asn Ser Phe Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Thr Arg Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Lys
85 90 95
Glu Asp Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 90
<211> 1395
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полинуклеотид"
<400> 90
atgggatggt cttggatctt tctgctgttt ctgtctggta ctgctggtgt gctgagccag 60
gtccagctgg tgcaatccgg cgcagaggtg aagaagccag gcgcttccgt gaaggtgagc 120
tgtaaggcct ctggctacat cttcacagca tacaccatgc actgggtgag gcaagctcct 180
gggcagggac tggagtggat gggatggatt aaacccaaca atgggctggc caactacgcc 240
cagaaattcc agggtagggt cactatgaca agggatacca gcatcagcac cgcatatatg 300
gagctgagca ggctgaggtc tgacgacact gctgtctatt attgcgccag gagcgaaatt 360
acaacagaat tcgattactg ggggcagggc accctggtga ccgtgtcctc tgccagcacc 420
aagggcccaa gcgtgttccc cctggccccc agcagcaaga gcaccagcgg cggcacagcc 480
gccctgggct gcctggtgaa ggactacttc cccgagcccg tgaccgtgtc ctggaacagc 540
ggagccctca cttctggagt tcataccttc ccagcagtat tgcagagcag tggcctgtat 600
tcactgtctt ccgtcgtaac agttccatcc tccagcctcg ggacacagac ttacatttgt 660
aacgtgaatc acaagcctag caacaccaag gtcgacaaga gagttgaacc aaagagttgt 720
gattgccact gtcctccctg cccagctcct gagctgcttg gcggtcccag tgtcttcttg 780
tttcccccta aacccaaaga caccctgatg atctcaagga ctcccgaggt gacatgcgtg 840
gtggtggatg tgtctcatga ggacccagag gtgaagttca actggtacgt ggacggcgtg 900
gaggtgcaca acgccaagac caagcccaga gaggagcagt acaacagcac ctacagggtg 960
gtgtccgtgc tgaccgtgct gcaccaggac tggctgaacg gcaaggagta caagtgtaag 1020
gtgtccaaca aggccctgcc agccccaatc gaaaagacca tcagcaaggc caagggccag 1080
ccaagagagc cccaggtgta caccctgcca cccagcaggg aggagatgac caagaaccag 1140
gtgtccctga cctgtctggt gaagggcttc tacccaagcg acatcgccgt ggagtgggag 1200
agcaacggcc agcccgagaa caactacaag accacccccc cagtgctgga cagcgacggc 1260
agcttcttcc tgtacagcaa gctgaccgtg gacaagagca gatggcagca gggcaacgtg 1320
ttcagctgct ccgtgatgca cgaggccctg cacaaccact acacccagaa gagcctgagc 1380
ctgtccccag gctga 1395
<210> 91
<211> 717
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полинуклеотид"
<400> 91
atggaaactg atacactgct gctgtgggtc ctgctgctgt gggtccctgg aagcacaggg 60
gacattgtga tgacccagtc tcccgatagc ctggccgtgt ccctgggcga gagggctacc 120
atcaactgta aaagctccga atctgtggac tcttacgcaa acagctttct gcactggtat 180
cagcaaaagc caggccaacc tccaaagctg ctgatttaca gggcttctac cagggagagc 240
ggcgtgcccg ataggttcag cggatctggc agcggcaccg actttacact gaccatctcc 300
agcctgcagg ccgaagatgt ggcagtctat tactgccagc agtccaagga ggaccccctg 360
actttcgggg gtggtactaa agtggagatc aagcgtacgg tggccgctcc cagcgtgttc 420
atcttccccc caagcgacga gcagctgaag agcggcaccg ccagcgtggt gtgtctgctg 480
aacaacttct accccaggga ggccaaggtg cagtggaagg tggacaacgc cctgcagagc 540
ggcaacagcc aggagagcgt caccgagcag gacagcaagg actccaccta cagcctgagc 600
agcaccctga ccctgagcaa ggccgactac gagaagcaca aggtgtacgc ctgtgaggtg 660
acccaccagg gcctgtccag ccccgtgacc aagagcttca acaggggcga gtgctga 717
<210> 92
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 92
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Leu His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Met Ile Asp Pro Ser Asn Ser Asp Thr Arg Phe Asn Pro Asn Phe
50 55 60
Lys Asp Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Tyr Arg Ser Tyr Val Thr Pro Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Ser
355 360 365
Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 93
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 93
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Leu Tyr Thr
20 25 30
Ser Ser Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ala Tyr Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 94
<211> 227
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 94
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
130 135 140
Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 95
<211> 441
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 95
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Val Asn Pro Asn Arg Arg Gly Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Glu Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Asn Trp Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys
210 215 220
Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu
340 345 350
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
420 425 430
Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440
<210> 96
<211> 215
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 96
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Val Ser Ser Ser Val Ser Ser Ile
20 25 30
Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln
65 70 75 80
Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Val Tyr Ser Gly Tyr Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 97
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 97
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 98
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 98
Gly Phe Leu Gly
1
<210> 99
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 99
Ala Leu Ala Leu
1
<210> 100
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетическая метка 6xHis"
<400> 100
His His His His His His
1 5
<210> 101
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 101
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Val Asn Pro Asn Arg Arg Gly Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Glu Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Asn Trp Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 102
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 102
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Val Ser Ser Ser Val Ser Ser Ile
20 25 30
Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln
65 70 75 80
Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Val Tyr Ser Gly Tyr Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 103
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 103
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Leu His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Met Ile Asp Pro Ser Asn Ser Asp Thr Arg Phe Asn Pro Asn Phe
50 55 60
Lys Asp Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Tyr Arg Ser Tyr Val Thr Pro Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 104
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 104
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Leu Tyr Thr
20 25 30
Ser Ser Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ala Tyr Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg
<210> 105
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 105
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Asp Asn Trp Phe Ala Tyr Val Val Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 106
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 106
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Leu Ala Ser
20 25 30
Gly Asn Gln Asn Asn Tyr Leu Ala Trp His Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Met Leu Ile Ile Trp Ala Ser Thr Arg Val Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
85 90 95
Ser Tyr Ser Ala Pro Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg
<210> 107
<211> 127
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 107
Gln Val Gln Leu Val Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Gly Ser Ile Thr Thr Asn
20 25 30
Tyr Tyr Tyr Trp Ser Trp Ile Arg Gln Ser Pro Gly Lys Gly Leu Glu
35 40 45
Trp Met Gly Val Ile Ala Tyr Asp Gly Ser Thr Asp Tyr Ser Pro Ser
50 55 60
Leu Lys Ser Arg Thr Ser Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Gln Leu Ser Ser Val Thr Pro Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Val Arg Val Ile Ala Thr Gly Trp Ala Thr Ala Asn
100 105 110
Ala Leu Asp Ala Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 108
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 108
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ser Pro Gly Lys
1 5 10 15
Thr Val Thr Ile Ser Cys Ala Gly Thr Ser Ser Asp Val Gly Tyr Gly
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu
35 40 45
Leu Ile Phe Ala Val Ser Tyr Arg Ala Ser Gly Ile Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Phe Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ser Tyr Arg Ser Ser
85 90 95
Asn Asn Ala Ala Val Phe Gly Gly Gly Thr His Leu Thr Val Leu
100 105 110
<210> 109
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 109
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Ile Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Asp Asn Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 110
<211> 115
<212> БЕЛОК
<213> Mus musculus
<400> 110
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Ala Trp
20 25 30
Ser Asn Gln Asn Asn Tyr Leu Ala Trp Tyr Leu Gln Lys Pro Gly Gln
35 40 45
Ser Pro Gln Met Leu Ile Ile Trp Ala Ile Thr Arg Val Gly Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys
65 70 75 80
Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln
85 90 95
Ser Tyr Ser Arg Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys Arg Thr
115
<210> 111
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 111
Gln Gln Ser Tyr Ser Arg Pro Tyr Thr
1 5
<210> 112
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 112
Gly Tyr Ile Phe Thr Ala Tyr Thr Met His
1 5 10
<210> 113
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 113
Trp Ile Lys Pro Asn Asn Gly Leu Ala Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 114
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 114
Ser Glu Ile Thr Thr Glu Phe Asp Tyr
1 5
<210> 115
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 115
Lys Ser Ser Glu Ser Val Asp Ser Tyr Ala Asn Ser Phe Leu His
1 5 10 15
<210> 116
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 116
Arg Ala Ser Thr Arg Glu Ser
1 5
<210> 117
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 117
Gln Gln Ser Lys Glu Asp Pro Leu Thr
1 5
<210> 118
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 118
Gly Tyr Ile Phe Thr Ala Tyr Thr Met His
1 5 10
<210> 119
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 119
Trp Ile Lys Pro Asn Asn Gly Leu Ala Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 120
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 120
Ser Glu Ile Thr Thr Glu Phe Asp Tyr
1 5
<210> 121
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 121
Lys Ser Ser Glu Ser Val Asp Ser Tyr Ala Asn Ser Phe Leu His
1 5 10 15
<210> 122
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 122
Arg Ala Ser Thr Arg Glu Ser
1 5
<210> 123
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 123
Gln Gln Ser Lys Glu Asp Pro Leu Thr
1 5
<210> 124
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический олигонуклеотид"
<400> 124
ggctacatct tcacagcata caccatgcac 30
<210> 125
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический олигонуклеотид"
<400> 125
tggattaaac ccaacaatgg gctggccaac tacgcccaga aattccaggg t 51
<210> 126
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический олигонуклеотид"
<400> 126
agcgaaatta caacagaatt cgattac 27
<210> 127
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический олигонуклеотид"
<400> 127
aaaagctccg aatctgtgga ctcttacgca aacagctttc tgcac 45
<210> 128
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический олигонуклеотид"
<400> 128
agggcttcta ccagggagag c 21
<210> 129
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический олигонуклеотид"
<400> 129
cagcagtcca aggaggaccc cctgact 27
<210> 130
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 130
Gly Tyr Thr Phe Thr Asp Tyr Tyr Met His
1 5 10
<210> 131
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 131
Arg Val Asn Pro Asn Arg Arg Gly Thr Thr Tyr Asn Gln Lys Phe Glu
1 5 10 15
Gly
<210> 132
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 132
Ala Asn Trp Leu Asp Tyr
1 5
<210> 133
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 133
Ser Val Ser Ser Ser Val Ser Ser Ile Tyr Leu His
1 5 10
<210> 134
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 134
Ser Thr Ser Asn Leu Ala Ser
1 5
<210> 135
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 135
Gln Val Tyr Ser Gly Tyr Pro Leu Thr
1 5
<210> 136
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 136
Gly Tyr Thr Phe Thr Ser Tyr Trp Leu His
1 5 10
<210> 137
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 137
Met Ile Asp Pro Ser Asn Ser Asp Thr Arg Phe Asn Pro Asn Phe Lys
1 5 10 15
Asp
<210> 138
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 138
Ala Thr Tyr Arg Ser Tyr Val Thr Pro Leu Asp Tyr
1 5 10
<210> 139
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 139
Lys Ser Ser Gln Ser Leu Leu Tyr Thr Ser Ser Gln Lys Asn Tyr Leu
1 5 10 15
Ala
<210> 140
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 140
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 141
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 141
Gln Gln Tyr Tyr Ala Tyr Pro Trp Thr
1 5
<210> 142
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 142
Asp Tyr Tyr Met Ser
1 5
<210> 143
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 143
Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Glu Tyr Ser
1 5 10
<210> 144
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 144
Arg Asp Asn Trp Phe Ala Tyr
1 5
<210> 145
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 145
Lys Ser Ser Gln Ser Leu Leu Ala Ser Gly Asn
1 5 10
<210> 146
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 146
Trp Ala Ser Thr Arg Val Ser
1 5
<210> 147
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 147
Gln Gln Ser Tyr Ser Ala Pro Leu Thr
1 5
<210> 148
<211> 7
<212> БЕЛОК
<213> Homo sapiens
<400> 148
Thr Asn Tyr Tyr Tyr Trp Ser
1 5
<210> 149
<211> 16
<212> БЕЛОК
<213> Homo sapiens
<400> 149
Val Ile Ala Tyr Asp Gly Ser Thr Asp Tyr Ser Pro Ser Leu Lys Ser
1 5 10 15
<210> 150
<211> 17
<212> БЕЛОК
<213> Homo sapiens
<400> 150
Asp Val Arg Val Ile Ala Thr Gly Trp Ala Thr Ala Asn Ala Leu Asp
1 5 10 15
Ala
<210> 151
<211> 14
<212> БЕЛОК
<213> Homo sapiens
<400> 151
Ala Gly Thr Ser Ser Asp Val Gly Tyr Gly Asn Tyr Val Ser
1 5 10
<210> 152
<211> 7
<212> БЕЛОК
<213> Homo sapiens
<400> 152
Ala Val Ser Tyr Arg Ala Ser
1 5
<210> 153
<211> 11
<212> БЕЛОК
<213> Homo sapiens
<400> 153
Ala Ser Tyr Arg Ser Ser Asn Asn Ala Ala Val
1 5 10
<210> 154
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 154
Asp Tyr Tyr Ile Ser
1 5
<210> 155
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 155
Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Glu Tyr Ser Ala Ser
1 5 10 15
Val Lys Gly
<210> 156
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 156
Asp Asn Trp Phe Ala Tyr
1 5
<210> 157
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 157
Lys Ser Ser Gln Ser Leu Leu Ala Trp Ser Asn Gln Asn Asn Tyr Leu
1 5 10 15
Ala
<210> 158
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 158
Trp Ala Ile Thr Arg Val Gly
1 5
<210> 159
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 159
Lys Ser Leu Leu His Ser Asn Gly Ile Thr Tyr
1 5 10
<210> 160
<211> 3
<212> БЕЛОК
<213> Mus musculus
<400> 160
Gln Met Ser
1
<210> 161
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 161
Ala Gln Asn Leu Glu Leu Pro Tyr Thr
1 5
<210> 162
<211> 8
<212> БЕЛОК
<213> Mus musculus
<400> 162
Gly Phe Thr Phe Ser Ser Tyr Ala
1 5
<210> 163
<211> 7
<212> БЕЛОК
<213> Mus musculus
<400> 163
Ile Met Gly Gly Gly Thr Thr
1 5
<210> 164
<211> 15
<212> БЕЛОК
<213> Mus musculus
<400> 164
Ala Arg Gly Arg Asp Tyr Gly Ile Arg Ser Tyr Ala Met Asp Tyr
1 5 10 15
<210> 165
<211> 15
<212> БЕЛОК
<213> Mus musculus
<400> 165
Ser Ser Lys Ser Leu Leu His Ser Asn Gly Ile Thr Tyr Leu Tyr
1 5 10 15
<210> 166
<211> 7
<212> БЕЛОК
<213> Mus musculus
<400> 166
Gln Met Ser Asn Leu Ala Ser
1 5
<210> 167
<211> 4
<212> БЕЛОК
<213> Mus musculus
<400> 167
Ser Tyr Ala Met
1
<210> 168
<211> 16
<212> БЕЛОК
<213> Mus musculus
<400> 168
Ser Ile Met Gly Gly Gly Thr Thr Tyr Tyr Pro Asp Ser Val Lys Gly
1 5 10 15
<210> 169
<211> 13
<212> БЕЛОК
<213> Mus musculus
<400> 169
Gly Arg Asp Tyr Gly Ile Arg Ser Tyr Ala Met Asp Tyr
1 5 10
<210> 170
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический шарнирный пептид, полученный из IgG1"
<400> 170
Pro Lys Ser Cys Asp Cys His Cys Pro Pro Cys Pro
1 5 10
<210> 171
<211> 445
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 171
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Ala Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Lys Pro Asn Asn Gly Leu Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Glu Ile Thr Thr Glu Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Cys His
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Cys Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 172
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический полипептид"
<400> 172
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Glu Ser Val Asp Ser Tyr
20 25 30
Ala Asn Ser Phe Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Thr Arg Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Lys
85 90 95
Glu Asp Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 173
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 173
Gly Tyr Ile Phe Thr Ala Tyr Thr Met His
1 5 10
<210> 174
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 174
Trp Ile Lys Pro Asn Asn Gly Leu Ala Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 175
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 175
Ser Glu Ile Thr Thr Glu Phe Asp Tyr
1 5
<210> 176
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 176
Lys Ser Ser Glu Ser Val Asp Ser Tyr Ala Asn Ser Phe Leu His
1 5 10 15
<210> 177
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 177
Arg Ala Ser Thr Arg Glu Ser
1 5
<210> 178
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический пептид"
<400> 178
Gln Gln Ser Lys Glu Asp Pro Leu Thr
1 5
<---
Claims (16)
1. Конъюгат анти-cMet антитела и лекарственного средства (ʺADCʺ), состоящий из анти-cMet антитела (Ab), конъюгированного с лекарственным средством монометилауристином Е («MMAE»), имеющий следующую структуру:
где Ab представляет собой антитело IgG, состоящее из тяжелых цепей, каждая состоит из аминокислотной последовательности SEQ ID NO: 86, и легких цепей, каждая состоит из аминокислотной последовательности SEQ ID NO: 87,
n имеет значение 2 и
конъюгирование каждого лекарственного средства MMAE с Ab происходит посредством тиоэфирной связи, образованной с сульфгидрильной группой цистеинового остатка.
2. Конъюгат анти-cMet антитела и лекарственного средства (ʺADCʺ), состоящий из анти-cMet антитела (Ab), конъюгированного с лекарственным средством монометилауристином Е («MMAE»), имеющий следующую структуру:
где Ab представляет собой антитело IgG, состоящее из тяжелых цепей, каждая состоит из аминокислотной последовательности SEQ ID NO: 86, и легких цепей, каждая состоит из аминокислотной последовательности SEQ ID NO: 87,
n имеет значение 4 и
конъюгирование каждого лекарственного средства MMAE с Ab происходит посредством тиоэфирной связи, образованной с сульфгидрильной группой цистеинового остатка.
3. Композиция для лечения рака, при котором сверхэкспрессируется сMet, содержащая конъюгат анти-cMet антитела и лекарственного средства (ʺADCʺ), где ADC состоит из анти-cMet антитела (Ab), конъюгированного с лекарственным средством монометилауристином Е («MMAE»), имеющий следующую структуру:
где Ab представляет собой антитело IgG, состоящее из тяжелых цепей, каждая состоит из аминокислотной последовательности SEQ ID NO: 86, и легких цепей, каждая состоит из аминокислотной последовательности SEQ ID NO: 87, и
конъюгирование каждого лекарственного средства MMAE с Ab происходит посредством тиоэфирной связи, образованной с сульфгидрильной группой цистеинового остатка, и
где композиция имеет среднее отношение лекарственное средство/антитело («DAR») в диапазоне от 2 до 4.
4. Композиция по п.3, где DAR равен 3.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662337796P | 2016-05-17 | 2016-05-17 | |
| US62/337,796 | 2016-05-17 | ||
| PCT/US2017/033176 WO2017201204A1 (en) | 2016-05-17 | 2017-05-17 | ANTI-cMet ANTIBODY DRUG CONJUGATES AND METHODS FOR THEIR USE |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| RU2018144315A RU2018144315A (ru) | 2020-06-17 |
| RU2018144315A3 RU2018144315A3 (ru) | 2020-07-22 |
| RU2740996C2 true RU2740996C2 (ru) | 2021-01-22 |
Family
ID=59014737
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2018144315A RU2740996C2 (ru) | 2016-05-17 | 2017-05-17 | КОНЪЮГАТЫ АНТИТЕЛА К cMet И ЛЕКАРСТВЕННОГО СРЕДСТВА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ |
Country Status (25)
| Country | Link |
|---|---|
| US (5) | US20170348429A1 (ru) |
| EP (4) | EP3458102B1 (ru) |
| JP (4) | JP2019521087A (ru) |
| KR (3) | KR20230028574A (ru) |
| CN (3) | CN114177308B (ru) |
| AU (1) | AU2017268342B2 (ru) |
| BR (1) | BR112018073574A2 (ru) |
| CA (1) | CA3024386C (ru) |
| CY (2) | CY1123256T1 (ru) |
| DK (2) | DK3458102T3 (ru) |
| ES (2) | ES2811351T3 (ru) |
| HR (2) | HRP20201186T1 (ru) |
| HU (2) | HUE050398T2 (ru) |
| IL (3) | IL262869B (ru) |
| LT (2) | LT3458102T (ru) |
| MX (1) | MX2018014175A (ru) |
| NZ (1) | NZ748314A (ru) |
| PL (2) | PL3458102T3 (ru) |
| PT (2) | PT3458102T (ru) |
| RS (2) | RS60663B1 (ru) |
| RU (1) | RU2740996C2 (ru) |
| SG (2) | SG11201810034XA (ru) |
| SI (2) | SI3458102T1 (ru) |
| WO (1) | WO2017201204A1 (ru) |
| ZA (1) | ZA201808386B (ru) |
Families Citing this family (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN114177308B (zh) | 2016-05-17 | 2024-07-09 | 艾伯维生物制药股份有限公司 | 抗cMet抗体药物偶联物及其使用方法 |
| TWI782930B (zh) | 2016-11-16 | 2022-11-11 | 美商再生元醫藥公司 | 抗met抗體,結合met之雙特異性抗原結合分子及其使用方法 |
| WO2018098035A1 (en) * | 2016-11-23 | 2018-05-31 | Eli Lilly And Company | Met antibody drug conjugates |
| CN110144325A (zh) * | 2018-02-12 | 2019-08-20 | 深圳宾德生物技术有限公司 | 一种靶向性t淋巴细胞及其制备方法和应用 |
| MX2020009469A (es) | 2018-03-13 | 2021-01-29 | Zymeworks Inc | Conjugados de anticuerpo y farmaco anti-her2 biparatopicos y metodos de uso. |
| WO2019183633A1 (en) | 2018-03-23 | 2019-09-26 | Case Western Reserve Univeristy | Psma targeted conjugate compounds and uses thereof |
| MA52238A (fr) | 2018-03-28 | 2021-02-17 | Mitsubishi Tanabe Pharma Corp | Conjugués de médicament d'agents de liaison monoclonaux cmet, et utilisations associées |
| BR112021004829A2 (pt) * | 2018-09-30 | 2021-06-08 | Jiangsu Hengrui Medicine Co., Ltd. | conjugado de anticorpo anti-b7h3-análogo de exatecano e uso medicinal do mesmo |
| KR102353568B1 (ko) * | 2018-11-14 | 2022-01-20 | 주식회사 헬릭스미스 | 안정성이 향상된 항 c-Met 항체 또는 그의 항원 결합 단편 |
| US11896682B2 (en) | 2019-09-16 | 2024-02-13 | Regeneron Pharmaceuticals, Inc. | Radiolabeled MET binding proteins for immuno-PET imaging and methods of use thereof |
| CN112604004B (zh) * | 2019-09-19 | 2022-05-10 | 中国医学科学院医药生物技术研究所 | 一类抗人egfr抗体药物偶联物及其制备方法与应用 |
| CN110893236A (zh) * | 2019-10-09 | 2020-03-20 | 中山大学 | 溶酶体靶向的抗体药物偶联物及其应用 |
| JP2023525034A (ja) | 2020-05-08 | 2023-06-14 | リジェネロン・ファーマシューティカルズ・インコーポレイテッド | Vegfトラップおよびミニトラップならびに眼障害およびがんの治療方法 |
| CA3161919A1 (en) * | 2020-09-01 | 2022-03-10 | Remegen Co., Ltd. | Anti-c-met antibody-drug conjugate and applications thereof |
| WO2022078279A1 (zh) * | 2020-10-12 | 2022-04-21 | 昆山新蕴达生物科技有限公司 | 抗体-药物偶联物及其应用 |
| CN114533891B (zh) * | 2020-11-24 | 2023-04-18 | 深圳先进技术研究院 | 一种靶向无痕释放药物缀合物及其制备方法与应用 |
| EP4288456B1 (en) * | 2021-02-03 | 2024-09-18 | Mythic Therapeutics, Inc. | Anti-met antibodies and uses thereof |
| TW202300178A (zh) | 2021-03-18 | 2023-01-01 | 美商西根公司 | 內化的生物活性化合物偶聯物選擇性釋放藥物 |
| WO2022216796A1 (en) * | 2021-04-06 | 2022-10-13 | Abbvie Biotherapeutics Inc. | Methods of treatment of non-small-cell lung carcinoma using telisotuzumab vedotin |
| US20240158493A1 (en) | 2021-04-07 | 2024-05-16 | Mythic Therapeutics, Inc. | Antigen-binding protein constructs and antibodies and uses thereof |
| JP2024515266A (ja) | 2021-04-08 | 2024-04-08 | ビョンディス・ビー.ブイ. | 抗c-MET抗体及び抗体薬物複合体 |
| AR125473A1 (es) | 2021-04-29 | 2023-07-19 | Abbvie Inc | Conjugados de anticuerpo anti-c-met y fármaco |
| WO2023086833A1 (en) | 2021-11-09 | 2023-05-19 | Case Western Reserve University | Psma targeted conjugate compounds and uses thereof |
| WO2023173109A1 (en) | 2022-03-11 | 2023-09-14 | Abbvie Biotherapeutics Inc. | Methods of treatment of non-small-cell lung carcinoma using telisotuzumab vedotin and osimertinib |
| WO2024065056A1 (en) * | 2022-09-28 | 2024-04-04 | Zymeworks Bc Inc. | Antibody drug conjugates targeting c-met and methods of use |
| WO2024081729A2 (en) | 2022-10-12 | 2024-04-18 | Mythic Therapeutics, Inc. | Lrrc-15-binding protein constructs and uses thereof |
| WO2024129585A1 (en) * | 2022-12-11 | 2024-06-20 | Mythic Therapeutics, Inc. | ANTI-cMET ANTIBODY DRUG CONJUGATES AND THERAPEUTIC USES THEREOF |
| FI20235292A1 (en) * | 2023-03-13 | 2024-09-14 | Glykos Finland Oy | ANTIBODY SEXATECANE CONJUGATE |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20090010945A1 (en) * | 2004-03-02 | 2009-01-08 | Seattle Genetics, Inc. | Partially Loaded Antibodies And Methods Of Their Conjugation |
| US20150071950A1 (en) * | 2013-09-12 | 2015-03-12 | Samsung Electronics Co., Ltd. | C-met targeting compound-bioactive material conjugate and use thereof |
| US20150110815A1 (en) * | 2011-11-28 | 2015-04-23 | Korea Research Institute Of Bioscience And Biotechnology | Drug conjugate comprising drug linked to human c-met antibody, and use therefor |
| RU2613906C2 (ru) * | 2011-05-08 | 2017-03-21 | Легокем Биосайенсис, Инк. | Конъюгаты белок-активное вещество и способ их получения |
Family Cites Families (80)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4444887A (en) | 1979-12-10 | 1984-04-24 | Sloan-Kettering Institute | Process for making human antibody producing B-lymphocytes |
| US4399216A (en) | 1980-02-25 | 1983-08-16 | The Trustees Of Columbia University | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| US4634665A (en) | 1980-02-25 | 1987-01-06 | The Trustees Of Columbia University In The City Of New York | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| US5179017A (en) | 1980-02-25 | 1993-01-12 | The Trustees Of Columbia University In The City Of New York | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| US4716111A (en) | 1982-08-11 | 1987-12-29 | Trustees Of Boston University | Process for producing human antibodies |
| US4510245A (en) | 1982-11-18 | 1985-04-09 | Chiron Corporation | Adenovirus promoter system |
| GB8308235D0 (en) | 1983-03-25 | 1983-05-05 | Celltech Ltd | Polypeptides |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US5807715A (en) | 1984-08-27 | 1998-09-15 | The Board Of Trustees Of The Leland Stanford Junior University | Methods and transformed mammalian lymphocyte cells for producing functional antigen-binding protein including chimeric immunoglobulin |
| US5168062A (en) | 1985-01-30 | 1992-12-01 | University Of Iowa Research Foundation | Transfer vectors and microorganisms containing human cytomegalovirus immediate-early promoter-regulatory DNA sequence |
| US4968615A (en) | 1985-12-18 | 1990-11-06 | Ciba-Geigy Corporation | Deoxyribonucleic acid segment from a virus |
| US5225539A (en) | 1986-03-27 | 1993-07-06 | Medical Research Council | Recombinant altered antibodies and methods of making altered antibodies |
| GB8607679D0 (en) | 1986-03-27 | 1986-04-30 | Winter G P | Recombinant dna product |
| WO1989012624A2 (en) | 1988-06-14 | 1989-12-28 | Cetus Corporation | Coupling agents and sterically hindered disulfide linked conjugates prepared therefrom |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| US5413923A (en) | 1989-07-25 | 1995-05-09 | Cell Genesys, Inc. | Homologous recombination for universal donor cells and chimeric mammalian hosts |
| GB8928874D0 (en) | 1989-12-21 | 1990-02-28 | Celltech Ltd | Humanised antibodies |
| ATE139258T1 (de) | 1990-01-12 | 1996-06-15 | Cell Genesys Inc | Erzeugung xenogener antikörper |
| GB9015198D0 (en) | 1990-07-10 | 1990-08-29 | Brien Caroline J O | Binding substance |
| DE69127627T2 (de) | 1990-08-29 | 1998-02-19 | Genpharm Int | Produktion und Nützung nicht-menschliche transgentiere zur Produktion heterologe Antikörper |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| US5814318A (en) | 1990-08-29 | 1998-09-29 | Genpharm International Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| EP0519596B1 (en) | 1991-05-17 | 2005-02-23 | Merck & Co. Inc. | A method for reducing the immunogenicity of antibody variable domains |
| IE922437A1 (en) | 1991-07-25 | 1993-01-27 | Idec Pharma Corp | Recombinant antibodies for human therapy |
| US5565332A (en) | 1991-09-23 | 1996-10-15 | Medical Research Council | Production of chimeric antibodies - a combinatorial approach |
| PT1024191E (pt) | 1991-12-02 | 2008-12-22 | Medical Res Council | Produção de auto-anticorpos a partir de reportórios de segmentos de anticorpo e exibidos em fagos |
| US5639641A (en) | 1992-09-09 | 1997-06-17 | Immunogen Inc. | Resurfacing of rodent antibodies |
| CA2761116A1 (en) | 1995-04-27 | 1996-10-31 | Amgen Fremont Inc. | Human antibodies derived from immunized xenomice |
| EP0823941A4 (en) | 1995-04-28 | 2001-09-19 | Abgenix Inc | HUMAN ANTIBODIES DERIVED FROM IMMUNIZED XENO MOUSES |
| US5916771A (en) | 1996-10-11 | 1999-06-29 | Abgenix, Inc. | Production of a multimeric protein by cell fusion method |
| ATE549918T1 (de) | 1996-12-03 | 2012-04-15 | Amgen Fremont Inc | Menschliche antikörper, die ausdrücklich menschliches tnf alpha binden |
| ES2172149T3 (es) | 1997-04-14 | 2002-09-16 | Micromet Ag | Nuevo metodo para la produccion de receptores de antigeno anti-humano y sus usos. |
| US6235883B1 (en) | 1997-05-05 | 2001-05-22 | Abgenix, Inc. | Human monoclonal antibodies to epidermal growth factor receptor |
| AU1728800A (en) | 1998-11-18 | 2000-06-05 | Genentech Inc. | Antibody variants with higher binding affinity compared to parent antibodies |
| EP1243276A1 (en) | 2001-03-23 | 2002-09-25 | Franciscus Marinus Hendrikus De Groot | Elongated and multiple spacers containing activatible prodrugs |
| EP2357006B1 (en) | 2002-07-31 | 2015-09-16 | Seattle Genetics, Inc. | Drug conjugates and their use for treating cancer, an autoimmune disease or an infectious disease |
| US20050271615A1 (en) | 2002-08-30 | 2005-12-08 | Doron Shabat | Self-immolative dendrimers releasing many active moieties upon a single activating event |
| US7217797B2 (en) | 2002-10-15 | 2007-05-15 | Pdl Biopharma, Inc. | Alteration of FcRn binding affinities or serum half-lives of antibodies by mutagenesis |
| AU2003282624A1 (en) | 2002-11-14 | 2004-06-03 | Syntarga B.V. | Prodrugs built as multiple self-elimination-release spacers |
| ES2347959T3 (es) | 2003-02-20 | 2010-11-26 | Seattle Genetics, Inc. | Conjugados de anticuerpos anti-cd70-farmaco y su uso para el tratamiento del cancer. |
| IN2012DN00313A (ru) * | 2003-06-27 | 2015-05-08 | Amgen Fremont Inc | |
| PT1725249E (pt) * | 2003-11-06 | 2014-04-10 | Seattle Genetics Inc | Compostos de monometilvalina capazes de conjugação a ligandos |
| JP5064037B2 (ja) | 2004-02-23 | 2012-10-31 | ジェネンテック, インコーポレイテッド | 複素環式自壊的リンカーおよび結合体 |
| WO2005123780A2 (en) | 2004-04-09 | 2005-12-29 | Protein Design Labs, Inc. | Alteration of fcrn binding affinities or serum half-lives of antibodies by mutagenesis |
| AU2005286607B2 (en) | 2004-09-23 | 2011-01-27 | Genentech, Inc. | Cysteine engineered antibodies and conjugates |
| US8039273B2 (en) | 2005-07-18 | 2011-10-18 | Seattle Genetics, Inc. | β-glucuronide-linker drug conjugates |
| CN101415679A (zh) | 2006-02-02 | 2009-04-22 | 辛塔佳有限公司 | 水溶性cc-1065类似物及其缀合物 |
| CA2699837C (en) | 2006-12-01 | 2017-06-13 | Seattle Genetics, Inc. | Variant target binding agents and uses thereof |
| EP2014681A1 (en) | 2007-07-12 | 2009-01-14 | Pierre Fabre Medicament | Novel antibodies inhibiting c-met dimerization, and uses thereof |
| JP5557746B2 (ja) | 2007-11-28 | 2014-07-23 | メルサナ セラピューティックス,インク. | 生体適合性生分解性フマギリンアナログ複合体 |
| US20140112911A9 (en) | 2008-12-02 | 2014-04-24 | Liliane Goetsch | Novel anti-cmet antibody |
| US9469691B2 (en) | 2008-12-02 | 2016-10-18 | Pierre Fabre Medicament | Anti-cMET antibody |
| AR074439A1 (es) | 2008-12-02 | 2011-01-19 | Pf Medicament | Anticuerpo anti-cmet (receptor c-met) |
| US8545839B2 (en) | 2008-12-02 | 2013-10-01 | Pierre Fabre Medicament | Anti-c-Met antibody |
| WO2010064089A1 (en) | 2008-12-02 | 2010-06-10 | Pierre Fabre Medicament | Novel anti-cmet antibody |
| US20100152725A1 (en) | 2008-12-12 | 2010-06-17 | Angiodynamics, Inc. | Method and system for tissue treatment utilizing irreversible electroporation and thermal track coagulation |
| WO2010138719A1 (en) | 2009-05-28 | 2010-12-02 | Mersana Therapeutics, Inc. | Polyal drug conjugates comprising variable rate-releasing linkers |
| EP2287197A1 (en) | 2009-08-21 | 2011-02-23 | Pierre Fabre Medicament | Anti-cMET antibody and its use for the detection and the diagnosis of cancer |
| US9337942B2 (en) | 2009-12-07 | 2016-05-10 | Ntt Docomo, Inc. | Propagation path estimation method and program and apparatus using the same |
| EP2545069A1 (en) | 2010-03-10 | 2013-01-16 | Novartis AG | Streptococcus thermophilus bacterium |
| DE102010012915A1 (de) | 2010-03-26 | 2011-09-29 | Schaeffler Technologies Gmbh & Co. Kg | Vorrichtung und Verfahren zur Ermittlung eines Schädigungszustands eines Radlagers |
| EP2553019A1 (en) | 2010-03-26 | 2013-02-06 | Mersana Therapeutics, Inc. | Modified polymers for delivery of polynucleotides, method of manufacture, and methods of use thereof |
| EP2402370A1 (en) | 2010-06-29 | 2012-01-04 | Pierre Fabre Médicament | Novel antibody for the diagnosis and/or prognosis of cancer |
| RU2617402C2 (ru) | 2011-06-10 | 2017-04-25 | Мерсана Терапьютикс, Инк. | Конъюгаты белок-полимер-лекарственное средство |
| EP2793585A4 (en) | 2011-12-05 | 2015-12-09 | Igenica Biotherapeutics Inc | Antibody-Agent Conjugates and Related Compounds, Compositions and Methods |
| WO2013096901A1 (en) | 2011-12-23 | 2013-06-27 | Mersana Therapeutics, Inc. | Pharmaceutical formulations for fumagillin derivative-phf conjugates |
| CA2864872C (en) * | 2012-02-24 | 2022-07-05 | Alteogen Inc. | Modified antibody in which motif comprising cysteine residue is bound |
| US9504756B2 (en) | 2012-05-15 | 2016-11-29 | Seattle Genetics, Inc. | Self-stabilizing linker conjugates |
| US20140017265A1 (en) | 2012-07-05 | 2014-01-16 | Mersana Therapeutics, Inc. | Terminally Modified Polymers and Conjugates Thereof |
| EP2928503B1 (en) | 2012-12-10 | 2019-02-20 | Mersana Therapeutics, Inc. | Conjugates of auristatin compounds |
| EP2928504B1 (en) | 2012-12-10 | 2019-02-20 | Mersana Therapeutics, Inc. | Protein-polymer-drug conjugates |
| EP2931316B1 (en) | 2012-12-12 | 2019-02-20 | Mersana Therapeutics, Inc. | Hydroxyl-polymer-drug-protein conjugates |
| SI2968588T1 (sl) * | 2013-03-15 | 2019-05-31 | AbbVie Deutschland GmbH & Co. KG | Formulacije konjugatov protitelo proti-EGFR zdravilo |
| ES2748295T3 (es) | 2014-09-16 | 2020-03-16 | Symphogen As | Anticuerpos anti-MET y composiciones |
| CN106188293A (zh) * | 2015-04-17 | 2016-12-07 | 江苏恒瑞医药股份有限公司 | 抗c-Met抗体和抗c-Met抗体-细胞毒性药物偶联物及其医药用途 |
| WO2016165580A1 (zh) * | 2015-04-17 | 2016-10-20 | 江苏恒瑞医药股份有限公司 | 抗c-Met抗体和抗c-Met抗体-细胞毒性药物偶联物及其医药用途 |
| CN114177308B (zh) | 2016-05-17 | 2024-07-09 | 艾伯维生物制药股份有限公司 | 抗cMet抗体药物偶联物及其使用方法 |
-
2017
- 2017-05-17 CN CN202111566314.4A patent/CN114177308B/zh active Active
- 2017-05-17 ES ES17728311T patent/ES2811351T3/es active Active
- 2017-05-17 DK DK17728311.6T patent/DK3458102T3/da active
- 2017-05-17 RS RS20200927A patent/RS60663B1/sr unknown
- 2017-05-17 US US15/597,624 patent/US20170348429A1/en not_active Abandoned
- 2017-05-17 EP EP17728311.6A patent/EP3458102B1/en active Active
- 2017-05-17 PL PL17728311T patent/PL3458102T3/pl unknown
- 2017-05-17 SG SG11201810034XA patent/SG11201810034XA/en unknown
- 2017-05-17 PT PT177283116T patent/PT3458102T/pt unknown
- 2017-05-17 LT LTEP17728311.6T patent/LT3458102T/lt unknown
- 2017-05-17 LT LTEP19197371.8T patent/LT3626273T/lt unknown
- 2017-05-17 AU AU2017268342A patent/AU2017268342B2/en active Active
- 2017-05-17 SI SI201730337T patent/SI3458102T1/sl unknown
- 2017-05-17 EP EP20208371.3A patent/EP3804765A1/en not_active Withdrawn
- 2017-05-17 IL IL262869A patent/IL262869B/en unknown
- 2017-05-17 CN CN202111593727.1A patent/CN114246953B/zh active Active
- 2017-05-17 IL IL294146A patent/IL294146B2/en unknown
- 2017-05-17 CA CA3024386A patent/CA3024386C/en active Active
- 2017-05-17 HU HUE17728311A patent/HUE050398T2/hu unknown
- 2017-05-17 PT PT191973718T patent/PT3626273T/pt unknown
- 2017-05-17 RS RS20210246A patent/RS61659B1/sr unknown
- 2017-05-17 PL PL19197371T patent/PL3626273T3/pl unknown
- 2017-05-17 KR KR1020237005212A patent/KR20230028574A/ko unknown
- 2017-05-17 SI SI201730649T patent/SI3626273T1/sl unknown
- 2017-05-17 EP EP23163423.9A patent/EP4233909A3/en active Pending
- 2017-05-17 WO PCT/US2017/033176 patent/WO2017201204A1/en unknown
- 2017-05-17 EP EP19197371.8A patent/EP3626273B1/en active Active
- 2017-05-17 JP JP2018559845A patent/JP2019521087A/ja active Pending
- 2017-05-17 CN CN201780044009.4A patent/CN109562189B/zh active Active
- 2017-05-17 HU HUE19197371A patent/HUE053332T2/hu unknown
- 2017-05-17 RU RU2018144315A patent/RU2740996C2/ru active
- 2017-05-17 KR KR1020227033500A patent/KR102512597B1/ko active IP Right Grant
- 2017-05-17 NZ NZ748314A patent/NZ748314A/en unknown
- 2017-05-17 KR KR1020187036427A patent/KR102449294B1/ko active IP Right Grant
- 2017-05-17 MX MX2018014175A patent/MX2018014175A/es unknown
- 2017-05-17 SG SG10201914095SA patent/SG10201914095SA/en unknown
- 2017-05-17 ES ES19197371T patent/ES2864150T3/es active Active
- 2017-05-17 BR BR112018073574-4A patent/BR112018073574A2/pt unknown
- 2017-05-17 DK DK19197371.8T patent/DK3626273T3/da active
-
2018
- 2018-03-02 US US15/910,788 patent/US10383948B2/en active Active
- 2018-12-12 ZA ZA2018/08386A patent/ZA201808386B/en unknown
-
2019
- 2019-05-28 US US16/424,324 patent/US10603389B2/en active Active
-
2020
- 2020-01-17 US US16/746,497 patent/US20200215200A1/en active Pending
- 2020-07-29 HR HRP20201186TT patent/HRP20201186T1/hr unknown
- 2020-08-10 CY CY20201100742T patent/CY1123256T1/el unknown
-
2021
- 2021-01-25 JP JP2021009320A patent/JP6870161B1/ja active Active
- 2021-02-25 HR HRP20210326TT patent/HRP20210326T1/hr unknown
- 2021-03-01 CY CY20211100168T patent/CY1123858T1/el unknown
- 2021-04-14 JP JP2021068144A patent/JP7150087B2/ja active Active
-
2022
- 2022-09-26 JP JP2022152185A patent/JP2022185003A/ja active Pending
-
2023
- 2023-02-22 US US18/172,769 patent/US20230321271A1/en active Pending
- 2023-07-25 IL IL304717A patent/IL304717A/en unknown
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20090010945A1 (en) * | 2004-03-02 | 2009-01-08 | Seattle Genetics, Inc. | Partially Loaded Antibodies And Methods Of Their Conjugation |
| RU2613906C2 (ru) * | 2011-05-08 | 2017-03-21 | Легокем Биосайенсис, Инк. | Конъюгаты белок-активное вещество и способ их получения |
| US20150110815A1 (en) * | 2011-11-28 | 2015-04-23 | Korea Research Institute Of Bioscience And Biotechnology | Drug conjugate comprising drug linked to human c-met antibody, and use therefor |
| US20150071950A1 (en) * | 2013-09-12 | 2015-03-12 | Samsung Electronics Co., Ltd. | C-met targeting compound-bioactive material conjugate and use thereof |
Non-Patent Citations (3)
| Title |
|---|
| DORONINA S. O. ET AL., Development of potent monoclonal antibody auristatin conjugates for cancer therapy Nature Biotechnology, 2003, Vol: 21, Nr: 7, Page(s): 778 - 784. * |
| DORONINA S. O. ET AL., Development of potent monoclonal antibody auristatin conjugates for cancer therapy Nature Biotechnology, 2003, Vol: 21, Nr: 7, Page(s): 778 - 784. Scott C Jeffrey "A Potent Anti-CD70 Antibody-Drug Conjugate Combining a Dimeric Pyrrolobenzodiazepine Drug with Site-Specific Conjugation Technology", Bioconjugate Chemistry, 2013, Vol: 24, Nr: 7, Page(s): 1256 - 1263. * |
| Scott C Jeffrey "A Potent Anti-CD70 Antibody-Drug Conjugate Combining a Dimeric Pyrrolobenzodiazepine Drug with Site-Specific Conjugation Technology", Bioconjugate Chemistry, 2013, Vol: 24, Nr: 7, Page(s): 1256 - 1263. * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2740996C2 (ru) | КОНЪЮГАТЫ АНТИТЕЛА К cMet И ЛЕКАРСТВЕННОГО СРЕДСТВА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | |
| US11045480B2 (en) | Anti-huLRRC15 antibody drug conjugates and methods for their use | |
| JP2019501124A (ja) | 抗huLRRC15抗体薬物コンジュゲート及びその使用方法 |