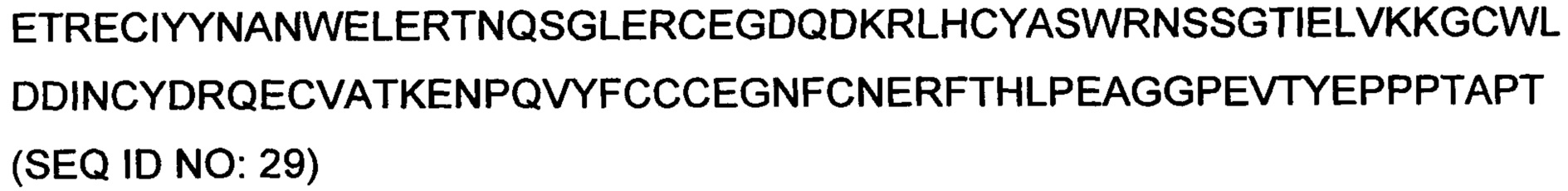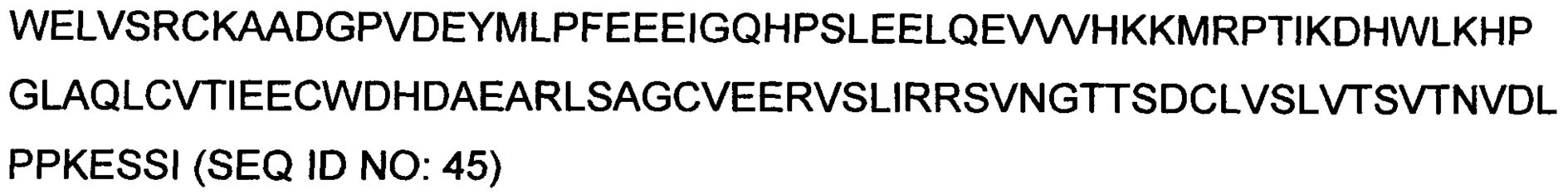RU2733492C2 - Новые гибридные ActRIIB белки-ловушки лигандов для лечения заболеваний, связанных с мышечной атрофией - Google Patents
Новые гибридные ActRIIB белки-ловушки лигандов для лечения заболеваний, связанных с мышечной атрофией Download PDFInfo
- Publication number
- RU2733492C2 RU2733492C2 RU2017138537A RU2017138537A RU2733492C2 RU 2733492 C2 RU2733492 C2 RU 2733492C2 RU 2017138537 A RU2017138537 A RU 2017138537A RU 2017138537 A RU2017138537 A RU 2017138537A RU 2733492 C2 RU2733492 C2 RU 2733492C2
- Authority
- RU
- Russia
- Prior art keywords
- seq
- amino acid
- actriib
- acid sequence
- ecd
- Prior art date
Links
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 title claims abstract description 28
- 201000000585 muscular atrophy Diseases 0.000 title claims abstract description 26
- 201000010099 disease Diseases 0.000 title claims abstract description 16
- 108090000623 proteins and genes Proteins 0.000 title claims description 180
- 102000004169 proteins and genes Human genes 0.000 title claims description 171
- 239000003446 ligand Substances 0.000 title description 132
- 101100437153 Rattus norvegicus Acvr2b gene Proteins 0.000 title 1
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 370
- 102000004196 processed proteins & peptides Human genes 0.000 claims abstract description 341
- 229920001184 polypeptide Polymers 0.000 claims abstract description 338
- 230000027455 binding Effects 0.000 claims abstract description 94
- 102100039939 Growth/differentiation factor 8 Human genes 0.000 claims abstract description 69
- 108010056852 Myostatin Proteins 0.000 claims abstract description 69
- 108010023082 activin A Proteins 0.000 claims abstract description 58
- 230000002829 reductive effect Effects 0.000 claims abstract description 44
- 238000011282 treatment Methods 0.000 claims abstract description 31
- 108010090290 Growth Differentiation Factor 2 Proteins 0.000 claims abstract description 9
- 210000000988 bone and bone Anatomy 0.000 claims abstract description 8
- 102000037280 Growth Differentiation Factor 2 Human genes 0.000 claims abstract 6
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 212
- 108020001507 fusion proteins Proteins 0.000 claims description 61
- 102000037865 fusion proteins Human genes 0.000 claims description 61
- 239000000203 mixture Substances 0.000 claims description 54
- 239000008194 pharmaceutical composition Substances 0.000 claims description 46
- 239000003937 drug carrier Substances 0.000 claims description 26
- 206010028289 Muscle atrophy Diseases 0.000 claims description 20
- 230000020763 muscle atrophy Effects 0.000 claims description 12
- 108060003951 Immunoglobulin Proteins 0.000 claims description 11
- 102000018358 immunoglobulin Human genes 0.000 claims description 11
- 102000018918 Activin Receptors Human genes 0.000 claims description 6
- 108010052946 Activin Receptors Proteins 0.000 claims description 6
- 208000029578 Muscle disease Diseases 0.000 claims description 2
- 238000007918 intramuscular administration Methods 0.000 claims description 2
- 238000001990 intravenous administration Methods 0.000 claims description 2
- 238000007913 intrathecal administration Methods 0.000 claims 1
- 238000007920 subcutaneous administration Methods 0.000 claims 1
- 230000000694 effects Effects 0.000 abstract description 28
- 239000003814 drug Substances 0.000 abstract description 15
- 108010059616 Activins Proteins 0.000 abstract description 12
- 208000021642 Muscular disease Diseases 0.000 abstract description 12
- 239000000488 activin Substances 0.000 abstract description 12
- 102100026818 Inhibin beta E chain Human genes 0.000 abstract description 11
- 239000000126 substance Substances 0.000 abstract description 3
- 125000000539 amino acid group Chemical group 0.000 description 234
- 235000018102 proteins Nutrition 0.000 description 166
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 105
- 102100040892 Growth/differentiation factor 2 Human genes 0.000 description 79
- 230000004927 fusion Effects 0.000 description 78
- 101000893585 Homo sapiens Growth/differentiation factor 2 Proteins 0.000 description 75
- 235000001014 amino acid Nutrition 0.000 description 69
- 210000004027 cell Anatomy 0.000 description 66
- 150000001413 amino acids Chemical class 0.000 description 61
- 229940024606 amino acid Drugs 0.000 description 60
- 238000000034 method Methods 0.000 description 60
- 239000004229 Alkannin Substances 0.000 description 51
- 102000040430 polynucleotide Human genes 0.000 description 51
- 108091033319 polynucleotide Proteins 0.000 description 51
- 239000002157 polynucleotide Substances 0.000 description 51
- 150000007523 nucleic acids Chemical class 0.000 description 43
- 102000039446 nucleic acids Human genes 0.000 description 41
- 108020004707 nucleic acids Proteins 0.000 description 41
- 230000014509 gene expression Effects 0.000 description 38
- 239000013598 vector Substances 0.000 description 37
- 206010028980 Neoplasm Diseases 0.000 description 27
- 108020004414 DNA Proteins 0.000 description 26
- 210000003205 muscle Anatomy 0.000 description 26
- 239000003795 chemical substances by application Substances 0.000 description 23
- 125000003729 nucleotide group Chemical group 0.000 description 22
- 239000002773 nucleotide Substances 0.000 description 21
- 230000001225 therapeutic effect Effects 0.000 description 21
- 230000003472 neutralizing effect Effects 0.000 description 19
- 238000006467 substitution reaction Methods 0.000 description 19
- 238000009396 hybridization Methods 0.000 description 18
- 230000011664 signaling Effects 0.000 description 18
- 210000001519 tissue Anatomy 0.000 description 18
- COXVTLYNGOIATD-HVMBLDELSA-N CC1=C(C=CC(=C1)C1=CC(C)=C(C=C1)\N=N\C1=C(O)C2=C(N)C(=CC(=C2C=C1)S(O)(=O)=O)S(O)(=O)=O)\N=N\C1=CC=C2C(=CC(=C(N)C2=C1O)S(O)(=O)=O)S(O)(=O)=O Chemical compound CC1=C(C=CC(=C1)C1=CC(C)=C(C=C1)\N=N\C1=C(O)C2=C(N)C(=CC(=C2C=C1)S(O)(=O)=O)S(O)(=O)=O)\N=N\C1=CC=C2C(=CC(=C(N)C2=C1O)S(O)(=O)=O)S(O)(=O)=O COXVTLYNGOIATD-HVMBLDELSA-N 0.000 description 17
- 108010076504 Protein Sorting Signals Proteins 0.000 description 17
- 201000011510 cancer Diseases 0.000 description 17
- 229960003699 evans blue Drugs 0.000 description 17
- 239000000523 sample Substances 0.000 description 17
- 230000001105 regulatory effect Effects 0.000 description 16
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 15
- 238000002648 combination therapy Methods 0.000 description 15
- 230000000295 complement effect Effects 0.000 description 15
- 208000007502 anemia Diseases 0.000 description 14
- 239000013604 expression vector Substances 0.000 description 14
- 239000002953 phosphate buffered saline Substances 0.000 description 14
- 239000003981 vehicle Substances 0.000 description 14
- 238000003556 assay Methods 0.000 description 13
- 208000020832 chronic kidney disease Diseases 0.000 description 13
- 206010012601 diabetes mellitus Diseases 0.000 description 13
- 206010016654 Fibrosis Diseases 0.000 description 12
- 239000001045 blue dye Substances 0.000 description 12
- 230000037396 body weight Effects 0.000 description 12
- 210000000056 organ Anatomy 0.000 description 12
- 239000013612 plasmid Substances 0.000 description 12
- 238000009097 single-agent therapy Methods 0.000 description 12
- 201000009623 Myopathy Diseases 0.000 description 11
- 208000035475 disorder Diseases 0.000 description 11
- 102000004127 Cytokines Human genes 0.000 description 10
- 108090000695 Cytokines Proteins 0.000 description 10
- 241001465754 Metazoa Species 0.000 description 10
- 241000699670 Mus sp. Species 0.000 description 10
- -1 but not limited to Substances 0.000 description 10
- 230000004761 fibrosis Effects 0.000 description 10
- 239000012634 fragment Substances 0.000 description 10
- 239000007924 injection Substances 0.000 description 10
- 238000002347 injection Methods 0.000 description 10
- 206010013801 Duchenne Muscular Dystrophy Diseases 0.000 description 9
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 9
- 210000003527 eukaryotic cell Anatomy 0.000 description 9
- 210000004072 lung Anatomy 0.000 description 9
- 229920001223 polyethylene glycol Polymers 0.000 description 9
- 238000012360 testing method Methods 0.000 description 9
- 108091028043 Nucleic acid sequence Proteins 0.000 description 8
- 239000000872 buffer Substances 0.000 description 8
- 208000019425 cirrhosis of liver Diseases 0.000 description 8
- 239000002552 dosage form Substances 0.000 description 8
- 239000000546 pharmaceutical excipient Substances 0.000 description 8
- 238000000746 purification Methods 0.000 description 8
- 102000005962 receptors Human genes 0.000 description 8
- 108020003175 receptors Proteins 0.000 description 8
- 238000003786 synthesis reaction Methods 0.000 description 8
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 7
- 238000011887 Necropsy Methods 0.000 description 7
- 208000008589 Obesity Diseases 0.000 description 7
- 208000022531 anorexia Diseases 0.000 description 7
- 239000011324 bead Substances 0.000 description 7
- 230000015572 biosynthetic process Effects 0.000 description 7
- 238000004113 cell culture Methods 0.000 description 7
- 230000001413 cellular effect Effects 0.000 description 7
- 150000001875 compounds Chemical class 0.000 description 7
- 206010061428 decreased appetite Diseases 0.000 description 7
- 230000001965 increasing effect Effects 0.000 description 7
- 238000004519 manufacturing process Methods 0.000 description 7
- 239000002609 medium Substances 0.000 description 7
- 235000020824 obesity Nutrition 0.000 description 7
- 210000001236 prokaryotic cell Anatomy 0.000 description 7
- 150000003839 salts Chemical class 0.000 description 7
- 206010006895 Cachexia Diseases 0.000 description 6
- 102000053602 DNA Human genes 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 239000004471 Glycine Substances 0.000 description 6
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 6
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 6
- 206010061535 Ovarian neoplasm Diseases 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 6
- 238000005516 engineering process Methods 0.000 description 6
- 208000014674 injury Diseases 0.000 description 6
- 238000012004 kinetic exclusion assay Methods 0.000 description 6
- 208000032839 leukemia Diseases 0.000 description 6
- 201000005202 lung cancer Diseases 0.000 description 6
- 208000020816 lung neoplasm Diseases 0.000 description 6
- 239000003550 marker Substances 0.000 description 6
- 230000004220 muscle function Effects 0.000 description 6
- 238000006386 neutralization reaction Methods 0.000 description 6
- 208000008338 non-alcoholic fatty liver disease Diseases 0.000 description 6
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 6
- 239000000725 suspension Substances 0.000 description 6
- 230000002381 testicular Effects 0.000 description 6
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 5
- 208000003174 Brain Neoplasms Diseases 0.000 description 5
- 206010007558 Cardiac failure chronic Diseases 0.000 description 5
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 5
- 101000970954 Homo sapiens Activin receptor type-2A Proteins 0.000 description 5
- 101000937269 Homo sapiens Activin receptor type-2B Proteins 0.000 description 5
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 5
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 5
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 5
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 5
- 108060001084 Luciferase Proteins 0.000 description 5
- 239000005089 Luciferase Substances 0.000 description 5
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 5
- 239000004472 Lysine Substances 0.000 description 5
- 206010033128 Ovarian cancer Diseases 0.000 description 5
- 239000002202 Polyethylene glycol Substances 0.000 description 5
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 5
- 235000004279 alanine Nutrition 0.000 description 5
- 235000009582 asparagine Nutrition 0.000 description 5
- 229960001230 asparagine Drugs 0.000 description 5
- 230000004071 biological effect Effects 0.000 description 5
- 230000000903 blocking effect Effects 0.000 description 5
- 210000004204 blood vessel Anatomy 0.000 description 5
- 208000022831 chronic renal failure syndrome Diseases 0.000 description 5
- 238000002474 experimental method Methods 0.000 description 5
- 238000009472 formulation Methods 0.000 description 5
- 230000006870 function Effects 0.000 description 5
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 5
- 235000004554 glutamine Nutrition 0.000 description 5
- 102000045412 human ACVR2B Human genes 0.000 description 5
- 210000004185 liver Anatomy 0.000 description 5
- 235000018977 lysine Nutrition 0.000 description 5
- 201000001441 melanoma Diseases 0.000 description 5
- 108020004999 messenger RNA Proteins 0.000 description 5
- 230000037257 muscle growth Effects 0.000 description 5
- 201000008482 osteoarthritis Diseases 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- 239000003755 preservative agent Substances 0.000 description 5
- 230000000750 progressive effect Effects 0.000 description 5
- 206010039073 rheumatoid arthritis Diseases 0.000 description 5
- 208000001076 sarcopenia Diseases 0.000 description 5
- 210000003491 skin Anatomy 0.000 description 5
- 239000000243 solution Substances 0.000 description 5
- 239000000600 sorbitol Substances 0.000 description 5
- 235000010356 sorbitol Nutrition 0.000 description 5
- 229940124597 therapeutic agent Drugs 0.000 description 5
- 210000003462 vein Anatomy 0.000 description 5
- 238000005406 washing Methods 0.000 description 5
- 239000004475 Arginine Substances 0.000 description 4
- 208000023275 Autoimmune disease Diseases 0.000 description 4
- 206010005003 Bladder cancer Diseases 0.000 description 4
- 208000020084 Bone disease Diseases 0.000 description 4
- 206010065687 Bone loss Diseases 0.000 description 4
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 4
- 206010009944 Colon cancer Diseases 0.000 description 4
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 4
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 4
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 4
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 4
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 4
- 102000013463 Immunoglobulin Light Chains Human genes 0.000 description 4
- 108010065825 Immunoglobulin Light Chains Proteins 0.000 description 4
- 229930195725 Mannitol Natural products 0.000 description 4
- 102100025744 Mothers against decapentaplegic homolog 1 Human genes 0.000 description 4
- 241001529936 Murinae Species 0.000 description 4
- 201000002481 Myositis Diseases 0.000 description 4
- 208000001132 Osteoporosis Diseases 0.000 description 4
- 208000002193 Pain Diseases 0.000 description 4
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 4
- 206010060862 Prostate cancer Diseases 0.000 description 4
- 101700032040 SMAD1 Proteins 0.000 description 4
- 208000005718 Stomach Neoplasms Diseases 0.000 description 4
- 229930006000 Sucrose Natural products 0.000 description 4
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 4
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 4
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 4
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 4
- 108010023079 activin B Proteins 0.000 description 4
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 4
- 206010003246 arthritis Diseases 0.000 description 4
- 230000001580 bacterial effect Effects 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 238000004422 calculation algorithm Methods 0.000 description 4
- 230000001684 chronic effect Effects 0.000 description 4
- 230000007882 cirrhosis Effects 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 239000003623 enhancer Substances 0.000 description 4
- 239000000945 filler Substances 0.000 description 4
- 206010017758 gastric cancer Diseases 0.000 description 4
- 239000000499 gel Substances 0.000 description 4
- 208000014829 head and neck neoplasm Diseases 0.000 description 4
- 210000002216 heart Anatomy 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 210000003734 kidney Anatomy 0.000 description 4
- 239000002502 liposome Substances 0.000 description 4
- 208000019423 liver disease Diseases 0.000 description 4
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 4
- 239000000594 mannitol Substances 0.000 description 4
- 235000010355 mannitol Nutrition 0.000 description 4
- 230000001404 mediated effect Effects 0.000 description 4
- 208000030159 metabolic disease Diseases 0.000 description 4
- 206010053219 non-alcoholic steatohepatitis Diseases 0.000 description 4
- 201000002528 pancreatic cancer Diseases 0.000 description 4
- 208000008443 pancreatic carcinoma Diseases 0.000 description 4
- 230000000717 retained effect Effects 0.000 description 4
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 238000007619 statistical method Methods 0.000 description 4
- 201000011549 stomach cancer Diseases 0.000 description 4
- 239000005720 sucrose Substances 0.000 description 4
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 4
- 230000008733 trauma Effects 0.000 description 4
- 241000701447 unidentified baculovirus Species 0.000 description 4
- 201000005112 urinary bladder cancer Diseases 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 3
- 108010077593 ACE-011 Proteins 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 208000010392 Bone Fractures Diseases 0.000 description 3
- 208000031229 Cardiomyopathies Diseases 0.000 description 3
- 208000024172 Cardiovascular disease Diseases 0.000 description 3
- 201000003883 Cystic fibrosis Diseases 0.000 description 3
- 238000002965 ELISA Methods 0.000 description 3
- 241000588724 Escherichia coli Species 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- 206010019280 Heart failures Diseases 0.000 description 3
- 206010019663 Hepatic failure Diseases 0.000 description 3
- 241000238631 Hexapoda Species 0.000 description 3
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 3
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 3
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 3
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 3
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 3
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 3
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 3
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 3
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 3
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 3
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 3
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 3
- 206010027476 Metastases Diseases 0.000 description 3
- 241000699666 Mus <mouse, genus> Species 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 3
- 108020004511 Recombinant DNA Proteins 0.000 description 3
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 3
- 206010039491 Sarcoma Diseases 0.000 description 3
- 229920002684 Sepharose Polymers 0.000 description 3
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 3
- 102000007562 Serum Albumin Human genes 0.000 description 3
- 108010071390 Serum Albumin Proteins 0.000 description 3
- 208000000453 Skin Neoplasms Diseases 0.000 description 3
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 3
- 229920002472 Starch Polymers 0.000 description 3
- 238000000692 Student's t-test Methods 0.000 description 3
- 201000009594 Systemic Scleroderma Diseases 0.000 description 3
- 206010042953 Systemic sclerosis Diseases 0.000 description 3
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 3
- 239000004473 Threonine Substances 0.000 description 3
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 3
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 3
- 241000700605 Viruses Species 0.000 description 3
- 210000000683 abdominal cavity Anatomy 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 230000032683 aging Effects 0.000 description 3
- 239000005557 antagonist Substances 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 239000002585 base Substances 0.000 description 3
- 210000004899 c-terminal region Anatomy 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 3
- 230000000747 cardiac effect Effects 0.000 description 3
- 230000009787 cardiac fibrosis Effects 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 239000002299 complementary DNA Substances 0.000 description 3
- 239000003636 conditioned culture medium Substances 0.000 description 3
- 239000003246 corticosteroid Substances 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 230000002638 denervation Effects 0.000 description 3
- 239000000975 dye Substances 0.000 description 3
- 239000003995 emulsifying agent Substances 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 230000002255 enzymatic effect Effects 0.000 description 3
- 239000000796 flavoring agent Substances 0.000 description 3
- 235000019634 flavors Nutrition 0.000 description 3
- 239000008103 glucose Substances 0.000 description 3
- 235000011187 glycerol Nutrition 0.000 description 3
- 201000010536 head and neck cancer Diseases 0.000 description 3
- 208000018578 heart valve disease Diseases 0.000 description 3
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 3
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 3
- 238000002513 implantation Methods 0.000 description 3
- 230000006872 improvement Effects 0.000 description 3
- 208000015181 infectious disease Diseases 0.000 description 3
- 230000002757 inflammatory effect Effects 0.000 description 3
- 239000003112 inhibitor Substances 0.000 description 3
- 230000000977 initiatory effect Effects 0.000 description 3
- 206010073096 invasive lobular breast carcinoma Diseases 0.000 description 3
- 229960000310 isoleucine Drugs 0.000 description 3
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 231100000835 liver failure Toxicity 0.000 description 3
- 208000007903 liver failure Diseases 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 229930182817 methionine Natural products 0.000 description 3
- 229960000485 methotrexate Drugs 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 201000006938 muscular dystrophy Diseases 0.000 description 3
- 206010028417 myasthenia gravis Diseases 0.000 description 3
- 208000010125 myocardial infarction Diseases 0.000 description 3
- 210000003739 neck Anatomy 0.000 description 3
- 208000015122 neurodegenerative disease Diseases 0.000 description 3
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 3
- 239000003921 oil Substances 0.000 description 3
- 235000019198 oils Nutrition 0.000 description 3
- 210000000496 pancreas Anatomy 0.000 description 3
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 3
- 230000036470 plasma concentration Effects 0.000 description 3
- 208000005987 polymyositis Diseases 0.000 description 3
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 3
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 3
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 235000013930 proline Nutrition 0.000 description 3
- 229960004063 propylene glycol Drugs 0.000 description 3
- 238000001742 protein purification Methods 0.000 description 3
- 238000001243 protein synthesis Methods 0.000 description 3
- 229950010131 puromycin Drugs 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 201000002793 renal fibrosis Diseases 0.000 description 3
- 230000010076 replication Effects 0.000 description 3
- 230000001850 reproductive effect Effects 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 3
- 210000002027 skeletal muscle Anatomy 0.000 description 3
- 235000015424 sodium Nutrition 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 241000894007 species Species 0.000 description 3
- 238000010186 staining Methods 0.000 description 3
- 235000019698 starch Nutrition 0.000 description 3
- 210000000130 stem cell Anatomy 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 208000011580 syndromic disease Diseases 0.000 description 3
- 239000003826 tablet Substances 0.000 description 3
- 230000008685 targeting Effects 0.000 description 3
- 230000000699 topical effect Effects 0.000 description 3
- 238000001890 transfection Methods 0.000 description 3
- 230000014616 translation Effects 0.000 description 3
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 3
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 3
- 239000004474 valine Substances 0.000 description 3
- 230000008728 vascular permeability Effects 0.000 description 3
- 230000003442 weekly effect Effects 0.000 description 3
- PUPZLCDOIYMWBV-UHFFFAOYSA-N (+/-)-1,3-Butanediol Chemical compound CC(O)CCO PUPZLCDOIYMWBV-UHFFFAOYSA-N 0.000 description 2
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 2
- IAKHMKGGTNLKSZ-INIZCTEOSA-N (S)-colchicine Chemical compound C1([C@@H](NC(C)=O)CC2)=CC(=O)C(OC)=CC=C1C1=C2C=C(OC)C(OC)=C1OC IAKHMKGGTNLKSZ-INIZCTEOSA-N 0.000 description 2
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 2
- WRMNZCZEMHIOCP-UHFFFAOYSA-N 2-phenylethanol Chemical compound OCCC1=CC=CC=C1 WRMNZCZEMHIOCP-UHFFFAOYSA-N 0.000 description 2
- 208000030507 AIDS Diseases 0.000 description 2
- 239000012114 Alexa Fluor 647 Substances 0.000 description 2
- 208000000103 Anorexia Nervosa Diseases 0.000 description 2
- 208000025494 Aortic disease Diseases 0.000 description 2
- 208000032467 Aplastic anaemia Diseases 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 206010003694 Atrophy Diseases 0.000 description 2
- 206010003827 Autoimmune hepatitis Diseases 0.000 description 2
- 208000008035 Back Pain Diseases 0.000 description 2
- 201000006935 Becker muscular dystrophy Diseases 0.000 description 2
- 208000008439 Biliary Liver Cirrhosis Diseases 0.000 description 2
- 208000033222 Biliary cirrhosis primary Diseases 0.000 description 2
- 108010007726 Bone Morphogenetic Proteins Proteins 0.000 description 2
- 102000007350 Bone Morphogenetic Proteins Human genes 0.000 description 2
- 241000701822 Bovine papillomavirus Species 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- 206010058019 Cancer Pain Diseases 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 201000009030 Carcinoma Diseases 0.000 description 2
- 208000011231 Crohn disease Diseases 0.000 description 2
- 208000032131 Diabetic Neuropathies Diseases 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- 208000032928 Dyslipidaemia Diseases 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- 208000037149 Facioscapulohumeral dystrophy Diseases 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 206010018276 Gingival bleeding Diseases 0.000 description 2
- 206010018364 Glomerulonephritis Diseases 0.000 description 2
- 108010070675 Glutathione transferase Proteins 0.000 description 2
- 102100029100 Hematopoietic prostaglandin D synthase Human genes 0.000 description 2
- 101000961146 Homo sapiens Immunoglobulin heavy constant gamma 2 Proteins 0.000 description 2
- 102000008100 Human Serum Albumin Human genes 0.000 description 2
- 108091006905 Human Serum Albumin Proteins 0.000 description 2
- 208000023105 Huntington disease Diseases 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- 201000009794 Idiopathic Pulmonary Fibrosis Diseases 0.000 description 2
- 102100026120 IgG receptor FcRn large subunit p51 Human genes 0.000 description 2
- 101710177940 IgG receptor FcRn large subunit p51 Proteins 0.000 description 2
- 208000014919 IgG4-related retroperitoneal fibrosis Diseases 0.000 description 2
- 102100039346 Immunoglobulin heavy constant gamma 2 Human genes 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 206010065390 Inflammatory pain Diseases 0.000 description 2
- 206010022489 Insulin Resistance Diseases 0.000 description 2
- 208000015710 Iron-Deficiency Anemia Diseases 0.000 description 2
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 2
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 208000017170 Lipid metabolism disease Diseases 0.000 description 2
- 206010025323 Lymphomas Diseases 0.000 description 2
- 101710175625 Maltose/maltodextrin-binding periplasmic protein Proteins 0.000 description 2
- 208000001826 Marfan syndrome Diseases 0.000 description 2
- 208000001145 Metabolic Syndrome Diseases 0.000 description 2
- 102100025751 Mothers against decapentaplegic homolog 2 Human genes 0.000 description 2
- 101710143123 Mothers against decapentaplegic homolog 2 Proteins 0.000 description 2
- 208000034578 Multiple myelomas Diseases 0.000 description 2
- 102000008934 Muscle Proteins Human genes 0.000 description 2
- 108010074084 Muscle Proteins Proteins 0.000 description 2
- 201000003793 Myelodysplastic syndrome Diseases 0.000 description 2
- 208000009525 Myocarditis Diseases 0.000 description 2
- 208000010316 Myotonia congenita Diseases 0.000 description 2
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 2
- 208000003510 Nephrogenic Fibrosing Dermopathy Diseases 0.000 description 2
- 206010067467 Nephrogenic systemic fibrosis Diseases 0.000 description 2
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 2
- 108020004711 Nucleic Acid Probes Proteins 0.000 description 2
- 108091034117 Oligonucleotide Proteins 0.000 description 2
- 206010031243 Osteogenesis imperfecta Diseases 0.000 description 2
- 208000018737 Parkinson disease Diseases 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- 102000035195 Peptidases Human genes 0.000 description 2
- 108091093037 Peptide nucleic acid Proteins 0.000 description 2
- 208000025584 Pericardial disease Diseases 0.000 description 2
- 206010035226 Plasma cell myeloma Diseases 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- 208000012654 Primary biliary cholangitis Diseases 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 201000004681 Psoriasis Diseases 0.000 description 2
- 206010038979 Retroperitoneal fibrosis Diseases 0.000 description 2
- 102000043168 TGF-beta family Human genes 0.000 description 2
- 108091085018 TGF-beta family Proteins 0.000 description 2
- 208000002903 Thalassemia Diseases 0.000 description 2
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 2
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 2
- 208000027418 Wounds and injury Diseases 0.000 description 2
- XLOMVQKBTHCTTD-UHFFFAOYSA-N Zinc monoxide Chemical compound [Zn]=O XLOMVQKBTHCTTD-UHFFFAOYSA-N 0.000 description 2
- 201000000690 abdominal obesity-metabolic syndrome Diseases 0.000 description 2
- 238000002835 absorbance Methods 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- 208000026594 alcoholic fatty liver disease Diseases 0.000 description 2
- 235000010443 alginic acid Nutrition 0.000 description 2
- 229920000615 alginic acid Polymers 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 230000001548 androgenic effect Effects 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 239000008346 aqueous phase Substances 0.000 description 2
- 206010003119 arrhythmia Diseases 0.000 description 2
- 229940009098 aspartate Drugs 0.000 description 2
- 230000037444 atrophy Effects 0.000 description 2
- 235000012216 bentonite Nutrition 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- SESFRYSPDFLNCH-UHFFFAOYSA-N benzyl benzoate Chemical compound C=1C=CC=CC=1C(=O)OCC1=CC=CC=C1 SESFRYSPDFLNCH-UHFFFAOYSA-N 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 125000004057 biotinyl group Chemical group [H]N1C(=O)N([H])[C@]2([H])[C@@]([H])(SC([H])([H])[C@]12[H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C(*)=O 0.000 description 2
- 229940112869 bone morphogenetic protein Drugs 0.000 description 2
- 239000004067 bulking agent Substances 0.000 description 2
- RYYVLZVUVIJVGH-UHFFFAOYSA-N caffeine Chemical compound CN1C(=O)N(C)C(=O)C2=C1N=CN2C RYYVLZVUVIJVGH-UHFFFAOYSA-N 0.000 description 2
- 244000309466 calf Species 0.000 description 2
- 239000001768 carboxy methyl cellulose Substances 0.000 description 2
- 208000037877 cardiac atrophy Diseases 0.000 description 2
- 238000000423 cell based assay Methods 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000002512 chemotherapy Methods 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 210000001072 colon Anatomy 0.000 description 2
- 239000003086 colorant Substances 0.000 description 2
- 230000000052 comparative effect Effects 0.000 description 2
- 230000004540 complement-dependent cytotoxicity Effects 0.000 description 2
- 238000002591 computed tomography Methods 0.000 description 2
- 201000011474 congenital myopathy Diseases 0.000 description 2
- 210000004087 cornea Anatomy 0.000 description 2
- 208000029078 coronary artery disease Diseases 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- DDRJAANPRJIHGJ-UHFFFAOYSA-N creatinine Chemical compound CN1CC(=O)NC1=N DDRJAANPRJIHGJ-UHFFFAOYSA-N 0.000 description 2
- 235000018417 cysteine Nutrition 0.000 description 2
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 2
- 230000007850 degeneration Effects 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 201000001981 dermatomyositis Diseases 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 238000004090 dissolution Methods 0.000 description 2
- 239000012636 effector Substances 0.000 description 2
- 230000007613 environmental effect Effects 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- 210000003743 erythrocyte Anatomy 0.000 description 2
- 208000008570 facioscapulohumeral muscular dystrophy Diseases 0.000 description 2
- 239000003925 fat Substances 0.000 description 2
- 235000019197 fats Nutrition 0.000 description 2
- 210000001035 gastrointestinal tract Anatomy 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 229930195712 glutamate Natural products 0.000 description 2
- 230000004217 heart function Effects 0.000 description 2
- 210000003709 heart valve Anatomy 0.000 description 2
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 2
- 239000003906 humectant Substances 0.000 description 2
- 238000003384 imaging method Methods 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 239000003701 inert diluent Substances 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 208000036971 interstitial lung disease 2 Diseases 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 239000008297 liquid dosage form Substances 0.000 description 2
- 230000004807 localization Effects 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 210000004379 membrane Anatomy 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 230000009401 metastasis Effects 0.000 description 2
- OKKJLVBELUTLKV-UHFFFAOYSA-N methanol Natural products OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- YACKEPLHDIMKIO-UHFFFAOYSA-N methylphosphonic acid Chemical class CP(O)(O)=O YACKEPLHDIMKIO-UHFFFAOYSA-N 0.000 description 2
- 239000000693 micelle Substances 0.000 description 2
- 238000010369 molecular cloning Methods 0.000 description 2
- 208000005264 motor neuron disease Diseases 0.000 description 2
- 201000006417 multiple sclerosis Diseases 0.000 description 2
- 230000035772 mutation Effects 0.000 description 2
- 206010028537 myelofibrosis Diseases 0.000 description 2
- 230000003274 myotonic effect Effects 0.000 description 2
- 210000005036 nerve Anatomy 0.000 description 2
- 208000004296 neuralgia Diseases 0.000 description 2
- 230000004770 neurodegeneration Effects 0.000 description 2
- 208000021722 neuropathic pain Diseases 0.000 description 2
- 238000007899 nucleic acid hybridization Methods 0.000 description 2
- 239000002853 nucleic acid probe Substances 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 208000005368 osteomalacia Diseases 0.000 description 2
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 239000006072 paste Substances 0.000 description 2
- 230000035515 penetration Effects 0.000 description 2
- 230000035699 permeability Effects 0.000 description 2
- WTJKGGKOPKCXLL-RRHRGVEJSA-N phosphatidylcholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCC=CCCCCCCCC WTJKGGKOPKCXLL-RRHRGVEJSA-N 0.000 description 2
- 230000035790 physiological processes and functions Effects 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 2
- 230000002035 prolonged effect Effects 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- AQHHHDLHHXJYJD-UHFFFAOYSA-N propranolol Chemical compound C1=CC=C2C(OCC(O)CNC(C)C)=CC=CC2=C1 AQHHHDLHHXJYJD-UHFFFAOYSA-N 0.000 description 2
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 2
- 230000017854 proteolysis Effects 0.000 description 2
- 208000005333 pulmonary edema Diseases 0.000 description 2
- 208000005069 pulmonary fibrosis Diseases 0.000 description 2
- 150000003856 quaternary ammonium compounds Chemical class 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 239000011541 reaction mixture Substances 0.000 description 2
- 210000000664 rectum Anatomy 0.000 description 2
- 210000002345 respiratory system Anatomy 0.000 description 2
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 2
- 229960004889 salicylic acid Drugs 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 238000002864 sequence alignment Methods 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 208000007056 sickle cell anemia Diseases 0.000 description 2
- 235000012239 silicon dioxide Nutrition 0.000 description 2
- 201000000849 skin cancer Diseases 0.000 description 2
- 210000000813 small intestine Anatomy 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000001509 sodium citrate Substances 0.000 description 2
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 2
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 2
- 239000007909 solid dosage form Substances 0.000 description 2
- 125000006850 spacer group Chemical group 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 150000003431 steroids Chemical class 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 210000002435 tendon Anatomy 0.000 description 2
- 210000001550 testis Anatomy 0.000 description 2
- 231100001274 therapeutic index Toxicity 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 210000001541 thymus gland Anatomy 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- 239000003053 toxin Substances 0.000 description 2
- 231100000765 toxin Toxicity 0.000 description 2
- 108700012359 toxins Proteins 0.000 description 2
- 238000012549 training Methods 0.000 description 2
- 201000008827 tuberculosis Diseases 0.000 description 2
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 2
- 210000005166 vasculature Anatomy 0.000 description 2
- 230000003612 virological effect Effects 0.000 description 2
- 239000001993 wax Substances 0.000 description 2
- 235000019786 weight gain Nutrition 0.000 description 2
- 239000000080 wetting agent Substances 0.000 description 2
- UBWXUGDQUBIEIZ-UHFFFAOYSA-N (13-methyl-3-oxo-2,6,7,8,9,10,11,12,14,15,16,17-dodecahydro-1h-cyclopenta[a]phenanthren-17-yl) 3-phenylpropanoate Chemical compound CC12CCC(C3CCC(=O)C=C3CC3)C3C1CCC2OC(=O)CCC1=CC=CC=C1 UBWXUGDQUBIEIZ-UHFFFAOYSA-N 0.000 description 1
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical class OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 1
- KILNVBDSWZSGLL-KXQOOQHDSA-N 1,2-dihexadecanoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCCCCCCCCC KILNVBDSWZSGLL-KXQOOQHDSA-N 0.000 description 1
- NRJAVPSFFCBXDT-HUESYALOSA-N 1,2-distearoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCCCCCCCCCCC NRJAVPSFFCBXDT-HUESYALOSA-N 0.000 description 1
- TZCPCKNHXULUIY-RGULYWFUSA-N 1,2-distearoyl-sn-glycero-3-phosphoserine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCCCCCC TZCPCKNHXULUIY-RGULYWFUSA-N 0.000 description 1
- 229940058015 1,3-butylene glycol Drugs 0.000 description 1
- AXTGDCSMTYGJND-UHFFFAOYSA-N 1-dodecylazepan-2-one Chemical compound CCCCCCCCCCCCN1CCCCCC1=O AXTGDCSMTYGJND-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- GZCWLCBFPRFLKL-UHFFFAOYSA-N 1-prop-2-ynoxypropan-2-ol Chemical compound CC(O)COCC#C GZCWLCBFPRFLKL-UHFFFAOYSA-N 0.000 description 1
- JNODDICFTDYODH-UHFFFAOYSA-N 2-hydroxytetrahydrofuran Chemical compound OC1CCCO1 JNODDICFTDYODH-UHFFFAOYSA-N 0.000 description 1
- OSJPPGNTCRNQQC-UWTATZPHSA-N 3-phospho-D-glyceric acid Chemical compound OC(=O)[C@H](O)COP(O)(O)=O OSJPPGNTCRNQQC-UWTATZPHSA-N 0.000 description 1
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 1
- 208000002008 AIDS-Related Lymphoma Diseases 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 102000013563 Acid Phosphatase Human genes 0.000 description 1
- 108010051457 Acid Phosphatase Proteins 0.000 description 1
- 102000005606 Activins Human genes 0.000 description 1
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 1
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- 235000017060 Arachis glabrata Nutrition 0.000 description 1
- 244000105624 Arachis hypogaea Species 0.000 description 1
- 235000010777 Arachis hypogaea Nutrition 0.000 description 1
- 235000018262 Arachis monticola Nutrition 0.000 description 1
- 208000006820 Arthralgia Diseases 0.000 description 1
- 206010058029 Arthrofibrosis Diseases 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 206010003571 Astrocytoma Diseases 0.000 description 1
- 206010060971 Astrocytoma malignant Diseases 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 108090001008 Avidin Proteins 0.000 description 1
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 1
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 102100026189 Beta-galactosidase Human genes 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 1
- 108010049951 Bone Morphogenetic Protein 3 Proteins 0.000 description 1
- 108010049974 Bone Morphogenetic Protein 6 Proteins 0.000 description 1
- 102100028726 Bone morphogenetic protein 10 Human genes 0.000 description 1
- 101710118482 Bone morphogenetic protein 10 Proteins 0.000 description 1
- 102100024504 Bone morphogenetic protein 3 Human genes 0.000 description 1
- 102100022525 Bone morphogenetic protein 6 Human genes 0.000 description 1
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 101710132601 Capsid protein Proteins 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 206010007953 Central nervous system lymphoma Diseases 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 208000018380 Chemical injury Diseases 0.000 description 1
- GHXZTYHSJHQHIJ-UHFFFAOYSA-N Chlorhexidine Chemical compound C=1C=C(Cl)C=CC=1NC(N)=NC(N)=NCCCCCCN=C(N)N=C(N)NC1=CC=C(Cl)C=C1 GHXZTYHSJHQHIJ-UHFFFAOYSA-N 0.000 description 1
- 208000017667 Chronic Disease Diseases 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- 206010009208 Cirrhosis alcoholic Diseases 0.000 description 1
- 101710094648 Coat protein Proteins 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 108091033380 Coding strand Proteins 0.000 description 1
- 206010009900 Colitis ulcerative Diseases 0.000 description 1
- 206010053138 Congenital aplastic anaemia Diseases 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 241000699802 Cricetulus griseus Species 0.000 description 1
- 229920000858 Cyclodextrin Polymers 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 1
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 1
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 1
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- 241000702421 Dependoparvovirus Species 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 208000007342 Diabetic Nephropathies Diseases 0.000 description 1
- 206010052337 Diastolic dysfunction Diseases 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 208000006402 Ductal Carcinoma Diseases 0.000 description 1
- 238000012286 ELISA Assay Methods 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- MBYXEBXZARTUSS-QLWBXOBMSA-N Emetamine Natural products O(C)c1c(OC)cc2c(c(C[C@@H]3[C@H](CC)CN4[C@H](c5c(cc(OC)c(OC)c5)CC4)C3)ncc2)c1 MBYXEBXZARTUSS-QLWBXOBMSA-N 0.000 description 1
- 206010014561 Emphysema Diseases 0.000 description 1
- 206010014759 Endometrial neoplasm Diseases 0.000 description 1
- 206010014967 Ependymoma Diseases 0.000 description 1
- 241000701959 Escherichia virus Lambda Species 0.000 description 1
- 241000206602 Eukaryota Species 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 239000001116 FEMA 4028 Substances 0.000 description 1
- 108010074864 Factor XI Proteins 0.000 description 1
- 201000004939 Fanconi anemia Diseases 0.000 description 1
- 108091006020 Fc-tagged proteins Proteins 0.000 description 1
- 239000012743 FreeStyle Max reagent Substances 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 229910052688 Gadolinium Inorganic materials 0.000 description 1
- 241000206672 Gelidium Species 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- 102000012004 Ghrelin Human genes 0.000 description 1
- 101800001586 Ghrelin Proteins 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- KOSRFJWDECSPRO-WDSKDSINSA-N Glu-Glu Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(O)=O KOSRFJWDECSPRO-WDSKDSINSA-N 0.000 description 1
- 208000002705 Glucose Intolerance Diseases 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- JZNWSCPGTDBMEW-UHFFFAOYSA-N Glycerophosphorylethanolamin Natural products NCCOP(O)(=O)OCC(O)CO JZNWSCPGTDBMEW-UHFFFAOYSA-N 0.000 description 1
- ZWZWYGMENQVNFU-UHFFFAOYSA-N Glycerophosphorylserin Natural products OC(=O)C(N)COP(O)(=O)OCC(O)CO ZWZWYGMENQVNFU-UHFFFAOYSA-N 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102100021181 Golgi phosphoprotein 3 Human genes 0.000 description 1
- 108010026389 Gramicidin Proteins 0.000 description 1
- 108010051696 Growth Hormone Proteins 0.000 description 1
- 102100040896 Growth/differentiation factor 15 Human genes 0.000 description 1
- 101710204270 Growth/differentiation factor 2 Proteins 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 208000031886 HIV Infections Diseases 0.000 description 1
- 208000037357 HIV infectious disease Diseases 0.000 description 1
- 239000012981 Hank's balanced salt solution Substances 0.000 description 1
- 208000018565 Hemochromatosis Diseases 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- 206010019668 Hepatic fibrosis Diseases 0.000 description 1
- 239000004705 High-molecular-weight polyethylene Substances 0.000 description 1
- 208000017604 Hodgkin disease Diseases 0.000 description 1
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000893549 Homo sapiens Growth/differentiation factor 15 Proteins 0.000 description 1
- 101000599951 Homo sapiens Insulin-like growth factor I Proteins 0.000 description 1
- 101000869690 Homo sapiens Protein S100-A8 Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 1
- 206010020772 Hypertension Diseases 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 1
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 102100026215 Immunoglobulin gamma-1 heavy chain Human genes 0.000 description 1
- 101710111858 Immunoglobulin gamma-1 heavy chain Proteins 0.000 description 1
- 102100037852 Insulin-like growth factor I Human genes 0.000 description 1
- 108010002352 Interleukin-1 Proteins 0.000 description 1
- 102000000589 Interleukin-1 Human genes 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 102000004889 Interleukin-6 Human genes 0.000 description 1
- 208000029523 Interstitial Lung disease Diseases 0.000 description 1
- 206010061252 Intraocular melanoma Diseases 0.000 description 1
- 206010065973 Iron Overload Diseases 0.000 description 1
- LPHGQDQBBGAPDZ-UHFFFAOYSA-N Isocaffeine Natural products CN1C(=O)N(C)C(=O)C2=C1N(C)C=N2 LPHGQDQBBGAPDZ-UHFFFAOYSA-N 0.000 description 1
- 208000007766 Kaposi sarcoma Diseases 0.000 description 1
- 206010023330 Keloid scar Diseases 0.000 description 1
- 206010023421 Kidney fibrosis Diseases 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- LEVWYRKDKASIDU-IMJSIDKUSA-N L-cystine Chemical compound [O-]C(=O)[C@@H]([NH3+])CSSC[C@H]([NH3+])C([O-])=O LEVWYRKDKASIDU-IMJSIDKUSA-N 0.000 description 1
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 1
- 206010062038 Lip neoplasm Diseases 0.000 description 1
- 239000004367 Lipase Substances 0.000 description 1
- 108090001060 Lipase Proteins 0.000 description 1
- 102000004882 Lipase Human genes 0.000 description 1
- 208000008930 Low Back Pain Diseases 0.000 description 1
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 101710125418 Major capsid protein Proteins 0.000 description 1
- 208000006644 Malignant Fibrous Histiocytoma Diseases 0.000 description 1
- 208000002720 Malnutrition Diseases 0.000 description 1
- 240000003183 Manihot esculenta Species 0.000 description 1
- 235000016735 Manihot esculenta subsp esculenta Nutrition 0.000 description 1
- 208000000172 Medulloblastoma Diseases 0.000 description 1
- 206010027452 Metastases to bone Diseases 0.000 description 1
- 229930192392 Mitomycin Natural products 0.000 description 1
- 206010027761 Mixed hepatocellular cholangiocarcinoma Diseases 0.000 description 1
- 102100025748 Mothers against decapentaplegic homolog 3 Human genes 0.000 description 1
- 101710143111 Mothers against decapentaplegic homolog 3 Proteins 0.000 description 1
- 208000003445 Mouth Neoplasms Diseases 0.000 description 1
- 108010085220 Multiprotein Complexes Proteins 0.000 description 1
- 102000007474 Multiprotein Complexes Human genes 0.000 description 1
- 208000010428 Muscle Weakness Diseases 0.000 description 1
- 206010028372 Muscular weakness Diseases 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 1
- 208000023137 Myotoxicity Diseases 0.000 description 1
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 1
- 208000028389 Nerve injury Diseases 0.000 description 1
- 208000009277 Neuroectodermal Tumors Diseases 0.000 description 1
- 244000061176 Nicotiana tabacum Species 0.000 description 1
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 1
- 208000001294 Nociceptive Pain Diseases 0.000 description 1
- 101710163270 Nuclease Proteins 0.000 description 1
- 101710141454 Nucleoprotein Proteins 0.000 description 1
- 240000007817 Olea europaea Species 0.000 description 1
- 208000003076 Osteolysis Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 108090000526 Papain Proteins 0.000 description 1
- 241001668545 Pascopyrum Species 0.000 description 1
- 208000031845 Pernicious anaemia Diseases 0.000 description 1
- 108010081690 Pertussis Toxin Proteins 0.000 description 1
- 206010057249 Phagocytosis Diseases 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 208000007641 Pinealoma Diseases 0.000 description 1
- 201000008199 Pleuropulmonary blastoma Diseases 0.000 description 1
- 101710182846 Polyhedrin Proteins 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 101710083689 Probable capsid protein Proteins 0.000 description 1
- 102100032442 Protein S100-A8 Human genes 0.000 description 1
- 208000003286 Protein-Energy Malnutrition Diseases 0.000 description 1
- 208000001647 Renal Insufficiency Diseases 0.000 description 1
- 208000017442 Retinal disease Diseases 0.000 description 1
- 201000000582 Retinoblastoma Diseases 0.000 description 1
- 206010038923 Retinopathy Diseases 0.000 description 1
- 235000004443 Ricinus communis Nutrition 0.000 description 1
- 102100030852 Run domain Beclin-1-interacting and cysteine-rich domain-containing protein Human genes 0.000 description 1
- AUVVAXYIELKVAI-UHFFFAOYSA-N SJ000285215 Natural products N1CCC2=CC(OC)=C(OC)C=C2C1CC1CC2C3=CC(OC)=C(OC)C=C3CCN2CC1CC AUVVAXYIELKVAI-UHFFFAOYSA-N 0.000 description 1
- 206010039710 Scleroderma Diseases 0.000 description 1
- 206010040047 Sepsis Diseases 0.000 description 1
- 206010041067 Small cell lung cancer Diseases 0.000 description 1
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 208000021712 Soft tissue sarcoma Diseases 0.000 description 1
- 240000003768 Solanum lycopersicum Species 0.000 description 1
- 235000002595 Solanum tuberosum Nutrition 0.000 description 1
- 244000061456 Solanum tuberosum Species 0.000 description 1
- 102100038803 Somatotropin Human genes 0.000 description 1
- SSZBUIDZHHWXNJ-UHFFFAOYSA-N Stearinsaeure-hexadecylester Natural products CCCCCCCCCCCCCCCCCC(=O)OCCCCCCCCCCCCCCCC SSZBUIDZHHWXNJ-UHFFFAOYSA-N 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 208000031673 T-Cell Cutaneous Lymphoma Diseases 0.000 description 1
- 101710137500 T7 RNA polymerase Proteins 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 206010053615 Thermal burn Diseases 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-N Thiophosphoric acid Chemical class OP(O)(S)=O RYYWUUFWQRZTIU-UHFFFAOYSA-N 0.000 description 1
- 102100036407 Thioredoxin Human genes 0.000 description 1
- 101710120037 Toxin CcdB Proteins 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 108700009124 Transcription Initiation Site Proteins 0.000 description 1
- GBOGMAARMMDZGR-UHFFFAOYSA-N UNPD149280 Natural products N1C(=O)C23OC(=O)C=CC(O)CCCC(C)CC=CC3C(O)C(=C)C(C)C2C1CC1=CC=CC=C1 GBOGMAARMMDZGR-UHFFFAOYSA-N 0.000 description 1
- 201000006704 Ulcerative Colitis Diseases 0.000 description 1
- 208000015778 Undifferentiated pleomorphic sarcoma Diseases 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 201000005969 Uveal melanoma Diseases 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- 102220514519 Vitronectin_T69E_mutation Human genes 0.000 description 1
- 208000004354 Vulvar Neoplasms Diseases 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- ATBOMIWRCZXYSZ-XZBBILGWSA-N [1-[2,3-dihydroxypropoxy(hydroxy)phosphoryl]oxy-3-hexadecanoyloxypropan-2-yl] (9e,12e)-octadeca-9,12-dienoate Chemical compound CCCCCCCCCCCCCCCC(=O)OCC(COP(O)(=O)OCC(O)CO)OC(=O)CCCCCCC\C=C\C\C=C\CCCCC ATBOMIWRCZXYSZ-XZBBILGWSA-N 0.000 description 1
- 210000001015 abdomen Anatomy 0.000 description 1
- 239000002250 absorbent Substances 0.000 description 1
- 230000002745 absorbent Effects 0.000 description 1
- 239000003655 absorption accelerator Substances 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 235000010419 agar Nutrition 0.000 description 1
- 208000010002 alcoholic liver cirrhosis Diseases 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 229910001508 alkali metal halide Inorganic materials 0.000 description 1
- 150000008045 alkali metal halides Chemical class 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- KOSRFJWDECSPRO-UHFFFAOYSA-N alpha-L-glutamyl-L-glutamic acid Natural products OC(=O)CCC(N)C(=O)NC(CCC(O)=O)C(O)=O KOSRFJWDECSPRO-UHFFFAOYSA-N 0.000 description 1
- AWUCVROLDVIAJX-UHFFFAOYSA-N alpha-glycerophosphate Natural products OCC(O)COP(O)(O)=O AWUCVROLDVIAJX-UHFFFAOYSA-N 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 1
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 1
- 235000011130 ammonium sulphate Nutrition 0.000 description 1
- 238000009167 androgen deprivation therapy Methods 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 230000003042 antagnostic effect Effects 0.000 description 1
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 229940027983 antiseptic and disinfectant quaternary ammonium compound Drugs 0.000 description 1
- 210000000436 anus Anatomy 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 239000000440 bentonite Substances 0.000 description 1
- 229910000278 bentonite Inorganic materials 0.000 description 1
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 229960004365 benzoic acid Drugs 0.000 description 1
- 229960002903 benzyl benzoate Drugs 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- WHGYBXFWUBPSRW-FOUAGVGXSA-N beta-cyclodextrin Chemical compound OC[C@H]([C@H]([C@@H]([C@H]1O)O)O[C@H]2O[C@@H]([C@@H](O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O3)[C@H](O)[C@H]2O)CO)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H]3O[C@@H]1CO WHGYBXFWUBPSRW-FOUAGVGXSA-N 0.000 description 1
- 235000011175 beta-cyclodextrine Nutrition 0.000 description 1
- 229960004853 betadex Drugs 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000008827 biological function Effects 0.000 description 1
- 230000033558 biomineral tissue development Effects 0.000 description 1
- RSIHSRDYCUFFLA-DYKIIFRCSA-N boldenone Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 RSIHSRDYCUFFLA-DYKIIFRCSA-N 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 210000000133 brain stem Anatomy 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 201000002143 bronchus adenoma Diseases 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 235000019437 butane-1,3-diol Nutrition 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 230000001612 cachectic effect Effects 0.000 description 1
- 229960001948 caffeine Drugs 0.000 description 1
- VJEONQKOZGKCAK-UHFFFAOYSA-N caffeine Natural products CN1C(=O)N(C)C(=O)C2=C1C=CN2C VJEONQKOZGKCAK-UHFFFAOYSA-N 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- FUFJGUQYACFECW-UHFFFAOYSA-L calcium hydrogenphosphate Chemical compound [Ca+2].OP([O-])([O-])=O FUFJGUQYACFECW-UHFFFAOYSA-L 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 230000001925 catabolic effect Effects 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 201000007335 cerebellar astrocytoma Diseases 0.000 description 1
- 208000030239 cerebral astrocytoma Diseases 0.000 description 1
- 229930183167 cerebroside Natural products 0.000 description 1
- 150000001784 cerebrosides Chemical class 0.000 description 1
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 229960000541 cetyl alcohol Drugs 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- NDAYQJDHGXTBJL-MWWSRJDJSA-N chembl557217 Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](C(C)C)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](C(C)C)NC(=O)[C@H](C)NC(=O)[C@H](NC(=O)CNC(=O)[C@@H](NC=O)C(C)C)CC(C)C)C(=O)NCCO)=CNC2=C1 NDAYQJDHGXTBJL-MWWSRJDJSA-N 0.000 description 1
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 1
- 229960003260 chlorhexidine Drugs 0.000 description 1
- 208000006990 cholangiocarcinoma Diseases 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 229940107161 cholesterol Drugs 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 1
- 150000001860 citric acid derivatives Chemical class 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 230000007012 clinical effect Effects 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 238000011260 co-administration Methods 0.000 description 1
- 229960001338 colchicine Drugs 0.000 description 1
- 238000001246 colloidal dispersion Methods 0.000 description 1
- 208000011588 combined hepatocellular carcinoma and cholangiocarcinoma Diseases 0.000 description 1
- 239000008139 complexing agent Substances 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 230000008602 contraction Effects 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 229940109239 creatinine Drugs 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 230000001186 cumulative effect Effects 0.000 description 1
- 201000007241 cutaneous T cell lymphoma Diseases 0.000 description 1
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 1
- 229960003067 cystine Drugs 0.000 description 1
- GBOGMAARMMDZGR-JREHFAHYSA-N cytochalasin B Natural products C[C@H]1CCC[C@@H](O)C=CC(=O)O[C@@]23[C@H](C=CC1)[C@H](O)C(=C)[C@@H](C)[C@@H]2[C@H](Cc4ccccc4)NC3=O GBOGMAARMMDZGR-JREHFAHYSA-N 0.000 description 1
- GBOGMAARMMDZGR-TYHYBEHESA-N cytochalasin B Chemical compound C([C@H]1[C@@H]2[C@@H](C([C@@H](O)[C@@H]3/C=C/C[C@H](C)CCC[C@@H](O)/C=C/C(=O)O[C@@]23C(=O)N1)=C)C)C1=CC=CC=C1 GBOGMAARMMDZGR-TYHYBEHESA-N 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- 229960000975 daunorubicin Drugs 0.000 description 1
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 1
- RSIHSRDYCUFFLA-UHFFFAOYSA-N dehydrotestosterone Natural products O=C1C=CC2(C)C3CCC(C)(C(CC4)O)C4C3CCC2=C1 RSIHSRDYCUFFLA-UHFFFAOYSA-N 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- CFCUWKMKBJTWLW-UHFFFAOYSA-N deoliosyl-3C-alpha-L-digitoxosyl-MTM Natural products CC=1C(O)=C2C(O)=C3C(=O)C(OC4OC(C)C(O)C(OC5OC(C)C(O)C(OC6OC(C)C(O)C(C)(O)C6)C5)C4)C(C(OC)C(=O)C(O)C(C)O)CC3=CC2=CC=1OC(OC(C)C1O)CC1OC1CC(O)C(O)C(C)O1 CFCUWKMKBJTWLW-UHFFFAOYSA-N 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 208000033679 diabetic kidney disease Diseases 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 235000019700 dicalcium phosphate Nutrition 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- 208000016097 disease of metabolism Diseases 0.000 description 1
- 208000037765 diseases and disorders Diseases 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- NAGJZTKCGNOGPW-UHFFFAOYSA-N dithiophosphoric acid Chemical class OP(O)(S)=S NAGJZTKCGNOGPW-UHFFFAOYSA-N 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 238000009547 dual-energy X-ray absorptiometry Methods 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 238000002592 echocardiography Methods 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- AUVVAXYIELKVAI-CKBKHPSWSA-N emetine Chemical compound N1CCC2=CC(OC)=C(OC)C=C2[C@H]1C[C@H]1C[C@H]2C3=CC(OC)=C(OC)C=C3CCN2C[C@@H]1CC AUVVAXYIELKVAI-CKBKHPSWSA-N 0.000 description 1
- 229960002694 emetine Drugs 0.000 description 1
- AUVVAXYIELKVAI-UWBTVBNJSA-N emetine Natural products N1CCC2=CC(OC)=C(OC)C=C2[C@H]1C[C@H]1C[C@H]2C3=CC(OC)=C(OC)C=C3CCN2C[C@H]1CC AUVVAXYIELKVAI-UWBTVBNJSA-N 0.000 description 1
- 230000002357 endometrial effect Effects 0.000 description 1
- 210000001163 endosome Anatomy 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 208000001780 epistaxis Diseases 0.000 description 1
- 210000003238 esophagus Anatomy 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 235000019441 ethanol Nutrition 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- ZMMJGEGLRURXTF-UHFFFAOYSA-N ethidium bromide Chemical compound [Br-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 ZMMJGEGLRURXTF-UHFFFAOYSA-N 0.000 description 1
- 229960005542 ethidium bromide Drugs 0.000 description 1
- 229940093499 ethyl acetate Drugs 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 239000013613 expression plasmid Substances 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 210000001508 eye Anatomy 0.000 description 1
- 230000001815 facial effect Effects 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 208000010706 fatty liver disease Diseases 0.000 description 1
- 230000003176 fibrotic effect Effects 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- 108091006047 fluorescent proteins Proteins 0.000 description 1
- 102000034287 fluorescent proteins Human genes 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- UIWYJDYFSGRHKR-UHFFFAOYSA-N gadolinium atom Chemical compound [Gd] UIWYJDYFSGRHKR-UHFFFAOYSA-N 0.000 description 1
- 210000000232 gallbladder Anatomy 0.000 description 1
- 150000002270 gangliosides Chemical class 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 238000005227 gel permeation chromatography Methods 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- GNKDKYIHGQKHHM-RJKLHVOGSA-N ghrelin Chemical compound C([C@H](NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)CN)COC(=O)CCCCCCC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1N=CNC=1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C1=CC=CC=C1 GNKDKYIHGQKHHM-RJKLHVOGSA-N 0.000 description 1
- 230000024924 glomerular filtration Effects 0.000 description 1
- 239000003862 glucocorticoid Substances 0.000 description 1
- 239000003292 glue Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 108010055341 glutamyl-glutamic acid Proteins 0.000 description 1
- YQEMORVAKMFKLG-UHFFFAOYSA-N glycerine monostearate Natural products CCCCCCCCCCCCCCCCCC(=O)OC(CO)CO YQEMORVAKMFKLG-UHFFFAOYSA-N 0.000 description 1
- SVUQHVRAGMNPLW-UHFFFAOYSA-N glycerol monostearate Natural products CCCCCCCCCCCCCCCCC(=O)OCC(O)CO SVUQHVRAGMNPLW-UHFFFAOYSA-N 0.000 description 1
- 230000002414 glycolytic effect Effects 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 239000000122 growth hormone Substances 0.000 description 1
- 208000011759 gum bleeding Diseases 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 201000009277 hairy cell leukemia Diseases 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 208000019622 heart disease Diseases 0.000 description 1
- 238000003505 heat denaturation Methods 0.000 description 1
- 208000007475 hemolytic anemia Diseases 0.000 description 1
- 230000011132 hemopoiesis Effects 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 1
- 210000001624 hip Anatomy 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 208000033519 human immunodeficiency virus infectious disease Diseases 0.000 description 1
- 210000004408 hybridoma Anatomy 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229960002163 hydrogen peroxide Drugs 0.000 description 1
- 229920001477 hydrophilic polymer Polymers 0.000 description 1
- 238000004191 hydrophobic interaction chromatography Methods 0.000 description 1
- 229910052588 hydroxylapatite Inorganic materials 0.000 description 1
- ZQDWXGKKHFNSQK-UHFFFAOYSA-N hydroxyzine Chemical compound C1CN(CCOCCO)CCN1C(C=1C=CC(Cl)=CC=1)C1=CC=CC=C1 ZQDWXGKKHFNSQK-UHFFFAOYSA-N 0.000 description 1
- 201000001421 hyperglycemia Diseases 0.000 description 1
- 230000002267 hypothalamic effect Effects 0.000 description 1
- 125000001841 imino group Chemical group [H]N=* 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 238000001114 immunoprecipitation Methods 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 201000008319 inclusion body myositis Diseases 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 208000000509 infertility Diseases 0.000 description 1
- 230000036512 infertility Effects 0.000 description 1
- 208000021267 infertility disease Diseases 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 230000003434 inspiratory effect Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 238000000185 intracerebroventricular administration Methods 0.000 description 1
- 210000003228 intrahepatic bile duct Anatomy 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 201000008893 intraocular retinoblastoma Diseases 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000007914 intraventricular administration Methods 0.000 description 1
- 238000004255 ion exchange chromatography Methods 0.000 description 1
- 238000001155 isoelectric focusing Methods 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- FZWBNHMXJMCXLU-BLAUPYHCSA-N isomaltotriose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1 FZWBNHMXJMCXLU-BLAUPYHCSA-N 0.000 description 1
- 239000000644 isotonic solution Substances 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 239000003410 keratolytic agent Substances 0.000 description 1
- 208000017169 kidney disease Diseases 0.000 description 1
- 201000006370 kidney failure Diseases 0.000 description 1
- 230000003907 kidney function Effects 0.000 description 1
- 210000000244 kidney pelvis Anatomy 0.000 description 1
- 210000003127 knee Anatomy 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 238000011005 laboratory method Methods 0.000 description 1
- 229910052747 lanthanoid Inorganic materials 0.000 description 1
- 150000002602 lanthanoids Chemical class 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 229960004194 lidocaine Drugs 0.000 description 1
- 235000019421 lipase Nutrition 0.000 description 1
- 210000005229 liver cell Anatomy 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 208000025036 lymphosarcoma Diseases 0.000 description 1
- 208000029791 lytic metastatic bone lesion Diseases 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 238000002595 magnetic resonance imaging Methods 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 208000030883 malignant astrocytoma Diseases 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 231100000682 maximum tolerated dose Toxicity 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 210000000716 merkel cell Anatomy 0.000 description 1
- 210000002901 mesenchymal stem cell Anatomy 0.000 description 1
- 230000001394 metastastic effect Effects 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 239000004530 micro-emulsion Substances 0.000 description 1
- 230000005486 microgravity Effects 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 235000013336 milk Nutrition 0.000 description 1
- 239000008267 milk Substances 0.000 description 1
- 210000004080 milk Anatomy 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 229960001156 mitoxantrone Drugs 0.000 description 1
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 230000003020 moisturizing effect Effects 0.000 description 1
- CQDGTJPVBWZJAZ-UHFFFAOYSA-N monoethyl carbonate Chemical compound CCOC(O)=O CQDGTJPVBWZJAZ-UHFFFAOYSA-N 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- 210000000663 muscle cell Anatomy 0.000 description 1
- 201000005962 mycosis fungoides Diseases 0.000 description 1
- 230000002107 myocardial effect Effects 0.000 description 1
- 230000010016 myocardial function Effects 0.000 description 1
- 210000004165 myocardium Anatomy 0.000 description 1
- 239000002088 nanocapsule Substances 0.000 description 1
- 230000008764 nerve damage Effects 0.000 description 1
- 230000000926 neurological effect Effects 0.000 description 1
- 208000018360 neuromuscular disease Diseases 0.000 description 1
- 201000001119 neuropathy Diseases 0.000 description 1
- 230000007823 neuropathy Effects 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 239000007764 o/w emulsion Substances 0.000 description 1
- 201000008106 ocular cancer Diseases 0.000 description 1
- 201000002575 ocular melanoma Diseases 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 230000033667 organ regeneration Effects 0.000 description 1
- 210000003463 organelle Anatomy 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 230000002611 ovarian Effects 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- 238000002638 palliative care Methods 0.000 description 1
- 229940055729 papain Drugs 0.000 description 1
- 235000019834 papain Nutrition 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 210000002990 parathyroid gland Anatomy 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 235000020232 peanut Nutrition 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 210000003899 penis Anatomy 0.000 description 1
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 1
- 239000000816 peptidomimetic Substances 0.000 description 1
- 238000011056 performance test Methods 0.000 description 1
- 210000000578 peripheral nerve Anatomy 0.000 description 1
- 208000033808 peripheral neuropathy Diseases 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 230000008782 phagocytosis Effects 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 125000001095 phosphatidyl group Chemical group 0.000 description 1
- 150000008104 phosphatidylethanolamines Chemical class 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 150000008298 phosphoramidates Chemical class 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 230000037081 physical activity Effects 0.000 description 1
- 230000036314 physical performance Effects 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 208000020943 pineal parenchymal cell neoplasm Diseases 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- 210000001778 pluripotent stem cell Anatomy 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 108010087782 poly(glycyl-alanyl) Proteins 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 229920000232 polyglycine polymer Polymers 0.000 description 1
- 229920002704 polyhistidine Polymers 0.000 description 1
- 239000012985 polymerization agent Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229940068977 polysorbate 20 Drugs 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229940068965 polysorbates Drugs 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 201000009104 prediabetes syndrome Diseases 0.000 description 1
- 208000016800 primary central nervous system lymphoma Diseases 0.000 description 1
- 208000025638 primary cutaneous T-cell non-Hodgkin lymphoma Diseases 0.000 description 1
- 208000029340 primitive neuroectodermal tumor Diseases 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000009465 prokaryotic expression Effects 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000001902 propagating effect Effects 0.000 description 1
- 239000003380 propellant Substances 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 229960003712 propranolol Drugs 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- 235000013772 propylene glycol Nutrition 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 235000019833 protease Nutrition 0.000 description 1
- 230000012743 protein tagging Effects 0.000 description 1
- 235000020826 protein-energy malnutrition Nutrition 0.000 description 1
- 208000002815 pulmonary hypertension Diseases 0.000 description 1
- HNJBEVLQSNELDL-UHFFFAOYSA-N pyrrolidin-2-one Chemical compound O=C1CCCN1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 230000000979 retarding effect Effects 0.000 description 1
- 230000001177 retroviral effect Effects 0.000 description 1
- 238000004366 reverse phase liquid chromatography Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 1
- 229920002477 rna polymer Polymers 0.000 description 1
- 210000003079 salivary gland Anatomy 0.000 description 1
- 210000001991 scapula Anatomy 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 150000004760 silicates Chemical class 0.000 description 1
- 238000011524 similarity measure Methods 0.000 description 1
- 238000002741 site-directed mutagenesis Methods 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 210000002460 smooth muscle Anatomy 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 229940079827 sodium hydrogen sulfite Drugs 0.000 description 1
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 229940001482 sodium sulfite Drugs 0.000 description 1
- 235000010265 sodium sulphite Nutrition 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000008247 solid mixture Substances 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 150000003408 sphingolipids Chemical class 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 208000020431 spinal cord injury Diseases 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 238000003153 stable transfection Methods 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 230000007863 steatosis Effects 0.000 description 1
- 231100000240 steatosis hepatitis Toxicity 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000005846 sugar alcohols Chemical class 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 229940037128 systemic glucocorticoids Drugs 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- 229960002372 tetracaine Drugs 0.000 description 1
- GKCBAIGFKIBETG-UHFFFAOYSA-N tetracaine Chemical compound CCCCNC1=CC=C(C(=O)OCCN(C)C)C=C1 GKCBAIGFKIBETG-UHFFFAOYSA-N 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 108060008226 thioredoxin Proteins 0.000 description 1
- 229940094937 thioredoxin Drugs 0.000 description 1
- 210000001685 thyroid gland Anatomy 0.000 description 1
- 230000017423 tissue regeneration Effects 0.000 description 1
- 239000012443 tonicity enhancing agent Substances 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 230000005030 transcription termination Effects 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 239000012096 transfection reagent Substances 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000010474 transient expression Effects 0.000 description 1
- 238000003146 transient transfection Methods 0.000 description 1
- ODLHGICHYURWBS-LKONHMLTSA-N trappsol cyclo Chemical compound CC(O)COC[C@H]([C@H]([C@@H]([C@H]1O)O)O[C@H]2O[C@@H]([C@@H](O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O3)[C@H](O)[C@H]2O)COCC(O)C)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H]3O[C@@H]1COCC(C)O ODLHGICHYURWBS-LKONHMLTSA-N 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- GPRLSGONYQIRFK-MNYXATJNSA-N triton Chemical compound [3H+] GPRLSGONYQIRFK-MNYXATJNSA-N 0.000 description 1
- 229960000281 trometamol Drugs 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 210000000626 ureter Anatomy 0.000 description 1
- 210000003708 urethra Anatomy 0.000 description 1
- 210000003932 urinary bladder Anatomy 0.000 description 1
- 230000002485 urinary effect Effects 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 210000002229 urogenital system Anatomy 0.000 description 1
- 208000037965 uterine sarcoma Diseases 0.000 description 1
- 208000013139 vaginal neoplasm Diseases 0.000 description 1
- 238000010200 validation analysis Methods 0.000 description 1
- 235000019871 vegetable fat Nutrition 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 208000009935 visceral pain Diseases 0.000 description 1
- 238000012800 visualization Methods 0.000 description 1
- 239000007762 w/o emulsion Substances 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- 230000003313 weakening effect Effects 0.000 description 1
- 230000004584 weight gain Effects 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
- 239000011787 zinc oxide Substances 0.000 description 1
- 235000014692 zinc oxide Nutrition 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/475—Growth factors; Growth regulators
- C07K14/495—Transforming growth factor [TGF]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/475—Growth factors; Growth regulators
- C07K14/51—Bone morphogenetic factor; Osteogenins; Osteogenic factor; Bone-inducing factor
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K19/00—Hybrid peptides, i.e. peptides covalently bound to nucleic acids, or non-covalently bound protein-protein complexes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Genetics & Genomics (AREA)
- Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Zoology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Gastroenterology & Hepatology (AREA)
- Immunology (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Toxicology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Physical Education & Sports Medicine (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Cell Biology (AREA)
- Rheumatology (AREA)
- Biotechnology (AREA)
- Wood Science & Technology (AREA)
- Biomedical Technology (AREA)
- General Engineering & Computer Science (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Obesity (AREA)
- Epidemiology (AREA)
- Microbiology (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
- Peptides Or Proteins (AREA)
Abstract
Изобретение относится к области биотехнологии, конкретно к получению мутантного растворимого полипептида внеклеточного домена рецептора активина IIB (ActRIIB-ECD), и может быть использовано в медицине. Мутантный полипептид ActRIIB-ECD способен к связыванию с миостатином и активином A, но демонстрирует пониженную аффинность связывания с костным морфогенетическим белком 9 (BMP9) относительно ActRIIB-ECD полипептида дикого типа и может быть использован для эффективного лечения связанных с мышечной атрофией заболеваний или заболеваний костной системы. 3 н. и 16 з.п. ф-лы, 12 ил., 8 табл., 8 пр.
Description
Перекрестная ссылка на родственные заявки
В данной заявке испрашивается приоритет предварительной заявки на патент США No. 62/150994, поданной 22 апреля 2015 года, и предварительной заявки на патент США No. 62/262356, поданной 2 декабря 2015 года, каждая из которых включена в данное описание ссылкой во всей полноте.
Предшествующий уровень техники
Мышечная атрофия относится к прогрессирующей потере мышечной массы и/или к прогрессирующему ослаблению и дегенерации мышц, включая скелетные и произвольно сокращающиеся мышцы, сердечные мышцы, контролирующие сердце (кардиомиопатии) и гладкие мышцы. Хроническая мышечная атрофия представляет собой состояние (а именно персистирующее в течение продолжительного периода времени), характеризующееся прогрессирующей потерей мышечной массы, а также мышечным ослаблением и дегенерацией. Потеря мышечной массы возникает, когда скорость распада мышечного белка превышает синтез мышечного белка.
Мышечная атрофия представляет собой инвалидизирующее и угрожающее жизни болезненное состояние, которое ассоциировано с развитием множества хронических, неврологических, генетических, воспалительных, фиброзных или инфекционных патологий, включая, например, мышечные дистрофии, боковой амиотрофический склероз, миозит, денервирующие мышечные атрофии, синдром анорексии-кахексии, злокачественные новообразования, ревматоидный артрит, остеоартрит, диабет, саркопеническое ожирение, возрастную саркопению, андрогенную депривацию, кортикостероидную миопатию, воспалительное заболевание кишечника, цирроз печени, хроническую обструктивную легочную болезнь, легочный фиброз, хроническую почечную недостаточность, травму, кардиомиопатию, хроническую сердечную недостаточность и ВИЧ-инфекцию. Другие состояния, которые вызывают мышечную атрофию, включают хроническую боль в нижней части спины, пожилой возраст, повреждение центральной нервной системы, поражение периферических нервов, химическое повреждение, обширные ожоги, бедренно/коленные протезы, дисфункциональную атрофию, воздействие микрогравитации и долговременную госпитализацию.
Рецептор активина IIA (ActRIIA) и рецептор активина IIB (ActRIIB) представляют собой рецепторы II типа для подсемейства членов семейства трансформирующего фактора роста бета (TGF-β), включая, например, активин А, миостатин (также известный как GDF-8), дифференцирующий фактор роста 11 (GDF-11) и различные другие костные морфогенетические белки (BMP), такие как BMP-3, BMP-6, BMP-9 (также известный как GDF-2) и BMP-10. Связывание этих лигандов семейства TGF-β с ActRIIA и/или ActRIIB может регулировать дифференцировку клеток, апоптоз, синтез и распад белка, минерализацию, гемопоэз, ангиогенез, синтез стероидов, адгезию, миграцию, продукцию внеклеточного матрикса и фиброгенез. Специфический ответ зависит от типов и уровней TGF-β лигандов и рецепторов, а также клеточного состояния и окружения. Известно, что измененная экспрессия этих лигандов ассоциирована с рядом заболеваний и расстройств. Например, повышенные уровни сывороточного активина А наблюдались при болезненных состояниях: мышечной атрофии, раке, хронической сердечной недостаточности, хронической почечной недостаточности, воспалении, фиброзе, анемии, потере костной массы и старении, и, как полагают, вносят вклад в патогенез и прогрессирование заболевания.
ActRIIA и ActRIIB были идентифицированы как рецепторы II типа для активинов, включая активин А, активин В и активин AB. ActRIIB представляет собой высокоаффинный рецептор для миостатина, ключевого негативного регулятора мышечного роста, и поэтому играет центральную роль в регулировании мышечной массы.
Различные ActRIIA-Fc и ActRIIB-Fc слитые белки проходили или проходят клиническую оценку в настоящее время. ActRIIA-Fc слитый белок (Acceleron Pharma's ACE-011) проходил клиническую оценку (Ph1, Ph2a) у пациентов с остеолитическими поражениями при множественной миеломе и остеопорозе. К сожалению, при явной эффективности клиническому потенциалу АСЕ-011 в отношении лечения остеопороза препятствовали проблемы безопасности (высокий рост числа эритроцитов в крови (RBC)). АСЕ-011 в настоящее время проходит оценку в отношении вызванной химиотерапией анемии (CIA) у пациентов с метастатическим немелкоклеточным раком легких (NSCLC) (Ph2/3) (ClinicalTrials.gov). ActRIIB-Fc слитый белок (Acceleron Pharma's ACE-031) проходил клиническую оценку (Ph1, Ph2) в отношении терапевтической эффективности при мышечной дистрофии Дюшенна (DMD). АСЕ-031 демонстрировал значительный рост мышц, который был более выраженным, чем вызванный селективным ингибитором миостатина, таким как антитело против миостатина, пептид-ассоциированное антитело или пропептид. К сожалению, несмотря на многообещающую эффективность в отношении мышечного роста, клиническому потенциалу АСЕ-031 препятствовали побочные эффекты в виде кровотечений из носа и десен у пациентов с DMD, поэтому имело место сдерживание в клиническом продвижении АСЕ-031 (Smith R.C. и Lin B.K., Curr Opin Support Palliat Care. 7(4): 352-360, 2013). ActRIIB-Fc слитый белок (Acceleron Pharma's ACE-083) в настоящее время проходит клиническую оценку в Ph1 на здоровых субъектах с использованием местной доставки посредством внутримышечной инъекции (ClinicalTrials.gov), a ActRIIB-Fc слитый белок от Atara Biotherapeutic's (STM 434) включен в оценку (идет набор испытуемых в Ph1) у пациентов с раком яичников или другими распространенными солидными опухолями (ClinicalTrials.gov).
Несмотря на эти преимущества, по-прежнему явно имеется критическая необходимость в предложении новых терапевтических средств, являющихся как высокоэффективными, так и безопасными для лечения заболеваний, связанных с мышечной атрофией.
Раскрытие изобретения
В одном аспекте настоящего изобретения предложены выделенные новые гибридные ActRIIB белки-ловушки лигандов, содержащие новые гибридные растворимые ActRIIB-ECD полипептиды, которые сохраняют нейтрализующие миостатин и активин А активности, но демонстрируют чрезвычайно пониженную нейтрализацию ВМР9. В различных воплощениях гибридные ActRIIB белки-ловушки лигандов содержат гибридный растворимый ActRIIB-ECD полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1, где по меньшей мере один из аминокислотных остатков R3, I6, Y7, Y8, L14, E15, S20, L22, R24, E26, E28, Q29, L33, L48, Y36, S38, R40, S42, Т45, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, F84, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108 или Т110 замещен другой аминокислотой, и где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях гибридные ActRIIB белки-ловушки лигандов содержат гибридный растворимый ActRIIB-ECD полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1, где по меньшей мере два из аминокислотных остатков R3, I6, Y7, Y8, L14, Е15, S20, L22, R24, Е26, Е28, Q29, L33, L48, Y36, S38, R40, S42, Т45, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, F84, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108 или Т110 замещены другой аминокислотой, и где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях гибридные ActRIIB белки-ловушки лигандов содержат гибридный растворимый ActRIIB-ECD полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1, где по меньшей мере три из аминокислотных остатков R3, I6, Y7, Y8, L14, Е15, S20, L22, R24, Е26, Е28, Q29, L33, L48, Y36, S38, R40, S42, Т45, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, F84, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108 или Т110 замещены другой аминокислотой, и где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях гибридные ActRIIB белки-ловушки лигандов содержат гибридный растворимый ActRIIB-ECD полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1, где по меньшей мере четыре из аминокислотных остатков R3, I6, Y7, Y8, L14, Е15, S20, L22, R24, Е26, Е28, Q29, L33, L48, Y36, S38, R40, S42, Т45, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, F84, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108 или Т110 замещены другой аминокислотой, и где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях гибридные ActRIIB белки-ловушки лигандов содержат гибридный растворимый ActRIIB-ECD полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1, где по меньшей мере пять из аминокислотных остатков R3, I6, Y7, Y8, L14, Е15, S20, L22, R24, Е26, Е28, Q29, L33, L48, Y36, S38, R40, S42, Т45, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, F84, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108 или Т110 замещены другой аминокислотой, и где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях гибридные ActRIIB белки-ловушки лигандов содержат гибридный растворимый ActRIIB-ECD полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1, где по меньшей мере шесть из аминокислотных остатков R3, I6, Y7, Y8, L14, Е15, S20, L22, R24, Е26, Е28, Q29, L33, L48, Y36, S38, R40, S42, Т45, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, F84, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108 или Т110 замещены другой аминокислотой, и где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях гибридные ActRIIB белки-ловушки лигандов содержат гибридный растворимый ActRIIB-ECD полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1, где по меньшей мере семь из аминокислотных остатков R3, I6, Y7, Y8, L14, Е15, S20, L22, R24, Е26, Е28, Q29, L33, L48, Y36, S38, R40, S42, Т45, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, F84, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108 или Т110 замещены другой аминокислотой, и где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях гибридные ActRIIB белки-ловушки лигандов содержат гибридный растворимый ActRIIB-ECD полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1, где по меньшей мере восемь из аминокислотных остатков R3, I6, Y7, Y8, L14, Е15, S20, L22, R24, Е26, Е28, Q29, L33, L48, Y36, S38, R40, S42, Т45, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, F84, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108 или Т110 замещены другой аминокислотой, и где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях гибридные ActRIIB белки-ловушки лигандов содержат гибридный растворимый ActRIIB-ECD полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1, где по меньшей мере девять из аминокислотных остатков R3, I6, Y7, Y8, L14, Е15, S20, L22, R24, Е26, Е28, Q29, L33, L48, Y36, S38, R40, S42, Т45, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, F84, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108 или Т110 замещены другой аминокислотой, и где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях гибридные ActRIIB белки-ловушки лигандов содержат гибридный растворимый ActRIIB-ECD полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1, где по меньшей мере десять из аминокислотных остатков R3, I6, Y7, Y8, L14, Е15, S20, L22, R24, Е26, Е28, Q29, L33, L48, Y36, S38, R40, S42, Т45, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, F84, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108 или Т110 замещены другой аминокислотой, и где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях гибридные ActRIIB белки-ловушки лигандов содержат гибридный растворимый ActRIIB-ECD полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1, где по меньшей мере пятнадцать из аминокислотных остатков R3, I6, Y7, Y8, L14, Е15, S20, L22, R24, Е26, Е28, Q29, L33, L48, Y36, S38, R40, S42, Т45, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, F84, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108 или Т110 замещены другой аминокислотой, и где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях гибридные ActRIIB белки-ловушки лигандов содержат гибридный растворимый ActRIIB-ECD полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1, где по меньшей мере двадцать из аминокислотных остатков R3, I6, Y7, Y8, L14, Е15, S20, L22, R24, Е26, Е28, Q29, L33, L48, Y36, S38, R40, S42, Т45, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, F84, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108 или Т110 замещены другой аминокислотой, и где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях гибридные ActRIIB белки-ловушки лигандов содержат гибридный растворимый ActRIIB-ECD полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1, где по меньшей мере двадцать пять из аминокислотных остатков R3, I6, Y7, Y8, L14, Е15, S20, L22, R24, Е26, Е28, Q29, L33, L48, Y36, S38, R40, S42, Т45, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, F84, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108 или Т110 замещены другой аминокислотой, и где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях гибридные ActRIIB белки-ловушки лигандов содержат гибридный растворимый ActRIIB-ECD полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1, где по меньшей мере тридцать из аминокислотных остатков R3, I6, Y7, Y8, L14, Е15, S20, L22, R24, Е26, Е28, Q29, L33, L48, Y36, S38, R40, S42, Т45, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, F84, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108 или Т110 замещены другой аминокислотой, и где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа.
В различных воплощениях гибридные ActRIIB белки-ловушки лигандов содержат гибридные растворимые ActRIIB-ECD полипептиды, имеющие аминокислотную последовательность, изложенную в SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36 или SEQ ID NO: 37, где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях гибридные растворимые ActRIIB полипептиды представляют собой гибридные растворимые ActRIIB полипептиды, имеющие аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности, выбранной из SEQ ID NO: 3-37, где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 74, SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, SEQ ID NO: 78, SEQ ID NO: 79, SEQ ID NO: 80, SEQ ID NO: 81, SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84, SEQ ID NO: 85, SEQ ID NO: 86, SEQ ID NO: 87, SEQ ID NO: 88, SEQ ID NO: 89, SEQ ID NO: 90, SEQ ID NO: 91, SEQ ID NO: 92, SEQ ID NO: 93, SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 112, SEQ ID NO: 113, SEQ ID NO: 114, SEQ ID NO: 115, SEQ ID NO: 116 или SEQ ID NO: 117, где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях гибридные растворимые ActRIIB полипептиды представляют собой гибридные растворимые ActRIIB полипептиды, имеющие аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности, выбранной из SEQ ID NO: 51-117, где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа.
В другом аспекте гибридные ActRIIB белки-ловушки лигандов по настоящему изобретению содержат гибридный растворимый ActRIIB-ECD полипептид и по меньшей мере один гетерологичный белок, где гибридный ActRIIB белок-ловушка лигандов способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях гетерологичный белок представляет собой Fc домен. В различных воплощениях Fc домен представляет собой Fc домен человеческого IgG. В различных воплощениях Fc домен имеет происхождение из последовательности константной области тяжелой цепи человеческого IgG1, изложенной в SEQ ID NO: 38. В различных воплощениях Fc домен представляет собой Fc домен, имеющий аминокислотную последовательность, изложенную в SEQ ID NO: 39. В различных воплощениях Fc домен имеет происхождение из последовательности константной области тяжелой цепи человеческого IgG2, изложенной в SEQ ID NO: 40. В различных воплощениях Fc домен представляет собой Fc домен, имеющий аминокислотную последовательность, изложенную в SEQ ID NO: 41. В различных воплощениях Fc домен имеет происхождение из последовательности константной области тяжелой цепи человеческого IgG4, изложенной в SEQ ID NO: 42. В различных воплощениях Fc домен представляет собой Fc домен, имеющий аминокислотную последовательность, изложенную в SEQ ID NO: 43.
В различных воплощениях гетерологичный белок присоединен к гибридному растворимому ActRIIB-ECD полипептиду посредством линкерного и/или шарнирного линкерного пептида. Линкер или шарнирный линкер может представлять собой искусственную последовательность между 5, 10, 15, 20, 30, 40 или более аминокислот, которые относительно свободны от вторичной структуры. В различных воплощениях линкер является обогащенным по содержанию G/S, например, по меньшей мере примерно 60%, 70%, 80%, 90% или более аминокислот в линкере представляют собой G или S. В различных воплощениях линкер имеет мотив (GGGGS (SEQ ID NO: 44))n, где n равно 1-6. В различных воплощениях линкер, имеющий аминокислотную последовательность, изложенную в SEQ ID NO: 44, используют с шарнирным линкером, имеющим аминокислотную последовательность, изложенную в SEQ ID NO: 118, для присоединения Fc человеческого IgG4 (SEQ ID NO: 43) к гибридному растворимому ActRIIB-ECD полипептиду (например, любой из SEQ ID NO: 3-37 или 51-117) по настоящему изобретению.
В другом аспекте настоящего изобретения предложены выделенные молекулы нуклеиновой кислоты, содержащие полинуклеотид, кодирующий гибридный растворимый ActRIIB-ECD полипептид по настоящему изобретению. В различных воплощениях полинуклеотиды кодируют одну из полипептидных последовательностей, изложенных в SEQ ID NO: 3-37 или 51-117, где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях полинуклеотиды кодируют полипептид, имеющий аминокислотную последовательность, по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичную любой из полипептидных последовательностей, изложенных в SEQ ID NO: 3-37 или 51-117, где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях полинуклеотиды кодируют полипептид, имеющий по меньшей мере 90%-ную идентичность любой из полипептидных последовательностей, изложенных в SEQ ID NO: 3-37 или 51-117, где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях полинуклеотиды кодируют полипептид, имеющий аминокислотную последовательность, по меньшей мере на 95% идентичную любой из полипептидных последовательностей, изложенных в SEQ ID NO: 3-37 или 51-117, где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа.
В различных воплощениях выделенные молекулы нуклеиновой кислоты содержат описанные здесь полинуклеотиды и дополнительно содержат полинуклеотид, кодирующий по меньшей мере один гетерологичный белок, описанный здесь. В различных воплощениях молекулы нуклеиновой кислоты дполнительно содержат полинуклеотиды, кодирующие линкеры и шарнирные линкеры, описанные здесь.
В другом аспекте настоящего изобретения предложены векторы, содержащие описанные здесь нуклеиновые кислоты. В различных воплощениях вектор представляет собой вектор экспрессии. В другом аспекте настоящего изобретения предложены выделенные клетки, содержащие нуклеиновые кислоты по изобретению. В различных воплощениях клетка представляет собой клетку-хозяин, содержащую вектор экспрессии по изобретению. В другом аспекте предложены способы получения ActRIIB белков-ловушек лигандов путем культивирования клеток-хозяев в условиях, способствующих экспрессии белков или полипептидов.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая выделенные гибридные растворимые ActRIIB полипептиды или гибридные ActRIIB белки-ловушки лигандов в смеси с фармацевтически приемлемым носителем.
В другом аспекте настоящего изобретения предложен способ лечения или предупреждения заболевания, связанного с мышечной атрофией, у субъекта, страдающего таким расстройством, путем введения указанному субъекту эффективного количества фармацевтической композиции, содержащей гибридный ActRIIB белок-ловушку лигандов по настоящему изобретению. Заболевания или состояния, связанные с мышечной атрофией, включают, без ограничения, следующие: мышечные дистрофии (такие как миодистрофия Дюшенна (DMD), мышечная дистрофия Беккера, дистрофия Лейдена-Мебиуса, миотоническая MD и плече-лопаточно-лицевая миопатия (FSHD)), миозит (такой как дерматомиозит, миозит с тельцами включения, юношеские формы миозита, полимиозит), миопатии (включая врожденную миопатию и приобретенную миопатию, такую как диабетическая миопатия или вызванная приемом лекарств миопатия), заболевания двигательных нейронов (такие как болезнь Лу Герига или боковой амиотрофический склероз), тяжелая миастения, нейродегенеративные расстройства (такие как болезнь Паркинсона, болезнь Гентингтона и болезнь Альцгеймера), мышечная атрофия, ассоциированная с раковыми заболеваниями (такими как рак поджелудочной железы, рак легкого, рак желудка, рак яичника, колоректальный рак, меланома, лейкоз, рак легких, рак предстательной железы, рак головного мозга, рак мочевого пузыря и рак головы и шеи), мышечная атрофия, ассоциированная с хронической сердечной недостаточностью (CHF), хронической болезнью почек (CKD), печеночной недостаточностью, диабетом, хронической обструктивной болезнью легких (COPD), эмфиземой, муковисцидозом, ревматоидным артритом, остеоартритом, фиброзом печени, циррозом, травмой (такой как ожоги или травма при мотоциклетной аварии), переломом кости, трансплантацией органа (такой как трансплантация сердца, легкого, печени или почки), критическим состоянием в отделении интенсивной терапии (ICU), денервацией (такой как удар или повреждение спинного мозга), андроген-депривационной терапией, кортикостероидной терапией, инфекциями (такими как СПИД или туберкулез), длительным постельным режимом, саркопеническим ожирением и возрастной саркопенией.
Кроме того, в настоящем изобретении предложены способы лечения сердечно-сосудистого заболевания у субъекта, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтических композиций по изобретению. В одном воплощении субъект представляет собой субъекта-человека. В различных воплощениях сердечнососудистое заболевание выбрано из сердечной недостаточности, сердечной атрофии, фиброза сердца, легочной гипертензии, миокардита, ишемической болезни сердца, инфаркта миокарда, сердечных аритмий, болезни сердечного клапана, кардиомиопатии, перикардиальной болезни, болезни аорты и синдрома Марфана.
Кроме того, в настоящем изобретении предложены способы лечения метаболического расстройства у субъекта, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтических композиций по изобретению. В одном воплощении субъект представляет собой субъекта-человека. В различных воплощениях метаболическое расстройство выбрано из ожирения, дислипидемии, саркопенического ожирения, неалкогольной жировой дистрофии печени, такой как неалкогольный стеатогепатит, алкогольной жировой болезни печени, инсулинорезистентности, диабета и метаболического синдрома, а также диабетической миопатии, диабетической нефропатии, диабетической нейропатии, диабетической ретинопатии и гемохроматоза.
Кроме того, в настоящем изобретении предложены способы лечения рака или метастаза рака у субъекта, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтических композиций по изобретению. В одном воплощении субъект представляет собой субъекта-человека. В различных воплощениях рак выбран из рака поджелудочной железы, рака желудка, рака яичника, колоректального рака, меланомы, лейкоза, миелодиспластического синдрома, рака легкого, рака предстательной железы, рака головного мозга, рака мочевого пузыря, рака головы и шеи или рабдомиосаркомы.
Кроме того, в настоящем изобретении предложены способы лечения аутоиммунного заболевания у субъекта, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтических композиций по изобретению. В одном воплощении субъект представляет собой субъекта-человека. В различных воплощениях заболевание выбрано из аутоиммунных расстройств, включая рассеянный склероз, системный склероз, диабет (типа 1), гломерулонефрит, тяжелую миастению, псориаз, системную красную волчанку, полимиозит, болезнь Крона, неспецифический язвенный колит и первичный билиарный цирроз.
Кроме того, в настоящем изобретении предложены способы лечения артрита у субъекта, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтических композиций по изобретению. В одном воплощении субъект представляет собой субъекта-человека. В различных воплощениях артрит выбран из ревматоидного артрита или остеоартрита.
Кроме того, в настоящем изобретении предложены способы лечения анорексии у субъекта, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтических композиций по изобретению. В одном воплощении субъект представляет собой субъекта-человека. В различных воплощениях анорексия выбрана из нервной анорексии и синдрома анорексии-кахексии.
Кроме того, в настоящем изобретении предложены способы лечения заболевания печени у субъекта, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтических композиций по изобретению. В одном воплощении субъект представляет собой субъекта-человека. В различных воплощениях заболевание печени выбрано из жировой дистрофии печени, включая неалкогольный стеатогепатит, фиброз печени или цирроз, печеночной недостаточности, аутоиммунного гепатита и печеночно-клеточной карциномы.
Также здесь предложены способы трансплантации органа или ткани у субъекта, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтических композиций по изобретению. В одном воплощении субъект представляет собой субъекта-человека. В различных воплощениях трансплантация выбрана из трансплантаций органов, таких как сердце, почки, печень, легкие, поджелудочная железа, кишечник и вилочковая железа, или из тканевых трансплантаций костей, сухожилий, роговицы, кожи, сердечных клапанов, нервов и кровеносных сосудов.
Кроме того, в настоящем изобретении предложены способы лечения анемии у субъекта, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтических композиций по изобретению. В одном воплощении субъект представляет собой субъекта-человека. В различных воплощениях анемия выбрана из различных анемических расстройств, включая железодефицитную анемию, перенасыщение железом, талассемию, гемолитическую анемию, серповидноклеточную анемию, пернициозную анемию, анемию Фанкони и апластическую анемию (такую как ассоциированную с раком анемию и вызванную химиотерапией анемию).
Кроме того, в настоящем изобретении предложены способы лечения фиброза у субъекта, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтических композиций по изобретению. В одном воплощении субъект представляет собой субъекта-человека. В различных воплощениях фиброз выбран из интерстициального заболевания легких, идиопатического фиброза легких, муковисцидоза, фиброза печени, цирроза, фиброза сердца, фиброза почек, миелофиброза, идиопатического ретроперитонеального фиброза, нефрогенной фиброзирующей дермопатии, воспалительного заболевания кишечника, келоидного фиброза, склеродермии или артрофиброза.
Кроме того, в настоящем изобретении предложены способы лечения боли у субъекта, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтических композиций по изобретению. В одном воплощении субъект представляет собой субъекта-человека. В различных воплощениях боль выбрана из невропатической боли, соматической боли, висцеральной боли, воспалительной боли, боли при раке, боли в спине или суставной боли.
Кроме того, в настоящем изобретении предложены способы лечения заболевания костной системы у субъекта, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтических композиций по изобретению. В одном воплощении субъект представляет собой субъекта-человека. В различных воплощениях заболевание костной системы выбрано из остеопороза, остеомаляции, несовершенного остеогенеза, прогрессирующей оссифицирующей фибродисплазии, вызванной костикостероидами потери костной массы, перелома кости или костного метастаза.
Кроме того, в настоящем изобретении предложены способы лечения состояния, связанного со старением, у субъекта, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтических композиций по изобретению. В одном воплощении субъект представляет собой субъекта-человека. В различных воплощениях состояние, связанное со старением, выбрано из хрупкости костей у пожилых, старческой саркопении или остеоартрита.
Также здесь предложены способы индуцирования роста стволовых клеток для восстановления ткани или регенерации органа у субъекта, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтических композиций по изобретению. В одном воплощении субъект представляет собой субъекта-человека. В различных воплощениях стволовая клетка выбрана из мышечной стволовой (сателлитной) клетки, сердечной стволовой клетки, мезенхимальной стволовой клетки, происходящей из костного мозга, и плюрипотентной стволовой клетки.
В другом аспекте изобретения предложены применения гибридных ActRIIB белков-ловушек лигандов для изготовления лекарственного средства для лечения любого расстройства или состояния, как описано здесь.
Краткое описание графических материалов
На Фиг. 1 показаны две иллюстративные молекулярные конфигурации для гибридных ActRIIB белков-ловушек лигандов по настоящему изобретению.
На Фиг. 2 показаны линейные графики с результатами клеточных анализов, используемых для оценки миостатин-нейтрализующих (левые панели), активин А-нейтрализующих (средние панели) и ВМР9-нейтрализующих (правые панели) способностей гибридного ActRIIB белка-ловушки лигандов, имеющего аминокислотную последовательность AG-0003 (SEQ ID NO: 5), и гибридного ActRIIB белка-ловушки лигандов, имеющего аминокислотную последовательность AG-0005 (SEQ ID NO: 7), в сравнении с таковыми для белка ActRIIB-Fc дикого типа в качестве эталона сравнения (WT).
На Фиг. 3 показаны линейные графики с результатами клеточных анализов нейтрализующих активностей в отношении миостатина (верхняя левая), активина А (правая верхняя), активина В (нижняя левая) и ВМР9 (нижняя правая) для гибридного ActRIIB белка-ловушки лигандов, имеющего аминокислотную последовательность AG-0014 (SEQ ID NO: 16), и гибридного ActRIIB белка-ловушки лигандов, имеющего аминокислотную последовательность AG-0027 (SEQ ID NO: 29), в сравнении с таковыми для белка ActRIIB-Fc дикого типа в качестве контроля (WT). Миостатин-, активин А- и активин В-нейтрализующие активности проверяли с использованием С2С12-CAGA-luc репортерного анализа, и ВМР9-нейтрализующие активности анализировали с использованием C2C12-BRE-luc репортерного анализа, как описано в Примерах.
На Фиг. 4 показаны линейные графики, отображающие эффекты в отношении массы тела у 9-недельных самцов мышей C57BI/6, которым подкожно инъецировали PBS (носитель), ActRIIB-Fc дикого типа (WT), AG-0014 (SEQ ID NO: 16) и AG-0027 (SEQ ID NO: 29), соответственно, в дозировке 10 мг/кг один раз в неделю. Массы тела записывали на сутки 0, сутки 5, сутки 12 и сутки 18. n=6/8 на группу. Excel Student T-TEST проводили для статистического анализа. ***: Р<0,001 против группы носителя.
На Фиг. 5 показана диаграмма, отображающая эффекты в отношении мышечной массы у 9-недельных самцов мышей C57BI/6, которым подкожно инъецировали PBS (носитель), ActRIIB-Fc дикого типа (WT), AG-0014 (SEQ ID NO: 16) и AG-0027 (SEQ ID NO: 29), соответственно, в дозировке 10 мг/кг один раз в неделю (n=6/8 на группу). Индивидуальные икроножные мышцы от каждого животного рассекали и взвешивали во время окончательной некропсии. Статистический анализ проводили с использованием Excel Student T-TEST. ***: Р<0,001 против группы носителя.
На Фиг. 6 показаны изображения мышиной абдоминальной полости в тесте проницаемости сосудов с окрашиванием красителем Evans blue. Иллюстративные изображения подвергнутой хирургическому вмешательству абдоминальной полости каждой группы отмечены на данной фигуре. 8-Недельных самцов мышей BalbC лечили PBS (носитель), ActRIIB-Fc дикого типа (WT), AG-0014 (SEQ ID NO: 16) и AG-0027 (SEQ ID NO: 29), соответственно, в дозировке 10 мг/кг один раз в неделю. Через две недели после лечения инъецировали 200 мкл красителя Evans blue (0,5% в PBS, pH 7,2) каждой группе животных (n=4) через хвостовую вену. Некропсию проводили через 90 мин после инъекции красителя Evans blue.
На Фиг. 7 показаны изображения мышиных яичек в тесте проницаемости сосудов с окрашиванием красителем Evans blue. Иллюстративные изображения подвергнутого иссечению органа яичек из каждой группы отмечены на данной фигуре. 8-Недельных самцов мышей BalbC лечили PBS (носитель), ActRIIB-Fc дикого типа (WT), AG-0014 (SEQ ID NO: 16) и AG-0027 (SEQ ID NO: 29), соответственно, в дозировке 10 мг/кг один раз в неделю. Через две недели после лечения инъецировали 200 мкл красителя Evans blue (0,5% в PBS, pH 7,2) каждой группе животных (n=4) через хвостовую вену. Некропсию проводили через 90 мин после инъекции красителя Evans blue.
На Фиг. 8 показаны изображения мышиных легких в тесте проницаемости сосудов с окрашиванием красителем Evans blue. Иллюстративные изображения подвергнутых иссечению тканей легких из каждой группы отмечены на данной фигуре. 8-Недельных самцов мышей BalbC лечили PBS (носитель), ActRIIB-Fc дикого типа (WT), AG-0014 (SEQ ID NO: 16) и AG-0027 (SEQ ID NO: 29), соответственно, в дозировке 10 мг/кг один раз в неделю. Через две недели после лечения инъецировали 200 мкл красителя Evans blue (0,5% в PBS, pH 7,2) каждой группе животных (n=4) через хвостовую вену. Некропсию проводили через 90 мин после инъекции красителя Evans blue.
На Фиг. 9 показаны диаграммы, отображающие количества экстравазированного красителя Evans blue на мг влажной легочной ткани (левая панель) и ткани яичек (правая панель) в различных группах, как отмечено на данной фигуре. 8-Недельных самцов мышей BalbC лечили PBS (носитель), ActRIIB-Fc дикого типа (WT), AG-0014 (SEQ ID NO: 16) и AG-0027 (SEQ ID NO: 29), соответственно, в дозировке 10 мг/кг один раз в неделю. Через две недели после лечения инъецировали 200 мкл красителя Evans blue (0,5% в PBS, pH 7,2) каждой группе животных (n=4) через хвостовую вену. Некропсию проводили через 90 мин после инъекции красителя Evans blue для сбора тканей яичек и легких. Ткани взвешивали и затем помещали индивидуально во флаконы, содержащие формамид для экстрагирования красителя Evans blue. После инкубации при 55°С в течение 24 часов образцы центрифугировали и поглощение водной фазы каждого образца измеряли при длине волны 610 нм с использованием спектрофотометра. Статистический анализ проводили с использованием Excel Student T-TEST. *: Р<0,05.
На Фиг. 10 показаны линейные графики с результатами клеточных анализов в отношении ВМР9-нетрализующих активностей для ряда иллюстративных гибридных ActRIIB белков-ловушек лигандов, включая AG-0014 (SEQ ID NO: 16), AG-0023 (SEQ ID NO: 25), AG-0024 (SEQ ID NO: 26), AG-0025 (SEQ ID NO: 27), AG0027 (SEQ ID NO: 29), AG-0028 (SEQ ID NO: 30), AG-0029 (SEQ ID NO: 31) и AG-0035 (SEQ ID NO: 37), в сравнении с таковыми для ActRIIB-Fc белка дикого типа в качестве контроля (WT). ВМР9-нейтрализующие активности анализировали с использованием C2C12-BRE-luc репортерного анализа.
На Фиг. 11 проиллюстрированы различия в миостатин-нейтрализующих показателях IC50 между некоторыми иллюстративными гибридными ActRIIB белками-ловушками лигандов относительно такового для WT ActRIIB-Fc белка. Миостатин-нейтрализующие активности индивидуальных белков проверяли с использованием C2C12-CAGA-luc репортерных культур и значения IC50 рассчитывали с использованием программного обеспечения Prism. График показывает разницу в процентах в миостатин-нейтрализующих значениях IC50 каждого из иллюстративных гибридных ActRIIB белков-ловушек лигандов, включая AG-0014 (SEQ ID NO: 16), AG-0023 (SEQ ID NO: 25), AG-0024 (SEQ ID NO: 26), AG0027 (SEQ ID NO: 29), AG-0028 (SEQ ID NO: 30) и AG-0029 (SEQ ID NO: 31), по сравнению с таковым для ActRIIB-Fc дикого типа.
На Фиг. 12 показаны результаты твердофазного иммуноферментного анализа (ELISA) в отношении BMP9-связывания двух иллюстративных гибридных ActRIIB белков-ловушек лигандов AG-0014 (SEQ ID NO: 16) и AG0027 (SEQ ID NO: 29), соответственно, в сравнении с ActRIIB-Fc дикого типа, а также ActRIIA-Fc дикого типа, при возрастающих концентрациях. Автоматизированный ELISA осуществляли с использованием оборудования KinEXA (Sapidyne Instruments). 20 мкг/мл ВМР9 связывали с гранулами NHS-активированной сефарозы 4 для быстрого потока (GE Healthcare) с использованием экспериментальной методики, рекомендованной Sapidyne Instruments. WT ActRIIB-Fc, WT ActRIIA-Fc и каждый гибридный ActRIIB белок-ловушку лигандов тестировали в отношении ВМР9-связывания при концентрациях 100 пМ, 1 нМ и 10 нМ, как показано на данной фигуре. Белки дикого типа и гибридные белки иммобилизировали на ВМР9-покрытых гранулах и детектировали с использованием козьего антитела против Fc человека, меченного Alexa Fluor 647 (Jackson ImmunoResearch Laboratories, Inc.). Сигналы ВМР9-связывания записывали с использованием программного обеспечения KinExA Pro (Sapidyne Instruments).
Способ(ы) осуществления изобретения
Согласно настоящему изобретению предложены новые выделенные гибридные ActRIIB белки-ловушки лигандов, генетически сконструированные как слитые белки, которые функционируют в качестве мультицитокинового антагониста, разработанные так чтобы селективно блокировать действия множества кахектических (вызывающих атрофию) цитокинов без влияния на передачу сигналов цитокинов, не связанных с мышцами. В различных воплощениях гибридные ActRIIB белки-ловушки лигандов содержат выделенные гибридные растворимые ActRIIB-ECD полипептиды, которые способны связывать миостатин и активин А, но демонстрируют пониженную аффинность связывания с ВМР9 (то есть, сохраняют миостатин- и активин А-нейтрализующие активности, но демонстрируют чрезвычайно сниженную ВМР9-нейтрализацию) относительно ActRIIB-ECD полипептида дикого типа. Настоящее изобретение основано частично на уникальном обнаружении авторов, что гибридные ActRIIB белки-ловушки лигандов, сконструированные для проявления значительно сниженного связывания с ВМР9 (тем самым имеющим пониженную ВМР9-нейтрализацию), в то же время проявляя свои сильные нейтрализующие активности против миостатина и активина, будут давать ингибиторы миостатина, которые являются более безопасными и более эффективными молекулами по сравнению с имеющимися в настоящее время доступными ингибиторами миостатина. Конкретно, авторы изобретения предположили, что гибридный растворимый ActRIIB полипептид, сконструированный с селективной заменой аминокислотных остатков в пределах внеклеточного домена ActRIIB (ECD) на соответствующие аминокислотные остатки из ActRIIA ECD, может обеспечить новые гибридные растворимые ActRIIB полипептиды, которые преимущественно нейтрализуют миостатин и активин А (ключевые негативные регуляторы мышечного роста) в сравнении с ВМР9. ВМР9 играет важную роль в ряде физиологических процессов (см., например, Tillet E, et al., Front Genet. 8; 5: 456, 2015), и было показано, что передача сигнала ВМР9 является существенной в сохранении нормальной сосудистой сети/проницаемости кровеносных сосудов (см., например, David L., et al., Circ Res. 25; 102(8): 914-22, 2008). Таким образом, постулируется, что субъекты, которых лечили новыми гибридными ActRIIB белками-ловушками лигандов, описанными здесь, могут избежать побочных эффектов в виде носового кровотечения и кровоточивости десен, наблюдаемых у субъектов, которых лечили существующими молекулами ActRIIB-Fc, которые связывают и нейтрализуют ВМР9 в сильной степени. Терапевтические преимущества, обеспечиваемые этими новыми гибридными ActRIIB белками-ловушками лигандов, дают терапевтические средства нового поколения, которые являются безопасными и эффективными для инверсии сильной потери мышечной массы и кахексии, а также для лечения широкого ряда хронических катаболических заболеваний, в которые вовлечены мышечная атрофия, потеря костной массы, воспаление и фиброз.
Определения
Термины «полипептид», «пептид» и «белок» используют в настоящем документе взаимозаменяемо по отношению к полимеру из аминокислотных остатков. В различных воплощениях изобретения «пептиды», «полипептиды» и «белки» представляют собой цепи из аминокислот, альфа-атомы углерода которых связаны посредством пептидных связей. Концевая аминокислота на одном конце цепи (амино-концевая), таким образом, имеет свободную аминогруппу, тогда как концевая аминокислота на другом конце цепи (карбокси-концевая) имеет свободную карбоксильную группу. При использовании в настоящем документе термин «амино-конец» (сокращенно N-конец) относится к свободной α-аминогруппе на аминокислоте при амино-конце пептида или к α-аминогруппе (иминогруппе при участии в пептидной связи) аминокислоты в любом другом положении внутри пептида. Аналогично, термин «карбокси-конец» относится к свободной карбоксильной группе на карбокси-конце пептида или к карбоксильной группе аминокислоты в любом другом положении внутри пептида. Пептиды также включают по существу любую полиаминокислоту, включая, без ограничений, пептидомиметики, такие как аминокислоты, соединенные эфирной связью в противоположность амидной.
Полипептиды по изобретению включают полипептиды, модифицированные любым путем и по любой причине, например, для: (1) снижения чувствительности к протеолизу, (2) снижения чувствительности к окислению, (3) изменения аффинности связывания для образования белковых комплексов, (4) изменения аффинностей связывания и (5) придания или модификации других физико-химических или функциональных свойств. Например, одиночные или множественные аминокислотные замены (например, консервативные аминокислотные замены) могут быть осуществлены в любой природной последовательности (например, в участке полипептида снаружи от домена(ов), образующего(их) межмолекулярные контакты). «Консервативная аминокислотная замена» относится к замене в полипептиде аминокислоты функционально подобной аминокислотой. Каждая из приведенных ниже шести групп содержит аминокислоты, представляющие собой консервативные замены друг для друга:
1) Аланин (А), серин (S) и треонин (Т)
2) Аспарагиновая кислота (D) и глутаминовая кислота (Е)
3) Аспарагин (N) и глутамин (Q)
4) Аргинин (R) и лизин (K)
5) Изолейцин (I), лейцин (L), метионин (М) и валин (V)
6) Фенилаланин (F), тирозин (Y) и триптофан (W).
«Неконсервативная аминокислотная замена» относится к замене члена одного из этих классов членом другого класса. При осуществлении таких замен в соответствии с различными воплощениями изобретения можно учитывать гидропатический индекс аминокислот. Каждой аминокислоте присвоен гидропатический индекс на основании характеристик ее гидрофобности и заряда. Эти индексы составляют: изолейцин (+4,5); валин (+4,2); лейцин (+3,8); фенилаланин (+2,8); цистеин/цистин (+2,5); метионин (+1,9); аланин (+1,8); глицин (-0,4); треонин (-0,7); серин (-0,8); триптофан (-0,9); тирозин (-1,3); пролин (-1,6); гистидин (-3,2); глутамат (-3,5); глутамин (-3,5); аспартат (-3,5); аспарагин (-3,5); лизин (-3,9) и аргинин (-4,5).
Значимость гидропатического индекса аминокислоты при придании белку интерактивной биологической функции понятна в данной области техники (см., например, Kyte et al., 1982, J. Mol. Biol. 157: 105-131). Известно, что некоторые аминокислоты можно заменять другими аминокислотами, имеющими сходный гидропатический индекс или балл, и при этом сохранять сходную биологическую активность. При создании изменений, основанных на гидропатическом индексе, в различных воплощениях изобретения включена замена аминокислот, гидропатические индексы которых находятся в пределах ±2. В различных воплощениях изобретения включены те аминокислоты, гидропатические индексы которых находятся в пределах ±1, и в различных воплощениях изобретения включены те аминокислоты, гидропатические индексы которых находятся в пределах ±0,5.
В данной области техники также понимают, что замену подобных аминокислот можно эффективно осуществлять на основе гидрофильности, в частности, где биологически функциональный белок или пептид, созданный таким образом, предназначен для применения в иммунологических воплощениях, как описано в настоящем документе. В различных воплощениях изобретения наибольшая локальная средняя гидрофильность белка, которая определяется гидрофильностью примыкающих аминокислот, коррелирует с его иммуногенностью и антигенностью, то есть с биологическим свойством белка.
Этим аминокислотным остаткам присвоены следующие значения гидрофильности: аргинин (+3,0); лизин (+3,0); аспартат (+3,0, ±0,1); глутамат (+3,0, ±0,1); серин (+0,3); аспарагин (+0,2); глутамин (+0,2); глицин (0); треонин (-0,4); пролин (-0,5, ±0,1); аланин (-0,5); гистидин (-0,5); цистеин (-1,0); метионин (-1,3); валин (-1,5); лейцин (-1,8); изолейцин (-1,8); тирозин (-2,3); фенилаланин (-2,5) и триптофан (-3,4). При создании изменений, основанных на значениях гидрофильности, в различных воплощениях изобретения включена замена аминокислот, значения гидрофильности которых находятся в пределах ±2, в различных воплощениях изобретения включена замена аминокислот, значения гидрофильности которых находятся в пределах ±1, и в различных воплощениях изобретения включена замена аминокислот, значения гидрофильности которых находятся в пределах ±0,5.
Иллюстративные аминокислотные замены приведены в Таблице 1.
Специалист в данной области техники способен определить подходящие варианты полипептидов, представленные в настоящем документе, используя хорошо известные методики. В различных воплощениях изобретения специалист в данной области техники может идентифицировать подходящие области молекулы, которые могут быть изменены без нарушения активности, путем нацеливания на участки, считающиеся незначимыми для активности. В других воплощениях изобретения специалист в данной области техники может идентифицировать остатки и участки молекул, которые являются консервативными между подобными полипептидами. В других воплощениях изобретения даже области, которые могут быть значимыми для биологической активности или для структуры, можно подвергать консервативным аминокислотным заменам, не нарушая биологическую активность или не оказывая нежелательное влияние на структуру полипептида.
Дополнительно специалист в данной области техники может провести обзор структурно-функциональных исследований, идентифицирующих остатки в подобных полипептидах, значимые для активности или структуры. В свете такого сравнения специалист в данной области техники может прогнозировать значимость аминокислотных остатков в полипептиде, соответствующих аминокислотным остаткам, значимым для активности или структуры, в подобных полипептидах. Для таких прогнозируемых значимых аминокислотных остатков специалист в данной области техники может выбрать химически подобные аминокислотные замены.
Специалист в данной области техники может также проанализировать трехмерную структуру и аминокислотную последовательность в отношении такой структуры в подобных полипептидах. В свете такой информации специалист в данной области техники может прогнозировать выравнивание аминокислотных остатков полипептида по отношению к его трехмерной структуре. В различных воплощениях изобретения специалист в данной области техники может сделать выбор в пользу отсутствия радикальных изменений аминокислотных остатков, расположение которых прогнозируется на поверхности пептида, поскольку такие остатки могут быть вовлечены в важные взаимодействия с другими молекулами. Кроме того, специалист в данной области техники может создать тестовые варианты, содержащие одиночную аминокислотную замену в каждом желаемом аминокислотном остатке. Затем эти варианты можно подвергать скринингу, используя методы определения активности, известные специалистам в данной области техники. Такие варианты можно использовать, чтобы собрать информацию о подходящих вариантах. Например, если обнаружено, что изменение определенного аминокислотного остатка приводит к нарушенной, нежелательно сниженной или неподходящей активности, вариантом с таким изменением можно избегать. Иными словами, на основании информации, собранной в таких стандартных экспериментах, специалист в данной области техники может легко определить аминокислоты, дальнейших замен которых следует избегать, как отдельно, так и в комбинации с другими мутациями.
Термин «полипептидный фрагмент» и «усеченный полипептид» при использовании в настоящем документе относится к полипептиду, имеющему амино-концевую и/или карбокси-концевую делецию по сравнению с соответствующим полноразмерным белком. В различных воплощениях изобретения длина фрагментов может составлять, например, по меньшей мере 5, по меньшей мере 10, по меньшей мере 25, по меньшей мере 50, по меньшей мере 100, по меньшей мере 150, по меньшей мере 200, по меньшей мере 250, по меньшей мере 300, по меньшей мере 350, по меньшей мере 400, по меньшей мере 450, по меньшей мере 500, по меньшей мере 600, по меньшей мере 700, по меньшей мере 800, по меньшей мере 900 или по меньшей мере 1000 аминокислот. В различных воплощениях изобретения длина фрагментов может составлять, например, максимум 1000, максимум 900, максимум 800, максимум 700, максимум 600, максимум 500, максимум 450, максимум 400, максимум 350, максимум 300, максимум 250, максимум 200, максимум 150, максимум 100, максимум 50, максимум 25, максимум 10 или максимум 5 аминокислот. Фрагмент может дополнительно содержать на любом или на обоих концах одну или более дополнительных аминокислот, например последовательность аминокислот из любого встречающегося в природе белка (например, домен Fc или лейциновую молнию) или искусственную аминокислотную последовательность (например, искусственную линкерную последовательность).
Термины «вариант полипептида», «гибридный полипептид» и «мутант полипептида» при использовании в настоящем документе относятся к полипептиду, содержащему аминокислотную последовательность, в которой один или более аминокислотных остатков в аминокислотной последовательности вставлен, делегирован и/или заменен относительно другой аминокислотной последовательности. В некоторых воплощениях число вставленных, делегированных или замененных аминокислотных остатков может составлять, например, по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 10, по меньшей мере 25, по меньшей мере 50, по меньшей мере 75, по меньшей мере 100, по меньшей мере 125, по меньшей мере 150, по меньшей мере 175, по меньшей мере 200, по меньшей мере 225, по меньшей мере 250, по меньшей мере 275, по меньшей мере 300, по меньшей мере 350, по меньшей мере 400, по меньшей мере 450 или по меньшей мере 500 аминокислот в длину. Гибриды по настоящему изобретению включают слитые белки.
«Производное» полипептида представляет собой полипептид, который был химически модифицирован, например, путем конъюгирования с другой химической группировкой, такой как, например, полиэтиленгликоль, альбумин (например, человеческий сывороточный альбумин), фосфорилирования и гликозилирования.
Термин «% идентичности последовательности» в настоящем документе используют взаимозаменяемо с термином «% идентичности», и он относится к уровню идентичности аминокислотной последовательности между двумя или более пептидными последовательностями или к уровню идентичности нуклеотидной последовательности между двумя или более нуклеотидными последовательностями при выравнивании с использованием программы выравнивания последовательностей. Например, при использовании в настоящем документе 80% идентичности означает то же, что 80% идентичности последовательности, определенной с помощью заданного алгоритма, и означает, что данная последовательность по меньшей мере на 80% идентична другой длине другой последовательности. В различных воплощениях изобретения % идентичности выбран, например, из по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 99% или более идентичности последовательности по сравнению с данной последовательностью. В некоторых воплощениях % идентичности находится в диапазоне, например, от приблизительно 60% до приблизительно 70%, от приблизительно 70% до приблизительно 80%, от приблизительно 80% до приблизительно 85%, от приблизительно 85% до приблизительно 90%, от приблизительно 90% до приблизительно 95% или от приблизительно 95% до приблизительно 99%.
Термин «% гомологии последовательности» в настоящем документе используют взаимозаменяемо с термином «% гомологии», и он относится к уровню гомологии аминокислотной последовательности между двумя или более пептидными последовательностями или к уровню гомологии нуклеотидной последовательности между двумя или более нуклеотидными последовательностями при выравнивании с использованием программы выравнивания последовательностей. Например, при использовании в настоящем документе 80% гомологии означает то же, что 80% гомологии последовательности, определенной с помощью заданного алгоритма, и соответственно гомолог данной последовательности имеет более 80% гомологии последовательности по всей длине данной последовательности. В различных воплощениях изобретения % гомологии выбран, например, из по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 99% или более гомологии последовательности по сравнению с данной последовательностью. В различных воплощениях изобретения % гомологии находится в диапазоне, например, от приблизительно 60% до приблизительно 70%, от приблизительно 70% до приблизительно 80%, от приблизительно 80% до приблизительно 85%, от приблизительно 85% до приблизительно 90%, от приблизительно 90% до приблизительно 95% или от приблизительно 95% до приблизительно 99%
Иллюстративные компьютерные программы, которые можно использовать для определения идентичности между двумя последовательностями, включают, без ограничения, пакет программ BLAST, например BLASTN, BLASTX и TBLASTX, BLASTP и TBLASTN, общедоступные в Интернете и на сайте NCBI (Национального центра биотехнологической информации). См. также статьи Altschul et al., J. Mol. Biol. 215: 403-10, 1990, (со специальной ссылкой на опубликованную установку параметров по умолчанию, то есть параметров w=4, t=17) и Altschul et al., Nucleic Acids Res., 25: 3389-3402, 1997. Поиск последовательностей, как правило, осуществляют с использованием программы BLASTP при оценке данной аминокислотной последовательности относительно аминокислотных последовательностей в базе данных белковых последовательностей GenBank и других общедоступных базах данных. Программа BLASTX предпочтительна для поиска нуклеиновокислотных последовательностей, транслированных во всех рамках считывания по сравнению с аминокислотными последовательностями в базе данных белковых последовательностей GenBank и других общедоступных базах данных. Обе программы BLASTP и BLASTX выполняют с использованием параметров по умолчанию: штраф на открытие пробела 11,0 и штраф на удлинение пробела 1,0, и применяют матрицу BLOSUM-62. См. те же источники.
Кроме вычисления процента идентичности последовательностей, алгоритм BLAST также выполняет статистический анализ подобия между двумя последовательностями (см., например, Karlin & Altschul, Proc. Nat'l. Acad. Sci. USA, 90: 5873-5787, 1993). Одной из мер подобия, предложенных алгоритмом BLAST, является наименьшая суммарная вероятность (Р(N)), обеспечивающая показатель вероятности того, что совпадение между двумя нуклеотидными или двумя аминокислотными последовательностями встречается случайно. Например, нуклеиновую кислоту считают подобной сравнительной последовательности, если наименьшая суммарная вероятность при сравнении исследуемой нуклеиновой кислоты со сравнительной нуклеиновой кислотой составляет, например, менее чем примерно 0,1, менее чем примерно 0,01 или менее чем примерно 0,001.
Термин «гетерологичный», как используют здесь, относится к составу или состоянию, которые не являются нативными или обнаруживаемыми в природе, например, которые могут быть достигнуты путем замены существующего состава или состояния теми, которые имеют происхождение из другого источника. Подобным образом, экспрессия белка в организме, отличном от организма, в котором такой белок экспрессируется в природе, составляет гетерологичную систему экспрессии и гетерологичный белок.
Термин «антитело», как используют здесь, относится к белку, содержащему один или более полипептидов, по существу или частично кодируемых генами иммуноглобулинов или фрагментами генов иммуноглобулинов, и имеющему специфичность к опухолевому антигену или специфичность к молекуле, сверхэкспрессирующейся в патологическом состоянии. Общепризнанные гены иммуноглобулинов включают гены константных областей каппа, лямбда, альфа, гамма, дельта, эпсилон и мю, а также подтипы этих генов и огромное количество генов вариабельных областей иммуноглобулинов. Легкие цепи (LC) классифицируют как либо каппа, либо лямбда. Тяжелые цепи (НС) классифицируют как гамма, мю, альфа, дельта или эпсилон, которые в свою очередь определяют классы иммуноглобулинов IgG, IgM, IgA, IgD и IgE, соответственно. Типичная структурная единица иммуноглобулина (например антитела) содержит тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, причем каждая пара имеет одну «легкую» (примерно 25 кДа) и одну «тяжелую» цепь (примерно 50-70 кДа). N-конец каждой цепи определяет вариабельную область примерно от 100 до 110 или более аминокислот, изначально ответственных за антигенное распознавание.
Термин «Fc область», как используют здесь, определяет С-концевую область тяжелой цепи иммуноглобулина, которая может быть генерирована расщеплением интактного антитела папаином. Fc область может представлять собой нативную последовательность Fc области или вариант Fc области. Fc область иммуноглобулина в общем содержит два константных домена, CH2 домен и CH3 домен, и возможно содержит CH4 домен. Fc часть антитела опосредует несколько важных эффекторных функций, например индукцию цитокинов, ADCC, фагоцитоз, комплементзависимую цитотоксичность (CDC) и время полужизни/скорость клиренса антитела и комплексов антиген-антитело (например, неонатальный FcR (FcRn) связывается с Fc областью IgG при кислом рН в эндосоме и защищает IgG от деградации, тем самым внося вклад в длительное время полужизни IgG в сыворотке). Замены аминокислотных остатков в Fc области для изменения эффекторной функции антитела известны в данной области техники (см., например, Winter et al., патент США No. 5648260 и 5624821).
«Полинуклеотид» относится к полимеру, состоящему из нуклеотидных звеньев. Полинуклеотиды включают природные нуклеиновые кислоты, такие как дезоксирибонуклеиновая кислота («ДНК») и рибонуклеиновая кислота («РНК»), а также аналоги нуклеиновых кислот. Аналоги нуклеиновых кислот включают нуклеиновые кислоты, в которые включены неприродные основания, нуклеотиды, задействованные в связях с другими нуклеотидами, отличающихся от природной фосфодиэфирной связи, или в которые включены основания, присоединенные посредством связей, отличающихся от фосфодиэфирных связей. Так, аналоги нуклеотидов включают, в качестве примера и без ограничения, фосфоротиоаты, фосфородитиоаты, фосфоротриэфиры, фосфорамидаты, боранофосфаты, метилфосфонаты, хиральные метилфосфонаты, 2-O-метилрибонуклеотиды, пептидные нуклеиновые кислоты (ПНК) и тому подобное. Такие полинуклеотиды можно синтезировать, например, с использованием автоматического синтезатора ДНК. Термин «нуклеиновая кислота», как правило, относится к полинуклеотидам большого размера. Термин «олигонуклеотид», как правило, относится к коротким полинуклеотидам, состоящим обычно не более чем из 50 нуклеотидов. Понятно, что, если нуклеотидная последовательность представлена последовательностью ДНК (то есть А, Т, G, С), она также включает последовательность РНК (то есть A, U, G, С), в которой «U» замещает «Т».
В данном документе для описания полинуклеотидных последовательностей используют общепринятые условные обозначения: левый конец однонитевой полинуклеотидной последовательности представляет собой 5'-конец; направление двунитевой полинуклеотидной последовательности влево обозначают как 5'-направление. Направление присоединения нуклеотидов к вновь образующимся транскриптам РНК от 5' к 3' обозначают как направление транскрипции. Нить ДНК, имеющую ту же последовательность, что и мРНК, обозначают как «кодирующая нить»; последовательности в нити ДНК, имеющей ту же последовательность, что и мРНК, транскрибируемая с этой ДНК, расположенные в 5' положении по отношению к 5'-концу транскрипта РНК, обозначают как «расположенные против хода транскрипции последовательности»; последовательности в нити ДНК, имеющей ту же последовательность, что и мРНК, транскрибируемая с этой ДНК, расположенные в 3' положении по отношению к 3'-концу кодирующего транскрипта РНК, обозначают как «расположенные по ходу транскрипции последовательности».
«Комплементарный» относится к топологической совместимости или совпадению друг с другом взаимодействующих поверхностей двух полинуклеотидов. Таким образом, две молекулы могут быть описаны как комплементарные и, кроме того, характеристики поверхности контакта комплементарны друг другу. Первый полинуклеотид комплементарен второму полинуклеотиду, если нуклеотидная последовательность первого полинуклеотида по существу идентична нуклеотидной последовательности полинуклеотидного партнера связывания второго полинуклеотида, или если первый полинуклеотид может гибридизоваться со вторым полинуклеотидом в жестких условиях гибридизации.
«Специфично гибридизующийся с», или «специфичная гибридизация», или «селективно гибридизуется с» относится к связыванию, образованию дуплекса или гибридизации молекулы нуклеиновой кислоты преимущественно с определенной нуклеотидной последовательностью в жестких условиях при наличии этой последовательности в комплексной смеси (например, суммарной клеточной) ДНК или РНК. Термин «жесткие условия» относится к условиям, в которых зонд преимущественно гибридизуется с его подпоследовательностью-мишенью, и в меньшей степени или совсем не гибридизуется с другими последовательностями. «Жесткая гибридизация» или «жесткие условия отмывки при гибридизации» в контексте экспериментов по гибридизации нуклеиновых кислот, таких как саузерн- и нозерн-гибридизация, зависят от последовательности и различаются для разных параметров окружающей среды. Подробное руководство по гибридизации нуклеиновых кислот можно найти в Tijssen, 1993, Laboratory Techniques in Biochemistry and Molecular Biology-Hybridization with Nucleic Acid Probes, часть I, глава 2, "Overview of principles of hybridization and the strategy of nucleic acid probe assays", Elsevier, N.Y.; Sambrook et al., 2001, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, 3.sup.rd ed., NY; и Ausubel et al., eds., Current Edition, Current Protocols in Molecular Biology, Greene Publishing Associates and Wiley Interscience, NY.
Обычно условия гибридизации и отмывки высокой жесткости выбирают как температуру примерно на 5°С ниже температуры плавления (Tm) для конкретной последовательности при заданной ионной силе и рН. Tm представляет собой температуру (при заданной ионной силе и рН), при которой 50% последовательности-мишени гибридизуется с совершенно совпадающим зондом. Очень жесткие условия выбирают как равные Tm для конкретного зонда. Пример жестких условий гибридизации для гибридизации комплементарных нуклеиновых кислот, имеющих более чем приблизительно 100 комплементарных остатков, на фильтре при саузерн- или нозерн-блоттинге представляет собой: 50% формалин с 1 мг гепарина при 42°С, при этом гибридизацию проводят в течение ночи. Пример условий отмывки высокой жесткости представляет собой 0,15 М NaCl при 72°С в течение приблизительно 15 минут. Пример жестких условий отмывки представляет собой отмывку в 0,2х SSC при 65°С в течение 15 минут. Описание буфера SSC см. в Sambrook et al. Отмывке высокой жесткости может предшествовать отмывка низкой жесткости для удаления фонового сигнала зонда. Иллюстративная отмывка средней жесткости для дуплекса длиной, например, более чем приблизительно 100 нуклеотидов, представляет собой 1х SSC при 45°С в течение 15 минут. Иллюстративная отмывка низкой жесткости для дуплекса длиной, например, более чем приблизительно 100 нуклеотидов, представляет собой 4-6х SSC при 40°С в течение 15 минут. Как правило, отношение сигнала к шуму 2х (или выше) по сравнению с наблюдаемым для постороннего зонда при конкретном анализе гибридизации указывает на выявление специфичной гибридизации.
«Праймер» относится к полинуклеотиду, способному к специфичной гибридизации с заданной полинуклеотидной матрицей и обеспечивающему точку инициации синтеза комплементарного полинуклеотида. Такой синтез происходит при помещении полинуклеотидного праймера в условия, при которых происходит индуцирование синтеза, то есть в присутствии нуклеотидов, комплементарной полинуклеотидной матрицы и агента для полимеризации, такого как ДНК-полимераза. Праймер, как правило, является однонитевым, но может быть двунитевым. Как правило, праймеры представляют собой дезоксирибонуклеиновые кислоты, но для многих применений полезен широкий ряд синтетических и природных праймеров. Праймер комплементарен матрице, для гибридизации с которой он предназначен, и служит в качестве сайта инициации синтеза, но необязательно отражает точную последовательность матрицы. В таком случае специфичная гибридизация праймера с матрицей зависит от жесткости условий гибридизации. Праймеры могут быть мечеными, например, хромогенными, радиоактивными или флуоресцентными группировками, и используются в качестве выявляемых группировок.
«Зонд» при использовании по отношению к полинуклеотиду относится к полинуклеотиду, способному к специфичной гибридизации с предназначенной последовательностью другого полинуклеотида. Зонд специфично гибридизуется с комплементарным полинуклеотидом-мишенью, но необязательно отражает точную комплементарную последовательность матрицы. В таком случае специфичная гибридизация зонда с мишенью зависит от жесткости условий гибридизации. Зонды могут быть мечеными, например, хромогенными, радиоактивными или флуоресцентными группировками, и используются в качестве выявляемых группировок. В тех случаях, когда зонд обеспечивает точку инициации синтеза комплементарного полинуклеотида, зонд может также представлять собой праймер.
«Вектор» представляет собой полинуклеотид, который можно использовать для введения другой связанной с ним нуклеиновой кислоты в клетку. Одним из типов векторов является «плазмида», которая относится к линейной или кольцевой двунитевой молекуле ДНК, внутри которой можно лигировать дополнительные сегменты нуклеиновой кислоты. Другим типом вектора является вирусный вектор (например, дефектные по репликации ретровирусы, аденовирусы и аденоассоциированные вирусы), где дополнительные сегменты ДНК можно вводить в вирусный геном. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую их вводят (например, бактериальные векторы, содержащие бактериальную точку начала репликации, и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) после введения в клетку-хозяина интегрируются в геном клетки-хозяина и, следовательно, реплицируются параллельно с геномом клетки-хозяина. «Экспрессионный вектор» представляет собой тип вектора, который может направлять экспрессию выбранного полинуклеотида.
«Регуляторная последовательность» представляет собой нуклеиновую кислоту, которая влияет на экспрессию (например, уровень, время или локализацию экспрессии) нуклеиновой кислоты, с которой она функционально связана. Регуляторная последовательность может, например, оказывать воздействие непосредственно на регулируемую нуклеиновую кислоту или посредством действия одной или более других молекул (например, полипептидов, которые связываются с регуляторной последовательностью и/или с нуклеиновой кислотой). Примеры регуляторных последовательностей включают промоторы, энхансеры и другие контрольные элементы экспрессии (например, сигналы полиаденилирования). Дополнительные примеры регуляторных последовательностей описаны, например, в Goeddel, 1990, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, Calif, и в статье Baron et al., 1995, Nucleic Acids Res. 23: 3605-06. Нуклеотидная последовательность «функционально связана» с регуляторной последовательностью, если эта регуляторная последовательность влияет на экспрессию (например, уровень, время или локализацию экспрессии) нуклеотидной последовательности.
«Клетка-хозяин» представляет собой клетку, которую можно использовать для экспрессии полинуклеотида по изобретению. Клетка-хозяин может представлять собой клетку прокариот, например, Е.coli, или может представлять собой клетку эукариот, например, одноклеточных эукариот (например, дрожжей или других грибов), растительную клетку (например, клетку растения табака или томата), животную клетку (например, клетку человека, клетку обезьяны, клетку хомяка, клетку крысы, клетку мыши или клетку насекомого) или гибридому. Как правило, клетка-хозяин представляет собой культивируемую клетку, которую можно трансформировать или трансфицировать кодирующей полипептид нуклеиновой кислотой, которая может впоследствии экспрессироваться в клетке-хозяине. Выражение «рекомбинантная клетка-хозяин» можно использовать для обозначения клетки-хозяина, трансформированной или трансфицированной нуклеиновой кислотой для ее экспрессии. Клетка-хозяин может также представлять собой клетку, содержащую нуклеиновую кислоту, но не экспрессирующую ее на желаемом уровне, если в клетку-хозяина не введена регуляторная последовательность так чтобы она была функционально связанной с нуклеиновой кислотой. Понятно, что термин «клетка-хозяин» относится не только к конкретному субъекту, но к потомству или потенциальному потомству такой клетки. Поскольку в последующих поколениях могут происходить некоторые модификации вследствие, например, мутации или влияния окружающей среды, такое потомство фактически может не быть идентичным родительской клетке, но все же включено в объем термина, используемого в настоящем документе.
Термин «выделенная молекула» (где молекула представляет собой, например, полипептид или полинуклеотид) означает молекулу, которая в силу ее происхождения или источника получения: (1) не связана с компонентами, сопутствующими ей в ее нативном состоянии в природе, (2) по существу не содержит других молекул того же вида, (3) экспрессируется клеткой из другого вида или (4) не встречается в природе. Таким образом, молекула, синтезированная химическим путем или экспрессированная в клеточной системе, отличающейся от клетки, из которой она имеет происхождение в природе, «выделена» от ее природных сопутствующих компонентов. Молекулу можно также сделать по существу свободной от природных сопутствующих компонентов путем выделения с использованием методик очистки, хорошо известных в данной области техники. Молекулярную чистоту или гомогенность можно определять с помощью ряда средств, известных в данной области техники. Например, чистоту образца полипептида можно определять с использованием электрофореза в полиакриламидном геле и окрашивания геля для визуализации полипептида с использованием методик, хорошо известных в данной области техники. Для некоторых целей более высокую степень разделения можно обеспечить путем использования ВЭЖХ (высокоэффективная жидкостная хроматография) или других средств очистки, хорошо известных в данной области техники.
Белок или полипептид является «по существу чистым», «по существу гомогенным» или «по существу очищенным», когда по меньшей мере примерно 60%-75% образца представляет собой только один вид полипептида. Полипептид или белок может быть мономерным или мультимерным. По существу чистый полипептид или белок, как правило, содержит приблизительно 50%, 60%, 70%, 80% или 90% масс./масс. образца белка, чаще всего приблизительно 95% и, например, имеет более 99% чистоты. Чистоту или гомогенность белка можно показать с помощью ряда средств, хорошо известных в данной области техники, таких как электрофорез в полиакриламидном геле образца белка с последующей визуализацией индивидуальной полосы полипептида после окрашивания геля красителем, хорошо известным в данной области техники. Для некоторых целей более высокую степень разделения можно обеспечить путем использования ВЭЖХ или других средств очистки, хорошо известных в данной области техники.
«Линкер» относится к молекуле, который соединяет две другие молекулы, либо ковалентно, либо посредством ионных, ван-дер-ваальсовых или водородных связей, например к молекуле нуклеиновой кислоты, которая гибридизуется с одной комплементарной последовательностью на 5' конце и с другой комплементарной последовательностью на 3' конце, соединяя, таким образом, две некомплементарные последовательности. «Расщепляемый линкер» относится к линкеру, который может распадаться или иным путем разрываться с разделением двух компонентов, соединенных расщепляемым линкером. Расщепляемые линкеры обычно расщепляются ферментами, как правило, пептидазами, протеазами, нуклеазами, липазами и тому подобными ферментами. Расщепляемые линкеры могут также расщепляться за счет внешних стимулов, таких как, например, специфичные ферментативные активности, изменения температуры, рН, концентрации соли и так далее.
Термины «метка» или «меченый», как используют здесь, относится к включению другой молекулы в антитело. В одном воплощении метка представляет собой обнаружимый маркер, например, включение меченой радиоизотопом аминокислоты или присоединение к полипептиду биотинил-группировки, которая может быть выявлена маркерным авидином (например, стрептавидин, содержащий флуоресцентный маркер или ферментативную активность, которые могут быть выявлены оптическими или калориметрическими методами). В другом воплощении метка или маркер могут быть терапевтическими, например, конъюгат с лекарственным средством или токсин. Различные методы введения меток в полипептиды и гликопротеины известны в данной области техники и могут быть использованы. Примеры меток для полипептидов включают, без ограничения, следующие: радиоизотопы или радионуклиды (например, 3Н, 14С, 15N, 35S, 90Y, 99Tc, 111In, 125I, 131I), флуоресцентные метки (например, FITC, родамин, люминофор на основе комплексов лантанидов), ферментативные метки (например, пероксидаза хрена, β-галактозидаза, люцифераза, щелочная фосфатаза), хемилюминесцентные маркеры, биотинил-группы, предопределенные полипептидные эпитопы, распознаваемые вторичным репортером (например, парные последовательности лейциновой молнии, сайты связывания для вторичных антител, металл-связывающие домены, эпитопные метки), магнетики, такие как хелаты гадолиния, токсины, такие как коклюшный токсин, таксол, цитохалазин В, грамицидин D, этидия бромид, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромицин и их аналоги или гомологи. В некоторых воплощениях метки присоединены с помощью спейсерных групп различной длины для снижения потенциальных стерических препятствий.
«Фармацевтическая композиция» относится к композиции, подходящей для фармацевтического применения у животного. Фармацевтическая композиция содержит фармакологически эффективное количество активного агента и фармацевтически приемлемый носитель. «Фармакологически эффективное количество» относится к количеству агента, эффективному для обеспечения предполагаемого фармакологического результата. «Фармацевтически приемлемый носитель» относится к любому из стандартных фармацевтических носителей, наполнителей, буферов и эксципиентов, таких как забуференный фосфатом физиологический раствор, 5% водный раствор декстрозы и эмульсии, такие как эмульсия масло-в-воде или вода-в-масле, и различных типов увлажняющих агентов и/или адъювантов. Подходящие фармацевтические носители и композиции описаны в Remington's Pharmaceutical Sciences, 21st Ed. 2005, Mack Publishing Co, Easton. «Фармацевтически приемлемая соль» представляет собой соль, которую можно включать в композицию соединения для фармацевтического применения, включая, например, соли металлов (натрия, калия, магния, кальция и так далее) и соли аммония или органических аминов.
Термины «лечить», «лечащий» и «лечение» относятся к способу облегчения или подавления биологического расстройства и/или по меньшей мере одного из сопровождающих его симптомов. При использовании в настоящем документе «облегчение» заболевания, расстройства или состояния означает уменьшение тяжести и/или частоты встречаемости симптомов заболевания, расстройства или состояния. Кроме того, в настоящем документе ссылки на «лечение» включают ссылки на терапевтическое, паллиативное и профилактическое лечение.
Следует понимать, что аспекты и воплощения изобретения, описанные здесь, включают «состоящие» и/или «состоящие по существу из» аспектов и воплощений.
Ссылка на «примерно» в контексте значения или параметра, упомянутого здесь, включает (и описывает) отклонения, которые относятся к этому значению или параметру как таковому. Например, описание со ссылкой на «примерно X» включает описание «X».
Как используют в данном описании и в прилагаемой формуле изобретения, формы единственногго числа включают формы множественного числа, если в контексте ясно не указано иное. Следует понимать, что аспекты и вариации описанного здесь изобретения включают «состоящие» и/или «состоящие по существу из» аспектов и вариаций.
Полипептиды рецептора активина
Как используют здесь, термин «рецепторы активина типа II В (ActRIIB)» относится к рецепторам человеческого активина, имеющим номер доступа NP_001097.2 (SEQ ID NO: 45 здесь), и его вариантам. Термин «ActRIIB-ECD дикого типа» относится к внеклеточному домену ActRIIB, аминокислоты с 1 по 134 (с сигнальной последовательностью) или аминокислоты 19-134 SEQ ID NO: 45 (без сигнальной последовательности) (обозначено здесь как SEQ ID NO: 46). Термин «рецепторы активина типа II A (ActRIIA)» относится к рецепторам человеческого активина, имеющим номер доступа UniProtKB/Swiss-Prot Р27037.1 (SEQ ID NO: 47 здесь), и его вариантам. Термин «ActRIIA-ECD дикого типа» относится к внеклеточному домену ActRIIA, аминокислоты с 1 по 135 (с сигнальной последовательностью) или аминокислоты 20-135 SEQ ID NO: 46 (без сигнальной последовательности) (обозначено здесь как SEQ ID NO: 48).
Растворимые гибридные ActRIIB полипептиды
Согласно настоящему изобретению предложены новые гибридные растворимые ActRIIB-ECD полипептиды, которые имеют происхождение из ActRIIB-ECD дикого типа и ActRIIA-ECD дикого типа. Гибридные растворимые ActRIIB полипептиды специально сконструированы путем замены одной или более аминокислот усеченного ActRIIB-ECD дикого типа аминокислотами из усеченного ActRIIA-ECD дикого типа в соответствующих положениях на основе выравнивания последовательностей между двумя усеченными ActRII ECD доменами на уровне аминокислот. Указанные одна или более аминокислотных замен специфически выбраны для целей предложения гибридных растворимых ActRIIB-ECD полипептидов, которые демонстрируют значительное снижение ВМР9-нейтрализации по сравнению с полипептидом ActRIIB-ECD, в то же время полностью сохраняя эффективную миостатин- и активин А-нейтрализацию.
В различных воплощениях усеченный внеклеточный домен ActRIIB, используемый для получения новых гибридных растворимых ActRIIB-ECD полипептидов, имеет последовательность из 110 аминокислот, изложенную в SEQ ID NO: 1:
В различных воплощениях усеченный внеклеточный домен ActRIIA, используемый для получения новых гибридных растворимых ActRIIB-ECD полипептидов, имеет последовательность из 110 аминокислот, изложенную в SEQ ID NO: 2:
В различных воплощениях гибридные ActRIIB белки-ловушки лигандов содержат гибридный растворимый ActRIIB-ECD полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1, где по меньшей мере один из аминокислотных остатков R3, I6, Y7, Y8, L14, Е15, S20, L22, R24, Е26, Е28, Q29, L33, L48, Y36, S38, R40, S42, Т45, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, F84, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108 или Т110 замещен аминокислотой по соответствующему положению последовательности ActRIIA-ECD дикого типа (SEQ ID NO: 2), и где гибридный растворимый ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 3, где аминокислотные остатки Е26, Е28, Q29, L33, F58, Q64, Е65, А68, Т69, Е70, Е71, N72 и Q74 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 4, где аминокислотные остатки Е26, Е28, Q29, L33, Q64, Е65, А68, Т69, Е70, Е71, N72 и Q74 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 5, где аминокислотные остатки F58, Q64, Е65, А68, Т69, Е70, Е71, N72 и Q74 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 6, где аминокислотные остатки F58, Q64, Е65, А68, Т69, Е70, Е71 и N72 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 7, где аминокислотные остатки Q64, Е65, А68, Т69, Е70, Е71 и N72 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 8, где аминокислотные остатки Q64, Е65, А68, Т69, Е70, Е71, N72 и Q74 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 9, где аминокислотные остатки А68, Т69, Е70, Е71, N72 и Q74 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 10, где аминокислотные остатки А68, Т69, Е70, Е71 и N72 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 11, где аминокислотные остатки F58, А68, Т69, Е70, Е71, N72 и Q74 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 12, где аминокислотные остатки Q64, Е65, А68, Т69, Е70, Е71, N72, Q74 и F84 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 13, где аминокислотные остатки А68, Т69, Е70, Е71, N72, Q74 и F84 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 14, где аминокислотные остатки R3, L14, Е15, S20, L22, R24, Е26, Е28, Q29 и L33 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 15, где аминокислотные остатки R3, L14, Е15, S20, L22 и R24 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 16, где аминокислотные остатки Е26, Е28, Q29 и L33 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 17, где аминокислотные остатки L14, Е15, S20, L22 и R24 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 18, где аминокислотные остатки R3, L14, Е15, S20, L22 и R24 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 19, где аминокислотные остатки R3, L14, Е15 и S20 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 20, где аминокислотные остатки R3, L14 и Е15 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 21, где аминокислотные остатки L14 и Е15 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 22, где аминокислотный остаток R3 SEQ ID NO: 1 был заменен аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 23, где аминокислотные остатки Y36, S38 и K51 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 24, где аминокислотные остатки Е26, Е28, Q29, L33 и F58 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 25, где аминокислотный остаток Е70 SEQ ID NO: 1 был заменен аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 26, где аминокислотный остаток F58 SEQ ID NO: 1 был заменен аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 27, где аминокислотные остатки F58 и Е70 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 28, где аминокислотные остатки Е28, Q29, F58 и Е70 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 29, где аминокислотные остатки Е28, F58 и Е70 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 30, где аминокислотные остатки Е28 и Е70 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 31, где аминокислотный остаток Е28 SEQ ID NO: 1 был заменен аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 32, где аминокислотные остатки Е26, Е28, Q29, L33, А68, Т69, Е70, Е71, N72 и Q74 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 33, где аминокислотные остатки Y7, Y8, L14, Е15, S20, L22 и R24 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 34, где аминокислотные остатки Y36, S38, R40, S42, T45 и K51 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 35, где аминокислотные остатки Q64 и Е65 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 36, где аминокислотный остаток F84 SEQ ID NO: 1 был заменен аминокислотным остатком в соответствующем положении SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 37, где аминокислотные остатки Е28 и F58 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 51, где аминокислотные остатки R3, I6, Y7, Y8, L14, Е15, L22, R24, Е26, Е28, Q29, L33 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 52, где аминокислотные остатки R3, I6, Y7, Y8, L14, Е15, L22, R24 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 53, где аминокислотные остатки I6, Y7, Y8, L14, Е15, L22, R24 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 54, где аминокислотные остатки I6, Y7, Y8, L14, Е15, L22, R24, Е26 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 55, где аминокислотные остатки I6, Y7, Y8, L14, Е15, L22, R24, Е26, Е28, Q29, L33 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 56, где аминокислотные остатки I6, Y7, Y8, L14, Е15, L22, R24, Е26, Е28, Q29, L33, Y36, S38, R40, S42, T45, L48, K51 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 57, где аминокислотные остатки I6, Y7, Y8, L14, Е15, L22, R24, Е26, Е28, Q29, L33, Y36, S38, R40, S42, Т45, L48, K51, F58 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 58, где аминокислотные остатки I6, Y7, Y8, L14, Е15, L22, R24, Е26, Е28, Q29, L33, Y36, S38, R40, S42, Т45, L48, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 59, где аминокислотные остатки R3, Е26, Е28, Q29, L33, Y36, S38, R40, S42, Т45, L48, K51, F58 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 60, где аминокислотные остатки Е26, Е28, Q29, L33, Y36, S38, R40, S42, Т45, L48, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 61, где аминокислотные остатки Е26, Е28, Q29, L33, Y36, S38, R40, S42, Т45, L48, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, F84 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 62, где аминокислотные остатки Y36, S38, R40, S42, Т45, L48, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 63, где аминокислотные остатки Y36, S38, R40, S42, Т45, L48, K51, F58, Q64, Е65 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 64, где аминокислотные остатки Y36, S38, R40, S42, Т45, L48, K51, Q64, Е65 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 65, где аминокислотные остатки Y36, S38, R40, S42, Т45, L48, K51 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 66, где аминокислотные остатки R3, Е26, Е28, Q29, L33, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 67, где аминокислотные остатки R3, Е26, Е28, Q29, L33, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, F84 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 68, где аминокислотные остатки R3, Е26, Е28, Q29, L33, Y36, S38, R40, S42, Т45, L48, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, F84 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 69, где аминокислотные остатки R3, Е26, Е28, Q29, L33, Y36, S38, R40, S42, Т45, L48, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 70, где аминокислотные остатки I6, Y7, Y8, L14, Е15, L22, R24, Y36, S38, R40, S42, Т45, L48, K51, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 71, где аминокислотные остатки I6, Y7, Y8, L14, Е15, L22, R24, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 72, где аминокислотные остатки I6, Y7, Y8, L14, Е15, L22, R24, Е26, Е28, Q29, L33, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 73, где аминокислотные остатки Е26, Е28, Q29, L33, Q64, Е65 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 74, где аминокислотные остатки Е26, Е28, Q29, L33, K51, Q64, Е65 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 75, где аминокислотные остатки Е26, Е28, Q29, L33, L48, Q64, Е65 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 76, где аминокислотные остатки Е26, Е28, Q29, L33, Т45, Q64, Е65 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 77, где аминокислотные остатки Е26, Е28, Q29, L33, Т45, L48, Q64, Е65 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 78, где аминокислотные остатки Е26, Е28, Q29, L33, Т45, L48, K51, Q64, Е65 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 79, где аминокислотные остатки Q64, Е65, F84 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 80, где аминокислотные остатки R88, Т90, Н91, L92, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 81, где аминокислотные остатки R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 82, где аминокислотные остатки Е26, Е28, Q29, L33, F58, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, R88, Т90, Н91, L92, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 83, где аминокислотные остатки Е26, Е28, Q29, L33, Q64, Е65, А68, Т69, Е70, Е71, N72, Q74, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 84, где аминокислотные остатки Е26, Е28, Q29, L33, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 85, где аминокислотные остатки Е26, Е28, Q29, L33, K51, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 86, где аминокислотные остатки Е26, Е28, Q29, L33, L48, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 87, где аминокислотные остатки Е26, Е28, Q29, L33, Т45, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 88, где аминокислотные остатки Т45, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 89, где аминокислотные остатки L48, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 90, где аминокислотные остатки K51, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 91, где аминокислотные остатки А68, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 92, где аминокислотные остатки А68, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 93, где аминокислотные остатки Е70, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 94, где аминокислотные остатки Е71, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 95, где аминокислотные остатки N72, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 96, где аминокислотные остатки Q74, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 97, где аминокислотные остатки Е28, Q29, А68, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 98, где аминокислотные остатки Q29, Т69, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 99, где аминокислотные остатки Е28, Е70, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 100, где аминокислотные остатки Е28, Q29, K51, Т69, Е70, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 101, где аминокислотные остатки Е28, Q29, L48, K51, Т69Е, Е70, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 102, где аминокислотные остатки Е26, Е28, Т45, L48, K51, Т69, Е70, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 103, где аминокислотные остатки Q29, L48, Е70, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 104, где аминокислотные остатки Е26, Е28, L33, Q70, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 105, где аминокислотные остатки L33, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 106, где аминокислотные остатки Е26, Т45, L48, Q64, Е65, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 107, где аминокислотные остатки L33, Т45, Т69, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 108, где аминокислотные остатки L33, L48, Т69, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 109, где аминокислотные остатки L33, Т45, L48, Е70, R88, Т90, Н91, L92, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 110, где аминокислотные остатки Е28, L48, Е70, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 111, где аминокислотные остатки Е28, Т45, Е70, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 112, где аминокислотные остатки Е28, Е70, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 113, где аминокислотные остатки L48, Е70, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 114, где аминокислотные остатки Е70, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 115, где аминокислотные остатки Е28, L48, T79, Е70, R88, Т90, Н91, L92, Е94, А95, G96, G97, Р98, Е99, V100, Y102, Е103, Р105, Р106, Т107, А108, Т110 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 116, где аминокислотные остатки R3, I6, Y7, Y8, L14, Е15, S20, L22, R24, Е26, Е28, Q29, L33, Y36, S38, R40, S42, Т45, L48, K51, F58, Q64, Е65, А68, Т69, Е71, N72, Q74, F84 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
В различных воплощениях гибридный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 117, где аминокислотные остатки Е26, Е28, Q29, L33, F56, E68 SEQ ID NO: 1 были заменены аминокислотными остатками в соответствующих положениях SEQ ID NO: 2.
Гетерологичные белки - Fc домены
В другом аспекте гибридные ActRII белки-ловушки лигандов содержат гибридный растворимый ActRIIB-ECD полипептид и по меньшей мере один гетерологичный белок, присоединенный к ActRIIB-ECD полипептиду либо непосредственно, либо через линкерную последовательность с образованием слитого белка, обозначенного здесь как гибридный ActRIIB белок-ловушка лигандов. Как используют здесь, термин «слитый белок», относится к белку, имеющему гетерологичный полипептид, присоединенный посредством методик рекомбинантных ДНК. В различных воплощениях гетерологичный белок выбран, без ограничения, из полигистидиновой метки, Glu-Glu, глутатион-S-трансферазы (GST), тиоредоксина, белка А, белка G, флуоресцентного белка, мальтоза-связывающего белка (МВР), человеческого сывороточного альбумина или Fc полипептида или Fc домена. В различных воплощениях Fc домен представляет собой Fc домен человеческого IgG. В различных воплощениях Fc домен имеет происхождение из последовательности константного домена тяжелой цепи человеческого IgG1, изложенной в SEQ ID NO: 38. В различных воплощениях Fc домен представляет собой Fc домен, имеющий аминокислотную последовательность, изложенную в SEQ ID NO: 39. В различных воплощениях Fc домен имеет происхождение из последовательности константного домена тяжелой цепи человеческого IgG2, изложенной в SEQ ID NO: 40. В различных воплощениях Fc домен представляет собой Fc домен, имеющий аминокислотную последовательность, изложенную в SEQ ID NO: 41. В различных воплощениях Fc домен имеет происхождение из последовательности константного домена тяжелой цепи человеческого IgG4, изложенной в SEQ ID NO: 42. В различных воплощениях Fc домен представляет собой Fc домен, имеющий аминокислотную последовательность, изложенную в SEQ ID NO: 43.
Линкеры
Гибридные ActRIIB белки-ловушки могут возможно дополнительно содержать «линкерную» или «шарнирную линкерную» последовательность. Линкер служит главным образом в качестве спейсера между гибридным растворимым ActRIIB-ECD полипептидом, гетерологичным белком или другим типом слияния или между двумя или более гибридными растворимыми ActRIIB-ECD полипептидами. В различных воплощениях гетерологичный белок присоединен к гибридному растворимому ActRIIB-ECD полипептиду посредством линкерного или шарнирного линкерного пептида. Линкер и/или шарнирный линкер может представлять собой искусственную последовательность между 5, 10, 15, 20, 30, 40 или более аминокислотами, которые относительно свободны от вторичной структуры. В различных воплощениях линкеры содержат аминокислоты, выбранные из глицина, аланина, пролина, аспарагина, глутамина и лизина. В различных воплощениях линкер создан из большинства аминокислот, которые не создают стерического затруднения, таких как глицин и аланин, и представляют собой полиглицины (в частности (Gly)5, (Gly)8, поли(Gly-Ala) и полиаланины. В различных воплощениях линкер является обогащенным по содержанию G/S (например, по меньшей мере примерно 60%, 70%, 80%, 90% или более аминокислот в линкере представляют сбой G или S). В различных воплощениях линкер имеет мотив (GGGGS (SEQ ID NO: 44))n, где n равно 1-6. Такие линкеры и шарнирные линкеры широко описаны в данной области техники (см., например, патент США 8410043 (Sun et al), включенный в данной описание путем ссылки для целей раскрытия таких линкеров). В различных воплощениях линкер, имеющий аминокислотную последовательность, изложенную в SEQ ID NO: 44, и шарнирный линкер, имеющий аминокислотную последовательность, изложенную в SEQ ID NO: 118, используют для присоединения человеческого IgG1 Fc (SEQ ID NO: 39) или человеческого IgG4 Fc (SEQ ID NO: 43) к гибридному растворимому ActRIIB-ECD полипептиду по настоящему изобретению.
Линкеры также могут представлять собой непептидные линкеры. Например, могут быть использованы алкильные линкеры, такие как -NH-(CH2)s-С(O)-, где s равно 2-20. Такие алкильные линкеры могут быть дополнительно замещены группой, не оказывающей стерических затруднений, такой как низший алкил (например C1-C6), низший ацил, галоген (например Cl, Br), CN, NH2, фенил и так далее.
Молекулярные конфигурации гибридных ActRIIB белков-ловушек лигандов
Следует понимать, что разные элементы гибридного ActRIIB белка-ловушки лигандов могут быть расположены в любом порядке, который согласуется с желаемой функциональностью. Например, гетерологичный белок может быть расположен на С-конце в гибридном растворимом ActRIIB-ECD полипептиде, или альтернативно, гибридный растворимый ActRIIB-ECD полипептид может быть расположен на С-конце гетерологичного домена. Гибридный растворимый ActRII-ECD полипептидный домен и гетерологичный домен необязательно должны быть смежными, и могут быть включены дополнительные домены или аминокислотные последовательности на С- или N-конце либо в домен, либо между доменами (то есть, включают описанный здесь линкер). Примерные молекулярные конфигурации новых ActRIIB белков-ловушек лигандов изображены на Фиг. 1.
Примерная конфигурация синтетической ДНК кассеты, кодирующей гибридный ActRIIB белок-ловушку лигандов, может быть в общем описана как содержащая следующие элементы: 1) сигнальный пептид (или лидерная последовательность), расположенный на N-конце, который может представлять собой либо нативный сигнальный пептид ActRIIB (например, SEQ ID NO: 49), либо заменяющий сигнальный пептид, способный опосредовать процессинг и секрецию секретируемых белков (например, путем использования лидерной последовательности легкой цепи человеческого иммуноглобулина (SEQ ID NO: 50) в качестве заменяющего сигнального пептида может быть достигнута эффективная секреция гибридных ActRIIB белков-ловушек лигандов в клетках СНО); 2) последовательность гибридного растворимого ActRIIB-ECD полипептида (например, любая последовательность из SEQ ID NO: 3-37 или 51-117), слитая с последовательностью сигнального пептида; 3) пептидная линкерная последовательность (например, SEQ ID NO: 44) и шарнирная линкерная последовательность (SEQ ID NO: 118) и 4) Fc домен (например, SEQ ID NO: 39, 41 или 43), слитый с последовательностью гибридного растворимого ActRIIB-ECD полипептида посредством пептидного/шарнирного линкера.
Примеры различных воплощений по настоящему изобретению включают, без ограничения, гибридные ActRIIB белки-ловушки лигандов, описанные в Таблице 2.
Полинуклеотиды
В другом аспекте настоящего изобретения предложены выделенные молекулы нуклеиновых кислот, содержащие полинуклеотид, кодирующий гибридный растворимый ActRIIB-ECD полипептид по настоящему изобретению. Рассматриваемые нуклеиновые кислоты могут быть одноцепочечными или двухцепочечными. Такие нуклеиновые кислоты могут представлять собой молекулы ДНК или РНК. ДНК включает, например, кДНК, геномную ДНК, синтетическую ДНК, амплифицированную посредством ПЦР ДНК и их комбинации. Геномную ДНК, кодирующую ActRIIB полипептиды, получают из геномных библиотек, которые доступны для множества видов. Синтетическая ДНК доступна в результате химического синтеза перекрывающихся олигонуклеотидных фрагментов с последующей сборкой этих фрагментов для воссоздания части или всех кодирующих участков и фланкирующих последовательностей. РНК может быть получена из прокариотических экспрессионных векторов, которые направляют синтез мРНК на высоком уровне, таких как векторы, использующие Т7 промоторы и РНК-полимеразу. кДНК получают из библиотек, получаемых на основе мРНК, выделенных из различных тканей, которые экспрессируют ActRIIB. Молекулы ДНК по изобретению включают полноразмерные гены, а также полинуклеотиды и их фрагменты. Полноразмерный ген может также включать последовательности, кодирующие N-концевую сигнальную последовательность.
Такие нуклеиновые кислоты могут быть использованы, например, в способах получения новых гибридных растворимых ActRIIB-ECD полипептидов. В различных воплощениях полинуклеотиды кодируют любые из полипептидных последовательностей, изложенных в SEQ ID NO: 3-37 или 51-117, где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях полинуклеотиды кодируют полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична любой из полипептидных последовательностей, изложенных в SEQ ID NO: 3-37 или 51-117, где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях полинуклеотиды кодируют полипептид, имеющий по меньшей мере 90%-ную идентичность любой из полипептидных последовательностей, изложенных в SEQ ID NO: 3-37 или 51-117, где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях полинуклеотиды кодируют полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 95% идентична любой из полипептидных последовательностей, изложенных в SEQ ID NO: 3-37 или 51-117, где гибридный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. В различных воплощениях последовательности нуклеиновой кислоты по настоящему изобретению могут быть выделенными, рекомбинантными и/или слитыми с гетерологичной нуклеотидной последовательностью, или из библиотеки ДНК.
В различных воплощениях настоящего изобретения предложены молекулы нуклеиновой кислоты, которые гибридизуются в строгих или умеренно строгих условиях с кодирующими полипептид участками описанных здесь полинуклеотидов, где кодируемый полипептид содержит аминокислотную последовательность, как изложено в SEQ ID NO: 3-37 или 51-117, и где кодируемый полипептид способен к связыванию с миостатином и активином А, но демонстрирует пониженную аффинность связывания с ВМР9 относительно ActRIIB-ECD полипептида дикого типа. Специалисту в данной области техники легко понятно, что условия подходящей строгости, которые стимулируют гибридизацию ДНК, могут варьировать. Например, гибридизация может быть осуществлена при 6,0 Х хлорида натрия/цитрата натрия (SSC) при примерно 45°С, с последующей отмывкой при 2,0 Х SSC при 50°С. Например, концентрация соли на стадии отмывки может быть выбрана от низкой строгости при примерно 2,0 Х SSC при 50°С до высокой строгости при примерно 0,2 Х SSC при 50°С. В дополнение, температура на стадии отмывки может быть увеличена от условий низкой строгости при комнатной температуре, примерно 22°С, до условий высокой строгости при примерно 65°С. И температура, и соль могут варьироваться, либо температуру или концентрацию соли можно поддерживать постоянной при изменении другой переменной. В одном воплощении изобретения предложены нуклеиновые кислоты, которые гибридизуются в условиях низкой строгости при 6 Х SSC при комнатной температуре с последующей отмывкой при 2 Х SSC при комнатной температуре.
В различных воплощениях выделенные молекулы нуклеиновой кислоты содержат описанные здесь полинуклеотиды и дополнительно содержат полинуклеотид, кодирующий по меньшей мере один описанный здесь гетерологичный белок. В различных воплощениях молекулы нуклеиновой кислоты дополнительно содержат полинуклеотиды, кодирующие описанные здесь линкеры или шарнирные линкеры.
В различных воплощениях рекомбинантные нуклеиновые кислоты по настоящему изобретению могут быть функционально связаны с одной или более регуляторными нуклеотидными последовательностями в экспрессионной конструкции. Регуляторные последовательности известны в данной области техники и выбираются для направления экспрессии гибридного растворимого ActRIIB-ECD полипептида. Соответственно, термин «регуляторная последовательность» включает промоторы, энхансеры и другие элементы для регуляции экспрессии. Иллюстративные регуляторные последовательности описаны в Goeddel; Gene Expression Technology: Methods in Enzymology, Academic Press, San Diego, Calif. (1990). Как правило, указанные одна или более регуляторных нуклеотидных последовательностей могут включать, без ограничения, промоторные последовательности, лидерные и сигнальные последовательности, сайты связывания с рибосомой, последовательности инициации и окончания транскрипции и последовательности энхансера или активатора. Конститутивные и индуцибельные промоторы как известные в данной области техники предусмотрены настоящим изобретением. Промоторы могут представлять собой существующие в природе промоторы или гибридные промоторы, которые объединяют элементы более чем одного промотора. Экспрессионная конструкция может присутствовать в клетке на эписоме, такой как плазмида, или экспрессионная конструкция может быть встроена в хромосому. В различных воплощениях экспрессионный вектор содержит селектируемый маркерный ген для обеспечения отбора трансформированных клеток-хозяев. Селектируемые маркерные гены хорошо известны в данной области техники и вариабельны в зависимости от используемой клетки-хозяина.
В другом аспекте по настоящему изобретению рассматриваемая нуклеиновая кислота предложена в экспрессионном векторе, содержащем нуклеотидную последовательность, кодирующую гибридный растворимый ActRIIB-ECD полипептид, и функционально связанную с по меньшей мере одной регуляторной последовательностью. Термин «экспрессионный вектор» относится к плазмиде, фагу, вирусу или вектору для экспрессирования полипептида с полинуклеотидной последовательности. Векторы, подходящие для экспрессии в клетках-хозяевах, легко доступны, и молекулы нуклеиновых кислот встраивают в векторы с использованием стандартных технологий рекомбинантных ДНК. Такие векторы могут включать широкий ряд экспрессионных контрольных последовательностей, которые регулируют экспрессию последовательности ДНК, когда они функционально связаны с ней и могут быть использованы в этих векторах для экспрессии ДНК последовательностей, кодирующих гибридный растворимый ActRIIB-ECD полипептид. Такие полезные экспрессионные контрольные последовательности включают, например, ранние и поздние промоторы SV40, тет-промотор, аденовирусные или цитомегаловирусные непосредственные ранние промоторы, RSV промоторы, lac систему, trp систему, ТАС или TRC систему, Т7 промотор, экспрессия которого направляется Т7 РНК-полимеразой, основной оператор и промоторные участки фага лямбда, контрольные участки для fd оболочечного белка, промотор для 3-фосфоглицераткиназы или других гликолитических ферментов, промоторы кислой фосфатазы, например, PhoS, промоторы a-mating факторов дрожжей, полиэдриновый промотор бакуловирусной системы и другие последовательности, известные для регуляции экспрессии генов прокариотических или эукариотических клеток или их вирусов и различных их комбинаций. Следует понимать, что конструкция экспрессионного вектора может зависеть от таких факторов, как выбор клетки-хозяина, подлежащей трансформации, и/или типа белка, который желательно экспрессировать. Кроме того, следует также принимать во внимание число копий вектора, способность контролировать это число копий, и экспрессию любого другого белка, кодируемого вектором, такого как антибиотические маркеры. Примерный экспрессионный вектор, подходящий для экспрессии vActRIIB представляет собой pDSRa (описанный в WO 90/14363, включенной в данное описание посредством ссылки) и его производные, содержащие vActRIIB полинуклеотиды, а также любые дополнительные подходящие векторы, известные в данной области техники или описанные ниже.
Рекомбинантная нуклеиновая кислота по настоящему изобретению может быть продуцирована путем лигирования клонированного гена или его части в вектор, подходящий для экспрессии в прокариотических клетках, эукариотических клетках (дрожжей, птиц, насекомых или млекопитающих), или и тех, и других. Экспрессионные носители для продуцирования рекомбинантного ActRIIB полипептида включают плазмиды и другие векторы. Например, подходящие векторы включают плазмиды следующих типов: плазмиды на основе pBR322, плазмиды на основе pEMBL, плазмиды на основе рЕХ, плазмиды на основе рВТас и плазмиды на основе pUC, для экспрессии в прокариотических клетках, таких как E.coli.
Некоторые экспрессионные векторы млекопитающих содержат как прокариотические последовательности для облегчения размножения вектора в бактериях, так и одну или более эукариотических транскрипционных единиц, которые экспрессируются в эукариотических клетках. Векторы на основе pcDNAI/amp, pcDNAI/neo, pRc/CMV, pSV2gpt, pSV2neo, pSV2-dhfr, pTk2, pRSVneo, pMSG, pSVT7, pko-neo и pHyg являются примерами экспрессионных векторов млекопитающих, подходящих для трансфекции эукариотических клеток. Некоторые из этих векторов модифицируют последовательностями из бактериальных плазмид, таких как pBR322, для облегчения репликации и отбора по лекарственной устойчивости как в прокариотических, так и в эукариотических клетках. Альтернативно, производные вирусов, таких как бычий вирус папилломы (BPV-1) или вирус Эпштейна-Барр (pHEBo, pREP-производное и р205), могут быть использованы для временной экспрессии белков в эукариотических клетках. Примеры других вирусных (в том числе ретровирусных) экспрессионных систем могут быть найдены ниже в описании систем доставки для генной терапии. Различные методы, используемые в получении плазмид и в трансформации организмов-хозяев, хорошо известны в данной области техники. В отношении других подходящих экспрессионных систем для прокариотических и эукариотических клеток, а также общих рекомбинантных методик см. Molecular Cloning A Laboratory Manual, 2nd Ed., ed. by Sambrook, Fritsch and Maniatis (Cold Spring Harbor Laboratory Press, 1989) Chapters 16-17. В некоторых случаях может быть желательно экспрессировать рекомбинантные полипептиды путем использования бакуловирусной экспрессионной системы. Примеры таких бакуловирусных экспрессионных систем включают векторы на основе pVL (такие как pVL1392, pVL1393 и pVL941), векторы на основе pAcUW (такие как pAcUW1) и векторы на основе pBlueBac (такие как B-gal, содержащий pBlueBac III).
В различных воплощениях вектор конструируют для продуцирования рассматриваемых гибридных растворимых ActRIIB-ECD полипептидов в клетках яичника китайского хомячка (СНО), например, вектор Pcmv-Script (Stratagene, La Jolla, Calif.), векторы pcDNA4 (Invitrogen, Carlsbad, Calif.) и векторы pCI-neo (Promega, Madison, Wis.). Как будет очевидно, рассматриваемые генетические конструкции могут быть использованы для индукции экспрессии рассматриваемых гибридных растворимых ActRIIB-ECD полипептидов в клетках, размножающихся в культуре, например, для продуцирования белков, включая слитые белки и варианты белков, для очистки.
Настоящее изобретение также относится к клетке-хозяину, трансфицированной рекомбинантным геном, включающим нуклеотидную последовательность, кодирующую аминокислотную последовательность (например, SEQ ID NO: 3-37 или 51-117) для одного или более рассматриваемых гибридных растворимых ActRIIB-ECD полипептидов. Клетка-хозяин может представлять собой любую прокариотическую или эукариотическую клетку. Например, гибридный растворимый ActRIIB-ECD полипептид по настоящему изобретению может экспрессироваться в бактериальных клетках, таких как E.coli, клетках насекомых (например, с использованием бакуловирусной экспрессионной системы), клетках дрожжей или клетках млекопитающих. Другие подходящие клетки-хозяева известны специалистам в данной области техники.
Соответственно, настоящее изобретение дополнительно относится к способам получения рассматриваемых гибридных растворимых ActRIIB-ECD полипептидов. Например, клетка-хозяин, трансфицированная экспрессионным вектором, кодирующим гибридный растворимый ActRIIB-ECD полипептид, может быть культивирована в условиях, подходящих для осуществления экспрессии гибридного растворимого ActRIIB-ECD полипептида. Гибридный растворимый ActRIIB-ECD полипептид может секретироваться, и его можно выделить из смеси клеток и среды, содержащей гибридный растворимый ActRIIB-ECD полипептид. Альтернативно, гибридный растворимый ActRIIB-ECD полипептид может оставаться в цитоплазме или в мембранной фракции, и клетки могут быть собраны и подвергнуты лизису с выделением белка. Культура клеток включает клетки-хозяева, среды и другие побочные продукты. Подходящие среды для клеточной культуры хорошо известны в данной области техники.
Полипептиды и белки по настоящему изобретению могут быть очищены согласно методикам очистки белков, которые хорошо известны специалистам в данной области техники. Эти методики включают, на первом уровне, грубое фракционирование на белковые и небелковые фракции. После отделения пептидов и полипептидов от других белков интересующие пептид или полипептид могут быть дополнительно очищены с использованием хроматографических и электрофоретических методик для достижения частичной или полной очистки (или очистки до однородности). Термин «выделенный полипептид» или «очищенный полипептид», как используют здесь, предназначен для ссылки на состав, отделяемый от других компонентов, где полипептид очищен до любой степени относительно его состояния, получаемого в природе. Таким образом, очищенный полипептид также относится к полипептиду, который свободен от окружения, в котором он может существовать в природе. В общем, «очищенный» относится к полипептидному составу, который был подвергнут фракционированию с удалением различных других компонентов и состав которого по существу сохраняет его экспрессируемую биологическую активность. Когда используют термин «по существу очищенный», это обозначение относится к пептидному или полипептидному составу, в котором полипептид или пептид образуют главный компонент этого состава, например, составляя примерно 50%, примерно 60%, примерно 70%, примерно 80%, примерно 85% или примерно 90% или более от белков в данном составе.
Различные методики, подходящие для использования в очистке, хорошо известны специалистам в данной области техники. Они включают, например, осаждение сульфатом аммония, полиэтиленгликолем (PEG), антителами (иммунопреципитация) и тому подобное, или посредством денатурации нагреванием с последующим центрифугированием; хроматографию, такую как аффинная хроматография (колонки с белком-А), ионообменная хроматография, гель-хроматография, обращенно-фазовая хроматография, хроматография на гидроксиапатите, хроматография гидрофобных взаимодействий; изоэлектрическое фокусирование; гель-электрофорез; и комбинации этих методик. Как хорошо известно в данной области техники, полагают, что порядок проведения различных стадий очистки может быть изменен, или что некоторые стадии могут быть опущены и все еще будут обеспечивать подходящий способ получения по существу очищенного полипептида.
Фармацевтические композиции
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая выделенные гибридные растворимые ActRIIB полипептиды или гибридные ActRIIB белки-ловушки лигандов в смеси с фармацевтически приемлемым носителем. Такие фармацевтически приемлемые носители хорошо известны и понятны специалистам в данной области техники и широко описаны (см., например, Remington's Pharmaceutical Sciences, 18th Edition, A. R. Gennaro, ed., Mack Publishing Company, 1990). Фармацевтически приемлемые носители могут быть включены для целей модифицирования, поддержания или сохранения, например, значения рН, осмоляльности, вязкости, прозрачности, цвета, изотоничности, запаха, стерильности, стабильности, скорости растворения или высобождения, адсорбции или проникновения композиции. Такие фармацевтические композиции могут влиять на физическое состояние, стабильность, скорость высвобождения in vivo и скорость клиренса in vivo полипептида. Подходящие фармацевтически приемлемые носители включают, без ограничения, аминокислоты (такие как глицин, глутамин, аспарагин, аргинин или лизин); антимикробные агенты; антиоксиданты (такие как аскорбиновая кислота, сульфит натрия или гидросульфит натрия); буферы (такие как борат, бикарбонат, Трис-HCl, цитраты, фосфаты, другие органические кислоты); объемообразующие агенты (такие как маннит или глицин), хелатообразующие агенты (такие как этилендиаминтетрауксусная кислота (EDTA)); комплексообразующие агенты (такие как кофеин, поливинилпирролидон, бета-циклодекстрин или гидроксипропил-бета-циклодекстрин); наполнители; моносахариды; дисахариды и другие углеводы (такие как глюкоза, манноза или декстрины); белки (такие как сывороточный альбумин, желатин или иммуноглобулины); красители; корригенты и разбавители; эмульгаторы; гидрофильные полимеры (такие как поливинилпирролидон); низкомолекулярные полипептиды; солеобразующие противоионы (такие как натрий); консерванты (такие как хлорид бензалкония, бензойная кислота, салициловая кислота, тимеросал, фенетиловый спирт, метилпарабен, пропилпарабен, хлоргексидин, сорбиновая кислота или пероксид водорода); растворители (такие как глицерин, пропиленгликоль или полиэтиленгликоль); сахарные спирты (такие как маннит или сорбит); суспендирующие агенты; поверхностно-активные агенты или увлажняющие агенты (такие как плюроники, PEG, сорбитановые сложные эфиры, полисорбаты, такие как полисорбат 20, полисорбат 80, тритон, трометамин, лецитин, холестерин, тилоксапал); усиливающие стабильность агенты (сахароза или сорбит); усиливающие тоничность агенты (такие как галогениды щелочных металлов (предпочтительно хлорид натрия или калия, маннит, сорбит); носители для доставки; разбавители; эксципиенты и/или фармацевтические адъюванты.
Основной наполнитель или носитель в фармацевтической композиции может быть водным или неводным по природе. Например, подходящий носитель или наполнитель может представлять собой воду для инъекций, физиологический солевой раствор или искусственную цереброспинальную жидкость, возможно дополненную другими материалами, обычно используемыми в композициях для парентерального введения. Нейтральный забуференный солевой раствор или солевой раствор, смешанный с сывороточным альбумином, являются дополнительными иллюстративными носителями. Другие иллюстративные фармацевтические композиции содержат Трио-буфер с рН примерно 7,0-8,5 или ацетатный буфер с рН примерно 4,0-5,5, которые могут дополнительно включать сорбит или его подходящую замену. В одном воплощении по настоящему изобретению композиции могут быть получены для хранения путем смешивания выбранной композиции, имеющей желаемую степень чистоты, с возможными агентами препарата (Remington's Pharmaceutical Sciences, выше) в форме лиофилизированного осадка или водного раствора. Кроме того, терапевтическая композиция может быть изготовлена в виде лиофилизата с использованием подходящих эксципиентов, таких как сахароза. Оптимальная фармацевтическая композиция будет определяться специалистом в данной области техники в зависимости от, например, намеченного пути введения, формата доставки и требуемой дозировки.
Когда предусмотрено парентеральное введение, терапевтические фармацевтические композиции могут быть представлены в форме апирогенного парентерально приемлемого водного раствора, содержащего требуемый ActRIIB полипептид в фармацевтически приемлемом носителе. Особенно подходящий носитель для парентеральной инъекции представляет собой стерильную дистиллированную воду, в которой полипептид готовят в виде стерильного изотонического раствора с подходящими консервантами. В различных воплощениях фармацевтические композиции, подходящие для инъекционного введения, могут быть изготовлены в водных растворах, предпочтительно в физиологически совместимых буферах, таких как раствор Хэнкса, раствор Рингера или физиологический буферный раствор. Водные инъекционные суспензии могут содержать вещества, которые увеличивают вязкость суспензии, такие как карбоксиметилцеллюлоза натрия, сорбит или декстран. Дополнительно, суспензии активных соединений могут быть получены в виде подходящих масляных инъекционных суспензий. Возможно, суспензия может также содержать подходящие стабилизаторы или агенты для повышения растворимости соединений и обеспечения возможности получения высококонцентрированных растворов.
В различных воплощениях терапевтические фармацевтические композиции могут быть изготовлены для направленной доставки с использованием коллоидной дисперсной системы. Коллоидные дисперсные системы включают макромолекулярные комплексы, нанокапсулы, микросферы, шарики и системы на основе липидов, включая эмульсии масло-в-воде, мицеллы, смешанные мицеллы и липосомы. Примеры липидов, полезных в получении липосом, включают фосфатидильные соединения, такие как фосфатидилглицерин, фосфатидилхолин, фосфатидилсерин, фосфатидилэтаноламин, сфинголипиды, цереброзиды и ганглиозиды. Иллюстративные фосфолипиды включают яичный фосфатидилхолин, дипальмитоилфосфатидилхолин и дистеароилфосфатидилхолин. Нацеливание липосом также возможно на основе, например, органной специфичности, клеточной специфичности и специфичности к органеллам и известно в данной области техники.
В различных воплощениях предусмотрено пероральное введение фармацевтических композиций. Фармацевтические композиции, которые вводят таким образом, могут быть изготовлены с использованием или без использования тех носителей, которые обычно используются в приготовлении твердых лекарственных форм, таких как таблетки и капсулы. В твердых лекарственных формах для перорального введения (капсулы, таблетки, пилюли, драже, порошки, гранулы и тому подобное), одно или более терапевтических соединений по настоящему изобретению могут быть смешаны с одним или более фармацевтически приемлемыми носителями, такими как цитрат натрия или гидрофосфат кальция, и/или любыми из следующих: (1) наполнители или объемообразующие агенты, такие как крахмалы, лактоза, сахароза, глюкоза, маннит и/или кремниевая кислота; (2) связывающие вещества, такие как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или аравийская камедь; (3) увлажнители, такие как глицерин; (4) разрыхлители, такие как агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия; (5) замедляющие растворение агенты, такие как парафин; (6) ускорители абсорбции, такие как соединения четвертичного аммония; (7) увлажняющие агенты, такие как, например, цетиловый спирт и глицеролмоностеарат; (8) абсорбенты, такие как каолин и бентонитовый клей; (9) смазывающие агенты, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси; и (10) красители. В случае капсул, таблеток и пилюль, фармацевтические композиции могут также содержать буферные агенты. Твердые композиции подобного типа также могут быть использованы в качестве наполнителей в мягких и твердых желатиновых капсулах с использованием таких эксципиентов, как лактоза или молочные сахара, а также высокомолекулярные полиэтиленгликоли и тому подобное. Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активному ингредиенту жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в данной области техники, такие как вода и другие растворители, солюбилизаторы и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в частности, хлопковое, арахисовое, кукурузное, масло ростков пшеницы, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и сложные эфиры сорбитана с жирными кислотами и их смеси. Помимо инертных разбавителей, пероральные композиции могут также включать адъюванты, такие как увлажнители, эмульгаторы и суспендирующие агенты, подсластители, корригенты, красители, отдушки и консерванты.
В различных воплощениях предусмотрено местное введение фармацевтических композиций, либо на кожу, либо на слизистые оболочки. Местные композиции могут дополнительно содержать один или более из широкого ряда агентов, про которые известно, что они являются эффективными в качестве усилителей проникновения в кожу или эпидермис. Примеры таких агентов представляют собой 2-пирролидон, N-метил-2-пирролидон, диметилацетамид, диметилформамид, пропиленгликоль, метиловый или изопропиловый спирт, диметилсульфоксид и азон. Дополнительные агенты могут дополнительно быть включены, для того чтобы сделать препарат косметически приемлемым. Примеры таких агентов представляют собой жиры, воски, масла, красители, отдушки, консерванты, стабилизаторы и поверхностно-активные агенты. Также могут быть включены кератолитические агенты, такие как те, которые известны в данной области техники. Примерами являются салициловая килота и сера. Лекарственные формы для местного и трансдермального введения включают порошки, спреи, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и ингаляторы. Активное соединение может быть смешано в стерильных условиях с фармацевтически приемлемым носителем и с любыми консервантами, буферами или пропеллентами, которые могут потребоваться. Мази, пасты, кремы и гели могут содержать, в дополнение к соединению по изобретению (например, гибридному ActRIIB белку-ловушке лигандов), эксципиенты, такие как животные и растительные жиры, масла, воски, парафины, крахмал, трагакантовая камедь, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевая кислота, тальк и оксид цинка, или их смеси.
Дополнительные фармацевтические композиции, предусмотренные для использования в настоящем изобретении, включают препараты, включающие полипептиды в виде препаратов непрерывной или контролируемой доставки. Методики для изготовления разнообразных других средств непрерывной или контролируемой доставки, таких как липосомные носители, биоразлагаемые микрочастицы или пористые шарики и инъекционные депо-препараты, также известны специалистам в данной области техники.
Эффективное количество фармацевтической композиции для терапевтического использования будет зависеть, например, от терапевтических целей и задач. Специалист в данной области техники понимает, что уровни подходящих дозировок для лечения будут таким образом варьировать в зависимости, отчасти, от доставляемой молекулы, показания, для которого полипептид следует использовать, пути введения и размеров (масса тела, поверхность тела или размер органа) и состояния (возраст и общее состояние здоровья) пациента. Соответственно, врач может титровать дозировку и модифицировать путь введения для получения оптимального терапевтического эффекта. Типичная дозировка может находиться в диапазоне от примерно 0,1 мг/кг вплоть до примерно 100 мг/кг или более, в зависимости от факторов, упомянутых выше. Полипептидные композиции могут быть предпочтительно инъецированы или введены внутривенно. Фармацевтические композиции длительного действия могут быть введены каждые три-четыре дня, каждую неделю или раз в две недели, в зависимости от периода полувыведения и скорости клиренса конкретного препарата. Частота дозирования будет зависеть от фармакокинетических параметров полипептида в используемом препарате. Как правило, композицию вводят до тех пор, пока не будет достигнута дозировка, обеспечивающая желаемый эффект. Композиция таким образом может быть введена в однократной дозе или в многократных дозах (при одних и тех же или разных концентрациях/дозировках) с течением времени или в виде непрерывной инфузии. Дополнительную коррекцию подходящей дозировки осуществляют обычными методами. Подходящие дозировки могут быть оценены через использование соответствующих данных доза-ответ.
Путь введения фармацевтической композиции соответствует известным методам, например, перорально, посредством инъекции внутривенным, внутрибрюшинным, интрацеребральным (интра-паренхимальным), интрацеребровентрикулярным, внутримышечным, внутриглазным, внутриартериальным, интрапортальным, внутриочаговым путями, интрамедуллярно, интратекально, интравентрикулярно, трансдермально, подкожно или внутрибрюшинно; а также интраназальными, энтеральными, местными, сублингвальными, уретральными, вагинальными или ректальными средствами, с помощью систем пролонгированного высвобождения или устройств имплантации. Когда желательно, композиции могут быть введены болюсной инъекцией или непрерывно путем инфузии или посредством устройства имплантации. Альтернативно или дополнительно, композиция может быть введена местно посредством имплантации мембраны, губки или другого подходящего материала, на котором желаемая молекула была адсорбирована или инкапсулирована. При использовании имплантационного устройства, это устройство может быть имплантировано в любую подходящую ткань или орган, и доставка желаемой молекулы может быть осуществлена посредством диффузии, болюса с высвобождением по времени или непрерывного введения.
Терапевтические применения
В другом аспекте настоящего изобретения предложен способ лечения расстройств, связанных с миостатином или связанных с активином А, у субъекта, включающий введение указанному субъекту терапевтически эффективного количества (либо в виде монотерапии, либо в схеме комбинированной терапии) гибридного ActRIIB белка-ловушки лигандов по настоящему изобретению в фармацевтически приемлемом носителе. Важным является то, что фармацевтические композиции по настоящему изобретению могут быть использованы для увеличения сухой мышечной массы в процентах от массы тела и уменьшения жировой массы в процентах от массы тела, в то же время избегая проблем безопасности, о которых сообщалось для существующих терапевтических средств на основе слитого белка ActRIIB-Fc.
В настоящем изобретении предложен способ лечения заболевания, связанного с мышечной атрофией, у субъекта, включающий введение указанному субъекту терапевтически эффективного количества (либо в виде монотерапии, либо в схеме комбинированной терапии) гибридного ActRIIB белка-ловушки лигандов по настоящему изобретению в фармацевтически приемлемом носителе, где такое введение ослабляет потерю мышечной массы и/или потерю мышечной функции. Конкретно, гибридный ActRIIB белок-ловушка лигандов по настоящему изобретению является полезным в лечении различных мышечных заболеваний, включая, без ограничения, мышечные дистрофии (такие как миодистрофия Дюшенна (DMD), мышечная дистрофия Беккера, дистрофия Лейдена-Мебиуса, миотоническая MD и плече-лопаточно-лицевая миопатия (FSHD)), миозит, миопатии (включая врожденную миопатию и приобретенную миопатию), заболевания двигательных нейронов (такие как болезнь Лу Герига или боковой амиотрофический склероз (ALS)), нейродегенеративные заболевания (такие как болезнь Паркинсона, болезнь Гентингтона и болезнь Альцгеймера), мышечную атрофию, ассоциированную со злокачественными новообразованиями (такими как рак поджелудочной железы, рак легких, рак желудка, рак яичников, колоректальный рак, меланома, лейкоз, рак легкого, рак предстательной железы, рак головного мозга, рак мочевого пузыря и рак головы и шеи), мышечную атрофию, ассоциированную с хронической сердечной недостаточностью, хронической почечной недостаточностью (CKD), диабетом, хронической обструктивной болезнью легких (COPD), инфекциями (такими как СПИД, туберкулез и сепсис), ревматоидным артритом, травмой (такой как ожоги и травма при мотоциклетной аварии), критическим состоянием в отделении интенсивной терапии (ICU), денервацией (такой как удар или повреждение спинного мозга), продолжительным постельным режимом, саркопеническим ожирением и возрастной саркопенией.
В настоящем изобретении предложен способ лечения сердечнососудистого заболевания у субъекта, включающий введение указанному субъекту терапевтически эффективного количества (либо в виде монотерапии, либо в схеме комбинированной терапии) гибридного ActRIIB белка-ловушки лигандов по настоящему изобретению в фармацевтически приемлемом носителе, где такое введение ослабляет потерю мышечной массы и/или мышечной функции. Конкретно, гибридный ActRIIB белок-ловушка лигандов по настоящему изобретению является полезным в лечении сердечной недостаточности, сердечной атрофии, гипертензии, миокардита, ишемической болезни сердца, инфаркта миокарда, сердечных аритмий, заболевания сердечного клапана, кардиомиопатии, перикардиального заболевания, болезни аорты и синдрома Марфана.
В настоящем изобретении предложен способ лечения сердечной дисфункции или сердечной недостаточности у субъекта, включающий введение эффективного количества гибридного ActRIIB белка-ловушки лигандов субъекту. Такая модуляция может улучшить сердечную функцию указанного субъекта на по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95%. Улучшение сердечной функции можно оценить посредством эхокардиографии для измерения: 1) функций сердечного насоса, фокусирующихся на объеме выбрасываемой крови и эффективности выбрасывания и 2) функций миокарда, фокусирующихся на силе сокращения миокарда.
В настоящем изобретении предложены способы лечения метаболических расстройств у субъекта, включающие введение указанному субъекту терапевтически эффективного количества (либо в виде монотерапии, либо в схеме комбинированной терапии) гибридного ActRIIB белка-ловушки лигандов по настоящему изобретению в фармацевтически приемлемом носителе. Конкретно, гибридный ActRIIB белок-ловушка лигандов по настоящему изобретению является полезным в лечении метаболического заболевания, выбранного из ожирения, дислипидемии, диабета, инсулинорезистентности, саркопенического ожирения, стеатоза и метаболического синдрома, а также диабетической миопатии, нефропатии, нейропатии, ретинопатии, потери костной массы, нарушения толерантности глюкозы, гипергликемии и андрогенной депривации.
В настоящем изобретении предложен способ лечения раковых клеток у субъекта, включающий введение указанному субъекту терапевтически эффективного количества (либо в виде монотерапии, либо в схеме комбинированной терапии) гибридного ActRIIB белка-ловушки лигандов по настоящему изобретению в фармацевтически приемлемом носителе, где такое введение ингибирует рост и/или пролиферацию раковой клетки. Конкретно, гибридный ActRIIB белок-ловушка лигандов по настоящему изобретению является полезным в лечении расстройств, характеризуемых как рак. Такие расстройства включают, без ограничения твердыми опухолями, такие как злокачественные новообразования молочной железы, дыхательных путей, головного мозга, репродуктивных органов, желудочно-кишечного тракта, мочеполовой системы, глаз, печени, кожи, головы и шеи, щитовидной железы, паращитовидной железы, а также их отдаленные метастазы, лимфомы, саркомы, множественную миелому и лейкоз. Примеры рака молочной железы включают, без ограничения инфильтративным протоковым раком, инвазивный дольковый рак, неинвазивный протоковый рак и неинвазивный дольковый рак. Примеры видов рака дыхательных путей включают, без ограничения мелкоклеточным и немелкоклеточным раком легких, также бронхиальную аденому и плевропульмональную бластому. Примеры видов рака головного мозга, без ограничения раком стволовой части мозга и гипоталамической глиомой, астроцитому мозжечка и церебральную астроцитому, медуллобластому, эпендимому, а также нейроэктодермальную опухоль и опухоль шишковидной железы. Опухоли мужских репродуктивных органов включают, без ограничения, рак предстательной железы и яичек. Опухоли женских репродуктивных органов включают, без ограничения, рак эндометрия, шейки матки, яичников, влагалища и вульвы, а также саркому матки. Опухоли желудочно-кишечного тракта включают, без ограничения, злокачественные новообразования ануса, толстой кишки, толстой и прямой кишки, пищевода, желчного пузыря, желудка, поджелудочной железы, прямой кишки, тонкого кишечника и слюнной железы. Опухоли мочевыводящей системы включают, без ограничения, злокачественные новообразования мочевого пузыря, пениса, почки, почечной лоханки, уретры и мочеточника. Раковые опухоли глаз включают, без ограничения, внутриглазную меланому и ретинобластому. Примеры злокачественных новообразований печени включают, без ограничения, гепатоцеллюлярную карциному (карциномы клеток печени с фиброламмелярным вариантом и без него), холангиокарциному (карцинома внутрипеченочных желчных протоков) и смешанную гепатоцеллюлярную холангиокарциному. Злокачественные новообразования кожи включают, без ограничения, плоскоклеточный рак, саркому Капоши, злокачественную меланому, рак кожи из клеток Меркеля и немелкоклеточный рак кожи. Злокачественные новообразования головы и шеи включают, без ограничения, назофарингиальный рак и рак губ и полости рта. Лимфомы включают, без ограничения, СПИД-ассоциированную лимфому, неходжкинскую лимфому, кожную Т-клеточную лимфому, болезнь Ходжкина и лимфому центральной нервной системы. Саркомы включают, без ограничения, саркому мягких тканей, остеосаркому, злокачественную фиброзную гистиоцитому, лимфосаркому и рабдомиосаркому. Лейкоз включает, без ограничения, острый миелогенный лейкоз, острый лимфобластный лейкоз, хронический лимфоцитарный лейкоз, хронический миелогенный лейкоз и волосатоклеточный лейкоз. В некоторых воплощениях рак представляет собой рак с высокой экспрессией члена семейства TGF-β, такого как активин А, миостатин, TGF-β и GDF15, например, рак поджелудочной железы, рак желудка, рак яичников, колоректальный рак, меланому, лейкоз, рак легких, рак предстательной железы, рак головного мозга, рак мочевого пузыря и рак головы и шеи.
В настоящем изобретении предложен способ лечения хронической почечной недостаточности (CKD) у субъекта, включающий введение указанному субъекту терапевтически эффективного количества (либо в виде монотерапии, либо в схеме комбинированной терапии) гибридного ActRIIB белка-ловушки лигандов по настоящему изобретению в фармацевтически приемлемом носителе, где такое введение ослабляет потерю мышечной массы и/или мышечной функции или ингибирует фиброз почки. Конкретно, гибридный ActRIIB белок-ловушка лигандов по настоящему изобретению является полезным в лечении CKD, включая почечную недостаточность, интерстициальный фиброз и почечный диализ, а также белково-энергетическую недостаточность (PEW), ассоциированную с CKD. Такое модулирование может улучшить CKD или PEW указанного субъекта на по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95%. Улучшение почечной функции можно оценить путем измерения индекса белок/креатинин (PCR) в моче и скорости клубочковой фильтрации (GFR). Улучшение PEW можно оценить путем измерения сывороточных уровней альбумина и воспалительных цитокинов, скорости синтеза и распада белка, массы тела, мышечной массы, физической активности и результатов питания.
В настоящем изобретении предложены способы лечения аутоиммунного заболевания у субъекта, включающие введение указанному субъекту терапевтически эффективного количества (либо в виде монотерапии, либо в схеме комбинированной терапии) гибридного ActRIIB белка-ловушки лигандов по настоящему изобретению в фармацевтически приемлемом носителе. Конкретно, гибридный ActRIIB белок-ловушка лигандов по настоящему изобретению является полезным в лечении аутоиммунного расстройства, выбранного из рассеянного склероза, диабета (типа-1), гломерулонефрита, тяжелой миастении, псориаза, системного склероза и системной красной волчанки, полимиозита и первичного билиарного цирроза.
В настоящем изобретении предложены способы лечения артрита у субъекта, включающие введение указанному субъекту терапевтически эффективного количества (либо в виде монотерапии, либо в схеме комбинированной терапии) гибридного ActRIIB белка-ловушки лигандов по настоящему изобретению в фармацевтически приемлемом носителе. Конкретно, гибридный ActRIIB белок-ловушка лигандов по настоящему изобретению является полезным в лечении артрита, выбранного из ревматоидного артрита и остеоартрита.
В настоящем изобретении предложены способы лечения анорексии у субъекта, включающие введение указанному субъекту терапевтически эффективного количества (либо в виде монотерапии, либо в схеме комбинированной терапии) гибридного ActRIIB белка-ловушки лигандов по настоящему изобретению в фармацевтически приемлемом носителе. Конкретно, гибридный ActRIIB белок-ловушка лигандов по настоящему изобретению является полезным в лечении анорексии, выбранной из нервной анорексии и синдрома анорексии/кахексии.
В настоящем изобретении предложены способы заболевания печени у субъекта, включающие введение указанному субъекту терапевтически эффективного количества (либо в виде монотерапии, либо в схеме комбинированной терапии) гибридного ActRIIB белка-ловушки лигандов по настоящему изобретению в фармацевтически приемлемом носителе. Конкретно, гибридный ActRIIB белок-ловушка лигандов по настоящему изобретению является полезным в лечении заболевания печени, выбранного из неалкогольной жировой болезни печени, неалкогольного стеатогепатита, алкогольной жировой болезни печени, цирроза печени, печеночной недостаточности, аутоиммунного гепатита и гепатоцеллюлярной карциномы.
В настоящем изобретении предложены способы для трансплантации органа и ткани у субъекта, включающий введение указанному субъекту терапевтически эффективного количества (либо в виде монотерапии, либо в схеме комбинированной терапии) гибридного ActRIIB белка-ловушки лигандов по настоящему изобретению в фармацевтически приемлемом носителе. Конкретно, гибридный ActRIIB белок-ловушка лигандов по настоящему изобретению является полезным в лечении при трансплантации, выбранной из трансплантации органов сердца, почек, печени, легких, поджелудочной железы, тонкого кишечника и вилочковой железы или из тканевых трансплантаций костей, сухожилий, роговицы, кожи, сердечных клапанов, нервов и кровеносных сосудов.
В настоящем изобретении предложены способы лечения анемии у субъекта, включающие введение указанному субъекту терапевтически эффективного количества (либо в виде монотерапии, либо в схеме комбинированной терапии) гибридного ActRIIB белка-ловушки лигандов по настоящему изобретению в фармацевтически приемлемом носителе. В различных воплощениях анемия выбрана из различных анемических расстройств, включая ассоциированную с раком анемию и вызванную химиотерапией анемию, ассоциированную с хронической почечной недостаточностью анемию, железодефицитную анемию, талассемию, серповидноклеточную анемию, апластическую анемию и миелодиспластические синдромы.
В настоящем изобретении предложены способы лечения фиброза у субъекта, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтических композиций по изобретению. В одном воплощении субъект представляет собой субъекта-человека. В различных воплощениях фиброз выбран из легочного фиброза (такого как идиопатический легочный фиброз и муковисцидоз), печеночного фиброза (такого как неалкогольный стеатогепатит и цирроз печени), сердечного фиброза (такого как инфаркт миокарда, диастолическая дисфункция или болезнь сердечного клапана), почечного фиброза (такого как интерстициальный фиброз), миелофиброза, идиопатического ретроперитонеального фиброза, нефрогенной фиброзирующей дермопатии, болезни Крона, келоидных рубцов, склеродермии, системного склероза и артрофиброза.
В настоящем изобретении предложены способы лечения боли у субъекта, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтических композиций по изобретению. В одном воплощении субъект представляет собой субъекта-человека. В различных воплощениях боль выбрана из нейропатической боли, воспалительной боли и боли при раке.
В настоящем изобретении предложены способы лечения заболевания костной системы у субъекта, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтических композиций по изобретению. В одном воплощении субъект представляет собой субъекта-человека. В различных воплощениях заболевание костной системы выбрано из остеомаляции, остеопороза, несовершенного остеогенеза, прогрессирующей оссифицирующей фибродисплазии, вызванной кортикостероидами потери костной массы, перелома кости и костных метастазов.
В настоящем изобретении предложен способ ингибирования потери мышечной массы и/или мышечной функции у субъекта, включающий введение эффективного количества гибридного ActRIIB белка-ловушки лигандов указанному субъекту. Такое модулирование может ослаблять потерю мышечной массы и/или мышечной функции указанного субъекта на по меньшей мере 5%, 10%, по меньшей мере 25%, по меньшей мере 50%, по меньшей мере 75% или по меньшей мере 90%. Ингибирование потери мышечной массы и функции можно оценить с использованием техник визуализации и тестов на физическую силу. Примеры техник визуализации для оценки мышечной массы включают двухэнергетическую рентгеновскую абсорбциометрию (DEXA), магнитно-резонансную томографию (MRI) и компьютерную томографию (СТ). Примеры тестирования мышечной функции включают измерение силы захвата, тест ходьбы по лестнице, краткий набор тестов по оценке физической производительности (SPPB) и 6-минутная ходьба, а также максимальное давление вдоха (MIP) и максимальное давление выдоха (МЕР), которые используют для измерения мышечной силы дыхательных путей.
«Терапевтически эффективное количество» или «терапевтически эффективная доза» относится к такому количеству терапевтического агента, подлежащего введению, которое будет облегчать до некоторой степени один или более симптомов расстройства, подлежащего лечению.
Терапевтически эффективную дозу можно оценить исходя из анализов на клеточной культуре путем определения IC50. Дозу затем можно пересчитать для животных моделей для достижения диапазона концентраций циркулирующих в плазме, который включает это значение IC50, как определено в клеточной культуре. Такую информацию можно использовать для более точного определения полезных доз у людей. Уровни в плазме можно измерить, например, посредством ВЭЖХ. Точный состав, путь введения и дозировку может выбрать индивидуально врач с учетом состояния субъекта.
Режимы дозирования можно регулировать для достижения оптимального желаемого ответа (например терапевтического или профилактического ответа). Например, может быть введен один болюс, могут быть введены несколько раздельных доз (множество, или повторных, или поддерживающих) с течением времени, и доза может быть пропорционально уменьшена или увеличена в соответствии с потребностями терапевтической ситуации. Особенно предпочтительно изготавливать парентеральные композиции в стандартной лекарственной форме для легкости введения и однородности дозирования. Стандартная лекарственная форма, как используют здесь, относится к физически дискретным единицам, подходящим в качестве универсальных дозировок для млекопитающих субъектов, подлежащих лечению, причем каждая единица содержит заранее определенное количество активного соединения, рассчитанное для проявления желаемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Спецификация для стандартных лекарственных форм по настоящему изобретению будет диктоваться главным образом уникальными характеристиками антитела и конкретного терапевтического или профилактического эффекта, который требуется достичь.
Таким образом, лечащий специалист понимает, основываясь на представленном здесь раскрытии, что дозу и режим дозирования корректируют в соответствии со способами, хорошо известными в терапевтических областях. То есть, максимальная переносимая доза может быть легко установлена, и эффективное количество, обеспечивающее обнаружимую терапевтическую пользу субъекту, также можно определить, насколько могут временные потребности для введения каждого агента обеспечить обнаружимую терапевтическую пользу субъекту. Соответственно, хотя здесь проиллюстрированы определенные дозы и режимы введения, эти примеры никоим образом не ограничивают дозу и режим введения, который может быть предложен субъекту при практическом применении настоящего изобретения.
Следует понимать, что значения дозировок могут варьировать в зависимости от типа и тяжести состояния, подлежащего лечению, и могут включать однократные или многократные дозы. Следует дополнительно понимать, что любой конкретный субъект, конкретные режимы дозировок должны подводиться со временем к индивидуальным потребностям и в соответствии с профессиональной подготовкой персонала, вводящего или контролирующего введение композиций, и что интервалы дозировок, изложенные в данном описании, являются лишь иллюстративными и не должны восприниматься как ограничивающие объем или применение на практике заявленной композиции. Кроме того, режим дозировок композиций по данному изобретению может основываться на ряде факторов, включая тип заболевания, возраст, массу тела, пол, медицинское состояние субъекта, тяжесть состояния, путь введения и конкретное используемое антитело. Таким образом, режим дозировок может варьировать широко, но может быть определен рутинным образом стандартными методами. Например, дозы могут быть подведены на основании фармакокинетических или фармакокинетических параметров, которые могут включать клинические эффекты, такие как токсические эффекты и/или лабораторные показатели. Таким образом, настоящее изобретение охватывает эскалацию доз у субъекта, как определяется специалистом врачом. Определение подходящих дозировок и режимов хорошо известно в релевантной области техники и будет понятно, что оно осуществимо специалистом-врачом при ознакомлении с раскрытыми здесь идеями.
Иллюстративный неограничивающий интервал дозирования для терапевтически или профилактически эффективного количества гибридного ActRIIB белка-ловушки лигандов по изобретению может составлять от 0,001 до 100 мг/кг, от 0,001 до 90 мг/кг, от 0,001 до 80 мг/кг, от 0,001 до 70 мг/кг, от 0,001 до 60 мг/кг, от 0,001 до 50 мг/кг, от 0,001 до 40 мг/кг, от 0,001 до 30 мг/кг, от 0,001 до 20 мг/кг, от 0,001 до 10 мг/кг, от 0,001 до 5 мг/кг, от 0,001 до 4 мг/кг, от 0,001 до 3 мг/кг, от 0,001 до 2 мг/кг, от 0,001 до 1 мг/кг, от 0,010 до 50 мг/кг, от 0,010 до 40 мг/кг, от 0,010 до 30 мг/кг, от 0,010 до 20 мг/кг, от 0,010 до 10 мг/кг, от 0,010 до 5 мг/кг, от 0,010 до 4 мг/кг, от 0,010 до 3 мг/кг, от 0,010 до 2 мг/кг, от 0,010 до 1 мг/кг, от 0,1 до 50 мг/кг, от 0,1 до 40 мг/кг, от 0,1 до 30 мг/кг, от 0,1 до 20 мг/кг, от 0,1 до 10 мг/кг, от 0,1 до 5 мг/кг, от 0,1 до 4 мг/кг, от 0,1 до 3 мг/кг, от 0,1 до 2 мг/кг, от 0,1 до 1 мг/кг, от 1 до 50 мг/кг, от 1 до 40 мг/кг, от 1 до 30 мг/кг, от 1 до 20 мг/кг, от 1 до 10 мг/кг, от 1 до 5 мг/кг, от 1 до 4 мг/кг, от 1 до 3 мг/кг, от 1 до 2 мг/кг или от 1 до 1 мг/кг массы тела. Следует отметить, что значения дозировок могут варьировать в зависимости от типа и тяжести состояний, подлежащих лечению. Следует дополнительно понимать, что любой конкретный субъект, конкретные режимы дозировок должны подводиться со временем к индивидуальным потребностям и в соответствии с профессиональной подготовкой персонала, вводящего или контролирующего введение композиций, и что интервалы дозировок, изложенные в данном описании, являются лишь иллюстративными и не должны восприниматься как ограничивающие объем или применение на практике заявленной композиции.
В различных воплощениях суммарная вводимая доза будет достигать концентрации антитела в плазме крови в диапазоне, например, примерно 1-1000 мкг/мл, примерно 1-750 мкг/мл, примерно 1-500 мкг/мл, примерно 1-250 мкг/мл, примерно 10-1000 мкг/мл, примерно 10-750 мкг/мл, примерно 10-500 мкг/мл, примерно 10-250 мкг/мл, примерно 20-1000 мкг/мл, примерно 20-750 мкг/мл, примерно 20-500 мкг/мл, примерно 20-250 мкг/мл, примерно 30-1000 мкг/мл, примерно 30-750 мкг/мл, примерно 30-500 мкг/мл, примерно 30-250 мкг/мл.
Токсичность и терапевтический индекс фармацевтических композиций по изобретению можно определить стандартными фармацевтическими методиками в клеточных культурах или на экспериментальных животных, например, для определения LD50 (доза, летальная для 50% популяции) и ED50 (доза, терапевтически эффективная у 50% популяции). Соотношение доз между токсической и терапевтически эффективной дозой представляет собой терапевтический индекс, и оно может быть выражено в виде соотношения LD50/ED50. Композиции, которые проявляют большие терапевтические индексы, как правило являются предпочтительными.
Частота дозирования при введении фармацевтической композиции гибридного ActRIIB белка-ловушки лигандов зависит от природы терапии и конкретного заболевания, подлежащего лечению. Субъекта можно лечить с регулярными интервалами, например еженедельно или ежемесячно, до достижения желаемого терапевтического результата. Репрезентативные примеры частоты дозирования включают, без ограничения: раз в неделю без перерыва; один раз в неделю через неделю; один раз в 2 недели; один раз в 3 недели; еженедельно без перерыва в течение 2 недель, затем ежемесячно; еженедельно без перерыва в течение 3 недель, затем ежемесячно; ежемесячно; один раз через месяц; один раз каждые три месяца; один раз каждые четыре месяца; один раз каждые пять месяцев; или один раз каждые шесть месяцев, или раз в год.
Комбинированная терапия
Как используют здесь, термины «совместное введение», «совместно введенные» и «в комбинации с», со ссылкой на гибридный ActRIIB белок-ловушку лигандов по изобретению и один или более других терапевтических агентов, предназначен для обозначения и действительно ссылается и включает следующее: одновременное введение такой комбинации гибридного ActRIIB белка-ловушки лигандов по изобретению и терапевтического(их) агента(ов) субъекту, нуждающемуся в лечении, где такие компоненты изготовлены вместе в виде одной лекарственной формы, которая высвобождает указанные компоненты по существу в одно и то же время в указанном субъекте; по существу одновременное введение такой комбинации гибридного ActRIIB белка-ловушки лигандов по изобретению и терапевтического(их) агента(ов) субъекту, нуждающемуся в лечении, где такие компоненты изготовлены отдельно друг от друга в раздельных лекарственных формах, которые принимаются по существу в одно и то же время указанным субъектом, причем указанные компоненты высвобождаются по существу в одно и то же время в указанном субъекте; последовательное введение такой комбинации гибридного ActRIIB белка-ловушки лигандов по изобретению и терапевтического(их) агента(ов) субъекту, нуждающемуся в лечении, где такие компоненты изготовлены отдельно друг от друга в раздельных лекарственных формах, которые принимаются друг за другом указанным субъектом со значительным интервалом времени между каждым введением, где указанные компоненты высвобождаются по существу в разные моменты времени в указанном субъекте; и последовательное введение такой комбинации гибридного ActRIIB белка-ловушки лигандов по изобретению и терапевтического(их) агента(ов) субъекту, нуждающемуся в лечении, где такие компоненты изготовлены вместе в одной лекарственной форме, которая высвобождает указанные компоненты контролируемым образом, где они одновременно, последовательно и/или перекрывающимся образом высвобождаются в одно и то же время и/или разные моменты времени в указанном субъекте, где каждая часть может быть введена либо одним и тем же путем, либо разными путями.
В другом аспекте настоящее изобретение относится к способам лечения заболеваний, связанных с мышечной атрофией, у субъекта, включающим введение комбинации а) терапевтически эффективного количества гибридного ActRIIB белка-ловушки лигандов по настоящему изобретению; и б) второго агента. Эта комбинированная терапия может быть особенно эффективной против заболевания, связанного с мышечной атрофией, которое резистентно или не поддается лечению с использованием второго агента в отдельности. В различных воплощениях второй агент выбран из гормона роста, грелина, IGF1, антагонистов воспалительных цитокинов, таких как TNF-альфа и TNF-альфа, IL-6, IL-1 и их рецепторы, и других антагонистов миостатина и активина А и их рецепторов.
В различных воплощениях комбинированная терапия включает введение композиции гибридного ActRIIB белка-ловушки лигандов и второго агента одновременно, либо в одной и той же фармацевтической композиции, либо в раздельных фармацевтических композициях. В различных воплощениях композицию гибридного ActRIIB белка-ловушки лигандов и композицию второго агента вводят последовательно, то есть композицию гибридного ActRIIB белка-ловушки лигандов вводят либо до, либо после введения композиции второго агента.
В различных воплощениях введения композиции гибридного ActRIIB белка-ловушки лигандов и композиции второго агента проводят одновременно, то есть периоды введения композиции гибридного ActRIIB белка-ловушки лигандов и композиции второго агента перекрываются друг с другом.
В различных воплощениях введения композиции гибридного ActRIIB белка-ловушки лигандов и композиции второго агента проводят не одновременно. Например, в различных воплощениях введение композиции гибридного ActRIIB белка-ловушки лигандов заканчивают до того как ввести композицию второго агента. В различных воплощениях введение композиции второго агента заканчивают до того как ввести кмопозицию гибридного ActRIIB белка-ловушки лигандов.
Следующие примеры предназначены для более полной иллюстрации изобретения, а не для ограничения его объема.
Пример 1
Полипептиды по настоящему изобретению могут быть получены в соответствии с рекомбинантными ДНК-технологиями, которые хорошо известны специалистам в данной области техники. В этом примере в общем описано получение гибридных растворимых ActRIIB-ECD полипептидов.
Различные гибридные ActRIIB-ECD полипептиды конструировали путем замещения нескольких аминокислотных остатков по выбранным положениям в пределах внеклеточного домена человеческого ActRIIB аминокислотными остатками, имеющими происхождение из внеклеточного домена человеческого ActRIIA в соответствующих положениях на основании выравнивания последовательностей на уровне аминокислот. Экспрессионные кассеты ДНК, кодирующие гибридные ActRIIB-ECD полипептиды, генерировали с использованием сайт-направленного мутагенеза и затем конструировали в виде Fc слитых белковых конструкций путем размещения в рамке считывания кДНК-фрагмента, кодирующего на 5'-конце сигнальный пептид легкой цепи человеческого иммуноглобулина и на 3'-конце ДНК-фрагмент, кодирующий пептидный линкер с последующим человеческим Fc.
Пример 2
В этом примере в общем описано получение гибридных ActRIIB белков-ловушек лигандов с конфигурацией, как она показана на Фиг. 1.
Синтетические ДНК кассеты, кодирующие различные гибридные ActRIIB белки-ловушки лигандов, каждый из которых содержит сигнальную пептидную лидерную последовательность (SEQ ID NO: 49 или 50), гибридный растворимый ActRIIB-ECD полипептид из Примера 1 (или последовательность ActRIIB-ECD дикого типа), пептидную линкерную последовательность (SEQ ID NO: 44), шарнирную линкерную последовательность (SEQ ID NO: 118) и последовательность Fc домена (SEQ ID NO: 39, или 41, или 43), клонировали в векторы экспрессии Freedom pCHO 1.0 и pcDNA3.1 (Life Technologies).
Для стабильной трансфекции векторы экспрессии pCHO 1.0, кодирующие различные гибридные ActRIIB белки-ловушки лигандов, трансфицировали каждый в клетки CHO-S с использованием FreeStyle MAX Reagent (Life Technologies). Через 48 часов после трансфекции клетки выращивали в бессывороточной среде CD FortiCHO, содержащей пуромицин и метотрексат (МТХ) для отбора, в течение 3-7 недель при 37°С в СО2 инкубаторе со встряхиванием. Стабильный пул генерировали до тех пор, пока клетки не превысили 90% жизнеспособность в среде, содержащей 30 М пуромицин и 500 нМ метотрексат. Стабильные клоны генерировали путем клонирования с разбавлением согласно протоколам, рекомендованным изготовителем (Life Technologies). Для временной трансфекции экспрессионные плазмиды pcDNA3.1, кодирующие различные гибридные ActRIIB белки-ловушки лигандов, трансфицировали каждый в клетки Expi293 с использованием реагента трансфекции ExpriFectamine293 (Life Technologies).
После трансфекции стабильно трансфицированные клетки CHO-S выращивали в полной бессывороточной среде CD FortiCHO, дополненной глюкозой, при 37°С в CO2 инкубаторе со встряхиванием в течение вплоть до 14 суток. Кондиционированную среду собирали для очистки белка. Временно трансфицированные клетки Expi293 культивировали в экспрессионной среде Expi293 при 37°С в CO2 инкубаторе со встряхиванием в течение вплоть до 7 суток и среду собирали для очистки белка.
Для очистки кондиционную среду, содержащую гибридный ActRIIB белок-ловушку лигандов, очищали посредством высокоэффективной колонки Hitrap с белком А с использованием AKTA FPLC (GE Healthcare). Гибридные ActRIIB белки-ловушки лигандов элюировали уксуснокислым буфером (рН 3,6), нейтрализовали с использованием 1 М Tris-HCl (рН 8,0) и затем подвергали замене буфера. Концентрации белка определяли с использованием спектрофотометра (Beckman).
Пример 3
В этом примере оценивали миостатин- и ВМР9-связывающие активности семи гибридных ActRIIB белков-ловушек лигандов.
Миостатин- и ВМР9-связывающие активности различных гибридных ActRIIB белков-ловушек лигандов сначала анализировали с использованием Octect Red (ForteBio). Очищенные белки или кондиционированные среды отдельно загружали в биосенсоры АНС с максимальной нагрузкой. После исходной фазы промывки сенсоры подвергали воздействию 10 нМ миостатина или ВМР9, соответственно, для стадии ассоциации с последующей стадией диссоциации. Все эксперименты осуществляли при встряхивании при 1000 об/мин. Связывающую активность анализировали с использованием программного обеспечения ForteBio, при этом значения KD рассчитывали с использованием соотношения Kd/Ka.
Результаты
Гибридные ActRIIB белки-ловушки лигандов исследовали в сравнении с слитым белком ActRIIB-ECD-Fc дикого типа в отношении связывающих активностей против миостатина и ВМР9. Результаты показывают, что гибридные ActRIIB белки-ловушки лигандов проявляют заметное снижение в связывающей аффинности с ВМР9 по сравнению с слитым белком ActRIIB-ECD-Fc дикого типа. Ряд гибридных ActRIIB белков-ловушек лигандов показали чрезвычайно сниженные аффинности связывания с ВМР9, которые более чем в 100 раз слабее таковой для белка ActRIIB-ECD-Fc дикого типа, и в то же время они сохраняли сильную аффинность связывания с миостатином, которая была аналогична таковой для белка ActRIIB-ECD-Fc дикого типа. Резюме предварительных данных по связыванию, полученных анализом Octet Red, приведено в Таблице 3.
+++ KD <10-8 M
++ KD: 10-6-10-7 М
+ KD 10-4-10-6 M
N.D. нет обнаружимого связывания
AG-0014 и AG-0027 анализировали в анализе кинетического исключения (KinExA) (Sapidyne Instruments, Inc.). 20-30 мкг/мл миостатина, активина А или ВМР-9 раздельно связывали с гранулами NHS-активированной сефарозы 4 для быстрого потока (GE Healthcare) с использованием экспериментальных методик, рекомендованных Sapidyne Instruments. Концентрацию для каждого гибридного ActRIIB белка-ловушки лигандов поддерживали постоянной по мере титрования лиганда в 2,5-кратном серийном разведении. Растворы оставляли достигать равновесия путем инкубации при комнатной температуре вплоть до 24 часов и затем пропускали через проточную ячейку, предварительно упакованную покрытыми лигандом гранулами сефарозы, на приборе KinExA 3000 (Sapidyne Instruments). Свободные гибридные ActRIIB белки-ловушки лигандов, захваченные на гранулах, детектировали с помощью козьего антитела против человеческого Fc, меченного Alexa Fluor 647 (Jackson ImmunoResearch Laboratories, Inc.). Значения аффинности связывания лиганда (KD) рассчитывали с использованием программного обеспечения KinExA Pro (Sapidyne Instruments).
Результаты
Резюме предварительных данных по связыванию, полученных анализом KinExA, приведено в Таблице 4. Эти данные показывают, что аналогично ActRIIB-Fc дикого типа, два репрезентативных гибридных ActRIIB белка-ловушки лигандов имели высокую аффинность в отношении как миостатина, так и активина А в одноразрядном пМ диапазоне. Однако, эти два гибридных ActRIIB белка-ловушки лигандов не показали никакого обнаружимого связывания с ВМР9, в противоположность ActRIIB-Fc дикого типа, который проявил сильную аффинность связывания с ВМР9 в одноразрядном пМ диапазоне.
Пример 4
В этом примере описан анализ передачи сигнала миостатина/активина А и анализ передачи сигнала ВМР9, которые использовали для количественного определения миостатин/активин А-блокирующих активностей и ВМР9-блокирующей активности, соответственно, гибридных ActRIIB белков-ловушек лигандов.
Для оценки передачи сигнала миостатина/активина А, репортерный конструкт с 12 повторами последовательности CAGA (Dennler et al, EMBO 17: 3091-3100, 1998) клонировали в репортерный вектор pGL3-luc (Promega). Сконструированный вектор pGL3-CAGA12-luc стабильно трансфицировали в клетки С2С12 для генерации клеточной линии с люциферазным репортером, C2C12-CAGA-luc, способной воспринимать передачу сигнала Smad3/4, опосредованную миостатином или активином А. Для измерения миостатин- и активин А-нейтрализующих активностей 4 нМ рекомбинантного миостатина или активина А предварительно инкубировали с различными гибридными ActRIIB белками-ловушками лигандов в повышающихся концентрациях, а также слитым белком ActRIIB-ECD-Fc дикого типа (в качестве контроля) в течение 1 часа при комнатной температуре. Затем реакционные смеси добавляли в клеточные культуры C2C12-CAGA-luc. Через 5 часов в CO2 инкубаторе при 37°С измеряли люциферазные активности репортерных культур C2C12-CAGA-luc с использованием LumiNOkan Ascent (Thermo Scientific).
Передачу сигнала ВМР9 тестировали в клетках С2С12, которые были стабильно трансфицированы люциферазным репортером, содержащим BMP чувствительный элемент (BRE), который воспринимает передачу сигнала Smad1/5/8 (Korchynski et.al, J. Biol. Chem. 277: 4883-4891, 2002). Конкретно, двухповторный BMP-чувствительный элемент (Briter et at, PLoS One, 2012) синтезировали и клонировали в вектор pGL3-luc (Promega). Вектор pGL3-2XBRE-luc затем стабильно трансфицировали в клетки С2С12. Стабильно трансфицированную репортерную клеточную линию C2C12-BRE-luc использовали для количественного определения BMP9-опосредованной передачи сигнала Smad1/5/8. Для измерения ВМР-нейтрализующей активности 4 нМ ВМР9 предварительно инкубировали с различными гибридными ActRIIB белками-ловушками лигандов в повышающихся концентрациях, а также слитым белком ActRIIB-ECD-Fc дикого типа (в качестве контроля) в течение 1 часа при комнатной температуре. Реакционные смеси затем добавляли к клеточным культурам C2C12-BRE-luc. Через 5 часов инкубации при 37°С в CO2 инкубаторе измеряли люциферазные активности репортерных культур С2С12 BRE-luc с использованием LumiNOkan Ascent (Thermo Scientific).
Результаты
Результаты показали, что в сравнении с слитым белком ActRIIB-ECD-Fc дикого типа два репрезентативных гибридных ActRIIB белка-ловушки лигандов сохраняли сильные миостатин- и активин А-нейтрализующие активности, но имели значимые снижения в ВМР9-нейтрализующей активности (см. Фиг. 2). На Фиг. 2 показаны клеточные нейтрализующие активности против миостатина, активина А и ВМР9 для двух репрезентативных гибридных ActRIIB белков-ловушек лигандов, AG-0003 (SEQ ID NO: 5) и AG-0005 (SEQ ID NO: 7), в сравнении с таковыми для контрольного слитого белка ActRIIB-ECD-Fc дикого типа.
Пример 5
В этом Примере использовали анализ передачи сигнала миостатина/активина А и анализ передачи сигнала ВМР9, описанный в Примере 4, для количественного определения миостатин/активин А-блокирующих активностей и BMP9-блокирующей активности, соответственно, следующих гибридных ActRIIB белков-ловушек лигандов: AG-0003 (SEQ ID NO: 5), AG-0014 (SEQ ID NO: 16), AG-0023 (SEQ ID NO: 25), AG-0024 (SEQ ID NO: 26), AG-0025 (SEQ ID NO: 27), AG-0027 (SEQ ID NO: 29), AG-0028 (SEQ ID NO: 30), AG-0029 (SEQ ID NO: 31) и AG-0035 (SEQ ID NO: 37).
Результаты
Результаты показали, что в сравнении с слитым белком ActRIIB-ECD-Fc дикого типа несколько из этих гибридных ActRIIB белков-ловушек лигандов сохраняли сильные миостатин- и активин А-нейтрализующие активности, но имели значимые снижения в ВМР9-нейтрализующей активности. На Фиг. 3 показаны клеточные нейтрализующие активности против миостатина, активина А и ВМР9 для двух репрезентативных гибридных ActRIIB белков-ловушек лигандов, AG-0014 и AG-0027, в сравнении с таковыми для контрольного слитого белка ActRIIB-ECD-Fc дикого типа.
И как показано в Таблицах 5 и 6, в сравнении с слитым белком ActRIIB-ECD-Fc дикого типа (WT ActRIIB-Fc), различные репрезентативные гибридные ActRIIB белки-ловушки лигандов показали чрезвычайно сниженную ВМР9-нейтрализующую активность в клеточном репортерном анализе Smad1/5/8 BRE-luc, в то же время сохраняя сильные нейтрализующие активности против миостатина, активина А и активина B в клеточном репортерном анализе Smad2/3 CAGA-luc. В Таблице 5 показаны значения IC50 для клеточной нейтрализации против миостатина, активина А, активина В и ВМР9 двух репрезентативных гибридных ActRIIB белков-ловушек лигандов AG-0014 (SEQ ID NO: 16) и AG-0027 (SEQ ID NO: 29), соответственно, в сравнении с таковыми для WT ActRIIB-Fc. В Таблице 6 показаны ВМР9- и миостатин-нейтрализующие активности нескольких репрезентативных гибридных ActRIIB белков-ловушек лигандов в сравнении с таковыми для WT ActRIIB-Fc. В сравнении с WT ActRIIB-Fc, гибридные белки AG-0003 (SEQ ID NO: 5), AG-0004 (SEQ ID NO: 6), AG-0005 (SEQ ID NO: 7), AG-0014 (SEQ ID NO: 16), AG-0023 (SEQ ID NO: 25), AG-0024 (SEQ ID NO: 26), AG-0025 (SEQ ID NO: 27), AG-0027 (SEQ ID NO: 29) и AG-0028 (SEQ ID NO: 30) показали чрезвычайно сниженную или практически нулевую ВМР9-нейтрализующую активность (также см. Фиг. 10); AG-0003 (SEQ ID NO: 5), AG-0005 (SEQ ID NO: 7), AG-0014 (SEQ ID NO: 16) и AG-0027 (SEQ ID NO: 29) сохраняли полную миостатин-нейтрализующую активность, в то время как AG-0004 (SEQ ID NO: 6), AG-0023 (SEQ ID NO: 25), AG-0024 (SEQ ID NO: 26), AG-0025 (SEQ ID NO: 27) и AG-0028 (SEQ ID NO: 30) продемонстрировали потерю миостатин-нейтрализующей активности (также см. Фиг. 11). В общем, эти результаты демонстрируют способность различных гибридных ActRIIB белков-ловушек лигандов к преимущественной блокаде миостатин/активин-опосредованной Smad2/3 передачи сигнала при минимальном влиянии или отсутствии влияния на ВМР9-опосредованную Smad1/5/8 передачу сигнала.
N.D.: нет обнаружимой нейтрализующей активности
++++: полная нейтрализующая активность; +++: частичная нейтрализующая активность; ++: слабая нейтрализующая активность; +: очень слабая нейтрализующая активность; +/-: маленькая активность или нет активности; -: нет нейтрализующей активности.
Пример 6
В данном Примере изучали эффекты в отношении массы тела и мышечной массы у 9-недельных самцов мышей линии С57ВI/6, которым подкожно инъецировали PBS (носитель), ActRIIB-Fc (WT) дикого типа, AG-0014 (SEQ ID NO: 16) и AG-0027 (SEQ ID NO: 29), соответственно, в дозировке 10 мг/кг один раз в неделю. Массу тела записывали на сутки 0, сутки 5, сутки 12 и сутки 18, n=6/8 на группу. Показатели изменения массы тела рассчитывали в виде процента повышения массы от исходного уровня на сутки 0. Индивидуальные икроножные мышцы от каждого животного иссекали и взвешивали во время окончательной некропсии. Показатели выражали в виде процента повышения средней массы икроножной мышцы в каждой группе лечения по сравнению с таковой для группы носителя. Как показано на Фиг. 4 и в Таблице 7, введение каждого из двух репрезентативных гибридных белков-ловушек лигандов способно заметно увеличивать прирост массы тела у мышей подобным образом, как и белок ActRIIB-Fc дикого типа.
Как показано на Фиг. 5 и в Таблице 8, введение двух репрезентативных гибридных белков-ловушек лигандов AG-0014 (SEQ ID NO: 16) и AG-0027 (SEQ ID NO: 29), соответственно, способно заметно увеличивать мышечную массу у мышей подобным образом, как и белок ActRIIB-Fc дикого типа.
Пример 7
В данном Примере изучали эффекты воздействия на мышиную брюшную полость, мышиные яички и мышиные легочные ткани у 8-недельных самцов мышей линии BalbC, которым вводили PBS (носитель), ActRIIB-Fc (WT) дикого типа, AG-0014 (SEQ ID NO: 16) и AG-0027 (SEQ ID NO: 29), соответственно, в дозировке 10 мг/кг один раз в неделю. Через две недели после обработки каждой группе животных (n=4) инъецировали через хвостовую вену 200 мкл красителя Evans blue (0,5% в PBS, pH 7,2). Некропсию осуществляли в момент времени 90 мин после инъекции красителя Evans blue. Репрезентативные изображения подвергнутой хирургической резекции абдоминальной полости, иссеченного органа яичек и иссеченной легочной ткани каждой группы отмечены на Фиг. 6-8, соответственно. Синее окрашивание указывает на просачивание из кровеносного сосуда. Ткани яичек и легких взвешивали и затем помещали по отдельности во флаконы, содержащие формамид, для экстрагирования красителя Evans blue. После инкубации при 55°С в течение 24 часов образцы центрифугировали. Поглощение водной фазы каждого образца измеряли при длине волны 610 нм с использованием спектрофотометра. Количества проникшего из сосудов в ткани красителя Evans blue на мг влажной легочной ткани (левая панель) и ткани яичек (правая панель) в разных группах лечения показаны на Фиг. 9.
Важным является то, что, как показано на Фиг. 6-9, введение двух репрезентативных гибридных белков-ловушек лигандов существенно снижает уровень просачивания из кровеносного сосуда по сравнению с белком ActRIIB-Fc дикого типа во всех тканях, оцененных у леченых животных.
Пример 8
Автоматизированный анализ ELISA осуществляли для дополнительной характеристики ВМР9-связывания гибридных ActRIIB белков-ловушек лигандов в различных концентрациях в сравнении как с ActRIIB ECD-Fc дикого типа (WT ActRIIB-Fc), так и ActRIIA ECD-Fc дикого типа (WT ActRIIA-Fc). Как показано на Фиг. 12, данные выявили, что два репрезентативных гибридных белка AG-0014 (SEQ ID NO: 16) и AG-0027 (SEQ ID NO: 29), соответственно, продемонстрировали значительно сниженное ВМР9-связывание по сравнению с WT ActRIIB-Fc или WT ActRIIA-Fc. Эти данные указывают на то, что гибридные ActRIIB белки-ловушки лигандов имеют значительную селективность ВМР9-связывания, которая отличается от WT ActRIIB-Fc и WT ActRIIA-Fc.
Эти данные демонстрируют, что гибридные ActRIIB белки-ловушки лигандов, описанные здесь, эффективно связывают и нейтрализуют цитокины, индуцирующие мышечную атрофию. И важным является то, что гибридные ActRIIB белки-ловушки лигандов имеют чрезвычайно повышенную селективность для мышц, то есть, при одновременном эффективном блокировании действий цитокинов, индуцирующих мышечную атрофию, они оставляют интактной передачу сигналов цитокинов, не связанных с мышцами, тем самым сохраняя нормальное физиологическое функционирование немышечных клеток. Как изложено выше, BMP играет важную роль в ряде физиологических процессов, и было показано, что передача сигналов ВМР9 важна в сохранении нормальной кровеносной сосудистой сети/проницаемости. Сохраняя передачу сигналов ВМР9 и преимущественно антагонизируя передачу сигналов миостатина и активина, гибридные ActRIIB белки-ловушки лигандов по настоящему изобретению обеспечивают более эффективное и более безопасное лечение по сравнению с существующими растворимыми ActRIIB белками, которые в сильной степени нейтрализуют ВМР-9, то есть, путем селективного нацеливания на цитокины, индуцирующие мышечную атрофию и параллельно избегая вмешательства в передачу сигналов цитокинов, не связанных с мышцами, эти гибридные ActRIIB белки-ловушки лигандов представляют класс клинических кандидатов с превосходной эффективностью мышечного роста и улучшенным профилем безопасности, и тем самым обеспечивая потенциал стать лучшим в классе лечением для борьбы с мышечной атрофией, кахексией и хрупкостью. Как таковые, эти новые гибридные ActRIIB белки-ловушки лигандов, как полагают, имеют широкий ряд клинических показаний, включая возрастную саркопению, кахексию при раке, мышечную атрофию, ассоциированную с хроническими заболеваниями (CHF, CKD, COPD, диабет и другие), мышечную атрофию вследствие бездействия или денервации, вызванную приемом лекарств миопатию, различные формы миозита, нейромышечные заболевания и нейродегенеративные заболевания.
Все продукты и способы, раскрытые и заявленные здесь, могут быть созданы и выполнены без излишнего экспериментирования в свете настоящего раскрытия. Хотя продукты и способы по данному избретению были описаны в контексте предпочтительных воплощений, специалистам в данной области техники очевидно, что вариации могут быть применимы к продуктам и способам, не отходя от идеи и объема раскрытия. Все такие вариации и эквиваленты, очевидные специалистам в данной области техники, независимо от того имеются ли они в настоящем или будут разработаны позднее, предусмотрены находиться в пределах сущности и объема данного изобретения, как определено прилагаемой формулой изобретения. Все патенты, патентные заявки и публикации, упомянутые в описании, отражают уровни специалистов в области техники, к которой относится данное изобретение. Все патенты, патентные заявки и публикации включены в данное описание путем ссылки во всей полноте для всех целей и до той же степени, как если бы каждая индивидуальная публикация была конкретно и индивидуально указана как включенная путем ссылки во всей своей полноте и для всех целей. Изобретение, иллюстративно описанное здесь, подходящим образом может быть использовано на практике в отсутствие какого-либо элемента(ов), не раскрытого конкретно здесь. Таким образом, следует понимать, что хотя настоящее изобретение было конкретно раскрыто посредством предпочтительных воплощений и возможных признаков, специалисты в данной области техники могут прибегнуть к модификации и вариации раскрытых здесь концепций, и такие модификации и вариации предусмотрены входить в объем данного изобретения, как определено прилагаемой формулой изобретения.
Перечни последовательностей
Последовательности нуклеиновых кислот и аминокислот, перечисленные в прилагаемом перечне последовательностей, показаны с использованием стандартных буквенных обозначений для нуклеотидных оснований и трехбуквенных кодов для аминокислот, как определено в 37 C.F.R. 1.822.
SEQ ID NO: 1 представляет собой аминокислотную последовательность усеченного человеческого полипептида ActRIIB-ECD дикого типа.
SEQ ID NO: 2 представляет собой аминокислотную последовательность усеченного человеческого полипептида ActRIIA-ECD дикого типа.
SEQ ID NO: 3-37 представляют собой аминокислотные последовательности различных гибридных растворимых ActRIIB-ECD полипептидов.
SEQ ID NO: 38 представляет собой аминокислотную последовательность константной области тяжелой цепи человеческого иммуноглобулина гамма-1 (IgG1).
SEQ ID NO: 39 представляет собой аминокислотную последовательность Fc домена IgG1.
SEQ ID NO: 40 представляет собой аминокислотную последовательность константной области тяжелой цепи человеческого иммуноглобулина гамма-2.
SEQ ID NO: 41 представляет собой аминокислотную последовательность Fc домена IgG2.
SEQ ID NO: 42 представляет собой аминокислотную последовательность константной области тяжелой цепи человеческого иммуноглобулина гамма-4.
SEQ ID NO: 43 представляет собой аминокислотную последовательность Fc домена IgG4.
SEQ ID NO: 44 представляет собой аминокислотную последовательность пептидного линкера.
SEQ ID NO: 45 представляет собой полноразмерную аминокислотную последовательность человеческого ActRIIB полипептида.
SEQ ID NO: 46 представляет собой аминокислотную последовательность внеклеточного домена человеческого ActRIIB дикого типа (19-134 SEQ ID NO: 45).
SEQ ID NO: 47 представляет собой полноразмерную аминокислотную последовательность человеческого ActRIIA полипептида.
SEQ ID NO: 48 представляет собой аминокислотную последовательность внеклеточного домена человеческого ActRIIA дикого типа (20-135 SEQ ID NO: 47).
SEQ ID NO: 49 представляет собой аминокислотную последовательность сигнального пептида нативного ActRIIB.
SEQ ID NO: 50 представляет собой аминокислотную последовательность сигнального пептида легкой цепи иммуноглобулина.
SEQ ID NO: 51-117 представляют собой аминокислотные последовательности различных гибридных растворимых ActRIIB-ECD полипептидов.
SEQ ID NO: 118 представляет собой аминокислотную последовательность пептидного линкера.
ПЕРЕЧНИ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Усеченный ActRIIB-ECD дикого типа
Усеченный ActRIIA-ECD дикого типа
Гибридный hu-ActRIIB-ECD (АО-0001)
Гибридный hu-ActRIIB-ECD (AG-0002)
Гибридный hu-ActRIIB-ECD (AG-0003)
Гибридный hu-ActRIIB-ECD (AG-0004)
Гибридный hu-ActRIIB-ECD (AG-0005)
Гибридный hu-ActRIIB-ECD (AG-0006)
Гибридный hu-ActRIIB-ECD (AG-0007)
Гибридный hu-ActRIIB-ECD (AG-0008)
Гибридный человеческий ActRIIA-ECD (AG-0009)
Гибридный hu-ActRIIB-ECD (AG-0010)
Гибридный hu-ActRIIB-ECD (AG-0011)
Гибридный hu-ActRIIB-ECD (AG-0012)
Гибридный hu-ActRIIB-ECD (AG-0013)
Гибридный hu-ActRIIB-ECD (AG-0014)
Гибридный hu-ActRIIB-ECD (AG-0015)
Гибридный hu-ActRIIB-ECD (AG-0016)
Гибридный hu-ActRIIB-ECD (AG-0017)
Гибридный hu-ActRIIB-ECD (AG-0018)
Гибридный hu-ActRIIB-ECD (AG-0019)
Гибридный hu-ActRIIB-ECD (AG-0020)
Гибридный hu-ActRIIB-ECD (AG-0021)
Гибридный hu-ActRIIB-ECD (AG-0022)
Гибридный hu-ActRIIB-ECD (AG-0023)
Гибридный hu-ActRIIB-ECD (AG-0024)
Гибридный hu-ActRIIB-ECD (AG-0025)
Гибридный hu-ActRIIB-ECD (AG-0026)
Гибридный hu-ActRIIB-ECD (AG-0027)
Гибридный hu-ActRIIB-ECD (AG-0028)
Гибридный hu-ActRIIB-ECD (AG-0029)
Гибридный hu-ActRIIB-ECD (AG-0030)
Гибридный hu-ActRIIB-ECD (AG-0031)
Гибридный hu-ActRIIB-ECD (AG-0032)
Гибридный hu-ActRIIB-ECD (AG-0033)
Гибридный hu-ActRIIB-ECD (AG-0034)
Гибридный hu-ActRIIB-ECD (AG-0035)
Константная область тяжелой цепи человеческого иммуноглобулина гамма-1
Fc домен IgG1
Константная область тяжелой цепи человеческого иммуноглобулина гамма-2
Fc домен IgG2
Константная область тяжелой цепи человеческого иммуноглобулина гамма-4
Fc домен IgG4
Последовательность пептидного линкера
Полноразмерная аминокислотная последовательность человеческого ActRIIB полипептида
Внеклеточный домен человеческого ActRIIB дикого типа (19-134 SEQ ID NO: 45)
Полноразмерная аминокислотная последовательность человеческого полипептида ActRIIA
Внеклеточный домен человеческого ActRIIA дикого типа (20-135 SEQ ID NO: 47)
Сигнальный пептид нативного ActRIIB:
Сигнальный пептид легкой цепи иммуноглобулина:
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Гибридный hu-ActRIIB-ECD
Последовательность пептидного линкера
Claims (19)
1. Выделенный белок, представляющий собой мутантный растворимый ActRIIB-ECD (рецептор активина IIB-внеклеточный домен) полипептид, который содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 5-10, 13, 16, 25-27, 29, 30, 31 и 37, где указанный мутантный ActRIIB-ECD полипептид способен к связыванию с миостатином и активином A, но демонстрирует пониженную аффинность связывания с костным морфогенетическим белком 9 (BMP9) относительно ActRIIB-ECD полипептида дикого типа.
2. Слитый белок, содержащий мутантный растворимый ActRIIB-ECD полипептид по п. 1 и Fc домен человеческого иммуноглобулина, где указанный белок способен к связыванию с миостатином и активином A, но демонстрирует пониженную аффинность связывания с костным морфогенетическим белком 9 (BMP9) относительно ActRIIB-ECD полипептида дикого типа.
3. Слитый белок по п. 2, где Fc домен выбран из группы, состоящей из Fc домена человеческого IgG1 (иммуноглобулина G1), Fc домена человеческого IgG2 и Fc домена человеческого IgG4.
4. Слитый белок по п. 2, где мутантный растворимый ActRIIB-ECD полипептид является слитым с Fc доменом человеческого иммуноглобулина посредством пептидной линкерной последовательности.
5. Слитый белок по п. 4, где Fc домен человеческого иммуноглобулина содержит Fc домен человека, содержащий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 39, SEQ ID NO: 41 и SEQ ID NO: 43.
6. Слитый белок по п. 5, где для связывания Fc домена человека с мутантным растворимым ActRIIB-ECD полипептидом использован линкер, содержащий аминокислотную последовательность, изложенную в SEQ ID NO: 44, вместе с шарнирным линкером, содержащим аминокислотную последовательность, изложенную в SEQ ID NO: 118.
7. Слитый белок по п. 4, где мутантный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 16 и SEQ ID NO: 29, и Fc домен человека содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 39, SEQ ID NO: 41 и SEQ ID NO: 43.
8. Слитый белок по п. 7, где мутантный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 16, и Fc домен человека содержит аминокислотную последовательность SEQ ID NO: 43.
9. Слитый белок по п. 7, где мутантный растворимый ActRIIB-ECD полипептид содержит аминокислотную последовательность SEQ ID NO: 29, и Fc домен человека содержит аминокислотную последовательность SEQ ID NO: 43.
10. Слитый белок по п. 5, где указанный мутантный растворимый ActRIIB-ECD полипептид присоединен к указанному Fc домену человека посредством линкера, содержащего аминокислотную последовательность, изложенную в SEQ ID NO: 44.
11. Слитый белок по п. 5, где указанный мутантный растворимый ActRIIB-ECD полипептид присоединен к указанному Fc домену человека посредством линкера, содержащего аминокислотную последовательность, изложенную в SEQ ID NO: 118.
12. Слитый белок по п. 8, где указанный мутантный растворимый ActRIIB-ECD полипептид присоединен к указанному Fc домену человека посредством линкера, содержащего аминокислотную последовательность, изложенную в SEQ ID NO: 44.
13. Слитый белок по п. 8, где указанный мутантный растворимый ActRIIB-ECD полипептид присоединен к указанному Fc домену человека посредством линкера, содержащего аминокислотную последовательность, изложенную в SEQ ID NO: 118.
14. Слитый белок по п. 9, где указанный мутантный растворимый ActRIIB-ECD полипептид присоединен к указанному Fc домену человека посредством линкера, содержащего аминокислотную последовательность, изложенную в SEQ ID NO: 44.
15. Слитый белок по п. 9, где указанный мутантный растворимый ActRIIB-ECD полипептид присоединен к указанному Fc домену человека посредством линкера, содержащего аминокислотную последовательность, изложенную в SEQ ID NO: 118.
16. Слитый белок по п. 6, где указанный мутантный растворимый ActRIIB-ECD полипептид состоит из аминокислотной последовательности SEQ ID NO: 16, где указанный мутантный растворимый ActRIIB-ECD полипептид является слитым с пептидным линкером, состоящим из аминокислотной последовательности, изложенной в SEQ ID NO: 44, где указанный пептидный линкер является слитым с шарнирным линкером, состоящим из аминокислотной последовательности, изложенной в SEQ ID NO: 118, и где указанный шарнирный линкер является слитым с Fc доменом, состоящим из аминокислотной последовательности SEQ ID NO: 43.
17. Слитый белок по п. 6, где указанный мутантный растворимый ActRIIB-ECD полипептид состоит из аминокислотной последовательности SEQ ID NO: 29, где указанный мутантный растворимый ActRIIB-ECD полипептид является слитым с пептидным линкером, состоящим из аминокислотной последовательности, изложенной в SEQ ID NO: 44, где указанный пептидный линкер является слитым с шарнирным линкером, состоящим из аминокислотной последовательности, изложенной в SEQ ID NO: 118, и где указанный шарнирный линкер является слитым с Fc доменом, состоящим из аминокислотной последовательности SEQ ID NO: 43.
18. Фармацевтическая композиция для лечения связанных с мышечной атрофией заболеваний или заболеваний костной системы, содержащая терапевтически эффективное количество выделенного белка по п. 1 или слитого белка по любому из пп. 2-17 в смеси с фармацевтически приемлемым носителем.
19. Фармацевтическая композиция по п. 18, где композиция пригодна для введения путем, выбранным из группы, состоящей из подкожного, внутримышечного, внутривенного и интратекального путей введения.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562150994P | 2015-04-22 | 2015-04-22 | |
| US62/150,994 | 2015-04-22 | ||
| US201562262356P | 2015-12-02 | 2015-12-02 | |
| US62/262,356 | 2015-12-02 | ||
| PCT/US2016/027046 WO2016171948A1 (en) | 2015-04-22 | 2016-04-12 | Novel hybrid actriib ligand trap proteins for treating muscle wasting diseases |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| RU2017138537A RU2017138537A (ru) | 2019-05-22 |
| RU2017138537A3 RU2017138537A3 (ru) | 2019-08-01 |
| RU2733492C2 true RU2733492C2 (ru) | 2020-10-02 |
Family
ID=57144520
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2017138537A RU2733492C2 (ru) | 2015-04-22 | 2016-04-12 | Новые гибридные ActRIIB белки-ловушки лигандов для лечения заболеваний, связанных с мышечной атрофией |
Country Status (25)
| Country | Link |
|---|---|
| US (4) | US10913782B2 (ru) |
| EP (2) | EP3286206B1 (ru) |
| JP (2) | JP6959487B2 (ru) |
| KR (1) | KR20180006386A (ru) |
| CN (1) | CN107683287B (ru) |
| AU (2) | AU2016251640B2 (ru) |
| BR (1) | BR112017022658A2 (ru) |
| CA (1) | CA2983440C (ru) |
| CY (1) | CY1124124T1 (ru) |
| DK (1) | DK3286206T3 (ru) |
| ES (1) | ES2856001T3 (ru) |
| HK (1) | HK1251588A1 (ru) |
| HR (1) | HRP20210725T1 (ru) |
| HU (1) | HUE054232T2 (ru) |
| IL (1) | IL255070B (ru) |
| LT (1) | LT3286206T (ru) |
| MX (1) | MX2017013520A (ru) |
| PL (1) | PL3286206T3 (ru) |
| PT (1) | PT3286206T (ru) |
| RS (1) | RS61881B1 (ru) |
| RU (1) | RU2733492C2 (ru) |
| SG (2) | SG10201913747PA (ru) |
| SI (1) | SI3286206T1 (ru) |
| WO (1) | WO2016171948A1 (ru) |
| ZA (2) | ZA201707821B (ru) |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20100028332A1 (en) * | 2006-12-18 | 2010-02-04 | Acceleron Pharma Inc. | Antagonists of actriib and uses for increasing red blood cell levels |
| CA2951926C (en) | 2014-06-13 | 2023-01-10 | Acceleron Pharma, Inc. | Methods and compositions for treating ulcers |
| EP3280728B1 (en) | 2015-04-06 | 2020-12-16 | Acceleron Pharma Inc. | Alk7:actriib heteromultimers and uses thereof |
| MA41919A (fr) | 2015-04-06 | 2018-02-13 | Acceleron Pharma Inc | Hétéromultimères alk4:actriib et leurs utilisations |
| CN113683708A (zh) | 2015-04-06 | 2021-11-23 | 阿塞勒隆制药公司 | 单臂i型和ii型受体融合蛋白和其用途 |
| DK3496739T3 (da) | 2016-07-15 | 2021-05-10 | Acceleron Pharma Inc | Sammensætninger omfattende actriia-polypeptider til brug i behandlingen af pulmonal hypertension |
| CA3039525A1 (en) | 2016-10-05 | 2018-04-12 | Acceleron Pharma Inc. | Variant actriib proteins and uses thereof |
| US10934532B2 (en) | 2016-10-05 | 2021-03-02 | Acceleron Pharma Inc. | ALK4.ActRIIB heteromultimers |
| JOP20190085A1 (ar) * | 2016-10-20 | 2019-04-17 | Biogen Ma Inc | طرق علاج الضمور العضلي ومرض العظام باستخدام بروتينات احتجاز مركب ترابطي actriib هجين حديثة |
| WO2018089706A2 (en) | 2016-11-10 | 2018-05-17 | Keros Therapeutics, Inc. | Activin receptor type iia variants and methods of use thereof |
| CA3054837A1 (en) * | 2017-03-24 | 2018-09-27 | Novartis Ag | Methods for preventing and treating heart disease |
| EP3706777B1 (en) | 2017-11-09 | 2024-05-22 | Keros Therapeutics, Inc. | Activin receptor type iia variants and methods of use thereof |
| JP7510875B2 (ja) * | 2018-01-12 | 2024-07-04 | ケロス セラピューティクス インコーポレイテッド | アクチビンiib型受容体変異体および同変異体を含む医薬組成物 |
| US20220242956A1 (en) * | 2019-05-30 | 2022-08-04 | Acceleron Pharma Inc. | Actrii-binding proteins and uses thereof |
| BR112022015387A2 (pt) * | 2020-02-03 | 2022-10-11 | Acceleron Pharma Inc | Proteínas actriib variantes e usos das mesmas |
| WO2021158695A1 (en) * | 2020-02-03 | 2021-08-12 | Acceleron Pharma Inc. | Compositions and methods for treating pulmonary hypertension |
| WO2021189019A1 (en) * | 2020-03-20 | 2021-09-23 | Keros Therapeutics, Inc. | Activin receptor type ii chimeras and methods of use thereof |
| WO2022040461A1 (en) * | 2020-08-20 | 2022-02-24 | Regeneron Pharmaceuticals, Inc. | Methods for preventing and treating cardiac dysfunction and covid-19 with activin a antagonists |
| US20240181007A1 (en) * | 2021-01-08 | 2024-06-06 | Acceleron Pharma Inc. | Compositions and methods for treating pulmonary hypertension |
| WO2023141724A1 (en) * | 2022-01-28 | 2023-08-03 | 35Pharma Inc. | Activin receptor type iib variants and uses thereof |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007053775A1 (en) * | 2005-11-01 | 2007-05-10 | Amgen Inc. | Novel activin receptor and uses thereof |
| EA201491231A1 (ru) * | 2011-12-19 | 2014-09-30 | Амген Инк. | Варианты полипептидов рецептора активина и их применение |
Family Cites Families (61)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0307434B2 (en) | 1987-03-18 | 1998-07-29 | Scotgen Biopharmaceuticals, Inc. | Altered antibodies |
| WO1990014363A1 (en) | 1989-05-19 | 1990-11-29 | Amgen Inc. | Metalloproteinase inhibitor |
| US5885794A (en) | 1991-05-10 | 1999-03-23 | The Salk Institute For Biological Studies | Recombinant production of vertebrate activin receptor polypeptides and identification of receptor DNAs in the activin/TGF-β superfamily |
| US6891082B2 (en) | 1997-08-01 | 2005-05-10 | The Johns Hopkins University School Of Medicine | Transgenic non-human animals expressing a truncated activintype II receptor |
| US6656475B1 (en) | 1997-08-01 | 2003-12-02 | The Johns Hopkins University School Of Medicine | Growth differentiation factor receptors, agonists and antagonists thereof, and methods of using same |
| EP1147413B1 (en) | 1999-01-21 | 2006-04-05 | Metamorphix, Inc. | Growth differentiation factor inhibitors and uses therefor |
| JP4487376B2 (ja) | 2000-03-31 | 2010-06-23 | 味の素株式会社 | 腎疾患治療剤 |
| AU2002248571B2 (en) * | 2001-03-07 | 2007-01-18 | Merck Patent Gmbh | Expression technology for proteins containing a hybrid isotype antibody moiety |
| AU2012204098B2 (en) | 2001-04-24 | 2014-05-15 | The Johns Hopkins University | Use of follistatin to increase muscle mass |
| US20040223966A1 (en) | 2002-10-25 | 2004-11-11 | Wolfman Neil M. | ActRIIB fusion polypeptides and uses therefor |
| CA2526669A1 (en) | 2003-06-02 | 2004-12-16 | Wyeth | Use of myostatin (gdf8) inhibitors in conjunction with corticosteroids for treating neuromuscular disorders |
| ES2454666T3 (es) * | 2003-11-13 | 2014-04-11 | Hanmi Science Co., Ltd. | Fragmento Fc de IgG para un vehículo de fármaco y procedimiento para la preparación del mismo |
| CA2891010C (en) | 2004-07-23 | 2022-09-20 | Acceleron Pharma Inc. | Actrii receptor polypeptides, methods and compositions |
| AU2015200950B2 (en) | 2004-07-23 | 2017-04-27 | Acceleron Pharma Inc. | ActRII receptor polypeptides, methods and compositions |
| CA2575563A1 (en) | 2004-08-12 | 2006-02-23 | Wyeth | Combination therapy for diabetes, obesity, and cardiovascular diseases using gdf-8 inhibitors |
| US9844528B2 (en) | 2006-08-24 | 2017-12-19 | University Of Tennessee Research Foundation | SARMs and method of use thereof |
| CN104524548A (zh) | 2006-12-18 | 2015-04-22 | 阿塞勒隆制药公司 | 活化素-actrii拮抗剂及在提高红细胞水平中的用途 |
| US20100028332A1 (en) | 2006-12-18 | 2010-02-04 | Acceleron Pharma Inc. | Antagonists of actriib and uses for increasing red blood cell levels |
| TWI432449B (zh) | 2007-02-02 | 2014-04-01 | Acceleron Pharma Inc | 衍生自ActRIIB的變體與其用途 |
| TWI454479B (zh) * | 2007-03-06 | 2014-10-01 | Amgen Inc | 變異之活動素受體多肽及其用途 |
| US7960343B2 (en) * | 2007-09-18 | 2011-06-14 | Acceleron Pharma Inc. | Activin-ActRIIa antagonists and uses for decreasing or inhibiting FSH secretion |
| PE20091163A1 (es) | 2007-11-01 | 2009-08-09 | Wyeth Corp | Anticuerpos para gdf8 |
| NZ602471A (en) | 2008-06-26 | 2014-10-31 | Acceleron Pharma Inc | Antagonists of activin-actriia and uses for increasing red blood cell levels |
| WO2009158025A2 (en) | 2008-06-26 | 2009-12-30 | Acceleron Pharma Inc. | Methods for dosing an actriib antagonist and monitoring of treated patients |
| HUE045456T2 (hu) | 2008-08-14 | 2019-12-30 | Acceleron Pharma Inc | GDF csapdák anémia kezelésére történõ alkalmazásra |
| US8216997B2 (en) | 2008-08-14 | 2012-07-10 | Acceleron Pharma, Inc. | Methods for increasing red blood cell levels and treating anemia using a combination of GDF traps and erythropoietin receptor activators |
| EP3101029B1 (en) | 2008-11-26 | 2019-04-03 | Amgen, Inc | Variants of activin iib receptor polypeptides and uses thereof |
| US8138142B2 (en) | 2009-01-13 | 2012-03-20 | Acceleron Pharma Inc. | Methods for increasing adiponectin in a patient in need thereof |
| EP3275900A1 (en) | 2009-04-27 | 2018-01-31 | Novartis AG | Compositions and methods for increasing muscle growth |
| MX2011013172A (es) | 2009-06-08 | 2012-04-02 | Acceleron Pharma Inc | Metodos para aumentar adipocitos termogenicos. |
| WO2010151426A1 (en) | 2009-06-12 | 2010-12-29 | Acceleron Pharma Inc. | Truncated actriib-fc fusion proteins |
| EP3838919A1 (en) | 2009-08-13 | 2021-06-23 | Acceleron Pharma Inc. | Combined use of gdf traps and erythropoietin receptor activators to increase red blood cell levels |
| BR112012005225B8 (pt) | 2009-09-09 | 2023-01-10 | Acceleron Pharma Inc | Uso de uma proteína de fusão actriib-fc para o tratamento de um transtorno relacionado ao osso ou associado à perda de músculo por crescimento muscular insuficiente |
| ES2869864T3 (es) | 2009-11-03 | 2021-10-26 | Acceleron Pharma Inc | Procedimientos para el tratamiento de la enfermedad del hígado graso |
| EP3332796A1 (en) * | 2009-11-17 | 2018-06-13 | Acceleron Pharma Inc. | Actriib proteins and variants and uses therefore relating to utrophin induction for muscular dystrophy therapy |
| US20110268736A1 (en) | 2010-04-30 | 2011-11-03 | Children's Medical Center Corporation | Method for treating congenital myopathy |
| WO2012027065A2 (en) | 2010-08-27 | 2012-03-01 | Celgene Corporation | Combination therapy for treatment of disease |
| ES2869168T3 (es) | 2011-10-17 | 2021-10-25 | Acceleron Pharma Inc | Composiciones para tratar la mielofibrosis |
| US8765385B2 (en) | 2011-10-27 | 2014-07-01 | Ravindra Kumar | Method of detection of neutralizing anti-actriib antibodies |
| PT2780368T (pt) * | 2011-11-14 | 2018-03-22 | Regeneron Pharma | Composições e métodos para aumentar a massa muscular e a força muscular antagonizando especificamente gdf8 e/ou activina a |
| GR1007832B (el) | 2011-11-21 | 2013-02-14 | Ιδρυμα Ιατροβιολογικων Ερευνων Ακαδημιας Αθηνων, | Αδρανοποιητες της ακτιβινης και χρηση τους για την θεραπεια ασθενειων που σχετιζονται με παρεκκλινουσα ενεργοποιηση της "αμυντικης αποκρισης του ξενιστη" |
| US9809636B2 (en) | 2012-04-06 | 2017-11-07 | Acceleron Pharma Inc. | Methods for increasing red blood cell levels comprising administering BMP9 |
| EP2912462B1 (en) | 2012-10-24 | 2019-08-07 | Celgene Corporation | Biomarker for use in treating anemia |
| AU2013337677B2 (en) | 2012-11-02 | 2018-06-28 | Celgene Corporation | Activin-ActRII antagonists and uses for treating bone and other disorders |
| US20140220033A1 (en) | 2013-02-01 | 2014-08-07 | Santa Maria Biotherapeutics, Inc. | Administration of an Anti-Activin-A Compound to a Subject |
| SG10201706148WA (en) | 2013-02-01 | 2017-08-30 | Santa Maria Biotherapeutics Inc | Administration of an anti-activin-a compound to a subject |
| US20150148345A1 (en) | 2013-11-26 | 2015-05-28 | Gilead Sciences, Inc. | Therapies for treating myeloproliferative disorders |
| EP3119418B1 (en) | 2014-03-21 | 2022-02-23 | Acceleron Pharma Inc. | Composition for use in a method of treating or preventing anemia by inhibiting activin b and gdf11 |
| JP6649895B2 (ja) | 2014-04-18 | 2020-02-19 | アクセルロン ファーマ, インコーポレイテッド | 赤血球レベルを増加させ、そして鎌状赤血球症を処置するための方法 |
| KR20170035891A (ko) | 2014-06-13 | 2017-03-31 | 산타 마리아 바이오테라퓨틱스, 인코포레이티드 | 제형화된 수용체 폴리펩타이드 및 관련 방법 |
| CA2951926C (en) | 2014-06-13 | 2023-01-10 | Acceleron Pharma, Inc. | Methods and compositions for treating ulcers |
| US20160075772A1 (en) | 2014-09-12 | 2016-03-17 | Regeneron Pharmaceuticals, Inc. | Treatment of Fibrodysplasia Ossificans Progressiva |
| EP3227675B1 (en) | 2014-12-03 | 2023-03-15 | Celgene Corporation | Activin-actrii antagonists and uses for treating myelodysplastic syndrome |
| MA41919A (fr) | 2015-04-06 | 2018-02-13 | Acceleron Pharma Inc | Hétéromultimères alk4:actriib et leurs utilisations |
| EP3280728B1 (en) | 2015-04-06 | 2020-12-16 | Acceleron Pharma Inc. | Alk7:actriib heteromultimers and uses thereof |
| EP3344660A4 (en) | 2015-08-31 | 2019-07-03 | National Research Council of Canada | TGF-BETA-RECEPTOR-EKTODOMÄNENFUSIONSMOLEKÜLE AND USES THEREOF |
| WO2017079591A2 (en) | 2015-11-04 | 2017-05-11 | Acceleron Pharma Inc. | Methods for increasing red blood cell levels and treating ineffective erythropoiesis |
| EP3380121B1 (en) | 2015-11-23 | 2023-12-20 | Acceleron Pharma Inc. | Actrii antagonist for use in treating eye disorders |
| CA3014197A1 (en) | 2016-02-22 | 2017-08-31 | Ravindra Kumar | Actrii antagonists for use in increasing immune activity |
| WO2017177013A1 (en) | 2016-04-06 | 2017-10-12 | Acceleron Pharma Inc. | Alk7 antagonists and uses thereof |
| CA3039525A1 (en) | 2016-10-05 | 2018-04-12 | Acceleron Pharma Inc. | Variant actriib proteins and uses thereof |
-
2016
- 2016-04-12 RU RU2017138537A patent/RU2733492C2/ru active
- 2016-04-12 SG SG10201913747PA patent/SG10201913747PA/en unknown
- 2016-04-12 ES ES16783603T patent/ES2856001T3/es active Active
- 2016-04-12 EP EP16783603.0A patent/EP3286206B1/en active Active
- 2016-04-12 HU HUE16783603A patent/HUE054232T2/hu unknown
- 2016-04-12 KR KR1020177033601A patent/KR20180006386A/ko not_active Application Discontinuation
- 2016-04-12 BR BR112017022658A patent/BR112017022658A2/pt active Search and Examination
- 2016-04-12 US US15/568,232 patent/US10913782B2/en active Active
- 2016-04-12 JP JP2017554902A patent/JP6959487B2/ja active Active
- 2016-04-12 DK DK16783603.0T patent/DK3286206T3/da active
- 2016-04-12 AU AU2016251640A patent/AU2016251640B2/en active Active
- 2016-04-12 PT PT167836030T patent/PT3286206T/pt unknown
- 2016-04-12 RS RS20210563A patent/RS61881B1/sr unknown
- 2016-04-12 SG SG11201708351XA patent/SG11201708351XA/en unknown
- 2016-04-12 CN CN201680036599.1A patent/CN107683287B/zh active Active
- 2016-04-12 CA CA2983440A patent/CA2983440C/en active Active
- 2016-04-12 MX MX2017013520A patent/MX2017013520A/es unknown
- 2016-04-12 EP EP21156657.5A patent/EP3878857A1/en not_active Withdrawn
- 2016-04-12 LT LTEP16783603.0T patent/LT3286206T/lt unknown
- 2016-04-12 PL PL16783603T patent/PL3286206T3/pl unknown
- 2016-04-12 SI SI201631191T patent/SI3286206T1/sl unknown
- 2016-04-12 WO PCT/US2016/027046 patent/WO2016171948A1/en active Application Filing
-
2017
- 2017-10-16 IL IL255070A patent/IL255070B/en unknown
- 2017-11-17 ZA ZA2017/07821A patent/ZA201707821B/en unknown
-
2018
- 2018-08-27 HK HK18110975.8A patent/HK1251588A1/zh unknown
-
2020
- 2020-06-08 US US16/895,670 patent/US11292826B2/en active Active
- 2020-10-07 AU AU2020250216A patent/AU2020250216B2/en active Active
- 2020-11-16 ZA ZA2020/07118A patent/ZA202007118B/en unknown
-
2021
- 2021-05-10 HR HRP20210725TT patent/HRP20210725T1/hr unknown
- 2021-05-14 CY CY20211100411T patent/CY1124124T1/el unknown
- 2021-08-30 JP JP2021139606A patent/JP7320571B2/ja active Active
-
2022
- 2022-02-28 US US17/682,277 patent/US11932677B2/en active Active
-
2024
- 2024-02-07 US US18/435,934 patent/US20240262883A1/en active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007053775A1 (en) * | 2005-11-01 | 2007-05-10 | Amgen Inc. | Novel activin receptor and uses thereof |
| EA201491231A1 (ru) * | 2011-12-19 | 2014-09-30 | Амген Инк. | Варианты полипептидов рецептора активина и их применение |
Non-Patent Citations (7)
| Title |
|---|
| . THOMPSON T. B. et al., Structures of an ActRIIB: activin A complex reveal a novel binding mode for TGF‐β ligand: receptor interactions, The EMBO journal, 2003, V. 22, N. 7, p.1555-1566. * |
| CHEN X. et al., Fusion protein linkers: property, design and functionality, Advanced drug delivery reviews, 2013, V. 65, N. 10, p.1357-1369 * |
| CHEN X. et al., Fusion protein linkers: property, design and functionality, Advanced drug delivery reviews, 2013, V. 65, N. 10, p.1357-1369. MAEDA Y. et al., Engineering of functional chimeric protein G-VargulaLuciferase, Analytical biochemistry, 1997, V. 249, N. 2, p.147-152. * |
| GRAY P. C. et al., Identification of a binding site on the type II activin receptor for activin and inhibin, Journal of Biological Chemistry, 2000, V. 275, N. 5, p.3206-3212. * |
| GRAY P. C. et al., Identification of a binding site on the type II activin receptor for activin and inhibin, Journal of Biological Chemistry, 2000, V. 275, N. 5, p.3206-3212. THOMPSON T. B. et al., Structures of an ActRIIB: activin A complex reveal a novel binding mode for TGF‐β ligand: receptor interactions, The EMBO journal, 2003, V. 22, N. 7, p.1555-1566. SAKO D. et al., Characterization of the ligand binding functionality of the extracellular domain of activin receptor type IIb, Journal of Biological Chemistry, 2010, V. 285, N. 27, p.21037-21048. * |
| MAEDA Y. et al., Engineering of functional chimeric protein G-VargulaLuciferase, Analytical biochemistry, 1997, V. 249, N. 2, p.147-152. * |
| SAKO D. et al., Characterization of the ligand binding functionality of the extracellular domain of activin receptor type IIb, Journal of Biological Chemistry, 2010, V. 285, N. 27, p.21037-21048. * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11932677B2 (en) | Hybrid ActRIIB ligand trap proteins for treating muscle wasting diseases | |
| US20220332791A1 (en) | Methods for treating muscle wasting and bone disease using novel hybrid actriib ligand trap proteins | |
| AU2021365525A1 (en) | Bifunctional antagonists of activin and tumor necrosis factor-alpha and uses thereof | |
| EP4444747A1 (en) | Modified actriib proteins and methods of use thereof | |
| CN116744959A (zh) | 肿瘤坏死因子-α和转化生长因子-β的双功能拮抗剂及其用途 | |
| CN116635059A (zh) | 激活蛋白和肿瘤坏死因子-α的双功能拮抗剂及其用途 |