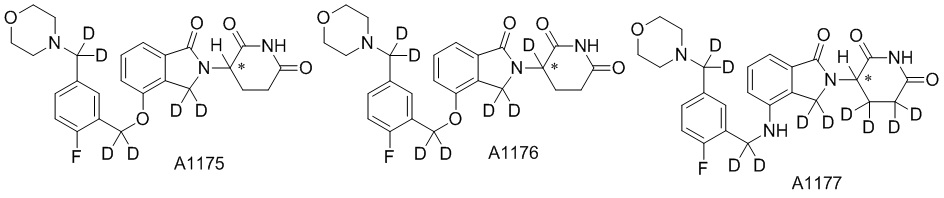
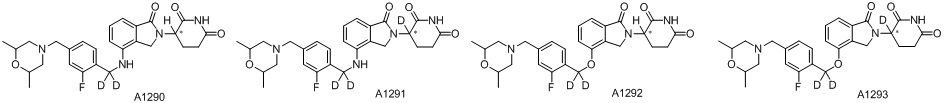
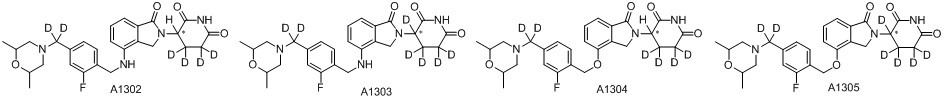
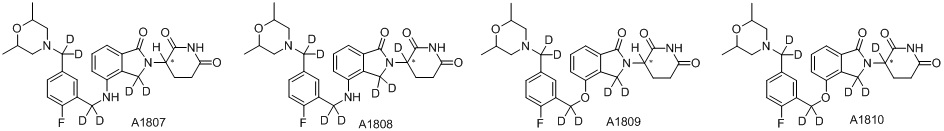
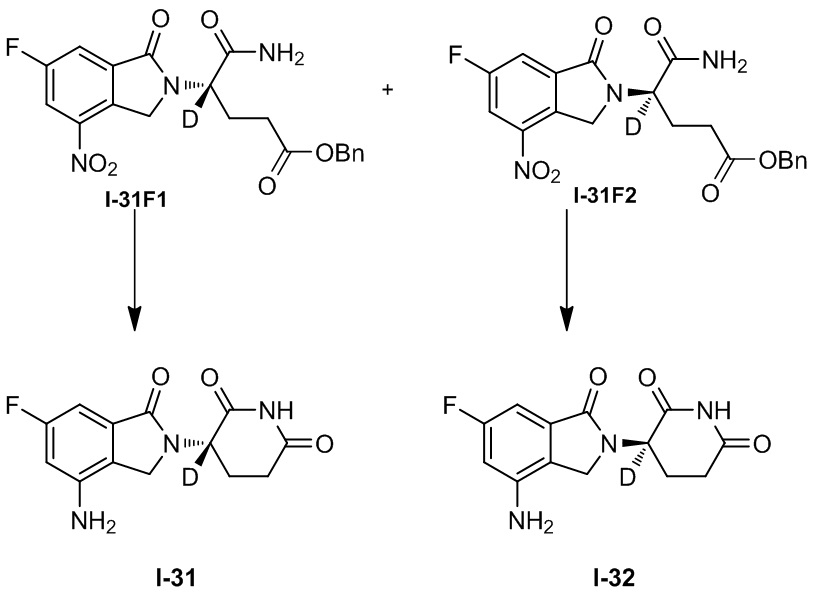
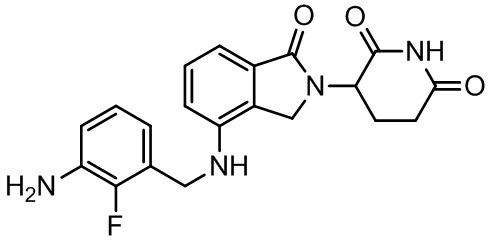
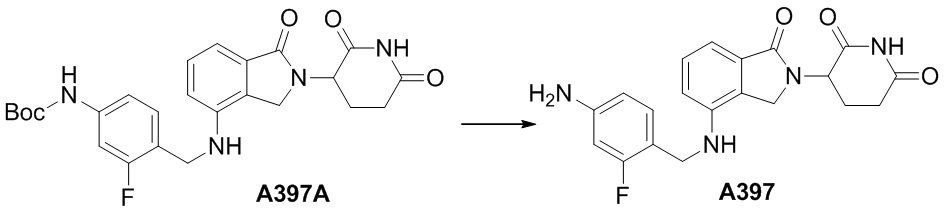
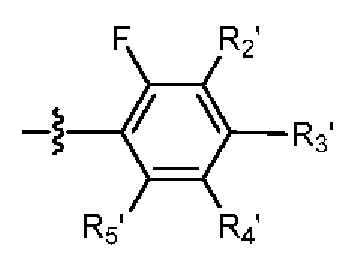
RU2695521C9 - Производное изоиндолина, промежуточный продукт, способ получения, фармацевтическая композиция и ее применение - Google Patents
Производное изоиндолина, промежуточный продукт, способ получения, фармацевтическая композиция и ее применение Download PDFInfo
- Publication number
- RU2695521C9 RU2695521C9 RU2017118453A RU2017118453A RU2695521C9 RU 2695521 C9 RU2695521 C9 RU 2695521C9 RU 2017118453 A RU2017118453 A RU 2017118453A RU 2017118453 A RU2017118453 A RU 2017118453A RU 2695521 C9 RU2695521 C9 RU 2695521C9
- Authority
- RU
- Russia
- Prior art keywords
- compound
- general formula
- substituted
- alkyl
- unsubstituted
- Prior art date
Links
- 150000001875 compounds Chemical class 0.000 claims abstract description 314
- 125000004400 (C1-C12) alkyl group Chemical group 0.000 claims abstract description 63
- 125000000592 heterocycloalkyl group Chemical group 0.000 claims abstract description 52
- 125000004642 (C1-C12) alkoxy group Chemical group 0.000 claims abstract description 41
- 229910052805 deuterium Inorganic materials 0.000 claims abstract description 37
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 32
- 230000000694 effects Effects 0.000 claims abstract description 29
- -1 cyano, hydroxy Chemical group 0.000 claims abstract description 24
- 229910052736 halogen Inorganic materials 0.000 claims abstract description 24
- 150000002367 halogens Chemical class 0.000 claims abstract description 24
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 23
- 229910052799 carbon Inorganic materials 0.000 claims abstract description 15
- 239000000126 substance Substances 0.000 claims abstract description 11
- 125000005257 alkyl acyl group Chemical group 0.000 claims abstract description 7
- 229910052760 oxygen Inorganic materials 0.000 claims abstract description 5
- 238000000034 method Methods 0.000 claims description 75
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 71
- 150000003839 salts Chemical class 0.000 claims description 59
- 230000000155 isotopic effect Effects 0.000 claims description 49
- 201000010099 disease Diseases 0.000 claims description 45
- 108060008682 Tumor Necrosis Factor Proteins 0.000 claims description 35
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 claims description 35
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 claims description 34
- 208000024891 symptom Diseases 0.000 claims description 29
- 208000035475 disorder Diseases 0.000 claims description 26
- GWVMLCQWXVFZCN-UHFFFAOYSA-N isoindoline Chemical class C1=CC=C2CNCC2=C1 GWVMLCQWXVFZCN-UHFFFAOYSA-N 0.000 claims description 22
- 239000008194 pharmaceutical composition Substances 0.000 claims description 21
- 238000004519 manufacturing process Methods 0.000 claims description 20
- 125000001424 substituent group Chemical group 0.000 claims description 17
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims description 13
- 238000006722 reduction reaction Methods 0.000 claims description 12
- 125000000229 (C1-C4)alkoxy group Chemical group 0.000 claims description 10
- 201000001441 melanoma Diseases 0.000 claims description 10
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 10
- 125000006239 protecting group Chemical group 0.000 claims description 10
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 claims description 9
- 206010035226 Plasma cell myeloma Diseases 0.000 claims description 8
- 229910052794 bromium Inorganic materials 0.000 claims description 8
- 238000006268 reductive amination reaction Methods 0.000 claims description 8
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 7
- 238000010511 deprotection reaction Methods 0.000 claims description 7
- 201000006845 reticulosarcoma Diseases 0.000 claims description 7
- 208000029922 reticulum cell sarcoma Diseases 0.000 claims description 7
- 208000025205 Mantle-Cell Lymphoma Diseases 0.000 claims description 6
- 206010060862 Prostate cancer Diseases 0.000 claims description 6
- 238000007112 amidation reaction Methods 0.000 claims description 6
- 229910052801 chlorine Inorganic materials 0.000 claims description 6
- 238000005859 coupling reaction Methods 0.000 claims description 6
- 229910052740 iodine Inorganic materials 0.000 claims description 6
- 208000003174 Brain Neoplasms Diseases 0.000 claims description 5
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 claims description 5
- 206010033128 Ovarian cancer Diseases 0.000 claims description 5
- 239000003937 drug carrier Substances 0.000 claims description 5
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 5
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 claims description 5
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 claims description 5
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 5
- 206010028537 myelofibrosis Diseases 0.000 claims description 5
- 208000025113 myeloid leukemia Diseases 0.000 claims description 5
- 230000002265 prevention Effects 0.000 claims description 5
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 5
- 206010003571 Astrocytoma Diseases 0.000 claims description 4
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 claims description 4
- 208000026310 Breast neoplasm Diseases 0.000 claims description 4
- 208000011691 Burkitt lymphomas Diseases 0.000 claims description 4
- 206010018338 Glioma Diseases 0.000 claims description 4
- 208000017604 Hodgkin disease Diseases 0.000 claims description 4
- 208000021519 Hodgkin lymphoma Diseases 0.000 claims description 4
- 208000010747 Hodgkins lymphoma Diseases 0.000 claims description 4
- 208000034578 Multiple myelomas Diseases 0.000 claims description 4
- 201000003793 Myelodysplastic syndrome Diseases 0.000 claims description 4
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 claims description 4
- 208000007452 Plasmacytoma Diseases 0.000 claims description 4
- 208000006265 Renal cell carcinoma Diseases 0.000 claims description 4
- 206010042971 T-cell lymphoma Diseases 0.000 claims description 4
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 claims description 4
- 208000024770 Thyroid neoplasm Diseases 0.000 claims description 4
- 201000005969 Uveal melanoma Diseases 0.000 claims description 4
- 230000033228 biological regulation Effects 0.000 claims description 4
- 230000001684 chronic effect Effects 0.000 claims description 4
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 claims description 4
- 230000001771 impaired effect Effects 0.000 claims description 4
- 201000002575 ocular melanoma Diseases 0.000 claims description 4
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 4
- 125000004213 tert-butoxy group Chemical group [H]C([H])([H])C(O*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 4
- 201000002510 thyroid cancer Diseases 0.000 claims description 4
- 206010006187 Breast cancer Diseases 0.000 claims description 3
- 206010007953 Central nervous system lymphoma Diseases 0.000 claims description 3
- 208000004463 Follicular Adenocarcinoma Diseases 0.000 claims description 3
- 206010073086 Iris melanoma Diseases 0.000 claims description 3
- 206010024305 Leukaemia monocytic Diseases 0.000 claims description 3
- 206010025323 Lymphomas Diseases 0.000 claims description 3
- 206010033701 Papillary thyroid cancer Diseases 0.000 claims description 3
- 208000000453 Skin Neoplasms Diseases 0.000 claims description 3
- 206010002022 amyloidosis Diseases 0.000 claims description 3
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 claims description 3
- 229910052731 fluorine Inorganic materials 0.000 claims description 3
- 208000005017 glioblastoma Diseases 0.000 claims description 3
- 208000002409 gliosarcoma Diseases 0.000 claims description 3
- 208000029824 high grade glioma Diseases 0.000 claims description 3
- 201000011614 malignant glioma Diseases 0.000 claims description 3
- 206010027191 meningioma Diseases 0.000 claims description 3
- 201000006894 monocytic leukemia Diseases 0.000 claims description 3
- 208000002154 non-small cell lung carcinoma Diseases 0.000 claims description 3
- 238000010534 nucleophilic substitution reaction Methods 0.000 claims description 3
- 208000016800 primary central nervous system lymphoma Diseases 0.000 claims description 3
- 201000000849 skin cancer Diseases 0.000 claims description 3
- 230000007480 spreading Effects 0.000 claims description 3
- 238000003892 spreading Methods 0.000 claims description 3
- 208000030901 thyroid gland follicular carcinoma Diseases 0.000 claims description 3
- 208000030045 thyroid gland papillary carcinoma Diseases 0.000 claims description 3
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 claims description 3
- 206010037779 Radiculopathy Diseases 0.000 claims description 2
- 230000000925 erythroid effect Effects 0.000 claims description 2
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 claims description 2
- 201000003444 follicular lymphoma Diseases 0.000 claims description 2
- 206010073071 hepatocellular carcinoma Diseases 0.000 claims description 2
- 231100000844 hepatocellular carcinoma Toxicity 0.000 claims description 2
- 125000005842 heteroatom Chemical group 0.000 claims description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 2
- 125000002510 isobutoxy group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])O* 0.000 claims description 2
- 208000032839 leukemia Diseases 0.000 claims description 2
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims description 2
- 125000002757 morpholinyl group Chemical group 0.000 claims description 2
- 125000004193 piperazinyl group Chemical group 0.000 claims description 2
- 206010062261 spinal cord neoplasm Diseases 0.000 claims description 2
- 125000004432 carbon atom Chemical group C* 0.000 claims 5
- 208000023890 Complex Regional Pain Syndromes Diseases 0.000 claims 1
- 229940126062 Compound A Drugs 0.000 claims 1
- NLDMNSXOCDLTTB-UHFFFAOYSA-N Heterophylliin A Natural products O1C2COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC2C(OC(=O)C=2C=C(O)C(O)=C(O)C=2)C(O)C1OC(=O)C1=CC(O)=C(O)C(O)=C1 NLDMNSXOCDLTTB-UHFFFAOYSA-N 0.000 claims 1
- 208000033559 Waldenström macroglobulinemia Diseases 0.000 claims 1
- 230000001886 ciliary effect Effects 0.000 claims 1
- 201000000564 macroglobulinemia Diseases 0.000 claims 1
- 201000011510 cancer Diseases 0.000 abstract description 19
- 150000001721 carbon Chemical group 0.000 abstract description 8
- 102000004127 Cytokines Human genes 0.000 abstract description 7
- 108090000695 Cytokines Proteins 0.000 abstract description 7
- 208000027866 inflammatory disease Diseases 0.000 abstract description 6
- 230000001900 immune effect Effects 0.000 abstract description 2
- 239000000203 mixture Substances 0.000 description 149
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 135
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 97
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 92
- 239000007787 solid Substances 0.000 description 85
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 84
- 239000000243 solution Substances 0.000 description 79
- 238000006243 chemical reaction Methods 0.000 description 65
- 239000011541 reaction mixture Substances 0.000 description 58
- 235000019439 ethyl acetate Nutrition 0.000 description 47
- 239000003112 inhibitor Substances 0.000 description 45
- 239000003814 drug Substances 0.000 description 41
- 239000000651 prodrug Substances 0.000 description 40
- 229940002612 prodrug Drugs 0.000 description 40
- 239000012453 solvate Substances 0.000 description 39
- 239000002207 metabolite Substances 0.000 description 36
- 239000011734 sodium Substances 0.000 description 36
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 35
- 239000012298 atmosphere Substances 0.000 description 30
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 27
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 25
- 239000012074 organic phase Substances 0.000 description 24
- 239000007858 starting material Substances 0.000 description 23
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 22
- 239000012267 brine Substances 0.000 description 21
- 239000012043 crude product Substances 0.000 description 21
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 21
- 239000010410 layer Substances 0.000 description 20
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 19
- 238000004809 thin layer chromatography Methods 0.000 description 19
- 239000000706 filtrate Substances 0.000 description 18
- 238000002360 preparation method Methods 0.000 description 17
- 230000015572 biosynthetic process Effects 0.000 description 16
- 238000002953 preparative HPLC Methods 0.000 description 16
- 239000003795 chemical substances by application Substances 0.000 description 15
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 14
- 229940124597 therapeutic agent Drugs 0.000 description 14
- 239000002904 solvent Substances 0.000 description 13
- 230000003111 delayed effect Effects 0.000 description 12
- 239000012071 phase Substances 0.000 description 12
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 11
- 210000004027 cell Anatomy 0.000 description 11
- 239000003921 oil Substances 0.000 description 11
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 11
- 230000002829 reductive effect Effects 0.000 description 11
- 238000004440 column chromatography Methods 0.000 description 10
- 229940079593 drug Drugs 0.000 description 10
- 238000002347 injection Methods 0.000 description 10
- 239000007924 injection Substances 0.000 description 10
- 238000000926 separation method Methods 0.000 description 10
- 238000010898 silica gel chromatography Methods 0.000 description 10
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 9
- 239000004480 active ingredient Substances 0.000 description 9
- 238000013270 controlled release Methods 0.000 description 9
- GOTYRUGSSMKFNF-UHFFFAOYSA-N lenalidomide Chemical compound C1C=2C(N)=CC=CC=2C(=O)N1C1CCC(=O)NC1=O GOTYRUGSSMKFNF-UHFFFAOYSA-N 0.000 description 9
- 238000000746 purification Methods 0.000 description 9
- 208000023275 Autoimmune disease Diseases 0.000 description 8
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 8
- 239000000047 product Substances 0.000 description 8
- 238000010791 quenching Methods 0.000 description 8
- 239000000741 silica gel Substances 0.000 description 8
- 229910002027 silica gel Inorganic materials 0.000 description 8
- 108010002350 Interleukin-2 Proteins 0.000 description 7
- 229910002091 carbon monoxide Inorganic materials 0.000 description 7
- 238000012377 drug delivery Methods 0.000 description 7
- 238000001914 filtration Methods 0.000 description 7
- 238000003818 flash chromatography Methods 0.000 description 7
- 239000001257 hydrogen Substances 0.000 description 7
- 229960004942 lenalidomide Drugs 0.000 description 7
- 239000012044 organic layer Substances 0.000 description 7
- 238000002390 rotary evaporation Methods 0.000 description 7
- 208000011580 syndromic disease Diseases 0.000 description 7
- 238000001308 synthesis method Methods 0.000 description 7
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 6
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 6
- 241000124008 Mammalia Species 0.000 description 6
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 6
- 230000005764 inhibitory process Effects 0.000 description 6
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 6
- 229910052708 sodium Inorganic materials 0.000 description 6
- 238000013268 sustained release Methods 0.000 description 6
- 239000012730 sustained-release form Substances 0.000 description 6
- 206010061218 Inflammation Diseases 0.000 description 5
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 5
- 201000004681 Psoriasis Diseases 0.000 description 5
- 206010040070 Septic Shock Diseases 0.000 description 5
- 230000033115 angiogenesis Effects 0.000 description 5
- 239000003153 chemical reaction reagent Substances 0.000 description 5
- 239000000839 emulsion Substances 0.000 description 5
- 150000002148 esters Chemical class 0.000 description 5
- 230000004054 inflammatory process Effects 0.000 description 5
- 229960003301 nivolumab Drugs 0.000 description 5
- 229960002621 pembrolizumab Drugs 0.000 description 5
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 5
- 230000001225 therapeutic effect Effects 0.000 description 5
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 4
- KVOKEUYGMDGQSP-UHFFFAOYSA-N 1-(chloromethyl)-2-fluoro-4-methoxybenzene Chemical compound COC1=CC=C(CCl)C(F)=C1 KVOKEUYGMDGQSP-UHFFFAOYSA-N 0.000 description 4
- UNWQNFJBBWXFBG-UHFFFAOYSA-N 2-fluoro-4-methoxybenzaldehyde Chemical compound COC1=CC=C(C=O)C(F)=C1 UNWQNFJBBWXFBG-UHFFFAOYSA-N 0.000 description 4
- KEOQHLMCDYDCIP-UHFFFAOYSA-N 3-(chloromethyl)-2-fluoro-N-methylaniline hydrochloride Chemical compound Cl.CNc1cccc(CCl)c1F KEOQHLMCDYDCIP-UHFFFAOYSA-N 0.000 description 4
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 4
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 4
- 239000003098 androgen Substances 0.000 description 4
- 239000008346 aqueous phase Substances 0.000 description 4
- 206010003246 arthritis Diseases 0.000 description 4
- HUMNYLRZRPPJDN-UHFFFAOYSA-N benzaldehyde Chemical compound O=CC1=CC=CC=C1 HUMNYLRZRPPJDN-UHFFFAOYSA-N 0.000 description 4
- 210000003169 central nervous system Anatomy 0.000 description 4
- RIFGWPKJUGCATF-UHFFFAOYSA-N ethyl chloroformate Chemical compound CCOC(Cl)=O RIFGWPKJUGCATF-UHFFFAOYSA-N 0.000 description 4
- 239000000945 filler Substances 0.000 description 4
- 125000000524 functional group Chemical group 0.000 description 4
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 4
- 239000005457 ice water Substances 0.000 description 4
- 238000001727 in vivo Methods 0.000 description 4
- 229940043355 kinase inhibitor Drugs 0.000 description 4
- 201000000050 myeloid neoplasm Diseases 0.000 description 4
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 4
- KNCYXPMJDCCGSJ-UHFFFAOYSA-N piperidine-2,6-dione Chemical compound O=C1CCCC(=O)N1 KNCYXPMJDCCGSJ-UHFFFAOYSA-N 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 4
- 239000003826 tablet Substances 0.000 description 4
- HZSBSRAVNBUZRA-RQDPQJJXSA-J (1r,2r)-cyclohexane-1,2-diamine;tetrachloroplatinum(2+) Chemical compound Cl[Pt+2](Cl)(Cl)Cl.N[C@@H]1CCCC[C@H]1N HZSBSRAVNBUZRA-RQDPQJJXSA-J 0.000 description 3
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 3
- DAYKWXUTUQWXRG-UHFFFAOYSA-N 2-fluoro-3-(morpholin-4-ylmethyl)benzaldehyde Chemical compound FC1=C(C=O)C=CC=C1CN1CCOCC1 DAYKWXUTUQWXRG-UHFFFAOYSA-N 0.000 description 3
- LIHCOUDNHILORI-UHFFFAOYSA-N 2-fluoro-3-methoxybenzaldehyde Chemical compound COC1=CC=CC(C=O)=C1F LIHCOUDNHILORI-UHFFFAOYSA-N 0.000 description 3
- DKIQXHIAEMGZGO-UHFFFAOYSA-N 2-fluoro-5-methoxybenzaldehyde Chemical compound COC1=CC=C(F)C(C=O)=C1 DKIQXHIAEMGZGO-UHFFFAOYSA-N 0.000 description 3
- INHVAMVMSWYFSD-UHFFFAOYSA-N 4-[[3-(chloromethyl)-4-fluorophenyl]methyl]morpholine hydrochloride Chemical compound Cl.Fc1ccc(CN2CCOCC2)cc1CCl INHVAMVMSWYFSD-UHFFFAOYSA-N 0.000 description 3
- QBTAOZPJURTGME-UHFFFAOYSA-N 4-[[4-(chloromethyl)phenyl]methyl]morpholine;hydrochloride Chemical compound Cl.C1=CC(CCl)=CC=C1CN1CCOCC1 QBTAOZPJURTGME-UHFFFAOYSA-N 0.000 description 3
- IDPUKCWIGUEADI-UHFFFAOYSA-N 5-[bis(2-chloroethyl)amino]uracil Chemical compound ClCCN(CCCl)C1=CNC(=O)NC1=O IDPUKCWIGUEADI-UHFFFAOYSA-N 0.000 description 3
- 208000030507 AIDS Diseases 0.000 description 3
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 3
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 3
- 201000001320 Atherosclerosis Diseases 0.000 description 3
- 201000009030 Carcinoma Diseases 0.000 description 3
- 208000011231 Crohn disease Diseases 0.000 description 3
- 241000282414 Homo sapiens Species 0.000 description 3
- 108010000817 Leuprolide Proteins 0.000 description 3
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 3
- 208000002193 Pain Diseases 0.000 description 3
- 206010040047 Sepsis Diseases 0.000 description 3
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 150000008065 acid anhydrides Chemical class 0.000 description 3
- 239000000654 additive Substances 0.000 description 3
- 239000000853 adhesive Substances 0.000 description 3
- 235000001014 amino acid Nutrition 0.000 description 3
- 150000001413 amino acids Chemical class 0.000 description 3
- 125000003277 amino group Chemical group 0.000 description 3
- QGZKDVFQNNGYKY-UHFFFAOYSA-N ammonia Natural products N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 229960003901 dacarbazine Drugs 0.000 description 3
- 239000003405 delayed action preparation Substances 0.000 description 3
- 201000001981 dermatomyositis Diseases 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 229960004137 elotuzumab Drugs 0.000 description 3
- 210000002308 embryonic cell Anatomy 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 229960005277 gemcitabine Drugs 0.000 description 3
- 229940121372 histone deacetylase inhibitor Drugs 0.000 description 3
- 239000003276 histone deacetylase inhibitor Substances 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 description 3
- 229960004338 leuprorelin Drugs 0.000 description 3
- 239000002502 liposome Substances 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 229960001924 melphalan Drugs 0.000 description 3
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 3
- QOEAMLSLLJPIRF-UHFFFAOYSA-N methyl 5-fluoro-2-methyl-3-nitrobenzoate Chemical compound COC(=O)C1=CC(F)=CC([N+]([O-])=O)=C1C QOEAMLSLLJPIRF-UHFFFAOYSA-N 0.000 description 3
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 3
- 239000012299 nitrogen atmosphere Substances 0.000 description 3
- 229950008017 ormaplatin Drugs 0.000 description 3
- 229960002087 pertuzumab Drugs 0.000 description 3
- 239000002244 precipitate Substances 0.000 description 3
- 108090000765 processed proteins & peptides Proteins 0.000 description 3
- 108090000623 proteins and genes Proteins 0.000 description 3
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 238000004007 reversed phase HPLC Methods 0.000 description 3
- 238000012552 review Methods 0.000 description 3
- 229960002930 sirolimus Drugs 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 3
- 229960000575 trastuzumab Drugs 0.000 description 3
- 229910052722 tritium Inorganic materials 0.000 description 3
- 229960001055 uracil mustard Drugs 0.000 description 3
- AZYGOIQKPGPBTM-UHFFFAOYSA-N (2-fluoro-4-methoxyphenyl)methanol Chemical compound COC1=CC=C(CO)C(F)=C1 AZYGOIQKPGPBTM-UHFFFAOYSA-N 0.000 description 2
- GLHVGEFEOAJQCI-UHFFFAOYSA-N 2-(chloromethyl)-1-fluoro-4-methoxybenzene Chemical compound COC1=CC=C(F)C(CCl)=C1 GLHVGEFEOAJQCI-UHFFFAOYSA-N 0.000 description 2
- KIHYWYIZMGEISJ-UHFFFAOYSA-N 3-[7-[(2-fluoro-3-methoxyphenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=CC=C1OC KIHYWYIZMGEISJ-UHFFFAOYSA-N 0.000 description 2
- SZYHPVYNYZWHPO-UHFFFAOYSA-N 3-[7-[[2-fluoro-5-(3-morpholin-4-ylpropoxy)phenyl]methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=C(C=C1)OCCCN1CCOCC1 SZYHPVYNYZWHPO-UHFFFAOYSA-N 0.000 description 2
- CLPFFLWZZBQMAO-UHFFFAOYSA-N 4-(5,6,7,8-tetrahydroimidazo[1,5-a]pyridin-5-yl)benzonitrile Chemical compound C1=CC(C#N)=CC=C1C1N2C=NC=C2CCC1 CLPFFLWZZBQMAO-UHFFFAOYSA-N 0.000 description 2
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 2
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 2
- CMZCBPLTJBYJHZ-UHFFFAOYSA-N 5-fluoro-2-methyl-3-nitrobenzoic acid Chemical compound CC1=C(C(O)=O)C=C(F)C=C1[N+]([O-])=O CMZCBPLTJBYJHZ-UHFFFAOYSA-N 0.000 description 2
- RTHKPHCVZVYDFN-UHFFFAOYSA-N 9-amino-5-(2-aminopyrimidin-4-yl)pyrido[3',2':4,5]pyrrolo[1,2-c]pyrimidin-4-ol Chemical compound NC1=NC=CC(C=2C3=C(O)C=CN=C3N3C(N)=NC=CC3=2)=N1 RTHKPHCVZVYDFN-UHFFFAOYSA-N 0.000 description 2
- 102100032187 Androgen receptor Human genes 0.000 description 2
- 206010002556 Ankylosing Spondylitis Diseases 0.000 description 2
- 229940088872 Apoptosis inhibitor Drugs 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 2
- 239000004342 Benzoyl peroxide Substances 0.000 description 2
- OMPJBNCRMGITSC-UHFFFAOYSA-N Benzoylperoxide Chemical compound C=1C=CC=CC=1C(=O)OOC(=O)C1=CC=CC=C1 OMPJBNCRMGITSC-UHFFFAOYSA-N 0.000 description 2
- NPTGDIHRIHGDPG-UHFFFAOYSA-N BrCC1=C(C(=O)OC)C=C(C=C1O[Si](C)(C)C(C)(C)C)F Chemical compound BrCC1=C(C(=O)OC)C=C(C=C1O[Si](C)(C)C(C)(C)C)F NPTGDIHRIHGDPG-UHFFFAOYSA-N 0.000 description 2
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 2
- LDZJNMJIPNOYGA-UHFFFAOYSA-N C1=C(OC(C)=O)C(OC)=CC=C1C1=C2C3=CC(OC)=C(OC(C)=O)C=C3C=CN2C2=C1C(C=C(OC)C(OC(C)=O)=C1)=C1OC2=O Chemical compound C1=C(OC(C)=O)C(OC)=CC=C1C1=C2C3=CC(OC)=C(OC(C)=O)C=C3C=CN2C2=C1C(C=C(OC)C(OC(C)=O)=C1)=C1OC2=O LDZJNMJIPNOYGA-UHFFFAOYSA-N 0.000 description 2
- 206010006895 Cachexia Diseases 0.000 description 2
- 206010007559 Cardiac failure congestive Diseases 0.000 description 2
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 2
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 2
- 206010009900 Colitis ulcerative Diseases 0.000 description 2
- 206010009944 Colon cancer Diseases 0.000 description 2
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 2
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 2
- AEMOLEFTQBMNLQ-AQKNRBDQSA-N D-glucopyranuronic acid Chemical compound OC1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O AEMOLEFTQBMNLQ-AQKNRBDQSA-N 0.000 description 2
- 201000004624 Dermatitis Diseases 0.000 description 2
- 206010012438 Dermatitis atopic Diseases 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- 102000001301 EGF receptor Human genes 0.000 description 2
- 206010014824 Endotoxic shock Diseases 0.000 description 2
- 208000001640 Fibromyalgia Diseases 0.000 description 2
- 208000007465 Giant cell arteritis Diseases 0.000 description 2
- 102100039619 Granulocyte colony-stimulating factor Human genes 0.000 description 2
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 2
- 208000031886 HIV Infections Diseases 0.000 description 2
- 208000037357 HIV infectious disease Diseases 0.000 description 2
- 206010019280 Heart failures Diseases 0.000 description 2
- XLYOFNOQVPJJNP-ZSJDYOACSA-N Heavy water Chemical compound [2H]O[2H] XLYOFNOQVPJJNP-ZSJDYOACSA-N 0.000 description 2
- 206010020751 Hypersensitivity Diseases 0.000 description 2
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 2
- 206010021245 Idiopathic thrombocytopenic purpura Diseases 0.000 description 2
- 102000014150 Interferons Human genes 0.000 description 2
- 108010050904 Interferons Proteins 0.000 description 2
- 206010061252 Intraocular melanoma Diseases 0.000 description 2
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 2
- 239000002136 L01XE07 - Lapatinib Substances 0.000 description 2
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 2
- 208000019693 Lung disease Diseases 0.000 description 2
- 208000028018 Lymphocytic leukaemia Diseases 0.000 description 2
- 229930126263 Maytansine Natural products 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 208000003445 Mouth Neoplasms Diseases 0.000 description 2
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical class C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 2
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 2
- 208000012902 Nervous system disease Diseases 0.000 description 2
- 108091034117 Oligonucleotide Proteins 0.000 description 2
- 239000012270 PD-1 inhibitor Substances 0.000 description 2
- 239000012668 PD-1-inhibitor Substances 0.000 description 2
- 239000012271 PD-L1 inhibitor Substances 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- 102000011143 Placentin Human genes 0.000 description 2
- 108050001350 Placentin Proteins 0.000 description 2
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 2
- YZCKVEUIGOORGS-IGMARMGPSA-N Protium Chemical compound [1H] YZCKVEUIGOORGS-IGMARMGPSA-N 0.000 description 2
- 241000720974 Protium Species 0.000 description 2
- 208000015634 Rectal Neoplasms Diseases 0.000 description 2
- 206010063837 Reperfusion injury Diseases 0.000 description 2
- 201000000582 Retinoblastoma Diseases 0.000 description 2
- OTKJDMGTUTTYMP-ROUUACIJSA-N Safingol ( L-threo-sphinganine) Chemical compound CCCCCCCCCCCCCCC[C@H](O)[C@@H](N)CO OTKJDMGTUTTYMP-ROUUACIJSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- CBPNZQVSJQDFBE-FUXHJELOSA-N Temsirolimus Chemical compound C1C[C@@H](OC(=O)C(C)(CO)CO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 CBPNZQVSJQDFBE-FUXHJELOSA-N 0.000 description 2
- 208000031981 Thrombocytopenic Idiopathic Purpura Diseases 0.000 description 2
- 102000036693 Thrombopoietin Human genes 0.000 description 2
- 108010041111 Thrombopoietin Proteins 0.000 description 2
- 201000006704 Ulcerative Colitis Diseases 0.000 description 2
- 108091008605 VEGF receptors Proteins 0.000 description 2
- 206010047115 Vasculitis Diseases 0.000 description 2
- 208000036142 Viral infection Diseases 0.000 description 2
- MWVQMAWLNHACQK-UHFFFAOYSA-N [4-(morpholin-4-ylmethyl)phenyl]methanol Chemical compound C1=CC(CO)=CC=C1CN1CCOCC1 MWVQMAWLNHACQK-UHFFFAOYSA-N 0.000 description 2
- IBXPAFBDJCXCDW-MHFPCNPESA-A [Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].Cc1cn([C@H]2C[C@H](O)[C@@H](COP([S-])(=O)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3CO)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c3nc(N)[nH]c4=O)n3ccc(N)nc3=O)n3cnc4c3nc(N)[nH]c4=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3ccc(N)nc3=O)n3cnc4c3nc(N)[nH]c4=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O Chemical compound [Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].Cc1cn([C@H]2C[C@H](O)[C@@H](COP([S-])(=O)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3COP([O-])(=S)O[C@H]3C[C@@H](O[C@@H]3CO)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c3nc(N)[nH]c4=O)n3ccc(N)nc3=O)n3cnc4c3nc(N)[nH]c4=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3ccc(N)nc3=O)n3cnc4c3nc(N)[nH]c4=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O IBXPAFBDJCXCDW-MHFPCNPESA-A 0.000 description 2
- LQUKVJPOSNXBRZ-UHFFFAOYSA-N [Si](C)(C)(C(C)(C)C)OC=1C(=C(C(=O)OC)C=C(C=1)F)C Chemical compound [Si](C)(C)(C(C)(C)C)OC=1C(=C(C(=O)OC)C=C(C=1)F)C LQUKVJPOSNXBRZ-UHFFFAOYSA-N 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 239000000556 agonist Substances 0.000 description 2
- 150000001299 aldehydes Chemical class 0.000 description 2
- 229960000473 altretamine Drugs 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 150000001408 amides Chemical class 0.000 description 2
- 150000003862 amino acid derivatives Chemical class 0.000 description 2
- 108010080146 androgen receptors Proteins 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 239000000158 apoptosis inhibitor Substances 0.000 description 2
- 208000006673 asthma Diseases 0.000 description 2
- 201000008937 atopic dermatitis Diseases 0.000 description 2
- 201000003710 autoimmune thrombocytopenic purpura Diseases 0.000 description 2
- 229960002756 azacitidine Drugs 0.000 description 2
- KLNFSAOEKUDMFA-UHFFFAOYSA-N azanide;2-hydroxyacetic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OCC(O)=O KLNFSAOEKUDMFA-UHFFFAOYSA-N 0.000 description 2
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 235000019400 benzoyl peroxide Nutrition 0.000 description 2
- 229960001467 bortezomib Drugs 0.000 description 2
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 2
- 229960000455 brentuximab vedotin Drugs 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 239000007894 caplet Substances 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 229960004562 carboplatin Drugs 0.000 description 2
- 229960005243 carmustine Drugs 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 238000001516 cell proliferation assay Methods 0.000 description 2
- 238000012054 celltiter-glo Methods 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000004296 chiral HPLC Methods 0.000 description 2
- 229960004630 chlorambucil Drugs 0.000 description 2
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 2
- 208000006990 cholangiocarcinoma Diseases 0.000 description 2
- 229960004316 cisplatin Drugs 0.000 description 2
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 2
- 206010009887 colitis Diseases 0.000 description 2
- 239000003086 colorant Substances 0.000 description 2
- 239000010779 crude oil Substances 0.000 description 2
- 229960004397 cyclophosphamide Drugs 0.000 description 2
- 229960000684 cytarabine Drugs 0.000 description 2
- 229940127089 cytotoxic agent Drugs 0.000 description 2
- 238000006356 dehydrogenation reaction Methods 0.000 description 2
- 229960003957 dexamethasone Drugs 0.000 description 2
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- NOPFSRXAKWQILS-UHFFFAOYSA-N docosan-1-ol Chemical compound CCCCCCCCCCCCCCCCCCCCCCO NOPFSRXAKWQILS-UHFFFAOYSA-N 0.000 description 2
- 229960004679 doxorubicin Drugs 0.000 description 2
- 229960001776 edrecolomab Drugs 0.000 description 2
- 229940121647 egfr inhibitor Drugs 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 239000002702 enteric coating Substances 0.000 description 2
- 238000009505 enteric coating Methods 0.000 description 2
- 229940082789 erbitux Drugs 0.000 description 2
- 229940011871 estrogen Drugs 0.000 description 2
- 239000000262 estrogen Substances 0.000 description 2
- 229950011548 fadrozole Drugs 0.000 description 2
- 239000000796 flavoring agent Substances 0.000 description 2
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 2
- CHPZKNULDCNCBW-UHFFFAOYSA-N gallium nitrate Chemical compound [Ga+3].[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O CHPZKNULDCNCBW-UHFFFAOYSA-N 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- 208000024908 graft versus host disease Diseases 0.000 description 2
- 239000003979 granulating agent Substances 0.000 description 2
- 229940022353 herceptin Drugs 0.000 description 2
- UUVWYPNAQBNQJQ-UHFFFAOYSA-N hexamethylmelamine Chemical compound CN(C)C1=NC(N(C)C)=NC(N(C)C)=N1 UUVWYPNAQBNQJQ-UHFFFAOYSA-N 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 208000033519 human immunodeficiency virus infectious disease Diseases 0.000 description 2
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 2
- 229960001101 ifosfamide Drugs 0.000 description 2
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 2
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 2
- 239000007943 implant Substances 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 229940079322 interferon Drugs 0.000 description 2
- 239000013067 intermediate product Substances 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- GURKHSYORGJETM-WAQYZQTGSA-N irinotecan hydrochloride (anhydrous) Chemical compound Cl.C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 GURKHSYORGJETM-WAQYZQTGSA-N 0.000 description 2
- 208000002551 irritable bowel syndrome Diseases 0.000 description 2
- TWBYWOBDOCUKOW-UHFFFAOYSA-N isonicotinic acid Chemical compound OC(=O)C1=CC=NC=C1 TWBYWOBDOCUKOW-UHFFFAOYSA-N 0.000 description 2
- 108010021336 lanreotide Proteins 0.000 description 2
- BCFGMOOMADDAQU-UHFFFAOYSA-N lapatinib Chemical compound O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 BCFGMOOMADDAQU-UHFFFAOYSA-N 0.000 description 2
- 208000012987 lip and oral cavity carcinoma Diseases 0.000 description 2
- 229960002247 lomustine Drugs 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- 206010025135 lupus erythematosus Diseases 0.000 description 2
- 208000003747 lymphoid leukemia Diseases 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- WKPWGQKGSOKKOO-RSFHAFMBSA-N maytansine Chemical compound CO[C@@H]([C@@]1(O)C[C@](OC(=O)N1)([C@H]([C@@H]1O[C@@]1(C)[C@@H](OC(=O)[C@H](C)N(C)C(C)=O)CC(=O)N1C)C)[H])\C=C\C=C(C)\CC2=CC(OC)=C(Cl)C1=C2 WKPWGQKGSOKKOO-RSFHAFMBSA-N 0.000 description 2
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical compound ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 2
- FCGIVHSBEKGQMZ-UHFFFAOYSA-N methyl 2-(bromomethyl)-3-nitrobenzoate Chemical compound COC(=O)C1=CC=CC([N+]([O-])=O)=C1CBr FCGIVHSBEKGQMZ-UHFFFAOYSA-N 0.000 description 2
- QHOSCSXREWAFFC-UHFFFAOYSA-N methyl 2-(bromomethyl)-5-fluoro-3-nitrobenzoate Chemical compound COC(=O)C1=CC(F)=CC([N+]([O-])=O)=C1CBr QHOSCSXREWAFFC-UHFFFAOYSA-N 0.000 description 2
- KKIKUUCOPAYYIW-UHFFFAOYSA-N methyl 3-amino-5-fluoro-2-methylbenzoate Chemical compound COC(=O)C1=CC(F)=CC(N)=C1C KKIKUUCOPAYYIW-UHFFFAOYSA-N 0.000 description 2
- GGDSIQSMQPTJQF-UHFFFAOYSA-N methyl 5-fluoro-3-hydroxy-2-methylbenzoate Chemical compound FC=1C=C(C(=C(C(=O)OC)C=1)C)O GGDSIQSMQPTJQF-UHFFFAOYSA-N 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 229950007221 nedaplatin Drugs 0.000 description 2
- 230000001613 neoplastic effect Effects 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 229960003347 obinutuzumab Drugs 0.000 description 2
- 229960000435 oblimersen Drugs 0.000 description 2
- 229960002450 ofatumumab Drugs 0.000 description 2
- 229960001756 oxaliplatin Drugs 0.000 description 2
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 2
- 208000008443 pancreatic carcinoma Diseases 0.000 description 2
- 229960001972 panitumumab Drugs 0.000 description 2
- 229960005184 panobinostat Drugs 0.000 description 2
- FPOHNWQLNRZRFC-ZHACJKMWSA-N panobinostat Chemical compound CC=1NC2=CC=CC=C2C=1CCNCC1=CC=C(\C=C\C(=O)NO)C=C1 FPOHNWQLNRZRFC-ZHACJKMWSA-N 0.000 description 2
- QNGNSVIICDLXHT-UHFFFAOYSA-N para-ethylbenzaldehyde Natural products CCC1=CC=C(C=O)C=C1 QNGNSVIICDLXHT-UHFFFAOYSA-N 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 229940121655 pd-1 inhibitor Drugs 0.000 description 2
- 229940121656 pd-l1 inhibitor Drugs 0.000 description 2
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- 230000004962 physiological condition Effects 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- 230000000770 proinflammatory effect Effects 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- 235000018102 proteins Nutrition 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 238000001959 radiotherapy Methods 0.000 description 2
- 239000002464 receptor antagonist Substances 0.000 description 2
- 229940044551 receptor antagonist Drugs 0.000 description 2
- 230000000306 recurrent effect Effects 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 229960004641 rituximab Drugs 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 201000000306 sarcoidosis Diseases 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- 229950003647 semaxanib Drugs 0.000 description 2
- WUWDLXZGHZSWQZ-WQLSENKSSA-N semaxanib Chemical compound N1C(C)=CC(C)=C1\C=C/1C2=CC=CC=C2NC\1=O WUWDLXZGHZSWQZ-WQLSENKSSA-N 0.000 description 2
- 230000036303 septic shock Effects 0.000 description 2
- NDVLTYZPCACLMA-UHFFFAOYSA-N silver oxide Chemical compound [O-2].[Ag+].[Ag+] NDVLTYZPCACLMA-UHFFFAOYSA-N 0.000 description 2
- 210000003491 skin Anatomy 0.000 description 2
- XBUIKNRVGYFSHL-IAVQPKKASA-M sodium;[(1e,3r,4r,6r,7z,9z,11e)-3,6,13-trihydroxy-3-methyl-1-[(2r)-6-oxo-2,3-dihydropyran-2-yl]trideca-1,7,9,11-tetraen-4-yl] hydrogen phosphate Chemical compound [Na+].OC/C=C/C=C\C=C/[C@H](O)C[C@@H](OP(O)([O-])=O)[C@@](O)(C)\C=C\[C@H]1CC=CC(=O)O1 XBUIKNRVGYFSHL-IAVQPKKASA-M 0.000 description 2
- 239000007901 soft capsule Substances 0.000 description 2
- 206010041823 squamous cell carcinoma Diseases 0.000 description 2
- 230000006641 stabilisation Effects 0.000 description 2
- 238000011105 stabilization Methods 0.000 description 2
- 230000000087 stabilizing effect Effects 0.000 description 2
- 239000011550 stock solution Substances 0.000 description 2
- PVYJZLYGTZKPJE-UHFFFAOYSA-N streptonigrin Chemical compound C=1C=C2C(=O)C(OC)=C(N)C(=O)C2=NC=1C(C=1N)=NC(C(O)=O)=C(C)C=1C1=CC=C(OC)C(OC)=C1O PVYJZLYGTZKPJE-UHFFFAOYSA-N 0.000 description 2
- 229960001052 streptozocin Drugs 0.000 description 2
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 2
- 238000000859 sublimation Methods 0.000 description 2
- 230000008022 sublimation Effects 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 206010043207 temporal arteritis Diseases 0.000 description 2
- NWLREMKEFHDCSV-RGMNGODLSA-N tert-butyl (4s)-4,5-diamino-5-oxopentanoate;hydrochloride Chemical compound Cl.CC(C)(C)OC(=O)CC[C@H](N)C(N)=O NWLREMKEFHDCSV-RGMNGODLSA-N 0.000 description 2
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 2
- 208000008732 thymoma Diseases 0.000 description 2
- 210000001685 thyroid gland Anatomy 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- TVPNFKRGOFJQOO-UHFFFAOYSA-N topsentin b1 Chemical compound C1=CC=C2C(C3=CN=C(N3)C(=O)C=3C4=CC=C(C=C4NC=3)O)=CNC2=C1 TVPNFKRGOFJQOO-UHFFFAOYSA-N 0.000 description 2
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 2
- 208000037965 uterine sarcoma Diseases 0.000 description 2
- 230000009385 viral infection Effects 0.000 description 2
- BMKDZUISNHGIBY-ZETCQYMHSA-N (+)-dexrazoxane Chemical compound C([C@H](C)N1CC(=O)NC(=O)C1)N1CC(=O)NC(=O)C1 BMKDZUISNHGIBY-ZETCQYMHSA-N 0.000 description 1
- MNHVIVWFCMBFCV-AVGNSLFASA-N (2S)-2-[[(2S)-2-[[(4S)-4-amino-4-carboxybutanoyl]amino]-6-diazo-5-oxohexanoyl]amino]-6-diazo-5-oxohexanoic acid Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CCC(=O)C=[N+]=[N-])C(=O)N[C@@H](CCC(=O)C=[N+]=[N-])C(O)=O MNHVIVWFCMBFCV-AVGNSLFASA-N 0.000 description 1
- MXABZXILAJGOTL-AUYMZICSSA-N (2S)-N-[(2S)-1-[(2S)-1-[(2S,3S)-1-[(2S)-1-[2-[(2S)-1,3-dihydroxy-1-[(E)-1-hydroxy-1-[(2S,3S)-1-hydroxy-3-methyl-1-[[(2Z,6S,9S,12R)-5,8,11-trihydroxy-9-(2-methylpropyl)-6-propan-2-yl-1-thia-4,7,10-triazacyclotrideca-2,4,7,10-tetraen-12-yl]imino]pentan-2-yl]iminobut-2-en-2-yl]iminopropan-2-yl]imino-2-hydroxyethyl]imino-1,5-dihydroxy-5-iminopentan-2-yl]imino-1-hydroxy-3-methylpentan-2-yl]imino-1-hydroxy-3-methylbutan-2-yl]imino-1-hydroxy-3-phenylpropan-2-yl]-2-[[(2S)-2-[[(2S)-2-[[(Z)-2-[[(2S)-2-[[(Z)-2-[[(2S)-2-[[[(2S)-1-[(Z)-2-[[(2S)-2-(dimethylamino)-1-hydroxypropylidene]amino]but-2-enoyl]pyrrolidin-2-yl]-hydroxymethylidene]amino]-1-hydroxypropylidene]amino]-1-hydroxybut-2-enylidene]amino]-1-hydroxy-3-phenylpropylidene]amino]-1-hydroxybut-2-enylidene]amino]-1-hydroxy-3-methylbutylidene]amino]-1-hydroxypropylidene]amino]pentanediimidic acid Chemical compound CC[C@H](C)[C@H](\N=C(/O)[C@@H](\N=C(/O)[C@H](Cc1ccccc1)\N=C(/O)[C@H](CCC(O)=N)\N=C(/O)[C@H](C)\N=C(/O)[C@@H](\N=C(/O)\C(=C\C)\N=C(/O)[C@H](Cc1ccccc1)\N=C(/O)\C(=C\C)\N=C(/O)[C@H](C)\N=C(/O)[C@@H]1CCCN1C(=O)\C(=C\C)\N=C(/O)[C@H](C)N(C)C)C(C)C)C(C)C)C(\O)=N\[C@@H](CCC(O)=N)C(\O)=N\C\C(O)=N\[C@@H](CO)C(\O)=N\C(=C\C)\C(\O)=N\[C@@H]([C@@H](C)CC)C(\O)=N\[C@H]1CS\C=C/N=C(O)\[C@@H](\N=C(O)/[C@H](CC(C)C)\N=C1\O)C(C)C MXABZXILAJGOTL-AUYMZICSSA-N 0.000 description 1
- LCADVYTXPLBAGB-AUQKUMLUSA-N (2e,4e,6z,8e,10e,14e)-13-hydroxy-n-(1-hydroxypropan-2-yl)-2,10,12,14,16-pentamethyl-18-phenyloctadeca-2,4,6,8,10,14-hexaenamide Chemical compound OCC(C)NC(=O)C(\C)=C\C=C\C=C/C=C/C(/C)=C/C(C)C(O)C(\C)=C\C(C)CCC1=CC=CC=C1 LCADVYTXPLBAGB-AUQKUMLUSA-N 0.000 description 1
- FKHUGQZRBPETJR-RXSRXONKSA-N (2r)-2-[[(4r)-4-[[(2s)-2-[[(2r)-2-[(3r,4r,5s,6r)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxypropanoyl]amino]propanoyl]amino]-5-amino-5-oxopentanoyl]amino]-6-(octadecanoylamino)hexanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(=O)NCCCC[C@H](C(O)=O)NC(=O)CC[C@H](C(N)=O)NC(=O)[C@H](C)NC(=O)[C@@H](C)O[C@H]1[C@H](O)[C@@H](CO)OC(O)[C@@H]1NC(C)=O FKHUGQZRBPETJR-RXSRXONKSA-N 0.000 description 1
- RCGXNDQKCXNWLO-WLEIXIPESA-N (2r)-n-[(2s)-5-amino-1-[[(2r,3r)-1-[[(3s,6z,9s,12r,15r,18r,19s)-9-benzyl-15-[(2r)-butan-2-yl]-6-ethylidene-19-methyl-2,5,8,11,14,17-hexaoxo-3,12-di(propan-2-yl)-1-oxa-4,7,10,13,16-pentazacyclononadec-18-yl]amino]-3-methyl-1-oxopentan-2-yl]amino]-1-oxopent Chemical compound N([C@@H](CCCN)C(=O)N[C@H]([C@H](C)CC)C(=O)N[C@H]1C(N[C@@H](C(=O)N[C@@H](C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)NC(/C(=O)N[C@H](C(=O)O[C@H]1C)C(C)C)=C\C)C(C)C)[C@H](C)CC)=O)C(=O)[C@H]1CCCN1C(=O)[C@H](NC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@H](NC(=O)CCCC(C)C)C(C)C)[C@@H](C)O)C(C)C)C(C)C RCGXNDQKCXNWLO-WLEIXIPESA-N 0.000 description 1
- NOENHWMKHNSHGX-IZOOSHNJSA-N (2s)-1-[(2s)-2-[[(2s)-2-[[(2r)-2-[[(2r)-2-[[(2s)-2-[[(2r)-2-[[(2s)-2-[[(2r)-2-acetamido-3-naphthalen-2-ylpropanoyl]amino]-3-(4-chlorophenyl)propanoyl]amino]-3-pyridin-3-ylpropanoyl]amino]-3-hydroxypropanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-6-(ca Chemical compound C([C@H](C(=O)N[C@H](CCCCNC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCNC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@H](C)C(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](CC=1C=NC=CC=1)NC(=O)[C@H](CC=1C=CC(Cl)=CC=1)NC(=O)[C@@H](CC=1C=C2C=CC=CC2=CC=1)NC(C)=O)C1=CC=C(O)C=C1 NOENHWMKHNSHGX-IZOOSHNJSA-N 0.000 description 1
- ZUQBAQVRAURMCL-DOMZBBRYSA-N (2s)-2-[[4-[2-[(6r)-2-amino-4-oxo-5,6,7,8-tetrahydro-1h-pyrido[2,3-d]pyrimidin-6-yl]ethyl]benzoyl]amino]pentanedioic acid Chemical compound C([C@@H]1CC=2C(=O)N=C(NC=2NC1)N)CC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 ZUQBAQVRAURMCL-DOMZBBRYSA-N 0.000 description 1
- JRBXPUUAYKCCLQ-QMMMGPOBSA-N (2s)-2-amino-2-[3-hydroxy-4-(hydroxymethyl)phenyl]acetic acid Chemical compound OC(=O)[C@@H](N)C1=CC=C(CO)C(O)=C1 JRBXPUUAYKCCLQ-QMMMGPOBSA-N 0.000 description 1
- BGGHCRNCRWQABU-JTQLQIEISA-N (2s)-2-amino-5-oxo-5-phenylmethoxypentanoic acid Chemical compound OC(=O)[C@@H](N)CCC(=O)OCC1=CC=CC=C1 BGGHCRNCRWQABU-JTQLQIEISA-N 0.000 description 1
- HJNZCKLMRAOTMA-BRBGIFQRSA-N (2s)-n-[(2s)-1-[[(2s)-1-[[(2s)-1-[[(2s)-1-[[(2r)-1-[[(2s)-1-[[(2s)-5-(diaminomethylideneamino)-1-[(2s)-2-(ethylcarbamoyl)pyrrolidin-1-yl]-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-3-(2-methyl-1h-indol-3-yl)-1-oxopropan-2-yl]amino]-3-(4-hydr Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=C(C)NC2=CC=CC=C12 HJNZCKLMRAOTMA-BRBGIFQRSA-N 0.000 description 1
- HWMMBHOXHRVLCU-QOUANJGESA-N (2s,4s,5s)-4-[(1e,3e,5e)-7-[(2r,6r)-6-[(2r,3s,4ar,12bs)-2,3,4a,8,12b-pentahydroxy-3-methyl-1,7,12-trioxo-2,4-dihydrobenzo[a]anthracen-9-yl]-2-methyloxan-3-yl]oxy-7-oxohepta-1,3,5-trienyl]-2,5-dimethyl-1,3-dioxolane-2-carboxylic acid Chemical compound C[C@@H]1O[C@](C)(C(O)=O)O[C@H]1\C=C\C=C\C=C\C(=O)OC1[C@@H](C)O[C@@H](C=2C(=C3C(=O)C4=C([C@]5(C(=O)[C@H](O)[C@@](C)(O)C[C@@]5(O)C=C4)O)C(=O)C3=CC=2)O)CC1 HWMMBHOXHRVLCU-QOUANJGESA-N 0.000 description 1
- NAALWFYYHHJEFQ-ZASNTINBSA-N (2s,5r,6r)-6-[[(2r)-2-[[6-[4-[bis(2-hydroxyethyl)sulfamoyl]phenyl]-2-oxo-1h-pyridine-3-carbonyl]amino]-2-(4-hydroxyphenyl)acetyl]amino]-3,3-dimethyl-7-oxo-4-thia-1-azabicyclo[3.2.0]heptane-2-carboxylic acid Chemical compound N([C@@H](C(=O)N[C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C=1C=CC(O)=CC=1)C(=O)C(C(N1)=O)=CC=C1C1=CC=C(S(=O)(=O)N(CCO)CCO)C=C1 NAALWFYYHHJEFQ-ZASNTINBSA-N 0.000 description 1
- LBVRLMKZSYVOCL-GOSISDBHSA-N (3R)-3-[7-[(2-fluoro-5-methoxyphenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(CNC2=C3CN(C(C3=CC=C2)=O)[C@H]2C(NC(CC2)=O)=O)C=C(C=C1)OC LBVRLMKZSYVOCL-GOSISDBHSA-N 0.000 description 1
- LBVRLMKZSYVOCL-SFHVURJKSA-N (3S)-3-[7-[(2-fluoro-5-methoxyphenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound C1=C(C(=CC(=C1)OC)CNC1=C2C(=CC=C1)C(=O)N(C2)[C@@H]1C(=O)NC(=O)CC1)F LBVRLMKZSYVOCL-SFHVURJKSA-N 0.000 description 1
- SGQYVCBNYMIUQV-QFIPXVFZSA-N (3S)-3-[7-[[4-(morpholin-4-ylmethyl)phenyl]methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound O1CCN(CC1)CC1=CC=C(CNC2=C3CN(C(C3=CC=C2)=O)[C@@H]2C(NC(CC2)=O)=O)C=C1 SGQYVCBNYMIUQV-QFIPXVFZSA-N 0.000 description 1
- FELGMEQIXOGIFQ-CYBMUJFWSA-N (3r)-9-methyl-3-[(2-methylimidazol-1-yl)methyl]-2,3-dihydro-1h-carbazol-4-one Chemical compound CC1=NC=CN1C[C@@H]1C(=O)C(C=2C(=CC=CC=2)N2C)=C2CC1 FELGMEQIXOGIFQ-CYBMUJFWSA-N 0.000 description 1
- TVIRNGFXQVMMGB-OFWIHYRESA-N (3s,6r,10r,13e,16s)-16-[(2r,3r,4s)-4-chloro-3-hydroxy-4-phenylbutan-2-yl]-10-[(3-chloro-4-methoxyphenyl)methyl]-6-methyl-3-(2-methylpropyl)-1,4-dioxa-8,11-diazacyclohexadec-13-ene-2,5,9,12-tetrone Chemical compound C1=C(Cl)C(OC)=CC=C1C[C@@H]1C(=O)NC[C@@H](C)C(=O)O[C@@H](CC(C)C)C(=O)O[C@H]([C@H](C)[C@@H](O)[C@@H](Cl)C=2C=CC=CC=2)C/C=C/C(=O)N1 TVIRNGFXQVMMGB-OFWIHYRESA-N 0.000 description 1
- FRCJDPPXHQGEKS-BCHFMIIMSA-N (4S,5R)-N-[4-[(2,3-dihydroxybenzoyl)amino]butyl]-N-[3-[(2,3-dihydroxybenzoyl)amino]propyl]-2-(2-hydroxyphenyl)-5-methyl-4,5-dihydro-1,3-oxazole-4-carboxamide Chemical compound C[C@H]1OC(=N[C@@H]1C(=O)N(CCCCNC(=O)c1cccc(O)c1O)CCCNC(=O)c1cccc(O)c1O)c1ccccc1O FRCJDPPXHQGEKS-BCHFMIIMSA-N 0.000 description 1
- DEQANNDTNATYII-OULOTJBUSA-N (4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-19-[[(2r)-2-amino-3-phenylpropanoyl]amino]-16-benzyl-n-[(2r,3r)-1,3-dihydroxybutan-2-yl]-7-[(1r)-1-hydroxyethyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-1,2-dithia-5,8,11,14,17-pentazacycloicosane-4-carboxa Chemical compound C([C@@H](N)C(=O)N[C@H]1CSSC[C@H](NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](CC=2C3=CC=CC=C3NC=2)NC(=O)[C@H](CC=2C=CC=CC=2)NC1=O)C(=O)N[C@H](CO)[C@H](O)C)C1=CC=CC=C1 DEQANNDTNATYII-OULOTJBUSA-N 0.000 description 1
- SWXOGPJRIDTIRL-DOUNNPEJSA-N (4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-n-[(2s)-1-amino-3-(1h-indol-3-yl)-1-oxopropan-2-yl]-19-[[(2r)-2-amino-3-phenylpropanoyl]amino]-16-[(4-hydroxyphenyl)methyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-7-propan-2-yl-1,2-dithia-5,8,11,14,17-pent Chemical compound C([C@H]1C(=O)N[C@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](N)CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(N)=O)=O)C(C)C)C1=CC=C(O)C=C1 SWXOGPJRIDTIRL-DOUNNPEJSA-N 0.000 description 1
- PUDHBTGHUJUUFI-SCTWWAJVSA-N (4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-n-[(2s,3r)-1-amino-3-hydroxy-1-oxobutan-2-yl]-19-[[(2r)-2-amino-3-naphthalen-2-ylpropanoyl]amino]-16-[(4-hydroxyphenyl)methyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-7-propan-2-yl-1,2-dithia-5,8,11,14,17-p Chemical compound C([C@H]1C(=O)N[C@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](N)CC=1C=C2C=CC=CC2=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(N)=O)=O)C(C)C)C1=CC=C(O)C=C1 PUDHBTGHUJUUFI-SCTWWAJVSA-N 0.000 description 1
- LKBBOPGQDRPCDS-YAOXHJNESA-N (7s,9r,10r)-7-[(2r,4s,5s,6s)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-9-ethyl-4,6,9,10,11-pentahydroxy-8,10-dihydro-7h-tetracene-5,12-dione Chemical compound O([C@H]1C[C@]([C@@H](C2=C(O)C=3C(=O)C4=CC=CC(O)=C4C(=O)C=3C(O)=C21)O)(O)CC)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 LKBBOPGQDRPCDS-YAOXHJNESA-N 0.000 description 1
- MWWSFMDVAYGXBV-FGBSZODSSA-N (7s,9s)-7-[(2r,4s,5r,6s)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-6,9,11-trihydroxy-9-(2-hydroxyacetyl)-4-methoxy-8,10-dihydro-7h-tetracene-5,12-dione;hydron;chloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 MWWSFMDVAYGXBV-FGBSZODSSA-N 0.000 description 1
- GYPCWHHQAVLMKO-XXKQIVDLSA-N (7s,9s)-7-[(2r,4s,5s,6s)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-6,9,11-trihydroxy-9-[(e)-n-[(1-hydroxy-2,2,6,6-tetramethylpiperidin-4-ylidene)amino]-c-methylcarbonimidoyl]-4-methoxy-8,10-dihydro-7h-tetracene-5,12-dione;hydrochloride Chemical group Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(\C)=N\N=C1CC(C)(C)N(O)C(C)(C)C1)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 GYPCWHHQAVLMKO-XXKQIVDLSA-N 0.000 description 1
- RCFNNLSZHVHCEK-YGCMNLPTSA-N (7s,9s)-7-[(2s,4r,6s)-4-amino-6-methyloxan-2-yl]oxy-6,9,11-trihydroxy-9-(2-hydroxyacetyl)-4-methoxy-8,10-dihydro-7h-tetracene-5,12-dione;hydrochloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)C[C@H](C)O1 RCFNNLSZHVHCEK-YGCMNLPTSA-N 0.000 description 1
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 1
- VHZXNQKVFDBFIK-NBBHSKLNSA-N (8r,9s,10r,13s,14s,16r)-16-fluoro-10,13-dimethyl-1,2,3,4,7,8,9,11,12,14,15,16-dodecahydrocyclopenta[a]phenanthren-17-one Chemical compound C1CCC[C@]2(C)[C@H]3CC[C@](C)(C([C@H](F)C4)=O)[C@@H]4[C@@H]3CC=C21 VHZXNQKVFDBFIK-NBBHSKLNSA-N 0.000 description 1
- LKJPYSCBVHEWIU-KRWDZBQOSA-N (R)-bicalutamide Chemical compound C([C@@](O)(C)C(=O)NC=1C=C(C(C#N)=CC=1)C(F)(F)F)S(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-KRWDZBQOSA-N 0.000 description 1
- DYLIWHYUXAJDOJ-OWOJBTEDSA-N (e)-4-(6-aminopurin-9-yl)but-2-en-1-ol Chemical compound NC1=NC=NC2=C1N=CN2C\C=C\CO DYLIWHYUXAJDOJ-OWOJBTEDSA-N 0.000 description 1
- BWDQBBCUWLSASG-MDZDMXLPSA-N (e)-n-hydroxy-3-[4-[[2-hydroxyethyl-[2-(1h-indol-3-yl)ethyl]amino]methyl]phenyl]prop-2-enamide Chemical compound C=1NC2=CC=CC=C2C=1CCN(CCO)CC1=CC=C(\C=C\C(=O)NO)C=C1 BWDQBBCUWLSASG-MDZDMXLPSA-N 0.000 description 1
- OJRZEKJECRTBPJ-NGAMADIESA-N (z,5s)-5-acetamido-1-diazonio-6-hydroxy-6-oxohex-1-en-2-olate Chemical compound CC(=O)N[C@H](C(O)=O)CC\C([O-])=C\[N+]#N OJRZEKJECRTBPJ-NGAMADIESA-N 0.000 description 1
- SCYULBFZEHDVBN-UHFFFAOYSA-N 1,1-Dichloroethane Chemical compound CC(Cl)Cl SCYULBFZEHDVBN-UHFFFAOYSA-N 0.000 description 1
- KPZGRMZPZLOPBS-UHFFFAOYSA-N 1,3-dichloro-2,2-bis(chloromethyl)propane Chemical compound ClCC(CCl)(CCl)CCl KPZGRMZPZLOPBS-UHFFFAOYSA-N 0.000 description 1
- UOAFGUOASVSLPK-UHFFFAOYSA-N 1-(2-chloroethyl)-3-(2,2-dimethylpropyl)-1-nitrosourea Chemical compound CC(C)(C)CNC(=O)N(N=O)CCCl UOAFGUOASVSLPK-UHFFFAOYSA-N 0.000 description 1
- YQYBWJPESSJLTK-HXFLIBJXSA-N 1-(2-chloroethyl)-3-[(2r,3s,4r,6s)-3-hydroxy-2-(hydroxymethyl)-6-methoxyoxan-4-yl]-1-nitrosourea Chemical compound CO[C@@H]1C[C@@H](NC(=O)N(CCCl)N=O)[C@H](O)[C@@H](CO)O1 YQYBWJPESSJLTK-HXFLIBJXSA-N 0.000 description 1
- RCLLNBVPCJDIPX-UHFFFAOYSA-N 1-(2-chloroethyl)-3-[2-(dimethylsulfamoyl)ethyl]-1-nitrosourea Chemical compound CN(C)S(=O)(=O)CCNC(=O)N(N=O)CCCl RCLLNBVPCJDIPX-UHFFFAOYSA-N 0.000 description 1
- JQJSFAJISYZPER-UHFFFAOYSA-N 1-(4-chlorophenyl)-3-(2,3-dihydro-1h-inden-5-ylsulfonyl)urea Chemical compound C1=CC(Cl)=CC=C1NC(=O)NS(=O)(=O)C1=CC=C(CCC2)C2=C1 JQJSFAJISYZPER-UHFFFAOYSA-N 0.000 description 1
- SNYUHPPZINRDSG-UHFFFAOYSA-N 1-(oxiran-2-ylmethyl)-4-[1-(oxiran-2-ylmethyl)piperidin-4-yl]piperidine Chemical compound C1CC(C2CCN(CC3OC3)CC2)CCN1CC1CO1 SNYUHPPZINRDSG-UHFFFAOYSA-N 0.000 description 1
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 1
- TUSDEZXZIZRFGC-UHFFFAOYSA-N 1-O-galloyl-3,6-(R)-HHDP-beta-D-glucose Natural products OC1C(O2)COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC1C(O)C2OC(=O)C1=CC(O)=C(O)C(O)=C1 TUSDEZXZIZRFGC-UHFFFAOYSA-N 0.000 description 1
- ZKFNOUUKULVDOB-UHFFFAOYSA-N 1-amino-1-phenylmethyl phosphonic acid Chemical compound OP(=O)(O)C(N)C1=CC=CC=C1 ZKFNOUUKULVDOB-UHFFFAOYSA-N 0.000 description 1
- 101710175516 14 kDa zinc-binding protein Proteins 0.000 description 1
- OOMDVERDMZLRFX-UHFFFAOYSA-N 2,2-bis(aminomethyl)propane-1,3-diol;cyclobutane-1,1-dicarboxylic acid;platinum Chemical compound [Pt].NCC(CN)(CO)CO.OC(=O)C1(C(O)=O)CCC1 OOMDVERDMZLRFX-UHFFFAOYSA-N 0.000 description 1
- VKDGNNYJFSHYKD-UHFFFAOYSA-N 2,5-diamino-2-(difluoromethyl)pentanoic acid;hydron;chloride Chemical compound Cl.NCCCC(N)(C(F)F)C(O)=O VKDGNNYJFSHYKD-UHFFFAOYSA-N 0.000 description 1
- WXTMDXOMEHJXQO-UHFFFAOYSA-N 2,5-dihydroxybenzoic acid Chemical compound OC(=O)C1=CC(O)=CC=C1O WXTMDXOMEHJXQO-UHFFFAOYSA-N 0.000 description 1
- NJWBUDCAWGTQAS-UHFFFAOYSA-N 2-(chrysen-6-ylmethylamino)-2-methylpropane-1,3-diol;methanesulfonic acid Chemical compound CS(O)(=O)=O.C1=CC=C2C(CNC(CO)(CO)C)=CC3=C(C=CC=C4)C4=CC=C3C2=C1 NJWBUDCAWGTQAS-UHFFFAOYSA-N 0.000 description 1
- QXLQZLBNPTZMRK-UHFFFAOYSA-N 2-[(dimethylamino)methyl]-1-(2,4-dimethylphenyl)prop-2-en-1-one Chemical compound CN(C)CC(=C)C(=O)C1=CC=C(C)C=C1C QXLQZLBNPTZMRK-UHFFFAOYSA-N 0.000 description 1
- XXVLKDRPHSFIIB-UHFFFAOYSA-N 2-[2-(dimethylamino)ethyl]-5-nitrobenzo[de]isoquinoline-1,3-dione Chemical compound [O-][N+](=O)C1=CC(C(N(CCN(C)C)C2=O)=O)=C3C2=CC=CC3=C1 XXVLKDRPHSFIIB-UHFFFAOYSA-N 0.000 description 1
- PXJJOGITBQXZEQ-JTHROIFXSA-M 2-[4-[(z)-1,2-diphenylbut-1-enyl]phenoxy]ethyl-trimethylazanium;iodide Chemical compound [I-].C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCC[N+](C)(C)C)=CC=1)/C1=CC=CC=C1 PXJJOGITBQXZEQ-JTHROIFXSA-M 0.000 description 1
- RTQWWZBSTRGEAV-PKHIMPSTSA-N 2-[[(2s)-2-[bis(carboxymethyl)amino]-3-[4-(methylcarbamoylamino)phenyl]propyl]-[2-[bis(carboxymethyl)amino]propyl]amino]acetic acid Chemical compound CNC(=O)NC1=CC=C(C[C@@H](CN(CC(C)N(CC(O)=O)CC(O)=O)CC(O)=O)N(CC(O)=O)CC(O)=O)C=C1 RTQWWZBSTRGEAV-PKHIMPSTSA-N 0.000 description 1
- HYHJFNXFVPGMBI-UHFFFAOYSA-N 2-[[2-chloroethyl(nitroso)carbamoyl]-methylamino]acetamide Chemical compound NC(=O)CN(C)C(=O)N(CCCl)N=O HYHJFNXFVPGMBI-UHFFFAOYSA-N 0.000 description 1
- QCXJFISCRQIYID-IAEPZHFASA-N 2-amino-1-n-[(3s,6s,7r,10s,16s)-3-[(2s)-butan-2-yl]-7,11,14-trimethyl-2,5,9,12,15-pentaoxo-10-propan-2-yl-8-oxa-1,4,11,14-tetrazabicyclo[14.3.0]nonadecan-6-yl]-4,6-dimethyl-3-oxo-9-n-[(3s,6s,7r,10s,16s)-7,11,14-trimethyl-2,5,9,12,15-pentaoxo-3,10-di(propa Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N=C2C(C(=O)N[C@@H]3C(=O)N[C@H](C(N4CCC[C@H]4C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]3C)=O)[C@@H](C)CC)=C(N)C(=O)C(C)=C2O2)C2=C(C)C=C1 QCXJFISCRQIYID-IAEPZHFASA-N 0.000 description 1
- VDCRFBBZFHHYGT-IOSLPCCCSA-N 2-amino-9-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-7-prop-2-enyl-3h-purine-6,8-dione Chemical compound O=C1N(CC=C)C=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O VDCRFBBZFHHYGT-IOSLPCCCSA-N 0.000 description 1
- NIXVOFULDIFBLB-QVRNUERCSA-N 2-amino-9-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]purine-6-sulfinamide Chemical compound C12=NC(N)=NC(S(N)=O)=C2N=CN1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O NIXVOFULDIFBLB-QVRNUERCSA-N 0.000 description 1
- LDLCZOVUSADOIV-UHFFFAOYSA-N 2-bromoethanol Chemical compound OCCBr LDLCZOVUSADOIV-UHFFFAOYSA-N 0.000 description 1
- SNILBNSNKISKLU-UHFFFAOYSA-N 2-fluoro-5-hydroxybenzaldehyde Chemical compound OC1=CC=C(F)C(C=O)=C1 SNILBNSNKISKLU-UHFFFAOYSA-N 0.000 description 1
- DSWLRNLRVBAVFC-UHFFFAOYSA-N 2-methylsulfinyl-1-pyridin-2-ylethanone Chemical compound CS(=O)CC(=O)C1=CC=CC=N1 DSWLRNLRVBAVFC-UHFFFAOYSA-N 0.000 description 1
- ZNGINKJHQQQORD-UHFFFAOYSA-N 2-trimethylsilylethanol Chemical compound C[Si](C)(C)CCO ZNGINKJHQQQORD-UHFFFAOYSA-N 0.000 description 1
- NDMPLJNOPCLANR-UHFFFAOYSA-N 3,4-dihydroxy-15-(4-hydroxy-18-methoxycarbonyl-5,18-seco-ibogamin-18-yl)-16-methoxy-1-methyl-6,7-didehydro-aspidospermidine-3-carboxylic acid methyl ester Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 NDMPLJNOPCLANR-UHFFFAOYSA-N 0.000 description 1
- GRLUHXSUZYFZCW-UHFFFAOYSA-N 3-(8,8-diethyl-2-aza-8-germaspiro[4.5]decan-2-yl)-n,n-dimethylpropan-1-amine;dihydrochloride Chemical compound Cl.Cl.C1C[Ge](CC)(CC)CCC11CN(CCCN(C)C)CC1 GRLUHXSUZYFZCW-UHFFFAOYSA-N 0.000 description 1
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 1
- QGJZLNKBHJESQX-UHFFFAOYSA-N 3-Epi-Betulin-Saeure Natural products C1CC(O)C(C)(C)C2CCC3(C)C4(C)CCC5(C(O)=O)CCC(C(=C)C)C5C4CCC3C21C QGJZLNKBHJESQX-UHFFFAOYSA-N 0.000 description 1
- ALKYHXVLJMQRLQ-UHFFFAOYSA-N 3-Hydroxy-2-naphthoate Chemical compound C1=CC=C2C=C(O)C(C(=O)O)=CC2=C1 ALKYHXVLJMQRLQ-UHFFFAOYSA-N 0.000 description 1
- GTJXPMSTODOYNP-BTKVJIOYSA-N 3-[(e)-1-[4-[2-(dimethylamino)ethoxy]phenyl]-2-phenylbut-1-enyl]phenol;2-hydroxypropane-1,2,3-tricarboxylic acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C=1C=CC=CC=1C(/CC)=C(C=1C=C(O)C=CC=1)\C1=CC=C(OCCN(C)C)C=C1 GTJXPMSTODOYNP-BTKVJIOYSA-N 0.000 description 1
- KZLZHYIKZMTSOA-UHFFFAOYSA-N 3-[5-fluoro-7-[(2-fluoro-3-methoxyphenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=CC(=C2CN(C(C2=C1)=O)C1C(NC(CC1)=O)=O)NCC1=C(C(=CC=C1)OC)F KZLZHYIKZMTSOA-UHFFFAOYSA-N 0.000 description 1
- KNFXDRWTCYDYQW-UHFFFAOYSA-N 3-[5-fluoro-7-[(2-fluoro-4-methoxyphenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound O(C1=CC=C(CNC2=CC(F)=CC=3C(=O)N(CC2=3)C2C(=O)NC(=O)CC2)C(F)=C1)C KNFXDRWTCYDYQW-UHFFFAOYSA-N 0.000 description 1
- KAAFLJMYTGYRMW-UHFFFAOYSA-N 3-[5-fluoro-7-[(2-fluoro-5-methoxyphenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound C1=C(C(=CC(=C1)OC)CNC1=CC(F)=CC=2C(=O)N(CC1=2)C1C(=O)NC(=O)CC1)F KAAFLJMYTGYRMW-UHFFFAOYSA-N 0.000 description 1
- DQZUSQMFCDBJRD-UHFFFAOYSA-N 3-[5-fluoro-7-[[4-(morpholin-4-ylmethyl)phenyl]methoxy]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound C1(=CC=C(CN2CCOCC2)C=C1)COC1=CC(F)=CC=2C(=O)N(CC1=2)C1C(=O)NC(=O)CC1 DQZUSQMFCDBJRD-UHFFFAOYSA-N 0.000 description 1
- NWSBZCNETOZIGJ-UHFFFAOYSA-N 3-[5-fluoro-7-[[4-(morpholin-4-ylmethyl)phenyl]methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=CC(=C2CN(C(C2=C1)=O)C1C(NC(CC1)=O)=O)NCC1=CC=C(C=C1)CN1CCOCC1 NWSBZCNETOZIGJ-UHFFFAOYSA-N 0.000 description 1
- ZSHGZKWRAFNWKZ-UHFFFAOYSA-N 3-[7-[(2-fluoro-3-hydroxyphenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=CC=C1O ZSHGZKWRAFNWKZ-UHFFFAOYSA-N 0.000 description 1
- ZYKIECFDYPADMM-UHFFFAOYSA-N 3-[7-[(2-fluoro-3-methoxyphenyl)methoxy]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(COC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=CC=C1OC ZYKIECFDYPADMM-UHFFFAOYSA-N 0.000 description 1
- VJDGTQRUWDLXRD-UHFFFAOYSA-N 3-[7-[(2-fluoro-3-methylphenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=CC=C1C VJDGTQRUWDLXRD-UHFFFAOYSA-N 0.000 description 1
- JLDRPPQCXHJIAC-UHFFFAOYSA-N 3-[7-[(2-fluoro-4-hydroxyphenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=CC(=C1)O JLDRPPQCXHJIAC-UHFFFAOYSA-N 0.000 description 1
- VFPWFHYDVYPKGA-UHFFFAOYSA-N 3-[7-[(2-fluoro-4-methoxyphenyl)methoxy]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(COC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=CC(=C1)OC VFPWFHYDVYPKGA-UHFFFAOYSA-N 0.000 description 1
- XIOZLYXCEADWGU-UHFFFAOYSA-N 3-[7-[(2-fluoro-5-hydroxyphenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=C(C=C1)O XIOZLYXCEADWGU-UHFFFAOYSA-N 0.000 description 1
- XYSWRWLSJVAAAA-UHFFFAOYSA-N 3-[7-[(2-fluoro-5-methoxyphenyl)methoxy]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(COC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=C(C=C1)OC XYSWRWLSJVAAAA-UHFFFAOYSA-N 0.000 description 1
- LBVRLMKZSYVOCL-UHFFFAOYSA-N 3-[7-[(2-fluoro-5-methoxyphenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=C(C=C1)OC LBVRLMKZSYVOCL-UHFFFAOYSA-N 0.000 description 1
- UADBLAIIUJUXPW-UHFFFAOYSA-N 3-[7-[(2-fluorophenyl)methoxy]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(COC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=CC=C1 UADBLAIIUJUXPW-UHFFFAOYSA-N 0.000 description 1
- BWQGPIFIZFBUNA-UHFFFAOYSA-N 3-[7-[(3,4-dimethylphenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound CC=1C=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=CC=1C BWQGPIFIZFBUNA-UHFFFAOYSA-N 0.000 description 1
- UIKLMZAPBQDRNA-UHFFFAOYSA-N 3-[7-[(3,5-dimethoxyphenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound COC=1C=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=C(C=1)OC UIKLMZAPBQDRNA-UHFFFAOYSA-N 0.000 description 1
- ZHUYFFJVJUBOLS-UHFFFAOYSA-N 3-[7-[(3-amino-2-fluorophenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound NC=1C(=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=CC=1)F ZHUYFFJVJUBOLS-UHFFFAOYSA-N 0.000 description 1
- IYKXCMAJRVIVJW-UHFFFAOYSA-N 3-[7-[(3-chloro-4-methoxyphenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound ClC=1C=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=CC=1OC IYKXCMAJRVIVJW-UHFFFAOYSA-N 0.000 description 1
- ZABLAFBJTDGQIT-UHFFFAOYSA-N 3-[7-[(3-chloro-4-methylphenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound ClC=1C=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=CC=1C ZABLAFBJTDGQIT-UHFFFAOYSA-N 0.000 description 1
- GZDNAZFPMHQWBZ-UHFFFAOYSA-N 3-[7-[(3-fluoro-4-methylphenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC=1C=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=CC=1C GZDNAZFPMHQWBZ-UHFFFAOYSA-N 0.000 description 1
- XWWCJEXESWUKMQ-UHFFFAOYSA-N 3-[7-[(4-fluoro-3-methylphenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(C=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=C1)C XWWCJEXESWUKMQ-UHFFFAOYSA-N 0.000 description 1
- XVJUWMDAVQSWJP-UHFFFAOYSA-N 3-[7-[(5-amino-2-fluorophenyl)methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound NC=1C=CC(=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=1)F XVJUWMDAVQSWJP-UHFFFAOYSA-N 0.000 description 1
- GIPMNJOVPNGOLO-UHFFFAOYSA-N 3-[7-[[2-fluoro-3-(methylamino)phenyl]methoxy]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(COC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=CC=C1NC GIPMNJOVPNGOLO-UHFFFAOYSA-N 0.000 description 1
- VXFBGLMDPBMCOC-UHFFFAOYSA-N 3-[7-[[2-fluoro-3-(methylamino)phenyl]methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=CC=C1NC VXFBGLMDPBMCOC-UHFFFAOYSA-N 0.000 description 1
- JLOKVCGUSOTRSU-UHFFFAOYSA-N 3-[7-[[2-fluoro-3-(morpholin-4-ylmethyl)phenyl]methoxy]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound C1(=C(C(=CC=C1)COC1=CC=CC=2C(=O)N(CC1=2)C1C(=O)NC(=O)CC1)F)CN1CCOCC1 JLOKVCGUSOTRSU-UHFFFAOYSA-N 0.000 description 1
- MTVDPXHAPGHPOB-UHFFFAOYSA-N 3-[7-[[2-fluoro-3-(morpholin-4-ylmethyl)phenyl]methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=CC=C1CN1CCOCC1 MTVDPXHAPGHPOB-UHFFFAOYSA-N 0.000 description 1
- LSWTTWZVLFJNEN-UHFFFAOYSA-N 3-[7-[[2-fluoro-4-(morpholin-4-ylmethyl)phenyl]methoxy]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(COC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=CC(=C1)CN1CCOCC1 LSWTTWZVLFJNEN-UHFFFAOYSA-N 0.000 description 1
- BLFGUOVIPZONGE-UHFFFAOYSA-N 3-[7-[[2-fluoro-4-(morpholin-4-ylmethyl)phenyl]methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=CC(=C1)CN1CCOCC1 BLFGUOVIPZONGE-UHFFFAOYSA-N 0.000 description 1
- TZECSDOUXKNZAG-UHFFFAOYSA-N 3-[7-[[2-fluoro-5-(2-hydroxyethoxy)phenyl]methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound C1(OCCO)=CC(CNC2=C3C(=CC=C2)C(=O)N(C3)C2C(=O)NC(=O)CC2)=C(F)C=C1 TZECSDOUXKNZAG-UHFFFAOYSA-N 0.000 description 1
- QKOFQQMUBXSYJL-UHFFFAOYSA-N 3-[7-[[2-fluoro-5-(2-methoxyethoxy)phenyl]methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound C1(OCCOC)=CC(CNC2=C3C(=CC=C2)C(=O)N(C3)C2C(=O)NC(=O)CC2)=C(F)C=C1 QKOFQQMUBXSYJL-UHFFFAOYSA-N 0.000 description 1
- KBBVVYWABYQBFV-UHFFFAOYSA-N 3-[7-[[2-fluoro-5-(2-morpholin-4-ylethoxy)phenyl]methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=C(C=C1)OCCN1CCOCC1 KBBVVYWABYQBFV-UHFFFAOYSA-N 0.000 description 1
- YPQCPVOFJOQPDZ-UHFFFAOYSA-N 3-[7-[[2-fluoro-5-(2-pyrrolidin-1-ylethoxy)phenyl]methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound C1=C(C(=CC(OCCN2CCCC2)=C1)CNC1=CC=CC=2C(=O)N(CC1=2)C1C(=O)NC(=O)CC1)F YPQCPVOFJOQPDZ-UHFFFAOYSA-N 0.000 description 1
- JYGRNWSGAKQPOW-UHFFFAOYSA-N 3-[7-[[2-fluoro-5-(methylamino)phenyl]methoxy]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(COC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=C(C=C1)NC JYGRNWSGAKQPOW-UHFFFAOYSA-N 0.000 description 1
- QXAWREFAOGIXEV-UHFFFAOYSA-N 3-[7-[[2-fluoro-5-(methylamino)phenyl]methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=C(C=C1)NC QXAWREFAOGIXEV-UHFFFAOYSA-N 0.000 description 1
- RRFFBUYHPLSUDL-UHFFFAOYSA-N 3-[7-[[2-fluoro-5-(morpholin-4-ylmethyl)phenyl]methoxy]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound C1=C(C(=CC(=C1)CN1CCOCC1)COC1=CC=CC=2C(=O)N(CC1=2)C1C(=O)NC(=O)CC1)F RRFFBUYHPLSUDL-UHFFFAOYSA-N 0.000 description 1
- WRSUZVGDRGBSRD-UHFFFAOYSA-N 3-[7-[[2-fluoro-5-(morpholin-4-ylmethyl)phenyl]methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=C(C=C1)CN1CCOCC1 WRSUZVGDRGBSRD-UHFFFAOYSA-N 0.000 description 1
- YSJHGZBMQIXXQB-UHFFFAOYSA-N 3-[7-[[2-fluoro-5-[2-(4-methylpiperazin-1-yl)ethoxy]phenyl]methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound FC1=C(CNC2=C3CN(C(C3=CC=C2)=O)C2C(NC(CC2)=O)=O)C=C(C=C1)OCCN1CCN(CC1)C YSJHGZBMQIXXQB-UHFFFAOYSA-N 0.000 description 1
- LYJMKRKOCDDJMI-UHFFFAOYSA-N 3-[7-[[5-[2-(dimethylamino)ethoxy]-2-fluorophenyl]methylamino]-3-oxo-1H-isoindol-2-yl]piperidine-2,6-dione Chemical compound C1=C(C(CNC2=CC=CC=3C(=O)N(CC2=3)C2C(=O)NC(=O)CC2)=CC(=C1)OCCN(C)C)F LYJMKRKOCDDJMI-UHFFFAOYSA-N 0.000 description 1
- WUIABRMSWOKTOF-OYALTWQYSA-N 3-[[2-[2-[2-[[(2s,3r)-2-[[(2s,3s,4r)-4-[[(2s,3r)-2-[[6-amino-2-[(1s)-3-amino-1-[[(2s)-2,3-diamino-3-oxopropyl]amino]-3-oxopropyl]-5-methylpyrimidine-4-carbonyl]amino]-3-[(2r,3s,4s,5s,6s)-3-[(2r,3s,4s,5r,6r)-4-carbamoyloxy-3,5-dihydroxy-6-(hydroxymethyl)ox Chemical compound OS([O-])(=O)=O.N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1NC=NC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C WUIABRMSWOKTOF-OYALTWQYSA-N 0.000 description 1
- FXLWCSIZCMDZKW-UHFFFAOYSA-N 3-[[[2-(2,6-dioxopiperidin-3-yl)-1-oxo-3H-isoindol-4-yl]amino]methyl]-2-fluoro-N-methylbenzamide Chemical compound C1(=C(C(=CC=C1)CNC1=CC=CC=2C(=O)N(CC1=2)C1C(=O)NC(=O)CC1)F)C(=O)NC FXLWCSIZCMDZKW-UHFFFAOYSA-N 0.000 description 1
- NHYQLTKCSIMRNW-UHFFFAOYSA-N 3-[[[2-(2,6-dioxopiperidin-3-yl)-1-oxo-3H-isoindol-4-yl]amino]methyl]-2-fluorobenzamide Chemical compound O=C1NC(CCC1N1C(C2=CC=CC(=C2C1)NCC=1C(=C(C(=O)N)C=CC=1)F)=O)=O NHYQLTKCSIMRNW-UHFFFAOYSA-N 0.000 description 1
- LAUXSHZGAQMDLT-UHFFFAOYSA-N 3-[[[2-(2,6-dioxopiperidin-3-yl)-1-oxo-3H-isoindol-4-yl]amino]methyl]-2-fluorobenzenesulfonamide Chemical compound S(=O)(=O)(C1=CC=CC(CNC2=CC=CC=3C(=O)N(CC2=3)C2C(=O)NC(=O)CC2)=C1F)N LAUXSHZGAQMDLT-UHFFFAOYSA-N 0.000 description 1
- BEHNVFSUTPGMRI-UHFFFAOYSA-N 3-[[[2-(2,6-dioxopiperidin-3-yl)-1-oxo-3H-isoindol-4-yl]amino]methyl]-2-fluorobenzonitrile Chemical compound O=C1NC(CCC1N1C(C2=CC=CC(=C2C1)NCC=1C(=C(C#N)C=CC=1)F)=O)=O BEHNVFSUTPGMRI-UHFFFAOYSA-N 0.000 description 1
- YCPULGHBTPQLRH-UHFFFAOYSA-N 3-aminopiperidine-2,6-dione;hydron;chloride Chemical compound Cl.NC1CCC(=O)NC1=O YCPULGHBTPQLRH-UHFFFAOYSA-N 0.000 description 1
- CLOUCVRNYSHRCF-UHFFFAOYSA-N 3beta-Hydroxy-20(29)-Lupen-3,27-oic acid Natural products C1CC(O)C(C)(C)C2CCC3(C)C4(C(O)=O)CCC5(C)CCC(C(=C)C)C5C4CCC3C21C CLOUCVRNYSHRCF-UHFFFAOYSA-N 0.000 description 1
- PDQGEKGUTOTUNV-TZSSRYMLSA-N 4'-deoxy-4'-iododoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](I)[C@H](C)O1 PDQGEKGUTOTUNV-TZSSRYMLSA-N 0.000 description 1
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 1
- KMAHWHPUXGNVBN-UHFFFAOYSA-N 4-(morpholin-4-ylmethyl)benzaldehyde Chemical compound C1=CC(C=O)=CC=C1CN1CCOCC1 KMAHWHPUXGNVBN-UHFFFAOYSA-N 0.000 description 1
- OUQPTBCOEKUHBH-LSDHQDQOSA-N 4-[2-[4-[(e)-2-(5,5,8,8-tetramethyl-6,7-dihydronaphthalen-2-yl)prop-1-enyl]phenoxy]ethyl]morpholine Chemical compound C=1C=C(C(CCC2(C)C)(C)C)C2=CC=1C(/C)=C/C(C=C1)=CC=C1OCCN1CCOCC1 OUQPTBCOEKUHBH-LSDHQDQOSA-N 0.000 description 1
- GIDAHNLLLGHUKZ-UHFFFAOYSA-N 4-[[4-(chloromethyl)-3-fluorophenyl]methyl]morpholine hydrochloride Chemical compound Cl.Fc1cc(CN2CCOCC2)ccc1CCl GIDAHNLLLGHUKZ-UHFFFAOYSA-N 0.000 description 1
- CTSNHMQGVWXIEG-UHFFFAOYSA-N 4-amino-n-(5-chloroquinoxalin-2-yl)benzenesulfonamide Chemical compound C1=CC(N)=CC=C1S(=O)(=O)NC1=CN=C(C(Cl)=CC=C2)C2=N1 CTSNHMQGVWXIEG-UHFFFAOYSA-N 0.000 description 1
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 1
- SGOOQMRIPALTEL-UHFFFAOYSA-N 4-hydroxy-N,1-dimethyl-2-oxo-N-phenyl-3-quinolinecarboxamide Chemical compound OC=1C2=CC=CC=C2N(C)C(=O)C=1C(=O)N(C)C1=CC=CC=C1 SGOOQMRIPALTEL-UHFFFAOYSA-N 0.000 description 1
- AKJHMTWEGVYYSE-FXILSDISSA-N 4-hydroxyphenyl retinamide Chemical compound C=1C=C(O)C=CC=1NC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C AKJHMTWEGVYYSE-FXILSDISSA-N 0.000 description 1
- 102100036009 5'-AMP-activated protein kinase catalytic subunit alpha-2 Human genes 0.000 description 1
- PXLPCZJACKUXGP-UHFFFAOYSA-N 5-(3,4-dichlorophenyl)-6-ethylpyrimidine-2,4-diamine Chemical compound CCC1=NC(N)=NC(N)=C1C1=CC=C(Cl)C(Cl)=C1 PXLPCZJACKUXGP-UHFFFAOYSA-N 0.000 description 1
- APNRZHLOPQFNMR-WEIUTZTHSA-N 5-[(e)-5-[(1s)-2,2-dimethyl-6-methylidenecyclohexyl]-3-methylpent-2-enyl]phenazin-1-one Chemical compound C12=CC=CC=C2N=C(C(C=CC=2)=O)C=2N1C\C=C(/C)CC[C@@H]1C(=C)CCCC1(C)C APNRZHLOPQFNMR-WEIUTZTHSA-N 0.000 description 1
- XAUDJQYHKZQPEU-KVQBGUIXSA-N 5-aza-2'-deoxycytidine Chemical compound O=C1N=C(N)N=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 XAUDJQYHKZQPEU-KVQBGUIXSA-N 0.000 description 1
- JVBLXLBINTYFPR-UHFFFAOYSA-N 5-fluoro-2-methylbenzoic acid Chemical compound CC1=CC=C(F)C=C1C(O)=O JVBLXLBINTYFPR-UHFFFAOYSA-N 0.000 description 1
- MJZJYWCQPMNPRM-UHFFFAOYSA-N 6,6-dimethyl-1-[3-(2,4,5-trichlorophenoxy)propoxy]-1,6-dihydro-1,3,5-triazine-2,4-diamine Chemical compound CC1(C)N=C(N)N=C(N)N1OCCCOC1=CC(Cl)=C(Cl)C=C1Cl MJZJYWCQPMNPRM-UHFFFAOYSA-N 0.000 description 1
- ATCGGEJZONJOCL-UHFFFAOYSA-N 6-(2,5-dichlorophenyl)-1,3,5-triazine-2,4-diamine Chemical compound NC1=NC(N)=NC(C=2C(=CC=C(Cl)C=2)Cl)=N1 ATCGGEJZONJOCL-UHFFFAOYSA-N 0.000 description 1
- WYWHKKSPHMUBEB-UHFFFAOYSA-N 6-Mercaptoguanine Natural products N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 1
- OTSZCHORPMQCBZ-UHFFFAOYSA-N 6-[(3-chlorophenyl)-imidazol-1-ylmethyl]-1h-benzimidazole;hydron;chloride Chemical compound Cl.ClC1=CC=CC(C(C=2C=C3NC=NC3=CC=2)N2C=NC=C2)=C1 OTSZCHORPMQCBZ-UHFFFAOYSA-N 0.000 description 1
- LRHPCRBOMKRVOA-UHFFFAOYSA-N 6-[2-(2-hydroxyethylamino)ethyl]indeno[1,2-c]isoquinoline-5,11-dione Chemical compound C12=CC=CC=C2C(=O)N(CCNCCO)C2=C1C(=O)C1=CC=CC=C12 LRHPCRBOMKRVOA-UHFFFAOYSA-N 0.000 description 1
- LJIRBXZDQGQUOO-KVTDHHQDSA-N 6-amino-3-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-1,4-dihydro-1,3,5-triazin-2-one Chemical compound C1NC(N)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 LJIRBXZDQGQUOO-KVTDHHQDSA-N 0.000 description 1
- GOYNNCPGHOBFCK-UHFFFAOYSA-N 7-[4-(dimethylamino)-5-[(2,9-dimethyl-3-oxo-4,4a,5a,6,7,9,9a,10a-octahydrodipyrano[4,2-a:4',3'-e][1,4]dioxin-7-yl)oxy]-6-methyloxan-2-yl]oxy-9-ethyl-4,6,9,10,11-pentahydroxy-8,10-dihydro-7h-tetracene-5,12-dione Chemical compound O=C1C2=C(O)C=CC=C2C(=O)C2=C1C(O)=C1C(OC3OC(C)C(OC4OC(C)C5OC6OC(C)C(=O)CC6OC5C4)C(C3)N(C)C)CC(CC)(O)C(O)C1=C2O GOYNNCPGHOBFCK-UHFFFAOYSA-N 0.000 description 1
- KABRXLINDSPGDF-UHFFFAOYSA-N 7-bromoisoquinoline Chemical compound C1=CN=CC2=CC(Br)=CC=C21 KABRXLINDSPGDF-UHFFFAOYSA-N 0.000 description 1
- GOJJWDOZNKBUSR-UHFFFAOYSA-N 7-sulfamoyloxyheptyl sulfamate Chemical compound NS(=O)(=O)OCCCCCCCOS(N)(=O)=O GOJJWDOZNKBUSR-UHFFFAOYSA-N 0.000 description 1
- LPDLEICKXUVJHW-QJILNLRNSA-N 78nz2pmp25 Chemical compound OS(O)(=O)=O.O([C@]12[C@H](OC(C)=O)[C@]3(CC)C=CCN4CC[C@@]5([C@H]34)[C@H]1N(C)C1=C5C=C(C(=C1)OC)[C@]1(C(=O)OC)C3=C(C4=CC=CC=C4N3)CCN3C[C@H](C1)C[C@@](C3)(O)CC)C(=O)N(CCCl)C2=O LPDLEICKXUVJHW-QJILNLRNSA-N 0.000 description 1
- ZGXJTSGNIOSYLO-UHFFFAOYSA-N 88755TAZ87 Chemical compound NCC(=O)CCC(O)=O ZGXJTSGNIOSYLO-UHFFFAOYSA-N 0.000 description 1
- 208000002008 AIDS-Related Lymphoma Diseases 0.000 description 1
- BUROJSBIWGDYCN-GAUTUEMISA-N AP 23573 Chemical compound C1C[C@@H](OP(C)(C)=O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 BUROJSBIWGDYCN-GAUTUEMISA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 208000002874 Acne Vulgaris Diseases 0.000 description 1
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 1
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 1
- 206010001052 Acute respiratory distress syndrome Diseases 0.000 description 1
- 229940123324 Acyltransferase inhibitor Drugs 0.000 description 1
- 208000026872 Addison Disease Diseases 0.000 description 1
- 208000008190 Agammaglobulinemia Diseases 0.000 description 1
- 229940126638 Akt inhibitor Drugs 0.000 description 1
- 201000004384 Alopecia Diseases 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- DHMQDGOQFOQNFH-UHFFFAOYSA-M Aminoacetate Chemical compound NCC([O-])=O DHMQDGOQFOQNFH-UHFFFAOYSA-M 0.000 description 1
- ITPDYQOUSLNIHG-UHFFFAOYSA-N Amiodarone hydrochloride Chemical compound [Cl-].CCCCC=1OC2=CC=CC=C2C=1C(=O)C1=CC(I)=C(OCC[NH+](CC)CC)C(I)=C1 ITPDYQOUSLNIHG-UHFFFAOYSA-N 0.000 description 1
- 206010061424 Anal cancer Diseases 0.000 description 1
- 229940122531 Anaplastic lymphoma kinase inhibitor Drugs 0.000 description 1
- BOJKULTULYSRAS-OTESTREVSA-N Andrographolide Chemical compound C([C@H]1[C@]2(C)CC[C@@H](O)[C@]([C@H]2CCC1=C)(CO)C)\C=C1/[C@H](O)COC1=O BOJKULTULYSRAS-OTESTREVSA-N 0.000 description 1
- 206010002329 Aneurysm Diseases 0.000 description 1
- 208000003343 Antiphospholipid Syndrome Diseases 0.000 description 1
- MJINRRBEMOLJAK-DCAQKATOSA-N Arg-Lys-Asp Chemical compound OC(=O)C[C@@H](C(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)CCCN=C(N)N MJINRRBEMOLJAK-DCAQKATOSA-N 0.000 description 1
- DRCNRVYVCHHIJP-AQBORDMYSA-N Arg-Lys-Glu-Val-Tyr Chemical compound NC(N)=NCCC[C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 DRCNRVYVCHHIJP-AQBORDMYSA-N 0.000 description 1
- BFYIZQONLCFLEV-DAELLWKTSA-N Aromasine Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC(=C)C2=C1 BFYIZQONLCFLEV-DAELLWKTSA-N 0.000 description 1
- 108010024976 Asparaginase Proteins 0.000 description 1
- 102000015790 Asparaginase Human genes 0.000 description 1
- 108700032558 Aspergillus restrictus MITF Proteins 0.000 description 1
- 241001263178 Auriparus Species 0.000 description 1
- 206010003827 Autoimmune hepatitis Diseases 0.000 description 1
- 208000003950 B-cell lymphoma Diseases 0.000 description 1
- 239000012664 BCL-2-inhibitor Substances 0.000 description 1
- 108091007065 BIRCs Proteins 0.000 description 1
- 229940124291 BTK inhibitor Drugs 0.000 description 1
- 206010004146 Basal cell carcinoma Diseases 0.000 description 1
- 229940123711 Bcl2 inhibitor Drugs 0.000 description 1
- VGGGPCQERPFHOB-MCIONIFRSA-N Bestatin Chemical compound CC(C)C[C@H](C(O)=O)NC(=O)[C@@H](O)[C@H](N)CC1=CC=CC=C1 VGGGPCQERPFHOB-MCIONIFRSA-N 0.000 description 1
- 102100030802 Beta-2-glycoprotein 1 Human genes 0.000 description 1
- 101710180007 Beta-2-glycoprotein 1 Proteins 0.000 description 1
- DIZWSDNSTNAYHK-XGWVBXMLSA-N Betulinic acid Natural products CC(=C)[C@@H]1C[C@H]([C@H]2CC[C@]3(C)[C@H](CC[C@@H]4[C@@]5(C)CC[C@H](O)C(C)(C)[C@@H]5CC[C@@]34C)[C@@H]12)C(=O)O DIZWSDNSTNAYHK-XGWVBXMLSA-N 0.000 description 1
- 208000008439 Biliary Liver Cirrhosis Diseases 0.000 description 1
- 208000033222 Biliary cirrhosis primary Diseases 0.000 description 1
- 208000020925 Bipolar disease Diseases 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 206010065553 Bone marrow failure Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 206010006143 Brain stem glioma Diseases 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- 229940124204 C-kit inhibitor Drugs 0.000 description 1
- NEOGZZUXDDUWDQ-UHFFFAOYSA-N C1CC(=O)NC(=O)C1N2CC3=C(C2=O)C=CC=C3NCC4=C(C=CC(=C4)CNC(=O)O)F Chemical compound C1CC(=O)NC(=O)C1N2CC3=C(C2=O)C=CC=C3NCC4=C(C=CC(=C4)CNC(=O)O)F NEOGZZUXDDUWDQ-UHFFFAOYSA-N 0.000 description 1
- 101150013553 CD40 gene Proteins 0.000 description 1
- JOVWYJVTJKBTRO-UHFFFAOYSA-N CN(CC1=CC(=C(C=C1)F)CNC2=CC=CC3=C2CN(C3=O)C4CCC(=O)NC4=O)C(=O)O Chemical compound CN(CC1=CC(=C(C=C1)F)CNC2=CC=CC3=C2CN(C3=O)C4CCC(=O)NC4=O)C(=O)O JOVWYJVTJKBTRO-UHFFFAOYSA-N 0.000 description 1
- 201000002829 CREST Syndrome Diseases 0.000 description 1
- FVLVBPDQNARYJU-XAHDHGMMSA-N C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O Chemical compound C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O FVLVBPDQNARYJU-XAHDHGMMSA-N 0.000 description 1
- 101100296719 Caenorhabditis elegans pde-4 gene Proteins 0.000 description 1
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 1
- OKTJSMMVPCPJKN-OUBTZVSYSA-N Carbon-13 Chemical compound [13C] OKTJSMMVPCPJKN-OUBTZVSYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-NJFSPNSNSA-N Carbon-14 Chemical compound [14C] OKTJSMMVPCPJKN-NJFSPNSNSA-N 0.000 description 1
- 208000005623 Carcinogenesis Diseases 0.000 description 1
- 229940122537 Casein kinase inhibitor Drugs 0.000 description 1
- JDVVGAQPNNXQDW-WCMLQCRESA-N Castanospermine Natural products O[C@H]1[C@@H](O)[C@H]2[C@@H](O)CCN2C[C@H]1O JDVVGAQPNNXQDW-WCMLQCRESA-N 0.000 description 1
- JDVVGAQPNNXQDW-TVNFTVLESA-N Castinospermine Chemical compound C1[C@H](O)[C@@H](O)[C@H](O)[C@H]2[C@@H](O)CCN21 JDVVGAQPNNXQDW-TVNFTVLESA-N 0.000 description 1
- 102000053642 Catalytic RNA Human genes 0.000 description 1
- 108090000994 Catalytic RNA Proteins 0.000 description 1
- 241000700199 Cavia porcellus Species 0.000 description 1
- 206010057248 Cell death Diseases 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 206010063094 Cerebral malaria Diseases 0.000 description 1
- JWBOIMRXGHLCPP-UHFFFAOYSA-N Chloditan Chemical compound C=1C=CC=C(Cl)C=1C(C(Cl)Cl)C1=CC=C(Cl)C=C1 JWBOIMRXGHLCPP-UHFFFAOYSA-N 0.000 description 1
- 201000005262 Chondroma Diseases 0.000 description 1
- 208000005243 Chondrosarcoma Diseases 0.000 description 1
- 206010008874 Chronic Fatigue Syndrome Diseases 0.000 description 1
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 1
- 208000030939 Chronic inflammatory demyelinating polyneuropathy Diseases 0.000 description 1
- PTOAARAWEBMLNO-KVQBGUIXSA-N Cladribine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PTOAARAWEBMLNO-KVQBGUIXSA-N 0.000 description 1
- 208000015943 Coeliac disease Diseases 0.000 description 1
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 1
- HVXBOLULGPECHP-WAYWQWQTSA-N Combretastatin A4 Chemical compound C1=C(O)C(OC)=CC=C1\C=C/C1=CC(OC)=C(OC)C(OC)=C1 HVXBOLULGPECHP-WAYWQWQTSA-N 0.000 description 1
- 206010010755 Conjunctivitis viral Diseases 0.000 description 1
- DFDTZECTHJFPHE-UHFFFAOYSA-N Crambescidin 816 Natural products C1CC=CC(CC)OC11NC(N23)=NC4(OC(C)CCC4)C(C(=O)OCCCCCCCCCCCCCCCC(=O)N(CCCN)CC(O)CCN)C3(O)CCC2C1 DFDTZECTHJFPHE-UHFFFAOYSA-N 0.000 description 1
- 208000009798 Craniopharyngioma Diseases 0.000 description 1
- 208000019707 Cryoglobulinemic vasculitis Diseases 0.000 description 1
- LUEYTMPPCOCKBX-UHFFFAOYSA-N Curacin A Natural products C=CCC(OC)CCC(C)=CC=CCCC=CC1CSC(C2C(C2)C)=N1 LUEYTMPPCOCKBX-UHFFFAOYSA-N 0.000 description 1
- LUEYTMPPCOCKBX-KWYHTCOPSA-N Curacin A Chemical compound C=CC[C@H](OC)CC\C(C)=C\C=C\CC\C=C/[C@@H]1CSC([C@H]2[C@H](C2)C)=N1 LUEYTMPPCOCKBX-KWYHTCOPSA-N 0.000 description 1
- PMATZTZNYRCHOR-CGLBZJNRSA-N Cyclosporin A Chemical compound CC[C@@H]1NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)N(C)C(=O)CN(C)C1=O PMATZTZNYRCHOR-CGLBZJNRSA-N 0.000 description 1
- 108010036949 Cyclosporine Proteins 0.000 description 1
- 206010011732 Cyst Diseases 0.000 description 1
- 102100028007 Cystatin-SA Human genes 0.000 description 1
- 101710144510 Cysteine proteinase inhibitor Proteins 0.000 description 1
- PQNNIEWMPIULRS-UHFFFAOYSA-N Cytostatin Natural products CC=CC=CC=CC(O)C(C)C(OP(O)(O)=O)CCC(C)C1OC(=O)C=CC1C PQNNIEWMPIULRS-UHFFFAOYSA-N 0.000 description 1
- SPKNARKFCOPTSY-UHFFFAOYSA-N D-asperlin Natural products CC1OC1C1C(OC(C)=O)C=CC(=O)O1 SPKNARKFCOPTSY-UHFFFAOYSA-N 0.000 description 1
- GSDBGCKBBJVPNC-UHFFFAOYSA-N D-lombricine Natural products OC(=O)C(N)COP(O)(=O)OCCN=C(N)N GSDBGCKBBJVPNC-UHFFFAOYSA-N 0.000 description 1
- 229940126289 DNA-PK inhibitor Drugs 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- 229940122964 Deacetylase inhibitor Drugs 0.000 description 1
- 206010051055 Deep vein thrombosis Diseases 0.000 description 1
- GJKXGJCSJWBJEZ-XRSSZCMZSA-N Deslorelin Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CNC2=CC=CC=C12 GJKXGJCSJWBJEZ-XRSSZCMZSA-N 0.000 description 1
- 208000013558 Developmental Bone disease Diseases 0.000 description 1
- KYHUYMLIVQFXRI-SJPGYWQQSA-N Didemnin B Chemical compound CN([C@H](CC(C)C)C(=O)N[C@@H]1C(=O)N[C@@H]([C@H](CC(=O)O[C@H](C(=O)[C@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N2CCC[C@H]2C(=O)N(C)[C@@H](CC=2C=CC(OC)=CC=2)C(=O)O[C@@H]1C)C(C)C)O)[C@@H](C)CC)C(=O)[C@@H]1CCCN1C(=O)[C@H](C)O KYHUYMLIVQFXRI-SJPGYWQQSA-N 0.000 description 1
- HWMMBHOXHRVLCU-UHFFFAOYSA-N Dioxamycin Natural products CC1OC(C)(C(O)=O)OC1C=CC=CC=CC(=O)OC1C(C)OC(C=2C(=C3C(=O)C4=C(C5(C(=O)C(O)C(C)(O)CC5(O)C=C4)O)C(=O)C3=CC=2)O)CC1 HWMMBHOXHRVLCU-UHFFFAOYSA-N 0.000 description 1
- 208000006926 Discoid Lupus Erythematosus Diseases 0.000 description 1
- MWWSFMDVAYGXBV-RUELKSSGSA-N Doxorubicin hydrochloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 MWWSFMDVAYGXBV-RUELKSSGSA-N 0.000 description 1
- ZQZFYGIXNQKOAV-OCEACIFDSA-N Droloxifene Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=C(O)C=CC=1)\C1=CC=C(OCCN(C)C)C=C1 ZQZFYGIXNQKOAV-OCEACIFDSA-N 0.000 description 1
- CYQFCXCEBYINGO-DLBZAZTESA-N Dronabinol Natural products C1=C(C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@H]21 CYQFCXCEBYINGO-DLBZAZTESA-N 0.000 description 1
- VQNATVDKACXKTF-UHFFFAOYSA-N Duocarmycin SA Natural products COC1=C(OC)C(OC)=C2NC(C(=O)N3C4=CC(=O)C5=C(C64CC6C3)C=C(N5)C(=O)OC)=CC2=C1 VQNATVDKACXKTF-UHFFFAOYSA-N 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 108060006698 EGF receptor Proteins 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 101150029707 ERBB2 gene Proteins 0.000 description 1
- 239000012824 ERK inhibitor Substances 0.000 description 1
- 208000034715 Enchondroma Diseases 0.000 description 1
- 206010014733 Endometrial cancer Diseases 0.000 description 1
- 206010014759 Endometrial neoplasm Diseases 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 201000008228 Ependymoblastoma Diseases 0.000 description 1
- 206010014967 Ependymoma Diseases 0.000 description 1
- 206010014968 Ependymoma malignant Diseases 0.000 description 1
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 206010015226 Erythema nodosum Diseases 0.000 description 1
- 102000003951 Erythropoietin Human genes 0.000 description 1
- 108090000394 Erythropoietin Proteins 0.000 description 1
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 1
- 108010008165 Etanercept Proteins 0.000 description 1
- DBVJJBKOTRCVKF-UHFFFAOYSA-N Etidronic acid Chemical compound OP(=O)(O)C(O)(C)P(O)(O)=O DBVJJBKOTRCVKF-UHFFFAOYSA-N 0.000 description 1
- ITIONVBQFUNVJV-UHFFFAOYSA-N Etomidoline Chemical compound C12=CC=CC=C2C(=O)N(CC)C1NC(C=C1)=CC=C1OCCN1CCCCC1 ITIONVBQFUNVJV-UHFFFAOYSA-N 0.000 description 1
- HKVAMNSJSFKALM-GKUWKFKPSA-N Everolimus Chemical compound C1C[C@@H](OCCO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 HKVAMNSJSFKALM-GKUWKFKPSA-N 0.000 description 1
- 208000006168 Ewing Sarcoma Diseases 0.000 description 1
- 229940124783 FAK inhibitor Drugs 0.000 description 1
- 239000001263 FEMA 3042 Substances 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 1
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 1
- 102100024785 Fibroblast growth factor 2 Human genes 0.000 description 1
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 1
- 201000008808 Fibrosarcoma Diseases 0.000 description 1
- 206010016654 Fibrosis Diseases 0.000 description 1
- 108010029961 Filgrastim Proteins 0.000 description 1
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 1
- 206010017533 Fungal infection Diseases 0.000 description 1
- 229910052688 Gadolinium Inorganic materials 0.000 description 1
- IAJILQKETJEXLJ-UHFFFAOYSA-N Galacturonsaeure Natural products O=CC(O)C(O)C(O)C(O)C(O)=O IAJILQKETJEXLJ-UHFFFAOYSA-N 0.000 description 1
- 206010051066 Gastrointestinal stromal tumour Diseases 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 206010018364 Glomerulonephritis Diseases 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- 102000002254 Glycogen Synthase Kinase 3 Human genes 0.000 description 1
- 108010014905 Glycogen Synthase Kinase 3 Proteins 0.000 description 1
- 208000009329 Graft vs Host Disease Diseases 0.000 description 1
- 206010072579 Granulomatosis with polyangiitis Diseases 0.000 description 1
- 208000035895 Guillain-Barré syndrome Diseases 0.000 description 1
- 229940125497 HER2 kinase inhibitor Drugs 0.000 description 1
- 229910004373 HOAc Inorganic materials 0.000 description 1
- 101100356020 Haemophilus influenzae (strain ATCC 51907 / DSM 11121 / KW20 / Rd) recA gene Proteins 0.000 description 1
- 208000035186 Hemolytic Autoimmune Anemia Diseases 0.000 description 1
- 208000029433 Herpesviridae infectious disease Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000783681 Homo sapiens 5'-AMP-activated protein kinase catalytic subunit alpha-2 Proteins 0.000 description 1
- 101000851181 Homo sapiens Epidermal growth factor receptor Proteins 0.000 description 1
- 101000582950 Homo sapiens Platelet factor 4 Proteins 0.000 description 1
- 101000692455 Homo sapiens Platelet-derived growth factor receptor beta Proteins 0.000 description 1
- 101000932478 Homo sapiens Receptor-type tyrosine-protein kinase FLT3 Proteins 0.000 description 1
- 101000617830 Homo sapiens Sterol O-acyltransferase 1 Proteins 0.000 description 1
- VSNHCAURESNICA-UHFFFAOYSA-N Hydroxyurea Chemical compound NC(=O)NO VSNHCAURESNICA-UHFFFAOYSA-N 0.000 description 1
- 208000037147 Hypercalcaemia Diseases 0.000 description 1
- 206010020649 Hyperkeratosis Diseases 0.000 description 1
- 206010020983 Hypogammaglobulinaemia Diseases 0.000 description 1
- MPBVHIBUJCELCL-UHFFFAOYSA-N Ibandronate Chemical compound CCCCCN(C)CCC(O)(P(O)(O)=O)P(O)(O)=O MPBVHIBUJCELCL-UHFFFAOYSA-N 0.000 description 1
- XDXDZDZNSLXDNA-UHFFFAOYSA-N Idarubicin Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XDXDZDZNSLXDNA-UHFFFAOYSA-N 0.000 description 1
- JJKOTMDDZAJTGQ-DQSJHHFOSA-N Idoxifene Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN2CCCC2)=CC=1)/C1=CC=C(I)C=C1 JJKOTMDDZAJTGQ-DQSJHHFOSA-N 0.000 description 1
- 208000029462 Immunodeficiency disease Diseases 0.000 description 1
- 101000668058 Infectious salmon anemia virus (isolate Atlantic salmon/Norway/810/9/99) RNA-directed RNA polymerase catalytic subunit Proteins 0.000 description 1
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 1
- 108700022013 Insecta cecropin B Proteins 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 108010002386 Interleukin-3 Proteins 0.000 description 1
- 102100039064 Interleukin-3 Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 208000005615 Interstitial Cystitis Diseases 0.000 description 1
- 102100024319 Intestinal-type alkaline phosphatase Human genes 0.000 description 1
- 239000012825 JNK inhibitor Substances 0.000 description 1
- 229940118135 JNK inhibitor Drugs 0.000 description 1
- 229940122245 Janus kinase inhibitor Drugs 0.000 description 1
- 208000003456 Juvenile Arthritis Diseases 0.000 description 1
- 208000012528 Juvenile dermatomyositis Diseases 0.000 description 1
- 206010059176 Juvenile idiopathic arthritis Diseases 0.000 description 1
- 208000001126 Keratosis Diseases 0.000 description 1
- GSDBGCKBBJVPNC-BYPYZUCNSA-N L-lombricine Chemical compound NC(=[NH2+])NCCOP([O-])(=O)OC[C@H]([NH3+])C([O-])=O GSDBGCKBBJVPNC-BYPYZUCNSA-N 0.000 description 1
- 108010043135 L-methionine gamma-lyase Proteins 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- 239000002177 L01XE27 - Ibrutinib Substances 0.000 description 1
- 201000005099 Langerhans cell histiocytosis Diseases 0.000 description 1
- 206010023825 Laryngeal cancer Diseases 0.000 description 1
- ZHTRILQJTPJGNK-FYBAATNNSA-N Leinamycin Chemical compound N([C@@H](C=1SC=C(N=1)\C=C/C=C/C(=O)[C@H](O)/C=C(C)/CC1)C)C(=O)C[C@@]21S(=O)SC(=O)[C@]2(C)O ZHTRILQJTPJGNK-FYBAATNNSA-N 0.000 description 1
- ZHTRILQJTPJGNK-UHFFFAOYSA-N Leinamycin Natural products C1CC(C)=CC(O)C(=O)C=CC=CC(N=2)=CSC=2C(C)NC(=O)CC21S(=O)SC(=O)C2(C)O ZHTRILQJTPJGNK-UHFFFAOYSA-N 0.000 description 1
- 108010062867 Lenograstim Proteins 0.000 description 1
- 229920001491 Lentinan Polymers 0.000 description 1
- 206010024229 Leprosy Diseases 0.000 description 1
- LMVRPBWWHMVLPC-KBPJCXPTSA-N Leptolstatin Natural products CC(CC=CC(=CC(C)C(=O)C(C)C(O)C(C)CC(=CCO)C)C)C=C(C)/C=C/C1CC=CC(=O)O1 LMVRPBWWHMVLPC-KBPJCXPTSA-N 0.000 description 1
- HLFSDGLLUJUHTE-SNVBAGLBSA-N Levamisole Chemical compound C1([C@H]2CN3CCSC3=N2)=CC=CC=C1 HLFSDGLLUJUHTE-SNVBAGLBSA-N 0.000 description 1
- 206010062038 Lip neoplasm Diseases 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 229910052765 Lutetium Inorganic materials 0.000 description 1
- 206010052178 Lymphocytic lymphoma Diseases 0.000 description 1
- 206010025312 Lymphoma AIDS related Diseases 0.000 description 1
- 229940126560 MAPK inhibitor Drugs 0.000 description 1
- 229940124647 MEK inhibitor Drugs 0.000 description 1
- 102100028198 Macrophage colony-stimulating factor 1 receptor Human genes 0.000 description 1
- 101710150918 Macrophage colony-stimulating factor 1 receptor Proteins 0.000 description 1
- 206010064281 Malignant atrophic papulosis Diseases 0.000 description 1
- 208000032271 Malignant tumor of penis Diseases 0.000 description 1
- BLOFGONIVNXZME-UHFFFAOYSA-N Mannostatin A Natural products CSC1C(N)C(O)C(O)C1O BLOFGONIVNXZME-UHFFFAOYSA-N 0.000 description 1
- 229940124183 Matrilysin inhibitor Drugs 0.000 description 1
- 208000000172 Medulloblastoma Diseases 0.000 description 1
- 208000027530 Meniere disease Diseases 0.000 description 1
- 201000009906 Meningitis Diseases 0.000 description 1
- 208000002030 Merkel cell carcinoma Diseases 0.000 description 1
- 206010027406 Mesothelioma Diseases 0.000 description 1
- 101710170181 Metalloproteinase inhibitor Proteins 0.000 description 1
- 206010049567 Miller Fisher syndrome Diseases 0.000 description 1
- 229930192392 Mitomycin Natural products 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 101100042680 Mus musculus Slc7a1 gene Proteins 0.000 description 1
- 206010052904 Musculoskeletal stiffness Diseases 0.000 description 1
- 101710135898 Myc proto-oncogene protein Proteins 0.000 description 1
- 102100038895 Myc proto-oncogene protein Human genes 0.000 description 1
- 206010062207 Mycobacterial infection Diseases 0.000 description 1
- 208000033833 Myelomonocytic Chronic Leukemia Diseases 0.000 description 1
- 201000007224 Myeloproliferative neoplasm Diseases 0.000 description 1
- USVMJSALORZVDV-SDBHATRESA-N N(6)-(Delta(2)-isopentenyl)adenosine Chemical compound C1=NC=2C(NCC=C(C)C)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O USVMJSALORZVDV-SDBHATRESA-N 0.000 description 1
- WUKZPHOXUVCQOR-UHFFFAOYSA-N N-(1-azabicyclo[2.2.2]octan-3-yl)-6-chloro-4-methyl-3-oxo-1,4-benzoxazine-8-carboxamide Chemical compound C1N(CC2)CCC2C1NC(=O)C1=CC(Cl)=CC2=C1OCC(=O)N2C WUKZPHOXUVCQOR-UHFFFAOYSA-N 0.000 description 1
- BNQSTAOJRULKNX-UHFFFAOYSA-N N-(6-acetamidohexyl)acetamide Chemical compound CC(=O)NCCCCCCNC(C)=O BNQSTAOJRULKNX-UHFFFAOYSA-N 0.000 description 1
- QJMCKEPOKRERLN-UHFFFAOYSA-N N-3,4-tridhydroxybenzamide Chemical compound ONC(=O)C1=CC=C(O)C(O)=C1 QJMCKEPOKRERLN-UHFFFAOYSA-N 0.000 description 1
- HCUZBHUYMOWBKX-UHFFFAOYSA-N N-[3-[[[2-(2,6-dioxopiperidin-3-yl)-1-oxo-3H-isoindol-4-yl]amino]methyl]-2-fluorophenyl]acetamide Chemical compound C1(=C(C(=CC=C1)CNC1=CC=CC=2C(=O)N(CC1=2)C1C(=O)NC(=O)CC1)F)NC(=O)C HCUZBHUYMOWBKX-UHFFFAOYSA-N 0.000 description 1
- 150000007945 N-acyl ureas Chemical class 0.000 description 1
- LYPFDBRUNKHDGX-SOGSVHMOSA-N N1C2=CC=C1\C(=C1\C=CC(=N1)\C(=C1\C=C/C(/N1)=C(/C1=N/C(/CC1)=C2/C1=CC(O)=CC=C1)C1=CC(O)=CC=C1)\C1=CC(O)=CC=C1)C1=CC(O)=CC=C1 Chemical compound N1C2=CC=C1\C(=C1\C=CC(=N1)\C(=C1\C=C/C(/N1)=C(/C1=N/C(/CC1)=C2/C1=CC(O)=CC=C1)C1=CC(O)=CC=C1)\C1=CC(O)=CC=C1)C1=CC(O)=CC=C1 LYPFDBRUNKHDGX-SOGSVHMOSA-N 0.000 description 1
- 108010021717 Nafarelin Proteins 0.000 description 1
- 208000002454 Nasopharyngeal Carcinoma Diseases 0.000 description 1
- 206010061306 Nasopharyngeal cancer Diseases 0.000 description 1
- 206010028851 Necrosis Diseases 0.000 description 1
- 206010061309 Neoplasm progression Diseases 0.000 description 1
- 102400000058 Neuregulin-1 Human genes 0.000 description 1
- 108090000556 Neuregulin-1 Proteins 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 206010029266 Neuroendocrine carcinoma of the skin Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical class O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- KYRVNWMVYQXFEU-UHFFFAOYSA-N Nocodazole Chemical compound C1=C2NC(NC(=O)OC)=NC2=CC=C1C(=O)C1=CC=CS1 KYRVNWMVYQXFEU-UHFFFAOYSA-N 0.000 description 1
- KGTDRFCXGRULNK-UHFFFAOYSA-N Nogalamycin Natural products COC1C(OC)(C)C(OC)C(C)OC1OC1C2=C(O)C(C(=O)C3=C(O)C=C4C5(C)OC(C(C(C5O)N(C)C)O)OC4=C3C3=O)=C3C=C2C(C(=O)OC)C(C)(O)C1 KGTDRFCXGRULNK-UHFFFAOYSA-N 0.000 description 1
- 208000010505 Nose Neoplasms Diseases 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 108010016076 Octreotide Proteins 0.000 description 1
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 1
- 208000000160 Olfactory Esthesioneuroblastoma Diseases 0.000 description 1
- VTAZRSXSBIHBMH-UHFFFAOYSA-N Ophiocordin Natural products OC1=CC(C(=O)O)=CC(O)=C1C(=O)C1=C(O)C=CC=C1C(=O)NC1C(OC(=O)C=2C=CC(O)=CC=2)CCCNC1 VTAZRSXSBIHBMH-UHFFFAOYSA-N 0.000 description 1
- 208000001388 Opportunistic Infections Diseases 0.000 description 1
- 206010031096 Oropharyngeal cancer Diseases 0.000 description 1
- 206010057444 Oropharyngeal neoplasm Diseases 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 208000001715 Osteoblastoma Diseases 0.000 description 1
- 208000000035 Osteochondroma Diseases 0.000 description 1
- 208000001132 Osteoporosis Diseases 0.000 description 1
- 208000007571 Ovarian Epithelial Carcinoma Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- LKBBOPGQDRPCDS-UHFFFAOYSA-N Oxaunomycin Natural products C12=C(O)C=3C(=O)C4=C(O)C=CC=C4C(=O)C=3C(O)=C2C(O)C(CC)(O)CC1OC1CC(N)C(O)C(C)O1 LKBBOPGQDRPCDS-UHFFFAOYSA-N 0.000 description 1
- 239000012661 PARP inhibitor Substances 0.000 description 1
- 229940124611 PDK1 inhibitor Drugs 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- VYOQBYCIIJYKJA-UHFFFAOYSA-N Palauamine Natural products C1N2C(=O)C3=CC=CN3C3N=C(N)NC32C2C1C(CN)C(Cl)C12NC(N)=NC1O VYOQBYCIIJYKJA-UHFFFAOYSA-N 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- FRCJDPPXHQGEKS-UHFFFAOYSA-N Parabactin Natural products CC1OC(=NC1C(=O)N(CCCCNC(=O)c1cccc(O)c1O)CCCNC(=O)c1cccc(O)c1O)c1ccccc1O FRCJDPPXHQGEKS-UHFFFAOYSA-N 0.000 description 1
- 206010061332 Paraganglion neoplasm Diseases 0.000 description 1
- 208000000821 Parathyroid Neoplasms Diseases 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 208000029082 Pelvic Inflammatory Disease Diseases 0.000 description 1
- 206010034277 Pemphigoid Diseases 0.000 description 1
- 201000011152 Pemphigus Diseases 0.000 description 1
- 208000002471 Penile Neoplasms Diseases 0.000 description 1
- 206010034299 Penile cancer Diseases 0.000 description 1
- LRBQNJMCXXYXIU-PPKXGCFTSA-N Penta-digallate-beta-D-glucose Natural products OC1=C(O)C(O)=CC(C(=O)OC=2C(=C(O)C=C(C=2)C(=O)OC[C@@H]2[C@H]([C@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)O2)OC(=O)C=2C=C(OC(=O)C=3C=C(O)C(O)=C(O)C=3)C(O)=C(O)C=2)O)=C1 LRBQNJMCXXYXIU-PPKXGCFTSA-N 0.000 description 1
- 108010057150 Peplomycin Proteins 0.000 description 1
- 208000031845 Pernicious anaemia Diseases 0.000 description 1
- 241000009328 Perro Species 0.000 description 1
- APNRZHLOPQFNMR-UHFFFAOYSA-N Phenazinomycin Natural products C12=CC=CC=C2N=C(C(C=CC=2)=O)C=2N1CC=C(C)CCC1C(=C)CCCC1(C)C APNRZHLOPQFNMR-UHFFFAOYSA-N 0.000 description 1
- 229940122907 Phosphatase inhibitor Drugs 0.000 description 1
- OAICVXFJPJFONN-OUBTZVSYSA-N Phosphorus-32 Chemical compound [32P] OAICVXFJPJFONN-OUBTZVSYSA-N 0.000 description 1
- 102100030304 Platelet factor 4 Human genes 0.000 description 1
- 102100026547 Platelet-derived growth factor receptor beta Human genes 0.000 description 1
- 229940121906 Poly ADP ribose polymerase inhibitor Drugs 0.000 description 1
- 208000007048 Polymyalgia Rheumatica Diseases 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 208000012654 Primary biliary cholangitis Diseases 0.000 description 1
- 108090000315 Protein Kinase C Proteins 0.000 description 1
- 102000003923 Protein Kinase C Human genes 0.000 description 1
- 102100032420 Protein S100-A9 Human genes 0.000 description 1
- 229940123924 Protein kinase C inhibitor Drugs 0.000 description 1
- PICZCWCKOLHDOJ-UHFFFAOYSA-N Pseudoaxinellin Natural products N1C(=O)C2CCCN2C(=O)C(CC(N)=O)NC(=O)C(C(C)C)NC(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C(C(C)C)NC(=O)C1CC1=CC=CC=C1 PICZCWCKOLHDOJ-UHFFFAOYSA-N 0.000 description 1
- 208000010378 Pulmonary Embolism Diseases 0.000 description 1
- 201000008183 Pulmonary blastoma Diseases 0.000 description 1
- 229940123827 Purine nucleoside phosphorylase inhibitor Drugs 0.000 description 1
- XESARGFCSKSFID-UHFFFAOYSA-N Pyrazofurin Natural products OC1=C(C(=O)N)NN=C1C1C(O)C(O)C(CO)O1 XESARGFCSKSFID-UHFFFAOYSA-N 0.000 description 1
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 1
- 102000003901 Ras GTPase-activating proteins Human genes 0.000 description 1
- 108090000231 Ras GTPase-activating proteins Proteins 0.000 description 1
- 229940078123 Ras inhibitor Drugs 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 102100020718 Receptor-type tyrosine-protein kinase FLT3 Human genes 0.000 description 1
- 208000013616 Respiratory Distress Syndrome Diseases 0.000 description 1
- OWPCHSCAPHNHAV-UHFFFAOYSA-N Rhizoxin Natural products C1C(O)C2(C)OC2C=CC(C)C(OC(=O)C2)CC2CC2OC2C(=O)OC1C(C)C(OC)C(C)=CC=CC(C)=CC1=COC(C)=N1 OWPCHSCAPHNHAV-UHFFFAOYSA-N 0.000 description 1
- 108010034782 Ribosomal Protein S6 Kinases Proteins 0.000 description 1
- 102000009738 Ribosomal Protein S6 Kinases Human genes 0.000 description 1
- VVDRDLMZLNTLEB-UHFFFAOYSA-N Rohitukin Natural products CC(C)CC(=O)OC1C(C(C(=C)C2(O)C(=O)CC(c3cocc3)C12C)C4(C)C(CC(=O)OC5(C)COC(=O)CC45)OC(=O)C)C(=O)O VVDRDLMZLNTLEB-UHFFFAOYSA-N 0.000 description 1
- 108010005173 SERPIN-B5 Proteins 0.000 description 1
- 229910006124 SOCl2 Inorganic materials 0.000 description 1
- 108010084592 Saporins Proteins 0.000 description 1
- YADVRLOQIWILGX-MIWLTHJTSA-N Sarcophytol A Chemical compound CC(C)C/1=C/C=C(C)/CC\C=C(C)\CC\C=C(C)\C[C@@H]\1O YADVRLOQIWILGX-MIWLTHJTSA-N 0.000 description 1
- 206010039710 Scleroderma Diseases 0.000 description 1
- 102100030333 Serpin B5 Human genes 0.000 description 1
- 208000021386 Sjogren Syndrome Diseases 0.000 description 1
- 206010072610 Skeletal dysplasia Diseases 0.000 description 1
- UIRKNQLZZXALBI-MSVGPLKSSA-N Squalamine Chemical compound C([C@@H]1C[C@H]2O)[C@@H](NCCCNCCCCN)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@H](C)CC[C@H](C(C)C)OS(O)(=O)=O)[C@@]2(C)CC1 UIRKNQLZZXALBI-MSVGPLKSSA-N 0.000 description 1
- UIRKNQLZZXALBI-UHFFFAOYSA-N Squalamine Natural products OC1CC2CC(NCCCNCCCCN)CCC2(C)C2C1C1CCC(C(C)CCC(C(C)C)OS(O)(=O)=O)C1(C)CC2 UIRKNQLZZXALBI-UHFFFAOYSA-N 0.000 description 1
- 229940122924 Src inhibitor Drugs 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 102100021993 Sterol O-acyltransferase 1 Human genes 0.000 description 1
- 208000005718 Stomach Neoplasms Diseases 0.000 description 1
- 101000697584 Streptomyces lavendulae Streptothricin acetyltransferase Proteins 0.000 description 1
- 229940096116 Survivin inhibitor Drugs 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- CYQFCXCEBYINGO-UHFFFAOYSA-N THC Natural products C1=C(C)CCC2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3C21 CYQFCXCEBYINGO-UHFFFAOYSA-N 0.000 description 1
- 208000001106 Takayasu Arteritis Diseases 0.000 description 1
- 229940123582 Telomerase inhibitor Drugs 0.000 description 1
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 1
- 208000031320 Teratogenesis Diseases 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 206010057644 Testis cancer Diseases 0.000 description 1
- WXZSUBHBYQYTNM-UHFFFAOYSA-N Tetrazomine Natural products C1=CC=2CC(N34)C(N5C)C(CO)CC5C4OCC3C=2C(OC)=C1NC(=O)C1NCCCC1O WXZSUBHBYQYTNM-UHFFFAOYSA-N 0.000 description 1
- FOCVUCIESVLUNU-UHFFFAOYSA-N Thiotepa Chemical compound C1CN1P(N1CC1)(=S)N1CC1 FOCVUCIESVLUNU-UHFFFAOYSA-N 0.000 description 1
- 206010043515 Throat cancer Diseases 0.000 description 1
- 108010078233 Thymalfasin Proteins 0.000 description 1
- 201000009365 Thymic carcinoma Diseases 0.000 description 1
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 1
- IWEQQRMGNVVKQW-OQKDUQJOSA-N Toremifene citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 IWEQQRMGNVVKQW-OQKDUQJOSA-N 0.000 description 1
- 206010044248 Toxic shock syndrome Diseases 0.000 description 1
- 231100000650 Toxic shock syndrome Toxicity 0.000 description 1
- 101710150448 Transcriptional regulator Myc Proteins 0.000 description 1
- 206010052779 Transplant rejections Diseases 0.000 description 1
- 108010050144 Triptorelin Pamoate Proteins 0.000 description 1
- 102100040247 Tumor necrosis factor Human genes 0.000 description 1
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 1
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 1
- 102100029823 Tyrosine-protein kinase BTK Human genes 0.000 description 1
- VGQOVCHZGQWAOI-UHFFFAOYSA-N UNPD55612 Natural products N1C(O)C2CC(C=CC(N)=O)=CN2C(=O)C2=CC=C(C)C(O)=C12 VGQOVCHZGQWAOI-UHFFFAOYSA-N 0.000 description 1
- 206010045515 Undifferentiated sarcoma Diseases 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 102000003990 Urokinase-type plasminogen activator Human genes 0.000 description 1
- 108090000435 Urokinase-type plasminogen activator Proteins 0.000 description 1
- 208000006593 Urologic Neoplasms Diseases 0.000 description 1
- 208000002495 Uterine Neoplasms Diseases 0.000 description 1
- 206010046851 Uveitis Diseases 0.000 description 1
- 229940124674 VEGF-R inhibitor Drugs 0.000 description 1
- 102000016549 Vascular Endothelial Growth Factor Receptor-2 Human genes 0.000 description 1
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 description 1
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 description 1
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 1
- 206010047249 Venous thrombosis Diseases 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- 208000005914 Viral Conjunctivitis Diseases 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 206010047642 Vitiligo Diseases 0.000 description 1
- 101150040313 Wee1 gene Proteins 0.000 description 1
- 230000004156 Wnt signaling pathway Effects 0.000 description 1
- MHDDZDPNIDVLNK-ZGIWMXSJSA-N Zanoterone Chemical compound C1C2=NN(S(C)(=O)=O)C=C2C[C@]2(C)[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CC[C@H]21 MHDDZDPNIDVLNK-ZGIWMXSJSA-N 0.000 description 1
- VUPBDWQPEOWRQP-RTUCOMKBSA-N [(2R,3S,4S,5R,6R)-2-[(2R,3S,4S,5S,6S)-2-[(1S,2S)-3-[[(2R,3S)-5-[[(2S,3R)-1-[[2-[4-[4-[[4-amino-6-[3-(4-aminobutylamino)propylamino]-6-oxohexyl]carbamoyl]-1,3-thiazol-2-yl]-1,3-thiazol-2-yl]-1-[(2S,3R,4R,5S,6S)-5-amino-3,4-dihydroxy-6-methyloxan-2-yl]oxy-2-hydroxyethyl]amino]-3-hydroxy-1-oxobutan-2-yl]amino]-3-hydroxy-5-oxopentan-2-yl]amino]-2-[[6-amino-2-[(1S)-3-amino-1-[[(2S)-2,3-diamino-3-oxopropyl]amino]-3-oxopropyl]-5-methylpyrimidine-4-carbonyl]amino]-1-(1H-imidazol-5-yl)-3-oxopropoxy]-4,5-dihydroxy-6-(hydroxymethyl)oxan-3-yl]oxy-3,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl] carbamate Chemical compound C[C@@H](O)[C@H](NC(=O)C[C@H](O)[C@@H](C)NC(=O)[C@@H](NC(=O)c1nc(nc(N)c1C)[C@H](CC(N)=O)NC[C@H](N)C(N)=O)[C@H](O[C@@H]1O[C@@H](CO)[C@@H](O)[C@H](O)[C@@H]1O[C@H]1O[C@H](CO)[C@@H](O)[C@H](OC(N)=O)[C@@H]1O)c1cnc[nH]1)C(=O)NC(O[C@@H]1O[C@@H](C)[C@@H](N)[C@@H](O)[C@H]1O)C(O)c1nc(cs1)-c1nc(cs1)C(=O)NCCCC(N)CC(=O)NCCCNCCCCN VUPBDWQPEOWRQP-RTUCOMKBSA-N 0.000 description 1
- SPKNARKFCOPTSY-XWPZMVOTSA-N [(2r,3s)-2-[(2s,3r)-3-methyloxiran-2-yl]-6-oxo-2,3-dihydropyran-3-yl] acetate Chemical compound C[C@H]1O[C@@H]1[C@H]1[C@@H](OC(C)=O)C=CC(=O)O1 SPKNARKFCOPTSY-XWPZMVOTSA-N 0.000 description 1
- YQCUZBLLIDLHIP-CKSHBZRKSA-N [(3s,3ar,4r,5r,6s,7as)-6-[(4s,5r,5ar,9as)-4-acetyloxy-5,9a-dimethyl-2,7-dioxo-4,5a,6,9-tetrahydro-3h-pyrano[3,4-b]oxepin-5-yl]-5-formyloxy-3-(furan-2-yl)-7a-hydroxy-3a-methyl-7-methylidene-1-oxo-3,4,5,6-tetrahydro-2h-inden-4-yl] 3-methylbutanoate Chemical compound C1([C@H]2CC(=O)[C@]3(O)C(=C)[C@@H]([C@@H](OC=O)[C@@H]([C@@]23C)OC(=O)CC(C)C)[C@@]2(C)[C@H](CC(=O)O[C@]3(C)COC(=O)C[C@@H]32)OC(C)=O)=CC=CO1 YQCUZBLLIDLHIP-CKSHBZRKSA-N 0.000 description 1
- IVCRCPJOLWECJU-XQVQQVTHSA-N [(7r,8r,9s,10r,13s,14s,17s)-7,13-dimethyl-3-oxo-2,6,7,8,9,10,11,12,14,15,16,17-dodecahydro-1h-cyclopenta[a]phenanthren-17-yl] acetate Chemical compound C1C[C@]2(C)[C@@H](OC(C)=O)CC[C@H]2[C@@H]2[C@H](C)CC3=CC(=O)CC[C@@H]3[C@H]21 IVCRCPJOLWECJU-XQVQQVTHSA-N 0.000 description 1
- PQNNIEWMPIULRS-SUTYWZMXSA-N [(8e,10e,12e)-7-hydroxy-6-methyl-2-(3-methyl-6-oxo-2,3-dihydropyran-2-yl)tetradeca-8,10,12-trien-5-yl] dihydrogen phosphate Chemical compound C\C=C\C=C\C=C\C(O)C(C)C(OP(O)(O)=O)CCC(C)C1OC(=O)C=CC1C PQNNIEWMPIULRS-SUTYWZMXSA-N 0.000 description 1
- IFJUINDAXYAPTO-UUBSBJJBSA-N [(8r,9s,13s,14s,17s)-17-[2-[4-[4-[bis(2-chloroethyl)amino]phenyl]butanoyloxy]acetyl]oxy-13-methyl-6,7,8,9,11,12,14,15,16,17-decahydrocyclopenta[a]phenanthren-3-yl] benzoate Chemical compound C([C@@H]1[C@@H](C2=CC=3)CC[C@]4([C@H]1CC[C@@H]4OC(=O)COC(=O)CCCC=1C=CC(=CC=1)N(CCCl)CCCl)C)CC2=CC=3OC(=O)C1=CC=CC=C1 IFJUINDAXYAPTO-UUBSBJJBSA-N 0.000 description 1
- KMLCRELJHYKIIL-UHFFFAOYSA-N [1-(azanidylmethyl)cyclohexyl]methylazanide;platinum(2+);sulfuric acid Chemical compound [Pt+2].OS(O)(=O)=O.[NH-]CC1(C[NH-])CCCCC1 KMLCRELJHYKIIL-UHFFFAOYSA-N 0.000 description 1
- JJULHOZRTCDZOH-JGJFOBQESA-N [1-[[[(2r,3s,4s,5r)-5-(4-amino-2-oxopyrimidin-1-yl)-3,4-dihydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-hydroxyphosphoryl]oxy-3-octadecylsulfanylpropan-2-yl] hexadecanoate Chemical compound O[C@H]1[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OCC(CSCCCCCCCCCCCCCCCCCC)OC(=O)CCCCCCCCCCCCCCC)O[C@H]1N1C(=O)N=C(N)C=C1 JJULHOZRTCDZOH-JGJFOBQESA-N 0.000 description 1
- PNDPGZBMCMUPRI-XXSWNUTMSA-N [125I][125I] Chemical compound [125I][125I] PNDPGZBMCMUPRI-XXSWNUTMSA-N 0.000 description 1
- XSMVECZRZBFTIZ-UHFFFAOYSA-M [2-(aminomethyl)cyclobutyl]methanamine;2-oxidopropanoate;platinum(4+) Chemical compound [Pt+4].CC([O-])C([O-])=O.NCC1CCC1CN XSMVECZRZBFTIZ-UHFFFAOYSA-M 0.000 description 1
- PEMKBDBOZNEDHR-UHFFFAOYSA-N [2-fluoro-3-(methylamino)phenyl]methanol Chemical compound FC1=C(C=CC=C1NC)CO PEMKBDBOZNEDHR-UHFFFAOYSA-N 0.000 description 1
- HJPLSUBYFCZLPE-UHFFFAOYSA-N [2-fluoro-4-(morpholin-4-ylmethyl)phenyl]methanol Chemical compound FC1=C(C=CC(=C1)CN1CCOCC1)CO HJPLSUBYFCZLPE-UHFFFAOYSA-N 0.000 description 1
- NAFFDQVVNWTDJD-UHFFFAOYSA-L [4-(azanidylmethyl)oxan-4-yl]methylazanide;cyclobutane-1,1-dicarboxylate;platinum(4+) Chemical compound [Pt+4].[NH-]CC1(C[NH-])CCOCC1.[O-]C(=O)C1(C([O-])=O)CCC1 NAFFDQVVNWTDJD-UHFFFAOYSA-L 0.000 description 1
- 229960000446 abciximab Drugs 0.000 description 1
- 239000002250 absorbent Substances 0.000 description 1
- 230000002745 absorbent Effects 0.000 description 1
- IPBVNPXQWQGGJP-UHFFFAOYSA-N acetic acid phenyl ester Natural products CC(=O)OC1=CC=CC=C1 IPBVNPXQWQGGJP-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-GUEYOVJQSA-N acetic acid-d4 Chemical compound [2H]OC(=O)C([2H])([2H])[2H] QTBSBXVTEAMEQO-GUEYOVJQSA-N 0.000 description 1
- RUGAHXUZHWYHNG-NLGNTGLNSA-N acetic acid;(4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-n-[(2s,3r)-1-amino-3-hydroxy-1-oxobutan-2-yl]-19-[[(2r)-2-amino-3-naphthalen-2-ylpropanoyl]amino]-16-[(4-hydroxyphenyl)methyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-7-propan-2-yl-1,2-dithia-5, Chemical compound CC(O)=O.CC(O)=O.CC(O)=O.CC(O)=O.CC(O)=O.C([C@H]1C(=O)N[C@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](N)CC=1C=C2C=CC=CC2=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(N)=O)=O)C(C)C)C1=CC=C(O)C=C1.C([C@H]1C(=O)N[C@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](N)CC=1C=C2C=CC=CC2=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(N)=O)=O)C(C)C)C1=CC=C(O)C=C1 RUGAHXUZHWYHNG-NLGNTGLNSA-N 0.000 description 1
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 1
- 239000012346 acetyl chloride Substances 0.000 description 1
- 150000008043 acidic salts Chemical class 0.000 description 1
- QAWIHIJWNYOLBE-OKKQSCSOSA-N acivicin Chemical compound OC(=O)[C@@H](N)[C@@H]1CC(Cl)=NO1 QAWIHIJWNYOLBE-OKKQSCSOSA-N 0.000 description 1
- 229950008427 acivicin Drugs 0.000 description 1
- USZYSDMBJDPRIF-SVEJIMAYSA-N aclacinomycin A Chemical compound O([C@H]1[C@@H](O)C[C@@H](O[C@H]1C)O[C@H]1[C@H](C[C@@H](O[C@H]1C)O[C@H]1C[C@]([C@@H](C2=CC=3C(=O)C4=CC=CC(O)=C4C(=O)C=3C(O)=C21)C(=O)OC)(O)CC)N(C)C)[C@H]1CCC(=O)[C@H](C)O1 USZYSDMBJDPRIF-SVEJIMAYSA-N 0.000 description 1
- 229960004176 aclarubicin Drugs 0.000 description 1
- 206010000496 acne Diseases 0.000 description 1
- 229940119059 actemra Drugs 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 239000002404 acyltransferase inhibitor Substances 0.000 description 1
- 229960002964 adalimumab Drugs 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 208000011341 adult acute respiratory distress syndrome Diseases 0.000 description 1
- 201000000028 adult respiratory distress syndrome Diseases 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 108700025316 aldesleukin Proteins 0.000 description 1
- 229960005310 aldesleukin Drugs 0.000 description 1
- 229960000548 alemtuzumab Drugs 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000008052 alkyl sulfonates Chemical class 0.000 description 1
- 230000002152 alkylating effect Effects 0.000 description 1
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- 231100000360 alopecia Toxicity 0.000 description 1
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 1
- 230000008382 alveolar damage Effects 0.000 description 1
- 229950010949 ambamustine Drugs 0.000 description 1
- 229950004821 ambomycin Drugs 0.000 description 1
- JKOQGQFVAUAYPM-UHFFFAOYSA-N amifostine Chemical compound NCCCNCCSP(O)(O)=O JKOQGQFVAUAYPM-UHFFFAOYSA-N 0.000 description 1
- 229960001097 amifostine Drugs 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 229960002749 aminolevulinic acid Drugs 0.000 description 1
- 229960002550 amrubicin Drugs 0.000 description 1
- VJZITPJGSQKZMX-XDPRQOKASA-N amrubicin Chemical compound O([C@H]1C[C@](CC2=C(O)C=3C(=O)C4=CC=CC=C4C(=O)C=3C(O)=C21)(N)C(=O)C)[C@H]1C[C@H](O)[C@H](O)CO1 VJZITPJGSQKZMX-XDPRQOKASA-N 0.000 description 1
- 229960001220 amsacrine Drugs 0.000 description 1
- XCPGHVQEEXUHNC-UHFFFAOYSA-N amsacrine Chemical compound COC1=CC(NS(C)(=O)=O)=CC=C1NC1=C(C=CC=C2)C2=NC2=CC=CC=C12 XCPGHVQEEXUHNC-UHFFFAOYSA-N 0.000 description 1
- 229960001694 anagrelide Drugs 0.000 description 1
- OTBXOEAOVRKTNQ-UHFFFAOYSA-N anagrelide Chemical compound N1=C2NC(=O)CN2CC2=C(Cl)C(Cl)=CC=C21 OTBXOEAOVRKTNQ-UHFFFAOYSA-N 0.000 description 1
- 201000007696 anal canal cancer Diseases 0.000 description 1
- 229960002932 anastrozole Drugs 0.000 description 1
- YBBLVLTVTVSKRW-UHFFFAOYSA-N anastrozole Chemical compound N#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1 YBBLVLTVTVSKRW-UHFFFAOYSA-N 0.000 description 1
- ASLUCFFROXVMFL-UHFFFAOYSA-N andrographolide Natural products CC1(CO)C(O)CCC2(C)C(CC=C3/C(O)OCC3=O)C(=C)CCC12 ASLUCFFROXVMFL-UHFFFAOYSA-N 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 108010070670 antarelix Proteins 0.000 description 1
- VGQOVCHZGQWAOI-HYUHUPJXSA-N anthramycin Chemical compound N1[C@@H](O)[C@@H]2CC(\C=C\C(N)=O)=CN2C(=O)C2=CC=C(C)C(O)=C12 VGQOVCHZGQWAOI-HYUHUPJXSA-N 0.000 description 1
- 230000000181 anti-adherent effect Effects 0.000 description 1
- 230000001772 anti-angiogenic effect Effects 0.000 description 1
- 230000003110 anti-inflammatory effect Effects 0.000 description 1
- 239000003146 anticoagulant agent Substances 0.000 description 1
- 229940127219 anticoagulant drug Drugs 0.000 description 1
- 239000000074 antisense oligonucleotide Substances 0.000 description 1
- 238000012230 antisense oligonucleotides Methods 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 229960003272 asparaginase Drugs 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-M asparaginate Chemical compound [O-]C(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-M 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- TWHSQQYCDVSBRK-UHFFFAOYSA-N asulacrine Chemical compound C12=CC=CC(C)=C2N=C2C(C(=O)NC)=CC=CC2=C1NC1=CC=C(NS(C)(=O)=O)C=C1OC TWHSQQYCDVSBRK-UHFFFAOYSA-N 0.000 description 1
- 229950011088 asulacrine Drugs 0.000 description 1
- 238000011914 asymmetric synthesis Methods 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 229950006933 atrimustine Drugs 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- 201000000448 autoimmune hemolytic anemia Diseases 0.000 description 1
- 229940120638 avastin Drugs 0.000 description 1
- 108010093161 axinastatin 1 Proteins 0.000 description 1
- PICZCWCKOLHDOJ-GHTSNYPWSA-N axinastatin 1 Chemical compound C([C@H]1C(=O)N[C@H](C(=O)N[C@H](C(=O)N2CCC[C@H]2C(=O)N[C@H](C(N[C@@H](CC(N)=O)C(=O)N2CCC[C@H]2C(=O)N1)=O)C(C)C)C(C)C)C(C)C)C1=CC=CC=C1 PICZCWCKOLHDOJ-GHTSNYPWSA-N 0.000 description 1
- 108010093000 axinastatin 2 Proteins 0.000 description 1
- OXNAATCTZCSVKR-AVGVIDKOSA-N axinastatin 2 Chemical compound C([C@H]1C(=O)N[C@H](C(=O)N[C@H](C(N2CCC[C@H]2C(=O)N[C@@H](C(=O)N[C@@H](CC(N)=O)C(=O)N2CCC[C@H]2C(=O)N1)C(C)C)=O)CC(C)C)C(C)C)C1=CC=CC=C1 OXNAATCTZCSVKR-AVGVIDKOSA-N 0.000 description 1
- UZCPCRPHNVHKKP-UHFFFAOYSA-N axinastatin 2 Natural products CC(C)CC1NC(=O)C2CCCN2C(=O)C(NC(=O)C(CC(=O)N)NC(=O)C3CCCN3C(=O)C(Cc4ccccc4)NC(=O)C(NC1=O)C(C)C)C(C)C UZCPCRPHNVHKKP-UHFFFAOYSA-N 0.000 description 1
- 108010092978 axinastatin 3 Proteins 0.000 description 1
- ANLDPEXRVVIABH-WUUSPZRJSA-N axinastatin 3 Chemical compound C([C@H]1C(=O)N[C@H](C(N[C@@H](CC(C)C)C(=O)N2CCC[C@H]2C(=O)N[C@@H](C(=O)N[C@@H](CC(N)=O)C(=O)N2CCC[C@H]2C(=O)N1)C(C)C)=O)[C@@H](C)CC)C1=CC=CC=C1 ANLDPEXRVVIABH-WUUSPZRJSA-N 0.000 description 1
- RTGMQVUKARGBNM-UHFFFAOYSA-N axinastatin 3 Natural products CCC(C)C1NC(=O)C(CC(C)C)NC(=O)C2CCCN2C(=O)C(NC(=O)C(CC(=O)N)NC(=O)C3CCCN3C(=O)C(Cc4ccccc4)NC1=O)C(C)C RTGMQVUKARGBNM-UHFFFAOYSA-N 0.000 description 1
- OPWOOOGFNULJAQ-UHFFFAOYSA-L azane;cyclopentanamine;2-hydroxybutanedioate;platinum(2+) Chemical compound N.[Pt+2].NC1CCCC1.[O-]C(=O)C(O)CC([O-])=O OPWOOOGFNULJAQ-UHFFFAOYSA-L 0.000 description 1
- 229950005951 azasetron Drugs 0.000 description 1
- MIXLRUYCYZPSOQ-HXPMCKFVSA-N azatoxin Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=C(C4=CC=CC=C4N3)C[C@@H]3N2C(OC3)=O)=C1 MIXLRUYCYZPSOQ-HXPMCKFVSA-N 0.000 description 1
- 150000001541 aziridines Chemical class 0.000 description 1
- 229950004295 azotomycin Drugs 0.000 description 1
- XYUFCXJZFZPEJD-PGRDOPGGSA-N balanol Chemical compound OC(=O)C1=CC=CC(O)=C1C(=O)C1=C(O)C=C(C(=O)O[C@H]2[C@H](CNCCC2)NC(=O)C=2C=CC(O)=CC=2)C=C1O XYUFCXJZFZPEJD-PGRDOPGGSA-N 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 229960004669 basiliximab Drugs 0.000 description 1
- 229960003270 belimumab Drugs 0.000 description 1
- 229960002707 bendamustine Drugs 0.000 description 1
- YTKUWDBFDASYHO-UHFFFAOYSA-N bendamustine Chemical compound ClCCN(CCCl)C1=CC=C2N(C)C(CCCC(O)=O)=NC2=C1 YTKUWDBFDASYHO-UHFFFAOYSA-N 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 229940022836 benlysta Drugs 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- 229950005567 benzodepa Drugs 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid group Chemical group C(C1=CC=CC=C1)(=O)O WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- MMIMIFULGMZVPO-UHFFFAOYSA-N benzyl 3-bromo-2,6-dinitro-5-phenylmethoxybenzoate Chemical compound [O-][N+](=O)C1=C(C(=O)OCC=2C=CC=CC=2)C([N+](=O)[O-])=C(Br)C=C1OCC1=CC=CC=C1 MMIMIFULGMZVPO-UHFFFAOYSA-N 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- VFIUCBTYGKMLCM-UHFFFAOYSA-N benzyl n-[bis(aziridin-1-yl)phosphoryl]carbamate Chemical compound C=1C=CC=CC=1COC(=O)NP(=O)(N1CC1)N1CC1 VFIUCBTYGKMLCM-UHFFFAOYSA-N 0.000 description 1
- QGJZLNKBHJESQX-FZFNOLFKSA-N betulinic acid Chemical compound C1C[C@H](O)C(C)(C)[C@@H]2CC[C@@]3(C)[C@]4(C)CC[C@@]5(C(O)=O)CC[C@@H](C(=C)C)[C@@H]5[C@H]4CC[C@@H]3[C@]21C QGJZLNKBHJESQX-FZFNOLFKSA-N 0.000 description 1
- 229960000397 bevacizumab Drugs 0.000 description 1
- 229940087430 biaxin Drugs 0.000 description 1
- 229960000997 bicalutamide Drugs 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 150000001621 bismuth Chemical class 0.000 description 1
- 229960004395 bleomycin sulfate Drugs 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 208000019664 bone resorption disease Diseases 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- PHEZJEYUWHETKO-UHFFFAOYSA-N brequinar Chemical compound N1=C2C=CC(F)=CC2=C(C(O)=O)C(C)=C1C(C=C1)=CC=C1C1=CC=CC=C1F PHEZJEYUWHETKO-UHFFFAOYSA-N 0.000 description 1
- 229950010231 brequinar Drugs 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 229960002092 busulfan Drugs 0.000 description 1
- 108700002839 cactinomycin Proteins 0.000 description 1
- 229950009908 cactinomycin Drugs 0.000 description 1
- LWQQLNNNIPYSNX-UROSTWAQSA-N calcipotriol Chemical compound C1([C@H](O)/C=C/[C@@H](C)[C@@H]2[C@]3(CCCC(/[C@@H]3CC2)=C\C=C\2C([C@@H](O)C[C@H](O)C/2)=C)C)CC1 LWQQLNNNIPYSNX-UROSTWAQSA-N 0.000 description 1
- 229960002882 calcipotriol Drugs 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- LSUTUUOITDQYNO-UHFFFAOYSA-N calphostin C Chemical compound C=12C3=C4C(CC(C)OC(=O)C=5C=CC=CC=5)=C(OC)C(O)=C(C(C=C5OC)=O)C4=C5C=1C(OC)=CC(=O)C2=C(O)C(OC)=C3CC(C)OC(=O)OC1=CC=C(O)C=C1 LSUTUUOITDQYNO-UHFFFAOYSA-N 0.000 description 1
- 229940112129 campath Drugs 0.000 description 1
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical class C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 description 1
- 229960001838 canakinumab Drugs 0.000 description 1
- 230000036952 cancer formation Effects 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- WNRZHQBJSXRYJK-UHFFFAOYSA-N carboxyamidotriazole Chemical compound NC1=C(C(=O)N)N=NN1CC(C=C1Cl)=CC(Cl)=C1C(=O)C1=CC=C(Cl)C=C1 WNRZHQBJSXRYJK-UHFFFAOYSA-N 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- 208000025188 carcinoma of pharynx Diseases 0.000 description 1
- 210000000748 cardiovascular system Anatomy 0.000 description 1
- XREUEWVEMYWFFA-CSKJXFQVSA-N carminomycin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=C(O)C=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XREUEWVEMYWFFA-CSKJXFQVSA-N 0.000 description 1
- 229950001725 carubicin Drugs 0.000 description 1
- BBZDXMBRAFTCAA-AREMUKBSSA-N carzelesin Chemical compound C1=2NC=C(C)C=2C([C@H](CCl)CN2C(=O)C=3NC4=CC=C(C=C4C=3)NC(=O)C3=CC4=CC=C(C=C4O3)N(CC)CC)=C2C=C1OC(=O)NC1=CC=CC=C1 BBZDXMBRAFTCAA-AREMUKBSSA-N 0.000 description 1
- 229950007509 carzelesin Drugs 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 229950010667 cedefingol Drugs 0.000 description 1
- 229960000590 celecoxib Drugs 0.000 description 1
- RZEKVGVHFLEQIL-UHFFFAOYSA-N celecoxib Chemical compound C1=CC(C)=CC=C1C1=CC(C(F)(F)F)=NN1C1=CC=C(S(N)(=O)=O)C=C1 RZEKVGVHFLEQIL-UHFFFAOYSA-N 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 229960003115 certolizumab pegol Drugs 0.000 description 1
- 108700008462 cetrorelix Proteins 0.000 description 1
- SBNPWPIBESPSIF-MHWMIDJBSA-N cetrorelix Chemical compound C([C@@H](C(=O)N[C@H](CCCNC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@H](C)C(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](CC=1C=NC=CC=1)NC(=O)[C@@H](CC=1C=CC(Cl)=CC=1)NC(=O)[C@@H](CC=1C=C2C=CC=CC2=CC=1)NC(C)=O)C1=CC=C(O)C=C1 SBNPWPIBESPSIF-MHWMIDJBSA-N 0.000 description 1
- 229960003230 cetrorelix Drugs 0.000 description 1
- 229960005395 cetuximab Drugs 0.000 description 1
- OWSKEUBOCMEJMI-KPXOXKRLSA-N chembl2105946 Chemical compound [N-]=[N+]=CC(=O)CC[C@H](NC(=O)[C@@H](N)C)C(=O)N[C@H](CCC(=O)C=[N+]=[N-])C(O)=O OWSKEUBOCMEJMI-KPXOXKRLSA-N 0.000 description 1
- UKTAZPQNNNJVKR-KJGYPYNMSA-N chembl2368925 Chemical compound C1=CC=C2C(C(O[C@@H]3C[C@@H]4C[C@H]5C[C@@H](N4CC5=O)C3)=O)=CNC2=C1 UKTAZPQNNNJVKR-KJGYPYNMSA-N 0.000 description 1
- ZWVZORIKUNOTCS-OAQYLSRUSA-N chembl401930 Chemical compound C1([C@H](O)CNC2=C(C(NC=C2)=O)C=2NC=3C=C(C=C(C=3N=2)C)N2CCOCC2)=CC=CC(Cl)=C1 ZWVZORIKUNOTCS-OAQYLSRUSA-N 0.000 description 1
- DCKFXSZUWVWFEU-JECTWPLRSA-N chembl499423 Chemical compound O1[C@@H](CC)CCCC[C@]11NC(N23)=N[C@]4(O[C@H](C)CCC4)[C@@H](C(=O)OCCCCCCCCCCCCCCCC(=O)N(CCCN)C[C@@H](O)CCN)[C@@]3(O)CC[C@H]2C1 DCKFXSZUWVWFEU-JECTWPLRSA-N 0.000 description 1
- 230000000973 chemotherapeutic effect Effects 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 201000010415 childhood type dermatomyositis Diseases 0.000 description 1
- 150000004035 chlorins Chemical class 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 208000037976 chronic inflammation Diseases 0.000 description 1
- 201000005795 chronic inflammatory demyelinating polyneuritis Diseases 0.000 description 1
- 208000037893 chronic inflammatory disorder Diseases 0.000 description 1
- 201000010902 chronic myelomonocytic leukemia Diseases 0.000 description 1
- 208000025302 chronic primary adrenal insufficiency Diseases 0.000 description 1
- 208000013507 chronic prostatitis Diseases 0.000 description 1
- ARUGKOZUKWAXDS-SEWALLKFSA-N cicaprost Chemical compound C1\C(=C/COCC(O)=O)C[C@@H]2[C@@H](C#C[C@@H](O)[C@@H](C)CC#CCC)[C@H](O)C[C@@H]21 ARUGKOZUKWAXDS-SEWALLKFSA-N 0.000 description 1
- 229950000634 cicaprost Drugs 0.000 description 1
- 229960001265 ciclosporin Drugs 0.000 description 1
- 229940090100 cimzia Drugs 0.000 description 1
- 230000005796 circulatory shock Effects 0.000 description 1
- JKNIRLKHOOMGOJ-UHFFFAOYSA-N cladochrome D Natural products COC1=C(CC(C)OC(=O)Oc2ccc(O)cc2)c3c4C(=C(OC)C(=O)c5c(O)cc(OC)c(c45)c6c(OC)cc(O)c(C1=O)c36)CC(C)OC(=O)c7ccc(O)cc7 JKNIRLKHOOMGOJ-UHFFFAOYSA-N 0.000 description 1
- SRJYZPCBWDVSGO-UHFFFAOYSA-N cladochrome E Natural products COC1=CC(O)=C(C(C(OC)=C(CC(C)OC(=O)OC=2C=CC(O)=CC=2)C2=3)=O)C2=C1C1=C(OC)C=C(O)C(C(C=2OC)=O)=C1C=3C=2CC(C)OC(=O)C1=CC=CC=C1 SRJYZPCBWDVSGO-UHFFFAOYSA-N 0.000 description 1
- 229960002436 cladribine Drugs 0.000 description 1
- AGOYDEPGAOXOCK-KCBOHYOISA-N clarithromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@](C)([C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)OC)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 AGOYDEPGAOXOCK-KCBOHYOISA-N 0.000 description 1
- GKIRPKYJQBWNGO-OCEACIFDSA-N clomifene Chemical class C1=CC(OCCN(CC)CC)=CC=C1C(\C=1C=CC=CC=1)=C(\Cl)C1=CC=CC=C1 GKIRPKYJQBWNGO-OCEACIFDSA-N 0.000 description 1
- 229960004022 clotrimazole Drugs 0.000 description 1
- VNFPBHJOKIVQEB-UHFFFAOYSA-N clotrimazole Chemical compound ClC1=CC=CC=C1C(N1C=NC=C1)(C=1C=CC=CC=1)C1=CC=CC=C1 VNFPBHJOKIVQEB-UHFFFAOYSA-N 0.000 description 1
- 108700021073 cold agglutinins Proteins 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 239000012230 colorless oil Substances 0.000 description 1
- 229960005537 combretastatin A-4 Drugs 0.000 description 1
- HVXBOLULGPECHP-UHFFFAOYSA-N combretastatin A4 Natural products C1=C(O)C(OC)=CC=C1C=CC1=CC(OC)=C(OC)C(OC)=C1 HVXBOLULGPECHP-UHFFFAOYSA-N 0.000 description 1
- 150000004814 combretastatins Chemical class 0.000 description 1
- 230000000536 complexating effect Effects 0.000 description 1
- GLESHRYLRAOJPS-DHCFDGJBSA-N conagenin Chemical compound C[C@@H](O)[C@H](C)[C@@H](O)C(=O)N[C@@](C)(CO)C(O)=O GLESHRYLRAOJPS-DHCFDGJBSA-N 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- SBRXTSOCZITGQG-UHFFFAOYSA-N crisnatol Chemical compound C1=CC=C2C(CNC(CO)(CO)C)=CC3=C(C=CC=C4)C4=CC=C3C2=C1 SBRXTSOCZITGQG-UHFFFAOYSA-N 0.000 description 1
- 229950007258 crisnatol Drugs 0.000 description 1
- PSNOPSMXOBPNNV-VVCTWANISA-N cryptophycin 1 Chemical class C1=C(Cl)C(OC)=CC=C1C[C@@H]1C(=O)NC[C@@H](C)C(=O)O[C@@H](CC(C)C)C(=O)O[C@H]([C@H](C)[C@@H]2[C@H](O2)C=2C=CC=CC=2)C/C=C/C(=O)N1 PSNOPSMXOBPNNV-VVCTWANISA-N 0.000 description 1
- 108010090203 cryptophycin 8 Proteins 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 208000004921 cutaneous lupus erythematosus Diseases 0.000 description 1
- 208000017763 cutaneous neuroendocrine carcinoma Diseases 0.000 description 1
- 125000004093 cyano group Chemical group *C#N 0.000 description 1
- 239000002875 cyclin dependent kinase inhibitor Substances 0.000 description 1
- 229940043378 cyclin-dependent kinase inhibitor Drugs 0.000 description 1
- PESYEWKSBIWTAK-UHFFFAOYSA-N cyclopenta-1,3-diene;titanium(2+) Chemical compound [Ti+2].C=1C=C[CH-]C=1.C=1C=C[CH-]C=1 PESYEWKSBIWTAK-UHFFFAOYSA-N 0.000 description 1
- 229930182912 cyclosporin Natural products 0.000 description 1
- 108010041566 cypemycin Proteins 0.000 description 1
- 208000031513 cyst Diseases 0.000 description 1
- 239000002852 cysteine proteinase inhibitor Substances 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 229960003109 daunorubicin hydrochloride Drugs 0.000 description 1
- 229960003603 decitabine Drugs 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- CYQFCXCEBYINGO-IAGOWNOFSA-N delta1-THC Chemical compound C1=C(C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@@H]21 CYQFCXCEBYINGO-IAGOWNOFSA-N 0.000 description 1
- 229960001251 denosumab Drugs 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 108700025485 deslorelin Proteins 0.000 description 1
- 229960005408 deslorelin Drugs 0.000 description 1
- 229960000605 dexrazoxane Drugs 0.000 description 1
- SGTNSNPWRIOYBX-HHHXNRCGSA-N dexverapamil Chemical compound C1=C(OC)C(OC)=CC=C1CCN(C)CCC[C@@](C#N)(C(C)C)C1=CC=C(OC)C(OC)=C1 SGTNSNPWRIOYBX-HHHXNRCGSA-N 0.000 description 1
- 229950005878 dexverapamil Drugs 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- WVYXNIXAMZOZFK-UHFFFAOYSA-N diaziquone Chemical compound O=C1C(NC(=O)OCC)=C(N2CC2)C(=O)C(NC(=O)OCC)=C1N1CC1 WVYXNIXAMZOZFK-UHFFFAOYSA-N 0.000 description 1
- KYHUYMLIVQFXRI-UHFFFAOYSA-N didemnin B Natural products CC1OC(=O)C(CC=2C=CC(OC)=CC=2)N(C)C(=O)C2CCCN2C(=O)C(CC(C)C)NC(=O)C(C)C(=O)C(C(C)C)OC(=O)CC(O)C(C(C)CC)NC(=O)C1NC(=O)C(CC(C)C)N(C)C(=O)C1CCCN1C(=O)C(C)O KYHUYMLIVQFXRI-UHFFFAOYSA-N 0.000 description 1
- 108010061297 didemnins Proteins 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical class OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- PZXJOHSZQAEJFE-UHFFFAOYSA-N dihydrobetulinic acid Natural products C1CC(O)C(C)(C)C2CCC3(C)C4(C)CCC5(C(O)=O)CCC(C(C)C)C5C4CCC3C21C PZXJOHSZQAEJFE-UHFFFAOYSA-N 0.000 description 1
- OTKJDMGTUTTYMP-UHFFFAOYSA-N dihydrosphingosine Natural products CCCCCCCCCCCCCCCC(O)C(N)CO OTKJDMGTUTTYMP-UHFFFAOYSA-N 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- 208000016097 disease of metabolism Diseases 0.000 description 1
- 208000037765 diseases and disorders Diseases 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- SVJSWELRJWVPQD-KJWOGLQMSA-L disodium;(2s)-2-[[4-[2-[(6r)-2-amino-4-oxo-5,6,7,8-tetrahydro-1h-pyrido[2,3-d]pyrimidin-6-yl]ethyl]benzoyl]amino]pentanedioate Chemical compound [Na+].[Na+].C([C@@H]1CC=2C(=O)N=C(NC=2NC1)N)CC1=CC=C(C(=O)N[C@@H](CCC([O-])=O)C([O-])=O)C=C1 SVJSWELRJWVPQD-KJWOGLQMSA-L 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 208000007784 diverticulitis Diseases 0.000 description 1
- 239000003534 dna topoisomerase inhibitor Substances 0.000 description 1
- 229960003668 docetaxel Drugs 0.000 description 1
- 229960000735 docosanol Drugs 0.000 description 1
- 229960003413 dolasetron Drugs 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 229960002918 doxorubicin hydrochloride Drugs 0.000 description 1
- 229960003722 doxycycline Drugs 0.000 description 1
- XQTWDDCIUJNLTR-CVHRZJFOSA-N doxycycline monohydrate Chemical compound O.O=C1C2=C(O)C=CC=C2[C@H](C)[C@@H]2C1=C(O)[C@]1(O)C(=O)C(C(N)=O)=C(O)[C@@H](N(C)C)[C@@H]1[C@H]2O XQTWDDCIUJNLTR-CVHRZJFOSA-N 0.000 description 1
- 229950004203 droloxifene Drugs 0.000 description 1
- NOTIQUSPUUHHEH-UXOVVSIBSA-N dromostanolone propionate Chemical compound C([C@@H]1CC2)C(=O)[C@H](C)C[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H](OC(=O)CC)[C@@]2(C)CC1 NOTIQUSPUUHHEH-UXOVVSIBSA-N 0.000 description 1
- 229960004242 dronabinol Drugs 0.000 description 1
- 239000006196 drop Substances 0.000 description 1
- 229950004683 drostanolone propionate Drugs 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 229950005133 duazomycin Drugs 0.000 description 1
- 229930192837 duazomycin Natural products 0.000 description 1
- VQNATVDKACXKTF-XELLLNAOSA-N duocarmycin Chemical compound COC1=C(OC)C(OC)=C2NC(C(=O)N3C4=CC(=O)C5=C([C@@]64C[C@@H]6C3)C=C(N5)C(=O)OC)=CC2=C1 VQNATVDKACXKTF-XELLLNAOSA-N 0.000 description 1
- 229960005510 duocarmycin SA Drugs 0.000 description 1
- 102000013035 dynein heavy chain Human genes 0.000 description 1
- 108060002430 dynein heavy chain Proteins 0.000 description 1
- 230000008482 dysregulation Effects 0.000 description 1
- 229950005678 ecomustine Drugs 0.000 description 1
- 229960002224 eculizumab Drugs 0.000 description 1
- FSIRXIHZBIXHKT-MHTVFEQDSA-N edatrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CC(CC)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FSIRXIHZBIXHKT-MHTVFEQDSA-N 0.000 description 1
- 229950006700 edatrexate Drugs 0.000 description 1
- 229960002759 eflornithine Drugs 0.000 description 1
- VLCYCQAOQCDTCN-UHFFFAOYSA-N eflornithine Chemical compound NCCCC(N)(C(F)F)C(O)=O VLCYCQAOQCDTCN-UHFFFAOYSA-N 0.000 description 1
- 229960002046 eflornithine hydrochloride Drugs 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- MGQRRMONVLMKJL-KWJIQSIXSA-N elsamitrucin Chemical compound O1[C@H](C)[C@H](O)[C@H](OC)[C@@H](N)[C@H]1O[C@@H]1[C@](O)(C)[C@@H](O)[C@@H](C)O[C@H]1OC1=CC=CC2=C(O)C(C(O3)=O)=C4C5=C3C=CC(C)=C5C(=O)OC4=C12 MGQRRMONVLMKJL-KWJIQSIXSA-N 0.000 description 1
- 229950002339 elsamitrucin Drugs 0.000 description 1
- 229950005627 embonate Drugs 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 201000003914 endometrial carcinoma Diseases 0.000 description 1
- JOZGNYDSEBIJDH-UHFFFAOYSA-N eniluracil Chemical compound O=C1NC=C(C#C)C(=O)N1 JOZGNYDSEBIJDH-UHFFFAOYSA-N 0.000 description 1
- 229950010625 enloplatin Drugs 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 1
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 1
- 206010015037 epilepsy Diseases 0.000 description 1
- 229950004926 epipropidine Drugs 0.000 description 1
- 229960001904 epirubicin Drugs 0.000 description 1
- 229960003265 epirubicin hydrochloride Drugs 0.000 description 1
- 229940105423 erythropoietin Drugs 0.000 description 1
- 201000004101 esophageal cancer Diseases 0.000 description 1
- FRPJXPJMRWBBIH-RBRWEJTLSA-N estramustine Chemical class ClCCN(CCCl)C(=O)OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 FRPJXPJMRWBBIH-RBRWEJTLSA-N 0.000 description 1
- 239000000328 estrogen antagonist Substances 0.000 description 1
- 229960000403 etanercept Drugs 0.000 description 1
- WCDWBPCFGJXFJZ-UHFFFAOYSA-N etanidazole Chemical compound OCCNC(=O)CN1C=CN=C1[N+]([O-])=O WCDWBPCFGJXFJZ-UHFFFAOYSA-N 0.000 description 1
- XPGDODOEEWLHOI-GSDHBNRESA-N ethyl (2s)-2-[[(2s)-2-[[(2s)-2-amino-3-(4-fluorophenyl)propanoyl]amino]-3-[3-[bis(2-chloroethyl)amino]phenyl]propanoyl]amino]-4-methylsulfanylbutanoate Chemical compound C([C@@H](C(=O)N[C@@H](CCSC)C(=O)OCC)NC(=O)[C@@H](N)CC=1C=CC(F)=CC=1)C1=CC=CC(N(CCCl)CCCl)=C1 XPGDODOEEWLHOI-GSDHBNRESA-N 0.000 description 1
- HZQPPNNARUQMJA-IMIWJGOWSA-N ethyl n-[4-[[(2r,4r)-2-(2,4-dichlorophenyl)-2-(imidazol-1-ylmethyl)-1,3-dioxolan-4-yl]methylsulfanyl]phenyl]carbamate;hydrochloride Chemical compound Cl.C1=CC(NC(=O)OCC)=CC=C1SC[C@@H]1O[C@@](CN2C=NC=C2)(C=2C(=CC(Cl)=CC=2)Cl)OC1 HZQPPNNARUQMJA-IMIWJGOWSA-N 0.000 description 1
- 229940009626 etidronate Drugs 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 229960000752 etoposide phosphate Drugs 0.000 description 1
- LIQODXNTTZAGID-OCBXBXKTSA-N etoposide phosphate Chemical compound COC1=C(OP(O)(O)=O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 LIQODXNTTZAGID-OCBXBXKTSA-N 0.000 description 1
- 229960005167 everolimus Drugs 0.000 description 1
- 229960000255 exemestane Drugs 0.000 description 1
- 208000021045 exocrine pancreatic carcinoma Diseases 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 210000001752 female genitalia Anatomy 0.000 description 1
- 229940126864 fibroblast growth factor Drugs 0.000 description 1
- 229940125829 fibroblast growth factor receptor inhibitor Drugs 0.000 description 1
- 230000004761 fibrosis Effects 0.000 description 1
- 229960004177 filgrastim Drugs 0.000 description 1
- 239000012065 filter cake Substances 0.000 description 1
- DBEPLOCGEIEOCV-WSBQPABSSA-N finasteride Chemical compound N([C@@H]1CC2)C(=O)C=C[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H](C(=O)NC(C)(C)C)[C@@]2(C)CC1 DBEPLOCGEIEOCV-WSBQPABSSA-N 0.000 description 1
- 229960004039 finasteride Drugs 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 229960000390 fludarabine Drugs 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 230000003325 follicular Effects 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 229950004217 forfenimex Drugs 0.000 description 1
- 229960004421 formestane Drugs 0.000 description 1
- OSVMTWJCGUFAOD-KZQROQTASA-N formestane Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CCC2=C1O OSVMTWJCGUFAOD-KZQROQTASA-N 0.000 description 1
- UXTSQCOOUJTIAC-UHFFFAOYSA-N fosquidone Chemical compound C=1N2CC3=CC=CC=C3C(C)C2=C(C(C2=CC=C3)=O)C=1C(=O)C2=C3OP(O)(=O)OCC1=CC=CC=C1 UXTSQCOOUJTIAC-UHFFFAOYSA-N 0.000 description 1
- 229950005611 fosquidone Drugs 0.000 description 1
- 229950010404 fostriecin Drugs 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 208000024386 fungal infectious disease Diseases 0.000 description 1
- 229940084434 fungoid Drugs 0.000 description 1
- UIWYJDYFSGRHKR-UHFFFAOYSA-N gadolinium atom Chemical compound [Gd] UIWYJDYFSGRHKR-UHFFFAOYSA-N 0.000 description 1
- 201000010175 gallbladder cancer Diseases 0.000 description 1
- 201000007487 gallbladder carcinoma Diseases 0.000 description 1
- 229940044658 gallium nitrate Drugs 0.000 description 1
- 108700032141 ganirelix Proteins 0.000 description 1
- GJNXBNATEDXMAK-PFLSVRRQSA-N ganirelix Chemical compound C([C@@H](C(=O)N[C@H](CCCCN=C(NCC)NCC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN=C(NCC)NCC)C(=O)N1[C@@H](CCC1)C(=O)N[C@H](C)C(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](CC=1C=NC=CC=1)NC(=O)[C@@H](CC=1C=CC(Cl)=CC=1)NC(=O)[C@@H](CC=1C=C2C=CC=CC2=CC=1)NC(C)=O)C1=CC=C(O)C=C1 GJNXBNATEDXMAK-PFLSVRRQSA-N 0.000 description 1
- 229960003794 ganirelix Drugs 0.000 description 1
- 238000004817 gas chromatography Methods 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 201000011243 gastrointestinal stromal tumor Diseases 0.000 description 1
- 229960005144 gemcitabine hydrochloride Drugs 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 201000007116 gestational trophoblastic neoplasm Diseases 0.000 description 1
- 229940080856 gleevec Drugs 0.000 description 1
- 229940097042 glucuronate Drugs 0.000 description 1
- 229940097043 glucuronic acid Drugs 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 229960001743 golimumab Drugs 0.000 description 1
- 230000002710 gonadal effect Effects 0.000 description 1
- 231100000226 haematotoxicity Toxicity 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 230000003862 health status Effects 0.000 description 1
- 239000003481 heat shock protein 90 inhibitor Substances 0.000 description 1
- 230000000004 hemodynamic effect Effects 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 230000013632 homeostatic process Effects 0.000 description 1
- 230000003054 hormonal effect Effects 0.000 description 1
- 208000018821 hormone-resistant prostate carcinoma Diseases 0.000 description 1
- 229940048921 humira Drugs 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- SOCGJDYHNGLZEC-UHFFFAOYSA-N hydron;n-methyl-n-[4-[(7-methyl-3h-imidazo[4,5-f]quinolin-9-yl)amino]phenyl]acetamide;chloride Chemical compound Cl.C1=CC(N(C(C)=O)C)=CC=C1NC1=CC(C)=NC2=CC=C(NC=N3)C3=C12 SOCGJDYHNGLZEC-UHFFFAOYSA-N 0.000 description 1
- 229960001330 hydroxycarbamide Drugs 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 230000000148 hypercalcaemia Effects 0.000 description 1
- 208000030915 hypercalcemia disease Diseases 0.000 description 1
- MPGWGYQTRSNGDD-UHFFFAOYSA-N hypericin Chemical compound OC1=CC(O)=C(C2=O)C3=C1C1C(O)=CC(=O)C(C4=O)=C1C1=C3C3=C2C(O)=CC(C)=C3C2=C1C4=C(O)C=C2C MPGWGYQTRSNGDD-UHFFFAOYSA-N 0.000 description 1
- 229940005608 hypericin Drugs 0.000 description 1
- PHOKTTKFQUYZPI-UHFFFAOYSA-N hypericin Natural products Cc1cc(O)c2c3C(=O)C(=Cc4c(O)c5c(O)cc(O)c6c7C(=O)C(=Cc8c(C)c1c2c(c78)c(c34)c56)O)O PHOKTTKFQUYZPI-UHFFFAOYSA-N 0.000 description 1
- 230000000222 hyperoxic effect Effects 0.000 description 1
- 230000009610 hypersensitivity Effects 0.000 description 1
- 208000013010 hypopharyngeal carcinoma Diseases 0.000 description 1
- 229960005236 ibandronic acid Drugs 0.000 description 1
- 229960001001 ibritumomab tiuxetan Drugs 0.000 description 1
- 229960001507 ibrutinib Drugs 0.000 description 1
- XYFPWWZEPKGCCK-GOSISDBHSA-N ibrutinib Chemical compound C1=2C(N)=NC=NC=2N([C@H]2CN(CCC2)C(=O)C=C)N=C1C(C=C1)=CC=C1OC1=CC=CC=C1 XYFPWWZEPKGCCK-GOSISDBHSA-N 0.000 description 1
- 229960000908 idarubicin Drugs 0.000 description 1
- 229960001176 idarubicin hydrochloride Drugs 0.000 description 1
- 229950002248 idoxifene Drugs 0.000 description 1
- 229940071829 ilaris Drugs 0.000 description 1
- NITYDPDXAAFEIT-DYVFJYSZSA-N ilomastat Chemical compound C1=CC=C2C(C[C@@H](C(=O)NC)NC(=O)[C@H](CC(C)C)CC(=O)NO)=CNC2=C1 NITYDPDXAAFEIT-DYVFJYSZSA-N 0.000 description 1
- 229960003696 ilomastat Drugs 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 229960002411 imatinib Drugs 0.000 description 1
- 229960002751 imiquimod Drugs 0.000 description 1
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical compound C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 230000005931 immune cell recruitment Effects 0.000 description 1
- 230000007124 immune defense Effects 0.000 description 1
- 229940124644 immune regulator Drugs 0.000 description 1
- 230000004957 immunoregulator effect Effects 0.000 description 1
- 230000003308 immunostimulating effect Effects 0.000 description 1
- 230000001024 immunotherapeutic effect Effects 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 208000033065 inborn errors of immunity Diseases 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 229960000598 infliximab Drugs 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 229910017053 inorganic salt Inorganic materials 0.000 description 1
- 102000028416 insulin-like growth factor binding Human genes 0.000 description 1
- 108091022911 insulin-like growth factor binding Proteins 0.000 description 1
- 229940125798 integrin inhibitor Drugs 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 229940044173 iodine-125 Drugs 0.000 description 1
- 229960005386 ipilimumab Drugs 0.000 description 1
- 229950010897 iproplatin Drugs 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- 229960000779 irinotecan hydrochloride Drugs 0.000 description 1
- 229950000855 iroplact Drugs 0.000 description 1
- 230000000302 ischemic effect Effects 0.000 description 1
- 108010091711 kahalalide F Proteins 0.000 description 1
- 208000017169 kidney disease Diseases 0.000 description 1
- 229960002437 lanreotide Drugs 0.000 description 1
- 229960001739 lanreotide acetate Drugs 0.000 description 1
- 229960004891 lapatinib Drugs 0.000 description 1
- 150000002605 large molecules Chemical class 0.000 description 1
- 206010023841 laryngeal neoplasm Diseases 0.000 description 1
- 201000010260 leiomyoma Diseases 0.000 description 1
- 229960002618 lenograstim Drugs 0.000 description 1
- 229940115286 lentinan Drugs 0.000 description 1
- 229960003881 letrozole Drugs 0.000 description 1
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 229960001614 levamisole Drugs 0.000 description 1
- UGFHIPBXIWJXNA-UHFFFAOYSA-N liarozole Chemical compound ClC1=CC=CC(C(C=2C=C3NC=NC3=CC=2)N2C=NC=C2)=C1 UGFHIPBXIWJXNA-UHFFFAOYSA-N 0.000 description 1
- 229950007056 liarozole Drugs 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 201000006721 lip cancer Diseases 0.000 description 1
- 239000008297 liquid dosage form Substances 0.000 description 1
- 108010020270 lissoclinamide 7 Proteins 0.000 description 1
- RBBBWKUBQVARPL-SWQMWMPHSA-N lissoclinamide 7 Chemical compound C([C@H]1C(=O)N2CCC[C@H]2C2=N[C@@H]([C@H](O2)C)C(=O)N[C@@H](C=2SC[C@H](N=2)C(=O)N[C@H](CC=2C=CC=CC=2)C=2SC[C@H](N=2)C(=O)N1)C(C)C)C1=CC=CC=C1 RBBBWKUBQVARPL-SWQMWMPHSA-N 0.000 description 1
- RBBBWKUBQVARPL-UHFFFAOYSA-N lissoclinamide 7 Natural products N1C(=O)C(N=2)CSC=2C(CC=2C=CC=CC=2)NC(=O)C(N=2)CSC=2C(C(C)C)NC(=O)C(C(O2)C)N=C2C2CCCN2C(=O)C1CC1=CC=CC=C1 RBBBWKUBQVARPL-UHFFFAOYSA-N 0.000 description 1
- 229910003002 lithium salt Inorganic materials 0.000 description 1
- 159000000002 lithium salts Chemical class 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 229950008991 lobaplatin Drugs 0.000 description 1
- 229950000909 lometrexol Drugs 0.000 description 1
- 229960003538 lonidamine Drugs 0.000 description 1
- WDRYRZXSPDWGEB-UHFFFAOYSA-N lonidamine Chemical compound C12=CC=CC=C2C(C(=O)O)=NN1CC1=CC=C(Cl)C=C1Cl WDRYRZXSPDWGEB-UHFFFAOYSA-N 0.000 description 1
- YROQEQPFUCPDCP-UHFFFAOYSA-N losoxantrone Chemical compound OCCNCCN1N=C2C3=CC=CC(O)=C3C(=O)C3=C2C1=CC=C3NCCNCCO YROQEQPFUCPDCP-UHFFFAOYSA-N 0.000 description 1
- 229950008745 losoxantrone Drugs 0.000 description 1
- XDMHALQMTPSGEA-UHFFFAOYSA-N losoxantrone hydrochloride Chemical compound Cl.Cl.OCCNCCN1N=C2C3=CC=CC(O)=C3C(=O)C3=C2C1=CC=C3NCCNCCO XDMHALQMTPSGEA-UHFFFAOYSA-N 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 229950005634 loxoribine Drugs 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 229940076783 lucentis Drugs 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- RVFGKBWWUQOIOU-NDEPHWFRSA-N lurtotecan Chemical compound O=C([C@]1(O)CC)OCC(C(N2CC3=4)=O)=C1C=C2C3=NC1=CC=2OCCOC=2C=C1C=4CN1CCN(C)CC1 RVFGKBWWUQOIOU-NDEPHWFRSA-N 0.000 description 1
- 229950002654 lurtotecan Drugs 0.000 description 1
- OHSVLFRHMCKCQY-UHFFFAOYSA-N lutetium atom Chemical compound [Lu] OHSVLFRHMCKCQY-UHFFFAOYSA-N 0.000 description 1
- 230000002101 lytic effect Effects 0.000 description 1
- 229940124302 mTOR inhibitor Drugs 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 201000004792 malaria Diseases 0.000 description 1
- 201000002350 malignant ciliary body melanoma Diseases 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 201000010978 malignant iris melanoma Diseases 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 1
- BLOFGONIVNXZME-YDMGZANHSA-N mannostatin A Chemical compound CS[C@@H]1[C@@H](N)[C@@H](O)[C@@H](O)[C@H]1O BLOFGONIVNXZME-YDMGZANHSA-N 0.000 description 1
- 229950008959 marimastat Drugs 0.000 description 1
- OCSMOTCMPXTDND-OUAUKWLOSA-N marimastat Chemical compound CNC(=O)[C@H](C(C)(C)C)NC(=O)[C@H](CC(C)C)[C@H](O)C(=O)NO OCSMOTCMPXTDND-OUAUKWLOSA-N 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 229960004961 mechlorethamine Drugs 0.000 description 1
- 229960002868 mechlorethamine hydrochloride Drugs 0.000 description 1
- QZIQJVCYUQZDIR-UHFFFAOYSA-N mechlorethamine hydrochloride Chemical compound Cl.ClCCN(C)CCCl QZIQJVCYUQZDIR-UHFFFAOYSA-N 0.000 description 1
- 229960004296 megestrol acetate Drugs 0.000 description 1
- RQZAXGRLVPAYTJ-GQFGMJRRSA-N megestrol acetate Chemical compound C1=C(C)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 RQZAXGRLVPAYTJ-GQFGMJRRSA-N 0.000 description 1
- 229960003846 melengestrol acetate Drugs 0.000 description 1
- LWYJUZBXGAFFLP-OCNCTQISSA-N menogaril Chemical compound O1[C@@]2(C)[C@H](O)[C@@H](N(C)C)[C@H](O)[C@@H]1OC1=C3C(=O)C(C=C4C[C@@](C)(O)C[C@H](C4=C4O)OC)=C4C(=O)C3=C(O)C=C12 LWYJUZBXGAFFLP-OCNCTQISSA-N 0.000 description 1
- 229950002676 menogaril Drugs 0.000 description 1
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- MJGFBOZCAJSGQW-UHFFFAOYSA-N mercury sodium Chemical compound [Na].[Hg] MJGFBOZCAJSGQW-UHFFFAOYSA-N 0.000 description 1
- 210000000716 merkel cell Anatomy 0.000 description 1
- 208000030159 metabolic disease Diseases 0.000 description 1
- 239000003475 metalloproteinase inhibitor Substances 0.000 description 1
- 229940126170 metalloproteinase inhibitor Drugs 0.000 description 1
- 230000001394 metastastic effect Effects 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- 208000010658 metastatic prostate carcinoma Diseases 0.000 description 1
- 108700025096 meterelin Proteins 0.000 description 1
- KPQJSSLKKBKWEW-RKDOVGOJSA-N methanesulfonic acid;5-nitro-2-[(2r)-1-[2-[[(2r)-2-(5-nitro-1,3-dioxobenzo[de]isoquinolin-2-yl)propyl]amino]ethylamino]propan-2-yl]benzo[de]isoquinoline-1,3-dione Chemical compound CS(O)(=O)=O.CS(O)(=O)=O.[O-][N+](=O)C1=CC(C(N([C@@H](CNCCNC[C@@H](C)N2C(C=3C=C(C=C4C=CC=C(C=34)C2=O)[N+]([O-])=O)=O)C)C2=O)=O)=C3C2=CC=CC3=C1 KPQJSSLKKBKWEW-RKDOVGOJSA-N 0.000 description 1
- OKKJLVBELUTLKV-VMNATFBRSA-N methanol-d1 Chemical compound [2H]OC OKKJLVBELUTLKV-VMNATFBRSA-N 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- DASQOOZCTWOQPA-GXKRWWSZSA-L methotrexate disodium Chemical compound [Na+].[Na+].C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC([O-])=O)C([O-])=O)C=C1 DASQOOZCTWOQPA-GXKRWWSZSA-L 0.000 description 1
- 229960004503 metoclopramide Drugs 0.000 description 1
- TTWJBBZEZQICBI-UHFFFAOYSA-N metoclopramide Chemical compound CCN(CC)CCNC(=O)C1=CC(Cl)=C(N)C=C1OC TTWJBBZEZQICBI-UHFFFAOYSA-N 0.000 description 1
- VQJHOPSWBGJHQS-UHFFFAOYSA-N metoprine, methodichlorophen Chemical compound CC1=NC(N)=NC(N)=C1C1=CC=C(Cl)C(Cl)=C1 VQJHOPSWBGJHQS-UHFFFAOYSA-N 0.000 description 1
- HPNSFSBZBAHARI-UHFFFAOYSA-N micophenolic acid Natural products OC1=C(CC=C(C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-UHFFFAOYSA-N 0.000 description 1
- 239000004531 microgranule Substances 0.000 description 1
- VKHAHZOOUSRJNA-GCNJZUOMSA-N mifepristone Chemical compound C1([C@@H]2C3=C4CCC(=O)C=C4CC[C@H]3[C@@H]3CC[C@@]([C@]3(C2)C)(O)C#CC)=CC=C(N(C)C)C=C1 VKHAHZOOUSRJNA-GCNJZUOMSA-N 0.000 description 1
- 229960003248 mifepristone Drugs 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- PQLXHQMOHUQAKB-UHFFFAOYSA-N miltefosine Chemical compound CCCCCCCCCCCCCCCCOP([O-])(=O)OCC[N+](C)(C)C PQLXHQMOHUQAKB-UHFFFAOYSA-N 0.000 description 1
- DYKFCLLONBREIL-KVUCHLLUSA-N minocycline Chemical compound C([C@H]1C2)C3=C(N(C)C)C=CC(O)=C3C(=O)C1=C(O)[C@@]1(O)[C@@H]2[C@H](N(C)C)C(O)=C(C(N)=O)C1=O DYKFCLLONBREIL-KVUCHLLUSA-N 0.000 description 1
- 229960004023 minocycline Drugs 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- DRCJGCOYHLTVNR-ZUIZSQJWSA-N mitindomide Chemical compound C1=C[C@@H]2[C@@H]3[C@H]4C(=O)NC(=O)[C@H]4[C@@H]3[C@H]1[C@@H]1C(=O)NC(=O)[C@H]21 DRCJGCOYHLTVNR-ZUIZSQJWSA-N 0.000 description 1
- 229950001314 mitindomide Drugs 0.000 description 1
- 229950002137 mitocarcin Drugs 0.000 description 1
- 239000002829 mitogen activated protein kinase inhibitor Substances 0.000 description 1
- 229950000911 mitogillin Drugs 0.000 description 1
- 229960003539 mitoguazone Drugs 0.000 description 1
- MXWHMTNPTTVWDM-NXOFHUPFSA-N mitoguazone Chemical compound NC(N)=N\N=C(/C)\C=N\N=C(N)N MXWHMTNPTTVWDM-NXOFHUPFSA-N 0.000 description 1
- VFKZTMPDYBFSTM-GUCUJZIJSA-N mitolactol Chemical compound BrC[C@H](O)[C@@H](O)[C@@H](O)[C@H](O)CBr VFKZTMPDYBFSTM-GUCUJZIJSA-N 0.000 description 1
- 229950010913 mitolactol Drugs 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 229950001745 mitonafide Drugs 0.000 description 1
- 229950005715 mitosper Drugs 0.000 description 1
- 229960000350 mitotane Drugs 0.000 description 1
- 229960001156 mitoxantrone Drugs 0.000 description 1
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 1
- ZAHQPTJLOCWVPG-UHFFFAOYSA-N mitoxantrone dihydrochloride Chemical compound Cl.Cl.O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO ZAHQPTJLOCWVPG-UHFFFAOYSA-N 0.000 description 1
- 229960004169 mitoxantrone hydrochloride Drugs 0.000 description 1
- QXYYYPFGTSJXNS-UHFFFAOYSA-N mitozolomide Chemical compound N1=NN(CCCl)C(=O)N2C1=C(C(=O)N)N=C2 QXYYYPFGTSJXNS-UHFFFAOYSA-N 0.000 description 1
- 229950005967 mitozolomide Drugs 0.000 description 1
- 229950008012 mofarotene Drugs 0.000 description 1
- 229960003063 molgramostim Drugs 0.000 description 1
- 108010032806 molgramostim Proteins 0.000 description 1
- 125000000896 monocarboxylic acid group Chemical group 0.000 description 1
- FOYWNSCCNCUEPU-UHFFFAOYSA-N mopidamol Chemical compound C12=NC(N(CCO)CCO)=NC=C2N=C(N(CCO)CCO)N=C1N1CCCCC1 FOYWNSCCNCUEPU-UHFFFAOYSA-N 0.000 description 1
- 229950010718 mopidamol Drugs 0.000 description 1
- 230000001002 morphogenetic effect Effects 0.000 description 1
- 229960001521 motavizumab Drugs 0.000 description 1
- 206010051747 multiple endocrine neoplasia Diseases 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- 208000029766 myalgic encephalomeyelitis/chronic fatigue syndrome Diseases 0.000 description 1
- 206010028417 myasthenia gravis Diseases 0.000 description 1
- 208000027531 mycobacterial infectious disease Diseases 0.000 description 1
- 229960000951 mycophenolic acid Drugs 0.000 description 1
- HPNSFSBZBAHARI-RUDMXATFSA-N mycophenolic acid Chemical compound OC1=C(C\C=C(/C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-RUDMXATFSA-N 0.000 description 1
- 210000000066 myeloid cell Anatomy 0.000 description 1
- 208000010125 myocardial infarction Diseases 0.000 description 1
- CRJGESKKUOMBCT-PMACEKPBSA-N n-[(2s,3s)-1,3-dihydroxyoctadecan-2-yl]acetamide Chemical compound CCCCCCCCCCCCCCC[C@H](O)[C@H](CO)NC(C)=O CRJGESKKUOMBCT-PMACEKPBSA-N 0.000 description 1
- NKFHKYQGZDAKMX-PPRKPIOESA-N n-[(e)-1-[(2s,4s)-4-[(2r,4s,5s,6s)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-2,5,12-trihydroxy-7-methoxy-6,11-dioxo-3,4-dihydro-1h-tetracen-2-yl]ethylideneamino]benzamide;hydrochloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(\C)=N\NC(=O)C=1C=CC=CC=1)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 NKFHKYQGZDAKMX-PPRKPIOESA-N 0.000 description 1
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 1
- ARKYUICTMUZVEW-UHFFFAOYSA-N n-[5-[[5-[(3-amino-3-iminopropyl)carbamoyl]-1-methylpyrrol-3-yl]carbamoyl]-1-methylpyrrol-3-yl]-4-[[4-[bis(2-chloroethyl)amino]benzoyl]amino]-1-methylpyrrole-2-carboxamide Chemical compound C1=C(C(=O)NCCC(N)=N)N(C)C=C1NC(=O)C1=CC(NC(=O)C=2N(C=C(NC(=O)C=3C=CC(=CC=3)N(CCCl)CCCl)C=2)C)=CN1C ARKYUICTMUZVEW-UHFFFAOYSA-N 0.000 description 1
- 125000006606 n-butoxy group Chemical group 0.000 description 1
- 125000003506 n-propoxy group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])O* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- RWHUEXWOYVBUCI-ITQXDASVSA-N nafarelin Chemical compound C([C@@H](C(=O)N[C@H](CC=1C=C2C=CC=CC2=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 RWHUEXWOYVBUCI-ITQXDASVSA-N 0.000 description 1
- 229960002333 nafarelin Drugs 0.000 description 1
- JZGDNMXSOCDEFQ-UHFFFAOYSA-N napavin Chemical compound C1C(CC)(O)CC(C2)CN1CCC(C1=CC=CC=C1N1)=C1C2(C(=O)OC)C(C(=C1)OC)=CC2=C1N(C)C1C2(C23)CCN3CC=CC2(CC)C(O)C1(O)C(=O)NCCNC1=CC=C(N=[N+]=[N-])C=C1[N+]([O-])=O JZGDNMXSOCDEFQ-UHFFFAOYSA-N 0.000 description 1
- 108010032539 nartograstim Proteins 0.000 description 1
- 229950010676 nartograstim Drugs 0.000 description 1
- 208000037830 nasal cancer Diseases 0.000 description 1
- 239000007922 nasal spray Substances 0.000 description 1
- 229940097496 nasal spray Drugs 0.000 description 1
- 201000011216 nasopharynx carcinoma Diseases 0.000 description 1
- 229960005027 natalizumab Drugs 0.000 description 1
- 230000017074 necrotic cell death Effects 0.000 description 1
- CTMCWCONSULRHO-UHQPFXKFSA-N nemorubicin Chemical compound C1CO[C@H](OC)CN1[C@@H]1[C@H](O)[C@H](C)O[C@@H](O[C@@H]2C3=C(O)C=4C(=O)C5=C(OC)C=CC=C5C(=O)C=4C(O)=C3C[C@](O)(C2)C(=O)CO)C1 CTMCWCONSULRHO-UHQPFXKFSA-N 0.000 description 1
- 229950010159 nemorubicin Drugs 0.000 description 1
- QZGIWPZCWHMVQL-UIYAJPBUSA-N neocarzinostatin chromophore Chemical compound O1[C@H](C)[C@H](O)[C@H](O)[C@@H](NC)[C@H]1O[C@@H]1C/2=C/C#C[C@H]3O[C@@]3([C@@H]3OC(=O)OC3)C#CC\2=C[C@H]1OC(=O)C1=C(O)C=CC2=C(C)C=C(OC)C=C12 QZGIWPZCWHMVQL-UIYAJPBUSA-N 0.000 description 1
- MQYXUWHLBZFQQO-UHFFFAOYSA-N nepehinol Natural products C1CC(O)C(C)(C)C2CCC3(C)C4(C)CCC5(C)CCC(C(=C)C)C5C4CCC3C21C MQYXUWHLBZFQQO-UHFFFAOYSA-N 0.000 description 1
- 201000008383 nephritis Diseases 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 229960002653 nilutamide Drugs 0.000 description 1
- XWXYUMMDTVBTOU-UHFFFAOYSA-N nilutamide Chemical compound O=C1C(C)(C)NC(=O)N1C1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 XWXYUMMDTVBTOU-UHFFFAOYSA-N 0.000 description 1
- OSTGTTZJOCZWJG-UHFFFAOYSA-N nitrosourea Chemical compound NC(=O)N=NO OSTGTTZJOCZWJG-UHFFFAOYSA-N 0.000 description 1
- 229950006344 nocodazole Drugs 0.000 description 1
- KGTDRFCXGRULNK-JYOBTZKQSA-N nogalamycin Chemical compound CO[C@@H]1[C@@](OC)(C)[C@@H](OC)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=C(O)C=C4[C@@]5(C)O[C@H]([C@H]([C@@H]([C@H]5O)N(C)C)O)OC4=C3C3=O)=C3C=C2[C@@H](C(=O)OC)[C@@](C)(O)C1 KGTDRFCXGRULNK-JYOBTZKQSA-N 0.000 description 1
- 229950009266 nogalamycin Drugs 0.000 description 1
- 230000000683 nonmetastatic effect Effects 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 229960002700 octreotide Drugs 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 229950001483 olcorolimus Drugs 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid group Chemical group C(CCCCCCC\C=C/CCCCCCCC)(=O)O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 201000008859 olfactory neuroblastoma Diseases 0.000 description 1
- 229960000470 omalizumab Drugs 0.000 description 1
- 229960005343 ondansetron Drugs 0.000 description 1
- 201000006958 oropharynx cancer Diseases 0.000 description 1
- ZLLOIFNEEWYATC-XMUHMHRVSA-N osaterone Chemical compound C1=C(Cl)C2=CC(=O)OC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)C)(O)[C@@]1(C)CC2 ZLLOIFNEEWYATC-XMUHMHRVSA-N 0.000 description 1
- 229950006466 osaterone Drugs 0.000 description 1
- 201000008482 osteoarthritis Diseases 0.000 description 1
- 208000003388 osteoid osteoma Diseases 0.000 description 1
- 208000008798 osteoma Diseases 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 230000002611 ovarian Effects 0.000 description 1
- 229950000370 oxisuran Drugs 0.000 description 1
- 102000002574 p38 Mitogen-Activated Protein Kinases Human genes 0.000 description 1
- 108010068338 p38 Mitogen-Activated Protein Kinases Proteins 0.000 description 1
- 229940118537 p53 inhibitor Drugs 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- VYOQBYCIIJYKJA-VORKOXQSSA-N palau'amine Chemical compound N([C@@]12[C@@H](Cl)[C@@H]([C@@H]3[C@@H]2[C@]24N=C(N)N[C@H]2N2C=CC=C2C(=O)N4C3)CN)C(N)=N[C@H]1O VYOQBYCIIJYKJA-VORKOXQSSA-N 0.000 description 1
- 229960000402 palivizumab Drugs 0.000 description 1
- WRUUGTRCQOWXEG-UHFFFAOYSA-N pamidronate Chemical compound NCCC(O)(P(O)(O)=O)P(O)(O)=O WRUUGTRCQOWXEG-UHFFFAOYSA-N 0.000 description 1
- 229960003978 pamidronic acid Drugs 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 201000002528 pancreatic cancer Diseases 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 208000003154 papilloma Diseases 0.000 description 1
- 208000007312 paraganglioma Diseases 0.000 description 1
- 201000003913 parathyroid carcinoma Diseases 0.000 description 1
- 208000017954 parathyroid gland carcinoma Diseases 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 229960001744 pegaspargase Drugs 0.000 description 1
- 108010001564 pegaspargase Proteins 0.000 description 1
- 229950006960 peliomycin Drugs 0.000 description 1
- 229960005079 pemetrexed Drugs 0.000 description 1
- QOFFJEBXNKRSPX-ZDUSSCGKSA-N pemetrexed Chemical compound C1=N[C]2NC(N)=NC(=O)C2=C1CCC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 QOFFJEBXNKRSPX-ZDUSSCGKSA-N 0.000 description 1
- 201000001976 pemphigus vulgaris Diseases 0.000 description 1
- VOKSWYLNZZRQPF-GDIGMMSISA-N pentazocine Chemical compound C1C2=CC=C(O)C=C2[C@@]2(C)[C@@H](C)[C@@H]1N(CC=C(C)C)CC2 VOKSWYLNZZRQPF-GDIGMMSISA-N 0.000 description 1
- 229960005301 pentazocine Drugs 0.000 description 1
- 229940043138 pentosan polysulfate Drugs 0.000 description 1
- 229960002340 pentostatin Drugs 0.000 description 1
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 1
- QIMGFXOHTOXMQP-GFAGFCTOSA-N peplomycin Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCCN[C@@H](C)C=1C=CC=CC=1)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1NC=NC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C QIMGFXOHTOXMQP-GFAGFCTOSA-N 0.000 description 1
- 229950003180 peplomycin Drugs 0.000 description 1
- WTWWXOGTJWMJHI-UHFFFAOYSA-N perflubron Chemical compound FC(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)Br WTWWXOGTJWMJHI-UHFFFAOYSA-N 0.000 description 1
- 229960001217 perflubron Drugs 0.000 description 1
- 210000005259 peripheral blood Anatomy 0.000 description 1
- 239000011886 peripheral blood Substances 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 238000001050 pharmacotherapy Methods 0.000 description 1
- LCADVYTXPLBAGB-GNCBHIOISA-N phenalamide A1 Natural products CC(CO)NC(=O)C(=CC=CC=C/C=C/C(=C/C(C)C(O)C(=CC(C)CCc1ccccc1)C)/C)C LCADVYTXPLBAGB-GNCBHIOISA-N 0.000 description 1
- 229940049953 phenylacetate Drugs 0.000 description 1
- WLJVXDMOQOGPHL-UHFFFAOYSA-N phenylacetic acid Chemical compound OC(=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-UHFFFAOYSA-N 0.000 description 1
- 208000028591 pheochromocytoma Diseases 0.000 description 1
- 229940097886 phosphorus 32 Drugs 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 229960002139 pilocarpine hydrochloride Drugs 0.000 description 1
- RNAICSBVACLLGM-GNAZCLTHSA-N pilocarpine hydrochloride Chemical compound Cl.C1OC(=O)[C@@H](CC)[C@H]1CC1=CN=CN1C RNAICSBVACLLGM-GNAZCLTHSA-N 0.000 description 1
- NJBFOOCLYDNZJN-UHFFFAOYSA-N pipobroman Chemical compound BrCCC(=O)N1CCN(C(=O)CCBr)CC1 NJBFOOCLYDNZJN-UHFFFAOYSA-N 0.000 description 1
- 229960000952 pipobroman Drugs 0.000 description 1
- NUKCGLDCWQXYOQ-UHFFFAOYSA-N piposulfan Chemical compound CS(=O)(=O)OCCC(=O)N1CCN(C(=O)CCOS(C)(=O)=O)CC1 NUKCGLDCWQXYOQ-UHFFFAOYSA-N 0.000 description 1
- 229950001100 piposulfan Drugs 0.000 description 1
- XESARGFCSKSFID-FLLFQEBCSA-N pirazofurin Chemical compound OC1=C(C(=O)N)NN=C1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 XESARGFCSKSFID-FLLFQEBCSA-N 0.000 description 1
- 150000003057 platinum Chemical class 0.000 description 1
- 210000004224 pleura Anatomy 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- 229950008499 plitidepsin Drugs 0.000 description 1
- 108010049948 plitidepsin Proteins 0.000 description 1
- UUSZLLQJYRSZIS-LXNNNBEUSA-N plitidepsin Chemical compound CN([C@H](CC(C)C)C(=O)N[C@@H]1C(=O)N[C@@H]([C@H](CC(=O)O[C@H](C(=O)[C@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N2CCC[C@H]2C(=O)N(C)[C@@H](CC=2C=CC(OC)=CC=2)C(=O)O[C@@H]1C)C(C)C)O)[C@@H](C)CC)C(=O)[C@@H]1CCCN1C(=O)C(C)=O UUSZLLQJYRSZIS-LXNNNBEUSA-N 0.000 description 1
- 201000006292 polyarteritis nodosa Diseases 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 208000005987 polymyositis Diseases 0.000 description 1
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 1
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 1
- 229960004618 prednisone Drugs 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 208000028529 primary immunodeficiency disease Diseases 0.000 description 1
- 208000029340 primitive neuroectodermal tumor Diseases 0.000 description 1
- 229960000624 procarbazine Drugs 0.000 description 1
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 1
- 229960001586 procarbazine hydrochloride Drugs 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 239000000186 progesterone Substances 0.000 description 1
- 229960003387 progesterone Drugs 0.000 description 1
- 229940092597 prolia Drugs 0.000 description 1
- UQOQENZZLBSFKO-POPPZSFYSA-N prostaglandin J2 Chemical compound CCCCC[C@H](O)\C=C\[C@@H]1[C@@H](C\C=C/CCCC(O)=O)C=CC1=O UQOQENZZLBSFKO-POPPZSFYSA-N 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 201000001514 prostate carcinoma Diseases 0.000 description 1
- 201000007094 prostatitis Diseases 0.000 description 1
- 239000003528 protein farnesyltransferase inhibitor Substances 0.000 description 1
- 239000003197 protein kinase B inhibitor Substances 0.000 description 1
- 239000003881 protein kinase C inhibitor Substances 0.000 description 1
- 229940126731 protein tyrosine phosphatase inhibitor Drugs 0.000 description 1
- 239000003806 protein tyrosine phosphatase inhibitor Substances 0.000 description 1
- SSKVDVBQSWQEGJ-UHFFFAOYSA-N pseudohypericin Natural products C12=C(O)C=C(O)C(C(C=3C(O)=CC(O)=C4C=33)=O)=C2C3=C2C3=C4C(C)=CC(O)=C3C(=O)C3=C(O)C=C(O)C1=C32 SSKVDVBQSWQEGJ-UHFFFAOYSA-N 0.000 description 1
- 238000010298 pulverizing process Methods 0.000 description 1
- 239000000784 purine nucleoside phosphorylase inhibitor Substances 0.000 description 1
- 229950010131 puromycin Drugs 0.000 description 1
- MKSVFGKWZLUTTO-FZFAUISWSA-N puromycin dihydrochloride Chemical compound Cl.Cl.C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO MKSVFGKWZLUTTO-FZFAUISWSA-N 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 238000011363 radioimmunotherapy Methods 0.000 description 1
- NTHPAPBPFQJABD-LLVKDONJSA-N ramosetron Chemical compound C12=CC=CC=C2N(C)C=C1C(=O)[C@H]1CC(NC=N2)=C2CC1 NTHPAPBPFQJABD-LLVKDONJSA-N 0.000 description 1
- 229950001588 ramosetron Drugs 0.000 description 1
- 229960003876 ranibizumab Drugs 0.000 description 1
- 108091006082 receptor inhibitors Proteins 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 229940116176 remicade Drugs 0.000 description 1
- 229940107685 reopro Drugs 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 1
- 229910052702 rhenium Inorganic materials 0.000 description 1
- WUAPFZMCVAUBPE-UHFFFAOYSA-N rhenium atom Chemical compound [Re] WUAPFZMCVAUBPE-UHFFFAOYSA-N 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- OWPCHSCAPHNHAV-LMONGJCWSA-N rhizoxin Chemical compound C/C([C@H](OC)[C@@H](C)[C@@H]1C[C@H](O)[C@]2(C)O[C@@H]2/C=C/[C@@H](C)[C@]2([H])OC(=O)C[C@@](C2)(C[C@@H]2O[C@H]2C(=O)O1)[H])=C\C=C\C(\C)=C\C1=COC(C)=N1 OWPCHSCAPHNHAV-LMONGJCWSA-N 0.000 description 1
- 229960004356 riboprine Drugs 0.000 description 1
- 108091092562 ribozyme Proteins 0.000 description 1
- 229960001302 ridaforolimus Drugs 0.000 description 1
- 238000007363 ring formation reaction Methods 0.000 description 1
- 239000011435 rock Substances 0.000 description 1
- 229950003733 romurtide Drugs 0.000 description 1
- 108700033545 romurtide Proteins 0.000 description 1
- 229960003522 roquinimex Drugs 0.000 description 1
- 229950008902 safingol Drugs 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 210000003296 saliva Anatomy 0.000 description 1
- QFMKPDZCOKCBAQ-NFCVMBANSA-N sar943-nxa Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)CC1 QFMKPDZCOKCBAQ-NFCVMBANSA-N 0.000 description 1
- YADVRLOQIWILGX-UHFFFAOYSA-N sarcophytol N Natural products CC(C)C1=CC=C(C)CCC=C(C)CCC=C(C)CC1O YADVRLOQIWILGX-UHFFFAOYSA-N 0.000 description 1
- 229960002530 sargramostim Drugs 0.000 description 1
- 108010038379 sargramostim Proteins 0.000 description 1
- 229960005399 satraplatin Drugs 0.000 description 1
- 190014017285 satraplatin Chemical compound 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 230000037390 scarring Effects 0.000 description 1
- 229960003440 semustine Drugs 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 239000011257 shell material Substances 0.000 description 1
- 230000035939 shock Effects 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 229910001923 silver oxide Inorganic materials 0.000 description 1
- 229940115586 simulect Drugs 0.000 description 1
- 208000037968 sinus cancer Diseases 0.000 description 1
- 208000017520 skin disease Diseases 0.000 description 1
- 208000019116 sleep disease Diseases 0.000 description 1
- 201000002314 small intestine cancer Diseases 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 229940006198 sodium phenylacetate Drugs 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 210000004872 soft tissue Anatomy 0.000 description 1
- 229940055944 soliris Drugs 0.000 description 1
- 229950009641 sparsomycin Drugs 0.000 description 1
- XKLZIVIOZDNKEQ-CLQLPEFOSA-N sparsomycin Chemical compound CSC[S@](=O)C[C@H](CO)NC(=O)\C=C\C1=C(C)NC(=O)NC1=O XKLZIVIOZDNKEQ-CLQLPEFOSA-N 0.000 description 1
- XKLZIVIOZDNKEQ-UHFFFAOYSA-N sparsomycin Natural products CSCS(=O)CC(CO)NC(=O)C=CC1=C(C)NC(=O)NC1=O XKLZIVIOZDNKEQ-UHFFFAOYSA-N 0.000 description 1
- YBZRLMLGUBIIDN-NZSGCTDASA-N spicamycin Chemical compound O1[C@@H](C(O)CO)[C@H](NC(=O)CNC(=O)CCCCCCCCCCCCC(C)C)[C@@H](O)[C@@H](O)[C@H]1NC1=NC=NC2=C1N=CN2 YBZRLMLGUBIIDN-NZSGCTDASA-N 0.000 description 1
- YBZRLMLGUBIIDN-UHFFFAOYSA-N spicamycin Natural products O1C(C(O)CO)C(NC(=O)CNC(=O)CCCCCCCCCCCCC(C)C)C(O)C(O)C1NC1=NC=NC2=C1NC=N2 YBZRLMLGUBIIDN-UHFFFAOYSA-N 0.000 description 1
- 208000037959 spinal tumor Diseases 0.000 description 1
- 229950004330 spiroplatin Drugs 0.000 description 1
- 108010032486 splenopentin Proteins 0.000 description 1
- ICXJVZHDZFXYQC-UHFFFAOYSA-N spongistatin 1 Natural products OC1C(O2)(O)CC(O)C(C)C2CCCC=CC(O2)CC(O)CC2(O2)CC(OC)CC2CC(=O)C(C)C(OC(C)=O)C(C)C(=C)CC(O2)CC(C)(O)CC2(O2)CC(OC(C)=O)CC2CC(=O)OC2C(O)C(CC(=C)CC(O)C=CC(Cl)=C)OC1C2C ICXJVZHDZFXYQC-UHFFFAOYSA-N 0.000 description 1
- HAOCRCFHEPRQOY-JKTUOYIXSA-N spongistatin-1 Chemical compound C([C@@H]1C[C@@H](C[C@@]2(C[C@@H](O)C[C@@H](C2)\C=C/CCC[C@@H]2[C@H](C)[C@@H](O)C[C@](O2)(O)[C@H]2O)O1)OC)C(=O)[C@@H](C)[C@@H](OC(C)=O)[C@H](C)C(=C)C[C@H](O1)C[C@](C)(O)C[C@@]1(O1)C[C@@H](OC(C)=O)C[C@@H]1CC(=O)O[C@H]1[C@H](O)[C@@H](CC(=C)C(C)[C@H](O)\C=C\C(Cl)=C)O[C@@H]2[C@@H]1C HAOCRCFHEPRQOY-JKTUOYIXSA-N 0.000 description 1
- 229950001248 squalamine Drugs 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 229940071598 stelara Drugs 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 201000011549 stomach cancer Diseases 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 125000005555 sulfoximide group Chemical group 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 229950007841 sulofenur Drugs 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- FIAFUQMPZJWCLV-UHFFFAOYSA-N suramin Chemical compound OS(=O)(=O)C1=CC(S(O)(=O)=O)=C2C(NC(=O)C3=CC=C(C(=C3)NC(=O)C=3C=C(NC(=O)NC=4C=C(C=CC=4)C(=O)NC=4C(=CC=C(C=4)C(=O)NC=4C5=C(C=C(C=C5C(=CC=4)S(O)(=O)=O)S(O)(=O)=O)S(O)(=O)=O)C)C=CC=3)C)=CC=C(S(O)(=O)=O)C2=C1 FIAFUQMPZJWCLV-UHFFFAOYSA-N 0.000 description 1
- 229960005314 suramin Drugs 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 229940036185 synagis Drugs 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 108700003774 talisomycin Proteins 0.000 description 1
- 229950002687 talisomycin Drugs 0.000 description 1
- 108010021891 tallimustine Proteins 0.000 description 1
- 229950005667 tallimustine Drugs 0.000 description 1
- 229950007866 tanespimycin Drugs 0.000 description 1
- AYUNIORJHRXIBJ-TXHRRWQRSA-N tanespimycin Chemical compound N1C(=O)\C(C)=C\C=C/[C@H](OC)[C@@H](OC(N)=O)\C(C)=C\[C@H](C)[C@@H](O)[C@@H](OC)C[C@H](C)CC2=C(NCC=C)C(=O)C=C1C2=O AYUNIORJHRXIBJ-TXHRRWQRSA-N 0.000 description 1
- LRBQNJMCXXYXIU-NRMVVENXSA-N tannic acid Chemical compound OC1=C(O)C(O)=CC(C(=O)OC=2C(=C(O)C=C(C=2)C(=O)OC[C@@H]2[C@H]([C@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)O2)OC(=O)C=2C=C(OC(=O)C=3C=C(O)C(O)=C(O)C=3)C(O)=C(O)C=2)O)=C1 LRBQNJMCXXYXIU-NRMVVENXSA-N 0.000 description 1
- 229940033123 tannic acid Drugs 0.000 description 1
- 235000015523 tannic acid Nutrition 0.000 description 1
- 229920002258 tannic acid Polymers 0.000 description 1
- 229950010168 tauromustine Drugs 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- 150000004579 taxol derivatives Chemical class 0.000 description 1
- 229940063683 taxotere Drugs 0.000 description 1
- 229960001674 tegafur Drugs 0.000 description 1
- WFWLQNSHRPWKFK-ZCFIWIBFSA-N tegafur Chemical compound O=C1NC(=O)C(F)=CN1[C@@H]1OCCC1 WFWLQNSHRPWKFK-ZCFIWIBFSA-N 0.000 description 1
- 229910052714 tellurium Inorganic materials 0.000 description 1
- PORWMNRCUJJQNO-UHFFFAOYSA-N tellurium atom Chemical compound [Te] PORWMNRCUJJQNO-UHFFFAOYSA-N 0.000 description 1
- 239000003277 telomerase inhibitor Substances 0.000 description 1
- RNVNXVVEDMSRJE-UHFFFAOYSA-N teloxantrone hydrochloride Chemical compound Cl.Cl.OCCNCCN1NC2=C3C(=O)C=CC(=O)C3=C(O)C3=C2C1=CC=C3NCCNC RNVNXVVEDMSRJE-UHFFFAOYSA-N 0.000 description 1
- 229960002197 temoporfin Drugs 0.000 description 1
- 229960004964 temozolomide Drugs 0.000 description 1
- 229960000235 temsirolimus Drugs 0.000 description 1
- QFJCIRLUMZQUOT-UHFFFAOYSA-N temsirolimus Natural products C1CC(O)C(OC)CC1CC(C)C1OC(=O)C2CCCCN2C(=O)C(=O)C(O)(O2)C(C)CCC2CC(OC)C(C)=CC=CC=CC(C)CC(C)C(=O)C(OC)C(O)C(C)=CC(C)C(=O)C1 QFJCIRLUMZQUOT-UHFFFAOYSA-N 0.000 description 1
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 1
- 229960001278 teniposide Drugs 0.000 description 1
- BRWIPGSUTYVUBF-ZCFIWIBFSA-N tert-butyl (4r)-4,5-diamino-5-oxopentanoate Chemical compound CC(C)(C)OC(=O)CC[C@@H](N)C(N)=O BRWIPGSUTYVUBF-ZCFIWIBFSA-N 0.000 description 1
- BCNZYOJHNLTNEZ-UHFFFAOYSA-N tert-butyldimethylsilyl chloride Chemical compound CC(C)(C)[Si](C)(C)Cl BCNZYOJHNLTNEZ-UHFFFAOYSA-N 0.000 description 1
- 125000001981 tert-butyldimethylsilyl group Chemical group [H]C([H])([H])[Si]([H])(C([H])([H])[H])[*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 201000003120 testicular cancer Diseases 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- WXZSUBHBYQYTNM-WMDJANBXSA-N tetrazomine Chemical compound C=1([C@@H]2CO[C@@H]3[C@H]4C[C@@H](CO)[C@H](N4C)[C@@H](N23)CC=1C=C1)C(OC)=C1NC(=O)C1NCCC[C@H]1O WXZSUBHBYQYTNM-WMDJANBXSA-N 0.000 description 1
- ZCTJIMXXSXQXRI-KYJUHHDHSA-N thalicarpine Chemical compound CN1CCC2=CC(OC)=C(OC)C3=C2[C@@H]1CC1=C3C=C(OC)C(OC2=C(C[C@H]3C4=CC(OC)=C(OC)C=C4CCN3C)C=C(C(=C2)OC)OC)=C1 ZCTJIMXXSXQXRI-KYJUHHDHSA-N 0.000 description 1
- 229960001196 thiotepa Drugs 0.000 description 1
- NZVYCXVTEHPMHE-ZSUJOUNUSA-N thymalfasin Chemical compound CC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O NZVYCXVTEHPMHE-ZSUJOUNUSA-N 0.000 description 1
- 229960004231 thymalfasin Drugs 0.000 description 1
- 229950010183 thymotrinan Drugs 0.000 description 1
- YFTWHEBLORWGNI-UHFFFAOYSA-N tiamiprine Chemical compound CN1C=NC([N+]([O-])=O)=C1SC1=NC(N)=NC2=C1NC=N2 YFTWHEBLORWGNI-UHFFFAOYSA-N 0.000 description 1
- 229950011457 tiamiprine Drugs 0.000 description 1
- 229940098465 tincture Drugs 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- MNRILEROXIRVNJ-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=NC=N[C]21 MNRILEROXIRVNJ-UHFFFAOYSA-N 0.000 description 1
- 229950002376 tirapazamine Drugs 0.000 description 1
- QVMPZNRFXAKISM-UHFFFAOYSA-N tirapazamine Chemical compound C1=CC=C2[N+]([O-])=NC(=N)N(O)C2=C1 QVMPZNRFXAKISM-UHFFFAOYSA-N 0.000 description 1
- 229960003989 tocilizumab Drugs 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 229940044693 topoisomerase inhibitor Drugs 0.000 description 1
- 229960000303 topotecan Drugs 0.000 description 1
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 1
- ONYVJPZNVCOAFF-UHFFFAOYSA-N topsentin Natural products Oc1ccc2cc([nH]c2c1)C(=O)c3ncc([nH]3)c4c[nH]c5ccccc45 ONYVJPZNVCOAFF-UHFFFAOYSA-N 0.000 description 1
- 229960005026 toremifene Drugs 0.000 description 1
- XFCLJVABOIYOMF-QPLCGJKRSA-N toremifene Chemical compound C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 XFCLJVABOIYOMF-QPLCGJKRSA-N 0.000 description 1
- 229960004167 toremifene citrate Drugs 0.000 description 1
- 229940100411 torisel Drugs 0.000 description 1
- 229960005267 tositumomab Drugs 0.000 description 1
- 229960001727 tretinoin Drugs 0.000 description 1
- PHYFQTYBJUILEZ-IUPFWZBJSA-N triolein Chemical class CCCCCCCC\C=C/CCCCCCCC(=O)OCC(OC(=O)CCCCCCC\C=C/CCCCCCCC)COC(=O)CCCCCCC\C=C/CCCCCCCC PHYFQTYBJUILEZ-IUPFWZBJSA-N 0.000 description 1
- 190014017283 triplatin tetranitrate Chemical compound 0.000 description 1
- 229950002860 triplatin tetranitrate Drugs 0.000 description 1
- VXKHXGOKWPXYNA-PGBVPBMZSA-N triptorelin Chemical compound C([C@@H](C(=O)N[C@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 VXKHXGOKWPXYNA-PGBVPBMZSA-N 0.000 description 1
- 229960004824 triptorelin Drugs 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 229960003688 tropisetron Drugs 0.000 description 1
- ZNRGQMMCGHDTEI-ITGUQSILSA-N tropisetron Chemical compound C1=CC=C2C(C(=O)O[C@H]3C[C@H]4CC[C@@H](C3)N4C)=CNC2=C1 ZNRGQMMCGHDTEI-ITGUQSILSA-N 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 229940046728 tumor necrosis factor alpha inhibitor Drugs 0.000 description 1
- 239000002452 tumor necrosis factor alpha inhibitor Substances 0.000 description 1
- 230000005751 tumor progression Effects 0.000 description 1
- 229940094060 tykerb Drugs 0.000 description 1
- 208000035408 type 1 diabetes mellitus 1 Diseases 0.000 description 1
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 1
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 1
- 150000004917 tyrosine kinase inhibitor derivatives Chemical class 0.000 description 1
- 229940079023 tysabri Drugs 0.000 description 1
- 229950009811 ubenimex Drugs 0.000 description 1
- YYSFXUWWPNHNAZ-PKJQJFMNSA-N umirolimus Chemical compound C1[C@@H](OC)[C@H](OCCOCC)CC[C@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 YYSFXUWWPNHNAZ-PKJQJFMNSA-N 0.000 description 1
- 229950007775 umirolimus Drugs 0.000 description 1
- 208000022810 undifferentiated (embryonal) sarcoma Diseases 0.000 description 1
- AUFUWRKPQLGTGF-FMKGYKFTSA-N uridine triacetate Chemical compound CC(=O)O[C@@H]1[C@H](OC(C)=O)[C@@H](COC(=O)C)O[C@H]1N1C(=O)NC(=O)C=C1 AUFUWRKPQLGTGF-FMKGYKFTSA-N 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 229960005356 urokinase Drugs 0.000 description 1
- 229960003824 ustekinumab Drugs 0.000 description 1
- 206010046766 uterine cancer Diseases 0.000 description 1
- 206010046885 vaginal cancer Diseases 0.000 description 1
- 208000013139 vaginal neoplasm Diseases 0.000 description 1
- 229960002730 vapreotide Drugs 0.000 description 1
- 108700029852 vapreotide Proteins 0.000 description 1
- 229940124676 vascular endothelial growth factor receptor Drugs 0.000 description 1
- 229950000578 vatalanib Drugs 0.000 description 1
- YCOYDOIWSSHVCK-UHFFFAOYSA-N vatalanib Chemical compound C1=CC(Cl)=CC=C1NC(C1=CC=CC=C11)=NN=C1CC1=CC=NC=C1 YCOYDOIWSSHVCK-UHFFFAOYSA-N 0.000 description 1
- LLDWLPRYLVPDTG-UHFFFAOYSA-N vatalanib succinate Chemical compound OC(=O)CCC(O)=O.C1=CC(Cl)=CC=C1NC(C1=CC=CC=C11)=NN=C1CC1=CC=NC=C1 LLDWLPRYLVPDTG-UHFFFAOYSA-N 0.000 description 1
- XLQGICHHYYWYIU-UHFFFAOYSA-N veramine Natural products O1C2CC3C4CC=C5CC(O)CCC5(C)C4CC=C3C2(C)C(C)C21CCC(C)CN2 XLQGICHHYYWYIU-UHFFFAOYSA-N 0.000 description 1
- 229960003895 verteporfin Drugs 0.000 description 1
- ZQFGRJWRSLZCSQ-ZSFNYQMMSA-N verteporfin Chemical compound C=1C([C@@]2([C@H](C(=O)OC)C(=CC=C22)C(=O)OC)C)=NC2=CC(C(=C2C=C)C)=NC2=CC(C(=C2CCC(O)=O)C)=NC2=CC2=NC=1C(C)=C2CCC(=O)OC ZQFGRJWRSLZCSQ-ZSFNYQMMSA-N 0.000 description 1
- KDQAABAKXDWYSZ-PNYVAJAMSA-N vinblastine sulfate Chemical compound OS(O)(=O)=O.C([C@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 KDQAABAKXDWYSZ-PNYVAJAMSA-N 0.000 description 1
- 229960004982 vinblastine sulfate Drugs 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- AQTQHPDCURKLKT-JKDPCDLQSA-N vincristine sulfate Chemical compound OS(O)(=O)=O.C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C=O)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 AQTQHPDCURKLKT-JKDPCDLQSA-N 0.000 description 1
- 229960002110 vincristine sulfate Drugs 0.000 description 1
- 229960004355 vindesine Drugs 0.000 description 1
- UGGWPQSBPIFKDZ-KOTLKJBCSA-N vindesine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(N)=O)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 UGGWPQSBPIFKDZ-KOTLKJBCSA-N 0.000 description 1
- 229960005212 vindesine sulfate Drugs 0.000 description 1
- BCXOZISMDZTYHW-IFQBWSDRSA-N vinepidine sulfate Chemical compound OS(O)(=O)=O.C([C@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C=O)C=2)OC)C[C@@H](C2)CC)N2CCC2=C1NC1=CC=CC=C21 BCXOZISMDZTYHW-IFQBWSDRSA-N 0.000 description 1
- 229960002066 vinorelbine Drugs 0.000 description 1
- GBABOYUKABKIAF-GHYRFKGUSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-GHYRFKGUSA-N 0.000 description 1
- 229960002166 vinorelbine tartrate Drugs 0.000 description 1
- GBABOYUKABKIAF-IWWDSPBFSA-N vinorelbinetartrate Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC(C23[C@H]([C@@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-IWWDSPBFSA-N 0.000 description 1
- XLMPPFTZALNBFS-INIZCTEOSA-N vorozole Chemical compound C1([C@@H](C2=CC=C3N=NN(C3=C2)C)N2N=CN=C2)=CC=C(Cl)C=C1 XLMPPFTZALNBFS-INIZCTEOSA-N 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- QDLHCMPXEPAAMD-QAIWCSMKSA-N wortmannin Chemical compound C1([C@]2(C)C3=C(C4=O)OC=C3C(=O)O[C@@H]2COC)=C4[C@@H]2CCC(=O)[C@@]2(C)C[C@H]1OC(C)=O QDLHCMPXEPAAMD-QAIWCSMKSA-N 0.000 description 1
- QDLHCMPXEPAAMD-UHFFFAOYSA-N wortmannin Natural products COCC1OC(=O)C2=COC(C3=O)=C2C1(C)C1=C3C2CCC(=O)C2(C)CC1OC(C)=O QDLHCMPXEPAAMD-UHFFFAOYSA-N 0.000 description 1
- 229940099073 xolair Drugs 0.000 description 1
- 229940055760 yervoy Drugs 0.000 description 1
- 229950005561 zanoterone Drugs 0.000 description 1
- 229950003017 zeniplatin Drugs 0.000 description 1
- 150000003751 zinc Chemical class 0.000 description 1
- 229950009268 zinostatin Drugs 0.000 description 1
- CGTADGCBEXYWNE-JUKNQOCSSA-N zotarolimus Chemical compound N1([C@H]2CC[C@@H](C[C@@H](C)[C@H]3OC(=O)[C@@H]4CCCCN4C(=O)C(=O)[C@@]4(O)[C@H](C)CC[C@H](O4)C[C@@H](/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C3)OC)C[C@H]2OC)C=NN=N1 CGTADGCBEXYWNE-JUKNQOCSSA-N 0.000 description 1
- 229950009819 zotarolimus Drugs 0.000 description 1
- 150000003952 β-lactams Chemical class 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/403—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with carbocyclic rings, e.g. carbazole
- A61K31/4035—Isoindoles, e.g. phthalimide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4412—Non condensed pyridines; Hydrogenated derivatives thereof having oxo groups directly attached to the heterocyclic ring
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/45—Non condensed piperidines, e.g. piperocaine having oxo groups directly attached to the heterocyclic ring, e.g. cycloheximide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene or sparfloxacin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
- A61P29/02—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID] without antiinflammatory effect
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/02—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring
- C07D209/44—Iso-indoles; Hydrogenated iso-indoles
- C07D209/46—Iso-indoles; Hydrogenated iso-indoles with an oxygen atom in position 1
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D407/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00
- C07D407/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/05—Isotopically modified compounds, e.g. labelled
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B59/00—Introduction of isotopes of elements into organic compounds ; Labelled organic compounds per se
- C07B59/002—Heterocyclic compounds
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Hematology (AREA)
- Oncology (AREA)
- Hospice & Palliative Care (AREA)
- Psychiatry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Plural Heterocyclic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Изобретение относится к соединениям формулы (I):
при этом в общей формуле (I) n1 выбран из 0 или 1; Z представляет собой , где атом углерода, помеченный *, представляет собой центр асимметрии; каждый из R1, R3, R4, R5, R6, R7, R8 и R9 независимо выбран из H или D; R2 выбран из H, D или F; каждый из L1 и L2 независимо выбран из CD2, CHD или CH2; X выбран из NH, ND или O; R10 представляет собой H, D или , где каждый из R2’, R3’, R4’ и R5’ независимо выбран из H, D, галогена, циано, гидрокси, , , , , замещенного или незамещенного (C1-C12)алкила, замещенного или незамещенного (C1-C12)алкокси, (C2-C6)гетероциклоалкила или дейтерированного (C2-C6)гетероциклоалкила; где каждый из Ra и Rb независимо представляет собой H, (C1-C12)алкил, (C1-C12)алкилацил; каждый из Rc и Rd независимо представляет собой H или (C1-C12)алкил; Re представляет собой ; причем каждый из Re1 и Re2 независимо представляет собой H или (C1-C12)алкил; которые способны регулировать активность иммунологических цитокинов, таким образом эффективно излечивая рак и воспалительное заболевание. 5 н. и 9 з.п. ф-лы, 3 табл., 78 пр.
Description
Настоящая заявка испрашивает приоритет заявки на патент Китая CN 2014/10605148.8, поданной 30 октября 2014 г., и заявки на патент Китая CN 2014/10632870.0, поданной 11 ноября 2014 г., содержание которых включено в данный документ посредством ссылки во всей их полноте.
Область изобретения
Настоящее изобретение относится к производному изоиндолина, промежуточному продукту, способу получения, фармацевтической композиции и ее применению.
Предшествующий уровень техники
Фактор-α некроза опухоли (TNF-α) представляет собой вид провоспалительного цитокина, который играет важную роль в иммунном гомеостазе, воспалении и иммунной защите. Было доказано, что TNF-α является одним из основных медиаторов воспаления. TNF-α также может продуцироваться опухолями, и может играть роль в стимулировании образования опухолей, также может вызывать запрограммированную гибель клеток опухолей. Кроме того, TNF-α также влияет на процессы, такие как апоптоз, некроз, ангиогенез, активация иммунных клеток, дифференциация и миграция клеток, все эти процессы играют важную роль в онкогенезе и прогрессировании опухолей.
Неконтролируемая активность TNF-α или чрезмерное продуцирование TNF-α связано с патологией различных заболеваний, в том числе без ограничения формы рака, такие как рак толстой кишки, прямой кишки, предстательной железы, молочной железы, головного мозга и толстой кишки; а также воспалительные заболевания, в частности воспаление, связанное с раком. Дисрегуляция TNF-α может приводить также к аутоиммунным заболеваниям, синдрому токсического шока, кахексии, артриту, псориазу, HIV-инфекции и AIDS, неврологическим заболеваниям и заболеваниям центральной нервной системы, сепсису, застойной сердечной недостаточности, отторжению аллотрансплантата и вирусным инфекциям. Таким образом, уменьшение уровня TNF-α или регулирование активности TNF-α является перспективной стратегией в лечении многих иммунологических, воспалительных и злокачественных заболеваний (например, форм рака и воспаления). Как например, Sethi et al. Front. Biosci. (2008) 13, 5094-5107 Results Prob. Cell Differ. (2009) 49, 1-15.
Леналидомид (3-(4-амино-1,3-дигидро-1-оксо-2H-изоиндол-2-ил)пиперидин-2,6-дион) представляет собой низкомолекулярный иммунный регулятор, было доказано, что он способен ингибировать секрецию TNF-α и других провоспалительных цитокинов, а также увеличивать секрецию противовоспалительных цитокинов. Леналидомид был одобрен для лечения множественной миеломы (в 2006 г.), миелодиспластического синдрома (в 2005 г.) и лимфомы из клеток мантийной зоны (в 2013 г.). Кроме того, в клинических испытаниях леналидомид, отдельно или в комбинации с другими терапевтическими средствами, способен лечить неходжкинскую лимфому, папиллярную и фолликулярную тиреоидную карциному, рак предстательной железы, хронический лимфоцитарный лейкоз, амилоидоз, комплексный регионарный болевой синдром I типа, злокачественную меланому, заболевание корешка нерва, миелофиброз, глиобластому, глиосаркому, злокачественную глиому, миелоидный лейкоз, рефракторную плазмоцитому, хронический миеломоноцитарный лейкоз, фолликулярную лимфому, меланому цилиарного тела и хроническую меланому, меланому радужной оболочки, рецидивирующую интраокулярную меланому, экстраокулярную распространяющуюся меланому, солидную опухоль, Т-клеточную лимфому, эритроидную лимфому, монобластный и моноцитарный лейкоз; миелоидный лейкоз и опухоли головного мозга, менингиому, опухоль спинного мозга, рак щитовидной железы, лимфому из клеток мантийной зоны, немелкоклеточный рак легкого, карциному яичника, почечно-клеточную карциному, миелофиброз, лимфому Беркитта, лимфому Ходжкина, крупноклеточную лимфому и макроглобулинемию (см. WO 2012/015986).
Однако леналидомид обладает множеством побочных действий. Более того, в информации о назначении леналидомида четко указано, что лекарственное средство характеризуется риском вызывать миелосупрессию, тромбоз глубоких вен, легочную эмболию и тератогенез. Во время клинических испытаний большинству пациентов, принимающих леналидомид, требуется снижение дозы из-за гематологической токсичности. Таким образом, несмотря на то, что леналидомид обладает полезной активностью, его действенность ограничена возникновением значительных побочных эффектов. Таким образом, срочно требуются производные леналидомида, характеризующиеся улучшенными структурами для оптимизации его характеристик в сфере применения.
Описание настоящего изобретения
Настоящее изобретение предусматривает производное изоиндолина, промежуточный продукт, способ получения, фармацевтическую композицию и ее применение. Производное изоиндолина по настоящему изобретению способно регулировать получение или активность цитокинов (например, TNF-α), с тем чтобы эффективно лечить формы рака и воспалительные заболевания.
Настоящее изобретение предусматривает производное изоиндолина, представленное общей формулой (I), его фармацевтически приемлемую соль, сольват, полиморф, стереоизомер, изотопное соединение, метаболит или пролекарство;
в общей формуле (I) n1 выбран из 0 или 1;
каждый из R1, R3, R4, R5, R6, R7, R8 и R9 независимо выбран из H или D;
R2 выбран из H, D или галогена;
каждый из L1 и L2 независимо выбран из CD2, CHD или CH2;
X выбран из NH, ND или O;
R10 представляет собой H, D или, где каждый из R1’, R2’, R3’, R4’ и R5’ независимо выбран из H, D, галогена, циано, гидроксила, , , , , замещенного или незамещенного (C1-C12)алкила, замещенного или незамещенного (C1-C12)алкокси, (C2-C20)гетероциклоалкила или дейтерированного (C2-C20)гетероциклоалкила; где каждый из Ra и Rb независимо представляет собой H, (C1-C12)алкил или (C1-C12)алкилацил; каждый из Rc и Rd независимо представляет собой H или (C1-C12)алкил; Re представляет собой или (C2-C20)гетероциклоалкил; причем каждый из Re1 и Re2 независимо представляет собой H или (C1-C12)алкил;
заместитель, содержащийся в замещенном (C1-C12)алкокси, выбран из группы, состоящей из D, галогена, гидроксила, (C1-C12)алкокси, (C2-C20)гетероциклоалкила, (C2-C20)гетероциклоалкила, замещенного (C1-C12)алкилом, и , где каждый из Rf и Rg независимо представляет собой H или (C1-C12)алкил; Rh представляет собой (C2-C20)гетероциклоалкил;
заместитель, содержащийся в замещенном (C1-C12)алкиле, выбран из группы, состоящей из D, (C2-C20)гетероциклоалкила, дейтерированного (C2-C20)гетероциклоалкила, (C2-C20)гетероциклоалкила, замещенного (C1-C12)алкилом, и (C2-C20)гетероциклоалкила, замещенного дейтерированным (C1-C12)алкилом;
в случае если в замещенном (C1-C12)алкокси или замещенном (C1-C12)алкокси содержится больше одного заместителя, – заместители являются одинаковыми или разными;
в каждой из вышеупомянутых групп гетероатом (C2-C20)гетероциклоалкила, содержащийся в (C2-C20)гетероциклоалкиле, дейтерированном (C2-C20)гетероциклоалкиле, (C2-C20)гетероциклоалкиле, замещенном (C1-C12)алкилом, или (C2-C20)гетероциклоалкиле, замещенном дейтерированным (C1-C12)алкилом, выбран из группы, состоящей из O, N и S;
при условии, что в общей формуле (I), в случае если n1 представляет собой 0, R1, R3 и R10 представляют собой H или D, X представляет собой NH или ND, R2 представляет собой галоген;
при условии, что в общей формуле (I), в случае если n1 представляет собой 1, X представляет собой O и R2 представляет собой H или D, R10 представляет собойили , причем в случае если R10 представляет собой, Re представляет собой (C2-C20)гетероциклоалкил;
при условии, что в общей формуле (I), в случае если n1 представляет собой 1 и X представляет собой NH, R10 представляет собой;
при условии, что в общей формуле (I) и Z, в случае если n1 представляет собой 1, X представляет собой NH, R1-R9 представляют собой H, и как L1, так и L2 представляет собой CH2, R10 не является или .
Предпочтительно, в общей формуле (I) центр асимметрии относится к ахиральному атому углерода, атому углерода с (S)-конфигурацией, обогащенному атому углерода с (S)-конфигурацией, атому углерода с (R)-конфигурацией, обогащенному атому углерода с (R)-конфигурацией или рацемату.
В общей формуле (I) Z предпочтительно выбран из группы, состоящей из
, , , , , ,, , , , , , , , , , , , , , , , , , , , , , , , , , , , и , где *определен, как описано выше.
В каждый из вышеупомянутых групп (C2-C20)гетероциклоалкил, содержащийся в (C2-C20)гетероциклоалкиле, дейтерированном (C2-C20)гетероциклоалкиле, (C2-C20)гетероциклоалкиле, замещенном (C1-C12)алкилом, или (C2-C20)гетероциклоалкиле, замещенном дейтерированным (C1-C12)алкилом, предпочтительно представляет собой (C2-C6)гетероциклоалкил, содержащий 1 или 2 гетероатома, выбранных из N или O. (C2-C6)гетероциклоалкил предпочтительно представляет собой пирролидин (например, ), морфолинил (например, ) или пиперазинил (например, ). (C1-C12)алкил, содержащийся в (C2-C20)гетероциклоалкиле, замещенном (C1-C12)алкилом, или (C2-C20)гетероциклоалкиле, замещенном дейтерированным (C1-C12)алкилом, предпочтительно представляет собой (C1-C4)алкил. (C1-C4)алкил предпочтительно представляет собой метил, этил, пропил, изопропил, н-бутил, изобутил или трет-бутил. Дейтерированный (C2-C20)гетероциклоалкил предпочтительно представляет собой . (C2-C20)гетероциклоалкил, замещенный (C1-C12)алкилом, предпочтительно представляет собой , , или . (C2-C20)гетероциклоалкил, замещенный дейтерированным (C1-C12)алкилом, предпочтительно представляет собой , , или .
В общей формуле (I), в случае если R10 представляет собой , каждый из R1’, R2’, R3’, R4’ и R5’ независимо выбран из , , или замещенного (C1-C12)алкокси, при этом каждый из Ra и Rb независимо представляет собой (C1-C12)алкил или (C1-C12)алкилацил, каждый из Rc и Rd независимо представляет собой (C1-C12)алкил, Re представляет собой, причем каждый из Re1 и Re2 независимо представляет собой (C1-C12)алкил, заместитель, содержащийся в замещенном (C1-C12)алкокси, представляет собой и каждый из Rf и Rg независимо представляет собой (C1-C12)алкил, при этом структура (C1-C12)алкилацила представляет собой , причем Ra1 представляет собой (C1-C12)алкил; в определениях Ra, Rb, Ra1, Rc, Rd, Re1, Re2, Rf и Rg (C1-C12)алкил предпочтительно представляет собой (C1-C4)алкил. (C1-C4)алкил предпочтительно представляет собой метил, этил, пропил, изопропил, н-бутил, изобутил или трет-бутил.
В общей формуле (I), в случае если R10 представляет собой , каждый из R1’, R2’, R3’, R4’ и R5’ независимо выбран из замещенного (C1-C12)алкокси и заместитель, содержащийся в замещенном (C1-C12)алкокси, выбран из (C1-C12)алкокси, (C1-C12)алкокси предпочтительно представляет собой (C1-C4)алкокси. (C1-C4)алкокси предпочтительно представляет собой метокси, этокси, пропокси, изопропокси, н-бутокси, изобутокси или трет-бутокси.
В общей формуле (I), в случае если R10 представляет собой , каждый из R1’, R2’, R3’, R4’ и R5’ независимо выбран из замещенного (C1-C12)алкокси и заместитель, содержащийся в замещенном (C1-C12)алкокси, выбран из , предпочтительно представляет собой или .
В общей формуле (I), в случае если R10 представляет собой , каждый из R1’, R2’, R3’, R4’ и R5’ независимо выбран из замещенного (C1-C12)алкокси и заместитель, содержащийся в замещенном (C1-C12)алкокси, выбран из , предпочтительно представляет собой .
В общей формуле (I), в случае если R10 представляет собой и каждый из R1’, R2’, R3’, R4’ и R5’ независимо выбран из галогена, галоген предпочтительно представляет собой F, Cl, Br или I.
В общей формуле (I), в случае если R10 представляет собой и каждый из R1’, R2’, R3’, R4’ и R5’ независимо выбран из замещенного или незамещенного (C1-C12)алкила, замещенный или незамещенный (C1-C12)алкил предпочтительно представляет собой замещенный или незамещенный (C1-C4)алкил. Замещенный или незамещенный (C1-C4)алкил предпочтительно представляет собой замещенный или незамещенный метил, замещенный или незамещенный этил, замещенный или незамещенный н-пропил, замещенный или незамещенный изопропил, замещенный или незамещенный н-бутил, замещенный или незамещенный изобутил или замещенный или незамещенный трет-бутил. Замещенный (C1-C12)алкил предпочтительно представляет собой , , , , , , , , или .
В общей формуле (I), в случае если R10 представляет собой и каждый из R1’, R2’, R3’, R4’ и R5’ независимо выбран из замещенного или незамещенного (C1-C12)алкокси, замещенный или незамещенный (C1-C12)алкокси предпочтительно представляет собой замещенный или незамещенный (C1-C4)алкокси. Замещенный или незамещенный (C1-C4)алкокси предпочтительно представляет собой замещенный или незамещенный метокси, замещенный или незамещенный этокси, замещенный или незамещенный н-пропокси, замещенный или незамещенный н-бутокси, замещенный или незамещенный изобутокси или замещенный или незамещенный трет-бутокси. Замещенный (C1-C12)алкокси предпочтительно представляет собой , , , , , , , , , , , или .
В общей формуле (I), в случае если R10 представляет собой и каждый из R1’, R2’, R3’, R4’ и R5’ независимо выбран из , предпочтительно представляет собой , или .
В общей формуле (I), в случае если R10 представляет собой и каждый из R1’, R2’, R3’, R4’ и R5’ независимо выбран из , предпочтительно представляет собой или .
В общей формуле (I), в случае если R10 представляет собой и каждый из R1’, R2’, R3’, R4’ и R5’ независимо выбран из , предпочтительно представляет собой , или .
В общей формуле (I) предпочтительно представляет собой , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , ,, , , , , , ,, , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , или .
В общей формуле (I) предпочтительно, в случае если n1 представляет собой 1, R2 представляет собой H или D.
В общей формуле (I) предпочтительно, в случае если n1 представляет собой 1 и R2 представляет собой H или D, R10 представляет собой . Предпочтительно, в определении R10 R5’ выбран из H или D, один из R2’, R3’ и R4’ выбран из галогена, циано, гидроксила, , , , , замещенного или незамещенного (C1-C12)алкила, замещенного или незамещенного (C1-C12)алкокси, (C2-C20)гетероциклоалкила или дейтерированного (C2-C20)гетероциклоалкила, другие выбраны из H или D; в вышеупомянутом случае, если R2’, R4’ и R5’ выбраны из H или D, то R3’ выбран из галогена, циано, , , , , замещенного или незамещенного (C1-C12)алкила, замещенного или незамещенного (C1-C12)алкокси, (C2-C20)гетероциклоалкила или дейтерированного (C2-C20)гетероциклоалкила.
В общей формуле (I), в случае если n1 представляет собой 1, R2 представляет собой H или D, X представляет собой NH или ND и R10 представляет собой предпочтительно R1’, R4’ и R5’ представляют собой H, R2’ выбран из галогена или замещенного или незамещенного (C1-C12)алкила; R3’ выбран из галогена, замещенного или незамещенного (C1-C12)алкила или замещенного или незамещенного (C1-C12)алкокси.
В общей формуле (I) предпочтительно, в случае если n1 представляет собой 1, R2 представляет собой галоген и R10 представляет собой скорее , R1’ или R5’, чем галоген. Предпочтительно, общая формула (I) выбрана из группы, состоящей из
Дейтерий (D или 2H) является стабильным нерадиоактивным изотопом водорода, его атомный вес составляет 2,0144. Водород существует в форме изотопной смеси H (водород или протий), D (2H или дейтерий) и T (3H или тритий) в естественных условиях, где распространенность дейтерия составляет 0,0156%. В соответствии с общими техническими знаниями в данной области, из всех соединений, чьи структуры содержат природные атомы водорода, атом водорода фактически представляет собой смесь H, D и T. Таким образом, если соединение содержит дейтерий, распространенность которого превышает его природную распространенность 0,0156% в любом положении, то эти соединения следует считать неприродными или обогащенными дейтерием; таким образом, эти соединения являются новыми по отношению к их необогащенным аналогам.
В настоящем изобретении «обогащенное дейтерием» соединение относится к соединению общей формулы (I), его фармацевтически приемлемой соли, сольвату, полиморфу, стереоизомеру, изотопному соединению, метаболиту или пролекарству, где распространенность дейтерия больше его распространенности в природе в любом соответствующем положении. Таким образом, в «обогащенном дейтерием» соединении распространенность дейтерия в соответствующем положении вероятно составляет от более 0,0156% до 100%. Обогащенное дейтерием положение представлено D, тогда как не обогащенное дейтерием положение представлено H. В соответствии с общими техническими знаниями в данной области, символ H можно не учитывать в необогащенном дейтерием положении. Примером способа получения обогащенного дейтерием соединения является замещение водорода дейтерием или использование обогащенного дейтерием исходного материала для синтеза соединения.
В настоящем изобретении процентное содержание дейтерия в обогащенном дейтерии или распространенность дейтерия относятся к молярной процентной концентрации.
В настоящем изобретении необогащенный дейтерием относится к водороду в естественных условиях, который находится в виде смеси изотопов H (водород или протий), D (2H или дейтерий) и T (3H или тритий).
Настоящее изобретение также предусматривает способ получения производного изоиндолина, представленного общей формулой (I), которое можно синтезировать в соответствии с известными способами с коммерчески доступными материалами, предпочтительно в соответствии со способом A, который включает осуществление реакции удаления защитных групп соединения A-06(1), как представлено ниже, с получением соединения A-06(a1); с последующей реакцией амидирования с участием соединения A-06(a1), как представлено ниже, с получением соединения общей формулы (I):
при этом в ходе осуществления способа A в определениях соединения A-06(1) соединения A-06(a1) или общей формулы (I) L1, L2, X, Z, *, R1-R10 и n1 определены, как описано выше; один из Ra и Rb представляет собой , другой представляет собой , или ; один из Ra1 и Rb1 представляет собой , другой представляет собой ; в определении каждый из Ra’’ и Rb’’ независимо представляет собой H или D.
В общей формуле (I), в случае если n1 представляет собой 0, соединение общей формулы (I) может быть дополнительно получено в соответствии со способом B, который включает осуществление реакции восстановления с участием соединения I-RS, как представлено ниже, с получением соединения общей формулы (I):
при этом в ходе осуществления способа B в определениях соединения I-RS или общей формулы (I) R2 представляет собой галоген, n1 представляет собой 0, X представляет собой NH или ND, R10 представляет собой H или D, L1, Z, R1 и R3 определены, как описано выше;
в случае если n1 представляет собой 1 и X представляет собой NH или ND в общей формуле (I), соединение общей формулы (I) может быть дополнительно получено в соответствии со способом С, который предпочтительно включает осуществление реакции восстановительного аминирования с участием соединения P-01 и , как представлено ниже, с получением соединения общей формулы (I):
в ходе осуществления способа C в определении , соединения P-01 или общей формулы (I) X представляет собой NH или ND, n1 представляет собой 0, каждый из Rp1, Rp2 и Rp3 независимо представляет собой H или D; L1, L2, Z, R1, R2 и R3 определены, как описано выше; в определении R10 представляет собой; R1’, R2’, R3’, R4’ и R5’ определены, как описано выше.
В ходе осуществления способа A, способа B или способа C, стадии и условия реакции удаления защитных групп, реакции амидирования, реакции восстановления или реакции восстановительного аминирования могут представлять собой стандартные стадия и условия для такой реакции в данной области. В случае если атом углерода, помеченный *, содержащийся в Z в соединении A-06(1) или соединении A-06(a1), соединении I-RS, соединении P-01 или общей формуле (I), представляет собой хиральный центр, соединение A-06(1), соединение A-06(a1), соединение I-RS, соединение P-01 или общая формула (I) могут быть выделены соответственно с применением стандартного способа хирального разделения в данной области с получением соединения с (R)-конфигурацией, обогащенного соединения с (R)-конфигурацией, соединения с (S)-конфигурацией или обогащенного соединения с (S)-конфигурацией по отдельности, и затем их соответственно подвергают реакции с получением соединения общей формулы (I).
В ходе осуществления способа A, в случае если n1 представляет собой 0 в общей формуле (I), способ получения соединения общей формулы (I) может дополнительно включать осуществление реакции восстановления с участием соединения A-05(1), как представлено ниже, с получением соединения A-06(1):
где в определениях соединения A-05(1) и A-06(1) L1, L2, R1-R8, Ra и Rb определены, как описано выше; в определении соединения A-06(1) X представляет собой NH или ND, n1 представляет собой 0; R10 представляет собой H или D. Стадии и условия, используемые в реакции восстановления, могут представлять собой стандартные стадии и условия, используемые в такой реакции в данной области.
В ходе осуществления способа A, в случае если X представляет собой NH или ND и n1 представляет собой 1 в общей формуле (I), способ получения соединения общей формулы (I) может дополнительно включать осуществление реакции восстановительного аминирования с участием соединения A-05(2) и , как представлено ниже, с получением соединения A-06(1):
где в определениях соединения A-05(2) и соединения A-06(1) L1, L2, R1-R8, Ra и Rb определены, как описано выше; в определении соединения A-06(1) X представляет собой NH или ND и n1 представляет собой 1; в определении Rp3 представляет собой H или D; R10 представляет собой ; R1’, R2’, R3’, R4’ и R5’ определены, как описано выше. Стадии и условия, используемые в реакции восстановительного аминирования, могут представлять собой стандартные стадии и условия, используемые в такой реакции в данной области.
В ходе осуществления способа A, в случае если X представляет собой O и n1 представляет собой 1 в соединении, имеющем структуру общей формулы (I), способ получения соединения, имеющего структуру общей формулы (I), может дополнительно включать осуществление реакции нуклеофильного замещения с участием соединения A-05(3) и , как представлено ниже, с получением соединения A-06(1):
где в определениях соединения A-05(3) и соединения A-06(1) L1, L2, R1-R8, Ra и Rb определены, как описано выше; в определении соединения A-06(1) X представляет собой O и n1 представляет собой 1; в определении Hal представляет собой галоген (например, F, Cl, Br или I); R10 представляет собой ; в определениях R10 R1’, R2’, R3’, R4’ и R5’ определены, как описано выше. Стадии и условия, используемые в реакции нуклеофильного замещения, могут представлять собой стандартные стадии и условия, используемые в такой реакции в данной области.
Способ получения соединения A-06(1) может дополнительно включать осуществление реакции сочетания с участием соединения Q-03 и соединения A-04(1), с последующим удалением защитных групп, как представлено ниже, с получением соединения A-05(3):
где в определении соединения Q-03 или соединения A-04(1) L1, *, R1-R8 определены, как описано выше, Hal представляет собой галоген (например, Cl, Br или I); один из Ra и Rb представляет собой , другой представляет собой , или ; в определении каждый из Ra’’ и Rb’’ независимо представляет собой H или D.
Способ получения соединения A-05(3) может дополнительно включать защиту коммерчески доступного исходного материала фенола Q-01 с помощью TBDMS с получением Q-02, с последующим осуществлением реакции с галогенированным реагентом (например, NBS) с получением бензилгалогенида Q-03:
где в определении соединения Q-01 R1-R3 и L1 определены, как описано выше.
В ходе осуществления способа B, при получении соединения, имеющего структуру общей формулы (I), соединение I-RS получают в соответствии с общим способом получения такого соединения в данной области, предпочтительно получают в соответствии со способом D или способом E; способ D предпочтительно включает осуществление реакции сочетания с участием соединения A-03 и соединения A-04(2) или их соли, как представлено ниже, с получением соединения I-RS:
где в определении соединения A-03, A-04(2) или I-RS L1, Z, *, R1-R9 определены, как описано выше; в определении соединения A-03 Hal представляет собой галоген (например, Cl, Br или I). Стадии и условия, используемые в реакции сочетания, могут представлять собой стандартные стадии и условия, используемые в такой реакции в данной области.
Способ E предпочтительно включает удаление защитных групп соединения A-05(1), как представлено ниже, с получением соединения A-06(a2), с последующим осуществлением реакции амидирования с участием соединения A-06(a2) с получением соединения I-RS:
где в определении соединения A-05(1), A-06(a2) или I-RS L1, Z, *, R1-R8, Ra и Rb определены, как описано выше; один из Ra2 и Rb2 представляет собой , другой представляет собой ; в определении каждый из Ra’’ и Rb’’ независимо представляет собой H или D. Стадии и условия, используемые в реакции удаления защитных групп и реакции амидирования, могут представлять собой стандартные стадии и условия, используемые в таких реакциях в данной области.
В ходе осуществления способа C способ получения соединения, имеющего структуру общей формулы (I), может дополнительно включать осуществление реакции восстановления с участием соединения I-RS, как представлено ниже, с получением соединения P-01:
В определении соединения I-RS или соединения P-01 R2 представляет собой H, D или галоген; каждый из Rp1 и Rp2 независимо представляет собой H или D; L1, L2, Z, R1 и R3 определены, как описано выше. Стадии и условия, используемые в реакции восстановления, могут представлять собой стандартные стадии и условия, используемые в такой реакции в данной области.
В ходе осуществления способа A способ получения соединения A-06(1) может предпочтительно дополнительно включать осуществление реакции сочетания с участием соединения A-03 и соединения A-04(1), как представлено ниже, с получением соединения A-05(1):
где в определении соединения A03, A-04(1) или A-05(1) L1, *, R1-R8, Ra и Rb определены, как описано выше; Hal представляет собой галоген (например, Cl, Br или I). Стадии и условия, используемые в реакции сочетания, могут представлять собой стандартные стадии и условия, используемые в такой реакции в данной области.
Способ получения производного изоиндолина, имеющего структуру формулы (I), включает стадии, конкретно относящиеся к схеме A и схеме P.
Схема A: сочетание бензилгалогенида A-03 с аминокислотным производным A-04(1) с получением продукта A-05(1), с последующим удалением защитных групп с получением соединения A-05(2), и превращение в амин A-06(1) посредством осуществления реакции восстановительного аминирования с альдегидом . В конечном итоге, осуществляют реакцию удаления защитных групп и реакцию циклизации с получением целевого соединения (I), в частности следующим образом:
На схеме A определение каждой буквы и группы является таким, как описано выше.
Исходный материал A-03 является коммерчески доступным или может быть синтезирован в соответствии с известным способом (см. Söderberg et al. Org. Syn. (2003) 80, 75; US 4678500; US 2012/0053159 и US 2007/0255076).
Аминокислотное производное A-04 является коммерчески доступным или может быть синтезировано в соответствии с известным способом (см. Chen et al. Biotechnol. Lett. (1992) 14, 269; WO 2012/015986; WO 2012/068512; US 2012/0053159; Manesis et al. J.Org.Chem. (1987) 52, 5342; Stogniew et al. J. Labelled Compd. RAD. (1981) 18, 897; Blomquist et al. J. Org. Chem. (1966) 31, 4121), который, в частности, относится к схемам F1, F2 и G.
Схема F1:
F1-01 восстанавливают с помощью Na-Hg в оксиде дейтерия с получением обогащенного дейтерием F1-02. Дикислоту F1-02 дегидрируют с помощью ацетилхлорида с получением ангидрида кислоты F1-03, с последующим осуществлением реакции с обезвоженным этанолом, оксидом серебра и бромом, соответственно с получением соединения брома F1-04. F1-04 обрабатывают реагентом F1-05 (Blomquist et al. J.Org.Chem. (1966) 31, 4121) с получением сложного триэтилового эфира F1-06. F1-06 нагревают в D2O-DCl, образуя таким образом обогащенную дейтерием аминокислоту F1-07, с последующей защитой аминогруппы с помощью аминозащитной группы (например, Boc, Cbz), и ангидрид уксусной кислоты превращают в ангидрид кислоты F1-08 посредством дегидрирования. F1-08 обрабатывают бензиловым спиртом, с последующим осуществлением, соответственно, реакции этилхлорформиата и водного аммиака, и наконец удалением защитных групп с получением целевого соединения F1-11. В определении F1-08, F1-09 и F1-10 W1 представляет собой стандартную аминозащитную группу, известную из уровня техники.
Схема F2:
F2-04 (коммерчески доступный) обрабатывают реагентом F2-05 (Blomquist et al. J. Org. Chem. (1966) 31, 4121) с получением сложного триэтилового эфира F2-06. F2-06 нагревают в D2O-DCl, образуя таким образом обогащенную дейтерием аминокислоту F1-07, с последующей защитой аминогруппы с помощью аминозащитной группы (например, Boc, Cbz), и ангидрид уксусной кислоты превращают в ангидрид кислоты F2-08 посредством дегидрирования. F2-08 обрабатывают бензиловым спиртом, с последующим осуществлением, соответственно, реакции этилхлорформиата и водного аммиака, и наконец удалением защитных групп с получением целевого соединения F2-11. В определении F2-08, F2-09 и F2-10 W1 представляет собой стандартную аминозащитную группу, известную из уровня техники.
Схема G:
На схеме G W представляет собой или , W1 представляет собой стандартную аминозащитную группу, известную из уровня техники, такую как Boc, Cbz и т. д.
Сложный эфир G-01 обрабатывают бензальдегидом в дейтерированной уксусной кислоте с получением обогащенного дейтерием соединения G-02. Аминогруппу в G-02 защищают аминозащитной группой, с последующим осуществлением, соответственно, реакции этилхлорформиата и водного аммиака с получением амида G-04. Аминозащитную группу в G-04 можно удалить в соответствии со стандартным способом удаления защитных групп, известным из уровня техники (например, ацидолиз или восстановление), за счет чего осуществляется превращение в целевое соединение G-05.
Осуществляют реакцию материала A-03 с аминосоединением P-03 с получением соединения P-02, с последующим восстановлением и восстановительным аминированием с альдегидом с получением соединения, имеющего структуру общей формулы (I). Аминосоединение P-03 является коммерчески доступным или может быть синтезировано в соответствии с известным способом (см. WO 2012/015986; WO 2012/068512; Muller et al. Bioorganic & Medicinal Chemistry Letters (1999) 9, 1625).
Схема P:
На схеме P определение каждой буквы и группы является таким, как описано выше.
Условия и стадии, используемые в химических реакциях, задействованных в вышеуказанных путях реакции, могут представлять собой стандартные условия и стадии для таких реакций, известные из уровня техники, и соединения, полученные в вышеуказанных способах, могут быть дополнительно модифицированы в периферийных положениях с получением других целевых соединений по настоящему изобретению.
Настоящее изобретение также предусматривает промежуточное соединение A-06(1), A-06(a1), I-RS или P-01 для получения производного изоиндолина, имеющего структуру общей формулы (I):
в определении соединения A-06(1), A-06(a1), I-RS или P-01 L1, L2, n1, Z, *, R1-R10, Ra, Rb, Ra1, Rb1, Rp1 и Rp2 определены, как описано выше; в определении соединения A-06(1) один из Ra и Rb представляет собой , другой представляет собой , или ; в определении соединения A-06(a1) один из Ra1 и Rb1 представляет собой , другой представляет собой ; в определении каждый из Ra’’ и Rb’’ независимо представляет собой H или D; в определении соединения P-01 каждый из Rp1 и Rp2 независимо представляет собой H или D.
Настоящее изобретение также предусматривает фармацевтическую композицию, при этом фармацевтическая композиция содержит терапевтически эффективное и/или профилактически эффективное количество вещества, выбранного из группы, состоящей из из производных изоиндолина, имеющих структуру общей формулы (I), фармацевтически приемлемой соли, сольвата, полиморфа, стереоизомера, изотопного соединения, метаболита и пролекарства.
В соответствии с вариантом осуществления настоящего изобретения фармацевтическая композиция может быть составлена для любой формы введения, в том числе инъекции (внутривенной), введения через слизистую оболочку, перорального введения (твердого и жидкого препарата), ингаляции, глазного введения, ректального введения, местного или парентерального (инфузии, инъекции, имплантации, подкожного, внутривенного, артериального, внутримышечного) введения. Фармацевтическая композиция по настоящему изобретению может также представлять собой лекарственные формы с контролируемым высвобождением или отсроченным высвобождением. Примеры твердого препарата для перорального введения включают без ограничения порошок, капсулу, каплет, мягкую капсулу или таблетку. Примеры жидкого препарата, вводимого посредством перорального введения или через слизистую оболочку, включают без ограничения суспензию, эмульсию, настойку и раствор. Примеры препарата для местного введения включают без ограничения препарат в виде эмульсии, геля, мази, крема, пластыря, пасты, пены, лосьона, капель или сыворотки. Примеры препарата для парентерального введения включают без ограничения раствор для инъекции, сухой препарат, который может быть растворенным или суспендированным в фармацевтически приемлемом носителе, инъекционную суспензию и инъекционную эмульсию. Примеры других пригодных препаратов соединения, имеющего структуру общей формулы (I), его фармацевтически приемлемой соли, сольвата, полиморфа, стереоизомера, изотопного соединения, метаболита или пролекарства включают без ограничения глазные капли и другие офтальмологические препараты; аэрозоли, такие как назальный спрей или ингаляция; жидкие лекарственные формы, подходящие для парентерального введения, суппозиторий и пастилку.
Фармацевтическая композиция по настоящему изобретению может дополнительно содержать фармацевтически приемлемый наполнитель, такой как наполнители, широко используемые в области изготовления лекарственных средств. Наполнители в основном используют для обеспечения безопасной, стабильной и функционализированной фармацевтической композиции, и могут также обеспечивать способ, который делает активный ингредиент растворимым с требуемой скоростью или способствует эффективному поглощению активных ингредиентов после введения субъекту. Наполнители могут представлять собой инертный наполнитель или обеспечивать некоторые функции, такие как стабилизация общего значения рН композиции или предотвращение деградации активных ингредиентов композиции.
В соответствии с вариантом осуществления настоящего изобретения фармацевтически приемлемый наполнитель может дополнительно содержать связующее вещество, суспендирующее средство, эмульгатор, разбавитель, наполнитель, гранулирующее средство, адгезивное средство, разрыхлитель, смазывающее средство, антиадгезивное средство, вещество, способствующее скольжению, смачивающее средство, желатинизирующее средство, замедлитель всасывания, ингибитор растворения или упрочняющее средство, адсорбирующее средство, буфер, комплексообразующее средство, консервант, краситель, ароматизатор и подсластитель. Фармацевтически приемлемый носитель может находится во многих формах, в соответствии с необходимым препаратом. Например, для жидкого препарата для перорального введения подходящие носители и добавки включают воду, гликоли, масла, спирты, ароматизаторы, консерванты, красители и т. д. В качестве другого иллюстративного примера для твердого препарата для перорального введения подходящие носители и добавки включают крахмал, сахар, разбавитель, гранулирующее средство, смазывающее средство, адгезивное средство, разрыхлитель и т. д. Как правило, фармацевтически приемлемые носители или наполнители должны быть нетоксичными. Фармацевтическая композиция по настоящему изобретению может содержать один или более одного подходящего(-их) носителя(-ей)/наполнителя(-ей). Количество и тип наполнителя варьируется в зависимости требований. На основе раскрытого в данном документе содержания специалист в данной области техники может легко определить подходящий(-ие) носитель(-и)/наполнитель(-и), подлежащие добавлению в фармацевтическую композицию по настоящему изобретению.
Фармацевтическую композицию по настоящему изобретению, которая содержит терапевтически эффективное или профилактически эффективное количество вещества, выбранного из группы, состоящей из соединений, имеющих структуру общей формулы (I), их фармацевтически приемлемой соли, сольвата, полиморфа, стереоизомера, изотопного соединения, метаболита и пролекарства, можно получить исходя из раскрытого в данном документе содержания, в соответствии с любыми способами, известными специалисту в данной области техники. Например, фармацевтическую композицию можно получить посредством смешивания соединения, имеющего структуру общей формулы (I), его фармацевтически приемлемой соли, сольвата, полиморфа, стереоизомера, изотопного соединения, метаболита или пролекарства с фармацевтически приемлемым носителем, исходя из общепринятой медицинской фармацевтической технологии. Технология включает без ограничения стандартное смешивание, растворение, гранулирование, эмульгирование, растирание в порошок, обертывание, заключение или способ сушки сублимацией.
В соответствии с вариантом осуществления настоящего изобретения, в дополнение к веществу, выбранному из группы, состоящей из соединения, имеющего структуру общей формулы (I), их фармацевтически приемлемой соли, сольвата, полиморфа, стереоизомера, изотопного соединения, метаболита и пролекарства, фармацевтическая композиция может дополнительно включать один или более одного других терапевтических средств. Другие терапевтические средства, которые могут быть включены в фармацевтическую композицию по настоящему изобретению, раскрыты ниже. Количество и тип других терапевтических средств зависят от заболевания, симптома или нарушения, подлежащих лечению или предупреждению, тяжести заболевания, симптома или нарушения, факторов субъекта, подлежащего введению, таких как возраст, вес, физическое состояние и т. д, пути введения и т. д.
В некоторых вариантах осуществления настоящее изобретение относится к препарату с контролируемым высвобождением соединения, имеющему структуру общей формулы (I), его фармацевтически приемлемой соли, сольвату, полиморфу, стереоизомеру, изотопному соединению, метаболиту или пролекарству. Используемый в данном документе «препарат с контролируемым высвобождением» относится к препарату, где терапевтически активный ингредиент композиции характеризуется скоростью контролируемого высвобождения или определенного отстроченного высвобождения для контроля участка высвобождения терапевтически активного ингредиента у субъекта, подлежащего введению. Один препарат с контролируемым высвобождением может включать средство с контролируемым высвобождением, такое как средство с замедленным высвобождением (замедленное высвобождение или отстроченное высвобождение) и средство с отсроченным высвобождением (отсроченное высвобождение).
Используемый в данном документе термин «замедленное высвобождение» и «отсроченное высвобождение» относится к продлению высвобождения терапевтически активного ингредиента из фармацевтической композиции. Используемый в данном документе термин «отсроченное высвобождение» относится к терапевтически активному ингредиенту, высвобождаемому из фармацевтической композиции в определенном участке или в требуемой среде после того, как композиция, действию которой подвергают субъекта, достигает необходимой среды или проходит определенный период времени.
Используемые в данном документе термины «средство с замедленным высвобождением» и «средство с отсроченным высвобождением» относятся к соединению или добавке, которые контролируют высвобождение терапевтически активного ингредиента из композиции, с тем чтобы сделать высвобождение постепенным и продлить время высвобождения. Средство с замедленным или отсроченным высвобождением может обеспечить высвобождение терапевтически активного ингредиента в течение особо длительного периода времени после того, как субъект был подвергнут действию композиции.
В соответствии с вариантом осуществления настоящего изобретения контролируемое высвобождение соединения, имеющего структуру общей формулы (I), его фармацевтически приемлемой соли, сольвата, кристаллической формы, стереоизомера, изотопного соединения, метаболита или пролекарства из композиции по настоящему изобретению, может быть достигнуто с помощью множества условий, при этом такие условия включают без ограничения значение pH, температуру, фермент, воду или другое физиологическое условие или соединение. Например, соединение по настоящему изобретению может дополнительно включать энтеросолюбильное покрытие, при этом энтеросолюбильное покрытие контролирует высвобождение соединения, имеющего структуру общей формулы (I), его фармацевтически приемлемой соли, сольвата, полиморфа, стереоизомера, изотопного соединения, метаболита или пролекарства, и обеспечивает их постепенное и непрерывное высвобождение из композиции в течение требуемого периода времени. Это обеспечивает соединению терапевтический или профилактический эффект в течение длительного периода времени.
В соответствии с вариантом осуществления настоящего изобретения фармацевтическая композиция с контролируемым высвобождением может дополнительно включать одно или более одного других терапевтических средств, раскрытых ниже.
Специалист в данной области техники может быть знаком с подходящими препаратами с контролируемым высвобождением, средствами с замедленным и отсроченным высвобождением на основе раскрытого в данном документе содержания. Неограничивающие примеры средств с контролируемым высвобождением, которые могут быть введены в фармацевтическую композицию по настоящему изобретению с целью обеспечения композиции с контролируемым высвобождением, включают полимеры, такие как гидроксипропил метил целлюлоза, гель, проницаемая оболочка, частица, липосома, микрогранула и их комбинации. Любая композиции, описанная в данном документе, может быть пригодна для препарата с контролируемым высвобождением, такого как таблетки, капсулы, мягкие капсулы и каплеты.
В соответствии с вариантом осуществления настоящего изобретения терапевтическое или профилактическое количество соединения, имеющего структуру общей формулы (I), его фармацевтически приемлемую соль, сольват, полиморф, стереоизомер, изотопное соединение, метаболит или пролекарство, его любую фармацевтическую композицию и препарат, и т. д., можно вводить субъекту в течение периода времени (медикаментозный цикл доставки) в соответствии с раскрытым в настоящем изобретении способом, с последующим периодом без применения соединения (немедикаментозный цикл доставки). Медикаментозный цикл доставки и немедикаментозный цикл доставки можно повторять в течение требуемых промежутков времени. Требуемая продолжительность и время медикаментозного цикла доставки и немедикаментозного цикла доставки зависят от типа и/или тяжести заболевания, симптома или нарушения, подлежащих лечению или предупреждению, а также пола, возраста, веса субъекта и других параметров (например, биологическое, физическое и физиологическое состояния субъекта и т. д.). Специалист в данной области техники, на основе раскрытого в данном документе содержания, может в достаточной мере определить подходящую продолжительность и время медикаментозного цикла доставки и немедикаментозного цикла доставки.
Соединение, имеющее структуру общей формулы (I), его фармацевтически приемлемая соль, сольват, полиморф, стереоизомер, изотопное соединение, метаболит или пролекарство можно использовать для нескольких целей, в том числе без ограничения использовать для изготовления лекарственного препарата для лечения или предупреждения заболевания, симптома или нарушения, обусловленных TNF-α или связанных с нарушенной регуляцией активности TNF-α.
Таким образом, в одном основном аспекте настоящее изобретение относится к применению терапевтически или профилактически эффективного количества производного изоиндолина, имеющего структуру общей формулы (I), его фармацевтически приемлемой соли, сольвата, полиморфа, стереоизомера, изотопного соединения, метаболита или пролекарства в изготовлении лекарственного препарата для лечения или предупреждения заболевания, симптома или нарушения. В другом аспекте настоящее изобретение относится к способу лечения или предупреждения заболевания, симптома или нарушения, обусловленных TNF-α или связанных с нарушенной регуляцией активности TNF-α, при этом способ включает введение субъекту терапевтически или профилактически эффективного количества вещества, выбранного из соединения, имеющего структуру общей формулы (I), его фармацевтически приемлемой соли, сольвата, полиморфа, стереоизомера, изотопного соединения, метаболита и пролекарства. В соответствии с данным способом примеры заболевания, симптома или нарушения, подлежащих лечению или предупреждению, включают без ограничения формы рака, в том числе солидные опухоли, нарушения, связанные с TNF-α, заболевания и нарушения, связанные с нежелательным ангиогенезом, боли, синдром макулярной дегенерации (MD), заболевания кожи, кератоз, заболевание дыхательной системы (такое как легочные заболевания), иммунодефицитные заболевания, заболевания центральной нервной системы (CNS), аутоиммунные заболевания, атеросклероз, наследственность, аллергию, вирусы, нарушения сна и связанный с ними синдром, воспалительные заболевания, заболевания, связанные с PDE-4 или заболевания, связанные с IL-2. Широко известные примеры заболеваний, симптомов или нарушений в данной области включают без ограничения описанные в патентных публикациях согласно РСТ WO 2012/015986 и WO 2006/018182, а также патентных публикациях США US 2010/0204227, некоторое содержание которых включено в настоящий документ посредством ссылки во всей их полноте.
В одном варианте осуществления заболевание, симптом или нарушение выбраны из неопластических или раковых заболеваний; аутоиммунных заболеваний, таких как заболевание Аддисона, анкилозирующий спондилит, синдром антифосфолипидных антител, атопический дерматит, аутоиммунная круговая алопеция, аутоиммунная гемолитическая анемия, аутоиммунный гепатит, аутоиммунное заболевание внутреннего уха, аутоиммунный лимфопролиферативный синдром (Alps), заболевание Бехчета, буллезный пемфигоид, кардиомиопатия, целиакия, синдром хронической усталости и иммунодефицита (CFIDS), хроническая воспалительная демиелинизирующая полинейропатия, рубцующийся пемфигоид, заболевание холодовых агглютининов, синдром CREST, заболевание Крона, заболевание Дего, дерматомиозит, юношеский дерматомиозит, дискоидная красная волчанка, экзема, первичная криоглобулинемия смешанного типа, фибромиалгия-фибромиозит, базедова болезнь, синдром Гийена-Барре, тиреоидит Хашимото, гнойный гидраденит, идиопатический легочный фиброз, идиопатическая тромбоцитопеническая пурпура (ITP), Ig A-нефропатия, инсулинозависимый сахарный диабет (I типа), юношеский артрит, эритематозная волчанка, заболевание Меньера, смешанное заболевание соединительной ткани, множественный склероз, миастения гравис, вульгарный пемфигус, пернициозная анемия, узелковый полиартериит, полихондрия, полигландулярный синдром, ревматическая полимиалгия, полимиозит и дерматомиозит, первичная агаммаглобулинемия, первичный биллиарный цирроз, псориаз, феномен Рейно, синдром Рейтера, ревматическая лихорадка, ревматоидный артрит, саркоидоз, склеродермия, синдром Шегрена, системная эритематозная волчанка, синдром мышечной скованности, артериит Такаясу, темпоральный артериит/гигантоклеточный артериит, ульцеративный колит, увеит, васкулит, витилиго, гранулематоз Вегенера и аутоиммунное заболевание Вильсона; легочного заболевания, такого как астма, хроническое обструктивное заболевание легких; заболевания нервной системы, такого как болезнь Альцгеймера, болезнь Паркинсона, депрессия, эпилепсия и биполярное расстройство; заболевания сердечно-сосудистой системы, такого как атеросклероз, инфаркт миокарда, остеопороз; метаболического заболевания, такого как ожирение, диабет II типа; респираторного дистресс-синдрома взрослых; заболевания резорбции кости, такого как артрит; гиперкальцемии; реакции трансплантат против хозяина; церебральной малярии; воспалительного заболевания, такого как акне, артрит, астма, атеросклероз, целиакия, хронический простатит, колит, заболевание Крона, дерматит, дивертикулит, гломерулярный нефрит, гепатит, гиперчувствительность, воспалительные заболевания кишечника, интерстициальный цистит, синдром раздраженного кишечника (IBS), эритематозная волчанка, нефрит, воспалительное заболевание органов таза, реперфузионное повреждение, ревматоидный артрит, саркоидоз, отторжение ткани, ульцеративный колит, васкулит, хроническое воспалительное заболевание легких, инсульт, циркуляторный шок; HIV-инфекции, AIDS и AIDS-оппортунистической инфекции; других заболеваний, таких как ревматоидный спондилит, остеоартрит и прочее нарушение, относящееся к артриту, септический шок, сепсис, эндотоксический шок, заболевание трансплантат против хозяина, истощение, заболевание Крона, ульцеративный колит, лепрозная узелковая эритема, нарушения, связанные с cAMP, такие как септический шок, сепсис, эндотоксический шок, гемодинамический шок и септический синдром, ишемически-реперфузионное повреждение, малярия, микобактериальная инфекция, менингит, застойная сердечная недостаточность, фиброзное заболевание, кахексия, отторжение трансплантата, радиационное поражение, гипероксическое альвеолярное повреждение; вирусной инфекции, такой как инфекции, вызванные вирусом герпеса; вирусного конъюнктивита или атопического дерматита.
Примеры неопластических или раковых заболеваний включают без ограничения острый лимфобластный лейкоз, острый миелоидный лейкоз, острый миелогенный лейкоз, кариотипный острый миелоидный лейкоз, хронический лимфоцитарный лейкоз, хронический миелоидный лейкоз, хронический гранулоцитный лейкоз, лейкоз ворсистых клеток, миелоидный лейкоз, адренокортикальную карциному, лимфому Беркитта, связанную с AIDS лимфому, Т-клеточную лимфому кожи, B-клеточную лимфому кожи, диффузную В-крупноклеточную лимфому, низкодифференцированную фолликулярную лимфому, лимфому Ходжкина, неходжкинскую лимфому, множественную миелому, вялотекущую миелому, миелодиспластический синдром, лимфому из клеток мантийной зоны, невыраженную миелому, хроническое миелопролиферативное заболевание, лимфому центральной нервной системы (CNS), рак анального канала, астроцитому, атипичную патологическую/рабдоидную опухоль, базальноклеточную карциному, холангиокарциному, рак мочевого пузыря, остеому, остеоидную остеому, остеохондрому, остеобластому, остеосаркому, энхондрому, аневризматическую кисту кости, фиброзную дисплазию костей, хондросаркому, саркому Юинга, фибросаркому, плеоморфную недифференцированную саркому, опухоль головного мозга, глиому ствола головного мозга, медуллобластому, медуллярную эпителиальную опухоль, опухоль шишковидной клетки, рак молочной железы, бронхиальную опухоль, карциноидную опухоль, рак шейки матки, хордому, рак толстой кишки, колоректальный рак, краниофарингиому, эмбриональную карциному, эпендимобластому, эпендимому, рак пищевода, ольфакторную нейробластому, экстракраниальную эмбрионально-клеточную опухоль, гонадную эмбрионально-клеточную опухоль, холангиокарциному, внутриглазную меланому, ретинобластому, карциному желчного пузыря, рак желудка, гастроинтестинальную стромальную опухоль, гестационную трофобластическую опухоль, глиому, рак головы и шеи, рак печени, гипофарингеальную карциному, внутриглазную меланому, опухоль островков поджелудочной железы, саркому Капоши, почечно-клеточную карциному, лангергансоклеточный гистиоцитоз, рак гортани, рак губы и ротовой полости, рак легкого, карциному из клеток Меркеля, мезотелиому, синдром множественной эндокринной неоплазии, фунгоидный микоз, рак носа и синуса, назофарингеальную карциному, нейробластому, рак ротовой полости, рак ротоглотки, карциному яичника, эпителиальную карциному яичников, эмбрионально-клеточную опухоль яичников, злокачественную опухоль яичника с низким потенциалом, рак поджелудочной железы, опухоль островков поджелудочной железы, карциному поджелудочной железы, папиллому, параганглиому, карциному паращитовидной железы, рак полового члена, фарингеальную карциному, феохромоцитому, плазмоцитому, плевролегочную бластому, гормонорезистентный рак предстательной железы, андрогеннезависимый рак предстательной железы, андрогензависимый неметастатический рак предстательной железы IV фазы, нечувствительный к гормону рак предстательной железы, нечувствительный к химиотерапии рак предстательной железы, рак прямой кишки, глиобластому сетчатки глаза, рабдомиосаркому, рак слюной железы, саркому мягких тканей, саркому матки, рак кожи (меланому), плоскоклеточную карциному, рак кожи из клеток Меркеля, рак тонкого кишечника, плоскоклеточный рак шейки матки, рак яичек, рак горла, тимому и тимусную карциному, рак щитовидной железы, рак мочевыводящих путей, карциному эндометрия, саркому матки, рак влагалища, рак женских наружных половых органов, астроцитому, гепатоцеллюлярную карциному, макроглобулинемию Вальденстрема, нефробластому.
В предпочтительном варианте осуществления заболевание, симптом или нарушение выбраны из миелодиспластического синдрома, множественной миеломы, лимфомы из клеток мантийной зоны, диффузной В-крупноклеточной лимфомы, лимфомы центральной нервной системы, неходжкинской лимфомы; папиллярной и фолликулярной тиреоидной карциномы; рака молочной железы, рака предстательной железы, хронического лимфоцитарного лейкоза, амилоидоза, комплексного регионарного болевого синдрома I типа, злокачественной меланомы, радикулопатии, миелофиброза, глиобластомы, саркоматозной глиомы, злокачественной глиомы, рефракторной плазмоцитомы, хронического миеломоноцитарного лейкоза, фолликулярной лимфомы, цилиарной и хронической меланомы, меланомы радужной оболочки, рецидивирующей меланомы глаза, экстраокулярной распространяющейся меланомы, солидной опухоли, T-клеточной лимфомы, эритроидной лимфомы, монобластного и моноцитарного лейкоза; миелоидного лейкоза, опухолей головного мозга, менингиом, опухолей спинного мозга, рака щитовидной железы, немелкоклеточного рака легкого, карциномы яичника, почечно-клеточной карциномы, миелофиброза, лимфомы Беркитта, лимфомы Ходжкина, крупноклеточной лимфомы, астроцитомы, гепатоцеллюлярной карциномы, первичной макроглобулинемии (макроглобулинемии Вальденстрема). В одном варианте осуществления рак является метастатическим. В другом варианте осуществления рак является рефракторным или лечение его посредством химиотерапии или лучевой терапии является неэффективным.
Способ лечения в настоящем изобретении включает введение фармацевтической композиции субъекту с помощью любых подходящих способов, таких как инъекция, введение через слизистую оболочку, пероральное введение, ингаляция, глазное, ректальное введение, имплантат длительного действия, липосома, эмульсия или способ замедленного высвобождения.
Специалист в данной области техники понимает, что терапевтически эффективное или профилактически эффективное количество соединения, используемое в настоящем изобретении, может варьировать в зависимости от факторов для определенного субъекта, таких как возраст, рацион, состояние здоровья и т. д., тяжести, сложности и типа симптома, заболевания или нарушения, подлежащих лечению или предупреждению, а также используемого препарата и т.д. В соответствии с раскрытиями в настоящем изобретении специалист в данной области техники может легко определить необходимое терапевтически эффективное или профилактически эффективное количество соединения, вводимого субъекту, для того, чтобы вызвать требуемый биологическую или медицинскую ответную реакцию у субъекта.
В соответствии с вариантом осуществления настоящего изобретения соединение, имеющее структуру общей формулы (I), его фармацевтически приемлемая соль, сольват, полиморф, стереоизомер, изотопное соединение, метаболит или пролекарство можно использовать для регуляции активности или образования TNF-α или IL-2. В одном варианте осуществления, в случае если термин «регулировать» используется для описания активности или образования определенной молекулы, он относится к ингибированию активности или образования молекулы. Однако в другом варианте осуществления, в случае если термин «регулировать» используется для описания активности или образования определенной молекулы, он относится к снижению или повышению активности или образования молекулы.
Таким образом, настоящее изобретение также предусматривает способ регулирования образования или активности TNF-α или IL-2. В соответствии с вариантом осуществления настоящего изобретения соединение, имеющее структуру общей формулы (I), его фармацевтически приемлемую соль, сольват, полиморф, стереоизомер, изотопное соединение, метаболит или пролекарство, или его композицию, можно вводить субъекту для регулирования образования и активности TNF-α или IL-2, что можно дополнительно использовать для лечения или предупреждения заболевания, симптома или нарушения, связанных с нарушенной регуляцией TNF-α или IL-2, или характеризующихся нарушенной регуляцией TNF- или IL-2.
В предпочтительном варианте осуществления соединение, имеющее структуру общей формулы (I), его фармацевтически приемлемую соль, сольват, полиморф, стереоизомер, изотопное соединение, метаболит или пролекарство, или его композицию, вводят субъекту для регулирования образования и активности TNF-α или IL-2 с целью лечения или предупреждения рака или воспаления.
В любых способах, описанных в настоящем изобретении, соединение, имеющее структуру общей формулы (I), его фармацевтически приемлемую соль, сольват, полиморф, стереоизомер, изотопное соединение, метаболит или пролекарство можно использовать отдельно или в комбинации с лучевой терапией или радиоиммунотерапией и т. д., и дополнительно можно использовать в комбинации с одним или более чем одним терапевтическим(-ми) средством(-ами), которые(-ое) обладает(-ют) фармацевтической активностью (далее в данном документе называются «другим(-и) терапевтическим(-и) средством(-ами)»).
В соответствии с вариантом осуществления настоящего изобретения соединение, имеющее структуру общей формулы (I), его фармацевтически приемлемая соль, сольват, полиморф, стереоизомер, изотопное соединение, метаболит или пролекарство, используемые в комбинации с другим(-и) терапевтическим(-и) средством(-ами), может(могут) обладать синергическими эффектами, в случае если любые заболевания, симптомы или нарушения обрабатывают или предупреждают в соответствии с содержанием, раскрытым в данном документе.
В соответствии с вариантом осуществления настоящего изобретения другое(-ие) терапевтическое(-ие) средство(-а) может(могут) представлять собой природное, полусинтетическое или синтетическое соединение. В другом варианте осуществления другое(-ие) терапевтическое(-ие) средство(-а) может(могут) представлять собой небольшую молекулу, такую как синтетическая органическая или неорганическая молекула, или большая молекула или биомолекула, такая как белки или нуклеиновые кислоты с фармакологической активностью. В другом варианте осуществления другое(-ие) терапевтическое(-ие) средство(-а) может(могут) представлять собой анти-ангиогенное, иммунорегулирующее, иммунотерапевтическое, химиотерапевтическое или гормональное соединение.
Примеры другого(-их) терапевтического(-их) средства(-ств), подходящего(-их) для настоящего изобретения, включают без ограничения моноклональное и поликлональное антитело, такое как обинутузумаб (Gazyva®), ниволумаб (Opdivo®), пембролизумаб (Keytruda®), элотузумаб, атитело к Her2/neu (например, трастузумаб (торговое название Herceptin®) и пертузумаб (торговое название Omnitarg™); абциксимаб (торговое название ReoPro®), ритуксимаб (торговое название Mabthera®), базиликсимаб (торговое название Simulect®), паливизумаб (торговое название Synagis®), инфликсимаб (торговое название Remicade®), трастузумаб (торговое название Herceptin®), алемтузумаб (торговое название Campath®), ибритумомаб тиуксетан (торговое название Zevalin®), адалимумаб (торговое название Humira®), омализумаб (торговое название Xolair®), тозитумомаб-I-131 (торговое название Bexxar®), цетуксимаб (торговое название Erbitux®), натализумаб (торговое название Tysabri®), тоцилизумаб (торговое название Actemra®), панитумумаб (торговое название Vectibix®), ранибизумаб (торговое название Lucentis®), экулизумаб (торговое название Soliris®), цертолизумаб пегол (торговое название Cimzia®), голимумаб (торговое название Simponi®), канакинумаб (торговое название Ilaris®), устекинумаб (торговое название Stelara®), офатумумаб (торговое название Arzerra®), деносумаб (торговое название Prolia®), мотавизумаб (торговое название Numax®), эдреколомаб (торговое название Panorex®), раксибакумаб (торговое название ABThrax®), белимумаб (торговое название Benlysta®), ипилимумаб (торговое название Yervoy®), брентуксимаб ведотин (торговое название Adcetris®), пертузумаб (торговое название Perjeta® или Omnitar™), адо-трастузумаб эмтанзин (торговое название Adcyla®), моноклональное антитело к CD40, антитело к TNF-α и антитело VEGFR (например, бевацизумаб (торговое название Avastin™); ингибитор Akt; ингибитор ALK; ингибитор AMPK; антисмысловой олигонуклеотид; алкилирующее химиотерапевтическое средство, такое как азотистые иприты (например, циклофосфамид), мехлорэтамин, HN2 (торговое название Mustardgen), урамустин, урациловый иприт, мелфалан, хлорамбуцил, ифосфамид и бендамустин; нитрозомочевину (например, кармустин), ломустин и стрептозоцин; алкилсульфонат (например, бусульфан); а также азиридины, такие как тиотепа; химиотерапевтическое средство на основе платины (например, цисплатин, карбоплатин, недаплатин, оксалиплатин, сатраплатин и триплатина тетранитрат, прокарбазин, алтретамин, дакарбазин, митозоломид и темозоломид; ингибитор APC; ген-регулятор апоптоза; регулятор апоптоза; ингибитор ATM/ATR; ингибитор киназы аврора; ингибитор Axl; ингибитор Bcl-2; антагонист BCR/ABL; ингибитор bFGF; ингибитор BTK; ингибитор казеинкиназы (ICOS); ингибитор цистеиновой протеиназы; CAR-T; ингибитор CDK, такой как палбоциклиб; ингибитор ChK; ингибитор c-Kit; ингибитор c-Met; ингибитор EGFR; ингибитор c-Myc; ингибитор C-RET; ингибитор CSF-1R; цитокин; ингибитор DNA-PK; ингибитор динеина; ингибитор рецептора EGF; ингибитор EGFR; ингибитор EGFR/ERBB; ингибитор белкового рецептора печени; ингибитор ERK; агонист эстрогена; антагонист эстрогена; ингибитор FAK; ингибитор FGFR; ингибитор FLT3; антагонист рецептора GF; ингибитор глутатиона; ингибитор GSK-3; ингибитор белка теплового шока-90 (например, 17-AAG); гемопоэтический фактор роста; ингибитор HDAC; ингибитор андрогеновых рецепторов, ингибитор биосинтеза андрогенов; ингибитор HER2; ингибитор HIF; ингибитор гистондеацетилазы (например, SAHA и LAQ 824); ингибитор HSP; ингибитор IAP; ингибитор IGF-1R; ингибитор киназы IkB; ингибитор рецептора инсулиноподобного фактора роста-1; ингибитор интегрина; агонист интерферона; интерферон; интерлейкин; ингибитор JAK; ингибитор JNK; ингибирующий фактор лейкемии; лейкоцитарный интерферон-α; ингибитор лизофосфатидной ацилтрансферазы; ингибитор матрилизина; ингибитор матричной металлопротеиназы; ингибитор Mdm; ингибитор MEK; ингибитор MIF; ингибитор mTOR; олигонуклеотид; ингибитор P13K (например, вортманнин); ингибитор p38 MAPK; ингибитор p53; ингибитор PAK; ингибитор PARP; ингибитор PDGFR; ингибитор PDK-1; ингибитор PD-1; ингибитор PD-L1; ингибитор фосфатазы; ингибитор Pim; ингибитор PKC; ингибитор PLK; иммуномодулирующее средство на основе белка A; ингибитор протеинкиназы C; ингибитор протеинтирозинфосфатазы; ингибитор пурин-нуклеозидфосфорилазы; ингибитор RacGTP-азы; ингибитор Raf; ингибитор фарнезил-протеинтрансферазы Ras; ингибитор Ras; ингибитор Ras-GAP; ингибитор ROCK; ингибитор киназы S6; ингибитор сигнальной трансдукции; ингибитор дезацетилазы; ингибитор Src; ингибитор STAT; ингибитор сурвивина; ингибитор Syk; ингибитор теломеразы; ингибитор TNF-α; ингибитор топоизомеразы; ингибитор Trk; ингибитор тирозинкиназы; антагонист рецептора урокиназы; ингибитор рецепторной киназы фактора роста эндотелия сосудов (например, PTK787); ингибитор VDA; ингибитор VEGFR (например, специфический ингибитор киназы flk-1, SU5416 и ptk787/zk222584); ингибитор Wee1 и ингибитор сигнального пути Wnt.
Другое(-ие) терапевтическое(-ие) средство(-а), подходящее(-ие) для настоящего изобретения, включает(-ют) без ограничения ацивицин; акларубицин; акодазола гидрохлорид; акронин; ацилфулвен; адеципенол; адозелезин; альдеслейкин; алтретамин; амбамустин; амбомицин; аметантрона ацетат; амидокс; амифостин; аминолевулиновую кислоту; амрубицин; амсакрин; анагрелид; анастрозол; андрографолид; антареликс; антрамицин; анти-дорсализующий морфогенетический белок-1; антинеопластон; афидиколина глицинат; апуриновую кислоту; ара-CDP-DL-PTBA; аспарагиназу; асперлин; асулакрин; атаместан; атримустин; аксинастатин-1; аксинастатин-2; аксинастатин-3; азацитидин; азасетрон; азатоксин; азатирозин; азетепу; азотомицин; баланол; батимастат; бензохлоринс; бензодепу; бензоилстауроспорин; производные бета-лактама; β-алетин; бетакламицин B; бетулиновую кислоту; бикалутамид; бисантрена гидрохлорид; бисазиридинилспермин; биснафид димесилат; бистратен A; бизелезин; блеомицина сульфат; бортезомиб (гемцитабин); бреквинар натрия; бретлат; бропиримин; будотитан; бусульфан; бутионина сульфоксимин; кактиномицин; кальципотриол; кальфостин C; калустерон; производные камптотецина; капецитабин; карацемид; карбитимер; карбоплатин; карбоксамидаминотриазол; карбоксиамидотриазол; кармустин; карубицина гидрохлорид; карзелезин; кастаноспермин; цекропин B; цедефингол; целекоксиб; цетрореликс; хлорамбуцил; хлорины; хлорхиноксалина сульфонамид; цикапрост; циролемицин; цисплатин; цис-порфирин; кладрибин; аналоги кломифена; клотримазол; коллизмицин A; коллизмицин B; комбретастатин A4; производные комбретастатина; конагенин; крамбесцидин-816; криснатол мезилат; криснатол; криптофицин-8; аналоги криптофицина A; курацин A; циклопентантрахиноны; циклофосфамид; циклоплатам; циклоспорин; ципемицин; цитарабина октофосфат; цитарабин; цитостатин; дакарбазин; дакликсимаб; дактиномицин; даунорубицина гидрохлорид; децитабин; дегидродидемнин B; деслорелин; дексаметазон; дексифосфамид; ормаплатин; декс(ормаплатин); дексразоксан; дексверапамил; дезагуанина мезилат; дезагуанин; диазиквон; дидемнин B; дидокс; диэтилнорспермин; дигидро-5-азацитидин; дигидротаксол-9; диоксамицин; дифенилспиромустин; доцетаксел; докозанол; доласетрон; доксифлуридин; доксорубицина гидрохлорид; доксорубицин; доксициклин; дролоксифена цитрат; дролоксифен; дромостанолона пропионат; дронабинол; дуазомицин; дуокармицин SA; эбселен; экомустин; эдатрексат; эделфосин; эдреколомаб; эфлорнитина гидрохлорид; эфлорнитин; элемен; элотузумаб; элсамитруцин; эмитефур; энлоплатин; энпромат; эпипропидин; эпирубицина гидрохлорид; эпирубицин; эпристерид; эрбитукс; эрбулозол; эзорубицина гидрохлорид; производные эстрамустина; этрамустина натрия фосфат; этрамустин; этанерцепт; этанидазол; этопозида фосфат; этопозид; этоприн; экземестан; фадрозола гидрохлорид; фадрозол; фазарабин; фенретинид; филграстим; финастерид; флавопиридол; флезеластин; флоксуридин; флуастерон; флударабина фосфат; флударабин; флуроцитабин; фтордаунорубицина гидрохлорид; фторурацил; форфенимекс; форместан; фосквидон; фостриецин натрия; фостриецин; фотемустин; гадолиния тексафирин; галлия нитрат; галоцитабин; ганиреликс; гемцитабина гидрохлорид; гемцитабин; гепсульфам; херегулин; гексаметилена бисацетамид; гидроксимочевину; гиперицин; ибандроновую кислоту; ибрутиниб; идарубицина гидрохлорид; идарубицин; идоксифен; идрамантон; ифосфамид; илмофосин; иломастат; иматиниб, торговое название Gleevec®; имиквимод; иммуностимулирующие пептиды; иобенгуан; йододоксорубицин; ипомеанол-4; ипроплатин; иринотекана гидрохлорид; иринотекан; ироплакт; ирсогладин; изобенгазол; изогомогаликондрин B; итазетрон; джасплакинолид; кахалалид F; ламелларина-N триацетат; ланреотида ацетат; ланреотид; лапатиниб, торговое название Tykerb®; леинамицин; ленограстим; лентинана сульфат; лептолстатин; летрозол; леупролида ацетат; леупролид+эстроген+прогестерон; леупрорелин; левамизол; лиарозола гидрохлорид; лиарозол; липофильный дисахаридпептид; липофильные аналоги платины; лиссоклинамид-7; лобаплатин; ломбрицин; лометрексол натрия; лометрексол; ломустин; лонидамин; лозоксантрона гидрохлорид; лозоксантрон; локсорибин; луртотекан; лютеция тексафирин; лизофиллин; литические пептиды; майтанзин; манностатин A; маримастат; мазопрокол; маспин; майтанзин; мехлорэтамина гидрохлорид; мегестрола ацетат; меленгестрола ацетат; мелфалан; меногарил; мербарон; меркаптопурин; метерелин; метиониназу; метотрексат натрия; метотрексат; метоклопрамид; метоприн; метуредепу; мифепристон; милтефосин; миримостим; митиндомид; митокарцин; митокромин; митогиллин; митогуазон; митолактол; митомалцин; производные митомицина; митомицин; митонафид; митоспер; митотан; митотоксиновый фактор роста фибробластов сапорин; митоксантрона гидрохлорид; митоксантрон; мофаротен; молграмостим; мопидамол; микапероксид B; микофеноловую кислоту; мириапорон; N-ацетилдиналин; нафарелин; нагрестип; наксолон+пентазоцин; напавин; нафтерпин; нартограстим; недаплатин; неморубицин; неридроновую кислоту; нилутамид; низамицин; нитруллин; ниволумаб (Opdivo®); нокодазол; ногаламицин; O6-бензилгуанидин; облимерсен (торговое название Genasense®); октреотид; окиценон; онапристон; ондансетрон; орацин; ормаплатин; осатерон; оксалиплатин; оксауномицин; оксисуран; паклитаксел; производные паклитаксела; палауамин; палбоциклиб; пальмитоилризоксин; памидроновую кислоту; панакситриол; паномифен; панобиностат; парабактин; пазеллиптин; пегаспаргазу; пелдезин; пелиомицин; пембролизумаб (Keytruda®); пентамустин; пентозанполисульфат натрия; пентостатин; пентрозол; пепломицина сульфат; перфлуброн; перфосфамид; периллиловый спирт; феназиномицин; фенилацетат; пицибанил; пилокарпина гидрохлорид; пипоброман; пипосульфан; пирарубицин; пиритрексим; пироксантрона гидрохлорид; плацетин A; плацетин B; комплекс платины; пликамицин; пломестан; порфимер натрия; порфирмицин; преднимустин; метакортандрацин; прокарбазина гидрохлорид; пропил бис-акридон; простагландин J2; пуромицина гидрохлорид; пуромицин; пурпурины; пиразофурин; пиразолакридин; ралтитрексед; рамосетрон; рапамицин; производные рапамицина(например, эверолимус); мерилимус; олкоролимус; ридафоролимус; сиролимус; темсиролимус (сиролимус,торговое название Torisel); умиролимус и (зотаролимус); деметилированный ретеллиптин; этидронат рения Re 186; ризоксин; рибоприн; рибозимы; RII ретинамид; рохитукин; ромуртид; рохинимекс; рубигинон B1; рубоксил; сафингола гидрохлорид; сафингол; саинтопин; SarCNU; саркофитол A; сарграмостим; миметики Sdi 1; семаксаниб; семустин; симтразен; сизофиран; собузоксан; борокаптат натрия; фенилацетат натрия; солверол; соматомедин-связывающий белок; сонермин; спарфосат натрия; спарфосат; спарсомицин; спикамицин D; спирогермания гидрохлорид; спиромустин; спироплатин; спленопентин; спонгистатин 1; скваламин; стипиамид; стрептонигрин; стрептозоцин; сульфинозин; сулофенур; сурадисту; сурамин; сваинсонин; тализомицин; таллимустин; тамоксифена метиодид; тауромустин; таксотер; текогалан натрия; тегафур; теллурапирилиум; телоксантрона гидрохлорид; темопорфин; тенипозид; тероксирон; тетрахлордекаоксид; тетразомин; талибластин; тиамиприн; тиокоралин; тиогуанин); тиотепу; миметики тромбопоэтина; тромбопоэтин; тималфазин; тимотринан; тиазофурин; олова этилэтиопурпурин; тирапазамин; титаноцена бихлорид; топсентин; торемифена цитрат; торемифен; трестолона ацетат; третиноин; триацетилуридин; трицирибина фосфат; трицирибин; триметрексата глюкуронат; триметрексат; трипторелин; трописетрон; тубулозола гидрохлорид; туростерид; тирфостины; убенимекс; урацил иприт; уредепу; вапреотид; вариолин B; веларезол; верамин; вердины; вертепорфин; винбластина сульфат; винкристина сульфат; виндезина сульфат; виндезин; винепидина сульфат; винглицината сульфат; винлеурозина сульфат; (винорелбина тартрат; винорелбин; винрозидина сульфат; винксалтин; винзолидина сульфат; витаксин; ворозол; занотерон; зениплатин; зиностатин; 5-этинилурацил и зорубицина гидрохлорид.
В предпочтительном варианте осуществления другое(-ие) терапевтическое(-ие) средство(-а) выбрано(-ы) из группы, состоящей из элотузумаба, палбоциклиба, панобиностата, ниволумаба, пембролизумаба, пеметрекседа, топотекана, доксорубицина, бортезомиба, гемцитабина, дакарбазина, дексаметазона, биаксина, винкристина, азацитидина, CAR-T, ритуксимаба, трастузумаба, ингибитора PD-1, ингибитора PD-L1, ингибитора HDAC, ингибитора андрогенового рецептора, ингибитора биосинтеза андрогена, преднизона, доцетаксела, инъекции клофарабина, ублитуксимаба, ромидепсина, ингибитора BTK, эритропоэтина, элтромбопага, миноциклина и мелфалана.
В варианте осуществления настоящего изобретения композицию, содержащую соединение, имеющее структуру общей формулы (I), его фармацевтически приемлемую соль, сольват, полиморф, стереоизомер, изотопное соединение, метаболит или пролекарство и одно другое терапевтическое средство вводят субъекту одновременно. В другом варианте осуществления соединение, имеющее структуру общей формулы (I), его фармацевтически приемлемую соль, сольват, полиморф, стереоизомер, изотопное соединение, метаболит или пролекарство и одно другое терапевтическое средство вводят последовательно. В другом варианте осуществления соединение, имеющее структуру общей формулы (I), его фармацевтически приемлемую соль, сольват, полиморф, стереоизомер, изотопное соединение, метаболит или пролекарство и одно другое терапевтическое средство вводят по отдельности. Другое терапевтическое средство можно вводить до, с последующим введением или после введения соединения, имеющего структуру общей формулы (I), его фармацевтически приемлемой соли, сольвата, полиморфа, стереоизомера, изотопного соединения, метаболита или пролекарства.
Одно или более чем одно другое терапевтическое средство, которое можно вводить в комбинации с соединением, имеющим структуру общей формулы (I), его фармацевтически приемлемой солью, сольватом, полиморфом, стереоизомером, изотопным соединением, метаболитом или пролекарством, зависит от множества факторов, таких как заболевание, симптом или нарушение, подлежащие лечению или предупреждению, и т. д. Специалист в данной области техники может легко определить подходящее другое терапевтическое средство, подлежащее введению в комбинации с соединением, имеющим структуру общей формулы (I), его фармацевтически приемлемой солью, сольватом, полиморфом, стереоизомером, изотопным соединением, метаболитом или пролекарством, исходя из раскрытого содержания.
Терапевтически эффективное количество другого терапевтического средства, используемого в способе по настоящему изобретению, известно специалисту в данной области техники, и инструкция по введению может ссылаться на опубликованные патенты и заявки, а также Wells et al, eds., Pharmacotherapy Handbook, 2nd Edition, Appleton and Lange, Stamford, Conn. (2000); PDR Pharmacopoeia, Tarascon Pocket Pharmacopoeia 2000, Deluxe Edition, Tarascon Publishing, Loma Linda, Calif. (2000) и другую медицинскую литературу, приведенную в настоящем документе. Однако специалист в данной области техники способен определить оптимальный диапазон доз другого терапевтического средства.
В соответствии с вариантом осуществления настоящего изобретения, при введении в комбинации с другим(-и) терапевтическим(-и) средством(-ами), терапевтически эффективное количество соединения, имеющего структуру общей формулы (I), его фармацевтически приемлемой соли, сольвата, полиморфа, стереоизомера, изотопного соединения, метаболита или пролекарства меньше необходимого терапевтически эффективного количества соединения, имеющего структуру общей формулы (I), его фармацевтически приемлемой соли, сольвата, полиморфа, стереоизомера, изотопного соединения, метаболита или пролекарства, в случае если не в комбинации с другим(-и) терапевтическим(-и) средством(-ами). В другом варианте осуществления терапевтически эффективное количество другого(-их) терапевтического(-их) средства(-ств) меньше, чем в случае если при введении не применяется соединение, имеющее структуру общей формулы (I), его фармацевтически приемлемая соль, сольват, полиморф, стереоизомер, изотопное соединение, метаболит или пролекарство. В соответствии с этим, побочные действия, связанные с любыми лекарственными средствами могут быть сведены к минимуму. Другие потенциальные преимущества, например улучшение введения раствора и/или снижение стоимости лекарственных средств, являются очевидными специалисту в данной области техники.
В соответствии с вариантом осуществления настоящего изобретения, в случае если соединение, имеющее структуру общей формулы (I), его фармацевтически приемлемую соль, сольват, полиморф, стереоизомер, изотопное соединение, метаболит или пролекарство и другое(-ие) терапевтическое(-ие) средство(-а) вводят субъекту для лечения или предупреждения заболевания, симптома или нарушения, соединение, имеющее структуру общей формулы (I), его фармацевтически приемлемую соль, сольват, полиморф, стереоизомер, изотопное соединение, метаболит или пролекарство и другое(-ие) терапевтическое(-ие) средство(-а) можно вводить с помощью такого же способа или разных способов. Другое(-ие) терапевтическое(-ие) средство(-а) можно вводить с помощью любых способов, описанных в данном документе, в том числе без ограничения, пероральным введением, ингаляцией, инъекцией, глазным введением, введением через слизистую оболочку, ректальным введением, эмульсией, липосомой, имплантантом длительного действия или введением с замедленным высвобождением. Определенное введение другого(-их) терапевтического(-их) средства(-ств) зависит от него(них) самого(самих), а также препарата и заболевания, симптома или нарушения, подлежащих предупреждению или лечению. В соответствии с раскрытиями в данном документе, специалист в данной области техники может определить введение другого(-их) терапевтического(-их) средства(-ств).
Настоящая заявка ссылается или описывает множество публикаций, литературных источников и патентов, при этом цель приведения или описания этих ссылок, или включения этих ссылок во всей их полноте, или обсуждения этих ссылок, состоит в определении предпосылок настоящего изобретения, однако это не означает, что содержание этих ссылок вносит вклад в часть предшествующего уровня техники настоящего изобретения.
Если не указано иное, то используемые в данном документе технические и научные термины имеют те же значения, которые обычно понимаются специалистом в данной области техники. В ином случае они имеют значения, указанные в настоящем описании. Все патенты, заявки на патент, которые уже были раскрыты, а также публикации, приведенные в данном документе, включены в настоящий документ посредством ссылки, точно так же, как подробно описано в данном документе. Необходимо отметить, что если в данном документе не указано иное, то форма единственного числа, используемая в данном документе и в прилагаемой формуле изобретения, имеет значение множественного числа.
Как используется в данном документе, в случае если определенная соль, композиция, а также наполнитель и т. д. являются «фармацевтически приемлемыми», это означает, что соль, композиция, наполнитель и т. д. являются, как правило, нетоксичными, безопасными и подходящими для введения субъекту, предпочтительно млекопитающему, более предпочтительно человеку.
В данном документеТермин «фармацевтически приемлемая соль» относится к фармацевтически приемлемой органической или неорганической соли. Примеры соли включают без ограничения соль серной, лимонной, уксусной, щавелевой, хлороводородной, бромистоводородной, йодистоводородной, азотной кислот, гидросульфат, фосфорной кислоты, кислой соли фосфорной кислоты, соль изоникотиновой кислоты, молочной, соль салициловой кислоты, лимонной кислоты, винной, олеиновой, соль дубильной кислоты, пантотеновой, винной, аскорбиновой, янтарной, малеиновой, гентизинатной, фумаровой, глюконовой, соль глюкуроновой кислоты, сахарной, муравьиной, бензойной, глутаминовой, метансульфоната, этансульфоната, бензолсульфоната, п-толуолсульфоната и эмбоната (т. е. 1-1-метилен-бис-(2-гидрокси-3-нафтоат)). Соединения по настоящему изобретению можно использовать для образования фармацевтически приемлемых солей с различными аминокислотами. Подходящая соль щелочного металла включает без ограничения соль алюминия, соль кальция, соль лития, соль магния, соль калия, соль натрия, соль цинка, соль висмута и соль диэтаноламина. Обзор, касающийся фармацевтически приемлемых солей, ссылается на Handbook of Pharmaceutical Salts: Properties, Selection, and Use (P. Heinrich Stahl and Camille G. Wermuth, ed., Wiley-VCH, 2002).
Используемый в данном документе термин «метаболит» относится к активному веществу, которое получают после изменения in vivo химической структуры молекулы лекарственного средства, при этом активное вещество, как правило, представляет собой производное вышеупомянутой молекулы лекарственного средства, и оно также может быть химически модифицированным.
Используемый в данном документе, и если не указано иное, термин «полиморф» относится к одному или более чем одному виду(-ам) кристаллической структуры, образованной посредством различного расположения молекул в пространственной решетке при кристаллизации.
Используемый в данном документе термин «сольват» относится к кристаллической форме соединения, имеющего структуру общей формулы (I), его фармацевтически приемлемой соли, полиморфа, стереоизомера, изотопного соединения, метаболита или пролекарства, которые дополнительно имеют один более одного вида(-ов) молекулы(-кул) растворителя, включенных в кристаллическую структуру. Сольват может включать стехиометрическое количество или нестехиометрическое количество растворителя, и молекула растворителя в растворителе может существовать в упорядоченной или неупорядоченной структуре. Сольват, содержащий нестехиометрическое количество молекул растворителя, может быть образован путем потери по меньшей мере одной молекулы растворителя (но не всех) из сольвата. В определенном варианте осуществления сольват относится к гидрату, что означает, что кристалл соединения дополнительно включает молекулу воды, и воду используют в качестве растворителя.
Используемый в данной документе, и если не указано иное, термин «пролекарство» относится к производному соединения, содержащему биологически реакционноспособную функциональную группу, при этом биологически реакционноспособная функциональная группа может быть отщеплена из соединения или реагировать по-другому, с получением соединения в биологических условиях (in vivo или in vitro). Как правило, пролекарство является неактивным или по меньшей мере имеет более низкую активность, чем соединение, что обеспечивает соединению способность проявлять активность до тех пор, пока оно не будет отщеплено от биологически реакционноспособной функциональной группы. Биологически реакционноспособная функциональная группа может быть гидролизована или окислена в биологических условиях с получением соединения. Например, пролекарство может содержать биологически гидролизуемую группу. Примеры биологически гидролизуемой группы включают без ограничения биологически гидролизуемый фосфат, биологически гидролизуемый сложный эфир, биологически гидролизуемый амид, биологически гидролизуемый сложный эфир угольной кислоты, биологически гидролизуемый карбамат и биологически гидролизуемый уреид. Обзор, касающийся пролекарства, ссылается, например, на J. Rautio et al., Nature Reviews Drug Discovery (2008) 7, 255-270 и Prodrugs: Challenges Rewards (V. Stella et al. ed., Springer, 2007).
Соединение имеющее в настоящем изобретении структуру общей формулы (I), его фармацевтически приемлемая соль, сольват, полиморф, стереоизомер, изотопное соединение, метаболит или пролекарство могут содержать один или более одного центров асимметрии («стереоизомер»). Используемый в данном документе термин «стереоизомер» относится ко всем стереоизомерам, в том числе энантиомеру, диастереоизомеру, эпимеру, эндо-экзо изомеру, атропоизомеру, региоизомеру, цис- и транс-изомеру. В данном документе выражение «стереоизомер»включает также «чистый стереоизомер» и «обогащенный стереоизомер» или «рацемический изомер» различных вышеупомянутых стереоизомеров. Такие стереоизомеры могут быть получены в соответствии со способом асимметрического синтеза, или разделены, очищены и обогащены посредством способа хирального разделения (включая без ограничения тонкослойную хроматографию, вращающуюся хроматографию, колоночную хроматографию, газовую хроматографию, жидкостную хроматографию высокого давления и т. д.), а также получены посредством хирального разделения с помощью связывания (химическое связывание и т. д.) или образования соли (физическое связывание и т. д.) с другим(-и) хиральным(-и) соединением(-ями). В данном документе термин «чистый стереоизомер» означает то, что массовая доля стереоизомера соединения составляет не менее 95% по сравнению с другими стереоизомерами соединения. В данном документе термин «обогащенный стереоизомер» означает то, что массовая доля стереоизомера соединения составляет не менее 50% по сравнению с другими стереоизомерами соединения. В данном документе термин «рацемический изомер» означает то, что массовая доля стереоизомера соединения равна массовой доле других стереоизомеров соединения.
Термин «изотопное соединение», используемый в данном документе, означает, что один или более одного атомного(-ных) изотопа(-ов) с природной или неприродной распространенностью содержатся в соединении, имеющем структуру общей формулы (I), его фармацевтически приемлемой соли, сольвате, полиморфе, стереоизомере, изотопном соединении, метаболите или пролекарстве. Атомные изотопы с неприродной распространенностью включают без ограничения дейтерий (2H или D), тритий (3H или T), йод-125 (125I), фосфор-32 (32P), углерод-13 (13C) или углерод-14 (14C). Вышеупомянутое изотопное соединение можно также использовать в качестве терапевтического или диагностического средства (т. е. внутреннего средства для визуализации) или инструмента исследования. Все изотопные варианты соединения по настоящему изобретению, независимо от того, являются они радиоактивными или нет, включены в объем настоящего изобретения.
Термин «обогащенный изотопом», используемый в данном документе, означает, что один или более одного атомного(-ых) изотопа(-ов) с природной или неприродной распространенностью содержатся в соединении, имеющем структуру общей формулы (I), его фармацевтически приемлемой соли, сольвате, полиморфе, стереоизомере, изотопном соединении, метаболите или пролекарстве. Термин «обогащенный изотопом» также означает, что соединение, имеющее структуру общей формулы (I), его фармацевтически приемлемая соль, сольват, полиморф, стереоизомер, изотопное соединение, метаболит или пролекарство содержат по меньшей мере один изотопный атом с неприродной распространенностью.
Используемый в данном документе термин «субъект» относится к любому животному, подлежащему предупреждению или лечению соединением или композицией в соответствии с вариантом осуществления настоящего изобретения, при этом предпочтительным является млекопитающее и оптимальным является человек. Термин «млекопитающее», используемый в данном документе, включает любых млекопитающих. Примеры млекопитающего включают без ограничения крупный рогатый скот, коня, овцу, свинью, кошку, собаку, мышь, крысу, кролика, морскую свинку, обезьяну, человека и т. д., при этом оптимальным является человек.
В одном варианте осуществления термины «лечить» и «лечение» относятся к улучшению, предупреждению или устранению заболевания или состояния, или по меньшей мере одного из их идентифицируемых симптомов, как например к лечению рака, нарушений, связанных с нежелательным ангиогенезом или TNF-α путем уменьшения или стабилизации симптомов рака или заболевания. В другом варианте осуществления выражения «лечить» и «лечение» относятся к улучшению, предупреждению или устранению по меньшей мере одного измеряемого параметра тела при заболевании или состоянии, подлежащих лечению, при этом заболевание или состояние могут не быть идентифицированы у млекопитающего, например к лечению рака или нарушения, связанного с нежелательным ангиогенезом или TNF-α путем ингибирования образования TNF-α или модулирования активности TNF-α. Однако в другом варианте осуществления термины «лечить» и «лечение» относятся к замедлению развития заболевания или симптома в физическом состоянии, например к стабилизации идентифицируемых симптомов, или в физиологическом состоянии, например к стабилизации физических параметров, или к обоим. В другом варианте осуществления термины «лечить» и «лечение» относятся к задержке развития заболевания или симптома.
В некоторых вариантах осуществления соединение вводят с целью предупреждения. Как используется в данном документе, выражения «предупреждать» или «предупреждение» относятся к уменьшению риска возникновения данного заболевания или симптома. В предпочтительном варианте осуществления указанное соединение вводят субъекту с целью предупреждения, например субъекту с семейным анамнезом или тенденцией возникновения рака или аутоиммунного заболевания.
Как используется в данном документе, «терапевтически эффективное количество» относится к количеству соединения или композиции, которое может вызвать биологическую или медицинскую ответную реакцию (которое ищут исследователи, ветеринары, врачи или другие клиницисты) у организма, животного или индивида, который может включать облегчение симптомов заболевания или симптома, подлежащих лечению. В предпочтительном варианте осуществления терапевтически эффективное количество является количеством, которого достаточно для эффективного лечения, улучшающего лечения или предупреждения рака, симптома или нарушения, связанных с нежелательным ангиогенезом или TNF-α.
Термин «профилактически эффективное количество» относится к количеству активного соединения или средства (которые ищут исследователи, ветеринары, врачи или другие клиницисты), которые могу ингибировать развитие заболевания у субъекта. Профилактически эффективное количество соединения относится к количеству терапевтического средства, используемого отдельно или в комбинации с другим активным соединением, которое может обеспечить терапевтическую пользу для лечения или предупреждения заболевания, симптома или нарушения.
Если не указано иное, то форма единственного числа термина, используемого в данном документе, включает также значение множественного числа.
Если не указано иное, то термин «или» или «и», используемый в данном документе, означает «и/или».
Если не указано иное, то обозначения «» или «» в определенной группе в данном документе относятся к положению соединения.
Каждое из вышеуказанных предпочтительных условий может быть объединено случайным образом, не отступая от общедоступных сведений в данной области техники, формируя тем самым различные предпочтительные варианты осуществления настоящего изобретения.
Все реагенты и исходные материалы, используемые в данном документе, являются коммерчески доступными.
Положительные эффекты, достигаемые с помощью настоящего изобретения, состоят в том, что производное изоиндолина, имеющее структуру общей формулы (I), способно регулировать образование и/или активность цитокинов (например, TNF-α), с тем чтобы эффективно лечить рак и воспалительные заболевания.
Примеры
Пример 1. Соединение I-28
Стадия A: к смеси 5-фтор-2-метилбензойной кислоты (6,0 г, 39,0 ммоль) в 98% H2SO4 (60 мл) добавляли 65% HNO3 (3,3 г, 50,7 ммоль) при от -5oC до 0oC, затем полученную смесь перемешивали при данной температуре в течение 1 ч. Смесь выливали в 200 г ледяной воды, затем экстрагировали с помощью MTBE (150 мл × 3). Объединенную органическую фазу промывали солевым раствором (20 мл), высушивали над Na2SO4, фильтровали и выпаривали досуха посредствомротационного выпаривания с получением 5-фтор-2-метил-3-нитробензойной кислоты (7,0 г, неочищенная) в виде желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
1H ЯМР (DMSO-d6, 300 МГц): δ 8,05 (dd, J = 8,1 Гц, 3,0 Гц, 1H), 7,85 (dd, J = 8,7, 3,0 Гц, 1H), 2,44 (s, 3H).
Стадия B: к смеси 5-фтор-2-метил-3-нитробензойной кислоты (7,0 г, неочищенная) в MeOH (70 мл) добавляли 98% H2SO4 (2 мл), затем полученную смесь перемешивали в течение ночи при 70oC. Смесь концентрировали, затем остаток разбавляли с помощью H2O (50 мл) и EtOAc (150 мл). Водный слой экстрагировали с помощью EtOAc (100 мл × 2), объединенную органическую фазу промывали солевым раствором (30 мл), высушивали над Na2SO4, фильтровали и выпаривали досуха посредством ротационного выпаривания. Остаток очищали с помощью колоночной хроматографии на силикагеле, элюированном с помощью (PE : EtOAc = от 10:1 до 3:1), с получением метил 5-фтор-2-метил-3-нитробензоата (3,5 г, выход 42%, две стадии) в виде светло-желтого твердого вещества.
1H ЯМР (DMSO-d6, 300 MГц): δ 8,10 (dd, J = 8,1, 3,0 Гц, 1H), 7,88 (dd, J = 8,7, 3,0 Гц, 1H), 3,86 (s, 3H), 2,41 (s, 3H).
Стадия C: к смеси метил-5-фтор-2-метил-3-нитробензоата (3,5 г, 16,4 ммоль) и пероксида бензоила (388 мг, 1,6 ммоль) в CCl4 (40 мл) добавляли NBS (3,2 г, 18,1 ммоль), затем полученную смесь перемешивали в течение ночи при 95oC. Смесь охлаждали до комнатной температуры и фильтровали, а фильтрат промывали солевым раствором (20 мл), высушивали над Na2SO4, фильтровали и выпаривали досуха посредствомротационного выпаривания. Остаток очищали с помощью колоночной хроматографии на силикагеле, элюированном с помощью (PE : EtOAc = 10:1-5:1), с получением метил-2-(бромметил)-5-фтор-3-нитробензоата (3,7 г, выход 77%) в виде светло-желтого масла.
1H ЯМР (DMSO-d6, 300 МГц): δ 8,21-8,25 (dd, J = 8,1, 3,0 Гц, 1H), 7,99-8,03 (dd, J = 8,7, 2,7 Гц, 1H), 4,97 (s, 2H), 3,93 (s, 3H).
Стадия D: к смеси 3-аминопиперидин-2,6-диона гидрохлорида (2,5 г, 15,1 ммоль) и KHCO3 (3,5 г, 34,2 ммоль) в CH3CN (80 мл) добавляли метил-2-(бромметил)-5-фтор-3-нитробензоат (4,0 г, 13,7 ммоль), затем полученную смесь перемешивали в течение ночи при 95oC. Смесь концентрировали, затем выливали в 100 г ледяной воды, затем смесь перемешивали в течение 0,5 ч. Смесь фильтровали и твердое вещество промывали с помощью H2O (50 мл × 3), высушивали с получением соединения I-28A [3-(6-фтор-4-нитро-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион] (3,8 г, выход 90%) в виде желтого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ 11,04 (s, 1H), 8,38 (dd, J = 8,8, 2,4 Гц, 1H), 8,11 (dd, J = 6,8, 2,4 Гц, 1H), 5,18 (dd, J = 13,2, 5,2 Гц, 1H), 4,88 (d, J = 19,2 Гц, 1H), 4,78 (d, J = 19,2 Гц, 1H), 2,87-2,96 (m, 1H), 2,54-2,63 (m, 2H), 2,01-2,05 (m, 1H).
Стадия E: смесь соединения I-28A (2,8 г, 9,1 ммоль) и Pd/C (10%, 280 мг, 50% воды) в DMF (30 мл) перемешивали в течение 6 ч. в атмосфере H2 при давлении 50 фунтов/кв. дюйм при комнатной температуре. Смесь фильтровали и твердое вещество промывали с помощью DMF (50 мл × 1). Фильтрат концентрировали, затем выливали в H2O (100 мл) и перемешивали в течение 0,5 ч. Смесь фильтровали, твердое вещество промывали с помощью H2O (50 мл × 3), высушивали с получением неочищенного продукта (2,1 г, выход 84%) в виде грязно-белого твердого вещества. 200 мг вышеуказанного неочищенного продукта очищали с помощью преп-HPLC с получением I-28 [3-(4-амино-6-фтор-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион] (148,8 мг) в виде грязно-белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): 11,01 (s, 1H), 6,55-6,63 (m, 2H), 5,79 (s, 2H), 5,10 (dd, J = 13,2, 4,8 Гц, 1H), 4,18 (d, J = 17,2 Гц, 1H), 4,08 (d, J = 17,2 Гц, 1H), 2,87-2,95 (m, 1H), 2,59-2,63 (m, 1H), 2,27-2,31 (m, 1H), 2,02-2,06 (m, 1H). LCMS: 278,1 ([M+1]+).
Соединения I-01-I-27 можно получить в соответствии со способом, описанным в примере 1.
Пример 2. Синтез соединений I-29 и I-30
800 мг соединения I-28 в 28 мл DMF разделяли с помощью хиральной HPLC (колонка: CHIRALPAK IA, 5 мкм, 30 x 250 мм; подвижная фаза: CH3CN; расход: 21 мл/мин.; температура: 26-28oC; длина волны: 230 нм; введение: 350 мкл) с получением 300 мг I-29 и 260 мг I-30.
I-29: [Rt=4,81 мин.; >99% ee; 1H ЯМР (DMSO-d6, 400 МГц): δ 11,01 (s, 1H), 6,55-6,63 (m, 2H), 5,80 (s, 2H), 5,07-5,12 (m, 1H), 4,18 (d, J = 16,8 Гц, 1H), 4,08 (d, J = 16,8 Гц, 1H), 2,87-2,93 (m, 1H), 2,59-2,63 (m, 1H), 2,27-2,31 (m, 1H), 2,02-2,07 (m, 1H). LCMS: 278,1 ([M+1]+)].
I-30:[Rt=7,08 мин.; >97,5% ee; 1H ЯМР (DMSO-d6, 400 МГц): δ 11,01 (s, 1H), 6,55-6,63 (m, 2H), 5,79 (s, 2H), 5,08-5,12 (m, 1H), 4,19 (d, J = 17,2 Гц, 1H), 4,08 (d, J = 17,2 Гц, 1H), 2,87-2,95 (m, 1H), 2,59-2,64 (m, 1H), 2,27-2,31 (m, 1H), 2,04-2,07 (m, 1H). LCMS: 278,1 ([M+1]+)].
Пример 3. Соединения I-31 и I-32
Стадия A: к раствору (S)-2-амино-5-(бензилокси)-5-оксопентановой кислоты (50,0 г, 221 ммоль) в CH3CO2D (150 мл) добавляли бензальдегид (1,34 г, 12,6 ммоль), смесь нагревали до 65oC и перемешивали в течение 18 часов. Реакционную смесь концентрировали и полученное твердое вещество растирали в порошок с MeOH (25 мл), CH3CN (50 мл) и t-BuOMe (200 мл) в течение 30 мин., осадок на фильтре промывали с помощью t-BuOMe (200 мл) и высушивали. Продукт подвергали такой же процедуре с получением соединения I-31A (32,5 г, выход = 65%).
1H ЯМР (CD3OD+D2O, 300 МГц): δ 7,33-7,42 (m, 5H), 5,14 (s, 2H), 3,70 (t,<0,05H), 2,58-2,63 (m, 2H), 2,13-2,17 (m, 2H).
Стадия B: к смеси THF (600 мл) и H2O (600 мл) добавляли соединение I-31A (32,5 г, 137 ммоль). NaHCO3 (12,6 г, 150 ммоль) добавляли к вышеуказанной смеси в ледяной бане, через 10 мин. медленно добавляли (BOC)2O (32,7 г, 150 ммоль), реакционную смесь перемешивали в течение 4 часов при комнатной температуре. THF удаляли при сниженном давлении (в вакууме), насыщ. раствор NaHCO3 добавляли к растворному остатку, смесь экстрагировали с помощью t-BuOMe (200 мл x 2). Водную фазу охлаждали с помощью ледяной бани и регулировали до рH=1 с помощью 3 н. HCl, затем экстрагировали с помощью EtOAc (300 мл x 2), объединенные органические слои высушивали над Na2SO4, фильтровали и концентрировали с получением I-31B (46,5 г, выход 100%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
1H ЯМР (CD3OD, 300 МГц): δ 7,29-7,35 (m, 5H), 5,12 (s, 2H), 4,13 (br s, 0,05H), 2,45-2,50 (m, 2H), 2,12-2,21 (m, 1H), 1,85-1,94 (m, 1H), 1,42 (s, 9H).
Стадия C: к раствору I-31B (46,5 г, 137 ммоль) в THF (500 мл), охлажденному до 5oC, медленно добавляли N-метилморфолин (NMM) (16,5 г, 164 ммоль) и этилхлоркарбонат (17,8 г, 164 ммоль). Реакционную смесь перемешивали при 0-5oC в течение 1 часа. К реакционной смеси добавляли 150 мл насыщенного NH3.H2O и затем перемешивали в течение 2 часов при комнатной температуре. Добавляли EtOAc (200 мл) и отделяли органическую фазу, водный слой экстрагировали с помощью EtOAc (200 мл), объединенную органическую фазу промывали последовательно с помощью водного NaHCO3 (200 мл х 2) и солевого раствора (200 мл), высушивали над Na2SO4, фильтровали и концентрировали с получением I-31C (41 г, 90%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 7,30-7,41 (m, 5H), 7,24 (s, 1H), 6,99 (s, 1H), 6,79 (s, 1H), 5,06 (s, 2H), 3,90 (m, <0,05H), 2,33-2,38 (m, 2H), 1,70-1,94 (m, 2H), 1,35 (s, 9H).
Стадия D: к раствору I-31C (41,0 г, 121 ммоль) в 1,4-диоксане (200 мл) добавляли раствор 6 н. HCl в 1,4-диоксане (300 мл), смесь перемешивали в течение 2 часов при комнатной температуре. Реакционную смесь концентрировали при сниженном давлении (в вакууме) с получением твердого вещества, которое растирали в порошок с помощью t-BuOMe (200 мл), а затем фильтровали и высушивали с получением продукта I-31D (31,3 г, выход 95%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ 8,37 (br s, 3H), 8,04 (s, 1H), 7,56 (s, 1H), 7,33-7,38 (m, 5H), 5,10 (s, 2H), 3,77 (t, <0,05H), 2,48-2,52 (m, 2H), 2,01-2,05 (m, 2H).
Стадия E: смесь метил-2-(бромметил)-5-фтор-3-нитробензоата (31,8 г, 108,9 ммоль), а также соединения I-31D (29,7 г, 109 ммоль) и Et3N (22,1 г, 218 ммоль) в CH3CN (550 мл) перемешивали при 75oC в течение ночи. Смесь концентрировали. Остаток растирали в порошок с помощью CH3CN (100 мл) с получением соединения I-31E (34,5 г, выход 76,2%) в виде бледно-желтого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 8,33 (dd, J = 8,7, 2,4 Гц, 1H), 8,04 (dd, J = 6,9, 2,4 Гц, 1H), 7,66 (s, 1H), 7,26-7,36 (m, 6H), 4,82-5,05 (m, 4H), 2,20-2,39 (m, 3H), 2,06-2,15 (m, 1H).
Стадия F: соединение I-31E подвергали разделению хиральной HPLC (колонка: DAICEL CHIRALPAK IA, 10 мкм, 25 x 250 мм; подвижная фаза: MeOH / DCM = 80/20 (об./об.); расход: 30 мл/мин.; температура: 35oC; длина волны: 254 нм) с получением двух соединений I-31F1 [1H ЯМР (DMSO-d6, 300 МГц): δ 8,31-8,35 (m, 1H), 8,03 (dd, J = 7,2, 2,1 Гц, 1H), 7,66 (s, 1H), 7,29-7,35 (m, 6H), 4,83-5,04 (m, 4H), 2,22-2,40 (m, 3H), 2,06-2,16 (m, 1H)] и I-31F2 [1H ЯМР (DMSO-d6, 300 МГц): δ 8,33 (dd, J = 9,3, 2,4 Гц, 1H), 8,03 (dd, J = 7,2, 2,4 Гц, 1H), 7,67 (s, 1H), 7,29-7,36 (m, 6H), 4,83-5,05 (m, 4H), 2,20-2,42 (m, 3H), 2,09-2,16 (m, 1H)].
Соединение I-32: смесь соединения I-31F2 (2,2 г, 5,3 ммоль) и Pd/C (10%, 200 мг, 50% воды) в безводном MeOH (30 мл) перемешивали в течение 4 ч. в атмосфере H2 при давлении 50 фунтов/кв. дюйм при комнатной температуре. Смесь фильтровали и фильтрат концентрировали, полученное твердое вещество добавляли в DCE (15 мл) и перемешивали в течение 5 мин., затем смесь концентрировали с получением остатка в виде грязно-белого твердого вещества (1,4 г). Вышеуказанное твердое вещество (1,1 г, 3,7 ммоль) растворяли в сухом THF (10 мл) и DCE (40 мл), а затем к смеси медленно добавляли SOCl2 (0,74 г, 9,3 ммоль) при -30oC, после перемешивания в течение 2 ч. добавляли пиридин (1,1 г, 9,3 ммоль) и перемешивали при данной температуре в течение 40 мин., добавляли Et3N (1,3 г, 13 ммоль) и затем смесь перемешивали в течение 2 ч. Добавляли H2O (0,1 мл) и затем смесь концентрировали досуха, остаток растворяли в H2O (5 мл) и экстрагировали с помощью EtOAc (70 мл x 5), высушивали над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью преп-HPLC с получением I-32 (340 мг, выход 33%, ee: 99%) в виде бледно-зеленого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): 11,00 (s, 1H), 6,56-6,61 (m, 2H), 5,78 (s, 2H), 5,05-5,11 (m, 0,05 H), 4,17 (d, J = 17,1 Гц, 1H), 4,05 (d, J = 17,1 Гц, 1H), 2,84-2,96 (m, 1H), 2,56-2,62 (m, 1H), 2,20-2,32 (m, 1H), 1,98-2,05 (m, 1H). LCMS: 279,1 ([M+1]+).
Соединение I-31: следуя тому же способу синтеза, как и для соединения I-32, соединение I-31F1 превращали в I-31 (99% ee). 1H ЯМР (DMSO-d6, 400 МГц): 10,99 (s, 1H), 6,52-6,61 (m, 2H), 5,71 (br s, 2H), 5,08 (dd, J = 18,0, 7,2 Гц, 0,04 H) 4,17 (d, J = 17,4 Гц, 1H), 4,06 (d, J = 17,4 Гц, 1H), 2,83-2,96 (m, 1H), 2,47-2,62 (m, 1H), 2,21-2,32 (m, 1H), 1,98-2,05 (m, 1H). LCMS: 279,1 ([M+1]+).
Пример 4. Соединение I-01
Следуя процедуре в вышеуказанном примере 3, соединение I-01 из примера 4 получали с применением рацемического I-31E.
1H ЯМР (DMSO-d6, 300 МГц): δ 10,94 (br s, 1H), 6,52-6,61 (m, 2H), 5,78 (s, 2H), 5,05-5,11 (m, 0,05 H), 4,16 (d, J = 16,8 Гц, 1H), 4,05 (d, J = 16,8 Гц, 1H), 2,84-2,96 (m, 1H), 2,54-2,62 (m, 1H), 2,21-2,31 (m, 1H), 1,98-2,04 (m, 1H). LCMS: 279,1 ([M+1]+).
Соединения I-33-I-56 можно получить в соответствии со способом синтеза, показанным в примерах 2 или 3 с подходящим исходным материалом.
Пример 5. Соединение A195
3-(4-((2-Фтор-5-метоксибензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A195:
К раствору A340D (40 мг, 0,096 ммоль) в CH3CN (3 мл) добавляли CDI (20 мг, 0,13 ммоль). Реакционную смесь перемешивали в течение ночи при 90oC в атмосфере N2. После концентрирования при сниженном давлении остаток растворяли в DCM (30 мл), промывали с помощью 0,1 н. HCl (10 мл), насыщ. водн. NaHCO3 (10 мл), а затем насыщ. NaCl (10 мл), высушивали над Na2SO4, фильтровали и концентрировали при сниженном давлении. Затем неочищенный продукт очищали с помощью преп-TLC (DCM / MeOH = 25:1) 2 раза с получением соединения A195 (46 мг, выход 81%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 10,98 (s, 1H), 7,23 (t, J = 7,8 Гц, 1H), 7,11 (t, J = 9,6 Гц, 1H), 6,90-6,95 (m, 2H), 6,78-6,84 (m, 1H), 6,66 (d, J = 7,8 Гц, 1H), 6,24 (t, J = 5,7 Гц, 1H), 5,10 (dd, J = 13,2, 5,4 Гц, 1H), 4,36 (d, J = 5,4 Гц, 2H), 4,30 (d, J = 17,7 Гц, 1H), 4,17 (d, J = 17,7 Гц, 1H), 3,65 (s, 3H), 2,85-2,97 (m, 1H), 2,57-2,64 (m, 1H), 2,24-2,36 (m, 1H), 2,00-2,07 (m, 1H). LCMS: 398,1 ([M+1]+).
Соединения из примеров 6-7 получали в соответствии со способом синтеза, показанным в примере 5, с соответствующими исходными материалами для замены A340D.
Пример 6. Соединение A196
3-(4-((2-Фтор-3-метоксибензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион A196:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,00 (s, 1H), 7,21 (t, J = 7,8 Гц, 1H), 7,00-7,04 (m, 2H), 6,90-6,95 (m, 2H), 6,62 (d, J = 7,8 Гц, 1H), 6,30 (t, J = 6,0 Гц, 1H), 5,10 (dd, J = 13,2, 5,7 Гц, 1H), 4,40 (d, J = 6,0 Гц, 2H), 4,28 (d, J = 17,4 Гц, 1H), 4,16 (d, J = 17,4 Гц, 1H), 3,81 (s, 3H), 2,85-2,97 (m, 1H), 2,56-2,63 (m, 1H), 2,26-2,32 (m, 1H), 1,99-2,07 (m, 1H). LCMS: 398,1 ([M+1]+).
Пример 7. Соединение A197
3-(4-((2-Фтор-3-метоксибензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион A197:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,00 (s, 1H), 7,19-7,31 (m, 2H), 6,92 (d, J = 7,2 Гц, 1H), 6,80 (dd, J = 12,0, 2,4 Гц, 1H), 6,71 (dd, J = 8,4, 2,4 Гц, 1H), 6,65 (d, J = 7,8 Гц, 1H), 6,20 (t, J = 5,7 Гц, 1H), 5,10 (dd, J = 13,2, 5,1 Гц, 1H), 4,24-4,33 (m, 3H), 4,14 (d, J = 17,1 Гц, 1H), 3,72 (s, 3H), 2,85-2,97 (m, 1H), 2,57-2,62 (m, 1H), 2,21-2,36 (m, 1H), 1,98-2,05 (m, 1H). LCMS: 398,1 ([M+1]+).
Пример 8. Соединение A318
3-(6-Фтор-4-((2-фтор-3-метоксибензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион A318:
Стадия A: к смеси соединения I-28A (1,0 г, 3,3 ммоль) в DMF (10 мл) добавляли Pd/C (0,18 г, 10%, 50% воды) и дегазировали с помощью H2 3 раза. Смесь перемешивали при 25oC в течение 5 часов в атмосфере H2 при давлении 50 фунтов/кв. дюйм. Затем реакционную смесь фильтровали и концентрировали, после чего растирали в порошок с помощью PE / EtOAc (5:1, 10 мл x 3) с получением I-28 (неочищенный, 0,9 г) в виде зеленого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 10,98 (s, 1H), 6,52-6,61 (m, 2H), 5,77 (s, 2H), 5,07 (dd, J = 5,4, 13,2 Гц, 1H), 4,17 (d, J = 17,1 Гц, 1H), 4,06 (d, J = 17,1 Гц, 1H), 2,83-2,95 (m, 1H), 2,55-2,62 (m, 1H), 2,20-2,34 (m, 1H), 1,97-2,07 (m, 1H).
Стадия B: к раствору соединения I-28 и 2-фтор-3-метоксибензальдегида (85 мг, 0,551 ммоль) в AcOH (3 мл) добавляли дихлорэтан (15 мл) и перемешивали в течение 1 часа. Затем добавляли NaBH(OAc)3 (235 мг, 1,09 ммоль) и смесь перемешивали в течение 18 часов. Добавляли еще одну часть NaBH(OAc)3 (50 мг, 0,236 ммоль) и смесь нагревали до 30oC в течение 8 часов. Затем добавляли еще одну часть 2-фтор-3-метоксибензальдегида (30 мг, 0,195 ммоль) и смесь перемешивали при 40oC в течение 16 часов. Смесь концентрировали и очищали с помощью преп-TLC с получением неочищенного продукта, который растирали в порошок с помощью MeOH (1 мл) с получением A318 (30 мг, выход 20%) в виде грязно-белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 11,00 (s, 1H), 7,05-7,07 (m, 2H), 6,91-6,94 (m, 1H), 6,61-6,65 (m, 2H), 6,44 (dd, J = 1,8, 12,9 Гц, 1H), 5,06-5,12 (m, 1H), 4,39 (d, J = 5,7 Гц, 2H), 4,26 (d, J = 17,1 Гц, 1H), 4,13 (d, J = 17,1 Гц, 1H), 3,81 (s, 3H), 2,86-2,90 (m, 1H), 2,57-2,63 (m, 1H), 2,24-2,30 (m, 1H), 2,02-2,06 (m, 1H). LCMS: 416,1 ([M+1]+).
Соединения из примеров 9-10 получали в соответствии со способом синтеза, показанным в примере 8, с соответствующим исходным материалом для замены 2-фтор-3-метоксибензальдегида на стадии B.
Пример 9. Соединение A319
3-(6-Фтор-4-((2-фтор-4-метоксибензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A319:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,00 (s, 1H), 7,30 (t, J = 9,0 Гц, 1H), 6,71-6,84 (m, 2H), 6,55-6,64 (m, 2H), 6,47 (dd, J = 2,1, 12,6 Гц, 1H), 5,05-5,11 (m, 1H), 4,31 (d, J = 5,1 Гц, 2H), 4,24 (d, J = 17,4 Гц, 1H), 4,11 (d, J = 17,4 Гц, 1H), 3,73 (s, 3H), 2,84-2,96 (m, 1H), 2,57-2,62 (m, 1H), 2,19-2,34 (m, 1H), 2,03-2,06 (m, 1H). LCMS: 416,1 ([M+1]+).
Пример 10. Соединение A320
3-(6-Фтор-4-((2-фтор-5-метоксибензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион A320:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,00 (s, 1H), 7,12 (t, J = 9,3 Гц, 1H), 6,81-6,94 (m, 2H), 6,60-6,66 (m, 2H), 6,48 (dd, J = 2,4, 12,6 Гц, 1H), 5,06-5,12 (m, 1H), 4,36 (d, J = 5,4 Гц, 2H), 4,27 (d, J = 17,7 Гц, 1H), 4,14 (d, J = 17,7 Гц, 1H), 3,67 (s, 3H), 2,83-2,97 (m, 1H), 2,57-2,62 (m, 1H), 2,20-2,35 (m, 1H), 2,00-2,08 (m, 1H). LCMS: 416,1 ([M+1]+).
Пример 11. Соединение A327
3-(6-Фтор-4-((4-(морфолинометил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A327:
Стадия A: к смеси (4-(морфолинометил)фенил)метанола (1,5 г, 7,2 ммоль) в DCM (20 мл) медленно добавляли SOCl2 (2,6 г, 21,8 ммоль) при 0oC, затем полученную смесь перемешивали в течение ночи при 25oC. LCMS продемонстрировала завершение реакции. Реакционную смесь концентрировали с получением неочищенного продукта 4-(4-(хлорметил)бензил)морфолина гидрохлорида (1,9 г) в виде грязно-белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ 11,70 (br s, 1H), 7,65-7,67 (m, 2H), 7,50-7,52 (m, 2H), 4,79 (s, 2H), 4,32-4,33 (m, 2H), 3,81-3,93 (m, 4H), 3,16-3,19 (m, 2H), 3,02-3,11 (m, 2H).
Стадия B: смесь метил-5-фтор-2-метил-3-нитробензоата (2,0 г, 9,4 ммоль) и Pd/C (10%, 200 мг, 50% воды) в MeOH (20 мл) перемешивали при комнатной температуре в течение ночи в атмосфере H2 при давлении 50 фунтов/кв. дюйм. TLC и LCMS продемонстрировали завершение реакции. Смесь фильтровали и твердое вещество промывали с помощью MeOH (50 мл × 1), фильтрат концентрировали с получением метил-3-амино-5-фтор-2-метилбензоата (1,3 г, неочищенный) в виде бесцветного масла.
1H ЯМР (DMSO-d6, 300 МГц), δ 6,57-6,60 (m, 1H), 5,44 (s, 2H), 3,77 (s, 3H), 2,11 (s, 3H).
Стадия C: к смеси метил-3-амино-5-фтор-2-метилбензоата (1,3 г, неочищенный) и 10% H2SO4 (43 г, 42,6 ммоль) в MeOH (20 мл) добавляли NaNO2 (750 мг, 10,87 ммоль) при 0oC в атмосфере N2, затем полученную смесь перемешивали в течение 1 ч. при данной температуре. Затем в реактор добавляли 50% H2SO4 (42,6 г, 213 ммоль), смесь перемешивали в течение 1 ч. при 100oC. TLC продемонстрировала завершение реакции. Реакционную смесь концентрировали, остаток разбавляли с помощью H2O (20 мл) и EtOAc (100 мл). Водный слой экстрагировали с помощью EtOAc (100 мл × 3). Объединенную органическую фазу высушивали над Na2SO4, фильтровали и выпаривали досуха с помощью ротационного выпаривания. Остаток очищали с помощью колоночной хроматографии на силикагеле, элюированном с помощью (PE : EtOAc = 50:1), с получением метил-5-фтор-3-гидрокси-2-метилбензоата (660 мг, выход 38% в течение двух стадий) в виде светло-желтого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ 10,25 (s, 1H), 6,93-6,96 (m, 1H), 6,78-6,82 (m, 1H), 3,81 (s, 3H), 2,23 (s, 3H).
Стадия D: к смеси метил-5-фтор-3-гидрокси-2-метилбензоата (1,2 г, 6,5 ммоль) и имидазола (1,33 г, 19,5 ммоль) в DCM (20 мл) добавляли TBDMSCl (1,96 г, 13,0 ммоль) в атмосфере N2 при 0oC, затем смесь перемешивали в течение 10 минут. Затем смесь перемешивали в течение 2 ч. при 25oC. TLC продемонстрировала завершение реакции. Смесь промывали с помощью H2O (50 мл), водный слой экстрагировали с помощью DCM (150 мл × 3), объединенную органическую фазу высушивали над Na2SO4, фильтровали и выпаривали досуха с помощью ротационного выпаривания. Остаток очищали с помощью колоночной хроматографии на силикагеле, элюированном с помощью (PE : EtOAc = 20:1-10:1), с получением метил-3-((трет-бутилдиметилсилил)окси)-5-фтор-2-метилбензоата (1,4 г, выход 72%) в виде светло-желтого масла.
1H ЯМР (DMSO-d6, 400 МГц): δ 7,12-7,15 (m, 1H), 6,84-6,87 (m, 1H), 3,82 (s, 3H), 2,26 (s, 3H), 0,98 (s, 9H), 0,23 (s, 6H).
Стадия E: к смеси метил-3-((трет-бутилдиметилсилил)окси)-5-фтор-2-метилбензоата (1,4 г, 4,7 ммоль) и NBS (1,0 г, 5,6 ммоль) в CCl4 (20 мл) добавляли пероксид бензоила (0,12 г, 0,5 ммоль) в атмосфере N2, смесь перемешивали в течение ночи при 80oC. TLC продемонстрировала завершение реакции. Смесь фильтровали, затем твердое вещество промывали с помощью DCM (50 мл), органическую фазу промывали с помощью H2O (50 мл), водный слой экстрагировали с помощью DCM (100 мл × 3), объединенную органическую фазу высушивали над Na2SO4, фильтровали и выпаривали досуха с помощью ротационного выпаривания. Остаток очищали с помощью колоночной хроматографии на силикагеле, элюированном с помощью (PE : EtOAc = 100:1), с получением метил-2-(бромметил)-3-((трет-бутилдиметилсилил)окси)-5-фторбензоата (1,4 г, чистота 90%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ 7,28-7,31 (m, 1H), 7,00-7,03 (m, 1H), 4,93 (s, 2H), 3,91 (s, 3H), 1,07 (s, 9H), 0,36 (s, 6H).
Стадия F: к смеси метил-2-(бромметил)-3-((трет-бутилдиметилсилил)окси)-5-фторбензоата (500 мг, 1,33 ммоль) и (S)-трет-бутил-4,5-диамино-5-оксопентаноата гидрохлорида (349 мг, 1,46 ммоль) и Et3N (405 мг, 4,0 ммоль) в CH3CN (10 мл) перемешивали в течение ночи в атмосфере N2 при 80oC. TLC продемонстрировала завершение реакции. Смесь концентрировали, остаток добавляли к THF (10 мл) и затем в реактор по каплям добавляли TBAF (4 мл, 1 M в THF). Смесь перемешивали в течение 0,5 ч. при комнатной температуре. TLC продемонстрировала завершение реакции. Смесь концентрировали, остаток очищали с помощью колоночной хроматографии на силикагеле, элюированном с помощью (PE : EtOAc = 5:1-1:1 - EtOAc), с получением A327A (200 мг, выход 34%, в течение 3 стадий) в виде светло-желтого твердого вещества.
1H ЯМР (MeOD, 400 МГц): δ 6,95-6,98 (m, 1H), 6,72-6,76 (m, 1H), 4,90-4,94 (m, 1H), 4,54 (d, J = 17,6 Гц, 1H), 4,42 (d, J = 17,6 Гц, 1H), 2,25-2,30 (m, 3H), 2,16-2,21 (m, 1H), 1,39 (s, 9H).
Стадия G: к смеси A327A (200 мг, 0,57 ммоль) и 4-(4-(хлорметил)бензил)морфолина гидрохлорида (445 мг, неочищенный) в сухом DMF(10 мл), в атмосфере N2 при комнатной температуре добавляли K2CO3 (393 мг, 2,90 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. LCMS продемонстрировала, что реакция не была завершена. Еще одну часть 4-(4-(хлорметил)бензил)морфолина гидрохлорида (445 мг, неочищенный) добавляли в реактор, реакционную смесь перемешивали в течение 6 ч. Смесь концентрировали, затем остаток разбавляли с помощью H2O (10 мл) и EtOAc (30 мл). Водный слой экстрагировали с помощью EtOAc (10 мл × 3), объединенную органическую фазу высушивали над Na2SO4, фильтровали и выпаривали досуха с помощью ротационного выпаривания. Остаток очищали с помощью колоночной хроматографии на силикагеле, элюированном с помощью (PE : EtOAc = 5:1-1:1 - EtOAc), с получением A327B (250 мг, выход 81%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ 7,57 (s, 1H), 7,44-7,46 (m, 2H), 7,34-7,36 (m, 2H), 7,19-7,27 (m, 2H), 7,06-7,08 (m, 1H), 5,23 (s, 2H), 4,68-4,72 (m, 1H), 4,50 (d, J = 17,6 Гц, 1H), 4,39 (d, J = 17,6 Гц, 1H), 3,56-3,58 (m, 4H), 3,47 (s, 2H), 2,30-2,38 (m, 4H), 2,13-2,17 (m, 3H), 2,00-2,05 (m, 1H), 1,32 (s, 9H).
Стадия H: к смеси A327B (250 мг, 0,46 ммоль) в сухом DCM (10 мл) добавляли TFA (4 мл) в атмосфере N2 при 0oC. Смесь перемешивали в течение 4 ч. TLC продемонстрировала завершение реакции. Смесь концентрировали с получением A327C (230 мг, неочищенный) в виде бледно-желтого твердого вещества.
Стадия I: к смеси A327C (230 мг, неочищенный) в CH3CN (15 мл) добавляли CDI (115 мг, 0,71 ммоль) в атмосфере N2 при комнатной температуре. После завершения добавления смесь перемешивали в течение ночи при 95oC. LCMS продемонстрировала завершение реакции. Смесь концентрировали, остаток очищали с помощью преп-HPLC с получением A327 (24 мг, выход 11%, две стадии) в виде желтого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ 10,98 (s, 1H), 7,43-7,45 (m, 2H), 7,28-7,35 (m, 3H), 7,11-7,13 (m, 1H), 5,23 (s, 2H), 5,08-5,13 (m, 1H), 4,39 (d, J = 17,2 Гц, 1H), 4,23 (d, J = 17,2 Гц, 1H), 3,55-3,58 (m, 4H), 3,47 (s, 2H), 2,87-2,91 (m, 1H), 2,54-2,59 (m, 1H), 2,42-2,45 (m, 1H), 2,35-2,41 (m, 4H), 1,97-1,99 (m, 1H). LCMS: 468,2 ([M+1]+).
Пример 12. Соединение A329
3-(4-((2-Фтор-4-метоксибензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A329:
Стадия A: к раствору 2-фтор-4-метоксибензальдегида (1,0 г, 6,49 ммоль) в MeOH (10 мл) добавляли NaBH4 (370 мг, 9,74 ммоль) при комнатной температуре, смесь перемешивали в течение 1 ч. TLC продемонстрировала завершение реакции. Добавляли HCl (1 н.), чтобы погасить реакцию и pH регулировали до значения 4-5. Добавляли DCM (50 мл) и воду (40 мл), и водный слой экстрагировали с помощью DCM (50 мл x 2), объединенную органическую фазу промывали солевым раствором (50 мл), высушивали над Na2SO4, фильтровали, концентрировали с получением продукта (2-фтор-4-метоксифенил)метанола (910 мг, выход 90%) в виде светло-желтоватого масла без дополнительной очистки для следующей стадии.
1H ЯМР (DMSO-d6, 300 МГц): δ 7,31 (t, J = 8,4 Гц, 1H), 6,72-6,76 (m, 2H), 5,08 (t, J = 5,7 Гц, 1H), 4,43 (d, J = 5,7 Гц, 2H), 3,73 (m, 3H).
Стадия B: к раствору (2-фтор-4-метоксифенил)метанола (400 мг, 2,56 ммоль) в сухом DCM (10 мл) добавляли SOCl2 (458 мг, 3,85 ммоль) при комнатной температуре, смесь перемешивали в течение 3 ч. LCMS продемонстрировала завершение реакции. Реакционную смесь концентрировали с получением 1-(хлорметил)-2-фтор-4-метоксибензола (450 мг) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки.
1H ЯМР (DMSO-d6, 300 МГц): δ 7,42 (t, J = 8,7 Гц, 1H), 6,85 (dd, J = 12,0, 2,7 Гц, 1H), 6,77 (dd, J = 11,4, 2,7 Гц, 1H), 4,72 (s, 2H), 3,76 (s, 3H).
Стадия C: к раствору A329B (200 мг, 0,68 ммоль) в DMF (15 мл) добавляли K2CO3 (283 мг, 2,05 ммоль) и [1-(хлорметил)-2-фтор-4-метоксибензол] (239 мг, 1,37 ммоль) при комнатной температуре, смесь перемешивали в течение ночи при комнатной температуре. LCMS продемонстрировала, что реакция не была завершена. Добавляли дополнительный [1-(хлорметил)-2-фтор-4-метоксибензол] (100 мг, 0,57 ммоль) и перемешивали в течение 3 ч. LCMS продемонстрировала завершение реакции. Реакционную смесь концентрировали и добавляли EtOAc (50 мл) и воду (30 мл), и водный слой экстрагировали с помощью EtOAc (50 мл x 2), объединенную органическую фазу промывали солевым раствором (50 мл), высушивали над Na2SO4, фильтровали и затем концентрировали с получением остатка. Остаток очищали с помощью преп-TLC (MeOH /DCM = 1/20) с получением A329A (190 мг, выход 65%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 7,57 (br s, 1H), 7,45-7,54 (m, 2H), 7,36 (d, J = 8,1 Гц, 1H), 7,30 (d, J = 7,5 Гц, 1H), 7,17 (br s, 1H), 6,87-6,92 (m, 1H), 6,81-6,85 (m, 1H), 5,19 (s, 2H), 4,69-4,74 (m, 1H). 4,47 (d, J = 17,7 Гц, 1H), 4,33 (d, J = 17,7 Гц, 1H), 3,79 (s, 3H), 3,50 (s, 3H), 2,13-2,27 (m, 3H), 2,00-2,10 (m, 1H).
Стадия D: к раствору A329A (190 мг, 0,44 ммоль) в DMF (10 мл) добавляли K2CO3 (183 мг, 1,33 ммоль), смесь перемешивали при 80oC в течение ночи в атмосфере N2. LCMS продемонстрировала завершение реакции. Реакционную смесь фильтровали и фильтрат концентрировали с получением остатка. Остаток очищали с помощью преп-HPLC и сушили сублимацией с получением A329 (120 мг, выход 68%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 10,79 (br s, 1H), 7,48-7,54 (m, 2H), 7,33-7,41 (m, 2H), 6,89 (dd, J = 12,3, 2,4 Гц, 1H), 6,81 (dd, J = 8,4, 2,4 Гц, 1H), 5,19 (s, 2H), 5,08-5,13 (m, 1H), 4,35 (d, J = 17,7 Гц, 1H), 4,18 (d, J = 17,7 Гц, 1H), 3,78 (s, 3H), 2,84-2,94 (m, 1H), 2,57-2,61 (m, 1H), 2,38-2,46 (m, 1H), 1,92-2,00 (m, 1H).
LCMS: 399,1 ([M+1]+).
Соединения в примерах 13-14 получали в соответствии с процедурой, описанной для примера 12, с соответствующим исходным материалом для замены 2-фтор-4-метоксибензальдегида на стадии A.
Пример 13. Соединение A331
3-(4-((2-Фтор-5-метоксибензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A331:
1H ЯМР (DMSO-d6, 300 МГц): δ 10,65 (br s, 1H), 7,51 (t, J = 7,8 Гц, 1H), 7,34-7,40 (m, 2H), 7,13-7,23 (m, 2H), 6,93-6,99 (m, 1H), 5,25 (s, 2H), 5,10 (dd, J = 10,2, 5,1 Гц,1H), 4,39 (d, J = 17,7 Гц, 1H), 4,23 (d, J = 17,7 Гц, 1H), 3,74 (s, 3H), 2,84-2,96 (m, 1H), 2,54-2,60 (m, 1H), 2,39-2,47 (m, 1H), 1,93-2,00 (m, 1H). LCMS: 399,1 ([M+1]+).
Пример 14. Соединение A334
3-(4-((2-Фтор-3-метоксибензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A334:
1H ЯМР (DMSO-d6, 400 МГц): 10,96 (s, 1H), 7,50 (t, J = 7,6 Гц, 1H), 7,34-7,38 (m, 2H), 7,13-7,20 (m, 3H), 5,28 (s, 2H), 5,10 (dd, J = 12,8, 4,4 Гц, 1H), 4,38 (d, J = 17,6 Гц, 1H), 4,22 (d, J = 17,6 Гц, 1H), 3,85 (s, 3H), 2,87-2,90 (m, 1H), 2,50-2,58 (m, 1H), 2,40-2,43 (m, 1H), 1,95-1,98 (m, 1H). LCMS: 399,1 ([M+1]+).
Пример 15. Соединение A336
3-[4-(2-Фторбензилокси)-1-оксо-1,3-дигидроизоиндол-2-ил]пиперидин-2,6-дион, A336:
1H ЯМР (DMSO-d6, 400 МГц): 10,92 (s, 1H), 6,53-6,63 (m, 1H), 7,50 (t, J = 8,0 Гц, 1H), 7,40-7,47 (m, 2H), 7,36 (t, J = 8,0 Гц, 1H), 7,23-7,29 (m, 2H), 5,30 (s, 2H), 5,11 (dd, J = 12,8, 5,2 Гц, 1H), 4,38 (d, J = 17,6 Гц, 1H), 4,23 (d, J = 17,6 Гц, 1H), 2,86-2,95 (m, 1H), 2,54-2,59 (m, 1H), 2,38-2,47 (m, 1H), 1,97-2,00 (m, 1H). LCMS: 369,1 ([M+1]+).
Пример 16. Соединение A340
(S)-3-(4-((2-Фтор-5-метоксибензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A340:
Стадия A: к раствору метил-2-(бромметил)-3-нитробензоата (2,00 г, 7,30 ммоль) в CH3CN (40 мл) добавляли (S)-трет-бутил-4,5-диамино-5-оксопентаноата гидрохлорид (1,91 г, 8,00 ммоль) и Et3N (1,63 г, 16,1 ммоль) в атмосфере N2, смесь перемешивали при 75oC в течение ночи. TLC продемонстрировала завершение реакции. Реакционную смесь концентрировали и добавляли EtOAc (50 мл) и воду (50 мл), водный слой экстрагировали с помощью EtOAc (50 мл x 2), объединенные органические фазы промывали солевым раствором (50 мл), высушивали над Na2SO4, фильтровали, концентрировали с получением неочищенного продукта. Неочищенный продукт растирали в порошок с помощью PE / EtOAc (4/1, об./об.), затем фильтровали с получением A340A (2,2 г, выход 83%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 8,45 (dd, J = 0,9, 8,1 Гц, 1H), 8,16 (dd, J = 0,9, 8,1 Гц, 1H), 7,82 (t, J = 8,1 Гц, 1H), 7,65 (br s, 1H), 7,27 (br s, 1H), 5,05 (d, J = 19,5 Гц, 1H), 4,90 (d, J = 19,5 Гц, 1H), 4,75-4,80 (m, 1H), 2,14-2,27 (m, 3H), 2,00-2,10 (m, 1H), 1,33 (s, 9H).
Стадия B: к раствору A340A (1,20 г, 3,30 ммоль) в MeOH добавляли Pd/C (10%, 200 мг, 50% воды), дегазировали с помощью H2 3 раза, смесь перемешивали при 25oC в течение ночи в атмосфере H2 (50 фунтов/кв. дюйм). LCMS продемонстрировала завершение реакции. Pd/C удаляли с помощью фильтрации и фильтрат концентрировали с получением A340B (1,19 г, неочищенный) в виде светло-желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
1H ЯМР (DMSO-d6, 300 МГц): δ 7,50 (br s, 1H), 7,11-7,16 (m, 2H), 6,85 (d, J = 7,2 Гц, 1H), 6,74 (d, J = 7,2 Гц, 1H), 5,41 (br s, 2H), 4,68-4,73 (m, 1H), 4,38 (d, J = 17,7 Гц, 1H), 4,16 (d, J = 17,7 Гц, 1H), 2,09-2,19 (m, 3H), 1,92-2,01(m, 1H), 1,32 (s, 9H).
Стадия C: к раствору A340B (1,00 г, неочищенный) и 2-фтор-5-метоксибензальдегида (601 мг, 3,90 ммоль) в MeOH (10 мл) добавляли AcOH (0,5 мл), смесь перемешивали при 25oC в течение 3 часов. Добавляли Pd/C (10%, 200 мг, 50% воды ), дегазировали с помощью H2 3 раза и перемешивали при 25oC в течение ночи в атмосфере H2 (баллон). LCMS продемонстрировала завершение реакции. Pd/C удаляли с помощью фильтрации и фильтрат концентрировали с получением остатка. Остаток очищали с помощью колоночной хроматографии на силикагеле (PE / EtOAc = 1/4) с получением требуемого продукта A340C (1,15 г, выход 88%, в течение двух стадий) в виде светло-желтоватого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 7,56 (br s, 1H), 7,09-7,24 (m, 3H), 6,91-6,96 (m, 2H), 6,80-6,85 (m, 1H), 6,63 (d, J = 8,4 Гц, 1H), 6,34-6,38 (m, 1H), 4,74 (dd, J = 10,2, 4,5 Гц, 1H), 4,50 (d, J = 18,0 Гц, 1H), 4,37 (d, J = 6,0 Гц, 2H), 4,28 (d, J = 18,0 Гц, 1H), 3,67 (s, 3H), 2,12-2,21 (m, 3H), 1,91-2,02 (m, 1H), 1,33 (s, 9H).
Стадия D: к раствору A340C (1,15 г, 2,44 ммоль) в DCM (20 мл), охлажденному до 0oC, по каплям добавляли TFA (4 мл), смесь перемешивали в течение ночи при 25℃. Реакционную смесь концентрировали при сниженном давлении. Остаток очищали с помощью флэш-хроматографии на C18 (40% ацетонитрила в воде), затем сушили сублимацией с получением A340D (800 мг, выход 79%) в виде светло-желтого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ 12,14 (br s, 1H), 7,57 (br s, 1H), 7,10-7,23 (m, 3H), 6,91-6,96 (m, 2H), 6,81-6,85 (m, 1H), 6,63 (d, J = 8,0 Гц, 1H), 6,35 (t, J = 6,0 Гц, 1H), 4,72-4,76 (m, 1H), 4,51 (d, J = 17,6 Гц, 1H), 4,37 (d, J = 5,6 Гц, 2H), 4,31 (d, J = 17,6 Гц, 1H), 3,67 (s, 3H), 2,18-2,23 (m, 3H), 1,96-2,02 (m, 1H).
Стадия E: раствор A340D (700 мг, 1,69 ммоль) в сухом DCM (70 мл) охлаждали до -40oC в атмосфере N2, к смеси медленно добавляли SOCl2 (1,00 г, 8,40 ммоль) при -40oC, затем добавляли раствор DMF (10 мг) в DCM (1 мл) и перемешивали в течение 2 ч., а затем по каплям добавляли пиридин (666 мг, 8,42 ммоль) и перемешивали при данной температуре в течение 40 мин., добавляли Et3N (852 мг, 8,42 ммоль) и затем смесь перемешивали в течение 2 ч. LCMS продемонстрировала завершение реакции. H2O (10 мл) добавляли, чтобы погасить реакцию, водный слой экстрагировали с помощью DCM (20 мл x 2), объединенную органическую фазу промывали солевым раствором (50 мл x 1), высушивали над Na2SO4, фильтровали, концентрировали с получением остатка. Остаток очищали с помощью преп-HPLC с получением A340 (460 мг, выход 68%, ee: 98%) в виде бледно-зеленого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 11,00 (br s, 1H), 7,23 (t, J = 7,8 Гц, 1H), 7,11 (t, J = 9,6 Гц, 1H), 6,90-6,95 (m, 2H), 6,78-6,84 (m, 1H), 6,65 (d, J = 8,1 Гц, 1H), 6,26 (t, J = 6,0 Гц, 1H), 5,10 (dd, J = 13,2, 5,1 Гц, 1H), 4,37 (d, J = 6,0 Гц, 2H), 4,30 (d, J = 17,1 Гц, 1H), 4,17 (d, J = 17,1 Гц, 1H), 3,65 (s, 3H), 2,85-2,96 (m,1H), 2,56-2,63 (m, 1H), 2,24-2,37 (m, 1H), 2,00-2,07 (m, 1H). LCMS: 398,1 ([M+1]+).
Пример 17. Соединение A341
(R)-3-(4-((2-Фтор-5-метоксибензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A341:
Стадия A: к раствору сложного метилового эфира 2-бромметил-3-нитробензойной кислоты (1,00 г, 3,65 ммоль) в CH3CN (50 мл) добавляли (R)-трет-бутил-4,5-диамино-5-оксопентаноата гидрохлорида (955 мг, 4,00 ммоль) и Et3N (815 мг, 8,05 ммоль), смесь перемешивали при 75oC в течение ночи в атмосфере N2. TLC продемонстрировала завершение реакции. Реакционную смесь концентрировали и добавляли EtOAc (50 мл) и воду (50 мл), водный слой экстрагировали с помощью EtOAc (50 мл x 2), объединенную органическую фазу промывали солевым раствором (50 мл), высушивали над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле (PE/EtOAc = 1/4), с получением A341A (800 мг, выход 60%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 8,45 (d, J = 6,0 Гц, 1H), 8,16 (d, J = 5,4 Гц, 1H), 7,82 (t, J = 6,0 Гц, 1H), 7,64 (br s, 1H), 7,27 (br s, 1H), 5,05 (d, J = 14,4 Гц, 1H), 4,91 (d, J = 14,4 Гц, 1H), 4,76-4,80 (m, 1H), 2,15-2,25 (m, 3H), 2,02-2,11 (m, 1H), 1,33 (s, 9H).
Стадия B: к раствору A341A (800 мг, 2,20 ммоль) в MeOH добавляли Pd/C (10%, 80 мг, 50% воды), смесь перемешивали при 25oC в течение ночи в атмосфере H2 (50 фунтов/кв. дюйм). LCMS продемонстрировала завершение реакции. Pd/C удаляли с помощью фильтрации и фильтрат концентрировали с получением неочищенного продукта A341C (680 мг, выход 93%) в виде светло-желтоватого твердого вещества. Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
1H ЯМР (DMSO-d6, 300 МГц): δ 7,54 (br s, 1H), 7,13-7,18 (m, 2H), 6,88 (d, J = 7,2 Гц, 1H), 6,76 (d, J = 7,8 Гц, 1H), 5,44 (br s, 2H), 4,70-4,75 (m, 1H), 4,41 (d, J = 17,7 Гц, 1H), 4,18 (d, J = 17,7 Гц, 1H), 2,09-2,21 (m, 3H), 1,92-2,06 (m, 1H), 1,34 (s, 9H).
Стадия C: к раствору A341C (680 мг, 2,04 ммоль) и 2-фтор-5-метоксибензальдегида (472 мг, 3,06 ммоль) в MeOH добавляли AcOH (0,5 мл), смесь перемешивали при 25oC в течение 3 часов. Добавляли Pd/C (10%, 50 мг, 50% воды), дегазировали с помощью H2 3 раза и перемешивали при 25oC в течение ночи в атмосфере H2 (баллон). LCMS продемонстрировала завершение реакции. Pd/C удаляли с помощью фильтрации и фильтрат концентрировали с получением остатка. Остаток очищали с помощью колоночной хроматографии на силикагеле (PE / EtOAc = 1/4) с получением требуемого продукта A341E (650 мг, выход 68%) в виде светло-желтого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ 7,56 (br s, 1H), 7,18-7,23 (m, 2H), 7,12 (t, J = 9,2 Гц, 1H), 6,91-6,95 (m, 2H), 6,81-6,85 (m, 1H), 6,63 (d, J = 8,0 Гц, 1H), 6,36 (t, J = 5,6 Гц, 1H), 4,72-4,76 (m, 1H), 4,50 (d, J = 17,6 Гц, 1H), 4,37 (d, J = 6,0 Гц, 2H), 4,29 (d, J = 17,6 Гц, 1H), 3,67 (s, 3H), 2,14-2,22 (m, 3H), 1,94-2,04 (m, 1H), 1,33 (s, 9H).
Стадия D: к раствору A341E (650 мг, 1,38 ммоль) в DCM (20 мл), охлажденному до 0oC, по каплям добавляли TFA (4 мл), смесь медленно нагревали до 25℃ и перемешивали в течение ночи. Реакционную смесь концентрировали при сниженном давлении (в вакууме) с целью удаления раствора. Остаток очищали с помощью флэш-хроматографии на C18 (40% ацетонитрила в воде), затем сушили сублимацией с получением A341G (450 мг, выход 79%) в виде светло-желтоватого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 7,56 (br s, 1H), 7,07-7,22 (m, 3H), 6,89-6,94 (m, 2H), 6,78-6,83 (m, 1H), 6,61 (d, J = 7,8 Гц, 1H), 6,34 (t, J = 6,3 Гц, 1H), 4,69-4,73 (m, 1H), 4,50 (d, J = 17,7 Гц, 1H), 4,35 (d, J = 5,7 Гц, 2H), 4,29 (d, J = 17,7 Гц, 1H), 3,65 (s, 3H), 2,12-2,19 (m, 3H), 1,93-1,98 (m, 1H).
Стадия E: к раствору A341G (450 мг, 1,08 ммоль), растворенному в сухом DCM (50 мл), охлажденному до -40oC в атмосфере N2, SOCl2 (644 мг, 5,41 ммоль) медленно добавляли к смеси при -40oC в атмосфере N2, затем раствор DMF (10 мг) в DCM (1 мл) добавляли и перемешивали в течение 2 ч., по каплям добавляли пиридин (428 мг, 5,41 ммоль) и перемешивали при данной температуре в течение 40 мин., добавляли Et3N (547 мг, 5,41 ммоль) и затем смесь перемешивали в течение 2 ч. LCMS продемонстрировала завершение реакции. H2O (10 мл) добавляли, чтобы погасить реакцию, водный слой экстрагировали с помощью DCM (30 мл x 2), объединенную органическую фазу промывали солевым раствором (50 мл), высушивали над Na2SO4, фильтровали, концентрировали с получением остатка. Остаток очищали с помощью преп-HPLC с получением A341 (260 мг, выход 61%, ee: 96%) в виде бледно-зеленого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 10,98 (br s, 1H), 7,23 (t, J = 7,8 Гц, 1H), 7,11 (t, J = 9,3 Гц, 1H), 6,90-6,95 (m, 2H), 6,78-6,84 (m, 1H), 6,65 (d, J = 8,1 Гц, 1H), 6,26 (t, J = 6,0 Гц, 1H), 5,10 (dd, J = 13,2, 5,1 Гц, 1H), 4,36 (d, J = 5,7 Гц, 2H), 4,30 (d, J = 17,1 Гц, 1H), 4,17 (d, J = 17,1 Гц, 1H), 3,65 (s, 3H), 2,85-2,97 (m, 1H), 2,56-2,63 (m, 1H), 2,22-2,35 (m, 1H), 2,00-2,07 (m, 1H). LCMS: 398,1 ([M+1]+).
Пример 18. Соединение A342
(R)-3-Дейтерий-3-(4-((2-фтор-5-метоксибензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A342:
Стадия A: к раствору A343F (31,7 г, 115,7 ммоль) в CH3CN (560 мл) добавляли A343G (31,5 г, 115,1 ммоль) и Et3N (23,3 г, 231,0 ммоль), смесь перемешивали при 75oC в течение ночи в атмосфере N2. Реакционную смесь концентрировали и добавляли EtOAc (50 мл) и 4 н. водный раствор HCl (150 мл), смесь фильтровали, а отфильтрованный осадок промывали водой (30 мл) и высушивали, при этом фильтрат экстрагировали с помощью EtOAc (250 мл x 2), объединенную органическую фазу промывали солевым раствором (30 мл), высушивали над Na2SO4, фильтровали, концентрировали с получением неочищенного продукта. Объединенное твердое вещество растирали в порошок с помощью CH3CN (40 мл x 2), фильтровали с получением A343E (37 г, выход 81%) в виде белого твердого вещества. Соединение A343E подвергали хиральному разделению с получением пика 1 A343E(S) (14,4 г, выход 77,8%, Rt=7,30 мин., 100% ee) и пика 2 A343E(R) (14,8 г, выход 80%, Rt=11,87 мин., 100% ee) в виде белого твердого вещества.
Условия хирального разделения: колонка: CHIRALPAK IE; размер частиц: 10 мкм, размеры: 50 x 250 мм; длина волны: 254 нм; подвижная фаза: MeOH/DCM=80/20 (об./об.); введение: 48 мл; расход: 60 мл/мин.; температура: 35oC. Растворитель: подвижная фаза, 17,1 мг/мл.
A343E(S): 1H ЯМР (DMSO-d6, 300 МГц): δ 8,43 (d, J = 8,1 Гц, 1H), 8,13 (d, J = 7,5 Гц, 1H), 7,79 (t, J = 8,1 Гц, 1H), 7,66 (br s, 1H), 7,26-7,35 (m, 6H), 4,86-5,07 (m, 4H), 2,42-2,21-2,43 (m, 3H), 2,06-2,16 (m, 1H).
A343E(R): 1H ЯМР (DMSO-d6, 300 МГц): δ 8,43 (d, J = 8,4 Гц, 1H), 8,13 (d, J = 7,2 Гц, 1H), 7,77-7,82 (m, 1H), 7,65 (br s, 1H), 7,35-7,23-7,35 (m, 6H), 4,86-5,07 (m, 4H), 2,20-2,42 (m, 3H), 2,06-2,15 (m, 1H).
Стадия B: к раствору A343E(R) (2,5 г, 6,3 ммоль) в MeOH (150 мл) и THF (150 мл) добавляли Pd/C (10%, 500 мг, 50% воды), смесь перемешивали в течение ночи в атмосфере H2 (50 фунтов/кв. дюйм) при 25℃. LCMS продемонстрировала завершение реакции. Pd/C удаляли с помощью фильтрации и фильтрат концентрировали с получением неочищенного продукта, который совместно выпаривали с CH3CN/DCE (50 мл/150 мл), а затем твердое вещество растворяли в THF (300 мл) и концентрировали с получением A342C (1,68 г, 97% выход) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
1H ЯМР (DMSO-d6, 300 МГц): δ 12,11 (br s, 1H), 7,54 (s, 1H), 7,11-7,16 (m, 2H), 6,85 (d, J = 7,8 Гц, 1H), 6,74 (d, J = 7,8 Гц, 1H), 5,43 (br s, 2H), 4,68-4,73 (m, 0,02H), 4,41 (d, J = 17,4 Гц, 1H), 4,17 (d, J = 17,4 Гц, 1H), 2,10-2,18 (m, 3H), 1,94-1,97 (m, 1H).
Стадия C: к раствору A342C и 2-фтор-5-метоксибензальдегида (831 мг, 5,39 ммоль) в MeOH добавляли AcOH (0,5 мл), смесь перемешивали при 25oC в течение 20 часов. Добавляли Pd/C (10%, 100 мг, 50% воды), дегазировали с помощью H2 3 раза и перемешивали при 25oC в течение ночи в атмосфере H2 (баллон). LCMS продемонстрировала завершение реакции. Pd/C удаляли с помощью фильтрации и фильтрат концентрировали с получением остатка. Остаток очищали с помощью флэш-хроматографии на C18 (CH3CN: H2O = 5% - 35%, 30 мин.; 35% - 45%, 30 мин.; 45% - 55% 20 мин.), затем сушили сублимацией с получением A342A (800 мг, выход 53%) в виде светло-желтого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 12,10 (br s, 1H), 7,56 (br s, 1H), 7,07-7,22 (m, 3H), 6,89-6,94 (m, 2H), 6,78-6,83 (m, 1H), 6,61 (d, J = 8,1 Гц, 1H), 6,34 (t, J = 6,0 Гц, 1H), 4,70-4,74 (m, 0,03H), 4,50 (d, J = 17,7 Гц, 1H), 4,35 (d, J = 5,7 Гц, 2H), 4,28 (d, J = 17,7 Гц, 1H), 3,65 (s, 3H), 2,10-2,21 (m, 3H), 1,92-2,02 (m, 1H).
Стадия D: к раствору A342A (450 мг, 1,10 ммоль) в сухом DCM (50 мл), охлажденному до -40oC в атмосфере N2, SOCl2 (572 мг, 4,81 ммоль) медленно добавляли к смеси при -40oC в атмосфере N2, затем добавляли раствор DMF (10 мг) в DCM (1 мл), перемешивали в течение 2 ч., затем по каплям добавляли пиридин (380 мг, 4,80 ммоль) при данной температуре, перемешивали в течение 40 мин., затем добавляли Et3N (486 мг, 4,80 ммоль) и затем смесь перемешивали в течение 2 ч. LCMS продемонстрировала завершение реакции. Чтобы погасить реакцию, добавляли H2O (10 мл), водный слой экстрагировали с помощью DCM (30 мл x 2), объединенную органическую фазу промывали солевым раствором (50 мл), высушивали над Na2SO4, фильтровали, концентрировали с получением остатка. Остаток очищали с помощью флэш-хроматографии на C18 (CH3CN: H2O = 5% - 35%, 30 мин.; 35% - 45%, 30 мин.; 45% - 55% 20 мин.) с получением A342 (220 мг, выход 58%, ee: 99%) в виде светло-желтого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 11,00 (br s, 1H), 7,23 (t, J = 7,8 Гц, 1H), 7,11 (t, J = 9,6 Гц, 1H), 6,90-6,95 (m, 2H), 6,79-6,84 (m, 1H), 6,65 (d, J = 7,8 Гц, 1H), 6,26 (t, J = 5,4 Гц, 1H), 5,07-5,14 (m, 0,01H), 4,36 (d, J = 5,7 Гц, 2H), 4,30 (d, J = 17,1 Гц, 1H), 4,17 (d, J = 17,1 Гц, 1H), 3,65 (s, 3H), 2,85-2,97 (m, 1H), 2,57-2,63 (m, 1H), 2,24-2,34 (m, 1H), 2,00-2,06 (m, 1H).
LCMS: 399,1 ([M+1]+).
Соединение из примера 19 получали в соответствии со способом синтеза, описанным в примере 18, с соответствующим исходным материалом для замены A343E(R) на стадии B.
Пример 19. A343
(S)-3-Дейтерий-3-(4-((2-фтор-5-метоксибензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A343:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,00 (br s, 1H), 7,23 (t, J = 8,1 Гц, 1H), 7,11 (t, J = 9,6 Гц, 1H), 6,90-6,95 (m, 2H), 6,78-6,84 (m, 1H), 6,65 (d, J = 8,1 Гц, 1H), 6,26 (t, J = 6,3 Гц, 1H), 5,07-5,13 (m, 0,02H), 4,36 (d, J = 5,7 Гц, 2H), 4,29 (d, J = 17,1 Гц, 1H), 4,17 (d, J = 17,1 Гц, 1H), 3,65 (s, 3H), 2,85-2,97 (m, 1H), 2,56-2,64 (m, 1H), 2,24-2,34 (m, 1H), 2,00-2,05 (m, 1H). LCMS: 399,1 ([M+1]+).
Пример 20. Соединение A346
(S)-3-(4-((4-(Морфолинометил)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A346:
A346A (119 мг, 0,58 ммоль) и соединение A308A (100 мг, 0,39 ммоль) растворяли в AcOH (2,5 мл) и DCM (2,5 мл), и раствор перемешивали в течение 1 часа при 30℃. Добавляли NaBH(OAc)3 (246 мг, 1,16 ммоль) и реакционную смесь перемешивали в течение 18 часов в атмосфере N2. TLC продемонстрировала завершение реакции. Растворитель удаляли и добавляли насыщ. водн. NaHCO3 (5 мл) для регулирования pH до значения 8. Смесь экстрагировали с помощью DCM (25 мл x 5) и объединенный органический слой высушивали над Na2SO4, фильтровали, концентрировали и растирали в порошок с помощью PE / EtOAc (1/1) (25 мл x 2) с получением 250 мг неочищенного продукта, который очищали с помощью преп-HPLC с получением A346 (140 мг, выход 80%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 11,00 (s, 1H), 7,16-7,33 (m, 5H), 6,90 (d, J = 7,2 Гц, 1H), 6,62 (d, J = 7,8 Гц, 1H), 6,33 (t, J = 5,7 Гц, 1H), 5,07-5,13 (m, 1H), 4,35 (d, J = 5,4 Гц, 2H), 4,29 (d, J = 17,1 Гц, 1H), 4,16 (d, J = 17,1 Гц, 1H), 3,53 (t, J = 4,5 Гц, 4H), 3,39 (s, 2H), 2,85-2,93 (m, 1H), 2,58-2,63 (m, 1H), 2,28-2,31 (m, 5H), 2,01-2,06 (m, 1H).
LCMS: 449,2 ([M+1]+).
Соединения в примерах 12-45 получали в соответствии с процедурой, описанной для примера 20, с соответствующим исходным материалом для замены A346A.
Пример 21. Соединение A359
3-(4-((2-Фтор-3-гидроксибензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A359:
1H ЯМР (DMSO-d6, 300 МГц): δ 10,96 (br, 1H), 9,79 (br, 1H), 7,21 (t, J = 7,8 Гц, 1H), 6,73-6,93 (m, 4H), 6,63 (d, J = 7,8 Гц, 1H), 6,25 (t, J = 6,0 Гц, 1H), 5,10 (dd, J = 13,2, 5,1 Гц, 1H), 4,37 (d, J = 5,7 Гц, 2H), 4,28 (d, J = 17,4 Гц, 1H), 4,15 (d, J = 17,4 Гц, 1H), 2,85-2,97 (m, 1H), 2,57-2,63 (m, 1H), 2,22-2,36 (m, 1H), 2,01-2,05 (m, 1H). LCMS: 384,1 ([M+1]+).
Пример 22. Соединение A360
3-(((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-4-ил)амино)метил)-2-фторбензонитрил, A360:
1H ЯМР (300 МГц, DMSO-d6): δ 11,03 (s, 1H), 7,81-7,86 (m, 1H), 7,71-7,76 (m, 1H), 7,36 (t, J = 7,8 Гц, 1H), 7,25 (t, J = 7,8 Гц, 1H), 6,97 (d, J = 7,5 Гц, 1H), 6,66 (d, J = 7,8 Гц, 1H), 6,41 (t, J = 5,7 Гц, 1H), 5,13, (dd, J = 12,9, 5,1 Гц, 1H), 4,50 (d, J = 5,7 Гц, 1H), 4,32 (d, J = 17,1 Гц, 1H), 4,19 (d, J = 17,1 Гц, 1H), 2,87-2,95 (m 1H), 2,50-2,65 (m 1H), 2,29-2,34 (m 1H), 2,02-2,07 (m 1H).
Пример 23. Соединение A361
3-(((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-4-ил)амино)метил)-2-фторбензамид, A361:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,02 (s, 1H), 7,75 (s, 1H), 7,63 (s, 1H), 7,45-7,53 (m, 2H), 7,16-7,27 (m, 2H), 6,96 (d, J = 7,2 Гц, 1H), 6,64 (d, J = 8,1 Гц, 1H), 6,35-6,38 (m, 1H), 5,13 (dd, J = 13,2, 4,8 Гц, 1H), 4,46 (d, J = 5,4 Гц, 2H), 4,33 (d, J = 17,4 Гц, 1H), 4,20 (d, J = 17,4 Гц, 1H), 2,87-2,98 (m, 1H), 2,60-2,65 (m, 1H), 2,25-2,39 (m, 1H), 2,03-2,07 (m, 1H). LCMS: 411,1 ([M+1]+).
Пример 24. Соединение A362
3-(((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-4-ил)амино)метил)-2-фтор-N-метилбензамид, A362:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,01 (s, 1H), 8,28 (d, J = 3,3 Гц, 1H), 7,46 (t, J = 7,2 Гц, 2H), 7,15-7,26 (m, 2H), 6,95 (d, J = 7,5 Гц, 1H), 6,63 (d, J = 8,4 Гц, 1H), 6,37 (t, J = 5,7 Гц, 1H), 5,12 (dd, J = 13,5, 4,8 Гц, 1H), 4,45 (d, J = 5,1 Гц, 2H), 4,32 (d, J = 17,4 Гц, 1H), 4,20 (d, J = 17,4 Гц, 1H), 2,87-2,99 (m, 1H), 2,78 (d, J = 4,8 Гц, 3H), 2,60-2,65 (m, 1H), 2,25-2,39 (m, 1H), 1,99-2,11 (m, 1H). LCMS: 425,1 ([M+1]+).
Пример 25. Соединение A363
3-(4-((5-(2-(Диметиламино)этокси)-2-фторбензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A363:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,02 (s, 1H), 7,24 (t, J = 8,1 Гц, 1H), 7,11 (t, J = 9,3 Гц, 1H), 6,90-6,96 (m, 2H), 6,80-6,86 (m, 1H), 6,65 (d, J = 8,4 Гц, 1H), 6,29 (t, J = 6,0 Гц,1H), 5,12 (dd, J = 13,2, 4,8 Гц, 1H), 4,29-4,39 (m, 3H), 4,19 (d, J = 17,1 Гц, 1H), 3,94 (t, J = 5,7 Гц, 2H), 2,87-2,99 (m, 1H), 2,51-2,65 (m, 3H), 2,24-2,38 (m, 1H), 2,15 (s, 6H), 2,00-2,10 (m, 1H). LCMS: 455,2 ([M+1]+).
Пример 26. Соединение A364
3-(4-((2-Фтор-5-гидроксибензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A364:
1H ЯМР (300 МГц, DMSO-d6): δ 11,01 (s, 1H), 9,24 (s, 1H), 7,22 (t, J = 7,8 Гц, 1H), 6,92-6,99 (m, 2H), 6,70-6,73 (m, 1H), 6,55-6,60 (m, 2H), 6,31 (t, J = 5,7 Гц, 1H), 5,11, (dd, J = 13,2, 5,1 Гц, 1H), 4,27-4,34 (m, 3H), 4,17 (d, J = 17,1 Гц, 1H), 2,86-2,96 (m 1H), 2,57-2,64 (m 1H), 2,24-2,33 (m 1H), 2,02-2,06 (m 1H).
Пример 27. Соединение A367
3-(4-((2-Фтор-3-метилбензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A367:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,03 (s, 1H), 7,14-7,26 (m, 3H), 6,93-7,04 (m, 2H), 6,64 (d, J = 7,5 Гц, 1H), 6,30 (br s, 1H), 5,09-5,16 (m, 1H), 4,42 (s, 2H), 4,31 (d, J = 17,4 Гц, 1H), 4,18 (d, J = 17,4 Гц, 1H), 2,89-2,98 (m, 1H), 2,59-2,65 (m, 1H), 2,25-2,46 (m, 4H), 2,02-2,07 (m, 1H). LCMS: 382,2 ([M+1]+).
Пример 28. Соединение A368
3-(4-((2-Фтор-5-(2-морфолиноэтокси)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A368:
1H ЯМР (DMSO-d6, 300 МГц): δ 10,98 (s, 1H), 7,23 (t, J = 7,5 Гц, 1H), 7,09 (t, J = 9,6 Гц, 1H), 6,79-6,95 (m, 3H), 6,64 (d, J = 7,5 Гц, 1H), 6,24 (br, 1H), 5,10 (dd, J = 13,2, 5,1 Гц, 1H), 4,36 (d, J = 5,7 Гц, 2H), 4,30 (d, J = 17,1 Гц, 1H), 4,18 (d, J = 17,1 Гц, 1H), 3,97 (t, J = 5,7 Гц, 2H), 3,51 (t, J = 4,5 Гц, 4H), 2,85-2,97 (m, 1H), 2,56-2,63 (m, 3H), 2,27-2,39 (m, 5H), 2,00-2,05 (m, 1H). LCMS: 497,2 ([M+1]+).
Пример 29. Соединение A369
3-(4-((2-Фтор-5-(3-морфолинопропокси)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A369:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,00 (s, 1H), 7,22 (t, J = 7,8 Гц, 1H), 7,09 (t, J = 9,3 Гц, 1H), 6,88-6,95 (m, 2H), 6,77-6,83 (m, 1H), 6,63 (d, J = 8,1 Гц, 1H), 6,27 (t, J = 5,7 Гц, 1H), 5,11 (dd, J = 13,2, 5,4 Гц, 1H), 4,36 (d, J = 5,7 Гц, 2H), 4,30 (d, J = 17,4 Гц, 1H), 4,17 (d, J = 17,4 Гц, 1H), 3,88 (t, J = 6,3 Гц, 2H), 3,52 (t, J = 3,9 Гц, 4H), 2,85-2,96 (m, 1H), 2,57-2,63 (m, 1H), 2,22-2,41 (m, 7H), 1,99-2,05 (m, 1H), 1,73-1,84 (m, 2H). LCMS: 511,2 ([M+1]+).
Пример 30. Соединение A370
3-(4-((2-Фтор-5-(2-метоксиэтокси)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A370:
1H ЯМР (300 МГц, DMSO-d6): δ 10,98 (s, 1H), 7,23 (t, J = 7,8 Гц, 1H), 7,06-7,12 (m, 1H), 6,90-6,95 (m, 2H), 6,79-6,84 (m, 1H), 6,64 (d, J = 8,1 Гц, 1H), 6,24 (t, J = 5,4 Гц, 1H), 5,10 (dd, J = 13,2, 5,1 Гц, 1H), 4,28-4,38 (m, 3H), 4,19 (d, J = 17,1 Гц, 1H), 3,96-3,99 (m, 2H), 3,55-3,58 (m, 2H), 3,23 (s, 3H), 2,85-2,95 (m 1H), 2,57-2,64 (m 1H), 2,24-2,36 (m 1H), 1,98-2,09 (m 1H).
Пример 31. Соединение A371
3-(((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-4-ил)амино)метил)-4-фторфенилметилкарбамат, A371:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,00 (s, 1H), 7,52-7,56 (m, 1H), 7,15-7,25 (m, 2H), 6,93-7,06 (m, 3H), 6,63 (d, J = 7,8 Гц, 1H), 6,28-6,32 (m, 1H), 5,10 (dd, J = 13,5, 4,5 Гц, 1H), 4,40 (d, J = 4,8 Гц, 2H), 4,30 (d, J = 17,4 Гц, 1H), 4,18 (d, J = 17,4 Гц, 1H), 2,84-2,97 (m, 1H), 2,59-2,69 (m, 4H), 2,23-2,37 (m, 1H), 1,99-2,08 (m, 1H). LCMS: 441,1 ([M+1]+).
Пример 32. Соединение A372
3-(4-((2-Фтор-3-(метиламино)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A372:
1H ЯМР (DMSO-d6, 300 МГц): δ 10,99 (s, 1H), 7,21 (t, J = 7,8 Гц, 1H), 6,85-6,92 (m, 2H), 6,63 (d, J = 8,1 Гц, 1H), 6,48-6,55 (m, 2H), 6,21 (t, J = 5,4 Гц, 1H), 5,48-6,49 (m, 1H), 5,09 (dd, J = 13,2, 5,1 Гц, 1H), 4,35 (d, J = 5,4 Гц, 2H), 4,27 (d, J = 17,4 Гц, 1H), 4,15 (d, J = 17,4 Гц, 1H), 2,85-2,97 (m, 1H), 2,69 (d, J = 4,5 Гц, 3H), 2,49-2,63 (m, 1H), 2,21-2,35 (m, 1H), 1,98-2,05 (m, 1H). LCMS=397,1 ([M+1]+)
Пример 33. Соединение A375
3-(4-((2-Фтор-5-(2-гидроксиэтокси)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A375:
1H ЯМР (DMSO-d6, 300 МГц): δ 9,35 (br s, 1H), 7,22 (t, J = 8,1 Гц, 1H), 7,10 (t, J = 9,3 Гц, 1H), 6,88-6,95 (m, 2H), 6,78-6,83 (m, 1H), 6,63 (d, J = 8,4 Гц, 1H), 6,31 (t, J = 6,0 Гц, 1H), 5,11 (dd, J = 13,5, 5,1 Гц, 1H), 4,82 (br s, 1H), 4,37 (d, J = 5,7 Гц, 2H), 4,30 (d, J = 17,1 Гц, 1H), 4,17 (t, J = 17,1 Гц, 1H), 3,85 (t, J = 4,8 Гц, 2H), 3,62 (t, J = 4,8 Гц, 2H), 2,85-2,97 (m, 1H), 2,55-2,65 (m, 1H), 2,24-2,36 (m, 1H), 2,01-2,05 (m, 1H). LCMS: 428,1 [(M+1)+].
Пример 34. Соединение A376
3-(4-((2-Фтор-5-(2-(пирролидин-1-ил)этокси)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A376:
1H ЯМР (300 МГц, DMSO-d6): δ 11,02 (s, 1H), 7,22 (t, J = 8,1 Гц, 1H), 7,06-7,13 (m, 1H), 6,89-6,95 (m, 2H), 6,78-6,84 (m, 1H), 6,63 (d, J = 7,8 Гц, 1H), 6,29 (t, J = 5,7 Гц, 1H), 5,11, (dd, J = 13,2, 5,1 Гц, 1H), 4,27-4,37 (m, 3H), 4,17 (d, J = 17,1 Гц, 1H), 3,94 (t, J = 6,0 Гц, 1H), 2,85-2,97 (m 1H), 2,57-2,69 (m 3H), 2,22-2,42 (m 5H), 1,98-2,06 (m 1H), 1,56-1,66 (m 4H).
Пример 35. Соединение A377
3-(4-((2-Фтор-5-(2-(4-метилпиперазин-1-ил)этокси)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A377:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,03 (s, 1H), 7,22 (t, J = 7,8 Гц, 1H), 7,09 (t, J = 9,6 Гц, 1H), 6,91-6,95 (m, 2H), 6,79-6,89 (m, 1H), 6,63 (d, J = 8,1 Гц, 1H), 6,29 (t, J = 6,0 Гц, 1H), 5,11 (dd, J = 13,5, 4,8 Гц, 1H), 4,27-4,37 (m, 3H), 4,17 (d, J = 17,4 Гц, 1H), 3,94 (t, J = 5,7 Гц, 2H), 2,85-2,98 (m, 1H), 2,55-2,62 (m, 4H), 2,20-2,42 (m, 8H), 2,12 (s, 3H), 1,98-2,07 (m, 1H). LCMS: 510,2 ([M+1]+).
Пример 36. Соединение A378
3-(((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-4-ил)амино)метил)-4-фторфенилдиметилкарбамат, A378:
1H ЯМР (300 МГц, DMSO-d6): δ 11,00 (s, 1H), 7,17-7,26 (m, 2H), 7,08-7,11 (m, 1H), 6,94-7,04 (m, 2H), 6,78-6,84 (m, 1H), 6,62 (d, J = 8,1 Гц, 1H), 6,30 (t, J = 5,9 Гц, 1H), 5,11, (dd, J = 13,2, 5,4 Гц, 1H), 4,40 (d, J = 5,7 Гц, 1H), 4,31 (d, J = 17,4 Гц, 1H), 4,18 (d, J = 17,4 Гц, 1H), 2,84-2,96 (m 7H), 2,57-2,63 (m 1H), 2,23-2,37 (m 1H), 2,00-2,05 (m 1H).
Пример 37. Соединение A382
3-(4-((2-Фтор-5-(3-морфолинопропокси)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A382:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,00 (s, 1H), 7,32 (t, J = 7,8 Гц, 1H), 7,22 (t, J = 7,8 Гц, 1H), 7,05-7,13 (m, 2H), 6,93 (d, J = 7,5 Гц, 1H), 6,64 (d, J = 7,8 Гц, 1H), 6,28 (t, J = 6,3 Гц, 1H), 5,07-5,13 (m, 1H), 4,38 (d, J = 5,7 Гц, 2H), 4,28 (d, J = 17,4 Гц, 1H), 4,16 (d, J = 17,4 Гц, 1H), 3,54 (t, J = 4,5 Гц, 4H), 3,42 (s, 2H), 2,85-2,97 (m, 1H), 2,57-2,63 (m, 1H), 2,26-2,38 (m, 5H), 2,00-2,09 (m, 1H). LCMS: 467,2 ([M+1]+).
Пример 38. Соединение A383
3-(4-((2-Фтор-5-(морфолинометил)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A383:
1H ЯМР (DMSO-d6, 300 МГц): δ 10,98 (br s, 1H), 7,34 (d, J = 0,9 Гц, 1H), 7,10-7,32 (m, 3H), 6,95 (d, J = 7,5 Гц, 1H), 6,64 (d, J = 7,8 Гц, 1H), 6,27 (br s, 1H), 5,12 (dd, J = 13,5, 5,1 Гц, 1H), 4,43 (d, J = 5,7 Гц, 2H), 4,32 (d, J = 17,1 Гц, 1H), 4,21 (d, J = 17,1 Гц, 1H), 3,45-3,48 (m, 4H), 3,38 (s, 2H), 2,87-2,99 (m, 1H), 2,30-2,36 (m, 1H), 2,23-2,25 (m, 4H), 2,22-2,36 (m, 1H), 2,01-2,09 (m, 1H). LCMS=467,2 [(M+1)+].
Пример 39. Соединение A381
3-(4-((2-Фтор-3-(морфолинометил)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A381:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,02 (s, 1H), 7,20-7,31 (m, 3H), 7,10 (t, J = 7,8 Гц, 1H), 6,95 (d, J = 7,5 Гц, 1H), 6,65 (d, J = 8,1 Гц, 1H), 6,31 (t, J = 5,7 Гц, 1H), 5,12 (dd, J1 = 13,8 Гц, J2 = 5,4 Гц, 1H), 4,43 (d, J = 5,4 Гц, 2H), 4,31 (d, J = 17,4 Гц, 1H), 4,19 (d, J = 17,4 Гц, 1H), 3,53-3,58 (m, 6H), 2,87-2,99 (m, 1H), 2,57-2,66 (m, 1H), 2,24-2,39 (m, 5H), 2,00-2,10 (m, 1H). LCMS=467,2 [(M+1)+].
Пример 40. Соединение A384
3-(4-((3-Амино-2-фторбензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A384:
1H ЯМР (DMSO-d6, 300 МГц): δ 9,76 (br s, 1H), 7,23 (t, J = 8,1 Гц, 1H), 6,93 (d, J = 7,5 Гц, 1H), 6,77 (t, J = 7,8 Гц, 1H), 6,61-6,67 (m, 2H), 6,49-6,54 (m 1H), 6,22 (t, J = 5,7 Гц, 1H), 5,09-5,15 (m, 3H), 4,35 (d, J = 5,4 Гц, 2H), 4,29 (d, J = 17,4 Гц, 1H), 4,17 (d, J = 17,4 Гц, 1H), 2,87-2,99 (m, 1H), 2,58-2,67 (m, 1H), 2,23-2,36 (m, 1H), 2,00-2,10 (m, 1H). LCMS=383,1 ([M+1]+).
Пример 41. Соединение A388
N-(3-(((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-4-ил)амино)метил)-2-фторфенил)ацетамид, A388:
1H ЯМР (DMSO-d6, 300 МГц): δ 10,96 (br s, 1H), 9,71 (s, 1H), 7,74 (t, J = 6,9 Гц, 1H), 7,22 (t, J = 7,8 Гц, 1H), 7,02-7,13 (m, 2H), 6,93 (d, J = 7,5 Гц, 1H), 6,64 (d, J = 7,8 Гц, 1H), 6,31 (t, J = 6,0 Гц, 1H), 5,10 (dd, J = 12,9, 5,1 Гц, 1H), 4,42 (d, J = 5,4 Гц, 2H), 4,29 (d, J = 17,1 Гц, 1H), 4,16 (d, J = 17,1 Гц, 1H), 2,85-2,95 (m, 1H), 2,55-2,64 (m, 1H), 2,22-2,36 (m, 1H), 1,99-2,07 (m, 4H). LCMS= 425,1 [(M+1)+].
Пример 42. Соединение A389
3-(((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-4-ил)амино)метил)-2-фторбензолсульфонамид, A389:
1H ЯМР (300 МГц, DMSO-d6): δ 11,02 (s, 1H), 7,85-7,88 (m, 1H), 7,73-7,78 (m, 1H), 7,39-7,45 (m, 3H), 7,24 (t, J = 7,8 Гц, 1H), 6,96 (d, J = 7,5 Гц, 1H), 6,63 (d, J = 8,1 Гц, 1H), 6,43 (t, J = 6,0 Гц, 1H), 5,11, (dd, J = 13,2, 5,1 Гц, 1H), 4,46 (d, J = 5,4 Гц, 2H), 4,29 (d, J = 17,4 Гц, 1H), 4,18 (d, J = 17,4 Гц, 1H), 2,85-2,97 (m 1H), 2,58-2,63 (m 1H), 2,24-2,36 (m 5H), 2,02-2,07 (m 1H).
Пример 43. Соединение A387
3-(4-((2-Фтор-5-(метиламино)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A387:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,02 (s, 1H), 7,22 (t, J = 7,5 Гц, 1H), 6,87-6,93 (m, 2H), 6,62 (d, J = 8,1 Гц, 1H), 6,50-6,53 (m, 1H), 6,31-6,36 (m, 1H), 6,25 (t, J = 5,7 Гц, 1H), 5,47-5,52 (m, 1H), 5,11 (dd, J = 4,8, 13,2 Гц, 1H), 4,25-4,30 (m, 3H), 4,15 (d, J = 17,4 Гц, 1H), 2,85-2,97 (m, 1H), 2,54-2,63 (m, 4H), 2,22-2,37 (m, 1H), 1,99-2,06 (m, 1H). LCMS: 397,21 ([M+1]+).
Пример 44. Соединение A396
3-(4-((2-Фтор-4-гидроксибензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A396:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,00 (br s, 1H), 9,74 (br s, 1H), 7,14-7,25 (m, 2H), 6,92 (d, J = 7,2 Гц, 1H), 6,66 (d, J = 8,1 Гц, 1H), 6,52-6,55 (m, 2H), 6,13 (t, J = 6,0 Гц, 1H), 5,07-5,13 (m, 1H), 4,24-4,29 (m, 3H), 4,14 (d, J = 17,1 Гц, 1H), 2,87-2,97 (m, 1H), 2,56-2,65 (m, 1H), 2,21-2,36 (m, 1H), 1,98-2,06 (m, 1H). LCMS: 384,1 [(M+1)+]
Пример 45. Соединение A391
[3-(4-((5-Амино-2-фторбензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион], A391
Стадия A: соединение A391G получали в соответствии со способом синтеза, показанным в примере 20, с соответствующими исходными материалами для замены A346A.
1H ЯМР (DMSO-d6, 400 МГц): δ 11,03 (s, 1H), 9,31 (s, 1H), 7,37-7,44 (m, 2H), 7,24 (t, J = 7,6 Гц, 1H), 7,09 (t, J = 9,2 Гц, 1H), 6,95 (d, J = 7,2 Гц, 1H), 6,62 (d, J = 8,0 Гц, 1H), 6,33 (t, J = 5,6 Гц, 1H), 5,11-5,16 (m, 1H), 4,36 (t, J = 5,2 Гц, 2H), 4,29 (d, J = 16,8 Гц, 1H), 4,19 (d, J = 17,2 Гц, 1H), 2,89-2,98 (m, 1H), 2,60-2,64 (m, 1H), 2,26-2,37 (m, 1H), 2,03-2,06 (m, 1H), 1,42 (s, 9H).
Стадия B: к раствору A391G (400 мг, 0,83 ммоль) в DCM (12 мл) добавляли CF3COOH (4 мл) и раствор перемешивали в течение 0,5 часа при 35oC. Растворитель удаляли и остаток растворяли с помощью 4 мл CH3CN и 100 мг Et3N, затем очищали с помощью преп-HPLC с получением A391 (130 мг, выход 41%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ 10,83 (s, 1H), 9,37 (t, J = 5,6 Гц, 1H), 8,03 (d, J = 8,8 Гц, 2H), 7,78-7,86 (m, 3H), 7,58 (s, 1H), 7,50 (d, J = 8,0 Гц, 2H), 7,17 (s, 1H), 4,64 (d, J = 5,6 Гц, 2H), 4,50-4,54 (m, 1H), 2,37-2,41 (m, 1H), 2,21-2,26 (m, 1H), 1,89-1,93 (m, 2H). LCMS: 523,1 ([M+1]+).
Пример 46. Соединение A397
3-(4-((5-Амино-2-фторбензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A397
Стадия A: соединение A397A получали в соответствии со способом синтеза, показанным в примере 20, с соответствующими исходными материалами для замены A346A.
1H ЯМР (DMSO-d6, 400 МГц): δ 11,04 (br s, 1H), 9,54 (br s, 1H), 7,38 (d, J = 12,8 Гц, 1H), 7,22-7,28 (m, 2H), 7,13 (d, J = 8,4 Гц, 1H), 6,94 (d, J = 7,6 Гц, 1H), 6,65 (d, J = 8,0 Гц, 1H), 6,24 (t, J = 5,6 Гц, 1H), 5,10-5,14 (m, 1H), 4,27-4,34 (m, 3H), 4,17 (d, J = 17,2 Гц, 1H), 2,89-2,97 (m, 1H), 2,64-2,67 (m, 1H), 2,25-2,36 (m, 1H), 2,03-2,06 (m, 1H), 1,46 (s, 9H).
Стадия B: к раствору соединения A397A (100 мг, 0,21 ммоль) в диоксане (20 мл) добавляли раствор 6 н. HCl в диоксане, смесь перемешивали в течение 2,5 ч. Реакционную смесь концентрировали, а остаток растворяли в DMF (10 мл) и регулировали значение pH=7-8 с помощью насыщ. NaHCO3, фильтровали. Фильтрат концентрировали и остаток очищали с помощью преп-HPLC с получением требуемого продукта A397 (35 мг, выход 44%) в виде светло-желтоватого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ 11,02 (br s, 1H), 7,24 (t, J = 8,4 Гц, 1H), 7,02 (t, J = 8,4 Гц, 1H), 6,93 (d, J = 7,6 Гц, 1H), 6,69 (d, J = 8,0 Гц, 1H), 6,04 (t, J = 5,6 Гц, 1H), 5,30 (br s, 2H), 5,09-5,14 (m, 1H), 4,25 (d, J = 17,2 Гц, 1H), 4,20 (d, J = 5,6 Гц, 1H), 4,14 (d, J = 17,2 Гц, 1H), 2,88-2,97 (m, 1H), 2,59-2,64 (m, 1H), 2,24-2,35 (m, 1H), 2,02-2,08 (m, 4H). LCMS: 383,2 [(M+1)+].
Пример 47. Соединение A373
(S)-3-Дейтерий-3-(4-((4-(морфолинометил)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A373:
Стадия A: к раствору A373C [4-(морфолинометил)бензальдегид] (0,8 г, 3,9 ммоль) и A356C (0,7 г, 2,5 ммоль) в MeOH (100 мл) добавляли AcOH (1 мл) и смесь перемешивали в течение ночи при 40oC в атмосфере N2. Затем к реакционной смеси добавляли Pd/C (50% воды, 10%, 150 мг) и дегазировали с помощью H2 3 раза. Смесь перемешивали в течение 5 часов при давлении водорода 1 атм. Реакционную смесь фильтровали, а фильтрат концентрировали и очищали с помощью RP-HPLC с получением A373A (1,0 г, выход 86%) в виде светло-желтого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 9,96 (br, 1H), 7,59 (s, 1H), 7,41-7,49 (m, 4H), 7,11-7,18 (m, 2H), 6,87 (d, J = 7,2 Гц, 1H), 6,54 (d, J = 8,1 Гц, 1H), 4,25-4,55 (m, 7H), 3,93 (d, J = 12,0 Гц, 2H), 3,58 (t, J = 12,3 Гц, 2H), 3,01-3,24 (m, 4H), 2,13-2,21 (m, 3H), 1,93-2,00 (m, 1H).
Стадия B: к раствору A373A (200 мг, 0,428 ммоль) в THF (12 мл) и DCM (12 мл) добавляли SOCl2 (204 мг, 1,71 ммоль в 1,7 мл DCM) при -40oC и смесь перемешивали при -40oC в течение 2 часов в атмосфере N2. Затем к реакционной смеси добавляли пиридин (135 мг, 1,71 ммоль) и перемешивали в течение 30 минут. Затем добавляли Et3N (173 мг, 1,71 ммоль) и обеспечивали нагревание реакционной смеси до комнатной температуры. Чтобы погасить реакцию, добавляли воду (0,5 мл) и смесь концентрировали и очищали с помощью преп-HPLC с обращенной фазой (подвижная фаза : вода/ацетонитрил) 2 раза с получением A373 (20 мг, выход 10%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 11,02 (s, 1H), 7,15-7,34 (m, 5H), 6,89 (d, J = 7,2 Гц, 1H), 6,61 (d, J = 7,8 Гц, 1H), 6,38 (t, J = 4,8 Гц, 1H), 5,08-5,14 (m, 0,04H), 4,35 (d, J = 5,1 Гц, 2H), 4,29 (d, J = 17,4 Гц, 1H), 4,16 (d, J = 17,4 Гц, 1H), 3,55 (br s, 4H), 3,42 (br.s, 2H), 2,85-2,98 (m, 1H), 2,57-2,63 (m, 1H), 2,24-2,34 (m, 5H), 1,99-2,05 (m, 1H).
LCMS: 450,2 ([M+1]+).
Пример 48. Соединение A374
2-(3-(((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-4-ил)амино)метил)-4-фторфенокси)этилпирролидин-1-карбоксилат, A374:
Стадия A: смесь пирролидина (3,77 г, 53 ммоль), 2-бромэтанола (6,25 г, 50 ммоль) и K2CO3 (6,9 г, 50 ммоль) в CH3CN (70 мл) нагревали до температуры флегмы и перемешивали в течение ночи в атмосфере N2. Реакционную смесь фильтровали и концентрировали, а также очищали с помощью колоночной хроматографии на силикагеле (DCM : MeOH = 100:1-10:1) с получением A374A (4 г, выход 50%) в виде светло-желтого масла.
1H ЯМР (CDCl3, 300 МГц): δ 4,25-4,28 (m, 2H), 3,80-3,85 (m, 2H), 3,36-3,43 (m, 4H), 2,92 (t, J = 5,7, 1H), 1,88-1,92 (m, 4H).
Стадия B: к раствору A374A (2,3 г, 14,4 ммоль) в CHCl3 (50 мл) добавляли SOCl2 (3,6 г, 30,0 ммоль) и реакционную смесь перемешивали в течение 1,5 ч. с обратным холодильником. Реакционную смесь концентрировали с получением неочищенного A374C (2,0 г, выход 78%) в виде белого твердого вещества.
1H ЯМР (CDCl3, 300 МГц): δ 4,21 (t, J = 5,7, 2H), 3,77 (t, J = 5,7, 2H), 3,21-3,32 (m, 4H), 1,75-1,83 (m, 4H).
Стадия C: смесь A374C (802 мг, 4,52 ммоль), 2-фтор-5-гидроксибензальдегида (280 мг, 2,0 ммоль) и K2CO3 (828 мг, 6,0 ммоль) в DMF (10 мл) нагревали до 90oC и перемешивали в течение ночи в атмосфере N2. Реакционную смесь вливали в ледяную воду (100 мл), перемешивали и фильтровали. Отфильтрованный осадок промывали водой (20 мл) и затем растворяли в EtOAc (50 мл), высушивали и концентрировали с получением продукта A374E (560 мг) в виде белого твердого вещества, которое использовали на следующей стадии без очистки.
1H ЯМР (CDCl3, 300 МГц): δ 10,32 (s, 1H), 7,31-7,34 (m, 1H), 7,09-7,17 (m, 2H), 4,42 (t, J = 5,1 Гц, 2H), 4,20 (t, J = 5,1 Гц, 2H) 3,30-3,41 (m, 4H), 1,85 (br s, 4H).
Стадия D: раствор A374E (206 мг, 0,732 ммоль), A308A (150 мг, 0,578 ммоль) и AcOH (6 мл) в дихлорметане (6 мл) перемешивали в течение 4 часов при комнатной температуре. Добавляли NaBH3CN (109 мг, 1,74 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи в атмосфере N2. Удаляли растворитель, а остаток растворяли в CH3CN и очищали с помощью преп-HPLC с получением A374 (105 мг, выход 35%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 11,00 (s, 1H), 7,20-7,25 (m, 1H), 7,11 (t, J = 9,3 Гц, 1H), 6,93-6,95 (m, 2H), 6,82-6,87 (m, 1H), 6,64 (d, J = 8,1 Гц, 1H), 6,24-6,29 (m, 1H), 5,11 (dd, J = 13,5, 5,1 Гц, 1H), 4,33-4,37 (m, 2H), 4,20-4,27 (m, 4H), 4,08-4,14 (m, 2H), 3,12-3,22 (m, 4H), 2,86-2,97 (m, 1H), 2,62-2,71 (m, 1H), 2,24-2,33 (m, 1H), 2,01-2,06 (m, 1H), 1,69-1,77 (m, 4H). LCMS: 525,2 ([M+1]+).
Пример 49. Соединение A349
[3-(4-((3,4-Диметоксибензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион], A349:
К раствору соединения A349A (100 мг, 0,23 ммоль) в DMF (5 мл) добавляли K2CO3 (47,0 мг, 0,34 ммоль), смесь перемешивали при 80oC (масляная баня) в течение ночи в атмосфере N2. TLC продемонстрировала завершение реакции. Реакционную смесь фильтровали и фильтрат концентрировали с получением остатка. Остаток очищали с помощью RP-HPLC с получением A349 (40 мг, выход 43%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 11,02 (s, 1H), 7,20 (t, J = 7,5 Гц, 1H), 7,01 (s, 1H), 6,85-6,92 (m, 3H), 6,68 (d, J = 7,8 Гц, 1H), 6,24-6,28(m, 1H), 5,08-5,14 (m, 1H), 4,25-4,33 (m, 3H), 4,18 (d, J = 17,1 Гц, 1H), 3,72 (s, 3H), 3,70 (s, 3H), 2,87-2,99 (m, 1H), 2,59-2,65 (m, 1H), 2,24-2,37 (m, 1H), 2,00-2,08 (m, 1H). LCMS: 410,2 ([M+1]+)
Пример 50. Соединение A350
3-(4-((3,4-Диметилбензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A350:
К раствору A350A (100 мг, 0,25 ммоль) в CH3CN (5 мл) добавляли CDI (62,0 мг, 0,38 ммоль), смесь перемешивали при 95oC (масляная баня) в течение ночи в атмосфере N2. TLC продемонстрировала завершение реакции. Реакционную смесь фильтровали и концентрировали с получением остатка. Остаток очищали с помощью RP-HPLC с получением A350 (61 мг, выход 65%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 11,01 (s, 1H), 7,15-7,21 (m, 2H), 7,04-7,10 (m, 2H), 6,91 (d, J = 7,2 Гц, 1H), 6,62 (d, J = 8,1 Гц, 1H), 6,27-6,31(m, 1H), 5,11 (dd, J = 13,2, 5,1 Гц, 1H), 4,28-4,33 (m, 3H), 4,18 (d, J = 17,7 Гц, 1H), 2,87-2,99 (m, 1H), 2,60-2,65 (m, 1H), 2,24-2,37 (m, 1H), 2,19 (s, 3H), 2,17 (s, 3H), 2,02-2,07 (m, 1H). LCMS: 378,2 ([M+1]+).
Соединения в примерах 51-55 получали в соответствии с процедурой, описанной в примере 50, с соответствующими исходными материалами для замены A350A.
Пример 51. Соединение A351
3-(4-((4-Фтор-3-метилбензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A351:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,02 (s, 1H), 7,29 (d, J = 6,0 Гц, 1H), 7,18-7,23 (m, 2H), 7,06 (t, J = 9,6 Гц, 1H), 6,92 (d, J = 7,2 Гц, 1H), 6,63 (d, J = 7,8 Гц, 1H), 6,34 (t, J = 6,0 Гц, 1H), 5,12 (dd, J = 13,2, 5,1 Гц, 1H), 4,28-4,33 (m, 3H), 4,18 (d, J = 17,4 Гц, 1H), 2,87-2,99 (m, 1H), 2,59-2,65 (m, 1H), 2,26-2,37 (m, 1H), 2,21 (s, 3H), 2,01-2,08 (m, 1H). LCMS: 382,1 ([M+1]+).
Пример 52. Соединение A352
3-(4-((3-Хлор-4-метилбензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A352:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,01 (s, 1H), 7,41 (s, 1H), 7,17-7,30 (m, 3H), 6,92 (d, J = 7,5 Гц, 1H), 6,61(d, J = 8,1 Гц, 1H), 6,39 (t, J = 6,0 Гц, 1H), 5,12 (dd, J = 13,2, 5,4 Гц, 1H), 4,29-4,37 (m, 3H), 4,18 (d, J = 17,1 Гц, 1H), 2,87-2,99 (m, 1H), 2,59-2,65 (m, 1H), 2,25-2,39 (m, 4H), 2,02-2,07 (m, 1H). LCMS: 398,1 ([M+1]+).
Пример 53. Соединение A353
3-(4-((3-Фтор-4-метилбензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A353:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,02 (s, 1H), 7,11-7,24 (m, 4H), 6,92 (d, J = 7,2 Гц, 1H), 6,61 (d, J = 7,5 Гц, 1H), 6,36-6,40 (m, 1H), 5,12 (dd, J = 13,5, 5,1 Гц, 1H), 4,29-4,37 (m, 3H), 4,19 (d, J = 17,4 Гц, 1H), 2,86-2,99 (m, 1H), 2,59-2,65 (m, 1H), 2,24-2,39 (m, 1H), 2,18 (s, 3H), 2,01-2,07 (m, 1H). LCMS: 382,1 ([M+1]+).
Пример 54. Соединение A354
3-(4-((3-Хлор-4-метоксибензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A354:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,02 (s, 1H), 7,44 (d, J = 1,8 Гц, 1H), 7,32 (dd, J = 8,4, 1,8 Гц, 1H), 7,21 (t, J = 7,8 Гц, 1H), 7,09 (d, J = 8,7 Гц, 1H), 6,93 (d, J = 7,2 Гц, 1H), 6,65 (d, J = 8,1 Гц, 1H), 6,35 (t, J = 5,9 Гц, 1H), 5,09-5,15 (m, 1H), 4,28-4,33 (m, 3H), 4,18 (d, J = 16,8 Гц, 1H), 3,81 (s, 3H), 2,87-2,99 (m, 1H), 2,58-2,67 (m, 1H), 2,24-2,37 (m, 1H), 2,01-2,09 (m, 1H). LCMS: 414,1 ([M+1]+).
Пример 55. Соединение A355
3-(4-((3,5-Диметоксибензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A355:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,03 (s, 1H), 7,18-7,24 (m, 1H), 6,92 (d, J = 7,5 Гц, 1H), 6,64 (d, J = 8,4 Гц, 1H), 6,55 (d, J = 2,1 Гц, 2H), 6,31-6,35 (m, 2H), 5,12 (dd, J = 13,2, 4,8 Гц, 1H), 4,28-4,34 (m, 3H), 4,19 (d, J = 16,8 Гц, 1H), 3,33 (s, 6H), 2,87-2,99 (m, 1H), 2,58-2,67 (m, 1H), 2,26-2,37 (m, 1H), 2,02-2,08 (m, 1H). LCMS: 410,2 ([M+1]+).
Пример 56. Соединение A356
(S)-3-Дейтерий-3-(4-((2-фтор-4-метоксибензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A356:
Стадия A: к раствору A356C (300 мг, 1,08 ммоль) и 2-фтор-4-метоксибензальдегида (249 мг, 1,62 ммоль) в MeOH (30 мл) добавляли ледяную AcOH (0,5 мл), смесь перемешивали при 30oC (масляная баня) в течение 5 часов. Добавляли Pd/C (10%, 100 мг, 50% воды) и перемешивали при 30oC (масляная баня) в течение ночи в атмосфере H2 (баллон). Pd/C удаляли с помощью фильтрации и фильтрат концентрировали с получением остатка. Остаток очищали с помощью флэш-хроматографии на C18 (CH3CN: H2O = 5% - 35%, 30 мин.; 35% - 45%, 30 мин.; 45% - 55% 20 мин.), затем сушили сублимацией с получением A356A (160 мг, выход 35%) в виде светло-желтоватого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 12,06 (br s, 1H), 7,55 (br s, 1H), 7,29 (t, J = 9,0 Гц, 1H), 7,16-7,22 (m, 2H), 6,88 (d, J = 7,5 Гц, 1H), 6,80 (dd, J = 12,6, 2,4 Гц, 1H), 6,71 (dd, J = 8,7, 2,7 Гц, 1H), 6,61 (d, J = 8,1 Гц, 1H), 6,28 (t, J = 6,0 Гц, 1H), 4,68-4,74 (m, 0,01H), 4,48 (d, J = 17,7 Гц, 1H), 4,23-4,31 (m, 3H), 3,72 (s, 3H), 2,10-2,19 (m, 3H), 1,93-2,01 (m, 1H).
Стадия B: к раствору A356A (160 мг, 0,39 ммоль) в сухом DCM (20 мл), охлажденному до -40oC, в атмосфере N2 к смеси медленно добавляли SOCl2 (229 мг, 1,92 ммоль) при -40oC в атмосфере N2, затем добавляли раствор DMF (5 мг) в DCM (1 мл). Реакционную смесь перемешивали при -40oC в течение 2 ч., по каплям добавляли пиридин (152 мг, 1,92 ммоль), перемешивали в течение 40 минут при данной температуре, добавляли Et3N (195 мг, 1,92 ммоль) и затем реакционную смесь перемешивали при -40oC в течение 2 ч. LCMS продемонстрировала завершение реакции. Чтобы погасить реакцию, добавляли H2O (10 мл), водный слой экстрагировали с помощью DCM (30 мл x 2), объединенную органическую фазу промывали солевым раствором (50 мл), высушивали над Na2SO4, фильтровали, концентрировали с получением остатка. Остаток очищали с помощью флэш-хроматографии на C18 (CH3CN: H2O = 5% - 35%, 30 мин.; 35% - 45%, 30 мин.; 45% - 55% 20 мин.) с получением A356 (70 мг, выход 46%, ee: 97%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 10,99 (br s, 1H), 7,31 (t, J = 9,0 Гц, 1H), 7,24 (t, J = 7,8 Гц, 1H), 6,94 (d, J = 7,2 Гц, 1H), 6,82 (dd, J = 12,3, 2,7 Гц, 1H), 6,71-6,75 (m, 1H), 6,68 (d, J = 7,8 Гц, 1H), 6,20 (t, J = 6,0 Гц, 1H), 5,08-5,14 (m, 0,04H), 4,26-4,35 (m, 3H), 4,17 (d, J = 16,8 Гц, 1H), 3,74 (s, 3H), 2,87-2,97 (m, 1H), 2,57-2,66 (m, 1H), 2,25-2,34 (m, 1H), 2,00-2,09 (m, 1H). LCMS: 399,1 ([M+1]+).
Соединение в примере 57 получали в соответствии с процедурой, описанной в примере 56, с соответствующим исходным материалом для замены 2-фтор-4-метоксибензальдегида на стадии A.
Пример 57. Соединение A357
(S)-3-Дейтерий-3-(4-((2-фтор-3-метоксибензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A357:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,00 (br s, 1H), 7,21 (t, J = 7,8 Гц, 1H), 7,00-7,07 (m, 2H), 6,89-6,93 (m, 2H), 6,78-6,84 (m, 1H), 6,61 (d, J = 8,4 Гц, 1H), 6,30 (t, J = 5,4 Гц, 1H), 5,07-5,13 (m, 0,03H), 4,40 (d, J = 5,7 Гц, 2H), 4,28 (d, J = 17,1 Гц, 1H), 4,16 (d, J = 17,1 Гц, 1H), 3,81 (s, 3H), 2,85-2,97 (m, 1H), 2,57-2,63 (m, 1H), 2,24-2,34 (m, 1H), 2,00-2,06 (m, 1H). LCMS: 399,1 ([M+1]+).
Пример 58. Соединение A379
(S)-3-Дейтерий-3-(4-((2-фтор-5-метоксибензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A379:
Стадия A: к смеси A379A1 (10,0 г, 27,8 ммоль) и A379A2 (8,01 г, 33,4 ммоль) в CH3CN (250 мл) добавляли DIPEA (7,92 г, 61,3 ммоль), смесь перемешивали при 45oC в течение ночи в атмосфере N2. Реакционную смесь концентрировали и добавляли DCM (300 мл) и H2O (100 мл), водную фазу экстрагировали с помощью DCM (200 мл x 1), объединенную органическую фазу промывали солевым раствором (200 мл), высушивали над Na2SO4, фильтровали, концентрировали с получением неочищенного продукта A379A (12,3 г) в виде желтого твердого вещества.
Стадия B: к раствору A379A (12,3 г, неочищенный) в THF (100 мл) добавляли 1 н. TBAF в THF (100 мл), смесь перемешивали в течение ночи при 25℃. LCMS продемонстрировала завершение реакции. Добавляли EtOAc (200 мл) и H2O (200 мл), водную фазу экстрагировали с помощью EtOAc (200 мл x 2), объединенную органическую фазу промывали солевым раствором (300 мл), высушивали над Na2SO4, фильтровали, концентрировали с получением остатка. Остаток растирали в порошок с помощью EtOAc (20 мл), фильтровали, промывали с помощью EtOAc (10 мл), затем высушивали с получением A379B (5,7 г) в виде белого твердого вещества. Фильтрат концентрировали и очищали с помощью колоночной хроматографии на силикагеле (PE / EtOAc = 1:4) с получением дополнительных 1,5 г A379B в виде белого твердого вещества; (общий выход 77%, в течение двух стадий).
1H ЯМР (DMSO-d6, 300 МГц): δ 10,01 (s, 1H), 7,54 (br s, 1H), 7,29 (t, J = 7,8 Гц, 1H), 7,12-7,16 (m, 2H), 6,96 (dd, J = 8,1, 0,6 Гц, 1H), 4,66-4,71 (m, 0,01H), 4,47 (d, J = 17,7 Гц, 1H), 4,29 (d, J = 17,7 Гц, 1H), 2,08-2,17 (m, 3H), 1,95-2,02 (m, 1H), 1,31 (s, 9H).
Стадия C: к раствору A379B (1,18 г, 3,52 ммоль) и 2-(хлорметил)-1-фтор-4-метоксибензола (1,23 г, 7,04 ммоль) в DMF (20 мл) добавляли K2CO3 (972 мг, 7,03 ммоль), смесь перемешивали в течение ночи при комнатной температуре. LCMS продемонстрировала завершение реакции. Реакционную смесь концентрировали и добавляли EtOAc (50 мл) и H2O (30 мл), водную фазу экстрагировали с помощью EtOAc (50 мл), объединенную органическую фазу промывали солевым раствором (50 мл), высушивали над Na2SO4, фильтровали, концентрировали с получением остатка. Остаток очищали с помощью колоночной хроматографии на силикагеле (MeOH/DCM = 1/30) с получением белого продукта (1,46 г, выход 87%). Белое твердое вещество подвергали хиральному разделению с получением A379C (650 мг) и A379D (650 мг).
Условия хирального разделения
Подвижная фаза: гексан/EtOH = 40/60 (об./об.), концентрация образца: 100 мг/мл в подвижной фазе; колонка: CHIRALPAK IC; 20 мм (I.D) x 250 мм (L); 5 мкм; температура: 35℃; объем введения: 250 мкл; расход: 10 мл/мин.; длина волны: 205 нм.
A379C: 1H ЯМР (DMSO-d6, 300 МГц): δ 7,55 (br s, 1H), 7,46 (t, J = 8,1 Гц, 1H), 7,28-7,34 (m, 2H), 7,11-7,21 (m, 3H), 6,92-6,97 (m, 1H), 5,22 (s, 2H), 4,49 (d, J = 18,0 Гц, 1H), 4,36 (d, J = 18,0 Гц, 1H), 3,73 (s, 3H), 2,05-2,13 (m, 3H), 1.96-2,02 (m, 1H), 1,30 (s, 9H).
Стадия D: к раствору A379C (650 мг, 1,37 ммоль) в DCM (20 мл) при 0oC по каплям добавляли TFA (10 мл), смесь нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь концентрировали при сниженном давлении (в вакууме). Остаток растворяли в CH3CN (4 мл) и очищали с помощью флэш-хроматографии на C18 (40% ацетонитрил в воде), затем сушили сублимацией с получением A379E (566 мг, выход 99%) в виде светло-желтоватого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 12,08 (br s, 1H), 7,58 (br s, 1H), 7,46 (t, J = 8,1 Гц, 1H), 7,28-7,35 (m, 2H), 7,11-7,21 (m, 3H), 6,92-6,97 (m, 1H), 5,22 (s, 2H), 4,51 (d, J = 17,7 Гц, 1H), 4,37 (d, J = 17,7 Гц, 1H), 3,73 (s, 3H), 2,08-2,20 (m, 3H), 1,96-2,05 (m, 1H).
Стадия E: к раствору A379E (366 мг, 0,88 ммоль) в сухом DCM (35 мл) и THF (5 мл) в атмосфере N2 при -40oC медленно добавляли SOCl2 (522 мг, 4,39 ммоль), а затем раствор DMF (5 мг) в DCM (1 мл). Реакционную смесь перемешивали при -40oC в течение 1 ч., добавляли пиридин (347 мг, 4,39 ммоль), через 40 мин. добавляли Et3N (444 мг, 4,39 ммоль) и затем смесь перемешивали в течение 1 ч. при -40oC. LCMS продемонстрировала завершение реакции. H2O (10 мл) добавляли, чтобы погасить реакцию, водный слой экстрагировали с помощью DCM (50 мл), объединенную органическую фазу промывали солевым раствором (50 мл), высушивали над Na2SO4, фильтровали, концентрировали с получением остатка. Неочищенный продукт очищали с помощью C18 с получением A379 (270 мг, выход 77%, ee: 100%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 10,96 (br s, 1H), 7,49 (t, J = 8,1 Гц, 1H), 7,32-7,38 (m, 2H), 7,11-7,21 (m, 2H), 6,91-6,97 (m, 1H), 5,23 (s, 2H), 5,06-5,12 (m, 0,01H), 4,37 (d, J = 17,4 Гц, 1H), 4,21 (d, J = 17,4 Гц, 1H), 3,72 (s, 3H), 2,82-2,94 (m, 1H), 2,57-2,60 (m, 1H), 2,38-2,48 (m, 1H), 1,92-1,97 (m, 1H). LCMS=400,1 ([M+1]+).
Соединение в примере 59 получали в соответствии с процедурой, описанной в примере 58, с соответствующим исходным материалом для замены 2-(хлорметил)-1-фтор-4-метоксибензола на стадии C.
Пример 59. Соединение A380
(S)-3-Дейтерий-3-(4-((2-фтор-3-метоксибензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A380:
1H ЯМР (DMSO-d6, 300 МГц): δ 10,95 (br s, 1H), 7,49 (t, J = 7,8 Гц, 1H), 7,31-7,37 (m, 2H), 7,07-7,19 (m, 3H), 5,26 (s, 2H), 5,05-5,11 (m, 0,01H), 4,36 (d, J = 17,4 Гц, 1H), 4,20 (d, J = 17,4 Гц, 1H), 3,83 (s, 3H), 2,82-2,94 (m, 1H), 2,51-2,60 (m, 1H), 2,37-2,46 (m, 1H), 1,92-1,99 (m, 1H). LCMS=400,1 ([M+1]+).
Пример 60. Соединение A393
(S)-3-Дейтерий-3-(4-((2-фтор-4-метоксибензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A393:
Стадия A: к раствору A379B (2,0 г, 6,0 ммоль) в DCM (30 мл) добавляли TFA (5 мл), после перемешивания в течение 3 часов при 25oC реакционную смесь концентрировали с получением остатка (1,7 г). Остаток (1,7 г) растворяли в DMF (5 мл) и обрабатывали 2-(триметилсилил)этанолом (3,55 г, 30 ммоль), EDCI (2,3 г, 12,0 ммоль) и DMAP (733 мг, 6,0 ммоль). Реакционную смесь перемешивали в течение ночи при 35oC и затем концентрировали. Остаток очищали с помощью колоночной хроматографии на силикагеле (DCM/MeOH = 40:1) с получением A393A (1,6 г, 70%).
1H ЯМР (DMSO-d6, 300 МГц): δ 9,99 (s, 1H), 7,54 (s, 1H), 7,28 (t, J = 7,8 Гц, 1H), 7,11-7,14 (m, 2H), 6,96 (d, J = 7,8 Гц, 1H), 4,47 (d, J = 18,0 Гц, 1H), 4,28 (d, J = 18,0 Гц, 1H), 3,92-3,99 (m, 2H), 2,00-2,25 (m, 4H), 0,80-0,85 (m, 2H), 0,04 (s, 9H).
Стадия B: к раствору A393A (1,02 г, 2,70 ммоль) в DMF (20 мл) добавляли K2CO3 (750 мг, 5,40 ммоль) и 1-хлорметил-2-фтор-4-метоксибензол (720 мг, 4,10 ммоль), эту смесь нагревали до 30oC и перемешивали в течение 17 часов, затем эту смесь фильтровали и концентрировали с получением неочищенного масла, которое очищали с помощью колоночной хроматографии на силикагеле (DCM/MeOH = 60/1) с получением A393C (1,0 г, 72%).
1H ЯМР (DMSO-d6, 300 МГц): δ 7,43-7,54 (m, 3H), 7,26-7,35 (m, 2H), 7,14 (s, 1H), 6,80-6,90 (m, 2H), 5,16 (s, 2H), 4,45 (d, J = 17,4 Гц, 1H), 4,30 (d, J = 17,4 Гц, 1H), 3,92-3,98 (m, 2H), 3,77 (s, 3H), 2,01-2,22 (m, 4H), 0,79-0,84 (m, 2H).
Стадия C: хиральное разделение
Условия хирального разделения
Подвижная фаза: MeOH / EtOH = 50/50 (об./об.); образец: 120 мг/мл в подвижной фазе; колонка: IF; 20 мм (I.D) x 250 мм (L); 5 мкм; температура: 35oC; объем введения: 300 мкл; расход: 9 мл/мин.; длина волны: 205 нм.
A393E
1H ЯМР (DMSO-d6, 300 МГц): δ 7,59 (s, 1H), 7,45-7,54 (m, 2H), 7,36 (d, J = 7,8 Гц, 1H), 7,29 (d, J = 7,2 Гц, 1H), 7,20 (s, 1H), 6,80-6,92 (m, 2H), 5,18 (s, 2H), 4,47 (d, J = 17,4 Гц, 1H), 4,32 (d, J = 17,4 Гц, 1H), 3,92-4,01 (m, 2H), 3,78 (s, 3H), 2,01-2,20 (m, 4H), 0,80-0,85 (m, 2H), 0,04 (s, 9H).
Стадия D: к раствору A393E (500 мг, 0,97 ммоль) в THF (5 мл) добавляли TBAF (1 н./THF, 5 мл), эту смесь перемешивали при 50oC в течение ночи, фильтровали и концентрировали, остаток очищали с помощью колоночной хроматографии (C18) с получением промежуточного продукта (420 мг). К раствору данного промежуточного продукта (300 мг) в DCM (15 мл) и DMF (1 мл) при -40oC добавляли SOCl2 (428 мг, 3,60 ммоль). Реакционную смесь перемешивали в течение 2 часов, добавляли пиридин (281 мг, 3,60 ммоль), смесь перемешивали в течение еще 30 мин., а затем добавляли Et3N (363 мг, 3,60 ммоль) и перемешивали в течение дополнительного 1 ч. при -40oC. Реакционную смесь обрабатывали водой (80 мл) и экстрагировали с помощью DCM (80 мл x 3), объединяли органические слои и высушивали над Na2SO4, фильтровали и концентрировали, а также очищали с помощью преп-HPLC с получением A393 (200 мг, 72%, в течение двух стадий).
1H ЯМР (DMSO-d6, 300 МГц): δ 10,95 (s, 1H), 7,48-7,53 (m, 2H), 7,32-7,40 (m, 2H), 6,80-6,91 (m, 2H), 5,19 (s, 2H), 4,35 (d, J = 17,4 Гц, 1H), 4,19 (d, J = 17,4 Гц, 1H), 3,78 (s, 3H), 2,84-2,96 (m, 1H), 2,37-2,59 (m, 2H), 1,93-1,99 (m, 1H). LCMS: 400,1 ([M+1]+).
Соединение из примера 61 получали в соответствии с процедурой, описанной для примера 60, с соответствующим исходным материалом для замены соединения A393E.
Пример 61. Соединение A392
(R)-3-Дейтерий-3-(4-((2-фтор-4-метоксибензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A392:
1H ЯМР (DMSO-d6, 300 МГц): δ 10,95 (s, 1H), 7,48-7,53 (m, 2H), 7,32-7,40 (m, 2H), 6,80-6,91 (m, 2H), 5,19 (s, 2H), 5,07-5,13 (m, 0,05H), 4,35 (d, J = 17,7 Гц, 1H), 4,19 (d, J = 17,7 Гц, 1H), 3,78 (s, 3H), 2,84-2,96 (s, 1H), 2,36-2,59 (m, 2H), 1,93-1,98 (m, 1H). LCMS: 400,1 ([M+1]+).
Пример 62. Соединение A385
3-(4-((2-Фтор-3-(метиламино)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A385:
Стадия A: к раствору (2-фтор-3-(метиламино)фенил)метанола в DCM (10 мл) добавляли SOCl2 (0,5 мл), смесь перемешивали в течение 4 ч. Реакционную смесь концентрировали с получением неочищенного продукта 3-(хлорметил)-2-фтор-N-метиланилина гидрохлорида (430 мг) в виде желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
1H ЯМР (DMSO-d6, 300 МГц): δ 9,97 (br s, 2H), 7,05 (t, J = 8,1 Гц, 1H), 6,84-6,92 (m, 2H), 4,72 (s, 2H), 2,74 (s, 3H).
Стадия B: к раствору A329B (300 мг, 1,03 ммоль) в DMF (10 мл) добавляли 3-(хлорметил)-2-фтор-N-метиланилина гидрохлорид (259 мг) и K2CO3 (355 мг, 2,57 ммоль), смесь перемешивали в течение ночи. LCMS продемонстрировала, что реакция не была завершена. Добавляли дополнительный 3-(хлорметил)-2-фтор-N-метиланилина гидрохлорид (150 мг) и K2CO3 (100 мг, 0,72 ммоль), и смесь перемешивали в течение ночи. Реакционную смесь концентрировали, а также добавляли EtOAc (20 мл) и H2O (10 мл). Водный слой экстрагировали с помощью EtOAc (20 мл x 2), объединенный органический слой промывали солевым раствором (20 мл), высушивали над Na2SO4, фильтровали, концентрировали с получением остатка. Остаток очищали с помощью преп-TLC (петролейный эфир / EtOAc = 1/4) с получением соединения A385A (242 мг, выход 55%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 7,55 (br s, 1H), 7,45 (t, J = 7,8 Гц, 1H), 7,27-7,33 (m, 2H), 7,15 (br s, 1H), 6,99 (t, J = 8,1 Гц, 1H), 6,61-6,71 (m, 2H), 5,59 (br s, 1H), 5,20 (s, 2H), 4,70 (dd, J = 10,5, 4,5 Гц, 1H), 4,47 (d, J = 17,7 Гц, 1H), 4,33 (d, J = 17,7 Гц, 1H), 3,48 (s, 3H), 2,71 (d, J = 4,2 Гц, 3H), 2,12-2,25 (m, 3H), 1,99-2,09 (m, 1H).
Стадия C: к раствору A385A (242 мг, 0,56 ммоль) в DMF (10 мл) добавляли K2CO3 (234 мг, 1,69 ммоль), смесь перемешивали в течение ночи при 80oC. Реакционную смесь концентрировали при сниженном давлении и остаток очищали с помощью преп-HPLC, затем сушили сублимацией с получением A385 (100 мг, выход 45%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 10,71 (br s, 1H), 7,50 (t, J = 8,1 Гц, 1H), 7,32-7,38 (m, 2H), 7,00 (t, J = 7,8 Гц, 1H), 6,63-6,72 (m, 2H), 5,61-5,62 (m, 1H), 5,23 (s, 2H), 5,10 (dd, J = 13,2, 5,1 Гц, 1H), 4,37 (d, J = 17,7 Гц, 1H), 4,21 (d, J = 17,7 Гц, 1H), 2,84-2,96 (m, 1H), 2,72 (d, J = 4,8 Гц, 3H), 2,51-2,60 (m, 1H), 2,37-2,47 (m, 1H), 1,93-2,00 (m, 1H). LCMS=398,1 ([M+1]+)
Соединения в примерах 63-66 получали в соответствии с процедурой, описанной для примера 62, с соответствующими исходными материалами для замены 3-(хлорметил)-2-фтор-N-метиланилина гидрохлорида на стадии B.
Пример 63. Соединение A390
3-(4-((2-Фтор-5-(метиламино)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A390:
1H ЯМР (DMSO-d6, 300 МГц): δ 10,97 (s, 1H), 7,48 (t, J = 7,8 Гц, 1H), 7,33 (t, J = 7,2 Гц, 2H), 6,96 (t, J = 9,3 Гц, 1H), 6,63-6,66 (m, 1H), 6,46-6,51 (m, 1H), 5,58-5,63 (m, 1H), 5,16 (s, 2H), 5,06-5,12 (m, 1H), 4,35 (d, J = 17,4 Гц, 1H), 4,19 (d, J = 17,4 Гц, 1H), 2,83-2,95 (m, 1H), 2,54-2,62 (m, 4H), 2,34-2,45 (m, 1H), 1,91-1,99 (m, 1H). LCMS: 398,1 ([M+1]+).
Пример 64. Соединение A398
3-(4-((2-Фтор-5-(морфолинометил)бензил)окси)-1-оксоизоиндолин-2-ил)-пиперидин-2,6-дион, A398:
1H ЯМР (DMSO-d6, 300 МГц): δ 10,92 (br s, 1H), 7,46-7,51 (m, 2H), 7,31-7,37 (m, 3H), 7,16-7,22 (m, 1H), 5,27 (s, 2H), 5,05-5,11 (m, 1H), 4,35 (d, J = 17,4 Гц, 1H), 4,20 (d, J = 17,4 Гц, 1H), 3,50-3,53 (m, 4H), 3,43 (s, 2H), 2,82-2,92 (m, 1H), 2,53-2,60 (m, 1H), 2,34-2,44 (m, 1H), 2,23-2,29 (m, 4H), 1,90-2,00 (m, 1H). LCMS=468,2 [(M+1)+].
Пример 65. Соединение A399
3-(4-((2-Фтор-3-(морфолинометил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A399:
1H ЯМР (DMSO-d6, 300 МГц): δ 10,98 (s, 1H), 7,49-7,54 (m, 2H), 7,34-7,45 (m, 3H), 7,19-7,24 (m, 1H), 5,29 (s, 2H), 5,08-5,14 (m, 1H), 4,39 (d, J = 17,7 Гц, 1H), 4,22 (d, J = 17,7 Гц, 1H), 3,50-3,57 (m, 6H), 2,84-2,98 (m, 1H), 2,54-2,60 (m, 1H), 2,34-2,47 (m, 5H), 1,92-2,01 (m, 1H). LCMS: 468,2 ([M+1]+).
Пример 66. Соединение A407
3-(4-((2-Фтор-4-(морфолинометил)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A407:
Стадия A: к раствору A327A (300 мг, 0,85 ммоль) и 4-(4-(хлорметил)-3-фторбензил)морфолина гидрохлорида (359 мг, 1,28 ммоль) в DMF (15 мл) добавляли K2CO3 (352 мг, 2,55 ммоль), смесь перемешивали в течение ночи при 40oC. Реакционную смесь фильтровали и фильтрат концентрировали с получением остатка. Остаток очищали с помощью преп-TLC (MeOH / DCM = 1/15) с получением белого твердого вещества A407B (430 мг, выход 90%).
1H ЯМР (DMSO-d6, 300 МГц): δ 7,51-7,56 (m, 2H), 7,33 (dd, J = 11,4, 1,5 Гц, 1H), 7,17-7,21 (m, 3H), 7,07 (dd, J=7,5, 1,5 Гц, 1H), 5,24 (s, 2H), 4,66-4,69 (m, 1H), 4,44 (d, J = 17,7 Гц, 1H), 4,32 (d, J = 17,7 Гц, 1H), 3,55-3,58 (m, 4H), 3,48 (s, 2H), 2,29-2,39 (m, 4H), 2,05-2,18 (m, 3H), 1,95-2,01 (m, 1H), 1,29 (s, 9H).
Стадия B: к раствору A407B (430 мг, 0,77 ммоль) в DCM (20 мл) по каплям добавляли TFA (5 мл) при комнатной температуре, смесь перемешивали в течение 3 часов при 25oC. LCMS продемонстрировала завершение реакции. Реакционную смесь концентрировали при сниженном давлении (в вакууме) с получением A407C (387 мг, выход 100%) в виде желтого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 10,33 (br s, 1H), 7,71 (t, J = 7,8 Гц, 1H), 7,61 (s, 1H), 7,33-7,47 (m, 3H), 7,19 (s, 1H), 7,09-7,11 (m, 1H), 5,31 (s, 2H), 4,69-4,72 (m, 1 H), 4,48 (d, J = 17,7 Гц, 1H), 4,38 (s, 2H), 4,35 (d, J = 17,7 Гц, 1H), 3,89-3,99 (m, 2H), 3,57-3,67 (m, 2H), 3,14-3,34 (m, 4H), 2,10-2,17 (m, 3H), 1,95-2,01 (m, 1H).
Стадия C: к раствору A407C (215 мг, 0,39 ммоль) в CH3CN (15 мл) добавляли CDI (190 мг, 1,17 ммоль), смесь нагревали с обратным холодильником в течение ночи в атмосфере N2. LCMS продемонстрировала завершение реакции. Реакционную смесь концентрировали с получением остатка и очищали с помощью преп-HPLC с получением A407 (80 мг, выход 43%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 10,96 (br s, 1H), 7,51-7,56 (m, 1H), 7,34-7,39 (m, 1H), 7,11-7,21 (m, 3H), 5,25 (s, 2H), 5,05-5,11 (m, 1H), 4,33 (d, J = 18,0 Гц, 1H), 4,16 (d, J = 18,0 Гц, 1H), 3,54-3,57 (m, 4H), 3,48 (s, 2H), 2,82-2,94 (m, 1H), 2,49-2,56 (m, 1H), 2,30-2,44 (m, 5H), 1,91-1,99 (m, 1H). LCMS=486,2 ([M+1]+).
Пример 67. A403
(S)-3-Дейтерий-3-(4-((2-фтор-5-(морфолинометил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A403:
Стадия A: к раствору соединения A379B (1,0 г, 3,59 ммоль) и 4-(3-(хлорметил)-4-фторбензил)морфолина гидрохлорида (1,23 г, 7,05 ммоль) в DMF (20 мл) добавляли K2CO3 (972 мг, 7,04 ммоль), смесь перемешивали в течение ночи при 25℃. Фильтровали и фильтрат концентрировали с получением остатка. Остаток очищали с помощью колоночной хроматографии на силикагеле с получением белого твердого вещества A403A (1,3 г, выход 80%).
1H ЯМР (DMSO-d6, 300 МГц): δ 7,54 (br s, 1H), 7,43-7,49 (m, 2H), 7,28-7,34 (m, 3H), 7,14-7,22 (m, 2H), 5,26 (s, 2H), 4,67-4,72 (m, 0,05H), 4,50 (d, J = 17,4 Гц, 1H), 4,33 (d, J = 17,4 Гц, 1H), 3,49-3,56 (m, 4H), 3,44 (s, 2H), 2,25-2,34 (m, 4H), 2,09-2,15 (m, 3H), 1,94-2,03 (m, 1H), 1,29 (s, 9H).
Стадия B: хиральное разделение
Осуществляли хиральное разделение A403A с получением A403C (500 мг) и A403E (500 мг).
Условия хирального разделения Подвижная фаза: гексан / IPA = 70/30 (об./об.); концентрация образца: 100 мг/мл; колонка: CHIRALPAK IA; 30 мм (I.D) x 250 мм (L); 5 мкм, температура: 35oC; длина волны: 205 нм; введение: 250 мкл; расход: 50 мл/мин.
A403C
(S)-Трет-бутил-5-амино-4-дейтерий-4-(4-((2-фтор-5-(морфолинометил)бензил)окси)-1-оксоизоиндолин-2-ил)-5-оксопентаноат:
1H ЯМР (DMSO-d6, 300 МГц): δ 7,55 (br s, 1H), 7,43-7,49 (m, 2H), 7,28-7,34 (m, 3H), 7,16-7,22 (m, 2H), 5,26 (s, 2H), 4,66-4,71 (m, 1H), 4,49 (d, J = 17,4 Гц, 1H), 4,33 (d, J = 17,4 Гц, 1H), 3,51-3,53 (m, 4H), 3,43 (s, 23H), 2,26-2,33 (m, 4H), 2,02-2,16 (m, 3H), 1,94-1,99 (m, 1H), 1,29 (s, 9H).
Стадия C: к раствору A403C (500 мг, 1,0 ммоль) в DCM (12 мл), охлажденному до 0oC, по каплям добавляли TFA (3 мл), смесь медленно нагревали до 25oC и перемешивали в течение ночи. Реакционную смесь концентрировали при сниженном давлении (в вакууме). Остаток растворяли в CH2Cl2 (20 мл) и добавляли насыщ. NaHCO3 для регулирования значения pH=8-9, смесь концентрировали и остаток очищали с помощью флэш-хроматографии на C18 (CH3CN: H2O = 5-40%, 40 мин.) с получением A403D (400 мг, выход 82%) в виде светло-желтоватого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц):δ 7,93 (br s, 1H), 7,41-7,49 (m, 2H), 7,26-7,32 (m, 3H), 7,16-7,22 (m, 1H), 7,06 (br s, 1H), 5,25 (s, 2H), 5,05-5,13 (m, 0,00H), 4,60 (d, J = 17,7 Гц, 1H), 4,30 (d, J = 17,7 Гц, 1H), 3,50-3,52 (m, 4H), 3,42 (s, 2H), 2,22-2,32 (m, 4H), 2,03-2,10 (m, 1H), 1,81-1,94 (m, 3H).
Стадия D: к раствору A403D (400 мг, 0,82 ммоль) в сухом DMF (1 мл), сухом DCM (40 мл) и THF (20 мл), охлажденному до -40oC, в атмосфере N2 к смеси медленно добавляли SOCl2 (488 мг, 4,1 ммоль) при -40oC. Реакционную смесь перемешивали в течение 1 ч. и затем добавляли пиридин (324 мг, 4,1 ммоль), через 40 мин. добавляли Et3N (415 мг, 4,1 ммоль), а затем смесь перемешивали в течение 1 ч. LCMS продемонстрировала завершение реакции. Чтобы погасить реакцию, добавляли DCM (50 мл) и H2O (2 мл), водный слой экстрагировали с помощью DCM (50 мл x 2), объединенную органическую фазу промывали солевым раствором (50 мл), высушивали над Na2SO4, фильтровали, концентрировали с получением остатка. Неочищенный продукт очищали с помощью C18 (CH3CN : H2O = 5% - 45%, 40 мин.) с получением A403 (300 мг, выход 78%, ee: 99%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 10,96 (br s, 1H), 7,46-7,51 (m, 2H), 7,31-7,37 (m, 3H), 7,16-7,22 (m, 1H), 5,27 (s, 2H), 5,05-5,13 (m, 0,04H), 4,35 (d, J = 17,7 Гц, 1H), 4,19 (d, J = 17,7 Гц, 1H), 3,5,-3,53 (m, 4H), 3,43 (s, 2H), 2,82-2,94 (m, 1H), 2,49-2,58 (m, 1H), 2,36-2,41 (m, 1H), 2,26-2,32 (m, 4H), 1,91-1,98 (m, 1H). LCMS=469,2 ([M+1]+).
Соединения в примерах 68 и 69 получали в соответствии с процедурой, описанной для примера 67, с соответствующими исходными материалами для замены 4-(3-(хлорметил)-4-фторбензил)морфолина гидрохлорида.
Пример 68. Соединение A404
(S)-3-Дейтерий-3-(4-((2-фтор-3-(морфолинометил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A404:
1H ЯМР (DMSO-d6, 300 МГц): δ 10,94 (s, 1H), 7,45-7,53 (m, 2H), 7,31-7,42 (m, 3H), 7,17-7,21 (m, 1H), 5,28 (s, 2H), 4,37 (d, J = 18,0 Гц, 1H), 4,21 (d, J = 18,0 Гц, 1H), 3,51-3,62 (m, 6H), 2,82-2,95 (m, 1H), 2,57-2,62 (m, 1H), 2,28-2,42 (m, 5H), 1,91-2,01 (m, 1H). LCMS: 469,2 ([M+1]+).
Пример 69. Соединение A406
(S)-3-Дейтерий-3-(4-((2-фтор-4-(морфолинометил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A406:
1H ЯМР (DMSO-d6, 300 МГц): δ 10,98 (s, 1H), 7,47-7,55 (m, 2H), 7,31-7,38 (m, 2H), 7,16-7,20 (m, 2H), 5,24 (s, 2H), 5,06-5,12 (m, 0,04H), 4,35 (d, J = 18,0 Гц, 1H), 4,19 (d, J = 18,0 Гц, 1H), 3,55 (br, 4H), 3,47 (s, 2H), 2,82-2,94 (m, 1H), 2,48-2,57 (m, 1H), 2,33-2,42 (m, 5H), 1,91-1,96 (m, 1H). LCMS: 469,2 ([M+1]+).
Пример 70. Соединение A400
(S)-3-Дейтерий-3-(4-((2-фтор-3-(морфолинометил)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A400:
Стадия A: к раствору соединения A356C (400 мг, 1,44 ммоль) в MeOH (30 мл) добавляли 2-фтор-3-(морфолинометил)бензальдегид (481 мг, 2,16 ммоль) и AcOH (0,5 мл). Реакционную смесь перемешивали в течение ночи при 30oC, затем добавляли Pd/C (150 мг, 10%, 50% воды) в атмосфере H2, смесь перемешивали в течение 3 часов, фильтровали и концентрировали с получением продукта A400A (580 мг).
1H ЯМР (DMSO-d6, 300 МГц): δ 7,57 (br s, 1H), 7,06-7,31 (m, 5H), 6,88-6,90 (m, 1H), 6,58-6,60 (m, 1H), 6,37 (s, 1H), 4,26-4,54 (m, 4H), 3,47-3,66 (m, 6H), 2,23-2,37 (m, 4H), 2,07-2,15 (m, 3H), 1,85-1,97 (m, 1H).
Стадия B: к раствору неочищенного A400A (480 мг, 0,99 ммоль) в DCM (20 мл), охлажденному до -40oC, добавляли DMF (1 мл), затем добавляли SOCl2 (589 мг, 4,95 ммоль) и перемешивали в течение 2 часов, добавляли пиридин (383 мг, 4,95 ммоль), смесь перемешивали в течение 30 мин., а затем добавляли Et3N (501 мг, 4,95 ммоль). Реакционную смесь перемешивали в течение еще 1 часа при -40oC и затем гасили водой (80 мл), экстрагировали с помощью DCM (80 мл x 3). Объединенную органическую фазу высушивали над Na2SO4, фильтровали и концентрировали с получением неочищенного масла, которое очищали с помощью колоночного хроматографа на силикагеле (DCM / MeOH = 40/1) с получением продукта A400 (251 мг, 54%).
1H ЯМР (DMSO-d6, 300 МГц): δ 11,02 (s, 1H), 7,20-7,31 (m, 3H), 7,10 (t, J = 7,8 Гц, 1H), 6,95 (d, J = 7,5 Гц, 1H), 6,65 (d, J = 7,8 Гц, 1H), 6,29-6,32 (m, 1H), 5,09-5,15 (m, 0,05H), 4,43 (d, J = 5,1 Гц, 2H), 4,31 (d, J = 17,1 Гц, 1H), 4,19 (d, J = 17,1 Гц, 1H), 3,49-3,64 (m, 6H), 2,87-2,99 (m, 1H), 2,58-2,65 (m, 1H), 2,25-2,44 (m, 5H), 2,01-2,06 (m, 1H). LCMS: 468,2 ([M+1]+).
Соединения в примерах 71 и 72 получали в соответствии с процедурой, описанной для примера 70, с соответствующими исходными материалами для замены 2-фтор-3-(морфолинометил)бензальдегида на стадии A.
Пример 71. Соединение A401
(S)-3-Дейтерий-3-(4-((2-фтор-5-(морфолинометил)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион A401:
1H ЯМР (DMSO-d6, 400 МГц): δ 11,03 (br s, 1H), 7,32 (d, J = 6,8 Гц, 1H), 7,12-7,23 (m, 3H), 6,94 (d, J = 7,6 Гц, 1H), 6,62 (d, J = 8,0 Гц, 1H), 6,34 (t, J = 6,0 Гц, 1H), 5,11-5,16 (m, 0,4H), 4,42 (d, J = 5,6 Гц, 2H), 4,31 (d, J = 16,8 Гц, 1H), 4,20 (d, J = 17,2 Гц, 1H), 3,42-3,49 (m, 4H), 3,37 (s, 2H), 2,89-2,98 (m, 1H), 2,58-2,67 (m, 1H), 2,28-2,35 (m, 1H), 2,18-2,26 (m, 4H), 2,02-2,06 (m, 1H). LCMS: 468,2 [(M+1)+].
Пример 72. Соединение A402
(S)-3-Дейтерий-3-(4-((2-фтор-4-(морфолинометил)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A402:
1H ЯМР (DMSO-d6, 300 МГц): δ 11,01 (s, 1H), 7,30-7,35 (m, 1H), 7,22 (t, J = 7,8 Гц, 1H), 7,05-7,13 (m, 2H), 6,92 (d, J = 7,5 Гц, 1H), 6,64 (d, J = 8,1 Гц, 1H), 6,27-6,31 (m, 1H), 5,08-5,14 (m, 0,05H), 4,38 (d, J = 5,4 Гц, 2H), 4,28 (d, J = 17,4 Гц, 1H), 4,16 (d, J = 17,4 Гц, 1H), 3,54 (br s, 4H), 3,42 (s, 2H), 2,85-2,97 (m, 1H), 2,56-2,62 (m, 1H), 2,24-2,31 (m, 5H), 1,98-2,06 (m, 1H). LCMS: 468,2 ([M+1]+).
Пример 73. Соединение A405
3-(6-Фтор-4-((4-(морфолинометил)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A405:
Стадия A: к раствору DMSO (156 мг, 2,0 ммоль) в DCM (10 мл) при -70oC в атмосфере N2 добавляли (COCl)2 (152 мг, 1,2 ммоль). Реакционную смесь перемешивали в течение 30 минут при -70oC. Добавляли раствор (4-(морфолинометил)фенил)метанола (207 мг, 1,0 ммоль) в DCM (3 мл) и реакционную смесь перемешивали в течение 1 часа. К реакционной смеси по каплям добавляли Et3N (405 мг, 4,0 ммоль) и смесь перемешивали в течение 1 часа при -70oC, затем обеспечивали повышение температуры до 25oC, реакционную смесь гасили с помощью H2O (10 мл) и добавляли раствор NaHCO3 (5 мл). Смесь разделяли и водный слой экстрагировали с помощью 10 мл DCM. Объединенный органический слой концентрировали и очищали посредством колоночной хроматографии (PE : EtOAc = 2:1) с получением A405A (180 мг, выход 88%) в виде светло-желтого масла.
1H ЯМР (CDCl3, 300 МГц): δ 9,99 (s, 1H), 7,84 (d, J = 7,8 Гц, 2H), 7,51 (d, J = 8,1 Гц, 2H), 3,70-3,73 (m, 4H), 3,57 (s, 2H), 2,46 (t, J = 4,2 Гц, 4H).
Стадия B: к раствору A405A (111 мг, 0,54 ммоль) и I-28 (100 мг, 0,36 ммоль) в DCM (6 мл) добавляли HOAc (6 мл) и реакционную смесь перемешивали в течение 3 часов при 25oC. Добавляли NaBH3CN (45 мг, 0,72 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли дополнительное A405A (40 мг, 0,14 ммоль) и смесь перемешивали при 40oC в течение 6 часов. Растворитель удаляли и добавляли раствор NaHCO3 (10 мл) и DCM (25 мл), и разделяли. Водный слой экстрагировали с помощью DCM (20 мл x 2). Объединенный органический слой концентрировали и очищали с помощью преп-HPLC, затем сушили сублимацией с получением твердого вещества, которое добавляли к 5 мл насыщ. раствора NaHCO3 для регулирования значения pH=8, а затем экстрагировали с помощью DCM (5 мл x 5), органический раствор объединяли, концентрировали с получением A405 (50 мг, выход 30%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 11,01 (s, 1H), 7,23-7,33 (m, 4H), 6,72 (br s, 1H), 6,60 (dd, J = 1,8 Гц, 7,5 Гц, 1H), 6,42 (dd, J = 2,1 Гц, 12,6 Гц, 1H), 5,09 (dd, J = 5,1 Гц, 13,2 Гц, 1H), 4,35 (d, J = 5,4 Гц, 2H), 4,27 (d, J = 17,4 Гц, 1H), 4,14 (d, J = 17,4 Гц, 1H), 3,53 (br s, 4H), 3,41 (s, 2H), 2,84-2,96 (m, 1H), 2,57-2,63 (m, 1H), 2,21-2,31 (m, 5H), 2,01-2,05 (m, 1H). LCMS: 467,2 ([M+1]+).
Пример 74. Соединение A386
3-(4-((2-Фтор-4-(морфолинометил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A386:
Стадия A: к раствору (2-фтор-4-(морфолинометил)фенил)метанола (1,0 г, 4,4 ммоль) в хлороформе (25 мл) добавляли SOCl2 (1,1 г, 9,2 ммоль) и смесь нагревали до температуры флегмы в течение 2 часов. Растворитель удаляли в вакууме и совместно выпаривали с хлороформом (25 мл x 2) с получением A386A (1,2 г, выход 97%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 400 МГц): δ 11,98 (br s, 1H), 7,70 (d, J = 10,8 Гц, 1H), 7,63 (t, J = 8,0 Гц, 1H), 7,70 (d, J =7,6 Гц, 1H), 4,82 (s, 2H), 4,37 (d, J = 4,8 Гц, 2H), 3,86-3,93 (m, 4H), 3,07-3,21 (m, 4H).
Стадия B: смесь A386A и A386B (0,8 г, 2,4 ммоль), K2CO3 (1,3 г, 9,6 ммоль) в DMF (20 мл) дегазировали с помощью N2, а также нагревали до 40oC и перемешивали в течение 18 часов. Реакционную смесь вливали в 100 мл ледяной воды и экстрагировали с помощью EtOAc (20 мл x 5). Объединенный органический слой промывали с помощью 20 мл воды, 20 мл солевого раствора и высушивали над Na2SO4, фильтровали, концентрировали и очищали с помощью колоночной хроматографии на силикагеле (PE : EtOAc = 2:1-1:1) с получением A386C (1,2 г, выход 92%) в виде белого твердого вещества.
1H ЯМР (CDCl3, 300 МГц): δ 7,37-7,47 (m, 3H), 7,10-7,16 (m, 3H), 6,30 (br s, 1H), 5,33 (br s, 1H), 5,18 (s, 2H), 4,86-4,91 (m, 1H), 4,36-4,51 (m, 2H), 3,71-3,74 (m, 4H), 3,51 (s, 2H), 2,45-2,48 (m, 4H), 2,09-2,40 (m, 4H), 1,42 (s, 9H).
Стадия C: к раствору A386C (1,2 г, 2,2 ммоль) в DCM (30 мл) добавляли TFA (15 мл) и перемешивали при 35oC в течение 2 часов. Реакционную смесь концентрировали и очищали с помощью преп-HPLC с получением A386E (1,4 г, выход 64%) в виде светло-желтого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 12,05 (br s, 1H), 7,56 (br s, 2H), 7,47 (t, J = 8,1 Гц, 1H), 7,29-7,36 (m, 4H), 7,15-7,22 (m, 1H), 5,25 (s, 2H), 4,68-4,73 (m, 1H), 4,50 (d, J = 17,7 Гц, 1H), 4,36 (d, J = 17,7 Гц, 1H), 3,56-3,60 (m, 6H), 2,26-2,45 (m, 2H), 1,94-2,16 (m, 4H), 1,72-1,77 (m, 2H).
Стадия D: к раствору A386E (421 мг, 0,867 ммоль) в DCM / THF (50 мл/5 мл) при -40oC добавляли SOCl2 (516 мг, 4,33 ммоль, в виде раствора в 10 мл DCM). Смесь перемешивали при от -40oC до -20oC в течение 2 часов и добавляли пиридин (339 мг, 4,33 ммоль), и реакционную смесь перемешивали при -40oC в течение 0,5 часа. Добавляли Et3N (438 мг, 4,33 ммоль) и медленно обеспечивали нагревание смеси до 25oC. Добавляли H2O (0,5 мл) и затем фильтровали. Отфильтрованный осадок растворяли с помощью CH3CN (5 мл), а нерастворенное твердое вещество отфильтровывали и удаляли CH3CN с получением неочищенного продукта. Слой DCM реакционной смеси промывали водой (25 мл x 2) и солевым раствором (25 мл), и концентрировали с получением дополнительного неочищенного продукта. Объединенный неочищенный продукт очищали дважды с помощью преп-HPLC с получением A386 (105 мг, выход 26%) в виде белого твердого вещества.
1H ЯМР (DMSO-d6, 300 МГц): δ 10,95 (s, 1H), 7,49-7,58 (m, 2H), 7,34-7,40 (m, 2H), 7,17-7,21 (m, 2H), 5,26 (s, 2H), 5,07-5,13 (m, 1H), 4,38 (d, J = 17,7 Гц, 1H), 4,22 (d, J = 17,7 Гц, 1H), 3,58 (br s, 4H), 3,49 (br s, 2H), 2,84-2,96 (m, 1H), 2,56-2,60 (m, 1H), 2,30-2,43 (m, 5H), 1,92-2,02 (m, 1H).
Пример 75. Соединение A425
3-Дейтерий-3-(4-((2-фтор-5-(морфолинометил)бензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A425:
Соединение A425 в примере 75 получали в соответствии с процедурой, описанной в примере 67, с рацемическим A403A в качестве подходящего исходного материала.
1H ЯМР (DMSO-d6, 300 МГц): δ 10,95 (s, 1H), 7,49-7,57 (m, 2H), 7,33-7,40 (m, 2H), 7,18-7,22 (m, 2H), 5,26 (s, 2H), 4,37 (d, J = 17,7 Гц, 2H), 4,21 (d, J = 17,7 Гц, 1H), 3,58-3,62 (m, 4H), 3,49 (s, 2H), 2,84-2,96 (m, 1H), 2,27-2,58 (m, 6H), 1,93-1,99 (m, 1H). LCMS=469,2 ([M+1]+).
Пример 76. Соединение A427
3-Дейтерий-3-(4-((4-((2,6-диметилморфолино)метил)-2-фторбензил)окси)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A427:
Соединение A427 в примере 76 получали в соответствии с процедурой, описанной в примере 67, с подходящим исходным материалом для замены 4-(3-(хлорметил)-4-фторбензил)морфолина гидрохлорида.
1H ЯМР (DMSO-d6, 300 МГц): δ 10,97 (s, 1H), 7,49-7,58 (m, 2H), 7,34-7,41 (m, 2H), 7,17-7,21 (m, 2H), 5,26 (s, 2H), 4,38 (d, J = 17,7 Гц, 1H), 4,21 (d, J = 17,7 Гц, 1H), 3,54-3,61 (m, 2H), 3,47 (s, 2H), 2,84-2,96 (m, 1H), 2,53-2,68 (m, 3H), 2,38-2,44 (m, 1H), 1,93-1,99 (m, 1H), 1,66 (t, J = 10,5 Гц, 2H), 1,02 (d, J = 6,0 Гц, 6H). LCMS: 497,2 ([M+1]+).
Пример 77. Соединение A426
3-Дейтерий-3-(4-((2-фтор-4-(морфолинометил)бензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A426:
Соединение A426 в примере 77 получали в соответствии с процедурой, описанной в примере 70, с рацемическим A400A в качестве подходящего исходного материала.
1H ЯМР (DMSO-d6, 300 МГц): δ 11,00 (s, 1H), 7,32 (t, J = 8,1 Гц, 1H), 7,22 (t, J = 7,8 Гц, 1H), 7,05-7,13 (m, 2H), 6,93 (d, J = 7,5 Гц, 1H), 6,64 (d, J = 8,1 Гц, 1H), 6,27 (t, J = 6,0 Гц, 1H), 5,07-5,13 (m, 0,01H), 4,38 (d, J = 5,4 Гц, 2H), 4,28 (d, J = 17,1 Гц, 1H), 4,16 (d, J = 17,1 Гц, 1H), 3,52-3,55 (m, 4H), 3,42 (s, 2H), 2,85-2,97 (m, 1H), 2,56-2,65 (m, 1H), 2,23-2,35 (m, 5H), 1,99-2,06 (m, 1H). LCMS: 468,2 ([M+1]+).
Пример 78. Соединение A428
3-Дейтерий-3-(4-((4-((2,6-диметилморфолино)метил)-2-фторбензил)амино)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион, A428:
Соединение A428 в примере 78 получали в соответствии с процедурой, описанной в примере 70, с подходящим исходным материалом для замены 2-фтор-3-(морфолинометил)бензальдегида на стадии A.
1H ЯМР (DMSO-d6, 300 МГц): δ 11,02 (s, 1H), 7,34 (t, J = 7,8 Гц, 1H), 7,24 (t, J = 7,8 Гц, 1H) 7,06-7,13 (m, 2H), 6,95 (d, J = 7,5 Гц, 1H), 6,67 (d, J = 7,8 Гц, 1H), 6,28 (t, J = 5,7 Гц, 1H), 4,40 (d, J = 5,1 Гц, 2H), 4,30 (d, J = 17,1 Гц, 1H), 4,18 (d, J = 17,1 Гц, 1H), 3,52-3,61 (m, 2H), 3,42 (s, 2H), 2,87-2,99 (m, 1H), 2,59-2,65 (m, 3H), 2,35-2,25 (m, 1H), 2,01-2,06 (m, 1H), 1,63 (t, J = 10,5 Гц, 2H), 1,01 (d, J = 6,0 Гц, 6H). LCMS: 496,2 ([M+1]+).
Примеры эффекта
Анализ ингибирования активности TNF-α
Собирали периферическую кровь от здоровых волонтеров, а собирали с помощью пробирок с антикоагулянтом EDTA. После 5-кратного разбавления средой 1640 (Gibco, № по каталогу 11875-093, США), кровь добавляли в 96-луночные планшеты для культуры клеток (Costar, № по каталогу 3599, США), а затем обрабатывали с помощью 10 мкл раствора соединения общей формулы (I) по настоящему изобретению в DMSO (Sigma, № по каталогу D2650, США). Конечная концентрация соединения составляла 100 нМ, а конечная концентрация DMSO составляла 0,2%. После инкубации в течение 60 минут в инкубаторе при 37°C в 5% CO2, 10 мкл LPS (Sigma, № по каталогу L-2880, США) добавляли в реакционную систему и конечная концентрация составляла 10 нг/мл. После дополнительного культивирования в течение 6 часов в инкубаторе при 37°C в 5% CO2, собирали надосадочную жидкость. Содержание TNF-α определяли с помощью ELISA (BD Biosciences, № по каталогу 555212, США). Коэффициент поглощения определяли при OD450 нм с помощью планшет-ридера, с OD 650 нм в качестве стандарта. Контроль, раствор, содержащий 0,2% среду DMSO, представлял собой 0% ингибирование. Записывали исходные данные и стандартные кривые. Кривую ингибирования с четырьмя параметрами лекарственного средства строили с помощью программного обеспечения XL-fit и рассчитывали скорость ингибирования каждого соединения, как показано в таблице 1.
Анализ пролиферации клеток
Клетки MM.1S (клетки миеломы) (ATCC, № по каталогу CRL-2974) высевали 1,8 x 103 на лунку в 96-луночный планшет для культуры клеток, содержащий среду RPMI-1964 (Gibco, № по каталогу A10491-01), и инкубировали в инкубаторе в течение 24 часов при 37°C в 5% CO2. Соединения получали в виде 20 мМ исходных растворов с DMSO (Sigma, № по каталогу D2650) и разбавляли средой до требуемой концентрации (конечная концентрация DMSO составляла 0,5%), а затем добавляли в каждую лунку, инкубировали в инкубаторе в течение 72 часов при 37°C в 5% CO2. Затем 20 мкл MTS (Promega, № по каталогу G3581) добавляли в каждую лунку и дополнительно инкубировали в течение 1-4 часов в инкубаторе при 37°C в 5% CO2. OD490 нм определяли с использованием OD650 нм в качестве стандарта. Контроль, раствор, содержащий 0,5% среду DMSO, представлял собой 0% ингибирование. Использовали GraphPad Prism 5, обеспечивали изменение углового коэффициента с целью получения кривой зависимости доза-эффект и рассчитывали значения IC50, более подробно показанные в таблице 2.
Примечание: A: <300 нМ; B : ≥300 нМ
Анализ пролиферации клеток CTG
Клетки Rec-1 (клетки лимфомы из клеток мантийной зоны) (ATCC, № по каталогу CRL-3004), клетки Namalwa.CSN/70 (клетки лимфомы Беркитта) (DSMZ, № по каталогу ACC-70) и клетки WSU-DLCL-2 (клетки диффузной В-крупноклеточной лимфомы) (DSMZ, № по каталогу ACC-575) высевали (5-15) x 103 на лунку в 96-луночный планшет с прозрачным дном и белыми стенками (Corning, № по каталогу CLS3903), содержащий определенную среду. Планшет помещали в инкубатор и инкубировали в течение 24 часов при 37°C в 5% CO2. Соединения получали в виде 150 мМ исходных растворов с DMSO (Sigma, № по каталогу 276855) и разбавляли средой до требуемой концентрации (конечная концентрация DMSO составляла 0,2%), а затем добавляли в каждую лунку, инкубировали в инкубаторе в течение 72-120 часов при 37°C в 5% CO2. Затем в каждую лунку добавляли 100 мкл реактива для анализа активности клеток CellTiter-Glo® (Promega, № по каталогу G7570). Перемешивание продолжали в течение 10 минут на шейкере, чтобы вызвать цитолиз. 96-Луночный планшет оставляли при комнатной температуре на 10 минут, чтобы сделать люминесцентный сигнал стабильным. Белую пленочную основу приклеивали на дно культурального планшета. Для тестирования планшета использовали EnSpire. Данные обрабатывали с помощью программного обеспечения XLfit и получали значения IC50, и более подробно они показаны в таблице 3.
Примечание: A: <100 нМ; B: 100-400 нМ; C: 401 нМ - 300 мкМ; D: >300 мкМ.
Следует понимать, что вышеизложенное описание предпочтительных вариантов осуществления предназначено исключительно для иллюстрации принципов настоящего изобретения, а не для полного его описания, и что изменения и варианты будут очевидны для специалистов в данной области техники, и что настоящее изобретение не предназначено для ограничения, кроме явно изложенного в следующей формуле изобретения.
Claims (110)
1. Производное изоиндолина, имеющее структуру общей формулы (I), его фармацевтически приемлемая соль, рацемат или изотопное соединение:
при этом в общей формуле (I) n1 выбран из 0 или 1;
каждый из R1, R3, R4, R5, R6, R7, R8 и R9 независимо выбран из Н или D;
R2 выбран из Н, D или F;
каждый из L1 и L2 независимо выбран из CD2, CHD или СН2;
X выбран из NH, ND или О;
R10 представляет собой Н, D или где каждый из R2', R3', R4' и R5' независимо выбран из Н, D, галогена, циано, гидрокси, замещенного или незамещенного (С1-С12)алкила, замещенного или незамещенного (С1-С12)алкокси, (С2-С6)гетероциклоалкила или дейтерированного (С2-С6)гетероциклоалкила; где каждый из Ra и Rb независимо представляет собой Н, (С1-С12)алкил, (С1-С12)алкилацил; каждый из Rc и Rd независимо представляет собой Н или (С1-С12)алкил; Re представляет собой причем каждый из Re1 и Re2 независимо представляет собой Н или (С1-С12)алкил; заместитель, содержащийся в замещенном (С1-С12)алкокси, выбран из группы, состоящей из D, галогена, гидрокси, (С1-С12)алкокси, (С2-С6)гетероциклоалкила, (С2-С6)гетероциклоалкила, замещенного (С1-С12)алкилом, где каждый из Rf и Rg независимо представляет собой (С1-С12)алкил; Rh представляет собой (С2-С6)гетероциклоалкил; заместитель, содержащийся в замещенном (С1-С12)алкиле, выбран из группы, состоящей из D, (С2-С6)гетероциклоалкила, дейтерированного (С2-С6)гетероциклоалкила, (С2-С6)гетероциклоалкила, замещенного (С1-С12)алкилом, или (С2-С6)гетероциклоалкила, замещенного дейтерированным (С1-С12)алкилом; в случае если в замещенном (С1-С12)алкокси или замещенном (С1-С12)алкиле содержится более одного заместителя, то заместители являются одинаковыми или разными;
в каждой из вышеупомянутых групп (С2-С6)гетероциклоалкил, дейтерированный (С2-С6)гетероциклоалкил, (С2-С6)гетероциклоалкил, замещенный (С1-С12)алкилом, или (С2-С6)гетероциклоалкил, замещенный дейтерированным (С1-С12)алкилом, содержащим 1 или 2 гетероатома, выбранных из группы, состоящей из О и/или N;
при условии, что в общей формуле (I), в случае если n1 представляет собой О, R1, R3 и R10 представляют собой Н или D, X представляет собой NH или ND, R2 представляет собой F;
при условии, что в общей формуле (I), в случае если n1 представляет собой 1,
2. Производное изоиндолина, имеющее структуру общей формулы (I), его фармацевтически приемлемая соль, рацемат или изотопное соединение по п. 1, где
в общей формуле (I) центр асимметрии относится к атому углерода с (S)-конфигурацией, обогащенному атому углерода с (S)-конфигурацией, атому углерода с (R)-конфигурацией или обогащенному атому углерода с (R)-конфигурацией;
3. Производное изоиндолина, имеющее структуру общей формулы (I), его фармацевтически приемлемая соль, рацемат или изотопное соединение по п. 1, где
каждый из R2', R3', R4' и R5' независимо выбран из или замещенного (С1-С12)алкокси, при этом каждый из Ra и Rb независимо представляет собой (С1-С12)алкил или (С1-С12)алкилацил, каждый из Rc и Rd независимо представляет собой (С1-С12)алкил; Re представляет собой причем каждый из Re1 и Re2 независимо представляет собой (С1-С12)алкил; заместитель, содержащийся в замещенном (С1-С12)алкокси, представляет собой и при этом каждый из Rf и Rg независимо представляет собой (C1-С12)алкил, при этом структура (С1-С12)алкилацила представляет собой причем Ra1 представляет собой (С1-С12)алкил; при этом в определении Ra, Rb, Ra1, Rc, Rd, Re1, Re2, Rf или Rg (С1-С12)алкил представляет собой (С1-С4)алкил;
4. Производное изоиндолина, имеющее структуру общей формулы (I), его фармацевтически приемлемая соль, рацемат или изотопное соединение по п. 3, где
(С2-С6)гетероциклоалкил представляет собой пирролидин, морфолинил или пиперазинил; (С1-С12)алкил, содержащийся в (С2-С6)гетероциклоалкиле, замещенном (С1-С12)алкилом, или (С2-С6)гетероциклоалкиле, замещенном дейтерированным (С1-С12)алкилом, представляет собой (C1-С4)алкил; дейтерированный (С2-С6)гетероциклоалкил представляет собой (С2-С6)гетероциклоалкил, замещенный (С1-С12)алкилом, представляет собой (С2-С6)гетероциклоалкил, замещенный дейтерированным (С1-С12)алкилом, представляет собой
и/или каждый из Ra, Rb, Ra1, Rc, Rd, Re1, Re2, Rf или Rg представляет собой (C1-С12)алкил, (С1-С12)алкил представляет собой (C1-С4)алкил; при этом (С1-С4)алкил представляет собой метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил или трет-бутил;
и/или в общей формуле (I), в случае если R10 представляет собой каждый из R2', R3', R4' и R5' независимо выбран из замещенного (С1-С12)алкокси, и в случае если заместитель, содержащийся в замещенном (С1-С12)алкокси, выбран из (С1-С4)алкокси, (С1-С4)алкокси представляет собой метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, изо-бутокси или трет-бутокси.
5. Производное изоиндолина, имеющее структуру общей формулы (I), его фармацевтически приемлемая соль, рацемат или изотопное соединение по п. 1, где
6. Производное изоиндолина, имеющее структуру общей формулы (I), его фармацевтически приемлемая соль, рацемат или изотопное соединение по п. 5, где
в общей формуле (I), в случае если R10 представляет собой и каждый из R2', R3', R4' и R5' независимо выбран из замещенного или незамещенного (C1-С4)алкила, замещенный или незамещенный (C1-С4)алкил представляет собой замещенный или незамещенный метил, замещенный или незамещенный этил, замещенный или незамещенный пропил, замещенный или незамещенный изо-пропил, замещенный или незамещенный н-бутил, замещенный или незамещенный изо-бутил или замещенный или незамещенный трет-бутил; при этом замещенный (С1-C12)алкил представляет собой
и/или в общей формуле (I), в случае если R10 представляет собой и каждый из R2', R3', R4' и R5' независимо выбран из замещенного или незамещенного (С1-С4)алкокси, замещенный или незамещенный (С1-С4)алкокси представляет собой замещенный или незамещенный метокси, замещенный или незамещенный этокси, замещенный или незамещенный н-пропокси, замещенный или незамещенный н-бутокси, замещенный или незамещенный изо-бутокси или замещенный или незамещенный трет-бутокси, при этом замещенный (С1-С12)алкокси представляет собой
7. Производное изоиндолина, имеющее структуру общей формулы (I), его фармацевтически приемлемая соль, рацемат или изотопное соединение по п. 1, где
8. Производное изоиндолина, имеющее структуру общей формулы (I), его фармацевтически приемлемая соль, рацемат или изотопное соединение по любому из пп. 1-7, где соединение, имеющее структуру общей формулы (I), выбрано из группы, состоящей из
9. Способ получения производного изоиндолина, имеющего структуру общей формулы (I), по любому из пп. 1-8, который предусматривает любой из следующих способов:
при этом способ А предусматривает осуществление реакции удаления защитных групп с участием соединения А-06(1), как представлено ниже, с получением соединения А-06(а1); с последующей реакцией амидирования с участием соединения А-06(а1), как представлено ниже, с получением соединения общей формулы (I):
при этом в ходе осуществления способа А в определении соединения А-06(1), соединения A-06(a1) или общей формулы (I) L1, L2, X, Z, *, R1-R10 и n1 определены, как указано в любом из пп. 1-8; один из Rax и Rbx представляет собой другой представляет собой один из Ray и Rby представляет собой другой представляет собой при этом в определении каждый из Ra'' и Rb'' независимо представляет собой Н или D;
в общей формуле (I), в случае если n1 представляет собой 0, соединение общей формулы (I) дополнительно получают в соответствии со способом В, при этом способ В предусматривает осуществление реакции восстановления с участием соединения I-RS, как представлено ниже, с получением соединения общей формулы (I):
при этом в ходе осуществления способа В в определениях соединения I-RS или общей формулы (I) R2 представляет собой F, n1 представляет собой О, X представляет собой NH или ND, R10 представляет собой Н или D, определения L1, Z, R1 и R3 относятся к таковым в п. 1 или 2;
в случае если в общей формуле (I) n1 представляет собой 1 и X представляет собой NH или ND, соединение общей формулы (I) дополнительно получают в соответствии со способом С, который предусматривает осуществление реакции восстановительного аминирования с участием соединения Р-01 и как представлено ниже, с получением соединения общей формулы (I):
при этом в ходе осуществления способа С в определении соединения Р-01 или общей формулы (I) X представляет собой NH или ND, n1 представляет собой 0, каждый из Rp1, Rp2 и Rp3 независимо представляет собой Н или D; определения L1, L2, Z, R1, R2 и R3 относятся к таковым в любом из пп. 1-8; в определении R10 представляет собой определения R2', R3', R4' и R5' относятся к таковым в любом из пп. 1-8.
10. Способ по п. 9, где
в ходе осуществления способа А, в случае если в общей формуле (I) n1 представляет собой 0, способ получения соединения общей формулы (I) предусматривает осуществление реакции восстановления с участием соединения А-05(1), как представлено ниже, с получением соединения А-06(1):
где в соединении А-05(1) и соединении А-06(1) определения L1, L2, R1-R8, Rax и Rbx относятся к таковым в п. 9; при этом в соединении A-06(l) X представляет собой NH или ND, n1 представляет собой 0; R10 представляет собой Н и D;
или в ходе осуществления способа А, в случае если X представляет собой NH или ND и n1 представляет собой 1 в общей формуле (I), способ получения соединения, имеющего структуру общей формулы (I), включает осуществление реакции восстановительного аминирования с участием соединения А-05(2) и как представлено ниже, с получением соединения А-06(1):
или в ходе осуществления способа А, в случае если X представляет собой О и n1 представляет собой 1 в соединении, имеющем структуру общей формулы (I), способ получения соединения, имеющего структуру общей формулы (I), включает осуществление реакции нуклеофильного замещения с участием соединения А-05(3) и как представлено ниже, с получением соединения А-06(1):
или в ходе осуществления способа В способ получения соединения, имеющего структуру общей формулы (I), включает осуществление реакции сочетания с участием соединения А-03 и соединения А-04(2) или их солью, как представлено ниже, с получением соединения I-RS:
где в соединении А-03, А-04(2) или I-RS определения L1, Z, *, R1-R9 относятся к таковым в п. 9; при этом в соединении А-03 Hal представляет собой галоген;
или в ходе осуществления способа В способ получения соединения, имеющего структуру общей формулы (I), включает осуществление удаления защитных групп и реакции амидирования последовательно с участием соединения А-05(1), как представлено ниже, с получением соединения I-RS:
или в ходе осуществления способа С способ получения соединения, имеющего структуру общей формулы (I), включает осуществление реакции восстановления с участием соединения I-RS, как представлено ниже, с получением соединения Р-01:
при этом в соединении I-RS или соединении Р-01 R2 представляет собой Н, D или F; каждый из Rp1 и Rp2 независимо представляет собой Н или D; определения L1, L2, Z, R1 и R3 относятся к таковым в п. 1 или 2.
11. Промежуточное соединение А-06(1) или А-06(а1) для получения производного изоиндолина, имеющего структуру общей формулы (I):
при этом в соединении А-06(1) или А-06(а1), определения L1, L2, n1, Z, *, R1-R10 относятся к таковым в любом из пп. 1-8; в соединении А-06(1) один из Rax и Rbx представляет собой другой представляет собой или в соединении А-06(а1) один из Ray и Rby представляет собой другой представляет собой каждый из Ra" и Rb" независимо представляет собой Н или D.
12. Фармацевтическая композиция для лечения или предупреждения заболевания, симптома или нарушения, обусловленных TNF-α или связанных с нарушенной регуляцией активности TNF-α, которая содержит терапевтически эффективное и/или профилактически эффективное количество вещества, выбранного из группы, состоящей из производных изоиндолина, имеющих структуру общей формулы (I), их фармацевтически приемлемой соли, рацемата и изотопного соединения по любому из пп. 1-8, и фармацевтически приемлемый наполнитель или носитель.
13. Применение производного изоиндолина, имеющего структуру общей формулы (I), его фармацевтически приемлемой соли, рацемата или изотопного соединения по любому из пп. 1-8 для лечения или предупреждения заболевания, симптома или нарушения, обусловленных TNF-α или связанных с нарушенной регуляцией активности TNF-α.
14. Применение по п. 13, где заболевание, симптом или нарушение включают миелодиспластический синдром, множественную миелому, лимфому из клеток мантийной зоны, неходжкинскую лимфому, папиллярную и фолликулярную тиреоидную карциному, рак молочной железы, рак предстательной железы, хронический лимфоцитарный лейкоз, амилоидоз, комплексный регионарный болевой синдром I типа, злокачественную меланому, радикулопатию, миелофиброз, глиобластому, саркоматозную глиому, злокачественную глиому, рефракторную плазмоцитому, хронический миеломоноцитарный лейкоз, фолликулярную лимфому, цилиарную и хроническую меланому, меланому радужной оболочки, рецидивирующую глазную меланому, экстраокулярную распространяющуюся меланому, солидную опухоль, Т-клеточную лимфому, эритроидную лимфому, монобластный и моноцитарный лейкоз; миелоидный лейкоз, лимфому центральной нервной системы, опухоли головного мозга, менингиомы, опухоль спинного мозга, рак щитовидной железы, немелкоклеточный рак легкого, карциному яичника, рак кожи, почечно-клеточную карциному, лимфому Беркитта, лимфому Ходжкина, крупноклеточную лимфому, диффузную В-крупноклеточную лимфому, астроцитому, гепатоцеллюлярную карциному, первичную макроглобулинемию.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201410605148.8 | 2014-10-30 | ||
| CN201410605148 | 2014-10-30 | ||
| CN201410632870.0 | 2014-11-11 | ||
| CN201410632870 | 2014-11-11 | ||
| PCT/CN2015/088312 WO2016065980A1 (zh) | 2014-10-30 | 2015-08-27 | 异吲哚啉衍生物、其中间体、制备方法、药物组合物及应用 |
Publications (4)
| Publication Number | Publication Date |
|---|---|
| RU2017118453A RU2017118453A (ru) | 2018-12-04 |
| RU2017118453A3 RU2017118453A3 (ru) | 2019-01-17 |
| RU2695521C2 RU2695521C2 (ru) | 2019-07-23 |
| RU2695521C9 true RU2695521C9 (ru) | 2019-08-19 |
Family
ID=55856570
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2017118453A RU2695521C9 (ru) | 2014-10-30 | 2015-08-27 | Производное изоиндолина, промежуточный продукт, способ получения, фармацевтическая композиция и ее применение |
Country Status (15)
| Country | Link |
|---|---|
| US (1) | US10017492B2 (ru) |
| EP (2) | EP3643709B1 (ru) |
| JP (1) | JP6546997B2 (ru) |
| KR (1) | KR102191256B1 (ru) |
| CN (2) | CN111205268B (ru) |
| AU (1) | AU2015341301B2 (ru) |
| CA (1) | CA2966038C (ru) |
| CY (1) | CY1123361T1 (ru) |
| DK (2) | DK3643709T3 (ru) |
| ES (2) | ES2901509T3 (ru) |
| NZ (1) | NZ731789A (ru) |
| PL (2) | PL3643709T3 (ru) |
| PT (2) | PT3214081T (ru) |
| RU (1) | RU2695521C9 (ru) |
| WO (1) | WO2016065980A1 (ru) |
Families Citing this family (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2730763T3 (es) | 2010-02-11 | 2019-11-12 | Celgene Corp | Derivados de arilmetoxi isoindolina y composiciones que los comprenden y métodos de uso de los mismos |
| WO2014116573A1 (en) | 2013-01-22 | 2014-07-31 | Celgene Corporation | Processes for the preparation of isotopologues of 3-(4-((4-(morpholinomethyl)benzyl)oxy)-1-oxoisoindolin-2-yl)piperidine-2,6-dione and pharmaceutically acceptable salts thereof |
| JP6546997B2 (ja) | 2014-10-30 | 2019-07-17 | カンプー バイオファーマシューティカルズ リミテッド | イソインドリン誘導体、その中間体、製造方法、薬物組成物及び応用 |
| CN106551934B (zh) * | 2015-09-29 | 2020-09-11 | 康朴生物医药技术(上海)有限公司 | 一种药物组合物及其应用 |
| JP7001614B2 (ja) * | 2016-04-06 | 2022-02-03 | ザ リージェンツ オブ ザ ユニヴァシティ オブ ミシガン | リガンド依存性の標的タンパク質分解のための単官能性中間体 |
| TWI808055B (zh) | 2016-05-11 | 2023-07-11 | 美商滬亞生物國際有限公司 | Hdac 抑制劑與 pd-1 抑制劑之組合治療 |
| TWI794171B (zh) | 2016-05-11 | 2023-03-01 | 美商滬亞生物國際有限公司 | Hdac抑制劑與pd-l1抑制劑之組合治療 |
| CN105968133B (zh) * | 2016-05-18 | 2018-09-21 | 大连和田科技有限公司 | 一种磷酸酯季铵盐杀菌剂的制备方法 |
| WO2018001270A1 (en) * | 2016-06-30 | 2018-01-04 | Noratech Pharmaceuticals, Inc. | Palbociclib prodrugs and composition thereof |
| WO2018010142A1 (en) * | 2016-07-14 | 2018-01-18 | Shanghai Meton Pharmaceutical Co., Ltd | Iso-citrate dehydrogenase (idh) inhibitor |
| ES2884064T3 (es) * | 2016-12-16 | 2021-12-10 | Kangpu Biopharmaceuticals Ltd | Composición combinada que comprende un compuesto benzoheterocíclico y un modulador de la vía de los receptores androgénicos y usos de la misma |
| ES2899372T3 (es) * | 2017-02-13 | 2022-03-11 | Kangpu Biopharmaceuticals Ltd | Combinación de tratamiento del cáncer de próstata, composición farmacéutica y método de tratamiento |
| CN108929307A (zh) * | 2017-05-22 | 2018-12-04 | 苏州偶领生物医药有限公司 | 一类异吲哚酮-酰亚胺环-1,3-二酮-2-烯化合物、其组合物和用途 |
| US11001552B2 (en) * | 2017-07-18 | 2021-05-11 | Lonza Ltd | Method for preparation of 5-fluoro-2-methyl-3-nitrobenzoic acid and its methyl ester |
| US10717703B2 (en) | 2017-08-21 | 2020-07-21 | Celgene Corporation | Processes for the preparation of (S)-tert-butyl 4,5-diamino-5-oxopentanoate |
| US10513515B2 (en) * | 2017-08-25 | 2019-12-24 | Biotheryx, Inc. | Ether compounds and uses thereof |
| EA202092248A1 (ru) * | 2018-04-23 | 2021-02-04 | Селджин Корпорейшн | Замещенные соединения 4-аминоизоиндолин-1,3-диона, их композиции и способы лечения ими |
| BR122022012697B1 (pt) | 2018-07-10 | 2023-04-04 | Novartis Ag | Usos de derivados de 3-(5-hidróxi-1-oxoisoindolin-2-il)piperidina-2,6- diona, e kit |
| AR116109A1 (es) * | 2018-07-10 | 2021-03-31 | Novartis Ag | Derivados de 3-(5-amino-1-oxoisoindolin-2-il)piperidina-2,6-diona y usos de los mismos |
| CA3106239A1 (en) | 2018-07-27 | 2020-01-30 | Biotheryx, Inc. | Bifunctional compounds as cdk modulators |
| AU2019348094B2 (en) * | 2018-09-30 | 2022-12-22 | Shanghai Institute Of Materia Medica, Chinese Academy Of Sciences | Isoindoline compound, preparation method, pharmaceutical composition and use thereof |
| WO2020102195A1 (en) * | 2018-11-13 | 2020-05-22 | Biotheryx, Inc. | Substituted isoindolinones |
| EP3896062A4 (en) | 2018-12-06 | 2022-06-15 | Shanghai Institute of Materia Medica, Chinese Academy of Sciences | ISOINDOLINE COMPOUND, PROCESS FOR ITS PRODUCTION, PHARMACEUTICAL COMPOSITION AND USE OF THE ISOINDOLINE COMPOUND |
| CN109776377B (zh) * | 2019-02-01 | 2021-08-24 | 沈阳药科大学 | 吲哚啉类化合物及其制备方法和应用 |
| AR119715A1 (es) | 2019-04-12 | 2022-01-05 | Celgene Corp | Métodos para tratar linfoma no hodgkin con el uso de 2-(2,6-dioxopiperidin-3-il)-4-((2-fluoro-4-((3-morfolinoazetidin-1-il)metil)bencil)amino)isoindolin-1,3-diona |
| FI4048278T3 (fi) * | 2019-10-21 | 2023-12-19 | Celgene Corp | Menetelmiä hematologisten syöpien hoitamiseksi 2-(2,6-dioksopiperidin-3-yyli)-4-((2-fluori-4-((3-morfolinoatsetidin-1-yyli)metyyli)bentsyyli)amino)isoindoliini-1,3-dionia käyttämällä |
| WO2021136461A1 (zh) * | 2019-12-31 | 2021-07-08 | 成都百裕制药股份有限公司 | 嘌呤衍生物及其在医药上的应用 |
| JP7408819B2 (ja) * | 2020-01-20 | 2024-01-05 | カング バイオファーマシューティカルズ リミテッド | イソインドリン誘導体、並びにその医薬組成物及び使用 |
| EP4112614A4 (en) * | 2020-02-25 | 2023-09-06 | Shanghaitech University | GLUTARIMIDE BACKGROUND-BASED COMPOUNDS AND USE THEREOF |
| US11897930B2 (en) | 2020-04-28 | 2024-02-13 | Anwita Biosciences, Inc. | Interleukin-2 polypeptides and fusion proteins thereof, and their pharmaceutical compositions and therapeutic applications |
| EP4144728A4 (en) * | 2020-04-30 | 2023-08-23 | Shanghaitech University | HETEROCYCLIC COMPOUND BASED ON A GLUTARIMIDE SKELETON AND USES THEREOF |
| CN113896711A (zh) * | 2020-07-06 | 2022-01-07 | 北京诺诚健华医药科技有限公司 | 杂环类免疫调节剂 |
| EP4277901A1 (en) | 2021-01-13 | 2023-11-22 | Monte Rosa Therapeutics, Inc. | Isoindolinone compounds |
| WO2024027694A1 (zh) * | 2022-08-01 | 2024-02-08 | 苏州开拓药业股份有限公司 | 一种蛋白降解剂 |
| CN118019736A (zh) * | 2022-09-08 | 2024-05-10 | 标新生物医药科技(上海)有限公司 | 基于cereblon蛋白设计的分子胶化合物及其应用 |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002059106A1 (en) * | 2000-12-27 | 2002-08-01 | Celgene Corporation | Isoindole-imide compounds, compositions, and uses thereof |
| US6458810B1 (en) * | 2000-11-14 | 2002-10-01 | George Muller | Pharmaceutically active isoindoline derivatives |
| WO2008115516A2 (en) * | 2007-03-20 | 2008-09-25 | Celgene Corporation | 4'-o-substituted isoindoline derivatives and compositions comprising and methods of using the same |
| RU2008112221A (ru) * | 2005-08-31 | 2009-10-10 | Селджин Корпорейшн (Us) | Соединения ряда изоиндолимидов, их композиции и способы применения |
| EP2305663A1 (en) * | 1996-07-24 | 2011-04-06 | Celgene Corporation | Substituted 2-(2,6-dioxopiperidin-3-yl)-phthalimides and 1-oxoisoindolines and method of reducing TNF alpha levels |
| WO2012079022A1 (en) * | 2010-12-10 | 2012-06-14 | Concert Pharmaceuticals, Inc. | Substituted dioxopiperidinyl phthalimide derivatives |
| RU2012138709A (ru) * | 2010-02-11 | 2014-03-20 | Селджин Корпорейшн | Производные арилметокси изоиндолина и композиции, включающие их, и способы их применения |
Family Cites Families (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4678500A (en) | 1984-06-29 | 1987-07-07 | E. I. Du Pont De Nemours And Company | Herbicidal 2,6-disubstituted benzylsulfonamides and benzenesulfamates |
| US5629327A (en) | 1993-03-01 | 1997-05-13 | Childrens Hospital Medical Center Corp. | Methods and compositions for inhibition of angiogenesis |
| HU228769B1 (en) | 1996-07-24 | 2013-05-28 | Celgene Corp | Substituted 2(2,6-dioxopiperidin-3-yl)phthalimides and -1-oxoisoindolines and their use for production of pharmaceutical compositions for mammals to reduce the level of tnf-alpha |
| US5955476A (en) * | 1997-11-18 | 1999-09-21 | Celgene Corporation | Substituted 2-(2,6-dioxo-3-fluoropiperidin-3-yl)-isoindolines and method of reducing inflammatory cytokine levels |
| CA2457319C (en) | 2001-08-06 | 2011-07-05 | The Children's Medical Center Corporation | Synthesis and anti-tumor activity of nitrogen substituted thalidomide analogs |
| TW200404054A (en) | 2002-07-26 | 2004-03-16 | Wako Pure Chem Ind Ltd | Method for deuteration of aromatic ring |
| CN1867331B (zh) | 2003-09-17 | 2010-05-26 | 美国政府健康及人类服务部 | 作为TNF-α调节剂的沙利度胺类似物 |
| US20060058311A1 (en) | 2004-08-14 | 2006-03-16 | Boehringer Ingelheim International Gmbh | Combinations for the treatment of diseases involving cell proliferation |
| MX2007002521A (es) * | 2004-09-03 | 2007-05-09 | Celgene Corp | Procesos para la preparacion de 2-(2,6-dioxopiperidin-3-il)-1- oxoisoindolinas sustituidas. |
| CN103382197A (zh) * | 2006-09-15 | 2013-11-06 | 细胞基因公司 | N-甲基氨甲基异吲哚化合物和包含它的组合物及其使用方法 |
| US8288414B2 (en) | 2007-09-12 | 2012-10-16 | Deuteria Pharmaceuticals, Inc. | Deuterium-enriched lenalidomide |
| CA2741299C (en) * | 2008-10-29 | 2017-03-28 | Celgene Corporation | Isoindoline compounds for use in the treatment of cancer |
| EA020117B1 (ru) | 2008-11-14 | 2014-08-29 | Консерт Фармасьютикалс Инк. | Замещенные диоксопиперидинилфталимидные производные |
| US9045453B2 (en) | 2008-11-14 | 2015-06-02 | Concert Pharmaceuticals, Inc. | Substituted dioxopiperidinyl phthalimide derivatives |
| EP2396312A1 (en) | 2009-02-11 | 2011-12-21 | Celgene Corporation | Isotopologues of lenalidomide |
| CN101580501B (zh) | 2009-06-01 | 2011-03-09 | 南京卡文迪许生物工程技术有限公司 | 3-(取代二氢异吲哚酮-2-基)-2,6-哌啶二酮的合成方法及其中间体 |
| PL2443089T3 (pl) * | 2009-06-18 | 2014-09-30 | Concert Pharmaceuticals Inc | Deuterowane pochodne izoindolino-1,3-dionu jako inhibitory pde4 i tnf-alfa |
| WO2011066351A1 (en) * | 2009-11-24 | 2011-06-03 | Celgene Corporation | Immunomodulatory compounds for the restoration of vitamin d sensitivity in vitamin d resistant tumor cells |
| ES2664872T3 (es) | 2010-06-18 | 2018-04-23 | Taiho Pharmaceutical Co., Ltd | Moduladores PRPK-TPRKB y sus usos |
| WO2012068512A1 (en) | 2010-11-18 | 2012-05-24 | Deuteria Pharmaceuticals Llc | 3-deutero-pomalidomide |
| US8927725B2 (en) | 2011-12-02 | 2015-01-06 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Thio compounds |
| WO2014116573A1 (en) | 2013-01-22 | 2014-07-31 | Celgene Corporation | Processes for the preparation of isotopologues of 3-(4-((4-(morpholinomethyl)benzyl)oxy)-1-oxoisoindolin-2-yl)piperidine-2,6-dione and pharmaceutically acceptable salts thereof |
| WO2014180882A2 (en) | 2013-05-07 | 2014-11-13 | Universitat De Barcelona | Treatment of brain metastasis from cancer |
| JP6546997B2 (ja) | 2014-10-30 | 2019-07-17 | カンプー バイオファーマシューティカルズ リミテッド | イソインドリン誘導体、その中間体、製造方法、薬物組成物及び応用 |
-
2015
- 2015-08-27 JP JP2017542243A patent/JP6546997B2/ja active Active
- 2015-08-27 ES ES19214472T patent/ES2901509T3/es active Active
- 2015-08-27 US US15/523,651 patent/US10017492B2/en active Active
- 2015-08-27 AU AU2015341301A patent/AU2015341301B2/en active Active
- 2015-08-27 WO PCT/CN2015/088312 patent/WO2016065980A1/zh active Application Filing
- 2015-08-27 PT PT158559864T patent/PT3214081T/pt unknown
- 2015-08-27 PT PT192144723T patent/PT3643709T/pt unknown
- 2015-08-27 NZ NZ731789A patent/NZ731789A/en unknown
- 2015-08-27 DK DK19214472.3T patent/DK3643709T3/da active
- 2015-08-27 KR KR1020177014411A patent/KR102191256B1/ko active IP Right Grant
- 2015-08-27 PL PL19214472T patent/PL3643709T3/pl unknown
- 2015-08-27 RU RU2017118453A patent/RU2695521C9/ru active
- 2015-08-27 CN CN201910389995.8A patent/CN111205268B/zh active Active
- 2015-08-27 EP EP19214472.3A patent/EP3643709B1/en active Active
- 2015-08-27 CA CA2966038A patent/CA2966038C/en active Active
- 2015-08-27 EP EP15855986.4A patent/EP3214081B1/en active Active
- 2015-08-27 PL PL15855986T patent/PL3214081T3/pl unknown
- 2015-08-27 ES ES15855986T patent/ES2812877T3/es active Active
- 2015-08-27 DK DK15855986.4T patent/DK3214081T3/da active
- 2015-08-27 CN CN201510536922.9A patent/CN105566290B/zh active Active
-
2020
- 2020-09-23 CY CY20201100896T patent/CY1123361T1/el unknown
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2305663A1 (en) * | 1996-07-24 | 2011-04-06 | Celgene Corporation | Substituted 2-(2,6-dioxopiperidin-3-yl)-phthalimides and 1-oxoisoindolines and method of reducing TNF alpha levels |
| US6458810B1 (en) * | 2000-11-14 | 2002-10-01 | George Muller | Pharmaceutically active isoindoline derivatives |
| WO2002059106A1 (en) * | 2000-12-27 | 2002-08-01 | Celgene Corporation | Isoindole-imide compounds, compositions, and uses thereof |
| RU2008112221A (ru) * | 2005-08-31 | 2009-10-10 | Селджин Корпорейшн (Us) | Соединения ряда изоиндолимидов, их композиции и способы применения |
| WO2008115516A2 (en) * | 2007-03-20 | 2008-09-25 | Celgene Corporation | 4'-o-substituted isoindoline derivatives and compositions comprising and methods of using the same |
| RU2012138709A (ru) * | 2010-02-11 | 2014-03-20 | Селджин Корпорейшн | Производные арилметокси изоиндолина и композиции, включающие их, и способы их применения |
| WO2012079022A1 (en) * | 2010-12-10 | 2012-06-14 | Concert Pharmaceuticals, Inc. | Substituted dioxopiperidinyl phthalimide derivatives |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3214081A1 (en) | 2017-09-06 |
| DK3643709T3 (da) | 2021-12-20 |
| CN105566290A (zh) | 2016-05-11 |
| US10017492B2 (en) | 2018-07-10 |
| NZ731789A (en) | 2019-04-26 |
| JP6546997B2 (ja) | 2019-07-17 |
| AU2015341301A1 (en) | 2017-06-01 |
| CA2966038C (en) | 2020-04-21 |
| RU2695521C2 (ru) | 2019-07-23 |
| CY1123361T1 (el) | 2021-12-31 |
| RU2017118453A (ru) | 2018-12-04 |
| PL3643709T3 (pl) | 2022-02-21 |
| WO2016065980A1 (zh) | 2016-05-06 |
| CA2966038A1 (en) | 2016-05-06 |
| KR102191256B1 (ko) | 2020-12-15 |
| CN111205268A (zh) | 2020-05-29 |
| PL3214081T3 (pl) | 2021-04-06 |
| EP3214081B1 (en) | 2020-07-08 |
| EP3214081A4 (en) | 2018-08-15 |
| CN111205268B (zh) | 2021-01-26 |
| AU2015341301B2 (en) | 2019-05-16 |
| ES2812877T3 (es) | 2021-03-18 |
| RU2017118453A3 (ru) | 2019-01-17 |
| ES2901509T3 (es) | 2022-03-22 |
| US20170313676A1 (en) | 2017-11-02 |
| EP3643709A1 (en) | 2020-04-29 |
| PT3214081T (pt) | 2020-08-31 |
| KR20170078740A (ko) | 2017-07-07 |
| DK3214081T3 (da) | 2020-09-28 |
| PT3643709T (pt) | 2021-12-20 |
| EP3643709B1 (en) | 2021-10-20 |
| JP2017533955A (ja) | 2017-11-16 |
| CN105566290B (zh) | 2020-05-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2695521C9 (ru) | Производное изоиндолина, промежуточный продукт, способ получения, фармацевтическая композиция и ее применение | |
| AU2022200946B2 (en) | Modulators of the integrated stress pathway | |
| AU2023201821A1 (en) | Modulators of the integrated stress pathway | |
| AU2024200013A1 (en) | Prodrug modulators of the integrated stress pathway | |
| US20240018133A1 (en) | Modulators of the integrated stress pathway | |
| CA3080806A1 (en) | Modulators of the integrated stress pathway | |
| CA3080968A1 (en) | Modulators of the integrated stress pathway | |
| JP6885999B2 (ja) | 水溶性プロドラッグ | |
| CA3023164A1 (en) | Modulators of the integrated stress pathway | |
| IL274406B2 (en) | Combined pressure pathway modulators | |
| CA3104507A1 (en) | Protein tyrosine phosphatase inhibitors and methods of use thereof | |
| CN104703978A (zh) | (s)-3-(4-((4-(吗啉代甲基)苄基)氧基)-1-氧代异二氢吲哚-2-基)哌啶-2,6-二酮的盐和固体形式及包含所述盐和固体形式的组合物及其使用方法 | |
| CA3191842A1 (en) | Protein tyrosine phosphatase inhibitors and methods of use thereof | |
| AU2024227527A1 (en) | Modulators of the integrated stress pathway | |
| JP2023539336A (ja) | Gpr52モジュレーター化合物 | |
| NZ787908A (en) | Modulators of the integrated stress pathway |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| TH4A | Reissue of patent specification | ||
| TH4A | Reissue of patent specification |