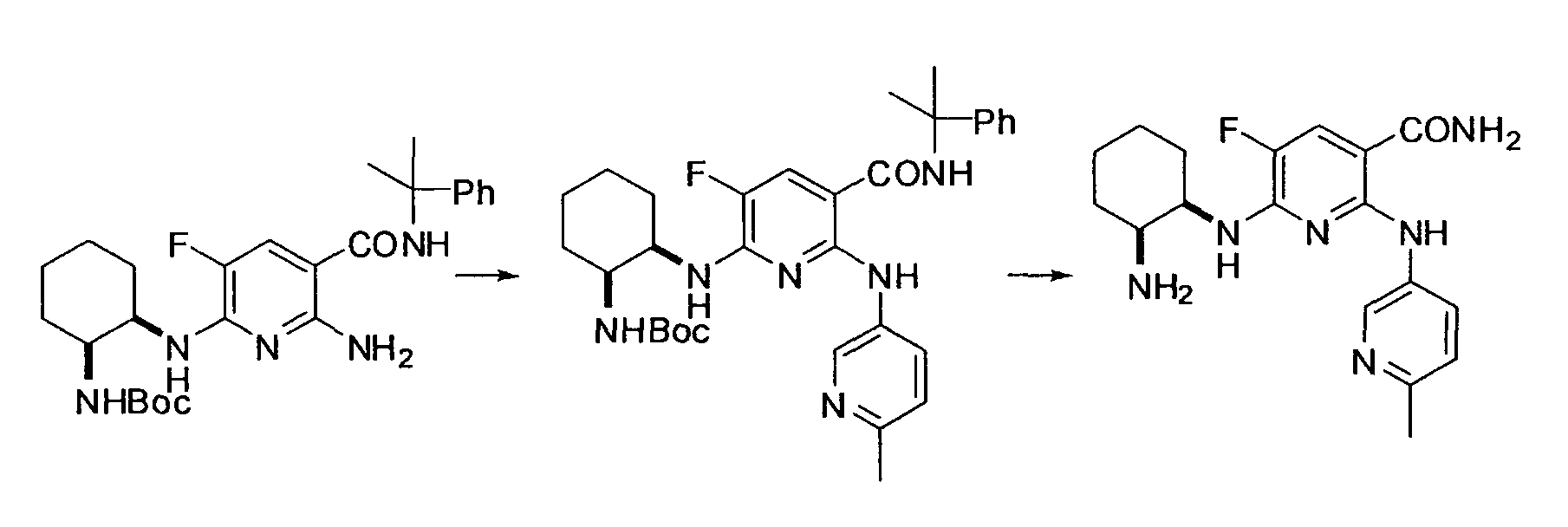
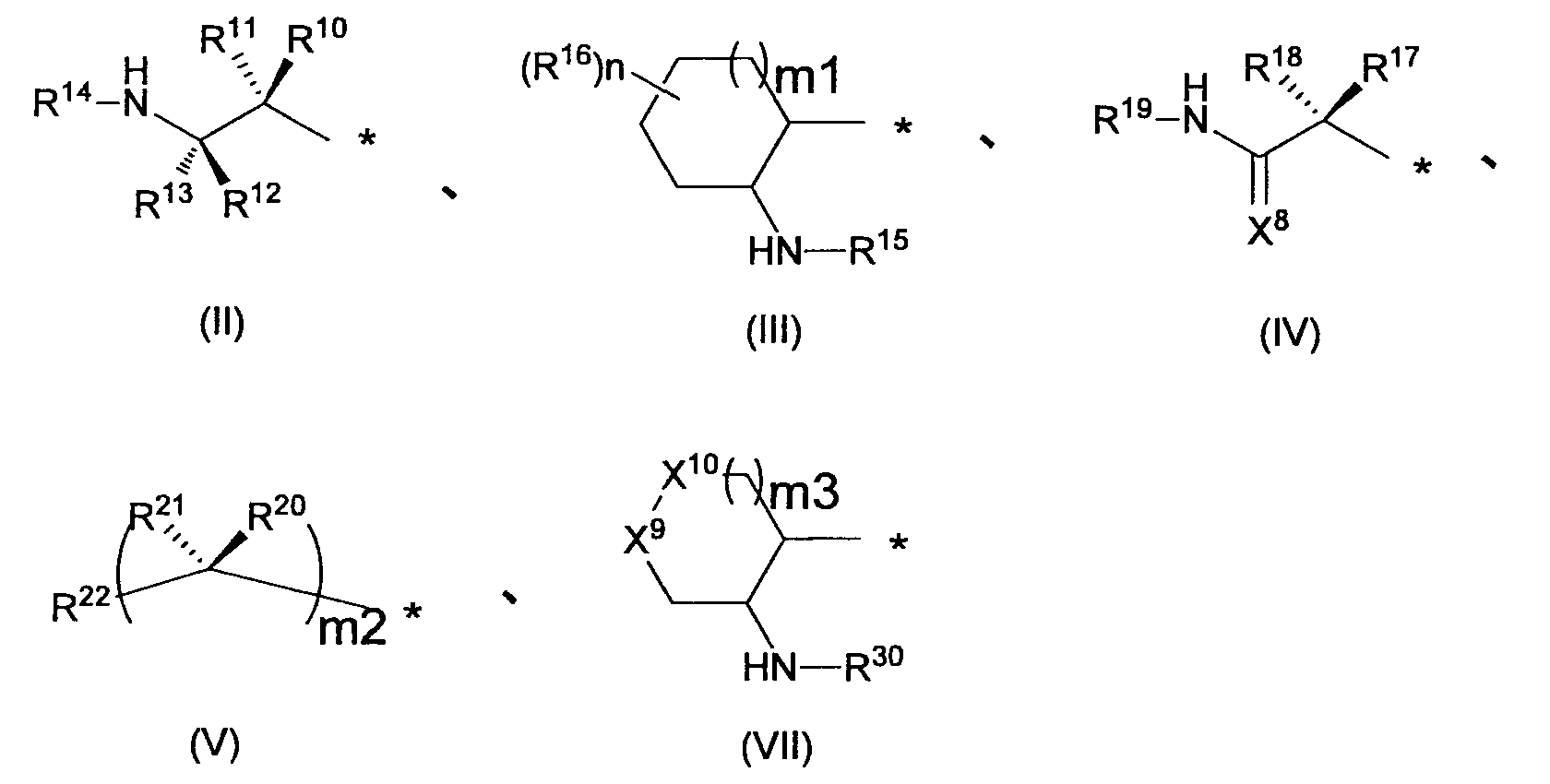
RU2560163C2 - Новое производное никотинамида или его соль - Google Patents
Новое производное никотинамида или его соль Download PDFInfo
- Publication number
- RU2560163C2 RU2560163C2 RU2013103792/04A RU2013103792A RU2560163C2 RU 2560163 C2 RU2560163 C2 RU 2560163C2 RU 2013103792/04 A RU2013103792/04 A RU 2013103792/04A RU 2013103792 A RU2013103792 A RU 2013103792A RU 2560163 C2 RU2560163 C2 RU 2560163C2
- Authority
- RU
- Russia
- Prior art keywords
- nicotinamide
- fluoro
- amino
- cis
- aminocyclohexylamino
- Prior art date
Links
- 150000005480 nicotinamides Chemical class 0.000 title claims abstract description 28
- 150000003839 salts Chemical class 0.000 title claims description 43
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims abstract description 128
- 125000005843 halogen group Chemical group 0.000 claims abstract description 126
- 125000004076 pyridyl group Chemical group 0.000 claims abstract description 44
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 14
- 101100459319 Arabidopsis thaliana VIII-2 gene Proteins 0.000 claims abstract description 10
- 101100132433 Arabidopsis thaliana VIII-1 gene Proteins 0.000 claims abstract 2
- 102000000551 Syk Kinase Human genes 0.000 claims abstract 2
- 108010016672 Syk Kinase Proteins 0.000 claims abstract 2
- 150000001875 compounds Chemical class 0.000 claims description 417
- -1 R 54 Chemical compound 0.000 claims description 295
- 125000001424 substituent group Chemical group 0.000 claims description 293
- DFPAKSUCGFBDDF-UHFFFAOYSA-N Nicotinamide Chemical compound NC(=O)C1=CC=CN=C1 DFPAKSUCGFBDDF-UHFFFAOYSA-N 0.000 claims description 172
- 125000000623 heterocyclic group Chemical group 0.000 claims description 153
- 125000000217 alkyl group Chemical group 0.000 claims description 135
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 claims description 90
- 235000005152 nicotinamide Nutrition 0.000 claims description 86
- 239000011570 nicotinamide Substances 0.000 claims description 86
- 229960003966 nicotinamide Drugs 0.000 claims description 86
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 59
- 125000003545 alkoxy group Chemical group 0.000 claims description 40
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 40
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 claims description 39
- 125000005529 alkyleneoxy group Chemical group 0.000 claims description 37
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 37
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 32
- 125000002541 furyl group Chemical group 0.000 claims description 31
- 125000001425 triazolyl group Chemical group 0.000 claims description 31
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 claims description 29
- 125000002883 imidazolyl group Chemical group 0.000 claims description 20
- 125000003226 pyrazolyl group Chemical group 0.000 claims description 20
- 125000000719 pyrrolidinyl group Chemical group 0.000 claims description 17
- 125000001715 oxadiazolyl group Chemical group 0.000 claims description 16
- 125000002971 oxazolyl group Chemical group 0.000 claims description 16
- 125000000168 pyrrolyl group Chemical group 0.000 claims description 16
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 15
- 201000010099 disease Diseases 0.000 claims description 13
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 13
- 125000004432 carbon atom Chemical group C* 0.000 claims description 12
- 125000002757 morpholinyl group Chemical group 0.000 claims description 11
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 9
- 239000001257 hydrogen Substances 0.000 claims description 9
- 229910052739 hydrogen Inorganic materials 0.000 claims description 9
- 125000001544 thienyl group Chemical group 0.000 claims description 8
- BONAGCCRPNTMME-UHFFFAOYSA-N 6-(2-aminoethylamino)-2-(3,5-dimethoxyanilino)-5-fluoropyridine-3-carboxamide Chemical compound COC1=CC(OC)=CC(NC=2C(=CC(F)=C(NCCN)N=2)C(N)=O)=C1 BONAGCCRPNTMME-UHFFFAOYSA-N 0.000 claims description 4
- LIFXKERXTZSWDD-DLBZAZTESA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-(3,5-dimethoxyanilino)-5-fluoropyridine-3-carboxamide Chemical compound COC1=CC(OC)=CC(NC=2C(=CC(F)=C(N[C@H]3[C@H](CCCC3)N)N=2)C(N)=O)=C1 LIFXKERXTZSWDD-DLBZAZTESA-N 0.000 claims description 4
- 125000004183 alkoxy alkyl group Chemical group 0.000 claims description 4
- NEHMKBQYUWJMIP-UHFFFAOYSA-N chloromethane Chemical compound ClC NEHMKBQYUWJMIP-UHFFFAOYSA-N 0.000 claims description 4
- 239000003112 inhibitor Substances 0.000 claims description 3
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 3
- MLWZASYCUZIAFF-ZWKOTPCHSA-N 2-[(8-acetamidoquinolin-3-yl)amino]-6-[[(1r,2s)-2-aminocyclohexyl]amino]-5-fluoropyridine-3-carboxamide Chemical compound C=1N=C2C(NC(=O)C)=CC=CC2=CC=1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N MLWZASYCUZIAFF-ZWKOTPCHSA-N 0.000 claims description 2
- WKUKZTUBAHGZFO-UHFFFAOYSA-N 6-(2-aminoethylamino)-2-(1,3-benzothiazol-6-ylamino)-5-fluoropyridine-3-carboxamide Chemical compound C1=C(F)C(NCCN)=NC(NC=2C=C3SC=NC3=CC=2)=C1C(N)=O WKUKZTUBAHGZFO-UHFFFAOYSA-N 0.000 claims description 2
- BWXYKBXDCJQSBW-UHFFFAOYSA-N 6-(3-aminopropylamino)-2-(3,5-dimethoxyanilino)-5-fluoropyridine-3-carboxamide Chemical compound COC1=CC(OC)=CC(NC=2C(=CC(F)=C(NCCCN)N=2)C(N)=O)=C1 BWXYKBXDCJQSBW-UHFFFAOYSA-N 0.000 claims description 2
- FJTSZSFRBFOGBB-UONOGXRCSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-(1,3-benzothiazol-5-ylamino)-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C3N=CSC3=CC=2)=C(C(N)=O)C=C1F FJTSZSFRBFOGBB-UONOGXRCSA-N 0.000 claims description 2
- IYHYKOSSCVSAAK-UONOGXRCSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-(1,3-benzothiazol-6-ylamino)-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C3SC=NC3=CC=2)=C(C(N)=O)C=C1F IYHYKOSSCVSAAK-UONOGXRCSA-N 0.000 claims description 2
- CMCNIKDYIHXYQN-QWHCGFSZSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-(2,1,3-benzothiadiazol-5-ylamino)-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC2=CC3=NSN=C3C=C2)=C(C(N)=O)C=C1F CMCNIKDYIHXYQN-QWHCGFSZSA-N 0.000 claims description 2
- IQPULRBXIURMTL-LSDHHAIUSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-(2,3-dihydro-1,4-benzodioxin-6-ylamino)-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C3OCCOC3=CC=2)=C(C(N)=O)C=C1F IQPULRBXIURMTL-LSDHHAIUSA-N 0.000 claims description 2
- LWZGJIYSHRHUMT-LSDHHAIUSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-(3-chloroanilino)-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C(Cl)C=CC=2)=C(C(N)=O)C=C1F LWZGJIYSHRHUMT-LSDHHAIUSA-N 0.000 claims description 2
- OAWUTGXVYLYHGZ-JKSUJKDBSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(1,3-dimethylpyrazolo[3,4-b]pyridin-5-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=C2C(C)=NN(C)C2=NC=C1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N OAWUTGXVYLYHGZ-JKSUJKDBSA-N 0.000 claims description 2
- PKSXLLLGRHZSQB-FUHWJXTLSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(1-cyclopropylpyrrolo[2,3-b]pyridin-4-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=3C=CN(C=3N=CC=2)C2CC2)=C(C(N)=O)C=C1F PKSXLLLGRHZSQB-FUHWJXTLSA-N 0.000 claims description 2
- MSLCMRXWSOQLHN-UONOGXRCSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(2,6-dimethoxypyridin-4-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound COC1=NC(OC)=CC(NC=2C(=CC(F)=C(N[C@H]3[C@H](CCCC3)N)N=2)C(N)=O)=C1 MSLCMRXWSOQLHN-UONOGXRCSA-N 0.000 claims description 2
- OZFARVWEGUMDKC-QWHCGFSZSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(2-ethoxy-3-fluoropyridin-4-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound CCOC1=NC=CC(NC=2C(=CC(F)=C(N[C@H]3[C@H](CCCC3)N)N=2)C(N)=O)=C1F OZFARVWEGUMDKC-QWHCGFSZSA-N 0.000 claims description 2
- NVGRHBLVRKSWGF-ZWKOTPCHSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(5-cyano-6-morpholin-4-ylpyridin-3-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C(C(N3CCOCC3)=NC=2)C#N)=C(C(N)=O)C=C1F NVGRHBLVRKSWGF-ZWKOTPCHSA-N 0.000 claims description 2
- GCIIVLHEAFCTGV-DLBZAZTESA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(5-cyclopropylpyridin-3-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C(C=NC=2)C2CC2)=C(C(N)=O)C=C1F GCIIVLHEAFCTGV-DLBZAZTESA-N 0.000 claims description 2
- YXZTXMKCBVFVLS-DOTOQJQBSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(8-aminoquinolin-3-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C3C=CC=C(N)C3=NC=2)=C(C(N)=O)C=C1F YXZTXMKCBVFVLS-DOTOQJQBSA-N 0.000 claims description 2
- CGZZQYATMMWHRU-PKOBYXMFSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[1-(cyclopropylmethyl)pyrrolo[2,3-b]pyridin-4-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=3C=CN(CC4CC4)C=3N=CC=2)=C(C(N)=O)C=C1F CGZZQYATMMWHRU-PKOBYXMFSA-N 0.000 claims description 2
- VYSFKCLGDKXVEK-PZJWPPBQSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[1-[2-(diethylamino)ethyl]pyrrolo[2,3-b]pyridin-4-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=CN=C2N(CCN(CC)CC)C=CC2=C1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N VYSFKCLGDKXVEK-PZJWPPBQSA-N 0.000 claims description 2
- MTDDPOFXNMKLSS-JKSUJKDBSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[8-(carbamoylamino)quinolin-3-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C3C=CC=C(NC(N)=O)C3=NC=2)=C(C(N)=O)C=C1F MTDDPOFXNMKLSS-JKSUJKDBSA-N 0.000 claims description 2
- XCHCXJYTUFETND-DLBZAZTESA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-5-fluoro-2-[(5-pyrazol-1-ylpyridin-3-yl)amino]pyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C(C=NC=2)N2N=CC=C2)=C(C(N)=O)C=C1F XCHCXJYTUFETND-DLBZAZTESA-N 0.000 claims description 2
- UATGAVMZTVIZJW-QGZVFWFLSA-N 6-[[(2r)-1-amino-4-methyl-1-oxopentan-2-yl]amino]-5-fluoro-2-(quinolin-6-ylamino)pyridine-3-carboxamide Chemical compound C1=C(F)C(N[C@H](CC(C)C)C(N)=O)=NC(NC=2C=C3C=CC=NC3=CC=2)=C1C(N)=O UATGAVMZTVIZJW-QGZVFWFLSA-N 0.000 claims description 2
- DBERPFBEMMJJPF-OAHLLOKOSA-N 6-[[(2r)-1-amino-4-methylpentan-2-yl]amino]-2-[(1-ethylindazol-5-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C=1C=C2N(CC)N=CC2=CC=1NC1=NC(N[C@@H](CN)CC(C)C)=C(F)C=C1C(N)=O DBERPFBEMMJJPF-OAHLLOKOSA-N 0.000 claims description 2
- IWCINELGJOGLHF-CYBMUJFWSA-N 6-[[(2r)-1-amino-4-methylpentan-2-yl]amino]-2-[(5,6-dimethylpyridin-3-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=C(F)C(N[C@@H](CN)CC(C)C)=NC(NC=2C=C(C)C(C)=NC=2)=C1C(N)=O IWCINELGJOGLHF-CYBMUJFWSA-N 0.000 claims description 2
- FNEZXYSASIYMRW-APPDUMDISA-N 6-[[(2r,3s)-3-amino-1-cyclopropylbutan-2-yl]amino]-2-[(5,6-dimethylpyridin-3-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C([C@H]([C@@H](N)C)NC=1C(=CC(=C(NC=2C=C(C)C(C)=NC=2)N=1)C(N)=O)F)C1CC1 FNEZXYSASIYMRW-APPDUMDISA-N 0.000 claims description 2
- APAXNWPFBDEYAL-MEDUHNTESA-N 6-[[(2s,3r)-2-aminohexan-3-yl]amino]-2-[(5,6-dimethylpyridin-3-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=C(F)C(N[C@H](CCC)[C@H](C)N)=NC(NC=2C=C(C)C(C)=NC=2)=C1C(N)=O APAXNWPFBDEYAL-MEDUHNTESA-N 0.000 claims description 2
- HKJVAQPXJKDLKG-MEDUHNTESA-N 6-[[(2s,3r)-2-aminopentan-3-yl]amino]-2-[(1-ethylindazol-5-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=C(F)C(N[C@H](CC)[C@H](C)N)=NC(NC=2C=C3C=NN(CC)C3=CC=2)=C1C(N)=O HKJVAQPXJKDLKG-MEDUHNTESA-N 0.000 claims description 2
- 239000003085 diluting agent Substances 0.000 claims description 2
- CZHVBCBXRHXZOJ-DLBZAZTESA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(1,3-dimethylindazol-5-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=C2C(C)=NN(C)C2=CC=C1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N CZHVBCBXRHXZOJ-DLBZAZTESA-N 0.000 claims 1
- OXDIWMYFENXWOC-JKSUJKDBSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(1-ethyl-3-fluoroindazol-5-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C=1C=C2N(CC)N=C(F)C2=CC=1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N OXDIWMYFENXWOC-JKSUJKDBSA-N 0.000 claims 1
- BWLCIHFEDPKNLE-JKSUJKDBSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(1-ethyl-3-fluoroindazol-6-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=C2N(CC)N=C(F)C2=CC=C1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N BWLCIHFEDPKNLE-JKSUJKDBSA-N 0.000 claims 1
- YUEUQBRQBQVMMB-ZWKOTPCHSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(1-ethyl-3-methylindazol-5-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C=1C=C2N(CC)N=C(C)C2=CC=1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N YUEUQBRQBQVMMB-ZWKOTPCHSA-N 0.000 claims 1
- DTOQWDOCWFAYMX-DOTOQJQBSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(1-ethylindazol-4-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=CC=C2N(CC)N=CC2=C1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N DTOQWDOCWFAYMX-DOTOQJQBSA-N 0.000 claims 1
- KOLJPDSYGRZQSB-DLBZAZTESA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(1-ethylindazol-5-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C=1C=C2N(CC)N=CC2=CC=1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N KOLJPDSYGRZQSB-DLBZAZTESA-N 0.000 claims 1
- KDGBXGBXHSFPQQ-DLBZAZTESA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(1-ethylindazol-6-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=C2N(CC)N=CC2=CC=C1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N KDGBXGBXHSFPQQ-DLBZAZTESA-N 0.000 claims 1
- SLIWJBZQQIOOGN-DLBZAZTESA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(2,3-diethoxyquinoxalin-6-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=C2N=C(OCC)C(OCC)=NC2=CC=C1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N SLIWJBZQQIOOGN-DLBZAZTESA-N 0.000 claims 1
- PNUYBQWQWZPJPJ-QFBILLFUSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(2,3-diethylquinoxalin-6-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=C2N=C(CC)C(CC)=NC2=CC=C1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N PNUYBQWQWZPJPJ-QFBILLFUSA-N 0.000 claims 1
- XOMOXTZWGPMSDA-LSDHHAIUSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(2,3-dimethoxyquinoxalin-6-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=C2N=C(OC)C(OC)=NC2=CC=C1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N XOMOXTZWGPMSDA-LSDHHAIUSA-N 0.000 claims 1
- RUMHQKZXZVECLP-DLBZAZTESA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(2,3-dimethylquinoxalin-6-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=C2N=C(C)C(C)=NC2=CC=C1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N RUMHQKZXZVECLP-DLBZAZTESA-N 0.000 claims 1
- AXDPCYKXYZZYMU-NZQKXSOJSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(2-benzylindazol-4-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C3=CN(CC=4C=CC=CC=4)N=C3C=CC=2)=C(C(N)=O)C=C1F AXDPCYKXYZZYMU-NZQKXSOJSA-N 0.000 claims 1
- IXCKVGRIELVSAN-JTHBVZDNSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(2-benzylindazol-5-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC2=CC3=CN(CC=4C=CC=CC=4)N=C3C=C2)=C(C(N)=O)C=C1F IXCKVGRIELVSAN-JTHBVZDNSA-N 0.000 claims 1
- LABZYBJJLUPPPJ-LSDHHAIUSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(2-ethoxypyridin-4-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=NC(OCC)=CC(NC=2C(=CC(F)=C(N[C@H]3[C@H](CCCC3)N)N=2)C(N)=O)=C1 LABZYBJJLUPPPJ-LSDHHAIUSA-N 0.000 claims 1
- VNNSFHAMDIBCKM-PKOBYXMFSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(2-ethoxyquinolin-6-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=CC2=NC(OCC)=CC=C2C=C1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N VNNSFHAMDIBCKM-PKOBYXMFSA-N 0.000 claims 1
- QAAMFKBBHHLQQX-JKSUJKDBSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(5,6-dimethylpyridin-3-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound N1=C(C)C(C)=CC(NC=2C(=CC(F)=C(N[C@H]3[C@H](CCCC3)N)N=2)C(N)=O)=C1 QAAMFKBBHHLQQX-JKSUJKDBSA-N 0.000 claims 1
- ITISZECBEXLLKB-JKSUJKDBSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(5-ethylpyridin-3-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound CCC1=CN=CC(NC=2C(=CC(F)=C(N[C@H]3[C@H](CCCC3)N)N=2)C(N)=O)=C1 ITISZECBEXLLKB-JKSUJKDBSA-N 0.000 claims 1
- ZMEYAWAVBHMWHB-DOTOQJQBSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[(6-cyclopropylpyridin-3-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=NC(=CC=2)C2CC2)=C(C(N)=O)C=C1F ZMEYAWAVBHMWHB-DOTOQJQBSA-N 0.000 claims 1
- KOWABZZJYFGFSK-DLBZAZTESA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[1-(2,2-difluoroethyl)-3-methylindazol-5-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=C2C(C)=NN(CC(F)F)C2=CC=C1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N KOWABZZJYFGFSK-DLBZAZTESA-N 0.000 claims 1
- WQZFDTKEYGTRJQ-JKSUJKDBSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[1-(2,2-difluoroethyl)indazol-5-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C3C=NN(CC(F)F)C3=CC=2)=C(C(N)=O)C=C1F WQZFDTKEYGTRJQ-JKSUJKDBSA-N 0.000 claims 1
- OVKNFPBTKGGAMY-JKSUJKDBSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[1-(2,2-difluoroethyl)indazol-6-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C3N(CC(F)F)N=CC3=CC=2)=C(C(N)=O)C=C1F OVKNFPBTKGGAMY-JKSUJKDBSA-N 0.000 claims 1
- XUQCQHUZKTZABG-PKOBYXMFSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[1-(cyclopropylmethyl)indazol-4-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=3C=NN(CC4CC4)C=3C=CC=2)=C(C(N)=O)C=C1F XUQCQHUZKTZABG-PKOBYXMFSA-N 0.000 claims 1
- ASLUEJUQOHZVJV-RBUKOAKNSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[1-(cyclopropylmethyl)indazol-6-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C3N(CC4CC4)N=CC3=CC=2)=C(C(N)=O)C=C1F ASLUEJUQOHZVJV-RBUKOAKNSA-N 0.000 claims 1
- JRDZBFCWSJFHIO-PZJWPPBQSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[1-[2-(2-ethoxyethoxy)ethyl]indazol-4-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=CC=C2N(CCOCCOCC)N=CC2=C1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N JRDZBFCWSJFHIO-PZJWPPBQSA-N 0.000 claims 1
- JSUQSPMAZRWZEL-ZWKOTPCHSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[2-(1,3-benzodioxol-5-yl)pyridin-4-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C(N=CC=2)C=2C=C3OCOC3=CC=2)=C(C(N)=O)C=C1F JSUQSPMAZRWZEL-ZWKOTPCHSA-N 0.000 claims 1
- KJFJNVLXCLYGHC-ZWKOTPCHSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[2-(2,3-difluorophenyl)pyridin-4-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C(N=CC=2)C=2C(=C(F)C=CC=2)F)=C(C(N)=O)C=C1F KJFJNVLXCLYGHC-ZWKOTPCHSA-N 0.000 claims 1
- SXYZXAZTMWKGQP-RBUKOAKNSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[2-(2,4-difluorophenyl)pyridin-4-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C(N=CC=2)C=2C(=CC(F)=CC=2)F)=C(C(N)=O)C=C1F SXYZXAZTMWKGQP-RBUKOAKNSA-N 0.000 claims 1
- RVTAYQFGZJXKNY-RBUKOAKNSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[2-(2,5-difluorophenyl)pyridin-4-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C(N=CC=2)C=2C(=CC=C(F)C=2)F)=C(C(N)=O)C=C1F RVTAYQFGZJXKNY-RBUKOAKNSA-N 0.000 claims 1
- FIXFRFHZUOBXHS-PZJWPPBQSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[2-(2-ethoxyethoxy)quinolin-6-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=CC2=NC(OCCOCC)=CC=C2C=C1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N FIXFRFHZUOBXHS-PZJWPPBQSA-N 0.000 claims 1
- MQCADAOXGJGWJM-ZWKOTPCHSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[2-(3-chloro-2-fluorophenyl)pyridin-4-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C(N=CC=2)C=2C(=C(Cl)C=CC=2)F)=C(C(N)=O)C=C1F MQCADAOXGJGWJM-ZWKOTPCHSA-N 0.000 claims 1
- XMTBWZJNVIMCFK-FXAWDEMLSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[2-(cyclopropylmethyl)indazol-4-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C3=CN(CC4CC4)N=C3C=CC=2)=C(C(N)=O)C=C1F XMTBWZJNVIMCFK-FXAWDEMLSA-N 0.000 claims 1
- DADDDLCVEUGBFE-JTHBVZDNSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[2-[2-(2-ethoxyethoxy)ethoxy]quinolin-6-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound C1=CC2=NC(OCCOCCOCC)=CC=C2C=C1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N DADDDLCVEUGBFE-JTHBVZDNSA-N 0.000 claims 1
- BOIDGCVVSYUNCM-FCHUYYIVSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[2-[2-(2-ethoxyethoxy)ethoxy]quinolin-7-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound C=1C2=NC(OCCOCCOCC)=CC=C2C=CC=1NC(C(=CC=1F)C(N)=O)=NC=1N[C@@H]1CCCC[C@@H]1N BOIDGCVVSYUNCM-FCHUYYIVSA-N 0.000 claims 1
- HNBSKZFGFNPJPY-RBUKOAKNSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[5-(1,3-benzodioxol-5-yl)pyridin-3-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C(C=NC=2)C=2C=C3OCOC3=CC=2)=C(C(N)=O)C=C1F HNBSKZFGFNPJPY-RBUKOAKNSA-N 0.000 claims 1
- KCDZZMCIAGPMBL-VQTJNVASSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-2-[[5-(cyclohexen-1-yl)pyridin-3-yl]amino]-5-fluoropyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C(C=NC=2)C=2CCCCC=2)=C(C(N)=O)C=C1F KCDZZMCIAGPMBL-VQTJNVASSA-N 0.000 claims 1
- KPTBTUHWSAGNEH-VQTJNVASSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-5-fluoro-2-[(3-pyrazol-1-ylquinolin-7-yl)amino]pyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C3N=CC(=CC3=CC=2)N2N=CC=C2)=C(C(N)=O)C=C1F KPTBTUHWSAGNEH-VQTJNVASSA-N 0.000 claims 1
- ZISUEEGSJAQVSA-LSDHHAIUSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-5-fluoro-2-[[2-(1,2,4-triazol-1-yl)pyridin-4-yl]amino]pyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C(N=CC=2)N2N=CN=C2)=C(C(N)=O)C=C1F ZISUEEGSJAQVSA-LSDHHAIUSA-N 0.000 claims 1
- NNLOOQOMWJGYNL-JKSUJKDBSA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-5-fluoro-2-[[5-(1,2,4-triazol-1-yl)pyridin-3-yl]amino]pyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C(C=NC=2)N2N=CN=C2)=C(C(N)=O)C=C1F NNLOOQOMWJGYNL-JKSUJKDBSA-N 0.000 claims 1
- XZCZBQMHBGAZGP-DLBZAZTESA-N 6-[[(1r,2s)-2-aminocyclohexyl]amino]-5-fluoro-2-[[5-(1h-pyrazol-4-yl)pyridin-3-yl]amino]pyridine-3-carboxamide Chemical compound N[C@H]1CCCC[C@H]1NC1=NC(NC=2C=C(C=NC=2)C2=CNN=C2)=C(C(N)=O)C=C1F XZCZBQMHBGAZGP-DLBZAZTESA-N 0.000 claims 1
- DECOBWFIDZYPEJ-KPZWWZAWSA-N 6-[[(2r,3s)-3-amino-1-cyclopropylbutan-2-yl]amino]-2-[(1-ethylindazol-5-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C([C@@H](NC=1N=C(C(=CC=1F)C(N)=O)NC=1C=C2C=NN(C2=CC=1)CC)[C@H](C)N)C1CC1 DECOBWFIDZYPEJ-KPZWWZAWSA-N 0.000 claims 1
- PXLISLSXRWBSSH-SCLBCKFNSA-N 6-[[(2s,3r)-2-amino-5-methylhexan-3-yl]amino]-2-[(1-ethylindazol-5-yl)amino]-5-fluoropyridine-3-carboxamide Chemical compound C=1C=C2N(CC)N=CC2=CC=1NC1=NC(N[C@H](CC(C)C)[C@H](C)N)=C(F)C=C1C(N)=O PXLISLSXRWBSSH-SCLBCKFNSA-N 0.000 claims 1
- 239000003937 drug carrier Substances 0.000 claims 1
- 239000000126 substance Substances 0.000 abstract description 40
- 230000000694 effects Effects 0.000 abstract description 11
- 239000003814 drug Substances 0.000 abstract description 7
- 230000001747 exhibiting effect Effects 0.000 abstract 1
- 229940043355 kinase inhibitor Drugs 0.000 abstract 1
- 239000003757 phosphotransferase inhibitor Substances 0.000 abstract 1
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 399
- 239000002904 solvent Substances 0.000 description 180
- 239000000243 solution Substances 0.000 description 178
- 238000006243 chemical reaction Methods 0.000 description 152
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 135
- 230000002829 reductive effect Effects 0.000 description 109
- 238000003756 stirring Methods 0.000 description 109
- 229910052731 fluorine Inorganic materials 0.000 description 98
- 125000001153 fluoro group Chemical group F* 0.000 description 98
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 description 97
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 96
- 125000003118 aryl group Chemical group 0.000 description 95
- 239000007787 solid Substances 0.000 description 88
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 87
- 238000005160 1H NMR spectroscopy Methods 0.000 description 82
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 78
- 238000010898 silica gel chromatography Methods 0.000 description 57
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 54
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 description 52
- 238000004519 manufacturing process Methods 0.000 description 51
- 239000012044 organic layer Substances 0.000 description 48
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 47
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 46
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 44
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 42
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 40
- 125000002252 acyl group Chemical group 0.000 description 40
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 39
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 39
- 238000001914 filtration Methods 0.000 description 39
- 229910052801 chlorine Inorganic materials 0.000 description 38
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical class O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 38
- 125000001309 chloro group Chemical group Cl* 0.000 description 36
- 238000000605 extraction Methods 0.000 description 36
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 34
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 33
- 239000002585 base Substances 0.000 description 33
- 239000011541 reaction mixture Substances 0.000 description 32
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 31
- 239000012267 brine Substances 0.000 description 31
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 30
- 125000003277 amino group Chemical group 0.000 description 29
- 125000006239 protecting group Chemical group 0.000 description 29
- 229920006395 saturated elastomer Polymers 0.000 description 27
- 239000007864 aqueous solution Substances 0.000 description 26
- 239000002244 precipitate Substances 0.000 description 25
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 24
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 24
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 24
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 23
- 239000003921 oil Substances 0.000 description 23
- 235000019198 oils Nutrition 0.000 description 23
- 229910000027 potassium carbonate Inorganic materials 0.000 description 23
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 22
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 22
- 150000001408 amides Chemical class 0.000 description 22
- 235000019270 ammonium chloride Nutrition 0.000 description 22
- 229910052757 nitrogen Inorganic materials 0.000 description 22
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 21
- 150000002170 ethers Chemical class 0.000 description 21
- 150000001298 alcohols Chemical class 0.000 description 20
- 239000000203 mixture Substances 0.000 description 20
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 20
- 239000002253 acid Substances 0.000 description 19
- 125000004104 aryloxy group Chemical group 0.000 description 19
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 18
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 18
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 18
- FVAUCKIRQBBSSJ-UHFFFAOYSA-M sodium iodide Chemical compound [Na+].[I-] FVAUCKIRQBBSSJ-UHFFFAOYSA-M 0.000 description 18
- 238000012360 testing method Methods 0.000 description 18
- 125000000304 alkynyl group Chemical group 0.000 description 17
- 125000004391 aryl sulfonyl group Chemical group 0.000 description 17
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 17
- 210000004027 cell Anatomy 0.000 description 17
- 150000002148 esters Chemical class 0.000 description 17
- 150000008282 halocarbons Chemical class 0.000 description 17
- 150000002825 nitriles Chemical class 0.000 description 17
- 125000004400 (C1-C12) alkyl group Chemical group 0.000 description 16
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 16
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 16
- 125000003342 alkenyl group Chemical group 0.000 description 16
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 16
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 16
- 229910000024 caesium carbonate Inorganic materials 0.000 description 16
- 238000001816 cooling Methods 0.000 description 16
- 150000002334 glycols Chemical class 0.000 description 16
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 16
- 150000002576 ketones Chemical class 0.000 description 16
- 239000012312 sodium hydride Substances 0.000 description 16
- 229910000104 sodium hydride Inorganic materials 0.000 description 16
- 150000003462 sulfoxides Chemical class 0.000 description 16
- 229910052717 sulfur Inorganic materials 0.000 description 16
- 125000006274 (C1-C3)alkoxy group Chemical group 0.000 description 15
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 15
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 15
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 14
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 14
- 125000002619 bicyclic group Chemical group 0.000 description 14
- 230000002401 inhibitory effect Effects 0.000 description 14
- 125000004739 (C1-C6) alkylsulfonyl group Chemical group 0.000 description 13
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 13
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 13
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 13
- 238000000034 method Methods 0.000 description 13
- 235000001968 nicotinic acid Nutrition 0.000 description 13
- 239000011664 nicotinic acid Substances 0.000 description 13
- 239000012299 nitrogen atmosphere Substances 0.000 description 13
- 229910052763 palladium Inorganic materials 0.000 description 13
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 12
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 12
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 12
- JRNVZBWKYDBUCA-UHFFFAOYSA-N N-chlorosuccinimide Chemical compound ClN1C(=O)CCC1=O JRNVZBWKYDBUCA-UHFFFAOYSA-N 0.000 description 12
- 238000005481 NMR spectroscopy Methods 0.000 description 12
- 125000004093 cyano group Chemical group *C#N 0.000 description 12
- 239000007788 liquid Substances 0.000 description 12
- 125000002950 monocyclic group Chemical group 0.000 description 12
- 125000004043 oxo group Chemical group O=* 0.000 description 12
- CXNIUSPIQKWYAI-UHFFFAOYSA-N xantphos Chemical compound C=12OC3=C(P(C=4C=CC=CC=4)C=4C=CC=CC=4)C=CC=C3C(C)(C)C2=CC=CC=1P(C=1C=CC=CC=1)C1=CC=CC=C1 CXNIUSPIQKWYAI-UHFFFAOYSA-N 0.000 description 12
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 11
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 11
- 238000009835 boiling Methods 0.000 description 11
- 230000002140 halogenating effect Effects 0.000 description 11
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 11
- 125000004433 nitrogen atom Chemical group N* 0.000 description 11
- 235000017557 sodium bicarbonate Nutrition 0.000 description 11
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 11
- 229910000029 sodium carbonate Inorganic materials 0.000 description 11
- 239000011593 sulfur Substances 0.000 description 11
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 10
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 10
- 125000005842 heteroatom Chemical group 0.000 description 10
- 150000007529 inorganic bases Chemical class 0.000 description 10
- 229910052760 oxygen Inorganic materials 0.000 description 10
- 239000001301 oxygen Substances 0.000 description 10
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 10
- 125000004454 (C1-C6) alkoxycarbonyl group Chemical group 0.000 description 9
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 9
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 9
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 9
- 230000004913 activation Effects 0.000 description 9
- 230000005764 inhibitory process Effects 0.000 description 9
- 150000007530 organic bases Chemical class 0.000 description 9
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 9
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 8
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 8
- 235000011054 acetic acid Nutrition 0.000 description 8
- PUJDIJCNWFYVJX-UHFFFAOYSA-N benzyl carbamate Chemical compound NC(=O)OCC1=CC=CC=C1 PUJDIJCNWFYVJX-UHFFFAOYSA-N 0.000 description 8
- 239000003153 chemical reaction reagent Substances 0.000 description 8
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 8
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 8
- 229910052751 metal Inorganic materials 0.000 description 8
- 239000002184 metal Substances 0.000 description 8
- 125000002098 pyridazinyl group Chemical group 0.000 description 8
- 238000010992 reflux Methods 0.000 description 8
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 8
- 238000003786 synthesis reaction Methods 0.000 description 8
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 8
- 125000006591 (C2-C6) alkynylene group Chemical group 0.000 description 7
- XTIGGAHUZJWQMD-UHFFFAOYSA-N 1-chloro-2-methoxyethane Chemical compound COCCCl XTIGGAHUZJWQMD-UHFFFAOYSA-N 0.000 description 7
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 7
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 7
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 7
- 125000004423 acyloxy group Chemical group 0.000 description 7
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 7
- 150000003863 ammonium salts Chemical class 0.000 description 7
- 125000005161 aryl oxy carbonyl group Chemical group 0.000 description 7
- 239000012298 atmosphere Substances 0.000 description 7
- 125000004122 cyclic group Chemical group 0.000 description 7
- 125000004430 oxygen atom Chemical group O* 0.000 description 7
- 238000002360 preparation method Methods 0.000 description 7
- 150000003254 radicals Chemical class 0.000 description 7
- 239000011734 sodium Substances 0.000 description 7
- VCGRFBXVSFAGGA-UHFFFAOYSA-N (1,1-dioxo-1,4-thiazinan-4-yl)-[6-[[3-(4-fluorophenyl)-5-methyl-1,2-oxazol-4-yl]methoxy]pyridin-3-yl]methanone Chemical compound CC=1ON=C(C=2C=CC(F)=CC=2)C=1COC(N=C1)=CC=C1C(=O)N1CCS(=O)(=O)CC1 VCGRFBXVSFAGGA-UHFFFAOYSA-N 0.000 description 6
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 description 6
- ZGYIXVSQHOKQRZ-COIATFDQSA-N (e)-n-[4-[3-chloro-4-(pyridin-2-ylmethoxy)anilino]-3-cyano-7-[(3s)-oxolan-3-yl]oxyquinolin-6-yl]-4-(dimethylamino)but-2-enamide Chemical compound N#CC1=CN=C2C=C(O[C@@H]3COCC3)C(NC(=O)/C=C/CN(C)C)=CC2=C1NC(C=C1Cl)=CC=C1OCC1=CC=CC=N1 ZGYIXVSQHOKQRZ-COIATFDQSA-N 0.000 description 6
- NDROWMOVSVLHDO-UHFFFAOYSA-N 3-bromoquinolin-8-amine Chemical compound BrC1=CN=C2C(N)=CC=CC2=C1 NDROWMOVSVLHDO-UHFFFAOYSA-N 0.000 description 6
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 6
- YYROPELSRYBVMQ-UHFFFAOYSA-N 4-toluenesulfonyl chloride Chemical compound CC1=CC=C(S(Cl)(=O)=O)C=C1 YYROPELSRYBVMQ-UHFFFAOYSA-N 0.000 description 6
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 6
- 102000009438 IgE Receptors Human genes 0.000 description 6
- 108010073816 IgE Receptors Proteins 0.000 description 6
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 6
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 6
- WGQKYBSKWIADBV-UHFFFAOYSA-N benzylamine Chemical compound NCC1=CC=CC=C1 WGQKYBSKWIADBV-UHFFFAOYSA-N 0.000 description 6
- 239000003054 catalyst Substances 0.000 description 6
- 239000003795 chemical substances by application Substances 0.000 description 6
- 239000012230 colorless oil Substances 0.000 description 6
- 239000000706 filtrate Substances 0.000 description 6
- 238000010438 heat treatment Methods 0.000 description 6
- 230000007062 hydrolysis Effects 0.000 description 6
- 238000006460 hydrolysis reaction Methods 0.000 description 6
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 6
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 6
- 229940110728 nitrogen / oxygen Drugs 0.000 description 6
- XSCHRSMBECNVNS-UHFFFAOYSA-N quinoxaline Chemical compound N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 description 6
- QDRKDTQENPPHOJ-UHFFFAOYSA-N sodium ethoxide Chemical compound [Na+].CC[O-] QDRKDTQENPPHOJ-UHFFFAOYSA-N 0.000 description 6
- 235000009518 sodium iodide Nutrition 0.000 description 6
- 125000004434 sulfur atom Chemical group 0.000 description 6
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 6
- 125000003161 (C1-C6) alkylene group Chemical group 0.000 description 5
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 5
- 206010021245 Idiopathic thrombocytopenic purpura Diseases 0.000 description 5
- 208000031981 Thrombocytopenic Idiopathic Purpura Diseases 0.000 description 5
- 201000003710 autoimmune thrombocytopenic purpura Diseases 0.000 description 5
- IJKVHSBPTUYDLN-UHFFFAOYSA-N dihydroxy(oxo)silane Chemical compound O[Si](O)=O IJKVHSBPTUYDLN-UHFFFAOYSA-N 0.000 description 5
- VAYGXNSJCAHWJZ-UHFFFAOYSA-N dimethyl sulfate Chemical compound COS(=O)(=O)OC VAYGXNSJCAHWJZ-UHFFFAOYSA-N 0.000 description 5
- 150000003949 imides Chemical class 0.000 description 5
- 125000002911 monocyclic heterocycle group Chemical group 0.000 description 5
- NTTOTNSKUYCDAV-UHFFFAOYSA-N potassium hydride Chemical compound [KH] NTTOTNSKUYCDAV-UHFFFAOYSA-N 0.000 description 5
- 229910000105 potassium hydride Inorganic materials 0.000 description 5
- RJSRSRITMWVIQT-UHFFFAOYSA-N quinolin-6-amine Chemical compound N1=CC=CC2=CC(N)=CC=C21 RJSRSRITMWVIQT-UHFFFAOYSA-N 0.000 description 5
- 239000000741 silica gel Substances 0.000 description 5
- 229910002027 silica gel Inorganic materials 0.000 description 5
- 239000000725 suspension Substances 0.000 description 5
- 229910000404 tripotassium phosphate Inorganic materials 0.000 description 5
- 235000019798 tripotassium phosphate Nutrition 0.000 description 5
- 125000006705 (C5-C7) cycloalkyl group Chemical group 0.000 description 4
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 4
- OZAIFHULBGXAKX-UHFFFAOYSA-N 2-(2-cyanopropan-2-yldiazenyl)-2-methylpropanenitrile Chemical compound N#CC(C)(C)N=NC(C)(C)C#N OZAIFHULBGXAKX-UHFFFAOYSA-N 0.000 description 4
- SSJTUNFEJHMAEH-NEPJUHHUSA-N 2-chloro-5-fluoro-6-[[(1r,2s)-2-[(2-methylpropan-2-yl)oxycarbonylamino]cyclohexyl]amino]pyridine-3-carboxylic acid Chemical compound CC(C)(C)OC(=O)N[C@H]1CCCC[C@H]1NC1=NC(Cl)=C(C(O)=O)C=C1F SSJTUNFEJHMAEH-NEPJUHHUSA-N 0.000 description 4
- SOSPMXMEOFGPIM-UHFFFAOYSA-N 3,5-dibromopyridine Chemical compound BrC1=CN=CC(Br)=C1 SOSPMXMEOFGPIM-UHFFFAOYSA-N 0.000 description 4
- BLBDTBCGPHPIJK-UHFFFAOYSA-N 4-Amino-2-chloropyridine Chemical compound NC1=CC=NC(Cl)=C1 BLBDTBCGPHPIJK-UHFFFAOYSA-N 0.000 description 4
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 4
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 4
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 4
- 206010020751 Hypersensitivity Diseases 0.000 description 4
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 4
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 4
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 4
- 150000004703 alkoxides Chemical class 0.000 description 4
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 4
- 229910021529 ammonia Inorganic materials 0.000 description 4
- 235000011114 ammonium hydroxide Nutrition 0.000 description 4
- 125000002618 bicyclic heterocycle group Chemical group 0.000 description 4
- 239000011575 calcium Substances 0.000 description 4
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 4
- 230000004069 differentiation Effects 0.000 description 4
- 238000005984 hydrogenation reaction Methods 0.000 description 4
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 4
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 4
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 4
- 125000000714 pyrimidinyl group Chemical group 0.000 description 4
- 125000003808 silyl group Chemical group [H][Si]([H])([H])[*] 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- DYHSDKLCOJIUFX-UHFFFAOYSA-N tert-butoxycarbonyl anhydride Chemical compound CC(C)(C)OC(=O)OC(=O)OC(C)(C)C DYHSDKLCOJIUFX-UHFFFAOYSA-N 0.000 description 4
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 4
- 231100000419 toxicity Toxicity 0.000 description 4
- 230000001988 toxicity Effects 0.000 description 4
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 4
- YWWDBCBWQNCYNR-UHFFFAOYSA-N trimethylphosphine Chemical compound CP(C)C YWWDBCBWQNCYNR-UHFFFAOYSA-N 0.000 description 4
- COIOYMYWGDAQPM-UHFFFAOYSA-N tris(2-methylphenyl)phosphane Chemical compound CC1=CC=CC=C1P(C=1C(=CC=CC=1)C)C1=CC=CC=C1C COIOYMYWGDAQPM-UHFFFAOYSA-N 0.000 description 4
- BWHDROKFUHTORW-UHFFFAOYSA-N tritert-butylphosphane Chemical compound CC(C)(C)P(C(C)(C)C)C(C)(C)C BWHDROKFUHTORW-UHFFFAOYSA-N 0.000 description 4
- RFFLAFLAYFXFSW-UHFFFAOYSA-N 1,2-dichlorobenzene Chemical compound ClC1=CC=CC=C1Cl RFFLAFLAYFXFSW-UHFFFAOYSA-N 0.000 description 3
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 3
- DUHZMMOZVKNZMO-UHFFFAOYSA-N 2-chloro-6-phenylpyridin-4-amine Chemical compound NC1=CC(Cl)=NC(C=2C=CC=CC=2)=C1 DUHZMMOZVKNZMO-UHFFFAOYSA-N 0.000 description 3
- PBGQDNSMFBXURC-UHFFFAOYSA-N 2-chloro-7-nitroquinoline Chemical compound C1=CC(Cl)=NC2=CC([N+](=O)[O-])=CC=C21 PBGQDNSMFBXURC-UHFFFAOYSA-N 0.000 description 3
- XIAPLHYFQYRMPL-UHFFFAOYSA-N 3-bromo-7-nitroquinoline Chemical compound C1=C(Br)C=NC2=CC([N+](=O)[O-])=CC=C21 XIAPLHYFQYRMPL-UHFFFAOYSA-N 0.000 description 3
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 3
- MFCPXRHDOOYWNO-UHFFFAOYSA-N 6-bromoquinolin-8-amine Chemical compound C1=CN=C2C(N)=CC(Br)=CC2=C1 MFCPXRHDOOYWNO-UHFFFAOYSA-N 0.000 description 3
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 3
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 3
- YNBADRVTZLEFNH-UHFFFAOYSA-N Methyl nicotinate Natural products COC(=O)C1=CC=CN=C1 YNBADRVTZLEFNH-UHFFFAOYSA-N 0.000 description 3
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- SORGEQQSQGNZFI-UHFFFAOYSA-N [azido(phenoxy)phosphoryl]oxybenzene Chemical compound C=1C=CC=CC=1OP(=O)(N=[N+]=[N-])OC1=CC=CC=C1 SORGEQQSQGNZFI-UHFFFAOYSA-N 0.000 description 3
- 208000026935 allergic disease Diseases 0.000 description 3
- 230000007815 allergy Effects 0.000 description 3
- 150000001412 amines Chemical class 0.000 description 3
- 239000000908 ammonium hydroxide Substances 0.000 description 3
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 3
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 3
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 3
- 150000001735 carboxylic acids Chemical class 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- GBRBMTNGQBKBQE-UHFFFAOYSA-L copper;diiodide Chemical compound I[Cu]I GBRBMTNGQBKBQE-UHFFFAOYSA-L 0.000 description 3
- 239000013078 crystal Substances 0.000 description 3
- YMHQVDAATAEZLO-UHFFFAOYSA-N cyclohexane-1,1-diamine Chemical compound NC1(N)CCCCC1 YMHQVDAATAEZLO-UHFFFAOYSA-N 0.000 description 3
- 239000012024 dehydrating agents Substances 0.000 description 3
- MTHSVFCYNBDYFN-UHFFFAOYSA-N diethylene glycol Chemical compound OCCOCCO MTHSVFCYNBDYFN-UHFFFAOYSA-N 0.000 description 3
- MKRTXPORKIRPDG-UHFFFAOYSA-N diphenylphosphoryl azide Chemical compound C=1C=CC=CC=1P(=O)(N=[N+]=[N-])C1=CC=CC=C1 MKRTXPORKIRPDG-UHFFFAOYSA-N 0.000 description 3
- 235000019253 formic acid Nutrition 0.000 description 3
- WBJINCZRORDGAQ-UHFFFAOYSA-N formic acid ethyl ester Natural products CCOC=O WBJINCZRORDGAQ-UHFFFAOYSA-N 0.000 description 3
- 125000003630 glycyl group Chemical group [H]N([H])C([H])([H])C(*)=O 0.000 description 3
- 150000004677 hydrates Chemical class 0.000 description 3
- 239000005457 ice water Substances 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 125000005945 imidazopyridyl group Chemical group 0.000 description 3
- 125000001041 indolyl group Chemical group 0.000 description 3
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 3
- 239000003446 ligand Substances 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 3
- 229960001238 methylnicotinate Drugs 0.000 description 3
- 150000007522 mineralic acids Chemical class 0.000 description 3
- 150000002940 palladium Chemical class 0.000 description 3
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 3
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 3
- 229910000073 phosphorus hydride Inorganic materials 0.000 description 3
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 3
- 239000012453 solvate Substances 0.000 description 3
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 3
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 2
- JRHPOFJADXHYBR-HTQZYQBOSA-N (1r,2r)-1-n,2-n-dimethylcyclohexane-1,2-diamine Chemical compound CN[C@@H]1CCCC[C@H]1NC JRHPOFJADXHYBR-HTQZYQBOSA-N 0.000 description 2
- SSJXIUAHEKJCMH-OLQVQODUSA-N (1s,2r)-cyclohexane-1,2-diamine Chemical compound N[C@H]1CCCC[C@H]1N SSJXIUAHEKJCMH-OLQVQODUSA-N 0.000 description 2
- 125000006590 (C2-C6) alkenylene group Chemical group 0.000 description 2
- GLDHCTXOXXKUEB-ONEGZZNKSA-N (e)-1-(5-bromopyridin-3-yl)-3-(dimethylamino)prop-2-en-1-one Chemical compound CN(C)\C=C\C(=O)C1=CN=CC(Br)=C1 GLDHCTXOXXKUEB-ONEGZZNKSA-N 0.000 description 2
- KEQGZUUPPQEDPF-UHFFFAOYSA-N 1,3-dichloro-5,5-dimethylimidazolidine-2,4-dione Chemical compound CC1(C)N(Cl)C(=O)N(Cl)C1=O KEQGZUUPPQEDPF-UHFFFAOYSA-N 0.000 description 2
- DPHWIISCANPMBC-UHFFFAOYSA-N 1-(2-methoxyethyl)-4-nitroindazole Chemical compound C1=CC=C2N(CCOC)N=CC2=C1[N+]([O-])=O DPHWIISCANPMBC-UHFFFAOYSA-N 0.000 description 2
- HHCLNZBCCQDVOQ-UHFFFAOYSA-N 1-[[4-[2-(2,3-dihydro-1H-inden-2-ylamino)pyrimidin-5-yl]-1-[2-oxo-2-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)ethyl]pyrazol-3-yl]methyl]piperazin-2-one Chemical compound C1C(CC2=CC=CC=C12)NC1=NC=C(C=N1)C=1C(=NN(C=1)CC(N1CC2=C(CC1)NN=N2)=O)CN1C(CNCC1)=O HHCLNZBCCQDVOQ-UHFFFAOYSA-N 0.000 description 2
- PAMIQIKDUOTOBW-UHFFFAOYSA-N 1-methylpiperidine Chemical compound CN1CCCCC1 PAMIQIKDUOTOBW-UHFFFAOYSA-N 0.000 description 2
- QWENRTYMTSOGBR-UHFFFAOYSA-N 1H-1,2,3-Triazole Chemical compound C=1C=NNN=1 QWENRTYMTSOGBR-UHFFFAOYSA-N 0.000 description 2
- GQHTUMJGOHRCHB-UHFFFAOYSA-N 2,3,4,6,7,8,9,10-octahydropyrimido[1,2-a]azepine Chemical compound C1CCCCN2CCCN=C21 GQHTUMJGOHRCHB-UHFFFAOYSA-N 0.000 description 2
- GXZUCLBKYYODLO-UHFFFAOYSA-N 2-(2-methoxyethyl)-4-nitroindazole Chemical compound [O-][N+](=O)C1=CC=CC2=NN(CCOC)C=C21 GXZUCLBKYYODLO-UHFFFAOYSA-N 0.000 description 2
- MUPOQIZIMMTOKC-UHFFFAOYSA-N 2-(triazol-1-yl)pyridin-4-amine Chemical compound NC1=CC=NC(N2N=NC=C2)=C1 MUPOQIZIMMTOKC-UHFFFAOYSA-N 0.000 description 2
- PFHOSZAOXCYAGJ-UHFFFAOYSA-N 2-[(2-cyano-4-methoxy-4-methylpentan-2-yl)diazenyl]-4-methoxy-2,4-dimethylpentanenitrile Chemical compound COC(C)(C)CC(C)(C#N)N=NC(C)(C#N)CC(C)(C)OC PFHOSZAOXCYAGJ-UHFFFAOYSA-N 0.000 description 2
- WYGWHHGCAGTUCH-UHFFFAOYSA-N 2-[(2-cyano-4-methylpentan-2-yl)diazenyl]-2,4-dimethylpentanenitrile Chemical compound CC(C)CC(C)(C#N)N=NC(C)(C#N)CC(C)C WYGWHHGCAGTUCH-UHFFFAOYSA-N 0.000 description 2
- VWVRASTUFJRTHW-UHFFFAOYSA-N 2-[3-(azetidin-3-yloxy)-4-[2-(2,3-dihydro-1H-inden-2-ylamino)pyrimidin-5-yl]pyrazol-1-yl]-1-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)ethanone Chemical compound O=C(CN1C=C(C(OC2CNC2)=N1)C1=CN=C(NC2CC3=C(C2)C=CC=C3)N=C1)N1CCC2=C(C1)N=NN2 VWVRASTUFJRTHW-UHFFFAOYSA-N 0.000 description 2
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 2
- WWSJZGAPAVMETJ-UHFFFAOYSA-N 2-[4-[2-(2,3-dihydro-1H-inden-2-ylamino)pyrimidin-5-yl]-3-ethoxypyrazol-1-yl]-1-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)ethanone Chemical compound C1C(CC2=CC=CC=C12)NC1=NC=C(C=N1)C=1C(=NN(C=1)CC(=O)N1CC2=C(CC1)NN=N2)OCC WWSJZGAPAVMETJ-UHFFFAOYSA-N 0.000 description 2
- ZRPAUEVGEGEPFQ-UHFFFAOYSA-N 2-[4-[2-(2,3-dihydro-1H-inden-2-ylamino)pyrimidin-5-yl]pyrazol-1-yl]-1-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)ethanone Chemical compound C1C(CC2=CC=CC=C12)NC1=NC=C(C=N1)C=1C=NN(C=1)CC(=O)N1CC2=C(CC1)NN=N2 ZRPAUEVGEGEPFQ-UHFFFAOYSA-N 0.000 description 2
- MARXMDRWROUXMD-UHFFFAOYSA-N 2-bromoisoindole-1,3-dione Chemical compound C1=CC=C2C(=O)N(Br)C(=O)C2=C1 MARXMDRWROUXMD-UHFFFAOYSA-N 0.000 description 2
- BAZVFQBTJPBRTJ-UHFFFAOYSA-N 2-chloro-5-nitropyridine Chemical compound [O-][N+](=O)C1=CC=C(Cl)N=C1 BAZVFQBTJPBRTJ-UHFFFAOYSA-N 0.000 description 2
- WDRFYIPWHMGQPN-UHFFFAOYSA-N 2-chloroisoindole-1,3-dione Chemical compound C1=CC=C2C(=O)N(Cl)C(=O)C2=C1 WDRFYIPWHMGQPN-UHFFFAOYSA-N 0.000 description 2
- YJUSELYBOUHDFP-UHFFFAOYSA-N 2-cyano-n'-quinolin-6-ylethanimidamide Chemical compound N1=CC=CC2=CC(NC(CC#N)=N)=CC=C21 YJUSELYBOUHDFP-UHFFFAOYSA-N 0.000 description 2
- CAYNHVKVMRLXEZ-UHFFFAOYSA-N 2-fluoro-4-hydroxybut-2-enoic acid Chemical compound OCC=C(F)C(O)=O CAYNHVKVMRLXEZ-UHFFFAOYSA-N 0.000 description 2
- PVDYNYCZGYOXAF-UHFFFAOYSA-N 2-fluoroethyl acetate Chemical compound CC(=O)OCCF PVDYNYCZGYOXAF-UHFFFAOYSA-N 0.000 description 2
- GBEBAFAPIXROKJ-UHFFFAOYSA-N 2-methoxy-7-nitroquinoline Chemical compound C1=CC([N+]([O-])=O)=CC2=NC(OC)=CC=C21 GBEBAFAPIXROKJ-UHFFFAOYSA-N 0.000 description 2
- 125000004200 2-methoxyethyl group Chemical group [H]C([H])([H])OC([H])([H])C([H])([H])* 0.000 description 2
- IUZXUDZAWMCDQL-UHFFFAOYSA-N 2-methyl-5-nitro-3-phenylpyridine Chemical compound CC1=NC=C([N+]([O-])=O)C=C1C1=CC=CC=C1 IUZXUDZAWMCDQL-UHFFFAOYSA-N 0.000 description 2
- WSKWHTGTIPBINS-UHFFFAOYSA-N 2-methyl-5-nitro-3-pyrrolidin-1-ylpyridine Chemical compound CC1=NC=C([N+]([O-])=O)C=C1N1CCCC1 WSKWHTGTIPBINS-UHFFFAOYSA-N 0.000 description 2
- YOETUEMZNOLGDB-UHFFFAOYSA-N 2-methylpropyl carbonochloridate Chemical compound CC(C)COC(Cl)=O YOETUEMZNOLGDB-UHFFFAOYSA-N 0.000 description 2
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 2
- WRXNJTBODVGDRY-UHFFFAOYSA-N 2-pyrrolidin-1-ylethanamine Chemical compound NCCN1CCCC1 WRXNJTBODVGDRY-UHFFFAOYSA-N 0.000 description 2
- JWDAMDYGEXCZJT-UHFFFAOYSA-N 3-(5-bromopyridin-3-yl)phenol Chemical compound OC1=CC=CC(C=2C=C(Br)C=NC=2)=C1 JWDAMDYGEXCZJT-UHFFFAOYSA-N 0.000 description 2
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 2
- XCOOCPCBUZXZJH-UHFFFAOYSA-N 3-bromo-5-(triazol-1-yl)pyridine Chemical compound BrC1=CN=CC(N2N=NC=C2)=C1 XCOOCPCBUZXZJH-UHFFFAOYSA-N 0.000 description 2
- CFJJZVMYMPQIRD-UHFFFAOYSA-N 3-bromoquinolin-7-ol Chemical compound C1=C(Br)C=NC2=CC(O)=CC=C21 CFJJZVMYMPQIRD-UHFFFAOYSA-N 0.000 description 2
- GPKCCBYZRFLVKN-UHFFFAOYSA-N 3-chloro-7-nitroquinoline Chemical compound C1=C(Cl)C=NC2=CC([N+](=O)[O-])=CC=C21 GPKCCBYZRFLVKN-UHFFFAOYSA-N 0.000 description 2
- LULAYUGMBFYYEX-UHFFFAOYSA-N 3-chlorobenzoic acid Chemical compound OC(=O)C1=CC=CC(Cl)=C1 LULAYUGMBFYYEX-UHFFFAOYSA-N 0.000 description 2
- BJMPEXIOBKRJRT-UHFFFAOYSA-N 4-(3-methyl-5-nitropyridin-2-yl)morpholine Chemical compound CC1=CC([N+]([O-])=O)=CN=C1N1CCOCC1 BJMPEXIOBKRJRT-UHFFFAOYSA-N 0.000 description 2
- CABIVQQMCQVZQS-UHFFFAOYSA-N 4-(4-bromo-1h-pyrrolo[2,3-b]pyridin-6-yl)morpholine Chemical compound N=1C=2NC=CC=2C(Br)=CC=1N1CCOCC1 CABIVQQMCQVZQS-UHFFFAOYSA-N 0.000 description 2
- YXNJSEFNCCQFLZ-UHFFFAOYSA-N 4-(5-bromopyridin-3-yl)phenol Chemical compound C1=CC(O)=CC=C1C1=CN=CC(Br)=C1 YXNJSEFNCCQFLZ-UHFFFAOYSA-N 0.000 description 2
- VJPPLCNBDLZIFG-ZDUSSCGKSA-N 4-[(3S)-3-(but-2-ynoylamino)piperidin-1-yl]-5-fluoro-2,3-dimethyl-1H-indole-7-carboxamide Chemical compound C(C#CC)(=O)N[C@@H]1CN(CCC1)C1=C2C(=C(NC2=C(C=C1F)C(=O)N)C)C VJPPLCNBDLZIFG-ZDUSSCGKSA-N 0.000 description 2
- DCVGCQPXTOSWEA-UHFFFAOYSA-N 4-[[4-[2-(2,3-dihydro-1H-inden-2-ylamino)pyrimidin-5-yl]-1-[2-oxo-2-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)ethyl]pyrazol-3-yl]methyl]-1-methylpiperazin-2-one Chemical compound CN1CCN(CC2=NN(CC(=O)N3CCC4=C(C3)N=NN4)C=C2C2=CN=C(NC3CC4=C(C3)C=CC=C4)N=C2)CC1=O DCVGCQPXTOSWEA-UHFFFAOYSA-N 0.000 description 2
- YHCHKDJGIIKNQY-UHFFFAOYSA-N 4-chloro-2-ethynyl-6-fluoroaniline Chemical compound NC1=C(F)C=C(Cl)C=C1C#C YHCHKDJGIIKNQY-UHFFFAOYSA-N 0.000 description 2
- UWSWCDGNCCBVCG-UHFFFAOYSA-N 4-chloro-2-fluoro-6-(2-trimethylsilylethynyl)aniline Chemical compound C[Si](C)(C)C#CC1=CC(Cl)=CC(F)=C1N UWSWCDGNCCBVCG-UHFFFAOYSA-N 0.000 description 2
- IRPVABHDSJVBNZ-RTHVDDQRSA-N 5-[1-(cyclopropylmethyl)-5-[(1R,5S)-3-(oxetan-3-yl)-3-azabicyclo[3.1.0]hexan-6-yl]pyrazol-3-yl]-3-(trifluoromethyl)pyridin-2-amine Chemical compound C1=C(C(F)(F)F)C(N)=NC=C1C1=NN(CC2CC2)C(C2[C@@H]3CN(C[C@@H]32)C2COC2)=C1 IRPVABHDSJVBNZ-RTHVDDQRSA-N 0.000 description 2
- LDOUIQIWJYFNAH-UHFFFAOYSA-N 5-bromo-1-(cyclopropylmethyl)indazole Chemical compound N1=CC2=CC(Br)=CC=C2N1CC1CC1 LDOUIQIWJYFNAH-UHFFFAOYSA-N 0.000 description 2
- BDPAUURZYYFEMX-UHFFFAOYSA-N 5-bromo-2-(cyclopropylmethyl)indazole Chemical compound C1=C2C=C(Br)C=CC2=NN1CC1CC1 BDPAUURZYYFEMX-UHFFFAOYSA-N 0.000 description 2
- MDQXGHBCDCOOSM-UHFFFAOYSA-N 5-bromopyridin-3-amine Chemical compound NC1=CN=CC(Br)=C1 MDQXGHBCDCOOSM-UHFFFAOYSA-N 0.000 description 2
- FQIUCPGDKPXSLL-UHFFFAOYSA-N 5-bromopyridine-3-carboxylic acid Chemical compound OC(=O)C1=CN=CC(Br)=C1 FQIUCPGDKPXSLL-UHFFFAOYSA-N 0.000 description 2
- RLNDYWNLXURYIE-UHFFFAOYSA-N 5-chloro-1-(4-methylphenyl)sulfonylindole Chemical compound C1=CC(C)=CC=C1S(=O)(=O)N1C2=CC=C(Cl)C=C2C=C1 RLNDYWNLXURYIE-UHFFFAOYSA-N 0.000 description 2
- AMZRSOQSOGPOQX-UHFFFAOYSA-N 5-chloro-2-fluoro-1-(4-methylphenyl)sulfonylindole Chemical compound C1=CC(C)=CC=C1S(=O)(=O)N1C2=CC=C(Cl)C=C2C=C1F AMZRSOQSOGPOQX-UHFFFAOYSA-N 0.000 description 2
- IGZAGWFBNMNPGL-UHFFFAOYSA-N 5-chloro-2-fluoro-1h-indole Chemical compound ClC1=CC=C2NC(F)=CC2=C1 IGZAGWFBNMNPGL-UHFFFAOYSA-N 0.000 description 2
- DEMKNLXJQNYAFY-UHFFFAOYSA-N 5-chloro-2-methylpyridine Chemical compound CC1=CC=C(Cl)C=N1 DEMKNLXJQNYAFY-UHFFFAOYSA-N 0.000 description 2
- ALVWLRRLYMWPAJ-UHFFFAOYSA-N 5-chloro-7-fluoro-1h-indole Chemical compound FC1=CC(Cl)=CC2=C1NC=C2 ALVWLRRLYMWPAJ-UHFFFAOYSA-N 0.000 description 2
- STZMOOCMZUHLQO-UHFFFAOYSA-N 5-fluoro-6-oxo-2-(quinolin-6-ylamino)-1h-pyridine-3-carbonitrile Chemical compound N1C(=O)C(F)=CC(C#N)=C1NC1=CC=C(N=CC=C2)C2=C1 STZMOOCMZUHLQO-UHFFFAOYSA-N 0.000 description 2
- GOEVQXBKWLMVEU-UHFFFAOYSA-N 5-nitro-n-(2-pyrrolidin-1-ylethyl)pyridin-2-amine Chemical compound N1=CC([N+](=O)[O-])=CC=C1NCCN1CCCC1 GOEVQXBKWLMVEU-UHFFFAOYSA-N 0.000 description 2
- BAXUDPKGRMMFBV-UHFFFAOYSA-N 5-phenylpyridin-3-amine Chemical compound NC1=CN=CC(C=2C=CC=CC=2)=C1 BAXUDPKGRMMFBV-UHFFFAOYSA-N 0.000 description 2
- AERQLDMEKUZFHF-UHFFFAOYSA-N 6-bromo-3-methylimidazo[4,5-b]pyridine Chemical compound BrC1=CN=C2N(C)C=NC2=C1 AERQLDMEKUZFHF-UHFFFAOYSA-N 0.000 description 2
- MXKZSCXYMSXOAO-UHFFFAOYSA-N 7-nitroquinoline Chemical compound C1=CC=NC2=CC([N+](=O)[O-])=CC=C21 MXKZSCXYMSXOAO-UHFFFAOYSA-N 0.000 description 2
- WREVVZMUNPAPOV-UHFFFAOYSA-N 8-aminoquinoline Chemical compound C1=CN=C2C(N)=CC=CC2=C1 WREVVZMUNPAPOV-UHFFFAOYSA-N 0.000 description 2
- ZRPZPNYZFSJUPA-UHFFFAOYSA-N ARS-1620 Chemical compound Oc1cccc(F)c1-c1c(Cl)cc2c(ncnc2c1F)N1CCN(CC1)C(=O)C=C ZRPZPNYZFSJUPA-UHFFFAOYSA-N 0.000 description 2
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 2
- 239000005695 Ammonium acetate Substances 0.000 description 2
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- GKQLYSROISKDLL-UHFFFAOYSA-N EEDQ Chemical compound C1=CC=C2N(C(=O)OCC)C(OCC)C=CC2=C1 GKQLYSROISKDLL-UHFFFAOYSA-N 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 239000007995 HEPES buffer Substances 0.000 description 2
- NTYJJOPFIAHURM-UHFFFAOYSA-N Histamine Chemical compound NCCC1=CN=CN1 NTYJJOPFIAHURM-UHFFFAOYSA-N 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 2
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- JLTDJTHDQAWBAV-UHFFFAOYSA-N N,N-dimethylaniline Chemical compound CN(C)C1=CC=CC=C1 JLTDJTHDQAWBAV-UHFFFAOYSA-N 0.000 description 2
- ZSXGLVDWWRXATF-UHFFFAOYSA-N N,N-dimethylformamide dimethyl acetal Chemical compound COC(OC)N(C)C ZSXGLVDWWRXATF-UHFFFAOYSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 2
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 2
- KFSLWBXXFJQRDL-UHFFFAOYSA-N Peracetic acid Chemical compound CC(=O)OO KFSLWBXXFJQRDL-UHFFFAOYSA-N 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 2
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 2
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 2
- JKSCHQPLVMOAEQ-UHFFFAOYSA-N [3-(5-bromopyridin-3-yl)pyrrol-1-yl]-tri(propan-2-yl)silane Chemical compound CC(C)[Si](C(C)C)(C(C)C)N1C=CC(C=2C=C(Br)C=NC=2)=C1 JKSCHQPLVMOAEQ-UHFFFAOYSA-N 0.000 description 2
- IBOSQEVNEMFOMC-UHFFFAOYSA-N [5-chloro-1-(4-methylphenyl)sulfonylindol-2-yl]-trimethylstannane Chemical compound C1=CC(C)=CC=C1S(=O)(=O)N1C2=CC=C(Cl)C=C2C=C1[Sn](C)(C)C IBOSQEVNEMFOMC-UHFFFAOYSA-N 0.000 description 2
- HDXRRLLMIBHKSP-UHFFFAOYSA-N [O-][N+]1=CC=C(Br)C2=C1NC=C2 Chemical compound [O-][N+]1=CC=C(Br)C2=C1NC=C2 HDXRRLLMIBHKSP-UHFFFAOYSA-N 0.000 description 2
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 2
- YRKCREAYFQTBPV-UHFFFAOYSA-N acetylacetone Chemical compound CC(=O)CC(C)=O YRKCREAYFQTBPV-UHFFFAOYSA-N 0.000 description 2
- 125000005278 alkyl sulfonyloxy group Chemical group 0.000 description 2
- 125000002947 alkylene group Chemical group 0.000 description 2
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 2
- 229940024606 amino acid Drugs 0.000 description 2
- 235000001014 amino acid Nutrition 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 235000019257 ammonium acetate Nutrition 0.000 description 2
- 229940043376 ammonium acetate Drugs 0.000 description 2
- SWLVFNYSXGMGBS-UHFFFAOYSA-N ammonium bromide Chemical compound [NH4+].[Br-] SWLVFNYSXGMGBS-UHFFFAOYSA-N 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- RDOXTESZEPMUJZ-UHFFFAOYSA-N anisole Chemical compound COC1=CC=CC=C1 RDOXTESZEPMUJZ-UHFFFAOYSA-N 0.000 description 2
- 125000003435 aroyl group Chemical group 0.000 description 2
- 125000005279 aryl sulfonyloxy group Chemical group 0.000 description 2
- 229960005261 aspartic acid Drugs 0.000 description 2
- 235000003704 aspartic acid Nutrition 0.000 description 2
- 125000002393 azetidinyl group Chemical group 0.000 description 2
- 150000001540 azides Chemical class 0.000 description 2
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 2
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 2
- JZEYMGMOBIYUOV-GFCCVEGCSA-N benzyl n-[(2r)-1-amino-4-methyl-1-oxopentan-2-yl]carbamate Chemical compound CC(C)C[C@H](C(N)=O)NC(=O)OCC1=CC=CC=C1 JZEYMGMOBIYUOV-GFCCVEGCSA-N 0.000 description 2
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 2
- CQEYYJKEWSMYFG-UHFFFAOYSA-N butyl acrylate Chemical compound CCCCOC(=O)C=C CQEYYJKEWSMYFG-UHFFFAOYSA-N 0.000 description 2
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 2
- 150000001718 carbodiimides Chemical class 0.000 description 2
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 2
- 230000024245 cell differentiation Effects 0.000 description 2
- 239000003638 chemical reducing agent Substances 0.000 description 2
- 239000000460 chlorine Substances 0.000 description 2
- MGNZXYYWBUKAII-UHFFFAOYSA-N cyclohexa-1,3-diene Chemical compound C1CC=CC=C1 MGNZXYYWBUKAII-UHFFFAOYSA-N 0.000 description 2
- HGCIXCUEYOPUTN-UHFFFAOYSA-N cyclohexene Chemical compound C1CCC=CC1 HGCIXCUEYOPUTN-UHFFFAOYSA-N 0.000 description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- LUHRUZNRQAULJS-UHFFFAOYSA-N cyclohexyl n-tert-butylcarbamate Chemical compound CC(C)(C)NC(=O)OC1CCCCC1 LUHRUZNRQAULJS-UHFFFAOYSA-N 0.000 description 2
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- VRLDVERQJMEPIF-UHFFFAOYSA-N dbdmh Chemical compound CC1(C)N(Br)C(=O)N(Br)C1=O VRLDVERQJMEPIF-UHFFFAOYSA-N 0.000 description 2
- YNHIGQDRGKUECZ-UHFFFAOYSA-N dichloropalladium;triphenylphosphanium Chemical compound Cl[Pd]Cl.C1=CC=CC=C1[PH+](C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1[PH+](C=1C=CC=CC=1)C1=CC=CC=C1 YNHIGQDRGKUECZ-UHFFFAOYSA-N 0.000 description 2
- VLNZUSMTOFYNPS-UHFFFAOYSA-N diethylphosphorylformonitrile Chemical compound CCP(=O)(CC)C#N VLNZUSMTOFYNPS-UHFFFAOYSA-N 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 238000000132 electrospray ionisation Methods 0.000 description 2
- 238000006911 enzymatic reaction Methods 0.000 description 2
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- LEQAOMBKQFMDFZ-UHFFFAOYSA-N glyoxal Chemical compound O=CC=O LEQAOMBKQFMDFZ-UHFFFAOYSA-N 0.000 description 2
- 229910052736 halogen Inorganic materials 0.000 description 2
- 150000002367 halogens Chemical class 0.000 description 2
- 125000006038 hexenyl group Chemical group 0.000 description 2
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000005980 hexynyl group Chemical group 0.000 description 2
- 150000001469 hydantoins Chemical class 0.000 description 2
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 2
- 230000002757 inflammatory effect Effects 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 102000006495 integrins Human genes 0.000 description 2
- 108010044426 integrins Proteins 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 2
- 238000000752 ionisation method Methods 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 125000004594 isoindolinyl group Chemical group C1(NCC2=CC=CC=C12)* 0.000 description 2
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000000555 isopropenyl group Chemical group [H]\C([H])=C(\*)C([H])([H])[H] 0.000 description 2
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 2
- 125000005956 isoquinolyl group Chemical group 0.000 description 2
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical compound [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 description 2
- 210000004698 lymphocyte Anatomy 0.000 description 2
- 229940098779 methanesulfonic acid Drugs 0.000 description 2
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 description 2
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 2
- BNALRGCGTXDHLO-UHFFFAOYSA-N n,n-bis(2-methoxyethyl)-5-nitropyridin-2-amine Chemical compound COCCN(CCOC)C1=CC=C([N+]([O-])=O)C=N1 BNALRGCGTXDHLO-UHFFFAOYSA-N 0.000 description 2
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- XBXCNNQPRYLIDE-UHFFFAOYSA-M n-tert-butylcarbamate Chemical compound CC(C)(C)NC([O-])=O XBXCNNQPRYLIDE-UHFFFAOYSA-M 0.000 description 2
- 125000001624 naphthyl group Chemical group 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N nickel Substances [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- MUJIDPITZJWBSW-UHFFFAOYSA-N palladium(2+) Chemical compound [Pd+2] MUJIDPITZJWBSW-UHFFFAOYSA-N 0.000 description 2
- NXJCBFBQEVOTOW-UHFFFAOYSA-L palladium(2+);dihydroxide Chemical compound O[Pd]O NXJCBFBQEVOTOW-UHFFFAOYSA-L 0.000 description 2
- PIBWKRNGBLPSSY-UHFFFAOYSA-L palladium(II) chloride Chemical compound Cl[Pd]Cl PIBWKRNGBLPSSY-UHFFFAOYSA-L 0.000 description 2
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 2
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 2
- 125000005981 pentynyl group Chemical group 0.000 description 2
- HXITXNWTGFUOAU-UHFFFAOYSA-N phenylboronic acid Chemical compound OB(O)C1=CC=CC=C1 HXITXNWTGFUOAU-UHFFFAOYSA-N 0.000 description 2
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 2
- 239000002953 phosphate buffered saline Substances 0.000 description 2
- 230000026731 phosphorylation Effects 0.000 description 2
- 238000006366 phosphorylation reaction Methods 0.000 description 2
- 125000004193 piperazinyl group Chemical group 0.000 description 2
- 229920000307 polymer substrate Polymers 0.000 description 2
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 2
- NROKBHXJSPEDAR-UHFFFAOYSA-M potassium fluoride Chemical compound [F-].[K+] NROKBHXJSPEDAR-UHFFFAOYSA-M 0.000 description 2
- 239000011698 potassium fluoride Substances 0.000 description 2
- FYRHIOVKTDQVFC-UHFFFAOYSA-M potassium phthalimide Chemical compound [K+].C1=CC=C2C(=O)[N-]C(=O)C2=C1 FYRHIOVKTDQVFC-UHFFFAOYSA-M 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 2
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 2
- HNJBEVLQSNELDL-UHFFFAOYSA-N pyrrolidin-2-one Chemical compound O=C1CCCN1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 description 2
- 125000006085 pyrrolopyridyl group Chemical group 0.000 description 2
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 2
- 125000005493 quinolyl group Chemical group 0.000 description 2
- 125000004621 quinuclidinyl group Chemical group N12C(CC(CC1)CC2)* 0.000 description 2
- 206010039073 rheumatoid arthritis Diseases 0.000 description 2
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- LPXPTNMVRIOKMN-UHFFFAOYSA-M sodium nitrite Chemical compound [Na+].[O-]N=O LPXPTNMVRIOKMN-UHFFFAOYSA-M 0.000 description 2
- VNFWTIYUKDMAOP-UHFFFAOYSA-N sphos Chemical group COC1=CC=CC(OC)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 VNFWTIYUKDMAOP-UHFFFAOYSA-N 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 150000003460 sulfonic acids Chemical class 0.000 description 2
- 230000001629 suppression Effects 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- 125000001981 tert-butyldimethylsilyl group Chemical group [H]C([H])([H])[Si]([H])(C([H])([H])[H])[*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- CIHOLLKRGTVIJN-UHFFFAOYSA-N tert‐butyl hydroperoxide Chemical compound CC(C)(C)OO CIHOLLKRGTVIJN-UHFFFAOYSA-N 0.000 description 2
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 2
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 2
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 2
- 125000000147 tetrahydroquinolinyl group Chemical group N1(CCCC2=CC=CC=C12)* 0.000 description 2
- 125000000335 thiazolyl group Chemical group 0.000 description 2
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 230000026683 transduction Effects 0.000 description 2
- 238000010361 transduction Methods 0.000 description 2
- YNJBWRMUSHSURL-UHFFFAOYSA-N trichloroacetic acid Chemical compound OC(=O)C(Cl)(Cl)Cl YNJBWRMUSHSURL-UHFFFAOYSA-N 0.000 description 2
- PVFOMCVHYWHZJE-UHFFFAOYSA-N trichloroacetyl chloride Chemical compound ClC(=O)C(Cl)(Cl)Cl PVFOMCVHYWHZJE-UHFFFAOYSA-N 0.000 description 2
- WLPUWLXVBWGYMZ-UHFFFAOYSA-N tricyclohexylphosphine Chemical compound C1CCCCC1P(C1CCCCC1)C1CCCCC1 WLPUWLXVBWGYMZ-UHFFFAOYSA-N 0.000 description 2
- IMNIMPAHZVJRPE-UHFFFAOYSA-N triethylenediamine Chemical compound C1CN2CCN1CC2 IMNIMPAHZVJRPE-UHFFFAOYSA-N 0.000 description 2
- QAEDZJGFFMLHHQ-UHFFFAOYSA-N trifluoroacetic anhydride Chemical compound FC(F)(F)C(=O)OC(=O)C(F)(F)F QAEDZJGFFMLHHQ-UHFFFAOYSA-N 0.000 description 2
- 125000000025 triisopropylsilyl group Chemical group C(C)(C)[Si](C(C)C)(C(C)C)* 0.000 description 2
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- HVLLSGMXQDNUAL-UHFFFAOYSA-N triphenyl phosphite Chemical compound C=1C=CC=CC=1OP(OC=1C=CC=CC=1)OC1=CC=CC=C1 HVLLSGMXQDNUAL-UHFFFAOYSA-N 0.000 description 2
- 229960004799 tryptophan Drugs 0.000 description 2
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 2
- 229920002554 vinyl polymer Polymers 0.000 description 2
- 239000003643 water by type Substances 0.000 description 2
- XROHNLJUBDMHDO-SNVBAGLBSA-N (1r)-1-(1h-imidazol-2-yl)-2-phenylethanamine Chemical compound C([C@@H](N)C=1NC=CN=1)C1=CC=CC=C1 XROHNLJUBDMHDO-SNVBAGLBSA-N 0.000 description 1
- AGSAKIVVCZROSV-RXMQYKEDSA-N (1r)-3-methyl-1-(2h-tetrazol-5-yl)butan-1-amine Chemical compound CC(C)C[C@@H](N)C=1N=NNN=1 AGSAKIVVCZROSV-RXMQYKEDSA-N 0.000 description 1
- MEFKFJOEVLUFAY-UHFFFAOYSA-N (2,2,2-trichloroacetyl) 2,2,2-trichloroacetate Chemical compound ClC(Cl)(Cl)C(=O)OC(=O)C(Cl)(Cl)Cl MEFKFJOEVLUFAY-UHFFFAOYSA-N 0.000 description 1
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 1
- FYRVVLIDHBWZBK-DDWIOCJRSA-N (2r)-2-amino-3-(4-fluorophenyl)propanamide;hydrochloride Chemical compound Cl.NC(=O)[C@H](N)CC1=CC=C(F)C=C1 FYRVVLIDHBWZBK-DDWIOCJRSA-N 0.000 description 1
- CIMIBCONSGDBFX-SBSPUUFOSA-N (2r)-2-amino-3-(4-methoxyphenyl)propanamide;hydrochloride Chemical compound Cl.COC1=CC=C(C[C@@H](N)C(N)=O)C=C1 CIMIBCONSGDBFX-SBSPUUFOSA-N 0.000 description 1
- XFCNYSGKNAWXFL-PGMHMLKASA-N (2r)-2-amino-3-methylbutanamide;hydrochloride Chemical compound Cl.CC(C)[C@@H](N)C(N)=O XFCNYSGKNAWXFL-PGMHMLKASA-N 0.000 description 1
- KLHLGTPNBQXSJT-DDWIOCJRSA-N (2r)-2-amino-3-phenylpropanamide;hydrochloride Chemical compound Cl.NC(=O)[C@H](N)CC1=CC=CC=C1 KLHLGTPNBQXSJT-DDWIOCJRSA-N 0.000 description 1
- FORGMRSGVSYZQR-RXMQYKEDSA-N (2r)-2-amino-4-methylpentanamide Chemical compound CC(C)C[C@@H](N)C(N)=O FORGMRSGVSYZQR-RXMQYKEDSA-N 0.000 description 1
- HDBMIDJFXOYCGK-AENDTGMFSA-N (2r)-2-aminobutanamide;hydrochloride Chemical compound Cl.CC[C@@H](N)C(N)=O HDBMIDJFXOYCGK-AENDTGMFSA-N 0.000 description 1
- CNAUTMPRKBSDLH-UHFFFAOYSA-N (3-bromopyrrol-1-yl)-tri(propan-2-yl)silane Chemical compound CC(C)[Si](C(C)C)(C(C)C)N1C=CC(Br)=C1 CNAUTMPRKBSDLH-UHFFFAOYSA-N 0.000 description 1
- MAYZWDRUFKUGGP-VIFPVBQESA-N (3s)-1-[5-tert-butyl-3-[(1-methyltetrazol-5-yl)methyl]triazolo[4,5-d]pyrimidin-7-yl]pyrrolidin-3-ol Chemical compound CN1N=NN=C1CN1C2=NC(C(C)(C)C)=NC(N3C[C@@H](O)CC3)=C2N=N1 MAYZWDRUFKUGGP-VIFPVBQESA-N 0.000 description 1
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- MOWXJLUYGFNTAL-DEOSSOPVSA-N (s)-[2-chloro-4-fluoro-5-(7-morpholin-4-ylquinazolin-4-yl)phenyl]-(6-methoxypyridazin-3-yl)methanol Chemical compound N1=NC(OC)=CC=C1[C@@H](O)C1=CC(C=2C3=CC=C(C=C3N=CN=2)N2CCOCC2)=C(F)C=C1Cl MOWXJLUYGFNTAL-DEOSSOPVSA-N 0.000 description 1
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 1
- SCYULBFZEHDVBN-UHFFFAOYSA-N 1,1-Dichloroethane Chemical compound CC(Cl)Cl SCYULBFZEHDVBN-UHFFFAOYSA-N 0.000 description 1
- 125000001607 1,2,3-triazol-1-yl group Chemical group [*]N1N=NC([H])=C1[H] 0.000 description 1
- 125000003626 1,2,4-triazol-1-yl group Chemical group [*]N1N=C([H])N=C1[H] 0.000 description 1
- AGYUOJIYYGGHKV-UHFFFAOYSA-N 1,2-bis(2-chloroethoxy)ethane Chemical compound ClCCOCCOCCCl AGYUOJIYYGGHKV-UHFFFAOYSA-N 0.000 description 1
- 125000005871 1,3-benzodioxolyl group Chemical group 0.000 description 1
- OTOSIXGMLYKKOW-UHFFFAOYSA-M 1,3-bis(2,4,6-trimethylphenyl)imidazol-1-ium;chloride Chemical compound [Cl-].CC1=CC(C)=CC(C)=C1N1C=[N+](C=2C(=CC(C)=CC=2C)C)C=C1 OTOSIXGMLYKKOW-UHFFFAOYSA-M 0.000 description 1
- WMKGGPCROCCUDY-UHFFFAOYSA-N 1,5-diphenylpenta-1,4-dien-3-one Chemical compound C=1C=CC=CC=1C=CC(=O)C=CC1=CC=CC=C1 WMKGGPCROCCUDY-UHFFFAOYSA-N 0.000 description 1
- APWRZPQBPCAXFP-UHFFFAOYSA-N 1-(1-oxo-2H-isoquinolin-5-yl)-5-(trifluoromethyl)-N-[2-(trifluoromethyl)pyridin-4-yl]pyrazole-4-carboxamide Chemical compound O=C1NC=CC2=C(C=CC=C12)N1N=CC(=C1C(F)(F)F)C(=O)NC1=CC(=NC=C1)C(F)(F)F APWRZPQBPCAXFP-UHFFFAOYSA-N 0.000 description 1
- KZEVSDGEBAJOTK-UHFFFAOYSA-N 1-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)-2-[5-[2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidin-5-yl]-1,3,4-oxadiazol-2-yl]ethanone Chemical compound N1N=NC=2CN(CCC=21)C(CC=1OC(=NN=1)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F)=O KZEVSDGEBAJOTK-UHFFFAOYSA-N 0.000 description 1
- LEPDQLQESOCEHE-UHFFFAOYSA-N 1-(2-methoxyethyl)indazol-4-amine Chemical compound C1=CC=C2N(CCOC)N=CC2=C1N LEPDQLQESOCEHE-UHFFFAOYSA-N 0.000 description 1
- QELFMFBHJLYFOS-UHFFFAOYSA-N 1-(2-methoxyethyl)indazol-6-amine Chemical compound C1=C(N)C=C2N(CCOC)N=CC2=C1 QELFMFBHJLYFOS-UHFFFAOYSA-N 0.000 description 1
- QTWCDCABFPLRHP-UHFFFAOYSA-N 1-(2-methoxyethyl)indol-4-amine Chemical compound C1=CC=C2N(CCOC)C=CC2=C1N QTWCDCABFPLRHP-UHFFFAOYSA-N 0.000 description 1
- ANPKSELAPHCLAQ-UHFFFAOYSA-N 1-(2-trimethylsilylethoxymethyl)indazol-6-amine Chemical compound C1=C(N)C=C2N(COCC[Si](C)(C)C)N=CC2=C1 ANPKSELAPHCLAQ-UHFFFAOYSA-N 0.000 description 1
- QQMJQSGXHOBGKJ-UHFFFAOYSA-N 1-(4-aminopyridin-2-yl)pyrrolidin-2-one Chemical compound NC1=CC=NC(N2C(CCC2)=O)=C1 QQMJQSGXHOBGKJ-UHFFFAOYSA-N 0.000 description 1
- OJCUHUIYERGNRZ-UHFFFAOYSA-N 1-(5-bromopyridin-3-yl)-4-methylpiperazine Chemical compound C1CN(C)CCN1C1=CN=CC(Br)=C1 OJCUHUIYERGNRZ-UHFFFAOYSA-N 0.000 description 1
- LDBPZEQZCOUYFT-UHFFFAOYSA-N 1-(5-bromopyridin-3-yl)ethanone Chemical compound CC(=O)C1=CN=CC(Br)=C1 LDBPZEQZCOUYFT-UHFFFAOYSA-N 0.000 description 1
- APDKNDDOVHRCGP-UHFFFAOYSA-N 1-(5-bromopyridin-3-yl)piperidin-2-one Chemical compound BrC1=CN=CC(N2C(CCCC2)=O)=C1 APDKNDDOVHRCGP-UHFFFAOYSA-N 0.000 description 1
- IFDRKGHFHOQTEA-UHFFFAOYSA-N 1-(cyclopropylmethyl)indazol-4-amine Chemical compound N1=CC=2C(N)=CC=CC=2N1CC1CC1 IFDRKGHFHOQTEA-UHFFFAOYSA-N 0.000 description 1
- ORAOYIOMGMVEMN-UHFFFAOYSA-N 1-(cyclopropylmethyl)indazol-6-amine Chemical compound C12=CC(N)=CC=C2C=NN1CC1CC1 ORAOYIOMGMVEMN-UHFFFAOYSA-N 0.000 description 1
- ZXOFAHRGRROAQR-UHFFFAOYSA-N 1-(isocyanomethylsulfonyl)-2-methylbenzene Chemical compound CC1=CC=CC=C1S(=O)(=O)C[N+]#[C-] ZXOFAHRGRROAQR-UHFFFAOYSA-N 0.000 description 1
- ABDDQTDRAHXHOC-QMMMGPOBSA-N 1-[(7s)-5,7-dihydro-4h-thieno[2,3-c]pyran-7-yl]-n-methylmethanamine Chemical compound CNC[C@@H]1OCCC2=C1SC=C2 ABDDQTDRAHXHOC-QMMMGPOBSA-N 0.000 description 1
- ZFTXGOOQRUZTBL-UHFFFAOYSA-N 1-[2-(2-ethoxyethoxy)ethyl]indazol-4-amine Chemical compound C1=CC=C2N(CCOCCOCC)N=CC2=C1N ZFTXGOOQRUZTBL-UHFFFAOYSA-N 0.000 description 1
- USBPWXFPHQRNPO-UHFFFAOYSA-N 1-[2-(2-ethoxyethoxy)ethyl]indazol-6-amine Chemical compound C1=C(N)C=C2N(CCOCCOCC)N=CC2=C1 USBPWXFPHQRNPO-UHFFFAOYSA-N 0.000 description 1
- AJRGCCSBBYUPQW-UHFFFAOYSA-N 1-[2-(6-aminoquinolin-2-yl)oxyethyl]pyrrolidin-2-one Chemical compound C1=CC2=CC(N)=CC=C2N=C1OCCN1CCCC1=O AJRGCCSBBYUPQW-UHFFFAOYSA-N 0.000 description 1
- OKMDCXDDZHEDQC-UHFFFAOYSA-N 1-[2-(6-chloroquinoxalin-2-yl)oxyethyl]pyrrolidin-2-one Chemical compound C1=NC2=CC(Cl)=CC=C2N=C1OCCN1CCCC1=O OKMDCXDDZHEDQC-UHFFFAOYSA-N 0.000 description 1
- 125000006204 1-benzoyl ethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(=O)C([H])(*)C([H])([H])[H] 0.000 description 1
- RRQYJINTUHWNHW-UHFFFAOYSA-N 1-ethoxy-2-(2-ethoxyethoxy)ethane Chemical compound CCOCCOCCOCC RRQYJINTUHWNHW-UHFFFAOYSA-N 0.000 description 1
- ZOXDRXYJSQDUJT-UHFFFAOYSA-N 1-methyl-2,3-dihydroindazol-6-amine Chemical compound C1=C(N)C=C2N(C)NCC2=C1 ZOXDRXYJSQDUJT-UHFFFAOYSA-N 0.000 description 1
- YTKNUPJYGSOVLV-UHFFFAOYSA-N 1-methylindazol-6-amine Chemical compound C1=C(N)C=C2N(C)N=CC2=C1 YTKNUPJYGSOVLV-UHFFFAOYSA-N 0.000 description 1
- FKQDTYKVWIDGNT-UHFFFAOYSA-N 1-methylindazol-7-amine Chemical compound C1=CC(N)=C2N(C)N=CC2=C1 FKQDTYKVWIDGNT-UHFFFAOYSA-N 0.000 description 1
- PGTSGPCXPIFQEL-UHFFFAOYSA-N 1-methylindol-5-amine Chemical compound NC1=CC=C2N(C)C=CC2=C1 PGTSGPCXPIFQEL-UHFFFAOYSA-N 0.000 description 1
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 1
- YQTCQNIPQMJNTI-UHFFFAOYSA-N 2,2-dimethylpropan-1-one Chemical group CC(C)(C)[C]=O YQTCQNIPQMJNTI-UHFFFAOYSA-N 0.000 description 1
- LXFQSRIDYRFTJW-UHFFFAOYSA-N 2,4,6-trimethylbenzenesulfonic acid Chemical compound CC1=CC(C)=C(S(O)(=O)=O)C(C)=C1 LXFQSRIDYRFTJW-UHFFFAOYSA-N 0.000 description 1
- OVSKIKFHRZPJSS-UHFFFAOYSA-N 2,4-D Chemical compound OC(=O)COC1=CC=C(Cl)C=C1Cl OVSKIKFHRZPJSS-UHFFFAOYSA-N 0.000 description 1
- DEDKKOOGYIMMBC-UHFFFAOYSA-N 2,6-dichloro-5-fluoropyridine-3-carbonitrile Chemical compound FC1=CC(C#N)=C(Cl)N=C1Cl DEDKKOOGYIMMBC-UHFFFAOYSA-N 0.000 description 1
- WAEZOSSWRXDWAX-UHFFFAOYSA-N 2,6-dichloropyridin-4-amine Chemical compound NC1=CC(Cl)=NC(Cl)=C1 WAEZOSSWRXDWAX-UHFFFAOYSA-N 0.000 description 1
- AJSGJCSWZUHDJB-UHFFFAOYSA-N 2,6-dimethoxypyridin-4-amine Chemical compound COC1=CC(N)=CC(OC)=N1 AJSGJCSWZUHDJB-UHFFFAOYSA-N 0.000 description 1
- LUYNNTZPFKVCSA-UHFFFAOYSA-N 2-(1,3-benzothiazol-6-ylamino)-6-chloro-5-fluoropyridine-3-carbonitrile Chemical compound N1=C(Cl)C(F)=CC(C#N)=C1NC1=CC=C(N=CS2)C2=C1 LUYNNTZPFKVCSA-UHFFFAOYSA-N 0.000 description 1
- BYEMIRPEJHCSJK-UHFFFAOYSA-N 2-(1-methoxypropan-2-yloxy)quinolin-6-amine Chemical compound C1=C(N)C=CC2=NC(OC(C)COC)=CC=C21 BYEMIRPEJHCSJK-UHFFFAOYSA-N 0.000 description 1
- RTGYIOBTMSHYQX-UHFFFAOYSA-N 2-(1-methoxypropan-2-yloxy)quinolin-7-amine Chemical compound C1=CC(N)=CC2=NC(OC(C)COC)=CC=C21 RTGYIOBTMSHYQX-UHFFFAOYSA-N 0.000 description 1
- QTBZUDNSJNOXPY-UHFFFAOYSA-N 2-(2,4-dimethoxyphenyl)pyridin-4-amine Chemical compound COC1=CC(OC)=CC=C1C1=CC(N)=CC=N1 QTBZUDNSJNOXPY-UHFFFAOYSA-N 0.000 description 1
- QETWRHABSOSAMF-UHFFFAOYSA-N 2-(2-butoxyethoxy)quinolin-6-amine Chemical compound C1=C(N)C=CC2=NC(OCCOCCCC)=CC=C21 QETWRHABSOSAMF-UHFFFAOYSA-N 0.000 description 1
- DEQYKFQEQDSGBB-UHFFFAOYSA-N 2-(2-carboxybenzoyl)peroxycarbonylbenzoic acid Chemical compound OC(=O)C1=CC=CC=C1C(=O)OOC(=O)C1=CC=CC=C1C(O)=O DEQYKFQEQDSGBB-UHFFFAOYSA-N 0.000 description 1
- AVTLBBWTUPQRAY-UHFFFAOYSA-N 2-(2-cyanobutan-2-yldiazenyl)-2-methylbutanenitrile Chemical compound CCC(C)(C#N)N=NC(C)(CC)C#N AVTLBBWTUPQRAY-UHFFFAOYSA-N 0.000 description 1
- JSGFOAORXXURMJ-UHFFFAOYSA-N 2-(2-ethoxyethoxy)ethyl 4-methylbenzenesulfonate Chemical compound CCOCCOCCOS(=O)(=O)C1=CC=C(C)C=C1 JSGFOAORXXURMJ-UHFFFAOYSA-N 0.000 description 1
- BBAFBWRQKYFRID-UHFFFAOYSA-N 2-(2-ethoxyethoxy)quinolin-6-amine Chemical compound C1=C(N)C=CC2=NC(OCCOCC)=CC=C21 BBAFBWRQKYFRID-UHFFFAOYSA-N 0.000 description 1
- TVZYXRLIXDHTMY-UHFFFAOYSA-N 2-(2-methoxyethoxy)-6-phenylpyridin-4-amine Chemical compound COCCOC1=CC(N)=CC(C=2C=CC=CC=2)=N1 TVZYXRLIXDHTMY-UHFFFAOYSA-N 0.000 description 1
- OXEOJNCWROVFSU-UHFFFAOYSA-N 2-(2-methoxyethoxy)quinolin-6-amine Chemical compound C1=C(N)C=CC2=NC(OCCOC)=CC=C21 OXEOJNCWROVFSU-UHFFFAOYSA-N 0.000 description 1
- JXYIVAVYCVLUEG-UHFFFAOYSA-N 2-(2-methoxyethoxy)quinolin-7-amine Chemical compound C1=CC(N)=CC2=NC(OCCOC)=CC=C21 JXYIVAVYCVLUEG-UHFFFAOYSA-N 0.000 description 1
- XPCUQXHKEWWDOG-UHFFFAOYSA-N 2-(2-methoxyethyl)indazol-4-amine Chemical compound NC1=CC=CC2=NN(CCOC)C=C21 XPCUQXHKEWWDOG-UHFFFAOYSA-N 0.000 description 1
- FKOKHDYNRYODRV-UHFFFAOYSA-N 2-(2-methoxyethyl)indazol-6-amine Chemical compound C1=CC(N)=CC2=NN(CCOC)C=C21 FKOKHDYNRYODRV-UHFFFAOYSA-N 0.000 description 1
- WMOSTCCXXDXSFQ-UHFFFAOYSA-N 2-(2-methylpropoxy)pyridin-4-amine Chemical compound CC(C)COC1=CC(N)=CC=N1 WMOSTCCXXDXSFQ-UHFFFAOYSA-N 0.000 description 1
- XMNIXWIUMCBBBL-UHFFFAOYSA-N 2-(2-phenylpropan-2-ylperoxy)propan-2-ylbenzene Chemical compound C=1C=CC=CC=1C(C)(C)OOC(C)(C)C1=CC=CC=C1 XMNIXWIUMCBBBL-UHFFFAOYSA-N 0.000 description 1
- GWGGKMGZLFLUMS-UHFFFAOYSA-N 2-(2-pyrrolidin-1-ylethoxy)pyridin-4-amine Chemical compound NC1=CC=NC(OCCN2CCCC2)=C1 GWGGKMGZLFLUMS-UHFFFAOYSA-N 0.000 description 1
- NSIIJGMCLKEMPU-UHFFFAOYSA-N 2-(2-pyrrolidin-1-ylethyl)-1H-pyridine-2,5-diamine Chemical compound N1(CCCC1)CCC1(NC=C(C=C1)N)N NSIIJGMCLKEMPU-UHFFFAOYSA-N 0.000 description 1
- ASCSRKZBXTVURS-UHFFFAOYSA-N 2-(2-trimethylsilylethoxymethyl)indazol-6-amine Chemical compound C1=CC(N)=CC2=NN(COCC[Si](C)(C)C)C=C21 ASCSRKZBXTVURS-UHFFFAOYSA-N 0.000 description 1
- BJYCBJPBIYILHA-UHFFFAOYSA-N 2-(3-bromophenyl)triazole Chemical compound BrC1=CC=CC(N2N=CC=N2)=C1 BJYCBJPBIYILHA-UHFFFAOYSA-N 0.000 description 1
- ZJBUGYYOCXRNOU-UHFFFAOYSA-N 2-(3-methoxybutoxy)quinolin-6-amine Chemical compound C1=C(N)C=CC2=NC(OCCC(C)OC)=CC=C21 ZJBUGYYOCXRNOU-UHFFFAOYSA-N 0.000 description 1
- QNJQYBNTWKPUEX-UHFFFAOYSA-N 2-(3-methoxybutoxy)quinolin-7-amine Chemical compound C1=CC(N)=CC2=NC(OCCC(C)OC)=CC=C21 QNJQYBNTWKPUEX-UHFFFAOYSA-N 0.000 description 1
- MCQBWEOSYOIMBX-UHFFFAOYSA-N 2-(3-methoxybutyl)pyridin-4-amine Chemical compound COC(C)CCC1=CC(N)=CC=N1 MCQBWEOSYOIMBX-UHFFFAOYSA-N 0.000 description 1
- UYXONDDPMDUNAF-UHFFFAOYSA-N 2-(5-bromopyridin-3-yl)-1,3-thiazole Chemical compound BrC1=CN=CC(C=2SC=CN=2)=C1 UYXONDDPMDUNAF-UHFFFAOYSA-N 0.000 description 1
- GEOFSNVOXMHJSE-UHFFFAOYSA-N 2-(5-methylfuran-2-yl)pyridin-4-amine Chemical compound O1C(C)=CC=C1C1=CC(N)=CC=N1 GEOFSNVOXMHJSE-UHFFFAOYSA-N 0.000 description 1
- FECHNIXZYMXJEE-MOPGFXCFSA-N 2-(benzylamino)-6-[[(1r,2s)-2-[(2-methylpropan-2-yl)oxycarbonylamino]cyclohexyl]amino]pyridine-3-carboxylic acid Chemical compound CC(C)(C)OC(=O)N[C@H]1CCCC[C@H]1NC1=CC=C(C(O)=O)C(NCC=2C=CC=CC=2)=N1 FECHNIXZYMXJEE-MOPGFXCFSA-N 0.000 description 1
- IWUFRWWFEDUWOZ-UHFFFAOYSA-N 2-(cyclopropylmethyl)indazol-4-amine Chemical compound C1=C2C(N)=CC=CC2=NN1CC1CC1 IWUFRWWFEDUWOZ-UHFFFAOYSA-N 0.000 description 1
- BAUALTQDNFJLBG-UHFFFAOYSA-N 2-(cyclopropylmethyl)indazol-6-amine Chemical compound N1=C2C=C(N)C=CC2=CN1CC1CC1 BAUALTQDNFJLBG-UHFFFAOYSA-N 0.000 description 1
- JXBIVANENPNFOP-UHFFFAOYSA-N 2-(furan-2-yl)pyridin-4-amine Chemical compound NC1=CC=NC(C=2OC=CC=2)=C1 JXBIVANENPNFOP-UHFFFAOYSA-N 0.000 description 1
- MCNRPODLGXATQF-UHFFFAOYSA-N 2-(oxolan-2-ylmethoxy)quinolin-6-amine Chemical compound C1=CC2=CC(N)=CC=C2N=C1OCC1CCCO1 MCNRPODLGXATQF-UHFFFAOYSA-N 0.000 description 1
- JVMFUVSDIMKCSF-UHFFFAOYSA-N 2-(triazol-2-yl)pyridin-4-amine Chemical compound NC1=CC=NC(N2N=CC=N2)=C1 JVMFUVSDIMKCSF-UHFFFAOYSA-N 0.000 description 1
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 1
- XNWFRZJHXBZDAG-UHFFFAOYSA-N 2-METHOXYETHANOL Chemical compound COCCO XNWFRZJHXBZDAG-UHFFFAOYSA-N 0.000 description 1
- MTLWTRLYHAQCAM-UHFFFAOYSA-N 2-[(1-cyano-2-methylpropyl)diazenyl]-3-methylbutanenitrile Chemical compound CC(C)C(C#N)N=NC(C#N)C(C)C MTLWTRLYHAQCAM-UHFFFAOYSA-N 0.000 description 1
- CEWFDJBNWSCGLE-JTQLQIEISA-N 2-[(2s)-2-methylbutoxy]quinolin-6-amine Chemical compound C1=C(N)C=CC2=NC(OC[C@@H](C)CC)=CC=C21 CEWFDJBNWSCGLE-JTQLQIEISA-N 0.000 description 1
- WMEPNJJPIQDNRR-UHFFFAOYSA-N 2-[1-tri(propan-2-yl)silylpyrrol-3-yl]pyridin-4-amine Chemical compound CC(C)[Si](C(C)C)(C(C)C)N1C=CC(C=2N=CC=C(N)C=2)=C1 WMEPNJJPIQDNRR-UHFFFAOYSA-N 0.000 description 1
- QJSROXUNXDKEAH-UHFFFAOYSA-N 2-[2-(2-butoxyethoxy)ethoxy]quinolin-6-amine Chemical compound C1=C(N)C=CC2=NC(OCCOCCOCCCC)=CC=C21 QJSROXUNXDKEAH-UHFFFAOYSA-N 0.000 description 1
- WUBSNBGXGOUORW-UHFFFAOYSA-N 2-[2-(2-ethoxyethoxy)ethoxy]quinolin-6-amine Chemical compound C1=C(N)C=CC2=NC(OCCOCCOCC)=CC=C21 WUBSNBGXGOUORW-UHFFFAOYSA-N 0.000 description 1
- DJKDVZHIKMEMEG-UHFFFAOYSA-N 2-[2-(2-ethoxyethoxy)ethoxy]quinolin-7-amine Chemical compound C1=CC(N)=CC2=NC(OCCOCCOCC)=CC=C21 DJKDVZHIKMEMEG-UHFFFAOYSA-N 0.000 description 1
- NBXHGYAAGQFARB-UHFFFAOYSA-N 2-[2-(2-ethoxyethoxy)ethyl]indazol-4-amine Chemical compound NC1=CC=CC2=NN(CCOCCOCC)C=C21 NBXHGYAAGQFARB-UHFFFAOYSA-N 0.000 description 1
- SQNXZNJBHVIRSN-UHFFFAOYSA-N 2-[2-(2-ethoxyethoxy)ethyl]indazol-6-amine Chemical compound C1=CC(N)=CC2=NN(CCOCCOCC)C=C21 SQNXZNJBHVIRSN-UHFFFAOYSA-N 0.000 description 1
- QMHBMPHRFKSGCJ-UHFFFAOYSA-N 2-[2-(2-methoxyethoxy)ethoxy]quinolin-6-amine Chemical compound C1=C(N)C=CC2=NC(OCCOCCOC)=CC=C21 QMHBMPHRFKSGCJ-UHFFFAOYSA-N 0.000 description 1
- VKOQRLKRLOMWRV-UHFFFAOYSA-N 2-[2-(2-methylpropoxy)ethoxy]quinolin-6-amine Chemical compound C1=C(N)C=CC2=NC(OCCOCC(C)C)=CC=C21 VKOQRLKRLOMWRV-UHFFFAOYSA-N 0.000 description 1
- RILZRCJGXSFXNE-UHFFFAOYSA-N 2-[4-(trifluoromethoxy)phenyl]ethanol Chemical compound OCCC1=CC=C(OC(F)(F)F)C=C1 RILZRCJGXSFXNE-UHFFFAOYSA-N 0.000 description 1
- JVKRKMWZYMKVTQ-UHFFFAOYSA-N 2-[4-[2-(2,3-dihydro-1H-inden-2-ylamino)pyrimidin-5-yl]pyrazol-1-yl]-N-(2-oxo-3H-1,3-benzoxazol-6-yl)acetamide Chemical compound C1C(CC2=CC=CC=C12)NC1=NC=C(C=N1)C=1C=NN(C=1)CC(=O)NC1=CC2=C(NC(O2)=O)C=C1 JVKRKMWZYMKVTQ-UHFFFAOYSA-N 0.000 description 1
- VXZBYIWNGKSFOJ-UHFFFAOYSA-N 2-[4-[5-(2,3-dihydro-1H-inden-2-ylamino)pyrazin-2-yl]pyrazol-1-yl]-1-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)ethanone Chemical compound C1C(CC2=CC=CC=C12)NC=1N=CC(=NC=1)C=1C=NN(C=1)CC(=O)N1CC2=C(CC1)NN=N2 VXZBYIWNGKSFOJ-UHFFFAOYSA-N 0.000 description 1
- QIXCMZROLNQSOR-UHFFFAOYSA-N 2-benzylindazol-5-amine Chemical compound C1=C2C=C(N)C=CC2=NN1CC1=CC=CC=C1 QIXCMZROLNQSOR-UHFFFAOYSA-N 0.000 description 1
- VBIWIHJKYQITCD-UHFFFAOYSA-N 2-butoxypyridin-4-amine Chemical compound CCCCOC1=CC(N)=CC=N1 VBIWIHJKYQITCD-UHFFFAOYSA-N 0.000 description 1
- GLVYLTSKTCWWJR-UHFFFAOYSA-N 2-carbonoperoxoylbenzoic acid Chemical compound OOC(=O)C1=CC=CC=C1C(O)=O GLVYLTSKTCWWJR-UHFFFAOYSA-N 0.000 description 1
- SXENUOHCHKWWPK-UHFFFAOYSA-N 2-chloro-5-fluoro-6-[(2-methylpropan-2-yl)oxycarbonyl-[2-[(2-methylpropan-2-yl)oxycarbonylamino]ethyl]amino]pyridine-3-carboxylic acid Chemical compound CC(C)(C)OC(=O)NCCN(C(=O)OC(C)(C)C)C1=NC(Cl)=C(C(O)=O)C=C1F SXENUOHCHKWWPK-UHFFFAOYSA-N 0.000 description 1
- LQQONZIVZCHCEG-UHFFFAOYSA-N 2-chloro-6-(ethylamino)-5-fluoropyridine-3-carbonitrile Chemical compound CCNC1=NC(Cl)=C(C#N)C=C1F LQQONZIVZCHCEG-UHFFFAOYSA-N 0.000 description 1
- FZZMTSNZRBFGGU-UHFFFAOYSA-N 2-chloro-7-fluoroquinazolin-4-amine Chemical compound FC1=CC=C2C(N)=NC(Cl)=NC2=C1 FZZMTSNZRBFGGU-UHFFFAOYSA-N 0.000 description 1
- XPQIRTZJJIHASD-UHFFFAOYSA-N 2-cyclopropyl-3-methyl-5-nitropyridine Chemical compound CC1=CC([N+]([O-])=O)=CN=C1C1CC1 XPQIRTZJJIHASD-UHFFFAOYSA-N 0.000 description 1
- VUXZVDOGWVABSA-UHFFFAOYSA-N 2-ethenyl-3-methyl-5-nitropyridine Chemical compound CC1=CC([N+]([O-])=O)=CN=C1C=C VUXZVDOGWVABSA-UHFFFAOYSA-N 0.000 description 1
- BLMNJPNTDHFAID-UHFFFAOYSA-N 2-ethoxyquinolin-6-amine Chemical compound C1=C(N)C=CC2=NC(OCC)=CC=C21 BLMNJPNTDHFAID-UHFFFAOYSA-N 0.000 description 1
- SUODCTNNAKSRHB-UHFFFAOYSA-N 2-ethylhexyl 3-sulfanylpropanoate Chemical compound CCCCC(CC)COC(=O)CCS SUODCTNNAKSRHB-UHFFFAOYSA-N 0.000 description 1
- MUBVFEYCVAWDSN-UHFFFAOYSA-N 2-methoxy-6-phenylpyridin-4-amine Chemical compound COC1=CC(N)=CC(C=2C=CC=CC=2)=N1 MUBVFEYCVAWDSN-UHFFFAOYSA-N 0.000 description 1
- IBZKBSXREAQDTO-UHFFFAOYSA-N 2-methoxy-n-(2-methoxyethyl)ethanamine Chemical compound COCCNCCOC IBZKBSXREAQDTO-UHFFFAOYSA-N 0.000 description 1
- IMIVOSRFWHGEBI-UHFFFAOYSA-N 2-methoxyquinolin-7-amine Chemical compound C1=CC(N)=CC2=NC(OC)=CC=C21 IMIVOSRFWHGEBI-UHFFFAOYSA-N 0.000 description 1
- FECYTFWPNCBIHC-UHFFFAOYSA-N 2-methyl-1,3-benzoxazol-5-amine Chemical compound NC1=CC=C2OC(C)=NC2=C1 FECYTFWPNCBIHC-UHFFFAOYSA-N 0.000 description 1
- NNHTUFOCRUBQCF-UHFFFAOYSA-N 2-methyl-1,3-benzoxazol-6-amine Chemical compound C1=C(N)C=C2OC(C)=NC2=C1 NNHTUFOCRUBQCF-UHFFFAOYSA-N 0.000 description 1
- GFYDDTFAVDJJAI-UHFFFAOYSA-N 2-methyl-1,3-benzoxazole-6-carboxylic acid Chemical compound C1=C(C(O)=O)C=C2OC(C)=NC2=C1 GFYDDTFAVDJJAI-UHFFFAOYSA-N 0.000 description 1
- JJRDRFZYKKFYMO-UHFFFAOYSA-N 2-methyl-2-(2-methylbutan-2-ylperoxy)butane Chemical compound CCC(C)(C)OOC(C)(C)CC JJRDRFZYKKFYMO-UHFFFAOYSA-N 0.000 description 1
- YAQDPWONDFRAHF-UHFFFAOYSA-N 2-methyl-2-(2-methylpentan-2-ylperoxy)pentane Chemical compound CCCC(C)(C)OOC(C)(C)CCC YAQDPWONDFRAHF-UHFFFAOYSA-N 0.000 description 1
- UCZSXRHVXKAGFU-UHFFFAOYSA-N 2-methyl-5-nitro-1,3-benzoxazole Chemical compound [O-][N+](=O)C1=CC=C2OC(C)=NC2=C1 UCZSXRHVXKAGFU-UHFFFAOYSA-N 0.000 description 1
- VZAGXOBOKSVVJK-UHFFFAOYSA-N 2-methyl-5-phenylpyridin-3-amine Chemical compound C1=C(N)C(C)=NC=C1C1=CC=CC=C1 VZAGXOBOKSVVJK-UHFFFAOYSA-N 0.000 description 1
- KUYDEGAEFLZVED-UHFFFAOYSA-N 2-morpholin-4-yl-6-phenylpyridin-4-amine Chemical compound C=1C(N)=CC(N2CCOCC2)=NC=1C1=CC=CC=C1 KUYDEGAEFLZVED-UHFFFAOYSA-N 0.000 description 1
- JKFXJFVFRGSAHO-UHFFFAOYSA-N 2-n,2-n-bis(2-methoxyethyl)pyridine-2,5-diamine Chemical compound COCCN(CCOC)C1=CC=C(N)C=N1 JKFXJFVFRGSAHO-UHFFFAOYSA-N 0.000 description 1
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 1
- RYFNILBIJULGJO-UHFFFAOYSA-N 2-phenylmethoxypyridin-4-amine Chemical compound NC1=CC=NC(OCC=2C=CC=CC=2)=C1 RYFNILBIJULGJO-UHFFFAOYSA-N 0.000 description 1
- KDFDOINBXBEOLZ-UHFFFAOYSA-N 2-phenylpropan-2-amine Chemical compound CC(C)(N)C1=CC=CC=C1 KDFDOINBXBEOLZ-UHFFFAOYSA-N 0.000 description 1
- DUISQAUONICSBN-UHFFFAOYSA-N 2-propan-2-yloxypyridin-4-amine Chemical compound CC(C)OC1=CC(N)=CC=N1 DUISQAUONICSBN-UHFFFAOYSA-N 0.000 description 1
- JQKYYNMKRVYYAH-UHFFFAOYSA-N 2-propan-2-yloxyquinolin-6-amine Chemical compound C1=C(N)C=CC2=NC(OC(C)C)=CC=C21 JQKYYNMKRVYYAH-UHFFFAOYSA-N 0.000 description 1
- BDGIMZHZSHEPSR-UHFFFAOYSA-N 2-propan-2-ylpyridin-3-amine Chemical compound CC(C)C1=NC=CC=C1N BDGIMZHZSHEPSR-UHFFFAOYSA-N 0.000 description 1
- XLUBTSIANJSREV-UHFFFAOYSA-N 2-propoxypyridin-4-amine Chemical compound CCCOC1=CC(N)=CC=N1 XLUBTSIANJSREV-UHFFFAOYSA-N 0.000 description 1
- PURLMAMKKLSNEN-UHFFFAOYSA-N 2-propoxyquinolin-6-amine Chemical compound C1=C(N)C=CC2=NC(OCCC)=CC=C21 PURLMAMKKLSNEN-UHFFFAOYSA-N 0.000 description 1
- WUXRMLYTUGMAPX-UHFFFAOYSA-N 2-pyrazol-1-ylpyridin-4-amine Chemical compound NC1=CC=NC(N2N=CC=C2)=C1 WUXRMLYTUGMAPX-UHFFFAOYSA-N 0.000 description 1
- YJHGQQMUSFJRDE-UHFFFAOYSA-N 2-pyridin-2-ylpyridin-4-amine Chemical compound NC1=CC=NC(C=2N=CC=CC=2)=C1 YJHGQQMUSFJRDE-UHFFFAOYSA-N 0.000 description 1
- QXOYEYGFMRZLRI-UHFFFAOYSA-N 2-pyrrol-1-ylpyridin-4-amine Chemical compound NC1=CC=NC(N2C=CC=C2)=C1 QXOYEYGFMRZLRI-UHFFFAOYSA-N 0.000 description 1
- ZBSQRSAMKYIVHH-UHFFFAOYSA-N 2-pyrrolidin-1-ylpyridin-4-amine Chemical compound NC1=CC=NC(N2CCCC2)=C1 ZBSQRSAMKYIVHH-UHFFFAOYSA-N 0.000 description 1
- WNRGWPVJGDABME-UHFFFAOYSA-N 3,5-Dimethoxyaniline Chemical compound COC1=CC(N)=CC(OC)=C1 WNRGWPVJGDABME-UHFFFAOYSA-N 0.000 description 1
- MZOXMTQTMDEHKS-UHFFFAOYSA-N 3-(1-benzylpyrazol-4-yl)-5-bromopyridine Chemical compound BrC1=CN=CC(C2=CN(CC=3C=CC=CC=3)N=C2)=C1 MZOXMTQTMDEHKS-UHFFFAOYSA-N 0.000 description 1
- HCDMJFOHIXMBOV-UHFFFAOYSA-N 3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-ethyl-8-(morpholin-4-ylmethyl)-4,7-dihydropyrrolo[4,5]pyrido[1,2-d]pyrimidin-2-one Chemical compound C=1C2=C3N(CC)C(=O)N(C=4C(=C(OC)C=C(OC)C=4F)F)CC3=CN=C2NC=1CN1CCOCC1 HCDMJFOHIXMBOV-UHFFFAOYSA-N 0.000 description 1
- YJDXLUSVVAGFFS-UHFFFAOYSA-N 3-(2-pyrrolidin-1-ylethoxy)aniline Chemical compound NC1=CC=CC(OCCN2CCCC2)=C1 YJDXLUSVVAGFFS-UHFFFAOYSA-N 0.000 description 1
- LJGHYPLBDBRCRZ-UHFFFAOYSA-N 3-(3-aminophenyl)sulfonylaniline Chemical compound NC1=CC=CC(S(=O)(=O)C=2C=C(N)C=CC=2)=C1 LJGHYPLBDBRCRZ-UHFFFAOYSA-N 0.000 description 1
- BYHQTRFJOGIQAO-GOSISDBHSA-N 3-(4-bromophenyl)-8-[(2R)-2-hydroxypropyl]-1-[(3-methoxyphenyl)methyl]-1,3,8-triazaspiro[4.5]decan-2-one Chemical compound C[C@H](CN1CCC2(CC1)CN(C(=O)N2CC3=CC(=CC=C3)OC)C4=CC=C(C=C4)Br)O BYHQTRFJOGIQAO-GOSISDBHSA-N 0.000 description 1
- YKEAQCXIDHBMLM-UHFFFAOYSA-N 3-(triazol-2-yl)aniline Chemical compound NC1=CC=CC(N2N=CC=N2)=C1 YKEAQCXIDHBMLM-UHFFFAOYSA-N 0.000 description 1
- YGYGASJNJTYNOL-CQSZACIVSA-N 3-[(4r)-2,2-dimethyl-1,1-dioxothian-4-yl]-5-(4-fluorophenyl)-1h-indole-7-carboxamide Chemical compound C1CS(=O)(=O)C(C)(C)C[C@@H]1C1=CNC2=C(C(N)=O)C=C(C=3C=CC(F)=CC=3)C=C12 YGYGASJNJTYNOL-CQSZACIVSA-N 0.000 description 1
- WNEODWDFDXWOLU-QHCPKHFHSA-N 3-[3-(hydroxymethyl)-4-[1-methyl-5-[[5-[(2s)-2-methyl-4-(oxetan-3-yl)piperazin-1-yl]pyridin-2-yl]amino]-6-oxopyridin-3-yl]pyridin-2-yl]-7,7-dimethyl-1,2,6,8-tetrahydrocyclopenta[3,4]pyrrolo[3,5-b]pyrazin-4-one Chemical compound C([C@@H](N(CC1)C=2C=NC(NC=3C(N(C)C=C(C=3)C=3C(=C(N4C(C5=CC=6CC(C)(C)CC=6N5CC4)=O)N=CC=3)CO)=O)=CC=2)C)N1C1COC1 WNEODWDFDXWOLU-QHCPKHFHSA-N 0.000 description 1
- SRVXSISGYBMIHR-UHFFFAOYSA-N 3-[3-[3-(2-amino-2-oxoethyl)phenyl]-5-chlorophenyl]-3-(5-methyl-1,3-thiazol-2-yl)propanoic acid Chemical compound S1C(C)=CN=C1C(CC(O)=O)C1=CC(Cl)=CC(C=2C=C(CC(N)=O)C=CC=2)=C1 SRVXSISGYBMIHR-UHFFFAOYSA-N 0.000 description 1
- PTTQIUHVDDBART-UHFFFAOYSA-N 3-bromo-2-chloro-5-nitropyridine Chemical compound [O-][N+](=O)C1=CN=C(Cl)C(Br)=C1 PTTQIUHVDDBART-UHFFFAOYSA-N 0.000 description 1
- DSPHJPRAYWVRPX-UHFFFAOYSA-N 3-bromo-2-ethynyl-5-(trifluoromethyl)aniline Chemical compound NC1=CC(C(F)(F)F)=CC(Br)=C1C#C DSPHJPRAYWVRPX-UHFFFAOYSA-N 0.000 description 1
- QWAOQTGMEGSRLN-UHFFFAOYSA-N 3-bromo-2-methyl-5-nitropyridine Chemical compound CC1=NC=C([N+]([O-])=O)C=C1Br QWAOQTGMEGSRLN-UHFFFAOYSA-N 0.000 description 1
- YRZYEYXCGVKATH-UHFFFAOYSA-N 3-bromo-5-(1h-pyrrol-3-yl)pyridine Chemical compound BrC1=CN=CC(C2=CNC=C2)=C1 YRZYEYXCGVKATH-UHFFFAOYSA-N 0.000 description 1
- BQQRUOZBZIKWJK-UHFFFAOYSA-N 3-bromo-5-(2,3-dihydro-1,4-benzodioxin-6-yl)pyridine Chemical compound BrC1=CN=CC(C=2C=C3OCCOC3=CC=2)=C1 BQQRUOZBZIKWJK-UHFFFAOYSA-N 0.000 description 1
- GPDFLPITJDKEHJ-UHFFFAOYSA-N 3-bromo-5-(2-methoxyphenyl)pyridine Chemical compound COC1=CC=CC=C1C1=CN=CC(Br)=C1 GPDFLPITJDKEHJ-UHFFFAOYSA-N 0.000 description 1
- YEFLJKWCTTZYOE-UHFFFAOYSA-N 3-bromo-5-(3-chlorophenyl)pyridine Chemical compound ClC1=CC=CC(C=2C=C(Br)C=NC=2)=C1 YEFLJKWCTTZYOE-UHFFFAOYSA-N 0.000 description 1
- KSGOPNBABYXQIH-UHFFFAOYSA-N 3-bromo-5-(3-fluorophenyl)pyridine Chemical compound FC1=CC=CC(C=2C=C(Br)C=NC=2)=C1 KSGOPNBABYXQIH-UHFFFAOYSA-N 0.000 description 1
- QAPUPMZZGCYQSF-UHFFFAOYSA-N 3-bromo-5-(3-methylphenyl)pyridine Chemical compound CC1=CC=CC(C=2C=C(Br)C=NC=2)=C1 QAPUPMZZGCYQSF-UHFFFAOYSA-N 0.000 description 1
- ARYLYSDKSRPBAO-UHFFFAOYSA-N 3-bromo-5-(furan-2-yl)pyridine Chemical compound BrC1=CN=CC(C=2OC=CC=2)=C1 ARYLYSDKSRPBAO-UHFFFAOYSA-N 0.000 description 1
- IKDBJFZHMDQJDY-UHFFFAOYSA-N 3-bromo-5-(furan-3-yl)pyridine Chemical compound BrC1=CN=CC(C2=COC=C2)=C1 IKDBJFZHMDQJDY-UHFFFAOYSA-N 0.000 description 1
- PZIOAHHGAFVUDR-UHFFFAOYSA-N 3-bromo-5-(triazol-2-yl)pyridine Chemical compound BrC1=CN=CC(N2N=CC=N2)=C1 PZIOAHHGAFVUDR-UHFFFAOYSA-N 0.000 description 1
- CAMFRQKDASQXFD-UHFFFAOYSA-N 3-bromo-5-[4-(2-methoxyethoxy)phenyl]pyridine Chemical compound C1=CC(OCCOC)=CC=C1C1=CN=CC(Br)=C1 CAMFRQKDASQXFD-UHFFFAOYSA-N 0.000 description 1
- SZQYSKHKTIIDKN-UHFFFAOYSA-N 3-bromo-5-cyclopropylpyridine Chemical compound BrC1=CN=CC(C2CC2)=C1 SZQYSKHKTIIDKN-UHFFFAOYSA-N 0.000 description 1
- PCCXEOYPUWBFGE-UHFFFAOYSA-N 3-bromo-5-piperidin-1-ylpyridine Chemical compound BrC1=CN=CC(N2CCCCC2)=C1 PCCXEOYPUWBFGE-UHFFFAOYSA-N 0.000 description 1
- VENROJLIHOQUPZ-UHFFFAOYSA-N 3-bromo-5-pyrrolidin-1-ylpyridine Chemical compound BrC1=CN=CC(N2CCCC2)=C1 VENROJLIHOQUPZ-UHFFFAOYSA-N 0.000 description 1
- OOVQIONIXTXWSX-UHFFFAOYSA-N 3-bromo-5-thiophen-2-ylpyridine Chemical compound BrC1=CN=CC(C=2SC=CC=2)=C1 OOVQIONIXTXWSX-UHFFFAOYSA-N 0.000 description 1
- IYAGRWHFCHXMGZ-UHFFFAOYSA-N 3-bromo-5-thiophen-3-ylpyridine Chemical compound BrC1=CN=CC(C2=CSC=C2)=C1 IYAGRWHFCHXMGZ-UHFFFAOYSA-N 0.000 description 1
- STUBVFZYJKVZBI-UHFFFAOYSA-N 3-bromo-7-(2-methoxyethoxy)quinoline Chemical compound C1=C(Br)C=NC2=CC(OCCOC)=CC=C21 STUBVFZYJKVZBI-UHFFFAOYSA-N 0.000 description 1
- OMKOKIFUOYNURM-UHFFFAOYSA-N 3-bromo-8-(2-methoxyethoxy)quinoline Chemical compound BrC1=CN=C2C(OCCOC)=CC=CC2=C1 OMKOKIFUOYNURM-UHFFFAOYSA-N 0.000 description 1
- WXYFGDYZNNITIB-UHFFFAOYSA-N 3-bromo-8-fluoro-7h-quinolin-8-amine Chemical compound BrC1=CN=C2C(N)(F)CC=CC2=C1 WXYFGDYZNNITIB-UHFFFAOYSA-N 0.000 description 1
- IIBFHHIYTFKPQR-UHFFFAOYSA-N 3-bromo-n,n-dimethylquinolin-7-amine Chemical compound C1=C(Br)C=NC2=CC(N(C)C)=CC=C21 IIBFHHIYTFKPQR-UHFFFAOYSA-N 0.000 description 1
- TWGHFWNCCLXRDC-UHFFFAOYSA-N 3-bromo-n-(cyclopropylmethyl)quinolin-8-amine Chemical compound C=1C=CC2=CC(Br)=CN=C2C=1NCC1CC1 TWGHFWNCCLXRDC-UHFFFAOYSA-N 0.000 description 1
- QZCMEVYKSCAWAI-UHFFFAOYSA-N 3-bromo-n-methyl-5-nitropyridin-2-amine Chemical compound CNC1=NC=C([N+]([O-])=O)C=C1Br QZCMEVYKSCAWAI-UHFFFAOYSA-N 0.000 description 1
- PUPYSBMMYVIJCB-UHFFFAOYSA-N 3-bromoquinolin-7-amine Chemical compound C1=C(Br)C=NC2=CC(N)=CC=C21 PUPYSBMMYVIJCB-UHFFFAOYSA-N 0.000 description 1
- VYGIVXTVBNTOLP-UHFFFAOYSA-N 3-bromoquinolin-8-ol Chemical compound BrC1=CN=C2C(O)=CC=CC2=C1 VYGIVXTVBNTOLP-UHFFFAOYSA-N 0.000 description 1
- KVHOHYUPINYSTI-UHFFFAOYSA-N 3-chloroquinolin-7-amine Chemical compound C1=C(Cl)C=NC2=CC(N)=CC=C21 KVHOHYUPINYSTI-UHFFFAOYSA-N 0.000 description 1
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 description 1
- 125000001397 3-pyrrolyl group Chemical group [H]N1C([H])=C([*])C([H])=C1[H] 0.000 description 1
- OTYZNDKWNPQQJP-UHFFFAOYSA-N 4-(2-pyrrolidin-1-ylethoxy)aniline Chemical compound C1=CC(N)=CC=C1OCCN1CCCC1 OTYZNDKWNPQQJP-UHFFFAOYSA-N 0.000 description 1
- AHMMGCODZJKQHU-UHFFFAOYSA-N 4-(3-bromoquinolin-7-yl)morpholine Chemical compound C1=CC2=CC(Br)=CN=C2C=C1N1CCOCC1 AHMMGCODZJKQHU-UHFFFAOYSA-N 0.000 description 1
- OAUSEDFJZNRYBG-UHFFFAOYSA-N 4-[2-(5-bromo-6-fluoroindol-1-yl)ethyl]morpholine Chemical compound C1=CC=2C=C(Br)C(F)=CC=2N1CCN1CCOCC1 OAUSEDFJZNRYBG-UHFFFAOYSA-N 0.000 description 1
- PQJITUXAPFKATP-UHFFFAOYSA-N 4-[2-(5-chloro-7-fluoroindol-1-yl)ethyl]morpholine Chemical compound C1=2C(F)=CC(Cl)=CC=2C=CN1CCN1CCOCC1 PQJITUXAPFKATP-UHFFFAOYSA-N 0.000 description 1
- KRKGLADHTKMEDG-UHFFFAOYSA-N 4-[2-[3-(5-bromopyridin-3-yl)phenoxy]ethyl]morpholine Chemical compound BrC1=CN=CC(C=2C=C(OCCN3CCOCC3)C=CC=2)=C1 KRKGLADHTKMEDG-UHFFFAOYSA-N 0.000 description 1
- BFAFBQHXDQTBHU-UHFFFAOYSA-N 4-[2-[4-(5-bromopyridin-3-yl)phenoxy]ethyl]morpholine Chemical compound BrC1=CN=CC(C=2C=CC(OCCN3CCOCC3)=CC=2)=C1 BFAFBQHXDQTBHU-UHFFFAOYSA-N 0.000 description 1
- HLFWFRJMUUDSAN-UHFFFAOYSA-N 4-[2-[4-bromo-6-(trifluoromethyl)indol-1-yl]ethyl]morpholine Chemical compound C12=CC(C(F)(F)F)=CC(Br)=C2C=CN1CCN1CCOCC1 HLFWFRJMUUDSAN-UHFFFAOYSA-N 0.000 description 1
- ZUFLINVJILCNLV-UHFFFAOYSA-N 4-[3-(furan-3-yl)-5-nitropyridin-2-yl]morpholine Chemical compound C1=COC=C1C1=CC([N+](=O)[O-])=CN=C1N1CCOCC1 ZUFLINVJILCNLV-UHFFFAOYSA-N 0.000 description 1
- YFCIFWOJYYFDQP-PTWZRHHISA-N 4-[3-amino-6-[(1S,3S,4S)-3-fluoro-4-hydroxycyclohexyl]pyrazin-2-yl]-N-[(1S)-1-(3-bromo-5-fluorophenyl)-2-(methylamino)ethyl]-2-fluorobenzamide Chemical compound CNC[C@@H](NC(=O)c1ccc(cc1F)-c1nc(cnc1N)[C@H]1CC[C@H](O)[C@@H](F)C1)c1cc(F)cc(Br)c1 YFCIFWOJYYFDQP-PTWZRHHISA-N 0.000 description 1
- KVCQTKNUUQOELD-UHFFFAOYSA-N 4-amino-n-[1-(3-chloro-2-fluoroanilino)-6-methylisoquinolin-5-yl]thieno[3,2-d]pyrimidine-7-carboxamide Chemical compound N=1C=CC2=C(NC(=O)C=3C4=NC=NC(N)=C4SC=3)C(C)=CC=C2C=1NC1=CC=CC(Cl)=C1F KVCQTKNUUQOELD-UHFFFAOYSA-N 0.000 description 1
- NUKYPUAOHBNCPY-UHFFFAOYSA-N 4-aminopyridine Chemical compound NC1=CC=NC=C1 NUKYPUAOHBNCPY-UHFFFAOYSA-N 0.000 description 1
- XUVGYBAPDVMOLH-UHFFFAOYSA-N 4-bromo-1-(1-methoxypropan-2-yloxy)isoquinoline Chemical compound C1=CC=C2C(OC(C)COC)=NC=C(Br)C2=C1 XUVGYBAPDVMOLH-UHFFFAOYSA-N 0.000 description 1
- IFZAIMGZYPLJNV-UHFFFAOYSA-N 4-bromo-1-(2-methoxyethoxy)isoquinoline Chemical compound C1=CC=C2C(OCCOC)=NC=C(Br)C2=C1 IFZAIMGZYPLJNV-UHFFFAOYSA-N 0.000 description 1
- QNEJRJYUUCCEGD-UHFFFAOYSA-N 4-bromo-1-(2-methoxyethyl)-6-(trifluoromethyl)indole Chemical compound C1=C(C(F)(F)F)C=C2N(CCOC)C=CC2=C1Br QNEJRJYUUCCEGD-UHFFFAOYSA-N 0.000 description 1
- XENFWFYQJWJEOV-UHFFFAOYSA-N 4-bromo-1-(3-methoxybutoxy)isoquinoline Chemical compound C1=CC=C2C(OCCC(C)OC)=NC=C(Br)C2=C1 XENFWFYQJWJEOV-UHFFFAOYSA-N 0.000 description 1
- KBJHKXKGJJKXJB-UHFFFAOYSA-N 4-bromo-1-[2-(2-ethoxyethoxy)ethoxy]isoquinoline Chemical compound C1=CC=C2C(OCCOCCOCC)=NC=C(Br)C2=C1 KBJHKXKGJJKXJB-UHFFFAOYSA-N 0.000 description 1
- BQMVHRXGXCDQEW-UHFFFAOYSA-N 4-bromo-1-methoxyisoquinoline Chemical compound C1=CC=C2C(OC)=NC=C(Br)C2=C1 BQMVHRXGXCDQEW-UHFFFAOYSA-N 0.000 description 1
- LEZHTYOQWQEBLH-UHFFFAOYSA-N 4-bromo-1h-pyrrolo[2,3-b]pyridine Chemical compound BrC1=CC=NC2=C1C=CN2 LEZHTYOQWQEBLH-UHFFFAOYSA-N 0.000 description 1
- TYRICULVJRGSTL-UHFFFAOYSA-N 4-bromo-2,3-dihydroisoindol-1-one Chemical compound BrC1=CC=CC2=C1CNC2=O TYRICULVJRGSTL-UHFFFAOYSA-N 0.000 description 1
- ANKYRIMBFGLHBP-UHFFFAOYSA-N 4-bromo-6-(1,2,4-triazol-1-yl)-1h-pyrrolo[2,3-b]pyridine Chemical compound N=1C=2NC=CC=2C(Br)=CC=1N1C=NC=N1 ANKYRIMBFGLHBP-UHFFFAOYSA-N 0.000 description 1
- BVAXUUBPFSRULA-UHFFFAOYSA-N 4-bromo-6-(triazol-1-yl)-1h-pyrrolo[2,3-b]pyridine Chemical compound N=1C=2NC=CC=2C(Br)=CC=1N1C=CN=N1 BVAXUUBPFSRULA-UHFFFAOYSA-N 0.000 description 1
- CIRHGDOBGKEWNT-UHFFFAOYSA-N 4-bromo-6-(triazol-2-yl)-1h-pyrrolo[2,3-b]pyridine Chemical compound N=1C=2NC=CC=2C(Br)=CC=1N1N=CC=N1 CIRHGDOBGKEWNT-UHFFFAOYSA-N 0.000 description 1
- GVQHXKQOACYLJU-UHFFFAOYSA-N 4-bromo-6-(trifluoromethyl)-1h-indole Chemical compound FC(F)(F)C1=CC(Br)=C2C=CNC2=C1 GVQHXKQOACYLJU-UHFFFAOYSA-N 0.000 description 1
- ZWNWZLXYXCKMBA-UHFFFAOYSA-N 4-bromo-6-fluoro-1-(2-methoxyethyl)indole Chemical compound C1=C(F)C=C2N(CCOC)C=CC2=C1Br ZWNWZLXYXCKMBA-UHFFFAOYSA-N 0.000 description 1
- DMOWKZSCECYXSE-UHFFFAOYSA-N 4-bromo-6-fluoro-1h-indole Chemical compound FC1=CC(Br)=C2C=CNC2=C1 DMOWKZSCECYXSE-UHFFFAOYSA-N 0.000 description 1
- UOCZORJPSDNBFT-UHFFFAOYSA-N 4-bromo-6-methoxy-1h-pyrrolo[2,3-b]pyridine Chemical compound COC1=CC(Br)=C2C=CNC2=N1 UOCZORJPSDNBFT-UHFFFAOYSA-N 0.000 description 1
- SSNQXCONXNVTJN-UHFFFAOYSA-N 4-chloro-2-fluoro-6-iodoaniline Chemical compound NC1=C(F)C=C(Cl)C=C1I SSNQXCONXNVTJN-UHFFFAOYSA-N 0.000 description 1
- SKWTUNAAJNDEIK-UHFFFAOYSA-N 4-fluoro-1-methyl-2-nitrobenzene Chemical compound CC1=CC=C(F)C=C1[N+]([O-])=O SKWTUNAAJNDEIK-UHFFFAOYSA-N 0.000 description 1
- 125000004217 4-methoxybenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1OC([H])([H])[H])C([H])([H])* 0.000 description 1
- RCEMAWTXZSGXRH-UHFFFAOYSA-N 4-methoxyquinolin-7-amine Chemical compound NC1=CC=C2C(OC)=CC=NC2=C1 RCEMAWTXZSGXRH-UHFFFAOYSA-N 0.000 description 1
- WBTVZVUYPVQEIF-UHFFFAOYSA-N 4-nitro-1h-indazole Chemical compound [O-][N+](=O)C1=CC=CC2=C1C=NN2 WBTVZVUYPVQEIF-UHFFFAOYSA-N 0.000 description 1
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 1
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical compound C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 description 1
- TVKIICVUNBRVQH-UHFFFAOYSA-N 5-(1,2,4-triazol-1-yl)pyridin-3-amine Chemical compound NC1=CN=CC(N2N=CN=C2)=C1 TVKIICVUNBRVQH-UHFFFAOYSA-N 0.000 description 1
- WVYOKENQXNLIFV-UHFFFAOYSA-N 5-(1,3-dihydrotriazol-2-yl)-6-methoxypyridin-3-amine Chemical compound COC1=NC=C(N)C=C1N1NC=CN1 WVYOKENQXNLIFV-UHFFFAOYSA-N 0.000 description 1
- JXLWMEPYMCOZQQ-UHFFFAOYSA-N 5-(1-methylindol-5-yl)pyridin-3-amine Chemical compound C=1C=C2N(C)C=CC2=CC=1C1=CN=CC(N)=C1 JXLWMEPYMCOZQQ-UHFFFAOYSA-N 0.000 description 1
- KQCSHIBGYABVDY-UHFFFAOYSA-N 5-(1-methylpyrrol-2-yl)pyridin-3-amine Chemical compound CN1C=CC=C1C1=CN=CC(N)=C1 KQCSHIBGYABVDY-UHFFFAOYSA-N 0.000 description 1
- WSYHMROKXBQDFZ-UHFFFAOYSA-N 5-(5-bromopyridin-3-yl)-1,2-oxazole Chemical compound BrC1=CN=CC(C=2ON=CC=2)=C1 WSYHMROKXBQDFZ-UHFFFAOYSA-N 0.000 description 1
- BTGMFLJMMTYKKI-UHFFFAOYSA-N 5-(5-bromopyridin-3-yl)-1,3-oxazole Chemical compound BrC1=CN=CC(C=2OC=NC=2)=C1 BTGMFLJMMTYKKI-UHFFFAOYSA-N 0.000 description 1
- MHHRWAYCGIBIDB-UHFFFAOYSA-N 5-(5-bromopyridin-3-yl)-1,3-thiazole Chemical compound BrC1=CN=CC(C=2SC=NC=2)=C1 MHHRWAYCGIBIDB-UHFFFAOYSA-N 0.000 description 1
- BIWBCTFQZBZWNO-UHFFFAOYSA-N 5-(5-bromopyridin-3-yl)-1h-indole Chemical compound BrC1=CN=CC(C=2C=C3C=CNC3=CC=2)=C1 BIWBCTFQZBZWNO-UHFFFAOYSA-N 0.000 description 1
- MNPHCUSQBHUZHN-UHFFFAOYSA-N 5-(5-methylfuran-2-yl)pyridin-3-amine Chemical compound O1C(C)=CC=C1C1=CN=CC(N)=C1 MNPHCUSQBHUZHN-UHFFFAOYSA-N 0.000 description 1
- MQMQANUJIRXFNK-UHFFFAOYSA-N 5-(furan-3-yl)-6-morpholin-4-ylpyridin-3-amine Chemical compound C1=COC=C1C1=CC(N)=CN=C1N1CCOCC1 MQMQANUJIRXFNK-UHFFFAOYSA-N 0.000 description 1
- CTLHNLHLHIJDAA-UHFFFAOYSA-N 5-[1-tri(propan-2-yl)silylpyrrol-3-yl]pyridin-3-amine Chemical compound CC(C)[Si](C(C)C)(C(C)C)N1C=CC(C=2C=C(N)C=NC=2)=C1 CTLHNLHLHIJDAA-UHFFFAOYSA-N 0.000 description 1
- RQTWDHZWYODRNQ-UHFFFAOYSA-N 5-bromo-1-(2-methoxyethoxy)isoquinoline Chemical compound C1=CC=C2C(OCCOC)=NC=CC2=C1Br RQTWDHZWYODRNQ-UHFFFAOYSA-N 0.000 description 1
- PPZIXNHXYHACGY-UHFFFAOYSA-N 5-bromo-1-(2-methoxyethyl)indazole Chemical compound BrC1=CC=C2N(CCOC)N=CC2=C1 PPZIXNHXYHACGY-UHFFFAOYSA-N 0.000 description 1
- RNIOGRCVOKPOOE-UHFFFAOYSA-N 5-bromo-1-(2-methoxypropoxy)isoquinoline Chemical compound C1=CC=C2C(OCC(C)OC)=NC=CC2=C1Br RNIOGRCVOKPOOE-UHFFFAOYSA-N 0.000 description 1
- TYJRSQIQLHNRRC-UHFFFAOYSA-N 5-bromo-1-[2-(2-ethoxyethoxy)ethoxy]isoquinoline Chemical compound C1=CC=C2C(OCCOCCOCC)=NC=CC2=C1Br TYJRSQIQLHNRRC-UHFFFAOYSA-N 0.000 description 1
- LLSXIRJCWNXSRQ-UHFFFAOYSA-N 5-bromo-1-[2-(2-ethoxyethoxy)ethyl]indazole Chemical compound BrC1=CC=C2N(CCOCCOCC)N=CC2=C1 LLSXIRJCWNXSRQ-UHFFFAOYSA-N 0.000 description 1
- TZUKTHIOLADGCW-UHFFFAOYSA-N 5-bromo-1-methoxyisoquinoline Chemical compound C1=CC=C2C(OC)=NC=CC2=C1Br TZUKTHIOLADGCW-UHFFFAOYSA-N 0.000 description 1
- STVHMYNPQCLUNJ-UHFFFAOYSA-N 5-bromo-1h-indazole Chemical compound BrC1=CC=C2NN=CC2=C1 STVHMYNPQCLUNJ-UHFFFAOYSA-N 0.000 description 1
- NXIXTCGGEFDKFK-UHFFFAOYSA-N 5-bromo-2-(2-methoxyethyl)indazole Chemical compound C1=C(Br)C=CC2=NN(CCOC)C=C21 NXIXTCGGEFDKFK-UHFFFAOYSA-N 0.000 description 1
- NFFJUWHGYKDCRF-UHFFFAOYSA-N 5-bromo-2-[2-(2-ethoxyethoxy)ethyl]indazole Chemical compound C1=C(Br)C=CC2=NN(CCOCCOCC)C=C21 NFFJUWHGYKDCRF-UHFFFAOYSA-N 0.000 description 1
- KXBXUHWCODHRHK-UHFFFAOYSA-N 5-bromo-3-hydroxy-1h-pyridin-2-one Chemical compound OC1=CC(Br)=CNC1=O KXBXUHWCODHRHK-UHFFFAOYSA-N 0.000 description 1
- XPERZSKJGNUSHI-UHFFFAOYSA-N 5-bromo-3-iodopyridin-2-amine Chemical compound NC1=NC=C(Br)C=C1I XPERZSKJGNUSHI-UHFFFAOYSA-N 0.000 description 1
- UCLLYIVDXZGQSZ-UHFFFAOYSA-N 5-bromo-6-methylpyridin-3-amine Chemical compound CC1=NC=C(N)C=C1Br UCLLYIVDXZGQSZ-UHFFFAOYSA-N 0.000 description 1
- NHTSTHBGCFFUMF-UHFFFAOYSA-N 5-bromo-n,n-dimethylpyridine-3-carboxamide Chemical compound CN(C)C(=O)C1=CN=CC(Br)=C1 NHTSTHBGCFFUMF-UHFFFAOYSA-N 0.000 description 1
- QHORMANADMCWSL-UHFFFAOYSA-N 5-bromo-n-methylpyridine-3-carboxamide Chemical compound CNC(=O)C1=CN=CC(Br)=C1 QHORMANADMCWSL-UHFFFAOYSA-N 0.000 description 1
- OLCNIPQERCZMGP-UHFFFAOYSA-N 5-bromo-n-phenylpyridine-3-carboxamide Chemical compound BrC1=CN=CC(C(=O)NC=2C=CC=CC=2)=C1 OLCNIPQERCZMGP-UHFFFAOYSA-N 0.000 description 1
- NGUVGKAEOFPLDT-UHFFFAOYSA-N 5-bromopyridine-3-carbaldehyde Chemical compound BrC1=CN=CC(C=O)=C1 NGUVGKAEOFPLDT-UHFFFAOYSA-N 0.000 description 1
- MYTGFBZJLDLWQG-UHFFFAOYSA-N 5-chloro-1h-indole Chemical compound ClC1=CC=C2NC=CC2=C1 MYTGFBZJLDLWQG-UHFFFAOYSA-N 0.000 description 1
- WSEWIGYMLABGAY-UHFFFAOYSA-N 5-chloro-2-fluoro-1-methylindole Chemical compound ClC1=CC=C2N(C)C(F)=CC2=C1 WSEWIGYMLABGAY-UHFFFAOYSA-N 0.000 description 1
- GULUPSIWTJBQDI-UHFFFAOYSA-N 5-chloro-7-fluoro-1-(2-methoxyethyl)indole Chemical compound ClC1=CC(F)=C2N(CCOC)C=CC2=C1 GULUPSIWTJBQDI-UHFFFAOYSA-N 0.000 description 1
- IBRXMTBOPCSWAF-UHFFFAOYSA-N 5-methyl-6-morpholin-4-ylpyridin-3-amine Chemical compound CC1=CC(N)=CN=C1N1CCOCC1 IBRXMTBOPCSWAF-UHFFFAOYSA-N 0.000 description 1
- ATYGFORKXNZCKZ-UHFFFAOYSA-N 5-pyrazol-1-ylpyridin-3-amine Chemical compound NC1=CN=CC(N2N=CC=C2)=C1 ATYGFORKXNZCKZ-UHFFFAOYSA-N 0.000 description 1
- 125000004938 5-pyridyl group Chemical group N1=CC=CC(=C1)* 0.000 description 1
- KWMHSSVKJIOUDF-UHFFFAOYSA-N 5-pyrrol-1-ylpyridin-3-amine Chemical compound NC1=CN=CC(N2C=CC=C2)=C1 KWMHSSVKJIOUDF-UHFFFAOYSA-N 0.000 description 1
- KCBWAFJCKVKYHO-UHFFFAOYSA-N 6-(4-cyclopropyl-6-methoxypyrimidin-5-yl)-1-[[4-[1-propan-2-yl-4-(trifluoromethyl)imidazol-2-yl]phenyl]methyl]pyrazolo[3,4-d]pyrimidine Chemical compound C1(CC1)C1=NC=NC(=C1C1=NC=C2C(=N1)N(N=C2)CC1=CC=C(C=C1)C=1N(C=C(N=1)C(F)(F)F)C(C)C)OC KCBWAFJCKVKYHO-UHFFFAOYSA-N 0.000 description 1
- DEXFNLNNUZKHNO-UHFFFAOYSA-N 6-[3-[4-[2-(2,3-dihydro-1H-inden-2-ylamino)pyrimidin-5-yl]piperidin-1-yl]-3-oxopropyl]-3H-1,3-benzoxazol-2-one Chemical compound C1C(CC2=CC=CC=C12)NC1=NC=C(C=N1)C1CCN(CC1)C(CCC1=CC2=C(NC(O2)=O)C=C1)=O DEXFNLNNUZKHNO-UHFFFAOYSA-N 0.000 description 1
- HSYOWUOUDXDSMC-UHFFFAOYSA-N 6-amino-2,2-dimethyl-4h-pyrido[3,2-b][1,4]oxazin-3-one Chemical compound C1=C(N)N=C2NC(=O)C(C)(C)OC2=C1 HSYOWUOUDXDSMC-UHFFFAOYSA-N 0.000 description 1
- XSYQUAQRSQYZNS-UHFFFAOYSA-N 6-bromo-1-(2-methoxyethoxy)isoquinoline Chemical compound BrC1=CC=C2C(OCCOC)=NC=CC2=C1 XSYQUAQRSQYZNS-UHFFFAOYSA-N 0.000 description 1
- WISVAANKCCHTAR-UHFFFAOYSA-N 6-bromo-1-(2-methylpropoxy)isoquinoline Chemical compound BrC1=CC=C2C(OCC(C)C)=NC=CC2=C1 WISVAANKCCHTAR-UHFFFAOYSA-N 0.000 description 1
- DTEBAAGZRVHPJR-UHFFFAOYSA-N 6-bromo-1-(oxolan-2-ylmethoxy)isoquinoline Chemical compound N=1C=CC2=CC(Br)=CC=C2C=1OCC1CCCO1 DTEBAAGZRVHPJR-UHFFFAOYSA-N 0.000 description 1
- QTQOCBUABSYUTH-UHFFFAOYSA-N 6-bromo-1-[2-(2-ethoxyethoxy)ethoxy]isoquinoline Chemical compound BrC1=CC=C2C(OCCOCCOCC)=NC=CC2=C1 QTQOCBUABSYUTH-UHFFFAOYSA-N 0.000 description 1
- RZWUFJTUNPDHSD-UHFFFAOYSA-N 6-bromo-1-[2-(2-methylpropoxy)ethoxy]isoquinoline Chemical compound BrC1=CC=C2C(OCCOCC(C)C)=NC=CC2=C1 RZWUFJTUNPDHSD-UHFFFAOYSA-N 0.000 description 1
- VOAHGGQULSSGQW-UHFFFAOYSA-N 6-bromo-1-chloroisoquinoline Chemical compound BrC1=CC=C2C(Cl)=NC=CC2=C1 VOAHGGQULSSGQW-UHFFFAOYSA-N 0.000 description 1
- ANJODKPUZKNWBJ-UHFFFAOYSA-N 6-bromo-1-ethoxyisoquinoline Chemical compound BrC1=CC=C2C(OCC)=NC=CC2=C1 ANJODKPUZKNWBJ-UHFFFAOYSA-N 0.000 description 1
- ZZLFZKRIXOWVTR-UHFFFAOYSA-N 6-bromo-1-propan-2-yloxyisoquinoline Chemical compound BrC1=CC=C2C(OC(C)C)=NC=CC2=C1 ZZLFZKRIXOWVTR-UHFFFAOYSA-N 0.000 description 1
- VQWHWLWLUBJOJW-UHFFFAOYSA-N 6-bromo-[1,3]thiazolo[4,5-b]pyridine Chemical compound BrC1=CN=C2N=CSC2=C1 VQWHWLWLUBJOJW-UHFFFAOYSA-N 0.000 description 1
- XSEOMYUQDKQLQC-UHFFFAOYSA-N 6-bromo-n-(2-methoxyethyl)quinolin-8-amine Chemical compound C1=CN=C2C(NCCOC)=CC(Br)=CC2=C1 XSEOMYUQDKQLQC-UHFFFAOYSA-N 0.000 description 1
- WXBWZSCJFQIGFZ-UHFFFAOYSA-N 6-bromo-n-methylquinolin-8-amine Chemical compound C1=CN=C2C(NC)=CC(Br)=CC2=C1 WXBWZSCJFQIGFZ-UHFFFAOYSA-N 0.000 description 1
- FPHVTTCGIUBMEF-UHFFFAOYSA-N 6-chloro-5-fluoro-2-(quinolin-3-ylamino)pyridine-3-carbonitrile Chemical compound N1=C(Cl)C(F)=CC(C#N)=C1NC1=CN=C(C=CC=C2)C2=C1 FPHVTTCGIUBMEF-UHFFFAOYSA-N 0.000 description 1
- KTICFFGQKOREIM-UHFFFAOYSA-N 6-chloro-5-fluoro-2-(quinolin-6-ylamino)pyridine-3-carbonitrile Chemical compound N1=C(Cl)C(F)=CC(C#N)=C1NC1=CC=C(N=CC=C2)C2=C1 KTICFFGQKOREIM-UHFFFAOYSA-N 0.000 description 1
- BSSLNJYIXMSTHZ-UHFFFAOYSA-N 6-cyclopropyl-5-methylpyridin-3-amine Chemical compound CC1=CC(N)=CN=C1C1CC1 BSSLNJYIXMSTHZ-UHFFFAOYSA-N 0.000 description 1
- GUXYHWLHJQKQIW-UHFFFAOYSA-N 6-ethyl-5-methylpyridin-3-amine Chemical compound CCC1=NC=C(N)C=C1C GUXYHWLHJQKQIW-UHFFFAOYSA-N 0.000 description 1
- QQNYZKCEEUVQRB-UHFFFAOYSA-N 6-methoxy-5-(triazol-2-yl)pyridin-3-amine Chemical compound COC1=NC=C(N)C=C1N1N=CC=N1 QQNYZKCEEUVQRB-UHFFFAOYSA-N 0.000 description 1
- DQUISKGDCQOPPG-UHFFFAOYSA-N 6-methyl-5-(1,2,4-triazol-1-yl)pyridin-3-amine Chemical compound CC1=NC=C(N)C=C1N1N=CN=C1 DQUISKGDCQOPPG-UHFFFAOYSA-N 0.000 description 1
- PSJAPRQXOKXHSR-UHFFFAOYSA-N 6-methyl-5-(triazol-1-yl)pyridin-3-amine Chemical compound CC1=NC=C(N)C=C1N1N=NC=C1 PSJAPRQXOKXHSR-UHFFFAOYSA-N 0.000 description 1
- UYFHEVQJQSGMMG-UHFFFAOYSA-N 6-methyl-5-(triazol-2-yl)pyridin-3-amine Chemical compound CC1=NC=C(N)C=C1N1N=CC=N1 UYFHEVQJQSGMMG-UHFFFAOYSA-N 0.000 description 1
- JZPIBCKYHJTQBL-UHFFFAOYSA-N 6-methyl-5-pyrazol-1-ylpyridin-3-amine Chemical compound CC1=NC=C(N)C=C1N1N=CC=C1 JZPIBCKYHJTQBL-UHFFFAOYSA-N 0.000 description 1
- LZVPKFQQKSWVPC-UHFFFAOYSA-N 6-methyl-5-pyrrolidin-1-ylpyridin-3-amine Chemical compound CC1=NC=C(N)C=C1N1CCCC1 LZVPKFQQKSWVPC-UHFFFAOYSA-N 0.000 description 1
- UUOKAVKPEMXSMG-UHFFFAOYSA-N 6-pyrazol-1-ylpyridin-3-amine Chemical compound N1=CC(N)=CC=C1N1N=CC=C1 UUOKAVKPEMXSMG-UHFFFAOYSA-N 0.000 description 1
- PMNCDNRJLYPTDB-UHFFFAOYSA-N 7-bromo-2,3-dihydro-[1,4]dioxino[2,3-b]pyridine Chemical compound O1CCOC2=CC(Br)=CN=C21 PMNCDNRJLYPTDB-UHFFFAOYSA-N 0.000 description 1
- YEDMUIQRKXNDQI-UHFFFAOYSA-N 7-bromopyrido[2,3-b]pyrazine Chemical compound N1=CC=NC2=CC(Br)=CN=C21 YEDMUIQRKXNDQI-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- CYJRNFFLTBEQSQ-UHFFFAOYSA-N 8-(3-methyl-1-benzothiophen-5-yl)-N-(4-methylsulfonylpyridin-3-yl)quinoxalin-6-amine Chemical compound CS(=O)(=O)C1=C(C=NC=C1)NC=1C=C2N=CC=NC2=C(C=1)C=1C=CC2=C(C(=CS2)C)C=1 CYJRNFFLTBEQSQ-UHFFFAOYSA-N 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- 238000012815 AlphaLISA Methods 0.000 description 1
- 102000006306 Antigen Receptors Human genes 0.000 description 1
- 108010083359 Antigen Receptors Proteins 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 239000004342 Benzoyl peroxide Substances 0.000 description 1
- OMPJBNCRMGITSC-UHFFFAOYSA-N Benzoylperoxide Chemical compound C=1C=CC=CC=1C(=O)OOC(=O)C1=CC=CC=C1 OMPJBNCRMGITSC-UHFFFAOYSA-N 0.000 description 1
- DKPFZGUDAPQIHT-UHFFFAOYSA-N Butyl acetate Natural products CCCCOC(C)=O DKPFZGUDAPQIHT-UHFFFAOYSA-N 0.000 description 1
- QAFSPWKCZZAVNE-UHFFFAOYSA-N C1(CCCCC1)P(C1=CC=CC=C1)C1CCCCC1.C(C)(=O)O.C(C)(=O)O Chemical compound C1(CCCCC1)P(C1=CC=CC=C1)C1CCCCC1.C(C)(=O)O.C(C)(=O)O QAFSPWKCZZAVNE-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 108010067225 Cell Adhesion Molecules Proteins 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- 206010012438 Dermatitis atopic Diseases 0.000 description 1
- 206010012442 Dermatitis contact Diseases 0.000 description 1
- 238000006646 Dess-Martin oxidation reaction Methods 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- BWLUMTFWVZZZND-UHFFFAOYSA-N Dibenzylamine Chemical compound C=1C=CC=CC=1CNCC1=CC=CC=C1 BWLUMTFWVZZZND-UHFFFAOYSA-N 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- GISRWBROCYNDME-PELMWDNLSA-N F[C@H]1[C@H]([C@H](NC1=O)COC1=NC=CC2=CC(=C(C=C12)OC)C(=O)N)C Chemical compound F[C@H]1[C@H]([C@H](NC1=O)COC1=NC=CC2=CC(=C(C=C12)OC)C(=O)N)C GISRWBROCYNDME-PELMWDNLSA-N 0.000 description 1
- 102000009109 Fc receptors Human genes 0.000 description 1
- 108010087819 Fc receptors Proteins 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 208000035186 Hemolytic Autoimmune Anemia Diseases 0.000 description 1
- AVXURJPOCDRRFD-UHFFFAOYSA-N Hydroxylamine Chemical compound ON AVXURJPOCDRRFD-UHFFFAOYSA-N 0.000 description 1
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 1
- 102000009490 IgG Receptors Human genes 0.000 description 1
- 108010073807 IgG Receptors Proteins 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 102100037850 Interferon gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 208000028018 Lymphocytic leukaemia Diseases 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- NTIZESTWPVYFNL-UHFFFAOYSA-N Methyl isobutyl ketone Chemical compound CC(C)CC(C)=O NTIZESTWPVYFNL-UHFFFAOYSA-N 0.000 description 1
- UIHCLUNTQKBZGK-UHFFFAOYSA-N Methyl isobutyl ketone Natural products CCC(C)C(C)=O UIHCLUNTQKBZGK-UHFFFAOYSA-N 0.000 description 1
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 1
- AYCPARAPKDAOEN-LJQANCHMSA-N N-[(1S)-2-(dimethylamino)-1-phenylethyl]-6,6-dimethyl-3-[(2-methyl-4-thieno[3,2-d]pyrimidinyl)amino]-1,4-dihydropyrrolo[3,4-c]pyrazole-5-carboxamide Chemical compound C1([C@H](NC(=O)N2C(C=3NN=C(NC=4C=5SC=CC=5N=C(C)N=4)C=3C2)(C)C)CN(C)C)=CC=CC=C1 AYCPARAPKDAOEN-LJQANCHMSA-N 0.000 description 1
- 206010029164 Nephrotic syndrome Diseases 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- IDRGFNPZDVBSSE-UHFFFAOYSA-N OCCN1CCN(CC1)c1ccc(Nc2ncc3cccc(-c4cccc(NC(=O)C=C)c4)c3n2)c(F)c1F Chemical compound OCCN1CCN(CC1)c1ccc(Nc2ncc3cccc(-c4cccc(NC(=O)C=C)c4)c3n2)c(F)c1F IDRGFNPZDVBSSE-UHFFFAOYSA-N 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- 235000006040 Prunus persica var persica Nutrition 0.000 description 1
- 240000006413 Prunus persica var. persica Species 0.000 description 1
- 239000007868 Raney catalyst Substances 0.000 description 1
- 229910000564 Raney nickel Inorganic materials 0.000 description 1
- 206010039085 Rhinitis allergic Diseases 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 239000004280 Sodium formate Substances 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 208000024780 Urticaria Diseases 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 235000010724 Wisteria floribunda Nutrition 0.000 description 1
- LXRZVMYMQHNYJB-UNXOBOICSA-N [(1R,2S,4R)-4-[[5-[4-[(1R)-7-chloro-1,2,3,4-tetrahydroisoquinolin-1-yl]-5-methylthiophene-2-carbonyl]pyrimidin-4-yl]amino]-2-hydroxycyclopentyl]methyl sulfamate Chemical compound CC1=C(C=C(S1)C(=O)C1=C(N[C@H]2C[C@H](O)[C@@H](COS(N)(=O)=O)C2)N=CN=C1)[C@@H]1NCCC2=C1C=C(Cl)C=C2 LXRZVMYMQHNYJB-UNXOBOICSA-N 0.000 description 1
- ZWGMJLNXIVRFRJ-UHFFFAOYSA-N [1-[(2-methylpropan-2-yl)oxycarbonyl]pyrrol-2-yl]boronic acid Chemical compound CC(C)(C)OC(=O)N1C=CC=C1B(O)O ZWGMJLNXIVRFRJ-UHFFFAOYSA-N 0.000 description 1
- LXEKPEMOWBOYRF-UHFFFAOYSA-N [2-[(1-azaniumyl-1-imino-2-methylpropan-2-yl)diazenyl]-2-methylpropanimidoyl]azanium;dichloride Chemical compound Cl.Cl.NC(=N)C(C)(C)N=NC(C)(C)C(N)=N LXEKPEMOWBOYRF-UHFFFAOYSA-N 0.000 description 1
- DXTVGSUGUFSDTN-UHFFFAOYSA-N [3-(4-nitropyridin-2-yl)pyrrol-1-yl]-tri(propan-2-yl)silane Chemical compound CC(C)[Si](C(C)C)(C(C)C)N1C=CC(C=2N=CC=C(C=2)[N+]([O-])=O)=C1 DXTVGSUGUFSDTN-UHFFFAOYSA-N 0.000 description 1
- ZTDRJDIKXGBJOS-UHFFFAOYSA-K [Sn].C[Sn](Cl)(Cl)Cl Chemical compound [Sn].C[Sn](Cl)(Cl)Cl ZTDRJDIKXGBJOS-UHFFFAOYSA-K 0.000 description 1
- KYIKRXIYLAGAKQ-UHFFFAOYSA-N abcn Chemical compound C1CCCCC1(C#N)N=NC1(C#N)CCCCC1 KYIKRXIYLAGAKQ-UHFFFAOYSA-N 0.000 description 1
- KXKVLQRXCPHEJC-UHFFFAOYSA-N acetic acid trimethyl ester Natural products COC(C)=O KXKVLQRXCPHEJC-UHFFFAOYSA-N 0.000 description 1
- HWZRXCHJIQVTPX-UHFFFAOYSA-N acetic acid;triphenylphosphanium;acetate Chemical compound CC(O)=O.CC(O)=O.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 HWZRXCHJIQVTPX-UHFFFAOYSA-N 0.000 description 1
- ORWKVZNEPHTCQE-UHFFFAOYSA-N acetic formic anhydride Chemical compound CC(=O)OC=O ORWKVZNEPHTCQE-UHFFFAOYSA-N 0.000 description 1
- XBJFCYDKBDVADW-UHFFFAOYSA-N acetonitrile;formic acid Chemical compound CC#N.OC=O XBJFCYDKBDVADW-UHFFFAOYSA-N 0.000 description 1
- FXXACINHVKSMDR-UHFFFAOYSA-N acetyl bromide Chemical compound CC(Br)=O FXXACINHVKSMDR-UHFFFAOYSA-N 0.000 description 1
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 1
- 239000012346 acetyl chloride Substances 0.000 description 1
- 125000003668 acetyloxy group Chemical group [H]C([H])([H])C(=O)O[*] 0.000 description 1
- 150000008065 acid anhydrides Chemical class 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 238000007792 addition Methods 0.000 description 1
- 229960003767 alanine Drugs 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 125000004450 alkenylene group Chemical group 0.000 description 1
- 125000004419 alkynylene group Chemical group 0.000 description 1
- 239000013566 allergen Substances 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- 208000030961 allergic reaction Diseases 0.000 description 1
- 201000010105 allergic rhinitis Diseases 0.000 description 1
- 201000010435 allergic urticaria Diseases 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- VZTDIZULWFCMLS-UHFFFAOYSA-N ammonium formate Chemical compound [NH4+].[O-]C=O VZTDIZULWFCMLS-UHFFFAOYSA-N 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 239000011260 aqueous acid Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 229960003121 arginine Drugs 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- 201000008937 atopic dermatitis Diseases 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 201000000448 autoimmune hemolytic anemia Diseases 0.000 description 1
- 125000000751 azo group Chemical group [*]N=N[*] 0.000 description 1
- 210000003651 basophil Anatomy 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- UPABQMWFWCMOFV-UHFFFAOYSA-N benethamine Chemical compound C=1C=CC=CC=1CNCCC1=CC=CC=C1 UPABQMWFWCMOFV-UHFFFAOYSA-N 0.000 description 1
- JUHORIMYRDESRB-UHFFFAOYSA-N benzathine Chemical compound C=1C=CC=CC=1CNCCNCC1=CC=CC=C1 JUHORIMYRDESRB-UHFFFAOYSA-N 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- CSKNSYBAZOQPLR-UHFFFAOYSA-N benzenesulfonyl chloride Chemical compound ClS(=O)(=O)C1=CC=CC=C1 CSKNSYBAZOQPLR-UHFFFAOYSA-N 0.000 description 1
- UREZNYTWGJKWBI-UHFFFAOYSA-M benzethonium chloride Chemical compound [Cl-].C1=CC(C(C)(C)CC(C)(C)C)=CC=C1OCCOCC[N+](C)(C)CC1=CC=CC=C1 UREZNYTWGJKWBI-UHFFFAOYSA-M 0.000 description 1
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000005874 benzothiadiazolyl group Chemical group 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- 235000019400 benzoyl peroxide Nutrition 0.000 description 1
- 125000001231 benzoyloxy group Chemical group C(C1=CC=CC=C1)(=O)O* 0.000 description 1
- MUALRAIOVNYAIW-UHFFFAOYSA-N binap Chemical group C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 MUALRAIOVNYAIW-UHFFFAOYSA-N 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 125000006267 biphenyl group Chemical group 0.000 description 1
- BFAKENXZKHGIGE-UHFFFAOYSA-N bis(2,3,5,6-tetrafluoro-4-iodophenyl)diazene Chemical compound FC1=C(C(=C(C(=C1F)I)F)F)N=NC1=C(C(=C(C(=C1F)F)I)F)F BFAKENXZKHGIGE-UHFFFAOYSA-N 0.000 description 1
- YNHIGQDRGKUECZ-UHFFFAOYSA-L bis(triphenylphosphine)palladium(ii) dichloride Chemical compound [Cl-].[Cl-].[Pd+2].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 YNHIGQDRGKUECZ-UHFFFAOYSA-L 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 210000002798 bone marrow cell Anatomy 0.000 description 1
- 150000001649 bromium compounds Chemical class 0.000 description 1
- AEILLAXRDHDKDY-UHFFFAOYSA-N bromomethylcyclopropane Chemical compound BrCC1CC1 AEILLAXRDHDKDY-UHFFFAOYSA-N 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical compound OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- 150000001244 carboxylic acid anhydrides Chemical class 0.000 description 1
- 230000020411 cell activation Effects 0.000 description 1
- 102000008395 cell adhesion mediator activity proteins Human genes 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000036755 cellular response Effects 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- 125000004218 chloromethyl group Chemical group [H]C([H])(Cl)* 0.000 description 1
- 125000003016 chromanyl group Chemical group O1C(CCC2=CC=CC=C12)* 0.000 description 1
- 125000004230 chromenyl group Chemical group O1C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000000259 cinnolinyl group Chemical group N1=NC(=CC2=CC=CC=C12)* 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 208000010247 contact dermatitis Diseases 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- YQHLDYVWEZKEOX-UHFFFAOYSA-N cumene hydroperoxide Chemical compound OOC(C)(C)C1=CC=CC=C1 YQHLDYVWEZKEOX-UHFFFAOYSA-N 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- SACLCSGWTQYOLP-UHFFFAOYSA-N cycloocta-1,3-diene;hydrochloride Chemical class Cl.C1CCC=CC=CC1 SACLCSGWTQYOLP-UHFFFAOYSA-N 0.000 description 1
- NXQGGXCHGDYOHB-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloropalladium;iron(2+) Chemical compound [Fe+2].Cl[Pd]Cl.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 NXQGGXCHGDYOHB-UHFFFAOYSA-L 0.000 description 1
- 125000004186 cyclopropylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C1([H])[H] 0.000 description 1
- 229960002433 cysteine Drugs 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 230000018044 dehydration Effects 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- NKLCNNUWBJBICK-UHFFFAOYSA-N dess–martin periodinane Chemical compound C1=CC=C2I(OC(=O)C)(OC(C)=O)(OC(C)=O)OC(=O)C2=C1 NKLCNNUWBJBICK-UHFFFAOYSA-N 0.000 description 1
- LSXWFXONGKSEMY-UHFFFAOYSA-N di-tert-butyl peroxide Chemical compound CC(C)(C)OOC(C)(C)C LSXWFXONGKSEMY-UHFFFAOYSA-N 0.000 description 1
- 239000012933 diacyl peroxide Substances 0.000 description 1
- FJBFPHVGVWTDIP-UHFFFAOYSA-N dibromomethane Chemical compound BrCBr FJBFPHVGVWTDIP-UHFFFAOYSA-N 0.000 description 1
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 1
- 229940019778 diethylene glycol diethyl ether Drugs 0.000 description 1
- SBZXBUIDTXKZTM-UHFFFAOYSA-N diglyme Chemical compound COCCOCCOC SBZXBUIDTXKZTM-UHFFFAOYSA-N 0.000 description 1
- 125000005594 diketone group Chemical group 0.000 description 1
- 125000005982 diphenylmethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- SACNIGZYDTUHKB-UHFFFAOYSA-N ditert-butyl-[2-[2,4,6-tri(propan-2-yl)phenyl]phenyl]phosphane Chemical group CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1C1=CC=CC=C1P(C(C)(C)C)C(C)(C)C SACNIGZYDTUHKB-UHFFFAOYSA-N 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- 239000003221 ear drop Substances 0.000 description 1
- 229940047652 ear drops Drugs 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 238000001952 enzyme assay Methods 0.000 description 1
- FRYHCSODNHYDPU-UHFFFAOYSA-N ethanesulfonyl chloride Chemical compound CCS(Cl)(=O)=O FRYHCSODNHYDPU-UHFFFAOYSA-N 0.000 description 1
- 125000005677 ethinylene group Chemical group [*:2]C#C[*:1] 0.000 description 1
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 description 1
- 125000005448 ethoxyethyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])C([H])([H])* 0.000 description 1
- 125000005745 ethoxymethyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])* 0.000 description 1
- ZIUSEGSNTOUIPT-UHFFFAOYSA-N ethyl 2-cyanoacetate Chemical compound CCOC(=O)CC#N ZIUSEGSNTOUIPT-UHFFFAOYSA-N 0.000 description 1
- LWRLKENDQISGEU-UHFFFAOYSA-N ethyl 5-bromo-1h-indole-2-carboxylate Chemical compound BrC1=CC=C2NC(C(=O)OCC)=CC2=C1 LWRLKENDQISGEU-UHFFFAOYSA-N 0.000 description 1
- RIFGWPKJUGCATF-UHFFFAOYSA-N ethyl chloroformate Chemical compound CCOC(Cl)=O RIFGWPKJUGCATF-UHFFFAOYSA-N 0.000 description 1
- 125000006125 ethylsulfonyl group Chemical group 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 229960004979 fampridine Drugs 0.000 description 1
- 150000004675 formic acid derivatives Chemical class 0.000 description 1
- HQVFCQRVQFYGRJ-UHFFFAOYSA-N formic acid;hydrate Chemical compound O.OC=O HQVFCQRVQFYGRJ-UHFFFAOYSA-N 0.000 description 1
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- 229960002989 glutamic acid Drugs 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 229960002743 glutamine Drugs 0.000 description 1
- 229960002449 glycine Drugs 0.000 description 1
- 229940015043 glyoxal Drugs 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 230000026030 halogenation Effects 0.000 description 1
- 238000005658 halogenation reaction Methods 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004836 hexamethylene group Chemical group [H]C([H])([*:2])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[*:1] 0.000 description 1
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 1
- 125000003707 hexyloxy group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])O* 0.000 description 1
- 229960001340 histamine Drugs 0.000 description 1
- 210000003630 histaminocyte Anatomy 0.000 description 1
- 229960002885 histidine Drugs 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- BICAGYDGRXJYGD-UHFFFAOYSA-N hydrobromide;hydrochloride Chemical compound Cl.Br BICAGYDGRXJYGD-UHFFFAOYSA-N 0.000 description 1
- SHFJWMWCIHQNCP-UHFFFAOYSA-M hydron;tetrabutylazanium;sulfate Chemical compound OS([O-])(=O)=O.CCCC[N+](CCCC)(CCCC)CCCC SHFJWMWCIHQNCP-UHFFFAOYSA-M 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 125000002962 imidazol-1-yl group Chemical group [*]N1C([H])=NC([H])=C1[H] 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 150000004693 imidazolium salts Chemical class 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 208000026278 immune system disease Diseases 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 208000030603 inherited susceptibility to asthma Diseases 0.000 description 1
- 239000003999 initiator Substances 0.000 description 1
- 239000000543 intermediate Substances 0.000 description 1
- 230000031146 intracellular signal transduction Effects 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 125000001977 isobenzofuranyl group Chemical group C=1(OC=C2C=CC=CC12)* 0.000 description 1
- DEGPIRUPAKWDBU-UHFFFAOYSA-N isoindole-1,3-dione;sodium Chemical compound [Na].C1=CC=C2C(=O)NC(=O)C2=C1 DEGPIRUPAKWDBU-UHFFFAOYSA-N 0.000 description 1
- 125000000904 isoindolyl group Chemical group C=1(NC=C2C=CC=CC12)* 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 125000005928 isopropyloxycarbonyl group Chemical group [H]C([H])([H])C([H])(OC(*)=O)C([H])([H])[H] 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 229960003136 leucine Drugs 0.000 description 1
- 150000002617 leukotrienes Chemical class 0.000 description 1
- 208000003747 lymphoid leukemia Diseases 0.000 description 1
- 229960003646 lysine Drugs 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 125000003099 maleoyl group Chemical group C(\C=C/C(=O)*)(=O)* 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- CUONGYYJJVDODC-UHFFFAOYSA-N malononitrile Chemical compound N#CCC#N CUONGYYJJVDODC-UHFFFAOYSA-N 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 229960004452 methionine Drugs 0.000 description 1
- UZKWTJUDCOPSNM-UHFFFAOYSA-N methoxybenzene Substances CCCCOC=C UZKWTJUDCOPSNM-UHFFFAOYSA-N 0.000 description 1
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 1
- WADLLLSMEPLCNO-UHFFFAOYSA-N methyl 2,6-dichloro-5-fluoropyridine-3-carboxylate Chemical compound COC(=O)C1=CC(F)=C(Cl)N=C1Cl WADLLLSMEPLCNO-UHFFFAOYSA-N 0.000 description 1
- WAZUVHBTXSADNW-OLZOCXBDSA-N methyl 2-chloro-5-fluoro-6-[[(1r,2s)-2-[(2-methylpropan-2-yl)oxycarbonylamino]cyclohexyl]amino]pyridine-3-carboxylate Chemical compound N1=C(Cl)C(C(=O)OC)=CC(F)=C1N[C@H]1[C@@H](NC(=O)OC(C)(C)C)CCCC1 WAZUVHBTXSADNW-OLZOCXBDSA-N 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 150000004682 monohydrates Chemical class 0.000 description 1
- PSHKMPUSSFXUIA-UHFFFAOYSA-N n,n-dimethylpyridin-2-amine Chemical compound CN(C)C1=CC=CC=N1 PSHKMPUSSFXUIA-UHFFFAOYSA-N 0.000 description 1
- WIPAEYIAUBBKRC-UHFFFAOYSA-N n-(4-chloropyridin-2-yl)acetamide Chemical compound CC(=O)NC1=CC(Cl)=CC=N1 WIPAEYIAUBBKRC-UHFFFAOYSA-N 0.000 description 1
- YKYONYBAUNKHLG-UHFFFAOYSA-N n-Propyl acetate Natural products CCCOC(C)=O YKYONYBAUNKHLG-UHFFFAOYSA-N 0.000 description 1
- NVDZAZXIBALFGT-UHFFFAOYSA-N n-methylquinolin-8-amine Chemical compound C1=CN=C2C(NC)=CC=CC2=C1 NVDZAZXIBALFGT-UHFFFAOYSA-N 0.000 description 1
- PSZYNBSKGUBXEH-UHFFFAOYSA-N naphthalene-1-sulfonic acid Chemical compound C1=CC=C2C(S(=O)(=O)O)=CC=CC2=C1 PSZYNBSKGUBXEH-UHFFFAOYSA-N 0.000 description 1
- DASJFYAPNPUBGG-UHFFFAOYSA-N naphthalene-1-sulfonyl chloride Chemical compound C1=CC=C2C(S(=O)(=O)Cl)=CC=CC2=C1 DASJFYAPNPUBGG-UHFFFAOYSA-N 0.000 description 1
- 125000001038 naphthoyl group Chemical group C1(=CC=CC2=CC=CC=C12)C(=O)* 0.000 description 1
- 125000004923 naphthylmethyl group Chemical group C1(=CC=CC2=CC=CC=C12)C* 0.000 description 1
- 125000005186 naphthyloxy group Chemical group C1(=CC=CC2=CC=CC=C12)O* 0.000 description 1
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 1
- 239000007923 nasal drop Substances 0.000 description 1
- 229940100662 nasal drops Drugs 0.000 description 1
- 239000002547 new drug Substances 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 125000004365 octenyl group Chemical group C(=CCCCCCC)* 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000005069 octynyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C#C* 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 210000002997 osteoclast Anatomy 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- MUMZUERVLWJKNR-UHFFFAOYSA-N oxoplatinum Chemical compound [Pt]=O MUMZUERVLWJKNR-UHFFFAOYSA-N 0.000 description 1
- 229910003445 palladium oxide Inorganic materials 0.000 description 1
- JQPTYAILLJKUCY-UHFFFAOYSA-N palladium(ii) oxide Chemical compound [O-2].[Pd+2] JQPTYAILLJKUCY-UHFFFAOYSA-N 0.000 description 1
- MXQOYLRVSVOCQT-UHFFFAOYSA-N palladium;tritert-butylphosphane Chemical compound [Pd].CC(C)(C)P(C(C)(C)C)C(C)(C)C.CC(C)(C)P(C(C)(C)C)C(C)(C)C MXQOYLRVSVOCQT-UHFFFAOYSA-N 0.000 description 1
- 150000002978 peroxides Chemical class 0.000 description 1
- XCRBXWCUXJNEFX-UHFFFAOYSA-N peroxybenzoic acid Chemical compound OOC(=O)C1=CC=CC=C1 XCRBXWCUXJNEFX-UHFFFAOYSA-N 0.000 description 1
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 229960005190 phenylalanine Drugs 0.000 description 1
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N phenylbenzene Natural products C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 1
- 125000003170 phenylsulfonyl group Chemical group C1(=CC=CC=C1)S(=O)(=O)* 0.000 description 1
- 150000003003 phosphines Chemical class 0.000 description 1
- AQSJGOWTSHOLKH-UHFFFAOYSA-N phosphite(3-) Chemical class [O-]P([O-])[O-] AQSJGOWTSHOLKH-UHFFFAOYSA-N 0.000 description 1
- 125000004592 phthalazinyl group Chemical group C1(=NN=CC2=CC=CC=C12)* 0.000 description 1
- XKJCHHZQLQNZHY-UHFFFAOYSA-N phthalimide Chemical compound C1=CC=C2C(=O)NC(=O)C2=C1 XKJCHHZQLQNZHY-UHFFFAOYSA-N 0.000 description 1
- 125000000612 phthaloyl group Chemical group C(C=1C(C(=O)*)=CC=CC1)(=O)* 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- IUGYQRQAERSCNH-UHFFFAOYSA-N pivalic acid Chemical compound CC(C)(C)C(O)=O IUGYQRQAERSCNH-UHFFFAOYSA-N 0.000 description 1
- 230000010118 platelet activation Effects 0.000 description 1
- 150000003057 platinum Chemical class 0.000 description 1
- 229910003446 platinum oxide Inorganic materials 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- LZMJNVRJMFMYQS-UHFFFAOYSA-N poseltinib Chemical compound C1CN(C)CCN1C(C=C1)=CC=C1NC1=NC(OC=2C=C(NC(=O)C=C)C=CC=2)=C(OC=C2)C2=N1 LZMJNVRJMFMYQS-UHFFFAOYSA-N 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 235000003270 potassium fluoride Nutrition 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 229960002429 proline Drugs 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- KPBSJEBFALFJTO-UHFFFAOYSA-N propane-1-sulfonyl chloride Chemical compound CCCS(Cl)(=O)=O KPBSJEBFALFJTO-UHFFFAOYSA-N 0.000 description 1
- FVSKHRXBFJPNKK-UHFFFAOYSA-N propionitrile Chemical compound CCC#N FVSKHRXBFJPNKK-UHFFFAOYSA-N 0.000 description 1
- 125000001501 propionyl group Chemical group O=C([*])C([H])([H])C([H])([H])[H] 0.000 description 1
- 229940090181 propyl acetate Drugs 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 125000001042 pteridinyl group Chemical group N1=C(N=CC2=NC=CN=C12)* 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000004309 pyranyl group Chemical group O1C(C=CC=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 1
- 125000002755 pyrazolinyl group Chemical group 0.000 description 1
- 125000004527 pyrimidin-4-yl group Chemical group N1=CN=C(C=C1)* 0.000 description 1
- 125000004528 pyrimidin-5-yl group Chemical group N1=CN=CC(=C1)* 0.000 description 1
- XFGPXURFKAUHQR-UHFFFAOYSA-N quinazolin-6-amine Chemical compound N1=CN=CC2=CC(N)=CC=C21 XFGPXURFKAUHQR-UHFFFAOYSA-N 0.000 description 1
- MSGRFBKVMUKEGZ-UHFFFAOYSA-N quinoxalin-6-amine Chemical compound N1=CC=NC2=CC(N)=CC=C21 MSGRFBKVMUKEGZ-UHFFFAOYSA-N 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000006722 reduction reaction Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- XIIOFHFUYBLOLW-UHFFFAOYSA-N selpercatinib Chemical compound OC(COC=1C=C(C=2N(C=1)N=CC=2C#N)C=1C=NC(=CC=1)N1CC2N(C(C1)C2)CC=1C=NC(=CC=1)OC)(C)C XIIOFHFUYBLOLW-UHFFFAOYSA-N 0.000 description 1
- 229960001153 serine Drugs 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- XGVXKJKTISMIOW-ZDUSSCGKSA-N simurosertib Chemical compound N1N=CC(C=2SC=3C(=O)NC(=NC=3C=2)[C@H]2N3CCC(CC3)C2)=C1C XGVXKJKTISMIOW-ZDUSSCGKSA-N 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 125000004436 sodium atom Chemical group 0.000 description 1
- HLBBKKJFGFRGMU-UHFFFAOYSA-M sodium formate Chemical compound [Na+].[O-]C=O HLBBKKJFGFRGMU-UHFFFAOYSA-M 0.000 description 1
- 235000019254 sodium formate Nutrition 0.000 description 1
- 235000010288 sodium nitrite Nutrition 0.000 description 1
- 230000003393 splenic effect Effects 0.000 description 1
- 125000002730 succinyl group Chemical group C(CCC(=O)*)(=O)* 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- BTIMRYLWZYRANR-CMDGGOBGSA-N tert-butyl (e)-3-[4-(aminomethyl)phenyl]prop-2-enoate Chemical compound CC(C)(C)OC(=O)\C=C\C1=CC=C(CN)C=C1 BTIMRYLWZYRANR-CMDGGOBGSA-N 0.000 description 1
- QSAGKXVHFJRBQZ-UHFFFAOYSA-N tert-butyl 2-(5-bromopyridin-3-yl)pyrrole-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1C=CC=C1C1=CN=CC(Br)=C1 QSAGKXVHFJRBQZ-UHFFFAOYSA-N 0.000 description 1
- GCRNGPNGNJSZCC-UHFFFAOYSA-N tert-butyl 3-amino-3a,4,6,6a-tetrahydro-1h-pyrrolo[3,4-c]pyrazole-5-carboxylate Chemical compound N1N=C(N)C2CN(C(=O)OC(C)(C)C)CC21 GCRNGPNGNJSZCC-UHFFFAOYSA-N 0.000 description 1
- DDOHSKQLHHBSEW-UHFFFAOYSA-N tert-butyl 4-bromo-6-fluoro-1H-indole-2-carboxylate Chemical compound C(C)(C)(C)OC(=O)C=1NC2=CC(=CC(=C2C1)Br)F DDOHSKQLHHBSEW-UHFFFAOYSA-N 0.000 description 1
- NRZYYKACXDZFRF-UHFFFAOYSA-N tert-butyl carbamate Chemical compound CC(C)(C)OC(N)=O.CC(C)(C)OC(N)=O NRZYYKACXDZFRF-UHFFFAOYSA-N 0.000 description 1
- RRCIEECLAFGKTM-ZETCQYMHSA-N tert-butyl n-[(2s)-2-aminobutyl]carbamate Chemical compound CC[C@H](N)CNC(=O)OC(C)(C)C RRCIEECLAFGKTM-ZETCQYMHSA-N 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- 125000003039 tetrahydroisoquinolinyl group Chemical group C1(NCCC2=CC=CC=C12)* 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 229960002898 threonine Drugs 0.000 description 1
- FGMPLJWBKKVCDB-UHFFFAOYSA-N trans-L-hydroxy-proline Natural products ON1CCCC1C(O)=O FGMPLJWBKKVCDB-UHFFFAOYSA-N 0.000 description 1
- GWFIZBYDIHGZRJ-UHFFFAOYSA-N tri(propan-2-yl)-[3-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pyrrol-1-yl]silane Chemical compound CC(C)[Si](C(C)C)(C(C)C)N1C=CC(B2OC(C)(C)C(C)(C)O2)=C1 GWFIZBYDIHGZRJ-UHFFFAOYSA-N 0.000 description 1
- XTTGYFREQJCEML-UHFFFAOYSA-N tributyl phosphite Chemical compound CCCCOP(OCCCC)OCCCC XTTGYFREQJCEML-UHFFFAOYSA-N 0.000 description 1
- IMFACGCPASFAPR-UHFFFAOYSA-N tributylamine Chemical compound CCCCN(CCCC)CCCC IMFACGCPASFAPR-UHFFFAOYSA-N 0.000 description 1
- 125000002306 tributylsilyl group Chemical group C(CCC)[Si](CCCC)(CCCC)* 0.000 description 1
- FICPQAZLPKLOLH-UHFFFAOYSA-N tricyclohexyl phosphite Chemical compound C1CCCCC1OP(OC1CCCCC1)OC1CCCCC1 FICPQAZLPKLOLH-UHFFFAOYSA-N 0.000 description 1
- GKASDNZWUGIAMG-UHFFFAOYSA-N triethyl orthoformate Chemical compound CCOC(OCC)OCC GKASDNZWUGIAMG-UHFFFAOYSA-N 0.000 description 1
- BDZBKCUKTQZUTL-UHFFFAOYSA-N triethyl phosphite Chemical compound CCOP(OCC)OCC BDZBKCUKTQZUTL-UHFFFAOYSA-N 0.000 description 1
- ILWRPSCZWQJDMK-UHFFFAOYSA-N triethylazanium;chloride Chemical compound Cl.CCN(CC)CC ILWRPSCZWQJDMK-UHFFFAOYSA-N 0.000 description 1
- PTMFUWGXPRYYMC-UHFFFAOYSA-N triethylazanium;formate Chemical compound OC=O.CCN(CC)CC PTMFUWGXPRYYMC-UHFFFAOYSA-N 0.000 description 1
- PNQBEPDZQUOCNY-UHFFFAOYSA-N trifluoroacetyl chloride Chemical compound FC(F)(F)C(Cl)=O PNQBEPDZQUOCNY-UHFFFAOYSA-N 0.000 description 1
- 125000001889 triflyl group Chemical group FC(F)(F)S(*)(=O)=O 0.000 description 1
- RKBCYCFRFCNLTO-UHFFFAOYSA-N triisopropylamine Chemical compound CC(C)N(C(C)C)C(C)C RKBCYCFRFCNLTO-UHFFFAOYSA-N 0.000 description 1
- CYTQBVOFDCPGCX-UHFFFAOYSA-N trimethyl phosphite Chemical compound COP(OC)OC CYTQBVOFDCPGCX-UHFFFAOYSA-N 0.000 description 1
- CWMFRHBXRUITQE-UHFFFAOYSA-N trimethylsilylacetylene Chemical group C[Si](C)(C)C#C CWMFRHBXRUITQE-UHFFFAOYSA-N 0.000 description 1
- YFTHZRPMJXBUME-UHFFFAOYSA-N tripropylamine Chemical compound CCCN(CCC)CCC YFTHZRPMJXBUME-UHFFFAOYSA-N 0.000 description 1
- 125000002221 trityl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C([*])(C1=C(C(=C(C(=C1[H])[H])[H])[H])[H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 229960004441 tyrosine Drugs 0.000 description 1
- 238000000825 ultraviolet detection Methods 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- NQPDZGIKBAWPEJ-UHFFFAOYSA-N valeric acid Chemical compound CCCCC(O)=O NQPDZGIKBAWPEJ-UHFFFAOYSA-N 0.000 description 1
- 125000003774 valeryl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 229960004295 valine Drugs 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- UGOMMVLRQDMAQQ-UHFFFAOYSA-N xphos Chemical group CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 UGOMMVLRQDMAQQ-UHFFFAOYSA-N 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/78—Carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/81—Amides; Imides
- C07D213/82—Amides; Imides in position 3
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/38—Nitrogen atoms
- C07D215/40—Nitrogen atoms attached in position 8
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/04—Ortho-condensed systems
- C07D491/044—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring
- C07D491/048—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring the oxygen-containing ring being five-membered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/04—Ortho-condensed systems
- C07D491/056—Ortho-condensed systems with two or more oxygen atoms as ring hetero atoms in the oxygen-containing ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/10—Spiro-condensed systems
- C07D491/107—Spiro-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D498/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D498/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D498/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains two hetero rings
- C07D513/04—Ortho-condensed systems
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/55—Design of synthesis routes, e.g. reducing the use of auxiliary or protecting groups
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Rheumatology (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Immunology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Pain & Pain Management (AREA)
- Physical Education & Sports Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Pyridine Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Quinoline Compounds (AREA)
Abstract
Изобретение относится к производным никотинамида формулы (I), обладающим свойством ингибитора Syk-киназы, и к фармацевтической композиции на их основе. В общей формуле (I) R1 обозначает атом галогена; R2 обозначает заместитель, представленный следующей формулой (II-1) , в R3 обозначает пиридильную группу, представленную следующими формулами (VIII-1) или (VIII-2), R4 и R5 обозначают атом водорода. Значения других радикалов раскрыты в формуле изобретения. 5 н. и 8 з.п. ф-лы, 2 ил., 25 табл., 47 пр.
Description
[Техническая область]
Настоящее изобретение относится к производному никотинамида, имеющему Syk-ингибирующую активность, или к его соли.
[Уровень техники]
Селезеночная тирозинкиназа (Syk), которая является внутриклеточной тирозинкиназой нерецепторного типа, играет существенную роль в активации ПРИ -лимфоцитов и во внутриклеточной системе трансдукции сигналов, опосредуемой рецептором Fc. Например, Syk связана с сигналом FcεRI, который является рецептором иммуноглобулина E в тучных клетках, базофилах и других клетках, и таким образом она регулирует генерацию воспалительных медиаторов, таких как гистамин или лейкотриен, а также цитокин, из этих клеток. В то же самое время, Syk играет роль в проведении сигналов активации, вызванных возбуждением рецептора Fcγ, в моноциты, дендритные клетки и другие клетки (Непатентные Документы 1 и 2). Кроме того, сообщалось, что Syk также связана с трансудкцией сигналов цитокина, вызванной интегрином, IL-13, IL-15 и т.п. (Непатентные Документы 3 и 4).
В случае ПРИ -клетки, проведение сигнала в клетку опосредуется экспрессией BCR (ПРИ -клеточный рецептор антигена) на мембране клетки, которая индуцирует активацию и дифференцировку клеток, приводя к генерации антитела. Сообщалось, что Syk является существенным для такого процесса активации и дифференцировки (НепатентныЙ Документ 5).
Ожидается, что возможно подавлять различные клеточные ответы, ингибируя Syk (Непатентные Документы 5 и 6).
В случае аллергии типа 1, которая является аллергической реакцией непосредственного типа, например, иммуноглобулин E (IgE) связывается с FcεRI, который является рецептором IgE с высоким сродством, и аллерген затем связывается с ним, промотируя активацию FcεRI и высвобождение воспалительного медиатора. В результате экспрессируются аллергические симптомы. Ожидается, что ингибирование активности Syk приведет к супрессии активации FcεRI, и что это будет полезно для лечения репрезентативных связанных с аллергией типа 1 заболеваний, таких как бронхиальная астма, аллергический ринит, крапивница и атопический дерматит.
Кроме того, считается, что ингибирование активности Syk приводит к супрессии активации и/или созревания иммунных ПРИ -клеток и генерации антител, и что такое ингибирование активности Syk может также регулировать иммунные реакции, отличные от аллергии типа 1. Соответственно, также ожидается, что ингибирование активности Syk будет эффективно в случае аутоиммунных заболеваний (ревматоидный артрит, системная красная волчанка и т.д.), аутоиммунной гемолитической анемии, нефротического синдрома, контактного дерматита и т.п. Кроме того, так как ингибирование активности Syk также приводит к супрессии активации макрофагов, ожидается, что ингибирование Syk будет также эффективно в случае идиопатической тромбоцитопенической пурпуры.
Далее, ингибирование активности Syk подавляет не только иммунные и/или воспалительные заболевания, но также и активацию и пролиферацию лимфоцитов, включая ПРИ -клетки как типичные примеры. Таким образом, ожидается, что ингибирование Syk будет также эффективно для лечения различных типов пролиферативных заболеваний, таких как лимфома и лимфоцитарный лейкоз. Также, так как ингибирование активности Syk регулирует пролиферацию и дифференцировку клеток костного мозга, ожидается, что это будет также эффективно в случае острого миелоцитарного лейкоза.
С другой стороны, известно, что Syk участвует в трансдукции сигналов, опосредованной интегрином, который является молекулой клеточной адгезии. Так как Syk экспрессируется в тромбоцитах и участвует в их активации, ожидается, что ингибитор такой Syk является эффективным в качестве терапевтического средства в случае заболеваний, связанных с активацией тромбоцитов.
Сообщалось о большом количестве соединений, имеющих Syk-ингибирующую активность (Патентные документы 1-4). В клинических тестах, в которых мишенью были ревматоидный артрит и идиопатическая тромбоцитопеническая пурпура, сообщалось о полезных соединениях (НепатентныЙ Документ 7) и соединениях, имеющие Syk- и/или JAK-ингибирующую активность (Патентные документы 5-8).
[Документы из уровня техники]
[Патентные документы]
[Патентный документ 1] Международная Публикация WO00/75113
[Патентный документ 2] Публикация Патента JP (Kokai) Номер 2008-013499 A
[Патентный документ 3] Международная Публикация WO07/120980
[Патентный документ 4] Международная Публикация WO07/124221
[Патентный документ 5] Международная Публикация WO09/026107
[Патентный документ 6] Международная Публикация WO09/131687
[Патентный документ 7] Международная Публикация WO09/136995
[Патентный документ 8] Международная Публикация WO09/145856
[Непатентные Документы]
[Non Patent Document 1] The Journal of Biological Chemistry, Vol. 266, pp. 15790-15796, 1991
[Non Patent Document 2] International Journal of Hematology, Vol. 75, No. 4, pp. 357-362, 2002
[Non Patent Document 3] The Journal of Biological Chemistry, Vol. 270, pp. 16189-16197, 1995
[Non Patent Document 4] The Journal of Immunology, Vol. 167, No. 11, pp. 6292-6302, 2001
[Non Patent Document 5] Expert Opinion on Investigational Drugs, Vol. 13, No. 7, pp. 743-762, 2004
[Non Patent Document 6] Expert Opinion on Therapeutic Targets, Vol. 9, No. 5, pp. 901-921, 2005
[Non Patent Document 7] IDrugs, Vol. 12, No. 3, pp. 174-185, 2009
[Сущность изобретения]
[Задача, решаемая в соответствии с изобретением]
До настоящего времени сообщалось о различных ингибиторах Syk, но они все же не были выведены на рынок. Было желательно разработать соединение и фармацевтическую композицию, которые имели бы превосходную Syk-ингибирующую активность.
[Средства решения задачи]
В результате интенсивных исследований, направленных на достижению вышеупомянутой цели, авторы настоящего изобретения обнаружили, что производное никотинамида, имеющее определенную структуру, или его соль имеет превосходную Syk-ингибирующую активность, таким образом осуществив настоящее изобретение.
В частности, производное никотинамида согласно настоящему изобретению или его фармацевтически приемлемая соль характеризуется тем, что оно представлено следующей формулой (I):
[Формула 1]
в которой
R1 обозначает атом галогена;
R2 обозначает C1-12 алкильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C2-12 алкенильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C2-12 алкинильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C3-8 циклоалкильную группу, в случае необходимости имеющую по меньшей мере один заместитель, арильную группу, в случае необходимости имеющую по меньшей мере один заместитель, ар-C1-6 алкильную группу, в случае необходимости имеющую по меньшей мере один заместитель, или гетероциклическую группу, в случае необходимости имеющую по меньшей мере один заместитель;
R3 обозначает арильную группу, в случае необходимости имеющую по меньшей мере один заместитель, или гетероциклическую группу, в случае необходимости имеющую по меньшей мере один заместитель; и
R4 и R5, каждый независимо, обозначает атом водорода, C1-12 алкильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C2-12 алкенильную группу, в случае необходимости имеющую по меньшей мере один заместитель, или C2-12 алкинильную группу, в случае необходимости имеющую по меньшей мере один заместитель.
Кроме того, настоящее изобретение относится к фармацевтической композиции, включающей вышеописанное производное никотинамида или его соль, в частности, к фармацевтической композиции для применения в лечении Syk-связанного заболевания, которая включает вышеописанное производное никотинамида или его соль, и к фармацевтической композиции для применения в лечении заболевания, выбранного из группы, состоящей из ревматизма и идиопатической тромбоцитопенической пурпуры, которая включает вышеописанное производное никотинамида или его соль.
С другой стороны, настоящее изобретение относится к следующему: применение вышеописанного производного никотинамида или его соли для получения вышеописанной фармацевтической композиции; способ лечения Syk-связанного заболевания, который включает стадию введения терапевтически эффективного количества вышеописанного производного никотинамида или его соли млекопитающим, включая человека; и способ лечения заболевания, выбранного из группы, состоящей из ревматизма и идиопатической тромбоцитопенической пурпуры, который включает стадию введения терапевтически эффективного количества вышеописанного производного никотинамида или его соли млекопитающим, включая человека.
[Эффекты изобретения]
Производное никотинамида согласно настоящему изобретению или его соль имеет превосходную Syk-ингибирующую активность, и оно может быть использовано как фармацевтическая композиция для применения в лечении Syk-связанного заболевания.
[Краткое описание рисунков]
[Фигура 1] Фигура 1 показывает результаты теста трансдукции сигналов внутриклеточного фосфорилирования.
[Фигура 2] Фигура 2 показывает результаты теста дифференцировки остеокластов.
[Описание вариантов осуществления]
В дальнейшем, соединение согласно настоящему изобретению будет описано подробно.
В настоящем описании используют следующие определения, если не указано иное.
Термин “атом галогена” означает атом фтора, атом хлора, атом брома или атом йода.
Термин “C1-12 алкильная группа” означает прямую или разветвленную C1-12 алкильную группу, такую как метил, этил, пропил, изопропил, бутил, втор-бутил, изобутил, трет-бутил, пентил, изопентил, гексил, гептил и октил.
Термин “C1-6 алкильная группа” означает прямую или разветвленную C1-6 алкильную группу, такую как метил, этил, пропил, изопропил, бутил, втор-бутил, изобутил, трет-бутил, пентил, изопентил и гексил.
Термин “C2-12 алкенильная группа” означает прямую или разветвленную C2-12 алкенильную группу, такую как винил, аллил, пропенил, изопропенил, бутенил, изобутенил, 1,3-бутадиенил, пентенил, гексенил, гептенил и октенил.
Термин “C2-6 алкенильная группа” означает прямую или разветвленную C2-6 алкенильную группу, такую как винил, аллил, пропенил, изопропенил, бутенил, изобутенил, 1,3-бутадиенил, пентенил и гексенил.
Термин “C2-12 алкинильная группа” означает прямую или разветвленную C2-12 алкинильную группу, такую как этинил, пропинил, бутинил, пентинил, гексинил, гептинил и октинил.
Термин “C2-6 алкинильная группа” означает прямую или разветвленную C2-6 алкинильную группу, такую как этинил, пропинил, бутинил, пентинил и гексинил.
Термин “C3-8 циклоалкильная группа” означает C3-8 циклоалкильную группу, такую как циклопропил, циклобутил, циклопентил и циклогексил.
Термин “C5-7 циклоалкильная группа” означает циклопентил, циклогексил или циклогептил.
Термин “арильная группа” означает фенил, нафтил, инданил или инденил.
Термин “ар-C1-6 алкильная группа” означает ар-C1-6 алкильную группу, такую как бензил, 2-фенилпропан-2-ил, дифенилметил, тритил, фенетил и нафтилметил.
Термин “C1-6 алкиленовая группа” означает прямую или разветвленную C1-6 алкиленовую группу, такую как метилен, этилен, пропилен, бутилен и гексилен.
Термин “C2-6 алкениленовая группа” означает прямую или разветвленную C2-6 алкениленовую группу, такую как винилен, пропенилен, бутенилен и пентенилен.
Термин “C2-6 алкиниленовая группа” означает прямую или разветвленную C2-6 алкиниленовую группу, такую как этинилен, пропинилен, бутинилен и пентинилен.
Термин “C1-6 алкоксигруппа” означает прямую или разветвленную C1-6 алкилоксигруппу, такую как метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси и гексилоксигруппы.
Термин “ар-C1-6 алкоксигруппа” означает ар-C1-6 алкилоксигруппу, такую как бензилокси, фенетилокси и нафтилметилокси.
Термин “арилоксигруппа” означает фенокси или нафтилокси.
Термин “C1-6 алкокси C1-6 алкильная группа” означает C1-6 алкилокси C1-6 алкильную группу, такую как метоксиметил и 1-этоксиэтил группы.
Термин “ар-C1-6 алкокси C1-6 алкильная группа” означает ар-C1-6 алкилокси C1-6 алкильную группу, такую как бензилоксиметил и фенетилоксиметил.
Термин “C2-12 алканоильная группа” означает прямую или разветвленную C2-12 алканоильную группу, такую как ацетил, пропионил, валерил, изовалерил и пивалоил.
Термин “ароильная группа” означает бензоил или нафтоил.
Термин “гетероциклическая карбонильная группа” означает никотиноил, теноил, пирролидинокарбонил или фуроил.
Термин “(α-замещенная)аминоацетильная группа” означает (α-замещенную)аминоацетильную группу, имеющую в случае необходимости защищенный N-конец, который получен из аминокислот (причем аминокислоты включают глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин, метионин, аспарагиновую кислоту, глутаминовую кислоту, аспарагин, глутамин, аргинин, лизин, гистидин, гидроксилизин, фенилаланин, тирозин, триптофан, пролин и гидроксипролин).
Термин "ацильная группа" означает формильную, сукцинильную группу, глутарильную группу, малеоильную группу, фталоильную группу, C2-12 алканоильную группу, ароильную группу, гетероциклическую карбонильную группу или (α-замещенную)аминоацетильную группу.
Термин “ацил C1-6 алкильная группа” означает ацил C1-6 алкильную группу, такую как ацетилметил, бензоилметил и 1-бензоилэтил.
Термин “C2-6 алканоилоксигруппа” означает прямую или разветвленную C2-6 алканоилоксигруппу, такую как ацетилокси и пропионилокси.
Термин “ароилоксигруппа” означает бензоилокси или нафтоилокси.
Термин “ацилоксигруппа” означает C2-6 алканоилоксигруппу или ароилоксигруппу.
Термин “ацилокси C1-6 алкильная группа” означает ацилокси C1-6 алкильную группу, такую как ацетоксиметил, пропионилоксиметил, пивалоилоксиметил, бензоилоксиметил и 1-(бензоилокси)этил.
Термин “C1-6 алкоксикарбонильная группа” (в котором C1-6 означает число атомов углерода, содержащихся в алкоксигруппе) означает прямую или разветвленную C1-6 алкилоксикарбонильную группу, такую как метоксикарбонил, этоксикарбонил, изопропоксикарбонил, трет-бутоксикарбонил и 1,1-диметилпропоксикарбонил.
Термин “ар-C1-6 алкоксикарбонильная группа” (в котором C1-6 означает число атомов углерода, содержащихся в алкоксигруппе) означает ар-C1-6 алкилоксикарбонильную группу, такую как бензилоксикарбонил и фенетилоксикарбонил.
Термин “арилоксикарбонильная группа” означает фенилоксикарбонил или нафтилоксикарбонил.
Термин “C1-6 алкилсульфонильная группа” означает C1-6 алкилсульфонильную группу, такую как метилсульфонил, этилсульфонил и пропилсульфонил.
Термин “арилсульфонильная группа” означает бензолсульфонил, п-толуолсульфонил или нафталинсульфонил.
Термин “силильная группа” означает триметилсилил, триэтилсилил или трибутилсилил группу.
Термин “моноциклическая азотсодержащая гетероциклическая группа” означает моноциклическую азотсодержащую гетероциклическую группу, содержащую только атом азота в качестве гетероатома, который образует кольцо, такую как азетидинил, пирролидинил, пирролинил, пирролил, пиперидил, тетрагидропиридил, пиридил, гомопиперидинил, октагидроазоцинил, имидазолидинил, имидазолинил, имидазолил, пиразолидинил, пиразолинил, пиразолил, пиперазинил, пиразинил, пиридазинил, пиримидинил, гомопиперазинил, триазолил и тетразолил.
Термин “моноциклическая кислородсодержащая гетероциклическая группа” означает тетрагидрофуранил, фуранил, тетрагидропиранил или пиранил.
Термин “моноциклическая серосодержащая гетероциклическая группа” означает тиенильную группу.
Термин “моноциклическая азот/кислородсодержащая гетероциклическая группа” означает моноциклическую азот/кислородсодержащую гетероциклическую группу, содержащую только атом азота и атом кислорода в качестве гетероатомов, образующих кольцо, такую как оксазолил, изоксазолил, оксадиазолил и морфолинил.
Термин “моноциклическая азот/серосодержащая гетероциклическая группа” означает моноциклическую азот/серосодержащую гетероциклическую группу, содержащую только атом азота и атом серы в качестве гетероатомов, образующих кольцо, такую как тиазолил, изотиазолил, тиадиазолил, тиоморфолинил, 1-оксид-тиоморфолинил и 1,1-диоксид-тиоморфолинил.
Термин “моноциклическая гетероциклическая группа” означает моноциклическую азотсодержащую гетероциклическую группу, моноциклическую кислородсодержащую гетероциклическую группу, моноциклическую серосодержащую гетероциклическую группу, моноциклическую азот/кислородсодержащую гетероциклическую группу или моноциклическую азот/серосодержащую гетероциклическую группу.
Термин “бициклическая азотсодержащая гетероциклическая группа” означает бициклическую азотсодержащую гетероциклическую группу, содержащую только атом азота в качестве гетероатома, образующего кольцо, такую как индолинил, индолил, изоиндолинил, изоиндолил, бензимидазолил, индазолил, бензотриазолил, хинолил, тетрагидрохинолинил, хинолил, тетрагидроизохинолинил, изохинолинил, хинолизинил, циннолинил, фталазинил, хиназолинил, дигидрохиноксалинил, хиноксалинил, нафтиридинил, пирролопиридил, имидазопиридил, индолидинил, дигидроциклопентапиридил, триазолопиридил, пиразолопиридил, пиридопиразил, пуринил, птеридинил и хинуклидинил.
Термин “бициклическая кислородсодержащая гетероциклическая группа” означает бициклическую кислородсодержащую гетероциклическую группу, содержащую только атом кислорода в качестве гетероатома, образующего кольцо, такую как 2,3-дигидробензофуранил, бензофуранил, изобензофуранил, хроманил, хроменил, изохроманил, 1,3-бензодиоксолил, 1,3-бензодиоксанил и 1,4-бензодиоксанил.
Термин “бициклическая серосодержащая гетероциклическая группа” означает бициклическую серосодержащую гетероциклическую группу, содержащую только атом серы в качестве гетероатома, образующего кольцо, такие как 2,3-дигидробензотиенил и бензотиенил.
Термин “бициклическая азот/кислородсодержащая гетероциклическая группа” означает бициклическую азот/кислородсодержащую гетероциклическую группу, содержащую только атом азота и атом кислорода в качестве гетероатомов, образующих кольцо, такую как бензоксазолил, бензоизоксазолил, бензоксадиазолил, бензоморфолинил, дигидропиранопиридил, дигидродиоксинопиридил, 1,3-диоксолопиридил и дигидропиридооксазинил.
Термин “бициклическая азот/серосодержащая гетероциклическая группа” означает бициклическую азот/серосодержащую гетероциклическую группу, содержащую атом азота и атом серы в качестве гетероатомов, образующих кольцо, такую как бензотиазолил, бензоизотиазолил, бензотиадиазолил и тиазолопиридил.
Термин “бициклическая гетероциклическая группа” означает бициклическую азотсодержащую гетероциклическую группу, бициклическую кислородсодержащую гетероциклическую группу, бициклическую серосодержащую гетероциклическую группу, бициклическую азот/кислородсодержащую гетероциклическую группу или бициклическую азот/серосодержащую гетероциклическую группу.
Термин “гетероциклическая группа” означает моноциклическую гетероциклическую группу или бициклическую гетероциклическую группу.
Термин “циклическая аминогруппа” означает 4-, 5-, 6- или 7-членную кольцевую, конденсированную кольцевую или соединенную мостиковой связью кольцевую циклическую аминогруппу, которая содержит один или более атомов азота в качестве гетероатомов, образующих кольцо и которая может дополнительно в случае необходимости содержать один или более атомов кислорода или атомов серы, такую как азетидинил, пирролидинил, пиперидинил, гомопиперидинил, имидазолидинил, пиперазинил, гомопиперазинил, морфолинил, тиоморфолинил, тетрагидрохинолинил, тетрагидроизохинолинил, бензоморфолинил, дигидропиридооксазинил и хинуклидинил.
Аминозащитная группа включает все группы, которые могут использоваться как обычные защитные группы для аминогрупп. Примеры такой аминозащитной группы включают группы, описанные в W. Greene et al., Protective Groups in Organic Synthesis, 4th edition, pp. 696 to 926, 2007, John Wiley & Sons, INC. Частные примеры включают ар-C1-6 алкильную группу, C1-6 алкокси C1-6 алкильную группу, ацильную группу, C1-6 алкоксикарбонильную группу, ар-C1-6 алкоксикарбонильную группу, арилоксикарбонильную группу, C1-6 алкилсульфонильную группу, арилсульфонильную группу и силильную группу.
Защитная группа для гидроксила включает все группы, которые могут использоваться как обычные защитные группы для гидроксильных групп. Примеры такой защитной группы для гидроксила включают группы, описанные в W. Greene et al., Protective Groups in Organic Synthesis, 4th edition, pp. 16 to 299, 2007, John Wiley & Sons, INC. Частные примеры включают C1-6 алкильную группу, C2-6 алкенильную группу, ар-C1-6 алкильную группу, C1-6 алкокси C1-6 алкильную группу, ар-C1-6 алкокси C1-6 алкильную группу, ацильную группу, C1-6 алкоксикарбонильную группу, ар-C1-6 алкоксикарбонильную группу, C1-6 алкилсульфонильную группу, арилсульфонильную группу, силильную группу, тетрагидрофуранильную группу и тетрагидропиранильную группу.
Защитная группа карбоксильной группы включает все группы, которые могут использоваться как обычные защитные группы для карбоксильных групп. Примеры такой защитной группы карбоксильной группы включают группы, описанные в W. Greene et al., Protective Groups in Organic Synthesis, 4th edition, pp. 533 to 643, 2007, John Wiley & Sons, INC. Частные примеры включают C1-6 алкильную группу, C2-6 алкенильную группу, арильную группу, ар-C1-6 алкильную группу, C1-6 алкокси C1-6 алкильную группу, ар-C1-6 алкокси C1-6 алкильную группу, ацил C1-6 алкильную группу, ацилокси C1-6 алкильную группу и силильную группу.
Примеры уходящей группы включают атом галогена, C1-6 алкилсульфонилоксигруппу и арилсульфонилоксигруппу.
Алифатические углеводороды включают пентан, гексан и циклогексан.
Галогенированные углеводороды включают метиленхлорид, хлороформ и дихлорэтан.
Спирты включают метанол, этанол, пропанол, 2-пропанол, бутанол и 2-метил-2-пропанол.
Гликоли включают этиленгликоль, пропиленгликоль и диэтиленгликоль.
Простые эфиры включают простой диэтиловый эфир, простой диизопропиловый эфир, диоксан, тетрагидрофуран, анизол, простой диметиловый эфир этиленгликоля, простой диметиловый эфир диэтиленгликоля и простой диэтиловый эфир диэтиленгликоля.
Кетоны включают ацетон, 2-бутанон и 4-метил-2-пентанон.
Сложные эфиры включают метилацетат, этилацетат, пропилацетат и бутилацетат.
Амиды включают N,N-диметилформамид, N,N-диметилацетамид и 1-метил-2-пирролидон.
Нитрилы включают ацетонитрил и пропионитрил.
Сульфоксиды включают диметилсульфоксид.
Ароматические углеводороды включают бензол, толуол и ксилол.
Соли соединения, представленного формулой [1], включают общеизвестные соли, а именно, соли основных групп, таких как аминогруппы, и соли кислотных групп, таких как гидроксильные или карбоксильные группы.
Примеры солей основных групп включают: соли с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, азотная кислота и серная кислота; соли с органическими карбоновыми кислотами, такими как муравьиная кислота, уксусная кислота, лимонная кислота, щавелевая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, яблочная кислота, винная кислота, аспарагиновая кислота, трихлоруксусная кислота и трифторуксусная кислота; и соли с сульфоновыми кислотами, такими как метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, мезитиленсульфоновая кислота и нафталинсульфоновая кислота.
Примеры солей кислотных групп включают: соли с щелочными металлами, такими как натрий и калий; соли с щёлочноземельными металлами, такими как кальций и магний; соли аммония; и соли с азотсодержащими органическими основаниями, такими как триметиламин, триэтиламин, трибутиламин, пиридин, N,N-диметиланилин, N-метил пиперидин, N-метил морфолин, диэтиламин, дициклогексиламин, прокаин, дибензиламин, N-бензил-β-фенетиламин, 1-эфенамин, и N,N'-дибензилэтилендиамин.
Среди вышеописанных солей предпочтительными являются фармацевтически приемлемые соли.
Производное никотинамида согласно настоящему изобретению характеризуется тем, что оно представлено следующей формулой (I):
[Формула 2]
R1 обозначает атом галогена. R1 предпочтительно обозначает атом фтора, атом хлора или атом брома, более предпочтительно атом фтора или атом хлора, и наиболее предпочтительно атом фтора.
R2 обозначает C1-12 алкил, C2-12 алкенил, C2-12 алкинил, C3-8 циклоалкил, арил, ар-C1-6 алкил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель.
R2 предпочтительно обозначает C1-12 алкил, C2-12 алкенил, C2-12 алкинил, C3-8 циклоалкил, арил, ар-C1-6 алкил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из следующей группы заместителей α1-1.
Группа заместителей α1-1 состоит из атома галогена; цианогруппы; нитрогруппы; оксогруппы; в случае необходимости защищенной карбоксильной группы; в случае необходимости защищенной гидроксильной группы; в случае необходимости защищенной аминогруппы; C1-6 алкила, C2-6 алкенила, C2-6 алкинила, C3-8 циклоалкила, арила, C1-6 алкокси, арилокси, ацила, C1-6 алкилсульфонила, арилсульфонила или гетероциклической группы, каждый из которых может иметь по меньшей мере один заместитель; и группы, представленной формулой -Q1-Q2-NR6R7 (в которой R6 и R7, каждый независимо, обозначает атом водорода; аминозащитную группу; C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, C1-6 алкокси, арил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель; или R6 и R7 могут образовывать циклическую аминогруппу, в случае необходимости имеющую по меньшей мере один заместитель, вместе с атомом азота, к которому они присоединены; Q1 обозначает -NH-; C1-6 алкилен, C2-6 алкенилен или C2-6 алкинилен, каждый из которых может иметь по меньшей мере один заместитель; или связь; Q2 обозначает группу, представленную -C(=X7)- (в которой X7 обозначает атом кислорода, атом серы или группу, представленную =NR29 (в которой R29 обозначает атом водорода или C1-12 алкил, C2-12 алкенил, C2-12 алкинил, C3-8 циклоалкил или C1-6 алкоксигруппу, каждый из которых может иметь по меньшей мере один заместитель)), C1-6 алкилен или связь).
Относительно R6 и R7, заместитель, который могут иметь C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, C1-6 алкокси, арил или гетероциклическая группа, особенно не ограничен. Предпочтительным примером является атом галогена, и среди прочих, предпочтительным является атом фтора.
Когда R6 и R7 могут образовывать циклическую аминогруппу вместе с атомом азота, к которому они присоединены, заместитель, который может иметь циклическая аминогруппа, особенно не ограничен. Предпочтительным примером является атом галогена, и среди прочих, предпочтительным является атом фтора.
Относительно Q1, заместитель, который связывается с C1-6 алкиленом, C2-6 алкениленом или C2-6 алкиниленом, особенно не ограничен. Предпочтительным примером является атом галогена, и среди прочих, предпочтительным является атом фтора.
Относительно R29, заместитель, который могут иметь C1-12 алкил, C2-12 алкенил, C2-12 алкинил, C3-8 циклоалкил или C1-6 алкокси, особенно не ограничена. Предпочтительным примером является атом галогена, и среди прочих, предпочтительным является атом фтора.
Кроме того, R2 более предпочтительно обозначает C1-12 алкил, C2-12 алкенил, C2-12 алкинил, C3-8 циклоалкил, арил, ар-C1-6 алкил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы заместителей α1-2.
Группа заместителей α1-2 состоит из атома галогена; цианогруппы; нитрогруппы; оксогруппы; в случае необходимости защищенной карбоксильной группы; в случае необходимости защищенной гидроксильной группы; в случае необходимости защищенной аминогруппы; C1-6 алкила, C2-6 алкенила, C2-6 алкинила, C3-8 циклоалкила, арила, C1-6 алкокси, арилокси, ацила, C1-6 алкилсульфонила, арилсульфонила или гетероциклической группы, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы заместителей β1-1; и формулы -Q1-Q2-NR6R7 (в которой Q1, Q2, R6 и R7 имеют те же самые определения, как описанные выше),
Группа заместителей β1-1 состоит из атома галогена; цианогруппы; нитрогруппы; оксогруппы; в случае необходимости защищенной карбоксильной группы; в случае необходимости защищенной гидроксильной группы; в случае необходимости защищенной аминогруппы; и C1-6 алкила, C3-8 циклоалкила, C1-6 алкокси, арила или гетероциклической группы, каждый из которых может иметь по меньшей мере один атом галогена.
Кроме того, R2 более предпочтительно обозначает C1-12 алкил, C2-12 алкенил, C2-12 алкинил, C3-8 циклоалкил, арил, ар-C1-6 алкил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы заместителей α1-3.
Группа заместителей α1-3 состоит из цианогруппы; оксогруппы; в случае необходимости защищенной гидроксильной группы; в случае необходимости защищенной аминогруппы; арила, C1-6 алкокси или гетероциклической группы, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы заместителей β1-2; и формулы -Q1-Q2-NR6R7 (в которой Q1, Q2, R6 и R7 имеют те же самые определения, как описанные выше), причем группа заместителей β1-2 состоит из атома галогена и в случае необходимости защищенной аминогруппы.
Кроме того, R2 более предпочтительно обозначает C1-12 алкильную или C3-8 циклоалкильную группу, каждая из которых может иметь, в качестве заместителя, в случае необходимости защищенную аминогруппу или гетероциклическую группу, имеющую по меньшей мере один заместитель, и еще более предпочтительно обозначает C1-12 алкильную или C3-8 циклоалкильную группу, имеющую аминогруппу в качестве заместителя.
Предпочтительным примером R2 является заместитель, представленный любой из следующих формул (II)-(V) и (VII). R2 предпочтительно обозначает заместитель, представленный формулой (II), (III) или (VII), и более предпочтительно заместитель, представленный формулой (II) или (III):
[Формула 3]
в которых R10, R11, R12, R13, R16, R17, R18, R20 и R21, каждый независимо, обозначает атом водорода или C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, арил, C1-6 алкокси, арилокси, ацил, C1-6 алкилсульфонил, арилсульфонил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, R14, R15, R19 и R30 каждый независимо, обозначают атом водорода или C1-12 алкильную или ацильную группу, каждая из которых может иметь по меньшей мере один заместитель, X8 обозначает атом кислорода, атом серы или =NR23 (где R23 обозначает атом водорода или C1-12 алкил, C2-12 алкенил, C2-12 алкинил, C3-8 циклоалкил или C1-6 алкоксигруппу, каждый из которых может иметь по меньшей мере один заместитель), R22 обозначает гетероциклическую группу, которая может иметь по меньшей мере один заместитель, X9 и X10, каждый независимо, обозначает атом кислорода, -NR31- (где R31 обозначает атом водорода или C1-12 алкил, C2-12 алкенил, C2-12 алкинил, C3-8 циклоалкил, C1-6 алкокси, ацил, C1-6 алкоксикарбонил, арилоксикарбонил или гетероциклический оксикарбонил, каждый из которых может иметь по меньшей мере один заместитель), или метиленовую группу (причем любой из X9 и X10 обозначает метиленовую группу, и когда m3 = 0, X10 обозначает метиленовую группу), m1 и m3, каждый независимо, означает целое число от 0 до 2, m2 означает целое число 1 или 2, причем R20 и R21 могут отличаться друг от друга, когда m2 = 2, n означает целое число от 0 до 4, R16 могут отличаться друг от друга, когда n=2-4, и причем R10 и R11, R12 и R13, R17 и R18, и R20 и R21 могут каждый вместе образовывать C3-8 циклоалкильную или гетероциклическую группу, каждая из которых может иметь по меньшей мере один заместитель.
Предпочтительно, R10, R11, R12, R13, R16, R17, R18, R20 и R21, каждый независимо, обозначает атом водорода или C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, арил, C1-6 алкокси, арилокси, ацил, C1-6 алкилсульфонил, арилсульфонил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из следующей группы заместителей γ1-1.
Группа заместителей γ1-1 состоит из атома галогена; цианогруппы; нитрогруппы; оксогруппы; в случае необходимости защищенной карбоксильной группы; в случае необходимости защищенной гидроксильной группы; в случае необходимости защищенной аминогруппы; C1-6 алкила, C3-8 циклоалкила или гетероциклической группы, в случае необходимости имеющей по меньшей мере один заместитель; и формулы -Q5-Q6-NR27R28 (в которой R27 и R28, каждый независимо, обозначает атом водорода; аминозащитную группу; или C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, C1-6 алкокси, арил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель; Q5 обозначает -NH-; C1-6 алкилен, C2-6 алкенилен или C2-6 алкинилен, каждый из которых может иметь по меньшей мере один заместитель; или связь; и Q6 обозначает -C(=O)-, C1-6 алкиленовую группу или связь).
Относительно R27 и R28, заместитель, который могут иметь C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, C1-6 алкокси, арил или гетероциклическую группу, особенно не ограничен. Предпочтительным примером является атом галогена, и среди прочих, предпочтительным является атом фтора.
Относительно Q5, заместитель, который могут иметь C1-6 алкилен, C2-6 алкенилен или C2-6 алкинилен, особенно не ограничен. Предпочтительным примером является атом галогена, и среди прочих, предпочтительным является атом фтора.
Относительно заместителя, представленного вышеописанной формулой (II), предпочтительно, R10, R11, R12 и R13, каждый независимо, обозначает атом водорода или C1-6 алкил, C1-6 алкокси, арил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из вышеописанного заместителя γ1-1.
R10 и R11, и R12 и R13 могут каждый вместе образовывать C3-8 циклоалкил или гетероциклическую группу, в случае необходимости имеющую заместитель. Предпочтительно, они могут образовывать C5-7 циклоалкил, моноциклическую кислородсодержащую гетероциклическую группу или бициклическую кислородсодержащую гетероциклическую группу, в случае необходимости имеющую заместитель.
Предпочтительно, R10 и R11, каждый независимо, обозначает атом водорода или C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, арил, C1-6 алкокси, арилокси, ацил, C1-6 алкилсульфонил, арилсульфонил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из вышеописанного заместителя γ1-1. Более предпочтительно, R10 и R11, каждый независимо, обозначает атом водорода или C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, арил, C1-6 алкокси, арилокси, ацил, C1-6 алкилсульфонил, арилсульфонил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из следующей группы заместителей γ1-2. Более предпочтительно, R10 и R11, каждый независимо, обозначает атом водорода или C1-6 алкил, C3-8 циклоалкил, арил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из следующей группы заместителей γ1-2.
Предпочтительные примеры гетероциклической группы, используемой здесь, включают имидазолил, пиридил, тиенил, триазолил, фуранил и пиразолил. Из них предпочтительными являются имидазолил, пиридил или тиенил. Кроме того, в качестве арильной группы, предпочтительной является фенильная группа.
Группа заместителей γ1-2 состоит из атома галогена и C1-6 алкила, C3-8 циклоалкила, арила или гетероциклической группы, в случае необходимости имеющих по меньшей мере один заместитель.
Предпочтительные примеры гетероциклической группы, используемой здесь, включают имидазолил, пиридил, тиенил, триазолил, фуранил и пиразолил. Кроме того, в качестве арильной группы, предпочтительной является фенильная группа. Заместитель, который могут иметь C1-6 алкил, C3-8 циклоалкил, арил или гетероциклическая группа, особенно не ограничен. Предпочтительным примером является атом галогена, и среди прочих, предпочтительным является атом фтора.
Относительно R10 и R11, или один из R10 и R11, и предпочтительно R11 обозначает атом водорода, а другой, и предпочтительно R10 предпочтительно обозначает C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, арил, C1-6 алкокси, арилокси, ацил, C1-6 алкилсульфонил, арилсульфонил или гетероциклическую группу, в случае необходимости имеющие по меньшей мере один заместитель, выбранный из вышеописанной группы заместителей γ1-1, и более предпочтительно обозначает C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, арил, C1-6 алкокси, арилокси, ацил, C1-6 алкилсульфонил, арилсульфонил или гетероциклическую группу, в случае необходимости имеющие по меньшей мере один заместитель, выбранный из вышеописанной группы заместителей γ1-2. Предпочтительные примеры гетероциклической группы, используемой здесь, включают имидазолил, пиридил, тиенил, триазолил, фуранил и пиразолил.
R12 и R13, каждый независимо, обозначает предпочтительно атом водорода или C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, арил, C1-6 алкокси, арилокси, ацил, C1-6 алкилсульфонил, арилсульфонил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из вышеописанной группы заместителей γ1-1, более предпочтительно атом водорода или C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, арил, C1-6 алкокси, арилокси, ацил, C1-6 алкилсульфонил, арилсульфонил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из вышеописанной группы заместителей γ1-2, и еще более предпочтительно атом водорода или C1-6 алкильную или C3-8 циклоалкильную группу, каждая из которых может иметь по меньшей мере один заместитель, выбранный из вышеописанной группы заместителей γ1-2.
R14 обозначает атом водорода или C1-12 алкильную или ацильную группу, каждая из которых может иметь по меньшей мере один заместитель, предпочтительно атом водорода или C1-6 алкильную или ацильную группу, и более предпочтительно атом водорода.
Заместитель, представленный вышеописанной формулой (II), предпочтительно представляет собой заместитель, представленный следующей формулой (1), более предпочтительно заместитель, представленный следующей формулой (2), и более предпочтительно заместитель, представленный следующей формулой (3):
[Формула 4]
в которых R32, R33, R96, R97, R34 и R35, каждый независимо, обозначает атом водорода или C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, арил, C1-6 алкокси, арилокси, ацил, C1-6 алкилсульфонил, арилсульфонил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из вышеописанной группы заместителей γ1-2.
R32, R96 и R34, каждый независимо, обозначает предпочтительно атом водорода или C1-6 алкил, C3-8 циклоалкил, арил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы заместителей γ1-2, и более предпочтительно алкильную группу; алкильную группу, замещенную циклоалкильной группой; циклоалкильную группу; или циклоалкильную группу, замещенную алкильной группой, каждая из которых всего содержит от 3 до 5 атомов углерода, или алкоксиалкильную группу, которая всего содержит от 2 до 4 атомов углерода. За счет использования настоящего заместителя токсичность может быть уменьшена.
Предпочтительные примеры алкильной группы, алкильной группы, замещенной циклоалкильной группой, циклоалкильной группы или циклоалкильной группы, замещенной алкильной группой, каждая из которых всего содержит от 3 до 5 атомов углерода, включают прямой или разветвленный пентил, н-бутил, изо-бутил, трет-бутил, н-пропил, изо-пропил, циклопропил, циклопропилметил и циклопропилэтил. Из них н-бутил, изо-бутил, н-пропил и циклопропильная группы являются предпочтительными.
Предпочтительные примеры алкоксиалкильной группы, содержащей всего от 2 до 4 атомов углерода, включают метоксиметил, метоксиэтил, этоксиметил и этоксиэтил.
R32, R96 и R34 предпочтительно обозначают метильную группу или этильную группу, замещенную гетероциклической группой, и более предпочтительно метильную группу, замещенную гетероциклической группой. Предпочтительные примеры гетероциклической группы, используемой здесь, включают имидазолил, пиридил, тиенил, триазолил, фуранил и пиразолил. За счет использования настоящего заместителя, токсичность может быть еще более уменьшена.
R33, R97 и R35, каждый независимо, обозначает предпочтительно атом водорода или C1-6 алкильную или C3-8 циклоалкильную группу, более предпочтительно атом водорода или C1-6 алкильную группу, и более предпочтительно C1-3 алкильную группу. Предпочтительные примеры включают метильную группу и этильную группу.
Общее число атомов углерода, содержащихся в R32 и R33, общее число атомов углерода, содержащихся в R96 и R97, и общее число атомов углерода, содержащихся в R34 и R35 составляет, каждое предпочтительно, от 4 до 6. За счет использования настоящего заместителя, токсичность может быть еще более уменьшена.
Заместитель, представленный вышеописанной формулой (III), предпочтительно представляет собой заместитель, представленный любой из следующих формул (III-1)-(III-3):
[Формула 5]
в которых R15, R16, m1 и n имеют те же самые определения, как описанные выше.
Предпочтительными формулами являются (III-1) и (III-2), и более предпочтительной формулой является (III-1).
В вышеописанной формуле (III) и вышеописанных формулах (III-1)-(III-3) R16 обозначает предпочтительно атом водорода или C1-6 алкил, C1-6 алкокси, арил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из вышеописанной группы заместителей γ1-1, более предпочтительно атом водорода или C1-6 алкил, C1-6 алкокси или арильную группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из вышеописанной группы заместителей γ1-1, и еще более предпочтительно атом водорода или C1-6 алкил, C1-6 алкокси или арильную группу.
m1 означает целое число от 0 до 2, и предпочтительно означает 1.
n означает целое число от 0 до 4, и R16 могут отличаться друг от друга, когда n=2-4. n предпочтительно означает целое число от 0 до 2, и более предпочтительно 0.
R15 обозначает атом водорода или C1-12 алкильную или ацильную группу, каждая из которых может иметь по меньшей мере один заместитель, предпочтительно атом водорода или C1-6 алкильную или ацильную группу, и более предпочтительно атом водорода.
Когда R2 обозначает заместитель, представленный вышеописанной формулой (III), он предпочтительно обозначает следующую формулу (III-4), более предпочтительно следующую формулу (III-5) и еще более предпочтительно следующую формулу (III-6).
[Формула 6]
Относительно заместителя, представленного вышеописанной формулой (IV), R17 и R18, каждый независимо, обозначает предпочтительно атом водорода или C1-6 алкил, C1-6 алкокси, арил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из вышеописанной группы заместителей γ1-1, более предпочтительно атом водорода или C1-6 алкил, C1-6 алкокси или арильную группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из вышеописанной группы заместителей γ1-1, и еще более предпочтительно атом водорода или C1-6 алкил, C1-6 алкокси или арильную группу.
R17 и R18 могут вместе образовывать C3-8 циклоалкильную или гетероциклическую группу, в случае необходимости имеющую заместитель. Среди прочих, C5-7 циклоалкильная или кислородсодержащая гетероциклическая группа, в случае необходимости имеющая заместитель, является предпочтительной.
R17 предпочтительно обозначает атом водорода. Кроме того, R18 предпочтительно обозначает C1-6 алкил, C1-6 алкокси, арил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из вышеописанной группы заместителей γ1-1, более предпочтительно C1-6 алкил, C1-6 алкокси или арильную группу, каждая из которых может иметь по меньшей мере один заместитель, выбранный из вышеописанной группы заместителей γ1-1, и еще более предпочтительно C1-6 алкил, C1-6 алкокси или арильную группу.
R19 обозначает атом водорода или C1-12 алкильную или ацильную группу, каждая из которых может иметь по меньшей мере один заместитель, предпочтительно атом водорода, C1-12 алкильную или ацильную группу, и более предпочтительно атом водорода.
Относительно заместителя, представленного вышеописанной формулой (V), R20 и R21, каждый независимо, обозначает предпочтительно атом водорода или C1-6 алкил, C1-6 алкокси, арил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из вышеописанной группы заместителей γ1-1, более предпочтительно атом водорода или C1-6 алкил, C1-6 алкокси или арильную группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из вышеописанной группы заместителей γ1-1, и еще более предпочтительно атом водорода или C1-6 алкильную группу, C1-6 алкокси или арильную группу.
R20 и R21 могут вместе образовывать C3-8 циклоалкильную или гетероциклическую группу, в случае необходимости имеющую заместитель. Среди прочих, C5-7 циклоалкильная или кислородсодержащая гетероциклическая группа, в случае необходимости имеющая заместитель, является предпочтительной.
R22 обозначает гетероциклическую группу, в случае необходимости имеющую заместитель.
m2 означает целое число 1 или 2. R20 и R21 могут отличаться друг от друга, когда m2 = 2. m2 предпочтительно означает 1.
R4 и R5, каждый независимо, обозначает атом водорода или C1-12 алкил, C2-12 алкенил или C2-12 алкинил, каждый из которых может иметь по меньшей мере один заместитель. R4 и R5 обозначают предпочтительно атом водорода или C1-6 алкил, C2-6 алкенил или C2-6 алкинил, более предпочтительно атом водорода или C1-6 алкильную группу, и еще более предпочтительно атом водорода.
Относительно заместителя, представленного вышеописанной формулой (VII), m3 означает целое число от 0 до 2, и предпочтительно означает 1.
R30 обозначает атом водорода или C1-12 алкильную или ацильную группу, каждая из которых может иметь по меньшей мере один заместитель, предпочтительно атом водорода, C1-6 алкильную или ацильную группу и более предпочтительно атом водорода.
X9 и X10, каждый независимо, обозначает атом кислорода, -NR31- (в котором R31 обозначает атом водорода или C1-12 алкил, C2-12 алкенил, C2-12 алкинил, C3-8 циклоалкил, C1-6 алкокси, ацил или C1-6 алкоксикарбонил, каждый из которых может иметь по меньшей мере один заместитель) или метиленовую группу (причем любой из X9 и X10 обозначает метиленовую группу, и когда m3 = 0, X10 обозначает метиленовую группу).
R31 обозначает атом водорода или C1-12 алкил, C2-12 алкенил, C2-12 алкинил, C3-8 циклоалкил, C1-6 алкокси, ацил, C1-6 алкоксикарбонил, арилоксикарбонил или гетероциклическую оксикарбонильную группу, каждый из которых может иметь по меньшей мере один заместитель, предпочтительно атом водорода, или C1-12 алкил, C3-8 циклоалкил, C1-6 алкокси, ацил, C1-6 алкоксикарбонил, арилоксикарбонил или гетероциклическую оксикарбонильную группу, каждый из которых может иметь по меньшей мере один заместитель, более предпочтительно атом водорода или C1-6 алкил, C3-6 циклоалкил, C1-6 алкокси, ацил, C1-6 алкоксикарбонил, арилоксикарбонил или гетероциклическую оксикарбонильную группу, каждый из которых может иметь по меньшей мере один заместитель, и еще более предпочтительно атом водорода или C1-6 алкил, C3-6 циклоалкил, C1-6 алкокси, ацил, C1-6 алкоксикарбонил, арилоксикарбонил или гетероциклическую оксикарбонильную группу.
Производное никотинамида согласно настоящему изобретению предпочтительно представлено следующей формулой (I-1).
[Формула 7]
в которой R3 обозначает тот же самый заместитель, как описано выше, и его предпочтительный диапазон также является тем же самым, как описано выше. R26 обозначает заместитель, представленный любой из вышеописанных формул (II)-(V) и (VII), и его предпочтительный диапазон также является тем же самым, как описано выше.
В вышеописанной формуле (I) и (I-1), R3 обозначает арильную или гетероциклическую группу, каждая из которых может иметь по меньшей мере один заместитель.
R3 предпочтительно обозначает арильную или гетероциклическую группу, каждая из которых может иметь по меньшей мере один заместитель, выбранный из группы заместителей α2-1.
Группа заместителей α2-1 состоит из атома галогена; цианогруппы; нитрогруппы; оксогруппы; в случае необходимости защищенной карбоксильной группы; в случае необходимости защищенной гидроксильной группы; в случае необходимости защищенной аминогруппы; C1-6 алкила, C2-6 алкенила, C2-6 алкинила, C3-8 циклоалкила, арила, C1-6 алкокси, арилокси, ацила, C1-6 алкилсульфонила, арилсульфонила или гетероциклической группы, каждый из которых может иметь по меньшей мере один заместитель; и формулы -Q3-Q4-NR24R25 (в которой R24 и R25, каждый независимо, обозначает атом водорода; аминозащитную группу; C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, C1-6 алкокси, ар-C1-6 алкил, арил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель; или R24 и R25 могут образовывать циклическую аминогруппу, в случае необходимости имеющую по меньшей мере один заместитель, вместе с атомом азота, к которому они присоединены; Q3 обозначает -NH-; C1-6 алкилен, C2-6 алкенилен или C2-6 алкинилен, каждый из которых может иметь по меньшей мере один заместитель; или связь; и Q4 обозначает -C(=O)-, алкиленовую группу C1-6 или связь).
Относительно R24 и R25, заместитель, который могут иметь C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, C1-6 алкокси, ар-C1-6 алкил, арил или гетероциклическая группа, особенно не ограничен. Предпочтительным примером является атом галогена, и среди прочих, предпочтительным является атом фтора.
Заместитель, который может иметь циклическая аминогруппа, образованная R24 и R25 вместе с атомом азота, к которому они присоединены, особенно не ограничен. Предпочтительным примером является атом галогена, и среди прочих, предпочтительным является атом фтора.
Относительно Q3, заместитель, который могут иметь C1-6 алкилен, C2-6 алкенилен или C2-6 алкинилен, особенно не ограничен. Предпочтительным примером является атом галогена, и среди прочих, предпочтительным является атом фтора.
Кроме того, R3 более предпочтительно обозначает арильную или гетероциклическую группу, каждая из которых может иметь по меньшей мере один заместитель, выбранный из группы заместителей α2-2.
Группа заместителей α2-2 состоит из атома галогена; цианогруппы; нитрогруппы; оксогруппы; в случае необходимости защищенной карбоксильной группы; в случае необходимости защищенной гидроксильной группы; в случае необходимости защищенной аминогруппы; C1-6 алкила, C2-6 алкенила, C2-6 алкинила, C3-8 циклоалкила, арила, C1-6 алкокси, арилокси, ацила, C1-6 алкилсульфонила, арилсульфонила или гетероциклической группы, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы заместителей β2-1; и формулы -Q3-Q4-NR24R25 (в которой Q3, Q4, R24 и R25 имеют те же самые определения, как описанные выше).
Группа заместителей β2-1 состоит из атома галогена; цианогруппы; нитрогруппы; оксогруппы; в случае необходимости защищенной карбоксильной группы; в случае необходимости защищенной гидроксильной группы; в случае необходимости защищенной аминогруппы, и C1-6 алкила, C3-8 циклоалкила, C1-6 алкокси, ар-C1-6 алкила, арила или гетероциклической группы, каждый из которых может иметь по меньшей мере один атом галогена.
Кроме того, R3 более предпочтительно обозначает арильную или гетероциклическую группу, каждая из которых может иметь по меньшей мере один заместитель, выбранный из группы заместителей α2-3.
Группа заместителей α2-3 состоит из атома галогена; цианогруппы; нитрогруппы; оксогруппы; в случае необходимости защищенной карбоксильной группы; в случае необходимости защищенной аминогруппы; C1-6 алкила, C3-8 циклоалкила, арила, C1-6 алкокси, арилокси, ацила, C1-6 алкилсульфонила или гетероциклической группы, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы заместителей β2-2; и формулы -Q3-Q4-NR24R25 (в которой Q3, Q4, R24 и R25 имеют те же самые определения, как описанные выше).
Группа заместителей β2-2 состоит из атома галогена; в случае необходимости защищенной гидроксильной группы; и C1-6 алкила, C3-8 циклоалкила, C1-6 алкокси, арила или гетероциклической группы, каждый из которых может иметь по меньшей мере один атом галогена.
R3 обозначает арильную или гетероциклическую группу, в случае необходимости имеющую по меньшей мере один заместитель. Предпочтительные примеры арильной или гетероциклической группы включают моноциклические и бициклические группы.
Предпочтительные примеры арильной группы включают фенил, нафтил и инданил. Среди таких арильных групп, фенильная группа является предпочтительной.
Предпочтительные примеры моноциклической гетероциклической группы включают пиридил, пиримидинил, пиридазинил, тиазолил и тиенил. В качестве таких моноциклических гетероциклических групп предпочтительны пиридил и пиридазинил, и пиридильная группа является более предпочтительной.
Предпочтительные примеры бициклической гетероциклической группы включают хинолил, изохинолил, хиноксалинил, хиназолинил, индазолил, индолил, индазолил, имидазопиридил, бензотиазолил, бензоксазолил, бензотиадиазолил, бензимидазолил, пирролопиридил, пиразолопиридил, пиридопиразил, тиазолопиридил, нафтиридинил, 1,3-бензодиоксолил, 1,4-бензодиоксанил, изоиндолинил, тетрагидроизохинолинил, и дигидропиридо оксазинил. В качестве таких бициклических гетероциклических групп предпочтительны хинолил, изохинолил, хиноксалинил, индолил, пирролопиридил, индазолил и имидазопиридил, более предпочтительны хиноксалинил и индазолил, и индазолильная группа является еще более предпочтительной.
R3 обозначает арильную или гетероциклическую группу, в случае необходимости имеющую по меньшей мере один заместитель. В качестве таких арильных или гетероциклических групп предпочтительны фенил, пиридил, пиридазинил, хиноксалинил и индазолил, предпочтительно пиридил. В качестве таких арильных или гетероциклических групп более предпочтительны пиридил, хиноксалинил и индазолил, и пиридил и индазолил являются еще более предпочтительными. За счет использования настоящего заместителя токсичность может быть еще более уменьшена.
Моноциклическая гетероциклическая группа предпочтительно представляет собой 5-членную кольцевую или 6-членную кольцевую группу.
Предпочтительным 6-членным кольцом являются пиридил или пиримидинил. Предпочтительные примеры пиридила и пиримидинила включают пиридин-5-ил, в случае необходимости имеющий заместитель(и) в положениях 2 и/или 3, пиридин-4-ил, в случае необходимости имеющий заместитель(и) в положениях 2 и/или 6, пиримидин-4-ил, в случае необходимости имеющий заместитель(и) в положениях 2 и/или 6, и пиримидин-5-ил, в случае необходимости имеющий заместитель в положении 2.
R3 предпочтительно обозначает фенил, пиридил, пиридазинил, хиноксалинил или индазолил, каждый из которых может иметь по меньшей мере один заместитель, более предпочтительно обозначает фенил, пиридил, пиридазинил, хиноксалинил или индазолил, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы заместителей α2-1, более предпочтительно обозначает фенил, пиридил, пиридазинил, хиноксалинил или индазолил, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы заместителей α2-2, и еще более предпочтительно обозначает фенил, пиридил, пиридазинил, хиноксалинил или индазолил, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы заместителей α2-3.
Когда R3 обозначает пиридил, в случае необходимости имеющий по меньшей мере один заместитель, заместитель, который может иметь пиридил, предпочтительно выбран из группы заместителей α2-1, более предпочтительно выбран из группы заместителей α2-4, еще более предпочтительно выбран из группы заместителей α2-5, и еще более предпочтительно выбран из группы заместителей α2-6.
Группа заместителей α2-4 состоит из атома галогена; цианогруппы; нитрогруппы; оксогруппы; в случае необходимости защищенной карбоксильной группы; в случае необходимости защищенной гидроксильной группы; в случае необходимости защищенной аминогруппы; C1-6 алкила, C2-6 алкенила, C2-6 алкинила, C3-8 циклоалкила, арила, C1-6 алкокси, арилокси, ацила, C1-6 алкилсульфонила, арилсульфонила или гетероциклической группы, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы заместителей β2-3; и формулы -Q3-Q4-NR24R25 (в которой Q3, Q4, R24 и R25 имеют те же самые определения, как описанные выше).
Группа заместителей β2-3 состоит из атома галогена; цианогруппы; нитрогруппы; оксогруппы; в случае необходимости защищенной карбоксильной группы; в случае необходимости защищенной гидроксильной группы; в случае необходимости защищенной аминогруппы; и C1-6 алкила, C3-8 циклоалкила, -Q5m4-R36 (в котором Q5 обозначает C1-6 алкиленоксигруппу (где сторона R36 обозначает алкиленовую группу), R36 обозначает атом водорода или C1-6 алкил, C3-8 циклоалкил, арил или гетероциклическую группу, и m4 означает целое число от 1 до 3, и Q5 могут отличаться друг от друга, когда m4 = 2 или 3), арил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один атом галогена.
Группа заместителей α2-5 состоит из атома галогена; цианогруппы; нитрогруппы; оксогруппы; в случае необходимости защищенной карбоксильной группы; в случае необходимости защищенной аминогруппы; C1-6 алкила, C3-8 циклоалкила, арила, C1-6 алкокси, арилокси, ацила, C1-6 алкилсульфонила или гетероциклической группы, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы заместителей β2-4; и формулы -Q3-Q4-NR24R25 (в которой Q3, Q4, R24 и R25 имеют те же самые определения, как описанные выше).
Группа заместителей β2-4 состоит из атома галогена; в случае необходимости защищенной гидроксильной группы; и C1-6 алкила, C3-8 циклоалкила, -Q5m4-R36 (в котором Q5, R36, m4 имеют те же самые определения, как описанные выше), арила или гетероциклической группы, каждый из которых может иметь по меньшей мере один атом галогена.
Группа заместителей α2-6 состоит из атома галогена; и C1-6 алкила, C3-8 циклоалкила, арила, C1-6 алкокси или гетероциклической группы, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы заместителей β2-5.
Группа заместителей β2-5 состоит из атома галогена; и C1-6 алкила, C3-8 циклоалкила, -Q5m4-R36 (в котором Q5, R36, m4 имеют те же самые определения, как описанные выше), арила или гетероциклической группы, каждый из которых может иметь по меньшей мере один атом галогена.
Когда R3 обозначает пиридильную группу, в случае необходимости имеющую по меньшей мере один заместитель, пиридильная группа предпочтительно представлена следующей формулой (VIII-1) или (VIII-2), и более предпочтительно представлена следующей формулой (VIII-1):
[Формула 8]
в которых R37, R38, R39, R40, R41, R42, R43 и R44, каждый независимо, обозначает атом водорода или заместитель, выбранный из вышеописанной группы заместителей α2-6.
R37 и R38, каждый независимо, обозначает предпочтительно атом водорода или атом галогена, более предпочтительно атом водорода или атом фтора, и еще более предпочтительно атом водорода.
R39 более предпочтительно обозначает атом водорода; атом галогена; или C1-6 алкил, арил, C1-6 алкокси или гетероциклическую группу, в случае необходимости имеющие по меньшей мере один заместитель, который, каждый независимо, выбирают из числа атома галогена, C1-6 алкила и C3-8 циклоалкила, и -Q5m4-R36 (в котором Q5, R36, m4 имеют те же самые определения, как описанные выше), и более предпочтительно обозначает атом галогена; или C1-6 алкил, арил, C1-6 алкокси или 5-членную кольцевую гетероциклическую группу, в случае необходимости имеющие по меньшей мере один заместитель, который, каждый независимо, выбирают из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36, m4 имеют те же самые определения, как описанные выше).
Предпочтительные примеры 5-членной кольцевой гетероциклической группы включают пирролил, пирролидинил, пиразолил, оксазолил, оксадиазолил, имидазолил, триазолил и фуранил. Среди этих групп, триазолил и фуранил более предпочтительны. Эта 5-членная кольцевая гетероциклическая группа предпочтительно незамещена или замещена заместителем, выбранным из группы, состоящей из атома фтора, атома хлора, метильной группы, этильной группы и пропильной группы, более предпочтительно незамещена или замещена заместителем, выбранным из группы, состоящей из атома фтора, метильной группы и этильной группы, и еще более предпочтительно незамещена или замещена атомом фтора или метильной группой.
Арильная группа предпочтительно представляет собой фенильную группу.
C1-6 алкильная группа предпочтительно представляет собой C1-3 алкильную группу, и более предпочтительно C1-2 алкильную группу.
C1-6 алкоксигруппа предпочтительно представляет собой C1-3 алкоксигруппу, и более предпочтительно C1-2 алкоксигруппу.
Атом галогена предпочтительно представляет собой атом фтора или атом хлора, и более предпочтительно атом фтора.
C3-8 циклоалкильная группа предпочтительно представляет собой циклопропильную группу.
Q5 предпочтительно обозначает C1-3 алкиленоксигруппу, и более предпочтительно C1-2 алкиленоксигруппу.
R36 предпочтительно обозначает атом водорода, C1-3 алкил или циклопропил, и более предпочтительно атом водорода или C1-2 алкильную группу.
m4 предпочтительно означает целое число 1 или 2.
R40 более предпочтительно обозначает атом водорода; атом галогена; или C1-6 алкил, арил, C1-6 алкокси или гетероциклическую группу, в случае необходимости имеющие по меньшей мере один заместитель, который, каждый независимо, выбирают из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R32, m3, Q6 имеют те же самые определения, как описанные выше), и более предпочтительно обозначает атом галогена; или C1-6 алкил, арил, C1-6 алкокси, или 5-членную кольцевую или 6-членную кольцевую гетероциклическую группу, в случае необходимости имеющие по меньшей мере один заместитель, который, каждый независимо, выбирают из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36, m4, Q6 имеют те же самые определения, как описанные выше).
Предпочтительные примеры 5-членной кольцевой гетероциклической группы включают пирролил, пирролидинил, пиразолил, оксазолил, оксадиазолил, имидазолил, триазолил и фуранил. Среди этих групп, триазолил и фуранил более предпочтительны. Эта 5-членная кольцевая гетероциклическая группа предпочтительно незамещена или замещена заместителем, выбранным из группы, состоящей из атома фтора, атома хлора, метильной группы, этильной группы и пропильной группы, более предпочтительно незамещена или замещена заместителем, выбранным из числа атома фтора, метильной группы и этильной группы, и еще более предпочтительно незамещена или замещена атомом фтора или метильной группой.
Предпочтительным примером 6-членной кольцевой гетероциклической группы является морфолинильная группа. Эта 6-членная кольцевая гетероциклическая группа предпочтительно незамещена или замещена заместителем, выбранным из группы, состоящей из атома фтора, атома хлора, метильной группы, этильной группы и пропильной группы, более предпочтительно незамещена или замещена заместителем, выбранным из числа атома фтора, метильной группы и этильной группы, более предпочтительно незамещена или замещена атомом фтора или метильной группой, и еще более предпочтительно незамещена.
Арильная группа предпочтительно представляет собой фенильную группу.
C1-6 алкильная группа предпочтительно представляет собой C1-3 алкильную группу, и более предпочтительно C1-2 алкильную группу.
C1-6 алкоксигруппа предпочтительно представляет собой C1-3 алкоксигруппу, и более предпочтительно C1-2 алкоксигруппу.
Атом галогена предпочтительно представляет собой атом фтора или атом хлора, и более предпочтительно атом фтора.
C3-8 циклоалкил предпочтительно представляет собой циклопропильную группу.
Q5 предпочтительно обозначает C1-3 алкиленоксигруппу, и более предпочтительно C1-2 алкиленоксигруппу.
R36 предпочтительно обозначает атом водорода, C1-3 алкильную или циклопропильную группу, и более предпочтительно атом водорода или C1-2 алкильную группу.
m4 предпочтительно означает целое число 1 или 2.
Когда R39 обозначает 5-членную кольцевую гетероциклическую группу, в случае необходимости имеющую по меньшей мере один заместитель, выбранный из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36, m4 имеют те же самые определения, как описанные выше), R40 предпочтительно обозначает атом галогена или C1-6 алкил или C1-6 алкоксигруппу.
Предпочтительные примеры 5-членной кольцевой гетероциклической группы включают пирролил, пирролидинил, пиразолил, оксазолил, оксадиазолил, имидазолил, триазолил и фуранил. Среди этих групп, триазолил и фуранил более предпочтительны. Эта 5-членная кольцевая гетероциклическая группа предпочтительно незамещена или замещена заместителем, выбранным из группы, состоящей из атома фтора, атома хлора, метильной группы, этильной группы и пропильной группы, более предпочтительно незамещена или замещена заместителем, выбранным из числа атома фтора, метильной группы и этильной группы, и еще более предпочтительно незамещена или замещена атомом фтора или метильной группой.
C1-6 алкильная группа предпочтительно представляет собой C1-3 алкильную группу, и более предпочтительно C1-2 алкильную группу.
C1-6 алкоксигруппа предпочтительно представляет собой C1-3 алкоксигруппу и более предпочтительно C1-2 алкоксигруппу.
Атом галогена предпочтительно представляет собой атом фтора или атом хлора, и более предпочтительно атом фтора.
C3-8 циклоалкильная группа предпочтительно представляет собой циклопропильную группу.
Q5 предпочтительно обозначает C1-3 алкиленоксигруппу, и более предпочтительно C1-2 алкиленоксигруппу.
R36 предпочтительно обозначает атом водорода, C1-3 алкильную или циклопропильную группу, и более предпочтительно атом водорода или C1-2 алкильную группу.
m4 предпочтительно означает целое число 1 или 2.
Когда R39 обозначает атом галогена; или C1-6 алкил или C1-6 алкоксигруппу, в случае необходимости имеющие по меньшей мере один атом галогена, R40 предпочтительно обозначает 5-членную кольцевую или 6-членную кольцевую гетероциклическую группу, в случае необходимости имеющую по меньшей мере один заместитель, который, каждый независимо, выбирают из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36, m4 имеют те же самые определения, как описанные выше).
В рамках изобретения, предпочтительные примеры 5-членной кольцевой гетероциклической группы включают пирролил, пирролидинил, пиразолил, оксазолил, оксадиазолил, имидазолил, триазолил и фуранил. Среди этих групп, триазолил и фуранил более предпочтительны. Эта 5-членная кольцевая гетероциклическая группа предпочтительно незамещена или замещена заместителем, выбранным из группы, состоящей из атома фтора, атома хлора, метильной группы, этильной группы и пропильной группы, более предпочтительно незамещена или замещена заместителем, выбранным из числа атома фтора, метильной группы и этильной группы, и еще более предпочтительно незамещена или замещена атомом фтора или метильной группой.
Предпочтительным примером 6-членной кольцевой гетероциклической группы является морфолинильная группа. Эта 6-членная кольцевая гетероциклическая группа предпочтительно незамещена или замещена заместителем, выбранным из группы, состоящей из атома фтора, атома хлора, метильной группы, этильной группы и пропильной группы, более предпочтительно незамещена или замещена заместителем, выбранным из числа атома фтора, метильной группы и этильной группы, еще более предпочтительно незамещена или замещена атомом фтора или метильной группой, и еще более предпочтительно незамещена.
Арильная группа предпочтительно представляет собой фенильную группу.
C1-6 алкильная группа предпочтительно представляет собой C1-3 алкильную группу, и более предпочтительно C1-2 алкильную группу.
C1-6 алкоксигруппа предпочтительно представляет собой C1-3 алкоксигруппа, и более предпочтительно C1-2 алкоксигруппа.
Атом галогена предпочтительно представляет собой атом фтора или атом хлора, и более предпочтительно атом фтора.
C3-8 циклоалкильная группа предпочтительно представляет собой циклопропильную группу.
Q5 предпочтительно обозначает C1-3 алкиленоксигруппу, и более предпочтительно C1-2 алкиленоксигруппу.
R36 предпочтительно обозначает атом водорода, C1-3 алкильную или циклопропильную группу, и более предпочтительно атом водорода или C1-2 алкильную группу.
m4 предпочтительно означает целое число 1 или 2.
Далее, соединение, в котором R39 обозначает атом фтора или метил или этил и R40 обозначает морфолинильную группу, является предпочтительным.
R41 и R42, каждый независимо, обозначает предпочтительно атом водорода или атом галогена, более предпочтительно атом водорода или атом фтора, и еще более предпочтительно атом водорода.
R43 и R44 каждый обозначает более предпочтительно атом водорода; атом галогена; или C1-6 алкил, арил, C1-6 алкокси или гетероциклическую группу, в случае необходимости имеющие по меньшей мере один заместитель, который, каждый независимо, выбирают из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36, m4 имеют те же самые определения, как описанные выше), более предпочтительно атом водорода; атом галогена; или C1-6 алкил или C1-6 алкоксигруппу, в случае необходимости имеющие по меньшей мере один заместитель, который, каждый независимо, выбирают из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36, m4 имеют те же самые определения, как описанные выше), и еще более предпочтительно атом водорода; атом галогена; или C1-6 алкил или C1-6 алкоксигруппу.
В рамках изобретения, предпочтительные примеры гетероциклической группы включают пирролил, пирролидинил, пиразолил, оксазолил, оксадиазолил, имидазолил, триазолил и фуранил. Среди этих групп, триазолил и фуранил более предпочтительны. Эта гетероциклическая группа предпочтительно незамещена или замещена заместителем, выбранным из группы, состоящей из атома фтора, атома хлора, метильной группы, этильной группы и пропильной группы, более предпочтительно незамещена или замещена заместителем, выбранным из числа атома фтора, метильной группы и этильной группы, и еще более предпочтительно незамещена или замещена атомом фтора или метильной группой.
Арильная группа предпочтительно представляет собой фенильную группу.
C1-6 алкильная группа предпочтительно представляет собой C1-3 алкильную группу, и более предпочтительно C1-2 алкильную группу.
C1-6 алкоксигруппа предпочтительно представляет собой C1-3 алкоксигруппу, и более предпочтительно C1-2 алкоксигруппу.
Атом галогена предпочтительно представляет собой атом фтора или атом хлора, и более предпочтительно атом фтора.
C3-8 циклоалкил предпочтительно представляет собой циклопропильную группу.
Q5 предпочтительно обозначает C1-3 алкиленоксигруппа, и более предпочтительно C1-2 алкиленоксигруппа.
R36 предпочтительно обозначает атом водорода, C1-3 алкильную или циклопропильную группы, и более предпочтительно атом водорода или C1-2 алкильную группу.
m4 предпочтительно означает целое число 1 или 2.
Среди пиридильных групп, представленных вышеописанной формулой (VIII-1), пиридильная группа, представленная следующей формулой (VIII-3), более предпочтительна. Среди пиридильных групп, представленных вышеописанной формулой (VIII-2), пиридильная группа, представленная следующей формулой (VIII-4), более предпочтительна. Среди прочих, пиридильная группа, представленная следующей формулой (VIII-3), еще более предпочтительна.
[Формула 9]
в которых R45, R46, R47 и R48 независимо обозначают атом водорода или заместитель, выбранный из вышеописанной группы заместителей α2-6.
R45 более предпочтительно обозначает атом водорода; атом галогена; или C1-6 алкил, арил, C1-6 алкокси или гетероциклическую группу, в случае необходимости имеющие по меньшей мере один заместитель, который, каждый независимо, выбирают из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36, m4 имеют те же самые определения, как описанные выше), и более предпочтительно обозначает атом галогена; или C1-6 алкил, арил, C1-6 алкокси или 5-членную кольцевую гетероциклическую группу, в случае необходимости имеющие по меньшей мере один заместитель, который, каждый независимо, выбирают из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36, m4 имеют те же самые определения, как описанные выше). В рамках изобретения, предпочтительные примеры 5-членной кольцевой гетероциклической группы включают пирролил, пирролидинил, пиразолил, оксазолил, оксадиазолил, имидазолил, триазолил и фуранил. Среди этих групп, триазолил и фуранил более предпочтительны. Эта 5-членная кольцевая гетероциклическая группа предпочтительно незамещена или замещена заместителем, выбранным из группы, состоящей из атома фтора, атома хлора, метильной группы, этильной группы и пропильной группы, более предпочтительно незамещена или замещена заместителем, выбранным из числа атома фтора, метильной группы и этильной группы, и еще более предпочтительно незамещена или замещена атомом фтора или метильной группой.
C1-6 алкильная группа предпочтительно представляет собой C1-3 алкильную группу, и более предпочтительно C1-2 алкильную группу.
C1-6 алкоксигруппа предпочтительно представляет собой C1-3 алкоксигруппу, и более предпочтительно C1-2 алкоксигруппу.
Атом галогена предпочтительно представляет собой атом фтора или атом хлора, и более предпочтительно атом фтора.
C3-8 циклоалкил предпочтительно представляет собой циклопропильную группу.
Q5 предпочтительно обозначает C1-3 алкиленоксигруппу, и более предпочтительно C1-2 алкиленоксигруппу.
R36 предпочтительно обозначает атом водорода, C1-3 алкильную или циклопропильную группы, и более предпочтительно атом водорода, или C1-2 алкильную группу.
m4 предпочтительно означает целое число 1 или 2.
R46 более предпочтительно обозначает атом водорода; атом галогена; или C1-6 алкил, арил, C1-6 алкокси или гетероциклическую группу, в случае необходимости имеющие по меньшей мере один заместитель, который, каждый независимо, выбирают из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R32, m3, Q6 имеют те же самые определения, как описанные выше), и более предпочтительно обозначает атом галогена; или C1-6 алкил, арил, C1-6 алкокси или 5-членную кольцевую или 6-членную кольцевую гетероциклическую группу, в случае необходимости имеющую по меньшей мере один заместитель, который, каждый независимо, выбирают из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36, m4, Q6 имеют те же самые определения, как описанные выше).
В рамках изобретения, предпочтительные примеры 5-членной кольцевой гетероциклической группы включают пирролил, пирролидинил, пиразолил, оксазолил, оксадиазолил, имидазолил, триазолил и фуранил. Среди этих групп, триазолил и фуранил предпочтительны. Эта 5-членная кольцевая гетероциклическая группа предпочтительно незамещена или замещена заместителем, выбранным из группы, состоящей из атома фтора, атома хлора, метильной группы, этильной группы и пропильной группы, более предпочтительно незамещена или замещена заместителем, выбранным из числа атома фтора, метильной группы и этильной группы, и еще более предпочтительно незамещена или замещена атомом фтора или метильной группой.
Предпочтительным примером 6-членной кольцевой гетероциклической группы является морфолинильная группа. Эта 6-членная кольцевая гетероциклическая группа предпочтительно незамещена или замещена заместителем, выбранным из группы, состоящей из атома фтора, атома хлора, метильной группы, этильной группы и пропильной группы, более предпочтительно незамещена или замещена заместителем, выбранным из числа атома фтора, метильной группы и этильной группы, еще более предпочтительно незамещена или замещена атомом фтора или метильной группой, и еще более предпочтительно незамещена.
Арильная группа предпочтительно представляет собой фенильную группу.
C1-6 алкильная группа предпочтительно представляет собой C1-3 алкильную группу, и более предпочтительно C1-2 алкильную группу.
C1-6 алкоксигруппа предпочтительно представляет собой C1-3 алкоксигруппу, и более предпочтительно C1-2 алкоксигруппу.
Атом галогена предпочтительно представляет собой атом фтора или атом хлора, и более предпочтительно атом фтора.
C3-8 циклоалкил предпочтительно представляет собой циклопропильную группу.
Q5 предпочтительно обозначает C1-3 алкиленоксигруппу, и более предпочтительно C1-2 алкиленоксигруппу.
R36 предпочтительно обозначает атом водорода, C1-3 алкильную или циклопропильная группы, и более предпочтительно атом водорода или C1-2 алкильную группу.
m4 предпочтительно означает целое число 1 или 2.
Когда R45 обозначает 5-членную кольцевую гетероциклическую группу, в случае необходимости имеющую по меньшей мере один заместитель, выбранный из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36, m4 имеют те же самые определения, как описанные выше), R46 предпочтительно обозначает атом галогена, C1-6 алкил или C1-6 алкоксигруппу.
В рамках изобретения, предпочтительные примеры 5-членной кольцевой гетероциклической группы включают пирролил, пирролидинил, пиразолил, оксазолил, оксадиазолил, имидазолил, триазолил и фуранил. Среди этих групп, триазолил и фуранил более предпочтительны. Эта 5-членная кольцевая гетероциклическая группа предпочтительно незамещена или замещена заместителем, выбранным из группы, состоящей из атома фтора, атома хлора, метильной группы, этильной группы и пропильной группы, более предпочтительно незамещена или замещена заместителем, выбранным из числа атома фтора, метильной группы и этильной группы, и еще более предпочтительно незамещена или замещена атомом фтора или метильной группой.
C1-6 алкильная группа предпочтительно представляет собой C1-3 алкильную группу, и более предпочтительно C1-2 алкильную группу.
C1-6 алкоксигруппа предпочтительно представляет собой C1-3 алкоксигруппу, и более предпочтительно C1-2 алкоксигруппу.
Атом галогена предпочтительно представляет собой атом фтора или атом хлора, и более предпочтительно атом фтора.
C3-8 циклоалкил предпочтительно представляет собой циклопропильную группу.
Q5 предпочтительно обозначает C1-3 алкиленоксигруппу, и более предпочтительно C1-2 алкиленоксигруппу.
R36 предпочтительно обозначает атом водорода, C1-3 алкильную или циклопропильную группы, и более предпочтительно атом водорода, или C1-2 алкильную группу.
m4 предпочтительно означает целое число 1 или 2.
Когда R45 обозначает атом галогена; или C1-6 алкильную или C1-6 алкоксигруппу, в случае необходимости имеющую по меньшей мере один атом галогена, R46 предпочтительно обозначает 5-членную кольцевую или 6-членную кольцевую гетероциклическую группу, в случае необходимости имеющую по меньшей мере один заместитель, который, каждый независимо, выбирают из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36, m4 имеют те же самые определения, как описанные выше).
В рамках изобретения, предпочтительные примеры 5-членной кольцевой гетероциклической группы включают пирролил, пирролидинил, пиразолил, оксазолил, оксадиазолил, имидазолил, триазолил и фуранил. Среди этих групп, триазолил и фуранил более предпочтительны. Эта 5-членная кольцевая гетероциклическая группа предпочтительно незамещена или замещена заместителем, выбранным из группы, состоящей из атома фтора, атома хлора, метильной группы, этильной группы и пропильной группы, более предпочтительно незамещена или замещена заместителем, выбранным из числа атома фтора, метильной группы и этильной группы, и еще более предпочтительно незамещена или замещена атомом фтора или метильной группой.
Предпочтительным примером 6-членной кольцевой гетероциклической группы является морфолинильная группа. Эта 6-членная кольцевая гетероциклическая группа предпочтительно незамещена или замещена заместителем, выбранным из группы, состоящей из атома фтора, атома хлора, метильной группы, этильной группы и пропильной группы, более предпочтительно незамещена или замещена заместителем, выбранным из числа атома фтора, метильной группы и этильной группы, еще более предпочтительно незамещена или замещена атомом фтора или метильной группой, и еще более предпочтительно незамещена.
Арильная группа предпочтительно представляет собой фенильную группу.
C1-6 алкильная группа предпочтительно представляет собой C1-3 алкильную группу, и более предпочтительно C1-2 алкильную группу.
C1-6 алкоксигруппа предпочтительно представляет собой C1-3 алкоксигруппу, и более предпочтительно C1-2 алкоксигруппу.
Атом галогена предпочтительно представляет собой атом фтора или атом хлора, и более предпочтительно атом фтора.
C3-8 циклоалкил предпочтительно представляет собой циклопропильную группу.
Q5 предпочтительно обозначает C1-3 алкиленоксигруппу, и более предпочтительно C1-2 алкиленоксигруппу.
R36 предпочтительно обозначает атом водорода, C1-3 алкильную или циклопропильную группы, и более предпочтительно атом водорода или C1-2 алкильную группу.
m4 предпочтительно означает целое число 1 или 2.
Далее, соединение, в котором R45 обозначает атом фтора или метил или этил, и R46 обозначает морфолинильную группу, является предпочтительным.
R47 и R48 каждый обозначает более предпочтительно атом водорода; атом галогена; или C1-6 алкил, арил, C1-6 алкокси или гетероциклическую группу, в случае необходимости имеющие по меньшей мере один заместитель, который, каждый независимо, выбирают из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36, m4 имеют те же самые определения, как описанные выше), еще более предпочтительно атом водорода; атом галогена; или C1-6 алкил или C1-6 алкоксигруппу, в случае необходимости имеющие по меньшей мере один заместитель, который, каждый независимо, выбирают из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36, m4 имеют те же самые определения, как описанные выше), и еще более предпочтительно атом водорода, атом галогена, или C1-6 алкил или C1-6 алкоксигруппу.
В рамках изобретения, предпочтительные примеры гетероциклической группы включают пирролил, пирролидинил, пиразолил, оксазолил, оксадиазолил, имидазолил, триазолил и фуранил. Среди этих групп, триазолил и фуранил более предпочтительны. Эта гетероциклическая группа предпочтительно незамещена или замещена заместителем, выбранным из группы, состоящей из атома фтора, атома хлора, метильной группы, этильной группы и пропильной группы, более предпочтительно незамещена или замещена заместителем, выбранным из числа атома фтора, метильной группы и этильной группы, и еще более предпочтительно незамещена или замещена атомом фтора или метильной группой.
Арильная группа предпочтительно представляет собой фенильную группу.
C1-6 алкильная группа предпочтительно представляет собой C1-3 алкильную группу, и более предпочтительно C1-2 алкильную группу.
C1-6 алкоксигруппа предпочтительно представляет собой C1-3 алкоксигруппу, и более предпочтительно C1-2 алкоксигруппу.
Атом галогена предпочтительно представляет собой атом фтора или атом хлора, и более предпочтительно атом фтора.
C3-8 циклоалкил предпочтительно представляет собой циклопропильную группу.
Q5 предпочтительно обозначает C1-3 алкиленоксигруппу, и более предпочтительно C1-2 алкиленоксигруппу.
R36 предпочтительно обозначает атом водорода, C1-3 алкильную или циклопропильную группы, и более предпочтительно атом водорода, или C1-2 алкильную группу.
m4 предпочтительно означает целое число 1 или 2.
Когда R3 обозначает индазолильную группу, в случае необходимости имеющую по меньшей мере один заместитель, он предпочтительно обозначает индазолильную группу, представленную любой из следующих формул (IX-1)-(IX-6), более предпочтительно обозначает индазолильную группу, представленную формулой (IX-1) или (IX-2), и более предпочтительно обозначает индазолильную группу, представленную формулой (IX-1):
[Формула 10]
в которых R49, R50, R51, R52, R53, R54, R55, R56, R57, R58, R59, R60, R61, R62, R63, R64, R65, R66, R67, R68, R69, R70, R71, R72, R73, R74, R75, R76, R77 и R78, каждый независимо, обозначает атом водорода, или заместитель, выбранный из вышеописанной группы заместителей α2-6.
R49, R50, R54, R55, R59, R60, R64, R65, R69, R70, R74 и R75, каждый независимо, обозначает предпочтительно атом водорода или атом галогена, более предпочтительно атом водорода или атом фтора, и еще более предпочтительно атом водорода.
R53, R58, R61, R68, R73 и R76, каждый независимо, обозначает предпочтительно атом галогена, или C1-6 алкил, арил или C1-6 алкоксигруппу, более предпочтительно атом водорода или атом галогена, еще более предпочтительно атом водорода или атом фтора, и еще более предпочтительно атом водорода.
R51, R57, R63, R66, R72 и R78, каждый независимо, обозначает предпочтительно атом водорода; атом галогена; или C1-6 алкил, C3-8 циклоалкил, C1-6 алкокси или арильную группу, в случае необходимости имеющие по меньшей мере один заместитель, который, каждый независимо, выбирают из числа C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R32, m4 имеют те же самые определения, как описанные выше), в случае необходимости имеющих по меньшей мере один атом галогена.
В рамках изобретения, C1-6 алкильная группа предпочтительно представляет собой C1-3 алкильную группу, и более предпочтительно C1-2 алкильную группу.
C1-6 алкоксигруппа предпочтительно представляет собой C1-3 алкоксигруппу, и более предпочтительно C1-2 алкоксигруппу.
Атом галогена предпочтительно представляет собой атом фтора или атом хлора, и более предпочтительно атом фтора.
C3-8 циклоалкил предпочтительно представляет собой циклопропильную группу.
Q5 предпочтительно представляет собой C1-3 алкиленоксигруппу, и более предпочтительно C1-2 алкиленоксигруппу.
R36 предпочтительно представляет собой атом водорода, C1-3 алкильную или циклопропильную группы, и более предпочтительно атом водорода или C1-2 алкильную группу.
m4 предпочтительно означает целое число 1 или 2.
R52, R56, R62, R67, R71 и R77, каждый независимо, обозначает предпочтительно атом водорода; атом галогена; или C1-6 алкил, C3-8 циклоалкил, C1-6 алкокси или арильную группу, в случае необходимости имеющие по меньшей мере один заместитель, который, каждый независимо, выбирают из числа C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36, m4 имеют те же самые определения, как описанные выше), в случае необходимости имеющих по меньшей мере один атом галогена.
В рамках изобретения, C1-6 алкильная группа предпочтительно представляет собой C1-3 алкильную группу, и более предпочтительно C1-2 алкильную группу.
C1-6 алкоксигруппа предпочтительно представляет собой C1-3 алкоксигруппу, и более предпочтительно C1-2 алкоксигруппу.
Атом галогена предпочтительно представляет собой атом фтора или атом хлора, и более предпочтительно атом фтора.
C3-8 циклоалкил предпочтительно представляет собой циклопропильную группу.
Арил предпочтительно представляет собой фенильную группу.
Q5 предпочтительно обозначает C1-3 алкиленоксигруппу, и более предпочтительно C1-2 алкиленоксигруппу.
R36 предпочтительно обозначает атом водорода, C1-3 алкильную или циклопропильную группы, и более предпочтительно атом водорода или C1-2 алкильную группу.
m4 предпочтительно означает целое число 1 или 2.
Относительно комбинаций, таких как R51 и R52, R56 и R57, R62 и R63, R66 и R67, R71 и R72, и R77 и R78, по меньшей мере любой предпочтительно обозначает атом галогена; или C1-6 алкил, C3-8 циклоалкил или C1-6 алкоксигруппу, в случае необходимости имеющие по меньшей мере один заместитель, который, каждый независимо, выбирают из числа C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36, m4 имеют те же самые определения, как описанные выше), в случае необходимости имеющих по меньшей мере один атом галогена.
В рамках изобретения, C1-6 алкильная группа предпочтительно представляет собой C1-3 алкильную группу, и более предпочтительно C1-2 алкильную группу.
C1-6 алкоксигруппа предпочтительно представляет собой C1-3 алкоксигруппу и более предпочтительно C1-2 алкоксигруппу.
Атом галогена предпочтительно представляет собой атом фтора или атом хлора, и более предпочтительно атом фтора.
C3-8 циклоалкил предпочтительно представляет собой циклопропильную группу.
Q5 предпочтительно обозначает C1-3 алкиленоксигруппу, и более предпочтительно C1-2 алкиленоксигруппу.
R36 предпочтительно обозначает атом водорода, C1-3 алкильную или циклопропильную группы, и более предпочтительно атом водорода, или C1-2 алкильную группу.
m4 предпочтительно означает целое число 1 или 2.
Среди индазолильных групп, представленных вышеописанной формулой (IX-1), индазолильная группа, представленная следующей формулой (IX-7), более предпочтительна. Среди индазолильных групп, представленных вышеописанной формулой (IX-2), индазолильная группа, представленная следующей формулой (IX-8), более предпочтительна. Среди прочих, индазолильная группа, представленная формулой (IX-7), еще более предпочтительна:
[Формула 11]
в которых R79, R80, R81 и R82, каждый независимо, обозначает атом водорода или заместитель, выбранный из вышеописанной группы заместителей α2-6, причем
R79 обозначает тот же самый заместитель как R51, и предпочтительный диапазон R79 также является тем же самым как для R51,
R80 обозначает тот же самый заместитель как R52, и предпочтительный диапазон R80 также является тем же самым как для R52,
R81 обозначает тот же самый заместитель как R56, и предпочтительный диапазон R81 также является тем же самым как для R56, и
R82 обозначает тот же самый заместитель как R57, и предпочтительный диапазон R82 также является тем же самым как для R57.
Когда R3 обозначает фенильную группу, в случае необходимости имеющую по меньшей мере один заместитель, заместитель, который может иметь фенильная группа, более предпочтительно представляет собой атом галогена; или C1-6 алкил, арил, C1-6 алкокси или гетероциклическую группу, в случае необходимости имеющие по меньшей мере один заместитель, который, каждый независимо, выбирают из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R32, m3, Q6 имеют те же самые определения, как описанные выше), и более предпочтительно обозначает атом галогена; или C1-6 алкил, арил, C1-6 алкокси или 5-членную кольцевую или 6-членную кольцевую гетероциклическую группу, в случае необходимости имеющие по меньшей мере один заместитель, который, каждый независимо, выбирают из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36, m4, Q6 имеют те же самые определения, как описанные выше).
В рамках изобретения, предпочтительные примеры 5-членной кольцевой гетероциклической группы включают пирролил, пирролидинил, пиразолил, оксазолил, оксадиазолил, имидазолил, триазолил и фуранил. Среди этих групп, триазолил и фуранил более предпочтительны. Эта 5-членная кольцевая гетероциклическая группа предпочтительно незамещена или замещена заместителем, выбранным из группы, состоящей из атома фтора, атома хлора, метильной группы, этильной группы и пропильной группы, более предпочтительно незамещена или замещена заместителем, выбранным из числа атома фтора, метильной группы и этильной группы, и еще более предпочтительно незамещена или замещена атомом фтора или метильной группой.
Предпочтительным примером 6-членной кольцевой гетероциклической группы является морфолинильная группа. Эта 6-членная кольцевая гетероциклическая группа предпочтительно незамещена или замещена заместителем, выбранным из группы, состоящей из атома фтора, атома хлора, метильной группы, этильной группы и пропильной группы, более предпочтительно незамещена или замещена заместителем, выбранным из числа атома фтора, метильной группы и этильной группы, еще более предпочтительно незамещена или замещена атомом фтора или метильной группой, и еще более предпочтительно незамещена.
Арильная группа предпочтительно представляет собой фенильную группу.
C1-6 алкильная группа предпочтительно представляет собой C1-3 алкильную группу, и более предпочтительно C1-2 алкильную группу.
C1-6 алкоксигруппа предпочтительно представляет собой C1-3 алкоксигруппу, и более предпочтительно C1-2 алкоксигруппу.
Атом галогена предпочтительно представляет собой атом фтора или атом хлора, и более предпочтительно атом фтора.
C3-8 циклоалкил предпочтительно представляет собой циклопропильную группу.
Q5 предпочтительно обозначает C1-3 алкиленоксигруппу, и более предпочтительно C1-2 алкиленоксигруппу.
R36 предпочтительно обозначает атом водорода, C1-3 алкильную или циклопропильную группы, и более предпочтительно атом водорода, или C1-2 алкильную группу.
m4 предпочтительно означает целое число 1 или 2.
Когда R3 обозначает хиноксалинильную группу, в случае необходимости имеющую по меньшей мере один заместитель, заместитель, который может иметь хиноксалинильная группа, предпочтительно представляет собой атом галогена; или C1-6 алкил, C3-8 циклоалкил, C1-6 алкокси или арильную группу, в случае необходимости имеющие по меньшей мере один заместитель, который, каждый независимо, выбирают из числа C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R32, m4 имеют те же самые определения, как описанные выше), в случае необходимости имеющих по меньшей мере один атом галогена.
В рамках изобретения, C1-6 алкильная группа предпочтительно представляет собой C1-3 алкильную группу, и более предпочтительно C1-2 алкильную группу.
C1-6 алкоксигруппа предпочтительно представляет собой C1-3 алкоксигруппу, и более предпочтительно C1-2 алкоксигруппу.
Атом галогена предпочтительно представляет собой атом фтора или атом хлора, и более предпочтительно атом фтора.
C3-8 циклоалкил предпочтительно представляет собой циклопропильную группу.
Арильная группа предпочтительно представляет собой фенильную группу.
Q5 предпочтительно обозначает C1-3 алкиленоксигруппу, и более предпочтительно C1-2 алкиленоксигруппу.
R36 предпочтительно обозначает атом водорода, C1-3 алкильную или циклопропильную группы, и более предпочтительно атом водорода или C1-2 алкильную группу.
m4 предпочтительно означает целое число 1 или 2.
Производное никотинамида согласно настоящему изобретению, или его фармацевтически приемлемая соль, предпочтительно представлено следующей формулой (I-2), более предпочтительно представлено следующей формулой (I-3), еще более предпочтительно представлено следующей формулой (I-4) и еще более предпочтительно представляется следующей формулой (I-5):
[Формула 12]
в которых
R83 обозначает тот же самый заместитель как R10, и предпочтительный диапазон R83 также является тем же самым как для R10,
R84 обозначает тот же самый заместитель как R11, и предпочтительный диапазон R84 также является тем же самым как для R11,
R85 обозначает тот же самый заместитель как R12, и предпочтительный диапазон R85 также является тем же самым как для R12,
R86 обозначает тот же самый заместитель как R13, и предпочтительный диапазон R86 также является тем же самым как для R13,
R88 обозначает тот же самый заместитель как R32, и предпочтительный диапазон R88 также является тем же самым как для R32,
R89 обозначает тот же самый заместитель как R33, и предпочтительный диапазон R89 также является тем же самым как для R33,
R91 обозначает тот же самый заместитель как R96, и предпочтительный диапазон R91 также является тем же самым как для R96,
R92 обозначает тот же самый заместитель как R97, и предпочтительный диапазон R92 также является тем же самым как для R97,
R98 обозначает тот же самый заместитель как R34, и предпочтительный диапазон R98 также является тем же самым как для R34,
R99 обозначает тот же самый заместитель как R35, и предпочтительный диапазон R99 также является тем же самым как для R35,
R87 обозначает тот же самый заместитель как R3, и предпочтительный диапазон R87 также является тем же самым как для R3,
R90 обозначает тот же самый заместитель как R3, и предпочтительный диапазон R90 также является тем же самым как для R3,
R93 обозначает тот же самый заместитель как R3, и предпочтительный диапазон R93 также является тем же самым как для R3, и
R100 обозначает тот же самый заместитель как R3, и предпочтительный диапазон R100 также является тем же самым как для R3.
В приведенных выше формулах, каждый из R87, R90, R93 и R100 предпочтительно обозначает индазолильную группу или пиридильную группу, в случае необходимости имеющую по меньшей мере один заместитель. Когда каждый из R87, R90, R93 и R100 обозначает пиридильную группу, в случае необходимости имеющую по меньшей мере один заместитель, он предпочтительно обозначает пиридильную группу, представленную вышеописанной формулой (VIII-1) или (VIII-2), и более предпочтительно пиридильную группу, представленную следующей формулой (VIII-1). Предпочтительные диапазоны пиридильных групп, представленных вышеописанными формулами (VIII-1) и (VIII-2), являются теми же самыми как описанные выше. Когда каждый из R87, R90, R93 и R100 обозначает индазолильную группу, в случае необходимости имеющую по меньшей мере один заместитель, он предпочтительно обозначает индазолильную группу, представленную любой из вышеописанных формул (IX-1)-(IX-6), более предпочтительно индазолильную группу, представленную формулой (IX-1) или (IX-2), и еще более предпочтительно индазолильную группу, представленную формулой (IX-1). Предпочтительные диапазоны индазолильных групп, представленных вышеописанными формулами (IX-1)-(IX-6), являются теми же самыми как описанные выше.
Производное никотинамида согласно настоящему изобретению, или его фармацевтически приемлемая соль, предпочтительно представлено следующей формулой (I-6), более предпочтительно представлено следующей формулой (I-7), и еще более предпочтительно представлено следующей формулой (I-8):
[Формула 13]
в которых
R94 обозначает тот же самый заместитель как R3, и предпочтительный диапазон R94 также является тем же самым как для R3,
R95 обозначает тот же самый заместитель как R3, и предпочтительный диапазон R95 также является тем же самым как для R3, и
R101 обозначает тот же самый заместитель как R3, и предпочтительный диапазон R101 также является тем же самым как для R3.
В вышеописанных формулах, каждый из R94, R95 и R101 более предпочтительно обозначает пиридильную группу, в случае необходимости имеющую по меньшей мере один заместитель, еще более предпочтительно пиридильную группу, представленную вышеописанной формулой (VIII-1) или (VIII-2), и еще более предпочтительно пиридильную группу, представленную следующей формулой (VIII-1). Предпочтительные диапазоны пиридильных групп, представленных вышеописанными формулами (VIII-1) и (VIII-2), являются теми же самыми как описанные выше.
Производное никотинамида согласно настоящему изобретению, или его фармацевтически приемлемая соль, предпочтительно представлено следующей формулой (I-9), более предпочтительно представлено следующей формулой (I-10), и еще более предпочтительно представлено следующей формулой (I-11):
[Формула 14]
в которых
R96 обозначает тот же самый заместитель как R3, и предпочтительный диапазон R96 также является тем же самым как для R3,
R97 обозначает тот же самый заместитель как R3, и предпочтительный диапазон R97 также является тем же самым как для R3,
R102 обозначает тот же самый заместитель как R3, и предпочтительный диапазон R102 также является тем же самым как для R3,
X11 обозначает тот же самый заместитель как X9, и предпочтительный диапазон X11 также является тем же самым как для X9,
X12 обозначает тот же самый заместитель как X10, и предпочтительный диапазон X12 также является тем же самым как для X10,
X13 обозначает тот же самый заместитель как X9, и предпочтительный диапазон X13 также является тем же самым как для X9,
X14 обозначает тот же самый заместитель как X10, и предпочтительный диапазон X14 также является тем же самым как для X10,
X15 обозначает тот же самый заместитель как X9, и предпочтительный диапазон X15 также является тем же самым как для X9, и
X16 обозначает тот же самый заместитель как X10, и предпочтительный диапазон X16 также является тем же самым как для X10.
Следует отметить, что, в вышеописанных формулах, R96, R97 и R102 каждый обозначает более предпочтительно пиридильную группу, в случае необходимости имеющую по меньшей мере один заместитель, еще более предпочтительно пиридильную группу, представленную вышеописанной формулой (VIII-1) или (VIII-2), и еще более предпочтительно пиридильную группу, представленную следующей формулой (VIII-1). Предпочтительные диапазоны пиридильных групп, представленных формулой (VIII-1) и (VIII-2), являются теми же самыми как описанные выше.
Предпочтительные примеры соединения, представленного формулой [1], согласно настоящему изобретению включают следующие соединения:
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-фенилпиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(3-метилфениламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(4-(морфолин-4-ил)фениламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(3,4,5-триметоксифениламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-метоксипиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(2,6-диметоксипиридин-4-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-(морфолин-4-ил)пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(6-(морфолин-4-ил)пиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(пиримидин-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1,5-нафтиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1,6-нафтиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1,6-нафтиридин-8-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(8-нитрохинолин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1H-пирроло[2,3-c]пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-(2-(пирролидин-1-ил)этил)-1H-пирроло[2,3-c]пиридин-4-иламино)никотинамид;
2-(8-ацетиламинохинолин-3-иламино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-(анилинокарбонил)пиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1H-пирроло[2,3-b]пиридин-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1H-пирроло[2,3-b]пиридин-4-иламино)никотинамид;
Метил-5-(3-аминокарбонил-6-(цис-2-аминоциклогексиламино)-5-фторпиридин-2-иламино)никотинат;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(6-метилпиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-метилпиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-(2-(пирролидин-1-ил)этил)-1H-пирроло[2,3-b]пиридин-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-(2-(пирролидин-1-ил)этил)-1H-пирроло[2,3-b]пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-(2-(морфолин-4-ил)этил)-1H-пирроло[2,3-b]пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-([1,3]тиазоло[4,5-b]пиридин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(1-(2-(диэтиламино)этил)-1H-пирроло[2,3-b]пиридин-4-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-(2-метоксиэтил)-1H-пирроло[2,3-b]пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-изобутил-1H-пирроло[2,3-b]пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(1-циклопропил-1H-пирроло[2,3-b]пиридин-4-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-(1-(циклопропилметил)-1H-пирроло[2,3-b]пиридин-4-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-(2H-1,2,3-триазол-2-ил)пиридин-3-иламино)-никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-(1H-пиррол-2-ил)пиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-(2-тиенил)пиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(5-циклопропилпиридин-3-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-(2-фурил)пиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(8-аминохинолин-3-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1H-пирроло[2,3-b]пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1H-пирроло[2,3-b]пиридин-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1H-пирроло[2,3-c]пиридин-4-иламино)никотинамид;
2-(8-(аминокарбонил)аминохинолин-3-иламино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
6-(2-аминоэтиламино)-5-фтор-2-(пиридин-4-иламино)никотинамид;
6-(2-аминоэтиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(2,1,3-бензотиадиазол-5-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-(1,3-бензотиазол-6-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1H-индазол-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-метил-1,3-бензоксазол-6-иламино)никотинамид;
6-(2-аминоэтиламино)-2-(1,3-бензотиазол-6-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-метил-1,3-бензоксазол-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-метилпиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(1,3-диметил-1H-пиразоло[3,4-b]пиридин-5-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-(2,3-дигидро-1,4-бензодиоксин-6-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(3-(2H-1,2,3-триазол-2-ил)фениламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(6-метоксихинолин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хинолин-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хиноксалин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(1,3-бензотиазол-5-иламино)-5-фторникотинамид;
6-(2-аминоэтиламино)-5-фтор-2-(изохинолин-4-иламино)никотинамид;
6-(2-аминоэтиламино)-5-фтор-2-(хинолин-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1H-индазол-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1H-бензоимидазол-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хиназолин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хиназолин-7-иламино)никотинамид;
цис-6-(2-аминоциклогексиламино)-5-фтор-2-(1-метил-1H-бензоимидазол-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-метилхинолин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хинолин-7-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1H-индазол-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-метилхиноксалин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-(2-(пирролидин-1-ил)этил)-1H-индазол-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-(2-(пирролидин-1-ил)этил)-2H-индазол-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1H-индазол-5-иламино)никотинамид;
6-(2-аминоэтиламино)-2-(3,5-диметоксифениламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хинолин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(3-хлорфениламино)-5-фторникотинамид;
6-(2-аминоэтиламино)-5-фтор-2-(хинолин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(изохинолин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1,8-нафтиридин-3-иламино)никотинамид;
5-фтор-6-(2-(1H-имидазол-5-ил)этиламино)-2-(хинолин-3-иламино)никотинамид;
6-((1R)-2-амино-2-оксо-1-фенилэтиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2R)-1-амино-4-метил-1-оксопентан-2-иламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2R)-1-амино-1-оксобутан-2-иламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2S)-2-аминобутиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2S)-2-амино-3-метилбутиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2S)-2-амино-2-фенилэтиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2R)-2-амино-3-метоксипропиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2S)-2-аминопропиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2S)-2-амино-4-метилпентиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-(3-аминопропиламино)-2-(3,5-диметоксифениламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-(3,5-диметоксифениламино)-5-фторникотинамид;
6-((1R,2S)-2-аминоциклогексиламино)-2-(3,5-диметоксифениламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-хлор-2-(хинолин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-бром-2-(хинолин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-хлор-2-(3-метоксифениламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-хлор-2-(5-метилпиридин-3-иламино)никотинамид и
6-(цис-2-аминоциклогексиламино)-5-бром-2-(5-метилпиридин-3-иламино)никотинамид.
Соединение, представленное формулой [1], согласно настоящему изобретению, предпочтительно обозначает соединение, имеющее Syk-ингибирующую активность IC50, которая составляет 50 нМ или менее, и также имеющее IC50 в тесте генерации TNFα, которая составляет 130 нМ или менее. Более частные примеры такого соединения включают соединения из Таблицы 21, показывающей результаты теста, выполненного согласно способу тестирования, описанному в “тесте фермента Syk” в Примере тестирования 1, представленном ниже, где Syk-ингибирующая активность IC50 составляет 50 нМ или менее (то есть, соответствует оценочным стандартам A и B), и в Таблице 22, показывающей результаты теста, выполненного согласно способу тестирования, описанному в “тесте генерации TNFα” в Примере тестирования 2, приведенном ниже, где IC50 составляет 130 нМ или менее (то есть, соответствует оценочным стандартам A и B).
Предпочтительные примеры соединения, представленного формулой [1], согласно настоящему изобретению включают следующие соединения.
Пример 4-17: 6-(цис-2-аминоциклогексиламино)-5-фтор-2-(6-метилпиридин-3-иламино)никотинамид;
Пример 4-228: 6-((цис-2-аминоциклогексил)амино)-2-((5-циано-6-морфолинопиридин-3-ил)амино)-5-фторникотинамид;
Пример 6-49: 6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-метилпиридин-3-иламино)никотинамид;
Пример 6-117: (R)-6-((1-амино-4-метилпентан-2-ил)амино)-5-фтор-2-((хинолин-6-ил)амино)никотинамид;
Пример 6-157: (R)-6-((1-амино-4-метилпентан-2-ил)амино)-5-фтор-2-((2-(2-метоксиэтокси)пиридин-4-ил)амино)никотинамид;
Пример 6-165: 6-((1R,2S)-2-аминоциклогексиламино)-5-фтор-2-((6-морфолинопиридин-3-ил)амино)никотинамид;
Пример 6-168: 2-((5-(1H-пиразол-1-ил)пиридин-3-ил)амино)-6-((1R,2S)-2-аминоциклогексиламино)-5-фторникотинамид;
Пример 6-177: (R)-6-((1-амино-4-метилпентан-2-ил)амино)-2-((5,6-диметилпиридин-3-ил)амино)-5-фторникотинамид;
Пример 6-211: 6-(((2S,3R)-2-аминопентан-3-ил)амино)-2-((1-этил-1H-индазол-5-ил)амино)-5-фторникотинамид;
Пример 6-249: 6-(((2S,3R)-2-аминогексан-3-ил)амино)-5-фтор-2-((2-метоксипиридин-4-ил)амино)никотинамид;
Пример 6-257: 6-(((2S,3R)-2-аминопентан-3-ил)амино)-5-фтор-2-((5-(2-фторфенил)пиридин-3-ил)амино)никотинамид;
Пример 6-263: 6-(((2S,3R)-2-аминопентан-3-ил)амино)-5-фтор-2-((1-метоксиизохинолин-6-ил)амино)никотинамид;
Пример 6-268: 6-(((2S,3R)-2-аминопентан-3-ил)амино)-5-фтор-2-((1-метил-1H-индазол-4-ил)амино)никотинамид;
Пример 6-296: 6-(((2S,3R)-2-аминогексан-3-ил)амино)-2-((5,6-диметилпиридин-3-ил)амино)-5-фторникотинамид;
Пример 6-301: 6-(((2S,3R)-2-аминогексан-3-ил)амино)-5-фтор-2-((5-фторпиридин-3-ил)амино)никотинамид;
Пример 6-311: 6-(((2S,3R)-2-аминогексан-3-ил)амино)-5-фтор-2-((2-пропоксипиридин-4-ил)амино)никотинамид;
Пример 6-322: (R)-6-((1-амино-4-метилпентан-2-ил)амино)-2-((1-этил-1H-индазол-5-ил)амино)-5-фторникотинамид;
Пример 6-342: 6-(((2R,3S)-3-амино-1-циклопропилбутан-2-ил)амино)-2-((1-этил-1H-индазол-5-ил)амино)-5-фторникотинамид;
Пример 6-368: 6-(((1R,2S)-2-амино-1-циклопропилпропил)амино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
Пример 6-375: 6-(((1R,2S)-2-аминоциклогексил)амино)-5-фтор-2-((6-метил-5-(2H-1,2,3-триазол-2-ил)пиридин-3-ил)амино)никотинамид;
Пример 6-377: 6-(((1R,2S)-2-аминоциклогексил)амино)-5-фтор-2-((6-метокси-5-(2H-1,2,3-триазол-2-ил)пиридин-3-ил)амино)никотинамид;
Пример 6-383: 6-(((2S,3R)-2-амино-5-метилгексан-3-ил)амино)-5-фтор-2-((1-метил-1H-индазол-5-ил)амино)никотинамид;
Пример 6-384: 6-(((2S,3R)-2-амино-5-метилгексан-3-ил)амино)-2-((1-этил-1H-индазол-5-ил)амино)-5-фторникотинамид;
Пример 6-395: 6-(((1R,2S)-2-аминоциклогексил)амино)-5-фтор-2-((5-фтор-6-морфолинопиридин-3-ил)амино)никотинамид;
Пример 6-433: 6-(((1R,2S)-2-аминоциклогексил)амино)-2-((2-этокси-3-фторпиридин-4-ил)амино)-5-фторникотинамид;
Пример 6-435: 6-(((2R,3S)-3-амино-1-циклопропилбутан-2-ил)амино)-2-((5,6-диметилпиридин-3-ил)амино)-5-фторникотинамид;
Пример 6-468: 6-(((2S,3S)-3-амино-1-метоксибутан-2-ил)амино)-5-фтор-2-(хинолин-6-иламино)никотинамид и
Пример 8-1: 6-(2-аминоэтиламино)-2-(3,5-диметоксифениламино)-5-фторникотинамид.
Фармацевтическая композиция согласно настоящему изобретению характеризуется тем, что она включает вышеописанное производное никотинамида согласно настоящему изобретению или его соль. Фармацевтическая композиция согласно настоящему изобретению может предпочтительно использоваться как фармацевтическая композиция для лечения Syk-связанного заболевания.
Примером Syk-связанного заболевания является заболевание, выбранное из группы, состоящей из ревматизма и идиопатической тромбоцитопенической пурпуры. Фармацевтическая композиция согласно настоящему изобретению может предпочтительно использоваться как фармацевтическая композиция для лечения этих заболеваний.
Когда изомеры (например, оптические изомеры, геометрические изомеры, таутомеры и т.д.) присутствуют в соединении, представленном формулой [1], или его соли, настоящее изобретение включает эти изомеры. Кроме того, настоящее изобретение также включает сольваты, гидраты и различные формы кристаллов.
Затем будет описан способ получения соединения согласно настоящему изобретению.
Соединение согласно настоящему изобретению может быть получено комбинацией известных способов. Например, соединение по изобретению может быть получено согласно способам получения, как описано ниже.
[Способ получения 1]
[Формула 15]
в которой R2a обозначает C1-12 алкил, C2-12 алкенил, C2-12 алкинил, C3-8 циклоалкил, арил, ар-C1-6 алкил или гетероциклическую группу, имеющие по меньшей мере одну аминогруппу, защищенную аминозащитной группой; Ra обозначает амино защитную группу; и R1, R2, R3, R4 и R5 имеют те же самые значения, как описанные выше.
Соединение формулы [1] может быть получено удалением защитной группы из соединения формулы [2] в присутствии кислоты. Эта реакция может быть осуществлена, например, способом, описанным в W. Greene et al., Protective Groups in Organic Synthesis, 4th edition, pp. 696 to 926, 2007, John Wiley & Sons, INC.
Примеры кислоты, используемой в этой реакции, включают: неорганические кислоты, такие как соляная кислота, серная кислота, фосфорная кислота, хлорид водорода и бромид водорода; органические карбоновые кислоты, такие как уксусная кислота, трихлоруксусная кислота и трифторуксусная кислота; и органические сульфоновые кислоты, такие как метансульфоновая кислота и п-толуолсульфоновая кислота.
Кислота может использоваться в молярной концентрации 1× или больше, и предпочтительно 1×-5× по сравнению с количеством соединения формулы [2]. Кроме того, кислота может использоваться в качестве растворителя.
Эта реакция может быть осуществлена в совместном присутствии растворителя, по мере необходимости. Используемый растворитель особенно не ограничен, при условии, что он не воздействует на реакцию. Примеры такого растворителя включают алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, простые эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Эти растворители могут использоваться в комбинации.
Предпочтительно использовать в качестве растворителя кислоту или водный раствор кислоты.
Эта реакция может быть осуществлена при температуре от 0°C до точки кипения растворителя, и предпочтительно от 10°C до 40°C, в течение от 1 минуты до 24 часов.
[Способ получения 2]
[Формула 16]
в которой R1, R2, R3, R4 и R5 имеют те же самые значения, как описанные выше.
Соединение формулы [1] может быть получено путем осуществления реакции соединения формулы [3] с аммиаком или солями аммония в присутствии конденсирующего агента и в присутствии основания.
Растворитель, используемый в этой реакции, особенно не ограничен, при условии, что он не воздействует на реакцию. Примеры такого растворителя включают алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, простые эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются амиды.
Примеры конденсирующего агента, используемого в этой реакции, включают: карбодиимиды, такие как N,N'-дициклогексилкарбодиимид и N-этил-N'-(3-диметиламинопропил)карбодиимид; карбонилы, такие как карбонилдиимидазол; азиды кислоты, такие как дифенилфосфорил азид; цианиды кислоты, такие как диэтилфосфорил цианид; 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин; O-бензотриазол-1-ил-1,1,3,3-тетраметилуроний гексафторфосфат; и O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат.
Примеры основания, используемого в этой реакции, включают: алкоксиды металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия и трет-бутоксид натрия; неорганические основания, такие как гидроксид натрия, гидроксид калия, гидрокарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия и гидрид калия; и органические основания, такие как триэтиламин, диизопропилэтиламин и пиридин.
Примеры солей аммония включают хлорид аммония, бромид аммония и ацетат аммония.
Аммиак или соли аммония могут использоваться в молярной концентрации от 1× до 100×, и предпочтительно от 1× до 10× по сравнению с концентрацией соединения формулы [3].
Конденсирующий агент и основание могут, каждый, использоваться в молярной концентрации 1× или больше, и предпочтительно от 1× до 5× по сравнению с концентрацией соединения формулы [3].
Эта реакция может быть осуществлена в присутствии промотора реакции.
Примеры такого промотора реакции включают 1-гидроксибензотриазол и N-гидроксисукцинимид.
Промотор реакции может использоваться в молярной концентрации 1х или больше, и предпочтительно от 1× до 5× по сравнению с концентрацией соединения формулы [3].
Эта реакция может быть осуществлена при температуре от -20°C до 150°C, и предпочтительно от 0°C до 100°C, в течение от 1 минуты до 24 часов.
[Способ получения 3]
[Формула 17]
в которой R1, R2, R3, R4 и R5 имеют те же самые значения, как описанные выше.
Соединение формулы [1] может быть получено гидролизом соединения формулы [4] в присутствии основания и в присутствии раствора пероксида водорода.
Растворитель, используемый в этой реакции, особенно не ограничен, при условии, что он не воздействует на реакцию. Примеры такого растворителя включают алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, простые эфиры, кетоны, сложные эфиры, амиды, сульфоксиды, ароматические углеводороды и воду. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются спирты и вода.
Примеры основания, используемого в этой реакции, включают: алкоксиды металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия и трет-бутоксид натрия; неорганические основания, такие как гидроксид натрия, гидроксид калия, гидрокарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия и гидрид калия; и органические основания, такие как триэтиламин, диизопропилэтиламин и пиридин.
Основание может использоваться в молярной концентрации 1× или больше, и предпочтительно от 1× до 5×, по сравнению с концентрацией соединения формулы [4].
Пероксид водорода может использоваться в молярной концентрации 1× или больше, и предпочтительно от 1× до 10×, по сравнению с концентрацией соединения формулы [4].
Эта реакция может быть осуществлена при температуре от 0°C до точки кипения растворителя, и предпочтительно от 10°C до 40°C, в течение от 1 минуты до 24 часов.
[Способ получения 4]
[Формула 18]
в которой L1 обозначает бензотриазол-1-илоксигруппу или сукцинимидо-1-илоксигруппу; и R1, R2, R3, R4 и R5 имеют те же самые значения, как описанные выше.
Соединение формулы [1] может быть получено путем реакции соединения формулы [5] с соединением формулы [6] в присутствии основания.
Например, триптофан известен как соединение формулы [6].
Растворитель, используемый в этой реакции, особенно не ограничен, при условии, что он не воздействует на реакцию. N-метилморфолин является предпочтительным.
Примеры основания, используемого в этой реакции, включают: неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, и трикалий фосфат; и органические основания, такие как пиридин, 4-(диметиламино)пиридин, триэтиламин и диизопропилэтиламин.
Основание может использоваться в молярной концентрации от 1× до 50×, и предпочтительно от 1× до 5×, по сравнению с концентрацией соединения формулы [5].
Соединение формулы [6] может использоваться в молярной концентрации от 1× до 50×, и предпочтительно от 1× до 2×, по сравнению с концентрацией соединения формулы [5].
Эта реакция может быть осуществлена при температуре от 0°C до точки кипения растворителя, и предпочтительно от 0°C до 150°C, в течение от 1 минуты до 24 часов.
Затем будет описан способ получения соединений, представленных формулами [2], [3], [4] и [5], которые используются в качестве сырого продукта в получении соединения согласно настоящему изобретению.
[Способ получения A1]
[Формула 19]
в которой La обозначает уходящую группу; и R1, R2a, R3, R4, R5 и Ra имеют те же самые значения, как описанные выше.
Соединение формулы [2] может быть получено путем реакции соединения формулы [Aa] с соединением формулы [Ab] в наличии или отсутствии основания, в присутствии катализатора на основе палладия и в присутствии или в отсутствие лиганда.
Соединение формулы [Aa] может быть получено, например, Способом получения A2 как описано позже.
Например, 6-аминохинолин известен как соединение формулы [Ab].
Растворитель, используемый в этой реакции, особенно не ограничен, при условии, что он не воздействует на реакцию. Примеры растворителя включают алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, простые эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются простые эфиры.
Примеры основания, используемого в этой реакции, если желательно, включают: неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия и трикалия фосфат; и органические основания, такие как пиридин, 4-(диметиламино)пиридин, триэтиламин и диизопропилэтиламин.
Основание может использоваться в молярной концентрации от 1× до 50×, и предпочтительно от 1× до 5×, по сравнению с концентрацией соединения формулы [Aa].
Примеры катализатора на основе палладия, используемого в этой реакции, включают: металлический палладий, такой как палладий на углероде и палладиевая чернь; неорганические соли палладия, такие как хлорид палладия; органические соли палладия, такие как ацетат палладия; органический палладиевый комплекс, такой как тетракис(трифенилфосфин)палладий (0), бис(трифенилфосфин)палладий (II) хлорид, 1,1'-бис(дифенилфосфино)ферроцен-палладий (II) хлорид и трис(дибензилиденацетон)дипалладий (0); и сцепленный с полимером органический палладиевый комплекс, такой как бис(ацетат)трифенилфосфин палладий (II) на полимерной подложке и ди(ацетат)дициклогексилфенилфосфин палладий (II) на полимерной подложке. Эти соединения могут использоваться в комбинации.
Катализатор на основе палладия может использоваться в молярной концентрации от 0,00001× до 1×, и предпочтительно от 0,001× до 0,1×, по сравнению с концентрацией соединения формулы [Aa].
Примеры лиганда, используемого в этой реакции, если желательно, включают: триалкилфосфины, такие как триметилфосфин и три-трет-бутилфосфин; трициклоалкилфосфины, такие как трициклогексилфосфин; триарилфосфины, такие как трифенилфосфин и тритолилфосфин; триалкилфосфиты, такие как триметилфосфит, триэтилфосфит и трибутилфосфит; трициклоалкилфосфиты, такие как трициклогексилфосфит; триарилфосфиты, такие как трифенилфосфит; соли имидазолия, такие как 1,3-бис(2,4,6-триметилфенил)имидазолий хлорид; дикетоны, такие как ацетилацетон и октафторацетилацетон; амины, такие как триметиламин, триэтиламин, трипропиламин и триизопропиламин; и 4,5-бис(дифенилфосфино)-9,9-диметил ксантен, 1,1'-бис(дифенилфосфино)ферроцен, 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, 2-дициклогексилфосфино-2',6'-диметоксибифенил, 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил, 2-(ди-трет-бутилфосфино)-2',4',6'-триизопропилбифенил и 2-(ди-трет-бутилфосфино)дифенил. Эти соединения могут использоваться в комбинации.
Лиганд может использоваться в молярной концентрации от 0,00001× до 1×, и предпочтительно от 0,001× до 0,5×, по сравнению с концентрацией соединения формулы [Aa].
Соединение формулы [Ab] может использоваться в молярной концентрации от 1× до 50×, и предпочтительно от 1× до 2×, по сравнению с концентрацией соединения формулы [Aa].
Эта реакция может быть предпочтительно осуществлена в атмосфере инертного газа (например, азота, аргона) при температуре от 40°C до 170°C в течение от 1 минуты до 96 часов.
[Способ получения A2]
[Формула 20]
в которой Rb обозначает защитную группу карбоксильной группы; Lb обозначает уходящую группу; и R1, R2a, R4, Ra и La имеют те же самые значения, как описанные выше.
(А2-1)
Соединение формулы [A2c] может быть получено путем реакции соединения формулы [A2a] с соединением формулы [A2b] в присутствии основания.
Например, 2,6-дихлор-5-фторметилникотинат известен как соединение формулы [A2a].
Например, (2-аминоэтил)трет-бутилкарбамат и (2-аминоциклогексил)трет-бутилкарбамат известны как соединения формулы [A2b].
Растворитель, используемый в этой реакции, особенно не ограничен, при условии, что он не воздействует на реакцию. Примеры растворителя включают алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, простые эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются амиды и простые эфиры.
Примеры основания, используемого в этой реакции, включают: неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия и трикалий фосфат; и органические основания, такие как пиридин, 4-(диметиламино)пиридин, триэтиламин и диизопропилэтиламин.
Основание может использоваться в молярной концентрации от 1× до 50×, и предпочтительно от 1× до 5×, по сравнению с концентрацией соединения формулы [A2a].
Соединение формулы [A2b] может использоваться в молярной концентрации от 1× до 50×, и предпочтительно от 1× до 2×, по сравнению с концентрацией соединения формулы [A2a].
Эта реакция может быть осуществлена при температуре от 0°C до точки кипения растворителя, и предпочтительно от 10°C до 40°C, в течение от 1 минуты до 24 часов.
Соединение формулы [A2c] может также быть получено путем реакции соединения формулы [A2a] с этилендиамином, циклогександиамином или подобным в присутствии основания в соответствии с вышеописанным способом получения с последующей защитой аминогруппы.
Защита аминогруппы может быть осуществлена, например, способом, описанным в W. Greene et al., Protective Groups in Organic Synthesis, 4th edition, pp. 696 to 926, 2007, John Wiley & Sons, INC.
(А2-2)
Соединение формулы [A2d] может быть получено гидролизом соединения формулы [A2c] в присутствии кислоты или основания.
Растворитель, используемый в этой реакции, особенно не ограничен, при условии, что он не воздействует на реакцию. Примеры растворителя включают алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, простые эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются спирты и вода.
Примеры кислоты, используемой в этой реакции, включают неорганические кислоты, такие как соляная кислота, бромистоводородная кислота и серная кислота.
Кислота может использоваться в молярной концентрации от 1× до 1000×, и предпочтительно от 1× до 100×, по сравнению с концентрацией соединения формулы [A2c].
Примеры основания, используемого в этой реакции, включают неорганические основания, такие как гидроксид натрия, гидроксид калия, гидрокарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия и гидрид калия.
Основание может использоваться в молярной концентрации от 1× до 1000×, и предпочтительно от 1× до 10×, по сравнению с концентрацией соединения формулы [A2c].
Эта реакция может быть осуществлена при температуре от 0°C до точки кипения растворителя, и предпочтительно от 0°C до 100°C, в течение от 1 минуты до 24 часов.
(А2-3)
Соединение формулы [Aa] может быть получено путем реакции соединения формулы [A2d] с соединением формулы [A2d] в соответствии со Способом получения 2.
Например, 2-фенил-2-пропанамин известен как соединение формулы [A2e].
[Способ получения B1]
[Формула 21]
в которой Rc обозначает аминозащитную группу; Lc обозначает уходящую группу; и R1, R2a, R3, R4, R5, Ra и La имеют те же самые значения, как описанные выше.
[0161]
(В1-1)
Соединение формулы [Bb] может быть получено путем реакции соединения формулы [Aa] с соединением формулы [Ba] в соответствии со Способом получения A1.
Например, бензиламин известен как соединение формулы [Ba].
(В1-2)
Соединение формулы [Bc] может быть получено удалением защитной группы из соединения формулы [Bb]. Эта реакция может быть осуществлена, например, способом, описанным в W. Greene et al., Protective Groups in Organic Synthesis, 4th edition, pp. 696 to 926, 2007, John Wiley & Sons, INC.
Когда Rc обозначает, например, бензильную группу, 4-метоксибензильную группу или 2,4-диметоксибензильную группу, соединение формулы [Bc] может быть получено восстановлением соединения формулы [Bb] в присутствии металлического катализатора.
Растворитель, используемый в этой реакции, особенно не ограничен, при условии, что он не воздействует на реакцию. Примеры растворителя включают алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, простые эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются спирты и простые эфиры.
Примеры металлического катализатора, используемого в этой реакции, включают: металлический палладий, такой как палладий на углероде и палладиевая чернь; соли палладия, такие как оксид палладия и гидроксид палладия; металлы никеля, такие как никель Ренея; и соли платины, такие как оксид платины.
Металлический катализатор может использоваться в количестве от 0,001× до 5× (вес./вес.), и предпочтительно от 0,01× до 1× (вес./вес.), по сравнению с количеством соединения формулы [Bb].
Примеры восстановителя включают: водород; муравьиная кислота; формиаты, такие как формиат натрия, формиат аммония и формиат триэтиламмония; и циклогексен и циклогексадиен.
Восстановитель может использоваться в молярной концентрации от 2× до 100×, и предпочтительно от 2× до 10×, по сравнению с концентрацией соединения формулы [Bb].
Эта реакция может быть осуществлена при температуре от 0°C до точки кипения растворителя, и предпочтительно от 10°C до 40°C, в течение от 1 минуты до 24 часов.
(В1-3)
Соединение формулы [2] может быть получено путем реакции соединения формулы [Bc] с соединением формулы [Bd] в соответствии со Способом получения A1.
Например, 2-метил-5-хлорпиридин известен как соединение формулы [Bd].
[Способ получения B2]
[Формула 22]
в которой R1a обозначает атом хлора или атом брома; и R2a, R4, R5, Ra, Rb, Rc, La и Lb имеют те же самые значения, как описанные выше.
(В2-1)
Соединение формулы [B2c] может быть получено путем реакции соединения формулы [B2a] с соединением формулы [B2b] в соответствии со Способом получения А2-1.
Например, 2,6-дихлорэтилникотинат известен как соединение формулы [B2a].
Например, бензиламин известен как соединение формулы [B2b].
(В2-2)
Соединение формулы [B2e] может быть получено путем реакции соединения формулы [B2c] с соединением формулы [B2d] в присутствии основания.
Например, (2-аминоэтил)трет-бутилкарбамат и (2-аминоциклогексил)трет-бутилкарбамат известны как соединения формулы [B2d].
Растворитель, используемый в этой реакции, особенно не ограничен, при условии, что он не воздействует на реакцию. N-метилморфолин является предпочтительным.
Примеры основания, используемого в этой реакции, включают: неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия и трикалий фосфат; и органические основания, такие как пиридин, 4-(диметиламино)пиридин, триэтиламин и диизопропилэтиламин.
Основание может использоваться в молярной концентрации от 1× до 50×, и предпочтительно от 1× до 5×, по сравнению с концентрацией соединения формулы [B2c].
Соединение формулы [B2d] может использоваться в молярной концентрации от 1× до 50×, и предпочтительно от 1× до 2×, по сравнению с концентрацией соединения формулы [B2c].
Эта реакция может быть предпочтительно осуществлена при температуре от 100°C до 200°C в течение от 1 минуты до 48 часов.
Соединение формулы [B2e] может также быть получено путем реакции соединения формулы [B2c] с этилендиамином, циклогександиамином или подобным в присутствии основания в соответствии с вышеописанным способом получения с последующей защитой аминогруппы.
Защита аминогруппы может быть осуществлена, например, способом, описанным в W. Greene et al., Protective Groups in Organic Synthesis, 4th edition, pp. 696 to 926, 2007, John Wiley & Sons, INC.
(В2-3)
Соединение формулы [B2f] может быть получено из соединения формулы [B2e] в соответствии со Способами получения A2-2 и A2-3.
(В2-4)
Соединение формулы [B2g] может быть получено удалением защитной группы из соединения формулы [B2f] в соответствии со Способом получения В1-2.
(В2-5)
Соединение формулы [B2h] может быть получено галогенированием соединения формулы [B2g] в присутствии галогенирующего реагента.
Растворитель, используемый в этой реакции, особенно не ограничен, при условии, что он не воздействует на реакцию. Примеры растворителя включают алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, простые эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются амиды.
Примеры галогенирующего реагента, используемого в этой реакции, включают: галогены, такие как хлор и бром; имиды, такие как N-хлорсукцинимид, N-бромсукцинимид, N-хлорфталимид и N-бромфталимид; гидантоины, такие как 1,3-дибром-5,5-диметилгидантоин и 1,3-дихлор-5,5-диметилгидантоин; и сульфурил хлорид.
Предпочтительные галогенирующие реагенты включают имиды.
Галогенирующий реагент может использоваться в молярной концентрации 1× или больше, и предпочтительно от 1× до 3×, по сравнению с концентрацией соединения формулы [B2g].
Эту реакцию предпочтительно осуществляют в присутствии генератора радикалов.
Генератор радикалов особенно не ограничен, при условии, что он является обычно используемым генератором радикалов. Примеры такого генератора радикалов включают: диалкил пероксиды, такие как ди-трет-бутил пероксид, ди-трет-амил пероксид, и ди(2-метил-2-пентил)пероксид; диацил пероксид, такие как бензоил пероксид, дикумил пероксид и дифталоил пероксид; алкил гидропероксиды, такие как трет-бутил гидропероксид и кумил гидропероксид; перкарбоновые кислоты, такие как бензоил гидропероксид, монопероксифталевая кислота, пермуравьиная кислота и перуксусная кислота; пероксосоединения неорганических кислот, такие как надсерная кислота; и органические азосоединения, такие как 2,2'-азобисизобутиронитрил, 2,2'-азобис(2,4-диметилвалеронитрил), 2,2'-азобис(2-метилбутиронитрил), 2,2'-азобисизовалеронитрил, 1,1'-азобис(циклогексанкарбонитрил), 2,2'-азобис(4-метокси-2,4-диметилвалеронитрил), 2,2'-азобис(2-амидинопропан) дигидрохлорид и 2,2'-азобисдиметилизобутират.
Предпочтительные генераторы радикалов включают органические азосоединения. Среди таких органических азосоединений более предпочтительны 2,2'-азобисизобутиронитрил, 2,2'-азобис(2,4-диметилвалеронитрил) и 2,2'-азобис(4-метокси-2,4-диметилвалеронитрил).
Количество используемого генератора радикалов особенно не ограничено. Ггенератор радикалов используется в молярной концентрации 0,01× или больше, и предпочтительно от 0,05× до 1×, по сравнению с концентрацией соединения формулы [B2g].
Эта реакция может быть осуществлена при температуре от 0°C до 200°C, и предпочтительно от 20°C до 100°C, в течение от 1 минуты до 24 часов.
[Способ получения C1]
[Формула 23]
в которой R1, R2a, R3, R4, R5, Rb и La имеют те же самые значения, как описанные выше.
(C1-1)
Соединение формулы [Cc] может быть получено путем реакции соединения формулы [Са] с соединением формулы [Cb] в соответствии со Способом получения А2-1.
Соединение формулы [Са] может быть получено Способом получения C4, как описано позже.
Например, 6-аминохинолин известен как соединение формулы [Cb].
(C1-2)
Соединение формулы [3] может быть получено гидролизом соединения формулы [Cc] в присутствии кислоты или основания в соответствии со Способом получения А2-2.
[Способ получения C2]
[Формула 24]
в которой Rd обозначает C1-6 алкильную группу; Ld обозначает атом хлора или атом брома; М обозначает атом калия или атом натрия; и R1, R2a, R3, R4, R5 и Rb имеют те же самые значения, как описанные выше.
[C2-1]
Соединение формулы [C2c] может быть получено путем реакции соединения формулы [C2a] с соединением формулы [C2b].
Например, 3-амино-3-этоксиметилакрилат известен как соединение формулы [C2a].
Например, 6-аминохинолин известен как соединение формулы [C2b].
Растворитель, используемый в этой реакции, особенно не ограничен, при условии, что он не воздействует на реакцию. Примеры растворителя включают алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, простые эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются амиды.
Соединение формулы [C2b] может использоваться в молярной концентрации 1× или больше, и предпочтительно от 1× до 2×, по сравнению с концентрацией соединения формулы [C2a].
Эта реакция может быть осуществлена при температуре от 0°C до точки кипения растворителя, и предпочтительно от 10°C до 40°C, в течение от 1 минуты до 24 часов.
(C2-2)
Соединение формулы [C2e] может быть получено путем реакции соединения формулы [C2c] с соединением формулы [C2d].
Например, калиевая соль 2-фтор-3-гидроксиметилакрилата известна как соединение формулы [C2d].
Растворитель, используемый в этой реакции, особенно не ограничен, при условии, что он не воздействует на реакцию. Примеры растворителя включают алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, простые эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются спирты.
Соединение формулы [C2d] может использоваться в молярной концентрации 1× или больше, и предпочтительно от 1× до 2×, по сравнению с концентрацией соединения формулы [C2c].
Эта реакция может быть осуществлена при температуре от 0°C до точки кипения растворителя, и предпочтительно от 40°C до 100°C, в течение от 1 минуты до 24 часов.
(C2-3)
Соединение формулы [C2f] может быть получено галогенированием соединения формулы [C2e] в присутствии фосфина и в присутствии галогенирующего реагента.
Растворитель, используемый в этой реакции, особенно не ограничен, при условии, что он не воздействует на реакцию. Примеры растворителя включают алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, простые эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются простые эфиры.
Примеры фосфина, используемого в этой реакции, включают: триалкилфосфины, такие как триметилфосфин и три-трет-бутилфосфин; трициклоалкилфосфины, такие как трициклогексилфосфин; и триарилфосфины, такие как трифенилфосфин и тритолилфосфин.
Предпочтительные фосфины включают триарилфосфины. Среди прочих, трифенилфосфин более предпочтителен.
Фосфин используется в молярной концентрации 1× или больше, и предпочтительно от 1× до 3×, по сравнению с концентрацией соединения формулы [C2e].
Примеры галогенирующего реагента, используемого в этой реакции, включают: галогены, такие как хлор и бром; имиды, такие как N-хлорсукцинимид, N-бромсукцинимид, N-хлорфталимид и N-бромфталимид; гидантоины, такие как 1,3-дибром-5,5-диметилгидантоин и 1,3-дихлор-5,5-диметилгидантоин; и сульфурил хлорид.
Предпочтительные галогенирующие реагенты включают имиды. Среди таких имидов более предпочтительны N-хлорсукцинимид или N-бромсукцинимид.
Галогенирующий реагент может использоваться в молярной концентрации 1× или больше, и предпочтительно от 1× до 5×, по сравнению с концентрацией соединения формулы [C2e].
Эта реакция может быть осуществлена при температуре от 0°C до точки кипения растворителя, и предпочтительно от 60°C до 100°C, в течение от 1 минуты до 24 часов.
(C2-4)
Соединение формулы [Cc] может быть получено путем реакции соединения формулы [C2f] с соединением формулы [C2g] в соответствии со Способом получения А2-1.
[Способ получения C3]
[Формула 25]
в которой R1, R2a, R3, R4, R5, Rb, Rc, La и Lc имеют те же самые значения, как описанные выше.
(C3-1)
Соединение формулы [C3c] может быть получено путем реакции соединения формулы [C3a] с соединением формулы [C3b] в соответствии со Способом получения А2-1.
Соединение формулы [C3a] может быть получено Способом получения C4 как описано позже.
Например, бензиламин известен как соединение формулы [C3b].
(C3-2)
Соединение формулы [C3d] может быть получено удалением защитной группы из соединения формулы [C3c] в соответствии со Способом получения В1-2.
(C3-3)
Соединение формулы [Cc] может быть получено путем реакции соединения формулы [C3d] с соединением формулы [C3e] в соответствии со Способом получения A1.
Например, 2-метил-5-хлорпиридин известен как соединение формулы [C3e].
[Способ получения C4]
[Формула 26]
в которой R1, R2a, R4, Rb, La и Lb имеют те же самые значения, как описанные выше.
Соединение формулы [Са] может быть получено путем реакции соединения формулы [C4a] с соединением формулы [C4b] в соответствии со Способом получения А2-1.
Например, 2,6-дихлор-5-фторметилникотинат известен как соединение формулы [C4a].
Например, (2-аминоэтил)трет-бутилкарбамат и (2-аминоциклогексил)трет-бутилкарбамат известны как соединения формулы [C4b].
[Способ получения D1]
[Формула 27]
в которой R1, R2, R3, R4, R5, Rb и La имеют те же самые значения, как описанные выше.
(D1-1)
Соединение формулы [Db] может быть получено гидролизом соединения формулы [Da] в присутствии кислоты или основания в соответствии со Способом получения А2-2.
Соединение формулы [Da] может быть получено, например, в соответствии со Способом получения C4.
(D1-2)
Соединение формулы [Dc] может быть получено из соединения формулы [Db] в соответствии со Способом получения 2.
(D1-3)
Соединение формулы [Dd] может быть получено путем реакции соединения формулы [Dc] с дегидратирующим агентом в присутствии основания.
Растворитель, используемый в этой реакции, особенно не ограничен, при условии, что он не воздействует на реакцию. Примеры растворителя включают алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, простые эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются галогенированные углеводороды.
Примеры основания, используемого в этой реакции, включают: алкоксиды металлов, такой как метоксид натрия, этоксид натрия, трет-бутоксид калия и трет-бутоксид натрия; неорганические основания, такие как гидроксид натрия, гидроксид калия, гидрокарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия и гидрид калия; и органические основания, такие как триэтиламин, диизопропилэтиламин и пиридин.
Примеры дегидратирующего агента, используемого в этой реакции, включают: ангидриды кислоты, такие как ацетилформилоксид, уксусный ангидрид, трихлоруксусный ангидрид и трифторуксусный ангидрид; смешанные ангидриды органических карбоновых кислот, такие как моноалкиловые эфиры уксусной кислоты с угольной кислотой, такие как этил хлоркарбонат и изобутил хлоркарбонат; смешанные ангидриды органических карбоновых кислот, таких как уксусная кислота, с органическими кислотами, такими как триметилуксусная кислота; хлорангидриды кислоты, такие как ацетил хлорид, хлорангидрид трихлоруксусной кислоты и хлорангидрид трифторуксусной кислоты; и бромангидриды кислоты, такие как ацетил бромид.
Основание и дегидратирующий агент могут, каждый, использоваться в молярной концентрации 1× или больше, и предпочтительно от 1× до 5×, по сравнению с концентрацией соединения формулы [Dc].
Эта реакция может быть осуществлена при температуре от -20°C до 100°C, и предпочтительно от 0°C до 50°C, в течение от 1 минуты до 24 часов.
(D1-4)
Соединение формулы [4] может быть получено путем реакции соединения формулы [Dd] с соединением формулы [De] в соответствии со Способом получения А2-1.
[Способ получения D2]
[Формула 28]
в которой R1, R2, R3, R4, R5, Rb, Rd, М и Ld имеют те же самые значения, как описанные выше.
(D2-1)
Соединение формулы [D2c] может быть получено путем реакции соединения формулы [D2a] с соединением формулы [D2b] в соответствии со Способом получения C2-1.
Например, 2-цианометил-ацетимидат известен как соединение формулы [D2a].
Например, 6-аминохинолин известен как соединение формулы [D2b].
[D2-2]
Соединение формулы [D2e] может быть получено путем реакции соединения формулы [D2c] с соединением формулы [D2d] в соответствии со Способом получения C2-2.
Например, калиевая соль 2-фтор-3-гидроксиметилакрилата известна как соединение формулы [D2d].
(D2-3)
Соединение формулы [D2f] может быть получено галогенированием соединения формулы [D2e] в соответствии со Способом получения C2-3.
(D2-4)
Соединение формулы [4] может быть получено путем реакции соединения формулы [D2f] с соединением формулы [D2g] в соответствии со Способом получения А2-1.
Например, этилендиамин и циклогександиамин известны как соединения формулы [D2g].
[Способ получения D3]
[Формула 29]
в которой Re обозначает аминозащитную группу; Le обозначает C1-6 алкилсульфонилоксигруппу или арилсульфонилоксигруппу; и R1, R3, R5, R10, R11, R12, R13 и Ld имеют те же самые значения, как описанные выше.
(D3-1)
Соединение формулы [D3b] может быть получено путем реакции соединения формулы [D3a] с сульфонилхлоридом.
Например, (1-гидроксипропан-2-ил)трет-бутилкарбамат известен как соединение формулы [D3a].
Растворитель, используемый в этой реакции, особенно не ограничен, при условии, что он не воздействует на реакцию. Примеры растворителя включают алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, простые эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются простые эфиры.
Примеры сульфонилхлорида, используемого в этой реакции, включают метилсульфонил хлорид, этилсульфонил хлорид, пропилсульфонил хлорид, бензолсульфонил хлорид, п-толуолсульфонил хлорид и нафталинсульфонил хлорид.
Предпочтительные сульфонил хлориды включают метилсульфонил хлорид и п-толуолсульфонил хлорид. Метилсульфонил хлорид является более предпочтительным.
Сульфонил хлорид используется в молярной концентрации 1× или больше, и предпочтительно от 1× до 3×, по сравнению с концентрацией соединения формулы [D3a].
Примеры основания, используемого в этой реакции, если желательно, включают: неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия и трикалий фосфат; и органические основания, такие как пиридин, 4-(диметиламино)пиридин, триэтиламин и диизопропилэтиламин.
Основание используется в молярной концентрации 1× или больше, и предпочтительно от 1× до 3×, по сравнению с концентрацией соединения формулы [D3a].
Эта реакция может быть осуществлена при температуре от -78°C до точки кипения растворителя, и предпочтительно от 0°C до 80°C, в течение от 1 минуты до 24 часов.
(D3-2)
Соединение формулы [D3c] может быть получено путем реакции соединения формулы [D3b] с соединением фталимида.
Растворитель, используемый в этой реакции, особенно не ограничен, при условии, что он не воздействует на реакцию. Примеры растворителя включают алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, простые эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются амиды.
Примеры соединения фталимида, используемого в этой реакции, включают фталимид натрия и фталимид калия.
Соединение фталимида может также быть получено в реакционной системе с использованием фталимида в качестве сырого соединения.
Предпочтительным соединением фталимида является фталимид калия.
Соединение фталимида используется в молярной концентрации 1× или больше, и предпочтительно от 1× до 3×, по сравнению с концентрацией соединения формулы [D3b].
Эта реакция может быть осуществлена при температуре от 0°C до точки кипения растворителя, и предпочтительно от 0°C до 100°C, в течение от 1 минуты до 24 часов.
(D3-3)
Соединение формулы [D3d] может быть получено удалением защитной группы из соединения формулы [D3c]. Эта реакция может быть осуществлена, например, способом, описанным в W. Greene et al., Protective Groups in Organic Synthesis, 4th edition, pp. 696 to 926, 2007, John Wiley & Sons, INC.
В этой реакции удаление защитной группы предпочтительно осуществляют, используя гидразин.
(D3-4)
Соединение формулы [4a] может быть получено путем реакции соединения формулы [D3d] с соединением формулы [D3e] в соответствии со Способом получения А2-1.
[Способ получения D4]
[Формула 30]
в которой R1, R3, R5, R10, R11, R12, R13, Re и Ld имеют те же самые значения, как описанные выше.
(D4-1)
Соединение формулы [D4a] может быть получено удалением защитной группы из соединения формулы [D3c] в соответствии со Способом получения В1-2.
(D4-2)
Соединение формулы [4b] может быть получено путем реакции соединения формулы [D4a] с соединением формулы [D3e] в соответствии со Способом получения А2-1.
[Способ получения D5]
[Формула 31]
в которой R1, R2a, R3, R4, R5, La и Lb имеют те же самые значения, как описанные выше.
(D5-1)
Соединение формулы [D5c] может быть получено путем реакции соединения формулы [D5a] с соединением формулы [D5b] в соответствии со Способом получения А2-1.
Например, 2,6-дихлор-3-циано-5-фторпиридин известен как соединение формулы [D5a].
Например, ((1R,2S)-1-циклопропил-1-гидроксипропан-2-ил)трет-бутилкарбамат известен как соединение формулы [D5b].
(D5-2)
Соединение формулы [4c] может быть получено путем реакции соединения формулы [D5c] с соединением формулы [D5d] в соответствии со Способом получения А2-1.
[Способ получения E]
[Формула 32]
в которой R1, R3, R5, Rb и L1 имеют те же самые значения, как описанные выше.
(Е-1)
Соединение формулы [Еа] может быть получено, например, в соответствии со Способом получения C2-2.
(Е-2)
Соединение формулы [Eb] может быть получено гидролизом соединения формулы [Еа] в присутствии кислоты или основания в соответствии со Способом получения А2-2.
(Е-3)
Соединение формулы [5] может быть получено путем реакции соединения формулы [Eb] с аммиаком или солями аммония в присутствии промотора реакции и в присутствии конденсирующего агента.
Растворитель, используемый в этой реакции, особенно не ограничен, при условии, что он не воздействует на реакцию. Примеры растворителя включают алифатические углеводороды, галогенированные углеводороды, спирты, гликоли, простые эфиры, кетоны, сложные эфиры, амиды, нитрилы, сульфоксиды, ароматические углеводороды и воду. Эти растворители могут использоваться в комбинации.
Предпочтительными растворителями являются амиды.
Примеры конденсирующего агента, используемого в этой реакции, включают: карбодиимиды, такие как N,N'-дициклогексилкарбодиимид и N-этил-N'-(3-диметиламинопропил)карбодиимид; карбонилы, такие как карбонилдиимидазол; азиды кислоты, такие как дифенилфосфорил азид; цианиды кислоты, такие как диэтилфосфорил цианид; 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин; O-бензотриазол-1-ил-1,1,3,3-тетраметилуроний гексафторфосфат; и O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат.
Примеры основания, используемого в этой реакции, включают: алкоксиды металлов, такие как метоксид натрия, этоксид натрия, трет-бутоксид калия и трет-бутоксид натрия; неорганические основания, такие как гидроксид натрия, гидроксид калия, гидрокарбонат натрия, карбонат натрия, карбонат калия, гидрид натрия и гидрид калия; и органические основания, такие как триэтиламин, диизопропилэтиламин и пиридин.
Примеры солей аммония включают хлорид аммония, бромид аммония и ацетат аммония.
Аммиак или соли аммония могут использоваться в молярной концентрации от 1× до 100×, и предпочтительно от 1× до 10×, по сравнению с концентрацией соединения формулы [Eb].
Примеры промотора реакции, используемого в этой реакции, включают 1-гидроксибензотриазол и N-гидроксисукцинимид.
Конденсирующий агент, основание и промотор реакции могут, каждый, использоваться в молярной концентрации 1× или больше, и предпочтительно от 1× до 5×, по сравнению с концентрацией соединения формулы [Eb].
Эта реакция может быть осуществлена при температуре от -20°C до 150°C, и предпочтительно от 0°C до 100°C, в течение от 1 минуты до 24 часов.
Соединения, полученные вышеописанными способами получения, могут быть превращены в другие соединения путем введения их в известные реакции, такие как конденсация, присоединение, окисление, восстановление, смещение, замещение, галогенирование, дегидратация или гидролиз, или комбинации этих реакций, если необходимо.
Когда амино, гидроксильная и/или карбоксильная группы присутствуют в соединениях, полученных вышеописанными способами получения, и их промежуточных соединениях, реакции могут быть осуществлены с заменой их защитных групп другими группами, если необходимо. Кроме того, когда присутствуют две или больше защитных групп, такие защитные группы могут быть селективно удалены известными реакциями.
Среди соединений, используемых в вышеописанных способах получения, соединения, которые могут быть в форме солей, могут использоваться в форме солей. Примеры таких солей являются теми же самыми, как примеры соли соединения, представленного формулой [1].
Когда изомеры (например, оптические изомеры, геометрические изомеры, таутомеры и т.д.) присутствуют в соединениях, используемых в вышеописанных способах получения, эти изомеры могут также использоваться. Кроме того, когда присутствуют сольваты, гидраты и различные формы кристаллов, эти сольваты, гидраты и различные формы кристаллов могут также использоваться.
Когда соединение, представленное формулой [1], согласно настоящему изобретению используется как лекарственное средство, фармацевтические добавки, обычно используемые в составе такого лекарственного средства, такие как эксципиент, носитель и разбавитель, могут быть примешаны к соединению согласно настоящему изобретению, если необходимо. Таким образом составленное лекарственное средство может перорально или парентерально вводиться в форме таблетки, капсулы, порошкового лекарственного средства, сиропа, гранулы, пилюли, суспендирующего агента, эмульсии, жидкого средства, порошкообразного средства, суппозитория, глазных капель, носовых капель, ушных капель, пластыря, мази или инъекции, согласно обычным способам. Способ введения, дозировка и число введений могут быть выбраны в зависимости от возраста, массы тела и симптомов пациента. В общем, лекарственное средство согласно настоящему изобретению может вводиться перорально или парентерально (например, инъекцией, капельной инфузией или введением в ректальный участок) в дозировке от 0,01 до 1000 мг/кг взрослому в сутки, однократно или разделенное на несколько раз.
Далее, пригодность репрезентативных соединений согласно настоящему изобретению будет описана в следующих Примерах тестирования.
Пример тестирования 1: Тест фермента Syk
(GST)-слитый полноразмерный человеческий белок Syk глутатион-S-трансферазы, полученный с использованием бакуловирусной системы экспрессии, использовали в тесте фермента Syk.
15 мкл реакционного раствора (1,2 нг Syk, 20 мМ HEPES, 10 мМ MgCl2, 50 мМ NaCl, 2 мМ DTT, 0,05% BSA, pH 7,0), содержащего белок Syk и предварительно определенную концентрацию тестируемого соединения, взбалтывали в течение 2 минут и затем оставляли в покое при комнатной температуре в течение 13 минут. После этого 5 мкл Биотин-EDPDYEWPSA-NH2 (конечная концентрация: 0,4 мкМ), служащего в качестве пептида субстрата, и 5 мкл АТФ (конечная концентрация: 27 мМ) к реакционному раствору добавляли, и полученную смесь затем взбалтывали в течение 2 минут. Реакционный раствор затем оставляли в покое при комнатной температуре в течение 40 минут, чтобы осуществить ферментативную реакцию.
После этого 50 мкл раствора для завершения реакции [5 мкл/мл Стрептавидина, 0,18 мкг/мл PT66-K, 30 мМ HEPES (pH 7,0), 150 мМ KF, 75 мМ EDTA, 0,15% BSA, 0,075% Tween20], который содержал Стрептавидин-Xlent (cisbio) и Mab ПТ66-К (cisbio), к реакционному раствору добавляли, чтобы завершить ферментативную реакцию. В то же самое время, реакционный раствор оставляли в покое при комнатной температуре в течение 1 часа, чтобы осуществить реакцию антиген-антитело. После этого, используя EnVision (PerkinElmer), флюоресценцию с временным разрешением измеряли при 615 нм и 665 нм, измеряя таким образом фосфорилирование пептидного субстрата.
В результате было обнаружено, что Syk-ингибирующая активность (IC50) каждого соединения в следующей группе соединений составляет 1 мкМ или меньше. Соединения в группе соединений показали превосходную Syk-ингибирующую активность.
Группа соединений: Пример 1, Примеры 2-1 - 2-7, Пример 2-9, Пример 2-10, Примеры 2-13 - 2-21, Пример 3, Примеры 4-1 - 4-42, Примеры 4-44 - 4-64, Пример 5, Пример 6-2, Примеры 6-6 - 6-11, Пример 6-18, Пример 6-20, Пример 6-21, Пример 6-23, Пример 6-24, Пример 6-26, Пример 6-27, Примеры 6-29 - 6-65, Пример 6-67, Пример 6-68, Примеры 6-70 - 6-88, Пример 7, Пример 8-1, Пример 8-2, Примеры 8-4 - 8-11, Пример 9, Пример 10-1, Пример 10-2, Пример 11, Примеры 12-1 - 12-6, Пример 12-8, Пример 12-9, Примеры 12-12 - 12-21, Пример 12-25, Пример 12-27, Пример 12-28, Примеры 12-31 - 12-34, Пример 13, Примеры 14-1 - 14-10, Пример 15, Пример 16-8, Пример 16-9, Пример 16-17, Пример 16-18, Пример 17, Пример 19, Пример 21, Пример 22-3, Примеры 22-5 - 22-7, Пример 23, Пример 24, Пример 26, Примеры 27-1 - 27-6, Пример 28, Пример 29-1, Примеры 29-3 - 29-8, Пример 29-12, Пример 29-13, Пример 30, Пример 31-3, Пример 31-4, Пример 32, Пример 33-1, Примеры 33-4 - 33-6, Пример 34, и Примеры 35-1 - 35-9.
Пример тестирования 2: тест генерации TNFα
Клетки THP-1 (2×105 клеток/мл), которые были человеческими моноцитоподобными клетками, культивировали в присутствии 10 нг/мл IFN-γ (Roche) в течение 2 дней, так, чтобы индуцировать дифференцировку клеток в макрофагоподобные клетки. Индуцированные дифференцировкой клетки THP-1 рекуперировали, и клеткам (1×106 клеток/мл) затем давали реагировать с предварительно определенной концентрацией тестируемого соединения при комнатной температуре в течение 30 минут. С другой стороны, 100 мкл человеческого IgG (10 мкг/мл, SIGMA-ALDRICH), разбавленного PBS, добавляли к планшету с 96 лунками, и этот планшет затем инкубировали при комнатной температуре в течение ночи. После этого, результант промывали PBS дважды, чтобы получить планшет, покрытый IgG человека. Затем, раствор клеток, который содержал соединение, инокулировали на покрытый человеческим IgG планшет (5×104 клеток/лунка), и этот планшет затем культивировали в течение 7 часов. После этого, культивируемый раствор рекуперировали, и затем количество TNFα, секретированного в культуральный раствор, измеряли способом ELISA (Roche/R & D Systems) или способом AlphaLISA (PerkinElmer).
В результате было обнаружено, что ингибирующая активность (IC50) в отношении генерации TNFα каждого соединения в следующей группе соединений составляет 200 нМ или меньше. Соединения в группе соединений показали превосходную ингибирующую активность в отношении генерации TNFα.
Группа соединений: Пример 1, Пример 2-1, Пример 2-3, Пример 2-5, Пример 2-7, Примеры 2-13 - 2-15, Пример 2-20, Пример 3, Примеры 4-2 - 4-8, Примеры 4-11 - 4-13, Примеры 4-16 - 4-18, Пример 4-22, Пример 4-23, Пример 4-25, Пример 4-26, Пример 4-28, Примеры 4-35 - 4-37, Пример 4-40, Пример 4-42, Примеры 4-53 - 4-55, Примеры 4-58 - 4-62, Пример 4-64, Пример 5, Пример 6-26, Пример 6-34, Пример 6-35, Пример 6-40, Пример 6-43, Пример 6-44, Пример 6-46, Примеры 6-49 - 6-58, Примеры 6-60 - 6-63, Пример 6-65, Пример 6-70, Пример 6-72, Пример 6-75, Пример 6-76, Пример 6-82, Пример 6-83, Пример 6-87, Пример 7, Пример 8-4, Пример 8-6, Пример 8-8, Пример 8-11, Пример 9, Пример 10-1, Пример 10-2, Пример 11, Пример 12-8, Пример 12-9, Пример 12-31, Пример 13, Пример 14-1, Пример 14-2, Пример 14-5, Пример 14-6, Пример 14-9, Пример 14-10, Пример 21, Пример 22-3, Пример 22-5, Пример 34, Примеры 35-1 - 35-4, и Пример 35-7.
Соединение согласно настоящему изобретению показало превосходную Syk-ингибирующую активность и ингибирующую активность в отношении генерации TNFα.
[Примеры]
Настоящее изобретение далее описано в отношении Справочных примеров и Примеров, хотя объем настоящего изобретения ими не ограничен.
Анализ LC/MS проводили в следующих условиях.
LC/MS анализатор: Waters SQD
Колонка: Waters BEHC18 1,73 3 мкм, 2,1×30 мм
Растворитель: Жидкость A: 0,1 % муравьиная кислота-вода
Жидкость B: 0,1 % муравьиная кислота-ацетонитрил
Цикл градиента: 0,00 мин. (Жидкость A/Жидкость B = 95/5), 2,00 мин. (Жидкость A/Жидкость B = 5/95), 3,00 мин. (Жидкость A/Жидкость B = 5/95), 3,01 мин. (Жидкость A/Жидкость B = 100/0), 3,80 мин. (Жидкость A/Жидкость B = 100/0)
Объемная скорость потока: 0,5 мл/мин. (температура колонки равнялась комнатной температуре, и никакую регулировку температуры не осуществляли).
Способ ионизации: Способ ионизации с электрораспылением (были обнаружены положительные и отрицательные ионные пики ESI.)
УФ-детекция: УФ 220 нм
Анализ MS проводили в следующих условиях.
MS анализатор: Hitachi M-8000
Растворитель: Метанол
Способ ионизации: Способ ионизации с электрораспылением (были обнаружены положительные и отрицательные ионные пики ESI.)
Спектры ЯМР представляют собой протонные спектры ЯМР. Спектры ЯМР измеряли, используя JEOL JNM-AL 400 (спектрометр на 400 МГц) или BRUKER AVANCE 300 (спектрометр на 300 МГц), и значение δ выражали в м.д..
Носитель, используемый для хроматографии на колонках с силикагелем, представляет собой PSQ100B (сферической формы) (Fuji Silysia Chemical Ltd.), и стеклянный планшет PLC представляет собой стеклянный планшет PLC с силикагелем 60 F254 (Merck), если не указано иное.
Соединение формулы [1a] представляет собой смесь соединения формулы [1b] и соединения формулы [1c].
[Формула 33]
Аббревиатуры, используемые в Справочных примерах и Примерах обозначают термины, приведенные ниже.
Ac: ацетил
Bn: бензил
Boc: трет-бутоксикарбонил
Bu: бутил
Cbz: бензилоксикарбонил
dba: 1,3-дибензилиденацетон
DMF: N,N-диметилформамид
ДМСО-d6: гексадейтеродиметил сульфоксид
DPPA: дифенилфосфорил азид
Et: этил
HOBt·H2O: 1-гидроксибензотриазол·моногидрат
Ме: метил
Ms: метансульфонил
Ph: фенил
RT, rt: время удерживания
SEM: (2-триметилсилилэтокси)метил
TBDMS: трет-бутилдиметилсилил
Tf: трифторметансульфонил
TFA: трифторуксусная кислота
TIPS: триизопропилсилил
TMS: триметилсилил
Ts: п-толуолсульфонил
WSC·HCl: 1-этил-3-(3-диметиламинопропил)-карбодиимид·гидрохлорид
Xantphos: 4,5-бис(дифенилфосфино)-9,9-диметилксантен
Справочный пример 1
[Формула 34]
Концентрированную серную кислоту (5 мл) добавляли к метанольному раствору (50 мл), содержащему 2,6-дихлор-5-фторникотиновую кислоту (25,0 г), с последующим перемешиванием при температуре от 50°C до 60°C в течение 6 часов и 30 минут. Полученный раствор оставляли в покое при комнатной температуре в течение 15 часов. Добавляли концентрированную серную кислоту (5 мл), с последующим перемешиванием при температуре от 50°C до 60°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, нейтрализовали 2н. водным раствором гидроксида натрия при охлаждении льдом и подщелачивали гидрокарбонатом натрия, после чего добавляли этилацетат. Органический слой собирали, промывали водой и затем насыщенным солевым раствором, и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении, и таким образом получали бесцветное масляное вещество 2,6-дихлор-5-фторметилникотината (22,2 г).
1H-ЯМР (CDCl3, 400 МГц) δ: 8,02 (д, 1H, J=7,3 Гц), 3,98 (с, 3H)
Справочный пример 2
[Формула 35]
1-ая стадия
Карбонат калия (14,8 г), цис-циклогексан-1,2-диамин (12,2 г), и DMF (20 мл) добавляли к раствору, содержащему метил 2,6-дихлор-5-фторникотинат (20,0 г), в DMF (180 мл), с последующим перемешиванием при комнатной температуре в течение 30 минут. К реакционной смеси добавляли воду, насыщенный водный раствор хлорида аммония и этилацетат. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении, и таким образом получали желтое масляное вещество (28,3 г).
2-ая стадия
Ди-трет-бутил бикарбонат (19,5 г) и N,N-диметиламинопиридин (1,10 г) добавляли к раствору, содержащему желтое масляное вещество (28,3 г), полученное на 1-ой стадии, в тетрагидрофуране (200 мл), с последующим перемешиванием при комнатной температуре в течение 30 минут. Растворитель отгоняли при пониженном давлении, и добавляли насыщенный водный раствор хлорида аммония и этилацетат. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. К полученному остатку добавляли гексан/этилацетат (4/1), твердое вещество собирали фильтрацией, и таким образом получали твердое вещество белого цвета 6-(цис-2-(трет-бутоксикарбониламино)-циклогексиламино)-2-хлор-5-фторметилникотинат (15,7 г).
1H ЯМР (CDCl3, 400 МГц) δ: 7,72 (д, 1H, J=10,9 Гц), 5,84 (ушир.с, 1H), 4,89 (ушир.с, 1H), 4,27-4,18 (м, 1H), 4,06-3,99 (м, 1H), 3,87 (с, 3H), 2,03-1,31 (м, 17H)
Справочный пример 3
[Формула 36]
1-ая стадия
К 1н. водному раствору гидроксида натрия (25 мл) добавляли раствор тетрагидрофурана (50 мл) и метанола (50 мл), содержащий метил-6-(цис-2-(трет-бутоксикарбониламино)циклогексиламино)-2-хлор-5-фторникотинат (5,00 г), с последующим перемешиванием при 70°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, растворитель отгоняли при пониженном давлении и добавляли насыщенный водный раствор хлорида аммония и этилацетат. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния, растворитель отгоняли при пониженном давлении, и таким образом получали 6-(цис-2-(трет-бутоксикарбониламино)циклогексиламино)-2-хлор-5-фторникотиновую кислоту.
MS (ESI, m/z): 388 (M+H), 410 (M+Na), 386 (М-Н)
2-ая стадия
Кумиламин (1,97 мл), WSC·HCl (2,62 г) и HOBt·H2O (2,10 г) добавляли к раствору, содержащему 6-(цис-2-(трет-бутоксикарбониламино)циклогексиламино)-2-хлор-5-фторникотиновую кислоту, полученную на 1-ой стадии, в DMF (60 мл) с последующим перемешиванием при комнатной температуре в течение 4 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и этилацетат. Органический слой собирали, промывали насыщенным водным раствором гидрокарбоната натрия и затем насыщенным солевым раствором и высушивали над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли простой диизопропиловый эфир и гексан, твердое вещество собирали фильтрацией, и таким образом получали твердое вещество белого цвета цис-2-(6-хлор-3-фтор-5-(2-фенилпропан-2-иламинокарбонил)-пиридин-2-иламино)циклогексил-трет-бутилкарбамат (4,41 г).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,46 (с, 1H), 7,53 (д, 1H, J=10,4 Гц), 7,45-7,39 (м, 2H), 7,33-7,26 (м, 2H), 7,21-7,15 (м, 1H), 6,71-6,54 (м, 2H), 4,09-3,98 (м, 1H), 3,87-3,77 (м, 1H), 1,84-1,17 (м, 23H)
MS (ESI, m/z): 406 (M-Boc+H)
Справочный пример 4
Следующее соединение получали, как описано в US2009/270405 A1.
[Формула 37]
5-фенилпиридин-3-амин
Справочный пример 5
Следующее соединение получали, как описано в US2003/220345 A1 или Helv. Chim. Acta, 1964, 47, 36.
[Формула 38]
2,6-диметоксипиридин-4-амин
Справочный пример 6
Следующее соединение получали, как описано в WO2006/118256 A1.
[Формула 39]
2-(пирролидин-1-ил)пиридин-4-амин
Справочный пример 7
[Формула 40]
1-ая стадия
1-(2-аминоэтил)пирролидин (237 мкл) добавляли к метанольной суспензии (1 мл), содержащей 2-хлор-5-нитропиридин (100 мг), с последующим перемешиванием при комнатной температуре в течение 3 часов и 30 минут. Добавляли 1-(2-аминоэтил)пирролидин (158 мкл), с последующим перемешиванием в течение 2 часов. К реакционной смеси добавляли воду и этилацетат. Органический слой собирали, промывали 10%-ым солевым раствором и затем насыщенным солевым раствором и высушивали над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли простой диизопропиловый эфир, твердое вещество собирали фильтрацией и промывали простым диизопропиловым эфиром и гексаном, и таким образом получали твердое вещество желтого цвета 5-нитро-N-(2-(пирролидин-1-ил)этил)пиридин-2-амин (27 мг).
MS (ESI, m/z): 237 (M+H), 235 (М-Н)
2-ая стадия
5%-ый Pd/C (8 мг) добавляли к метанольному раствору (2 мл), содержащему 5-нитро-N-(2-(пирролидин-1-ил)этил)пиридин-2-амин (27 мг), с последующим перемешиванием при комнатной температуре в течение 2 часов в атмосфере водорода. Нерастворимое вещество удаляли фильтрацией, и отфильтрованный осадок промывали этилацетатом. Фильтрат смешивали с промывным раствором, растворитель отгоняли при пониженном давлении, и таким образом получали красное масляное вещество N2-(2-(пирролидин-1-ил)этил)пиридин-2,5-диамин (24 мг).
1H-ЯМР (CDCl3, 400 МГц) δ: 7,72-7,66 (м, 1H), 6,99-6,92 (м, 1H), 6,38-6,32 (м, 1H), 4,66 (ушир.с, 1H), 3,36-3,28 (м, 2H), 2,73-2,68 (м, 2H), 2,59-2,50 (м, 4H), 2,03 (ушир.с, 2H), 1,83-1,73 (м, 4H)
MS (ESI, m/z): 207 (M+H)
Справочный пример 8
[Формула 41]
Следующее соединение получали как описано на 1-ой стадии Примера 1.
цис-2-(6-бензиламино-3-фтор-5-(2-фенилпропан-2-иламинокарбонил)пиридин-2-иламино)циклогексил-трет-бутилкарбамат
MS (ESI, m/z): 576 (M+H), 574 (М-Н)
Справочный пример 9
[Формула 42]
Гидроксид палладия (0,29 г) добавляли к раствору тетрагидрофурана (7,2 мл) и метанола (14,3 мл), содержащему цис-2-(6-бензиламино-3-фтор-5-(2-фенилпропан-2-иламинокарбонил)пиридин-2-иламино)циклогексил-трет-бутилкарбамат (1,43 г), с последующим перемешиванием при комнатной температуре в течение 1 часа в атмосфере водорода. Нерастворимое вещество удаляли фильтрацией, и отфильтрованный осадок промывали этилацетатом. Фильтрат смешивали с промывным раствором, и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли простой диизопропиловый эфир и гексан, твердое вещество собирали фильтрацией, и таким образом получали твердое вещество белого цвета цис-2-(6-амино-3-фтор-5-(2-фенилпропан-2-иламинокарбонил)пиридин-2-иламино)циклогексил-трет-бутилкарбамат (870 мг).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 7,90 (д, 1H, J=12,7 Гц), 7,74 (с, 1H), 7,35-7,30 (м, 2H), 7,29-7,22 (м, 2H), 7,17-7,11 (м, 1H), 6,81 (с, 2H), 6,69 (д, 1H, J=7,7 Гц), 6,11 (д, 1H, J=7,8 Гц), 4,13-4,03 (м, 1H), 3,80-3,72 (м, 1H), 1,84-1,20 (м, 23H)
MS (ESI, m/z): 486 (M+H), 484 (M-H)
Справочный пример 10
Следующее соединение получали, как описано в EP1375486.
[Формула 43]
3-бромхинолин-8-амин
Справочный пример 11
Следующее соединение получали, как описано в WO2007/5668.
[Формула 44]
4-бромизоиндолин-1-он
Справочный пример 12
[Формула 45]
Анилин (99 мкл), WSC·HCl (209 мг), и HOBt·H2O (167 мг) добавляли к раствору, содержащему 5-бромникотиновую кислоту (200 мг), в DMF (5 мл) с последующим перемешиванием при комнатной температуре в течение 3 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и этилацетат. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли простой диизопропиловый эфир и гексан, твердое вещество собирали фильтрацией, и таким образом получали твердое вещество белого цвета 5-бром-N-фенилникотинамид (268 мг).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 10,50 (с, 1H), 9,07 (д, 1H, J=2,2 Гц), 8,92 (д, 1H, J=2,0 Гц), 8,55 (дд, 1H, J=2,0, 2,0 Гц), 7,76 (д, 2H, J=7,6 Гц), 7,42-7,35 (м, 2H), 7,14 (т, 1H, J=7,2 Гц)
MS (ESI, m/z): 277, 279 (M+H), 275, 277 (M-H)
Справочный пример 13
[Формула 46]
Гидрид натрия (60 % в масле) (28 мг) добавляли к раствору, содержащему 5-бром-N-метилникотинамид (100 мг), в DMF (2,4 мл) с последующим перемешиванием при 45°C в течение 1 часа. Метил йодид (43 мкл) добавляли при охлаждении льдом с последующим перемешиванием при комнатной температуре в течение 1 часа. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и этилацетат. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. К полученному остатку добавляли гексан, твердое вещество собирали фильтрацией и таким образом получали твердое вещество белого цвета 5-бром-N,N-диметилникотинамид (42 мг).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,78 (д, 1H, J=2,2 Гц), 8,61 (д, 1H, J=1,8 Гц), 8,14 (дд, 1H, J=1,9, 2,2 Гц), 3,00 (с, 3H), 2,92 (с, 3H)
MS (ESI, m/z): 229, 231 (M+H)
Справочный пример 14
Следующее соединение получали, как описано в J. Chem. Soc., 1948, 17, 1389.
[Формула 47]
7-бромпиридо[2,3-b]пиразин
Справочный пример 15
[Формула 48]
1-ая стадия
Диизопропилэтиламин (286 мкл), (2-этилгексил)-3-меркаптопропионат (167 мкл), Pd2(dba)3 (31 мг), и Xantphos (39 мг) добавляли к раствору 1,4-диоксана (3,4 мл), содержащему 2-амино-5-бром-3-йодпиридин (200 мг), с последующим перемешиванием при 95°C в течение 30 минут в атмосфере азота. К реакционной смеси добавляли воду и этилацетат, и нерастворимое вещество удаляли фильтрацией. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат = от 100:0 до 65:35), и таким образом получали желтое масляное вещество (167 мг).
2-ая стадия
20%-ый раствор этилат натрия/этанол (0,5 мл) добавляли к раствору тетрагидрофурана (1 мл), содержащему желтое масляное вещество (167 мг), полученное на 1-ой стадии, с последующим перемешиванием при комнатной температуре в течение 15 минут. К реакционной смеси добавляли муравьиную кислоту (1 мл) и этилортоформиат (2 мл), с последующим перемешиванием в течение 30 минут и затем при 100°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетат. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат = от 10:0 до 2:1), и таким образом получали твердое вещество желтого цвета 6-бром[1,3]тиазоло[4,5-b]пиридин (56 мг).
1H-ЯМР (CDCl3, 400 МГц) δ: 9,28 (с, 1H), 8,84 (д, 1H, J=2,2 Гц), 8,48 (д, 1H, J=2,2 Гц)
MS (ESI, m/z): 215, 217 (M+H)
Справочный пример 16
Следующее соединение получали, как описано в J. Heterocycl. Chem., 1948, 32, 467.
[Формула 49]
6-бром-3-метил-3H-имидазо[4,5-b]пиридин
Справочный пример 17
Следующее соединение получали, как описано в J. Heterocycl. Chem., 1948, 32, 467.
[Формула 50]
6-бром-3-метил-3H-имидазо[4,5-b]пиридин
Справочный пример 18
[Формула 51]
3,5-дибромпиридин (400 мг) и карбонат цезия (550 мг) добавляли к раствору, содержащему 1H-1,2,3-триазол (117 мг), в N-метилпирролидоне (4 мл) с последующим перемешиванием при 100°C в течение 21 часа. Реакционную смесь охлаждали до комнатной температуры и добавляли воду и этилацетат. Органический слой собирали, промывали водой и затем насыщенным солевым раствором и высушивали над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат = от 10:0 до 2:3), и таким образом получали твердое вещество белого цвета 3-бром-5-(2H-1,2,3-триазол-2-ил)пиридин (55 мг) и твердое вещество белого цвета 3-бром-5-(1H-1,2,3-триазол-1-ил)пиридин (48 мг).
3-бром-5-(2H-1,2,3-триазол-2-ил)пиридин
1H ЯМР (DMSO-d6, 400 МГц) δ: 9,24 (д, 1H, J=2,2 Гц), 8,81-8,78 (м, 1H), 8,60 (дд, 1H, J=2,1 Гц, 2,2 Гц), 8,27 (с, 2H)
MS (ESI, m/z): 225, 227 (M+H)
3-бром-5-(1H-1,2,3-триазол-1-ил)пиридин
1H ЯМР (DMSO-d6, 400 МГц) δ: 9,21-9,19 (м, 1H), 8,97 (д, 1H, J=1,2 Гц), 8,86-8,84 (м, 1H), 8,69 (дд, 1H, J=2,1 Гц, 2,2 Гц), 8,06 (д, 1H, J=1,2 Гц)
MS (ESI, m/z): 225, 227 (M+H)
Справочный пример 19
Следующее соединение получали, как описано в US2008/15191.
[Формула 52]
N-(4-хлорпиридин-2-ил) ацетамид
Справочный пример 20
[Формула 53]
Карбонат цезия (275 мг) и пиперидин (83 мкл) добавляли к раствору, содержащему 3,5-дибромпиридин (200 мг), в N-метилпирролидоне (2 мл)с последующим перемешиванием при 80°C в течение 2 часов. Добавляли пиперидин (83 мкл) с последующим перемешиванием при 80°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли насыщенный водный раствор хлорида аммония и хлороформ. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат = от 20:0 до 17:3), и таким образом получали желтое масляное вещество 3-бром-5-(пиперидин-1-ил)пиридин (18 мг).
1H-ЯМР (CDCl3, 400 МГц) δ: 8,20 (д, 1H, J=2,6 Гц), 8,06 (д, 1H, J=1,8 Гц), 7,28 (дд, 1H, J=2,0 Гц, 2,5 Гц), 3,23-3,18 (м, 4H), 1,74-1,57 (м, 6H)
Справочный пример 21
Следующее соединение получали, как описано в US2009/69305 A1 и US2009/181941 A1.
[Формула 54]
1-(5-бромпиридин-3-ил)-4-метилпиперазин
Справочный пример 22
[Формула 55]
Карбонат цезия (165 мг), 1-(трет-бутоксикарбонил)-1H-пиррол-2-илбороновую кислоту (136 мг) и Pd(PPh3)4 (24 мг) добавляли к раствору 1,4-диоксана (4 мл), содержащему 3,5-дибромпиридин (100 мг), с последующим нагреванием с обратным холодильником в течение 4 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, и добавляли воду и этилацетат. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (силикагель: силикагель 60 (сферическая форма) (Kanto Chemical Co., Inc.); гексан:этилацетат = 4:1), и таким образом получали твердое вещество белого цвета трет-бутила 2-(5-бромпиридин-3-ил)-1H-пиррол-1-карбоксилат (73 мг).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,64 (д, 1H, J=2,4 Гц), 8,57 (д, 1H, J=1,9 Гц), 8,14-8,12 (м, 1H), 7,47-7,44 (м, 1H), 6,48-6,45 (м, 1H), 6,36-6,33 (м, 1H), 1,35 (с, 9H)
MS (ESI, m/z): 323 (M+H), 325 (M+H)
Справочный пример 23
Следующее соединение получали как описано в Справочном примере 22.
[Формула 56]
3-бром-5-(2-тиенил)пиридин
1H ЯМР (DMSO-d6, 400 МГц) δ: 8,88 (д, 1H, J=2,0 Гц), 8,62(д, 1H, 2,2 Гц), 8,36 (дд, 1H, J=2,0, 2,2 Гц), 7,76 (дд, 1H, J=1,2, 3,8 Гц), 7,72 (дд, 1H, J=1,2, 5,1 Гц), 7,21 (дд, 1H, J=3,8, 5,1 Гц)
MS (ESI, m/z): 240 (M+H), 242 (M+H)
Справочный пример 24
Следующее соединение получали как описано в Справочном примере 22.
[Формула 57]
3-бром-5-циклопропилпиридин
1H ЯМР (DMSO-d6, 400 МГц) δ: 8,45 (д, 1H, J=2,2 Гц), 8,39 (д, 1H, J=2,0 Гц), 7,70 (дд, 1H, J=2,0, 2,2 Гц), 2,01-1,93 (м, 1H), 1,05-0,99 (м, 2H), 0,84-0,78 (м, 2H)
Справочный пример 25
Следующее соединение получали как описано в Справочном примере 22.
[Формула 58]
3-бром-5-(2,3-дигидро-1,4-бензодиоксин-6-ил)пиридин
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,83 (д, 1H, J=2,0 Гц), 8,63 (д, 1H, J=2,2 Гц), 8,28 (дд, 1H, J=2,0, 2,1 Гц), 7,32 (д, 1H, J=2,2 Гц), 7,26 (дд, 1H, J=2,2, 8,5 Гц), 6,97 (д, 1H, J=8,5 Гц), 4,19 (с, 4H)
MS (ESI, m/z): 292 (M+H), 294 (M+H)
Справочный пример 26
Следующее соединение получали как описано в Справочном примере 22.
[Формула 59]
3-бром-5-(2-фурил)пиридин
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,93 (д, 1H, J=2,0 Гц), 8,61 (д, 1H, J=2,2 Гц), 8,34 (дд, 1H, J=2,0, 2,1 Гц), 7,88 (дд, 1H, J=0,7, 1,8 Гц), 7,26 (дд, 1H, J=0,7, 3,4 Гц), 6,68 (дд, 1H, J=1,8, 3,4 Гц)
MS (ESI, m/z): 224 (M+H), 226 (M+H)
Справочный пример 27
[Формула 60]
1-ая стадия
1н. водный раствор гидроксида натрия (15 мл) добавляли к раствору тетрагидрофурана (30 мл) и метанола (30 мл), содержащему 6-(цис-2-(трет-бутоксикарбониламино)циклогексиламино)-2-хлор-5-фторметилникотинат (3,00 г), с последующим перемешиванием при 65°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, растворитель отгоняли при пониженном давлении и добавляли насыщенный водный раствор хлорида аммония, тетрагидрофуран и этилацетат. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. Таким образом получали бесцветное масляное вещество 6-(цис-2-(трет-бутоксикарбониламино)циклогексиламино)-2-хлор-5-фторникотиновая кислота (3,00 г).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 7,80-7,63 (м, 1H), 6,68 (д, 1H, J=7,7 Гц), 6,44 (ушир.с, 1H), 4,09-3,97 (м, 1H), 3,87-3,75 (м, 1H), 1,87-1,08 (м, 17H)
MS (ESI, m/z): 410, 412 (M+Na), 386, 388 (M-H)
2-ая стадия
Хлорид аммония (1,10 г), WSC•HCl (2,97 г), HOBt•H2O (2,37 г) и диизопропилэтиламин (7,06 мл) добавляли к раствору, содержащему 6-(цис-2-(трет-бутоксикарбониламино)циклогексиламино)-2-хлор-5-фторникотиновую кислоту (2,00 г), в DMF (40 мл) с последующим перемешиванием при комнатной температуре в течение 7 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, воду и этилацетат. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли простой диизопропиловый эфир, твердое вещество собирали фильтрацией, и таким образом получали твердое вещество белого цвета цис-2-(5-аминокарбонил-6-хлор-3-фторпиридин-2-иламино)циклогексил-трет-бутилкарбамат (1,75 г).
1H ЯМР (DMSO-d6, 400 МГц) δ: 7,72-7,61 (м, 1H), 7,56 (д, 1H, J=10,8 Гц), 7,52-7,46 (м, 1H), 6,71-6,59 (м, 2H), 4,08-3,98 (м, 1H), 3,85-3,77 (м, 1H), 1,82-1,14 (м, 17H)
MS (ESI, m/z): 409 (M+Na)
3-я стадия
Хлорангидрид трихлоруксусной кислоты (0,55 мл) добавляли по каплям к суспензии дихлорметана (17 мл), содержащей цис-2-(5-аминокарбонил-6-хлор-3-фторпиридин-2-иламино)циклогексил-трет-бутилкарбамат (1,74 г) и триэтиламин (1,38 мл) при охлаждении льдом, с последующим перемешиванием при комнатной температуре в течение 1 часа. Растворитель отгоняли при пониженном давлении и добавляли насыщенный водный раствор хлорида аммония и этилацетат. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на колонках с силикагелем (гексан:этилацетат = от 10:0 до 3:1), добавляли простой диизопропиловый эфир, твердое вещество собирали фильтрацией, и таким образом получали твердое вещество белого цвета цис-2-(6-хлор-5-циано-3-фторпиридин-2-иламино)циклогексил-трет-бутилкарбамат (1,26 г).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 7,96 (д, 1H, J=10,5 Гц), 7,50 (д, 1H, J=5,8 Гц), 6,68 (д, 1H, J=8,0 Гц), 4,10-4,00 (м, 1H), 3,89-3,81 (м, 1H), 1,80-1,08 (м, 17H)
MS (ESI, m/z): 367 (M-H)
Справочный пример 28
[Формула 61]
Следующие соединения получали как описано в Справочном примере 2.
6-(2-(трет-бутоксикарбониламино)этиламино)-2-хлор-5-фторметилникотинат
1H-ЯМР (DMSO-d6, 400 МГц) δ: 7,98-7,88 (м, 2H), 7,10-7,00 (м, 1H), 3,91 (с, 3H), 3,56-3,48 (м, 2H), 3,32-3,24 (м, 2H), 1,50 (с, 9H)
6-((трет-бутоксикарбонил)(2-(трет-бутоксикарбониламино)этил)амино)-2-хлор-5-фторметилникотинат
1H-ЯМР (CDCl3, 400 МГц) δ: 7,96 (д, 1H, J=9,3 Гц), 5,39-5,29 (ушир., 1H), 3,97-3,90 (м, 5H), 3,41-3,31 (м, 2H), 1,46 (с, 9H), 1,40 (с, 9H)
6-((2-бис(трет-бутоксикарбонил)аминоэтил)(трет-бутоксикарбонил)амино)-2-хлор-5-фторметилникотинат
1H-ЯМР (CDCl3, 400 МГц) δ: 7,93 (д, 1H, J=9,3 Гц), 4,06 (т, 2H, J=6,0 Гц), 3,95 (с, 3H), 3,88 (т, 2H, J=6,0 Гц), 1,47-1,44 (м, 27H)
Справочный пример 29
[Формула 62]
Следующее соединение получали как описано в Справочном примере 27.
2-(6-хлор-5-циано-3-фторпиридин-2-иламино)этил-трет-бутилкарбамат
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,16 (ушир.с, 1H), 7,96 (д, 1H, J=10,6 Гц), 6,91 (т, 1H, J=5,6 Гц), 3,39 (т, 2H, J=6,2 Гц), 3,13 (dt, 2H, J=5,6, 6,2 Гц), 1,36 (с, 9H)
MS (ESI, m/z): 313 (M-H)
Справочный пример 30
[Формула 63]
Следующие соединения получали как описано в Справочном примере 27.
6-((трет-бутоксикарбонил)(2-(трет-бутоксикарбониламино)этил)амино)-2-хлор-5-фторникотиновая кислота
1H-ЯМР (DMSO-d6, 400 МГц) δ: 7,73 (д, 1H, J=8,5 Гц), 6,80-6,73 (м, 1H), 3,65 (т, 2H, J=6,6 Гц), 3,13-3,03 (м, 2H), 1,37 (с, 9H), 1,32 (с, 9H)
2-((5-аминокарбонил-6-хлор-3-фторпиридин-2-ил)(трет-бутоксикарбонил)амино)этил-трет-бутилкарбамат
1H-ЯМР (CDCl3, 400 МГц) δ: 8,02 (д, 1H, J=9,3 Гц), 6,96 (ушир.с, 1H), 6,69 (ушир.с, 1H), 5,33 (ушир.с, 1H), 3,92 (т, 2H, J=5,7 Гц), 3,40-3,32 (м, 2H), 1,45 (с, 9H), 1,40 (с, 9H)
2-((трет-бутоксикарбонил)(5-циано-6-хлор-3-фторпиридин-2-ил)амино)этил-трет-бутилкарбамат
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,65 (д, 1H, J=9,2 Гц), 6,82-6,72 (ушир., 1H), 3,81 (т, 2H, J=5,9 Гц), 3,19-3,10 (м, 2H), 1,41 (с, 9H), 1,30 (с, 9H)
Справочный пример 31
[Формула 64]
Следующее соединение получали как описано на 2-ой стадии Справочного примера 2.
2-((трет-бутоксикарбонил)(5-циано-6-хлор-3-фторпиридин-2-ил)амино)этилимидди-трет-бутилдикарбамат
1H-ЯМР (CDCl3, 400 МГц) δ: 7,64 (д, 1H, J=8,8 Гц), 4,06-4,03 (м, 2H), 3,87-3,83 (м, 2H), 1,45-1,42 (м, 27H)
Справочный пример 32
[Формула 65]
Следующее соединение получали как описано в Справочном примере 27.
2-хлор-6-этиламино-5-фторникотинонитрил
1H-ЯМР (CDCl3, δ: 7,66 (д, 1H, J=8,4 Гц), 3,87 (кв., 1H, J=7,2 Гц), 1,47 (с, 9H), 1,26 (т, 3H, J=7,2 Гц)
Справочный пример 33
Следующее соединение получали, как описано в J. Org. Chem., 2006, 71, 5392.
[Формула 66]
1-(2-(триметилсилил)этоксиметил)-1H-индазол-6-амин
Справочный пример 34
Следующее соединение получали, как описано в WO2009/136995 A2.
[Формула 67]
6-амино-2,2-диметил-2H-пиридо[3,2-b][1,4]оксазин-3(4H)-он
Справочный пример 35
Следующее соединение получали, как описано в J. Org. Chem., 2006, 71, 5392.
[Формула 68]
2-(2-(триметилсилил)этоксиметил)-2H-индазол-6-амин
Справочный пример 36
[Формула 69]
Хлорид аммония (893 мг), воду (3 мл) и порошок железа (939 мг) добавляли к раствору этанола, содержащему 2-метил-5-нитро-1,3-бензоксазол (500 мг), с последующим перемешиванием при 85°C в течение 2 часов и 30 минут. Нерастворимое вещество удаляли фильтрацией, и отфильтрованный осадок промывали водой и этилацетатом. Фильтрат смешивали с промывным раствором и добавляли этилацетат. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на колонках с силикагелем, и таким образом получали светло-коричневое масляное вещество 2-метил-1,3-бензоксазол-5-амин (402 мг).
1H ЯМР (CDCl3, 300 МГц) δ: 7,23 (д, 1H, J=9,0 Гц), 6,93 (д, 1H, J=2,4 Гц), 6,64 (дд, 1H, J=2,4, 9,0 Гц), 2,57 (с, 3H)
Справочный пример 37
[Формула 70]
Триэтиламин (765 мкл), трет-бутиловый спирт (10 мл) и DPPA (1,18 мл) добавляли к раствору 1,4-диоксана (20 мл), содержащему 2-метил-1,3-бензоксазол-6-карбоновую кислоту (885 мг), с последующим перемешиванием при 100°C в течение 1 часа и 30 минут. Растворитель отгоняли при пониженном давлении и добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетат. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на колонках с силикагелем, и таким образом получали твердое вещество белого цвета (2-метил-1,3-бензоксазол-6-ил)трет-бутилкарбамат (1,00 г).
1H-ЯМР (CDCl3, 300 МГц) δ: 7,85 (ушир.с, 1H), 7,50 (д, 1H, J=8,7 Гц), 7,00 (д, 1H, J=8,7 Гц), 6,60 (ушир.с, 1H), 2,60 (с, 3H)
Справочный пример 38
[Формула 71]
TFA (0,5 мл) добавляли к раствору, содержащему (2-метил-1,3-бензоксазол-6-ил)трет-бутилкарбамат (50 мг), в хлороформе (1 мл) при 0°C, с последующим перемешиванием при комнатной температуре в течение 3 часов. Растворитель отгоняли при пониженном давлении. К полученному остатку добавляли хлороформ, и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли насыщенный водный раствор гидрокарбоната натрия и хлороформ. Органический слой собирали и высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество светло-коричневого цвета 2-метил-1,3-бензоксазол-6-амин (24 мг).
1H-ЯМР (CDCl3, 300 МГц) δ: 7,40 (д, 1H, J=8,7 Гц), 6,79 (д, 1H, J=1,8 Гц), 6,65 (дд, 1H, J=1,8, 8,7 Гц), 3,75 (ушир.с, 2H), 2,58 (с, 3H)
Справочный пример 39
Следующее соединение получали, как описано в J. Heterocyclic. Chem., 1979, 16, 1599.
[Формула 72]
1-метил-1H-индазол-6-амин
Справочный пример 40
Следующее соединение получали, как описано в J. Heterocyclic. Chem., 1979, 16, 1599.
[Формула 73]
1-метил-2H-индазол-6-амин
Справочный пример 41
Следующее соединение получали, как описано в J. Med. Chem., 2006, 49, 4551.
[Формула 74]
4-(2-(пирролидин-1-ил)этокси)анилин
Справочный пример 42
Следующее соединение получали, как описано в J. Med. Chem., 2006, 49, 4551.
[Формула 75]
3-(2-(пирролидин-1-ил)этокси)анилин
Справочный пример 43
Следующее соединение получали, как описано в WO2009/090548.
[Формула 76]
3-(2H-1,2,3-триазол-2-ил)анилин
Справочный пример 44
Следующее соединение получали, как описано в Tetrahedron, 2006, 62, 12351.
[Формула 77]
Хиназолин-6-амин
[Формула 78]
Хиноксалин-6-амин
Справочный пример 45
Следующее соединение получали, как описано в Tetrahedron, 2005, 61, 8218.
[Формула 79]
1-метил-1H-индазол-7-амин
Справочный пример 46
Следующее соединение получали, как описано в J. Med. Chem., 2005, 48, 3417.
[Формула 80]
1-метил-1H-индол-5-амин
Справочный пример 47
[Формула 81]
Следующее соединение получали как описано на 1-ой стадии Примера 1.
2-бензиламино-6-(цис-2-(трет-бутоксикарбониламино)циклогексиламино)-5-фторметилникотинат
Справочный пример 48
[Формула 82]
Следующее соединение получали как описано в Справочном примере 9.
2-амино-6-(цис-2-(трет-бутоксикарбониламино)циклогексиламино)-5-фторметилникотинат
1H-ЯМР (DMSO-d6, 400 МГц) δ: 7,45 (д, 1H, J=12,0 Гц), 7,10-6,80 (ушир., 2H), 6,69 (д, 1H, J=7,2 Гц), 6,51 (д, 1H, J=7,2 Гц), 4,18-4,09 (м, 1H), 3,82-3,75 (м, 1H), 3,70 (с, 3H), 1,84-1,69 (м, 2H), 1,63-1,18 (м, 15H)
MS (ESI, m/z): 383 (M+H), 381 (M-H)
Справочный пример 49
[Формула 83]
1-ая стадия
4н. хлорид водорода/1,4-диоксан (104 мл) добавляли по каплям к раствору простого диизопропилового эфира (200 мл), тетрагидрофурана (50 мл) и метанола (19,1 мл), содержащему малононитрил (25,0 г) при охлаждении льдом, с последующим перемешиванием в течение 3 часов. Твердое вещество собирали фильтрацией и промывали простым диизопропиловым эфиром, и таким образом получали твердое вещество белого цвета (12,8 г).
2-ая стадия
Ацетат натрия (4,95 г) добавляли к раствору, содержащему твердое вещество белого цвета (4,49 г), полученное на 1-ой стадии, и 6-аминохинолин (4,35 г), в DMF (60 мл), с последующим перемешиванием при комнатной температуре в течение 6 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, хлорид натрия и этилацетат. Органический слой собирали и высушивали над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на колонках с силикагелем (хлороформ:метанол = от 100:0 до 20:1), и таким образом получали желтое масляное вещество 2-циано-N-(хинолин-6-ил) ацетамидин (4,30 г).
3-я стадия
Этил формиат (16,1 мл) добавляли при комнатной температуре к суспензии гексана (40 мл), содержащей гидрид натрия (60 % в масле, 2,4 г), и затем фторэтил ацетат (3,86 мл) добавляли по каплям при охлаждении льдом с последующим перемешиванием при комнатной температуре в течение 15 минут. К реакционной смеси добавляли этанол (50 мл), и затем добавляли по каплям раствор, содержащий 2-циано-N-(хинолин-6-ил)ацетамидин (4,20 г), в этаноле (50 мл), с последующим перемешиванием при 80°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры. Затем твердое вещество собирали фильтрацией и промывали этилацетатом, и таким образом получали твердое вещество желтого цвета 5-фтор-6-оксо-2-(хинолин-6-иламино)-1,6-дигидропиридин-3-карбонитрил (3,71 г).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,64 (дд, 1H, J=1,6, 4,3 Гц), 8,51 (с, 1H), 8,19 (с, 1H), 8,16 (д, 1H, J=2,4 Гц), 8,13-8,06 (м, 1H), 7,91 (дд, 1H, J=2,4, 9,2 Гц), 7,80 (д, 1H, J=9,2 Гц), 7,38 (дд, 1H, J=4,2, 8,3 Гц), 7,02 (д, 1H, J=11,0 Гц)
MS (ESI, m/z): 279 (M-H)
Справочный пример 50
[Формула 84]
Раствор, содержащий N-хлорсукцинимид (4,15 г) в 1,4-диоксане (100 мл), добавляли по каплям при 50°C к раствору, содержащему трифенилфосфин (8,58 г) в 1,4-диоксане (50 мл), с последующим перемешиванием в течение 30 минут. К реакционной смеси добавляли 5-фтор-6-оксо-2-(хинолин-6-иламино)-1,6-дигидропиридин-3-карбонитрил (2,61 г), с последующим перемешиванием при 70°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры. Затем твердое вещество собирали фильтрацией и промывали тетрагидрофураном, и таким образом получали твердое вещество серого цвета 6-хлор-5-фтор-2-(хинолин-6-иламино)никотинонитрил (2,34 г).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 9,85 (с, 1Н), 8,80 (дд, 1Н, J=1,5, 4,2 Гц), 8,50 (д, 1H, J=8,0 Гц), 8,29-8,23 (м, 1H), 8,02 (д, 1H, J=2,4 Гц), 7,98 (д, 1H, J=9,0 Гц), 7,90 (дд, 1H, J=2,4, 9,0 Гц), 7,49 (дд, 1H, J=4,2, 8,3 Гц)
MS (ESI, m/z): 299 (M+H), 297 (M-H)
Справочный пример 51
Следующее соединение получали как описано в Справочных примерах 49 и 50.
[Формула 85]
2-(1,3-бензотиазол-6-иламино)-6-хлор-5-фторникотинонитрил
1H-ЯМР (CDCl3, 400 МГц) δ: 8,95 (с, 1H), 8,43 (д, 1H, J=2,3 Гц), 8,12 (д, 1H, J=8,8 Гц), 7,64 (д, 1H, J=6,8 Гц), 7,50 (дд, 1H, J=2,3, 8,8 Гц), 7,18 (ушир.с, 1H)
MS (ESI, m/z): 305 (M+H), 303 (M-H)
Справочный пример 52
Следующее соединение получали как описано в Справочных примерах 49 и 50.
[Формула 86]
6-хлор-5-фтор-2-(хинолин-3-иламино)никотинонитрил
1H-ЯМР (DMSO-d6, 400 МГц) δ: 9,94 (с, 1H), 9,04 (д, 1H, J=2,7 Гц), 8,52 (д, 1H, J=8,1 Гц), 8,37 (д, 1H, J=2,7 Гц), 8,02-7,86 (м, 2H), 7,73-7,54 (м, 2H)
MS (ESI, m/z): 299 (M+H), 297 (M-H)
Справочный пример 53
[Формула 87]
1-ая стадия
Изобутил хлорформиат (811 мкл) добавляли по каплям к смеси N-бензилоксикарбонил-D-лецин•дициклогексиламина (2,23 г), 1,2-диметоксиэтана (25 мл) и N-метилморфолина (687 мкл) при охлаждении льдом, с последующим перемешиванием при той же самой температуре в течение 1 часа. К реакционной смеси добавляли при охлаждении льдом 25%-ый водный раствор гидроксида аммония (3,4 мл), с последующим перемешиванием при той же самой температуре в течение 1 часа. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетат. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. К полученному остатку добавляли гексан, и таким образом получали твердое вещество, собирали фильтрацией, и твердое вещество белого цвета N2-бензилоксикарбонил-D-лейцинамид (1,47 г).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 7,45-7,25 (м, 7H), 6,95 (ушир.с, 1H), 5,02 (с, 2H), 4,05-3,90 (м, 1H), 1,70-1,53 (м, 1H), 1,53-1,30 (м, 2H), 0,96-0,76 (м, 6H)
2-ая стадия
Pd/C (106 мг) добавляли к раствору, содержащему N2-бензилоксикарбонил-D-лейцинамид (529 мг) в этаноле (20 мл), с последующим перемешиванием при комнатной температуре в течение 3 часов в атмосфере водорода. Нерастворимое вещество удаляли фильтрацией и добавляли 1,4-диоксан (2 мл) и 4н хлорид водорода/1,4-диоксан. Твердое вещество собирали фильтрацией, и таким образом получали твердое вещество белого цвета D-лейцинамид·гидрохлорид (308 мг).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,24 (ушир.с, 3H), 8,00 (ушир.с, 1H), 7,52 (ушир.с, 1H), 3,75-3,61 (м, 1H), 1,76-1,61 (м, 1H), 1,61-1,50 (м, 2H), 0,97-0,84 (м, 6H)
Справочный пример 54
Следующее соединение получали как описано в Справочном примере 53.
[Формула 88]
D-фенилаланинамид·гидрохлорид
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,13 (ушир.с, 3H), 7,88 (ушир.с, 1H), 7,56 (ушир.с, 1H), 7,40-7,22 (м, 5H), 4,00-3,88 (м, 1H), 3,09 (дд, 1H, J=6,0, 13,9 Гц), 2,98 (дд, 1H, J=7,8, 13,9 Гц)
Справочный пример 55
Следующее соединение получали, как описано в J. Org. Chem., 2002, 67, 3687.
[Формула 89]
Справочный пример 56
[Формула 90]
1-ая стадия
Перйодинан Десса-Мартина (849 мг) добавляли к раствору, содержащему ((2R)-1-гидрокси-3-фенилпропан-2-ил)бензилкарбамат (571 мг) в дихлорметане (20 мл), с последующим перемешиванием при комнатной температуре в течение 3 часов и 30 минут. Нерастворимое вещество удаляли фильтрацией, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат = от 10:1 до 2:1), и таким образом получали твердое вещество белого цвета ((2R)-1-оксо-3-фенилпропан-2-ил)бензилкарбамат (501 мг).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 9,56 (с, 1H), 7,75 (д, 1H, J=7,8 Гц), 7,50-7,00 (м, 10H), 5,05-4,80 (м, 3H), 3,14 (дд, 1H, J=4,3, 14,2 Гц), 2,70 (дд, 1H, 10,4, 14,2 Гц)
2-ая стадия
Смесь ((2R)-1-оксо-3-фенилпропан-2-ил)бензилкарбамата (484 мг), глиоксаля (359 мг), раствора 2M гидроксид аммония/метанол (8,55 мл) и метанола (1,71 мл) перемешивали при комнатной температуре в течение 7 часов. К реакционной смеси добавляли воду, хлорид натрия и этилацетат. Органический слой собирали и высушивали над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на колонках с силикагелем (хлороформ:метанол = от 20:0 до 20:1), добавляли жидкую смесь этилацетата и изопропанола, и твердое вещество собирали фильтрацией, и таким образом получали твердое вещество белого цвета ((1R)-1-(1H-имидазол-2-ил)-2-фенилэтил)бензилкарбамат (111 мг).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 11,76 (ушир.с, 1H), 7,69 (д, 1H, J=8,8 Гц), 7,38-7,12 (м, 10H), 6,98 (с, 1H), 6,81 (с, 1H), 5,03-4,80 (м, 3H), 3,23 (дд, 1H, J=5,6, 13,6 Гц), 2,97 (дд, 1H, J=9,3, 13,6 Гц)
3-я стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 53.
(1R)-1-(1H-имидазол-2-ил)-2-фенилэтиламин
Справочный пример 57
[Формула 91]
1-ая стадия
Следующее соединение получали как описано на 3-ей стадии Справочного примера 27.
((1R)-1-циано-3-метилбутил)бензилкарбамат
1H-ЯМР (CDCl3, 400 МГц) δ: 7,42-7,30 (м, 5H), 5,14 (с, 2H), 5,07-4,96 (м, 1H), 4,72-4,57 (м, 1H), 1,90-1,57 (м, 3H), 0,97 (д, 6H, J=6,8 Гц)
MS (ESI, m/z): 269 (M+Na)
2-ая стадия
Триэтиламин·гидрохлорид (508 мг) и азид натрия (241 мг) добавляли к раствору, содержащему ((1R)-1-циано-3-метилбутил)бензилкарбамат (303 мг) в толуоле (12 мл), с последующим перемешиванием при 100°C в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры, и добавляли воду и этилацетат. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении, и таким образом получали бесцветное масляное вещество ((1R)-3-метил-1-(1H-тетразол-5-ил)бутил)бензилкарбамат (310 мг).
3-я стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 53.
(1R)-3-метил-1-(1H-тетразол-5-ил)бутиламин
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,26 (ушир.с, 1H), 4,49-4,38 (м, 1H), 1,90-1,77 (м, 1H), 1,72-1,59 (м, 1H), 1,56-1,41 (м, 1H), 0,88 (д, 3H, J=6,5 Гц), 0,83 (д, 3H, J=6,5 Гц)
Справочный пример 58
[Формула 92]
Следующее соединение получали как описано в Справочном примере 56.
((1R)-1-(1H-имидазол-2-ил)-3-метилбутил)бензилкарбамат
MS (ESI, m/z): 288 (M+H)
Справочный пример 59
[Формула 93]
Следующее соединение получали как описано в Справочном примере 53.
(2R)-2-аминобутанамид·гидрохлорид
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,22 (ушир.с, 3H), 7,95 (ушир.с, 1H), 7,51 (ушир.с, 1H), 3,68-3,62 (м, 1H), 1,82-1,68 (м, 2H), 0,88 (т, 3H, J=7,4 Гц)
Справочный пример 60
[Формула 94]
Следующее соединение получали как описано в Справочном примере 53.
D-валинамид·гидрохлорид
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,09 (ушир.с, 3H), 7,86 (ушир.с, 1H), 7,58 (ушир.с, 1H), 3,53 (д, 1H, J=5,4 Гц), 2,16-2,02 (м, 1H), 0,94 (дд, 6H, J=7,0, 10,1 Гц)
Справочный пример 61
[Формула 95]
Следующее соединение получали как описано в Справочном примере 53.
4-фтор-D-фенилаланинамид·гидрохлорид
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,18 (ушир.с, 3H), 7,95 (ушир.с, 1H), 7,55 (ушир.с, 1H), 7,34-7,26 (м, 2H), 7,20-7,10 (м, 2H), 3,96-3,88 (м, 1H), 3,09 (дд, 1H, J=6,0, 14,0 Гц), 2,98 (дд, 1H, J=7,6, 14,0 Гц)
Справочный пример 62
[Формула 96]
Следующее соединение получали как описано в Справочном примере 53.
O-метил-D-тирозинамид·гидрохлорид
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,16 (ушир.с, 3H), 7,93 (ушир.с, 1H), 7,51 (ушир.с, 1H), 7,18 (д, 2H, J=8,5 Гц), 6,88 (д, 2H, J=8,5 Гц), 3,94-3,83 (м, 1H), 3,72 (с, 3H), 3,02 (дд, 1H, J=6,2, 14,0 Гц), 2,93 (дд, 1H, J=7,3, 14,0 Гц)
Справочный пример 63
Следующее соединение получали, как описано в WO2009/136995.
[Формула 97]
(2S)-трет-бутил-2-аминобутилкарбамат
Справочный пример 64
[Формула 98]
1-ая стадия
Хлорид водород при -15°C вводили в смесь этил цианоацетата (56,6 г) и фенола (47,1 г), с последующим перемешиванием при охлаждении льдом в течение 3 часов. Реакционную смесь оставляли в покое при 4°C в течение 40 часов. К реакционной смеси добавляли простой диэтиловый эфир. Твердое вещество собирали фильтрацией и промывали простым диэтиловым эфиром, и таким образом получали твердое вещество белого цвета (60,1 г).
2-ая стадия
Этилацетатный (300 мл) раствор, содержащий твердое вещество белого цвета (60,1 г), полученное на 1-ой стадии, и 3,5-диметоксианилин (37,8 г), нагревали с обратным холодильником в течение 2 часов и 30 минут. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат (100 мл), с последующим перемешиванием при охлаждении льдом в течение 1 часа. Твердое вещество собирали фильтрацией и промывали этилацетатом, и таким образом получали твердое вещество белого цвета 3-(3,5-диметоксифенил)амино-3-иминоэтилпропионато·гидрохлорид (60,8 г).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 11,79 (ушир.с, 1H), 9,81 (ушир.с, 1H), 8,97 (ушир.с, 1H), 6,58 (т, 1H, J=2,2 Гц), 6,42 (д, 2H, J=2,2 Гц), 4,20 (кв., 2H, J=7,1 Гц), 3,85 (с, 2H), 3,79 (с, 6H), 1,25 (т, 3H, J=7,1 Гц)
3-я стадия
[1]
Гидрид натрия (60 % в масле, 11,3 г) добавляли при охлаждении льдом к раствору, содержащему фторэтил ацетат (27,2 мл) и этил формиат (22,7 мл) в гексане (250 мл), с последующим перемешиванием при той же самой температуре в течение 1 часа и затем при комнатной температуре в течение 1 часа. Твердое вещество собирали фильтрацией и промывали гексаном, и таким образом получали твердое вещество.
[2]
1н. Водный раствор гидроксида натрия добавляли к смеси 3-(3,5-диметоксифенил)амино-3-иминоэтилпропионато·гидрохлорида (28,4 г), воды (150 мл) и этилацетата (150 мл), чтобы сообщить смеси щелочные свойства (рН >10). Органический слой собирали и высушивали над безводным сульфатом магния, растворитель отгоняли при пониженном давлении, и таким образом получали остаток.
[3]
Этанольный (600 мл) раствор, содержащий вещества, полученные в [1] и [2], нагревали с обратным холодильником в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры, и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли этанол. Твердое вещество собирали фильтрацией, растворяли в этилацетате и промывали 1н. соляной кислотой. Затем растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество серого цвета 2-(3,5-диметоксифенил)амино-5-фтор-6-оксо-1,6-дигидропиридин-3-этилкарбоксилат (24,6 г).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 10,11 (с, 1H), 7,84 (д, 1H, J=11,7 Гц), 6,81-6,72 (м, 2H), 6,26-6,22 (м, 1H), 4,28 (кв., 2H, J=7,1 Гц), 3,75 (с, 6H), 1,31 (т, 3H, J=7,1 Гц)
Справочный пример 65
[Формула 99]
Следующее соединение получали как описано в Справочном примере 50.
6-хлор-2-(3,5-диметоксифениламино)-5-фторэтилникотинат
1H-ЯМР (CDCl3, 400 МГц) δ: 10,19 (с, 1H), 8,03 (д, 1H, J=8,2 Гц), 6,96 (д, 2H, J=2,2 Гц), 6,22 (т, 1H, J=2,2 Гц), 4,41 (кв., 2H, J=7,1 Гц), 3,82 (с, 6H), 1,42 (т, 3H, J=7,1 Гц)
Справочный пример 66
Следующее соединение получали, как описано в WO2009/18344 A1.
[Формула 100]
(E)-трет-бутил-3-(4-(аминометил)фенил)акрилат
Справочный пример 67
[Формула 101]
Следующее соединение получали как описано в Справочном примере 2.
2-хлор-6-(бензил(трет-бутоксикарбонил)амино)-5-фторметилникотинат
1H ЯМР (CDCl3, 400 МГц) δ: 7,89 (д, 1H, J=9,1 Гц), 7,32-7,18 (м, 5H), 5,07 (с, 2H), 3,93 (с, 3H), 1,43 (с, 9H)
Справочный пример 68
[Формула 102]
Следующее соединение получали как описано в Примере 1 и Справочном примере 9.
6-амино-5-фтор-2-(хинолин-3-иламино)метилникотинат
1H ЯМР (DMSO-d6, 400 МГц) δ: 10,56 (с, 1H), 9,14 (д, 1H, J=2,6 Гц), 8,90 (д, 1H, J=2,6 Гц), 7,96-7,90 (м, 2H), 7,74 (д, 1H, J=11,6 Гц), 7,61-7,54 (м, 2H), 7,45 (ушир.с, 2H), 3,83 (с, 3H)
MS (ESI, m/z): 313 (M+H), 311 (M-H)
Справочный пример 69
[Формула 103]
Следующее соединение получали как описано в Справочном примере 67.
6-амино-5-фтор-2-(3-(трифторметил)фениламино)метилникотинат
1H-ЯМР (CDCl3, 400 МГц) δ: 10,42 (с, 1H), 8,07 (с, 1H), 7,78 (д, 1H, J=11,1 Гц), 7,76-7,71 (м, 1H), 7,39 (дд, 1H, J=7,9, 7,9 Гц), 7,29-7,23 (м, 1H), 4,99 (ушир.с, 2H), 3,87 (с, 3H)
Справочный пример 70
Следующее соединение получали, как описано в WO2008/49855.
[Формула 104]
Справочный пример 71
Следующее соединение получали, как описано в EP2119706.
[Формула 105]
Справочный пример 72
[Формула 106]
Следующее соединение получали как описано в Справочном примере 1.
2,6-дихлорметилникотинат
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,33 (д, 1H, J=8,0 Гц), 7,73 (д, 1H, J=8,0 Гц), 3,89 (с, 3H)
Справочный пример 73
[Формула 107]
Следующее соединение получали как описано на 1-ой стадии Справочного примера 2.
2-бензиламино-6-хлорметилникотинат
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,57-8,49 (м, 1H), 8,10 (д, 1H, J=8,0 Гц), 7,37-7,30 (м, 4H), 7,30-7,22 (м, 1H), 6,69 (д, 1H, J=8,0 Гц), 4,64 (д, 2H, J=5,9 Гц), 3,82(с, 3H)
MS (ESI, m/z): 277 (M+H), 279 (M+H)
Справочный пример 74
[Формула 108]
Диизопропилэтиламин (7,5 мл) и цис-циклогексан-1,2-диамин (5,0 г) добавляли к раствору, содержащему 2-бензиламино-6-хлорметилникотинат (6,0 г) в N-метилпирролидоне (50 мл), с последующим перемешиванием при 120°C в течение 11 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли воду и этилацетат. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Ди-трет-бутил бикарбонат (4,7 г) добавляли к раствору, содержащему полученный остаток в тетрагидрофуране (50 мл), и полученную смесь оставляли в покое при комнатной температуре в течение 3 дней. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на колонках с силикагелем (силикагель:силикагель 60 (сферическая форма) (Kanto Chemical Co., Inc.); гексан:этилацетат = 3:1), и таким образом получали твердое вещество светло-желтого цвета 2-бензиламино-6-(цис-2-(трет-бутоксикарбониламино)циклогексиламино)метилникотинат (7,7 г).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,50-8,40 (ушир., 1H), 7,70-7,57 (м, 1H), 7,37-7,18 (м, 5H), 6,80-6,65 (ушир., 1H), 6,55-6,42 (ушир., 1H), 5,87-5,77 (м, 1H), 4,71-4,48 (м, 2H), 4,20-4,09 (м, 1H), 3,73-3,64 (м, 4H), 1,70-1,10 (м, 17H)
MS (ESI, m/z): 455 (M+H), 477 (M+Na)
Справочный пример 75
[Формула 109]
Следующее соединение получали как описано в Справочном примере 3.
2-бензиламино-6-(цис-2-(трет-бутоксикарбониламино)циклогексиламино)никотиновая кислота
1H ЯМР (DMSO-d6, 400 МГц) δ: 11,86-11,65 (ушир., 1H), 8,64-8,53 (ушир., 1H), 7,63 (д, 1H, J=8,6 Гц), 7,36-7,26 (м, 4H), 7,26-7,18 (м, 1H), 6,70-6,40 (м, 2H), 5,80 (д, 1H, J=8,6 Гц), 4,72-4,50 (м, 2H), 4,15-3,99 (м, 1H), 3,74-3,62 (м, 1H), 1,70-1,13 (м, 17H)
MS (ESI, m/z): 441 (M+H), 463 (M+Na), 439 (M-H)
цис-2-(6-бензиламино-5-(2-фенилпропан-2-иламинокарбонил)пиридин-2-иламино)циклогексил-трет-бутилкарбамат
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,96-8,88 (ушир., 1H), 7,85 (д, 1H, J=8,7 Гц), 7,73-7,66 (ушир., 1H), 7,34-7,10 (м, 10H), 6,50-6,42 (м, 1H), 6,37-6,26 (м, 1H), 5,78 (д, 1H, J=8,7 Гц), 4,57-4,38 (м, 2H), 4,06-3,95 (м, 1H), 3,70-3,58 (м, 1H), 1,70-1,14 (м, 23H)
MS (ESI, m/z): 558 (M+H)
Справочный пример 76
[Формула 110]
Следующее соединение получали как описано в Справочном примере 9.
цис-2-(6-амино-5-(2-фенилпропан-2-иламинокарбонил)пиридин-2-иламино)циклогексил-трет-бутилкарбамат
1H-ЯМР (DMSO-d6, 400 МГц) δ: 7,81 (д, 1H, J=8,7 Гц), 7,70-7,63 (ушир., 1H), 7,35-7,30 (м, 2H), 7,28-7,22 (м, 2H), 7,16-7,10 (м, 1H), 6,82-6,74 (ушир., 2H), 6,54-6,47 (м, 1H), 6,21-6,13 (м, 1H), 5,80 (д, 1H, J=8,7 Гц), 4,05-3,94 (м, 1H), 3,70-3,62 (м, 1H), 1,80-1,20 (м, 23H)
MS (ESI, m/z): 468 (M+H)
Справочный пример 77
[Формула 111]
N-хлорсукцинимид (17 мг) добавляли при 0°C к раствору, содержащему цис-2-(6-амино-5-(2-фенилпропан-2-иламинокарбонил)пиридин-2-иламино)циклогексил-трет-бутилкарбамат (60 мг) в DMF (5 мл), с последующим перемешиванием в течение 1 часа. К реакционной смеси добавляли воду и этилацетат. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (силикагель:силикагель 60 (сферическая форма) (Kanto Chemical Co., Inc.); гексан:этилацетат = 3:1), и таким образом получали твердое вещество белого цвета цис-2-(6-амино-3-хлор-5-(2-фенилпропан-2-иламинокарбонил)пиридин-2-иламино)циклогексил-трет-бутилкарбамат (50 мг).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,06 (с, 1H), 7,93 (с, 1H), 7,35-7,30 (м, 2H), 7,28-7,22 (м, 2H), 7,17-7,11 (м, 1H), 7,03-6,95 (ушир., 2H), 6,95-6,89 (м, 1H), 5,85-5,77 (м, 1H), 4,11-4,02 (м, 1H), 3,85-3,77 (м, 1H), 1,80-1,22 (м, 23H)
MS (ESI, m/z): 502 (M+H), 504 (M+H)
Справочный пример 78
[Формула 112]
N-бромсукцинимид (22 мг) добавляли при 0°C к раствору, содержащему цис-2-(6-амино-5-(2-фенилпропан-2-иламинокарбонил)пиридин-2-иламино)циклогексил-трет-бутилкарбамат (60 мг) в DMF (5 мл), с последующим перемешиванием в течение 1 часа. К реакционной смеси добавляли воду и этилацетат. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (силикагель:силикагель 60 (сферическая форма) (Kanto Chemical Co., Inc.); гексан:этилацетат = от 4:1 до 3:1), и таким образом получали твердое вещество белого цвета цис-2-(6-амино-3-бром-5-(2-фенилпропан-2-иламинокарбонил)пиридин-2-иламино)циклогексил-трет-бутилкарбамат (68 мг).
1H ЯМР (DMSO-d6, 400 МГц) δ: 8,17 (с, 1H), 7,96 (с, 1H), 7,36-7,30 (м, 2H), 7,30-7,22 (м, 2H), 7,17-7,11 (м, 1H), 7,10-6,94 (м, 3H), 5,70-5,60 (м, 1H), 4,11-4,00 (м, 1H), 3,87-3,78 (м, 1H), 1,80-1,21 (м, 23H)
MS (ESI, m/z): 546 (M+H), 548 (M+H)
Справочный пример 79
Следующее соединение получали как описано в Справочном примере 18.
[Формула 113]
2-(3-бромфенил)-2H-1,2,3-триазол
1H ЯМР (CDCl3, 400 МГц) δ: 8,32-8,28 (м, 1H), 8,08-8,02 (м, 1H), 7,83 (с, 2H), 7,52-7,46 (м, 1H), 7,40-7,32 (м, 1H)
Справочный пример 80
Следующее соединение получали как описано в Справочном примере 22.
[Формула 114]
2-(5-бромпиридин-3-ил)тиазол
MS (ESI m/z): 241, 243 (M+H)
1H-ЯМР (DMSO-d6, 400 МГц) δ: 9,13 (д, 1H, J=2,0 Гц), 8,81 (д, 1H, J=2,2 Гц), 8,55-8,53 (м, 1H), 8,04 (д, 1H, J=3,2 Гц), 8,00-7,92 (м, 1H)
Справочный пример 81
Следующее соединение получали как описано в Справочном примере 22.
[Формула 115]
5-(5-бромпиридин-3-ил)тиазол
MS (ESI m/z): 241, 243 (M+H)
1H-ЯМР (DMSO-d6, 400 МГц) δ: 9,23-9,21 (м, 1H), 8,93-8,89 (м, 1H), 8,71-8,68 (м, 1H), 8,54 (с, 1H), 8,48-8,45 (м, 1H)
Справочный пример 82
Следующее соединение получали как описано в Справочном примере 22.
[Формула 116]
3-(1-бензил-1H-пиразол-4-ил)-5-бромпиридин
MS (ESI m/z): 312, 314 (M+H)
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,85 (д, 1H, J=2,0 Гц), 8,51-8,49 (м, 2H), 8,32-8,29 (м, 1H), 8,11 (с, 1H), 7,39-7,25 (м, 5H), 5,36 (с, 2H)
Справочный пример 83
Следующее соединение получали как описано в Справочном примере 22.
[Формула 117]
5-(5-бромпиридин-3-ил)-1H-индол
MS (ESI m/z): 273, 275 (M+H)
1H-ЯМР (DMSO-d6, 400 МГц) δ: 11,27 (с, 1H), 8,90 (д, 1H, J=1,9 Гц), 8,62 (д, 1H, J=2,2 Гц), 8,34-8,31 (м, 1H), 7,96 (с, 1H), 7,54-7,46 (м, 2H), 7,44-7,41 (м, 1H), 6,53-6,50 (м, 1H)
Справочный пример 84
Следующее соединение получали как описано в Справочном примере 22.
[Формула 118]
3-бром-5-(тиофен-3-ил)пиридин
MS (ESI m/z): 240, 242 (M+H)
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,99 (д, 1H, J=1,9 Гц), 8,61 (д, 1H, J=2,2 Гц), 8,45-8,43 (м, 1H), 8,20-8,18 (м, 1H), 7,73-7,71 (м, 2H)
Справочный пример 85
Следующее соединение получали как описано в Справочном примере 22.
[Формула 119]
3-бром-5-(фуран-3-ил)пиридин
MS (ESI m/z): 224, 226 (M+H)
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,89 (д, 1H, J=2,0 Гц), 8,58 (д, 1H, J=2,2 Гц), 8,43-8,40 (м, 1H), 8,37-8,34 (м, 1H), 7,15-7,13 (м, 1H)
Справочный пример 86
Следующее соединение получали как описано в Справочном примере 22.
[Формула 120]
5-бром-3-(м-толил)пиридин
1H-ЯМР (DMSO-d6, 300 МГц) δ: 8,88 (д, 1H, J=2,1 Гц), 8,67 (д, 1H, J=2,1 Гц), 8,35-8,32 (м, 1H), 7,71-7,66 (м, 2H), 7,35-7,30 (м, 2H), 2,37 (с, 3H)
Справочный пример 87
Следующее соединение получали как описано в Справочном примере 22.
[Формула 121]
2-(4-аминопиридин-2-ил)-1H-пиррол-1-трет-бутилкарбоксилат
MS (ESI m/z): 260 (M+H)
RT (мин.): 0,83
Справочный пример 88
Следующее соединение получали как описано в Справочном примере 22.
[Формула 122]
2-(фуран-2-ил)пиридин-4-амин
MS (ESI m/z): 161 (M+H)
RT (мин.): 0,46
Справочный пример 89
Следующее соединение получали как описано в Справочном примере 22.
[Формула 123]
3-бром-5-(3-фторфенил)пиридин
MS (ESI m/z): 252, 254 (M+H)
RT (мин.): 1,56
Справочный пример 90
Следующее соединение получали как описано в Справочном примере 22.
[Формула 124]
3-бром-5-(3-хлорфенил)пиридин
MS (ESI m/z): 268, 270, 272 (M+H)
RT (мин.): 1,70
Справочный пример 91
Следующее соединение получали как описано в Справочном примере 22.
[Формула 125]
3-бром-5-(2-метоксифенил)пиридин
MS (ESI m/z): 264, 266 (M+H)
RT (мин.): 1,55
Справочный пример 92
Следующее соединение получали как описано в Справочном примере 22.
[Формула 126]
2-(2,4-диметоксифенил)пиридин-4-амин
MS (ESI m/z): 231 (M+H)
RT (мин.): 0,74
Справочный пример 93
[Формула 127]
1-ая стадия
М-Хлорбензойную кислоту (1,0 г) при охлаждении льдом добавляли к раствору, содержащему 4-бром-7-азаиндол (760 мг) в хлороформе (19 мл), с последующим перемешиванием в течение 30 минут. Затем хлороформ (10 мл) отгоняли при пониженном давлении, добавляли простой диизопропиловый эфир, нерастворимый осадок собирали фильтрацией, и таким образом получали твердое вещество белого цвета 4-бром-1H-пирроло[2,3-b]пиридин 7-оксид (1,085 г).
MS (ESI m/z): 213, 215 (M+H)
RT (мин.): 0,75
2-ая стадия
Диметилсульфат (410 мг) добавляли к раствору, содержащему твердое вещество белого цвета 4-бром-1H-пирроло[2,3-b]пиридин 7-оксид (1,085 г), полученный на 1-ой стадии, в ацетонитриле (7,6 мл) с последующим перемешиванием при 60°C в течение 25,5 часов в атмосфере азота. Затем реакционный раствор охлаждали до комнатной температуры и разбавляли добавлением ацетонитрила (7,6 мл).
MS (ESI m/z): 227, 229 (M+H)
RT (мин.): 0,45
3-я стадия
Морфолин (0,22 мл) добавляли к части (1,2 мл) раствора ацетонитрила, полученного на 2-ой стадии, в атмосфере азота, с последующим перемешиванием при 60°C в течение 30 минут. Реакционный раствор охлаждали до комнатной температуры и добавляли насыщенный водный раствор хлорида аммония. Затем нерастворимый осадок промывали водой, и таким образом получали 4-(4-бром-1H-пирроло[2,3-b]пиридин-6-ил)морфолин (36 мг).
MS (ESI m/z): 282, 284 (M+H)
RT (мин.): 1,30
4-ая стадия
Гидрид натрия (60 % в масле) (6 мг) добавляли в атмосфере азота к раствору, содержащему 4-(4-бром-1H-пирроло[2,3-b]пиридин-6-ил)морфолин (36 мг), полученный на 3-ей стадии, в DMF (1,3 мл) при охлаждении льдом с последующим перемешиванием в течение 30 минут. Затем добавляли ди-трет-бутил дикарбонат (50 мг), с последующим перемешиванием при комнатной температуре в течение 1 часа. Далее, насыщенный водный раствор хлорида аммония к реакционному раствору добавляли с последующей экстракцией этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:1 до 0:1), и таким образом получали бесцветное масляное вещество 4-бром-6-морфолино-1H-пирроло[2,3-b]пиридин-1-трет-бутилкарбоксилат (34 мг).
MS (ESI m/z): 382, 384 (M+H)
RT (мин.): 1,98
Справочный пример 94
Следующее соединение получали как описано в Справочном примере 93.
[Формула 128]
4-бром-6-метокси-1H-пирроло[2,3-b]пиридин
MS (ESI m/z): 227, 229 (M+H)
RT (мин.): 1,42
4-бром-6-метокси-1H-пирроло[2,3-b]пиридин-1-трет-бутилкарбоксилат
MS (ESI m/z): 327, 329 (M+H)
RT (мин.): 2,12
Справочный пример 95
Следующие соединения получали как описано в Справочном примере 93.
[Формула 129]
4-бром-6-(2H-1,2,3-триазол-2-ил)-1H-пирроло[2,3-b]пиридин
MS (ESI m/z): 264, 266 (M+H)
RT (мин.): 1,22
4-бром-6-(1H-1,2,3-триазол-1-ил)-1H-пирроло[2,3-b]пиридин
MS (ESI m/z): 264, 266 (M+H)
RT (мин.): 1,30
4-бром-6-(2H-1,2,3-триазол-2-ил)-1H-пирроло[2,3-b]пиридин-1- трет-бутилкарбоксилат
MS (ESI m/z): 264, 266 (M+H)
RT (мин.): 1,79
4-бром-6-(1H-1,2,3-триазол-1-ил)-1H-пирроло[2,3-b]пиридин-1-трет-бутилкарбоксилат
MS (ESI m/z): 364, 366 (M+H)
RT (мин.): 1,79
Справочный пример 96
Следующие соединения получали как описано в Справочном примере 93.
[Формула 130]
4-бром-6-(1H-1,2,4-триазол-1-ил)-1H-пирроло[2,3-b]пиридин
MS (ESI m/z): 264, 266 (M+H)
RT (мин.): 1,22
4-бром-6-(1H-1,2,4-триазол-1-ил)-1H-пирроло[2,3-b]пиридин-1-трет-бутилкарбоксилат
MS (ESI m/z): 364, 366 (M+H)
RT (мин.): 1,79
Справочный пример 97
[Формула 131]
1-ая стадия
Следующее соединение получали как описано в Справочном примере 22.
(5-(1-метил-1H-пиррол-2-ил)пиридин-3-ил)трет-бутилкарбамат
MS (ESI m/z): 274 (M+H), 272 (М-Н)
1H-ЯМР (DMSO-d6, 400 МГц) δ: 9,62 (с, 1H), 8,56 (д, 1H, J=2,4 Гц), 8,28 (д, 1H, J=2,0 Гц), 7,91 (с, 1H), 6,92-6,89 (м, 1H), 6,26-6,23 (м, 1H), 6,11-6,08 (м, 1H), 3,65 (с, 3H), 1,49 (с, 9H)
2-ая стадия
4M хлорид водорода/1,4-диоксан (1 мл) добавляли к раствору, содержащему (5-(1-метил-1H-пиррол-2-ил)пиридин-3-ил)трет-бутилкарбамат (80 мг), полученный на 1-ой стадии, в этилацетате (2 мл) с последующим перемешиванием при комнатной температуре в течение 15 часов. Нерастворимый осадок собирали фильтрацией, и таким образом получали твердое вещество светло-коричневого цвета 5-(1-метил-1H-пиррол-2-ил)пиридин-3-амин·гидрохлорид (42 мг).
MS (ESI m/z): 174 (M+H)
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,13 (д, 1H, J=1,2 Гц), 7,91 (д, 1H, J=2,0 Гц), 7,71-7,68 (м, 1H), 7,02-7,69 (м, 1H), 6,47-6,43 (м, 1H), 6,16-6,13 (м, 1H), 3,73 (с, 3H)
Справочный пример 98
Следующие соединения получали как описано в Справочном примере 97.
[Формула 132]
(5-(1-метил-1H-индол-5-ил)пиридин-3-ил)трет-бутилкарбамат
MS (ESI m/z): 324 (M+H), 322 (М-Н)
1H-ЯМР (DMSO-d6, 400 МГц) δ: 9,64 (с, 1H), 8,56-8,48 (м, 2H), 8,19 (с, 1H), 7,82 (д, 1H, J=1,2 Гц), 7,56 (д, 1H, J=8,8 Гц), 7,45-7,41 (м, 1H), 7,42-7,38 (м, 1H), 6,53-6,50 (м, 1H), 3,82 (с, 3H), 1,51 (с, 9H)
5-(1-метил-1H-индол-5-ил)пиридин-3-амин·гидрохлорид
MS (ESI m/z): 224 (M+H)
1H-ЯМР (CDCl3, 400 МГц) δ: 8,33 (д, 1H, J=2,0 Гц), 8,05 (д, 1H, J=2,7 Гц), 7,82-7,80 (м, 1H), 7,45-7,38 (м, 1H), 7,25-7,21 (м, 1H), 7,10 (д, 1H, J=3,0 Гц), 6,54 (д, 1H, J=3,0 Гц), 3,83 (с, 3H), 3,80-3,70 (м, 2H)
Справочный пример 99
Следующее соединение получали, как описано в US2006/79522 A1.
[Формула 133]
3-бром-2-метил-5-нитропиридин
Справочный пример 100
[Формула 134]
1-ая стадия
Следующее соединение получали как описано в Справочном примере 22.
2-метил-5-нитро-3-фенилпиридин
1H-ЯМР (DMSO-d6, 400 МГц) δ: 9,28 (д, 1H, J=2,6 Гц), 8,32 (д, 1H, J=2,7 Гц), 7,57-7,47 (м, 5H), 2,58 (с, 3H)
2-ая стадия
10%-ый Pd/C (30 мг) добавляли к раствору метанол/этилацетат (1 мл/1 мл), содержащему 2-метил-5-нитро-3-фенилпиридин (40 мг), полученный на 1-ой стадии, с последующим перемешиванием при комнатной температуре в течение 2,5 часов в атмосфере водорода. Нерастворимое вещество удаляли, растворитель отгоняли при пониженном давлении, и таким образом получали светло-желтое масляное вещество 2-метил-5-фенилпиридин-3-амин (32 мг).
MS (ESI m/z): 185 (M+H)
1H-ЯМР (DMSO-d6, 400 МГц) δ: 7,84 (д, 1H, J=2,7 Гц), 7,47-7,30 (м, 5H), 6,76 (д, 1H, J=2,4 Гц), 5,15 (ушир., 2H), 2,22 (с, 3H), 1,97 (с, 2H)
Справочный пример 101
[Формула 135]
1-ая стадия
Триэтиламин (4 мл), бис(трифенилфосфин)палладий дихлорид (70 мг), йодид меди (38 мг) и триметилсилилацетилен (1,4 мл) добавляли в атмосфере азота к раствору, содержащему 4-хлор-2-фтор-6-йоданилин (542 мг) в тетрагидрофуране (4 мл), с последующим перемешиванием при комнатной температуре в течение 30 минут. Затем к реакционному раствору добавляли этилацетат, и нерастворимый осадок удаляли. Органические слои объединяли, и растворитель отгоняли при пониженном давлении. Остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 1:1), и таким образом получали 4-хлор-2-фтор-6-((триметилсилил)этинил)анилин.
MS (ESI m/z): 242, 244 (M+H)
RT (мин.): 2,11
2-ая стадия
Карбонат калия (550 мг) добавляли к метанольному раствору (5 мл), содержащему 4-хлор-2-фтор-6-((триметилсилил)этинил)анилин, полученный на 1-ой стадии, с последующим перемешиванием при комнатной температуре в течение 30 минут. Нерастворимый осадок удаляли, и затем растворитель отгоняли при пониженном давлении. Остаток очищали хроматографией на силикагеле, и таким образом получали бесцветное масляное вещество 4-хлор-2-этинил-6-фторанилин (214 мг).
MS (ESI m/z): 170, 172 (M+H)
RT (мин.): 1,48
3-я стадия
Димер циклооктадиен хлорида (6 мг) добавляли к раствору, содержащему 4-хлор-2-этинил-6-фторанилин (214 мг), полученный на 2-ой стадии, в DMF (6 мл) с последующим перемешиванием при 85°C в течение 16 часов в атмосфере азота. К реакционному раствору добавляли насыщенный водный раствор гидрокарбоната натрия, нерастворимый осадок собирали фильтрацией и промывали водой. Затем полученное твердое вещество растворяли в этилацетате, и органический слой промывали водой и насыщенным солевым раствором и высушивали над безводным сульфатом натрия. После этого растворитель отгоняли при пониженном давлении, и таким образом получали зеленое масляное вещество 5-хлор-7-фтор-1H-индол (124 мг).
MS (ESI m/z): 170, 172 (M+H)
RT (мин.): 1,56
Справочный пример 102
Следующее соединение получали как описано в Справочном примере 101.
[Формула 136]
3-бром-2-этинил-5-(трифторметил)анилин
MS (ESI m/z): 264, 266 (M+H)
RT (мин.): 1,65
4-бром-6-(трифторметил)-1H-индол
MS (ESI m/z): 264, 266 (M+H)
RT (мин.): 1,75
Справочный пример 103
[Формула 137]
5-хлор-7-фтор-1H-индол (124 мг) и 2-метоксиэтил хлорид (17 мг) в атмосфере азота при охлаждении льдом добавляли к суспензии DMF (2 мл), содержащей гидрид натрия (61 % в масле) (6 мг), с последующим перемешиванием при комнатной температуре в течение 1 часа. Далее добавляли гидрид натрия (61 % в масле) (6 мг), с последующим перемешиванием при 110°C в течение 30 минут. Затем к реакционному раствору добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на колонках с силикагелем, и таким образом получали 5-хлор-7-фтор-1-(2-метоксиэтил)-1H-индол (27 мг).
MS (ESI m/z): 228, 230 (M+H)
RT (мин.): 1,71
Справочный пример 104
Следующее соединение получали как описано в Справочном примере 103.
[Формула 138]
4-(2-(5-хлор-7-фтор-1H-индол-1-ил)этил)морфолин
MS (ESI m/z): 283, 285 (M+H)
RT (мин.): 0,92
Справочный пример 105
Следующее соединение получали как описано в Справочном примере 103.
[Формула 139]
4-(2-(5-бром-6-фтор-1H-индол-1-ил)этил)морфолин
MS (ESI m/z): 327, 329 (M+H)
RT (мин.): 1,01
Справочный пример 106
Следующее соединение получали как описано в Справочном примере 103.
[Формула 140]
4-бром-6-фтор-1-(2-метоксиэтил)-1H-индол
MS (ESI m/z): 272, 274 (M+H)
RT (мин.): 1,70
Справочный пример 107
Следующее соединение получали как описано в Справочном примере 103.
[Формула 141]
4-(2-(4-бром-6-(трифторметил)-1H-индол-1-ил)этил)морфолин
MS (ESI m/z): 377, 379 (M+H)
RT (мин.): 1,20
Справочный пример 108
Следующее соединение получали как описано в Справочном примере 103.
[Формула 142]
4-бром-(2-метоксиэтил)-6-(трифторметил)-1H-индол
MS (ESI m/z): 322, 324 (M+H)
RT (мин.): 1,90
Справочный пример 110
[Формула 143]
1-ая стадия
Концентрированную серную кислоту (2,5 мл) и N-бромсукцинимид (3,44 г) добавляли к раствору TFA (8 мл), содержащему 4-фтор-2-нитротолуол (2 г), с последующим перемешиванием при комнатной температуре в течение 15 часов. Затем реакционный раствор лили в воду со льдом, с последующей экстракцией этилацетатом. Полученный органический слой промывали водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и высушивали над безводным сульфатом натрия. После этого растворитель отгоняли при пониженном давлении. Остаток очищали хроматографией на силикагеле, и таким образом получали светло-желтое масляное вещество.
2-ая стадия
N,N-диметилформамид диметилацеталь (7,7 г) добавляли в атмосфере азота к раствору DMF (20 мл), содержащему светло-желтое масляное вещество, полученное на 1-ой стадии, с последующим нагреванием с обратным холодильником в течение 30 минут. Реакционный раствор охлаждали до комнатной температуры. Добавляли воду, этилацетат и 1M соляную кислоту, и затем органический слой отделяли. Полученный органический слой промывали 1M соляной кислотой (×3) и насыщенным солевым раствором и высушивали над безводным сульфатом натрия. После этого растворитель отгоняли при пониженном давлении, и таким образом получали темно-коричневое масляное вещество.
3-я стадия
Раствор уксусной кислоты (20 мл), содержащий темно-коричневое масляное вещество, полученное на 2-ой стадии, добавляли при 110°C в течение 30 минут к смеси порошка железа (3,61 г) и уксусной кислоты (20 мл). Полученную смесь перемешивали в течение 1 часа и затем разбавляли этилацетатом. Нерастворимое вещество удаляли фильтрацией через Целит, фильтрат промывали водой и 1M соляной кислотой (×3). Полученный органический слой лили в насыщенный водный раствор гидрокарбоната натрия, чтобы отделить органический слой, и этот органический слой промывали водой и насыщенным солевым раствором и высушивали над безводным сульфатом натрия. После этого добавляли активированный уголь, и нерастворимое вещество удаляли фильтрацией через Целит. Растворитель отгоняли при пониженном давлении, и таким образом получали светло-коричневое масляное вещество 4-бром-6-фтор-1H-индол (880 мг).
MS (ESI m/z): 214, 216 (M+H)
RT (мин.): 1,56
1H-ЯМР (DMSO-d6, 300 МГц) δ: 11,53 (ушир., 1H), 7,46 (т, 1H, J=3,0 Гц), 7,24 (дд, 1H, J=5,6, 3,0 Гц), 7,19 (дд, 1H, J=9,2, 2,0 Гц), 6,39 (д, 1H, J=2,0 Гц)
4-ая стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 2.
трет-бутил-4-бром-6-фтор-1H-индол-карбоксилат
Справочный пример 111
[Формула 144]
Гидрид натрия (61 % в масле) (40 мг) добавляли при охлаждении льдом к раствору DMF (1 мл), содержащему 2-(этоксикарбонил)-5-броминдол (134 мг), с последующим перемешиванием в течение 10 минут. Затем добавляли раствор DMF (1 мл), содержащий ди-трет-бутилдикарбонат (108 мг), с последующим перемешиванием при комнатной температуре в течение 5 минут. К реакционному раствору добавляли воду, и твердый осадок собирали фильтрацией, полученное твердое вещество очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 1:1), и таким образом получали бесцветное масляное вещество 2-этил-5-бром-1H-индол-1,2-ди-трет-бутилкарбоксилат (100 мг).
1H-ЯМР (DMSO-d6, 300 МГц) δ: 7,96 (т, 1H, J=2,6 Гц), 7,92 (д, 1H, J=9,2 Гц), 7,62 (дд, 1H, J=8,6, 2,0 Гц), 7,24 (с, 1H), 4,33 (кв., 2H, J=7,0 Гц), 1,57 (с, 9H), 1,32 (т, 3H, J=7,0 Гц)
Справочный пример 112
[Формула 145]
1-ая стадия
Карбонат калия (200 мг) и простой 2-хлорэтилметиловый эфир (0,1 мл) добавляли к раствору DMF (1,5 мл), содержащему 4-нитро-1H-индазол (80 мг), с последующим перемешиванием при 60°C в течение 4 часов. Затем нерастворимый осадок собирали фильтрацией и промывали этилацетатом, и смесь таким образом получали 1-(2-метоксиэтил)-4-нитро-1H-индазола и 2-(2-метоксиэтил)-4-нитро-2H-индазола.
1-(2-метоксиэтил)-4-нитро-1H-индазол
MS (ESI m/z): 222 (M+H)
RT (мин.): 1,19
2-(2-метоксиэтил)-4-нитро-2H-индазол
MS (ESI m/z): 222 (M+H)
RT (мин.): 1,12
2-ая стадия
Порошок железа (170 мг), хлорид аммония (160 мг) и воду (3 мл) добавляли к раствору этанола (10 мл), содержащему смесь, полученную на 1-ой стадии, с последующим перемешиванием при 80°C в течение 2 часов. К реакционному раствору добавляли этилацетат, нерастворимое вещество удаляли, фильтраты объединяли, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на колонках с силикагелем и оксидом алюминия, и таким образом получали 1-(2-метоксиэтил)-1H-индол-4-амин (49 мг) и 2-(2-метоксиэтил)-2H-индол-4-амин (40 мг).
1-(2-метоксиэтил)-1H-индазол-4-амин
MS (ESI m/z): 192 (M+H)
RT (мин.): 0,72
2-(2-метоксиэтил)-2H-индазол-4-амин
MS (ESI m/z): 192 (M+H)
RT (мин.): 0,53
Справочный пример 113
Следующие соединения получали как описано в Справочном примере 112.
[Формула 146]
1-(циклопропилметил)-1H-индазол-4-амин
MS (ESI m/z): 188 (M+H)
RT (мин.): 1,03
2-(циклопропилметил)-2H-индазол-4-амин
MS (ESI m/z): 188 (M+H)
RT (мин.): 0,69
Справочный пример 114
Следующие соединения получали как описано в Справочном примере 112.
[Формула 147]
1-(2-(2-этоксиэтокси)этил)-1H-индазол-4-амин
MS (ESI m/z): 250 (M+H)
RT (мин.): 0,89
2-(2-(2-этоксиэтокси)этил)-2H-индазол-4-амин
MS (ESI m/z): 250 (M+H)
RT (мин.): 0,71
Справочный пример 115
Следующие соединения получали как описано в Справочном примере 112.
[Формула 148]
1-(циклопропилметил)-1H-индазол-6-амин
1H-ЯМР (DMSO-d6, 300 МГц) δ: 8,81 (с, 1H), 8,32 (с, 1H), 8,02 (д, 1H, J=8,6 Гц), 7,95 (дд, 1H, J=8,6, 1,7 Гц), 4,49 (д, 2H, J=7,3 Гц), 1,32 (дд, 1H, J=12,2, 7,3 Гц), 0,47 (м, 4H)
2-(циклопропилметил)-2H-индазол-6-амин
1H-ЯМР (DMSO-d6, 300 МГц) δ: 8,69 (с, 1H), 8,64 (с, 1H), 7,99 (д, 1H, J=9,2 Гц), 7,82 (дд, 1H, J=9,2, 2,0 Гц), 4,40 (д, 2H, J=7,3 Гц), 1,49-1,37 (м, 1H), 0,63-0,54 (м, 2H), 0,51-0,46 (м, 2H)
Справочный пример 116
Следующие соединения получали как описано в Справочном примере 112.
[Формула 149]
6-амино-1-(метоксиэтил)-1H-индазол
1H-ЯМР (DMSO-d6, 300 МГц) δ: 8,74 (д, 1H, J=2,0 Гц), 8,33 (с, 1H), 8,01 (д, 1H, J=8,6 Гц), 7,95 (дд, 1H, J=8,6, 2,0 Гц), 4,75 (т, 2H, J=5,0 Гц), 3,77 (т, 2H, J=5,0 Гц), 3,18 (с, 3H)
6-амино-2-(метоксиэтил)-2H-индазол
1H-ЯМР (DMSO-d6, δ: 8,63 (с, 1H), 7,98 (д, 1H, J=9,2 Гц), 7,81 (дд, 1H, J=9,2, 2,0 Гц), 4,70 (т, 2H, J=5,0 Гц), 3,86 (т, 2H, J=5,0 Гц), 3,23 (с, 3H)
Справочный пример 117
Следующие соединения получали как описано в Справочном примере 112.
[Формула 150]
6-амино-1-(2-(2-этоксиэтокси)этил)-1H-индазол
1H-ЯМР (DMSO-d6, 300 МГц) δ: 8,75 (с, 1H), 8,33 (с, 1H), 8,00 (д, 1H, J=9,2 Гц), 7,94 (дд, 1H, J=9,2, 1,7 Гц), 4,75 (т, 2H, J=5,0 Гц), 3,84 (т, 2H, J=5,0 Гц), 3,45 (т, 2H, J=4,9 Гц), 3,32 (т, 2H, J=4,9 Гц), 3,24 (кв., 2H, J=7,0 Гц), 0,94 (т, 3H, J=7,0 Гц)
6-амино-2-(2-(2-этоксиэтокси)этил)-2H-индазол
1H-ЯМР (DMSO-d6, 300 МГц) δ: 8,64 (с, 1H), 7,98 (д, 1H, J=9,2 Гц), 7,82 (дд, 1H, J=9,2, 2,0 Гц), 4,70 (т, 2H, J=5,3 Гц), 3,95 (т, 2H, J=5,3 Гц), 3,51 (т, 2H, J=5,0 Гц), 3,40 (т, 2H, J=5,0 Гц), 3,28 (кв., 2H, J=6,9 Гц), 1,02 (т, 3H, J=6,9 Гц) Справочный пример 118
[Формула 151]
Карбонат калия (200 мг) и 1-(бромметил)циклопропан (0,1 мл) добавляли к раствору DMF (1,5 мл), содержащему 5-бром-1H-индазол (100 мг), с последующим перемешиванием при 60°C в течение 4 часов. К реакционному раствору добавляли этилацетат, нерастворимый осадок удаляли, и органический слой промывали 1M соляной кислотой (×2) и насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученное твердое вещество очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 1:1), и таким образом получали 5-бром-1-(циклопропилметил)-1H-индазол (63 мг) и 5-бром-2-(циклопропилметил)-2H-индазол (42 мг).
5-бром-1-(циклопропилметил)-1H-индазол
MS (ESI m/z): 251, 253 (M+H)
RT (мин.): 1,65
5-бром-2-(циклопропилметил)-2H-индазол
MS (ESI m/z): 251, 253 (M+H)
RT (мин.): 1,50
Справочный пример 119
Следующие соединения получали как описано в Справочном примере 118
[Формула 152]
5-бром-1-(2-(2-этоксиэтокси)этил)-1H-индазол
MS (ESI m/z): 313, 315 (M+H)
RT (мин.): 1,49
5-бром-2-(2-(2-этоксиэтокси)этил)-2H-индазол
MS (ESI m/z): 313, 315 (M+H)
RT (мин.): 1,39
Справочный пример 120
Следующие соединения получали как описано в Справочном примере 118.
[Формула 153]
5-бром-1-(метоксиэтил)-1H-индазол
MS (ESI m/z): 255, 257 (M+H)
RT (мин.): 1,37
5-бром-2-(метоксиэтил)-2H-индазол
MS (ESI m/z): 255, 257 (M+H)
RT (мин.): 1,25
Справочный пример 121
Следующее соединение получали, как описано в Bioorganic and Medicinal Chemistry Letters, 2001, vol. 11, #11, pp. 1401-1406.
[Формула 154]
2-бензил-2H-индазол-5-амин
Справочный пример 122
[Формула 155]
1-ая стадия
Триэтиламин (8,3 мл), DPPA (12,8 мл) и трет-бутанол (7,6 мл) добавляли к раствору толуола (100 мл), содержащему 5-бром-никотиновую кислоту (10 г), с последующим перемешиванием в 100°C в течение 2,5 часов. Реакционный раствор лили в воду, с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, добавляли н-гексан:этилацетат (=10:1), и нерастворимый осадок собирали фильтрацией, и таким образом получали твердое вещество белого цвета (5-бромпиридин-3-ил)бензилкарбамат (10,8 г).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 10,25 (с, 1H), 8,59 (д, 1H, J=2,2 Гц), 8,34 (д, 1H, J=2,2 Гц), 8,20-8,15 (м, 1H), 7,46-7,33 (м, 5H), 5,19 (с, 2H)
2-ая стадия
Следующее соединение получали как описано в Справочном примере 22.
(5-(проп-1-ен-2-ил)пиридин-3-ил)бензилкарбамат
MS (ESI m/z): 269 (M+H), 267 (М-Н)
1H-ЯМР (DMSO-d6, 400 МГц) δ: 10,02 (с, 1H), 8,57-8,54 (м, 1H), 8,39 (д, 1H, J=2,0 Гц), 8,00 (с, 1H), 7,46-7,32 (м, 5H), 5,46 (с, 1H), 5,22-5,20 (м, 1H), 5,18 (с, 2H), 2,10 (с, 3H)
3-я стадия
10%-ый Pd/C (106 мг) добавляли к раствору метанол/этилацетат (2 мл/2 мл), содержащему (5-(проп-1-ен-2-ил)пиридин-3-ил)бензилкарбамат (64 мг), полученный на 2-ой стадии, с последующим перемешиванием при комнатной температуре в течение 2 часов в атмосфере водорода. Нерастворимое вещество удаляли через Целит, растворитель отгоняли при пониженном давлении, и таким образом получали бесцветное масляное вещество изопропилпиридин-3-амин (30 мг).
MS (ESI m/z): 137 (M+H)
1H-ЯМР (DMSO-d6, 400 МГц) δ: 7,74 (д, 1H, J=2,7 Гц), 7,65-7,63 (м, 1H), 6,78-6,75 (м, 1H), 5,17 (ушир., 2H), 2,80-2,71 (м, 1H), 1,17 (с, 3H), 1,15 (с, 3H)
Справочный пример 123
Следующее соединение получали, как описано в US2003/125267 A1.
[Формула 156]
[2,2'-бипиридин]-4-амин
Справочный пример 124
[Формула 157]
Карбонат цезия (213 мг), пирролидин-2-он (45 мг), Xantphos (76 мг) и Pd2(dba)3 (60 мг) добавляли в атмосфере азота к раствору 1,4-диоксана (4 мл), содержащему 3,5-дибромпиридин (100 мг), с последующим нагреванием с обратным холодильником в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли воду, с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 3:1 до 1:1), и таким образом получали твердое вещество белого цвета 1-(5-бромпиридин-3-ил)пирролидин-2-он (45 мг).
MS (ESI m/z): 241, 243 (M+H)
RT (мин.): 0,91
Справочный пример 125
[Формула 158]
1-ая стадия
Следующее соединение получали как описано в Справочном примере 124.
2-метил-5-нитро-3-(пирролидин-1-ил)пиридин
MS (ESI m/z): 208 (M+H)
1H-ЯМР (DMSO-d6, 400 МГц) δ: 8,79 (д, 1H, J=2,3 Гц), 7,70 (д, 1H, J=2,3 Гц), 3,38-3,32 (м, 4H), 2,67 (с, 3H), 2,05-2,00 (м, 4H)
2-ая стадия
10%-ый Pd/C (15 мг) добавляли к раствору метанол/этилацетат (2 мл/2 мл), содержащему 2-метил-5-нитро-3-(пирролидин-1-ил)пиридин (16 мг), с последующим перемешиванием при комнатной температуре в течение 2,5 часов в атмосфере водорода. Нерастворимое вещество удаляли через Целит, растворитель отгоняли при пониженном давлении, и таким образом получали бесцветное масляное вещество 6-метил-5-(пирролидин-1-ил)пиридин-3-амин (15 мг).
1H-ЯМР (CDCl3, 400 МГц) δ: 7,58 (д, 1H, J=2,4 Гц), 6,47 (д, 1H, J=2,4 Гц), 3,47 (ушир., 2H), 3,21-3,15 (м, 4H), 2,45 (с, 3H), 1,96-1,91 (м, 4H)
Справочный пример 126
Следующее соединение получали как описано в Справочном примере 124.
[Формула 159]
1-(5-бромпиридин-3-ил)пиперидин-2-он
MS (ESI m/z): 255, 257 (M+H)
RT (мин.): 0,88
Справочный пример 127
Следующие соединения получали как описано в Справочном примере 124 и 2-ой стадии Справочного примера 97.
[Формула 160]
(2-(2-оксопирролидин-1-ил)пиридин-4-ил)трет-бутилкарбамат
MS (ESI m/z): 278 (M+H)
RT (мин.): 0,89
1-(4-аминопиридин-2-ил)пирролидин-2-он
MS (ESI m/z): 178 (M+H)
RT (мин.): 0,21, 0,30
Справочный пример 128
[Формула 161]
1-ая стадия
Следующее соединение получали как описано в Справочном примере 22.
3-(5-бромпиридин-3-ил)фенол
MS (ESI m/z): 250, 252 (M+H)
RT (мин.): 1,23
2-ая стадия
Карбонат калия (17 мг) и простой 2-хлорэтилметиловый эфир (9 мг) добавляли к раствору N,N-диметилацетамида (2 мл), содержащему 3-(5-бромпиридин-3-ил)фенол (20 мг), полученный на 1-ой стадии, с последующим перемешиванием при 80°C в течение 6 часов. Добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 7:1 до 3:1), и таким образом получали бесцветное масляное вещество 3-бром-5-(3-(2-метоксиэтокси)фенил)пиридин (18 мг).
MS (ESI m/z): 308, 310 (M+H)
RT (мин.): 1,62
Справочный пример 129
Следующее соединение получали как описано в Справочном примере 128.
[Формула 162]
4-(5-бромпиридин-3-ил)фенол
MS (ESI m/z): 250, 252 (M+H)
Минута RT (мин): 1,20
3-бром-5-(4-(2-метоксиэтокси)фенил)пиридин
MS (ESI m/z): 308, 310 (M+H)
Минута RT (мин): 1,50
Справочный пример 130
Следующее соединение получали как описано в Справочном примере 128.
[Формула 163]
4-(5-бромпиридин-3-ил)фенол
MS (ESI m/z): 250, 252 (M+H)
RT (мин.): 1,20
4-(2-(4-(5-бромпиридин-3-ил)фенокси)этил)морфолин
MS (ESI m/z): 363, 365 (M+H)
RT (мин.): 0,90
Справочный пример 131
Следующее соединение получали как описано на 2-ой стадии Справочного примера 128.
[Формула 164]
4-(2-(3-(5-бромпиридин-3-ил)фенокси)этил)морфолин
MS (ESI m/z): 363, 365 (M+H)
RT (мин.): 0,95
Справочный пример 132
[Формула 165]
Изопропанольный раствор (2 мл), содержащий 2-хлорпиридин-4-амин (300 мг) и гидроксид натрия (467 мг), добавляли в пробирку, и пробирку герметизировали с последующим перемешиванием при 170°C в течение 3 часов. Реакционный раствор охлаждали до комнатной температуры. Добавляли насыщенный солевой раствор с последующей экстракцией этилацетатом. Затем результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 4:1 до 1:1), и таким образом получали светло-желтое масляное вещество 2-изопропоксипиридин-4-амин (168 мг).
MS (ESI m/z): 153 (M+H)
RT (мин.): 0,46
Справочный пример 133
Следующее соединение получали как описано в Справочном примере 132.
[Формула 166]
2-(2-(пирролидин-1-ил)этокси)пиридин-4-амин
MS (ESI m/z): 208 (M+H)
RT (мин.): 0,21
Справочный пример 134
Следующее соединение получали как описано в Справочном примере 132.
[Формула 167]
2-(2-метоксиэтокси)-6-фенилпиридин-4-амин
MS (ESI m/z): 245 (M+H)
RT (мин.): 0,69
Справочный пример 135
Следующие соединения получали как описано в Tetrahedron, 2004, vol. 60, p. 5487.
[Формула 168]
8-бром-2-фториндолизин-3-этилкарбоксилат
6-бром-2-фториндолизин-3-этилкарбоксилат
Справочный пример 136
Следующее соединение получали, как описано в US2009/270405 A1.
[Формула 169]
5-фенилпиридин-3-амин
Справочный пример 137
Следующее соединение получали, как описано в Journal of the American Chemical Society, 1946, vol. 68, p. 1544.
[Формула 170]
3-бромхинолин-8-амин
Справочный пример 138
[Формула 171]
Раствор DMF (2 мл), содержащий 3-бромхинолин-8-амин (223 мг), диметилсульфат (189 мг), карбонат калия (415 мг) и йодид натрия (20 мг) добавляли в пробирку и пробирку закупоривали с последующим перемешиванием при 95°C в течение 17 часов. Реакционный раствор охлаждали до комнатной температуры, добавляли этилацетат, нерастворимый осадок удаляли, и органический слой промывали 1M соляной кислотой, водой и насыщенным солевым раствором. Затем органический слой высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 0:1 до 1:1), и таким образом получали твердое вещество желтого цвета 3-бром-N-метилхинолин-8-амин (52 мг).
MS (ESI m/z): 237, 239 (M+H)
RT (мин.): 1,76
Справочный пример 139
[Формула 172]
1-ая стадия
п-толуолсульфонил хлорид (2 г) и тетрабутил аммоний гидросульфат (250 мг) добавляли к раствору толуола (20 мл), содержащему 5-хлориндол (1,52 г), с последующим перемешиванием при комнатной температуре в течение 11 часов. К реакционному раствору добавляли воду, с последующей экстракцией этилацетатом. Результант промывали водой (×3) и насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 0:1 до 1:1), и таким образом получали бесцветное твердое вещество 5-хлор-1-тозил-1H-индол (3,18 г).
2-ая стадия
Литий диизопропиламид (2M раствор тетрагидрофурана) (3,41 мл) при -78°C в атмосфере азота медленно добавляли к тетрагидрофурановому (65 мл) раствору, содержащему 5-хлор-1-тозил-1H-индол (1,98 г), полученный на 1-ой стадии. Реакционный раствор охлаждали до комнатной температуры. Затем добавляли триметил хлорид олова (1,36 г), с последующим перемешиванием в течение 17 часов. К реакционному раствору добавляли насыщенный водный раствор фторида калия, и тетрагидрофуран отгоняли при пониженном давлении. Добавляли этилацетат, результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 0:1 до 1:1), и таким образом получали бесцветное вязкое масляное вещество 5-хлор-1-тозил-2-(триметилстаннил)-1H-индол (2,05 г).
3-я стадия
N-фтор-N'-(хлорметил)триэтилендиамин бис(тетрафторборат) (2,33 г) добавляли в атмосфере азота к раствору ацетонитрила (88 мл), содержащему 5-хлор-1-тозил-2-(триметилстаннил)-1H-индол (2,05 г), полученный на 2-ой стадии, с последующим перемешиванием при комнатной температуре в течение 16 часов. К реакционному раствору добавляли хлороформ, нерастворимый осадок удаляли, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 0:1 до 1:100), и таким образом получали твердое вещество светло-желтого цвета 5-хлор-2-фтор-1-тозил-1H-индол (520 мг).
4-ая стадия
Гидроксид калия (246 мг) добавляли к раствору тетрагидрофуран/этанол (3 мл/6 мл), содержащему 5-хлор-2-фтор-1-тозил-1H-индол (520 мг), полученный на 3-ей стадии, с последующим перемешиванием при 50°C в течение 17 часов. К реакционному раствору добавляли воду, с последующей экстракцией этилацетатом (×2). Органические слои объединяли и промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 0:1 до 1:1), и таким образом получали светло-желтое масляное вещество 5-хлор-2-фтор-1H-индол (69 мг).
5-ая стадия
Гидрид натрия (60 % в масле) (16 мг) добавляли при комнатной температуре к раствору DMF (1 мл), содержащему 5-хлор-2-фтор-1H-индол (45 мг), полученный на 4-ой стадии, с последующим перемешиванием в течение 10 минут. Затем добавляли диметил сульфат (50 мг), с последующим перемешиванием при комнатной температуре в течение 30 минут. К реакционному раствору добавляли воду, с последующей экстракцией этилацетатом, результант промывали водой (×3) и насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали PLC (н-гексан:этилацетат = 10:1), и таким образом получали 5-хлор-2-фтор-1-метил-1H-индол (18 мг).
Справочный пример 140
[Формула 173]
Толуолсульфонилметилизоцианид (126 мг) и 1,8-диазабицикло[5,4,0]ундец7-ен (122 мг) при комнатной температуре добавляли к дихлорметановому (4 мл) раствору, содержащему 5-бром-3-пиридинкарбоксальдегид (100 мг), с последующим перемешиванием в течение 5 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 4:1 до 5:2), и таким образом получали твердое вещество белого цвета 5-(5-бромпиридин-3-ил)оксазол (96 мг).
MS (ESI m/z): 225, 227 (M+H)
RT (мин.): 1,00
Справочный пример 141
[Формула 174]
1-ая стадия
Следующее соединение получали как описано в Справочном примере 22.
(5-(5-метилфуран-2-ил)пиридин-3-ил)трет-бутилкарбамат
MS (ESI m/z): 275 (M+H)
RT (мин.): 1,46
2-ая стадия
TFA (1 мл) добавляли к раствору хлороформа (2 мл), содержащему (5-(5-метилфуран-2-ил)пиридин-3-ил)трет-бутилкарбамат (61 мг), полученный на 1-ой стадии, с перемешиванием при комнатной температуре в течение 2 часов. Растворитель отгоняли при пониженном давлении, полученный остаток растворяли в хлороформе, и результант промывали водой и насыщенным водным раствором гидрокарбоната натрия. Затем водные слои объединяли, с последующей экстракцией хлороформом (×2). Органические слои объединяли и высушивали над безводным сульфатом натрия. Растворитель отгоняли из полученных органических слоев при пониженном давлении, и таким образом получали твердое вещество белого цвета 5-(5-метилфуран-2-ил)пиридин-3-амин (46 мг).
MS (ESI m/z): 175 (M+H)
RT (мин.): 0,63
Справочный пример 142
Следующие соединения получали как описано в Справочном примере 141.
[Формула 175]
(2-(5-метилфуран-2-ил)пиридин-4-ил)трет-бутилкарбамат
MS (ESI m/z): 275 (M+H)
RT (мин.): 1,10
2-(5-метилфуран-2-ил)пиридин-4-амин
MS (ESI m/z): 175 (M+H)
RT (мин.): 0,59
Справочный пример 143
[Формула 176]
1-ая стадия
Триэтиламин (200 мг), бис(пинаколято)диборон (127 мг), 2-дициклогексилфосфино-2',6'-диметоксибифенил (100 мг) и бис(ацетонитрил)палладий дихлорид (17 мг) добавляли в атмосфере азота к раствору (4 мл) 1,4-диоксана, содержащему 3-бром-1-(триизопропилсилил)пиррол (200 мг), с последующим перемешиванием в течение 10 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 100:1 до 10:1), и таким образом получали светло-желтое масляное вещество 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-(триизопропилсилил)-1H-пиррол (58 мг).
MS (ESI m/z): 350 (M+H)
RT (мин.): 2,56
2-ая стадия
Следующее соединение получали как описано в Справочном примере 22.
5-(1-(триизопропилсилил)-1H-пиррол-3-ил)пиридин-3-амин
MS (ESI m/z): 316 (M+H)
RT (мин.): 1,43
Справочный пример 144
[Формула 177]
1-ая стадия
Следующее соединение получали как описано в Справочном примере 22.
3-бром-5-(1-(триизопропилсилил)-1H-пиррол-3-ил)пиридин
MS (ESI m/z): 379, 381 (M+H)
RT (мин.): 2,38
2-ая стадия
Тетрабутиламмоний фторид (1M раствор в тетрагидрофуране: 1 мл) добавляли к тетрагидрофурановому (2 мл) раствору, содержащему 3-бром-5-(1-(триизопропилсилил)-1H-пиррол-3-ил)пиридин (71 мг), с последующим перемешиванием при комнатной температуре в течение 2 часов. Реакционный раствор лили в воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 5:1 до 2:1), и таким образом получали твердое вещество белого цвета 3-бром-5-(1H-пиррол-3-ил)пиридин (28 мг).
MS (ESI m/z): 223, 225 (M+H)
RT (мин.): 1,06
3-я стадия
Гидрид натрия (60 % в масле) (6 мг) добавляли к раствору DMF (1 мл), содержащему 3-бром-5-(1H-пиррол-3-ил)пиридин (28 мг), с последующим перемешиванием. Добавляли метил йодид (9 мкл), с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционный раствор лили в воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 30:1 до 3:1), и таким образом получали твердое вещество белого цвета 3-бром-5-(1-метил-1H-пиррол-3-ил)пиридин (18 мг).
MS (ESI m/z): 237, 239 (M+H)
RT (мин.): 1,29
Справочный пример 145
[Формула 178]
1-ая стадия
Карбонат цезия (300 мг), фенилбороновую кислоту (82 мг) и бис(трифенилфосфин)палладий дихлорид (43 мг) добавляли в атмосфере азота к тетрагидрофурановому (2 мл) раствору, содержащему 4-амино-2,6-дихлорпиридин (100 мг), с последующим перемешиванием в течение 8,5 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 9:1 до 6:1), и таким образом получали бесцветное масляное вещество 2-хлор-6-фенилпиридин-4-амин (26 мг).
MS (ESI m/z): 205, 207 (M+H)
RT (мин.): 1,02
2-ая стадия
Метилат натрия (28%-ый метанольный раствор) (1 мл) добавляли при комнатной температуре к метанольному раствору (2 мл), содержащему 2-хлор-6-фенилпиридин-4-амин (26 мг), полученный на 1-ой стадии, с последующим перемешиванием при 150°C в течение 6,5 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 50:1 до 6:1), и таким образом получали 2-метокси-6-фенилпиридин-4-амин (6 мг).
MS (ESI m/z): 201 (M+H)
RT (мин.): 0,64
Справочный пример 146
[Формула 179]
1-ая стадия
N-бромсукцинимид (360 мг) добавляли к раствору в уксусной кислоте (6 мл), содержащему 7-нитрохинолин (700 мг), с последующим перемешиванием при 110°C в течение 3 часов. Снова добавляли N-бромсукцинимид (360 мг) с последующим перемешиванием при 110°C в течение 10 минут. Реакционный раствор лили в воду со льдом, нерастворимый осадок собирали фильтрацией, и таким образом получали 3-бром-7-нитрохинолин светло-коричневого цвета (660 мг).
MS (ESI m/z): 253, 255 (M+H)
RT (мин.): 1,44
2-ая стадия
12M соляную кислоту (2 мл) и 3-бром-7-нитрохинолин (660 мг), полученный на 1-ой стадии, добавляли к суспензии порошка железа (3,61 г), этанола (33 мл) и воды (2 мл), с последующим нагреванием с обратным холодильником в течение 4 часов. Затем добавляли 6M соляную кислоту (4 мл), с последующим нагреванием с обратным холодильником в течение 2,5 часов. Затем растворитель отгоняли при пониженном давлении, и нерастворимый осадок отфильтровывали и промывали этилацетатом. Затем фильтрат собирали, растворитель снова отгоняли при пониженном давлении, 28%-ый водный раствор гидроксида аммония добавляли к полученному масляному веществу, и твердый осадок отфильтровывали и промывали водой. Затем полученное твердое вещество растворяли в этилацетате, нерастворимый осадок удаляли, и растворитель отгоняли при пониженном давлении. Затем к полученному твердому веществу добавляли простой диизопропиловый эфир, нерастворимый осадок собирали фильтрацией, и таким образом получали смесь светло-коричневого твердого вещества 3-бром-7-нитрохинолина и 3-бромхинолин-7-амина (170 мг).
MS (ESI m/z): 223, 225 (M+H)
RT (мин.): 0,65
3-я стадия
Карбонат калия (92 мг), йодид натрия (10 мг) и бис(2-хлорэтокси)этан (64 мг) добавляли в пробирку, содержащую раствор DMF (0,5 мл), содержащий часть (50 мг) смеси, полученной на 2-ой стадии, и пробирку закупоривали, с последующим перемешиванием при 130°C в течение 14 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали водой (×3) и насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 1:1), и таким образом получали твердое вещество желтого цвета 4-(3-бромхинолин-7-ил)морфолин (15 мг).
MS (ESI m/z): 278, 280 (M+H)
RT (мин.): 1,45
Справочный пример 147
[Формула 180]
1-ая стадия
55%-ый раствор серной кислоты (420 мл), содержащий часть (33 мг) смеси, полученной на 2-ой стадии Справочного примера 146, облучали в микроволновой печи (Initiator™, 220°C, 1 час, 2,45 ГГц, 0-240 Вт). К реакционному раствору добавляли воду со льдом и нейтрализовали 28%-ой аммиачной водой, с последующей экстракцией этилацетатом (×2). Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество светло-коричневого цвета 3-бромхинолин-7-ол (21 мг).
2-ая стадия
Гидрид натрия (61 % в масле) и простой 2-хлорэтилметиловый эфир (6 мг) добавляли в атмосфере азота к раствору DMF (0,5 мл), содержащему 3-бромхинолин-7-ол (21 мг), полученный на 1-ой стадии, с последующим перемешиванием при 120°C в течение 30 минут. К реакционному раствору добавляли воду, нерастворимый осадок собирали фильтрацией, и таким образом получали 3-бром-7-(2-метоксиэтокси)хинолин светло-коричневого цвета (17 мг).
MS (ESI m/z): 282, 284 (M+H)
RT (мин.): 1,33
Справочный пример 148-1
Следующее соединение получали, как описано в Monatshefte fuer Chemie, 1991, vol. 122, # 11, pp. 935-942.
[Формула 181]
3-бромхинолин-8-ол
Справочный пример 148-2
Следующее соединение получали как описано на 2-ой стадии Справочного примера 147.
[Формула 182]
3-бром-8-(2-метоксиэтокси)хинолин
MS (ESI m/z): 282, 284 (M+H)
RT (мин.): 1,25
Справочный пример 149
[Формула 183]
Карбонат калия (92 мг) и простой 2-хлорэтилметиловый эфир (32 мг) добавляли в пробирку, содержащую раствор DMF (0,5 мл), содержащий 3-бромхинолин-8-амин (50 мг), и пробирку закупоривали с последующим перемешиванием при 110°C-130°C в течение 22 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали водой (×3) и насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 1:1), и таким образом получали светло-желтое масляное вещество 3-бром-N-(2-метоксиэтил)хинолин-8-амин (15 мг).
MS (ESI m/z): 281, 283 (M+H)
RT (мин.): 1,86
Справочный пример 150
[Формула 184]
Карбонат калия (92 мг) и диметилсульфат (100 мг) добавляли к раствору DMF (0,5 мл), содержащему часть (50 мг) смеси, полученной на 2-ой стадии Справочного примера 146, с последующим перемешиванием при 60°C в течение 5 часов и при 80°C в течение 3 часов. Реакционный раствор разбавляли этилацетатом, нерастворимое вещество удаляли, растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 9:1), и таким образом получали твердое вещество светло-желтого цвета 3-бром-N,N-диметилхинолин-7-амин (25 мг).
MS (ESI m/z): 251, 253 (M+H)
RT (мин.): 1,42
Справочный пример 151
[Формула 185]
Морфолин (1 мл) добавляли к 2-хлор-6-фенилпиридин-4-амину (30 мг) с последующим перемешиванием при 130°C в течение 2 часов и 170°C в течение 4 часов. Реакционный раствор охлаждали до комнатной температуры и добавляли 10%-ый солевой раствор с последующей экстракцией этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этил ацетат = от 2:1 до 1:2), и таким образом получали бесцветное масляное вещество 2-морфолино-6-фенилпиридин-4-амин (24 мг).
MS (ESI m/z): 256 (M+H)
RT (мин.): 0,71
Справочный пример 152
[Формула 186]
Воду (0,5 мл), карбонат натрия (92 мг), 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-трет-бутилкарбоксилат (203 мг) и бис(три-трет-бутилфосфин)палладий (30 мг) добавляли в атмосфере азота к тетрагидрофурановому (4,5 мл) раствору, содержащему 5-бромпиридин-3-амин (100 мг), с последующим перемешиванием в течение 2,75 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол = от 1:0 до 30:1), и таким образом получали твердое вещество белого цвета трет-бутил-4-(5-аминопиридин-3-ил)-1H-пиразол-1-карбоксилат (52 мг).
MS (ESI m/z): 261 (M+H)
RT (мин.): 0,75
Справочный пример 153
Следующее соединение получали как описано в Справочном примере 152.
[Формула 187]
MS (ESI m/z): 261 (M+H)
RT (мин.): 0,74
Справочный пример 154
[Формула 188]
Карбонат калия (69 мг), йодид натрия (20 мг) и 2-(2-этоксиэтокси)этил-4-метилбензолсульфонат (Tetrahedron Letters, 2009, vol. 50, # 37, pp. 5231-5234) добавляли в пробирку, содержащую раствор DMF (2 мл), содержащий 3-бромхинолин-8-амин (223 мг), и пробирку закупоривали с последующим перемешиванием при 130°C в течение 7 часов. Реакционный раствор охлаждали до комнатной температуры и добавляли воду с последующей экстракцией этилацетатом. Результант промывали водой (×3) и насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = 1:7), и таким образом получали светло-желтое масляное вещество 3-бром-N-(2-(2-этоксиэтокси)этил)хинолин-8-амин (40 мг).
MS (ESI m/z): 339, 341 (M+H)
RT (мин.): 1,82
Справочный пример 155
Следующее соединение получали как описано в Справочном примере 154.
[Формула 189]
3-бром-N-(циклопропилметил)хинолин-8-амин
MS (ESI m/z): 277, 279 (M+H)
RT (мин.): 2,05
Справочный пример 156
[Формула 190]
Смесь 3-бромхинолин-8-амина (38 мг), 48%-ого водного раствора фторборной кислоты (0,5 мл) и нитрита натрия (16 мг) перемешивали при комнатной температуре в течение 1 часа. В реакционный раствор лили воду, и нерастворимый осадок собирали фильтрацией. Затем твердое вещество, собранное фильтрацией, растворяли в 1,2-дихлорбензоле (1 мл) и перемешивали при 130°C в течение 1 часа и при 190°C в течение 0,5 часа. К реакционному раствору добавляли 1M соляную кислоту с последующей экстракцией этилацетатом. Результант промывали водой (×2) и насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 1:1), и таким образом получали 3-бром-8-фторхинолин-8-амин (32 мг).
MS (ESI m/z): 226, 228 (M+H)
RT (мин.): 1,34
Справочный пример 157-1
Следующее соединение получали, как описано в Monatshefte fuer Chemie, 1994, vol. 125, # 6/7, pp. 723-730.
[Формула 191]
6-бромхинолин-8-амин
Справочный пример 157-2
[Формула 192]
Карбонат калия (69 мг), йодид натрия (5 мг) и диметилсульфат (31 мг) добавляли к раствору DMF (1 мл), содержащему 6-бромхинолин-8-амин (37 мг), с последующим перемешиванием при 100°C в течение 14 часов. Реакционный раствор охлаждали до комнатной температуры и добавляли воду, с последующей экстракцией этилацетатом. Органический слой промывали водой (×3) и насыщенным солевым раствором, и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 1:1), и таким образом получали 6-бром-N-метилхинолин-8-амин (17 мг).
MS (ESI m/z): 237, 239 (M+H)
RT (мин.): 1,68
Справочный пример 158
[Формула 193]
Карбонат калия (69 мг), йодид натрия (5 мг) и 2-метоксиэтил хлорид (24 мг) добавляли к раствору DMF (1 мл), содержащему 6-бромхинолин-8-амин (37 мг), с последующим перемешиванием при 140°C в течение 12 часов. Затем добавляли карбонат цезия (160 мг), йодид натрия (20 мг), N,N-диметил-4-аминопиридин (100 мг) и 2-метоксиэтил хлорид (120 мг), с последующим перемешиванием при 160°C в течение 4,5 часов. Реакционный раствор охлаждали до комнатной температуры и добавляли воду с последующей экстракцией этилацетатом. Результант промывали водой (×3) и насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 4:1), и таким образом получали 6-бром-N-(2-метоксиэтил)хинолин-8-амин (10 мг).
MS (ESI m/z): 281, 283 (M+H)
RT (мин.): 1,68
Справочный пример 159
[Формула 194]
1-ая стадия
Карбонат цезия (214 мг), пиррол (30 мг), Xantphos (63 мг) и Pd2(dba)3 (50 мг) добавляли в атмосфере азота к раствору 1,4-диоксана (5 мл), содержащему (5-бромпиридин-3-ил)трет-бутилкарбамат (100 мг), с последующим перемешиванием при 100°C в течение 8 часов. Реакционный раствор охлаждали до комнатной температуры и добавляли воду с последующей экстракцией этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 5:1 до 1:1), и таким образом получали твердое вещество светло-желтого цвета (5-(1H-пиррол-1-ил)пиридин-3-ил)трет-бутилкарбамат (36 мг).
MS (ESI m/z): 260 (M+H)
RT (мин.): 1,38
2-ая стадия
TFA (1 мл) добавляли к раствору хлороформа (1 мл), содержащему (5-(1H-пиррол-1-ил)пиридин-3-ил)трет-бутилкарбамат (36 мг), полученный на 1-ой стадии, с последующим перемешиванием при комнатной температуре в течение 1 часа. Затем растворитель отгоняли при пониженном давлении, и остаток добавляли к смеси хлороформа, воды и 1M водного раствора гидроксида натрия, с последующей экстракцией хлороформом. Результант высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество светло-коричневого цвета 5-(1H-пиррол-1-ил)пиридин-3-амин (23 мг).
MS (ESI m/z): 160 (M+H)
RT (мин.): 0,52
Справочный пример 160
Следующие соединения получали как описано в Справочном примере 159.
[Формула 195]
(2-(1H-пиррол-1-ил)пиридин-4-ил)трет-бутилкарбамат
MS (ESI m/z): 260 (M+H)
RT (мин.): 1,55
2-(1H-пиррол-1-ил)пиридин-4-амин
MS (ESI m/z): 160 (M+H)
RT (мин.): 0,48
Справочный пример 161
[Формула 196]
1-ая стадия
Триэтиламин (191 мг) и морфолин (120 мг) добавляли к тетрагидрофурановому (4 мл) раствору, содержащему 3-бром-2-хлор-5-нитропиридин (300 мг), с последующим перемешиванием в течение 40 минут. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол = от 1:0 до 3:1), и таким образом получали твердое вещество желтого цвета 4-(3-бром-5-нитропиридин-2-ил)морфолин (346 мг).
MS (ESI m/z): 288, 290 (M+H)
RT (мин.): 1,37
2-ая стадия
Следующее соединение получали как описано в Справочном примере 22.
4-(3-метил-5-нитропиридин-2-ил)морфолин
MS (ESI m/z): 224 (M+H)
RT (мин.): 1,20
3-я стадия
Метанольный раствор (20 мл), содержащий 4-(3-метил-5-нитропиридин-2-ил)морфолин (67 мг), получали и подвергали реакции гидрирования (комнатная температура; 1 бар; объемная скорость потока: 1 мл/мин.; 10%-ый Pd/C) с использованием H-cube™. Затем растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество фиолетового цвета 5-метил-6-морфолинопиридин-3-амин (52,4 мг).
MS (ESI m/z): 194 (M+H)
RT (мин.): 0,46
Справочный пример 162
Следующие соединения получали как описано в Справочном примере 161.
[Формула 197]
4-(3-(фуран-3-ил)-5-нитропиридин-2-ил)морфолин
MS (ESI m/z): 276 (M+H)
RT (мин.): 1,42
5-(фуран-3-ил)-6-морфолинопиридин-3-амин
MS (ESI m/z): 246 (M+H)
RT (мин.): 0,68
Справочный пример 163
Следующее соединение получали как описано на 3-ей стадии Справочного примера 161.
[Формула 198]
6-(1H-пиразол-1-ил)пиридин-3-амин
MS (ESI m/z): 161 (M+H)
RT (мин.): 0,67
Справочный пример 164
Следующие соединения получали как описано на 2-ой и 3-ей стадиях Справочного примера 161.
[Формула 199]
3-метил-5-нитро-2-винилпиридин
MS (ESI m/z): 165 (M+H)
RT (мин.): 1,36
6-этил-5-метилпиридин-3-амин
MS (ESI m/z): 137 (M+H)
RT (мин.): 0,47
Справочный пример 165
Следующие соединения получали как описано на 2-ой и 3-ей стадиях Справочного примера 161.
[Формула 200]
2-циклопропил-3-метил-5-нитропиридин
MS (ESI m/z): 179 (M+H)
RT (мин.): 1,56
6-циклопропил-5-метилпиридин-3-амин
MS (ESI m/z): 149 (M+H)
RT (мин.): 0,52
Справочный пример 166
[Формула 201]
1-ая стадия
Карбонат калия (262 мг) и бис(2-метоксиэтил)амин (840 мг) добавляли к раствору DMF (2 мл), содержащему 2-хлор-5-нитропиридин (100 мг), с последующим перемешиванием при комнатной температуре в течение 5 часов. К реакционному раствору добавляли воду (15 мл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Нерастворимое вещество собирали фильтрацией, и таким образом получали твердое вещество белого цвета N,N-бис(2-метоксиэтил)-5-нитропиридин-2-амин (117 мг).
MS (ESI m/z): 256 (M+H)
RT (мин.): 1,26
2-ая стадия
Раствор этилацетат/метанол (10 мл/5 мл), содержащий N,N-бис(2-метоксиэтил)-5-нитропиридин-2-амин (20 мг), полученный на 1-ой стадии, получали и подвергали реакции гидрирования (комнатная температура; 1 бар; объемная скорость потока: 1 мл/мин.; 10%-ый Pd/C) с использованием H-cube™. Затем растворитель отгоняли при пониженном давлении, и таким образом получали светло-персиковое масляное вещество N2,N2-бис(2-метоксиэтил)пиридин-2,5-диамин (18 мг).
MS (ESI m/z): 226 (M+H)
RT (мин.): 0,47
Справочный пример 167
[Формула 202]
1-ая стадия
Раствор N,N-диметилформамид диметилацеталя (2 мл), содержащий 1-(5-бромпиридин-3-ил)этанон (100 мг) (WO2009/87224 A1) перемешивали при 100°C в течение 5 часов. Растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество желтого цвета 1-(5-бромпиридин-3-ил)-3-(диметиламино)проп-2-ен-1-он.
MS (ESI m/z): 255, 257 (M+H)
RT (мин.): 0,89
2-ая стадия
Гидроксиамин·гидрохлорид (42 мг) добавляли к метанольному раствору (2 мл), содержащему 1-(5-бромпиридин-3-ил)-3-(диметиламино)проп-2-ен-1-он, полученный на 1-ой стадии, с последующим нагреванием с обратным холодильником в течение 2 часов. Растворитель отгоняли при пониженном давлении, и к полученному остатку добавляли воду с последующей экстракцией этилацетатом. Затем органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 1:3), и таким образом получали твердое вещество белого цвета 5-(5-бромпиридин-3-ил)изоксазол (59,5 мг).
MS (ESI m/z): 225, 227 (M+H)
RT (мин.): 1,10
Справочный пример 168
[Формула 203]
Карбонат цезия (1,9 г) и 1H-1,2,3-триазол (540 мг) добавляли в пробирку, содержащую раствор DMF (2 мл), содержащий 2-хлорпиридин-4-амин (500 мг), и пробирку закупоривали с последующим перемешиванием при 180°C в течение 6 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:3 до 0:1), и таким образом получали твердое вещество белого цвета 2-(2H-1,2,3-триазол-2-ил)пиридин-4-амин (75,7 мг) и коричневое масляное вещество 2-(1H-1,2,3-триазол-1-ил)пиридин-4-амин (25,1 мг).
2-(2H-1,2,3-триазол-2-ил)пиридин-4-амин
1H-ЯМР (DMSO-d6, 300 МГц) δ: 8,06 (с, 2H), 7,95 (д, 1H, 5,4 Гц), 7,12 (д, 1H, J=1,8 Гц), 6,54 (дд, 1H, J=1,8, 5,4 Гц), 6,49 (ушир., 2H)
2-(1H-1,2,3-триазол-1-ил)пиридин-4-амин
1H-ЯМР (DMSO-d6, 300 МГц) δ: 8,70 (с, 1H), 7,97 (д, 1H, J=5,4 Гц), 7,91 (с, 1H), 7,23 (д, 1H, J=2,1 Гц), 6,60 (ушир., 2H), 6,57 (дд, 1H, J=2,1, 5,4 Гц)
Справочный пример 169
[Формула 204]
Имидазол (42 мг), карбонат цезия (340 мг), транс-N,N'-диметилциклогексан-1,2-диамин (74 мг) и йодид меди (50 мг) добавляли в атмосфере азота в пробирку, содержащую N,N-диметилацетамидный (2 мл) раствор, содержащий 5-бромпиридин-3-амин (90 мг), и пробирку закупоривали с последующим перемешиванием при 150°C в течение 14,5 часов. Реакционный раствор охлаждали до комнатной температуры и добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол = от 1:0 до 10:1), и таким образом получали твердое вещество коричневого цвета 5-(1H-имидазол-1-ил)пиридин-3-амин (25,8 мг).
MS (ESI m/z): 161 (M+H)
RT (мин.): 0,19
Справочный пример 170
Следующее соединение получали как описано в Справочном примере 169.
[Формула 205]
5-(1H-пиразол-1-ил)пиридин-3-амин
MS (ESI m/z): 161 (M+H)
RT (мин.): 0,38
Справочный пример 171
Следующее соединение получали, как описано в US6133253 A1.
[Формула 206]
5-бром-6-метилпиридин-3-амин
Справочный пример 172
Следующее соединение получали как описано в Справочном примере 169.
[Формула 207]
6-метил-5-(2H-1,2,3-триазол-2-ил)пиридин-3-амин
MS (ESI m/z): 176 (M+H)
RT (мин.): 0,44
1H-ЯМР (DMSO-d6, 300 МГц) δ: 8,11 (с, 2H), 7,96 (д, 1H, J=2,7 Гц), 7,25 (д, 1H, J=2,7 Гц), 5,52 (ушир., 2H), 2,32 (с, 3H)
6-метил-5-(1H-1,2,3-триазол-1-ил)пиридин-3-амин
MS (ESI m/z): 176 (M+H)
RT (мин.): 0,20, 0,27
Справочный пример 173
Следующее соединение получали как описано в Справочном примере 169.
[Формула 208]
2-(1H-пиразол-1-ил)пиридин-4-амин
MS (ESI m/z): 161 (M+H)
RT (мин.): 0,36
Справочный пример 174
Следующее соединение получали как описано в Справочном примере 169.
[Формула 209]
6-метил-5-(1H-пиразол-1-ил)пиридин-3-амин
MS (ESI m/z): 175 (M+H)
RT (мин.): 0,42
Справочный пример 175
Следующее соединение получали как описано в Справочном примере 169.
[Формула 210]
5-(1H-1,2,4-триазол-1-ил)пиридин-3-амин
MS (ESI m/z): 162 (M+H)
RT (мин.): 0,27
Справочный пример 176
Следующее соединение получали как описано в Справочном примере 169.
[Формула 211]
6-метил-5-(1H-1,2,4-триазол-1-ил)пиридин-3-амин
MS (ESI m/z): 176 (M+H)
RT (мин.): 0,27
Справочный пример 178
[Формула 212]
Гидроксид натрия (311 мг) добавляли в пробирку, содержащую н-пропанольный раствор (2 мл), содержащий 2-хлорпиридин-4-амин (200 мг), и пробирку закупоривали с последующим перемешиванием при 150°C в течение 5 часов. Реакционный раствор охлаждали до комнатной температуры и добавляли воду с последующей экстракцией толуолом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 7:3 до 2:3), и таким образом получали желтое масляное вещество 2-пропоксипиридин-4-амин (200 мг).
MS (ESI m/z): 153 (M+H)
RT (мин.): 0,48
Справочный пример 179
Следующее соединение получали как описано в Справочном примере 178.
[Формула 213]
2-бутоксипиридин-4-амин
MS (ESI m/z): 167 (M+H)
RT (мин.): 0,59
Справочный пример 180
Следующее соединение получали как описано в Справочном примере 178.
[Формула 214]
2-изобутоксипиридин-4-амин
MS (ESI m/z): 167 (M+H)
RT (мин.): 0,58
Справочный пример 181
Следующее соединение получали как описано в Справочном примере 178.
[Формула 215]
2-(3-метоксибутил)пиридин-4-амин
MS (ESI m/z): 197 (M+H)
RT (мин.): 0,51
Справочный пример 182
Следующее соединение получали как описано в Справочном примере 178.
[Формула 216]
2-(бензилокси)пиридин-4-амин
MS (ESI m/z): 201 (M+H)
RT (мин.): 0,65
Справочный пример 183
[Формула 217]
1-ая стадия
Следующее соединение получали как описано в Справочном примере 22.
4-нитро-2-(1-(триизопропилсилил)-1H-пиррол-3-ил)пиридин
MS (ESI m/z): 346 (M+H)
RT (мин.): 2,26
2-ая стадия
Следующее соединение получали как описано на 3-ей стадии Справочного примера 161.
2-(1-(триизопропилсилил)-1H-пиррол-3-ил)пиридин-4-амин
MS (ESI m/z): 316 (M+H)
RT (мин.): 1,42
Справочный пример 184
[Формула 218]
1-ая стадия
N-хлорсукцинимид (45 мг) добавляли к раствору уксусной кислоты (0,5 мл), содержащему 7-нитрохинолин (39 мг), с последующим перемешиванием при 160°C в течение 0,5 часов. К реакционному раствору добавляли воду, нерастворимый осадок очищали хроматографией на силикагеле (н-гексан:этилацетат = 1:1), и таким образом получали 3-хлор-7-нитрохинолин (12 мг).
MS (ESI m/z): 209, 211 (M+H)
RT (мин.): 1,37
2-ая стадия
Хлорид аммония (19 мг) и порошок железа (19 мг) добавляли к раствору этанола, содержащему 3-хлор-7-нитрохинолин (12 мг), с последующим перемешиванием при 80°C в течение 2 часов. Растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на колонках с силикагелем (н-гексан:этилацетат = от 1: 0 до 0: 1), и таким образом получали 3-хлорхинолин-7-амин (7 мг).
MS (ESI m/z): 179, 181 (M+H)
RT (мин.): 0,61
Справочный пример 185
Следующее соединение получали, как описано в Journal of Medicinal Chemistry, 1988, vol. 31, # 7, pp. 1347-1351.
[Формула 219]
2-хлор-7-нитрохинолин
Справочный пример 186
[Формула 220]
1-ая стадия
Метилат натрия (28%-ый метанольный раствор) (50 мг) добавляли к раствору DMF (1 мл), содержащему 2-хлор-7-нитрохинолин (42 мг), с последующим перемешиванием при 0°C в течение 5 минут. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония, нерастворимый осадок промывали водой, и таким образом получали 2-метокси-7-нитрохинолин (33 мг).
2-ая стадия
Метанольный раствор (10 мл), содержащий 2-метокси-7-нитрохинолин (33 мг), полученный на 1-ой стадии, получали и подвергали реакции гидрирования (60°C; 50 бар; объемная скорость потока: 1 мл/мин.; 10%-ый Pd/C) с использованием H-cube™. Затем растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество фиолетового цвета 2-метоксихинолин-7-амин (28 мг).
MS (ESI m/z): 175 (M+H)
RT (мин.): 0,55
Справочный пример 187
Следующее соединение получали как описано в Справочном примере 186.
[Формула 221]
4-метоксихинолин-7-амин
MS (ESI m/z): 175 (M+H)
RT (мин.): 0,54
Справочный пример 188
Следующее соединение получали как описано на 1-ой стадии Справочного примера 186.
[Формула 222]
4-бром-1-метоксиизохинолин
MS (ESI m/z): 238, 240 (M+H)
RT (мин.): 1,82
Справочный пример 189
Следующее соединение получали как описано на 1-ой стадии Справочного примера 186.
[Формула 223]
5-бром-1-метоксиизохинолин
MS (ESI m/z): 238, 240 (M+H)
RT (мин.): 1,76
Справочный пример 190
[Формула 224]
1-ая стадия
Гидрид натрия (61 % в масле) (4 мг) и метоксиэтанол (30 мкл) добавляли при охлаждении льдом к раствору DMF (1,3 мл), содержащему 2-хлор-7-нитрохинолин (30 мг), с последующим перемешиванием в течение 0,5 часов. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония, и твердый осадок собирали фильтрацией.
2-ая стадия
Метанольный раствор (на 10 мл), содержащий твердое вещество, полученное на 1-ой стадии, получали и подвергали реакции гидрирования (60°C; 50 бар; объемная скорость потока: 2 мл/мин.; 10%-ый Pd/C) с использованием H-cube™. Затем растворитель отгоняли при пониженном давлении, и таким образом получали 2-(2-метоксиэтокси)хинолин-7-амин (24 мг).
MS (ESI m/z): 219 (M+H)
RT (мин.): 0,64
Справочный пример 191
Следующее соединение получали как описано в Справочном примере 190.
[Формула 225]
2-((1-метоксипропан-2-ил)окси)хинолин-7-амин
MS (ESI m/z): 233 (M+H)
RT (мин.): 0,72
Справочный пример 192
Следующее соединение получали как описано в Справочном примере 190.
[Формула 226]
2-(3-метоксибутокси)-хинолин-7-амин
MS (ESI m/z): 247 (M+H)
RT (мин.): 0,81
Справочный пример 193
Следующее соединение получали как описано в Справочном примере 190.
[Формула 227]
2-(2-(2-этоксиэтокси)этокси)-хинолин-7-амин
MS (ESI m/z): 277 (M+H)
RT (мин.): 0,79
Справочный пример 194
Следующее соединение получали как описано в Справочном примере 190.
[Формула 228]
2-(2-метоксиэтокси)хинолин-6-амин
MS (ESI m/z): 219 (M+H)
RT (мин.): 0,67
Справочный пример 195
Следующее соединение получали как описано в Справочном примере 190.
[Формула 229]
2-((1-метоксипропан-2-ил)окси)хинолин-6-амин
MS (ESI m/z): 233 (M+H)
RT (мин.): 0,82
Справочный пример 196
Следующее соединение получали как описано в Справочном примере 190.
[Формула 230]
2-(3-метоксибутокси)хинолин-6-амин
MS (ESI m/z): 247 (M+H)
RT (мин.): 1,68
Справочный пример 197
Следующее соединение получали как описано в Справочном примере 190.
[Формула 231]
2-(2-(2-этоксиэтокси)этокси)хинолин-6-амин
MS (ESI m/z): 277 (M+H)
RT (мин.): 0,82
Справочный пример 198
Следующее соединение получали как описано на 1-ой стадии Справочного примера 190.
[Формула 232]
4-бром-1-(2-метоксиэтокси)изохинолин
MS (ESI m/z): 282, 284 (M+H)
RT (мин.): 2,25
Справочный пример 199
Следующее соединение получали как описано на 1-ой стадии Справочного примера 190.
[Формула 233]
4-бром-1-(3-метоксибутокси)изохинолин
MS (ESI m/z): 310 (M+H)
RT (мин.): 2,00
Справочный пример 200
Следующее соединение получали как описано на 1-ой стадии Справочного примера 190.
[Формула 234]
4-бром-1-(2-(2-этоксиэтокси)этокси)изохинолин
MS (ESI m/z): 340, 342 (M+H)
RT (мин.): 1,82
Справочный пример 201
Следующее соединение получали как описано на 1-ой стадии Справочного примера 190.
[Формула 235]
5-бром-1-(2-метоксиэтокси)изохинолин
MS (ESI m/z): 282, 284 (M+H)
RT (мин.): 1,67
Справочный пример 202
Следующее соединение получали как описано на 1-ой стадии Справочного примера 190.
[Формула 236]
5-бром-1-(2-метоксипропан-2-ил)окси)изохинолин
MS (ESI m/z): 296, 298 (M+H)
RT (мин.): 1,87
Справочный пример 203
Следующее соединение получали как описано на 1-ой стадии Справочного примера 190.
[Формула 237]
5-бром-1-(2-метоксипропокси)изохинолин
MS (ESI m/z): 209, 210 (M+H)
RT (мин.): 1,37
Справочный пример 204
Следующее соединение получали как описано на 1-ой стадии Справочного примера 190.
[Формула 238]
5-бром-1-(2-(2-этоксиэтокси)этокси)изохинолин
MS (ESI m/z): 340, 342 (M+H)
Справочный пример 205
Следующее соединение получали как описано на 1-ой стадии Справочного примера 190.
[Формула 239]
4-бром-1-((1-метоксипропан-2-ил)окси)изохинолин
MS (ESI m/z): 296, 298 (M+H)
RT (мин.): 1,93
Справочный пример 206
Следующее соединение получали как описано на 1-ой стадии Справочного примера 190.
[Формула 240]
6-бром-1-изопропоксиизохинолин
MS (ESI m/z): 266, 268 (M+H)
RT (мин.): 2,07
Справочный пример 207
Следующее соединение получали как описано на 1-ой стадии Справочного примера 190.
[Формула 241]
6-бром-1-изобутоксиизохинолин
MS (ESI m/z): 280, 282 (M+H)
RT (мин.): 2,18
Справочный пример 208
Следующее соединение получали как описано на 1-ой стадии Справочного примера 190.
[Формула 242]
6-бром-1-(2-метоксиэтокси)изохинолин
MS (ESI m/z): 282, 284 (M+H)
RT (мин.): 1,64
Справочный пример 209
Следующее соединение получали как описано на 1-ой стадии Справочного примера 190.
[Формула 243]
6-бром-1-(2-(2-этоксиэтокси)этокси)изохинолин
MS (ESI m/z): 340, 342 (M+H)
RT (мин.): 1,73
Справочный пример 210
Следующее соединение получали как описано на 1-ой стадии Справочного примера 190.
[Формула 244]
6-бром-1-(2-изобутоксиэтокси)изохинолин
MS (ESI m/z): 324, 326 (M+H)
RT (мин.): 2,11
Справочный пример 211
Следующее соединение получали как описано на 1-ой стадии Справочного примера 190.
[Формула 245]
6-бром-1-((тетрагидрофуран-2-ил)метокси)изохинолин
MS (ESI m/z): 308, 310 (M+H)
RT (мин.): 1,73
Справочный пример 212
Следующее соединение получали как описано в Справочном примере 190.
[Формула 246]
2-этоксихинолин-6-амин
MS (ESI m/z): 189 (M+H)
RT (мин.): 0,77
Справочный пример 213
Следующее соединение получали как описано в Справочном примере 190.
[Формула 247]
2-изопропоксихинолин-6-амин
MS (ESI m/z): 203 (M+H)
RT (мин.): 0,92
Справочный пример 214
Следующее соединение получали как описано в Справочном примере 190.
[Формула 248]
(S)-2-(2-метилбутокси)хинолин-6-амин
MS (ESI m/z): 231 (M+H)
RT (мин.): 1,34
Справочный пример 215
Следующее соединение получали как описано в Справочном примере 190.
[Формула 249]
2-(2-этоксиэтокси)хинолин-6-амин
MS (ESI m/z): 233 (M+H)
RT (мин.): 0,80
Справочный пример 216
Следующее соединение получали как описано в Справочном примере 190.
[Формула 250]
2-(2-бутоксиэтокси)хинолин-6-амин
MS (ESI m/z): 261 (M+H)
RT (мин.): 1,19
Справочный пример 217
Следующее соединение получали как описано в Справочном примере 190.
[Формула 251]
2-(2-изобутоксиэтокси)хинолин-6-амин
MS (ESI m/z): 261 (M+H)
RT (мин.): 1,21
Справочный пример 218
Следующее соединение получали как описано в Справочном примере 190.
[Формула 252]
2-(2-(2-метоксиэтокси)этокси)хинолин-6-амин
MS (ESI m/z): 263 (M+H)
RT (мин.): 0,70
Справочный пример 219
Следующее соединение получали как описано в Справочном примере 190.
[Формула 253]
2-(2-(2-бутоксиэтокси)этокси)хинолин-6-амин
MS (ESI m/z): 305 (M+H)
RT (мин.): 1,17
Справочный пример 220
Следующее соединение получали как описано в Справочном примере 190.
[Формула 254]
2-((тетрагидрофуран-2-ил)метокси)хинолин-6-амин
MS (ESI m/z): 245 (M+H)
RT (мин.): 0,78
Справочный пример 221
Следующее соединение получали как описано в Справочном примере 190.
[Формула 255]
1-(2-((6-аминохинолин-2-ил)окси)этил)пирролидин-2-он
MS (ESI m/z): 272 (M+H)
RT (мин.): 0,64
Справочный пример 222
Следующее соединение получали как описано в Справочном примере 190.
[Формула 256]
1-(2-((6-хлорхиноксалин-2-ил)окси)этил)пирролидин-2-он
MS (ESI m/z): 292, 294 (M+H)
RT (мин.): 1,25
Справочный пример 223
[Формула 257]
Дибромметан (91 мг) и карбонат цезия (380 мг) добавляли в пробирку, содержащую раствор DMF (4 мл), содержащий 5-бромпиридин-2,3-диол (100 мг), и пробирку закупоривали с последующим перемешиванием при 100°C-110°C в течение 8 часов. Реакционный раствор охлаждали до комнатной температуры и добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 50:1 до 4:1), и таким образом получали твердое вещество коричневого цвета 5-бром-[1,3]диоксоло[4,5-b]пиридин (13,8 мг).
MS (ESI m/z): 202, 204 (M+H)
RT (мин.): 1,09
Справочный пример 224
Следующее соединение получали как описано в Справочном примере 223.
[Формула 258]
7-бром-2,3-дигидро-[1,4]диоксино[2,3-b]пиридин
MS (ESI m/z): 216, 218 (M+H)
RT (мин.): 1,08
Справочный пример 225
[Формула 259]
Этилат натрия (20%-ый раствор в этаноле, 112 мг) добавляли к раствору DMF (0,5 мл), содержащему 6-бром-1-хлоризохинолин (40 мг), с последующим перемешиванием при комнатной температуре в течение 2 часов. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Результант промывали водой и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле, и таким образом получали 6-бром-1-этоксиизохинолин (31 мг).
MS (ESI m/z): 252, 254 (M+H)
RT (мин.): 1,91
Справочный пример 226
Следующее соединение получали, как описано в Chem. Abstr. 1960, p. 17397.
[Формула 260]
2-пропоксихинолин-6-амин
Справочный пример 227
[Формула 261]
1H-1,2,4-триазол (540 мг), карбонат цезия (1,9 г), транс-N,N'-диметилциклогексан-1,2-диамин (74 мг) и йодид меди (50 мг) добавляли в пробирку, содержащую раствор DMF (5 мл), содержащий 2-хлорпиридин-4-амин (500 мг), и пробирку закупоривали с последующим перемешиванием при 150°C в течение 14,5 часов. Реакционный раствор охлаждали до комнатной температуры и добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол = от 1:0 до 10:1), и таким образом получали твердое вещество коричневого цвета 2-(1H-1,2,4-триазол-1-ил)пиридин-4-амин (25,8 мг).
MS (ESI m/z): 162 (M+H)
RT (мин.): 0,30
1H-ЯМР (DMSO-d6, 300 МГц) δ: 9,20 (с, 1H), 8,21 (с, 1H), 7,92 (д, 1H, J=5,1 Гц), 7,00 (д, 1H, J=1,8 Гц), 6,55 (ушир., 2H), 6,51 (дд, 1H, J=1,8, 5,1 Гц)
Справочный пример 228
Следующее соединение получали как описано в Справочном примере 227.
[Формула 262]
6-метокси-5-(2H-1,2,3-триазол-2-ил)пиридин-3-амин
MS (ESI m/z): 192 (M+H)
RT (мин.): 0,58
1H-ЯМР (CDCl3, 300 МГц) δ: 7,87 (с, 2H), 7,77 (д, 1H, J=2,4 Гц), 7,39 (д, 1H, J=2,4 Гц), 3,98 (с, 3H), 3,53 (ушир., 2H)
6-метокси-5-(1H-1,2,3-триазол-2-ил)пиридин-3-амин
MS (ESI m/z): 192 (M+H)
RT (мин.): 0,56
1H-ЯМР (CDCl3, 300 МГц) δ: 8,36-8,33 (м, 1H), 7,82 (с, 1H), 7,77-7,72 (м, 2H), 3,98 (с, 3H), 3,60 (ушир., 2H)
Справочный пример 229
[Формула 263]
1-ая стадия
Триэтиламин (32 мкл), н-бутилакрилат (33 мкл), три(o-толуил)фосфин (24 мг) и ацетат палладия (5 мг) добавляли в пробирку, содержащую раствор DMF (3 мл), содержащий 3-бром-N-метил-5-нитропиридин-2-амин (45 мг), и пробирку закупоривали с последующим перемешиванием при 100°C в течение 8 часов. Реакционный раствор охлаждали до комнатной температуры, и снова добавляли в пробирку н-бутилакрилат (33 мкл), три(o-толуил)фосфин (24 мг) и ацетат палладия (5 мг), и пробирку закупоривали с последующим перемешиванием при 100°C в течение 9 часов. Далее реакционный раствор охлаждали до комнатной температуры и добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 16:1 до 3:1), и таким образом получали твердое вещество желтого цвета н-бутила 3-(2-(метиламино)-5-нитропиридин-3-ил)акрилат (44 мг).
MS (ESI m/z): 280 (M+H), 278 (М-Н)
RT (мин.): 1,62
2-ая стадия
5M метилат натрия (метанольный раствор) (0,5 мл) добавляли к метанольному раствору (2 мл), содержащему 3-(2-(метиламино)-5-нитропиридин-3-ил)н-бутилакрилат (43 мг), полученный на 1-ой стадии, с последующим нагреванием с обратным холодильником в течение 3,5 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 4:1 до 2:1), и таким образом получали твердое вещество белого цвета 1-метил-6-нитро-1,8-нафтиридин-2(1H)-он (24 мг).
MS (ESI m/z): 206 (M+H)
RT (мин.): 0,94
3-я стадия
Следующее соединение получали как описано на 3-ей стадии Справочного примера 161.
MS (ESI m/z): 176 (M+H)
RT (мин.): 0,49
Справочный пример 230
[Формула 264]
1-ая стадия
Триэтиламин (53 мкл) и 2-метоксиэтиламин (23 мг) добавляли к тетрагидрофурановому раствору (2 мл), содержащему 3-бром-2-хлор-5-нитропиридин (60 мг), с последующим перемешиванием при комнатной температуре в течение 1 часа. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 6:1 до 3:1), и таким образом получали твердое вещество светло-желтого цвета 3-бром-N-(2-метоксиэтил)-5-нитропиридин-2-амин (93,5 мг).
MS (ESI m/z): 276, 278 (M+H)
RT (мин.): 1,30
2-ая, 3-я и 4-ая стадии
Следующие соединения получали как описано на 1-ой, 2-ой и 3-ей стадиях Справочного примера 229.
3-(2-((2-метоксиэтил)амино)-5-нитропиридин-3-ил)бутилакрилат
MS (ESI m/z): 324 (M+H)
RT (мин.): 1,67
1-(2-метоксиэтил)-6-нитро-1,8-нафтиридин-2(1H)-он
MS (ESI m/z): 250 (M+H)
RT (мин.): 1,01
6-амино-1-(2-метоксиэтил)-1,8-нафтиридин-2(1H)-он
MS (ESI m/z): 220 (M+H)
RT (мин.): 0,57
Справочный пример 231
[Формула 265]
Гидрид натрия (61 % в масле) (11 мг) добавляли к раствору DMF (0,9 мл), содержащий (5-бромпиридин-3-ил)метанол (34 мг) при охлаждении льдом с последующим перемешиванием в течение 1 часа. Затем добавляли метил йодид (17 мкл), с последующим перемешиванием при комнатной температуре в течение 13 часов. После этого к реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 4:1 до 1:1), и таким образом получали твердое вещество светло-желтого цвета 3-бром-5-(метоксиметил)пиридин (26,5 мг).
MS (ESI, m/z): 202, 204 (M+H)
RT (мин.): 0,97
Справочный пример 232
Следующее соединение получали, как описано в Journal of the American Chemical Society, 2005, vol. 127, # 1, pp. 74-75.
[Формула 266]
6-бромхинолин-8-ол
Справочный пример 233
Следующее соединение получали как описано в Справочном примере 231.
[Формула 267]
6-бром-8-метоксихинолин
MS (ESI m/z): 238, 240 (M+H)
RT (мин.): 1,68
Справочный пример 234
Следующее соединение получали как описано в Справочном примере 231.
[Формула 268]
6-бром-8-(2-метоксиэтокси)хинолин
MS (ESI m/z): 281, 283 (M+H)
RT (мин.): 0,98
Справочный пример 235
Следующее соединение получали как описано в Справочном примере 231.
[Формула 269]
8-(бензилокси)-6-бромхинолин
MS (ESI m/z): 314, 316 (M+H)
RT (мин.): 1,49
Справочный пример 236
Следующее соединение получали как описано в Справочном примере 231.
[Формула 270]
3-((бензилокси)метил)-5-бромпиридин
MS (ESI, m/z): 278, 280 (M+H)
RT (мин.): 1,55
Справочный пример 237
Следующее соединение получали как описано в Справочном примере 231.
[Формула 271]
4-хлор-2-(метоксиметил)пиридин
MS (ESI, m/z): 158, 160 (M+H)
RT (мин.): 0,84
Справочный пример 238
[Формула 272]
Триэтиламин (70 мкл) и простой бис(2-бромэтиловый) эфир (28 мкл) добавляли к раствору DMF (2 мл), содержащему 3-(5-бромпиридин-3-ил)анилин (50 мг), с последующим перемешиванием при 80°C в течение 3,5 часов. Добавляли бис(2-бромэтиловый) эфир (30 мкл) с последующим перемешиванием при 80°C в течение 3 часов. Снова добавляли бис(2-бромэтиловый) эфир (30 мкл) с последующим перемешиванием при 80°C в течение 4,5 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 10:1 до 3:1), и таким образом получали бесцветное масляное вещество 4-(3-(5-бромпиридин-3-ил)фенил)морфолин (12,3 мг).
MS (ESI m/z): 319, 321 (M+H)
RT (мин.): 1,47
Справочный пример 239
Следующее соединение получали как описано в Справочном примере 238.
[Формула 273]
4-(4-(5-бромпиридин-3-ил)фенил)морфолин
MS (ESI m/z): 319, 321 (M+H)
RT (мин.): 1,45
Справочный пример 240
Следующее соединение получали как описано в Справочном примере 231.
[Формула 274]
(4-(5-бромпиридин-3-ил)фенил)метил-трет-бутилкарбамат
MS (ESI m/z): 363, 365 (M+H)
RT (мин.): 1,78
Справочный пример 241
[Формула 275]
Гидрид натрия (61 % в масле, 14 мг) и 6-бром-2-хлорхинолин (80 мг) добавляли в атмосфере азота к раствору DMF (0,5 мл), содержащему 1-(3-гидроксипропил)-2-пирролидон (52 мг), с последующим перемешиванием при комнатной температуре в течение 6 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 0:1), и таким образом получали 1-(3-((6-бромхинолин-2-ил)окси)пропил)пирролидин-2-он (46 мг).
MS (ESI m/z): 349, 351 (M+H)
RT (мин.): 1,48
Справочный пример 242
Следующее соединение получали как описано в Справочном примере 241.
[Формула 276]
3-(2-(6-бромхинолин-2-ил)окси)этил)оксазолидин-2-он
MS (ESI m/z): 337, 339 (M+H)
RT (мин.): 1,42
Справочный пример 243
[Формула 277]
1-ая стадия
Получали раствор уксусной кислоты (1 мл), содержащий 7-нитрохинолин (93 мг), и добавляли N-йодсукцинимид (132 мг), с последующим перемешиванием при 110°C в течение 1,5 часов. Снова добавляли N-йодсукцинимид (400 мг) и уксусную кислоту (1 мл), с последующим перемешиванием при 110°C в течение 1 часа. К реакционному раствору добавляли воду и 25%-ый водный раствор гидроксида аммония, нерастворимый осадок очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 4:1), и таким образом получали 3-йод-7-нитрохинолин (90 мг).
MS (ESI m/z): 301 (M+H)
RT (мин.): 1,48
2-ая стадия
Пиразол (20 мг), транс-N,N'-диметилциклогексан-1,2-диамин (24 мкл), йодид меди (14 мг) и карбонат цезия (73 мг) добавляли к раствору N,N-диметилпропиленмочевины (2 мл), содержащему 3-йод-7-нитрохинолин (45 мг), с последующим перемешиванием при 70°C в течение 2,5 часов в атмосфере азота. К реакционному раствору добавляли воду, нерастворимый осадок очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 0:1), и таким образом получали твердое вещество светло-желтого цвета 7-нитро-3-(1H-пиразол-1-ил)хинолин (36 мг).
MS (ESI m/z): 241 (M+H)
RT (мин.): 1,26
3-я стадия
Метанольный раствор (10 мл), содержащий 7-нитро-3-(1H-пиразол-1-ил)хинолин (36 мг), получали и подвергали реакции гидрирования (80°C; 50 бар; объемная скорость потока: 1 мл/мин.; 10%-ый Pd/C) с использованием H-cube™. После этого растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество фиолетового цвета 3-(1H-пиразол-1-ил)хинолин-7-амин (20 мг).
MS (ESI m/z): 211 (M+H)
RT (мин.): 0,61
Справочный пример 244
Следующее соединение получали как описано на 2-ой стадии Справочного примера 243.
[Формула 278]
3-бром-7-(1H-пиразол-1-ил)хинолин
MS (ESI m/z): 274, 276 (M+H)
RT (мин.): 1,39
Справочный пример 245
Следующее соединение получали как описано на 3-ей стадии Справочного примера 243.
[Формула 279]
1-этил-1H-индазол-4-амин
MS (ESI m/z): 162 (M+H)
RT (мин.): 0,92
Справочный пример 246
[Формула 280]
1-ая стадия
Следующее соединение получали как описано в Справочном примере 22.
3-(2-фторфенил)-2-метокси-5-нитропиридин
MS (ESI m/z): 249 (M+H)
RT (мин.): 1,62
2-ая стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 161.
5-(2-фторфенил)-6-метоксипиридин-3-амин
MS (ESI m/z): 219 (M+H)
RT (мин.): 0,96
Справочный пример 247
Следующие соединения получали как описано в Справочном примере 246.
[Формула 281]
3-(фуран-2-ил)-2-метокси-5-нитропиридин
MS (ESI m/z): 221 (M+H)
RT (мин.): 1,60
5-(фуран-2-ил)-6-метоксипиридин-3-амин
MS (ESI m/z): 191 (M+H)
RT (мин.): 0,85
Справочный пример 248
Следующие соединения получали как описано в Справочном примере 246.
[Формула 282]
3-(фуран-3-ил)-2-метокси-5-нитропиридин
MS (ESI m/z): 221 (M+H)
RT (мин.): 1,53
5-(фуран-3-ил)-6-метоксипиридин-3-амин
MS (ESI m/z): 191 (M+H)
RT (мин.): 0,85
Справочный пример 249
Следующие соединения получали как описано в Справочном примере 246.
[Формула 283]
3-циклопропил-2-метокси-5-нитропиридин
MS (ESI m/z): 195 (M+H)
RT (мин.): 1,53
5-циклопропил-6-метоксипиридин-3-амин
MS (ESI m/z): 165 (M+H)
RT (мин.): 0,67
Справочный пример 250
[Формула 284]
Гидрид натрия (61 % в масле, 30 мг) и пиразол (68 мг) добавляли в атмосфере азота к раствору DMF (1 мл), содержащему 2,6-дихлорхиноксалин (100 мг), с последующим перемешиванием при 100°C в течение 30 минут. К реакционному раствору добавляли воду, и нерастворимый осадок собирали фильтрацией, и таким образом получали 6-хлор-2-(1H-пиразол-1-ил)хиноксалин (109 мг).
MS (ESI m/z): 230, 232 (M+H)
RT (мин.): 1,62
Справочный пример 251
Следующее соединение получали как описано в Справочном примере 250.
[Формула 285]
6-бром-2-(2H-1,2,3-триазол-2-ил)хинолин
MS (ESI m/z): 275, 277 (M+H)
RT (мин.): 1,49
Справочный пример 252
Следующее соединение получали как описано в Справочном примере 250.
[Формула 286]
6-бром-2-(1H-пиразол-1-ил)хинолин
MS (ESI m/z): 274, 276 (M+H)
RT (мин.): 1,79
Справочный пример 253
[Формула 287]
1-ая и 2-ая стадии
Следующие соединения получали как описано на 1-ой и 2-ой стадиях Справочного примера 146.
3-бром-7-нитрохинолин
MS (ESI m/z): 253, 255 (M+H)
RT (мин.): 1,42
3-бромхинолин-7-амин
MS (ESI m/z): 223, 225 (M+H)
RT (мин.): 0,65
3-я стадия
Йодид цезия (564 мг), йодид меди (94 мг), йод (250 мг) и изоамил нитрат (1,23 мл) добавляли к 1,2-диметоксиэтановому раствору (5,6 мл), содержащему 3-бромхинолин-7-амин (440 мг), с последующим перемешиванием при 65°C в течение 1 часа. К реакционному раствору добавляли насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией этилацетатом (×2). Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 10:1), и таким образом получали 3-бром-7-йодхинолин (440 мг).
MS (ESI m/z): 334, 336 (M+H)
RT (мин.): 1,75
4-ая стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 243.
3-бром-7-(2H-1,2,3-триазол-2-ил)хинолин
MS (ESI m/z): 275, 277 (M+H)
RT (мин.): 1,50
Справочный пример 254
[Формула 288]
1-ая стадия
Пирролидин-2-он (129 мг), карбонат цезия (412 мг), Pd2(dba)3 (116 мг) и Xantphos (146 мг) добавляли в атмосфере азота к раствору 1,4-диоксана (10 мл), содержащему 2-хлор-5-нитропиридин (200 мг), с последующим перемешиванием при 100°C в течение 5 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 4:1 до 2:1), и таким образом получали твердое вещество светло-красного цвета 1-(5-нитропиридин-2-ил)пирролидин-2-он (261 мг).
1H-ЯМР (CDCl3, 300 МГц) δ: 9,23-9,20 (м, 1H), 8,67-8,62 (м, 1H), 8,46 (дд, 1H, J=2,8, 9,4 Гц), 4,17 (т, 2H, J=7,3 Гц), 2,73 (т, 2H, J=8,3 Гц), 2,26-2,13 (м, 2H)
2-ая стадия
Метанольный раствор (20 мл), содержащий 1-(5-нитропиридин-2-ил)пирролидин-2-он (31 мг), получали и подвергали реакции гидрирования (30°C; 1 бар; объемная скорость потока: 1 мл/мин.; 10%-ый Pd/C) с использованием H-cube™. Затем растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество фиолетового цвета 1-(5-аминопиридин-2-ил)пирролидин-2-он (29 мг).
MS (ESI m/z): 178 (M+H)
RT (мин.): 0,38
Справочный пример 255
Следующие соединения получали как описано в Справочном примере 254.
[Формула 289]
4-(5-нитропиридин-2-ил)-2H-бензо[b][1,4]оксазин-3(4H)-он
1H-ЯМР (CDCl3, 300 МГц) δ: 9,46-9,43 (м, 1H), 8,68 (дд, 1H, J=2,8, 8,8 Гц), 7,79-7,74 (м, 1H), 7,15-7,07 (м, 2H), 6,99-6,91 (м, 1H), 6,64-6,58 (м, 1H), 4,77 (с, 2H)
4-(5-аминопиридин-2-ил)-2H-бензо[b][1,4]оксазин-3(4H)-он
MS (ESI m/z): 242 (M+H)
RT (мин.): 0,88
Справочный пример 256
Следующие соединения получали как описано в Справочном примере 254.
[Формула 290]
2,2-диметил-4-(5-нитропиридин-2-ил)-2H-пиридо[3,2-b][1,4]оксазин-3(4H)-он
1H ЯМР (CDCl3, 300 МГц) δ: 9,49 (д, 1H, J=2,6 Гц), 8,67 (дд, 1H, J=3,0, 8,6 Гц), 7,96 (дд, 1H, J=1,7, 5,0 Гц), 7,57 (д, 1H, J=8,6 Гц), 7,02 (дд, 1H, J=5,0, 7,9 Гц), 1,66 (с, 6H)
4-(5-аминопиридин-2-ил)-2,2-диметил-2H-пиридо[3,2-b][1,4]оксазин-3(4H)-он
MS (ESI m/z): 271 (M+H)
RT (мин.): 0,85
Справочный пример 257
Следующие соединения получали как описано в Справочном примере 254.
[Формула 291]
4-(5-нитропиридин-2-ил)морфолин-3-он
1H-ЯМР (CDCl3, 300 МГц) δ: 9,27-9,24 (м, 1H), 8,60-8,54 (м, 1H), 8,48 (дд, 1H, J=2,6, 9,2 Гц), 4,41 (с, 2H), 4,23-4,15 (м, 2H), 4,12-4,04 (м, 2H)
4-(5-аминопиридин-2-ил)морфолин-3-он
MS (ESI, m/z): 194 (M+H)
RT (мин.): 0,38
Справочный пример 258
[Формула 292]
Пиридин-1-ол (96 мг), карбонат цезия (412 мг) и йодид меди (50 мг) добавляли в пробирку, содержащую раствор DMF (4 мл), содержащий 3,5-дибромпиридин (200 мг), и пробирку закупоривали в атмосфере азота с последующим перемешиванием при 120°C в течение 11 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:5 до 1:1), и таким образом получали твердое вещество коричневого цвета 5'-бром-2H-[1,3'-бипиридин]-2-он (25,8 мг).
MS (ESI m/z): 251, 253 (M+H)
RT (мин.): 0,76
Справочный пример 259
Следующее соединение получали, как описано в Roczniki Chemii, 1967, vol. 41, # 2, p. 279.
[Формула 293]
3-фтор-2-метилпиридин-4-амин
Справочный пример 260
[Формула 294]
1-ая стадия
Тетрагидрофурановый раствор (5 мл), содержащий 2-хлор-5-фторпиридин (500 мг), добавляли при -75°C в атмосфере азота к тетрагидрофурановому раствору (20 мл), содержащему литий-N,N-диизопропиламид (2M раствор тетрагидрофуран/этилбензол/гептан) (2,9 мл), с последующим перемешиванием при -75°C в течение 3 часов. Затем добавляли тетрагидрофурановый (5 мл) раствор, содержащий йод (1,16 г), с последующим перемешиванием при -75°C в течение 1 часа. Затем к реакционному раствору при -75°C, -50°C и -35°C, соответственно, медленно добавляли воду/тетрагидрофуран (2 мл/8 мл), воду (10 мл) и 3M водный раствор тиосульфата натрия. Реакционный раствор охлаждали до комнатной температуры с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. После этого растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 20:1 до 10:1), и таким образом получали твердое вещество белого цвета 2-хлор-5-фтор-4-йодпиридин (457 мг).
1H-ЯМР (CDCl3, 300 МГц) δ: 8,14 (с, 1H), 7,77 (д, 1H, J=4,3 Гц)
2-ая стадия
Следующее соединение получали как описано в Справочном примере 124.
(2-хлор-5-фторпиридин-4-ил)трет-бутилкарбамат
MS (ESI m/z): 247, 249 (M+H)
RT (мин.): 1,51
3-я стадия
Следующее соединение получали как описано в Справочном примере 22.
(5-фтор-2-метилпиридин-4-ил)трет-бутилкарбамат
MS (ESI m/z): 227 (M+H)
RT (мин.): 0,79
4-ая стадия
TFA (2 мл) добавляли к (5-фтор-2-метилпиридин-4-ил)трет-бутилкарбамату (20 мг), полученному на 3-ей стадии, с последующим перемешиванием при комнатной температуре в течение 1 часа. Растворитель отгоняли при пониженном давлении, добавляли толуол для азеотропного кипячения (×2), и таким образом получали 5-фтор-2-метилпиридин-4-амин (32 мг).
MS (ESI m/z): 127 (M+H)
RT (мин.): 0,23
Справочный пример 261
Следующие соединения получали как описано в Справочном примере 124 и 4-ой стадии Справочного примера 260.
[Формула 295]
(5-фтор-2-морфолинопиридин-4-ил)трет-бутилкарбамат
MS (ESI m/z): 298 (M+H)
RT (мин.): 1,08
5-фтор-2-морфолинопиридин-4-амин
MS (ESI m/z): 198 (M+H)
RT (мин.): 0,40
Справочный пример 262
[Формула 296]
1-ая и 2-ая стадии
Следующие соединения получали как описано на 1-ой и 2-ой стадиях Справочного примера 260
2-хлор-3-фтор-4-йодпиридин
1H ЯМР (CDCl3, 300 МГц) δ: 7,87 (д, 1H, J=5,3 Гц), 7,66 (дд, 1H, J=4,0, 5,0 Гц)
(2-хлор-3-фторпиридин-4-ил)трет-бутилкарбамат
MS (ESI m/z): 247, 249 (M+H)
RT (мин.): 1,46
3-я стадия
Следующее соединение получали как описано в Справочном примере 124.
(3-фтор-2-морфолинопиридин-4-ил)трет-бутилкарбамат
MS (ESI m/z): 298 (M+H)
RT (мин.): 1,21
4-ая стадия
Следующее соединение получали как описано на 4-ой стадии Справочного примера 260.
3-фтор-2-морфолинопиридин-4-амин
MS (ESI m/z): 198 (M+H)
RT (мин.): 0,43
Справочный пример 263
[Формула 297]
1-ая стадия
Следующее соединение получали как описано на 4-ой стадии Справочного примера 260.
2-хлор-3-фторпиридин-4-амин
MS (ESI m/z): 147, 149 (M+H)
RT (мин.): 0,60
2-ая стадия
Следующее соединение получали как описано в Справочном примере 22.
3-фтор-2-фенилпиридин-4-амин
MS (ESI m/z): 189 (M+H)
RT (мин.): 0,61
Справочный пример 264
Следующие соединения получали как описано в Справочном примере 263.
[Формула 298]
2-хлор-5-фторпиридин-4-амин
MS (ESI m/z): 147, 149 (M+H)
RT (мин.): 0,56
5-фтор-2-фенилпиридин-4-амин
MS (ESI m/z): 189 (M+H)
RT (мин.): 0,55
Справочный пример 265
[Формула 299]
1-ая стадия
Следующее соединение получали как описано в Справочном примере 22.
4-(5-бромпиридин-3-ил)-анилин
MS (ESI m/z): 249, 251 (M+H)
RT (мин.): 1,02
2-ая стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 2.
(4-(5-бромпиридин-3-ил)фенил)трет-бутилкарбамат
MS (ESI m/z): 349, 351 (M+H)
RT (мин.): 1,71
Справочный пример 266
[Формула 300]
1-ая стадия
Следующее соединение получали как описано в Справочном примере 22.
3-(5-бромпиридин-3-ил)анилин
MS (ESI m/z): 249, 251 (M+H)
RT (мин.): 1,00
2-ая стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 2.
(3-(5-бромпиридин-3-ил)фенил)трет-бутилкарбамат
MS (ESI m/z): 349, 351 (M+H)
RT (мин.): 1,72
3-я стадия
Следующее соединение получали как описано в Справочном примере 231.
(3-(5-бромпиридин-3-ил)фенил)(метил)трет-бутилкарбамат
MS (ESI m/z): 363, 365 (M+H)
RT (мин.): 1,77
Справочный пример 268
[Формула 301]
Уксусный ангидрид (18 мкл) добавляли к тетрагидрофурановому раствору (2 мл), содержащему 3-(5-бромпиридин-3-ил)анилин (50 мг), с последующим перемешиванием при комнатной температуре в течение 5,5 часов. Добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество белого цвета N-(4-(5-бромпиридин-3-ил)фенил)ацетамид (56,6 мг).
MS (ESI m/z): 291, 293 (M+H)
RT (мин.): 1,14
Справочный пример 269
[Формула 302]
Триэтиламин (70 мкл) и 4-хлорбутирил хлорид (25 мкл) добавляли к тетрагидрофурановому (2 мл) раствору, содержащему 3-(5-бромпиридин-3-ил)анилин (50 мг), с последующим перемешиванием при комнатной температуре в течение 3,5 часов. Затем добавляли гидрид натрия (61 % в масле, 12 мг) с последующим перемешиванием в течение 3 часов. Снова добавляли гидрид натрия (61 % в масле, 12 мг) с последующим перемешиванием в течение 2 часов. Добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 10: 1 до 3: 1), и таким образом получали бесцветное масляное вещество 1-(3-(5-бромпиридин-3-ил)фенил)пирролидин-2-он (12,3 мг).
MS (ESI m/z): 317, 319 (M+H)
RT (мин.): 1,28
Справочный пример 270
Следующее соединение получали как описано в Справочном примере 269.
[Формула 303]
1-(4-(5-бромпиридин-3-ил)фенил)пирролидин-2-он
MS (ESI m/z): 317, 319 (M+H)
RT (мин.): 1,28
Справочный пример 271
[Формула 304]
Карбонат калия (83 мг) и метил йодид (62 мкл) добавляли к N,N-диметилацетамидному раствору (1 мл), содержащему 3-(5-бромпиридин-3-ил)анилин (50 мг), с последующим перемешиванием при 80°C в течение 4 часов. Добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 10:1 до 3:1), и таким образом получали твердое вещество белого цвета 3-(5-бромпиридин-3-ил)-N,N-диметиланилин (7,1 мг).
MS (ESI m/z): 277, 279 (M+H)
RT (мин.): 1,45
Справочный пример 272
[Формула 305]
N-бромсукцинимид (141 мг) добавляли к раствору DMF (3 мл), содержащему 2-морфолиноникотинонитрил (100 мг), с последующим перемешиванием при 80°C в течение 5 часов. Реакционный раствор охлаждали до комнатной температуры. Затем добавляли водный насыщенный раствор тиосульфата натрия с последующей экстракцией этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 10:1 до 7:3), и таким образом получали твердое вещество светло-желтого цвета 5-бром-2-морфолиноникотинонитрил (120 мг).
MS (ESI m/z): 268, 270 (M+H)
RT (мин.): 1,37
Справочный пример 273
[Формула 306]
1-ая стадия
Карбонат калия (87 мг) и фенол (47 мг) добавляли к N,N-диметилацетамидному раствору (1 мл), содержащему 3-бром-2-хлор-5-нитропиридин (100 мг), с последующим перемешиванием при 70°C в течение 3 часов. Добавляли в атмосфере азота ацетат палладия (20 мг) с последующим перемешиванием при 100°C в течение 3,5 часов. Добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, к полученному остатку добавляли гексан и этилацетат, нерастворимый осадок собирали фильтрацией, и таким образом получали твердое вещество светло-желтого цвета 3-нитробензофуро[2,3-b]пиридин (47,1 мг).
MS (ESI m/z): 215 (M+H)
RT (мин.): 1,48
2-ая стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 166.
Бензофуро[ 2,3-b]пиридин-3-амин
MS (ESI m/z): 185 (M+H)
RT (мин.): 0,94
Справочный пример 274
[Формула 307]
Стадия 1
Дихлорметановый раствор (10 мл), содержащий 2,2-дифторэтанол (5,0 г) и триэтиламин (8,44 мл), при -78°C в атмосфере азота медленно добавляли к дихлорметановому раствору (10 мл), содержащему трифторметансульфоновый ангидрид (10,2 мл), с последующим перемешиванием в течение 45 минут. Растворитель отгоняли при пониженном давлении, и таким образом получали бесцветное масляное вещество 2,2-дифторэтил фтороформетан сульфонат (9,04 г).
2-ая стадия
Карбонат кальция (517 мг) добавляли при комнатной температуре в атмосфере азота к раствору (2,5 мл) 1,4-диоксана, содержащему 2,2-дифторэтил фтороформетан сульфонат (642 мг), полученный на 1-ой стадии, и 5-нитроиндазол (407 мг), с последующим перемешиванием при 100°C в течение 3 часов. Добавляли этилацетат, нерастворимое вещество удаляли, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 5:1 до 1:1). Затем добавляли гексан и этилацетат, и нерастворимый осадок собирали фильтрацией, и таким образом получали 1-(2,2-дифторэтил)-5-нитро-1H-индазол (173 мг).
MS (ESI m/z): 228 (M+H)
RT (мин.): 1,18
3-я стадия
Следующее соединение получали как описано на 3-ей стадии Справочного примера 243.
1-(2,2-дифторэтил)-1H-индазол-5-амин
Справочный пример 275
[Формула 308]
1-ая стадия
Select flour (173 мг) и уксусную кислоту (2,5 мл) добавляли к раствору ацетонитрила (2,5 мл), содержащему 5-нитроиндазол (615 мг), и облучали с использованием микроволновой печи (Initiator™, 150°C, 0,5 часа, 2,45 ГГц, 0-240 Вт). Полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 1:1), и таким образом получали 3-фтор-5-нитро-1H-индазол (404 мг).
2-ая стадия
Метил йодид (41 мкл) и карбонат калия (114 мг) добавляли к раствору (2,5 мл) 1,4-диоксана, содержащему 3-фтор-5-нитро-1H-индазол (100 мг), с последующим перемешиванием при 100°C в течение 2 часов. Добавляли этилацетат, нерастворимый осадок собирали фильтрацией, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 1:1), и таким образом получали 3-фтор-1-метил-5-нитро-1H-индазол.
3-я стадия
Следующее соединение получали как описано на 3-ей стадии Справочного примера 243.
3-фтор-1-метил-1H-индазол-5-амин
MS (ESI m/z): 166 (M+H)
RT (мин.): 1,32
Справочный пример 276
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 309]
1-этил-3-фтор-1H-индазол-5-амин
MS (ESI m/z): 180 (M+H)
RT (мин.): 0,57
Справочный пример 277
Следующие соединения получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 310]
3-фтор-1-метил-6-нитро-1H-индазол
MS (ESI m/z): 196 (M+H)
RT (мин.): 1,38
3-фтор-1-метил-1H-индазол-6-амин
Справочный пример 278
Следующие соединения получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 311]
1-этил-3-фтор-6-нитро-1H-индазол
MS (ESI m/z): 210 (M+H)
RT (мин.): 1,54
1-этил-3-фтор-1H-индазол-6-амин
Справочный пример 279
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 312]
1-(2-фторэтил)-1H-индазол-5-амин
MS (ESI m/z): 180 (M+H)
RT (мин.): 0,28
Справочный пример 280
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 313]
1-(2-фторэтил)-1H-индазол-6-амин
MS (ESI m/z): 180 (M+H)
RT (мин.): 0,38
Справочный пример 281
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 314]
3-фтор-1-(2-фторэтил)-1H-индазол-5-амин
MS (ESI m/z): 198 (M+H)
RT (мин.): 0,89
Справочный пример 282
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 315]
3-фтор-1-(2-фторэтил)-1H-индазол-6-амин
MS (ESI m/z): 198 (M+H)
RT (мин.): 0,50
Справочный пример 283
Следующее соединение получали, как описано в Journal of Organic Chemistry, 1966, vol. 31, pp. 677-681.
[Формула 316]
1,3-диметил-1H-индазол-5-амин
Справочный пример 284-1
Следующее соединение получали, как описано в US2009/312314 A1.
[Формула 317]
1-этил-3-метил-5-нитро-1H-индазол
Справочный пример 284-2
Следующее соединение получали как описано на 3-ей стадии Справочного примера 275.
[Формула 318]
Следующее соединение получали, как описано в US2009/312314 A1.
1-этил-3-метил-1H-индазол-5-амин
MS (ESI m/z): 176 (M+H)
RT (мин.): 0,51
Справочный пример 285
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 319]
1-(2-метоксиэтил)-3-метил-1H-индазол-5-амин
MS (ESI m/z): 206 (M+H)
RT (мин.): 0,79
Справочный пример 286
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 320]
1-(2-фторэтил)-3-метил-1H-индазол-5-амин
MS (ESI m/z): 194 (M+H)
RT (мин.): 0,45
Справочный пример 287
Следующее соединение получали, как описано в Organic Letters, 2008, vol. 10, # 5, pp. 1021-1023.
[Формула 321]
3-метил-5-нитро-1H-индазол
Справочный пример 288
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 322]
1-(2,2-дифторэтил)-3-метил-1H-индазол-5-амин
MS (ESI m/z): 212 (M+H)
RT (мин.): 0,49
Справочный пример 289
Следующее соединение получали, как описано в Organic Letters, 2008, vol. 10, # 5, pp. 1021-1023.
[Формула 323]
3-этил-1H-индазол
Справочный пример 290
[Формула 324]
1-ая стадия
Нитрат натрия (430 мг) добавляли при охлаждении льдом к 50%-ому водному раствору серной кислоты (2,5 мл), содержащему 3-этил-1H-индазол (730 мг), с последующим перемешиванием при 80°C в течение 2 часов. К реакционному раствору добавляли воду и этилацетат, с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 4:1), и таким образом получали 3-этил-5-нитро-1H-индазол (197 мг).
2-ая и 3-я стадии
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
3-этил-1-метил-1H-индазол-5-амин
MS (ESI m/z): 176 (M+H)
RT (мин.): 0,53
Справочный пример 291
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 325]
1,3-диэтил-1H-индазол-5-амин
MS (ESI m/z): 190 (M+H)
RT (мин.): 0,62
Справочный пример 292
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 326]
3-этил-1-(2-метоксиэтил)-1H-индазол-5-амин
MS (ESI m/z): 220 (M+H)
RT (мин.): 0,58
Справочный пример 293
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 327]
3-этил-1-(2-фторэтил)-1H-индазол-5-амин
MS (ESI m/z): 208 (M+H)
RT (мин.): 0,57
Справочный пример 294
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 328]
1-(2,2-дифторэтил)-3-этил-1H-индазол-5-амин
MS (ESI m/z): 226 (M+H)
RT (мин.): 0,65
Справочный пример 295
Следующее соединение получали, как описано в European Journal of Organic Chemistry, 2009, # 19, pp. 3184-3188.
[Формула 329]
3-пропил-1H-индазол
Справочный пример 296
[Формула 330]
Следующее соединение получали как описано в Справочном примере 290.
1-метил-3-пропил-1H-индазол-5-амин
MS (ESI m/z): 190 (M+H)
RT (мин.): 0,62
Справочный пример 297
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 331]
1-этил-3-пропил-1H-индазол-5-амин
MS (ESI m/z): 204 (M+H)
RT (мин.): 0,74
Справочный пример 298
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 332]
1-(2-метоксиэтил)-3-пропил-1H-индазол-5-амин
MS (ESI m/z): 234 (M+H)
RT (мин.): 0,70
Справочный пример 299
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 333]
1-(2-фторэтил)-3-пропил-1H-индазол-5-амин
MS (ESI m/z): 222 (M+H)
RT (мин.): 0,69
Справочный пример 300
1-ая стадия
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 334]
1-(2,2-дифторэтил)-3-пропил-1H-индазол-5-амин
MS (ESI m/z): 240 (M+H)
RT (мин.): 0,76
Справочный пример 301-1
Следующее соединение получали, как описано в US2008/139558 A1.
[Формула 335]
3-изопропил-5-нитро-1H-индазол
Справочный пример 301-2
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 336]
3-изопропил-1-метил-1H-индазол-5-амин
MS (ESI m/z): 190 (M+H)
RT (мин.): 0,63
Справочный пример 302
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 337]
1-этил-3-изопропил-1H-индазол-5-амин
MS (ESI m/z): 204 (M+H)
RT (мин.): 0,74
Справочный пример 303
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 338]
3-изопропил-1-(2-метоксиэтил)-1H-индазол-5-амин
MS (ESI m/z): 234 (M+H)
RT (мин.): 0,70
Справочный пример 304
Следующее соединение получали, как описано в Journal of Organic Chemistry, 2008, vol. 73, # 16, pp. 6441-6444.
[Формула 339]
1-циклопропил-5-нитро-1H-индазол
Справочный пример 305
[Формула 340]
Метанольный раствор (15 мл), содержащий 1-циклопропил-5-нитро-1H-имидазол (60 мг), получали и подвергали реакции гидрирования (80°C; 50 баров; объемная скорость потока: 2 мл/мин.; 10%-ый Pd/C) с использованием H-cube™. После этого растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество фиолетового цвета 1-циклопропил-1H-имидазол-5-амин (20 мг).
Справочный пример 306
Следующее соединение получали, как описано в 2009/122180 A1, 2009.
[Формула 341]
1-циклопропил-1H-индазол-6-амин
Справочный пример 307
[Формула 342]
1-ая стадия
Циклопропилбороновую кислоту·моногидрат (52 мг), ацетат меди (55 мг), карбонат натрия (64 мг) и пиридин (24 мкл) добавляли в атмосфере азота к раствору дихлорэтана (1 мл), содержащему 4-нитроиндазол (50 мг), с последующим перемешиванием при 70°C в течение 3 часов. К реакционному раствору добавляли этилацетат, нерастворимый осадок удаляли, и растворитель отгоняли при пониженном давлении. Затем полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 1:1), и таким образом получали 1-циклопропил-4-нитро-1H-индазол (30 мг).
MS (ESI m/z): 204 (M+H)
RT (мин.): 1,37
2-ая стадия
Следующее соединение получали как описано в Справочном примере 305.
1-циклопропил-1H-индазол-4-амин
MS (ESI m/z): 174 (M+H)
RT (мин.): 0,87
Справочный пример 308
Следующие соединения получали как описано в Справочном примере 307.
[Формула 343]
1-циклопропил-3-фтор-5-нитро-1H-индазол
MS (ESI m/z): 222 (M+H)
RT (мин.): 1,46
1-циклопропил-3-фтор-1H-индазол-5-амин
MS (ESI m/z): 192 (M+H)
RT (мин.): 0,63
Справочный пример 309
Следующие соединения получали как описано в Справочном примере 307.
[Формула 344]
1-циклопропил-3-фтор-6-нитро-1H-индазол
MS (ESI m/z): 222 (M+H)
RT (мин.): 1,50
1-циклопропил-3-фтор-1H-индазол-6-амин
MS (ESI m/z): 192 (M+H)
RT (мин.): 0,97
Справочный пример 311
Следующие соединения получали как описано в Справочном примере 307.
[Формула 345]
1-циклопропил-3-метил-5-нитро-1H-индазол
MS (ESI m/z): 218 (M+H)
RT (мин.): 1,36
1-циклопропил-3-метил-1H-индазол-5-амин
MS (ESI m/z): 188 (M+H)
RT (мин.): 0,54
Справочный пример 312
Следующие соединения получали как описано в Справочном примере 307.
[Формула 346]
1-циклопропил-3-этил-5-нитро-1H-индазол
MS (ESI m/z): 232 (M+H)
RT (мин.): 1,59
1-циклопропил-3-этил-1H-индазол-5-амин
MS (ESI m/z): 202 (M+H)
RT (мин.): 0,64
Справочный пример 313
Следующие соединения получали как описано в Справочном примере 307.
[Формула 347]
1-циклопропил-5-нитро-3-пропил-1H-индазол
MS (ESI m/z): 246 (M+H)
RT (мин.): 1,72
1-циклопропил-3-пропил-1H-индазол-5-амин
MS (ESI m/z): 216 (M+H)
RT (мин.): 0,73
Справочный пример 314
Следующие соединения получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 348]
1,3-диметил-6-нитро-1H-индазол
MS (ESI m/z): 192 (M+H)
RT (мин.): 1,37
1,3-диметил-1H-индазол-6-амин
MS (ESI m/z): 162 (M+H)
RT (мин.): 0,52
Справочный пример 315
Следующие соединения получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 349]
1-этил-3-метил-6-нитро-1H-индазол
MS (ESI m/z): 206 (M+H)
RT (мин.): 1,34
1-этил-3-метил-1H-индазол-6-амин
MS (ESI m/z): 176 (M+H)
RT (мин.): 0,60
Справочный пример 316
Следующие соединения получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 350]
1-(2-метоксиэтил)-3-метил-6-нитро-1H-индазол
MS (ESI m/z): 236 (M+H)
RT (мин.): 1,40
1-(2-метоксиэтил)-3-метил-1H-индазол-6-амин
MS (ESI m/z): 206 (M+H)
RT (мин.): 0,58
Справочный пример 317
Следующие соединения получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 351]
1-(2-фторэтил)-3-метил-6-нитро-1H-индазол
MS (ESI m/z): 224 (M+H)
RT (мин.): 1,30
1-(2-фторэтил)-3-метил-1H-индазол-6-амин
MS (ESI m/z): 194 (M+H)
RT (мин.): 0,59
Справочный пример 318
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Справочного примера 275.
[Формула 352]
1-(2,2-дифторэтил)-3-метил-1H-индазол-6-амин
MS (ESI m/z): 212 (M+H)
RT (мин.): 0,75
Справочный пример 319
Следующие соединения получали как описано в Справочном примере 275.
[Формула 353]
3-фтор-1-(2-метоксиэтил)-4-нитро-1H-индазол
MS (ESI m/z): 240 (M+H)
RT (мин.): 1,39
3-фтор-1-(2-метоксиэтил)-1H-индазол-4-амин
MS (ESI m/z): 210 (M+H)
RT (мин.): 0,93
Справочный пример 320
Следующие соединения получали как описано в Справочном примере 319.
[Формула 354]
3-фтор-5-нитро-1H-индазол
MS (ESI m/z): 182 (M+H)
RT (мин.): 1,30
1-(2,2-дифторэтил)-3-фтор-5-нитро-1H-индазол
MS (ESI m/z): 246 (M+H)
RT (мин.): 1,58
1-(2,2-дифторэтил)-3-фтор-1H-индазол-5-амин
MS (ESI m/z): 216 (M+H)
RT (мин.): 0,57
Справочный пример 321
[Формула 355]
1-ая стадия
2-фторэтилтрифторметан сульфонат (30 мкл) и карбонат калия (31 мг) добавляли в атмосфере азота к раствору (0,4 мл) 1,4-диоксана, содержащему 3-фтор-4-нитро-1H-индазол (20 мг), с последующим перемешиванием при 70°C в течение 5 часов. К реакционному раствору добавляли этилацетат, нерастворимый осадок удаляли, и растворитель отгоняли при пониженном давлении. Затем полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 1:1), и таким образом получали 3-фтор-1-(2-фторэтил)-4-нитро-1H-индазол (13 мг).
MS (ESI m/z): 228 (M+H)
RT (мин.): 1,40
2-ая стадия
Следующее соединение получали как описано в Справочном примере 305.
3-фтор-1-(2-фторэтил)-1H-индазол-4-амин
MS (ESI m/z): 198 (M+H)
RT (мин.): 0,95
Справочный пример 322
Следующие соединения получали как описано в Справочном примере 321.
[Формула 356]
1-(2,2-дифторэтил)-3-фтор-4-нитро-1H-индазол
MS (ESI m/z): 246 (M+H)
RT (мин.): 1,45
1-(2,2-дифторэтил)-3-фтор-1H-индазол-4-амин
MS (ESI m/z): 216 (M+H)
RT (мин.): 1,06
Справочный пример 323
Следующие соединения получали как описано в Справочном примере 22 и на 1-ой стадии Справочного примера 190.
[Формула 357]
1-ая стадия
5-бром-2'-хлор-3,4'-бипиридин
MS (ESI m/z): 269, 271, 273 (M+H)
RT (мин.): 1,33
2-ая стадия
5-бром-2'-метокси-3,4'-бипиридин
MS (ESI m/z): 265, 267 (M+H)
RT (мин.): 1,35
Справочный пример 324
[Формула 358]
1-ая стадия
Карбонат цезия (550 мг), L-пролин (65 мг) и 1H-1,2,3-триазол (92 мг) добавляли к раствору диметилсульфоксида (3 мл), содержащему 2-гидрокси-3-йод-5-нитропиридин (300 мг), и затем добавляли в атмосфере азота йодид меди (106 мг) с последующим перемешиванием при 100°C в течение 3 часов. Реакционный раствор охлаждали до комнатной температуры. Добавляли воду и этилацетат. Доводили рН до рН 7 с помощью 1M соляной кислоты. Нерастворимое вещество отфильтровывали с последующей экстракцией этилацетатом (×3). Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол = от 1:0 до 10:1), и таким образом получали смесь (184 мг) 5-нитро-3-(2H-1,2,3-триазол-2-ил)пиридин-2-ола и 5-нитро-3-(1H-1,2,3-триазол-1-ил)пиридин-2-ола в форме твердого вещества оранжевого цвета.
2-ая стадия
Карбонат серебра (377 мг) и метил йодид (366 мкл) добавляли к раствору хлороформа (10 мл), содержащему смесь 5-нитро-3-(2H-1,2,3-триазол-2-ил)пиридин-2-ол и 5-нитро-3-(1H-1,2,3-триазол-1-ил)пиридин-2-ол (184 мг), полученный на 1-ой стадии, экранируя свет, с последующим нагреванием с обратным холодильником в течение 2 часов. Добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 2:5 до 2:3), и таким образом получали твердое вещество белого цвета 1-метил-5-нитро-3-(2H-1,2,3-триазол-2-ил)пиридин-2(1H)-он (28,1 мг) и твердое вещество белого цвета 1-метил-5-нитро-3-(1H-1,2,3-триазол-1-ил)пиридин-2(1H)-он (23,3 мг).
3-я стадия
Следующие соединения получали как описано на 3-ей стадии Справочного примера 161.
5-Амино-1-метил-3-(2H-1,2,3-триазол-2-ил)пиридин-2(1H)-он
MS (ESI m/z): 129 (M+H)
RT (мин.): 0,21, 0,26
1H-ЯМР (DMSO-d6, 300 МГц) δ: 8,00 (с, 2H), 7,41 (д, 1H, J=2,4 Гц), 7,13 (д, 1H, J=2,4 Гц), 4,53 (ушир., 2H), 3,51 (с, 3H)
5-Амино-1-метил-3-(1H-1,2,3-триазол-1-ил)пиридин-2(1H)-он
MS (ESI m/z): 192 (M+H)
RT (мин.): 0,29
1H-ЯМР (DMSO-d6, 300 МГц) δ: 8,85-8,83 (м, 1H), 7,89-7,87 (м, 1H), 7,85 (д, 1H, J=2,7 Гц), 7,12 (д, 1H, J=2,7 Гц), 1,82 (ушир., 2H), 3,51 (с, 3H)
Справочный пример 325
[Формула 359]
1-ая стадия
TFA (1 мл) добавляли к (2-хлор-5-фторпиридин-4-ил)трет-бутилкарбамату (100 мг), с последующим перемешиванием при комнатной температуре в течение 0,5 часов. Растворитель отгоняли при пониженном давлении. Остаток использовали на следующем стадии.
2-ая стадия
Остаток, полученный на 1-ой стадии, и раствор метилата натрия (5M метанольный раствор) (5 мл) добавляли в пробирку, и пробирку закупоривали с последующим перемешиванием при 170°C в течение 3 часов. Реакционный раствор охлаждали до комнатной температуры. Добавляли гидроксид натрия (49 мг) с последующим перемешиванием при 170°C в течение 1 часа. Реакционный раствор охлаждали до комнатной температуры, растворитель отгоняли при пониженном давлении и добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Затем результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 4:1 до 1:1), и таким образом получали желтое масляное вещество 3-фтор-2-метоксипиридин-4-амин (27 мг).
MS (ESI m/z): 143 (M+H)
RT (мин.): 0,41
Справочный пример 326
Следующее соединение получали как описано в Справочном примере 325.
[Формула 360]
2-Этокси-3-фторпиридин-4-амин
MS (ESI m/z): 157 (M+H)
RT (мин.): 0,53
Справочный пример 327
Следующее соединение получали, как описано в Journal of Medicinal Chemistry, 2007, vol. 50, # 15, pp. 3730-3742.
[Формула 361]
4-(5-бром-3-метоксипиридин-2-ил)морфолин
Справочный пример 328
[Формула 362]
1-ая стадия
Метилат натрия (5M метанольный раствор) (0,5 мл) добавляли к метанольному раствору (1 мл) 2,3-дихлор-5-нитропиридина (50 мг) с последующим перемешиванием при комнатной температуре в течение 1,5 часов. Добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, и таким образом получали бесцветное масляное вещество 3-хлор-2-метокси-5-нитропиридин (45,8 мг).
2-ая стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 112.
5-Хлор-6-метоксипиридин-3-амин
MS (ESI m/z): 159, 161 (M+H)
RT (мин.): 0,74
Справочный пример 329
[Формула 363]
1-ая стадия
Следующее соединение получали как описано в Справочном примере 18.
3-Хлор-5-нитро-2-(1H-пиразол-1-ил)пиридин
MS (ESI m/z): 225, 227 (M+H)
RT (мин.): 1,15
2-ая стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 112.
5-Хлор-6-(1H-пиразол-1-ил)пиридин-3-амин
MS (ESI m/z): 195, 197 (M+H)
RT (мин.): 0,80
Справочный пример 330
[Формула 364]
1-ая стадия
Следующее соединение получали как описано в Справочном примере 18.
2-хлор-5-фтор-6-(1H-пиразол-1-ил)метилникотинат
MS (ESI m/z): 256, 258 (M+H)
RT (мин.): 1,26
2-ая стадия
10% Pd/C (40 мг) и формиат аммония (210 мг) добавляли к метанольному раствору (10 мл), содержащему 2-хлор-5-фтор-6-(1H-пиразол-1-ил)метилникотинат (42 мг), полученный на 1-ой стадии, с последующим перемешиванием при 70°C в течение 1,5 часов. Нерастворимое вещество удаляли, и растворитель отгоняли при пониженном давлении.
5-фтор-6-(1H-пиразол-1-ил)метилникотинат
MS (ESI m/z): 222 (M+H)
RT (мин.): 1,08
3-я стадия
1M водный раствор гидроксида натрия (1 мл) добавляли к раствору метанол/тетрагидрофуран (1 мл/1 мл), содержащему остаток, полученный на 2-ой стадии, с последующим нагреванием с обратным холодильником в течение 1,5 часов. Затем добавляли 2M водный раствор гидроксида натрия (1 мл) с последующим нагреванием с обратным холодильником в течение 0,5 часов. Нерастворимое вещество удаляли, и растворитель отгоняли при пониженном давлении. К реакционному раствору добавляли воду, и реакционный раствор подкисляли 1M соляной кислотой с последующей экстракцией этилацетатом (×3). Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, и таким образом получали бесцветное масляное вещество 5-фтор-6-(1H-пиразол-1-ил) никотиновая кислота (45,8 мг).
MS (ESI m/z): 208 (M+H)
RT (мин.): 1,08
4-ая стадия
Триэтиламин (193 мкл), трет-бутанол (227 мкл) и DPPA (525 мкл) добавляли к толуольному (5 мл) раствору, содержащему 5-фтор-6-(1H-пиразол-1-ил)никотиновую кислоту (330 мг), с последующим нагреванием с обратным холодильником в течение 3 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 10:1 до 3:1), и таким образом получали твердое вещество белого цвета (5-фтор-6-(1H-пиразол-1-ил)пиридин-3-ил)трет-бутилкарбамат (210 мг).
MS (ESI m/z): 279 (M+H)
RT (мин.): 1,37
1H ЯМР (DMSO-d6, 300 МГц) δ: 10,03 (с, 1H), 8,37 (д, 1H, J=2,1 Гц), 8,30 (д, 1H, J=2,7 Гц), 8,05 (дд, 1H, J=2,1, 12,3 Гц), 7,79 (д, 1H, J=1,2 Гц), 6,57-6,53 (м, 1H), 1,50 (с, 3H)
5-ая стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 141.
5-Фтор-6-(1H-пиразол-1-ил)пиридин-3-амин
MS (ESI m/z): 179 (M+H)
RT (мин.): 0,71
Справочный пример 331
[Формула 365]
1-ая стадия
Следующее соединение получали как описано на 1-ой стадии Справочного примера 18.
3-Йод-5-нитро-2-(1H-пиразол-1-ил)пиридин
MS (ESI m/z): 317 (M+H)
RT (мин.): 1,30
2-ая стадия
Порошок железа (160 мг) и хлорид аммония (50 мг) добавляли к этанольному раствору (4 мл), содержащему остаток, полученный на 1-ой стадии, с последующим нагреванием с обратным холодильником в течение 5 часов. Нерастворимое вещество удаляли и добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество желтого цвета 5-йод-6-(1H-пиразол-1-ил)пиридин-3-амин (210 мг).
MS (ESI m/z): 287 (M+H)
RT (мин.): 0,86
3-я стадия
L-пролин (7 мг), карбонат цезия (60 мг) и йодид меди (12 мг) добавляли в атмосфере азота к раствору диметилсульфоксида (1 мл), содержащему 5-йод-6-(1H-пиразол-1-ил)пиридин-3-амин (35 мг), с последующим перемешиванием при 100°C в течение 5 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 5:1 до 1:1), и получали твердое вещество желтого цвета 5,6-ди-(1H-пиразол-1-ил)пиридин-3-амин (4 мг).
MS (ESI m/z): 227 (M+H)
RT (мин.): 0,75
Справочный пример 332
[Формула 366]
Следующие соединения получали как описано на 3-ей стадии Справочного примера 331.
6-(1H-пиразол-1-ил)-5-(2H-1,2,3-триазол-2-ил)пиридин-3-амин
MS (ESI m/z): 228 (M+H)
RT (мин.): 0,70
1H-ЯМР (CDCl3, 300 МГц) δ: 8,10-8,00 (м, 1H), 7,90-7,80 (м, 1H), 7,76 (с, 2H), 7,55-7,47 (м, 1H), 7,44-7,36 (м, 1H), 6,41-6,33 (м, 1H), 4,06 (ушир., 2H)
6-(1H-пиразол-1-ил)-5-(1H-1,2,3-триазол-1-ил)пиридин-3-амин
MS (ESI m/z): 228 (M+H)
RT (мин.): 0,59
1H-ЯМР (CDCl3, 300 МГц) δ: 8,08 (д, 1H, J=2,7 Гц), 7,67 (д, 1H, J=1,5 Гц), 7,64-7,62 (м, 2H), 7,49 (д, 1H, J=2,7 Гц), 7,27-7,25 (м, 1H), 6,39-6,36
Справочный пример 333
Следующее соединение получали, как описано в WO2006/95159 A1.
[Формула 367]
5-хлор-6-морфолинопиридин-3-амин
MS (ESI m/z): 214, 216 (M+H)
RT (мин.): 0,77
Справочный пример 334
[Формула 368]
1-ая стадия
Карбонат калия (78 мг) и 2-окса-6-азаспиро[3,3]гептан (30 мг) добавляли к раствору метанол/DMF (1 мл/2 мл), содержащему 2-хлор-5-нитропиридин (30 мг), с последующим перемешиванием при 80°C в течение 3 часов. Реакционный раствор охлаждали до комнатной температуры и добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:1 до 1:4), и таким образом получали твердое вещество белого цвета 6-(5-нитропиридин-2-ил)-2-окса-6-азаспиро [3,3] гептан (23 мг).
MS (ESI m/z): 222 (M+H)
RT (мин.): 0,88
2-ая стадия
Следующее соединение получали как описано на 1-ой стадии Справочного примера 263.
6-(2-окса-6-азаспиро [3,3]гептан-6-ил)пиридин-3-амин
MS (ESI m/z): 192 (M+H)
RT (мин.): 0,30
Справочный пример 335
Следующее соединение получали как описано на 3-ей стадии Справочного примера 347.
[Формула 369]
4-(4-бром-1H-пирроло[2,3-c]пиридин-7-ил)морфолин
MS (ESI m/z): 282, 284 (M+H)
RT (мин.): 0,74
Справочный пример 336
Следующее соединение получали, как описано в WO2007/120729 A2, 2007.
[Формула 370]
5-фтор-6-метоксиникотиновая кислота
Справочный пример 337
[Формула 371]
1-ая стадия
Триэтиламин (267 мкл), трет-бутанол (230 мкл) и DPPA (413 мкл) добавляли к толуольному раствору (5 мл), содержащему 5-фтор-6-метоксиникотиновую кислоту (275 мг), с последующим нагреванием с обратным холодильником в течение 3 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 10:1 до 3:1), и таким образом получали бесцветное масляное вещество (5-фтор-6-метоксипиридин-3-ил)трет-бутилкарбамат (279 мг).
MS (ESI m/z): 243 (M+H)
RT (мин.): 1,46
2-ая стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 141.
5-фтор-6-метоксипиридин-3-амин
MS (ESI m/z): 143 (M+H)
RT (мин.): 0,56
Справочный пример 338
[Формула 372]
N,N-диметилглицин (1,27 г), йодид меди (1,88 г), трет-бутоксид калия (4,1 г) и 1H-1,2,3-триазол (1,7 г) добавляли к раствору диметилсульфоксида (25 мл), содержащему 5-бром-6-метоксипиридин-3-амин (25 г), с последующим перемешиванием при 130°C в течение 2 часов. К реакционному раствору добавляли воду и подкисляли до рН 4 с помощью 4M соляной кислоты с последующей экстракцией этилацетатом (×5). Результант высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = 1:1), и таким образом получали желтое масляное вещество 6-метокси-5-(2H-1,2,3-триазол-2-ил)пиридин-3-амин (1 г) и твердое вещество светло-желтого цвета 6-метокси-5-(1H-1,2,3-триазол-1-ил)пиридин-3-амин (525 мг).
(Химические данные: См. Справочный пример 280),
Справочный пример 339
[Формула 373]
1-ая стадия
Следующее соединение получали как описано на 1-ой стадии Справочного примера 190.
2-Этокси-3-йод-5-нитропиридин
MS (ESI m/z): 295 (M+H)
RT (мин.): 1,68
2-ая стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 331.
6-Этокси-5-йодпиридин-3-амин
MS (ESI m/z): 265 (M+H)
RT (мин.): 1,09
3-я стадия
Следующее соединение получали как описано в Справочном примере 337.
6-Этокси-5-(1H-пиразол-1-ил)пиридин-3-амин
MS (ESI m/z): 205 (M+H)
RT (мин.): 0,91
Справочный пример 340
Следующие соединения получали как описано в Справочном примере 338.
[Формула 374]
6-Этокси-5-(2H-1,2,3-триазол-2-ил)пиридин-3-амин
MS (ESI m/z): 206 (M+H)
RT (мин.): 0,75
1H-ЯМР (CDCl3, 300 МГц) δ: 7,85 (с, 2H), 7,76 (д, 1H, J=3,3 Гц), 7,34 (д, 1H, J=3,3 Гц), 4,41 (кв., 2H, J=7,2 Гц), 3,51 (ушир., 2H), 1,36 (т, 3H, J=7,2 Гц)
6-Этокси-5-(1H-1,2,3-триазол-1-ил)пиридин-3-амин
MS (ESI m/z): 206 (M+H)
RT (мин.): 0,78
1H-ЯМР (CDCl3, 300 МГц) δ: 8,39 (с, 1H), 7,83-7,80 (м, 1H), 7,77 (д, 1H, J=2,7 Гц), 7,72 (д, 1H, J=2,7 Гц), 4,43 (кв., 2H, J=7,2 Гц), 3,60 (ушир., 2H), 1,40 (т, 3H, J=7,2 Гц)
Справочный пример 341
[Формула 375]
1-ая стадия
Следующее соединение получали как описано на 1-ой стадии Справочного примера 190.
2-Этокси-3-метил-5-нитропиридин
MS (ESI m/z): 183 (M+H)
RT (мин.): 1,64
2-ая стадия
Следующее соединение получали как описано на 3-ей стадии Справочного примера 161.
6-Этокси-5-метилпиридин-3-амин
MS (ESI m/z): 153 (M+H)
RT (мин.): 0,67
Справочный пример 342
Следующее соединение получали как описано в Справочном примере 341.
[Формула 376]
1-ая стадия
2-(Метоксиэтокси)-3-метил-5-нитропиридин
MS (ESI m/z): 213 (M+H)
RT (мин.): 1,38
2-ая стадия
6-(Метоксиэтокси)-5-метилпиридин-3-амин
MS (ESI m/z): 183 (M+H)
RT (мин.): 0,58
Справочный пример 343
[Формула 377]
1-ая стадия
Карбонат цезия (75 мг) и пиразол (12 мг) добавляли к N,N-диметилацетамидному раствору (5 мл), содержащему 6-хлор-5-метилпиридин-3-амин (12 мг), с последующим нагреванием с обратным холодильником в течение 3,5 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 1:0 до 10:1), и получали твердое вещество светло-желтого цвета 3-метил-5-нитро-2-(1H-пиразол-1-ил)пиридин (12 мг).
MS (ESI m/z): 205 (M+H)
RT (мин.): 1,39
2-ая стадия
Следующее соединение получали как описано на 3-ей стадии Справочного примера 161.
5-Метил-6-(1H-пиразол-1-ил)пиридин-3-амин
MS (ESI m/z): 175 (M+H)
RT (мин.): 0,71
Справочный пример 344
Следующие соединения получали как описано в Справочном примере 343.
[Формула 378]
1-ая стадия
3-Метил-5-нитро-2-(2H-1,2,3-триазол-2-ил)пиридин
MS (ESI m/z): 206 (M+H)
RT (мин.): 1,08
1H-ЯМР (CDCl3, 300 МГц) δ: 9,28 (д, 1H, J=2,7 Гц), 8,56 (д, 1H, J=2,7 Гц), 7,99 (с, 2H), 2,74 (с, 3H)
3-Метил-5-нитро-2-(1H-1,2,3-триазол-1-ил)пиридин
MS (ESI m/z): 206 (M+H)
RT (мин.): 1,01
1H-ЯМР (CDCl3, 300 МГц) δ: 9,21 (д, 1H, J=2,7 Гц), 8,59 (д, 1H, J=2,7 Гц), 8,57-8,54 (м, 1H), 7,89-7,86 (м, 1H), 2,87 (с, 3H)
2-ая стадия
5-Метил-6-(2H-1,2,3-триазол-1-ил)пиридин-3-амин
MS (ESI m/z): 176 (M+H)
RT (мин.): 0,67
5-Метил-6-(2H-1,2,3-триазол-2-ил)пиридин-3-амин
MS (ESI m/z): 176 (M+H)
RT (мин.): 0,58
Справочный пример 345
[Формула 379]
1-ая стадия
Карбонат цезия (2,45 г), 1H-1,2,3-триазол (0,52 г), 2,2,6,6-тетраметилгептан-3,5-дион (0,39 мл) и йодид меди (I) (0,72 г) добавляли к раствору N-метилпирролидона (10 мл), содержащему 2-гидрокси-3-йод-5-нитропиридин (1,00 г), с последующим перемешиванием при 170°C в течение 30 минут. Реакционный раствор охлаждали до комнатной температуры, добавляли воду, нерастворимый осадок удаляли и добавляли 6M соляной кислоты (1,5 мл) и хлорид натрия (10,0 г), с последующей экстракцией этилацетатом. Затем результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток подвергали хроматографии на силикагеле (н-гексан:этилацетат = от 1:1 до 1:4) для удаления исходных компонентов, и таким образом получали смесь 2-гидрокси-5-нитро-3-(2H-1,2,3-триазол-2-ил)пиридина и 2-гидрокси-5-нитро-3-(1H-1,2,3-триазол-1-ил)пиридина (385 мг) в форме твердого вещества желтого цвета.
2-ая стадия
Тионил хлорид (3,9 мл) и DMF (0,39 мл) добавляли к смеси 2-гидрокси-5-нитро-3-(2H-1,2,3-триазол-2-ил)пиридина и 2-гидрокси-5-нитро-3-(1H-1,2,3-триазол-1-ил)пиридина (385 мг), с последующим перемешиванием при 90°C в течение 2 часов. Реакционный раствор охлаждали до комнатной температуры, медленно добавляли к воде со льдом и перемешивали при охлаждении льдом в течение 30 минут с последующей экстракцией этилацетатом. Затем результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 9:1 до 2:1), и таким образом получали твердое вещество желтого цвета 2-хлор-5-нитро-3-(2H-1,2,3-триазол-2-ил)пиридин (177 мг) и твердое вещество желтого цвета 2-хлор-5-нитро-3-(1H-1,2,3-триазол-1-ил)пиридин (83 мг).
2-Хлор-5-нитро-3-(2H-1,2,3-триазол-2-ил)пиридин
MS (ESI m/z): 226, 228 (M+H)
RT (мин.): 1,10
1H-ЯМР (DMSO-d6, 300 МГц) δ: 9,32 (д, 1H, J=2,5 Гц), 8,85 (д, 1H, J=2,5 Гц), 8,01 (с, 2H)
2-Хлор-5-нитро-3-(1H-1,2,3-триазол-1-ил)пиридин
MS (ESI m/z): 226, 228 (M+H)
RT (мин.): 0,84
1H-ЯМР (DMSO-d6, 300 МГц) δ: 9,38 (д, 1H, J=2,3 Гц), 8,90 (д, 1H, J=2,3 Гц),
Справочный пример 346
Следующее соединение получали как описано в Справочном примере 341.
[Формула 380]
2-(2-Метоксиэтокси)-5-нитро-3-(1H-1,2,3-триазол-1-ил)пиридин
MS (ESI m/z): 266 (M+H)
RT (мин.): 1,26
6-(2-Метоксиэтокси)-5-(1H-1,2,3-триазол-1-ил)пиридин-3-амин
MS (ESI m/z): 236 (M+H)
RT (мин.): 0,69
Справочный пример 347
[Формула 381]
1-ая стадия
Пиразол (0,60 г), карбонат цезия (3,6 г), N,N-диметилглицин (0,76 г) и йодид меди (I) (0,76 г) добавляли в атмосфере азота к раствору N,N-диметилацетамида (20 мл), содержащему 2-гидрокси-3-йод-5-нитропиридин (2,00 г), с последующим перемешиванием при 90°C в течение 2,5 часов. Реакционный раствор охлаждали до комнатной температуры, добавляли воду и этилацетат, и нерастворимый осадок удаляли. Подкисляли до рН 2 добавлением 6M соляной кислоты. Затем органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении. К полученному остатку добавляли этилацетат, твердый осадок собирали фильтрацией, и таким образом получали твердое вещество зеленого цвета 2-гидрокси-5-нитро-3-(1H-пиразол-1-ил)пиридин (0,35 г). После этого фильтрат собирали, растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этил ацетат = от 3:1 до 0:1), и таким образом получали твердое вещество светло-зеленого цвета 2-гидрокси-5-нитро-3-(1H-пиразол-1-ил)пиридин (1,02 г).
MS (ESI m/z): 207 (M+H)
RT (мин.): 0,94
2-ая стадия
Тионил хлорид (6 мл) и DMF (0,1 мл) добавляли к 2-гидрокси-5-нитро-3-(1H-пиразол-1-ил)пиридину (1,37 г) с последующим перемешиванием при 80°C в течение 2,5 часов. Реакционный раствор охлаждали до комнатной температуры и медленно добавляли к воде со льдом с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 5:1 до 3:1), и таким образом получали твердое вещество желтого цвета 2-хлор-5-нитро-3-(1H-пиразол-1-ил)пиридин (0,12 г).
MS (ESI m/z): 225, 227 (M+H)
RT (мин.): 1,14
3-я стадия
Морфолин (50 мкл) добавляли к раствору тетрагидрофурана (1 мл), содержащему 2-хлор-5-нитро-3-(1H-пиразол-1-ил)пиридин (30 мг), с последующим перемешиванием при комнатной температуре в течение 2 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество желтого цвета 2-морфолино-5-нитро-3-(1H-пиразол-1-ил)пиридин (37 мг).
MS (ESI m/z): 276 (M+H)
RT (мин.): 1,13
4-ая стадия
Метанольный раствор (5 мл), содержащий 2-морфолино-5-нитро-3-(1H-пиразол-1-ил)пиридин (37 мг), получали и подвергали реакции гидрирования (комнатная температура; 1 бар; объемная скорость потока: 1 мл/мин.; 10%-ый Pd/C) с использованием H-cube™. Затем растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество белого цвета 6-морфолино-5-(1H-пиразол-1-ил)пиридин-3-амин (31 мг).
MS (ESI m/z): 246 (M+H)
RT (мин.): 0,70
Справочный пример 348
[Формула 382]
1-ая стадия
Карбонат цезия (3,6 г), циклопропилбороновой кислоты·моногидрат (1,0 г), тетракис(трифенилфосфин)палладий (0,87 г) и воду (0,2 мл) добавляли в атмосфере азота к раствору (20 мл) 1,4-диоксана, содержащему 2-гидрокси-3-йод-5-нитропиридин (2,00 г), с последующим перемешиванием в течение 10 часов. Затем к реакционному раствору добавляли N,N-диметилацетамид (10 мл) с последующим перемешиванием при 120°C в течение 7,5 часов. Реакционный раствор охлаждали до комнатной температуры и подкисляли до рН 2 добавлением воды и 6M соляной кислоты с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 3:1 до 0:1), и таким образом получали твердое вещество белого цвета 2-гидрокси-5-нитро-3-циклопропилпиридин (0,41 г).
MS (ESI m/z): 181 (M+H)
RT (мин.): 1,04
2-ая, 3-я и 4-ая стадии
Следующие соединения получали как описано на 2-ой, 3-ей и 4-ой стадиях Справочного примера 347.
2-Хлор-5-нитро-3-(1H-пиразол-1-ил)пиридин
MS (ESI m/z): 199, 201 (M+H)
RT (мин.): 1,44
2-Морфолино-5-нитро-3-циклопропилпиридин
MS (ESI m/z): 250 (M+H)
RT (мин.): 1,44
6-Морфолино-5-циклопропилпиридин-3-амин
MS (ESI m/z): 220 (M+H)
RT (мин.): 0,63
Справочный пример 349
[Формула 383]
1-ая стадия
Морфолин (0,5 мл) добавляли к раствору 1,4-диоксана (1 мл), содержащему 2-хлор-5-нитро-3-(2H-1,2,3-триазол-2-ил)пиридин (30 мг), с последующим перемешиванием при комнатной температуре в течение 30 минут. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество желтого цвета 5-нитро-2-морфолино-3-(2H-1,2,3-триазол-2-ил)пиридин (33 мг).
MS (ESI m/z): 277 (M+H)
RT (мин.): 1,15
2-ая стадия
Метанольный раствор (15 мл), содержащий 5-нитро-2-морфолино-3-(2H-1,2,3-триазол-2-ил)пиридин (33 мг), получали и подвергали реакции гидрирования (комнатная температура; 1 бар; объемная скорость потока: 1 мл/мин.; 10%-ый Pd/C) с использованием H-cube™. Затем растворитель отгоняли при пониженном давлении, и таким образом получали бесцветное масляное вещество 6-морфолино-3-(2H-1,2,3-триазол-2-ил)пиридин-4-амин (30 мг).
MS (ESI m/z): 247 (M+H)
RT (мин.): 0,60
Справочный пример 350
Следующие соединения получали как описано в Справочном примере 349.
[Формула 384]
5-Нитро-2-морфолино-3-(1H-1,2,3-триазол-1-ил)пиридин
MS (ESI m/z): 277 (M+H)
RT (мин.): 0,97
6-Морфолино-3-(1H-1,2,3-триазол-1-ил)пиридин-4-амин
MS (ESI m/z): 247 (M+H)
RT (мин.): 0,61
Справочный пример 351
Следующие соединения получали как описано в Справочном примере 254.
[Формула 385]
2-(Имидазол-1-ил)-5-нитропиридин
MS (ESI m/z): 191 (M+H)
RT (мин.): 0,48
6-(Имидазол-1-ил)-пиридин-3-амин
MS (ESI m/z): 161 (M+H)
RT (мин.): 0,28
Справочный пример 352
Следующие соединения получали как описано в Справочном примере 254.
[Формула 386]
2-(2-Метилимидазол-1-ил)-5-нитропиридин
MS (ESI m/z): 205 (M+H)
RT (мин.): 0,44
6-(2-Метилимидазол-1-ил)-пиридин-3-амин
MS (ESI m/z): 175 (M+H)
RT (мин.): 0,28
Справочный пример 353
Следующие соединения получали как описано в Справочном примере 254.
[Формула 387]
2-((Оксазолидин-2-он)-3-ил)-5-нитропиридин
MS (ESI m/z): 210 (M+H)
RT (мин.): 0,95
6-((Оксазолидин-2-он)-1-ил)-пиридин-3-амин
MS (ESI m/z): 180 (M+H)
RT (мин.): 0,36
Справочный пример 354
Следующее соединение получали как описано в Справочном примере 22.
[Формула 388]
5-(нитробензол-3-ил)-пиридин-3-амин
MS (ESI m/z): 216 (M+H)
RT (мин.): 0,68
Справочный пример 355
Следующее соединение получали, как описано в Synthesis, 1990, # 6, pp. 499-501.
[Формула 389]
3-Бром-2-хлор-5-нитропиридин
Справочный пример 356
[Формула 390]
1-ая стадия
Метилат натрия (28%-ый метанольный раствор) (2 мл) добавляли к метанольному раствору (2 мл), содержащему 3-бром-2-хлор-5-нитропиридин (100 мг), с последующим перемешиванием при комнатной температуре в течение 1 часа. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество желтого цвета 3-бром-2-метокси-5-нитропиридин (96 мг).
MS (ESI m/z): 233, 235 (M+H)
RT (мин.): 1,43
2-ая стадия
Морфолин (54 мкл), карбонат цезия (336 мг), Pd2(dba)3 (57 мг) и Xantphos (72 мг) добавляли в атмосфере азота к раствору 1,4-диоксана (3 мл), содержащему 3-бром-2-метокси-5-нитропиридин (96 мг), с последующим перемешиванием при 100°C в течение 10 часов. Реакционный раствор охлаждали до комнатной температуры и добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 4:1 до 2:1), и таким образом получали твердое вещество желтого цвета 2-метокси-3-морфолино-5-нитропиридин (54 мг).
MS (ESI m/z): 240 (M+H)
RT (мин.): 1,21
3-я стадия
Метанольный раствор (15 мл), содержащий 2-метокси-3-морфолино-5-нитропиридин (27 мг), получали и подвергали реакции гидрирования (комнатная температура; 1 бар; объемная скорость потока: 1 мл/мин.; 10%-ый Pd/C) с использованием H-cube™. Затем растворитель отгоняли при пониженном давлении, и таким образом получали бесцветное масляное вещество 6-метокси-5-морфолинопиридин-3-амин (28 мг).
MS (ESI m/z): 210 (M+H)
RT (мин.): 0,53
Справочный пример 357
Следующие соединения получали как описано в Справочном примере 356.
[Формула 391]
3-Бром-2-этокси-5-нитропиридин
MS (ESI m/z): 247, 249 (M+H)
RT (мин.): 1,62
2-Этокси-3-морфолино-5-нитропиридин
MS (ESI m/z): 254 (M+H)
RT (мин.): 1,39
6-Этокси-5-морфолинопиридин-3-амин
MS (ESI m/z): 224 (M+H)
RT (мин.): 0,65
Справочный пример 358
[Формула 392]
1-ая стадия
2-метоксиэтанол (133 мкл) при охлаждении льдом добавляли к раствору тетрагидрофурана (50 мл), содержащему гидрид натрия (60 % в масле, 51 мг), с последующим перемешиванием при комнатной температуре в течение 30 минут. Реакционный раствор снова охлаждали льдом и добавляли 3-бром-2-хлор-5-нитропиридин (200 мг) с последующим перемешиванием при комнатной температуре в течение 1 часа. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (н-гексан:этил ацетат = от 4:1 до 1:1), и получали твердое вещество желтого цвета 2-(2-метоксиэтокси)-3-морфолино-5-нитропиридин (97 мг).
MS (ESI, m/z): 277, 279 (M+H)
RT (мин.): 1,40
2-ая и 3-я стадии
Следующие соединения получали как описано на 2-ой и 3-ей стадиях Справочного примера 356.
2-(2-Метоксиэтокси)-3-морфолино-5-нитропиридин
MS (ESI m/z): 284 (M+H)
RT (мин.): 1,23
6-(2-Метоксиэтокси)-5-морфолинопиридин-3-амин
MS (ESI m/z): 254 (M+H)
RT (мин.): 0,58
Справочный пример 359
[Формула 393]
1-ая стадия
Следующее соединение получали как описано на 1-ой стадии Справочного примера 358.
2-хлор-5-фтор-6-(2-метоксиэтокси)-фторметилникотинат
MS (ESI m/z): 264, 266 (M+H)
RT (мин.): 1,38
2-ая, 3-я, 4-ая и 5-ая стадии
Следующие соединения получали как описано на 2-ой, 3-ей, 4-ой и 5-ой стадиях Справочного примера 330.
6-(2-метоксиэтокси)-фторметилникотинат
MS (ESI m/z): 230 (M+H)
RT (мин.): 1,23
6-(2-Метоксиэтокси)-5-фторникотинат
MS (ESI m/z): 216 (M+H)
RT (мин.): 0,93
(5-фтор-6-(2-метоксиэтокси)пиридин-3-ил)трет-бутилкарбамат
MS (ESI m/z): 287 (M+H)
RT (мин.): 1,45
6-(2-Метоксиэтокси)-5-фторпиридин-3-амин
MS (ESI m/z): 187 (M+H)
RT (мин.): 0,64
Справочный пример 360
[Формула 394]
1-ая стадия
Следующее соединение получали как описано в Справочном примере 22.
2-хлор-6-циклопропил-5-фторметилникотинат
MS (ESI m/z): 230, 232 (M+H)
RT (мин.): 1,62
2-ая, 3-я, 4-ая и 5-ая стадии
Следующие соединения получали как описано на 2-ой, 3-ей, 4-ой и 5-ой стадиях Справочного примера 330.
6-циклопропил-5-фторметилникотинат
MS (ESI m/z): 196 (M+H)
RT (мин.): 1,46
6-Циклопропил-5-фторникотиновая кислота
MS (ESI m/z): 182 (M+H)
RT (мин.): 1,10
(6-циклопропил-5-фторпиридин-3-ил)трет-бутилкарбамат
MS (ESI m/z): 253 (M+H)
RT (мин.): 1,64
6-Циклопропил-5-фторпиридин-3-амин
MS (ESI m/z): 153 (M+H)
RT (мин.): 0,57
Справочный пример 361
[Формула 395]
1-ая стадия
Следующее соединение получали как описано в Справочном примере 22.
2-хлор-5-фтор-6-винилметилникотинат
MS (ESI m/z): 216, 218 (M+H)
RT (мин.): 1,49
2-ая, 3-я, 4-ая и 5-ая стадии
Следующие соединения получали как описано на 2-ой, 3-ей, 4-ой и 5-ой стадиях Справочного примера 330.
6-этил-5-фторметилникотинат
MS (ESI m/z): 184 (M+H)
RT (мин.): 1,27
6-Этил-5-фторникотиновая кислота
MS (ESI m/z): 170 (M+H)
RT (мин.): 0,93
(6-этил-5-фторпиридин-3-ил)трет-бутилкарбамат
MS (ESI m/z): 241 (M+H)
RT (мин.): 1,48
6-Этил-5-фторпиридин-3-амин
MS (ESI m/z): 141 (M+H)
RT (мин.): 0,46
Справочный пример 362
[Формула 396]
1-ая стадия
Карбонат цезия (338 мг), метилбороновую кислоту (47 мг) и тетракис(трифенилфосфин)палладий (60 мг) добавляли к раствору 1,4-диоксана (3 мл), содержащему 2,3-дихлор-5-нитропиридин (100 мг), с последующим перемешиванием при 100°C в течение 6 часов. Реакционный раствор охлаждали до комнатной температуры и добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, и таким образом получали 3-хлор-2-метил-5-нитропиридин (344 мг).
2-ая стадия
Воду (1 мл), порошок железа (344 мг) и хлорид аммония (172 мг) добавляли к раствору этанола (5 мл), содержащему сырой продукт (344 мг), полученный на 1-ой стадии, с последующим перемешиванием при 90°C в течение 1 часа. Реакционный раствор охлаждали до комнатной температуры, добавляли воду и этилацетат, и нерастворимое вещество удаляли фильтрацией. Полученный органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат = от 4:1 до 1:1), и таким образом получали желтое масляное вещество 5-хлор-6-метилпиридин-3-амин (53 мг).
MS (ESI m/z): 143, 145 (M+H)
RT (мин.): 0,42
Справочный пример 363
Следующее соединение получали как описано в Справочном примере 362.
[Формула 397]
5-Хлор-6-этилпиридин-3-амин
MS (ESI m/z): 157, 159 (M+H)
RT (мин.): 0,59
Справочный пример 364
Следующее соединение получали как описано в Справочном примере 362.
[Формула 398]
5-Хлор-6-циклопропилпиридин-3-амин
MS (ESI m/z): 169, 171 (M+H)
RT (мин.): 0,75
Справочный пример 365
Следующее соединение получали как описано на 1-ой стадии Справочного примера 356 и 2-ой стадии Справочного примера 362.
[Формула 399]
5-Хлор-6-этоксипиридин-3-амин
MS (ESI m/z): 173, 175 (M+H)
RT (мин.): 1,08
Справочный пример 366
Следующее соединение получали как описано на 1-ой стадии Справочного примера 358 и 2-ой стадии Справочного примера 362.
[Формула 400]
5-Хлор-6-(2-метоксиэтокси)пиридин-3-амин
MS (ESI m/z): 203, 205 (M+H)
RT (мин.): 0,83
Справочный пример 367
[Формула 401]
1-ая стадия
Следующее соединение получали как описано на 1-ой стадии Справочного примера 358.
2-хлор-6-этокси-5-фторметилникотинат
MS (ESI, m/z): 234, 236 (M+H)
RT (мин.): 1,58
2-ая, 3-я, 4-ая и 5-ая стадии
Следующие соединения получали как описано на 2-ой, 3-ей, 4-ой и 5-ой стадиях Справочного примера 330.
6-этокси-5-фторметилникотинат
MS (ESI m/z): 200 (M+H)
RT (мин.): 1,44
6-Этокси-5-фторникотиновая кислота
MS (ESI m/z): 1,10 (M+H)
RT (мин.): 186
(6-этокси-5-фторпиридин-3-ил)трет-бутилкарбамат
MS (ESI m/z): 257 (M+H)
RT (мин.): 1,59
6-Этокси-5-фторпиридин-3-амин
MS (ESI m/z): 157 (M+H)
RT (мин.): 0,76
Справочный пример 368
[Формула 402]
1-ая стадия
Следующее соединение получали как описано на 1-ой стадии Справочного примера 358.
3-Циклопропил-2-этокси-5-нитропиридин
MS (ESI m/z): 209 (M+H)
RT (мин.): 1,72
2-ая стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 330.
6-Этокси-3-циклопропилпиридин-3-амин
MS (ESI m/z): 179 (M+H)
RT (мин.): 0,83
Справочный пример 369
Следующее соединение получали как описано в Справочном примере 368.
[Формула 403]
1-ая стадия
3-Циклопропил-2-(2-метоксиэтокси)-5-нитропиридин
MS (ESI m/z): 239 (M+H)
RT (мин.): 1,50
2-ая стадия
6-(2-Метоксиэтокси)-3-циклопропилпиридин-3-амин
MS (ESI m/z): 209 (M+H)
RT (мин.): 0,73
Справочный пример 370
Следующие соединения получали как описано в Справочном примере 368.
[Формула 404]
1-ая стадия
2-(2-Метоксиэтокси)-5-нитро-3-(1H-пиразол-1-ил)пиридин
MS (ESI m/z): 265 (M+H)
RT (мин.): 1,34
2-ая стадия
6-(2-Метоксиэтокси)-5-(1H-пиразол-1-ил)пиридин-3-амин
MS (ESI m/z): 235 (M+H)
RT (мин.): 0,80
Справочный пример 371
[Формула 405]
1-ая стадия
Гидроксид калия (6,45 г) и йод (15,6 г) добавляли к раствору DMF (60 мл), содержащему 5-нитроиндазол (5,0 г), с последующим перемешиванием при 65°C в течение 1 часа. Реакционный раствор охлаждали до комнатной температуры и вливали в насыщенный водный раствор гидрокарбоната натрия, твердый осадок собирали фильтрацией, и таким образом получали твердое вещество желтого цвета 3-йод-5-нитро-1H-индазол (6,83 г).
MS (ESI m/z): 290 (M+H)
RT (мин.): 1,28
2-ая стадия
Следующее соединение получали как описано в Справочном примере 103.
3-Йод-1-метил-5-нитро-1H-индазол
MS (ESI m/z): 304 (M+H)
RT (мин.): 1,41
3-я стадия
Следующее соединение получали как описано в Справочном примере 338.
1-Метил-5-нитро-3-(1H-пиразол-1-ил)-1H-индазол
MS (ESI m/z): 244 (M+H)
RT (мин.): 1,41
4-ая стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 190.
1-Метил-3-(1H-пиразол-1-ил)-1H-индазол-5-амин
MS (ESI m/z): 214 (M+H)
RT (мин.): 1,61
Справочный пример 372
[Формула 406]
1-ая стадия
Гидразин·моногидрат (6,38 мл) добавляли к этанольному раствору (5 мл), содержащий 2-бром-5-нитрометилбензоат (3,41 г), с последующим нагреванием с обратным холодильником в течение 1 часа. Реакционный раствор охлаждали до комнатной температуры, добавляли воду и 1M соляной кислоты, и нерастворимый осадок собирали фильтрацией. Таким образом получали твердое вещество светло-коричневого цвета 5-нитро-1H-индазол-3-ол (1,15 г).
MS (ESI m/z): 180 (M+H)
RT (мин.): 0,73
2-ая стадия
Следующее соединение получали как описано в Справочном примере 103.
3-Метокси-1-метил-5-нитро-1H-индазол
MS (ESI m/z): 208 (M+H)
RT (мин.): 1,33
3-я стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 190.
3-Метокси-1-метил-1H-индазол-5-амин
MS (ESI m/z): 178 (M+H)
RT (мин.): 0,44
Справочный пример 373
[Формула 407]
Следующие соединения получали как описано на 2-ой и 3-ей стадиях Справочного примера 372.
1-ая стадия
3-Этокси-1-этил-5-нитро-1H-индазол
MS (ESI m/z): 236 (M+H)
RT (мин.): 1,66
2-ая стадия
3-Этокси-1-этил-1H-индазол-5-амин
MS (ESI m/z): 206 (M+H)
RT (мин.): 0,64
Справочный пример 374-1
Следующее соединение синтезировали как описано в WO2010/097248.
[Формула 408]
((3R,4R)-4-аминотетрагидро-2H-пиран-3-ил)трет-бутилкарбамат
Справочный пример 374-2
Следующее соединение синтезировали как описано в WO2010/097248.
[Формула 409]
((3R,4R)-4-азидотетрагидро-2H-пиран-3-ил)трет-бутилкарбамат
Справочный пример 375
[Формула 410]
1-ая стадия
TFA (1 мл) добавляли к раствору хлороформа (1 мл), содержащему ((3R,4R)-4-азидотетрагидро-2H-пиран-3-ил)трет-бутилкарбамат (60 мг), с последующим перемешиванием при комнатной температуре в течение 1 часа. Величину рН реакционного раствора доводили до рН 12 добавлением воды, хлороформа и 5M водного раствора гидроксида натрия. Органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, и таким образом получали бесцветное масляное вещество (3R,4R)-4-азидотетрагидро-2H-пиран-3-амин (22 мг).
Справочный пример 376
Следующее соединение синтезировали как описано в WO2005/066176.
[Формула 411]
(транс)-бензил-4-((трет-бутоксикарбонил)амино)-3-гидроксипиперидин-1-карбоксилат
Справочный пример 377
[Формула 412]
1-ая стадия
Триэтиламин (209 мкл) и метансульфонил хлорид (93 мкл) добавляли при охлаждении льдом к раствору дихлорметана (5 мл), содержащему (транс)-бензил-4-((трет-бутоксикарбонил)амино)-3-гидроксипиперидин-1-карбоксилат (350 мг), с последующим перемешиванием при комнатной температуре в течение 5 часов. Реакционный раствор снова охлаждали льдом и добавляли воду с последующей экстракцией этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 4:1 до 3:2), и таким образом получали бесцветное масляное вещество (транс)-бензил-4-((трет-бутоксикарбонил)амино)-3-((метилсульфонил)окси)пиперидин-1-карбоксилат (535 мг).
2-ая стадия
Ацетат натрия (204 мг) и азид натрия (161 мг) добавляли к раствору DMF (5 мл), содержащему (транс)-бензил-4-((трет-бутоксикарбонил)амино)-3-((метилсульфонил)окси)пиперидин-1-карбоксилат (532 мг), с последующим перемешиванием при 80°C в течение 4 часов. Величину рН реакционного раствора доводили до рН 12 добавлением воды и 2M водного раствора гидроксида натрия, с последующей экстракцией этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 4:1 до 2:1), и таким образом получали твердое вещество белого цвета (цис)-бензил-3-азидо-4-((трет-бутоксикарбонил)амино)пиперидин-1-карбоксилат (124 мг).
3-я стадия
Трифенилфосфин (172 мг) добавляли к раствору тетрагидрофуран/вода (4,95/0,05 мл), содержащему (цис)-бензил-3-азидо-4-((трет-бутоксикарбонил)амино)пиперидин-1-карбоксилат (123 мг), с последующим перемешиванием при 100°C в течение 6 часов. Величину рН реакционного раствора доводили до рН 1 добавлением воды и 2M соляной кислоты. Реакционный раствор промывали этилацетатом. Величину рН водного слоя доводили до рН 13 добавлением 5M водного раствора гидроксида натрия с последующей экстракцией этилацетатом. Полученный органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, и таким образом получали бесцветное масляное вещество (цис)-бензил-3-амино-4-((трет-бутоксикарбонил)амино)пиперидин-1-карбоксилат (61 мг).
Справочный пример 378
Следующие соединения синтезировали как описано в Справочном примере 377.
[Формула 413]
(транс)-бензил-3-((трет-бутоксикарбонил)амино)-4-((метилсульфонил)окси)пиперидин-1-карбоксилат
(цис)-бензил-4-азидо-3-((трет-бутоксикарбонил)амино)пиперидин-1-карбоксилат
(цис)-бензил-4-амино-3-((трет-бутоксикарбонил)амино)пиперидин-1-карбоксилат
Справочный пример 379
[Формула 414]
1-ая стадия
Триэтиламин (640 мг) и метансульфонил хлорид (470 мг) добавляли к раствору тетрагидрофурана (10 мл), содержащему (S)-трет-бутил-(1-гидроксибутан-2-ил)карбамат (600 мг) в ванне со льдом с последующим перемешиванием при комнатной температуре в течение 1,5 часов. К реакционному раствору добавляли насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией этилацетатом. Результант высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, и таким образом получали (S)-2-((трет-бутоксикарбонил)амино)бутилметансульфонат.
2-ая стадия
Фталимид калия (650 мг) добавляли к раствору DMF (10 мл), содержащему (S)-2-((трет-бутоксикарбонил)амино)бутилметансульфонат, полученный на 1-ой стадии, с последующим перемешиванием при 70°C в течение 1 часа. Реакционный раствор охлаждали до комнатной температуры и добавляли по каплям к насыщенному водному раствору гидрокарбоната натрия (300 мл), и твердый осадок собирали фильтрацией. Затем полученное твердое вещество очищали хроматографией на силикагеле (н-гексан:этил ацетат = 3:1), и таким образом получали твердое вещество белого цвета (S)-трет-бутил(2-((1,3-диоксоизоиндолин-2-ил)бутан-2-ил)карбамат (560 мг).
MS (ESI m/z): 319 (M+H)
RT (мин.): 1,46
3-я стадия
Гидразин·моногидрат (0,076 мл) добавляли к этанольному (6 мл) раствору, содержащему (S)-трет-бутил-(2-((1,3-диоксоизоиндолин-2-ил)бутан-2-ил)карбамат (250 мг) с последующим перемешиванием при комнатной температуре в течение 2 часов. Растворитель отгоняли при пониженном давлении и добавляли простой диизопропиловый эфир с последующим перемешиванием. Нерастворимое вещество удаляли. 4M хлорид водорода/1,4-диоксан (1 мл) добавляли к полученному раствору, твердый осадок собирали фильтрацией, и таким образом получали твердое вещество белого цвета (S)-трет-бутил-(1-аминобутан-2-ил)карбамат (160 мг).
MS (ESI m/z): 190 (M+H)
Справочный пример 380
Следующие соединения получали как описано в Справочном примере 379.
[Формула 415]
(S)-трет-бутил(1-(1,3-диоксоизоиндолин-2-ил)пропан-2-ил)карбамат
MS (ESI m/z): 306 (M+H)
RT (мин.): 1,35
(S)-трет-бутил(1-аминопропан-2-ил)карбамат
MS (ESI m/z): 175 (M+H)
Справочный пример 381
Следующие соединения получали как описано в Справочном примере 379.
[Формула 416]
(R)-трет-бутил(2-((1,3-диоксоизоиндолин-2-ил)бутан-2-ил)карбамат
MS (ESI m/z): 319 (M+H)
RT (мин.): 1,46
(R)-трет-бутил(1-аминобутан-2-ил)карбамат
MS (ESI m/z): 190 (M+H)
Справочный пример 382
Следующие соединения получали как описано в Справочном примере 379.
[Формула 417]
(S)-трет-бутил(1-(1,3-диоксоизоиндолин-2-ил)-3-метилбутан-2-ил)карбамат
MS (ESI m/z): 333 (M+H)
RT (мин.): 1,56
(S)-трет-бутил(1-амино-3-метилбутан-2-ил)карбамат
MS (ESI m/z): 203 (M+H)
Справочный пример 383
Следующие соединения получали как описано в Справочном примере 379.
[Формула 418]
(S)-трет-бутил(1-(1,3-диоксоизоиндолин-2-ил)-3,3-диметилбутан-2-ил)карбамат
MS (ESI m/z): 347 (M+H)
RT (мин.): 1,65
(S)-трет-бутил(1-амино-3,3-диметилбутан-2-ил)карбамат
MS (ESI m/z): 217 (M+H)
RT (мин.): 0,82
Справочный пример 384
Следующие соединения получали как описано в Справочном примере 379.
[Формула 419]
(R)-трет-бутил(1-(1,3-диоксоизоиндолин-2-ил)-3-метоксипропан-2-ил)карбамат
MS (ESI m/z): 335 (M+H)
RT (мин.): 1,35
(R)-трет-бутил(1-амино-3-метоксипропан-2-ил)карбамат
MS (ESI m/z): 205 (M+H)
Справочный пример 385
Следующее соединение получали как описано в Справочном примере 379.
[Формула 420]
(S)-трет-бутил(1-(1,3-диоксоизоиндолин-2-ил)-4-метилпентан-2-ил)карбамат
MS (ESI m/z): 347 (M+H)
RT (мин.): 1,67
Справочный пример 386
[Формула 421]
Карбонат калия (139 мг) и 6-хлор-5-фтор-2-(хинолин-6-иламино)никотинонитрил (60 мг) добавляли в пробирку, содержащую раствор 1,4-диоксана (2 мл), содержащий (S)-трет-бутил(1-амино-4-метилпентан-2-ил)карбамат (76 мг), и пробирку закупоривали с последующим перемешиванием с нагреванием при 140°C в течение 13,5 часов. Реакционный раствор охлаждали до комнатной температуры, и нерастворимый осадок удаляли. Затем растворитель отгоняли при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат = 1:1), и таким образом получали твердое вещество белого цвета (S)-трет-бутил(1-((5-циано-3-фтор-6-(хинолин-6-иламино)пиридин-2-ил)амино)-4-метилпентан-2-ил)карбамат (50 мг).
MS (ESI m/z): 479 (M+H)
RT (мин.): 1,39
Справочный пример 387
Следующие соединения получали как описано в Справочном примере 379.
[Формула 422]
(S)-трет-бутил(2-(1,3-диоксоизоиндолин-2-ил)-1-фенилэтил)карбамат
MS (ESI m/z): 367 (M+H)
RT (мин.): 1,62
(S)-трет-бутил(2-амино-1-фенилэтил)карбамат
MS (ESI m/z): 237 (M+H)
RT (мин.): 0,79
Справочный пример 388
Следующие соединения получали как описано в Справочном примере 379.
[Формула 423]
(R)-трет-бутил(2-(1,3-диоксоизоиндолин-2-ил)-1-(пиридин-2-ил)этил)карбамат
MS (ESI m/z): 368 (M+H)
RT (мин.): 1,35
(R)-трет-бутил(2-амино-1-(пиридин-2-ил)этил)карбамат
MS (ESI m/z): 238 (M+H)
RT (мин.): 0,67
Справочный пример 389
Следующие соединения получали как описано в Справочном примере 379.
[Формула 424]
(S)-трет-бутил(2-(1,3-диоксоизоиндолин-2-ил)-1-(пиридин-3-ил)этил)карбамат
MS (ESI m/z): 368 (M+H)
RT (мин.): 1,00
(S)-трет-бутил(2-амино-1-(пиридин-3-ил)этил)карбамат
MS (ESI m/z): 238 (M+H)
RT (мин.): 0,47
Справочный пример 390
Следующие соединения получали как описано в Справочном примере 379.
[Формула 425]
(S)-трет-бутил(2-(1,3-диоксоизоиндолин-2-ил)-1-(тиофен-3-ил)этил)карбамат
MS (ESI m/z): 373 (M+H)
RT (мин.): 1,56
(S)-трет-бутил(2-амино-1-(тифен-3-ил)этил)карбамат
MS (ESI m/z): 243 (M+H)
RT (мин.): 0,77
Справочный пример 391
Следующие соединения получали как описано в Справочном примере 379.
[Формула 426]
(S)-трет-бутил(1-(1,3-диоксоизоиндолин-2-ил)-3-фенилпропан-2-ил)карбамат
MS (ESI m/z): 381 (M+H)
RT (мин.): 1,64
(S)-трет-бутил(1-амино-3-фенилпропан-2-ил)карбамат
MS (ESI m/z): 251 (M+H)
Справочный пример 392
[Формула 427]
1-ая стадия
HOBt·H2O (353 мг), WSC·HCl (460 мг), диизопропилэтиламин (986 мг) и хлорид аммония (500 мг) добавляли при комнатной температуре к раствору DMF (5 мл), содержащему 2-((трет-бутоксикарбонил)амино)-2-циклопропилуксусную кислоту (500 мг), с последующим перемешиванием при комнатной температуре в течение 3 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией этилацетатом. Результант высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество белого цвета (2-амино-1-циклопропил-2-оксоэтил)трет-бутилкарбамат (500 мг).
MS (ESI m/z): 215 (M+H)
2-ая стадия
Комплекс боран-тетрагидрофуран (1,1 М тетрагидрофурана, 1,69 мл) медленно добавляли к тетрагидрофурановому раствору (5 мл), содержащему (2-амино-1-циклопропил-2-оксоэтил)трет-бутилкарбамат (200 мг), с последующим нагреванием с обратным холодильником в течение 2 часов. Реакционный раствор охлаждали до комнатной температуры, и к реакционному раствору медленно добавляли метанол до прекращения пенообразования. Далее добавляли хлороформ, результант промывали 1M водным раствором гидроксида натрия и насыщенным солевым раствором и высушивали над сульфатом натрия, растворитель отгоняли при пониженном давлении, и остаток непосредственно использовали в последующей реакции.
MS (ESI m/z): 201 (M+H)
Справочный пример 393
Следующие соединения получали как описано в Справочном примере 392.
[Формула 428]
(R)-трет-бутил(3-амино-1,1,1-трифтор-3-оксопропан-2-ил)карбамат
MS (ESI m/z): 241 (М-Н)
(R)-трет-бутил(3-амино-1,1,1-трифторпропан-2-ил)карбамат
MS (ESI m/z): 229 (M+H)
Справочный пример 394
Следующее соединение получали как описано в Справочном примере 392.
[Формула 429]
(1-карбамоилциклопропил)трет-бутилкарбамат
MS (ESI m/z): 201 (M+H)
(1-(аминометил)циклопропил)трет-бутилкарбамат
MS (ESI m/z): 187 (M+H)
Справочный пример 395
Следующее соединение получали как описано на 1-ой стадии Справочного примера 2.
[Формула 430]
(S)-трет-бутил(2-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-1-фенилэтил)карбамат
MS (ESI m/z): 391 (M+H)
RT (мин.): 1,71
Справочный пример 396
Следующие соединения получали как описано на 1-ой и 2-ой стадиях Справочного примера 379 и 2-ой стадии Справочного примера 97.
[Формула 431]
(R)-трет-бутил(1-(1,3-диоксоизоиндолин-2-ил)пропан-2-ил)карбамат
MS (ESI m/z): 306 (M+H)
RT (мин.): 1,35
(R)-2-(2-аминопропил)изоиндолин-1,3-дион
MS (ESI m/z): 206 (M+H)
RT (мин.): 0,49
Справочный пример 397
Следующие соединения получали как описано в Справочном примере 396.
[Формула 432]
(R)-трет-бутил(1-(1,3-диоксоизоиндолин-2-ил)бутан-2-ил)карбамат
MS (ESI m/z): 319 (M+H)
RT (мин.): 1,46
(R)-2-(2-аминобутил)изоиндолин-1,3-дион
MS (ESI m/z): 219 (M+H)
RT (мин.): 0,59
Справочный пример 398
[Формула 433]
1-ая стадия
Карбонат калия (146 мг) и 6-хлор-5-фтор-2-(хинолин-6-иламино)никотинонитрил (63 мг) добавляли в пробирку, содержащую раствор (2 мл) 1,4-диоксана, содержащий (R)-2-(2-аминобутил)изоиндолин-1,3-дион (60 мг), и пробирку закупоривали с последующим перемешиванием с нагреванием при 140°C в течение 13 часов. Реакционный раствор охлаждали и добавляли насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией этилацетатом. Органический слой высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении. Остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = 3:2), и таким образом получали твердое вещество желтого цвета (R)-6-((1-(1,3-диоксоизоиндолин-2-ил)бутан-2-ил)амино)-5-фтор-2-(хинолин-6-иламино)никотинонитрил (20 мг).
MS (ESI m/z): 481 (M+H)
RT (мин.): 1,13
2-ая стадия
Следующее соединение получали как описано на 3-ей стадии Примера 379.
(R)-6-((1-аминобутан-2-ил)амино)-5-фтор-2-(хинолин-6-иламино)никотинонитрил
MS (ESI m/z): 351 (M+H)
RT (мин.): 0,68
3-я стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 2.
(R)-трет-бутил(2-((5-циано-3-фтор-6-(хинолин-6-иламино)пиридин-2-ил)амино)бутил)карбамат
MS (ESI m/z): 451 (M+H)
RT (мин.): 1,21
Справочный пример 399
Следующие соединения получали как описано в Справочном примере 396.
[Формула 434]
(R)-трет-бутил(1-(1,3-диоксоизоиндолин-2-ил)-4-метилпентан-2-ил)карбамат
MS (ESI m/z): 347 (M+H)
RT (мин.): 1,65
(R)-2-(2-амино-4-метилпентил)изоиндолин-1,3-дион
MS (ESI m/z): 247 (M+H)
RT (мин.): 0,75
Справочный пример 400
[Формула 435]
Следующие соединения получали как описано в Справочном примере 398.
(R)-6-((1-(1,3-диоксоизоиндолин-2-ил)-4-метилпентан-2-ил)амино)-5-фтор-2-(хинолин-6-иламино)никотинонитрил
MS (ESI m/z): 509 (M+H)
RT (мин.): 1,28
(R)-6-((1-амино-4-метилпентан-2-ил)амино)-5-фтор-2-(хинолин-6-иламино)никотинонитрил
MS (ESI m/z): 379 (M+H)
RT (мин.): 0,83
(R)-трет-бутил(2-((5-циано-3-фтор-6-(хинолин-6-иламино)пиридин-2-ил)амино)-4-метилпентил)карбамат
MS (ESI m/z): 479 (M+H)
RT (мин.): 1,34
Справочный пример 401
Следующие соединения получали как описано в Справочном примере 396.
[Формула 436]
(R)-трет-бутил(2-(1,3-диоксоизоиндолин-2-ил)-1-фенилэтил)карбамат
MS (ESI m/z): 367 (M+H)
RT (мин.): 1,61
(R)-2-(2-амино-2-фенилэтил)изоиндолин-1,3-дион
MS (ESI m/z): 267 (M+H)
RT (мин.): 0,73
Справочный пример 402
Следующие соединения получали как описано в Справочном примере 398.
[Формула 437]
(R)-6-((2-(1,3-диоксоизоиндолин-2-ил)-1-фенилэтил)амино)-5-фтор-2-(хинолин-6-иламино)никотинонитрил
MS (ESI m/z): 529 (M+H)
RT (мин.): 1,29
(R)-6-((2-амино-1-фенилэтил)амино)-5-фтор-2-(хинолин-6-иламино)никотинонитрил
MS (ESI m/z): 399 (M+H)
RT (мин.): 0,76
(R)-трет-бутил(2-((5-циано-3-фтор-6-(хинолин-6-иламино)пиридин-2-ил)амино)-2-фенилэтил)карбамат
MS (ESI m/z): 499 (M+H)
RT (мин.): 1,34
Справочный пример 403
Следующие соединения получали как описано в Справочном примере 396.
[Формула 438]
(S)-трет-бутил(2-(1,3-диоксоизоиндолин-2-ил)-1-(пиридин-2-ил)этил)карбамат
MS (ESI m/z): 368 (M+H)
RT (мин.): 1,35
(S)-2-(2-амино-2-(пиридин-2-ил)этил)изоиндолин-1,3-дион
MS (ESI m/z): 268 (M+H)
RT (мин.): 0,62
Справочный пример 404
Следующие соединения получали как описано в Справочном примере 398.
[Формула 439]
(S)-6-((2-(1,3-диоксоизоиндолин-2-ил)-1-(пиридин-2-ил)этил)амино)-5-фтор-2-(хинолин-6-иламино)никотинонитрил
MS (ESI m/z): 530 (M+H)
RT (мин.): 1,14
(S)-6-((2-амино-1-(пиридин-2-ил)этил)амино)-5-фтор-2-(хинолин-6-иламино)никотинонитрил
MS (ESI m/z): 400 (M+H)
RT (мин.): 0,66
(S)-трет-бутил(2-((5-циано-3-фтор-6-(хинолин-6-иламино)пиридин-2-ил)амино)-2-(пиридин-2-ил)этил)карбамат
MS (ESI m/z): 500 (M+H)
RT (мин.): 1,15
Справочный пример 405
[Формула 440]
1-ая стадия
2,6-дихлор-5-фтор-3-пиридинкарбонитрил (3,3 г) и карбонат калия (1,1 г) добавляли к раствору DMF (5 мл), содержащему (R)- 2-(2-аминопропил)изоиндолин-1,3-дион·гидрохлорид (690 мг), с последующим перемешиванием с нагреванием при 60°C в течение 5,5 часов. Реакционный раствор охлаждали до комнатной температуры и добавляли насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией этилацетатом. Полученный органический слой высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, остаток очищали хроматографией на силикагеле (н-гексан:этил ацетат = 7:3), и таким образом получали твердое вещество желтого цвета (R)-2-хлор-6-((1-(1,3-диоксоизоиндолин-2-ил)пропан-2-ил)амино)-5-фторникотинонитрил (300 мг).
MS (ESI m/z): 359 (M+H)
RT (мин.): 1,46
2-ая стадия
Гидразин·моногидрат (0,124 мл) добавляли к раствору этанол/тетрагидрофуран (5 мл/1 мл), содержащему (R)-2-хлор-6-((1-(1,3-диоксоизоиндолин-2-ил)пропан-2-ил)амино)-5-фторникотинонитрил (300 мг), с последующим перемешиванием при комнатной температуре в течение 14 часов. Затем добавляли гидразин·моногидрат (0,062 мл) с последующим перемешиванием при комнатной температуре в течение 8,5 часов. Растворитель отгоняли при пониженном давлении, добавляли хлороформ, и нерастворимое вещество удаляли. Затем растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество желтого цвета (R)-6-((1-аминопропан-2-ил)амино)-2-хлор-5-фторникотинонитрил (38 мг).
MS (ESI m/z): 229 (M+H)
RT (мин.): 0,65
3-я стадия
Карбонат калия (127 мг) и ди-трет-бутил дикарбонат (220 мг) добавляли к раствору тетрагидрофуран/вода (8 мл/1,5 мл), содержащему (R)-6-((1-аминопропан-2-ил)амино)-2-хлор-5-фторникотинонитрил (190 мг), с последующим перемешиванием при комнатной температуре в течение 30 минут. Растворитель отгоняли при пониженном давлении, остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = 2:1), и таким образом получали желтое масляное вещество (R)-трет-бутил(2-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)пропил)карбамат (160 мг).
MS (ESI m/z): 329 (M+H)
RT (мин.): 1,54
Справочный пример 406
Следующие соединения получали как описано в Справочных примерах 396 и 405.
[Формула 441]
(R)-трет-бутил(1-(1,3-диоксоизоиндолин-2-ил)-3-метилбутан-2-ил)карбамат
MS (ESI m/z): 333 (M+H)
RT (мин.): 1,54
(R)-2-(2-амино-3-метилбутил)изоиндолин-1,3-дион
MS (ESI m/z): 233 (M+H)
RT (мин.): 0,67
(R)-2-хлор-6-((1-(1,3-диоксоизоиндолин-2-ил)-3-метилбутан-2-ил)амино)-5-фторникотинонитрил
MS (ESI m/z): 387 (M+H)
RT (мин.): 1,63
(R)-6-((1-амино-3-метилбутан-2-ил)амино)-2-хлор-5-фторникотинонитрил
MS (ESI m/z): 257 (M+H)
RT (мин.): 0,88
(R)-трет-бутил(2-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-3-метилбутил)карбамат
MS (ESI m/z): 357 (M+H)
RT (мин.): 1,71
Справочный пример 407
Следующие соединения получали как описано в Справочных примерах 396 и 405.
[Формула 442]
(R)-трет-бутил(1-циклопропил-2-(1,3-диоксоиндолин-2-ил)этил)карбамат
MS (ESI m/z): 331 (M+H)
RT (мин.): 1,48
(R)-2-(2-амино-2-циклопропилэтил)изоиндолин-1,3-дион
MS (ESI m/z): 231 (M+H)
RT (мин.): 0,62
(R)-2-хлор-6-((1-циклопропил-2-(1,3-диоксоиндолин-2-ил)этил)амино)-5-фторникотинонитрил
MS (ESI m/z): 385 (M+H)
RT (мин.): 1,57
(R)-трет-бутил(2-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-2-циклопропилэтил)карбамат
MS (ESI m/z): 355 (M+H)
RT (мин.): 1,64
Справочный пример 408
Следующие соединения получали как описано в Справочных примерах 396 и 405.
[Формула 443]
(R)-2-(2-амино-3,3-диметилбутил)изоиндолин-1,3-дион
MS (ESI m/z): 347 (M+H)
RT (мин.): 1,63
(R)-трет-бутил(1-(1,3-диоксоиндолин-2-ил)-3,3-диметилбутан-2-ил)карбамат
MS (ESI m/z): 247 (M+H)
RT (мин.): 0,73
(R)-2-хлор-6-((1-(1,3-диоксоиндолин-2-ил)-3,3-диметилбутан-2-ил)амино)-5-фторникотинонитрил
MS (ESI m/z): 401 (M+H)
RT (мин.): 1,70
(R)-6-((1-амино-3,3-диметилбутан-2-ил)амино)-2-хлор-5-фторникотинонитрил
MS (ESI m/z): 271 (M+H)
RT (мин.): 0,97
(R)-трет-бутил(2-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-3,3-диметилбутил)карбамат
MS (ESI m/z): 371 (M+H)
RT (мин.): 1,78
Справочный пример 409
Следующие соединения получали как описано в Справочных примерах 396 и 405.
[Формула 444]
(R)-трет-бутил(1-гидроксипентан-2-ил)карбамат
MS (ESI m/z): 333 (M+H)
RT (мин.): 1,56
(R)-2-(2-аминопентил)изоиндолин-1,3-дион
MS (ESI m/z): 233 (M+H)
RT (мин.): 0,64
(R)-2-хлор-6-((1-(1,3-диоксоиндолин-2-ил)пентан-2-ил)амино)-5-фторникотинонитрил
MS (ESI m/z): 387 (M+H)
RT (мин.): 1,65
(R)-6-((1-аминопентан-2-ил)амино)-2-хлор-5-фторникотинонитрил
MS (ESI m/z): 257 (M+H)
RT (мин.): 0,86
(R)-трет-бутил(2-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)пентил)карбамат
MS (ESI m/z): 357 (M+H)
RT (мин.): 1,73
Справочный пример 410
Следующие соединения получали как описано в Справочных примерах 396 и 405.
[Формула 445]
(R)-2-хлор-6-((1-(1,3-диоксоиндолин-2-ил)гексан-2-ил)амино)-5-фторникотинонитрил
MS (ESI m/z): 401 (M+H)
RT (мин.): 1,79
(R)-6-((1-аминогексан-2-ил)амино)-2-хлор-5-фторникотинонитрил
MS (ESI m/z): 271 (M+H)
RT (мин.): 1,02
(R)-трет-бутил(2-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)гексил)карбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,27 (д, 1H, J=9,3 Гц), 5,90 (д, 1H, J=7,3 Гц), 4,79 (ушир., 1H), 4,30-4,13 (м, 1H), 3,45-3,26 (м, 2H), 1,51-1,28 (м, 15H), 0,99-0,80 (м, 3H)
MS (ESI m/z): 371 (M+H)
RT (мин.): 1,83
Справочный пример 411
Следующие соединения получали как описано в Справочных примерах 396 и 405.
[Формула 446]
(R)-трет-бутил(1-(1,3-диоксоизоиндолин-2-ил)-5,5,5-трифторпентан-2-ил)карбамат
MS (ESI m/z): 387 (M+H)
RT (мин.): 1,58
(R)-2-хлор-6-((1-(1,3-диоксоиндолин-2-ил)-5,5,5-трифторпентан-2-ил)амино)-5-фторникотинонитрил
MS (ESI m/z): 441 (M+H)
RT (мин.): 1,64
(R)-трет-бутил(2-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-5,5,5-трифторпентил)карбамат
MS (ESI m/z): 412 (M+H)
RT (мин.): 1,72
Справочный пример 412
Следующие соединения получали как описано в Справочных примерах 396 и 405.
[Формула 447]
(R)-трет-бутил(1-(1,3-диоксоиндолин-2-ил)-4-метилпентан-2-ил)карбамат
MS (ESI m/z): 347 (M+H)
RT (мин.): 1,65
(R)-2-(2-амино-4-метилпентил)изоиндолин-1,3-дион
MS (ESI m/z): 247 (M+H)
RT (мин.): 0,75
(R)-2-хлор-6-((1-(1,3-диоксоиндолин-2-ил)-4-метилпентан-2-ил)амино)-5-фторникотинонитрил
MS (ESI m/z): 401 (M+H)
RT (мин.): 1,73
(R)-6-((1-амино-4-метилпентан-2-ил)амино)-2-хлор-5-фторникотинонитрил
MS (ESI m/z): 271 (M+H)
RT (мин.): 0,96
(R)-трет-бутил(2-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-4-метилпентил)карбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,27 (д, 1H, J=9,3 Гц), 5,74 (д, 1H, J=5,9 Гц), 4,79 (ушир., 1H), 4,42-4,24 (м, 1H), 3,42-3,22 (м, 2H), 1,72-1,30 (м, 12H), 1,00-0,92 (м, 6H)
MS (ESI m/z): 371 (M+H)
RT (мин.): 1,81
Справочный пример 413
Следующие соединения получали как описано в Справочных примерах 396 и 405.
[Формула 448]
(S)-трет-бутил(1-(1,3-диоксоиндолин-2-ил)-4-метилпентан-2-ил)карбамат
MS (ESI m/z): 347 (M+H)
RT (мин.): 1,67
(S)-2-(2-амино-4-метилпентил)изоиндолин-1,3-дион
MS (ESI m/z): 247 (M+H)
RT (мин.): 0,76
(S)-2-хлор-6-((1-(1,3-диоксоиндолин-2-ил)-4-метилпентан-2-ил)амино)-5-фторникотинонитрил
MS (ESI m/z): 401 (M+H)
RT (мин.): 1,73
(S)-6-((1-амино-4-метилпентан-2-ил)амино)-2-хлор-5-фторникотинонитрил
MS (ESI m/z): 271 (M+H)
RT (мин.): 0,98
(S)-трет-бутил(2-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-4-метилпентил)карбамат
MS (ESI m/z): 371 (M+H)
RT (мин.): 1,81
Справочный пример 414
Следующие соединения получали как описано в Справочных примерах 396 и 405.
[Формула 449]
(R)-трет-бутил(1-циклопропил-3-(1,3-диоксоиндолин-2-ил)пропан-2-ил)карбамат
MS (ESI m/z): 345 (M+H)
RT (мин.): 1,57
(R)-2-(2-амино-3-циклопропилпропил)изоиндолин-1,3-дион
MS (ESI m/z): 245 (M+H)
RT (мин.): 0,68
(R)-2-хлор-6-((1-циклопропил-3-(1,3-диоксоиндолин-2-ил)пропан-2-ил)амино)-5-фторникотинонитрил
MS (ESI m/z): 399 (M+H)
RT (мин.): 1,66
(R)-трет-бутил(2-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-3-циклопропилпропил)карбамат
MS (ESI m/z): 369 (M+H)
RT (мин.): 1,73
Справочный пример 415
Следующие соединения получали как описано в Справочных примерах 396 и 405.
[Формула 450]
(R)-трет-бутил(2-(1,3-диоксоиндолин-2-ил)-1-фенилэтил)карбамат
MS (ESI m/z): 367 (M+H)
RT (мин.): 1,61
(R)-2-(2-амино-2-фенилэтил)изоиндолин-1,3-дион
MS (ESI m/z): 267 (M+H)
RT (мин.): 0,73
(R)-2-хлор-6-((2-(1,3-диоксоиндолин-2-ил)-1-фенилэтил)амино)-5-фторникотинонитрил
MS (ESI m/z): 421 (M+H)
RT (мин.): 1,68
(R)-6-((2-амино-1-фенилэтил)амино)-2-хлор-5-фторникотинонитрил
MS (ESI m/z): 291 (M+H)
RT (мин.): 0,93
(R)-трет-бутил(2-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-2-фенилэтил)карбамат
MS (ESI m/z): 391 (M+H)
RT (мин.): 1,72
Справочный пример 416
Следующие соединения получали как описано в Справочных примерах 396 и 405.
[Формула 451]
трет-бутил(1-((1,3-диоксоиндолин-2-ил)метил)циклопропил)карбамат
MS (ESI m/z): 317 (M+H)
RT (мин.): 1,39
2-((1-аминоциклопропил)метил)изоиндолин-1,3-дион
MS (ESI m/z): 217 (M+H)
RT (мин.): 0,58
2-хлор-6-((1-((1,3-диоксоиндолин-2-ил)метил)циклопропил)амино)-5-фторникотинонитрил
MS (ESI m/z): 371 (M+H)
RT (мин.): 1,52
((1-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)циклопропил)метил)трет-бутилкарбамат
MS (ESI m/z): 341 (M+H)
RT (мин.): 1,53
Справочный пример 417
[Формула 452]
1-ая стадия
н-пропилмагний бромид (2M раствор в тетрагидрофуране) (100 мл) добавляли по каплям в течение 30 минут при охлаждении водой к раствору тетрагидрофурана (50 мл), содержащему (S)-трет-бутил(1-(метокси(метил)амино)-1-оксопропан-2-ил)карбамат (5 г), с последующим перемешиванием при комнатной температуре в течение 5 часов. Реакционный раствор охлаждали льдом и добавляли по каплям к 1M соляной кислоты с последующей экстракцией этилацетатом. Органический слой высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученное твердое вещество очищали хроматографией на силикагеле (н-гексан:этилацетат = 4:1), и таким образом получали желтое масляное вещество (S)-трет-бутил(3-оксогексан-2-ил)карбамат (3,7 г).
MS (ESI m/z): 216 (M+H)
RT (мин.): 1,37
2-ая стадия
Борогидрид натрия (3,7 г) добавляли в разделенных частях при комнатной температуре к раствору метанол/изопропанол (30 мл/30 мл), содержащему (S)-трет-бутил(3-оксогексан-2-ил)карбамат (17,5 г), с последующим перемешиванием в течение 1 часа. Растворитель отгоняли при пониженном давлении и добавляли воду с последующей экстракцией этилацетатом. Полученный органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, и получали твердое вещество белого цвета ((2S)-3-гидроксигексан-2-ил)трет-бутилакарбамат (17 г).
MS (ESI m/z): 218 (M+H)
RT (мин.): 1,27
3-я стадия
4-нитробензоат (16,3 г), трифенилфосфин (32 г) и диизопропил азодикарбоксилат (40%-ый раствор в толуоле) (64 мл) добавляли по каплям в течение 30 минут к тетрагидрофурановому (50 мл) раствору, содержащему ((2S)-3-гидроксигексан-2-ил)трет-бутилкарбамат (17 г), с последующим перемешиванием при комнатной температуре в течение 14 часов. Растворитель отгоняли из реакционного раствора при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = 5,5:1), и таким образом получали твердое вещество желтого цвета (2S)-2-((трет-бутоксикарбонил)амино)гексан-3-ил 4-нитробензоат (17 г).
MS (ESI m/z): 367 (M+H)
RT (мин.): 1,86
4-ая стадия
1M водный раствор гидроксида лития (60 мл) добавляли при комнатной температуре к раствору тетрагидрофуран/метанол (50 мл/100 мл), содержащему (2S)-2-((трет-бутоксикарбонил)амино)гексан-3-ил 4-нитробензоат (17 г), с последующим перемешиванием в течение 30 минут. Растворитель отгоняли при пониженном давлении и добавляли воду с последующей экстракцией этилацетатом. Полученный органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении, и таким образом получали бесцветное масляное вещество ((2S)-3-гидроксигексан-2-ил)трет-бутилкарбамат (9 г).
MS (ESI m/z): 218 (M+H)
RT (мин.): 1,27
5-ая стадия
Фталимид (8,2 г), трифенилфосфин (18 г) и диизопропил азодикарбоксилат (40%-ый раствор толуола) (37 мл) добавляли по каплям в течение 30 минут к раствору тетрагидрофурана (50 мл), содержащему ((2S)-3-гидроксигексан-2-ил)трет-бутилкарбамат (17 г), с последующим перемешиванием при комнатной температуре в течение 13,5 часов. Растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = 5,5:1 и гексан:ацетон = 9:1), и таким образом получали желтое масляное вещество ((2S,3R)-3-(1,3-диоксоиндолин-2-ил)гексан-2-ил)трет-бутилкарбамат (6 г).
1H ЯМР (CDCl3, 300 МГц) δ: 7,88-7,79 (м, 2H), 7,76-7,65 (м, 2H), 4,62-4,42 (м, 1H), 4,33-4,00 (м, 2H), 2,40-2,20 (м, 1H), 1,81-1,62 (м, 1H), 1,44 (с, 9H), 1,35-1,20 (м, 2H), 1,11 (д, 3H, J=6,6 Гц), 0,89 (т, 3H, J=7,3 Гц)
MS (ESI m/z): 347 (M+H)
RT (мин.): 1,70
6-ая стадия
Гидразин·моногидрат (2,6 г) добавляли к этанольному (20 мл) раствору, содержащему ((2S,3R)-3-(1,3-диоксоиндолин-2-ил)гексан-2-ил)трет-бутилкарбамат (6 г), с последующим перемешиванием при 80°C в течение 6 часов. Затем растворитель отгоняли при пониженном давлении, добавляли хлороформ, и нерастворимое вещество удаляли. Затем растворитель отгоняли при пониженном давлении, и таким образом получали ((2S,3R)-3-аминогексан-2-ил)трет-бутилкарбамат (6 г).
MS (ESI m/z): 217 (M+H)
RT (мин.): 0,79
7-ая стадия
Карбонат калия (4,8 г) и 2,6-дихлор-5-фтор-3-пиридинкарбонитрил (3,3 г) добавляли к раствору DMF (10 мл), содержащему ((2S,3R)-3-аминогексан-2-ил)трет-бутилкарбамат (6 г), с последующим перемешиванием при 60°C в течение 1 часа. Добавляли воду с последующей экстракцией этилацетатом. Органический слой высушивали над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении, остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = 9:1→4,5:1), и таким образом получали оранжевое масляное вещество ((2S,3R)-3-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)гексан-2-ил)трет-бутилкарбамат (3,8 г).
1H-ЯМР (CDCl3, 300 МГц) δ: 7,29 (д, 1H, J=9,3 Гц), 5,76 (д, 1H, J=7,3 Гц), 4,67 (д, 1H, J=6,6 Гц), 4,36-4,20 (м, 1H), 3,96-3,80 (м, 1H), 1,70-1,29 (м, 13H), 1,17 (д, 3H, J=6,6 Гц), 0,94 (т, 3H, J=7,3 Гц)
MS (ESI m/z): 371 (M+H)
RT (мин.): 1,78
Справочный пример 418
Следующие соединения получали как описано в Tetrahedron: Asymmetry, Vol. 8, No, 14, pp. 2381-2401, 1997.
[Формула 453]
((2S,3R)-3-аминобутан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 189 (M+H)
[Формула 454]
((2S,3S)-3-аминобутан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 189 (M+H)
RT (мин.): 0,62
Справочный пример 419
Следующее соединение получали как описано на 7-ой стадии Справочного примера 417.
[Формула 455]
((2S,3R)-3-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)бутан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 343 (M+H)
Справочный пример 420
Следующее соединение получали как описано на 7-ой стадии Справочного примера 417.
[Формула 456]
((2S,3S)-3-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)бутан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 343 (M+H)
RT (мин.): 1,63
Справочный пример 421
Следующее соединение получали как описано в Справочном примере 417.
[Формула 457]
((2S)-3-гидроксипентан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 204 (M+H)
RT (мин.): 1,12
(2S)-2-((трет-бутоксикарбонил)амино)пентан-3-ил 4-нитробензоат
MS (ESI m/z): 353 (M+H)
RT (мин.): 1,75
((2S)-3-гидроксипентан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 204 (M+H)
RT (мин.): 1,13
((2S,3R)-3-(1,3-диоксоиндолине-2-ил)пентан-2-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,84 (дд, 2H, J=3,3, 5,4 Гц), 7,72 (дд, 2H, J=3,3, 5,4 Гц), 4,60-4,50 (м, 1H), 4,35-4,20 (м, 1H), 4,10-3,95 (м, 1H), 2,38-2,17 (м, 1H), 1,93-1,80 (м, 1H), 1,43 (с, 9H), 1,11 (д, 3H, J=6,6 Гц), 0,86 (д, 3H, J=7,3 Гц)
MS (ESI m/z): 333 (M+H)
RT (мин.): 1,56
((2S,3R)-3-аминопентан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 203 (M+H)
RT (мин.): 0,69
((2S,3R)-3-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)пентан-2-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,29 (д, 1H, J=9,9 Гц), 5,76 (д, 1H, J=6,6 Гц), 4,68 (д, 1H, J=6,6 Гц), 4,26-4,14 (м, 1H), 3,98-3,84 (м, 1H), 1,80-1,62 (м, 1H), 1,49-1,36 (м, 10H), 1,17 (д, 3H, J=7,2 Гц), 0,97 (т, 3H, J=7,7 Гц)
MS (ESI m/z): 357 (M+H)
RT (мин.): 1,67
Справочный пример 422
Следующие соединения получали как описано в Справочном примере 417.
[Формула 458]
((2S,3S)-3-(1,3-диоксоиндолин-2-ил)пентан-2-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,85 (дд, 2H, J=3,3, 5,4 Гц), 7,73 (дд, 2H, J=3,3, 5,4 Гц), 5,50 (д, 1H, J=9,3 Гц), 4,12-4,09 (м, 2H), 2,19-2,03 (м, 1H), 1,87-1,73 (м, 1H), 1,31 (с, 9H), 1,12 (д, 3H, J=6,6 Гц), 0,87 (д, 3H, J=7,3 Гц)
MS (ESI m/z): 333 (M+H)
RT (мин.): 1,56
((2S,3S)-3-аминопентан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 203 (M+H)
RT (мин.): 0,67
((2S,3S)-3-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)пентан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 357 (M+H)
RT (мин.): 1,72
Справочный пример 423
Следующее соединение получали как описано в Справочном примере 417.
[Формула 459]
((2S)-1-циклопропил-1-гидроксипропан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 216 (M+H)
RT (мин.): 1,14
(2S)-2-((трет-бутоксикарбонил)амино)-1-циклопропилпропил-4-нитробензоат
MS (ESI m/z): 365 (M+H)
RT (мин.): 1,76
((2S)-1-циклопропил-1-гидроксипропан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 216 (M+H)
RT (мин.): 1,14
((1R,2S)-1-циклопропил-1-(1,3-диоксоиндолин-2-ил)пропан-2-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,87-7,68 (м, 4H), 4,62 (ушир., 1H), 4,45-4,28 (м, 1H), 3,31 (дд, 1H, J=10,7, 6,8 Гц), 2,25-1,75 (м, 1H), 1,40 (с, 9H), 1,18 (т, 3H, J=6,9 Гц), 0,85-0,72 (м, 1H), 0,52-0,38 (м, 2H), 0,16-0,04 (м, 1H)
MS (ESI m/z): 345 (M+H)
RT (мин.): 1,60
((1R,2S)-1-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-1-циклопропилпропан-2-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,32-7,28 (м, 1H), 6,20 (ушир., 1H), 4,90-4,74 (м, 1H), 4,12-3,98 (м, 1H), 3,68-3,50 (м, 1Й), 1,44 (с, 9H), 1,27 (т, 3H, J=3,3 Гц), 0,98-0,85 (м, 1H), 0,73-0,40 (м, 4H)
MS (ESI m/z): 369 (M+H)
RT (мин.): 1,72
Справочный пример 424
Следующие соединения получали как описано в Справочном примере 417.
[Формула 460]
(2S)-2-((трет-бутоксикарбонил)амино)-1-циклобутилпропил-4-нитробензоат
MS (ESI m/z): 379 (M+H)
RT (мин.): 1,91
((1R,2S)-1-циклобутил-1-(1,3-диоксоизоиндолин-2-ил)пропан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 359 (M+H)
RT (мин.): 1,71
((1R,2S)-1-амино-1-циклобутилпропан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 229 (M+H)
RT (мин.): 0,85
((1R,2S)-1-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-1-циклобутилпропан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 384 (M+H)
RT (мин.): 1,83
Справочный пример 425
Следующие соединения получали как описано в Справочном примере 417.
[Формула 461]
((2S)-4-циклопропил-3-гидроксибутан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 230 (M+H)
RT (мин.): 1,32
(3S)-3-((трет-бутоксикарбонил)амино)-1-циклопропилбутан-2-ил)-4-нитробензоат
MS (ESI m/z): 379 (M+H)
RT (мин.): 1,89
((2S)-4-циклопропил-3-гидроксибутан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 230 (M+H)
RT (мин.): 1,32
((2S,3R)-4-циклопропил-3-(1,3-диоксоиндолин-2-ил)бутан-2-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,87-7,69 (м, 4H), 5,81-5,66 (м, 1H), 5,00-4,82 (м, 2H), 4,58-4,46 (ушир., 1H), 4,33-4,06 (м, 2H), 2,55-1,80 (м, 2H), 1,44 (с, 9H), 1,34-1,26 (м, 2H), 1,11 (д, 3H, J=6,6 Гц)
MS (ESI m/z): 359 (M+H)
RT (мин.): 1,70
((2S,3R)-3-амино-4-циклопропилбутан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 229 (M+H)
RT (мин.): 0,89
((2S,3R)-3-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-4-циклопропилбутан-2-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,29 (д, 1H, J=9,9 Гц), 5,94-5,74 (м, 1H), 5,06-4,95 (м, 2H), 4,62 (ушир., 1H), 4,34-4,25 (м, 1H), 3,96-3,87 (м, 1H), 2,17-2,08 (м, 2H), 1,78-1,67 (м, 1H), 1,55-1,46 (м, 2H), 1,44 (с, 9H), 1,18 (д, 3H, J=7,3 Гц)
MS (ESI m/z): 383 (M+H)
RT (мин.): 1,77
Справочный пример 426
Следующие соединения получали как описано в Справочном примере 417.
[Формула 462]
(S)-(3-оксогептан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 230 (M+H)
RT (мин.): 1,53
((2S)-3-гидроксигептан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 232 (M+H)
RT (мин.): 1,40
(2S)-2-((трет-бутоксикарбонил)амино)гептан-3-ил-4-нитробензоат
MS (ESI m/z): 381 (M+H)
RT (мин.): 1,96
((2S)-3-гидроксигептан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 232 (M+H)
RT (мин.): 1,43
((2S,3R)-3-(1,3-диоксоиндолин-2-ил)гептан-2-ил)трет-бутилкарбамат
1H ЯМР (CDCl3, 300 МГц) δ: 7,87-7,79 (м, 2H), 7,76-7,68 (м, 2H), 4,53 (ушир., 1H), 4,32-3,99 (м, 2H), 2,40-2,17 (м, 1H), 1,86-1,69 (м, 1H), 1,44 (с, 9H), 1,36-1,04 (м, 7H), 0,83 (т, 3H, J=7,2 Гц)
MS (ESI m/z): 361 (M+H)
RT (мин.): 1,81
((2S,3R)-3-аминогептан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 231 (M+H)
RT (мин.): 0,89
((2S,3R)-3-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)гептан-2-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,29 (д, 1H, J=9,9 Гц), 5,74 (д, 1H, J=7,3 Гц), 4,68 (д, 1H, J=6,6 Гц), 4,34-4,18 (м, 1H), 3,97-3,80 (м, 1H), 1,71-1,22 (м, 15H), 1,17 (т, 3H, J=6,6 Гц), 0,89 (т, 3H, J=6,3 Гц)
MS (ESI m/z): 385 (M+H)
RT (мин.): 1,87
Справочный пример 427
Следующие соединения получали как описано в Справочном примере 417.
[Формула 463]
(S)-(5-метил-3-оксогексан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 230 (M+H)
RT (мин.): 1,53
((2S)-3-гидрокси-5-метилгексан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 232 (M+H)
RT (мин.): 1,42
(2S)-2-((трет-бутоксикарбонил)амино)-5-метилгексан-3-ил-4-нитробензоат
MS (ESI m/z): 381 (M+H)
RT (мин.): 1,95
((2S)-3-гидрокси-5-метилгексан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 232 (M+H)
RT (мин.): 1,42
((2S,3R)-3-(1,3-диоксоиндолин-2-ил)-5-метилгексан-2-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,86-7,77 (м, 2H), 7,75-7,66 (м, 2H), 4,55 (ушир., 1H), 4,32-4,12 (м, 2H), 2,48-2,30 (м, 1H), 1,51-1,36 (с, 10H), 1,32-1,22 (м, 1H), 1,11 (д, 3H, J=6,6 Гц), 0,92-0,84 (м, 6H)
MS (ESI m/z): 361 (M+H)
RT (мин.): 1,80
((2S,3R)-3-амино-5-метилгексан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 231 (M+H)
RT (мин.): 0,89
((2S,3R)-3-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-5-метилгексан-2-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,29 (д, 1H, J=9,9 Гц), 5,69 (д, 1H, J=7,9 Гц), 4,67 (д, 1H, J=6,6 Гц), 4,46-4,28 (м, 1H), 3,96-3,80 (м, 1H), 1,70-1,32 (м, 12H), 1,16 (д, 3H, J=6,6 Гц), 0,94 (дд, 6H, J=6,6, 2,0 Гц)
MS (ESI m/z): 385 (M+H)
RT (мин.): 1,86
Справочный пример 428
Следующие соединения получали как описано в Справочном примере 417.
[Формула 464]
(S)-(5-метил-3-оксогекса-5-ен-2-ил)трет-бутилкарбамат
MS (ESI, m/z): 228 (M+H)
RT (мин.): 1,40
((2S)-3-гидрокси-5-метилгекса-5-ен-2-ил)трет-бутилкарбамат
MS (ESI m/z): 230 (M+H)
RT (мин.): 1,30
(2S)-2-((трет-бутоксикарбонил)амино)-5-метилгексан-3-ил-4-нитробензоат
MS (ESI m/z): 379 (M+H)
RT (мин.): 1,85
((2S)-3-гидрокси-5-метилгексан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 230 (M+H)
RT (мин.): 1,30
((2S,3R)-3-(1,3-диоксоиндолин-2-ил)-5-метилгекса-5-ен-2-ил)трет-бутилкарбамат
MS (ESI m/z): 359 (M+H)
RT (мин.): 1,71
((2S,3R)-3-амино-5-метилгекса-5-ен-2-ил)трет-бутилкарбамат
MS (ESI m/z): 229 (M+H)
RT (мин.): 0,90
((2S,3R)-3-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-5-метилгекса-5-ен-2-ил)трет-бутилкарбамат
MS (ESI m/z): 383 (M+H)
RT (мин.): 1,77
Справочный пример 429
Следующие соединения получали как описано на 1-ой, 2-ой, 5-ой, 6-ой и 7-ой стадиях Справочного примера 417.
[Формула 465]
((2S)-1-гидрокси-1-фенилпропан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 252 (M+H)
RT (мин.): 1,34
((1R,2S)-1-(1,3-диоксоиндолин-2-ил)-1-фенилпропан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 381 (M+H)
RT (мин.): 1,67
((1R,2S)-1-амино-1-фенилпропан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 251
RT (мин.): 0,86
((1R,2S)-1-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-1-фенилпропан-2-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,95 (ушир., 1H), 7,42-7,19 (м, 6H), 5,04 (д, 1H, J=6,3 Гц), 4,37-4,20 (м, 2H), 1,49 (с, 9H), 1,13 (д, 3H, J=6,3 Гц)
MS (ESI m/z): 405 (M+H)
RT (мин.): 1,96
Справочный пример 430
Следующие соединения получали как описано в Справочном примере 417.
[Формула 466]
((2S)-1-(4-фторфенил)-1-гидроксипропан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 270 (M+H)
RT (мин.): 1,57
(2S)-2-((трет-бутоксикарбонил)амино)-1-(4-фторфенил)пропил-4-нитробензоат
MS (ESI m/z): 419 (M+H)
RT (мин.): 1,85
((2S)-1-(4-фторфенил)-1-гидроксипропан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 270 (M+H)
RT (мин.): 1,57
((1R,2S)-1-(1,3-диоксоиндолин-2-ил)-1-(4-фторфенил)пропан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 399 (M+H)
RT (мин.): 1,74
((1R,2S)-1-амино-1-(4-фторфенил)пропан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 269 (M+H)
RT (мин.): 0,89
((1R,2S)-1-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-1-(4-фторфенил)пропан-2-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 8,07 (ушир., 1H), 7,25-7,16 (м, 3H), 7,09-6,98 (м, 2H), 4,99 (д, 1H, J=5,9 Гц), 4,36-4,16 (м, 2H), 1,50 (с, 9H), 1,12 (д, 3H, J=6,6 Гц)
MS (ESI m/z): 423 (M+H)
RT (мин.): 1,81
Справочный пример 431
Следующие соединения получали как описано в Справочном примере 417.
[Формула 467]
(S)-(2-оксопентан-3-ил)трет-бутилкарбамат
MS (ESI m/z): 202 (M+H)
RT (мин.): 1,19
((3S)-2-гидроксипентан-3-ил)трет-бутилкарбамат
MS (ESI m/z): 204 (M+H)
RT (мин.): 1,09
(3S)-3-((трет-бутоксикарбонил)амино)пентан-2-ил-4-нитробензоат
MS (ESI m/z): 353 (M+H)
RT (мин.): 1,75
((3S)-2-гидроксипентан-3-ил)трет-бутилкарбамат
MS (ESI m/z): 204 (M+H)
RT (мин.): 1,09
((2R,3S)-2-(1,3-диоксоиндолин-2-ил)пентан-3-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,89-7,75 (м, 2H), 7,76-7,66 (м, 2H), 4,46 (д, 1H, J=8,6 Гц), 4,36-4,02 (м, 2H), 1,41 (с, 9H), 1,37-1,22 (м, 5H), 0,92 (т, 3H, J=7,2)
MS (ESI m/z): 333 (M+H)
RT (мин.): 1,58
((2R,3S)-2-аминопентан-3-ил)трет-бутилкарбамат
MS (ESI m/z): 203 (M+H)
RT (мин.): 0,69
((2R,3S)-2-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)пентан-3-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,25 (д, 1H, J=9,9 Гц), 6,79 (д, 1H, J=5,4 Гц), 4,46 (д, 1H, J=7,9 Гц), 4,30-4,15 (м, 1H), 3,80-3,68 (м, 1H), 1,71-1,30 (м, 11H), 1,17 (д, 3H, J=6,6 Гц), 1,02 (т, 3H, J=7,6 Гц)
MS (ESI m/z): 357 (M+H)
RT (мин.): 1,72
Справочный пример 432
Следующие соединения получали как описано в Справочном примере 417.
[Формула 468]
(S)-(4-оксогексан-3-ил)трет-бутилкарбамат
MS (ESI m/z): 216 (M+H)
RT (мин.): 1,36
((3S)-4-гидроксигексан-3-ил)трет-бутилкарбамат
MS (ESI m/z): 218 (M+H)
RT (мин.): 1,26
(4S)-4-((трет-бутоксикарбонил)амино)гексан-3-ил-4-нитробензоат
MS (ESI m/z): 367 (M+H)
RT (мин.): 1,85
((3S)-4-гидроксигексан-3-ил)трет-бутилкарбамат
MS (ESI m/z): 218 (M+H)
RT (мин.): 1,26
((3S,4R)-4-(1,3-диоксоиндолин-2-ил)гексан-3-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,89-7,78 (м, 2H), 7,76-7,66 (м, 2H), 4,46 (д, 1H, J=8,6 Гц), 4,36-3,90 (м, 2H), 2,39-2,15 (м, 1H), 1,96-1,76 (м, 1H), 1,67-1,40 (м, 10H), 1,34-1,16 (м, 1H), 0,96-0,80 (м, 6H)
MS (ESI m/z): 347 (M+H)
RT (мин.): 1,68
((3S,4R)-4-аминогексан-3-ил)трет-бутилкарбамат
MS (ESI m/z): 217 (M+H)
RT (мин.): 0,75
((3S,4R)-4-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)гексан-3-ил)трет-бутилкарбамат
1H-ЯМР (DMSO-d6, 300 МГц) δ: 7,28 (д, 1H, J=9,9 Гц), 5,80 (д, 1H, J=7,9 Гц), 4,43 (д, 1H, J=8,6 Гц), 4,29-4,05 (м, 1H), 3,74-3,60 (м, 1H), 1,78-1,27 (м, 13H), 1,00 (т, 3H, J=7,7 Гц), 0,96 (т, 3H, J=7,5 Гц)
MS (ESI m/z): 371 (M+H)
RT (мин.): 1,77
Справочный пример 433
Следующие соединения получали как описано в Справочном примере 417.
[Формула 469]
(S)-(4-оксогептан-3-ил)трет-бутилкарбамат
MS (ESI m/z): 230 (M+H)
RT (мин.): 1,53
((3S)-4-гидроксигептан-3-ил)трет-бутилкарбамат
MS (ESI m/z): 232 (M+H)
RT (мин.): 1,39
(3S)-3-((трет-бутоксикарбонил)амино)гептан-4-ил-4-нитробензоат
MS (ESI m/z): 381 (M+H)
RT (мин.): 1,95
((3S)-4-гидроксигептан-3-ил)трет-бутилкарбамат
MS (ESI m/z): 232 (M+H)
RT (мин.): 1,42
((3S,4R)-4-(1,3-диоксоиндолин-2-ил)гептан-3-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,86-7,78 (м, 2H), 7,77-7,65 (м, 2H), 4,42 (д, 1H, J=9,3 Гц), 4,20-4,00 (м, 2H), 2,42-2,12 (м, 1H), 1,80-1,58 (м, 1H), 1,43 (с, 9H), 1,38-1,08 (м, 4H), 0,96-0,84 (м, 6H)
MS (ESI m/z): 361 (M+H)
RT (мин.): 1,79
((3S,4R)-4-аминогептан-3-ил)трет-бутилкарбамат
MS (ESI m/z): 231 (M+H)
RT (мин.): 0,89
((3S,4R)-4-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)гептан-3-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,27 (д, 1H, J=9,9 Гц), 5,80 (д, 1H, J=7,9 Гц), 4,43 (д, 1H, J=8,6 Гц), 4,37-4,21 (м, 1H), 3,75-3,61 (м, 1H), 1,70-1,19 (м, 15H), 1,05-0,87 (м, 6H)
MS (ESI m/z): 385 (M+H)
RT (мин.): 1,88
Справочный пример 434
Следующие соединения получали как описано в Справочном примере 417.
[Формула 470]
1-ая стадия
1,1'-карбонилдиимидазол (1,9 г) добавляли к раствору дихлорметана (10 мл), содержащему (R)-2-((трет-бутоксикарбонил)амино)-3-метоксипропионовую кислоту (2 г) в ванне со льдом, с последующим перемешиванием в течение 30 минут. Затем добавляли триэтиламин (1,2 г) и N,O-диметилгидроксиламин (1,2 г) с последующим перемешиванием при комнатной температуре в течение 2,5 часов. Реакционный раствор добавляли по каплям к 4M соляной кислоты с последующей экстракцией этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и водой и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, и таким образом получали желтое масляное вещество (R)-(1-(метокси (метил)амино)-1-оксобутан-2-ил)трет-бутилкарбамат (1,8 г).
MS (ESI m/z): 263 (M+H)
RT (мин.): 1,03
2-ая, 3-я, 4-ая, 5-ая, 6-ая и 7-ая стадии
Следующие соединения получали как описано на 1-ой, 2-ой, 3-ей, 4-ой и 5-ой стадиях Справочного примера 417 и 2-ой стадии Справочного примера 97.
(R)-(1-метокси-3-оксобутан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 218 (M+H)
RT (мин.): 1,07
((2R)-3-гидрокси-1-метоксибутан-2-ил)трет-бутилкарбамат
MS (ESI, m/z): 220 (M+H)
RT (мин.): 0,92
(3R)-3-((трет-бутоксикарбонил)амино)-4-метоксибутан-2-ил-4-нитробензоат
MS (ESI m/z): 369 (M+H)
RT (мин.): 1,67
((2R)-3-гидрокси-1-метоксибутан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 220 (M+H)
RT (мин.): 0,92
((2S,3S)-3-((1,3-диоксоизоиндолин-2-ил)-1-метоксибутан-2-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,85-7,78 (м, 2H), 7,74-7,66 (м, 2H), 5,08-4,92 (м, 1H), 4,54-4,34 (м, 2H), 3,44-3,26 (м, 2H), 3,22 (с, 3H), 1,52 (д, 3H, J=6,6 Гц), 1,45 (с, 9H)
MS (ESI m/z): 349 (M+H)
RT (мин.): 1,50
2-((2S,3S)-3-амино-4-метоксибутан-2-ил)изоиндолин-1,3-дион
MS (ESI m/z): 249 (M+H),
RT (мин.): 0,64
Справочный пример 435
[Формула 471]
1-ая стадия
Следующее соединение получали как описано на 1-ой стадии Справочного примера 405.
2-хлор-6-(((2S,3S)-3-(1,3-диоксоиндолин-2-ил)-1-метоксибутан-2-ил)амино)-5-фторникотинонитрил
MS (ESI m/z): 403 (M+H),
RT (мин.): 1,59
2-ая стадия
Следующее соединение получали как описано на 3-ей стадии Справочного примера 379.
6-(((2S,3S)-3-амино-1-метоксибутан-2-ил)амино)-2-хлор-5-фторникотинонитрил
MS (ESI m/z): 273 (M+H),
RT (мин.): 0,72
3-я стадия
Следующее соединение получали как описано в Справочном примере 395.
((2S,3S)-3-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-4-метоксибутан-2-ил)трет-бутилкарбамат
1H ЯМР (CDCl3, 300 МГц) δ: 7,31 (д, 1H, J=9,6 Гц), 6,10 (д, 1H, J=7,6 Гц), 5,17(д, 1H, J=8,9 Гц), 4,36-4,19 (м, 1H), 4,12-3,94 (м, 1H), 3,89 (с, 3H), 3,84-3,75 (м, 1H), 3,58-3,48 (м, 1H), 1,44 (с, 9H), 1,24 (д, 3H, J=7,2 Гц)
MS (ESI m/z): 373 (M+H)
RT (мин.): 1,60
Справочный пример 436
[Формула 472]
1-ая стадия
2,6-дихлор-5-фтор-3-пиридинкарбонитрил (300 мг) и карбонат калия (1,1 г) добавляли при комнатной температуре к раствору DMF (6 мл), содержащему мезо-2,3-диаминобутан (690 мг), с последующим перемешиванием в течение 3,5 часов. После охлаждения реакционного раствора добавляли насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией этилацетатом. Органический слой высушивали над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении, и остаток очищали хроматографией на силикагеле NH (н-гексан:этилацетат = от 4:1 до 3:2), и таким образом получали твердое вещество желтого цвета 6-(((цис)-3-аминобутан-2-ил)амино)-2-хлор-5-фторникотинонитрил (150 мг).
MS (ESI m/z): 243 (M+H)
2-ая стадия
Следующее соединение получали как описано в Справочном примере 395.
((цис)-3-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)бутан-2-ил)трет-бутилкарбамат
1H ЯМР (CDCl3, 300 МГц) δ: 7,26 (д, 1H, J=9,9 Гц), 6,88 (ушир., 1H), 4,59 (д, 1H, J=6,6 Гц), 4,26-4,10 (м, 1H), 4,06-3,90 (м, 1H), 1,46 (с, 9H), 1,24-1,14 (м, 6H)
MS (ESI m/z): 343 (M+H)
RT (мин.): 1,62
Справочный пример 437
Следующие соединения получали как описано в Справочном примере 436.
[Формула 473]
6-(((цис)-2-амино-1,2-дифенилэтил)амино)-2-хлор-5-фторникотинонитрил
MS (ESI m/z): 367 (M+H)
RT (мин.): 1,05
((цис)-2-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-1,2-дифенилэтил)трет-бутилкарбамат
MS (ESI m/z): 467 (M+H)
RT (мин.): 1,87
Справочный пример 438
Следующие соединения получали как описано на 1-ой стадии Справочного примера 386 и 3-ей стадии Справочного примера 396.
[Формула 474]
1-ая стадия
Следующее соединение получали как описано в Справочном примере 386.
6-(((цис)-3-аминобутан-2-ил)амино)-5-фтор-2-(хинолин-6-иламино)никотинонитрил
MS (ESI m/z): 351 (M+H)
RT (мин.): 0,59
2-ая стадия
Следующее соединение получали как описано в Справочном примере 395.
((цис)-3-((5-циано-3-фтор-6-(хинолин-6-иламино)пиридин-2-ил)амино)бутан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 451 (M+H)
RT (мин.): 1,21
Справочный пример 439-1
Следующие соединения получали как описано в Tetrahedron: Asymmetry, Vol. 8, No, 14, pp. 2381-2401, 1997.
[Формула 475]
((2R,3S)-3-аминобутан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 343 (M+H), 341 (М-Н)
[Формула 476]
((2R,3R)-3-аминобутан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 343 (M+H), 341 (М-Н)
Справочный пример 439-2
Следующее соединение получали как описано на 7-ой стадии Справочного примера 417.
[Формула 477]
((2R,3S)-3-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)бутан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 343 (M+H), 341 (М-Н)
[Формула 478]
((2R,3R)-3-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)бутан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 343 (M+H), 341 (М-Н)
Справочный пример 440
Следующее соединение получали, как описано в Archiv der Pharmazie (Weinheim, Германия), 2004, vol. 337, # 12, pp. 654-667.
[Формула 479]
(с,Z)-N-(2-((трет-бутоксикарбонил)амино)бутилидин)-1-фенилметанаминоксид
Справочный пример 441
[Формула 480]
1-ая стадия
Метилмагний бромид (3M раствор в простом диэтиловом эфире, 0,86 мл) добавляли по каплям при -50°C к раствору тетрагидрофурана (5 мл), содержащему (с,Z)-N-(2-((трет-бутоксикарбонил)амино)бутилидин)-1-фенилметанаминоксид (250 мг), с последующим перемешиванием при температуре от -50°C до -35°C в течение 2 часов. Затем к реакционному раствору добавляли по каплям метилмагний бромид (3M раствор в простом диэтиловом эфире, 0,86 мл), с последующим перемешиванием при температуре от -45°C до -40°C в течение 1 часа. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 19:1 до 4:1), и таким образом получали ((3S,4R)-4-(бензил(гидрокси)амино)пентан-3-ил)трет-бутилкарбамат (39 мг).
1H-ЯМР (CDCl3, 300 МГц) δ: 7,39-7,18 (м, 5H), 6,70 (с, 1H), 4,43 (д, 1H, J=10,2 Гц), 4,11 (д, 1H, J=13,9 Гц), 4,10-3,97 (м, 1H), 3,64 (д, 1H, J=13,9 Гц), 2,78-2,68 (м, 1H), 1,47 (с, 9H), 1,44-1,26 (м, 2H), 1,03-0,94 (м, 9H)
2-ая стадия
Метанольный раствор (20 мл), содержащий ((3S,4R)-4-(бензил(гидрокси)амино)пентан-3-ил)трет-бутилкарбамат (39 мг), получали и подвергали реакции гидрирования (45°C; 100 бар; объемная скорость потока: 1 мл/мин.; 20%-ый Pd(ОН)2/C) с использованием H-cube™. Затем растворитель отгоняли при пониженном давлении, и таким образом получали бесцветное масляное вещество ((3S,4R)-4-аминопентан-3-ил)трет-бутилкарбамат (27 мг).
3-я стадия
Следующее соединение получали как описано на 7-ой стадии Справочного примера 417.
((2R,3S)-2-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)пентан-3-ил)трет-бутилкарбамат
MS (ESI m/z): 357 (M+H), 355 (М-Н)
Справочный пример 442
Следующие соединения получали как описано в Справочном примере 441.
[Формула 481]
((3S,4R)-4-(бензил(гидрокси)амино)гексан-3-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,40-7,20 (м, 5H), 5,88 (с, 1H), 4,62 (д, 1H, J=9,6 Гц), 4,07 (д, 1H, J=13,9 Гц), 4,01-3,88 (м, 1H), 3,73 (д, 1H, J=13,9 Гц), 2,59-2,50 (м, 1H), 1,69-1,32 (м, 4H), 1,45 (с, 9H), 1,05 (т, 3H, J=7,6 Гц), 0,98 (т, 3H, J=7,3 Гц)
((3S,4R)-4-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)гексан-3-ил)трет-бутилкарбамат
MS (ESI m/z): 371 (M+H), 369 (М-Н)
Справочный пример 443
Следующие соединения получали как описано в Справочном примере 441.
[Формула 482]
((3S,4R)-4-(бензил(гидрокси)амино)гептан-3-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,39-7,20 (м, 5H), 5,96 (с, 1H), 4,60 (д, 1H, J=9,9 Гц), 4,05 (д, 1H, J=13,9 Гц), 4,01-3,88 (м, 1H), 3,72 (д, 1H, J=13,9 Гц), 2,63-2,55 (м, 1H), 1,69-1,20 (м, 1H), 1,46 (с, 9H), 0,97 (т, 3H, J=7,6 Гц), 0,93 (т, 3H, J=6,9 Гц)
((3S,4R)-4-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)гептан-3-ил)трет-бутилкарбамат
MS (ESI m/z): 385 (M+H), 383 (М-Н)
Справочный пример 444
Следующие соединения получали как описано в Справочном примере 441.
[Формула 483]
((3S,4R)-4-(бензил(гидрокси)амино)-6-метилгептан-3-ил)трет-бутилкарбамат
1H-ЯМР (CDCl3, 300 МГц) δ: 7,39-7,23 (м, 5H), 5,85 (с, 1H), 4,59 (д, 1H, J=9,9 Гц), 4,04 (д, 1H, J=13,5 Гц), 4,01-3,88 (м, 1H), 3,73 (д, 1H, J=13,5 Гц), 2,72-2,63 (м, 1H), 1,81-1,69 (м, 1H), 1,50-1,13 (м, 4H), 1,46 (с, 9H), 1,02-0,89 (м, 9H)
((3S,4R)-4-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)-6-метилгептан-3-ил)трет-бутилкарбамат
MS (ESI m/z): 399 (M+H), 397 (М-Н)
Справочный пример 445
[Формула 484]
1-ая стадия
Раствор тетрагидрофурана (50 мл), содержащий (S)-(3-оксогекса-5-ен-2-ил)трет-бутилкарбамат (8 г), добавляли по каплям к 9-борабицикло[3,3,1]нонану (0,5 М раствор в тетрагидрофуране) (225 мл) в ванне со льдом с последующим перемешиванием при комнатной температуре в течение 4 часов. К реакционному раствору добавляли в ванне со льдом 6M водный раствор гидроксида натрия (50 мл) и затем 30%-ый раствор пероксида водорода (50 мл). Нерастворимый осадок удаляли с последующей экстракцией этилацетатом. Полученный органический слой промывали водой и насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, и таким образом получали бесцветное масляное вещество ((2S)-3,6-дигидроксигексан-2-ил)трет-бутилкарбамат (4,4 г).
MS (ESI m/z): 232 (M+H)
RT (мин.): 0,85
2-ая стадия
Раствор DMF (5 мл), содержащий имидазол (1,4 г) и трет-бутилдиметилсилил хлорид (3 г) добавляли к раствору DMF (10 мл), содержащему ((2S)-3,6-дигидроксигексан-2-ил)трет-бутилкарбамат (4,4 г), с последующим перемешиванием при комнатной температуре в течение 40 минут. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Полученный органический слой промывали 1M водным раствором лимонной кислоты и высушивали над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = 7:3), и таким образом получали бесцветное масляное вещество ((2S)-6-((трет-бутилдиметилсилил)окси)-3-гидроксигексан-2-ил)трет-бутилкарбамат (4,9 г).
MS (ESI m/z): 348 (M+H)
RT (мин.): 1,94
3-я, 4-ая, 5-ая, 6-ая и 7-ая стадии
Следующие соединения получали как описано на 3-ей, 4-ой, 5-ой, 6-ой и 7-ой стадиях Справочного примера 417.
((2S)-6-((трет-бутилдиметилсилил)окси)-3-(4-нитробензоил)оксигексан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 497 (M+H)
RT (мин.): 2,29
((2S,3R)-6-((трет-бутилдиметилсилил)оксо)-3-(1,3-диоксоизоиндолин-2-ил)гексан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 477 (M+H)
RT (мин.): 2,22
((2S,3R)-6-((трет-бутилдиметилсилил)оксо)-3-((6-хлор-5-циано-3-фторпиридин-2-ил)амино)гексан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 502 (M+H)
RT (мин.): 2,26
Справочный пример 446
[Формула 485]
1-ая стадия
Следующее соединение получали как описано на 1-ой стадии Примера 5.
((2S,3R)-6-((трет-бутилдиметилсилил)оксо)-3-((5-циано-6-((5,6-диметилпиридин-3-ил)амино)-3-фторпиридин-2-ил)амино)гексан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 588 (M+H)
RT (мин.): 1,58
2-ая стадия
Следующее соединение получали как описано на 2-ой стадии Примера 5.
((2S,3R)-6-((трет-бутилдиметилсилил)окси)-3-((5-карбамоил-6-((5,6-диметилпиридин-3-ил)амино)-3-фторпиридин-2-ил)амино)гексан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 606 (M+H)
RT (мин.): 1,57
Справочный пример 447
[Формула 486]
1-ая стадия
Тетрабутиламмоний фторид (1M раствор в тетрагидрофуране, 150 мкл) добавляли к раствору тетрагидрофурана (2 мл), содержащей ((2S,3R)-6-((трет-бутилдиметилсилил)окси)-3-((5-карбамоил-6-((5,6-диметилпиридин-3-ил)амино)-3-фторпиридин-2-ил)амино)гексан-2-ил)трет-бутилкарбамат (60 мг), с последующим перемешиванием в течение 30 минут. Затем добавляли тетрабутиламмоний фторид (1M в тетрагидрофуране, 300 мкл) с последующим перемешиванием в течение 1 часа. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Полученный органический слой высушивали над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Остаток очищали хроматографией на силикагеле (этилацетат:метанол = от 1:0 до 97:3) и использовали в последующей реакции.
2-ая и 3-я стадии
Следующие соединения получали как описано на 5-ой и 6-ой стадиях Справочного примера 417.
((2S,3R)-3-((5-карбамоил-6-((5,6-диметилпиридин-3-ил)амино)-3-фторпиридин-2-ил)амино)-6-(1,3-диоксоизоиндолин-2-ил)гексан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 621 (M+H)
RT (мин.): 1,16
((2S,3R)-6-амино-3-((5-карбамоил-6-((5,6-диметилпиридин-3-ил)амино)-3-фторпиридин-2-ил)амино)гексан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 491 (M+H)
RT (мин.): 0,80
Справочный пример 447
Следующее соединение получали как описано в Справочном примере 386.
[Формула 487]
(2-((5-циано-6-(хинолин-6-иламино)пиридин-2-ил)амино)-2-метилпропил)трет-бутилкарбамат
MS (ESI m/z): 451 (M+H)
RT (мин.): 1,27
Справочный пример 448
Следующее соединение получали как описано в Справочном примере 386.
[Формула 488]
(1-((5-циано-3-фтор-6-(хинолин-6-иламино)пиридин-2-ил)амино)-2-метилпропан-2-ил)трет-бутилкарбамат
MS (ESI m/z): 451 (M+H)
RT (мин.): 1,26
Пример 1
[Формула 489]
1-ая стадия
5-фенилпиридин-3-амин (10 мг), карбонат цезия (32 мг), Pd2(dba)3 (5 мг) и Xantphos (7 мг) добавляли к раствору 1,4-диоксана (0,8 мл), содержащему цис-2-(6-хлор-3-фтор-5-(2-фенилпропан-2-иламинокарбонил)пиридин-2-иламино)циклогексил-трет-бутилкарбамат (20 мг), с последующим перемешиванием при 100°C в течение 2 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры. Затем добавляли воду и этилацетат. Нерастворимое вещество удаляли фильтрацией, и отфильтрованный осадок промывали этилацетатом и водой. Фильтрат смешивали с промывным раствором. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали, используя стеклянный планшет PLC (гексан:этилацетат = 1:1), добавляли простой диизопропиловый эфир и гексан, твердое вещество собирали фильтрацией, и таким образом получали светло-желтое масляное вещество цис-2-(3-фтор-5-(2-фенилпропан-2-иламинокарбонил)-6-(5-фенилпиридин-3-иламино)пиридин-2-иламино)циклогексил-трет-бутилкарбамат (11 мг).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 11,30 (с, 1H), 8,59 (д, 1H, J=2,3 Гц), 8,38 (д, 1H, J=2,0 Гц), 8,35 (с, 1H), 8,19 (д, 1H, J=13,3 Гц), 8,14 (с, 1H), 7,72-7,66 (м, 2H), 7,52-7,45 (м, 2H), 7,44-7,36 (м, 3H), 7,32-7,26 (м, 2H), 7,20-7,14 (м, 1H), 6,67-6,60 (м, 2H), 4,03-3,94 (м, 1H), 3,84-3,76 (м, 1H), 1,74-1,10 (м, 23H)
MS (ESI, m/z): 639 (M+H), 637 (М-Н)
2-ая стадия
Смесь цис-2-(3-фтор-5-(2-фенилпропан-2-иламинокарбонил)-6-(5-фенилпиридин-3-иламино)пиридин-2-иламино)циклогексил-трет-бутилкарбамата (10 мг) и TFA (0,2 мл) перемешивали при комнатной температуре в течение 30 минут. Растворитель отгоняли при пониженном давлении (40°C или меньше) и добавляли этилацетат и 4н. хлорид водород/1,4-диоксан (20 мкл), с последующим перемешиванием при комнатной температуре в течение 30 минут. Твердое вещество собирали фильтрацией и промывали этилацетатом, и таким образом получали твердое вещество желтого цвета 6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-фенилпиридин-3-иламино)никотинамид·гидрохлорид (8 мг).
(Данные 1H-ЯМР и данные MS показаны в таблице 1.)
Пример 2
Соединения, перечисленные в таблице 1, получали как описано в Примере 1.
Пример 3
[Формула 490]
1-ая стадия
5-бром-2-пиколин (13 мг), карбонат цезия (42 мг), Pd2(dba)3 (7 мг) и Xantphos (9 мг) добавляли к раствору (0,5 мл) 1,4-диоксана, содержащему цис-2-(6-амино-3-фтор-5-(2-фенилпропан-2-иламинокарбонил)пиридин-2-иламино)циклогексил-трет-бутилкарбамат (25 мг), с последующим перемешиванием при 100°C в течение 2 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры и добавляли воду и этилацетат. Нерастворимое вещество удаляли фильтрацией, и отфильтрованный осадок промывали водой и этилацетатом. Фильтрат смешивали с промывным раствором, органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали, используя стеклянный планшет PLC (гексан:этилацетат = 1:1), добавляли простой диизопропиловый эфир и гексан, твердое вещество собирали фильтрацией, и таким образом получали твердое вещество светло-желтого цвета цис-2-(3-фтор-5-(2-фенилпропан-2-иламинокарбонил)-6-(6-метилпиридин-3-иламино)пиридин-2-иламино)циклогексил-трет-бутилкарбамат (14 мг).
1H-ЯМР (DMSO-d6, 400 МГц) δ: 11,07 (с, 1H), 8,50 (д, 1H, J=2,5 Гц), 8,15 (д, 1H, J=12,7 Гц), 8,08 (с, 1H), 7,92 (дд, 1H, J=2,5 Гц, 8,4 Гц), 7,40-7,34 (м, 2H), 7,31-7,25 (м, 2H), 7,19-7,13 (м, 1H), 7,10 (д, 1H, J=8,4 Гц), 6,72-6,60 (м, 2H), 4,06-3,87 (м, 2H), 2,37 (с, 3H), 1,88-1,10 (м, 23H)
MS (ESI, m/z): 577 (M+H), 575 (М-Н)
2-ая стадия
Смесь цис-2-(3-фтор-5-(2-фенилпропан-2-иламинокарбонил)-6-(6-метилпиридин-3-иламино)пиридин-2-иламино)циклогексил-трет-бутилкарбамат (13 мг) и TFA (0,26 мл) перемешивали при комнатной температуре в течение 30 минут. Растворитель отгоняли при пониженном давлении (40°C или меньше) и добавляли этилацетат и 4н. хлорид водород/1,4-диоксан (28 мкл), с последующим перемешиванием при комнатной температуре в течение 30 минут. Твердое вещество собирали фильтрацией, промывали этилацетатом, и таким образом получали твердое вещество желтого цвета 6-(цис-2-аминоциклогексиламино)-5-фтор-2-(6-метилпиридин-3-иламино)никотинамид·гидрохлорид (11 мг).
(Данные 1H-ЯМР и данные MS показаны в таблице 2.)
Пример 4
Соединения, перечисленные {внесенные в список} в таблице 2 получали как описано в Примере 3.
Пример 5
[Формула 491]
1-ая стадия
5-метил-3-пиридинамин (191 мг), карбонат цезия (1,10 г), Pd2(dba)3 (186 мг) и Xantphos (235 мг) добавляли к раствору 1,4-диоксана (14 мл), содержащему цис-2-(6-хлор-5-циано-3-фторпиридин-2-иламино)циклогексил-трет-бутилкарбамат (500 мг), с последующим перемешиванием при 100°C в течение 2 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры и добавляли воду и этилацетат. Нерастворимое вещество удаляли фильтрацией, отфильтрованный осадок промывали водой и этилацетатом, органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на колонках с силикагелем (гексан:этилацетат = от 10:0 до 1:4), добавляли простой диизопропиловый эфир, твердое вещество собирали фильтрацией, и таким образом получали твердое вещество светло-желтого цвета цис-2-(6-(5-метилпиридин-3-иламино)-5-циано-3-фторпиридин-2-иламино)циклогексил-трет-бутилкарбамат (523 мг).
1Н-ЯМР (DMSO-d6, 400 МГц) δ: 8,90 (с, 1H), 8,55-8,51 (м, 1H), 8,05-8,02 (м, 1H), 7,78 (с, 1H), 7,67 (д, 1H, J=11,1 Гц), 7,00-6,94 (м, 1H), 6,67-6,62 (м, 1H), 3,95-3,80 (м, 2H), 2,28 (с, 3H), 1,82-1,10 (м, 17H)
MS (ESI, m/z): 441 (M+H), 439 (М-Н)
2-ая стадия
5н. водный раствор гидроксида натрия и 30%-ый раствор пероксида водорода (1,18 мл) (0,70 мл) добавляли к раствору диметилсульфоксида (10 мл) и этанола (10 мл), содержащего цис-2-(6-(5-метилпиридин-3-иламино)-5-циано-3-фторпиридин-2-иламино)циклогексил-трет-бутилкарбамат (520 мг), с последующим перемешиванием при 34°C в течение 30 минут. Реакционную смесь охлаждали до комнатной температуры и добавляли воду. Твердое вещество собирали фильтрацией, растворяли в этилацетате и тетрагидрофуране, промывали водой и затем насыщенным солевым раствором и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Полученный остаток добавляли к простому диизопропиловому эфиру, твердое вещество собирали фильтрацией и промывали простым диизопропиловым эфиром и гексаном, и таким образом получали твердое вещество светло-желтого цвета цис-2-(5-аминокарбонил-3-фтор-6-(5-метилпиридин-3-иламино)пиридин-2-иламино)циклогексил-трет-бутилкарбамат (506 мг).
1Н-ЯМР (DMSO-d6, 400 МГц) δ: 11,72 (с, 1H), 8,59 (д, 1H, J=2,2 Гц), 8,01 (с, 1H), 7,97 (с, 1H), 7,89 (д, 1H, J=12,6 Гц), 7,76 (ушир.с, 1H), 7,26 (ушир.с, 1H), 6,74-6,64 (м, 2H), 4,14-4,04 (м, 1H), 3,95-3,86 (м, 1H), 2,31 (с, 3H), 1,87-1,10 (м, 17H)
MS (ESI, m/z): 459 (M+H), 457 (М-Н)
3-я стадия
Смесь цис-2-(5-аминокарбонил-3-фтор-6-(5-метилпиридин-3-иламино)-пиридин-2-иламино)циклогексил-трет-бутилкарбамата (500 мг) и TFA (5 мл) перемешивали при комнатной температуре в течение 30 минут. Растворитель отгоняли при пониженном давлении (при 40°C или меньше). 4н хлорид водород/1,4-диоксан (1,36 мл) добавляли к суспензии тетрагидрофуран/метанол (10/1) (50 мл), содержащей полученный остаток, с последующим перемешиванием при комнатной температуре в течение 30 минут. Твердое вещество собирали фильтрацией, промывали тетрагидрофураном/метанолом (10/1), и получали твердое вещество светло-желтого цвета 6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-метилпиридин-3-иламино)никотинамид·гидрохлорид (498 мг).
(Данные 1H-ЯМР и данные MS показаны в таблице 3.)
Пример 6
Соединения, перечисленные в таблице 3 получали как описано в Примере 5.
Пример 7
[Формула 492]
1-ая стадия
Следующее соединение получали как описано в Справочном примере 2.
6-(цис-2-(бис(трет-бутоксикарбонил)амино)циклогексиламино)-2-хлор-5-фторметилникотинат
1H ЯМР (CDCI3, 400 МГц) δ: 7,69 (д, 1H, J=10,7 Гц), 7,32 (ушир.с, 1H), 4,34 (дт, 1H, J=3,7 Гц, 13,0 Гц), 4,30-4,24 (м, 1H), 3,86 (с, 3H), 2,51-2,43 (м, 1H), 2,31-2,17 (м, 1H), 1,90-1,82 (м, 1H), 1,65-1,30 (м, 5H), 1,47 (с, 18H)
2-ая стадия
Следующее соединение получали как описано на 1-ой стадии Примера 1.
6-(цис-2-(бис(трет-бутоксикарбонил)амино)циклогексиламино)-5-фтор-2-(хинолин-3-иламино)метилникотинат
MS (ESI, m/z): 610 (M+H), 608 (М-Н)
3-я стадия
Следующее соединение получали как описано на 1-ой стадии Справочного примера 3.
6-(цис-2-(бис(трет-бутоксикарбонил)амино)циклогексиламино)-5-фтор-2-(хинолин-3-иламино)никотиновая кислота
MS (ESI, m/z): 596 (M+H), 594 (М-Н)
4-ая стадия
Смесь 6-(цис-2-(бис(трет-бутоксикарбонил)амино)-циклогексиламино)-5-фтор-2-(хинолин-3-иламино)никотиновой кислоты (65 мг), HOBt·H2O (67 мг), WSC·HCl (84 мг) и DMF (3 мл) перемешивали при комнатной температуре в течение 2 часов добавляли и 25%-ую аммиачную воду (1 мл), с последующим перемешиванием при 40°C в течение 30 минут. К реакционной смеси добавляли этилацетат, реакционную смесь промывали водой и затем насыщенным солевым раствором и высушивали над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на колонках с силикагелем (гексан:этилацетат = от 10:0 до 1:1), и таким образом получали твердое вещество светло-желтого цвета ди-трет-бутил-цис-2-(5-аминокарбонил-3-фтор-6-(хинолин-3-иламино)пиридин-2-иламино)циклогексилимиддикарбамат (41 мг).
MS (ESI, m/z): 595 (M+H)
5-ая стадия
Следующее соединение получали как описано на 2-ой стадии Примера 1.
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хинолин-3-иламино)никотинамид
(Данные 1H-ЯМР и данные MS показаны в таблице 4.)
Пример 8
Соединения, перечисленные в таблице 4, получали как описано в Примере 7.
Пример 9
[Формула 493]
1-ая стадия
4-бромизохинолин (65 мг), карбонат цезия (170 мг), Pd2(dba)3 (29 мг) и Xantphos (36 мг) добавляли к раствору 1,4-диоксана (2,1 мл), содержащему 2-амино-6-(цис-2-(трет-бутоксикарбониламино)циклогексиламино)-5-фторметилникотинат (80 мг), с последующим перемешиванием при 100°C в течение 3 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры и добавляли воду и этилацетат. Нерастворимое вещество удаляли фильтрацией, и отфильтрованный осадок промывали водой и этилацетатом. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на колонках с силикагелем (гексан:этилацетат = от 10:0 до 1:2), добавляли простой диизопропиловый эфир, твердое вещество собирали фильтрацией, и получали твердое вещество светло-желтого цвета 6-(цис-2-(трет-бутоксикарбониламино)циклогексиламино)-5-фтор-2-(изохинолин-4-иламино)метилникотинат (77 мг).
MS (ESI, m/z): 510 (M+H), 508 (М-Н)
2-ая стадия
1н. водный раствор гидроксида натрия (2 мл) добавляли к раствору тетрагидрофурана (2 мл) и метанола (2 мл), содержащему 6-(цис-2-(трет-бутоксикарбониламино)циклогексиламино)-5-фтор-2-(изохинолин-4-иламино)метилникотинат (75 мг), с последующим перемешиванием при 65°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли насыщенный водный раствор хлорида аммония, твердое вещество собирали фильтрацией и промывали водой и этилацетатом, и таким образом получали твердое вещество желтого цвета 6-(цис-2-(трет-бутоксикарбониламино)циклогексиламино)-5-фтор-2-(изохинолин-4-иламино)никотиновую кислоту (67 мг).
MS (ESI, m/z): 496 (M+H), 494 (М-Н)
3-я стадия
Хлорид аммония (28 мг), WSC·HCl (75 мг), HOBt·H2O (60 мг) и диизопропилэтиламин (180 мкл) добавляли к суспензии DMF (1,3 мл), содержащей 6-(цис-2-(трет-бутоксикарбониламино)циклогексиламино)-5-фтор-2-(изохинолин-4-иламино)никотиновую кислоту (65 мг), с последующим перемешиванием при комнатной температуре в течение 3 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и этилацетат. Твердое вещество собирали фильтрацией и промывали водой и этилацетатом, и таким образом получали твердое вещество светло-желтого цвета цис-2-(5-аминокарбонил-3-фтор-6-(изохинолин-4-иламино)пиридин-2-иламино)циклогексил-трет-бутилкарбамат (47 мг).
1H ЯМР (DMSO-de, 400 МГц) δ: 12,39 (с, 1H), 9,56 (с, 1H), 8,95 (с, 1H), 8,18 (д, 1H, J=8,8 Гц), 8,13 (д, 1H, J=8,2 Гц), 7,96 (д, 1H, J=12,6 Гц), 7,91-7,81 (м, 2H), 7,74-7,68 (м, 1H), 7,40-7,28 (ушир., 1H), 6,82-6,75 (м, 1H), 6,72-6,65 (м, 1H), 4,12-4,01 (м, 1H), 3,99-3,92 (м, 1H), 1,89-1,03 (м, 17H)
MS (ESI, m/z): 495 (M+H), 493 (М-Н)
4-ая стадия
Смесь цис-2-(5-аминокарбонил-3-фтор-6-(изохинолин-4-иламино)пиридин-2-иламино)циклогексил-трет-бутилкарбамата (45 мг) и TFA (0,9 мл) перемешивали при комнатной температуре в течение 30 минут. Растворитель отгоняли при пониженном давлении (при 40°C или меньше) и к полученному остатку добавляли этилацетат и 4н. хлорид водорода/1,4-диоксан (34 мкл), с последующим перемешиванием при комнатной температуре в течение 30 минут. Твердое вещество собирали фильтрацией и промывали этилацетатом, и таким образом получали твердое вещество желтого цвета 6-(цис-2-аминоциклогексиламино)-5-фтор-2-(изохинолин-4-иламино)никотинамид·гидрохлорид (47 мг).
(Данные 1H-ЯМР и данные MS показаны в таблице 5.)
Пример 10
Соединения, перечисленные в таблице 5, получали как описано в Примере 9.
Пример 11
[Формула 494]
1-ая стадия
Карбонат кальция (138 мг) и D-лейцинамид·гидрохлорид (83 мг) добавляли к раствору (1 мл) 1,4-диоксана, содержащему 6-хлор-5-фтор-2-(хинолин-6-иламино)никотинонитрил (30 мг), с последующим нагреванием с обратным холодильником в течение 15 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли воду, хлорид натрия и этилацетат. Органический слой собирали и высушивали над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли простой диизопропиловый эфир, твердое вещество собирали фильтрацией, и таким образом получали твердое вещество желтого цвета (2R)-2-(5-циано-3-фтор-6-(хинолин-6-иламино)пиридин-2-иламино)-4-метилпентанамид (33 мг).
MS (ESI, m/z): 393 (M+H), 391 (М-Н)
2-ая стадия
Карбонат калия (35 мг) и 30%-ый раствор пероксида водорода (29 мкл) добавляли к этанольному (1 мл) раствору, содержащему (2R)-2-(5-циано-3-фтор-6-(хинолин-6-иламино)пиридин-2-иламино)-4-метилпентанамид (20 мг), с последующим перемешиванием при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 30%-ый раствор пероксида водорода (29 мкл), с последующим перемешиванием при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду, хлорид натрия и этилацетат. Органический слой собирали и высушивали над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. Полученный остаток растворяли в этилацетате и добавляли простой диизопропиловый эфир. Твердое вещество собирали фильтрацией и промывали простым диизопропиловым эфиром, и таким образом получали твердое вещество желтого цвета 6-((2R)-1-амино-4-метил-1-оксопентан-2-иламино)-5-фтор-2-(хинолин-6-иламино)никотинамид (8 мг).
(Данные 1H-ЯМР и данные MS показаны в таблице 6.)
Пример 12
Соединения, перечисленные в таблице 6 ниже, получали как описано в Примере 11.
Пример 13
[Формула 495]
1-ая стадия
((2S)-1-аминопропан-2-ил)трет-бутилкарбамат (63 мг) и карбонат калия (139 мг) добавляли к раствору 1,4-диоксана (2 мл), содержащему 6-хлор-5-фтор-2-(хинолин-6-иламино)никотинонитрил (60 мг), с последующим нагреванием с обратным холодильником в течение 13 часов. Реакционную смесь охлаждали до комнатной температуры. Добавляли этилацетат и насыщенный водный раствор гидрокарбоната натрия. Результант подвергали экстракции этилацетатом три раза. Экстракты объединяли и высушивали над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле, и таким образом получали бесцветное масляное вещество (50 мг).
2-ая стадия
1н. водный раствор гидроксида натрия (573 мкл) и 30%-ый раствор пероксида водорода (65 мкл) добавляли к этанольному (1 мл) раствору, содержащему бесцветное масляное вещество (50 мг), полученное на 1-ой стадии, с последующим перемешиванием при комнатной температуре в течение 5 минут. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, твердое вещество собирали фильтрацией, и таким образом получали твердое вещество светло-желтого цвета.
3-я стадия
4н. хлорид водород/1,4-диоксан добавляли к суспензии метанола (1 мл) и хлороформа (1 мл), содержащей твердое вещество светло-желтого цвета, полученное на 2-ой стадии, с последующим перемешиванием при комнатной температуре в течение 3 часов и 30 минут. К реакционной смеси добавляли метанол и этилацетат, твердое вещество собирали фильтрацией, и таким образом получали твердое вещество оранжевого цвета 6-((2S)-2-аминопропиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид (28 мг).
(Данные 1H-ЯМР и данные MS показаны в таблице 7)
Пример 14
Соединения, перечисленные в таблице 7, получали как описано в Примере 13.
Пример 15
[Формула 496]
1-ая стадия
Следующее соединение получали как описано на 1-ой стадии Справочного примера 2.
2-(3,5-диметоксифениламино)-6-этиламино-5-фторэтилникотинат
1Н-ЯМР (CDCl3, 400 МГц) δ: 10,47 (с, 1H), 7,67 (д, 1H, J=11,7 Гц), 6,99 (д, 2H, J=2,3 Гц), 6,16 (т, 1H, J=2,3 Гц), 5,02-4,96 (м, 1H), 4,30 (кв., 2H, J=7,2 Гц), 3,79 (с, 6H), 3,68-3,59 (м, 2H), 1,37 (т, 3H, J=7,2 Гц), 1,31 (д, 3H, J=7,2 Гц)
2-ая и 3-я стадии
Следующее соединение получали как описано на 3-ей и 4-ой стадиях Примера 7.
2-(3,5-диметоксифениламино)-6-(этиламино)-5-фторникотинамид
(1H-ЯМР и данные ESI-MS показаны в таблице 8)
Пример 16
Соединения, перечисленные в таблице 8, получали как описано в Примере 15.
Пример 17
[Формула 497]
1-ая, 2-ая и 3-я стадии
Следующее соединение получали как описано в Примере 15.
((3R)-1-(5-карбамоил-6-(3,5-диметоксифениламино)-3-фторпиридин-2-ил)пирролидин-3-ил)трет-бутилкарбамат
1Н-ЯМР (DMSO-d6, 400 МГц) δ: 11,66 (с, 1H), 7,89 (д, 1H, J=14,8 Гц), 7,76(ушир.с, 1H), 7,30-7,14 (м, 2H), 6,89-6,83 (м, 2H), 6,10-6,05 (м, 1H), 4,14-4,03 (м, 1H), 3,91-3,73 (м, 3H), 3,72 (с, 6H), 3,55-3,49 (м, 1H), 2,15-2,01 (м, 1H), 1,94-1,82 (м, 1H), 1,39 (с, 9H)
MS (ESI, m/z): 476 (М-Н), 474 (М-Н)
Следующее соединение получали как описано на 2-ой стадии Примера 1.
6-((3R)-3-аминопирролидин-1-ил)-2-(3,5-диметоксифениламино)-5-фторникотинамид
(1H-ЯМР и данные ESI-MS показаны в таблице 9)
Пример 18
Соединения, перечисленные в таблице 9, получали как описано в Примере 17.
Пример 19
[Формула 498]
1-ая стадия
Следующее соединение получали как описано на 1-ой стадии Справочного примера 3.
2-(3,5-диметоксифениламино)-5-фтор-6-оксо-1,6-дигидропиридин-3-карбоновая кислота
1Н-ЯМР (DMSO-d6, 400 МГц) δ: 10,37 (с, 1H), 7,81 (д, 1H, J=11,0 Гц), 6,80-6,70 (ушир., 2H), 6,26-6,20 (ушир., 1H), 3,75 (с, 6H)
MS (ESI, m/z): 309 (M+H), 331 (M+Na), 307 (М-Н)
2-ая стадия
Смесь 2-(3,5-диметоксифениламино)-5-фтор-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты (200 мг), WSC ·HCl (312 мг), HOBt·H2O (249 мг) и DMF (2 мл) перемешивали при комнатной температуре в течение 45 минут. Добавляли 25%-ую аммиачную воду (1 мл) с последующим перемешиванием при той же самой температуре в течение 2 часов. К реакционной смеси добавляли этилацетат. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния, растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат = от 7:3 до 1:1), и таким образом получали твердое вещество желтого цвета 6-(1H-1,2,3-бензотриазол-1-илокси)-2-(3,5-диметоксифениламино)-5-фторникотинамид (109 мг).
1Н-ЯМР (DMSO-d6, 400 МГц) δ: 11,30 (с, 1H), 8,52 (д, 1H, J=11,0 Гц), 8,30 (ушир.с, 1H), 8,18 (д, 1H, J=8,6 Гц), 7,90-7,76 (м, 2H), 7,66-7,58 (м, 1H), 7,56-7,48 (м, 1H), 5,96-5,91 (м, 1H), 5,88 (д, 2H, J=2,2 Гц), 3,51 (с, 6H)
MS (ESI, m/z): 425 (M+H), 423 (М-Н)
3-я стадия
Карбонат калия (27 мг) и триптамин (32 мг) добавляли к раствору N-метилпирролидона (1 мл), содержащему 6-(1H-1,2,3-бензотриазол-1-илокси)-2-(3,5-диметоксифениламино)-5-фторникотинамид (41 мг), с последующим перемешиванием при 90°C в течение 7 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли карбонат калия (14 мг) и триптамин (16 мг), с последующим перемешиванием при 90°C в течение 7 часов. Реакционную смесь охлаждали до комнатной температуры, и затем добавляли воду, хлорид натрия и этилацетат. Органический слой собирали и высушивали над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол = от 10:0 до 20:1), добавляли простой диизопропиловый эфир, твердое вещество собирали фильтрацией, и таким образом получали твердое вещество светло-коричневого цвета 2-(3,5-диметоксифениламино)-5-фтор-6-(2-(1H-индол-3-ил)этиламино)никотинамид (19 мг).
(1H-ЯМР и данные ESI-MS показаны в таблице 10)
Пример 20
Соединения, перечисленные ниже в таблице 10, получали как описано в Примере 19.
[Таблица 10-1]
Пример 21
[Формула 499]
1-ая стадия
Следующее соединение получали как описано на 1-ой стадии Примера 15.
6-(цис-2-(трет-бутоксикарбониламино)циклогексиламино)-2-(3,5-диметоксифениламино)-5-фторэтилникотинат
MS (ESI, m/z): 533 (M+H), 531 (М-Н)
2-ая, 3-я и 4-ая стадии
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Примера 15 и 1-ой стадии Примера.
6-(цис-2-аминоциклогексиламино)-2-(3,5-диметоксифениламино)-5-фторникотинамид
(1H-ЯМР и данные ESI-MS показаны в таблице 11.)
Пример 22
Соединения, перечисленные в таблице 11, получали как описано в Примере 21.
Пример 23
[Формула 500]
Следующее соединение получали как описано в Справочном примере 9.
2-(3,5-диметоксифениламино)-5-фтор-6-(метиламино)никотинамид
1H ЯМР (DMSO-d6, 400 МГц) δ: 11,72 (с, 1H), 7,82 (д, 1H, J=12,7 Гц), 7,31-7,25 (м, 1H), 6,93 (т, 2H, J=2,2 Гц), 6,08 (т, 1H, J=2,2 Гц), 3,72 (с, 6H), 2,95 (д, 3H, J=4,5 Гц)
MS (ESI, m/z): 321 (M+H)
Пример 24
[Формула 501]
Следующее соединение получали как описано на 1-ой стадии Примера 1
5-фтор-6-(пиридин-3-иламино)-2-(хинолин-3-иламино)метилникотинат
Следующее соединение получали как описано на 1-ой и 2-ой стадиях Справочного примера 27 или 3-ей и 4-ой стадиях Примера 7.
5-фтор-6-(пиридин-3-иламино)-2-(хинолин-3-иламино)никотинамид
(1H-ЯМР и данные ESI-MS показаны в таблице 12.)
Пример 25
Соединения, перечисленные в таблице 12, получали как описано в Примере 24.
Пример 26
[Формула 502]
1-ая стадия
Следующее соединение получали как описано на 1-ой стадии Примера 3.
(5-(6-(цис-2-(трет-бутоксикарбониламино)циклогексиламино)-5-фтор-3-(2-фенилпропан-2-иламинокарбонил)пиридин-2-иламино)пиридин-3-ил)бензилкарбамат
1H ЯМР (DMSO-d6, 400 МГц) δ: 11,18 (с, 1H), 9,88 (с, 1H), 8,39 (д, 1H, J=2,1 Гц), 8,20-8,08 (м, 4H), 7,44-7,25 (м, 9H), 7,19-7,14 (м, 1H), 6,69-6,61 (м, 2H), 5,16 (с, 2H), 4,16-4,08 (м, 1H), 3,92-3,84 (м, 1H), 1,80-1,10 (м, 23H)
MS (ESI, m/z): 712 (M+H), 710 (М-Н)
2-ая стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 53.
цис-2-(6-(5-аминопиридин-3-иламино)-3-фтор-5-(2-фенилпропан-2-иламинокарбонил)пиридин-2-иламино)циклогексил-трет-бутилкарбамат
1Н-ЯМР (DMSO-d6, 400 МГц) δ: 10,99 (с, 1H), 8,16-8,04 (м, 3H), 7,51 (д, 1H, J=2,3 Гц), 7,39-7,34 (м, 2H), 7,32-7,25 (м, 2H), 7,19-7,13 (м, 1H), 7,04 (с, 1H), 6,72-6,65 (м, 1H), 6,59-6,53 (м, 1H), 4,16-4,06 (м, 1H), 3,96-3,87 (м, 1H), 1,84-1,11 (м, 23H)
MS (ESI, m/z): 578 (M+H), 576 (М-Н)
3-я и 4-ая стадии
Следующее соединение получали как описано на 2-ой стадии Справочного примера 3 и 2-ой стадии Примера 1.
6-(цис-2-аминоциклогексиламино)-2-(5-бензоиламинопиридин-3-иламино)-5-фторникотинамид
(Данные 1H-ЯМР и данные MS показаны в таблице 13)
Пример 27
Соединения, перечисленные в таблице 13, получали как описано в Примере 26.
Пример 28
[Формула 503]
1-ая, 2-ая и 3-я стадии
Следующее соединение получали как описано на 1-ой стадии Примера 3 и 1-ой и 2-ой стадиях Справочного примера 27.
цис-2-(6-(5-(аминокарбонил)пиридин-3-иламино)-5-(трет-бутиламинокарбонил)-3-фторпиридин-2-иламино)циклогексил-трет-бутилкарбамат
1Н-ЯМР (DMSO-d6, 400 МГц) δ: 11,59 (с, 1H), 8,89 (с, 1H), 8,60-8,52 (м, 2H), 8,13 (с, 1H), 7,98 (д, 1H, J=12,8 Гц), 7,58 (с, 1H), 7,49 (с, 1H), 6,70-6,56 (м, 2H), 4,20-4,10 (м, 1H), 3,92-3,84 (м, 1H), 1,80-1,05 (м, 26H)
MS (ESI, m/z): 544 (M+H), 542 (М-Н)
4-ая стадия
Следующее соединение получали как описано на 2-ой стадии Примера 1.
2-(5-аминокарбонилпиридин-3-иламино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид
(Данные 1H-ЯМР и данные MS показаны в таблице 14.)
Пример 29
Соединения, перечисленные в таблице 14, получали как описано в Примере 28.
Пример 30
[Формула 504]
Следующее соединение получали как описано на 1-ой и 2-ой стадиях Примера 5, 2-ой стадии Справочного примера 3, 1-ой стадии Справочного примера 3 и 2-ой стадии Примера 1.
6-(2-аминоэтиламино)-2-(3-(анилинокарбонил)фениламино)-5-фторникотинамид
(Данные 1H-ЯМР и данные MS показаны в таблице 15)
Пример 31
Соединения, перечисленные в таблице 15, получали как описано в Примере 30.
Пример 32
[Формула 505]
Следующее соединение получали как описано на 1-ой стадии Справочного примера 2, 2-ой стадии Справочного примера 27 или 4-ой стадии Примера 7.
6-(1-аминокарбонил-2-метилпропиламино)-2-(3,5-диметоксифениламино)-5-фторникотинамид
(1H-ЯМР и данные ESI-MS показаны в таблице 16)
Пример 33
Соединения, перечисленные в таблице 16, получали как описано в Примере 32.
Пример 34
[Формула 506]
1-ая стадия
Xantphos (5 мг) и Pd2(dba)3 (4 мг) добавляли в атмосфере азота к смеси цис-2-(6-амино-3-хлор-5-(2-фенилпропан-2-иламинокарбонил)пиридин-2-иламино)циклогексил-трет-бутилкарбамата (20 мг), карбоната цезия (20 мг), 3-бром-5-метилпиридина (9 мг) и 1,4 диоксана (2 мл) с последующим нагреванием с обратным холодильником в течение 3 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры и добавляли воду и этилацетат. Органический слой собирали, промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (силикагель: Kanto Chemical Co., Inc., силикагель 60 (сферическая форма), гексан·этилацетат = от 2:1 до 3:1), и таким образом получали твердое вещество белого цвета цис-2-(3-хлор-5-(2-фенилпропан-2-иламинокарбонил)-6-(5-метилпиридин-3-иламино)пиридин-2-иламино)циклогексил-трет-бутилкарбамат (13 мг).
MS (ESI, m/z): 593 (M+H), 595 (M+H)
2-ая стадия
Смесь цис-2-(3-хлор-5-(2-фенилпропан-2-иламинокарбонил)-6-(5-метилпиридин-3-иламино)пиридин-2-иламино)циклогексил-трет-бутилкарбамата (12 мг) и TFA (0,5 мл) перемешивали при комнатной температуре в течение 1 часа. Растворитель отгоняли при пониженном давлении (при 40°C или меньше), добавляли этилацетат и 4н. хлорид водорода/1,4-диоксан (25 мкл), и результант оставляли в покое в течение ночи при комнатной температуре. Твердое вещество собирали фильтрацией, и таким образом получали твердое вещество белого цвета 6-(цис-2-аминоциклогексиламино)-5-хлор-2-(5-метилпиридин-3-иламино)никотинамид·гидрохлорид (8 мг).
(1H-ЯМР и данные ESI-MS показаны в таблице 17)
Пример 35
Соединения, показанные в таблице 17, получали как описано в Примере 34.
Пример 36
[Формула 507]
1-ая стадия
Карбонат натрия (32 мг), 5-аминохинолин (30 мг), Xantphos (11 мг) и Pd2(dba)3 (9 мг) добавляли в атмосфере азота к раствору (0,4 мл) 1,4-диоксана, содержащему 2-хлор-6-(((1R,2S)-2-(1,3-диоксоизоиндолин-2-ил)циклогексил)амино)-5-фторникотинонитрил (40 мг), с последующим перемешиванием при 100°C в течение 12 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат с последующей фильтрацией. Растворитель отгоняли при пониженном давлении, и полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 9:1 до 1:1), и таким образом получали 6-(((1R,2S)-2-(1,3-диоксоизоиндолин-2-ил)циклогексил)амино)-5-фтор-2-(хинолин-5-иламино)никотинонитрил (30 мг).
MS (ESI m/z): 508 (M+H)
RT (мин.): 1,37
2-ая стадия
Гидразин·моногидрат (50 мкл) добавляли к раствору этанол/тетрагидрофуран (1 мл/0,2 мл), содержащему 6-(((1R,2S)-2-(1,3-диоксоизоиндолин-2-ил)циклогексил)амино)-5-фтор-2-(хинолин-5-иламино)никотинонитрил (30 мг), с последующим перемешиванием при комнатной температуре в течение 2,5 часов. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Результант промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, и таким образом получали 6-(((1R,2S)-2-аминоциклогексил)амино)-5-фтор-2-(хинолин-5-иламино)никотинонитрил (20 мг).
MS (ESI m/z): 377 (M+H)
RT (мин.): 0,73
3-я стадия
5M водный раствор гидроксида натрия (0,1 мл) и 30%-ый раствор пероксида водорода (0,1 мл) добавляли к раствору диметилсульфоксида (1 мл) и этанола (0,5 мл), содержащему 6-(((1R,2S)-2-аминоциклогексил)амино)-5-фтор-2-(хинолин-5-иламино)никотинонитрил (20 мг), с последующим перемешиванием при комнатной температуре в течение 1 часа. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и высушивали над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли 4M хлорид водорода/1,4-диоксан (0,5 мл), полученный осадок собирали фильтрацией, и таким образом получали твердое вещество красного цвета 6-(((1R,2S)-2-аминоциклогексил)амино)-5-фтор-2-(хинолин-5-иламино)никотинамид (12 мг).
MS (ESI m/z): 395 (M+H)
RT (мин.): 0,70
Пример 37
Соединения, показанные в таблице 18, получали как описано в Примере 36.
Пример 38
[Формула 508]
1-ая стадия
Карбонат калия (115 мг) и 6-хлор-5-фтор-2-(хинолин-6-иламино)никотинонитрил (50 мг) добавляли в пробирку, содержащую раствор 1,4-диоксана (2 мл), содержащий (R)-2-(2-аминопропил)изоиндолин-1,3-дион (52 мг), и пробирку закупоривали с последующим перемешиванием с нагреванием при 140°C в течение 13 часов. Реакционный раствор охлаждали до комнатной температуры и добавляли насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией этилацетатом. Органический слой высушивали над безводным сульфатом натрия. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = 3:2), и таким образом получали твердое вещество желтого цвета (R)-6-((1-(1,3-диоксоизоиндолин-2-ил)пропан-2-ил)амино)-5-фтор-2-(хинолин-6-иламино)никотинонитрил (57 мг).
MS (ESI m/z): 467 (M+H)
RT (мин.): 1,03
2-ая стадия
Следующее соединение получали как описано на 3-ей стадии Справочного примера 379.
(R)-6-((1-аминопропан-2-ил)амино)-5-фтор-2-(хинолин-6-иламино)никотинонитрил
MS (ESI m/z): 337 (M+H)
RT (мин.): 0,60
3-я стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 2.
(R)-трет-бутил(2-((5-циано-3-фтор-6-(хинолин-6-иламино)пиридин-2-ил)амино)пропил)карбамат
MS (ESI m/z): 437 (M+H)
RT (мин.): 1,14
4-ая и 5-ая стадии
Следующее соединение получали как описано на 2-ой и 3-ей стадиях Примера 5.
(R)-трет-бутил(2-((5-карбамоил-3-фтор-6-(хинолин-6-иламино)пиридин-2-ил)амино)пропил)карбамат
MS (ESI m/z): 455 (M+H)
RT (мин.): 1,02
(R)-6-((1-аминопропан-2-ил)амино)-5-фтор-2-(хинолин-6-иламино)никотинамид
MS (ESI m/z): 355 (M+H)
RT (мин.): 0,56
Пример 39
Соединения, перечисленные в таблице 19, получали как описано в Примере 38.
Пример 40
[Формула 509]
1-ая стадия
Карбонат цезия (238 мг), 3-бром-8-нитрохинолин (92 мг), 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (23 мг) и Pd2(dba)3 (22 мг) добавляли в атмосфере азота к раствору 1,4-диоксана (2 мл), содержащему ((цис)-2-((6-амино-3-фтор-5-((2-фенилпропан-2-ил)карбамоил)пиридин-2-ил)амино)циклогексил)трет-бутилкарбамат (118 мг), с последующим перемешиванием при 100°C в течение 45 минут. Реакционный раствор охлаждали до комнатной температуры, добавляли этилацетат, и нерастворимое вещество отфильтровывали. Затем растворитель отгоняли при пониженном давлении, полученный остаток очищали хроматографией на силикагеле (н-гексан:этилацетат = от 9:1 до 3:7) и таким образом получали ((цис)-2-((3-фтор-6-((8-нитрохинолин-3-ил)амино)-5-((2-фенилпропан-2-ил)карбамоил)пиридин-2-ил)амино)циклогексил)трет-бутилкарбамат (98 мг).
MS (ESI m/z): 658 (M+H)
RT (мин.): 2,08
2-ая стадия
Следующее соединение получали как описано на 2-ой стадии Справочного примера 186.
((цис)-2-((6-((8-аминохинолин-3-ил)амино)-3-фтор-5-((2-фенилпропан-2-ил)карбамоил)пиридин-2-ил)амино)циклогексил)трет-бутилкарбамат
MS (ESI m/z): 629 (M+H), 627 (М-Н)
RT (мин.): 1,98
3-я стадия
Триэтиламин (4 мкл) и метансульфонил хлорид (1,4 мкл) добавляли к раствору дихлорметана (1 мл), содержащему ((цис)-2-((6-((8-аминохинолин-3-ил)амино)-3-фтор-5-((2-фенилпропан-2-ил)карбамоил)пиридин-2-ил)амино)циклогексил)трет-бутилкарбамат (10 мг), полученный на 2-ой стадии, с последующим перемешиванием при комнатной температуре в течение 1 часа. К реакционной смеси снова добавляли триэтиламин (12 мкл) и метансульфонил хлорид (5 мкл), с последующим перемешиванием при комнатной температуре в течение 1 часа. Добавляли насыщенный водный раствор бикарбоната натрия с последующей экстракцией этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении, и таким образом получали ((цис)-2-((3-фтор-6-((8-(метилсульфонамид)хинолин-3-ил)амино)-5-((2-фенилпропан-2-ил)карбамоил)пиридин-2-ил)амино)циклогексил)трет-бутилкарбамат (12 мг).
MS (ESI m/z): 707 (M+H)
RT (мин.): 2,06
4-ая стадия
Следующее соединение получали как описано на 2-ой стадии Примера 1.
6-(((цис)-2-аминоциклогексил)амино)-5-фтор-2-((8-(метилсульфонамид)хинолин-3-ил)амино)никотинамид
MS (ESI m/z): 488 (M+H), 486 (М-Н)
RT (мин.): 0,97
Пример 41
Соединения, перечисленные в таблице 20, получали как описано в Примере 40.
Пример 42
[Формула 510]
1-ая стадия
Следующее соединение получали как описано на 1-ой стадии Примера 40.
((цис)-2-((6-((8-(бензилокси)хинолин-6-ил)амино)-3-фтор-5-((2-фенилпропан-2-ил)карбамоил)пиридин-2-ил)амино)циклогексил)трет-бутилкарбамат
MS (ESI m/z): 720 (M+H), 718 (М-Н)
RT (мин.): 1,75
2-ая стадия
Следующее соединение получали как описано на 2-ой стадии Примера 1.
6-(((цис)-2-аминоциклогексил)амино)-2-((8-(бензилокси)хинолин-6-ил)амино)-5-фторникотинамид
MS (ESI m/z): 502 (M+H)
RT (мин.): 0,87
3-я стадия
Метанольный раствор (5 мл), содержащий 6-(((цис)-2-аминоциклогексил)амино)-2-((8-(бензилокси)хинолин-6-ил)амино)-5-фторникотинамид (20 мг), получали и подвергали реакции гидрирования (комнатная температура; 1 бар; объемная скорость потока: 1 мл/мин.; 20%-ый Pd(ОН)2/C) с использованием H-cube™. Затем растворитель отгоняли при пониженном давлении. Остаток растворяли в этилацетате, добавляли 4M хлорид водорода/1,4-диоксан (50 мкл), полученный осадок собирали фильтрацией, и таким образом получали твердое вещество желтого цвета 6-(((цис)-2-аминоциклогексил)амино)-5-фтор-2-((8-гидроксихинолин-6-ил)амино)никотинамид (12 мг).
6-(((цис)-2-аминоциклогексил)амино)-5-фтор-2-((8-гидроксихинолин-6-ил)амино)никотинамид
MS (ESI m/z): 411 (M+H)
RT (мин.): 0,66
Пример 43
[Формула 511]
1-ая стадия
Следующее соединение получали как описано на 1-ой стадии Примера 5.
((1S,2R)-2-((5-циано-3-фтор-6-((5-(3-нитрофенил)пиридин-3-ил)амино)пиридин-2-ил)амино)циклогексил)трет-бутилкарбамат
MS (ESI m/z): 548 (M+H)
RT (мин.): 1,69
2-ая стадия
Формиат аммония (0,2 г) и 10%-ый Pd/C (0,2 г) добавляли к метанольному раствору (10 мл), содержащему ((1S,2R)-2-((5-циано-3-фтор-6-((5-(3-нитрофенил)пиридин-3-ил)амино)пиридин-2-ил)амино)циклогексил)трет-бутилкарбамат (87 мг), с последующим нагреванием с обратным холодильником с нагреванием в течение 30 минут. Реакционную смесь охлаждали до комнатной температуры и фильтровали через Целит, растворитель отгоняли при пониженном давлении, и таким образом получали твердое вещество желтого цвета ((1S,2R)-2-((6-((5-(3-аминофенил)пиридин-3-ил)амино)-5-циано-3-фторпиридин-2-ил)амино)циклогексил)трет-бутилкарбамат (90 мг).
MS (ESI m/z): 518 (M+H)
RT (мин.): 1,32
3-я стадия
Следующее соединение получали как описано на 2-ой стадии Примера 5.
((1S,2R)-2-((6-((5-(3-аминофенил)пиридин-3-ил)амино)-5-карбамоил-3-фторпиридин-2-ил)амино)циклогексил)трет-бутилкарбамат
MS (ESI m/z): 536 (M+H)
RT (мин.): 1,18
4-ая стадия
Следующее соединение получали как описано на 2-ой стадии Примера 1.
6-(((1R,2S)-2-аминоциклогексил)амино)-2-((5-(3-аминофенил)пиридин-3-ил)амино)-5-фторникотинамид
MS (ESI m/z): 436 (M+H)
RT (мин.): 0,70
Пример 44
[Формула 512]
Следующее соединение получали как описано на 3-ей стадии Примера 5.
6-(((2S,3R)-2-амино-6-гидроксигексан-3-ил)амино)-2-((5,6-диметилпиридин-3-ил)амино)-5-фторникотинамид
1Н-ЯМР (DMSO-d6, 300 МГц) δ: 12,20 (д, 1H, J=6,6 Гц), 9,38 (с, 1H), 8,25-7,86 (м, 6H), 7,55-7,43 (м, 1H), 7,40-7,25 (м, 1H), 4,45-4,25 (м, 2H), 3,49-3,34 (м, 1H), 2,82-2,67 (м, 2H), 2,63 (с, 3H), 2,39 (с, 3H), 1,80-1,32 (м, 4H), 1,25 (д, 3H, J=5,9 Гц).
MS (ESI m/z): 391 (M+H)
RT (мин.): 0,51
Пример 45
[Формула 513]
1-ая стадия
N,N-диизопропилэтиламин (3,4 мкл) и ди-трет-бутил дикарбонат (4,4 мг) добавляли к раствору тетрагидрофурана (1 мл), содержащему ((2S,3R)-6-амино-3-((5-карбамоил-6-((5,6-диметилпиридин-3-ил)амино)-3-фторпиридин-2-ил)амино)гексан-2-ил)трет-бутилкарбамат (7 мг), с последующим перемешиванием при комнатной температуре в течение 15 минут. Растворитель отгоняли при пониженном давлении, остаток очищали хроматографией на силикагеле (этилацетат) и использовали в последующей реакции.
2-ая стадия
Следующее соединение получали как описано на 3-ей стадии Примера 5.
6-(((2S,3R)-2-амино-6-аминогексан-3-ил)амино)-2-((5,6-диметилпиридин-3-ил)амино)-5-фторникотинамид
1H ЯМР (DMSO-d6) δ: 12,20 (с, 1H), 9,40 (с, 1H), 8,26-7,34 (м, 11H), 4,40 (с, 2H), 3,49-3,34 (м, 1H), 2,62 (с, 3H), 2,39 (с, 3H), 1,86-1,50 (м, 4H), 1,26 (д, 3H, J=6,6 Гц)
MS (ESI m/z): 390 (M+H)
RT (мин.): 0,35
Пример 46
[Формула 514]
1-ая стадия
Натрий триацетоксиборгидрид (10,6 мг) добавляли к смеси ((2S,3R)-6-амино-3-((5-карбамоил-6-((5,6-диметилпиридин-3-ил)амино)-3-фторпиридин-2-ил)амино)гексан-2-ил)трет-бутилкарбамата (7 мг), хлороформа (1 мл) и 35%-ого водного раствора формальдегида (6,0 мкл), с последующим перемешиванием при комнатной температуре в течение 15 минут. Растворитель отгоняли при пониженном давлении, остаток очищали хроматографией на силикагеле (этилацетат:метанол = 9:1) и использовали в последующей реакции.
2-ая стадия
Следующее соединение получали как описано на 3-ей стадии Примера 5.
6-(((2S,3R)-2-амино-6-(диметиламино)гексан-3-ил)амино)-2-((5,6-диметилпиридин-3-ил)амино)-5-фторникотинамид
1H ЯМР (DMSO-d6) δ: 12,17 (с, 1H), 9,95-9,70 (м, 1H), 9,45-9,25 (м, 1H), 8,30-7,84 (м, 5H), 7,55-7,25 (м, 2H), 4,45-4,35 (м, 1H), 3,49-3,34 (м, 1H), 3,07-2,95 (м, 2H), 2,73-2,62 (м, 9H), 2,39 (с, 3H), 1,82-1,58 (м, 4H), 1,26 (д, 3H, J=6,6 Гц)
MS (ESI m/z): 417 (M+H)
RT (мин.): 0,43
Пример 47
[Формула 515]
1-ая стадия
Ацетил хлорид (1,2 мкл) добавляли к смеси ((2S,3R)-6-амино-3-((5-карбамоил-6-((5,6-диметилпиридин-3-ил)амино)-3-фторпиридин-2-ил)амино)гексан-2-ил)трет-бутилкарбамата (7 мг), дихлорметана (1 мл) и N,N-диизопропилэтиламина (3,4 мкл), с последующим перемешиванием при комнатной температуре в течение 15 минут. Растворитель отгоняли при пониженном давлении, остаток очищали хроматографией на силикагеле (этилацетат:метанол = 9:1) и использовали в последующей реакции.
2-ая стадия
Следующее соединение получали как описано на 3-ей стадии Примера 5.
6-(((2S,3R)-6-ацетамид-2-аминогексан-3-ил)амино)-2-((5,6-диметилпиридин-3-ил)амино)-5-фторникотинамид
1H ЯМР (DMSO-d6) δ: 12,19 (с, 1H), 9,38 (с, 1H), 8,20-7,78 (м, 7H), 7,55-7,25 (м, 2H), 4,45-4,30 (м, 1H), 3,49-3,34 (м, 1H), 3,05-2,90 (м, 2H), 2,65 (с, 3H), 2,39 (с, 3H), 1,80-1,30 (м, 7H), 1,24 (д, 3H, J=6,6 Гц)
MS (ESI m/z): 432 (M+H)
RT (мин.): 0,53
Пример тестирования 1: тест фермента Syk
Таблица 21 демонстрирует результаты теста, проведенного согласно способу тестирования, описанному в “тесте фермента Syk” в Примере тестирования 1. Кроме того, следующее представляет собой стандарты для оценки IC50 Syk-ингибирующей активности, используемой в Таблице 21.
A: До 10 нМ
B: 10-50 нМ
C: 50-100 нМ
D: 100-1000 нМ
Набор чисел (XYZ-xyz), приведенных в каждом столбце номера Примера, указывает соответствующий номер Примера (Пример XYZ-xyz) в Таблице 21.
Концентрации тестируемых соединений доводили до 100 нМ. Тестируемые соединения исследовали, используя наборы Profiler Pro (Caliper) в терминах активности против каждого из 170 типов киназ, исключая Syk. В результате были получены высокоселективные соединения (Пример 6-296, Пример 6-368 и Пример 6-395), имеющие степень ингибирования киназ 75% или больше в отношении только от 0 до 2 типов киназ. Было также получено соединение (Пример 6-157), имеющие степень ингибирования киназ 75% или больше в отношении 12 типов киназ. Также был получен ингибитор (Пример 6-373), имеющий степень ингибирования киназ 75% или больше в отношении 24 типов киназ.
Пример тестирования 2: тест генерации TNFα
Таблица 22 показывает результаты тестирования, полученные способом тестирования, описанным в “тесте генерации TNFα” в Примере тестирования 2. Кроме того, следующее используется в Таблице 22 для обозначения критериев оценки IC50 в тесте генерации TNFα.
A: До 65 нМ
B: 65-130 нМ
C: 130-200 нМ
Пример тестирования 3: Тест сигнала внутриклеточного фосфорилирования
Клетки THP-1, дифференцировка которых была индуцирована IFNγ, собирали как описано в Примере тестирования 2 и инкубировали с тестируемыми соединениями в течение 30 минут. После этого клетки, смешанные с соединениями, высевали на покрытый человеческим IgG планшет с последующей инкубацией при 37°C в течение 45 минут. Затем лизат клеток получали, используя буфер AlphaScreen SureFire Lysis (PerkinElmer). Затем добавляли буфер ImmunoPure Lane Marker Reducing Sample (Thermo) с последующей обработкой при 95°C в течение 5 минут. Таким образом получали образцы Вестерн-блоттинга с последующим электрофорезом SDS для разделения белка, и образцы перемещали на мембрану Immobilon FL PVDF (Millipore). Мембрану, на которую были перемещены белки, инкубировали в буфере Odyssey Blocking (LI-COR) при комнатной температуре в течение 1 часа для блокировки обработки. Затем белки вводили в реакцию в течение ночи с первичными антителами [SLP76 Antibody, AKT Antibody, Phospho-AKT (Ser473) Antibody, MEK Antibody, Phospho-MEK (Tyr128) Antibody, Phospho-p38 (Thr180/Tyr182) Antibody, Phospho-JNK (Thr183/Tyr185) Antibody (Cell Signaling Technology), Phospho-SLP76 (Tyr128) Antibody, p38 Antibody, и JNK Antibody (BD Biosciences)] при 4°C.
На следующий день, белки вводили в реакцию с флуоресцентно-меченными вторичными антителами [IRDye 680 осла против IgG кролика, IRDye 680 осла против IgG мыши, IRDye 800CW осла против IgG кролика и IRDye 800CW осла против IgG мыши (LI-COR)] при комнатной температуре в течение 1 часа, и детекцию проводили, используя Odyssey Infrared Imaging System. В результате было показано, что добавление соединений вызывает ингибирование фосфорилирования SLP76, Akt, Mek, p38MAPK и JNK2, которые являются молекулами, располагающимися ниже Syk, как показано на фиг. 1.
Пример тестирования 4: Тест дифференцировки остеокластов
Клетки RAW264, которые представляют собой линию макрофагоподобных клеток мыши, высевали на 96-луночный планшет (3000 клеток/лунка), в каждую лунку которого добавляли RANKL (R&D) (конечная концентрация: 150 нг/мл) и тестируемое соединение и культивировали в течение 4 дней с последующим окрашиванием стойкой к тартрату кислой фосфатазой (TRAP), которая является маркером остеокластов. На фиг. 2 показан пример, где использовалось соединение, которое было способно ингибировать дифференцировку остеокластов.
Пример тестирования 5: Тест зависимого от антитела фагоцитоза
Клетки THP-1 (2×105 клеток/мл), которые представляют собой линию человеческих моноцитоподобных клеток, культивировали в присутствии 10 нг/мл IFNγ в течение 2 дней, так, чтобы индуцировать дифференцировку клеток в макрофагоподобные клетки. Клетки THP-1, дифференцировка которых была индуцирована, собирали. Клетки (5×104 клеток/лунка) вводили в реакцию с тестируемыми соединениями, имеющими данные концентрации, при комнатной температуре в течение 30 минут. После этого, Escherichia coli (Life Technologies), меченные рН-чувствительным красителем (pHrodo) подвергали опсонизации, используя антитело анти-Escherichia coli (Molecular Probes). Затем результант добавляли к клеткам THP-1, смешанным с тестируемыми соединениями, дифференцировка которых была индуцирована, с последующей инкубацией при 37°C в течение 3 часов. Во время добавления опсонизованных Escherichia coli, одновременно добавляли проницаемый для клеток флуоресцентный краситель (Calcein АМ), и фагоцитоз опсонизованных Escherichia coli в жизнеспособных клетках количественно определяли, используя IN Cell Analyzer.
Результаты тестирования, полученные вышеописанным способом тестирования, приведены ниже в Таблице 23. Кроме того, следующее используется в Таблице 23 для обозначения стандартов оценки IC50 после ингибирования фагоцитоза.
A: До 1 мкМ
B: 1-3 мкМ
C: 3-6 мкМ
Пример тестирования 6: Тест Эймса
Четыре штамма Salmonella typhimurium (TA100, TA1535, TA98 и TA1537) и один Escherichia coli штамм (WP2uvrA) использовались для теста Эймса.
Раствор, содержащий тестируемое соединение (0,1 мл), добавляли в пробирку. 0,1 М Na-фосфатный буфер (0,5 мл) добавляли в пробирку для отсутвия метаболической активации (S9(-)), или смесь S-9 (Kikkoman) (0,5 мл) добавляли в пробирку для метаболической активации (S9(+)). Далее в пробирку добавляли предварительно культивируемую суспензию бактериальных клеток (0,1 мл), с последующим взбалтыванием при 37°C в течение 20 минут. После этого добавляли 2 мл топ-агара (раствор, полученный смешиванием 5 мМ L-гистидина и раствора 5 мМ препарата D-биотина в объемной доле 99:1 в водном растворе агара BactoTM для сальмонеллы, или раствор, полученный смешиванием водного раствора 5 мМ L-триптофана и раствора 5 мМ препарата D-биотина в объемной доле 99:1 в водном растворе агара BactoTM для Escherichia coli), с последующим достаточным перемешиванием. Содержимое пробирки лили на планшет с минимальной глюкозосодержащей агаровой средой и культивировали при 37°C в течение 48 часов.
Число колоний подсчитывали при использовании автоматизированного счиетчика колоний в чашках Петри. Кроме того, значение измерения определяли как среднее число колоний на два планшета.
Результаты тестирования были получены для различных доз. Когда среднее число колоний ревертанта на планшет для тестируемого соединения было по меньшей мере вдвое или меньше чем вдвое большим, чем для отрицательного контроля (только растворитель ДМСО), такое тестируемое соединение определяли как приводящее к положительному или отрицательному результату тестирования, соответственно. Кроме того, тестируемое вещество оценивали как приводящее к положительному результату тестирования, когда увеличение среднего числа колоний ревертанта коррелировало с зависимостью от дозы или воспроизводимостью.
Соединения, перечисленные в Таблице 24, были проверены вышеописанным способом тестирования. В результате было обнаружено, что каждое соединение приводит к отрицательному результату тестирования.
Пример тестирования 7: Микроядерный тест с использованием культуры клеток
Клетки CHL (из легкого Китайского хомячка) высевали на 96 -луночный планшет (5000 клеток/лунка) и культивировали при 37°C в 5%-ом CO2 в течение 24 часов. После этого клетки CHL разделяли на группу без метаболической активации (S9(-)) и группу метаболической активации (S9(+)). К каждой группе добавляли фосфатный буферный солевой раствор (далее указываемый как PBS (-)) или размороженную замороженную смесь S-9 для тестирования хромосомных аномалий (Kikkoman). Также добавляли тестируемые вещества с последующим культивированием при 37°C и в 5% CO2 в течение 6 часов. Затем планшет промывали PBS(-), и снова добавляли раствор культуры (100 мкл) с последующим культивированием при 37°C и в 5% CO2 в течение 18 часов. Клетки фиксировали этанолом с последующим удалением PBS(-). В каждую лунку добавляли 100 мкл PBS(-), содержащего 2 мкг/мд Hoechst 33342 (Invitrogen) и 2 мкг/мл CellMask (Invitrogen), и клетки окрашивали при комнатной температуре в течение 30 минут. Клетки промывали однократно PBS(-), добавляли PBS(-) (100 мкл), и проводили анализ изображения, используя IN Cell Analyzer (GE) для детекции клеток, имеющих микроядра. Были проанализированы по меньшей мере 1000 клеток на лунку для вычисления частоты микроядер. Кроме того, испытание на клеточную токсичность с использованием CellTiter-GloBuffer (Promega) проводили одновременно с микроядерным тестом, чтобы оценить мутагенность каждого тестируемого вещества согласно критериям, описанным ниже. Статистический анализ Даннетта проводили для теста статистической значимости.
Соединения, перечисленные в Таблице 25, были проверены вышеописанным способом тестирования. В результате было обнаружено, что каждое соединение приводит к отрицательному результату тестирования. Следующее представляет собой стандарты исследования.
Положительный: статистически значимое увеличение и зависимость от дозы
Отрицательный: отсутствие значительного увеличения
Ложноположительный: значительное увеличение и отсутствие зависимости от дозы или
Значительное увеличение и сильная клеточная токсичность (выживаемость: 50 % или меньше)
Пример тестирования 8: Индуцированный антителом к мышиному коллагену типа II артрит
Соединение, синтезированное в Примере 8-1, тестировали, чтобы исследовать эффекты на индуцированный антителом к мышиному коллагену типа II артрит. Смесь антител к коллагену типа II (Chondrex) внутрибрюшинно вводили самкам мышей BALB/c 7-недельного возраста (Charles River Laboratories Japan, Inc) (1,5 мг на мышь) (День 0). Раствор 0111:B4 LPS (Chondrex) (50 мкг) внутрибрюшинно вводили три дня спустя (День 3), таким образом вызывая артрит. Степень отека определяли для четырех конечностей каждой мыши один раз в день со Дня 3 до Дня 14. В частности, оценку осуществляли, используя шкалу из двенадцати пунктов для суммы оценок для этих четырех конечностей для каждой мыши: 0 пунктов: отсутствие изменений; 1 пункт: умеренная эритема/набухание на запястной области или области лодыжки/пяточной области; 2 пункта: очевидное набухание на запястной области или области лодыжки/пяточной области; 3 пункта: тяжелое набухание в передних или задних конечностях. Соединение, синтезированное в Примере 8-1, внутрибрюшинно вводили в количестве 30 мг/кг/сутки два раза в день в последовательные дни (со Дня 0 до Дня 13). Оценку деструкции кости определяли на основании на мягких рентгенограммах четырех конечностей в День 14. В частности, оценку остеопороза (0: отсутствие изменений; 0,5: изображение остеопороза сустава и вблизи сустава) и оценку эрозии кости (0: отсутствие изменений; 1: частичное изображение деструкции кости в суставе и вблизи сустава; 2: полное изображение деструкции кости в суставе и вблизи сустава) определяли для следующих оценочных участков:
передняя конечность: от 2-ого до 5-ого межфалангового сустава, от 1-ого до 5-ого пястно-фалангового сустава и запястная область;
задняя конечность: от 2-ого до 5-ого межфалангового сустава, от 1-ого до 5-ого плюснефалангового сустава, область лодыжки и пяточная кость.
Оценку деструкции кости получали как сумму обеих оценок, чтобы вычислить полную оценку для четырех конечностей (максимальная оценка деструкции кости: 105 пунктов на мышь). Было обнаружено, что соединение, синтезированное в Примере 8-1, почти полностью ингибирует увеличение степени отека и увеличение степени деструкции кости.
Пример тестирования 9: Индуцированный коллагеном мыши типа II артрит (тест профилактического введения и тест терапевтического введения)
Соединения, синтезированные в Примере 8-1, Примере 4-17 и Примере 6-49, тестировали, чтобы исследовать эффекты на индуцированный коллагеном мыши типа II артрит. К раствору 2 мг/мл бычьего коллагена типа II (Koken, Ltd.), растворенного в 0,1 моль/л уксусной кислоты, добавляли равное количество полного адъюванта Фройнда (Wako Pure Chemical Industries, Ltd.), чтобы получить эмульсию. Часть эмульсии внутрикожно вводили в основание хвоста самцов мышей DBA/1J 7-или 8-недельного возраста (Charles River Laboratories Japan, Inc) в дозе 0,2 мл на мышь (количество антигена: 0,2 мг/мышь) в День 0 и День 21 дважды, чтобы индуцировать артрит. Каждое соединение вводили один раз в сутки со Дня 21 до Дня 34 в тесте профилактического введения (1-30 мг/кг/сутки), и вводили один раз в сутки со Дня 27 до Дня 35 в тесте терапевтического введения (25 мг/кг/сутки). Оценку артрита для четырех конечностей для каждой мыши определяли, начиная со Дня 21. В частности, полную оценку четырех конечностей мыши определяли как индивидуальную оценку артрита (12 пунктов в максимуме на мышь) на основании следующего: 0 пунктов: отсутствие изменений; 1 пункт: отек 1 или 2 пальцевых суставов или умеренный отек только запястной области/области лодыжки; 2 пункта: отек по меньшей мере 3 пальцевых суставов или очевидный отек запястной области/области лодыжки; и 3 пункта: очевидный отек передних или задних конечностей.
Соединения, синтезированные в Примере 8-1, Примере 4-17 и Примере 6-49, сильно ингибировали развитие артрита после начала, и соединение, синтезированное в Примере 6-49, также сильно ингибировало развитие артрита в тесте терапевтического введения.
Пример тестирования 10: Индуцированный коллагеном крысы типа II артрит
Соединения тестировали, чтобы исследовать эффекты на индуцированный коллагеном крысы типа II артрит. К раствору 3 мг/мл бычьего коллагена типа II (Collagen Gijutsu Kenshu-Kai), растворенного в 0,05 моль/л уксусной кислоты, добавляли равное количество полного адъюванта Фройнда (Wako Pure Chemical Industries, Ltd.), чтобы получить эмульсию. Часть эмульсии (0,5 мл) внутрикожно вводили в основание хвоста самок крыс Льюиса 7-или 8-недельного возраста (Charles River Laboratories Japan, Inc) (День 0). Каждую крысу подвергали тому же самому лечению в День 7 после начальной инокуляции, чтобы индуцировать артрит. Каждое тестируемое соединение перорально вводили со Дня 7 до Дня 20 один раз в сутки. В установленный срок в течение периода со Дня 7 до Дня 21 объем задней конечности крыс определяли, используя плетизмометр (UGO BASILE), и результат определяли как индекс артрита. Следующая группа соединений ингибировала отек задней конечности на 85 % или больше по сравнению с контрольной группой в случае перорального введения в количестве 10 мг/кг/сутки: соединения Примера 4-17, Примера 6-49, Примера 6-117, Примера 6-157, Примера 6-249, Примера 6-322, Примера 6-375 и Примера 6-395.
Пример тестирования 11: модель тромбоцитопении у мышей
Тестируемые соединения тестировали, чтобы исследовать эффекты на тромбоцитопению у мышей. Каждое тестируемое соединение вводили самкам мышей CD1 в возрасте от 5 до 7 недель (Charles River Laboratories Japan, Inc). Через один час после этого антитело (SCB) к CD41 мыши (Integrin αIIb) (1 мкг (200 мкл)) внутривенно вводили каждой мыши, чтобы индуцировать тромбоцитопению. Спустя четыре часа после введения антитела анти-CD41 осуществляли забор крови из подкожной вены нижней конечности. Количество тромбоцитов подсчитывали при использовании автоматизированного гематологического анализатора.
Следующие соединения были проверены вышеописанным способом тестирования, и в результате наблюдали уменьшение количества тромбоцитов (на 50 % или больше):
Пример 4-228, Пример 6-165, Пример 6-168, Пример 6-177, Пример 6-211, Пример 6-249, Пример 6-257, Пример 6-263, Пример 6-268, Пример 6-296, Пример 6-301, Пример 6-311, Пример 6-322, Пример 6-342, Пример 6-368, Пример 6-375, Пример 6-377, Пример 6-383, Пример 6-384, Пример 6-395, Пример 6-433, Пример 6-435 и Пример 6-468.
[Промышленная применимость]
Производное никотинамида или его соль согласно настоящему изобретению имеют превосходную ингибирующую активность в отношении Syk и таким образом могут быть использованы в качестве фармацевтической композиции для лечения Syk-связанных заболеваний.
Заявленные варианты осуществления настоящих изобретений описаны ниже.
(1) Производное никотинамида, представленное следующей формулой (I), или его соль:
[Формула 516]
в которой
R1 обозначает атом галогена;
R2 обозначает C1-12 алкильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C2-12 алкенильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C2-12 алкинильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C3-8 циклоалкильную группу, в случае необходимости имеющую по меньшей мере один заместитель, арильную группу, в случае необходимости имеющую по меньшей мере один заместитель, ар-C1-6 алкильную группу, в случае необходимости имеющую по меньшей мере один заместитель, или гетероциклическую группу, в случае необходимости имеющую по меньшей мере один заместитель;
R3 обозначает арильную группу, в случае необходимости имеющую по меньшей мере один заместитель, или гетероциклическую группу, в случае необходимости имеющую по меньшей мере один заместитель; и
R4 и R5, каждый независимо, обозначает атом водорода, C1-12 алкильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C2-12 алкенильную группу, в случае необходимости имеющую по меньшей мере один заместитель, или C2-12 алкинильную группу, в случае необходимости имеющую по меньшей мере один заместитель.
(2) Производное никотинамида или его соль согласно пункту (1), в котором заместитель, который могут иметь C1-12 алкильная группа, C2-12 алкенильная группа, C2-12 алкинильная группа, C3-8 циклоалкильная группа, арильная группа, ар-C1-6 алкильная группа или гетероциклическая группа, представленная R2, выбраны из следующей группы заместителей α1-1, причем
группа заместителей α1-1 состоит из атома галогена; цианогруппы; нитрогруппы; оксогруппы; в случае необходимости защищенной карбоксильной группы; в случае необходимости защищенной гидроксильной группы; в случае необходимости защищенной аминогруппы; C1-6 алкильной группы, в случае необходимости имеющей по меньшей мере один заместитель; C2-6 алкенильной группы, в случае необходимости имеющей по меньшей мере один заместитель; C2-6 алкинильной группы, в случае необходимости имеющей по меньшей мере один заместитель; C3-8 циклоалкильной группы, в случае необходимости имеющей по меньшей мере один заместитель; арильной группы, в случае необходимости имеющей по меньшей мере один заместитель; C1-6 алкоксигруппы, в случае необходимости имеющей по меньшей мере один заместитель; арилоксигруппы, в случае необходимости имеющей по меньшей мере один заместитель; ацильной группы, в случае необходимости имеющей по меньшей мере один заместитель; C1-6 алкилсульфонильной группы, в случае необходимости имеющей по меньшей мере один заместитель; арилсульфонильной группы, в случае необходимости имеющей по меньшей мере один заместитель; гетероциклической группы, в случае необходимости имеющей по меньшей мере один заместитель; и группы, представленной формулой -Q1-Q2-NR6R7 (в которой R6 и R7, каждый независимо, обозначает атом водорода, аминозащитную группу, C1-6 алкильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C2-6 алкенильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C2-6 алкинильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C3-8 циклоалкильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C1-6 алкоксигруппу, в случае необходимости имеющую по меньшей мере один заместитель, арильную группу, в случае необходимости имеющую по меньшей мере один заместитель, или гетероциклическую группу, в случае необходимости имеющую по меньшей мере один заместитель, или R6 и R7 могут образовывать циклическую аминогруппу, в случае необходимости имеющую по меньшей мере один заместитель, вместе с атомом азота, к которому они присоединены; Q1 обозначает -NH-, C1-6 алкиленовую группу, в случае необходимости имеющую по меньшей мере один заместитель, C2-6 алкениленовую группу, в случае необходимости имеющую по меньшей мере один заместитель, C2-6 алкиниленовую группу, в случае необходимости имеющую по меньшей мере один заместитель, или связь; Q2 обозначает группу, представленную -C(=X7)- (в которой X7 обозначает атом кислорода, атом серы или группу, представленную =NR29 (в которой R29 обозначает атом водорода, C1-12 алкильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C2-12 алкенильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C2-12 алкинильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C3-8 циклоалкильную группу, в случае необходимости имеющую по меньшей мере один заместитель, или C1-6 алкоксигруппу, в случае необходимости имеющую по меньшей мере один заместитель)), C1-6 алкиленовую группу или связь).
(3) Производное никотинамида или его соль согласно пункту (1) или (2), в котором заместитель, который могут иметь C1-12 алкильная группа, C2-12 алкенильная группа, C2-12 алкинильная группа, C3-8 циклоалкильная группа, арильная группа, ар-C1-6 алкильная группа или гетероциклическая группа, представленная R2, выбраны из следующей группы заместителей α1-2, причем
группа заместителей α1-2 состоит из атома галогена; цианогруппы; нитрогруппы; оксогруппы; в случае необходимости защищенной карбоксильной группы; в случае необходимости защищенной гидроксильной группы; в случае необходимости защищенной аминогруппы; C1-6 алкильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β1-1; C2-6 алкенильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β1-1; C2-6 алкинильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β1-1; C3-8 циклоалкильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β1-1; арильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β1-1; C1-6 алкоксигруппы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β1-1; арилоксигруппы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β1-1; ацильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β1-1; C1-6 алкилсульфонильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β1-1; арилсульфонильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β1-1; гетероциклической группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β1-1; и группы, представленная формулой -Q1-Q2-NR6R7 (в которой Q1, Q2, R6 и R7 каждый имеет те же самые определения, как описанные в пункте 2), причем
группа заместителей β1-1 состоит из атома галогена, цианогруппы, нитрогруппы, оксогруппы, в случае необходимости защищенной карбоксильной группы, в случае необходимости защищенной гидроксильной группы, в случае необходимости защищенной аминогруппы, C1-6 алкильной группы, в случае необходимости имеющей по меньшей мере один атом галогена, C3-8 циклоалкильной группы, в случае необходимости имеющей по меньшей мере один атом галогена, C1-6 алкоксигруппы, в случае необходимости имеющей по меньшей мере один атом галогена, арильной группы, в случае необходимости имеющей по меньшей мере один атом галогена, и гетероциклической группы, в случае необходимости имеющей по меньшей мере один атом галогена.
(4) Производное никотинамида или его соль согласно любому из пунктов (1)-(3), в котором заместитель, который могут иметь C1-12 алкильная группа, C2-12 алкенильная группа, C2-12 алкинильная группа, C3-8 циклоалкильная группа, арильная группа, ар-C1-6 алкильная группа или гетероциклическая группа, представленная R2, выбраны из следующей группы заместителей α1-3, причем
группа заместителей α1-3 состоит из цианогруппы; оксогруппы; в случае необходимости защищенной гидроксильной группы; в случае необходимости защищенной аминогруппы; арильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β1-2; C1-6 алкоксигруппы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β1-2; гетероциклической группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β1-2; и группы, представленной формулой -Q1-Q2-NR6R7 (в которой Q1, Q2, R6 и R7 каждый имеет те же самые определения, как описанные в пункте 2); причем
группа заместителей β1-2 состоит из атома галогена и в случае необходимости защищенной аминогруппы.
(5) Производное никотинамида или его соль согласно любому из пунктов (1)-(4), в котором R2 обозначает C1-12 алкильную группу, имеющую в качестве заместителя в случае необходимости защищенную аминогруппу или гетероциклическую группу, в случае необходимости имеющую по меньшей мере один заместитель, или C3-8 циклоалкильную группу, имеющую в качестве заместителя в случае необходимости защищенную аминогруппу или гетероциклическую группу, в случае необходимости имеющую по меньшей мере один заместитель.
(6) Производное никотинамида или его соль согласно пункту (1), в котором R2 обозначает заместитель, представленный любой из следующих формул (II)-(V) и (VII):
[Формула 517]
в которых R10, R11, R12, R13, R16, R17, R18, R20 и R21, каждый независимо, обозначает атом водорода или C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, арил, C1-6 алкокси, арилокси, ацил, C1-6 алкилсульфонил, арилсульфонил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, R14, R15, R19 и R30, каждый независимо, обозначают атом водорода или C1-12 алкил или ацильную группу, каждый из которых может иметь по меньшей мере один заместитель, X8 обозначает атом кислорода, атом серы или =NR23 (в котором R23 обозначает атом водорода или C1-12 алкил, C2-12 алкенил, C2-12 алкинил, C3-8 циклоалкил или C1-6 алкоксигруппу, каждый из которых может иметь по меньшей мере один заместитель), R22 обозначает гетероциклическую группу, в случае необходимости имеющую по меньшей мере один заместитель, X9 и X10, каждый независимо, обозначает атом кислорода, -NR31- (в котором R31 обозначает атом водорода или C1-12 алкил, C2-12 алкенил, C2-12 алкинил, C3-8 циклоалкил, C1-6 алкокси, ацил, C1-6 алкоксикарбонил, арилоксикарбонил или гетероциклическую оксикарбонильную группу, каждый из которых может иметь по меньшей мере один заместитель), или метиленовую группу (причем любой из X9 и X10 обозначает метиленовую группу, и когда m3 = 0, X10 обозначает метиленовую группу), m1 и m3, каждый независимо, означает целое число от 0 до 2, m2 означает целое число 1 или 2, причем R20 и R21 могут отличаться друг от друга, когда m2 = 2, n означает целое число от 0 до 4, R16 могут отличаться друг от друга, когда n=2-4, и причем R10 и R11, R12 и R13, R17 и R18, и R20 и R21 могут, каждый, вместе образовывать C3-8 циклоалкильную или гетероциклическую группу, каждая из которых может иметь по меньшей мере один заместитель.
(7) Производное никотинамида или его соль согласно пункту (6), в котором R2 обозначает заместитель, представленный следующей формулой (1):
[Формула 518]
в которой R32 и R33, каждый независимо, обозначает атом водорода или C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, арил, C1-6 алкокси, арилокси, ацил, C1-6 алкилсульфонил, арилсульфонил или гетероциклическую группу, каждый из которых может иметь по меньшей мере один заместитель, выбранный из следующей группы заместителей γ1-2, причем
группа заместителей γ1-2 состоит из атома галогена и C1-6 алкила, C3-8 циклоалкила, арила и гетероциклической группы, каждый из которых может иметь по меньшей мере один заместитель.
(8) Производное никотинамида или его соль согласно пункту (7), в котором R32 обозначает алкильную группу; алкильную группу, замещенную циклоалкильной группой; циклоалкильную группу; или циклоалкильную группу, замещенную алкильной группой, каждая из которых всего содержит от 3 до 5 атомов углерода, или алкоксиалкильную группу, содержащую всего от 2 до 4 атомов углерода.
(9) Производное никотинамида или его соль согласно пункту (7), в котором R32 обозначает метильную или этильную группу, замещенную гетероциклической группой.
(10) Производное никотинамида или его соль согласно любому из пунктов (7)-(9), в котором R33 обозначает атом водорода или C1-6 алкильную или C3-8 циклоалкильную группу.
(11) Производное никотинамида или его соль согласно пункту (6), в котором R2 обозначает заместитель, представленный следующим (III-4):
[Формула 519]
(12) Производное никотинамида или его соль согласно любому из пунктов (1)-(11), в котором R4 и R5 каждый обозначает атом водорода.
(13) Производное никотинамида или его соль согласно любому из пунктов (1)-(6), который представлен следующей формулой (I-1):
[Формула 520]
в которой R26 обозначает заместитель, представленный любой из вышеуказанных формул (II)-(V) и (VII), и R3 имеет те же самые определения, как описанные в пункте 1.
(14) Производное никотинамида или его соль согласно любому из пунктов (1)-(13), в котором арильная группа или гетероциклическая группа арильной группы или гетероциклической группы, каждая из которых может иметь по меньшей мере один заместитель, представленный R3, представляет собой фенил, пиридил, пиридазинил, хиноксалинил или индазолил.
(15) Производное никотинамида или его соль согласно пункту (14), в котором арильная группа или гетероциклическая группа арильной группы или гетероциклической группы, каждая из которых может иметь по меньшей мере один заместитель, представленный R3, представляет собой пиридил, хиноксалинил или индазолил.
(16) Производное никотинамида или его соль согласно любому из пунктов (1)-(15), в котором заместитель, который могут иметь арильная или гетероциклическая группа, представленная R3, выбран из следующей группы заместителей α2-1, причем
группа заместителей α2-1 состоит из атома галогена; цианогруппы; нитрогруппы; оксогруппы; в случае необходимости защищенной карбоксильной группы; в случае необходимости защищенной гидроксильной группы; в случае необходимости защищенной аминогруппы; C1-6 алкильной группы, в случае необходимости имеющей по меньшей мере один заместитель; C2-6 алкенильной группы, в случае необходимости имеющей по меньшей мере один заместитель; C2-6 алкинильной группы, в случае необходимости имеющей по меньшей мере один заместитель; C3-8 циклоалкильной группы, в случае необходимости имеющей по меньшей мере один заместитель; арильной группы, в случае необходимости имеющей по меньшей мере один заместитель; C1-6 алкоксигруппы, в случае необходимости имеющей по меньшей мере один заместитель; арилоксигруппы, в случае необходимости имеющей по меньшей мере один заместитель; ацильной группы, в случае необходимости имеющей по меньшей мере один заместитель; C1-6 алкилсульфонильной группы, в случае необходимости имеющей по меньшей мере один заместитель; арилсульфонильной группы, в случае необходимости имеющей по меньшей мере один заместитель; гетероциклической группы, в случае необходимости имеющей по меньшей мере один заместитель; и группы, представленной формулой -Q3-Q4-NR24R25 (в которой R24 и R25, каждый независимо, обозначает атом водорода, аминозащитную группу, C1-6 алкильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C2-6 алкенильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C2-6 алкинильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C3-8 циклоалкильную группу, в случае необходимости имеющую по меньшей мере один заместитель, C1-6 алкоксигруппу, в случае необходимости имеющую по меньшей мере один заместитель, ар-C1-6 алкильную группу, в случае необходимости имеющую по меньшей мере один заместитель, арильную группу, в случае необходимости имеющую по меньшей мере один заместитель, гетероциклическую группу, в случае необходимости имеющую по меньшей мере один заместитель, или R24 и R25 могут образовывать циклическую аминогруппу, в случае необходимости имеющую по меньшей мере один заместитель, вместе с атомом азота, к которому они присоединены; Q3 обозначает -NH-, C1-6 алкиленовую группу, в случае необходимости имеющую по меньшей мере один заместитель, C2-6 алкениленовую группу, в случае необходимости имеющую по меньшей мере один заместитель, C2-6 алкиниленовую группу, в случае необходимости имеющую по меньшей мере один заместитель, или связь; и Q4 обозначает -C(=O)-, C1-6 алкиленовую группу или связь).
(17) Производное никотинамида или его соль согласно пункту (16), в котором заместитель, который могут иметь арильная или гетероциклическая группа, представленная R3, выбран из следующей группы заместителей α2-2, причем
группа заместителей α2-2 состоит из атома галогена; цианогруппы; нитрогруппы; оксогруппы; в случае необходимости защищенной карбоксильной группы; в случае необходимости защищенной гидроксильной группы; в случае необходимости защищенной аминогруппы; C1-6 алкильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-1; C2-6 алкенильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-1; C2-6 алкинильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-1; C3-8 циклоалкильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-1; арильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-1; C1-6 алкоксигруппы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-1; арилоксигруппы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-1; ацильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-1; C1-6 алкилсульфонильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-1; арилсульфонильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-1; гетероциклической группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-1; и группы, представленной формулой -Q3-Q4-NR24R25 (в которой Q3, Q4, R24 и R25 каждый имеет те же самые определения, как описанные в пункте 9); причем
группа заместителей β2-1 состоит из атома галогена, цианогруппы, нитрогруппы, оксогруппы, в случае необходимости защищенной карбоксильной группы, в случае необходимости защищенной гидроксильной группы, в случае необходимости защищенной аминогруппы, C1-6 алкильной группы, в случае необходимости имеющей по меньшей мере один атом галогена, C3-8 циклоалкильной группы, в случае необходимости имеющей по меньшей мере один атом галогена, C1-6 алкоксигруппы, в случае необходимости имеющей по меньшей мере один атом галогена, ар-C1-6 алкильной группы, в случае необходимости имеющей по меньшей мере один атом галогена, арильной группы, в случае необходимости имеющей по меньшей мере один атом галогена, и гетероциклической группы, в случае необходимости имеющей по меньшей мере один атом галогена.
(18) Производное никотинамида или его соль согласно пункту (17), в котором заместитель, который могут иметь арильная или гетероциклическая группа, представленная R3, выбран из следующей группы заместителей α2-3, причем
группа заместителей α2-3 состоит из атома галогена; цианогруппы; нитрогруппы; оксогруппы; в случае необходимости защищенной карбоксильной группы; в случае необходимости защищенной аминогруппы; C1-6 алкильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-2; C3-8 циклоалкильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-2; арильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-2; C1-6 алкоксигруппы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-2; арилоксигруппы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-2; ацильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-2; C1-6 алкилсульфонильной группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-2; гетероциклической группы, в случае необходимости имеющей по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-2; и группы, представленной формулой -Q3-Q4-NR24R25 (в которой Q3, Q4, R24 и R25 каждый имеет те же самые определения, как описанные в пункте 9); причем
группа заместителей β2-2 состоит из атома галогена, в случае необходимости защищенной гидроксильной группы, C1-6 алкильной группы, в случае необходимости имеющей по меньшей мере один атом галогена, C3-8 циклоалкильной группы, в случае необходимости имеющей по меньшей мере один атом галогена, C1-6 алкоксигруппы, в случае необходимости имеющей по меньшей мере один атом галогена, арильной группы, в случае необходимости имеющей по меньшей мере один атом галогена, и гетероциклической группы, в случае необходимости имеющей по меньшей мере один атом галогена.
(19) Производное никотинамида или его соль согласно любому из пунктов (1)-(18), в котором R3 обозначает пиридильную группу, в случае необходимости имеющую заместитель, выбранный из следующей группы заместителей α2-4, причем
группа заместителей α2-4 состоит из атома галогена; цианогруппы; нитрогруппы; оксогруппы; в случае необходимости защищенной карбоксильной группы; в случае необходимости защищенной гидроксильной группы; в случае необходимости защищенной аминогруппы; C1-6 алкильной, C2-6 алкенильной, C2-6 алкинильной, C3-8 циклоалкильной, арильной, C1-6 алкокси, арилокси, ацильной, C1-6 алкилсульфонильной, арилсульфонильной или гетероциклической группы, каждая из которых может иметь по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-3; и формулы -Q3-Q4-NR24R25 (в которой Q3, Q4, R24 и R25 имеют те же самые определения, как описанные выше); причем
группа заместителей β2-3 состоит из атома галогена; цианогруппы; нитрогруппы; оксогруппы; в случае необходимости защищенной карбоксильной группы; в случае необходимости защищенной гидроксильной группы; в случае необходимости защищенной аминогруппы; и C1-6 алкила, C3-8 циклоалкила, -Q5m4-R36 (в котором Q5 обозначает C1-6 алкиленоксигруппу (причем сторона R36 представляет собой алкиленовую группу), R36 обозначает атом водорода или C1-6 алкильную, C3-8 циклоалкильную, арильную или гетероциклическую группу, m4 обозначает целое число от 1 до 3, и Q5 могут отличаться друг от друга, когда m4 = 2 или 3), арильную или гетероциклическую группу, каждая из которых может иметь по меньшей мере один атом галогена.
(20) Производное никотинамида или его соль согласно пункту (19), в котором R3 обозначает пиридильную группу, представленную следующей формулой (VIII-1) или (VIII-2):
[Формула 521]
в которых R37, R38, R39, R40, R41, R42, R43 и R44, каждый независимо, обозначает атом водорода или заместитель, выбранный из следующей группы заместителей α2-6; причем
группа заместителей α2-6 состоит из атома галогена; и C1-6 алкильной, C3-8 циклоалкильной, арильной, C1-6 алкокси или гетероциклической группы, каждая из которых может иметь по меньшей мере один заместитель, выбранный из следующей группы заместителей β2-5; причем
группа заместителей β2-5 состоит из атома галогена; и C1-6 алкильной, C3-8 циклоалкильной, -Q5m4-R36 (в котором Q5, R36 и m4 имеют те же самые определения, как описанные выше), арильной или гетероциклической группы, каждая из которых может иметь по меньшей мере один атом галогена.
(21) Производное никотинамида или его соль согласно пункту (20), в котором R3 обозначает пиридильную группу, представленную следующей формулой (VIII-3) или (VIII-4):
[Формула 522]
в которых R45, R46, R47 и R48, каждый независимо, обозначает атом водорода или заместитель, выбранный из вышеописанной группы заместителей α2-6.
(22) Производное никотинамида или его соль согласно пункту (21), в котором R45 обозначает 5-членную кольцевую гетероциклическую группу, в случае необходимости имеющую по меньшей мере один заместитель, выбранный из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36 и m4 имеют те же самые определения, как описано выше), и R48 обозначает атом галогена, C1-6 алкильную группу или C1-6 алкоксигруппу.
(23) Производное никотинамида или его соль согласно пункту (21), в котором R45 обозначает атом галогена; или C1-6 алкильную или C1-6 алкоксигруппу, в случае необходимости имеющую по меньшей мере один атом галогена, и R46 обозначает 5-членную кольцевую или 6-членную кольцевую гетероциклическую группу, каждая из которых может иметь по меньшей мере один заместитель, выбранный из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36 и m4 имеют те же самые определения, как описанные выше).
(24) Производное никотинамида или его соль согласно пункту (21), в котором R47 и R48, каждый независимо, обозначает атом водорода; атом галогена; или C1-6 алкильную, арильную, C1-6 алкокси или гетероциклическую группу, каждая из которых может иметь по меньшей мере один заместитель, независимо выбранный из числа атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5m4-R36 (в котором Q5, R36 и m4 имеют те же самые определения, как описанные выше).
(25) Производное никотинамида или его соль согласно пункту (19), в котором R3 обозначает индазолильную группу, представленную любой из следующих формул (IX-1)-(IX-6):
[Формула 523]
в которых R49, R50, R51, R52, R53, R54, R55, R56, R57, R58, R59, R60, R61, R62, R63, R64, R65, R66, R67, R68, R69, R70, R71, R72, R73, R74, R75, R76, R77 и R78, каждый независимо, обозначает атом водорода или заместитель, выбранный из вышеописанной группы заместителей α2-6.
(26) Производное никотинамида или его соль согласно пункту (25), в котором R3 обозначает индазолильную группу, представленную следующей формулой (IX-7) или (IX-8):
[Формула 524]
в которых R79, R80, R81 и R82, каждый независимо, обозначает атом водорода или заместитель, выбранный из вышеописанной группы заместителей α2-6.
(27) Производное никотинамида или его соль согласно пункту (1), в котором формула (I) представлена следующей формулой (I-2):
[Формула 525]
в которой R83, R84, R85 и R86, каждый независимо, обозначает атом водорода или C1-6 алкильную, C2-6 алкенильную, C2-6 алкинильную, C3-8 циклоалкильную, арильную, C1-6 алкокси, арилокси, ацильную, C1-6 алкилсульфонильную, арилсульфонильную или гетероциклическую группу, каждая из которых может иметь по меньшей мере один заместитель, R87 имеет те же самые определения, как для R3, описанного в пункте 1, причем R83 и R84, и R85 и R86 могут, каждый, вместе образовывать C3-8 циклоалкильную или гетероциклическую группу, каждая из которых может иметь по меньшей мере один заместитель.
(28) Производное никотинамида или его соль согласно пункту (1), в котором формула (I) представлена следующей формулой (I-6):
[Формула 526]
в которой R94 имеет те же самые определения, как для R3, описанного в пункте 1.
(29) Фармацевтическая композиция, включающая производное никотинамида или его соль согласно любому из пунктов (1)-(28).
(30) Фармацевтическая композиция согласно пункту (29), которая предназначена для применения в лечении Syk-связанного заболевания.
(31) Фармацевтическая композиция согласно пункту (29), которая предназначена для применения в лечении заболевания, выбранного из группы, состоящей из ревматизма и идиопатической тромбоцитопенической пурпуры.
Claims (13)
1. Производное никотинамида, представленное следующей формулой (I), или его соль:
[Формула 1]
в которой
R1 обозначает атом галогена;
R2 обозначает заместитель, представленный следующей формулой (II-1):
в которой R32 обозначает атом водорода или C1-6 алкил, С3-8 циклоалкил, фенил, пиридил или тиофенил, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы, состоящей из атома галогена, C1-6 алкила, С3-8 циклоалкила, фенила, или алкоксиалкил, содержащий всего от 2 до 4 атомов углерода;
R33 обозначает атом водорода, C1-6 алкил или С3-8 циклоалкил;
или заместитель, представленный следующими формулами:
R3 обозначает пиридильную группу, представленную следующими формулами (VIII-1) или (VIII-2):
в которых R37 и R38, каждый независимо, обозначает атом водорода или атом галогена;
R39 обозначает атом водорода, атом галогена или C1-6 алкил, фенил, C1-6 алкокси, пирролил, пирролидинил, пиразолил, оксазолил, оксадиазолил, имидазолил, триазолил или фуранил, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы, состоящей из атома галогена, C1-6 алкила, С3-8 циклоалкила и -Q5-R36 (в котором Q5 обозначает C1-3 алкиленокси, и R36 обозначает атом водорода, C1-3 алкил или циклопропил);
R40 обозначает атом водорода, атом галогена или C1-6 алкил, фенил, C1-6 алкокси, пирролил, пирролидинил, пиразолил, оксазолил, оксадиазолил, имидазолил, триазолил, фуранил или морфолинил, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы, состоящей из атома галогена, C1-6 алкила, С3-8 циклоалкила и -Q5-R36 (в котором Q5 обозначает C1-3 алкиленокси, и R36 обозначает атом водорода, C1-3 алкил или циклопропил);
R41 и R42, каждый независимо, обозначает атом водорода или атом галогена;
R43 и R44, каждый независимо, обозначает атом водорода, атом галогена или C1-6 алкил, фенил, C1-6 алкокси, пирролил, пирролидинил, пиразолил, оксазолил, оксадиазолил, имидазолил, триазолил или фуранил, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы, состоящей из атома галогена, C1-6 алкила, С3-8 циклоалкила и -Q5-R36 (в котором Q5 обозначает C1-3 алкиленокси, и R36 обозначает атом водорода, C1-3 алкил или циклопропил);
индазолильную группу, представленную одной из следующих формул (IX-1) - (IX-6):
в которых R49, R50, R54, R55, R59, R60, R64, R65, R69, R70, R74 и R75, каждый независимо, обозначает атом водорода или атом галогена;
R53, R58, R61, R68, R73 и R76, каждый независимо, обозначает атом водорода, атом галогена, C1-6 алкил или C1-6 алкокси;
R51, R57, R63, R66, R72 и R78, каждый независимо, обозначает атом водорода, атом галогена или C1-6 алкил, С3-8 циклоалкил или C1-6 алкокси, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы, состоящей из атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5-R36 (в котором Q5 обозначает C1-3 алкиленокси, и R36 обозначает атом водорода, C1-3 алкил или циклопропил), каждый из которых может иметь по меньшей мере один атом галогена;
R52, R56, R62, R67, R71 и R77, каждый независимо, обозначает атом водорода, атом галогена или C1-6 алкил, С3-8 циклоалкил, C1-6 алкокси или фенил, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы, состоящей из атома галогена, C1-6 алкила, С3-8 циклоалкила и -Q5-R36 (в котором Q5 обозначает С1-3 алкиленокси, и R36 обозначает атом водорода, C1-3 алкил или циклопропил), каждый из которых может иметь по меньшей мере один атом галогена;
или фенильную группу, которая может иметь по меньшей мере один заместитель, выбранный из группы, состоящей из атома галогена или С1-6 алкила, фенила, С1-6 алкокси, пирролила, пирролидинила, пиразолила, оксазолила, оксадиазолила, имидазолила, триазолила, фуранила или морфолинила, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы, состоящей из атома галогена, C1-6 алкила, С3-8 циклоалкила и -Q5-R36 (в котором Q5 обозначает C1-3 алкиленокси, и R36 обозначает атом водорода, C1-3 алкил или циклопропил);
R4 и R5 обозначают атом водорода.
[Формула 1]
в которой
R1 обозначает атом галогена;
R2 обозначает заместитель, представленный следующей формулой (II-1):
в которой R32 обозначает атом водорода или C1-6 алкил, С3-8 циклоалкил, фенил, пиридил или тиофенил, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы, состоящей из атома галогена, C1-6 алкила, С3-8 циклоалкила, фенила, или алкоксиалкил, содержащий всего от 2 до 4 атомов углерода;
R33 обозначает атом водорода, C1-6 алкил или С3-8 циклоалкил;
или заместитель, представленный следующими формулами:
R3 обозначает пиридильную группу, представленную следующими формулами (VIII-1) или (VIII-2):
в которых R37 и R38, каждый независимо, обозначает атом водорода или атом галогена;
R39 обозначает атом водорода, атом галогена или C1-6 алкил, фенил, C1-6 алкокси, пирролил, пирролидинил, пиразолил, оксазолил, оксадиазолил, имидазолил, триазолил или фуранил, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы, состоящей из атома галогена, C1-6 алкила, С3-8 циклоалкила и -Q5-R36 (в котором Q5 обозначает C1-3 алкиленокси, и R36 обозначает атом водорода, C1-3 алкил или циклопропил);
R40 обозначает атом водорода, атом галогена или C1-6 алкил, фенил, C1-6 алкокси, пирролил, пирролидинил, пиразолил, оксазолил, оксадиазолил, имидазолил, триазолил, фуранил или морфолинил, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы, состоящей из атома галогена, C1-6 алкила, С3-8 циклоалкила и -Q5-R36 (в котором Q5 обозначает C1-3 алкиленокси, и R36 обозначает атом водорода, C1-3 алкил или циклопропил);
R41 и R42, каждый независимо, обозначает атом водорода или атом галогена;
R43 и R44, каждый независимо, обозначает атом водорода, атом галогена или C1-6 алкил, фенил, C1-6 алкокси, пирролил, пирролидинил, пиразолил, оксазолил, оксадиазолил, имидазолил, триазолил или фуранил, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы, состоящей из атома галогена, C1-6 алкила, С3-8 циклоалкила и -Q5-R36 (в котором Q5 обозначает C1-3 алкиленокси, и R36 обозначает атом водорода, C1-3 алкил или циклопропил);
индазолильную группу, представленную одной из следующих формул (IX-1) - (IX-6):
в которых R49, R50, R54, R55, R59, R60, R64, R65, R69, R70, R74 и R75, каждый независимо, обозначает атом водорода или атом галогена;
R53, R58, R61, R68, R73 и R76, каждый независимо, обозначает атом водорода, атом галогена, C1-6 алкил или C1-6 алкокси;
R51, R57, R63, R66, R72 и R78, каждый независимо, обозначает атом водорода, атом галогена или C1-6 алкил, С3-8 циклоалкил или C1-6 алкокси, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы, состоящей из атома галогена, C1-6 алкила, C3-8 циклоалкила и -Q5-R36 (в котором Q5 обозначает C1-3 алкиленокси, и R36 обозначает атом водорода, C1-3 алкил или циклопропил), каждый из которых может иметь по меньшей мере один атом галогена;
R52, R56, R62, R67, R71 и R77, каждый независимо, обозначает атом водорода, атом галогена или C1-6 алкил, С3-8 циклоалкил, C1-6 алкокси или фенил, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы, состоящей из атома галогена, C1-6 алкила, С3-8 циклоалкила и -Q5-R36 (в котором Q5 обозначает С1-3 алкиленокси, и R36 обозначает атом водорода, C1-3 алкил или циклопропил), каждый из которых может иметь по меньшей мере один атом галогена;
или фенильную группу, которая может иметь по меньшей мере один заместитель, выбранный из группы, состоящей из атома галогена или С1-6 алкила, фенила, С1-6 алкокси, пирролила, пирролидинила, пиразолила, оксазолила, оксадиазолила, имидазолила, триазолила, фуранила или морфолинила, каждый из которых может иметь по меньшей мере один заместитель, выбранный из группы, состоящей из атома галогена, C1-6 алкила, С3-8 циклоалкила и -Q5-R36 (в котором Q5 обозначает C1-3 алкиленокси, и R36 обозначает атом водорода, C1-3 алкил или циклопропил);
R4 и R5 обозначают атом водорода.
2. Производное никотинамида или его соль по п. 1, в котором R32 обозначает алкильную группу; алкильную группу, замещенную циклоалкильной группой; циклоалкильную группу; или циклоалкильную группу, замещенную алкильной группой, каждая из которых всего содержит от 3 до 5 атомов углерода, или алкоксиалкильную группу, содержащую всего от 2 до 4 атомов углерода.
3. Производное никотинамида или его соль по п. 1, в котором R32 обозначает метильную или этильную группу, замещенную гетероциклической группой.
5. Производное никотинамида или его соль по п. 1, в котором R3 обозначает пиридильную группу, представленную следующей формулой формулой (VIII-3) или (VIII-4):
[Формула 7]
в которых
R45 имеет те же самые определения, что R39, описанный в п. 1,
R46 имеет те же самые определения, что R40, описанный в п. 1,
R47 и R48, каждый независимо, имеют те же самые определения, что R43 и R44, описанные в п. 1.
[Формула 7]
в которых
R45 имеет те же самые определения, что R39, описанный в п. 1,
R46 имеет те же самые определения, что R40, описанный в п. 1,
R47 и R48, каждый независимо, имеют те же самые определения, что R43 и R44, описанные в п. 1.
6. Производное никотинамида или его соль по п. 1, в котором R3 обозначает индазолильную группу, представленную следующей формулой (IX-7) или (IX-8):
[Формула 9]
в которых
R79 и R82, каждый независимо, имеют те же самые определения, что R51 и R57, описанные в п. 1;
R80 и R81, каждый независимо, имеют те же самые определения, что R52 и R56, описанные в п. 1.
[Формула 9]
в которых
R79 и R82, каждый независимо, имеют те же самые определения, что R51 и R57, описанные в п. 1;
R80 и R81, каждый независимо, имеют те же самые определения, что R52 и R56, описанные в п. 1.
7. Производное никотинамида или его соль по п. 1, которое представлено следующей формулой (I-3):
в которой
R88 имеет те же самые определения, что R32, описанный в п. 1,
R89 имеет те же самые определения, что R33, описанный в п. 1,
R90 имеет те же самые определения, что R3, описанный в п. 1.
в которой
R88 имеет те же самые определения, что R32, описанный в п. 1,
R89 имеет те же самые определения, что R33, описанный в п. 1,
R90 имеет те же самые определения, что R3, описанный в п. 1.
9. Фармацевтическая композиция, имеющая свойство ингибитора Syk киназы, включающая производное никотинамида или его соль по любому из пп. 1-8 и один или более компонентов, выбранных из фармацевтически приемлемого эксципиента, носителя или разбавителя.
10. Фармацевтическая композиция по п. 29, которая предназначена для применения в лечении Syk-связанного заболевания.
11. Соединение, выбранное из группы, состоящей из следующих соединений:
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-фенилпиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(3-метилфениламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(4-(морфолин-4-ил)фениламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(3,4,5-триметоксифениламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-метоксипиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(2,6-диметоксипиридин-4-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-(морфолин-4-ил)пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(6-(морфолин-4-ил)пиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(пиримидин-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1,5-нафтиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1,6-нафтиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1,6-нафтиридин-8-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(8-нитрохинолин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1Н-пирроло[2,3-с]пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-(2-(пирролидин-1-ил)этил)-1Н-пирроло[2,3-с]пиридин-4-иламино)никотинамид;
2-(8-ацетиламинохинолин-3-иламино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-(анилинокарбонил)пиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1Н-пирроло[2,3-b]пиридин-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1Н-пирроло[2,3-b]пиридин-4-иламино)никотинамид;
метил-5-(3-аминокарбонил-6-(цис-2-аминоциклогексиламино)-5-фторпиридин-2-иламино)никотинат;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(6-метилпиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-метилпиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-(2-(пирролидин-1-ил)этил)-1Н-пирроло[2,3-b]пиридин-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-(2-(пирролидин-1-ил)этил)-1Н-пирроло[2,3-b]пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-(2-(морфолин-4-ил)этил)-1Н-пирроло[2,3-b]пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-([1,3]тиазоло[4,5-b]пиридин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(1-(2-(диэтиламино)этил)-1Н-пирроло[2,3-b]пиридин-4-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-(2-метоксиэтил)-1Н-пирроло[2,3-b]пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-изобутил-1Н-пирроло[2,3-b]пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(1-циклопропил-1Н-пирроло[2,3-b]пиридин-4-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-(1-(циклопропилметил)-1Н-пирроло[2,3-b]пиридин-4-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-(2Н-1,2,3-триазол-2-ил)пиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-(1Н-пиррол-2-ил)пиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-(2-тиенил)пиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(5-циклопропилпиридин-3-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-(2-фурил)пиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(8-аминохинолин-3-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1Н-пирроло[2,3-b]пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1Н-пирроло[2,3-b]пиридин-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1Н-пирроло [2,3-c]пиридин-4-иламино)никотинамид;
2-(8-(аминокарбонил)аминохинолин-3-иламино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
6-(2-аминоэтиламино)-5-фтор-2-(пиридин-4-иламино)никотинамид;
6-(2-аминоэтиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(2,1,3-бензотиадиазол-5-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-(1,3-бензотиазол-6-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1Н-индазол-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-метил-1,3-бензоксазол-6-иламино)никотинамид;
6-(2-аминоэтиламино)-2-(1,3-бензотиазол-6-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-метил-1,3-бензоксазол-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-метилпиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(1,3-диметил-1Н-пиразоло[3,4-b]пиридин-5-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-(2,3-дигидро-1,4-бензодиоксин-6-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(3-(2Н-1,2,3-триазол-2-ил)фениламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(6-метоксихинолин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хинолин-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хиноксалин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(1,3-бензотиазол-5-иламино)-5-фторникотинамид;
6-(2-аминоэтиламино)-5-фтор-2-(изохинолин-4-иламино)никотинамид;
6-(2-аминоэтиламино)-5-фтор-2-(хинолин-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1Н-индазол-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1Н-бензоимидазол-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хиназолин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хиназолин-7-иламино)никотинамид;
цис-6-(2-аминоциклогексиламино)-5-фтор-2-(1-метил-1Н-бензоимидазол-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-метилхинолин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хинолин-7-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1Н-индазол-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-метилхиноксалин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-(2-(пирролидин-1-ил)этил)-1Н-индазол-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-(2-(пирролидин-1-ил)этил)-2Н-индазол-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1Н-индазол-5-иламино)никотинамид;
6-(2-аминоэтиламино)-2-(3,5-диметоксифениламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хинолин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(3-хлорфениламино)-5-фторникотинамид;
6-(2-аминоэтиламино)-5-фтор-2-(хинолин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(изохинолин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1,8-нафтиридин-3-иламино)никотинамид;
5-фтор-6-(2-(1Н-имидазол-5-ил)этиламино)-2-(хинолин-3-иламино)никотинамид;
6-((1R)-2-амино-2-оксо-1-фенилэтиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2R)-1-амино-4-метил-1-оксопентан-2-иламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2R)-1-амино-1-оксобутан-2-иламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2S)-2-аминобутиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2S)-2-амино-3-метилбутиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2S)-2-амино-2-фенилэтиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2R)-2-амино-3-метоксипропиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2S)-2-аминопропиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2S)-2-амино-4-метилпентиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-(3-аминопропиламино)-2-(3,5-диметоксифениламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-(3,5-диметоксифениламино)-5-фторникотинамид;
6-((1R,2S)-2-аминоциклогексиламино)-2-(3,5-диметоксифениламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-хлор-2-(хинолин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-бром-2-(хинолин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-хлор-2-(3-метоксифениламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-хлор-2-(5-метилпиридин-3-иламино)никотинамид; и
6-(цис-2-аминоциклогексиламино)-5-бром-2-(5-метилпиридин-3-иламино)никотинамид.
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-фенилпиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(3-метилфениламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(4-(морфолин-4-ил)фениламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(3,4,5-триметоксифениламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-метоксипиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(2,6-диметоксипиридин-4-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-(морфолин-4-ил)пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(6-(морфолин-4-ил)пиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(пиримидин-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1,5-нафтиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1,6-нафтиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1,6-нафтиридин-8-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(8-нитрохинолин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1Н-пирроло[2,3-с]пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-(2-(пирролидин-1-ил)этил)-1Н-пирроло[2,3-с]пиридин-4-иламино)никотинамид;
2-(8-ацетиламинохинолин-3-иламино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-(анилинокарбонил)пиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1Н-пирроло[2,3-b]пиридин-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1Н-пирроло[2,3-b]пиридин-4-иламино)никотинамид;
метил-5-(3-аминокарбонил-6-(цис-2-аминоциклогексиламино)-5-фторпиридин-2-иламино)никотинат;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(6-метилпиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-метилпиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-(2-(пирролидин-1-ил)этил)-1Н-пирроло[2,3-b]пиридин-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-(2-(пирролидин-1-ил)этил)-1Н-пирроло[2,3-b]пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-(2-(морфолин-4-ил)этил)-1Н-пирроло[2,3-b]пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-([1,3]тиазоло[4,5-b]пиридин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(1-(2-(диэтиламино)этил)-1Н-пирроло[2,3-b]пиридин-4-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-(2-метоксиэтил)-1Н-пирроло[2,3-b]пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-изобутил-1Н-пирроло[2,3-b]пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(1-циклопропил-1Н-пирроло[2,3-b]пиридин-4-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-(1-(циклопропилметил)-1Н-пирроло[2,3-b]пиридин-4-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-(2Н-1,2,3-триазол-2-ил)пиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-(1Н-пиррол-2-ил)пиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-(2-тиенил)пиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(5-циклопропилпиридин-3-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-(2-фурил)пиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(8-аминохинолин-3-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1Н-пирроло[2,3-b]пиридин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1Н-пирроло[2,3-b]пиридин-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1Н-пирроло [2,3-c]пиридин-4-иламино)никотинамид;
2-(8-(аминокарбонил)аминохинолин-3-иламино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
6-(2-аминоэтиламино)-5-фтор-2-(пиридин-4-иламино)никотинамид;
6-(2-аминоэтиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(2,1,3-бензотиадиазол-5-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-(1,3-бензотиазол-6-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1Н-индазол-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-метил-1,3-бензоксазол-6-иламино)никотинамид;
6-(2-аминоэтиламино)-2-(1,3-бензотиазол-6-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-метил-1,3-бензоксазол-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-метилпиридин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(1,3-диметил-1Н-пиразоло[3,4-b]пиридин-5-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-(2,3-дигидро-1,4-бензодиоксин-6-иламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(3-(2Н-1,2,3-триазол-2-ил)фениламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(6-метоксихинолин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хинолин-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хиноксалин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(1,3-бензотиазол-5-иламино)-5-фторникотинамид;
6-(2-аминоэтиламино)-5-фтор-2-(изохинолин-4-иламино)никотинамид;
6-(2-аминоэтиламино)-5-фтор-2-(хинолин-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1Н-индазол-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1Н-бензоимидазол-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хиназолин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хиназолин-7-иламино)никотинамид;
цис-6-(2-аминоциклогексиламино)-5-фтор-2-(1-метил-1Н-бензоимидазол-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-метилхинолин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хинолин-7-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-метил-1Н-индазол-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-метилхиноксалин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1-(2-(пирролидин-1-ил)этил)-1Н-индазол-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(2-(2-(пирролидин-1-ил)этил)-2Н-индазол-5-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1Н-индазол-5-иламино)никотинамид;
6-(2-аминоэтиламино)-2-(3,5-диметоксифениламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хинолин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-(3-хлорфениламино)-5-фторникотинамид;
6-(2-аминоэтиламино)-5-фтор-2-(хинолин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(изохинолин-4-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(1,8-нафтиридин-3-иламино)никотинамид;
5-фтор-6-(2-(1Н-имидазол-5-ил)этиламино)-2-(хинолин-3-иламино)никотинамид;
6-((1R)-2-амино-2-оксо-1-фенилэтиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2R)-1-амино-4-метил-1-оксопентан-2-иламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2R)-1-амино-1-оксобутан-2-иламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2S)-2-аминобутиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2S)-2-амино-3-метилбутиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2S)-2-амино-2-фенилэтиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2R)-2-амино-3-метоксипропиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2S)-2-аминопропиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-((2S)-2-амино-4-метилпентиламино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-(3-аминопропиламино)-2-(3,5-диметоксифениламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-(3,5-диметоксифениламино)-5-фторникотинамид;
6-((1R,2S)-2-аминоциклогексиламино)-2-(3,5-диметоксифениламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-хлор-2-(хинолин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-бром-2-(хинолин-3-иламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-хлор-2-(3-метоксифениламино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-хлор-2-(5-метилпиридин-3-иламино)никотинамид; и
6-(цис-2-аминоциклогексиламино)-5-бром-2-(5-метилпиридин-3-иламино)никотинамид.
12. Соединение, выбранное из группы, состоящей из следующих соединений:
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(6-метилпиридин-3-иламино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-2-((5-циано-6-морфолинопиридин-3-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-метилпиридин-3-иламино)никотинамид;
(R)-6-((1-амино-4-метилпентан-2-ил)амино)-5-фтор-2-((хинолин-6-ил)амино)никотинамид;
(R)-6-((1-амино-4-метилпентан-2-ил)амино)-5-фтор-2-((2-(2-метоксиэтокси)пиридин-4-ил)амино)никотинамид;
6-((1R,2S)-2-аминоциклогексиламино)-5-фтор-2-((6-морфолинопиридин-3-ил)амино)никотинамид;
2-((5-(1Н-пиразол-1-ил)пиридин-3-ил)амино)-6-((1R,2S)-2-аминоциклогексиламино)-5-фторникотинамид;
(R)-6-((1-амино-4-метилпентан-2-ил)амино)-2-((5,6-диметилпиридин-3-ил)амино)-5-фторникотинамид;
6-(((2S,3R)-2-аминопентан-3-ил)амино)-2-((1-этил-1Н-индазол-5-ил)амино)-5-фторникотинамид;
6-(((2S,3R)-2-аминогексан-3-ил)амино)-5-фтор-2-((2-метоксипиридин-4-ил)амино)никотинамид;
6-(((2S,3R)-2-аминопентан-3-ил)амино)-5-фтор-2-((5-(2-фторфенил)пиридин-3-ил)амино)никотинамид;
6-(((2S,3R)-2-аминопентан-3-ил)амино)-5-фтор-2-((1-метоксиизохинолин-6-ил)амино)никотинамид;
6-(((2S,3R)-2-аминопентан-3-ил)амино)-5-фтор-2-((1-метил-1Н-индазол-4-ил)амино)никотинамид;
6-(((2S,3R)-2-аминогексан-3-ил)амино)-2-((5,6-диметилпиридин-3-ил)амино)-5-фторникотинамид;
6-(((2S,3R)-2-аминогексан-3-ил)амино)-5-фтор-2-((5-фторпиридин-3-ил)амино)никотинамид;
6-(((2S,3R)-2-аминогексан-3-ил)амино)-5-фтор-2-((2-пропоксипиридин-4-ил)амино)никотинамид;
(R)-6-((1-амино-4-метилпентан-2-ил)амино)-2-((1-этил-1Н-индазол-5-ил)амино)-5-фторникотинамид;
6-(((2R,3S)-3-амино-1-циклопропилбутан-2-ил)амино)-2-((1-этил-1Н-индазол-5-ил)амино)-5-фторникотинамид;
6-(((1R,2S)-2-амино-1-циклопропилпропил)амино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-(((1R,2S)-2-аминоциклогексил)амино)-5-фтор-2-((6-метил-5-(2Н-1,2,3-триазол-2-ил)пиридин-3-ил)амино)никотинамид;
6-(((1R,2S)-2-аминоциклогексил)амино)-5-фтор-2-((6-метокси-5-(2Н-1,2,3-триазол-2-ил)пиридин-3-ил)амино)никотинамид;
6-(((2S,3R)-2-амино-5-метилгексан-3-ил)амино)-5-фтор-2-((1-метил-1Н-индазол-5-ил)амино)никотинамид;
6-(((2S,3R)-2-амино-5-метилгексан-3-ил)амино)-2-((1-этил-1Н-индазол-5-ил)амино)-5-фторникотинамид;
6-(((1R,2S)-2-аминоциклогексил)амино)-5-фтор-2-((5-фтор-6-морфолинопиридин-3-ил)амино)никотинамид;
6-(((1R,2S)-2-аминоциклогексил)амино)-2-((2-этокси-3-фторпиридин-4-ил)амино)-5-фторникотинамид;
6-(((2R,3S)-3-амино-1-циклопропилбутан-2-ил)амино)-2-((5,6-диметилпиридин-3-ил)амино)-5-фторникотинамид;
6-(((2S,3S)-3-амино-1-метоксибутан-2-ил)амино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-(2-аминоэтиламино)-2-(3,5-диметоксифениламино)-5-фторникотинамид;
6-((1R,2S)-2-аминоциклогексиламино)-5-фтор-2-((5-метилпиридин-3-ил)амино)никотинамид; и
6-((1R,2S)-2-аминоциклогексиламино)-5-фтор-2-((6-метилпиридин-3-ил)амино)никотинамид.
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(6-метилпиридин-3-иламино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-2-((5-циано-6-морфолинопиридин-3-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-(5-метилпиридин-3-иламино)никотинамид;
(R)-6-((1-амино-4-метилпентан-2-ил)амино)-5-фтор-2-((хинолин-6-ил)амино)никотинамид;
(R)-6-((1-амино-4-метилпентан-2-ил)амино)-5-фтор-2-((2-(2-метоксиэтокси)пиридин-4-ил)амино)никотинамид;
6-((1R,2S)-2-аминоциклогексиламино)-5-фтор-2-((6-морфолинопиридин-3-ил)амино)никотинамид;
2-((5-(1Н-пиразол-1-ил)пиридин-3-ил)амино)-6-((1R,2S)-2-аминоциклогексиламино)-5-фторникотинамид;
(R)-6-((1-амино-4-метилпентан-2-ил)амино)-2-((5,6-диметилпиридин-3-ил)амино)-5-фторникотинамид;
6-(((2S,3R)-2-аминопентан-3-ил)амино)-2-((1-этил-1Н-индазол-5-ил)амино)-5-фторникотинамид;
6-(((2S,3R)-2-аминогексан-3-ил)амино)-5-фтор-2-((2-метоксипиридин-4-ил)амино)никотинамид;
6-(((2S,3R)-2-аминопентан-3-ил)амино)-5-фтор-2-((5-(2-фторфенил)пиридин-3-ил)амино)никотинамид;
6-(((2S,3R)-2-аминопентан-3-ил)амино)-5-фтор-2-((1-метоксиизохинолин-6-ил)амино)никотинамид;
6-(((2S,3R)-2-аминопентан-3-ил)амино)-5-фтор-2-((1-метил-1Н-индазол-4-ил)амино)никотинамид;
6-(((2S,3R)-2-аминогексан-3-ил)амино)-2-((5,6-диметилпиридин-3-ил)амино)-5-фторникотинамид;
6-(((2S,3R)-2-аминогексан-3-ил)амино)-5-фтор-2-((5-фторпиридин-3-ил)амино)никотинамид;
6-(((2S,3R)-2-аминогексан-3-ил)амино)-5-фтор-2-((2-пропоксипиридин-4-ил)амино)никотинамид;
(R)-6-((1-амино-4-метилпентан-2-ил)амино)-2-((1-этил-1Н-индазол-5-ил)амино)-5-фторникотинамид;
6-(((2R,3S)-3-амино-1-циклопропилбутан-2-ил)амино)-2-((1-этил-1Н-индазол-5-ил)амино)-5-фторникотинамид;
6-(((1R,2S)-2-амино-1-циклопропилпропил)амино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-(((1R,2S)-2-аминоциклогексил)амино)-5-фтор-2-((6-метил-5-(2Н-1,2,3-триазол-2-ил)пиридин-3-ил)амино)никотинамид;
6-(((1R,2S)-2-аминоциклогексил)амино)-5-фтор-2-((6-метокси-5-(2Н-1,2,3-триазол-2-ил)пиридин-3-ил)амино)никотинамид;
6-(((2S,3R)-2-амино-5-метилгексан-3-ил)амино)-5-фтор-2-((1-метил-1Н-индазол-5-ил)амино)никотинамид;
6-(((2S,3R)-2-амино-5-метилгексан-3-ил)амино)-2-((1-этил-1Н-индазол-5-ил)амино)-5-фторникотинамид;
6-(((1R,2S)-2-аминоциклогексил)амино)-5-фтор-2-((5-фтор-6-морфолинопиридин-3-ил)амино)никотинамид;
6-(((1R,2S)-2-аминоциклогексил)амино)-2-((2-этокси-3-фторпиридин-4-ил)амино)-5-фторникотинамид;
6-(((2R,3S)-3-амино-1-циклопропилбутан-2-ил)амино)-2-((5,6-диметилпиридин-3-ил)амино)-5-фторникотинамид;
6-(((2S,3S)-3-амино-1-метоксибутан-2-ил)амино)-5-фтор-2-(хинолин-6-иламино)никотинамид;
6-(2-аминоэтиламино)-2-(3,5-диметоксифениламино)-5-фторникотинамид;
6-((1R,2S)-2-аминоциклогексиламино)-5-фтор-2-((5-метилпиридин-3-ил)амино)никотинамид; и
6-((1R,2S)-2-аминоциклогексиламино)-5-фтор-2-((6-метилпиридин-3-ил)амино)никотинамид.
13. Соединение, выбранное из группы, состоящей из следующих соединений:
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((6-метил-5-фенилпиридин-3-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((5,6-диметилпиридин-3-ил)амино)-5-фторникотинамид;
2-((1Н-индазол-4-ил)амино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((1-(2-(пирролидин-1-ил)этил)-1Н-индазол-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((1-(2-морфолиноэтил)-1Н-индазол-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((1-(циклопропилметил)-1Н-индазол-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((1-(2-метоксиэтил)-1Н-индазол-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((1-(2-(2-этоксиэтокси)этил)-1Н-индазол-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(циклопропилметил)-2Н-индазол-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-бензил-2Н-индазол-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-метоксиэтил)-2Н-индазол-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-бензил-2Н-индазол-5-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((5-этилпиридин-3-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-метил-2Н-индазол-5-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((1-(циклопропилметил)-1Н-индазол-6-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((1-(2-метоксиэтил)-1Н-индазол-6-ил)амино)никотинамид;
2-((2-(1Н-пиррол-2-ил)пиридин-4-ил)амино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-фенилпиридин-4-ил) амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(фуран-2-ил)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-изопропоксипиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(фуран-3-ил)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(метиламино)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-этоксипиридин-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2,6-диэтоксипиридин-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((5-(5-метилфуран-2-ил)пиридин-3-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(5-метилфуран-2-ил)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-метокси-6-фенилпиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-метоксиэтокси)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-морфолино-6-фенилпиридин-4-ил)амино)никотинамид;
2-((5-(1Н-пиразол-4-ил)пиридин-3-ил)амино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
2-((2-(1Н-пиразол-4-ил)пиридин-4-ил)амино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-пропоксипиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-бутоксипиридин-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-изобутоксипиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-метоксихинолин-7-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-метоксиэтокси)хинолин-7-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-((1-метоксипропан-2-ил)окси)хинолин-7-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(3-метоксибутокси)хинолин-7-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(2-(2-этоксиэтокси)этокси)хинолин-7-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((5-(1-циклогексен-1-ил)пиридин-3-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-метоксиэтокси)хинолин-6-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-((1-метоксипропан-2-ил)окси)хинолин-6-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(3-метоксибутокси)хинолин-6-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(2-(2-этоксиэтокси)этокси)хинолин-6-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-метоксихинолин-6-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-этоксихинолин-6-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-пропоксихинолин-6-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(2-этоксиэтокси)хинолин-6-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-(2-метоксиэтокси)этокси)хинолин-6-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-((тетрагидрофуран-2-ил)метокси)хинолин-6-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-(2-оксопирролидин-1-ил)этокси)хинолин-6-ил)амино)никотинамид;
2-((2-(1Н-1,2,4-триазол-1-ил)пиридин-4-ил)амино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((5-(фуран-3-ил)-6-метилпиридин-3-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2,3-диметоксихиноксалин-6-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2,3-диэтоксихиноксалин-6-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((4-метил-3,4-дигидро-2Н-[1,4]оксазино[2,3-b]хиноксалин-7-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2,3-диметилхиноксалин-6-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2,3-диэтилхиноксалин-6-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((1-этил-1Н-индазол-5-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((1-пропил-1Н-индазол-5-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-фторфенил)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(2,4-дифторфенил)пиридин-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((6-метил-5-(2Н-1,2,3-триазол-2-ил)пиридин-3-ил)амино)никотинамид;
2-((5-(1Н-1,2,4-триазол-1-ил)пиридин-3-ил)амино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-фтор-3-метоксифенил)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-фтор-4-метоксифенил)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-фтор-5-метоксифенил)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((6-циклопропилпиридин-3-ил)амино)-5-фторникотинамид;
2-((3-(1Н-пиразол-1-ил)хинолин-7-ил)амино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(2,3-дифторфенил)пиридин-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(2,5-дифторфенил)пиридин-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(3-хлор-2-фторфенил)пиридин-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(5-хлор-2-фторфенил)пиридин-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((5-(бензо[d][1,3]диоксол-5-ил)пиридин-3-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(бензо[d][1,3]диоксол-5-ил)пиридин-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((5-(3-оксо-3,4-дигидро-2Н-бензо[b][1,4]оксазин-6-ил)пиридин-3-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(3-оксо-3,4-дигидро-2Н-бензо[b][1,4]оксазин-6-ил)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(3-метоксифенил)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(4-метоксифенил)пиридин-4-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-2-((1-этил-1Н-индазол-6-ил)амино)-5-фторникотинамид;
6-((цис-2-аминоциклогексил)амино)-2-((1-этил-1Н-индазол-4-ил)амино)-5-фторникотинамид;
6-((цис-2-аминоциклогексил)амино)-2-((1-(2,2-дифторэтил)-1Н-индазол-5-ил)амино)-5-фторникотинамид;
6-((цис-2-аминоциклогексил)амино)-2-((1-(2,2-дифторэтил)-1Н-индазол-6-ил)амино)-5-фторникотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((5-(хинолин-7-ил)пиридин-3-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((5-(изохинолин-6-ил)пиридин-3-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((5-(изохинолин-7-ил)пиридин-3-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((2-(хинолин-7-ил)пиридин-4-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((2-(изохинолин-6-ил)пиридин-4-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((2-(изохинолин-7-ил)пиридин-4-ил)амино)никотинамид;
6-((цис)-2-аминоциклогексил)амино)-2-((бензофуро[2,3-b]пиридин-3-ил)амино)-5-фторникотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((3-фтор-1-метил-1Н-индазол-5-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-2-((1-этил-3-фтор-1Н-индазол-5-ил)амино)-5-фторникотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((3-фтор-1-метил-1Н-индазол-6-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-2-((1-этил-3-фтор-1Н-индазол-6-ил)амино)-5-фторникотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((1-(2-фторэтил)-1Н-индазол-5-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((1-(2-фторэтил)-1Н-индазол-6-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((3-фтор-1-(2-фторэтил)-1Н-индазол-5-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((3-фтор-1-(2-фторэтил)-1Н-индазол-6-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-2-((1,3-диметил-1Н-индазол-5-ил)амино)-5-фторникотинамид;
6-((цис-2-аминоциклогексил)амино)-2-((1-этил-3-метил-1Н-индазол-5-ил)амино)-5-фторникотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((1-(2-метоксиэтил)-3-метил-1Н-индазол-5-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((1-(2-фторэтил)-3-метил-1Н-индазол-5-ил)амино)никотинамид; и
6-((цис-2-аминоциклогексил)амино)-2-((1-(2,2-дифторэтил)-3-метил-1Н-индазол-5-ил)амино)-5-фторникотинамид.
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((6-метил-5-фенилпиридин-3-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((5,6-диметилпиридин-3-ил)амино)-5-фторникотинамид;
2-((1Н-индазол-4-ил)амино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((1-(2-(пирролидин-1-ил)этил)-1Н-индазол-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((1-(2-морфолиноэтил)-1Н-индазол-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((1-(циклопропилметил)-1Н-индазол-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((1-(2-метоксиэтил)-1Н-индазол-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((1-(2-(2-этоксиэтокси)этил)-1Н-индазол-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(циклопропилметил)-2Н-индазол-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-бензил-2Н-индазол-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-метоксиэтил)-2Н-индазол-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-бензил-2Н-индазол-5-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((5-этилпиридин-3-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-метил-2Н-индазол-5-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((1-(циклопропилметил)-1Н-индазол-6-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((1-(2-метоксиэтил)-1Н-индазол-6-ил)амино)никотинамид;
2-((2-(1Н-пиррол-2-ил)пиридин-4-ил)амино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-фенилпиридин-4-ил) амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(фуран-2-ил)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-изопропоксипиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(фуран-3-ил)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(метиламино)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-этоксипиридин-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2,6-диэтоксипиридин-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((5-(5-метилфуран-2-ил)пиридин-3-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(5-метилфуран-2-ил)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-метокси-6-фенилпиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-метоксиэтокси)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-морфолино-6-фенилпиридин-4-ил)амино)никотинамид;
2-((5-(1Н-пиразол-4-ил)пиридин-3-ил)амино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
2-((2-(1Н-пиразол-4-ил)пиридин-4-ил)амино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-пропоксипиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-бутоксипиридин-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-изобутоксипиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-метоксихинолин-7-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-метоксиэтокси)хинолин-7-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-((1-метоксипропан-2-ил)окси)хинолин-7-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(3-метоксибутокси)хинолин-7-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(2-(2-этоксиэтокси)этокси)хинолин-7-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((5-(1-циклогексен-1-ил)пиридин-3-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-метоксиэтокси)хинолин-6-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-((1-метоксипропан-2-ил)окси)хинолин-6-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(3-метоксибутокси)хинолин-6-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(2-(2-этоксиэтокси)этокси)хинолин-6-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-метоксихинолин-6-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-этоксихинолин-6-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-пропоксихинолин-6-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(2-этоксиэтокси)хинолин-6-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-(2-метоксиэтокси)этокси)хинолин-6-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-((тетрагидрофуран-2-ил)метокси)хинолин-6-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-(2-оксопирролидин-1-ил)этокси)хинолин-6-ил)амино)никотинамид;
2-((2-(1Н-1,2,4-триазол-1-ил)пиридин-4-ил)амино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((5-(фуран-3-ил)-6-метилпиридин-3-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2,3-диметоксихиноксалин-6-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2,3-диэтоксихиноксалин-6-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((4-метил-3,4-дигидро-2Н-[1,4]оксазино[2,3-b]хиноксалин-7-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2,3-диметилхиноксалин-6-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2,3-диэтилхиноксалин-6-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((1-этил-1Н-индазол-5-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((1-пропил-1Н-индазол-5-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-фторфенил)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(2,4-дифторфенил)пиридин-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((6-метил-5-(2Н-1,2,3-триазол-2-ил)пиридин-3-ил)амино)никотинамид;
2-((5-(1Н-1,2,4-триазол-1-ил)пиридин-3-ил)амино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-фтор-3-метоксифенил)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-фтор-4-метоксифенил)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(2-фтор-5-метоксифенил)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-2-((6-циклопропилпиридин-3-ил)амино)-5-фторникотинамид;
2-((3-(1Н-пиразол-1-ил)хинолин-7-ил)амино)-6-(цис-2-аминоциклогексиламино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(2,3-дифторфенил)пиридин-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(2,5-дифторфенил)пиридин-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(3-хлор-2-фторфенил)пиридин-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(5-хлор-2-фторфенил)пиридин-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((5-(бензо[d][1,3]диоксол-5-ил)пиридин-3-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-2-((2-(бензо[d][1,3]диоксол-5-ил)пиридин-4-ил)амино)-5-фторникотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((5-(3-оксо-3,4-дигидро-2Н-бензо[b][1,4]оксазин-6-ил)пиридин-3-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(3-оксо-3,4-дигидро-2Н-бензо[b][1,4]оксазин-6-ил)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(3-метоксифенил)пиридин-4-ил)амино)никотинамид;
6-(цис-2-аминоциклогексиламино)-5-фтор-2-((2-(4-метоксифенил)пиридин-4-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-2-((1-этил-1Н-индазол-6-ил)амино)-5-фторникотинамид;
6-((цис-2-аминоциклогексил)амино)-2-((1-этил-1Н-индазол-4-ил)амино)-5-фторникотинамид;
6-((цис-2-аминоциклогексил)амино)-2-((1-(2,2-дифторэтил)-1Н-индазол-5-ил)амино)-5-фторникотинамид;
6-((цис-2-аминоциклогексил)амино)-2-((1-(2,2-дифторэтил)-1Н-индазол-6-ил)амино)-5-фторникотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((5-(хинолин-7-ил)пиридин-3-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((5-(изохинолин-6-ил)пиридин-3-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((5-(изохинолин-7-ил)пиридин-3-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((2-(хинолин-7-ил)пиридин-4-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((2-(изохинолин-6-ил)пиридин-4-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((2-(изохинолин-7-ил)пиридин-4-ил)амино)никотинамид;
6-((цис)-2-аминоциклогексил)амино)-2-((бензофуро[2,3-b]пиридин-3-ил)амино)-5-фторникотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((3-фтор-1-метил-1Н-индазол-5-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-2-((1-этил-3-фтор-1Н-индазол-5-ил)амино)-5-фторникотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((3-фтор-1-метил-1Н-индазол-6-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-2-((1-этил-3-фтор-1Н-индазол-6-ил)амино)-5-фторникотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((1-(2-фторэтил)-1Н-индазол-5-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((1-(2-фторэтил)-1Н-индазол-6-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((3-фтор-1-(2-фторэтил)-1Н-индазол-5-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((3-фтор-1-(2-фторэтил)-1Н-индазол-6-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-2-((1,3-диметил-1Н-индазол-5-ил)амино)-5-фторникотинамид;
6-((цис-2-аминоциклогексил)амино)-2-((1-этил-3-метил-1Н-индазол-5-ил)амино)-5-фторникотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((1-(2-метоксиэтил)-3-метил-1Н-индазол-5-ил)амино)никотинамид;
6-((цис-2-аминоциклогексил)амино)-5-фтор-2-((1-(2-фторэтил)-3-метил-1Н-индазол-5-ил)амино)никотинамид; и
6-((цис-2-аминоциклогексил)амино)-2-((1-(2,2-дифторэтил)-3-метил-1Н-индазол-5-ил)амино)-5-фторникотинамид.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2010-150495 | 2010-06-30 | ||
| JP2010150495 | 2010-06-30 | ||
| PCT/JP2011/065530 WO2012002577A1 (ja) | 2010-06-30 | 2011-06-30 | 新規なニコチンアミド誘導体またはその塩 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2013103792A RU2013103792A (ru) | 2014-08-10 |
| RU2560163C2 true RU2560163C2 (ru) | 2015-08-20 |
Family
ID=45402271
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2013103792/04A RU2560163C2 (ru) | 2010-06-30 | 2011-06-30 | Новое производное никотинамида или его соль |
Country Status (21)
| Country | Link |
|---|---|
| US (1) | US8895585B2 (ru) |
| EP (1) | EP2589592B1 (ru) |
| JP (1) | JP5744021B2 (ru) |
| KR (1) | KR101789129B1 (ru) |
| CN (1) | CN102958918B (ru) |
| AU (1) | AU2011272198B2 (ru) |
| BR (1) | BR112012033770A2 (ru) |
| CA (1) | CA2803842C (ru) |
| DK (1) | DK2589592T3 (ru) |
| ES (1) | ES2689103T3 (ru) |
| HK (1) | HK1181762A1 (ru) |
| IL (1) | IL223818B (ru) |
| MX (1) | MX2012015023A (ru) |
| MY (1) | MY177250A (ru) |
| NZ (1) | NZ603837A (ru) |
| PL (1) | PL2589592T3 (ru) |
| RU (1) | RU2560163C2 (ru) |
| SG (1) | SG186877A1 (ru) |
| TW (1) | TWI561512B (ru) |
| WO (1) | WO2012002577A1 (ru) |
| ZA (1) | ZA201300095B (ru) |
Families Citing this family (40)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2011323484B2 (en) * | 2010-11-01 | 2016-10-06 | Portola Pharmaceuticals, Inc. | Benzamides and nicotinamides as Syk modulators |
| EP2714941A4 (en) * | 2011-05-24 | 2014-12-03 | Wistar Inst | COMPOSITIONS AND METHODS FOR MODULATING THE EFFECT OF THE EPSTEIN-BARR NUCLEAR ANTIGEN 1 |
| EP2762476A4 (en) | 2011-09-30 | 2015-03-25 | Taiho Pharmaceutical Co Ltd | 1,2,4-triazine-6-carboxamide derivative |
| KR101744607B1 (ko) * | 2011-12-28 | 2017-06-08 | 후지필름 가부시키가이샤 | 신규인 니코틴아미드 유도체 또는 그 염 |
| UY34807A (es) | 2012-05-16 | 2013-12-31 | Novartis Ag | Derivados monocíclicos de heteroarilcicloalquil- diamina |
| US9550750B2 (en) * | 2012-10-05 | 2017-01-24 | Merck Sharp & Dohme Corp. | Indoline compounds as aldosterone synthase inhibitors |
| JP2016113366A (ja) * | 2013-03-29 | 2016-06-23 | 大鵬薬品工業株式会社 | アセトアミド基を有する1,2,4−トリアジン−6−カルボキサミド誘導体 |
| CN105960404B (zh) | 2013-12-05 | 2019-09-03 | 药品循环有限责任公司 | 布鲁顿氏酪氨酸激酶的抑制剂 |
| CA2935392C (en) | 2014-01-01 | 2022-07-26 | Medivation Technologies, Inc. | Amino pyridine derivatives for the treatment of conditions associated with excessive tgf.beta activity |
| JO3517B1 (ar) | 2014-01-17 | 2020-07-05 | Novartis Ag | ان-ازاسبيرو الكان حلقي كبديل مركبات اريل-ان مغايرة وتركيبات لتثبيط نشاط shp2 |
| ES2699354T3 (es) | 2014-01-17 | 2019-02-08 | Novartis Ag | Derivados de 1-(triazin-3-il/piridazin-3-il)-piper(-azin)idina y composiciones de las mismas para inhibir la actividad de SHP2 |
| CN105899491B (zh) | 2014-01-17 | 2019-04-02 | 诺华股份有限公司 | 用于抑制shp2活性的1-哒嗪-/三嗪-3-基-哌(-嗪)/啶/吡咯烷衍生物及其组合物 |
| ES2741746T3 (es) | 2015-06-19 | 2020-02-12 | Novartis Ag | Compuestos y composiciones para inhibir la actividad de SHP2 |
| CN107922388B (zh) | 2015-06-19 | 2020-12-29 | 诺华股份有限公司 | 用于抑制shp2活性的化合物和组合物 |
| WO2016203405A1 (en) | 2015-06-19 | 2016-12-22 | Novartis Ag | Compounds and compositions for inhibiting the activity of shp2 |
| JP6472419B2 (ja) | 2015-09-30 | 2019-02-20 | 富士フイルム株式会社 | 芳香族化合物の製造方法 |
| PT3364958T (pt) | 2015-10-23 | 2023-04-10 | Navitor Pharm Inc | Moduladores de interação sestrina-gator2 e utilizações dos mesmos |
| AU2017283769B2 (en) | 2016-06-14 | 2019-08-15 | Novartis Ag | Compounds and compositions for inhibiting the activity of SHP2 |
| AU2018207464B2 (en) | 2017-01-10 | 2020-05-14 | Novartis Ag | Pharmaceutical combination comprising an ALK inhibitor and a SHP2 inhibitor |
| JP7122759B2 (ja) | 2017-01-26 | 2022-08-22 | サイクラセル リミテッド | プリン誘導体を調製するための方法 |
| MD3483164T2 (ro) | 2017-03-20 | 2020-07-31 | Forma Therapeutics Inc | Compoziții pirolopirolice ca activatori ai piruvat kinazei (PKR) |
| CN116370448A (zh) | 2017-04-26 | 2023-07-04 | 纳维托制药有限公司 | Sestrin-gator2相互作用的调节剂及其用途 |
| AU2018269947B2 (en) * | 2017-05-15 | 2021-10-14 | The Regents Of The University Of Michigan | Pyrrolo(2,3-c)pyridines and related analogs as LSD-1 inhibitors |
| CA3065114A1 (en) * | 2017-06-14 | 2018-12-20 | Chia Tai Tianqing Pharmaceutical Group Co., Ltd. | Syk inhibitor and use method therefor |
| ES2927860T3 (es) | 2017-12-13 | 2022-11-11 | Lupin Ltd | Compuestos heterocíclicos bicíclicos sustituidos como inhibidores de PRMT5 |
| CN113226356A (zh) | 2018-09-19 | 2021-08-06 | 福马治疗股份有限公司 | 活化丙酮酸激酶r |
| US10675274B2 (en) | 2018-09-19 | 2020-06-09 | Forma Therapeutics, Inc. | Activating pyruvate kinase R |
| WO2020086816A1 (en) | 2018-10-24 | 2020-04-30 | Navitor Pharmaceuticals, Inc. | Polymorphic compounds and uses thereof |
| US20220055992A1 (en) * | 2018-12-21 | 2022-02-24 | Saltigo Gmbh | Process for preparing 2-alkoxy-4-amino-5-methyl-pyridines and/or 2-alkoxy-4-alkylamino-5-methyl-pyridines |
| AU2020242287A1 (en) | 2019-03-21 | 2021-09-02 | INSERM (Institut National de la Santé et de la Recherche Médicale) | A Dbait molecule in combination with kinase inhibitor for the treatment of cancer |
| DK3980417T3 (en) | 2019-06-10 | 2023-12-18 | Lupin Ltd | PRMT5-Inhibitorer |
| CN112538072B (zh) * | 2019-09-21 | 2024-02-06 | 齐鲁制药有限公司 | 氨基嘧啶类egfr抑制剂 |
| JP2022554276A (ja) | 2019-11-01 | 2022-12-28 | ナビター ファーマシューティカルズ, インコーポレイテッド | Mtorc1モジュレーターを使用する処置方法 |
| CN114761006A (zh) | 2019-11-08 | 2022-07-15 | Inserm(法国国家健康医学研究院) | 对激酶抑制剂产生耐药性的癌症的治疗方法 |
| WO2021148581A1 (en) | 2020-01-22 | 2021-07-29 | Onxeo | Novel dbait molecule and its use |
| AR121149A1 (es) | 2020-01-30 | 2022-04-20 | Fmc Corp | Compuestos piridina para controlar plagas de invertebrados |
| US12128035B2 (en) | 2021-03-19 | 2024-10-29 | Novo Nordisk Health Care Ag | Activating pyruvate kinase R |
| TW202317528A (zh) | 2021-06-24 | 2023-05-01 | 美商富曼西公司 | 用於防治無脊椎有害生物的唑類化合物 |
| CN114230490A (zh) * | 2021-12-28 | 2022-03-25 | 乐威医药(江苏)股份有限公司 | 一种n-烷基化双胺的制备方法 |
| MX2024008057A (es) | 2021-12-30 | 2024-08-28 | Biomea Fusion Inc | Compuestos de pirazina como inhibidores de flt3. |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1184376A1 (en) * | 1999-06-09 | 2002-03-06 | Yamanouchi Pharmaceutical Co. Ltd. | Novel heterocyclic carboxamide derivatives |
| JP2008013499A (ja) * | 2006-07-06 | 2008-01-24 | Sankyo Co Ltd | 5−シアノニコチンアミド誘導体 |
| RU2007132976A (ru) * | 2005-02-04 | 2009-03-10 | Астразенека Аб (Se) | Производные пиразолиламинопиридина, пригодные в качестве ингибиторов киназы |
Family Cites Families (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6133253A (en) | 1996-12-10 | 2000-10-17 | Abbott Laboratories | 3-Pyridyl enantiomers and their use as analgesics |
| US7022711B2 (en) | 2000-08-04 | 2006-04-04 | Warner-Lambert Company | 2-(4-Pyridyl)amino-6-dialkoxyphenyl-pyrido[2,3-d]pyrimidin-7-ones |
| HUP0400175A2 (en) | 2001-03-01 | 2007-07-30 | Shionogi & Co | Nitrogen-containing heteroaryl compounds having hiv integrase inhibitory activity, their use and pharmaceutical compositions containing them |
| EP1430068A1 (en) | 2001-09-17 | 2004-06-23 | Ortho-Mcneil Pharmaceutical, Inc. | 6-o-carbamate-11,12-lacto-ketolide antimicrobials |
| MY145634A (en) | 2003-12-29 | 2012-03-15 | Bristol Myers Squibb Co | Pyrrolotriazine compounds as kinase inhibitors |
| US20060079522A1 (en) | 2004-10-08 | 2006-04-13 | Marzabadi Mohammad R | Amino substituted aryloxybenzylpiperidine derivatives |
| GB0428082D0 (en) | 2004-12-22 | 2005-01-26 | Welcome Trust The Ltd | Therapeutic compounds |
| EP2383268B1 (en) * | 2005-02-04 | 2015-09-02 | AstraZeneca AB | Pyrazolylaminopyridine derivatives useful as kinase inhibitors |
| GB0504753D0 (en) | 2005-03-08 | 2005-04-13 | Astrazeneca Ab | Chemical compounds |
| US8227455B2 (en) | 2005-04-18 | 2012-07-24 | Rigel Pharmaceuticals, Inc. | Methods of treating cell proliferative disorders |
| EP1878727A4 (en) | 2005-04-28 | 2013-11-13 | Kyowa Hakko Kirin Co Ltd | 2-AMINOQUINAZOLINE DERIVATIVES |
| CA2611688A1 (en) | 2005-06-30 | 2007-01-11 | Amgen Inc. | Bis-aryl kinase inhibitors and their use in the treatment of inflammation, angiogenesis and cancer |
| KR101411695B1 (ko) * | 2006-02-17 | 2014-07-03 | 리겔 파마슈티칼스, 인크. | 자가면역 질환의 치료 또는 예방을 위한 2,4-피리미딘디아민 화합물 |
| TW200803855A (en) | 2006-02-24 | 2008-01-16 | Kalypsys Inc | Quinolones useful as inducible nitric oxide synthase inhibitors |
| RU2008144571A (ru) | 2006-04-12 | 2010-05-20 | Мерк энд Ко., Инк. (US) | Пиридиламидные антагонисты кальциевых каналов т-типа |
| WO2008087485A2 (en) | 2006-09-14 | 2008-07-24 | Tessera Technologies Hungary Kft. | Imaging system with relaxed assembly tolerances and associated methods |
| WO2008049855A2 (en) | 2006-10-27 | 2008-05-02 | Glaxo Group Limited | 7-azaindole derivatives as c-met kinase inhibitors |
| CN101605761A (zh) | 2007-02-23 | 2009-12-16 | 卫材R&D管理有限公司 | 对hgfr基因扩增细胞株显示优异的细胞增殖抑制效果和抗肿瘤效果的吡啶衍生物或嘧啶衍生物 |
| TW200904421A (en) * | 2007-05-03 | 2009-02-01 | Astellas Pharma Inc | New compounds |
| WO2009018344A1 (en) | 2007-07-30 | 2009-02-05 | Regents Of The University Of Minnesota | Anticancer agents |
| US7705004B2 (en) | 2007-08-17 | 2010-04-27 | Portola Pharmaceuticals, Inc. | Protein kinase inhibitors |
| US8022209B2 (en) | 2007-09-12 | 2011-09-20 | Janssen Pharmaceutica Nv | Substituted nitrogen-containing heteroaryl derivatives useful as modulators of the histamine H4 receptor |
| AR068509A1 (es) * | 2007-09-19 | 2009-11-18 | Jerini Ag | Antagosnistas del receptor de bradiquinina b1 |
| AR070127A1 (es) | 2008-01-11 | 2010-03-17 | Novartis Ag | Pirrolo - pirimidinas y pirrolo -piridinas |
| MX2010007604A (es) | 2008-01-11 | 2010-08-02 | Novartis Ag | Pirimidinas como inhibidores de cinasa. |
| WO2009090548A2 (en) | 2008-01-17 | 2009-07-23 | Glenmark Pharmaceuticals, S.A. | 3-azabicyclo [3.1.0] hexane derivatives as vanilloid receptor ligands |
| VN29259A1 (en) * | 2008-04-16 | 2012-04-25 | Portola Pharm Inc | 2, 6-diamino- pyrimidin- 5-yl-carboxamides as syk or JAK kinases inhibitors |
| WO2009145856A1 (en) | 2008-04-16 | 2009-12-03 | Portola Pharmaceuticals, Inc. | 2, 6-diamino-pyrimidin- 5-yl-carboxamides as syk or jak kinases inhibitors |
| AU2009238590A1 (en) | 2008-04-22 | 2009-10-29 | Portola Pharmaceuticals, Inc. | Inhibitors of protein kinases |
| US7863291B2 (en) | 2008-04-23 | 2011-01-04 | Bristol-Myers Squibb Company | Quinuclidine compounds as alpha-7 nicotinic acetylcholine receptor ligands |
| AU2009259494A1 (en) | 2008-06-16 | 2009-12-23 | F. Hoffmann-La Roche Ag | Heteroaromatic monoamides as orexinin receptor antagonists |
| CN102112942A (zh) * | 2008-07-31 | 2011-06-29 | 圣纳普斯有限责任公司 | 基于计算机的算盘训练系统 |
| KR20110100679A (ko) | 2009-01-13 | 2011-09-14 | 글락소 그룹 리미티드 | Syk 키나아제의 억제제로서 피리미딘카르복사미드 유도체 |
| CN102458402B (zh) * | 2009-06-12 | 2013-10-02 | 百时美施贵宝公司 | 用作激酶调节剂的烟酰胺化合物 |
| AU2011323484B2 (en) * | 2010-11-01 | 2016-10-06 | Portola Pharmaceuticals, Inc. | Benzamides and nicotinamides as Syk modulators |
-
2011
- 2011-06-30 PL PL11801034T patent/PL2589592T3/pl unknown
- 2011-06-30 RU RU2013103792/04A patent/RU2560163C2/ru active
- 2011-06-30 AU AU2011272198A patent/AU2011272198B2/en not_active Ceased
- 2011-06-30 CN CN201180031719.6A patent/CN102958918B/zh not_active Expired - Fee Related
- 2011-06-30 BR BR112012033770A patent/BR112012033770A2/pt not_active Application Discontinuation
- 2011-06-30 TW TW100123081A patent/TWI561512B/zh not_active IP Right Cessation
- 2011-06-30 SG SG2012096632A patent/SG186877A1/en unknown
- 2011-06-30 MY MYPI2012005634A patent/MY177250A/en unknown
- 2011-06-30 NZ NZ603837A patent/NZ603837A/en not_active IP Right Cessation
- 2011-06-30 MX MX2012015023A patent/MX2012015023A/es active IP Right Grant
- 2011-06-30 CA CA2803842A patent/CA2803842C/en not_active Expired - Fee Related
- 2011-06-30 EP EP11801034.7A patent/EP2589592B1/en active Active
- 2011-06-30 KR KR1020137001065A patent/KR101789129B1/ko active IP Right Grant
- 2011-06-30 ES ES11801034.7T patent/ES2689103T3/es active Active
- 2011-06-30 DK DK11801034.7T patent/DK2589592T3/en active
- 2011-06-30 JP JP2012522731A patent/JP5744021B2/ja not_active Expired - Fee Related
- 2011-06-30 WO PCT/JP2011/065530 patent/WO2012002577A1/ja active Application Filing
-
2012
- 2012-12-24 IL IL223818A patent/IL223818B/en active IP Right Grant
- 2012-12-28 US US13/730,000 patent/US8895585B2/en active Active
-
2013
- 2013-01-04 ZA ZA2013/00095A patent/ZA201300095B/en unknown
- 2013-08-01 HK HK13109009.5A patent/HK1181762A1/zh not_active IP Right Cessation
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1184376A1 (en) * | 1999-06-09 | 2002-03-06 | Yamanouchi Pharmaceutical Co. Ltd. | Novel heterocyclic carboxamide derivatives |
| RU2007132976A (ru) * | 2005-02-04 | 2009-03-10 | Астразенека Аб (Se) | Производные пиразолиламинопиридина, пригодные в качестве ингибиторов киназы |
| JP2008013499A (ja) * | 2006-07-06 | 2008-01-24 | Sankyo Co Ltd | 5−シアノニコチンアミド誘導体 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20130116430A1 (en) | 2013-05-09 |
| MX2012015023A (es) | 2013-04-03 |
| SG186877A1 (en) | 2013-02-28 |
| ZA201300095B (en) | 2014-03-26 |
| US8895585B2 (en) | 2014-11-25 |
| AU2011272198B2 (en) | 2016-09-22 |
| EP2589592B1 (en) | 2018-08-22 |
| HK1181762A1 (zh) | 2013-11-15 |
| TWI561512B (en) | 2016-12-11 |
| KR101789129B1 (ko) | 2017-11-20 |
| BR112012033770A2 (pt) | 2016-11-22 |
| CN102958918A (zh) | 2013-03-06 |
| NZ603837A (en) | 2014-01-31 |
| IL223818B (en) | 2019-09-26 |
| PL2589592T3 (pl) | 2019-03-29 |
| RU2013103792A (ru) | 2014-08-10 |
| DK2589592T3 (en) | 2018-11-26 |
| TW201215602A (en) | 2012-04-16 |
| JP5744021B2 (ja) | 2015-07-01 |
| JPWO2012002577A1 (ja) | 2013-08-29 |
| CA2803842A1 (en) | 2012-01-05 |
| CA2803842C (en) | 2020-01-07 |
| MY177250A (en) | 2020-09-10 |
| KR20130088130A (ko) | 2013-08-07 |
| ES2689103T3 (es) | 2018-11-08 |
| WO2012002577A1 (ja) | 2012-01-05 |
| CN102958918B (zh) | 2015-12-09 |
| AU2011272198A1 (en) | 2013-02-07 |
| EP2589592A1 (en) | 2013-05-08 |
| EP2589592A4 (en) | 2014-01-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2560163C2 (ru) | Новое производное никотинамида или его соль | |
| RU2615130C2 (ru) | Гетероциклические соединения, используемые в качестве ингибиторов pdk1 | |
| JP5878178B2 (ja) | 1,2,4−トリアジン−6−カルボキサミド誘導体 | |
| RU2576623C2 (ru) | Новое производное никотинамида или его соль | |
| AU2012272895B2 (en) | TRPM8 antagonists and their use in treatments | |
| TWI726397B (zh) | 一種新型的喹啉衍生物抑制劑 | |
| JP2018505207A (ja) | 置換モノおよびポリアザナフタレン誘導体およびその使用 | |
| AU2012288969A1 (en) | Substituted quinolines and their use as medicaments | |
| WO2019141202A1 (zh) | Tam家族激酶/和csf1r激酶抑制剂及其用途 | |
| TWI822754B (zh) | 作為crhr2拮抗劑之稠合環狀脲衍生物 | |
| KR20080018907A (ko) | 수용체 티로신 키나아제 met의 억제제로서의벤조사이클로헵타피리딘 | |
| JP2014198693A (ja) | 免疫疾患の予防及び/又は治療剤 | |
| JP2023544789A (ja) | Mrgx2アンタゴニスト | |
| TW202412773A (zh) | 雜芳基衍生化合物及其用途 |