RU2233273C2 - Ароматические азотсодержащие 6-членные циклические соединения и фармацевтическая композиция - Google Patents
Ароматические азотсодержащие 6-членные циклические соединения и фармацевтическая композиция Download PDFInfo
- Publication number
- RU2233273C2 RU2233273C2 RU2002109792/04A RU2002109792A RU2233273C2 RU 2233273 C2 RU2233273 C2 RU 2233273C2 RU 2002109792/04 A RU2002109792/04 A RU 2002109792/04A RU 2002109792 A RU2002109792 A RU 2002109792A RU 2233273 C2 RU2233273 C2 RU 2233273C2
- Authority
- RU
- Russia
- Prior art keywords
- group
- nitrogen
- formula
- methoxybenzylamino
- chloro
- Prior art date
Links
- -1 Aromatic nitrogen-containing 6-membered cyclic compounds Chemical class 0.000 title claims abstract description 47
- 239000008194 pharmaceutical composition Substances 0.000 title claims description 3
- 150000001875 compounds Chemical class 0.000 claims abstract description 353
- 125000000623 heterocyclic group Chemical group 0.000 claims abstract description 83
- 150000003839 salts Chemical class 0.000 claims abstract description 52
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims abstract description 24
- 230000002401 inhibitory effect Effects 0.000 claims abstract description 19
- 125000005843 halogen group Chemical group 0.000 claims abstract description 17
- 229910052760 oxygen Inorganic materials 0.000 claims abstract description 9
- 125000004093 cyano group Chemical group *C#N 0.000 claims abstract description 6
- 206010051153 Diabetic gastroparesis Diseases 0.000 claims abstract description 5
- 208000002815 pulmonary hypertension Diseases 0.000 claims abstract description 5
- 230000004064 dysfunction Effects 0.000 claims abstract description 4
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims abstract description 4
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims abstract 23
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 claims abstract 11
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 claims abstract 8
- 125000004433 nitrogen atom Chemical group N* 0.000 claims abstract 8
- 239000001301 oxygen Substances 0.000 claims abstract 8
- 229910052717 sulfur Inorganic materials 0.000 claims abstract 8
- 125000004434 sulfur atom Chemical group 0.000 claims abstract 8
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 claims abstract 4
- 125000003161 (C1-C6) alkylene group Chemical group 0.000 claims abstract 2
- 125000003107 substituted aryl group Chemical group 0.000 claims abstract 2
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 claims description 76
- 125000000217 alkyl group Chemical group 0.000 claims description 49
- 125000003545 alkoxy group Chemical group 0.000 claims description 25
- 125000001424 substituent group Chemical group 0.000 claims description 18
- WEAJZXNPAWBCOA-INIZCTEOSA-N avanafil Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=NC=C1C(=O)NCC1=NC=CC=N1 WEAJZXNPAWBCOA-INIZCTEOSA-N 0.000 claims description 13
- 201000001881 impotence Diseases 0.000 claims description 11
- 125000003277 amino group Chemical group 0.000 claims description 9
- 125000004043 oxo group Chemical group O=* 0.000 claims description 9
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 9
- ZUOSZNKVOBXTON-UHFFFAOYSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-(6,8-dihydro-5h-1,7-naphthyridin-7-yl)-n-(2-morpholin-4-ylethyl)pyrimidine-5-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2CC3=NC=CC=C3CC2)=NC=C1C(=O)NCCN1CCOCC1 ZUOSZNKVOBXTON-UHFFFAOYSA-N 0.000 claims description 8
- BZIKYOBRYFDAQS-KRWDZBQOSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]-n-(1,3,5-trimethylpyrazol-4-yl)pyrimidine-5-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=NC=C1C(=O)NC1=C(C)N(C)N=C1C BZIKYOBRYFDAQS-KRWDZBQOSA-N 0.000 claims description 8
- 125000002757 morpholinyl group Chemical group 0.000 claims description 8
- 125000004193 piperazinyl group Chemical group 0.000 claims description 8
- JDEHGBFVLSFNQF-INIZCTEOSA-N 3-[(3-chloro-4-methoxyphenyl)methylamino]-5-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]-n-(pyrimidin-2-ylmethyl)pyrazine-2-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=CN=C1C(=O)NCC1=NC=CC=N1 JDEHGBFVLSFNQF-INIZCTEOSA-N 0.000 claims description 7
- 208000010228 Erectile Dysfunction Diseases 0.000 claims description 7
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 claims description 7
- 125000000714 pyrimidinyl group Chemical group 0.000 claims description 7
- KPRNHBREBJMQRF-UHFFFAOYSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-(6,8-dihydro-5h-imidazo[1,2-a]pyrazin-7-yl)-n-(pyrimidin-2-ylmethyl)pyrimidine-5-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2CC3=NC=CN3CC2)=NC=C1C(=O)NCC1=NC=CC=N1 KPRNHBREBJMQRF-UHFFFAOYSA-N 0.000 claims description 6
- UWBVOGVFKRJBOW-HNNXBMFYSA-N 1-[4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]pyrimidin-5-yl]-3-methoxypropan-1-one Chemical compound COCCC(=O)C1=CN=C(N2[C@@H](CCC2)CO)N=C1NCC1=CC=C(OC)C(Cl)=C1 UWBVOGVFKRJBOW-HNNXBMFYSA-N 0.000 claims description 5
- AMUQMYUCCDGCBH-KRWDZBQOSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]-n-(pyrimidin-5-ylmethyl)pyrimidine-5-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=NC=C1C(=O)NCC1=CN=CN=C1 AMUQMYUCCDGCBH-KRWDZBQOSA-N 0.000 claims description 5
- PDKSTSHJWLVVPD-SFHVURJKSA-N 3-[(3-chloro-4-methoxyphenyl)methylamino]-5-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]-n-(2-morpholin-4-ylethyl)pyrazine-2-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=CN=C1C(=O)NCCN1CCOCC1 PDKSTSHJWLVVPD-SFHVURJKSA-N 0.000 claims description 4
- RVNOPBSKJLVSGX-UHFFFAOYSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-(6,8-dihydro-5h-imidazo[1,2-a]pyrazin-7-yl)-n-(2-morpholin-4-ylethyl)pyrimidine-5-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2CC3=NC=CN3CC2)=NC=C1C(=O)NCCN1CCOCC1 RVNOPBSKJLVSGX-UHFFFAOYSA-N 0.000 claims description 4
- QEZPSGKEUQYEJJ-SFHVURJKSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]-n-(2-morpholin-4-ylethyl)pyrimidine-5-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=NC=C1C(=O)NCCN1CCOCC1 QEZPSGKEUQYEJJ-SFHVURJKSA-N 0.000 claims description 4
- YRUWWUCFHIDILY-KRWDZBQOSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]-n-(pyrimidin-4-ylmethyl)pyrimidine-5-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=NC=C1C(=O)NCC1=CC=NC=N1 YRUWWUCFHIDILY-KRWDZBQOSA-N 0.000 claims description 4
- DKEPQDALHOKEMO-QAQDUYKDSA-N C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2CC(=O)N(C)CC2)=NC=C1C(=O)N[C@@H]1CC[C@@H](O)CC1 Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2CC(=O)N(C)CC2)=NC=C1C(=O)N[C@@H]1CC[C@@H](O)CC1 DKEPQDALHOKEMO-QAQDUYKDSA-N 0.000 claims description 4
- DRDRFIHQQVYKOQ-IYARVYRRSA-N C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2CCN(CC2)C=O)=NC=C1C(=O)N[C@@H]1CC[C@@H](O)CC1 Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2CCN(CC2)C=O)=NC=C1C(=O)N[C@@H]1CC[C@@H](O)CC1 DRDRFIHQQVYKOQ-IYARVYRRSA-N 0.000 claims description 4
- 125000002252 acyl group Chemical group 0.000 claims description 4
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 claims description 4
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 4
- 125000004076 pyridyl group Chemical group 0.000 claims description 4
- YNNKKCCWMQZSKY-SFHVURJKSA-N 1-[4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]pyrimidin-5-yl]-3-morpholin-4-ylpropan-1-one Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=NC=C1C(=O)CCN1CCOCC1 YNNKKCCWMQZSKY-SFHVURJKSA-N 0.000 claims description 3
- ZKVBUXINNNFHDQ-AWEZNQCLSA-N 1-[4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]pyrimidin-5-yl]ethanone Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=NC=C1C(C)=O ZKVBUXINNNFHDQ-AWEZNQCLSA-N 0.000 claims description 3
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 claims description 3
- 125000004122 cyclic group Chemical group 0.000 claims description 3
- UJGJGLRWBIDXDS-CALCHBBNSA-N 2-[(2s,5r)-2,5-bis(hydroxymethyl)pyrrolidin-1-yl]-4-[(3-chloro-4-methoxyphenyl)methylamino]-n-(pyrimidin-2-ylmethyl)pyrimidine-5-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CC[C@@H]2CO)CO)=NC=C1C(=O)NCC1=NC=CC=N1 UJGJGLRWBIDXDS-CALCHBBNSA-N 0.000 claims description 2
- HYKWSWIXOFMTGB-UHFFFAOYSA-N 3-[(3-chloro-4-methoxyphenyl)methylamino]-5-(6,8-dihydro-5h-imidazo[1,2-a]pyrazin-7-yl)-n-(pyrimidin-2-ylmethyl)pyrazine-2-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2CC3=NC=CN3CC2)=CN=C1C(=O)NCC1=NC=CC=N1 HYKWSWIXOFMTGB-UHFFFAOYSA-N 0.000 claims description 2
- JBMBVESUUWXWDY-KRWDZBQOSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]-n-(pyridazin-4-ylmethyl)pyrimidine-5-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=NC=C1C(=O)NCC1=CC=NN=C1 JBMBVESUUWXWDY-KRWDZBQOSA-N 0.000 claims description 2
- BGQRCENSNLFTCS-SFHVURJKSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]-n-(pyridin-2-ylmethyl)pyrimidine-5-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=NC=C1C(=O)NCC1=CC=CC=N1 BGQRCENSNLFTCS-SFHVURJKSA-N 0.000 claims description 2
- CFQCGXUAGOJKPS-ROUUACIJSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]-n-[[(2s)-4-methylmorpholin-2-yl]methyl]pyrimidine-5-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=NC=C1C(=O)NC[C@@H]1OCCN(C)C1 CFQCGXUAGOJKPS-ROUUACIJSA-N 0.000 claims description 2
- WOEITLRBTOCXAD-UHFFFAOYSA-N 4-[(3-cyano-4-methoxyphenyl)methylamino]-2-(5,7-dihydropyrrolo[3,4-b]pyridin-6-yl)-n-(2-morpholin-4-ylethyl)pyrimidine-5-carboxamide Chemical compound C1=C(C#N)C(OC)=CC=C1CNC1=NC(N2CC3=NC=CC=C3C2)=NC=C1C(=O)NCCN1CCOCC1 WOEITLRBTOCXAD-UHFFFAOYSA-N 0.000 claims description 2
- GHOHWVFYZJFDDG-UHFFFAOYSA-N 4-[(3-cyano-4-methoxyphenyl)methylamino]-2-(5,7-dihydropyrrolo[3,4-b]pyridin-6-yl)-n-(pyrimidin-2-ylmethyl)pyrimidine-5-carboxamide Chemical compound C1=C(C#N)C(OC)=CC=C1CNC1=NC(N2CC3=NC=CC=C3C2)=NC=C1C(=O)NCC1=NC=CC=N1 GHOHWVFYZJFDDG-UHFFFAOYSA-N 0.000 claims description 2
- SESDYPVYQSBTDT-MEMLXQNLSA-N C1=C(C#N)C(OC)=CC=C1CNC1=NC(N2CC3=NC=CC=C3C2)=NC=C1C(=O)N[C@@H]1CC[C@@H](O)CC1 Chemical compound C1=C(C#N)C(OC)=CC=C1CNC1=NC(N2CC3=NC=CC=C3C2)=NC=C1C(=O)N[C@@H]1CC[C@@H](O)CC1 SESDYPVYQSBTDT-MEMLXQNLSA-N 0.000 claims description 2
- UAMDGRULSTUHIJ-IYARVYRRSA-N C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2CC3=NC=CN3CC2)=NC=C1C(=O)N[C@@H]1CC[C@@H](O)CC1 Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2CC3=NC=CN3CC2)=NC=C1C(=O)N[C@@H]1CC[C@@H](O)CC1 UAMDGRULSTUHIJ-IYARVYRRSA-N 0.000 claims description 2
- 125000000440 benzylamino group Chemical group [H]N(*)C([H])([H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 claims description 2
- 125000006619 (C1-C6) dialkylamino group Chemical group 0.000 claims 2
- 125000004890 (C1-C6) alkylamino group Chemical group 0.000 claims 1
- 125000004739 (C1-C6) alkylsulfonyl group Chemical group 0.000 claims 1
- BZIKYOBRYFDAQS-UHFFFAOYSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[2-(hydroxymethyl)pyrrolidin-1-yl]-n-(1,3,5-trimethylpyrazol-4-yl)pyrimidine-5-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2C(CCC2)CO)=NC=C1C(=O)NC1=C(C)N(C)N=C1C BZIKYOBRYFDAQS-UHFFFAOYSA-N 0.000 claims 1
- QGPZRJMJDWTBPK-WGSAOQKQSA-N C1C[C@@H](OC)CC[C@@H]1NC(=O)C1=CN=C(N2CC3=NC=CN3CC2)N=C1NCC1=CC=C(OC)C(Cl)=C1 Chemical compound C1C[C@@H](OC)CC[C@@H]1NC(=O)C1=CN=C(N2CC3=NC=CN3CC2)N=C1NCC1=CC=C(OC)C(Cl)=C1 QGPZRJMJDWTBPK-WGSAOQKQSA-N 0.000 claims 1
- 239000004480 active ingredient Substances 0.000 claims 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 claims 1
- 125000002911 monocyclic heterocycle group Chemical group 0.000 claims 1
- 230000000694 effects Effects 0.000 abstract description 12
- 239000000126 substance Substances 0.000 abstract description 4
- 102000011016 Type 5 Cyclic Nucleotide Phosphodiesterases Human genes 0.000 abstract description 3
- 108010037581 Type 5 Cyclic Nucleotide Phosphodiesterases Proteins 0.000 abstract description 3
- 230000001747 exhibiting effect Effects 0.000 abstract description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 179
- 239000000203 mixture Substances 0.000 description 87
- 239000002904 solvent Substances 0.000 description 84
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 78
- 238000006243 chemical reaction Methods 0.000 description 73
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 70
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 66
- 239000000243 solution Substances 0.000 description 65
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 61
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 57
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 51
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 48
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 46
- 150000003254 radicals Chemical class 0.000 description 38
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 35
- 238000000034 method Methods 0.000 description 34
- 239000011541 reaction mixture Substances 0.000 description 33
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 30
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 30
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 30
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 27
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 26
- 230000003993 interaction Effects 0.000 description 25
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 24
- 102000004861 Phosphoric Diester Hydrolases Human genes 0.000 description 24
- 108090001050 Phosphoric Diester Hydrolases Proteins 0.000 description 24
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 24
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 23
- 235000017557 sodium bicarbonate Nutrition 0.000 description 23
- 229920006395 saturated elastomer Polymers 0.000 description 22
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 22
- 239000012267 brine Substances 0.000 description 21
- 239000012044 organic layer Substances 0.000 description 21
- 238000007254 oxidation reaction Methods 0.000 description 21
- 239000007864 aqueous solution Substances 0.000 description 20
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 19
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 19
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical class [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 19
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 17
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 16
- NUJOXMJBOLGQSY-UHFFFAOYSA-N manganese dioxide Chemical compound O=[Mn]=O NUJOXMJBOLGQSY-UHFFFAOYSA-N 0.000 description 16
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 16
- 239000000741 silica gel Substances 0.000 description 16
- 229910002027 silica gel Inorganic materials 0.000 description 16
- 239000000843 powder Substances 0.000 description 15
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 14
- 239000002585 base Substances 0.000 description 14
- 238000001816 cooling Methods 0.000 description 14
- 239000003795 chemical substances by application Substances 0.000 description 13
- 230000008569 process Effects 0.000 description 13
- 238000010898 silica gel chromatography Methods 0.000 description 13
- 239000013078 crystal Substances 0.000 description 12
- 229910052938 sodium sulfate Inorganic materials 0.000 description 12
- 235000011152 sodium sulphate Nutrition 0.000 description 12
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 11
- 239000002253 acid Substances 0.000 description 11
- UHOVQNZJYSORNB-UHFFFAOYSA-N monobenzene Natural products C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 11
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 10
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 10
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 10
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 10
- 239000002244 precipitate Substances 0.000 description 10
- 239000000047 product Substances 0.000 description 10
- 235000011121 sodium hydroxide Nutrition 0.000 description 10
- 238000012360 testing method Methods 0.000 description 10
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 9
- 125000003282 alkyl amino group Chemical group 0.000 description 9
- 238000001914 filtration Methods 0.000 description 9
- 230000003647 oxidation Effects 0.000 description 9
- 125000006239 protecting group Chemical group 0.000 description 9
- 239000000523 sample Substances 0.000 description 9
- 239000011780 sodium chloride Substances 0.000 description 9
- 239000007858 starting material Substances 0.000 description 9
- 239000000725 suspension Substances 0.000 description 9
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 8
- 239000000706 filtrate Substances 0.000 description 8
- 238000003818 flash chromatography Methods 0.000 description 8
- 239000003921 oil Substances 0.000 description 8
- 150000007530 organic bases Chemical class 0.000 description 8
- 229910000027 potassium carbonate Inorganic materials 0.000 description 8
- 235000011181 potassium carbonates Nutrition 0.000 description 8
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 7
- ZOOGRGPOEVQQDX-UUOKFMHZSA-N 3',5'-cyclic GMP Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=C(NC2=O)N)=C2N=C1 ZOOGRGPOEVQQDX-UUOKFMHZSA-N 0.000 description 7
- 0 C*C1=**C(*)C(NC*)=N1 Chemical compound C*C1=**C(*)C(NC*)=N1 0.000 description 7
- 125000003118 aryl group Chemical group 0.000 description 7
- 239000000284 extract Substances 0.000 description 7
- 230000001590 oxidative effect Effects 0.000 description 7
- BNRNXUUZRGQAQC-UHFFFAOYSA-N sildenafil Chemical compound CCCC1=NN(C)C(C(N2)=O)=C1N=C2C(C(=CC=1)OCC)=CC=1S(=O)(=O)N1CCN(C)CC1 BNRNXUUZRGQAQC-UHFFFAOYSA-N 0.000 description 7
- 229910000029 sodium carbonate Inorganic materials 0.000 description 7
- 235000017550 sodium carbonate Nutrition 0.000 description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 6
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 6
- 229910052783 alkali metal Inorganic materials 0.000 description 6
- 229910052799 carbon Inorganic materials 0.000 description 6
- 125000004432 carbon atom Chemical group C* 0.000 description 6
- 239000012230 colorless oil Substances 0.000 description 6
- 125000000753 cycloalkyl group Chemical group 0.000 description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 6
- 239000003814 drug Substances 0.000 description 6
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 6
- 230000002140 halogenating effect Effects 0.000 description 6
- 229910052751 metal Inorganic materials 0.000 description 6
- 239000002184 metal Substances 0.000 description 6
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 6
- 239000007800 oxidant agent Substances 0.000 description 6
- XQYZDYMELSJDRZ-UHFFFAOYSA-N papaverine Chemical compound C1=C(OC)C(OC)=CC=C1CC1=NC=CC2=CC(OC)=C(OC)C=C12 XQYZDYMELSJDRZ-UHFFFAOYSA-N 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 5
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 5
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 5
- HVVNJUAVDAZWCB-YFKPBYRVSA-N [(2s)-pyrrolidin-2-yl]methanol Chemical compound OC[C@@H]1CCCN1 HVVNJUAVDAZWCB-YFKPBYRVSA-N 0.000 description 5
- 239000012043 crude product Substances 0.000 description 5
- 239000008187 granular material Substances 0.000 description 5
- 230000007062 hydrolysis Effects 0.000 description 5
- 238000006460 hydrolysis reaction Methods 0.000 description 5
- 150000007529 inorganic bases Chemical class 0.000 description 5
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 239000003826 tablet Substances 0.000 description 5
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 4
- BGWWPPIKYCSEDY-AWEZNQCLSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]pyrimidine-5-carbaldehyde Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=NC=C1C=O BGWWPPIKYCSEDY-AWEZNQCLSA-N 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical group C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 4
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 4
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 4
- 230000003213 activating effect Effects 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- WLOQDGSMJNYRRC-UHFFFAOYSA-N ethyl 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-methylsulfanylpyrimidine-5-carboxylate Chemical compound CCOC(=O)C1=CN=C(SC)N=C1NCC1=CC=C(OC)C(Cl)=C1 WLOQDGSMJNYRRC-UHFFFAOYSA-N 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical compound [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 description 4
- 238000004519 manufacturing process Methods 0.000 description 4
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 description 4
- 239000002590 phosphodiesterase V inhibitor Substances 0.000 description 4
- 238000012746 preparative thin layer chromatography Methods 0.000 description 4
- 238000011160 research Methods 0.000 description 4
- 239000012312 sodium hydride Substances 0.000 description 4
- 229910000104 sodium hydride Inorganic materials 0.000 description 4
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 4
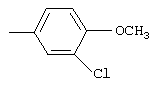
- OCNMSDZALRAYEX-UHFFFAOYSA-N (3-chloro-4-methoxyphenyl)methanamine Chemical compound COC1=CC=C(CN)C=C1Cl OCNMSDZALRAYEX-UHFFFAOYSA-N 0.000 description 3
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 3
- GJNVFCGWBLSCAB-AWEZNQCLSA-N 1-[4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]pyrimidin-5-yl]prop-2-en-1-one Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=NC=C1C(=O)C=C GJNVFCGWBLSCAB-AWEZNQCLSA-N 0.000 description 3
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 3
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 3
- XNBNWZGTSKLCLL-LBPRGKRZSA-N 3-[(3-chloro-4-methoxyphenyl)methylamino]-5-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]pyrazine-2-carboxylic acid Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=CN=C1C(O)=O XNBNWZGTSKLCLL-LBPRGKRZSA-N 0.000 description 3
- PXYYGISXAWKTCT-UHFFFAOYSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-methylsulfanylpyrimidine-5-carboxylic acid Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(SC)=NC=C1C(O)=O PXYYGISXAWKTCT-UHFFFAOYSA-N 0.000 description 3
- 229930008281 A03AD01 - Papaverine Natural products 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 3
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 3
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 3
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 3
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 3
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 3
- 241000283973 Oryctolagus cuniculus Species 0.000 description 3
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 3
- ZMTSEFRGIOZFCH-UHFFFAOYSA-N [4-[(3-chloro-4-methoxyphenyl)methylamino]-2-methylsulfanylpyrimidin-5-yl]methanol Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(SC)=NC=C1CO ZMTSEFRGIOZFCH-UHFFFAOYSA-N 0.000 description 3
- 125000002947 alkylene group Chemical group 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 238000000354 decomposition reaction Methods 0.000 description 3
- UAOMVDZJSHZZME-UHFFFAOYSA-N diisopropylamine Chemical compound CC(C)NC(C)C UAOMVDZJSHZZME-UHFFFAOYSA-N 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 239000012530 fluid Substances 0.000 description 3
- 239000005457 ice water Substances 0.000 description 3
- 235000015097 nutrients Nutrition 0.000 description 3
- 229960001789 papaverine Drugs 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- ROSKZJGILXBSFM-UHFFFAOYSA-N pyrimidin-2-ylmethanamine Chemical compound NCC1=NC=CC=N1 ROSKZJGILXBSFM-UHFFFAOYSA-N 0.000 description 3
- 238000010992 reflux Methods 0.000 description 3
- 229960003310 sildenafil Drugs 0.000 description 3
- 238000010561 standard procedure Methods 0.000 description 3
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 3
- RMVRSNDYEFQCLF-UHFFFAOYSA-N thiophenol Chemical compound SC1=CC=CC=C1 RMVRSNDYEFQCLF-UHFFFAOYSA-N 0.000 description 3
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 3
- PLUKWDNGSYQOGK-CVMIBEPCSA-N (1s)-1-[4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[2-(hydroxymethyl)pyrrolidin-1-yl]pyrimidin-5-yl]pentan-1-ol Chemical compound CCCC[C@H](O)C1=CN=C(N2C(CCC2)CO)N=C1NCC1=CC=C(OC)C(Cl)=C1 PLUKWDNGSYQOGK-CVMIBEPCSA-N 0.000 description 2
- SSKYEGDFVZBPJV-JRZJBTRGSA-N (1s)-1-[4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[2-(hydroxymethyl)pyrrolidin-1-yl]pyrimidin-5-yl]prop-2-en-1-ol Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2C(CCC2)CO)=NC=C1[C@@H](O)C=C SSKYEGDFVZBPJV-JRZJBTRGSA-N 0.000 description 2
- SCYULBFZEHDVBN-UHFFFAOYSA-N 1,1-Dichloroethane Chemical compound CC(Cl)Cl SCYULBFZEHDVBN-UHFFFAOYSA-N 0.000 description 2
- HZNVUJQVZSTENZ-UHFFFAOYSA-N 2,3-dichloro-5,6-dicyano-1,4-benzoquinone Chemical compound ClC1=C(Cl)C(=O)C(C#N)=C(C#N)C1=O HZNVUJQVZSTENZ-UHFFFAOYSA-N 0.000 description 2
- QFRPWAKKEPGOKN-HNNXBMFYSA-N 2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]-4-phenylsulfanyl-n-(pyrimidin-2-ylmethyl)pyrimidine-5-carboxamide Chemical compound OC[C@@H]1CCCN1C(N=C1SC=2C=CC=CC=2)=NC=C1C(=O)NCC1=NC=CC=N1 QFRPWAKKEPGOKN-HNNXBMFYSA-N 0.000 description 2
- HWTGXYYMBMNJTF-NSHDSACASA-N 2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]-4-phenylsulfanylpyrimidine-5-carboxylic acid Chemical compound OC[C@@H]1CCCN1C1=NC=C(C(O)=O)C(SC=2C=CC=CC=2)=N1 HWTGXYYMBMNJTF-NSHDSACASA-N 0.000 description 2
- QRFOSHOPPFYNAH-UHFFFAOYSA-N 3,5-dichloropyrazine-2-carboxylic acid Chemical compound OC(=O)C1=NC=C(Cl)N=C1Cl QRFOSHOPPFYNAH-UHFFFAOYSA-N 0.000 description 2
- LWIJBYWKDPGHGO-UHFFFAOYSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-(6,8-dihydro-5h-imidazo[1,2-a]pyrazin-7-yl)pyrimidine-5-carboxylic acid Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2CC3=NC=CN3CC2)=NC=C1C(O)=O LWIJBYWKDPGHGO-UHFFFAOYSA-N 0.000 description 2
- KJYHORVTWSYSQP-LBPRGKRZSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]pyrimidine-5-carboxylic acid Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=NC=C1C(O)=O KJYHORVTWSYSQP-LBPRGKRZSA-N 0.000 description 2
- YVCMOTIPFAJOMI-UHFFFAOYSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-methylsulfanylpyrimidine-5-carbaldehyde Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(SC)=NC=C1C=O YVCMOTIPFAJOMI-UHFFFAOYSA-N 0.000 description 2
- 206010002383 Angina Pectoris Diseases 0.000 description 2
- 206010004446 Benign prostatic hyperplasia Diseases 0.000 description 2
- PVOAHINGSUIXLS-UHFFFAOYSA-N CN1CCNCC1 Chemical compound CN1CCNCC1 PVOAHINGSUIXLS-UHFFFAOYSA-N 0.000 description 2
- IIZBRUSPEBQBFD-UHFFFAOYSA-N CN1Cc2ncccc2CC1 Chemical compound CN1Cc2ncccc2CC1 IIZBRUSPEBQBFD-UHFFFAOYSA-N 0.000 description 2
- 206010007556 Cardiac failure acute Diseases 0.000 description 2
- 206010007558 Cardiac failure chronic Diseases 0.000 description 2
- 206010010774 Constipation Diseases 0.000 description 2
- 206010012735 Diarrhoea Diseases 0.000 description 2
- 208000000289 Esophageal Achalasia Diseases 0.000 description 2
- 206010020772 Hypertension Diseases 0.000 description 2
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 2
- 206010030136 Oesophageal achalasia Diseases 0.000 description 2
- KFSLWBXXFJQRDL-UHFFFAOYSA-N Peracetic acid Chemical compound CC(=O)OO KFSLWBXXFJQRDL-UHFFFAOYSA-N 0.000 description 2
- 208000004403 Prostatic Hyperplasia Diseases 0.000 description 2
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 2
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 2
- 201000000621 achalasia Diseases 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 229910000288 alkali metal carbonate Inorganic materials 0.000 description 2
- 150000008041 alkali metal carbonates Chemical class 0.000 description 2
- 150000008044 alkali metal hydroxides Chemical class 0.000 description 2
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 2
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 2
- 239000002168 alkylating agent Substances 0.000 description 2
- 229940100198 alkylating agent Drugs 0.000 description 2
- 208000006673 asthma Diseases 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 238000009835 boiling Methods 0.000 description 2
- 239000001569 carbon dioxide Substances 0.000 description 2
- 229910002092 carbon dioxide Inorganic materials 0.000 description 2
- 150000004697 chelate complex Chemical class 0.000 description 2
- 239000003638 chemical reducing agent Substances 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 230000004456 color vision Effects 0.000 description 2
- 238000004891 communication Methods 0.000 description 2
- 238000010511 deprotection reaction Methods 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 239000006196 drop Substances 0.000 description 2
- SRJBDGLSCPDXBL-UHFFFAOYSA-N ethyl 2,4-dichloropyrimidine-5-carboxylate Chemical compound CCOC(=O)C1=CN=C(Cl)N=C1Cl SRJBDGLSCPDXBL-UHFFFAOYSA-N 0.000 description 2
- JDLZATZOHSKDTL-ZDUSSCGKSA-N ethyl 2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]-4-phenylsulfanylpyrimidine-5-carboxylate Chemical compound CCOC(=O)C1=CN=C(N2[C@@H](CCC2)CO)N=C1SC1=CC=CC=C1 JDLZATZOHSKDTL-ZDUSSCGKSA-N 0.000 description 2
- SWSNZILYPHIOKE-UHFFFAOYSA-N ethyl 2-chloro-4-[(3-chloro-4-methoxyphenyl)methylamino]pyrimidine-5-carboxylate Chemical compound CCOC(=O)C1=CN=C(Cl)N=C1NCC1=CC=C(OC)C(Cl)=C1 SWSNZILYPHIOKE-UHFFFAOYSA-N 0.000 description 2
- VRWHVJWIDMTDBC-UHFFFAOYSA-N ethyl 2-chloro-4-phenylsulfanylpyrimidine-5-carboxylate Chemical compound CCOC(=O)C1=CN=C(Cl)N=C1SC1=CC=CC=C1 VRWHVJWIDMTDBC-UHFFFAOYSA-N 0.000 description 2
- HPWWGZRNBFATPZ-UHFFFAOYSA-N ethyl 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-methylsulfinylpyrimidine-5-carboxylate Chemical compound CCOC(=O)C1=CN=C(S(C)=O)N=C1NCC1=CC=C(OC)C(Cl)=C1 HPWWGZRNBFATPZ-UHFFFAOYSA-N 0.000 description 2
- SNNHLSHDDGJVDM-UHFFFAOYSA-N ethyl 4-chloro-2-methylsulfanylpyrimidine-5-carboxylate Chemical compound CCOC(=O)C1=CN=C(SC)N=C1Cl SNNHLSHDDGJVDM-UHFFFAOYSA-N 0.000 description 2
- JXDHLYZHVMLIGM-UHFFFAOYSA-N ethyl 6-[(3-chloro-4-methoxyphenyl)methylamino]-2-oxo-1h-pyrimidine-5-carboxylate Chemical compound CCOC(=O)C1=CN=C(O)N=C1NCC1=CC=C(OC)C(Cl)=C1 JXDHLYZHVMLIGM-UHFFFAOYSA-N 0.000 description 2
- 239000006260 foam Substances 0.000 description 2
- 238000005658 halogenation reaction Methods 0.000 description 2
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 2
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 2
- 125000002883 imidazolyl group Chemical group 0.000 description 2
- 230000001771 impaired effect Effects 0.000 description 2
- 239000012535 impurity Substances 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 2
- 239000010410 layer Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- VEDWLDKMRDJFNF-UHFFFAOYSA-N methyl 3,5-dichloropyrazine-2-carboxylate Chemical compound COC(=O)C1=NC=C(Cl)N=C1Cl VEDWLDKMRDJFNF-UHFFFAOYSA-N 0.000 description 2
- WQMGAFJLUWWXDI-ZDUSSCGKSA-N methyl 3-[(3-chloro-4-methoxyphenyl)methylamino]-5-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]pyrazine-2-carboxylate Chemical compound COC(=O)C1=NC=C(N2[C@@H](CCC2)CO)N=C1NCC1=CC=C(OC)C(Cl)=C1 WQMGAFJLUWWXDI-ZDUSSCGKSA-N 0.000 description 2
- VLOSIUOYOFRTJK-UHFFFAOYSA-N methyl 5-chloro-3-[(3-chloro-4-methoxyphenyl)methylamino]pyrazine-2-carboxylate Chemical compound COC(=O)C1=NC=C(Cl)N=C1NCC1=CC=C(OC)C(Cl)=C1 VLOSIUOYOFRTJK-UHFFFAOYSA-N 0.000 description 2
- 150000007522 mineralic acids Chemical class 0.000 description 2
- 125000002950 monocyclic group Chemical group 0.000 description 2
- 208000010125 myocardial infarction Diseases 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- SONNWYBIRXJNDC-VIFPVBQESA-N phenylephrine Chemical compound CNC[C@H](O)C1=CC=CC(O)=C1 SONNWYBIRXJNDC-VIFPVBQESA-N 0.000 description 2
- 229960001802 phenylephrine Drugs 0.000 description 2
- 239000002570 phosphodiesterase III inhibitor Substances 0.000 description 2
- 239000002587 phosphodiesterase IV inhibitor Substances 0.000 description 2
- XHXFXVLFKHQFAL-UHFFFAOYSA-N phosphoryl trichloride Chemical compound ClP(Cl)(Cl)=O XHXFXVLFKHQFAL-UHFFFAOYSA-N 0.000 description 2
- 229920001467 poly(styrenesulfonates) Polymers 0.000 description 2
- HVVNJUAVDAZWCB-UHFFFAOYSA-N prolinol Chemical compound OCC1CCCN1 HVVNJUAVDAZWCB-UHFFFAOYSA-N 0.000 description 2
- 230000002040 relaxant effect Effects 0.000 description 2
- 239000011347 resin Substances 0.000 description 2
- 229920005989 resin Polymers 0.000 description 2
- 229950005741 rolipram Drugs 0.000 description 2
- JQWHASGSAFIOCM-UHFFFAOYSA-M sodium periodate Chemical compound [Na+].[O-]I(=O)(=O)=O JQWHASGSAFIOCM-UHFFFAOYSA-M 0.000 description 2
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 description 2
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 2
- 239000013589 supplement Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 239000008096 xylene Substances 0.000 description 2
- FNGVAIIBEOSGGJ-NBFOIZRFSA-N (1s)-1-[4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[2-(hydroxymethyl)pyrrolidin-1-yl]pyrimidin-5-yl]ethanol Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2C(CCC2)CO)=NC=C1[C@H](C)O FNGVAIIBEOSGGJ-NBFOIZRFSA-N 0.000 description 1
- BJFPYGGTDAYECS-UHFFFAOYSA-N (3-chlorophenyl)methanamine Chemical compound NCC1=CC=CC(Cl)=C1 BJFPYGGTDAYECS-UHFFFAOYSA-N 0.000 description 1
- SOBFKNVNVLNAJQ-UHFFFAOYSA-N (4-methylmorpholin-2-yl)methanamine Chemical compound CN1CCOC(CN)C1 SOBFKNVNVLNAJQ-UHFFFAOYSA-N 0.000 description 1
- SSDGMKHZMNTWLS-UHFFFAOYSA-N 1,3,5-trimethylpyrazol-4-amine Chemical compound CC1=NN(C)C(C)=C1N SSDGMKHZMNTWLS-UHFFFAOYSA-N 0.000 description 1
- APWRZPQBPCAXFP-UHFFFAOYSA-N 1-(1-oxo-2H-isoquinolin-5-yl)-5-(trifluoromethyl)-N-[2-(trifluoromethyl)pyridin-4-yl]pyrazole-4-carboxamide Chemical compound O=C1NC=CC2=C(C=CC=C12)N1N=CC(=C1C(F)(F)F)C(=O)NC1=CC(=NC=C1)C(F)(F)F APWRZPQBPCAXFP-UHFFFAOYSA-N 0.000 description 1
- IDPURXSQCKYKIJ-UHFFFAOYSA-N 1-(4-methoxyphenyl)methanamine Chemical compound COC1=CC=C(CN)C=C1 IDPURXSQCKYKIJ-UHFFFAOYSA-N 0.000 description 1
- CUPPQUXJCANOHH-AWEZNQCLSA-N 1-[4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]pyrimidin-5-yl]-2-methoxyethanone Chemical compound COCC(=O)C1=CN=C(N2[C@@H](CCC2)CO)N=C1NCC1=CC=C(OC)C(Cl)=C1 CUPPQUXJCANOHH-AWEZNQCLSA-N 0.000 description 1
- ZUJREGZNWMELCJ-NTEVMMBTSA-N 1-[4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]pyrimidin-5-yl]-3-morpholin-4-ylpropan-1-one;dihydrochloride Chemical compound Cl.Cl.C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=NC=C1C(=O)CCN1CCOCC1 ZUJREGZNWMELCJ-NTEVMMBTSA-N 0.000 description 1
- XVUOVBWKQLIMHI-UHFFFAOYSA-N 1-[4-[(3-chloro-4-methoxyphenyl)methylamino]-2-methylsulfanylpyrimidin-5-yl]-2-diazoethanone Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(SC)=NC=C1C(=O)C=[N+]=[N-] XVUOVBWKQLIMHI-UHFFFAOYSA-N 0.000 description 1
- AJYDRPIYBNVISH-UHFFFAOYSA-N 1-[4-[(3-chloro-4-methoxyphenyl)methylamino]-2-methylsulfanylpyrimidin-5-yl]-2-methoxyethanone Chemical compound COCC(=O)C1=CN=C(SC)N=C1NCC1=CC=C(OC)C(Cl)=C1 AJYDRPIYBNVISH-UHFFFAOYSA-N 0.000 description 1
- PJUPKRYGDFTMTM-UHFFFAOYSA-N 1-hydroxybenzotriazole;hydrate Chemical compound O.C1=CC=C2N(O)N=NC2=C1 PJUPKRYGDFTMTM-UHFFFAOYSA-N 0.000 description 1
- LSEAAPGIZCDEEH-UHFFFAOYSA-N 2,6-dichloropyrazine Chemical compound ClC1=CN=CC(Cl)=N1 LSEAAPGIZCDEEH-UHFFFAOYSA-N 0.000 description 1
- FOYHNROGBXVLLX-UHFFFAOYSA-N 2,6-diethylaniline Chemical compound CCC1=CC=CC(CC)=C1N FOYHNROGBXVLLX-UHFFFAOYSA-N 0.000 description 1
- PXYUJKLVETYYJO-UHFFFAOYSA-N 2-(4-methylmorpholin-3-yl)ethanamine Chemical compound CN1CCOCC1CCN PXYUJKLVETYYJO-UHFFFAOYSA-N 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-N 2-Methylbenzenesulfonic acid Chemical compound CC1=CC=CC=C1S(O)(=O)=O LBLYYCQCTBFVLH-UHFFFAOYSA-N 0.000 description 1
- SLDZWDGMJFBYLK-KRWDZBQOSA-N 2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]-4-[(4-methoxyphenyl)methylamino]-n-(pyrimidin-2-ylmethyl)pyrimidine-5-carboxamide Chemical compound C1=CC(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=NC=C1C(=O)NCC1=NC=CC=N1 SLDZWDGMJFBYLK-KRWDZBQOSA-N 0.000 description 1
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical compound CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 description 1
- QFRPWAKKEPGOKN-UHFFFAOYSA-N 2-[2-(hydroxymethyl)pyrrolidin-1-yl]-4-phenylsulfanyl-n-(pyrimidin-2-ylmethyl)pyrimidine-5-carboxamide Chemical compound OCC1CCCN1C(N=C1SC=2C=CC=CC=2)=NC=C1C(=O)NCC1=NC=CC=N1 QFRPWAKKEPGOKN-UHFFFAOYSA-N 0.000 description 1
- VNJOEUSYAMPBAK-UHFFFAOYSA-N 2-methylbenzenesulfonic acid;hydrate Chemical compound O.CC1=CC=CC=C1S(O)(=O)=O VNJOEUSYAMPBAK-UHFFFAOYSA-N 0.000 description 1
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- JNZYGZGILHHLDB-ZENAZSQFSA-N 3-[(3-chloro-4-methoxyphenyl)methylamino]-5-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]-n-[(4-methylmorpholin-2-yl)methyl]pyrazine-2-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=CN=C1C(=O)NCC1OCCN(C)C1 JNZYGZGILHHLDB-ZENAZSQFSA-N 0.000 description 1
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 description 1
- MRXTVLLRGYRJQI-HNNXBMFYSA-N 4-[(3-chloro-4-hydroxyphenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]-n-(pyrimidin-2-ylmethyl)pyrimidine-5-carboxamide Chemical compound OC[C@@H]1CCCN1C(N=C1NCC=2C=C(Cl)C(O)=CC=2)=NC=C1C(=O)NCC1=NC=CC=N1 MRXTVLLRGYRJQI-HNNXBMFYSA-N 0.000 description 1
- VFUOOSBEUXOHJA-UHFFFAOYSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-(6,8-dihydro-5h-imidazo[1,2-a]pyrazin-7-yl)-n-[(4-methylmorpholin-2-yl)methyl]pyrimidine-5-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2CC3=NC=CN3CC2)=NC=C1C(=O)NCC1OCCN(C)C1 VFUOOSBEUXOHJA-UHFFFAOYSA-N 0.000 description 1
- SFFJQKQQGYMNOB-INIZCTEOSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]-n-pyrimidin-5-ylpyrimidine-5-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=NC=C1C(=O)NC1=CN=CN=C1 SFFJQKQQGYMNOB-INIZCTEOSA-N 0.000 description 1
- FLFAFGBEZTUCCL-UHFFFAOYSA-N 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-methylsulfanyl-n-pyrimidin-5-ylpyrimidine-5-carboxamide Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(SC)=NC=C1C(=O)NC1=CN=CN=C1 FLFAFGBEZTUCCL-UHFFFAOYSA-N 0.000 description 1
- ICJLDACZRSVDAT-KRWDZBQOSA-N 4-[(3-chlorophenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]-n-(pyrimidin-2-ylmethyl)pyrimidine-5-carboxamide Chemical compound OC[C@@H]1CCCN1C(N=C1NCC=2C=C(Cl)C=CC=2)=NC=C1C(=O)NCC1=NC=CC=N1 ICJLDACZRSVDAT-KRWDZBQOSA-N 0.000 description 1
- 125000004938 5-pyridyl group Chemical group N1=CC=CC(=C1)* 0.000 description 1
- TYNSUEXNGLNQSS-UHFFFAOYSA-N 6-carbamoyl-5-hydroxy-4-methoxy-7,8-dihydro-3h-pyrrolo[3,2-e]indole-2-carboxylic acid Chemical compound C1=2C=C(C(O)=O)NC=2C(OC)=C(O)C2=C1CCN2C(N)=O TYNSUEXNGLNQSS-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- NCKVNRXIOFXMEB-UHFFFAOYSA-N CC(CCC1OC)CC1Cl Chemical compound CC(CCC1OC)CC1Cl NCKVNRXIOFXMEB-UHFFFAOYSA-N 0.000 description 1
- UNCTXUJDBIQKKF-UHFFFAOYSA-N CN(CC1)Cc2c1nc(CN(CC1)CC3=C1NNC3)[s]2 Chemical compound CN(CC1)Cc2c1nc(CN(CC1)CC3=C1NNC3)[s]2 UNCTXUJDBIQKKF-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- BHPQYMZQTOCNFJ-UHFFFAOYSA-N Calcium cation Chemical compound [Ca+2] BHPQYMZQTOCNFJ-UHFFFAOYSA-N 0.000 description 1
- 102000000584 Calmodulin Human genes 0.000 description 1
- 108010041952 Calmodulin Proteins 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- TWGNOYAGHYUFFR-UHFFFAOYSA-N Cc1cncnc1 Chemical compound Cc1cncnc1 TWGNOYAGHYUFFR-UHFFFAOYSA-N 0.000 description 1
- RQSCFNPNNLWQBJ-UHFFFAOYSA-N Cc1nnc[s]1 Chemical compound Cc1nnc[s]1 RQSCFNPNNLWQBJ-UHFFFAOYSA-N 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- AGNXGTYMZXJALS-UHFFFAOYSA-N ClC=1C=C(CNC2=NC=NC=C2C(=O)OCC)C=CC1OC Chemical compound ClC=1C=C(CNC2=NC=NC=C2C(=O)OCC)C=CC1OC AGNXGTYMZXJALS-UHFFFAOYSA-N 0.000 description 1
- 241000557626 Corvus corax Species 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- YXHKONLOYHBTNS-UHFFFAOYSA-N Diazomethane Chemical compound C=[N+]=[N-] YXHKONLOYHBTNS-UHFFFAOYSA-N 0.000 description 1
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 206010057671 Female sexual dysfunction Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 239000007818 Grignard reagent Substances 0.000 description 1
- NYHBQMYGNKIUIF-UUOKFMHZSA-N Guanosine Chemical compound C1=NC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O NYHBQMYGNKIUIF-UUOKFMHZSA-N 0.000 description 1
- 229920003115 HPC-SL Polymers 0.000 description 1
- 206010019233 Headaches Diseases 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- 239000012448 Lithium borohydride Substances 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 239000012425 OXONE® Substances 0.000 description 1
- JWIPGAFCGUDKEY-UHFFFAOYSA-L O[Cr](Cl)(=O)=O.C1=CC=NC=C1 Chemical compound O[Cr](Cl)(=O)=O.C1=CC=NC=C1 JWIPGAFCGUDKEY-UHFFFAOYSA-L 0.000 description 1
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 1
- FXTTXRHGRZVUAG-UHFFFAOYSA-N P.Cl.Cl.Cl.Cl.Cl Chemical compound P.Cl.Cl.Cl.Cl.Cl FXTTXRHGRZVUAG-UHFFFAOYSA-N 0.000 description 1
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 1
- 229940123932 Phosphodiesterase 4 inhibitor Drugs 0.000 description 1
- 229940099471 Phosphodiesterase inhibitor Drugs 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- DORMTBIPKNPJPY-UHFFFAOYSA-N acetic acid;iodobenzene Chemical compound CC(O)=O.IC1=CC=CC=C1 DORMTBIPKNPJPY-UHFFFAOYSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 150000001350 alkyl halides Chemical class 0.000 description 1
- DOAYJPJLHNHQSU-UHFFFAOYSA-N aluminum;lithium;hydrate Chemical compound [Li].O.[Al] DOAYJPJLHNHQSU-UHFFFAOYSA-N 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 238000005349 anion exchange Methods 0.000 description 1
- 239000006286 aqueous extract Substances 0.000 description 1
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 description 1
- 239000012131 assay buffer Substances 0.000 description 1
- 229910052788 barium Inorganic materials 0.000 description 1
- DSAJWYNOEDNPEQ-UHFFFAOYSA-N barium atom Chemical compound [Ba] DSAJWYNOEDNPEQ-UHFFFAOYSA-N 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- MVIOINXPSFUJEN-UHFFFAOYSA-N benzenesulfonic acid;hydrate Chemical compound O.OS(=O)(=O)C1=CC=CC=C1 MVIOINXPSFUJEN-UHFFFAOYSA-N 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- 125000002619 bicyclic group Chemical group 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 230000000740 bleeding effect Effects 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Chemical compound BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- KOAVNZURYJRNDR-UHFFFAOYSA-N bromoethene;magnesium Chemical compound [Mg].BrC=C KOAVNZURYJRNDR-UHFFFAOYSA-N 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 229910001424 calcium ion Inorganic materials 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 235000013736 caramel Nutrition 0.000 description 1
- 235000011089 carbon dioxide Nutrition 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 150000001728 carbonyl compounds Chemical class 0.000 description 1
- 238000010531 catalytic reduction reaction Methods 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 238000007906 compression Methods 0.000 description 1
- 230000006835 compression Effects 0.000 description 1
- 210000002808 connective tissue Anatomy 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- ZWWWLCMDTZFSOO-UHFFFAOYSA-N diethoxyphosphorylformonitrile Chemical compound CCOP(=O)(C#N)OCC ZWWWLCMDTZFSOO-UHFFFAOYSA-N 0.000 description 1
- 125000005052 dihydropyrazolyl group Chemical group N1(NCC=C1)* 0.000 description 1
- 125000005053 dihydropyrimidinyl group Chemical group N1(CN=CC=C1)* 0.000 description 1
- 229940043279 diisopropylamine Drugs 0.000 description 1
- MKRTXPORKIRPDG-UHFFFAOYSA-N diphenylphosphoryl azide Chemical compound C=1C=CC=CC=1P(=O)(N=[N+]=[N-])C1=CC=CC=C1 MKRTXPORKIRPDG-UHFFFAOYSA-N 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- DQYBDCGIPTYXML-UHFFFAOYSA-N ethoxyethane;hydrate Chemical compound O.CCOCC DQYBDCGIPTYXML-UHFFFAOYSA-N 0.000 description 1
- ZGWRPRAWZHNEGN-UHFFFAOYSA-N ethyl 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-(6,8-dihydro-5h-imidazo[1,2-a]pyrazin-7-yl)pyrimidine-5-carboxylate Chemical compound CCOC(=O)C1=CN=C(N2CC3=NC=CN3CC2)N=C1NCC1=CC=C(OC)C(Cl)=C1 ZGWRPRAWZHNEGN-UHFFFAOYSA-N 0.000 description 1
- NUTJUOHYJBWTSH-AWEZNQCLSA-N ethyl 4-[(3-chloro-4-methoxyphenyl)methylamino]-2-[(2s)-2-(hydroxymethyl)pyrrolidin-1-yl]pyrimidine-5-carboxylate Chemical compound CCOC(=O)C1=CN=C(N2[C@@H](CCC2)CO)N=C1NCC1=CC=C(OC)C(Cl)=C1 NUTJUOHYJBWTSH-AWEZNQCLSA-N 0.000 description 1
- DEFVIWRASFVYLL-UHFFFAOYSA-N ethylene glycol bis(2-aminoethyl)tetraacetic acid Chemical compound OC(=O)CN(CC(O)=O)CCOCCOCCN(CC(O)=O)CC(O)=O DEFVIWRASFVYLL-UHFFFAOYSA-N 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 238000005469 granulation Methods 0.000 description 1
- 230000003179 granulation Effects 0.000 description 1
- 150000004795 grignard reagents Chemical class 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 230000026030 halogenation Effects 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 231100000869 headache Toxicity 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- 230000003301 hydrolyzing effect Effects 0.000 description 1
- BNSOYWDFFBDEFB-UHFFFAOYSA-L hydroxy-(hydroxy(dioxo)chromio)oxy-dioxochromium;pyridine Chemical compound C1=CC=NC=C1.O[Cr](=O)(=O)O[Cr](O)(=O)=O BNSOYWDFFBDEFB-UHFFFAOYSA-L 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 235000015110 jellies Nutrition 0.000 description 1
- 238000012417 linear regression Methods 0.000 description 1
- 239000000865 liniment Substances 0.000 description 1
- 239000012280 lithium aluminium hydride Substances 0.000 description 1
- 229910003002 lithium salt Inorganic materials 0.000 description 1
- 159000000002 lithium salts Chemical class 0.000 description 1
- ANYSGBYRTLOUPO-UHFFFAOYSA-N lithium tetramethylpiperidide Chemical compound [Li]N1C(C)(C)CCCC1(C)C ANYSGBYRTLOUPO-UHFFFAOYSA-N 0.000 description 1
- JCIVHYBIFRUGKO-UHFFFAOYSA-N lithium;2,2,6,6-tetramethylpiperidine Chemical compound [Li].CC1(C)CCCC(C)(C)N1 JCIVHYBIFRUGKO-UHFFFAOYSA-N 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 1
- 235000019341 magnesium sulphate Nutrition 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- DVSDBMFJEQPWNO-UHFFFAOYSA-N methyllithium Chemical compound C[Li] DVSDBMFJEQPWNO-UHFFFAOYSA-N 0.000 description 1
- 230000003020 moisturizing effect Effects 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- 210000000214 mouth Anatomy 0.000 description 1
- 210000002464 muscle smooth vascular Anatomy 0.000 description 1
- PSHKMPUSSFXUIA-UHFFFAOYSA-N n,n-dimethylpyridin-2-amine Chemical compound CN(C)C1=CC=CC=N1 PSHKMPUSSFXUIA-UHFFFAOYSA-N 0.000 description 1
- OUMGIYIBWRLOAF-UHFFFAOYSA-N n,n-dimethylpyrimidin-2-amine Chemical compound CN(C)C1=NC=CC=N1 OUMGIYIBWRLOAF-UHFFFAOYSA-N 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 239000007923 nasal drop Substances 0.000 description 1
- 229940100662 nasal drops Drugs 0.000 description 1
- 238000011587 new zealand white rabbit Methods 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 210000003899 penis Anatomy 0.000 description 1
- 238000010647 peptide synthesis reaction Methods 0.000 description 1
- 150000004965 peroxy acids Chemical class 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- 125000005936 piperidyl group Chemical group 0.000 description 1
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 1
- 239000011736 potassium bicarbonate Substances 0.000 description 1
- 229910000028 potassium bicarbonate Inorganic materials 0.000 description 1
- 235000015497 potassium bicarbonate Nutrition 0.000 description 1
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 description 1
- 229940086066 potassium hydrogencarbonate Drugs 0.000 description 1
- 239000012286 potassium permanganate Substances 0.000 description 1
- OKBMCNHOEMXPTM-UHFFFAOYSA-M potassium peroxymonosulfate Chemical compound [K+].OOS([O-])(=O)=O OKBMCNHOEMXPTM-UHFFFAOYSA-M 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- 125000000246 pyrimidin-2-yl group Chemical group [H]C1=NC(*)=NC([H])=C1[H] 0.000 description 1
- FVLAYJRLBLHIPV-UHFFFAOYSA-N pyrimidin-5-amine Chemical compound NC1=CN=CN=C1 FVLAYJRLBLHIPV-UHFFFAOYSA-N 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 238000006722 reduction reaction Methods 0.000 description 1
- 230000001850 reproductive effect Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 210000001525 retina Anatomy 0.000 description 1
- 230000002207 retinal effect Effects 0.000 description 1
- 206010039083 rhinitis Diseases 0.000 description 1
- HJORMJIFDVBMOB-UHFFFAOYSA-N rolipram Chemical compound COC1=CC=C(C2CC(=O)NC2)C=C1OC1CCCC1 HJORMJIFDVBMOB-UHFFFAOYSA-N 0.000 description 1
- 239000012047 saturated solution Substances 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 208000012201 sexual and gender identity disease Diseases 0.000 description 1
- 208000015891 sexual disease Diseases 0.000 description 1
- 210000002460 smooth muscle Anatomy 0.000 description 1
- 239000003998 snake venom Substances 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 239000012453 solvate Substances 0.000 description 1
- 208000010110 spontaneous platelet aggregation Diseases 0.000 description 1
- 239000006190 sub-lingual tablet Substances 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- IXZDIALLLMRYOU-UHFFFAOYSA-N tert-butyl hypochlorite Chemical compound CC(C)(C)OCl IXZDIALLLMRYOU-UHFFFAOYSA-N 0.000 description 1
- 239000012085 test solution Substances 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 238000004809 thin layer chromatography Methods 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 231100000048 toxicity data Toxicity 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/46—Two or more oxygen, sulphur or nitrogen atoms
- C07D239/48—Two nitrogen atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/10—Drugs for genital or sexual disorders; Contraceptives for impotence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/36—Radicals substituted by singly-bound nitrogen atoms
- C07D213/40—Acylated substituent nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/04—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D295/12—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by singly or doubly bound nitrogen atoms
- C07D295/125—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by singly or doubly bound nitrogen atoms with the ring nitrogen atoms and the substituent nitrogen atoms attached to the same carbon chain, which is not interrupted by carbocyclic rings
- C07D295/13—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by singly or doubly bound nitrogen atoms with the ring nitrogen atoms and the substituent nitrogen atoms attached to the same carbon chain, which is not interrupted by carbocyclic rings to an acyclic saturated chain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains two hetero rings
- C07D513/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/645—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having two nitrogen atoms as the only ring hetero atoms
- C07F9/6509—Six-membered rings
- C07F9/6512—Six-membered rings having the nitrogen atoms in positions 1 and 3
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/6558—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom containing at least two different or differently substituted hetero rings neither condensed among themselves nor condensed with a common carbocyclic ring or ring system
- C07F9/65583—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom containing at least two different or differently substituted hetero rings neither condensed among themselves nor condensed with a common carbocyclic ring or ring system each of the hetero rings containing nitrogen as ring hetero atom
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Diabetes (AREA)
- Endocrinology (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Vascular Medicine (AREA)
- Pulmonology (AREA)
- Gynecology & Obstetrics (AREA)
- Reproductive Health (AREA)
- Emergency Medicine (AREA)
- Obesity (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Pyridine Compounds (AREA)
- Compositions Of Macromolecular Compounds (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Hydrogenated Pyridines (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
Изобретение относится к новым ароматическим азотсодержащим 6-членным циклическим соединениям формулы (I) или их фармацевтически приемлемым солям, демонстрирующим отличную селективную PDE V ингибирующую активность. Следовательно, указанные соединения могут быть использованы для лечения, например, дисфункции, связанной с нарушением эрекции, диабетического гастропареза, легочной гипертонии. В соединениях формулы (I):
кольцо А представляет собой замещенную 5- или 6-членную азотсодержащую гетеромоноциклическую группу, имеющую 1-2 атома азота и также возможно содержащую атом кислорода или серы в гетероциклическом остатке, или 8-10-членную азотсодержащую гетеробициклическую группу, имеющую 1-3 атома азота и также возможно содержащую атом кислорода или серы в гетероциклическом остатке; R1 представляет собой (1) замещенную C1-6алкильную группу, которая может быть необязательно замещена, (2) группу формулы -NH-Q-R3 (в которой R3 представляет собой замещенную 5- или 6-членную азотсодержащую гетеромоноциклическую группу, имеющую 1-2 атома азота, и также возможно содержащую атом кислорода или серы в гетероциклическом остатке, или 8-10-членную азотсодержащую гетеробициклическую группу, имеющую 1-3 атома азота и также возможно содержащую атом кислорода или серы в гетероциклическом остатке; и Q представляет собой C1-6алкиленовую группу или простую связь) или (3) группу формулы: -NH-R4 (в которой R4 представляет собой замещенную С3-8циклоалкильную группу, которая может быть необязательно замещена группой, выбранной из группы, состоящей из гидроксигруппы, C1-6алкоксигруппы и пиримидинилоксигруппы); R2 представляет собой замещенную арильную группу, которая может быть необязательно замещена группой, выбранной из группы, состоящей из C1-6алкоксигруппы, атома галогена, цианогруппы, нитрогруппы, гидроксигруппы и C1-6алкильной группы; один из Y и Z представляет собой группу формулы =СН—, а другой представляет собой группу формулы =N-. 2 с. и 23 з.п. ф-лы, 10 табл.
Description
Область техники, к которой относится изобретение
Настоящее изобретение относится к новому ароматическому азотсодержащему 6-членному циклическому соединению, проявляющему cGMP специфичную ингибиторную активность по отношению к фосфодиэстеразе (PDE) (PDE V ингибиторная активность) и которое может быть полезным в качестве лекарственного средства, а также способу его получения.
Предшествующий уровень техники
Вообще известно, что cGMP, который является межклеточным вторичным связующим, разрушается и инактивируется фосфодиэстеразой, которая широко распространена во многих типах клеток и тканей живого организма и, когда снижается активность указанной PDE, уровень cGMP в клетках повышается, как следствие этого, возникают различные виды фармакологическиой активности, например расслабление васкулярной гладкой мышцы, расслабление бронхиальной гладкой мышцы и ингибирование аггрегации тромбоцитов.
Кроме того, сообщалось, что такие cGMP специфичные PDE ингибиторы (т.е. PDE V ингибиторы) пригодны для лечения заболеваний, вызванных функциональными расстройствами cGMP-связи, включая гипертонию, стенокардию, инфаркт миокарды, хроническую или острую сердечную недостаточность, легочную гипертонию и т.д. (см. WO 96/05176 и т.д.), а также простатическую гиперплазию (AU 9955977). Сообщалось также, что PDE V ингибиторы могут использоваться для лечения женских сексуальных расстройств (Vemulapalli и др. Life Sciences, 67, 23-29 (2000)), диабетического гастропареза (Watkins и др. J. Clin. Invest. 106: 373-384 (2000)), ахалазии (Bortolotti и др. Gastroenterology; 118: 253-257 (2000)), диареи (Mule и др. Вr. J. Pharmacol., 127, 514-520 (1999)), запора (Bakre и др. J. Cell. Biochem. 77: 159-167 (2000)) и астмы (Turner и др. Br. J. Pharmacol., 111, 1198-1204 (1994)).
Кроме того, сообщалось, что 1-[4-этокси-3-(6,7-дигидро-1-метил-7-оксо-3-пропил-1Н-пиразоло[4,3-d]пиримидин-5-ил)фенилсульфонил]-4-метилпиперазин [общее название: силденафил], обладающий PDE V ингибиторной активностью, пригоден для лечения заболеваний, таких как нарушение эрекции (детородная импотенция) и т.д. (см. Boolell и др. Journal Urology, Supplement, vol. 155, no. 5, р. 495А739 (1996); Terrett и др. Bioorganic & Medicinal Chemistry Letters, vol. 6, no. 15, p. 1819 (1996); и Ballard и др. British Journal Pharmacology, Proceeding Supplement, vol. 118, p. 153(1996)).
Однако силденафил, как сообщалось, вызывает побочные эффекты, такие как головная боль, румянец, кишечные расстройства, ринит, нарушение восприятия цвета, продление эрекции и т.д. (Irwin и др. New England Journal Medicine, vol. 338, no. 20, p. 1397-1404 (1998); Morales и др. International Journal Impotence Research, vol. 10, no. 2, p. 69-73 (1998); и Goldenberg, Clinical Therapeutics, vol. 20, no. 6, p. 1033-1048 (1998)).
К тому же, как было показано в опытах на собаках, воздействие силденафила на ткани сетчатки в отношении ее ответа на свет и его PDE VI ингибиторная активность находятся в связи друг с другом (Morales и др. International Journal Impotence Research, vol. 10, no. 2, p. 69-73 (1998)), при этом было показано, что PDE VI на сетчатке играет важную роль с точки зрения чувствительности к свету (Morrales и др. International Journal of Impotence Research, vol. 10, no. 2, p. 69-73 (1998); Estrade и др. European Journal of Pharmacology, vol. 352, p. 157-163 (1998)).
Сущность изобретения
Объектом настоящего изобретения является новое ароматическое азотсодержащее 6-членное циклическое соединение, проявляющее отличную ингибиторную активность по отношению к фосфодиэстеразе V (PDE V), которое может быть полезным в качестве лекарственного средства для профилактики или лечения нарушения эрекции с небольшими побочными эффектами. Другой объект настоящего изобретения относится к способу получения указанного нового ароматического азотсодержащего 6-членного циклического соединения.
Настоящее изобретение относится к ароматическому азотсодержащему 6-членному циклическому соединению формулы (I):
где кольцо А представляет собой замещенную или незамещенную азотсодержащую гетероциклическую группу; R1 представляет собой замещенную или незамещенную низшую алкильную группу, группу формулы: -NH-Q-R3 (в которой R3 представляет собой замещенную или незамещенную азотсодержащую гетероциклическую группу и Q представляет собой низшую алкиленовую группу или простую связь) или группу формулы: -NH-R4 (в которой R4 представляет собой замещенную или незамещенную циклоалкильную группу); R2 представляет собой замещенную или незамещенную арильную группу; один из Y и Z представляет собой группу формулы: =СН-, и другой представляет собой группу формулы: =N- или его фармацевтически приемлемую соль, а также способ его получения.
Среди соединений (I) настоящего изобретения азотсодержащая гетероциклическая группа "замещенной или незамещенной азотсодержащей гетероциклической группы" для кольца А представляет собой от 5- до 10-членную моноциклическую или бициклическую азотсодержащую гетероциклическую группу, более предпочтительно 5- или 6-членную азотсодержащую гетеромоноциклическую группу и от 8- до 10-членную азотсодержащую гетеробициклическую группу и наиболее предпочтительно 5- или 6-членную неароматическую азотсодержащую гетеромоноциклическую группу, такую как пирролидинильная группа, пиперазинильная группа, пиперидинильная группа, морфолиногруппа и т.д., 5- или 6-членную ароматическую азотсодержащую гетеромоноциклическую группу, такую как имидазолильная группа, пирролильная группа и т.д., и азотсодержащую гетеробициклическую группу, такую как 6,7-дигидро-5Н-пирроло[3,4-b]пиридин-6-ильная группа, 5,6,7,8-тетрагидроимидазо[1,2-]-пиразин-7-ильная группа, 5,6,7,8-тетрагидро-1,7-нафтиридин-7-ильная группа, 1,2,3,4-тетрагидро-2-изохинолинильная группа, 1Н-2,3,4,5,6,7-гексагидропиразоло[4,3-с]пиридин-5-ильная группа, 4,5,6,7-тетрагидротиазоло[5,4-с]пиридин-6-ильная группа, 5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-6-ильная группа, 4,5,6,7-тетрагидро-3Н-имидазо[4,5-с]пиридин-3-ильная группа и т.д.
Азотсодержащая гетероциклическая группа "замещенной или незамещенной азотсодержащей гетероциклической группы" для R3 представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу или от 8- до 10-членную азотсодержащую гетеробициклическую группу, например 5- или 6-членную неароматическую азотсодержащую гетеромоноциклическую группу, такую как морфолинильная группа, пиперазинильная группа, пиперидильная группа, тиадиазолильная группа, дигидропиримидинильная группа, дигидропиразолильная группа, 5- или 6-членную ароматическую азотсодержащую гетеромоноциклическую группу, такую как пиримидинильная группа, пиридазинильная группа, пиридильная группа, пиразолильная группа, имидазолильная группа, оксазолильная группа, тиазолильная группа, пиразинильная группа, и от 8- до 10-членную азотсодержащую гетеробициклическую группу, такую как бензотиазолильная группа, хинолильная группа, дигидробензоксазолильная группа и т.д.
Заместитель "замещенной или незамещенной азотсодержащей гетероциклической группы" для кольца А и R представляет собой, например, (1) низшую алкильную группу, (2) гидроксизамещенную низшую алкильную группу, (3) формильную группу, (4) оксогруппу, (5) аминогруппу, (6) ди-(низший алкил)аминогруппу, (7) гидроксигруппу, (8) низшую алкоксигруппу, (9) низшую алкоксикарбонильную группу, (10) низшую алкоксизамещенную низшую алканоильную группу, (11) низшую алканоильную группу, (12) цианозамещенную низшую алкильную группу и (13) пиримидинильную группу, замещенные (i) бензиламиногруппой, замещенной атомом галогена и низшей алкоксигруппой, и (ii) циклоалкилкарбамоильной группой, замещенной гидроксигруппой и т.д.
Арильная группа "замещенной или незамещенной арильной группы" для R2 представляет собой, например, от 5- до 10-членную моноциклическую или бициклическую ароматическую углеводородную группу, такую как фенильная группа, нафтильная группа и т.д.
Заместитель "замещенной или незамещенной арильной группы" для R2 представляет собой, например, низшую алкоксигруппу, атом галогена, цианогруппу, нитрогруппу, гидроксигруппу, низшую алкильную группу и т.д.
Заместитель "замещенной или незамещенной низшей алкильной группы" для R1 и заместитель "замещенной или незамещенной циклоалкильной группы" для R4 представляет собой, например, низшую алкоксигруппу, гидроксигруппу, морфолинильную группу, низшую алкилсульфонильную группу, ди-(низший алкил)фосфиногруппу, ди-(низший алкил)аминогруппу, пиримидинилзамещенную низшую алкиламиногруппу, пиридильную группу, пиридиламиногруппу, низшую алкилзамещенную пиперазинильную группу, пиримидинилоксигруппу и т.д.
В соответствии с настоящим изобретением "низшая алкильная группа" обозначает линейную или разветвленную алкильную группу, имеющую от 1 до 6 атомов углерода, такую как метил, этил, пропил изопропил, бутил изобутил, трет-бутил и т.д. "Низшая алкоксигруппа" обозначает линейную или разветвленную алкоксигруппу, имеющую от 1 до 6 атомов углерода, такую как метокси, этокси, пропокси изопропилокси, бутилокси изобутилокси, трет-бутилокси и т.д.
"Циклоалкильная группа" обозначает циклоалкил, имеющий от 3 до 8 атомов углерода, такой как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.д. "Низшая алкиленовая группа" обозначает линейную или разветвленную алкиленовую группу, имеющую от 1 до 6 атомов углерода, такую как метилен, этилен, триметилен и т.д.
"Атом галогена" обозначает атом фтора, атом хлора, атом брома или атом йода.
Среди соединений (I) настоящего изобретения предпочтительными являются соединения формулы (I), в которых азотсодержащая гетероциклическая группа "замещенной или незамещенной азотсодержащей гетероциклической группы" для кольца А представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу или от 8- до 10-членную азотсодержащую гетеробициклическую группу и заместитель указанной "замещенной или незамещенной азотсодержащей гетероциклической группы" выбирают из группы, состоящей из (1) низшей алкильной группы, (2) гидроксизамещенной низшей алкильной группы, (3) формильной группы, (4) оксогруппы, (5) аминогруппы, (6) гидроксигруппы, (7) низшей алкоксикарбонильной группы и (8) пиримидинильной группы, замещенной (i) бензиламиногруппой, замещенной атомом галогена и низшей алкоксигруппой, и (ii) циклоалкилкарбамоильной группой, замещенной гидроксигруппой, R1 представляет собой низшую алкильную группу, которая может быть необязательно замещена группой, выбранной из группы, состоящей из низшей алкоксигруппы, гидроксигруппы, морфолинильной группы, низшей алкилсульфонильной группы, ди-(низший алкил)фосфиногруппы, ди-(низший алкил)аминогруппы, пиримидинилзамещенной низшей алкиламиногруппы, пиридильной группы, пиридиламиногруппы и низшей алкилзамещенной пиперазинильной группы, группу формулы: -NH-Q-R3 или группу формулы: -NH-R4, азотсодержащая гетероциклическая группа "замещенной или незамещенной азотсодержащей гетероциклической группы" для R3 представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу или от 8- до 10-членную азотсодержащую гетеробициклическую группу и заместитель указанной "замещенной или незамещенной азотсодержащей гетероциклической группы" выбирают из группы, состоящей из низшей алкильной группы, гидроксизамещенной низшей алкильной группы, оксогруппы, аминогруппы, ди-(низший алкил)аминогруппы, низшей алканоильной группы и цианозамещенной низшей алкильной группы, R4 представляет собой циклоалкильную группу, замещенную группой, выбранной из группы, состоящей из гидроксигруппы, низшей алкоксигруппы и пиримидинилоксигруппы, R2 представляет собой фенильную группу, замещенную группой, выбранной из группы, состоящей из низшей алкоксигруппы, атома галогена, цианогруппы, нитрогруппы, гидроксигруппы и низшей алкильной группы.
В частности, предпочтительными соединениями настоящего изобретения являются соединения формулы (I), в которых азотсодержащая гетероциклическая группа "замещенной или незамещенной азотсодержащей гетероциклической группы" для кольца А представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу формулы:
или азотсодержащую гетеробициклическую группу следующей формулы, где указанная выше 5- или 6-членная азотсодержащая гетеромоноциклическая группа и 5- или 6-членная циклическая группа являются конденсированными:
и азотсодержащая гетероциклическая группа "замещенной или незамещенной азотсодержащей гетероциклической группы" для R3 представляет собой неароматическую азотсодержащую гетеромоноциклическую группу формулы:
или ароматическую азотсодержащую гетероциклическую группу формулы:
Среди соединений (I) настоящего изобретения другими предпочтительными соединениями являются соединения формулы (I), где азотсодержащая гетероциклическая группа "замещенной или незамещенной азотсодержащей гетероциклической группы" для кольца А представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу или от 8- до 10-членную азотсодержащую гетеробициклическую группу и заместитель указанной "замещенной или незамещенной азотсодержащей гетероциклической группы" выбирают из группы, состоящей из низшей алкильной группы, гидроксизамещенной низшей алкильной группы, формильной группы и оксогруппы, R1 представляет собой низшую алкильную группу, которая может быть необязательно замещена группой, выбранной из группы, состоящей из низшей алкоксигруппы и морфолинильной группы, группу формулы: -NH-Q-R3 или группу формулы: -NH-R4, "замещенная или незамещенная азотсодержащая гетероциклическая группа" для R3 представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу, которая может быть необязательно замещена низшей алкильной группой, R4 представляет собой циклоалкильную группу, замещенную группой, выбранной из группы, состоящей из гидроксигруппы и низшей алкоксигруппы, R2 представляет собой фенильную группу, замещенную группой, выбранной из группы, состоящей из низшей алкоксигруппы, атома галогена и цианогруппы.
В особенности, предпочтительными соединениями настоящего изобретения являются соединения формулы (I), где азотсодержащая гетероциклическая группа "замещенной или незамещенной азотсодержащей гетероциклической группы" для кольца А представляет собой 5- или 6-членную неароматическую азотсодержащую гетеромоноциклическую группу формулы:
или азотсодержащую гетеробициклическую группу следующей формулы, где указанная выше 5- или 6-членная неароматическая азотсодержащая гетеромоноциклическая группа и 5- или 6-членная ароматическая азотсодержащая гетеромоноциклическая группа являются конденсированными:
азотсодержащая гетероциклическая группа "замещенной или незамещенной азотсодержащей гетероциклической группы" для R3 представляет собой неароматическую азотсодержащую гетеромоноциклическую группу формулы:
или ароматическую азотсодержащую гетеромоноциклическую группу формулы:
В особенности, предпочтительными соединениями настоящего изобретения являются соединения формулы (I), где кольцо А представляет собой группу формулы:
R1 представляет собой низшую алкильную группу, низшую алкоксизамещенную низшую алкильную группу, морфолинилзамещенную низшую алкильную группу, группу формулы: -NH-Q-R3 или группу формулы: -NH-R4, R3 представляет собой группу формулы:
R2 представляет собой группу формулы:
Среди соединений (I) настоящего изобретения более предпочтительными соединениями являются соединения формулы (I), в которых азотсодержащая гетероциклическая группа "замещенной или незамещенной азотсодержащей гетероциклической группы" для кольца А представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу или от 8- до 10-членную азотсодержащую гетеробициклическую группу и заместитель указанной "замещенной или незамещенной азотсодержащей гетероциклической группы" представляет собой группу, выбираемую из группы, состоящей из низшей алкильной группы, гидроксизамещенной низшей алкильной группы, формильной группы и оксогруппы, R1 представляет собой низшую алкоксизамещенную низшую алкильную группу, группу формулы: -NH-Q-R3 или группу формулы: -NH-R4, "замещенная или незамещенная азотсодержащая гетероциклическая группа" для R3 представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу, которая может быть необязательно замещена низшей алкильной группой, R4 представляет собой гидроксизамещенную циклоалкильную группу и R2 представляет собой фенильную группу, замещенную группой, выбранной из группы, состоящей из низшей алкоксигруппы и атома галогена.
В особенности, более предпочтительными соединениями настоящего изобретения являются соединения формулы (I), в которых азотсодержащая гетероциклическая группа "замещенной или незамещенной азотсодержащей гетероциклической группы" для кольца А представляет собой 5- или 6-членную неароматическую азотсодержащую гетеромоноциклическую группу формулы:
или группу формулы:
азотсодержащая гетероциклическая группа "замещенной или незамещенной азотсодержащей гетероциклической группы" для R3 представляет собой неароматическую азотсодержащую гетеромоноциклическую группу формулы:
или ароматическую азотсодержащую гетеромоноциклическую группу формулы:
В особенности, более предпочтительными соединениями настоящего изобретения являются соединения формулы (I), где кольцо А представляет собой группу формулы:
R1 представляет собой низшую алкоксизамещенную низшую алкильную группу, группу формулы: -NH-Q-R3 или группу формулы: -NH-R4, R3 представляет собой группу формулы:
Среди соединений (I) настоящего изобретения следующими предпочтительными соединениями являются соединения формулы (I), где азотсодержащая гетероциклическая группа "замещенной или незамещенной азотсодержащей гетероциклической группы" для кольца А представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу или от 8- до 10-членную азотсодержащую гетеробициклическую группу и заместитель указанной "замещенной или незамещенной азотсодержащей гетероциклической группы" представляет собой гидроксизамещенную низшую алкильную группу, R1 представляет собой группу формулы: -NH-Q-R3, "замещенная или незамещенная азотсодержащая гетероциклическая группа" для R3 представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу, которая может быть необязательно замещена низшей алкильной группой и R2 представляет собой фенильную группу, замещенную группой, выбранной из группы, состоящей из низшей алкоксигруппы и атома галогена.
В особенности, более предпочтительными соединениями настоящего изобретения являются соединения формулы (I), в которых азотсодержащая гетероциклическая группа "замещенной или незамещенной азотсодержащей гетероциклической группы" для кольца А представляет собой 5- или 6-членную неароматическую азотсодержащую гетеромоноциклическую группу формулы:
или группу формулы:
азотсодержащая гетероциклическая группа "замещенной или незамещенной азотсодержащей гетероциклической группы" для R3 представляет собой неароматическую азотсодержащую гетеромоноциклическую группу формулы:
или ароматическую азотсодержащую гетеромоноциклическую группу формулы:
В особенности, предпочтительными соединениями настоящего изобретения являются соединения формулы (I), где кольцо А представляет собой группу формулы:
R1 представляет собой группу формулы: -NH-Q-R3, R3 представляет собой группу формулы:
и R2 представляет собой группу формулы:
Среди соединений (I) настоящего изобретения наиболее предпочтительными соединениями являются соединения формулы (I), в которых Y представляет собой группу формулы: =N- и Z представляет собой группу формулы: =СН-.
Среди соединений (I) настоящего изобретения фармацевтически предпочтительными соединениями являются соединения, выбираемые из следующей группы или их фармацевтически приемлемой соли.
(S)-2-(2-Гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино) - 5-[N-(2-пиримидинилметил)карбамоил]пиримидин;
2-(6,7-дигидро-5Н-пирроло[3,4-b]пиридин-6-ил)-4-(3-циано-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидроимидазо[1,2-]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(транс-4-метоксициклогексил)карбамоил]пиримидин;
2-(6,7-дигидро-5Н-пирроло[3,4-b]пиридин-6-ил)-4-(3-циано-4-метоксибензиламино)-5-[N-(транс-4-гидроксициклогексил)карбамоил]пиримидин;
2-(6,7-дигидро-5Н-пирроло[3,4-b]пиридин-6-ил)-4-(3-циано-4-метоксибензиламино)-5-[N-(2-морфолиноэтил)карбамоил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-морфолиноэтил)карбамоил]пиримидин;
2-[(2S)-2-гидроксиметил-1-пирролидинил]-4-(3-хлор-4-метоксибензиламино)-5-[N-[[(2R)-4-метил-2-морфолинил]метил]карбамоил]пиримидин;
2-[(2S)-2-гидроксиметил-1-пирролидинил]-4-(3-хлор-4-метоксибензиламино)-5-[N-[[(2S)-4-метил-2-морфолинил]метил]карбамоил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(4-пиримидинилметил)карбамоил]пиримидин;
2-(4-метил-3-оксо-1-пиперазинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(транс-4-гидроксициклогексил)карбамоил]пиримидин;
2-(4-формил-1-пиперазинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(транс-4-гидроксициклогексил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-4-(3-хлор-4-мeтoкcибeнзилaминo)-5-[N-(тpaнc-4-гидpoкcициклoгeкcил)кapбaмoил]пиpимидин;
2-[цис-2,5-бис(гидроксиметил)-1-пирролидинил]-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-морфолиноэтил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидро-1,7-нафтиридин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-мopфoлинoэтил)кapбaмoил]пиpимидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-ацетилпиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(4-пиридазинилметил)карбамоил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(5-пиримидинилметил)карбамоил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиридилметил)карбамоил]пиримидин;
(S)-2-[N-(2-пиримидинилметил)карбамоил]-3-(3-хлор-4-метоксибензиламино)-5-[2-гидроксиметил-1-пирролидинил]пиразин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[(2-морфолиноэтил)карбонил]пиримидин;
2-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-[(4-метил-2-морфолинил)метил]карбамоил]пиримидин;
(S)-2-[N-(2-морфолиноэтил)карбамоил]-3-(3-хлор-4-метоксибензиламино)-5-(2-гидроксиметил-1-пирролидинил)пиразин;
2-[N-(2-пиримидинилметил)карбамоил]-3-(3-хлор-4-метоксибензиламино)-5-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)пиразин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[(2-метоксиэтил)карбонил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(1,3,5-триметил-4-пиразолил)карбамоил]пиримидин или их фармацевтически приемлемая соль.
Среди соединений (I) настоящего изобретения фармацевтически более предпочтительными соединениями являются соединения, выбираемые из следующей группы или их фармацевтически приемлемой соли.
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)карбамоил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(4-пиримидинилметил)карбамоил]пиримидин;
2-(4-метил-3-оксо-1-пиперазинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(транс-4-гидроксициклогексил)карбамоил]пиримидин;
2-(4-формил-1-пиперазинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(транс-4-гидроксициклогексил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-морфолиноэтил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидро-1,7-нафтиридин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-морфолиноэтил)карбамоил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(5-пиpимидинилмeтил)кapбaмoил]пиpимидин;
(S)-2-[N-(2-пиримидинилметил)карбамоил]-3-(3-хлор-4-метоксибензиламино)-5-(2-гидроксиметил-1-пирролидинил)пиразин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[(2-метоксиэтил)карбонил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(l,3,5-тpимeтил-4-пиpaзoлил)кapбaмoил]пиpимидин или их фармацевтически приемлемая соль.
Среди соединений (I) настоящего изобретения другими фармацевтически предпочтительными соединениями являются соединения, выбираемыми из следующей группы или их фармацевтически приемлемой соли.
(S)-2-(2-Гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)карбамоил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-морфолиноэтил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидро-1,7-нафтиридин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-морфолиноэтил)карбамоил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(5-пиримидинилметил)карбамоил]пиримидин;
(S)-2-[N-(2-пиримидинилметил)карбамоил]-3-(3-хлор-4-метоксибензиламино)-5-(2-гидроксиметил-1-пирролидинил)пиразин;
(S)-2-[N-(2-морфолиноэтил)карбамоил]-3-(3-хлор-4-метоксибензиламино)-5-(2-гидроксиметил-1-пирролидинил)пиразин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(1,3,5-триметил-4-пиразолил)карбамоил]пиримидин или их фармацевтически приемлемая соль.
Среди соединений (I) настоящего изобретения особенно фармацевтически предпочтительными соединениями являются соединения, выбираемые из следующей группы или их фармацевтически приемлемой соли.
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)карбамоил]пиримидин или его фармацевтически приемлемая соль, 2-(5,6,7,8-тетрагидро-1,7-нафтиридин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-морфолиноэтил)карбамоил]пиримидин или его фармацевтически приемлемая соль; далее (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(1,3,5-триметил-4-пиразолил)карбамоил]пиримидин или его фармацевтически приемлемая соль.
Если соединение (I) в соответствии с настоящим изобретением или его фармацевтически приемлемая соль имеет асимметричный атом углерода при кольце А, R1 и/или R2, оно может существовать в форме его оптически активного изомера по отношению к его указанному асимметричному атому углерода и настоящее изобретение также включает их оптические изомеры и их смеси.
Соединение (I) в соответствии с настоящим изобретением или его фармацевтически приемлемая соль проявляет отличную селективную PDE V ингибиторную активность, но по существу вызывает несколько побочных эффектов, таких как нарушение восприятия цвета, и, следовательно, оно может использоваться для профилактики или лечения нарушения эрекции.
Соединение (I) в соответствии с настоящим изобретением может использоваться для лечения или в свободном виде, или в виде его фармацевтически приемлемой соли. Фармацевтически приемлемая соль соединения (I) включает его соль с неорганической кислотой, такую как гидрохлорид, сульфат, нитрат или гидробромид, или его соль с органической кислотой, такую как ацетат, фумарат, оксалат, цитрат, метансульфонат, бензолсульфонат, тозилат или малеат.
Соединение (I) в соответствии с настоящим изобретением или его соль включает как его внутримолекулярную или аддитивную соль, так и их сольваты или гидраты.
Соединение (I) в соответствии с настоящим изобретением или его фармацевтически приемлемую соль вводят или орально, или парентерально, при этом они могут быть введены в обычные фармацевтические препараты, такие как таблетки, гранулы, тонкие гранулы, пилюли, капсулы, порошки, инъекции, ингаляции, трансбуккальные препараты, подъязычные таблетки, сиропы, сухие сиропы, желе, суппозитории, мази, элексиры, линименты, примочки, напитки, капли для носа, препараты для подкожного введения и таблетки, быстро измельчающиеся в полости рта, и так далее. Указанные фармацевтические препараты могу быть приготовлены путем их формования с фармацевтически приемлемыми аддитивами, такими как эксципиент, связующее, увлажняющий агент, дезинтегратор, уплотняющий агент и так далее, обычным методом.
Дозу соединения (I) в соответствии с настоящим изобретением или его фармацевтически приемлемой соли варьируют в зависимости от способа введения, возраста, веса и состояния пациента. Например, если вводят препарат путем инъекции, то доза обычно находится в интервале около 0.001-100 мг/кг/день, предпочтительно в интервале около 0.1-10 мг/кг/день. Если препарат вводят орально, то обычно в интервале около 0.1-200 мг/кг/день, предпочтительно в интервале около 0.1-80 мг/кг/день.
Кроме того, поскольку соединение (I) по настоящему изобретению или его фармацевтически приемлемая соль обладают отличной селективной PDE V ингибирующей активностью, они также могут быть полезны при профилактике или лечении заболеваний, вызванных функциональными расстройствами cGMP-связи, такими как легочная гипертония, диабетический гастропарез, гипертензия, стенокардия, инфаркт миокарда, хроническая или острая сердечная недостаточность, женская сексуальная дисфункция, простатическая гиперплазия, астма, диарея, запор и ахалазия в дополнение к упомянутой выше эректильной дисфункции
Предпочтительные пути осуществления изобретения.
Соединения (I) в соответствии с настоящим изобретением могут быть получены в соответствии со следующими способами от А до F.
Способ А
Среди соединений (I) в соответствии с настоящим изобретением соединение формулы (I), в котором R1 представляет собой группу формулы: -NH-Q-R3 или -NH-R4, то есть соединение формулы (I-а):
(где R11 представляет собой группу формулы: -NH-Q-R3 или -NH-R4 и другие радикалы имеют значения, как определено выше) может быть получено путем взаимодействия соединения (II):
где X1 представляет собой атом галогена, R5 представляет собой группу, защищающую карбоксильную группу, R9 представляет собой замещенную или незамещенную низшую алкильную группу или замещенную или незамещенную арильную группу, а другие радикалы определены выше, с соединением формулы (III):
где значения радикалов определены выше, окислением полученного в результате соединения формулы (IV):
где радикалы имеют значения, определенные выше, до получения сульфонильного (или сульфинильного) соединения формулы (V):
где n имеет значение 1 или 2, а другие радикалы имеют значения, определенные выше, взаимодействием соединения формулы (V) с соединением формулы (VI):
где радикалы имеют значения такие, как определено выше, или с его солью, что приводит к получению соединения формулы (VII):
где радикалы имеют значения такие, как определено выше, удалением защитной группы R5 карбоксильной группы соединения (VII) с получением соединения формулы (VIII):
где радикалы имеют значения такие, как определено выше,
с последующим взаимодействием соединения (VIII) с соединением формулы (IX-a):
где радикалы имеют значения такие, как определено выше.
Соединение (I-а) может быть также получено путем галогенирования соединения (VIII) с образованием соединения формулы (X):
где X2 представляет собой атом галогена, а другие радикалы имеют значения такие, как определено выше, с последующим взаимодействием соединения (X) с соединением (IX-а). Кроме того, указанное выше соединение (VII) может быть также получено путем обработки дигалоидного производного формулы (XI):
где X3 и X4 представляют собой атом галогена, а другие радикалы имеют значения такие, как определено выше, с двуокисью углерода, введением защиты карбоксильной группы в полученном в результате соединении формулы (ХII):
где радикалы имеют значения такие, как определено выше, с образованием соединения формулы (ХIII):
где радикалы имеют значения такие, как определено выше,
взаимодействием соединения (ХIII) с соединением (III), при этом получают соединение формулы (XIV):
где радикалы имеют значения такие, как определено выше,
с последующим взаимодействием соединения (XIV) с соединением (VI). Кроме того, приведенное выше соединение (XIV) может быть также получено путем гидролиза соединения (V) с последующим галогенированием образующегося в результате соединения формулы (XV):
где радикалы имеют значения такие, как определено выше.
Способ В
Среди соединений (I) в соответствии с настоящим изобретением соединение формулы (I), где R1 представляет собой замещенную или незамещенную низшую алкильную группу, то есть соединение формулы (I-b):
(где R12 представляет собой замещенную или незамещенную низшую алкильную группу, а другие радикалы имеют значения такие, как определено выше) может быть получено путем окисления соединения формулы (XVI):
где радикалы имеют значения такие, как определено выше, которое получают восстановлением соединения (IV), с образованием соединения формулы (XVII)
где радикалы имеют значения такие, как определено выше,
затем, окисляя соединение (XVII), получают соединение формулы (XVIII):
где радикалы имеют значения такие, как определено выше,
в результате взаимодействия соединения (XVIII) с соединением (VI) получают соединение формулы (XIX):
где радикалы имеют значения такие, как определено выше,
при взаимодействии соединения (XIX) с металлической солью соединения формулы (IX-b):
где R12 такой, как определено выше, получают соединение формулы (XX):
где радикалы имеют значения такие, как определено выше,
с последующим окислением соединения (XX).
Кроме того, среди соединений (I) по настоящему изобретению соединение формулы (I), где группа R1 представляет собой низшую алкоксизамещенную этильную группу, морфолинозамещенную этильную группу, 4-низшую алкилпиперазинилзамещенную этильную группу, 3-пиридиламинозамещенную этильную группу, 2-пиридил-низшую алкиламинозамещенную этильную группу, ди-низшую алкиламиноэтильную группу или гидроксиэтильную группу, то есть соединение формулы (I-с):
где R6 представляет собой низшую алкоксигруппу, морфолиногруппу, 4-низшую алкилпиперазинильную группу, 3-пиридиламиногруппу, 2-пиримидил-низшую алкиламиногруппу, ди-низшую алкиламиногруппу или гидроксигруппу, а другие радикалы имеют значения такие, как определено выше, могут быть получены путем взаимодействия соединения (XIX) с реагентом Гриньяра формулы:
с получением соединения формулы (ХХII):
где радикалы имеют значения такие, как определено выше, которое при окислении дает соединение формулы (ХХIII):
где радикалы имеют значения такие, как определено выше,
с последующим взаимодействием соединения (ХХШ) с соединением формулы (XXIV):
где значение R6 определено выше.
Способ С
Соединение (I-а) может быть получено путем взаимодействия соединения формулы (XXV):
где радикалы имеют значения такие, как определено выше, которое в свою очередь получают путем удаления защитной группы R с карбоксильной группы соединения (IV), с соединением (IХ-а) с образванием соединения формулы (XXVI-a):
где радикалы имеют значения такие, как определено выше,
окислением соединения (XXVI-a), что приводит к соединению формулы (XXVII-а):
где радикалы имеют значения такие, как определены выше,
с последующим взаимодействием соединения (XXVD-a) с соединением (VI).
Способ D
Соединение (I-b) может быть получено путем окисления соединения формулы (XXVIII):
где радикалы имеют значения такие, как определено выше, которое в свою очередь получают путем взаимодействия соединения (XVII) с металлической солью соединения (IX-b), что дает соединение формулы (XXVI-b):
где радикалы имеют значения такие, как определено выше, затем окислением соединения (XXVI-b) с получением соединение формулы (XXVII-b):
где радикалы имеют значения такие, как определено выше,
с последующим взаимодействием соединения (XXVII-b) с соединением (VI).
Способ Е
Соединение (I-b) может быть получено путем окисления соединения формулы (XXX):
где радикалы имеют значения такие, как определено выше, которое в свою очередь получают путем взаимодействия дигалоидного производного (XI) с соединением формулы (XXIX):
где R12 определено выше, с образованием соединения формулы (XXXI):
где радикалы имеют значения такие, как определено выше,
взаимодействия соединения (XXXI) с соединением (III), что приводит к получению соединения формулы (ХХХII):
где радикалы имеют значения такие, как определено выше,
с последующим взаимодействием соединения (ХХХII) с соединением (VI). Упомянутое выше соединение (ХХХII) может быть также получено путем взаимодействия соединения (XXX) с соединением (III) с образованием соединения формулы (ХХХIII):
где радикалы имеют значения, определенные выше, с последующим окислением соединения (ХХХIII).
Процесс F
Соединение (I-а) может быть получено путем взаимодействия соединения (ХIII) с соединением формулы (XXXIV):
RSH (XXXIV),
где R представляет собой замещенную или незамещенную низшую алкильную группу или замещенную или незамещенную арильную группу, с получением соединения формулы (XXXV):
где радикалы имеют значения такие, как определено выше,
взаимодействия соединения (XXXV) с соединением (VI) или его солью с получением соединения формулы (XXXVI):
где радикалы имеют значения, которые определены выше,
удалением защитной группы R5 с карбоксильной группы соединения (XXXVI), с получением соединения формулы (XXXVII):
где радикалы имеют значения такие, как определено выше,
взаимодействием соединения (XXXVII) с соединением (IХ-а), что дает соединение формулы (XXXIX):
где радикалы имеют значения, которые определены выше,
окисление соединения (XXXIX) с получением сульфонильного или сульфинильного соединения, с последующим взаимодействием полученного в результате продукта с соединением (III).
Указанные выше способы от А до F могут быть выполнены следующим образом.
Способ А
Взаимодействие соединения (II) с соединением (III) осуществляют в присутствии или отсутствии акцептора кислоты в растворителе. Акцептор кислоты включает, например, органическое основание, такое как N,N-диизопропилэтиламин, N-метилморфолин, триэтиламин, пиридин и так далее, и неорганическое основание, такое как гидрид натрия, карбонат натрия, карбонат калия, гидрокарбонат натрия и так далее. Растворитель может быть любым растворителем, который не нарушает режим реакции, например диметилсульфоксид, тетрагидрофуран, толуол, этилацетат, хлороформ, диметоксиэтан, ксилол, N,N-диметилформамид и так далее. Процесс выполняют при температуре от -10°С до комнатной, предпочтительно при температуре от 0°С до комнатной.
Реакцию окисления соединения (IV) для получения сульфонил (или сульфинил) соединения (V) осуществляют в присутствии окисляющего агента и растворителя. Окисляющий агент включает, например, перкислоты, такие как м-хлорпербензойная кислота, перуксусная кислота и так далее, и неорганический окисляющий агент, такой как диоксид марганца, периодат натрия, пероксид водорода, диазотный тетроксид, галоген, гидропероксид, иодбензолацетат, трет-бутил гипохлорит, хлорид сульфурила, пероксимоносульфат калия и так далее. Растворитель может быть любым растворителем, который не мешает режиму реакции, например хлороформ, хлористый метилен, дихлорэтан, уксусная кислота и так далее. Реакцию выполняют при температуре от -78°С до 50°С, предпочтительно при температуре от -10°С до 10°С.
Взаимодействие соединения (V) с соединением (VI) или его солью может быть выполнено в присутствии или в отсутствии акцептора кислоты в растворителе. Акцептор кислоты включает, например, органическое основание, такое как N,N-диизопропилэтиламин, N-метилморфолин, триэтиламин, пиридин и так далее, и неорганическое основание, такое как гидрид натрия, карбонат натрия, карбонат калия, гидрокарбонат натрия и так далее. Соль соединения (VI) представляет собой предпочтительно соль щелочного металла, такую как натриевая соль, калиевая соль и так далее. Растворитель может быть любым растворителем, который не нарушает режим реакции, например N,N-диметилформамид, тетрагидрофуран, диметоксиэтан, диметилсульфоксид и так далее. Реакцию выполняют при температуре от 0°С до 150°С, предпочтительно при температуре от комнатной температуры до 60°С.
Реакцию по удалению защитной группы R5 с карбоксильной группы соединения (VII) для получения соединения (VIII) может быть выполнена стандартным методом, таким как гидролиз, каталитическое восстановление и так далее, который выбирают в соответствии с типом удаляемой защитной группы для карбоксильной группы. Если группу, защищающую карбоксильную группу, удаляют гидролизом, гидролиз осуществляют, например, в присутствии основания в растворителе. Основанием является предпочтительно, например, гидроксид щелочного металла, такой как гидроксид натрия, гидроксид калия, гидроксид лития и так далее, или карбонат щелочного металла, такой как карбонат натрия, карбонат калия и так далее. Растворителем может быть вода или смесь воды и метанола, этанол, тетрагидрофуран, диоксан, N,N-диметилформамид, диметилсульфоксид и так далее. Процесс выполняют при температуре от 0 до 80°С, предпочтительно при температуре от 5°С до 60°С. Защитная группа для карбоксильной группы, представленная как R5, может быть любой стандартной групой, защищающей карбоксильную группу, такой как низшая алкильная группа, бензильная группа и так далее.
Реакция соединения (VIII) с соединением (IХ-а) может быть осуществлена в присутствии или отсутствии конденсирующего агента, основания или активирующего агента в подходящем растворителе. Конденсирующий агент представляет собой, например, дициклогексилкарбодиимид, 1-этил-3-(3-диметиламинопропил)карбодиимид, дифенилфосфорилазид, диэтилцианофосфонат и так далее, который обычно используют в пептидном синтезе. Основание включает, например, органическое основание, такое как триэтиламин, N-метилморфолин и так далее, и активирующий агент, представляющий собой, например 1-гидроксибензотриазол и так далее. Растворитель может быть любым растворителем, который не препятствует режиму реакции, например, хлористый метилен, тетрагидрофуран, N,N-диметилформамид, ацетонитрил, N,N-диметилацетамид, этилацетат и так далее. Процесс выполняют при температуре от -30°С до 50°С, предпочтительно при температуре от -10°С до 10°С.
Альтернативный процесс превращения соединения (VIII) в соединение (X), которое затем взаимодействует с соединением (IХ-а), может быть осуществлен вначале путем взаимодействия соединения (VIII) с галогенирующим агентом в присутстии или отсутствии активирующего агента стандартным методом, а затем взаимодействием полученного соединения (X) с соединением (IX-а). Взаимодействие соединения (VIII) с галогенирующим агентом осуществляют в растворителе. В качестве галогенирующего агента используют предпочтительно тионилхлорид, оксалилхлорид, пентахлоридфосфора и так далее. В качестве активирующего агента предпочтительно используют амидное соединение, такое как N,N-диметилформамид и так далее. Растворитель может быть любым растворителем, который не нарушает режим реакции, например хлористый метилен, хлороформ, тетрагидрофуран, бензол, толуол, диоксан и так далее. Процесс выполняют при температуре от -30°С до 100°С, предпочтительно при температуре от -5°С до 10°С.
Последующее взаимодействие с соединением (IХ-а) выполняют в присутствии акцептора кислоты в растворителе. Акцептор кислоты включает, например, органическое основание, такое как N,N-диизопропилэтиламин, N-метилморфолин, триэтиламин, пиридин, диметиламинопиридин и так далее, и неорганическое основание, такое как гидрид натрия, карбонат натрия, карбонат калия, гидрокарбонат натрия и так далее. В качестве растворителя может быть использован любой растворитель, который не нарушает режим реакции, например тетрагидрофуран, хлористый метилен, хлороформ, толуол, бензол, диоксан, этилацетат и так далее. Процесс осуществляют при температуре от -30°С до 100°С, предпочтительно при температуре от -5°С до 10°С.
Процесс взаимодействия дигалоидного соединения (XI) с диоксидом углерода для получения соединения (ХII) может быть выполнен в присутствии основания в растворителе. Основание включает, например, соль щелочного металла органического основания, такого как диизопропиламид лития, литий 2,2,6,6-тетраметилпиперидин и так далее. В качестве растворителя может быть любой растворитель, который не нарушает режим реакции, например тетрагидрофуран, 1,2-диметоксиэтан, диэтиловый эфир и так далее. Процесс осуществляют при температуре от -100°С до -30°С, предпочтительно при температуре от -100°С до -70°С.
Реакция по введению защиты по карбоксильной группе соединения (ХII) дает соединение (ХIII), и она может быть выполнена стандартным методом, например путем взаимодействия с алкилирующим агентом в присутствии основания в растворителе, где защитная группа представляет собой низшую алкильную группу. Алкилирующий агент представляет собой предпочтительно низший галоидный алкил, такой как йодистый метил. Основание - это бикарбонаты щелочного металла такие как гидрокарбонат натрия, растворитель может быть любым растворителем, который не нарушает режим реакции, например N,N-диметилформамид, тетрагидрофуран и так далее. Процесс осуществляют при температуре от 0°С до 100°С, предпочтительно при температуре от комнатной температуры до 70°С.
Взаимодействие соединения (XIII) с соединением (III) для получения соединения (XIV) может быть выполнено таким же способом, что и взаимодействие соединения (II) с соединением (III).
Реакция соединения (XIV) с соединением (VI) для получения соединения (VII) может быть выполнена таким же образом, как и взаимодействие соединения (V) с соединением (VI).
Гидролиз соединения (V) для получения соединения (XV) проводят в присутствии основания в растворителе. Основание включает, например, гидроксид щелочного металла, такой как гидроксид натрия, гидроксид калия, гидроксид лития и так далее, и карбонат щелочного металла, такой как карбонат натрия, карбонат калия и так далее. Растворитель представляет собой предпочтительно воду или смесь воды и метанола, этанол, тетрагидрофуран, диоксан, N,N-диметилформамид, диметилсульфоксид и так далее. Реакцию осуществляют при температуре от -20°С до 80°С, предпочтительно при температуре от -5°С до 60°С.
Реакция галогенирования соединения (XV), приводящая к соединению (XIV), может быть осуществлена тем же способом, что и реакция получения соединения (X) путем галогенирования соединения (XIII) галогенирующим агентом.
Способ В
Реакция восстановления соединения (IV) для получения соединения (XVI) может быть выполнена в присутствии восстанавливающего агента в подходящем растворителе. Восстанавливающий агент представляет собой предпочтительно алюмогидрид щелочного металла, такой как алюмогадрид лития и боргидрид щелочного металла, такой как боргидрид лития, и так далее. Растворитель может быть использован любой, который не нарушает режим реакции, например тетрагидрофуран, диоксан, диэтиловый эфир, диметоксиэтан и так далее. Процесс осуществляют при температуре от -78°С до температуры кипения растворителя, который был использован предпочтительно при температуре от -10°С до комнатной температуры.
Реакцию окисления соединения (XVI) для получения соединения (ХVII) выполняют в присутствии окисляющего агента в растворе. Окисляющий агент может быть любой, который может превратить спирт в карбонильное соединение, например диоксид марганца, перманганат бария, перманаганат калия, 2,3-дихлор-5,6-дициано-1,4-бензохинон, хлорхромат пиридина, дихромат пиридина и так далее. В качестве растворителя может быть выбран любой растворитель, который не нарушает режим реакции, например хлороформ, толуол, этилацетат, 1,2-дихлорэтан, метиленхлорид, тетрагидрофуран и так далее. Процесс выполняют при температуре от 0°С до 100°С, предпочтительно при температуре от комнатной температуры до 70°С.
Реакцию окисления соединения (XVII) для получения соединения (XVIII) выполняют в тех же условиях, как и реакцию получения соединения (V) путем окисления соединения (IV).
Реакцию взаимодействия соединения (XVIII) с соединением (VI) для получения соединения (XIX) выполняют таким же образом, как и реакцию соединения (V) с соединением (IV).
Реакция взаимодействия соединения (XIX) с металлической солью (IX-b) для получения соединения (XX) может быть выполнена в подходящем растворителе.
Металлическая соль соединения (IX-b) представляет собой предпочтительно литиевую соль и так далее. В качестве растворителя может быть любой растворитель, который не нарушает режим реакции, например тетрагидрофуран, диоксан, диэтиловый эфир, диметоксиэтан и так далее. Реакция может предпочтительно протекать при температуре от -78°С до комнатной температуры.
Реакция окисления соединения (XX), приводящая к получению соединения (I-b), может быть выполнена тем же способом, что и реакция получения (XVII) путем окисления соединения (XVI).
Реакция взаимодействия соединения (XIX) с соединением Гриньяра может быть выполнена в подходящем растворителе. Растворитель представляет собой предпочтительно тетрагидрофуран, диоксан, диэтиловый эфир и так далее. Реакция может быть предпочительно осуществлена при температуре от -78°С до 60°С, предпочтительно при температуре от -78°С до комнатной температуры.
Реакцию окисления соединения (ХХII) для получения соединения (ХХIII) выполняют так же, как и реакцию получения соединения (XVII) путем окисления соединения (XVI).
Взаимодействие соединения (ХХIII) с соединением (XXIV), где R6 представляет собой морфолиногруппу, 4-низшую алкилпиперазинильную группу, 3-пиридиламиногруппу, 2-пиримидил-низшую алкиламиногруппу или ди-низшую алкиламиногруппу для получения соединения (I-с), где R6 представляет собой морфолиногруппу, 4-низшую алкилпиперазинильную группу, 3-пиридиламиногруппу, 2-пиримидинил-низшую алкиламиногруппу или ди-низшую алкиламиногруппу, может быть выполнена в присутствии или отсутствии основания в подходящем растворителе. Основание включает, например, органическое основание, такое как N,N-диизопропилэтиламин, N- метилморфолин, триэтиламин, пиридин и так далее, и неорганическое основание, такое как гидроксид натрия, карбонат натрия, карбонат калия, гидрокарбонат калия и так далее. Растворитель предпочтительно может быть этанолом, N,N-диметилформамидом, тетрагидрофураном, диметоксиэтаном, диметилсульфоксидом и так далее. Реакция может быть предпочтительно осуществлена при температуре от 0°С до 150°С, предпочтительно при температуре от комнатной температуры до 60°С.
С другой стороны, реакция соединения (ХХIII) с соединением (XXIV), где R6 - гидроксигруппа или низшая алкоксигруппа, для получения соединения (XXI), где R6 представляет собой гидроксигруппу или низшую алкоксигруппу, может быть выполнена в присутствии кислоты в растворителе или без растворителя. Кислота представляет собой, например, неорганическую кислоту, такую как серная кислота и так далее, или органическую кислоту, такую как метансульфокислота, камфоросульфокислота, толуолсульфокислота, бензолсульфокислота и так далее. Растворителем может быть предпочтительно диэтиловый эфир, толуол, бензол, N,N-диметилформамид, диметоксиэтан, диметилсульфоксид и так далее. Реакция может предпочтительно протекать при температуре от 0°С до 150°С, предпочтительно при температуре от комнатной температуры до 60°С.
Способ С
Реакция удаления защитной группы R5 с карбоксильной группы соединения (IV) для получения соединения (XXV) может быть выполнена в тех же условиях, что и реакция получения соединения (VIII), путем удаления защитной группы R5 с карбоксильной группы соединения (VII).
Реакция соединения (XXV) с соединением (IХ-а) для получения соединения (XXVI-a) может быть осуществлена тем же способом, что и реакция соединения (VIII) с соединением (IХ-а).
Реакция окисления соединения (XXVI-a) для получения соединения (XXVII-1) может быть выполнена таким же образом, что и реакция получения соединения (V) путем окисления указанного выше соединения (IV).
Реакция соединения (XXVII-a) с соединением (VI) для получения соединения (I-а) в соответствии с настоящим изобретением может быть выполнена тем же способом, что и реакция соединения (V) с соединением (VI).
Способ D
Реакция соединения (XVII) с металлической солью соединения (IX-b) для получения соединения (XXVIII) может быть выполнена таким же способом, что и реакция соединения (XIX) с металлической солью соединения (IX-b).
Реакция окисления соединения (XXVIII) для получения соединения (XXVI-b) может быть выполнена таким же способом, что и реакция получения соединения (ХVII) путем окисления соединения (XVI).
Процесс, при котором соединение (XXVI-b) окисляют, что дает соединение (XXVII-b), которое в дальнейшем превращают в соединение (I-b) в соответствии с настоящим изобретением, может быть выполнен таким же образом, как и процесс, при котором соединение (XXVI-a) окисляют с получением соединения (XXVII-b), которое в дальнейшем превращают в соединение (I-а) в соответствии с настоящим изобретением.
Способ Е
Взаимодействие соединения (XI) с соединением (XXIX) для получения соединения (XXX) осуществляют в присутствии основания в подходящем растворителе. Основание включает, например, соль щелочного металла органического основания, такую как диизопропиламид лития, 2,2,6,6-тетраметилпиперидид лития и так далее. Растворителем может быть любой растворитель, который не нарушает режим реакции, например тетрагидрофуран, 1,2-диметоксиэтан, диэтиловый эфир и так далее. Реакцию осуществляют при температуре от -100°С до -30°С, предпочтительно при температуре от -100°С до -70°С.
Реакция окисления соединения (XXX) для получения соединения (XXXI) может быть выполнена таким же способом, как и реакция окисления соединения (XVI) при получении соединения (XVII).
Взаимодействие соединения (XXXI) с соединением (III) для получения соединения (ХХХII) может быть выполнено в тех же условиях, что и реакция соединения (II) с соединением (III).
Реакция соединения (ХХХII) с соединением (VI) или его солью с тем, чтобы получить соединение (I-b) в соответствии с настоящим изобретением, может быть выполнена таким же способом, как и реакция соединения (V) с соединением (VI).
Взаимодействие соединения (XXX) с соединением (III) для получения соединения (ХХХIII) может быть выполнено таким же способом, что и реакция соединения (II) с соединением (III). Кроме того, реакция окисления соединения (ХХХIII) для получения соединения (ХХХII) может быть выполнена таким же образом, что и реакция окисления соединения (XVI) для получения соединения (XVII).
Способ F
Реакция соединения (ХIII) с соединением (XXXIV) может быть выполнена в присутствии или отсутствии акцептора кислоты в растворителе. Акцептор кислоты включает, например, органическое основание, такое как N,N-диизопропилэтиламин, N-метилморфолин, триэтиламин, пиридин и так далее, или неорганические основание, такое как гидрид натрия, карбонат натрия, карбонат калия, гидрокарбонат натрия и так далее. Растворитель может быть любым растворителем, не нарушающим режим реакции, например, N,N-диметилформамид, тетрагидрофуран, толуол, этилацетат, хлороформ, диметоксиэтан, ксилол, диметилформамид и так далее. Реакцию выполняют при температуре от -10°С до комнатной температуры, предпочтительно при температуре от 0°С до комнатной температуры.
Взаимодействие соединения (XXXV) с соединением (VI) или его солью может быть выполнено таким же образом, что и реакция соединения (V) с соединением (VI).
Реакция удаления защитной группы R5 с карбоксильной группы соединения (XXXVI) для получения соединения (XXXVII) может быть выполнена таким же образом, как реакция удаления защитной группы R5 с карбоксильной группы соединения (VII) с получением соединения (VIII).
Реакция соединения (XXXVII) с соединением (IХ-а) может быть выполнена таким же образом, что и реакция соединения (VIII) с соединением (IХ-а).
Реакция окисления соединения (XXXIX) может быть выполнена таким же образом, что и реакция соединения (IV) с получением соединения (V). Окисляющий агент представляет собой предпочтительно m-хлорпербензойную кислоту и так далее. Растворитель может быть любым растворителем, который не нарушает режим реакции, например хлороформ, метиленхлорид, дихлорэтан, уксусная кислота и так далее. Реакцию осуществляют при температуре от -78°С до 50°С, предпочтительно при температуре от -10°С до 10°С.
Последующая реакция с соединением (III) может быть выполнена таким же образом, что и реакция соединения (II) и соединения (III).
Соединение (I), полученное выше, может быть превращено в его фармацевтически приемлемую соль.
Исходное соединение (II) может быть получено, например, по методике, раскрытой в Journal of American Chemical Society, p. 350, vol. 65, 1943.
Примеры соединения (I) в соответствии с настоящим изобретением, которое может быть получено указанными выше способами, иллюстрирует настоящее изобретение, но оно не должно быть ограничено ими.
Пример 1
(1) При охлаждении льдом к раствору 4-хлор-5-этоксикарбонил-2-метилтиопиримидина (25.33 г) в N,N-диметилформамиде (85 мл) добавляют раствор 3-хлор-4-метоксибензиламина (19.62 г) в N,N-диметилформамиде (15 мл) и триэтиламин (16.7 мл). Смесь перемешивают при комнатной температуре в течение 20 минут, после чего добавляют 3-хлор-4-метоксибензиламин (940 мг) и перемешивают еще в течение 15 минут. Затем к смеси добавляют указанный амин (940 мг) и перемешивают еще в течение 15 минут. Реакционную массу выливают в смесь ледяной воды и лимонной кислоты и экстрагируют этилацетатом. Экстракт промывают последовательно 10%-ным водным раствором лимонной кислоты, водой и рассолом, а затем сушат над безводным сульфатом натрия. Растворитель упаривают при пониженном давлении, остаток промывают н-гексаном, что дает 4-(3-хлор-4-метоксибензиламино)-5-этоксикарбонил-2-метилтиопиримидин (38.34 г), т.пл. 86°С.
(2) При охлаждении льдом к раствору полученного выше соединения (5.00 г), как указано в (1), в хлороформе (50 мл) добавляют раствор м-хлорпербензойной кислоты (4.00 г) в хлороформе (50 мл) и смесь перемешивают в течение 2 часов. Затем реакционную смесь промывают насыщенным водным раствором гидрокарбоната натрия и рассолом, органический слой сушат над безводным сульфатом натрия и растворитель упаривают при пониженном давлении, что дает сырой 4-(3-хлор-4-метоксибензиламино)-5-этоксикарбонил-2-метилсульфинилпиримидин, MS (м/е): 447 (МН+).
(3) Полученный выше сырой продукт, как указано в (2), растворяют в тетрагидрофуране (40 мл), после чего при комнатной температуре добавляют раствор L-пролинола (1.50 г) и триэтиламина (1.60 г) в тетрагидрофуране (10 мл). Смесь перемешивают в течение ночи, реакционную смесь разбавляют этилацетатом и промывают водным раствором гидрокарбоната натрия и рассолом. Органический слой сушат над безводным сульфатом натрия и растворитель упаривают при пониженном давлении. Остаток очищают на хроматографической колонке с силикагелем (растворитель; хлороформ) и кристаллизуют из смеси эфира и н-гексана, что дает (S)-4-(3-хлор-4-метоксибензиламино)-5-этоксикарбонил-2-(2-гидроксиметил-1-пирролидинил)пиримидин (4.72 г), т.пл. 88-90°С, MS (м/е): 421 (МН+).
(4) Полученную выше смесь соединения (3.4 г), как указано в (3), а также 10%-ный водный раствор гидроксида натрия (23 мл) и диметилсульфоксид (34 мл) перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в 10%-ный водный раствор лимонной кислоты и осадок кристаллизуют из смеси тетрагидрофурана и эфира, что дает (S)-4-(3-хлор-4-метоксибензиламино)-5-карбокси-2-(2-гидроксиметил-1-пирролидинил)пиримидин (2.52 г), т.пл. 205-208°С, MS (м/е): 391 (М-Н)-.
(5) Смесь соединения (600 мг), как указано в (4), 2-аминометилпиримидина (217 мг), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (323 мг), моногидрата 1-гидроксибензотриазола (227 мг) и N,N-диметилформамида (12 мл) перемешивают при комнатной температуре в течение 8 часов, после чего реакционную смесь выливают в водный раствор гидрокарбоната натрия. Смесь экстрагируют этилацетатом, промывают рассолом и сушат над безводным сульфатом натрия. Растворитель упаривают при пониженном давлении и остаток очищают на хроматографической колонке с силикагелем (растворитель; хлороформ : метанол = 50:1), что дает (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидилметил)карбамоил]пиримидин (610 мг), т.пл. 160-163°С. Пример 2
(1) К суспензии алюмогидрата лития (4.15 г) в тетрагидрофуране (150 мл) добавляют раствор 2-метилтио-4-(3-хлор-4-метоксибензиламино)-5-этоксикарбонилпиримидина (38.32 г) в тетрагидрофуране (100 мл) при охлаждении льдом при температуре от 5°С до 10°С в течение более одного часа. После прибавления ледяную баню удаляют и реакционную смесь перемешивают при комнатной температуре в течение одного часа. Затем к реакционной смеси добавляют воду (4.15 мл) вновь при охлаждении льдом, после чего добавляют 3N водный раствор гидроксида натрия (4.15 мл). Затем в смесь добавляют воду (4.15 мл) три раза и перемешивают при комнатной температуре в течение одного часа. Реакционную смесь обрабатывают сульфатом магния и выпавший твердый осадок фильтруют. Осадок промывают тетрагидрофураном. Фильтрат и промывные воды объединяют и концентрируют при пониженном давлении, затем растирают со смесью этилацетата и изопропилового эфира. Полученные кристаллы собирают фильтрованием и промывают тщательно изопропиловым эфиром, что дает 2-метилтио-4-(3-хлор-4-метоксибензиламино)-5-гидроксиметилпиримидин в виде бледно-желтого кристаллического порошка.
Первая порция: выход 25.10 г, т.пл. 162-163°С.
Вторая порция: выход 2.32 г, т.пл. 159-160°С.
Дополнительно полученный выше твердый осадок промывают вновь изопропиловым эфиром и фильтрат концентрируют при пониженном давлении, что дает бесцветные кристаллы. Полученное твердое вещество суспендируют в изопропиловом эфире, фильтруют и осадок тщательно промывают изопропиловым эфиром и гексаном, после чего получают 2-метилтио-4-(3-хлор-4-метоксибензиламино)-5-гидроксиметилпиримидин (4.26 г) в виде бесцветных кристаллов, т.пл. 161-162°С.
(2) К суспензии 2-метилтио-4-(3-хлор-4-метоксибензиламино)-5-гидроксиметилпиримидина (25.10 г), полученного выше в (1), в хлороформе (150 мл) добавляют порошок диоксида марганца (37.6 г) и смесь энергично перемешивают при комнатной температуре в течение одного дня. Затем к смеси вновь добавляют порошок диоксида марганца (12.6 г, 0.5 часть исходного соединения) и смесь вновь перемешивают в течение трех дней. Нерастворимые продукты быстро удаляют фильтрованием на целите, а фильтрат концентрируют при пониженном давлении. Остаток суспендируют в смесь этилацетата и изопропилового эфира. Осадок фильтруют и промывают последовательно изопропиловым эфиром и гексаном, что дает 2-метилтио-4-(3-хлор-4-метоксибензиламино)-5-формилпиримидин (22.43 г) в виде бесцветных кристаллов, т.пл. 124-125°С.
(3) Раствор 2-метилтио-4-(3-хлор-4-метоксибензиламино)-5-формилпиримидина (2.057 г) в хлороформе (20 мл) обрабатывают с м-хлорпербензойной кислотой (80%, 1.468 г) при 0°С в течение 30 минут. К реакционной смеси добавляют L-пролинол (0.901 г) и затем триэтиламин (1.33 мл), и реакция протекает при 0°С в течение одного часа. Реакционную смесь нагревают до комнатной температуры и растворяют этилацетатом. Смесь промывают последовательно насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным раствором хлорида натрия, а затем сушат над безводным сульфатом натрия. Осадок удаляют фильтрованием через силикагельную подушку. Фильтрат концентрируют при пониженном давлении, что дает (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-формилпиримидин (1.9990 г) в виде бесцветного аморфного вещества, MS (м/е): 377 (МН+).
(4) К раствору (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-формилпиримидина (91.0 мг) в тетрагидрофуране (20 мл) добавляют 1.10 М раствор метиллития в эфире (1.1 мл) при -78°С, после чего смесь реагирует в течение 10 минут, затем к ней добавляют водный раствор гидрокарбоната натрия. Реакционную смесь экстрагируют этилацетатом, что дает сырой (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-(1-гидроксиэтил)пиримидин, MS (м/е): 393 (МН+).
(5) Сырой продукт, полученный выше, как указано в (4), обрабатывают диоксидом марганца (0.5 г) при комнатной температуре, после чего смесь перемешивают в течение ночи. Затем реакционную смесь нагревают при кипении с обратным холодильником в течение 5 часов и нерастворимые продукты удаляют фильтрованием. Фильтрат концентрируют при пониженном давлении и очищают на хроматографической колонке с силикагелем (растворитель; хлороформ : этилацетат = 3:1), что дает (S)-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-ацетилпиримидин (56.7 мг) в виде бесцветного масла, MS (м/е): 391 (МН+).
Пример 3
(1) К раствору (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-формилпиримидина (84 мг) в тетрагидрофуране (около 1 мл) добавляют по капле 1.0 М раствор винилбромида магния в тетрагидрофуране в сухой бане изо льда и ацетона. Реакционную смесь перемешивают при -78°С в течение 10 минут, а затем перемешивают при комнатной температуре в течение 10 минут. Затем ее выливают в смесь льда и насыщенного водного раствора гидрокарбоната натрия и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой и рассолом, сушат над безводным сульфатом натрия, затем концентрируют при пониженном давлении.
Полученный выше сырой продукт подвергают препаративной тонкослойной хроматографии (растворитель; этилацетат : метанол = 20:1), что дает (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-(1-гидрокси-2-пропен-1-ил)пиримидин (30 мг) в виде бесцветного масла, MS (м/е): 405 (МН+).
(2) К раствору (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-(1-гидрокси-2-пропен-1-ил)пиримидина (144 мг) в хлороформе (2.5 мл) добавляют диоксид марганца (432 мг) и смесь энергично перемешивают при комнатной температуре в течение трех дней. Нерастворимые продукты отделяют фильтрованием на целите и фильтрат концентрируют при пониженном давлении, что дает бледно-желтое масло (124 мг). Полученный сырой продукт очищают на хроматографической колонке с силикагелем (силикагель 20 г, растворитель; хлороформ : этилацетат = 2:1), что дает (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-(акрилоил)пиримидин (90 мг) в виде бесцветных кристаллов, т.пл. 113-115°С, MS (м/е): 403 (МН+).
(3) К раствору (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-(акрилоил)пиримидина (72 мг) в этаноле (2 мл) добавляют морфолин (78 мкл) при комнатной температуре и смесь перемешивают при комнатной температуре в течение 40 минут. Затем реакционную смесь концентрируют при пониженном давлении и остаток выливают в воду, после чего смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой и рассолом, сушат над безводным сульфатом магния и концентрируют досуха при пониженном давлении, что дает (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[(2-морфолиноэтил)карбонил]пиримидин (91 мг).
Полученный выше сырой продукт растворяют в этилацетате (10 мл) и раствор обрабатывают насыщенным раствором соляной кислоты в метаноле (5 мл) и концентрируют при пониженном давлении. К остатку добавляют этилацетат и смесь фильтруют. Полученное твердое вещество промывают гексаном, что дает (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[(2-морфолиноэтил)карбонил]пиримидин дигидрохдорид (65 мг), MS (м/е): 490 (МН+).
Пример 4
(1) При охлаждении льдом к раствору 4-(3-хлор-4-метоксибензиламино)-5-этоксикарбонил-2-метилтиопиримидина (972 мг), полученного выше, как указано в примере 1-(1), в хлороформе (8 мл) добавляют раствор м-хлорпербензойной кислоты (80%, 598 мг) в хлороформе (10 мл) в течение более 30 минут. Реакционную смесь перемешивают при охлаждении льдом в течение одного часа. Затем ее разбавляют раствором насыщенного водного раствора гидрокарбоната натрия и хлороформовый слой собирают, промывают последовательно насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, что дает с количественным выходом 2-метилсульфинил-4-(3-хлор-4-метоксибензиламино)-5-этоксикарбонилпиримидин в виде бесцветных карамелек, MS (м/е): 384 (MH+).
(2) При охлаждении льдом к раствору 2-метилсульфинил-4-(3-хлор-4-метоксибензиламино)-5-этоксикарбонилпиримидина (общее количество), полученного выше, как указано в (1), в тетрагидрофуране (6 мл) добавляют по капле 2N водный раствор гидроксида натрия (1.32 мл) в течение более 2 минут. Реакционную смесь перемешивают при охлаждении льдом в течение 30 минут и к ней добавляют тетрагидрофуран (8 мл) и N,N-диметилацетамид (6 мл). Затем ее вновь перемешивают при охлаждении льдом в течение 30 минут, а затем добавляют воду (5 мл) и N,N-диметилацетамид (2 мл), а затем перемешивают при охлаждении льдом в течение одного часа. Реакционную смесь подкисляют 10%-ным водным раствором лимонной кислоты, разбавляют водой и экстрагируют дважды этилацетатом. Экстракты объединяют, промывают водой и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток отделяют на хроматографической колонке с силикагелем (силикагель: 20 г, растворитель; хлороформ : этилацетат = 5:1 → хлороформ : изопропанол = 30:1), что дает 2-гидрокси-4-(3-хлор-4-метоксибензиламино)-5-этоксикарбонилпиримидин (618 мг) в виде слегка желтого кристаллического порошка, т.пл. 195-197°С.
(3) Смесь 2-гидрокси-4-(3-хлор-4-метоксибензиламино)-5-этоксикарбонилпиримидина (500 мг), полученного выше, как указано в (2), диэтиламинобензола (2 мл) и оксихлорида фосфора (4 мл) перемешивают при 80°С в течение 30 минут, а затем при 100°С в течение 5 часов. После охлаждения реакциионный раствор выливают в ледяную воду и смесь перемешивают при комнатной температуре в течение 30 минут. Затем ее экстрагируют этилацетатом и органический слой промывают водой и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на хроматографической колонке с силикагелем (силикагель: 7 г, растворитель; хлороформ), что дает 2-хлор-4-(3-хлор-4-метоксибензиламино)-5-этоксикарбонилпиримидин (375 мг) в виде слегка желтого кристаллического порошка, т.пл. 114-115°, MS (м/е): 356 (MH+).
(4) Смесь 2-хлор-4-(3-хлор-4-метоксибензиламино)-5-этоксикарбонилпиримидина (285 мг), полученного выше, как указано в (3), 5,6,7,8-тетрагидроимидазо[1,2-]пиразина (197 мг), триэтиламина (0.22 мл) и хлороформа (3 мл) перемешивают в течение 2.5 часов при комнатной температуре, а затем в течение еще 2.5 часов при 60°С. Реакционную смесь разбавляют этилацетатом и промывают водой. Водный слой экстрагируют этилацетатом и органический слой промывают водой и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на хроматографической колонке с силикагелем (силикагель: 10 г, растворитель; хлороформ : метанол = 50:1) и концентрируют при пониженном давлении. Реакционную смесь обрабатывают изопропиловым эфиром, что дает 2-(5,6,7,8-тетрагидроимидазо[1,2-]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-этоксикарбонилпиримидин (290 мг) в виде бесцветного кристаллического порошка, т.пл. 179-182°С, MS (м/е): 443 (MH+).
(5) Суспензию 2-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-этоксикарбонилпиримидина (290 мг), полученного, как указано в (4), и 2N водного раствора гидроксида натрия (1.64 мл) в смеси диметилсульфоксида (5 мл) и воды (1 мл) перемешивают при комнатной температуре в течение одного часа. Затем в смесь добавляют тетрагидрофуран (5 мл) и перемешивают при комнатной температуре в течение 13 часов. Тетрагидрофуран упаривают при пониженном давлении и полученный раствор разбавляют водой и нейтрализуют 10%-ным водным раствором лимонной кислоты. Осадок собирают фильтрованием, промывают водой, метанолом и изопропиловым эфиром, что дает 2-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-карбоксипиримидин (187 мг) в виде бесцветного кристаллического порошка, т.пл. 223-226°С (разложение), MS (м/е): 413 (М-Н)-.
(6) Смесь 2-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-карбоксипиримидина (60 мг), 4-метил-2-аминоэтилморфолина (22.7 мг), 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохдорида (30.6 мг), 1-гидроксибензотриазола (21.6 мг) и N,N-диметилформамида (3 мл) перемешивают при комнатной температуре в течение 22 часов. В реакционную смесь вливают воду и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой, насыщенным водным раствором гидрокарбоната натрия, водой и рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, что дает бесцветные кристаллы (70.0 мг), которые в дальнейшем перекристаллизовывают из смеси хлороформа и гексана, что приводит к 2-(5,б,7,8-тетрагидроимидазо[1,2-а]-пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-[(4-метил-2-морфолинил)метил]карбамоил]пиримидину (51.7 мг) в виде бесцветных игл, т.пл. 132-134°С, MS (м/е): 527 (МН+).
Примеры 5-6
Соответствующие исходные продукты аналогично обрабатывают в соответствии с методикой примера 4-(6), что дает соединения, представленные в таблице 1.
Пример 7-21
Соответствующие исходные продукты аналогично обрабатывают, что дает соединения, представленные в таблице 2.
Пример 22
(1) К раствору диизопропиламина (0.78 г) в тетрагидрофуране (40 мл) по капле добавляют 1.6 М раствор н-бутиллития в гексане (4.82 мл) в сухой бане изо льда и ацетона в течение более 3 минут. Смесь перемешивают в той же бане еще в течение 30 минут. Затем к смеси добавляют по капле раствор 2,6-дихлорпиразина (0.50 г) в тетрагидрофуране (5 мл) при той же температуре в течение более 15 минут, после чего смесь перемешивают в течение одного часа. Реакционную смесь выливают в сухой лед и смесь перемешивают при комнатной температуре в течение одного часа. Затем разбавляют 10%-ным водным раствором соляной кислоты, чтобы довести значение ее рН до около 2, и затем экстрагируют этилацетатом. Объединенные органические слои экстрагируют насыщенным водным раствором гидрокарбоната натрия и водный экстракт промывают этилацетатом, подкисляют 10%-ным водным раствором соляной кислоты и экстрагируют этилацетатом. Объединенный органический слой промывают водой и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток обрабатывают смесью хлороформа и гексана (1:1), что дает 2-карбокси-3,5-дихлорпиразина (234 мг) в виде слегка коричневого кристаллического порошка, т.пл. 139-141°С, MS (м/е): 191 (М-Н)-.
(2) Смесь 2-карбокси-3,5-дихлорпиразина (226 мг), полученного выше, как указано в (1), гидрокарбоната натрия (118 мг), йодистого метила (0.5 мл) и N,N-диметилформамида (1.8 мл) перемешивают при комнатной температуре в течение 14 часов. Смесь разбавляют 10% водным раствором лимонной кислоты и экстрагируют этилацетатом. Объединенный органический слой промывают водой и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, что дает 2-метоксикарбонил-3,5-дихлорпиразин (245 мг) в виде бледно-коричневого кристаллического порошка, т.пл. 60-63°С, MS (м/е): 206 (М+).
(3) Смесь 2-метоксикарбонил-3,5-дихлорпиразина (234 мг), полученного выше, как указано в (2), 3-хлор-4-метоксибензиламина (204 мг), триэтиламина (0.17 мл) и сухого толуола (3 мл) перемешивают при комнатной температуре в течение 7 часов. Реакционную смесь разбавляют 10%-ным водным раствором лимонной кислоты и экстрагируют этилацетатом. Экстракт промывают водой и насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток отделяют и очищают на хроматографической колонке с силикагелем (силикагель: 5 г, растворитель; гексан : хлороформ = 1:1) и желаемые фракции концентрируют при пониженном давлении, что дает 2-метоксикарбонил-3-(3-хлор-4-метоксибензиламино)-5-хлорпиразин (102 мг) в виде бледно-желтого кристаллического порошка, т.пл. 149-151°С, MS (м/е): 342 (МН+).
(4) Смесь 2-метоксикарбонил-3-(3-хлор-4-метоксибензиламино)-5-хлорпиразина (150 мг), 2-гидроксиметилпирролидина (88.6 мг) и триэтиламина (0.12 мл) в тетрагидрофуране (5 мл) перемешивают при комнатной температуре в течение 4 часов и нагревают при 50°С в течение 2 часов. Затем к смеси добавляют 2-гидроксиметилпирролидин (44.3 мг) и ее перемешивают при 50°С в течение одного часа. После охлаждения к смеси добавляют воду и экстрагируют этилацетатом. Экстракт промывают водой и рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученное желтое масло очищают на хроматографической колонке с силикагелем (растворитель; хлороформ : гексан = 1:1), что дает (S)-2-метоксикарбонил-3-(3-хлор-4-метоксибензиламино)-5-(2-гидроксиметил-1-пирролидинил)пиразин (123 мг) в виде бледно-желтого порошка, MS (м/е): 407 (МH+).
(5) К раствору (S)-2-метоксикарбонил-3-(3-хлор-4-метоксибензиламино)-5-(2-гидроксиметил-1-пирролидинил)пиразина (775 мг), полученного выше, как указано в (4), в этаноле (8 мл) добавляют 4N водный раствор гидроксида натрия (1.43 мл) и смесь перемешивают при комнатной температуре в течение 24 часов. Реакционную смесь подкисляют 10%-ным водным раствором соляной кислоты и экстрагируют этилацетатом. Органический слой промывают водой и рассолом, сушат над безводным сульфатом натрия, концентрируют при пониженном давлении и промывают дизопропиловым спиртом, что дает (S)-2-карбокси-3-(3-хлор-4-метоксибензиламино)-5-(2-гидроксиметил-1-пирролидинил)пиразин (537 мг) в виде желтых кристаллов, т.пл. 169-171°С, MS (м/е): 391 (М-Н)-.
(6) Смесь (S)-2-карбокси-3-(3-хлор-4-метоксибензиламино)-5-(2-гидроксиметил-1-пирролидинил)пиразина (80 мг), полученного выше, как указано в (5), 2-аминометилпиримидина (26.7 мг), 1,2-дихлорэтана (43 мг), 1-гидроксибензотриазола (30.3 мг) в N,N-диметилформамиде (3 мл) перемешивают при комнатной температуре в течение 18 часов. В реакционную смесь выливают воду и экстрагируют этилацетатом. Экстракт промывают водой, насыщенным водным раствором гидрокарбоната натрия и рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на хроматографической колонке с силикагелем (растворитель; этилацетат), что дает (S)-2-[N-(2-пиримидилметил)карбамоил]-3-(3-хлор-4-метоксибензиламино)-5-(2-гидроксиметил-1-пирролидинил)пиразин (87.6 мг), MS (м/е):484 (МН+).
Примеры 23-24
Соответствующие исходные продукты аналогично обрабатывают, как указано в примере 22, что дает соединения, представленные в таблице 3.
Пример 25
Смесь (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-(акрилоил)пиримидин (31 мг), метанола (1 мл) и концентрированной серной кислоты (одна капля) нагревают при кипении с обратным холодильником в течение 2 дней. После того как реакция завершена, растворитель упаривают при пониженном давлении и остаток разделяют тонкослойной хроматографией на силикагеле (растворитель; хлороформ : метанол = 30:1), что дает (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[(2-метоксиэтил)карбонил] пиримидин (27 мг) в виде бесцветного масла, MS (м/е): 435 (МН+).
Пример 26
Раствор (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидилметил)карбамоил]пиримидина (82.48 г) и моногидрата бензолсульфокислоты (60.06 г) в метаноле (1000 мл) концентрируют и перекристаллизовывают из смеси метанола и ацетона, что дает (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)-карбамоил]пиримидин дибензосульфанат (121.8 г) в виде бесцветных кристаллов, т.пл. 158.5-161.5°С.
Пример 27
Смесь (S)-4-(3-хлор-4-метоксибензиламино)-5-карбокси-2-(2-гидроксиметил-1-пирролидинил)пиримидина (100 мг), полученного выше в примере 1-(4), 4-амино-1,3,5-триметилпиразола (47.9 мг), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (58.7 мг), моногидрада 1-гидроксибензотриазола (41.3 мг) и N,N-диметилформамида (3 мл) перемешивают при комнатной температуре в течение 8 часов и выливают в водный раствор гидрокарбоната натрия. Смесь экстрагируют этилацетатом и органический слой промывают водой и насыщенным рассолом, а затем сушат над безводным сульфатом натрия. Растворитель упаривают при пониженном давлении и остаток очищают на хроматографической колонке с силикагелем (растворитель; хлороформ : метанол = 5:1), что дает (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(1,3,5-триметил-4-пиразолил)карбамоил] пиримидин (115 мг), MS (м/е): 500 (МH+).
Пример 28
(1) Раствор 4-хлор-5-этоксикарбонил-2-метилтиопиримидина (5.0 г) в сульфурилхлориде (20 мл) нагревают при 50°С в течение одного часа. Реакционную смесь концентрируют и затем в нее вливают насыщенный водный раствор гидрокарбоната натрия. Смесь экстрагируют этилацетатом и органический слой промывают водой и рассолом, сушат над сульфатом натрия и концентрируют. Остаток очищают флэш-хроматографией на колонке с силикагелем (растворитель; этилацетат : гексан = 1:10), что дает с количественным выходом 2,4-дихлор-5-этоксикарбонилпиримидин (4.87 г) в виде желтого масла, MS (м/е): 220 (М+).
(2) К раствору 2,4-дихлор-5-этоксикарбонилпиримидина (4.2 г), полученного выше, как указано в (1), и меркаптобензола (2.30 г) в толуоле (40 мл) добавляют карбонат калия (3.94 г) при 0°С и смесь перемешивают при комнатной температуре в течение одного часа, а затем перемешивают при 50°С в течение еще одного часа, а затем при 100°С еще в течение 10 минут. Затем в смесь вливают воду и экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над сульфатом натрия и концентрируют. Остаток очищают флэш-хроматографией на колонке с силикагелем (растворитель; этилацетат : гексан = 1:20 - этилацетат : гексан = 1:10), что дает 2-хлор-4-фенилтио-5-этоксикарбонилпиримидин (4.16 г) в виде бесцветных кристаллов, MS (м/е): 295 (МН+).
(3) К раствору 2-хлор-4-фенилтио-5-этоксикарбонилпиримидина (4.05 г), полученного выше, как указано в (2), в тетрагидрофуране (40 мл), добавляют L-пролинол (1.66 г) и триэтиламин (2.77 г) и смесь перемешивают при комнатной температуре в течение 20 часов. В реакционную смесь вливают воду и экстрагируют этилацетатом. Органический слой промывают рассолом, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш хроматографией на колонке с силикагелем (растворитель; этилацетат : гексан = 1:2), что дает (S)-2-(2-гидроксиметил- 1-пирролидинил)-4-фенилтио-5-этоксикарбонилпиримидин (4.16 г) в виде бесцветного вязкого масла, MS (м/е): 360 (MH+).
(4) К раствору (S)-2-(2-гидроксиметил-1-пирролидинил)-4-фенилтио-5-этоксикарбонилпиримидина (4.10 г), полученного выше, как указано в (3), в этаноле (50 мл) добавляют 4N водный раствор гидроксида натрия (8.6 мл) и смесь перемешивают при комнатной температуре в течение 15 часов. К реакционному раствору добавляют 10%-ный водный раствор лимонной кислоты (30 мл), пока раствор не станет слабокислым, и смесь экстрагируют этилацетатом. Органический слой промывают водой и рассолом, сушат над сульфатом натрия и концентрируют, что дает (S)-2-(2-гидроксиметил-1-пирролидинил)-4-фенилтио-5-карбоксипиримидин (3.65 г) в виде бесцветных кристаллов, MS (м/е): 330 (М-Н)-.
(5) Смесь (S)-2-(2-гидроксиметил-1-пирролидинил)-4-фенилтио-5-карбоксипиримидина (2.55 г), полученного выше, как указано в (4), 2-аминометилпиримидина (1.09 г), 1,2-дихлорэтана (1.77 г) и 1-гидроксибензотриазола (1.25 г) в N,N-диметилформамиде (40 мл) перемешивают при комнатной температуре в течение 16 часов. Затем в смесь вливают воду и экстрагируют этилацетатом. Органический слой промывают водой, насыщенный водным раствором гидрокарбоната натрия и рассолом, сушат над сульфатом натрия и концентрируют, что дает бледно-желтые кристаллы (4.05 г), которые в дальнейшем очищают флэш-хроматографией на колонке с силикагелем (растворитель; этилацетат), что дает 2-(2-гидроксиметил-1-пирролидинил)-4-фенилтио-5-[N-(2-пиримидилметил)карбамоил]пиримидин (2.39 г) в виде бесцветных кристаллов, т.пл. 154-156°С, ИК (Nujol): 1633 см-1, MS (м/е): 423 (МН+).
(6) К раствору (S)-2-(2-гидроксиметил-1-пирролидинил)-4-фенилтио-5-[N-(2-пиримидилметил)карбамоил]пиримидина (100 мг), полученного выше, как указано в (5), в хлороформе (3 мл) добавляют м-хлорпербензойную кислоту (70.1 мг) при 0°С и смесь перемешивают при 0°С в течение 30 минут. Затем к смеси добавляют 3-хлорбензиламин (50.3 мг) и триэтиламин (48.0 мг) при 0°С и перемешивают при комнатной температуре в течение 17 часов. После этого в смесь вливают воду и экстрагируют хлороформом. Органический слой промывают рассолом, сушат над сульфатом натрия и концентрируют при пониженном давлении, что дает желтое масло (169 мг), которое очищают флэш-хроматографией на колонке с силикагелем (растворитель; этилацетат) и растирают в порошок со смесью этилацетата и гексана, что дает (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлорбензиламино)-5-[N-(2-пиримидилметил)карбамоил]пиримидин (95.3 мг) в виде бесцветного порошка, т.пл. 153-156°С, ИК (Nujol): 3241, 1637 см-1, MS (м/е): 454 (MH+).
(7) К раствору (S)-2-(2-гидроксиметил-1-пирролидинил)-4-фенилтио-5-[N-(2-пиримидилметил)карбамоил]пиримидина (100 мг), полученного выше, как указано в (5), в хлороформе (3 мл) добавляют м-хлорпербензойную кислоту (70%, 70.1 мг) при 0°С и смесь перемешивают при 0°С в течение 30 минут. Затем к смеси добавляют 4-метоксибензиламин (48.8 мг) и триэтиламин (48.0 мг) при 0°С и перемешивают при комнатной температуре в течение 20 минут. Затем в смесь вливают воду и экстрагируют хлороформом и органический слой промывают рассолом, сушат над сульфатом натрия и концентрируют, что дает желтое масло (143 мг), которое очищают флэш-хроматографией на колонке с силикагелем (растворитель; этилацетат), что дает (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(4-метоксибензиламино)-5-[N-(2-пиримидилметил)карбамоил]пиримидин (88.2 мг) в виде бесцветного порошка, ИК (чистый): 3296, 1633 см-1, MS (м/е): 450 (MH+).
Пример 29
(1) Раствор (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-формилпиримидина (10.0 мг) в тетрагидрофуране (1.0 мл), полученного выше в примере 2 (3), обрабатывают 1.6 М раствором н-бутиллития в гексане (83 мкл) при -78°С в течение 3 минут, затем добавляют водный раствор гидрокарбоната натрия. Реакционную смесь экстрагируют этилацетатом, что дает (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-(1-гидроксипентил] пиримидин (13.7 мг) в виде масла.
(2) (S)-2-(2-Гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-(1-гидроксипентил)пиримидин, полученный как указано выше, обрабатывают диоксидом марганца (25 мг) при комнатной температуре и в полученную смесь постепенно добавляют дополнительное количество диоксида марганца (100 мг), затем перемешивают в течение ночи. Реакционную смесь нагревают при кипении с обратным холодильником в течение 5 часов и нерастворимые продукты удаляют фильтрованием. Фильтрат концентрируют при пониженном давлении и отделяют с помощью препаративной тонкослойной хроматографии, что дает (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-пентанолпиримидин (5.8 мг) в виде бесцветного масла, MS (м/е): 433 (МН+).
Примеры 30-83
Соответствующие исходные соединения обрабатывают по аналогичной методике, что дает соединения, приведенные в таблице 4.
Примеры 84-86
Соответствующие исходные соединения обрабатывают по аналогичной методике, что дает соединения, приведенные в таблице 5.
Пример 87
Смесь (S)-2-карбокси-3-(3-хлор-4-метоксибензиламино)-5-(2-гидроксиметил-1-пирролидинил)пиразина (80 мг), полученного выше в примере 22 (5), 2-аминометил-4-метилморфолина (31.9 мг), гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (43 мг), 1-гидроксибензотриазола (30.3 мг) в N,N-диметилформамиде (3 мл) перемешивают при комнатной температуре в течение 18 часов. В реакционную смесь вливают воду и экстрагируют этилацетатом. Экстракт промывают водой, насыщенным водным раствором гидрокарбоната натрия и рассолом, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке с силикагелем (растворитель; этилацетат), что дает (S)-2-[N-(4-метил-2-морфолинил)метилкарбамоил]-3-(3-хлор-4-метоксибензиламино)-5-(2-гидроксиметил-1-пирролидинил)пиразин (80.5 мг), MS (м/е): 505 (МН+), ИК (Nujol): 3295, 1635 см-1.
Примеры 88-91
Соответствующие исходные соединения обрабатывают по аналогичной методике, что дает соединения, приведенные в таблице 6.
Примеры 92-145
Соответствующие исходные соединения обрабатывают по аналогичной методике, что дает соединения, приведенные в таблице 7.
Пример 146
Соответствующие исходные соединения обрабатывают по аналогичной методике, что дает соединение следующей формулы в виде пены MS (м/е): 464 (МН+)
Пример 147
Соответствующие исходные соединения обрабатывают по аналогичной методике, что дает соединение следующей формулы, т.пл. 140-144°С
Пример 148
К раствору (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[Н-(2-пиримидилметил)карбамоил]пиримидина (307 мг), полученного выше в примере 1-(5), в хлористом метилене (6 мл) добавляют по капле бромид брома (300 мкл) при охлаждении льдом. Реакционную смесь перемешивают при 0°С в течение 4 часов, а затем добавляют метанол и насыщенный водный раствор гидрокарбоната натрия при охлаждении льдом. Смесь экстрагируют смесью этилацетата и тетрагидрофурана, органический слой промывают последовательно водой и рассолом. Смесь сушат над сульфатом натрия и концентрируют при пониженном давлении, что дает слегка коричневое аморфное вещество (227 мг). Его суспендируют в хлороформе и полученные нерастворимые продукты удаляют фильтрованием. Фильтрат подвергают хроматографии на колонке с силикагелем, а затем очищают с помощью колоночной хроматографии на NH-силикагеле, что дает (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-гидроксибензиламино)-5-[N-(2-пиримидилметил)карбамоил]пиримидин (129 мг) в виде бесцветной пены, MS (м/е): 470 (MH+), ИК (Nujol): 3279, 1632, 1593, 1569, 1518, 1463 см-1.
Пример 149
(1) Суспензию 2-метилтио-4-(3-хлор-4-метоксибензиламино)-5-этоксикарбонилпиримидина (2.00 г), полученного выше в примере 1 (1), в диметилсульфоксиде (10 мл) обрабатывают 10%-ным водным раствором гидроксида натрия (10 мл) при комнатной температуре. К реакционной смеси добавляют диметилсульфоксид (5 мл) и перемешивают при комнатной температуре в течение ночи. К полученному бесцветному раствору добавляют лимонную кислоту, пока раствор не станет кислым. К раствору добавляют избыточное количество воды (около 50 мл) и полученный осадок собирают фильтрованием. Осадок последовательно промывают изопропиловым спиртом и изопропиловым эфиром и сушат при пониженном давлении, что дает 2-метилтио-4-(3-хлор-4-метоксибензиламино)-5-карбоксипиримидин (1.864 г) в виде бледно-желтого мельчайшего порошка, т.пл. 238-240°С (разложение).
(2) К суспензии 4-(3-хлор-4-метоксибензиламино)-5-карбокси-2-метилтиопиримидина (200 мг) в хлористом метилене (5 мл) добавляют оксалилхлорид (150 мг) и N,N-диметилформамид и смесь перемешивают при комнатной температуре в течение 30 минут и концентрируют. К суспензии полученных хлорида кислоты и 5-аминопиримидина (84.0 мг) в хлористом метилене (5 мл) добавляют диметиламинопиримидин (144 мг) при комнатной температуре и смесь перемешивают при комнатной температуре. Затем в смесь вливают воду и экстрагируют этилацетатом. Экстракт промывают насыщенным водным раствором гидрокарбоната натрия, водой и рассолом, сушат над сульфатом натрия и концентрируют. Остаток обрабатывают смесью этилацетата и н-гексана, что дает 4-(3-хлор-4-метоксибензиламино)-5-(5-пиримидиниламинокарбонил)-2-метилтиопиримидин (216 мг) в виде бледно-желтых игл, т.пл. 238-240°С, ИК (Nujol): 3251, 1666 см-1, MS (м/е): 416 (М+).
(3) К суспензии соединения (150 мг), полученного выше, как указано в (2), в хлороформе (10 мл) добавляют м-хлорпербензойную кислоту (107 мг) при 0°С и смесь перемешивают при 0°С в течение одного часа, затем при комнатной температуре в течение еще одного часа. После этого к смеси добавляют м-хлорпербензойную кислоту (53 мг) при 0°С и перемешивают при 0°С в течение 30 минут. Затем добавляют L-пролинол (43.7 мг) и триэтиламин (72.9 мг) при 0°С и смесь перемешивают при комнатной температуре в течение 20 часов. Затем в смесь вливают воду и экстрагируют хлороформом. Органический слой промывают рассолом, сушат над сульфатом натрия и концентрируют при пониженном давлении, что дает желтое вязкого масло (201 мг), которое очищают с помощью флэш-хроматографии на NH-силикагелевой колонке (растворитель; этилацетат), промывают смесью этилацетата и гексана, что дает (S)-4-(3-хлор-4-метоксибензиламино)-5-(5-пиримидиниламинокарбонил)-2-(гидроксиметил-1-пирролидинил)пиримидин (81 мг) в виде бесцветных игл, т.пл. 192-195°С, ИК (Nujol): 3279, 1669 см-1, MS (м/е): 470 (МН+).
Примеры 150-157
Соответствующие исходные соединения обрабатывают по аналогичной методике, что дает соединения, приведенные в таблице 8.
Пример 158
(1) Суспензию 4-(3-хлор-4-метоксибензиламино)-5-карбокси-2-метилтиопиримидина (154.0 мг), полученного выше в примере 149 (1), в хлористом метилене (5 мл) обрабатывают оксалилхлоридом (119 мкл) при комнатной температуре и в нее добавляют N,N-диметилформамид. Смесь перемешивают в течение одного часа и растворитель упаривают при пониженном давлении. Остаток обрабатывают эфиром и выдерживают в холодильнике в течение ночи. Летучие продукты удаляют при пониженном давлении и остаток обрабатывают избыточным количеством диазометана при 0°С, после чего оставляют в холодильнике на ночь. Реакцию захолаживают метанолом и смесь очищают с помощью хроматографии на силикагеле (растворитель; гексан : этилацетат = 2:1), что дает 4-(3-хлор-4-метоксибензиламино)-5-(диазометилкарбонил)-2-метилтиопиримидин (21.5 мг) в виде бледно-желтого твердого вещества ИК (Nujol): 3277, 2115, 1607, 1567, 1461, 1377, 1357, 1141 см-1, MS (м/е): 364 (МН+), т.пл. 162-165°С (разложение).
(2) Суспензию соединения, полученного выше, как указано в (1), (16.5 мг) в метаноле (3 мл) обрабатывают моногидратом толуолсульфокислоты (16.5 мг) при комнатной температуре. Растворитель упаривают при пониженном давлении и остаток очищают препаративной ТСХ (растворитель; гексан : этилацетат = 2:1), что дает 4-(3-хлор-4-метоксибензиламино)-5-(метоксиметилкарбонил)-2-метилтиопиримидин (11.0 мг) в виде бесцветного масла.
(3) Раствор соединения (11.0 мг), полученного выше (2), в хлороформе (1 мл) обрабатывают с м-хлорпербензойной кислотой (7.4 мг) при 0°С. Смесь обрабатывают триэтиламином (8.3 мкл) и L-пролинолом (36 мг) при комнатной температуре и полученную реакционную смесь перемешивают в течение ночи. Затем ее разбавляют этилацетатом, промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. Остаток очищают препаративной ТСХ (растворитель; хлороформ : этилацетат = 1:1), что дает (S)-4-(3-хлор-4-метоксибензиламино)-5-(метоксиметилкарбонил)-2-(2-гидроксиметил-1-пирролидинил)пиримидин (8.5 мг) в виде бесцветного масла, MS (м/е): 421 (МН+).
Промышленная применимость
Соединение (I) в соответствии с настоящим изобретением и его фармацевтически приемлемая соль демонстрируют отличную PDE V ингибирующую активность и они применимы в качестве фармацевтических соединений для профилактики и лечения заболеваний, таких как нарушение эрекции, дисфункции и т.д.
Результаты фармакологических экспериментов
Эксперимент 1. Ингибирующая активность в отношении фосфодиэстеразы (PDE V)
[Получение PDE V]
Гомогенат легкого, извлеченного из нечистокровного кобеля, центрифугируют, и супернатант фракционируют методом анионообменной колоночной хроматографии. Фракции, удовлетворяющие приведенным далее условиям 1-5, смешивают и получают образец частично очищенной PDE V.
Условие 1. Она может селективно гидролизовать cGMP.
Условие 2. На гидролизующую активность в отношении cGMP не влияют EGTA*1 или калмодулин.
Условие 3. Ее активность не подавляется селективным ингибитором фосфодиэстеразы III С1930*2.
Условие 4. Ее активность не подавляется селективным ингибитором фосфодиэстеразы IV ролипрамом*3.
Условие 5. Ее активность не подавляется селективным ингибитором фосфодиэстеразы V Е-4021*4.
[Примечания]
*1 - EGTA представляет собой образующий хелатный комплекс с кальцием агент формулы (xv)
[-CH2OCH2CH2N(CH2COOH)2]2 (XV),
который может ингибировать активность PDE I, образуя хелатный комплекс с ионом кальция в растворе фермента.
*2 - CI930 является селективным ингибитором PDE III формулы (xvi)
Его используют с целью подтверждения отсутствия примеси PDE III в растворе фермента PDE V.
*3 - Ролипрам является селективным ингибитором PDE IV формулы (xvii)
Его используют с целью подтверждения отсутствия примеси PDE IV в растворе фермента PDEV.
*4 - Е-4021 является селективным ингибитором PDE V формулы (xviii)
[Измерение активности PDE V]
Измерение осуществляют с использованием частично модифицированного способа процедуры Thompson et al. (см. Advances in Cyclic Nucleotide Research, Vol. 10, Raven Press, New York, pp. 69-92, 1979) следующим образом.
Образец частично очищенной PDE V разводят в 50 мМ трис-НСl (рН 8,0) таким образом, чтобы можно было гидролизовать примерно 10% всего субстрата. Указанный образец (100 мкл) вводят в стеклянную пробирку. В пробирку добавляют буфер для анализа (50 мМ трис-HCl, рН 8,0, содержащий 12,5 мМ MgCl2, 10 мМ 2-меркаптоэтанола) (200 мкл) и добавляют также раствор (5 мкл) испытываемого соединения (соединения примеров) (100-кратная концентрация) в диметилсульфоксиде. После инкубации при 37°С в течение 5 минут добавляют 2,5 мкМ [3H]-cGMP (3,7 кБк/200 мкл) (200 мкл) для инициации реакции (конечная концентрация 50 мМ трис-HCl, рН 8,0, 5 мМ MgCb, 4 мМ 2-меркаптоэтанола). После взаимодействия при 37°С в течение 30 минут пробирку переносят в кипящую водяную баню для прекращения реакции. Через 90 секунд пробирку переносят в баню со смесью воды со льдом для охлаждения реакционной смеси до комнатной температуры. После предварительной инкубации при 37°С в течение 5 минут в пробирку добавляют водный раствор (100 мкл) змеиного яда и проводят реакцию в смеси при 37°С в течение 30 минут. Реакцию прекращают, добавляя в пробирку метанол (500 мкл), и реакционную смесь (1 мл) загружают в колонку, заполненную смолой Dowex (торговое наименование Dowex 1×8, производится Sigma Inc.) (200 мл). Смолу промывают метанолом (1 мл). Реакционный раствор, пропущенный через колонку, объединяют с промывочным раствором, и определяют активность PDE V в объединенном растворе, определяя радиоактивность [3H]-гуанозина в растворе.
Такую же процедуру осуществляют для раствора-пустышки (используют только буфер для анализа без добавления образца фермента) и также для растворителя (диметилсульфоксида) вместо испытываемого раствора, в то время как образец фермента добавляют.
Показатель ингибирования испытываемых соединений определяют, вычисляя процент ингибирующей активности каждого испытываемого соединения относительно ингибирующей активности контрольного раствора, и ингибирующую активность в отношении PDE V оценивают по IC50 (т.е. по количеству (нМ) испытываемого соединения, показывающего степень ингибирования 50% относительно контроля). IС50 вычисляют методом линейной регрессии на основе ингибирующих концентраций для 3 или большего числа концентраций испытываемого соединения. Результаты показаны в таблице 9.
Эксперимент 2. Релаксация пещеристого тела, иссеченного из кроликов
[Получение образца]
Используют новозеландских белых кроликов (в возрасте 10-20 недель). Сразу же после того, как кроликов умерщвляют, спуская кровь под наркозом, из полового члена кроликов иссекают пещеристое тело. После удаления соединительной ткани иссеченное пещеристое тело нарезают на полоски (длиной примерно 5 мм) и получают образцы. На образцы в виде полосок дают остаточную нагрузку 1,5 г в пробирке Магнуса, содержащей питательную жидкость* (10 мл), и напряжение на образцах стабилизируют в течение примерно 60 минут. После подтверждения сократительной реакции образцов в водном растворе КСl высокой концентрации (120 нМ) образцы подвергают испытанию. Во время испытания питательную жидкость выдерживают при температуре 37±0,5°С при пропускании газа 95% О2 - 5% CO2. Изометрическое напряжение измеряют с помощью U-образного датчика и усилителя деформации (серия АР600, изготовляется Nippon Koden) и регистрируют на перьевом самописце (Graphtec Multicorder MC6621).
*) Питательная жидкость содержит 118,0 мМ NaCl; 4,7 мМ КСl; 1,5 мМ СаСl2; 1,2 мМ КН2РO4; 1,2 мМ MgSO4; 25,0 мМ NaHCO3; 11,0 мМ глюкозы и 0,023 мМ ЭДТК.
[Релаксация образца, сокращенного фенилэфрином]
Образец сокращается под действием фенилэфрина. После сокращения образцов, ставших непрерывной фазой, кумулятивно добавляют испытываемое соединение в количестве 0,1, 1, 10, 100 и 1000 нМ с интервалом 30 минут. Наконец, добавляют папаверин (100 мкМ), с помощью которого определяют максимальную реакцию релаксации. Степень релаксации от испытываемых соединений при каждой концентрации вычисляют, основываясь на максимальной релаксации под действием папаверина (100 мкМ), которую принимают за 100%. Степень релаксации испытываемого соединения оценивают как ЕС30 (т.е. количество (нМ) испытываемого соединения, при котором наблюдают степень релаксации в 30% от релаксации в случае папаверина). Результаты показаны в таблице 10.
Пример приготовления фармацевтической композиции в виде таблетки.
К (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)карбамоил]пиримидину (т.е. ингибитору PDE-V) (250 г), маннитолу (325 г) и фумаровой кислоте (100 г) добавляют 25 мас.% водный раствор гидроксипропилцеллюлозы (HPC-SL, Nippon Soda Co., Ltd.) (70 г) и смешивают для грануляции с помощью планетарной мешалки (5DMV-01-r, Dalton Co., Ltd.). Гранулы сушат, сортируют по размеру с помощью классификатора (P-02S, Dalton Co., Ltd.) и просеивают через сито №22. К аликвоте (650 г) полученных гранул добавляют гидроксипропилцеллюлозу с низкой степенью замещения (L-НРС, Shin-Etsu Chemical Co., Ltd.) (41,9 г) и стеарат магния (7,0 г) и смешивают с помощью барабанного смесителя двухконусного типа (Yashima Chemical Engineering Co., Ltd.) при 55 об/мин в течение 3 минут и получают гранулы для таблетирования. Гранулы прессуют на роторной таблетирующей машине (СРС818 HUK-DC-AWC, Kikusui Seisakusyo Ltd., пуансон 07,5, 11R, давление сжатия 6 кН/пуансон) и получают таблетки, содержащие ингибитор PDE-V (150 мг/таблетку).
Данные по токсичности:
При пероральном введении коротконогим гончим соединения примера 1 в дозе 100 мг/кг в течение одной недели ни одно животное не погибло.
Claims (27)
1. Ароматическое азотсодержащее 6-членное циклическое соединение формулы (I)
где кольцо А представляет собой замещенную азотсодержащую гетероциклическую группу, где азотсодержащая гетероциклическая группа представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу, имеющую 1-2 атома азота и также возможно содержащую атом кислорода или серы в гетероциклическом остатке, или 8-10-членную азотсодержащую гетеробициклическую группу, имеющую 1-3 атома азота и также возможно содержащую атом кислорода или серы в гетероциклическом остатке; заместитель азотсодержащей гетероциклической группы выбирают из группы, состоящей из (1) C1-6алкильной группы, (2) гидроксизамещенной C1-6алкильной группы, (3) формильной группы, (4) оксогруппы, (5) аминогруппы, (6) гидроксигруппы, (7) (C1-6алкокси)карбонильной группы, (8)пиримидильной группы, замещенной (i) бензиламиногруппой, замещенной атомом галогена и C1-6алкоксигруппой, и (ii) (С3-8циклоалкил)карбамоильной группой, замещенной гидроксигруппой;
R1 представляет собой (1) замещенную C1-6 алкильную группу, которая может быть необязательно замещена группой, выбранной из группы, состоящей из C1-6алкоксигруппы, гидроксигруппы, морфолинильной группы, C1-6 алкилсульфонильной группы, ди(C1-6алкил)фосфиногруппы, ди(C1-6алкил)аминогруппы, пиримидинилзамещенной C1-6алкиламиногруппы, пиридильной группы, пиридиламиногруппы и C1-6алкилзамещенной пиперазинильной группы, группы формулы -NH-Q-R3, где Q и R3 имеют значения, определенные ниже, или группы формулы: -NH-R4, где R4 имеет значения, определенные ниже, (2) группу формулы -NH-Q-R3 (в которой R3 представляет собой замещенную азотсодержащую гетероциклическую группу, где азотосодержащая гетероциклическая группа представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу, имеющую 1-2 атома азота, и также возможно содержащую атом кислорода или серы в гетероциклическом остатке, или 8-10-членную азотсодержащую гетеробициклическую группу, имеющую 1-3 атома азота и также возможно содержащую атом кислорода или серы в гетероциклическом остатке; заместитель азотсодержащей гетероциклической группы выбирают из группы, состоящей из C1-6алкильной группы, гидроксизамещенной C1-6алкильной группы, оксогруппы, аминогруппы, ди(C1-6алкил)аминогруппы, C2-7алканоильной группы и цианозамещенной C1-6алкильной группы, и Q представляет собой C1-6алкиленовую группу или простую связь) или (3) группу формулы -NH-R4 (в которой R4 представляет собой замещенную С3-8циклоалкильную группу, которая может быть необязательно замещена группой, выбранной из группы, состоящей из гидроксигруппы, C1-6алкоксигруппы и пиримидинилоксигруппы);
R2 представляет собой замещенную арильную группу, которая может быть необязательно замещена группой, выбранной из группы, состоящей из C1-6алкоксигруппы, атома галогена, цианогруппы, нитрогруппы, гидроксигруппы и C1-6алкильной группы;
один из Y и Z представляет собой группу формулы =СН—, а другой представляет собой группу формулы =N—,
или его фармацевтически приемлемая соль.
2. Соединение по п.1, в котором азотсодержащая гетероциклическая группа "замещенной азотсодержащей гетероциклической группы" для кольца А представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу формулы
или азотсодержащую гетеробициклическую группу следующей формулы, где указанная выше 5- или 6-членная азотсодержащая гетеромоноциклическая группа и 5- или 6-членная циклическая группа являются конденсированными:
и азотсодержащая гетероциклическая группа "замещенной азотсодержащей гетероциклической группы" для R3 представляет собой неароматическую азотсодержащую гетероциклическую группу формулы
или ароматическую азотсодержащую гетероциклическую группу формулы
или его фармацевтически приемлемая соль.
3. Соединение по п.1, в котором азотсодержащая гетероциклическая группа "замещенной азотсодержащей гетероциклической группы" для кольца А представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу или 8-10-членную азотсодержащую гетеробициклическую группу и заместитель указанной "замещенной азотсодержащей гетероциклической группы" выбирают из группы, состоящей из C1-6алкильной группы, гидроксизамещенной C1-6алкильной группы, формильной группы, оксогруппы, R1 представляет собой C1-6алкильную группу, которая может необязательно иметь заместитель, выбранный из группы, состоящей из C1-6алкоксигруппы, морфолинильной группы, группу формулы -NH-Q-R3 или группу формулы -NH-R4, "замещенная азотсодержащая гетероциклическая группа" для R3 представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу, которая может быть необязательно замещена C1-6алкильной группой; R4 представляет собой циклоС3-8алкильную группу, имеющую заместитель, выбранный из группы, состоящей из гидроксигруппы, C1-6алкоксигруппы; R2 представляет собой фенильную группу, имеющую заместитель, выбранный из группы, состоящей из C1-6алкоксигруппы, атома галогена, цианогруппы.
4. Соединение по п.3, в котором азотсодержащая гетероциклическая группа "замещенной азотсодержащей гетероциклической группы" для кольца А представляет собой 5- или 6-членную неароматическую азотсодержащую гетеромоноциклическую группу формулы
или азотсодержащую гетеробициклическую группу следующей формулы, где указанная выше 5- или 6-членная неароматическая азотсодержащая гетеромоноциклическая группа и 5- или 6-членная ароматическая азотсодержащая гетеромоноциклическая группа являются конденсированными:
азотсодержащая гетероциклическая группа "замещенной азотсодержащей гетероциклической группы" для R3 представляет собой неароматическую азотсодержащую гетеромоноциклическую группу формулы
или ароматическую азотсодержащую гетеромоноциклическую группу формулы
5. Соединение по п.1, в котором кольцо А представляет собой группу формулы
R1 представляет собой C1-6алкильную группу, C1-6алкоксизамещенную C1-6алкильную группу, морфолинилзамещенную C1-6алкильную группу, группу формулы -NH-Q-R3 или группу формулы -NH-R4; R3 представляет собой группу формулы
R4 представляет собой группу формулы
и R2 представляет собой группу формулы
6. Соединение по п.1, в котором азотсодержащая гетероциклическая группа "замещенной азотсодержащей гетероциклической группы" для кольца А представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу или 8-10-членную азотсодержащую гетеробициклическую группу и заместитель указанной "замещенной азотсодержащей гетероциклической группы" выбирают из группы, состоящей из C1-6алкильной группы, гидроксизамещенной C1-6алкильной группы, формильной группы, оксогруппы; R1 представляет собой C1-6алкоксизамещенную C1-6алкильную группу, группу формулы -NH-Q-R3 или группу формулы -NH-R4, "замещенная азотсодержащая гетероциклическая группа" для R3 представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу, которая может быть необязательно замещена C1-6алкильной группой; R4 представляет собой гидроксизамещенную С3-8циклоалкильную группу; R2 представляет собой фенильную группу, имеющую заместитель, выбранный из группы, состоящей из C1-6 алкоксигруппы и атома галогена.
7. Соединение по п.6, в котором азотсодержащая гетероциклическая группа "замещенной азотсодержащей гетероциклической группы" для кольца А представляет собой 5- или 6-членную неароматическую азотсодержащую гетеромоноциклическую группу формулы
или группу формулы
азотсодержащая гетероциклическая группа "замещенной азотсодержащей гетероциклической группы" для R3 представляет собой неароматическую азотсодержащую гетеромоноциклическую группу формулы
ароматическую азотсодержащую гетеромоноциклическую группу формулы
8. Соединение по п.1, в котором кольцо А представляет собой группу формулы
или
R1 представляет собой C1-6алкоксизамещенную C1-6алкильную группу, группу формулы -NH-Q-R3 или группу формулы -NH-R4, R3 представляет собой группу формулы
или
R4 представляет собой группу формулы
и R2 представляет собой группу формулы
9. Соединение по п.1, в котором азотсодержащая гетероциклическая группа "замещенной азотсодержащей гетероциклической группы" для кольца А представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу или 8-10-членную азотсодержащую гетеробициклическую группу и заместитель указанной "замещенной азотсодержащей гетероциклической группы" представляет собой гидроксизамещенную C1-6алкильную группу; R1 представляет собой группу формулы -NH-Q-R3, "замещенная азотсодержащая гетероциклическая группа" для R3 представляет собой 5- или 6-членную азотсодержащую гетеромоноциклическую группу, которая может быть необязательно замещена C1-6алкильной группой; R2 представляет собой фенильную группу, замещенную группой, выбранной из группы, состоящей из C1-6алкоксигруппы и атома галогена.
10. Соединение по п.9, в котором азотсодержащая гетероциклическая группа "замещенной азотсодержащей гетероциклической группы" для кольца А представляет собой 5- или 6-членную неароматическую азотсодержащую гетеромоноциклическую группу формулы
или группу формулы
азотсодержащая гетероциклическая группа "замещенной азотсодержащей гетероциклической группы" для R3 представляет собой неароматическую азотсодержащую гетеромоноциклическую группу формулы
или ароматическую азотсодержащую гетеромоноциклическую группу формулы
или
12. Соединение по любому из пп.1-11, в котором Y представляет собой группу формулы =N-, и Z представляет собой группу формулы =СН-.
13. Соединение по п.1, выбранное из группы, включающей
(S)-2-(2-Гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)карбамоил]пиримидин;
2-(6,7-дигидро-5Н-пирроло[3,4-b]пиридин-6-ил)-4-(3-циано-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(транс-4-метоксициклогексил)карбамоил]пиримидин;
2-(6,7-дигидро-5Н-пирроло[3,4-b]пиридин-6-ил)-4-(3-циано-4-метоксибензиламино)-5-[N-(транс-4-гидроксициклогексил)карбамоил]пиримидин;
2-(6,7-дигидро-5H-пирроло[3,4-b]пиридин-6-ил)-4-(3-циано-4-метоксибензиламино)-5-[N-(2-морфолиноэтил)карбамоил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-морфолиноэтил)карбамоил]пиримидин;
2-[(2S)-2-гидроксиметил-1-пирролидинил]-4-(3-хлор-4-метоксибензиламино)-5-[N-[[(2R)-4-метил-2-морфолинил]метил]карбамоил]пиримидин;
2-[(2S)-2-гидроксиметил-1-пирролидинил]-4-(3-хлор-4-метоксибензиламино)-5-[N-[[(2S)-4-метил-2-морфолинил]метил]карбамоил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(4-пиримидинилметил)карбамоил]пиримидин;
2-(4-метил-3-оксо-1-пиперазинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(транс-4-гидроксициклогексил)карбамоил]пиримидин;
2-(4-формил-1-пиперазинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(транс-4-гидроксициклогексил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(транс-4-гидроксициклогексил)карбамоил]пиримидин;
2-[цис-2,5-бис(гидроксиметил)-1-пирролидинил]-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-морфолиноэтил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидро-1,7-нафтиридин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-морфолиноэтил)карбамоил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-ацетилпиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(4-пиридазинилметил)карбамоил]пиримидин;
(S)-2-(2-гидpoкcимeтил-1-пиppoлидинил)-4-(3-xлop-4-мeтoкcибeнзилaминo)-5-[N-(5-пиримидинилметил)карбамоил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиридилметил)карбамоил]пиримидин;
(S)-2-[N-(2-пиримидинилметил)карбамоил]-3-(3-хлор-4-метоксибензиламино)-5-[2-гидроксиметил-1-пирролидинил]пиразин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[(2-морфолиноэтил)карбонил]пиримидин;
2-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-[(4-метил-2-морфолинил)метил]карбамоил]пиримидин;
(S)-2-[N-(2-морфолиноэтил)карбамоил]-3-(3-хлор-4-метоксибензиламино)-5-(2-гидроксиметил-1-пирролидинил)пиразин;
2-[N-(2-пиримидинилметил)карбамоил]-3-(3-хлор-4-метоксибензиламино)-5-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)пиразин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[(2-метоксиэтил)карбонил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(1,3,5-триметил-4-пиразолил)карбамоил]пиримидин
или его фармацевтически приемлемая соль.
14. Соединение по п.1, выбранное из группы, включающей
(S)-2-(2-Гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)карбамоил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(4-пиримидинилметил)карбамоил]пиримидин;
2-(4-метил-3-оксо-1-пиперазинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(транс-4-гидроксициклогексил)карбамоил]пиримидин;
2-(4-формил-1-пиперазинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(транс-4-гидроксициклогексил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-морфолиноэтил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидро-1,7-нафтиридин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-морфолиноэтил)карбамоил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(5-пиримидинилметил)карбамоил]пиримидин;
(S)-2-[N-(2-пиримидинилметил)карбамоил]-3-(3-хлор-4-метоксибензиламино)-5-(2-гидроксиметил-1-пирролидинил)пиразин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[(2-метоксиэтил)карбонил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(1,3,5-триметил-4-пиразолил)карбамоил]пиримидин
или его фармацевтически приемлемая соль.
15. Соединение по п.1, выбранное из группы, включающей:
(S)-2-(2-Гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)карбамоил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-морфолиноэтил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидроимидазо[1,2-а]пиразин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)карбамоил]пиримидин;
2-(5,6,7,8-тетрагидро-1,7-нафтиридин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-морфолиноэтил)карбамоил]пиримидин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(5-пиримидинилметил)карбамоил]пиримидин;
(S)-2-[N-(2-пиримидинилметил)карбамоил]-3-(3-хлор-4-метоксибензиламино)-5-(2-гидроксиметил-1-пирролидинил)пиразин;
(S)-2-[N-(2-морфолиноэтил)карбамоил]-3-(3-хлор-4-метоксибензиламино)-5-(2-гидроксиметил-1-пирролидинил)пиразин;
(S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(1,3,5-триметил-4-пиразолил)карбамоил]пиримидин
или его фармацевтически приемлемая соль.
16. Соединение по п.1, представляющее собой (S)-2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-пиримидинилметил)карбамоил]пиримидин или его фармацевтически приемлемую соль.
17. Соединение по п.1, представляющее собой 2-(5,6,7,8-тетрагидро-1,7-нафтиридин-7-ил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(2-морфолиноэтил)карбамоил]пиримидин или его фармацевтически приемлемую соль.
18. Соединение по п.1, представляющее собой 2-(2-гидроксиметил-1-пирролидинил)-4-(3-хлор-4-метоксибензиламино)-5-[N-(1,3,5-триметил-4-пиразолил)карбамоил]пиримидин или его фармацевтически приемлемую соль.
19. Соединение или его фармацевтически приемлемая соль по любому из пп.1-18, обладающие PDE V ингибирующей активностью, пригодные для лечения пациента от дисфункции, связанной с нарушением эрекции.
20. Соединение или его фармацевтически приемлемая соль по любому из пп.1-18, обладающие PDE V ингибирующей активностью, пригодные для лечения пациента от диабетического гастропареза.
21. Соединение или его фармацевтически приемлемая соль по любому из пп.1-18, обладающие PDE V ингибирующей активностью, пригодные для лечения пациента от легочной гипертонии.
22. Фармацевтическая композиция, обладающая PDE V ингибирующей активностью, содержащая в качестве активного ингредиента соединение по любому из пп.1-18 или его фармацевтически приемлемую соль.
23. Соединение по любому из пп.1-18 или его фармацевтически приемлемая соль для использования при лечении пациента от дисфункции, связанной с нарушением эрекции.
24. Соединение по любому из пп.1-18 или его фармацевтически приемлемая соль для использования при лечении пациента от легочной гипертонии.
25. Соединение по любому из пп.1-18 или его фармацевтически приемлемая соль для использования при лечении пациента от диабетического гастропареза.
Приоритет по пунктам:
28.04.200 по п.1 (за исключением соединений, охарактеризованных в п.16 и 17), 2-15. 18-25;
16.09.1999 по пп.16 и 17.
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP11/261852 | 1999-09-16 | ||
| JP26185299 | 1999-09-16 | ||
| JP2000130371 | 2000-04-28 | ||
| JP2000/130371 | 2000-04-28 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| RU2002109792A RU2002109792A (ru) | 2003-12-27 |
| RU2233273C2 true RU2233273C2 (ru) | 2004-07-27 |
| RU2233273C3 RU2233273C3 (ru) | 2019-07-17 |
Family
ID=26545273
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2002109792A RU2233273C3 (ru) | 1999-09-16 | 2000-09-13 | Ароматические азотсодержащие 6-членные циклические соединения и фармацевтическая композиция |
Country Status (27)
| Country | Link |
|---|---|
| US (2) | US6656935B2 (ru) |
| EP (1) | EP1219609B1 (ru) |
| KR (1) | KR100532546B1 (ru) |
| CN (2) | CN102584799A (ru) |
| AR (1) | AR025668A1 (ru) |
| AT (1) | ATE358670T1 (ru) |
| AU (1) | AU767558B2 (ru) |
| BE (1) | BE2013C051I2 (ru) |
| BG (1) | BG65453B1 (ru) |
| BR (1) | BRPI0014526C1 (ru) |
| CA (1) | CA2383466C (ru) |
| CY (2) | CY1106534T1 (ru) |
| DE (1) | DE60034239T2 (ru) |
| DK (1) | DK1219609T3 (ru) |
| ES (1) | ES2283315T3 (ru) |
| FR (1) | FR13C0050I2 (ru) |
| HK (1) | HK1044535A1 (ru) |
| HU (1) | HU225917B1 (ru) |
| IL (2) | IL148291A0 (ru) |
| LU (1) | LU92249I2 (ru) |
| MY (1) | MY123528A (ru) |
| NO (2) | NO322038B1 (ru) |
| PT (1) | PT1219609E (ru) |
| RU (1) | RU2233273C3 (ru) |
| TR (1) | TR200200701T2 (ru) |
| TW (1) | TWI258471B (ru) |
| WO (1) | WO2001019802A1 (ru) |
Families Citing this family (98)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6403597B1 (en) * | 1997-10-28 | 2002-06-11 | Vivus, Inc. | Administration of phosphodiesterase inhibitors for the treatment of premature ejaculation |
| US7273868B2 (en) * | 2000-04-28 | 2007-09-25 | Tanabe Seiyaku Co., Ltd. | Pyrazine derivatives |
| US20080027037A1 (en) * | 2000-04-28 | 2008-01-31 | Tanabe Seiyaku Co., Ltd. | Cyclic compounds |
| NZ522217A (en) * | 2000-04-28 | 2004-04-30 | Tanabe Seiyaku Co | Cyclic compounds |
| US7501409B2 (en) | 2000-09-06 | 2009-03-10 | Mitsubishi Tanabe Pharma Corporation | Preparations for oral administration |
| DK1330452T3 (da) * | 2000-09-20 | 2009-03-16 | Ortho Mcneil Janssen Pharm | Pyrazinderivater som modulatorer af tyrosinkinaser |
| US6878714B2 (en) | 2001-01-12 | 2005-04-12 | Amgen Inc. | Substituted alkylamine derivatives and methods of use |
| US20020147198A1 (en) * | 2001-01-12 | 2002-10-10 | Guoqing Chen | Substituted arylamine derivatives and methods of use |
| US6995162B2 (en) | 2001-01-12 | 2006-02-07 | Amgen Inc. | Substituted alkylamine derivatives and methods of use |
| US20030134836A1 (en) | 2001-01-12 | 2003-07-17 | Amgen Inc. | Substituted arylamine derivatives and methods of use |
| CN100372536C (zh) | 2001-02-15 | 2008-03-05 | 田边三菱制药株式会社 | 在口腔中迅速崩解的片剂 |
| AR036375A1 (es) * | 2001-08-30 | 2004-09-01 | Novartis Ag | Compuestos pirrolo [2,3-d] pirimidina -2- carbonitrilo, un proceso para su preparacion, una composicion farmaceutica y el uso de dichos compuestos para la preparacion de medicamentos |
| EP2332924A1 (de) * | 2001-10-17 | 2011-06-15 | Boehringer Ingelheim Pharma GmbH & Co. KG | Pyrimidinderivate, Arzneimittel enthaltend diese Verbindungen, deren Verwendung und Verfahren zu ihrer Herstellung |
| EP1453516A2 (de) | 2001-10-17 | 2004-09-08 | Boehringer Ingelheim Pharma GmbH & Co.KG | 5-substituierte 4-amino-2-phenylamino-pyrimdinderivate und ihre verwendung als beta-amyloid modulatoren |
| EP1321463B1 (en) * | 2001-12-21 | 2007-08-08 | Virochem Pharma Inc. | Thiazole derivatives and their use for the treatment or prevention of Flavivirus infections |
| US6924290B2 (en) * | 2002-01-23 | 2005-08-02 | Bayer Pharmaceuticals Corporation | Rho-kinase inhibitors |
| US7176310B1 (en) | 2002-04-09 | 2007-02-13 | Ucb Sa | Pyrimidinecarboxamide derivatives and their use as anti-inflammatory agents |
| US7166595B2 (en) * | 2002-05-09 | 2007-01-23 | Cytokinetics, Inc. | Compounds, methods and compositions |
| WO2003101994A1 (en) * | 2002-05-29 | 2003-12-11 | Abbott Laboratories | Fused bicyclic aromatic compounds that are useful in treating sexual dysfunction |
| US7057042B2 (en) | 2002-05-29 | 2006-06-06 | Abbott Laboratories | Fused bicyclic aromatic compounds that are useful in treating sexual dysfunction |
| AU2003250482A1 (en) * | 2002-08-13 | 2004-02-25 | Warner-Lambert Company Llc | Phthalimide derivatives as matrix metalloproteinase inhibitors |
| ATE440827T1 (de) | 2002-12-04 | 2009-09-15 | Ore Pharmaceuticals Inc | Melanocortin-rezeptormodulatoren |
| BRPI0510453A (pt) * | 2004-04-30 | 2007-10-30 | Warner Lambert Co | composto substituìdos com morfolina para o tratamento de distúrbios do sistema nervoso central |
| GB0409744D0 (en) * | 2004-04-30 | 2004-06-09 | Pfizer Ltd | Novel compounds |
| GB0425758D0 (en) | 2004-11-23 | 2004-12-22 | Vectura Ltd | Preparation of pharmaceutical compositions |
| CN101163476A (zh) | 2005-04-19 | 2008-04-16 | 尼科梅德有限责任公司 | 用于治疗肺动脉高血压的罗氟司特 |
| EP2258357A3 (en) | 2005-08-26 | 2011-04-06 | Braincells, Inc. | Neurogenesis with acetylcholinesterase inhibitor |
| EP1928437A2 (en) | 2005-08-26 | 2008-06-11 | Braincells, Inc. | Neurogenesis by muscarinic receptor modulation |
| US8247556B2 (en) | 2005-10-21 | 2012-08-21 | Amgen Inc. | Method for preparing 6-substituted-7-aza-indoles |
| CA2625153A1 (en) | 2005-10-21 | 2007-04-26 | Braincells, Inc. | Modulation of neurogenesis by pde inhibition |
| AU2006308889A1 (en) | 2005-10-31 | 2007-05-10 | Braincells, Inc. | GABA receptor mediated modulation of neurogenesis |
| US20100216734A1 (en) | 2006-03-08 | 2010-08-26 | Braincells, Inc. | Modulation of neurogenesis by nootropic agents |
| AU2007249399A1 (en) | 2006-05-09 | 2007-11-22 | Braincells, Inc. | Neurogenesis by modulating angiotensin |
| US20080051413A1 (en) * | 2006-08-25 | 2008-02-28 | Kaohsiung Medical University | Nitrophenylpiperazine derivative of xanthine which relaxes tracheal airway and increases respiratory performance |
| MEP8509A (en) | 2006-09-07 | 2011-12-20 | Combination treatment for diabetes mellitus | |
| US20100184806A1 (en) | 2006-09-19 | 2010-07-22 | Braincells, Inc. | Modulation of neurogenesis by ppar agents |
| TW200827346A (en) | 2006-11-03 | 2008-07-01 | Astrazeneca Ab | Chemical compounds |
| TW200836719A (en) | 2007-02-12 | 2008-09-16 | Astrazeneca Ab | Chemical compounds |
| TW200914457A (en) * | 2007-05-31 | 2009-04-01 | Kyowa Hakko Kogyo Kk | Pyrimidodiazepinone derivative |
| WO2008149346A2 (en) | 2007-06-04 | 2008-12-11 | Ben Gurion University Of The Negev Research And Development Authority | Enhanced sensitivity polymerase chain reactions |
| US8071557B2 (en) | 2007-06-13 | 2011-12-06 | Vivus, Inc. | Treatment of pulmonary hypertension with carbonic anhydrase inhibitors |
| WO2009013286A1 (en) * | 2007-07-24 | 2009-01-29 | Novartis Ag | Organic compounds |
| EP2202228B1 (en) * | 2007-10-15 | 2014-12-10 | Takeda Pharmaceutical Company Limited | Amide compounds and use of the same |
| EP2082772A1 (en) | 2008-01-24 | 2009-07-29 | Vectura Delivery Devices Limited | Inhaler |
| EP2082767A1 (en) | 2008-01-24 | 2009-07-29 | Vectura Delivery Devices Limited | Inhaler |
| EP2082771A1 (en) | 2008-01-24 | 2009-07-29 | Vectura Delivery Devices Limited | Inhaler |
| EP2082766A1 (en) | 2008-01-24 | 2009-07-29 | Vectura Delivery Devices Limited | Blister Strip Coil Forming |
| EP2082768A1 (en) | 2008-01-24 | 2009-07-29 | Vectura Delivery Devices Limited | Inhaler |
| AU2009225869B2 (en) | 2008-03-18 | 2014-01-23 | Merck Sharp & Dohme Llc | Substituted 4-hydroxypyrimidine-5-carboxamides |
| US20100216805A1 (en) | 2009-02-25 | 2010-08-26 | Braincells, Inc. | Modulation of neurogenesis using d-cycloserine combinations |
| CN102458402B (zh) | 2009-06-12 | 2013-10-02 | 百时美施贵宝公司 | 用作激酶调节剂的烟酰胺化合物 |
| US8354593B2 (en) * | 2009-07-10 | 2013-01-15 | Nanocomp Technologies, Inc. | Hybrid conductors and method of making same |
| GB0921481D0 (en) | 2009-12-08 | 2010-01-20 | Vectura Ltd | Process and product |
| EP2361911A1 (en) * | 2010-02-18 | 2011-08-31 | GenKyoTex SA | Pyrazolo piperidine derivatives as NADPH oxidase inhibitors |
| EP2361912A1 (en) * | 2010-02-18 | 2011-08-31 | GenKyoTex SA | Pyrazolo piperidine derivatives as NADPH oxidase inhibitors |
| KR101377178B1 (ko) | 2010-04-05 | 2014-03-26 | 에스케이케미칼주식회사 | Pde5 억제제를 함유하는 피부 주름 개선용 조성물 |
| CN101798301A (zh) * | 2010-04-13 | 2010-08-11 | 漆又毛 | 吡咯烷基嘧啶甲磺酰胺衍生物及制备方法 |
| TW201210584A (en) | 2010-08-18 | 2012-03-16 | Alcon Res Ltd | Bradykinin receptor agonists and uses thereof to treat ocular hypertension and glaucoma |
| CN102372697A (zh) * | 2010-08-19 | 2012-03-14 | 山东轩竹医药科技有限公司 | 取代的嘧啶类化合物 |
| EP2735567B1 (en) * | 2011-07-21 | 2016-10-26 | Xuanzhu Pharma Co., Ltd. | Heterocyclic substituted pyrimidine compound |
| US9402877B2 (en) | 2011-11-04 | 2016-08-02 | Xion Pharmaceuticals Corporation | Methods and compositions for oral administration of melanocortin receptor agonist compounds |
| EP2804603A1 (en) | 2012-01-10 | 2014-11-26 | President and Fellows of Harvard College | Beta-cell replication promoting compounds and methods of their use |
| WO2014026467A1 (zh) | 2012-08-14 | 2014-02-20 | 山东轩竹医药科技有限公司 | 双环取代的嘧啶类化合物 |
| AU2013351550A1 (en) | 2012-11-28 | 2015-07-16 | Grünenthal GmbH | Specific carboxamides as KCNQ2/3 modulators |
| JP2016508118A (ja) * | 2012-11-28 | 2016-03-17 | グリュネンタール・ゲゼルシャフト・ミト・ベシュレンクテル・ハフツング | Kcnq2/3モジュレーターとしての置換アミノ−アリールカルボキサミド |
| US9248122B2 (en) | 2012-11-28 | 2016-02-02 | Grünenthal GmbH | Heteroquinoline-3-carboxamides as KCNQ2/3 modulators |
| CN104059025B (zh) * | 2013-03-20 | 2017-07-04 | 广州朗圣药业有限公司 | 一种用于制备阿伐那非的中间体及其制备方法 |
| EP2980087B1 (en) * | 2013-03-29 | 2018-06-06 | Xuanzhu Pharma Co., Ltd. | Prodrugs of bicyclic substituted pyrimidine type pde-5 inhibitors |
| WO2014174529A2 (en) * | 2013-04-23 | 2014-10-30 | Hetero Research Foundation | Polymorphs of avanafil |
| CN103265534B (zh) * | 2013-05-23 | 2014-07-23 | 苏州明锐医药科技有限公司 | 阿伐那非的制备方法 |
| CN103254179B (zh) * | 2013-05-23 | 2014-09-10 | 苏州明锐医药科技有限公司 | 阿伐那非的制备方法 |
| WO2014187273A1 (zh) * | 2013-05-23 | 2014-11-27 | 苏州明锐医药科技有限公司 | 阿伐那非的制备方法 |
| CN103254180B (zh) * | 2013-05-23 | 2014-07-23 | 苏州明锐医药科技有限公司 | 一种阿伐那非的制备方法 |
| WO2015001567A1 (en) * | 2013-07-01 | 2015-01-08 | Msn Laboratories Private Limited | Process for the preparation of (s)-4-[(3-chloro-4-methoxybenzyl)amino]-2-[2- (hydroxymethyl)-1-pyrrolidinyl]-n-(2-pyrimidinyl methyl-5-pyrimidine carboxamide |
| CN104557877B (zh) * | 2013-10-28 | 2016-08-17 | 重庆安格龙翔医药科技有限公司 | 一种阿伐那非中间体及其制备方法和应用 |
| CR20160207A (es) | 2013-11-05 | 2016-08-10 | Ben Gurion Univ Of The Negev Res And Dev Authority | Compuestos para el tratamiento de la diabetes y las complicaciones que surgen de la misma enfermedad |
| CN104628708A (zh) * | 2013-11-13 | 2015-05-20 | 北大方正集团有限公司 | 一种阿伐那非的晶型及其制备方法、用途和药物组合物 |
| CN104628707A (zh) * | 2013-11-13 | 2015-05-20 | 北大方正集团有限公司 | 一种阿伐那非的无定型及其制备方法、用途和药物组合物 |
| CN104650045B (zh) * | 2013-11-19 | 2017-04-19 | 苏州旺山旺水生物医药有限公司 | 阿伐那非的制备方法 |
| GB201321748D0 (en) | 2013-12-09 | 2014-01-22 | Ucb Pharma Sa | Therapeutic agents |
| CN103833736A (zh) * | 2014-03-04 | 2014-06-04 | 北京澳合药物研究院有限公司 | 一种阿伐那非的制备方法 |
| WO2015177807A1 (en) * | 2014-05-22 | 2015-11-26 | Wanbury Ltd. | A process for the preparation of avanafil and its novel intermediates |
| CN104003981A (zh) * | 2014-05-28 | 2014-08-27 | 河北康泰药业有限公司 | 阿伐那非的合成方法 |
| CN104151299B (zh) * | 2014-08-22 | 2017-03-08 | 北京科莱博医药开发有限责任公司 | 化合物、晶型化合物及其制备方法 |
| CN104356115B (zh) * | 2014-11-21 | 2016-08-24 | 齐鲁天和惠世制药有限公司 | 一种4-[(3-氯-4-甲氧基苄基)氨基]-2-[2-(羟甲基)-1-吡咯烷基]嘧啶-5-羧酸乙酯的制备方法 |
| CN104530015B (zh) * | 2014-12-10 | 2017-01-04 | 齐鲁天和惠世制药有限公司 | 一种阿伐那非的制备方法 |
| WO2017168174A1 (en) | 2016-04-02 | 2017-10-05 | N4 Pharma Uk Limited | New pharmaceutical forms of sildenafil |
| CN105924402A (zh) * | 2016-05-06 | 2016-09-07 | 蚌埠中实化学技术有限公司 | 一种2-胺基甲基嘧啶盐酸盐的制备方法 |
| AU2017296338A1 (en) | 2016-07-14 | 2019-01-03 | Pfizer Inc. | Novel pyrimidine carboxamides as inhibitors of vanin-1 enzyme |
| CN106496201A (zh) * | 2016-10-31 | 2017-03-15 | 昆药集团股份有限公司 | 一种阿伐那非原料药的制备方法 |
| MX2019006938A (es) | 2016-12-14 | 2019-09-06 | Respira Therapeutics Inc | Metodos y composiciones para trataminto de hipertension pulmonar y otros trastornos del pulmon. |
| CN107879986A (zh) * | 2017-12-20 | 2018-04-06 | 重庆英斯凯化工有限公司 | 一种阿伐那非杂质的合成方法 |
| CN108658872B (zh) * | 2018-05-03 | 2021-06-22 | 无锡富泽药业有限公司 | 一种阿伐那非中间体的制备方法 |
| WO2020030489A1 (en) | 2018-08-06 | 2020-02-13 | Nicox S.A. | Nitric oxide releasing phosphodiesterase type 5 inhibitor |
| CN109280049B (zh) * | 2018-09-25 | 2021-02-02 | 重庆奥舍生物化工有限公司 | 一种医药化合物阿伐那非的合成方法 |
| CN109776505B (zh) * | 2019-03-14 | 2021-07-27 | 扬州市三药制药有限公司 | 一种阿伐那非的制备方法 |
| CN110078713B (zh) * | 2019-04-10 | 2021-06-04 | 北京精华耀邦医药科技有限公司 | 一种用于治疗男性勃起功能障碍的化合物 |
| CN110117274A (zh) * | 2019-05-08 | 2019-08-13 | 梯尔希(南京)药物研发有限公司 | 一种阿伐那非杂质的制备方法 |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1229413A (ru) * | 1967-06-14 | 1971-04-21 | ||
| JPS5481299A (en) * | 1977-12-09 | 1979-06-28 | Daito Koeki Kk | Preparation of 2,8-disubstituted-6-formyl-5,8-dihydro-5- oxopyrido 2,3-d pyrimidine derivative |
| AT392789B (de) * | 1985-01-23 | 1991-06-10 | Toyama Chemical Co Ltd | Verfahren zur herstellung von 1-substituierten aryl-1,4-dihydro-4-oxonaphthyridinderivaten |
| DE3752141T2 (de) * | 1986-02-24 | 1998-03-26 | Mitsui Petrochemical Ind | Mittel zur behandlung von neuropathie |
| DE69115126T2 (de) | 1990-05-16 | 1996-05-09 | Tomoegawa Paper Mfg Co Ltd | Leitfähiges Substrat und seine Verwendung in den Druckmedien. |
| GB9012316D0 (en) | 1990-06-01 | 1990-07-18 | Wellcome Found | Pharmacologically active cns compounds |
| US5252604A (en) | 1992-07-10 | 1993-10-12 | Hoffmann-La Roche Inc. | Compositions of retinoic acids and tocopherol for prevention of dermatitis |
| GB9311920D0 (en) | 1993-06-09 | 1993-07-28 | Pfizer Ltd | Therapeutic agents |
| ES2114662T3 (es) * | 1993-08-26 | 1998-06-01 | Ono Pharmaceutical Co | Derivados de la 4-aminopirimidina. |
| KR100189863B1 (ko) | 1993-12-27 | 1999-06-01 | 나이또 하루오 | 안트라닐산 유도체 |
| CN1151136C (zh) | 1994-08-09 | 2004-05-26 | 卫材株式会社 | 缩合哒嗪系化合物 |
| KR100239800B1 (ko) | 1996-11-28 | 2000-03-02 | 손경식 | 4,5-디아미노 피리미딘 유도체 및 이의 제조방법 |
| JP2000072751A (ja) * | 1998-08-26 | 2000-03-07 | Tanabe Seiyaku Co Ltd | イソキノリノン誘導体 |
| IL132406A0 (en) | 1998-10-21 | 2001-03-19 | Pfizer Prod Inc | Treatment of bph with cgmp elevators |
| GB9823101D0 (en) * | 1998-10-23 | 1998-12-16 | Pfizer Ltd | Pharmaceutically active compounds |
-
2000
- 2000-09-13 AT AT00960979T patent/ATE358670T1/de active
- 2000-09-13 CN CN2012100068594A patent/CN102584799A/zh active Pending
- 2000-09-13 HU HU0202795A patent/HU225917B1/hu active Protection Beyond IP Right Term
- 2000-09-13 CA CA002383466A patent/CA2383466C/en not_active Expired - Lifetime
- 2000-09-13 DK DK00960979T patent/DK1219609T3/da active
- 2000-09-13 TR TR2002/00701T patent/TR200200701T2/xx unknown
- 2000-09-13 KR KR10-2002-7003536A patent/KR100532546B1/ko active IP Right Grant
- 2000-09-13 BR BRPI0014526A patent/BRPI0014526C1/pt not_active IP Right Cessation
- 2000-09-13 RU RU2002109792A patent/RU2233273C3/ru active Protection Beyond IP Right Term
- 2000-09-13 EP EP00960979A patent/EP1219609B1/en not_active Expired - Lifetime
- 2000-09-13 DE DE60034239T patent/DE60034239T2/de not_active Expired - Lifetime
- 2000-09-13 ES ES00960979T patent/ES2283315T3/es not_active Expired - Lifetime
- 2000-09-13 TW TW089118673A patent/TWI258471B/zh not_active IP Right Cessation
- 2000-09-13 WO PCT/JP2000/006258 patent/WO2001019802A1/ja active IP Right Grant
- 2000-09-13 CN CN00812968A patent/CN1374953A/zh active Pending
- 2000-09-13 AU AU73118/00A patent/AU767558B2/en active Active
- 2000-09-13 IL IL14829100A patent/IL148291A0/xx active IP Right Grant
- 2000-09-13 PT PT00960979T patent/PT1219609E/pt unknown
- 2000-09-13 MY MYPI20004248 patent/MY123528A/en unknown
- 2000-09-14 AR ARP000104829A patent/AR025668A1/es active IP Right Grant
-
2001
- 2001-08-10 US US09/925,892 patent/US6656935B2/en active Active
-
2002
- 2002-02-21 IL IL148291A patent/IL148291A/en unknown
- 2002-03-15 NO NO20021308A patent/NO322038B1/no not_active IP Right Cessation
- 2002-04-02 BG BG106566A patent/BG65453B1/bg unknown
- 2002-08-21 HK HK02106107A patent/HK1044535A1/xx unknown
-
2003
- 2003-05-01 US US10/426,884 patent/US6797709B2/en not_active Expired - Lifetime
-
2007
- 2007-04-20 CY CY20071100542T patent/CY1106534T1/el unknown
-
2013
- 2013-07-10 LU LU92249C patent/LU92249I2/fr unknown
- 2013-07-22 BE BE2013C051C patent/BE2013C051I2/fr unknown
- 2013-08-13 FR FR13C0050C patent/FR13C0050I2/fr active Active
- 2013-09-04 CY CY2013034C patent/CY2013034I2/el unknown
- 2013-12-10 NO NO2013018C patent/NO2013018I2/no unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2233273C2 (ru) | Ароматические азотсодержащие 6-членные циклические соединения и фармацевтическая композиция | |
| EP1689751B1 (en) | 5,7-diaminopyrazolo[4,3-d]pyrimidines with pde-5 inhibiting activity | |
| EP0911333B1 (en) | Pyrazolo[4,3-d]pyrimidine derivatives and pharmaceutical compositions containing them | |
| JP4178816B2 (ja) | 医薬組成物 | |
| CA3013618C (en) | Substituted pyrazolo[1,5-a]pyrimidine compounds as trk kinase inhibitors | |
| US7268128B2 (en) | 1,3,5-trisubstituted-5-phenyl and 5-pyridyl pyrazolopyrimidinone derivatives having PDE7 inhibiting action | |
| KR20170023156A (ko) | 단백질 키나제 저해제로서의 아미노피리다지논 화합물 | |
| WO1993017682A1 (en) | Angiotensin ii receptor antagonists | |
| EP1347980A1 (en) | Compounds specific to adenosine-a1,-a2a, and- a3-receptor and uses thereof | |
| JP2002523507A (ja) | ジヒドロ−[1,2,3]トリアゾロ−[4,5−d]ピリミジン−7−オン | |
| AU2002233706C1 (en) | Pyridopyrimidine or naphthyridine derivative | |
| EP1742950B1 (en) | Pyrazolo[4,3-d] pyrimidines | |
| JP3637961B2 (ja) | 芳香族含窒素六員環化合物 | |
| JP2004083587A (ja) | 医薬組成物 | |
| NZ540450A (en) | Novel compounds having selective inhibiting effect at GSK3 | |
| JP5570981B2 (ja) | キナーゼ阻害剤としての縮合チアゾール誘導体 | |
| KR20180088318A (ko) | 다중 표적 키나아제 저해제로서 융합피리미딘 유도체 | |
| US20090124600A1 (en) | N-Alkyl-Azacycloalkyl NMDA/NR2B Antagonists | |
| JP2001233875A (ja) | ピリミジン−5−カルボキサミド化合物、その製造法およびその用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PD4A | Correction of name of patent owner | ||
| TK4A | Correction to the publication in the bulletin (patent) |
Free format text: CORRECTION TO CHAPTER -FG4A- IN JOURNAL 21-2004 |
|
| ND4A | Extension of patent duration |
Effective date: 20190717 |