RU2039058C1 - 4-aminopyridine derivatives - Google Patents
4-aminopyridine derivatives Download PDFInfo
- Publication number
- RU2039058C1 RU2039058C1 SU925010806A SU5010806A RU2039058C1 RU 2039058 C1 RU2039058 C1 RU 2039058C1 SU 925010806 A SU925010806 A SU 925010806A SU 5010806 A SU5010806 A SU 5010806A RU 2039058 C1 RU2039058 C1 RU 2039058C1
- Authority
- RU
- Russia
- Prior art keywords
- ppm
- amino
- pri
- title compound
- method described
- Prior art date
Links
Images
Landscapes
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
Abstract
Description
Изобретение относится к производным 4-аминопиридина общей формулы I
AB где А означает группу R в которой фрагмент СН в положении "а" может быть заменен атомом азота,
В означает группу
или где прерывистая линия представляет необязательную двойную связь;
R3 водород или фтор в положении "в",
Y1 означает СН2, О или S;
Y2 означает СН2, СН, О или S;
Y3 означает СН2 или СН, при условии, что группа формулы Ia может иметь двойную связь только в том случае, когда Y2 и Y3 означает СН, и при условии, что, когда А означает указанную группу, в которой R3 водород и азот отсутствует в положении "а", только один из Y1 и Y2 означает СН2;
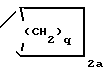
q 1.The invention relates to derivatives of 4-aminopyridine of the general formula I
A B where A is a group R in which the CH moiety in position a can be replaced by a nitrogen atom,
B means a group
or where the dashed line represents an optional double bond;
R 3 hydrogen or fluorine in position "in",
Y 1 means CH 2 , O or S;
Y 2 means CH 2 , CH, O or S;
Y 3 means CH 2 or CH, provided that a group of formula Ia can have a double bond only when Y 2 and Y 3 means CH, and provided that when A means a specified group in which R 3 is hydrogen and nitrogen is absent in position "a", only one of Y 1 and Y 2 means CH 2 ;
Соединения формулы 1 полезны для лечения различных нарушений памяти, обусловленных пониженной холинергической функцией, например болезнью Альцгеймера. Кроме того, эти соединения стимулируют нейромышечную передачу, усиливают процессы возбуждения в возбуждаемых тканях (нервы, гладкие и поперечно-полосатые мышцы), а также восстанавливают проводимость в нервах и нейромышечных синапсах в случае их повреждения. Соединения согласно изобретению проявляют также антидепрессантную активность, которая особенно помогает пациентам, страдающим болезнью Альцгеймера. Как правило, соединения согласно изобретению менее токсичны и характеризуются более широким, чем известные соединения, например такрин и физотигмин, спектром терапевтического действия, что делает их более терапевтически предпочтительными. The compounds of
При лечении болезни Альцгеймера дозировка соединений согласно изобретению меняется в зависимости от способа введения и выбранного конкретного соединения. Кроме того дозировка меняется в зависимости от конкретного больного, возраста, массы тела и состояния подлежащего лечению больного, а также от природы и степени тяжести симптомов. Однако обычно вводят дозу в интервале приблизительно 1-300 мг/день в виде единичной дозы при разделенных дозах. Предпочтительная доза находится в интервале приблизительно 1-150 мг/день в виде единичной или разделенных доз. In the treatment of Alzheimer's disease, the dosage of the compounds according to the invention varies depending on the route of administration and the particular compound selected. In addition, the dosage varies depending on the particular patient, age, body weight and condition of the patient to be treated, as well as on the nature and severity of the symptoms. However, usually a dose is administered in the range of about 1-300 mg / day as a unit dose in divided doses. A preferred dose is in the range of about 1-150 mg / day in single or divided doses.
Обычно лечение начинают с небольших доз, значительно меньших, чем оптимальная доза данного соединения. Затем дозу постепенно увеличивают на небольшое количество до достижения оптимального эффекта. Typically, treatment begins with small doses, significantly lower than the optimal dose of this compound. Then the dose is gradually increased by a small amount until the optimal effect is achieved.
Соединения согласно изобретению применяют отдельно или в сочетании с фармакологически приемлемыми носителями, количестко которых определяется растворимостью и химической природой соединения, выбранным способом введения и обычной медицинской практикой. Например, их вводят орально в виде капсул, таблеток, суспензий или растворов, или они могут быть введены парентерально. Капсулы и таблетки являются предпочтительной формой введения. Для парентерального введения соединения согласно изобретению могут быть применены в виде стерильного раствора, содержащего также другие растворенные вещества, например соль или глюкозу в количестве, достаточном для образования изотонического раствора. The compounds of the invention are used alone or in combination with pharmacologically acceptable carriers, a quantity of which is determined by the solubility and chemical nature of the compound, the chosen route of administration and standard medical practice. For example, they are administered orally in the form of capsules, tablets, suspensions or solutions, or they can be administered parenterally. Capsules and tablets are the preferred form of administration. For parenteral administration, the compounds according to the invention can be used in the form of a sterile solution containing also other dissolved substances, for example, salt or glucose in an amount sufficient to form an isotonic solution.
Капсулы и таблетки с композициями могут содержать активный ингредиент в смеси с одним или более фармацевтическим эксципиентом, пригодным для изготовления капсул и таблеток. Пригодными фармацевтическими эксципиантами являются, например, крахмал, молочный сахар и некоторые виды глин. Таблетки могут быть без покрытия или они могут быть покрыты известными способами для замедления разложения и абсорбции в желудочно-кишечном тракте, благодаря чему обеспечивается более продолжительное действие лекарства. Capsules and tablets with the compositions may contain the active ingredient in admixture with one or more pharmaceutical excipients suitable for the manufacture of capsules and tablets. Suitable pharmaceutical excipients are, for example, starch, milk sugar and certain types of clays. The tablets may be uncoated or they may be coated by known methods to slow down decomposition and absorption in the gastrointestinal tract, thereby providing a longer duration of action of the drug.
Водные суспензии соединений формулы 1 содержат активный ингредиент в смеси с одним или более фармацевтическими эксципиентами, пригодными для изготовления водных суспензий. Пригодными эксцепиентами являются, например, метилцеллюлоза, альгинат натрия, аравийская камедь, лецитин и т.п. Водные суспензии могут также содержать один или более консервирующие агенты, один или более красящие агенты, одну или более отдушки и один или более подслащивающие агенты. Aqueous suspensions of the compounds of
Неводные суспензии могут быть приготовлены путем суспендирования активного ингредиента в растительном масле, например в арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, либо в минеральном масле, например жидком парафине, и суспензия может содержать загуститель, например пчелиный воск, твердый парафин или цетиловый спирт. Эти композиции могут содержать также подслащивающий агент, отдушку и антиоксидант. Non-aqueous suspensions may be prepared by suspending the active ingredient in vegetable oil, for example peanut oil, olive oil, sesame oil or coconut oil, or in mineral oil, for example liquid paraffin, and the suspension may contain a thickening agent, for example beeswax, hard paraffin or cetyl alcohol. These compositions may also contain a sweetening agent, fragrance and antioxidant.
Следующие примеры иллюстрируют получение и свойства соединений согласно настоящему изобретению. Все температуры плавления не скорректированы. Тонкослойную хроматографию (ТСХ) проводили на силикагеле. The following examples illustrate the preparation and properties of the compounds of the present invention. All melting points are not adjusted. Thin layer chromatography (TLC) was performed on silica gel.
П р и м е р 1. 9-Амино-1,2,3,4-тетрагидро-1,4-метаноакридин. PRI me
Раствор антранилонитрила (3,6 г, 30,0 ммоль), норкамфары (3,3 г, 30,0 ммоль) и n-толуолсульфоновой кислоты (50 мг) в бензоле (50 мл) нагревают с рефлюксом в приборе Дина-Старка. После нагревания в течение 18 ч реакционную смесь охлаждают (25оС) и удаляют отделившуюся воду (приблизительно 1,5 мл). Затем избыток бензола отгоняют в вакууме (1 мм рт.ст. 15 мин). Полученный таким образом маслянистый остаток растворяют в тетрагидрофуране (ТГФ, 10 мл) и охлаждают до 0оС, затем добавляют раствор литийдиизопропиламида в ТГФ (1М, 36 мл, 36 ммоль). Потом эту реакционную смесь перемешивают при 0оС в течение 3 ч. К концу этого периода времени реакцию прекращают путем добавления к реакционной смеси 40 мл воды и реакционную смесь экстрагируют метиленхлоридом (200 мл). Полученную органическую фазу промывают водой (2х50 мл) и сушат (безводный сульфат магния). Метиленхлорид отгоняют в вакууме и получают остаток, который помещают в силикагельную колонку для флеш-хроматографии. Элюируют 5% метанола в метиленхлориде, содержащем 1% триэтиламина, и получают указанное в заголовке соединение в количестве 1,6 г (25%) в виде масла, твердеющего при стоянии. Т.пл. 185-186оС.A solution of anthranilonitrile (3.6 g, 30.0 mmol), norkamfara (3.3 g, 30.0 mmol) and n-toluenesulfonic acid (50 mg) in benzene (50 ml) is heated with reflux in a Dean-Stark apparatus. After heating for 18 hours the reaction mixture was cooled (25 ° C) and removing the separated water (about 1.5 mL). Then the excess benzene is distilled off in vacuo (1 mm Hg for 15 minutes). The thus obtained oily residue was dissolved in tetrahydrofuran (THF, 10 mL) and cooled to 0 ° C, then added a solution of lithium diisopropylamide in THF (1M, 36 mL, 36 mmol). Then this reaction mixture was stirred at 0 ° C. for 3 hours. At the end of this time, the reaction was stopped by adding 40 ml of water to the reaction mixture and the reaction mixture was extracted with methylene chloride (200 ml). The resulting organic phase is washed with water (2x50 ml) and dried (anhydrous magnesium sulfate). Methylene chloride was distilled off in vacuo to give a residue, which was placed on a silica gel flash chromatography column. Elute 5% methanol in methylene chloride containing 1% triethylamine to give the title compound in an amount of 1.6 g (25%) as an oil which solidifies upon standing. Mp 185-186 about S.
П р и м е р 2. 9-Амино-8-фтор-1,2,3,4-тетрагидро-1,4-метаноакридин. PRI me
По методике, описанной в примере 1, но с заменой антранилонитрила на 2-амино-6-фторбензонитрил получают указанное в заголовке соединение, 23% т. пл. 173оС.According to the method described in example 1, but with the replacement of anthranilonitrile with 2-amino-6-fluorobenzonitrile, the title compound is obtained, 23% mp 173 about S.
П р и м е р 3. 9-Амино-7-хлор-1,2,3,4-тетрагидро-1,4-метаноакридин. PRI me R 3. 9-amino-7-chloro-1,2,3,4-tetrahydro-1,4-methanoacridine.
По методике, описанной в примере 1, но с заменой антранилонитрила на 2-амино-5-хлорбензонитрил получают указанное в заголовке соединение, 14% т. пл. 183-184оС.According to the method described in example 1, but with the replacement of anthranilonitrile with 2-amino-5-chlorobenzonitrile, the title compound was obtained, 14% mp 183-184 about S.
П р и м е р 4. 9-Амино-1,4-дигидро-1,4-метаноакридин. PRI me R 4. 9-amino-1,4-dihydro-1,4-methanoacridine.
По методике, описанной в примере 1, но с заменой норкамфары на 5-норборнен-2-он получают указанное в заголовке соединение, 26% т.пл. 123оС.By the method described in example 1, but with the replacement of minkfara with 5-norbornen-2-one, the title compound was obtained, 26% mp 123 about S.
П р и м е р 5. 9-Амино-2-окса-1,2,3,4-тетрагидроакридин. PRI me
Антранилонитрил (2,95 г, 25 ммоль), хлорид цинка (3,1 г, 25 ммоль) и тетрагидро-4Н-пиран-4-он растворяют в толуоле (40 мл) и нагревают с рефлюксом в течение 2,5 дня. К концу этого периода реакционную смесь охлаждают (25оС), разбавляют водным раствором гидроксида натрия (70 мл) и экстрагируют метиленхлоридом (4х60 мл). Соединенные органические фазы промывают водой (2х100 мл) и высушивают (безводный сульфат магния). Органические растворители удаляют в вакууме и получают желтый остаток, который загружают в силикагельную колонку для флеш-хроматографии. Элюируют 5% метанола в метиленхлориде и получают указанное в заголовке соединение в виде желтых кристаллов, 155 мг, 31% т.пл. 195-196оС.Anthranilonitrile (2.95 g, 25 mmol), zinc chloride (3.1 g, 25 mmol) and tetrahydro-4H-pyran-4-one were dissolved in toluene (40 ml) and heated with reflux for 2.5 days. By the end of this period, the reaction mixture was cooled (25 ° C), diluted aqueous sodium hydroxide solution (70 ml) and extracted with methylene chloride (4h60 mL). The combined organic phases are washed with water (2x100 ml) and dried (anhydrous magnesium sulfate). The organic solvents are removed in vacuo and a yellow residue is obtained, which is loaded onto a silica gel flash column. Elute 5% methanol in methylene chloride to give the title compound as yellow crystals, 155 mg, 31% mp. 195-196 about S.
П р и м е р 6. 9-Амино-2-тиа-1,2,3,4-тетрагидроакридин. PRI me
Антранилонитрил (2,6 г, 21,5 ммоль), тетрагидротиопиран-4-он (5,0 г, 43 ммоль) и хлорид цинка (2,54 г, 21,5 ммоль) соединяют и нагревают до 120оС в течение 20 мин. Реакционную смесь охлаждают и твердый остаток отфильтровывают с применением этилового эфира (100 мл). Полученное твердое вещество оранжевого цвета (5,2 г) помещают в химический стакан, содержащий насыщенный раствор ЭДТК (этилендиаминтетрауксусная кислота) в виде (125 мл) и рН доводят до 13 при помощи 12%-ного водного раствора гидроксида натрия. Затем водную фазу экстрагируют метиленхлоридом (4х5, мл) и экстракт промывают водой (2х70 мл) и высушивают (сульфат магния). После удаления метиленхлорида в вакууме получают желтую пасту (2,0 г), которую растирают с эфиром и фильтруют, получают твердое вещество светло-желтого цвета, 1,36 г, 29% т.пл. 205оС (разлагается).Anthranilonitrile (2.6 g, 21.5 mmol), tetrahydrothiopyran-4-one (5.0 g, 43 mmol) and zinc chloride (2.54 g, 21.5 mmol) are combined and heated to 120 ° C for 20 minutes. The reaction mixture was cooled and the solid residue was filtered using ethyl ether (100 ml). The obtained orange solid (5.2 g) was placed in a beaker containing a saturated solution of EDTA (ethylenediaminetetraacetic acid) in the form (125 ml) and the pH was adjusted to 13 with a 12% aqueous sodium hydroxide solution. Then the aqueous phase is extracted with methylene chloride (4x5 ml) and the extract is washed with water (2x70 ml) and dried (magnesium sulfate). After removal of methylene chloride in vacuo, a yellow paste (2.0 g) is obtained, which is triturated with ether and filtered to give a pale yellow solid, 1.36 g, 29% mp. 205 ° C (decomposed).
П р и м е р 7. 9-Амино-4-окса-1,2,3,4-тетрагидроакридин. PRI me
К перемешиваемому при -20оС раствору дельта-валеролактона (1,0 г, 10,0 ммоль) в метиленхлориде (10 мл) добавляют 1 М раствор хлорида титана (IV) в метиленхлориде (20 мл). Реакционная смесь приобретает темно-желтую окраску и к ней добавляют смесь триэтиламина (2,0 г, 20 ммоль) и антранилонитрила (1,2 г, 10,0 ммоль) в метиленхлориде (30 мл). Реакционная смесь сразу же становится темной, ее оставляют нагреваться до комнатной температуры (приблизительно 25оС) и затем перемешивают в течение 15 ч. К концу этого периода реакционную смесь обрабатывают 25%-ным водным раствором гидроксида натрия (40 мл) и метиленхлоридом (100 мл) и фильтруют через прокладку из диатомовой земли толщиной 2 дюйма (торговое название целит, Сelit), которую промывают метиленхлоридом (50 мл) и водой (100 мл). Органический слой отделяют, промывают один раз водой (30 мл) и высушивают (безводный сульфат магния). Метиленхлорид отгоняют в вакууме и получают масло, которое растирают с эфиром, получают указанное в заголовке соединение в виде белого твердого вещества, 565 мг, 28%
1Н-ЯМР (СDCl3, 300 МГц, g): 2H, м, 2,02-2,18 м.д. 2Н, Т. 2,63 м.д. (J 6,0 Гц); 2Н, Т. 4,36 м.д. (J 6,0 Гц); 2Н, с. 4,64 м.д. 1Н, Т. 7,25 (J 8,0 Гц); 1Н, Т. 7,5 (J 8,0 Гц); 1Н, g, 7,72 (J 8,0 Гц).To a stirred -20 ° C solution of delta-valerolactone (1.0 g, 10.0 mmol) in methylene chloride (10 ml) was added 1M solution of titanium chloride (IV) in methylene chloride (20 mL). The reaction mixture becomes dark yellow and a mixture of triethylamine (2.0 g, 20 mmol) and anthranilonitrile (1.2 g, 10.0 mmol) in methylene chloride (30 ml) is added. The reaction mixture immediately became dark, it was allowed to warm to room temperature (about 25 C) and then stirred for 15 hours. At the end of this period, the reaction mixture was treated with 25% aqueous sodium hydroxide (40 ml) and methylene chloride (100 ml) and filtered through a 2 inch thick pad of diatomaceous earth (trade name Celite, Celit), which is washed with methylene chloride (50 ml) and water (100 ml). The organic layer was separated, washed once with water (30 ml) and dried (anhydrous magnesium sulfate). Methylene chloride was distilled off in vacuo to give an oil which was triturated with ether to give the title compound as a white solid, 565 mg, 28%
1 H-NMR (CDCl 3 , 300 MHz, g): 2H, m, 2.02-2.18 ppm. 2H, T. 2.63 ppm. (J 6.0 Hz); 2H, T. 4.36 ppm. (J 6.0 Hz); 2H, s. 4.64 ppm 1H, T. 7.25 (J, 8.0 Hz); 1H, T. 7.5 (J, 8.0 Hz); 1H, g, 7.72 (J 8.0 Hz).
П р и м е р 8. 9-Амино-8-фтор-4-окса-1,2,3,4-тетрагидроакридин. PRI me
По методике, описанной в примере 7, но с заменой антранилонитрила на 2-амино-6-фторбензонитрил получают указанное в заголовке соединение, 8% т. рл. 195-196оС.According to the procedure described in example 7, but with the replacement of anthranilonitrile with 2-amino-6-fluorobenzonitrile, the title compound was obtained, 8% mp. 195-196 about S.
П р и м е р 9. 9-Амино-7-фтор-4-окса-1,2,3,4-тетрагидроакридин. PRI me R 9. 9-amino-7-fluoro-4-oxa-1,2,3,4-tetrahydroacridine.
По методике, описанной в примере 7, но с заменой антранилонитрила на 2-амино-5-хлорбензонитрил получают указанное в заголовке соединение, 2% т. пл. 278-279оС.According to the procedure described in example 7, but with the replacement of anthranilonitrile with 2-amino-5-chlorobenzonitrile, the title compound was obtained, 2% mp 278-279 about S.
П р и м е р 10. 9-Амино-4-окса-1,2,3,4,5,6,7,8-октагидроакридин. PRI me
По методу, описанному в примере 7, но с заменой антранилонитрила на 2-амино-1-циано-1-циклогексен получают указанное в заголовке соединение, 8% т. пл. 145оС.By the method described in example 7, but with the replacement of anthranilonitrile with 2-amino-1-cyano-1-cyclohexene, the title compound was obtained, 8% mp 145 about S.
П р и м е р 11. 9-Амино-2,3,7,8-тетрагидро-1Н-циклопента(е)-6Н-пирано)-/2',3'-b/пиридин. PRI me R 11. 9-amino-2,3,7,8-tetrahydro-1H-cyclopenta (e) -6H-pyrano) - / 2 ', 3'-b / pyridine.
По методу, описанному в примере 7, но с заменой антранилонитрила на 2-амино-1-циано-1-циклопентен получают указанное в заголовке соединение, 22% т. пл. 164оС.According to the method described in example 7, but with the replacement of anthranilonitrile with 2-amino-1-cyano-1-cyclopentene, the title compound was obtained, 22% mp 164 about S.
П р и м е р 12. 2,3-Дигидротиено(3,2-b)хинолин-9-амин. PRI me
К перемешиваемому при -78оС раствору тетрагидротиофен-3-она (1,1 г, 11 ммоль) в метиленхлориде (10 мл) добавляют 1 М раствор хлорида титана (IV) в метиленхлориде (11 мл). Затем к реакционной смеси добавляют в течение 5 мин смесь триэтиламина (2,2 г, 22 ммоль) и антранилонитрила (1,2 г, 10,0 ммоль) в метиленхлориде (30 мл). После этого реакционную смесь медленно нагревают до комнатной температуры и перемешивают в течение 2 ч. Потом добавляют в реакционной смеси тетрагидротиофен-3-он (1 мл) и хлорид титана (IV) (1,0 мл) и смесь перемешивают при 25оС в течение 16 ч. Затем к реакционной смеси быстро приливают 12%-ный водный раствор гидроксида натрия (100 мл), после чего реакционную смесь энергично перемешивают с дополнительным количеством метиленхлорида (300 мл). Затем реакционную смесь фильтруют через диатомовую землю (торговое название целит) и органическую фазу отделяют. Органические растворители удаляют в вакууме и получают остаток, который загружают в флеш-хроматографическую колонку. Элюируют 5% метанола в метиленхлориде, содержащем 1% триэтиламина, и получают указанное в заголовке соединение (1,3 г 64%), которое кристаллизуют из хлороформа, 560 мг, 32% т.пл. 208-210оС.To a stirred -78 ° C solution of tetrahydrothiophene-3-one (1.1 g, 11 mmol) in methylene chloride (10 ml) was added 1M solution of titanium chloride (IV) in methylene chloride (11 mL). Then, a mixture of triethylamine (2.2 g, 22 mmol) and anthranilonitrile (1.2 g, 10.0 mmol) in methylene chloride (30 ml) was added over 5 minutes to the reaction mixture. Thereafter, the reaction mixture was slowly warmed to room temperature and stirred for 2 h. Then the reaction mixture was added a tetrahydrothiophene-3-one (1 ml) and titanium chloride (IV) (1,0 ml) and the mixture was stirred at 25 ° C for 16 hours. Then, a 12% aqueous sodium hydroxide solution (100 ml) was quickly poured into the reaction mixture, after which the reaction mixture was vigorously stirred with an additional amount of methylene chloride (300 ml). Then the reaction mixture is filtered through diatomaceous earth (trade name celite) and the organic phase is separated. The organic solvents were removed in vacuo to give a residue, which was loaded onto a flash chromatography column.
П р и м е р 13. 9-Амино-1,2,3,4,5,6,7,8-октагидро-1,4-метаноакридин. PRI me R 13. 9-amino-1,2,3,4,5,6,7,8-octahydro-1,4-methanoacridine.
К перемешиваемому при -20оС раствору норкамфоры (0,9 г, 8,2 ммоль) в метиленхлориде (8,0 мл) добавляют смесь триэтиламина (1,7 г, 16,4 ммоль) и 2-амино-1-циано-1-циклогексена (1,0 г, 8,2 ммоль) в метиленхлориде (24 мл) и полученную смесь перемешивают при 25оС в течение 15 мин. Затем к реакционной смеси быстро приливают 12%-ный водный раствор гидроксида натрия (60 мл) и энергично перемешивают с метиленхлоридом (60 мл). После этого реакционную смесь фильтруют через прокладку из диатомовой земли толщиной 2 дюйма (торговое название целит). Органическую фазу отделяют промывают водой (2х50 мл) и затем сушат (безводный сульфат магния). Потом метиленхлорид удаляют при пониженном давлении и получают масло, которое растирают с пентаном, получают указанное в заголовке соединение в виде беловатого твердого вещества, 225 мг, 13% т.пл. 131-133оС.To a stirred -20 ° C solution norkamfory (0.9 g, 8.2 mmol) in methylene chloride (8.0 ml) was added a mixture of triethylamine (1.7 g, 16.4 mmol) and 2-amino-1-cyano -1-cyclohexene (1.0 g, 8.2 mmol) in methylene chloride (24 mL) and the resulting mixture was stirred at 25 ° C for 15 min. Then, a 12% aqueous sodium hydroxide solution (60 ml) was quickly poured into the reaction mixture and stirred vigorously with methylene chloride (60 ml). After that, the reaction mixture was filtered through a 2-inch-thick diatomaceous earth pad (trade name Celite). The organic phase is separated, washed with water (2x50 ml) and then dried (anhydrous magnesium sulfate). Methylene chloride was then removed under reduced pressure to give an oil which was triturated with pentane to give the title compound as an off-white solid, 225 mg, 13% mp. 131-133 about S.
П р и м е р 14. 9-Амино-6-аза-1,2,3,4-тетрагидроакридин. PRI me R 14. 9-amino-6-aza-1,2,3,4-tetrahydroacridine.
Хлорид титана (IV) (1,5 мл) добавляют к перемешиваемому раствору 3-амино-4-цианопиридина (500 мг, 4,2 ммоль) и циклогексанона (0,5 мл) в 1,2-дихлорэтане (15 мл). Затем реакционную смесь выдерживают при 90оС в течение 12 ч. К концу этого периода к реакционной смеси добавляют циклогексанон (2,0 мл) и 1,2-дихлорэтан (5,0 мл) и нагревание продолжают в течение еще 12 ч. Затем добавляют дополнительные количества циклогексанона (2,0 мл) и хлорида титана (IV) (1,2 мл) и реакционную смесь выдерживают при 90оС в течение 6 ч. Затем реакционную смесь охлаждают и быстро приливают к ней 5%-ный водный раствор гидроксида натрия (250 мл) и энергично перемешивают с метиленхлоридом (200 мл, 25 мин). Потом реакционную смесь обрабатывают, как описано в примере 8, и получают указанное в заголовке соединение (170 мг, 95%-ная чистота, 20%) после флеш-хроматографии на силикагеле (элюент 95:5:1 метиленхлорид: метанол:гидроксид аммония). Этот материал дополнительно очищают методом хроматографии и получают указанное в заголовке соединение, 75 мг, т.пл. 180-181оС.Titanium (IV) chloride (1.5 ml) is added to a stirred solution of 3-amino-4-cyanopyridine (500 mg, 4.2 mmol) and cyclohexanone (0.5 ml) in 1,2-dichloroethane (15 ml). The reaction mixture was kept at 90 ° C for 12 hours. At the end of this period the reaction mixture was added cyclohexanone (2.0 mL) and 1,2-dichloroethane (5.0 mL) was added and heating continued for a further 12 hours. The An additional amount of cyclohexanone (2.0 ml) and titanium chloride (IV) (1,2 ml) and the reaction mixture was kept at 90 ° C for 6 hours. The reaction mixture was cooled rapidly and poured thereto a 5% aqueous solution sodium hydroxide (250 ml) and vigorously stirred with methylene chloride (200 ml, 25 min). Then, the reaction mixture was worked up as described in Example 8, and the title compound (170 mg, 95% pure, 20%) was obtained after flash chromatography on silica gel (eluent 95: 5: 1 methylene chloride: methanol: ammonium hydroxide) . This material was further purified by chromatography to give the title compound, 75 mg, mp. 180-181 about S.
П р и м е р 15. 9-Амино-5-аза-1,2,3,4-тетрагидроакридин. PRI me
По методу, описанному в примере 14, но с заменой 3-амино-4-цианопиридина на 2-амино-3-цианопиридин получают указанное в заголовке соединение, 38% т. пл. 225-228оС (разлагается).By the method described in example 14, but with the replacement of 3-amino-4-cyanopyridine with 2-amino-3-cyanopyridine, the title compound was obtained, 38% mp 225-228 ° C (decomposed).
1Н-ЯМР (CDCl3+CD3OD, 300 МГц, δ ):4Н, шир. с. 1,86 м.д. 2Н, шир.т. 2,5 м. д. 2Н, шир.т. 2,97 м.д. 2Н, оч.шир.с. 3,0-3,3 м.д. 1Н, дд. 7,2 м.д. (J 8,0, 4,0 Гц); 1Н, дд. 8,18 м.д. (J 8,0, 1-2 Гц); 1Н, дд. 8,77 м.д. (J 4,0, 1-2 Гц). 1 H-NMR (CDCl 3 + CD 3 OD, 300 MHz, δ): 4H, broad. from. 1.86 ppm 2H, br 2.5 ppm 2H, br 2.97 ppm 2H, br.s. 3.0-3.3 ppm 1H, dd. 7.2 ppm (J 8.0, 4.0 Hz); 1H, dd. 8.18 ppm (J 8.0, 1-2 Hz); 1H, dd. 8.77 ppm (J 4.0, 1-2 Hz).
П р и м е р 16. 9-Амино-4,5-оксаза-1,2,3,4-тетрагидроакридин. PRI me R 16. 9-amino-4,5-oxase-1,2,3,4-tetrahydroacridine.
К перемешиваемому раствору 2-амино-3-цианопиридина (360 мг, 3,0 ммоль) и дельта-валеролактона (360 мг, 3,6 ммоль) в 1,2-дихлорэтане (7,0 мл) добавляют хлорид титана (IV) (0,9 мл), после чего реакционную смесь выдерживают при 90оС в течение 18 ч. После этого реакционную смесь быстро охлаждают путем добавления 15%-ного водного раствора гидроксида натрия (200 мл) и энергично перемешивают с метиленхлоридом (200 мл, 25 мин). Потом реакционную смесь обрабатывают так, как описано в примере 15, и получают указанное в заголовке соединение, 8% т.пл. 269-270оС (разлагается).Titanium (IV) chloride is added to a stirred solution of 2-amino-3-cyanopyridine (360 mg, 3.0 mmol) and delta-valerolactone (360 mg, 3.6 mmol) in 1,2-dichloroethane (7.0 ml) (0.9 mL) and the reaction mixture was kept at 90 ° C for 18 hours. The reaction mixture was quenched by addition of 15% aqueous sodium hydroxide solution (200 ml) and stirred vigorously with methylene chloride (200 mL, 25 min). Then, the reaction mixture was worked up as described in Example 15, and the title compound was obtained, 8% mp. 269-270 ° C (decomposed).
П р и м е р 17. 9-Амино-4,6-оксаза-1,2,3,4-тетрагидроакридин. PRI me R 17. 9-amino-4,6-oxase-1,2,3,4-tetrahydroacridine.
По методу, описанному в примере 16, но с применением 3-амино-4-цианопиридина вместо 2-амино-3-цианопиридина получают указанное в заголовке соединение, 16% т.пл. 237-238оС.By the method described in example 16, but using 3-amino-4-cyanopyridine instead of 2-amino-3-cyanopyridine, the title compound was obtained, 16% mp. 237-238 about S.
П р и м е р 18. 9-Амино-5-аза-1,2,3,4-тетрагидро-1,4-метаноакридин. PRI me R 18. 9-amino-5-aza-1,2,3,4-tetrahydro-1,4-methanoacridine.
По методу, описанному в примере 16, но с применением норкамфоры вместо дельта-валеролактона получают указанное в заголовке соединение (29% т.пл. 243-244оС).According to the method described in Example 16, but using instead norkamfory delta-valerolactone afforded the title compound (29% m.p. 243-244 ° C).
П р и м е р 19. 9-Амино-6-аза-1,2,3,4-тетрагидро-1,4-метаноакридин. PRI me R 19. 9-amino-6-aza-1,2,3,4-tetrahydro-1,4-methanoacridine.
По методу, описанному в примере 16, но с применением норкамфоры вместо дельта-валеролактона и 3-амино-4-цианопиридина вместо 2-амино-3-цианопиридина получают указанное в заголовке соединение, 16% т.пл. 236-237оС.By the method described in example 16, but using norkormora instead of delta-valerolactone and 3-amino-4-cyanopyridine instead of 2-amino-3-cyanopyridine, the title compound was obtained, 16% mp 236-237 about S.
П р и м е р 20. 9-Циклогексилметиламино-8-фтор-4-окса-1,2,3,4-тетрагидроакрид-ин. PRI me R 20. 9-Cyclohexylmethylamino-8-fluoro-4-oxa-1,2,3,4-tetrahydroacrid-in.
Смесь гидрида натрия (60% масло, 110 мг, 2,75 ммоль), указанного в заголовке примера 6 соединения (600 мг, 2,75 ммоль), циклогексилметилбромида (487 мг, 2,75 ммоль) и диметилформамида (3,0 мл) нагревают при перемешивании при 25оС в течение 12 ч, затем при 65оС в течение 12 ч. К концу этого периода реакционную смесь быстро охлаждают выливанием ее в воду (45 мл) и затем полученную смесь экстрагируют этилацетатом (3 х 35 мл). Соединенные органические соли промывают водой (2 х 40 мл) и высушивают (безводный сульфат магния). Этилацетат отгоняют в вакууме и получают остаток, который загружают в колонку с силикагелем, предназначенную для флеш-хроматографии. Элюируют этилацетатом и получают масло, твердеющее при стоянии. При растирании этого твердого вещества с пентаном получают указанное в заголовке соединение (110 мг, 13% ) в виде желтовато-коричневого кристаллического вещества, т.пл. 100оС.A mixture of sodium hydride (60% oil, 110 mg, 2.75 mmol) of the title compound of Example 6 (600 mg, 2.75 mmol), cyclohexylmethyl bromide (487 mg, 2.75 mmol) and dimethylformamide (3.0 ml ) was heated with stirring at 25 ° C for 12 h, then at 65 ° C for 12 hours. at the end of this period, the reaction mixture was quenched by pouring it into water (45 ml) and then the resulting mixture was extracted with ethyl acetate (3 x 35 ml ) The combined organic salts were washed with water (2 x 40 ml) and dried (anhydrous magnesium sulfate). Ethyl acetate was distilled off in vacuo to give a residue, which was loaded onto a silica gel column for flash chromatography. Elute with ethyl acetate to give an oil that solidifies upon standing. Trituration of this solid with pentane gave the title compound (110 mg, 13%) as a tan crystalline solid, mp. 100 about S.
П р и м е р 21. 9-Циклогексилэтиламино-8-фтор-4-окса-1,2,3,4-тетрагидроакрид-ин. PRI me R 21. 9-Cyclohexylethylamino-8-fluoro-4-oxa-1,2,3,4-tetrahydroacrid-in.
По методу, описанному в примере 20, но с применением циклогексилэтилбромида вместо циклогексилметилбромида получают указанное в заголовке соединение (34%). According to the method described in example 20, but using cyclohexyl ethyl bromide instead of cyclohexyl methyl bromide, the title compound (34%) was obtained.
1Н-ЯМР (СDCl3, 300 МГц, δ ): 2Н, м. 0,8-1,02 м.д. 4Н, м. 1,02-1,4 м.д. 2Н, м. 1,44-1,56 м.д. 5Н, шир. д. 1,56-1,8 м.д. 2Н, кв. 1,92-2,04 м.д. (J 6,0 Гц); 2Н, т. 2,8 м.д. (J 6 Гц); 2Н, шир.т. 3,38 м.д. 2Н, т, 4,36 м.д. (J 6 Гц); 1Н, шир.д. 5,6 м.д. (J 20 Гц); 1Н, дд. 6,38 д.д. 6,38 м.д. (J 14,0, 7,5 Гц); 1Н, дд. 7,24-7,38 м.д. 1Н, д. 7,48 м.д. (J 8,2 Гц). 1 H-NMR (CDCl 3 , 300 MHz, δ): 2H, m, 0.8-1.02 ppm. 4H, m. 1.02-1.4 ppm. 2H, m. 1.44-1.56 ppm. 5H, broad d. 1.56-1.8 ppm. 2H, apt. 1.92-2.04 ppm (J 6.0 Hz); 2H, t, 2.8 ppm. (
П р и м е р 22. 9-Бензиламино-8-фтор-4-окса-1,2,3,4-тетрагидроакридин. PRI me R 22. 9-Benzylamino-8-fluoro-4-oxa-1,2,3,4-tetrahydroacridine.
По методу, описанному в примере 20, но с заменой циклогексилметилбромида на бензилбромид получают указанное в заголовке соединение, 38% т.пл. 134-135оС.By the method described in example 20, but with the replacement of cyclohexylmethyl bromide with benzyl bromide, the title compound was obtained, 38% mp. 134-135 about S.
П р и м е р 23. 9-Фенетиламино-8-фтор-4-окса-1,2,3,4-тетрагидроакридин. PRI me R 23. 9-Phenethylamino-8-fluoro-4-oxa-1,2,3,4-tetrahydroacridine.
По методу, описанному в примере 20, но с заменой циклогексилметилбромида на (2-бромэтил)бензол получают указанное в заголовке соединение, 20% т.пл. 125-126оС.By the method described in example 20, but with the replacement of cyclohexylmethyl bromide with (2-bromoethyl) benzene, the title compound was obtained, 20% mp 125-126 about S.
П р и м е р 24. 9-Фениропиламино-8-фтор-4-окса-1,2,3,4-тетрагидроакридин. PRI me R 24. 9-Phenyropylamino-8-fluoro-4-oxa-1,2,3,4-tetrahydroacridine.
По методу, описанному в примере 20, но с заменой циклогексилметилбромида на 1-бром-3-фенилпропан получают указанное в заготовке соединение (53% масло). By the method described in example 20, but with the replacement of cyclohexylmethyl bromide with 1-bromo-3-phenylpropane, the title compound (53% oil) was obtained.
1Н-ЯМР (СDCl3, 300 МГц, δ ): 4Н, м, 1,82-2,02 м.д. 4Н, м. 2,62-2,78 м.д. 2Н, шир. с. 2,34 м.д. 2Н, t, 4,35 м.д. (J 6,0 Гц); 1Н, шир.д. 5,7 м.д. (J 20 Гц); 1Н, дд. 6,86 м.д. (J 14, 7,5 Гц); 6Н, м. 7,04-7,4 м.д. 1Н, д. 7,51 м.д. (J 8,2 Гц). 1 H-NMR (CDCl 3 , 300 MHz, δ): 4H, m, 1.82-2.02 ppm. 4H, m. 2.62-2.78 ppm. 2H, broad from. 2.34 ppm 2H, t, 4.35 ppm. (J 6.0 Hz); 1H, broad d 5.7 ppm (J 20 Hz); 1H, dd. 6.86 ppm (J 14, 7.5 Hz); 6H, m. 7.04-7.4 ppm. 1H, d. 7.51 ppm. (J 8.2 Hz).
П р и м е р 25. 9-(3,3-дифенилпропиламино)-8-фтор-4-окса-1,2,3,4-тетрагидроакр- идин. PRI me R 25. 9- (3,3-diphenylpropylamino) -8-fluoro-4-oxa-1,2,3,4-tetrahydroacridin.
По методу, описанному в примере 20, но с заменой циклогексилметилбромида на 1-бром-3,3-дифенилпропан получают указанное в заголовке соединение, 32% т.пл. 134-135оС.By the method described in example 20, but with the replacement of cyclohexylmethyl bromide with 1-bromo-3,3-diphenylpropane, the title compound was obtained, 32% mp. 134-135 about S.
П р и м е р 26. 9-Амино-4-тиа-1,2,3,4-тетрагидроакридин. PRI me
По методу, описанному в примере 7, но с заменой дельта-валеролактона на дельта-тиовалеролактон получают указанное в заголовке соединение, 4% т.пл. 190оС.According to the method described in example 7, but with the substitution of delta-valerolactone for delta-thiovalerolactone, the title compound was obtained, 4% mp. 190 about S.
П р и м е р 27. 9-Амино-3-метил-4-окса-1,2,3,4-тетрагидроакридин. PRI me R 27. 9-amino-3-methyl-4-oxa-1,2,3,4-tetrahydroacridine.
По способу, описанному в примере 7, но с заменой дельта-валеролактона на 6-метилтетрагидропиран-2-он получают указанное в заголовке соединение, 23% т.пл. 202-203оС.By the method described in example 7, but with the replacement of delta-valerolactone with 6-methyltetrahydropyran-2-one, the title compound was obtained, 23% mp. 202-203 about S.
П р и м е р 28. 9-Амино-3-метил-8-фтор-4-окса-1,2,3,4-тетрагидроакридин. PRI me R 28. 9-amino-3-methyl-8-fluoro-4-oxa-1,2,3,4-tetrahydroacridine.
По методу, описанному в примере 7, но с заменой дельта-валеролактона на 6-метилтетрагидропиран-2-он и антрагилонитрила на 2-амино-6-фторбензонитрил получают указанное в заголовке соединение, 13% т.пл. 217-218оС.According to the method described in example 7, but with the replacement of delta-valerolactone with 6-methyltetrahydropyran-2-one and anthragilonitrile with 2-amino-6-fluorobenzonitrile, the title compound was obtained, 13% mp 217-218 about S.
П р и м е р 29. 9-Амино-8-фтор-2-тиа-1,2,3,4-тетрагидроакридин. PRI me R 29. 9-amino-8-fluoro-2-thia-1,2,3,4-tetrahydroacridine.
По способу, описанному в примере 7, но с заменой дельта-валеролактона на тетрагидротиопиран-4-он и антранилонитрила на 2-амино-6-фторбензонитрил получают указанное в заголовке соединение, 19% т.пл. 175-176оС.By the method described in example 7, but with the replacement of delta-valerolactone with tetrahydrothiopyran-4-one and anthranilonitrile with 2-amino-6-fluorobenzonitrile, the title compound was obtained, 19% mp. 175-176 about S.
П р и м е р 30. 9-Амино-1,2,3,4-тетрагидро-1,4-этаноакридин. PRI me R 30. 9-amino-1,2,3,4-tetrahydro-1,4-ethanoacridine.
По способу, описанному в примере 1, но с применением дицикло-(2,2,2)октан-2-она вместо норкамфоры получают указанное в заголовке соединение, 20% т.пл. 197-199оС.By the method described in example 1, but using dicyclo- (2,2,2) octan-2-one instead of norkormora, the title compound was obtained, 20% mp 197-199 about S.
П р и м е р 31. 2,3-Дигидрофуро(2,3-b)хинолин-4-амин. PRI me R 31. 2,3-Dihydrofuro (2,3-b) quinolin-4-amine.
По способу, описанному в примере 7, но с применением гамма-бутиролактона вместо дельта-валеролактона получают указанное в заголовке соединение, т.пл. 300оС (разлагается).By the method described in example 7, but using gamma-butyrolactone instead of delta-valerolactone, the title compound is obtained, mp. 300 about C (decomposes).
1Н-ЯМР (СDCl3, 300 МГц δ ): 2Н, т. 3,17 м.д. (J 8 Гц); 2Н, шир. с. 4,6 м. д. 2Н, т. 4,69 м.д. (J 8 Гц); 1Н, т. 7,28 м.д. (J 8 Гц); 1Н, т. 7,53 м.д. (J 8 Гц); 1Н, д. 7,62 м.д. (J 8 Гц); 1Н, д. 7,77 м.д. (J 8 Гц). 1 H-NMR (CDCl 3 , 300 MHz δ): 2H, t, 3.17 ppm. (
П р и м е р 32. 6Н-(1)Бензопирано(4,3-b)хинолин-7-амин. PRI me R 32. 6H- (1) Benzopyrano (4,3-b) quinolin-7-amine.
По способу, описанному в примере 7, но с применением 4-хротманона вместо дельта-валеролактона получают указанное в заголовке соединение, 3% т.пл. 275оС (разлагается).By the method described in example 7, but using 4-chromotmanone instead of delta-valerolactone, the title compound was obtained, 3% mp 275 ° C (decomposed).
1Н-ЯМР (ДМСО, 300 МГц, δ ): 2Н, с. 5,3 м.д. 1Н, д. 6,97 м.д. (J 8,2 Гц); 1Н, т. 7,08 м.д. (J 7,0 Гц); 2Н, м. 7,15-7,4 м.д. 1Н, т. 7,57 м.д. (J 7,0 Гц); 1Н, д. 7,78 м.д. (J 7,0 Гц); 1Н, д. 8,16 м.д. (J 8,0 Гц); 1Н, дд. 8,24 м.д. (J 7,0, 2,0 Гц). 1 H-NMR (DMSO, 300 MHz, δ): 2H, s. 5.3 ppm 1H, d, 6.97 ppm. (J 8.2 Hz); 1H, t. 7.08 ppm. (J 7.0 Hz); 2H, m, 7.15-7.4 ppm. 1H, t, 7.57 ppm. (J 7.0 Hz); 1H, d. 7.78 ppm. (J 7.0 Hz); 1H, d, 8.16 ppm. (J 8.0 Hz); 1H, dd. 8.24 ppm (J 7.0, 2.0 Hz).
П р и м е р 33. 6Н-(1)-Бензотиопирано(4,3-b)хинолин-7-амин. PRI me R 33. 6H- (1) -Benzothiopyrano (4,3-b) quinolin-7-amine.
По способу, описанному в примере 7, но с применением тиохроман-4-она вместо дельта-валеролактона получают указанное в заголовке соединение, 13% т.пл. 211-212оС.By the method described in example 7, but using thiochroman-4-one instead of delta-valerolactone, the title compound was obtained, 13% mp 211-212 about S.
П р и м е р 34. 9-Метиламино-8-фтор-4-окса-1,2,3,4-тетрагидроакридин. PRI me R 34. 9-Methylamino-8-fluoro-4-oxa-1,2,3,4-tetrahydroacridine.
По способу, описанному в примере 20, но с применением йодметана вместо циклогексилметилбромида получают указанное в заголовке соединение (для гидрохлорида т.пл. 240оС).According to the method described in Example 20 but using cyclohexylmethyl bromide instead of iodomethane, the title compound (hydrochloride of m.p. 240 ° C).
1Н-ЯМР (ДМСО, 300 МГц, δ ): 2Н, м. 2,0 м.д. 2Н т. 2,95 м.д. (J 6,5 Гц); 3Н, шир. д. 3,3 м.д. 2Н, т. 4,53 м.д. (J 6,5 Гц); 1Н, дд. 7,34 м.д. (J 8,14 Гц); 1Н, дд. 7,44 м.д. (J8,0 Гц); 1Н, м. 7,7-7,8 м.д. 1Н, шир. м. 7,94-8,06 м.д. 1 H-NMR (DMSO, 300 MHz, δ): 2H, m, 2.0 ppm. 2H t. 2.95 ppm. (J 6.5 Hz); 3H, broad d.3.3 ppm 2H, t. 4.53 ppm. (J 6.5 Hz); 1H, dd. 7.34 ppm (J 8.14 Hz); 1H, dd. 7.44 ppm (J8.0 Hz); 1H, m. 7.7-7.8 ppm. 1H, broad m. 7.94-8.06 ppm.
П р и м е р 35. 2,3-Дигидро-8-фтортиено/3,2-b/хинолин-9-амин (соединение А) и 1,3-дигидро-8-фтортиено/3,4-b/хинолин-9-амин. PRI me
По способу, описанному в примере 12, но с применением 2-амино-6-фторбензонитрила вместо антранилонитрила получают смесь 1:1 обоих указанных в заголовке соединений. Соединение А, т.пл 137оС, соединение В (т.пл. 198оС, разлагается):
1Н-ЯМР (СDCl3, 300 МГц, δ ): 2Н, с. 4,09 м.д. 2Н с. 4,38 м.д. 2Н, шир.с. 5,3 м. д. 1Н, дд. 7,0 м.д. (J 7,3, 14,5 Гц); 1Н, дд. 7,47 м.д. (J 7,3, 10,5 Гц); 1Н, д. 7,68 м.д. (J 10,5 Гц).By the method described in Example 12, but using 2-amino-6-fluorobenzonitrile instead of anthranilonitrile, a 1: 1 mixture of both of the title compounds was obtained. Compound A, mp 137 ° C, Compound B (m.p. 198 ° C decomposed)
1 H-NMR (CDCl 3 , 300 MHz, δ): 2H, s. 4.09 ppm 2H s 4.38 ppm 2H, br.s. 5.3 ppm, 1H, dd. 7.0 ppm (J 7.3, 14.5 Hz); 1H, dd. 7.47 ppm (J 7.3, 10.5 Hz); 1H, d. 7.68 ppm. (J 10.5 Hz).
П р и м е р 36. 9-Амино-1,2-дигидроакридин-4(3Н)-он. PRI me R 36. 9-amino-1,2-dihydroacridin-4 (3H) -one.
По способу, описанному в примере 1, но с применением 1,2-циклогександиона вместо норкамфоры получают указанное в заголовке соединение, 11% т.пл. 240оС (разлагается).By the method described in example 1, but using 1,2-cyclohexanedione instead of norkormora, the title compound was obtained, 11% mp. 240 C (decomposes).
1Н-ЯМР (СDCl3, 300 МГц, δ ): 2Н, квинт. 2,31 м.д. 4Н мг. 2,8-2,95 м.д. 2Н, шир. с. 4,95 м.д. 1Н, т. 7,29 м.д. (J 8,5 Гц); 1Н, т. 7,64 м.д. (J 8,5 Гц); 1Н, д. 7,74 м.д. (J 8,5 Гц); 1Н, д. 8,2 м.д. (J 8,51 Гц). 1 H-NMR (CDCl 3 , 300 MHz, δ): 2H, quint. 2.31 ppm 4H mg. 2.8-2.95 ppm 2H, broad from. 4.95 ppm 1H, t, 7.29 ppm. (J 8.5 Hz); 1H, t. 7.64 ppm. (J 8.5 Hz); 1H, d. 7.74 ppm. (J 8.5 Hz); 1H, d, 8.2 ppm. (J 8.51 Hz).
П р и м е р 37. 8-Фтор-9-амино-1,2,3,4-тетрагидроакридин. PRI me R 37. 8-Fluoro-9-amino-1,2,3,4-tetrahydroacridine.
К перемешиваемому при -20оС раствору циклогексанона (1,0 г, 10,0 ммоль) в метиленхлориде (10 мл) добавляют 1 М раствор хлорида титана (IV) в метиленхлориде (20 мл). Реакционная смесь приобретает желтую окраску, и к ней добавляют смесь триэтиламина (2,0 Г, 20 ммоль) и 2-амино-6-фторбензонитрила (1,36 г, 10,0 ммоль) в метиленхлориде (30 мл). Реакционная смесь сразу же становится темного цвета и ее оставляют нагреваться до комнатной температуры (приблизительно 25оС) и перемешивают еще в течение 15 ч. К концу этого периода реакционную смесь обрабатывают 12%-ным водным раствором гидроксида натрия (100 мл) и метиленхлоридом (100 мл). Затем реакционную смесь фильтруют через прокладку из диатомовой земли толщиной 2 дюйма (торговое название целит) и прокладку промывают метиленхлоридом (50 мл) и водой (100 мл). Органический слой отделяют, промывают водой (1 х 30 мл) и сушат (безводный сульфат магния). Метиленхлорид удаляют в вакууме и получают масло, которое растирают с эфиром, получают указанное в заголовке соединение в виде белого твердого вещества, 218 мг, 10% т.пл. 175оС.To a stirred -20 ° C solution of cyclohexanone (1.0 g, 10.0 mmol) in methylene chloride (10 ml) was added 1M solution of titanium chloride (IV) in methylene chloride (20 mL). The reaction mixture turns yellow and a mixture of triethylamine (2.0 g, 20 mmol) and 2-amino-6-fluorobenzonitrile (1.36 g, 10.0 mmol) in methylene chloride (30 ml) is added. The reaction mixture immediately became dark in color and it was allowed to warm to room temperature (about 25 C) and stirred for a further 15 hours. At the end of this period, the reaction mixture was treated with 12% aqueous sodium hydroxide (100 ml) and methylene chloride ( 100 ml). The reaction mixture is then filtered through a 2 inch thick pad of diatomaceous earth (trade name Celite) and the pad is washed with methylene chloride (50 ml) and water (100 ml). The organic layer was separated, washed with water (1 x 30 ml) and dried (anhydrous magnesium sulfate). Methylene chloride was removed in vacuo to give an oil which was triturated with ether to give the title compound as a white solid, 218 mg, 10% mp. 175 about S.
П р и м е р 38. 9-Амино-8-метил-1,2,3,4-тетрагидроакридин. PRI me R 38. 9-amino-8-methyl-1,2,3,4-tetrahydroacridine.
По способу, описанному в примере 37, но с применением 2-амино-6-метилбензонитрила вместо 2-амино-6-фторбензонитрила получают указанное в заголовке соединение, 11% т.пл. 143-145оС.By the method described in example 37, but using 2-amino-6-methylbenzonitrile instead of 2-amino-6-fluorobenzonitrile, the title compound was obtained, 11% mp. 143-145 about S.
П р и м е р 39. 9-Амино-8-хлор-1,2,3,4-тетрагидроакридин. PRI me R 39. 9-amino-8-chloro-1,2,3,4-tetrahydroacridine.
По способу, описанному в примере 37, но с применением 2-амино-6-хлорбензонитрила вместо 2-амино-6-фторбензонитрила получают указанное в заголовке соединение, 23% т.пл. 144-145оС.By the method described in example 37, but using 2-amino-6-chlorobenzonitrile instead of 2-amino-6-fluorobenzonitrile, the title compound was obtained, 23% mp. 144-145 about S.
П р и м е р 40. 4-Амино-5-фтор-2,3-пентаметиленхинолин. PRI me R 40. 4-amino-5-fluoro-2,3-pentamethylene quinoline.
По способу, описанному в примере 37, но с применением циклогептанона вместо циклогексанона получают указанное в заголовке соединение, 22% т.пл. 203оС.By the method described in example 37, but using cycloheptanone instead of cyclohexanone, the title compound was obtained, 22% mp. 203 about S.
П р и м е р 41. 4-Амино-5-хлор-2,3-пентаметиленхинолин. PRI me R 41. 4-amino-5-chloro-2,3-pentamethylene quinoline.
По способу, описанному в примере 37, но с применением циклогептанона вместо циклогексанона и 2-амино-6-хлорбензонитрила вместо 2-амино-6-фторбензонитрила получают указанное в заголовке соединение, 11% т.пл. 194-195оС.By the method described in example 37, but using cycloheptanone instead of cyclohexanone and 2-amino-6-chlorobenzonitrile instead of 2-amino-6-fluorobenzonitrile, the title compound was obtained, 11% mp. 194-195 about S.
П р и м е р 42. 4-Амино-5-фтор-2,3-триметиленхинолин. PRI me R 42. 4-amino-5-fluoro-2,3-trimethylene quinoline.
По способу, описанному в примере 37, но с применением циклопентанона вместо циклогексанона получают указанное в заголовке соединение, 6% т.пл. 179-181оС.By the method described in example 37, but using cyclopentanone instead of cyclohexanone, the title compound was obtained, 6% mp. 179-181 about S.
П р и м е р 43. 9-Амино-8-хлор-4-оксо-1,2,3,4-тетрагидроакридин. PRI me R 43. 9-amino-8-chloro-4-oxo-1,2,3,4-tetrahydroacridine.
По способу, описанному в примере 7, но с применением 2-амино-6-хлорбензонитрила вместо антранилонитрила получают указанное в заголовке соединение, 15% т.пл. 205оС.By the method described in example 7, but using 2-amino-6-chlorobenzonitrile instead of anthranilonitrile, the title compound was obtained, 15% mp 205 about S.
П р и м е р 44. 9-Амино-8-метил-4-окса-1,2,3,4-тетрагидроакридин. PRI me R 44. 9-amino-8-methyl-4-oxa-1,2,3,4-tetrahydroacridine.
По способу, описанному в примере 7, но с применением 2-амино-6-метилбензонитрила вместо антранилонитрила получают указанное в заголовке соединение, 20% т.пл. 177-179оС.By the method described in example 7, but using 2-amino-6-methylbenzonitrile instead of anthranilonitrile, the title compound was obtained, 20% mp 177-179 about S.
1Н-ЯМР (CDCl3, 300 МГц, δ ): 1Н, д. 7,56 м.д. (J 7 Гц); 1Н, т. 6,95 м.д. (J 7 Гц); 2Н, шир. с. 4,93 м.д. 2Н, т. 4,29 м. д. (J 6 Гц); 3Н, с. 2,89 м.д. 2Н, т. 2,52 м.д. (J 6 Гц); 2Н, м. 2,08-2,11 м.д. 1 H-NMR (CDCl 3 , 300 MHz, δ): 1H, d, 7.56 ppm. (
П р и м е р 45. 9-Амино-8-метокси-1,2,3,4-тетрагидроакридин. PRI me R 45. 9-amino-8-methoxy-1,2,3,4-tetrahydroacridine.
По способу, описанному в примере 37, но с применением 2-амино-6-метоксибензонитрила вместо 2-амино-6-фторбензонитрила получают указанное в заголовке соединение, 14% т.пл. 187-188оС.By the method described in example 37, but using 2-amino-6-methoxybenzonitrile instead of 2-amino-6-fluorobenzonitrile, the title compound was obtained, 14% mp. 187-188 about S.
П р и м е р 46. 9-Амино-8-метокси-4-окса-1,2,3,4-тетрагидроакридин. PRI me R 46. 9-amino-8-methoxy-4-oxa-1,2,3,4-tetrahydroacridine.
По способу, описанному в примере 7, но с применением 2-амино-6-метоксибензонитрила вместо антранилонитрила получают указанное в заголовке соединение, 11% т.пл. 205-207оС.By the method described in example 7, but using 2-amino-6-methoxybenzonitrile instead of anthranilonitrile, the title compound was obtained, 11% mp. 205-207 about S.
1Н-ЯМР (СDCl3, 300 МГц, δ ): 2Н, м. 7,33 м.д. 1Н, дд. 6,57 м.д. (J 3,6 Гц); 2Н, шир. с. 5,92 м.д. 2Н. т. 4,29 м.д. (J 2,6 Гц); 3Н, с. 3,95 м.д. 2Н, т. 2,5 м.д. (J 2,6 Гц); 2Н, м. 2,13-2,07 м.д. 1 H-NMR (CDCl 3 , 300 MHz, δ): 2H, m, 7.33 ppm. 1H, dd. 6.57 ppm (J 3.6 Hz); 2H, broad from. 5.92 ppm 2H. t. 4.29 ppm (J 2.6 Hz); 3H, s. 3.95 ppm 2H, t. 2.5 ppm. (J 2.6 Hz); 2H, m. 2.13-2.07 ppm.
П р и м е р 47. Способность соединений, указанных в заголовках примеров 1-16, 18, 26-29 и 35-46, подавлять ацетилхолинстеразу мозга была определена спектрофотометрическим методом I.Z/Ellman и др. (Biochemical Pharmacology, 7, 88 (1961)). Для всех соединений значения ПК50 (в молях) находились в интервале 5 мкмоль-01 мкмоль.PRI me R 47. The ability of the compounds indicated in the headings of examples 1-16, 18, 26-29 and 35-46 to suppress brain acetylcholinesterase was determined spectrophotometrically by IZ / Ellman et al. (Biochemical Pharmacology, 7, 88 ( 1961)). For all compounds, the values of PK 50 (in moles) were in the range of 5 μmol-01 μmol.
В таблице приведены данные испытаний. The table shows the test data.
Claims (3)
где A группа
в которой фрагмент CH в положении a может быть заменен атомом азота.1. 4-AMINOPYRIDINE DERIVATIVES of the General Formula
where is a group
in which the CH moiety in position a can be replaced by a nitrogen atom.
где прерывистая линия представляет необязательную двойную связь;
R3 водород или фтор в положении "b";
Y1 CH2, O или S;
Y2 CH2, CH, O или S;
Y3 CH2 или CH,
при условии, что группа формулы I а может иметь двойную связь только в том случае, когда Y2 и Y3 CH, и при условии, что, когда A означает указанную группу, где R3 водород, и азот отсутствует в положении "a", только один из Y1 и Y2 CH2
q 1.B group:
where the dashed line represents an optional double bond;
R 3 is hydrogen or fluoro in position "b";
Y 1 CH 2 , O or S;
Y 2 CH 2 , CH, O or S;
Y 3 CH 2 or CH,
provided that the group of formula I a can have a double bond only when Y 2 and Y 3 CH, and provided that when A means the specified group, where R 3 is hydrogen and nitrogen is not in position "a" , only one of Y 1 and Y 2 CH 2
q 1.
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PCT/US1988/001070 WO1989002740A1 (en) | 1987-10-05 | 1988-03-30 | 4-aminopyridine derivatives |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2039058C1 true RU2039058C1 (en) | 1995-07-09 |
Family
ID=22208635
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| SU925010806A RU2039058C1 (en) | 1988-03-30 | 1992-02-18 | 4-aminopyridine derivatives |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2039058C1 (en) |
-
1992
- 1992-02-18 RU SU925010806A patent/RU2039058C1/en active
Non-Patent Citations (2)
| Title |
|---|
| Патент США N 4550113, кл. A 61K 31/47, 1986. * |
| Патент США N 4631286, кл. A 61K 31/47, 1986. * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0311303A2 (en) | 4-aminopyridine derivatives | |
| SU1750425A3 (en) | Method of obtaining aromatic and heteroaromatic compounds | |
| KR900007243B1 (en) | 4-amino pyridine derivatives | |
| DE69323883T2 (en) | PYRRIDINO, PYRROLIDINO AND AZEPINO SUBSTITUTED OXIMES AS ANTIATHEROSCLEROSIC AGENTS AND ANTIHYPERCHOLESTEROLEMIC AGENTS | |
| KR100225927B1 (en) | Geneserine derivatives as cholinesterase inhibitors | |
| DE2757503A1 (en) | 5.6-DIHYDROBENZO SQUARE CLAMP ON 5.6 SQUARE BRACKET FOR CYCLOHEPTA SQUARE BRACKET ON 1.2-ANGLE BRACKET FOR PYRAZOLO SQUARE BRACKET ON 4.3-SQUARE BRACKET FOR -PYRIDINE-11 (1H) -ONE AND -IMINE AND THEIR SALTS AND THE USE OF THESE COMPOUNDS AS PSYCHOTROPIC AND ANTI-INFLAMMATORY DRUGS | |
| CN102958937A (en) | Benzodioxole or benzodioxepine heterocyclic compounds phosphodiesterase inhibitors | |
| EP0148440A1 (en) | 1,3,4,5-Tetrahydrobenzo(c,d)indoles, process for their preparation and their uses | |
| US5420134A (en) | Substituted hexahydrobenzo[A]phenanthridines | |
| DE69233255T2 (en) | CARBAMAT ANALOGS OF THIAPHYSOVENIN, PHARMACEUTICAL COMPOSITIONS AND METHOD FOR INHIBITING CHOLINESTERASES | |
| US4670462A (en) | Substituted 1,3,4,9-tetrahydropyrano(3,4-B)indole-1-acetic acids | |
| RU2039058C1 (en) | 4-aminopyridine derivatives | |
| EP0508334B1 (en) | Novel aminophenol derivatives and pharmaceutical compositions thereof | |
| US5202440A (en) | Certain 9-amino-2-(or 4)-oxa 1,2,3,4-tetrahydro- or 1,2,3,4,5,6,7,8-octahydro-acridines | |
| EP0473550A1 (en) | Indolonaphthyridines | |
| DE2722383C2 (en) | ||
| DE60033447T2 (en) | Optically pure camptothecin analogues | |
| DD206377A5 (en) | PROCESS FOR THE PREPARATION OF (THIENYL-2) - AND (THIENYL-3) -2-ETHYLAMINE DERIVATIVES | |
| US4138489A (en) | Vasodilating octahydro-1,12-methano-oxymethano[2,3-a]-indoloquinolizines | |
| JP2835050B2 (en) | Heteroalkylenequinolineamine and method for producing the same | |
| KR0156241B1 (en) | Hydroxy-1,2,3,4-tetra hydroaminoacridines | |
| EP0235347B1 (en) | Dihydropyridine lactols, processes for their preparation, and their use as pharmaceutical compounds | |
| DE69818988T2 (en) | 9,10-DIAZATRYCLO [4.2.11 2,5] DECAN- AND 9,10-DIAZATRICYCLO [3.3.1.1 2,6] DECANDERIVE WITH ANALGETIC EFFECT | |
| JP2956788B2 (en) | Spiroisoindoline compound, method for producing the same, medicament for treating neurosis containing the same, and intermediate for producing the same | |
| US4910311A (en) | 3-7-diheterabicyclo[3.3.1]nonanes as antiarrhythmic agents |