KR900006742B1 - N-[(2-옥소피롤리딘-1-일)아세틸]피페라진 유도체 및 노인성 치매용 약제 - Google Patents
N-[(2-옥소피롤리딘-1-일)아세틸]피페라진 유도체 및 노인성 치매용 약제 Download PDFInfo
- Publication number
- KR900006742B1 KR900006742B1 KR1019880008858A KR880008858A KR900006742B1 KR 900006742 B1 KR900006742 B1 KR 900006742B1 KR 1019880008858 A KR1019880008858 A KR 1019880008858A KR 880008858 A KR880008858 A KR 880008858A KR 900006742 B1 KR900006742 B1 KR 900006742B1
- Authority
- KR
- South Korea
- Prior art keywords
- compound
- formula
- alkyl
- aryl
- optionally substituted
- Prior art date
Links
- 0 CC(C)C[C@@](CCC(C)C*)CC(C)[C@@]([C@]1[C@](C)CC1)[C@@]1[C@](C)C[C@](C)C1 Chemical compound CC(C)C[C@@](CCC(C)C*)CC(C)[C@@]([C@]1[C@](C)CC1)[C@@]1[C@](C)C[C@](C)C1 0.000 description 2
- HNJBEVLQSNELDL-UHFFFAOYSA-N O=C1NCCC1 Chemical compound O=C1NCCC1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/18—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having one double bond between ring members or between a ring member and a non-ring member
- C07D207/22—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having one double bond between ring members or between a ring member and a non-ring member with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D207/24—Oxygen or sulfur atoms
- C07D207/26—2-Pyrrolidones
- C07D207/263—2-Pyrrolidones with only hydrogen atoms or radicals containing only hydrogen and carbon atoms directly attached to other ring carbon atoms
- C07D207/27—2-Pyrrolidones with only hydrogen atoms or radicals containing only hydrogen and carbon atoms directly attached to other ring carbon atoms with substituted hydrocarbon radicals directly attached to the ring nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02C—CAPTURE, STORAGE, SEQUESTRATION OR DISPOSAL OF GREENHOUSE GASES [GHG]
- Y02C20/00—Capture or disposal of greenhouse gases
- Y02C20/40—Capture or disposal of greenhouse gases of CO2
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
내용 없음.
Description
본 발명은 N-[(2-옥소피롤리딘-1-일)아세틸]피페라진 유도체에 관한 것이다. 특히, 본 발명은 노인성 치매, 향정신성 및/또는 건망증 방지제용 약제로 특히 유용하다고 밝혀진 N-[(2-옥소피롤리딘-1-일)아세틸]피페라진 유도체, 그의 제조방법, 그의 용도 및 이 화합물을 함유하는 약학제제에 관한 것이다.
N-[(2-옥소피롤리딘-1-일)아세틸]피페라진 유도체는 예를들면, 영국 특허 공개 제2162843-A호 및 유럽 특허 공고 제89900-B호에 유용한 건망증 방지제로 공지되었었다.
본 발명의 발명가들은 이러한 화합물을 포함하는 피페라진족의 건망증 방지제에 대해 연구해왔었다. 그러므로, 본 발명이 완성되었다.
본 발명의 화합물은 몇몇 종류의 노인성 치매를 치료하는데 적용될 수 있다.
본 발명에 따라서, 하기 일반식( I )의 N-[(2-옥소피롤리딘-1-일)아세틸]피페라진 유도체 및 그의 약학적으로 허용 가능한 산-부가염이 제공된다 :
(식중, R은-SO2R1또는-CONHR2이고 ; R1은C1∼C5알킬, C8∼C12페닐알케닐, 아미노. 디메틸아미노, 임의치환된 C6∼C12아릴, 또는 N,S 및 O로 이루어진 군에서 선택된 최소한 하나의 헤테로 원자를 포함하는 5- 또는 6-원 헤테로사이클기이며 ; R2는 아미노, C1∼C5알킬아미노, C1∼C5알킬, 또는 임의 치환된 C6∼C12아릴이다).
상기 정의에서 사용되는 용어는 하기에 설명된다.
알킬로는, 메틸, 에틸, n-프로필, 이소프로필, n-부틸, 2차-부틸, 이소부틸, 3차-부틸, n-펜틸, 및 이소펜틸을 예로들 수 있다.
페닐알케닐로는, 스티릴, 페닐프로페닐, 페닐부테닐, 및 페닐펜테닐을 예로들 수 있다.
아릴로는, 페닐, α-나프틸, 및 β-나프틸을 예로들 수 있다.
헤테로사이클기로는, 티에닐, 푸릴, 피리딜, 및 피리미디닐을 예로들 수 있다.
아릴에 존재할 수 있는 치환체로는, 상술한 알킬, 알콕시, 할로겐, 아세틸아미노, 및 니트로를 예로들 수있다.
할로겐으로는 염소, 불소, 브롬 및 요오드를 예로들 수 있다.
알콕시로는, 메톡시, 에톡시, 및 프로폭시를 예로들 수 있다.
본 발명의 화합물( I )은 주로 하기 도식에 따라 제조된다 :
(식중, Hal 및 X는 각각 할로겐이고 ; R1및 R2는 상기 정의와 동일하다. 그러나, 방법 B에서 R2는 알킬 또는 임의 치환된 아릴이다. )
(방법 A)
화합물(II)를 적절한 용매내에서 설포닐 할라이드(III)과 반응시켜 화합물( I a )을 수득한다.
용매로는, 반응 시약이 용해될 수 있는 불활성 유기 용매를 사용할 수 있다. 예를들면, 벤젠, 톨루엔, 및 크실렌과 같은 방향족 용매 ; 메탄올, 에탄올, 및 이소프로판올과 같은 알칸올 ; 디옥산, 테트라히드로푸란, 디에틸렌글리콜, 디에틸 에테르, 및 디부틸 에테르와 같은 에테르 ; 디메틸포름아미드, 및 디메틸설폭시드를 사용할 수 있다.
또한, 트리에틸아민 또는 피리딘과 같은 3차 아민을 산 수용체로 가하여 반응을 가속시킬 수 있다.
반응은 -20∼100℃, 바람직하게는 -5∼30℃의 온도에서 수행한다.
(방법 B)
화합물(II)를 적절한 용매내에서 이소시아네이트(IV)와 반응시켜 목적 화합물( I b )를 수득한다. 용매로는, 메탄올, 에탄올, 벤젠, 클로로포름, 디클로로메탄, 및 사염화탄소를 사용할 수 있다.
반응은 -10∼100℃, 바람직하게는 실온 부근(1∼30℃)의 온도에서 수행한다.
(방법 C)
(1) 화합물(II)를 적절한 용매내에서 페닐 할로게노포르메이트(V)와 반응시켜 화합물(VI)을 수득한다. 용매로는, 메탄올, 에탄올, 벤젠, 클로로포름, 디클로로메탄, 및 사염화탄소를 사용할 수 있고, 산 수용체로는, 트리에틸아민 또는 피리딘과 같은 염기를 사용할 수 있다.
반응은 -10∼100℃, 바람직하게는 실온 부근에서 수행한다.
(2) 이전 단계(1)에서 수득된 화합물(VI)을 아민(VII)과 반응시켜 목적 화합물( I b )을 수득한다.
반응은 50∼150℃, 바람직하게는 100℃부근에서 수행한다.
상기 방법 A∼방법 C와는 별도로, 하기 방법을 목적 화합물( I )의 합성 방법으로 제시한다.
(a)
(식중, R1은 상기 정의와 동일하고 ; R3는 C1∼C3알킬이다.)
(b)
(식중, R1은 상기 정의와 동일하고 ; Ha1은 할로겐이고 ; M은 금속원자(예. 나트륨,칼륨)이다.)
(c)
(식중, R1은 상기 정의와 동일하고 ; R4는 히드록시 또는 할로겐이다.)
출발물질(II)는 예를들면, 하기 제조방법으로 제조된다.
(식중, R3는 상기 정의와 동일하다.)
화합물( I )은 그의 약학적으로 허용 가능한 산 부가염으로 전환시킬 수 있다. 이러한 산으로는 염산, 황산, 인산, 질산, 브롬화수소산, 및 요오드화 수소산과 같은 무기산 및 아세트산, 말레산, 말산, 시트르산, 락트산, 숙신산, 및 메탄설폰산과 같은 유기산이 포함된다.
본 발명의 화합물( I )은 노인성치매, 정신병, 또는 건망증 환자를 치료하는데 효과적이며 노인성 치매, 향정신성 또는 건망증 방지제용 약제로서 유용하다.
본 발명의 목적 화합물( I )을 사람 또는 동물이 경구 또는 비경구 투여할 수 있다. 예를들면, 화합물( I )을 정제, 입제, 분제, 캡슐, 또는 액형의 형태로 경구 투여, 또는 주사제 또는 좌제로 비경구 투여할 수 있다. 이 제제는 희석제, 결합제, 붕해제, 윤활제, 안정제, 교미제, 현탁제, 분산제, 가용화제 및 방부제와 같은 부가제를 사용하여 공지된 제조방법으로 제조한다. 희석제로는 락토오스,슈크로오스, 녹말, 셀룰로오스, 및 소르비트 ; 결합제로는 아라비아검, 젤라틴 및 폴리비닐피롤리돈 ; 및 윤활제로는, 마그네슘 스테아레이트, 활석 및 실리카겔을 각각 예로들 수 있다. 본 발명의 목적 화합물( I )을 노인성 치매의 치료에서 사용할때에, 약 0.01∼20mg/kg의 일일 투여량을 일회에 또는 몇차례에 걸쳐 경구 또는 비경구 투여할 수있다.
본 발명의 구현은 하기 제시되는 실시예, 참고예 및 제조예에서 기술하겠다.
실시예, 참고예 및 표에서 사용되는 약어는 하기 의미를 갖는다.
Me : 메틸, Et : 에틸, i-Pr : i-프로필, n-Bu : n-부틸, Ac : 아세틸, MeOH : 메탄올, EtOH : 에탄올, Et2O : 디에틸 에테르, Et3N : 트리에틸아민
[실시예]
[실시예 1]
1-[(2-옥소피롤리디닐-1-일)아세틸]-4-(4-메톡시벤젠설포닐)피페라진
1.030g(4.88밀리몰)의 [(2-옥소피롤리디닐-1-일)아세틸]피페라진(II)을 15ml의 디클로로메탄에 용해시키고, 1.108g(5.36밀리몰)의 4-메톡시벤젠설포닐 클로라이드 및 0.748ml(5.36밀리몰)의 트리에틸아민을 빙냉 교반하에서 혼합물을 가하고, 혼합물을 실온에서 5시간 45분동안 교반한 후, CH2Cl2로 희석한다. 용액을 묽은 HCl, 물, 수성 NaHCO3, 및 물로 각각 세척하고 건조시킨다. 용매를 증발시킨후, 잔류물을 실리카겔컬럼 크로마토그래피(실리카겔 : 91g)시키고 CHCl3-MeOH(30 : 1∼9 : 1 v/v)로 용출시킨다. 용출분획으로부터 수득된 1.63g의 결정을 MeOH에서 재결정시켜, 1.339g의 프리즘상 목적 화합물(수율 : 72.0%)을 수득한다.
원소분석 : C17H23N3O5S
계산치 : C ; 53.53, H ; 6.08, N ; 11.02, S ; 8.41(%)
실측치 : C ; 53.30, H ; 6.06, N ; 10.97, S ; 8.29(%)
IR(Nujo1) : 3082,1687,1668,1598,1578,1498,1458,1448,1408cm-1
NMR(CDC13-CD3OD=4 : 1 v/v) : δ1.9∼2.2(m,2H), 2.41(t,J=7Hz,2H), 3.03(br,4H), 3.45(t,J=7Hz,2H), 3.61(br,4H), 3.89(s,3H), 4.04(s,2H), 7.05(d, J =10Hz,2H), 7.71(d, J =10Hz,2H)
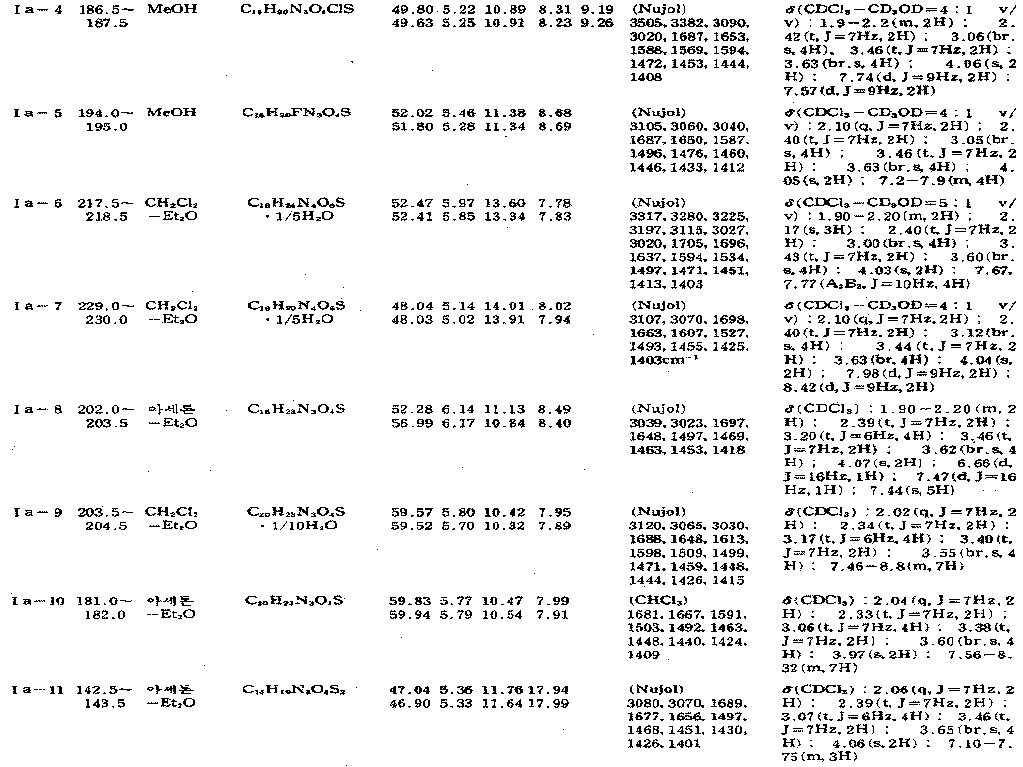
[실시예 2 내지 17]
(식중, R1은 상기 정의와 동일하다. )
실시예 1와 동일한 방법에서, 반응을 표 1에 제시된 조건에서 수행하여, 목적 화합물( I )을 수득한다. 그 성질은 표 2에 제시한다.
[표 1]
[표 2]
[실시예 18]
1-메틸카르바모일-4-[(2-옥소피롤리딘-l-일)아세틸]피페라진(Ib-1)
700mg(3.31밀리몰)의 (2-옥소피롤리딘-1-일)아세틸피페라진을 10.5m1의 CH2C12에 용해시키고, 0.215ml(3.64밀리몰)의 메틸 이소시아네이트를 빙냉하에서 혼합물에 가하고, 혼합물을 실온으로 가온하고 1시간동안 교반한다. CH2C12를 증발시킨 후, 침전된 결정을 Et2O로 세척하고 여과로 수거한다. EtOH-Et2O에서 재결정하여, 856mg의 무색 프리즘상 목적 화합물(수율 : 96.3%)을 수득한다.
융점 : 203.0∼205.0℃
원소분석 : C12H20N4O3
계산치 : C ; 53.72, H ; 7.51, N ; 20.88(%)
실측치 : C ; 53.77, H ; 7.53, N ; 20.69(%)
IR(Nujo1) : 3347,1681,1658,1620,1552,1492,1469,1454,1411,1398(cm-1)
NMR(CDCl3-CD3OD=4 : 1 v/v) : δ2.14(q,J=7Hz,2H) ; 2.46(t,J=7Hz,2H) ; 2.77(s,3H) ; 3.37∼3.60(m,10H) ; 4.13(s,2H)
[실시예 19 내지 22]
(식중, R2는 상기 정의와 동일하다. )
실시예 17과 동일한 방법으로, 반응을 표 3에 제시된 조건하에서 수행하여, 목적 화합물( I b )을 수득한다. 그 성질은 표 4에 제시된다.
[표 3]
[표 4]
[실시예 23]
1-[(2-옥소피롤리딘-1-일)아세틸]-4-히드라지노카르보닐피페라진( I b-5)
(1) 5.026g(23.790밀리몰)의 [(2-옥소피롤리딘-1-일)아세틸]피페라진을 90ml의 디클로로메탄에 용해시키고, 3.283ml(26.169밀리몰)의 페닐 클로로포르메이트 및 3.982ml(28.549밀리몰)의 트리에틸아민을 빙냉 교반하에서 혼합물에 가한다. 10분후, 혼합물을 실온으르 가온하고 1시간동안 교반한다. 반응용액을 묽은 HCl, 수성 NaHCO3, 및 물로 각각 세척한다. 건조후, 용매를 유거한다. 잔류물을 Et2O로 세척하고 CH2CI2-Et2O에서 재결정하여, 7.710g의 프리즘상 목적 화합물(수율 : 97.8%, 융점 : 185.0∼186.0℃)을 수득한다.
원소분석 : C17H21N3O4
계산치 : C ; 61.62, H ; 6.39, N ; 12.68(%)
실측치 : C ; 61.56, H ; 6.40, N ; 12.65(%)
IR(Nujo1) : 1722,l679,1661,1592,1494,1460,1443,1419cm-1
IR(CHC13) : 1719,1682,1664,1594,1495,146l,1421cm-1
NMR[CDC13) : δ2.12(오중선,J=7Hz,2H), 243(t,J=7Hz,2H), 330∼3.85(m,10H), 4.12(s,2H), 7.00∼7.50(m,5H)
(2) 3.380g(10.200밀리몰)의 1-페녹시카르보닐-4-(2-옥소피롤리딘-1-일) 아세틸피페라진에 10ml의 히드라진 수화물(100%)을 가하고, 혼합물을 90℃에서 30분 동안 교반한다. 감압하에서, 용액을 농축하고, 잔류물을 실리카겔 컬럼 크로마토그래피(실리카겔 : 273.9g)시키고, CHC13-MeOH-진한 암모니아수(32 : 6 : 1 v/v/v)로 용출시켜, 1.302g의 프리즘상 표제 화합물(수율.46.8%)을 수득한다.
융점 : 164.0∼166.0℃(i-프로필 알콜에서 재결정)
원소분석 : C11H19N5O3·1/5H2O
계산치 : C ; 48.41, H ; 7.17, N ; 25.66(%)
실측치 : C ; 48.35, H ; 7.12, N ; 25.88(%)
IR(Nujo1) : 3200,1683,1648,1510,1500,1454,1412cm-1
NMR(CDC13-CD3OD=10 : 1 v/v) : δ2.0g(오중선,2H), 2.44(t,2H,J=7Hz), 320∼3.80(m,10H), 411(s,2H)
[참고예]
(2 - 옥소피롤리딘-1-일) 아세틸피페라진
18.133g(115밀리몰)의 메틸 2-옥소-1-피롤리디닐 아세테이트에 19.778g(230밀리몰)의 피페라진을 가하고, 혼합물을 100℃에서 2시간 20분 동안 가열한다. 감압하에서 과량의 피페라진을 증발시킨후, 잔류물을 실라카겔 컬럼 크로마토그래피시키고 CHCl3-MeOH-진한 암모니아수(32 : 4 : 0.5∼32 : 6 : 1 v/v/v)의 혼합물로 용출시킨다. 용출 분획을 감압하에서 농축시켜, 16,856g의 결정상 목적 화합물(수율 : 69.1%)을 수득한다.
융점 : 1l6.0∼l17.0℃(i-프로판올-Et2O에서 재결정)
원소분석 : C10H17N3O2
계산치 : C ; 56.85, H ; 8.11, N ; 19.89(%)
실측치 : C ; 56.74, H ; 8.08, N ; 19.75(%)
IR(Nujo1) : 3295,1676,1642,l488,1463,1451,1436,1408cm-1
NMR(CDC13) : δ1.87(br,s,1H ; CD3OD의 첨가로 감소됨) 1.95∼2.25(m,2H), 2.43(t,J=7Hz,2H), 3.84(t,J=6Hz,4H), 3.4∼3.6(m,5H), 4.10(s,2H)
[실험예]
마우스에서 ECS-유도된 건망증에 대한 예방
시험 장치는 백색 나무단(10×10×1cm)이 한쪽 가장자리에 놓인 전기 전도성 격자 바닥의 흑색 아크릴수지 상자(30×30×30cm)이다. 계단 내려서기 수동적 회피(step-down passive avoidance) 시험을 각각 10SD마우스(수컷,4∼5주됨)의 3군에 대해 수행한다. 대조군인 첫번째 군의 동물에게 용매를 경구 투여하고 획득 시도 60분전에 다른 2군에 5 및 50mg/kg투여량의 시험 화합물을 경구 투여한다. 획득 시도에서, 마우스를 각각 단에 놓고 마우스가 단을 벗어나자마자 격자 바닥을 통해 기어오르는 발에 충격(3mA,5초 동안)을 주었다. 발에 충격을 준지 5∼10분후, 전기 경련 충격(30mA,l00Hz(장방형 파선),0.2초 동안)을 각막을 통해 1회 준후 각 동물을 원래의 케이지에 놓는다. 24시간후에, 각각의 마우스를 다시 단에 놓고 격자 바닥으로 내려서는 잠복기를 측정한다. 기억력 시험에서 잠복기가 길면 잘 획득했음을 나타낸다. 단을 내려가는데 있어서의 잠복기는 맨-휘트니(Mann-Whitney) U-시험을 사용하여 평가한다.
표 5에서, 결과는 대조군에 대한 잠복기를 100으로 정의할때의 백분율 변화로 나타낸다.
[표 5]
전기 경련 충격에 의해 유도된 건망증에 대한 화합물의 효과
*p<0.05 **p<0.025 ***<0.01
Claims (7)
- 제 1 항에 있어서, 1- [(2-옥소피롤리딘-1-일)아세틸]-4- [(4-플루오로벤젠) 설포닐]피페라진인 화합물.
- 제 1 항에 있어서, 1- [(2-옥소피롤리딘-1-일)아세틸]-4- [(2-페닐에테닐)설포닐]피페라진인 화합물.
- 제 l 항에 있어서, 1-카르바조일-4-[(2-옥소피롤리딘-1-일)아세틸]피페라진인 화합물.
- 하기 일반식( I )의 화합물 또는 그의 약학적으로 허용 가능한 산-부가염을 약리학적 유효량으로 함유하는 노인성 치매, 정신병, 또는 건망증 환자의 치료용 약학 조성물 :(식중, R은 -SO2R1또는 -CONHR2이고 ; R1은 C1∼C5알킬, C8∼C12페닐알케닐, 아미노, 디메틸아미노, 임의 치환된 C6∼C12아릴, 또는 N,S, 및 O로 이루어진 군에서 선택된 최소한 하나의 헤테로 원자를 포함하는 5- 또는 6-원 헤테로사이클기이며 ; R2는 아미노, C1∼C5알킬아미노, C1∼C5알킬, 또는 임의 치환된 C6∼C12아릴이다).
- 하기 일반식(II}의 화합물을 하기 일반식(III)의 설포닐할라이드, 또는 하기 일반식(IV)의 화합물과 반응시킴을 특징으로 하는 하기 일반식( I )의 화합물의 제조방법 :Hal-SO2R1(III)R2NCO (IV)(식중, R은 -SO2R1또는 -CONHR2이고 , R1은 C1∼C5알킬, C8∼C12페닐알케닐, 아미노, 디메틸아미노, 임의 치환된 C6∼C12아릴, 또는 N,S, 및 O로 이루어진 군에서 선택된 최소한 하나의 헤테로 원자를 포함하는 5- 또는 6-원 헤테로사이클기이며 ; R2는 아미노, C1∼C5알킬아미노, C1∼C5알킬, 또는 임의 치환된 C6∼C12아릴이고, Ha1은 할로겐이다).
- 하기 일반식(II)의 화합물을 하기 일반식(V)의 페닐 할로게노포르메이트와 반응시켜 하기 일반식(VI)의 화합물을 수득하고, 화합물(VI)를 하기 일반식(VII)의 아민과 반응시킴을 특징으로 하는 하기 일반식( I )의 화합물의 제조방법 :X-COO-Ph (V)R2NH2 (VII)(식중, R은-SO2R1또는-CONHR2이고, R1은C1∼C5알킬, C8∼C12페닐알케닐, 아미노, 디메틸아미노, 임의 치환된 C6∼C12아릴, 또는 N,S, 및 O로 이루어진 군에서 선택된 최소한 하나의 헤테로 원자를 포함하는 5- 또는 6-원 헤테로사이클기이며 ; R2는 아미노, C1∼C5알킬아미노, C1∼C5알킬, 또는 임의 치환된 C6∼C12아릴이고 ; Ph는 페닐이고, X는 할로겐이다).
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP17806487 | 1987-07-15 | ||
| JP62-178064 | 1987-07-15 | ||
| JP178064/87 | 1987-07-15 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR890002097A KR890002097A (ko) | 1989-04-07 |
| KR900006742B1 true KR900006742B1 (ko) | 1990-09-20 |
Family
ID=16041980
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1019880008858A KR900006742B1 (ko) | 1987-07-15 | 1988-07-15 | N-[(2-옥소피롤리딘-1-일)아세틸]피페라진 유도체 및 노인성 치매용 약제 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US4904663A (ko) |
| EP (1) | EP0299493B1 (ko) |
| KR (1) | KR900006742B1 (ko) |
| AT (1) | ATE106868T1 (ko) |
| AU (1) | AU608025B2 (ko) |
| CA (1) | CA1322199C (ko) |
| DE (1) | DE3889987T2 (ko) |
| DK (1) | DK393488A (ko) |
| ES (1) | ES2056860T3 (ko) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IT1231477B (it) * | 1989-07-12 | 1991-12-07 | Sigma Tau Ind Farmaceuti | (pirrolidin-2-one-1-il) acetammidi quali attivatori dei processi di apprendimento e della memoria e composizioni farmaceutiche comprendenti tali composti |
| US5250528A (en) * | 1989-08-02 | 1993-10-05 | Fujisawa Pharmaceutical Co., Ltd. | New aminopiperazine derivatives |
| IT1243702B (it) * | 1990-08-08 | 1994-06-21 | Pulitzer Italiana | Composti ad attivita' nootropa, procedimento per la loro preparazione e relative composizioni farmaceutiche |
| CA2287292A1 (en) | 1997-05-30 | 1998-12-03 | Takeda Chemical Industries, Ltd. | Sulfonamide derivatives, their production and use |
| CN1290254A (zh) | 1998-02-05 | 2001-04-04 | 武田药品工业株式会社 | 氨磺酰衍生物及其制备和用途 |
| AUPP818099A0 (en) | 1999-01-14 | 1999-02-11 | Fujisawa Pharmaceutical Co., Ltd. | New n-containing heterocyclic compounds |
| CA2440389A1 (en) | 2001-03-09 | 2002-10-03 | Ortho-Mcneil Pharmaceutical, Inc. | Aminopyrrolidine sulfonamides as serine protease inhibitors |
| US6710061B2 (en) | 2001-03-09 | 2004-03-23 | Ortho-Mcneil Pharamceutical, Inc. | Aminopyrrolidine sulfonamides as serine protease inhibitors |
| ATE445838T1 (de) | 2001-07-25 | 2009-10-15 | Raptor Pharmaceutical Inc | Zusammensetzungen und verfahren zur modulation des transports durch die blut-hirn-schranke |
| WO2006116718A2 (en) | 2005-04-28 | 2006-11-02 | Proteus Biomedical, Inc. | Pharma-informatics system |
| JP2010503710A (ja) | 2006-09-18 | 2010-02-04 | ラプトール ファーマシューティカル インコーポレイテッド | 受容体関連タンパク質(rap)結合体の投与による肝障害の処置 |
| WO2010095940A2 (en) | 2009-02-20 | 2010-08-26 | To-Bbb Holding B.V. | Glutathione-based drug delivery system |
| KR101741629B1 (ko) | 2009-05-06 | 2017-05-31 | 라보라토리 스킨 케어, 인크. | 활성제-칼슘 포스페이트 입자 복합체를 포함하는 피부 전달 조성물 및 이들을 이용하는 방법 |
| US20120077778A1 (en) | 2010-09-29 | 2012-03-29 | Andrea Bourdelais | Ladder-Frame Polyether Conjugates |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BE864269A (fr) * | 1977-03-03 | 1978-06-16 | Parke Davis & Co | Nouveaux n-(aminoalkyl substitue)-2-oxo-1-pyrrolidine-acetamides et procedes pour les produire |
| EP0005689B1 (fr) * | 1978-05-08 | 1981-03-18 | U C B, S.A. | Nouveaux acides lactame-N-acétiques et leurs amides, leurs procédés de préparation et compositions thérapeutiques |
| US4372960A (en) * | 1980-12-12 | 1983-02-08 | Warner-Lambert Company | Quaternary derivatives of N-(substituted-aminoalkyl)-2-oxo-1-pyrrolidine-acetamides as cognition activators |
| FR2515179A1 (fr) * | 1981-07-24 | 1983-04-29 | Hoffmann La Roche | Derives de pyrrolidine, leur procede de preparation, les intermediaires pour leur synthese et leur application therapeutique |
| EP0089900B1 (en) * | 1982-03-24 | 1985-12-27 | Prodes S.A. | New n-((2-oxo-1-pyrrolidinyl)acetyl)piperazines, the methods of producing such new compounds and their salts as well as pharmaceutical preparations for therapeutic use containing these compounds or salts |
| US4668687A (en) * | 1984-07-23 | 1987-05-26 | Bristol-Myers Company | Psychogeriatric 1-(2-pyrimidinyl)piperazinyl derivatives of 1-pyrrolidin-2-ones |
| CA1250291A (en) * | 1984-07-23 | 1989-02-21 | Bristol-Myers Company | Psychogeriatric 1-(2-pyrimidinyl)-piperazinyl derivatives of 1-pyrrolidin-2-ones |
| GB8512163D0 (en) * | 1985-05-14 | 1985-06-19 | Fujisawa Pharmaceutical Co | Oxothiazolidine compound |
-
1988
- 1988-07-06 CA CA000571320A patent/CA1322199C/en not_active Expired - Fee Related
- 1988-07-13 AU AU19013/88A patent/AU608025B2/en not_active Ceased
- 1988-07-14 EP EP88111353A patent/EP0299493B1/en not_active Expired - Lifetime
- 1988-07-14 AT AT88111353T patent/ATE106868T1/de not_active IP Right Cessation
- 1988-07-14 DK DK393488A patent/DK393488A/da not_active Application Discontinuation
- 1988-07-14 DE DE3889987T patent/DE3889987T2/de not_active Expired - Fee Related
- 1988-07-14 ES ES88111353T patent/ES2056860T3/es not_active Expired - Lifetime
- 1988-07-15 US US07/221,450 patent/US4904663A/en not_active Expired - Fee Related
- 1988-07-15 KR KR1019880008858A patent/KR900006742B1/ko not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| DE3889987T2 (de) | 1994-09-15 |
| EP0299493A3 (en) | 1990-05-23 |
| ATE106868T1 (de) | 1994-06-15 |
| ES2056860T3 (es) | 1994-10-16 |
| AU608025B2 (en) | 1991-03-21 |
| US4904663A (en) | 1990-02-27 |
| EP0299493B1 (en) | 1994-06-08 |
| EP0299493A2 (en) | 1989-01-18 |
| KR890002097A (ko) | 1989-04-07 |
| DK393488A (da) | 1989-01-16 |
| AU1901388A (en) | 1989-01-19 |
| DE3889987D1 (de) | 1994-07-14 |
| CA1322199C (en) | 1993-09-14 |
| DK393488D0 (da) | 1988-07-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR0142417B1 (ko) | 3급알킬작용성화된피레라진유도체 | |
| KR900006742B1 (ko) | N-[(2-옥소피롤리딘-1-일)아세틸]피페라진 유도체 및 노인성 치매용 약제 | |
| FR2696178A1 (fr) | Amides basiques quaternaires, procédé pour leur préparation et compositions pharmaceutiques en contenant. | |
| CS240954B2 (en) | Preparation method of 1,2-dihydropyridines | |
| CA2636929A1 (en) | Biaryl nitrogen heterocycle inhibitors of lta4h for treating inflammation | |
| WO2004108685A1 (fr) | Produits aryl-heteroaromatiques, compositions les contenant et utilisation | |
| EP0330026A1 (en) | Piperidinoalkyl derivatives of carboxylic acid amides | |
| JPH05194359A (ja) | 新規尿素誘導体、その製法と治療用途 | |
| US4499286A (en) | Derivatives of thienylacetic acid amides and their pharmaceutically acceptable acid salts and a process for the preparation thereof | |
| JP3169188B2 (ja) | カルバミン酸誘導体及びその製造方法 | |
| JPH05331135A (ja) | 新規なナフタミド誘導体と、その合成方法と、その治療分野への応用 | |
| JP2003231633A (ja) | 医薬組成物 | |
| CA2173693A1 (en) | 4-indolylpiperazinyl derivatives | |
| US4505920A (en) | Certain N-substituted-4-aryl-3,5-pyridine dicarboxylates and their antihypertensive use | |
| JPH0692915A (ja) | 1,2−ジアミノシクロブテン−3,4−ジオン誘導体及びその用途 | |
| HU199827B (en) | Process for production of derivatives of n-/1-pirrolil/-piridin-amin and medical composition containing them | |
| CS241064B2 (en) | Method of n-substituted nicotinamide's 1-oxide and its salts production | |
| KR940008288B1 (ko) | 헤테로사이클릭 화합물의 제조방법 | |
| JPH05202054A (ja) | アミノメチル置換2,3−ジヒドロピラノ〔2,3−b〕ピリジン類 | |
| JPH01104041A (ja) | N−[(2−オキソ−1−ピロリジニル)アセチル]ピペラジン誘導体、その製造方法および老人性痴呆症薬 | |
| JP2974791B2 (ja) | カルボキシイミダミド誘導体 | |
| US5039687A (en) | N-(pyrrol-1-yl)pyridinamine compounds having enhancing activity | |
| JPH0495071A (ja) | カルバミン酸誘導体 | |
| KR0148365B1 (ko) | 4,5,5a,6-테트라하이드로-3H-이소옥사졸로[5,4,3-kl]아크리딘 유도체, 이의 제조방법 및 이를 함유하는 약제학적 조성물 | |
| US5158950A (en) | 1,3-dithiol-2-ylidene derivatives and process for the preparation thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| G160 | Decision to publish patent application | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20000710 Year of fee payment: 11 |
|
| LAPS | Lapse due to unpaid annual fee |