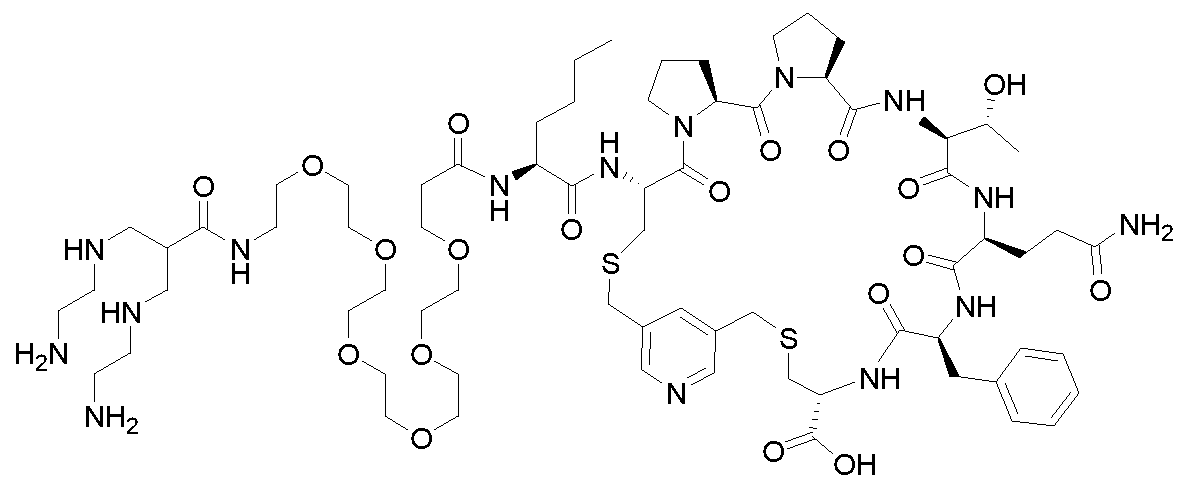
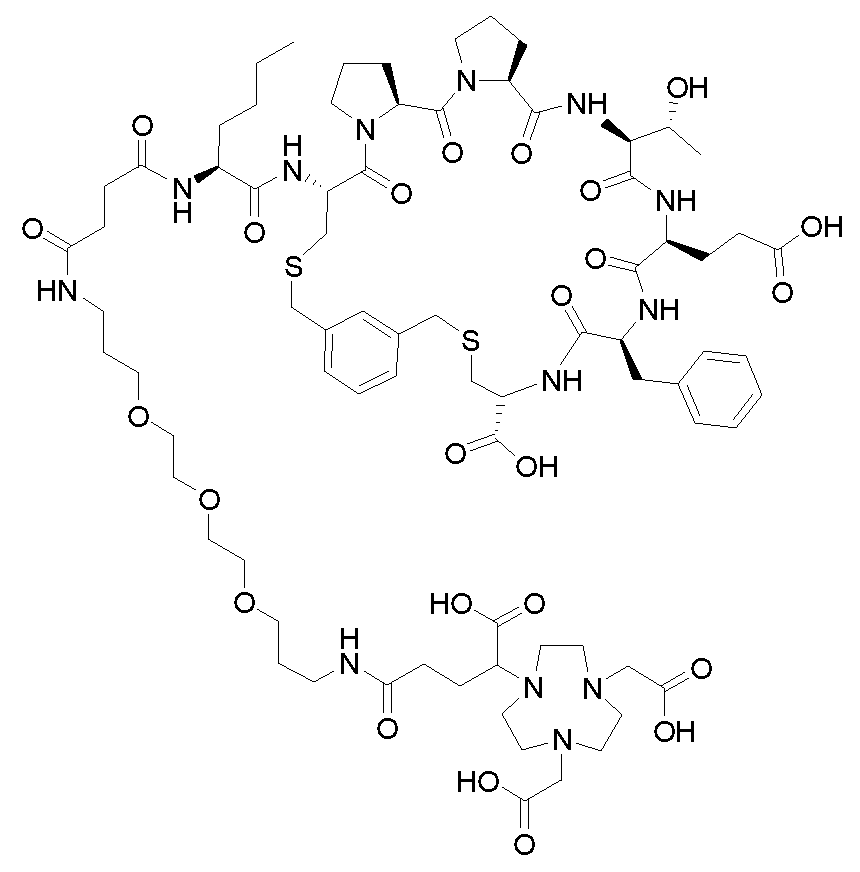
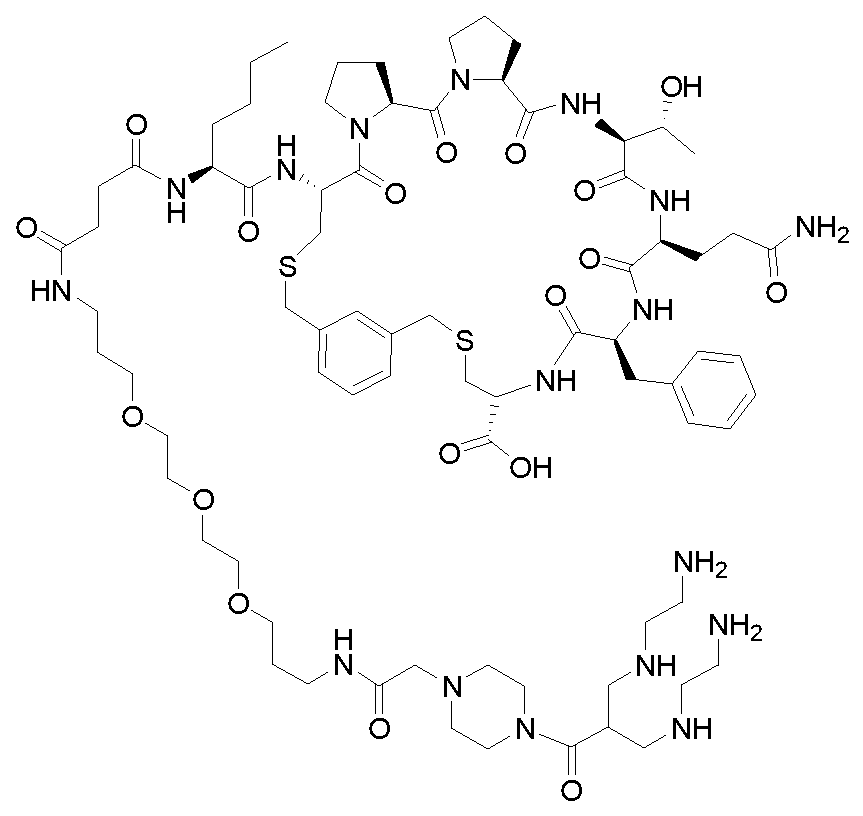
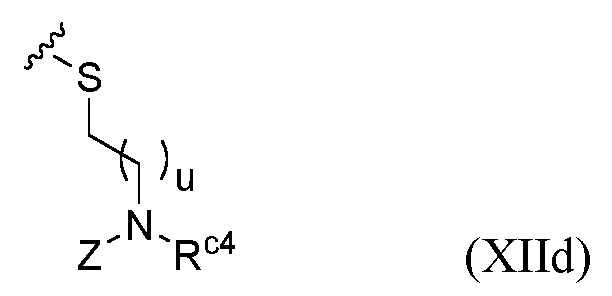KR20230129261A - 섬유모세포 활성화 단백질 리간드를 포함하는 화합물및 그의 용도 - Google Patents
섬유모세포 활성화 단백질 리간드를 포함하는 화합물및 그의 용도 Download PDFInfo
- Publication number
- KR20230129261A KR20230129261A KR1020237026404A KR20237026404A KR20230129261A KR 20230129261 A KR20230129261 A KR 20230129261A KR 1020237026404 A KR1020237026404 A KR 1020237026404A KR 20237026404 A KR20237026404 A KR 20237026404A KR 20230129261 A KR20230129261 A KR 20230129261A
- Authority
- KR
- South Korea
- Prior art keywords
- group
- cys
- amino acid
- compound
- formula
- Prior art date
Links
- 150000001875 compounds Chemical class 0.000 title claims abstract description 576
- 210000002950 fibroblast Anatomy 0.000 title claims description 60
- 108090000623 proteins and genes Proteins 0.000 title claims description 40
- 102000004169 proteins and genes Human genes 0.000 title claims description 38
- 230000003213 activating effect Effects 0.000 title claims description 6
- 239000003446 ligand Substances 0.000 title description 6
- 150000001413 amino acids Chemical class 0.000 claims abstract description 222
- 108010069514 Cyclic Peptides Proteins 0.000 claims abstract description 30
- 102000001189 Cyclic Peptides Human genes 0.000 claims abstract description 30
- -1 aromatic L-α-amino acids Chemical class 0.000 claims description 244
- 125000000539 amino acid group Chemical group 0.000 claims description 218
- 201000010099 disease Diseases 0.000 claims description 153
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 153
- 125000005647 linker group Chemical group 0.000 claims description 139
- 239000002738 chelating agent Substances 0.000 claims description 135
- 238000000034 method Methods 0.000 claims description 119
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 108
- 125000001424 substituent group Chemical group 0.000 claims description 67
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 61
- 125000003118 aryl group Chemical group 0.000 claims description 57
- 229910052757 nitrogen Inorganic materials 0.000 claims description 42
- 125000004434 sulfur atom Chemical group 0.000 claims description 42
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 38
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 35
- FRJNIHLOMXIQKH-UHFFFAOYSA-N 1-amino-15-oxo-4,7,10-trioxa-14-azaoctadecan-18-oic acid Chemical group NCCCOCCOCCOCCCNC(=O)CCC(O)=O FRJNIHLOMXIQKH-UHFFFAOYSA-N 0.000 claims description 34
- 229910052736 halogen Inorganic materials 0.000 claims description 34
- 239000003112 inhibitor Substances 0.000 claims description 34
- 229910052717 sulfur Inorganic materials 0.000 claims description 33
- 150000003568 thioethers Chemical class 0.000 claims description 33
- 230000001225 therapeutic effect Effects 0.000 claims description 30
- 230000004913 activation Effects 0.000 claims description 28
- ONDPHDOFVYQSGI-UHFFFAOYSA-N zinc nitrate Chemical compound [Zn+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O ONDPHDOFVYQSGI-UHFFFAOYSA-N 0.000 claims description 28
- 150000002367 halogens Chemical class 0.000 claims description 27
- 125000006526 (C1-C2) alkyl group Chemical group 0.000 claims description 26
- 125000004209 (C1-C8) alkyl group Chemical group 0.000 claims description 26
- 125000005365 aminothiol group Chemical group 0.000 claims description 26
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 26
- 229910052739 hydrogen Inorganic materials 0.000 claims description 25
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 claims description 25
- WDLRUFUQRNWCPK-UHFFFAOYSA-N Tetraxetan Chemical compound OC(=O)CN1CCN(CC(O)=O)CCN(CC(O)=O)CCN(CC(O)=O)CC1 WDLRUFUQRNWCPK-UHFFFAOYSA-N 0.000 claims description 24
- 125000006297 carbonyl amino group Chemical group [H]N([*:2])C([*:1])=O 0.000 claims description 24
- 125000001072 heteroaryl group Chemical group 0.000 claims description 24
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims description 23
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 20
- JHALWMSZGCVVEM-UHFFFAOYSA-N 2-[4,7-bis(carboxymethyl)-1,4,7-triazonan-1-yl]acetic acid Chemical compound OC(=O)CN1CCN(CC(O)=O)CCN(CC(O)=O)CC1 JHALWMSZGCVVEM-UHFFFAOYSA-N 0.000 claims description 19
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 19
- 229910052760 oxygen Inorganic materials 0.000 claims description 19
- 230000000903 blocking effect Effects 0.000 claims description 18
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims description 17
- SYFGLWDDLZQFNI-UHFFFAOYSA-N 2-[4-(carboxymethyl)-1,4,8,11-tetrazabicyclo[6.6.2]hexadecan-11-yl]acetic acid Chemical compound C1CN(CC(O)=O)CCCN2CCN(CC(=O)O)CCCN1CC2 SYFGLWDDLZQFNI-UHFFFAOYSA-N 0.000 claims description 17
- QPCDCPDFJACHGM-UHFFFAOYSA-N N,N-bis{2-[bis(carboxymethyl)amino]ethyl}glycine Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(=O)O)CCN(CC(O)=O)CC(O)=O QPCDCPDFJACHGM-UHFFFAOYSA-N 0.000 claims description 17
- 238000006467 substitution reaction Methods 0.000 claims description 17
- 230000015572 biosynthetic process Effects 0.000 claims description 16
- 210000004899 c-terminal region Anatomy 0.000 claims description 16
- 229910052801 chlorine Inorganic materials 0.000 claims description 16
- GRUVVLWKPGIYEG-UHFFFAOYSA-N 2-[2-[carboxymethyl-[(2-hydroxyphenyl)methyl]amino]ethyl-[(2-hydroxyphenyl)methyl]amino]acetic acid Chemical compound C=1C=CC=C(O)C=1CN(CC(=O)O)CCN(CC(O)=O)CC1=CC=CC=C1O GRUVVLWKPGIYEG-UHFFFAOYSA-N 0.000 claims description 14
- FDSYTWVNUJTPMA-UHFFFAOYSA-N 2-[3,9-bis(carboxymethyl)-3,6,9,15-tetrazabicyclo[9.3.1]pentadeca-1(15),11,13-trien-6-yl]acetic acid Chemical compound C1N(CC(O)=O)CCN(CC(=O)O)CCN(CC(O)=O)CC2=CC=CC1=N2 FDSYTWVNUJTPMA-UHFFFAOYSA-N 0.000 claims description 14
- 229910052731 fluorine Inorganic materials 0.000 claims description 14
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 14
- 125000006570 (C5-C6) heteroaryl group Chemical group 0.000 claims description 13
- FQIHLPGWBOBPSG-UHFFFAOYSA-N 2-[4,7,10-tris(2-amino-2-oxoethyl)-1,4,7,10-tetrazacyclododec-1-yl]acetamide Chemical compound NC(=O)CN1CCN(CC(N)=O)CCN(CC(N)=O)CCN(CC(N)=O)CC1 FQIHLPGWBOBPSG-UHFFFAOYSA-N 0.000 claims description 13
- 229910052794 bromium Inorganic materials 0.000 claims description 13
- 125000004122 cyclic group Chemical group 0.000 claims description 13
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 13
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 claims description 13
- 229910004013 NO 2 Inorganic materials 0.000 claims description 12
- 208000035896 Twin-reversed arterial perfusion sequence Diseases 0.000 claims description 12
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 claims description 12
- RSPCKAHMRANGJZ-UHFFFAOYSA-N thiohydroxylamine Chemical compound SN RSPCKAHMRANGJZ-UHFFFAOYSA-N 0.000 claims description 12
- 150000008575 L-amino acids Chemical group 0.000 claims description 11
- 125000000623 heterocyclic group Chemical group 0.000 claims description 11
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 11
- 108010072257 fibroblast activation protein alpha Proteins 0.000 claims description 9
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 claims description 8
- 229910052698 phosphorus Inorganic materials 0.000 claims description 8
- 150000008574 D-amino acids Chemical group 0.000 claims description 7
- 239000011574 phosphorus Substances 0.000 claims description 7
- NVOVSXGZALWAFS-UHFFFAOYSA-N 3,6,10,13,16,19-hexazabicyclo[6.6.6]icosane Chemical compound C1NCCNCC2CNCCNCC1CNCCNC2 NVOVSXGZALWAFS-UHFFFAOYSA-N 0.000 claims description 5
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 5
- 108010070783 alanyltyrosine Proteins 0.000 claims description 4
- 125000000896 monocarboxylic acid group Chemical group 0.000 claims 7
- ACHQFNGCBWWVRR-UHFFFAOYSA-N NOPO Chemical compound NOPO ACHQFNGCBWWVRR-UHFFFAOYSA-N 0.000 claims 4
- 241001181114 Neta Species 0.000 claims 4
- GQZXNSPRSGFJLY-UHFFFAOYSA-N hydroxyphosphanone Chemical compound OP=O GQZXNSPRSGFJLY-UHFFFAOYSA-N 0.000 claims 4
- 206010028980 Neoplasm Diseases 0.000 description 194
- 235000001014 amino acid Nutrition 0.000 description 180
- 210000004027 cell Anatomy 0.000 description 109
- 201000011510 cancer Diseases 0.000 description 66
- 230000003902 lesion Effects 0.000 description 54
- 125000000174 L-prolyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])([H])[C@@]1([H])C(*)=O 0.000 description 53
- 230000009826 neoplastic cell growth Effects 0.000 description 42
- 210000001519 tissue Anatomy 0.000 description 42
- 201000009030 Carcinoma Diseases 0.000 description 41
- 230000003211 malignant effect Effects 0.000 description 37
- 235000018102 proteins Nutrition 0.000 description 35
- 238000011282 treatment Methods 0.000 description 32
- 206010025323 Lymphomas Diseases 0.000 description 29
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 26
- 208000003200 Adenoma Diseases 0.000 description 24
- 201000001441 melanoma Diseases 0.000 description 24
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 23
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 23
- 206010039491 Sarcoma Diseases 0.000 description 23
- 208000009956 adenocarcinoma Diseases 0.000 description 21
- 239000000203 mixture Substances 0.000 description 21
- 206010001233 Adenoma benign Diseases 0.000 description 20
- 239000010949 copper Substances 0.000 description 19
- 238000003745 diagnosis Methods 0.000 description 18
- 102000004196 processed proteins & peptides Human genes 0.000 description 18
- 206010027145 Melanocytic naevus Diseases 0.000 description 15
- 210000000481 breast Anatomy 0.000 description 15
- 229910052751 metal Inorganic materials 0.000 description 15
- 239000002184 metal Substances 0.000 description 15
- 125000003275 alpha amino acid group Chemical group 0.000 description 14
- 125000004429 atom Chemical group 0.000 description 14
- 206010041823 squamous cell carcinoma Diseases 0.000 description 14
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 13
- 208000024172 Cardiovascular disease Diseases 0.000 description 13
- 241000282414 Homo sapiens Species 0.000 description 13
- 230000003176 fibrotic effect Effects 0.000 description 13
- 238000002560 therapeutic procedure Methods 0.000 description 13
- 206010009944 Colon cancer Diseases 0.000 description 12
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 12
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical group NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 12
- 150000001408 amides Chemical class 0.000 description 12
- 239000000460 chlorine Substances 0.000 description 12
- 208000006990 cholangiocarcinoma Diseases 0.000 description 12
- 230000000694 effects Effects 0.000 description 12
- 206010016629 fibroma Diseases 0.000 description 12
- 230000003325 follicular Effects 0.000 description 12
- 208000032839 leukemia Diseases 0.000 description 12
- 206010027191 meningioma Diseases 0.000 description 12
- 201000011519 neuroendocrine tumor Diseases 0.000 description 12
- 230000008569 process Effects 0.000 description 12
- 150000003839 salts Chemical class 0.000 description 12
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 11
- UBQYURCVBFRUQT-UHFFFAOYSA-N N-benzoyl-Ferrioxamine B Chemical compound CC(=O)N(O)CCCCCNC(=O)CCC(=O)N(O)CCCCCNC(=O)CCC(=O)N(O)CCCCCN UBQYURCVBFRUQT-UHFFFAOYSA-N 0.000 description 11
- 206010033128 Ovarian cancer Diseases 0.000 description 11
- 206010061535 Ovarian neoplasm Diseases 0.000 description 11
- 125000001118 alkylidene group Chemical group 0.000 description 11
- 125000004432 carbon atom Chemical group C* 0.000 description 11
- 210000002808 connective tissue Anatomy 0.000 description 11
- 230000001747 exhibiting effect Effects 0.000 description 11
- 201000005202 lung cancer Diseases 0.000 description 11
- 208000020816 lung neoplasm Diseases 0.000 description 11
- ZNYVGVMHKCUCAT-UHFFFAOYSA-N 3-[[4,7-bis[[hydroxy(hydroxymethyl)phosphoryl]methyl]-1,4,7-triazonan-1-yl]methyl-hydroxyphosphoryl]propanoic acid Chemical compound OCP(O)(=O)CN1CCN(CP(O)(=O)CO)CCN(CP(O)(=O)CCC(O)=O)CC1 ZNYVGVMHKCUCAT-UHFFFAOYSA-N 0.000 description 10
- 206010006187 Breast cancer Diseases 0.000 description 10
- 208000026310 Breast neoplasm Diseases 0.000 description 10
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 10
- 206010060862 Prostate cancer Diseases 0.000 description 10
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 10
- 239000002253 acid Substances 0.000 description 10
- 206010003246 arthritis Diseases 0.000 description 10
- 239000003795 chemical substances by application Substances 0.000 description 10
- 239000012636 effector Substances 0.000 description 10
- 201000010536 head and neck cancer Diseases 0.000 description 10
- 208000014829 head and neck neoplasm Diseases 0.000 description 10
- 208000027866 inflammatory disease Diseases 0.000 description 10
- 230000005764 inhibitory process Effects 0.000 description 10
- 230000000527 lymphocytic effect Effects 0.000 description 10
- 201000002120 neuroendocrine carcinoma Diseases 0.000 description 10
- 230000007170 pathology Effects 0.000 description 10
- 239000000126 substance Substances 0.000 description 10
- 206010004146 Basal cell carcinoma Diseases 0.000 description 9
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 9
- 206010027406 Mesothelioma Diseases 0.000 description 9
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 9
- 210000003238 esophagus Anatomy 0.000 description 9
- 125000000524 functional group Chemical group 0.000 description 9
- 238000003384 imaging method Methods 0.000 description 9
- 210000004072 lung Anatomy 0.000 description 9
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 9
- 201000002528 pancreatic cancer Diseases 0.000 description 9
- 208000008443 pancreatic carcinoma Diseases 0.000 description 9
- 208000004476 Acute Coronary Syndrome Diseases 0.000 description 8
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 8
- 201000006107 Familial adenomatous polyposis Diseases 0.000 description 8
- 208000017604 Hodgkin disease Diseases 0.000 description 8
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 8
- 208000007256 Nevus Diseases 0.000 description 8
- 108700020796 Oncogene Proteins 0.000 description 8
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Natural products NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 8
- 230000003143 atherosclerotic effect Effects 0.000 description 8
- 208000002458 carcinoid tumor Diseases 0.000 description 8
- 208000029664 classic familial adenomatous polyposis Diseases 0.000 description 8
- 210000001072 colon Anatomy 0.000 description 8
- 239000000032 diagnostic agent Substances 0.000 description 8
- 238000002405 diagnostic procedure Methods 0.000 description 8
- 239000003814 drug Substances 0.000 description 8
- 150000002148 esters Chemical class 0.000 description 8
- 210000001165 lymph node Anatomy 0.000 description 8
- 230000036210 malignancy Effects 0.000 description 8
- 208000003154 papilloma Diseases 0.000 description 8
- 210000000578 peripheral nerve Anatomy 0.000 description 8
- 230000002285 radioactive effect Effects 0.000 description 8
- 210000002784 stomach Anatomy 0.000 description 8
- 206010003571 Astrocytoma Diseases 0.000 description 7
- 108010050904 Interferons Proteins 0.000 description 7
- 102000014150 Interferons Human genes 0.000 description 7
- 102000056251 Prolyl Oligopeptidases Human genes 0.000 description 7
- 208000006265 Renal cell carcinoma Diseases 0.000 description 7
- 239000013543 active substance Substances 0.000 description 7
- 210000002889 endothelial cell Anatomy 0.000 description 7
- 229940079322 interferon Drugs 0.000 description 7
- 210000002901 mesenchymal stem cell Anatomy 0.000 description 7
- 206010039073 rheumatoid arthritis Diseases 0.000 description 7
- 210000003491 skin Anatomy 0.000 description 7
- 210000000329 smooth muscle myocyte Anatomy 0.000 description 7
- 230000008685 targeting Effects 0.000 description 7
- 208000009888 Adrenocortical Adenoma Diseases 0.000 description 6
- 201000001320 Atherosclerosis Diseases 0.000 description 6
- 208000037260 Atherosclerotic Plaque Diseases 0.000 description 6
- 206010005003 Bladder cancer Diseases 0.000 description 6
- 208000011231 Crohn disease Diseases 0.000 description 6
- 206010014733 Endometrial cancer Diseases 0.000 description 6
- 206010014759 Endometrial neoplasm Diseases 0.000 description 6
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 6
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 6
- 206010051066 Gastrointestinal stromal tumour Diseases 0.000 description 6
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 6
- 208000007871 Odontogenic Tumors Diseases 0.000 description 6
- 208000024770 Thyroid neoplasm Diseases 0.000 description 6
- 208000015234 adrenal cortex adenoma Diseases 0.000 description 6
- 201000003354 adrenal cortical adenoma Diseases 0.000 description 6
- 210000000988 bone and bone Anatomy 0.000 description 6
- 125000002843 carboxylic acid group Chemical group 0.000 description 6
- 210000003679 cervix uteri Anatomy 0.000 description 6
- 208000019425 cirrhosis of liver Diseases 0.000 description 6
- 150000004696 coordination complex Chemical class 0.000 description 6
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 6
- 206010017758 gastric cancer Diseases 0.000 description 6
- 201000011243 gastrointestinal stromal tumor Diseases 0.000 description 6
- 230000001965 increasing effect Effects 0.000 description 6
- 210000001503 joint Anatomy 0.000 description 6
- 206010061289 metastatic neoplasm Diseases 0.000 description 6
- 208000027825 odontogenic neoplasm Diseases 0.000 description 6
- 201000008968 osteosarcoma Diseases 0.000 description 6
- 239000008177 pharmaceutical agent Substances 0.000 description 6
- 230000005258 radioactive decay Effects 0.000 description 6
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 6
- 201000002510 thyroid cancer Diseases 0.000 description 6
- VILCJCGEZXAXTO-UHFFFAOYSA-N 2,2,2-tetramine Chemical compound NCCNCCNCCN VILCJCGEZXAXTO-UHFFFAOYSA-N 0.000 description 5
- 208000023275 Autoimmune disease Diseases 0.000 description 5
- 206010007275 Carcinoid tumour Diseases 0.000 description 5
- 206010008342 Cervix carcinoma Diseases 0.000 description 5
- 102100025012 Dipeptidyl peptidase 4 Human genes 0.000 description 5
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 5
- 201000008808 Fibrosarcoma Diseases 0.000 description 5
- 206010053717 Fibrous histiocytoma Diseases 0.000 description 5
- 101000908391 Homo sapiens Dipeptidyl peptidase 4 Proteins 0.000 description 5
- 201000009794 Idiopathic Pulmonary Fibrosis Diseases 0.000 description 5
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 5
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 description 5
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 5
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 5
- 101710178372 Prolyl endopeptidase Proteins 0.000 description 5
- 208000005718 Stomach Neoplasms Diseases 0.000 description 5
- 206010043276 Teratoma Diseases 0.000 description 5
- 208000007536 Thrombosis Diseases 0.000 description 5
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 5
- 206010053648 Vascular occlusion Diseases 0.000 description 5
- 150000001412 amines Chemical class 0.000 description 5
- 238000013459 approach Methods 0.000 description 5
- 208000001119 benign fibrous histiocytoma Diseases 0.000 description 5
- 230000027455 binding Effects 0.000 description 5
- 210000004556 brain Anatomy 0.000 description 5
- 201000003149 breast fibroadenoma Diseases 0.000 description 5
- 229910052799 carbon Inorganic materials 0.000 description 5
- 150000001735 carboxylic acids Chemical class 0.000 description 5
- 201000010881 cervical cancer Diseases 0.000 description 5
- 125000003636 chemical group Chemical group 0.000 description 5
- 238000002591 computed tomography Methods 0.000 description 5
- 239000000824 cytostatic agent Substances 0.000 description 5
- 230000001085 cytostatic effect Effects 0.000 description 5
- 229940090124 dipeptidyl peptidase 4 (dpp-4) inhibitors for blood glucose lowering Drugs 0.000 description 5
- 201000004101 esophageal cancer Diseases 0.000 description 5
- 210000002744 extracellular matrix Anatomy 0.000 description 5
- 230000002496 gastric effect Effects 0.000 description 5
- 230000001434 glomerular Effects 0.000 description 5
- 210000003128 head Anatomy 0.000 description 5
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 5
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 5
- 230000000977 initiatory effect Effects 0.000 description 5
- 208000036971 interstitial lung disease 2 Diseases 0.000 description 5
- 230000000670 limiting effect Effects 0.000 description 5
- 201000007270 liver cancer Diseases 0.000 description 5
- 208000014018 liver neoplasm Diseases 0.000 description 5
- 208000010125 myocardial infarction Diseases 0.000 description 5
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 5
- 210000001989 nasopharynx Anatomy 0.000 description 5
- 229920001184 polypeptide Polymers 0.000 description 5
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 5
- 239000011734 sodium Substances 0.000 description 5
- 229910052708 sodium Inorganic materials 0.000 description 5
- 241000894007 species Species 0.000 description 5
- 201000011549 stomach cancer Diseases 0.000 description 5
- 125000000383 tetramethylene group Chemical group [H]C([H])([*:1])C([H])([H])C([H])([H])C([H])([H])[*:2] 0.000 description 5
- 201000005112 urinary bladder cancer Diseases 0.000 description 5
- 208000021331 vascular occlusion disease Diseases 0.000 description 5
- SLXKOJJOQWFEFD-UHFFFAOYSA-N 6-aminohexanoic acid Chemical compound NCCCCCC(O)=O SLXKOJJOQWFEFD-UHFFFAOYSA-N 0.000 description 4
- 208000009458 Carcinoma in Situ Diseases 0.000 description 4
- 102000008186 Collagen Human genes 0.000 description 4
- 108010035532 Collagen Proteins 0.000 description 4
- 206010014967 Ependymoma Diseases 0.000 description 4
- 208000007659 Fibroadenoma Diseases 0.000 description 4
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 4
- 208000028018 Lymphocytic leukaemia Diseases 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 4
- 206010061332 Paraganglion neoplasm Diseases 0.000 description 4
- 208000007452 Plasmacytoma Diseases 0.000 description 4
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 4
- 239000007983 Tris buffer Substances 0.000 description 4
- 230000002378 acidificating effect Effects 0.000 description 4
- 125000000217 alkyl group Chemical group 0.000 description 4
- 125000003277 amino group Chemical group 0.000 description 4
- 239000002585 base Chemical class 0.000 description 4
- 208000035269 cancer or benign tumor Diseases 0.000 description 4
- 229920001436 collagen Polymers 0.000 description 4
- 230000021615 conjugation Effects 0.000 description 4
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 4
- 208000010932 epithelial neoplasm Diseases 0.000 description 4
- 239000012634 fragment Substances 0.000 description 4
- 208000005017 glioblastoma Diseases 0.000 description 4
- 201000011066 hemangioma Diseases 0.000 description 4
- 201000004933 in situ carcinoma Diseases 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 4
- 238000002372 labelling Methods 0.000 description 4
- 201000010260 leiomyoma Diseases 0.000 description 4
- 210000003141 lower extremity Anatomy 0.000 description 4
- 208000003747 lymphoid leukemia Diseases 0.000 description 4
- 208000025036 lymphosarcoma Diseases 0.000 description 4
- 201000010078 malignant spindle cell melanoma Diseases 0.000 description 4
- 239000003550 marker Substances 0.000 description 4
- 208000023356 medullary thyroid gland carcinoma Diseases 0.000 description 4
- 230000001394 metastastic effect Effects 0.000 description 4
- 239000000178 monomer Substances 0.000 description 4
- 208000004707 mucinous cystadenoma Diseases 0.000 description 4
- 208000025113 myeloid leukemia Diseases 0.000 description 4
- 102000039446 nucleic acids Human genes 0.000 description 4
- 108020004707 nucleic acids Proteins 0.000 description 4
- 150000007523 nucleic acids Chemical class 0.000 description 4
- 210000002741 palatine tonsil Anatomy 0.000 description 4
- 210000000496 pancreas Anatomy 0.000 description 4
- 208000007312 paraganglioma Diseases 0.000 description 4
- 239000008194 pharmaceutical composition Substances 0.000 description 4
- 239000000546 pharmaceutical excipient Substances 0.000 description 4
- 229920000570 polyether Polymers 0.000 description 4
- 201000002025 prostate sarcoma Diseases 0.000 description 4
- 239000012217 radiopharmaceutical Substances 0.000 description 4
- 229940121896 radiopharmaceutical Drugs 0.000 description 4
- 230000002799 radiopharmaceutical effect Effects 0.000 description 4
- 238000007363 ring formation reaction Methods 0.000 description 4
- 229920006395 saturated elastomer Polymers 0.000 description 4
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 4
- 208000005893 serous cystadenoma Diseases 0.000 description 4
- 150000003384 small molecules Chemical class 0.000 description 4
- 208000019798 spindle cell melanoma Diseases 0.000 description 4
- 150000003460 sulfonic acids Chemical class 0.000 description 4
- 208000024891 symptom Diseases 0.000 description 4
- 206010042863 synovial sarcoma Diseases 0.000 description 4
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- NQRYJNQNLNOLGT-UHFFFAOYSA-N tetrahydropyridine hydrochloride Natural products C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 4
- 125000003396 thiol group Chemical group [H]S* 0.000 description 4
- UMGDCJDMYOKAJW-UHFFFAOYSA-N thiourea Chemical compound NC(N)=S UMGDCJDMYOKAJW-UHFFFAOYSA-N 0.000 description 4
- 208000030901 thyroid gland follicular carcinoma Diseases 0.000 description 4
- 125000003258 trimethylene group Chemical group [H]C([H])([*:2])C([H])([H])C([H])([H])[*:1] 0.000 description 4
- 210000004881 tumor cell Anatomy 0.000 description 4
- 210000001364 upper extremity Anatomy 0.000 description 4
- UDOPJKHABYSVIX-UHFFFAOYSA-N 2-[4,7,10-tris(carboxymethyl)-6-[(4-isothiocyanatophenyl)methyl]-1,4,7,10-tetrazacyclododec-1-yl]acetic acid Chemical compound C1N(CC(O)=O)CCN(CC(=O)O)CCN(CC(O)=O)CCN(CC(O)=O)C1CC1=CC=C(N=C=S)C=C1 UDOPJKHABYSVIX-UHFFFAOYSA-N 0.000 description 3
- GTACSIONMHMRPD-UHFFFAOYSA-N 2-[4-[2-(benzenesulfonamido)ethylsulfanyl]-2,6-difluorophenoxy]acetamide Chemical compound C1=C(F)C(OCC(=O)N)=C(F)C=C1SCCNS(=O)(=O)C1=CC=CC=C1 GTACSIONMHMRPD-UHFFFAOYSA-N 0.000 description 3
- RXACEEPNTRHYBQ-UHFFFAOYSA-N 2-[[2-[[2-[(2-sulfanylacetyl)amino]acetyl]amino]acetyl]amino]acetic acid Chemical compound OC(=O)CNC(=O)CNC(=O)CNC(=O)CS RXACEEPNTRHYBQ-UHFFFAOYSA-N 0.000 description 3
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 241000321096 Adenoides Species 0.000 description 3
- 208000004804 Adenomatous Polyps Diseases 0.000 description 3
- 208000007690 Brenner tumor Diseases 0.000 description 3
- 206010073258 Brenner tumour Diseases 0.000 description 3
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- 208000005243 Chondrosarcoma Diseases 0.000 description 3
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 3
- 102000005593 Endopeptidases Human genes 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- 208000004463 Follicular Adenocarcinoma Diseases 0.000 description 3
- 208000007569 Giant Cell Tumors Diseases 0.000 description 3
- 206010018338 Glioma Diseases 0.000 description 3
- 206010060980 Granular cell tumour Diseases 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 101001095266 Homo sapiens Prolyl endopeptidase Proteins 0.000 description 3
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 3
- 102000004157 Hydrolases Human genes 0.000 description 3
- 108090000604 Hydrolases Proteins 0.000 description 3
- 206010024305 Leukaemia monocytic Diseases 0.000 description 3
- 108010000817 Leuprolide Proteins 0.000 description 3
- 206010024612 Lipoma Diseases 0.000 description 3
- 206010025219 Lymphangioma Diseases 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- 208000007054 Medullary Carcinoma Diseases 0.000 description 3
- 206010054949 Metaplasia Diseases 0.000 description 3
- 206010027476 Metastases Diseases 0.000 description 3
- 241000699670 Mus sp. Species 0.000 description 3
- 206010029260 Neuroblastoma Diseases 0.000 description 3
- 206010052399 Neuroendocrine tumour Diseases 0.000 description 3
- 201000004404 Neurofibroma Diseases 0.000 description 3
- 201000010133 Oligodendroglioma Diseases 0.000 description 3
- 206010035226 Plasma cell myeloma Diseases 0.000 description 3
- 208000033014 Plasma cell tumor Diseases 0.000 description 3
- 241000700159 Rattus Species 0.000 description 3
- 201000000582 Retinoblastoma Diseases 0.000 description 3
- 201000010208 Seminoma Diseases 0.000 description 3
- 208000000097 Sertoli-Leydig cell tumor Diseases 0.000 description 3
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 3
- 208000008383 Wilms tumor Diseases 0.000 description 3
- 210000002534 adenoid Anatomy 0.000 description 3
- 230000001919 adrenal effect Effects 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 239000005557 antagonist Substances 0.000 description 3
- 230000001093 anti-cancer Effects 0.000 description 3
- 239000002246 antineoplastic agent Substances 0.000 description 3
- 229940041181 antineoplastic drug Drugs 0.000 description 3
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 3
- 230000005255 beta decay Effects 0.000 description 3
- 208000007047 blue nevus Diseases 0.000 description 3
- 239000004202 carbamide Substances 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 239000013522 chelant Substances 0.000 description 3
- 201000005217 chondroblastoma Diseases 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 230000000536 complexating effect Effects 0.000 description 3
- 230000000875 corresponding effect Effects 0.000 description 3
- 238000009109 curative therapy Methods 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 210000003298 dental enamel Anatomy 0.000 description 3
- 229940088598 enzyme Drugs 0.000 description 3
- BTCSSZJGUNDROE-UHFFFAOYSA-N gamma-aminobutyric acid Chemical compound NCCCC(O)=O BTCSSZJGUNDROE-UHFFFAOYSA-N 0.000 description 3
- 201000008361 ganglioneuroma Diseases 0.000 description 3
- 201000006604 granular cell tumor Diseases 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 150000002430 hydrocarbons Chemical group 0.000 description 3
- 210000003026 hypopharynx Anatomy 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 230000002401 inhibitory effect Effects 0.000 description 3
- 239000000543 intermediate Substances 0.000 description 3
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 3
- 150000002540 isothiocyanates Chemical class 0.000 description 3
- 230000000155 isotopic effect Effects 0.000 description 3
- 208000022013 kidney Wilms tumor Diseases 0.000 description 3
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 description 3
- 229960004338 leuprorelin Drugs 0.000 description 3
- 206010024627 liposarcoma Diseases 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 210000001370 mediastinum Anatomy 0.000 description 3
- 210000002418 meninge Anatomy 0.000 description 3
- 230000015689 metaplastic ossification Effects 0.000 description 3
- 201000010225 mixed cell type cancer Diseases 0.000 description 3
- 208000029638 mixed neoplasm Diseases 0.000 description 3
- 210000000214 mouth Anatomy 0.000 description 3
- 210000004877 mucosa Anatomy 0.000 description 3
- 201000005962 mycosis fungoides Diseases 0.000 description 3
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 3
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 3
- 208000025402 neoplasm of esophagus Diseases 0.000 description 3
- 201000008026 nephroblastoma Diseases 0.000 description 3
- 208000016065 neuroendocrine neoplasm Diseases 0.000 description 3
- 208000004128 odontoma Diseases 0.000 description 3
- 210000003300 oropharynx Anatomy 0.000 description 3
- 208000008798 osteoma Diseases 0.000 description 3
- 239000001301 oxygen Substances 0.000 description 3
- 208000004019 papillary adenocarcinoma Diseases 0.000 description 3
- 201000010148 papillary adenoma Diseases 0.000 description 3
- 239000002245 particle Substances 0.000 description 3
- 210000004197 pelvis Anatomy 0.000 description 3
- 125000003538 pentan-3-yl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])[H] 0.000 description 3
- 229960003330 pentetic acid Drugs 0.000 description 3
- 208000010626 plasma cell neoplasm Diseases 0.000 description 3
- 230000003389 potentiating effect Effects 0.000 description 3
- 230000001737 promoting effect Effects 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 208000014212 sarcomatoid carcinoma Diseases 0.000 description 3
- 230000001953 sensory effect Effects 0.000 description 3
- 229950008684 sibrotuzumab Drugs 0.000 description 3
- 238000002603 single-photon emission computed tomography Methods 0.000 description 3
- 208000000649 small cell carcinoma Diseases 0.000 description 3
- 210000000813 small intestine Anatomy 0.000 description 3
- 210000004872 soft tissue Anatomy 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 210000002536 stromal cell Anatomy 0.000 description 3
- 230000002739 subcortical effect Effects 0.000 description 3
- 229940124530 sulfonamide Drugs 0.000 description 3
- 150000003456 sulfonamides Chemical class 0.000 description 3
- 239000011593 sulfur Substances 0.000 description 3
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 3
- 229940124597 therapeutic agent Drugs 0.000 description 3
- RMVRSNDYEFQCLF-UHFFFAOYSA-N thiophenol Chemical compound SC1=CC=CC=C1 RMVRSNDYEFQCLF-UHFFFAOYSA-N 0.000 description 3
- 230000001988 toxicity Effects 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 3
- 206010044412 transitional cell carcinoma Diseases 0.000 description 3
- 208000010556 transitional cell papilloma Diseases 0.000 description 3
- 201000004420 transitional papilloma Diseases 0.000 description 3
- 150000003852 triazoles Chemical class 0.000 description 3
- 230000004614 tumor growth Effects 0.000 description 3
- 208000009540 villous adenoma Diseases 0.000 description 3
- FELGMEQIXOGIFQ-CYBMUJFWSA-N (3r)-9-methyl-3-[(2-methylimidazol-1-yl)methyl]-2,3-dihydro-1h-carbazol-4-one Chemical compound CC1=NC=CN1C[C@@H]1C(=O)C(C=2C(=CC=CC=2)N2C)=C2CC1 FELGMEQIXOGIFQ-CYBMUJFWSA-N 0.000 description 2
- QBPPRVHXOZRESW-UHFFFAOYSA-N 1,4,7,10-tetraazacyclododecane Chemical compound C1CNCCNCCNCCN1 QBPPRVHXOZRESW-UHFFFAOYSA-N 0.000 description 2
- KIUIVKNVSSLOAG-UHFFFAOYSA-N 1,4,7,10-tetrazacyclotridecan-11-one Chemical compound O=C1CCNCCNCCNCCN1 KIUIVKNVSSLOAG-UHFFFAOYSA-N 0.000 description 2
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical compound C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 2
- AJPADPZSRRUGHI-RFZPGFLSSA-N 1-deoxy-D-xylulose 5-phosphate Chemical compound CC(=O)[C@@H](O)[C@H](O)COP(O)(O)=O AJPADPZSRRUGHI-RFZPGFLSSA-N 0.000 description 2
- SNUSZUYTMHKCPM-UHFFFAOYSA-N 1-hydroxypyridin-2-one Chemical compound ON1C=CC=CC1=O SNUSZUYTMHKCPM-UHFFFAOYSA-N 0.000 description 2
- RPNMGUBLKCLAEK-UHFFFAOYSA-N 2-(4-chlorophenyl)sulfanyl-n,n-diethylethanamine;hydrochloride Chemical compound [Cl-].CC[NH+](CC)CCSC1=CC=C(Cl)C=C1 RPNMGUBLKCLAEK-UHFFFAOYSA-N 0.000 description 2
- HHLZCENAOIROSL-UHFFFAOYSA-N 2-[4,7-bis(carboxymethyl)-1,4,7,10-tetrazacyclododec-1-yl]acetic acid Chemical compound OC(=O)CN1CCNCCN(CC(O)=O)CCN(CC(O)=O)CC1 HHLZCENAOIROSL-UHFFFAOYSA-N 0.000 description 2
- WQMDWBJCGNFKRK-UHFFFAOYSA-N 2-[4-[2-[bis(carboxymethyl)amino]ethyl]-7-(carboxymethyl)-1,4,7-triazonan-1-yl]acetic acid Chemical compound OC(=O)CN(CC(O)=O)CCN1CCN(CC(O)=O)CCN(CC(O)=O)CC1 WQMDWBJCGNFKRK-UHFFFAOYSA-N 0.000 description 2
- 125000006176 2-ethylbutyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(C([H])([H])*)C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000005916 2-methylpentyl group Chemical group 0.000 description 2
- UQQQAKFVWNQYTP-UHFFFAOYSA-N 3,6,10,13,16,19-hexazabicyclo[6.6.6]icosane-1,8-diamine Chemical compound C1NCCNCC2(N)CNCCNCC1(N)CNCCNC2 UQQQAKFVWNQYTP-UHFFFAOYSA-N 0.000 description 2
- 125000005917 3-methylpentyl group Chemical group 0.000 description 2
- HVBSAKJJOYLTQU-UHFFFAOYSA-N 4-aminobenzenesulfonic acid Chemical compound NC1=CC=C(S(O)(=O)=O)C=C1 HVBSAKJJOYLTQU-UHFFFAOYSA-N 0.000 description 2
- ALYNCZNDIQEVRV-UHFFFAOYSA-N 4-aminobenzoic acid Chemical compound NC1=CC=C(C(O)=O)C=C1 ALYNCZNDIQEVRV-UHFFFAOYSA-N 0.000 description 2
- KJSJBKBZMGSIPT-UHFFFAOYSA-N 4-oxo-3-phenylmethoxypyran-2-carboxylic acid Chemical compound O1C=CC(=O)C(OCC=2C=CC=CC=2)=C1C(=O)O KJSJBKBZMGSIPT-UHFFFAOYSA-N 0.000 description 2
- OOLRAQKFMNOZBV-UHFFFAOYSA-N 8-n-[(4-aminophenyl)methyl]-3,6,10,13,16,19-hexazabicyclo[6.6.6]icosane-1,8-diamine Chemical compound C1=CC(N)=CC=C1CNC1(CNCCNC2)CNCCNCC2(N)CNCCNC1 OOLRAQKFMNOZBV-UHFFFAOYSA-N 0.000 description 2
- 206010000830 Acute leukaemia Diseases 0.000 description 2
- 208000037540 Alveolar soft tissue sarcoma Diseases 0.000 description 2
- 206010051810 Angiomyolipoma Diseases 0.000 description 2
- 201000003076 Angiosarcoma Diseases 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 101710130081 Aspergillopepsin-1 Proteins 0.000 description 2
- 208000005440 Basal Cell Neoplasms Diseases 0.000 description 2
- 201000009586 Basophil Adenoma Diseases 0.000 description 2
- 206010061692 Benign muscle neoplasm Diseases 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 208000003170 Bronchiolo-Alveolar Adenocarcinoma Diseases 0.000 description 2
- 208000011691 Burkitt lymphomas Diseases 0.000 description 2
- LDZJNMJIPNOYGA-UHFFFAOYSA-N C1=C(OC(C)=O)C(OC)=CC=C1C1=C2C3=CC(OC)=C(OC(C)=O)C=C3C=CN2C2=C1C(C=C(OC)C(OC(C)=O)=C1)=C1OC2=O Chemical compound C1=C(OC(C)=O)C(OC)=CC=C1C1=C2C3=CC(OC)=C(OC(C)=O)C=C3C=CN2C2=C1C(C=C(OC)C(OC(C)=O)=C1)=C1OC2=O LDZJNMJIPNOYGA-UHFFFAOYSA-N 0.000 description 2
- 101100243399 Caenorhabditis elegans pept-2 gene Proteins 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 206010007269 Carcinogenicity Diseases 0.000 description 2
- 201000000274 Carcinosarcoma Diseases 0.000 description 2
- 208000007389 Cementoma Diseases 0.000 description 2
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 description 2
- 208000010126 Chondromatosis Diseases 0.000 description 2
- 208000006332 Choriocarcinoma Diseases 0.000 description 2
- 208000004378 Choroid plexus papilloma Diseases 0.000 description 2
- 201000005171 Cystadenoma Diseases 0.000 description 2
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 2
- 102100031007 Cytosolic non-specific dipeptidase Human genes 0.000 description 2
- 108090000194 Dipeptidyl-peptidases and tripeptidyl-peptidases Proteins 0.000 description 2
- 102000003779 Dipeptidyl-peptidases and tripeptidyl-peptidases Human genes 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- 229910052692 Dysprosium Inorganic materials 0.000 description 2
- 108010059378 Endopeptidases Proteins 0.000 description 2
- 206010014958 Eosinophilic leukaemia Diseases 0.000 description 2
- 208000005163 Extra-Adrenal Paraganglioma Diseases 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- 102000003973 Fibroblast growth factor 21 Human genes 0.000 description 2
- 108090000376 Fibroblast growth factor 21 Proteins 0.000 description 2
- 206010016654 Fibrosis Diseases 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical group C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- 229910052688 Gadolinium Inorganic materials 0.000 description 2
- 208000021309 Germ cell tumor Diseases 0.000 description 2
- 208000008999 Giant Cell Carcinoma Diseases 0.000 description 2
- 208000032612 Glial tumor Diseases 0.000 description 2
- 206010018404 Glucagonoma Diseases 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- 208000005234 Granulosa Cell Tumor Diseases 0.000 description 2
- 208000002125 Hemangioendothelioma Diseases 0.000 description 2
- 208000006050 Hemangiopericytoma Diseases 0.000 description 2
- 206010019629 Hepatic adenoma Diseases 0.000 description 2
- 208000017605 Hodgkin disease nodular sclerosis Diseases 0.000 description 2
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 2
- 206010048643 Hypereosinophilic syndrome Diseases 0.000 description 2
- 206010020751 Hypersensitivity Diseases 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- 241001313288 Labia Species 0.000 description 2
- 208000018142 Leiomyosarcoma Diseases 0.000 description 2
- 201000004462 Leydig Cell Tumor Diseases 0.000 description 2
- 208000002404 Liver Cell Adenoma Diseases 0.000 description 2
- 229910052765 Lutetium Inorganic materials 0.000 description 2
- 208000030289 Lymphoproliferative disease Diseases 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- 208000035771 Malignant Sertoli-Leydig cell tumor of the ovary Diseases 0.000 description 2
- 229930126263 Maytansine Natural products 0.000 description 2
- 208000000172 Medulloblastoma Diseases 0.000 description 2
- 208000003351 Melanosis Diseases 0.000 description 2
- 208000034578 Multiple myelomas Diseases 0.000 description 2
- 241000699660 Mus musculus Species 0.000 description 2
- 201000004458 Myoma Diseases 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- 206010073137 Myxoid liposarcoma Diseases 0.000 description 2
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 2
- SEQKRHFRPICQDD-UHFFFAOYSA-N N-tris(hydroxymethyl)methylglycine Chemical compound OCC(CO)(CO)[NH2+]CC([O-])=O SEQKRHFRPICQDD-UHFFFAOYSA-N 0.000 description 2
- 206010061309 Neoplasm progression Diseases 0.000 description 2
- 208000034176 Neoplasms, Germ Cell and Embryonal Diseases 0.000 description 2
- 208000008846 Neurocytoma Diseases 0.000 description 2
- MWUXSHHQAYIFBG-UHFFFAOYSA-N Nitric oxide Chemical compound O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 2
- 206010029488 Nodular melanoma Diseases 0.000 description 2
- 208000010191 Osteitis Deformans Diseases 0.000 description 2
- 208000000035 Osteochondroma Diseases 0.000 description 2
- 229930012538 Paclitaxel Natural products 0.000 description 2
- 208000037064 Papilloma of choroid plexus Diseases 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- 102000035195 Peptidases Human genes 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 2
- 241001440127 Phyllodes Species 0.000 description 2
- 208000009077 Pigmented Nevus Diseases 0.000 description 2
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 2
- 102100023832 Prolyl endopeptidase FAP Human genes 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 2
- 208000034541 Rare lymphatic malformation Diseases 0.000 description 2
- 206010041067 Small cell lung cancer Diseases 0.000 description 2
- 206010068771 Soft tissue neoplasm Diseases 0.000 description 2
- 208000000102 Squamous Cell Carcinoma of Head and Neck Diseases 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 206010042658 Sweat gland tumour Diseases 0.000 description 2
- KKEYFWRCBNTPAC-UHFFFAOYSA-N Terephthalic acid Chemical compound OC(=O)C1=CC=C(C(O)=O)C=C1 KKEYFWRCBNTPAC-UHFFFAOYSA-N 0.000 description 2
- 241000011102 Thera Species 0.000 description 2
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 2
- 208000015778 Undifferentiated pleomorphic sarcoma Diseases 0.000 description 2
- 208000027418 Wounds and injury Diseases 0.000 description 2
- FKCMADOPPWWGNZ-YUMQZZPRSA-N [(2r)-1-[(2s)-2-amino-3-methylbutanoyl]pyrrolidin-2-yl]boronic acid Chemical compound CC(C)[C@H](N)C(=O)N1CCC[C@H]1B(O)O FKCMADOPPWWGNZ-YUMQZZPRSA-N 0.000 description 2
- 210000001015 abdomen Anatomy 0.000 description 2
- 230000003187 abdominal effect Effects 0.000 description 2
- 208000005310 acidophil adenoma Diseases 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 201000000452 adenoid squamous cell carcinoma Diseases 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- 229950004955 adozelesin Drugs 0.000 description 2
- BYRVKDUQDLJUBX-JJCDCTGGSA-N adozelesin Chemical compound C1=CC=C2OC(C(=O)NC=3C=C4C=C(NC4=CC=3)C(=O)N3C[C@H]4C[C@]44C5=C(C(C=C43)=O)NC=C5C)=CC2=C1 BYRVKDUQDLJUBX-JJCDCTGGSA-N 0.000 description 2
- 239000000556 agonist Substances 0.000 description 2
- 125000003282 alkyl amino group Chemical group 0.000 description 2
- 230000005262 alpha decay Effects 0.000 description 2
- 210000002255 anal canal Anatomy 0.000 description 2
- 208000009887 angiolipoma Diseases 0.000 description 2
- JFCQEDHGNNZCLN-UHFFFAOYSA-N anhydrous glutaric acid Natural products OC(=O)CCCC(O)=O JFCQEDHGNNZCLN-UHFFFAOYSA-N 0.000 description 2
- RWZYAGGXGHYGMB-UHFFFAOYSA-N anthranilic acid Chemical compound NC1=CC=CC=C1C(O)=O RWZYAGGXGHYGMB-UHFFFAOYSA-N 0.000 description 2
- 230000001028 anti-proliverative effect Effects 0.000 description 2
- 229940049595 antibody-drug conjugate Drugs 0.000 description 2
- 230000006907 apoptotic process Effects 0.000 description 2
- 125000006615 aromatic heterocyclic group Chemical group 0.000 description 2
- 210000001188 articular cartilage Anatomy 0.000 description 2
- 210000001815 ascending colon Anatomy 0.000 description 2
- 210000003403 autonomic nervous system Anatomy 0.000 description 2
- 210000000270 basal cell Anatomy 0.000 description 2
- 210000003651 basophil Anatomy 0.000 description 2
- 201000007551 basophilic adenocarcinoma Diseases 0.000 description 2
- XFILPEOLDIKJHX-QYZOEREBSA-N batimastat Chemical compound C([C@@H](C(=O)NC)NC(=O)[C@H](CC(C)C)[C@H](CSC=1SC=CC=1)C(=O)NO)C1=CC=CC=C1 XFILPEOLDIKJHX-QYZOEREBSA-N 0.000 description 2
- 229950001858 batimastat Drugs 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- UCMIRNVEIXFBKS-UHFFFAOYSA-N beta-alanine Chemical compound NCCC(O)=O UCMIRNVEIXFBKS-UHFFFAOYSA-N 0.000 description 2
- 230000000975 bioactive effect Effects 0.000 description 2
- 201000000053 blastoma Diseases 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 201000008275 breast carcinoma Diseases 0.000 description 2
- 210000000621 bronchi Anatomy 0.000 description 2
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 2
- VHRGRCVQAFMJIZ-UHFFFAOYSA-N cadaverine Chemical compound NCCCCCN VHRGRCVQAFMJIZ-UHFFFAOYSA-N 0.000 description 2
- 238000004364 calculation method Methods 0.000 description 2
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 2
- 230000007670 carcinogenicity Effects 0.000 description 2
- 231100000260 carcinogenicity Toxicity 0.000 description 2
- 230000000747 cardiac effect Effects 0.000 description 2
- 210000000845 cartilage Anatomy 0.000 description 2
- 230000010261 cell growth Effects 0.000 description 2
- 210000002421 cell wall Anatomy 0.000 description 2
- 230000002490 cerebral effect Effects 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 229910052729 chemical element Inorganic materials 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 210000000038 chest Anatomy 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 208000021668 chronic eosinophilic leukemia Diseases 0.000 description 2
- 208000024207 chronic leukemia Diseases 0.000 description 2
- 208000009060 clear cell adenocarcinoma Diseases 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 201000010989 colorectal carcinoma Diseases 0.000 description 2
- 239000000562 conjugate Substances 0.000 description 2
- 201000010305 cutaneous fibrous histiocytoma Diseases 0.000 description 2
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 2
- 235000018417 cysteine Nutrition 0.000 description 2
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 2
- 229960000684 cytarabine Drugs 0.000 description 2
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 2
- 210000001731 descending colon Anatomy 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 229940039227 diagnostic agent Drugs 0.000 description 2
- 150000004985 diamines Chemical class 0.000 description 2
- 108700013553 diamsar chelate Proteins 0.000 description 2
- 150000001991 dicarboxylic acids Chemical class 0.000 description 2
- VURFVHCLMJOLKN-UHFFFAOYSA-N diphosphane Chemical compound PP VURFVHCLMJOLKN-UHFFFAOYSA-N 0.000 description 2
- NOPFSRXAKWQILS-UHFFFAOYSA-N docosan-1-ol Chemical compound CCCCCCCCCCCCCCCCCCCCCCO NOPFSRXAKWQILS-UHFFFAOYSA-N 0.000 description 2
- 201000008184 embryoma Diseases 0.000 description 2
- 210000003372 endocrine gland Anatomy 0.000 description 2
- 201000003914 endometrial carcinoma Diseases 0.000 description 2
- 230000002255 enzymatic effect Effects 0.000 description 2
- 230000002327 eosinophilic effect Effects 0.000 description 2
- 210000002919 epithelial cell Anatomy 0.000 description 2
- HCZKYJDFEPMADG-UHFFFAOYSA-N erythro-nordihydroguaiaretic acid Natural products C=1C=C(O)C(O)=CC=1CC(C)C(C)CC1=CC=C(O)C(O)=C1 HCZKYJDFEPMADG-UHFFFAOYSA-N 0.000 description 2
- FRPJXPJMRWBBIH-RBRWEJTLSA-N estramustine Chemical compound ClCCN(CCCl)C(=O)OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 FRPJXPJMRWBBIH-RBRWEJTLSA-N 0.000 description 2
- 229940011871 estrogen Drugs 0.000 description 2
- 239000000262 estrogen Substances 0.000 description 2
- 239000000328 estrogen antagonist Substances 0.000 description 2
- WCDWBPCFGJXFJZ-UHFFFAOYSA-N etanidazole Chemical compound OCCNC(=O)CN1C=CN=C1[N+]([O-])=O WCDWBPCFGJXFJZ-UHFFFAOYSA-N 0.000 description 2
- 125000000816 ethylene group Chemical group [H]C([H])([*:1])C([H])([H])[*:2] 0.000 description 2
- IFQUWYZCAGRUJN-UHFFFAOYSA-N ethylenediaminediacetic acid Chemical compound OC(=O)CNCCNCC(O)=O IFQUWYZCAGRUJN-UHFFFAOYSA-N 0.000 description 2
- 229960000752 etoposide phosphate Drugs 0.000 description 2
- LIQODXNTTZAGID-OCBXBXKTSA-N etoposide phosphate Chemical compound COC1=C(OP(O)(O)=O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 LIQODXNTTZAGID-OCBXBXKTSA-N 0.000 description 2
- 210000000744 eyelid Anatomy 0.000 description 2
- 230000001815 facial effect Effects 0.000 description 2
- 201000008825 fibrosarcoma of bone Diseases 0.000 description 2
- 230000004761 fibrosis Effects 0.000 description 2
- 239000012467 final product Substances 0.000 description 2
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 2
- 201000004260 follicular adenoma Diseases 0.000 description 2
- 201000003444 follicular lymphoma Diseases 0.000 description 2
- 208000030878 follicular thyroid adenoma Diseases 0.000 description 2
- 239000001530 fumaric acid Substances 0.000 description 2
- CHPZKNULDCNCBW-UHFFFAOYSA-N gallium nitrate Chemical compound [Ga+3].[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O CHPZKNULDCNCBW-UHFFFAOYSA-N 0.000 description 2
- 229960003692 gamma aminobutyric acid Drugs 0.000 description 2
- 230000005253 gamme decay Effects 0.000 description 2
- 208000015419 gastrin-producing neuroendocrine tumor Diseases 0.000 description 2
- 201000000052 gastrinoma Diseases 0.000 description 2
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- 230000002440 hepatic effect Effects 0.000 description 2
- 208000006359 hepatoblastoma Diseases 0.000 description 2
- 201000002735 hepatocellular adenoma Diseases 0.000 description 2
- 230000013632 homeostatic process Effects 0.000 description 2
- 150000004677 hydrates Chemical class 0.000 description 2
- 239000001257 hydrogen Substances 0.000 description 2
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 2
- 229910052738 indium Inorganic materials 0.000 description 2
- 230000002757 inflammatory effect Effects 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 206010022498 insulinoma Diseases 0.000 description 2
- 230000000968 intestinal effect Effects 0.000 description 2
- 201000003159 intraductal papilloma Diseases 0.000 description 2
- GURKHSYORGJETM-WAQYZQTGSA-N irinotecan hydrochloride (anhydrous) Chemical compound Cl.C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 GURKHSYORGJETM-WAQYZQTGSA-N 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N iron Substances [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- 230000007794 irritation Effects 0.000 description 2
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 2
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 2
- QQVIHTHCMHWDBS-UHFFFAOYSA-N isophthalic acid Chemical compound OC(=O)C1=CC=CC(C(O)=O)=C1 QQVIHTHCMHWDBS-UHFFFAOYSA-N 0.000 description 2
- 230000000366 juvenile effect Effects 0.000 description 2
- 210000000244 kidney pelvis Anatomy 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 108010021336 lanreotide Proteins 0.000 description 2
- 244000144972 livestock Species 0.000 description 2
- 201000000014 lung giant cell carcinoma Diseases 0.000 description 2
- OHSVLFRHMCKCQY-UHFFFAOYSA-N lutetium atom Chemical compound [Lu] OHSVLFRHMCKCQY-UHFFFAOYSA-N 0.000 description 2
- 210000000260 male genitalia Anatomy 0.000 description 2
- 201000009020 malignant peripheral nerve sheath tumor Diseases 0.000 description 2
- 201000000289 malignant teratoma Diseases 0.000 description 2
- 208000027202 mammary Paget disease Diseases 0.000 description 2
- 229960003951 masoprocol Drugs 0.000 description 2
- HCZKYJDFEPMADG-TXEJJXNPSA-N masoprocol Chemical compound C([C@H](C)[C@H](C)CC=1C=C(O)C(O)=CC=1)C1=CC=C(O)C(O)=C1 HCZKYJDFEPMADG-TXEJJXNPSA-N 0.000 description 2
- 201000006512 mast cell neoplasm Diseases 0.000 description 2
- WKPWGQKGSOKKOO-RSFHAFMBSA-N maytansine Chemical compound CO[C@@H]([C@@]1(O)C[C@](OC(=O)N1)([C@H]([C@@H]1O[C@@]1(C)[C@@H](OC(=O)[C@H](C)N(C)C(C)=O)CC(=O)N1C)C)[H])\C=C\C=C(C)\CC2=CC(OC)=C(Cl)C1=C2 WKPWGQKGSOKKOO-RSFHAFMBSA-N 0.000 description 2
- 210000003716 mesoderm Anatomy 0.000 description 2
- 150000002739 metals Chemical class 0.000 description 2
- 230000009401 metastasis Effects 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 208000029796 mixed epithelioid and spindle cell melanoma Diseases 0.000 description 2
- 201000006894 monocytic leukemia Diseases 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- 201000010879 mucinous adenocarcinoma Diseases 0.000 description 2
- 208000010492 mucinous cystadenocarcinoma Diseases 0.000 description 2
- 208000009091 myxoma Diseases 0.000 description 2
- 210000000653 nervous system Anatomy 0.000 description 2
- 208000029974 neurofibrosarcoma Diseases 0.000 description 2
- 210000000440 neutrophil Anatomy 0.000 description 2
- 201000000032 nodular malignant melanoma Diseases 0.000 description 2
- 208000025275 nodular sclerosis classical Hodgkin lymphoma Diseases 0.000 description 2
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 2
- 229960005343 ondansetron Drugs 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 201000008482 osteoarthritis Diseases 0.000 description 2
- 230000002611 ovarian Effects 0.000 description 2
- 208000012221 ovarian Sertoli-Leydig cell tumor Diseases 0.000 description 2
- 201000010302 ovarian serous cystadenocarcinoma Diseases 0.000 description 2
- 210000001672 ovary Anatomy 0.000 description 2
- 229960001592 paclitaxel Drugs 0.000 description 2
- 238000002638 palliative care Methods 0.000 description 2
- 210000000277 pancreatic duct Anatomy 0.000 description 2
- 208000021255 pancreatic insulinoma Diseases 0.000 description 2
- 201000010198 papillary carcinoma Diseases 0.000 description 2
- 208000000793 papillary cystadenoma Diseases 0.000 description 2
- 210000003899 penis Anatomy 0.000 description 2
- 210000003668 pericyte Anatomy 0.000 description 2
- 210000004303 peritoneum Anatomy 0.000 description 2
- 239000012071 phase Substances 0.000 description 2
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 2
- XNGIFLGASWRNHJ-UHFFFAOYSA-N phthalic acid Chemical compound OC(=O)C1=CC=CC=C1C(O)=O XNGIFLGASWRNHJ-UHFFFAOYSA-N 0.000 description 2
- 208000021857 pituitary gland basophilic carcinoma Diseases 0.000 description 2
- 208000031223 plasma cell leukemia Diseases 0.000 description 2
- 238000002600 positron emission tomography Methods 0.000 description 2
- 239000002243 precursor Substances 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- 235000019260 propionic acid Nutrition 0.000 description 2
- 210000002307 prostate Anatomy 0.000 description 2
- 208000013368 pseudoglandular squamous cell carcinoma Diseases 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 2
- KIDHWZJUCRJVML-UHFFFAOYSA-N putrescine Chemical compound NCCCCN KIDHWZJUCRJVML-UHFFFAOYSA-N 0.000 description 2
- 210000001187 pylorus Anatomy 0.000 description 2
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 2
- 230000001950 radioprotection Effects 0.000 description 2
- 230000003439 radiotherapeutic effect Effects 0.000 description 2
- 238000001959 radiotherapy Methods 0.000 description 2
- 230000000241 respiratory effect Effects 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 210000003079 salivary gland Anatomy 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 210000000717 sertoli cell Anatomy 0.000 description 2
- 239000012453 solvate Substances 0.000 description 2
- 229950006050 spiromustine Drugs 0.000 description 2
- 230000003393 splenic effect Effects 0.000 description 2
- 230000002269 spontaneous effect Effects 0.000 description 2
- 208000022159 squamous carcinoma in situ Diseases 0.000 description 2
- PVYJZLYGTZKPJE-UHFFFAOYSA-N streptonigrin Chemical compound C=1C=C2C(=O)C(OC)=C(N)C(=O)C2=NC=1C(C=1N)=NC(C(O)=O)=C(C)C=1C1=CC=C(OC)C(OC)=C1O PVYJZLYGTZKPJE-UHFFFAOYSA-N 0.000 description 2
- 125000000542 sulfonic acid group Chemical group 0.000 description 2
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 2
- 201000011138 superficial basal cell carcinoma Diseases 0.000 description 2
- 208000030034 superficial multifocal basal cell carcinoma Diseases 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 229910052713 technetium Inorganic materials 0.000 description 2
- 210000001550 testis Anatomy 0.000 description 2
- 210000000115 thoracic cavity Anatomy 0.000 description 2
- 208000008732 thymoma Diseases 0.000 description 2
- 210000001685 thyroid gland Anatomy 0.000 description 2
- 230000007838 tissue remodeling Effects 0.000 description 2
- 210000003384 transverse colon Anatomy 0.000 description 2
- XFNJVJPLKCPIBV-UHFFFAOYSA-N trimethylenediamine Chemical compound NCCCN XFNJVJPLKCPIBV-UHFFFAOYSA-N 0.000 description 2
- 230000001573 trophoblastic effect Effects 0.000 description 2
- 230000005751 tumor progression Effects 0.000 description 2
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 2
- PSVXZQVXSXSQRO-UHFFFAOYSA-N undecaethylene glycol Chemical compound OCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCO PSVXZQVXSXSQRO-UHFFFAOYSA-N 0.000 description 2
- 208000010576 undifferentiated carcinoma Diseases 0.000 description 2
- 230000002485 urinary effect Effects 0.000 description 2
- 210000004509 vascular smooth muscle cell Anatomy 0.000 description 2
- 210000003905 vulva Anatomy 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 230000029663 wound healing Effects 0.000 description 2
- BMKDZUISNHGIBY-ZETCQYMHSA-N (+)-dexrazoxane Chemical compound C([C@H](C)N1CC(=O)NC(=O)C1)N1CC(=O)NC(=O)C1 BMKDZUISNHGIBY-ZETCQYMHSA-N 0.000 description 1
- OGNSCSPNOLGXSM-UHFFFAOYSA-N (+/-)-DABA Natural products NCCC(N)C(O)=O OGNSCSPNOLGXSM-UHFFFAOYSA-N 0.000 description 1
- HZSBSRAVNBUZRA-RQDPQJJXSA-J (1r,2r)-cyclohexane-1,2-diamine;tetrachloroplatinum(2+) Chemical compound Cl[Pt+2](Cl)(Cl)Cl.N[C@@H]1CCCC[C@H]1N HZSBSRAVNBUZRA-RQDPQJJXSA-J 0.000 description 1
- QDZOEBFLNHCSSF-PFFBOGFISA-N (2S)-2-[[(2R)-2-[[(2S)-1-[(2S)-6-amino-2-[[(2S)-1-[(2R)-2-amino-5-carbamimidamidopentanoyl]pyrrolidine-2-carbonyl]amino]hexanoyl]pyrrolidine-2-carbonyl]amino]-3-(1H-indol-3-yl)propanoyl]amino]-N-[(2R)-1-[[(2S)-1-[[(2R)-1-[[(2S)-1-[[(2S)-1-amino-4-methyl-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-3-(1H-indol-3-yl)-1-oxopropan-2-yl]amino]-1-oxo-3-phenylpropan-2-yl]amino]-3-(1H-indol-3-yl)-1-oxopropan-2-yl]pentanediamide Chemical compound C([C@@H](C(=O)N[C@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(N)=O)NC(=O)[C@@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](N)CCCNC(N)=N)C1=CC=CC=C1 QDZOEBFLNHCSSF-PFFBOGFISA-N 0.000 description 1
- MNHVIVWFCMBFCV-AVGNSLFASA-N (2S)-2-[[(2S)-2-[[(4S)-4-amino-4-carboxybutanoyl]amino]-6-diazo-5-oxohexanoyl]amino]-6-diazo-5-oxohexanoic acid Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CCC(=O)C=[N+]=[N-])C(=O)N[C@@H](CCC(=O)C=[N+]=[N-])C(O)=O MNHVIVWFCMBFCV-AVGNSLFASA-N 0.000 description 1
- NOENHWMKHNSHGX-IZOOSHNJSA-N (2s)-1-[(2s)-2-[[(2s)-2-[[(2r)-2-[[(2r)-2-[[(2s)-2-[[(2r)-2-[[(2s)-2-[[(2r)-2-acetamido-3-naphthalen-2-ylpropanoyl]amino]-3-(4-chlorophenyl)propanoyl]amino]-3-pyridin-3-ylpropanoyl]amino]-3-hydroxypropanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-6-(ca Chemical compound C([C@H](C(=O)N[C@H](CCCCNC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCNC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@H](C)C(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](CC=1C=NC=CC=1)NC(=O)[C@H](CC=1C=CC(Cl)=CC=1)NC(=O)[C@@H](CC=1C=C2C=CC=CC2=CC=1)NC(C)=O)C1=CC=C(O)C=C1 NOENHWMKHNSHGX-IZOOSHNJSA-N 0.000 description 1
- CUCSSYAUKKIDJV-FAXBSAIASA-N (2s)-2-[[(2r)-2-[[(2s)-2-[[(2r)-2-[[(2s)-2-amino-5-(diaminomethylideneamino)pentanoyl]amino]-3-(1h-indol-3-yl)propanoyl]-methylamino]-3-phenylpropanoyl]amino]-3-(1h-indol-3-yl)propanoyl]amino]-n-[(2s)-1-amino-4-methylsulfanyl-1-oxobutan-2-yl]-4-methylpent Chemical compound C([C@@H](C(=O)N[C@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(N)=O)N(C)C(=O)[C@@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@@H](N)CCCN=C(N)N)C1=CC=CC=C1 CUCSSYAUKKIDJV-FAXBSAIASA-N 0.000 description 1
- ZUQBAQVRAURMCL-DOMZBBRYSA-N (2s)-2-[[4-[2-[(6r)-2-amino-4-oxo-5,6,7,8-tetrahydro-1h-pyrido[2,3-d]pyrimidin-6-yl]ethyl]benzoyl]amino]pentanedioic acid Chemical compound C([C@@H]1CC=2C(=O)N=C(NC=2NC1)N)CC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 ZUQBAQVRAURMCL-DOMZBBRYSA-N 0.000 description 1
- JRBXPUUAYKCCLQ-QMMMGPOBSA-N (2s)-2-amino-2-[3-hydroxy-4-(hydroxymethyl)phenyl]acetic acid Chemical compound OC(=O)[C@@H](N)C1=CC=C(CO)C(O)=C1 JRBXPUUAYKCCLQ-QMMMGPOBSA-N 0.000 description 1
- NAALWFYYHHJEFQ-ZASNTINBSA-N (2s,5r,6r)-6-[[(2r)-2-[[6-[4-[bis(2-hydroxyethyl)sulfamoyl]phenyl]-2-oxo-1h-pyridine-3-carbonyl]amino]-2-(4-hydroxyphenyl)acetyl]amino]-3,3-dimethyl-7-oxo-4-thia-1-azabicyclo[3.2.0]heptane-2-carboxylic acid Chemical compound N([C@@H](C(=O)N[C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C=1C=CC(O)=CC=1)C(=O)C(C(N1)=O)=CC=C1C1=CC=C(S(=O)(=O)N(CCO)CCO)C=C1 NAALWFYYHHJEFQ-ZASNTINBSA-N 0.000 description 1
- TVIRNGFXQVMMGB-OFWIHYRESA-N (3s,6r,10r,13e,16s)-16-[(2r,3r,4s)-4-chloro-3-hydroxy-4-phenylbutan-2-yl]-10-[(3-chloro-4-methoxyphenyl)methyl]-6-methyl-3-(2-methylpropyl)-1,4-dioxa-8,11-diazacyclohexadec-13-ene-2,5,9,12-tetrone Chemical compound C1=C(Cl)C(OC)=CC=C1C[C@@H]1C(=O)NC[C@@H](C)C(=O)O[C@@H](CC(C)C)C(=O)O[C@H]([C@H](C)[C@@H](O)[C@@H](Cl)C=2C=CC=CC=2)C/C=C/C(=O)N1 TVIRNGFXQVMMGB-OFWIHYRESA-N 0.000 description 1
- DEQANNDTNATYII-OULOTJBUSA-N (4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-19-[[(2r)-2-amino-3-phenylpropanoyl]amino]-16-benzyl-n-[(2r,3r)-1,3-dihydroxybutan-2-yl]-7-[(1r)-1-hydroxyethyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-1,2-dithia-5,8,11,14,17-pentazacycloicosane-4-carboxa Chemical compound C([C@@H](N)C(=O)N[C@H]1CSSC[C@H](NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](CC=2C3=CC=CC=C3NC=2)NC(=O)[C@H](CC=2C=CC=CC=2)NC1=O)C(=O)N[C@H](CO)[C@H](O)C)C1=CC=CC=C1 DEQANNDTNATYII-OULOTJBUSA-N 0.000 description 1
- PUDHBTGHUJUUFI-SCTWWAJVSA-N (4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-n-[(2s,3r)-1-amino-3-hydroxy-1-oxobutan-2-yl]-19-[[(2r)-2-amino-3-naphthalen-2-ylpropanoyl]amino]-16-[(4-hydroxyphenyl)methyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-7-propan-2-yl-1,2-dithia-5,8,11,14,17-p Chemical compound C([C@H]1C(=O)N[C@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](N)CC=1C=C2C=CC=CC2=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(N)=O)=O)C(C)C)C1=CC=C(O)C=C1 PUDHBTGHUJUUFI-SCTWWAJVSA-N 0.000 description 1
- LKBBOPGQDRPCDS-YAOXHJNESA-N (7s,9r,10r)-7-[(2r,4s,5s,6s)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-9-ethyl-4,6,9,10,11-pentahydroxy-8,10-dihydro-7h-tetracene-5,12-dione Chemical compound O([C@H]1C[C@]([C@@H](C2=C(O)C=3C(=O)C4=CC=CC(O)=C4C(=O)C=3C(O)=C21)O)(O)CC)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 LKBBOPGQDRPCDS-YAOXHJNESA-N 0.000 description 1
- MWWSFMDVAYGXBV-FGBSZODSSA-N (7s,9s)-7-[(2r,4s,5r,6s)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-6,9,11-trihydroxy-9-(2-hydroxyacetyl)-4-methoxy-8,10-dihydro-7h-tetracene-5,12-dione;hydron;chloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 MWWSFMDVAYGXBV-FGBSZODSSA-N 0.000 description 1
- RCFNNLSZHVHCEK-YGCMNLPTSA-N (7s,9s)-7-[(2s,4r,6s)-4-amino-6-methyloxan-2-yl]oxy-6,9,11-trihydroxy-9-(2-hydroxyacetyl)-4-methoxy-8,10-dihydro-7h-tetracene-5,12-dione;hydrochloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)C[C@H](C)O1 RCFNNLSZHVHCEK-YGCMNLPTSA-N 0.000 description 1
- VHZXNQKVFDBFIK-NBBHSKLNSA-N (8r,9s,10r,13s,14s,16r)-16-fluoro-10,13-dimethyl-1,2,3,4,7,8,9,11,12,14,15,16-dodecahydrocyclopenta[a]phenanthren-17-one Chemical compound C1CCC[C@]2(C)[C@H]3CC[C@](C)(C([C@H](F)C4)=O)[C@@H]4[C@@H]3CC=C21 VHZXNQKVFDBFIK-NBBHSKLNSA-N 0.000 description 1
- IEXUMDBQLIVNHZ-YOUGDJEHSA-N (8s,11r,13r,14s,17s)-11-[4-(dimethylamino)phenyl]-17-hydroxy-17-(3-hydroxypropyl)-13-methyl-1,2,6,7,8,11,12,14,15,16-decahydrocyclopenta[a]phenanthren-3-one Chemical compound C1=CC(N(C)C)=CC=C1[C@@H]1C2=C3CCC(=O)C=C3CC[C@H]2[C@H](CC[C@]2(O)CCCO)[C@@]2(C)C1 IEXUMDBQLIVNHZ-YOUGDJEHSA-N 0.000 description 1
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 description 1
- 125000006705 (C5-C7) cycloalkyl group Chemical group 0.000 description 1
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 1
- LKJPYSCBVHEWIU-KRWDZBQOSA-N (R)-bicalutamide Chemical compound C([C@@](O)(C)C(=O)NC=1C=C(C(C#N)=CC=1)C(F)(F)F)S(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-KRWDZBQOSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- UWYVPFMHMJIBHE-OWOJBTEDSA-N (e)-2-hydroxybut-2-enedioic acid Chemical compound OC(=O)\C=C(\O)C(O)=O UWYVPFMHMJIBHE-OWOJBTEDSA-N 0.000 description 1
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 1
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 1
- OJRZEKJECRTBPJ-NGAMADIESA-N (z,5s)-5-acetamido-1-diazonio-6-hydroxy-6-oxohex-1-en-2-olate Chemical compound CC(=O)N[C@H](C(O)=O)CC\C([O-])=C\[N+]#N OJRZEKJECRTBPJ-NGAMADIESA-N 0.000 description 1
- KUHVCGKIRQEOHA-SAPNQHFASA-N 1,1-dimethyl-3-[(e)-[phenyl(pyridin-2-yl)methylidene]amino]thiourea Chemical compound C=1C=CC=NC=1C(=N/NC(=S)N(C)C)/C1=CC=CC=C1 KUHVCGKIRQEOHA-SAPNQHFASA-N 0.000 description 1
- GEYOCULIXLDCMW-UHFFFAOYSA-N 1,2-phenylenediamine Chemical compound NC1=CC=CC=C1N GEYOCULIXLDCMW-UHFFFAOYSA-N 0.000 description 1
- FONKWHRXTPJODV-DNQXCXABSA-N 1,3-bis[2-[(8s)-8-(chloromethyl)-4-hydroxy-1-methyl-7,8-dihydro-3h-pyrrolo[3,2-e]indole-6-carbonyl]-1h-indol-5-yl]urea Chemical compound C1([C@H](CCl)CN2C(=O)C=3NC4=CC=C(C=C4C=3)NC(=O)NC=3C=C4C=C(NC4=CC=3)C(=O)N3C4=CC(O)=C5NC=C(C5=C4[C@H](CCl)C3)C)=C2C=C(O)C2=C1C(C)=CN2 FONKWHRXTPJODV-DNQXCXABSA-N 0.000 description 1
- WZCQRUWWHSTZEM-UHFFFAOYSA-N 1,3-phenylenediamine Chemical compound NC1=CC=CC(N)=C1 WZCQRUWWHSTZEM-UHFFFAOYSA-N 0.000 description 1
- ITWBWJFEJCHKSN-UHFFFAOYSA-N 1,4,7-triazonane Chemical compound C1CNCCNCCN1 ITWBWJFEJCHKSN-UHFFFAOYSA-N 0.000 description 1
- MDAXKAUIABOHTD-UHFFFAOYSA-N 1,4,8,11-tetraazacyclotetradecane Chemical compound C1CNCCNCCCNCCNC1 MDAXKAUIABOHTD-UHFFFAOYSA-N 0.000 description 1
- CBCKQZAAMUWICA-UHFFFAOYSA-N 1,4-phenylenediamine Chemical compound NC1=CC=C(N)C=C1 CBCKQZAAMUWICA-UHFFFAOYSA-N 0.000 description 1
- OUPZKGBUJRBPGC-HLTSFMKQSA-N 1,5-bis[[(2r)-oxiran-2-yl]methyl]-3-[[(2s)-oxiran-2-yl]methyl]-1,3,5-triazinane-2,4,6-trione Chemical compound O=C1N(C[C@H]2OC2)C(=O)N(C[C@H]2OC2)C(=O)N1C[C@H]1CO1 OUPZKGBUJRBPGC-HLTSFMKQSA-N 0.000 description 1
- UOAFGUOASVSLPK-UHFFFAOYSA-N 1-(2-chloroethyl)-3-(2,2-dimethylpropyl)-1-nitrosourea Chemical compound CC(C)(C)CNC(=O)N(N=O)CCCl UOAFGUOASVSLPK-UHFFFAOYSA-N 0.000 description 1
- YQYBWJPESSJLTK-HXFLIBJXSA-N 1-(2-chloroethyl)-3-[(2r,3s,4r,6s)-3-hydroxy-2-(hydroxymethyl)-6-methoxyoxan-4-yl]-1-nitrosourea Chemical compound CO[C@@H]1C[C@@H](NC(=O)N(CCCl)N=O)[C@H](O)[C@@H](CO)O1 YQYBWJPESSJLTK-HXFLIBJXSA-N 0.000 description 1
- NVFRHTFJDGAFQS-UHFFFAOYSA-N 1-(3,4,5-trihydroxyphenyl)nonan-1-one Chemical compound CCCCCCCCC(=O)C1=CC(O)=C(O)C(O)=C1 NVFRHTFJDGAFQS-UHFFFAOYSA-N 0.000 description 1
- ZKFNOUUKULVDOB-UHFFFAOYSA-N 1-amino-1-phenylmethyl phosphonic acid Chemical compound OP(=O)(O)C(N)C1=CC=CC=C1 ZKFNOUUKULVDOB-UHFFFAOYSA-N 0.000 description 1
- VEXRMMJOMMTPKJ-ZVSIBQGLSA-N 1-methyl-3-[(e)-[(1e)-1-(methylcarbamothioylhydrazinylidene)propan-2-ylidene]amino]thiourea Chemical compound CNC(=S)N\N=C\C(\C)=N\NC(=S)NC VEXRMMJOMMTPKJ-ZVSIBQGLSA-N 0.000 description 1
- UTPYTEWRMXITIN-YDWXAUTNSA-N 1-methyl-3-[(e)-[(3e)-3-(methylcarbamothioylhydrazinylidene)butan-2-ylidene]amino]thiourea Chemical compound CNC(=S)N\N=C(/C)\C(\C)=N\NC(=S)NC UTPYTEWRMXITIN-YDWXAUTNSA-N 0.000 description 1
- RTBFRGCFXZNCOE-UHFFFAOYSA-N 1-methylsulfonylpiperidin-4-one Chemical compound CS(=O)(=O)N1CCC(=O)CC1 RTBFRGCFXZNCOE-UHFFFAOYSA-N 0.000 description 1
- CUNDRHORZHFPLY-UHFFFAOYSA-N 138154-39-9 Chemical compound O=C1C2=CC(O)=CC=C2N2C=NC3=CC=C(NCCN(CC)CC)C1=C32 CUNDRHORZHFPLY-UHFFFAOYSA-N 0.000 description 1
- 125000004338 2,2,3-trimethylbutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000003562 2,2-dimethylpentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- XBNGYFFABRKICK-UHFFFAOYSA-N 2,3,4,5,6-pentafluorophenol Chemical compound OC1=C(F)C(F)=C(F)C(F)=C1F XBNGYFFABRKICK-UHFFFAOYSA-N 0.000 description 1
- LDGWQMRUWMSZIU-LQDDAWAPSA-M 2,3-bis[(z)-octadec-9-enoxy]propyl-trimethylazanium;chloride Chemical compound [Cl-].CCCCCCCC\C=C/CCCCCCCCOCC(C[N+](C)(C)C)OCCCCCCCC\C=C/CCCCCCCC LDGWQMRUWMSZIU-LQDDAWAPSA-M 0.000 description 1
- 125000003660 2,3-dimethylpentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(C([H])([H])[H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000003764 2,4-dimethylpentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- VKDGNNYJFSHYKD-UHFFFAOYSA-N 2,5-diamino-2-(difluoromethyl)pentanoic acid;hydron;chloride Chemical compound Cl.NCCCC(N)(C(F)F)C(O)=O VKDGNNYJFSHYKD-UHFFFAOYSA-N 0.000 description 1
- TXQPXJKRNHJWAX-UHFFFAOYSA-N 2-(3-aminopropylamino)ethylsulfanylphosphonic acid;trihydrate Chemical compound O.O.O.NCCCNCCSP(O)(O)=O TXQPXJKRNHJWAX-UHFFFAOYSA-N 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-N 2-Methylbenzenesulfonic acid Chemical compound CC1=CC=CC=C1S(O)(=O)=O LBLYYCQCTBFVLH-UHFFFAOYSA-N 0.000 description 1
- ABEIJMWLNYUWMD-KRWDZBQOSA-N 2-[(5s)-4,7-bis(carboxymethyl)-5-[(4-isothiocyanatophenyl)methyl]-1,4,7-triazonan-1-yl]acetic acid Chemical compound OC(=O)CN1CCN(CC(=O)O)CCN(CC(O)=O)C[C@@H]1CC1=CC=C(N=C=S)C=C1 ABEIJMWLNYUWMD-KRWDZBQOSA-N 0.000 description 1
- FSOBASOXWBKMSC-QFIPXVFZSA-N 2-[(8s)-3,9-bis(carboxymethyl)-8-[(4-isothiocyanatophenyl)methyl]-3,6,9,15-tetrazabicyclo[9.3.1]pentadeca-1(15),11,13-trien-6-yl]acetic acid Chemical compound C([C@@H]1N(CC(O)=O)CC=2C=CC=C(N=2)CN(CC(O)=O)CCN(C1)CC(=O)O)C1=CC=C(N=C=S)C=C1 FSOBASOXWBKMSC-QFIPXVFZSA-N 0.000 description 1
- VRELIIISCCUCHF-IBGZPJMESA-N 2-[(9s)-7,10-bis(carboxymethyl)-9-[(4-isothiocyanatophenyl)methyl]-1-oxa-4,7,10-triazacyclododec-4-yl]acetic acid Chemical compound C1N(CC(O)=O)CCN(CC(=O)O)CCOCCN(CC(O)=O)[C@H]1CC1=CC=C(N=C=S)C=C1 VRELIIISCCUCHF-IBGZPJMESA-N 0.000 description 1
- QXLQZLBNPTZMRK-UHFFFAOYSA-N 2-[(dimethylamino)methyl]-1-(2,4-dimethylphenyl)prop-2-en-1-one Chemical compound CN(C)CC(=C)C(=O)C1=CC=C(C)C=C1C QXLQZLBNPTZMRK-UHFFFAOYSA-N 0.000 description 1
- FHQWIXXRHHMBQL-UHFFFAOYSA-N 2-[1,3,10-tris(carboxymethyl)-1,3,6,10-tetrazacyclododec-6-yl]acetic acid Chemical compound OC(=O)CN1CCCN(CC(O)=O)CCN(CC(O)=O)CN(CC(O)=O)CC1 FHQWIXXRHHMBQL-UHFFFAOYSA-N 0.000 description 1
- RUVRGYVESPRHSZ-UHFFFAOYSA-N 2-[2-(2-azaniumylethoxy)ethoxy]acetate Chemical compound NCCOCCOCC(O)=O RUVRGYVESPRHSZ-UHFFFAOYSA-N 0.000 description 1
- SJBOEHIKNDEHHO-UHFFFAOYSA-N 2-[2-aminoethyl(carboxymethyl)amino]acetic acid Chemical compound NCCN(CC(O)=O)CC(O)=O SJBOEHIKNDEHHO-UHFFFAOYSA-N 0.000 description 1
- XSVWFLQICKPQAA-UHFFFAOYSA-N 2-[4,10-bis(carboxymethyl)-7-[2-(2,5-dioxopyrrolidin-1-yl)oxy-2-oxoethyl]-1,4,7,10-tetrazacyclododec-1-yl]acetic acid Chemical compound C1CN(CC(O)=O)CCN(CC(=O)O)CCN(CC(O)=O)CCN1CC(=O)ON1C(=O)CCC1=O XSVWFLQICKPQAA-UHFFFAOYSA-N 0.000 description 1
- DFPHZEYJGWLQJE-UHFFFAOYSA-N 2-[4,7,10-tris(2-amino-2-oxoethyl)-1,4,7,10-tetrazacyclododec-1-yl]acetic acid Chemical compound NC(=O)CN1CCN(CC(N)=O)CCN(CC(O)=O)CCN(CC(N)=O)CC1 DFPHZEYJGWLQJE-UHFFFAOYSA-N 0.000 description 1
- LZBLLVHUXJXXNS-UHFFFAOYSA-N 2-[4,7,10-tris(2-amino-2-oxoethyl)-6-[(4-isothiocyanatophenyl)methyl]-1,4,7,10-tetrazacyclododec-1-yl]acetamide Chemical compound C1N(CC(N)=O)CCN(CC(=O)N)CCN(CC(N)=O)CCN(CC(N)=O)C1CC1=CC=C(N=C=S)C=C1 LZBLLVHUXJXXNS-UHFFFAOYSA-N 0.000 description 1
- ALRKEASEQOCKTJ-UHFFFAOYSA-N 2-[4,7-bis(2-amino-2-oxoethyl)-1,4,7-triazonan-1-yl]acetamide Chemical compound NC(=O)CN1CCN(CC(N)=O)CCN(CC(N)=O)CC1 ALRKEASEQOCKTJ-UHFFFAOYSA-N 0.000 description 1
- FQVAEMASBCTTJN-UHFFFAOYSA-N 2-[4,7-bis(2-sulfanylethyl)-1,4,7-triazonan-1-yl]ethanethiol Chemical compound SCCN1CCN(CCS)CCN(CCS)CC1 FQVAEMASBCTTJN-UHFFFAOYSA-N 0.000 description 1
- AUTDIWAXETZSGJ-UHFFFAOYSA-N 2-[4,7-bis(carboxymethyl)-10-[2-[2-(2,5-dioxopyrrol-1-yl)ethylamino]-2-oxoethyl]-1,4,7,10-tetrazacyclododec-1-yl]acetic acid Chemical compound C1CN(CC(O)=O)CCN(CC(=O)O)CCN(CC(O)=O)CCN1CC(=O)NCCN1C(=O)C=CC1=O AUTDIWAXETZSGJ-UHFFFAOYSA-N 0.000 description 1
- DFLZYMYLAHJXCB-UHFFFAOYSA-N 2-[4-(carboxymethyl)-6-[carboxymethyl(methyl)amino]-6-methyl-1,4-diazepan-1-yl]acetic acid Chemical group CN(CC(O)=O)C1(C)CN(CC(O)=O)CCN(CC(O)=O)C1 DFLZYMYLAHJXCB-UHFFFAOYSA-N 0.000 description 1
- ZILCESMEIDXGNS-UHFFFAOYSA-N 2-[[2-[[2-(3-sulfanylpropanoylamino)acetyl]amino]acetyl]amino]acetic acid Chemical compound OC(=O)CNC(=O)CNC(=O)CNC(=O)CCS ZILCESMEIDXGNS-UHFFFAOYSA-N 0.000 description 1
- VASZYFIKPKYGNC-UHFFFAOYSA-N 2-[[2-[bis(carboxymethyl)amino]cyclohexyl]-(carboxymethyl)amino]acetic acid;hydrate Chemical compound O.OC(=O)CN(CC(O)=O)C1CCCCC1N(CC(O)=O)CC(O)=O VASZYFIKPKYGNC-UHFFFAOYSA-N 0.000 description 1
- WYMDDFRYORANCC-UHFFFAOYSA-N 2-[[3-[bis(carboxymethyl)amino]-2-hydroxypropyl]-(carboxymethyl)amino]acetic acid Chemical compound OC(=O)CN(CC(O)=O)CC(O)CN(CC(O)=O)CC(O)=O WYMDDFRYORANCC-UHFFFAOYSA-N 0.000 description 1
- QCXJFISCRQIYID-IAEPZHFASA-N 2-amino-1-n-[(3s,6s,7r,10s,16s)-3-[(2s)-butan-2-yl]-7,11,14-trimethyl-2,5,9,12,15-pentaoxo-10-propan-2-yl-8-oxa-1,4,11,14-tetrazabicyclo[14.3.0]nonadecan-6-yl]-4,6-dimethyl-3-oxo-9-n-[(3s,6s,7r,10s,16s)-7,11,14-trimethyl-2,5,9,12,15-pentaoxo-3,10-di(propa Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N=C2C(C(=O)N[C@@H]3C(=O)N[C@H](C(N4CCC[C@H]4C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]3C)=O)[C@@H](C)CC)=C(N)C(=O)C(C)=C2O2)C2=C(C)C=C1 QCXJFISCRQIYID-IAEPZHFASA-N 0.000 description 1
- VOXBZHOHGGBLCQ-UHFFFAOYSA-N 2-amino-3,7-dihydropurine-6-thione;hydrate Chemical compound O.N1C(N)=NC(=S)C2=C1N=CN2.N1C(N)=NC(=S)C2=C1N=CN2 VOXBZHOHGGBLCQ-UHFFFAOYSA-N 0.000 description 1
- SNDPXSYFESPGGJ-UHFFFAOYSA-N 2-aminopentanoic acid Chemical compound CCCC(N)C(O)=O SNDPXSYFESPGGJ-UHFFFAOYSA-N 0.000 description 1
- 125000000143 2-carboxyethyl group Chemical group [H]OC(=O)C([H])([H])C([H])([H])* 0.000 description 1
- 125000003229 2-methylhexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- IQUPABOKLQSFBK-UHFFFAOYSA-N 2-nitrophenol Chemical compound OC1=CC=CC=C1[N+]([O-])=O IQUPABOKLQSFBK-UHFFFAOYSA-N 0.000 description 1
- WLJVXDMOQOGPHL-PPJXEINESA-N 2-phenylacetic acid Chemical class O[14C](=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-PPJXEINESA-N 0.000 description 1
- 125000004336 3,3-dimethylpentyl group Chemical group [H]C([H])([H])C([H])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- NDMPLJNOPCLANR-UHFFFAOYSA-N 3,4-dihydroxy-15-(4-hydroxy-18-methoxycarbonyl-5,18-seco-ibogamin-18-yl)-16-methoxy-1-methyl-6,7-didehydro-aspidospermidine-3-carboxylic acid methyl ester Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 NDMPLJNOPCLANR-UHFFFAOYSA-N 0.000 description 1
- AJHPGXZOIAYYDW-UHFFFAOYSA-N 3-(2-cyanophenyl)-2-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)NC(C(O)=O)CC1=CC=CC=C1C#N AJHPGXZOIAYYDW-UHFFFAOYSA-N 0.000 description 1
- GRLUHXSUZYFZCW-UHFFFAOYSA-N 3-(8,8-diethyl-2-aza-8-germaspiro[4.5]decan-2-yl)-n,n-dimethylpropan-1-amine;dihydrochloride Chemical compound Cl.Cl.C1C[Ge](CC)(CC)CCC11CN(CCCN(C)C)CC1 GRLUHXSUZYFZCW-UHFFFAOYSA-N 0.000 description 1
- ZDBWYUOUYNQZBM-UHFFFAOYSA-N 3-(aminomethyl)aniline Chemical compound NCC1=CC=CC(N)=C1 ZDBWYUOUYNQZBM-UHFFFAOYSA-N 0.000 description 1
- GSWYUZQBLVUEPH-UHFFFAOYSA-N 3-(azaniumylmethyl)benzoate Chemical compound NCC1=CC=CC(C(O)=O)=C1 GSWYUZQBLVUEPH-UHFFFAOYSA-N 0.000 description 1
- XOBIGRNRXCAMJQ-UHFFFAOYSA-N 3-(dipyridin-2-ylmethylideneamino)-1,1-dimethylthiourea Chemical compound C=1C=CC=NC=1C(=NNC(=S)N(C)C)C1=CC=CC=N1 XOBIGRNRXCAMJQ-UHFFFAOYSA-N 0.000 description 1
- QGJZLNKBHJESQX-UHFFFAOYSA-N 3-Epi-Betulin-Saeure Natural products C1CC(O)C(C)(C)C2CCC3(C)C4(C)CCC5(C(O)=O)CCC(C(=C)C)C5C4CCC3C21C QGJZLNKBHJESQX-UHFFFAOYSA-N 0.000 description 1
- GTJXPMSTODOYNP-BTKVJIOYSA-N 3-[(e)-1-[4-[2-(dimethylamino)ethoxy]phenyl]-2-phenylbut-1-enyl]phenol;2-hydroxypropane-1,2,3-tricarboxylic acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C=1C=CC=CC=1C(/CC)=C(C=1C=C(O)C=CC=1)\C1=CC=C(OCCN(C)C)C=C1 GTJXPMSTODOYNP-BTKVJIOYSA-N 0.000 description 1
- UZFPOOOQHWICKY-UHFFFAOYSA-N 3-[13-[1-[1-[8,12-bis(2-carboxyethyl)-17-(1-hydroxyethyl)-3,7,13,18-tetramethyl-21,24-dihydroporphyrin-2-yl]ethoxy]ethyl]-18-(2-carboxyethyl)-8-(1-hydroxyethyl)-3,7,12,17-tetramethyl-22,23-dihydroporphyrin-2-yl]propanoic acid Chemical compound N1C(C=C2C(=C(CCC(O)=O)C(C=C3C(=C(C)C(C=C4N5)=N3)CCC(O)=O)=N2)C)=C(C)C(C(C)O)=C1C=C5C(C)=C4C(C)OC(C)C1=C(N2)C=C(N3)C(C)=C(C(O)C)C3=CC(C(C)=C3CCC(O)=O)=NC3=CC(C(CCC(O)=O)=C3C)=NC3=CC2=C1C UZFPOOOQHWICKY-UHFFFAOYSA-N 0.000 description 1
- QNKJFXARIMSDBR-UHFFFAOYSA-N 3-[2-[bis(2-chloroethyl)amino]ethyl]-1,3-diazaspiro[4.5]decane-2,4-dione Chemical compound O=C1N(CCN(CCCl)CCCl)C(=O)NC11CCCCC1 QNKJFXARIMSDBR-UHFFFAOYSA-N 0.000 description 1
- WUIABRMSWOKTOF-OYALTWQYSA-N 3-[[2-[2-[2-[[(2s,3r)-2-[[(2s,3s,4r)-4-[[(2s,3r)-2-[[6-amino-2-[(1s)-3-amino-1-[[(2s)-2,3-diamino-3-oxopropyl]amino]-3-oxopropyl]-5-methylpyrimidine-4-carbonyl]amino]-3-[(2r,3s,4s,5s,6s)-3-[(2r,3s,4s,5r,6r)-4-carbamoyloxy-3,5-dihydroxy-6-(hydroxymethyl)ox Chemical compound OS([O-])(=O)=O.N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1NC=NC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C WUIABRMSWOKTOF-OYALTWQYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- 125000004337 3-ethylpentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(C([H])([H])C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003542 3-methylbutan-2-yl group Chemical group [H]C([H])([H])C([H])(*)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000003469 3-methylhexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- CLOUCVRNYSHRCF-UHFFFAOYSA-N 3beta-Hydroxy-20(29)-Lupen-3,27-oic acid Natural products C1CC(O)C(C)(C)C2CCC3(C)C4(C(O)=O)CCC5(C)CCC(C(=C)C)C5C4CCC3C21C CLOUCVRNYSHRCF-UHFFFAOYSA-N 0.000 description 1
- PDQGEKGUTOTUNV-TZSSRYMLSA-N 4'-deoxy-4'-iododoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](I)[C@H](C)O1 PDQGEKGUTOTUNV-TZSSRYMLSA-N 0.000 description 1
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- CLPFFLWZZBQMAO-UHFFFAOYSA-N 4-(5,6,7,8-tetrahydroimidazo[1,5-a]pyridin-5-yl)benzonitrile Chemical compound C1=CC(C#N)=CC=C1C1N2C=NC=C2CCC1 CLPFFLWZZBQMAO-UHFFFAOYSA-N 0.000 description 1
- BFWYZZPDZZGSLJ-UHFFFAOYSA-N 4-(aminomethyl)aniline Chemical compound NCC1=CC=C(N)C=C1 BFWYZZPDZZGSLJ-UHFFFAOYSA-N 0.000 description 1
- DMEDOWYXHVUPMO-UHFFFAOYSA-N 4-(carboxymethyl)benzoic acid Chemical compound OC(=O)CC1=CC=C(C(O)=O)C=C1 DMEDOWYXHVUPMO-UHFFFAOYSA-N 0.000 description 1
- AKJHMTWEGVYYSE-AIRMAKDCSA-N 4-HPR Chemical compound C=1C=C(O)C=CC=1NC(=O)/C=C(\C)/C=C/C=C(C)C=CC1=C(C)CCCC1(C)C AKJHMTWEGVYYSE-AIRMAKDCSA-N 0.000 description 1
- HSBKFSPNDWWPSL-CAHLUQPWSA-N 4-amino-5-fluoro-1-[(2r,5s)-5-(hydroxymethyl)-2,5-dihydrofuran-2-yl]pyrimidin-2-one Chemical compound C1=C(F)C(N)=NC(=O)N1[C@H]1C=C[C@@H](CO)O1 HSBKFSPNDWWPSL-CAHLUQPWSA-N 0.000 description 1
- CTSNHMQGVWXIEG-UHFFFAOYSA-N 4-amino-n-(5-chloroquinoxalin-2-yl)benzenesulfonamide Chemical compound C1=CC(N)=CC=C1S(=O)(=O)NC1=CN=C(C(Cl)=CC=C2)C2=N1 CTSNHMQGVWXIEG-UHFFFAOYSA-N 0.000 description 1
- IIKWGTMGEYTNCQ-UHFFFAOYSA-N 5-(2-aminoethylamino)-5-oxo-2-[4,7,10-tris(carboxymethyl)-1,4,7,10-tetrazacyclododec-1-yl]pentanoic acid Chemical compound NCCNC(CCC(C(=O)O)N1CCN(CCN(CCN(CC1)CC(=O)O)CC(=O)O)CC(=O)O)=O IIKWGTMGEYTNCQ-UHFFFAOYSA-N 0.000 description 1
- PXLPCZJACKUXGP-UHFFFAOYSA-N 5-(3,4-dichlorophenyl)-6-ethylpyrimidine-2,4-diamine Chemical compound CCC1=NC(N)=NC(N)=C1C1=CC=C(Cl)C(Cl)=C1 PXLPCZJACKUXGP-UHFFFAOYSA-N 0.000 description 1
- IDPUKCWIGUEADI-UHFFFAOYSA-N 5-[bis(2-chloroethyl)amino]uracil Chemical compound ClCCN(CCCl)C1=CNC(=O)NC1=O IDPUKCWIGUEADI-UHFFFAOYSA-N 0.000 description 1
- XAUDJQYHKZQPEU-KVQBGUIXSA-N 5-aza-2'-deoxycytidine Chemical compound O=C1N=C(N)N=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 XAUDJQYHKZQPEU-KVQBGUIXSA-N 0.000 description 1
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 1
- DQOGWKZQQBYYMW-LQGIGNHCSA-N 5-methyl-6-[(3,4,5-trimethoxyanilino)methyl]quinazoline-2,4-diamine;(2s,3s,4s,5r,6s)-3,4,5,6-tetrahydroxyoxane-2-carboxylic acid Chemical compound O[C@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O.COC1=C(OC)C(OC)=CC(NCC=2C(=C3C(N)=NC(N)=NC3=CC=2)C)=C1 DQOGWKZQQBYYMW-LQGIGNHCSA-N 0.000 description 1
- ATCGGEJZONJOCL-UHFFFAOYSA-N 6-(2,5-dichlorophenyl)-1,3,5-triazine-2,4-diamine Chemical compound NC1=NC(N)=NC(C=2C(=CC=C(Cl)C=2)Cl)=N1 ATCGGEJZONJOCL-UHFFFAOYSA-N 0.000 description 1
- WYWHKKSPHMUBEB-UHFFFAOYSA-N 6-Mercaptoguanine Natural products N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 1
- OTSZCHORPMQCBZ-UHFFFAOYSA-N 6-[(3-chlorophenyl)-imidazol-1-ylmethyl]-1h-benzimidazole;hydron;chloride Chemical compound Cl.ClC1=CC=CC(C(C=2C=C3NC=NC3=CC=2)N2C=NC=C2)=C1 OTSZCHORPMQCBZ-UHFFFAOYSA-N 0.000 description 1
- KXBCLNRMQPRVTP-UHFFFAOYSA-N 6-amino-1,5-dihydroimidazo[4,5-c]pyridin-4-one Chemical compound O=C1NC(N)=CC2=C1N=CN2 KXBCLNRMQPRVTP-UHFFFAOYSA-N 0.000 description 1
- ZNTIXVYOBQDFFV-UHFFFAOYSA-N 6-amino-1,5-dihydroimidazo[4,5-c]pyridin-4-one;methanesulfonic acid Chemical compound CS(O)(=O)=O.O=C1NC(N)=CC2=C1N=CN2 ZNTIXVYOBQDFFV-UHFFFAOYSA-N 0.000 description 1
- LJIRBXZDQGQUOO-KVTDHHQDSA-N 6-amino-3-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-1,4-dihydro-1,3,5-triazin-2-one Chemical compound C1NC(N)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 LJIRBXZDQGQUOO-KVTDHHQDSA-N 0.000 description 1
- HBBSDZXXUIHKJE-UHFFFAOYSA-N 6-hydrazinylpyridine-3-carboxylic acid Chemical compound NNC1=CC=C(C(O)=O)C=N1 HBBSDZXXUIHKJE-UHFFFAOYSA-N 0.000 description 1
- GOYNNCPGHOBFCK-UHFFFAOYSA-N 7-[4-(dimethylamino)-5-[(2,9-dimethyl-3-oxo-4,4a,5a,6,7,9,9a,10a-octahydrodipyrano[4,2-a:4',3'-e][1,4]dioxin-7-yl)oxy]-6-methyloxan-2-yl]oxy-9-ethyl-4,6,9,10,11-pentahydroxy-8,10-dihydro-7h-tetracene-5,12-dione Chemical compound O=C1C2=C(O)C=CC=C2C(=O)C2=C1C(O)=C1C(OC3OC(C)C(OC4OC(C)C5OC6OC(C)C(=O)CC6OC5C4)C(C3)N(C)C)CC(CC)(O)C(O)C1=C2O GOYNNCPGHOBFCK-UHFFFAOYSA-N 0.000 description 1
- KABRXLINDSPGDF-UHFFFAOYSA-N 7-bromoisoquinoline Chemical compound C1=CN=CC2=CC(Br)=CC=C21 KABRXLINDSPGDF-UHFFFAOYSA-N 0.000 description 1
- GOJJWDOZNKBUSR-UHFFFAOYSA-N 7-sulfamoyloxyheptyl sulfamate Chemical compound NS(=O)(=O)OCCCCCCCOS(N)(=O)=O GOJJWDOZNKBUSR-UHFFFAOYSA-N 0.000 description 1
- LPDLEICKXUVJHW-QJILNLRNSA-N 78nz2pmp25 Chemical compound OS(O)(=O)=O.O([C@]12[C@H](OC(C)=O)[C@]3(CC)C=CCN4CC[C@@]5([C@H]34)[C@H]1N(C)C1=C5C=C(C(=C1)OC)[C@]1(C(=O)OC)C3=C(C4=CC=CC=C4N3)CCN3C[C@H](C1)C[C@@](C3)(O)CC)C(=O)N(CCCl)C2=O LPDLEICKXUVJHW-QJILNLRNSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- ZGXJTSGNIOSYLO-UHFFFAOYSA-N 88755TAZ87 Chemical compound NCC(=O)CCC(O)=O ZGXJTSGNIOSYLO-UHFFFAOYSA-N 0.000 description 1
- 208000003693 Abdominal Fibromatosis Diseases 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 1
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 1
- 206010000871 Acute monocytic leukaemia Diseases 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- 208000036762 Acute promyelocytic leukaemia Diseases 0.000 description 1
- 206010052747 Adenocarcinoma pancreas Diseases 0.000 description 1
- 208000005748 Aggressive Fibromatosis Diseases 0.000 description 1
- 208000035805 Aleukaemic leukaemia Diseases 0.000 description 1
- DHMQDGOQFOQNFH-UHFFFAOYSA-M Aminoacetate Chemical compound NCC([O-])=O DHMQDGOQFOQNFH-UHFFFAOYSA-M 0.000 description 1
- ITPDYQOUSLNIHG-UHFFFAOYSA-N Amiodarone hydrochloride Chemical compound [Cl-].CCCCC=1OC2=CC=CC=C2C=1C(=O)C1=CC(I)=C(OCC[NH+](CC)CC)C(I)=C1 ITPDYQOUSLNIHG-UHFFFAOYSA-N 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- BOJKULTULYSRAS-OTESTREVSA-N Andrographolide Chemical compound C([C@H]1[C@]2(C)CC[C@@H](O)[C@]([C@H]2CCC1=C)(CO)C)\C=C1/[C@H](O)COC1=O BOJKULTULYSRAS-OTESTREVSA-N 0.000 description 1
- 208000003120 Angiofibroma Diseases 0.000 description 1
- 108020000948 Antisense Oligonucleotides Proteins 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- BFYIZQONLCFLEV-DAELLWKTSA-N Aromasine Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC(=C)C2=C1 BFYIZQONLCFLEV-DAELLWKTSA-N 0.000 description 1
- 108010024976 Asparaginase Proteins 0.000 description 1
- 102000015790 Asparaginase Human genes 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- 206010065869 Astrocytoma, low grade Diseases 0.000 description 1
- 206010064755 Atypical fibroxanthoma Diseases 0.000 description 1
- YOZSEGPJAXTSFZ-ZETCQYMHSA-N Azatyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=N1 YOZSEGPJAXTSFZ-ZETCQYMHSA-N 0.000 description 1
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 1
- 208000003950 B-cell lymphoma Diseases 0.000 description 1
- 208000037398 BCR-ABL1 negative atypical chronic myeloid leukemia Diseases 0.000 description 1
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- DIZWSDNSTNAYHK-XGWVBXMLSA-N Betulinic acid Natural products CC(=C)[C@@H]1C[C@H]([C@H]2CC[C@]3(C)[C@H](CC[C@@H]4[C@@]5(C)CC[C@H](O)C(C)(C)[C@@H]5CC[C@@]34C)[C@@H]12)C(=O)O DIZWSDNSTNAYHK-XGWVBXMLSA-N 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 206010005969 Bone giant cell tumour Diseases 0.000 description 1
- 206010073106 Bone giant cell tumour malignant Diseases 0.000 description 1
- 208000018084 Bone neoplasm Diseases 0.000 description 1
- 208000013165 Bowen disease Diseases 0.000 description 1
- 208000019337 Bowen disease of the skin Diseases 0.000 description 1
- 208000006274 Brain Stem Neoplasms Diseases 0.000 description 1
- 101800000407 Brain natriuretic peptide 32 Proteins 0.000 description 1
- 241000219198 Brassica Species 0.000 description 1
- 235000003351 Brassica cretica Nutrition 0.000 description 1
- 235000003343 Brassica rupestris Nutrition 0.000 description 1
- 206010058354 Bronchioloalveolar carcinoma Diseases 0.000 description 1
- NOHFVHQBEMKKMB-UHFFFAOYSA-N C(=O)(O)C(CCC(=O)NCCN1C(C=CC1=O)=O)N1CCN(CCN(CCN(CC1)CC(=O)O)CC(=O)O)CC(=O)O Chemical compound C(=O)(O)C(CCC(=O)NCCN1C(C=CC1=O)=O)N1CCN(CCN(CCN(CC1)CC(=O)O)CC(=O)O)CC(=O)O NOHFVHQBEMKKMB-UHFFFAOYSA-N 0.000 description 1
- XTHKVNZIGSIYAV-UHFFFAOYSA-N C(=O)(O)CCC(N1CCN(CCN(CC1)C([PH2]=O)(O)CCC(=O)O)CP(=O)(CCC(=O)O)O)([PH2]=O)O Chemical compound C(=O)(O)CCC(N1CCN(CCN(CC1)C([PH2]=O)(O)CCC(=O)O)CP(=O)(CCC(=O)O)O)([PH2]=O)O XTHKVNZIGSIYAV-UHFFFAOYSA-N 0.000 description 1
- YNXLOPYTAAFMTN-SBUIBGKBSA-N C([C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)C1=CC=C(O)C=C1 Chemical compound C([C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)C1=CC=C(O)C=C1 YNXLOPYTAAFMTN-SBUIBGKBSA-N 0.000 description 1
- 125000001433 C-terminal amino-acid group Chemical group 0.000 description 1
- DVMJSPPZRCFNGK-UHFFFAOYSA-N CC(C(=O)O)C1=CC=CC=C1.N1(CCN(CCNCC1)CC(=O)O)CC(=O)O Chemical compound CC(C(=O)O)C1=CC=CC=C1.N1(CCN(CCNCC1)CC(=O)O)CC(=O)O DVMJSPPZRCFNGK-UHFFFAOYSA-N 0.000 description 1
- FVLVBPDQNARYJU-XAHDHGMMSA-N C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O Chemical compound C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O FVLVBPDQNARYJU-XAHDHGMMSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 1
- 208000001843 Carotid Body Tumor Diseases 0.000 description 1
- 208000037211 Carotid body tumour Diseases 0.000 description 1
- 102000005403 Casein Kinases Human genes 0.000 description 1
- 108010031425 Casein Kinases Proteins 0.000 description 1
- 208000003163 Cavernous Hemangioma Diseases 0.000 description 1
- 206010062564 Cementoblastoma Diseases 0.000 description 1
- JWBOIMRXGHLCPP-UHFFFAOYSA-N Chloditan Chemical compound C=1C=CC=C(Cl)C=1C(C(Cl)Cl)C1=CC=C(Cl)C=C1 JWBOIMRXGHLCPP-UHFFFAOYSA-N 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 206010008583 Chloroma Diseases 0.000 description 1
- 108010089448 Cholecystokinin B Receptor Proteins 0.000 description 1
- 201000009047 Chordoma Diseases 0.000 description 1
- 102000011022 Chorionic Gonadotropin Human genes 0.000 description 1
- 108010062540 Chorionic Gonadotropin Proteins 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- PTOAARAWEBMLNO-KVQBGUIXSA-N Cladribine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PTOAARAWEBMLNO-KVQBGUIXSA-N 0.000 description 1
- 206010073140 Clear cell sarcoma of soft tissue Diseases 0.000 description 1
- 102000012422 Collagen Type I Human genes 0.000 description 1
- 108010022452 Collagen Type I Proteins 0.000 description 1
- 206010048832 Colon adenoma Diseases 0.000 description 1
- 206010052358 Colorectal cancer metastatic Diseases 0.000 description 1
- HVXBOLULGPECHP-WAYWQWQTSA-N Combretastatin A4 Chemical compound C1=C(O)C(OC)=CC=C1\C=C/C1=CC(OC)=C(OC)C(OC)=C1 HVXBOLULGPECHP-WAYWQWQTSA-N 0.000 description 1
- 206010065859 Congenital fibrosarcoma Diseases 0.000 description 1
- 208000009798 Craniopharyngioma Diseases 0.000 description 1
- LUEYTMPPCOCKBX-KWYHTCOPSA-N Curacin A Chemical compound C=CC[C@H](OC)CC\C(C)=C\C=C\CC\C=C/[C@@H]1CSC([C@H]2[C@H](C2)C)=N1 LUEYTMPPCOCKBX-KWYHTCOPSA-N 0.000 description 1
- LUEYTMPPCOCKBX-UHFFFAOYSA-N Curacin A Natural products C=CCC(OC)CCC(C)=CC=CCCC=CC1CSC(C2C(C2)C)=N1 LUEYTMPPCOCKBX-UHFFFAOYSA-N 0.000 description 1
- 108010009392 Cyclin-Dependent Kinase Inhibitor p16 Proteins 0.000 description 1
- 102100024458 Cyclin-dependent kinase inhibitor 2A Human genes 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- 206010011732 Cyst Diseases 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- PQNNIEWMPIULRS-UHFFFAOYSA-N Cytostatin Natural products CC=CC=CC=CC(O)C(C)C(OP(O)(O)=O)CCC(C)C1OC(=O)C=CC1C PQNNIEWMPIULRS-UHFFFAOYSA-N 0.000 description 1
- SPKNARKFCOPTSY-UHFFFAOYSA-N D-asperlin Natural products CC1OC1C1C(OC(C)=O)C=CC(=O)O1 SPKNARKFCOPTSY-UHFFFAOYSA-N 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- 208000008334 Dermatofibrosarcoma Diseases 0.000 description 1
- 206010057070 Dermatofibrosarcoma protuberans Diseases 0.000 description 1
- 208000001154 Dermoid Cyst Diseases 0.000 description 1
- GJKXGJCSJWBJEZ-XRSSZCMZSA-N Deslorelin Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CNC2=CC=CC=C12 GJKXGJCSJWBJEZ-XRSSZCMZSA-N 0.000 description 1
- 206010059352 Desmoid tumour Diseases 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- KYHUYMLIVQFXRI-SJPGYWQQSA-N Didemnin B Chemical compound CN([C@H](CC(C)C)C(=O)N[C@@H]1C(=O)N[C@@H]([C@H](CC(=O)O[C@H](C(=O)[C@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N2CCC[C@H]2C(=O)N(C)[C@@H](CC=2C=CC(OC)=CC=2)C(=O)O[C@@H]1C)C(C)C)O)[C@@H](C)CC)C(=O)[C@@H]1CCCN1C(=O)[C@H](C)O KYHUYMLIVQFXRI-SJPGYWQQSA-N 0.000 description 1
- 102100020751 Dipeptidyl peptidase 2 Human genes 0.000 description 1
- 102100036968 Dipeptidyl peptidase 8 Human genes 0.000 description 1
- 102100036969 Dipeptidyl peptidase 9 Human genes 0.000 description 1
- 101710087012 Dipeptidyl-peptidase 7 Proteins 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- MWWSFMDVAYGXBV-RUELKSSGSA-N Doxorubicin hydrochloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 MWWSFMDVAYGXBV-RUELKSSGSA-N 0.000 description 1
- ZQZFYGIXNQKOAV-OCEACIFDSA-N Droloxifene Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=C(O)C=CC=1)\C1=CC=C(OCCN(C)C)C=C1 ZQZFYGIXNQKOAV-OCEACIFDSA-N 0.000 description 1
- CYQFCXCEBYINGO-DLBZAZTESA-N Dronabinol Natural products C1=C(C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@H]21 CYQFCXCEBYINGO-DLBZAZTESA-N 0.000 description 1
- 101100294331 Drosophila melanogaster nod gene Proteins 0.000 description 1
- 208000037162 Ductal Breast Carcinoma Diseases 0.000 description 1
- VQNATVDKACXKTF-UHFFFAOYSA-N Duocarmycin SA Natural products COC1=C(OC)C(OC)=C2NC(C(=O)N3C4=CC(=O)C5=C(C64CC6C3)C=C(N5)C(=O)OC)=CC2=C1 VQNATVDKACXKTF-UHFFFAOYSA-N 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 208000029497 Elastoma Diseases 0.000 description 1
- 208000005431 Endometrioid Carcinoma Diseases 0.000 description 1
- NBEALWAVEGMZQY-UHFFFAOYSA-N Enpromate Chemical compound C=1C=CC=CC=1C(C#C)(C=1C=CC=CC=1)OC(=O)NC1CCCCC1 NBEALWAVEGMZQY-UHFFFAOYSA-N 0.000 description 1
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 1
- 208000002519 Epithelioid Leiomyoma Diseases 0.000 description 1
- 201000005231 Epithelioid sarcoma Diseases 0.000 description 1
- VAPSMQAHNAZRKC-PQWRYPMOSA-N Epristeride Chemical compound C1C=C2C=C(C(O)=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)NC(C)(C)C)[C@@]1(C)CC2 VAPSMQAHNAZRKC-PQWRYPMOSA-N 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 229910052691 Erbium Inorganic materials 0.000 description 1
- 206010015150 Erythema Diseases 0.000 description 1
- 208000031637 Erythroblastic Acute Leukemia Diseases 0.000 description 1
- 208000036566 Erythroleukaemia Diseases 0.000 description 1
- 208000032027 Essential Thrombocythemia Diseases 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical group C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 229910052693 Europium Inorganic materials 0.000 description 1
- 208000006168 Ewing Sarcoma Diseases 0.000 description 1
- 102000018389 Exopeptidases Human genes 0.000 description 1
- 108010091443 Exopeptidases Proteins 0.000 description 1
- 208000010368 Extramammary Paget Disease Diseases 0.000 description 1
- 101150027576 FAP gene Proteins 0.000 description 1
- 229910052687 Fermium Inorganic materials 0.000 description 1
- TZXKOCQBRNJULO-UHFFFAOYSA-N Ferriprox Chemical compound CC1=C(O)C(=O)C=CN1C TZXKOCQBRNJULO-UHFFFAOYSA-N 0.000 description 1
- 102100024785 Fibroblast growth factor 2 Human genes 0.000 description 1
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 1
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 1
- GYHNNYVSQQEPJS-UHFFFAOYSA-N Gallium Chemical compound [Ga] GYHNNYVSQQEPJS-UHFFFAOYSA-N 0.000 description 1
- 201000004066 Ganglioglioma Diseases 0.000 description 1
- 206010017708 Ganglioneuroblastoma Diseases 0.000 description 1
- 206010061968 Gastric neoplasm Diseases 0.000 description 1
- 208000007882 Gastritis Diseases 0.000 description 1
- 101710088083 Glomulin Proteins 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- IQUHNCOJRJBMSU-UHFFFAOYSA-N H3HP-DO3A Chemical compound CC(O)CN1CCN(CC(O)=O)CCN(CC(O)=O)CCN(CC(O)=O)CC1 IQUHNCOJRJBMSU-UHFFFAOYSA-N 0.000 description 1
- 208000001258 Hemangiosarcoma Diseases 0.000 description 1
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 1
- 208000002291 Histiocytic Sarcoma Diseases 0.000 description 1
- 208000017662 Hodgkin disease lymphocyte depletion type stage unspecified Diseases 0.000 description 1
- 208000017628 Hodgkin disease lymphocyte predominance type stage unspecified Diseases 0.000 description 1
- 208000017609 Hodgkin disease mixed cellularity stage unspecified Diseases 0.000 description 1
- 208000019052 Hodgkin granuloma Diseases 0.000 description 1
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 1
- 208000025786 Hodgkin paragranuloma Diseases 0.000 description 1
- 229910052689 Holmium Inorganic materials 0.000 description 1
- 101000804947 Homo sapiens Dipeptidyl peptidase 8 Proteins 0.000 description 1
- 101000804945 Homo sapiens Dipeptidyl peptidase 9 Proteins 0.000 description 1
- 101000583175 Homo sapiens Prolactin-inducible protein Proteins 0.000 description 1
- 241000243251 Hydra Species 0.000 description 1
- AVXURJPOCDRRFD-UHFFFAOYSA-N Hydroxylamine Chemical class ON AVXURJPOCDRRFD-UHFFFAOYSA-N 0.000 description 1
- VSNHCAURESNICA-UHFFFAOYSA-N Hydroxyurea Chemical compound NC(=O)NO VSNHCAURESNICA-UHFFFAOYSA-N 0.000 description 1
- 206010062767 Hypophysitis Diseases 0.000 description 1
- 108010031794 IGF Type 1 Receptor Proteins 0.000 description 1
- MPBVHIBUJCELCL-UHFFFAOYSA-N Ibandronate Chemical compound CCCCCN(C)CCC(O)(P(O)(O)=O)P(O)(O)=O MPBVHIBUJCELCL-UHFFFAOYSA-N 0.000 description 1
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 1
- JJKOTMDDZAJTGQ-DQSJHHFOSA-N Idoxifene Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN2CCCC2)=CC=1)/C1=CC=C(I)C=C1 JJKOTMDDZAJTGQ-DQSJHHFOSA-N 0.000 description 1
- 101000668058 Infectious salmon anemia virus (isolate Atlantic salmon/Norway/810/9/99) RNA-directed RNA polymerase catalytic subunit Proteins 0.000 description 1
- 108700022013 Insecta cecropin B Proteins 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 102100039688 Insulin-like growth factor 1 receptor Human genes 0.000 description 1
- 102100040018 Interferon alpha-2 Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 108010079944 Interferon-alpha2b Proteins 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 206010051925 Intestinal adenocarcinoma Diseases 0.000 description 1
- 208000037396 Intraductal Noninfiltrating Carcinoma Diseases 0.000 description 1
- 208000009164 Islet Cell Adenoma Diseases 0.000 description 1
- WVWWZNXKZNACRW-UHFFFAOYSA-N Isohomohalichondrin B Natural products O1C2C(C)CC3(OC4CC(O)C(CC(=O)CCO)OC4C(C)C3)OC2CC1(OC1CC2OC3CC4C(=C)C(C)CC(O4)CCC4C(=C)CC(O4)CC4)CC1OC2C(C)C3OC(=O)CC(O1)CCC2C1C(O1)C3OC5CC14OC5C3O2 WVWWZNXKZNACRW-UHFFFAOYSA-N 0.000 description 1
- 208000007766 Kaposi sarcoma Diseases 0.000 description 1
- 206010023330 Keloid scar Diseases 0.000 description 1
- 150000007649 L alpha amino acids Chemical class 0.000 description 1
- 108010043135 L-methionine gamma-lyase Proteins 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- 206010023856 Laryngeal squamous cell carcinoma Diseases 0.000 description 1
- 208000001791 Leiomyomatosis Diseases 0.000 description 1
- 229920001491 Lentinan Polymers 0.000 description 1
- LMVRPBWWHMVLPC-KBPJCXPTSA-N Leptolstatin Natural products CC(CC=CC(=CC(C)C(=O)C(C)C(O)C(C)CC(=CCO)C)C)C=C(C)/C=C/C1CC=CC(=O)O1 LMVRPBWWHMVLPC-KBPJCXPTSA-N 0.000 description 1
- 102000004058 Leukemia inhibitory factor Human genes 0.000 description 1
- 108090000581 Leukemia inhibitory factor Proteins 0.000 description 1
- HLFSDGLLUJUHTE-SNVBAGLBSA-N Levamisole Chemical compound C1([C@H]2CN3CCSC3=N2)=CC=CC=C1 HLFSDGLLUJUHTE-SNVBAGLBSA-N 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- 208000000265 Lobular Carcinoma Diseases 0.000 description 1
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 1
- 206010049459 Lymphangioleiomyomatosis Diseases 0.000 description 1
- 208000004138 Lymphangiomyoma Diseases 0.000 description 1
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 1
- 208000006644 Malignant Fibrous Histiocytoma Diseases 0.000 description 1
- 206010025566 Malignant haemangiopericytoma Diseases 0.000 description 1
- BLOFGONIVNXZME-UHFFFAOYSA-N Mannostatin A Natural products CSC1C(N)C(O)C(O)C1O BLOFGONIVNXZME-UHFFFAOYSA-N 0.000 description 1
- 102000004318 Matrilysin Human genes 0.000 description 1
- 108090000855 Matrilysin Proteins 0.000 description 1
- 108010000684 Matrix Metalloproteinases Proteins 0.000 description 1
- 102000002274 Matrix Metalloproteinases Human genes 0.000 description 1
- 208000010728 Meckel diverticulum Diseases 0.000 description 1
- 208000037196 Medullary thyroid carcinoma Diseases 0.000 description 1
- 208000035490 Megakaryoblastic Acute Leukemia Diseases 0.000 description 1
- 101710151321 Melanostatin Proteins 0.000 description 1
- 206010027193 Meningioma malignant Diseases 0.000 description 1
- 201000009574 Mesenchymal Chondrosarcoma Diseases 0.000 description 1
- 229930192392 Mitomycin Natural products 0.000 description 1
- PCZOHLXUXFIOCF-UHFFFAOYSA-N Monacolin X Natural products C12C(OC(=O)C(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 PCZOHLXUXFIOCF-UHFFFAOYSA-N 0.000 description 1
- 208000035489 Monocytic Acute Leukemia Diseases 0.000 description 1
- 206010057269 Mucoepidermoid carcinoma Diseases 0.000 description 1
- 206010048723 Multiple-drug resistance Diseases 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 101000857304 Mus musculus Glomulin Proteins 0.000 description 1
- 208000007727 Muscle Tissue Neoplasms Diseases 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 1
- 208000007182 Myelolipoma Diseases 0.000 description 1
- 206010028570 Myelopathy Diseases 0.000 description 1
- 208000014767 Myeloproliferative disease Diseases 0.000 description 1
- 201000007224 Myeloproliferative neoplasm Diseases 0.000 description 1
- 206010066948 Myxofibrosarcoma Diseases 0.000 description 1
- USVMJSALORZVDV-SDBHATRESA-N N(6)-(Delta(2)-isopentenyl)adenosine Chemical compound C1=NC=2C(NCC=C(C)C)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O USVMJSALORZVDV-SDBHATRESA-N 0.000 description 1
- WUKZPHOXUVCQOR-UHFFFAOYSA-N N-(1-azabicyclo[2.2.2]octan-3-yl)-6-chloro-4-methyl-3-oxo-1,4-benzoxazine-8-carboxamide Chemical compound C1N(CC2)CCC2C1NC(=O)C1=CC(Cl)=CC2=C1OCC(=O)N2C WUKZPHOXUVCQOR-UHFFFAOYSA-N 0.000 description 1
- BNQSTAOJRULKNX-UHFFFAOYSA-N N-(6-acetamidohexyl)acetamide Chemical compound CC(=O)NCCCCCCNC(C)=O BNQSTAOJRULKNX-UHFFFAOYSA-N 0.000 description 1
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 1
- 125000001429 N-terminal alpha-amino-acid group Chemical group 0.000 description 1
- LYPFDBRUNKHDGX-SOGSVHMOSA-N N1C2=CC=C1\C(=C1\C=CC(=N1)\C(=C1\C=C/C(/N1)=C(/C1=N/C(/CC1)=C2/C1=CC(O)=CC=C1)C1=CC(O)=CC=C1)\C1=CC(O)=CC=C1)C1=CC(O)=CC=C1 Chemical compound N1C2=CC=C1\C(=C1\C=CC(=N1)\C(=C1\C=C/C(/N1)=C(/C1=N/C(/CC1)=C2/C1=CC(O)=CC=C1)C1=CC(O)=CC=C1)\C1=CC(O)=CC=C1)C1=CC(O)=CC=C1 LYPFDBRUNKHDGX-SOGSVHMOSA-N 0.000 description 1
- 108010021717 Nafarelin Proteins 0.000 description 1
- 102000003729 Neprilysin Human genes 0.000 description 1
- 108090000028 Neprilysin Proteins 0.000 description 1
- 102400000058 Neuregulin-1 Human genes 0.000 description 1
- 108090000556 Neuregulin-1 Proteins 0.000 description 1
- 208000009277 Neuroectodermal Tumors Diseases 0.000 description 1
- 208000033383 Neuroendocrine tumor of pancreas Diseases 0.000 description 1
- 208000009905 Neurofibromatoses Diseases 0.000 description 1
- 208000005890 Neuroma Diseases 0.000 description 1
- 102400000064 Neuropeptide Y Human genes 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- KYRVNWMVYQXFEU-UHFFFAOYSA-N Nocodazole Chemical compound C1=C2NC(NC(=O)OC)=NC2=CC=C1C(=O)C1=CC=CS1 KYRVNWMVYQXFEU-UHFFFAOYSA-N 0.000 description 1
- KGTDRFCXGRULNK-UHFFFAOYSA-N Nogalamycin Natural products COC1C(OC)(C)C(OC)C(C)OC1OC1C2=C(O)C(C(=O)C3=C(O)C=C4C5(C)OC(C(C(C5O)N(C)C)O)OC4=C3C3=O)=C3C=C2C(C(=O)OC)C(C)(O)C1 KGTDRFCXGRULNK-UHFFFAOYSA-N 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 108091005461 Nucleic proteins Proteins 0.000 description 1
- UMDBGTRUNWFBPE-UHFFFAOYSA-N O.Cl.Cl.CNCCNc1ccc2c3c(nn2CCNCCO)c4c(O)ccc(O)c4C(=O)c13 Chemical compound O.Cl.Cl.CNCCNc1ccc2c3c(nn2CCNCCO)c4c(O)ccc(O)c4C(=O)c13 UMDBGTRUNWFBPE-UHFFFAOYSA-N 0.000 description 1
- 229960005524 O6-benzylguanine Drugs 0.000 description 1
- KRWMERLEINMZFT-UHFFFAOYSA-N O6-benzylguanine Chemical compound C=12NC=NC2=NC(N)=NC=1OCC1=CC=CC=C1 KRWMERLEINMZFT-UHFFFAOYSA-N 0.000 description 1
- 108010016076 Octreotide Proteins 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- VTAZRSXSBIHBMH-UHFFFAOYSA-N Ophiocordin Natural products OC1=CC(C(=O)O)=CC(O)=C1C(=O)C1=C(O)C=CC=C1C(=O)NC1C(OC(=O)C=2C=CC(O)=CC=2)CCCNC1 VTAZRSXSBIHBMH-UHFFFAOYSA-N 0.000 description 1
- 201000011436 Ossifying Fibroma Diseases 0.000 description 1
- 208000001715 Osteoblastoma Diseases 0.000 description 1
- 208000008558 Osteophyte Diseases 0.000 description 1
- LKBBOPGQDRPCDS-UHFFFAOYSA-N Oxaunomycin Natural products C12=C(O)C=3C(=O)C4=C(O)C=CC=C4C(=O)C=3C(O)=C2C(O)C(CC)(O)CC1OC1CC(N)C(O)C(C)O1 LKBBOPGQDRPCDS-UHFFFAOYSA-N 0.000 description 1
- 108010050095 PT-100 dipeptide Proteins 0.000 description 1
- 208000027868 Paget disease Diseases 0.000 description 1
- 208000027067 Paget disease of bone Diseases 0.000 description 1
- 206010067517 Pancreatic neuroendocrine tumour Diseases 0.000 description 1
- 206010050026 Panmyelopathy Diseases 0.000 description 1
- 206010033733 Papule Diseases 0.000 description 1
- 108010088847 Peptide YY Proteins 0.000 description 1
- 102100029909 Peptide YY Human genes 0.000 description 1
- 201000007286 Pilocytic astrocytoma Diseases 0.000 description 1
- 206010050487 Pinealoblastoma Diseases 0.000 description 1
- 239000004721 Polyphenylene oxide Substances 0.000 description 1
- HRHKSTOGXBBQCB-UHFFFAOYSA-N Porfiromycine Chemical compound O=C1C(N)=C(C)C(=O)C2=C1C(COC(N)=O)C1(OC)C3N(C)C3CN12 HRHKSTOGXBBQCB-UHFFFAOYSA-N 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- HFVNWDWLWUCIHC-GUPDPFMOSA-N Prednimustine Chemical compound O=C([C@@]1(O)CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)[C@@H](O)C[C@@]21C)COC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 HFVNWDWLWUCIHC-GUPDPFMOSA-N 0.000 description 1
- 102100030350 Prolactin-inducible protein Human genes 0.000 description 1
- 208000033766 Prolymphocytic Leukemia Diseases 0.000 description 1
- 208000033826 Promyelocytic Acute Leukemia Diseases 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 208000001671 Pulmonary Adenomatosis Diseases 0.000 description 1
- 239000005700 Putrescine Substances 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 208000005678 Rhabdomyoma Diseases 0.000 description 1
- 206010073139 Round cell liposarcoma Diseases 0.000 description 1
- KJQFBVYMGADDTQ-UHFFFAOYSA-N S-butyl-DL-homocysteine (S,R)-sulfoximine Chemical compound CCCCS(=N)(=O)CCC(N)C(O)=O KJQFBVYMGADDTQ-UHFFFAOYSA-N 0.000 description 1
- 108010005173 SERPIN-B5 Proteins 0.000 description 1
- OTKJDMGTUTTYMP-ROUUACIJSA-N Safingol ( L-threo-sphinganine) Chemical compound CCCCCCCCCCCCCCC[C@H](O)[C@@H](N)CO OTKJDMGTUTTYMP-ROUUACIJSA-N 0.000 description 1
- 229910052772 Samarium Inorganic materials 0.000 description 1
- 206010039710 Scleroderma Diseases 0.000 description 1
- 229940124639 Selective inhibitor Drugs 0.000 description 1
- 102000012479 Serine Proteases Human genes 0.000 description 1
- 108010022999 Serine Proteases Proteins 0.000 description 1
- 241000287219 Serinus canaria Species 0.000 description 1
- 102100030333 Serpin B5 Human genes 0.000 description 1
- 208000003274 Sertoli cell tumor Diseases 0.000 description 1
- 208000002669 Sex Cord-Gonadal Stromal Tumors Diseases 0.000 description 1
- 208000009359 Sezary Syndrome Diseases 0.000 description 1
- 208000021388 Sezary disease Diseases 0.000 description 1
- 208000009574 Skin Appendage Carcinoma Diseases 0.000 description 1
- 201000011683 Small Cell Sarcoma Diseases 0.000 description 1
- 208000021712 Soft tissue sarcoma Diseases 0.000 description 1
- 208000008093 Squamous Odontogenic Tumor Diseases 0.000 description 1
- 208000036844 Squamous cell carcinoma of the larynx Diseases 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 208000001662 Subependymal Glioma Diseases 0.000 description 1
- 102400000096 Substance P Human genes 0.000 description 1
- 101800003906 Substance P Proteins 0.000 description 1
- 206010049418 Sudden Cardiac Death Diseases 0.000 description 1
- 208000006183 Supraglottitis Diseases 0.000 description 1
- 208000025194 Sweat Gland Neoplasms Diseases 0.000 description 1
- UZMAPBJVXOGOFT-UHFFFAOYSA-N Syringetin Natural products COC1=C(O)C(OC)=CC(C2=C(C(=O)C3=C(O)C=C(O)C=C3O2)O)=C1 UZMAPBJVXOGOFT-UHFFFAOYSA-N 0.000 description 1
- CYQFCXCEBYINGO-UHFFFAOYSA-N THC Natural products C1=C(C)CCC2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3C21 CYQFCXCEBYINGO-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 206010043189 Telangiectasia Diseases 0.000 description 1
- 206010048460 Teratoma benign Diseases 0.000 description 1
- 229910052771 Terbium Inorganic materials 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 201000000331 Testicular germ cell cancer Diseases 0.000 description 1
- 206010057644 Testis cancer Diseases 0.000 description 1
- FOCVUCIESVLUNU-UHFFFAOYSA-N Thiotepa Chemical compound C1CN1P(N1CC1)(=S)N1CC1 FOCVUCIESVLUNU-UHFFFAOYSA-N 0.000 description 1
- 229910052776 Thorium Inorganic materials 0.000 description 1
- 229910052775 Thulium Inorganic materials 0.000 description 1
- 201000009365 Thymic carcinoma Diseases 0.000 description 1
- 206010061031 Thymoma malignant Diseases 0.000 description 1
- 208000033781 Thyroid carcinoma Diseases 0.000 description 1
- 208000002474 Tinea Diseases 0.000 description 1
- LYJKREGDQDJIDC-UHFFFAOYSA-N Tirandamycin B Natural products O1C(C2(OC2C2=O)CO)(C)OC2C(C)C1C(C)C=C(C)C=CC(O)=C1C(=O)CNC1=O LYJKREGDQDJIDC-UHFFFAOYSA-N 0.000 description 1
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 1
- IWEQQRMGNVVKQW-OQKDUQJOSA-N Toremifene citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 IWEQQRMGNVVKQW-OQKDUQJOSA-N 0.000 description 1
- 241000893966 Trichophyton verrucosum Species 0.000 description 1
- 239000007997 Tricine buffer Substances 0.000 description 1
- VGQOVCHZGQWAOI-UHFFFAOYSA-N UNPD55612 Natural products N1C(O)C2CC(C=CC(N)=O)=CN2C(=O)C2=CC=C(C)C(O)=C12 VGQOVCHZGQWAOI-UHFFFAOYSA-N 0.000 description 1
- 208000024780 Urticaria Diseases 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- 206010066969 Vitello-intestinal duct remnant Diseases 0.000 description 1
- 206010052428 Wound Diseases 0.000 description 1
- 208000012018 Yolk sac tumor Diseases 0.000 description 1
- 229910052769 Ytterbium Inorganic materials 0.000 description 1
- SPKNARKFCOPTSY-XWPZMVOTSA-N [(2r,3s)-2-[(2s,3r)-3-methyloxiran-2-yl]-6-oxo-2,3-dihydropyran-3-yl] acetate Chemical compound C[C@H]1O[C@@H]1[C@H]1[C@@H](OC(C)=O)C=CC(=O)O1 SPKNARKFCOPTSY-XWPZMVOTSA-N 0.000 description 1
- IVCRCPJOLWECJU-XQVQQVTHSA-N [(7r,8r,9s,10r,13s,14s,17s)-7,13-dimethyl-3-oxo-2,6,7,8,9,10,11,12,14,15,16,17-dodecahydro-1h-cyclopenta[a]phenanthren-17-yl] acetate Chemical compound C1C[C@]2(C)[C@@H](OC(C)=O)CC[C@H]2[C@@H]2[C@H](C)CC3=CC(=O)CC[C@@H]3[C@H]21 IVCRCPJOLWECJU-XQVQQVTHSA-N 0.000 description 1
- PQNNIEWMPIULRS-SUTYWZMXSA-N [(8e,10e,12e)-7-hydroxy-6-methyl-2-(3-methyl-6-oxo-2,3-dihydropyran-2-yl)tetradeca-8,10,12-trien-5-yl] dihydrogen phosphate Chemical compound C\C=C\C=C\C=C\C(O)C(C)C(OP(O)(O)=O)CCC(C)C1OC(=O)C=CC1C PQNNIEWMPIULRS-SUTYWZMXSA-N 0.000 description 1
- IFJUINDAXYAPTO-UUBSBJJBSA-N [(8r,9s,13s,14s,17s)-17-[2-[4-[4-[bis(2-chloroethyl)amino]phenyl]butanoyloxy]acetyl]oxy-13-methyl-6,7,8,9,11,12,14,15,16,17-decahydrocyclopenta[a]phenanthren-3-yl] benzoate Chemical compound C([C@@H]1[C@@H](C2=CC=3)CC[C@]4([C@H]1CC[C@@H]4OC(=O)COC(=O)CCCC=1C=CC(=CC=1)N(CCCl)CCCl)C)CC2=CC=3OC(=O)C1=CC=CC=C1 IFJUINDAXYAPTO-UUBSBJJBSA-N 0.000 description 1
- KMLCRELJHYKIIL-UHFFFAOYSA-N [1-(azanidylmethyl)cyclohexyl]methylazanide;platinum(2+);sulfuric acid Chemical compound [Pt+2].OS(O)(=O)=O.[NH-]CC1(C[NH-])CCCCC1 KMLCRELJHYKIIL-UHFFFAOYSA-N 0.000 description 1
- JJULHOZRTCDZOH-JGJFOBQESA-N [1-[[[(2r,3s,4s,5r)-5-(4-amino-2-oxopyrimidin-1-yl)-3,4-dihydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-hydroxyphosphoryl]oxy-3-octadecylsulfanylpropan-2-yl] hexadecanoate Chemical compound O[C@H]1[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OCC(CSCCCCCCCCCCCCCCCCCC)OC(=O)CCCCCCCCCCCCCCC)O[C@H]1N1C(=O)N=C(N)C=C1 JJULHOZRTCDZOH-JGJFOBQESA-N 0.000 description 1
- XSMVECZRZBFTIZ-UHFFFAOYSA-M [2-(aminomethyl)cyclobutyl]methanamine;2-oxidopropanoate;platinum(4+) Chemical compound [Pt+4].CC([O-])C([O-])=O.NCC1CCC1CN XSMVECZRZBFTIZ-UHFFFAOYSA-M 0.000 description 1
- GZOSMCIZMLWJML-VJLLXTKPSA-N abiraterone Chemical compound C([C@H]1[C@H]2[C@@H]([C@]3(CC[C@H](O)CC3=CC2)C)CC[C@@]11C)C=C1C1=CC=CN=C1 GZOSMCIZMLWJML-VJLLXTKPSA-N 0.000 description 1
- 229960000853 abiraterone Drugs 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 239000000370 acceptor Substances 0.000 description 1
- RUGAHXUZHWYHNG-NLGNTGLNSA-N acetic acid;(4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-n-[(2s,3r)-1-amino-3-hydroxy-1-oxobutan-2-yl]-19-[[(2r)-2-amino-3-naphthalen-2-ylpropanoyl]amino]-16-[(4-hydroxyphenyl)methyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-7-propan-2-yl-1,2-dithia-5, Chemical compound CC(O)=O.CC(O)=O.CC(O)=O.CC(O)=O.CC(O)=O.C([C@H]1C(=O)N[C@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](N)CC=1C=C2C=CC=CC2=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(N)=O)=O)C(C)C)C1=CC=C(O)C=C1.C([C@H]1C(=O)N[C@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](N)CC=1C=C2C=CC=CC2=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(N)=O)=O)C(C)C)C1=CC=C(O)C=C1 RUGAHXUZHWYHNG-NLGNTGLNSA-N 0.000 description 1
- 208000006336 acinar cell carcinoma Diseases 0.000 description 1
- QAWIHIJWNYOLBE-OKKQSCSOSA-N acivicin Chemical compound OC(=O)[C@@H](N)[C@@H]1CC(Cl)=NO1 QAWIHIJWNYOLBE-OKKQSCSOSA-N 0.000 description 1
- 229950008427 acivicin Drugs 0.000 description 1
- USZYSDMBJDPRIF-SVEJIMAYSA-N aclacinomycin A Chemical compound O([C@H]1[C@@H](O)C[C@@H](O[C@H]1C)O[C@H]1[C@H](C[C@@H](O[C@H]1C)O[C@H]1C[C@]([C@@H](C2=CC=3C(=O)C4=CC=CC(O)=C4C(=O)C=3C(O)=C21)C(=O)OC)(O)CC)N(C)C)[C@H]1CCC(=O)[C@H](C)O1 USZYSDMBJDPRIF-SVEJIMAYSA-N 0.000 description 1
- 229960004176 aclarubicin Drugs 0.000 description 1
- 208000017733 acquired polycythemia vera Diseases 0.000 description 1
- 229910052767 actinium Inorganic materials 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 208000021841 acute erythroid leukemia Diseases 0.000 description 1
- 208000020700 acute megakaryocytic leukemia Diseases 0.000 description 1
- 150000001263 acyl chlorides Chemical class 0.000 description 1
- 208000002517 adenoid cystic carcinoma Diseases 0.000 description 1
- 208000002938 adenomyoma Diseases 0.000 description 1
- 201000008395 adenosquamous carcinoma Diseases 0.000 description 1
- 235000011037 adipic acid Nutrition 0.000 description 1
- 150000001279 adipic acids Chemical class 0.000 description 1
- 210000000577 adipose tissue Anatomy 0.000 description 1
- 238000009098 adjuvant therapy Methods 0.000 description 1
- 210000003152 adnexa uteri Anatomy 0.000 description 1
- 210000004404 adrenal cortex Anatomy 0.000 description 1
- 210000004100 adrenal gland Anatomy 0.000 description 1
- 208000026565 adrenal gland myelolipoma Diseases 0.000 description 1
- 210000001943 adrenal medulla Anatomy 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 108700025316 aldesleukin Proteins 0.000 description 1
- 229960005310 aldesleukin Drugs 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 150000001345 alkine derivatives Chemical class 0.000 description 1
- 208000030961 allergic reaction Diseases 0.000 description 1
- 150000001371 alpha-amino acids Chemical class 0.000 description 1
- 235000008206 alpha-amino acids Nutrition 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229960000473 altretamine Drugs 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 206010065867 alveolar rhabdomyosarcoma Diseases 0.000 description 1
- 201000010614 alveoli adenoma Diseases 0.000 description 1
- 229950010817 alvocidib Drugs 0.000 description 1
- BIIVYFLTOXDAOV-YVEFUNNKSA-N alvocidib Chemical compound O[C@@H]1CN(C)CC[C@@H]1C1=C(O)C=C(O)C2=C1OC(C=1C(=CC=CC=1)Cl)=CC2=O BIIVYFLTOXDAOV-YVEFUNNKSA-N 0.000 description 1
- 229950010949 ambamustine Drugs 0.000 description 1
- 229950004821 ambomycin Drugs 0.000 description 1
- 229960001097 amifostine Drugs 0.000 description 1
- 229960004050 aminobenzoic acid Drugs 0.000 description 1
- 229960003437 aminoglutethimide Drugs 0.000 description 1
- ROBVIMPUHSLWNV-UHFFFAOYSA-N aminoglutethimide Chemical compound C=1C=C(N)C=CC=1C1(CC)CCC(=O)NC1=O ROBVIMPUHSLWNV-UHFFFAOYSA-N 0.000 description 1
- 229960002749 aminolevulinic acid Drugs 0.000 description 1
- QCTBMLYLENLHLA-UHFFFAOYSA-N aminomethylbenzoic acid Chemical compound NCC1=CC=C(C(O)=O)C=C1 QCTBMLYLENLHLA-UHFFFAOYSA-N 0.000 description 1
- 229960003375 aminomethylbenzoic acid Drugs 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 229960002550 amrubicin Drugs 0.000 description 1
- VJZITPJGSQKZMX-XDPRQOKASA-N amrubicin Chemical compound O([C@H]1C[C@](CC2=C(O)C=3C(=O)C4=CC=CC=C4C(=O)C=3C(O)=C21)(N)C(=O)C)[C@H]1C[C@H](O)[C@H](O)CO1 VJZITPJGSQKZMX-XDPRQOKASA-N 0.000 description 1
- 229960001220 amsacrine Drugs 0.000 description 1
- XCPGHVQEEXUHNC-UHFFFAOYSA-N amsacrine Chemical compound COC1=CC(NS(C)(=O)=O)=CC=C1NC1=C(C=CC=C2)C2=NC2=CC=CC=C12 XCPGHVQEEXUHNC-UHFFFAOYSA-N 0.000 description 1
- 229960001694 anagrelide Drugs 0.000 description 1
- OTBXOEAOVRKTNQ-UHFFFAOYSA-N anagrelide Chemical compound N1=C2NC(=O)CN2CC2=C(Cl)C(Cl)=CC=C21 OTBXOEAOVRKTNQ-UHFFFAOYSA-N 0.000 description 1
- 229960002932 anastrozole Drugs 0.000 description 1
- YBBLVLTVTVSKRW-UHFFFAOYSA-N anastrozole Chemical compound N#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1 YBBLVLTVTVSKRW-UHFFFAOYSA-N 0.000 description 1
- ASLUCFFROXVMFL-UHFFFAOYSA-N andrographolide Natural products CC1(CO)C(O)CCC2(C)C(CC=C3/C(O)OCC3=O)C(=C)CCC12 ASLUCFFROXVMFL-UHFFFAOYSA-N 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 239000004037 angiogenesis inhibitor Substances 0.000 description 1
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 1
- 201000009431 angiokeratoma Diseases 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 108010070670 antarelix Proteins 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- VGQOVCHZGQWAOI-HYUHUPJXSA-N anthramycin Chemical compound N1[C@@H](O)[C@@H]2CC(\C=C\C(N)=O)=CN2C(=O)C2=CC=C(C)C(O)=C12 VGQOVCHZGQWAOI-HYUHUPJXSA-N 0.000 description 1
- 230000003135 anti-embryonic effect Effects 0.000 description 1
- 229940046836 anti-estrogen Drugs 0.000 description 1
- 230000001833 anti-estrogenic effect Effects 0.000 description 1
- 230000005809 anti-tumor immunity Effects 0.000 description 1
- 239000000611 antibody drug conjugate Substances 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 229910052787 antimony Inorganic materials 0.000 description 1
- 229940045985 antineoplastic platinum compound Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 239000000074 antisense oligonucleotide Substances 0.000 description 1
- 238000012230 antisense oligonucleotides Methods 0.000 description 1
- 210000000436 anus Anatomy 0.000 description 1
- 210000002413 aortic body Anatomy 0.000 description 1
- IOASYARYEYRREA-LQAJYKIKSA-N aphidicolin glycinate Chemical compound C1[C@]23[C@]4(C)CC[C@H](O)[C@](C)(CO)[C@H]4CC[C@@H]3C[C@@H]1[C@@](COC(=O)CN)(O)CC2 IOASYARYEYRREA-LQAJYKIKSA-N 0.000 description 1
- 201000007436 apocrine adenocarcinoma Diseases 0.000 description 1
- 201000005130 apocrine adenoma Diseases 0.000 description 1
- 229940076005 apoptosis modulator Drugs 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 108010055530 arginyl-tryptophyl-N-methylphenylalanyl-tryptophyl-leucyl-methioninamide Proteins 0.000 description 1
- 125000000732 arylene group Chemical group 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229960003272 asparaginase Drugs 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-M asparaginate Chemical compound [O-]C(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-M 0.000 description 1
- 229910052789 astatine Inorganic materials 0.000 description 1
- TWHSQQYCDVSBRK-UHFFFAOYSA-N asulacrine Chemical compound C12=CC=CC(C)=C2N=C2C(C(=O)NC)=CC=CC2=C1NC1=CC=C(NS(C)(=O)=O)C=C1OC TWHSQQYCDVSBRK-UHFFFAOYSA-N 0.000 description 1
- 229950011088 asulacrine Drugs 0.000 description 1
- 229950006933 atrimustine Drugs 0.000 description 1
- 229960002756 azacitidine Drugs 0.000 description 1
- OPWOOOGFNULJAQ-UHFFFAOYSA-L azane;cyclopentanamine;2-hydroxybutanedioate;platinum(2+) Chemical compound N.[Pt+2].NC1CCCC1.[O-]C(=O)C(O)CC([O-])=O OPWOOOGFNULJAQ-UHFFFAOYSA-L 0.000 description 1
- KLNFSAOEKUDMFA-UHFFFAOYSA-N azanide;2-hydroxyacetic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OCC(O)=O KLNFSAOEKUDMFA-UHFFFAOYSA-N 0.000 description 1
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 1
- 229950005951 azasetron Drugs 0.000 description 1
- HRXVDDOKERXBEY-UHFFFAOYSA-N azatepa Chemical compound C1CN1P(=O)(N1CC1)N(CC)C1=NN=CS1 HRXVDDOKERXBEY-UHFFFAOYSA-N 0.000 description 1
- MIXLRUYCYZPSOQ-HXPMCKFVSA-N azatoxin Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=C(C4=CC=CC=C4N3)C[C@@H]3N2C(OC3)=O)=C1 MIXLRUYCYZPSOQ-HXPMCKFVSA-N 0.000 description 1
- 150000001540 azides Chemical class 0.000 description 1
- 229950004295 azotomycin Drugs 0.000 description 1
- 150000004200 baccatin III derivatives Chemical class 0.000 description 1
- XYUFCXJZFZPEJD-PGRDOPGGSA-N balanol Chemical compound OC(=O)C1=CC=CC(O)=C1C(=O)C1=C(O)C=C(C(=O)O[C@H]2[C@H](CNCCC2)NC(=O)C=2C=CC(O)=CC=2)C=C1O XYUFCXJZFZPEJD-PGRDOPGGSA-N 0.000 description 1
- 201000000036 balloon cell malignant melanoma Diseases 0.000 description 1
- 238000002869 basic local alignment search tool Methods 0.000 description 1
- 208000012999 benign epithelial neoplasm Diseases 0.000 description 1
- 208000021592 benign granular cell tumor Diseases 0.000 description 1
- 208000023028 benign synovial neoplasm Diseases 0.000 description 1
- RFRXIWQYSOIBDI-UHFFFAOYSA-N benzarone Chemical compound CCC=1OC2=CC=CC=C2C=1C(=O)C1=CC=C(O)C=C1 RFRXIWQYSOIBDI-UHFFFAOYSA-N 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 229950005567 benzodepa Drugs 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- QRUDEWIWKLJBPS-UHFFFAOYSA-N benzotriazole Chemical compound C1=CC=C2N[N][N]C2=C1 QRUDEWIWKLJBPS-UHFFFAOYSA-N 0.000 description 1
- 239000012964 benzotriazole Substances 0.000 description 1
- MMIMIFULGMZVPO-UHFFFAOYSA-N benzyl 3-bromo-2,6-dinitro-5-phenylmethoxybenzoate Chemical compound [O-][N+](=O)C1=C(C(=O)OCC=2C=CC=CC=2)C([N+](=O)[O-])=C(Br)C=C1OCC1=CC=CC=C1 MMIMIFULGMZVPO-UHFFFAOYSA-N 0.000 description 1
- VFIUCBTYGKMLCM-UHFFFAOYSA-N benzyl n-[bis(aziridin-1-yl)phosphoryl]carbamate Chemical compound C=1C=CC=CC=1COC(=O)NP(=O)(N1CC1)N1CC1 VFIUCBTYGKMLCM-UHFFFAOYSA-N 0.000 description 1
- 230000005266 beta plus decay Effects 0.000 description 1
- 229940000635 beta-alanine Drugs 0.000 description 1
- 150000001576 beta-amino acids Chemical class 0.000 description 1
- QGJZLNKBHJESQX-FZFNOLFKSA-N betulinic acid Chemical compound C1C[C@H](O)C(C)(C)[C@@H]2CC[C@@]3(C)[C@]4(C)CC[C@@]5(C(O)=O)CC[C@@H](C(=C)C)[C@@H]5[C@H]4CC[C@@H]3[C@]21C QGJZLNKBHJESQX-FZFNOLFKSA-N 0.000 description 1
- 229960000997 bicalutamide Drugs 0.000 description 1
- 210000003445 biliary tract Anatomy 0.000 description 1
- 230000002051 biphasic effect Effects 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- QKSKPIVNLNLAAV-UHFFFAOYSA-N bis(2-chloroethyl) sulfide Chemical compound ClCCSCCCl QKSKPIVNLNLAAV-UHFFFAOYSA-N 0.000 description 1
- 229950008548 bisantrene Drugs 0.000 description 1
- 229950006844 bizelesin Drugs 0.000 description 1
- 201000001531 bladder carcinoma Diseases 0.000 description 1
- 201000011177 bladder transitional cell papilloma Diseases 0.000 description 1
- 229960004395 bleomycin sulfate Drugs 0.000 description 1
- 208000016738 bone Paget disease Diseases 0.000 description 1
- 201000011143 bone giant cell tumor Diseases 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 1
- 125000005620 boronic acid group Chemical group 0.000 description 1
- 210000000133 brain stem Anatomy 0.000 description 1
- 235000008429 bread Nutrition 0.000 description 1
- 201000003714 breast lobular carcinoma Diseases 0.000 description 1
- 201000010987 breast neuroendocrine neoplasm Diseases 0.000 description 1
- 210000004190 broad ligament Anatomy 0.000 description 1
- 210000003123 bronchiole Anatomy 0.000 description 1
- 201000002143 bronchus adenoma Diseases 0.000 description 1
- 210000005178 buccal mucosa Anatomy 0.000 description 1
- 108700002839 cactinomycin Proteins 0.000 description 1
- 229950009908 cactinomycin Drugs 0.000 description 1
- LWQQLNNNIPYSNX-UROSTWAQSA-N calcipotriol Chemical compound C1([C@H](O)/C=C/[C@@H](C)[C@@H]2[C@]3(CCCC(/[C@@H]3CC2)=C\C=C\2C([C@@H](O)C[C@H](O)C/2)=C)C)CC1 LWQQLNNNIPYSNX-UROSTWAQSA-N 0.000 description 1
- 229960002882 calcipotriol Drugs 0.000 description 1
- 229960005084 calcitriol Drugs 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- LSUTUUOITDQYNO-UHFFFAOYSA-N calphostin C Chemical compound C=12C3=C4C(CC(C)OC(=O)C=5C=CC=CC=5)=C(OC)C(O)=C(C(C=C5OC)=O)C4=C5C=1C(OC)=CC(=O)C2=C(O)C(OC)=C3CC(C)OC(=O)OC1=CC=C(O)C=C1 LSUTUUOITDQYNO-UHFFFAOYSA-N 0.000 description 1
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical class C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- 208000001969 capillary hemangioma Diseases 0.000 description 1
- 201000007163 capillary lymphangioma Diseases 0.000 description 1
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 1
- 229960004562 carboplatin Drugs 0.000 description 1
- WNRZHQBJSXRYJK-UHFFFAOYSA-N carboxyamidotriazole Chemical compound NC1=C(C(=O)N)N=NN1CC(C=C1Cl)=CC(Cl)=C1C(=O)C1=CC=C(Cl)C=C1 WNRZHQBJSXRYJK-UHFFFAOYSA-N 0.000 description 1
- 125000002057 carboxymethyl group Chemical group [H]OC(=O)C([H])([H])[*] 0.000 description 1
- XREUEWVEMYWFFA-CSKJXFQVSA-N carminomycin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=C(O)C=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XREUEWVEMYWFFA-CSKJXFQVSA-N 0.000 description 1
- 229960005243 carmustine Drugs 0.000 description 1
- 230000008355 cartilage degradation Effects 0.000 description 1
- 229950001725 carubicin Drugs 0.000 description 1
- BBZDXMBRAFTCAA-AREMUKBSSA-N carzelesin Chemical compound C1=2NC=C(C)C=2C([C@H](CCl)CN2C(=O)C=3NC4=CC=C(C=C4C=3)NC(=O)C3=CC4=CC=C(C=C4O3)N(CC)CC)=C2C=C1OC(=O)NC1=CC=CC=C1 BBZDXMBRAFTCAA-AREMUKBSSA-N 0.000 description 1
- 229950007509 carzelesin Drugs 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 210000003164 cauda equina Anatomy 0.000 description 1
- 210000004534 cecum Anatomy 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 201000003340 cellular leiomyoma Diseases 0.000 description 1
- 201000010882 cellular myxoid liposarcoma Diseases 0.000 description 1
- 210000004718 centriole Anatomy 0.000 description 1
- 235000013339 cereals Nutrition 0.000 description 1
- 210000001638 cerebellum Anatomy 0.000 description 1
- 208000019065 cervical carcinoma Diseases 0.000 description 1
- 210000005023 cervical esophagus Anatomy 0.000 description 1
- 239000012986 chain transfer agent Substances 0.000 description 1
- 150000004697 chelate complex Chemical class 0.000 description 1
- OWSKEUBOCMEJMI-KPXOXKRLSA-N chembl2105946 Chemical compound [N-]=[N+]=CC(=O)CC[C@H](NC(=O)[C@@H](N)C)C(=O)N[C@H](CCC(=O)C=[N+]=[N-])C(O)=O OWSKEUBOCMEJMI-KPXOXKRLSA-N 0.000 description 1
- UKTAZPQNNNJVKR-KJGYPYNMSA-N chembl2368925 Chemical compound C1=CC=C2C(C(O[C@@H]3C[C@@H]4C[C@H]5C[C@@H](N4CC5=O)C3)=O)=CNC2=C1 UKTAZPQNNNJVKR-KJGYPYNMSA-N 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 229960004630 chlorambucil Drugs 0.000 description 1
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 1
- 201000008863 chondroblastic osteosarcoma Diseases 0.000 description 1
- 210000003161 choroid Anatomy 0.000 description 1
- 229910052804 chromium Inorganic materials 0.000 description 1
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 1
- 201000006778 chronic monocytic leukemia Diseases 0.000 description 1
- 201000010902 chronic myelomonocytic leukemia Diseases 0.000 description 1
- 201000010903 chronic neutrophilic leukemia Diseases 0.000 description 1
- ARUGKOZUKWAXDS-SEWALLKFSA-N cicaprost Chemical compound C1\C(=C/COCC(O)=O)C[C@@H]2[C@@H](C#C[C@@H](O)[C@@H](C)CC#CCC)[C@H](O)C[C@@H]21 ARUGKOZUKWAXDS-SEWALLKFSA-N 0.000 description 1
- 229950000634 cicaprost Drugs 0.000 description 1
- 210000004240 ciliary body Anatomy 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- JKNIRLKHOOMGOJ-UHFFFAOYSA-N cladochrome D Natural products COC1=C(CC(C)OC(=O)Oc2ccc(O)cc2)c3c4C(=C(OC)C(=O)c5c(O)cc(OC)c(c45)c6c(OC)cc(O)c(C1=O)c36)CC(C)OC(=O)c7ccc(O)cc7 JKNIRLKHOOMGOJ-UHFFFAOYSA-N 0.000 description 1
- SRJYZPCBWDVSGO-UHFFFAOYSA-N cladochrome E Natural products COC1=CC(O)=C(C(C(OC)=C(CC(C)OC(=O)OC=2C=CC(O)=CC=2)C2=3)=O)C2=C1C1=C(OC)C=C(O)C(C(C=2OC)=O)=C1C=3C=2CC(C)OC(=O)C1=CC=CC=C1 SRJYZPCBWDVSGO-UHFFFAOYSA-N 0.000 description 1
- 229960002436 cladribine Drugs 0.000 description 1
- 210000003109 clavicle Anatomy 0.000 description 1
- 201000000898 clear cell adenofibroma Diseases 0.000 description 1
- 201000002141 clear cell adenoma Diseases 0.000 description 1
- 201000000292 clear cell sarcoma Diseases 0.000 description 1
- 210000003029 clitoris Anatomy 0.000 description 1
- GKIRPKYJQBWNGO-OCEACIFDSA-N clomifene Chemical class C1=CC(OCCN(CC)CC)=CC=C1C(\C=1C=CC=CC=1)=C(\Cl)C1=CC=CC=C1 GKIRPKYJQBWNGO-OCEACIFDSA-N 0.000 description 1
- 229960004022 clotrimazole Drugs 0.000 description 1
- VNFPBHJOKIVQEB-UHFFFAOYSA-N clotrimazole Chemical compound ClC1=CC=CC=C1C(N1C=NC=C1)(C=1C=CC=CC=1)C1=CC=CC=C1 VNFPBHJOKIVQEB-UHFFFAOYSA-N 0.000 description 1
- 210000000860 cochlear nerve Anatomy 0.000 description 1
- 230000011382 collagen catabolic process Effects 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 208000011588 combined hepatocellular carcinoma and cholangiocarcinoma Diseases 0.000 description 1
- 229960005537 combretastatin A-4 Drugs 0.000 description 1
- HVXBOLULGPECHP-UHFFFAOYSA-N combretastatin A4 Natural products C1=C(O)C(OC)=CC=C1C=CC1=CC(OC)=C(OC)C(OC)=C1 HVXBOLULGPECHP-UHFFFAOYSA-N 0.000 description 1
- 150000004814 combretastatins Chemical class 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 230000001010 compromised effect Effects 0.000 description 1
- 238000013170 computed tomography imaging Methods 0.000 description 1
- 210000000795 conjunctiva Anatomy 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 210000004246 corpus luteum Anatomy 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 230000001054 cortical effect Effects 0.000 description 1
- 210000003792 cranial nerve Anatomy 0.000 description 1
- PSNOPSMXOBPNNV-VVCTWANISA-N cryptophycin 1 Chemical class C1=C(Cl)C(OC)=CC=C1C[C@@H]1C(=O)NC[C@@H](C)C(=O)O[C@@H](CC(C)C)C(=O)O[C@H]([C@H](C)[C@@H]2[C@H](O2)C=2C=CC=CC=2)C/C=C/C(=O)N1 PSNOPSMXOBPNNV-VVCTWANISA-N 0.000 description 1
- 108010090203 cryptophycin 8 Proteins 0.000 description 1
- 208000017563 cutaneous Paget disease Diseases 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 208000031513 cyst Diseases 0.000 description 1
- 208000002445 cystadenocarcinoma Diseases 0.000 description 1
- 208000007321 cystadenofibroma Diseases 0.000 description 1
- 208000014014 cystic hygroma Diseases 0.000 description 1
- 208000003688 cystic lymphangioma Diseases 0.000 description 1
- 208000012106 cystic neoplasm Diseases 0.000 description 1
- 230000001461 cytolytic effect Effects 0.000 description 1
- 210000005220 cytoplasmic tail Anatomy 0.000 description 1
- 229940104302 cytosine Drugs 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- YCWXIQRLONXJLF-PFFGJIDWSA-N d06307 Chemical compound OS(O)(=O)=O.C([C@]1([C@@H]2O1)CC)N(CCC=1C3=CC=CC=C3NC=11)C[C@H]2C[C@]1(C(=O)OC)C1=CC([C@]23[C@H]([C@@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC.C([C@]1([C@@H]2O1)CC)N(CCC=1C3=CC=CC=C3NC=11)C[C@H]2C[C@]1(C(=O)OC)C1=CC([C@]23[C@H]([C@@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC YCWXIQRLONXJLF-PFFGJIDWSA-N 0.000 description 1
- 229960003901 dacarbazine Drugs 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- 229960003109 daunorubicin hydrochloride Drugs 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 229960003603 decitabine Drugs 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 229960003266 deferiprone Drugs 0.000 description 1
- CYQFCXCEBYINGO-IAGOWNOFSA-N delta1-THC Chemical compound C1=C(C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@@H]21 CYQFCXCEBYINGO-IAGOWNOFSA-N 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 229960005408 deslorelin Drugs 0.000 description 1
- 108700025485 deslorelin Proteins 0.000 description 1
- 201000006827 desmoid tumor Diseases 0.000 description 1
- VPOCYEOOFRNHNL-RQDPQJJXSA-J dexormaplatin Chemical compound Cl[Pt](Cl)(Cl)Cl.N[C@@H]1CCCC[C@H]1N VPOCYEOOFRNHNL-RQDPQJJXSA-J 0.000 description 1
- 229950001640 dexormaplatin Drugs 0.000 description 1
- 229960000605 dexrazoxane Drugs 0.000 description 1
- SGTNSNPWRIOYBX-HHHXNRCGSA-N dexverapamil Chemical compound C1=C(OC)C(OC)=CC=C1CCN(C)CCC[C@@](C#N)(C(C)C)C1=CC=C(OC)C(OC)=C1 SGTNSNPWRIOYBX-HHHXNRCGSA-N 0.000 description 1
- 229950005878 dexverapamil Drugs 0.000 description 1
- 229950010621 dezaguanine Drugs 0.000 description 1
- WVYXNIXAMZOZFK-UHFFFAOYSA-N diaziquone Chemical compound O=C1C(NC(=O)OCC)=C(N2CC2)C(=O)C(NC(=O)OCC)=C1N1CC1 WVYXNIXAMZOZFK-UHFFFAOYSA-N 0.000 description 1
- 229950002389 diaziquone Drugs 0.000 description 1
- KYHUYMLIVQFXRI-UHFFFAOYSA-N didemnin B Natural products CC1OC(=O)C(CC=2C=CC(OC)=CC=2)N(C)C(=O)C2CCCN2C(=O)C(CC(C)C)NC(=O)C(C)C(=O)C(C(C)C)OC(=O)CC(O)C(C(C)CC)NC(=O)C1NC(=O)C(CC(C)C)N(C)C(=O)C1CCCN1C(=O)C(C)O KYHUYMLIVQFXRI-UHFFFAOYSA-N 0.000 description 1
- 108010061297 didemnins Proteins 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 206010012818 diffuse large B-cell lymphoma Diseases 0.000 description 1
- 210000002249 digestive system Anatomy 0.000 description 1
- 150000004683 dihydrates Chemical class 0.000 description 1
- PZXJOHSZQAEJFE-UHFFFAOYSA-N dihydrobetulinic acid Natural products C1CC(O)C(C)(C)C2CCC3(C)C4(C)CCC5(C(O)=O)CCC(C(C)C)C5C4CCC3C21C PZXJOHSZQAEJFE-UHFFFAOYSA-N 0.000 description 1
- KCFYHBSOLOXZIF-UHFFFAOYSA-N dihydrochrysin Natural products COC1=C(O)C(OC)=CC(C2OC3=CC(O)=CC(O)=C3C(=O)C2)=C1 KCFYHBSOLOXZIF-UHFFFAOYSA-N 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- SVJSWELRJWVPQD-KJWOGLQMSA-L disodium;(2s)-2-[[4-[2-[(6r)-2-amino-4-oxo-5,6,7,8-tetrahydro-1h-pyrido[2,3-d]pyrimidin-6-yl]ethyl]benzoyl]amino]pentanedioate Chemical compound [Na+].[Na+].C([C@@H]1CC=2C(=O)N=C(NC=2NC1)N)CC1=CC=C(C(=O)N[C@@H](CCC([O-])=O)C([O-])=O)C=C1 SVJSWELRJWVPQD-KJWOGLQMSA-L 0.000 description 1
- 150000004662 dithiols Chemical class 0.000 description 1
- 229960003668 docetaxel Drugs 0.000 description 1
- 229960000735 docosanol Drugs 0.000 description 1
- 229960003413 dolasetron Drugs 0.000 description 1
- BJAJDJDODCWPNS-UHFFFAOYSA-N dotp Chemical compound O=C1N2CCOC2=NC2=C1SC=C2 BJAJDJDODCWPNS-UHFFFAOYSA-N 0.000 description 1
- 230000003828 downregulation Effects 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 229960002918 doxorubicin hydrochloride Drugs 0.000 description 1
- 229950004203 droloxifene Drugs 0.000 description 1
- NOTIQUSPUUHHEH-UXOVVSIBSA-N dromostanolone propionate Chemical compound C([C@@H]1CC2)C(=O)[C@H](C)C[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H](OC(=O)CC)[C@@]2(C)CC1 NOTIQUSPUUHHEH-UXOVVSIBSA-N 0.000 description 1
- 229960004242 dronabinol Drugs 0.000 description 1
- 229950004683 drostanolone propionate Drugs 0.000 description 1
- 238000002651 drug therapy Methods 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 229950005133 duazomycin Drugs 0.000 description 1
- 229930192837 duazomycin Natural products 0.000 description 1
- 208000028715 ductal breast carcinoma in situ Diseases 0.000 description 1
- VQNATVDKACXKTF-XELLLNAOSA-N duocarmycin Chemical compound COC1=C(OC)C(OC)=C2NC(C(=O)N3C4=CC(=O)C5=C([C@@]64C[C@@H]6C3)C=C(N5)C(=O)OC)=CC2=C1 VQNATVDKACXKTF-XELLLNAOSA-N 0.000 description 1
- 229960005510 duocarmycin SA Drugs 0.000 description 1
- 210000001198 duodenum Anatomy 0.000 description 1
- 210000000883 ear external Anatomy 0.000 description 1
- 210000000959 ear middle Anatomy 0.000 description 1
- 229950005678 ecomustine Drugs 0.000 description 1
- FSIRXIHZBIXHKT-MHTVFEQDSA-N edatrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CC(CC)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FSIRXIHZBIXHKT-MHTVFEQDSA-N 0.000 description 1
- 229950006700 edatrexate Drugs 0.000 description 1
- 229960001776 edrecolomab Drugs 0.000 description 1
- 229960002046 eflornithine hydrochloride Drugs 0.000 description 1
- 230000005264 electron capture Effects 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- MGQRRMONVLMKJL-KWJIQSIXSA-N elsamitrucin Chemical compound O1[C@H](C)[C@H](O)[C@H](OC)[C@@H](N)[C@H]1O[C@@H]1[C@](O)(C)[C@@H](O)[C@@H](C)O[C@H]1OC1=CC=CC2=C(O)C(C(O3)=O)=C4C5=C3C=CC(C)=C5C(=O)OC4=C12 MGQRRMONVLMKJL-KWJIQSIXSA-N 0.000 description 1
- 230000002124 endocrine Effects 0.000 description 1
- 208000001991 endodermal sinus tumor Diseases 0.000 description 1
- 201000000330 endometrial stromal sarcoma Diseases 0.000 description 1
- 208000028730 endometrioid adenocarcinoma Diseases 0.000 description 1
- 208000029179 endometrioid stromal sarcoma Diseases 0.000 description 1
- 210000004696 endometrium Anatomy 0.000 description 1
- JOZGNYDSEBIJDH-UHFFFAOYSA-N eniluracil Chemical compound O=C1NC=C(C#C)C(=O)N1 JOZGNYDSEBIJDH-UHFFFAOYSA-N 0.000 description 1
- 229950001022 enpromate Drugs 0.000 description 1
- 210000000918 epididymis Anatomy 0.000 description 1
- 201000010063 epididymitis Diseases 0.000 description 1
- 210000002409 epiglottis Anatomy 0.000 description 1
- 208000001606 epiglottitis Diseases 0.000 description 1
- 229960001904 epirubicin Drugs 0.000 description 1
- 229960003265 epirubicin hydrochloride Drugs 0.000 description 1
- 208000037828 epithelial carcinoma Diseases 0.000 description 1
- 210000003237 epithelioid cell Anatomy 0.000 description 1
- 208000011524 epithelioid cell nevus Diseases 0.000 description 1
- 201000002658 epithelioid leiomyosarcoma Diseases 0.000 description 1
- 229950009537 epristeride Drugs 0.000 description 1
- 229950001426 erbulozole Drugs 0.000 description 1
- KLEPCGBEXOCIGS-QPPBQGQZSA-N erbulozole Chemical compound C1=CC(NC(=O)OCC)=CC=C1SC[C@@H]1O[C@@](CN2C=NC=C2)(C=2C=CC(OC)=CC=2)OC1 KLEPCGBEXOCIGS-QPPBQGQZSA-N 0.000 description 1
- 231100000321 erythema Toxicity 0.000 description 1
- 229960001842 estramustine Drugs 0.000 description 1
- 229960001766 estramustine phosphate sodium Drugs 0.000 description 1
- IIUMCNJTGSMNRO-VVSKJQCTSA-L estramustine sodium phosphate Chemical compound [Na+].[Na+].ClCCN(CCCl)C(=O)OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)OP([O-])([O-])=O)[C@@H]4[C@@H]3CCC2=C1 IIUMCNJTGSMNRO-VVSKJQCTSA-L 0.000 description 1
- AFAXGSQYZLGZPG-UHFFFAOYSA-N ethanedisulfonic acid Chemical compound OS(=O)(=O)CCS(O)(=O)=O AFAXGSQYZLGZPG-UHFFFAOYSA-N 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- 210000001180 ethmoid sinus Anatomy 0.000 description 1
- XPGDODOEEWLHOI-GSDHBNRESA-N ethyl (2s)-2-[[(2s)-2-[[(2s)-2-amino-3-(4-fluorophenyl)propanoyl]amino]-3-[3-[bis(2-chloroethyl)amino]phenyl]propanoyl]amino]-4-methylsulfanylbutanoate Chemical compound C([C@@H](C(=O)N[C@@H](CCSC)C(=O)OCC)NC(=O)[C@@H](N)CC=1C=CC(F)=CC=1)C1=CC=CC(N(CCCl)CCCl)=C1 XPGDODOEEWLHOI-GSDHBNRESA-N 0.000 description 1
- 235000019439 ethyl acetate Nutrition 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 229960000255 exemestane Drugs 0.000 description 1
- 201000010934 exostosis Diseases 0.000 description 1
- 210000002603 extrahepatic bile duct Anatomy 0.000 description 1
- 210000003414 extremity Anatomy 0.000 description 1
- 210000003054 facial bone Anatomy 0.000 description 1
- 229950011548 fadrozole Drugs 0.000 description 1
- 210000001752 female genitalia Anatomy 0.000 description 1
- 210000005002 female reproductive tract Anatomy 0.000 description 1
- 229950003662 fenretinide Drugs 0.000 description 1
- 201000010009 fetal adenoma Diseases 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 208000020336 fibromyxoid tumor Diseases 0.000 description 1
- 230000000893 fibroproliferative effect Effects 0.000 description 1
- 201000003671 fibrosarcomatous osteosarcoma Diseases 0.000 description 1
- 201000006986 fibrous meningioma Diseases 0.000 description 1
- DBEPLOCGEIEOCV-WSBQPABSSA-N finasteride Chemical compound N([C@@H]1CC2)C(=O)C=C[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H](C(=O)NC(C)(C)C)[C@@]2(C)CC1 DBEPLOCGEIEOCV-WSBQPABSSA-N 0.000 description 1
- 229960004039 finasteride Drugs 0.000 description 1
- 238000009093 first-line therapy Methods 0.000 description 1
- 230000004992 fission Effects 0.000 description 1
- 229960000961 floxuridine Drugs 0.000 description 1
- ODKNJVUHOIMIIZ-RRKCRQDMSA-N floxuridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(F)=C1 ODKNJVUHOIMIIZ-RRKCRQDMSA-N 0.000 description 1
- 229960000390 fludarabine Drugs 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- 229950004217 forfenimex Drugs 0.000 description 1
- 229960004421 formestane Drugs 0.000 description 1
- OSVMTWJCGUFAOD-KZQROQTASA-N formestane Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CCC2=C1O OSVMTWJCGUFAOD-KZQROQTASA-N 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 229960004783 fotemustine Drugs 0.000 description 1
- YAKWPXVTIGTRJH-UHFFFAOYSA-N fotemustine Chemical compound CCOP(=O)(OCC)C(C)NC(=O)N(CCCl)N=O YAKWPXVTIGTRJH-UHFFFAOYSA-N 0.000 description 1
- 210000001652 frontal lobe Anatomy 0.000 description 1
- 210000001214 frontal sinus Anatomy 0.000 description 1
- KXTYBXCEQOANSX-WYKQKOHHSA-N fusicoccin Chemical compound O([C@H]1[C@H](O)[C@H](C)[C@@H]\2CC[C@@H](C/2=C/[C@@]2(C)[C@@H](O)CC(=C21)[C@H](C)COC(C)=O)COC)[C@H]1O[C@H](COC(C)(C)C=C)[C@@H](O)[C@H](OC(C)=O)[C@H]1O KXTYBXCEQOANSX-WYKQKOHHSA-N 0.000 description 1
- UIWYJDYFSGRHKR-UHFFFAOYSA-N gadolinium atom Chemical compound [Gd] UIWYJDYFSGRHKR-UHFFFAOYSA-N 0.000 description 1
- 210000000232 gallbladder Anatomy 0.000 description 1
- 229910052733 gallium Inorganic materials 0.000 description 1
- 229940044658 gallium nitrate Drugs 0.000 description 1
- 229950004410 galocitabine Drugs 0.000 description 1
- GJNXBNATEDXMAK-PFLSVRRQSA-N ganirelix Chemical compound C([C@@H](C(=O)N[C@H](CCCCN=C(NCC)NCC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN=C(NCC)NCC)C(=O)N1[C@@H](CCC1)C(=O)N[C@H](C)C(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](CC=1C=NC=CC=1)NC(=O)[C@@H](CC=1C=CC(Cl)=CC=1)NC(=O)[C@@H](CC=1C=C2C=CC=CC2=CC=1)NC(C)=O)C1=CC=C(O)C=C1 GJNXBNATEDXMAK-PFLSVRRQSA-N 0.000 description 1
- 108700032141 ganirelix Proteins 0.000 description 1
- 229960003794 ganirelix Drugs 0.000 description 1
- 208000010749 gastric carcinoma Diseases 0.000 description 1
- 210000002599 gastric fundus Anatomy 0.000 description 1
- SSBRJDBGIVUNDK-QOGDCIHTSA-N gastrin-14 Chemical compound C([C@@H](C(=O)NCC(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CC=1C2=CC=CC=C2NC=1)C1=CC=C(O)C=C1 SSBRJDBGIVUNDK-QOGDCIHTSA-N 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 239000002406 gelatinase inhibitor Substances 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- 229960005144 gemcitabine hydrochloride Drugs 0.000 description 1
- 201000011610 giant cell glioblastoma Diseases 0.000 description 1
- 210000004907 gland Anatomy 0.000 description 1
- 210000003904 glomerular cell Anatomy 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 230000002710 gonadal effect Effects 0.000 description 1
- 208000003064 gonadoblastoma Diseases 0.000 description 1
- 208000030316 grade III meningioma Diseases 0.000 description 1
- 201000007574 granular cell carcinoma Diseases 0.000 description 1
- 201000009277 hairy cell leukemia Diseases 0.000 description 1
- 208000009117 halo nevus Diseases 0.000 description 1
- 210000001983 hard palate Anatomy 0.000 description 1
- 201000000615 hard palate cancer Diseases 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 239000001307 helium Substances 0.000 description 1
- 229910052734 helium Inorganic materials 0.000 description 1
- SWQJXJOGLNCZEY-UHFFFAOYSA-N helium atom Chemical class [He] SWQJXJOGLNCZEY-UHFFFAOYSA-N 0.000 description 1
- 201000002222 hemangioblastoma Diseases 0.000 description 1
- 210000000777 hematopoietic system Anatomy 0.000 description 1
- 210000004024 hepatic stellate cell Anatomy 0.000 description 1
- UUVWYPNAQBNQJQ-UHFFFAOYSA-N hexamethylmelamine Chemical compound CN(C)C1=NC(N(C)C)=NC(N(C)C)=N1 UUVWYPNAQBNQJQ-UHFFFAOYSA-N 0.000 description 1
- 208000027833 hibernoma Diseases 0.000 description 1
- 201000005133 hidradenoma Diseases 0.000 description 1
- 208000029824 high grade glioma Diseases 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 229940084986 human chorionic gonadotropin Drugs 0.000 description 1
- SOCGJDYHNGLZEC-UHFFFAOYSA-N hydron;n-methyl-n-[4-[(7-methyl-3h-imidazo[4,5-f]quinolin-9-yl)amino]phenyl]acetamide;chloride Chemical compound Cl.C1=CC(N(C(C)=O)C)=CC=C1NC1=CC(C)=NC2=CC=C(NC=N3)C3=C12 SOCGJDYHNGLZEC-UHFFFAOYSA-N 0.000 description 1
- 125000002887 hydroxy group Chemical class [H]O* 0.000 description 1
- 229960001330 hydroxycarbamide Drugs 0.000 description 1
- MPGWGYQTRSNGDD-UHFFFAOYSA-N hypericin Chemical compound OC1=CC(O)=C(C2=O)C3=C1C1C(O)=CC(=O)C(C4=O)=C1C1=C3C3=C2C(O)=CC(C)=C3C2=C1C4=C(O)C=C2C MPGWGYQTRSNGDD-UHFFFAOYSA-N 0.000 description 1
- 229940005608 hypericin Drugs 0.000 description 1
- PHOKTTKFQUYZPI-UHFFFAOYSA-N hypericin Natural products Cc1cc(O)c2c3C(=O)C(=Cc4c(O)c5c(O)cc(O)c6c7C(=O)C(=Cc8c(C)c1c2c(c78)c(c34)c56)O)O PHOKTTKFQUYZPI-UHFFFAOYSA-N 0.000 description 1
- 230000001969 hypertrophic effect Effects 0.000 description 1
- 229960005236 ibandronic acid Drugs 0.000 description 1
- 229960001176 idarubicin hydrochloride Drugs 0.000 description 1
- 229950002248 idoxifene Drugs 0.000 description 1
- 229960001101 ifosfamide Drugs 0.000 description 1
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 1
- 210000003405 ileum Anatomy 0.000 description 1
- NITYDPDXAAFEIT-DYVFJYSZSA-N ilomastat Chemical compound C1=CC=C2C(C[C@@H](C(=O)NC)NC(=O)[C@H](CC(C)C)CC(=O)NO)=CNC2=C1 NITYDPDXAAFEIT-DYVFJYSZSA-N 0.000 description 1
- 229960003696 ilomastat Drugs 0.000 description 1
- 239000012216 imaging agent Substances 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 229960002751 imiquimod Drugs 0.000 description 1
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical compound C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 230000003308 immunostimulating effect Effects 0.000 description 1
- 229940051026 immunotoxin Drugs 0.000 description 1
- 230000002637 immunotoxin Effects 0.000 description 1
- 239000002596 immunotoxin Substances 0.000 description 1
- 231100000608 immunotoxin Toxicity 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 201000008600 infiltrating lipoma Diseases 0.000 description 1
- 210000004969 inflammatory cell Anatomy 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 201000004472 intracystic papillary adenoma Diseases 0.000 description 1
- 208000007098 intradermal nevus Diseases 0.000 description 1
- 210000003228 intrahepatic bile duct Anatomy 0.000 description 1
- 201000009370 intramuscular hemangioma Diseases 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- 206010073095 invasive ductal breast carcinoma Diseases 0.000 description 1
- 201000010985 invasive ductal carcinoma Diseases 0.000 description 1
- 206010073096 invasive lobular breast carcinoma Diseases 0.000 description 1
- 201000010151 inverted papilloma Diseases 0.000 description 1
- 150000002496 iodine Chemical class 0.000 description 1
- 230000005865 ionizing radiation Effects 0.000 description 1
- 229950010897 iproplatin Drugs 0.000 description 1
- 229910052741 iridium Inorganic materials 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- 229960000779 irinotecan hydrochloride Drugs 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 210000004153 islets of langerhan Anatomy 0.000 description 1
- 239000012948 isocyanate Substances 0.000 description 1
- 150000002513 isocyanates Chemical class 0.000 description 1
- WVWWZNXKZNACRW-MRQXMKSQSA-N isohomohalichondrin b Chemical compound O([C@@H]1[C@@H](C)[C@@H]2O[C@@H]3C[C@]4(C[C@@H]5O[C@@]6(O[C@H]7C[C@@H](O)[C@@H](CC(=O)CCO)O[C@H]7[C@@H](C)C6)C[C@@H]([C@@H]5O4)C)O[C@@H]3C[C@@H]2O[C@H]1C[C@@H]1C(=C)[C@H](C)C[C@@H](O1)CC[C@H]1C(=C)C[C@@H](O1)CC1)C(=O)C[C@H](O2)CC[C@H]3[C@H]2[C@H](O2)[C@@H]4O[C@@H]5C[C@@]21O[C@@H]5[C@@H]4O3 WVWWZNXKZNACRW-MRQXMKSQSA-N 0.000 description 1
- QRXWMOHMRWLFEY-UHFFFAOYSA-N isoniazide Chemical compound NNC(=O)C1=CC=NC=C1 QRXWMOHMRWLFEY-UHFFFAOYSA-N 0.000 description 1
- GQWYWHOHRVVHAP-DHKPLNAMSA-N jaspamide Chemical compound C1([C@@H]2NC(=O)[C@@H](CC=3C4=CC=CC=C4NC=3Br)N(C)C(=O)[C@H](C)NC(=O)[C@@H](C)C/C(C)=C/[C@H](C)C[C@@H](OC(=O)C2)C)=CC=C(O)C=C1 GQWYWHOHRVVHAP-DHKPLNAMSA-N 0.000 description 1
- 108010052440 jasplakinolide Proteins 0.000 description 1
- GQWYWHOHRVVHAP-UHFFFAOYSA-N jasplakinolide Natural products C1C(=O)OC(C)CC(C)C=C(C)CC(C)C(=O)NC(C)C(=O)N(C)C(CC=2C3=CC=CC=C3NC=2Br)C(=O)NC1C1=CC=C(O)C=C1 GQWYWHOHRVVHAP-UHFFFAOYSA-N 0.000 description 1
- 210000001630 jejunum Anatomy 0.000 description 1
- 230000003780 keratinization Effects 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 229940043355 kinase inhibitor Drugs 0.000 description 1
- 238000011813 knockout mouse model Methods 0.000 description 1
- 210000001865 kupffer cell Anatomy 0.000 description 1
- 210000004561 lacrimal apparatus Anatomy 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 229960002437 lanreotide Drugs 0.000 description 1
- 229960001739 lanreotide acetate Drugs 0.000 description 1
- 208000003849 large cell carcinoma Diseases 0.000 description 1
- 210000002263 laryngeal cartilage Anatomy 0.000 description 1
- 210000000867 larynx Anatomy 0.000 description 1
- 229910052745 lead Inorganic materials 0.000 description 1
- 229940115286 lentinan Drugs 0.000 description 1
- 229960003881 letrozole Drugs 0.000 description 1
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 229960001614 levamisole Drugs 0.000 description 1
- 210000003041 ligament Anatomy 0.000 description 1
- 125000003473 lipid group Chemical group 0.000 description 1
- 230000013190 lipid storage Effects 0.000 description 1
- 201000002156 lipoadenoma Diseases 0.000 description 1
- 208000010033 lipoblastoma Diseases 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 208000019423 liver disease Diseases 0.000 description 1
- 229950008991 lobaplatin Drugs 0.000 description 1
- 229950000909 lometrexol Drugs 0.000 description 1
- 229960002247 lomustine Drugs 0.000 description 1
- PCZOHLXUXFIOCF-BXMDZJJMSA-N lovastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 PCZOHLXUXFIOCF-BXMDZJJMSA-N 0.000 description 1
- 229960004844 lovastatin Drugs 0.000 description 1
- QLJODMDSTUBWDW-UHFFFAOYSA-N lovastatin hydroxy acid Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(C)C=C21 QLJODMDSTUBWDW-UHFFFAOYSA-N 0.000 description 1
- 201000000966 lung oat cell carcinoma Diseases 0.000 description 1
- 208000012804 lymphangiosarcoma Diseases 0.000 description 1
- 201000010953 lymphoepithelioma-like carcinoma Diseases 0.000 description 1
- 230000002101 lytic effect Effects 0.000 description 1
- 150000002678 macrocyclic compounds Chemical class 0.000 description 1
- 208000026662 macrocystic lymphatic malformation Diseases 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 230000036244 malformation Effects 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 201000007055 malignant Leydig cell tumor Diseases 0.000 description 1
- 208000014432 malignant adrenal gland pheochromocytoma Diseases 0.000 description 1
- 201000004593 malignant giant cell tumor Diseases 0.000 description 1
- 201000006812 malignant histiocytosis Diseases 0.000 description 1
- 208000006178 malignant mesothelioma Diseases 0.000 description 1
- 201000006782 malignant pheochromocytoma Diseases 0.000 description 1
- 210000005075 mammary gland Anatomy 0.000 description 1
- 210000004373 mandible Anatomy 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- BLOFGONIVNXZME-YDMGZANHSA-N mannostatin A Chemical compound CS[C@@H]1[C@@H](N)[C@@H](O)[C@@H](O)[C@H]1O BLOFGONIVNXZME-YDMGZANHSA-N 0.000 description 1
- 229950008959 marimastat Drugs 0.000 description 1
- OCSMOTCMPXTDND-OUAUKWLOSA-N marimastat Chemical compound CNC(=O)[C@H](C(C)(C)C)NC(=O)[C@H](CC(C)C)[C@H](O)C(=O)NO OCSMOTCMPXTDND-OUAUKWLOSA-N 0.000 description 1
- 208000000516 mast-cell leukemia Diseases 0.000 description 1
- 201000008749 mast-cell sarcoma Diseases 0.000 description 1
- 208000006971 mastocytoma Diseases 0.000 description 1
- 208000008585 mastocytosis Diseases 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 239000003771 matrix metalloproteinase inhibitor Substances 0.000 description 1
- 229940121386 matrix metalloproteinase inhibitor Drugs 0.000 description 1
- 210000004086 maxillary sinus Anatomy 0.000 description 1
- 229960002868 mechlorethamine hydrochloride Drugs 0.000 description 1
- QZIQJVCYUQZDIR-UHFFFAOYSA-N mechlorethamine hydrochloride Chemical compound Cl.ClCCN(C)CCCl QZIQJVCYUQZDIR-UHFFFAOYSA-N 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 229960004296 megestrol acetate Drugs 0.000 description 1
- RQZAXGRLVPAYTJ-GQFGMJRRSA-N megestrol acetate Chemical compound C1=C(C)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 RQZAXGRLVPAYTJ-GQFGMJRRSA-N 0.000 description 1
- 230000003101 melanogenic effect Effects 0.000 description 1
- 229960003846 melengestrol acetate Drugs 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 208000011645 metastatic carcinoma Diseases 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- BKBBTCORRZMASO-ZOWNYOTGSA-M methotrexate monosodium Chemical compound [Na+].C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C([O-])=O)C=C1 BKBBTCORRZMASO-ZOWNYOTGSA-M 0.000 description 1
- 229960003058 methotrexate sodium Drugs 0.000 description 1
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 1
- TTWJBBZEZQICBI-UHFFFAOYSA-N metoclopramide Chemical compound CCN(CC)CCNC(=O)C1=CC(Cl)=C(N)C=C1OC TTWJBBZEZQICBI-UHFFFAOYSA-N 0.000 description 1
- 229960004503 metoclopramide Drugs 0.000 description 1
- QTFKTBRIGWJQQL-UHFFFAOYSA-N meturedepa Chemical compound C1C(C)(C)N1P(=O)(NC(=O)OCC)N1CC1(C)C QTFKTBRIGWJQQL-UHFFFAOYSA-N 0.000 description 1
- 229950009847 meturedepa Drugs 0.000 description 1
- HPNSFSBZBAHARI-UHFFFAOYSA-N micophenolic acid Natural products OC1=C(CC=C(C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-UHFFFAOYSA-N 0.000 description 1
- 230000002025 microglial effect Effects 0.000 description 1
- BMGQWWVMWDBQGC-IIFHNQTCSA-N midostaurin Chemical class CN([C@H]1[C@H]([C@]2(C)O[C@@H](N3C4=CC=CC=C4C4=C5C(=O)NCC5=C5C6=CC=CC=C6N2C5=C43)C1)OC)C(=O)C1=CC=CC=C1 BMGQWWVMWDBQGC-IIFHNQTCSA-N 0.000 description 1
- VKHAHZOOUSRJNA-GCNJZUOMSA-N mifepristone Chemical compound C1([C@@H]2C3=C4CCC(=O)C=C4CC[C@H]3[C@@H]3CC[C@@]([C@]3(C2)C)(O)C#CC)=CC=C(N(C)C)C=C1 VKHAHZOOUSRJNA-GCNJZUOMSA-N 0.000 description 1
- 229960003248 mifepristone Drugs 0.000 description 1
- 229960003775 miltefosine Drugs 0.000 description 1
- PQLXHQMOHUQAKB-UHFFFAOYSA-N miltefosine Chemical compound CCCCCCCCCCCCCCCCOP([O-])(=O)OCC[N+](C)(C)C PQLXHQMOHUQAKB-UHFFFAOYSA-N 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 108010076432 minigastrin Proteins 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- DRCJGCOYHLTVNR-ZUIZSQJWSA-N mitindomide Chemical compound C1=C[C@@H]2[C@@H]3[C@H]4C(=O)NC(=O)[C@H]4[C@@H]3[C@H]1[C@@H]1C(=O)NC(=O)[C@H]21 DRCJGCOYHLTVNR-ZUIZSQJWSA-N 0.000 description 1
- 229950001314 mitindomide Drugs 0.000 description 1
- 229950002137 mitocarcin Drugs 0.000 description 1
- 229960003539 mitoguazone Drugs 0.000 description 1
- MXWHMTNPTTVWDM-NXOFHUPFSA-N mitoguazone Chemical compound NC(N)=N\N=C(/C)\C=N\N=C(N)N MXWHMTNPTTVWDM-NXOFHUPFSA-N 0.000 description 1
- VFKZTMPDYBFSTM-GUCUJZIJSA-N mitolactol Chemical compound BrC[C@H](O)[C@@H](O)[C@@H](O)[C@H](O)CBr VFKZTMPDYBFSTM-GUCUJZIJSA-N 0.000 description 1
- 229950010913 mitolactol Drugs 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 229960000350 mitotane Drugs 0.000 description 1
- ZAHQPTJLOCWVPG-UHFFFAOYSA-N mitoxantrone dihydrochloride Chemical compound Cl.Cl.O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO ZAHQPTJLOCWVPG-UHFFFAOYSA-N 0.000 description 1
- 229960004169 mitoxantrone hydrochloride Drugs 0.000 description 1
- 201000002026 mixed cell adenoma Diseases 0.000 description 1
- 208000037524 mixed cellularity Hodgkin lymphoma Diseases 0.000 description 1
- 201000004058 mixed glioma Diseases 0.000 description 1
- 206010073136 mixed-type liposarcoma Diseases 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 229910052750 molybdenum Inorganic materials 0.000 description 1
- 150000004682 monohydrates Chemical class 0.000 description 1
- 210000000865 mononuclear phagocyte system Anatomy 0.000 description 1
- 229940035032 monophosphoryl lipid a Drugs 0.000 description 1
- 230000001002 morphogenetic effect Effects 0.000 description 1
- 208000022669 mucinous neoplasm Diseases 0.000 description 1
- 235000010460 mustard Nutrition 0.000 description 1
- HPNSFSBZBAHARI-RUDMXATFSA-N mycophenolic acid Chemical compound OC1=C(C\C=C(/C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-RUDMXATFSA-N 0.000 description 1
- 229960000951 mycophenolic acid Drugs 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 201000005987 myeloid sarcoma Diseases 0.000 description 1
- 230000002071 myeloproliferative effect Effects 0.000 description 1
- 201000004130 myoblastoma Diseases 0.000 description 1
- 210000000754 myometrium Anatomy 0.000 description 1
- 208000001611 myxosarcoma Diseases 0.000 description 1
- LNOPIUAQISRISI-UHFFFAOYSA-N n'-hydroxy-2-propan-2-ylsulfonylethanimidamide Chemical compound CC(C)S(=O)(=O)CC(N)=NO LNOPIUAQISRISI-UHFFFAOYSA-N 0.000 description 1
- NKFHKYQGZDAKMX-PPRKPIOESA-N n-[(e)-1-[(2s,4s)-4-[(2r,4s,5s,6s)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-2,5,12-trihydroxy-7-methoxy-6,11-dioxo-3,4-dihydro-1h-tetracen-2-yl]ethylideneamino]benzamide;hydrochloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(\C)=N\NC(=O)C=1C=CC=CC=1)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 NKFHKYQGZDAKMX-PPRKPIOESA-N 0.000 description 1
- NJSMWLQOCQIOPE-OCHFTUDZSA-N n-[(e)-[10-[(e)-(4,5-dihydro-1h-imidazol-2-ylhydrazinylidene)methyl]anthracen-9-yl]methylideneamino]-4,5-dihydro-1h-imidazol-2-amine Chemical compound N1CCN=C1N\N=C\C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1\C=N\NC1=NCCN1 NJSMWLQOCQIOPE-OCHFTUDZSA-N 0.000 description 1
- TVYPSLDUBVTDIS-FUOMVGGVSA-N n-[1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-methyloxolan-2-yl]-5-fluoro-2-oxopyrimidin-4-yl]-3,4,5-trimethoxybenzamide Chemical compound COC1=C(OC)C(OC)=CC(C(=O)NC=2C(=CN(C(=O)N=2)[C@H]2[C@@H]([C@H](O)[C@@H](C)O2)O)F)=C1 TVYPSLDUBVTDIS-FUOMVGGVSA-N 0.000 description 1
- MTHMMXFBHKGAAI-UHFFFAOYSA-N n-[2-(2-cyanopyrrolidin-1-yl)-2-oxoethyl]quinoline-4-carboxamide Chemical compound C=1C=NC2=CC=CC=C2C=1C(=O)NCC(=O)N1CCCC1C#N MTHMMXFBHKGAAI-UHFFFAOYSA-N 0.000 description 1
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- RWHUEXWOYVBUCI-ITQXDASVSA-N nafarelin Chemical compound C([C@@H](C(=O)N[C@H](CC=1C=C2C=CC=CC2=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 RWHUEXWOYVBUCI-ITQXDASVSA-N 0.000 description 1
- 229960002333 nafarelin Drugs 0.000 description 1
- UZHSEJADLWPNLE-GRGSLBFTSA-N naloxone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(O)C2=C5[C@@]13CCN4CC=C UZHSEJADLWPNLE-GRGSLBFTSA-N 0.000 description 1
- 229960004127 naloxone Drugs 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 229950010676 nartograstim Drugs 0.000 description 1
- 108010032539 nartograstim Proteins 0.000 description 1
- 210000003928 nasal cavity Anatomy 0.000 description 1
- 208000014761 nasopharyngeal type undifferentiated carcinoma Diseases 0.000 description 1
- 210000003739 neck Anatomy 0.000 description 1
- 229950007221 nedaplatin Drugs 0.000 description 1
- CTMCWCONSULRHO-UHQPFXKFSA-N nemorubicin Chemical compound C1CO[C@H](OC)CN1[C@@H]1[C@H](O)[C@H](C)O[C@@H](O[C@@H]2C3=C(O)C=4C(=O)C5=C(OC)C=CC=C5C(=O)C=4C(O)=C3C[C@](O)(C2)C(=O)CO)C1 CTMCWCONSULRHO-UHQPFXKFSA-N 0.000 description 1
- 229950010159 nemorubicin Drugs 0.000 description 1
- 238000009099 neoadjuvant therapy Methods 0.000 description 1
- 208000018221 neoplasm of aortic body Diseases 0.000 description 1
- MQYXUWHLBZFQQO-UHFFFAOYSA-N nepehinol Natural products C1CC(O)C(C)(C)C2CCC3(C)C4(C)CCC5(C)CCC(C(=C)C)C5C4CCC3C21C MQYXUWHLBZFQQO-UHFFFAOYSA-N 0.000 description 1
- PUUSSSIBPPTKTP-UHFFFAOYSA-N neridronic acid Chemical compound NCCCCCC(O)(P(O)(O)=O)P(O)(O)=O PUUSSSIBPPTKTP-UHFFFAOYSA-N 0.000 description 1
- 229950010733 neridronic acid Drugs 0.000 description 1
- 208000023833 nerve sheath neoplasm Diseases 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 208000007538 neurilemmoma Diseases 0.000 description 1
- 201000004931 neurofibromatosis Diseases 0.000 description 1
- 230000001272 neurogenic effect Effects 0.000 description 1
- 208000004235 neutropenia Diseases 0.000 description 1
- 229960002653 nilutamide Drugs 0.000 description 1
- XWXYUMMDTVBTOU-UHFFFAOYSA-N nilutamide Chemical compound O=C1C(C)(C)NC(=O)N1C1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 XWXYUMMDTVBTOU-UHFFFAOYSA-N 0.000 description 1
- 210000002445 nipple Anatomy 0.000 description 1
- PCHKPVIQAHNQLW-CQSZACIVSA-N niraparib Chemical compound N1=C2C(C(=O)N)=CC=CC2=CN1C(C=C1)=CC=C1[C@@H]1CCCNC1 PCHKPVIQAHNQLW-CQSZACIVSA-N 0.000 description 1
- 229950011068 niraparib Drugs 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 229950006344 nocodazole Drugs 0.000 description 1
- 201000004590 nodular tenosynovitis Diseases 0.000 description 1
- KGTDRFCXGRULNK-JYOBTZKQSA-N nogalamycin Chemical compound CO[C@@H]1[C@@](OC)(C)[C@@H](OC)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=C(O)C=C4[C@@]5(C)O[C@H]([C@H]([C@@H]([C@H]5O)N(C)C)O)OC4=C3C3=O)=C3C=C2[C@@H](C(=O)OC)[C@@](C)(O)C1 KGTDRFCXGRULNK-JYOBTZKQSA-N 0.000 description 1
- 229950009266 nogalamycin Drugs 0.000 description 1
- 239000012457 nonaqueous media Substances 0.000 description 1
- 210000001331 nose Anatomy 0.000 description 1
- URPYMXQQVHTUDU-OFGSCBOVSA-N nucleopeptide y Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CC=C(O)C=C1 URPYMXQQVHTUDU-OFGSCBOVSA-N 0.000 description 1
- 238000011580 nude mouse model Methods 0.000 description 1
- 210000000869 occipital lobe Anatomy 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 229940127059 octreoscan Drugs 0.000 description 1
- 229960002700 octreotide Drugs 0.000 description 1
- 206010063413 odontogenic cyst Diseases 0.000 description 1
- FAQDUNYVKQKNLD-UHFFFAOYSA-N olaparib Chemical compound FC1=CC=C(CC2=C3[CH]C=CC=C3C(=O)N=N2)C=C1C(=O)N(CC1)CCN1C(=O)C1CC1 FAQDUNYVKQKNLD-UHFFFAOYSA-N 0.000 description 1
- 229960000572 olaparib Drugs 0.000 description 1
- 210000000196 olfactory nerve Anatomy 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 150000002482 oligosaccharides Chemical class 0.000 description 1
- 229950011093 onapristone Drugs 0.000 description 1
- 230000000771 oncological effect Effects 0.000 description 1
- 210000001328 optic nerve Anatomy 0.000 description 1
- 201000002740 oral squamous cell carcinoma Diseases 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 229950008017 ormaplatin Drugs 0.000 description 1
- ZLLOIFNEEWYATC-XMUHMHRVSA-N osaterone Chemical compound C1=C(Cl)C2=CC(=O)OC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)C)(O)[C@@]1(C)CC2 ZLLOIFNEEWYATC-XMUHMHRVSA-N 0.000 description 1
- 229950006466 osaterone Drugs 0.000 description 1
- 229910052762 osmium Inorganic materials 0.000 description 1
- 210000003101 oviduct Anatomy 0.000 description 1
- 229960001756 oxaliplatin Drugs 0.000 description 1
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 1
- 210000003254 palate Anatomy 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 1
- WLJNZVDCPSBLRP-UHFFFAOYSA-N pamoic acid Chemical compound C1=CC=C2C(CC=3C4=CC=CC=C4C=C(C=3O)C(=O)O)=C(O)C(C(O)=O)=CC2=C1 WLJNZVDCPSBLRP-UHFFFAOYSA-N 0.000 description 1
- 201000002094 pancreatic adenocarcinoma Diseases 0.000 description 1
- 201000002530 pancreatic endocrine carcinoma Diseases 0.000 description 1
- 208000021010 pancreatic neuroendocrine tumor Diseases 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 201000010210 papillary cystadenocarcinoma Diseases 0.000 description 1
- 201000000393 papillary ependymoma Diseases 0.000 description 1
- 208000029178 papillary meningioma Diseases 0.000 description 1
- 201000010941 papillary squamous carcinoma Diseases 0.000 description 1
- 201000001494 papillary transitional carcinoma Diseases 0.000 description 1
- 208000031101 papillary transitional cell carcinoma Diseases 0.000 description 1
- 208000029211 papillomatosis Diseases 0.000 description 1
- 208000029532 parasympathetic paraganglioma Diseases 0.000 description 1
- 210000002990 parathyroid gland Anatomy 0.000 description 1
- 210000001152 parietal lobe Anatomy 0.000 description 1
- 210000003681 parotid gland Anatomy 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 229960001744 pegaspargase Drugs 0.000 description 1
- 108010001564 pegaspargase Proteins 0.000 description 1
- 210000003049 pelvic bone Anatomy 0.000 description 1
- IZUPBVBPLAPZRR-UHFFFAOYSA-N pentachloro-phenol Natural products OC1=C(Cl)C(Cl)=C(Cl)C(Cl)=C1Cl IZUPBVBPLAPZRR-UHFFFAOYSA-N 0.000 description 1
- 125000004817 pentamethylene group Chemical group [H]C([H])([*:2])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[*:1] 0.000 description 1
- VOKSWYLNZZRQPF-GDIGMMSISA-N pentazocine Chemical compound C1C2=CC=C(O)C=C2[C@@]2(C)[C@@H](C)[C@@H]1N(CC=C(C)C)CC2 VOKSWYLNZZRQPF-GDIGMMSISA-N 0.000 description 1
- 229960005301 pentazocine Drugs 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 210000003800 pharynx Anatomy 0.000 description 1
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N phenylbenzene Natural products C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 1
- 208000028591 pheochromocytoma Diseases 0.000 description 1
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 208000001095 pilomatrixoma Diseases 0.000 description 1
- 208000024724 pineal body neoplasm Diseases 0.000 description 1
- 210000004560 pineal gland Anatomy 0.000 description 1
- NUKCGLDCWQXYOQ-UHFFFAOYSA-N piposulfan Chemical compound CS(=O)(=O)OCCC(=O)N1CCN(C(=O)CCOS(C)(=O)=O)CC1 NUKCGLDCWQXYOQ-UHFFFAOYSA-N 0.000 description 1
- 229950001100 piposulfan Drugs 0.000 description 1
- 210000003635 pituitary gland Anatomy 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Substances [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 1
- 150000003058 platinum compounds Chemical class 0.000 description 1
- 201000010968 pleomorphic carcinoma Diseases 0.000 description 1
- 210000004224 pleura Anatomy 0.000 description 1
- 208000004748 plexiform neurofibroma Diseases 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- 229950008499 plitidepsin Drugs 0.000 description 1
- 108010049948 plitidepsin Proteins 0.000 description 1
- UUSZLLQJYRSZIS-LXNNNBEUSA-N plitidepsin Chemical compound CN([C@H](CC(C)C)C(=O)N[C@@H]1C(=O)N[C@@H]([C@H](CC(=O)O[C@H](C(=O)[C@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N2CCC[C@H]2C(=O)N(C)[C@@H](CC=2C=CC(OC)=CC=2)C(=O)O[C@@H]1C)C(C)C)O)[C@@H](C)CC)C(=O)[C@@H]1CCCN1C(=O)C(C)=O UUSZLLQJYRSZIS-LXNNNBEUSA-N 0.000 description 1
- 229920000768 polyamine Polymers 0.000 description 1
- 208000037244 polycythemia vera Diseases 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 210000001316 polygonal cell Anatomy 0.000 description 1
- 238000010837 poor prognosis Methods 0.000 description 1
- 229960004293 porfimer sodium Drugs 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 230000001376 precipitating effect Effects 0.000 description 1
- 229960004694 prednimustine Drugs 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 208000003476 primary myelofibrosis Diseases 0.000 description 1
- 208000029340 primitive neuroectodermal tumor Diseases 0.000 description 1
- 229960001586 procarbazine hydrochloride Drugs 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 239000000186 progesterone Substances 0.000 description 1
- 229960003387 progesterone Drugs 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 125000001500 prolyl group Chemical group [H]N1C([H])(C(=O)[*])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 201000005825 prostate adenocarcinoma Diseases 0.000 description 1
- 208000023958 prostate neoplasm Diseases 0.000 description 1
- 235000019419 proteases Nutrition 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- SSKVDVBQSWQEGJ-UHFFFAOYSA-N pseudohypericin Natural products C12=C(O)C=C(O)C(C(C=3C(O)=CC(O)=C4C=33)=O)=C2C3=C2C3=C4C(C)=CC(O)=C3C(=O)C3=C(O)C=C(O)C1=C32 SSKVDVBQSWQEGJ-UHFFFAOYSA-N 0.000 description 1
- 208000005069 pulmonary fibrosis Diseases 0.000 description 1
- 229950010131 puromycin Drugs 0.000 description 1
- MKSVFGKWZLUTTO-FZFAUISWSA-N puromycin dihydrochloride Chemical compound Cl.Cl.C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO MKSVFGKWZLUTTO-FZFAUISWSA-N 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 210000003065 pyriform sinus Anatomy 0.000 description 1
- 239000000700 radioactive tracer Substances 0.000 description 1
- 229940051022 radioimmunoconjugate Drugs 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 230000008458 response to injury Effects 0.000 description 1
- 230000000284 resting effect Effects 0.000 description 1
- 230000003307 reticuloendothelial effect Effects 0.000 description 1
- 201000006845 reticulosarcoma Diseases 0.000 description 1
- 208000029922 reticulum cell sarcoma Diseases 0.000 description 1
- 210000001525 retina Anatomy 0.000 description 1
- 229910052702 rhenium Inorganic materials 0.000 description 1
- 229910052703 rhodium Inorganic materials 0.000 description 1
- 239000010948 rhodium Substances 0.000 description 1
- 229960004356 riboprine Drugs 0.000 description 1
- 125000006413 ring segment Chemical group 0.000 description 1
- 239000011435 rock Substances 0.000 description 1
- QXKJWHWUDVQATH-UHFFFAOYSA-N rogletimide Chemical compound C=1C=NC=CC=1C1(CC)CCC(=O)NC1=O QXKJWHWUDVQATH-UHFFFAOYSA-N 0.000 description 1
- 229950005230 rogletimide Drugs 0.000 description 1
- HMABYWSNWIZPAG-UHFFFAOYSA-N rucaparib Chemical compound C1=CC(CNC)=CC=C1C(N1)=C2CCNC(=O)C3=C2C1=CC(F)=C3 HMABYWSNWIZPAG-UHFFFAOYSA-N 0.000 description 1
- 229950004707 rucaparib Drugs 0.000 description 1
- 229910052707 ruthenium Inorganic materials 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 201000007416 salivary gland adenoid cystic carcinoma Diseases 0.000 description 1
- 201000003774 sarcomatosis Diseases 0.000 description 1
- 201000003769 sarcomatosis of the meninges Diseases 0.000 description 1
- 210000004761 scalp Anatomy 0.000 description 1
- 229910052706 scandium Inorganic materials 0.000 description 1
- 206010039667 schwannoma Diseases 0.000 description 1
- 210000004706 scrotum Anatomy 0.000 description 1
- 201000008407 sebaceous adenocarcinoma Diseases 0.000 description 1
- 201000005218 sebaceous adenoma Diseases 0.000 description 1
- 125000003548 sec-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000000467 secondary amino group Chemical group [H]N([*:1])[*:2] 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 229960003440 semustine Drugs 0.000 description 1
- UQDJGEHQDNVPGU-UHFFFAOYSA-N serine phosphoethanolamine Chemical compound [NH3+]CCOP([O-])(=O)OCC([NH3+])C([O-])=O UQDJGEHQDNVPGU-UHFFFAOYSA-N 0.000 description 1
- 208000004548 serous cystadenocarcinoma Diseases 0.000 description 1
- 208000016596 serous neoplasm Diseases 0.000 description 1
- 208000028467 sex cord-stromal tumor Diseases 0.000 description 1
- 210000001599 sigmoid colon Anatomy 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 239000010944 silver (metal) Substances 0.000 description 1
- 210000002027 skeletal muscle Anatomy 0.000 description 1
- 206010040882 skin lesion Diseases 0.000 description 1
- 231100000444 skin lesion Toxicity 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 208000014680 small intestine neoplasm Diseases 0.000 description 1
- 210000001584 soft palate Anatomy 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 229950009641 sparsomycin Drugs 0.000 description 1
- XKLZIVIOZDNKEQ-CLQLPEFOSA-N sparsomycin Chemical compound CSC[S@](=O)C[C@H](CO)NC(=O)\C=C\C1=C(C)NC(=O)NC1=O XKLZIVIOZDNKEQ-CLQLPEFOSA-N 0.000 description 1
- XKLZIVIOZDNKEQ-UHFFFAOYSA-N sparsomycin Natural products CSCS(=O)CC(CO)NC(=O)C=CC1=C(C)NC(=O)NC1=O XKLZIVIOZDNKEQ-UHFFFAOYSA-N 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 210000004267 spermatic cord Anatomy 0.000 description 1
- 210000003718 sphenoid sinus Anatomy 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 201000002245 spindle cell lipoma Diseases 0.000 description 1
- 208000008542 spindle cell nevus Diseases 0.000 description 1
- 201000000270 spindle cell sarcoma Diseases 0.000 description 1
- 229950004330 spiroplatin Drugs 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 201000010159 squamous cell papilloma Diseases 0.000 description 1
- 208000017015 squamous papilloma Diseases 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 230000000707 stereoselective effect Effects 0.000 description 1
- 201000000498 stomach carcinoma Diseases 0.000 description 1
- 238000013517 stratification Methods 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 201000009444 subacute leukemia Diseases 0.000 description 1
- 201000005955 subacute monocytic leukemia Diseases 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 201000004059 subependymal giant cell astrocytoma Diseases 0.000 description 1
- 208000030819 subependymoma Diseases 0.000 description 1
- 210000003670 sublingual gland Anatomy 0.000 description 1
- 210000001913 submandibular gland Anatomy 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 125000000446 sulfanediyl group Chemical group *S* 0.000 description 1
- 229950000244 sulfanilic acid Drugs 0.000 description 1
- 150000003459 sulfonic acid esters Chemical class 0.000 description 1
- 230000008093 supporting effect Effects 0.000 description 1
- 210000000106 sweat gland Anatomy 0.000 description 1
- 208000003080 sweat gland adenoma Diseases 0.000 description 1
- 208000027371 sweat gland benign neoplasm Diseases 0.000 description 1
- 208000012190 sympathetic paraganglioma Diseases 0.000 description 1
- 210000005222 synovial tissue Anatomy 0.000 description 1
- 210000002437 synoviocyte Anatomy 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 208000004022 syringoma Diseases 0.000 description 1
- VAZAPHZUAVEOMC-UHFFFAOYSA-N tacedinaline Chemical compound C1=CC(NC(=O)C)=CC=C1C(=O)NC1=CC=CC=C1N VAZAPHZUAVEOMC-UHFFFAOYSA-N 0.000 description 1
- 108010009573 talabostat Proteins 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 229940063683 taxotere Drugs 0.000 description 1
- URLYINUFLXOMHP-HTVVRFAVSA-N tcn-p Chemical compound C=12C3=NC=NC=1N(C)N=C(N)C2=CN3[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@H]1O URLYINUFLXOMHP-HTVVRFAVSA-N 0.000 description 1
- GKLVYJBZJHMRIY-UHFFFAOYSA-N technetium atom Chemical compound [Tc] GKLVYJBZJHMRIY-UHFFFAOYSA-N 0.000 description 1
- 208000009056 telangiectasis Diseases 0.000 description 1
- 229960002197 temoporfin Drugs 0.000 description 1
- 210000003478 temporal lobe Anatomy 0.000 description 1
- 210000002435 tendon Anatomy 0.000 description 1
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 1
- 229960001278 teniposide Drugs 0.000 description 1
- 208000001608 teratocarcinoma Diseases 0.000 description 1
- 208000022375 teratoma with malignant transformation Diseases 0.000 description 1
- 229950008703 teroxirone Drugs 0.000 description 1
- 125000001973 tert-pentyl group Chemical group [H]C([H])([H])C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000002381 testicular Effects 0.000 description 1
- 201000003120 testicular cancer Diseases 0.000 description 1
- 229960005353 testolactone Drugs 0.000 description 1
- BPEWUONYVDABNZ-DZBHQSCQSA-N testolactone Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(OC(=O)CC4)[C@@H]4[C@@H]3CCC2=C1 BPEWUONYVDABNZ-DZBHQSCQSA-N 0.000 description 1
- 150000004685 tetrahydrates Chemical class 0.000 description 1
- 150000004905 tetrazines Chemical class 0.000 description 1
- 230000004797 therapeutic response Effects 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- 125000000101 thioether group Chemical group 0.000 description 1
- 229930192474 thiophene Natural products 0.000 description 1
- 229960001196 thiotepa Drugs 0.000 description 1
- 210000005018 thoracic esophagus Anatomy 0.000 description 1
- ZSLUVFAKFWKJRC-FTXFMUIASA-N thorium-227 Chemical class [227Th] ZSLUVFAKFWKJRC-FTXFMUIASA-N 0.000 description 1
- 230000001732 thrombotic effect Effects 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 208000013077 thyroid gland carcinoma Diseases 0.000 description 1
- 208000029481 thyroid gland fetal adenoma Diseases 0.000 description 1
- 208000013818 thyroid gland medullary carcinoma Diseases 0.000 description 1
- 208000015191 thyroid gland papillary and follicular carcinoma Diseases 0.000 description 1
- YFTWHEBLORWGNI-UHFFFAOYSA-N tiamiprine Chemical compound CN1C=NC([N+]([O-])=O)=C1SC1=NC(N)=NC2=C1NC=N2 YFTWHEBLORWGNI-UHFFFAOYSA-N 0.000 description 1
- 229950011457 tiamiprine Drugs 0.000 description 1
- 230000036962 time dependent Effects 0.000 description 1
- 229910052718 tin Inorganic materials 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- URGUBECARCAPRI-UHFFFAOYSA-N tirandamycin A Natural products O1C(C2(OC2C2=O)C)(C)OC2C(C)C1C(C)C=C(C)C=CC(O)=C1C(=O)CNC1=O URGUBECARCAPRI-UHFFFAOYSA-N 0.000 description 1
- 229950002376 tirapazamine Drugs 0.000 description 1
- QVMPZNRFXAKISM-UHFFFAOYSA-N tirapazamine Chemical compound C1=CC=C2[N+]([O-])=NC(=N)N(O)C2=C1 QVMPZNRFXAKISM-UHFFFAOYSA-N 0.000 description 1
- 239000010936 titanium Substances 0.000 description 1
- 229910052719 titanium Inorganic materials 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-M toluene-4-sulfonate Chemical compound CC1=CC=C(S([O-])(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-M 0.000 description 1
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 1
- 229960002190 topotecan hydrochloride Drugs 0.000 description 1
- 229960004167 toremifene citrate Drugs 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 231100000563 toxic property Toxicity 0.000 description 1
- 210000003437 trachea Anatomy 0.000 description 1
- URYYVOIYTNXXBN-OWOJBTEDSA-N trans-cyclooctene Chemical compound C1CCC\C=C\CC1 URYYVOIYTNXXBN-OWOJBTEDSA-N 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000001131 transforming effect Effects 0.000 description 1
- 238000011830 transgenic mouse model Methods 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 201000007003 transitional meningioma Diseases 0.000 description 1
- 108091005703 transmembrane proteins Proteins 0.000 description 1
- 102000035160 transmembrane proteins Human genes 0.000 description 1
- 150000004684 trihydrates Chemical class 0.000 description 1
- 229960001099 trimetrexate Drugs 0.000 description 1
- NOYPYLRCIDNJJB-UHFFFAOYSA-N trimetrexate Chemical compound COC1=C(OC)C(OC)=CC(NCC=2C(=C3C(N)=NC(N)=NC3=CC=2)C)=C1 NOYPYLRCIDNJJB-UHFFFAOYSA-N 0.000 description 1
- 229960000538 trimetrexate glucuronate Drugs 0.000 description 1
- MBYLVOKEDDQJDY-UHFFFAOYSA-N tris(2-aminoethyl)amine Chemical compound NCCN(CCN)CCN MBYLVOKEDDQJDY-UHFFFAOYSA-N 0.000 description 1
- 201000007423 tubular adenocarcinoma Diseases 0.000 description 1
- 208000022271 tubular adenoma Diseases 0.000 description 1
- 208000025443 tumor of adipose tissue Diseases 0.000 description 1
- 208000017997 tumor of parathyroid gland Diseases 0.000 description 1
- 208000025421 tumor of uterus Diseases 0.000 description 1
- 230000007306 turnover Effects 0.000 description 1
- 230000003827 upregulation Effects 0.000 description 1
- 229960001055 uracil mustard Drugs 0.000 description 1
- SPDZFJLQFWSJGA-UHFFFAOYSA-N uredepa Chemical compound C1CN1P(=O)(NC(=O)OCC)N1CC1 SPDZFJLQFWSJGA-UHFFFAOYSA-N 0.000 description 1
- 229950006929 uredepa Drugs 0.000 description 1
- 210000000626 ureter Anatomy 0.000 description 1
- 210000003708 urethra Anatomy 0.000 description 1
- 208000010570 urinary bladder carcinoma Diseases 0.000 description 1
- 208000012477 urothelial papilloma Diseases 0.000 description 1
- 206010046766 uterine cancer Diseases 0.000 description 1
- 208000024719 uterine cervix neoplasm Diseases 0.000 description 1
- 210000002396 uvula Anatomy 0.000 description 1
- 210000001215 vagina Anatomy 0.000 description 1
- 206010055031 vascular neoplasm Diseases 0.000 description 1
- 201000009371 venous hemangioma Diseases 0.000 description 1
- 230000002861 ventricular Effects 0.000 description 1
- ZQFGRJWRSLZCSQ-ZSFNYQMMSA-N verteporfin Chemical compound C=1C([C@@]2([C@H](C(=O)OC)C(=CC=C22)C(=O)OC)C)=NC2=CC(C(=C2C=C)C)=NC2=CC(C(=C2CCC(O)=O)C)=NC2=CC2=NC=1C(C)=C2CCC(=O)OC ZQFGRJWRSLZCSQ-ZSFNYQMMSA-N 0.000 description 1
- 229960003895 verteporfin Drugs 0.000 description 1
- KDQAABAKXDWYSZ-PNYVAJAMSA-N vinblastine sulfate Chemical compound OS(O)(=O)=O.C([C@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 KDQAABAKXDWYSZ-PNYVAJAMSA-N 0.000 description 1
- 229960004982 vinblastine sulfate Drugs 0.000 description 1
- AQTQHPDCURKLKT-JKDPCDLQSA-N vincristine sulfate Chemical compound OS(O)(=O)=O.C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C=O)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 AQTQHPDCURKLKT-JKDPCDLQSA-N 0.000 description 1
- 229960002110 vincristine sulfate Drugs 0.000 description 1
- 229960004355 vindesine Drugs 0.000 description 1
- UGGWPQSBPIFKDZ-KOTLKJBCSA-N vindesine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(N)=O)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 UGGWPQSBPIFKDZ-KOTLKJBCSA-N 0.000 description 1
- 229960005212 vindesine sulfate Drugs 0.000 description 1
- BCXOZISMDZTYHW-IFQBWSDRSA-N vinepidine sulfate Chemical compound OS(O)(=O)=O.C([C@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C=O)C=2)OC)C[C@@H](C2)CC)N2CCC2=C1NC1=CC=CC=C21 BCXOZISMDZTYHW-IFQBWSDRSA-N 0.000 description 1
- 229960002166 vinorelbine tartrate Drugs 0.000 description 1
- GBABOYUKABKIAF-IWWDSPBFSA-N vinorelbinetartrate Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC(C23[C@H]([C@@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-IWWDSPBFSA-N 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
- XLMPPFTZALNBFS-INIZCTEOSA-N vorozole Chemical compound C1([C@@H](C2=CC=C3N=NN(C3=C2)C)N2N=CN=C2)=CC=C(Cl)C=C1 XLMPPFTZALNBFS-INIZCTEOSA-N 0.000 description 1
- 201000001132 water-clear cell adenoma Diseases 0.000 description 1
- 229910052727 yttrium Inorganic materials 0.000 description 1
- 229910052726 zirconium Inorganic materials 0.000 description 1
- 150000003952 β-lactams Chemical class 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/06—Linear peptides containing only normal peptide links having 5 to 11 amino acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/64—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue
- C12N9/6421—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue from mammals
- C12N9/6424—Serine endopeptidases (3.4.21)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/02—Linear peptides containing at least one abnormal peptide link
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/08—Peptides, e.g. proteins, carriers being peptides, polyamino acids, proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/08—Peptides, e.g. proteins, carriers being peptides, polyamino acids, proteins
- A61K51/088—Peptides, e.g. proteins, carriers being peptides, polyamino acids, proteins conjugates with carriers being peptides, polyamino acids or proteins
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/81—Protease inhibitors
- C07K14/8103—Exopeptidase (E.C. 3.4.11-19) inhibitors
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/08—Linear peptides containing only normal peptide links having 12 to 20 amino acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/485—Exopeptidases (3.4.11-3.4.19)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/14—Dipeptidyl-peptidases and tripeptidyl-peptidases (3.4.14)
- C12Y304/14001—Dipeptidyl-peptidase I (3.4.14.1), i.e. cathepsin-C
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/21—Serine endopeptidases (3.4.21)
- C12Y304/21026—Prolyl oligopeptidase (3.4.21.26), i.e. proline-specific endopeptidase
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biochemistry (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biomedical Technology (AREA)
- Biophysics (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Physics & Mathematics (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- General Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Optics & Photonics (AREA)
- Analytical Chemistry (AREA)
- Cell Biology (AREA)
- Food Science & Technology (AREA)
- Gastroenterology & Hepatology (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
본 발명은 화학식 (I)의 시클릭 펩티드 및 Xaa1에 부착된 N-말단 변형 기 A를 포함하는 화합물에 관한 것이며:
여기서, Xaa1, Xaa2, Xaa3, Xaa4, Xaa5, Xaa6 및 Xaa7 각각 및 이들 중 어느 하나는 아미노산의 잔기이고, Yc는 화학식 (X)의 구조이다:
.
여기서, Xaa1, Xaa2, Xaa3, Xaa4, Xaa5, Xaa6 및 Xaa7 각각 및 이들 중 어느 하나는 아미노산의 잔기이고, Yc는 화학식 (X)의 구조이다:
.
Description
본 발명은 화학적 화합물; 섬유모세포 활성화 단백질 (FAP)의 억제제; 각각 상기 화합물 및 억제제를 포함하는 조성물; 각각 질환의 진단 방법에 사용하기 위한 상기 화합물, 상기 억제제 및 상기 조성물; 각각 질환의 치료 방법에 사용하기 위한 상기 화합물, 상기 억제제 및 상기 조성물; 각각 "치료진단(thera(g)nosis)" 또는 "치료진단법(thera(g)nostics)"으로도 지칭되는 질환의 진단 및 치료 방법에 사용하기 위한 상기 화합물, 상기 억제제 및 상기 조성물; 각각 FAP-발현 조직에 이펙터를 전달하는 방법에 사용하기 위한 상기 화합물, 상기 억제제 및 상기 조성물; 각각 상기 화합물, 상기 억제제 및 상기 조성물을 사용하여 질환을 진단하는 방법; 각각 상기 화합물, 상기 억제제 및 상기 조성물을 사용하여 질환을 치료하는 방법; 각각 상기 화합물, 상기 억제제 및 상기 조성물을 사용하여 "치료진단" 또는 "치료진단법"으로도 지칭되는 질환을 진단 및 치료하는 방법; 각각 상기 화합물, 상기 억제제 및 상기 조성물을 사용하여 FAP-발현 조직에 이펙터를 전달하는 방법에 관한 것이다.
치료 옵션의 이용가능성이 증가함에도 불구하고, 암은 여전히 전세계적으로 두 번째 주요 사망 원인이다. 치료 전략은 주로 악성 암 세포 자체를 표적화하는 것에 초점을 맞추며, 이는 치료 암 세포 작용제의 접근을 제한하는 지속적으로 존재하는 주위 종양 미세환경 (TME)은 무시한다 (문헌 [Valkenburg, et al., Nat Rev Clin Oncol, 2018, 15: 366]). TME는 종양 덩어리의 일부이고, 암 세포의 이종 집단 뿐만 아니라 다양한 상주 및 침윤 숙주 세포, 분비된 인자 및 세포외 매트릭스 단백질로 이루어진다 (문헌 [Quail, et al., Nat Med, 2013, 19: 1423]). TME에서 발견되는 우세한 세포 유형은 암 연관 섬유모세포 (CAF)이다 (문헌 [Kalluri, Nat Rev Cancer, 2016, 16: 582]). CAF에 대한 공급원 및 기원으로서 많은 다양한 세포 유형, 예컨대 예를 들어 섬유모세포, 중간엽 줄기 세포, 평활근 세포, 상피 기원의 세포 또는 내피 세포가 기재되었다 (문헌 [Madar, et al., Trends Mol Med, 2013, 19: 447]). CAF는 중간엽-유사 특징을 나타내며, 종종 고형 종양 덩어리 내에서 우세한 세포 유형이다. CAF는 종양 진행 및 항상성의 플레이어로서 점점 더 주목을 받고 있다 (문헌 [Gascard, et al., Genes Dev, 2016, 30: 1002]; [LeBleu, et al., Dis Model Mech, 2018, 11]).
최근 수년 동안, 섬유모세포 활성화 단백질 (FAP)은 CAF의 마커로서 평판을 얻었다 (문헌 [Shiga, et al., Cancers (Basel), 2015, 7: 2443]; [Pure, et al., Oncogene, 2018, 37: 4343]; [Jacob, et al., Curr Mol Med, 2012, 12: 1220]). 종양 내 CAF 및 기질의 편재성(omnipresence)으로 인해, FAP는 방사성제약 진단에 적합한 마커로서 및 방사성제약 요법에 적합한 표적으로서 발견되었다 (Siveke, J Nucl Med, 2018, 59: 1412).
섬유모세포 활성화 단백질 α (FAP)는 유형 II 막횡단 세린 프로테아제이고, S9 프롤릴 올리고펩티다제 패밀리의 구성원이다 (문헌 [Park, et al., J Biol Chem, 1999, 274: 36505]). 가장 가까운 패밀리 구성원 DPP4는 FAP와 53% 상동성을 공유한다. 다른 DPP 효소 (DPP4, DPP7, DPP8, DPP9)와 같이, FAP는 프롤린-후 엑소펩티다제 활성을 갖는다. 또한, FAP는 프롤릴 올리고펩티다제/엔도펩티다제 (POP/PREP)와 유사한 엔도펩티다제 활성을 보유한다. FAP 유전자는 다양한 종에 걸쳐 고도로 보존된다. 인간 FAP의 세포외 도메인은 마우스 및 래트 FAP와 90% 아미노산 서열 동일성을 공유한다. 마우스 FAP는 래트 FAP와 97% 서열 동일성을 갖는다.
구조적으로, FAP는 짧은 N-말단 세포질 꼬리 (6개 아미노산), 단일 막횡단 도메인 (20개 아미노산), 및 734개 아미노산 세포외 도메인으로 구성된 760개 아미노산 막횡단 단백질이다 (문헌 [Aertgeerts, et al., J Biol Chem, 2005, 280: 19441]). 이 세포외 도메인은 8-블레이드 β-프로펠러 및 α/β 히드롤라제 도메인으로 이루어진다. 촉매 트리아드는 Ser624, Asp702 및 His734로 구성되고, β-프로펠러 및 히드롤라제 도메인의 계면에 위치한다. 활성 부위는 β-프로펠러 도메인의 중앙 구멍을 통해 또는 β-프로펠러와 히드롤라제 도메인 사이의 좁은 공동을 통해 접근가능하다. FAP 단량체는 활성이 아니지만, 활성 동종이량체 뿐만 아니라 DPP4와의 이종이량체를 형성한다 (문헌 [Ghersi, et al., Cancer Res, 2006, 66: 4652]). 가용성 동종이량체 FAP가 또한 기재되어 있다 (문헌 [Keane, et al., FEBS Open Bio, 2013, 4: 43]; [Lee, et al., Blood, 2006, 107: 1397]).
FAP는 이중 효소 활성을 보유한다 (문헌 [Hamson, et al., Proteomics Clin Appl, 2014, 8: 454]). 그의 디펩티딜 펩티다제 활성은 프롤린 잔기 뒤의 N-말단의 2개의 아미노산을 절단하는 것을 허용한다. 그의 디펩티딜 펩티다제 활성을 통해 신속하게 절단되는 FAP 기질은 뉴로펩티드 Y, 펩티드 YY, 물질 P 및 B형 나트륨이뇨 펩티드이다. 콜라겐 I 및 III, 섬유모세포 성장 인자 21 (FGF21) 및 α2-항플라스민은 FAP의 엔도펩티다제 활성에 의해 절단되는 것으로 나타났다. FAP는 천연 콜라겐을 절단할 수 없지만, 다른 프로테아제, 예컨대 매트릭스 메탈로프로테이나제에 의한 전소화가 FAP에 의한 추가의 콜라겐 절단을 용이하게 한다. 콜라겐의 프로세싱은 암 세포의 이동 능력에 영향을 미칠 수 있다. 세포외 매트릭스의 재형성을 통한 암 세포의 침습성의 증가 이외에, 증식 및 혈관신생의 증가를 비롯한 여러 다른 FAP-매개 종양 촉진 역할이 제안되었다. 또한, FAP의 기질 발현은 다양한 암에서 면역감시로부터 벗어나는 것과 연관되며, 이는 항종양 면역에서의 역할을 시사한다 (문헌 [Pure, et al., Oncogene, 2018, 37: 4343]).
FAP는 정상 발생 동안 일시적으로 발현되지만, 건강한 성인 조직에서는 단지 드물게 발현된다. 트랜스제닉 마우스에서, FAP는 지방 조직, 골격근, 피부, 골 및 췌장에 의해 발현되는 것으로 나타났다 (문헌 [Pure, et al., Oncogene, 2018, 37: 4343]; [Roberts, et al., J Exp Med, 2013, 210: 1137]). 그러나, FAP 녹아웃 마우스는 건강한 표현형을 가지며, 이는 정상 조건 하에 중복 역할을 시사한다 (문헌 [Niedermeyer, et al., Mol Cell Biol, 2000, 20: 1089]). 상처 치유, 섬유증, 관절염, 아테롬성동맥경화증 및 암을 포함한 활성 조직 재형성의 부위에서, FAP는 기질 세포에서 고도로 상향조절된다 (문헌 [Pure, et al., Oncogene, 2018, 37: 4343]).
상피 암종의 90%의 종양 기질에서의 FAP 발현은 모노클로날 항체, F19를 사용하여 1990년에 처음 보고되었다 (문헌 [Garin-Chesa, et al., Proc Natl Acad Sci U S A, 1990, 87: 7235]; [Rettig, et al., Cancer Res, 1993, 53: 3327]). FAP-발현 기질 세포는 암-연관 섬유모세포 (CAF) 및 암-연관 혈관주위세포로서 추가로 특징화되었다 (문헌 [Cremasco, et al., Cancer Immunol Res, 2018, 6: 1472]). 악성 상피 세포 상에서의 FAP 발현이 또한 보고되었지만, 그의 유의성은 여전히 규정되어야 한다 (문헌 [Pure, et al., Oncogene, 2018, 37: 4343]). 문헌 [Busek et al. (Busek, et al., Front Biosci (Landmark Ed), 2018, 23: 1933)]으로부터의 하기 표 1은 종양 유형 및 세포 발현을 나타낸 다양한 악성종양에서의 FAP의 발현을 요약한다.
표 1: 인간 악성종양에서의 FAP 발현 (문헌 [Busek et al.]으로부터의 것)
CAF에서의 FAP 발현은 거의 모든 암종 및 육종에 대해 나타났다 (문헌 [Pure, et al., Oncogene, 2018, 37: 4343]; [Busek, et al., Front Biosci (Landmark Ed), 2018, 23: 1933]). 또한, CAF는 혈액 악성종양에 존재한다 (문헌 [Raffaghello, et al., Oncotarget, 2015, 6: 2589]). 따라서, 치료 표적으로서의 FAP의 이용은 특정 종양 실체에 제한되지 않는다.
FAP-발현 CAF의 존재비는 불량한 예후와 상관관계가 있는 것으로 설명된다. 광범위한 인간 종양 적응증에 걸쳐, FAP 발현은 보다 높은 종양 등급 및 보다 불량한 전체 생존과 상관관계가 있는 것으로 기재된다 (문헌 [Pure, et al., Oncogene, 2018, 37: 4343]).
상기 기재된 바와 같이, FAP 뿐만 아니라 종양 미세환경에 존재하는 FAP-발현 세포는 종양 진행에 유의하게 영향을 미치는 것으로 나타났다 (문헌 [Hanahan, et al., Cancer Cell, 2012, 21: 309]). 추가로, 종양에서의 그의 비교적 선택적인 발현으로 인해, FAP는 하기 기재된 바와 같이 치료제 및 진단제에 적합한 표적으로 간주된다 (문헌 [Siveke, J Nucl Med, 2018, 59: 1412]; [Christiansen, et al., Neoplasia, 2013, 15: 348]; [Zi, et al., Mol Med Rep, 2015, 11: 3203]).
그의 발견 직후, FAP를 암에서의 치료 표적으로 이용하였다. 오늘날까지, 예를 들어 FAP 효소 활성의 억제, FAP-양성 세포의 제거 또는 세포독성 화합물의 표적화된 전달을 비롯한 다양한 전략이 연구되고 있다.
2007년에, FAP 및 DPP4의 억제제인 탈라보스타트 (Val-boro-Pro, PT-100)가 포인트 테라퓨틱스(Point Therapeutics)에 의해 개발되었다 (예를 들어, 미국 특허 번호 6,890,904, 공개 국제 특허 출원 WO9916864에 기재된 바와 같음). 문헌 [Pennisi et al. (Pennisi, et al., Br J Haematol, 2009, 145: 775)은 다발성 골수종 동물 모델에서 뿐만 아니라 암 동계 마우스 모델에서 감소된 종양 성장을 관찰하였다. 또한, 여러 다른 프롤릴 보론산 유도체가 개발되었고, FAP에 대한 추정 선택적 억제제로서 보고되었다. 이들 유도체는 생리적 pH의 수성 환경에서 불안정성 (문헌 [Coutts, et al., J Med Chem, 1996, 39: 2087]) 및 다른 효소와의 비-특이적 반응성을 나타낸다.
WO 2008/116054는, 화합물이 C-말단 비스-아미노 또는 보론산 관능기를 포함하는 헥사펩티드 유도체를 개시하였다.
US 2017/0066800은 FAP에 대해 효과적인 슈도펩티드 억제제, 예컨대 M83을 개시하였다. 이들 억제제를 면역결핍 마우스의 폐암 및 결장암 이종이식편에서 평가하였다. 종양 성장의 억제가 관찰되었다 (문헌 [Jackson, et al., Neoplasia, 2015, 17: 43]). 이들 슈도펩티드는 프롤릴 올리고펩티다제 (POP/PREP) 및 FAP 둘 다의 활성을 억제하고, 따라서 특이적 치료 FAP 억제제로서의 그의 용도는 배제된다.
US 2008/280856은 나노몰의 보론산-기재 억제제를 개시하였다. 이 억제제는 FAP 및 PREP의 이중특이적 억제를 나타내고, 따라서 특이적 치료 FAP 억제제로서의 그의 용도는 배제된다.
시클릭 펩티드를 기재로 하는 FAP 억제제는, 예를 들어 WO 2016/146174 및 WO 2006/042282에 개시되어 있다. WO 2016/146174는 FAP에 대한 특이성을 나타내는 FAP를 발현하는 종양의 진단 및 치료를 위한 펩티드를 개시하였으며, 이에 의해 밀접하게 관련된 상동체 DPP4는 상기 펩티드에 의해 인식되지 않았다. WO 2006/042282는 흑색종 치료용 폴리펩티드를 개시하였다. 누드 마우스에서, 흑색종 성장 및 흑색종 전이의 억제가 나타났다.
WO 99/75151 및 WO 01/68708은 인간화 FAP 모노클로날 항체, F19, (시브로투주맙)을 개시하였다. 또한, 항-FAP 항체 F19 및 그의 인간화 버전은 WO 99/57151 및 WO 01/68708에 개시되어 있다. 개발 접근법은, 예를 들어 2가 유도체로 전환된 고친화도 종 교차-반응성 FAP-특이적 scFv의 생성을 수반하였다 (문헌 [Brocks, et al., Mol Med, 2001, 7: 461]). I상 및 II상 임상 시험에서, 시브로투주맙은 특이적 종양 농축을 나타내는 한편, 전이성 결장직장암을 갖는 환자에서 측정가능한 치료 활성을 입증하는데 실패하였고, 17명의 환자 중 단지 2명만이 안정 질환을 가졌다 (문헌 [Hofheinz, et al., Onkologie, 2003, 26: 44]). 이 F19 항체는 FAP의 임의의 세포 또는 프로테아제 기능을 차단하는 것으로 나타나지 않았으며, 이는 치료 효과의 결여를 설명할 수 있다 (문헌 [Hofheinz, et al., Onkologie, 2003, 26: 44]; [Scott, et al., Clin Cancer Res, 2003, 9: 1639]).
US 2018/022822는, FAP에 의해 유도된 질환 및 상태의 치료에 유용한 인간-유래 항체 및 키메라 항원 수용체 (CAR)로서 인간 FAP 및 그의 에피토프에 특이적으로 결합하는 신규 분자를 개시하였다. 동소 동계 MC38 결장직장 종양을 보유하는 마우스의 항-FAP 항체로의 치료는 종양 직경 및 전이의 수를 감소시켰다. WO 2012/020006은 Fc 영역에 변형된 올리고사카라이드를 보유하는 당조작된 항체를 개시하였다. 후속적으로, FAP 및 DR5에 특이적인 이중특이적 항체를 WO 2014/161845의 주제로서 개발하였다. 이들 항체는 FAP-양성 기질을 갖는 시험관내 및 생체내 전임상 종양 모델에서 종양 세포 아폽토시스를 촉발한다 (문헌 [Brunker, et al., Mol Cancer Ther, 2016, 15: 946]). FAP를 표적화하는 항체 약물 접합체 및 면역독소는 WO 2015/118030에 기재되어 있다. 항-hu/moFAP hu36:시토리신 ADC 후보의 적용 후에 종양 성장의 시험관내 독성 뿐만 아니라 생체내 억제가 나타났다. 이들 항체가 FAP 활성을 억제할 수 있는지 여부는 불명확하다.
낮은 나노몰의 억제 효력 및 관련 DPP 및 PREP에 대한 높은 선택성을 나타내는 (4-퀴놀리노일)글리실-2-시아노피롤리딘을 기재로 하는 소분자 FAP 억제제는 얀센(Jansen) 등에 의해 기재되었고 (문헌 [Jansen, et al., J Med Chem, 2014, 57: 3053]; [Jansen, et al., ACS Med Chem Lett, 2013, 4: 491]), WO 2013/107820에 개시되었다. 그러나, 상기 화합물은 본 발명의 화합물과 구조적으로 관련이 없으며, FAP에 대한 공유 결합을 유도하는 워헤드를 포함한다.
최근 수년간, 본원에 예시적으로 기재된 여러 FAP-표적화 방사성제약 접근법이 개발되었다.
WO 2010/036814는 FAP 효소 활성의 억제를 통한 치료제로서 또는 FAP로의 결합을 통한 방사성약제로서 사용하기 위한 FAP의 소분자 억제제를 개시하였다.
WO 2019/083990은 얀센 등 (문헌 [Jansen, et al., J Med Chem, 2014, 57: 3053]; [Jansen, et al., ACS Med Chem Lett, 2013, 4: 491])에 의해 기재된 소분자 FAP-억제제에 기초한 영상화제 및 방사선요법제를 개시하였다. 또한, 몇몇 저자들은 얀센 등 (문헌 [Jansen, et al., J Med Chem, 2014, 57: 3053]; [Jansen, et al., ACS Med Chem Lett, 2013, 4: 491])에 의해 기재된 FAP-억제제에 기초한 영상화제 및 방사선요법제의 암 환자의 종양에서의 선택적 흡수를 기재하였다 (문헌 [Lindner, et al., J Nucl Med, 2018, 59: 1415]; [Loktev, et al., J Nucl Med, 2018, 59: 1423]; [Giesel, et al., J Nucl Med, 2019, 60: 386]; [Loktev, et al., J Nucl Med, 2019, Mar 8 (epub ahead of print)]; [Giesel, et al., Eur J Nucl Med Mol Imaging, 2019, 46: 1754]; [Kratochwil, et al., J Nucl Med, 2019, 60: 801]).
F19 항체 (시브로투주맙)의 131I-표지된 인간화 형태의 임상 평가는 결장직장 암종 또는 비소세포 폐암을 갖는 환자에서 종양에 의해 선택적으로 흡수되지만 정상 조직에 의해서는 그렇지 않다는 것을 밝혀냈다 (문헌 [Scott, et al., Clin Cancer Res, 2003, 9: 1639]). 이는 방사성핵종을 수반하는 진단, 치료 또는 치료 접근법에 이들을 부적합하게 만드는 항체의 긴 순환 시간 때문일 수 있다.
WO 2011/040972는 강력한 방사성면역접합체로서 인간 및 뮤린 FAP 항원 둘 다를 인식하는 고친화도 항체를 개시하였다. ESC11 IgG1은 표면 FAP의 하향 조정 및 내재화를 유도한다 (문헌 [Fischer, et al., Clin Cancer Res, 2012, 18: 6208]). WO 2017/211809는 표적화 모이어티가 FAP에 대한 특이성을 갖는 조직 표적화 토륨-227 착물을 개시하였다. 그러나, 항체의 긴 순환 시간은 이들을 방사성핵종을 수반하는 진단, 치료 또는 치료 접근법에 부적합하게 만든다.
FAP는 또한 종양학 적응증 이외의 다른 질환에 관여하는 것으로 기재되었으며, 그 예는 하기에 주어진다.
환자의 류마티스 관절염성 관절에서 섬유모세포-유사 활막세포는 FAP의 유의하게 증가된 발현을 나타낸다 (문헌 [Bauer, et al., Arthritis Res Ther, 2006, 8: R171]; [Milner, et al., Arthritis Res Ther, 2006, 8: R23]). 류마티스 관절염에서, 기질 세포는 세포외 매트릭스 성분을 생산하고, 침윤 면역 세포를 동원하고, 염증 매개체를 분비함으로써 관절의 활막 조직의 구조를 조직화하는데 중요한 역할을 한다. 염증 및 관절 손상의 지속성을 유도하는데 있어서 이들 세포의 역할을 지지하는 상당한 증거가 존재한다 (문헌 [Bartok, et al., Immunol Rev, 2010, 233: 233]; [Turner, et al., Curr Opin Rheumatol, 2015, 27: 175]). 류마티스 관절염에서 FAP는 적어도 프로테오글리칸 손실의 촉진 및 후속적으로 연골 분해에 의해 연골 전환에서 병리학적 역할을 한다 (문헌 [Bauer, et al., Arthritis Res Ther, 2006, 8: R171]; [Waldele, et al., Arthritis Res Ther, 2015, 17: 12]). 따라서, 이는 환자 계층화에 대한 마커로서, 치료 성공의 평가 및 추적을 위해 또는 치료 표적으로서 기능할 수 있다 (문헌 [Bauer, et al., Arthritis Res Ther, 2006, 8: R171]). 마우스에서, 치료 반응은 99mTc-표지된 항-FAP 항체의 SPECT/CT 영상화를 사용하여 입증되었다 (문헌 [van der Geest, et al., Rheumatology (Oxford), 2018, 57: 737]; [Laverman, et al., J Nucl Med, 2015, 56: 778]; [van der Geest, et al., J Nucl Med, 2017, 58: 151]).
추가로, FAP는 손상 반응에서 활성화된 섬유모세포의 마커로서 (문헌 [Tillmanns, et al., Int J Cardiol, 2013, 168: 3926]), 뿐만 아니라 상처의 치유 과정에서 중요한 플레이어로서 (문헌 [Ramirez-Montagut, et al., Oncogene, 2004, 23: 5435]) 인식되었다. 징(Jing) 등은 래트에서 화상 상처 후 FAP 발현의 시간-의존성 변화 과정을 입증하였다 (문헌 [Jing, et al., Nan Fang Yi Ke Da Xue Bao, 2013, 33: 615]). 통상적인 양성 섬유증식성 망상 피부 병변인 켈로이드 반흔에서 반응성 상처 섬유모세포에서의 FAP 활성의 억제는 질환 진행을 예방하기 위한 치료 옵션을 제공할 수 있다 (문헌 [Dienus, et al., Arch Dermatol Res, 2010, 302: 725]).
섬유화 질환에서, FAP의 상향조절된 발현은 예를 들어 특발성 폐 섬유증, 크론병 및 간 섬유증에서 관찰되었다. 과도한 불균형 세포외 매트릭스 (ECM) 침착을 특징으로 하는 만성 장 염증성 질환인 크론병에 대한 생체외 모델에서, 상향조절된 FAP 발현이 관찰되었다. FAP 억제는 세포외 매트릭스 항상성을 재구성하였다 (문헌 [Truffi, et al., Inflamm Bowel Dis, 2018, 24: 332]). 폐 섬유증의 뮤린 모델의 사용 하에 유사한 관찰이 에거(Egger) 등 (문헌 [Egger, et al., Eur J Pharmacol, 2017, 809: 64])에 의해 이루어졌다. FAP의 억제는 감소된 섬유화 병리상태로 이어진다. FAP는 또한 만성적으로 손상된 간의 조직 재형성 영역에서 발현되고 (문헌 [Wang, et al., Front Biosci, 2008, 13: 3168]), 간 성상 세포에 의한 FAP 발현은 간 질환의 조직학적 중증도와 상관관계가 있다 (문헌 [Gorrell, et al., Adv Exp Med Biol, 2003, 524: 235]). 따라서, FAP는 또한 간 섬유증의 치료에서 유망한 표적이다 (문헌 [Lay, et al., Front Biosci (Landmark Ed), 2019, 24: 1]).
FAP는 동맥경화성 병변에서 발현되고, 활성화된 혈관 평활근 세포에서 상향조절된다 (문헌 [Monslow, et al., Circulation, 2013, 128: A17597]). 몬슬로우 (Monslow) 등은 동맥경화성 병변에서의 FAP의 표적화된 억제가 염증에 비해 매트릭스-풍부 병변을 선호함으로써 병변 구조를 변경시키는 그의 능력을 통해 전체 병변 부담을 감소시키고, 염증 세포 귀소를 억제하고, 병변 안정성을 증가시킬 수 있다는 것을 나타냈다. 보다 중요하게는, 대부분의 동맥경화성 병리상태는 공통적인 병원성 특색: 동맥경화성 병변을 유도하는 아테롬성동맥경화성판의 파열을 공유한다 (문헌 [Davies, et al., Br Heart J, 1985, 53: 363]; [Falk, Am J Cardiol, 1989, 63: 114e]). 진행성 아테롬성동맥경화성판에서의 섬유성 캡의 파열은 심근경색 및 심장 돌연사로 이어질 수 있는 급성 관상동맥 증후군의 중요한 촉발인자이다. 판 불안정성을 촉진하는데 있어서 핵심 사건 중 하나는 섬유성 캡의 분해이며, 이는 기저 혈전형성 판 코어를 혈류에 노출시켜 혈전증 및 후속 혈관 폐쇄를 유발한다 (문헌 [Farb, et al., Circulation, 1996, 93: 1354]; [Virmani, et al., J Am Coll Cardiol, 2006, 47: C13]). 브로코프(Brokopp) 등은 FAP가 섬유성 캡에서 유형 I 콜라겐 분해에 기여한다는 것을 나타냈다 (문헌 [Brokopp, et al., Eur Heart J, 2011, 32: 2713]). 방사성표지된 추적자가 개발되었고, 아테롬성동맥경화증 영상화에 대한 그의 적용가능성이 제시되었다 (문헌 [Meletta, et al., Molecules, 2015, 20: 2081]).
본 발명의 근본적인 과제는, 특히 진단 및/또는 치료 활성 이펙터에 접합된 경우, 진단제 및/또는 제약 작용제로서 적합한 화합물의 제공이다. 본 발명의 추가의 근본적인 과제는, 특히 진단 및/또는 치료 활성 이펙터에 접합된 경우, 진단제 및/또는 제약 작용제로서 적합한 화합물의 제공이며, 여기서 화합물은 FAP 활성의 강력한 억제제이고; 바람직하게는 화합물의 pIC50은 6.0 이상이다. 본 발명의 추가의 근본적인 과제는 이환 세포 및/또는 이환 조직이 FAP를 발현하는 질환의 진단 및/또는 요법에서, 특히 진단 및/또는 치료 활성 이펙터에 접합된 경우, 진단제 및/또는 제약 작용제로서 적합한 화합물의 제공이다. 본 발명의 또 다른 추가의 근본적인 과제는 진단 및/또는 치료상 유효한 작용제를 각각 이환 세포 및/또는 이환 조직, 보다 특히 FAP-발현 이환 세포 및/또는 이환 조직, 바람직하게는 암 연관 섬유모세포를 포함하거나 함유하는 이환 조직에 전달하는데 적합한 화합물의 제공이다. 또한, 본 발명의 근본적인 과제는 질환의 진단 방법, 질환의 치료 및/또는 예방 방법 및 질환의 조합 진단 및 치료 방법을 제공하는 것이고; 바람직하게는 이러한 질환은 FAP-발현 세포 및/또는 조직, 보다 특히 FAP-발현 이환 세포 및/또는 이환 조직을 수반하는 질환이고, 바람직하게는 이환 조직은 암 연관 섬유모세포를 포함하거나 함유한다. 본 발명의 추가의 근본적인 과제는 질환의 치료에 반응할 가능성이 있거나 또는 반응하지 않을 가능성이 있는 대상체를 확인하는 방법, 대상체의 군으로부터 질환의 치료에 반응할 가능성이 있거나 또는 반응하지 않을 가능성이 있는 대상체를 선택하는 방법을 제공하는 것이다. 또한, 본 발명의 근본적인 과제는 상기 요약된 바와 같은 특징을 갖는 화합물을 함유하는 제약 조성물의 제공이다. 또한, 본 발명의 근본적인 과제는 상기 방법 중 임의의 것에 사용하기에 적합한 키트의 제공이다.
특히 진단 및/또는 치료 활성 이펙터에 접합된 경우, 진단제 및/또는 제약 작용제로서 적합한 화합물이 필요하다. 추가로, 특히 진단 및/또는 치료 활성 이펙터에 접합된 경우, 진단제 및/또는 제약 작용제로서 적합하며, 이에 의해 FAP 활성의 강력한 억제제이고; 바람직하게는 화합물의 pIC50이 6.0 이상인 화합물에 대한 필요가 존재한다. 추가로, 이환 세포 및/또는 이환 조직이 FAP를 발현하는 질환의 진단 및/또는 요법에서, 특히 진단 및/또는 치료 활성 이펙터에 접합된 경우, 진단제 및/또는 제약 작용제로서 적합한 화합물이 필요하다. 또한, 진단 및/또는 치료상 유효한 작용제를 각각 이환 세포 및/또는 이환 조직, 보다 특히 FAP-발현 이환 세포 및/또는 이환 조직, 바람직하게는 암 연관 섬유모세포를 포함하거나 함유하는 이환 조직에 전달하는데 적합한 화합물이 필요하다. 또한, 질환의 진단 방법, 질환의 치료 및/또는 예방 방법, 및 질환의 조합 진단 및 치료 방법이 필요하고; 바람직하게는 상기 질환은 FAP-발현 세포 및/또는 조직, 보다 특히 FAP-발현 이환 세포 및/또는 이환 조직을 수반하는 질환이고, 바람직하게는 이환 조직은 암 연관 섬유모세포를 포함하거나 함유한다. 또한, 질환의 치료에 반응할 가능성이 있거나 또는 반응하지 않을 가능성이 있는 대상체를 확인하는 방법, 대상체의 군으로부터 질환의 치료에 반응할 가능성이 있거나 또는 반응하지 않을 가능성이 있는 대상체를 선택하는 방법이 필요하다. 추가로, 상기 개략된 바와 같은 특징을 갖는 화합물을 함유하는 제약 조성물이 필요하다. 또한, 상기 방법 중 임의의 것에 사용하기에 적합한 키트가 필요하다. 본 발명은 이들 필요를 만족시킨다.
이들 및 다른 과제는 첨부된 청구범위의 대상에 의해 해결된다.
본 발명의 이들 및 다른 근본적인 과제는 또한 하기 실시양태에 의해 해결된다.
실시양태 1. 화학식 (I)의 시클릭 펩티드 및 Xaa1에 부착된 N-말단 변형 기 A를 포함하는 화합물:
여기서,
펩티드 서열은 N에서 C-말단 방향으로 좌측에서 우측으로 그려지고,
Xaa1은 화학식 (II)의 아미노산의 잔기이고:
여기서
R1a는 -NH-이고,
R1b는 H 또는 CH3이고,
n = 0 또는 1이고,
N-말단 변형 기 A는 Xaa1의 질소 원자에 공유 부착되고,
Xaa1의 카르보닐 기는 Xaa2의 질소에 공유 부착되고,
Xaa1의 황 원자는 Yc에 티오에테르로서 공유 부착되고;
Xaa2는 화학식 (III), (IV) 또는 (XX)의 아미노산의 잔기이고:
여기서
R2a, R2b 및 R2c는 각각 및 독립적으로 (C1-C2)알킬 및 H로 이루어진 군으로부터 선택되고, 여기서 상기 (C1-C2)알킬은 OH, NH2, 할로겐, (C5-C7)시클로알킬로 이루어진 군으로부터 선택되는 치환기에 의해 치환될 수 있고,
p = 0, 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
화학식 (IV)의 아미노산은 나타낸 고리 위치 3 및 4에서 메틸, OH, NH2 및 F로 이루어진 군으로부터 선택되는 1 또는 2개의 치환기에 의해 치환될 수 있고;
Xaa3은 화학식 (V) 또는 (XX)의 아미노산의 잔기이고:
여기서
X3은 CH2, CF2, CH-R3b, S, O 및 NH로 이루어진 군으로부터 선택되고,
p = 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
R3a는 H, 메틸, OH, NH2 또는 F이고,
R3b는 메틸, OH, NH2 또는 F이고;
Xaa4는 화학식 (VI)의 아미노산의 잔기이고:
여기서
R4a는 H, OH, COOH, CONH2, X4 및 -NH-CO-X4로 이루어진 군으로부터 선택되고, 여기서 X4는 (C1-C6)알킬, (C5-C6)아릴 및 (C5-C6)헤테로아릴로 이루어진 군으로부터 선택되고, X4는 메틸, CONH2, 할로겐, NH2 및 OH로 이루어진 군으로부터 선택되는 1 또는 2개의 치환기에 의해 치환될 수 있고;
q = 1, 2 또는 3이고, 여기서 임의로, 상기 1, 2 또는 3개의 CH2-기의 1 또는 2개의 수소는 각각 및 개별적으로 메틸, 에틸, (C5-C6)아릴 또는 (C5-C6)헤테로아릴에 의해 치환되고,
R4b는 메틸 또는 H이고;
Xaa5는 구조 (VII)의 아미노산의 잔기이고:
여기서
R5는 OH 및 NH2의 군으로부터 선택되고,
r = 1, 2 또는 3이고;
Xaa6은 방향족 L-α-아미노산 및 헤테로방향족 L-α-아미노산으로 이루어진 군으로부터 선택되는 아미노산이고;
Xaa7은 화학식 (IX)의 아미노 티올 또는 아미노산의 잔기이고:
여기서
R7a는 -CO-, -COOH, -CONH2, -CH2-OH, -(CO)-NH-R7b, -(CO)-(NR7c)-R7b 또는 H이고, 여기서 R7b 및 R7c는 각각 및 독립적으로 (C1-C4)알킬이고,
t는 1 또는 2이고;
Yc는 화학식 (X)의 구조이고:
2개의 티오에테르 연결의 형성 하에 Xaa1의 S 원자 및 Xaa7의 S 원자를 연결하여 화학식 (XXI)의 시클릭 구조를 형성하고:
화학식 (X)에서 방향족 기의 치환 패턴은 오르토, 메타 또는 파라이고,
n = 0 또는 1이고,
t = 1 또는 2이고,
Y1은 C-H 또는 N이고,
Y2는 N 또는 C-Rc1이고,
Rc1은 H 또는 CH2-Rc2이고,
Rc2는 화학식 (XI), (XII) 또는 (XXII)의 구조이고:
여기서
Rc3 및 Rc4는 각각 및 독립적으로 H 및 (C1-C4)알킬로 이루어진 군으로부터 선택되고,
u = 1, 2, 3, 4, 5 또는 6이고,
x 및 y는 각각 및 독립적으로 1, 2 또는 3이고,
X = O 또는 S이고,
화학식 (XI) 및 (XXII)에서 질소 원자 중 1개는 Rc1의 -CH2-에 부착되고, 화학식 (XII)에서 -X-는 Rc1의 -CH2-에 부착되고;
N-말단 변형 기 A는 차단 기 Abl이고, 여기서 차단 기 Abl은 Ra1-NH-C(O)-이고; Ra1은 C3 알킬, C4 알킬 또는 C5 알킬로 이루어진 군으로부터 선택되고, 각각 독립적으로 OH, F, COOH, (C3-C8)시클로알킬, 아릴, 헤테로아릴 및 (C3-C8)헤테로사이클로 이루어진 군으로부터 각각 독립적으로 선택된 2개 이하의 치환기에 의해 임의로 치환되고, (C1-C8)알킬에서 -CH2- 기 중 1개는 -S- 또는 -O-에 의해 임의로 대체된다.
실시양태 2. 실시양태 1에 있어서, Ra1이 C3 알킬, C4 알킬 또는 C5 알킬로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 3. 실시양태 1 또는 2에 있어서, Ra1이 C4 알킬인 화합물.
실시양태 4. 실시양태 3에 있어서, Ra1이 n-부틸인 화합물.
실시양태 5. 실시양태 1 내지 4 중 어느 하나에 있어서, Xaa1이 cys, hcy 및 pen으로 이루어진 군으로부터 선택된 D-아미노산 잔기이거나, 또는 Xaa1이 Cys, Hcy 및 Pen으로 이루어진 군으로부터 선택된 L-아미노산 잔기인 화합물.
실시양태 6. 실시양태 5에 있어서, Xaa1이 Cys인 화합물.
실시양태 7. 실시양태 1, 2, 3, 4, 5 및 6 중 어느 하나에 있어서, Xaa2가 Pro, Gly, Nmg 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 8. 실시양태 7에 있어서, Xaa2가 Pro 및 Nmg로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 9. 실시양태 7 또는 8에 있어서, Xaa2가 Pro의 아미노산 잔기인 화합물.
실시양태 10. 실시양태 1, 2, 3, 4, 5, 6, 7, 8 및 9 중 어느 하나에 있어서, Xaa3이 Pro, Hyp, Tfp, Cfp, Dmp, Aze 및 Pip 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 11. 실시양태 10에 있어서, Xaa3이 Pro의 아미노산 잔기인 화합물.
실시양태 12. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 및 11 중 어느 하나에 있어서, Xaa4가 Thr, Hse, Asn, Gln 및 Ser 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 13. 실시양태 12에 있어서, Xaa4가 Thr인 화합물.
실시양태 14. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 및 13 중 어느 하나에 있어서, Xaa5가 Gln 및 Glu 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 15. 실시양태 14에 있어서, Xaa5가 Gln 및 Glu로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 16. 실시양태 15에 있어서, Xaa5가 Gln의 아미노산 잔기인 화합물.
실시양태 17. 실시양태 15에 있어서, Xaa5가 Glu의 아미노산 잔기인 화합물.
실시양태 18. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 및 17 중 어느 하나에 있어서, Xaa6이 화학식 (VIIIa), (VIIIb), (VIIIc) 및 (VIIId) 중 어느 하나의 아미노산 잔기인 화합물:
여기서
R6a 및 R6b는 각각 독립적으로 H, 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
R6c는 0 내지 3개의 치환기를 나타내고, 각각의 이러한 치환기는 각각 독립적으로 Cl, F, Br, NO2, NH2, CN, CF3, OH, OR6d 및 C1-C4 알킬로 이루어진 군으로부터 선택되고,
R6d는 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
s는 0 또는 1이다.
실시양태 19. 실시양태 18에 있어서, Xaa6이 화학식 (VIIIa), (VIIIb), (VIIIc) 및 (VIIId) 중 어느 하나의 아미노산 잔기인 화합물:
여기서
R6a 및 R6b은 각각 H이고,
R6c는 0 내지 2개의 치환기를 나타내고, 각각의 이러한 치환기는 각각 독립적으로 Cl, F, Br, NO2, NH2, CN, CF3, OH, OR6d 및 메틸로 이루어진 군으로부터 선택되고,
R6d는 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
s는 0이다.
실시양태 20. 실시양태 18 또는 19에 있어서, Xaa6이 Phe, Ocf, Ppa, Thi, 1Ni, Otf 및 Mpa 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 21. 실시양태 20에 있어서, Xaa6이 Phe의 아미노산 잔기인 화합물.
실시양태 22. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 및 21 중 어느 하나에 있어서, Xaa7이 Cys, Cys-OH, Cys-NH2, Cysol, AET, Hcy, cys, cys-OH, cys-NH2 및 hcy로 이루어진 군으로부터 선택된 아미노 티올 잔기인 화합물.
실시양태 23. 실시양태 22에 있어서, Xaa7이 Cys, Cys-OH, Cys-NH2, Cysol 및 AET로 이루어진 군으로부터 선택된 아미노 티올 잔기인 화합물.
실시양태 24. 실시양태 23에 있어서, Xaa7이 Cys, Cys-OH 또는 Cys-NH2, 바람직하게는 Cys-OH의 아미노 티올 잔기인 화합물.
실시양태 25. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 및 24 중 어느 하나, 바람직하게는 실시양태 1, 2, 3 및 4 중 어느 하나에 있어서,
Xaa1은 Cys의 아미노산 잔기이고,
Xaa2는 Pro 또는 Nmg의 아미노산 잔기, 바람직하게는 Pro의 아미노산 잔기이고,
Xaa3은 Pro의 아미노산 잔기이고,
Xaa4는 Thr의 아미노산 잔기이고,
Xaa5는 Gln 또는 Glu의 아미노산 잔기, 바람직하게는 Gln의 아미노산 잔기이고,
Xaa6은 Phe의 아미노산 잔기이고,
Xaa7은 Cys의 아미노산 잔기인 화합물.
실시양태 26. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 및 24 중 어느 하나, 바람직하게는 실시양태 1, 2, 3 및 4 중 어느 하나에 있어서,
Xaa1은 Cys의 아미노산 잔기이고,
Xaa2는 Pro의 아미노산 잔기이고,
Xaa3은 Pro의 아미노산 잔기이고,
Xaa4는 Thr의 아미노산 잔기이고,
Xaa5는 Gln의 아미노산 잔기이고,
Xaa6은 Phe의 아미노산 잔기이고,
Xaa7은 Cys의 아미노산 잔기인 화합물.
실시양태 27. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 및 24 중 어느 하나, 바람직하게는 실시양태 1, 2, 3 및 4 중 어느 하나에 있어서,
Xaa1은 Cys의 아미노산 잔기이고,
Xaa2는 Pro의 아미노산 잔기이고,
Xaa3은 Pro의 아미노산 잔기이고,
Xaa4는 Thr의 아미노산 잔기이고,
Xaa5는 Glu의 아미노산 잔기이고,
Xaa6은 Phe의 아미노산 잔기이고,
Xaa7은 Cys의 아미노산 잔기인 화합물.
실시양태 28. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 및 24 중 어느 하나, 바람직하게는 실시양태 1, 2, 3 및 4 중 어느 하나에 있어서,
Xaa1은 Cys의 아미노산 잔기이고,
Xaa2는 Nmg의 아미노산 잔기이고,
Xaa3은 Pro의 아미노산 잔기이고,
Xaa4는 Thr의 아미노산 잔기이고,
Xaa5는 Gln의 아미노산 잔기이고,
Xaa6은 Phe의 아미노산 잔기이고,
Xaa7은 Cys의 아미노산 잔기인 화합물.
실시양태 29. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27 및 28 중 어느 하나에 있어서, Yc가
의 구조인 화합물:
여기서
Rc1은 CH2-Rc2 또는 H이고,
CH2-Rc2는 화학식 (XIId) 또는 화학식 (XXIIb)의 구조이고:
여기서
Z는 임의로 링커를 포함하는 킬레이트화제이고,
Rc4는 H 또는 메틸이고,
u = 1, 2, 3, 4 또는 5이다.
실시양태 30. 실시양태 29에 있어서, Rc2가 화학식 (XIId)의 구조인 화합물:
실시양태 31. 실시양태 29 또는 30에 있어서, Rc2가 화학식 (XIId)의 구조인 화합물:
여기서
u = 1이고,
Rc4는 H이다.
실시양태 32. 실시양태 29에 있어서, Rc2가 화학식 (XXIIc)의 구조인 화합물:
실시양태 33. 실시양태 29, 30, 31 및 32 중 어느 하나에 있어서, Z가 링커가 결여된 킬레이트화제인 화합물.
실시양태 34. 실시양태 29, 30, 31 및 32 중 어느 하나에 있어서, Z가 링커를 포함하는 킬레이트화제인 화합물.
실시양태 35. 실시양태 34에 있어서, 링커가 킬레이트화제에 공유 연결되고 화학식 (XIId)의 구조의 N-원자에 공유 연결된 것인 화합물:
실시양태 36. 실시양태 34에 있어서, 링커가 킬레이트화제에 공유 연결되고 화학식 (XXIIc)의 구조의 N-원자에 공유 연결된 것인 화합물:
실시양태 37. 실시양태 34, 35 및 36 중 어느 하나에 있어서, 링커가 Ttds 및 O2Oc로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 38. 실시양태 37에 있어서, 링커가 Ttds인 화합물.
실시양태 39. 실시양태 37에 있어서, 링커가 O2Oc인 화합물.
실시양태 39. 실시양태 29에 있어서, Rc1이 H인 화합물.
실시양태 40. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38 및 39 중 어느 하나에 있어서, 아미노산 또는 펩티드가 Xaa7에 부착되며, 여기서 상기 펩티드의 대부분의 아미노산은 하전되거나 극성이고, 펩티드의 알짜 전하는 -2, -1, 0, +1 또는 +2인 화합물.
실시양태 41. 실시양태 40에 있어서, 아미노산이 Xaa7에 부착된 것인 화합물.
실시양태 42. 실시양태 41에 있어서, Xaa 7에 부착된 아미노산이 Asp, asp, Bal, Gly, Gab, Ser, Nmg, Bhf, Lys, Ape, Ttds 및 Bhk로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 43. 실시양태 42에 있어서, Xaa7에 부착된 아미노산이 Bhk, Ape 및 Lys로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 44. 실시양태 43에 있어서, Xaa7에 부착된 아미노산이 Bhk인 화합물.
실시양태 45. 실시양태 41, 42, 43 및 44 중 어느 하나에 있어서, 킬레이트화제 Z가 Xaa7에 부착된 아미노산에 공유 부착된 것인 화합물.
실시양태 46. 실시양태 45에 있어서, Rc1이 H인 화합물.
실시양태 47. 실시양태 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45 및 46 중 어느 하나에 있어서, Z가 99mTc(CO)3-킬레이트화제, CB-TE2A, CHX-A"-DTPA, DTPA, DATA, DFO, HBED, 크라운(Crown), DOTAGA, DOTAM (TCMC로도 불림), FSC, H4옥타파, 마크로파(Macropa), HEHA, HOPO, Hynic, PCTA, PSC, NETA, DOTA, NODA-MPAA, NODAGA, NOTP, NxS4-x (N4, N2S2, N3S), NOPO, NOTA, Pycup, RESCA, 사르코파진(Sarcophagine), TETA, THP, 및 TRAP로 이루어진 군으로부터 선택된 킬레이트화제인 화합물.
실시양태 48. 실시양태 47에 있어서, Z가 DOTAM, 마크로파, PCTA, DOTA, N4Ac, NODAGA, NOPO 및 NOTA로 이루어진 군으로부터 선택된 킬레이트화제인 화합물.
실시양태 49. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47 및 48 중 어느 하나에 있어서, 하기로 이루어진 군으로부터 선택된 화합물:
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3940):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(N4Ac-PP))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4533):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(N4Ac-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4534):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-NH2 (3BP-4560):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-PP))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4564):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-PP))-Pro-Pro-Thr-Gln-Phe-Cys]-NH2 (3BP-4565):
하기 화학식의 화합물 nBu-CAyl-[Cys(3MeBn)-Pro-Pro-Thr-Gln-Phe-Cys]-Bhk(N4Ac)-OH (3BP-4589):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-AET))-Nmg-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4607):
및 하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-AET))-Nmg-Pro-Thr-Gln-Phe-Cys]-NH2 (3BP-4621):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(NODAGA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4723):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(NODAGA-AET))-Pro-Pro-Thr-Glu-Phe-Cys]-OH (3BP-4724):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(NOPO-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4768):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(NOPO-AET))-Pro-Pro-Thr-Glu-Phe-Cys]-OH (3BP-4778):
및 하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(NOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-5210):
실시양태 50. 실시양태 49에 있어서, 하기로 이루어진 군으로부터 선택된 화합물:
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3940):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-NH2 (3BP-4560):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(NOPO-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4768):
실시양태 51. 실시양태 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 및 50 중 어느 하나에 있어서, 킬레이트화제가 핵종을 포함하고, 바람직하게는 핵종이 킬레이트화제에 의해 배위 결합된 것인 화합물.
실시양태 52. 실시양태 51에 있어서, 핵종이 진단 활성 핵종 또는 치료 활성 핵종인 화합물.
실시양태 53. 실시양태 52에 있어서, 진단 활성 핵종이 진단 활성 방사성핵종인 화합물.
실시양태 54. 실시양태 53에 있어서, 진단 활성 방사성핵종이 18F, 43Sc, 44Sc, 51Mn, 52Mn, 64Cu, 67Ga, 68Ga, 76Br, 77Br, 86Y, 89Zr, 94mTc, 99mTc, 111In, 123I, 124I, 125I, 152Tb, 155Tb, 177Lu, 201Tl, 및 203Pb로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 55. 실시양태 54에 있어서, 진단 활성 방사성핵종이 18F, 68Ga, 99mTc, 111In 및 203Pb로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 56. 실시양태 52에 있어서, 치료 활성 핵종이 치료 활성 방사성핵종인 화합물.
실시양태 57. 실시양태 56에 있어서, 치료 활성 방사성핵종이 47Sc, 67Cu, 89Sr, 90Y, 131I, 111In, 153Sm, 149Tb, 161Tb, 177Lu, 186Re, 188Re, 211At, 212Pb, 213Bi, 223Ra, 224Ra, 225Ac, 226Th 및 227Th로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 58. 실시양태 57에 있어서, 치료 활성 방사성핵종이 90Y, 177Lu, 212Pb, 및 225Ac인 화합물.
실시양태 59. 화학식 (I)의 시클릭 펩티드 및 Xaa1에 부착된 N-말단 변형 기 A를 포함하는 화합물:
여기서
펩티드 서열은 N에서 C-말단 방향으로 좌측에서 우측으로 그려지고,
Xaa1은 화학식 (II)의 아미노산의 잔기이고:
여기서
R1a는 -NH-이고,
R1b는 H 또는 CH3이고,
n = 0 또는 1이고,
N-말단 변형 기 A는 Xaa1의 질소 원자에 공유 부착되고,
Xaa1의 카르보닐 기는 Xaa2의 질소에 공유 부착되고,
Xaa1의 황 원자는 Yc에 티오에테르로서 공유 부착되고;
Xaa2는 화학식 (III), (IV) 또는 (XX)의 아미노산의 잔기이고:
여기서
R2a, R2b 및 R2c는 각각 독립적으로 (C1-C2)알킬 및 H로 이루어진 군으로부터 선택되고, 여기서 상기 (C1-C2)알킬은 OH, NH2, 할로겐, (C5-C7)시클로알킬로 이루어진 군으로부터 선택된 치환기에 의해 치환될 수 있고,
p = 0, 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
화학식 (IV)의 아미노산은 나타낸 고리 위치 3 및 4에서 메틸, OH, NH2 및 F로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
Xaa3은 화학식 (V) 또는 (XX)의 아미노산의 잔기이고:
여기서
X3은 CH2, CF2, CH-R3b, S, O 및 NH로 이루어진 군으로부터 선택되고,
p = 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
R3a는 H, 메틸, OH, NH2 또는 F이고,
R3b은 메틸, OH, NH2 또는 F이고;
Xaa4는 화학식 (VI)의 아미노산의 잔기이고:
여기서
R4a는 H, OH, COOH, CONH2, X4 및 -NH-CO-X4로 이루어진 군으로부터 선택되고, 여기서 X4는 (C1-C6)알킬, (C5-C6)아릴 및 (C5-C6)헤테로아릴로 이루어진 군으로부터 선택되고, X4는 메틸, CONH2, 할로겐, NH2 및 OH로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
q = 1, 2 또는 3이고, 여기서 임의로, 상기 1, 2 또는 3개의 CH2-기의 1 또는 2개의 수소는 메틸, 에틸, (C5-C6)아릴 또는 (C5-C6)헤테로아릴에 의해 각각 개별적으로 치환되고,
R4b는 메틸 또는 H이고;
Xaa5는 구조 (VII)의 아미노산의 잔기이고:
여기서
R5는 OH 및 NH2의 군으로부터 선택되고,
r = 1, 2 또는 3이고;
Xaa6은 방향족 L-α-아미노산 및 헤테로방향족 L-α-아미노산으로 이루어진 군으로부터 선택된 아미노산이고;
Xaa7은 화학식 (IX)의 아미노 티올 또는 아미노산의 잔기이고:
여기서
R7a는 -CO-, -COOH, -CONH2, -CH2-OH, -(CO)-NH-R7b, -(CO)-(NR7c)-R7b 또는 H이고, 여기서 R7b 및 R7c는 각각 독립적으로 (C1-C4)알킬이고,
t는 1 또는 2이고;
Yc는 화학식 (X)의 구조이고:
2개의 티오에테르 연결의 형성 하에 Xaa1의 S 원자 및 Xaa7의 S 원자를 연결하여 화학식 (XXI)의 시클릭 구조를 형성하고:
화학식 (X)에서 방향족 기의 치환 패턴은 오르토, 메타 또는 파라, 바람직하게는 메타이고,
n = 0 또는 1이고,
t = 1 또는 2이고,
Y1은 C-H이고,
Y2는 C-Rc1이고,
Rc1은 CH2-Rc2 또는 H이고,
Rc2는 화학식 (XIId) 또는 (XXIIc)의 구조이고:
여기서
u = 1이고,
Rc4는 H이고,
Z는 임의로 링커를 포함하는 킬레이트화제이고;
N-말단 변형 기 A는 차단 기 Abl이고, 여기서 차단 기 Abl은 Ra1-NH-C(O)-이고; Ra1은 OH, F, COOH, (C3-C8)시클로알킬, 아릴, 헤테로아릴 및 (C3-C8)헤테로사이클로 이루어진 군으로부터 각각 독립적으로 선택된 2개 이하의 치환기에 의해 임의로 치환된 (C1-C8)알킬이고, (C1-C8)알킬에서 -CH2- 기 중 1개는 -S- 또는 -O-에 의해 임의로 대체된다.
실시양태 60. 실시양태 59에 있어서, Rc2가 화학식 (XIId)의 구조인 화합물:
여기서
u = 1이고,
Rc4는 H이고,
Z는 임의로 링커를 포함하는 킬레이트화제이다.
실시양태 61. 실시양태 60에 있어서, Z가 링커가 결여된 킬레이트화제인 화합물.
실시양태 62. 실시양태 60에 있어서, Z가 링커를 포함하는 것인 화합물.
실시양태 63. 실시양태 62에 있어서, 링커가 킬레이트화제를 화학식 (XIId)의 구조의 N-원자에 공유 연결하는 것인 화합물.
실시양태 64. 실시양태 62 또는 63에 있어서, 링커가 Ttds, O2Oc 및 PEG6, 바람직하게는 Ttds 및 O2Oc로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 65. 실시양태 59에 있어서, Rc2가 화학식 (XXIIc)의 구조인 화합물:
여기서 Z는 임의로 링커를 포함하는 킬레이트화제이다.
실시양태 66. 실시양태 65에 있어서, Z가 링커가 결여된 킬레이트화제인 화합물.
실시양태 67. 실시양태 65에 있어서, Z가 링커를 포함하는 것인 화합물.
실시양태 68. 실시양태 67에 있어서, 링커가 킬레이트화제를 화학식 (XXIIc)의 구조의 N-원자에 공유 연결하는 것인 화합물.
실시양태 69. 실시양태 67 또는 68에 있어서, 링커가 Ttds, O2Oc 및 PEG6으로 이루어진 군으로부터 선택되고, 바람직하게는 링커가 Ttds 및 O2Oc로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 70. 실시양태 59에 있어서, Rc1이 H인 화합물.
실시양태 71. 실시양태 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69 및 70 중 어느 하나에 있어서, Ra1이 C3 알킬, C4 알킬 또는 C5 알킬로 이루어진 군으로부터 선택되고, 이들 각각 독립적으로 OH, F, COOH, (C3-C8)시클로알킬, 아릴, 헤테로아릴 및 (C3-C8)헤테로사이클로 이루어진 군으로부터 각각 독립적으로 선택된 2개 이하의 치환기에 의해 임의로 치환되고, 여기서 (C1-C8)알킬에서 -CH2-기 중 1개는 -S- 또는 -O-에 의해 임의로 대체된 것인 화합물.
실시양태 72. 실시양태 71에 있어서, Ra1이 C3 알킬, C4 알킬 또는 C5 알킬로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 73. 실시양태 71 또는 72에 있어서, Ra1이 C4 알킬인 화합물.
실시양태 74. 실시양태 73에 있어서, Ra1이 n-부틸인 화합물.
실시양태 75. 실시양태 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73 및 74 중 어느 하나에 있어서, Xaa1이 cys, hcy 및 pen으로 이루어진 군으로부터 선택된 D-아미노산 잔기이거나, 또는 Xaa1이 Cys, Hcy 및 Pen으로 이루어진 군으로부터 선택된 L-아미노산 잔기인 화합물.
실시양태 76. 실시양태 75에 있어서, Xaa1이 Cys인 화합물.
실시양태 77. 실시양태 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75 및 76 중 어느 하나에 있어서, Xaa2가 Pro, Gly, Nmg 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 78. 실시양태 77에 있어서, Xa2가 Pro 및 Nmg로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 79. 실시양태 77 또는 78에 있어서, Xaa2가 Pro의 아미노산 잔기인 화합물.
실시양태 80. 실시양태 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78 및 79 중 어느 하나에 있어서, Xaa3이 Pro, Hyp, Tfp, Cfp, Dmp, Aze 및 Pip 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 81. 실시양태 80에 있어서, Xaa3이 Pro의 아미노산 잔기인 화합물.
실시양태 82. 실시양태 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80 및 81 중 어느 하나에 있어서, Xaa4가 Thr, Hse, Asn, Gln 및 Ser 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 83. 실시양태 82에 있어서, Xaa4가 Thr인 화합물.
실시양태 84. 실시양태 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82 및 83 중 어느 하나에 있어서, Xaa5가 Gln 및 Glu 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 85. 실시양태 84에 있어서, Xaa5가 Gln 및 Glu로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 86. 실시양태 85에 있어서, Xaa5가 Gln의 아미노산 잔기인 화합물.
실시양태 87. 실시양태 85에 있어서, Xaa5가 Glu의 아미노산 잔기인 화합물.
실시양태 88. 실시양태 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85 및 86 중 어느 하나에 있어서, Xaa6이 화학식 (VIIIa), (VIIIb), (VIIIc) 및 (VIIId) 중 어느 한 화학식의 아미노산 잔기인 화합물:
여기서
R6a 및 R6b는 각각 독립적으로 H, 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
R6c는 0 내지 3개의 치환기를 나타내고, 각각의 이러한 치환기는 각각 독립적으로 Cl, F, Br, NO2, NH2, CN, CF3, OH, OR6d 및 C1-C4 알킬로 이루어진 군으로부터 선택되고,
R6d는 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
s는 0 또는 1이다.
실시양태 89. 실시양태 88에 있어서, Xaa6이 화학식 (VIIIa), (VIIIb), (VIIIc) 및 (VIIId) 중 어느 하나의 아미노산 잔기인 화합물:
여기서
R6a 및 R6b은 각각 H이고,
R6c는 0 내지 2개의 치환기를 나타내고, 각각의 이러한 치환기는 각각 독립적으로 Cl, F, Br, NO2, NH2, CN, CF3, OH, OR6d 및 메틸로 이루어진 군으로부터 선택되고,
R6d는 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
s는 0이다.
실시양태 90. 실시양태 88 또는 89에 있어서, Xaa6이 Phe, Ocf, Ppa, Thi, 1Ni, Otf 및 Mpa 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 91. 실시양태 90에 있어서, Xaa6이 Phe의 아미노산 잔기인 화합물.
실시양태 92. 실시양태 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80 및 81 중 어느 하나에 있어서, Xaa7이 Cys, Cys-OH, Cys-NH2 Cysol, AET, Hcy, cys, cys-OH, cys-NH2 및 hcy로 이루어진 군으로부터 선택된 아미노 티올 잔기인 화합물.
실시양태 93. 실시양태 92에 있어서, Xaa7이 Cys, Cys-OH, Cys-NH2, Cysol 및 AET로 이루어진 군으로부터 선택된 아미노 티올 잔기인 화합물.
실시양태 94. 실시양태 93에 있어서, Xaa7이 Cys, Cys-OH 또는 Cys-NH2, 바람직하게는 Cys-OH의 아미노 티올 잔기인 화합물.
실시양태 95. 실시양태 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93 및 94 중 어느 하나에 있어서,
Xaa1은 Cys의 아미노산 잔기이고,
Xaa2는 Pro 또는 Nmg의 아미노산 잔기, 바람직하게는 Pro의 아미노산 잔기이고,
Xaa3은 Pro의 아미노산 잔기이고,
Xaa4는 Thr의 아미노산 잔기이고,
Xaa5는 Gln 또는 Glu의 아미노산 잔기, 바람직하게는 Gln의 아미노산 잔기이고,
Xaa6은 Phe의 아미노산 잔기이고,
Xaa7은 Cys의 아미노산 잔기인 화합물.
실시양태 96. 실시양태 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93 및 94 중 어느 하나에 있어서,
Xaa1은 Cys의 아미노산 잔기이고,
Xaa2는 Pro의 아미노산 잔기이고,
Xaa3은 Pro의 아미노산 잔기이고,
Xaa4는 Thr의 아미노산 잔기이고,
Xaa5는 Gln의 아미노산 잔기이고,
Xaa6은 Phe의 아미노산 잔기이고,
Xaa7은 Cys의 아미노산 잔기인 화합물.
실시양태 97. 실시양태 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93 및 94 중 어느 하나에 있어서,
Xaa1은 Cys의 아미노산 잔기이고,
Xaa2는 Pro의 아미노산 잔기이고,
Xaa3은 Pro의 아미노산 잔기이고,
Xaa4는 Thr의 아미노산 잔기이고,
Xaa5는 Glu의 아미노산 잔기이고,
Xaa6은 Phe의 아미노산 잔기이고,
Xaa7은 Cys의 아미노산 잔기인 화합물.
실시양태 98. 실시양태 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93 및 94 중 어느 하나에 있어서,
Xaa1은 Cys의 아미노산 잔기이고,
Xaa2는 Nmg의 아미노산 잔기이고,
Xaa3은 Pro의 아미노산 잔기이고,
Xaa4는 Thr의 아미노산 잔기이고,
Xaa5는 Gln의 아미노산 잔기이고,
Xaa6은 Phe의 아미노산 잔기이고,
Xaa7은 Cys의 아미노산 잔기인 화합물.
실시양태 99. 실시양태 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97 및 98 중 어느 하나에 있어서, 아미노산 또는 펩티드가 Xaa7에 부착되며, 여기서 상기 펩티드의 대부분의 아미노산은 하전되거나 극성이고, 펩티드의 알짜 전하는 -2, -1, 0, +1 또는 +2인 화합물.
실시양태 100. 실시양태 99에 있어서, 아미노산이 Xaa7에 부착된 것인 화합물.
실시양태 101. 실시양태 100에 있어서, Xaa 7에 부착된 아미노산이 Asp, asp, Bal, Gly, Gab, Ser, Nmg, Bhf, Lys, Ape, Ttds 및 Bhk로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 102. 실시양태 101에 있어서, Xaa7에 부착된 아미노산이 Bhk, Ape 및 Lys로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 103. 실시양태 102에 있어서, Xaa7에 부착된 아미노산이 Bhk인 화합물.
실시양태 104. 실시양태 100, 101, 192 및 103 중 어느 하나에 있어서, 킬레이트화제 Z가 Xaa7에 부착된 아미노산에 공유 부착된 것인 화합물.
실시양태 105. 실시양태 104에 있어서, Rc1이 H인 화합물.
실시양태 106. 실시양태 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104 및 105 중 어느 하나에 있어서, Z가 99mTc(CO)3-킬레이트화제, CB-TE2A, CHX-A"-DTPA, DTPA, DATA, DFO, HBED, 크라운, DOTAGA, DOTAM (TCMC로도 불림), FSC, H4옥타파, 마크로파, HEHA, HOPO, Hynic, PCTA, PSC, NETA, DOTA, NODA-MPAA, NODAGA, NOTP, NxS4-x (N4, N2S2, N3S), NOPO, NOTA, Pycup, RESCA, 사르코파진, TETA, THP, 및 TRAP로 이루어진 군으로부터 선택된 킬레이트화제인 화합물.
실시양태 107. 실시양태 106에 있어서, Z가 DOTAM, 마크로파, PCTA, DOTA, N4Ac, NODAGA, NOPO 및 NOTA로 이루어진 군으로부터 선택된 킬레이트화제인 화합물.
실시양태 108. 실시양태 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106 및 107 중 어느 하나에 있어서, 하기로 이루어진 군으로부터 선택된 화합물:
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3940):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(N4Ac-PP))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4533):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(N4Ac-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4534):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-NH2 (3BP-4560):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-PP))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4564):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-PP))-Pro-Pro-Thr-Gln-Phe-Cys]-NH2 (3BP-4565):
하기 화학식의 화합물 nBu-CAyl-[Cys(3MeBn)-Pro-Pro-Thr-Gln-Phe-Cys]-Bhk(N4Ac)-OH (3BP-4589):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-AET))-Nmg-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4607):
및 하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-AET))-Nmg-Pro-Thr-Gln-Phe-Cys]-NH2 (3BP-4621):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(NODAGA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4723):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(NODAGA-AET))-Pro-Pro-Thr-Glu-Phe-Cys]-OH (3BP-4724):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(NOPO-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4768):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(NOPO-AET))-Pro-Pro-Thr-Glu-Phe-Cys]-OH (3BP-4778):
및 하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(NOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-5210):
실시양태 109. 실시양태 108에 있어서, 하기로 이루어진 군으로부터 선택된 화합물:
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3940):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-NH2 (3BP-4560):
및 하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(NOPO-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4768):
실시양태 110. 실시양태 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108 및 109 중 어느 하나에 있어서, 킬레이트화제가 핵종을 포함하고, 바람직하게는 핵종이 킬레이트화제에 의해 배위 결합된 것인 화합물.
실시양태 111. 실시양태 110에 있어서, 핵종이 진단 활성 핵종 또는 치료 활성 핵종인 화합물.
실시양태 112. 실시양태 111에 있어서, 진단 활성 핵종이 진단 활성 방사성핵종인 화합물.
실시양태 113. 실시양태 112에 있어서, 진단 활성 방사성핵종이 18F, 43Sc, 44Sc, 51Mn, 52Mn, 64Cu, 67Ga, 68Ga, 76Br, 77Br, 86Y, 89Zr, 94mTc, 99mTc, 111In, 123I, 124I, 125I, 152Tb, 155Tb, 177Lu, 201Tl 및 203Pb로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 114. 실시양태 113에 있어서, 진단 활성 방사성핵종이 18F, 68Ga, 99mTc, 111In 및 203Pb로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 115. 실시양태 111에 있어서, 치료 활성 핵종이 치료 활성 방사성핵종인 화합물.
실시양태 116. 실시양태 115에 있어서, 치료 활성 방사성핵종이 47Sc, 67Cu, 89Sr, 90Y, 131I, 111In, 153Sm, 149Tb, 161Tb, 177Lu, 186Re, 188Re, 211At, 212Pb, 213Bi, 223Ra, 224Ra, 225Ac, 226Th 및 227Th로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 117. 실시양태 116에 있어서, 치료 활성 방사성핵종이 90Y, 177Lu, 212Pb 및 225Ac인 화합물.
실시양태 118. 화학식 (I)의 시클릭 펩티드 및 Xaa1에 부착된 N-말단 변형 기 A를 포함하는 화합물:
여기서
펩티드 서열은 N에서 C-말단 방향으로 좌측에서 우측으로 그려지고,
Xaa1은 화학식 (II)의 아미노산의 잔기이고:
여기서
R1a는 -NH-이고,
R1b는 H 또는 CH3이고,
n = 0 또는 1이고,
N-말단 변형 기 A는 Xaa1의 질소 원자에 공유 부착되고,
Xaa1의 카르보닐 기는 Xaa2의 질소에 공유 부착되고,
Xaa1의 황 원자는 Yc에 티오에테르로서 공유 부착되고;
Xaa2는 화학식 (III), (IV) 또는 (XX)의 아미노산의 잔기이고:
여기서
R2a, R2b 및 R2c는 각각 독립적으로 (C1-C2)알킬 및 H로 이루어진 군으로부터 선택되고, 여기서 상기 (C1-C2)알킬은 OH, NH2, 할로겐, (C5-C7)시클로알킬로 이루어진 군으로부터 선택된 치환기에 의해 치환될 수 있고,
p = 0, 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
화학식 (IV)의 아미노산은 나타낸 고리 위치 3 및 4에서 메틸, OH, NH2 및 F로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
Xaa3은 화학식 (V) 또는 (XX)의 아미노산의 잔기이고:
여기서
X3은 CH2, CF2, CH-R3b, S, O 및 NH로 이루어진 군으로부터 선택되고,
p = 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
R3a는 H, 메틸, OH, NH2 또는 F이고,
R3b은 메틸, OH, NH2 또는 F이고;
Xaa4는 화학식 (VI)의 아미노산의 잔기이고:
여기서
R4a는 H, OH, COOH, CONH2, X4 및 -NH-CO-X4로 이루어진 군으로부터 선택되고, 여기서 X4는 (C1-C6)알킬, (C5-C6)아릴 및 (C5-C6)헤테로아릴로 이루어진 군으로부터 선택되고, X4는 메틸, CONH2, 할로겐, NH2 및 OH로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
q = 1, 2 또는 3이고, 여기서 임의로, 상기 1, 2 또는 3개의 CH2-기의 1 또는 2개의 수소는 메틸, 에틸, (C5-C6)아릴 또는 (C5-C6)헤테로아릴에 의해 각각 개별적으로 치환되고,
R4b는 메틸 또는 H이고;
Xaa5는 구조 (VII)의 아미노산의 잔기이고:
여기서
R5는 OH 및 NH2의 군으로부터 선택되고,
r = 1, 2 또는 3이고;
Xaa6은 방향족 L-α-아미노산 및 헤테로방향족 L-α-아미노산으로 이루어진 군으로부터 선택된 아미노산이고;
Xaa7은 화학식 (IX)의 아미노 티올 또는 아미노산의 잔기이고:
여기서
R7a는 -CO-, -COOH, -CONH2, -CH2-OH, -(CO)-NH-R7b, -(CO)-(NR7c)-R7b 또는 H이고, 여기서 R7b 및 R7c는 각각 독립적으로 (C1-C4)알킬이고,
t는 1 또는 2이고;
Yc는 화학식 (X)의 구조이고:
2개의 티오에테르 연결의 형성 하에 Xaa1의 S 원자 및 Xaa7의 S 원자를 연결하여 화학식 (XXI)의 시클릭 구조를 형성하고:
화학식 (X)에서 방향족 기의 치환 패턴은 메타이고,
n = 0 또는 1이고,
t = 1 또는 2이고,
Y1은 C-H 또는 N이고,
Y2는 C-Rc1이고,
Rc1은 H이고;
N-말단 변형 기 A는 아미노산 Aaa이고,
여기서
아미노산 Aaa는 구조 (XIV)의 L-아미노산 잔기이고:
여기서
Ra2는 (C1-C6)알킬 및 변형된 (C1-C6)알킬로 이루어진 군으로부터 선택되고,
여기서 변형된 (C1-C6)알킬에서 1개의 -CH2- 기는 -S- 또는 -O-에 의해 대체되고,
아미노산 Aaa는 링커에 공유 부착되고, 여기서 링커는 킬레이트화제 Z에 공유 연결되고, 링커는 (a) 제1 링커 또는 (b) 제1 링커 및 제2 링커로 이루어지고, 여기서
링커가 제1 링커로 이루어지는 경우에, 제1 링커는 킬레이트화제 및 아미노산 Aaa에 공유 연결되고,
제1 링커가 제1 링커 및 제2 링커로 이루어지는 경우에, 제1 링커는 아미노산 Aaa 및 제2 링커에 공유 연결되고, 제2 링커는 킬레이트화제에 공유 연결되고,
제1 링커는 Ttds 및 PEG6으로 이루어진 군으로부터 선택되고, 바람직하게는 제1 링커는 Ttds이고,
제2 링커는 PPAc 및 PEG6으로 이루어진 군으로부터 선택되고, 바람직하게는 제2 링커는 PPAc이다.
실시양태 119. 실시양태 118에 있어서, Ra2가 C4알킬인 화합물.
실시양태 120. 실시양태 118 또는 119에 있어서, 아미노산 Aaa가 Nle의 잔기인 화합물.
실시양태 121. 실시양태 118, 119 및 120 중 어느 하나에 있어서, Y1이 C-H인 화합물.
실시양태 122. 실시양태 118, 119 및 120 중 어느 하나에 있어서, Y1이 N인 화합물.
실시양태 123. 실시양태 118, 119, 120, 121 및 122 중 어느 하나, 바람직하게는 실시양태 120 내지 122 중 어느 하나에 있어서, 링커가 제1 링커로 이루어지고, 여기서 제1 링커는 Ttds 및 PEG6으로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 124. 실시양태 123에 있어서, 제1 링커가 Ttds이고, 바람직하게는 아미노산 Aaa가 Nle의 잔기인 화합물.
실시양태 125. 실시양태 123에 있어서, 제1 링커가 PEG6이고, 바람직하게는 아미노산 Aaa가 Nle의 잔기인 화합물.
실시양태 126. 실시양태 118, 119, 120, 121 및 122 중 어느 하나, 바람직하게는 실시양태 120, 121 및 122 중 어느 하나에 있어서, 링커가 제1 링커 및 제2 링커로 이루어지고, 여기서 제1 링커가 Ttds 및 PEG6으로 이루어진 군으로부터 선택되고, 제2 링커가 PPAc 및 PEG6, 바람직하게는 PPAc로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 127. 실시양태 126에 있어서, 제1 링커가 Ttds이고, 제2 링커가 PPAc이고, 바람직하게는 아미노산 Aaa가 Nle의 잔기인 화합물.
실시양태 128. 실시양태 126에 있어서, 제1 링커가 Ttds이고, 제2 링커가 PEG6이고, 바람직하게는 아미노산 Aaa가 Nle의 잔기인 화합물.
실시양태 129. 실시양태 118, 119, 120, 121, 122, 123, 124, 125, 126, 127 및 128 중 어느 하나에 있어서, Xaa1이 cys, hcy 및 pen으로 이루어진 군으로부터 선택된 D-아미노산 잔기이거나, 또는 Xaa1이 Cys, Hcy 및 Pen으로 이루어진 군으로부터 선택된 L-아미노산 잔기인 화합물.
실시양태 130. 실시양태 129에 있어서, Xaa1이 Cys인 화합물.
실시양태 131. 실시양태 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129 및 130 중 어느 하나에 있어서, Xaa2가 Pro, Gly, Nmg 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 132. 실시양태 131에 있어서, Xaa2가 Pro 및 Nmg로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 133. 실시양태 131 또는 132에 있어서, Xaa2가 Pro의 아미노산 잔기인 화합물.
실시양태 134. 실시양태 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132 및 133 중 어느 하나에 있어서, Xaa3이 Pro, Hyp, Tfp, Cfp, Dmp, Aze 및 Pip 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 135. 실시양태 134에 있어서, Xaa3이 Pro의 아미노산 잔기인 화합물.
실시양태 136. 실시양태 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134 및 135 중 어느 하나에 있어서, Xaa4가 Thr, Hse, Asn, Gln 및 Ser 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 137. 실시양태 136에 있어서, Xaa4가 Thr인 화합물.
실시양태 138. 실시양태 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136 및 137 중 어느 하나에 있어서, Xaa5가 Gln 및 Glu 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 139. 실시양태 138에 있어서, Xaa5가 Gln 및 Glu로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 140. 실시양태 139에 있어서, Xaa5가 Gln의 아미노산 잔기인 화합물.
실시양태 141. 실시양태 140에 있어서, Xaa5가 Glu의 아미노산 잔기인 화합물.
실시양태 142. 실시양태 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140 및 141 중 어느 하나에 있어서, Xaa6이 화학식 (VIIIa), (VIIIb), (VIIIc) 및 (VIIId) 중 어느 하나의 아미노산 잔기인 화합물:
여기서
R6a 및 R6b는 각각 독립적으로 H, 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
R6c는 0 내지 3개의 치환기를 나타내고, 각각의 이러한 치환기는 각각 독립적으로 Cl, F, Br, NO2, NH2, CN, CF3, OH, OR6d 및 C1-C4 알킬로 이루어진 군으로부터 선택되고,
R6d는 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
s는 0 또는 1이다.
실시양태 143. 실시양태 142에 있어서, Xaa6이 화학식 (VIIIa), (VIIIb), (VIIIc) 및 (VIIId) 중 어느 하나의 아미노산 잔기인 화합물.
여기서
R6a 및 R6b은 각각 H이고,
R6c는 0 내지 2개의 치환기를 나타내고, 각각의 이러한 치환기는 각각 독립적으로 Cl, F, Br, NO2, NH2, CN, CF3, OH, OR6d 및 메틸로 이루어진 군으로부터 선택되고,
R6d는 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
s는 0이다.
실시양태 144. 실시양태 142 또는 143에 있어서, Xaa6이 Phe, Ocf, Ppa, Thi, 1Ni, Otf 및 Mpa 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 145. 실시양태 144에 있어서, Xaa6이 Phe의 아미노산 잔기인 화합물.
실시양태 146. 실시양태 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144 및 145 중 어느 하나에 있어서, Xaa7이 Cys, Cys-OH, Cys-NH2 Cysol, AET, Hcy, cys, cys-OH, cys-NH2 및 hcy로 이루어진 군으로부터 선택된 아미노 티올 잔기인 화합물.
실시양태 147. 실시양태 146에 있어서, Xaa7이 Cys, Cys-OH, Cys-NH2, Cysol 및 AET로 이루어진 군으로부터 선택된 아미노 티올 잔기인 화합물.
실시양태 148. 실시양태 147에 있어서, Xaa7이 Cys, Cys-OH 또는 Cys-NH2, 바람직하게는 Cys-OH의 아미노 티올 잔기인 화합물.
실시양태 149. 실시양태 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147 및 148 중 어느 하나에 있어서,
Xaa1은 Cys의 아미노산 잔기이고,
Xaa2는 Pro 또는 Nmg의 아미노산 잔기, 바람직하게는 Pro의 아미노산 잔기이고,
Xaa3은 Pro의 아미노산 잔기이고,
Xaa4는 Thr의 아미노산 잔기이고,
Xaa5는 Gln 또는 Glu의 아미노산 잔기, 바람직하게는 Gln의 아미노산 잔기이고,
Xaa6은 Phe의 아미노산 잔기이고,
Xaa7은 Cys의 아미노산 잔기인 화합물.
실시양태 150. 실시양태 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147 및 148 중 어느 하나에 있어서,
Xaa1은 Cys의 아미노산 잔기이고,
Xaa2는 Pro의 아미노산 잔기이고,
Xaa3은 Pro의 아미노산 잔기이고,
Xaa4는 Thr의 아미노산 잔기이고,
Xaa5는 Gln의 아미노산 잔기이고,
Xaa6은 Phe의 아미노산 잔기이고,
Xaa7은 Cys의 아미노산 잔기인 화합물.
실시양태 151. 실시양태 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147 및 148 중 어느 하나에 있어서,
Xaa1은 Cys의 아미노산 잔기이고,
Xaa2는 Pro의 아미노산 잔기이고,
Xaa3은 Pro의 아미노산 잔기이고,
Xaa4는 Thr의 아미노산 잔기이고,
Xaa5는 Glu의 아미노산 잔기이고,
Xaa6은 Phe의 아미노산 잔기이고,
Xaa7은 Cys의 아미노산 잔기인 화합물.
실시양태 152. 실시양태 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147 및 148 중 어느 하나에 있어서,
Xaa1은 Cys의 아미노산 잔기이고,
Xaa2는 Nmg의 아미노산 잔기이고,
Xaa3은 Pro의 아미노산 잔기이고,
Xaa4는 Thr의 아미노산 잔기이고,
Xaa5는 Gln의 아미노산 잔기이고,
Xaa6은 Phe의 아미노산 잔기이고,
Xaa7은 Cys의 아미노산 잔기인 화합물.
실시양태 153. 실시양태 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151 및 152 중 어느 하나에 있어서, 아미노산 또는 펩티드가 Xaa7에 부착되며, 여기서 상기 펩티드의 대부분의 아미노산은 하전되거나 극성이고, 펩티드의 알짜 전하는 -2, -1, 0, +1 또는 +2인 화합물.
실시양태 154. 실시양태 153에 있어서, 아미노산이 Xaa7에 부착된 것인 화합물.
실시양태 155. 실시양태 154에 있어서, Xaa 7에 부착된 아미노산이 Asp, asp, Bal, Gly, Gab, Ser, Nmg, Bhf, Lys, Ape, Ttds 및 Bhk로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 156. 실시양태 155에 있어서, Xaa7에 부착된 아미노산이 Bal 또는 Asp인 화합물.
실시양태 157. 실시양태 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156 중 어느 하나에 있어서, Z가 99mTc(CO)3-킬레이트화제, CB-TE2A, CHX-A"-DTPA, DTPA, DATA, DFO, HBED, 크라운, DOTAGA, DOTAM (또한 TCMC로 불림), FSC, H4옥타파, 마크로파, HEHA, HOPO, Hynic, PCTA, PSC, NETA, DOTA, NODA-MPAA, NODAGA, NOTP, NxS4-x (N4, N2S2, N3S), NOPO, NOTA, Pycup, RESCA, 사르코파진, TETA, THP 및 TRAP로 이루어진 군으로부터 선택된 킬레이트화제인 화합물.
실시양태 158. 실시양태 157에 있어서, Z가 DOTAM, 마크로파, PCTA, DOTA, N4Ac, NODAGA, NOPO 및 NOTA로 이루어진 군으로부터 선택된 킬레이트화제인 화합물.
실시양태 159. 실시양태 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157 및 158 중 어느 하나에 있어서, 하기로 이루어진 군으로부터 선택된 화합물:
하기 화학식의 화합물 N4Ac-PPAc-Ttds-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4541):
하기 화학식의 화합물 N4Ac-Ttds-Nle-[Cys(3Lut)-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4549):
하기 화학식의 화합물 N4Ac-PEG6-Nle-[Cys(3Lut)-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4550):
하기 화학식의 화합물 N4Ac-PEG6-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4551):
하기 화학식의 화합물 N4Ac-PEG6-Ttds-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4552):
하기 화학식의 화합물 NODAGA-Ttds-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4713):
하기 화학식의 화합물 NODAGA-Ttds-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Glu-Phe-Cys]-OH (3BP-4714):
하기 화학식의 화합물 NODAGA-Ttds-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Glu-Phe-Cys]-NH2 (3BP-4743):
하기 화학식의 화합물 N4Ac-PEG6-Nle-[Cys(3Lut)-Pro-Pro-Thr-Glu-Phe-Cys]-OH (3BP-4773):
하기 화학식의 화합물 N4Ac-PPAc-Ttds-Nle-[Cys(3Lut)-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4774):
하기 화학식의 화합물 N4Ac-PPAc-Ttds-Nle-[Cys(3Lut)-Pro-Pro-Thr-Glu-Phe-Cys]-OH (3BP-4775):
하기 화학식의 화합물 N4Ac-PEG6-Ttds-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Glu-Phe-Cys]-OH (3BP-4780):
하기 화학식의 화합물 N4Ac-PPAc-PEG6-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Glu-Phe-Cys]-OH (3BP-4781):
하기 화학식의 화합물 N4Ac-PPAc-Ttds-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Glu-Phe-Cys]-OH (3BP-4782):
하기 화학식의 화합물 N4Ac-PPAc-Ttds-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Glu-Phe-Cys]-Bal-OH (3BP-4784):
하기 화학식의 화합물 N4Ac-PPAc-Ttds-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Glu-Phe-Cys]-Asp-OH (3BP-4785):
하기 화학식의 화합물 N4Ac-PPAc-Ttds-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Gln-Phe-Cys]-Bal-OH (3BP-4960):
하기 화학식의 화합물 N4Ac-PPAc-Ttds-Nle-[Cys(3Lut)-Pro-Pro-Thr-Gln-Phe-Cys]-Bal-OH (3BP-4961):
및 하기 화학식의 화합물 NOTA-Ttds-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-5201):
실시양태 160. 실시양태 159에 있어서, 하기로 이루어진 군으로부터 선택된 화합물:
하기 화학식의 화합물 N4Ac-PPAc-Ttds-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4541):
하기 화학식의 화합물 NODAGA-Ttds-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4713):
하기 화학식의 화합물 N4Ac-PPAc-Ttds-Nle-[Cys(3Lut)-Pro-Pro-Thr-Gln-Phe-Cys]-Bal-OH (3BP-4961):
및 하기 화학식의 화합물 NOTA-Ttds-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-5201):
실시양태 161. 실시양태 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159 및 160 중 어느 하나에 있어서, 킬레이트화제가 핵종을 포함하고, 바람직하게는 핵종이 킬레이트화제에 의해 배위 결합된 것인 화합물.
실시양태 162. 실시양태 161에 있어서, 핵종이 진단 활성 핵종 또는 치료 활성 핵종인 화합물.
실시양태 163. 실시양태 162에 있어서, 진단 활성 핵종이 진단 활성 방사성핵종인 화합물.
실시양태 164. 실시양태 163에 있어서, 진단 활성 방사성핵종이 18F, 43Sc, 44Sc, 51Mn, 52Mn, 64Cu, 67Ga, 68Ga, 76Br, 77Br, 86Y, 89Zr, 94mTc, 99mTc, 111In, 123I, 124I, 125I, 152Tb, 155Tb, 177Lu, 201Tl 및 203Pb로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 165. 실시양태 164에 있어서, 진단 활성 방사성핵종이 18F, 68Ga, 99mTc, 111In 및 203Pb로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 166. 실시양태 162에 있어서, 치료 활성 핵종이 치료 활성 방사성핵종인 화합물.
실시양태 167. 실시양태 166에 있어서, 치료 활성 방사성핵종이 47Sc, 67Cu, 89Sr, 90Y, 131I, 111In, 153Sm, 149Tb, 161Tb, 177Lu, 186Re, 188Re, 211At, 212Pb, 213Bi, 223Ra, 224Ra, 225Ac, 226Th 및 227Th로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 168. 실시양태 167에 있어서, 치료 활성 방사성핵종이 90Y, 177Lu, 212Pb 및 225Ac인 화합물.
실시양태 169. 화학식 (I)의 시클릭 펩티드 및 Xaa1에 부착된 N-말단 변형 기 A를 포함하는 화합물:
여기서
펩티드 서열은 N에서 C-말단 방향으로 좌측에서 우측으로 그려지고,
Xaa1은 화학식 (II)의 아미노산의 잔기이고:
여기서
R1a는 -NH-이고,
R1b는 H 또는 CH3이고,
n = 0 또는 1이고,
N-말단 변형 기 A는 Xaa1의 질소 원자에 공유 부착되고,
Xaa1의 카르보닐 기는 Xaa2의 질소에 공유 부착되고,
Xaa1의 황 원자는 Yc에 티오에테르로서 공유 부착되고;
Xaa2는 화학식 (III), (IV) 또는 (XX)의 아미노산의 잔기이고:
여기서
R2a, R2b 및 R2c는 각각 독립적으로 (C1-C2)알킬 및 H로 이루어진 군으로부터 선택되고, 여기서 상기 (C1-C2)알킬은 OH, NH2, 할로겐, (C5-C7)시클로알킬로 이루어진 군으로부터 선택된 치환기에 의해 치환될 수 있고,
p = 0, 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
화학식 (IV)의 아미노산은 나타낸 고리 위치 3 및 4에서 메틸, OH, NH2 및 F로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
Xaa3은 화학식 (V) 또는 (XX)의 아미노산의 잔기이고:
여기서
X3은 CH2, CF2, CH-R3b, S, O 및 NH로 이루어진 군으로부터 선택되고,
p = 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
R3a는 H, 메틸, OH, NH2 또는 F이고,
R3b은 메틸, OH, NH2 또는 F이고;
Xaa4는 화학식 (VI)의 아미노산의 잔기이고:
여기서
R4a는 H, OH, COOH, CONH2, X4 및 -NH-CO-X4로 이루어진 군으로부터 선택되고, 여기서 X4는 (C1-C6)알킬, (C5-C6)아릴 및 (C5-C6)헤테로아릴로 이루어진 군으로부터 선택되고, X4는 메틸, CONH2, 할로겐, NH2 및 OH로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
q = 1, 2 또는 3이고, 여기서 임의로, 상기 1, 2 또는 3개의 CH2-기의 1 또는 2개의 수소는 메틸, 에틸, (C5-C6)아릴 또는 (C5-C6)헤테로아릴에 의해 각각 개별적으로 치환되고,
R4b는 메틸 또는 H이고;
Xaa5는 구조 (VII)의 아미노산의 잔기이고:
여기서
R5는 OH 및 NH2의 군으로부터 선택되고,
r = 1, 2 또는 3이고;
Xaa6은 방향족 L-α-아미노산 및 헤테로방향족 L-α-아미노산으로 이루어진 군으로부터 선택된 아미노산이고;
Xaa7은 화학식 (IX)의 아미노 티올 또는 아미노산의 잔기이고:
여기서
R7a는 -CO-, -COOH, -CONH2, -CH2-OH, -(CO)-NH-R7b, -(CO)-(NR7c)-R7b 또는 H이고, 여기서 R7b 및 R7c는 각각 독립적으로 (C1-C4)알킬이고,
t는 1 또는 2이고;
Yc는 화학식 (X)의 구조이고:
2개의 티오에테르 연결의 형성 하에 Xaa1의 S 원자 및 Xaa7의 S 원자를 연결하여 화학식 (XXI)의 시클릭 구조를 형성하고:
화학식 (X)에서 방향족 기의 치환 패턴은 메타이고,
n = 0 또는 1이고,
t = 1 또는 2이고,
Y1은 C-H이고,
Y2는 C-Rc1이고,
Rc1은 CH2-Rc2이고,
Rc2는 화학식 (XIId)의 구조이고:
여기서
u = 1, 2, 3, 4, 5 또는 6, 바람직하게는 u = 1이고,
Rc4는 H 또는 메틸이고,
Z는 임의로 링커를 포함하는 킬레이트화제이고,
N-말단 변형 기 A는 차단 기 Abl이고, 여기서 차단 기 Abl은 Ra11-C(O)-로 이루어진 군으로부터 선택되고, 여기서 Ra11은 C4 알킬 또는 C5 알킬이고, 여기서 C4 알킬 및 C5 알킬 중 각각에서 및 임의의 1개에서 개별적으로 및 독립적으로 -CH2- 기 중 1개는 -O- 또는 -S-에 의해 임의로 대체된다.
실시양태 170. 실시양태 169에 있어서, Ra11이 C5 알킬인 화합물.
실시양태 171. 실시양태 170에 있어서, Ra11이 n-펜틸인 화합물.
실시양태 172. 실시양태 170에 있어서, Ra11이 구조 (XXX)의 것인 화합물:
실시양태 173. 실시양태 169에 있어서, Ra11이 C4-알킬인 화합물.
실시양태 174. 실시양태 173에 있어서, Ra11이 n-부틸인 화합물.
실시양태 175. 실시양태 169에 있어서, R11a가 구조 (XXXI)의 것인 화합물:
실시양태 176. 실시양태 169에 있어서, R11a가 구조 (XXXII)의 것인 화합물:
실시양태 177. 실시양태 169에 있어서, R11a가 구조 (XXXIII)의 것인 화합물:
실시양태 178. 실시양태 169 내지 177에 있어서, 킬레이트화제 Z가 화학식 (XIId)의 구조의 N 원자에 공유 연결된 것인 화합물:
실시양태 179. 실시양태 170에 있어서, u = 1인 화합물.
실시양태 180. 실시양태 178 또는 179에 있어서, Rc4가 H인 화합물.
실시양태 181. 실시양태 169, 170, 171, 172, 173, 174, 175, 176 및 177 중 어느 하나에 있어서, 킬레이트화제 Z가 링커를 포함하는 것인 화합물.
실시양태 182. 실시양태 181에 있어서, 링커가 킬레이트화제에 공유 연결되고 화학식 (XIId)의 구조의 N 원자에 공유 연결된 것인 화합물:
실시양태 183. 실시양태 182에 있어서, u = 1인 화합물.
실시양태 184. 실시양태 182 또는 183에 있어서, Rc4가 H인 화합물.
실시양태 185. 실시양태 181, 182, 183 및 184 중 어느 하나에 있어서, 링커가 Ttds 및 O2Oc로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 186. 실시양태 181, 182, 183 및 184 중 어느 하나에 있어서, 링커가 Ttds인 화합물.
실시양태 187. 실시양태 181, 182, 183 및 184 중 어느 하나에 있어서, 링커가 O2Oc인 화합물.
실시양태 188. 실시양태 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185 및 187 중 어느 하나에 있어서, Xaa1이 cys, hcy 및 pen으로 이루어진 군으로부터 선택된 D-아미노산 잔기이거나, 또는 Xaa1이 Cys, Hcy 및 Pen으로 이루어진 군으로부터 선택된 L-아미노산 잔기인 화합물.
실시양태 189. 실시양태 188에 있어서, Xaa1이 Cys인 화합물.
실시양태 190. 실시양태 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188 및 189 중 어느 하나에 있어서, Xaa2가 Pro, Gly, Nmg 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 191. 실시양태 190에 있어서, Xaa2가 Pro 및 Nmg로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 192. 실시양태 190 또는 191에 있어서, Xaa2가 Pro의 아미노산 잔기인 화합물.
실시양태 193. 실시양태 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191 및 192 중 어느 하나에 있어서, Xaa3이 Pro, Hyp, Tfp, Cfp, Dmp, Aze 및 Pip 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 194. 실시양태 193에 있어서, Xaa3이 Pro의 아미노산 잔기인 화합물.
실시양태 195. 실시양태 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193 및 194 중 어느 하나에 있어서, Xaa4가 Thr, Hse, Asn, Gln 및 Ser 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 196. 실시양태 195에 있어서, Xaa4가 Thr인 화합물.
실시양태 197. 실시양태 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195 및 196 중 어느 하나에 있어서, Xaa5가 Gln 및 Glu 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 198. 실시양태 197에 있어서, Xaa5가 Gln 및 Glu로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 199. 실시양태 198에 있어서, Xaa5가 Gln의 아미노산 잔기인 화합물.
실시양태 200. 실시양태 199에 있어서, Xaa5가 Glu의 아미노산 잔기인 화합물.
실시양태 201. 실시양태 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199 및 200 중 어느 하나에 있어서, Xaa6이 화학식 (VIIIa), (VIIIb), (VIIIc) 및 (VIIId) 중 어느 하나의 아미노산 잔기인 화합물:
여기서
R6a 및 R6b는 각각 독립적으로 H, 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
R6c는 0 내지 3개의 치환기를 나타내고, 각각의 이러한 치환기는 각각 독립적으로 Cl, F, Br, NO2, NH2, CN, CF3, OH, OR6d 및 C1-C4 알킬로 이루어진 군으로부터 선택되고,
R6d는 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
s는 0 또는 1이다.
실시양태 202. 실시양태 201에 있어서, Xaa6이 화학식 (VIIIa), (VIIIb), (VIIIc) 및 (VIIId) 중 어느 하나의 아미노산 잔기인 화합물:
여기서
R6a 및 R6b은 각각 H이고,
R6c는 0 내지 2개의 치환기를 나타내고, 각각의 이러한 치환기는 각각 독립적으로 Cl, F, Br, NO2, NH2, CN, CF3, OH, OR6d 및 메틸로 이루어진 군으로부터 선택되고,
R6d는 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
s는 0이다.
실시양태 203. 실시양태 201 또는 202에 있어서, Xaa6이 Phe, Ocf, Ppa, Thi, 1Ni, Otf 및 Mpa 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
실시양태 204. 실시양태 203에 있어서, Xaa6이 Phe의 아미노산 잔기인 화합물.
실시양태 205. 실시양태 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203 및 204 중 어느 하나에 있어서, Xaa7이 Cys, Cys-OH, Cys-NH2 Cysol, AET, Hcy, cys, cys-OH, cys-NH2 및 hcy로 이루어진 군으로부터 선택된 아미노 티올 잔기인 화합물.
실시양태 206. 실시양태 205에 있어서, Xaa7이 Cys, Cys-OH, Cys-NH2, Cysol 및 AET로 이루어진 군으로부터 선택된 아미노 티올 잔기인 화합물.
실시양태 207. 실시양태 206에 있어서, Xaa7이 Cys 또는 Cys-NH2, 바람직하게는 Cys-OH의 아미노 티올 잔기인 화합물.
실시양태 208. 실시양태 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206 및 207 중 어느 하나에 있어서,
Xaa1은 Cys의 아미노산 잔기이고,
Xaa2는 Pro 또는 NmG의 아미노산 잔기, 바람직하게는 Pro의 아미노산 잔기이고,
Xaa3은 Pro의 아미노산 잔기이고,
Xaa4는 Thr의 아미노산 잔기이고,
Xaa5는 Gln 또는 Glu의 아미노산 잔기, 바람직하게는 Gln의 아미노산 잔기이고,
Xaa6은 Phe의 아미노산 잔기이고,
Xaa7은 Cys의 아미노산 잔기인 화합물.
실시양태 209. 실시양태 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206 및 207 중 어느 하나에 있어서,
Xaa1은 Cys의 아미노산 잔기이고,
Xaa2는 Pro의 아미노산 잔기이고,
Xaa3은 Pro의 아미노산 잔기이고,
Xaa4는 Thr의 아미노산 잔기이고,
Xaa5는 Gln의 아미노산 잔기이고,
Xaa6은 Phe의 아미노산 잔기이고,
Xaa7은 Cys의 아미노산 잔기인 화합물.
실시양태 210. 실시양태 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206 및 207 중 어느 하나에 있어서,
Xaa1은 Cys의 아미노산 잔기이고,
Xaa2는 Pro의 아미노산 잔기이고,
Xaa3은 Pro의 아미노산 잔기이고,
Xaa4는 Thr의 아미노산 잔기이고,
Xaa5는 Glu의 아미노산 잔기이고,
Xaa6은 Phe의 아미노산 잔기이고,
Xaa7은 Cys의 아미노산 잔기인 화합물.
실시양태 211. 실시양태 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206 및 207 중 어느 하나에 있어서,
Xaa1은 Cys의 아미노산 잔기이고,
Xaa2는 Nmg의 아미노산 잔기이고,
Xaa3은 Pro의 아미노산 잔기이고,
Xaa4는 Thr의 아미노산 잔기이고,
Xaa5는 Gln의 아미노산 잔기이고,
Xaa6은 Phe의 아미노산 잔기이고,
Xaa7은 Cys의 아미노산 잔기인 화합물.
실시양태 212. 실시양태 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210 및 211 중 어느 하나에 있어서, Z가 99mTc(CO)3-킬레이트화제, CB-TE2A, CHX-A"-DTPA, DTPA, DATA, DFO, HBED, 크라운, DOTAGA, DOTAM (또한 TCMC로 불림), FSC, H4옥타파, 마크로파, HEHA, HOPO, Hynic, PCTA, PSC, NETA, DOTA, NODA-MPAA, NODAGA, NOTP, NxS4-x (N4, N2S2, N3S), NOPO, NOTA, Pycup, RESCA, 사르코파진, TETA, THP 및 TRAP로 이루어진 군으로부터 선택된 킬레이트화제인 화합물.
실시양태 213. 실시양태 212에 있어서, Z가 DOTAM, 마크로파, PCTA, DOTA, N4Ac, NODAGA, NOPO 및 NOTA로 이루어진 군으로부터 선택된 킬레이트화제인 화합물.
실시양태 214. 실시양태 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212 및 213 중 어느 하나에 있어서, 하기로 이루어진 군으로부터 선택된 화합물:
하기 화학식의 화합물 iHex-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3907):
하기 화학식의 화합물 Pent-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3910):
하기 화학식의 화합물 EtOPr-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3918):
하기 화학식의 화합물 MeOBut-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3937):
하기 화학식의 화합물 PrOAc-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3938):
하기 화학식의 화합물 nBu-COyl-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3941):
하기 화학식의 화합물 Hex-[Cys(tMeBn(DATA-Ttds-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4384):
하기 화학식의 화합물 Hex-[Cys(tMeBn(NODAGA-AET))-Pro-Pro-Thr-Glu-Phe-Cys]-OH (3BP-4695):
하기 화학식의 화합물 Hex-[Cys(tMeBn(NODAGA-O2Oc-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-NH2 (3BP-4708):
하기 화학식의 화합물 Hex-[Cys(tMeBn(NOPO-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-NH2 (3BP-4729):
하기 화학식의 화합물 Hex-[Cys(tMeBn(NOPO-AET))-Pro-Pro-Thr-Glu-Phe-Cys]-OH (3BP-4818):
하기 화학식의 화합물 Hex-[Cys(tMeBn(AcPCTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-5273):
하기 화학식의 화합물 Hex-[Cys(tMeBn(LSC-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-5288):
및 하기 화학식의 화합물 Hex-[Cys(tMeBn(DOTAM-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-5323):
실시양태 215. 실시양태 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213 및 214 중 어느 하나에 있어서, 킬레이트화제가 핵종을 포함하고, 바람직하게는 핵종이 킬레이트화제에 의해 배위 결합된 것인 화합물.
실시양태 216. 실시양태 215에 있어서, 핵종이 진단 활성 핵종 또는 치료 활성 핵종인 화합물.
실시양태 217. 실시양태 216에 있어서, 진단 활성 핵종이 진단 활성 방사성핵종인 화합물.
실시양태 218. 실시양태 217에 있어서, 진단 활성 방사성핵종이 18F, 43Sc, 44Sc, 51Mn, 52Mn, 64Cu, 67Ga, 68Ga, 76Br, 77Br, 86Y, 89Zr, 94mTc, 99mTc, 111In, 123I, 124I, 125I, 152Tb, 155Tb, 177Lu, 201Tl 및 203Pb로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 219. 실시양태 218에 있어서, 진단 활성 방사성핵종이 18F, 68Ga, 99mTc, 111In 및 203Pb로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 220. 실시양태 216에 있어서, 치료 활성 핵종이 치료 활성 방사성핵종인 화합물.
실시양태 221. 실시양태 220에 있어서, 치료 활성 방사성핵종이 47Sc, 67Cu, 89Sr, 90Y, 131I, 111In, 153Sm, 149Tb, 161Tb, 177Lu, 186Re, 188Re, 211At, 212Pb, 213Bi, 223Ra, 224Ra, 225Ac, 226Th 및 227Th로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 222. 실시양태 221에 있어서, 치료 활성 방사성핵종이 90Y, 177Lu, 212Pb 및 225Ac인 화합물.
실시양태 223. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221 및 222 중 어느 하나에 있어서, 화합물이 섬유모세포 활성화 단백질 (FAP), 바람직하게는 서열식별번호: 1의 아미노산 서열을 갖는 인간 FAP 또는 그의 상동체와 상호작용하며, 여기서 상동체의 아미노산 서열은 서열식별번호: 1의 아미노산 서열에 대해 적어도 85%의 동일성을 갖는 것인 화합물.
실시양태 224. 실시양태 223에 있어서, 섬유모세포 활성화 단백질 (FAP)의 억제제인 화합물.
실시양태 225. 실시양태 1 내지 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223 및 224 중 어느 하나에 있어서, 서열식별번호: 1의 인간 FAP에 대해 ≥ 6.0, 바람직하게는 ≥ 7.0, 가장 바람직하게는 ≥ 8.0의 pIC50 값을 갖는 화합물.
실시양태 226. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224 및 225 중 어느 하나, 바람직하게는 실시양태 5 내지 55, 110 내지 114, 161 내지 165 및 215 내지 219 중 어느 하나에 있어서, 질환의 진단 방법에 사용하기 위한 화합물.
실시양태 227. 실시양태 226에 있어서, 질환이 섬유모세포 활성화 단백질 (FAP), 바람직하게는 섬유모세포 활성화 단백질 (FAP)의 상향조절된 발현을 수반하는 질환인 화합물.
실시양태 228. 실시양태 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226 및 227 중 어느 하나에 있어서, 질환이 섬유모세포 활성화 단백질 (FAP)의 상향조절된 발현을 나타내는 세포, 바람직하게는 섬유모세포 활성화 단백질 (FAP)의 상향조절된 발현을 나타내는 세포를 함유하는 이환 조직을 수반하고, 보다 바람직하게는 질환이 종양 연관 섬유모세포를 수반하는 것인 화합물.
실시양태 229. 실시양태 226, 227 및 228 중 어느 하나에 있어서, 질환이 신생물, 바람직하게는 암 또는 종양인 화합물.
실시양태 230. 실시양태 229에 있어서, 신생물, 암 및 종양이 고형 종양, 상피 종양, 방광암, 유방암, 자궁경부암, 결장직장암, 담관암종, 자궁내막암, 식도암, 위암, 위장 기질 종양, 두경부암, 간암, 폐암, 흑색종, 중피종, 신경내분비 종양 및 암종, 난소암, 췌장암, 전립선암, 신세포 암종, 타액 암종, 육종, 편평 세포 암종 및 갑상선암을 포함하는 군으로부터 각각 개별적으로 선택된 것인 화합물.
실시양태 231. 실시양태 230에 있어서, 신생물, 암 및 종양이 유방암, 결장직장암, 담관암종, 두경부암, 폐암, 중피종, 신경내분비 종양 및 암종, 난소암, 췌장암, 전립선암, 육종 및 편평 세포 암종을 포함하는 군으로부터 각각 개별적으로 선택된 것인 화합물.
실시양태 232. 실시양태 226, 227 및 228 중 어느 하나에 있어서, 질환이 염증성 질환, 심혈관 질환, 자가면역 질환 및 섬유화 질환을 포함하는 군으로부터 선택된 것인 화합물.
실시양태 233. 실시양태 232에 있어서, 질환이 염증성 질환인 화합물.
실시양태 234. 실시양태 233에 있어서, 질환이 아테롬성동맥경화증, 관절염 또는 류마티스 관절염인 화합물.
실시양태 235. 실시양태 232에 있어서, 질환이 심혈관 질환인 화합물.
실시양태 236. 실시양태 235에 있어서, 질환이 아테롬성동맥경화성 플라크를 수반하는 심혈관 질환인 화합물.
실시양태 237. 실시양태 236에 있어서, 질환이 플라크의 파열, 급성 관상동맥 증후군, 심근경색, 혈전증 또는 혈관 폐쇄에 의해 유발된 아테롬성동맥경화성 병리상태인 화합물.
실시양태 238. 실시양태 232에 있어서, 질환이 섬유화 질환인 화합물.
실시양태 239. 실시양태 238에 있어서, 질환이 특발성 폐 섬유증, 크론병 및 간 섬유증을 포함하는 군으로부터 선택된 것인 화합물.
실시양태 240. 실시양태 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238 및 239 중 어느 하나에 있어서, 진단 활성 핵종, 바람직하게는 진단 활성 방사성핵종을 포함하는 화합물.
실시양태 241. 실시양태 240에 있어서, 진단 활성 핵종이 18F, 43Sc, 44Sc, 51Mn, 52Mn, 64Cu, 67Ga, 68Ga, 76Br, 77Br, 86Y, 89Zr, 94mTc, 99mTc, 111In, 123I, 124I, 125I, 152Tb, 155Tb, 177Lu, 201Tl 및 203Pb, 바람직하게는 18F, 68Ga, 99mTc, 111In 및 203Pb를 포함하는 군으로부터 선택된 것인 화합물.
실시양태 242. 실시양태 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240 및 241 중 어느 하나에 있어서, 진단 방법이 영상화 방법인 화합물.
실시양태 243. 실시양태 242에 있어서, 영상화 방법이 섬광조영술, 단일 광자 방출 컴퓨터 단층촬영 (SPECT) 및 양전자 방출 단층촬영 (PET)으로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 244. 실시양태 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242 및 243 중 어느 하나에 있어서, 방법이 진단 유효량의 화합물을 대상체, 바람직하게는 포유동물에게 투여하는 것을 포함하며, 여기서 포유동물은 인간, 반려 동물, 애완동물 및 가축을 포함하는 군으로부터 선택되고, 보다 바람직하게는 대상체는 인간, 개, 고양이, 말 및 소를 포함하는 군으로부터 선택되고, 가장 바람직하게는 대상체는 인간인 화합물.
실시양태 245. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224 및 225 중 어느 하나, 바람직하게는 실시양태 51, 52, 56 내지 58, 110, 111, 115 내지 117, 161, 162, 166 내지 168, 215, 216 및 220 내지 222 중 어느 하나에 있어서, 질환의 치료 방법에 사용하기 위한 화합물.
실시양태 246. 실시양태 245에 있어서, 질환이 섬유모세포 활성화 단백질 (FAP), 바람직하게는 섬유모세포 활성화 단백질 (FAP)의 상향조절된 발현을 수반하는 질환인 화합물.
실시양태 247. 실시양태 245 또는 246에 있어서, 질환이 섬유모세포 활성화 단백질 (FAP)의 상향조절된 발현을 나타내는 세포, 바람직하게는 섬유모세포 활성화 단백질 (FAP)의 상향조절된 발현을 나타내는 세포를 함유하는 이환 조직을 수반하고, 보다 바람직하게는 질환이 종양 연관 섬유모세포를 수반하는 것인 화합물.
실시양태 248. 실시양태 245, 246 및 247 중 어느 하나에 있어서, 질환이 신생물, 바람직하게는 암 또는 종양인 화합물.
실시양태 249. 실시양태 248에 있어서, 신생물, 암 및 종양이 고형 종양, 상피 종양, 방광암, 유방암, 자궁경부암, 결장직장암, 담관암종, 자궁내막암, 식도암, 위암, 위장 기질 종양, 두경부암, 간암, 폐암, 흑색종, 중피종, 신경내분비 종양 및 암종, 난소암, 췌장암, 전립선암, 신세포 암종, 타액 암종, 육종, 편평 세포 암종 및 갑상선암을 포함하는 군으로부터 각각 개별적으로 선택된 것인 화합물.
실시양태 250. 실시양태 249에 있어서, 신생물, 암 및 종양이 유방암, 결장직장암, 담관암종, 두경부암, 폐암, 중피종, 신경내분비 종양 및 암종, 난소암, 췌장암, 전립선암, 육종 및 편평 세포 암종을 포함하는 군으로부터 각각 개별적으로 선택된 것인 화합물.
실시양태 251. 실시양태 245, 246 및 247 중 어느 하나에 있어서, 질환이 염증성 질환, 심혈관 질환, 자가면역 질환 및 섬유화 질환을 포함하는 군으로부터 선택된 것인 화합물.
실시양태 252. 실시양태 251에 있어서, 질환이 염증성 질환인 화합물.
실시양태 253. 실시양태 252에 있어서, 질환이 아테롬성동맥경화증, 관절염 또는 류마티스 관절염인 화합물.
실시양태 254. 실시양태 251에 있어서, 질환이 심혈관 질환인 화합물.
실시양태 255. 실시양태 254에 있어서, 질환이 아테롬성동맥경화성 플라크를 수반하는 심혈관 질환인 화합물.
실시양태 256. 실시양태 255에 있어서, 질환이 플라크의 파열, 급성 관상동맥 증후군, 심근경색, 혈전증 또는 혈관 폐쇄에 의해 유발된 아테롬성동맥경화성 병리상태인 화합물.
실시양태 257. 실시양태 251에 있어서, 질환이 섬유화 질환인 화합물.
실시양태 258. 실시양태 257에 있어서, 질환이 특발성 폐 섬유증, 크론병 및 간 섬유증을 포함하는 군으로부터 선택된 것인 화합물.
실시양태 259. 실시양태 245, 246, 247 및 248 중 어느 하나에 있어서, 치료 활성 핵종, 바람직하게는 치료 활성 방사성핵종을 포함하는 화합물.
실시양태 260. 실시양태 259에 있어서, 치료 활성 핵종이 47Sc, 67Cu, 89Sr, 90Y, 131I, 111In, 153Sm, 149Tb, 161Tb, 177Lu, 186Re, 188Re, 211At, 212Pb, 213Bi, 223Ra, 224Ra, 225Ac, 226Th 및 227Th, 바람직하게는 90Y,177Lu, 212Pb 및 225Ac를 포함하는 군으로부터 선택된 것인 화합물.
실시양태 261. 실시양태 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259 및 260 중 어느 하나에 있어서, 방법이 치료 유효량의 화합물을 대상체, 바람직하게는 포유동물에게 투여하는 것을 포함하며, 여기서 포유동물은 인간, 반려 동물, 애완동물 및 가축을 포함하는 군으로부터 선택되고, 보다 바람직하게는 대상체는 인간, 개, 고양이, 말 및 소를 포함하는 군으로부터 선택되고, 가장 바람직하게는 대상체는 인간인 화합물.
실시양태 262. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224 및 225 중 어느 하나에 있어서, 상기 실시양태 중 어느 하나의 화합물을 사용하는 진단 방법, 바람직하게는 실시양태 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243 및 244 중 어느 하나에 기재된 바와 같은 질환의 진단 방법을 수행하는 것을 포함하는, 질환의 치료에 반응할 가능성이 있거나 또는 반응하지 않을 가능성이 있는 대상체를 확인하는 방법에 사용하기 위한 화합물.
실시양태 263. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224 및 225 중 어느 하나에 있어서, 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224 및 225 중 어느 하나의 화합물을 사용하는 진단 방법, 바람직하게는 실시양태 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243 및 244 중 어느 하나에 기재된 바와 같은 질환의 진단 방법을 수행하는 것을 포함하는, 대상체의 군으로부터 질환의 치료에 반응할 가능성이 있거나 반응하지 않을 가능성이 있는 대상체를 선택하는 방법에 사용하기 위한 화합물.
실시양태 264. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224 및 225 중 어느 하나에 있어서, 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224 및 225 중 어느 하나의 화합물을 사용하는 진단 방법, 바람직하게는 실시양태 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243 및 244 중 어느 하나에 기재된 바와 같은 질환의 진단 방법을 수행하는 것을 포함하는, 질환의 치료에 반응할 가능성이 있는 대상체 및 질환의 치료에 반응할 가능성이 없는 대상체로 대상체의 군을 계층화하는 방법에 사용하기 위한 화합물.
실시양태 265. 실시양태 262, 263 및 264 중 어느 하나에 있어서, 질환이 섬유모세포 활성화 단백질 (FAP), 바람직하게는 섬유모세포 활성화 단백질 (FAP)의 상향조절된 발현을 수반하는 질환인 화합물.
실시양태 266. 실시양태 262, 263, 264 및 265 중 어느 하나에 있어서, 질환이 섬유모세포 활성화 단백질 (FAP)의 상향조절된 발현을 나타내는 세포, 바람직하게는 섬유모세포 활성화 단백질 (FAP)의 상향조절된 발현을 나타내는 세포를 함유하는 이환 조직을 수반하고, 보다 바람직하게는 질환이 종양 연관 섬유모세포를 수반하는 것인 화합물.
실시양태 267. 실시양태 262, 263, 264, 165 및 266 중 어느 하나에 있어서, 질환이 신생물, 바람직하게는 암 또는 종양인 화합물.
실시양태 268. 실시양태 267에 있어서, 신생물, 암 및 종양이 고형 종양, 상피 종양, 방광암, 유방암, 자궁경부암, 결장직장암, 담관암종, 자궁내막암, 식도암, 위암, 위장 기질 종양, 두경부암, 간암, 폐암, 흑색종, 중피종, 신경내분비 종양 및 암종, 난소암, 췌장암, 전립선암, 신세포 암종, 타액 암종, 육종, 편평 세포 암종 및 갑상선암을 포함하는 군으로부터 각각 개별적으로 선택된 것인 화합물.
실시양태 269. 실시양태 268에 있어서, 신생물, 암 및 종양이 유방암, 결장직장암, 담관암종, 두경부암, 폐암, 중피종, 신경내분비 종양 및 암종, 난소암, 췌장암, 전립선암, 육종 및 편평 세포 암종을 포함하는 군으로부터 각각 개별적으로 선택된 것인 화합물.
실시양태 270. 실시양태 262, 263, 264, 265 및 266 중 어느 하나에 있어서, 질환이 염증성 질환, 심혈관 질환, 자가면역 질환 및 섬유화 질환을 포함하는 군으로부터 선택된 것인 화합물.
실시양태 271. 실시양태 270에 있어서, 질환이 염증성 질환인 화합물.
실시양태 272. 실시양태 271에 있어서, 질환이 아테롬성동맥경화증, 관절염 또는 류마티스 관절염인 화합물.
실시양태 273. 실시양태 272에 있어서, 질환이 심혈관 질환인 화합물.
실시양태 274. 실시양태 273에 있어서, 질환이 아테롬성동맥경화성 플라크를 수반하는 심혈관 질환인 화합물.
실시양태 275. 실시양태 274에 있어서, 질환이 플라크의 파열, 급성 관상동맥 증후군, 심근경색, 혈전증 또는 혈관 폐쇄에 의해 유발된 아테롬성동맥경화성 병리상태인 화합물.
실시양태 276. 실시양태 270에 있어서, 질환이 섬유화 질환인 화합물.
실시양태 277. 실시양태 276에 있어서, 질환이 특발성 폐 섬유증, 크론병 및 간 섬유증을 포함하는 군으로부터 선택된 것인 화합물.
실시양태 278. 실시양태 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276 및 277 중 어느 하나에 있어서, 진단 방법이 영상화 방법인 화합물.
실시양태 279. 실시양태 278에 있어서, 영상화 방법이 섬광조영술, 단일 광자 방출 컴퓨터 단층촬영 (SPECT) 및 양전자 방출 단층촬영 (PET)을 포함하는 군으로부터 선택된 것인 화합물.
실시양태 280. 실시양태 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278 및 279 중 어느 하나에 있어서, 진단 활성 핵종, 바람직하게는 진단 활성 방사성핵종을 포함하는 화합물.
실시양태 281. 실시양태 280에 있어서, 진단 활성 핵종이 18F, 43Sc, 44Sc, 51Mn, 52Mn, 64Cu, 67Ga, 68Ga, 76Br, 77Br, 86Y, 89Zr, 94mTc, 99mTc, 111In, 123I, 124I, 125I, 152Tb, 155Tb, 177Lu, 201Tl 및 203Pb, 바람직하게는 18F, 68Ga, 99mTc, 111In, 및 203Pb를 포함하는 군으로부터 선택된 것인 화합물.
실시양태 282. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224 및 225 중 어느 하나에 있어서, 진단 활성제 및 치료 활성제를 포함하는 군으로부터 선택된 이펙터를 섬유모세포 활성화 단백질 (FAP), 바람직하게는 인간 섬유모세포 활성화 단백질 (FAP)에 전달하는 방법에 사용하기 위한 화합물.
실시양태 283. 실시양태 282에 있어서, 이펙터가 진단 활성 핵종 및 치료 활성 핵종을 포함하는 군으로부터 선택된 것인 화합물.
실시양태 284. 실시양태 283에 있어서, 진단 활성 핵종이 진단 활성 방사성핵종인 화합물.
실시양태 285. 실시양태 284에 있어서, 진단 활성 방사성핵종이 18F, 43Sc, 44Sc, 51Mn, 52Mn, 64Cu, 67Ga, 68Ga, 76Br, 77Br, 86Y, 89Zr, 94mTc, 99mTc, 111In, 123I, 124I, 125I, 152Tb, 155Tb, 177Lu, 201Tl 및 203Pb, 바람직하게는 18F, 68Ga, 99mTc, 111In, 및 203Pb로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 286. 실시양태 282, 283, 284 및 285 중 어느 하나에 있어서, 섬유모세포 활성화 단백질 (FAP)이 각각 섬유모세포 활성화 단백질 (FAP)의 상향조절된 발현을 나타내는 세포, 바람직하게는 섬유모세포, 중간엽 줄기 세포, 평활근 세포, 상피 기원의 세포, 또는 내피 세포, 보다 바람직하게는 인간 섬유모세포, 중간엽 줄기 세포, 평활근 세포, 상피 기원의 세포, 또는 내피 세포, 가장 바람직하게는 인간 섬유모세포, 중간엽 줄기 세포, 평활근 세포, 상피 기원의 세포, 또는 내피 세포에 의해 발현되는 것인 화합물.
실시양태 287. 실시양태 286에 있어서, 세포가 조직, 바람직하게는 질환을 앓고 있는 대상체의 이환 조직에 함유되거나 또는 그의 일부인 화합물.
실시양태 288. 실시양태 287에 있어서, 질환이 섬유모세포 활성화 단백질 (FAP)의 상향조절된 발현을 나타내는 세포, 바람직하게는 섬유모세포 활성화 단백질 (FAP)의 상향조절된 발현을 나타내는 세포를 함유하는 이환 조직을 수반하고, 보다 바람직하게는 질환이 종양 연관 섬유모세포를 수반하는 것인 화합물.
실시양태 289. 실시양태 287 또는 288에 있어서, 질환이 신생물, 바람직하게는 암 또는 종양인 화합물.
실시양태 290. 실시양태 289에 있어서, 신생물, 암 및 종양이 고형 종양, 상피 종양, 방광암, 유방암, 자궁경부암, 결장직장암, 담관암종, 자궁내막암, 식도암, 위암, 위장 기질 종양, 두경부암, 간암, 폐암, 흑색종, 중피종, 신경내분비 종양 및 암종, 난소암, 췌장암, 전립선암, 신세포 암종, 타액 암종, 육종, 편평 세포 암종 및 갑상선암을 포함하는 군으로부터 각각 개별적으로 선택된 것인 화합물.
실시양태 291. 실시양태 290에 있어서, 신생물, 암 및 종양이 유방암, 결장직장암, 담관암종, 두경부암, 폐암, 중피종, 신경내분비 종양 및 암종, 난소암, 췌장암, 전립선암, 육종 및 편평 세포 암종을 포함하는 군으로부터 각각 개별적으로 선택된 것인 화합물.
실시양태 292. 실시양태 287 또는 288에 있어서, 질환이 염증성 질환, 심혈관 질환, 자가면역 질환 및 섬유화 질환을 포함하는 군으로부터 선택된 것인 화합물.
실시양태 293. 실시양태 292에 있어서, 질환이 염증성 질환인 화합물.
실시양태 294. 실시양태 293에 있어서, 질환이 아테롬성동맥경화증, 관절염 또는 류마티스 관절염인 화합물.
실시양태 295. 실시양태 292에 있어서, 질환이 심혈관 질환인 화합물.
실시양태 296. 실시양태 295에 있어서, 질환이 아테롬성동맥경화성 플라크를 수반하는 심혈관 질환인 화합물.
실시양태 297. 실시양태 296에 있어서, 질환이 플라크의 파열, 급성 관상동맥 증후군, 심근경색, 혈전증 또는 혈관 폐쇄에 의해 유발된 아테롬성동맥경화성 병리상태인 화합물.
실시양태 298. 실시양태 292에 있어서, 질환이 섬유화 질환인 화합물.
실시양태 299. 실시양태 298에 있어서, 질환이 특발성 폐 섬유증, 크론병 및 간 섬유증을 포함하는 군으로부터 선택된 것인 화합물.
실시양태 300. 실시양태 283에 있어서, 치료 활성 핵종이 치료 활성 방사성핵종인 화합물.
실시양태 301. 실시양태 300에 있어서, 치료 활성 방사성핵종이 47Sc, 67Cu, 89Sr, 90Y, 131I, 111In, 153Sm, 149Tb, 161Tb, 177Lu, 186Re, 188Re, 211At, 212Pb, 213Bi, 223Ra, 224Ra, 225Ac, 226Th 및 227Th, 바람직하게는 90Y,177Lu, 212Pb 및 225Ac로 이루어진 군으로부터 선택된 것인 화합물.
실시양태 302. 실시양태 300 또는 301에 있어서, 섬유모세포 활성화 단백질 (FAP)이 섬유모세포 활성화 단백질 (FAP)의 상향조절된 발현을 나타내는 세포, 바람직하게는 섬유모세포, 중간엽 줄기 세포, 평활근 세포, 상피 기원의 세포, 또는 내피 세포, 보다 바람직하게는 인간 섬유모세포, 중간엽 줄기 세포, 평활근 세포, 상피 기원의 세포, 또는 내피 세포, 가장 바람직하게는 인간 섬유모세포, 중간엽 줄기 세포, 평활근 세포, 상피 기원의 세포, 또는 내피 세포에 의해 발현되는 것인 화합물.
실시양태 303. 실시양태 302에 있어서, 세포가 조직, 바람직하게는 질환을 앓고 있는 대상체의 이환 조직에 함유되거나 또는 그의 일부인 화합물.
실시양태 304. 실시양태 303에 있어서, 질환이 섬유모세포 활성화 단백질 (FAP)의 상향조절된 발현을 나타내는 세포, 바람직하게는 섬유모세포 활성화 단백질 (FAP)의 상향조절된 발현을 나타내는 세포를 함유하는 이환 조직을 수반하고, 보다 바람직하게는 질환이 종양 연관 섬유모세포를 수반하는 것인 화합물.
실시양태 305. 실시양태 302, 303 및 304 중 어느 하나에 있어서, 질환이 신생물, 바람직하게는 암 또는 종양인 화합물.
실시양태 306. 실시양태 305에 있어서, 신생물, 암 및 종양이 고형 종양, 상피 종양, 방광암, 유방암, 자궁경부암, 결장직장암, 담관암종, 자궁내막암, 식도암, 위암, 위장 기질 종양, 두경부암, 간암, 폐암, 흑색종, 중피종, 신경내분비 종양 및 암종, 난소암, 췌장암, 전립선암, 신세포 암종, 타액 암종, 육종, 편평 세포 암종 및 갑상선암을 포함하는 군으로부터 각각 개별적으로 선택된 것인 화합물.
실시양태 307. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224 및 225 중 어느 하나에 따른 화합물 및 제약상 허용되는 부형제를 포함하는 조성물, 바람직하게는 제약 조성물.
실시양태 308. 실시양태 307에 있어서, 제1항 내지 제307항 중 어느 한 항에 정의된 바와 같은 임의의 방법에 사용하기 위한 조성물.
실시양태 309. 대상체에게 진단 유효량의 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224 및 225 중 어느 하나에 따른 화합물을 투여하는 것을 포함하는, 대상체에서 질환을 진단하는 방법.
실시양태 310. 실시양태 309에 있어서, 화합물이 진단 활성제를 포함하며, 여기서 작용제는 바람직하게는 방사성핵종인 방법.
실시양태 311. 대상체에게 치료 유효량의 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224 및 225 중 어느 하나에 따른 화합물을 투여하는 것을 포함하는, 대상체에서 질환을 치료하는 방법.
실시양태 312. 실시양태 311에 있어서, 화합물이 치료 활성제를 포함하며, 여기서 작용제는 바람직하게는 방사성핵종인 방법.
실시양태 313. 실시양태 309, 310, 311 및 312 중 어느 하나에 있어서, 질환이 섬유모세포 활성화 단백질 (FAP), 바람직하게는 섬유모세포 활성화 단백질 (FAP)의 상향조절된 발현을 수반하는 질환인 방법.
실시양태 314. 실시양태 309, 310, 311, 312 및 313 중 어느 하나에 있어서, 질환이 섬유모세포 활성화 단백질 (FAP)의 상향조절된 발현을 나타내는 세포, 바람직하게는 섬유모세포 활성화 단백질 (FAP)의 상향조절된 발현을 나타내는 세포를 함유하는 이환 조직을 수반하고, 보다 바람직하게는 질환이 종양 연관 섬유모세포를 수반하는 것인 방법.
실시양태 315. 실시양태 309, 310, 311, 312, 313 및 314 중 어느 하나에 있어서, 질환이 신생물, 바람직하게는 암 또는 종양, 및 염증성 질환, 심혈관 질환, 자가면역 질환 및 섬유화 질환을 포함하는 군으로부터 선택된 것인 방법.
실시양태 316. 실시양태 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224 및 225 중 어느 하나에 따른 화합물, 1종 이상의 임의적인 부형제(들) 및 임의로 1종 이상의 장치(들)를 포함하며, 여기서 장치(들)는 표지 장치, 정제 장치, 취급 장치, 방사선보호 장치, 분석 장치 또는 투여 장치를 포함하는 군으로부터 선택된 것인 키트.
실시양태 317. 실시양태 316에 있어서, 상기 실시양태 중 어느 하나에 정의된 바와 같은 임의의 방법에 사용하기 위한 키트.
보다 구체적으로, 본 발명의 근본적인 과제는 제1 측면에서 화학식 (I)의 시클릭 펩티드 및 Xaa1에 부착된 N-말단 변형 기 A를 포함하는 화합물에 의해 해결된다:
여기서
펩티드 서열은 N에서 C-말단 방향으로 좌측에서 우측으로 그려지고,
Xaa1은 화학식 (II)의 아미노산의 잔기이고:
여기서
R1a는 -NH-이고,
R1b는 H 또는 CH3이고,
n = 0 또는 1이고,
N-말단 변형 기 A는 Xaa1의 질소 원자에 공유 부착되고,
Xaa1의 카르보닐 기는 Xaa2의 질소에 공유 부착되고,
Xaa1의 황 원자는 Yc에 티오에테르로서 공유 부착되고;
Xaa2는 화학식 (III), (IV) 또는 (XX)의 아미노산의 잔기이고:
여기서
R2a, R2b 및 R2c는 각각 독립적으로 (C1-C2)알킬 및 H로 이루어진 군으로부터 선택되고, 여기서 상기 (C1-C2)알킬은 OH, NH2, 할로겐, (C5-C7)시클로알킬로 이루어진 군으로부터 선택된 치환기에 의해 치환될 수 있고,
p = 0, 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
화학식 (IV)의 아미노산은 나타낸 고리 위치 3 및 4에서 메틸, OH, NH2 및 F로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
Xaa3은 화학식 (V) 또는 (XX)의 아미노산의 잔기이고:
여기서
X3은 CH2, CF2, CH-R3b, S, O 및 NH로 이루어진 군으로부터 선택되고,
p = 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
R3a는 H, 메틸, OH, NH2 또는 F이고,
R3b은 메틸, OH, NH2 또는 F이고;
Xaa4는 화학식 (VI)의 아미노산의 잔기이고:
여기서
R4a는 H, OH, COOH, CONH2, X4 및 -NH-CO-X4로 이루어진 군으로부터 선택되고, 여기서 X4는 (C1-C6)알킬, (C5-C6)아릴 및 (C5-C6)헤테로아릴로 이루어진 군으로부터 선택되고, X4는 메틸, CONH2, 할로겐, NH2 및 OH로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
q = 1, 2 또는 3이고, 여기서 임의로, 상기 1, 2 또는 3개의 CH2-기의 1 또는 2개의 수소는 메틸, 에틸, (C5-C6)아릴 또는 (C5-C6)헤테로아릴에 의해 각각 개별적으로 치환되고,
R4b는 메틸 또는 H이고;
Xaa5는 구조 (VII)의 아미노산의 잔기이고:
여기서
R5는 OH 및 NH2의 군으로부터 선택되고,
r = 1, 2 또는 3이고;
Xaa6은 방향족 L-α-아미노산 및 헤테로방향족 L-α-아미노산으로 이루어진 군으로부터 선택된 아미노산이고;
Xaa7은 화학식 (IX)의 아미노 티올 또는 아미노산의 잔기이고:
여기서
R7a는 -CO-, -COOH, -CONH2, -CH2-OH, -(CO)-NH-R7b, -(CO)-(NR7c)-R7b 또는 H이고, 여기서 R7b 및 R7c는 각각 독립적으로 (C1-C4)알킬이고,
t는 1 또는 2이고;
Yc는 화학식 (X)의 구조이고:
2개의 티오에테르 연결의 형성 하에 Xaa1의 S 원자 및 Xaa7의 S 원자를 연결하여 화학식 (XXI)의 시클릭 구조를 형성하고:
화학식 (X)에서 방향족 기의 치환 패턴은 오르토, 메타 또는 파라이고,
n = 0 또는 1이고,
t = 1 또는 2이고,
Y1은 C-H 또는 N이고,
Y2는 N 또는 C-Rc1이고,
Rc1은 H 또는 CH2-Rc2이고,
Rc2는 화학식 (XI), (XII) 또는 (XXII)의 구조이고:
여기서
Rc3 및 Rc4는 각각 독립적으로 H 및 (C1-C4)알킬로 이루어진 군으로부터 선택되고,
u = 1, 2, 3, 4, 5 또는 6이고,
x 및 y는 각각 독립적으로 1, 2 또는 3이고,
X = O 또는 S이고,
화학식 (XI) 및 (XXII)에서 질소 원자 중 1개는 Rc1의 -CH2-에 부착되고, 화학식 (XII)에서 -X-는 Rc1의 -CH2-에 부착되고;
N-말단 변형 기 A는 차단 기 Abl이고, 여기서 차단 기 Abl은 Ra1-NH-C(O)-이고; Ra1은 C3 알킬, C4 알킬 또는 C5 알킬로 이루어진 군으로부터 선택되고, 각각 독립적으로 OH, F, COOH, (C3-C8)시클로알킬, 아릴, 헤테로아릴 및 (C3-C8)헤테로사이클로 이루어진 군으로부터 각각 독립적으로 선택된 2개 이하의 치환기에 의해 임의로 치환되고, (C1-C8)알킬에서 -CH2- 기 중 1개는 -S- 또는 -O-에 의해 임의로 대체된다.
보다 구체적으로, 본 발명의 근본적인 과제는 제2 측면에서 화학식 (I)의 시클릭 펩티드 및 Xaa1에 부착된 N-말단 변형 기 A를 포함하는 화합물에 의해 해결된다:
여기서
펩티드 서열은 N에서 C-말단 방향으로 좌측에서 우측으로 그려지고,
Xaa1은 화학식 (II)의 아미노산의 잔기이고:
여기서
R1a는 -NH-이고,
R1b는 H 또는 CH3이고,
n = 0 또는 1이고,
N-말단 변형 기 A는 Xaa1의 질소 원자에 공유 부착되고,
Xaa1의 카르보닐 기는 Xaa2의 질소에 공유 부착되고,
Xaa1의 황 원자는 Yc에 티오에테르로서 공유 부착되고;
Xaa2는 화학식 (III), (IV) 또는 (XX)의 아미노산의 잔기이고:
여기서
R2a, R2b 및 R2c는 각각 독립적으로 (C1-C2)알킬 및 H로 이루어진 군으로부터 선택되고, 여기서 상기 (C1-C2)알킬은 OH, NH2, 할로겐, (C5-C7)시클로알킬로 이루어진 군으로부터 선택된 치환기에 의해 치환될 수 있고,
p = 0, 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
화학식 (IV)의 아미노산은 나타낸 고리 위치 3 및 4에서 메틸, OH, NH2 및 F로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
Xaa3은 화학식 (V) 또는 (XX)의 아미노산의 잔기이고:
여기서
X3은 CH2, CF2, CH-R3b, S, O 및 NH로 이루어진 군으로부터 선택되고,
p = 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
R3a는 H, 메틸, OH, NH2 또는 F이고,
R3b은 메틸, OH, NH2 또는 F이고;
Xaa4는 화학식 (VI)의 아미노산의 잔기이고:
여기서
R4a는 H, OH, COOH, CONH2, X4 및 -NH-CO-X4로 이루어진 군으로부터 선택되고, 여기서 X4는 (C1-C6)알킬, (C5-C6)아릴 및 (C5-C6)헤테로아릴로 이루어진 군으로부터 선택되고, X4는 메틸, CONH2, 할로겐, NH2 및 OH로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
q = 1, 2 또는 3이고, 여기서 임의로, 상기 1, 2 또는 3개의 CH2-기의 1 또는 2개의 수소는 메틸, 에틸, (C5-C6)아릴 또는 (C5-C6)헤테로아릴에 의해 각각 개별적으로 치환되고,
R4b는 메틸 또는 H이고;
Xaa5는 구조 (VII)의 아미노산의 잔기이고:
여기서
R5는 OH 및 NH2의 군으로부터 선택되고,
r = 1, 2 또는 3이고;
Xaa6은 방향족 L-α-아미노산 및 헤테로방향족 L-α-아미노산으로 이루어진 군으로부터 선택된 아미노산이고;
Xaa7은 화학식 (IX)의 아미노 티올 또는 아미노산의 잔기이고:
여기서
R7a는 -CO-, -COOH, -CONH2, -CH2-OH, -(CO)-NH-R7b, -(CO)-(NR7c)-R7b 또는 H이고, 여기서 R7b 및 R7c는 각각 독립적으로 (C1-C4)알킬이고,
t는 1 또는 2이고;
Yc는 화학식 (X)의 구조이고:
2개의 티오에테르 연결의 형성 하에 Xaa1의 S 원자 및 Xaa7의 S 원자를 연결하여 화학식 (XXI)의 시클릭 구조를 형성하고:
화학식 (X)에서 방향족 기의 치환 패턴은 오르토, 메타 또는 파라, 바람직하게는 메타이고,
n = 0 또는 1이고,
t = 1 또는 2이고,
Y1은 C-H이고,
Y2는 C-Rc1이고,
Rc1은 CH2-Rc2 또는 H이고,
Rc2는 화학식 (XIId) 또는 (XXIIc)의 구조이고:
여기서
u = 1이고,
Rc4는 H이고,
Z는 임의로 링커를 포함하는 킬레이트화제이고;
N-말단 변형 기 A는 차단 기 Abl이고, 여기서 차단 기 Abl은 Ra1-NH-C(O)-이고; Ra1은 OH, F, COOH, (C3-C8)시클로알킬, 아릴, 헤테로아릴 및 (C3-C8)헤테로사이클로 이루어진 군으로부터 각각 독립적으로 선택된 2개 이하의 치환기에 의해 임의로 치환된 (C1-C8)알킬이고, (C1-C8)알킬에서 -CH2- 기 중 1개는 -S- 또는 -O-에 의해 임의로 대체된다.
보다 구체적으로, 본 발명의 근본적인 과제는 제3 측면에서 화학식 (I)의 시클릭 펩티드 및 Xaa1에 부착된 N-말단 변형 기 A를 포함하는 화합물에 의해 해결된다:
여기서
펩티드 서열은 N에서 C-말단 방향으로 좌측에서 우측으로 그려지고,
Xaa1은 화학식 (II)의 아미노산의 잔기이고:
여기서
R1a는 -NH-이고,
R1b는 H 또는 CH3이고,
n = 0 또는 1이고,
N-말단 변형 기 A는 Xaa1의 질소 원자에 공유 부착되고,
Xaa1의 카르보닐 기는 Xaa2의 질소에 공유 부착되고,
Xaa1의 황 원자는 Yc에 티오에테르로서 공유 부착되고;
Xaa2는 화학식 (III), (IV) 또는 (XX)의 아미노산의 잔기이고:
여기서
R2a, R2b 및 R2c는 각각 독립적으로 (C1-C2)알킬 및 H로 이루어진 군으로부터 선택되고, 여기서 상기 (C1-C2)알킬은 OH, NH2, 할로겐, (C5-C7)시클로알킬로 이루어진 군으로부터 선택된 치환기에 의해 치환될 수 있고,
p = 0, 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
화학식 (IV)의 아미노산은 나타낸 고리 위치 3 및 4에서 메틸, OH, NH2 및 F로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
Xaa3은 화학식 (V) 또는 (XX)의 아미노산의 잔기이고:
여기서
X3은 CH2, CF2, CH-R3b, S, O 및 NH로 이루어진 군으로부터 선택되고,
p = 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
R3a는 H, 메틸, OH, NH2 또는 F이고,
R3b은 메틸, OH, NH2 또는 F이고;
Xaa4는 화학식 (VI)의 아미노산의 잔기이고:
여기서
R4a는 H, OH, COOH, CONH2, X4 및 -NH-CO-X4로 이루어진 군으로부터 선택되고, 여기서 X4는 (C1-C6)알킬, (C5-C6)아릴 및 (C5-C6)헤테로아릴로 이루어진 군으로부터 선택되고, X4는 메틸, CONH2, 할로겐, NH2 및 OH로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
q = 1, 2 또는 3이고, 여기서 임의로, 상기 1, 2 또는 3개의 CH2-기의 1 또는 2개의 수소는 메틸, 에틸, (C5-C6)아릴 또는 (C5-C6)헤테로아릴에 의해 각각 개별적으로 치환되고,
R4b는 메틸 또는 H이고;
Xaa5는 구조 (VII)의 아미노산의 잔기이고:
여기서
R5는 OH 및 NH2의 군으로부터 선택되고,
r = 1, 2 또는 3이고;
Xaa6은 방향족 L-α-아미노산 및 헤테로방향족 L-α-아미노산으로 이루어진 군으로부터 선택된 아미노산이고;
Xaa7은 화학식 (IX)의 아미노 티올 또는 아미노산의 잔기이고:
여기서
R7a는 -CO-, -COOH, -CONH2, -CH2-OH, -(CO)-NH-R7b, -(CO)-(NR7c)-R7b 또는 H이고, 여기서 R7b 및 R7c는 각각 독립적으로 (C1-C4)알킬이고,
t는 1 또는 2이고;
Yc는 화학식 (X)의 구조이고:
2개의 티오에테르 연결의 형성 하에 Xaa1의 S 원자 및 Xaa7의 S 원자를 연결하여 화학식 (XXI)의 시클릭 구조를 형성하고:
화학식 (X)에서 방향족 기의 치환 패턴은 메타이고,
n = 0 또는 1이고,
t = 1 또는 2이고,
Y1은 C-H 또는 N이고,
Y2는 C-Rc1이고,
Rc1은 H이고;
N-말단 변형 기 A는 아미노산 Aaa이고,
여기서
아미노산 Aaa는 구조 (XIV)의 L-아미노산 잔기이고:
여기서
Ra2는 (C1-C6)알킬 및 변형된 (C1-C6)알킬로 이루어진 군으로부터 선택되고,
여기서 변형된 (C1-C6)알킬에서 1개의 -CH2- 기는 -S- 또는 -O-에 의해 대체되고,
아미노산 Aaa는 링커에 공유 부착되고, 여기서 링커는 킬레이트화제 Z에 공유 연결되고, 링커는 (a) 제1 링커 또는 (b) 제1 링커 및 제2 링커로 이루어지고, 여기서
링커가 제1 링커로 이루어지는 경우에, 제1 링커는 킬레이트화제 및 아미노산 Aaa에 공유 연결되고,
제1 링커가 제1 링커 및 제2 링커로 이루어지는 경우에, 제1 링커는 아미노산 Aaa 및 제2 링커에 공유 연결되고, 제2 링커는 킬레이트화제에 공유 연결되고,
제1 링커는 Ttds 및 PEG6으로 이루어진 군으로부터 선택되고, 바람직하게는 제1 링커는 Ttds이고,
제2 링커는 PPAc 및 PEG6으로 이루어진 군으로부터 선택되고, 바람직하게는 제2 링커는 PPAc이다.
보다 구체적으로, 본 발명의 기초가 되는 과제는 제4 측면에서 화학식 (I)의 시클릭 펩티드 및 Xaa1에 부착된 N-말단 변형 기 A를 포함하는 화합물에 의해 해결된다:
여기서
펩티드 서열은 N에서 C-말단 방향으로 좌측에서 우측으로 그려지고,
Xaa1은 화학식 (II)의 아미노산의 잔기이고:
여기서
R1a는 -NH-이고,
R1b는 H 또는 CH3이고,
n = 0 또는 1이고,
N-말단 변형 기 A는 Xaa1의 질소 원자에 공유 부착되고,
Xaa1의 카르보닐 기는 Xaa2의 질소에 공유 부착되고,
Xaa1의 황 원자는 Yc에 티오에테르로서 공유 부착되고;
Xaa2는 화학식 (III), (IV) 또는 (XX)의 아미노산의 잔기이고:
여기서
R2a, R2b 및 R2c는 각각 독립적으로 (C1-C2)알킬 및 H로 이루어진 군으로부터 선택되고, 여기서 상기 (C1-C2)알킬은 OH, NH2, 할로겐, (C5-C7)시클로알킬로 이루어진 군으로부터 선택된 치환기에 의해 치환될 수 있고,
p = 0, 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
화학식 (IV)의 아미노산은 나타낸 고리 위치 3 및 4에서 메틸, OH, NH2 및 F로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
Xaa3은 화학식 (V) 또는 (XX)의 아미노산의 잔기이고:
여기서
X3은 CH2, CF2, CH-R3b, S, O 및 NH로 이루어진 군으로부터 선택되고,
p = 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
R3a는 H, 메틸, OH, NH2 또는 F이고,
R3b은 메틸, OH, NH2 또는 F이고;
Xaa4는 화학식 (VI)의 아미노산의 잔기이고:
여기서
R4a는 H, OH, COOH, CONH2, X4 및 -NH-CO-X4로 이루어진 군으로부터 선택되고, 여기서 X4는 (C1-C6)알킬, (C5-C6)아릴 및 (C5-C6)헤테로아릴로 이루어진 군으로부터 선택되고, X4는 메틸, CONH2, 할로겐, NH2 및 OH로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
q = 1, 2 또는 3이고, 여기서 임의로, 상기 1, 2 또는 3개의 CH2-기의 1 또는 2개의 수소는 메틸, 에틸, (C5-C6)아릴 또는 (C5-C6)헤테로아릴에 의해 각각 개별적으로 치환되고,
R4b는 메틸 또는 H이고;
Xaa5는 구조 (VII)의 아미노산의 잔기이고:
여기서
R5는 OH 및 NH2의 군으로부터 선택되고,
r = 1, 2 또는 3이고;
Xaa6은 방향족 L-α-아미노산 및 헤테로방향족 L-α-아미노산으로 이루어진 군으로부터 선택된 아미노산이고;
Xaa7은 화학식 (IX)의 아미노 티올 또는 아미노산의 잔기이고:
여기서
R7a는 -CO-, -COOH, -CONH2, -CH2-OH, -(CO)-NH-R7b, -(CO)-(NR7c)-R7b 또는 H이고, 여기서 R7b 및 R7c는 각각 독립적으로 (C1-C4)알킬이고,
t는 1 또는 2이고;
Yc는 화학식 (X)의 구조이고:
2개의 티오에테르 연결의 형성 하에 Xaa1의 S 원자 및 Xaa7의 S 원자를 연결하여 화학식 (XXI)의 시클릭 구조를 형성하고:
화학식 (X)에서 방향족 기의 치환 패턴은 메타이고,
n = 0 또는 1이고,
t = 1 또는 2이고,
Y1은 C-H이고,
Y2는 C-Rc1이고,
Rc1은 CH2-Rc2이고,
Rc2는 화학식 (XIId)의 구조이고:
여기서
u = 1, 2, 3, 4, 5 또는 6, 바람직하게는 u = 1이고,
Rc4는 H 또는 메틸이고,
Z는 임의로 링커를 포함하는 킬레이트화제이고,
N-말단 변형 기 A는 차단 기 Abl이고, 여기서 차단 기 Abl은 Ra11-C(O)-로 이루어진 군으로부터 선택되고, 여기서 Ra11은 C4 알킬 또는 C5 알킬이고, 여기서 C4 알킬 및 C5 알킬 중 각각에서 및 임의의 1개에서 개별적으로 및 독립적으로 -CH2- 기 중 1개는 -O- 또는 -S-에 의해 임의로 대체된다.
보다 구체적으로, 본 발명의 근본적인 과제는 제5 측면에서 질환의 진단 방법에 사용하기 위한 제1 측면, 제2 측면, 제3 측면 및 제4 측면 (그의 임의의 실시양태 포함)에 따른 화합물에 의해 해결된다.
보다 구체적으로, 본 발명의 근본적인 과제는 제6 측면에서 질환의 치료 방법에 사용하기 위한 제1 측면, 제2 측면, 제3 측면 및 제4 측면 (그의 임의의 실시양태 포함)에 따른 화합물에 의해 해결된다.
보다 구체적으로, 본 발명의 근본적인 과제는 제7 측면에서, 제1 측면, 제2 측면, 제3 측면 및 제4 측면 (그의 임의의 실시양태 포함)에 따른 화합물을 사용하여 진단 방법을 수행하는 것을 포함하는, 질환의 치료에 반응할 가능성이 있거나 반응하지 않을 가능성이 있는 대상체의 확인 방법에 사용하기 위한 제1 측면, 제2 측면, 제3 측면 및 제4 측면 (그의 임의의 실시양태 포함)에 따른 화합물에 의해 해결된다.
보다 구체적으로, 본 발명의 근본적인 과제는 제8 측면에서, 제1 측면, 제2 측면, 제3 측면 및 제4 측면 (그의 임의의 실시양태 포함)에 따른 화합물을 사용하여 진단 방법을 수행하는 것을 포함하는, 대상체의 군으로부터 질환의 치료에 반응할 가능성이 있거나 또는 반응하지 않을 가능성이 있는 대상체를 선택하는 방법에 사용하기 위한 제1 측면, 제2 측면, 제3 측면 및 제4 측면 (그의 임의의 실시양태 포함)에 따른 화합물에 의해 해결된다.
보다 구체적으로, 본 발명의 근본적인 과제는 제9 측면에서, 제1 측면, 제2 측면, 제3 측면 및 제4 측면 (그의 임의의 실시양태 포함)에 따른 화합물을 사용하여 진단 방법을 수행하는 것을 포함하는, 질환의 치료에 반응할 가능성이 있는 대상체 및 질환의 치료에 반응할 가능성이 없는 대상체로 대상체의 군을 계층화하는 방법에 사용하기 위한 제1 측면, 제2 측면, 제3 측면 및 제4 측면 (그의 임의의 실시양태 포함)에 따른 화합물에 의해 해결된다.
보다 구체적으로, 본 발명의 근본적인 과제는 제10 측면에서 제1 측면, 제2 측면, 제3 측면 및 제4 측면에 따른 화합물 (그의 임의의 실시양태 포함) 및 제약상 허용되는 부형제를 포함하는 조성물, 바람직하게는 제약 조성물에 의해 해결된다.
보다 구체적으로, 본 발명의 근본적인 과제는 제11 측면에서 대상체에게 진단 유효량의 제1 측면, 제2 측면, 제3 측면 및 제4 측면 (그의 임의의 실시양태 포함)에 따른 화합물을 투여하는 것을 포함하는, 대상체에서 질환을 진단하는 방법에 의해 해결된다.
보다 구체적으로, 본 발명의 근본적인 과제는 제12 측면에서 대상체에게 치료 유효량의 제1 측면, 제2 측면, 제3 측면 및 제4 측면 (그의 임의의 실시양태 포함)에 따른 화합물을 투여하는 것을 포함하는, 대상체에서 질환을 치료하는 방법에 의해 해결된다.
보다 구체적으로, 본 발명의 근본적인 과제는 제13 측면에서 제1 측면, 제2 측면, 제3 측면 및 제4 측면 (그의 임의의 실시양태 포함)에 따른 화합물, 1종 이상의 임의적인 부형제(들) 및 임의로 1종 이상의 장치(들)를 포함하며, 여기서 장치(들)는 표지 장치, 정제 장치, 취급 장치, 방사선보호 장치, 분석 장치 또는 투여 장치를 포함하는 군으로부터 선택된 것인 키트에 의해 해결된다.
관련 기술분야의 통상의 기술자는 본 발명의 화합물이 임의의 상기 실시양태 및 임의의 하기 실시양태에 기재된 임의의 화합물을 포함하나 이에 제한되지는 않는 본원에 개시된 임의의 화합물임을 알 것이다.
관련 기술분야의 통상의 기술자는 본 발명의 방법이 임의의 상기 실시양태 및 임의의 하기 실시양태에 기재된 임의의 방법을 포함하나 이에 제한되지는 않는 본원에 개시된 임의의 방법임을 알 것이다.
관련 기술분야의 통상의 기술자는 본 발명의 조성물이 임의의 상기 실시양태 및 임의의 하기 실시양태에 기재된 임의의 조성물을 포함하나 이에 제한되지는 않는 본원에 개시된 임의의 조성물임을 알 것이다.
관련 기술분야의 통상의 기술자는 본 발명의 키트가 임의의 상기 실시양태 및 임의의 하기 실시양태에 기재된 임의의 키트를 포함하나 이에 제한되지는 않는 본원에 개시된 임의의 키트임을 알 것이다.
본 발명과 관련하여, 본 발명의 임의의 측면의 임의의 실시양태는 또한 그의 임의의 실시양태를 포함한 본 발명의 임의의 다른 측면의 실시양태일 수 있는 것으로 인지될 것이다.
본 발명은, 나노몰 친화도를 갖는 섬유모세포 활성화 단백질 (FAP)-특이적 시클릭 펩티드-기재 억제제가 지금까지 기재되지 않았기 때문에, 본 발명의 화합물 및 보다 구체적으로 그의 시클릭 펩티드가 FAP에 대한 이러한 시클릭 펩티드를 포함하는 화합물의 고도로 특이적인 결합을 제공한다는 본 발명자들의 놀라운 발견에 기초한다.
또한, 본 발명은 직접적으로 또는 간접적으로, 즉 링커를 사용하여 킬레이트화제가 3개의 상이한 위치에서 상기 시클릭 펩티드에 부착될 수 있다는 놀라운 발견에 기초한다. 제1 위치는 Xaa1의 S 원자와 Xaa7의 S 원자를 연결하여 2개의 티오에테르 연결을 형성하는 화학식 (X)의 구조를 갖는 Yc이고; 제2 위치는 화학식 (I)의 시클릭 펩티드의 Xaa1에 부착된 Aaa이고, 제3 위치는 Xaa7에 부착된 아미노산 또는 펩티드이다. 놀랍게도, 이러한 킬레이트화제의 부착은 FAP에 대한 본 발명의 화합물의 결합 및 각각 FAP에 대한 본 발명의 화합물의 억제 특징에 유의하게 영향을 미치지 않는다. 한 실시양태에서, 본 발명은 킬레이트화제 (Z 기)가 상기 정의된 바와 같은 제1, 제2 또는 제3 위치 중 단지 하나에 부착된 것인 화학식 (I)의 시클릭 펩티드에 관한 것이다. 킬레이트화제가 상기 정의된 바와 같은 제1, 제2 및 제3 위치의 임의의 조합에서 화학식 (I)의 시클릭 펩티드에 부착되는 것 또한 본 발명의 범위에 속한다. 보다 구체적으로, 본 발명은 또한 Z 기가 상기 정의된 바와 같은 제1 및 제2 위치 둘 다에 부착된 화학식 (I)의 화합물, Z 기가 상기 정의된 바와 같은 제1 및 제3 위치 둘 다에 부착된 화학식 (I)의 화합물, Z 기가 상기 정의된 바와 같은 제2 및 제3 위치 둘 다에 부착된 화학식 (I)의 화합물, 및 Z 기가 상기 정의된 바와 같은 제1, 제2 및 제3 위치에 부착된 화학식 (I)의 화합물에 관한 것이다. 2 또는 3개의 Z 기를 포함하는 이들 화합물은 본원에 개시된 바와 같은 본 발명의 임의의 실시양태에서 실현될 수 있다.
마지막으로, 본 발명자들은 본 발명의 화합물이 놀랍게도 혈장에서 안정하고, 놀랍게도 영상화제로서 유용하며, 종양을 수축시키는데 효과적이라는 것을 발견하였다.
본원에 바람직하게 사용된 표현 알킬은 각각 및 개별적으로 포화, 직쇄 또는 분지형 탄화수소 기를 지칭하고, 통상적으로 그것이 함유할 수 있는 탄소 원자의 수를 명시하는 수식어가 동반된다. 예를 들어, 표현 (C1-C6)알킬은 각각 및 개별적으로 메틸, 에틸, n-프로필, 이소프로필, n-부틸, 이소부틸, sec-부틸, tert-부틸, n-펜틸, 1-메틸-부틸, 1-에틸-프로필, 3-메틸-부틸, 1,2-디메틸-프로필, 2-메틸-부틸, 1,1-디메틸-프로필, 2,2-디메틸프로필, n-헥실, 1,1-디메틸-부틸 및 6개의 포화 탄소 원자를 함유하는 알킬 기의 임의의 다른 이소형 중 임의의 것을 의미한다.
한 실시양태에서 및 본원에 바람직하게 사용된 (C1-C2)알킬은 각각 및 개별적으로 메틸 및 에틸 중 임의의 것을 의미한다.
한 실시양태에서 및 본원에 바람직하게 사용된 (C1-C3)알킬은 각각 및 개별적으로 메틸, 에틸, n-프로필 및 이소프로필 중 임의의 것을 의미한다.
한 실시양태에서 및 본원에 바람직하게 사용된 (C1-C4)알킬은 각각 및 개별적으로 메틸, 에틸, n-프로필, 이소프로필, n-부틸, 이소부틸, sec-부틸 및 tert-부틸 중 임의의 것을 의미한다.
한 실시양태에서 및 본원에 바람직하게 사용된 (C1-C6)알킬은 각각 및 개별적으로 메틸, 에틸, n-프로필, 이소프로필, n-부틸, 이소부틸, sec-부틸, tert-부틸, n-펜틸, 2-펜틸, 2-메틸-부틸, 3-메틸-부틸, 3-펜틸, 3-메틸-부트-2-일, 2-메틸-부트-2-일, 2,2-디메틸프로필, n-헥실, 2-헥실, 2-메틸-펜틸, 3-메틸-펜틸, 4-메틸-펜틸, 3-헥실, 2-에틸-부틸, 2-메틸-펜트-2-일, 2,2-디메틸-부틸, 3,3-디메틸-부틸, 3-메틸-펜트-2-일, 4-메틸-펜트-2-일, 2,3-디메틸-부틸, 3-메틸-펜트-3-일, 2-메틸-펜트-3-일, 2,3-디메틸-부트-2-일 및 3,3-디메틸-부트-2-일 중 임의의 것을 의미한다.
한 실시양태에서 및 본원에 바람직하게 사용된 (C1-C8)알킬은 1 내지 8개의 탄소 원자를 갖는 포화 또는 불포화, 직쇄 또는 분지형 탄화수소 기를 지칭한다. 대표적인 (C1-C8)알킬 기는 메틸, 에틸, n-프로필, 이소프로필, n-부틸, 이소부틸, sec-부틸, tert-부틸, n-펜틸, 2-펜틸, 2-메틸-부틸, 3-메틸-부틸, 3-펜틸, 3-메틸-부트-2-일, 2-메틸-부트-2-일, 2,2-디메틸프로필, n-헥실, 2-헥실, 2-메틸-펜틸, 3-메틸-펜틸, 4-메틸-펜틸, 3-헥실, 2-에틸-부틸, 2-메틸-펜트-2-일, 2,2-디메틸-부틸, 3,3-디메틸-부틸, 3-메틸-펜트-2-일, 4-메틸-펜트-2-일, 2,3-디메틸-부틸, 3-메틸-펜트-3-일, 2-메틸-펜트-3-일, 2,3-디메틸-부트-2-일, 3,3-디메틸-부트-2-일, n-헵틸, 2-헵틸, 2-메틸-헥실, 3-메틸-헥실, 4-메틸-헥실, 5-메틸-헥실, 3-헵틸, 2-에틸-펜틸, 3-에틸-펜틸, 4-헵틸, 2-메틸-헥스-2-일, 2,2-디메틸-펜틸, 3,3-디메틸-펜틸, 4,4-디메틸-펜틸, 3-메틸-헥스-2-일, 4-메틸-헥스-2-일, 5-메틸-헥스-2-일, 2,3-디메틸-펜틸, 2,4-디메틸-펜틸, 3,4-디메틸-펜틸, 3-메틸-헥스-3-일, 2-에틸-2-메틸-부틸, 4-메틸-헥스-3-일, 5-메틸-헥스-3-일, 2-에틸-3-메틸-부틸, 2,3-디메틸-펜트-2-일, 2,4-디메틸-펜트-2-일, 3,3-디메틸-펜트-2-일, 4,4-디메틸-펜트-2-일, 2,2,3-트리메틸-부틸, 2,3,3-트리메틸-부틸, 2,3,3-트리메틸-부트-2-일, n-옥틸, 2-옥틸, 2-메틸-헵틸, 3-메틸-헵틸, 4-메틸-헵틸, 5-메틸-헵틸, 6-메틸-헵틸, 3-옥틸, 2-에틸-헥실, 3-에틸-헥실, 4-에틸-헥실, 4-옥틸, 2-프로필-펜틸, 2-메틸-헵트-2-일, 2,2-디메틸-헥실, 3,3-디메틸-헥실, 4,4-디메틸-헥실, 5,5-디메틸-헥실, 3-메틸-헵트-2-일, 4-메틸-헵트-2-일, 5-메틸-헵트-2-일, 6-메틸-헵트-2-일, 2,3-디메틸-헥스-1-일, 2,4-디메틸-헥스-1-일, 2,5-디메틸-헥스-1-일, 3,4-디메틸-헥스-1-일, 3,5-디메틸-헥스-1-일, 3,5-디메틸-헥스-1-일, 3-메틸-헵트-3-일, 2-에틸-2-메틸-1-일, 3-에틸-3-메틸-1-일, 4-메틸-헵트-3-일, 5-메틸-헵트-3-일, 6-메틸-헵트-3-일, 2-에틸-3-메틸-펜틸, 2-에틸-4-메틸-펜틸, 3-에틸-4-메틸-펜틸, 2,3-디메틸-헥스-2-일, 2,4-디메틸-헥스-2-일, 2,5-디메틸-헥스-2-일, 3,3-디메틸-헥스-2-일, 3,4-디메틸-헥스-2-일, 3,5-디메틸-헥스-2-일, 4,4-디메틸-헥스-2-일, 4,5-디메틸-헥스-2-일, 5,5-디메틸-헥스-2-일, 2,2,3-트리메틸-펜틸, 2,2,4-트리메틸-펜틸, 2,3,3-트리메틸-펜틸, 2,3,4-트리메틸-펜틸, 2,4,4-트리메틸-펜틸, 3,3,4-트리메틸-펜틸, 3,4,4-트리메틸-펜틸, 2,3,3-트리메틸-펜트-2-일, 2,3,4-트리메틸-펜트-2-일, 2,4,4-트리메틸-펜트-2-일, 3,4,4-트리메틸-펜트-2-일, 2,2,3,3-테트라메틸-부틸, 3,4-디메틸-헥스-3-일, 3,5-디메틸-헥스-3-일, 4,4-디메틸-헥스-3-일, 4,5-디메틸-헥스-3-일, 5,5-디메틸-헥스-3-일, 3-에틸-3-메틸-펜트-2-일, 3-에틸-4-메틸-펜트-2-일, 3-에틸-헥스-3-일, 2,2-디에틸-부틸, 3-에틸-3-메틸-펜틸, 4-에틸-헥스-3-일, 5-메틸-헵트-3-일, 2-에틸-3-메틸-펜틸, 4-메틸-헵트-4-일, 3-메틸-헵트-4-일, 2-메틸-헵트-4-일, 3-에틸-헥스-2-일, 2-에틸-2-메틸-펜틸, 2-이소프로필-펜틸, 2,2-디메틸-헥스-3-일, 2,2,4-트리메틸-펜트-3-일 및 2-에틸-3-메틸-펜틸을 포함하나 이에 제한되지는 않는다. (C1-C8)알킬 기는 비치환되거나, 또는 (C1-C8)알킬, -O-[(C1-C8)알킬], -아릴, -CO-R', -O-CO-R', -CO-OR', -CO-NH2, -CO-NHR', -CO-NR'2, -NH-CO-R', -SO2-R', -SO-R', -OH, -할로겐, -N3, -NH2, -NHR', -NR'2 및 -CN을 포함하나 이에 제한되지는 않는 1개 이상의 기로 치환될 수 있고; 여기서 각각의 R'은 독립적으로 -(C1-C8)알킬 및 아릴로부터 선택된다.
본원에 바람직하게 사용된 표현 알킬리덴은 2개의 치환 지점이 명시된 포화 직쇄 또는 분지형 탄화수소 기를 지칭한다. 메탄-1,1-디일, 에탄-1,2-디일, 프로판-1,3-디일, 부탄-1,4-디일 및 펜탄-1,5-디일과 같이 2개의 치환 지점이 서로에 대해 최대 거리에 있는 단순 알킬 쇄는 또한 메틸렌 (또한 메탄-1,1-디일로 지칭됨), 에틸렌 (또한 에탄-1,2-디일로 지칭됨), 프로필렌 (또한 프로판-1,3-디일로 지칭됨), 부틸렌 (또한 부탄-1,4-디일로 지칭됨) 및 펜틸렌 (또한 펜탄-1,5-디일로 지칭됨)으로 지칭된다.
한 실시양태에서 및 본원에 바람직하게 사용된 (C1-C10)알킬리덴은 각각 및 개별적으로 메틸렌, 에탄-1,2-디일, 프로판-1,3-디일, 프로판-1,2-디일, 부탄-1,4-디일, 부탄-1,3-디일, 부탄-1,2-디일, 2-메틸-프로판-1,2-디일, 2-메틸-프로판-1,3-디일, 펜탄-1,5-디일, 펜탄-1,4-디일, 펜탄-1,3-디일, 펜탄-1,2-디일, 펜탄-2,3-디일, 펜탄-2,4-디일, 5개의 탄소 원자를 갖는 임의의 다른 이성질체, 헥산-1,6-디일, 6개의 탄소 원자를 갖는 임의의 다른 이성질체, 헵탄-1,7-디일, 7개의 탄소 원자를 갖는 임의의 다른 이성질체, 옥탄-1,8-디일, 8개의 탄소 원자를 갖는 임의의 다른 이성질체, 노난-1,9-디일, 9개의 탄소 원자를 갖는 임의의 다른 이성질체, 데칸-1,10-디일 및 10개의 탄소 원자를 갖는 임의의 다른 이성질체 중 임의의 것을 의미하고, 바람직하게는 (C1-C10)알킬리덴은 각각 및 개별적으로 임의의 메틸렌, 에탄-1,2-디일, 프로판-1,3-디일, 부탄-1,4-디일, 펜탄-1,5-디일, 헥산-1,6-디일, 헵탄-1,7-디일, 옥탄-1,8-디일, 노난-1,9-디일 및 데칸-1,10-디일 중 임의의 것을 의미한다. (C1-C10)알킬리덴 기는 비치환되거나, 또는 (C1-C8)알킬, -O-[(C1-C8)알킬], -아릴, -CO-R', -O-CO-R', -CO-OR', -CO-NH2, -CO-NHR', -CO-NR'2, -NH-CO-R', -SO2-R', -SO-R', -OH, -할로겐, -N3, -NH2, -NHR', -NR'2 및 -CN을 포함하나 이에 제한되지는 않는 1개 이상의 기로 치환될 수 있고; 여기서 각각의 R'은 독립적으로 -(C1-C8)알킬 및 아릴로부터 선택된다.
한 실시양태에서 및 본원에 바람직하게 사용된 (C3-C8)시클로알킬은 각각 및 개별적으로 시클로프로필, 시클로부틸, 시클로펜틸, 시클로헥실, 시클로헵틸 및 시클로옥틸 중 임의의 것을 의미한다.
한 실시양태에서 및 본원에 바람직하게 사용된 (C5-C7)시클로알킬은 각각 및 개별적으로 시클로펜틸, 시클로헥실 및 시클로헵틸 중 임의의 것을 의미한다.
한 실시양태에서 및 본원에 바람직하게 사용된 (C3-C8)카르보사이클은 3-, 4-, 5-, 6-, 7- 또는 8-원 포화 또는 불포화 비-방향족 카르보시클릭 고리를 지칭한다. 대표적인 (C3-C8)카르보사이클은 -시클로프로필, -시클로부틸, -시클로펜틸, -시클로펜타디에닐, -시클로헥실, -시클로헥세닐, -1,3-시클로헥사디에닐, -1,4-시클로헥사디에닐, -시클로헵틸, -1,3-시클로헵타디에닐, -1,3,5-시클로헵타트리에닐, -시클로옥틸 및 -시클로옥타디에닐 중 임의의 것을 포함하나 이에 제한되지는 않는다. (C3-C8)카르보사이클 기는 비치환되거나, 또는 (C1-C8)알킬, -O-[(C1-C8)알킬], -아릴, -CO-R', -O-CO-R', -CO-OR', -CO-NH2, -CO-NHR', -CO-NR'2, -NH-CO-R', -SO2-R', -SO-R', -OH, -할로겐, -N3, -NH2, -NHR', -NR'2 및 -CN을 포함하나 이에 제한되지는 않는 1개 이상의 기로 치환될 수 있고; 여기서 각각의 R'은 독립적으로 -(C1-C8)알킬 및 아릴로부터 선택된다.
한 실시양태에서 및 본원에 바람직하게 사용된 (C3-C8)카르보시클로는 카르보사이클 기 수소 원자 중 1개가 결합으로 대체된 상기 정의된 (C3-C8)카르보사이클 기를 지칭한다.
한 실시양태에서 및 본원에 바람직하게 사용된 "아릴"은 카르보시클릭 방향족 기를 지칭한다. 아릴 기의 예는 페닐, 나프틸 및 안트라세닐을 포함하나 이에 제한되지는 않는다.
한 실시양태에서 및 본원에 바람직하게 사용된 (C5-C6)아릴은 카르보시클릭 방향족 기를 포함하는 5 또는 6개의 탄소 원자를 지칭한다. 카르보시클릭 방향족 기는 비치환되거나, 또는 -(C1-C8)알킬, -O-[(C1-C8)알킬], -아릴, -CO-R', -O-CO-R', -CO-OR', -CO-NH2, -CO-NHR', -CO-NR'2, -NH-CO-R', -SO2-R', -SO-R', -OH, -할로겐, -N3, -NH2, -NHR', -NR'2 및 -CN을 포함하나 이에 제한되지는 않는 1개 이상의 기로 치환될 수 있고; 여기서 각각의 R'은 독립적으로 -(C1-C8)알킬 및 아릴로부터 선택된다.
한 실시양태에서 및 본원에 바람직하게 사용된 "헤테로아릴"은 헤테로시클릭 방향족 기를 지칭한다. 헤테로아릴 기의 예는 푸란, 티오펜, 피리딘, 피리미딘, 벤조티오펜, 벤조푸란 및 퀴놀린을 포함하나 이에 제한되지는 않는다.
한 실시양태에서 및 본원에 바람직하게 사용된 (C5-C6)헤테로아릴은 적어도 1개의 원자가 탄소와 상이한 것인, 바람직하게는 질소, 황 또는 산소인 5 또는 6개의 고리 원자로 이루어진 헤테로시클릭 방향족 기를 지칭한다. 헤테로시클릭 방향족 기는 비치환되거나, 또는 -(C1-C8)알킬, -O-[(C1-C8)알킬], -아릴, -CO-R', -O-CO-R', -CO-OR', -CO-NH2, -CO-NHR', -CO-NR'2, -NH-CO-R', -SO2-R', -SO-R', -OH, -할로겐, -N3, -NH2, -NHR', -NR'2 및 -CN을 포함하나 이에 제한되지는 않는 1개 이상의 기로 치환될 수 있고; 여기서 각각의 R'은 독립적으로 -(C1-C8)알킬 및 아릴로부터 선택된다.
한 실시양태에서 및 본원에 바람직하게 사용된 (C3-C8)헤테로시클로는 카르보사이클 기 수소 원자 중 1개가 결합으로 대체된 상기 정의된 (C3-C8)헤테로사이클 기를 지칭한다. (C3-C8)헤테로시클로는 비치환되거나, 또는 (C1-C8)알킬, -O-[(C1-C8)알킬], -아릴, -CO-R', -O-CO-R', -CO-OR', -CO-NH2, -CO-NHR', -CO-NR'2, -NH-CO-R', -SO2-R', -SO-R', -OH, -할로겐, -N3, -NH2, -NHR', -NR'2 및 -CN을 포함하는 6개 이하의 기로 치환될 수 있고; 여기서 각각의 R'은 독립적으로 -(C1-C8)알킬 및 아릴로부터 선택된다.
한 실시양태에서 및 본원에 바람직하게 사용된 아릴렌은 2개의 공유 결합을 갖는 아릴 기를 지칭하며, 하기 구조에 도시된 바와 같은 오르토, 메타 또는 파라 배위일 수 있다:
여기서, 페닐 기는 비치환되거나, 또는 (C1-C8)알킬, -O-[(C1-C8)알킬], -아릴, -CO-R', -O-CO-R', -CO-OR', -CO-NH2, -CO-NHR', -CO-NR'2, -NH-CO-R', -SO2-R', -SO-R', -OH, -할로겐, -N3, -NH2, -NHR', -NR'2 및 -CN을 포함하나 이에 제한되지는 않는 4개의 기로 치환될 수 있고; 여기서 각각의 R'은 독립적으로 -(C1-C8)알킬 및 아릴로부터 선택된다.
각각의 및 임의의 측면의 한 실시양태 (그의 임의의 실시양태 포함)에서, 산화될 수 있는 임의의 S 원자, 바람직하게는 티오에테르 기의 S 원자는 -S-, -S(O)- 또는 -S(O2)- 또는 그의 혼합물로서 존재한다.
한 실시양태에서 및 본원에 바람직하게 사용된 바와 같이, 임의의 구조 화학식에서 또는 청구범위를 포함한 본 명세서의 임의의 구절에서 명시되지 않은 원자 질량 수를 갖는 원자는 명시되지 않은 동위원소 조성물, 동위원소의 자연 발생 혼합물 또는 개별 동위원소이다. 이는 특히 탄소, 산소, 질소, 황, 인, 할로겐, 및 C, O, N, S, F, P, Cl, Br, At, Sc, Cr, Mn, Co, Fe, Cu, Ga, Sr, Zr, Y, Mo, Tc, Ru, Rh, Pd, Pt, Ag, In, Sb, Sn, Te, I, Pr, Pm, Dy, Sm, Gd, Tb, Ho, Dy, Er, Yb, Tm, Lu, Sn, Re, Rd, Os, Ir, Au, Pb, Bi, Po, Fr, Ra, Ac, Th 및 Fm을 포함하나 이에 제한되지는 않는 금속 원자에 적용된다.
한 실시양태에서 및 본원에 바람직하게 사용된 킬레이트화제는 킬레이트를 형성할 수 있는 화합물이며, 여기서 킬레이트는 화합물, 바람직하게는 전자 갭을 갖는 금속 또는 모이어티 또는 고립 전자 쌍이 고리의 형성에 참여하는 시클릭 화합물이다. 보다 바람직하게는, 킬레이트화제는 단일 리간드가 중심 원자에서 1개 초과의 배위 부위를 점유하는 이러한 종류의 화합물이다.
한 실시양태에서 및 본원에 바람직하게 사용된 진단 활성 화합물은 질환의 진단에 적합하거나 또는 그에 유용한 화합물이다.
한 실시양태에서 및 본원에 바람직하게 사용된 진단제 또는 진단 활성제는 질환의 진단에 적합하거나 또는 그에 유용한 화합물이다.
한 실시양태에서 및 본원에 바람직하게 사용된 치료 활성 화합물은 질환의 치료에 적합하거나 또는 그에 유용한 화합물이다.
한 실시양태에서 및 본원에 바람직하게 사용된 치료제 또는 치료 활성제는 질환의 치료에 적합하거나 또는 그에 유용한 화합물이다.
한 실시양태에서 및 본원에 바람직하게 사용된 치료 활성 화합물은 질환의 진단 및 요법 둘 다에 적합하거나 또는 그에 유용한 화합물이다.
한 실시양태에서 및 본원에 바람직하게 사용된 진단제 또는 치료 활성제는 질환의 진단 및 요법 둘 다에 적합하거나 또는 그에 유용한 화합물이다.
한 실시양태에서 및 본원에 바람직하게 사용된 치료제는 질환의 조합 진단 및 요법을 위한 방법이며; 바람직하게는, 치료제에 사용되는 조합 진단 및 치료 활성 화합물은 방사성표지된다.
한 실시양태에서 및 본원에 바람직하게 사용된 질환의 치료는 질환의 치료 및/또는 예방이다.
한 실시양태에서 및 본원에 바람직하게 사용된 FAP를 수반하는 질환은, FAP를 발현하는, 바람직하게는 상향조절된 방식으로 FAP를 발현하는 섬유모세포를 포함하나 이에 제한되지는 않는 세포, 및 FAP를 발현하거나 또는 바람직하게는 각각 상향조절된 방식으로 FAP를 발현하는 섬유모세포와 같은 세포를 함유하거나 포함하는 조직이 질환 및/또는 질환의 증상에 대한 원인이거나 또는 질환의 기저가 되는 병리상태의 일부인 질환이다. 바람직한 FAP-발현 세포는 암 연관 섬유모세포 (CAF)이다. 질환의 한 실시양태에서, 바람직하게는 질환의 치료, 치료 및/또는 요법과 관련하여 사용되는 경우, 세포, 조직 및 병리상태에 영향을 미치는 것은 각각 질환 및/또는 질환의 증상의 치유, 치료 또는 개선을 유발한다. 질환의 한 실시양태에서, 바람직하게는 질환의 진단 및/또는 진단과 관련하여 사용되는 경우, FAP-발현 세포 및/또는 FAP-발현 조직의 표지화는 상기 세포 및/또는 상기 조직을 건강한 또는 FAP-비-발현 세포 및/또는 건강한 또는 FAP 비-발현 조직으로부터 식별 또는 구별할 수 있게 한다. 보다 바람직하게는, 이러한 식별 또는 구별은 각각 상기 진단 및 진단을 위한 기초를 형성한다. 그의 한 실시양태에서, 표지화는 FAP-발현 세포 및/또는 FAP-발현 조직 또는 상기 FAP-발현 세포를 함유하는 조직과 직접 또는 간접적으로 검출가능한 표지의 상호작용을 의미하고; 보다 바람직하게는, 상기 상호작용은 표지 또는 상기 표지를 보유하는 화합물과 FAP의 상호작용을 포함하거나 이에 기초한다.
한 실시양태에서 및 본원에 바람직하게 사용된 표적 세포는 FAP를 발현하고, 질환 및/또는 질환의 증상에 대한 원인이거나 또는 질환의 기저가 되는 병리상태의 일부인 세포이다.
한 실시양태에서 및 본원에 바람직하게 사용된 비-표적 세포는 FAP를 발현하지 않고/거나, 질환 및/또는 질환의 증상에 대한 원인이 아니거나 또는 질환의 기저가 되는 병리상태의 일부가 아닌 세포이다.
한 실시양태에서 및 본원에 바람직하게 사용된 신생물은 세포의 비정상적인 새로운 성장이다. 신생물 내의 세포는 정상 세포보다 더 신속하게 성장하고, 치료되지 않으면 계속 성장할 것이다. 신생물은 양성 또는 악성일 수 있다.
한 실시양태에서 및 본원에 바람직하게 사용된 종양은 양성 또는 악성일 수 있는 종괴 병변이다.
한 실시양태에서 및 본원에 바람직하게 사용된 암은 악성 신생물이다.
한 실시양태에서 및 본원에 바람직하게 사용된 연결은 2개의 독립적인 모이어티의 2개의 원자의 부착이다. 바람직한 연결은 화학 결합 또는 복수의 화학 결합들이다. 보다 바람직하게는, 화학 결합은 공유 결합 또는 복수의 화학 결합들이다. 가장 바람직하게는 연결은 공유 결합 또는 배위 결합이다. 본원에 바람직하게 사용되는 바와 같이, 배위 결합의 실시양태는 금속이 킬레이트화제에 의해 결합될 때 실현되는 결합 또는 결합 군이다. 연결된 원자의 유형 및 그의 원자 환경에 따라 상이한 유형의 연결이 생성된다. 이러한 유형의 연결은 연결에 의해 생성된 원자 배열의 유형에 의해 규정된다. 예를 들어, 아민을 포함하는 모이어티와 카르복실산을 포함하는 모이어티의 연결은 아미드 (이는 또한 아미드 연결, -CO-N-, -N-CO-로도 지칭됨)로 지칭되는 연결을 유도한다. 관련 기술분야의 통상의 기술자는 연결을 생성하는 이러한 예 및 하기 예가 단지 모범 예이고, 결코 본 출원의 범주를 제한하지 않는다는 것을 알 것이다. 이소티오시아네이트를 포함하는 모이어티와 아민을 포함하는 모이어티의 연결은 티오우레아 (이는 또한 티오우레아 연결, -N-CS-N-으로도 지칭됨)를 유도하고, C 원자를 포함하는 모이어티와 티올-기 (-C-SH)를 포함하는 모이어티의 연결은 티오에테르 (이는 또한 티오에테르 연결, -C-S-C-로도 지칭됨)를 유도한다는 것이 관련 기술분야의 통상의 기술자에 의해 인지될 것이다. 본 발명의 킬레이트화제 및 링커와 관련하여 바람직하게 사용되는 연결의 비제한적 목록 및 그의 특징적인 유형의 원자 배열이 표 2에 제시된다.
표 2:
본 발명의 일부 실시양태에서, 킬레이트화제와 링커 사이의 연결 또는 킬레이트화제와 본 발명의 화합물 사이의 직접 연결의 형성에 사용되는 반응성 기의 예를 표 3에 요약한다. 그러나, 관련 기술분야의 통상의 기술자는 본 발명의 접합체의 형성을 위한 실시양태에서 실현될 수 있는 연결이 표 3의 것 또는 이러한 연결을 형성하는 반응성 기로 제한되지 않는다는 것을 이해할 것이다.
표 3:
다음은 본 발명의 접합체의 실시양태에 사용된 바와 같은 모이어티 또는 구조 사이의 연결을 형성하는 데 이용되거나 그에 적용가능한 반응성 기 및 관능기이다:
1급 또는 2급 아미노, 카르복실산, 활성화된 카르복실산, 클로로, 브로모, 아이오도, 술프히드릴, 히드록실, 술폰산, 활성화된 술폰산, 술폰산 에스테르, 예컨대 메실레이트 또는 토실레이트, 마이클(Michael) 수용자, 변형된 알켄, 예컨대 트랜스 시클로옥텐, 이소시아네이트, 이소티오시아네이트, 아지드, 알킨 및 테트라진.
본원에 바람직하게 사용된 용어 "활성화된 카르복실산"은 화학식 -CO-X를 갖는 카르복실산 기를 지칭하며, 여기서 X는 이탈기이다. 예를 들어, 카르복실산 기의 활성화된 형태는 아실 클로라이드, 대칭 또는 비대칭 무수물 및 에스테르를 포함할 수 있으나 이에 제한되지는 않는다. 일부 실시양태에서, 활성화된 카르복실산 기는 이탈기로서 펜타플루오로페놀, 니트로페놀, 벤조트리아졸, 아자벤조트리아졸, 티오페놀 또는 N-히드록시숙신이미드 (NHS)와의 에스테르이다.
본원에 바람직하게 사용된 용어 "활성화된 술폰산"은 화학식 -SO2-X를 갖는 술폰산 기를 지칭하며, 여기서 X는 이탈기이다. 예를 들어, 술폰산의 활성화된 형태는 술포닐 클로라이드 또는 술폰산 무수물을 포함할 수 있으나 이에 제한되지는 않는다. 일부 실시양태에서, 활성화된 술폰산 기는 이탈기로서 클로라이드를 갖는 술포닐클로라이드이다.
한 실시양태에서 및 본원에 바람직하게 사용된 용어 "연결을 매개하는"은 연결 또는 연결의 유형, 바람직하게는 2개의 모이어티 사이의 연결이 확립되는 것을 의미한다. 바람직한 실시양태에서, 연결 및 연결의 유형은 본원에 정의된 바와 같다.
본 출원에서 하한 정수 및 상한 정수로 명시된 범위, 예컨대, 예를 들어 1-4로 지칭되는 경우, 이러한 범위는 하한 정수, 상한 정수 및 하한 정수와 상한 정수 사이의 임의의 정수를 나타낸다. 상기 범위는 실제로 상기 정수의 개별화된 개시이다. 상기 예에서, 1-4의 범위는 따라서 1, 2, 3 및 4를 의미한다.
본 발명의 화합물은 전형적으로 본원에 제공된 바와 같은 아미노산 서열을 함유한다. 천연 아미노산으로도 지칭되는 통상적인 아미노산은 표 4에 제시된 바와 같은 그의 표준 3-문자 코드 및 1-문자 약어에 따라 식별된다.
표 4: 통상적인 아미노산 및 그의 약어
비-천연 아미노산으로도 지칭되는 비-통상적인 아미노산은 아미노 기 및 카르복실 기를 포함하고 통상적인 아미노산이 아닌 임의의 종류의 비-올리고머 화합물이다.
본 발명의 구축 화합물에 사용된 비-통상적인 아미노산 및 다른 빌딩 블록의 예는 표 5에 나타낸 그의 약어 또는 명칭에 따라 식별된다. 일부 빌딩 블록의 구조는 빌딩 블록을 펩티드 내로 도입하기 위한 예시적인 시약 (예를 들어, 카르복실산과 같음)으로 도시되거나 또는 이들 빌딩 블록은 펩티드 또는 아미노산과 같은 또 다른 구조에 완전히 부착된 잔기로서 제시된다. 아미노산의 구조는 펩티드 서열에서 구현 후에 제시되는 명시적 아미노산으로서 나타내어지고, 아미노산의 잔기로서 나타내어지지 않는다. 1개 초과의 모이어티로 이루어진 일부 더 큰 화학적 모이어티가 또한 명확성의 이유로 제시된다.
표 5: 비-천연 아미노산 및 다른 빌딩 블록 및 화학적 모이어티의 약어, 명칭 및 구조
본원에 제공된 펩티드의 아미노산 서열은 관련 기술분야의 통상의 기술자에 의해 이해되는 바와 같이 전형적인 펩티드 서열 포맷으로 제시된다. 예를 들어, 통상적인 아미노산의 3-문자 코드 또는 비-통상적인 아미노산에 대한 코드 또는 추가의 빌딩 블록에 대한 약어는 펩티드 서열 내의 명시된 위치에서의 아미노산 또는 빌딩 블록의 존재를 나타낸다. 각각의 아미노산 또는 빌딩 블록에 대한 코드는 하이픈 (전형적으로 아미드 연결을 나타냄)에 의해 서열 내의 다음 및/또는 이전 아미노산 또는 빌딩 블록에 대한 코드에 연결된다.
아미노산이 1개 초과의 아미노 및/또는 카르복시 기를 함유하는 경우, 이 아미노산의 모든 배향이 원칙적으로 가능하지만, α-아미노산에서 α-아미노 및 α-카르복시 기의 사용이 바람직하고, 다르게는 바람직한 배향이 명백하게 명시된다.
아미노산의 경우, 그의 약어에서 첫 번째 문자는 적용가능한 경우 C-α-원자의 입체화학을 나타낸다. 예를 들어, 첫번째 대문자는 L-형태의 아미노산이 펩티드 서열에 존재함을 나타내는 반면, 첫번째 소문자는 D-형태의 상응하는 아미노산이 펩티드 서열에 존재함을 나타낸다.
한 실시양태에서 및 본원에 바람직하게 사용된 방향족 L-α-아미노산은 아릴 기를 포함하는 임의의 종류의 L-α-아미노산이다.
한 실시양태에서 및 본원에 바람직하게 사용된 헤테로방향족 L-α-아미노산은 헤테로아릴 기를 포함하는 임의의 종류의 L-α-아미노산이다.
관련 기술분야의 통상의 기술자는 입체중심이 본 발명의 화합물의 아미노산 모이어티의 일부인지 또는 임의의 다른 부분 또는 모이어티인지에 관계 없이 본원에 개시된 화합물에 입체중심이 존재하는지 알 것이다. 따라서, 본 발명은 가능한 입체이성질체 둘 다를 포함하고, 라세미 화합물 뿐만 아니라 개별 거울상이성질체 및/또는 부분입체이성질체도 포함한다. 화합물이 단일 거울상이성질체 또는 부분입체이성질체로서 요구되는 경우, 이는 입체특이적 합성에 의해 또는 최종 생성물 또는 임의의 편리한 중간체의 분해에 의해 수득될 수 있다. 최종 생성물, 중간체 또는 출발 물질의 분해는 관련 기술분야에 공지된 임의의 적합한 방법에 의해 영향을 받을 수 있다. 예를 들어, 문헌 ["Stereochemistry of Organic Compounds" by E. L. Eliel, S. H. Wilen, and L. N. Mander (Wiley-lnterscience, 1994)]을 참조한다.
본 출원에서, 화합물의 구조 화학식은 일부 경우에 편의상 특정 이성질체를 나타내지만, 본 발명은 모든 이성질체, 예컨대 기하 이성질체, 비대칭 탄소를 기재로 하는 광학 이성질체, 입체이성질체, 호변이성질체 등을 포함한다. 본 명세서에서, 화합물의 구조 화학식은 일부 경우에 편의상 특정 이성질체를 나타내지만, 본 발명은 모든 이성질체, 예컨대 기하 이성질체, 비대칭 탄소를 기재로 하는 광학 이성질체, 입체이성질체, 호변이성질체 등을 포함한다.
달리 나타내지 않는 한, 아미노산 서열은 본원에서 N-에서 C-말단 방향으로 제시된다.
본 발명의 펩티드를 구성하는 아미노산의 유도체는 표 6에 제시된 바와 같을 수 있다. 임의의 실시양태에서, 본 발명의 화합물의 1개 이상의 아미노산은 상응하는 바람직한 아미노산의 유도체로 치환된다.
표 6: 본 발명의 화합물에 함유된 바람직한 아미노산의 예시적인 유도체
선형 펩티드
일반적인 선형 펩티드는 전형적으로 하기 나타낸 바와 같이 N-말단에서 C-말단 방향으로 작성된다:
여기서,
1. Xaax는 표 5에 나타낸 바와 같은 특정 서열 위치 x에 있는 아미노산 또는 빌딩 블록에 대한 약어, 기술어 또는 기호이고,
2. NT는 N-말단 기, 예를 들어 'H' (유리 N-말단 아미노 기의 경우 수소) 또는 특정 종결 카르복실산에 대한 약어, 예컨대 아세트산에 대한 'Ac', 또는 하이픈을 통해 N-말단 아미노산 코드 (Xaa1)에 연결된 다른 화학기 또는 화학기의 구조 화학식이고,
3. CT는 전형적으로 'OH' 또는 'NH2' (말단 카르복실산 또는 아미드로서)인 C-말단 기, 또는 하이픈을 통해 C-말단 아미노산 코드 (Xaan)에 연결된 특정 종결 아민에 대한 약어이다.
특정 빌딩 블록 또는 펩티드에 의해 변형된 측쇄를 갖는 분지형 펩티드
일반적인 선형, 분지형 펩티드는 하기 나타낸 바와 같이 N-말단에서 C-말단 방향으로 작성된다:
여기서, 분지형 펩티드의 주쇄에서 Xaax, NT 및 CT의 사양에 대해서는 선형 펩티드의 기재의 진술 1.- 3.이 적용된다.
분지의 위치는 Xaax 약어 다음에 괄호로 명시된다. 분지는 전형적으로 리신 (Lys) 잔기 (또는 유사 잔기)에서 발생하며, 이는 분지가 아미드 결합을 통해 리신의 측쇄 ε-아미노 관능기에 부착됨을 의미한다.
괄호 안의 내용은 펩티드 분지 'NT-Xab1-Xab2-... ...Xabn'의 서열/구조를 기재한다. 여기서,
1. Xabx는 표 3에 나타낸 바와 같은 분지의 특정 서열 위치 x에서의 아미노산 또는 빌딩 블록에 대한 약어, 기술어 또는 기호이고,
2. NT는 N-말단 기, 예를 들어 특정 종결 카르복실산에 대한 약어, 예컨대 아세트산에 대한 'Ac', 또는 하이픈을 통해 N-말단 아미노산 코드 (Xab1)에 연결된 다른 화학기 또는 화학기의 구조 화학식이고,
3. 분지의 마지막 빌딩 블록 Xabn은 상기 리신 (또는 유사한 잔기)의 측쇄 아미노 관능기와 그 자체의 카르복실 관능기를 갖는 아미드 결합을 형성함으로써 주쇄와 분지를 연결한다.
시클릭 펩티드
N-말단에서 C-말단 방향으로 작성된 예시적인 일반적 시클릭 펩티드가 하기에 제시된다:
여기서, 시클릭 펩티드의 주쇄에서 Xaax, NT 및 CT의 사양에 대해서는 선형 펩티드의 기재의 진술 1.- 3.이 적용된다. 펩티드 사이클의 특징이 대괄호 안에 명시되어 있다.
1. 개방 대괄호는 그의 측쇄에서 사이클이 개시되는 (사이클 개시 잔기) 빌딩 블록을 나타내고,
2. 닫힌 대괄호는 그의 측쇄에서 사이클이 종결되는 (사이클 종결 잔기) 빌딩 블록을 나타낸다.
이들 두 잔기 사이의 연결의 화학적 성질은
1. 이들 나타낸 잔기 중에서 1개의 잔기가 그의 측쇄에 아미노 관능기 (예를 들어, Lys)를 함유하고 다른 것이 그의 측쇄에 카르복실 관능기 (예를 들어, Glu)를 함유하는 경우에 아미드 결합, 또는
2. 나타낸 잔기/아미노산이 술프히드릴 모이어티 (예를 들어, Cys)를 함유하는 경우에 디술피드 결합
이다.
추가의 고리화 요소 (Yc)를 함유하는 시클릭 펩티드
N-말단에서 C-말단 방향으로 작성된 일반적인 연장된 시클릭 펩티드를 하기에 나타낸다:
여기서, 시클릭 펩티드의 주쇄에서 Xaax, NT 및 CT의 사양에 대해서는 선형 펩티드의 기재의 진술 1.- 3.이 적용된다. 또한, Yc는 고리화 요소이다. 시클릭 펩티드의 경우에서와 같이, 사이클의 특징은 사이클 개시 잔기 및 사이클 종결 잔기를 나타내는 대괄호로 명시된다.
사이클 개시 잔기에 인접한 괄호 안의 내용은 연장된 펩티드 사이클 내의 고리화 요소 Yc를 특정한다. Yc 요소는 상기 잔기의 측쇄에 연결된다. 또한, Yc 요소는 사이클 종결 잔기의 측쇄에 연결된다. 이들 잔기 Yc 요소 사이의 연결의 화학적 성질은 상응하는 아미노산 Xaan의 측쇄 관능기에 의존한다. Xaan의 측쇄가 술프히드릴 기 (예를 들어, Cys)를 함유하는 경우에 연결은 티오에테르이다.
비제한적 예로서 Ac-[Cys(tMeBn(DOTA-PP))-Pro-Pro-Thr-Gln-Phe-Cys]-OH의 구조를 하기에 나타낸다.
여기서,
1. Ac는 상기 일반 화학식에서 NT에 상응한다.
2. Cys, Pro, Thr, Gln, Phe 및 Cys는 상기 일반 화학식에서 Xaa1 내지 Xaa7에 상응한다.
3. OH는 상기 화학식에서의 CT에 상응한다.
4. 서열 내 N-말단 시스테인에 인접한 개방 대괄호 (,[')는 이 잔기에서 사이클이 개시된다는 것 (사이클 개시 잔기)을 나타낸다.
5. 서열 내 N-말단 시스테인에 인접한 닫힌 대괄호 (,]')는 이 잔기에서 사이클이 종결된다는 것 (사이클 종결 잔기)을 나타낸다.
6. 개시 잔기로 나타낸 Cys에 인접한 괄호 내의 tMeBn은 고리화 요소 Yc를 명시한다. 이는 사이클 종결 잔기로 나타낸 Cys에 추가로 결합된다. Yc 요소는 티오에테르 연결을 통해 상기 잔기에 연결된다.
7. tMeBn 잔기의 나머지 연결 지점에 DOTA 킬레이트화제를 PP 링커를 통해 부착시킨다. 명확성을 위해, "Cys(tMeBn(DOTA-PP))"와 같은 용어는 표 2의 화학 구조의 목록에 포함된다.
본 발명의 한 실시양태에서, 아미노산 또는 펩티드는 Xaa7에 부착되며, 여기서 이 펩티드의 아미노산의 대부분은 하전되거나 극성이고, 펩티드의 알짜 전하는 -2, -1, 0, +1 또는 +2이다.
펩티드 알짜 전하를 계산하는 경우, 음으로 하전된 아미노산은 그의 측쇄에 -COOH 또는 -SO3H와 같은 산성 기를 보유하는 아미노산이고, 그의 알짜 전하는 산성 기의 수에 상응하며, 예를 들어 Asp 또는 Glu의 알짜 전하는 -1이다.
이러한 계산의 경우, 양으로 하전된 아미노산은 그의 측쇄에 아미노 또는 -구아니디노와 같은 염기성 기를 보유하는 아미노산이고, 그의 알짜 전하는 염기성 기의 수에 상응하며, 예를 들어 Lys 또는 Arg의 알짜 전하는 +1이다.
극성 아미노산은 그의 측쇄에 극성 기를 보유하는 아미노산이다. 극성 기는, 예컨대 CONH2, OH, F, Cl, CN, 및 헤테로사이클, 예컨대 예를 들어 히스티딘에서 이미다졸이다.
극성 아미노산은 0의 알짜 전하를 갖는다. 일부 질소 함유 헤테로사이클의 경우, 알짜 전하는 환경의 pH에 따라 평형에서 양성자화되어 어느 정도로 양으로 하전될 수 있는 것으로 인정되지만 본 발명자들의 계산을 위해 0으로 간주된다.
이 펩티드의 아미노산의 대부분 (적어도 50%)은 하전되거나 극성이다.
바람직하게는, 양전하 또는 음전하는 때때로 극성 또는 비-극성 아미노산에 의해 분리된다.
일부 실시양태에서, 음으로 하전된 아미노산의 존재는 Xaa10에서 바람직하다.
일부 실시양태에서, 양으로 하전된 아미노산의 존재는 Xaa13에서 바람직하고, 바람직하게는 Arg 및 arg이다.
본 발명에 따라, 본 발명의 화합물은 Z 기를 포함할 수 있다. Z 기는 킬레이트화제 및 임의로 링커를 포함한다. 바람직하게 사용되는 바와 같이, 링커는 분자의 2개의 부분을 분리하는 요소, 모이어티 또는 구조이다. 본 발명에서, 링커 기는 킬레이트화제 기 및 Z가 부착된 본 발명의 화합물의 각각의 부분 둘 다와 공유 결합을 형성한다. 링커 기는 원칙적으로 킬레이트화제 기 및 명시된 위치에서 본 발명의 화합물의 부분 둘 다와 결합을 형성할 수 있는 임의의 화학적 기일 수 있다.
링커의 중요한 특성 또는 특징은 킬레이트화제와 본 발명의 화합물의 시클릭 펩티드 부분을 이격시킨다는 것이다. 이는 시클릭 펩티드의 표적 결합 능력이 인접한 킬레이트화제에 의해 손상되는 경우에 특히 중요하다. 그러나, 그의 가장 연장된 이형태체에서의 전체 링커 길이는 200Å을 초과하지 않아야 하고, 바람직하게는 150Å 이하, 가장 바람직하게는 100Å 이하여야 한다.
바람직한 실시양태에서, 링커는 -[X]a-이고, 여기서 a는 1 내지 10의 정수이고, 각각의 X는 아미드 연결, 우레아 연결, 카르바메이트 연결, 에스테르 연결, 에테르 연결, 티오에테르 연결, 술폰아미드, 트리아졸 및 디술피드 연결을 포함하는 것으로부터 선택되는 관능기에 의해 서열 내의 그의 이웃에 독립적으로 연결된 개별 빌딩 블록이다.
X1은 킬레이트화제에 연결되고, 존재하는 경우에 X2에 또는 명시된 위치에서 본 발명의 화합물에 연결된다. Xa는 존재하는 경우에 Xa-1 및 명시된 위치에서 본 발명의 화합물에 연결된다.
링커 기의 보다 바람직한 부류는 -[X]a-에 의해 나타내어지며, 여기서 a는 1 내지 10의 정수이고, 바람직하게는 a는 1 내지 8, 1 내지 6, 1 내지 5, 1 내지 4 또는 1 내지 3의 정수이고, 각각의 X는 아미드 연결, 우레아 연결, 카르바메이트 연결, 에스테르 연결, 에테르 연결, 티오에테르 연결, 술폰아미드 연결, 트리아졸 연결 및 디술피드 연결을 포함하는 군으로부터 선택되는 관능기에 의해 서열에서 그의 이웃에 독립적으로 연결된 개별 빌딩 블록이다.
한 실시양태에서, 빌딩 블록 X는 화학식 (8)을 갖는다.
여기서,
존재하는 경우 단편 Lin2 및 존재하는 경우 단편 Lin3은 각각 개별적으로 및 독립적으로 -CO-, -NR10-, -S-, -CO-NR10-, -CS-NR10-, -O-, -숙신이미드- 및 -CH2-CO-NR10-를 포함하는 군으로부터 선택되고; 단 Lin2 또는 Lin3 중 적어도 하나는 R9에 연결되고, 여기서 탄소 원자 및 모든 질소 함유 단편의 질소 원자가 R9에 연결되고;
여기서 R10은 수소 및 (C1-C4)알킬로 이루어진 군으로부터 선택되고;
여기서 R9는 -(C1-C10)알킬리덴-, -(C3-C8)카르보시클로-, -아릴렌-, -(C1-C10)알킬리덴-아릴렌-, -아릴렌-(C1-C10)알킬리덴-, -(C1-C10)알킬리덴-아릴렌-(C1-C10)알킬리덴-, -(C1-C10)알킬리덴-(C3-C8)카르보시클로-, -(C3-C8)카르보시클로-(C1-C10)알킬리덴-, -(C1-C10)알킬리덴-(C3-C8)카르보시클로-(C1-C10)알킬리덴-, -(C3-C8)헤테로시클로-, (C1-C10)알킬리덴-(C3-C8)헤테로시클로-, -(C3-C8)헤테로시클로-(C1-C10)알킬리덴-, -(C1-C10)알킬리덴-(C3-C8)헤테로시클로-(C1-C10)알킬리덴-, -(CH2CH2O)r-, 및 -(CH2)s-(CH2CH2O)r-(CH2)t-로부터 선택되고;
여기서,
r은 1, 2, 3, 4, 5, 6, 7, 8, 9 및 10의 임의의 정수이고;
s는 0, 1, 2, 3 및 4의 임의의 정수이고;
t는 0, 1, 2, 3 및 4의 임의의 정수이다.
바람직하게는, X1과 킬레이트화제 사이의 연결 이외의 연결은 아미드 연결이다. 보다 바람직하게는, 빌딩 블록 X2 내지 Xa는 독립적으로 아미노산, 디카르복실산 및 디아민을 포함하는 군으로부터 선택되고, 각각의 연결은 아미드이다.
한 실시양태에서 빌딩 블록 X2 내지 Xa는 바람직하게는 아미노산이며, 여기서 아미노산은 통상적인 아미노산 및 비통상적인 아미노산을 포함하는 군으로부터 선택된다. 한 실시양태에서, 아미노산은 β-아미노산, γ-아미노산, δ-아미노산, ε-아미노산 및 ω-아미노산을 포함하는 군으로부터 선택되는 것이다. 추가 실시양태에서, 아미노산은 시클릭 아미노산 또는 선형 아미노산이다. 관련 기술분야의 통상의 기술자는 입체생성 중심을 갖는 아미노산의 경우에 모든 입체이성질체 형태가 빌딩 블록 X에 사용될 수 있음을 알 것이다.
한 실시양태에서, 빌딩 블록 X2 내지 Xa는 바람직하게는 아미노산이며, 여기서 아미노산은 카르복실 기로부터 아미노 기의 간격이 상이한 아미노산을 포함하는 군으로부터 선택된다. 이러한 종류의 아미노산은 일반적으로 다음과 같이 나타낼 수 있다:
이러한 아미노산이 추가로 치환되지 않는 것이 본 발명의 범위에 속한다. 그러나, 이러한 아미노산이 추가로 치환되는 것 또한 본 발명의 범위에 속하고; 바람직하게는 이러한 치환은 CO-NH2 및/또는 Ac-NH-이다.
빌딩 블록 X로서 사용될 수 있는 이러한 종류의 아미노산 (구조 32)의 대표적인 것은 글리신 (Gly), β-알라닌 (Bal), γ-아미노부티르산 (GABA), 아미노펜탄산, 아미노헥산산, 및 10개 이하의 CH2 기를 갖는 상동체이다.
빌딩 블록 X로서 보다 바람직하게 사용되는 이러한 종류의 아미노산 (구조 33)의 대표적인 것은 3-아미노메틸-벤조산, 4-아미노메틸-벤조산, 안트라닐산, 3-아미노 벤조산 및 4-아미노 벤조산이다.
관련 빌딩 블록은 NH2를 COOH로 대체함으로써 아미노산 (구조 32 + 33)으로부터 유도된 디아민이고, 이는 바람직하게는 빌딩 블록 X로서 사용되며, 디아미노 에탄, 1,3-디아미노 프로판, 1,4-디아미노 부탄, 1,5-디아미노 펜탄, 3-아미노메틸-아닐린, 4-아미노메틸-아닐린, 1,2-디아미노 벤젠, 1,3-디아미노 벤젠 및 1,4-디아미노 벤젠이다.
관련 빌딩 블록은 COOH를 NH2로 대체함으로써 아미노산 (구조 32 + 33)으로부터 유도된 디카르복실산이고, 이는 보다 바람직하게는 빌딩 블록 X로서 사용되며, 말론산, 숙신산, 글루타르산, 아디프산, 프탈산, 테레프탈산, 이소프탈산, 및 2, 3 또는 4 카르복시-페닐 아세트산이다.
추가 실시양태에서, 아미노산은 바람직하게는 백본으로서 폴리에테르를 함유하는 아미노산이다. 바람직하게는 이러한 폴리에테르는 폴리에틸렌 글리콜이고, 30개 이하의 단량체 단위로 이루어진다. 바람직하게는, 이러한 폴리에테르를 포함하는 아미노산은 이러한 폴리에테르를 포함하지 않는 아미노산과 비교하여 친수성의 증가를 나타낸다. 빌딩 블록 X 및 궁극적으로 링커 기 [X]a에 혼입되는 경우, 결과는 전형적으로 친수성의 증가이다. 이러한 종류의 아미노산의 바람직한 실시양태는 하기에 도시되며, 여기서 이러한 아미노산은 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 또는 12개의 에틸렌 옥시드 모이어티를 포함할 수 있는 것으로 인지될 것이다:
바람직한 에틸렌 글리콜 함유 아미노산은 Ttds (N-(3-{2-[2-(3-아미노-프로폭시)-에톡시]-에톡시}-프로필)-숙신아미드산) 및 O2Oc ([2-(2-아미노-에톡시)-에톡시]-아세트산)이고, 그의 화학식은 다음과 같다:
바람직한 실시양태에서, 링커는 Ttds, O2Oc, Apac, Gly, Bal, Gab, Mamb, Pamb, Ppac, 4Amc, Inp, Sni, Rni, Nmg, Cmp, PEG6, PEG12, PEG-아미노산의 군으로부터 선택되는 단지 하나의 특정 아미노산의 올리고머 또는 단량체를 포함하고, 보다 바람직하게는 링커는 단량체이다.
또 다른 바람직한 실시양태에서, 링커는 Ttds, O2Oc, Apac, Gly, Bal, Gab, Mamb Pamb, PEG6, PEG12 및 PEG-아미노산의 군으로부터 선택되는 하나의 빌딩 블록 X2, 및 X2의 아미노-질소에 직접 결합되고 아미드 연결, 우레아 연결, 카르바메이트 연결, 에스테르 연결, 에테르 연결, 티오에테르 연결, 술폰아미드, 트리아졸 및 디술피드 연결로 이루어진 군으로부터 선택되는 연결에 의해 킬레이트화제에 직접 부착된 제2 빌딩 블록 X1을 포함한다. 이 경우 X1은, X1이 킬레이트화제의 연결에 대한 관련 상보적 관능기를 제공한다는 의미에서 아미노산 X2의 질소-원자에 대한 킬레이트화제에 의해 제공된 상이한 종류의 부착 관능기의 연결을 매개하는 어댑터로서 작용한다.
그러나, 링커의 사용은 통상적으로 목적을 따른다. 일부 상황에서, 높은 생물활성을 유지하기 위해 생물활성 분자로부터 더 큰 모이어티를 이격시키는 것이 필요하다. 다른 상황에서, 링커의 도입은 극성 또는 다중 전하의 도입에 의해 분자의 물리화학적 특성을 조정할 기회를 제공한다. 특정 상황에서, 이러한 링커를 필요로 하지 않으면서 킬레이트화제를 생물활성 화합물과 조합할 수 있다면 강점 및 성과가 될 수 있다. 특히, 킬레이트화제가 2개의 티오에테르 연결의 형성 하에 Xaa1의 S 원자 및 Xaa7의 S 원자를 연결하는 화학식 (X)의 Yc에 부착된 본 발명의 화합물은 전형적으로 임의의 전용 링커의 사용 없이 탁월하게 수행된다.
한 실시양태에서, 본 발명의 화합물은 킬레이트화제를 포함한다. 바람직하게는, 킬레이트화제는 본 발명의 화합물의 일부이며, 여기서 킬레이트화제는 직접적으로 또는 간접적으로, 예컨대 본 발명의 화합물에 부착된 링커에 의해 존재한다. 바람직한 킬레이트화제는 바람직하게는 적어도 하나의 방사성 금속을 포함하는 금속 킬레이트를 형성하는 킬레이트화제이다. 적어도 하나의 방사성 금속은 바람직하게는 진단 및/또는 치료 및/또는 치료진단 용도에 유용하거나 적합하고, 보다 바람직하게는 영상화 및/또는 방사선요법에 유용하거나 적합하다.
질환의 진단 및/또는 요법을 비롯한 본 발명의 실시에 원칙적으로 유용하고/거나 적합한 킬레이트화제는 관련 기술분야의 통상의 기술자에게 공지되어 있다. 매우 다양한 각각의 킬레이트화제가 이용가능하고, 예를 들어 문헌 [Banerjee et al. (Banerjee, et al., Dalton Trans, 2005, 24: 3886)] 및 그의 참조문헌 (문헌 [Price, et al., Chem Soc Rev, 2014, 43: 260]; [Wadas, et al., Chem Rev, 2010, 110: 2858])에 의해 검토되었다. 이러한 킬레이트화제는 US 5,367,080 A, US 5,364,613 A, US 5,021,556 A, US 5,075,099 A 및 US 5,886,142 A에 개시된 바와 같은 선형, 시클릭, 마크로시클릭, 테트라피리딘, N3S, N2S2 및 N4 킬레이트화제를 포함하나 이에 제한되지는 않는다.
본원에서 킬레이트화제로서 또한 지칭되는 대표적인 킬레이트화 작용제, 및 본 발명의 실시에 적합한 그의 유도체는 99mTc(CO)3-킬레이트화제, AAZTA, BAT, CDTA, DTA, DTPA, CY-DTA, DTCBP, CHX-A"-DTPA, CTA, 시클람, 시클렌, TETA, 사르코파진, CPTA, TEAMA, 크라운, 시클렌, DO3A, DO2A, TRITA, DATA, DFO, DATA(M), DATA(P), DATA(Ph), DATA(PPh), DEDPA, H4옥타파, H2데드파, H5데카파, H2아자파, H2CHX DEDPA, DFO-Chx-MAL, DFO-p-SCN, DFO-1AC, DFO-BAC, p-SCN-Bn-DFO, DFO-pPhe-NCS, DFO-HOPO, DFC, 디포스핀, DOTA, DOTAGA, DOTA-MFCO, DOTAM-모노-산, 니트로-DOTA, 니트로-PA-DOTA, p-NCS-Bz-DOTA, PA-DOTA, DOTA-NCS, DOTA-NHS, CB-DO2A, PCTA, p-NH2-Bn-PCTA, p-SCN-Bn-PCTA, p-SCN-Bn-DOTA, DOTMA, NB-DOTA, H4NB-DOTA, H4TCE-DOTA, 3,4,3-(Li-1,2-HOPO), TREN(Me-3,2-HOPO), TCE-DOTA, DOTP, DOXP, p-NCS-DOTA, p-NCS-TRITA, TRITA, TETA, 3p-C-DEPA, 3p-C-DEPA-NCS, p-NH2-BN-OXO-DO3A, p-SCN-BN-TCMC, TCMC, 4-아미노부틸-DOTA, 아지도-모노-아미드-DOTA, BCN-DOTA, 부틴-DOTA, BCN-DOTA-GA, DOA3P, DO2a2p, DO2A(트랜스-H2do2a), DO3A, DO3A-티올, DO3AtBu-N-(2-아미노에틸)에탄아미드, DO2AP, CB-DO2A, C3B-DO2A, HP-DO3A, DOTA-NHS-에스테르, 말레이미드-DOTA-GA, 말레이미도-모노-아미드-DOTA, 말레이미드-DOTA, NH2-DOTA-GA, NH2-PEG4-DOTA-GA, p-NH2-Bn-DOTA, p-NO2-Bn-DOTA, p-SCN-Bn-DOTA, p-SCN-Bz-DOTA, TA-DOTA, TA-DOTA-GA, OTTA, DOXP, TSC, DTC, DTCBP, PTSM, ATSM, FSC, H2ATSM, H2PTSM, Dp44mT, DpC, Bp44mT, QT, 하이브리드 티오세미카르바존-벤조티아졸, 티오세미카르바존-스티릴피리딘 네자리 리간드 H2L2-4, HBED, HBED-CC, dmHBED, dmEHPG, HBED-nn, SHBED, Br-Me2HBED, BPCA, HEHA, BF-HEHA, 디페리프론, THP, HOPO, HYNIC (2-히드라지노 니코틴아미드), NHS-HYNIC, HYNIC-Kp-DPPB, HYNIC-Ko-DPPB, (HYNIC)(트리신)2, (HYNIC)(EDDA)Cl, p-EDDHA, AIM, AIM A,IAM B, MAMA, MAMA-DGal, MAMA-MGal, MAMA-DA, MAMA-HAD, 마크로파, 마크로파퀸, 마크로퀸-SO3, NxS4-x, N2S2, N3S, N4, MAG3B, NOTA, NODAGA, SCN-Bz-NOTA-R, NOT-P (NOTMP), NOTAM, p-NCS-NOTA, TACN, TACN-TM, NETA, NETA-모노아민, p-SCN-PhPr-NE3TA, C-NE3TA-NCS, C-NETA-NCS, 3p-C-NETA, NODASA, NOPO, NODA, NO2A, N-벤질-NODA, NODA-MPAA, C-NOTA, BCNOT-모노아민, 말레이미도-모노-아미드-NOTA, NO2A-아지드, NO2A-부틴, NO2AP, NO3AP, N-NOTA, 옥소-DO3A, p-NH2-Bn-NOTA, p-NH2-Bn-옥소-DO3A, p-NO2-Bn-시클렌, PSC, p-SCN-Bn-NOTA, NOTP, p-SCN-Bn-옥소-DO3A, TRAP, PEPA, BF-PEPA, Pycup, Pycup2A, Pycup1A1Bn, Pycup2Bn, RESCA, SarAr-R, 디암사르, AmBaSar-R, siamSar, Sar, 타크피르, 타크피르-(6-Me), TAM A, TAM B, TAME, TAME-Hex, THP-Ph-NCS, THP-NCS, THP-TATE, NTP, H3THP, THPN, CB-TE2A, PCB-TE1A1P, TETA-NHS, CPTA, CPTA-NHS, CB-TE1K1P, CB-TE2A, TE2A, H2CB-TE2A, TE2P, CB-TE2P, MM-TE2A, DM-TE2A, 2C-TETA, 6C-TETA, BAT, BAT-6, NHS-BAT 에스테르, SSBAT, SCN-CHX-A-DTPA-P, SCN-TETA, TMT-아민, p-BZ-HTCPP, HYNIC, DTPA, EDTA, DOTA, TETA, 비스아미노 비스티올 (BAT) 기반 킬레이트화제 (US 5,720,934에 개시된 바와 같음); 데스페리옥사민 (DFO) (문헌 [Doulias, et al., Free Radic Biol Med, 2003, 35: 719]에 개시된 바와 같음), 테트라피리딘 및 N3S, N2S2 및 N4 킬레이트화제 (US 5,367,080 A, US 5,364,613 A, US 5,021,556 A, US 5,075,099 A, US 5,886,142 A에 개시된 바와 같음) (모든 참고문헌은 그 전문이 본원에 참조로 포함됨)를 포함하나 이에 제한되지는 않는다. 6-아미노-6-메틸퍼히드로-1,4-디아제핀-N,N',N",N"-테트라아세트산 (AAZTA)은 문헌 [Pfister et al., (Pfister, et al., EJNMMI Res, 2015, 5: 74)]에 개시되어 있고, 데페리프론, 1,2-디메틸-3,4-히드록시피리디논 및 헥사덴테이트 트리스(3,4-히드록시피리디논) (THP)는 문헌 [Cusnir et al. (Cusnir, et al., Int J Mol Sci, 2017, 18)]에 개시되어 있고, 모노아민-모노아미드 디티올 (MAMA)-기반 킬레이트화제는 문헌 [Demoin et al. (Demoin, et al., Nucl Med Biol, 2016, 43: 802)]에 개시되어 있으며, MACROPA 및 유사체는 문헌 [Thiele et al. (Thiele, et al., Angew Chem Int Ed Engl, 2017, 56: 14712)]에 개시되어 있고, 1,4,7,10,13,16-헥사아자시클로헥사데칸-N,N',N'',N''',N'''',N'''''-헥사아세트산 (HEHA) 및 PEPA 유사체는 문헌 [Price and Orvig (Price, et al., Chem Soc Rev, 2014, 43: 260)]에 개시되어 있고, Pycup 및 유사체는 문헌 [Boros et al. (Boros, et al., Mol Pharm, 2014, 11: 617]에 개시되어 있고, N,N-비스(2-히드록시벤질)에틸렌디아민-N,N-디아세트산 (HBED), 1,4,7,10-테트라키스(카르바모일메틸)-1,4,7,10-테트라아자시클로도데칸 (TCM), 2-[(카르복시메틸)]-[5-(4-니트로페닐-1-[4,7,10-트리스-(카르복시메틸)-1,4,7,10-테트라아자시클로도데칸-1-일]펜탄-2-일)-아미노]아세트산 (3p-C-DEPA), CB-TE2A, TE2A, TE1A1P, 디암사르, 1-N-(4-아미노벤질)-3,6,10,13,16,19-헥사아자비시클로[6.6.6]-에이코산-1,8-디아민 (SarAr), NETA, N,N0,N00, 트리스(2-메르캅토에틸)-1,4,7-트리아자시클로노난 (TACN-TM), {4-[2-(비스-카르복시메틸-아미노)-에틸]-7-카르복시메틸-[1,4,7]트리아조난-1-일}-아세트산 (NETA), 디에틸렌트리아민펜타아세트산 (DTP), 3-({4,7-비스-[(2-카르복시-에틸)-히드록시-포스피노일메틸]-[1,4,7]트리아조난-1-일메틸}-히드록시-포스피노일)-프로피온산 (TRAP), NOPO, H4옥타파, SHBED, BPCA, 3,6,9,15-테트라아자비시클로[9.3.1]-펜타데카-1(15),11,13-트리엔-3,6,9,-트리아세트산 (PCTA), 및 1,4,7,10,13-펜타아자시클로펜타데칸-N,N',N'',N''',N''''-펜타아세트산 (PEPA)은 문헌 [Price and Orvig (Price, et al., Chem Soc Rev, 2014, 43: 260)]에 개시되어 있고, 1-히드록시-2-피리돈 리간드 (HOPO)는 문헌 [Allott et al. (Allott, et al., Chem Commun (Camb), 2017, 53: 8529)]에 개시되어 있으며, [4-카르복시메틸-6-(카르복시메틸-메틸-아미노)-6-메틸-[1,4]디아제판-1-일]-아세트산 (DATA)은 문헌 [Tornesello et al. (Tornesello, et al., Molecules, 2017, 22: 1282)]에 개시되어 있고, 테트라키스(아미노메틸)메탄 (TAM) 및 유사체는 문헌 [McAuley 1988 (McAuley, et al., Canadian Journal of Chemistry, 1989, 67: 1657)]에 개시되어 있고, 헥사덴테이트 트리스(3,4-히드록시피리디논) (THP) 및 유사체는 문헌 [Ma et al. (Ma, et al., Dalton Trans, 2015, 44: 4884)]에 개시되어 있다.
상기 킬레이트화제 중 일부의 진단 및/또는 치료 용도는 선행 기술에 기재되어 있다. 예를 들어, 2-히드라지노 니코틴아미드 (HYNIC)는 99mTc 및 186,188Re의 혼입을 위해 공동리간드의 존재 하에 널리 사용되어 왔고 (문헌 [Schwartz, et al., Bioconjug Chem, 1991, 2: 333]; [Babich, et al., J Nucl Med, 1993, 34: 1964]; [Babich, et al., Nucl Med Biol, 1995, 22: 25]); DTPA는 111In을 착물화하기 위해 옥트레오스캔(Octreoscan)®에서 사용되고, 여러 변형은 문헌에 기재되어 있고 (문헌 [Li, et al., Nucl Med Biol, 2001, 28: 145]; [Brechbiel, et al., Bioconjug Chem, 1991, 2: 187]); 방사선요법 적용을 위한 DOTA 유형 킬레이트화제는 미국 특허 4,885,363 (Tweedle et al.)에 기재되어 있고; 3가 동위원소 금속을 킬레이트화하기 위한 다른 폴리아자 마크로사이클은 문헌 [Eisenwiener et al. (Eisenwiener, et al., Bioconjug Chem, 2002, 13: 530)]에 기재되어 있으며; N4-킬레이트화제, 예컨대 99mTc-N4-킬레이트화제는 CCK-2 수용체를 표적화하기 위한 미니가스트린의 경우에 펩티드 표지에 사용되었다 (문헌 [Nock, et al., J Nucl Med, 2005, 46: 1727]).
한 실시양태에서, 금속 킬레이트화제는 DOTA, DOTAGA, NOTA, NODAGA, NODA-MPAA, HBED, TETA, CB-TE2A, DTPA, DFO, 마크로파, HOPO, TRAP, THP, DATA, NOTP, 사르코파진, FSC, NETA, H4옥타파, Pycup, NxS4-x (N4, N2S2, N3S), Hynic, 99mTc(CO)3-킬레이트화제 및 그의 유사체를 포함하는 군으로부터 선택되지만 이에 제한되지는 않고, 여기서
DOTA는 1,4,7,10-테트라아자시클로도데칸-1,4,7,10-테트라아세트산을 나타내고,
DOTAGA는 1,4,7,10-테트라아자시클로도세칸,1-(글루타르산)-4,7,10-트리아세트산을 나타내고,
NOTA는 1,4,7-트리아자시클로노난트리아세트산을 나타내고,
NODAGA는 1,4,7-트리아자시클로노난-N-글루타르산-N',N"-디아세트산을 나타내고,
NODA-MPAA는 1,4,7-트리아자시클로노난-1,4-디아세테이트-메틸 페닐아세트산을 나타내고,
HBED는 비스(2-히드록시벤질)에틸렌디아민디아세트산을 나타내고,
TETA는 1,4,8,11-테트라아자시클로도데칸-1,4,8,11-테트라아세트산을 나타내고,
CB-TE2A는 4,11-비스-(카르복시메틸)-1,4,8,11-테트라아자비시클로[6.6.2]-헥사데칸을 나타내고,
DTPA는 디에틸렌트리아민펜타아세트산을 나타내고,
DFO는 킬레이트화제의 데스페랄 또는 데스페리옥사민 유형 군을 나타내고, 비제한적 예의 화학 명칭은 N-[5-({3-[5-(아세틸-히드록시-아미노)-펜틸카르바모일]-프로피오닐}-히드록시-아미노)-펜틸]-N'-(5-아미노-펜틸)-N'-히드록시-숙신아미드,
마크로파는 N,N'-비스[(6-카르복시-2-피리딜)메틸]-4,13-디아자-18-크라운을 나타내고,
HOPO는 킬레이트화제의 옥타덴테이트 히드록시피리디논 유형 기를 나타내고, 비제한적 예의 구조는 하기에 제시된다.
TRAP는 3-({4,7-비스-[(2-카르복시-에틸)-히드록시-포스피노일메틸]-[1,4,7]트리아조난-1-일메틸}-히드록시-포스피노일)-프로피온산을 나타내고,
THP는 헥사덴테이트 트리스(3,4-히드록시피리디논)를 나타내고,
DATA는 [4-카르복시메틸-6-(카르복시메틸-메틸-아미노)-6-메틸-[1,4]디아제판-1-일]-아세트산을 나타내고,
NOTP는 1,4,7-트리아자시클로노난-N,N'N"-트리스(메틸렌 포스폰산)를 나타내고,
사르코파진은 3,6,10,13,16,19-헥사아자비시클로[6.6.6]이코산을 나타내고,
FSC는 3,15,27-트리아미노-7,19,31-트리히드록시-10,22,34-트리메틸-1,13,25-트리옥사-7,19,31-트리아자-시클로헥사트리아콘타-9,21,33-트리엔-2,8,14,20,26,32-헥사온을 나타내고,
NETA는 {4-[2-(비스-카르복시메틸-아미노)-에틸]-7-카르복시메틸-[1,4,7]트리아조난-1-일}-아세트산을 나타내고,
H4옥타파는 N,N'-(6-카르복시-2-피리딜메틸)-N,N'-디아세트산-1,2-디아미노에탄을 나타내고,
Pycup은 1,8-(2,6-피리딘디메틸렌)-1,4,8,11-테트라아자시클로-테트라데칸을 나타내고,
NxS4-x (N4, N2S2, N3S)는 Tc-착물, 특히 Tc (V)-옥소 착물을 안정화시키는 공여자로서 N-원자 (염기성 아민 또는 비-염기성 아미드) 및 티올을 갖는 네자리 킬레이트화제의 군을 나타낸다. 하나의 대표적인 비제한적 예 MAG3의 구조를 하기에 나타내고,
MAG3은 {2-[2-(3-메르캅토-프로피오닐아미노)-아세틸아미노]-아세틸아미노}-아세트산을 나타내고,
HYNIC는 6-히드라지노-니코틴산을 나타내고,
99mTc(CO)3-킬레이트화제는 테크네튬 트리카르보닐 단편과 안정한 착물을 형성할 수 있는 두자리 또는 세자리 킬레이트화제를 나타내며,
그의 화학 구조는 다음과 같다:
바람직한 실시양태에서, 금속 킬레이트화제는 DOTA, DOTAGA, NOTA, NODAGA, NODA-MPAA, HBED, CB-TE2A, DFO, THP, N4 및 이들의 유사체로 이루어진 군으로부터 선택된다.
보다 바람직한 실시양태에서, 금속 킬레이트화제는 DOTA, DOTAGA, NOTA, N4Ac 및 NODAGA 및 그의 유사체로 이루어진 군으로부터 선택된다.
킬레이트화제는 원칙적으로 본 발명의 화합물이 진단 또는 요법에 사용되는지 또는 그에 적합한지에 무관하게 사용될 수 있다는 것이 관련 기술분야의 통상의 기술자에 의해 인지될 것이다. 이러한 원칙은 특히 국제 특허 출원 WO 2009/109332 A1에 약술되어 있다.
본 발명의 화합물에서의 킬레이트화제의 존재는, 달리 언급되지 않는 한, 킬레이트화제가 임의의 금속 착물 파트너, 즉 원칙적으로 킬레이트화제에 의해 착물화될 수 있는 임의의 금속에 착물화될 가능성을 포함한다는 것이 관련 기술분야의 통상의 기술자에 의해 추가로 인지될 것이다. 본 발명의 화합물의 명백하게 언급된 킬레이트화제 또는 본 발명의 화합물과 관련된 일반 용어 킬레이트화제는 비착물화된 킬레이트화제 그 자체 또는 임의의 금속 착물 파트너가 결합된 킬레이트화제를 지칭하며, 여기서 금속 착물 파트너는 임의의 방사성 또는 비-방사성 금속 착물 파트너이다. 바람직하게는, 금속 착물 파트너가 결합되는 킬레이트화제인 킬레이트화제 금속 착물은 안정한 킬레이트화제 금속 착물이다.
비-방사성 킬레이트화제 금속 착물은, 예를 들어 달리 측정하기 어려운 안정성 또는 활성과 같은 특성을 평가하기 위한 여러 용도를 갖는다. 한 측면은 금속 착물 파트너의 방사성 버전의 콜드 변형체 (예를 들어, 실시예에 기재된 바와 같은 비-방사성 갈륨, 루테튬 또는 인듐 착물)가 방사성 화합물의 대용물로서 작용할 수 있다는 것이다. 또한, 이들은 시험관내 또는 생체내 대사물을 확인하기 위한, 뿐만 아니라 본 발명의 화합물의 독성 특성을 평가하기 위한 가치있는 도구이다. 추가로, 킬레이트화제 금속 착물은 별개의 리간드 (예를 들어, 유로퓸 염)를 갖는 일부 금속 착물의 형광 특성을 이용하는 결합 검정에 사용될 수 있다.
펩티드 또는 아미노산에의 접합을 위한 매우 다양한 (가능하게는 이미 활성화된) 기를 갖는 킬레이트화제는 합성될 수 있거나 또는 상업적으로 입수가능하다. 본 발명의 각각의 화합물의 아미노-질소에 대한 킬레이트화제의 직접 접합은 DOTA, DOTAGA, NOTA, NODAGA, NODA-MPAA, HBED, TETA, CB-TE2A, DTPA, DFO, DATA, 사르코파진, N4, MAG3 및 Hynic, 바람직하게는 DOTA, DOTAGA, NOTA, NODAGA, NODA-MPAA, CB-TE2A 및 N4로 이루어진 군으로부터 선택되는 킬레이트화제에 대해 충분히 가능하다. 이와 관련하여 바람직한 연결은 아미드 연결이다.
킬레이트화제를 아미노-질소에 직접 접합시키기 위한 이상적인 전구체인 킬레이트화제에서의 관능기는 관련 기술분야의 통상의 기술자에게 공지되어 있고, 카르복실산, 활성화된 카르복실산, 예를 들어 활성 에스테르, 예를 들어 NHS-에스테르, 펜타플루오로페놀-에스테르, HOBt-에스테르 및 HOAt-에스테르, 이소티오시아네이트를 포함하나 이에 제한되지는 않는다.
킬레이트화제를 펩티드의 카르복실 기에 직접 접합시키기 위한 이상적인 전구체인 킬레이트화제에서의 관능기는 관련 기술분야의 통상의 기술자에게 공지되어 있고, 알킬아미노 및 아릴아미노 질소를 포함하나 이에 제한되지는 않는다. 각각의 킬레이트화제 시약은 상업적으로 입수가능한 일부 킬레이트화제, 예를 들어 알킬아미노 또는 아릴아미노 질소를 갖는 DOTA에 대한 것이다.
본 발명의 화합물에 부착되거나 부착될 방사성 핵종은 각각 치료될 질환 및/또는 진단될 질환 및/또는 각각 치료될 및 진단될 환자 및 환자군의 특이성을 고려하여 선택된다는 것이 관련 기술분야의 통상의 기술자에 의해 인지될 것이다.
본 발명의 한 실시양태에서, 방사성 핵종은 또한 방사성핵종으로 지칭된다. 방사성 붕괴는 불안정한 원자의 원자 핵이 이온화 입자 (이온화 방사선)를 방출함으로써 에너지를 손실하는 과정이다. 다양한 유형의 방사성 붕괴가 있다. 모 방사성핵종으로 불리는 한 유형의 핵을 갖는 원자가 상이한 상태의 핵을 갖는 원자로 또는 상이한 수의 양성자 및 중성자를 함유하는 상이한 핵으로 변환될 때 붕괴 또는 에너지 손실이 발생한다. 이들 생성물 중 어느 하나는 딸 핵종으로 명명된다. 일부 붕괴에서, 모체 및 딸체는 상이한 화학 원소이고, 따라서 붕괴 과정은 핵 변형 (새로운 원소의 원자의 생성)을 초래한다. 예를 들어, 방사성 붕괴는 알파 붕괴, 베타 붕괴 및 감마 붕괴일 수 있다. 알파 붕괴는 핵이 알파 입자 (헬륨 핵)를 방출할 때 발생한다. 이는 핵을 방출하는 가장 흔한 과정이지만, 보다 드문 유형의 붕괴에서 핵은 양성자 또는 다른 원소의 특정 핵을 방출할 수 있다 (클러스터 붕괴로 불리는 과정에서). 베타 붕괴는 양성자를 중성자로 변화시키는 과정에서 또는 그 반대의 방식으로 핵이 전자 (β--붕괴) 또는 양전자 (β+-붕괴) 및 중성미자의 유형을 방출하는 경우에 발생한다. 대조적으로, 변형을 일으키지 않는 방사성 붕괴 과정이 존재한다. 여기된 핵의 에너지는 감마 감쇠에서 감마선으로서 방출될 수 있거나, 또는 내부 전환으로 불리는 과정에서 여기된 핵과의 상호작용에 의해 궤도 전자를 방출하는데 사용될 수 있거나, 또는 전자 쉘로부터 내부 원자 전자를 흡수하여 핵 양성자의 중성자로의 변화가 전자 포획 (EC)으로 불리는 과정에서 전자 중성미자의 방출을 유발하는데 사용될 수 있거나, 또는 이성질체 전이 (IT)로 불리는 과정에서 그의 양성자 및 중성자의 수를 변화시키지 않으면서 방출될 수 있다. 방사성 붕괴의 또 다른 형태인 자발 핵분열 (SF)은 매우 무거운 화학 원소에서만 발견되며, 이는 더 작은 핵 및 소수의 단리된 핵 입자로의 자발적 파괴를 초래한다.
본 발명의 바람직한 실시양태에서, 방사성핵종은 본 발명의 화합물의 표지에 사용될 수 있다.
본 발명의 한 실시양태에서, 방사성핵종은 방사성핵종 킬레이트 착물을 생성하는 킬레이트화제와의 착물에 적합하다.
추가 실시양태에서, 본 발명의 화합물의 1개 이상의 원자는 비-천연 동위원소 조성을 갖고, 바람직하게는 이들 원자는 방사성핵종; 보다 바람직하게는 탄소, 산소, 질소, 황, 인 및 할로겐의 방사성핵종이다: 이들 방사성 원자는 전형적으로 아미노산, 일부 경우에 할로겐 함유 아미노산 및/또는 본 발명의 화합물 각각의 빌딩 블록 및 일부 경우에 할로겐화 빌딩 블록의 일부이다.
본 발명의 바람직한 실시양태에서, 방사성핵종은 진단 및/또는 치료 의학적 용도를 허용하는 반감기를 갖는다. 구체적으로, 반감기는 1분 내지 100일이다.
본 발명의 바람직한 실시양태에서, 방사성핵종은 진단 및/또는 치료 의학적 용도를 가능하게 하는 붕괴 에너지를 갖는다. 구체적으로, γ-방출 동위원소의 경우, 붕괴 에너지는 진단 용도를 위해 0.004 내지 10 MeV, 바람직하게는 0.05 내지 4 MeV이다. 양전자-방출 동위원소의 경우, 붕괴 에너지는 진단 용도를 위해 0.6 내지 13.2 MeV, 바람직하게는 1 내지 6 MeV이다. 입자-방출 동위원소의 경우, 붕괴 에너지는 치료 용도를 위해 0.039 내지 10 MeV, 바람직하게는 0.4 내지 6.5 MeV이다.
본 발명의 바람직한 실시양태에서, 방사성핵종은 의학적 용도를 위해 산업적으로 제조된다. 구체적으로, 방사성핵종은 GMP 품질로 이용가능하다.
본 발명의 바람직한 실시양태에서, 방사성핵종의 방사성 붕괴 후의 딸 핵종(들)은 진단 및/또는 치료 의학적 용도와 상용성이다. 또한, 딸 핵종은 진단 및/또는 치료 의학적 용도를 방해하지 않거나 심지어 이를 지지하지 않는 방식으로 안정하거나 추가로 붕괴된다. 본 발명과 관련하여 사용될 수 있는 대표적인 방사성핵종은 표 7에 요약된다.
표 7: 관련 방사성핵종의 주요 특성 - 반감기, 붕괴 유형 및 붕괴 에너지
본 발명의 한 실시양태에서, 방사성핵종은 진단에 사용된다. 바람직하게는, 방사성 동위원소는 43Sc, 44Sc, 51Mn, 52Mn, 64Cu, 67Ga, 68Ga, 86Y, 89Zr, 94mTc, 99mTc, 111In, 152Tb, 155Tb, 177Lu, 201Tl, 203Pb, 18F, 76Br, 77Br, 123I, 124I, 125I를 포함하는 군으로부터 선택되나 이에 제한되지는 않는다. 보다 바람직하게는, 방사성핵종은 43Sc, 44Sc, 64Cu, 67Ga, 68Ga, 86Y, 89Zr, 99mTc, 111In, 152Tb, 155Tb, 203Pb, 18F, 76Br, 77Br, 123I, 124I, 125I를 포함하는 군으로부터 선택된다. 보다 더 바람직하게는, 방사성핵종은 64Cu, 68Ga, 89Zr, 99mTc, 111In, 18F, 123I, 및 124I를 포함하는 군으로부터 선택된다. 그러나, 상기 방사성핵종의 용도는 진단 목적으로 제한되지 않고, 본 발명의 화합물에 접합되는 경우 요법 및 진단학에서의 그의 용도를 포괄한다는 것이 또한 관련 기술분야의 통상의 기술자에 의해 인지될 것이다.
본 발명의 한 실시양태에서, 방사성핵종은 요법에 사용된다. 바람직하게는, 방사성 동위원소는 47Sc, 67Cu, 89Sr, 90Y, 111In, 153Sm, 149Tb, 161Tb, 177Lu, 186Re, 188Re, 212Pb, 213Bi, 223Ra, 225Ac, 226Th, 227Th, 131I, 211At를 포함하는 군으로부터 선택된다. 보다 바람직하게는, 방사성 동위원소는 47Sc, 67Cu, 90Y, 177Lu, 188Re, 212Pb, 213Bi, 225Ac, 227Th, 131I, 211At를 포함하는 군으로부터 선택된다. 보다 더 바람직하게는, 방사성핵종은 90Y, 177Lu, 225Ac, 227Th, 131I 및 211At를 포함하는 군으로부터 선택된다. 그러나, 상기 방사성핵종의 용도는 치료 목적으로 제한되지 않고, 본 발명의 화합물에 접합되는 경우에 진단 및 치료진단에서의 그의 용도를 포괄한다는 것이 또한 관련 기술분야의 통상의 기술자에 의해 인지될 것이다.
한 실시양태에서, 본 발명의 화합물은 제약상 허용되는 염으로서 존재한다.
본 발명의 화합물의 "제약상 허용되는 염"은 바람직하게는, 일반적으로 관련 기술분야에서 과도한 독성 또는 발암성 없이, 바람직하게는 자극, 알레르기 반응 또는 다른 문제 또는 합병증 없이 인간 또는 동물의 조직과 접촉하여 사용하기에 적합한 것으로 간주되는 산 염 또는 염기 염이다. 이러한 염은 염기성 잔기, 예컨대 아민의 무기 및 유기 산 염, 뿐만 아니라 산성 잔기, 예컨대 카르복실산의 알칼리 또는 유기 염을 포함한다. 본 발명의 화합물은 또한 제약상 허용되는 염인 내부 염을 형성할 수 있다.
적합한 제약상 허용되는 염은 산, 예컨대 염산, 인산, 브로민화수소산, 말산, 글리콜산, 푸마르산, 황산, 술팜산, 술파닐산, 포름산, 톨루엔술폰산, 메탄술폰산, 벤젠 술폰산, 에탄 디술폰산, 2-히드록시에틸술폰산, 질산, 벤조산, 2-아세톡시벤조산, 시트르산, 타르타르산, 락트산, 스테아르산, 살리실산, 글루탐산, 아스코르브산, 파모산, 숙신산, 푸마르산, 말레산, 프로피온산, 히드록시말레산, 아이오딘화수소산, 페닐아세트산, 알칸산, 예컨대 아세트산, HOOC-(CH2)n-COOH (여기서, n은 0 내지 4의 임의의 정수, 즉 0, 1, 2, 3 또는 4임) 등의 염을 포함하나 이에 제한되지는 않는다. 유사하게, 제약상 허용되는 양이온은 나트륨, 칼륨, 칼슘, 알루미늄, 리튬 및 암모늄을 포함하나 이에 제한되지는 않는다. 관련 기술분야의 통상의 기술자는 본원에 제공된 화합물에 대한 추가의 제약상 허용되는 염을 알 것이다. 일반적으로, 제약상 허용되는 산 또는 염기 염은 임의의 통상적인 화학적 방법에 의해 염기성 또는 산성 모이어티를 함유하는 모 화합물로부터 합성될 수 있다. 간략하게, 이러한 염은 이들 화합물의 유리 산 또는 염기 형태를 물 또는 유기 용매 중에서 또는 이들 둘의 혼합물 중에서 화학량론적 양의 적절한 염기 또는 산과 반응시킴으로써 제조될 수 있다. 일반적으로, 비-수성 매질, 예컨대 에테르, 에틸 아세테이트, 에탄올, 이소프로판올 또는 아세토니트릴의 사용이 바람직하다.
본 발명의 화합물의 "제약상 허용되는 용매화물"은 바람직하게는 본 발명의 화합물의 1개 이상의 분자에 대한 1개 이상의 용매 분자의 회합에 의해 형성된 본 발명의 화합물의 용매화물이다. 바람직하게는, 용매는 일반적으로 관련 기술분야에서 과도한 독성 또는 발암성 없이, 바람직하게는 자극, 알레르기 반응 또는 다른 문제 또는 합병증 없이 인간 또는 동물의 조직과 접촉하여 사용하기에 적합한 것으로 간주되는 것이다. 이러한 용매는 유기 용매, 예컨대 알콜, 에테르, 에스테르 및 아민을 포함한다.
본 발명의 화합물의 "수화물"은 본 발명의 화합물의 1개 이상의 분자에 대한 1개 이상의 물 분자의 회합에 의해 형성된다. 이러한 수화물은 반수화물, 1수화물, 2수화물, 3수화물 및 4수화물을 포함하나 이에 제한되지는 않는다. 수화물 조성과는 독립적으로 모든 수화물은 일반적으로 제약상 허용되는 것으로 간주된다.
본 발명의 화합물은 FAP에 대한 높은 결합 친화도 및 FAP에 대한 높은 억제 활성을 갖는다. 이러한 높은 결합 친화도로 인해, 본 발명의 화합물은 표적화제로서 효과적이고/거나, 그로서 유용하고/거나, 그로서 적합하고, 또 다른 모이어티에 접합된 경우에는 표적화 모이어티로서 적합하다. 본원에서 바람직하게 사용되는 표적화제는 본 경우에 상기 FAP인 표적 분자와 상호작용하는 작용제이다. 이에 따라 본 발명의 화합물에 의해 표적화된 세포 및 조직의 관점에서, 상기 FAP를 발현하는 임의의 세포 및 조직이 각각 표적화되거나 또는 표적화될 수 있다.
한 실시양태에서, 화합물은 섬유모세포 활성화 단백질 (FAP), 바람직하게는 서열식별번호: 1의 아미노산 서열을 갖는 인간 FAP 또는 그의 상동체와 상호작용하며, 여기서 상동체의 아미노산 서열은 서열식별번호: 1의 아미노산 서열에 대해 적어도 85%인 FAP의 동일성을 갖는다. 바람직한 실시양태에서, 동일성은 90%, 바람직하게는 95%, 96%, 97%, 98% 또는 99%이다.
2개의 핵산 분자 사이의 동일성은 관련 기술분야의 통상의 기술자에게 공지된 바와 같이 결정될 수 있다. 보다 구체적으로, 서열 비교 알고리즘을 사용하여 지정된 프로그램 파라미터에 기초해 참조 서열에 대한 시험 서열(들)의 퍼센트 서열 상동성을 계산할 수 있다. 시험 서열은 바람직하게는 상이한 단백질 또는 폴리펩티드와 동일한지 및 동일한 경우 어느 정도로 동일한지 시험되는 서열 또는 단백질 또는 폴리펩티드이고, 상기 상이한 단백질 또는 폴리펩티드는 또한 참조 서열로도 언급되고, 바람직하게는 야생형의 단백질 또는 폴리펩티드, 보다 바람직하게는 서열식별번호: 1의 인간 FAP이다.
비교를 위한 서열의 최적 정렬은, 예를 들어 스미스 & 워터맨(Smith & Waterman)의 국부 상동성 알고리즘 (문헌 [Smith, et al., Advances in Applied Mathematics, 1981, 2: 482]), 니들만 & 분쉬(Needleman & Wunsch)의 상동성 정렬 알고리즘 (문헌 [Needleman, et al., J Mol Biol, 1970, 48: 443]), 피어슨 & 립만(Pearson & Lipman)의 유사성 검색 방법 (문헌 [Pearson, et al., Proc Natl Acad Sci U S A, 1988, 85: 2444]), 이들 알고리즘의 컴퓨터 구현 (위스콘신 제네틱스 소프트웨어 패키지(Wisconsin Genetics Software Package) (제네틱스 컴퓨터 그룹(Genetics Computer Group), 위스콘신주 매디슨 사이언스 드라이브 575)의 GAP, BESTFIT, FASTA 및 TFASTA) 또는 육안 검사에 의해 수행될 수 있다.
퍼센트 서열 동일성을 결정하는데 적합한 알고리즘의 한 예는 베이직 로컬 얼라인먼트 서치 툴 (이하 "BLAST")에서 사용되는 알고리즘이며, 예를 들어 문헌 [Altschul et al., 1990 (Altschul, et al., J Mol Biol, 1990, 215: 403)] 및 [Altschul et al., 1997 (Altschul, et al., Nucleic Acids Res, 1997, 25: 3389]을 참조한다. BLAST 분석을 수행하기 위한 소프트웨어는 미국 국립 생물 정보 센터(National Center for Biotechnology Information) (이하 "NCBI")를 통해 공개적으로 이용가능하다. NCBI로부터 이용가능한 소프트웨어, 예를 들어 BLASTN (뉴클레오티드 서열의 경우) 및 BLASTP (아미노산 서열의 경우)를 사용하여 서열 동일성을 결정하는데 사용된 디폴트 파라미터는 문헌 [McGinnis et al. (McGinnis, et al., Nucleic Acids Res, 2004, 32: W20)]에 기재되어 있다.
본 발명의 화합물이 본원에 개시된 바와 같은 질환의 치료 방법에 사용되거나 또는 사용하기 위한 것이 본 발명의 범위에 속한다. 이러한 방법은 바람직하게는 치료 유효량의 본 발명의 화합물을 그를 필요로 하는 대상체에게 투여하는 단계를 포함한다. 이러한 방법은 치유적 또는 아주반트 암 치료를 포함하나 이에 제한되지는 않는다. 이는 치유가 가능하지 않은 완화적 치료로서 사용되고, 목적은 국부 질환 제어 또는 증상 완화를 위한 것이거나 또는 요법이 생존 이익을 갖고 치유적일 수 있는 치유적 치료로서 사용된다.
본원에 개시된 바와 같은 질환의 치료 방법은 종양 및 암을 포함한 본원에 개시된 질환의 치료를 포함하고, 1차 요법으로서 또는 2차, 3차, 4차 또는 마지막 차수 요법으로서 사용될 수 있다. 본 발명의 화합물을 추가의 치료 접근법과 조합하는 것이 또한 본 발명의 범위에 속한다. 치유적, 아주반트, 네오아주반트, 치료적 또는 완화적 치료 의도를 포함한 정확한 치료 의도는 종양 유형, 위치 및 병기, 뿐만 아니라 환자의 전반적 건강에 따라 달라질 것임이 관련 기술분야의 통상의 기술자에게 널리 공지되어 있다.
본 발명의 한 실시양태에서, 질환은 신생물 nos, 신생물 양성, 양성 또는 악성 여부에 관계없는 신생물, 신생물 악성, 신생물 전이성, 원발성 또는 전이성 여부에 관계없는 신생물 악성, 종양 세포 양성, 양성 또는 악성 여부에 관계없는 종양 세포, 종양 세포 악성, 악성 종양 소세포 유형, 악성 종양 거대 세포 유형, 악성 종양 방추 세포 유형, 상피 신생물 nos, 상피 종양 양성, 상피내 암종 nos, 암종 nos, 전이성 암종 nos, 암종증, 양성 상피종, 악성 상피종, 대세포 암종 nos, 미분화 암종 유형 nos, 역형성 암종 유형 nos, 다형성 암종, 거대 세포 및 방추 세포 암종, 거대 세포 암종, 방추 세포 암종, 가성육종성 암종, 다각형 세포 암종, 타원 세포 암종, 종양렛, 소세포 암종 nos, 귀리 세포 암종, 소세포 암종, 방추 세포 유형, 유두상 및 편평 세포 신생물, 유두종 nos, 유두상 상피내 암종, 유두상 암종 nos, 사마귀양 유두종, 사마귀양 암종 nos, 편평 세포 유두종,유두상 편평 세포 암종, 도립 유두종, 유두종증 nos, 편평 세포 상피내 암종 nos, 편평 세포 암종 nos, 편평 세포 암종 전이 nos, 편평 세포 암종, 각질화 유형 nos, 편평 세포 암종 대세포 비각질화 유형, 편평 세포 암종 소세포 비각질화 유형, 편평 세포 암종 방추 세포 유형, 선양 편평 세포 암종, 의심스러운 기질 침습을 갖는 상피내 편평 세포 암종, 편평 세포 암종 미세침습성, 퀘이어트 홍색비후증, 보웬병, 림프상피 암종, 기저 세포 신생물, 기저 세포 종양, 기저 세포 암종 nos, 다중심성 기저 세포 암종, 기저 세포 암종 반상경피증 유형, 기저 세포 암종 섬유상피 유형, 기저편평상피 암종, 변형성 암종, 자다손의 표피내 상피종, 모낭상피종, 트리코폴리쿨로마, 트리콜레모마, 모기질세포종, 이행 세포 유두종 및 암종, 이행 세포 유두종 nos, 요로상피 유두종, 이행 세포 상피내 암종, 이행 세포 암종 nos, 스크네이데리안 유두종, 이행 세포 유두종, 역위 유형, 스크네이데리안 암종, 이행 세포 암종 방추 세포 유형, 기저세포양 암종, 배설원성 암종, 유두상 이행 세포 암종, 선종 및 선암종, 선종 nos, 기관지 선종 nos, 계내 선암종, 선암종 nos, 전이성 선암종 nos, 경변성 선암종, 증식성 위벽염, 표재성 확산 선암종, 장형 선암종, 미만형 암종, 단형성 선종, 기저 세포 선종, 도세포 선종, 도세포 암종, 인슐린종 nos, 악성 인슐린종, 글루카곤종 nos, 악성 글루카곤종, 가스트린종 nos, 악성 가스트린종, 혼합 도세포 및 외분비 선암종, 담관 선종, 담관암종, 담관 낭선종, 담관 낭선암종, 간 세포 선종, 간세포성 암종 nos, 양성 간담관종, 복합 간세포성 암종 및 담관암종, 지주 선종, 지주 선암종, 배아성 선종, 에크린 피부 원주종, 선양 낭성 암종, 사상 암종, 선종성 폴립 nos, 선종성 폴립에서의 선암종, 관상 선종 nos, 관상 선암종, 선종성 결장 폴립증, 선종성 결장 폴립증에서의 선암종, 다발성 선종성 폴립, 고형 암종 nos, 단순 암종, 카르시노이드 종양 nos, 카르시노이드 종양 악성, 카르시노이드 종양 아르겐타핀 nos, 카르시노이드 종양 아르겐타핀 악성, 카르시노이드 종양 비아르겐타핀 nos, 카르시노이드 종양 비아르겐타핀 악성, 뮤코카르시노이드 종양 악성, 복합 카르시노이드, 폐 선종증, 세기관지-폐포 선암종, 폐포 선종, 폐포 선암종, 유두상 선종 nos, 유두상 선암종 nos, 융모성 선종 nos, 융모성 선종에서의 선암종, 융모성 선암종, 세관융모성 선종, 혐색소성 선종, 혐색소성 암종, 호산구 선종, 호산구 암종, 혼합 호산구-호염기구 선종, 혼합 호산구-호염기구 암종, 호산구성 선종, 호산구성 선암종, 호염기구 선종, 호염기구 암종, 투명 세포 선종, 투명 세포 선암종 nos, 고신성 종양, 신세포 암종, 투명 세포 선섬유종, 과립 세포 암종, 으뜸 세포 선종, 물-투명 세포 선종, 물-투명 세포 선암종, 혼합 세포 선종, 혼합 세포 선암종, 지방선종, 여포성 선종, 여포성 선암종 nos, 잘 분화된 유형의 여포성 선암종, 여포성 선암종 지주형, 미세여포성 선종, 거대여포성 선종, 유두상 및 여포성 선암종, 비캡슐화 경화성 암종, 다발성 내분비 선종, 사구체근접 종양, 부신 피질 선종 nos, 부신 피질 암종, 부신 피질 선종 치밀 세포 유형,부신 피질 선종 심하게 색소침착된 변이체, 부신 피질 선종 투명 세포 유형, 부신 피질 선종 사구층 세포 유형, 부신 피질 선종 혼합 세포 유형, 자궁내막양 선종 nos, 자궁내막양 선종, 경계선 악성종양, 자궁내막양 암종, 자궁내막양 선섬유종 nos, 자궁내막양 선섬유종 경계선 악성종양, 악성 자궁내막양 선섬유종, 부신 및 피부 부속기 신생물, 피부 부속기 선종, 피부 부속기 암종, 한선 선종, 한선 종양 nos, 한선 선암종, 아포크린 선종, 아포크린 선암종, 에크린 선단한선종, 에크린 척수선종, 털낭종, 유두상 수선종, 유두상 시린지선종, 시린지종 nos, 피지 선종, 피지 선암종, 세루미너스 선종, 세루미너스 선암종, 점액표피양 신생물, 점액표피양 종양, 점액표피양 암종, 낭성, 점액성 및 장액성 신생물, 낭선종 nos, 낭선암종 nos, 장액성 낭선종 nos, 장액성 낭선종 경계선 악성종양, 장액성 낭선암종 nos, 유두상 낭선종 nos, 유두상 낭선종 경계선 악성종양, 유두상 낭선암종 nos, 유두상 장액성 낭선종 nos, 유두상 장액성 낭선종 경계선 악성종양, 유두상 장액성 낭선암종, 장액성 표면 유두종 nos, 장액성 표면 유두종 경계선 악성종양, 장액성 표면 유두상 암종, 점액성 낭선종 nos, 점액성 낭선종 경계선 악성종양, 점액성 낭선암종 nos, 유두상 점액성 낭선종 nos, 유두상 점액성 낭선종 경계선 악성종양, 유두상 점액성 낭선암종, 점액성 선종, 점액성 선암종, 복막 가성점액종, 뮤신-생산 선암종, 인환 세포 암종, 전이성 인환 세포 암종, 관, 소엽성 및 수질 신생물, 관내 암종 비침윤성 nos, 침윤성 관 암종, 면포암종, 비침윤성 면포암종 nos, 유방의 소아 암종, 관내 유두종, 비침윤성 관내 유두상 선암종, 낭내 유두상 선종, 비침윤성 낭내 암종, 관내 유두종증 nos, 세동맥관하 유두종증, 수질 암종 nos, 아밀로이드 기질을 동반한 수질 암종, 림프성 기질을 동반한 수질 암종, 소엽성 상피내 암종, 소엽성 암종 nos, 침윤성 소관 암종, 염증성 암종, 유방 파제트병, 파제트병 및 유방의 침윤성 관 암종, 유방외 파제트병, 세엽 세포 신생물, 세엽 세포 선종, 세엽 세포 종양, 세엽 세포 암종, 복합 상피 신생물, 선편평상피 암종, 선림프종, 편평 화생을 동반한 선암종, 연골성 및 골성 화생을 동반한 선암종, 방추 세포 화생을 동반한 선암종, 아포크린성 화생을 동반한 선암종, 흉선종 양성, 흉선종 악성, 특수 생식선 신생물, 성삭-기질 종양, 난포막종 nos, 난포막 세포 암종, 황체종 nos, 과립막 세포 종양 nos, 과립막 세포 종양 악성, 과립막 세포-난포막 세포 종양, 안드로블라스토마 양성, 안드로블라스토마 nos, 악성 안드로블라스토마, 세르톨리-라이디히 세포 종양, 음양모세포종, 세르톨리 세포 암종 nos, 세르톨리 세포 암종, 지질 저장을 갖는 관상 안드로블라스토마, 라이디히 세포 종양 양성, 라이디히 세포 종양 nos, 악성 라이디히 세포 종양, 폐문 세포 종양, 난소의 지질 세포 종양, 부신 휴지 종양, 부신경절종 및 사구 종양, 부신경절종 nos, 악성 부신경절종, 교감성 부신경절종, 부교감성 부신경절종, 경정맥구 종양, 대동맥체 종양, 경동맥 소체 종양, 부신외 부신경절종 nos, 부신외 부신경절종 악성, 크롬친화세포종 nos, 악성 크롬친화세포종, 사구체육종, 사구 종양, 사구맥관종, 모반 및 흑색종, 색소 모반 nos, 악성 흑색종 nos, 결절성 흑색종, 풍선 세포 모반, 풍선 세포 흑색종, 달무리모반, 코의 섬유성 구진, 신경모반, 거대세포 모반, 비색소침착 모반, 무멜라닌 흑색종, 경계 모반, 경계 모반에서의 악성 흑색종, 전암성 흑색종 nos, 전암성 흑색종에서의 악성 흑색종, 허친슨의 멜라닌성 주근깨, 허친슨의 멜라닌성 주근깨에서의 악성 흑색종, 표재 확산성 흑색종, 피내 모반, 복합 모반, 거대 색소 모반, 거대 색소 모반에서의 악성 흑색종, 상피양 및 방추 세포 모반, 상피양 세포 흑색종, 방추 세포 흑색종 nos, 방추 세포 흑색종 유형 a, 방추 세포 흑색종 유형 b, 혼합 상피양 및 방추 세포 흑색종, 청색 모반 nos, 청색 모반 악성, 세포 청색 모반, 연부 조직 종양 및 육종 nos, 연부 조직 종양 양성, 육종 nos, 육종증 nos, 방추 세포 육종, 거대 세포 육종, 소세포 육종, 상피양 세포 육종, 섬유종성 신생물, 섬유종 nos, 섬유육종 nos, 섬유점액종, 섬유점액육종, 골막 섬유종, 골막 섬유육종, 근막 섬유종, 근막 섬유육종, 영아 섬유육종, 탄력섬유종, 공격성 섬유종증, 복부 섬유종증, 결합조직형성 섬유종, 섬유성 조직구종 nos, 비정형 섬유성 조직구종, 악성 섬유성 조직구종, 섬유황색종 nos, 비정형 섬유황색종, 악성 섬유황색종, 피부섬유종 nos, 융기성 피부섬유종, 피부섬유육종 nos, 점액종성 신생물, 점액종 nos, 점액육종, 지방종성 신생물, 지방종 nos, 지방육종 nos, 섬유지방종, 잘 분화된 유형의 지방육종, 섬유점액지방종,점액양 지방육종, 원형 세포 지방육종, 다형성 지방육종, 혼합형 지방육종, 근육내 지방종, 방추 세포 지방종, 혈관근지방종, 혈관근지방육종, 혈관지방종 nos, 혈관지방종 침윤, 골수지방종, 하이버노마, 지방모세포종증, 근종성 신생물, 평활근종 nos, 혈관내 평활근종증, 평활근육종 nos, 상피양 평활근종, 상피양 평활근육종, 세포성 평활근종, 이목 평활근종, 혈관근종, 혈관근육종, 근종, 근육종, 횡문근종 nos, 횡문근육종 nos, 다형성 횡문근육종, 혼합형 횡문근육종, 태아성 횡문근종, 성인성 횡문근종, 배아성 횡문근육종, 폐포성 횡문근육종, 복합 혼합형 및 기질성 신생물, 자궁내막 기질성 육종, 내림프성 기질성 근육증, 선근종, 다형성 선종, 혼합형 종양, 악성 nos, 뮐러 혼합형 종양, 중배엽 혼합형 종양, 중배엽성 신종, 신모세포종 nos, 상피성 신모세포종, 중간엽성 신모세포종, 간모세포종, 암육종 nos, 암육종 배아형, 근상피종, 중간엽종 양성, 중간엽종 nos, 중간엽종 악성, 배아성 육종, 섬유상피성 신생물, 브레너 종양 nos, 브레너 종양, 경계선 악성종양, 브레너 종양 악성, 섬유선종 nos, 소관내 섬유선종 nos, 항문주위 섬유선종, 선섬유종 nos, 장액성 선섬유종, 점액성 선섬유종, 세포성 항문관내 섬유선종, 엽상 낭육종 nos, 악성 엽상 낭육종, 소아 섬유선종, 활막 신생물, 양성 활막종, 활막 육종 nos, 활막 육종 방추 세포 유형, 활막 육종 상피양 세포 유형, 활막 육종 2상 유형, 힘줄 및 무신경세포의 투명 세포 육종, 중피 신생물, 양성 중피종, 악성 중피종, 섬유성 중피종 양성, 섬유성 중피종 악성, 상피양 중피종 양성, 상피양 중피종 악성, 중피종 2상 유형 양성, 중피종 2상 유형 악성, 선종성 종양 nos, 배세포 신생물, 미분화배세포종, 정상피종 nos, 정상피종 역형성 유형, 정세포성 정상피종, 배세포종, 배아성 암종 nos, 내배엽동 종양, 다배아종, 생식선모세포종, 기형종 양성, 기형종 nos, 기형종 악성 nos, 기형암종, 악성 기형종 미분화 유형, 악성 기형종 중간형, 유피낭, 악성 형질전환을 갖는 유피낭, 난소층 nos, 악성 난소층, 기질 카르시노이드, 영양막 신생물, 포상 기태 몰 nos, 침습성 포상 기태 몰스, 융모막암종, 기형종과 조합된 융모막암종, 악성 기형종 영양막종, 중신종, 중신종 양성, 중신 종양, 중신종 악성, 내안검비종, 혈관 종양, 혈관종 nos, 혈관육종, 해면상 혈관종, 정맥 혈관종, 라세미 혈관종, 쿠퍼 세포 육종, 혈관내피종 양성, 혈관내피종 nos, 혈관내피종 악성, 모세혈관종, 근육내 혈관종, 카포시 육종, 혈관각화종, 사마귀양 각화성 혈관종, 혈관주위세포종 양성, 혈관주위세포종 nos, 악성 혈관주위세포종, 혈관섬유종 nos, 혈관모세포종, 림프관 종양, 림프관종 nos, 림프관육종, 모세관 림프관종, 해면 림프관종, 낭성 림프관종, 림프관근종, 림프관근종증, 혈액림프관종, 골종 및 골육종, 골종 nos, 골육종 nos, 연골모세포성 골육종, 섬유모세포성 골육종, 모세혈관확장성 골육종, 골의 파제트병에서의 골육종, 피질근접 골육종, 유골 골종 nos, 골모세포종, 연골종성 신생물, 골연골종, 골연골종증 nos, 연골종 nos,연골종증 nos, 연골육종 nos, 피질근접 연골종, 피질근접 연골육종, 연골모세포종 nos, 악성 연골모세포종, 중간엽 연골육종, 연골점액양 섬유종, 거대 세포 종양, 골의 거대 세포 종양 nos, 악성 골의 거대 세포 종양, 연질부의 거대 세포 종양 nos, 연질부의 악성 거대 세포 종양, 기타 골 종양, 유잉 육종, 장골의 사기질종, 골화 섬유종, 치원성 종양, 치원성 종양 양성, 치원성 종양 nos, 치원성 종양 악성, 상아질종, 시멘트종 nos, 시멘트질모세포종 양성, 시멘트화 섬유종, 거대 시멘트종, 치아종 nos, 화합물 치아종, 복합 치아종, 사기질모세포성 섬유-치아종, 사기질모세포성 치아육종, 선종양 치원성 종양, 석회화 치원성낭, 사기질모세포종 nos, 악성 사기질모세포종, 치아사기질모세포종, 편평 치원성 종양, 치원성 점액종, 치원성 섬유종 nos, 사기질모세포 섬유종, 사기질모세포 섬유육종, 석회화 상피 치원성 종양, 기타 종양, 두개인두종, 송과체종, 송과체세포종, 송과체모세포종, 멜라닌성 신경외배엽 종양, 척삭종, 신경교종, 악성 신경교종, 대뇌 신경교종증, 혼합 신경교종, 뇌실막하 신경교종, 뇌실막하 거대 세포 성상세포종, 맥락총 유두종 nos, 악성 맥락총 유두종, 상의세포종 nos, 상의세포종 역형성 유형, 유두상 상의세포종, 점액유두상 상의세포종, 성상세포종 nos, 성상세포종, 역형성 유형, 원형질성 성상세포종, 팽대세포성 성상세포종, 원섬유성 성상세포종, 모양세포성 성상세포종, 해면모세포종 nos, 극성 해면모세포종, 성상모세포종, 교모세포종 nos, 거대 세포 아교모세포종, 육종 성분을 갖는 교모세포종, 원시 극성 해면모세포종, 핍지교종 nos, 핍지교종, 역형성 유형, 핍지교모세포종, 수모세포종 nos, 결합조직형성 수모세포종, 수질근모세포종, 소뇌 육종 nos, 단세포성 육종, 신경상피종성 신생물, 신경절신경종, 신경절신경모세포종, 신경절신경종증, 신경모세포종 nos, 수질상피종 nos, 기형 수질상피종, 신경상피종 nos, 해면신경모세포종, 신경절교종, 신경세포종, 백선 종양, 망막모세포종 nos, 망막모세포종 분화형, 망막모세포종 미분화형, 후각 신경원성 종양, 감각신경세포종, 감각신경모세포종, 감각신경상피종, 수막종, 수막종 nos, 수막종증 nos, 악성 수막종, 수막종성 수막종, 섬유성 수막종, 사종체 수막종, 혈관종성 수막종, 혈관모세포성 수막종, 혈관주위세포성 수막종, 이행성 수막종, 유두상 수막종, 수막 육종증, 신경초 종양, 신경섬유종 nos, 신경섬유종증 nos, 신경섬유육종, 멜라닌성 신경섬유종, 총상 신경섬유종, 신경초종 nos, 신경종증, 악성 신경초종, 신경종 nos, 과립 세포 종양 및 폐포 연부 육종, 과립상 세포 종양 nos, 과립상 세포 종양 악성, 폐포 연부 육종, 림프종 nos 또는 미만성, 림프종성 종양 양성, 악성 림프종 nos, 악성 림프종 비 호지킨 유형, 악성 림프종 미분화 세포 유형 nos, 악성 림프종 줄기 세포 유형, 악성 림프종 선천성 세포 유형 nos, 림프육종 nos, 악성 림프종 림프형질세포양 유형, 악성 림프종 면역모세포성 유형, 악성 림프종 혼합 림프구성-조직구성 nos, 악성 림프종 중심모세포성-중심세포성 미만성, 악성 림프종 여포성 중심 세포 nos, 악성 림프종 림프구성 잘 분화된 nos, 악성 림프종 림프구성 중간 분화 nos, 악성 림프종 중심세포성, 악성 림프종 여포성 중심 세포 절단된 nos, 악성 림프종 림프구성 불량하게 분화된 nos, 전림프구성 림프육종, 악성 림프종 중심모세포성 유형 nos, 악성 림프종 여포성 중심 세포 비절단된 nos, 망상육종, 망상육종 nos, 다형성 망상육종 세포 유형, 결절성 망상육종, 호지킨병, 호지킨병 nos, 호지킨병 림프구성 우세형, 호지킨병 혼합 세포충실성, 호지킨병 림프구성 고갈 nos, 호지킨병 림프구성 고갈 미만성 섬유증, 호지킨병 림프구성 고갈 망상 유형, 호지킨병 결절성 경화증 nos, 호지킨병 결절성 경화증 세포 상, 호지킨 파라육아종, 호지킨 육아종, 호지킨 육종, 결절성 또는 여포성 림프종, 악성 림프종 결절성 nos, 악성 림프종 혼합 림프구성-조직구성 결절, 악성 림프종 중심모세포-중심세포성 여포성, 악성 림프종 림프구성 고분화 결절성, 악성 림프종 림프구성 중간 분화 결절성, 악성 림프종 여포 중심 세포 절단된 여포성, 악성 림프종 림프구성 불량 분화 결절성, 악성 림프종 중심모세포형 여포성, 악성 림프종 여포성 중심 세포 비절단된 여포성, 균상 식육종, 균상 식육종, 세자리병, 기타 세망내피 신생물, 소교세포종, 악성 조직구증, 조직구성 수질 세망증, 레터-스위병, 형질 세포 종양, 형질 세포 골수종, 형질 세포 종양 양성, 형질세포종 nos, 형질 세포 종양 악성, 비만 세포 종양, 비만세포종 nos, 비만 세포 육종, 악성 비만세포증, 버킷 종양, 버킷 종양, 백혈병, 백혈병 nos, 백혈병 nos, 급성 백혈병 nos, 아급성 백혈병 nos, 만성 백혈병 nos, 무백혈병성 백혈병 nos, 화합물 백혈병, 화합물 백혈병, 림프성 백혈병, 림프성 백혈병 nos, 급성 림프성 백혈병, 아급성 림프성 백혈병, 만성 림프성 백혈병, 무백혈병성 림프성 백혈병, 전림프구성 백혈병, 형질 세포 백혈병, 형질 세포 백혈병, 적백혈병, 급성 적혈병, 만성 적혈병, 림프육종 세포 백혈병, 림프육종 세포 백혈병, 골수성 백혈병, 골수성 백혈병 nos, 급성 골수성 백혈병, 아급성 골수성 백혈병, 만성 골수성 백혈병, 무백혈병성 골수성 백혈병, 호중구성 백혈병, 급성 전골수구성 백혈병, 호염기구성 백혈병, 호염기구성 백혈병, 호산구성 백혈병, 호산구성 백혈병, 단핵구성 백혈병, 단핵구성 백혈병 nos, 급성 단핵구성 백혈병, 아급성 단핵구성 백혈병, 만성 단핵구성 백혈병, 무백혈병성 단핵구성 백혈병, 기타 백혈병, 비만 세포 백혈병, 거핵구성 백혈병, 거핵구성 골수증, 골수성 육종, 털세포 백혈병, 기타 골수증식성 및 림프증식성 장애, 진성 다혈구혈증, 급성 범골수증, 만성 골수증식성 질환, 골수 화생을 동반한 골수경화증, 특발성 혈소판혈증, 만성 림프증식성 질환을 포함하는 군으로부터 선택된다.
본 발명의 한 실시양태에서, 질환은 췌장의 종양, 췌장 선암종, 췌두, 췌장 몸통, 췌장 꼬리, 췌장관, 랑게르한스섬, 췌장의 경부, 전립선의 종양, 전립선 선암종, 전립선선, 신경내분비 종양, 유방암, 유방의 중심 부분의 종양, 유방의 상부 내부 사분면, 유방의 하부 내부 사분면, 유방의 상부 외부 사분면, 유방의 하부 외부 사분면, 유방의 젖샘가쪽 돌기, 유방의 중첩 병변, 유방의 소아 암종, 부갑상선의 종양, 골수종, 폐암, 소세포 폐암, 비소세포 폐암, 주기관지, 상엽 폐, 중엽 폐, 하엽 폐의 종양, 결장직장 암종, 상행 결장, 결장의 간 만곡, 횡행 결장, 결장의 비장 만곡, 하행 결장, S자형 결장, 결장의 중첩 병변, 소장의 종양, 간의 종양, 간 세포 선종, 간세포성 암종, 간담관종, 조합 간세포성 암종 및 담관암종, 간모세포종, 난소 암종, 육종, 골육종, 섬유육종, 위장 기질 종양, 위장관, 위 암종, 갑상선 암종, 수질성 갑상선 암종, 갑상선, 신세포 암종, 신우, 방광 종양, 방광 암종, 삼각 방광 종양, 방광 종양, 측벽 방광 종양, 후방벽 방광 종양, 요관 구멍 종양, 요추 종양, 방광 중첩 병변, 기저 세포 암종, 기저 세포 신생물, 기저 세포 종양, 기저 세포 암종, 다중심성 기저 세포 암종, 기저세포양 암종, 기저 세포 선종, 편평 세포 암종, 구강 편평 세포 암종, 후두의 편평 세포 암종, 자궁경부 암종, 자궁외막의 종양, 자궁경부의 중첩 병변의 종양, 자궁경부의 종양, 자궁 협부의 종양, 자궁의 종양, 난소의 종양, 자궁경부 식도의 종양, 흉부 식도의 종양, 복부 식도의 종양, 식도의 상부 1/3의 종양, 식도의 중간 1/3의 종양, 식도의 하부 1/3의 종양, 식도의 중첩 병변의 종양, 자궁내막 암종, 두경부암, 림프종, 악성 중피종, 중피 신생물, 중피종, 섬유성 중피종, 섬유성 중피종, 상피양 중피종, 상피양 중피종, 십이지장 암종, 신경내분비 종양, 폐의 신경내분비 종양, 췌장의 신경내분비 종양, 앞창자의 신경내분비 종양, 중창자의 신경내분비 종양, 뒷창자의 신경내분비 종양, 위장췌장 신경내분비 종양, 신경내분비 암종, 유방의 신경내분비 종양, 난소의 신경내분비 종양, 고환암, 흉선 암종, 위 종양, 위 안저, 위 몸통, 위문, 유문, 위의 소만곡, 위의 대만곡, 위의 중첩 병변, 부신경절종, 신경절종, 흑색종, 악성 흑색종, 결절성 흑색종, 무멜라닌 흑색종, 표재 확산성 흑색종, 상피양 세포 흑색종, 방추 세포 흑색종, 혼합 상피양 및 방추 세포 흑색종을 포함하는 군으로부터 선택된다.
추가 실시양태에서, 상기 언급된 적응증은 외부 윗입술, 외부 아랫입술, 외부 입술 nos, 윗입술 점막, 아랫입술 점막, 점막 입술 nos, 입술 연결부, 입술의 중첩 병변, 혓바닥 nos, 배측 표면 혀 nos, 혀의 가장자리, 혀의 복부 표면 nos, 혀의 전방 2/3 nos, 설편도, 혀의 중첩 병변, 혀 nos, 윗잇몸, 아랫잇몸, 잇몸 nos, 전방 구강저, 외측 구강저, 구강저의 중첩 병변, 구강저 nos, 경구개, 연구개 nos, 목젖, 구개의 중첩 병변, 구개 nos, 협부 점막, 구강의 전정부, 구치후부, 구강의 다른 및 상세불명의 부분의 중첩 병변, 구강 nos, 이하선, 상악하선, 설하선, 주요 타액선의 중첩 병변, 주요 타액선 nos, 편도와, 편도기둥, 편도의 중첩 병변, 편도 nos, 판막, 후두개의 전방 표면, 외측 벽 구인두, 후방 벽 구인두, 인두틈, 구인두의 중첩 병변, 구인두 nos, 비인두의 상부 벽, 후방 벽 비인두, 외측 벽 비인두, 전방 벽 비인두, 비인두의 중첩 병변, 비인두 nos, 이상동, 후륜상연골부, 피열후두개 주름의 하인두 측면, 후벽 하인두, 하인두의 중첩 병변, 하인두 nos, 인두 nos, 후인두, 왈데이어 고리, 입술 구강 및 인두의 중첩 병변, 경부 식도, 흉부 식도, 복부 식도, 식도의 상부 1/3, 식도의 중간 1/3, 식도의 하부 1/3, 식도의 중첩 병변, 식도 nos, 심장 nos, 안저 위, 위 몸통, 위 문, 유문, 위의 소만곡 nos, 위의 대만곡 nos, 위의 중첩 병변, 위 nos, 십이지장, 공장, 회장, 멕켈 게실, 소장의 중첩 병변, 소장 nos, 맹장, 충수, 상행 결장, 결장의 간 만곡, 횡행 결장, 결장의 비장 만곡, 하행 결장, S자형 결장, 결장의 중첩 병변, 결장 nos, 직장구불결장 이행부, 직장 nos, 항문 nos, 항문관, 배설촉진 구역, 직장 항문 및 항문관의 중첩 병변, 간, 간내 담관, 담낭, 간외 담관, 바터 팽대부, 담도의 중첩 병변, 담도 nos, 췌두, 췌장 몸통, 꼬리 췌장, 췌장관, 랑게르한스섬, 췌장의 경부, 췌장의 중첩 병변, 췌장 nos, 장관 nos, 소화기계의 중첩 병변, 위장관 nos, 비강, 중이, 상악동, 사골 부비동, 전두동, 접형동, 부속 부비동의 중첩 병변, 부속 부비동 nos, 성문염, 성문상염, 성문하염, 후두 연골, 후두의 중첩 병변, 후두 nos, 기관, 주기관지, 상엽 폐, 중엽 폐, 하엽 폐, 폐의 중첩 병변, 폐 nos, 흉선, 심장, 전종격동, 후종격동, 중격동 nos, 흉막 nos, 심장 종격 및 흉막의 중첩 병변, 상기도 nos, 호흡기계 및 흉곽내 기관의 중첩 병변, 호흡기도 nos, 상지 긴 골 관절, 상지 짧은 골 관절, 하지 장골 관절, 하지 단골 관절, 골 관절 및 사지의 관절 연골의 중첩 병변, 골지 nos, 두개골 및 안면골, 하악, 척주, 흉골 쇄골, 골반골, 골 관절 및 관절 연골의 중첩 병변, 골 nos, 혈액, 골수, 비장, 세망내피계 nos, 조혈계 nos, 입술 피부 nos, 안검 nos, 외이, 얼굴 피부, 두피 경부 피부, 몸통 피부, 사지 상부 피부, 사지 하부 피부, 말초 신경 두경부, 말초 신경 어깨 팔, 말초 신경 하지, 말초 신경 흉곽, 말초 신경 복부, 말초 신경 골반, 말초 신경 몸통, 말초 신경 및 자율 신경계의 중첩 병변, 자율 신경계 nos, 복막후강, 복막, 복막 nos, 복막후강 및 복막의 중첩 병변, 결합 조직 머리, 결합 조직 팔, 결합 조직 다리, 결합 조직 흉부, 결합 조직 복부, 결합 조직 골반, 결합 조직 몸통 nos, 결합 피하 및 다른 연부 조직의 중첩 병변, 결합 조직 nos, 유두, 유방의 중심 부분, 유방의 상부 내부 사분면, 유방의 하부 내부 사분면, 유방의 상부 외부 사분면, 유방의 하부 외부 사분면, 유방의 젖샘가쪽 돌기, 유방의 중첩 병변, 유방 nos, 대음순, 소음순, 음핵, 외음부의 중첩 병변, 외음부 nos, 질 nos, 내자궁경부, 외자궁경부, 자궁경부의 중첩 병변, 자궁경부, 자궁 협부, 자궁내막, 자궁근층, 자궁 안저, 자궁체부의 중접 병변, 자궁체부, 자궁 nos, 난소, 난관, 광인대, 원형 인대, 자궁주위조직, 자궁 부속기, 울피안 소체, 여성 생식 기관의 중첩 병변, 여성 생식관 nos, 음경꺼풀, 음경 귀두, 음경 몸체, 음경의 중첩 병변, 음경 nos, 전립선, 비후성 고환, 하행성 고환, 고환 nos, 부고환, 정삭, 음낭 nos, 질막, 남성 생식 기관의 중첩 병변, 남성 생식 기관 nos, 신장 nos, 신우, 요관, 삼각 방광, 돔 방광, 측벽 방광, 후방벽 방광, 요관 구멍, 두드러기, 방광의 중첩 병변, 방광 nos, 요도, 부요도선, 비뇨기관의 중첩 병변, 비뇨기계 nos, 결막, 각막 nos, 망막, 맥락막, 모양체, 누선, 안와 nos, 눈 및 부속기의 중첩 병변, 눈 nos, 뇌 수막, 척수막, 수막 nos, 뇌, 전두엽, 측두엽, 두정엽, 후두엽, 심실 nos, 소뇌 nos, 뇌간, 뇌의 중첩 병변, 뇌 nos, 척수, 말총, 후각 신경, 시신경, 청신경, 뇌신경 nos, 뇌 및 중추 신경계의 중첩 병변, 신경계 nos, 갑상선, 부신 피질, 부신 수질, 부신 nos, 부갑상선, 뇌하수체, 두개인두관, 송과선, 경동맥 소체, 대동맥체, 내분비선 및 관련 구조의 중첩 병변, 내분비선 nos, 두부 안면 또는 경부 nos, 흉곽 nos, 복부 nos, 골반 nos, 상지 nos, 하지 nos, 다른 불명확한 부위, 불명확한 부위의 중첩 병변, 림프절 안면 두경부, 흉곽내 림프절, 복강내 림프절, 림프절 겨드랑이 팔, 림프절 서혜부 다리, 림프절 골반, 다중 영역의 림프절, 림프절 nos, 원인불명 원발성 부위를 포함하는 군으로부터 선택되는 기관 및 조직에서 발생할 수 있다.
본원에 개시 및 청구된 화합물로 치료된 대상체는 다른 비-외과적 항증식성 (예를 들어, 항암) 약물 요법과 조합하여 치료될 수 있다. 한 실시양태에서, 화합물은 항암 화합물, 예컨대 세포증식억제 화합물과 조합하여 투여될 수 있다. 세포증식억제 화합물은 세포 성장 및/또는 증식을 억제하는 화합물 (예를 들어, 소분자, 핵산 또는 단백질)이다. 일부 실시양태에서, 세포증식억제 화합물은 종양의 악성 세포에 대해 지시된다. 또 다른 실시양태에서, 세포증식억제 화합물은 혈관 평활근 세포 또는 섬유모세포의 성장 및/또는 증식을 억제하는 것이다.
본원에 개시 및 청구된 화합물과 조합하여 사용되는 적합한 항증식성 약물 또는 세포증식억제 화합물은 항암 약물을 포함한다. 사용될 수 있는 수많은 항암 약물이 널리 공지되어 있고, 아시비신; 아클라루비신; 아코다졸 히드로클로라이드; 아크로닌; 아도젤레신; 알데스류킨; 알트레타민; 암보마이신; 아메탄트론 아세테이트; 아미노글루테티미드; 암사크린; 아나스트로졸; 안트라마이신; 아스파라기나제; 아스페를린; 아자시티딘; 아제테파; 아조토마이신; 바티마스타트; 벤조데파; 비칼루타미드; 비산트렌 히드로클로라이드; 비스나피드 디메실레이트; 비젤레신; 블레오마이신 술페이트; 브레퀴나르 소듐; 브로피리민; 부술판; 칵티노마이신; 칼루스테론; 카라세미드; 카르베티머; 카르보플라틴; 카르무스틴; 카루비신 히드로클로라이드; 카르젤레신; 세데핀골; 클로람부실; 시롤레마이신; 시스플라틴; 클라드리빈; 크리스나톨 메실레이트; 시클로포스파미드; 시타라빈; 다카르바진; 닥티노마이신; 다우노루비신 히드로클로라이드; 데시타빈; 덱스오르마플라틴; 데자구아닌; 데자구아닌 메실레이트; 디아지쿠온; 도세탁셀; 독소루비신; 독소루비신 히드로클로라이드; 드롤록시펜; 드롤록시펜 시트레이트; 드로모스타놀론 프로피오네이트; 두아조마이신; 에다트렉세이트; 에플로르니틴 히드로클로라이드; 엘사미트루신; 엔로플라틴; 엔프로메이트; 에피프로피딘; 에피루비신 히드로클로라이드; 에르불로졸; 에소루비신 히드로클로라이드; 에스트라무스틴; 에스트라무스틴 포스페이트 소듐; 에타니다졸; 에토포시드; 에토포시드 포스페이트; 에토프린; 파드로졸 히드로클로라이드; 파자라빈; 펜레티니드; 플록수리딘; 플루다라빈 포스페이트; 플루오로우라실; 플루오로시타빈; 포스퀴돈; 포스트리에신 소듐; 겜시타빈; 겜시타빈 히드로클로라이드; 히드록시우레아; 이다루비신 히드로클로라이드; 이포스파미드; 일모포신; 인터페론 알파-2a; 인터페론 알파-2b; 인터페론 알파-n1; 인터페론 알파-n3; 인터페론 베타-I a; 인터페론 감마-I b; 이프로플라틴; 이리노테칸 히드로클로라이드; 란레오티드 아세테이트; 레트로졸; 류프롤리드 아세테이트; 리아로졸 히드로클로라이드; 로메트렉솔 소듐;로무스틴; 로속산트론 히드로클로라이드; 마소프로콜; 메이탄신; 메클로레타민 히드로클로라이드; 메게스트롤 아세테이트; 멜렌게스트롤 아세테이트; 멜팔란; 메노가릴; 메르캅토퓨린; 메토트렉세이트; 메토트렉세이트 소듐; 메토프린; 메투레데파; 미틴도미드; 미토카르신; 미토크로민; 미토길린; 미토말신; 미토마이신; 미토스퍼; 미토탄; 미톡산트론 히드로클로라이드; 미코페놀산; 니라파립; 노코다졸; 노갈라마이신; 올라파립; 오르마플라틴; 옥시수란; 파클리탁셀; 페가스파르가제; 펠리오마이신; 펜타무스틴; 페플로마이신 술페이트; 페르포스파미드; 피포브로만; 피포술판; 피록산트론 히드로클로라이드; 플리카마이신; 플로메스탄; 포르피머 소듐; 포르피로마이신; 프레드니무스틴; 프로카르바진 히드로클로라이드; 퓨로마이신; 퓨로마이신 히드로클로라이드; 피라조푸린; 리보프린; 로글레티미드; 루카파립; 사핀골; 사핀골 히드로클로라이드; 세무스틴; 심트라젠; 스파르포세이트 소듐; 스파르소마이신; 스피로게르마늄 히드로클로라이드; 스피로무스틴; 스피로플라틴; 스트렙토니그린; 스트렙토조신; 술로페누르; 탈라조파립; 탈리소마이신; 탁솔; 탁소테레; 테코갈란 소듐; 테가푸르; 텔록산트론 히드로클로라이드;테모포르핀; 테니포시드; 테록시론; 테스토락톤; 티아미프린; 티오구아닌; 티오테파; 티아조푸린; 티라파자민; 토포테칸 히드로클로라이드; 토레미펜 시트레이트; 트레스톨론 아세테이트; 트리시리빈 포스페이트; 트리메트렉세이트; 트리메트렉세이트 글루쿠로네이트; 투불로졸 히드로클로라이드; 우라실 머스타드; 우레데파; 바프레오티드; 벨라파립; 베르테포르핀; 빈블라스틴 술페이트; 빈크리스틴 술페이트; 빈데신; 빈데신 술페이트; 비네피딘 술페이트; 빈글리시네이트 술페이트; 빈류로신 술페이트; 비노렐빈 타르트레이트; 빈로시딘 술페이트; 빈졸리딘 술페이트; 보로졸; 제니플라틴; 지노스타틴; 및 조루비신 히드로클로라이드를 포함하나 이에 제한되지는 않는다.
다른 항암 약물은 20-에피-1,25 디히드록시비타민 D3; 5-에티닐우라실; 아비라테론; 아실풀벤; 아데시페놀; 아도젤레신; ALL-TK 길항제; 암바무스틴; 아미독스; 아미포스틴; 아미노레불린산; 암루비신; 아나그렐리드; 안드로그라폴리드; 혈관신생 억제제; 길항제 D; 길항제 G; 안타렐릭스; 항-배방화 형태발생 단백질-1; 항에스트로겐; 안티네오플라스톤; 안티센스 올리고뉴클레오티드; 아피디콜린 글리시네이트; 아폽토시스 유전자 조정제; 아폽토시스 조절제; 아퓨린산; ara-CDP-DL-PTBA; 아르기닌 데아미나제; 아술라크린; 아타메스탄; 아트리무스틴; 악시나스타틴 1; 악시나스타틴 2; 악시나스타틴 3; 아자세트론; 아자톡신; 아자티로신; 바카틴 III 유도체; 발라놀; 바티마스타트; BCR/ABL 길항제; 벤조클로린; 벤조일스타우로스포린; 베타 락탐 유도체; 베타-알레틴; 베타클라마이신 B; 베툴린산; bFGF 억제제; 비스아지리디닐스페르민; 비스나피드; 비스트라텐 A; 브레플레이트; 부도티탄; 부티오닌 술폭시민; 칼시포트리올; 칼포스틴 C; 캄프토테신 유도체; 카나리폭스 IL-2; 카페시타빈; 카르복스아미드-아미노-트리아졸; 카르복시아미도트리아졸; 카레스트(CaRest) M3; CARN 700; 연골 유래 억제제; 카세인 키나제 억제제 (ICOS); 카스타노스페르민; 세크로핀 B; 세트로렐릭스; 클로린; 클로로퀴녹살린 술폰아미드; 시카프로스트; 시스-포르피린; 클로미펜 유사체; 클로트리마졸; 콜리스마이신 A; 콜리스마이신 B; 콤브레타스타틴 A4; 콤브레타스타틴 유사체; 코나게닌; 크람베시딘 816; 크리스나톨; 크립토피신 8; 크립토피신 A 유도체; 쿠라신 A; 시클로펜탄트라퀴논; 시클로플라탐; 시페마이신; 시타라빈 옥포스페이트; 세포용해 인자; 시토스타틴; 다클릭시맙; 데히드로디뎀닌 B; 데슬로렐린; 덱스이포스파미드; 덱스라족산; 덱스베라파밀; 디뎀닌 B; 디독스; 디에틸노르스페르민; 디히드로-5-아자시티딘; 디히드로탁솔, 9-; 디옥사마이신; 디페닐 스피로무스틴; 도코산올; 돌라세트론; 독시플루리딘; 드로나비놀; 두오카르마이신 SA; 에브셀렌; 에코무스틴; 에델포신; 에드레콜로맙; 에플로미틴; 엘레멘; 에미테푸르; 에피루비신; 에프리스테리드; 에스트라무스틴 유사체; 에스트로겐 효능제; 에스트로겐 길항제; 에타니다졸; 에토포시드 포스페이트; 엑세메스탄; 필그라스팀; 피나스테리드; 플라보피리돌; 플레젤라스틴; 플루아스테론; 플루다라빈; 플루오로다우노루니신 히드로클로라이드; 포르페니멕스; 포르메스탄; 포테무스틴; 가돌리늄 텍사피린; 질산갈륨; 갈로시타빈; 가니렐릭스; 젤라티나제 억제제; 글루타티온 억제제; 헵술팜; 헤레귤린; 헥사메틸렌 비스아세트아미드; 히페리신; 이반드론산; 이독시펜; 이드라만톤; 일모포신; 일로마스타트; 이미다조아크리돈; 이미퀴모드; 면역자극 펩티드; 인슐린-유사 성장 인자-I 수용체 억제제; 인터페론 효능제; 인터페론; 인터류킨; 이오벤구안; 아이오도독소루비신; 이포메아놀, 4-; 이리노테칸; 이로플락트; 이르소글라딘; 이소벤가졸; 이소호모할리콘드린 B; 이타세트론; 자스플라키놀리드; 카할랄리드 F; 라멜라린-N 트리아세테이트; 란레오티드; 레이나마이신; 레노그라스팀; 렌티난 술페이트; 렙톨스타틴; 백혈병 억제 인자; 백혈구 알파 인터페론; 류프롤리드 + 에스트로겐 + 프로게스테론; 류프로렐린; 레바미솔; 리아로졸; 선형 폴리아민 유사체; 친지성 디사카라이드 펩티드; 친지성 백금 화합물; 리소클리나미드 7; 로바플라틴; 롬브리신; 로메트렉솔; 로니다민; 로속산트론; 로바스타틴; 록소리빈; 루르토테칸; 루테튬 텍사피린; 리소필린; 용해 펩티드; 마이탄신; 만노스타틴 A; 마리마스타트; 마소프로콜; 마스핀; 마트릴리신 억제제; 매트릭스 메탈로프로테이나제 억제제; 메르바론; 메테렐린; 메티오니나제; 메토클로프라미드; MIF 억제제; 미페프리스톤;밀테포신; 미리모스팀; 미스매치된 이중 가닥 RNA; 미토구아존; 미토락톨; 미토마이신 유사체; 미토나피드; 미토톡신 섬유모세포 성장 인자-사포린; 모파로텐; 몰그라모스팀; 모노클로날 항체, 인간 융모성 고나도트로핀; 모노포스포릴 지질 A + 미오박테리움 세포벽 sk; 모피다몰; 다중 약물 내성 유전자 억제제; 다중 종양 억제자 1-기반 요법; 머스타드 항암 화합물; 미카퍼옥시드 B; 미코박테리아 세포벽 추출물; 미리아포론; N-아세틸디날린; N-치환된 벤즈아미드; 나파렐린; 나그레스팁; 날록손 + 펜타조신; 나파빈; 나프테르핀; 나르토그라스팀; 네다플라틴; 네모루비신; 네리드론산; 중성 엔도펩티다제; 닐루타미드; 니사마이신; 산화질소 조정제; 니트록시드 항산화제; 니트룰린; O6-벤질구아닌; 옥트레오티드; 오키세논; 올리고뉴클레오티드; 오나프리스톤; 온단세트론; 온단세트론; 오라신; 경구 시토카인 유도제; 오사테론; 옥살리플라틴; 옥사우노마이신; 파클리탁셀 유사체; 파클리탁셀 유도체; 팔라우아민; 팔미토일리족신; 파미드론산; 파낙시트리올; 파노미펜; 파라박틴; 파젤립틴; 페가스파르가제; 펠데신; 펜토산 폴리술페이트 소듐; 펜토스타틴; 펜트로졸; 퍼플루브론; 퍼포스파미드; 페릴릴 알콜; 페나지노마이신; 페닐아세테이트; 포스파타제 억제제; 피시바닐; 필로카르핀 히드로클로라이드; 피라루비신; 피리트렉심; 플라세틴 A; 플라세틴 B; 플라스미노겐 활성화제 억제제; 백금 착물; 백금 화합물; 백금-트리아민 착물; 포르피머 소듐; 포르피로마이신; 프로필 비스-아크리돈; 프로스타글란딘 J2; 프로테아솜 억제제; 단백질 A-기반 면역 조정제; 단백질 키나제 C 억제제; 단백질 키나제 C 억제제, 미세조류; 단백질 티로신 포스파타제 억제제; 퓨린 뉴클레오시드 포스포릴라제 억제제; 푸르푸린; 피라졸로아크리딘; 피리독실화 헤모글로빈 폴리옥시에틸렌 접합체; raf 길항제; 랄티트렉세드; 라모세트론; ras 파르네실 단백질 트랜스퍼라제 억제제; ras 억제제; ras-GAP 억제제; 탈메틸화된 레텔립틴; 레늄 Re 186 에티드로네이트; 리족신; 리보자임; RII 레틴아미드; 로히투킨; 로무르티드; 로퀴니멕스; 루비기논 B1; 루복실; 사인토핀; SarCNU; 사르코피톨 A; 사르그라모스팀; Sdi 1 모방체; 노쇠 유래 억제제 1; 센스 올리고뉴클레오티드; 신호 전달 억제제; 신호 전달 조정제; 단일 쇄 항원 결합 단백질; 시조푸란; 소부족산; 소듐 보로캅테이트; 소듐 페닐아세테이트; 솔베롤; 소마토메딘 결합 단백질; 소네르민; 스파르포스산; 스피카마이신 D; 스피로무스틴; 스플레노펜틴; 스폰지스타틴 1; 스쿠알라민; 줄기 세포 억제제; 줄기-세포 분열 억제제; 스티피아미드; 스트로멜리신 억제제; 술피노신; 초활성 혈관활성 장 펩티드 길항제; 수라디스타; 수라민; 스와인소닌; 합성 글리코사미노글리칸; 탈리무스틴; 타목시펜 메티오디드; 타우로무스틴; 타자로텐; 테코갈란 소듐; 테가푸르; 텔루라피릴륨; 텔로머라제 억제제; 테모졸로미드; 테트라클로로데카옥시드; 테트라조민; 탈리블라스틴; 탈리도미드; 티오코랄린; 트롬보포이에틴; 트롬보포이에틴 모방체; 티말파신; 티모포이에틴 수용체 효능제; 티모트리난; 갑상선 자극 호르몬; 주석 에틸 에티오푸르푸린; 티타노센 디클로라이드; 톱센틴; 토레미펜; 전능 줄기 세포 인자; 번역 억제제; 트레티노인; 트리아세틸우리딘; 트리시리빈; 트로피세트론; 투로스테리드; 티로신 키나제 억제제; 티르포스틴; UBC 억제제; 우베니멕스; 비뇨생식동-유래 성장 억제 인자; 우로키나제 수용체 길항제; 바리올린 B; 벡터 시스템, 적혈구 유전자 요법; 벨라레솔; 베라민; 베르딘; 비노렐빈; 빈크살틴; 비탁신; 자노테론; 질라스코르브; 및 지노스타틴 스티말라머를 포함하나 이에 제한되지는 않는다.
본원에 개시 및 청구된 화합물은 또한 하기 치료제 중 임의의 것과 조합하여 사용될 수 있다:
결함있는 DNA-손상 복구를 갖는 표적화 암에 지시된 화학요법제의 부류인 폴리 (ADP-리보스) 폴리머라제 (PARP)의 억제제와 조합된 요법 (문헌 [Yuan, et al., Expert Opin Ther Pat, 2017, 27: 363]). 이러한 PARP 억제제는 올라파립, 루파카립, 벨라파립, 니라파립, 탈라조파립, 파미파립, 이니파립, E7449 및 A-966492를 포함하나 이에 제한되지는 않는다.
예를 들어, 핵 인자-카파B 신호전달과 같은 DNA 단일 및 이중 가닥 파괴의 복구를 유도하는 신호전달 경로 및 메카니즘의 억제제와 조합된 요법 (문헌 [Pilie, et al., Nat Rev Clin Oncol, 2019, 16: 81; Zhang, et al., Chin J Cancer, 2012, 31: 359]). 이러한 억제제는 ATM 및 ATR 키나제, 체크포인트 키나제 1 및 2, DNA-의존성 단백질 키나제 및 WEE1 키나제의 억제제를 포함하나 이에 제한되지는 않는다 (문헌 [Pilie, et al., Nat Rev Clin Oncol, 2019, 16: 81]).
면역조정제 (문헌 [Khalil, et al., Nat Rev Clin Oncol, 2016, 13: 394]), 암 백신 (문헌 [Hollingsworth, et al., NPJ Vaccines, 2019, 4: 7]), 면역 체크포인트 억제제 (예를 들어, PD-1, PD-L1, CTLA-4-억제제) (문헌 [Wei, et al., Cancer Discov, 2018, 8: 1069]), 시클린-D-키나제 4/6 억제제 (문헌 [Goel, et al., Trends Cell Biol, 2018, 28: 911]), 종양 세포 및/또는 전이에 결합할 수 있고 항체-의존성 세포성 세포독성 (ADCC)을 유도할 수 있는 항체 (문헌 [Kellner, et al., Transfus Med Hemother, 2017, 44: 327]), T 세포- 또는 NK 세포 연관체 (예를 들어, 이중특이적 항체) (문헌 [Yu, et al., J Cancer Res Clin Oncol, 2019, 145: 941]), 확장된 자가 또는 동종 면역 세포 (예를 들어, 키메라 항원 수용체 T (CAR-T) 세포)를 사용하는 세포 요법 (문헌 [Khalil, et al., Nat Rev Clin Oncol, 2016, 13: 394])과 조합된 요법. 면역 체크포인트 억제제는 니볼루맙, 이필리무맙, 펨브롤리주맙, 아테졸리주맙, 아벨루맙, 두르발루맙 및 세미플리맙을 포함하나 이에 제한되지는 않는다.
본 발명에 따르면, 화합물은 다른 항암 화합물 전에, 동시에 또는 후에 투여될 수 있다. 투여 스케줄은 상이한 작용제를 교대 방식으로 투여하는 것을 수반할 수 있다. 다른 실시양태에서, 화합물은 다른 요법으로의 치료 전 및 동안, 또는 동안 및 후에, 또는 전 및 후에 전달될 수 있다. 일부 경우, 화합물은 다른 항증식 치료의 투여 24시간 초과 전에 투여된다. 다른 실시양태에서, 1종 초과의 항증식 요법이 대상체에게 투여될 수 있다. 예를 들어, 대상체는 수술 및 적어도 1종의 다른 항증식성 화합물 둘 다와 조합하여 본 발명의 화합물을 받을 수 있다. 대안적으로, 화합물은 1종 초과의 항암 약물과 조합하여 투여될 수 있다.
한 실시양태에서, 본 발명의 화합물은 FAP를 과다발현하는 세포 및 조직을 검출하는데 사용되며, 여기서 이러한 검출은 검출가능한 표지를 본 발명의 화합물, 바람직하게는 검출가능한 방사성핵종에 접합시킴으로써 달성된다. 바람직한 실시양태에서, 검출된 세포 및 조직은 이환 세포 및 조직이고/거나, 질환 및/또는 질환의 증상에 대한 원인이거나, 또는 질환의 기저가 되는 병리상태의 일부이다. 추가의 바람직한 실시양태에서, 이환 세포 및 조직은 종양학 적응증 (예를 들어, 신생물, 종양 및 암) 또는 비-종양학 적응증 (예를 들어, 염증성 질환, 심혈관 질환, 자가면역 질환 및 섬유화 질환)을 유발하고/거나 그의 일부이다.
또 다른 실시양태에서, 본 발명의 화합물은 FAP를 과다발현하는 세포 및 조직을 치료하는데 사용된다. 바람직한 실시양태에서, 치료되는 세포 및 조직은 이환 세포 및 조직이고/거나, 질환 및/또는 질환의 증상의 원인이거나 또는 질환의 기저가 되는 병리상태의 일부이다. 추가의 바람직한 실시양태에서, 이환 세포 및 조직은 종양학 적응증 (예를 들어, 신생물, 종양 및 암)을 유발하고/거나 그의 일부이고, 치료 활성은 치료 활성 이펙터를 본 발명의 화합물, 바람직하게는 치료 활성 방사성핵종에 접합시킴으로써 달성된다. 추가의 바람직한 실시양태에서, 이환 세포 및 조직은 비-종양학 적응증 (예를 들어, 염증성 질환, 심혈관 질환, 자가면역 질환 및 섬유화 질환)을 유발하고/거나 그의 일부이고, 치료 활성은 FAP의 효소적 활성의 억제에 의해 달성된다.
추가 실시양태에서, 특히 질환이 비-종양학 질환 또는 비-종양학 적응증 (예를 들어, 염증성 질환, 심혈관 질환, 자가면역 질환 및 섬유화 질환)인 경우, 본 발명의 화합물은 치료 유효량으로 투여되고; 바람직하게는 본 발명의 화합물은 치료 활성 핵종을 포함하지 않는다. 유효량은 화합물이 투여되는 대상체에서 치료상 또는 의학적으로 바람직한 결과 또는 효과를 제공하기에 충분한 화합물의 투여량이다. 유효량은 건강 진료의의 지식 및 전문지식 내에서 치료할 특정한 상태, 치료할 대상체의 연령 및 신체 상태, 상태의 중증도, 치료 지속기간, 공동 또는 조합 요법 (존재하는 경우)의 성질, 구체적 투여 경로 및 기타 요인에 따라 달라질 것이다. 예를 들어, 비정상적 세포 증식을 특징으로 하는 상태를 갖는 대상체를 치료하는 것에 관한 방법과 관련하여, 증식을 억제하는 유효량은 세포 덩어리, 예컨대 예를 들어 종양의 발생 또는 진행을 늦추거나 또는 정지시키도록 비정상적 세포 증식을 감소시키거나 또는 완전히 정지시키기에 충분한 양일 것이다. 실시양태에 사용된 "억제하다"는 상기 모두를 포괄한다.
다른 실시양태에서, 치료 유효량은 수술 또는 약물 요법 후에 미세전이의 휴면을 연장시키거나 또는 임의의 잔류 원발성 종양 세포를 안정화시키는데 필요한 양일 것이다.
일반적으로, 치료 활성 방사성핵종 없이 비접합 화합물을 사용하는 경우, 치료 유효량은 대상체의 연령, 상태 및 성별, 뿐만 아니라 대상체에서의 질환의 성질 및 정도에 따라 달라질 것이며, 이들 모두는 관련 기술분야의 통상의 기술자에 의해 결정될 수 있다. 투여량은 특히 임의의 합병증의 경우에 개별 의사 또는 수의사에 의해 조정될 수 있다. 치료 유효량은 전형적으로 1일 이상 동안 1일 1회 이상의 용량 투여로 0.1 μg/kg 내지 약 2000 mg/kg 또는 1.0 μg/kg 내지 약 1000 mg/kg 또는 약 0.1 mg/kg 내지 약 500 mg/kg 또는 약 1.0 mg/kg 내지 약 100 mg/kg 범위의 양이지만 이에 제한되지는 않는다. 원하는 경우, 활성 화합물의 유효 1일 용량은, 예를 들어 임의로 단위 투여 형태로 하루에 걸쳐 적절한 간격으로 개별적으로 투여되는 2, 3, 4, 5, 6회 또는 그 초과의 하위-용량으로서 투여될 수 있다. 일부 실시양태에서, 화합물은 7일 초과, 10일 초과, 14일 초과 및 20일 초과 동안 투여된다. 또 다른 실시양태에서, 화합물은 수주 또는 수개월의 기간에 걸쳐 투여된다. 또 다른 실시양태에서, 화합물은 격일로 전달된다. 예를 들어, 작용제는 2일마다 또는 3일마다 또는 4일마다 또는 5일마다 또는 6일마다 또는 매주 또는 매달 전달된다.
바람직한 실시양태에서, 본 발명의 화합물은 질환의 치료 및/또는 예방에 사용하기 위한 것이며, 여기서 이러한 치료는 방사성핵종 요법이다.
바람직하게는, 방사성핵종 요법은 방사성핵종에 의해 방출되는 여러 형태의 방사선을 사용하거나 또는 이를 기초로 한다. 이러한 방사선은, 예를 들어 광자의 방사선, β--입자 및 오거-전자를 포함하나 이에 제한되지는 않는 전자의 방사선, 양성자의 방사선, 중성자의 방사선, 양전자의 방사선, α-입자의 방사선 또는 이온 빔 중 어느 하나일 수 있다. 상기 방사성핵종에 의해 방출되는 입자 또는 방사선의 종류에 따라, 방사성핵종 요법은 예를 들어 광자 방사성핵종 요법, 전자 방사성핵종 요법, 양성자 방사성핵종 요법, 중성자 방사성핵종 요법, 양전자 방사성핵종 요법, α-입자 방사성핵종 요법 또는 이온 빔 방사성핵종 요법으로서 구별될 수 있다. 방사성핵종 요법의 이들 형태는 모두 본 발명에 포괄되고, 방사성핵종 요법의 이들 형태는 모두, 바람직하게는 본 발명의 화합물에 부착된 방사성핵종이 보다 바람직하게는 이펙터로서 이러한 종류의 방사선을 제공한다는 조건 하에 본 발명의 화합물에 의해 실현될 수 있다.
방사성핵종 요법은 바람직하게는 세포의 DNA를 손상시킴으로써 작용한다. 손상은 DNA 쇄를 구성하는 원자를 직접적으로 또는 간접적으로 이온화하는 광자, 전자, 양성자, 중성자, 양전자, α-입자 또는 이온 빔에 의해 유발된다. 간접 이온화는 물의 이온화의 결과로서 발생하여, 자유 라디칼, 특히 히드록실 라디칼을 형성하고, 이는 이어서 DNA를 손상시킨다.
방사성핵종 요법의 가장 흔한 형태에서, 대부분의 방사선 효과는 자유 라디칼을 통한 것이다. 세포는 DNA 손상을 복구하기 위한 메카니즘을 갖기 때문에, 양쪽 가닥 상의 DNA를 파괴하는 것이 세포 특징을 변형시키는데 있어서 가장 중요한 기술인 것으로 입증되었다. 암 세포는 일반적으로 미분화 및 줄기 세포-유사이기 때문에, 이들은 대부분의 건강한 분화 세포와 비교하여 더 많이 재생하고, 준치사 손상을 복구하는 능력이 감소된다. DNA 손상은 세포 분열을 통해 유전되고, 암 세포에 손상이 축적되어, 이들이 보다 느리게 사멸 또는 재생되도록 한다.
산소는 DNA-손상 자유 라디칼을 형성함으로써 주어진 선량의 방사선의 유효성을 증가시키는 강력한 방사선증감제이다. 따라서, 고압 산소 탱크, 증가된 산소를 운반하는 혈액 대체물, 저산소 세포 방사선증감제, 예컨대 미소니다졸 및 메트로니다졸, 및 저산소 세포독소, 예컨대 티라파자민의 사용이 적용될 수 있다.
방사성 선량을 선택할 때 고려되는 다른 요인은 환자가 화학요법을 받고 있는지 여부, 방사선 요법이 수술 전 또는 후에 투여되고 있는지 여부 및 수술의 성공 정도를 포함한다.
총 방사성 선량은 분할조사될 수 있으며, 이는 여러 중요한 이유로 하나 이상의 치료에서 시간 경과에 따라 확산된다. 분할조사는 정상 세포가 회복할 시간을 주는 반면, 종양 세포는 일반적으로 분할 사이에 복구되기에 덜 효율적이다. 분할조사는 또한 1회의 치료 동안 세포 주기의 상대적으로 방사선-저항성 시기에 있었던 종양 세포가 다음 분할이 제공되기 전에 주기의 감수성 시기로 순환되도록 한다. 유사하게, 만성으로 또는 급성으로 저산소성이고, 따라서 보다 방사성저항성인 종양 세포는 분할 사이에서 재산소화되어 종양 세포 사멸을 개선시킬 수 있다.
다양한 암이 방사선 요법에 상이하게 반응하는 것으로 일반적으로 공지되어 있다. 방사선에 대한 암의 반응은 그의 방사선감수성에 의해 설명된다. 고도로 방사선감수성인 암 세포는 크지 않은 선량의 방사선에 의해 급속히 사멸한다. 이들은 백혈병, 대부분의 림프종 및 배세포 종양을 포함한다.
실제 임상 실무에서 내부적으로 전달된 방사성 선량에 의한 암의 "치유성"으로부터 어느 정도 실험실 척도인 특정 종양의 방사선감수성을 구별하는 것이 중요하다. 예를 들어, 백혈병은 신체를 통해 전파되기 때문에 일반적으로 방사선요법으로 치료가능하지 않다. 림프종은 신체의 한 영역에 국재화되는 경우에 근본적으로 치유가능할 수 있다. 유사하게, 많은 흔한 중등도 방사선반응성 종양은 이들이 초기 단계에 있는 경우에 치유 용량의 방사능으로 치료될 수 있다. 이는, 예를 들어 비-흑색종 피부암, 두경부암, 비소세포 폐암, 자궁경부암, 항문암, 전립선암에 적용된다.
방사선요법에 대한 종양의 반응은 또한 그의 크기와 관련된다. 복합적 이유로 인해, 매우 큰 종양은 보다 작은 종양 또는 현미경적 질환보다 방사선에 덜 반응한다. 이러한 효과를 극복하기 위해 다양한 전략이 사용된다. 가장 흔한 기술은 방사선요법 전의 외과적 절제이다. 이는 광범위 국소 절제 또는 유방절제술 후에 보조 방사선요법으로 이어지는 유방암의 치료에서 가장 통상적으로 나타난다. 또 다른 방법은 라디칼 방사성핵종 요법 전에 신보조 화학요법으로 종양을 수축시키는 것이다. 제3 기술은 방사선요법 과정 동안 특정 약물을 제공함으로써 암의 방사선감수성을 증진시키는 것이다. 방사선증감 약물의 예는 시스플라틴, 니모라졸 및 세툭시맙을 포함하나 이에 제한되지는 않는다.
수술중 방사선요법은 암의 외과적 제거 직후에 전달되는 특별한 유형의 방사선요법이다. 이 방법은 유방암 (표적화된(TARGeted) 수술중 방사선요법), 뇌 종양 및 직장암에 사용되어 왔다.
방사성핵종 요법은 그 자체로 통증이 없다. 많은 저선량 완화적 치료는 부작용을 최소로 유발하거나 전혀 유발하지 않는다. 보다 높은 선량으로의 치료는 치료 동안에 (급성 부작용), 치료 후 수개월 또는 수년 내에 (장기간 부작용), 또는 재치료 후에 (누적 부작용) 다양한 부작용을 유발할 수 있다. 부작용의 성질, 중증도 및 수명은 방사선을 받은 기관, 치료 자체 (방사성핵종의 유형, 선량, 분할조사, 공동 화학요법) 및 환자에 따라 달라진다.
본 발명의 질환의 치료 방법이, 관련 기술분야에 공지된 바와 같고 본 발명의 추가 실시양태를 구성하는 한, 각각의 및 임의의 상기 전략을 실현할 수 있다는 것이 본 발명의 범위에 속한다.
본 발명의 화합물이 본원에 개시된 바와 같은 질환의 진단 방법에 사용되는 것 또한 본 발명의 범위에 속한다. 이러한 방법은 바람직하게는 진단 유효량의 본 발명의 화합물을 그를 필요로 하는 대상체에게 투여하는 단계를 포함한다.
본 발명에 따르면, 영상화 방법은 섬광조영술, 단일 광자 방출 컴퓨터 단층촬영 (SPECT) 및 양전자 방출 단층촬영 (PET)으로 이루어진 군으로부터 선택된다.
본 발명의 바람직한 실시양태에서, N4 킬레이트화제 패밀리로부터의 킬레이트화제, 보다 바람직하게는 Tc 방사성핵종을 킬레이트화하는 것을 포함하는 본 발명에 따른 화합물은 SPECT를 이용하는 방법 및 절차에 사용하기에 특히 적합하다. 그의 실시양태에서, N4 킬레이트화제 패밀리로부터의 킬레이트화제는 N4Ac이다.
본 발명의 바람직한 실시양태에서, 킬레이트화제 NODAGA, 보다 바람직하게는 Ga 방사성핵종을 킬레이트화하는 것을 포함하는 본 발명에 따른 화합물은 PET를 이용하는 방법 및 절차에 사용하기에 특히 적합하다.
섬광조영술은 핵 의학에 사용되는 진단 시험 또는 방법의 형태이며, 여기서 방사성약제는 세포, 조직 및/또는 기관에 의해 내재화되고, 바람직하게는 생체내 내재화되고, 상기 내재화된 방사성약제에 의해 방출된 방사선은 외부 검출기 (감마 카메라)에 의해 포획되어 2차원 영상을 형성하고 디스플레이한다. 이와 대조적으로, SPECT 및 PET는 3차원 영상을 형성하고 디스플레이한다. 이로 인해, SPECT 및 PET는 섬광조영술과 별개의 기술로서 분류되지만, 이들은 또한 감마 카메라를 사용하여 내부 방사선을 검출한다. 섬광조영술은 외부 방사선이 신체를 통과하여 영상을 형성하는 진단 X선과 다르다.
단일 광자 방출 단층촬영 (SPECT) 스캔은 감마선을 사용하는 핵 영상화 기술의 유형이다. 이들은 감마 카메라를 사용하는 통상적인 핵 의학 평면 영상화와 매우 유사하다. SPECT 스캔 전에, 환자에게 스캐너에 의해 검출될 수 있는 방사성표지된 화학적 방출 감마선을 주입한다. 컴퓨터는 감마 카메라로부터 정보를 수집하고, 이를 2차원 단면으로 변환시킨다. 이들 단면은 함께 다시 부가되어 기관 또는 조직의 3차원 영상을 형성할 수 있다. SPECT는 방사성표지된 화학물질에 의해 제공된 방사성핵종에 의해 단독으로 및 순차적으로 방출된 감마선의 검출을 포함한다. SPECT 영상을 획득하기 위해, 감마 카메라를 환자 주위로 회전시킨다. 투영도는 회전 동안 규정된 지점에서, 전형적으로 3-6도마다 획득된다. 대부분의 경우, 완전한 360도 회전이 최적의 재구성을 얻기 위해 사용된다. 각각의 투영도를 얻는데 걸리는 시간은 또한 가변적이지만, 15-20초가 전형적이다. 이는 15-20분의 총 스캔 시간을 제공한다. 멀티-헤드형 감마 카메라는 보다 빠르다. SPECT 획득은 평면 감마 카메라 영상화와 매우 유사하기 때문에, 동일한 방사성약제가 사용될 수 있다.
양전자 방출 단층촬영 (PET)은 인체 내의 세포의 생화학적 상태 또는 대사 활성을 측정하기 위한 비-침습성 진단 영상화 기술이다. PET는 신체의 기본 생화학 또는 기능의 영상을 생성하기 때문에 고유하다. 전통적인 진단 기술, 예컨대 X선, CT 스캔 또는 MRI는 신체의 해부학 또는 구조의 영상을 생성한다. 이들 기술의 전제는 질환과 연관된 구조 또는 해부학에서의 임의의 변화를 볼 수 있다는 것이다. 생화학적 과정은 또한 질환에 의해 변경되고, 해부학에서의 임의의 육안적 변화 전에 발생할 수 있다. PET는 이들 초기 생화학적 변화의 일부를 가시화할 수 있는 영상화 기술이다. PET 스캐너는 환자로부터 방출된 방사선에 의존하여 영상을 생성한다. 각각의 환자에게 신체에 의해 사용되는 천연 물질과 밀접하게 유사하거나 또는 수용체 또는 분자 구조에 특이적으로 결합하는 미량의 방사성약제가 제공된다. 방사성동위원소가 양전자 방출 붕괴 (양성 베타 붕괴로도 공지됨)를 겪는 동안 전자의 항입자 대응물인 양전자를 방출한다. 몇 밀리미터까지 이동한 후, 양전자는 전자와 만나고 소멸되어 반대 방향으로 이동하는 한 쌍의 소멸 (감마) 광자를 생성한다. 이들은 스캐닝 장치에서 섬광 물질에 도달하여 광 폭발을 생성할 때 검출되며, 이는 광전자 증배 튜브 또는 규소 애벌란치 광다이오드에 의해 검출된다. 기술은 광자 쌍의 동시 또는 일치 검출에 의존한다. 쌍으로, 즉 몇 나노초 이내에 도달하지 않는 광자는 무시된다. 모든 일치는 최종 영상 데이터가 영상 재구성 절차를 사용하여 생성되는 영상 처리 유닛으로 전달된다.
SPECT/CT 및 PET/CT는 SPECT 및 PET와 컴퓨터 단층촬영 (CT)의 조합이다. 이들 양식의 조합의 주요 이점은 판독기의 신뢰도 및 정확도를 개선시키는 것이다. 전통적인 PET 및 SPECT의 경우, 비정상 영역으로부터 방출된 제한된 수의 광자는 영역을 해부학적으로 국재화하는 것을 어렵게 하는 매우 낮은 수준의 배경을 생성한다. CT를 부가하는 것은 해부학적 관점으로부터 비정상 영역의 위치를 결정하는 것을 돕고, 이것이 질환을 나타낼 가능성을 분류한다.
본 발명의 질환의 진단 방법이, 관련 기술분야에 공지된 바와 같고 본 발명의 추가의 실시양태를 구성하는 한, 각각의 및 임의의 상기 전략을 실현할 수 있다는 것이 본 발명의 범위에 속한다.
본 발명의 화합물은 환자를 계층화하는데, 즉 환자가 주어진 약물에 어떻게 반응할 것인지에 대한 보다 상세한 정보를 제공하는 환자 집단 내의 하위세트를 생성하는데 유용하다. 계층화는 신규 요법에 반응할 가능성이 가장 높은 집단의 하위세트를 확인함으로써 임상 시험을 부정적 또는 중립적 결과로부터 긍정적 결과를 갖는 것으로 전환시키는데 중요한 요소일 수 있다.
계층화는 환자에 대한 최적 관리를 선택하고, 위험 평가, 위험 예방 및 최적 치료 결과의 달성의 관점에서 최상의 가능한 결과를 달성하기 위한 공유된 "생물학적" 특징을 갖는 환자 군의 식별을 포함한다.
본 발명의 화합물은 가능한 한 조기에 특정 질환 (진단 용도임), 질환 발생 위험 (감수성/위험 용도임), 무통성 대 공격성을 비롯한 질환의 진화 (예후 용도임)를 평가 또는 검출하는데 사용될 수 있고, 이는 주어진 치료에 대한 반응 및 독성을 예측하는데 사용될 수 있다 (예측 용도임).
본 발명의 화합물이 치료진단 방법에 사용되는 것이 또한 본 발명의 범위에 속한다. 진단학의 개념은 치료제를 치료 약물의 임상 용도를 증가시킬 수 있는 상응하는 진단 시험과 합하는 것이다. 진단학의 개념은 점점 더 매력적이며, 의사가 주어진 요법으로부터 이익을 얻을 수 있는 환자를 확인하고 따라서 불필요한 치료를 피하는 것을 돕는 것에 의해 약물 치료의 효율을 개선시키는 핵심으로 널리 간주된다.
진단학의 개념은 의사가 주어진 요법으로부터 가장 이익을 얻을 환자를 식별하는 것을 가능하게 하는 진단 시험과 치료제를 합하는 것이다. 한 실시양태에서 및 본원에 바람직하게 사용된 본 발명의 화합물은 환자의 진단, 즉 원발성 종양 덩어리 뿐만 아니라 잠재적 국부 및 원격 전이의 확인 및 국재화에 사용된다. 또한, 종양 부피는 특히 3차원 진단 양식, 예컨대 SPECT 또는 PET를 이용하여 측정될 수 있다. FAP-양성 종양 덩어리를 갖고, 따라서 주어진 요법으로부터 이익을 얻을 수 있는 환자만이 특정한 요법을 위해 선택되고, 이로 인해 불필요한 치료는 회피된다. 바람직하게는, 이러한 요법은 본 발명의 화합물을 사용하는 FAP-표적화 요법이다. 한 특정 실시양태에서, 화학적으로 동일한 종양-표적화 진단제, 바람직하게는 섬광조영술, PET 또는 SPECT 및 방사선치료제에 대한 영상화 진단제가 적용된다. 이러한 화합물은 단지 방사성핵종에서만 상이하고, 따라서 통상적으로 동일하지 않더라도 매우 유사한 약동학적 프로파일을 갖는다. 이는 킬레이트화제 및 진단용 또는 치료용 방사성금속을 사용하여 실현될 수 있다. 대안적으로, 이는 진단 또는 치료 방사성핵종을 사용한 방사성표지 및 방사성표지를 위한 전구체를 사용하여 실현될 수 있다. 한 실시양태에서, 진단 영상화는 바람직하게는 진단 방사성핵종의 방사선의 정량화 및 관련 기술분야의 통상의 기술자에게 공지된 후속 선량측정 및 취약성 부작용 기관과 비교한 종양에서의 약물 농도의 예측에 의해 사용된다. 따라서, 환자에 대한 진정으로 개별화된 약물 투여 요법이 달성된다.
한 실시양태에서 및 본원에 바람직하게 사용된 치료진단 방법은 진단상 검출가능한 방사선 (예를 들어, 양전자 또는 감마선) 뿐만 아니라 치료상 유효한 방사선 (예를 들어, 전자 또는 알파 입자)을 방출하는 방사성핵종으로 표지된 본 발명의 화합물과 같은 단지 1종의 치료 활성 화합물로 실현된다.
본 발명은 또한 대상체에서 FAP를 발현하는 이환 조직을 수술 중에 확인/밝혀내는 방법을 고려한다. 이러한 방법은 본 발명의 화합물을 사용하며, 여기서 이러한 본 발명의 화합물은 바람직하게는 이펙터로서 진단 활성제를 포함한다.
본 발명의 추가 실시양태에 따르면, 본 발명의 화합물은, 특히 방사성핵종과 착물화된 경우, 대부분의 고립된 고형암의 1차 치료 방법으로서의 수술, 근접요법 형태의 밀봉된 내부 공급원 또는 외부 공급원을 사용하여 암의 증상을 치유 또는 개선시키려는 시도로 이온화 방사선의 사용을 수반하는 방사선 요법, 화학요법 예컨대 알킬화제, 항대사물, 안트라시클린, 식물 알칼로이드, 토포이소머라제 억제제, 및 다른 항종양제, 종양 세포를 직접 공격하지 않으면서 이들 세포 거동을 조정하는 호르몬 치료, 모노클로날 항체 및 티로신 키나제 억제제를 포함한 특정 유형의 암에서 분자 이상을 직접 표적화하는 표적화 작용제, 혈관신생 억제제, 면역요법, 암 백신접종, 환자의 삶의 질을 개선시키기 위한 물리적, 정서적, 질적 및 정신-사회적 곤란을 감소시키는 작용을 포함한 완화적 관리, 및 다양한 군의 건강 관리 시스템, 실시 및 통상적인 의약의 일부가 아닌 제품을 포함한 대안적 치료를 포함한 임의의 다른 종양 치료에 대한 보조제 또는 아주반트로서 사용될 수 있다.
본 발명의 방법의 한 실시양태에서, 대상체는 환자이다. 한 실시양태에서, 환자는 질환이 본원에 기재된 바와 같은 질환, 바람직하게는 FAP를 수반하는 질환인 질환을 앓고 있는 것으로 진단되었거나 또는 그를 앓고 있는 것으로 의심되거나 또는 그를 앓거나 또는 그가 발생할 위험이 있는 대상체이다.
방사성핵종이 사용되고 보다 구체적으로 본 발명의 화합물에 부착되거나 그의 일부가 되는, 치료 및 진단 방법을 각각 실시하는데 사용되는 투여량은, 예를 들어 치료할 특정한 상태, 예를 들어 종양 유형의 공지된 방사선감수성, 종양의 부피 및 목적하는 요법에 따라 달라질 것이다. 일반적으로, 용량은 각각의 기관에 대한 방사능 분포 및 관찰된 표적 흡수에 기초하여 계산된다. γ-방출 착물은 진단 영상화를 위해 1회 또는 수회 투여될 수 있다. 동물에서, 지시된 용량 범위는 예를 들어 1 내지 200 MBq의 111In 또는 89Zr과 착물화된 본 발명의 화합물 0.1 μg/kg 내지 5 mg/kg일 수 있다. 본 발명의 화합물의 β-방출 착물은 여러 시점에, 예를 들어 1 내지 3주 또는 그 초과의 기간에 걸쳐 투여될 수 있다. 동물에서, 지시된 투여량 범위는 예를 들어 1 내지 200 MBq 90Y 또는 177Lu와 착물화된 본 발명의 화합물 0.1 μg/kg 내지 5 mg/kg일 수 있다. 보다 큰 포유동물, 예를 들어 인간에서, 지시된 투여량 범위는 예를 들어 10 내지 400 MBq 111In 또는 89Zr과 착물화된 본 발명의 화합물 0.1 내지 100 μg/kg이다. 보다 큰 포유동물, 예를 들어 인간에서, 지시된 투여량 범위는 예를 들어 10 내지 5000 MBq 90Y 또는 177Lu와 착물화된 본 발명의 화합물 0.1 내지 100 μg/kg이다.
추가 측면에서, 본 발명은 특히 본 발명의 화합물을 포함하는 조성물 및 제약 조성물에 관한 것이다.
본 발명의 제약 조성물은 본 발명의 적어도 1종의 화합물 및 임의로 1종 이상의 담체 물질, 부형제 및/또는 아주반트를 포함한다. 제약 조성물은, 예를 들어 물, 완충제, 예컨대 예를 들어 중성 완충 염수 또는 포스페이트 완충 염수, 에탄올, 미네랄 오일, 식물성 오일, 디메틸술폭시드, 탄수화물, 예컨대 예를 들어 글루코스, 만노스, 수크로스 또는 덱스트란, 만니톨, 단백질, 아주반트, 폴리펩티드 또는 아미노산, 예컨대 글리신, 항산화제, 킬레이트화제, 예컨대 EDTA 또는 글루타티온 및/또는 보존제 중 1종 이상을 추가로 포함할 수 있다. 또한, 1종 이상의 다른 활성 성분이 본 발명의 제약 조성물에 포함될 수 있지만, 반드시 그럴 필요는 없다.
본 발명의 제약 조성물은, 예를 들어 국소, 예컨대 경피 또는 안구, 경구, 협측, 비강, 질, 직장 또는 비경구 투여를 비롯한 임의의 적절한 투여 경로를 위해 제제화될 수 있다. 본원에 사용된 용어 비경구는 피하, 피내, 혈관내, 예컨대 예를 들어 정맥내, 근육내, 척수강내 및 복강내 주사, 뿐만 아니라 임의의 유사한 주사 또는 주입 기술을 포함한다. 바람직한 투여 경로는 정맥내 투여이다.
본 발명의 한 실시양태에서, 방사성핵종을 포함하는 본 발명의 화합물은 임의의 통상적인 경로에 의해, 특히 정맥내로, 예를 들어 주사액 또는 현탁액의 형태로 투여된다. 본 발명의 화합물은 또한 유리하게는 주입에 의해, 예를 들어 30 내지 60분의 주입에 의해 투여될 수 있다.
종양의 부위에 따라, 본 발명의 화합물은 종양 부위에 가능한 가깝게, 예를 들어 카테터에 의해 투여될 수 있다. 이러한 투여는 종양 조직 내로 또는 주위 조직 내로 또는 구심성 혈관 내로 직접 수행될 수 있다. 본 발명의 화합물은 또한 용량으로, 바람직하게는 분할 용량으로 반복적으로 투여될 수 있다.
본 발명의 바람직한 실시양태에 따르면, 본 발명의 제약 조성물은 본 발명의 화합물의 자가방사선분해를 억제하는 안정화제, 예를 들어 자유 라디칼 스캐빈저를 포함한다. 적합한 안정화제는, 예를 들어 혈청 알부민, 아스코르브산, 레티놀, 겐티스산 또는 그의 유도체, 또는 예를 들어 비경구 단백질 공급에 사용되는, 바람직하게는 전해질 및 글루코스가 없는 아미노산 주입 용액, 예를 들어 상업적으로 입수가능한 아미노산 주입액, 예컨대 프로테인스테릴(Proteinsteril)® KE 네프로(Nephro)를 포함한다. 아스코르브산 및 겐티스산이 바람직하다.
본 발명의 제약 조성물은 추가의 첨가제, 예를 들어 pH를 7.2 내지 7.4로 조정하는 작용제, 예를 들어 아세트산나트륨 또는 아세트산암모늄 또는 Na2HPO4를 포함할 수 있다. 바람직하게는, 안정화제는 본 발명의 비-방사성 화합물에 첨가되고, 방사성핵종의 도입, 예를 들어 방사성핵종과의 착물화는 안정화제의 존재 하에 실온에서 또는 바람직하게는 40 내지 120℃의 온도에서 수행된다. 착물화는 편리하게는 공기 무함유 조건 하에, 예를 들어 N2 또는 Ar 하에 수행될 수 있다. 추가의 안정화제가 착물화 후에 조성물에 첨가될 수 있다.
본 발명의 화합물의 배출은, 특히 이펙터가 방사성핵종인 경우, 본질적으로 신장을 통해 일어난다. 방사능 축적으로부터의 신장의 추가의 보호는 리신 또는 아르기닌, 또는 고함량의 리신 및/또는 아르기닌을 갖는 아미노산 용액, 예를 들어 상업적으로 입수가능한 아미노산 용액, 예컨대 신타민(Synthamin)®-14 또는 -10을, 특히 이펙터가 방사성핵종인 경우, 본 발명의 화합물의 주사 전에 또는 그와 함께 투여함으로써 달성될 수 있다. 신장의 보호는 또한 아미노산 주입 대신에 또는 그에 추가로 혈장 확장제, 예컨대 예를 들어 겔로푸신의 투여에 의해 달성될 수 있다. 신장의 보호는 또한 배뇨 속도를 상승시키는 강제 이뇨의 수단을 제공하는 이뇨제의 투여에 의해 달성될 수 있다. 이러한 이뇨제는 고효능 루프 이뇨제, 티아지드, 탄산 안히드라제 억제제, 칼륨-보존성 이뇨제, 칼슘-보존성 이뇨제, 삼투성 이뇨제 및 저효능 이뇨제를 포함한다. 본 발명의 제약 조성물은 본 발명의 화합물 이외에도, 본 발명의 화합물이 투여되는 대상체의 신장 보호, 바람직하게는 신장 보호를 위해 의도되거나 또는 이에 적합한 이들 추가의 화합물 중 적어도 1종을 함유할 수 있다.
관련 기술분야의 통상의 기술자는 다양한 방법에 사용하기 위한 본 발명의 화합물이 본원에 개시됨을 이해할 것이다. 본 발명의 조성물 및 본 발명의 제약 조성물이 상기 다양한 방법에서 동등하게 사용될 수 있다는 것이 관련 기술분야의 통상의 기술자에 의해 추가로 이해될 것이다. 또한, 관련 기술분야의 통상의 기술자는 다양한 방법에 사용하기 위한 본 발명의 조성물 및 제약 조성물이 본원에 개시됨을 이해할 것이다. 본 발명의 화합물이 상기 다양한 방법에 동등하게 사용될 수 있다는 것이 관련 기술분야의 통상의 기술자에 의해 동등하게 이해될 것이다.
본 발명의 조성물 및 본 발명의 제약 조성물은 본 발명의 화합물에 추가로 1종 이상의 추가의 화합물을 함유하는 것으로 관련 기술분야의 통상의 기술자에 의해 인지될 것이다. 이러한 1종 이상의 추가의 화합물이 본 발명의 조성물 및/또는 본 발명의 제약 조성물의 일부인 것으로 본원에 개시된 경우, 이러한 1종 이상의 추가의 화합물은 본 발명의 방법에 노출된 대상체 또는 본 발명의 방법의 대상체에게 본 발명의 화합물과 개별적으로 투여될 수 있는 것으로 이해될 것이다. 1종 이상의 추가의 화합물의 이러한 투여는 본 발명의 화합물의 투여 전에, 동시에 또는 후에 수행될 수 있다. 본 발명의 방법에서, 본 발명의 화합물 이외에도, 1종 이상의 추가의 화합물이 대상체에게 투여될 수 있다는 것이 관련 기술분야의 통상의 기술자에 의해 또한 인지될 것이다. 1종 이상의 추가의 화합물의 이러한 투여는 본 발명의 화합물의 투여 전에, 동시에 또는 후에 수행될 수 있다. 이러한 1종 이상의 추가의 화합물이 본 발명의 방법의 일부로서 투여되는 것으로 본원에 개시된 경우, 이러한 1종 이상의 추가의 화합물은 본 발명의 조성물 및/또는 본 발명의 제약 조성물의 일부인 것으로 이해될 것이다. 본 발명의 화합물 및 1종 이상의 추가의 화합물이 동일하거나 상이한 제제에 함유될 수 있다는 것이 본 발명의 범위에 속한다. 본 발명의 화합물 및 1종 이상의 추가의 화합물이 동일한 제제에 함유되지 않고, 본 발명의 화합물을 포함하는 제1 제제 및 1종 이상의 추가의 화합물을 포함하는 제2 제제를 함유하는 동일한 패키지에 함유되며, 여기서 제제의 유형은 동일하거나 상이할 수 있는 것 또한 본 발명의 범위에 속한다.
본 발명의 화합물의 1종 초과의 유형이 본 발명의 조성물 및/또는 본 발명의 제약 조성물에 함유되는 것이 본 발명의 범위에 속한다. 본 발명의 방법에서 1종 초과의 유형의 본 발명의 화합물이 사용되는 것, 바람직하게는 투여되는 것 또한 본 발명의 범위에 속한다.
본 발명의 조성물 및 본 발명의 제약 조성물은 통상적인 방식으로 제조될 수 있다는 것이 인지될 것이다.
방사성약제는 방사성 붕괴의 결과로서 시간에 따라 감소하는 방사능 함량을 갖는다. 방사성핵종의 물리적 반감기는 종종 방사성제약 진단제의 경우 짧다. 이들 경우, 최종 제조는 환자에게 투여하기 직전에 수행되어야 한다. 이는 특히 단층촬영을 위한 양전자 방출 방사성약제 (PET 방사성약제)의 경우 그래야 한다. 이는 종종 반-제조 제품, 예컨대 방사성핵종 발생기, 방사성 전구체 및 키트의 사용으로 이어진다.
바람직하게는, 본 발명의 키트는 1종 또는 1종 초과의 본 발명의 화합물 이외에 전형적으로 하기 중 적어도 하나를 포함한다: 사용, 최종 제조 및/또는 품질 관리를 위한 지침서, 1종 이상의 임의적인 부형제(들), 표지화 절차를 위한 1종 이상의 임의적인 시약, 임의로 1종 이상의 방사성핵종(들) (차폐 용기 함유 또는 무함유) 및 임의로 1종 이상의 장치(들) (여기서 장치(들)는 표지 장치, 정제 장치, 분석 장치, 취급 장치, 방사선보호 장치 또는 투여 장치를 포함하는 군으로부터 선택됨).
방사성제약 용기의 일반적인 취급 및 수송을 위한 "피그(pig)"로 공지된 차폐 용기는 병, 바이알, 시린지 등과 같은 방사성제약 용기를 보유하기 위한 다양한 구성으로 제공된다. 한 형태는 종종 보유된 방사성제약 용기에 대한 접근을 허용하는 제거가능한 커버를 포함한다. 피그 덮개가 제 위치에 있을 때, 방사선 노출이 허용된다.
표지 장치는 개방 반응기, 폐쇄 반응기, 마이크로유체 시스템, 나노반응기, 카트리지, 압력 용기, 바이알, 온도 제어가능한 반응기, 혼합 또는 진탕 반응기 및 그의 조합의 군으로부터 선택된다.
정제 장치는 바람직하게는 이온 교환 크로마토그래피 칼럼 또는 장치, 크기-배제 크로마토그래피 칼럼 또는 장치, 친화성 크로마토그래피 칼럼 또는 장치, 기체 또는 액체 크로마토그래피 칼럼 또는 장치, 고체 상 추출 칼럼 또는 장치, 여과 장치, 원심분리 바이알 칼럼 또는 장치의 군으로부터 선택된다.
분석 장치는 바람직하게는 방사성표지된 화합물의 정체, 방사화학적 순도, 방사성핵종 순도, 방사능의 함량 및 특이적 방사능을 결정하기 위한 시험 또는 시험 장치의 군으로부터 선택된다.
조작 장치는 바람직하게는 방사성의약을 대상체에 혼합, 희석, 분배, 표지, 주사 및 투여하기 위한 장치로 이루어진 군으로부터 선택된다.
치료 또는 진단 방사성핵종을 사용할 때 의사 및 다른 직원을 방사선으로부터 보호하기 위해 방사성보호 장치가 사용된다. 방사선보호 장치는 바람직하게는 알루미늄, 플라스틱, 목재, 납, 철, 납 유리, 물, 고무, 플라스틱, 천으로 이루어진 군으로부터 선택되는 방사선-흡수 물질의 보호 장벽을 갖는 장치, 방사선원으로부터의 적절한 거리를 보장하는 장치, 방사성핵종에 대한 노출 시간을 감소시키는 장치, 흡입, 섭취 또는 신체 내로의 방사성 물질의 다른 진입 방식을 제한하는 장치 및 이들 수단의 조합을 제공하는 장치로 이루어진 군으로부터 선택된다.
투여 장치는 바람직하게는 시린지, 차폐 시린지, 바늘, 펌프 및 주입 장치의 군으로부터 선택된다. 시린지 차폐부는 취급자가 시린지 플런저 및 시린지 내의 액체 체적을 볼 수 있게 하는 납 유리 윈도우를 가지면서 통상적으로 시린지의 원통형 본체를 수용하는 중공 원통형 구조체이고, 납 또는 텅스텐으로 구성된다.
본 발명은 이제부터 추가의 특징, 실시양태 및 이점이 취해질 수 있는 하기 도면 및 실시예를 참조하여 추가로 설명된다.
도 1은 합성 직후에 분석된 100 mg/mL 아스코르베이트 및 5 mg/mL L-메티오닌을 함유하는 제제 완충제 중 177Lu-3BP-3407의 방사성크로마토그램을 도시하고;
도 2는 합성 6일 후에 분석된 100 mg/mL 아스코르베이트 및 5 mg/mL L-메티오닌을 함유하는 제제 완충제 중 177Lu-3BP-3407의 방사성크로마토그램을 도시하고;
도 3은 합성 직후에 분석된 100 mg/mL 아스코르베이트 및 5 mg/mL L-메티오닌을 함유하는 제제 완충제 중 177Lu-3BP-3554의 방사성크로마토그램을 도시하고;
도 4는 합성 6일 후에 분석된 100 mg/mL 아스코르베이트 및 5 mg/mL L-메티오닌을 함유하는 제제 완충제 중 177Lu-3BP-3554의 방사성크로마토그램을 도시하고;
도 5는 마우스 모델로의 주사 1시간, 3시간, 6시간 및 24시간 후 111In-3BP-3105 (A) 및 111In-3BP-3168 (B)의 SPECT-영상화에 의해 측정된 바와 같은 신장, 간, 혈액풀 및 HEK-FAP 종양에서의 조직 그램당 주사 용량의 백분율 (%ID/g) 흡수를 도시하고;
도 6은 마우스 모델로의 주사 1시간, 3시간, 6시간 및 24시간 후 111In-3BP-3320 (A) 및 111In-3BP-3321 (B)의 SPECT-영상화에 의해 측정된 바와 같은 신장, 간, 혈액풀 및 HEK-FAP 종양에서의 조직 그램당 주사 용량의 백분율 (%ID/g) 흡수를 도시하고;
도 7은 마우스 모델로의 주사 1시간, 3시간, 6시간 및 24시간 후 111In-3BP-3275 (A) 및 111In-3BP-3397 (B)의 SPECT-영상화에 의해 측정된 바와 같은 신장, 간, 혈액풀 및 HEK-FAP 종양에서의 조직 그램당 주사 용량의 백분율 (%ID/g) 흡수를 도시하고;
도 8은 마우스 모델로의 주사 1시간, 3시간, 6시간 및 24시간 후 111In-3BP-3398 (A) 및 111In-3BP-3407 (B)의 SPECT-영상화에 의해 측정된 바와 같은 신장, 간, 혈액풀 및 HEK-FAP 종양에서의 조직 그램당 주사 용량의 백분율 (%ID/g) 흡수를 도시하고;
도 9는 마우스 모델로의 주사 1시간, 3시간, 6시간 및 24시간 후 111In-3BP-3554 (A) 및 111In-3BP-3652 (B)의 SPECT-영상화에 의해 측정된 바와 같은 신장, 간, 혈액풀 및 HEK-FAP 종양에서의 조직 그램당 주사 용량의 백분율 (%ID/g) 흡수를 도시하고;
도 10은 마우스 모델로의 주사 1시간, 3시간, 6시간 및 24시간 후 111In-3BP-3654 (A) 및 111In-3BP-3656 (B)의 SPECT-영상화에 의해 측정된 바와 같은 신장, 간, 혈액풀 및 HEK-FAP 종양에서의 조직 그램당 주사 용량의 백분율 (%ID/g) 흡수를 도시하고;
도 11은 마우스 모델로의 주사 1시간, 3시간, 6시간 및 24시간 후 111In-3BP-3659 (A) 및 111In-3BP-3678 (B)의 SPECT-영상화에 의해 측정된 바와 같은 신장, 간, 혈액풀 및 HEK-FAP 종양에서의 조직 그램당 주사 용량의 백분율 (%ID/g) 흡수를 도시하고;
도 12는 마우스 모델로의 주사 1시간, 3시간, 6시간 및 24시간 후 111In-3BP-3692 (A) 및 111In-3BP-3767 (B)의 SPECT-영상화에 의해 측정된 바와 같은 신장, 간, 혈액풀 및 HEK-FAP 종양에서의 조직 그램당 주사 용량의 백분율 (%ID/g) 흡수를 도시하고;
도 13은 HEK-FAP 종양을 갖는 마우스로의 주사 1시간, 3시간, 6시간, 24시간 및 48시간 후 111In-3BP-3554의 SPECT-영상을 도시하고;
도 14는 HEK-FAP 종양을 갖는 마우스로의 주사 1시간, 3시간, 6시간, 24시간 및 48시간 후 111In-3BP-3767의 SPECT-영상을 도시하고;
도 15A는 비히클, 콜드 화합물 natLu-3BP-3554, 30 MBq (저용량) 177Lu-3BP-3554, 및 60 MBq (고용량) 177Lu-3BP-3554로 치료된 HEKFAP 종양을 갖는 마우스에서의 시간 경과에 따른 종양 성장을 도시하고;
도 15B는 비히클, 콜드 화합물 natLu-3BP-3554, 30 MBq (저용량) 177Lu-3BP-3554, 및 60 MBq (고용량) 177Lu-3BP-3554로 치료된 HEK-FAP 종양을 갖는 마우스에서의 시간 경과에 따른 퍼센트 체중 변화를 도시하고;
도 16A는 HEK-FAP 종양을 갖는 마우스에서 생체분포 60 MBq 177Lu-3BP-3554의 시간 경과에 따른 대표적인 SPECT/CT 영상을 도시하고;
도 16B는 HEK-FAP 종양을 갖는 마우스에서 생체분포 30 MBq 177Lu-3BP-3554의 시간 경과에 따른 대표적인 SPECT/CT 영상을 도시하고;
도 17A는 111In-3BP-3554 투여 3시간 후 4종의 상이한 육종 PDX 모델의 대표적인 SPECT/CT 영상을 도시하고;
도 17B는 주사 3시간 후 4종의 상이한 육종 PDX 모델에서의 111In-3BP-3554의 %ID/g 흡수를 도시하고;
도 18A는 비히클, 콜드 화합물 natLu-3BP-3554, 30 MBq 177Lu-3BP-3554 또는 60 MBq 177Lu-3BP-3554로 치료된 Sarc4809 PDX 종양을 갖는 마우스에서의 시간 경과에 따른 종양 성장을 도시하고;
도 18B는 비히클, 콜드 화합물 natLu-3BP-3554, 30 MBq 177Lu-3BP-3554 또는 60 MBq 177Lu-3BP-3554로 치료된 육종 Sarc4809 PDX 종양을 갖는 마우스에서의 시간 경과에 따른 체중 변화를 도시하고;
도 19는 인간 섬유모세포 활성화 단백질 (FAP) (서열식별번호: 1), 인간 디펩티딜 펩티다제 4 (DDP4) (서열식별번호: 2) 및 인간 프롤릴 엔도펩티다제 (PREP) (서열식별번호: 3)의 아미노산 서열을 도시하고;
도 20은 마우스 모델로의 주사 1시간, 3시간, 6시간 및 24시간 후 111In-3BP-3940의 SPECT-영상화에 의해 측정된 바와 같은 신장, 간, 혈액풀 및 HEK-FAP 종양에서의 조직 그램당 주사 용량 백분율 (%ID/g) 흡수를 도시하고;
도 21은 HEK-FAP 종양을 갖는 마우스로의 주사 1시간, 3시간, 6시간, 24시간 및 48시간 후 111In-3BP-3940의 SPECT-영상을 도시하고;
도 22는 HEK-FAP 종양을 갖는 마우스로의 주사 1시간, 3시간 및 6시간 후 99mTc-3BP-4219의 생체분포의 대표적인 SPECT/CT-영상을 도시하고;
도 23은 HEK-FAP 종양을 갖는 마우스로의 주사 1시간, 3시간 및 6시간 후 99mTc-3BP-4221의 생체분포의 대표적인 SPECT/CT-영상을 도시하고;
도 24는 HEK-FAP 종양을 갖는 마우스로의 주사 1시간, 3시간 및 6시간 후 99mTc-3BP-4541의 생체분포의 대표적인 SPECT/CT-영상을 도시하고;
도 25는 HEK-FAP 종양을 갖는 마우스로의 주사 1시간, 3시간 및 6시간 후 99mTc-3BP-4961의 생체분포의 대표적인 SPECT/CT-영상을 도시하고;
도 26은 HEK-FAP 종양을 갖는 마우스로의 주사 0.25시간, 1시간 및 3시간 후 68Ga-3BP-4768의 생체분포의 대표적인 PET/CT-영상을 도시하고;
도 27은 HEK-FAP 종양을 갖는 마우스로의 주사 0.25시간, 1시간 및 3시간 후 68Ga-3BP-5201의 생체분포의 대표적인 PET/CT-영상을 도시하고;
도 28은 HEK-FAP 종양을 갖는 마우스로의 주사 1시간, 3시간, 및 6시간, 24시간, 및 48시간 후 111In-3BP-4560의 생체분포의 대표적인 SPECT/CT-영상을 도시한다.
도 1은 합성 직후에 분석된 100 mg/mL 아스코르베이트 및 5 mg/mL L-메티오닌을 함유하는 제제 완충제 중 177Lu-3BP-3407의 방사성크로마토그램을 도시하고;
도 2는 합성 6일 후에 분석된 100 mg/mL 아스코르베이트 및 5 mg/mL L-메티오닌을 함유하는 제제 완충제 중 177Lu-3BP-3407의 방사성크로마토그램을 도시하고;
도 3은 합성 직후에 분석된 100 mg/mL 아스코르베이트 및 5 mg/mL L-메티오닌을 함유하는 제제 완충제 중 177Lu-3BP-3554의 방사성크로마토그램을 도시하고;
도 4는 합성 6일 후에 분석된 100 mg/mL 아스코르베이트 및 5 mg/mL L-메티오닌을 함유하는 제제 완충제 중 177Lu-3BP-3554의 방사성크로마토그램을 도시하고;
도 5는 마우스 모델로의 주사 1시간, 3시간, 6시간 및 24시간 후 111In-3BP-3105 (A) 및 111In-3BP-3168 (B)의 SPECT-영상화에 의해 측정된 바와 같은 신장, 간, 혈액풀 및 HEK-FAP 종양에서의 조직 그램당 주사 용량의 백분율 (%ID/g) 흡수를 도시하고;
도 6은 마우스 모델로의 주사 1시간, 3시간, 6시간 및 24시간 후 111In-3BP-3320 (A) 및 111In-3BP-3321 (B)의 SPECT-영상화에 의해 측정된 바와 같은 신장, 간, 혈액풀 및 HEK-FAP 종양에서의 조직 그램당 주사 용량의 백분율 (%ID/g) 흡수를 도시하고;
도 7은 마우스 모델로의 주사 1시간, 3시간, 6시간 및 24시간 후 111In-3BP-3275 (A) 및 111In-3BP-3397 (B)의 SPECT-영상화에 의해 측정된 바와 같은 신장, 간, 혈액풀 및 HEK-FAP 종양에서의 조직 그램당 주사 용량의 백분율 (%ID/g) 흡수를 도시하고;
도 8은 마우스 모델로의 주사 1시간, 3시간, 6시간 및 24시간 후 111In-3BP-3398 (A) 및 111In-3BP-3407 (B)의 SPECT-영상화에 의해 측정된 바와 같은 신장, 간, 혈액풀 및 HEK-FAP 종양에서의 조직 그램당 주사 용량의 백분율 (%ID/g) 흡수를 도시하고;
도 9는 마우스 모델로의 주사 1시간, 3시간, 6시간 및 24시간 후 111In-3BP-3554 (A) 및 111In-3BP-3652 (B)의 SPECT-영상화에 의해 측정된 바와 같은 신장, 간, 혈액풀 및 HEK-FAP 종양에서의 조직 그램당 주사 용량의 백분율 (%ID/g) 흡수를 도시하고;
도 10은 마우스 모델로의 주사 1시간, 3시간, 6시간 및 24시간 후 111In-3BP-3654 (A) 및 111In-3BP-3656 (B)의 SPECT-영상화에 의해 측정된 바와 같은 신장, 간, 혈액풀 및 HEK-FAP 종양에서의 조직 그램당 주사 용량의 백분율 (%ID/g) 흡수를 도시하고;
도 11은 마우스 모델로의 주사 1시간, 3시간, 6시간 및 24시간 후 111In-3BP-3659 (A) 및 111In-3BP-3678 (B)의 SPECT-영상화에 의해 측정된 바와 같은 신장, 간, 혈액풀 및 HEK-FAP 종양에서의 조직 그램당 주사 용량의 백분율 (%ID/g) 흡수를 도시하고;
도 12는 마우스 모델로의 주사 1시간, 3시간, 6시간 및 24시간 후 111In-3BP-3692 (A) 및 111In-3BP-3767 (B)의 SPECT-영상화에 의해 측정된 바와 같은 신장, 간, 혈액풀 및 HEK-FAP 종양에서의 조직 그램당 주사 용량의 백분율 (%ID/g) 흡수를 도시하고;
도 13은 HEK-FAP 종양을 갖는 마우스로의 주사 1시간, 3시간, 6시간, 24시간 및 48시간 후 111In-3BP-3554의 SPECT-영상을 도시하고;
도 14는 HEK-FAP 종양을 갖는 마우스로의 주사 1시간, 3시간, 6시간, 24시간 및 48시간 후 111In-3BP-3767의 SPECT-영상을 도시하고;
도 15A는 비히클, 콜드 화합물 natLu-3BP-3554, 30 MBq (저용량) 177Lu-3BP-3554, 및 60 MBq (고용량) 177Lu-3BP-3554로 치료된 HEKFAP 종양을 갖는 마우스에서의 시간 경과에 따른 종양 성장을 도시하고;
도 15B는 비히클, 콜드 화합물 natLu-3BP-3554, 30 MBq (저용량) 177Lu-3BP-3554, 및 60 MBq (고용량) 177Lu-3BP-3554로 치료된 HEK-FAP 종양을 갖는 마우스에서의 시간 경과에 따른 퍼센트 체중 변화를 도시하고;
도 16A는 HEK-FAP 종양을 갖는 마우스에서 생체분포 60 MBq 177Lu-3BP-3554의 시간 경과에 따른 대표적인 SPECT/CT 영상을 도시하고;
도 16B는 HEK-FAP 종양을 갖는 마우스에서 생체분포 30 MBq 177Lu-3BP-3554의 시간 경과에 따른 대표적인 SPECT/CT 영상을 도시하고;
도 17A는 111In-3BP-3554 투여 3시간 후 4종의 상이한 육종 PDX 모델의 대표적인 SPECT/CT 영상을 도시하고;
도 17B는 주사 3시간 후 4종의 상이한 육종 PDX 모델에서의 111In-3BP-3554의 %ID/g 흡수를 도시하고;
도 18A는 비히클, 콜드 화합물 natLu-3BP-3554, 30 MBq 177Lu-3BP-3554 또는 60 MBq 177Lu-3BP-3554로 치료된 Sarc4809 PDX 종양을 갖는 마우스에서의 시간 경과에 따른 종양 성장을 도시하고;
도 18B는 비히클, 콜드 화합물 natLu-3BP-3554, 30 MBq 177Lu-3BP-3554 또는 60 MBq 177Lu-3BP-3554로 치료된 육종 Sarc4809 PDX 종양을 갖는 마우스에서의 시간 경과에 따른 체중 변화를 도시하고;
도 19는 인간 섬유모세포 활성화 단백질 (FAP) (서열식별번호: 1), 인간 디펩티딜 펩티다제 4 (DDP4) (서열식별번호: 2) 및 인간 프롤릴 엔도펩티다제 (PREP) (서열식별번호: 3)의 아미노산 서열을 도시하고;
도 20은 마우스 모델로의 주사 1시간, 3시간, 6시간 및 24시간 후 111In-3BP-3940의 SPECT-영상화에 의해 측정된 바와 같은 신장, 간, 혈액풀 및 HEK-FAP 종양에서의 조직 그램당 주사 용량 백분율 (%ID/g) 흡수를 도시하고;
도 21은 HEK-FAP 종양을 갖는 마우스로의 주사 1시간, 3시간, 6시간, 24시간 및 48시간 후 111In-3BP-3940의 SPECT-영상을 도시하고;
도 22는 HEK-FAP 종양을 갖는 마우스로의 주사 1시간, 3시간 및 6시간 후 99mTc-3BP-4219의 생체분포의 대표적인 SPECT/CT-영상을 도시하고;
도 23은 HEK-FAP 종양을 갖는 마우스로의 주사 1시간, 3시간 및 6시간 후 99mTc-3BP-4221의 생체분포의 대표적인 SPECT/CT-영상을 도시하고;
도 24는 HEK-FAP 종양을 갖는 마우스로의 주사 1시간, 3시간 및 6시간 후 99mTc-3BP-4541의 생체분포의 대표적인 SPECT/CT-영상을 도시하고;
도 25는 HEK-FAP 종양을 갖는 마우스로의 주사 1시간, 3시간 및 6시간 후 99mTc-3BP-4961의 생체분포의 대표적인 SPECT/CT-영상을 도시하고;
도 26은 HEK-FAP 종양을 갖는 마우스로의 주사 0.25시간, 1시간 및 3시간 후 68Ga-3BP-4768의 생체분포의 대표적인 PET/CT-영상을 도시하고;
도 27은 HEK-FAP 종양을 갖는 마우스로의 주사 0.25시간, 1시간 및 3시간 후 68Ga-3BP-5201의 생체분포의 대표적인 PET/CT-영상을 도시하고;
도 28은 HEK-FAP 종양을 갖는 마우스로의 주사 1시간, 3시간, 및 6시간, 24시간, 및 48시간 후 111In-3BP-4560의 생체분포의 대표적인 SPECT/CT-영상을 도시한다.
하기 실시예는 본원에 개시된 주제의 대표적인 실시양태를 실시하기 위해 관련 기술분야의 통상의 기술자에게 지침을 제공하기 위해 포함되었다. 본 개시내용 및 관련 기술분야의 일반적 수준에 비추어, 관련 기술분야의 통상의 기술자는 하기 실시예가 단지 예시적인 것으로 의도되며, 본원에 개시된 대상의 범주로부터 벗어나지 않으면서 수많은 변화, 변형 및 변경이 사용될 수 있음을 인지할 수 있다. 하기 합성 설명 및 구체적 실시예는 단지 예시의 목적을 위한 것이며, 다른 방법에 의해 본 개시내용의 화합물을 제조하는 어떠한 방식으로도 제한하는 것으로 해석되어서는 안된다.
실시예
본 출원 및 하기 실시예에 사용된 약어는 특히 하기와 같다:
4PL은 4 파라미터 로지스틱 곡선 피팅을 의미한다.
옹스트롬기호는 옹스트롬을 의미한다.
ACN은 아세토니트릴을 의미한다.
Ahx는 6-아미노헥산산을 의미한다.
AMC는 7-아미노-4-메틸쿠마린을 의미한다.
amu는 원자 질량 단위를 의미한다.
aq.는 수성을 의미한다.
AUCinf는 무한대로 외삽된 곡선하 면적을 의미한다.
BPS는 혈액 풀 대용물을 의미한다.
BSA는 소 혈청 알부민을 의미한다.
C0은 화합물의 초기 농도를 의미한다.
CAF는 암 연관 섬유모세포를 의미한다.
CL은 클리어런스를 의미한다.
CM은 켐매트릭스(ChemMatrix)TM을 의미한다.
CT는 컴퓨터 단층촬영을 의미한다.
Cy5는 시아닌-5를 의미한다.
DAD는 다이오드 어레이 검출기를 의미한다.
DCM은 디클로로메탄을 의미한다.
Dde는 N-(1-(4,4-디메틸-2,6-디옥소시클로헥실리덴)에틸)을 의미한다.
DEG는 디에틸렌 글리콜 디메타크릴레이트를 의미한다.
DIC는 N,N'-디이소프로필카르보디이미드를 의미한다.
DICOM은 의학에서의 디지털 영상화 및 통신을 의미한다.
DIPEA는 디이소프로필에틸아민을 의미한다.
DMF는 N,N-디메틸포름아미드를 의미한다.
DMSO는 디메틸 술폭시드를 의미한다.
DOTA는 1,4,7,10-테트라아자시클로도데칸-1,4,7,10-테트라아세트산을 의미한다.
DOTA(tBu)3-OH는 트리-tert-부틸-1,4,7,10-테트라아자시클로-도데칸-1,4,7,10-테트라아세테이트를 의미한다.
DPP는 디펩티딜 펩티다제를 의미한다.
EC는 전자 포획을 의미한다.
EC50은 반수-최대 흥분 농도를 의미한다.
ECACC는 인증된 세포 배양물의 유럽 콜렉션을 의미한다.
EDC는 1-에틸-3-(3-디메틸아미노프로필)카르보디이미드를 의미한다.
EMEM은 이글 최소 필수 배지(Eagle's Minimum Essential Medium)를 의미한다.
eq 또는 eq.는 당량을 의미한다.
ESI는 전기분무 이온화를 의미한다.
Et2O는 디에틸에테르를 의미한다.
EtOAc는 에틸아세테이트를 의미한다.
FACS는 형광-활성화 세포 분류를 의미한다.
FAP는 섬유모세포 활성화 단백질을 의미한다.
Fb는 배경 형광 강도를 의미한다.
FBS는 태아 소 혈청을 의미한다.
FGF21은 섬유모세포 성장 인자 21을 의미한다.
FITC는 5(6)-플루오레세인 이소티오시아네이트를 의미한다.
Fmoc는 9-플루오레닐메톡시카르보닐을 의미한다.
FRET는 형광 공명 에너지 전달을 의미한다.
Ft는 형광 강도를 의미한다.
Gab는 감마-아미노 부티르산을 의미한다.
GABA는 감마-아미노 부티르산을 의미한다.
h는 시간을 의미한다.
HATU는 O-(7-아자벤조트리아졸-1-일)-N,N,N',N'-테트라메틸우로늄 헥사플루오로포스페이트를 의미한다.
HBST는 SPR 구동 완충제를 의미한다.
HEK-FAP는 인간 FAP를 발현하는 인간 배아 신장 293 세포를 의미한다.
HEPES는 4-(2-히드록시에틸)-1-피페라진에탄술폰산을 의미한다.
HFIP는 헥사플루오로-2-이소프로판올을 의미한다.
HOAc는 아세트산을 의미한다.
HOAt는 1-히드록시-7-아자벤조트리아졸을 의미한다.
HPLC는 고성능 액체 크로마토그래피를 의미한다.
HPLC/MS는 고성능 액체 크로마토그래피/질량 분광측정법을 의미한다.
IC50은 반수-최대 억제 농도를 의미한다.
ID/g는 그램당 주사된 용량을 의미한다.
IS는 이성질체 전이를 의미한다.
iTLC-SG는 즉석 박층 크로마토그래피-실리카-겔을 의미한다.
K2EDTA는 에틸렌디아민테트라아세트산 이칼륨을 의미한다.
KD는 해리 상수를 의미한다.
kDa는 1000 달톤을 의미한다.
Ki는 억제 상수를 의미한다.
koff는 해리 속도를 의미한다.
kon는 회합 속도를 의미한다.
LC/TOF-MS는 액체 크로마토그래피/비행 시간/질량 분광측정법을 의미한다.
LC-MS는 질량 분광측정법과 커플링된 고성능 액체 크로마토그래피를 의미한다.
LDH는 락테이트 데히드로게나제를 의미한다.
Leu는 류신을 의미한다.
LiOH는 수산화리튬을 의미한다.
M은 몰(molar) 또는 리터당 몰(mol)을 의미한다.
m/z는 질량을 전하로 나눈 것을 의미한다.
최대는 최대를 의미한다.
MeOH는 메탄올을 의미한다.
MeV는 메가 전자 볼트를 의미한다.
min은 분을 의미한다.
MMP는 매트릭스 메탈로프로테이나제를 의미한다.
MRM은 다중 반응 모니터링을 의미한다.
MTBE는 메틸-tert-부틸에테르를 의미한다.
Mtt는 메틸트리틸을 의미한다.
MTV는 평균 종양 부피를 의미한다.
MW는 분자량을 의미한다.
n.d.는 결정되지 않음을 의미한다.
Na2SO4는 황산나트륨을 의미한다.
NaCl은 염화나트륨을 의미한다.
NaHCO3은 탄산수소나트륨을 의미한다.
NCA는 비-구획 분석을 의미한다.
NHS는 N-히드록시숙신이미드를 의미한다.
NMP는 1-메틸-2-피롤리돈을 의미한다.
NOS는 달리 명시되지 않음을 의미한다.
Oic는 L-옥타히드로인돌-2-카본우레아를 의미한다.
p.a.는 분석 목적용 (품질 등급)을 의미한다.
p.i.는 주사 후를 의미한다.
Pbf는 2,2,4,6,7-펜타메틸-2,3-디히드로벤조푸란-5-술포닐을 의미한다.
PBS는 포스페이트 완충 염수를 의미한다.
PDX는 환자-유래 이종이식편을 의미한다.
PET는 양전자 방출 단층촬영을 의미한다.
pIC50은 몰로 전환될 때 IC50 값의 음의 로그를 의미한다.
POP는 프롤릴 올리고펩티다제를 의미한다.
ppm은 백만분율을 의미한다.
PREP는 프롤릴 엔도펩티다제를 의미한다.
prep.은 정제용을 의미한다.
PS는 폴리스티렌을 의미한다.
Q-TOF는 사중극자 비행 시간을 의미한다.
Ref는 참조를 의미한다.
RFU는 상대 형광 단위를 의미한다.
RLB는 방사성리간드 결합 검정을 의미한다.
RMCE는 레콤비나제-매개 카세트 교환을 의미한다.
RP는 역상을 의미한다.
Rt는 체류 시간을 의미한다.
RT는 실온을 의미한다.
RU는 공명 단위를 의미한다.
SAR은 구조 활성 관계를 의미한다.
sat.는 포화를 의미한다.
SCID는 중증 복합 면역결핍을 의미한다.
SCK는 단일 사이클 동역학을 의미한다.
sec 또는 s는 초를 의미한다.
SF는 자발 핵분열을 의미한다.
SPECT는 단일 광자 방출 컴퓨터 단층촬영을 의미한다.
SPPS는 고체 상 펩티드 합성을 의미한다.
t1/2는 말단 반감기를 의미한다.
tBu는 tert. 부틸을 의미한다.
TFA는 트리플루오로아세테이트 또는 트리플루오로아세트산을 의미한다.
TG는 텐타겔(TentaGel)을 의미한다.
TGI는 종양 성장 억제를 의미한다.
THF는 테트라히드로푸란을 의미한다.
TIPS는 트리이소프로필실란을 의미한다.
TLC는 박층 크로마토그래피를 의미한다.
TME는 종양 미세환경을 의미한다.
tR은 체류 시간을 의미한다.
UHPLC는 초고성능 액체 크로마토그래피를 의미한다.
UV는 자외선을 의미한다.
VSS는 정상 상태에서의 분포 부피를 의미한다.
VZ는 말기 상에서의 분포 부피를 의미한다.
실시예 1: 물질 및 방법
물질 및 방법 뿐만 아니라 일반적 방법을 하기 실시예에 의해 추가로 예시한다.
용매:
용매를 추가 정제 없이 명시된 품질로 사용하였다. 아세토니트릴 (초 구배(Super Gradient), HPLC, VWR - 분석용; 프렙솔브(PrepSolv), 머크 - 정제용); 디클로로메탄 (합성, 로트(Roth)); 에틸 아세테이트 (합성 등급, 로트); N,N-디메틸포름아미드 (펩티드 합성 등급, 바이오솔브(Biosolve)); 1-메틸-2-피롤리돈 (펩티드 등급, 아이리스 바이오테크(IRIS BioTech)) 1,4-디옥산 (reinst, 로트); 메탄올 (p. a., 머크).
물: 밀리-큐 플러스(Milli-Q Plus), 밀리포어(Millipore), 탈염.
화학물질:
화학물질을 문헌 절차에 따라 또는 그와 유사하게 합성하거나, 또는 시그마-알드리치-머크(Sigma-Aldrich-Merck) (독일 다이젠호펜), 바켐(Bachem) (스위스 부벤도르프), VWR (독일 다름슈타트), 노바바이오켐(Novabiochem) (머크 그룹(Merck Group), 독일 다름슈타트), 아크로스 오가닉스(Acros Organics) (유통사 피셔 사이언티픽 게엠베하(Fisher Scientific GmbH), 독일 슈베르테), 아이리스 바이오테크(Iris Biotech) (독일 마르크트레드비츠), 아마테크 케미칼(Amatek Chemical) (중국 지앙수), 로트 (도이칠란드 카를스루에), 몰레큘라 디바이시스(Molecular Devices) (미국 시카고), 바이오크롬(Biochrom) (독일 베를린), 펩테크(Peptech) (미국 매사추세츠주 캠브리지), 신테테크(Synthetech) (미국 오리건주 알바니), 파마코어(Pharmacore) (미국 노스캐롤라이나주 하이 포인트), PCAS 바이오매트릭스 인크(PCAS Biomatrix Inc) (캐나다 퀘벡주 셍-쟝-슈흐-히슐리유), 알파 에이사(Alfa Aesar) (독일 카를스루에), 톈진 난카이 허청 S&T 캄파니, 리미티드 (Tianjin Nankai Hecheng S&T Co., Ltd) (중국 톈진), 케마테크(CheMatech) (프랑스 디종) 및 아나스펙(Anaspec) (미국 캘리포니아주 새너제이) 또는 다른 회사로부터 구입하고, 추가 정제 없이 지정된 품질로 사용하였다.
Boc4N4Ac-OH를 문헌 절차 (Maecke et al. Chem. Eur. J., 2010, 16, 7, 2115)에 따라 합성하였다.
세포:
HT29 (ECACC Cat. No. 91072201) 및 WI-38 (ECACC Cat. No. 90020107)을 ECACC로부터 구입하고, 인간 FAP (Q12884)를 발현하는 HEK293 세포를 인스크린엑스 게엠베하(InSCREENeX GmbH) (독일 브라운슈바이크)에 의해 레콤비나제-매개 카세트 교환 (RMCE)을 사용하여 생산하였다. RMCE 절차는 문헌 [Nehlsen et al. (Nehlsen, et al., BMC Biotechnol, 2009, 9: 100)]에 기재되어 있다.
HPLC/MS 분석
HPLC/MS 분석은 모든 크로마토그램에 대해 2단계 구배 (12분 내 5 → 65% B, 이어서 0.5분 내 65 → 90%, A: 물 중 0.1% TFA 및 B: ACN 중 0.1% TFA)를 사용하여 샘플 용액 5 μl의 주입에 의해 수행하였다. RP 칼럼은 애질런트(Agilent) (유형 포로쉘(Poroshell) 120, 2.7 μm, EC-C18, 50 x 3.00 mm, 유량 0.8 ml, HPLC, 실온에서); 질량 분광계: 애질런트 6230 LC/TOF-MS, ESI 이온화로부터 입수하였다. 매스헌터 정성 분석(MassHunter Qualitative Analysis) B.07.00 SP2를 소프트웨어로서 사용하였다. UV 검출은 λ = 230 nm에서 수행하였다. 체류 시간 (Rt)은 소수점 (예를 들어 1.9분 = 1분 54초)으로 나타내고, UV 분광계에서의 검출을 지칭한다. 관찰된 화합물 질량의 평가를 위해, '화학식에 의한 화합물 찾기'-특징을 사용하였다. 특히, 개별적인 '화합물의 중성 질량 (달톤 단위)'-값 및 상응하는 동위원소 분포 패턴을 사용하여 화합물 실체를 확인하였다. 질량 분광계의 정확도는 대략 ± 5 ppm이었다.
정제용 HPLC:
정제용 HPLC 분리는 정지상으로서 역상 칼럼 (페노메넥스(Phenomenex)로부터의 키네텍스(Kinetex) 5 μ XB-C18 100 Å, 150 x 30 mm 또는 RLRP-S 8 μ, 100 Å, 150 x 25 mm)을 사용하여 수행하였다. 이동상으로서 물 중 0.1% TFA (A) 및 ACN 중 0.1% TFA (B)를 사용하였으며, 이를 선형 2원 구배로 혼합하였다. 구배는 "30분 내 10 → 40% B"로 기재되며, 이는 10% B (및 상응하게 90% A) → 40% B (및 상응하게 60% A)의 선형 구배가 30분 내 실행되었음을 의미한다. 유량은 30 내지 50 ml/분의 범위 내였다. 본 발명의 화합물의 정제를 위한 전형적인 구배는 5-25% B에서 출발하여 35-50% B에서 30분 후에 종료되고, 종료 및 출발에서의 백분율 B들 사이의 차이는 적어도 10%였다. 통상적으로 사용되는 구배는 "30분 내 15 → 40% B"였다.
자동화/반-자동화 고체-상 합성을 위한 일반적 절차:
펩티드 및 폴리아미드의 자동화 고체-상을 테트라스 펩티드 합성기(Tetras Peptide Synthesizer) (어드밴스드 켐테크(Advanced ChemTech)) 상에서 50 μmol 및 100 μmol 규모로 수행하였다. 프릿 (재료 PE, 롤랜드 베터 래보르베다르프 오하게(Roland Vetter Laborbedarf OHG), 독일 아머부흐)이 장착된 플라스틱 시린지에서 수동 단계를 수행하였다. 달리 언급되지 않는 한, 기재된 프로토콜에서의 시약의 양은 100 μmol 규모에 상응한다.
고체-상 합성을 폴리스티렌 (1,4-디비닐벤젠 (PS) 또는 디 (에틸렌 글리콜) 디메타크릴레이트 (DEG)와 가교됨), 켐매트릭스 (CM) 또는 텐타겔 (TG) 수지 상에서 수행하였다. 수지 링커는 트리틸, 왕(wang) 및 링크 아미드였다.
수지 로딩:
트리틸 링커의 경우, 제1 빌딩 블록의 부착 (수지 로딩)을 하기와 같이 수행하였다. 수지 (폴리스티렌 (PS) 트리틸 클로라이드, 초기 로딩: 1.8 mmol/g)를 DCM (5 ml) 중에서 30분 동안 팽윤시키고, 후속적으로 DCM (3 ml, 1분)으로 세척하였다. 이어서 수지를 DCM (4 ml) 중 상응하는 빌딩 블록 (0.5 mmol, 5 당량) 및 DIPEA (350 μl, 3.5 mmol, 35 당량)의 혼합물로 1시간 동안 처리하였다. 그 후, 수지를 메탄올 (5 ml, 5분) 및 DMF (3 ml, 2x 1분)로 세척하였다.
왕 링커의 경우, 사전-로딩된 수지 (폴리스티렌 (PS) 및 텐타겔 (TG))를 사용하였다.
링크 아미드 링커의 경우, 수지 (CM, DEG)에 대한 제1 잔기의 부착을 하기 기재된 바와 같은 쇄 어셈블리에 대한 것과 동일한 절차로 수행하였다.
Alloc/알릴-탈보호:
DMF 중에서 팽윤시킨 후, 수지를 DMF 및 DCM으로 세척하였다. DCM을 질소의 스트림을 교반 용매에 통과시킴으로써 탈산소화시켰다. 산소-무함유 용매를 사용하여 수지를 3회 세척하였다. 이어서 산소-무함유 DCM 중 바르비투르산의 2 M 용액 2 ml 및 산소-무함유 DCM 중 테트라키스(트리페닐포스핀)팔라듐(0)의 25 μM 용액 1 ml을 수지에 첨가하였다. 수지를 1시간 동안 교반한 다음, DCM, MeOH, DMF, DMF 중 5% DIPEA, DMF 중 5% 디티오카르바메이트, DMF 및 DCM으로 세척하였다 (각각의 세척 단계를 3 ml, 1분으로 3회 반복함).
Fmoc-탈보호:
DMF 중에서 팽윤시킨 후, 수지를 DMF로 세척한 다음, 피페리딘/DMF (1:4, 3 ml, 2 및 20분)로 처리하고, 후속적으로 DMF (3 ml, 5x 1분)로 세척하였다.
Dde-탈보호:
DMF 중에서 팽윤시킨 후, 수지를 DMF로 세척한 다음, 히드라진-수화물/DMF (2/98, 3 ml 2x 10분)로 처리하고, 후속적으로 DMF (3 ml, 5x 1분)로 세척하였다.
Mtt-탈보호:
DCM 중에서 팽윤시킨 후, 수지를 DCM으로 세척한 다음, HFIP/DCM (7/3, 4 - 6 ml, 4시간)으로 처리하고, 후속적으로 DCM (3 ml, 3x 1분), DMF (3 ml, 3x 1ml) 및 DIPEA (DMF 중 0.9 M, 3 ml, 1분)로 세척하였다.
시약의 용액:
빌딩 블록 (DMF 또는 NMP 중 0.3 M), DIPEA (DMF 중 0.9 M), HATU (DMF 중 0.4 M), 아세트산 무수물 (DMF 중 0.75 M)
커플링: 빌딩 블록/아미노산의 커플링 (쇄 어셈블리):
달리 언급되지 않는 한, 빌딩 블록의 커플링은 하기와 같이 수행하였다: 상응하는 빌딩 블록의 용액 (1.7 ml, 5당량), DIPEA 용액 (1.15 ml, 10 당량), 및 HATU 용액 (1.25 ml, 5 당량)의 후속 첨가 후, 수지를 45분 동안 진탕시켰다. 필요한 경우, 수지를 DMF (3 ml, 1분)로 세척하고, 커플링 단계를 반복하였다.
말단 아세틸화:
DIPEA 용액 (1.75 ml, 16 당량) 및 아세트산 무수물 용액 (1.75 ml, 13 당량)의 첨가 후, 수지를 10분 동안 진탕시켰다. 그 후, 수지를 DMF (3 ml, 6x 1분)로 세척하였다.
절단 방법 A: 과산 불안정성 수지로부터의 보호된 단편의 절단:
서열의 어셈블리의 완료 후, 수지를 최종적으로 DCM (3 ml, 4x 1분)으로 세척한 다음, 진공 하에 건조시켰다. 이어서 수지를 HFIP/DCM (7/1, 4 ml, 4시간)으로 처리하고, 수집된 용액을 증발 건조시켰다. 잔류물을 정제용 HPLC로 정제하거나 또는 추가 정제 없이 사용하였다.
절단 방법 B: 비보호된 단편의 절단 (완전한 수지 절단):
서열의 어셈블리 완료 후, 수지를 최종적으로 DCM (3 ml, 4x 1분)으로 세척하고, 진공 하에 밤새 건조시키고, TFA, EDT, 물 및 TIPS (94/2.5/2.5/1)로 2시간 동안 처리하였다 (달리 언급되지 않는 한). 그 후, 절단 용액을 MTBE 및 시클로헥산의 냉각된 혼합물 (1/1, 절단 용액의 부피에 비해 10배 과량)에 붓고, 4℃에서 5분 동안 원심분리하고, 침전물을 수집하고, 진공 하에 건조시켰다. 잔류물을 물/아세토니트릴로부터 동결건조시킨 후 정제 또는 추가 변형시켰다.
절단 방법 C: 용액 중 펩티드의 보호기의 절단
보호된/부분 보호된 화합물을 TFA, 물 및 TIPS (95/2.5/2.5) 중에 2시간 동안 용해시켰다 (달리 언급되지 않는 한). 그 후, 절단 용액을 MTBE 및 시클로헥산의 냉각된 혼합물 (1/1, 절단 용액의 부피에 비해 10배 과량)에 붓고, 4℃에서 5분 동안 원심분리하고, 침전물을 수집하고, 진공 하에 건조시켰다. 잔류물을 물/아세토니트릴로부터 동결건조시킨 후 정제 또는 추가 변형시켰다.
보다 관련된 Fmoc-고체-상-펩티드 합성 방법은 문헌 ["Fmoc Solid Phase Peptide Synthesis" Editors W. Chan, P. White, Oxford University Press, USA, 2000]에 상세히 기재되어 있다. 적절한 경우에, 화합물을 메스트레노바(MestreNova) 버전 12 Mnova IUPAC 네임 플러그인 (메스트렐라브 리서치, 에스.엘.(Mestrelab Research, S.L.)), 또는 오토놈(AutoNom) 버전 2.2 (바일스타인 인포메이션스시스템 카피라이트(Beilstein Informationssysteme Copyright)ⓒ 1988-1998, 바일스타인 케미데텐 앤드 소프트웨어 게엠베하(Beilstein Chemiedaten and Software GmbH)로 라이센싱된 바일스타인 인스티튜트 퓌르 리테라투르 데 오르가니쉔 케미(Beilstein Institut fuer Literatur der Organischen Chemie))를 사용하여 명명하였다.
화합물의 제조:
본 발명의 화합물의 제조를 위한 구체적 실시양태는 하기 실시예에 제공된다. 달리 명시되지 않는 한, 모든 출발 물질 및 시약은 표준 상업용 등급의 것이고, 추가 정제 없이 사용되거나, 또는 상용 방법에 의해 이러한 물질로부터 용이하게 제조된다. 유기 합성의 관련 기술분야의 통상의 기술자는 본 개시내용에 비추어 출발 물질 및 반응 조건이 본 발명에 의해 포괄되는 화합물을 제조하는데 사용되는 추가의 단계를 포함하여 달라질 수 있다는 것을 인식할 것이다.
본 발명의 화합물에 대한 하나의 일반적 합성 경로는 하기를 포함한다:
1. 2개의 티올 모이어티를 갖는 선형 펩티드 전구체의 고체 상 펩티드 합성 (SPPS).
2. 하기 유도체를 사용한 상기 선형 펩티드 전구체의 티올-부위 특이적 고리화:
a. 비스(브로모메틸)벤젠 유도체 또는
b. 트리스(브로모메틸)벤젠 유도체
3. 트리스(브로모메틸)벤젠 유도체를 사용한 고리화의 경우, 고리화 반응에서 형성된 중간체를 킬레이트화제의 부착을 가능하게 하는 링커와 추가로 반응시킴.
실시예 2: Ac-Met-[Cys(3MeBn)-Pro-Pro-Thr-Glu-Phe-Cys]-Asp-His-Nmf-Arg-Asp-NH2 (3BP-3188)의 합성
펩티드의 서열 (Ac-Met-Cys-Pro-Pro-Thr-Glu-Phe-Cys-Asp-His-Nmf-Arg-Asp-NH2)을 '자동화/반자동화 고체-상 합성을 위한 일반적 절차'에 따라 링크 아미드 수지 상에서 50 μmol 규모로 어셈블리하였다. '절단 방법 B'의 단계를 수행한 후, 동결건조된 조 펩티드 잔류물을 중탄산암모늄 용액 (50 mM, pH = 8.5) 및 아세토니트릴의 1:1 혼합물 60 ml 중에 용해시켰다. 이 혼합물에 0.5 ml 아세토니트릴 중 14.5 mg α,α'-디브로모-m-크실렌 (55 μmol, 초기 수지 로딩과 비교하여 1.1 당량)의 용액을 첨가하였다. 고리화 반응의 완결 시, 50 μl TFA를 첨가하고, 용매를 동결건조에 의해 제거하였다. 나머지를 HPLC 정제 (30분 내 15 → 45% B - 키네텍스)에 적용하여 순수한 표제 화합물 8.61 mg (9.8%)을 수득하였다. HPLC: Rt = 5.87 분. LC/TOF-MS: 정확한 질량 1753.716 (계산치 1753.705). C79H107N19O21S3 (MW = 1755.011).
실시예 3: DOTA-Ttds-Leu-[Cys(3MeBn)-Pro-Pro-Thr-Glu-Phe-Cys]-Asp-His-Phe-Arg-Asp-NH2 (3BP-3172)의 합성
펩티드의 서열 (DOTA-Ttds-Leu-Cys-Pro-Pro-Thr-Glu-Phe-Cys-Asp-His-Phe-Arg-Asp-NH2)을 '자동화/반자동화 고체-상 합성을 위한 일반적 절차'에 따라 링크 아미드 수지 상에서 50 μmol 규모로 어셈블리하였다. '절단 방법 B'의 단계를 수행한 후, 동결건조된 조 펩티드 잔류물을 중탄산암모늄 용액 (50 mM, pH = 8.5) 및 아세토니트릴의 1:1 혼합물 60 ml 중에 용해시켰다. 이 혼합물에 0.5 ml 아세토니트릴 중 14.5 mg α,α'-디브로모-m-크실렌 (55 μmol, 초기 수지 로딩과 비교하여 1.1 당량)의 용액을 첨가하였다. 고리화 반응의 완결 시, 50 μl TFA를 첨가하고, 용매를 동결건조에 의해 제거하였다. 나머지를 HPLC 정제 (30분 내 20 → 45% B - 키네텍스)에 적용하여 순수한 표제 화합물 35.46 mg (29.8%)을 수득하였다. HPLC: Rt = 5.9 분. LC/TOF-MS: 정확한 질량 2368.091 (계산치 2368.087). C107H157N25O32S2 (MW = 2369.676).
실시예 4: Hex-[Cys(3MeBn)-Pro-Pro-Thr-Glu-Phe-Cys]-Asp-His-Ppa-arg-Ttds-Lys(DOTA)-NH2 (3BP-3277)의 합성
펩티드의 서열 (Hex-Cys-Pro-Pro-Thr-Glu-Phe-Cys-Asp-His-Ppa-arg-Ttds-Lys(Mtt)-NH2)을 '자동화/반자동화 고체-상 합성을 위한 일반적 절차'에 따라 링크 아미드 수지 상에서 50 μmol 규모로 어셈블리하였다. 이어서 '자동화/반-자동화 고체-상 합성을 위한 일반적 절차'에 기재된 'Mtt 탈보호'를 수행하여 펩티드 수지의 C-말단 리신 잔기의 ε-아미노 관능기를 유리시켰다. DOTA(tBu)3-OH (143.3 mg, 250 μmol, 초기 수지 로딩과 비교하여 5 당량)를 DMF 중 HATU의 0.4 M 용액 0.6 ml 및 DMF 중 DIPEA의 0.9 M 0.65 ml 중에 용해시켰다. 예비-활성화를 위해 혼합물을 1분 동안 방치한 후, 이를 수지에 첨가하였다. 1시간 후에 3.2 M의 DMF 중 DIC 0.2 ml을 첨가하고, 수지의 완만한 교반을 추가 1시간 동안 계속하였다. 수지를 완전히 세척하고, '절단 방법 B' 프로토콜에 적용하였다. 동결건조된 나머지 (선형, 분지형 펩티드 Hex-Cys-Pro-Pro-Thr-Glu-Phe-Cys-Asp-His-Ppa-arg-Ttds-Lys(DOTA)-NH2)를 중탄산암모늄 용액 (50 mM, pH = 8.5) 및 아세토니트릴의 1:1 혼합물 60 ml 중에 용해시켰다. 이 혼합물에 0.5 ml 아세토니트릴 중 14.5 mg α,α'-디브로모-m-크실렌 (55 μmol, 초기 수지 로딩과 비교하여 1.1 당량)의 용액을 첨가하였다. 고리화 반응의 완결 시, 50 μl TFA를 첨가하고, 용매를 동결건조에 의해 제거하였다. 나머지를 HPLC 정제 (30분 내 15 → 40% B - 키네텍스)에 적용하여 순수한 표제 화합물 17.18 mg (14.5%)을 수득하였다. HPLC: Rt = 5.8 분. LC/TOF-MS: 정확한 질량 2367.150 (계산치 2367.139). C108H162N26O30S2 (MW = 2368.735).
실시예 5: N4Ac-Glu(AGLU)-Ttds-Nle-[Cys-(3MeBn)-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4246)의 합성
펩티드의 서열 (N4Ac-Glu(OAll)-Ttds-Nle-Cys-Pro-Pro-Thr-Gln-Phe-Cys-OH)을 '자동화/반자동화 고체-상 합성을 위한 일반적 절차'에 따라 Fmoc-Cys(Trt) WANG 텐타겔 수지 상에서 50 μmol 규모로 어셈블리하였다. 'Alloc/알릴-탈보호'를 수행하여 알릴 에스테르 보호기의 제거를 수행하였다. 3,4;5,6-디-O-이소프로필리덴-1-아미노-1-데옥시-D-글루시톨 (J. Org. Chem., 2002, 75, 3685) (52.2 mg, 200 μmol, 4 eq.), 옥시마 (28.4 mg, 200 μmol, 4 당량) 및 DIC (31 μL, 200 μmol, 4 당량)을 DMF (1.5 mL) 중에 용해시키고, 용액을 수지에 첨가하고, 후자를 90분 동안 교반하였다. 수지를 세척하고, 아미노-글루시톨 빌딩 블록의 커플링을 1회 더 반복하였다. 수지를 세척하고, 건조시키고, 최종적으로 TFA, 물, TIPS 및 1,3-디메톡시벤졸 (90/2.5/2.5/5, 3 mL)로 2시간 동안 처리하여 수지로부터의 분리 및 측쇄 보호기의 제거를 실시하였다. 물/아세토니트릴로부터의 침전 및 동결건조 후, 조 선형 펩티드를 중탄산암모늄 용액 (50 mM, pH= 8.5) 및 아세토니트릴의 1:1 혼합물 60 ml 중에 용해시켰다. 이 혼합물에 0.5 ml 아세토니트릴 중 14.5 mg α,α'-디브로모-m-크실렌 (55 μmol, 초기 수지 로딩과 비교하여 1.1 당량)의 용액을 첨가하였다. 고리화 반응의 완결 시, 50 μl TFA를 첨가하고, 용매를 동결건조에 의해 제거하였다. 나머지를 HPLC 정제 (30분 내 15 → 40% B - 키네텍스)에 적용하여 순수한 표제 화합물 8.97 mg (10%)을 수득하였다. HPLC: Rt = 5.5 분. LC/TOF-MS: 정확한 질량 1789.901 (계산치 1789.899). C81H131N17O24S2 (MW = 1791.142).
실시예 6: 펜틸-SO2-[Cys(tMeBn(DOTA-PP))-Pro-Pro-Thr-Gln-Phe-Cys]-Asp-NH2 (3BP-3692)의 합성
펩티드의 서열 (H-Cys-Pro-Pro-Thr-Gln-Phe-Cys-Asp-NH2)을 '자동화/반자동화 고체-상 합성을 위한 일반적 절차'에 따라 링크 아미드 수지 상에서 50 μmol 규모로 어셈블리하였다. 수지 결합된 펩티드를 n-펜틸 술포닐 클로라이드 (42.7 μl, 300 μmol, 6 당량) 및 2,4,6-콜리딘 (29.7 μl, 225 μmol, 4.5 당량)의 용액으로 처리함으로써 N-말단 술폰아미드를 부착시켰다. 밤새 교반한 후, 수지를 완전히 세척하고, '절단 방법 B' 프로토콜에 적용하였다. 동결건조된 나머지 (선형 펩티드 펜틸-SO2-Cys-Pro-Pro-Thr-Gln-Phe-Cys-Asp-NH2)를 중탄산암모늄 용액 (50 mM, pH= 8.5) 및 아세토니트릴의 1:1 혼합물 60 ml 중에 용해시켰다. 이 혼합물에 0.5 ml 아세토니트릴 중 26.8 mg 1,3,5-트리스(브로모메틸)벤젠 (75 μmol, 초기 수지 로딩과 비교하여 1.5 당량)의 용액을 첨가하였다. 용액을 1시간 동안 교반한 후, 43 mg 피페라진 (500 μmol, 초기 수지 로딩과 비교하여 10 당량)을 첨가하였다. 2시간 후, 50 μl TFA를 첨가하고, 용매를 동결건조에 의해 제거하였다. 나머지를 HPLC 정제 (30분 내 15 → 45% B - 키네텍스)에 적용하여 펩티드 중간체 펜틸-SO2-[Cys(tMeBn(H-PP))-Pro-Pro-Thr-Gln-Phe-Cys]-Asp-NH2 9.15 mg (7.4 μmol) (14.7%)를 수득하였다. 150 μl DMSO 중 후자의 용액에 2.5 μl DIPEA를 첨가하여 pH 값을 대략 7.5 - 8로 조정하였다. 이어서 100 μl DMSO 중 8.4 mg의 DOTA-NHS (11 μmol, 펩티드 중간체와 비교하여 1.5 당량)를 첨가하였다. LC/TOF-MS 모니터링되는 반응의 과정 동안 2.5 μl DIPEA를 3회 첨가하여 pH 값을 출발 값으로 재조정하였다. 반응 완결 후, 용액을 HPLC 정제 (30분 내 15 → 45% B - 키네텍스)에 적용하여 순수한 표제 화합물 7.09 mg (8.7% 총 수율)을 수득하였다. HPLC: Rt = 6.0 분. LC/TOF-MS: 정확한 질량 1628.706 (계산치 1628.704). C72H108N16O21S3 (MW = 1629.924).
실시예 7: Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4089)의 합성
실시예 7a: 2가지 상이한 방법에 의한 Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4089)의 합성
표제 화합물의 합성은 먼저 선형 펩티드 전구체를 고체 상에서 합성하고, 후속적으로 용액 상 고리화 (비-수용액 중에서 (방법 A) 또는 수용액 중에서 (방법 B))를 수행하거나 또는 고체 상에서 모든 단계를 수행함으로써 수행하였다. 후자의 접근법 (실시예 7b)은 추가의 유도체화를 위한 출발점의 역할을 하였다.
제1 접근법 (실시예 7a)을 위해 Fmoc-Cys(Trt)-OH를 '자동화/반자동화 고체-상 합성을 위한 일반적 절차'에 기재된 바와 같이 트리틸 수지 상에 50 μmol 규모로 로딩하였다. 이 수지 상에 펩티드의 서열 (Hex-Cys-Pro-Pro-Thr-Gln-Phe-Cys-OH)을 '자동화/반자동화 고체-상 합성을 위한 일반적 절차'에 따라 어셈블리하였다. '절단 방법 B'의 단계를 수행한 후, 조 펩티드를 동결건조시키고, 2가지 대안적 방법에 의해 용액 중에서 고리화하였다.
고리화 방법 A:
조 펩티드 (50 μmol 수지 로딩에 기초함)를 에탄올 및 아세토니트릴의 1:1 혼합물 10 ml 중에 용해시켰다. 이 혼합물에 먼저 35 μl DIPEA에 이어서 23.7 mg의 1,3,5-트리스(브로모메틸)벤젠 (66.6 μmol, 초기 수지 로딩과 비교하여 1.3 당량)을 첨가하였다. 용액을 1시간 동안 교반한 다음, 42.8 mg 시스테아민 (555 μmol, 초기 수지 로딩과 비교하여 11 당량)을 첨가하였다. 1시간 후, 용매를 진공 하에 제거하고, 아세토니트릴 및 물의 1:1 혼합물 25 ml (50 μl TFA 함유)를 첨가하였다. 용매를 동결건조에 의해 제거하였다. 나머지를 HPLC 정제 (30분 내 15 → 45% B - 키네텍스)에 적용하여 중간체 Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH 17.8 mg (16.4 μmol) (32.8%)를 수득하였다.
고리화 방법 B:
조 펩티드 (50 μmol 수지 로딩에 기초함)를 중탄산암모늄 용액 (50 mM, pH = 8.5) 및 아세토니트릴의 1:1 혼합물 60 ml 중에 용해시켰다. 이 혼합물에 0.5 ml 아세토니트릴 중 26.8 mg 1,3,5-트리스(브로모메틸)벤젠 (75 μmol, 초기 수지 로딩과 비교하여 1.5 당량)의 용액을 첨가하였다. 용액을 1시간 동안 교반한 다음, 38.6 mg 시스테아민 (500 μmol, 초기 수지 로딩과 비교하여 10 당량)을 첨가하였다. 2시간 후, 50 μl TFA를 첨가하고, 용매를 동결건조에 의해 제거하였다. 나머지를 HPLC 정제 (30분 내 15 → 45% B - 키네텍스)에 적용하여 Hex-[Cys(tMeBn (H-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH 19.47 mg (18 μmol) (35.9%)을 수득하였다.
용액-기반 고리화 방법 둘 다를 유사하게 수행하였으며, 필적하는 수율 및 유사한 순도를 달성한다.
실시예 7b: Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr(tBu)-Gln(Trt)-Phe-Cys]-O-WANG-텐타겔 (펩티드 수지 상에 결합된 3BP-4089)의 합성
수지 결합된 표제 화합물의 합성을 위해 Fmoc-Cys(Trt)-WANG 텐타겔 수지를 출발 물질로서 사용하였다. 후자 상에 펩티드의 서열 (Hex-Cys(Trt)-Pro-Pro-Thr(tBu)-Gln(Trt)-Phe-Cys-OH)을 '자동화/반자동화 고체-상 합성을 위한 일반적 절차'에 따라 1 mmol 규모로 어셈블리하였다. 서열 어셈블리의 완결 후, 수지를 DCM (3x 1분)으로 세척한 다음, 트리틸 보호기를 TFA, TIPS 및 DCM의 용액 (5/5/90, 5x 5분)으로 처리하여 수지로부터 선택적으로 제거하였다. 수지를 DCM, DMF, DMF 중 0.9 M DIPEA, DMF, DCM (3/3/2/3/3)으로 세척하고, 진공 하에 건조시켰다. 후속 고리화를 200 μmol 부분으로 수행하였다. 이를 위해 수지를 DMF 중에서 팽윤시킨 다음, 2 mL DMF 중 1,3,5-트리스(브로모메틸)벤젠 (86 mg, 240 μmol, 1.2 당량), DIPEA (235 μL, 1 mmol, 5 당량)의 용액으로 50℃에서 90분 동안 처리하였다. 용액을 제거하고, 수지를 DMF로 세척한 다음, 시스테아민의 용액 (154.3 mg, 2 mmol, 10 당량)을 수지에 첨가하였다. 수지를 50 ℃에서 추가 90분 동안 교반하였다. 수지를 DMF 및 DCM (3/3)으로 세척한 후, 펩티드 수지 (Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr(tBu)-Gln(Trt)-Phe-Cys]-O-WANG-텐타겔)를 건조시키고, 추가의 유도체화를 위해 유지하였다. 이 절차에 의해 글루타민에서의 트리틸-기가 부분적으로 또는 완전히 탈보호될 수 있다. 임의의 경우에, 이는 AET의 유리 아미노 기의 임의적인 유도체화를 방해하지 않는다.
실시예 8a): Hex-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3554)의 합성
300 μl DMSO 중 Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (19.5 mg, 18 μmol, 3BP-4089 - 실시예 7a에 기재됨)의 용액에, 5 μl DIPEA를 첨가하여 pH 값을 대략 7.5 - 8로 조정하였다. 이어서 200 μl DMSO 중 20.5 mg의 DOTA-NHS (27 μmol, 펩티드 중간체와 비교하여 1.5 당량)를 첨가하였다. LC/TOF-MS 모니터링되는 반응의 과정 동안 5 μl DIPEA를 3회 첨가하여 pH 값을 출발 값으로 재조정하였다. 반응 완결 후, 용액을 HPLC 정제 (30분 내 15 → 45% B - 키네텍스)에 적용하여 순수한 표제 화합물 20.44 mg (77.4% 수율)을 수득하였다. HPLC: Rt = 5.9 분. LC/TOF-MS: 정확한 질량 1469.640 (계산치 1469.639). C67H99N13O18S3 (MW = 1470.780).
실시예 8b): nBu-CAyl-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3940)의 합성
3BP-3554의 합성 (실시예 7a, 고리화 방법 A 및 실시예 8a))과 유사한 방법을 표제 화합물의 합성에 사용하였다. 유일한 차이는 선형 펩티드 서열의 조립 후에 실온에서 DMF 중 부틸 이소시아네이트 (5 당량) 및 DIPEA (10 당량)의 밤샘 반응에 의해 말단 우레아 모이어티를 도입한 것이었다. 고리화 단계 및 DOTA 도입을 동일한 방법에 의해 수행하였다.
HPLC 정제 후 (30분 내 15 → 40% B - 키네텍스), 순수한 표제 화합물 28.28 mg (25.6% 수율)을 단리하였다. HPLC: Rt = 5.8분. LC/TOF-MS: 정확한 질량 1470.644 (계산치 1470.635). C66H98N14O18S3 (MW = 1471.768).
실시예 9: Hex-[Cys-(tMeBn(NODAGA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4162)의 합성
(R)-NODA-GA(tBu)3-OH (50 mg, 92 μmol, 1 당량), HATU (35 mg, 92 μmol, 1 당량) 및 DIPEA (32 μL, 184 μmol, 2 당량)를 0.4 mL DMF 중에 용해시켰다. 혼합물을 2분 동안 교반하여 킬레이트화제 빌딩 블록의 예비-활성화를 보장하였다. 이어서 이 혼합물을 2 mL DMF 및 20 μL DIPEA 중 Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (100 mg, 92 μmol, 3BP-4089 - 실시예 7a에 기재됨)의 용액에 첨가하였으며, 이를 첨가하여 펩티드 용액의 pH 값을 대략 7.5 - 8로 조정하였다. 90분 후, 모든 휘발성 물질을 진공 하에 제거하고, 나머지를 동결건조시켰다. '절단 방법 C'의 단계를 수행한 후, 조 펩티드를 동결건조시키고, 후속적으로 HPLC 정제 (30분 내 15 → 45% B - 키네텍스)에 적용하여 순수한 표제 화합물 48.54 mg (33.7% 수율)을 수득하였다. HPLC: Rt = 6.8 분. LC/TOF-MS: 정확한 질량 1440.613 (계산치 1440.613). C66H96N12O18S3 (MW = 1441.739).
실시예 10: Hex-[Cys-(tMeBn(DTPA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4214)의 합성
DTPA(tBu)4-OH (디에틸렌트리아민-N,N,N",N"-테트라-tert-부틸 아세테이트-N'-아세트산) (28.5 mg, 46 μmol, 1 당량), HATU (17.5 mg, 46 μmol, 1 당량) 및 DIPEA (16 μL, 92 μmol, 2 당량)를 100 μL DMF 중에 용해시켰다. 혼합물을 2분 동안 교반하여 킬레이트화제 빌딩 블록의 예비-활성화를 보장하였다. 이어서 이 혼합물을 600 μL DMF 및 10 μL DIPEA 중 Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (50 mg, 46 μmol, 3BP-4089 - 실시예 7a에 기재됨)의 용액에 첨가하였으며, 이를 첨가하여 펩티드 용액의 pH 값을 대략 7.5 - 8로 조정하였다. 180분 후, 모든 휘발성 물질을 진공 하에 제거하고, 나머지를 동결건조시켰다. '절단 방법 C'의 단계를 수행한 후, 조 펩티드를 동결건조시키고, 후속적으로 HPLC 정제 (30분 내 15 → 45% B - 키네텍스)에 적용하여 순수한 표제 화합물 15.4 mg (22.9% 수율)을 수득하였다. HPLC: Rt = 6.5 분. LC/TOF-MS: 정확한 질량 1458.587 (계산치 1458.587). C65H94N12O20S3 (MW = 1459.711).
실시예 11: Hex-[Cys-(tMeBn(N4Ac-O2Oc-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4088)의 합성
Fmoc-O2Oc-OH를 '자동화/반-자동화 고체-상 합성을 위한 일반적 절차'에 기재된 바와 같이 트리틸 수지 상에 100 μmol 규모로 로딩하였다. 이 수지 상에 서열 Boc4N4Ac-OH를 '자동화/반-자동화 고체-상 합성을 위한 일반적 절차'에 따라 커플링시켰다. '절단 방법 A'의 단계를 수행한 후, 보호된 접합된 조물질을 동결건조시키고 (조 수율 154 mg), 후속 단계에 정제 없이 사용하였다. Boc4N4Ac-O2Oc-OH (75 mg, 100 μmol, 1.2 당량), HATU (38 mg, 100 μmol, 1.2 당량) 및 DIPEA (68 μL, 400 μmol, 4 당량)를 500 μL DMF 중에 용해시켰다. 혼합물을 2분 동안 교반하여 킬레이트화제-링커 빌딩 블록의 예비-활성화를 보장하였다. 이어서 이 혼합물을 2 mL DMF 및 20 μL DIPEA 중 Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (90 mg, 83 μmol, 3BP-4089 - 실시예 7a에 기재됨)의 용액에 첨가하였으며, 이를 첨가하여 펩티드 용액의 pH 값을 대략 7.5 - 8로 조정하였다. 60분 후, 모든 휘발성 물질을 진공 하에 제거하고, 나머지를 동결건조시켰다. '절단 방법 C'의 단계를 수행한 후, 조 펩티드를 동결건조시키고, 후속적으로 HPLC 정제 (30분 내 20 → 45% B - 키네텍스)에 적용하여 순수한 표제 화합물 67.4 mg (55% 수율)을 수득하였다. HPLC: Rt = 6.0 분. LC/TOF-MS: 정확한 질량 1414.681 (계산치 1414.681). C65H102N14O15S3 (MW = 1415.791).
실시예 12: Hex-[Cys-(tMeBn(ReON4Ac-O2Oc-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4147)의 합성
에탄올 (3 mL) 중 Hex-[Cys-(tMeBn(N4Ac-O2Oc-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (25 mg, 17.7 μmol, 1 당량) 및 트리클로로옥소비스(트리페닐포스핀)-레늄(V) (14.7 mg, 17.7 μmol, 1 당량)의 용액에 10 μL DIPEA를 첨가하였다. 혼합물을 50℃에서 밤새 교반하였다. 반응 용매 부피를 대략 0.5 mL로 감소시킨 후, 동량의 물을 첨가하고, 생성된 용액을 HPLC 정제 (30분 내 15 → 45% B, TFA 개질제 없는 용리액 - 키네텍스)에 적용하여 순수한 표제 화합물 6.1 mg (21% 수율)을 수득하였다. HPLC: Rt = 6.0 분. LC/TOF-MS: 정확한 질량 1612.606 (계산치 1612.608). C65H98N14O16ReS3 (MW = 1613.968).
실시예 13: Hex-[Cys-(tMeBn(Bio-Ttds-Ttds-Ttds-Ttds-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4170)의 합성
Fmoc-Ttds-OH를 '자동화/반자동화 고체-상 합성을 위한 일반적 절차'에 기재된 바와 같이 트리틸 수지 상에 100 μmol 규모로 로딩하였다. 이 수지 상에 서열 (Bio-Ttds-Ttds-Ttds-Ttds-OH)을 '자동화/반자동화 고체-상 합성을 위한 일반적 절차'에 따라 어셈블리하였다. '절단 방법 B'의 단계를 수행한 후, 나머지를 동결건조시키고, HPLC 정제에 적용하여 정제된 중간체 생성물 116.8 mg (80%)을 수득하였다. Bio-Ttds-Ttds-Ttds-Ttds-OH (86 mg, 59 μmol, 1 당량), HATU (22.4 mg, 59 μmol, 1 당량) 및 DIPEA (20.5 μL, 120 μmol, 2 당량)를 1 mL DMF 중에 용해시켰다. 혼합물을 2분 동안 교반하여 비오틴-링커 접합체 빌딩 블록의 예비-활성화를 보장하였다. 이어서 이 혼합물을 2 mL DMF 및 20 μL DIPEA 중 Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (64 mg, 59 μmol, 3BP-4089 - 실시예 7a에 기재됨)의 용액에 첨가하였으며, 이를 첨가하여 펩티드 용액의 pH 값을 대략 7.5 - 8로 조정하였다. 120분 후, 모든 휘발성 물질을 진공 하에 제거하고, 나머지를 동결건조시켰다. 나머지를 HPLC 정제 (30분 내 20 → 45% B - 키네텍스)에 적용하여 순수한 표제 화합물 27.46 mg (18% 수율)을 수득하였다. HPLC: Rt = 7.3 분. LC/TOF-MS: 정확한 질량 2518.274 (계산치 2518.273). C117H191N19O33S4 (MW = 2520.145).
실시예 14: Hex-[Cys-(tMeBn(DTPA-O2Oc-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4224)의 합성
Boc-O2Oc-OH (디시클로헥실아민 염) (20.5 mg, 46 μmol, 1 당량), 옥시마 (9.8 mg, 69 μmol, 1.5 당량) 및 DIC (10.7 μL, 69 μmol)를 DMF 중에 용해시키고, 5분 동안 교반하여 링커 빌딩 블록의 예비-활성화를 보장하였다. 이어서 이 혼합물을 2 mL DMF 및 20 μL DIPEA 중 Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (50 mg, 46 μmol, 3BP-4089 - 실시예 7a에 기재됨)의 용액에 첨가하였으며, 이를 첨가하여 펩티드 용액의 pH 값을 대략 7.5 - 8로 조정하였다. 4시간 후, 또 다른 부분의 Boc-O2Oc-OH (상기 언급된 바와 동일한 양)를 예비-활성화시키고, 펩티드 반응 용액에 첨가하였다. 혼합물을 밤새 교반하였다. 이어서 모든 휘발성 물질을 진공 하에 제거하고, 나머지를 물/아세토니트릴로부터 동결건조시켰다. 동결-건조된 조 생성물을 '절단 방법 C'에 적용하여 Boc-보호기를 제거하고, 후속적으로 정제용 HPLC (30분 내 15 → 45% B - 키네텍스)에 의해 정제하여 순수한 중간체 펩티드 Hex-[Cys(tMeBn(H-O2Oc-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH 16.25 mg (29% 수율)를 수득하였다. 후속 단계를 위해 DTPA(tBu)4-OH (디에틸렌트리아민-N,N,N",N"-테트라-tert-부틸 아세테이트-N'-아세트산) (8.2 mg, 13.2 μmol, 1 당량), HATU (5 mg, 13.2 μmol, 1 당량) 및 DIPEA (4.6 μL, 26.4 μmol, 2 당량)를 100 μL DMF 중에 용해시켰다. 킬레이트화제 빌딩 블록의 예비-활성화를 보장하기 위해 2분 동안 교반한 후, 이 혼합물을 중간체 펩티드 16.25 mg (13.2 μmol)의 용액에 첨가하고, 그의 pH 값을 5 μL DIPEA의 첨가에 의해 대략 7.5 - 8로 조정하였다. 180분 후, 모든 휘발성 물질을 진공 하에 제거하고, 나머지를 HPLC 정제 (30분 내 35 → 75% B - 키네텍스)에 적용하여 순수한 보호된 중간체 펩티드 Hex-[Cys(tMeBn(DTPA(tBu)4-O2Oc-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH 12.76 mg (7 μmol) (53% 수율)을 수득하였다. 후자를 '절단 방법 C'에 적용하여 모든 휘발성 물질을 진공 하에 제거하고, 나머지를 HPLC 정제 (30분 내 15 → 45% B - 키네텍스)에 적용하여 순수한 표제 화합물 5.9 mg (3.7 μmol) (53% 수율 - 전체 수율: 8%)을 수득하였다. HPLC: Rt = 6.6 분. LC/TOF-MS: 정확한 질량 1603.661 (계산치 1603.661). C71H105N13O23S3 (MW = 1604.868).
실시예 15: Hex-[Cys-(tMeBn(H-HYNIC-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4342)의 합성
Boc-HYNIC-OH (9.2 mg, 36 μmol, 1.3 당량), HATU (13.7 mg, 36 μmol, 1.3 당량) 및 DIPEA (12.2 μL, 72 μmol, 2.6 당량)를 250 μL DMF 중에 용해시켰다. 혼합물을 2분 동안 교반하여 킬레이트화제-링커 빌딩 블록의 예비-활성화를 보장하였다. 이어서 이 혼합물을 400 μL DMF 및 10 μL DIPEA 중 Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (30 mg, 27.8 μmol, 1 당량, 3BP-4089 - 실시예 7a에 기재됨)의 용액에 첨가하였으며, 이를 첨가하여 펩티드 용액의 pH 값을 대략 7.5 - 8로 조정하였다. 60분 후, 모든 휘발성 물질을 진공 하에 제거하고, 나머지를 DMSO 중에 재용해시키고, 이 용액을 HPLC 정제 (30분 내 25 → 55% B - 키네텍스)에 적용하여 중간체 보호된 펩티드 17.8 mg (13.5 μmol, 48.5%)을 수득하였다. 펩티드를 HCl (37%, 40 μL)로 처리하여 Boc-보호기의 제거를 달성하였다. 생성된 혼합물을 아세트산나트륨 완충제 (pH 4.5, 1.8 mL) 및 아세토니트릴 (0.2 mL)로 용해시키고, 용액을 HPLC 정제 (30분 내 20 → 50% B (0.1% TFA 대신 0.02% 포름산) - 키네텍스)에 적용하여, 순수한 표제 화합물 1.15 mg (0.9 μmol) (7% 수율 - 전체 수율: 3.4%)을 수득하였다. HPLC: Rt = 6.9 분. LC/TOF-MS: 정확한 질량 1218.505 (계산치 1218.502). C57H78N12O12S3 (MW = 1219.503).
실시예 16: Hex-[Cys-(tMeBn(NOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4310)의 합성
표제 화합물의 합성을 위한 출발점은 100 μmol 규모로 사용된 실시예 7b로부터의 3BP-4089 펩티드 수지 (Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr(tBu)-Gln(Trt)-Phe-Cys]-O-WANG-텐타겔)였다. '자동화/반-자동화 고체-상 합성을 위한 일반적 절차'에 따라 NOTA(tBu)2-OH (2-(4,7-비스(2-(tert-부톡시)-2-옥소에틸)-1,4,7-트리아조난-1-일)아세트산)을 커플링시켰다. 수지를 건조시킨 후, '절단 방법 B'에 적용하였다. 조 펩티드를 동결건조시키고, 후속적으로 정제용 HPLC 정제 (30분 내 20 → 45% B - 키네텍스)에 의해 정제하여 순수한 표제 화합물 5.6 mg (4.1 μmol) (4%)을 수득하였다. HPLC: Rt = 6.8 분. LC/TOF-MS: 정확한 질량 1368.592 (계산치 1368.592). C63H92N12O16S3 (MW = 1369.676).
실시예 17: Hex-[Cys-(tMeBn(DTPA2-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4309)의 합성
표제 화합물의 합성을 위한 출발점은 100 μmol 규모로 사용된 실시예 7b로부터의 3BP-4089 펩티드 수지 (Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr(tBu)-Gln(Trt)-Phe-Cys]-O-WANG-텐타겔)였다. '자동화/반-자동화 고체-상 합성을 위한 일반적 절차'에 따라 DTPA2(tBu)4-OH (3,6,9-트리스(2-(tert-부톡시)-2-옥소에틸)-13,13-디메틸-11-옥소-12-옥사-3,6,9-트리아자테트라데칸-1-산)을 커플링시켰다. 수지를 건조시킨 후, '절단 방법 B'에 적용하였다. 조 펩티드를 동결건조시키고, 후속적으로 정제용 HPLC (30분 내 20 → 45% B - 키네텍스)에 의해 정제하여 순수한 표제 화합물 5.8 mg (3.9 μmol) (3.9%)을 수득하였다. HPLC: Rt = 6.5 분. LC/TOF-MS: 정확한 질량 1458.587 (계산치 1458.587). C65H94N12O20S3 (MW = 1459.711).
실시예 18: Hex-[Cys-(tMeBn(NODAGA-O2Oc-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4251)의 합성
표제 화합물의 합성을 위한 출발점은 50 μmol 규모로 사용된 실시예 7b로부터의 3BP-4089 펩티드 수지 (Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr(tBu)-Gln(Trt)-Phe-Cys]-O-WANG-텐타겔)였다. '자동화/반-자동화 고체-상 합성을 위한 일반적 절차'에 따라 연속적으로 Fmoc-O2Oc-OH 및 (R)-NODA-GA(tBu)3-OH를 커플링시켰다. 수지를 건조시킨 후, '절단 방법 B'에 적용하였다. 조 펩티드를 동결건조시키고, 후속적으로 정제용 HPLC (30분 내 15 → 45% B - 키네텍스)에 의해 정제하여 순수한 표제 화합물 4.31 mg (2.7 μmol) (5.4%)을 수득하였다. HPLC: Rt = 6.7 분. LC/TOF-MS: 정확한 질량 1585.687 (계산치 1585.687). C72H107N13O21S3 (MW = 1586.896).
실시예 19: Hex-[Cys-(tMeBn(NOTA-Ttds-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4344)의 합성
표제 화합물의 합성을 위한 출발점은 100 μmol 규모로 사용된 실시예 7b로부터의 3BP-4089 펩티드 수지 (Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr(tBu)-Gln(Trt)-Phe-Cys]-O-WANG-텐타겔)였다. '자동화/반-자동화 고체-상 합성을 위한 일반적 절차'에 따라 연속적으로 Fmoc-Ttds-OH 및 NOTA(tBu)2-OH (2-(4,7-비스(2-(tert-부톡시)-2-옥소에틸)-1,4,7-트리아조난-1-일)아세트산)을 커플링시켰다. 수지를 건조시킨 후, '절단 방법 B'에 적용하였다. 조 펩티드를 동결건조시키고, 후속적으로 정제용 HPLC (30분 내 20 → 45% B - 키네텍스)에 의해 정제하여 순수한 표제 화합물 10.1 mg (6.0 μmol) (6%)을 수득하였다. HPLC: Rt = 6.8 분. LC/TOF-MS: 정확한 질량 1670.776 (계산치 1670.776). C77H118N14O21S3 (MW = 1672.043).
실시예 20: Hex-[Cys-(tMeBn(DTPA2-Ttds-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4352)의 합성
표제 화합물의 합성을 위한 출발점은 100 μmol 규모로 사용된 실시예 7b로부터의 3BP-4089 펩티드 수지 (Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr(tBu)-Gln(Trt)-Phe-Cys]-O-WANG-텐타겔)였다. '자동화/반-자동화 고체-상 합성을 위한 일반적 절차'에 따라, Fmoc-Ttds-OH 및 DTPA2(tBu)4-OH (3,6,9-트리스(2-(tert-부톡시)-2-옥소에틸)-13,13-디메틸-11-옥소-12-옥사-3,6,9-트리아자테트라데칸-1-산)을 커플링시켰다. 수지를 건조시킨 후, '절단 방법 B'에 적용하였다. 조 펩티드를 동결건조시키고, 후속적으로 정제용 HPLC (30분 내 20 → 45% B - 키네텍스)에 의해 정제하여 순수한 표제 화합물 6.87 mg (3.9 μmol) (3.9%)을 수득하였다. HPLC: Rt = 6.7 분. LC/TOF-MS: 정확한 질량 1760.771 (계산치 1760.771). C79H120N14O25S3 (MW = 1762.078).
실시예 21: Hex-[Cys-(tMeBn(H-SAc-Ser-Ser-Ser-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4301)의 합성
표제 화합물의 합성을 위한 출발점은 100 μmol 규모로 사용된 실시예 7b로부터의 3BP-4089 펩티드 수지 (Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr(tBu)-Gln(Trt)-Phe-Cys]-O-WANG-텐타겔)였다. 자동화/반-자동화 고체-상 합성을 위한 일반적 절차'에 따라, Fmoc-Ser(tBu)-OH를 3회 커플링시키고, 이어서 트리틸메르캅토 아세트산을 커플링시켰다. 수지를 건조시킨 후, '절단 방법 B'에 적용하였다. 조 펩티드를 동결건조시키고, 후속적으로 정제용 HPLC (30분 내 20 → 45% B - 키네텍스)에 의해 정제하여 순수한 표제 화합물 5.25 mg (3.7 μmol) (3.7%)을 수득하였다.
HPLC: Rt = 6.8 분. LC/TOF-MS: 정확한 질량 1418.553 (계산치 1418.538). C62H90N12O18S4 (MW = 1419.714).
실시예 22: Hex-[Cys-(tMeBn(H-Asp-Asp-Cys-Ttds-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4302)의 합성
표제 화합물의 합성을 위한 출발점은 100 μmol 규모로 사용된 실시예 7b로부터의 3BP-4089 펩티드 수지 (Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr(tBu)-Gln(Trt)-Phe-Cys]-O-WANG-텐타겔)였다. '자동화/반-자동화 고체-상 합성을 위한 일반적 절차'에 따라, Fmoc-Ttds-OH, Fmoc-Cys(Trt)-OH, 및 2회 Fmoc-Asp(OtBu)-OH를 커플링시켰다. 수지를 건조시킨 후, '절단 방법 B'에 적용하였다. 조 펩티드를 동결건조시키고, 후속적으로 정제용 HPLC (30분 내 20 → 45% B - 키네텍스)에 의해 정제하여 순수한 표제 화합물 5.52 mg (3.2 μmol) (3.2%)을 수득하였다. HPLC: Rt = 6.8 분. LC/TOF-MS: 정확한 질량 1718.705 (계산치 1718.706). C76H114N14O23S4 (MW = 1720.066).
실시예 23: Hex-[Cys-(tMeBn(DTPABzl-글루타르-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4366)의 합성
표제 화합물의 합성을 위한 출발점은 100 μmol 규모로 사용된 실시예 7b로부터의 3BP-4089 펩티드 수지 (Hex-[Cys(tMeBn(H-AET))-Pro-Pro-Thr(tBu)-Gln(Trt)-Phe-Cys]-O-WANG-텐타겔)였다. 글루타르산 무수물 (57 mg, 0.5 mmol, 5 당량) 및 DIPEA (165 μL, 1mmol, 10 당량)을 DMF (3 mL) 중에 용해시키고, 용액을 수지에 첨가하고, 후자를 1시간 동안 교반하였다. p-NH2-Bn-DTPA(OtBu)5 (S-2-(4-아미노벤질)-디에틸렌트리아민 펜타-tert-부틸 아세테이트, 155 mg, 200 μmol, 2 당량), 옥시마 (27.2 mg, 200 μmol, 2 당량), DIPEA (70 μL, 400 μmol, 4 당량) 및 DIC (31 μL, 200 μmol, 2 당량)을 DMF (1.7 mL) 중에 용해시키고, 용액을 수지에 첨가하고, 후자를 50℃에서 90분 동안 교반하였다. DIC의 첨가를 반복하고, 50℃에서의 수지의 교반을 추가로 90분 동안 반복하였다. 그 후, DIC의 또 다른 부분을 첨가하고, 수지를 실온에서 밤새 교반하였다. 이어서 DIC 첨가와 50℃에서의 후속 교반을 추가로 3회 반복하였다. 이어서 수지를 세척하고, '절단 방법 B'에 적용하였다. 조 펩티드를 동결건조시키고, 후속적으로 정제용 HPLC (30분 내 20 → 40% B - 키네텍스)에 의해 정제하여 순수한 표제 화합물 10.53 mg (6.3 μmol) (6.3%)을 수득하였다. HPLC: Rt = 7.0 분. LC/TOF-MS: 정확한 질량 1677.688 (계산치 1677.676). C77H107N13O23S3 (MW = 1678.948).
실시예 24: Hex-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-AET] (3BP-3654)의 합성
이 합성은 상업적으로 입수가능한 사전-로딩된 아미노에탄티올 트리틸 수지를 선형 펩티드 전구체 Hex-Cys-Pro-Pro-Thr-Gln-Phe-AET의 어셈블리에 사용하였다는 사실을 제외하고는 실시예 7a에 기재된 3BP-3554의 합성과 같이 수행하였다. 실시예 7에 기재된 모든 단계를 수행한 후, HPLC (30분 내 15 → 45% B - 키네텍스)에 의해 정제하여 최종적으로 순수한 표제 화합물 21.25 mg (29.8% 총 수율)을 수득하였다. HPLC: Rt = 6.2 분. LC/TOF-MS: 정확한 질량 1425.661 (계산치 1425.649). C66H99N13O16S3 (MW = 1426.771).
실시예 25: Hex-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cysol] (3BP-3762)의 합성
이 합성은 Fmoc-시스테인올(Trt)-OH를 트리틸 수지 상에 로딩하였다는 사실을 제외하고는 실시예 7a에 기재된 3BP-3554의 합성과 같이 수행하였다. '자동화/반-자동화 고체-상 합성에 대한 일반적 절차'에서의 기재와 상이하게, 이를 하기와 같이 달성하였다: 트리틸 수지 50 μmol을 THF 중에서 팽윤시키고, 후속적으로 건조 THF (3회)로 세척하였다. 이어서 수지를 건조 THF (1 ml) 중 Fmoc-시스테인올(Trt)-OH (57 mg, 100 μmol, 2 당량) 및 피리딘 (16.1 μl, 200 μmol, 4 당량)의 용액으로 60℃에서 20시간 동안 처리하였다. 수지를 완전히 세척한 후 (THF, MeOH, DCM, DMF, 3 ml, 3x 1분), 선형 펩티드 전구체 Hex-Cys-Pro-Pro-Thr-Gln-Phe-Cysol을 '자동화/반자동화 고체-상 합성에 대한 일반적 절차'에 기재된 바와 같이 어셈블리하였다. 실시예 7에 기재된 모든 단계를 수행한 후, HPLC (30분 내 15 → 45% B - 키네텍스)에 의해 정제하여 최종적으로 순수한 표제 화합물 7.8 mg (10.7% 전체 수율)을 수득하였다. HPLC: Rt = 5.9 분. LC/TOF-MS: 정확한 질량 1455.666 (계산치 1455.660). C67H101N13O17S3 (MW = 1456.797).
실시예 26: Hex-[Cys(tMeBn(DOTA-PP))-Pro-Pro-Thr-Gln-Phe-Cys]-Asp-NH2 (3BP-3407)의 합성
a) 2가지 상이한 고리화 방법에 의한 중간체 Hex-[Cys(tMeBn(H-PP))-Pro-Pro-Thr-Gln-Phe-Cys]-Asp-NH2의 합성
펩티드의 서열 (Hex-Cys-Pro-Pro-Thr-Gln-Phe-Cys-Asp-NH2)을 '자동화/반자동화 고체-상 합성을 위한 일반적 절차'에 따라 링크 아미드 수지 상에서 50 μmol 규모로 어셈블리하였다. '절단 방법 B'의 단계를 수행한 후, 조 펩티드를 동결건조시키고, 2가지 대안적 방법에 의해 고리화하였다.
고리화 방법 A:
조 펩티드 (50 μmol 수지 로딩에 기초함)를 에탄올 및 아세토니트릴의 1:1 혼합물 10 ml 중에 용해시켰다. 이 혼합물에 먼저 30 μl DIPEA 및 이어서 26.8 mg의 1,3,5-트리스(브로모메틸)벤젠 (75 μmol, 초기 수지 로딩과 비교하여 1.5 당량)을 첨가하였다. 용액을 45분 동안 교반한 후, 에탄올/아세토니트릴의 1:1 혼합물 200 μl 중 43 mg 피페라진 (500 μmol, 초기 수지 로딩과 비교하여 10 당량)의 용액을 첨가하였다. 1시간 후, 용매를 진공 하에 제거하고, 아세토니트릴 및 물의 1:1 혼합물 (50 μl TFA 함유) 25 ml을 첨가하고, 용매를 동결건조에 의해 제거하였다. 나머지를 HPLC 정제 (30분 내 15 → 40% B - 키네텍스)에 적용하여 펩티드 중간체 Hex-Cys(tMeBn(H-PP))-Pro-Pro-Thr-Gln-Phe-Cys]-Asp-NH2 15.3 mg (12.7 μmol) (25.3%)를 수득하였다.
고리화 방법 B:
조 펩티드 (50 μmol 수지 로딩에 기초함)를 중탄산암모늄 용액 (50 mM, pH = 8.5) 및 아세토니트릴의 1:1 혼합물 60 ml 중에 용해시켰다. 이 혼합물에 1,3,5-트리스(브로모메틸)벤젠 26.8 mg (75 μmol, 초기 수지 로딩과 비교하여 1.5 당량)을 첨가하였다. 용액을 1시간 동안 교반하고, 43 mg 피페라진 (500 μmol, 초기 수지 로딩과 비교하여 10 당량)을 첨가하였다. 6시간 후, 100 μl TFA를 첨가하고, 용매를 동결건조에 의해 제거하였다. 나머지를 HPLC 정제 (30분 내 15 → 40% B - 키네텍스)에 적용하여 펩티드 중간체 Hex-Cys(tMeBn(H-PP))-Pro-Pro-Thr-Gln-Phe-Cys]-Asp-NH2 17.2 mg (14.2 μmol) (28.4%)를 수득하였다.
고리화 방법 둘 다를 유사하게 수행하였으며, 필적하는 수율 및 유사한 순도를 달성한다.
b) Hex-[Cys(tMeBn(DOTA-PP))-Pro-Pro-Thr-Gln-Phe-Cys]-Asp-NH2 (3BP-3407)의 합성의 최종 단계: DOTA-커플링 및 정제
200 μl DMSO 중 중간체 (고리화 방법 B에 의해 수득됨)의 용액에 2.5 μl DIPEA를 첨가하여 pH 값을 대략 7.5 - 8로 조정하였다. 이어서 100 μl DMSO 중 16.3 mg의 DOTA-NHS (21.4 μmol, 펩티드 중간체와 비교하여 1.5 당량)를 첨가하였다. LC/TOF-MS 모니터링되는 반응의 과정 동안 2.5 μl DIPEA를 5회 첨가하여 pH 값을 출발 값으로 재조정하였다. 반응 완결 후, 용액을 HPLC 정제 (30분 내 15 → 40% B - 키네텍스)에 적용하여 순수한 표제 화합물 19.1 mg (12.0 μmol) (85%)을 수득하였다. HPLC: Rt = 5.70 분. LC/TOF-MS: 정확한 질량 1592.737 (계산치 1592.737). C73H108N16O20S2 (MW = 1593.866).
실시예 27: Hex-[Cys(3MeBn)-Pro-Pro-Thr-Gln-Phe-Cys]-Asp-NH2 (3BP-3476)의 합성
펩티드의 서열 (Hex-Cys-Pro-Pro-Thr-Gln-Phe-Cys-Asp-NH2)을 '자동화/반자동화 고체-상 합성을 위한 일반적 절차'에 따라 링크 아미드 수지 상에서 50 μmol 규모로 어셈블리하였다. '절단 방법 B'의 단계를 수행한 후, 조 펩티드를 동결건조시키고, 2가지 대안적 방법에 의해 고리화하였다.
고리화 방법 A:
조 펩티드 (50 μmol 수지 로딩에 기초함)를 에탄올 및 아세토니트릴의 1:1 혼합물 10 ml 중에 용해시켰다. 이 혼합물에 먼저 25 μl DIPEA 및 이어서 60 μl 아세토니트릴/에탄올 1:1 중 15.9 mg 1,3,5-트리스(브로모메틸)벤젠 (60 μmol, 초기 수지 로딩과 비교하여 1.2 당량)의 용액을 첨가하였다. 용액을 90분 동안 교반한 다음, 77 mg 디티오트레이톨 (500 μmol, 초기 수지 로딩과 비교하여 10 당량)을 첨가하였다. 밤새 교반한 후, 용매를 진공 하에 제거하고, 아세토니트릴 및 물의 1:1 혼합물 (50 μl TFA 함유) 30 ml을 첨가하였다. 용매를 동결건조에 의해 제거하였다. 나머지를 HPLC 정제 (30분 내 15 → 40% B - 키네텍스)에 적용하여 순수한 표제 화합물 16.0 mg (14.4 μmol) (28.8%)을 수득하였다. HPLC: Rt = 7.36 분. LC/TOF-MS: 정확한 질량 1108.476 (계산치 1108.472). C52H72N10O13S2 (MW = 1109.320).
고리화 방법 B:
동결건조된 조 펩티드 (50 μmol 수지 로딩에 기초함)를 중탄산암모늄 용액 (50 mM, pH= 8.5) 및 아세토니트릴의 1:1 혼합물 60 ml 중에 용해시켰다. 이 혼합물에 0.5 ml 아세토니트릴 중 15.8 mg α,α'-디브로모-m-크실렌 (60 μmol, 초기 수지 로딩과 비교하여 1.2 당량)의 용액을 첨가하였다. 고리화 반응의 완결 시, 50 μl TFA를 첨가하고, 용매를 동결건조에 의해 제거하였다. 나머지를 HPLC 정제 (30분 내 25 → 45% B - 키네텍스)에 적용하여 순수한 표제 화합물 16.9 mg (15.2 μmol) (30.4%)을 수득하였다. HPLC: Rt = 7.24 분. LC/TOF-MS: 정확한 질량 1108.476 (계산치 1108.472). C52H72N10O13S2 (MW = 1109.320).
고리화 방법 (A 및 B) 둘 다는 수율 및 순도의 관점에서 유사하게 효과적이고, 따라서 둘 다 적용가능하다.
실시예 28: 본 발명의 화합물의 DOTA-전이 금속 착물의 제조
A. 비착물화된 DOTA를 포함하는 상응하는 펩티드로부터 DOTA-전이 금속-착물을 포함하는 펩티드의 제조를 위한 일반적 절차
하기 완충제 중에 비착물화된 DOTA에 포함된 펩티드의 0.1 mM 용액:
ㆍ 0.4 M 아세트산나트륨, pH= 5 (완충제 A) (Cu(II), Zn(II), In(III), Lu(III) 또는 (Ga)(III) 착물의 경우) 또는
ㆍ 0.1 M 아세트산암모늄, pH= 8 (완충제 B) (Eu(III) 착물의 경우)
을 물 중 상응하는 금속 염의 0.1 mM 용액의 용액으로 희석하여 펩티드 대 금속의 몰비를 1 : 3으로 조정하였다. 용액을 하기 조건에서 교반하였다:
ㆍ 50℃에서 20분 동안 (또한 본원에서 조건 A로 지칭됨) (In(III), Lu(III), Ga(III), Zn(II) 또는 (Cu)(II) 착물의 경우) 또는
ㆍ 실온에서 밤새 (또한 본원에서 조건 B로 지칭됨) (Eu(III) 착물의 경우).
이어서 용액을 하기에 적용하였다:
ㆍ HPLC 정제 (또한 본원에서 정제 A로 지칭됨) 또는
ㆍ 고체 상 추출 (또한 본원에서 정제 B로 지칭됨).
고체 상 추출의 경우, 250 mg 배리안 본데실-ENV(Varian Bondesil-ENV)를 15 ml 폴리스티렌 시린지에 넣고, 메탄올 (1 x 5 ml) 및 물 (2 x 5 ml)로 사전-세척하였다. 이어서 반응 용액을 칼럼에 적용하였다. 그 후, 물 (2 x 5 ml - 과량의 염을 제거하기 위함)로 용리를 수행하고, 제1 분획으로서 물 중 50% ACN 5 ml로 용리를 수행하고, 각각의 후속 분획을 0.1% TFA를 함유하는 물 중 50% ACN 5 ml로 용리하였다.
어느 경우든 (HPLC 정제 또는 고체 상 추출) 순수한 생성물을 함유하는 분획을 모으고 동결 건조시켰다.
B. Hex-[Cys(tMeBn(DOTA-PP))-Pro-Pro-Thr-Gln-Phe-Cys]-Asp-NH2 (3BP-3590)의 인듐-착물
완충제 A 중에 용해된 펩티드 3BP-3407 25 mg (15.7 μmol)로부터 출발하고, 조건 A로 처리된 InCl3 x 4 H2O의 용액으로 희석하여 착물을 제조하였다. 정제 단계에서 '정제 A'를 사용하여 (30분 내 15 → 40% B - RLRP-S) 순수한 표제 화합물 18.24 mg (68.1% 수율)을 수득하였다. HPLC: Rt = 5.6 분. LC/TOF-MS: 정확한 질량 1702.622 (계산치 1702.617). C73H105InN16O20S2 (MW = 1705.663).
C. Hex-[Cys(tMeBn(DOTA-PP))-Pro-Pro-Thr-Gln-Phe-Cys]-Asp-NH2 (3BP-3592)의 갈륨-착물
완충제 A 중에 용해된 펩티드 3BP-3407 25 mg (15.7 μmol)로부터 출발하고, 조건 A로 처리된 Ga(NO3)3 x H2O의 용액으로 희석하여 착물을 제조하였다. 정제 단계에서 '정제 A'를 사용하여 (30분 내 15 → 40% B - RLRP-S) 순수한 표제 화합물 16.78 mg (69.3% 수율)을 수득하였다. HPLC: Rt = 5.7 분. LC/TOF-MS: 정확한 질량 1658.664 (계산치 1658.639). C73H105GaN16O20S2 (MW = 1660.568).
D. Hex-[Cys(tMeBn(DOTA-PP))-Pro-Pro-Thr-Gln-Phe-Cys]-Asp-NH2 (3BP-3591)의 루테튬-착물
완충제 A 중에 용해된 펩티드 3BP-3407 25 mg (15.7 μmol)으로부터 출발하고, 조건 A로 처리된 LuCl3의 용액으로 희석하여 착물을 제조하였다. 정제 단계에서 '정제 A'를 사용하여 (30분 내 15 → 40% B - RLRP-S) 순수한 표제 화합물 16.66 mg (60.1% 수율)을 수득하였다. HPLC: Rt = 5.6 분. LC/TOF-MS: 정확한 질량 1764.654 (계산치 1764.654). C73H105LuN16O20S2 (MW = 1765.812).
E. Hex-[Cys(tMeBn(DOTA-PP))-Pro-Pro-Thr-Gln-Phe-Cys]-Asp-NH2 (3BP-3661)의 유로퓸-착물
완충제 B 중에 용해된 펩티드 9.5 mg (6 μmol) 3BP-3407로부터 출발하고, 조건 B로 처리된 EuCl3 x 6 H2O의 용액으로 희석하여 착물을 제조하였다. 정제 단계에서 '정제 B'를 사용하여 순수한 표제 화합물 8.24 mg (79.3% 수율)을 수득하였다. HPLC: Rt = 5.7 분. LC/TOF-MS: 정확한 질량 1740.636 (계산치 1740.633). C73H105EuN16O20S2 (MW = 1742.809).
F. Hex-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3623)의 인듐-착물
완충제 A 중에 용해된 6 mg 펩티드 3BP-3554 (4.1 μmol)로부터 출발하고, 조건 A로 처리된 InCl3 x 4 H2O의 용액으로 희석하여 착물을 제조하였다. 정제 단계에서 '정제 B'를 사용하여 순수한 표제 화합물 5.26 mg (81% 수율)을 수득하였다. HPLC: Rt = 5.8 분. LC/TOF-MS: 정확한 질량 1579.524 (계산치 1579.520). C67H96InN13O18S3 (MW = 1582.574).
G. Hex-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3624)의 루테튬-착물
완충제 A 중에 용해된 6 mg 펩티드 3BP-3554 (4.1 μmol)로부터 출발하고, 조건 A로 처리된 LuCl3의 용액으로 희석하여 착물을 제조하였다. 정제 단계에서 '정제 B'를 사용하여 순수한 표제 화합물 5.5 mg (82% 수율)을 수득하였다. HPLC: Rt = 5.9 분. LC/TOF-MS: 정확한 질량 1641.560 (계산치 1641.557). C67H96LuN13O18S3 (MW = 1642.723).
H. Hex-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3949)의 갈륨-착물
완충제 A 중에 용해된 7.9 mg 펩티드 3BP-3554 (5.4 μmol)로부터 출발하고, 조건 A로 처리된 Ga(NO3)3 x H2O의 용액으로 희석하여 착물을 제조하였다. 정제 단계에서 '정제 B'를 사용하여 순수한 표제 화합물 4.2 mg (51% 수율)을 수득하였다. HPLC: Rt = 6.6 분. LC/TOF-MS: 정확한 질량 1535.543 (계산치 1535.541). C67H96GaN13O18S3 (MW = 1537.479).
I. Hex-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3662)의 유로퓸-착물
완충제 B 중에 용해된 3.4 mg 펩티드 3BP-3554 (2.3 μmol)로부터 출발하고, 조건 B로 처리된 EuCl3 x 6 H2O의 용액으로 희석하여 착물을 제조하였다. 정제 단계에서 '정제 B'를 사용하여 순수한 표제 화합물 3.1 mg (83% 수율)을 수득하였다. HPLC: Rt = 5.9 분. LC/TOF-MS: 정확한 질량 1617.541 (계산치 1617.536). C67H96EuN13O18S3 (MW = 1619.721).
J. Hex-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4293)의 구리(II)-착물
완충제 A 중에 용해된 펩티드 3BP-3554 18 mg (12.2 μmol)으로부터 출발하고, 조건 A로 처리된 Cu(OAc)2의 용액으로 희석하여 착물을 제조하였다. 정제 단계에서 '정제 B'를 사용하여 순수한 표제 화합물 16.5 mg (88% 수율)을 수득하였다. HPLC: Rt = 6.5 분. LC/TOF-MS: 정확한 질량 1530.553 (계산치 1530.553). C67H97CuN13O18S3 (MW = 1532.310).
K. Hex-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4343)의 아연-착물
완충제 A 중에 용해된 펩티드 3BP-3554 20 mg (13.6 μmol)으로부터 출발하고, 조건 A로 처리된 ZnCl2의 용액으로 희석하여 착물을 제조하였다. 정제 단계에서 '정제 B'를 사용하여 순수한 표제 화합물 16.1 mg (77% 수율)을 수득하였다. HPLC: Rt = 6.4 분. LC/TOF-MS: 정확한 질량 1531.553 (계산치 1531.553). C67H97N13O18S3Zn (MW = 1534.160).
L. Hex-[Cys(tMeBn(NODAGA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4184)의 갈륨-착물
완충제 A 중에 용해된 펩티드 3BP-4162 7.4 mg (5.1 μmol)으로부터 출발하고, 조건 A로 처리된 Ga(NO3)3 x H2O의 용액으로 희석하여 착물을 제조하였다. 정제 단계에서 '정제 B'를 사용하여 순수한 표제 화합물 6.3 mg (80% 수율)을 수득하였다. HPLC: Rt = 6.5 분. LC/TOF-MS: 정확한 질량 1506.515 (계산치 1506.515). C66H93GaN12O18S3 (MW = 1508.438).
실시예 29: 혈장 안정성 검정
인간 및 마우스 혈장에서의 본 발명의 선택되는 화합물의 안정성을 결정하기 위해, 혈장 안정성 검정을 수행하였다. 이러한 혈장 안정성 검정은 혈장에서의 본 발명의 화합물의 분해를 측정한다. 이는, 혈장에서 신속하게 분해되는 전구약물을 제외하고는, 일반적으로 불량한 생체내 효능을 나타내는 화합물로서의 화합물의 중요한 특징이다. 결과는 이들 화합물이 인간 및 마우스 혈장에서 고도로 안정함을 보여준다. 안정성은 본 발명에 따른 이들 화합물의 진단, 치료 및 치료진단 용도에 충분하다.
혈장 안정성 샘플은 50 μl 혈장 분취물 (모두 K2EDTA)을 DMSO 중 0.5 mM 화합물 원액 1 μl와 섞어 제조하였다. 볼텍싱 후, 샘플을 써모믹서에서 37℃에서 0, 4 및 24시간 동안 인큐베이션하였다. 인큐베이션 후, 샘플을 추가의 처리까지 얼음 상에서 저장하였다. 모든 샘플을 이중으로 제조하였다.
적합한 내부 표준물을 각각의 샘플 (DMSO 중 0.5 mM 원액 1 μl)에 첨가하였다. 단백질 침전을 표 8에 나타낸 바와 같은 화합물 조건에 따라 2가지 상이한 방법을 사용하여 수행하였다.
A) 1% 트리플루오로아세트산을 함유하는 아세토니트릴 250 μl을 첨가하였다. 실온에서 30분 동안 인큐베이션한 후, 침전물을 원심분리에 의해 분리하고, 상청액 150 μl을 1% 수성 포름산 150 μl로 희석하였다.
B) 78% 0.1 M 황산아연 및 22% 아세토니트릴을 함유하는 황산아연 침전제 150 μl을 첨가하였다. 실온에서 30분 동안 인큐베이션한 후, 침전물을 원심분리에 의해 분리하였다. 100 μl의 상청액에 10 μl의 1% 포름산을 첨가한 후, 화합물이 유리 DOTA 모이어티를 함유하는 경우, 60℃에서 10분 동안 추가로 인큐베이션하여 아연 킬레이트의 형성을 완료하였다.
깨끗한 샘플 용액 중 분석물의 결정은 애질런트 6530 Q-TOF 질량 분광계에 커플링된 애질런트 1290 UHPLC 시스템 상에서 수행하였다. 크로마토그래피 분리를 페노메넥스 바이오젠(Phenomenex BioZen) XB-C18 HPLC 칼럼 (50 x 2 mm, 1.7 μm 입자 크기) 상에서 용리액 A로서 물 중 0.1% 포름산 및 용리액 B로서 아세토니트릴의 혼합물을 사용하는 구배 용리 (7분 내 2% B → 41%, 800 μl/분, 40℃)로 수행하였다. 질량 분광측정 검출은 양이온 ESI 모드에서 2/초의 샘플링 속도로 m/z 50 내지 3000의 질량 범위를 스캐닝함으로써 수행하였다.
질량 분광측정 미가공 데이터로부터 이중 또는 삼중 하전된 단일동위원소 신호에 대한 이온 전류를 화합물 및 내부 표준 둘 다에 대해 추출하였다.
적분된 분석물 신호를 사용하여 내부 표준으로 외부 매트릭스 보정에 의해 정량화를 수행하였다.
추가적으로, 특정량의 화합물로 처리한 후 내부 표준만을 함유하는 순수한 혈장 샘플을 스파이킹하여 회수율을 결정하였다.
캐리-오버를 최고 보정 샘플 후 블랭크 샘플 (20% 아세토니트릴)의 분석에 의해 평가하였다.
본 발명에 따른 화합물 중 일부에 대해 수행된 이 검정의 결과는 하기 표 8에 주어진다. 결과는 "4시간 또는 24시간 후 남아있는 무손상 화합물 (%)"로서 언급되고, 이는 언급된 백분율이 실험 개시시 물질의 양으로부터 LC-MS 정량화에 의해 실험 종료시 변화되지 않은 물질로서 검출됨을 의미한다. 모든 화합물이 적어도 4시간 후에 50% 초과로 무손상이기 때문에, 이들은 진단 및 치료 용도에 충분히 안정한 것으로 간주된다.
표 8: 혈장 안정성 검정의 결과
실시예 30: FACS 결합 검정
FAP-발현 세포에 대한 본 발명에 따른 화합물의 결합을 결정하기 위해, 경쟁적 FACS 결합 검정을 확립하였다.
FAP-발현 인간 WI-38 섬유모세포 (ECACC)를 15% 태아 소 혈청, 2mM L-글루타민 및 1% 비필수 아미노산을 포함하는 EMEM 중에서 배양하였다. 세포를 아큐타제(Accutase) (바이오레전드(Biolegend), #BLD-423201)로 분리시키고, FACS 완충제 (1% FBS를 포함하는 PBS) 중에서 세척하였다. 세포를 FACS 완충제 중에 ml당 100,000개 세포의 최종 농도로 희석하고, 세포 현탁액 200 μl을 u-형상 비-결합 96-웰 플레이트 (그라이너(Greiner))로 옮겼다. 세포를 빙냉 FACS 완충제 중에서 세척하고, 증가하는 농도의 펩티드의 존재 하에 3 nM의 Cy5-표지된 화합물 (H-Met-[Cys(3MeBn)-Pro-Pro-Thr-Glu-Phe-Cys]-Asp-His-Phe-Arg-Asp-Ttds-Lys(Cy5SO3)-NH2)과 함께 4℃에서 1시간 동안 인큐베이션하였다. 세포를 FACS 완충제로 2회 세척하고, 200 μl FACS 완충제 중에 재현탁시켰다. 세포를 애튠(Attune) NxT 유동 세포측정기에서 분석하였다. 중앙 형광 강도 (Cy5 채널)를 애튠 NxT 소프트웨어에 의해 계산하고, 펩티드 농도에 대해 플롯팅하였다. 액티비티베이스(ActivityBase) 소프트웨어를 사용하여 4 파라미터 로지스틱 (4PL) 곡선 피팅 및 pIC50 계산을 수행하였다. 본 발명에 따른 각각의 화합물에 대한 이 검정의 결과 뿐만 아니라 실시예 31에 따른 FAP 프로테아제 활성 검정의 결과를 표 9에 나타내었다 (실시예 31에 나타냄). pIC50 카테고리 A는 pIC50 값 >8.0을 나타내고, 카테고리 B는 pIC50 값 7.1 내지 8.0을 나타내고, 카테고리 C는 pIC50 값 6.1 내지 7.0을 나타내고, 카테고리 D는 pIC50 값 ≤ 6.0을 나타낸다.
실시예 31: FAP 프로테아제 활성 검정
FAP-발현 세포에 대한 본 발명에 따른 화합물의 억제 활성을 결정하기 위해, FRET-기반 FAP 프로테아제 활성 검정을 확립하였다.
재조합 인간 FAP (알앤디 시스템즈(R&D systems), #3715-SE)를 검정 완충제 (50 mM 트리스, 1 M NaCl, 1 mg/mL BSA, pH 7.5) 중에 3.6 nM의 농도로 희석하였다. FAP 용액 25 μl을 시험 화합물의 3배 연속 희석물 25 μl와 혼합하고, 백색 96-웰 프록시플레이트(ProxiPlate) (퍼킨 엘머(Perkin Elmer))에서 5분 동안 인큐베이션하였다. 특이적 FAP 기질로서 FRET-펩티드 하이라이트플루오르(HiLyteFluor)TM 488 - VS(D-)P SQG K(QXL® 520) - NH2를 사용하였다 (Bainbridge, et al., Sci Rep, 2017, 7: 12524). 검정 완충제 중에 희석된 30 μM 기질 용액 25 μL을 첨가하였다. 모든 용액을 사용 전에 37℃에서 평형화시켰다. 기질 절단 및 형광의 증가 (485 nm에서의 여기 및 538 nm에서의 방출)를 스펙트라맥스(SPECTRAmax) M5 플레이트 판독기에서 37℃에서 5분 동안 동역학적 모드로 측정하였다. RFU/sec를 소프트맥스 프로(SoftMax Pro) 소프트웨어에 의해 계산하고, 펩티드 농도에 대해 플롯팅하였다. 액티비티베이스 소프트웨어를 사용하여 4 파라미터 로지스틱 (4PL) 곡선 피팅 및 pIC50 계산을 수행하였다. 본 발명에 따른 각각의 화합물에 대한 이 검정의 결과는 표 9에 주어진다. pIC50 카테고리 A는 pIC50 값 >8.0을 나타내고, 카테고리 B는 pIC50 값 7.1 내지 8.0을 나타내고, 카테고리 C는 pIC50 값 6.1 내지 7.0을 나타내고, 카테고리 D는 pIC50 값 ≤ 6.0을 나타낸다.
표 9로부터 명백한 바와 같이, 본 발명의 화합물은 FACS 결합 검정 및 FAP 프로테아제 활성 검정 둘 다에서 놀랍게도 우수한 결과를 나타내었다.
또한, 접합된 킬레이트화제를 갖는 화합물이, 킬레이트화제를 갖지 않지만 유사한 펩티드 서열을 갖는 화합물과 매우 유사한 활성을 갖는다는 것을 입증하는 SAR-데이터를 쉽게 발견할 수 있다. 예를 들어, 3BP-3168 및 3BP-3169는 C-말단에 킬레이트화제 및 링커를 보유하고 (DOTA-Ttds-Nle/Met), pIC50 > 8의 최고 활성 카테고리에 있다. N-말단에 킬레이트화제 및 링커를 갖지 않는 상응하는 화합물 (N-말단 Hex-를 갖는 3BP-2974, N-말단 Ac-Met를 갖는 3BP-2975 및 N-말단 H-met를 갖는 3BP-2976)은 킬레이트화제 포함 화합물 3BP-3168 및 3BP-3169와 비교하여 모두 유사한 활성을 나타낸다.
이는 킬레이트화제 무함유 화합물로부터의 활성 데이터가 킬레이트화제 포함 화합물의 활성을 예측한다는 것을 의미한다. 이러한 현상은 킬레이트화제가 다른 2가지 명시된 가능성에 따라 본 발명의 화합물에 접합되는 경우에도 추가로 관찰된다. 킬레이트화제가 없는 상응하는 화합물과 비교하여 C-말단에의 킬레이트화제 부착에 대한 예는 동일한 경향을 나타내고, 3BP-3105 대 3BP-2974, 3BP-3395 또는 3BP-3397 대 3BP-3476이고, 킬레이트화제가 없는 상응하는 화합물과 비교하여 Yc에의 킬레이트화제 부착에 대한 예는 3BP-3407 대 3BP-3476 또는 3BP-3426 대 3BP-3476이다.
표 9: 화합물 ID, 서열, 정확한 질량 계산치, 정확한 질량 실측치, 체류 시간 (분) (HPLC에 의해 측정됨) 및 FACS 결합 및 FAP 활성 검정의 pIC50 카테고리
실시예 32: 표면 플라즈몬 공명 검정
표면 플라즈몬 공명 연구를 비아코어(Biacore)TM T200 SPR 시스템을 사용하여 수행하였다. 간략하게, 편광은 금-표지된 센서 표면을 향하고, 최소 강도의 반사광이 검출된다. 반사광의 각도는 분자가 결합하고 해리함에 따라 변화한다. 금-표지된 센서 표면에 FAP 표적 단백질을 보유하는 FAP 항체가 로딩되어 있으며, 이에 의해 FAP의 기질-결합 부위에서 항체 결합이 발생하지 않는다. 시험 화합물을 로딩된 표면과 접촉시키고, FAP 리간드와의 실시간 상호작용 프로파일을 센서그램에 기록한다. 실시간으로, 결합 상호작용의 회합 및 해리를 측정하여, 회합 및 해리 속도 상수 및 상응하는 친화도 상수의 계산을 가능하게 한다. 중요하게는, 구동 완충제 및 샘플 완충제의 굴절률의 차이, 뿐만 아니라 플로우 셀 표면에 대한 시험 화합물의 비특이적 결합으로 인해 배경 반응이 생성된다. 이러한 배경은 고정된 FAP의 부재 하에 동일한 밀도의 포획 항체로 코팅된 대조군 플로우 셀 상에서 샘플을 구동시킴으로써 측정하고 차감한다. 또한, 고정된 항체로부터의 포획된 FAP의 느린 해리에 의해 야기되는 결합 데이터의 기준선 드리프트 보정을 수행한다. 이러한 드리프트는 센서 표면에 고정된 항체 및 FAP를 갖는 플로우 셀을 통해 구동 완충제를 주입함으로써 측정된다.
비아코어TM CM5 센서 칩을 사용하였다. 인간 항-FAP 항체 (MAB3715, 알앤디 시스템즈)를 10 mM 아세테이트 완충제, pH 4.5 중에 50 μg/mL의 최종 농도로 희석하였다. 150 μL 분취물을 플라스틱 바이알로 옮기고, 비아코어TM T200 기기의 샘플 랙에 넣었다. 아민 커플링 키트 시약 용액을 플라스틱 바이알로 옮기고, 샘플 랙에 넣었다: 90 μL의 0.4 M 1-에틸-3-(3-디메틸아미노프로필)카르보디이미드 (EDC), 및 90 μL의 0.1 M N-히드록시숙신이미드 (NHS). 130 μL 분취량의 1 M 에탄올아민-HCl, pH 8.5를 플라스틱 바이알로 옮기고, 샘플 랙에 넣었다. 비아코어TM 액체 시스템을 하기와 같이 설정하였다: 증류수 (1 L), 구동 완충제 (500 mL)를 함유하는 별개의 병, 뿐만 아니라 폐기물을 위한 빈 병을 완충제 트레이 상에 놓았다. 고정화를 위해 사전설치된 프로그램을 7000 RU의 고정화 수준으로 사용하였다. 고정화를 25℃에서 수행하였다. 항-FAP 항체의 고정화 절차를 표 10에 기재된 바와 같이 수행하였다.
표 10: CM5 센서 칩 상에 사용된 항-FAP 항체에 대한 고정화 프로토콜.
인간 재조합 FAP를 구동 완충제 중에 20 μg/mL의 최종 농도로 희석하였다. 인간 FAP-작업-용액의 100 μL 분취물을 플라스틱 바이알로 옮기고, 샘플 랙에 넣었다. 0.5 mM 화합물-원액-용액을 각각의 화합물을 DMSO 중에 용해시킴으로써 제조하였다. 각각의 시험 화합물에 대해, 화합물-원액-용액을 구동 완충제 (HBST) 중에 500 nM로 희석하고, HBST-DMSO 완충제 (0.1% DMSO)로 추가로 희석하였다. 2원 복합체에 대한 SPR 결합 분석을 25℃에서 SCK 모드로 수행하였다. 표 11은 결합 동역학의 포획 및 평가를 위한 프로토콜을 기재한다. 3회의 SCK 측정 후, 항체 및 FAP가 센서 표면에 고정되어 있는 플로우 셀을 통해 구동 완충제를 주입함으로써 기준선 드리프트를 평가하였다.
표 11: 결합 동역학을 평가하기 위한 프로토콜.
각각의 시험 화합물에 대해, 공명 단위 (RU) 형태의 SPR 미가공 데이터를 비아코어TM T200 제어 소프트웨어를 사용하여 센서그램으로서 플롯팅하였다. 블랭크 센서그램으로부터의 신호를 시험 화합물 센서그램의 신호로부터 차감하였다 (블랭크 보정됨). 블랭크 보정된 센서그램을 시험 화합물 없이 실행된 SCK (구동 완충제 단독)의 센서그램을 차감함으로써 기준선 드리프트에 대해 보정하였다. 회합 속도 (kon), 해리 속도 (koff), 해리 상수 (KD), 및 t1/2를 비아코어TM T200 평가 소프트웨어로부터의 1:1 랭뮤어(Langmuir) 결합 모델을 사용하여 블랭크-정규화 SPR 데이터로부터 계산하였다. 미가공 데이터 및 피팅 결과를 IDBS에 텍스트 파일로서 입력하였다. pKD 값 (해리 상수의 음의 십진 로그)을 IDBS 엑셀 템플릿으로 계산하였다.
본 발명에 따른 화합물의 선택에 대한 본 검정의 결과는 표 12에 제시된다. 카테고리 A는 pKD 값 >8.0, 카테고리 B는 7.1 내지 8.0의 pKD 값, 카테고리 C는 6.1 내지 7.0의 pKD 값을 나타낸다.
표 12: 화합물 ID, 서열 및 비아코어 검정의 pkD 카테고리
실시예 33: PREP 및 DPP4 프로테아제 활성 검정
PREP 및 DPP4 둘 다에 대한 FAP 결합 펩티드의 선택성을 시험하기 위해, 하기 예외를 제외하고 상기 기재된 FAP 활성 검정과 유사하게 프로테아제 활성 검정을 수행하였다.
PREP 활성을 재조합 인간 PREP (알앤디 시스템즈, #4308-SE)로 측정하였다. 기질로서 50 μM Z-GP-AMC (바켐, #4002518)를 사용하였다. DPP4 활성 검정을 DPP 검정 완충제 (25 mM 트리스, pH 8.0) 중에서 수행하였다. 재조합 인간 DPP4는 R&D 시스템즈 (#9168-SE)로부터 구입하였다. 20 μM의 GP-AMC (산타 크루즈 바이오테크놀로지(Santa Cruz Biotechnology), #115035-46-6)를 기질로서 사용하였다.
절단 후 AMC의 형광 (380 nm에서의 여기 및 460 nm에서의 방출)을 스펙트라맥스 M5 플레이트 판독기에서 37℃에서 5분 동안 동역학적 모드로 측정하였다. RFU/sec를 소프트맥스 프로(SoftMax Pro) 소프트웨어에 의해 계산하고, 펩티드 농도에 대해 플롯팅하였다. 액티비티베이스 소프트웨어를 사용하여 4 파라미터 로지스틱 (4PL) 곡선 피팅 및 pIC50 계산을 수행하였다. 본 발명에 따른 화합물 중 일부에 대한 이 검정의 결과는 하기 표 13에 주어진다.
표 13: PREP 및 DPP4 활성 검정의 결과 (pIC50 값)
실시예 34: 특이성 스크린
본 발명의 화합물의 유의한 오프-타겟 상호작용을 조기에 확인하기 위해 특이성 스크리닝을 수행하였다. 특이성은, 문헌 [Bowes et al. (Bowes, et al., Nat Rev Drug Discov, 2012, 11: 909)]에 의해 권장된, 44개의 선택 표적 및 그에 결합하는 화합물 ("참조 화합물", Ref. 화합물로 지칭됨)을 포함하는 검정의 표준 배터리 ("세이프티스크린(SafetyScreen)44TM 패널")를 사용하여 시험하였다. 참조 화합물은 각각의 검정에 대한 양성 대조군으로서의 역할을 하였으며, 따라서 이들 참조 화합물로 억제가 검출될 것으로 예상된다. 그러나, 본 발명의 화합물은 이들 검정에서 억제를 나타낼 것으로 예상되지 않았다. 이들 결합 및 효소 억제 검정은 유로핀스 세렙 SA(Eurofins Cerep SA) (프랑스 셀 레베스카울트)에 의해 수행하였다.
3BP-3407 및 3BP-3554를 10 μM에서 시험하였다. 화합물 결합을 각각의 표적에 특이적인 방사성 표지된 리간드의 결합의 % 억제 ("특이적 결합의 % 억제" (3BP-3407) 또는 (3BP-3554) 각각)로서 계산하였다. 화합물 효소 억제 효과를 대조군 효소 활성의 % 억제로서 계산하였다.
50% 초과의 억제 또는 자극을 나타내는 결과는 시험 화합물의 유의한 효과를 나타내는 것으로 간주된다. 이러한 효과는 하기 표 14에 열거된 연구된 수용체 중 어느 것에서도 관찰되지 않았다. 본 검정의 결과를 하기 표 14에 요약하였다.
표 14: 10 μM 3BP-3407 및 10 μM 3BP-3554에 대한 특이성 스크리닝 (세이프티스크린44TM 패널)의 결과
추가적으로, 프로테아제에 대한 특이성 스크린을 BPS 바이오사이언시스(BPS Biosciences)에 의해 수행하여 본 발명의 화합물의 특이성을 추가로 결정하였다 (Turk, Nat Rev Drug Discov, 2006, 5: 785; Overall, et al., Nat Rev Cancer, 2006, 6: 227; Anderson, et al., Handb Exp Pharmacol, 2009, 189: 85).
3BP-3407 및 3BP-3554를 1 μM 및 10 μM에서 이중으로 시험하였다. 화합물의 부재 하에, 각각의 데이터 세트에서의 형광 강도 (Ft)를 100% 활성으로서 정의하였다. 효소의 부재 하에, 각각의 데이터 세트에서의 배경 형광 강도 (Fb)를 0% 활성으로서 정의하였다. 각각의 화합물의 존재 하의 퍼센트 활성을 하기 방정식에 따라 계산하였다: %활성 = (F-Fb)/(Ft-Fb), 여기서 F= 화합물의 존재 하의 형광 강도. 억제 백분율을 하기 방정식에 따라 계산하였다: % 억제 = 100% - %활성. 50% 초과의 억제를 나타내는 결과는 시험 화합물의 유의한 효과를 나타내는 것으로 간주된다. 본 검정의 결과는 하기 표 15에 주어진다.
표 15: 1 μM 및 10 μM 3BP-3407 및 1 μM 및 10 μM 3BP-3554에 대한 특이성 프로테아제 스크리닝의 결과
실시예 35: 선택 화합물의 111In- 및 177Lu-표지
진단, 치료 또는 치료 활성제로서 작용하기 위해, 화합물은 방사성 동위원소로 표지될 필요가 있다. 표지화 절차는 본 발명의 방사성표지된 화합물의 높은 방사화학적 수율 및 순도를 보장하는데 적절해야 한다. 본 실시예는 본 발명의 화합물이 방사성표지에 대해 적절하고, 높은 방사화학적 수율 및 순도로 표지될 수 있음을 보여준다.
30-100 MBq의 111InCl3 (0.02 M HCl 중)을 30 MBq당 1 nmol의 화합물 (0.1 M HEPES pH 7 중 200 μM 원액) 및 완충제 (1 M 아세트산나트륨 완충제 pH 5 또는 1 M 아세트산나트륨/아스코르브산 완충제 pH 5 (25 mg/ml 메티오닌을 함유))와 0.1 - 0.2 M의 최종 완충제 농도로 혼합하였다. 혼합물을 80℃로 20-30분 동안 가열하였다. 냉각 후, DTPA 및 트윈(TWEEN)-20을 각각 0.2 mM 및 0.1%의 최종 농도로 첨가하였다.
0.2 - 2.0 GBq 177LuCl3 (0.04 M HCl 중)을 45 MBq당 1 nmol의 화합물 (0.1 M HEPES pH 7 중 200 μM 원액) 및 완충제 (25 mg/ml 메티오닌을 함유하는 1 M 아세트산나트륨/아스코르브산 완충제 pH 5)와 ~0.4 M의 최종 완충제 농도로 혼합하였다. 혼합물을 90℃로 20분 동안 가열하였다. 냉각 후, DTPA 및 트윈-20을 각각 0.2 mM 및 0.1%의 최종 농도로 첨가하였다.
인간 사용에 적합한 제제 중 177Lu-표지된 화합물의 장기간 안정성을 평가하기 위해, 냉각 후 반응 혼합물을 적합한 안정화제 (예를 들어, 아스코르베이트, 메티오닌)를 함유하는 제제 완충제 9 부피로 희석하고, 시간 경과에 따라 방사화학적 순도를 모니터링하였다.
표지 효율을 박층 크로마토그래피 (TLC) 및 HPLC에 의해 분석하였다. TLC 분석을 위해, 1-2 μl의 희석된 표지 용액을 iTLC-SG 크로마토그래피 종이 (애질런트, 7.6 x 2.3 mm)의 스트립에 적용하고, 시트레이트-덱스트로스 용액 (시그마(Sigma)) 중에서 전개시켰다. 이어서 iTLC 스트립을 3개의 조각으로 절단하고, 연관된 방사능을 감마-카운터로 측정하였다. 용매 선단에서 측정된 방사능은 유리 방사성핵종 및 콜로이드를 나타내는 반면, 원점에서의 방사능은 방사성표지된 화합물을 나타낸다. HPLC를 위해, 5 μl의 희석된 표지 용액을 포로쉘 SB-C18 2.7 μm (애질런트)로 분석하였다. 용리액 A: MeCN, 용리액 B: H2O, 0.1% TFA, 구배 15분 내 5% B → 70% B, 유량 0.5 ml/분; 검출기: NaI (레이테스트(Raytest)), DAD 230 nm. 불감 부피로 용리되는 피크는 유리 방사성핵종을 나타내고, 비표지된 샘플로 결정된 바와 같은 펩티드-특이적 체류 시간으로 용리되는 피크는 방사성표지된 화합물을 나타낸다.
합성 종료시 방사성핵종 혼입 수율은 ≥ 90%였고, 방사화학적 순도는 ≥ 76%였다. 111In-표지된 화합물에 대한 예시적인 방사화학적 순도는 표 16에 제시된다. 인간 사용에 적합한 제제 중 177Lu-표지된 화합물은 합성 후 6일까지 ≥ 90%의 방사화학적 순도를 유지하였다 (표 17). 선택되는 화합물에 대한 방사선크로마토그램을 도 1 내지 4에 나타내었으며, 여기서 도 1은 합성 직후에 분석된 100 mg/mL 아스코르베이트 및 5 mg/mL L-메티오닌을 함유하는 제제 완충제 중 177Lu-3BP-3407의 방사선크로마토그램을 나타내고, 도 2는 합성 후 6일에 분석된 100 mg/mL 아스코르베이트 및 5 mg/mL L-메티오닌을 함유하는 제제 완충제 중 177Lu-3BP-3407의 방사선크로마토그램을 나타내고, 도 3은 합성 직후에 분석된 100 mg/mL 아스코르베이트 및 5 mg/mL L-메티오닌을 함유하는 제제 완충제 중 177Lu-3BP-3554의 방사선크로마토그램을 나타내고, 도 4는 합성 후 6일에 분석된 100 mg/mL 아스코르베이트 및 5 mg/mL L-메티오닌을 함유하는 제제 완충제 중 177Lu-3BP-3554의 방사선크로마토그램을 나타낸다.
표 16: 111In-표지된 화합물의 HPLC에 의한 방사화학적 순도.
표 17: 합성 종료 후 제0일 및 제6일에 분석된 100 mg/mL 아스코르베이트 및 5 mg/mL L-메티오닌을 함유하는 제제 완충제 중 177Lu-표지된 화합물의 HPLC에 의한 방사화학적 순도.
실시예 36: 영상화 및 생체분포 연구
방사성 표지된 화합물은 영상화 방법, 예컨대 SPECT 및 PET에 의해 검출될 수 있다. 또한, 이러한 기술에 의해 획득된 데이터는 방사성 표지된 본 발명의 화합물을 주사한 동물로부터 제조된 개별 기관에 함유된 방사능의 직접 측정에 의해 확인할 수 있다. 따라서, 방사성 표지된 화합물의 생체분포 (개별 기관에서의 방사능의 측정)를 결정하고 분석할 수 있다. 본 실시예는 본 발명의 화합물이 종양의 진단 영상화 및 치유적 치료에 적절한 생체분포를 나타낸다는 것을 보여준다.
모든 동물 실험은 독일 동물 보호법에 따라 수행하였다. 수컷 SCID 베이지 (6- 내지 8-주령, 찰스 리버(Charles River), 독일 슐츠펠트)의 한쪽 어깨에 5 x 106 HEK-FAP (높은 수준의 FAP를 발현하도록 유전자 조작된 배아 인간 신장 293 세포) 세포를 접종하였다. 종양이 > 150 mm3의 크기에 도달하였을 때, 마우스의 꼬리 정맥을 통해 정맥내로 본 발명의 ~30 MBq 111In-표지된 화합물 (PBS로 100 μL로 희석됨)을 투여하였다. 영상을 나노SPECT(NanoSPECT)/CT 시스템 (메디소 메디칼 이미징 시스템즈(Mediso Medical Imaging Systems), 헝가리 부다페스트) 상에서 예시적으로 하기 획득 및 재구성 파라미터를 사용하여 수득하였다 (표 18).
표 18: 나노SPECT/CT 영상화의 획득 및 재구성 파라미터
영상화 데이터를 DICOM 파일로서 저장하고, 비보퀀트(VivoQuant)TM 소프트웨어 (인비크로, 미국 보스톤)를 사용하여 분석하였다. 결과는 조직 그램당 주사된 용량의 백분율 (%ID/g)로서 표현된다. 생체분포 연구를 위해, 동물을 주사 24시간 또는 48시간 후에 경추 탈구에 의해 희생시킨 다음, 절개하였다. 상이한 기관 및 조직을 수집하고 칭량하고, 방사능을 γ-카운팅에 의해 결정하였다. 시점당 2마리의 동물을 사용하였다. 결과는 조직 그램당 주사된 용량의 백분율 (%ID/g)로서 표현된다.
선택 화합물에 대한 영상화 및 생체분포 연구의 결과를 도 5-14, 20 및 21에 나타내었다.
실시예 37: 효능 연구 - HEK-FAP
방사성 표지된 화합물은 다양한 질환, 특히 암에서의 치료 및 진단 용도에 사용될 수 있다. 본 실시예는 본 발명의 화합물이 종양의 치유적 치료에 적합한 항종양 활성을 갖는다는 것을 보여준다.
모든 동물 실험은 독일 동물 보호법에 따라 수행하였다. 암컷 스위스 누드 마우스 (7- 내지 8-주령, 찰스 리버 래보러토리즈(Charles River Laboratories), 프랑스)의 한쪽 어깨에 5 x 106 HEK-FAP 세포를 접종하고, 종양이 160 ± 44 mm3의 평균 종양 부피에 도달하였을 때 치료를 투여하였다. 마우스를 10마리 동물/군의 4개의 상이한 군으로 나누었다: 군 1 - 비히클 대조군, 군 2 - 콜드 화합물 natLu-3BP-3554, 군 3 - 30 MBq 177Lu-3BP-3554 (저용량), 및 군 4 - 60 MBq 177Lu-FAP-3554 (고용량). 치료는 제0일에 꼬리 정맥 내로 4 mL/kg (100 μL/마우스)으로 정맥내 주사에 의해 투여하였다. 종양 부피 및 체중을 제0일 (즉 방사성추적자 투여의 제1일)에 측정한 다음, 연구의 완료까지 매주 3회 측정하였다.
177Lu-표지된 3BP-3554가 주사된 마우스에서의 추적자 분포를 3개의 마우스 투여 군에서 SPECT 영상화에 의해 결정하였다. 후속적으로, SPECT 후, 해부학적 정보에 대해 CT 스캔을 수행하였다. 주사후 3시간, 24시간, 48시간 및 120시간에 나노SPECT/CT 시스템 (메디소 메디칼 이미징 시스템즈, 헝가리 부다페스트)으로 예시적으로 하기 획득 및 재구성 파라미터를 사용하여 영상화를 수행하였다 (표 19).
표 19: 나노SPECT/CT 영상화의 획득 및 재구성 파라미터
영상화 데이터를 DICOM 파일로서 저장하고, 비보퀀트TM 소프트웨어 (인비크로, 미국 보스톤)를 사용하여 분석하였다. 결과는 조직 그램당 주사된 용량의 백분율 (%ID/g)로서 표현된다.
비히클 및 콜드 화합물 natLu-3BP-3554-치료된 마우스에서의 종양은 제14일에 각각 1338 ± 670 mm3 및 1392 ± 420 mm3의 평균 종양 부피 (MTV)에 도달하였다 (도 15A). 통계적으로 유의한 (P < 0.01) 항종양 활성이 두 치료군의 마우스에서 관찰되었다. 제14일에 종양 성장 억제 (TGI)는, 30 또는 60 MBq 177Lu-3BP-3554의 단일 용량으로 치료된 마우스에서 비히클-처리군에 비해 각각 111% 및 113%였다. 177Lu-3BP-3554로 치료된 모든 마우스에서의 MTV는 제14일에 ≤70 mm3으로 감소하였다. 종양을 제42일에 (이는 연구의 종료를 나타냄) 재성장에 대해 모니터링하였고, 30 또는 60 MBq 177Lu-3BP-3554로 각각 치료된 10마리 마우스 중 3마리 및 10마리 마우스 중 9마리는 무종양 (< 10 mm3)이었으며, 이는 이 모델에서 잠재적 용량-반응을 시사한다. 연구 전반에 걸쳐 치료-관련 체중 감소는 관찰되지 않았다 (도 15B). 제2일에 모든 군에서 체중의 3-5% 감소가 관찰된 후, 동물의 체중은 시간 경과에 따라 증가하였다.
177Lu-표지된 두 치료군의 3마리 동물의 SPECT/CT 영상화는 모든 검사된 시점 (주사후 (p.i.) 3-120시간) 동안 높은 종양-대-배경 대조를 나타내었다. 120시간까지 높은 종양 체류가 관찰되었다. 가장 높은 비-표적 흡수를 갖는 기관은 신장이었고, 종양-대-신장 비는 30 또는 60 MBq 177Lu-3BP3554로 치료된 마우스 각각에서 p.i. 3시간에 8.6 ± 0.6 및 8.0 ± 1.6이었다. 이들 비는 시간 경과에 따라 증가하여, 30 또는 60 MBq 177Lu-3BP3554로 치료된 마우스 각각에서 40 ± 7.9 및 32 ± 7.4 종양-대-신장 비로 120시간에 최고 값을 달성하였다. 고용량 투여 동물인 마우스 5에 대한 SPECT/CT 영상의 예시적인 패널을 도 16A에 제시하고, 저용량 투여 동물인 마우스 1에 대한 SPECT/CT 영상의 예시적인 패널을 도 16B에 제시한다.
실시예 38: 영상화 연구 - 육종 PDX 모델
육종 종양은 FAP를 발현하는 것으로 보고되었으며, 4가지 상이한 육종 환자-유래 이종이식편 (PDX) 종양 모델의 영상화를 수행하여 3BP-3554 흡수를 평가하였다. Sarc4183, Sarc4605, Sarc4809 및 Sarc12616 PDX 모델은 각각 횡문근육종, 골육종, 미분화 육종 및 미분화 다형성 육종을 갖는 환자로부터 유래되었다 (Experimental Pharmacology & Oncology Berlin-Buch, Germany). 종양 단편을 8-주령 NMRI nu/nu 마우스 (얀비에 랩스(Janvier Labs), 프랑스)의 좌측 옆구리에 피하 이식하였다. 모든 동물 실험은 독일 동물 보호법에 따라 수행하였다. 이식 후 47일 (Sarc4183, Sarc4809) 또는 46일 (Sarc4605, Sarc12616)에, 모델당 2-3마리의 마우스를 30 MBq의 111In-3BP-3554의 단일 정맥내 주사 후 3시간에 영상화하였다. 영상화를 실시예 36에 기재된 바와 같이 수행하였다.
111In-3BP-3554를 사용한 영상화 결과는 3h p.i.에 높은 종양 흡수 및 높은 종양-대-배경 대조를 나타내었다. 대표적인 SPECT/CT 영상을 도 17A에 제시한다. 2마리 (Sarc4605, Sarc12616) 또는 3마리 (Sarc4183, Sarc4809) PDX-보유 마우스 각각의 종양 흡수의 정량화는 도 17B에 도시된 바와 같이 4.9 ± 1.7 (Sarc4183), 5.2 ± 0.8 (Sarc4605), 4.4 ± 0.7 (Sarc4809) 및 6.1 ± 0.6 (Sarc12616)의 %ID/g 값을 나타내었다. 이들 결과는 모든 4가지 육종 모델에서 111In-3BP-3554 흡수를 입증하였다. 종양-대-신장 비는 4.7 ± 1.2 (Sarc4183), 3.2 ± 0.4 (Sarc4605), 4.1 ± 0.7 (Sarc4809) 및 4.3 ± 1.2 (Sarc12616)였다.
실시예 39: 효능 연구 - 육종 Sarc4809 PDX 모델
177Lu-3BP-3554의 효능을 인간 육종 PDX 종양 모델 Sarc4809에서 조사하였다. 미분화 육종의 이러한 모델은 111In-3BP-3554 흡수를 입증하고 (실시예 38), 또한 면역조직화학에 의해 FAP를 발현하는 것으로 나타났다.
모든 동물 실험은 독일 동물 보호법에 따라 수행하였다. Sarc4809 종양 단편을 8-주령 NMRI nu/nu 마우스 (얀비에 랩스, 프랑스)의 좌측 옆구리에 피하 이식하였다. 치료는 이식 23일 후에 187.08 ± 123.8 mm3의 평균 종양 부피로 시작하였다. 마우스를 10마리 동물/군의 4개의 군으로 나누었다: 군 1 - 비히클 대조군, 군 2 - 콜드 화합물 natLu-FAP-3554, 군 3 - 30 MBq 177Lu-3BP-3554, 군 4 - 60 MBq 177Lu-FAP-3554. 치료는 제0일에 꼬리 정맥 내로 4 mL/kg (100 μL/마우스)으로 정맥내 주사에 의해 투여하였다. 종양 부피 및 체중을 제0일 (방사성추적자 투여의 제1일)에 측정한 다음, 연구의 완료까지 매주 3회 측정하였다.
모든 종양은 제42일까지 연구의 추적 기간 전반에 걸쳐 계속 성장하였다. 비히클 및 natLu-3BP-3554 치료된 마우스 (대조군)에서의 종양은 제31일 (군당 적어도 50% 마우스가 여전히 살아있는 마지막 날)에 각각 894 ± 610 mm3 및 1225 ± 775 mm3의 MTV에 도달하였다. 30 또는 60 MBq 177Lu-3BP-3554의 단일 용량으로 치료된 마우스에서의 종양은 제31일에 각각 635 ± 462 및 723 ± 391 mm3의 MTV에 도달하였다 (도 18A). 통계적으로 유의한 (P < 0.05) 항종양 활성이 두 치료군의 마우스에서 관찰되었다. 제31일에서의 종양 성장 억제 (TGI)는, 30 또는 60 MBq 177Lu-3BP-3554의 단일 용량으로 치료된 마우스에서 비히클-처리군에 비해 각각 61% 및 73%였다. 연구 전반에 걸쳐 치료-관련 체중 감소 (BWL)는 관찰되지 않았다. 모든 군에서, 연구 추적 동안 체중이 증가하였다 (도 18B).
실시예 40: 약동학 연구
선택되는 화합물의 약동학적 거동을 마우스 및 래트에서 평가하였다. 화합물의 약동학적 거동의 이러한 특징화는 화합물의 분포 및 제거, 및 노출의 계산에 대한 새로운 통찰을 가능하게 한다.
상이한 양의 화합물을 PBS 중에서 안정하게 제제화하였다. 제제를 마우스에서 4 nmol/kg, 40 nmol/kg 및 400 nmol/kg 및 래트에서 2 nmo/kg, 20 nmol/kg 및 200 nmol/kg (3BP-3554) 또는 40 nmol/kg 및 400 mol/kg (3BP-3623)의 용량으로 정맥내로 적용하였다. 인간에서 마우스로 12.3, 및 인간에서 래트로 6.2의 알로메트릭 전환 인자를 가정하면 (Nair AB, Jacob S. Journal of Basic and Clinical Pharmacy, 2016, 7(2): 27-31), 적용된 용량은 0.325 nmol/kg 내지 32.5 nmol/kg의 인간 용량 범위를 나타낸다.
혈액 샘플을 꼬리 정맥 (래트) 또는 안구후 (마우스)로부터 상이한 시간 (5분, 15분, 30분, 1시간, 2시간, 4시간, 6시간, 8시간) 후에 수집하였다.
원심분리에 의해 혈장으로부터 혈액 세포를 분리한 후, 제조된 혈장 샘플 중 화합물을 정량화하고, 단백질 침전 절차에 적용하였다. 78% 0.1 M 황산아연 및 22% 아세토니트릴을 함유하는 황산아연 침전제 150 μl을 첨가하였다. 실온에서 30분 동안 인큐베이션한 후, 침전물을 원심분리에 의해 분리하였다. 100 μl의 상청액에 10 μl의 1% 포름산을 첨가한 후, 화합물이 유리 DOTA 모이어티를 함유하는 경우, 60℃에서 10분 동안 추가로 인큐베이션하여 아연 킬레이트의 형성을 완료하였다.
깨끗한 샘플 용액 중 분석물의 결정은 애질런트 6470 삼중 사중극자 질량 분광계에 커플링된 애질런트 1290 UHPLC 시스템 상에서 수행하였다. 크로마토그래피 분리를 페노메넥스 바이오젠 펩티드 XB-C18 HPLC 칼럼 (50 x 2 mm, 1.7 μm 입자 크기) 상에서 40℃에서 용리액 A로서 물 중 0.1% 포름산 및 용리액 B로서 아세토니트릴의 혼합물을 사용하는 구배 용리 (1분 동안 5% B에서 등용매에 이어서 4분 내 43% B로의 선형 구배, 500 μl/분)로 수행하였다.
질량 분광측정 검출을 표 20에 기재된 바와 같은 검출 파라미터로 다중 반응 모니터링 (MRM)에 의해 양이온 ESI 모드에서 수행하였다.
표 20: 질량 분광측정 검출 파라미터
시험 항목의 정량화는 애질런트 매스헌터(Agilent MassHunter) 소프트웨어 스위트의 정량적 분석 소프트웨어를 사용하여 달성하였다. 이차 회귀를 1/x의 가중 인자로 수행하였다.
혈장 수준을 하기 결과를 갖는 비-구획 분석 (NCA)에 적용하였다: 화합물의 초기 농도(C0), 정상 상태에서의 분포의 부피 (Vss), 말기에서의 분포의 부피 (Vz), 말기 반감기 (t1/2 ), 클리어런스 (CL) 및 무한대로 외삽된 곡선하 면적 (AUCinf). 3BP-3554의 NCA 파라미터의 요약은 마우스 혈장에서 3BP-3554에 대해 표 21에 및 래트 혈장에서 3BP-3554에 대해 표 22에 제시되고, 3BP-3623의 NCA 파라미터의 요약은 마우스 혈장에서 3BP-3623에 대해 표 23에 및 래트 혈장에서 3BP-3623에 대해 표 24에 제시된다.
표 21: 마우스 혈장에서의 3BP-3554의 NCA 파라미터의 요약
표 22: 래트 혈장에서의 3BP-3554의 NCA 파라미터의 요약
표 23: 마우스 혈장에서의 3BP-3623의 NCA 파라미터의 요약
표 24: 래트 혈장에서의 3BP-3623의 NCA 파라미터의 요약
결과는 주로 혈액 및 간질액에서의 분포 및 마우스에서 23분 내지 59분 및 래트에서 45분 내지 71분의 말기 반감기로 펩티드에 대한 전형적인 클리어런스를 나타낸다. AUC에 의해 기재된 바와 같은 노출은 주사된 용량과 거의 선형으로 상관관계가 있고, 클리어런스는 특정한 동물 모델에서 모든 적용된 용량에 대해 일정하다. 이들 관찰은 인간 대상 최초 (first-in-human) 용량 계산을 위해 고려될 필요가 있는 약동학 거동의 유의한 비-선형성이 없음을 시사한다.
명세서, 청구범위, 서열 목록 및/또는 도면에 개시된 본 발명의 특색은 개별적으로 및 그의 임의의 조합으로 둘 다 본 발명을 그의 다양한 형태로 실현하기 위한 자료일 수 있다.
실시예 41: nBu-CAyl-[Cys(tMeBn(NOPO-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4768)의 합성
3BP-3940의 합성 (실시예 8b, 및 고리화 방법 B)과 유사한 방법을 표제 화합물의 합성에 사용하였다. 3BP-3940과 달리, AET 아민 모이어티는 DOTA-NHS 대신에 예비활성화된 NOPO-킬레이트화제에 접합되었다. 간략하게, 1 ml DMF 중 nBu-CAyl-[Cys(tMeBn(H-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (78.0 mg, 71.8 μmol)의 용액에, DIPEA 22 μl을 첨가하여 pH 값을 대략 7.5 - 8로 조정하였다. DMF/DMSO의 혼합물 (1:1, v/v, 500 μl) 중 NOPO (35.6 mg, 71.8 μmol, 1 당량) 및 DIPEA (50 μl, 288 μmol, 4 당량)의 용액에 250 μl DMF 중 HATU (55 mg, 143.6 μmol, 2 당량)의 용액을 첨가하였다. 단지 2초의 예비활성화 후, 킬레이트화제 믹스를 즉시 펩티드로 옮기고, 수득된 용액의 pH를 DIPEA를 사용하여 8로 재조정하였다. 완전 전환을 위해, NOPO 접합 단계를 1회 반복하였다. LC/TOF-MS에 의해 판단된 반응의 완결 후, 휘발성 물질을 진공 하에 제거한 다음, 물/아세토니트릴의 혼합물로부터 동결건조시켰다. 조 생성물을 HPLC 정제 (15분 내 20 → 40% B - 키네텍스)로 처리하여 순수한 표제 화합물 35.95 mg (32.0% 수율)을 수득하였다. HPLC: Rt = 6.0분. LC/TOF-MS: 정확한 질량 1561.572 (계산치 1561.574). C64H102N13O20P3S3 (MW = 1562.692).
실시예 42: FACS 결합 검정
FAP-발현 세포에 대한 본 발명에 따른 화합물의 결합을 결정하기 위해, 경쟁적 FACS 결합 검정을 확립하였다.
FAP-발현 인간 WI-38 섬유모세포 (ECACC)를 15% 태아 소 혈청, 2mM L-글루타민 및 1% 비필수 아미노산을 포함하는 EMEM 중에서 배양하였다. 세포를 아큐타제(Accutase) (바이오레전드, #BLD-423201)로 분리시키고, FACS 완충제 (1% FBS를 포함하는 PBS) 중에서 세척하였다. 세포를 FACS 완충제 중에 ml당 100,000개 세포의 최종 농도로 희석하고, 세포 현탁액 200 μl을 u-형상 비-결합 96-웰 플레이트 (그라이너(Greiner))로 옮겼다. 세포를 빙냉 FACS 완충제 중에서 세척하고, 증가하는 농도의 펩티드의 존재 하에 3 nM의 Cy5-표지된 화합물 (H-Met-[Cys(3MeBn)-Pro-Pro-Thr-Glu-Phe-Cys]-Asp-His-Phe-Arg-Asp-Ttds-Lys(Cy5SO3)-NH2)과 함께 4℃에서 1시간 동안 인큐베이션하였다. 세포를 FACS 완충제로 2회 세척하고, 200 μl FACS 완충제 중에 재현탁시켰다. 세포를 애튠(Attune) NxT 유동 세포측정기에서 분석하였다. 중앙 형광 강도 (Cy5 채널)를 애튠 NxT 소프트웨어에 의해 계산하고, 펩티드 농도에 대해 플롯팅하였다. 액티비티베이스(ActivityBase) 소프트웨어를 사용하여 4 파라미터 로지스틱 (4PL) 곡선 피팅 및 pIC50 계산을 수행하였다. 본 발명에 따른 각각의 화합물에 대한 상기 검정의 결과 뿐만 아니라 실시예 43에 따른 FAP 프로테아제 활성 검정의 결과를 표 25에 나타내었다 (실시예 43에 나타냄). pIC50 카테고리 A는 pIC50 값 >8.0을 나타내고, 카테고리 B는 pIC50 값 7.1 내지 8.0을 나타내고, 카테고리 C는 pIC50 값 6.1 내지 7.0을 나타내고, 카테고리 D는 pIC50 값 ≤ 6.0을 나타낸다.
실시예 43: FAP 프로테아제 활성 검정
FAP-발현 세포에 대한 본 발명에 따른 화합물의 억제 활성을 결정하기 위해, FRET-기반 FAP 프로테아제 활성 검정을 확립하였다.
재조합 인간 FAP (알앤디 시스템즈, #3715-SE)를 검정 완충제 (50 mM 트리스, 1 M NaCl, 1 mg/mL BSA, pH 7.5) 중에 3.6 nM의 농도로 희석하였다. FAP 용액 25 μl을 시험 화합물의 3배 연속 희석물 25 μl과 혼합하고, 백색 96-웰 프록시플레이트(ProxiPlate) (퍼킨 엘머)에서 5분 동안 인큐베이션하였다. 특이적 FAP 기질로서 FRET-펩티드 하이라이트플루오르(HiLyteFluor)TM 488 - VS(D-)P SQG K(QXL® 520) - NH2를 사용하였다 (Bainbridge, et al., Sci Rep, 2017, 7: 12524). 검정 완충제 중에 희석된 30 μM 기질 용액 25 μL을 첨가하였다. 모든 용액을 사용 전에 37℃에서 평형화시켰다. 기질 절단 및 형광의 증가 (485 nm에서의 여기 및 538 nm에서의 방출)를 스펙트라맥스(SPECTRAmax) M5 플레이트 판독기에서 37℃에서 5분 동안 동역학적 모드로 측정하였다. RFU/sec를 소프트맥스 프로(SoftMax Pro) 소프트웨어에 의해 계산하고, 펩티드 농도에 대해 플롯팅하였다. 액티비티베이스(ActivityBase) 소프트웨어를 사용하여 4 파라미터 로지스틱 (4PL) 곡선 피팅 및 pIC50 계산을 수행하였다. 본 발명에 따른 각각의 화합물에 대한 본 검정의 결과는 표 9 및 표 25에 주어진다. pIC50 카테고리 A는 pIC50 값 >8.0을 나타내고, 카테고리 B는 pIC50 값 7.1 내지 8.0을 나타내고, 카테고리 C는 pIC50 값 6.1 내지 7.0을 나타내고, 카테고리 D는 pIC50 값 ≤ 6.0을 나타낸다.
표 25로부터 명백한 바와 같이, 본 발명의 화합물은 FACS 결합 검정 및 FAP 프로테아제 활성 검정 둘 다에서 놀랍게도 우수한 결과를 나타내었다.
표 25: 화합물 ID, 서열, 정확한 질량 계산치, 정확한 질량 실측치, 체류 시간 (분) (HPLC에 의해 측정됨), 및 FACS 결합 및 FAP 활성 검정의 pIC50 카테고리
N.D. - 측정되지 않음
실시예 44: 표면 플라즈몬 공명 검정
표면 플라즈몬 공명 연구를 비아코어(Biacore)TM T200 SPR 시스템을 사용하여 수행하였다. 간략하게, 편광은 금-표지된 센서 표면을 향하고, 최소 강도의 반사광이 검출된다. 반사광의 각도는 분자가 결합하고 해리함에 따라 변한다. 금-표지된 센서 표면에 FAP 표적 단백질을 보유하는 FAP 항체가 로딩되어 있으며, 이에 의해 FAP의 기질-결합 부위에서 항체 결합이 발생하지 않는다. 시험 화합물을 로딩된 표면과 접촉시키고, FAP 리간드와의 실시간 상호작용 프로파일을 센서그램에 기록한다. 실시간으로, 결합 상호작용의 회합 및 해리를 측정하여, 회합 및 해리 속도 상수 및 상응하는 친화도 상수의 계산을 가능하게 한다. 중요하게는, 구동 완충제 및 샘플 완충제의 굴절률의 차이, 뿐만 아니라 플로우 셀 표면에 대한 시험 화합물의 비특이적 결합으로 인해 배경 반응이 생성된다. 이러한 배경은 고정된 FAP의 부재 하에 동일한 밀도의 포획 항체로 코팅된 대조군 플로우 셀 상에서 샘플을 구동시킴으로써 측정하고 차감한다. 또한, 고정된 항체로부터의 포획된 FAP의 느린 해리에 의해 야기되는 결합 데이터의 기준선 드리프트 보정을 수행한다. 이러한 드리프트는 센서 표면에 고정된 항체 및 FAP를 갖는 플로우 셀을 통해 구동 완충제를 주입함으로써 측정된다.
비아코어TM CM5 센서 칩을 사용하였다. 인간 항-FAP 항체 (MAB3715, 알앤디 시스템즈)를 10 mM 아세테이트 완충제, pH 4.5 중에 50 μg/mL의 최종 농도로 희석하였다. 150 μL 분취물을 플라스틱 바이알로 옮기고, 비아코어TM T200 기기의 샘플 랙에 넣었다. 아민 커플링 키트 시약 용액을 플라스틱 바이알로 옮기고, 샘플 랙에 넣었다: 90 μL의 0.4 M 1-에틸-3-(3-디메틸아미노프로필)카르보디이미드 (EDC), 및 90 μL의 0.1 M N-히드록시숙신이미드 (NHS). 130 μL 분취량의 1 M 에탄올아민-HCl, pH 8.5를 플라스틱 바이알로 옮기고, 샘플 랙에 넣었다. 비아코어TM 액체 시스템을 하기와 같이 설정하였다: 증류수 (1 L), 구동 완충제 (500 mL)를 함유하는 별개의 병, 뿐만 아니라 폐기물을 위한 빈 병을 완충제 트레이 상에 놓았다. 고정화를 위해 사전설치된 프로그램을 7000 RU의 고정화 수준으로 사용하였다. 고정화를 25℃에서 수행하였다. 항-FAP 항체의 고정화 절차를 표 26에 기재된 바와 같이 수행하였다.
표 26: CM5 센서 칩 상에 사용된 항-FAP 항체에 대한 고정화 프로토콜.
인간 재조합 FAP를 구동 완충제 중에 20 μg/mL의 최종 농도로 희석하였다. 인간 FAP-작업-용액의 100 μL 분취물을 플라스틱 바이알로 옮기고, 샘플 랙에 넣었다. 0.5 mM 화합물-원액을 각각의 화합물을 DMSO 중에 용해시킴으로써 제조하였다. 각각의 시험 화합물에 대해, 화합물-원액을 구동 완충제 (HBST) 중에 500 nM로 희석하고, HBST-DMSO 완충제 (0.1% DMSO)로 추가로 희석하였다. 2원 복합체에 대한 SPR 결합 분석을 25℃에서 SCK 모드로 수행하였다. 표 27은 결합 동역학의 포획 및 평가를 위한 프로토콜을 기재한다. 3회의 SCK 측정 후, 항체 및 FAP가 센서 표면에 고정되어 있는 플로우 셀을 통해 구동 완충제를 주입함으로써 기준선 드리프트를 평가하였다.
표 27: 결합 동역학을 평가하기 위한 프로토콜.
각각의 시험 화합물에 대해, 공명 단위 (RU) 형태의 SPR 미가공 데이터를 비아코어TM T200 제어 소프트웨어를 사용하여 센서그램으로서 플롯팅하였다. 블랭크 센서그램으로부터의 신호를 시험 화합물 센서그램의 것으로부터 차감하였다 (블랭크 보정됨). 블랭크 보정된 센서그램을 시험 화합물 없이 실행된 SCK (구동 완충제 단독)의 센서그램을 차감함으로써 기준선 드리프트에 대해 보정하였다. 회합 속도 (kon), 해리 속도 (koff), 해리 상수 (KD), 및 t1/2를 비아코어TM T200 평가 소프트웨어로부터의 1:1 랭뮤어(Langmuir) 결합 모델을 사용하여 블랭크-정규화 SPR 데이터로부터 계산하였다. 미가공 데이터 및 피트 결과를 IDBS에 텍스트 파일로서 입력하였다. pKD 값 (해리 상수의 음의 십진 로그)을 IDBS 엑셀 템플릿으로 계산하였다.
본 발명에 따른 화합물의 선택에 대한 상기 검정의 결과를 표 28에 제시한다. 카테고리 A는 pKD 값 >8.0을, 카테고리 B는 pKD 값 7.1 내지 8.0을, 카테고리 C는 pKD 값 6.1 내지 7.0을 나타낸다.
표 28: 화합물 ID, 서열, 및 비아코어 검정의 pkD 카테고리
실시예 45: 선택된 화합물의 111In-표지
진단, 치료 또는 치료 활성제로서 작용하기 위해, 화합물은 방사성 동위원소로 표지될 필요가 있다. 표지화 절차는 본 발명의 방사성표지된 화합물의 높은 방사화학적 수율 및 순도를 보장하는데 적절해야 한다. 본 실시예는 본 발명의 화합물이 방사성표지에 대해 적절하고, 높은 방사화학적 수율 및 순도로 표지될 수 있음을 보여준다.
20 - 100 MBq의 111InCl3 (0.02 M HCl 중)를 30 MBq당 1 nmol의 화합물 (0.1 M HEPES pH 7 중 200 μM 원액) 및 1 M 아세트산나트륨 완충제 pH 5 (25 mg/ml 메티오닌을 함유)을 0.1 M의 최종 완충제 농도로 혼합하였다. 혼합물을 20-30분 동안 80℃로 가열하였다. 냉각 후, 아스코르브산, DTPA 및 트윈-20을 각각 25 mg/ml, 0.2 mM 및 0.1%의 최종 농도로 첨가하였다.
HPLC에 의한 방사화학적 순도의 분석을 위해, 5 μl의 희석된 표지 용액을 포로쉘 SB-C18 2.7 μm (애질런트)로 분석하였다. 용리액 A: H2O, 0.1% TFA, 용리액 B: MeCN, 15분 내 5% B → 70% B의 구배, 유량 0.5 ml/분; 검출기: NaI (레이테스트(Raytest)), DAD 230 nm. 불감 부피로 용리되는 피크는 유리 방사성핵종을 나타내고, 비표지된 샘플로 결정된 펩티드-특이적 체류 시간으로 용리되는 피크는 방사성표지된 화합물을 나타낸다. 합성 종료시 방사화학적 순도는 ≥ 85%였다. 111In-표지된 화합물에 대한 예시적인 방사화학적 순도는 표 29에 제시된다.
표 29: 111In-표지된 화합물의 HPLC에 의한 방사화학적 순도.
실시예 46: 선택된 화합물의 99mTc-표지
100 - 500 MBq의 99mTcO4 (염수 중)를 100 μl 방사성핵종 용액당 11 μl의 0.5 M 포스페이트 완충제 pH 11.5 - 12.0 및 1.1 μl의 0.1 M 시트르산삼나트륨과 혼합하였다. 45 MBq당 1 nmol의 화합물 (물 중 200 μM 원액)을 첨가하고, 이어서 100 μl 방사성핵종 용액당 질소-퍼징된 무수 에탄올 중 1.1 mg/ml 염화주석 2수화물 3.0 μl을 첨가하였다. 혼합물을 25 - 50℃에서 30분 동안 인큐베이션하였다. 인큐베이션 시간의 종료 시, 혼합물을 10 μl 포스페이트 완충제당 3.0 μl 1 M HCl로 중화시키고, 트윈(TWEEN)-20을 0.1%의 최종 농도로 첨가하였다.
HPLC에 의한 방사화학적 순도의 분석을 위해, 5 μl의 희석된 표지 용액을 포로쉘 SB-C18 2.7 μm (애질런트)로 분석하였다. 용리액 A: H2O, 0.1% TFA, 용리액 B: MeCN, 15분 내 5% B → 70% B의 구배, 유량 0.5 ml/분; 검출기: NaI (레이테스트(Raytest)), DAD 230 nm. 불감 부피로 용리되는 피크는 유리 방사성핵종을 나타내고, 비표지된 샘플로 결정된 펩티드-특이적 체류 시간으로 용리되는 피크는 방사성표지된 화합물을 나타낸다. 합성 종료시 방사화학적 순도는 ≥ 85%였다. 99mTc-표지된 화합물에 대한 예시적인 방사화학적 순도는 표 30에 제시된다.
표 30: 99mTc-표지된 화합물의 HPLC에 의한 방사화학적 순도.
N/A = 적용가능하지 않음
실시예 47: 선택된 화합물의 68Ga-표지
750 μl Ga-68 용리액 (200 - 500 MBq; 0.1 M HCl)을 750 μl 표지 완충제 (1.0 M 아세트산암모늄 완충제 pH 4 또는 1.0 M 아세트산암모늄 완충제 / 0.125 M 아스코르브산 4:1 pH 4)와 혼합하였다. 400 μl의 50% EtOH를 첨가하고, 혼합물을 예열하였다. 활성을 측정하고, 적절한 양의 펩티드 (0.1 M HEPES 중 200 μM 원액)를 첨가하여 목적 몰 활성 (20 MBq/nmol)을 달성하였다. 혼합물을 80℃ (3BP-4713, 3BP-4714, 3BP-4724) 또는 40℃ (3BP-4768 또는 3BP-4778, 3BP-5201, 3BP-5210)에서 15분 동안 가열하였다. 인큐베이션 시간의 종료 시, 반응 혼합물을 10 ml 물로 희석한 후, 사전-컨디셔닝된 (5 ml 무수 에탄올에 이어서 10 ml 물) 오아시스 HLB 플러스 라이트(Oasis HLB plus light) 카트리지 상에 옮겼다. 칼럼을 2 ml 물로 세척하고, 생성물을 250 μl 무수 에탄올 중에 용리시켰다. 최종 생성물을 0.9% 멸균 NaCl 또는 0.9% 멸균 NaCl (10 mg/ml 아스코르브산 함유 pH 7) 중에서 최종 농도 100 MBq 및 10 nmol/ml 및 최종 에탄올 농도 < 9%로 제제화하였다. 방사화학적 순도의 결정을 위해 즉시 및 최종 주입 후에 샘플을 회수하였다.
HPLC에 의한 방사화학적 순도의 분석을 위해, 5 μl의 희석된 표지 용액을 엑스브리지 C18 3.5 μM 4.6 x 50 mm 칼럼 (워터스)으로 분석하였다. 용리액 A: H2O, 0.1% TFA, 용리액 B: MeCN, 0.1% TFA; 구배 1분 내 5% B → 20% B, 이어서 7분 내 20% B → 50% B, 유량 1.5 ml/분; 검출기: NaI (레이테스트), DAD 220 nm. 불감 부피로 용리되는 피크는 유리 방사성핵종을 나타내고, 비표지된 샘플로 결정된 펩티드-특이적 체류 시간으로 용리되는 피크는 방사성표지된 화합물을 나타낸다. 합성 종료시 방사화학적 순도는 ≥ 95%였다. 68Ga-표지된 화합물에 대한 예시적인 방사화학적 순도는 표 31에 제시된다.
표 31: 68Ga-표지된 화합물의 HPLC에 의한 방사화학적 순도.
실시예 48: 생체내 영상화 연구
방사성 표지된 화합물은 영상화 방법, 예컨대 SPECT 및 PET에 의해 검출될 수 있다. 또한, 이러한 기술에 의해 획득된 데이터는 방사성 표지된 본 발명의 화합물을 주사한 동물로부터 제조된 개별 기관에 함유된 방사능의 직접 측정에 의해 확인될 수 있다. 따라서, 방사성 표지된 화합물의 생체분포 (개별 기관에서의 방사능의 측정)를 결정 및 분석할 수 있다. 본 실시예는 본 발명의 화합물이 종양의 진단 영상화 및 치유적 치료에 적절한 생체분포를 나타낸다는 것을 보여준다.
모든 동물 실험은 독일 또는 덴마크 동물 보호 법칙에 따라 수행하였다. PET/CT 연구를 위해 암컷 무흉선 누드 (6- 내지 8-주령, 찰스 리버 래보러토리즈(Charles River Laboratories), 독일), 및 SPECT/CT를 위해 스위스 누드 마우스 (6- 내지 8-주령, 찰스 리버 래보러토리즈, 프랑스)의 한쪽 어깨에 5 x 106 HEK-FAP 세포 (높은 수준의 FAP를 발현하도록 유전자 조작된 배아 인간 신장 293 세포)를 접종하였으며, 예외적으로 종양을 전혀 보유하지 않는 동물에 111In-3BP-4560를 투여하였다. 종양이 > 150 mm3의 크기에 도달하였을 때, 마우스의 꼬리 정맥을 통해 ~30 MBq의 99mTc-표지된 본 발명의 화합물, ~30 MBq 111In 또는 ~10 MBq의 68Ga-표지된 본 발명의 화합물 (PBS 또는 염수로 100 μL로 희석됨)을 정맥내로 투여하였다. 나노스캔(nanoScan)® SPECT/CT 시스템 (메디소 메디칼 이미징 시스템즈(Mediso Medical Imaging Systems), 헝가리 부다페스트) 또는 나노스캔® PET/CT (메디소 메디칼 이미징 시스템즈, 헝가리 부다페스트)으로 예시적으로 표 32 및 33에 열거된 획득 및 재구성 파라미터를 사용하여 영상을 수득하였다.
영상화 데이터를 DICOM 파일로서 저장하고, SPECT/CT에 대해 비보퀀트(VivoQuant)TM (인비크로(Invicro), 미국 보스턴) 또는 PET/CT에 대해 인터뷰(InterView)TM FUSION (메디소(Mediso), 헝가리 부다페스트) 소프트웨어를 사용하여 분석하였다. 결과는 조직 그램당 주사 용량의 백분율 (%ID/g)로서 표현된다.
영상화 연구의 결과는 SPECT/CT에 대해 표 34 및 PET/CT에 대해 표 35에 제시되고; 선택된 화합물의 획득 스캔은 도 22-28에 제시된다.
놀랍게도, N4Ac-킬레이트화제가 부착된 N-말단 링커의 변형은 추적자의 생체분포를 크게 개선하였다. 도 22-25에서, 4종의 99mTc-표지된 화합물의 대표적인 생체분포가 시간 경과에 따라 (주사 후 1-6시간) 제시된다. N4Ac와 노르류신 사이에 PPAc-Ttds 링커를 갖는 화합물 (3BP-4541 및 -4961)은 상이한 링커, 예컨대 Ttds 또는 PEG6를 갖는 화합물 (3BP-4219 및 3BP-4221)과 비교하였을 때 시간 경과에 따라 건강한 조직에서, 특히 위장관 및 신장에서 감소된 흡수를 나타내었다.
추가로, N-말단 우레아 모티프를 포함하는 추적자의 극적으로 개선된 생체분포가 발견되었다. 도 21 및 28에서, 111In-표지된 3BP-3940 및 3BP-4560의 대표적인 생체분포가 시간 경과에 따라 (주사 후 0.25-3 h) 제시된다. 추적자는 건강한 조직, 특히 신장에서 매우 낮은 흡수를 나타내었다.
표 32: SPECT/CT 영상화의 획득 및 재구성 파라미터
표 33: PET/CT 영상화의 획득 및 재구성 파라미터
표 34: 추적자 주사 1시간, 3시간 및 6시간 후 99mTc-표지된 화합물의 SPECT/CT-영상화에 의해 측정된 바와 같은 HEK-FAP 종양, 신장 및 BPS (혈액 풀 대용물)에서의 조직 그램당 주사 용량의 백분율 (%ID/g) 흡수를 보여줌.
표 35: 추적자 주사 0.25시간, 1시간 및 3시간 후 68Ga-표지된 화합물의 PET/CT-영상화에 의해 측정된 바와 같은 HEK-FAP 종양, 신장 및 BPS (혈액 풀 대용물)에서의 조직 그램당 주사 용량의 백분율 (%ID/g) 흡수를 보여줌;
참고문헌
본원에 인용된 각각의 및 임의의 문헌의 개시내용은 참조로 포함된다.
SEQUENCE LISTING
<110> 3B Pharmaceuticals GmbH
<120> Compounds comprising a fibroblast activation protein ligand and
use thereof
<130> D 10030 PCT
<150> US 63/134,704
<151> 2021-01-07
<160> 3
<170> PatentIn version 3.5
<210> 1
<211> 760
<212> PRT
<213> Homo sapiens
<400> 1
Met Lys Thr Trp Val Lys Ile Val Phe Gly Val Ala Thr Ser Ala Val
1 5 10 15
Leu Ala Leu Leu Val Met Cys Ile Val Leu Arg Pro Ser Arg Val His
20 25 30
Asn Ser Glu Glu Asn Thr Met Arg Ala Leu Thr Leu Lys Asp Ile Leu
35 40 45
Asn Gly Thr Phe Ser Tyr Lys Thr Phe Phe Pro Asn Trp Ile Ser Gly
50 55 60
Gln Glu Tyr Leu His Gln Ser Ala Asp Asn Asn Ile Val Leu Tyr Asn
65 70 75 80
Ile Glu Thr Gly Gln Ser Tyr Thr Ile Leu Ser Asn Arg Thr Met Lys
85 90 95
Ser Val Asn Ala Ser Asn Tyr Gly Leu Ser Pro Asp Arg Gln Phe Val
100 105 110
Tyr Leu Glu Ser Asp Tyr Ser Lys Leu Trp Arg Tyr Ser Tyr Thr Ala
115 120 125
Thr Tyr Tyr Ile Tyr Asp Leu Ser Asn Gly Glu Phe Val Arg Gly Asn
130 135 140
Glu Leu Pro Arg Pro Ile Gln Tyr Leu Cys Trp Ser Pro Val Gly Ser
145 150 155 160
Lys Leu Ala Tyr Val Tyr Gln Asn Asn Ile Tyr Leu Lys Gln Arg Pro
165 170 175
Gly Asp Pro Pro Phe Gln Ile Thr Phe Asn Gly Arg Glu Asn Lys Ile
180 185 190
Phe Asn Gly Ile Pro Asp Trp Val Tyr Glu Glu Glu Met Leu Ala Thr
195 200 205
Lys Tyr Ala Leu Trp Trp Ser Pro Asn Gly Lys Phe Leu Ala Tyr Ala
210 215 220
Glu Phe Asn Asp Thr Asp Ile Pro Val Ile Ala Tyr Ser Tyr Tyr Gly
225 230 235 240
Asp Glu Gln Tyr Pro Arg Thr Ile Asn Ile Pro Tyr Pro Lys Ala Gly
245 250 255
Ala Lys Asn Pro Val Val Arg Ile Phe Ile Ile Asp Thr Thr Tyr Pro
260 265 270
Ala Tyr Val Gly Pro Gln Glu Val Pro Val Pro Ala Met Ile Ala Ser
275 280 285
Ser Asp Tyr Tyr Phe Ser Trp Leu Thr Trp Val Thr Asp Glu Arg Val
290 295 300
Cys Leu Gln Trp Leu Lys Arg Val Gln Asn Val Ser Val Leu Ser Ile
305 310 315 320
Cys Asp Phe Arg Glu Asp Trp Gln Thr Trp Asp Cys Pro Lys Thr Gln
325 330 335
Glu His Ile Glu Glu Ser Arg Thr Gly Trp Ala Gly Gly Phe Phe Val
340 345 350
Ser Thr Pro Val Phe Ser Tyr Asp Ala Ile Ser Tyr Tyr Lys Ile Phe
355 360 365
Ser Asp Lys Asp Gly Tyr Lys His Ile His Tyr Ile Lys Asp Thr Val
370 375 380
Glu Asn Ala Ile Gln Ile Thr Ser Gly Lys Trp Glu Ala Ile Asn Ile
385 390 395 400
Phe Arg Val Thr Gln Asp Ser Leu Phe Tyr Ser Ser Asn Glu Phe Glu
405 410 415
Glu Tyr Pro Gly Arg Arg Asn Ile Tyr Arg Ile Ser Ile Gly Ser Tyr
420 425 430
Pro Pro Ser Lys Lys Cys Val Thr Cys His Leu Arg Lys Glu Arg Cys
435 440 445
Gln Tyr Tyr Thr Ala Ser Phe Ser Asp Tyr Ala Lys Tyr Tyr Ala Leu
450 455 460
Val Cys Tyr Gly Pro Gly Ile Pro Ile Ser Thr Leu His Asp Gly Arg
465 470 475 480
Thr Asp Gln Glu Ile Lys Ile Leu Glu Glu Asn Lys Glu Leu Glu Asn
485 490 495
Ala Leu Lys Asn Ile Gln Leu Pro Lys Glu Glu Ile Lys Lys Leu Glu
500 505 510
Val Asp Glu Ile Thr Leu Trp Tyr Lys Met Ile Leu Pro Pro Gln Phe
515 520 525
Asp Arg Ser Lys Lys Tyr Pro Leu Leu Ile Gln Val Tyr Gly Gly Pro
530 535 540
Cys Ser Gln Ser Val Arg Ser Val Phe Ala Val Asn Trp Ile Ser Tyr
545 550 555 560
Leu Ala Ser Lys Glu Gly Met Val Ile Ala Leu Val Asp Gly Arg Gly
565 570 575
Thr Ala Phe Gln Gly Asp Lys Leu Leu Tyr Ala Val Tyr Arg Lys Leu
580 585 590
Gly Val Tyr Glu Val Glu Asp Gln Ile Thr Ala Val Arg Lys Phe Ile
595 600 605
Glu Met Gly Phe Ile Asp Glu Lys Arg Ile Ala Ile Trp Gly Trp Ser
610 615 620
Tyr Gly Gly Tyr Val Ser Ser Leu Ala Leu Ala Ser Gly Thr Gly Leu
625 630 635 640
Phe Lys Cys Gly Ile Ala Val Ala Pro Val Ser Ser Trp Glu Tyr Tyr
645 650 655
Ala Ser Val Tyr Thr Glu Arg Phe Met Gly Leu Pro Thr Lys Asp Asp
660 665 670
Asn Leu Glu His Tyr Lys Asn Ser Thr Val Met Ala Arg Ala Glu Tyr
675 680 685
Phe Arg Asn Val Asp Tyr Leu Leu Ile His Gly Thr Ala Asp Asp Asn
690 695 700
Val His Phe Gln Asn Ser Ala Gln Ile Ala Lys Ala Leu Val Asn Ala
705 710 715 720
Gln Val Asp Phe Gln Ala Met Trp Tyr Ser Asp Gln Asn His Gly Leu
725 730 735
Ser Gly Leu Ser Thr Asn His Leu Tyr Thr His Met Thr His Phe Leu
740 745 750
Lys Gln Cys Phe Ser Leu Ser Asp
755 760
<210> 2
<211> 766
<212> PRT
<213> Homo sapiens
<400> 2
Met Lys Thr Pro Trp Lys Val Leu Leu Gly Leu Leu Gly Ala Ala Ala
1 5 10 15
Leu Val Thr Ile Ile Thr Val Pro Val Val Leu Leu Asn Lys Gly Thr
20 25 30
Asp Asp Ala Thr Ala Asp Ser Arg Lys Thr Tyr Thr Leu Thr Asp Tyr
35 40 45
Leu Lys Asn Thr Tyr Arg Leu Lys Leu Tyr Ser Leu Arg Trp Ile Ser
50 55 60
Asp His Glu Tyr Leu Tyr Lys Gln Glu Asn Asn Ile Leu Val Phe Asn
65 70 75 80
Ala Glu Tyr Gly Asn Ser Ser Val Phe Leu Glu Asn Ser Thr Phe Asp
85 90 95
Glu Phe Gly His Ser Ile Asn Asp Tyr Ser Ile Ser Pro Asp Gly Gln
100 105 110
Phe Ile Leu Leu Glu Tyr Asn Tyr Val Lys Gln Trp Arg His Ser Tyr
115 120 125
Thr Ala Ser Tyr Asp Ile Tyr Asp Leu Asn Lys Arg Gln Leu Ile Thr
130 135 140
Glu Glu Arg Ile Pro Asn Asn Thr Gln Trp Val Thr Trp Ser Pro Val
145 150 155 160
Gly His Lys Leu Ala Tyr Val Trp Asn Asn Asp Ile Tyr Val Lys Ile
165 170 175
Glu Pro Asn Leu Pro Ser Tyr Arg Ile Thr Trp Thr Gly Lys Glu Asp
180 185 190
Ile Ile Tyr Asn Gly Ile Thr Asp Trp Val Tyr Glu Glu Glu Val Phe
195 200 205
Ser Ala Tyr Ser Ala Leu Trp Trp Ser Pro Asn Gly Thr Phe Leu Ala
210 215 220
Tyr Ala Gln Phe Asn Asp Thr Glu Val Pro Leu Ile Glu Tyr Ser Phe
225 230 235 240
Tyr Ser Asp Glu Ser Leu Gln Tyr Pro Lys Thr Val Arg Val Pro Tyr
245 250 255
Pro Lys Ala Gly Ala Val Asn Pro Thr Val Lys Phe Phe Val Val Asn
260 265 270
Thr Asp Ser Leu Ser Ser Val Thr Asn Ala Thr Ser Ile Gln Ile Thr
275 280 285
Ala Pro Ala Ser Met Leu Ile Gly Asp His Tyr Leu Cys Asp Val Thr
290 295 300
Trp Ala Thr Gln Glu Arg Ile Ser Leu Gln Trp Leu Arg Arg Ile Gln
305 310 315 320
Asn Tyr Ser Val Met Asp Ile Cys Asp Tyr Asp Glu Ser Ser Gly Arg
325 330 335
Trp Asn Cys Leu Val Ala Arg Gln His Ile Glu Met Ser Thr Thr Gly
340 345 350
Trp Val Gly Arg Phe Arg Pro Ser Glu Pro His Phe Thr Leu Asp Gly
355 360 365
Asn Ser Phe Tyr Lys Ile Ile Ser Asn Glu Glu Gly Tyr Arg His Ile
370 375 380
Cys Tyr Phe Gln Ile Asp Lys Lys Asp Cys Thr Phe Ile Thr Lys Gly
385 390 395 400
Thr Trp Glu Val Ile Gly Ile Glu Ala Leu Thr Ser Asp Tyr Leu Tyr
405 410 415
Tyr Ile Ser Asn Glu Tyr Lys Gly Met Pro Gly Gly Arg Asn Leu Tyr
420 425 430
Lys Ile Gln Leu Ser Asp Tyr Thr Lys Val Thr Cys Leu Ser Cys Glu
435 440 445
Leu Asn Pro Glu Arg Cys Gln Tyr Tyr Ser Val Ser Phe Ser Lys Glu
450 455 460
Ala Lys Tyr Tyr Gln Leu Arg Cys Ser Gly Pro Gly Leu Pro Leu Tyr
465 470 475 480
Thr Leu His Ser Ser Val Asn Asp Lys Gly Leu Arg Val Leu Glu Asp
485 490 495
Asn Ser Ala Leu Asp Lys Met Leu Gln Asn Val Gln Met Pro Ser Lys
500 505 510
Lys Leu Asp Phe Ile Ile Leu Asn Glu Thr Lys Phe Trp Tyr Gln Met
515 520 525
Ile Leu Pro Pro His Phe Asp Lys Ser Lys Lys Tyr Pro Leu Leu Leu
530 535 540
Asp Val Tyr Ala Gly Pro Cys Ser Gln Lys Ala Asp Thr Val Phe Arg
545 550 555 560
Leu Asn Trp Ala Thr Tyr Leu Ala Ser Thr Glu Asn Ile Ile Val Ala
565 570 575
Ser Phe Asp Gly Arg Gly Ser Gly Tyr Gln Gly Asp Lys Ile Met His
580 585 590
Ala Ile Asn Arg Arg Leu Gly Thr Phe Glu Val Glu Asp Gln Ile Glu
595 600 605
Ala Ala Arg Gln Phe Ser Lys Met Gly Phe Val Asp Asn Lys Arg Ile
610 615 620
Ala Ile Trp Gly Trp Ser Tyr Gly Gly Tyr Val Thr Ser Met Val Leu
625 630 635 640
Gly Ser Gly Ser Gly Val Phe Lys Cys Gly Ile Ala Val Ala Pro Val
645 650 655
Ser Arg Trp Glu Tyr Tyr Asp Ser Val Tyr Thr Glu Arg Tyr Met Gly
660 665 670
Leu Pro Thr Pro Glu Asp Asn Leu Asp His Tyr Arg Asn Ser Thr Val
675 680 685
Met Ser Arg Ala Glu Asn Phe Lys Gln Val Glu Tyr Leu Leu Ile His
690 695 700
Gly Thr Ala Asp Asp Asn Val His Phe Gln Gln Ser Ala Gln Ile Ser
705 710 715 720
Lys Ala Leu Val Asp Val Gly Val Asp Phe Gln Ala Met Trp Tyr Thr
725 730 735
Asp Glu Asp His Gly Ile Ala Ser Ser Thr Ala His Gln His Ile Tyr
740 745 750
Thr His Met Ser His Phe Ile Lys Gln Cys Phe Ser Leu Pro
755 760 765
<210> 3
<211> 710
<212> PRT
<213> Homo sapiens
<400> 3
Met Leu Ser Leu Gln Tyr Pro Asp Val Tyr Arg Asp Glu Thr Ala Val
1 5 10 15
Gln Asp Tyr His Gly His Lys Ile Cys Asp Pro Tyr Ala Trp Leu Glu
20 25 30
Asp Pro Asp Ser Glu Gln Thr Lys Ala Phe Val Glu Ala Gln Asn Lys
35 40 45
Ile Thr Val Pro Phe Leu Glu Gln Cys Pro Ile Arg Gly Leu Tyr Lys
50 55 60
Glu Arg Met Thr Glu Leu Tyr Asp Tyr Pro Lys Tyr Ser Cys His Phe
65 70 75 80
Lys Lys Gly Lys Arg Tyr Phe Tyr Phe Tyr Asn Thr Gly Leu Gln Asn
85 90 95
Gln Arg Val Leu Tyr Val Gln Asp Ser Leu Glu Gly Glu Ala Arg Val
100 105 110
Phe Leu Asp Pro Asn Ile Leu Ser Asp Asp Gly Thr Val Ala Leu Arg
115 120 125
Gly Tyr Ala Phe Ser Glu Asp Gly Glu Tyr Phe Ala Tyr Gly Leu Ser
130 135 140
Ala Ser Gly Ser Asp Trp Val Thr Ile Lys Phe Met Lys Val Asp Gly
145 150 155 160
Ala Lys Glu Leu Pro Asp Val Leu Glu Arg Val Lys Phe Ser Cys Met
165 170 175
Ala Trp Thr His Asp Gly Lys Gly Met Phe Tyr Asn Ser Tyr Pro Gln
180 185 190
Gln Asp Gly Lys Ser Asp Gly Thr Glu Thr Ser Thr Asn Leu His Gln
195 200 205
Lys Leu Tyr Tyr His Val Leu Gly Thr Asp Gln Ser Glu Asp Ile Leu
210 215 220
Cys Ala Glu Phe Pro Asp Glu Pro Lys Trp Met Gly Gly Ala Glu Leu
225 230 235 240
Ser Asp Asp Gly Arg Tyr Val Leu Leu Ser Ile Arg Glu Gly Cys Asp
245 250 255
Pro Val Asn Arg Leu Trp Tyr Cys Asp Leu Gln Gln Glu Ser Ser Gly
260 265 270
Ile Ala Gly Ile Leu Lys Trp Val Lys Leu Ile Asp Asn Phe Glu Gly
275 280 285
Glu Tyr Asp Tyr Val Thr Asn Glu Gly Thr Val Phe Thr Phe Lys Thr
290 295 300
Asn Arg Gln Ser Pro Asn Tyr Arg Val Ile Asn Ile Asp Phe Arg Asp
305 310 315 320
Pro Glu Glu Ser Lys Trp Lys Val Leu Val Pro Glu His Glu Lys Asp
325 330 335
Val Leu Glu Trp Ile Ala Cys Val Arg Ser Asn Phe Leu Val Leu Cys
340 345 350
Tyr Leu His Asp Val Lys Asn Ile Leu Gln Leu His Asp Leu Thr Thr
355 360 365
Gly Ala Leu Leu Lys Thr Phe Pro Leu Asp Val Gly Ser Ile Val Gly
370 375 380
Tyr Ser Gly Gln Lys Lys Asp Thr Glu Ile Phe Tyr Gln Phe Thr Ser
385 390 395 400
Phe Leu Ser Pro Gly Ile Ile Tyr His Cys Asp Leu Thr Lys Glu Glu
405 410 415
Leu Glu Pro Arg Val Phe Arg Glu Val Thr Val Lys Gly Ile Asp Ala
420 425 430
Ser Asp Tyr Gln Thr Val Gln Ile Phe Tyr Pro Ser Lys Asp Gly Thr
435 440 445
Lys Ile Pro Met Phe Ile Val His Lys Lys Gly Ile Lys Leu Asp Gly
450 455 460
Ser His Pro Ala Phe Leu Tyr Gly Tyr Gly Gly Phe Asn Ile Ser Ile
465 470 475 480
Thr Pro Asn Tyr Ser Val Ser Arg Leu Ile Phe Val Arg His Met Gly
485 490 495
Gly Ile Leu Ala Val Ala Asn Ile Arg Gly Gly Gly Glu Tyr Gly Glu
500 505 510
Thr Trp His Lys Gly Gly Ile Leu Ala Asn Lys Gln Asn Cys Phe Asp
515 520 525
Asp Phe Gln Cys Ala Ala Glu Tyr Leu Ile Lys Glu Gly Tyr Thr Ser
530 535 540
Pro Lys Arg Leu Thr Ile Asn Gly Gly Ser Asn Gly Gly Leu Leu Val
545 550 555 560
Ala Ala Cys Ala Asn Gln Arg Pro Asp Leu Phe Gly Cys Val Ile Ala
565 570 575
Gln Val Gly Val Met Asp Met Leu Lys Phe His Lys Tyr Thr Ile Gly
580 585 590
His Ala Trp Thr Thr Asp Tyr Gly Cys Ser Asp Ser Lys Gln His Phe
595 600 605
Glu Trp Leu Val Lys Tyr Ser Pro Leu His Asn Val Lys Leu Pro Glu
610 615 620
Ala Asp Asp Ile Gln Tyr Pro Ser Met Leu Leu Leu Thr Ala Asp His
625 630 635 640
Asp Asp Arg Val Val Pro Leu His Ser Leu Lys Phe Ile Ala Thr Leu
645 650 655
Gln Tyr Ile Val Gly Arg Ser Arg Lys Gln Ser Asn Pro Leu Leu Ile
660 665 670
His Val Asp Thr Lys Ala Gly His Gly Ala Gly Lys Pro Thr Ala Lys
675 680 685
Val Ile Glu Glu Val Ser Asp Met Phe Ala Phe Ile Ala Arg Cys Leu
690 695 700
Asn Val Asp Trp Ile Pro
705 710
Claims (71)
- 화학식 (I)의 시클릭 펩티드 및 Xaa1에 부착된 N-말단 변형 기 A를 포함하는 화합물:
여기서
펩티드 서열은 N에서 C-말단 방향으로 좌측에서 우측으로 그려지고,
Xaa1은 화학식 (II)의 아미노산의 잔기이고:
여기서
R1a는 -NH-이고,
R1b는 H 또는 CH3이고,
n = 0 또는 1이고,
N-말단 변형 기 A는 Xaa1의 질소 원자에 공유 부착되고,
Xaa1의 카르보닐 기는 Xaa2의 질소에 공유 부착되고,
Xaa1의 황 원자는 Yc에 티오에테르로서 공유 부착되고;
Xaa2는 화학식 (III), (IV) 또는 (XX)의 아미노산의 잔기이고:
여기서
R2a, R2b 및 R2c는 각각 독립적으로 (C1-C2)알킬 및 H로 이루어진 군으로부터 선택되고, 여기서 상기 (C1-C2)알킬은 OH, NH2, 할로겐, (C5-C7)시클로알킬로 이루어진 군으로부터 선택된 치환기에 의해 치환될 수 있고,
p = 0, 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
화학식 (IV)의 아미노산은 나타낸 고리 위치 3 및 4에서 메틸, OH, NH2 및 F로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
Xaa3은 화학식 (V) 또는 (XX)의 아미노산의 잔기이고:
여기서
X3은 CH2, CF2, CH-R3b, S, O 및 NH로 이루어진 군으로부터 선택되고,
p = 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
R3a는 H, 메틸, OH, NH2 또는 F이고,
R3b은 메틸, OH, NH2 또는 F이고;
Xaa4는 화학식 (VI)의 아미노산의 잔기이고:
여기서
R4a는 H, OH, COOH, CONH2, X4 및 -NH-CO-X4로 이루어진 군으로부터 선택되고, 여기서 X4는 (C1-C6)알킬, (C5-C6)아릴 및 (C5-C6)헤테로아릴로 이루어진 군으로부터 선택되고, X4는 메틸, CONH2, 할로겐, NH2 및 OH로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
q = 1, 2 또는 3이고, 여기서 임의로, 상기 1, 2 또는 3개의 CH2-기의 1 또는 2개의 수소는 메틸, 에틸, (C5-C6)아릴 또는 (C5-C6)헤테로아릴에 의해 각각 개별적으로 치환되고,
R4b는 메틸 또는 H이고;
Xaa5는 구조 (VII)의 아미노산의 잔기이고:
여기서
R5는 OH 및 NH2의 군으로부터 선택되고,
r = 1, 2 또는 3이고;
Xaa6은 방향족 L-α-아미노산 및 헤테로방향족 L-α-아미노산으로 이루어진 군으로부터 선택된 아미노산이고;
Xaa7은 화학식 (IX)의 아미노 티올 또는 아미노산의 잔기이고:
여기서
R7a는 -CO-, -COOH, -CONH2, -CH2-OH, -(CO)-NH-R7b, -(CO)-(NR7c)-R7b 또는 H이고, 여기서 R7b 및 R7c는 각각 독립적으로 (C1-C4)알킬이고,
t는 1 또는 2이고;
Yc는 화학식 (X)의 구조이고:
2개의 티오에테르 연결의 형성 하에 Xaa1의 S 원자 및 Xaa7의 S 원자를 연결하여 화학식 (XXI)의 시클릭 구조를 형성하고:
화학식 (X)에서 방향족 기의 치환 패턴은 오르토, 메타 또는 파라이고,
n = 0 또는 1이고,
t = 1 또는 2이고,
Y1은 C-H 또는 N이고,
Y2는 N 또는 C-Rc1이고,
Rc1은 H 또는 CH2-Rc2이고,
Rc2는 화학식 (XI), (XII) 또는 (XXII)의 구조이고:
여기서
Rc3 및 Rc4는 각각 독립적으로 H 및 (C1-C4)알킬로 이루어진 군으로부터 선택되고,
u = 1, 2, 3, 4, 5 또는 6이고,
x 및 y는 각각 독립적으로 1, 2 또는 3이고,
X = O 또는 S이고,
화학식 (XI) 및 (XXII)에서 질소 원자 중 1개는 Rc1의 -CH2-에 부착되고, 화학식 (XII)에서 -X-는 Rc1의 -CH2-에 부착되고;
N-말단 변형 기 A는 차단 기 Abl이고, 여기서 차단 기 Abl은 Ra1-NH-C(O)-이고; Ra1은 C3 알킬, C4 알킬 또는 C5 알킬로 이루어진 군으로부터 선택되고, 각각 독립적으로 OH, F, COOH, (C3-C8)시클로알킬, 아릴, 헤테로아릴 및 (C3-C8)헤테로사이클로 이루어진 군으로부터 각각 독립적으로 선택된 2개 이하의 치환기에 의해 임의로 치환되고, (C1-C8)알킬에서 -CH2- 기 중 1개는 -S- 또는 -O-에 의해 임의로 대체된다. - 제1항에 있어서, Ra1이 C4 알킬이고, 바람직하게는 Ra1이 n-부틸인 화합물.
- 제1항 또는 제2항에 있어서, Xaa1이 cys, hcy 및 pen으로 이루어진 군으로부터 선택된 D-아미노산 잔기이거나, 또는 Xaa1이 Cys, Hcy 및 Pen으로 이루어진 군으로부터 선택된 L-아미노산 잔기이고, 바람직하게는 Xaa1이 Cys인 화합물.
- 제1항 내지 제3항 중 어느 한 항에 있어서, Xaa2가 Pro, Gly, Nmg 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 바람직하게는 Xaa2가 Pro 및 Nmg로 이루어진 군으로부터 선택된 아미노산 잔기이고, 보다 바람직하게는 Xaa2가 Pro의 아미노산 잔기인 화합물.
- 제1항 내지 제4항 중 어느 한 항에 있어서, Xaa3이 Pro, Hyp, Tfp, Cfp, Dmp, Aze 및 Pip 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 바람직하게는 Xaa3이 Pro의 아미노산 잔기인 화합물.
- 제1항 내지 제5항 중 어느 한 항에 있어서, Xaa4가 Thr, Hse, Asn, Gln 및 Ser 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 바람직하게는 Xaa4가 Thr인 화합물.
- 제1항 내지 제6항 중 어느 한 항에 있어서, Xaa5가 Gln 및 Glu 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
- 제1항 내지 제7항 중 어느 한 항에 있어서, Xaa6이 화학식 (VIIIa), (VIIIb), (VIIIc) 및 (VIIId) 중 어느 하나의 아미노산 잔기이고:
여기서
R6a 및 R6b는 각각 독립적으로 H, 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
R6c는 0 내지 3개의 치환기를 나타내고, 각각의 이러한 치환기는 각각 독립적으로 Cl, F, Br, NO2, NH2, CN, CF3, OH, OR6d 및 C1-C4 알킬로 이루어진 군으로부터 선택되고,
R6d는 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
s는 0 또는 1이고, 바람직하게는 Xaa6이 Phe, Ocf, Ppa, Thi, 1Ni, Otf 및 Mpa 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 보다 바람직하게는 Xaa6이 Phe의 아미노산 잔기인 화합물. - 제1항 내지 제8항 중 어느 한 항에 있어서, Xaa7이 Cys, Cys-OH, Cys-NH2, Cysol, AET, Hcy, cys, cys-OH, cys-NH2 및 hcy로 이루어진 군으로부터 선택된 아미노 티올 잔기이고, 바람직하게는 Xaa7이 Cys, Cys-OH, Cys-NH2, Cysol 및 AET로 이루어진 군으로부터 선택된 아미노 티올 잔기이고, 보다 바람직하게는 Xaa7이 Cys, Cys-OH 또는 Cys-NH2의 아미노 티올 잔기이고, 가장 바람직하게는 Xaa7이 Cys-OH의 아미노 티올 잔기인 화합물.
- 제1항 내지 제9항 중 어느 한 항에 있어서, Yc가 하기의 구조인 화합물:
여기서
Rc1은 CH2-Rc2 또는 H이고,
CH2-Rc2는 화학식 (XIId) 또는 화학식 (XXIIb)의 구조이고:
여기서
Z는 임의로 링커를 포함하는 킬레이트화제이고,
Rc4는 H 또는 메틸이고,
u = 1, 2, 3, 4 또는 5이다. - 제10항에 있어서, Rc2가 화학식 (XIId)의 구조인 화합물:
여기서
u = 1이고,
Rc4는 H이다. - 제10항 또는 제11항에 있어서, 링커가 Ttds 및 O2Oc로 이루어진 군으로부터 선택된 것인 화합물.
- 제10항 내지 제12항 중 어느 한 항에 있어서, 킬레이트화제 Z가 99mTc(CO)3-킬레이트화제, CB-TE2A, CHX-A"-DTPA, DTPA, DATA, DFO, HBED, 크라운, DOTAGA, DOTAM (TCMC로도 불림), FSC, H4옥타파, 마크로파, HEHA, HOPO, Hynic, PCTA, PSC, NETA, DOTA, NODA-MPAA, NODAGA, NOTP, NxS4-x (N4, N2S2, N3S), NOPO, NOTA, Pycup, RESCA, 사르코파진, TETA, THP 및 TRAP로 이루어진 군으로부터 선택된 것인 화합물.
- 제1항 내지 제13항 중 어느 한 항에 있어서, 하기로 이루어진 군으로부터 선택된 화합물:
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3940):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-NH2 (3BP-4560):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(NOPO-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4768):
. - 제1항 내지 제14항, 바람직하게는 제10항 내지 제14항 중 어느 한 항에 있어서, 진단 활성 핵종 또는 치료 활성 핵종을 포함하는 화합물.
- 화학식 (I)의 시클릭 펩티드 및 Xaa1에 부착된 N-말단 변형 기 A를 포함하는 화합물:
여기서
펩티드 서열은 N에서 C-말단 방향으로 좌측에서 우측으로 그려지고,
Xaa1은 화학식 (II)의 아미노산의 잔기이고:
여기서
R1a는 -NH-이고,
R1b는 H 또는 CH3이고,
n = 0 또는 1이고,
N-말단 변형 기 A는 Xaa1의 질소 원자에 공유 부착되고,
Xaa1의 카르보닐 기는 Xaa2의 질소에 공유 부착되고,
Xaa1의 황 원자는 Yc에 티오에테르로서 공유 부착되고;
Xaa2는 화학식 (III), (IV) 또는 (XX)의 아미노산의 잔기이고:
여기서
R2a, R2b 및 R2c는 각각 독립적으로 (C1-C2)알킬 및 H로 이루어진 군으로부터 선택되고, 여기서 상기 (C1-C2)알킬은 OH, NH2, 할로겐, (C5-C7)시클로알킬로 이루어진 군으로부터 선택된 치환기에 의해 치환될 수 있고,
p = 0, 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
화학식 (IV)의 아미노산은 나타낸 고리 위치 3 및 4에서 메틸, OH, NH2 및 F로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
Xaa3은 화학식 (V) 또는 (XX)의 아미노산의 잔기이고:
여기서
X3은 CH2, CF2, CH-R3b, S, O 및 NH로 이루어진 군으로부터 선택되고,
p = 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
R3a는 H, 메틸, OH, NH2 또는 F이고,
R3b은 메틸, OH, NH2 또는 F이고;
Xaa4는 화학식 (VI)의 아미노산의 잔기이고:
여기서
R4a는 H, OH, COOH, CONH2, X4 및 -NH-CO-X4로 이루어진 군으로부터 선택되고, 여기서 X4는 (C1-C6)알킬, (C5-C6)아릴 및 (C5-C6)헤테로아릴로 이루어진 군으로부터 선택되고, X4는 메틸, CONH2, 할로겐, NH2 및 OH로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
q = 1, 2 또는 3이고, 여기서 임의로, 상기 1, 2 또는 3개의 CH2-기의 1 또는 2개의 수소는 메틸, 에틸, (C5-C6)아릴 또는 (C5-C6)헤테로아릴에 의해 각각 개별적으로 치환되고,
R4b는 메틸 또는 H이고;
Xaa5는 구조 (VII)의 아미노산의 잔기이고:
여기서
R5는 OH 및 NH2의 군으로부터 선택되고,
r = 1, 2 또는 3이고;
Xaa6은 방향족 L-α-아미노산 및 헤테로방향족 L-α-아미노산으로 이루어진 군으로부터 선택된 아미노산이고;
Xaa7은 화학식 (IX)의 아미노 티올 또는 아미노산의 잔기이고:
여기서
R7a는 -CO-, -COOH, -CONH2, -CH2-OH, -(CO)-NH-R7b, -(CO)-(NR7c)-R7b 또는 H이고, 여기서 R7b 및 R7c는 각각 독립적으로 (C1-C4)알킬이고,
t는 1 또는 2이고;
Yc는 화학식 (X)의 구조이고:
2개의 티오에테르 연결의 형성 하에 Xaa1의 S 원자 및 Xaa7의 S 원자를 연결하여 화학식 (XXI)의 시클릭 구조를 형성하고:
화학식 (X)에서 방향족 기의 치환 패턴은 오르토, 메타 또는 파라, 바람직하게는 메타이고,
n = 0 또는 1이고,
t = 1 또는 2이고,
Y1은 C-H이고,
Y2는 C-Rc1이고,
Rc1은 CH2-Rc2 또는 H이고,
Rc2는 화학식 (XIId) 또는 (XXIIc)의 구조이고:
여기서
u = 1이고,
Rc4는 H이고,
Z는 임의로 링커를 포함하는 킬레이트화제이고;
N-말단 변형 기 A는 차단 기 Abl이고, 여기서 차단 기 Abl은 Ra1-NH-C(O)-이고; Ra1은 OH, F, COOH, (C3-C8)시클로알킬, 아릴, 헤테로아릴 및 (C3-C8)헤테로사이클로 이루어진 군으로부터 각각 독립적으로 선택된 2개 이하의 치환기에 의해 임의로 치환된 (C1-C8)알킬이고, (C1-C8)알킬에서 -CH2- 기 중 1개는 -S- 또는 -O-에 의해 임의로 대체된다. - 제16항에 있어서, Rc2가 화학식 (XIId)의 구조인 화합물:
여기서
u = 1이고,
Rc4는 H이고,
Z는 임의로 링커를 포함하는 킬레이트화제이다. - 제17항에 있어서, 링커가 Ttds, O2Oc 및 PEG6, 바람직하게는 Ttds 및 O2Oc로 이루어진 군으로부터 선택된 것인 화합물.
- 제16항 내지 제18항 중 어느 한 항에 있어서, Ra1이 C3 알킬, C4 알킬 또는 C5 알킬로 이루어진 군으로부터 선택되고, 각각 독립적으로 OH, F, COOH, (C3-C8)시클로알킬, 아릴, 헤테로아릴 및 (C3-C8)헤테로사이클로 이루어진 군으로부터 각각 독립적으로 선택된 2개 이하의 치환기에 의해 임의로 치환되고, 여기서 (C1-C8)알킬에서 -CH2- 기 중 1개는 -S- 또는 -O-에 의해 임의로 대체된 것인 화합물.
- 제19항에 있어서, Ra1이 C3 알킬, C4 알킬 또는 C5 알킬로 이루어진 군으로부터 선택되고, 바람직하게는 Ra1이 C4 알킬이고, 보다 바람직하게는 Ra1이 n-부틸인 화합물.
- 제16항 내지 제20항 중 어느 한 항에 있어서, Xaa1이 cys, hcy 및 pen으로 이루어진 군으로부터 선택된 D-아미노산 잔기이거나, 또는 Xaa1이 Cys, Hcy 및 Pen으로 이루어진 군으로부터 선택된 L-아미노산 잔기이고, 바람직하게는 Xaa1이 Cys인 화합물.
- 제16항 내지 제21항 중 어느 한 항에 있어서, Xaa2가 Pro, Gly, Nmg 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 바람직하게는 Xa2가 Pro 및 Nmg로 이루어진 군으로부터 선택된 아미노산 잔기이고, 보다 바람직하게는 Xaa2가 Pro의 아미노산 잔기인 화합물.
- 제16항 내지 제22항 중 어느 한 항에 있어서, Xaa3이 Pro, Hyp, Tfp, Cfp, Dmp, Aze 및 Pip 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 바람직하게는 Xaa3이 Pro의 아미노산 잔기인 화합물.
- 제16항 내지 제23항 중 어느 한 항에 있어서, Xaa4가 Thr, Hse, Asn, Gln 및 Ser 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 바람직하게는 Xaa4가 Thr인 화합물.
- 제16항 내지 제24항 중 어느 한 항에 있어서, Xaa5가 Gln 및 Glu 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 바람직하게는 Xaa5가 Gln 및 Glu로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
- 제16항 내지 제25항 중 어느 한 항에 있어서, Xaa6이 화학식 (VIIIa), (VIIIb), (VIIIc) 및 (VIIId) 중 어느 하나의 아미노산 잔기이고:
여기서
R6a 및 R6b는 각각 독립적으로 H, 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
R6c는 0 내지 3개의 치환기를 나타내고, 각각의 이러한 치환기는 각각 독립적으로 Cl, F, Br, NO2, NH2, CN, CF3, OH, OR6d 및 C1-C4 알킬로 이루어진 군으로부터 선택되고,
R6d는 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
s는 0 또는 1이고, 바람직하게는 Xaa6이 Phe, Ocf, Ppa, Thi, 1Ni, Otf 및 Mpa 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 보다 바람직하게는 Xaa6이 Phe의 아미노산 잔기인 화합물. - 제16항 내지 제26항 중 어느 한 항에 있어서, Xaa7이 Cys, Cys-OH, Cys-NH2, Cysol, AET, Hcy, cys, cys-OH, cys-NH2 및 hcy로 이루어진 군으로부터 선택된 아미노 티올 잔기이고, 바람직하게는 Xaa7이 Cys, Cys-OH, Cys-NH2, Cysol 및 AET로 이루어진 군으로부터 선택된 아미노 티올 잔기이고, 보다 바람직하게는 Xaa7이 Cys, Cys-OH 또는 Cys-NH2, 가장 바람직하게는 Cys-OH의 아미노 티올 잔기인 화합물.
- 제16항 내지 제27항 중 어느 한 항에 있어서, 킬레이트화제 Z가 99mTc(CO)3-킬레이트화제, CB-TE2A, CHX-A"-DTPA, DTPA, DATA, DFO, HBED, 크라운, DOTAGA, DOTAM (TCMC로도 지칭됨), FSC, H4옥타파, 마크로파, HEHA, HOPO, Hynic, PCTA, PSC, NETA, DOTA, NODA-MPAA, NODAGA, NOTP, NxS4-x (N4, N2S2, N3S), NOPO, NOTA, Pycup, RESCA, 사르코파진, TETA, THP 및 TRAP로 이루어진 군으로부터 선택된 것인 화합물.
- 제16항 내지 제28항 중 어느 한 항에 있어서, 하기로 이루어진 군으로부터 선택된 화합물:
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3940):
하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-NH2 (3BP-4560):
및 하기 화학식의 화합물 nBu-CAyl-[Cys(tMeBn(NOPO-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4768):
. - 제16항 내지 제29항 중 어느 한 항에 있어서, 진단 활성 핵종 또는 치료 활성 핵종을 포함하는 화합물.
- 화학식 (I)의 시클릭 펩티드 및 Xaa1에 부착된 N-말단 변형 기 A를 포함하는 화합물:
여기서
펩티드 서열은 N에서 C-말단 방향으로 좌측에서 우측으로 그려지고,
Xaa1은 화학식 (II)의 아미노산의 잔기이고:
여기서
R1a는 -NH-이고,
R1b는 H 또는 CH3이고,
n = 0 또는 1이고,
N-말단 변형 기 A는 Xaa1의 질소 원자에 공유 부착되고,
Xaa1의 카르보닐 기는 Xaa2의 질소에 공유 부착되고,
Xaa1의 황 원자는 Yc에 티오에테르로서 공유 부착되고;
Xaa2는 화학식 (III), (IV) 또는 (XX)의 아미노산의 잔기이고:
여기서
R2a, R2b 및 R2c는 각각 독립적으로 (C1-C2)알킬 및 H로 이루어진 군으로부터 선택되고, 여기서 상기 (C1-C2)알킬은 OH, NH2, 할로겐, (C5-C7)시클로알킬로 이루어진 군으로부터 선택된 치환기에 의해 치환될 수 있고,
p = 0, 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
화학식 (IV)의 아미노산은 나타낸 고리 위치 3 및 4에서 메틸, OH, NH2 및 F로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
Xaa3은 화학식 (V) 또는 (XX)의 아미노산의 잔기이고:
여기서
X3은 CH2, CF2, CH-R3b, S, O 및 NH로 이루어진 군으로부터 선택되고,
p = 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
R3a는 H, 메틸, OH, NH2 또는 F이고,
R3b은 메틸, OH, NH2 또는 F이고;
Xaa4는 화학식 (VI)의 아미노산의 잔기이고:
여기서
R4a는 H, OH, COOH, CONH2, X4 및 -NH-CO-X4로 이루어진 군으로부터 선택되고, 여기서 X4는 (C1-C6)알킬, (C5-C6)아릴 및 (C5-C6)헤테로아릴로 이루어진 군으로부터 선택되고, X4는 메틸, CONH2, 할로겐, NH2 및 OH로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
q = 1, 2 또는 3이고, 여기서 임의로, 상기 1, 2 또는 3개의 CH2-기의 1 또는 2개의 수소는 메틸, 에틸, (C5-C6)아릴 또는 (C5-C6)헤테로아릴에 의해 각각 개별적으로 치환되고,
R4b는 메틸 또는 H이고;
Xaa5는 구조 (VII)의 아미노산의 잔기이고:
여기서
R5는 OH 및 NH2의 군으로부터 선택되고,
r = 1, 2 또는 3이고;
Xaa6은 방향족 L-α-아미노산 및 헤테로방향족 L-α-아미노산으로 이루어진 군으로부터 선택된 아미노산이고;
Xaa7은 화학식 (IX)의 아미노 티올 또는 아미노산의 잔기이고:
여기서
R7a는 -CO-, -COOH, -CONH2, -CH2-OH, -(CO)-NH-R7b, -(CO)-(NR7c)-R7b 또는 H이고, 여기서 R7b 및 R7c는 각각 독립적으로 (C1-C4)알킬이고,
t는 1 또는 2이고;
Yc는 화학식 (X)의 구조이고:
2개의 티오에테르 연결의 형성 하에 Xaa1의 S 원자 및 Xaa7의 S 원자를 연결하여 화학식 (XXI)의 시클릭 구조를 형성하고:
화학식 (X)에서 방향족 기의 치환 패턴은 메타이고,
n = 0 또는 1이고,
t = 1 또는 2이고,
Y1은 C-H 또는 N이고,
Y2는 C-Rc1이고,
Rc1은 H이고;
N-말단 변형 기 A는 아미노산 Aaa이고,
여기서
아미노산 Aaa는 구조 (XIV)의 L-아미노산 잔기이고:
여기서
Ra2는 (C1-C6)알킬 및 변형된 (C1-C6)알킬로 이루어진 군으로부터 선택되고,
여기서 변형된 (C1-C6)알킬에서 1개의 -CH2- 기는 -S- 또는 -O-에 의해 대체되고,
아미노산 Aaa는 링커에 공유 부착되고, 여기서 링커는 킬레이트화제 Z에 공유 연결되고, 링커는 (a) 제1 링커 또는 (b) 제1 링커 및 제2 링커로 이루어지고, 여기서
링커가 제1 링커로 이루어지는 경우에, 제1 링커는 킬레이트화제 및 아미노산 Aaa에 공유 연결되고,
제1 링커가 제1 링커 및 제2 링커로 이루어지는 경우에, 제1 링커는 아미노산 Aaa 및 제2 링커에 공유 연결되고, 제2 링커는 킬레이트화제에 공유 연결되고,
제1 링커는 Ttds 및 PEG6으로 이루어진 군으로부터 선택되고, 바람직하게는 제1 링커는 Ttds이고,
제2 링커는 PPAc 및 PEG6으로 이루어진 군으로부터 선택되고, 바람직하게는 제2 링커는 PPAc이다. - 제31항에 있어서, Ra2가 C4 알킬이고, 바람직하게는 Ra2가 n-부틸인 화합물.
- 제31항 또는 제32항에 있어서, 아미노산 Aaa가 Nle의 잔기인 화합물.
- 제31항 내지 제33항 중 어느 한 항에 있어서, Y1이 C-H인 화합물.
- 제31항 내지 제34항 중 어느 한 항에 있어서, 링커가 제1 링커로 이루어지며, 여기서 제1 링커는 Ttds 및 PEG6으로 이루어진 군으로부터 선택된 것인 화합물.
- 제31항 내지 제35항 중 어느 한 항에 있어서, 링커가 제1 링커 및 제2 링커로 이루어지며, 여기서 제1 링커는 Ttds 및 PEG6으로 이루어진 군으로부터 선택되고, 제2 링커는 PPAc 및 PEG6으로 이루어진 군으로부터 선택되고, 바람직하게는 PPAc인 화합물.
- 제36항에 있어서, 제1 링커가 Ttds이고, 제2 링커가 PPAc이고, 바람직하게는 아미노산 Aaa가 Nle의 잔기인 화합물.
- 제31항 내지 제37항 중 어느 한 항에 있어서, Xaa1이 cys, hcy 및 pen으로 이루어진 군으로부터 선택된 D-아미노산 잔기이거나, 또는 Xaa1이 Cys, Hcy 및 Pen으로 이루어진 군으로부터 선택된 L-아미노산 잔기이고, 바람직하게는 Xaa1이 Cys인 화합물.
- 제31항 내지 제38항 중 어느 한 항에 있어서, Xaa2가 Pro, Gly, Nmg 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 바람직하게는 Xaa2가 Pro 및 Nmg로 이루어진 군으로부터 선택된 아미노산 잔기이고, 보다 바람직하게는 Xaa2가 Pro의 아미노산 잔기인 화합물.
- 제31항 내지 제39항 중 어느 한 항에 있어서, Xaa3이 Pro, Hyp, Tfp, Cfp, Dmp, Aze 및 Pip 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 바람직하게는 Xaa3이 Pro의 아미노산 잔기인 화합물.
- 제31항 내지 제40항 중 어느 한 항에 있어서, Xaa4가 Thr, Hse, Asn, Gln 및 Ser 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 바람직하게는 Xaa4가 Thr인 화합물.
- 제31항 내지 제41항 중 어느 한 항에 있어서, Xaa5가 Gln 및 Glu 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 바람직하게는 Xaa5가 Gln 및 Glu로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
- 제31항 내지 제42항 중 어느 한 항에 있어서, Xaa6이 화학식 (VIIIa), (VIIIb), (VIIIc) 및 (VIIId) 중 어느 하나의 아미노산 잔기이고:
여기서
R6a 및 R6b는 각각 독립적으로 H, 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
R6c는 0 내지 3개의 치환기를 나타내고, 각각의 이러한 치환기는 각각 독립적으로 Cl, F, Br, NO2, NH2, CN, CF3, OH, OR6d 및 C1-C4 알킬로 이루어진 군으로부터 선택되고,
R6d는 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
s는 0 또는 1이고, 바람직하게는 Xaa6이 Phe, Ocf, Ppa, Thi, 1Ni, Otf 및 Mpa 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 보다 바람직하게는 Xaa6이 Phe의 아미노산 잔기인 화합물. - 제31항 내지 제43항 중 어느 한 항에 있어서, Xaa7이 Cys, Cys-OH, Cys-NH2, Cysol, AET, Hcy, cys, cys-OH, cys-NH2 및 hcy로 이루어진 군으로부터 선택된 아미노 티올 잔기이고, 바람직하게는 Xaa7이 Cys, Cys-OH, Cys-NH2, Cysol 및 AET로 이루어진 군으로부터 선택된 아미노 티올 잔기이고, 보다 바람직하게는 Xaa7이 Cys, Cys-OH 또는 Cys-NH2의 아미노 티올 잔기이고, 가장 바람직하게는 Xaa7이 Cys-OH의 아미노 티올 잔기인 화합물.
- 제31항 내지 제40항 중 어느 한 항에 있어서, 아미노산이 Xaa7에 부착되고, 바람직하게는 Xaa7에 부착된 아미노산이 Asp, asp, Bal, Gly, Gab, Ser, Nmg, Bhf, Lys, Ape, Ttds 및 Bhk로 이루어진 군으로부터 선택되고, 보다 바람직하게는 Xaa7에 부착된 아미노산이 Bal 또는 Asp인 화합물.
- 제31항 내지 제45항 중 어느 한 항에 있어서, 킬레이트화제 Z가 99mTc(CO)3-킬레이트화제, CB-TE2A, CHX-A"-DTPA, DTPA, DATA, DFO, HBED, 크라운, DOTAGA, DOTAM (TCMC로도 불림), FSC, H4옥타파, 마크로파, HEHA, HOPO, Hynic, PCTA, PSC, NETA, DOTA, NODA-MPAA, NODAGA, NOTP, NxS4-x (N4, N2S2, N3S), NOPO, NOTA, Pycup, RESCA, 사르코파진, TETA, THP 및 TRAP로 이루어진 군으로부터 선택된 것인 화합물.
- 제31항 내지 제46항 중 어느 한 항에 있어서, 하기로 이루어진 군으로부터 선택된 화합물:
하기 화학식의 화합물 N4Ac-PPAc-Ttds-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4541):
하기 화학식의 화합물 NODAGA-Ttds-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4713):
하기 화학식의 화합물 N4Ac-PPAc-Ttds-Nle-[Cys(3Lut)-Pro-Pro-Thr-Gln-Phe-Cys]-Bal-OH (3BP-4961):
하기 화학식의 화합물 NOTA-Ttds-Nle-[Cys(3MeBn)-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-5201):
. - 제31항 내지 제48항 중 어느 한 항에 있어서, 진단 활성 핵종 또는 치료 활성 핵종을 포함하는 화합물.
- 화학식 (I)의 시클릭 펩티드 및 Xaa1에 부착된 N-말단 변형 기 A를 포함하는 화합물:
여기서
펩티드 서열은 N에서 C-말단 방향으로 좌측에서 우측으로 그려지고,
Xaa1은 화학식 (II)의 아미노산의 잔기이고:
여기서
R1a는 -NH-이고,
R1b는 H 또는 CH3이고,
n = 0 또는 1이고,
N-말단 변형 기 A는 Xaa1의 질소 원자에 공유 부착되고,
Xaa1의 카르보닐 기는 Xaa2의 질소에 공유 부착되고,
Xaa1의 황 원자는 Yc에 티오에테르로서 공유 부착되고;
Xaa2는 화학식 (III), (IV) 또는 (XX)의 아미노산의 잔기이고:
여기서
R2a, R2b 및 R2c는 각각 독립적으로 (C1-C2)알킬 및 H로 이루어진 군으로부터 선택되고, 여기서 상기 (C1-C2)알킬은 OH, NH2, 할로겐, (C5-C7)시클로알킬로 이루어진 군으로부터 선택된 치환기에 의해 치환될 수 있고,
p = 0, 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
화학식 (IV)의 아미노산은 나타낸 고리 위치 3 및 4에서 메틸, OH, NH2 및 F로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
Xaa3은 화학식 (V) 또는 (XX)의 아미노산의 잔기이고:
여기서
X3은 CH2, CF2, CH-R3b, S, O 및 NH로 이루어진 군으로부터 선택되고,
p = 1 또는 2이고,
v = 1 또는 2이고,
w = 1, 2 또는 3이고,
R3a는 H, 메틸, OH, NH2 또는 F이고,
R3b은 메틸, OH, NH2 또는 F이고;
Xaa4는 화학식 (VI)의 아미노산의 잔기이고:
여기서
R4a는 H, OH, COOH, CONH2, X4 및 -NH-CO-X4로 이루어진 군으로부터 선택되고, 여기서 X4는 (C1-C6)알킬, (C5-C6)아릴 및 (C5-C6)헤테로아릴로 이루어진 군으로부터 선택되고, X4는 메틸, CONH2, 할로겐, NH2 및 OH로 이루어진 군으로부터 선택된 1 또는 2개의 치환기에 의해 치환될 수 있고;
q = 1, 2 또는 3이고, 여기서 임의로, 상기 1, 2 또는 3개의 CH2-기의 1 또는 2개의 수소는 메틸, 에틸, (C5-C6)아릴 또는 (C5-C6)헤테로아릴에 의해 각각 개별적으로 치환되고,
R4b는 메틸 또는 H이고;
Xaa5는 구조 (VII)의 아미노산의 잔기이고:
여기서
R5는 OH 및 NH2의 군으로부터 선택되고,
r = 1, 2 또는 3이고;
Xaa6은 방향족 L-α-아미노산 및 헤테로방향족 L-α-아미노산으로 이루어진 군으로부터 선택된 아미노산이고;
Xaa7은 화학식 (IX)의 아미노 티올 또는 아미노산의 잔기이고:
여기서
R7a는 -CO-, -COOH, -CONH2, -CH2-OH, -(CO)-NH-R7b, -(CO)-(NR7c)-R7b 또는 H이고, 여기서 R7b 및 R7c는 각각 독립적으로 (C1-C4)알킬이고,
t는 1 또는 2이고;
Yc는 화학식 (X)의 구조이고:
2개의 티오에테르 연결의 형성 하에 Xaa1의 S 원자 및 Xaa7의 S 원자를 연결하여 화학식 (XXI)의 시클릭 구조를 형성하고:
화학식 (X)에서 방향족 기의 치환 패턴은 메타이고,
n = 0 또는 1이고,
t = 1 또는 2이고,
Y1은 C-H이고,
Y2는 C-Rc1이고,
Rc1은 CH2-Rc2이고,
Rc2는 화학식 (XIId)의 구조이고:
여기서
u = 1, 2, 3, 4, 5 또는 6, 바람직하게는 u = 1이고,
Rc4는 H 또는 메틸이고,
Z는 임의로 링커를 포함하는 킬레이트화제이고,
N-말단 변형 기 A는 차단 기 Abl이고, 여기서 차단 기 Abl은 Ra11-C(O)-로 이루어진 군으로부터 선택되고, 여기서 Ra11은 C4 알킬 또는 C5 알킬이고, 여기서 C4 알킬 및 C5 알킬 중 각각에서 및 임의의 1개에서 개별적으로 및 독립적으로 -CH2- 기 중 1개는 -O- 또는 -S-에 의해 임의로 대체된다. - 제49항에 있어서, Ra11이 C5 알킬이고, 바람직하게는
Ra11이 n-펜틸, 또는 구조 (XXX)의 것인 화합물:
. - 제49항에 있어서, Ra11이 C4 알킬이고, 바람직하게는 Ra11이 n-부틸인 화합물.
- 제49항에 있어서, R11a가 구조 (XXXI)의 것인 화합물:
. - 제49항에 있어서, R11a가 구조 (XXXII)의 것인 화합물:
. - 제49항에 있어서, R11a가 구조 (XXXIII)의 것인 화합물:
. - 제49항 내지 제54항 중 어느 한 항에 있어서, 킬레이트화제 Z가 화학식 (XIId)의 구조의 N 원자에 공유 연결된 것인 화합물:
여기서
u = 1이고,
Rc4는 H이다. - 제49항 내지 제55항 중 어느 한 항에 있어서, 킬레이트화제 Z가 링커를 포함하며, 여기서 링커는 킬레이트화제에 공유 연결되고 화학식 (XIId)의 구조의 N 원자에 공유 연결된 것인 화합물:
. - 제56항에 있어서, 링커가 Ttds 및 O2Oc로 이루어진 군으로부터 선택된 것인 화합물.
- 제49항 내지 제57항 중 어느 한 항에 있어서, Xaa1이 cys, hcy 및 pen으로 이루어진 군으로부터 선택된 D-아미노산 잔기이거나, 또는 Xaa1이 Cys, Hcy 및 Pen으로 이루어진 군으로부터 선택된 L-아미노산 잔기이고, 바람직하게는 Xaa1이 Cys인 화합물.
- 제49항 내지 제58항 중 어느 한 항에 있어서, Xaa2가 Pro, Gly, Nmg 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 바람직하게는 Xaa2가 Pro 및 Nmg로 이루어진 군으로부터 선택된 아미노산 잔기이고, 보다 바람직하게는 Xaa2가 Pro의 아미노산 잔기인 화합물.
- 제49항 내지 제59항 중 어느 한 항에 있어서, Xaa3이 Pro, Hyp, Tfp, Cfp, Dmp, Aze 및 Pip 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 바람직하게는 Xaa3이 Pro의 아미노산 잔기인 화합물.
- 제49항 내지 제60항 중 어느 한 항에 있어서, Xaa4가 Thr, Hse, Asn, Gln 및 Ser 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 바람직하게는 Xaa4가 Thr인 화합물.
- 제49항 내지 제61항 중 어느 한 항에 있어서, Xaa5가 Gln 및 Glu 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 바람직하게는 Xaa5가 Gln 및 Glu로 이루어진 군으로부터 선택된 아미노산 잔기인 화합물.
- 제49항 내지 제62항 중 어느 한 항에 있어서, Xaa6이 화학식 (VIIIa), (VIIIb), (VIIIc) 및 (VIIId) 중 어느 하나의 아미노산 잔기이고:
여기서
R6a 및 R6b는 각각 독립적으로 H, 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
R6c는 0 내지 3개의 치환기를 나타내고, 각각의 이러한 치환기는 각각 독립적으로 Cl, F, Br, NO2, NH2, CN, CF3, OH, OR6d 및 C1-C4 알킬로 이루어진 군으로부터 선택되고,
R6d는 메틸, 에틸, 프로필 및 이소프로필로 이루어진 군으로부터 선택되고,
s는 0 또는 1이고, 바람직하게는 Xaa6이 Phe, Ocf, Ppa, Thi, 1Ni, Otf 및 Mpa 및 그의 유도체로 이루어진 군으로부터 선택된 아미노산 잔기이고, 보다 바람직하게는 Xaa6이 Phe의 아미노산 잔기인 화합물. - 제49항 내지 제63항 중 어느 한 항에 있어서, Xaa7이 Cys, Cys-OH, Cys-NH2, Cysol, AET, Hcy, cys, cys-OH, cys-NH2 및 hcy로 이루어진 군으로부터 선택된 아미노 티올 잔기이고, 바람직하게는 Xaa7이 Cys, Cys-OH, Cys-NH2, Cysol 및 AET로 이루어진 군으로부터 선택된 아미노 티올 잔기이고, 보다 바람직하게는 Xaa7이 Cys 또는 Cys-NH2, 가장 바람직하게는 Cys-OH의 아미노 티올 잔기인 화합물.
- 제49항 내지 제64항 중 어느 한 항에 있어서, 킬레이트화제가 99mTc(CO)3-킬레이트화제, CB-TE2A, CHX-A"-DTPA, DTPA, DATA, DFO, HBED, 크라운, DOTAGA, DOTAM (TCMC로도 불림), FSC, H4옥타파, 마크로파, HEHA, HOPO, Hynic, PCTA, PSC, NETA, DOTA, NODA-MPAA, NODAGA, NOTP, NxS4-x (N4, N2S2, N3S), NOPO, NOTA, Pycup, RESCA, 사르코파진, TETA, THP 및 TRAP로 이루어진 군으로부터 선택된 것인 화합물.
- 제49항 내지 제65항 중 어느 한 항에 있어서, 하기로 이루어진 군으로부터 선택된 화합물:
하기 화학식의 화합물 iHex-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3907):
하기 화학식의 화합물 Pent-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3910):
하기 화학식의 화합물 EtOPr-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3918):
하기 화학식의 화합물 MeOBut-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3937):
하기 화학식의 화합물 PrOAc-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3938):
하기 화학식의 화합물 nBu-COyl-[Cys(tMeBn(DOTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-3941):
하기 화학식의 화합물 Hex-[Cys(tMeBn(DATA-Ttds-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-4384):
하기 화학식의 화합물 Hex-[Cys(tMeBn(NODAGA-AET))-Pro-Pro-Thr-Glu-Phe-Cys]-OH (3BP-4695):
하기 화학식의 화합물 Hex-[Cys(tMeBn(NODAGA-O2Oc-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-NH2 (3BP-4708):
하기 화학식의 화합물 Hex-[Cys(tMeBn(NOPO-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-NH2 (3BP-4729):
하기 화학식의 화합물 Hex-[Cys(tMeBn(NOPO-AET))-Pro-Pro-Thr-Glu-Phe-Cys]-OH (3BP-4818):
하기 화학식의 화합물 Hex-[Cys(tMeBn(AcPCTA-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-5273):
하기 화학식의 화합물 Hex-[Cys(tMeBn(LSC-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-5288):
및 하기 화학식의 화합물 Hex-[Cys(tMeBn(DOTAM-AET))-Pro-Pro-Thr-Gln-Phe-Cys]-OH (3BP-5323):
. - 제49항 내지 제66항 중 어느 한 항에 있어서, 진단 활성 핵종 또는 치료 활성 핵종을 포함하는 화합물.
- 제1항 내지 제67항 중 어느 한 항에 있어서, 화합물이 섬유모세포 활성화 단백질 (FAP), 바람직하게는 서열식별번호: 1의 아미노산 서열을 갖는 인간 FAP 또는 그의 상동체와 상호작용하며, 여기서 상동체의 아미노산 서열은 서열식별번호: 1의 아미노산 서열과 85% 이상의 동일성을 갖는 것인 화합물.
- 제68항에 있어서, 섬유모세포 활성화 단백질 (FAP)의 억제제인 화합물.
- 제1항 내지 제70항 중 어느 한 항에 있어서, 질환의 진단 방법에 사용하기 위한 화합물.
- 제1항 내지 제70항 중 어느 한 항에 있어서, 질환의 치료 방법에 사용하기 위한 화합물.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US202163134704P | 2021-01-07 | 2021-01-07 | |
| US63/134,704 | 2021-01-07 | ||
| PCT/EP2022/050280 WO2022148843A1 (en) | 2021-01-07 | 2022-01-07 | Compounds comprising a fibroblast activation protein ligand and use thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20230129261A true KR20230129261A (ko) | 2023-09-07 |
Family
ID=80050672
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020237026404A KR20230129261A (ko) | 2021-01-07 | 2022-01-07 | 섬유모세포 활성화 단백질 리간드를 포함하는 화합물및 그의 용도 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US20230212549A1 (ko) |
| EP (1) | EP4274835A1 (ko) |
| JP (1) | JP2024503637A (ko) |
| KR (1) | KR20230129261A (ko) |
| CN (1) | CN116940585A (ko) |
| AU (1) | AU2022205523A1 (ko) |
| CA (1) | CA3206863A1 (ko) |
| CL (1) | CL2023001991A1 (ko) |
| IL (1) | IL303925A (ko) |
| MX (1) | MX2023007869A (ko) |
| WO (1) | WO2022148843A1 (ko) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN118647415A (zh) | 2022-02-09 | 2024-09-13 | 诺华股份有限公司 | 包含225锕标记的络合物和铋多价螯合剂的药物组合物 |
| WO2024198836A1 (zh) * | 2023-03-27 | 2024-10-03 | 晶核生物医药科技(南京)有限公司 | 环状多肽类化合物及其应用 |
| CN118754936A (zh) * | 2023-03-27 | 2024-10-11 | 晶核生物医药科技(南京)有限公司 | 环状多肽类化合物及其应用 |
| CN118754938A (zh) * | 2023-03-27 | 2024-10-11 | 晶核生物医药科技(南京)有限公司 | 环状多肽类化合物及其应用 |
Family Cites Families (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4885363A (en) | 1987-04-24 | 1989-12-05 | E. R. Squibb & Sons, Inc. | 1-substituted-1,4,7-triscarboxymethyl-1,4,7,10-tetraazacyclododecane and analogs |
| US5021556A (en) | 1987-07-22 | 1991-06-04 | Neorx Corporation | Method of radiolabeling chelating compounds comprising sulfur atoms with metal radionuclides |
| US5075099A (en) | 1988-05-31 | 1991-12-24 | Neorx Corporation | Metal radionuclide chelating compounds for improved chelation kinetics |
| US5364613A (en) | 1989-04-07 | 1994-11-15 | Sieving Paul F | Polychelants containing macrocyclic chelant moieties |
| US5367080A (en) | 1990-11-08 | 1994-11-22 | Sterling Winthrop Inc. | Complexing agents and targeting radioactive immunoreagents useful in therapeutic and diagnostic imaging compositions and methods |
| US5886142A (en) | 1997-05-20 | 1999-03-23 | Thomas Jefferson University | Radiolabeled thrombus imaging agents |
| JP2001518290A (ja) | 1997-09-29 | 2001-10-16 | ポイント セラピューティクス, インコーポレイテッド | インビトロでの造血細胞の刺激 |
| EP0953639A1 (en) | 1998-04-30 | 1999-11-03 | Boehringer Ingelheim International GmbH | FAPalpha-specific antibody with improved producibility |
| US6890904B1 (en) | 1999-05-25 | 2005-05-10 | Point Therapeutics, Inc. | Anti-tumor agents |
| WO2001068708A2 (en) | 2000-03-17 | 2001-09-20 | Boehringer Ingelheim Pharma Kg | Human and humanized fap-alpha-specific antibodies |
| US7374898B2 (en) | 2004-10-12 | 2008-05-20 | The Research Foundation Of State University Of New York | Peptide inhibitors against seprase |
| WO2006125227A2 (en) | 2005-05-19 | 2006-11-23 | Genentech, Inc. | Fibroblast activation protein inhibitor compounds and methods |
| US8933201B2 (en) | 2006-06-07 | 2015-01-13 | The Board Of Regents Of The University Of Oklahoma | Substrates and inhibitors of antiplasmin cleaving enzyme and fibroblast activation protein and methods of use |
| US20100105753A1 (en) | 2007-03-20 | 2010-04-29 | Trustees Of Tufts College | Inhibitors of Fibroblast Activation Protein, and Methods of Use Thereof |
| EP2349995A1 (en) | 2008-09-25 | 2011-08-03 | Molecular Insight Pharmaceuticals, Inc. | Selective seprase inhibitors |
| US8999342B2 (en) | 2009-10-02 | 2015-04-07 | Ludwig Institute For Cancer Research, Ltd. | Anti-fibroblast activation protein antibodies and methods and uses thereof |
| EP3333194B1 (en) | 2010-08-13 | 2021-03-17 | Roche Glycart AG | Anti-fap antibodies and methods of use |
| WO2013107820A1 (en) | 2012-01-17 | 2013-07-25 | Universiteit Antwerpen | Novel fap inhibitors |
| UA118028C2 (uk) | 2013-04-03 | 2018-11-12 | Рош Глікарт Аг | Біспецифічне антитіло, специфічне щодо fap і dr5, антитіло, специфічне щодо dr5, і спосіб їх застосування |
| GB201402006D0 (en) | 2014-02-06 | 2014-03-26 | Oncomatryx Biopharma S L | Antibody-drug conjugates and immunotoxins |
| WO2016146174A1 (en) | 2015-03-17 | 2016-09-22 | Biontech Ag | Compositions and methods for diagnosis and treatment of cancer |
| MX2018015340A (es) | 2016-06-10 | 2019-03-28 | Bayer Pharma AG | Complejos radio-farmaceuticos. |
| JP2018035137A (ja) | 2016-07-13 | 2018-03-08 | マブイミューン ダイアグノスティックス エイジーMabimmune Diagnostics Ag | 新規な抗線維芽細胞活性化タンパク質(fap)結合薬剤およびその使用 |
| CN111511408A (zh) | 2017-10-23 | 2020-08-07 | 约翰霍普金斯大学 | 靶向成纤维细胞活化蛋白-α(FAP-α)的成像剂及放射治疗剂 |
| EP3763726A1 (en) * | 2019-07-08 | 2021-01-13 | 3B Pharmaceuticals GmbH | Compounds comprising a fibroblast activation protein ligand and use thereof |
-
2022
- 2022-01-07 CN CN202280019456.5A patent/CN116940585A/zh active Pending
- 2022-01-07 IL IL303925A patent/IL303925A/en unknown
- 2022-01-07 EP EP22700892.7A patent/EP4274835A1/en active Pending
- 2022-01-07 MX MX2023007869A patent/MX2023007869A/es unknown
- 2022-01-07 CA CA3206863A patent/CA3206863A1/en active Pending
- 2022-01-07 US US17/571,067 patent/US20230212549A1/en active Pending
- 2022-01-07 KR KR1020237026404A patent/KR20230129261A/ko unknown
- 2022-01-07 AU AU2022205523A patent/AU2022205523A1/en active Pending
- 2022-01-07 WO PCT/EP2022/050280 patent/WO2022148843A1/en active Application Filing
- 2022-01-07 JP JP2023541264A patent/JP2024503637A/ja active Pending
-
2023
- 2023-07-06 CL CL2023001991A patent/CL2023001991A1/es unknown
Also Published As
| Publication number | Publication date |
|---|---|
| US20230212549A1 (en) | 2023-07-06 |
| CN116940585A (zh) | 2023-10-24 |
| IL303925A (en) | 2023-08-01 |
| CL2023001991A1 (es) | 2023-12-15 |
| WO2022148843A1 (en) | 2022-07-14 |
| AU2022205523A1 (en) | 2023-07-13 |
| EP4274835A1 (en) | 2023-11-15 |
| MX2023007869A (es) | 2023-09-22 |
| CA3206863A1 (en) | 2022-07-14 |
| JP2024503637A (ja) | 2024-01-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN114341158B (zh) | 包含成纤维细胞活化蛋白配体的化合物及其用途 | |
| CN114341159B (zh) | 包含成纤维细胞活化蛋白配体的化合物及其用途 | |
| EP4050018A1 (en) | Compounds comprising a fibroblast activation protein ligand and use thereof | |
| KR20230129261A (ko) | 섬유모세포 활성화 단백질 리간드를 포함하는 화합물및 그의 용도 | |
| EP3763726A1 (en) | Compounds comprising a fibroblast activation protein ligand and use thereof | |
| WO2022123462A1 (en) | Radiolabelled prostate specific membrane antigen (psma) inhibitors and use thereof | |
| KR20240040092A (ko) | 섬유모세포 활성화 단백질 억제제 및 그의 용도 | |
| TW202334177A (zh) | 包含纖維母細胞活化蛋白配體之化合物和彼之用途 | |
| CN118930608A (en) | Compounds comprising fibroblast activation protein ligands and uses thereof | |
| WO2023111350A2 (en) | Carbonic anhydrase ix ligands | |
| WO2024052431A1 (en) | Prostate specific membrane antigen (psma) ligands and use thereof | |
| CN118591549A (zh) | 碳酸酐酶ix配位体 |