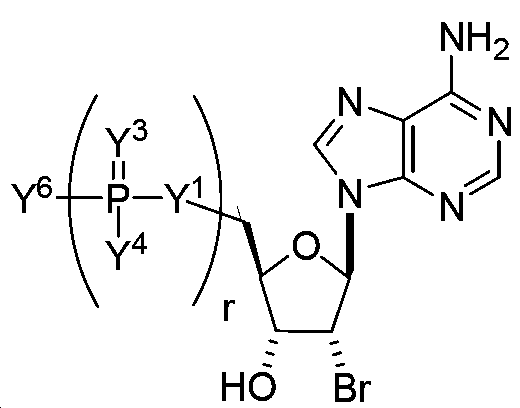
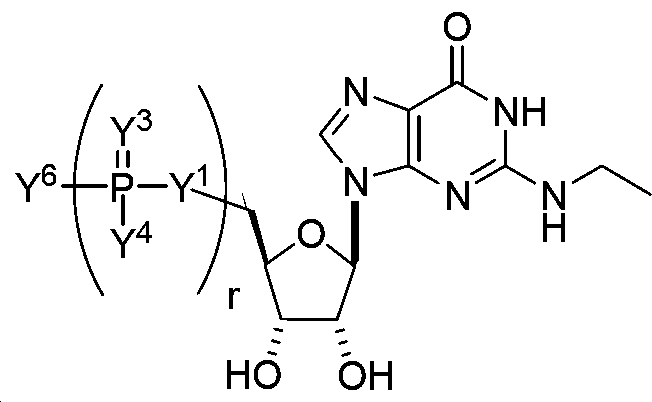
KR20140068245A - 변형된 뉴클레오사이드, 뉴클레오타이드, 및 핵산, 및 이들의 용도 - Google Patents
변형된 뉴클레오사이드, 뉴클레오타이드, 및 핵산, 및 이들의 용도 Download PDFInfo
- Publication number
- KR20140068245A KR20140068245A KR1020147011467A KR20147011467A KR20140068245A KR 20140068245 A KR20140068245 A KR 20140068245A KR 1020147011467 A KR1020147011467 A KR 1020147011467A KR 20147011467 A KR20147011467 A KR 20147011467A KR 20140068245 A KR20140068245 A KR 20140068245A
- Authority
- KR
- South Korea
- Prior art keywords
- optionally substituted
- formula
- alkyl
- independently
- isolated polynucleotide
- Prior art date
Links
- 125000003729 nucleotide group Chemical group 0.000 title claims abstract description 207
- 239000002773 nucleotide Substances 0.000 title claims abstract description 147
- 125000003835 nucleoside group Chemical group 0.000 title claims abstract description 75
- 150000007523 nucleic acids Chemical class 0.000 title abstract description 227
- 102000039446 nucleic acids Human genes 0.000 title abstract description 214
- 108020004707 nucleic acids Proteins 0.000 title abstract description 214
- 238000000034 method Methods 0.000 claims abstract description 116
- 102000040430 polynucleotide Human genes 0.000 claims description 194
- 108091033319 polynucleotide Proteins 0.000 claims description 194
- 239000002157 polynucleotide Substances 0.000 claims description 194
- 125000000547 substituted alkyl group Chemical group 0.000 claims description 173
- 150000001875 compounds Chemical class 0.000 claims description 154
- 125000005415 substituted alkoxy group Chemical group 0.000 claims description 122
- 210000004027 cell Anatomy 0.000 claims description 119
- 125000000217 alkyl group Chemical group 0.000 claims description 112
- 125000005843 halogen group Chemical group 0.000 claims description 97
- 229910052760 oxygen Inorganic materials 0.000 claims description 95
- 229910052739 hydrogen Inorganic materials 0.000 claims description 91
- -1 cells Proteins 0.000 claims description 87
- 239000002777 nucleoside Substances 0.000 claims description 85
- 229910052717 sulfur Inorganic materials 0.000 claims description 85
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 84
- 229910052799 carbon Inorganic materials 0.000 claims description 78
- 125000005017 substituted alkenyl group Chemical group 0.000 claims description 78
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 74
- 150000003839 salts Chemical class 0.000 claims description 71
- 125000004426 substituted alkynyl group Chemical group 0.000 claims description 71
- 239000000126 substance Substances 0.000 claims description 68
- 229920001184 polypeptide Polymers 0.000 claims description 64
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 63
- 108090000623 proteins and genes Proteins 0.000 claims description 63
- 102000004169 proteins and genes Human genes 0.000 claims description 54
- 125000004103 aminoalkyl group Chemical group 0.000 claims description 53
- 125000000623 heterocyclic group Chemical group 0.000 claims description 51
- 239000000203 mixture Substances 0.000 claims description 50
- 230000027455 binding Effects 0.000 claims description 49
- 150000001413 amino acids Chemical class 0.000 claims description 43
- 125000005021 aminoalkenyl group Chemical group 0.000 claims description 42
- 125000005014 aminoalkynyl group Chemical group 0.000 claims description 42
- 150000003833 nucleoside derivatives Chemical class 0.000 claims description 42
- 125000002947 alkylene group Chemical group 0.000 claims description 40
- 125000003107 substituted aryl group Chemical group 0.000 claims description 40
- 125000003302 alkenyloxy group Chemical group 0.000 claims description 39
- 125000005083 alkoxyalkoxy group Chemical group 0.000 claims description 38
- 229920001223 polyethylene glycol Chemical group 0.000 claims description 38
- 239000002202 Polyethylene glycol Chemical group 0.000 claims description 36
- 229910052757 nitrogen Inorganic materials 0.000 claims description 36
- 125000005078 alkoxycarbonylalkyl group Chemical group 0.000 claims description 34
- 125000004474 heteroalkylene group Chemical group 0.000 claims description 34
- 125000005309 thioalkoxy group Chemical group 0.000 claims description 33
- 150000003573 thiols Chemical class 0.000 claims description 33
- 125000003827 glycol group Chemical group 0.000 claims description 32
- 230000004048 modification Effects 0.000 claims description 31
- 238000012986 modification Methods 0.000 claims description 31
- 125000005133 alkynyloxy group Chemical group 0.000 claims description 28
- 125000002768 hydroxyalkyl group Chemical group 0.000 claims description 27
- 125000001424 substituent group Chemical group 0.000 claims description 25
- 125000005242 carbamoyl alkyl group Chemical group 0.000 claims description 24
- 239000002904 solvent Substances 0.000 claims description 24
- 239000008194 pharmaceutical composition Substances 0.000 claims description 22
- 235000000346 sugar Nutrition 0.000 claims description 22
- 125000003118 aryl group Chemical group 0.000 claims description 21
- 125000003342 alkenyl group Chemical group 0.000 claims description 20
- 125000005016 hydroxyalkynyl group Chemical group 0.000 claims description 20
- 125000002431 aminoalkoxy group Chemical group 0.000 claims description 19
- 125000005020 hydroxyalkenyl group Chemical group 0.000 claims description 19
- 125000000446 sulfanediyl group Chemical group *S* 0.000 claims description 19
- 125000003358 C2-C20 alkenyl group Chemical group 0.000 claims description 16
- 125000004181 carboxyalkyl group Chemical group 0.000 claims description 16
- 125000002252 acyl group Chemical group 0.000 claims description 15
- 125000000304 alkynyl group Chemical group 0.000 claims description 15
- 102000004127 Cytokines Human genes 0.000 claims description 14
- 108090000695 Cytokines Proteins 0.000 claims description 14
- 125000000852 azido group Chemical group *N=[N+]=[N-] 0.000 claims description 14
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 14
- 229910052711 selenium Inorganic materials 0.000 claims description 14
- 229910052770 Uranium Inorganic materials 0.000 claims description 13
- 125000005085 alkoxycarbonylalkoxy group Chemical group 0.000 claims description 13
- 125000004429 atom Chemical group 0.000 claims description 13
- 125000005113 hydroxyalkoxy group Chemical group 0.000 claims description 13
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 13
- 125000005111 carboxyalkoxy group Chemical group 0.000 claims description 12
- 229940029575 guanosine Drugs 0.000 claims description 12
- 125000005080 alkoxycarbonylalkenyl group Chemical group 0.000 claims description 11
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 11
- 239000001257 hydrogen Substances 0.000 claims description 11
- 230000001965 increasing effect Effects 0.000 claims description 11
- 125000001153 fluoro group Chemical group F* 0.000 claims description 10
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 10
- 125000001300 boranyl group Chemical group [H]B([H])[*] 0.000 claims description 9
- 125000005158 carboxyaminoalkyl group Chemical group 0.000 claims description 9
- 125000006649 (C2-C20) alkynyl group Chemical group 0.000 claims description 8
- 125000005041 acyloxyalkyl group Chemical group 0.000 claims description 8
- 125000005086 alkoxycarbonylalkynyl group Chemical group 0.000 claims description 8
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 8
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 7
- 239000012530 fluid Substances 0.000 claims description 7
- 125000001188 haloalkyl group Chemical group 0.000 claims description 7
- 241000124008 Mammalia Species 0.000 claims description 6
- 125000004945 acylaminoalkyl group Chemical group 0.000 claims description 6
- 125000004432 carbon atom Chemical group C* 0.000 claims description 6
- 239000003995 emulsifying agent Substances 0.000 claims description 6
- ZAYHVCMSTBRABG-UHFFFAOYSA-N 5-Methylcytidine Natural products O=C1N=C(N)C(C)=CN1C1C(O)C(O)C(CO)O1 ZAYHVCMSTBRABG-UHFFFAOYSA-N 0.000 claims description 5
- ZAYHVCMSTBRABG-JXOAFFINSA-N 5-methylcytidine Chemical compound O=C1N=C(N)C(C)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 ZAYHVCMSTBRABG-JXOAFFINSA-N 0.000 claims description 5
- 210000001124 body fluid Anatomy 0.000 claims description 5
- 239000010839 body fluid Substances 0.000 claims description 5
- 239000002270 dispersing agent Substances 0.000 claims description 5
- 239000002105 nanoparticle Substances 0.000 claims description 5
- 229920000642 polymer Polymers 0.000 claims description 5
- 150000003230 pyrimidines Chemical class 0.000 claims description 5
- 230000028327 secretion Effects 0.000 claims description 5
- 239000004094 surface-active agent Substances 0.000 claims description 5
- UGQMRVRMYYASKQ-KQYNXXCUSA-N Inosine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C2=NC=NC(O)=C2N=C1 UGQMRVRMYYASKQ-KQYNXXCUSA-N 0.000 claims description 4
- 229930010555 Inosine Natural products 0.000 claims description 4
- 108091026898 Leader sequence (mRNA) Proteins 0.000 claims description 4
- 239000003125 aqueous solvent Substances 0.000 claims description 4
- 239000003085 diluting agent Substances 0.000 claims description 4
- 229960003786 inosine Drugs 0.000 claims description 4
- PTJWIQPHWPFNBW-GBNDHIKLSA-N pseudouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1C1=CNC(=O)NC1=O PTJWIQPHWPFNBW-GBNDHIKLSA-N 0.000 claims description 4
- 229910052721 tungsten Inorganic materials 0.000 claims description 4
- UTAIYTHAJQNQDW-KQYNXXCUSA-N 1-methylguanosine Chemical compound C1=NC=2C(=O)N(C)C(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O UTAIYTHAJQNQDW-KQYNXXCUSA-N 0.000 claims description 3
- 241000180579 Arca Species 0.000 claims description 3
- 229930185560 Pseudouridine Natural products 0.000 claims description 3
- PTJWIQPHWPFNBW-UHFFFAOYSA-N Pseudouridine C Natural products OC1C(O)C(CO)OC1C1=CNC(=O)NC1=O PTJWIQPHWPFNBW-UHFFFAOYSA-N 0.000 claims description 3
- 108060008682 Tumor Necrosis Factor Proteins 0.000 claims description 3
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 claims description 3
- 125000002877 alkyl aryl group Chemical group 0.000 claims description 3
- WGDUUQDYDIIBKT-UHFFFAOYSA-N beta-Pseudouridine Natural products OC1OC(CN2C=CC(=O)NC2=O)C(O)C1O WGDUUQDYDIIBKT-UHFFFAOYSA-N 0.000 claims description 3
- 125000001309 chloro group Chemical group Cl* 0.000 claims description 3
- 210000004209 hair Anatomy 0.000 claims description 3
- 238000002347 injection Methods 0.000 claims description 3
- 239000007924 injection Substances 0.000 claims description 3
- 239000007951 isotonicity adjuster Substances 0.000 claims description 3
- 150000002632 lipids Chemical class 0.000 claims description 3
- 210000004909 pre-ejaculatory fluid Anatomy 0.000 claims description 3
- 239000002562 thickening agent Substances 0.000 claims description 3
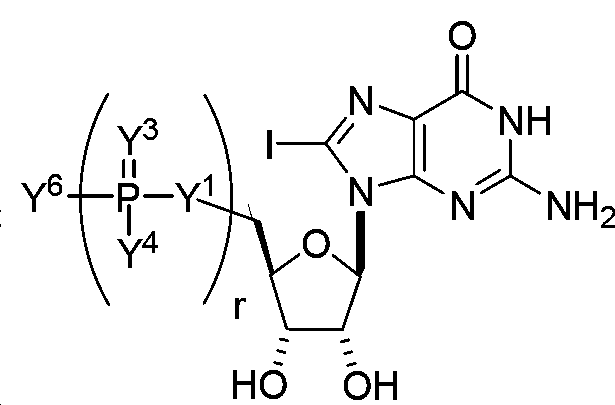
- BGTXMQUSDNMLDW-AEHJODJJSA-N 2-amino-9-[(2r,3s,4r,5r)-3-fluoro-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-3h-purin-6-one Chemical compound C1=2NC(N)=NC(=O)C=2N=CN1[C@@H]1O[C@H](CO)[C@@H](O)[C@]1(O)F BGTXMQUSDNMLDW-AEHJODJJSA-N 0.000 claims description 2
- 102000001974 Hyaluronidases Human genes 0.000 claims description 2
- 108050009363 Hyaluronidases Proteins 0.000 claims description 2
- 102000006992 Interferon-alpha Human genes 0.000 claims description 2
- 108010047761 Interferon-alpha Proteins 0.000 claims description 2
- 208000005228 Pericardial Effusion Diseases 0.000 claims description 2
- RJFAYQIBOAGBLC-BYPYZUCNSA-N Selenium-L-methionine Chemical compound C[Se]CC[C@H](N)C(O)=O RJFAYQIBOAGBLC-BYPYZUCNSA-N 0.000 claims description 2
- RJFAYQIBOAGBLC-UHFFFAOYSA-N Selenomethionine Natural products C[Se]CCC(N)C(O)=O RJFAYQIBOAGBLC-UHFFFAOYSA-N 0.000 claims description 2
- 150000001409 amidines Chemical class 0.000 claims description 2
- 150000001412 amines Chemical class 0.000 claims description 2
- 210000004381 amniotic fluid Anatomy 0.000 claims description 2
- 210000003567 ascitic fluid Anatomy 0.000 claims description 2
- 210000000941 bile Anatomy 0.000 claims description 2
- 210000004952 blastocoel Anatomy 0.000 claims description 2
- 210000001175 cerebrospinal fluid Anatomy 0.000 claims description 2
- 210000002939 cerumen Anatomy 0.000 claims description 2
- 210000003756 cervix mucus Anatomy 0.000 claims description 2
- 210000001268 chyle Anatomy 0.000 claims description 2
- 210000004913 chyme Anatomy 0.000 claims description 2
- 239000011258 core-shell material Substances 0.000 claims description 2
- 125000004093 cyano group Chemical class *C#N 0.000 claims description 2
- 210000002726 cyst fluid Anatomy 0.000 claims description 2
- 239000002612 dispersion medium Substances 0.000 claims description 2
- 210000003722 extracellular fluid Anatomy 0.000 claims description 2
- 210000003608 fece Anatomy 0.000 claims description 2
- 238000007918 intramuscular administration Methods 0.000 claims description 2
- 239000002502 liposome Substances 0.000 claims description 2
- 210000002751 lymph Anatomy 0.000 claims description 2
- 230000005906 menstruation Effects 0.000 claims description 2
- 210000004912 pericardial fluid Anatomy 0.000 claims description 2
- 210000004910 pleural fluid Anatomy 0.000 claims description 2
- 210000004915 pus Anatomy 0.000 claims description 2
- 230000005855 radiation Effects 0.000 claims description 2
- 210000002374 sebum Anatomy 0.000 claims description 2
- 229960002718 selenomethionine Drugs 0.000 claims description 2
- 238000007920 subcutaneous administration Methods 0.000 claims description 2
- 125000005346 substituted cycloalkyl group Chemical group 0.000 claims description 2
- 239000000725 suspension Substances 0.000 claims description 2
- 210000004243 sweat Anatomy 0.000 claims description 2
- 210000001138 tear Anatomy 0.000 claims description 2
- 210000002700 urine Anatomy 0.000 claims description 2
- 230000008673 vomiting Effects 0.000 claims description 2
- 125000004356 hydroxy functional group Chemical group O* 0.000 claims 14
- 210000002966 serum Anatomy 0.000 claims 4
- ASAADZNSXOCOCZ-MXSWDONDSA-N (2s,3s,4r,5r)-5-(2-amino-6-oxo-3h-purin-9-yl)-3,4-dihydroxyoxolane-2-carboxylic acid Chemical compound C1=NC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](C(O)=O)[C@@H](O)[C@H]1O ASAADZNSXOCOCZ-MXSWDONDSA-N 0.000 claims 1
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 claims 1
- 206010036790 Productive cough Diseases 0.000 claims 1
- 108091036066 Three prime untranslated region Proteins 0.000 claims 1
- 206010047700 Vomiting Diseases 0.000 claims 1
- 210000001185 bone marrow Anatomy 0.000 claims 1
- 238000005461 lubrication Methods 0.000 claims 1
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 claims 1
- OHDXDNUPVVYWOV-UHFFFAOYSA-N n-methyl-1-(2-naphthalen-1-ylsulfanylphenyl)methanamine Chemical compound CNCC1=CC=CC=C1SC1=CC=CC2=CC=CC=C12 OHDXDNUPVVYWOV-UHFFFAOYSA-N 0.000 claims 1
- 210000001819 pancreatic juice Anatomy 0.000 claims 1
- 210000005259 peripheral blood Anatomy 0.000 claims 1
- 239000011886 peripheral blood Substances 0.000 claims 1
- 210000002381 plasma Anatomy 0.000 claims 1
- 210000003296 saliva Anatomy 0.000 claims 1
- 210000003802 sputum Anatomy 0.000 claims 1
- 208000024794 sputum Diseases 0.000 claims 1
- 238000002604 ultrasonography Methods 0.000 claims 1
- 206010057190 Respiratory tract infections Diseases 0.000 description 159
- 108020004999 messenger RNA Proteins 0.000 description 58
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 55
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 54
- 235000018102 proteins Nutrition 0.000 description 49
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 45
- 229940024606 amino acid Drugs 0.000 description 35
- 235000001014 amino acid Nutrition 0.000 description 35
- 229920002477 rna polymer Polymers 0.000 description 35
- 238000006243 chemical reaction Methods 0.000 description 33
- 125000005647 linker group Chemical group 0.000 description 32
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 31
- 239000003814 drug Substances 0.000 description 27
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 25
- 230000014616 translation Effects 0.000 description 24
- 229940104302 cytosine Drugs 0.000 description 23
- 229940124597 therapeutic agent Drugs 0.000 description 23
- DRTQHJPVMGBUCF-XVFCMESISA-N Uridine Chemical class O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-XVFCMESISA-N 0.000 description 21
- 229940035893 uracil Drugs 0.000 description 21
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 20
- 239000002585 base Substances 0.000 description 20
- 108020004414 DNA Proteins 0.000 description 19
- 102000053602 DNA Human genes 0.000 description 19
- 239000011669 selenium Substances 0.000 description 18
- 239000003795 chemical substances by application Substances 0.000 description 17
- 230000014509 gene expression Effects 0.000 description 17
- 230000015788 innate immune response Effects 0.000 description 16
- 230000003993 interaction Effects 0.000 description 16
- 238000003786 synthesis reaction Methods 0.000 description 16
- 230000015572 biosynthetic process Effects 0.000 description 15
- 230000002829 reductive effect Effects 0.000 description 15
- 229930024421 Adenine Natural products 0.000 description 14
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 14
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 14
- 229960000643 adenine Drugs 0.000 description 14
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 14
- 125000004043 oxo group Chemical group O=* 0.000 description 14
- 239000002126 C01EB10 - Adenosine Substances 0.000 description 13
- 229960005305 adenosine Drugs 0.000 description 13
- 239000003755 preservative agent Substances 0.000 description 13
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 12
- NYHBQMYGNKIUIF-UUOKFMHZSA-N Guanosine Chemical compound C1=NC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O NYHBQMYGNKIUIF-UUOKFMHZSA-N 0.000 description 12
- 108091028043 Nucleic acid sequence Proteins 0.000 description 12
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 12
- 238000007385 chemical modification Methods 0.000 description 12
- UHDGCWIWMRVCDJ-ZAKLUEHWSA-N cytidine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O1 UHDGCWIWMRVCDJ-ZAKLUEHWSA-N 0.000 description 12
- 229940045145 uridine Drugs 0.000 description 12
- 239000002299 complementary DNA Substances 0.000 description 11
- 238000001727 in vivo Methods 0.000 description 11
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 10
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 10
- 150000004703 alkoxides Chemical class 0.000 description 10
- 239000001768 carboxy methyl cellulose Substances 0.000 description 10
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 10
- 238000004128 high performance liquid chromatography Methods 0.000 description 10
- 230000028993 immune response Effects 0.000 description 10
- 239000000463 material Substances 0.000 description 10
- 125000006239 protecting group Chemical group 0.000 description 10
- 210000001519 tissue Anatomy 0.000 description 10
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 9
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 9
- DRTQHJPVMGBUCF-PSQAKQOGSA-N beta-L-uridine Natural products O[C@H]1[C@@H](O)[C@H](CO)O[C@@H]1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-PSQAKQOGSA-N 0.000 description 9
- 201000010099 disease Diseases 0.000 description 9
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 9
- 230000000694 effects Effects 0.000 description 9
- 238000003384 imaging method Methods 0.000 description 9
- 238000000338 in vitro Methods 0.000 description 9
- 230000008569 process Effects 0.000 description 9
- DRTQHJPVMGBUCF-UHFFFAOYSA-N uracil arabinoside Natural products OC1C(O)C(CO)OC1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-UHFFFAOYSA-N 0.000 description 9
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 8
- 230000015556 catabolic process Effects 0.000 description 8
- 238000006731 degradation reaction Methods 0.000 description 8
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 8
- 230000006870 function Effects 0.000 description 8
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 8
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 8
- LFGREXWGYUGZLY-UHFFFAOYSA-N phosphoryl Chemical group [P]=O LFGREXWGYUGZLY-UHFFFAOYSA-N 0.000 description 8
- 230000001225 therapeutic effect Effects 0.000 description 8
- 238000013519 translation Methods 0.000 description 8
- 125000004044 trifluoroacetyl group Chemical group FC(C(=O)*)(F)F 0.000 description 8
- UHDGCWIWMRVCDJ-UHFFFAOYSA-N 1-beta-D-Xylofuranosyl-NH-Cytosine Natural products O=C1N=C(N)C=CN1C1C(O)C(O)C(CO)O1 UHDGCWIWMRVCDJ-UHFFFAOYSA-N 0.000 description 7
- UHDGCWIWMRVCDJ-PSQAKQOGSA-N Cytidine Natural products O=C1N=C(N)C=CN1[C@@H]1[C@@H](O)[C@@H](O)[C@H](CO)O1 UHDGCWIWMRVCDJ-PSQAKQOGSA-N 0.000 description 7
- 102000004190 Enzymes Human genes 0.000 description 7
- 108090000790 Enzymes Proteins 0.000 description 7
- 229910019142 PO4 Inorganic materials 0.000 description 7
- 229920002472 Starch Polymers 0.000 description 7
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 7
- 125000003545 alkoxy group Chemical group 0.000 description 7
- 238000004458 analytical method Methods 0.000 description 7
- 235000019441 ethanol Nutrition 0.000 description 7
- 230000003834 intracellular effect Effects 0.000 description 7
- 230000000670 limiting effect Effects 0.000 description 7
- 238000004519 manufacturing process Methods 0.000 description 7
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 7
- 235000021317 phosphate Nutrition 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- 235000019698 starch Nutrition 0.000 description 7
- 229940032147 starch Drugs 0.000 description 7
- 239000008107 starch Substances 0.000 description 7
- PEHVGBZKEYRQSX-UHFFFAOYSA-N 7-deaza-adenine Chemical compound NC1=NC=NC2=C1C=CN2 PEHVGBZKEYRQSX-UHFFFAOYSA-N 0.000 description 6
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 6
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 6
- 241000282412 Homo Species 0.000 description 6
- 241001465754 Metazoa Species 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 6
- 239000002253 acid Substances 0.000 description 6
- 239000004480 active ingredient Substances 0.000 description 6
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 6
- 238000003776 cleavage reaction Methods 0.000 description 6
- 230000014759 maintenance of location Effects 0.000 description 6
- 239000001301 oxygen Substances 0.000 description 6
- 239000010452 phosphate Substances 0.000 description 6
- 230000004952 protein activity Effects 0.000 description 6
- 102000005962 receptors Human genes 0.000 description 6
- 108020003175 receptors Proteins 0.000 description 6
- 230000007017 scission Effects 0.000 description 6
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 6
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 6
- 125000004964 sulfoalkyl group Chemical group 0.000 description 6
- 230000002194 synthesizing effect Effects 0.000 description 6
- MIKUYHXYGGJMLM-GIMIYPNGSA-N Crotonoside Natural products C1=NC2=C(N)NC(=O)N=C2N1[C@H]1O[C@@H](CO)[C@H](O)[C@@H]1O MIKUYHXYGGJMLM-GIMIYPNGSA-N 0.000 description 5
- NYHBQMYGNKIUIF-UHFFFAOYSA-N D-guanosine Natural products C1=2NC(N)=NC(=O)C=2N=CN1C1OC(CO)C(O)C1O NYHBQMYGNKIUIF-UHFFFAOYSA-N 0.000 description 5
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 5
- 102100039619 Granulocyte colony-stimulating factor Human genes 0.000 description 5
- 241000700605 Viruses Species 0.000 description 5
- 125000002015 acyclic group Chemical group 0.000 description 5
- 235000012000 cholesterol Nutrition 0.000 description 5
- 230000000875 corresponding effect Effects 0.000 description 5
- 230000003247 decreasing effect Effects 0.000 description 5
- 238000010511 deprotection reaction Methods 0.000 description 5
- XPPKVPWEQAFLFU-UHFFFAOYSA-J diphosphate(4-) Chemical compound [O-]P([O-])(=O)OP([O-])([O-])=O XPPKVPWEQAFLFU-UHFFFAOYSA-J 0.000 description 5
- 235000011180 diphosphates Nutrition 0.000 description 5
- 125000001072 heteroaryl group Chemical group 0.000 description 5
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 5
- 230000001976 improved effect Effects 0.000 description 5
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 5
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 5
- 210000004940 nucleus Anatomy 0.000 description 5
- 150000004713 phosphodiesters Chemical class 0.000 description 5
- 239000000376 reactant Substances 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 238000006722 reduction reaction Methods 0.000 description 5
- 210000003705 ribosome Anatomy 0.000 description 5
- 229910021653 sulphate ion Inorganic materials 0.000 description 5
- 238000001890 transfection Methods 0.000 description 5
- WRMNZCZEMHIOCP-UHFFFAOYSA-N 2-phenylethanol Chemical compound OCCC1=CC=CC=C1 WRMNZCZEMHIOCP-UHFFFAOYSA-N 0.000 description 4
- CFKMVGJGLGKFKI-UHFFFAOYSA-N 4-chloro-m-cresol Chemical compound CC1=CC(O)=CC=C1Cl CFKMVGJGLGKFKI-UHFFFAOYSA-N 0.000 description 4
- HCGHYQLFMPXSDU-UHFFFAOYSA-N 7-methyladenine Chemical compound C1=NC(N)=C2N(C)C=NC2=N1 HCGHYQLFMPXSDU-UHFFFAOYSA-N 0.000 description 4
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 4
- 206010010356 Congenital anomaly Diseases 0.000 description 4
- 102000012605 Cystic Fibrosis Transmembrane Conductance Regulator Human genes 0.000 description 4
- 108010079245 Cystic Fibrosis Transmembrane Conductance Regulator Proteins 0.000 description 4
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 4
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 4
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 4
- 102000014150 Interferons Human genes 0.000 description 4
- 108010050904 Interferons Proteins 0.000 description 4
- 108010007622 LDL Lipoproteins Proteins 0.000 description 4
- 102000007330 LDL Lipoproteins Human genes 0.000 description 4
- 238000005481 NMR spectroscopy Methods 0.000 description 4
- 108091093037 Peptide nucleic acid Proteins 0.000 description 4
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 4
- 229920002125 Sokalan® Polymers 0.000 description 4
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 4
- 230000002159 abnormal effect Effects 0.000 description 4
- 150000007513 acids Chemical class 0.000 description 4
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical compound C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 235000010443 alginic acid Nutrition 0.000 description 4
- 229920000615 alginic acid Polymers 0.000 description 4
- 125000003277 amino group Chemical group 0.000 description 4
- 238000003556 assay Methods 0.000 description 4
- 229910052789 astatine Inorganic materials 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 4
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 4
- 230000001413 cellular effect Effects 0.000 description 4
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 4
- 239000000306 component Substances 0.000 description 4
- 231100000599 cytotoxic agent Toxicity 0.000 description 4
- 238000001514 detection method Methods 0.000 description 4
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 4
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 4
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 4
- 230000006698 induction Effects 0.000 description 4
- 230000001939 inductive effect Effects 0.000 description 4
- 239000003112 inhibitor Substances 0.000 description 4
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 4
- 239000003446 ligand Substances 0.000 description 4
- 238000004949 mass spectrometry Methods 0.000 description 4
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 4
- 108091070501 miRNA Proteins 0.000 description 4
- 239000002679 microRNA Substances 0.000 description 4
- 230000035772 mutation Effects 0.000 description 4
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 125000002652 ribonucleotide group Chemical group 0.000 description 4
- 150000003290 ribose derivatives Chemical class 0.000 description 4
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 239000007858 starting material Substances 0.000 description 4
- 150000008163 sugars Chemical class 0.000 description 4
- 239000011593 sulfur Substances 0.000 description 4
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 3
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 3
- UVBYMVOUBXYSFV-XUTVFYLZSA-N 1-methylpseudouridine Chemical compound O=C1NC(=O)N(C)C=C1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 UVBYMVOUBXYSFV-XUTVFYLZSA-N 0.000 description 3
- 108020005345 3' Untranslated Regions Proteins 0.000 description 3
- DXEJZRDJXRVUPN-XUTVFYLZSA-N 3-Methylpseudouridine Chemical compound O=C1N(C)C(=O)NC=C1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 DXEJZRDJXRVUPN-XUTVFYLZSA-N 0.000 description 3
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 108700028369 Alleles Proteins 0.000 description 3
- 239000004322 Butylated hydroxytoluene Substances 0.000 description 3
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 3
- 108010078791 Carrier Proteins Proteins 0.000 description 3
- 108010051109 Cell-Penetrating Peptides Proteins 0.000 description 3
- 102000020313 Cell-Penetrating Peptides Human genes 0.000 description 3
- 229920002261 Corn starch Polymers 0.000 description 3
- 201000003883 Cystic fibrosis Diseases 0.000 description 3
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical group OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 3
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 3
- 241000710198 Foot-and-mouth disease virus Species 0.000 description 3
- 108091093094 Glycol nucleic acid Proteins 0.000 description 3
- 238000008214 LDL Cholesterol Methods 0.000 description 3
- 229930195725 Mannitol Chemical group 0.000 description 3
- 108060004795 Methyltransferase Proteins 0.000 description 3
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 3
- 102000007399 Nuclear hormone receptor Human genes 0.000 description 3
- 108020005497 Nuclear hormone receptor Proteins 0.000 description 3
- 101710163270 Nuclease Proteins 0.000 description 3
- 108091030071 RNAI Proteins 0.000 description 3
- 108091028664 Ribonucleotide Proteins 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- PZBFGYYEXUXCOF-UHFFFAOYSA-N TCEP Chemical compound OC(=O)CCP(CCC(O)=O)CCC(O)=O PZBFGYYEXUXCOF-UHFFFAOYSA-N 0.000 description 3
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 3
- RYYWUUFWQRZTIU-UHFFFAOYSA-N Thiophosphoric acid Chemical class OP(O)(S)=O RYYWUUFWQRZTIU-UHFFFAOYSA-N 0.000 description 3
- 108091046915 Threose nucleic acid Proteins 0.000 description 3
- 102000002689 Toll-like receptor Human genes 0.000 description 3
- 108020000411 Toll-like receptor Proteins 0.000 description 3
- VGQOVCHZGQWAOI-UHFFFAOYSA-N UNPD55612 Natural products N1C(O)C2CC(C=CC(N)=O)=CN2C(=O)C2=CC=C(C)C(O)=C12 VGQOVCHZGQWAOI-UHFFFAOYSA-N 0.000 description 3
- 230000002378 acidificating effect Effects 0.000 description 3
- 239000000783 alginic acid Substances 0.000 description 3
- 229960001126 alginic acid Drugs 0.000 description 3
- 150000004781 alginic acids Chemical class 0.000 description 3
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 3
- VGQOVCHZGQWAOI-HYUHUPJXSA-N anthramycin Chemical compound N1[C@@H](O)[C@@H]2CC(\C=C\C(N)=O)=CN2C(=O)C2=CC=C(C)C(O)=C12 VGQOVCHZGQWAOI-HYUHUPJXSA-N 0.000 description 3
- 239000003963 antioxidant agent Substances 0.000 description 3
- 235000006708 antioxidants Nutrition 0.000 description 3
- 235000010323 ascorbic acid Nutrition 0.000 description 3
- 229960005070 ascorbic acid Drugs 0.000 description 3
- 239000011668 ascorbic acid Substances 0.000 description 3
- MVCRZALXJBDOKF-JPZHCBQBSA-N beta-hydroxywybutosine 5'-monophosphate Chemical compound C1=NC=2C(=O)N3C(CC(O)[C@H](NC(=O)OC)C(=O)OC)=C(C)N=C3N(C)C=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@H]1O MVCRZALXJBDOKF-JPZHCBQBSA-N 0.000 description 3
- 239000011230 binding agent Substances 0.000 description 3
- 235000010354 butylated hydroxytoluene Nutrition 0.000 description 3
- 229940095259 butylated hydroxytoluene Drugs 0.000 description 3
- 229910000019 calcium carbonate Inorganic materials 0.000 description 3
- 229960003563 calcium carbonate Drugs 0.000 description 3
- 235000010216 calcium carbonate Nutrition 0.000 description 3
- 235000013927 calcium gluconate Nutrition 0.000 description 3
- 239000004227 calcium gluconate Substances 0.000 description 3
- 229960004494 calcium gluconate Drugs 0.000 description 3
- NEEHYRZPVYRGPP-UHFFFAOYSA-L calcium;2,3,4,5,6-pentahydroxyhexanoate Chemical compound [Ca+2].OCC(O)C(O)C(O)C(O)C([O-])=O.OCC(O)C(O)C(O)C(O)C([O-])=O NEEHYRZPVYRGPP-UHFFFAOYSA-L 0.000 description 3
- 150000001721 carbon Chemical group 0.000 description 3
- 239000002738 chelating agent Substances 0.000 description 3
- 125000003636 chemical group Chemical group 0.000 description 3
- 239000003638 chemical reducing agent Substances 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 235000019868 cocoa butter Nutrition 0.000 description 3
- 229940110456 cocoa butter Drugs 0.000 description 3
- 229940125904 compound 1 Drugs 0.000 description 3
- 229940125782 compound 2 Drugs 0.000 description 3
- 239000002872 contrast media Substances 0.000 description 3
- 239000008120 corn starch Substances 0.000 description 3
- 229960000684 cytarabine Drugs 0.000 description 3
- 229940127089 cytotoxic agent Drugs 0.000 description 3
- 239000002619 cytotoxin Substances 0.000 description 3
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 3
- 230000007423 decrease Effects 0.000 description 3
- 235000014113 dietary fatty acids Nutrition 0.000 description 3
- MTHSVFCYNBDYFN-UHFFFAOYSA-N diethylene glycol Chemical compound OCCOCCO MTHSVFCYNBDYFN-UHFFFAOYSA-N 0.000 description 3
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 3
- 239000007884 disintegrant Substances 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 230000002255 enzymatic effect Effects 0.000 description 3
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 3
- 229960004756 ethanol Drugs 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N ethylene glycol Natural products OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- 229930195729 fatty acid Natural products 0.000 description 3
- 239000000194 fatty acid Substances 0.000 description 3
- 238000010575 fractional recrystallization Methods 0.000 description 3
- 239000012634 fragment Substances 0.000 description 3
- 230000030279 gene silencing Effects 0.000 description 3
- 230000009368 gene silencing by RNA Effects 0.000 description 3
- 238000007429 general method Methods 0.000 description 3
- 210000005260 human cell Anatomy 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 150000002500 ions Chemical class 0.000 description 3
- UQSXHKLRYXJYBZ-UHFFFAOYSA-N iron oxide Inorganic materials [Fe]=O UQSXHKLRYXJYBZ-UHFFFAOYSA-N 0.000 description 3
- 239000000314 lubricant Substances 0.000 description 3
- 239000001630 malic acid Substances 0.000 description 3
- 235000011090 malic acid Nutrition 0.000 description 3
- 229940099690 malic acid Drugs 0.000 description 3
- 239000000594 mannitol Chemical group 0.000 description 3
- 235000010355 mannitol Nutrition 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- 239000003921 oil Substances 0.000 description 3
- 235000019198 oils Nutrition 0.000 description 3
- 239000002674 ointment Substances 0.000 description 3
- 229920000136 polysorbate Polymers 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 3
- 239000002336 ribonucleotide Substances 0.000 description 3
- 125000000548 ribosyl group Chemical group C1([C@H](O)[C@H](O)[C@H](O1)CO)* 0.000 description 3
- 239000011734 sodium Substances 0.000 description 3
- 229910052708 sodium Inorganic materials 0.000 description 3
- 235000015424 sodium Nutrition 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 235000002906 tartaric acid Nutrition 0.000 description 3
- 239000011975 tartaric acid Substances 0.000 description 3
- 229960001367 tartaric acid Drugs 0.000 description 3
- ABZLKHKQJHEPAX-UHFFFAOYSA-N tetramethylrhodamine Chemical compound C=12C=CC(N(C)C)=CC2=[O+]C2=CC(N(C)C)=CC=C2C=1C1=CC=CC=C1C([O-])=O ABZLKHKQJHEPAX-UHFFFAOYSA-N 0.000 description 3
- 125000003396 thiol group Chemical group [H]S* 0.000 description 3
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 3
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 3
- 239000013598 vector Substances 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- 239000001993 wax Substances 0.000 description 3
- GVJHHUAWPYXKBD-IEOSBIPESA-N α-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 3
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 2
- DNISEZBAYYIQFB-PHDIDXHHSA-N (2r,3r)-2,3-diacetyloxybutanedioic acid Chemical compound CC(=O)O[C@@H](C(O)=O)[C@H](C(O)=O)OC(C)=O DNISEZBAYYIQFB-PHDIDXHHSA-N 0.000 description 2
- KYJLJOJCMUFWDY-UUOKFMHZSA-N (2r,3r,4s,5r)-2-(6-amino-8-azidopurin-9-yl)-5-(hydroxymethyl)oxolane-3,4-diol Chemical compound [N-]=[N+]=NC1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O KYJLJOJCMUFWDY-UUOKFMHZSA-N 0.000 description 2
- JZSSTKLEXRQFEA-HEIFUQTGSA-N (2s,3r,4s,5r)-2-(6-aminopurin-9-yl)-3,4-dihydroxy-5-(hydroxymethyl)oxolane-2-carboxamide Chemical compound C1=NC2=C(N)N=CN=C2N1[C@]1(C(=O)N)O[C@H](CO)[C@@H](O)[C@H]1O JZSSTKLEXRQFEA-HEIFUQTGSA-N 0.000 description 2
- 125000003837 (C1-C20) alkyl group Chemical group 0.000 description 2
- IAKHMKGGTNLKSZ-INIZCTEOSA-N (S)-colchicine Chemical compound C1([C@@H](NC(C)=O)CC2)=CC(=O)C(OC)=CC=C1C1=C2C=C(OC)C(OC)=C1OC IAKHMKGGTNLKSZ-INIZCTEOSA-N 0.000 description 2
- UEJHQHNFRZXWRD-UAKXSSHOSA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-(trifluoromethyl)pyrimidine-2,4-dione Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(C(F)(F)F)=C1 UEJHQHNFRZXWRD-UAKXSSHOSA-N 0.000 description 2
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- QUKPALAWEPMWOS-UHFFFAOYSA-N 1h-pyrazolo[3,4-d]pyrimidine Chemical class C1=NC=C2C=NNC2=N1 QUKPALAWEPMWOS-UHFFFAOYSA-N 0.000 description 2
- UZYQSNQJLWTICD-UHFFFAOYSA-N 2-(n-benzoylanilino)-2,2-dinitroacetic acid Chemical compound C=1C=CC=CC=1N(C(C(=O)O)([N+]([O-])=O)[N+]([O-])=O)C(=O)C1=CC=CC=C1 UZYQSNQJLWTICD-UHFFFAOYSA-N 0.000 description 2
- FZWGECJQACGGTI-UHFFFAOYSA-N 2-amino-7-methyl-1,7-dihydro-6H-purin-6-one Chemical compound NC1=NC(O)=C2N(C)C=NC2=N1 FZWGECJQACGGTI-UHFFFAOYSA-N 0.000 description 2
- MWBWWFOAEOYUST-UHFFFAOYSA-N 2-aminopurine Chemical compound NC1=NC=C2N=CNC2=N1 MWBWWFOAEOYUST-UHFFFAOYSA-N 0.000 description 2
- KMGUEILFFWDGFV-UHFFFAOYSA-N 2-benzoyl-2-benzoyloxy-3-hydroxybutanedioic acid Chemical compound C=1C=CC=CC=1C(=O)C(C(C(O)=O)O)(C(O)=O)OC(=O)C1=CC=CC=C1 KMGUEILFFWDGFV-UHFFFAOYSA-N 0.000 description 2
- YIZYCHKPHCPKHZ-PNHWDRBUSA-N 5-methoxycarbonylmethyluridine Chemical compound O=C1NC(=O)C(CC(=O)OC)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 YIZYCHKPHCPKHZ-PNHWDRBUSA-N 0.000 description 2
- 229920001817 Agar Polymers 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- 241000272517 Anseriformes Species 0.000 description 2
- 108020005544 Antisense RNA Proteins 0.000 description 2
- 102100037435 Antiviral innate immune response receptor RIG-I Human genes 0.000 description 2
- 101710127675 Antiviral innate immune response receptor RIG-I Proteins 0.000 description 2
- 108091023037 Aptamer Proteins 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 241000271566 Aves Species 0.000 description 2
- QFOHBWFCKVYLES-UHFFFAOYSA-N Butylparaben Chemical compound CCCCOC(=O)C1=CC=C(O)C=C1 QFOHBWFCKVYLES-UHFFFAOYSA-N 0.000 description 2
- 101710167800 Capsid assembly scaffolding protein Proteins 0.000 description 2
- 108090000994 Catalytic RNA Proteins 0.000 description 2
- 102000053642 Catalytic RNA Human genes 0.000 description 2
- LZZYPRNAOMGNLH-UHFFFAOYSA-M Cetrimonium bromide Chemical compound [Br-].CCCCCCCCCCCCCCCC[N+](C)(C)C LZZYPRNAOMGNLH-UHFFFAOYSA-M 0.000 description 2
- 108010049048 Cholera Toxin Proteins 0.000 description 2
- 102000009016 Cholera Toxin Human genes 0.000 description 2
- 235000010919 Copernicia prunifera Nutrition 0.000 description 2
- 244000180278 Copernicia prunifera Species 0.000 description 2
- 235000001543 Corylus americana Nutrition 0.000 description 2
- 235000007466 Corylus avellana Nutrition 0.000 description 2
- 241000710127 Cricket paralysis virus Species 0.000 description 2
- 101710112752 Cytotoxin Proteins 0.000 description 2
- YTBSYETUWUMLBZ-UHFFFAOYSA-N D-Erythrose Natural products OCC(O)C(O)C=O YTBSYETUWUMLBZ-UHFFFAOYSA-N 0.000 description 2
- YTBSYETUWUMLBZ-IUYQGCFVSA-N D-erythrose Chemical compound OC[C@@H](O)[C@@H](O)C=O YTBSYETUWUMLBZ-IUYQGCFVSA-N 0.000 description 2
- 108010092160 Dactinomycin Proteins 0.000 description 2
- 108091027757 Deoxyribozyme Proteins 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- 108010016626 Dipeptides Proteins 0.000 description 2
- 206010056474 Erythrosis Diseases 0.000 description 2
- 239000005977 Ethylene Substances 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- GLZPCOQZEFWAFX-UHFFFAOYSA-N Geraniol Chemical compound CC(C)=CCCC(C)=CCO GLZPCOQZEFWAFX-UHFFFAOYSA-N 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- 241000711549 Hepacivirus C Species 0.000 description 2
- 101001082073 Homo sapiens Interferon-induced helicase C domain-containing protein 1 Proteins 0.000 description 2
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 2
- 238000004566 IR spectroscopy Methods 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- 102100027353 Interferon-induced helicase C domain-containing protein 1 Human genes 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 2
- 240000007472 Leucaena leucocephala Species 0.000 description 2
- 108090001030 Lipoproteins Proteins 0.000 description 2
- 102000004895 Lipoproteins Human genes 0.000 description 2
- 108060001084 Luciferase Proteins 0.000 description 2
- 239000005089 Luciferase Substances 0.000 description 2
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 2
- 241000714177 Murine leukemia virus Species 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- ZBYRSRLCXTUFLJ-IOSLPCCCSA-O N(2),N(7)-dimethylguanosine Chemical compound CNC=1NC(C=2[N+](=CN([C@H]3[C@H](O)[C@H](O)[C@@H](CO)O3)C=2N=1)C)=O ZBYRSRLCXTUFLJ-IOSLPCCCSA-O 0.000 description 2
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 2
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 2
- 206010028980 Neoplasm Diseases 0.000 description 2
- 229930012538 Paclitaxel Natural products 0.000 description 2
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 2
- ABLZXFCXXLZCGV-UHFFFAOYSA-N Phosphorous acid Chemical class OP(O)=O ABLZXFCXXLZCGV-UHFFFAOYSA-N 0.000 description 2
- 108091007412 Piwi-interacting RNA Proteins 0.000 description 2
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 2
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- 101710130420 Probable capsid assembly scaffolding protein Proteins 0.000 description 2
- ZTHYODDOHIVTJV-UHFFFAOYSA-N Propyl gallate Chemical compound CCCOC(=O)C1=CC(O)=C(O)C(O)=C1 ZTHYODDOHIVTJV-UHFFFAOYSA-N 0.000 description 2
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 2
- 238000003332 Raman imaging Methods 0.000 description 2
- AUNGANRZJHBGPY-SCRDCRAPSA-N Riboflavin Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-SCRDCRAPSA-N 0.000 description 2
- 101710204410 Scaffold protein Proteins 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 108091027967 Small hairpin RNA Proteins 0.000 description 2
- 108020004459 Small interfering RNA Proteins 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- RAHZWNYVWXNFOC-UHFFFAOYSA-N Sulphur dioxide Chemical compound O=S=O RAHZWNYVWXNFOC-UHFFFAOYSA-N 0.000 description 2
- 230000024932 T cell mediated immunity Effects 0.000 description 2
- UWHCKJMYHZGTIT-UHFFFAOYSA-N Tetraethylene glycol, Natural products OCCOCCOCCOCCO UWHCKJMYHZGTIT-UHFFFAOYSA-N 0.000 description 2
- 108020004566 Transfer RNA Proteins 0.000 description 2
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 2
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 239000008272 agar Substances 0.000 description 2
- 229940023476 agar Drugs 0.000 description 2
- 235000010419 agar Nutrition 0.000 description 2
- 150000001298 alcohols Chemical class 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- SNAAJJQQZSMGQD-UHFFFAOYSA-N aluminum magnesium Chemical compound [Mg].[Al] SNAAJJQQZSMGQD-UHFFFAOYSA-N 0.000 description 2
- 125000000539 amino acid group Chemical group 0.000 description 2
- 230000000843 anti-fungal effect Effects 0.000 description 2
- 230000000845 anti-microbial effect Effects 0.000 description 2
- 229940121375 antifungal agent Drugs 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 230000006907 apoptotic process Effects 0.000 description 2
- 125000004104 aryloxy group Chemical group 0.000 description 2
- TZCXTZWJZNENPQ-UHFFFAOYSA-L barium sulfate Chemical compound [Ba+2].[O-]S([O-])(=O)=O TZCXTZWJZNENPQ-UHFFFAOYSA-L 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 238000009835 boiling Methods 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 235000019282 butylated hydroxyanisole Nutrition 0.000 description 2
- FUFJGUQYACFECW-UHFFFAOYSA-L calcium hydrogenphosphate Chemical compound [Ca+2].OP([O-])([O-])=O FUFJGUQYACFECW-UHFFFAOYSA-L 0.000 description 2
- MKJXYGKVIBWPFZ-UHFFFAOYSA-L calcium lactate Chemical compound [Ca+2].CC(O)C([O-])=O.CC(O)C([O-])=O MKJXYGKVIBWPFZ-UHFFFAOYSA-L 0.000 description 2
- 235000011086 calcium lactate Nutrition 0.000 description 2
- 239000001527 calcium lactate Substances 0.000 description 2
- 229960002401 calcium lactate Drugs 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 235000011010 calcium phosphates Nutrition 0.000 description 2
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 235000014633 carbohydrates Nutrition 0.000 description 2
- 239000004359 castor oil Substances 0.000 description 2
- 235000019438 castor oil Nutrition 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 230000030833 cell death Effects 0.000 description 2
- 210000000170 cell membrane Anatomy 0.000 description 2
- 229960002798 cetrimide Drugs 0.000 description 2
- 229960001927 cetylpyridinium chloride Drugs 0.000 description 2
- NFCRBQADEGXVDL-UHFFFAOYSA-M cetylpyridinium chloride monohydrate Chemical compound O.[Cl-].CCCCCCCCCCCCCCCC[N+]1=CC=CC=C1 NFCRBQADEGXVDL-UHFFFAOYSA-M 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 229960004926 chlorobutanol Drugs 0.000 description 2
- 229960002242 chlorocresol Drugs 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- ZYGHJZDHTFUPRJ-UHFFFAOYSA-N coumarin Chemical compound C1=CC=C2OC(=O)C=CC2=C1 ZYGHJZDHTFUPRJ-UHFFFAOYSA-N 0.000 description 2
- GLNDAGDHSLMOKX-UHFFFAOYSA-N coumarin 120 Chemical compound C1=C(N)C=CC2=C1OC(=O)C=C2C GLNDAGDHSLMOKX-UHFFFAOYSA-N 0.000 description 2
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 2
- 210000000805 cytoplasm Anatomy 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 229960000975 daunorubicin Drugs 0.000 description 2
- 238000000354 decomposition reaction Methods 0.000 description 2
- 230000002939 deleterious effect Effects 0.000 description 2
- 235000019700 dicalcium phosphate Nutrition 0.000 description 2
- ZPTBLXKRQACLCR-XVFCMESISA-N dihydrouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)CC1 ZPTBLXKRQACLCR-XVFCMESISA-N 0.000 description 2
- NAGJZTKCGNOGPW-UHFFFAOYSA-N dithiophosphoric acid Chemical class OP(O)(S)=S NAGJZTKCGNOGPW-UHFFFAOYSA-N 0.000 description 2
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 2
- 229960004679 doxorubicin Drugs 0.000 description 2
- 239000000975 dye Substances 0.000 description 2
- 229960001484 edetic acid Drugs 0.000 description 2
- MMXKVMNBHPAILY-UHFFFAOYSA-N ethyl laurate Chemical compound CCCCCCCCCCCC(=O)OCC MMXKVMNBHPAILY-UHFFFAOYSA-N 0.000 description 2
- 239000000796 flavoring agent Substances 0.000 description 2
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 230000005714 functional activity Effects 0.000 description 2
- 125000002541 furyl group Chemical group 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 2
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 2
- 229910052737 gold Inorganic materials 0.000 description 2
- 239000010931 gold Substances 0.000 description 2
- 239000003979 granulating agent Substances 0.000 description 2
- 125000001475 halogen functional group Chemical group 0.000 description 2
- 125000005842 heteroatom Chemical group 0.000 description 2
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 2
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 2
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 2
- FDGQSTZJBFJUBT-UHFFFAOYSA-N hypoxanthine Chemical compound O=C1NC=NC2=C1NC=N2 FDGQSTZJBFJUBT-UHFFFAOYSA-N 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 229940079322 interferon Drugs 0.000 description 2
- 229940047124 interferons Drugs 0.000 description 2
- 239000000543 intermediate Substances 0.000 description 2
- 235000013980 iron oxide Nutrition 0.000 description 2
- 150000002540 isothiocyanates Chemical class 0.000 description 2
- 235000014655 lactic acid Nutrition 0.000 description 2
- 239000004310 lactic acid Substances 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 230000004807 localization Effects 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 238000002595 magnetic resonance imaging Methods 0.000 description 2
- 229960002510 mandelic acid Drugs 0.000 description 2
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 2
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 2
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 2
- 229960002216 methylparaben Drugs 0.000 description 2
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 2
- 239000008108 microcrystalline cellulose Substances 0.000 description 2
- 229940016286 microcrystalline cellulose Drugs 0.000 description 2
- 229960004857 mitomycin Drugs 0.000 description 2
- 208000010125 myocardial infarction Diseases 0.000 description 2
- 125000001624 naphthyl group Chemical group 0.000 description 2
- 238000002515 oligonucleotide synthesis Methods 0.000 description 2
- 238000012014 optical coherence tomography Methods 0.000 description 2
- 238000005457 optimization Methods 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 230000001590 oxidative effect Effects 0.000 description 2
- 229960001592 paclitaxel Drugs 0.000 description 2
- 229940067107 phenylethyl alcohol Drugs 0.000 description 2
- 150000008298 phosphoramidates Chemical class 0.000 description 2
- 230000026731 phosphorylation Effects 0.000 description 2
- 238000006366 phosphorylation reaction Methods 0.000 description 2
- 238000006303 photolysis reaction Methods 0.000 description 2
- 230000015843 photosynthesis, light reaction Effects 0.000 description 2
- 229920001983 poloxamer Polymers 0.000 description 2
- 125000003367 polycyclic group Chemical group 0.000 description 2
- 239000011591 potassium Substances 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- 229960003975 potassium Drugs 0.000 description 2
- 235000007686 potassium Nutrition 0.000 description 2
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 2
- RWPGFSMJFRPDDP-UHFFFAOYSA-L potassium metabisulfite Chemical compound [K+].[K+].[O-]S(=O)S([O-])(=O)=O RWPGFSMJFRPDDP-UHFFFAOYSA-L 0.000 description 2
- 229940043349 potassium metabisulfite Drugs 0.000 description 2
- 235000010263 potassium metabisulphite Nutrition 0.000 description 2
- 239000002243 precursor Substances 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 235000019260 propionic acid Nutrition 0.000 description 2
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 2
- 125000000168 pyrrolyl group Chemical group 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 239000012857 radioactive material Substances 0.000 description 2
- 238000003127 radioimmunoassay Methods 0.000 description 2
- 239000002342 ribonucleoside Substances 0.000 description 2
- 108091092562 ribozyme Proteins 0.000 description 2
- 238000007493 shaping process Methods 0.000 description 2
- 239000004055 small Interfering RNA Substances 0.000 description 2
- 235000010413 sodium alginate Nutrition 0.000 description 2
- 239000000661 sodium alginate Substances 0.000 description 2
- 229940005550 sodium alginate Drugs 0.000 description 2
- WXMKPNITSTVMEF-UHFFFAOYSA-M sodium benzoate Chemical compound [Na+].[O-]C(=O)C1=CC=CC=C1 WXMKPNITSTVMEF-UHFFFAOYSA-M 0.000 description 2
- 235000010234 sodium benzoate Nutrition 0.000 description 2
- 239000004299 sodium benzoate Substances 0.000 description 2
- HRZFUMHJMZEROT-UHFFFAOYSA-L sodium disulfite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])(=O)=O HRZFUMHJMZEROT-UHFFFAOYSA-L 0.000 description 2
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 2
- 229940001584 sodium metabisulfite Drugs 0.000 description 2
- 235000010262 sodium metabisulphite Nutrition 0.000 description 2
- 239000001488 sodium phosphate Substances 0.000 description 2
- 229910000162 sodium phosphate Inorganic materials 0.000 description 2
- 235000011008 sodium phosphates Nutrition 0.000 description 2
- 239000008109 sodium starch glycolate Substances 0.000 description 2
- 229920003109 sodium starch glycolate Polymers 0.000 description 2
- 229940079832 sodium starch glycolate Drugs 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 2
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 2
- 238000001931 thermography Methods 0.000 description 2
- 125000001544 thienyl group Chemical group 0.000 description 2
- 238000004809 thin layer chromatography Methods 0.000 description 2
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 2
- ZEMGGZBWXRYJHK-UHFFFAOYSA-N thiouracil Chemical compound O=C1C=CNC(=S)N1 ZEMGGZBWXRYJHK-UHFFFAOYSA-N 0.000 description 2
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 2
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 2
- 238000004448 titration Methods 0.000 description 2
- 108700012359 toxins Proteins 0.000 description 2
- 210000003412 trans-golgi network Anatomy 0.000 description 2
- 238000013518 transcription Methods 0.000 description 2
- 230000035897 transcription Effects 0.000 description 2
- 229960000575 trastuzumab Drugs 0.000 description 2
- 238000011282 treatment Methods 0.000 description 2
- URAYPUMNDPQOKB-UHFFFAOYSA-N triacetin Chemical compound CC(=O)OCC(OC(C)=O)COC(C)=O URAYPUMNDPQOKB-UHFFFAOYSA-N 0.000 description 2
- 230000001960 triggered effect Effects 0.000 description 2
- 238000012285 ultrasound imaging Methods 0.000 description 2
- NQPDZGIKBAWPEJ-UHFFFAOYSA-N valeric acid Chemical compound CCCCC(O)=O NQPDZGIKBAWPEJ-UHFFFAOYSA-N 0.000 description 2
- 229960003636 vidarabine Drugs 0.000 description 2
- 229960003048 vinblastine Drugs 0.000 description 2
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 2
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 2
- 229960004528 vincristine Drugs 0.000 description 2
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 2
- YZSZLBRBVWAXFW-LNYQSQCFSA-N (2R,3R,4S,5R)-2-(2-amino-6-hydroxy-6-methoxy-3H-purin-9-yl)-5-(hydroxymethyl)oxolane-3,4-diol Chemical compound COC1(O)NC(N)=NC2=C1N=CN2[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O YZSZLBRBVWAXFW-LNYQSQCFSA-N 0.000 description 1
- UHLXKKURVBBPRP-IOSLPCCCSA-N (2R,3R,4S,5R)-2-(6-amino-7-methylpurin-9-ium-9-yl)-5-(hydroxymethyl)oxolane-3,4-diol Chemical compound Cn1c[n+]([C@@H]2O[C@H](CO)[C@@H](O)[C@H]2O)c2ncnc(N)c12 UHLXKKURVBBPRP-IOSLPCCCSA-N 0.000 description 1
- ZVVCYWXWKCVZEQ-MCHASIABSA-N (2R,3R,4S,5S)-2-(6-aminopurin-9-yl)-5-(2-hydroxypropan-2-yl)oxolane-3,4-diol Chemical compound O[C@@H]1[C@H](O)[C@@H](C(C)(O)C)O[C@H]1N1C2=NC=NC(N)=C2N=C1 ZVVCYWXWKCVZEQ-MCHASIABSA-N 0.000 description 1
- MJYQFWSXKFLTAY-OVEQLNGDSA-N (2r,3r)-2,3-bis[(4-hydroxy-3-methoxyphenyl)methyl]butane-1,4-diol;(2r,3r,4s,5s,6r)-6-(hydroxymethyl)oxane-2,3,4,5-tetrol Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O.C1=C(O)C(OC)=CC(C[C@@H](CO)[C@H](CO)CC=2C=C(OC)C(O)=CC=2)=C1 MJYQFWSXKFLTAY-OVEQLNGDSA-N 0.000 description 1
- DJONVIMMDYQLKR-WOUKDFQISA-N (2r,3r,4r,5r)-2-(hydroxymethyl)-5-(6-imino-1-methylpurin-9-yl)-4-methoxyoxolan-3-ol Chemical compound CO[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CN(C)C2=N)=C2N=C1 DJONVIMMDYQLKR-WOUKDFQISA-N 0.000 description 1
- IXOXBSCIXZEQEQ-KQYNXXCUSA-N (2r,3r,4s,5r)-2-(2-amino-6-methoxypurin-9-yl)-5-(hydroxymethyl)oxolane-3,4-diol Chemical compound C1=NC=2C(OC)=NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O IXOXBSCIXZEQEQ-KQYNXXCUSA-N 0.000 description 1
- PHFMCMDFWSZKGD-IOSLPCCCSA-N (2r,3s,4r,5r)-2-(hydroxymethyl)-5-[6-(methylamino)-2-methylsulfanylpurin-9-yl]oxolane-3,4-diol Chemical compound C1=NC=2C(NC)=NC(SC)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O PHFMCMDFWSZKGD-IOSLPCCCSA-N 0.000 description 1
- QGKMIGUHVLGJBR-UHFFFAOYSA-M (4z)-1-(3-methylbutyl)-4-[[1-(3-methylbutyl)quinolin-1-ium-4-yl]methylidene]quinoline;iodide Chemical compound [I-].C12=CC=CC=C2N(CCC(C)C)C=CC1=CC1=CC=[N+](CCC(C)C)C2=CC=CC=C12 QGKMIGUHVLGJBR-UHFFFAOYSA-M 0.000 description 1
- ALSTYHKOOCGGFT-KTKRTIGZSA-N (9Z)-octadecen-1-ol Chemical compound CCCCCCCC\C=C/CCCCCCCCO ALSTYHKOOCGGFT-KTKRTIGZSA-N 0.000 description 1
- 125000003161 (C1-C6) alkylene group Chemical group 0.000 description 1
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 1
- DSSYKIVIOFKYAU-XCBNKYQSSA-N (R)-camphor Chemical compound C1C[C@@]2(C)C(=O)C[C@@H]1C2(C)C DSSYKIVIOFKYAU-XCBNKYQSSA-N 0.000 description 1
- ICLYJLBTOGPLMC-KVVVOXFISA-N (z)-octadec-9-enoate;tris(2-hydroxyethyl)azanium Chemical compound OCCN(CCO)CCO.CCCCCCCC\C=C/CCCCCCCC(O)=O ICLYJLBTOGPLMC-KVVVOXFISA-N 0.000 description 1
- ZORQXIQZAOLNGE-UHFFFAOYSA-N 1,1-difluorocyclohexane Chemical compound FC1(F)CCCCC1 ZORQXIQZAOLNGE-UHFFFAOYSA-N 0.000 description 1
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical compound C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 description 1
- FYADHXFMURLYQI-UHFFFAOYSA-N 1,2,4-triazine Chemical compound C1=CN=NC=N1 FYADHXFMURLYQI-UHFFFAOYSA-N 0.000 description 1
- 238000011925 1,2-addition Methods 0.000 description 1
- DTOUUUZOYKYHEP-UHFFFAOYSA-N 1,3-bis(2-ethylhexyl)-5-methyl-1,3-diazinan-5-amine Chemical compound CCCCC(CC)CN1CN(CC(CC)CCCC)CC(C)(N)C1 DTOUUUZOYKYHEP-UHFFFAOYSA-N 0.000 description 1
- DUFUXAHBRPMOFG-UHFFFAOYSA-N 1-(4-anilinonaphthalen-1-yl)pyrrole-2,5-dione Chemical compound O=C1C=CC(=O)N1C(C1=CC=CC=C11)=CC=C1NC1=CC=CC=C1 DUFUXAHBRPMOFG-UHFFFAOYSA-N 0.000 description 1
- OTFGHFBGGZEXEU-PEBGCTIMSA-N 1-[(2r,3r,4r,5r)-4-hydroxy-5-(hydroxymethyl)-3-methoxyoxolan-2-yl]-3-methylpyrimidine-2,4-dione Chemical compound CO[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)N(C)C(=O)C=C1 OTFGHFBGGZEXEU-PEBGCTIMSA-N 0.000 description 1
- ZOEGVPMIKKQYKQ-FJGDRVTGSA-N 1-[(2r,3r,4s,5r)-2,3,4-trihydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidine-2,4-dione Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@@]1(O)N1C(=O)NC(=O)C=C1 ZOEGVPMIKKQYKQ-FJGDRVTGSA-N 0.000 description 1
- VGHXKGWSRNEDEP-OJKLQORTSA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-2,5-bis(hydroxymethyl)oxolan-2-yl]-2,4-dioxopyrimidine-5-carboxylic acid Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)N1C(=O)NC(=O)C(C(O)=O)=C1 VGHXKGWSRNEDEP-OJKLQORTSA-N 0.000 description 1
- KYEKLQMDNZPEFU-KVTDHHQDSA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-1,3,5-triazine-2,4-dione Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)N=C1 KYEKLQMDNZPEFU-KVTDHHQDSA-N 0.000 description 1
- XIJAZGMFHRTBFY-FDDDBJFASA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-2-$l^{1}-selanyl-5-(methylaminomethyl)pyrimidin-4-one Chemical compound [Se]C1=NC(=O)C(CNC)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 XIJAZGMFHRTBFY-FDDDBJFASA-N 0.000 description 1
- UTQUILVPBZEHTK-ZOQUXTDFSA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-3-methylpyrimidine-2,4-dione Chemical compound O=C1N(C)C(=O)C=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 UTQUILVPBZEHTK-ZOQUXTDFSA-N 0.000 description 1
- HXVKEKIORVUWDR-FDDDBJFASA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-(methylaminomethyl)-2-sulfanylidenepyrimidin-4-one Chemical compound S=C1NC(=O)C(CNC)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 HXVKEKIORVUWDR-FDDDBJFASA-N 0.000 description 1
- KJLRIEFCMSGNSI-HKUMRIAESA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-[(3-methylbut-3-enylamino)methyl]-2-sulfanylidenepyrimidin-4-one Chemical compound S=C1NC(=O)C(CNCCC(=C)C)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 KJLRIEFCMSGNSI-HKUMRIAESA-N 0.000 description 1
- RKSLVDIXBGWPIS-UAKXSSHOSA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-iodopyrimidine-2,4-dione Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(I)=C1 RKSLVDIXBGWPIS-UAKXSSHOSA-N 0.000 description 1
- BTFXIEGOSDSOGN-KWCDMSRLSA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-methyl-1,3-diazinane-2,4-dione Chemical compound O=C1NC(=O)C(C)CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 BTFXIEGOSDSOGN-KWCDMSRLSA-N 0.000 description 1
- QLOCVMVCRJOTTM-TURQNECASA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-prop-1-ynylpyrimidine-2,4-dione Chemical compound O=C1NC(=O)C(C#CC)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 QLOCVMVCRJOTTM-TURQNECASA-N 0.000 description 1
- BNXGRQLXOMSOMV-UHFFFAOYSA-N 1-[4-hydroxy-5-(hydroxymethyl)-3-methoxyoxolan-2-yl]-4-(methylamino)pyrimidin-2-one Chemical compound O=C1N=C(NC)C=CN1C1C(OC)C(O)C(CO)O1 BNXGRQLXOMSOMV-UHFFFAOYSA-N 0.000 description 1
- OKMWKBLSFKFYGZ-UHFFFAOYSA-N 1-behenoylglycerol Chemical compound CCCCCCCCCCCCCCCCCCCCCC(=O)OCC(O)CO OKMWKBLSFKFYGZ-UHFFFAOYSA-N 0.000 description 1
- FKKAGFLIPSSCHT-UHFFFAOYSA-N 1-dodecoxydodecane;sulfuric acid Chemical compound OS(O)(=O)=O.CCCCCCCCCCCCOCCCCCCCCCCCC FKKAGFLIPSSCHT-UHFFFAOYSA-N 0.000 description 1
- ZTTARJIAPRWUHH-UHFFFAOYSA-N 1-isothiocyanatoacridine Chemical compound C1=CC=C2C=C3C(N=C=S)=CC=CC3=NC2=C1 ZTTARJIAPRWUHH-UHFFFAOYSA-N 0.000 description 1
- WJNGQIYEQLPJMN-IOSLPCCCSA-N 1-methylinosine Chemical compound C1=NC=2C(=O)N(C)C=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O WJNGQIYEQLPJMN-IOSLPCCCSA-N 0.000 description 1
- UVBYMVOUBXYSFV-UHFFFAOYSA-N 1-methylpseudouridine Natural products O=C1NC(=O)N(C)C=C1C1C(O)C(O)C(CO)O1 UVBYMVOUBXYSFV-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- PNDPGZBMCMUPRI-HVTJNCQCSA-N 10043-66-0 Chemical compound [131I][131I] PNDPGZBMCMUPRI-HVTJNCQCSA-N 0.000 description 1
- FPIPGXGPPPQFEQ-UHFFFAOYSA-N 13-cis retinol Natural products OCC=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-UHFFFAOYSA-N 0.000 description 1
- BNGVWAFGHGJATM-UHFFFAOYSA-N 1h-imidazo[1,5-a][1,3,5]triazin-2-one Chemical compound N1C(=O)N=CN2C=NC=C21 BNGVWAFGHGJATM-UHFFFAOYSA-N 0.000 description 1
- UHUHBFMZVCOEOV-UHFFFAOYSA-N 1h-imidazo[4,5-c]pyridin-4-amine Chemical compound NC1=NC=CC2=C1N=CN2 UHUHBFMZVCOEOV-UHFFFAOYSA-N 0.000 description 1
- HUTNOYOBQPAKIA-UHFFFAOYSA-N 1h-pyrazin-2-one Chemical compound OC1=CN=CC=N1 HUTNOYOBQPAKIA-UHFFFAOYSA-N 0.000 description 1
- RFCQJGFZUQFYRF-UHFFFAOYSA-N 2'-O-Methylcytidine Natural products COC1C(O)C(CO)OC1N1C(=O)N=C(N)C=C1 RFCQJGFZUQFYRF-UHFFFAOYSA-N 0.000 description 1
- OVYNGSFVYRPRCG-UHFFFAOYSA-N 2'-O-Methylguanosine Natural products COC1C(O)C(CO)OC1N1C(NC(N)=NC2=O)=C2N=C1 OVYNGSFVYRPRCG-UHFFFAOYSA-N 0.000 description 1
- SXUXMRMBWZCMEN-UHFFFAOYSA-N 2'-O-methyl uridine Natural products COC1C(O)C(CO)OC1N1C(=O)NC(=O)C=C1 SXUXMRMBWZCMEN-UHFFFAOYSA-N 0.000 description 1
- RFCQJGFZUQFYRF-ZOQUXTDFSA-N 2'-O-methylcytidine Chemical compound CO[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)N=C(N)C=C1 RFCQJGFZUQFYRF-ZOQUXTDFSA-N 0.000 description 1
- OVYNGSFVYRPRCG-KQYNXXCUSA-N 2'-O-methylguanosine Chemical compound CO[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=C(N)NC2=O)=C2N=C1 OVYNGSFVYRPRCG-KQYNXXCUSA-N 0.000 description 1
- HPHXOIULGYVAKW-IOSLPCCCSA-N 2'-O-methylinosine Chemical compound CO[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC2=O)=C2N=C1 HPHXOIULGYVAKW-IOSLPCCCSA-N 0.000 description 1
- HPHXOIULGYVAKW-UHFFFAOYSA-N 2'-O-methylinosine Natural products COC1C(O)C(CO)OC1N1C(NC=NC2=O)=C2N=C1 HPHXOIULGYVAKW-UHFFFAOYSA-N 0.000 description 1
- WGNUTGFETAXDTJ-OOJXKGFFSA-N 2'-O-methylpseudouridine Chemical compound CO[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1C1=CNC(=O)NC1=O WGNUTGFETAXDTJ-OOJXKGFFSA-N 0.000 description 1
- 239000000263 2,3-dihydroxypropyl (Z)-octadec-9-enoate Substances 0.000 description 1
- CHHHXKFHOYLYRE-UHFFFAOYSA-M 2,4-Hexadienoic acid, potassium salt (1:1), (2E,4E)- Chemical compound [K+].CC=CC=CC([O-])=O CHHHXKFHOYLYRE-UHFFFAOYSA-M 0.000 description 1
- PIINGYXNCHTJTF-UHFFFAOYSA-N 2-(2-azaniumylethylamino)acetate Chemical compound NCCNCC(O)=O PIINGYXNCHTJTF-UHFFFAOYSA-N 0.000 description 1
- WGIMXKDCVCTHGW-UHFFFAOYSA-N 2-(2-hydroxyethoxy)ethyl dodecanoate Chemical compound CCCCCCCCCCCC(=O)OCCOCCO WGIMXKDCVCTHGW-UHFFFAOYSA-N 0.000 description 1
- FKOKUHFZNIUSLW-UHFFFAOYSA-N 2-Hydroxypropyl stearate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(C)O FKOKUHFZNIUSLW-UHFFFAOYSA-N 0.000 description 1
- JCNGYIGHEUKAHK-DWJKKKFUSA-N 2-Thio-1-methyl-1-deazapseudouridine Chemical compound CC1C=C(C(=O)NC1=S)[C@H]2[C@@H]([C@@H]([C@H](O2)CO)O)O JCNGYIGHEUKAHK-DWJKKKFUSA-N 0.000 description 1
- BVLGKOVALHRKNM-XUTVFYLZSA-N 2-Thio-1-methylpseudouridine Chemical compound CN1C=C(C(=O)NC1=S)[C@H]2[C@@H]([C@@H]([C@H](O2)CO)O)O BVLGKOVALHRKNM-XUTVFYLZSA-N 0.000 description 1
- CWXIOHYALLRNSZ-JWMKEVCDSA-N 2-Thiodihydropseudouridine Chemical compound C1C(C(=O)NC(=S)N1)[C@H]2[C@@H]([C@@H]([C@H](O2)CO)O)O CWXIOHYALLRNSZ-JWMKEVCDSA-N 0.000 description 1
- VHXUHQJRMXUOST-PNHWDRBUSA-N 2-[1-[(2r,3r,4r,5r)-4-hydroxy-5-(hydroxymethyl)-3-methoxyoxolan-2-yl]-2,4-dioxopyrimidin-5-yl]acetamide Chemical compound CO[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(CC(N)=O)=C1 VHXUHQJRMXUOST-PNHWDRBUSA-N 0.000 description 1
- LCZVSXRMYJUNFX-UHFFFAOYSA-N 2-[2-(2-hydroxypropoxy)propoxy]propan-1-ol Chemical compound CC(O)COC(C)COC(C)CO LCZVSXRMYJUNFX-UHFFFAOYSA-N 0.000 description 1
- VJKJOPUEUOTEBX-TURQNECASA-N 2-[[1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-2,4-dioxopyrimidin-5-yl]methylamino]ethanesulfonic acid Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(CNCCS(O)(=O)=O)=C1 VJKJOPUEUOTEBX-TURQNECASA-N 0.000 description 1
- LCKIHCRZXREOJU-KYXWUPHJSA-N 2-[[5-[(2S,3R,4S,5R)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-2,4-dioxopyrimidin-1-yl]methylamino]ethanesulfonic acid Chemical compound C(NCCS(=O)(=O)O)N1C=C([C@H]2[C@H](O)[C@H](O)[C@@H](CO)O2)C(NC1=O)=O LCKIHCRZXREOJU-KYXWUPHJSA-N 0.000 description 1
- QZWIMRRDHYIPGN-KYXWUPHJSA-N 2-[[5-[(2S,3R,4S,5R)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-2-oxo-4-sulfanylidenepyrimidin-1-yl]methylamino]ethanesulfonic acid Chemical compound C(NCCS(=O)(=O)O)N1C=C([C@H]2[C@H](O)[C@H](O)[C@@H](CO)O2)C(NC1=O)=S QZWIMRRDHYIPGN-KYXWUPHJSA-N 0.000 description 1
- LAXVMANLDGWYJP-UHFFFAOYSA-N 2-amino-5-(2-aminoethyl)naphthalene-1-sulfonic acid Chemical compound NC1=CC=C2C(CCN)=CC=CC2=C1S(O)(=O)=O LAXVMANLDGWYJP-UHFFFAOYSA-N 0.000 description 1
- JRYMOPZHXMVHTA-DAGMQNCNSA-N 2-amino-7-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-1h-pyrrolo[2,3-d]pyrimidin-4-one Chemical compound C1=CC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O JRYMOPZHXMVHTA-DAGMQNCNSA-N 0.000 description 1
- OTDJAMXESTUWLO-UUOKFMHZSA-N 2-amino-9-[(2R,3R,4S,5R)-3,4-dihydroxy-5-(hydroxymethyl)-2-oxolanyl]-3H-purine-6-thione Chemical compound C12=NC(N)=NC(S)=C2N=CN1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OTDJAMXESTUWLO-UUOKFMHZSA-N 0.000 description 1
- JLYURAYAEKVGQJ-IOSLPCCCSA-N 2-amino-9-[(2r,3r,4r,5r)-4-hydroxy-5-(hydroxymethyl)-3-methoxyoxolan-2-yl]-1-methylpurin-6-one Chemical compound CO[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=C(N)N(C)C2=O)=C2N=C1 JLYURAYAEKVGQJ-IOSLPCCCSA-N 0.000 description 1
- OKLHOZOTIGAINF-RPKMEZRRSA-N 2-amino-9-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)-2-methyloxolan-2-yl]-3h-purine-6-thione Chemical compound C1=NC(C(N=C(N)N2)=S)=C2N1[C@]1(C)O[C@H](CO)[C@@H](O)[C@H]1O OKLHOZOTIGAINF-RPKMEZRRSA-N 0.000 description 1
- OZNBTMLHSVZFLR-GWTDSMLYSA-N 2-amino-9-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-3h-purin-6-one;6-amino-1h-pyrimidin-2-one Chemical compound NC=1C=CNC(=O)N=1.C1=NC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OZNBTMLHSVZFLR-GWTDSMLYSA-N 0.000 description 1
- PBFLIOAJBULBHI-JJNLEZRASA-N 2-amino-n-[[9-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]purin-6-yl]carbamoyl]acetamide Chemical compound C1=NC=2C(NC(=O)NC(=O)CN)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O PBFLIOAJBULBHI-JJNLEZRASA-N 0.000 description 1
- RFVNOJDQRGSOEL-UHFFFAOYSA-N 2-hydroxyethyl octadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCCO RFVNOJDQRGSOEL-UHFFFAOYSA-N 0.000 description 1
- QCPQCJVQJKOKMS-VLSMUFELSA-N 2-methoxy-5-methyl-cytidine Chemical compound CC(C(N)=N1)=CN([C@@H]([C@@H]2O)O[C@H](CO)[C@H]2O)C1OC QCPQCJVQJKOKMS-VLSMUFELSA-N 0.000 description 1
- TUDKBZAMOFJOSO-UHFFFAOYSA-N 2-methoxy-7h-purin-6-amine Chemical compound COC1=NC(N)=C2NC=NC2=N1 TUDKBZAMOFJOSO-UHFFFAOYSA-N 0.000 description 1
- WBVPJIKOWUQTSD-ZOQUXTDFSA-N 2-methoxyuridine Chemical compound COC1=NC(=O)C=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 WBVPJIKOWUQTSD-ZOQUXTDFSA-N 0.000 description 1
- SMADWRYCYBUIKH-UHFFFAOYSA-N 2-methyl-7h-purin-6-amine Chemical compound CC1=NC(N)=C2NC=NC2=N1 SMADWRYCYBUIKH-UHFFFAOYSA-N 0.000 description 1
- FZIIBDOXPQOKBP-UHFFFAOYSA-N 2-methyloxetane Chemical compound CC1CCO1 FZIIBDOXPQOKBP-UHFFFAOYSA-N 0.000 description 1
- QTWJRLJHJPIABL-UHFFFAOYSA-N 2-methylphenol;3-methylphenol;4-methylphenol Chemical compound CC1=CC=C(O)C=C1.CC1=CC=CC(O)=C1.CC1=CC=CC=C1O QTWJRLJHJPIABL-UHFFFAOYSA-N 0.000 description 1
- FXGXEFXCWDTSQK-UHFFFAOYSA-N 2-methylsulfanyl-7h-purin-6-amine Chemical compound CSC1=NC(N)=C2NC=NC2=N1 FXGXEFXCWDTSQK-UHFFFAOYSA-N 0.000 description 1
- VZQXUWKZDSEQRR-SDBHATRESA-N 2-methylthio-N(6)-(Delta(2)-isopentenyl)adenosine Chemical compound C12=NC(SC)=NC(NCC=C(C)C)=C2N=CN1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O VZQXUWKZDSEQRR-SDBHATRESA-N 0.000 description 1
- QEWSGVMSLPHELX-UHFFFAOYSA-N 2-methylthio-N6-(cis-hydroxyisopentenyl) adenosine Chemical compound C12=NC(SC)=NC(NCC=C(C)CO)=C2N=CN1C1OC(CO)C(O)C1O QEWSGVMSLPHELX-UHFFFAOYSA-N 0.000 description 1
- QCDWFXQBSFUVSP-UHFFFAOYSA-N 2-phenoxyethanol Chemical compound OCCOC1=CC=CC=C1 QCDWFXQBSFUVSP-UHFFFAOYSA-N 0.000 description 1
- VRVXMIJPUBNPGH-XVFCMESISA-N 2-thio-dihydrouridine Chemical compound OC[C@H]1O[C@H]([C@H](O)[C@@H]1O)N1CCC(=O)NC1=S VRVXMIJPUBNPGH-XVFCMESISA-N 0.000 description 1
- RHFUOMFWUGWKKO-XVFCMESISA-N 2-thiocytidine Chemical compound S=C1N=C(N)C=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 RHFUOMFWUGWKKO-XVFCMESISA-N 0.000 description 1
- GJTBSTBJLVYKAU-XVFCMESISA-N 2-thiouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=S)NC(=O)C=C1 GJTBSTBJLVYKAU-XVFCMESISA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- 108020005065 3' Flanking Region Proteins 0.000 description 1
- CPBJMKMKNCRKQB-UHFFFAOYSA-N 3,3-bis(4-hydroxy-3-methylphenyl)-2-benzofuran-1-one Chemical compound C1=C(O)C(C)=CC(C2(C3=CC=CC=C3C(=O)O2)C=2C=C(C)C(O)=CC=2)=C1 CPBJMKMKNCRKQB-UHFFFAOYSA-N 0.000 description 1
- GOLORTLGFDVFDW-UHFFFAOYSA-N 3-(1h-benzimidazol-2-yl)-7-(diethylamino)chromen-2-one Chemical compound C1=CC=C2NC(C3=CC4=CC=C(C=C4OC3=O)N(CC)CC)=NC2=C1 GOLORTLGFDVFDW-UHFFFAOYSA-N 0.000 description 1
- YXNIEZJFCGTDKV-JANFQQFMSA-N 3-(3-amino-3-carboxypropyl)uridine Chemical compound O=C1N(CCC(N)C(O)=O)C(=O)C=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 YXNIEZJFCGTDKV-JANFQQFMSA-N 0.000 description 1
- UBLAMKHIFZBBSS-UHFFFAOYSA-N 3-Methylbutyl pentanoate Chemical compound CCCCC(=O)OCCC(C)C UBLAMKHIFZBBSS-UHFFFAOYSA-N 0.000 description 1
- RDPUKVRQKWBSPK-UHFFFAOYSA-N 3-Methylcytidine Natural products O=C1N(C)C(=N)C=CN1C1C(O)C(O)C(CO)O1 RDPUKVRQKWBSPK-UHFFFAOYSA-N 0.000 description 1
- UTQUILVPBZEHTK-UHFFFAOYSA-N 3-Methyluridine Natural products O=C1N(C)C(=O)C=CN1C1C(O)C(O)C(CO)O1 UTQUILVPBZEHTK-UHFFFAOYSA-N 0.000 description 1
- BINGDNLMMYSZFR-QYVSTXNMSA-N 3-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-6,7-dimethyl-5h-imidazo[1,2-a]purin-9-one Chemical compound C1=NC=2C(=O)N3C(C)=C(C)N=C3NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O BINGDNLMMYSZFR-QYVSTXNMSA-N 0.000 description 1
- RDPUKVRQKWBSPK-ZOQUXTDFSA-N 3-methylcytidine Chemical compound O=C1N(C)C(=N)C=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 RDPUKVRQKWBSPK-ZOQUXTDFSA-N 0.000 description 1
- RZRNAYUHWVFMIP-GDCKJWNLSA-N 3-oleoyl-sn-glycerol Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@H](O)CO RZRNAYUHWVFMIP-GDCKJWNLSA-N 0.000 description 1
- CYDQOEWLBCCFJZ-UHFFFAOYSA-N 4-(4-fluorophenyl)oxane-4-carboxylic acid Chemical compound C=1C=C(F)C=CC=1C1(C(=O)O)CCOCC1 CYDQOEWLBCCFJZ-UHFFFAOYSA-N 0.000 description 1
- WFCJCYSSTXNUED-UHFFFAOYSA-N 4-(dimethylamino)-1-[4-hydroxy-5-(hydroxymethyl)-3-methoxyoxolan-2-yl]pyrimidin-2-one Chemical compound COC1C(O)C(CO)OC1N1C(=O)N=C(N(C)C)C=C1 WFCJCYSSTXNUED-UHFFFAOYSA-N 0.000 description 1
- ZLOIGESWDJYCTF-UHFFFAOYSA-N 4-Thiouridine Natural products OC1C(O)C(CO)OC1N1C(=O)NC(=S)C=C1 ZLOIGESWDJYCTF-UHFFFAOYSA-N 0.000 description 1
- OSWZKAVBSQAVFI-UHFFFAOYSA-N 4-[(4-isothiocyanatophenyl)diazenyl]-n,n-dimethylaniline Chemical compound C1=CC(N(C)C)=CC=C1N=NC1=CC=C(N=C=S)C=C1 OSWZKAVBSQAVFI-UHFFFAOYSA-N 0.000 description 1
- YBBDRHCNZBVLGT-FDDDBJFASA-N 4-amino-1-[(2r,3r,4r,5r)-4-hydroxy-5-(hydroxymethyl)-3-methoxyoxolan-2-yl]-2-oxopyrimidine-5-carbaldehyde Chemical compound CO[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)N=C(N)C(C=O)=C1 YBBDRHCNZBVLGT-FDDDBJFASA-N 0.000 description 1
- OCMSXKMNYAHJMU-JXOAFFINSA-N 4-amino-1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-2-oxopyrimidine-5-carbaldehyde Chemical compound C1=C(C=O)C(N)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 OCMSXKMNYAHJMU-JXOAFFINSA-N 0.000 description 1
- LQQGJDJXUSAEMZ-UAKXSSHOSA-N 4-amino-1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-iodopyrimidin-2-one Chemical compound C1=C(I)C(N)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 LQQGJDJXUSAEMZ-UAKXSSHOSA-N 0.000 description 1
- OZHIJZYBTCTDQC-JXOAFFINSA-N 4-amino-1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-methylpyrimidine-2-thione Chemical compound S=C1N=C(N)C(C)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 OZHIJZYBTCTDQC-JXOAFFINSA-N 0.000 description 1
- PJWBTAIPBFWVHX-FJGDRVTGSA-N 4-amino-1-[(2r,3s,4r,5r)-3-fluoro-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidin-2-one Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@](F)(O)[C@H](O)[C@@H](CO)O1 PJWBTAIPBFWVHX-FJGDRVTGSA-N 0.000 description 1
- HIQIXEFWDLTDED-UHFFFAOYSA-N 4-hydroxy-1-piperidin-4-ylpyrrolidin-2-one Chemical compound O=C1CC(O)CN1C1CCNCC1 HIQIXEFWDLTDED-UHFFFAOYSA-N 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N 4-hydroxybenzoic acid Chemical compound OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- GCNTZFIIOFTKIY-UHFFFAOYSA-N 4-hydroxypyridine Chemical compound OC1=CC=NC=C1 GCNTZFIIOFTKIY-UHFFFAOYSA-N 0.000 description 1
- OXRWICUICBZVAE-UHFFFAOYSA-N 4-methylpent-1-yne Chemical compound CC(C)CC#C OXRWICUICBZVAE-UHFFFAOYSA-N 0.000 description 1
- OVONXEQGWXGFJD-UHFFFAOYSA-N 4-sulfanylidene-1h-pyrimidin-2-one Chemical compound SC=1C=CNC(=O)N=1 OVONXEQGWXGFJD-UHFFFAOYSA-N 0.000 description 1
- ZLOIGESWDJYCTF-XVFCMESISA-N 4-thiouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=S)C=C1 ZLOIGESWDJYCTF-XVFCMESISA-N 0.000 description 1
- 108020005029 5' Flanking Region Proteins 0.000 description 1
- CNVRVGAACYEOQI-FDDDBJFASA-N 5,2'-O-dimethylcytidine Chemical compound CO[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)N=C(N)C(C)=C1 CNVRVGAACYEOQI-FDDDBJFASA-N 0.000 description 1
- SJQRQOKXQKVJGJ-UHFFFAOYSA-N 5-(2-aminoethylamino)naphthalene-1-sulfonic acid Chemical compound C1=CC=C2C(NCCN)=CC=CC2=C1S(O)(=O)=O SJQRQOKXQKVJGJ-UHFFFAOYSA-N 0.000 description 1
- FAWQJBLSWXIJLA-VPCXQMTMSA-N 5-(carboxymethyl)uridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(CC(O)=O)=C1 FAWQJBLSWXIJLA-VPCXQMTMSA-N 0.000 description 1
- VSCNRXVDHRNJOA-PNHWDRBUSA-N 5-(carboxymethylaminomethyl)uridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(CNCC(O)=O)=C1 VSCNRXVDHRNJOA-PNHWDRBUSA-N 0.000 description 1
- NMUSYJAQQFHJEW-UHFFFAOYSA-N 5-Azacytidine Natural products O=C1N=C(N)N=CN1C1C(O)C(O)C(CO)O1 NMUSYJAQQFHJEW-UHFFFAOYSA-N 0.000 description 1
- NFEXJLMYXXIWPI-JXOAFFINSA-N 5-Hydroxymethylcytidine Chemical compound C1=C(CO)C(N)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NFEXJLMYXXIWPI-JXOAFFINSA-N 0.000 description 1
- ZYEWPVTXYBLWRT-UHFFFAOYSA-N 5-Uridinacetamid Natural products O=C1NC(=O)C(CC(=O)N)=CN1C1C(O)C(O)C(CO)O1 ZYEWPVTXYBLWRT-UHFFFAOYSA-N 0.000 description 1
- ITGWEVGJUSMCEA-KYXWUPHJSA-N 5-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-1-prop-1-ynylpyrimidine-2,4-dione Chemical compound O=C1NC(=O)N(C#CC)C=C1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 ITGWEVGJUSMCEA-KYXWUPHJSA-N 0.000 description 1
- BNAWMJKJLNJZFU-GBNDHIKLSA-N 5-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-4-sulfanylidene-1h-pyrimidin-2-one Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1C1=CNC(=O)NC1=S BNAWMJKJLNJZFU-GBNDHIKLSA-N 0.000 description 1
- IPRQAJTUSRLECG-UHFFFAOYSA-N 5-[6-(dimethylamino)purin-9-yl]-2-(hydroxymethyl)-4-methoxyoxolan-3-ol Chemical compound COC1C(O)C(CO)OC1N1C2=NC=NC(N(C)C)=C2N=C1 IPRQAJTUSRLECG-UHFFFAOYSA-N 0.000 description 1
- YJCCSLGGODRWKK-UHFFFAOYSA-N 5-acetamido-2-[2-(4-isothiocyanato-2-sulfophenyl)ethenyl]benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC(NC(=O)C)=CC=C1C=CC1=CC=C(N=C=S)C=C1S(O)(=O)=O YJCCSLGGODRWKK-UHFFFAOYSA-N 0.000 description 1
- OZQDLJNDRVBCST-SHUUEZRQSA-N 5-amino-2-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-1,2,4-triazin-3-one Chemical compound O=C1N=C(N)C=NN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 OZQDLJNDRVBCST-SHUUEZRQSA-N 0.000 description 1
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 1
- ZWONWYNZSWOYQC-UHFFFAOYSA-N 5-benzamido-3-[[5-[[4-chloro-6-(4-sulfoanilino)-1,3,5-triazin-2-yl]amino]-2-sulfophenyl]diazenyl]-4-hydroxynaphthalene-2,7-disulfonic acid Chemical compound OC1=C(N=NC2=CC(NC3=NC(NC4=CC=C(C=C4)S(O)(=O)=O)=NC(Cl)=N3)=CC=C2S(O)(=O)=O)C(=CC2=C1C(NC(=O)C1=CC=CC=C1)=CC(=C2)S(O)(=O)=O)S(O)(=O)=O ZWONWYNZSWOYQC-UHFFFAOYSA-N 0.000 description 1
- AGFIRQJZCNVMCW-UAKXSSHOSA-N 5-bromouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(Br)=C1 AGFIRQJZCNVMCW-UAKXSSHOSA-N 0.000 description 1
- ZYEWPVTXYBLWRT-VPCXQMTMSA-N 5-carbamoylmethyluridine Chemical compound O=C1NC(=O)C(CC(=O)N)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 ZYEWPVTXYBLWRT-VPCXQMTMSA-N 0.000 description 1
- VKLFQTYNHLDMDP-PNHWDRBUSA-N 5-carboxymethylaminomethyl-2-thiouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=S)NC(=O)C(CNCC(O)=O)=C1 VKLFQTYNHLDMDP-PNHWDRBUSA-N 0.000 description 1
- HLZXTFWTDIBXDF-PNHWDRBUSA-N 5-methoxycarbonylmethyl-2-thiouridine Chemical compound S=C1NC(=O)C(CC(=O)OC)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 HLZXTFWTDIBXDF-PNHWDRBUSA-N 0.000 description 1
- ZXIATBNUWJBBGT-JXOAFFINSA-N 5-methoxyuridine Chemical compound O=C1NC(=O)C(OC)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 ZXIATBNUWJBBGT-JXOAFFINSA-N 0.000 description 1
- SNNBPMAXGYBMHM-JXOAFFINSA-N 5-methyl-2-thiouridine Chemical compound S=C1NC(=O)C(C)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 SNNBPMAXGYBMHM-JXOAFFINSA-N 0.000 description 1
- HXVKEKIORVUWDR-UHFFFAOYSA-N 5-methylaminomethyl-2-thiouridine Natural products S=C1NC(=O)C(CNC)=CN1C1C(O)C(O)C(CO)O1 HXVKEKIORVUWDR-UHFFFAOYSA-N 0.000 description 1
- USVMJSALORZVDV-UHFFFAOYSA-N 6-(gamma,gamma-dimethylallylamino)purine riboside Natural products C1=NC=2C(NCC=C(C)C)=NC=NC=2N1C1OC(CO)C(O)C1O USVMJSALORZVDV-UHFFFAOYSA-N 0.000 description 1
- WQZIDRAQTRIQDX-UHFFFAOYSA-N 6-carboxy-x-rhodamine Chemical compound OC(=O)C1=CC=C(C([O-])=O)C=C1C(C1=CC=2CCCN3CCCC(C=23)=C1O1)=C2C1=C(CCC1)C3=[N+]1CCCC3=C2 WQZIDRAQTRIQDX-UHFFFAOYSA-N 0.000 description 1
- BZTDTCNHAFUJOG-UHFFFAOYSA-N 6-carboxyfluorescein Chemical compound C12=CC=C(O)C=C2OC2=CC(O)=CC=C2C11OC(=O)C2=CC=C(C(=O)O)C=C21 BZTDTCNHAFUJOG-UHFFFAOYSA-N 0.000 description 1
- AFWWNHLDHNSVSD-UHFFFAOYSA-N 6-methyl-7h-purin-2-amine Chemical compound CC1=NC(N)=NC2=C1NC=N2 AFWWNHLDHNSVSD-UHFFFAOYSA-N 0.000 description 1
- SYMHUEFSSMBHJA-UHFFFAOYSA-N 6-methylpurine Chemical compound CC1=NC=NC2=C1NC=N2 SYMHUEFSSMBHJA-UHFFFAOYSA-N 0.000 description 1
- CBNRZZNSRJQZNT-IOSLPCCCSA-O 6-thio-7-deaza-guanosine Chemical compound CC1=C[NH+]([C@@H]([C@@H]2O)O[C@H](CO)[C@H]2O)C(NC(N)=N2)=C1C2=S CBNRZZNSRJQZNT-IOSLPCCCSA-O 0.000 description 1
- RFHIWBUKNJIBSE-KQYNXXCUSA-O 6-thio-7-methyl-guanosine Chemical compound C1=2NC(N)=NC(=S)C=2N(C)C=[N+]1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O RFHIWBUKNJIBSE-KQYNXXCUSA-O 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- YALJZNKPECPZAS-UHFFFAOYSA-N 7-(diethylamino)-3-(4-isothiocyanatophenyl)-4-methylchromen-2-one Chemical compound O=C1OC2=CC(N(CC)CC)=CC=C2C(C)=C1C1=CC=C(N=C=S)C=C1 YALJZNKPECPZAS-UHFFFAOYSA-N 0.000 description 1
- JBNOVHJXQSHGRL-UHFFFAOYSA-N 7-amino-4-(trifluoromethyl)coumarin Chemical compound FC(F)(F)C1=CC(=O)OC2=CC(N)=CC=C21 JBNOVHJXQSHGRL-UHFFFAOYSA-N 0.000 description 1
- ISSMDAFGDCTNDV-UHFFFAOYSA-N 7-deaza-2,6-diaminopurine Chemical compound NC1=NC(N)=C2NC=CC2=N1 ISSMDAFGDCTNDV-UHFFFAOYSA-N 0.000 description 1
- SMXRCJBCWRHDJE-UHFFFAOYSA-N 7-deaza-8-aza-2-aminopurine Chemical compound NC1=NC=C2C=NNC2=N1 SMXRCJBCWRHDJE-UHFFFAOYSA-N 0.000 description 1
- LOSIULRWFAEMFL-UHFFFAOYSA-N 7-deazaguanine Chemical compound O=C1NC(N)=NC2=C1CC=N2 LOSIULRWFAEMFL-UHFFFAOYSA-N 0.000 description 1
- VJNXUFOTKNTNPG-IOSLPCCCSA-O 7-methylinosine Chemical compound C1=2NC=NC(=O)C=2N(C)C=[N+]1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O VJNXUFOTKNTNPG-IOSLPCCCSA-O 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- HRYKDUPGBWLLHO-UHFFFAOYSA-N 8-azaadenine Chemical compound NC1=NC=NC2=NNN=C12 HRYKDUPGBWLLHO-UHFFFAOYSA-N 0.000 description 1
- LPXQRXLUHJKZIE-UHFFFAOYSA-N 8-azaguanine Chemical compound NC1=NC(O)=C2NN=NC2=N1 LPXQRXLUHJKZIE-UHFFFAOYSA-N 0.000 description 1
- 229960005508 8-azaguanine Drugs 0.000 description 1
- SGAOZXGJGQEBHA-UHFFFAOYSA-N 82344-98-7 Chemical compound C1CCN2CCCC(C=C3C4(OC(C5=CC(=CC=C54)N=C=S)=O)C4=C5)=C2C1=C3OC4=C1CCCN2CCCC5=C12 SGAOZXGJGQEBHA-UHFFFAOYSA-N 0.000 description 1
- FJNCXZZQNBKEJT-UHFFFAOYSA-N 8beta-hydroxymarrubiin Natural products O1C(=O)C2(C)CCCC3(C)C2C1CC(C)(O)C3(O)CCC=1C=COC=1 FJNCXZZQNBKEJT-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- JSRIPIORIMCGTG-WOUKDFQISA-N 9-[(2R,3R,4R,5R)-4-hydroxy-5-(hydroxymethyl)-3-methoxyoxolan-2-yl]-1-methylpurin-6-one Chemical compound CO[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CN(C)C2=O)=C2N=C1 JSRIPIORIMCGTG-WOUKDFQISA-N 0.000 description 1
- OJTAZBNWKTYVFJ-IOSLPCCCSA-N 9-[(2r,3r,4r,5r)-4-hydroxy-5-(hydroxymethyl)-3-methoxyoxolan-2-yl]-2-(methylamino)-3h-purin-6-one Chemical compound C1=2NC(NC)=NC(=O)C=2N=CN1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1OC OJTAZBNWKTYVFJ-IOSLPCCCSA-N 0.000 description 1
- MSSXOMSJDRHRMC-UHFFFAOYSA-N 9H-purine-2,6-diamine Chemical compound NC1=NC(N)=C2NC=NC2=N1 MSSXOMSJDRHRMC-UHFFFAOYSA-N 0.000 description 1
- GJCOSYZMQJWQCA-UHFFFAOYSA-N 9H-xanthene Chemical compound C1=CC=C2CC3=CC=CC=C3OC2=C1 GJCOSYZMQJWQCA-UHFFFAOYSA-N 0.000 description 1
- 108010049290 ADP Ribose Transferases Proteins 0.000 description 1
- 102000009062 ADP Ribose Transferases Human genes 0.000 description 1
- 230000005730 ADP ribosylation Effects 0.000 description 1
- 108091006112 ATPases Proteins 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N Acrylic acid Chemical group OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 208000030090 Acute Disease Diseases 0.000 description 1
- 102000057290 Adenosine Triphosphatases Human genes 0.000 description 1
- 240000006054 Agastache cana Species 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- 244000144725 Amygdalus communis Species 0.000 description 1
- 108010085443 Anserine Proteins 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 231100000699 Bacterial toxin Toxicity 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 1
- 229930185605 Bisphenol Natural products 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 235000014698 Brassica juncea var multisecta Nutrition 0.000 description 1
- 235000006008 Brassica napus var napus Nutrition 0.000 description 1
- 235000006618 Brassica rapa subsp oleifera Nutrition 0.000 description 1
- 244000188595 Brassica sinapistrum Species 0.000 description 1
- 235000004977 Brassica sinapistrum Nutrition 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- LVDKZNITIUWNER-UHFFFAOYSA-N Bronopol Chemical compound OCC(Br)(CO)[N+]([O-])=O LVDKZNITIUWNER-UHFFFAOYSA-N 0.000 description 1
- 239000004255 Butylated hydroxyanisole Substances 0.000 description 1
- AEQMMXWVFGMKOX-JJHYMCDRSA-N COC=1C(NC(N([C@]2([C@](O)([C@H](O)[C@@H](CO)O2)N)C)C1)=O)=O Chemical compound COC=1C(NC(N([C@]2([C@](O)([C@H](O)[C@@H](CO)O2)N)C)C1)=O)=O AEQMMXWVFGMKOX-JJHYMCDRSA-N 0.000 description 1
- CQLLPAQXAAAIQK-VHQAPHLWSA-O CONC=1NC(C=2[N+](=CN([C@H]3[C@](O)([C@H](O)[C@@H](CO)O3)C)C2N1)OC)=O Chemical compound CONC=1NC(C=2[N+](=CN([C@H]3[C@](O)([C@H](O)[C@@H](CO)O3)C)C2N1)OC)=O CQLLPAQXAAAIQK-VHQAPHLWSA-O 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 208000024172 Cardiovascular disease Diseases 0.000 description 1
- QRYRORQUOLYVBU-VBKZILBWSA-N Carnosic acid Natural products CC([C@@H]1CC2)(C)CCC[C@]1(C(O)=O)C1=C2C=C(C(C)C)C(O)=C1O QRYRORQUOLYVBU-VBKZILBWSA-N 0.000 description 1
- 108010087806 Carnosine Proteins 0.000 description 1
- PTHCMJGKKRQCBF-UHFFFAOYSA-N Cellulose, microcrystalline Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC)C(CO)O1 PTHCMJGKKRQCBF-UHFFFAOYSA-N 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- GHXZTYHSJHQHIJ-UHFFFAOYSA-N Chlorhexidine Chemical compound C=1C=C(Cl)C=CC=1NC(N)=NC(N)=NCCCCCCN=C(N)N=C(N)NC1=CC=C(Cl)C=C1 GHXZTYHSJHQHIJ-UHFFFAOYSA-N 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 241000206575 Chondrus crispus Species 0.000 description 1
- 241000723346 Cinnamomum camphora Species 0.000 description 1
- 244000223760 Cinnamomum zeylanicum Species 0.000 description 1
- YASYEJJMZJALEJ-UHFFFAOYSA-N Citric acid monohydrate Chemical compound O.OC(=O)CC(O)(C(O)=O)CC(O)=O YASYEJJMZJALEJ-UHFFFAOYSA-N 0.000 description 1
- 241000710777 Classical swine fever virus Species 0.000 description 1
- 235000013162 Cocos nucifera Nutrition 0.000 description 1
- 244000060011 Cocos nucifera Species 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 240000009226 Corylus americana Species 0.000 description 1
- 240000007582 Corylus avellana Species 0.000 description 1
- 102100021906 Cyclin-O Human genes 0.000 description 1
- PMPVIKIVABFJJI-UHFFFAOYSA-N Cyclobutane Chemical compound C1CCC1 PMPVIKIVABFJJI-UHFFFAOYSA-N 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 1
- AUNGANRZJHBGPY-UHFFFAOYSA-N D-Lyxoflavin Natural products OCC(O)C(O)C(O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-UHFFFAOYSA-N 0.000 description 1
- ZAKOWWREFLAJOT-CEFNRUSXSA-N D-alpha-tocopherylacetate Chemical compound CC(=O)OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C ZAKOWWREFLAJOT-CEFNRUSXSA-N 0.000 description 1
- FBPFZTCFMRRESA-KAZBKCHUSA-N D-altritol Chemical group OC[C@@H](O)[C@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KAZBKCHUSA-N 0.000 description 1
- ZZZCUOFIHGPKAK-UHFFFAOYSA-N D-erythro-ascorbic acid Natural products OCC1OC(=O)C(O)=C1O ZZZCUOFIHGPKAK-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 125000000824 D-ribofuranosyl group Chemical group [H]OC([H])([H])[C@@]1([H])OC([H])(*)[C@]([H])(O[H])[C@]1([H])O[H] 0.000 description 1
- WEAHRLBPCANXCN-UHFFFAOYSA-N Daunomycin Natural products CCC1(O)CC(OC2CC(N)C(O)C(C)O2)c3cc4C(=O)c5c(OC)cccc5C(=O)c4c(O)c3C1 WEAHRLBPCANXCN-UHFFFAOYSA-N 0.000 description 1
- CYCGRDQQIOGCKX-UHFFFAOYSA-N Dehydro-luciferin Natural products OC(=O)C1=CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 CYCGRDQQIOGCKX-UHFFFAOYSA-N 0.000 description 1
- 239000004287 Dehydroacetic acid Substances 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- 108010053187 Diphtheria Toxin Proteins 0.000 description 1
- 102000016607 Diphtheria Toxin Human genes 0.000 description 1
- 241000271571 Dromaius novaehollandiae Species 0.000 description 1
- ZGTMUACCHSMWAC-UHFFFAOYSA-L EDTA disodium salt (anhydrous) Chemical compound [Na+].[Na+].OC(=O)CN(CC([O-])=O)CCN(CC(O)=O)CC([O-])=O ZGTMUACCHSMWAC-UHFFFAOYSA-L 0.000 description 1
- QZKRHPLGUJDVAR-UHFFFAOYSA-K EDTA trisodium salt Chemical compound [Na+].[Na+].[Na+].OC(=O)CN(CC([O-])=O)CCN(CC([O-])=O)CC([O-])=O QZKRHPLGUJDVAR-UHFFFAOYSA-K 0.000 description 1
- 101150029707 ERBB2 gene Proteins 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- MBYXEBXZARTUSS-QLWBXOBMSA-N Emetamine Natural products O(C)c1c(OC)cc2c(c(C[C@@H]3[C@H](CC)CN4[C@H](c5c(cc(OC)c(OC)c5)CC4)C3)ncc2)c1 MBYXEBXZARTUSS-QLWBXOBMSA-N 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- QTANTQQOYSUMLC-UHFFFAOYSA-O Ethidium cation Chemical compound C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 QTANTQQOYSUMLC-UHFFFAOYSA-O 0.000 description 1
- FPVVYTCTZKCSOJ-UHFFFAOYSA-N Ethylene glycol distearate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCCOC(=O)CCCCCCCCCCCCCCCCC FPVVYTCTZKCSOJ-UHFFFAOYSA-N 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 244000004281 Eucalyptus maculata Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- BJGNCJDXODQBOB-UHFFFAOYSA-N Fivefly Luciferin Natural products OC(=O)C1CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 BJGNCJDXODQBOB-UHFFFAOYSA-N 0.000 description 1
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 1
- 108091006027 G proteins Proteins 0.000 description 1
- 102000003688 G-Protein-Coupled Receptors Human genes 0.000 description 1
- 108090000045 G-Protein-Coupled Receptors Proteins 0.000 description 1
- 102000030782 GTP binding Human genes 0.000 description 1
- 108091000058 GTP-Binding Proteins 0.000 description 1
- 229910052688 Gadolinium Inorganic materials 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 239000005792 Geraniol Substances 0.000 description 1
- GLZPCOQZEFWAFX-YFHOEESVSA-N Geraniol Natural products CC(C)=CCC\C(C)=C/CO GLZPCOQZEFWAFX-YFHOEESVSA-N 0.000 description 1
- 108010026389 Gramicidin Proteins 0.000 description 1
- 108010054017 Granulocyte Colony-Stimulating Factor Receptors Proteins 0.000 description 1
- 102100039622 Granulocyte colony-stimulating factor receptor Human genes 0.000 description 1
- 108010009202 Growth Factor Receptors Proteins 0.000 description 1
- 102000009465 Growth Factor Receptors Human genes 0.000 description 1
- 229920002907 Guar gum Polymers 0.000 description 1
- 108010034791 Heterochromatin Proteins 0.000 description 1
- SQUHHTBVTRBESD-UHFFFAOYSA-N Hexa-Ac-myo-Inositol Natural products CC(=O)OC1C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C1OC(C)=O SQUHHTBVTRBESD-UHFFFAOYSA-N 0.000 description 1
- 102100033636 Histone H3.2 Human genes 0.000 description 1
- 108010033040 Histones Proteins 0.000 description 1
- 101000897441 Homo sapiens Cyclin-O Proteins 0.000 description 1
- 101000746367 Homo sapiens Granulocyte colony-stimulating factor Proteins 0.000 description 1
- 101000864662 Homo sapiens Probable ATP-dependent RNA helicase DHX58 Proteins 0.000 description 1
- 101000669402 Homo sapiens Toll-like receptor 7 Proteins 0.000 description 1
- 101000800483 Homo sapiens Toll-like receptor 8 Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 1
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 1
- 208000031226 Hyperlipidaemia Diseases 0.000 description 1
- UGQMRVRMYYASKQ-UHFFFAOYSA-N Hypoxanthine nucleoside Natural products OC1C(O)C(CO)OC1N1C(NC=NC2=O)=C2N=C1 UGQMRVRMYYASKQ-UHFFFAOYSA-N 0.000 description 1
- 235000010650 Hyssopus officinalis Nutrition 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 208000029462 Immunodeficiency disease Diseases 0.000 description 1
- 208000026350 Inborn Genetic disease Diseases 0.000 description 1
- 108090000862 Ion Channels Proteins 0.000 description 1
- 102000004310 Ion Channels Human genes 0.000 description 1
- 108010019437 Janus Kinase 2 Proteins 0.000 description 1
- SLRNWACWRVGMKD-UHFFFAOYSA-N L-anserine Natural products CN1C=NC(CC(NC(=O)CCN)C(O)=O)=C1 SLRNWACWRVGMKD-UHFFFAOYSA-N 0.000 description 1
- 239000011786 L-ascorbyl-6-palmitate Substances 0.000 description 1
- QAQJMLQRFWZOBN-LAUBAEHRSA-N L-ascorbyl-6-palmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](O)[C@H]1OC(=O)C(O)=C1O QAQJMLQRFWZOBN-LAUBAEHRSA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- 108010028554 LDL Cholesterol Proteins 0.000 description 1
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 1
- DDWFXDSYGUXRAY-UHFFFAOYSA-N Luciferin Natural products CCc1c(C)c(CC2NC(=O)C(=C2C=C)C)[nH]c1Cc3[nH]c4C(=C5/NC(CC(=O)O)C(C)C5CC(=O)O)CC(=O)c4c3C DDWFXDSYGUXRAY-UHFFFAOYSA-N 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- PWHULOQIROXLJO-UHFFFAOYSA-N Manganese Chemical compound [Mn] PWHULOQIROXLJO-UHFFFAOYSA-N 0.000 description 1
- 240000003183 Manihot esculenta Species 0.000 description 1
- 235000016735 Manihot esculenta subsp esculenta Nutrition 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- VFKZTMPDYBFSTM-KVTDHHQDSA-N Mitobronitol Chemical compound BrC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CBr VFKZTMPDYBFSTM-KVTDHHQDSA-N 0.000 description 1
- 229930192392 Mitomycin Natural products 0.000 description 1
- 244000179970 Monarda didyma Species 0.000 description 1
- 235000010672 Monarda didyma Nutrition 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 101100412856 Mus musculus Rhod gene Proteins 0.000 description 1
- 208000003926 Myelitis Diseases 0.000 description 1
- 208000014767 Myeloproliferative disease Diseases 0.000 description 1
- RSPURTUNRHNVGF-IOSLPCCCSA-N N(2),N(2)-dimethylguanosine Chemical compound C1=NC=2C(=O)NC(N(C)C)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O RSPURTUNRHNVGF-IOSLPCCCSA-N 0.000 description 1
- SLEHROROQDYRAW-KQYNXXCUSA-N N(2)-methylguanosine Chemical compound C1=NC=2C(=O)NC(NC)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O SLEHROROQDYRAW-KQYNXXCUSA-N 0.000 description 1
- NIDVTARKFBZMOT-PEBGCTIMSA-N N(4)-acetylcytidine Chemical compound O=C1N=C(NC(=O)C)C=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NIDVTARKFBZMOT-PEBGCTIMSA-N 0.000 description 1
- USVMJSALORZVDV-SDBHATRESA-N N(6)-(Delta(2)-isopentenyl)adenosine Chemical compound C1=NC=2C(NCC=C(C)C)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O USVMJSALORZVDV-SDBHATRESA-N 0.000 description 1
- VQAYFKKCNSOZKM-IOSLPCCCSA-N N(6)-methyladenosine Chemical compound C1=NC=2C(NC)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O VQAYFKKCNSOZKM-IOSLPCCCSA-N 0.000 description 1
- OVBPIULPVIDEAO-UHFFFAOYSA-N N-Pteroyl-L-glutaminsaeure Natural products C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-UHFFFAOYSA-N 0.000 description 1
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 1
- CQOVPNPJLQNMDC-UHFFFAOYSA-N N-beta-alanyl-L-histidine Natural products NCCC(=O)NC(C(O)=O)CC1=CN=CN1 CQOVPNPJLQNMDC-UHFFFAOYSA-N 0.000 description 1
- LZCNWAXLJWBRJE-ZOQUXTDFSA-N N4-Methylcytidine Chemical compound O=C1N=C(NC)C=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 LZCNWAXLJWBRJE-ZOQUXTDFSA-N 0.000 description 1
- GOSWTRUMMSCNCW-UHFFFAOYSA-N N6-(cis-hydroxyisopentenyl)adenosine Chemical compound C1=NC=2C(NCC=C(CO)C)=NC=NC=2N1C1OC(CO)C(O)C1O GOSWTRUMMSCNCW-UHFFFAOYSA-N 0.000 description 1
- VZQXUWKZDSEQRR-UHFFFAOYSA-N Nucleosid Natural products C12=NC(SC)=NC(NCC=C(C)C)=C2N=CN1C1OC(CO)C(O)C1O VZQXUWKZDSEQRR-UHFFFAOYSA-N 0.000 description 1
- JXNORPPTKDEAIZ-QOCRDCMYSA-N O-4''-alpha-D-mannosylqueuosine Chemical compound NC(N1)=NC(N([C@@H]([C@@H]2O)O[C@H](CO)[C@H]2O)C=C2CN[C@H]([C@H]3O)C=C[C@@H]3O[C@H]([C@H]([C@H]3O)O)O[C@H](CO)[C@H]3O)=C2C1=O JXNORPPTKDEAIZ-QOCRDCMYSA-N 0.000 description 1
- 241000219925 Oenothera Species 0.000 description 1
- 235000004496 Oenothera biennis Nutrition 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 108700026244 Open Reading Frames Proteins 0.000 description 1
- 235000014643 Orbignya martiana Nutrition 0.000 description 1
- 244000021150 Orbignya martiana Species 0.000 description 1
- BPQQTUXANYXVAA-UHFFFAOYSA-N Orthosilicate Chemical compound [O-][Si]([O-])([O-])[O-] BPQQTUXANYXVAA-UHFFFAOYSA-N 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 235000008673 Persea americana Nutrition 0.000 description 1
- 244000025272 Persea americana Species 0.000 description 1
- 108010081690 Pertussis Toxin Proteins 0.000 description 1
- 241000286209 Phasianidae Species 0.000 description 1
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 1
- BELBBZDIHDAJOR-UHFFFAOYSA-N Phenolsulfonephthalein Chemical compound C1=CC(O)=CC=C1C1(C=2C=CC(O)=CC=2)C2=CC=CC=C2S(=O)(=O)O1 BELBBZDIHDAJOR-UHFFFAOYSA-N 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 241000709664 Picornaviridae Species 0.000 description 1
- 208000000474 Poliomyelitis Diseases 0.000 description 1
- RVGRUAULSDPKGF-UHFFFAOYSA-N Poloxamer Chemical compound C1CO1.CC1CO1 RVGRUAULSDPKGF-UHFFFAOYSA-N 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 229920000954 Polyglycolide Polymers 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 229920001214 Polysorbate 60 Polymers 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 108010013381 Porins Proteins 0.000 description 1
- 102000017033 Porins Human genes 0.000 description 1
- HLCFGWHYROZGBI-JJKGCWMISA-M Potassium gluconate Chemical compound [K+].OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O HLCFGWHYROZGBI-JJKGCWMISA-M 0.000 description 1
- 241000210053 Potentilla elegans Species 0.000 description 1
- 229910052777 Praseodymium Inorganic materials 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 102100030090 Probable ATP-dependent RNA helicase DHX58 Human genes 0.000 description 1
- 235000009827 Prunus armeniaca Nutrition 0.000 description 1
- 244000018633 Prunus armeniaca Species 0.000 description 1
- 241000589516 Pseudomonas Species 0.000 description 1
- 230000026279 RNA modification Effects 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 102000002278 Ribosomal Proteins Human genes 0.000 description 1
- 108010000605 Ribosomal Proteins Proteins 0.000 description 1
- 235000004443 Ricinus communis Nutrition 0.000 description 1
- AUVVAXYIELKVAI-UHFFFAOYSA-N SJ000285215 Natural products N1CCC2=CC(OC)=C(OC)C=C2C1CC1CC2C3=CC(OC)=C(OC)C=C3CCN2CC1CC AUVVAXYIELKVAI-UHFFFAOYSA-N 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 206010040047 Sepsis Diseases 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- 102000039471 Small Nuclear RNA Human genes 0.000 description 1
- 108020003224 Small Nucleolar RNA Proteins 0.000 description 1
- 102000042773 Small Nucleolar RNA Human genes 0.000 description 1
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- BCKXLBQYZLBQEK-KVVVOXFISA-M Sodium oleate Chemical compound [Na+].CCCCCCCC\C=C/CCCCCCCC([O-])=O BCKXLBQYZLBQEK-KVVVOXFISA-M 0.000 description 1
- IYFATESGLOUGBX-YVNJGZBMSA-N Sorbitan monopalmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O IYFATESGLOUGBX-YVNJGZBMSA-N 0.000 description 1
- HVUMOYIDDBPOLL-XWVZOOPGSA-N Sorbitan monostearate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O HVUMOYIDDBPOLL-XWVZOOPGSA-N 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- ZSJLQEPLLKMAKR-UHFFFAOYSA-N Streptozotocin Natural products O=NN(C)C(=O)NC1C(O)OC(CO)C(O)C1O ZSJLQEPLLKMAKR-UHFFFAOYSA-N 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 229910052771 Terbium Inorganic materials 0.000 description 1
- 101100242191 Tetraodon nigroviridis rho gene Proteins 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 102100039390 Toll-like receptor 7 Human genes 0.000 description 1
- 102100033110 Toll-like receptor 8 Human genes 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 108020005202 Viral DNA Proteins 0.000 description 1
- FPIPGXGPPPQFEQ-BOOMUCAASA-N Vitamin A Natural products OC/C=C(/C)\C=C\C=C(\C)/C=C/C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-BOOMUCAASA-N 0.000 description 1
- 229930003268 Vitamin C Natural products 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- JCZSFCLRSONYLH-UHFFFAOYSA-N Wyosine Natural products N=1C(C)=CN(C(C=2N=C3)=O)C=1N(C)C=2N3C1OC(CO)C(O)C1O JCZSFCLRSONYLH-UHFFFAOYSA-N 0.000 description 1
- YXNIEZJFCGTDKV-UHFFFAOYSA-N X-Nucleosid Natural products O=C1N(CCC(N)C(O)=O)C(=O)C=CN1C1C(O)C(O)C(CO)O1 YXNIEZJFCGTDKV-UHFFFAOYSA-N 0.000 description 1
- 101100020289 Xenopus laevis koza gene Proteins 0.000 description 1
- 241000607479 Yersinia pestis Species 0.000 description 1
- VWQVUPCCIRVNHF-OUBTZVSYSA-N Yttrium-90 Chemical compound [90Y] VWQVUPCCIRVNHF-OUBTZVSYSA-N 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- IJCWFDPJFXGQBN-RYNSOKOISA-N [(2R)-2-[(2R,3R,4S)-4-hydroxy-3-octadecanoyloxyoxolan-2-yl]-2-octadecanoyloxyethyl] octadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@@H](OC(=O)CCCCCCCCCCCCCCCCC)[C@H]1OC[C@H](O)[C@H]1OC(=O)CCCCCCCCCCCCCCCCC IJCWFDPJFXGQBN-RYNSOKOISA-N 0.000 description 1
- ISPNGVKOLBSRNR-DBINCYRJSA-N [(2r,3r,4r,5r)-5-(2-amino-6-oxo-3h-purin-9-yl)-4-[(3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]oxy-3-hydroxyoxolan-2-yl]methyl dihydrogen phosphate Chemical compound O([C@@H]1[C@H](O)[C@@H](COP(O)(O)=O)O[C@H]1N1C=NC=2C(=O)N=C(NC=21)N)C1O[C@H](CO)[C@@H](O)[C@H]1O ISPNGVKOLBSRNR-DBINCYRJSA-N 0.000 description 1
- YWBULOYFCXZCGF-UHFFFAOYSA-N [1,3]thiazolo[4,5-d]pyrimidine Chemical compound C1=NC=C2SC=NC2=N1 YWBULOYFCXZCGF-UHFFFAOYSA-N 0.000 description 1
- PNDPGZBMCMUPRI-XXSWNUTMSA-N [125I][125I] Chemical compound [125I][125I] PNDPGZBMCMUPRI-XXSWNUTMSA-N 0.000 description 1
- GAQQBMHVUQQMRR-TXICZTDVSA-N [C@@H]1([C@H](O)[C@H](O)[C@@H](CO)O1)N1C(=O)NC(=O)N=N1 Chemical compound [C@@H]1([C@H](O)[C@H](O)[C@@H](CO)O1)N1C(=O)NC(=O)N=N1 GAQQBMHVUQQMRR-TXICZTDVSA-N 0.000 description 1
- YKTSYUJCYHOUJP-UHFFFAOYSA-N [O--].[Al+3].[Al+3].[O-][Si]([O-])([O-])[O-] Chemical compound [O--].[Al+3].[Al+3].[O-][Si]([O-])([O-])[O-] YKTSYUJCYHOUJP-UHFFFAOYSA-N 0.000 description 1
- VODXWKROAHHHBQ-UHFFFAOYSA-N [dimethylamino(hydroxy)methylidene]-dimethylazanium bromide Chemical compound [Br-].CN(C(=[N+](C)C)O)C VODXWKROAHHHBQ-UHFFFAOYSA-N 0.000 description 1
- 239000000370 acceptor Substances 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- 229960000583 acetic acid Drugs 0.000 description 1
- 235000011054 acetic acid Nutrition 0.000 description 1
- 229930183665 actinomycin Natural products 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 238000007792 addition Methods 0.000 description 1
- 150000003838 adenosines Chemical class 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 230000001476 alcoholic effect Effects 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 150000001335 aliphatic alkanes Chemical class 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 150000001345 alkine derivatives Chemical class 0.000 description 1
- 125000004183 alkoxy alkyl group Chemical group 0.000 description 1
- 125000003282 alkyl amino group Chemical group 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- OENHQHLEOONYIE-UKMVMLAPSA-N all-trans beta-carotene Natural products CC=1CCCC(C)(C)C=1/C=C/C(/C)=C/C=C/C(/C)=C/C=C/C=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C OENHQHLEOONYIE-UKMVMLAPSA-N 0.000 description 1
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 1
- FPIPGXGPPPQFEQ-OVSJKPMPSA-N all-trans-retinol Chemical compound OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-OVSJKPMPSA-N 0.000 description 1
- 235000020224 almond Nutrition 0.000 description 1
- 229940087168 alpha tocopherol Drugs 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 229940024545 aluminum hydroxide Drugs 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 150000003862 amino acid derivatives Chemical class 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 229960001040 ammonium chloride Drugs 0.000 description 1
- MYYIAHXIVFADCU-QMMMGPOBSA-N anserine Chemical compound CN1C=NC=C1C[C@H](NC(=O)CC[NH3+])C([O-])=O MYYIAHXIVFADCU-QMMMGPOBSA-N 0.000 description 1
- 230000003042 antagnostic effect Effects 0.000 description 1
- YUENFNPLGJCNRB-UHFFFAOYSA-N anthracen-1-amine Chemical compound C1=CC=C2C=C3C(N)=CC=CC3=CC2=C1 YUENFNPLGJCNRB-UHFFFAOYSA-N 0.000 description 1
- 229940045799 anthracyclines and related substance Drugs 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 239000003080 antimitotic agent Substances 0.000 description 1
- 229940027983 antiseptic and disinfectant quaternary ammonium compound Drugs 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- PYMYPHUHKUWMLA-WDCZJNDASA-N arabinose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)C=O PYMYPHUHKUWMLA-WDCZJNDASA-N 0.000 description 1
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 description 1
- 235000010385 ascorbyl palmitate Nutrition 0.000 description 1
- 230000002238 attenuated effect Effects 0.000 description 1
- 229960002756 azacitidine Drugs 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 239000000688 bacterial toxin Substances 0.000 description 1
- POJOORKDYOPQLS-UHFFFAOYSA-L barium(2+) 5-chloro-2-[(2-hydroxynaphthalen-1-yl)diazenyl]-4-methylbenzenesulfonate Chemical compound [Ba+2].C1=C(Cl)C(C)=CC(N=NC=2C3=CC=CC=C3C=CC=2O)=C1S([O-])(=O)=O.C1=C(Cl)C(C)=CC(N=NC=2C3=CC=CC=C3C=CC=2O)=C1S([O-])(=O)=O POJOORKDYOPQLS-UHFFFAOYSA-L 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 239000000440 bentonite Substances 0.000 description 1
- 229910000278 bentonite Inorganic materials 0.000 description 1
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 229960004365 benzoic acid Drugs 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 description 1
- 235000013734 beta-carotene Nutrition 0.000 description 1
- 239000011648 beta-carotene Substances 0.000 description 1
- TUPZEYHYWIEDIH-WAIFQNFQSA-N beta-carotene Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CCCC1(C)C)C=CC=C(/C)C=CC2=CCCCC2(C)C TUPZEYHYWIEDIH-WAIFQNFQSA-N 0.000 description 1
- 229960002747 betacarotene Drugs 0.000 description 1
- 230000002210 biocatalytic effect Effects 0.000 description 1
- 239000000090 biomarker Substances 0.000 description 1
- 229920001222 biopolymer Polymers 0.000 description 1
- IISBACLAFKSPIT-UHFFFAOYSA-N bisphenol A Chemical compound C=1C=C(O)C=CC=1C(C)(C)C1=CC=C(O)C=C1 IISBACLAFKSPIT-UHFFFAOYSA-N 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 229960003168 bronopol Drugs 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 150000004648 butanoic acid derivatives Chemical class 0.000 description 1
- 229940043253 butylated hydroxyanisole Drugs 0.000 description 1
- CZBZUDVBLSSABA-UHFFFAOYSA-N butylated hydroxyanisole Chemical compound COC1=CC=C(O)C(C(C)(C)C)=C1.COC1=CC=C(O)C=C1C(C)(C)C CZBZUDVBLSSABA-UHFFFAOYSA-N 0.000 description 1
- 229940067596 butylparaben Drugs 0.000 description 1
- 229910052792 caesium Inorganic materials 0.000 description 1
- TVFDJXOCXUVLDH-UHFFFAOYSA-N caesium atom Chemical compound [Cs] TVFDJXOCXUVLDH-UHFFFAOYSA-N 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229960005069 calcium Drugs 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000001110 calcium chloride Substances 0.000 description 1
- 229910001628 calcium chloride Inorganic materials 0.000 description 1
- 229960002713 calcium chloride Drugs 0.000 description 1
- 235000011148 calcium chloride Nutrition 0.000 description 1
- FNAQSUUGMSOBHW-UHFFFAOYSA-H calcium citrate Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O.[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O FNAQSUUGMSOBHW-UHFFFAOYSA-H 0.000 description 1
- 239000001354 calcium citrate Substances 0.000 description 1
- 229960004256 calcium citrate Drugs 0.000 description 1
- 229940078480 calcium levulinate Drugs 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 235000011132 calcium sulphate Nutrition 0.000 description 1
- 229960000846 camphor Drugs 0.000 description 1
- 229930008380 camphor Natural products 0.000 description 1
- MIOPJNTWMNEORI-UHFFFAOYSA-N camphorsulfonic acid Chemical class C1CC2(CS(O)(=O)=O)C(=O)CC1C2(C)C MIOPJNTWMNEORI-UHFFFAOYSA-N 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 229940096529 carboxypolymethylene Drugs 0.000 description 1
- 229940044199 carnosine Drugs 0.000 description 1
- CQOVPNPJLQNMDC-ZETCQYMHSA-N carnosine Chemical compound [NH3+]CCC(=O)N[C@H](C([O-])=O)CC1=CNC=N1 CQOVPNPJLQNMDC-ZETCQYMHSA-N 0.000 description 1
- 235000010418 carrageenan Nutrition 0.000 description 1
- 239000000679 carrageenan Substances 0.000 description 1
- 229920001525 carrageenan Polymers 0.000 description 1
- 229940113118 carrageenan Drugs 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000005018 casein Substances 0.000 description 1
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 1
- 235000021240 caseins Nutrition 0.000 description 1
- 230000006652 catabolic pathway Effects 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 230000036755 cellular response Effects 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- 229960000541 cetyl alcohol Drugs 0.000 description 1
- 239000013522 chelant Substances 0.000 description 1
- NDAYQJDHGXTBJL-MWWSRJDJSA-N chembl557217 Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](C(C)C)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](C(C)C)NC(=O)[C@H](C)NC(=O)[C@H](NC(=O)CNC(=O)[C@@H](NC=O)C(C)C)CC(C)C)C(=O)NCCO)=CNC2=C1 NDAYQJDHGXTBJL-MWWSRJDJSA-N 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 229960003260 chlorhexidine Drugs 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 235000017803 cinnamon Nutrition 0.000 description 1
- 230000004087 circulation Effects 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 229960004106 citric acid Drugs 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 229960002303 citric acid monohydrate Drugs 0.000 description 1
- 239000004927 clay Substances 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- 235000019516 cod Nutrition 0.000 description 1
- 235000016213 coffee Nutrition 0.000 description 1
- 235000013353 coffee beverage Nutrition 0.000 description 1
- 229960001338 colchicine Drugs 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 229940126214 compound 3 Drugs 0.000 description 1
- 238000002591 computed tomography Methods 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 235000001671 coumarin Nutrition 0.000 description 1
- 229960000956 coumarin Drugs 0.000 description 1
- 229930003836 cresol Natural products 0.000 description 1
- 229940013361 cresol Drugs 0.000 description 1
- LXWYCLOUQZZDBD-LIYNQYRNSA-N csfv Chemical compound C([C@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)[C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(O)=O)C1=CC=C(O)C=C1 LXWYCLOUQZZDBD-LIYNQYRNSA-N 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 125000000000 cycloalkoxy group Chemical group 0.000 description 1
- HCAJEUSONLESMK-UHFFFAOYSA-N cyclohexylsulfamic acid Chemical compound OS(=O)(=O)NC1CCCCC1 HCAJEUSONLESMK-UHFFFAOYSA-N 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 239000002254 cytotoxic agent Substances 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- 230000005860 defense response to virus Effects 0.000 description 1
- 235000019258 dehydroacetic acid Nutrition 0.000 description 1
- 229940061632 dehydroacetic acid Drugs 0.000 description 1
- PGRHXDWITVMQBC-UHFFFAOYSA-N dehydroacetic acid Natural products CC(=O)C1C(=O)OC(C)=CC1=O PGRHXDWITVMQBC-UHFFFAOYSA-N 0.000 description 1
- JEQRBTDTEKWZBW-UHFFFAOYSA-N dehydroacetic acid Chemical compound CC(=O)C1=C(O)OC(C)=CC1=O JEQRBTDTEKWZBW-UHFFFAOYSA-N 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 238000002716 delivery method Methods 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 229940039227 diagnostic agent Drugs 0.000 description 1
- 239000000032 diagnostic agent Substances 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 229940061607 dibasic sodium phosphate Drugs 0.000 description 1
- CGMRCMMOCQYHAD-UHFFFAOYSA-J dicalcium hydroxide phosphate Chemical compound [OH-].[Ca++].[Ca++].[O-]P([O-])([O-])=O CGMRCMMOCQYHAD-UHFFFAOYSA-J 0.000 description 1
- 229940095079 dicalcium phosphate anhydrous Drugs 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- KCIDZIIHRGYJAE-YGFYJFDDSA-L dipotassium;[(2r,3r,4s,5r,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl] phosphate Chemical compound [K+].[K+].OC[C@H]1O[C@H](OP([O-])([O-])=O)[C@H](O)[C@@H](O)[C@H]1O KCIDZIIHRGYJAE-YGFYJFDDSA-L 0.000 description 1
- SZXQTJUDPRGNJN-UHFFFAOYSA-N dipropylene glycol Chemical compound OCCCOCCCO SZXQTJUDPRGNJN-UHFFFAOYSA-N 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- OOYIOIOOWUGAHD-UHFFFAOYSA-L disodium;2',4',5',7'-tetrabromo-4,5,6,7-tetrachloro-3-oxospiro[2-benzofuran-1,9'-xanthene]-3',6'-diolate Chemical compound [Na+].[Na+].O1C(=O)C(C(=C(Cl)C(Cl)=C2Cl)Cl)=C2C21C1=CC(Br)=C([O-])C(Br)=C1OC1=C(Br)C([O-])=C(Br)C=C21 OOYIOIOOWUGAHD-UHFFFAOYSA-L 0.000 description 1
- WSDISUOETYTPRL-UHFFFAOYSA-N dmdm hydantoin Chemical compound CC1(C)N(CO)C(=O)N(CO)C1=O WSDISUOETYTPRL-UHFFFAOYSA-N 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 229940009662 edetate Drugs 0.000 description 1
- 210000002969 egg yolk Anatomy 0.000 description 1
- 230000005518 electrochemistry Effects 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 229960002694 emetine Drugs 0.000 description 1
- AUVVAXYIELKVAI-CKBKHPSWSA-N emetine Chemical compound N1CCC2=CC(OC)=C(OC)C=C2[C@H]1C[C@H]1C[C@H]2C3=CC(OC)=C(OC)C=C3CCN2C[C@@H]1CC AUVVAXYIELKVAI-CKBKHPSWSA-N 0.000 description 1
- AUVVAXYIELKVAI-UWBTVBNJSA-N emetine Natural products N1CCC2=CC(OC)=C(OC)C=C2[C@H]1C[C@H]1C[C@H]2C3=CC(OC)=C(OC)C=C3CCN2C[C@H]1CC AUVVAXYIELKVAI-UWBTVBNJSA-N 0.000 description 1
- 238000006911 enzymatic reaction Methods 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- IINNWAYUJNWZRM-UHFFFAOYSA-L erythrosin B Chemical compound [Na+].[Na+].[O-]C(=O)C1=CC=CC=C1C1=C2C=C(I)C(=O)C(I)=C2OC2=C(I)C([O-])=C(I)C=C21 IINNWAYUJNWZRM-UHFFFAOYSA-L 0.000 description 1
- 229940011411 erythrosine Drugs 0.000 description 1
- 239000004174 erythrosine Substances 0.000 description 1
- 235000012732 erythrosine Nutrition 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- 125000001033 ether group Chemical group 0.000 description 1
- ZMMJGEGLRURXTF-UHFFFAOYSA-N ethidium bromide Chemical compound [Br-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 ZMMJGEGLRURXTF-UHFFFAOYSA-N 0.000 description 1
- 229960005542 ethidium bromide Drugs 0.000 description 1
- 229960001617 ethyl hydroxybenzoate Drugs 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 235000010228 ethyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004403 ethyl p-hydroxybenzoate Substances 0.000 description 1
- NUVBSKCKDOMJSU-UHFFFAOYSA-N ethylparaben Chemical compound CCOC(=O)C1=CC=C(O)C=C1 NUVBSKCKDOMJSU-UHFFFAOYSA-N 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 238000013265 extended release Methods 0.000 description 1
- 210000001723 extracellular space Anatomy 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 235000019197 fats Nutrition 0.000 description 1
- 210000004700 fetal blood Anatomy 0.000 description 1
- 235000019688 fish Nutrition 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 235000004426 flaxseed Nutrition 0.000 description 1
- ZFKJVJIDPQDDFY-UHFFFAOYSA-N fluorescamine Chemical compound C12=CC=CC=C2C(=O)OC1(C1=O)OC=C1C1=CC=CC=C1 ZFKJVJIDPQDDFY-UHFFFAOYSA-N 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- 238000000799 fluorescence microscopy Methods 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- 229960000304 folic acid Drugs 0.000 description 1
- 235000019152 folic acid Nutrition 0.000 description 1
- 239000011724 folic acid Substances 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 229960002598 fumaric acid Drugs 0.000 description 1
- UIWYJDYFSGRHKR-UHFFFAOYSA-N gadolinium atom Chemical compound [Gd] UIWYJDYFSGRHKR-UHFFFAOYSA-N 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 208000016361 genetic disease Diseases 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 229940113087 geraniol Drugs 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- 229960005150 glycerol Drugs 0.000 description 1
- 229940049654 glyceryl behenate Drugs 0.000 description 1
- 229940075507 glyceryl monostearate Drugs 0.000 description 1
- 239000001087 glyceryl triacetate Substances 0.000 description 1
- 235000013773 glyceryl triacetate Nutrition 0.000 description 1
- 125000003055 glycidyl group Chemical group C(C1CO1)* 0.000 description 1
- 235000010417 guar gum Nutrition 0.000 description 1
- 239000000665 guar gum Substances 0.000 description 1
- 229960002154 guar gum Drugs 0.000 description 1
- 230000009931 harmful effect Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 125000004404 heteroalkyl group Chemical group 0.000 description 1
- 210000004458 heterochromatin Anatomy 0.000 description 1
- 229960004867 hexetidine Drugs 0.000 description 1
- 239000010903 husk Substances 0.000 description 1
- 150000002431 hydrogen Chemical group 0.000 description 1
- 239000008172 hydrogenated vegetable oil Substances 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 1
- 239000012216 imaging agent Substances 0.000 description 1
- 230000008088 immune pathway Effects 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 230000007813 immunodeficiency Effects 0.000 description 1
- 238000010166 immunofluorescence Methods 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 238000003364 immunohistochemistry Methods 0.000 description 1
- 238000001114 immunoprecipitation Methods 0.000 description 1
- 230000003308 immunostimulating effect Effects 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 238000011503 in vivo imaging Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 150000002484 inorganic compounds Chemical class 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- CDAISMWEOUEBRE-GPIVLXJGSA-N inositol Chemical compound O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](O)[C@@H]1O CDAISMWEOUEBRE-GPIVLXJGSA-N 0.000 description 1
- 229960000367 inositol Drugs 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 210000003093 intracellular space Anatomy 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229940044173 iodine-125 Drugs 0.000 description 1
- NTHXOOBQLCIOLC-UHFFFAOYSA-N iohexol Chemical compound OCC(O)CN(C(=O)C)C1=C(I)C(C(=O)NCC(O)CO)=C(I)C(C(=O)NCC(O)CO)=C1I NTHXOOBQLCIOLC-UHFFFAOYSA-N 0.000 description 1
- 229960001025 iohexol Drugs 0.000 description 1
- 229910052741 iridium Inorganic materials 0.000 description 1
- GKOZUEZYRPOHIO-UHFFFAOYSA-N iridium atom Chemical compound [Ir] GKOZUEZYRPOHIO-UHFFFAOYSA-N 0.000 description 1
- VBMVTYDPPZVILR-UHFFFAOYSA-N iron(2+);oxygen(2-) Chemical class [O-2].[Fe+2] VBMVTYDPPZVILR-UHFFFAOYSA-N 0.000 description 1
- 125000001261 isocyanato group Chemical group *N=C=O 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 229960000829 kaolin Drugs 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 239000004922 lacquer Substances 0.000 description 1
- 239000000832 lactitol Substances 0.000 description 1
- VQHSOMBJVWLPSR-JVCRWLNRSA-N lactitol Chemical compound OC[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O VQHSOMBJVWLPSR-JVCRWLNRSA-N 0.000 description 1
- 235000010448 lactitol Nutrition 0.000 description 1
- 229960003451 lactitol Drugs 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 210000005228 liver tissue Anatomy 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- HWYHZTIRURJOHG-UHFFFAOYSA-N luminol Chemical compound O=C1NNC(=O)C2=C1C(N)=CC=C2 HWYHZTIRURJOHG-UHFFFAOYSA-N 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 229960000816 magnesium hydroxide Drugs 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 230000031852 maintenance of location in cell Effects 0.000 description 1
- 229940107698 malachite green Drugs 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- 239000011572 manganese Substances 0.000 description 1
- 229960001855 mannitol Drugs 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 238000013178 mathematical model Methods 0.000 description 1
- HLZXTFWTDIBXDF-UHFFFAOYSA-N mcm5sU Natural products COC(=O)Cc1cn(C2OC(CO)C(O)C2O)c(=S)[nH]c1=O HLZXTFWTDIBXDF-UHFFFAOYSA-N 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 108020004084 membrane receptors Proteins 0.000 description 1
- 102000006240 membrane receptors Human genes 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 208000030159 metabolic disease Diseases 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- XOTXNXXJZCFUOA-UGKPPGOTSA-N methyl 2-[1-[(2r,3r,4r,5r)-4-hydroxy-5-(hydroxymethyl)-3-methoxyoxolan-2-yl]-2,4-dioxopyrimidin-5-yl]acetate Chemical compound CO[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(CC(=O)OC)=C1 XOTXNXXJZCFUOA-UGKPPGOTSA-N 0.000 description 1
- WCNMEQDMUYVWMJ-UHFFFAOYSA-N methyl 4-[3-[3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-4,6-dimethyl-9-oxoimidazo[1,2-a]purin-7-yl]-3-hydroperoxy-2-(methoxycarbonylamino)butanoate Chemical compound C1=NC=2C(=O)N3C(CC(C(NC(=O)OC)C(=O)OC)OO)=C(C)N=C3N(C)C=2N1C1OC(CO)C(O)C1O WCNMEQDMUYVWMJ-UHFFFAOYSA-N 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- WZRYXYRWFAPPBJ-PNHWDRBUSA-N methyl uridin-5-yloxyacetate Chemical compound O=C1NC(=O)C(OCC(=O)OC)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 WZRYXYRWFAPPBJ-PNHWDRBUSA-N 0.000 description 1
- 230000011987 methylation Effects 0.000 description 1
- 238000007069 methylation reaction Methods 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- BEGLCMHJXHIJLR-UHFFFAOYSA-N methylisothiazolinone Chemical compound CN1SC=CC1=O BEGLCMHJXHIJLR-UHFFFAOYSA-N 0.000 description 1
- 101150084874 mimG gene Proteins 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- 229960005485 mitobronitol Drugs 0.000 description 1
- 235000013379 molasses Nutrition 0.000 description 1
- 239000001788 mono and diglycerides of fatty acids Substances 0.000 description 1
- 229940045641 monobasic sodium phosphate Drugs 0.000 description 1
- RZRNAYUHWVFMIP-UHFFFAOYSA-N monoelaidin Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC(O)CO RZRNAYUHWVFMIP-UHFFFAOYSA-N 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 235000019799 monosodium phosphate Nutrition 0.000 description 1
- 229910000403 monosodium phosphate Inorganic materials 0.000 description 1
- PJUIMOJAAPLTRJ-UHFFFAOYSA-N monothioglycerol Chemical compound OCC(O)CS PJUIMOJAAPLTRJ-UHFFFAOYSA-N 0.000 description 1
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 description 1
- 210000001167 myeloblast Anatomy 0.000 description 1
- DUWWHGPELOTTOE-UHFFFAOYSA-N n-(5-chloro-2,4-dimethoxyphenyl)-3-oxobutanamide Chemical compound COC1=CC(OC)=C(NC(=O)CC(C)=O)C=C1Cl DUWWHGPELOTTOE-UHFFFAOYSA-N 0.000 description 1
- CYDFBLGNJUNSCC-QCNRFFRDSA-N n-[1-[(2r,3r,4r,5r)-4-hydroxy-5-(hydroxymethyl)-3-methoxyoxolan-2-yl]-2-oxopyrimidin-4-yl]acetamide Chemical compound CO[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)N=C(NC(C)=O)C=C1 CYDFBLGNJUNSCC-QCNRFFRDSA-N 0.000 description 1
- 229940031182 nanoparticles iron oxide Drugs 0.000 description 1
- 230000004770 neurodegeneration Effects 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 230000002352 nonmutagenic effect Effects 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 238000013421 nuclear magnetic resonance imaging Methods 0.000 description 1
- 108020004017 nuclear receptors Proteins 0.000 description 1
- 238000001668 nucleic acid synthesis Methods 0.000 description 1
- 239000012038 nucleophile Substances 0.000 description 1
- 230000000269 nucleophilic effect Effects 0.000 description 1
- 230000030648 nucleus localization Effects 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- JPMIIZHYYWMHDT-UHFFFAOYSA-N octhilinone Chemical compound CCCCCCCCN1SC=CC1=O JPMIIZHYYWMHDT-UHFFFAOYSA-N 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 229960002969 oleic acid Drugs 0.000 description 1
- 229940055577 oleyl alcohol Drugs 0.000 description 1
- XMLQWXUVTXCDDL-UHFFFAOYSA-N oleyl alcohol Natural products CCCCCCC=CCCCCCCCCCCO XMLQWXUVTXCDDL-UHFFFAOYSA-N 0.000 description 1
- 210000003463 organelle Anatomy 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- AHHWIHXENZJRFG-UHFFFAOYSA-N oxetane Chemical compound C1COC1 AHHWIHXENZJRFG-UHFFFAOYSA-N 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- AFAIELJLZYUNPW-UHFFFAOYSA-N pararosaniline free base Chemical compound C1=CC(N)=CC=C1C(C=1C=CC(N)=CC=1)=C1C=CC(=N)C=C1 AFAIELJLZYUNPW-UHFFFAOYSA-N 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 102000007863 pattern recognition receptors Human genes 0.000 description 1
- 108010089193 pattern recognition receptors Proteins 0.000 description 1
- 235000010987 pectin Nutrition 0.000 description 1
- 239000001814 pectin Substances 0.000 description 1
- 229920001277 pectin Polymers 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 150000002972 pentoses Chemical class 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 229960003742 phenol Drugs 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- 229960003531 phenolsulfonphthalein Drugs 0.000 description 1
- 229960005323 phenoxyethanol Drugs 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- PDTFCHSETJBPTR-UHFFFAOYSA-N phenylmercuric nitrate Chemical compound [O-][N+](=O)O[Hg]C1=CC=CC=C1 PDTFCHSETJBPTR-UHFFFAOYSA-N 0.000 description 1
- PTMHPRAIXMAOOB-UHFFFAOYSA-L phosphoramidate Chemical group NP([O-])([O-])=O PTMHPRAIXMAOOB-UHFFFAOYSA-L 0.000 description 1
- 229960004838 phosphoric acid Drugs 0.000 description 1
- 235000011007 phosphoric acid Nutrition 0.000 description 1
- 150000003014 phosphoric acid esters Chemical class 0.000 description 1
- 150000008299 phosphorodiamidates Chemical class 0.000 description 1
- 125000004437 phosphorous atom Chemical group 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- IEQIEDJGQAUEQZ-UHFFFAOYSA-N phthalocyanine Chemical compound N1C(N=C2C3=CC=CC=C3C(N=C3C4=CC=CC=C4C(=N4)N3)=N2)=C(C=CC=C2)C2=C1N=C1C2=CC=CC=C2C4=N1 IEQIEDJGQAUEQZ-UHFFFAOYSA-N 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- 210000001778 pluripotent stem cell Anatomy 0.000 description 1
- 229960000502 poloxamer Drugs 0.000 description 1
- 239000004584 polyacrylic acid Substances 0.000 description 1
- 229920000768 polyamine Polymers 0.000 description 1
- 239000008389 polyethoxylated castor oil Substances 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 239000004633 polyglycolic acid Substances 0.000 description 1
- 229920000193 polymethacrylate Polymers 0.000 description 1
- 229920000056 polyoxyethylene ether Polymers 0.000 description 1
- 229920000259 polyoxyethylene lauryl ether Polymers 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 229940068984 polyvinyl alcohol Drugs 0.000 description 1
- 238000002600 positron emission tomography Methods 0.000 description 1
- 235000011056 potassium acetate Nutrition 0.000 description 1
- 229960004109 potassium acetate Drugs 0.000 description 1
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 1
- 235000010235 potassium benzoate Nutrition 0.000 description 1
- 239000004300 potassium benzoate Substances 0.000 description 1
- 229940103091 potassium benzoate Drugs 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 229960002816 potassium chloride Drugs 0.000 description 1
- 239000004224 potassium gluconate Substances 0.000 description 1
- 235000013926 potassium gluconate Nutrition 0.000 description 1
- 229960003189 potassium gluconate Drugs 0.000 description 1
- 229940096992 potassium oleate Drugs 0.000 description 1
- 235000010241 potassium sorbate Nutrition 0.000 description 1
- 239000004302 potassium sorbate Substances 0.000 description 1
- 229940069338 potassium sorbate Drugs 0.000 description 1
- MLICVSDCCDDWMD-KVVVOXFISA-M potassium;(z)-octadec-9-enoate Chemical compound [K+].CCCCCCCC\C=C/CCCCCCCC([O-])=O MLICVSDCCDDWMD-KVVVOXFISA-M 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- PUDIUYLPXJFUGB-UHFFFAOYSA-N praseodymium atom Chemical compound [Pr] PUDIUYLPXJFUGB-UHFFFAOYSA-N 0.000 description 1
- 230000002250 progressing effect Effects 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 229940095574 propionic acid Drugs 0.000 description 1
- 239000000473 propyl gallate Substances 0.000 description 1
- 235000010388 propyl gallate Nutrition 0.000 description 1
- 229940075579 propyl gallate Drugs 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- 229940093625 propylene glycol monostearate Drugs 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 108020001580 protein domains Proteins 0.000 description 1
- 230000004853 protein function Effects 0.000 description 1
- 230000026447 protein localization Effects 0.000 description 1
- 238000001243 protein synthesis Methods 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 125000004219 purine nucleobase group Chemical group 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 239000002718 pyrimidine nucleoside Substances 0.000 description 1
- 150000003856 quaternary ammonium compounds Chemical class 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 210000003370 receptor cell Anatomy 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 229930002330 retinoic acid Natural products 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- MYFATKRONKHHQL-UHFFFAOYSA-N rhodamine 123 Chemical compound [Cl-].COC(=O)C1=CC=CC=C1C1=C2C=CC(=[NH2+])C=C2OC2=CC(N)=CC=C21 MYFATKRONKHHQL-UHFFFAOYSA-N 0.000 description 1
- 229940043267 rhodamine b Drugs 0.000 description 1
- KIWUVOGUEXMXSV-UHFFFAOYSA-N rhodanine Chemical compound O=C1CSC(=S)N1 KIWUVOGUEXMXSV-UHFFFAOYSA-N 0.000 description 1
- 239000002151 riboflavin Substances 0.000 description 1
- 235000019192 riboflavin Nutrition 0.000 description 1
- 229960002477 riboflavin Drugs 0.000 description 1
- DWRXFEITVBNRMK-JXOAFFINSA-N ribothymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 DWRXFEITVBNRMK-JXOAFFINSA-N 0.000 description 1
- RHFUOMFWUGWKKO-UHFFFAOYSA-N s2C Natural products S=C1N=C(N)C=CN1C1C(O)C(O)C(CO)O1 RHFUOMFWUGWKKO-UHFFFAOYSA-N 0.000 description 1
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 description 1
- KZUNJOHGWZRPMI-AKLPVKDBSA-N samarium-153 Chemical compound [153Sm] KZUNJOHGWZRPMI-AKLPVKDBSA-N 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 231100000241 scar Toxicity 0.000 description 1
- 238000003345 scintillation counting Methods 0.000 description 1
- CDAISMWEOUEBRE-UHFFFAOYSA-N scyllo-inosotol Natural products OC1C(O)C(O)C(O)C(O)C1O CDAISMWEOUEBRE-UHFFFAOYSA-N 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- JRPHGDYSKGJTKZ-UHFFFAOYSA-N selenophosphoric acid Chemical class OP(O)([SeH])=O JRPHGDYSKGJTKZ-UHFFFAOYSA-N 0.000 description 1
- 238000002864 sequence alignment Methods 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 1
- 235000012239 silicon dioxide Nutrition 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 210000000813 small intestine Anatomy 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 108091029842 small nuclear ribonucleic acid Proteins 0.000 description 1
- 229960003885 sodium benzoate Drugs 0.000 description 1
- 229940001607 sodium bisulfite Drugs 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 235000017550 sodium carbonate Nutrition 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 229960001790 sodium citrate Drugs 0.000 description 1
- 235000011083 sodium citrates Nutrition 0.000 description 1
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical compound [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 1
- 229940037001 sodium edetate Drugs 0.000 description 1
- 239000001540 sodium lactate Substances 0.000 description 1
- 235000011088 sodium lactate Nutrition 0.000 description 1
- 229940005581 sodium lactate Drugs 0.000 description 1
- 229960003339 sodium phosphate Drugs 0.000 description 1
- JXKPEJDQGNYQSM-UHFFFAOYSA-M sodium propionate Chemical compound [Na+].CCC([O-])=O JXKPEJDQGNYQSM-UHFFFAOYSA-M 0.000 description 1
- 235000010334 sodium propionate Nutrition 0.000 description 1
- 239000004324 sodium propionate Substances 0.000 description 1
- 229960003212 sodium propionate Drugs 0.000 description 1
- 229910052979 sodium sulfide Inorganic materials 0.000 description 1
- GRVFOGOEDUUMBP-UHFFFAOYSA-N sodium sulfide (anhydrous) Chemical compound [Na+].[Na+].[S-2] GRVFOGOEDUUMBP-UHFFFAOYSA-N 0.000 description 1
- 238000010532 solid phase synthesis reaction Methods 0.000 description 1
- 239000012453 solvate Substances 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 235000011069 sorbitan monooleate Nutrition 0.000 description 1
- 239000001593 sorbitan monooleate Substances 0.000 description 1
- 229940035049 sorbitan monooleate Drugs 0.000 description 1
- 235000011071 sorbitan monopalmitate Nutrition 0.000 description 1
- 239000001570 sorbitan monopalmitate Substances 0.000 description 1
- 229940031953 sorbitan monopalmitate Drugs 0.000 description 1
- 235000011076 sorbitan monostearate Nutrition 0.000 description 1
- 239000001587 sorbitan monostearate Substances 0.000 description 1
- 229940035048 sorbitan monostearate Drugs 0.000 description 1
- 235000011078 sorbitan tristearate Nutrition 0.000 description 1
- 239000001589 sorbitan tristearate Substances 0.000 description 1
- 229960004129 sorbitan tristearate Drugs 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 229960002920 sorbitol Drugs 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 238000004611 spectroscopical analysis Methods 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 125000004079 stearyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- CIOAGBVUUVVLOB-OUBTZVSYSA-N strontium-89 Chemical compound [89Sr] CIOAGBVUUVVLOB-OUBTZVSYSA-N 0.000 description 1
- 229940006509 strontium-89 Drugs 0.000 description 1
- 125000000020 sulfo group Chemical group O=S(=O)([*])O[H] 0.000 description 1
- 150000003460 sulfonic acids Chemical class 0.000 description 1
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 1
- 150000003462 sulfoxides Chemical class 0.000 description 1
- 229940044609 sulfur dioxide Drugs 0.000 description 1
- 235000010269 sulphur dioxide Nutrition 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- GZCRRIHWUXGPOV-UHFFFAOYSA-N terbium atom Chemical compound [Tb] GZCRRIHWUXGPOV-UHFFFAOYSA-N 0.000 description 1
- 125000006169 tetracyclic group Chemical group 0.000 description 1
- TXEYQDLBPFQVAA-UHFFFAOYSA-N tetrafluoromethane Chemical compound FC(F)(F)F TXEYQDLBPFQVAA-UHFFFAOYSA-N 0.000 description 1
- SDVHRXOTTYYKRY-UHFFFAOYSA-J tetrasodium;dioxido-oxo-phosphonato-$l^{5}-phosphane Chemical compound [Na+].[Na+].[Na+].[Na+].[O-]P([O-])(=O)P([O-])([O-])=O SDVHRXOTTYYKRY-UHFFFAOYSA-J 0.000 description 1
- MPLHNVLQVRSVEE-UHFFFAOYSA-N texas red Chemical compound [O-]S(=O)(=O)C1=CC(S(Cl)(=O)=O)=CC=C1C(C1=CC=2CCCN3CCCC(C=23)=C1O1)=C2C1=C(CCC1)C3=[N+]1CCCC3=C2 MPLHNVLQVRSVEE-UHFFFAOYSA-N 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 150000003568 thioethers Chemical class 0.000 description 1
- 239000005450 thionucleoside Substances 0.000 description 1
- 229940104230 thymidine Drugs 0.000 description 1
- 229940113082 thymine Drugs 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- 229960000984 tocofersolan Drugs 0.000 description 1
- 235000010384 tocopherol Nutrition 0.000 description 1
- 229930003799 tocopherol Natural products 0.000 description 1
- 229960001295 tocopherol Drugs 0.000 description 1
- 239000011732 tocopherol Substances 0.000 description 1
- 229940042585 tocopherol acetate Drugs 0.000 description 1
- 238000003325 tomography Methods 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- 239000012096 transfection reagent Substances 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- 108091005703 transmembrane proteins Proteins 0.000 description 1
- 102000035160 transmembrane proteins Human genes 0.000 description 1
- 229960001727 tretinoin Drugs 0.000 description 1
- 229960002622 triacetin Drugs 0.000 description 1
- 229940001496 tribasic sodium phosphate Drugs 0.000 description 1
- 235000013337 tricalcium citrate Nutrition 0.000 description 1
- 235000019731 tricalcium phosphate Nutrition 0.000 description 1
- 125000006168 tricyclic group Chemical group 0.000 description 1
- 229940117013 triethanolamine oleate Drugs 0.000 description 1
- ZIBGPFATKBEMQZ-UHFFFAOYSA-N triethylene glycol Chemical compound OCCOCCOCCO ZIBGPFATKBEMQZ-UHFFFAOYSA-N 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 229960005066 trisodium edetate Drugs 0.000 description 1
- BENFPBJLMUIGGD-UHFFFAOYSA-I trisodium;2-[2-[carboxylatomethyl-[[3-hydroxy-2-methyl-5-(phosphonatooxymethyl)pyridin-4-yl]methyl]amino]ethyl-[[3-hydroxy-5-[[hydroxy(oxido)phosphoryl]oxymethyl]-2-methylpyridin-4-yl]methyl]amino]acetate;manganese(2+) Chemical compound [H+].[H+].[H+].[Na+].[Na+].[Na+].[Mn+2].CC1=NC=C(COP([O-])([O-])=O)C(CN(CCN(CC([O-])=O)CC=2C(=C(C)N=CC=2COP([O-])([O-])=O)[O-])CC([O-])=O)=C1[O-] BENFPBJLMUIGGD-UHFFFAOYSA-I 0.000 description 1
- 229960000281 trometamol Drugs 0.000 description 1
- RVCNQQGZJWVLIP-VPCXQMTMSA-N uridin-5-yloxyacetic acid Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(OCC(O)=O)=C1 RVCNQQGZJWVLIP-VPCXQMTMSA-N 0.000 description 1
- YIZYCHKPHCPKHZ-UHFFFAOYSA-N uridine-5-acetic acid methyl ester Natural products COC(=O)Cc1cn(C2OC(CO)C(O)C2O)c(=O)[nH]c1=O YIZYCHKPHCPKHZ-UHFFFAOYSA-N 0.000 description 1
- 229960005486 vaccine Drugs 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 235000019155 vitamin A Nutrition 0.000 description 1
- 239000011719 vitamin A Substances 0.000 description 1
- 235000019154 vitamin C Nutrition 0.000 description 1
- 239000011718 vitamin C Substances 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 229940045997 vitamin a Drugs 0.000 description 1
- 210000004916 vomit Anatomy 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 210000002268 wool Anatomy 0.000 description 1
- QAOHCFGKCWTBGC-QHOAOGIMSA-N wybutosine Chemical compound C1=NC=2C(=O)N3C(CC[C@H](NC(=O)OC)C(=O)OC)=C(C)N=C3N(C)C=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O QAOHCFGKCWTBGC-QHOAOGIMSA-N 0.000 description 1
- QAOHCFGKCWTBGC-UHFFFAOYSA-N wybutosine Natural products C1=NC=2C(=O)N3C(CCC(NC(=O)OC)C(=O)OC)=C(C)N=C3N(C)C=2N1C1OC(CO)C(O)C1O QAOHCFGKCWTBGC-UHFFFAOYSA-N 0.000 description 1
- 229920001285 xanthan gum Polymers 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
- UHVMMEOXYDMDKI-JKYCWFKZSA-L zinc;1-(5-cyanopyridin-2-yl)-3-[(1s,2s)-2-(6-fluoro-2-hydroxy-3-propanoylphenyl)cyclopropyl]urea;diacetate Chemical compound [Zn+2].CC([O-])=O.CC([O-])=O.CCC(=O)C1=CC=C(F)C([C@H]2[C@H](C2)NC(=O)NC=2N=CC(=CC=2)C#N)=C1O UHVMMEOXYDMDKI-JKYCWFKZSA-L 0.000 description 1
- 235000004835 α-tocopherol Nutrition 0.000 description 1
- 239000002076 α-tocopherol Substances 0.000 description 1
- OENHQHLEOONYIE-JLTXGRSLSA-N β-Carotene Chemical compound CC=1CCCC(C)(C)C=1\C=C\C(\C)=C\C=C\C(\C)=C\C=C\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C OENHQHLEOONYIE-JLTXGRSLSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/005—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'active' part of the composition delivered, i.e. the nucleic acid delivered
- A61K48/0066—Manipulation of the nucleic acid to modify its expression pattern, e.g. enhance its duration of expression, achieved by the presence of particular introns in the delivered nucleic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/193—Colony stimulating factors [CSF]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/0008—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition
- A61K48/0025—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition wherein the non-active part clearly interacts with the delivered nucleic acid
- A61K48/0033—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition wherein the non-active part clearly interacts with the delivered nucleic acid the non-active part being non-polymeric
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/0075—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the delivery route, e.g. oral, subcutaneous
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
- A61K9/0021—Intradermal administration, e.g. through microneedle arrays, needleless injectors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5107—Excipients; Inactive ingredients
- A61K9/5123—Organic compounds, e.g. fats, sugars
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/02—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with ribosyl as saccharide radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/52—Cytokines; Lymphokines; Interferons
- C07K14/53—Colony-stimulating factor [CSF]
- C07K14/535—Granulocyte CSF; Granulocyte-macrophage CSF
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/67—General methods for enhancing the expression
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Genetics & Genomics (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Biotechnology (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Zoology (AREA)
- Biomedical Technology (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- General Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Epidemiology (AREA)
- Biophysics (AREA)
- Immunology (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Plant Pathology (AREA)
- Gastroenterology & Hepatology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Toxicology (AREA)
- Dermatology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Nanotechnology (AREA)
- Optics & Photonics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Saccharide Compounds (AREA)
- Medicinal Preparation (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
본 개시는, 변형된 뉴클레오사이드, 뉴클레오타이드, 및 핵산, 및 이들의 사용 방법을 제공한다.
Description
서열 목록에 대한 참조
본 출원은 전자 양식의 서열 목록과 함께 출원되어 있다. 명칭이 M009SQLST.txt인 서열 목록 파일은 2012년 10월 3일자로 작성되었고, 크기는 9,859 바이트이다. 서열 목록의 전자 양식의 정보는, 이의 전문이 인용에 의해 포함된다.
관련 출원에 대한 상호 참조
본 출원은, 2011년 10월 3일자로 출원된 발명의 명칭 Modified Nucleosides, Nucleotides, and Nucleic Acids, and Uses Thereof의 미국 가특허출원 제61/542,533호에 대해 우선권을 주장하고, 이의 내용은 전문이 인용에 의해 포함된다.
기술 분야
본 개시는, 변형된 핵산을 사용하여 세포 기능을 조정하는 조성물 및 방법을 제공한다. 본 발명의 변형된 핵산은 펩타이드, 폴리펩타이드 또는 다중 단백질을 암호화할 수 있다. 암호화된 분자는 치료제 및/또는 진단제로서 사용될 수 있다.
본 발명의 배경
천연 발생 RNA는 4개의 기본 리보뉴클레오타이드들: ATP, CTP, UTP 및 GTP로부터 합성되지만, 전사-후 변형된 뉴클레오타이드를 함유할 수 있다. 또한, 대략 100개의 상이한 뉴클레오사이드 변형들이 RNA에서 확인되었다[참조: Rozenski, J, Crain, P, and McCloskey, J.(1999). The RNA Modification Database: 1999 update. Nucl Acids Res 27: 196-197]. 그러나, 면역-자극성 잠재능 및 RNA의 번역 효능에 있어서 뉴클레오사이드 변형의 역할은 명확하지 않다.
단백질 발현에 영향을 미치는 선행 방법론에 다수의 문제점들이 존재한다. 예를 들면, 세포 내에 도입된 이종 DNA는 딸 세포들에 의해서(이종 DNA가 염색체 내로 통합되어 있는지의 여부에 관계없이) 또는 자손(offspring)에 의해서 유전될 수 있다. 도입된 DNA는 숙주 세포 게놈 DNA 내로 소정 빈도로 통합되어 숙주 세포 게놈 DNA에 변경 및/또는 손상을 초래할 수 있다. 또한, 단백질이 제조되기 전에 다수의 단계들이 일어나야 한다. 일단 세포 내부에서, DNA는 RNA로 전사되는 핵내로 수송되어야 한다. 이어서, DNA로부터 전사된 RNA는, 이것이 단백질로 번역되는 세포질로 진입되어야 한다. 다중 프로세싱 단계들에 대한 이러한 요구는 목적한 단백질의 생성 전에 이는 지체 시간(lag time)을 생성한다. 또한, 세포 내에서 DNA 발현을 수득하는 것은 어렵고; DNA는 빈번하게 세포 내로 진입하지만 발현되지 않거나 충분한 비율 또는 농도로 발현되지 않는다. 이는, DNA가 원시 세포 또는 변형된 세포주와 같은 세포 내로 도입되는 경우 특히 문제가 될 수 있다.
핵산의 세포내 번역의 조정을 해결하기 위한 생물학적 양식(biological modality)에 대한 당해 분야에서의 요구가 존재한다.
본 발명의 요약
본 개시는, 특히, 생체내 및 생체외 둘 다에서, 세포의 집단 내로 도입되는 경우, 감소된 선천적 면역 반응을 나타낼 수 있는, 변형된 뉴클레오사이드, 변형된 뉴클레오타이드, 및 변형된 핵산을 제공한다.
본 발명은, 단리되거나 정제될 수 있는 폴리뉴클레오타이드를 제공한다. 이들 폴리뉴클레오타이드는 하나 이상의 목적한 폴리펩타이드들을 암호화할 수 있고, A, G, U 또는 C 뉴클레오사이드 또는 뉴클레오타이드의 화학 구조와 비교하여 적어도 하나의 변형된 뉴클레오사이드 또는 뉴클레오타이드를 포함하는 n개의 연결된 뉴클레오사이드들 또는 뉴클레오타이드들의 서열을 포함한다. 또한, 폴리뉴클레오타이드는 하나 이상의 코작(Kozak) 서열을 포함하는 5' UTR, 3' UTR, 및 하나 이상의 5' 캡 구조(cap structure)도 함유할 수 있다. 단리된 폴리뉴클레오타이드는 폴리-A 테일(tail)을 추가로 함유할 수 있고, 정제될 수 있다.
또한, 본 발명의 단리된 폴리뉴클레오타이드는, Cap 0, Cap 1, ARCA, 이노신, N1-메틸-구아노신, 2'플루오로-구아노신, 7-데아자-구아노신, 8-옥소-구아노신, 2-아미노-구아노신, LNA-구아노신, 및 2-아지도-구아노신으로 이루어진 그룹으로부터 선택된 하나 이상의 5' Cap 구조도 포함한다.
본 발명의 폴리뉴클레오타이드의 변형은, 폴리뉴클레오타이드를 포함하는 뉴클레오사이드의 뉴클레오사이드 염기 및/또는 당 부분 상에 존재할 수 있다.
일부 실시형태에서, 변형은 핵염기 상에 존재하고, 슈도우리딘(psuedouridine) 또는 N1-메틸슈도우리딘으로 이루어진 그룹으로부터 선택된다.
일부 실시형태에서, 변형된 뉴클레오사이드는 슈도우리딘(Ψ) 또는 5-메틸-사이티딘(m5C)이 아니다.
일부 실시형태에서, 다중 변형은, 변형된 핵산 내에 또는 하나 이상의 개별 뉴클레오사이드 또는 뉴클레오타이드 내에 포함된다. 예를 들면, 뉴클레오사이드에 대한 변형은, 핵염기 및 당에 대한 하나 이상의 변형들을 포함할 수 있다.
일부 실시형태에서, 변형된 폴리뉴클레오타이드 및 이들의 합성 및 제조 방법에 대한 신규한 빌딩 블록(building block), 예를 들면, 뉴클레오사이드 및 뉴클레오타이드가 제공된다.
또한, 본 발명은, 본원에 기술된 변형된 폴리뉴클레오타이드를 포함하는 약제학적 조성물을 제공한다. 또한, 이들은, 용매, 수성 용매, 비-수성 용매, 분산 매질, 희석제, 분산제, 현탁 보조제, 계면 활성제, 등장성 제제, 증점제 또는 유화제, 방부제, 지질, 리피도이드(lipidoid), 리포좀, 지질 나노입자, 코어-쉘 나노입자(core-shell nanoparticle), 중합체, 리포플렉스 펩타이드(lipoplexe peptide), 단백질, 세포, 히알루로니다제, 및 이들의 혼합물로부터 선택되는 하나 이상의 약제학적으로 허용되는 부형제들을 추가로 포함할 수 있다.
또한, 본 발명의 폴리뉴클레오타이드 및 변형된 핵산을 사용하는 방법도 제공된다. 이러한 예에서, 폴리뉴클레오타이드는 당해 분야에 공지되어 있는 임의의 수단에 의해 제형화될 수 있거나, 피내, 피하 또는 근육내 수단에 의한 주사를 포함하는 몇몇의 경로들 중 임의의 경로를 통해 투여될 수 있다.
본 발명의 변형된 핵산의 투여는, 2개 이상의 동등하거나 동등하지 않은 분할 용량들을 통해 이루어질 수 있다. 일부 실시형태에서, 분할 용량들의 폴리펩타이드를 투여함으로써 대상체에 의해 생산된 폴리펩타이드의 수준은, 단일 투여로서 폴리뉴클레오타이드의 동일한 총 1일 용량을 투여함으로써 생산된 수준보다 더 크다.
변형된 핵산 또는 암호화된 폴리펩타이드의 검출은, 대상체 또는 환자의 체액 내에서 수행될 수 있고, 여기서, 체액은, 말초 혈액, 혈청, 혈장, 복수액, 뇨, 뇌척수액(CSF), 객담, 타액, 골수, 윤활액, 수성 체액, 양수, 귀지(cerumen), 모유, 기관지 폐포 세척액, 정액, 전립선액, 쿠퍼액(cowper's fluid) 또는 전-사정액(pre-ejaculatory fluid), 땀, 대변, 모발, 눈물, 낭액(cyst fluid), 흉막액 및 복막액, 심막액, 림프, 미즙(chyme), 암죽(chyle), 담즙, 간질액, 월경, 고름, 피지, 구토, 질 분비액, 점막 분비액, 대변 물, 췌액, 비강 세척액, 기관지폐 흡인물, 배난강액(blastocyl cavity fluid), 및 제대혈로 이루어진 그룹으로부터 선택된다.
일부 실시형태에서, 투여는, 시간, 일, 주, 달, 또는 년의 과정에 걸쳐 발생하는 투약 용법에 따른 것이고, 다중-니들 주사 시스템, 카테터(catheter) 또는 내강 시스템(lumen system), 및 초음파, 전기 또는 방사선 기반 시스템으로부터 선택되는 하나 이상의 장치들을 사용함으로써 달성할 수 있다.
달리 정의하지 않는 한, 본원에 사용된 모든 기술적 및 과학적 용어는 본 발명이 속하는 당해 분야의 통상의 기술자에 의해 일반적으로 이해되는 바와 동일한 의미를 갖는다. 방법 및 재료는 본 개시에서 사용하기 위해 본원에 기술되어 있으며; 당해 분야에 공지되어 있는 다른 적합한 방법 및 재료도 또한 사용될 수 있다. 재료, 방법, 및 실시예는 단지 예시적인 것이고, 제한되는 것으로 의도되지 않는다. 본원에 언급된 모든 공보, 특허 출원, 특허, 서열목록, 데이터베이스 조사, 및 다른 참조문헌은, 이들의 전문이 인용에 의해 포함된다. 상충하는 경우에, 정의를 포함하는 본 명세서가 제어할 것이다.
본 개시의 다른 특징 및 이점은 다음의 발명을 실시하기 위한 구체적인 내용 및 도면, 및 특허청구범위로부터 명백해질 것이다.
상기 및 다른 목적, 특징 및 이점은, 유사한 참조 특징이 상이한 관점에 걸쳐 동일한 부분을 언급하는 첨부되는 도면에 나타낸 바와 같이, 본 발명의 특정 실시형태들의 다음 설명으로부터 명백해질 것이다. 도면은 본 발명의 각종 실시형태들의 원리를 나타내는 대신에 규모를 조정하고 강조하는데 필수적인 것은 아니다.
도 1은, N4-Me-CTP(화합물 1의 NTP)에 대한 분석 결과의 스펙트럼 및 그래프를 제공한다. 도 1a는 DMSO에서의 핵 자기 공명(NMR) 스펙트럼을 제공하고, 도 1b는 D2O에서의 NMR 스펙트럼을 제공하며, 도 1c는 질량 분광법(MS) 결과를 제공하고, 도 1d는 N4-메틸사이티딘(N4-Me-사이티딘, 화합물 1)에 대한 고성능 액체 크로마토그래피(HPLC) 결과이다.
도 2는 N4-Me-CTP(화합물 1의 NTP)에 대한 HPLC 결과를 나타낸다.
도 3은 2'-OMe-N, N-디-Me-CTP(화합물 2의 NTP)에 대한 분석 결과를 제공한다. 도 3a는 NMR 스펙트럼을 제공한다. 도 3b는 MS 결과를 제공한다. 도 3c는 2'-O-메틸-N4, N4-디메틸사이티딘(2'-OMe-N,N-디-Me-사이티딘, 화합물 2)에 대한 HPLC 결과를 제공한다.
도 4는 2'-OMe-N, N-디-Me-CTP(화합물 2의 NTP)에 대한 HPLC 결과를 나타낸다.
도 5는 5-메톡시카보닐메톡시-UTP(화합물 3의 NTP)에 대한 HPLC 결과를 제공한다.
도 6은 3-메틸 슈도우리딘(화합물 4)에 대한 분석 결과를 제공한다. 도 6a는 3-메틸 슈도우리딘(화합물 4)의 NMR 스펙트럼을 제공하고, 도 6b는 3-메틸 슈도우리딘(화합물 4)에 대한 HPLC 결과를 제공한다.
도 7은 5-TBDMS-OCH2-사이티딘(화합물 6)의 분석 결과를 제공한다. 도 7a는 NMR 스펙트럼을 제공하고, 도 7b는 MS 결과를 제공하며, 도 7c는 5-TBDMS-OCH2-사이티딘(화합물 6)에 대한 HPLC 결과를 제공한다.
도 8은 5-트리플루오로메틸 우리딘(화합물 8)의 분석 결과를 제공한다. 도 8a는 NMR 스펙트럼을 제공하고, 도 8b는 MS 결과를 제공하며, 도 8c는 5-트리플루오로메틸 우리딘(화합물 8)에 대한 HPLC 결과를 제공한다.
도 9는 5-(메톡시카보닐)메틸 우리딘(화합물 9)에 대한 NMR 스펙트럼 결과를 제공한다.
도 10은, 변형 퍼센트(퍼센트 변형; percent modification)의 함수로서의 단백질(GCSF; 라인 B) 및 사이토카인(인터페론-알파(IFNα); 라인 및 종양 괴사 인자-알파(TNFα); 라인 C) 발현의 가변성을 나타내는 그래프를 제공한다.
도 1은, N4-Me-CTP(화합물 1의 NTP)에 대한 분석 결과의 스펙트럼 및 그래프를 제공한다. 도 1a는 DMSO에서의 핵 자기 공명(NMR) 스펙트럼을 제공하고, 도 1b는 D2O에서의 NMR 스펙트럼을 제공하며, 도 1c는 질량 분광법(MS) 결과를 제공하고, 도 1d는 N4-메틸사이티딘(N4-Me-사이티딘, 화합물 1)에 대한 고성능 액체 크로마토그래피(HPLC) 결과이다.
도 2는 N4-Me-CTP(화합물 1의 NTP)에 대한 HPLC 결과를 나타낸다.
도 3은 2'-OMe-N, N-디-Me-CTP(화합물 2의 NTP)에 대한 분석 결과를 제공한다. 도 3a는 NMR 스펙트럼을 제공한다. 도 3b는 MS 결과를 제공한다. 도 3c는 2'-O-메틸-N4, N4-디메틸사이티딘(2'-OMe-N,N-디-Me-사이티딘, 화합물 2)에 대한 HPLC 결과를 제공한다.
도 4는 2'-OMe-N, N-디-Me-CTP(화합물 2의 NTP)에 대한 HPLC 결과를 나타낸다.
도 5는 5-메톡시카보닐메톡시-UTP(화합물 3의 NTP)에 대한 HPLC 결과를 제공한다.
도 6은 3-메틸 슈도우리딘(화합물 4)에 대한 분석 결과를 제공한다. 도 6a는 3-메틸 슈도우리딘(화합물 4)의 NMR 스펙트럼을 제공하고, 도 6b는 3-메틸 슈도우리딘(화합물 4)에 대한 HPLC 결과를 제공한다.
도 7은 5-TBDMS-OCH2-사이티딘(화합물 6)의 분석 결과를 제공한다. 도 7a는 NMR 스펙트럼을 제공하고, 도 7b는 MS 결과를 제공하며, 도 7c는 5-TBDMS-OCH2-사이티딘(화합물 6)에 대한 HPLC 결과를 제공한다.
도 8은 5-트리플루오로메틸 우리딘(화합물 8)의 분석 결과를 제공한다. 도 8a는 NMR 스펙트럼을 제공하고, 도 8b는 MS 결과를 제공하며, 도 8c는 5-트리플루오로메틸 우리딘(화합물 8)에 대한 HPLC 결과를 제공한다.
도 9는 5-(메톡시카보닐)메틸 우리딘(화합물 9)에 대한 NMR 스펙트럼 결과를 제공한다.
도 10은, 변형 퍼센트(퍼센트 변형; percent modification)의 함수로서의 단백질(GCSF; 라인 B) 및 사이토카인(인터페론-알파(IFNα); 라인 및 종양 괴사 인자-알파(TNFα); 라인 C) 발현의 가변성을 나타내는 그래프를 제공한다.
상세한 설명
본 개시는, 특히, 세포의 집단 내로 도입되는 경우 감소된 선천적 면역 반응을 포함하지만, 이에 한정되지 않는 개선된 치료학적 특성을 나타내는 변형된 뉴클레오사이드, 변형된 뉴클레오타이드, 및 변형된 핵산을 제공한다.
폴리펩타이드 또는 이의 단편을 암호화하는 핵산의 세포내 번역 및 프로세싱의 효과적인 조정을 둘러싼 무수한 장애물들을 다루기 위한 치료학적 양상들(therapeutic modalities)에 대한 요구가 당해 분야에 남아 있으므로, 본 발명자들은, 소정의 변형된 mRNA 서열이 면역 반응을 단지 회피하거나, 모면하거나, 제거하는 것 이상의 이익을 갖는 치료제로서의 가능성을 가짐을 나타내었다.
본 발명은, 목적한 폴리펩타이드(예를 들면, 변형된 mRNA)를 암호화하고 당해 분야에서의 과제들 중 하나 이상을 모면하는 구조적 및/또는 화학적 특징, 예를 들면, 핵산-계 치료제들을 최적화하지만 발현의 한계(threshold)를 극복하고, 발현율들, 반감기 및/또는 단백질 농도를 개선하고, 단백질 국재화를 최적화하고, 면역 반응 및/또는 분해 경로와 같은 유해한 생체-반응들을 모면하는데 유용한 특징을 갖는 핵산계 화합물 또는 폴리뉴클레오타이드를 제공함으로써 이러한 요구를 다루고 있다.
본원에서, 화학적으로 변형되어 조직 내에서 안정성 및/또는 청소율, 수용체 흡수 및/또는 동역학, 조성물들에 의한 세포적 접근, 번역 기구와의 관계(engagement), mRNA 반감기, 번역 효율, 면역 회피, 단백질 생산능, 분비 효능(적용가능한 경우), 순환에 대한 접근성, 단백질 반감기, 및/또는 세포의 상태, 기능 및/또는 활성의 조정 중 하나 이상을 개선시키는, 목적하는 폴리펩타이드를 암호화하는 폴리뉴클레오타이드가 일부 제공된다.
본원에 교시된 변형들의 조합을 포함하는, 본 발명의 변형된 뉴클레오사이드, 뉴클레오타이드 및 핵산은, 이들을 치료학적 양상으로서 보다 더 적합하도록 하는 우수한 특성들을 갖는다.
당해 분야의 "전부 또는 전무(all or none)" 모델도 변형된 mRNA의 치료학적 유용성과 관련된 생물학적 현상들을 설명하는데 매우 불충분함이 측정되어 왔다. 본 발명자들은, 단백질 생산을 개선하기 위해, 변형 또는 변형들의 조합의 특성인 퍼센트 변형을 고려할 수 있고, 특정 변형된 mRNA의 효능 및 위험 프로파일을 측정하기 위해, 하나 이상의 사이토카인을 측량하거나 계량할 수 있다고 결정하였다.
본 발명의 한 양상에서, 변형되지 않은 mRNA와 비교하여 변형된 mRNA의 효과를 측정하는 방법들은, 이의 발현이 본 발명의 외인성 핵산의 투여에 의해 촉발되는 하나 이상의 사이토카인들의 측정 및 분석을 포함한다. 이들 값들은, 변형되지 않은 핵산의 투여에 대해 또는 사이토카인 반응, PolyIC, R-848 또는 당해 분야에 공지되어 있는 다른 표준물과 같은 표준 계량법에 대해 비교된다.
본원에서 개발된 표준 계량법의 하나의 예는, 변형된 핵산의 투여 또는 변형된 핵산과의 접촉의 결과로서 이의 발현이 세포, 조직 또는 유기체 내에서 촉발되는 사이토카인들 중 하나 이상(또는 패널)의 수준 또는 양에 대해 세포, 조직 또는 유기체 내에 생산된 암호화된 폴리펩타이드(단백질)의 수준 또는 양의 비를 측정하는 것이다. 이러한 비들은 본원에서 단백질:사이토카인 비 또는 "PC" 비로서 언급된다. PC 비가 높을 수록, 변형된 핵산(측정된 단백질을 암호화하는 폴리뉴클레오타이드)가 보다 효율적이다. 본 발명의 사이토카인에 의한 바람직한 PC 비들은 1 초과, 10 초과, 100 초과, 1000 초과, 10,000 이상 초과일 수 있다. 상이하거나 변형되지 않은 작제물(construct)의 변형된 핵산보다 더 높은 PC 비들을 갖는 변형된 핵산들이 바람직하다.
PC 비는 폴리뉴클레오타이드내에 존재하는 변형 퍼센트에 의해 추가로 한정될 수 있다. 예를 들면, 100% 변형된 핵산에 대해 표준화하여, 사이토카인의 기능(또는 위험) 또는 사이토카인 프로파일(profile)로서 단백질 생산을 측정할 수 있다.
한 실시형태에서, 본 발명은, 변형된 핵산(폴리뉴클레오타이드)의 PC 비를 비교함으로써 화학물질에 걸쳐, 사이토카인 또는 변형 퍼센트, 임의의 특정 변형된 폴리뉴클레오타이드의 상대적인 효능을 측정하는 방법을 제공한다.
다른 실시형태에서, 화학적으로 변형된 mRNA는 실질적으로 비독성이고 비돌연변이성이다.
한 실시형태에서, 변형된 뉴클레오사이드, 변형된 뉴클레오타이드, 및 변형된 핵산은 주요 그루브 페이스(groove face) 상에서 화학적으로 변형됨으로써 주요 그루브 결합 파트너 상호작용을 방해할 수 있으며, 이는 선천적 면역 반응을 유발할 수 있다. 추가로, 이들 변형된 뉴클레오사이드, 변형된 뉴클레오타이드, 및 변형된 핵산을 사용하여 페이로드(payload), 예를 들면, 검출가능한 또는 치료학적 제제를 생물학적 표적에 전달할 수 있다. 예를 들면, 핵산들을 페이로드에, 예를 들면, 검출가능한 또는 치료학적 제제에, 핵염기 또는 당 모이어티(moiety)에 부착된 링커(linker)를 통하여 공유 결합시킬 수 있다. 본원에 기술된 조성물들 및 방법들은 생체내 및 시험관내에서, 세포외적으로 또는 세포내적으로 둘 다, 및 또한 세포 불포함 검정(cell free assay)과 같은 검정에서 사용될 수 있다.
일부 실시형태에서, 본 개시는, 주요 그루브 상호작용의 결합, 예를 들면, 핵산과의 결합 파트너의 결합을 방해하는 뉴클레오타이드를 포함하는 화합물을 제공하며, 여기서, 당해 뉴클레오타이드는 주요 그루브 상호작용 파트너들에 대한 결합 친화성을 감소시켰다.
다른 양상에서, 본 개시는, 화학적 변형을 함유하는 뉴클레오타이드를 제공하며, 여기서, 당해 뉴클레오타이드는 주요 그루브 상호작용 파트너들에 대한 결합을 변경하였다.
일부 실시형태에서, 화학적 변형은 핵염기의 주요 그루브 페이스 상에 위치하며, 여기서, 화학적 변형은, 피리미딘 핵염기의 원자를 아민, SH, 알킬(예를 들면, 메틸 또는 에틸), 또는 할로(예를 들면, 클로로 또는 플루오로)로 대체하거나 치환함을 포함할 수 있다.
다른 양상에서, 본 개시는, 뉴클레오타이드의 당 모이어티 상에 위치한 화학적 변형을 제공한다.
다른 양상에서, 본 개시는 핵산의 포스페이트 골격 상에 위치한 화학적 변형을 제공한다.
일부 실시형태에서, 화학적 변형들은 핵산의 주요 그루브 페이스 상에서의 전기화학을 변경시킨다.
다른 양상에서, 본 개시는, 화학적 변형들을 함유하는 뉴클레오타이드들을 제공하며, 여기서, 당해 뉴클레오타이드는, 상응하는 변형되지 않은 핵산에 의해 유도된 세포의 선천적 면역과 비교하여 세포의 선천적 면역 반응을 감소시킨다.
다른 양상에서, 본 개시는 적어도 2개의 뉴클레오타이드들을 포함하는 핵산 서열들을 제공하며, 여기서, 핵산 서열은, 핵산 서열과 주요 그루브 상호작용 파트너의 결합을 방해하는 뉴클레오타이드를 포함하고, 여기서, 뉴클레오타이드는 주요 그루브 결합 파트너에 대한 결합 친화성을 감소시켰다.
다른 양상에서, 본 개시는 본원에 기술된 바와 같은 화합물을 포함하는 조성물들을 제공한다. 일부 실시형태에서, 당해 조성물은 반응 혼합물이다. 일부 실시형태에서, 조성물은 약제학적 조성물이다. 일부 실시형태에서, 조성물은 세포 배양물이다. 일부 실시형태에서, 조성물은 RNA 폴리머라제 및 cDNA 주형을 추가로 포함한다. 일부 실시형태에서, 조성물은 아데노신, 사이토신, 구아노신, 및 우라실로 이루어진 그룹으로부터 선택되는 뉴클레오타이드를 추가로 포함한다.
추가의 양상에서, 본 개시는, 사람 세포들의 제1 집단을 본원에 기술된 방법들에 의해 제조된 약제학적 핵산으로 형질감염시킴을 포함하는, 생리학적으로 활성인 분비된 단백질을 포함하는 약제학적 제형을 제조하는 방법들을 제공하며, 여기서, 분비된 단백질은 사람 세포들의 제2 집단에 대해 활성이다.
일부 실시형태에서, 분비된 단백질은 제2 집단에 존재하는 적어도 하나의 세포의 표면 상의 수용체와 상호작용할 수 있다.
일부 실시형태에서, 분비된 단백질은 과립구-콜로니 자극 인자(G-CSF)이다.
일부 실시형태에서, 제2 집단은 G-CSF 수용체를 발현하는 골수아세포를 함유한다.
특정 실시형태에서, 항체-의존성 세포 독성을 유도하는 단백질과 함께 포유동물 대상체의 면역성을 증강시키는 단백질 또는 단백질들을 암호화하는 번역가능한 영역들을 함유하는 하나 이상의 변형된 핵산들을 함유하는 병용 치료제들이 본원에 제공된다. 예를 들면, 트라스투주마브 및 과립구-콜로니 자극 인자(G-CSF)를 암호화하는 하나 이상의 핵산들을 함유하는 치료제들이 제공된다. 특히, 이러한 병용 치료제들은 트라스투주마브에 대해 유도된 내성으로 발달하는 Her2+ 유방암 환자들에서 유용하다. [참조: 예를 들면, Albrecht, Immunotherapy. 2(6):795-8(2010)].
한 실시형태에서, 본 개시의 화합물들은 안정한 것으로 의도된다. 명확성을 위해, 별도의 실시형태들의 내용에 기술된, 본 개시의 특정 특징들이 또한 단일 실시형태에서 병용으로 제공될 수 있음이 추가로 이해된다. 역으로, 간결성을 위해, 단일 실시형태의 내용에 기술된 본 개시의 각종 특징들도 별도로 또는 임의의 적합한 하위조합(subcombination)으로 제공될 수 있다.
본 발명의 변형된
뉴레오타이드
,
뉴클레오사이드
및
폴리뉴클레오타이드
본원에서, 뉴클레오타이드, 뉴클레오사이드 또는 폴리뉴클레오타이드(예를 들면, 본 발명의 핵산들, 예를 들면, mRNA 분자)에서, 용어 "변형" 또는 적절하게는 "변형된"은 A, G, U 또는 C 리보뉴클레오타이드들에 관한 변형을 말한다. 일반적으로, 본원에서, 이들 용어들은 천연적으로 발생하는 5'-말단 mRNA 캡 모이어티 내의 리보뉴클레오타이드 변형들을 말하는 것으로 의도되지 않는다. 폴리펩타이드에서, 용어 "변형"은 20개 아미노산들의 정규 세트, 모이어티와 비교한 변형을 말한다.
변형들은 각종의 명백한 변형들일 수 있다. 일부 실시형태에서, 핵산이 mRNA인 경우, 암호화 영역, 플랭킹 영역들(flanking regions) 및/또는 말단 영역들은 1개, 2개, 또는 그 이상의(임의로 상이한) 뉴클레오사이드 또는 뉴클레오타이드 변형들을 함유할 수 있다. 일부 실시형태에서, 세포에 도입된 변형된 폴리뉴클레오타이드는, 변형되지 않은 폴리뉴클레오타이드와 비교하여, 세포에서 감소된 분해를 나타낼 수 있다.
폴리뉴클레오타이드들은, 당, 핵염기, 또는 뉴클레오사이드간 연결에 대한(예를 들면, 연결 포스페이트에 대한/포스포디에스테르 연결에 대한/포스포디에스테르 골격에 대한) 임의의 유용한 변형을 포함할 수 있다. 예를 들면, 폴리뉴클레오타이드의 주요 그루브, 또는 핵염기의 주요 그루브 페이스는 하나 이상의 변형들을 포함할 수 있다. 피리딘 핵염기의(예를 들면, 주요 그루브 페이스 상의) 하나 이상의 원자들은, 임의로 치환된 아미노, 임의로 치환된 티올, 임의로 치환된 알킬(예를 들면, 메틸 또는 에틸), 또는 할로(예를 들면, 클로로 또는 플루오로)로 대체되거나 치환될 수 있다. 특정 실시형태에서, 변형들(예를 들면, 하나 이상의 변형들)은 각각의 당 및 뉴클레오사이드간 연결 각각에 존재한다. 본 발명에 따른 변형들은 리보핵산(RNA)의 데옥시리보핵산들(DNA)로의 변형들, 예를 들면, 리보푸라니실 환의 2'OH의 2'H, 트레오스 핵산(TNA), 글리콜 핵산(GNA), 펩타이드 핵산(PNA), 잠금(locked) 핵산(LNAs) 또는 이들의 하이브리드로의 치환일 수 있다. 추가의 변형들이 본원에 기술되어 있다.
본원에 기술된 바와 같이, 본 발명의 폴리뉴클레오타이드는, 폴리뉴클레오타이드(예를 들면, mRNA)가 도입된 세포의 선천적 면역 반응을 실질적으로 유도하지 않는다. 유도된 선천적 면역 반응의 특징들로는 1) 염증-촉진성 사이토카인들의 증가된 발현, 2) 세포내 PRR들(RIG-I, MDA5 등)의 활성화, 및/또는 3) 단백질 번역에 있어서의 종결 또는 감소가 포함된다.
소정 실시형태에서, 변형된 핵산 분자를 세포내로 도입시켜 세포내적으로 분해되도록 하는 것이 바람직할 수 있다. 예를 들면, 변형된 핵산 분자의 분해는, 단백질 생산의 정확한 시기선택(precise timing)이 요구되는 경우에 바람직할 수 있다. 따라서, 일부 실시형태에서, 본 발명은, 세포 내에서의 직접적인 방식으로 작용할 수 있는, 분해 도메인(domain)을 함유하는 변형된 핵산 분자를 제공한다. 다른 양상에서, 본 개시는, 주요 그루브 상호작용의 결합, 예를 들면, 파트너와 폴리뉴클레오타이드의 결합(예를 들면, 변형된 뉴클레오타이드가, 변형되지 않은 뉴클레오타이드와 비교하여, 주요 그루브 상호작용 파트너에 대한 결합 친화성을 감소시킨 경우)을 방해할 수 있는 뉴클레오사이드 또는 뉴클레오타이드를 포함하는 폴리뉴클레오타이드들을 제공한다.
폴리뉴클레오타이드들은 다른 제제들[예를 들면, RNAi-유도제, RNAi 제제, siRNA, shRNA, miRNA, 안티센스 RNA, 리보자임, 촉매적 DNA, tRNA, 삼중 나선 형성을 유도하는 RNA, 압타머(aptamer), 벡터 등]을 임의로 포함할 수 있다. 일부 실시형태에서, 폴리뉴클레오타이드들은 하나 이상의 변형된 뉴클레오사이드 또는 뉴클레오타이드들(즉, 변형된 mRNA 분자들)을 갖는 하나 이상의 전령 RNA(mRNA)를 포함할 수 있다. 이들 폴리뉴클레오타이드에 대한 세부사항은 다음과 같다.
폴리뉴클레오타이드
본 발명의 폴리뉴클레오타이드는, 목적한 폴리펩타이드를 암호화하는 연결된 뉴클레오사이드의 제1 영역, 제1 영역의 5' 말단에 위치한 제1 플랭킹(flanking) 영역, 및 제1 영역의 3' 말단에 위치한 제2 플랭킹 영역을 포함한다.
일부 실시형태에서, 폴리뉴클레오타이드(예를 들면, 제1 영역, 제1 플랭킹 영역, 또는 제2 플랭킹 영역)은 하기 화학식 Ia 또는 화학식 Ia-1을 갖는 n개의 연결된 뉴클레오사이드들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 포함하고:
[화학식 Ia]
[화학식 Ia-1]
상기 화학식 Ia 또는 화학식 Ia-1에서, U는 O, S, N(RU)nu, 또는 C(RU)nu이고, 여기서, nu는 0 내지 2의 정수이며, 각각의 RU는 독립적으로, H, 할로, 또는 임의로 치환된 알킬이며;
각각의 R1', R2', R1 ", R2 ", R1, R2, R3, R4, 및 R5는 존재하는 경우, 독립적으로, H, 할로, 하이드록시, 티올, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시, 임의로 치환된 하이드록시알콕시, 임의로 치환된 아미노, 아지도, 임의로 치환된 아릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐이거나, 부재하고; 여기서, R3과, R1', R1 ", R2', R2 ", 또는 R5 중 하나 이상과의 조합(예를 들면, R1'과 R3의 조합, R1 "과 R3의 조합, R2'과 R3의 조합, R2 "과 R3의 조합, 또는 R5와 R3의 조합)은 함께 결합하여, 이들이 부착된 탄소들과 함께, 임의로 치환된 알킬렌 또는 임의로 치환된 헤테로알킬렌을 형성할 수 있고, 상기 조합은, 이들이 부착된 탄소들과 함께, 임의로 치환된 헤테로사이클릴(예를 들면, 비사이클릭, 트리사이클릭, 또는 테트라사이클릭 헤테로사이클릴)을 제공하며; 여기서, R5와, R1', R1 ", R2', 또는 R2 " 중 하나 이상과의 조합(예를 들면, R1'과 R5의 조합, R1 "과 R5의 조합, R2'과 R5의 조합, 또는 R2 "과 R5의 조합)은 함께 결합하여, 임의로 치환된 알킬렌 또는 임의로 치환된 헤테로알킬렌을 형성할 수 있으며, 상기 조합은, 이들이 부착된 탄소들과 함께, 임의로 치환된 헤테로사이클릴(예를 들면, 비사이클릭, 트리사이클릭, 또는 테트라사이클릭 헤테로사이클릴)을 제공하며; 여기서, R4와, R1', R1 ", R2', R2 ", R3, 또는 R5 중 하나 이상과의 조합은 함께 결합하여, 임의로 치환된 알킬렌 또는 임의로 치환된 헤테로알킬렌을 형성할 수 있으며, 상기 조합은, 이들이 부착된 탄소들과 함께, 임의로 치환된 헤테로사이클릴(예를 들면, 비사이클릭, 트리사이클릭, 또는 테트라사이클릭 헤테로사이클릴)을 제공하고;
각각의 m' 및 m"은 독립적으로 0 내지 3(예를 들면, 0 내지 2, 0 내지 1, 1 내지 3, 또는 1 내지 2)의 정수이고;
각각의 Y1, Y2, 및 Y3은, 독립적으로, O, S, Se, -NRN1-, 임의로 치환된 알킬렌, 또는 임의로 치환된 헤테로알킬렌이며, 여기서, RN1은 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 아릴이거나, 부재하고;
각각의 Y4는, 독립적으로, H, 하이드록시, 티올, 보라닐, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 티오알콕시, 임의로 치환된 알콕시알콕시, 또는 임의로 치환된 아미노이며;
각각의 Y5는, 독립적으로, O, S, Se, 임의로 치환된 알킬렌(예를 들면, 메틸렌), 또는 임의로 치환된 헤테로알킬렌이고;
n은 1 내지 100,000의 정수이며;
B는 핵염기(예를 들면, 퓨린, 피리미딘, 또는 이들의 유도체들)이고, 여기서, B와 R1'의 조합, B와 R2'의 조합, B와 R1"의 조합, 또는 B와 R2"의 조합은, 이들이 부착된 탄소들과 함께, 비사이클릭 그룹(예를 들면, 비사이클릭 헤테로사이클릴)을 임의로 형성하거나, 여기서, B, R1 " 및 R3의 조합 또는 B, R2 " 및 R3의 조합은 트리사이클릭 또는 테트라사이클릭 그룹(예를 들면, 트리사이클릭 또는 테트라사이클릭 헤테로사이클릴, 예를 들면, 본원의 화학식 IIo 내지 IIp)를 임의로 형성할 수 있다.
일부 실시형태에서, 폴리뉴클레오타이드는, 변형된 리보스를 포함한다. 일부 실시형태에서, 폴리뉴클레오타이드(예를 들면, 제1 영역, 제1 플랭킹 영역, 또는 제2 플랭킹 영역)는 n개의, 화학식 Ia-2 내지 화학식 Ia-5의 연결된 뉴클레오사이드들 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 포함한다:
[화학식 Ia-2]
[화학식 Ia-3]
[화학식 Ia-4]
[화학식 Ia-5]
일부 실시형태에서, 폴리뉴클레오타이드(예를 들면, 제1 영역, 제1 플랭킹 영역, 또는 제2 플랭킹 영역)는 n개의, 화학식 Ib 또는 화학식 Ib-1의 연결된 뉴클레오사이드들 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 포함하고:
[화학식 Ib]
[화학식 Ib-1]
여기서, U는 O, S, N(RU)nu, 또는 C(RU)nu이고, 여기서, nu는 0 내지 2의 정수이며, 각각의 RU는, 독립적으로, H, 할로, 또는 임의로 치환된 알킬이고;
각각의 R1, R3', R3", 및 R4는, 독립적으로, H, 할로, 하이드록시, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시, 임의로 치환된 하이드록시알콕시, 임의로 치환된 아미노, 아지도, 임의로 치환된 아릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐이거나, 부재하고; 여기서, R1과 R3'의 조합 또는 R1과 R3 "의 조합은 함께, 임의로 치환된 알킬렌 또는 임의로 치환된 헤테로알킬렌을 형성할 수 있고[예를 들면, 잠금(locked) 핵산을 생산할 수 있고];
각각의 R5는, 독립적으로, H, 할로, 하이드록시, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시이거나, 부재하며;
각각의 Y1, Y2, 및 Y3은, 독립적으로, O, S, Se, NRN1-, 임의로 치환된 알킬렌, 또는 임의로 치환된 헤테로알킬렌이고, 여기서, RN1은 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 또는 임의로 치환된 아릴이며;
각각의 Y4는, 독립적으로, H, 하이드록시, 티올, 보라닐, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 알콕시알콕시, 또는 임의로 치환된 아미노이고;
n은 1 내지 100,000의 정수이며;
B는 핵염기이다.
일부 실시형태에서, 폴리뉴클레오타이드(예를 들면, 제1 영역, 제1 플랭킹 영역, 또는 제2 플랭킹 영역)는 n개의, 화학식 Ic의 연결된 뉴클레오사이드들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 포함하고:
[화학식 Ic]
상기 화학식 Ic에서, U는 O, S, N(RU)nu, 또는 C(RU)nu이고, 여기서, nu는 0 내지 2의 정수이며, 각각의 RU는, 독립적으로, H, 할로, 또는 임의로 치환된 알킬이고;
각각의 B1, B2, 및 B3은, 독립적으로, 핵염기(예를 들면, 본원에 기술된 바와 같은, 퓨린, 피리미딘, 또는 이들의 유도체), H, 할로, 하이드록시, 티올, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시, 임의로 치환된 하이드록시알콕시, 임의로 치환된 아미노, 아지도, 임의로 치환된 아릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 또는 임의로 치환된 아미노알키닐이고, 여기서, B1, B2, 및 B3 중 하나 및 단지 하나는 핵염기이고;
각각의 Rb1, Rb2, Rb3, R3, 및 R5는, 독립적으로, H, 할로, 하이드록시, 티올, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시, 임의로 치환된 하이드록시알콕시, 임의로 치환된 아미노, 아지도, 임의로 치환된 아릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 또는 임의로 치환된 아미노알키닐이며;
각각의 Y1, Y2, 및 Y3은, 독립적으로, O, S, Se, -NRN1-, 임의로 치환된 알킬렌, 또는 임의로 치환된 헤테로알킬렌이고, 여기서, RN1은 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 또는 임의로 치환된 아릴이며;
각각의 Y4는, 독립적으로, H, 하이드록시, 티올, 보라닐, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 티오알콕시, 임의로 치환된 알콕시알콕시, 또는 임의로 치환된 아미노이고;
각각의 Y5는, 독립적으로, O, S, Se, 임의로 치환된 알킬렌(예를 들면, 메틸렌), 또는 임의로 치환된 헤테로알킬렌이며;
n은 1 내지 100,000의 정수이고;
여기서, U를 포함하는 환은 하나 이상의 이중 결합들을 포함할 수 있다.
특정 실시형태에서, U를 포함하는 환은 U-CB3Rb3 사이에 또는 CB3Rb3-CB2Rb2 사이에 이중 결합을 갖지 않는다.
일부 실시형태에서, 폴리뉴클레오타이드(예를 들면, 제1 영역, 제1 플랭킹 영역, 또는 제2 플랭킹 영역)는 n개의, 화학식 Id의 연결된 뉴클레오사이드들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 포함하고:
[화학식 Id]
상기 화학식 Id에서, U는 O, S, N(RU)nu, 또는 C(RU)nu이고, 여기서, nu는 0 내지 2의 정수이고, 각각의 RU는, 독립적으로, H, 할로, 또는 임의로 치환된 알킬이며;
각각의 R3은, 독립적으로, H, 할로, 하이드록시, 티올, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시, 임의로 치환된 하이드록시알콕시, 임의로 치환된 아미노, 아지도, 임의로 치환된 아릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 또는 임의로 치환된 아미노알키닐이며;
각각의 Y1, Y2, 및 Y3는, 독립적으로, O, S, Se, -NRN1-, 임의로 치환된 알킬렌, 또는 임의로 치환된 헤테로알킬렌이고, 여기서, RN1은 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 또는 임의로 치환된 아릴이며;
각각의 Y4는, 독립적으로, H, 하이드록시, 티올, 보라닐, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 티오알콕시, 임의로 치환된 알콕시알콕시, 또는 임의로 치환된 아미노이고;
각각의 Y5는, 독립적으로, O, S, 임의로 치환된 알킬렌(예를 들면, 메틸렌), 또는 임의로 치환된 헤테로알킬렌이며;
n은 1 내지 100,000의 정수이고;
B는 핵염기(예를 들면, 퓨린, 피리미딘, 또는 이들의 유도체)이다.
일부 실시형태에서, 폴리뉴클레오타이드(예를 들면, 제1 영역, 제1 플랭킹 영역, 또는 제2 플랭킹 영역)은 n개의, 화학식 Ie의 연결된 뉴클레오사이드들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 포함하고:
[화학식 Ie]
상기 화학식 Ie에서, 각각의 U' 및 U"은, 독립적으로, O, S, N(RU)nu, 또는 C(RU)nu이고, 여기서, nu는 0 내지 2의 정수이며, 각각의 RU는, 독립적으로, H, 할로, 또는 임의로 치환된 알킬이고;
각각의 R6은, 독립적으로, H, 할로, 하이드록시, 티올, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시, 임의로 치환된 하이드록시알콕시, 임의로 치환된 아미노, 아지도, 임의로 치환된 아릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 또는 임의로 치환된 아미노알키닐이며;
각각의 Y5'은, 독립적으로, O, S, 임의로 치환된 알킬렌(예를 들면, 메틸렌 또는 에틸렌), 또는 임의로 치환된 헤테로알킬렌이고;
n은 1 내지 100,000의 정수이며;
B는 핵염기(예를 들면, 퓨린, 피리미딘, 또는 이들의 유도체)이다.
일부 실시형태에서, 폴리뉴클레오타이드(예를 들면, 제1 영역, 제1 플랭킹 영역, 또는 제2 플랭킹 영역)은 n개의, 화학식 If 또는 화학식 If-1의 연결된 뉴클레오사이드들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 포함하고:
[화학식 If]
[화학식 If-1]
상기 화학식 If 또는 If-1에서, 각각의 U' 및 U"은, 독립적으로, O, S, N, N(RU)nu, 또는 C(RU)nu이며, 여기서, nu는 0 내지 2의 정수이고,각각의 RU는, 독립적으로, H, 할로, 또는 임의로 치환된 알킬(예를 들면, U'은 O이고,U"은 N이다)이며;
각각의 R1', R2', R1", R2", R3, 및 R4는, 독립적으로, H, 할로, 하이드록시, 티올, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시, 임의로 치환된 하이드록시알콕시, 임의로 치환된 아미노, 아지도, 임의로 치환된 아릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐이거나, 부재하며; 여기서, R1'과 R3의 조합, R1"과 R3의 조합, R2'과 R3의 조합, 또는 R2 "과 R3의 조합은 함께, 임의로 치환된 알킬렌 또는 임의로 치환된 헤테로알킬렌을 형성(예를 들면, 잠금 핵산을 생산)할 수 있으며; 각각의 m' 및 m"은, 독립적으로, 0 내지 3(예를 들면, 0 내지 2, 0 내지 1, 1 내지 3, 또는 1 내지 2)의 정수이고;
각각의 Y1, Y2, 및 Y3은, 독립적으로, O, S, Se, -NRN1-, 임의로 치환된 알킬렌, 또는 임의로 치환된 헤테로알킬렌이며, 여기서, RN1는 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 아릴이거나, 부재하며;
각각의 Y4는, 독립적으로, H, 하이드록시, 티올, 보라닐, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 티오알콕시, 임의로 치환된 알콕시알콕시, 또는 임의로 치환된 아미노이고;
각각의 Y5는, 독립적으로, O, S, Se, 임의로 치환된 알킬렌(예를 들면, 메틸렌), 또는 임의로 치환된 헤테로알킬렌이며;
n은 1 내지 100,000의 정수이고;
B는 핵염기(예를 들면, 퓨린, 피리미딘, 또는 이들의 유도체)이다.
폴리뉴클레오타이드들[예를 들면, 화학식 Ia 내지 화학식 Ia-5, 화학식 Ib 내지 화학식 If-1, 화학식 IIa 내지 화학식 IIp, 화학식 IIb-1, 화학식 IIb-2, 화학식 IIc-1 내지 화학식 IIc-2, 화학식 IIn-1, 화학식 IIn-2, 화학식 IVa 내지 화학식 IVl, 및 화학식 IXa 내지 화학식 IXr]의 일부 실시형태에서, U를 포함하는 환은 1개 또는 2개의 이중 결합을 갖는다.
폴리뉴클레오타이드들[예를 들면, 화학식 Ia 내지 화학식 Ia-5, 화학식 Ib 내지 화학식 If-1, 화학식 IIa 내지 화학식 IIp, 화학식 IIb-1, 화학식 IIb-2, 화학식 IIc-1 내지 화학식 IIc-2, 화학식 IIn-1, 화학식 IIn-2, 화학식 IVa 내지 화학식 IVl, 및 화학식 IXa 내지 화학식 IXr]의 일부 실시형태에서, 각각의 R1, R1', 및 R1 "은, 존재하는 경우, H이다. 추가의 실시형태에서, 각각의 R2, R2' 및 R2"은, 존재하는 경우, 독립적으로, H, 할로(예를 들면, 플루오로), 하이드록시, 임의로 치환된 알콕시(예를 들면, 메톡시 또는 에톡시), 또는 임의로 치환된 알콕시알콕시이다. 특정 실시형태에서, 알콕시알콕시는 -(CH2)s2(OCH2CH2)s1(CH2)s3OR'이고, 여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, R'은 H 또는 C1-20 알킬이다. 일부 실시형태에서, s2는 0이고, s1은 1 또는 2이며, s3은 0 또는 1이고, R'은 C1-6 알킬이다.
폴리뉴클레오타이드들[예를 들면, 화학식 Ia 내지 화학식 Ia-5, 화학식 Ib 내지 화학식 If-1, 화학식 IIa 내지 화학식 IIp, 화학식 IIb-1, 화학식 IIb-2, 화학식 IIc-1 내지 화학식 IIc-2, 화학식 IIn-1, 화학식 IIn-2, 화학식 IVa 내지 화학식 IVl, 및 화학식 IXa 내지 화학식 IXr]의 일부 실시형태에서, 각각의 R2, R2', 및 R2 "은, 존재하는 경우, H이다. 추가의 실시형태에서, 각각의 R1, R1' 및 R1 "은, 존재하는 경우, 독립적으로, H, 할로(예를 들면, 플루오로), 하이드록시, 임의로 치환된 알콕시(예를 들면, 메톡시 또는 에톡시), 또는 임의로 치환된 알콕시알콕시이다. 특정 실시형태에서, 알콕시알콕시는 -(CH2)s2(OCH2CH2)s1(CH2)s3OR'이고, 여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, R'은 H 또는 C1 -20 알킬이다. 일부 실시형태에서, s2는 0이고, s1은 1 또는 2이며, s3은 0 또는 1이고, R'은 C1-6 알킬이다.
폴리뉴클레오타이드들[예를 들면, 화학식 Ia 내지 화학식 Ia-5, 화학식 Ib 내지 화학식 If-1, 화학식 IIa 내지 화학식 IIp, 화학식 IIb-1, 화학식 IIb-2, 화학식 IIc-1 내지 화학식 IIc-2, 화학식 IIn-1, 화학식 IIn-2, 화학식 IVa 내지 화학식 IVl, 및 화학식 IXa 내지 화학식 IXr]의 일부 실시형태에서, 각각의 R3, R4, 및 R5는, 독립적으로, H, 할로(예를 들면, 플루오로), 하이드록시, 임의로 치환된 알킬, 임의로 치환된 알콕시(예를 들면, 메톡시 또는 에톡시), 또는 임의로 치환된 알콕시알콕시이다. 특정 실시형태에서, R3은 H이거나, R4는 H이거나, R5는 H이거나, R3, R4, 및 R5는 모두 H이다. 특정 실시형태에서, R3은 C1-6 알킬이거나, R4는 C1-6 알킬이거나, R5는 C1-6 알킬이거나, R3, R4, 및 R5는 모두 C1 -6 알킬이다. 특정 실시형태에서, R3 및 R4는 둘 다 H이고, R5는 C1 -6 알킬이다.
폴리뉴클레오타이드들[예를 들면, 화학식 Ia 내지 화학식 Ia-5, 화학식 Ib 내지 화학식 If-1, 화학식 IIa 내지 화학식 IIp, 화학식 IIb-1, 화학식 IIb-2, 화학식 IIc-1 내지 화학식 IIc-2, 화학식 IIn-1, 화학식 IIn-2, 화학식 IVa 내지 화학식 IVl, 및 화학식 IXa 내지 화학식 IXr]의 일부 실시형태에서, R3과 R5는 함께 결합하여, 임의로 치환된 알킬렌 또는 임의로 치환된 헤테로알킬렌을 형성하고, 이들이 부착된 탄소들과 함께, 임의로 치환된 헤테로사이클릴[예를 들면, 비사이클릭, 트리사이클릭, 또는 테트라사이클릭 헤테로사이클릴, 예를 들면, 트랜스-3',4' 유사체, 여기서, R3과 R5는 함께 결합하여 헤테로알킬렌(예를 들면, -(CH2)b1O(CH2)b2O(CH2)b3-를 형성하고, 여기서, 각각의 b1, b2, 및 b3은, 독립적으로, 0 내지 3의 정수이다]을 제공한다.
폴리뉴클레오타이드들[예를 들면, 화학식 Ia 내지 화학식 Ia-5, 화학식 Ib 내지 화학식 If-1, 화학식 IIa 내지 화학식 IIp, 화학식 IIb-1, 화학식 IIb-2, 화학식 IIc-1 내지 화학식 IIc-2, 화학식 IIn-1, 화학식 IIn-2, 화학식 IVa 내지 화학식 IVl, 및 화학식 IXa 내지 화학식 IXr]의 일부 실시형태에서, R3과, R1', R1 ", R2', R2 ", 또는 R5 중 하나 이상은 함께 결합하여, 임의로 치환된 알킬렌 또는 임의로 치환된 헤테로알킬렌을 형성하고, 상기 조합은, 이들이 부착된 탄소들과 함께, 임의로 치환된 헤테로사이클릴(예를 들면, 비사이클릭, 트리사이클릭, 또는 테트라사이클릭 헤테로사이클릴)을 제공하고, R3과, R1', R1", R2', R2", 또는 R5 중 하나 이상은 함께 결합하여 헤테로알킬렌[예를 들면, -(CH2)b1O(CH2)b2O(CH2)b3-, 여기서, 각각의 b1, b2, 및 b3은, 독립적으로, 0 내지 3의 정수이다]을 형성한다.
폴리뉴클레오타이드들[예를 들면, 화학식 Ia 내지 화학식 Ia-5, 화학식 Ib 내지 화학식 If-1, 화학식 IIa 내지 화학식 IIp, 화학식 IIb-1, 화학식 IIb-2, 화학식 IIc-1 내지 화학식 IIc-2, 화학식 IIn-1, 화학식 IIn-2, 화학식 IVa 내지 화학식 IVl, 및 화학식 IXa 내지 화학식 IXr]의 일부 실시형태에서, R5와, R1', R1 ", R2', 또는 R2 " 중 하나 이상은 함께 결합하여, 임의로 치환된 알킬렌 또는 임의로 치환된 헤테로알킬렌을 형성하고, 상기 조합은, 이들이 부착된 탄소들과 함께, 임의로 치환된 헤테로사이클릴(예를 들면, 비사이클릭, 트리사이클릭, 또는 테트라사이클릭 헤테로사이클릴)을 제공하고, R5와, R1', R1 ", R2', 또는 R2 " 중 하나 이상은 함께 결합하여 헤테로알킬렌[예를 들면, -(CH2)b1O(CH2)b2O(CH2)b3-, 여기서, 각각의 b1, b2, 및 b3은, 독립적으로, 0 내지 3의 정수이다]을 형성한다.
폴리뉴클레오타이드들[예를 들면, 화학식 Ia 내지 화학식 Ia-5, 화학식 Ib 내지 화학식 If-1, 화학식 IIa 내지 화학식 IIp, 화학식 IIb-1, 화학식 IIb-2, 화학식 IIc-1 내지 화학식 IIc-2, 화학식 IIn-1, 화학식 IIn-2, 화학식 IVa 내지 화학식 IVl, 및 화학식 IXa 내지 화학식 IXr]의 일부 실시형태에서, 각각의 Y2는, 독립적으로, O, S, 또는 -NRN1-이고, 여기서, RN1은 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 또는 임의로 치환된 아릴이다. 특정 실시형태에서, Y2는 NRN1-이고, 여기서, RN1은 H 또는 임의로 치환된 알킬(예를 들면, C1-6 알킬, 예를 들면, 메틸, 에틸, 이소프로필, 또는 n-프로필)이다.
폴리뉴클레오타이드들[예를 들면, 화학식 Ia 내지 화학식 Ia-5, 화학식 Ib 내지 화학식 If-1, 화학식 IIa 내지 화학식 IIp, 화학식 IIb-1, 화학식 IIb-2, 화학식 IIc-1 내지 화학식 IIc-2, 화학식 IIn-1, 화학식 IIn-2, 화학식 IVa 내지 화학식 IVl, 및 화학식 IXa 내지 화학식 IXr]의 일부 실시형태에서, 각각의 Y3은, 독립적으로, O 또는 S이다.
폴리뉴클레오타이드들[예를 들면, 화학식 Ia 내지 화학식 Ia-5, 화학식 Ib 내지 화학식 If-1, 화학식 IIa 내지 화학식 IIp, 화학식 IIb-1, 화학식 IIb-2, 화학식 IIc-1 내지 화학식 IIc-2, 화학식 IIn-1, 화학식 IIn-2, 화학식 IVa 내지 화학식 IVl, 및 화학식 IXa 내지 화학식 IXr]의 일부 실시형태에서, R1은 H이고; 각각의 R2는, 독립적으로, H, 할로(예를 들면, 플루오로), 하이드록시, 임의로 치환된 알콕시(예를 들면, 메톡시 또는 에톡시), 또는 임의로 치환된 알콕시알콕시[예를 들면, -(CH2)s2(OCH2CH2)s1(CH2)s3OR', 여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, R'은 H 또는 C1-20 알킬이고, 예를 들면, 여기서, s2는 0이고, s1은 1 또는 2이며, s3은 0 또는 1이거나, R'은 C1-6 알킬이다]이고; 각각의 Y2는, 독립적으로, O 또는 -NRN1-이고, 여기서, RN1은 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 또는 임의로 치환된 아릴[예를 들면, 여기서, RN1은 H 또는 임의로 치환된 알킬(예를 들면, C1-6 알킬, 예를 들면, 메틸, 에틸, 이소프로필, 또는 n-프로필)이다]이며; 각각의 Y3은, 독립적으로, O 또는 S(예를 들면, S)이다. 추가의 실시형태에서, R3은 H, 할로(예를 들면, 플루오로), 하이드록시, 임의로 치환된 알킬, 임의로 치환된 알콕시(예를 들면, 메톡시 또는 에톡시), 또는 임의로 치환된 알콕시알콕시이다. 또한 추가의 실시형태에서, 각각의 Y1는, 독립적으로, O 또는 -NRN1-이고, 여기서, RN1은 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 또는 임의로 치환된 아릴[예를 들면, 여기서, RN1은 H 또는 임의로 치환된 알킬(예를 들면, C1-6 알킬, 예를 들면, 메틸, 에틸, 이소프로필, 또는 n-프로필)이다]이고; 각각의 Y4는, 독립적으로, H, 하이드록시, 티올, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 티오알콕시, 임의로 치환된 알콕시알콕시, 또는 임의로 치환된 아미노이다.
폴리뉴클레오타이드들[예를 들면, 화학식 Ia 내지 화학식 Ia-5, 화학식 Ib 내지 화학식 If-1, 화학식 IIa 내지 화학식 IIp, 화학식 IIb-1, 화학식 IIb-2, 화학식 IIc-1 내지 화학식 IIc-2, 화학식 IIn-1, 화학식 IIn-2, 화학식 IVa 내지 화학식 IVl, 및 화학식 IXa 내지 화학식 IXr]의 일부 실시형태에서, 각각의 R1은, 독립적으로, H, 할로(예를 들면, 플루오로), 하이드록시, 임의로 치환된 알콕시(예를 들면, 메톡시 또는 에톡시), 또는 임의로 치환된 알콕시알콕시[예를 들면, -(CH2)s2(OCH2CH2)s1(CH2)s3OR', 여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이고, R'은 H 또는 C1-20 알킬, 예를 들면, s2는 0이고, s1는 1 또는 2이며, s3은 0 또는 1이고, R'은 C1-6 알킬이다]이고; R2는 H이며; 각각의 Y2는, 독립적으로, O 또는 -NRN1-이고, 여기서, RN1은 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 또는 임의로 치환된 아릴[예를 들면, 여기서, RN1은 H 또는 임의로 치환된 알킬(예를 들면, C1-6 알킬, 예를 들면, 메틸, 에틸, 이소프로필, 또는 n-프로필)이다]이고; 각각의 Y3은, 독립적으로, O 또는 S(예를 들면, S)이다. 추가의 실시형태에서, R3은 H, 할로(예를 들면, 플루오로), 하이드록시, 임의로 치환된 알킬, 임의로 치환된 알콕시(예를 들면, 메톡시 또는 에톡시), 또는 임의로 치환된 알콕시알콕시이다. 또한 추가의 실시형태에서, 각각의 Y1은, 독립적으로, O 또는 -NRN1-이고, 여기서, RN1은 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 또는 임의로 치환된 아릴[예를 들면, 여기서, RN1은 H 또는 임의로 치환된 알킬(예를 들면, C1-6 알킬, 예를 들면, 메틸, 에틸, 이소프로필, 또는 n-프로필)이다]이고; 각각의 Y4는, 독립적으로, H, 하이드록시, 티올, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 티오알콕시, 임의로 치환된 알콕시알콕시, 또는 임의로 치환된 아미노이다.
폴리뉴클레오타이드들[예를 들면, 화학식 Ia 내지 화학식 Ia-5, 화학식 Ib 내지 화학식 If-1, 화학식 IIa 내지 화학식 IIp, 화학식 IIb-1, 화학식 IIb-2, 화학식 IIc-1 내지 화학식 IIc-2, 화학식 IIn-1, 화학식 IIn-2, 화학식 IVa 내지 화학식 IVl, 및 화학식 IXa 내지 화학식 IXr]의 일부 실시형태에서, U를 포함하는 환은 β-D(예를 들면, β-D-리보) 구조(configuration) 내에 있다.
폴리뉴클레오타이드들[예를 들면, 화학식 Ia 내지 화학식 Ia-5, 화학식 Ib 내지 화학식 If-1, 화학식 IIa 내지 화학식 IIp, 화학식 IIb-1, 화학식 IIb-2, 화학식 IIc-1 내지 화학식 IIc-2, 화학식 IIn-1, 화학식 IIn-2, 화학식 IVa 내지 화학식 IVl, 및 화학식 IXa 내지 화학식 IXr]의 일부 실시형태에서, U를 포함하는 환은 α-L(예를 들면, α-L-리보) 구조 내에 있다.
폴리뉴클레오타이드들[예를 들면, 화학식 Ia 내지 화학식 Ia-5, 화학식 Ib 내지 화학식 If-1, 화학식 IIa 내지 화학식 IIp, 화학식 IIb-1, 화학식 IIb-2, 화학식 IIc-1 내지 화학식 IIc-2, 화학식 IIn-1, 화학식 IIn-2, 화학식 IVa 내지 화학식 IVl, 및 화학식 IXa 내지 화학식 IXr]의 일부 실시형태에서, 하나 이상의 B는 슈도우리딘(Ψ) 또는 5-메틸-사이티딘(m5C)이 아니다.
일부 실시형태에서, n개의 B 핵염기들 중 약 10% 내지 약 100%는 Ψ 또는 m5C이 아니다(예를 들면, n개의 B 중 10% 내지 20%, 10% 내지 35%, 10% 내지 50%, 10% 내지 60%, 10% 내지 75%, 10% 내지 90%, 10% 내지 95%, 10% 내지 98%, 10% 내지 99%, 20% 내지 35%, 20% 내지 50%, 20% 내지 60%, 20% 내지 75%, 20% 내지 90%, 20% 내지 95%, 20% 내지 98%, 20% 내지 99%, 20% 내지 100%, 50% 내지 60%, 50% 내지 75%, 50% 내지 90%, 50% 내지 95%, 50% 내지 98%, 50% 내지 99%, 50% 내지 100%, 75% 내지 90%, 75% 내지 95%, 75% 내지 98%, 75% 내지 99%, 및 75% 내지 100%는 Ψ 또는 m5C가 아니다). 일부 실시형태에서, B는 Ψ 또는 m5C가 아니다.
폴리뉴클레오타이드들[예를 들면, 화학식 Ia 내지 화학식 Ia-5, 화학식 Ib 내지 화학식 If-1, 화학식 IIa 내지 화학식 IIp, 화학식 IIb-1, 화학식 IIb-2, 화학식 IIc-1 내지 화학식 IIc-2, 화학식 IIn-1, 화학식 IIn-2, 화학식 IVa 내지 화학식 IVl, 및 화학식 IXa 내지 화학식 IXr]의 일부 실시형태에서, B가, 사이토신, 구아닌, 우라실 및 아데닌으로부터 선택되는 변형되지 않은 핵염기인 경우, Y1, Y2, 또는 Y3 중 하나 이상은 O이 아니다.
일부 실시형태에서, 폴리뉴클레오타이드는, 변형된 리보스를 포함한다. 일부 실시형태에서, 폴리뉴클레오타이드(예를 들면, 제1 영역, 제1 플랭킹 영역, 또는 제2 플랭킹 영역)는 n개의, 화학식 IIa 내지 화학식 IIc의 연결된 뉴클레오사이드들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 포함한다:
[화학식 IIa]
[화학식 IIb]
[화학식 IIc]
특정 실시형태에서, U는 O 또는 C(RU)nu이고, 여기서, nu는 0 내지 2의 정수이며, 각각의 RU는, 독립적으로, H, 할로, 또는 임의로 치환된 알킬(예를 들면, U는 -CH2- 또는 -CH-이다)이다. 다른 실시형태에서, 각각의 R1, R2, R3, R4, 및 R5는, 독립적으로, H, 할로, 하이드록시, 티올, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시, 임의로 치환된 하이드록시알콕시, 임의로 치환된 아미노, 아지도, 임의로 치환된 아릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐이거나, 부재하며(예를 들면, 각각의 R1 및 R2는, 독립적으로 H, 할로, 하이드록시, 임의로 치환된 알킬, 또는 임의로 치환된 알콕시이고; 각각의 R3 및 R4는, 독립적으로, H 또는 임의로 치환된 알킬이며; R5는 H 또는 하이드록시이다), 는 단일결합 또는 이중 결합이다.
특정 실시형태에서, 폴리뉴클레오타이드(예를 들면, 제1 영역, 제1 플랭킹 영역, 또는 제2 플랭킹 영역)는 n개의, 화학식 IIb-1 내지 화학식 IIb-2의 연결된 뉴클레오사이드들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 포함한다:
[화학식 IIb-1]
[화학식 IIb-2]
일부 실시형태에서, U는 O 또는 C(RU)nu이고, 여기서, nu는 0 내지 2의 정수이며, 각각의 RU는, 독립적으로, H, 할로, 또는 임의로 치환된 알킬(예를 들면, U는 -CH2- 또는 -CH-이다)이다. 다른 실시형태에서, 각각의 R1 및 R2는, 독립적으로, H, 할로, 하이드록시, 티올, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시, 임의로 치환된 하이드록시알콕시, 임의로 치환된 아미노, 아지도, 임의로 치환된 아릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐이거나, 부재한다(예를 들면, 각각의 R1 및 R2는, 독립적으로, H, 할로, 하이드록시, 임의로 치환된 알킬, 또는 임의로 치환된 알콕시, 예를 들면, H, 할로, 하이드록시, 알킬, 또는 알콕시이다). 특정 실시형태에서, R2는 하이드록시 또는 임의로 치환된 알콕시(예를 들면, 메톡시, 에톡시, 또는 본원에 기술된 임의의 것)이다.
특정 실시형태에서, 폴리뉴클레오타이드(예를 들면, 제1 영역, 제1 플랭킹 영역, 또는 제2 플랭킹 영역)는 n개의, 화학식 IIc-1 내지 화학식 IIc-4의 연결된 뉴클레오사이드들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 포함한다:
[화학식 IIc-1]
[화학식 IIc-2]
[화학식 IIc-3]
[화학식 IIc-4]
일부 실시형태에서, U는 O 또는 C(RU)nu이고, 여기서, nu는 0 내지 2의 정수이며, 각각의 RU는, 독립적으로, H, 할로, 또는 임의로 치환된 알킬(예를 들면, U는 -CH2- 또는 -CH-이다)이다. 일부 실시형태에서, 각각의 R1, R2, 및 R3은, 독립적으로, H, 할로, 하이드록시, 티올, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시, 임의로 치환된 하이드록시알콕시, 임의로 치환된 아미노, 아지도, 임의로 치환된 아릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐이거나, 부재한다(예를 들면, 각각의 R1 및 R2는, 독립적으로, H, 할로, 하이드록시, 임의로 치환된 알킬, 또는 임의로 치환된 알콕시, 예를 들면, H, 할로, 하이드록시, 알킬, 또는 알콕시이고; 각각의 R3은, 독립적으로, H 또는 임의로 치환된 알킬이다). 특정 실시형태에서, R2는 임의로 치환된 알콕시(예를 들면, 메톡시 또는 에톡시, 또는 본원에 기술된 임의의 것)이다. 특정 실시형태에서, R1은 임의로 치환된 알킬이고, R2는 하이드록시이다. 다른 실시형태에서, R1은 하이드록시이고, R2는 임의로 치환된 알킬이다. 추가의 실시형태에서, R3은 임의로 치환된 알킬이다.
일부 실시형태에서, 폴리뉴클레오타이드는 아실 변형된 리보스를 포함한다. 일부 실시형태에서, 폴리뉴클레오타이드(예를 들면, 제1 영역, 제1 플랭킹 영역, 또는 제2 플랭킹 영역)는 n개의, 화학식 IId 내지 화학식 IIf의 연결된 뉴클레오사이드들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 포함한다.
[화학식 IId]
[화학식 IIe]
[화학식 IIf]
일부 실시형태에서, 폴리뉴클레오타이드는 아실 변형된 헥시톨을 포함한다. 일부 실시형태에서, 폴리뉴클레오타이드(예를 들면, 제1 영역, 제1 플랭킹 영역, 또는 제2 플랭킹 영역)는 n개의, 화학식 IIg 내지 화학식 IIj의 연결된 뉴클레오사이드들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 포함한다:
[화학식 IIg]
[화학식 IIh]
[화학식 IIi]
[화학식 IIj]
일부 실시형태에서, 폴리뉴클레오타이드는 축약되거나 확장된 리보스 환을 갖는 당 모이어티를 포함한다. 일부 실시형태에서, 폴리뉴클레오타이드(예를 들면, 제1 영역, 제1 플랭킹 영역, 또는 제2 플랭킹 영역)는 n개의, 화학식 IIk 내지 화학식 IIm의 연결된 뉴클레오사이드들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 포함하고:
[화학식 IIk]
[화학식 IIl]
[화학식 IIm]
상기 화학식 IIk 내지 화학식 IIm에서, 각각의 R1', R1", R2' 및 R2"은, 독립적으로, H, 할로, 하이드록시, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시이거나, 부재하고; 여기서, R2'과 R3의 조합 또는 R2 "과 R3의 조합은 함께, 임의로 치환된 알킬렌 또는 임의로 치환된 헤테로알킬렌을 형성할 수 있다.
일부 실시형태에서, 폴리뉴클레오타이드는 잠금 변형된 리보스를 포함한다. 일부 실시형태에서, 폴리뉴클레오타이드(예를 들면, 제1 영역, 제1 플랭킹 영역, 또는 제2 플랭킹 영역)은 n개의, 화학식 IIn의 연결된 뉴클레오사이드들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 포함하고:
[화학식 IIn]
상기 화학식 IIn에서, R3'은 O, S, 또는 -NRN1-이고, 여기서, RN1은 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 또는 임의로 치환된 아릴이며, R3"은 임의로 치환된 알킬렌(예를 들면, -CH2-, -CH2CH2-, 또는 -CH2CH2CH2-) 또는 임의로 치환된 헤테로알킬렌(예를 들면, -CH2NH-, -CH2CH2NH-, -CH2OCH2-, 또는 -CH2CH2OCH2-)[예를 들면, R3'은 O이고 R3"은 임의로 치환된 알킬렌(예를 들면, -CH2-, -CH2CH2-, 또는 -CH2CH2CH2-)이다]이다.
일부 실시형태에서, 폴리뉴클레오타이드(예를 들면, 제1 영역, 제1 플랭킹 영역, 또는 제2 플랭킹 영역)은 n개의, 화학식 IIn-1 내지 화학식 II-n2의 연결된 뉴클레오사이드들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 포함하고:
[화학식 IIn-1]
[화학식 IIn-2]
상기 화학식 IIn-1 또는 화학식 IIn2에서, R3'은 O, S, 또는 -NRN1-이고, 여기서, RN1은 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 또는 임의로 치환된 아릴이며, R3"은 임의로 치환된 알킬렌(예를 들면, -CH2-, -CH2CH2-, 또는 -CH2CH2CH2-) 또는 임의로 치환된 헤테로알킬렌(예를 들면, -CH2NH-, -CH2CH2NH-, -CH2OCH2-, 또는 -CH2CH2OCH2-)[예를 들면, R3'은 O이고, R3"은 임의로 치환된 알킬렌(예를 들면, -CH2-, -CH2CH2-, 또는 -CH2CH2CH2-)이다]이다.
일부 실시형태에서, 폴리뉴클레오타이드는 테트라사이클릭 헤테로사이클릴을 형성하는 잠금 변형된 리보스를 포함한다. 일부 실시형태에서, 폴리뉴클레오타이드(예를 들면, 제1 영역, 제1 플랭킹 영역, 또는 제2 플랭킹 영역)는 n개의, 화학식 IIo 또는 화학식 IIp의 연결된 뉴클레오사이드들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 포함하고:
[화학식 IIo]
[화학식 IIp]
상기 화학식 IIo 또는 화학식 IIp에서, R12a, R12c, T1', T1", T2', T2", V1, 및 V3은 본원에 기술된 바와 같다.
폴리뉴클레오타이드들에 대한 화학식들 중 어느 하나는, 본원에 기술된 하나 이상의 핵염기들[예를 들면, 화학식 b1 내지 화학식 b43]을 포함할 수 있다.
한 실시형태에서, 본 발명은, 주요 그루브 상호작용 파트너와 핵산의 결합을 방해하는 하나 이상의 뉴클레오타이드를 포함하는 폴리뉴클레오타이드를 제조하는 방법을 제공하며, 여기서, 폴리뉴클레오타이드는 본원에 정의된 바와 같은, n개의, 화학식 Ia의 뉴클레오사이드를 포함하며:
[화학식 Ia]
당해 방법은 본원에 정의된 바와 같은 화학식 IIIa의 화합물과, RNA 폴리머라제, 및 cDNA 주형(template)을 반응시킴을 포함한다:
[화학식 IIIa]
추가의 실시형태에서, 본 발명은, 주요 그루브 상호작용 파트너와 폴리뉴클레오타이드 서열의 결합을 방해하는 하나 이상의 뉴클레오타이드(예를 들면, 변형된 mRNA 분자)를 포함하는 폴리뉴클레오타이드를 증폭시키는 방법을 제공하며, 당해 방법은, 본원에 정의된 바와 같은, 화학식 IIIa의 화합물과, 프라이머, cDNA 주형, 및 RNA 폴리머라제를 반응시킴을 포함한다.
한 실시형태에서, 본 발명은, 주요 그루브 상호작용 파트너와 핵산의 결합을 방해하는 하나 이상의 뉴클레오타이드를 포함하는 폴리뉴클레오타이드를 제조하는 방법을 제공하며, 여기서, 폴리뉴클레오타이드는 본원에 정의된 바와 같은, n개의, 화학식 Ia-1의 뉴클레오사이드들을 포함하고:
[화학식 Ia-1]
당해 방법은 본원에 정의된 바와 같이, 화학식 IIIa-1의 화합물과, RNA 폴리머라제, 및 cDNA 주형을 반응시킴을 포함한다.
[화학식 IIIa-1]
추가의 실시형태에서, 본 발명은 주요 그루브 결합 파트너와 폴리뉴클레오타이드 서열의 결합을 방해하는 하나 이상의 뉴클레오타이드(예를 들면, 변형된 mRNA 분자)를 포함하는 폴리뉴클레오타이드를 증폭시키는 방법들을 제공하며, 당해 방법은 본원에 정의된 바와 같은, 화학식 IIIa-1의 화합물과, 프라이머, cDNA 주형, 및 RNA 폴리머라제를 반응시킴을 포함한다.
한 실시형태에서, 본 발명은, 주요 그루브 상호작용 파트너와 핵산 서열의 결합을 방해하는 하나 이상의 뉴클레오타이드를 포함하는 폴리뉴클레오타이드를 제조하는 방법들을 제공하며, 여기서, 폴리뉴클레오타이드는 본원에 정의된 바와 같은, n개의, 화학식 Ia-2의 뉴클레오사이드를 포함하고:
[화학식 Ia-2]
당해 방법은, 본원에 정의된 바와 같은 화학식 IIIa-2의 화합물과, RNA 폴리머라제, 및 cDNA 주형을 반응시킴을 포함한다:
[화학식 IIIa-2]
추가의 실시형태에서, 본 발명은, 주요 그루브 결합 파트너와 폴리뉴클레오타이드의 결합을 방해하는 하나 이상의 뉴클레오타이드(예를 들면, 변형된 mRNA 분자)를 포함하는 폴리뉴클레오타이드를 증폭시키는 방법을 제공하며, 당해 방법은, 본원에 정의된 바와 같은 화학식 IIIa-2의 화합물과, 프라이머, cDNA 주형, 및 RNA 폴리머라제를 반응시킴을 포함한다.
일부 실시형태에서, 당해 반응은 1 내지 약 7,000회 반복될 수 있다. 본원의 실시형태들 중의 어느 하나에서, B는 화학식 b1 내지 화학식 b43의 핵염기일 수 있다.
폴리뉴클레오타이드들은 본원에 기술된, 5' 및/또는 3' 플랭킹 영역들을 임의로 포함할 수 있다.
변형된 뉴클레오타이드 및 뉴클레오사이드
본 발명은, 또한, 빌딩 블록들, 예를 들면, 폴리뉴클레오타이드들의 변형된 리보뉴클레오사이드들, 변형된 리보뉴클레오타이드들, 예를 들면, 변형된 RNA(또는 mRNA) 분자들을 포함한다. 예를 들면, 이들 빌딩 블록들은 본 발명의 폴리뉴클레오타이드를 제조하는데 유용할 수 있다.
일부 실시형태에서, 빌딩 블록 분자는 화학식 IIIa 또는 화학식 IIIa-1의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 가지며:
[화학식 IIIa]
[화학식 IIIa-1]
상기 화학식 IIIa 또는 화학식 IIIa-1에서, 치환체들은 본원에 기술된 바와 같고[예를 들면, 화학식 Ia 및 화학식 Ia-1의 경우], 여기서, B가, 사이토신, 구아닌, 우라실 및 아데닌으로부터 선택되는 변형되지 않은 핵염기인 경우, Y1, Y2, 또는 Y3 중 하나 이상은 O가 아니다.
일부 실시형태에서, 폴리뉴클레오타이드 내로 혼입될 수 있는 빌딩 블록 분자는 화학식 IVa 내지 화학식 IVb의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 가지며:
[화학식 IVa]
[화학식 IVb]
상기 화학식 IVa 또는 화학식 IVb에서, B는 본원에 기술된 바와 같다[예를 들면, 화학식 b1 내지 화학식 b43 중의 하나의 화합물].
특정 실시형태에서, 화학식 IVa 또는 화학식 IVb는, 변형된 우라실[예를 들면, 화학식 b1 내지 화학식 b9, 화학식 b21 내지 화학식 b23, 및 화학식 b28 내지 화학식 b31 중 어느 하나의 화합물, 예를 들면, 화학식 b1, 화학식 b8, 화학식 b28, 화학식 b29, 또는 화학식 b30의 화합물]과 결합된다. 특정 실시형태에서, 화학식 IVa 또는 화학식 IVb는, 변형된 사이토신[예를 들면, 화학식 b10 내지 화학식 b14, 화학식 b24, 화학식 b25, 및 화학식 b32 내지 화학식 b36 중 어느 하나의 화합물, 예를 들면, 화학식 b10 또는 화학식 b32의 화합물]과 결합된다. 특정 실시형태에서, 화학식 IVa 또는 화학식 IVb는, 변형된 구아닌[예를 들면, 화학식 b15 내지 화학식 b17 및 화학식 b37 내지 화학식 b40 중 어느 하나의 화합물]과 결합된다. 특정 실시형태에서, 화학식 IVa 또는 IVb는, 변형된 아데닌[예를 들면, 화학식 b18 내지 화학식 b20 및 화학식 b41 내지 화학식 b43의 화합물]와 결합된다.
일부 실시형태에서, 폴리뉴클레오타이드내로 혼입될 수 있는 빌딩 블록 분자는 화학식 IVc 내지 화학식 IVk의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 가지며:
[화학식 IVc]
[화학식 IVd]
[화학식 IVe]
[화학식 IVf]
[화학식 IVg]
[화학식 IVh]
[화학식 IVi]
[화학식 IVj]
[화학식 IVk]
[화학식 IVl]
상기 화학식 IVc 내지 화학식 IVl에서, B는 본원에 기술된 바와 같다[예를 들면, 화학식 b1 내지 화학식 b43 중의 어느 하나의 화합물].
특정 실시형태에서, 화학식 IVc 내지 화학식 IVk의 화합물 중 하나는, 변형된 우라실[예를 들면, 화학식 b1 내지 화학식 b9, 화학식 b21 내지 화학식 b23, 및 화학식 b28 내지 화학식 b31 중 어느 하나의 화합물, 예를 들면, 화학식 b1, 화학식 b8, 화학식 b28, 화학식 b29, 또는 화학식 b30의 화합물]과 결합한다.
특정 실시형태에서, 화학식 IVc 내지 화학식 IVk의 화합물 중 하나는, 변형된 사이토신[예를 들면, 화학식 b10 내지 화학식 b14, 화학식 b24, 화학식 b25, 및 화학식 b32 내지 화학식 b36 중 어느 하나의 화합물, 예를 들면, 화학식 b10 또는 화학식 b32의 화합물]과 결합한다.
특정 실시형태에서, 화학식 IVc 내지 화학식 IVk의 화합물 중 하나는, 변형된 구아닌[예를 들면, 화학식 b15 내지 화학식 b17 및 화학식 b37 내지 화학식 b40 중 어느 하나의 화합물]과 결합한다.
특정 실시형태에서, 화학식 IVc 내지 화학식 IVk의 화합물 중 하나는, 변형된 아데닌[예를 들면, 화학식 b18 내지 화학식 b20 및 화학식 b41 내지 화학식 b43 중 어느 하나의 화합물]과 결합한다.
다른 실시형태에서, 폴리뉴클레오타이드 내로 혼입될 수 있는 빌딩 블록 분자는 화학식 Va 또는 화학식 Vb의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 가지며, 여기서, B는 본원에 기술된 바와 같다[예를 들면, 화학식 b1 내지 화학식 b43 중 어느 하나의 화합물]:
[화학식 Va]
[화학식 Vb]
다른 실시형태에서, 폴리뉴클레오타이드 내로 혼입될 수 있는 빌딩 블록 분자는 화학식 IXa 내지 화학식 IXd의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 가지며, 여기서, B는 본원에 기술된 바와 같다[예를 들면, 화학식 b1 내지 화학식 b43 중 어느 하나의 화합물]:
[화학식 IXa]
[화학식 IXb]
[화학식 IXc]
[화학식 IXd]
특정 실시형태에서, 화학식 IXa 내지 IXd의 화합물 중 하나는, 변형된 우라실[예를 들면, 화학식 b1 내지 화학식 b9, 화학식 b21 내지 화학식 b23, 및 화학식 b28 내지 화학식 b31 중 어느 하나의 화합물, 예를 들면, 화학식 b1, 화학식 b8, 화학식 b28, 화학식 b29, 또는 화학식 b30의 화합물]과 결합된다. 특정 실시형태에서, 화학식 IXa 내지 화학식 IXd의 화합물 중 하나는, 변형된 사이토신[예를 들면, 화학식 b10 내지 화학식 b14, 화학식 b24, 화학식 b25, 및 화학식 b32 내지 화학식 b36 중 어느 하나의 화합물, 예를 들면, 화학식 b10 또는 화학식 b32의 화합물]과 결합한다.
특정 실시형태에서, 화학식 IXa 내지 화학식 IXd의 화합물 중 하나는, 변형된 구아닌[예를 들면, 화학식 b15 내지 화학식 b17 및 화학식 b37 내지 화학식 b40 중 어느 하나의 화합물]과 결합한다.
특정 실시형태에서, 화학식 IXa 내지 화학식 IXd의 화합물 중 하나는, 변형된 아데닌[예를 들면, 화학식 b18 내지 화학식 b20 및 화학식 b41 내지 화학식 b43의 화합물]과 결합한다.
다른 실시형태에서, 폴리뉴클레오타이드 내로 혼입될 수 있는 빌딩 블록 분자는 화학식 IXe 내지 화학식 IXg의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 가지며,
[화학식 IXe]
[화학식 IXf]
[화학식 IXg]
상기 화학식 IXe 내지 화학식 IXg에서, B는 본원에 기술된 바와 같다[예를 들면, 화학식 b1 내지 화학식 b43 중의 어느 하나의 화합물].
특정 실시형태에서, 화학식 IXe 내지 화학식 IXg의 화합물 중 하나는, 변형된 우라실[예를 들면, 화학식 b1 내지 화학식 b9, 화학식 b21 내지 화학식 b23, 및 화학식 b28 내지 화학식 b31 중 어느 하나, 예를 들면, 화학식 b1, 화학식 b8, 화학식 b28, 화학식 b29, 또는 화학식 b30의 화합물]과 결합한다.
특정 실시형태에서, 화학식 IXe 내지 화학식 IXg의 화합물 중 하나는, 변형된 사이토신[예를 들면, 화학식 b10 내지 화학식 b14, 화학식 b24, 화학식 b25, 및 화학식 b32 내지 화학식 b36의 화합물 중 어느 하나, 예를 들면, 화학식 b10 또는 화학식 b32의 화합물]과 결합한다.
특정 실시형태에서, 화학식 IXe 내지 화학식 IXg의 화합물 중 하나는, 변형된 구아닌[예를 들면, 화학식 b15 내지 화학식 b17 및 화학식 b37 내지 화학식 b40의 화합물 중 어느 하나]과 결합한다.
특정 실시형태에서, 화학식 IXe 내지 화학식 IXg의 화합물 중 하나는, 변형된 아데닌[예를 들면, 화학식 b18 내지 화학식 b20 및 화학식 b41 내지 화학식 b43의 화합물 중 어느 하나]과 결합한다.
다른 실시형태에서, 폴리뉴클레오타이드 내로 혼입될 수 있는 빌딩 블록 분자는 화학식 IXh 내지 화학식 IXk의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 가지며:
[화학식 IXh]
[화학식 IXi]
[화학식 IXj]
[화학식 IXk]
상기 화학식 IXh 내지 화학식 IXk에서, B는 본원에 기술된 바와 같다[예를 들면, 화학식 b1 내지 화학식 b43의 화합물 중 어느 하나]. 특정 실시형태에서, 화학식 IXh 내지 화학식 IXk의 화합물 중 하나는, 변형된 우라실[예를 들면, 화학식 b1 내지 화학식 b9, 화학식 b21 내지 화학식 b23, 및 화학식 b28 내지 화학식 b31의 화합물 중 어느 하나, 예를 들면, 화학식 b1, 화학식 b8, 화학식 b28, 화학식 b29, 또는 화학식 b30의 화합물]과 결합한다. 특정 실시형태에서, 화학식 IXh 내지 화학식 IXk의 화합물 중 하나는, 변형된 사이토신[예를 들면, 화학식 b10 내지 화학식 b14, 화학식 b24, 화학식 b25, 및 화학식 b32 내지 화학식 b36의 화합물 중 어느 하나, 예를 들면, 화학식 b10 또는 화학식 b32]과 결합한다.
특정 실시형태에서, 화학식 IXh 내지 화학식 IXk의 화합물 중 하나는, 변형된 구아닌[예를 들면, 화학식 b15 내지 화학식 b17 및 화학식 b37 내지 화학식 b40의 화합물 중 어느 하나]과 결합한다. 특정 실시형태에서, 화학식 IXh 내지 화학식 IXk의 화합물 중 하나는, 변형된 아데닌[예를 들면, 화학식 b18 내지 화학식 b20 및 화학식 b41 내지 화학식 b43의 화합물 중 어느 하나]과 결합한다.
다른 실시형태에서, 폴리뉴클레오타이드 내로 혼입될 수 있는 빌딩 블록 분자는 화학식 IXl 내지 화학식 IXr의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체를 가지며:
[화학식 IXl]
[화학식 IXm]
[화학식 IXn]
[화학식 IXo]
[화학식 IXp]
[화학식 IXq]
[화학식 IXr]
상기 화학식 IXl 내지 화학식 Ixr에서, 각각의 r1 및 r2는, 독립적으로, 0 내지 5(예를 들면, 0 내지 3, 1 내지 3, 또는 1 내지 5)의 정수이고, B는 본원에 기술된 바와 같다[예를 들면, 화학식 b1 내지 화학식 b43의 화합물 중 어느 하나].
특정 실시형태에서, 화학식 IXl 내지 화학식 IXr의 화합물 중 하나는, 변형된 우라실[예를 들면, 화학식 b1 내지 화학식 b9, 화학식 b21 내지 화학식 b23, 및 화학식 b28 내지 화학식 b31의 화합물 중 어느 하나, 예를 들면, 화학식 b1, 화학식 b8, 화학식 b28, 화학식 b29, 또는 화학식 b30의 화합물]과 결합한다.
특정 실시형태에서, 화학식 IXl 내지 화학식 IXr의 화합물 중 하나는, 변형된 사이토신[예를 들면, 화학식 b10 내지 화학식 b14, 화학식 b24, 화학식 b25, 및 화학식 b32 내지 화학식 b36의 화합물 중 어느 하나, 예를 들면, 화학식 b10 또는 화학식 b32의 화합물]과 결합한다.
특정 실시형태에서, 화학식 IXl 내지 화학식 IXr의 화합물 중 하나는, 변형된 구아닌[예를 들면, 화학식 b15 내지 화학식 b17 및 화학식 b37 내지 화학식 b40의 화합물 중 어느 하나]과 결합한다. 특정 실시형태에서, 화학식 IXl 내지 화학식 IXr의 화합물 중 하나는, 변형된 아데닌[예를 들면, 화학식 b18 내지 화학식 b20 및 화학식 b41 내지 화학식 b43 중 어느 하나]과 결합한다.
일부 실시형태에서, 폴리뉴클레오타이드 내로 혼입될 수 있는 빌딩 블록 분자는 하기 화학식 BB-1 내지 화학식 BB-12의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체로 이루어진 그룹으로부터 선택될 수 있다:
[화학식 BB-1]
[화학식 BB-2]
[화학식 BB-3]
[화학식 BB-4]
[화학식 BB-5]
[화학식 BB-6]
[화학식 BB-7]
[화학식 BB-8]
[화학식 BB-9]
[화학식 BB-10]
[화학식 BB-11]
[화학식 BB-12]
상기 화학식 BB-1 내지 화학식 BB-12에서, 각각의 r은, 독립적으로, 0 내지 5(예를 들면, 0 내지 3, 1 내지 3, 또는 1 내지 5)의 정수이다.
일부 실시형태에서, 폴리뉴클레오타이드 내로 혼입될 수 있는 빌딩 블록 분자는 하기 화학식 BB-13 내지 화학식 BB-20의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체로 이루어진 그룹으로부터 선택될 수 있다:
[화학식 BB-13]
[화학식 BB-14]
[화학식 BB-15]
[화학식 BB-16]
[화학식 BB-17]
[화학식 BB-18]
[화학식 BB-19]
[화학식 BB-20]
상기 화학식 BB-13 내지 화학식 BB-20에서, 각각의 r은, 독립적으로, 0 내지 5(예를 들면, 0 내지 3, 1 내지 3, 또는 1 내지 5)의 정수이고, s1은 본원에 기술된 바와 같다.
일부 실시형태에서, 핵산(예를 들면, RNA, mRNA, 폴리뉴클레오타이드) 내로 혼입될 수 있는 빌딩 블록 분자는, 변형된 우리딘이다[예를 들면, 하기 화학식 BB-21 내지 화학식 BB-125의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체로 이루어진 그룹으로부터 선택될 수 있다]:
[화학식 BB-21]
[화학식 BB-22]
[화학식 BB-23]
[화학식 BB-24]
[화학식 BB-25]
[화학식 BB-26]
[화학식 BB-27]
[화학식 BB-28]
[화학식 BB-29]
[화학식 BB-30]
[화학식 BB-31]
[화학식 BB-32]
[화학식 BB-33]
[화학식 BB-34]
[화학식 BB-35]
[화학식 BB-36]
[화학식 BB-37]
[화학식 BB-38]
[화학식 BB-39]
[화학식 BB-40]
[화학식 BB-41]
[화학식 BB-42]
[화학식 BB-43]
[화학식 BB-44]
[화학식 BB-45]
[화학식 BB-46]
[화학식 BB-47]
[화학식 BB-48]
[화학식 BB-49]
[화학식 BB-50]
[화학식 BB-51]
[화학식 BB-52]
[화학식 BB-53]
[화학식 BB-54]
[화학식 BB-55]
[화학식 BB-56]
[화학식 BB-57]
[화학식 BB-58]
[화학식 BB-59]
[화학식 BB-60]
[화학식 BB-61]
[화학식 BB-62]
[화학식 BB-63]
[화학식 BB-64]
[화학식 BB-65]
[화학식 BB-66]
[화학식 BB-67]
[화학식 BB-68]
[화학식 BB-69]
[화학식 BB-70]
[화학식 BB-71]
[화학식 BB-72]
[화학식 BB-73]
[화학식 BB-74]
[화학식 BB-75]
[화학식 BB-76]
[화학식 BB-77]
[화학식 BB-78]
[화학식 BB-79]
[화학식 BB-80]
[화학식 BB-81]
[화학식 BB-82]
[화학식 BB-83]
[화학식 BB-84]
[화학식 BB-85]
[화학식 BB-86]
[화학식 BB-87]
[화학식 BB-88]
[화학식 BB-89]
[화학식 BB-90]
[화학식 BB-91]
[화학식 BB-92]
[화학식 BB-93]
[화학식 BB-94]
[화학식 BB-95]
[화학식 BB-96]
[화학식 BB-97]
[화학식 BB-98]
[화학식 BB-99]
[화학식 BB-100]
[화학식 BB-101]
[화학식 BB-102]
[화학식 BB-103]
[화학식 BB-104]
[화학식 BB-105]
[화학식 BB-106]
[화학식 BB-107]
[화학식 BB-108]
[화학식 BB-109]
[화학식 BB-110]
[화학식 BB-111]
[화학식 BB-112]
[화학식 BB-113]
[화학식 BB-114]
[화학식 BB-115]
[화학식 BB-116]
[화학식 BB-117]
[화학식 BB-118]
[화학식 BB-119]
[화학식 BB-120]
[화학식 BB-121]
[화학식 BB-122]
[화학식 BB-123]
[화학식 BB-124]
[화학식 BB-125]
상기 화학식 BB-21 내지 화학식 BB-125에서, Y1, Y3, Y4, Y6, 및 r은 본원에 기술된 바와 같다(예를 들면, 각각의 r은, 독립적으로, 0 내지 5의 정수, 예를 들면, 0 내지 3, 1 내지 3, 또는 1 내지 5의 정수이다.
일부 실시형태에서, 폴리뉴클레오타이드 내로 혼입될 수 있는 빌딩 블록 분자는, 변형된 사이티딘이다[예를 들면, 하기 화학식 BB-126 내지 화학식 BB-159의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체로 이루어진 그룹으로부터 선택될 수 있다]:
[화학식 BB-126]
[화학식 BB-127]
[화학식 BB-128]
[화학식 BB-129]
[화학식 BB-130]
[화학식 BB-131]
[화학식 BB-132]
[화학식 BB-133]
[화학식 BB-134]
[화학식 BB-135]
[화학식 BB-136]
[화학식 BB-137]
[화학식 BB-138]
[화학식 BB-139]
[화학식 BB-140]
[화학식 BB-141]
[화학식 BB-142]
[화학식 BB-143]
[화학식 BB-144]
[화학식 BB-145]
[화학식 BB-146]
[화학식 BB-147]
[화학식 BB-148]
[화학식 BB-149]
[화학식 BB-150]
[화학식 BB-151]
[화학식 BB-152]
[화학식 BB-153]
[화학식 BB-154]
[화학식 BB-155]
[화학식 BB-156]
[화학식 BB-157]
[화학식 BB-158]
[화학식 BB-159]
[상기 화학식 BB-126 내지 화학식 BB-159에서, Y1, Y3, Y4, Y6, 및 r은 본원에 기술된 바와 같다(예를 들면, 각각의 r은, 독립적으로, 0 내지 5의 정수, 예를 들면, 0 내지 3, 1 내지 3, 또는 1 내지 5의 정수이다. 예를 들면, 폴리뉴클레오타이드 내로 혼입될 수 있는 빌딩 블록 분자는 하기 화학식 BB-160 또는 화학식 BB-161의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체이다:
[화학식 BB-160]
[화학식 BB-161]
상기 화학식 BB-160 또는 화학식 BB-161에서, 각각의 r은, 독립적으로, 0 내지 5(예를 들면, 0 내지 3, 1 내지 3, 또는 1 내지 5)의 정수이다.
일부 실시형태에서, 폴리뉴클레오타이드 내로 혼입될 수 있는 빌딩 블록 분자는, 변형된 아데노신이다[예를 들면, 하기 화학식 BB-162 내지 화학식 BB-200의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체로 이루어진 그룹으로부터 선택된다]:
[화학식 BB-162]
[화학식 BB-163]
[화학식 BB-164]
[화학식 BB-165]
[화학식 BB-166]
[화학식 BB-167]
[화학식 BB-168]
[화학식 BB-169]
[화학식 BB-170]
[화학식 BB-171]
[화학식 BB-172]
[화학식 BB-173]
[화학식 BB-174]
[화학식 BB-175]
[화학식 BB-176]
[화학식 BB-177]
[화학식 BB-178]
[화학식 BB-179]
[화학식 BB-180]
[화학식 BB-181]
[화학식 BB-182]
[화학식 BB-183]
[화학식 BB-184]
[화학식 BB-185]
[화학식 BB-186]
[화학식 BB-187]
[화학식 BB-188]
[화학식 BB-189]
[화학식 BB-190]
[화학식 BB-191]
[화학식 BB-192]
[화학식 BB-193]
[화학식 BB-194]
[화학식 BB-195]
[화학식 BB-196]
[화학식 BB-197]
[화학식 BB-198]
[화학식 BB-199]
[화학식 BB-200]
상기 화학식 BB-162 내지 화학식 BB-200에서, Y1, Y3, Y4, Y6, 및 r은 본원에 기술된 바와 같다(예를 들면, 각각의 r은, 독립적으로, 0 내지 5, 예를 들면, 0 내지 3, 1 내지 3, 또는 1 내지 5의 정수이다).
일부 실시형태에서, 폴리뉴클레오타이드 내로 혼입될 수 있는 빌딩 블록 분자는, 변형된 구아노신이다[예를 들면, 하기 화학식 BB-201 내지 화학식 BB-237의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체로 이루어진 그룹으로부터 선택된다]:
[화학식 BB-201]
[화학식 BB-202]
[화학식 BB-203]
[화학식 BB-204]
[화학식 BB-205]
[화학식 BB-206]
[화학식 BB-207]
[화학식 BB-208]
[화학식 BB-209]
[화학식 BB-210]
[화학식 BB-211]
[화학식 BB-212]
[화학식 BB-213]
[화학식 BB-214]
[화학식 BB-215]
[화학식 BB-216]
[화학식 BB-217]
[화학식 BB-218]
[화학식 BB-219]
[화학식 BB-220]
[화학식 BB-221]
[화학식 BB-222]
[화학식 BB-223]
[화학식 BB-224]
[화학식 BB-225]
[화학식 BB-226]
[화학식 BB-227]
[화학식 BB-228]
[화학식 BB-229]
[화학식 BB-230]
[화학식 BB-231]
[화학식 BB-232]
[화학식 BB-233]
[화학식 BB-234]
[화학식 BB-235]
[화학식 BB-236]
[화학식 BB-237]
상기 화학식 BB-201 내지 화학식 BB-237에서, Y1, Y3, Y4, Y6, 및 r은 본원에 기술된 바와 같다(예를 들면, 각각의 r은, 독립적으로, 0 내지 5, 예를 들면, 0 내지 3, 1 내지 3, 또는 1 내지 5의 정수이다).
일부 실시형태에서, 주요 그루브 화학적 변형은 환의 C-5에서 C 그룹(예를 들면, 사이토신 또는 우라실과 같은 피리미딘 뉴클레오사이드의 경우)의 N으로의 대체[예를 들면, C-5에서 >CH 그룹의 >NRN1 그룹(여기서, RN1는 H 또는 임의로 치환된 알킬이다)으로의 대체]를 포함할 수 있다. 예를 들면, 폴리뉴클레오타이드 내로 혼입될 수 있는 빌딩 블록 분자는 하기 화학식 BB-238 내지 화학식 BB-241의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체일 수 있다:
[화학식 BB-238]
[화학식 BB-239]
[화학식 BB-240]
[화학식 BB-241]
상기 화학식 BB-238 내지 화학식 BB-241에서, 각각의 r은, 독립적으로, 0 내지 5(예를 들면, 0 내지 3, 1 내지 3, 또는 1 내지 5)의 정수이다.
다른 실시형태에서, 주요 그루브 화학적 변형은, 사이토신의 C-5에서 할로(예를 들면, Br, Cl, F, 또는 I)로의 대체 또는 임의로 치환된 알킬(예를 들면, 메틸)로의 대체를 포함할 수 있다. 예를 들면, 폴리뉴클레오타이드 내로 혼입될 수 있는 빌딩 블록 분자는 하기 화학식 BB-242 내지 화학식 BB-245의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체일 수 있다:
[화학식 BB-242]
[화학식 BB-243]
[화학식 BB-244]
[화학식 BB-245]
상기 화학식 BB-242 내지 화학식 BB-245에서, 각각의 r은, 독립적으로, 0 내지 5(예를 들면, 0 내지 3, 1 내지 3, 또는 1 내지 5)의 정수이다.
또한 추가의 실시형태에서, 주요 그루브 화학적 변형은, C-4 위치에서 NH2 및 C-5 위치에서 탄소 원자에 의해 형성된 융합 환을 포함할 수 있다. 예를 들면, 폴리뉴클레오타이드 내로 혼입될 수 있는 빌딩 블록 분자는 하기 화학식 BB-246의 화합물, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체일 수 있다:
[화학식 BB-246]
상기 화학식 BB-246에서, 각각의 r은, 독립적으로, 0 내지 5(예를 들면, 0 내지 3, 1 내지 3, 또는 1 내지 5)의 정수이다.
당에 대한 변형
폴리뉴클레오타이드(예를 들면, RNA 또는 mRNA, 본원에 기술된 바와 같음) 내로 혼입될 수 있는, 변형된 뉴클레오사이드 및 뉴클레오타이드(예를 들면, 빌딩 블록 분자)는 리보핵산의 당 상에서 변형될 수 있다. 예를 들면, 2' 하이드록실 그룹(OH)은 다수의 상이한 치환체들로 변형되거나 대체될 수 있다. 2'-위치에서의 예시적인 치환체로는, H, 할로, 임의로 치환된 C1-6 알킬; 임의로 치환된 C1-6 알콕시; 임의로 치환된 C6-10 아릴옥시; 임의로 치환된 C3-8 사이클로알킬; 임의로 치환된 C3-8 사이클로알콕시; 임의로 치환된 C6-10 아릴옥시; 임의로 치환된 C6-10 아릴-C1-6 알콕시, 임의로 치환된 C1 - 12(헤테로사이클릴)옥시; 당(예를 들면, 리보스, 펜토스, 또는 본원에 기술된 임의의 것); 폴리에틸렌글리콜(PEG), -O(CH2CH2O)nCH2CH2OR(여기서, R은 H 또는 임의로 치환된 알킬이고, n은 0 내지 20의 정수(예를 들면, 0 내지 4, 0 내지 8, 0 내지 10, 0 내지 16, 1 내지 4, 1 내지 8, 1 내지 10, 1 내지 16, 1 내지 20, 2 내지 4, 2 내지 8, 2 내지 10, 2 내지 16, 2 내지 20, 4 내지 8, 4 내지 10, 4 내지 16, 및 4 내지 20의 정수); 2'-하이드록실이 C1-6 알킬렌 또는 C1-6 헤테로알킬렌 브릿지에 의해 동일한 리보스 당의 4'-탄소에 연결된 "잠금" 핵산(LNA)(여기서, 예시적인 브릿지들은 메틸렌, 프로필렌, 에테르, 또는 아미노 브릿지들을 포함하였다); 본원에 정의된 바와 같은 아미노알킬; 본원에 정의된 바와 같은 아미노알콕시; 본원에 정의된 바와 같은 아미노; 및 본원에 정의된 바와 같은 아미노산이 포함되지만, 이들에 한정되지 않는다.
일반적으로, RNA는, 산소를 갖는 5-원 환인 당 그룹 리보스를 포함한다. 예시적인, 비-제한적인 변형된 뉴클레오타이드는 리보스 내의 산소의 (예를 들면, S, Se, 또는 알킬렌, 예를 들면, 메틸렌 또는 에틸렌으로의) 대체; 이중 결합의 첨가(예를 들면, 리보스를 사이클로펜테닐 또는 사이클로헥세닐로 대체시키기 위함); 리보스의 환 축약(예를 들면, 사이클로부탄 또는 옥세탄의 4-원 환을 형성시키기 위해); 리보스의 환 확장(예를 들면, 추가의 탄소 또는 헤테로 원자, 예를 들면, 안하이드로헥시톨, 알트리톨, 만니톨, 사이클로헥사닐, 사이클로헥세닐, 및 포스포르아미데이트 골격도 갖는 모르폴리노를 갖는 6- 또는 7-원 환을 형성하기 위함); 다환 형태[예를 들면, 트리사이클로; 및 "잠금되지 않은(unlocked)" 형태, 예를 들면, 글리콜 핵산(GNA)(예를 들면, R-GNA 또는 S-GNA, 여기서, 리보스는 포스포디에스테르 결합에 부착된 글리콜 단위로 대체된다), 트레오스 핵산(TNA, 여기서, 리보스는 α-L-트레오푸라노실-(3'→2')로 대체된다)], 및 펩타이드 핵산(PNA, 여기서, 2-아미노-에틸-글리신 연결들은 리보스 및 포스포디에스테르 골격을 대체한다)을 포함한다. 당 그룹은 또한 리보스 내에 상응하는 탄소의 입체화학적 입체배치보다 반대의 입체화학적 입체배치를 지닌 하나 이상의 탄소들을 함유할 수 있다. 따라서, 폴리뉴클레오타이드 분자는, 예를 들면, 당으로서 아라비노스를 함유하는 뉴클레오타이드를 포함할 수 있다.
핵염기
상에서의 변형
본 개시는, 변형된 뉴클레오사이드 및 뉴클레오타이드를 제공한다. 본원에 기술된 바와 같은 "뉴클레오사이드"는, 유기 염기(예를 들면, 퓨린 또는 피리미딘) 또는 이의 유도체(본원에서 "핵염기"로서도 언급됨)와 조합하여 당 분자(예를 들면, 펜토스 또는 리보스)를 함유하는 화합물 또는 이의 유도체로서 정의된다. 본원에 기술된 바와 같은 "뉴클레오타이드"는, 포스페이트 그룹을 포함하는 뉴클레오사이드로 정의된다. 일부 실시형태에서, 본원에 기술된 뉴클레오사이드 및 뉴클레오타이드는 일반적으로 주요 그루브 페이스 상에서 화학적으로 변형된다. 예시적인 비-제한적 변형들은 아미노 그룹, 티올 그룹, 알킬 그룹, 할로 그룹, 또는 본원에 기술된 임의의 것을 포함한다. 변형된 뉴클레오타이드들은 본원에 기술된 바와 같은 임의의 유용한 방법에 의해 (예를 들면, 하나 이상의 변형된 또는 비-천연의 뉴클레오사이드들을 포함하도록 화학적으로, 효소적으로, 또는 재조합적으로) 합성될 수 있다.
변형된 뉴클레오타이드 염기 쌍 형성은 표준 아데노신-티미딘, 아데노신-우라실, 또는 구아노신-사이토신 염기 쌍뿐만 아니라, 뉴클레오타이드 및/또는 비-표준 또는 변형된 염기를 포함하는 변형된 뉴클레오타이드들 사이에 형성된 염기 쌍도 포함하며, 여기서, 수소 결합 공여체들과 수소 결합 수용체들의 배열은 비-표준 염기와 표준 염기 사이에 또는 2개의 상보적인 비-표준 염기 구조들 사이에 수소 결합을 허용한다. 이러한 비-표준 염기 쌍 형성 중 한 예는, 변형된 뉴클레오타이드 이노신과 아데노신, 사이토신 또는 우라실 사이의 염기 쌍 형성이다.
변형된 뉴클레오사이드 및 뉴클레오타이드는 변형된 핵염기를 포함할 수 있다. RNA에서 발견된 핵염기의 예로는, 아데닌, 구아닌, 사이토신, 및 우라실이 포함되지만 이들에 한정되지 않는다. DNA에서 발견된 핵염기의 예로는 아데닌, 구아닌, 사이토신, 및 티민이 포함되지만 이들에 한정되지 않는다. 이들 핵염기들은 변형되거나 전체적으로 대체되어 특성들, 예를 들면, 뉴클레아제들에 대한 내성, 안전성이 향상된 폴리뉴클레오타이드 분자들을 제공하며, 이들 특성들은 주요 그루브 결합 파트너의 결합의 파괴를 통해 나타날 수 있다. 예를 들면, 기술된 뉴클레오사이드 및 뉴클레오타이드는 주요 그루브 페이스 상에서 화학적으로 변형될 수 있다. 일부 실시형태에서, 주요 그루브 화학적 변형들은 아미노 그룹, 티올 그룹, 알킬 그룹, 또는 할로 그룹을 포함할 수 있다.
하기 표 1은 각각의 정규 뉴클레오타이드의 화학적 측면들을 확인한다. 원(circle)들은, 각각의 화학적 영역들을 포함하는 원자들을 확인한다.
일부 실시형태에서, B는, 변형된 우라실이다. 예시적인 변형된 우라실로는 화학식 b1 내지 화학식 b5를 갖는 화합물들, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체가 포함된다:
[화학식 b1]
[화학식 b2]
[화학식 b3]
[화학식 b4]
[화학식 b5]
상기 화학식 b1 내지 화학식 b5에서,
각각의 T1', T1", T2', 및 T2"은, 독립적으로, H, 임의로 치환된 알킬, 임의로 치환된 알콕시, 또는 임의로 치환된 티오알콕시이거나, T1'과 T1 "의 조합이 함께 결합하여 또는 T2'과 T2 "의 조합이 함께 결합하여(예를 들면, T2에서와 같음), O(옥소), S(티오), 또는 Se(셀레노)를 형성하고;
각각의 V1 및 V2는, 독립적으로, O, S, N(RVb)nv, 또는 C(RVb)nv이고, 여기서, nv는 0 내지 2의 정수이며, 각각의 rVb는, 독립적으로, H, 할로, 임의로 치환된 아미노산, 임의로 치환된 알킬, 임의로 치환된 할로알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 아미노알킬(예를 들면, N-보호 그룹, 예를 들면, 본원에 기술된 임의의 것, 예를 들면, 트리플루오로아세틸로 치환됨), 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐, 임의로 치환된 아실아미노알킬(예를 들면, N-보호 그룹, 예를 들면, 본원에 기술된 임의의 것, 예를 들면, 트리플루오로아세틸로 치환됨), 임의로 치환된 알콕시카보닐알킬, 임의로 치환된 알콕시카보닐알케닐, 임의로 치환된 알콕시카보닐알키닐, 또는 임의로 치환된 알콕시카보닐알콕시(예를 들면, 본원에 기술된 임의의 치환체, 예를 들면, 알킬의 경우 (1) 내지 (21)로부터 선택되는 것들로 임의로 치환됨)이며;
R10은 H, 할로, 임의로 치환된 아미노산, 하이드록시, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 아미노알킬, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐, 임의로 치환된 알콕시, 임의로 치환된 알콕시카보닐알킬, 임의로 치환된 알콕시카보닐알케닐, 임의로 치환된 알콕시카보닐알키닐, 임의로 치환된 알콕시카보닐알콕시, 임의로 치환된 카복시알콕시, 임의로 치환된 카복시알킬, 또는 임의로 치환된 카바모일알킬이고;
R11은 H 또는 임의로 치환된 알킬이며;
R12a는 H, 임의로 치환된 알킬, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 또는 임의로 치환된 아미노알키닐, 임의로 치환된 카복시알킬(예를 들면, 하이드록시로 임의로 치환됨), 임의로 치환된 카복시알콕시, 임의로 치환된 카복시아미노알킬, 또는 임의로 치환된 카바모일알킬이고;
R12c는 H, 할로, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 티오알콕시, 임의로 치환된 아미노, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 또는 임의로 치환된 아미노알키닐이다.
다른 예시적인 변형된 우라실로는 화학식 b6 내지 화학식 b9의 화합물들, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체가 포함된다:
[화학식 b6]
[화학식 b7]
[화학식 b8]
[화학식 b9]
상기 화학식 b6 내지 화학식 b9에서,
각각의 T1', T1", T2', 및 T2"은, 독립적으로, H, 임의로 치환된 알킬, 임의로 치환된 알콕시, 또는 임의로 치환된 티오알콕시이거나, T1'과 T1 "의 조합이 함께 결합하여(예를 들면, T1에서와 같이) 또는 T2'과 T2 "의 조합이 함께 결합하여(예를 들면, T2에서와 같이), O(옥소), S(티오), 또는 Se(셀레노)를 형성하거나, 각각의 T1 및 T2는, 독립적으로, O(옥소), S(티오), 또는 Se(셀레노)이며;
각각의 W1 및 W2는, 독립적으로, N(RWa)nw 또는 C(RWa)nw이고, 여기서, nw는 0 내지 2의 정수이며, 각각의 RWa는, 독립적으로, H, 임의로 치환된 알킬, 또는 임의로 치환된 알콕시이고;
각각의 V3는, 독립적으로, O, S, N(RVa)nv, 또는 C(RVa)nv이며, 여기서, nv는 0 내지 2의 정수이고, 각각의 RVa는, 독립적으로, H, 할로, 임의로 치환된 아미노산, 임의로 치환된 알킬, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 헤테로사이클릴, 임의로 치환된 알크헤테로사이클릴, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 또는 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알킬(예를 들면, N-보호 그룹, 예를 들면, 본원에 기술된 임의의 것, 예를 들면, 트리플루오로아세틸, 또는 설포알킬로 치환됨), 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐, 임의로 치환된 아실아미노알킬(예를 들면, N-보호 그룹, 예를 들면, 본원에 기술된 임의의 것, 예를 들면, 트리플루오로아세틸로 치환됨), 임의로 치환된 알콕시카보닐알킬, 임의로 치환된 알콕시카보닐알케닐, 임의로 치환된 알콕시카보닐알키닐, 임의로 치환된 알콕시카보닐아실, 임의로 치환된 알콕시카보닐알콕시, 임의로 치환된 카복시알킬(예를 들면, 하이드록시 및/또는 O-보호 그룹으로 임의로 치환됨), 임의로 치환된 카복시알콕시, 임의로 치환된 카복시아미노알킬, 또는 임의로 치환된 카바모일알킬(예를 들면, 본원에 기술된 임의의 치환체, 예를 들면, 알킬의 경우 (1) 내지 (21)로부터 선택되는 것들로 임의로 치환됨)이고, 여기서, RVa 및 R12c는 이들이 부착된 탄소 원자들과 함께, 임의로 치환된 사이클로알킬, 임의로 치환된 아릴, 또는 임의로 치환된 헤테로사이클릴(예를 들면, 5- 또는 6-원 환)을 형성하고;
R12a는 H, 임의로 치환된 알킬, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐, 임의로 치환된 카복시알킬(예를 들면, 하이드록시 및/또는 O-보호 그룹으로 임의로 치환됨), 임의로 치환된 카복시알콕시, 임의로 치환된 카복시아미노알킬, 임의로 치환된 카바모일알킬이거나, 부재하며;
R12b는 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐, 임의로 치환된 알크아릴, 임의로 치환된 헤테로사이클릴, 임의로 치환된 알크헤테로사이클릴, 임의로 치환된 아미노산, 임의로 치환된 알콕시카보닐아실, 임의로 치환된 알콕시카보닐알콕시, 임의로 치환된 알콕시카보닐알킬, 임의로 치환된 알콕시카보닐알케닐, 임의로 치환된 알콕시카보닐알키닐, 임의로 치환된 알콕시카보닐알콕시, 임의로 치환된 카복시알킬(예를 들면, 하이드록시 및/또는 O-보호 그룹으로 임의로 치환됨), 임의로 치환된 카복시알콕시, 임의로 치환된 카복시아미노알킬, 또는 임의로 치환된 카바모일알킬이고,
여기서, R12b와 T1'의 조합 또는 R12b와 R12c의 조합은 함께 결합하여, 임의로 치환된 헤테로사이클릴을 형성하고;
R12c는 H, 할로, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 티오알콕시, 임의로 치환된 아미노, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 또는 임의로 치환된 아미노알키닐이다.
추가의 예시적인 변형된 우라실로는 화학식 b28 내지 화학식 b31의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체가 포함되며:
[화학식 b28]
[화학식 b29]
[화학식 b30]
[화학식 b31]
상기 화학식 b28 내지 화학식 b31에서,
각각의 T1 및 T2는, 독립적으로, O(옥소), S(티오), 또는 Se(셀레노)이고;
각각의 rVb' 및 RVb"은, 독립적으로, H, 할로, 임의로 치환된 아미노산, 임의로 치환된 알킬, 임의로 치환된 할로알킬, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알킬(예를 들면, N-보호 그룹, 예를 들면, 본원에 기술된 임의의 것, 예를 들면, 트리플루오로아세틸, 또는 설포알킬로 치환됨), 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐, 임의로 치환된 아실아미노알킬(예를 들면, N-보호 그룹, 예를 들면, 본원에 기술된 임의의 것, 예를 들면, 트리플루오로아세틸로 치환됨), 임의로 치환된 알콕시카보닐알킬, 임의로 치환된 알콕시카보닐알케닐, 임의로 치환된 알콕시카보닐알키닐, 임의로 치환된 알콕시카보닐아실, 임의로 치환된 알콕시카보닐알콕시, 임의로 치환된 카복시알킬(예를 들면, 하이드록시 및/또는 O-보호 그룹으로 임의로 치환됨), 임의로 치환된 카복시알콕시, 임의로 치환된 카복시아미노알킬, 또는 임의로 치환된 카바모일알킬(예를 들면, 본원에 기술된 임의의 치환체, 예를 들면, 알킬의 경우 (1) 내지 (21)로부터 선택되는 것들로 임의로 치환됨)(예를 들면, RVb'은 임의로 치환된 알킬, 임의로 치환된 알케닐, 또는 임의로 치환된 아미노알킬이며, 예를 들면, N-보호 그룹, 예를 들면, 본원에 기술된 임의의 것, 예를 들면, 트리플루오로아세틸, 또는 설포알킬로 치환된다)이고;
R12a는 H, 임의로 치환된 알킬, 임의로 치환된 카복시아미노알킬, 임의로 치환된 아미노알킬(예를 들면, 예를 들면, N-보호 그룹, 예를 들면, 본원에 기술된 임의의 것, 예를 들면, 트리플루오로아세틸, 또는 설포알킬로 치환됨), 임의로 치환된 아미노알케닐, 또는 임의로 치환된 아미노알키닐이며;
R12b는 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐(예를 들면, 예를 들면, N-보호 그룹, 예를 들면, 본원에 기술된 임의의 것, 예를 들면, 트리플루오로아세틸, 또는 설포알킬로 치환됨), 임의로 치환된 알콕시카보닐아실, 임의로 치환된 알콕시카보닐알콕시, 임의로 치환된 알콕시카보닐알킬, 임의로 치환된 알콕시카보닐알케닐, 임의로 치환된 알콕시카보닐알키닐, 임의로 치환된 알콕시카보닐알콕시, 임의로 치환된 카복시알콕시, 임의로 치환된 카복시알킬, 또는 임의로 치환된 카바모일알킬이다.
특정 실시형태에서, T1은 O(옥소)이고, T2는 S(티오) 또는 Se(셀레노)이다. 다른 실시형태에서, T1은 S(티오)이고, T2는 O(옥소) 또는 Se(셀레노)이다. 일부 실시형태에서, RVb'은 H, 임의로 치환된 알킬, 또는 임의로 치환된 알콕시이다.
다른 실시형태에서, 각각의 R12a 및 R12b는, 독립적으로, H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 또는 임의로 치환된 하이드록시알킬이다. 특정 실시형태에서, R12a는 H이다. 다른 실시형태에서, R12a와 R12b 둘 다는 H이다.
일부 실시형태에서, 각각의 R12b의 RVb'은, 독립적으로, 임의로 치환된 아미노알킬(예를 들면, N-보호 그룹, 예를 들면, 본원에 기술된 임의의 것, 예를 들면, 트리플루오로아세틸, 또는 설포알킬로 치환됨), 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐, 또는 임의로 치환된 아실아미노알킬(예를 들면, N-보호 그룹, 예를 들면, 본원에 기술된 임의의 것, 예를 들면, 트리플루오로아세틸로 치환됨)이다. 일부 실시형태에서, 임의로 치환된 아미노알킬의 아미노 및/또는 알킬은, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 설포알킬, 임의로 치환된 카복시(예를 들면, O-보호 그룹으로 치환됨), 임의로 치환된 하이드록시(예를 들면, O-보호 그룹으로 치환됨), 임의로 치환된 카복시알킬(예를 들면, O-보호 그룹으로 치환됨), 임의로 치환된 알콕시카보닐알킬(예를 들면, O-보호 그룹으로 치환됨), 또는 N-보호 그룹 중 하나 이상으로 치환된다. 일부 실시형태에서, 임의로 치환된 아미노알킬은 임의로 치환된 설포알킬 또는 임의로 치환된 알케닐로 치환된다. 특정 실시형태에서, R12a 및 RVb "은 둘 다 H이다. 특정 실시형태에서, T1은 O(옥소)이고, T2는 S(티오) 또는 Se(셀레노)이다.
일부 실시형태에서, RVb'은, 임의로 치환된 알콕시카보닐알킬 또는 임의로 치환된 카바모일알킬이다.
특정 실시형태에서, R12a, R12b, R12c, 또는 RVa에 대한 임의의 치환체는 폴리에틸렌 글리콜 그룹[예를 들면, -(CH2)s2(OCH2CH2)s1(CH2)s3OR'이고, 여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이며, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이고, R'은 H 또는 C1-20 알킬이다]; 또는 아미노-폴리에틸렌 글리콜 그룹[예를 들면, -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1이고, 여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, 각각의 RN1은, 독립적으로, 수소 또는 임의로 치환된 C1-6 알킬이다)이다.
일부 실시형태에서, B는, 변형된 사이토신이다. 예시적인 변형된 사이토신으로는 화학식 b10 내지 화학식 b14의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체가 포함된다:
[화학식 b10]
[화학식 b11]
[화학식 b12]
[화학식 b13]
[화학식 b14]
상기 화학식 b10 내지 화학식 b14에서,
각각의 T3' 및 T3"은, 독립적으로, H, 임의로 치환된 알킬, 임의로 치환된 알콕시, 또는 임의로 치환된 티오알콕시이거나, T3'과 T3 "의 조합이 함께 결합하여(예를 들면, T3에서와 같이), O(옥소), S(티오), 또는 Se(셀레노)를 형성하고;
각각의 V4는, 독립적으로, O, S, N(RVc)nv, 또는 C(RVc)nv이고, 여기서, nv는 0 내지 2의 정수이며, 각각의 RVc는, 독립적으로, H, 할로, 임의로 치환된 아미노산, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 헤테로사이클릴, 임의로 치환된 알크헤테로사이클릴, 또는 임의로 치환된 알키닐옥시(예를 들면, 본원에 기술된 임의의 치환체, 예를 들면, 알킬의 경우 (1) 내지 (21)로부터 선택되는 것들로 임의로 치환됨)이고, 여기서, R13b와 RVc의 조합은 함께, 임의로 치환된 헤테로사이클릴을 형성할 수 있고;
각각의 V5는, 독립적으로, N(RVd)nv, 또는 C(RVd)nv이며, 여기서, nv는 0 내지 2의 정수이고, 각각의 RVd는, 독립적으로, H, 할로, 임의로 치환된 아미노산, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 헤테로사이클릴, 임의로 치환된 알크헤테로사이클릴, 또는 임의로 치환된 알키닐옥시(예를 들면, 본원에 기술된 임의의 치환체, 예를 들면, 알킬의 경우 (1) 내지 (21)로부터 선택되는 것들로 임의로 치환됨)(예를 들면, V5는 -CH 또는 N이다)이며;
각각의 R13a 및 R13b는, 독립적으로, H, 임의로 치환된 아실, 임의로 치환된 아실옥시알킬, 임의로 치환된 알킬, 또는 임의로 치환된 알콕시이고, 여기서, R13b와 R14의 조합은 함께, 임의로 치환된 헤테로사이클릴을 형성할 수 있고;
각각의 R14는, 독립적으로, H, 할로, 하이드록시, 티올, 임의로 치환된 아실, 임의로 치환된 아미노산, 임의로 치환된 알킬, 임의로 치환된 할로알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 하이드록시알킬(예를 들면, O-보호 그룹으로 치환됨), 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시, 임의로 치환된 아실옥시알킬, 임의로 치환된 아미노(예를 들면, -NHR, 여기서, R은 H, 알킬, 아릴, 또는 포스포릴이다), 아지도, 임의로 치환된 아릴, 임의로 치환된 헤테로사이클릴, 임의로 치환된 알크헤테로사이클릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 또는 임의로 치환된 아미노알키닐이고;
각각의 R15 및 R16은, 독립적으로, H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 또는 임의로 치환된 알키닐이다.
추가의 예시적인 변형된 사이토신으로는 화학식 b32 내지 화학식 b35의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체가 포함되며:
[화학식 b32]
[화학식 b33]
[화학식 b34]
[화학식 b35]
상기 화학식 b32 내지 화학식 b35에서,
각각의 T1 및 T3은, 독립적으로, O(옥소), S(티오), 또는 Se(셀레노)이고;
각각의 R13a 및 R13b는, 독립적으로, H, 임의로 치환된 아실, 임의로 치환된 아실옥시알킬, 임의로 치환된 알킬, 또는 임의로 치환된 알콕시이며, 여기서, R13b와 R14의 조합은 함께, 임의로 치환된 헤테로사이클릴을 형성할 수 있고;
각각의 R14는, 독립적으로, H, 할로, 하이드록시, 티올, 임의로 치환된 아실, 임의로 치환된 아미노산, 임의로 치환된 알킬, 임의로 치환된 할로알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 하이드록시알킬(예를 들면, O-보호 그룹으로 치환됨), 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시, 임의로 치환된 아실옥시알킬, 임의로 치환된 아미노(예를 들면, -NHR, 여기서, R은 H, 알킬, 아릴, 또는 포스포릴이다), 아지도, 임의로 치환된 아릴, 임의로 치환된 헤테로사이클릴, 임의로 치환된 알크헤테로사이클릴, 임의로 치환된 아미노알킬(예를 들면, 하이드록시알킬, 알킬, 알케닐, 또는 알키닐), 임의로 치환된 아미노알케닐, 또는 임의로 치환된 아미노알키닐이며;
각각의 R15 및 R16은, 독립적으로, H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 또는 임의로 치환된 알키닐(예를 들면, R15는 H이고, R16은 H 또는 임의로 치환된 알킬이다)이다.
일부 실시형태에서, R15는 H이고, R16은 H 또는 임의로 치환된 알킬이다. 특정 실시형태에서, R14는 H, 아실, 또는 하이드록시알킬이다. 일부 실시형태에서, R14는 할로이다. 일부 실시형태에서, R14 및 R15는 둘 다 H이다. 일부 실시형태에서, R15 및 R16은 둘 다 H이다. 일부 실시형태에서, 각각의 R14 및 R15 및 R16은 H이다. 추가의 실시형태에서, 각각의 R13a 및 R13b는 독립적으로, H 또는 임의로 치환된 알킬이다.
변형된 사이토신들의 추가의 비-제한적인 예들은 화학식 b36의 화합물, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체를 포함한다:
[화학식 b36]
상기 화학식 b36에서,
각각의 R13b는, 독립적으로, H, 임의로 치환된 아실, 임의로 치환된 아실옥시알킬, 임의로 치환된 알킬, 또는 임의로 치환된 알콕시이고, 여기서, R13b와 R14b의 조합은 함께, 임의로 치환된 헤테로사이클릴을 형성할 수 있고;
각각의 R14a 및 R14b는, 독립적으로, H, 할로, 하이드록시, 티올, 임의로 치환된 아실, 임의로 치환된 아미노산, 임의로 치환된 알킬, 임의로 치환된 할로알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 하이드록시알킬(예를 들면, O-보호 그룹으로 치환됨), 임의로 치환된 하이드록시알케닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시, 임의로 치환된 아실옥시알킬, 임의로 치환된 아미노(예를 들면, -NHR, 여기서, R은 H, 알킬, 아릴, 포스포릴, 임의로 치환된 아미노알킬, 또는 임의로 치환된 카복시아미노알킬이다), 아지도, 임의로 치환된 아릴, 임의로 치환된 헤테로사이클릴, 임의로 치환된 알크헤테로사이클릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 또는 임의로 치환된 아미노알키닐이고;
각각의 R15는, 독립적으로, H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 또는 임의로 치환된 알키닐이다.
특정 실시형태에서, R14b는 임의로 치환된 아미노산(예를 들면, 임의로 치환된 라이신)이다. 일부 실시형태에서, R14a는 H이다.
일부 실시형태에서, B는, 변형된 구아닌이다. 예시적인 변형된 구아닌으로는 화학식 b15 내지 화학식 b17의 화합물들, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체를 포함한다:
[화학식 b15]
[화학식 b16]
[화학식 b17]
상기 화학식 b15 내지 b17에서,
각각의 T4', T4", T5', T5", T6' 및 T6"은, 독립적으로, H, 임의로 치환된 알킬, 또는 임의로 치환된 알콕시이고, 여기서, T4'과 T4 "의 조합(예를 들면, T4에서와 같이) 또는 T5'과 T5 "의 조합(예를 들면, T5에서와 같이) 또는 T6'과 T6 "의 조합이 함께 결합하여(예를 들면, T6에서와 같이), O(옥소), S(티오), 또는 Se(셀레노)를 형성하고;
각각의 V5 및 V6은, 독립적으로, O, S, N(RVd)nv, 또는 C(RVd)nv이고, 여기서, nv는 0 내지 2의 정수이며, 각각의 RVd는, 독립적으로, H, 할로, 티올, 임의로 치환된 아미노산, 시아노, 아미딘, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시(예를 들면, 본원에 기술된 임의의 치환체, 예를 들면, 알킬의 경우 (1) 내지 (21)의 화합물로부터 선택되는 것들로 임의로 치환된다), 임의로 치환된 티오알콕시, 또는 임의로 치환된 아미노이며;
각각의 R17, R18, R19a, R19b, R21, R22, R23, 및 R24는, 독립적으로, H, 할로, 티올, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 티오알콕시, 임의로 치환된 아미노, 또는 임의로 치환된 아미노산이다.
예시적인 변형된 구아노신으로는 화학식 b37 내지 화학식 b40의 화합물들, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체가 포함된다:
[화학식 b37]
[화학식 b38]
[화학식 b39]
[화학식 b40]
상기 화학식 b37 내지 화학식 b40에서,
각각의 T4'은, 독립적으로, H, 임의로 치환된 알킬, 또는 임의로 치환된 알콕시이고, 각각의 T4는, 독립적으로, O(옥소), S(티오), 또는 Se(셀레노)이며;
각각의 R18, R19a, R19b, 및 R21은, 독립적으로, H, 할로, 티올, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 티오알콕시, 임의로 치환된 아미노, 또는 임의로 치환된 아미노산이다.
일부 실시형태에서, R18은 H 또는 임의로 치환된 알킬이다. 추가의 실시형태에서, T4는 옥소이다. 일부 실시형태에서, 각각의 R19a 및 R19b는, 독립적으로, H 또는 임의로 치환된 알킬이다.
일부 실시형태에서, B는, 변형된 아데닌이다. 예시적인 변형된 아데닌으로는 화학식 b18 내지 화학식 b20의 화합물들, 또는 이들의 약제학적으로 허용되는 염 또는 입체이성체가 포함된다:
[화학식 b18]
[화학식 b19]
[화학식 b20]
상기 화학식 b18 내지 화학식 b20에서,
각각의 V7은, 독립적으로, O, S, N(RVe)nv, 또는 C(RVe)nv이고, 여기서, nv는 0 내지 2의 정수이며, 각각의 RVe는, 독립적으로, H, 할로, 임의로 치환된 아미노산, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 또는 임의로 치환된 알키닐옥시[예를 들면, 본원에 기술된 임의의 치환체, 예를 들면, 알킬의 경우 (1) 내지 (21)의 화합물로부터 선택되는 것들로 임의로 치환된다]이고;
각각의 R25는, 독립적으로, H, 할로, 티올, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 티오알콕시, 또는 임의로 치환된 아미노이며;
각각의 R26a 및 R26b는, 독립적으로, H, 임의로 치환된 아실, 임의로 치환된 아미노산, 임의로 치환된 카바모일알킬, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 알콕시, 또는 폴리에틸렌 글리콜 그룹[예를 들면, -(CH2)s2(OCH2CH2)s1(CH2)s3OR'이고, 여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이며, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이고, R'은 H 또는 C1-20 알킬이다]; 또는 아미노-폴리에틸렌 글리콜 그룹[예를 들면, -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1(여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, 각각의 RN1은, 독립적으로, 수소 또는 임의로 치환된 C1-6 알킬이다)]이며;
각각의 R27은, 독립적으로, H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 티오알콕시, 또는 임의로 치환된 아미노이며;
각각의 R28은, 독립적으로, H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 또는 임의로 치환된 알키닐이고;
각각의 R29은, 독립적으로, H, 임의로 치환된 아실, 임의로 치환된 아미노산, 임의로 치환된 카바모일알킬, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 알콕시, 또는 임의로 치환된 아미노이다.
예시적인 변형된 아데닌으로는 화학식 b41 내지 화학식 b43의 화합물들, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체가 포함된다:
[화학식 b41]
[화학식 b42]
[화학식 b43]
상기 화학식 b41 내지 화학식 b43에서,
각각의 R25는, 독립적으로, H, 할로, 티올, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 티오알콕시, 또는 임의로 치환된 아미노이고;
각각의 R26a 및 R26b는, 독립적으로, H, 임의로 치환된 아실, 임의로 치환된 아미노산, 임의로 치환된 카바모일알킬, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 알콕시, 또는 폴리에틸렌 글리콜 그룹[예를 들면, -(CH2)s2(OCH2CH2)s1(CH2)s3OR', 여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이고, R'은 H 또는 C1-20 알킬이다]; 또는 아미노-폴리에틸렌 글리콜 그룹[예를 들면, -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1, 여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, 각각의 RN1은, 독립적으로, 수소 또는 임의로 치환된 C1-6 알킬이다]이고;
각각의 R27은, 독립적으로, H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 티오알콕시, 또는 임의로 치환된 아미노이다.
일부 실시형태에서, R26a는 H이고, R26b는 임의로 치환된 알킬이다. 일부 실시형태에서, 각각의 R26a 및 R26b는, 독립적으로, 임의로 치환된 알킬이다. 특정 실시형태에서, R27은 임의로 치환된 알킬, 임의로 치환된 알콕시, 또는 임의로 치환된 티오알콕시이다. 다른 실시형태에서, R25는 임의로 치환된 알킬, 임의로 치환된 알콕시, 또는 임의로 치환된 티오알콕시이다.
특정 실시형태에서, R26a, R26b, 또는 R29에 대한 임의의 치환체는 폴리에틸렌 글리콜 그룹[예를 들면, -(CH2)s2(OCH2CH2)s1(CH2)s3OR', 여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, R'은 H 또는 C1-20 알킬이다]; 또는 아미노-폴리에틸렌 글리콜 그룹[예를 들면, -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1, 여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, 각각의 RN1은, 독립적으로, 수소 또는 임의로 치환된 C1-6 알킬이다]이다.
일부 실시형태에서, B는 화학식 b21의 화합물을 가질 수 있고:
[화학식 b21]
상기 화학식 b21에서, X12는, 독립적으로, O, S, 임의로 치환된 알킬렌(예를 들면, 메틸렌), 또는 임의로 치환된 헤테로알킬렌이고, xa는 0 내지 3의 정수이며, R12a 및 T2는 본원에 기술된 바와 같다.
일부 실시형태에서, B는 화학식 b22를 가질 수 있고:
[화학식 b22]
상기 화학식 b22에서, R10'은, 독립적으로, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 아릴, 임의로 치환된 헤테로사이클릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐, 임의로 치환된 알콕시, 임의로 치환된 알콕시카보닐알킬, 임의로 치환된 알콕시카보닐알케닐, 임의로 치환된 알콕시카보닐알키닐, 임의로 치환된 알콕시카보닐알콕시, 임의로 치환된 카복시알콕시, 임의로 치환된 카복시알킬, 또는 임의로 치환된 카바모일알킬이며, R11, R12a, T1, 및 T2는 본원에 기술된 바와 같다.
일부 실시형태에서, B는 화학식 b23을 가질 수 있고:
[화학식 b23]
상기 화학식 b23에서, R10은 임의로 치환된 헤테로사이클릴(예를 들면, 임의로 치환된 푸릴, 임의로 치환된 티에닐, 또는 임의로 치환된 피롤릴), 임의로 치환된 아릴(예를 들면, 임의로 치환된 페닐 또는 임의로 치환된 나프틸), 또는 본원에 기술된 임의의 치환체(예를 들면, R10의 경우)이고; 여기서, R11(예를 들면, H 또는 본원에 기술된 임의의 치환체), R12a(예를 들면, H 또는 본원에 기술된 임의의 치환체), T1 (예를 들면, 옥소 또는 본원에 기술된 임의의 치환체), 및 T2(예를 들면, 옥소 또는 본원에 기술된 임의의 치환체)는 본원에 기술된 바와 같다.
일부 실시형태에서, B는 화학식 b24를 가질 수 있고:
[화학식 b24]
상기 화학식 b24에서, R14'은, 독립적으로, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 아릴, 임의로 치환된 헤테로사이클릴, 임의로 치환된 알크아릴, 임의로 치환된 알크헤테로사이클릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐, 임의로 치환된 알콕시, 임의로 치환된 알콕시카보닐알킬, 임의로 치환된 알콕시카보닐알케닐, 임의로 치환된 알콕시카보닐알키닐, 임의로 치환된 알콕시카보닐알콕시, 임의로 치환된 카복시알콕시, 임의로 치환된 카복시알킬, 또는 임의로 치환된 카바모일알킬이며, R13a, R13b, R15, 및 T3은 본원에 기술된 바와 같다.
일부 실시형태에서, B는 화학식 b25를 가질 수 있고:
[화학식 b25]
상기 화학식 b25에서, R14'은, 임의로 치환된 헤테로사이클릴(예를 들면, 임의로 치환된 푸릴, 임의로 치환된 티에닐, 또는 임의로 치환된 피롤릴), 임의로 치환된 아릴(예를 들면, 임의로 치환된 페닐 또는 임의로 치환된 나프틸), 또는 본원에 기술된 어떠한 치환체(예를 들면, R14 또는 R14'의 경우)이며; 여기서, R13a(예를 들면, H 또는 본원에 기술된 임의의 치환체), R13b(예를 들면, H 또는 본원에 기술된 임의의 치환체), R15(예를 들면, H 또는 본원에 기술된 임의의 치환체), 및 T3(예를 들면, 옥소 또는 본원에 기술된 임의의 치환체)는 본원에 기술된 바와 같다.
일부 실시형태에서, B는 사이토신, 구아닌, 아데닌, 및 우라실로 이루어진 그룹으로부터 선택되는 핵염기이다. 일부 실시형태에서, B는:
[화학식 b26]
[화학식 b27]
일부 실시형태에서, 변형된 핵염기는, 변형된 우라실이다. 변형된 우라실을 갖는 예시적인 핵염기 및 뉴클레오사이드는, 슈도우리딘(Ψ), 피리딘-4-온 리보뉴클레오사이드, 5-아자-우리딘, 6-아자-우리딘, 2-티오-5-아자-우리딘, 2-티오-우리딘(s2U), 4-티오-우리딘(s4U), 4-티오-슈도우리딘, 2-티오-슈도우리딘, 5-하이드록시-우리딘(ho5U), 5-아미노알릴-우리딘, 5-할로-우리딘(예를 들면, 5-요오도-우리딘 또는 5-브로모-우리딘), 3-메틸-우리딘(m3U), 5-메톡시-우리딘(mo5U), 우리딘 5-옥시아세트산(cmo5U), 우리딘 5-옥시아세트산 메틸 에스테르(mcmo5U), 5-카복시메틸-우리딘(cm5U), 1-카복시메틸-슈도우리딘, 5-카복시하이드록시메틸-우리딘(chm5U), 5-카복시하이드록시메틸-우리딘 메틸 에스테르(mchm5U), 5-메톡시카보닐메틸-우리딘(mcm5U), 5-메톡시카보닐메틸-2-티오-우리딘(mcm5s2U), 5-아미노메틸-2-티오-우리딘(nm5s2U), 5-메틸아미노메틸-우리딘(mnm5U), 5-메틸아미노메틸-2-티오-우리딘(mnm5s2U), 5-메틸아미노메틸-2-셀레노-우리딘(mnm5se2U), 5-카바모일메틸-우리딘(ncm5U), 5-카복시메틸아미노메틸-우리딘(cmnm5U), 5-카복시메틸아미노메틸-2-티오-우리딘(cmnm5s2U), 5-프로피닐-우리딘, 1-프로피닐-슈도우리딘, 5-타우리노메틸-우리딘(τm5U), 1-타우리노메틸-슈도우리딘, 5-타우리노메틸-2-티오-우리딘(τm5s2U), 1-타우리노메틸-4-티오-슈도우리딘, 5-메틸-우리딘(m5U, 즉, 핵염기 데옥시티미딘을 갖는 것), 1-메틸-슈도우리딘(m1Ψ), 5-메틸-2-티오-우리딘(m5s2U), 1-메틸-4-티오-슈도우리딘(m1s4Ψ), 4-티오-1-메틸-슈도우리딘, 3-메틸-슈도우리딘(m3Ψ), 2-티오-1-메틸-슈도우리딘, 1-메틸-1-데아자-슈도우리딘, 2-티오-1-메틸-1-데아자-슈도우리딘, 디하이드로우리딘(D), 디하이드로슈도우리딘, 5,6-디하이드로우리딘, 5-메틸-디하이드로우리딘(m5D), 2-티오-디하이드로우리딘, 2-티오-디하이드로슈도우리딘, 2-메톡시-우리딘, 2-메톡시-4-티오-우리딘, 4-메톡시-슈도우리딘, 4-메톡시-2-티오-슈도우리딘, N1-메틸-슈도우리딘, 3-(3-아미노-3-카복시프로필)우리딘(acp3U), 1-메틸-3-(3-아미노-3-카복시프로필)슈도우리딘(acp3Ψ), 5-(이소펜테닐아미노메틸)우리딘(inm5U), 5-(이소펜테닐아미노메틸)-2-티오-우리딘(inm5s2U), α-티오-우리딘, 2'-O-메틸-우리딘(UM), 5,2'-O-디메틸-우리딘(m5Um), 2'-O-메틸-슈도우리딘(Ψm), 2-티오-2'-O-메틸-우리딘(s2Um), 5-메톡시카보닐메틸-2'-O-메틸-우리딘(mcm5Um), 5-카바모일메틸-2'-O-메틸-우리딘(ncm5Um), 5-카복시메틸아미노메틸-2'-O-메틸-우리딘(cmnm5Um), 3,2'-O-디메틸-우리딘(m3Um), 및 5-(이소펜테닐아미노메틸)-2'-O-메틸-우리딘(inm5Um), 1-티오-우리딘, 데옥시티미딘, 2'-F-아라-우리딘, 2'-F-우리딘, 2'-OH-아라-우리딘, 5-(2-카보메톡시비닐)우리딘, 및 5-[3-(1-E-프로페닐아미노)우리딘을 포함한다.
일부 실시형태에서, 변형된 핵염기는, 변형된 사이토신이다. 변형된 사이토신을 갖는 예시적인 핵염기 및 뉴클레오사이드로는, 5-아자-사이티딘, 6-아자-사이티딘, 슈도이소사이티딘, 3-메틸-사이티딘(m3C), N4-아세틸-사이티딘(ac4C), 5-포르밀-사이티딘(f5C), N4-메틸-사이티딘(m4C), 5-메틸-사이티딘(m5C), 5-할로-사이티딘(예를 들면, 5-요오도-사이티딘), 5-하이드록시메틸-사이티딘(hm5C), 1-메틸-슈도이소사이티딘, 피롤로-사이티딘, 피롤로-슈도이소사이티딘, 2-티오-사이티딘(s2C), 2-티오-5-메틸-사이티딘, 4-티오-슈도이소사이티딘, 4-티오-1-메틸-슈도이소사이티딘, 4-티오-1-메틸-1-데아자-슈도이소사이티딘, 1-메틸-1-데아자-슈도이소사이티딘, 제불라린, 5-아자-제불라린, 5-메틸-제불라린, 5-아자-2-티오-제불라린, 2-티오-제불라린, 2-메톡시-사이티딘, 2-메톡시-5-메틸-사이티딘, 4-메톡시-슈도이소사이티딘, 4-메톡시-1-메틸-슈도이소사이티딘, 라이시딘(k2C), α-티오-사이티딘, 2'-O-메틸-사이티딘(Cm), 5,2'-O-디메틸-사이티딘(m5Cm), N4-아세틸-2'-O-메틸-사이티딘(ac4Cm), N4,2'-O-디메틸-사이티딘(m4Cm), 5-포르밀-2'-O-메틸-사이티딘(f5Cm), N4,N4,2'-O-트리메틸-사이티딘(m4 2Cm), 1-티오-사이티딘, 2'-F-아라-사이티딘, 2'-F-사이티딘, 및 2'-OH-아라-사이티딘이 포함된다.
일부 실시형태에서, 변형된 핵염기는, 변형된 아데닌이다. 변형된 아데닌을 갖는 예시적인 핵염기 및 뉴클레오사이드로는, 2-아미노-퓨린, 2, 6-디아미노퓨린, 2-아미노-6-할로-퓨린(예를 들면, 2-아미노-6-클로로-퓨린), 6-할로-퓨린(예를 들면, 6-클로로-퓨린), 2-아미노-6-메틸-퓨린, 8-아지도-아데노신, 7-데아자-아데닌, 7-데아자-8-아자-아데닌, 7-데아자-2-아미노-퓨린, 7-데아자-8-아자-2-아미노-퓨린, 7-데아자-2,6-디아미노퓨린, 7-데아자-8-아자-2,6-디아미노퓨린, 1-메틸-아데노신(m1A), 2-메틸-아데닌(m2A), N6-메틸-아데노신(m6A), 2-메틸티오-N6-메틸-아데노신(ms2m6A), N6-이소펜테닐-아데노신(i6A), 2-메틸티오-N6-이소펜테닐-아데노신(ms2i6A), N6-(시스-하이드록시이소펜테닐)아데노신(io6A), 2-메틸티오-N6-(시스-하이드록시이소펜테닐)아데노신(ms2io6A), N6-글리시닐카바모일-아데노신(g6A), N6-트레오닐카바모일-아데노신(t6A), N6-메틸-N6-트레오닐카바모일-아데노신(m6t6A), 2-메틸티오-N6-트레오닐카바모일-아데노신(ms2g6A), N6,N6-디메틸-아데노신(m6 2A), N6-하이드록시노르발릴카바모일-아데노신(hn6A), 2-메틸티오-N6-하이드록시노르발릴카바모일-아데노신(ms2hn6A), N6-아세틸-아데노신(ac6A), 7-메틸-아데닌, 2-메틸티오-아데닌, 2-메톡시-아데닌, α-티오-아데노신, 2'-O-메틸-아데노신(Am), N6,2'-O-디메틸-아데노신(m6Am), N6,N6,2'-O-트리메틸-아데노신(m6 2Am), 1,2'-O-디메틸-아데노신(m1Am), 2'-O-리보실아데노신(포스페이트)(Ar(p)), 2-아미노-N6-메틸-퓨린, 1-티오-아데노신, 8-아지도-아데노신, 2'-F-아라-아데노신, 2'-F-아데노신, 2'-OH-아라-아데노신, 및 N6-(19-아미노-펜타옥사노나데실)-아데노신을 포함한다.
일부 실시형태에서, 변형된 핵염기는, 변형된 구아닌이다. 변형된 구아닌을 갖는 예시적인 핵염기 및 뉴클레오사이드로는 이노신(I), 1-메틸-이노신(m1I), 와이오신(imG), 메틸와이오신(mimG), 4-데메틸-와이오신(imG-14), 이소와이오신(imG2), 와이부토신(yW), 퍼옥시와이부토신(o2yW), 하이드록시와이부토신(OHyW), 변형중인(undermodified) 하이드록시와이부토신(OHyW*), 7-데아자-구아노신, 쿠에우오신(Q), 에폭시쿠에우오신(oQ), 갈락토실-쿠에우오신(galQ), 만노실-쿠에우오신(manQ), 7-시아노-7-데아자-구아노신(preQ0), 7-아미노메틸-7-데아자-구아노신(preQ1), 아르카에오신(G+), 7-데아자-8-아자-구아노신, 6-티오-구아노신, 6-티오-7-데아자-구아노신, 6-티오-7-데아자-8-아자-구아노신, 7-메틸-구아노신(m7G), 6-티오-7-메틸-구아노신, 7-메틸-이노신, 6-메톡시-구아노신, 1-메틸-구아노신(m1G), N2-메틸-구아노신(m2G), N2,N2-디메틸-구아노신(m2 2G), N2,7-디메틸-구아노신(m2,7G), N2, N2,7-디메틸-구아노신(m2,2,7G), 8-옥소-구아노신, 7-메틸-8-옥소-구아노신, 1-메틸-6-티오-구아노신, N2-메틸-6-티오-구아노신, N2,N2-디메틸-6-티오-구아노신, α-티오-구아노신, 2'-O-메틸-구아노신(Gm), N2-메틸-2'-O-메틸-구아노신(m2Gm), N2,N2-디메틸-2'-O-메틸-구아노신(m2 2Gm), 1-메틸-2'-O-메틸-구아노신(m1Gm), N2,7-디메틸-2'-O-메틸-구아노신(m2,7Gm), 2'-O-메틸-이노신(Im), 1,2'-O-디메틸-이노신(m1Im), 2'-O-리보실구아노신(포스페이트)(Gr(p)), 1-티오-구아노신, O6-메틸-구아노신, 2'-F-아라-구아노신, 및 2'-F-구아노신이 포함된다.
일부 실시형태에서, 뉴클레오타이드는 주요 그루브 페이스 상에서 변형될 수 있다. 예를 들면, 이러한 변형은, 우라실 또는 사이토신의 C-5 상의 수소를 알킬(예를 들면, 메틸) 또는 할로로 대체함을 포함한다.
뉴클레오타이드의 핵염기는, 퓨린, 피리미딘, 퓨린 또는 피리미딘 유사체로부터 독립적으로 선택될 수 있다. 예를 들면, 핵염기는 아데닌, 사이토신, 구아닌, 우라실, 또는 하이포크산틴으로부터 각각 독립적으로 선택될 수 있다. 다른 실시형태에서, 핵염기는 또한 예를 들면, 염기의 자연 발생 및 합성 유도체, 예를 들면, 아데닌 및 구아닌의 피라졸로[3,4-d]피리미딘, 5-메틸사이토신(5-me-C), 5-하이드록시메틸 사이토신, 크산틴, 하이포크산틴, 2-아미노아데닌, 6-메틸 및 다른 알킬 유도체, 아데닌 및 구아닌의 2-프로필 및 다른 알킬 유도체, 2-티오우라실, 2-티오티민 및 2-티오사이토신, 5-프로피닐 우라실 및 사이토신, 6-아조 우라실, 사이토신 및 티민, 5-우라실(슈도우라실), 4-티오우라실, 8-할로(예를 들면, 8-브로모), 8-아미노, 8-티올, 8-티오알킬, 8-하이드록실 및 다른 8-치환된 아데닌 및 구아닌, 5-할로, 특히 5-브로모, 5-트리플루오로메틸 및 다른 5-치환된 우라실 및 사이토신, 7-메틸구아닌 및 7-메틸아데닌, 8-아자구아닌 및 8-아자아데닌, 데아자구아닌, 7-데아자구아닌, 3-데아자구아닌, 데아자아데닌, 7-데아자아데닌, 3-데아자아데닌, 피라졸로[3,4-d]피리미딘, 이미다조[1,5-a]1,3,5 트리아지논, 9-데아자퓨린, 이미다조[4,5-d]피라진, 티아졸로[4,5-d]피리미딘, 피라진-2-온, 1,2,4-트리아진, 피리다진; 및 1,3,5 트리아진을 또한 포함할 수 있다. 뉴클레오타이드들을 단축된 A, G, C, T 또는 U를 사용하여 나타내는 경우, 각각의 문자는 대표적인 염기 및/또는 이의 유도체를 말하며, 예를 들면, A는 아데닌 또는 아데닌 유사체, 예를 들면, 7-데아자 아데닌을 포함한다.
일부 실시형태에서, 변형된 뉴클레오타이드는 화학식 XI의 화합물이다:
[화학식 XI]
상기 화학식 XI에서,
Z는 -CRaRb-일 수 있고 A와 결합을 형성할 수 있으며;
A는 H, OH, NHR이고, 여기서, R은 알킬 또는 아릴 또는 포스포릴, 설페이트, -NH2, N3, 아지도, -SH, N 아미노산, 또는 1 내지 12개의 아미노산들을 포함하는 펩타이드이고;
D는 H, OH, NHR(여기서, R은 알킬 또는 아릴 또는 포스포릴, -NH2, -SH, 아미노산, 1 내지 12개의 아미노산들을 포함하는 펩타이드이다), 또는 화학식 XII의 그룹이거나:
[화학식 XII]
A 및 D는 이들이 부착된 탄소 원자들과 함께 5-원 환을 형성하고;
X는 O 또는 S이며;
각각의 Y1은 -ORa1, -NRa1Rb1, 및 -SRa1로부터 독립적으로 선택되고;
각각의 Y2 및 Y3은 O, -CRaRb-, NRc, S, 또는 C, O, N, 및 S로 이루어진 그룹으로부터 선택되는 하나 이상의 원자들을 포함하는 링커로부터 독립적으로 선택되며;
n은 0, 1, 2, 또는 3이고;
m은 0, 1, 2 또는 3이며;
B는 핵염기이고;
Ra 및 Rb는 각각 독립적으로 H, C1-12 알킬, C2-12 알케닐, C2-12 알키닐, 또는 C6-20 아릴이며;
Rc는 H, C1-12 알킬, C2-12 알케닐, 페닐, 벤질, 폴리에틸렌 글리콜 그룹, 또는 아미노-폴리에틸렌 글리콜 그룹이고;
Ra1 및 Rb1는 각각 독립적으로 H 또는 반대이온이며;
-ORc1은 약 1의 pH에서 OH이거나 -ORc1은 생리학적 pH에서 O-이고;
단, 변수들 A, B, D, U, Z, Y2 및 Y3을 포함하는 환은 리보스일 수 없다.
일부 실시형태에서, B는 사이토신, 구아닌, 아데닌, 및 우라실로 이루어진 그룹으로부터 선택되는 핵염기이다.
일부 실시형태에서, 핵염기는 피리미딘 또는 이의 유도체이다.
일부 실시형태에서, 변형된 뉴클레오타이드들은 화학식 XI-a의 화합물이다:
[화학식 XI-a]
일부 실시형태에서, 변형된 뉴클레오타이드들은 화학식 XI-b의 화합물이다:
[화학식 XI-b]
일부 실시형태에서, 변형된 뉴클레오타이드들은 화학식 XI-c1, XI-c2, 또는 XI-c3의 화합물이다:
[화학식 XI-c1]
[화학식 XI-c2]
[화학식 XI-c3]
일부 실시형태에서, 변형된 뉴클레오타이드들은 화학식 XI의 화합물이다:
[화학식 XI]
상기 화학식 XI에서,
Z는 -CRaRb-일 수 있고 A와 결합을 형성할 수 있으며;
A는 H, OH, 설페이트, -NH2, -SH, 아미노산, 또는 1 내지 12개의 아미노산들을 포함하는 펩타이드이고;
D는 H, OH, -NH2, -SH, 아미노산, 1 내지 12개의 아미노산들을 포함하는 펩타이드, 또는 화학식 XII의 그룹이거나:
[화학식 XII]
A 및 D는, 이들이 부착된 탄소 원자들과 함께 5-원 환을 형성하고;
X는 O 또는 S이며;
각각의 Y1은 -ORa1, -NRa1Rb1, 및 -SRa1로부터 독립적으로 선택되고;
각각의 Y2 및 Y3은, O, -CRaRb-, NRc, S, 또는 C, O, N, 및 S로 이루어진 그룹으로부터 선택되는 하나 이상의 원자들을 포함하는 링커로부터 독립적으로 선택되며;
n은 0, 1, 2, 또는 3이고;
m은 0, 1, 2 또는 3이며;
B는 화학식 XIII의 핵염기이고:
[화학식 XIII]
상기 화학식 XIII에서,
V는 N 또는 양으로 하전된 NRc이고;
R3은 NRcRd, -ORa, 또는 -SRa이며;
R4는 H이거나 Y3과의 결합을 임의로 형성할 수 있고;
R5는 H, -NRcRd, 또는 -ORa이며;
Ra 및 Rb는 각각 독립적으로 H, C1-12 알킬, C2-12 알케닐, C2-12 알키닐, 또는 C6-20 아릴이고;
Rc는 H, C1-12 알킬, C2-12 알케닐, 페닐, 벤질, 폴리에틸렌 글리콜 그룹, 또는 아미노-폴리에틸렌 글리콜 그룹이며;
Ra1 및 Rb1는 각각 독립적으로 H 또는 반대이온이고;
-ORc1은 약 1의 pH에서 OH이거나, 또는 -ORc1은 생리학적 pH에서 O-이다.
일부 실시형태에서, 변형된 뉴클레오타이드들은 화학식 I-d의 화합물이다:
[화학식 I-d]
일부 실시형태에서, 변형된 뉴클레오타이드들은 하기 화학식 BB-247 내지 화학식 BB-258로 이루어진 그룹으로부터 선택되는 화합물들, 또는 이의 약제학적으로 허용되는 염이다:
[화학식 BB-247]
[화학식 BB-248]
[화학식 BB-249]
[화학식 BB-250]
[화학식 BB-251]
[화학식 BB-252]
[화학식 BB-253]
[화학식 BB-254]
[화학식 BB-255]
[화학식 BB-256]
[화학식 BB-257]
[화학식 BB-258]
일부 실시형태에서, 변형된 뉴클레오타이드들은 하기 화학식 BB-259 내지 화학식 BB-274로 이루어진 그룹으로부터 선택되는 화합물들, 또는 이의 약제학적으로 허용되는 염이다:
[화학식 BB-259]
[화학식 BB-260]
[화학식 BB-261]
[화학식 BB-262]
[화학식 BB-263]
[화학식 BB-264]
[화학식 BB-265]
[화학식 BB-266]
[화학식 BB-267]
[화학식 BB-268]
[화학식 BB-269]
[화학식 BB-270]
[화학식 BB-271]
[화학식 BB-272]
[화학식 BB-273]
[화학식 BB-274]
뉴클레오사이드간 연결(linkage)에 있어서의 변형들
폴리뉴클레오타이드 분자 내로 혼입될 수 있는 변형된 뉴클레오타이드들은 뉴클레오사이드간 연결(예를 들면, 포스페이트 골격) 상에서 변형될 수 있다. 여기서, 폴리뉴클레오타이드 골격과 관련하여, 어구들 "포스페이트" 및 "포스포디에스테르"는 상호교환적으로 사용된다. 골격 포스페이트 그룹들은 하나 이상의 산소 원자들을 상이한 치환체로 대체시킴으로써 변형시킬 수 있다. 추가로, 변형된 뉴클레오사이드들 및 뉴클레오타이드들은 변형되지 않은 포스페이트 잔기를 본원에 기술된 바와 같은 다른 뉴클레오사이드간 결합으로 대규모로 대체시킴을 포함할 수 있다. 변형된 포스페이트 그룹들의 예는 포스포로티오에이트, 포스포로셀레네이트들, 보라노포스페이트들, 보라노포스페이트 에스테르들, 수소 포스포네이트들, 포스포르아미데이트들, 포스포로디아미데이트들, 알킬 또는 아릴 포스포네이트들, 및 포스포트리에스테르들을 포함하나 이에 한정되지 않는다. 포스포로디티오에이트들은 둘다 황으로 대체된 연결되지 않은 산소들을 갖는다. 포스포로디티오에이트들은 둘다 황으로 대체된 연결되지 않은 산소들을 갖는다. 포스페이트 링커들은 결합 산소를 질소(브릿지된 포스포르아미데이트들), 황(브릿지된 포스포로티오에이트들), 및 탄소(브릿지된 메틸렌-포스포네이트들)로 대체시킴으로써 또한 변형시킬 수 있다.
α-티오 치환된 포스페이트 잔기는 RNA 및 DNA 중합체들에 대해 비천연의 포스포로티오에이트 골격 연결들을 통해 안정성을 부여하기 위해 제공된다. 포스포로티오에이트 DNA 및 RNA는, 뉴클레아제 내성이 증가되어 있으며 결과적으로 세포 환경에서 반감기가 더 길다. 이론에 얽메이려는 것은 아니지만, 포스포로티오에이트 연결된 폴리뉴클레오타이드 분자들은 또한 세포의 선천적인 면역 분자들의 보다 약한 결합/활성화를 통해 선천적 면역 반응을 감소시키는 것으로 또한 예측된다.
구체적인 실시형태에서, 변형된 뉴클레오사이드는 알파-티오-뉴클레오사이드(예를 들면, 5'-O-(1-티오포스페이트)-아데노신, 5'-O-(1-티오포스페이트)-사이티딘(α-티오-사이티딘), 5'-O-(1-티오포스페이트)-구아노신, 5'-O-(1-티오포스페이트)-우리딘, 또는 5'-O-(1-티오포스페이트)-슈도우리딘)을 포함한다.
인 원자를 함유하지 않는 뉴클레오사이드간 연결들을 포함하는, 본 발명에 따라 사용될 수 있는 다른 뉴클레오사이드간 연결들은 본원에서 하기에 기술되어 있다.
변형된 당들, 핵염기들, 및 뉴클레오사이드간 연결들의 조합들
본 발명의 폴리뉴클레오타이드는 당, 핵염기, 및/또는 뉴클레오사이드간 연결에 대한 변형들의 조합을 포함할 수 있다. 이들 조합들은 본원에 기술된 하나 이상의 변형들을 포함할 수 있다. 예를 들면, 본원에서 화학식들 (Ia), (Ia-1) 내지 (Ia-3), (Ib) 내지 (If), (IIa) 내지 (IIp), (IIb-1), (IIb-2), (IIc-1) 내지 (IIc-2), (IIn-1), (IIn-2), (IVa) 내지 (IVl), 및 (IXa) 내지 (IXr)에 기술된 뉴클레오타이드들 중 임의의 것도 본원에 기술된 핵염기들 중 임의의 것(예를 들면, 화학식 (b1) 내지 (b43) 또는 본원에 기술된 다른 임의의 것)과 조합될 수 있다.
폴리뉴클레오타이드 분자들의 합성
본 발명에 따라 사용하기 위한 폴리뉴클레오타이드 분자들은 본원에 기술된 바와 같은 어떠한 유용한 기술에 따라서도 제조할 수 있다. 본원에 기재된 폴리뉴클레오타이드 분자들의 합성에 사용된 변형된 뉴클레오사이드들 및 뉴클레오타이드들은 다음의 일반적인 방법들 및 과정들을 사용하여 용이하게 이용가능한 출발 물질들로부터 제조할 수 있다. 대표적이거나 바람직한 공정 조건들(예를 들면, 반응 온도들, 시간들, 반응물들의 몰비들, 용매들, 압력들 등)이 제공되는 경우, 숙련가는 추가의 공정 조건들을 최적화하여 개발할 수 있을 것이다. 최적의 반응 조건들은 사용된 특수한 반응물들 또는 용매에 따라 변할 수 있지만 이러한 조건들은 통상의 최적화 과정들에 의해 당해 분야의 숙련가에 의해 측정될 수 있다.
본원에 기술된 공정들은 당해 분야에 공지된 어떠한 적합한 방법에 따라서도 모니터링할 수 있다. 예를 들면, 생성물 형성은 분광기적 수단들, 예를 들면, 핵 자기 공명 분광법(예를 들면, 1H 또는 13C) 적외선 분광법, 분광측정법(예를 들면, UV-가시광), 또는 질량 분석법에 의해서, 또는 크로마토그래피, 예를 들면, 고 성능 액체 크로마토그래피(HPLC) 또는 박층 크로마토그래피에 의해 모니터링될 수 있다.
본 발명의 폴리뉴클레오타이드 분자들의 제조는 다양한 화학 그룹들의 보호 및 탈보호를 포함할 수 있다. 적절한 보호 그룹들의 보호 및 탈보호, 및 선택에 대한 필요성은 당해 분야의 숙련가에 의해 용이하게 결정될 수 있다. 보호 그룹들의 화학은, 예를 들면, 이의 전문이 참조로 본원에 혼입된 문헌(참조: Greene, et al., Protective Groups in Organic Synthesis, 2d. Ed., Wiley & Sons, 1991)에서 찾을 수 있다.
본원에 기술된 과정들의 반응들은 유기 합성의 분야에서의 숙련가에 의해 용이하게 선택될 수 있는, 적합한 용매들 속에서 수행할 수 있다. 적합한 용매들은 출발 물질들(반응물들), 중간체들, 또는 생성물들과, 반응들이 수행되는 온도들, 즉, 용매의 동결 온도 내지 용매의 비등 온도 범위일 수 있는 온도에서 실질적으로 비반응성일 수 있다. 주어진 반응은 하나의 용매 또는 하나 이상의 용매의 혼합물에서 수행할 수 있다. 특정 반응 단계에 따라서, 특수한 반응 단계에 적합한 용매들을 선택할 수 있다.
변형된 폴리뉴클레오타이드들 또는 핵산들(예를 들면, 폴리뉴클레오타이드들 또는 변형된 mRNA 분자들)의 라세믹 혼합물들의 분해는 당해 분야에 공지된 다수의 방법들 중 임의의 것으로도 수행할 수 있다. 예시적인 방법은 광학적으로 활성인, 염-형성 유기 산인 "키랄 분해산"을 사용한 분별 재결정을 포함한다. 분불 재결정 방법들용으로 적합한 분해제들은 예를 들면, 광학적으로 활성인 산들, 예를 들면, 타르타르산, 디아세틸타르타르산, 디벤조일타르타르산, 만델산, 말산, 락트산 또는 다양한 광학적으로 활성인 캄포르설폰산들의 D 및 L 형태들이다. 라세믹(racemic) 혼합물들의 분해는 또한 광학적으로 활성인 분해제(예를 들면, 디니트로벤조일페닐글리신)로 채워진 컬럼위에서 용출시켜 수행할 수 있다. 적합한 용출 용매 조성물은 당해 분야의 숙련가에 의해 결정될 수 있다.
변형된 뉴클레오사이드들 및 뉴클레오타이드들(예를 들면, 빌딩 블록 분자들)은, 각각이 이들의 전문이 본원에 참조로 혼입된, 문헌[참조: Ogata et al., J. Org. Chem. 74:2585-2588(2009); Purmal et al., Nucl. Acids Res. 22(1): 72-78, (1994); Fukuhara et al., Biochemistry, 1(4): 563-568(1962); 및 Xu et al., 테트라hedron, 48(9): 1729-1740 (1992)]에 기술된 합성 방법들에 따라 제조할 수 있다.
본 발명의 폴리뉴클레오타이드는 분자의 전체 길이에 따라 균일하게 변형되거나 변형되지 않을 수 있다. 예를 들면, 뉴클레오타이드(예를 들면, 퓨린 또는 피리미딘, 또는 A, G, U, C 중 어느 하나 이상 또는 모두) 중 하나 이상 또는 모든 유형들은 본 발명의 폴리뉴클레오타이드내에서, 또는 이의 제공된 예정 서열 영역내에서 균일하게 변형되거나 변형되지 않을 수 있다. 일부 실시형태에서, 본 발명의 폴리뉴클레오타이드(또는 이의 제공된 서열 영역)내 모든 뉴클레오타이드 X는 변형되며, 여기서, X는 뉴클레오타이드들 A, G, U, C 중 어느 하나, 또는 A+G, A+U, A+C, G+U, G+C, U+C, A+G+U, A+G+C, G+U+C 또는 A+G+C의 조합들 중 어느 하나일 수 있다.
상이한 당 변형들, 뉴클레오타이드 변형들, 및/또는 뉴클레오사이드간 연결들(예를 들면, 골격 구조들)이 폴리뉴클레오타이드의 다양한 위치들내에서 존재할 수 있다. 당해 분야에서 통상의 지술자는, 이러한 뉴클레오타이드 동족체들 또는 다른 변형(들)이 폴리뉴클레오타이드의 어떠한 위치(들)에도 위치하여 폴리뉴클레오타이드의 기능이 실질적으로 감소되지 않도록 할 수 있음을 인식할 것이다. 변형은 또한 5' 또는 3' 말단 변형일 수 있다. 폴리뉴클레오타이드는 약 1% 내지 약 100%의 변형된 뉴클레오타이드들(전체 뉴클레오타이드 함량과 관련하여, 또는 뉴클레오타이드의 하나 이상의 유형들, 즉, A, G, U 또는 C 중 어느 하나 이상과 관련하여) 또는 어떠한 개재 퍼센트(예를 들면, 1% 내지 20%, 1% 내지 25%, 1% 내지 50%, 1% 내지 60%, 1% 내지 70%, 1% 내지 80%, 1% 내지 90%, 1% 내지 95%, 10% 내지 20%, 10% 내지 25%, 10% 내지 50%, 10% 내지 60%, 10% 내지 70%, 10% 내지 80%, 10% 내지 90%, 10% 내지 95%, 10% 내지 100%, 20% 내지 25%, 20% 내지 50%, 20% 내지 60%, 20% 내지 70%, 20% 내지 80%, 20% 내지 90%, 20% 내지 95%, 20% 내지 100%, 50% 내지 60%, 50% 내지 70%, 50% 내지 80%, 50% 내지 90%, 50% 내지 95%, 50% 내지 100%, 70% 내지 80%, 70% 내지 90%, 70% 내지 95%, 70% 내지 100%, 80% 내지 90%, 80% 내지 95%, 80% 내지 100%, 90% 내지 95%, 90% 내지 100%, 및 95% 내지 100%)를 함유할 수 있다.
일부 실시형태에서, 폴리뉴클레오타이드는, 변형된 피리미딘(예를 들면, 변형된 우라실/우리딘/U 또는 변형된 사이토신/사이티딘/C)을 포함한다. 일부 실시형태에서, 폴리뉴클레오타이드 분자내 우라실 또는 우리딘(일반적으로: U)은 약 1% 내지 약 100%의 변형된 우라실 또는 변형된 우리딘(예를 들면, 1% 내지 20%, 1% 내지 25%, 1% 내지 50%, 1% 내지 60%, 1% 내지 70%, 1% 내지 80%, 1% 내지 90%, 1% 내지 95%, 10% 내지 20%, 10% 내지 25%, 10% 내지 50%, 10% 내지 60%, 10% 내지 70%, 10% 내지 80%, 10% 내지 90%, 10% 내지 95%, 10% 내지 100%, 20% 내지 25%, 20% 내지 50%, 20% 내지 60%, 20% 내지 70%, 20% 내지 80%, 20% 내지 90%, 20% 내지 95%, 20% 내지 100%, 50% 내지 60%, 50% 내지 70%, 50% 내지 80%, 50% 내지 90%, 50% 내지 95%, 50% 내지 100%, 70% 내지 80%, 70% 내지 90%, 70% 내지 95%, 70% 내지 100%, 80% 내지 90%, 80% 내지 95%, 80% 내지 100%, 90% 내지 95%, 90% 내지 100%, 및 95% 내지 100%의 변형된 우라실 또는 변형된 우리딘)으로 대체될 수 있다. 변형된 우라실 또는 우리딘은 단일의 유일한 구조를 갖는 화합물에 의해 또는 상이한 구조들(예를 들면, 본원에 기술된 바와 같은 2, 3, 4 이상의 유일한 구조들)을 갖는 다수의 화합물들에 의해 대체될 수 있다. 일부 실시형태에서, 폴리뉴클레오타이드 분자내 사이토신 또는 사이티딘(일반적으로: C)는 약 1% 내지 약 100%의 변형된 사이토신 또는 변형된 사이티딘(예를 들면, 1% 내지 20%, 1% 내지 25%, 1% 내지 50%, 1% 내지 60%, 1% 내지 70%, 1% 내지 80%, 1% 내지 90%, 1% 내지 95%, 10% 내지 20%, 10% 내지 25%, 10% 내지 50%, 10% 내지 60%, 10% 내지 70%, 10% 내지 80%, 10% 내지 90%, 10% 내지 95%, 10% 내지 100%, 20% 내지 25%, 20% 내지 50%, 20% 내지 60%, 20% 내지 70%, 20% 내지 80%, 20% 내지 90%, 20% 내지 95%, 20% 내지 100%, 50% 내지 60%, 50% 내지 70%, 50% 내지 80%, 50% 내지 90%, 50% 내지 95%, 50% 내지 100%, 70% 내지 80%, 70% 내지 90%, 70% 내지 95%, 70% 내지 100%, 80% 내지 90%, 80% 내지 95%, 80% 내지 100%, 90% 내지 95%, 90% 내지 100%, 및 95% 내지 100%의 변형된 사이토신 또는 변형된 사이티딘)에 의해 대체될 수 있다. 변형된 사이토신 또는 사이티딘은 하나의 유일한 구조를 갖는 화합물 또는 상이한 구조들(예를 들면, 본원에 기술된 바와 같은 2, 3, 4 이상의 구조들)을 갖는 다수의 화합물들에 의해 대체될 수 있다.
일부 실시형태에서, 본 개시는 하기 화학식 (Ia-1)를 갖는 n개의 연결된 뉴클레오사이드들을 포함하는 폴리뉴클레오타이드(예를 들면, 제1 영역, 제1 플랭킹 영역, 또는 제2 플랭킹 영역)를 합성하는 방법들을 제공하며::
[화학식 Ia-1]
당해 방법들은:
a) 화학식 (IV-1)의 뉴클레오타이드:
[화학식 IV-1]
를 화학식 (V-1)의 포스포르아미디트 화합물:
[화학식 V-1]
[여기서, Y9는 H, 하이드록시, 포스포릴, 피로포스페이트, 설페이트, 아미노, 티올, 임의로 치환된 아미노산, 또는 펩타이드(예를 들면, 2 내지 12개의 아미노산들 포함)이며; 각각의 P1, P2, 및 P3은, 독립적으로, 적합한 보호 그룹이고; 는 고체 지지체이다]의 포스포르아미디트 화합물과 반응시켜 화학식 (VI-1):
[화학식 VI-1]
의 폴리뉴클레오타이드를 제공하는 단계, 및
b) 화학식 (V)의 폴리뉴클레오타이드를 산화시키거나 황화시켜 화학식 (VII-1):
[화학식 VII-1]
의 폴리뉴클레오타이드를 수득하는 단계, 및
c) 보호 그룹들을 제거하여 화학식 (Ia)의 폴리뉴클레오타이드를 수득하는 단계를 포함한다.
일부 실시형태에서, 단계 a) 및 b)는 1 내지 약 10,000회 반복된다. 일부 실시형태에서, 당해 방법은 A, C, G 및 U 아데노신, 사이토신, 구아노신, 및 우라실로 이루어진 그룹으로부터 선택되는 뉴클레오타이드를 추가로 포함한다. 일부 실시형태에서, 핵염기는 피리미딘 또는 이의 유도체일 수 있다. 일부 실시형태에서, 폴리뉴클레오타이드는 번역가능하다.
폴리뉴클레오타이드들의 다른 성분들은 임의적이며 일부 실시형태에서 유리하다. 예를 들면, 5' 번역되지 않은 영역(UTR) 및/또는 3'UTR이 제공되며, 여기서, 각각의 영역 또는 둘 다는 하나 이상의 상이한 뉴클레오타이드 변형들을 독립적으로 함유할 수 있다. 이러한 실시형태에서, 뉴클레오타이드 변형들은 또한 번역가능한 영역 내에 존재할 수 있다. 또한, 코작 서열을 함유하는 폴리뉴클레오타이드들이 제공된다.
뉴클레오타이드들의 조합들
변형된 뉴클레오타이드들 및 변형된 뉴클레오타이드 조합들의 추가의 예들이 하기 표 2에 제공된다. 이들 변형된 뉴클레오타이드들의 변형들을 사용하여 본 발명의 폴리뉴클레오타이드를 형성할 수 있다. 달리 나타내지 않는 한, 변형된 뉴클레오타이드들은 본 발명의 폴리뉴클레오타이드의 천연 뉴클레오타이드들에 대해 완전히 치환될 수 있다. 비-제한적인 예로서, 천연의 뉴클레오타이드 우리딘은 본원에 기술된 변형된 뉴클레오사이드로 치환될 수 있다. 다른 비-제한적인 예에서, 천연의 뉴클레오타이드 우리딘은 본원에 기재된 변형된 뉴클레오사이드 중 적어도 하나와 부분적으로 치환될 수 있다(예를 들면, 약 0.1%, 1%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% 또는 99.9%).
특정의 변형된 뉴클레오타이드들 및 뉴클레오타이드 조합들이 본 발명자들에 의해 실험되어 왔다. 이들 발견들은 가공된 핵산들 및 이의 사용 방법들이라는 명칭으로 2010년 10월 1일자로 출원된 미국 가특허원 제61/404,413호, 변형된 뉴클레오타이드들, 및 핵산들, 및 이의 용도들이라는 명칭으로 2011년 10월 3일자로 출원되어 현재 포기된 미국 특허원 제13/251,840호, 변형된 뉴클레오타이드들, 및 핵산들, 및 이들의 용도들이라는 명칭으로 2012년 5월 25일자로 출원된 미국 특허원 제13/481,127호, 변형된 뉴클레오사이드들, 뉴클레오타이드들, 및 핵산들, 및 이의 용도들이라는 명칭으로 2011년 10월 3일자로 출원된 국제 특허 공보 제WO2012045075호, 가공된 핵산들 및 이의 사용 방법이라는 명칭으로 2011년 10월 3일자로 출원된 미국 특허공보 제US20120237975호, 및 국제 특허 공보 제WO2012045082호에 기술되어 있으며, 이들은, 이들의 전문이 참조로 혼입되어 있다.
변형된 뉴클레오타이드 조합들의 추가의 예들은 하기 표 3에 제공된다. 변형된 뉴클레오타이드들의 이들 조합들을 사용하여 본 발명의 폴리뉴클레오타이드를 형성할 수 있다.
일부 실시형태에서, 사이토신들 중의 적어도 25%는 화학식 (b10) 내지 (b14), (b24), (b25), 또는(b32) 내지 (b35)의 화합물[예를 들면, 적어도 약 30%, 적어도 약 35%, 적어도 약 40%, 적어도 약 45%, 적어도 약 50%, 적어도 약 55%, 적어도 약 60%, 적어도 약 65%, 적어도 약 70%, 적어도 약 75%, 적어도 약 80%, 적어도 약 85%, 적어도 약 90%, 적어도 약 95%, 또는 약 100%의, 예를 들면, 화학식 (b10) 또는 (b32)의 화합물]로 대체된다.
일부 실시형태에서, 우라실들 중의 적어도 25%는 화학식 b1 내지 화학식 b9, 화학식 b21 내지 화학식 b23, 또는 화학식 b28 내지 화학식 b31의 화합물[예를 들면, 적어도 약 30%, 적어도 약 35%, 적어도 약 40%, 적어도 약 45%, 적어도 약 50%, 적어도 약 55%, 적어도 약 60%, 적어도 약 65%, 적어도 약 70%, 적어도 약 75%, 적어도 약 80%, 적어도 약 85%, 적어도 약 90%, 적어도 약 95%, 또는 약 100%의, 예를 들면, 화학식 (b1), (b8), (b28), (b29), 또는 (b30)의 화합물]로 대체된다.
일부 실시형태에서, 사이토신들 중의 적어도 25%는 화학식 (b10) 내지 (b14), (b24), (b25), 또는 (b32) 내지 (b35)의 화합물[예를 들면, 화학식 (b10) 또는 (b32)의 화합물]로 대체되고, 우라실들 중의 적어도 25%는 화학식 b1 내지 화학식 b9, 화학식 b21 내지 화학식 b23, 또는 화학식 b28 내지 화학식 b31의 화합물[예를 들면, 화학식 (b1), (b8), (b28), (b29), 또는 (b30)의 화합물](예를 들면, 적어도 약 30%, 적어도 약 35%, 적어도 약 40%, 적어도 약 45%, 적어도 약 50%, 적어도 약 55%, 적어도 약 60%, 적어도 약 65%, 적어도 약 70%, 적어도 약 75%, 적어도 약 80%, 적어도 약 85%, 적어도 약 90%, 적어도 약 95%, 또는 약 100%)로 대체된다.
링커 및 페이로드(페이로드)를 포함하는 변형들
뉴클레오타이드의 핵염기는 어떠한 화학적으로 적절한 위치에서 페이로드, 예를 들면, 검출가능한 제제 또는 치료제에 공유결합적으로 연결될 수 있다. 예를 들면, 핵염기는 데아자-아데노신 또는 데아자-구아노신일 수 있으며 링커는 데아자-아데노신 또는 데아자-구아노신의 C-7 또는 C-8 위치들에 부착될 수 있다. 다른 실시형태에서, 핵염기는 사이토신 또는 우라실일 수 있으며 링커는 사이토신 또는 우라실의 N-3 또는 C-5 위치들에 부착될 수 있다. 하기 반응식 1은 예시적인 변형된 뉴클레오타이드를 묘사하며, 여기서, 핵염기, 아데닌은 7-데아자 아데닌의 C-7 탄소에서 링커에 부착된다. 또한, 반응식 1은 mRNA의 3' 말단 위에 혼입된 링커와 페이로드, 예를 들면, 검출가능한 제제를 지닌 변형된 뉴클레오타이드를 나타낸다. 이황화물 절단 및 프로파르길 에스테르 상으로 티올 그룹의 1,2-첨가는 검출가능한 제제를 방출한다. 나머지 구조(예를 들면, 반응식 1에서 pApC5Parg로 나타냄)는 억제제이다. 변형된 뉴클레오타이드들의 구조에 대한 해석은, 테써드(tethered) 억제제가, 제2 염기를 혼입시키는 폴리머라제의 능력을 입체적으로 방해한다는 것이다. 따라서, 테써(tether)가 이러한 기능에 영향을 미치도록 충분히 길어야 하고 억제제가 성장하는 폴리뉴클레오타이드 쇄내로 제2의 및 후속하는 뉴클레오타이드들을 억제하거나 금지하는 입체화학적 배향으로 존재하는 것이 중요하다.
[반응식 1]
링커
본원에 사용된 것으로서 용어 "링커"는 원자들, 예를 들며, 10 내지 1,000개의 원자들의 그룹을 말하며, 탄소, 아미노, 알킬아미노, 산소, 황, 설폭사이드, 설포닐, 카보닐, 및 이민과 같은, 그러나 이에 한정되지 않는 원자들 또는 그룹들로 구성될 수 있다. 링커는 제1 말단에서 핵염기 또는 당 모이어티 위의 변형된 뉴클레오사이드 또는 뉴클레오타이드에, 및 제2 말단에서 페이로드, 예를 들면, 검출가능한 제제 또는 치료제에 부착될 수 있다. 링커는 핵산 서열내로의 혼입을 방해하지 않을 정도의 충분한 길이이다.
링커내로 혼입될 수 있는 화학 그룹들의 예들은 알킬, 알켄, 알킨, 아미도, 에테르, 티오에테르, 또는 에스테르 그룹을 포함하나, 이에 한정되지 않는다. 링커 쇄는 또한 폴리사이클릭 및 헤테로방향족 환들을 포함하는 포화되거나, 불포화되거나, 또는 방향족인 환의 일부를 포함할 수 있으며, 여기서, 헤테로방향족 환은 1 내지 4개의 헤테로원자들, N, O 또는 S를 함유하는 아릴 그룹이다. 링커들의 구체적인 예들은 불포화된 알칸들, 폴리에틸렌 글리콜들, 및 덱스트란 중합체들을 포함하나, 이에 한정되지 않는다.
예를 들면, 링커는 에틸렌 또는 프로필렌 글리콜 단량체 단위들, 예를 들면, 디에틸렌 글리콜, 디프로필렌 글리콜, 트리에틸렌 글리콜, 트리프로필렌 글리콜, 테트라에틸렌 글리콜, 또는 테트라에틸렌 글리콜을 포함할 수 있다. 일부 실시형태에서, 링커는 2가 알킬, 알케닐, 및/또는 알키닐 잔기를 포함할 수 있다. 링커는 에스테르, 아미드, 또는 에테르 잔기를 포함할 수 있다.
다른 예들은 링커내에 절단가능한 잔기들, 예를 들면, 이황화물 결합(-S-S-) 또는 아조 결합(-N=N-)을 포함하며, 이는 환원제 또는 광분해를 사용하여 절단시킬 수 있다. 링커내로 혼입되고 변형된 뉴클레오타이드에 부착된 절단가능한 결합은, 절단 시, 뉴클레오타이드 상에 예를 들면, 짧은 "스카(scar)" 또는 화학적 변형을 생성한다. 예를 들면, 절단 후, 변형된 뉴클레오타이드의 일부를 형성하고, 폴리뉴클레오타이드 쇄내로 혼입된, 뉴클레오타이드 염기 상에 수득되는 스카는 비반응성이며 화학적으로 중화시킬 필요가 없다. 이는, 후속적인 뉴클레오타이드가 핵산 중합체 주형의 서열분석 동안 혼입될 수 있는 용이성을 증가시킨다. 예를 들면, 조건들은 트리스(2-카복시에틸)포스핀(TCEP), 디티오트레이톨(DTT) 및/또는 이황화물 결합의 절단을 위한 다른 환원제들의 사용을 포함한다. 아미도 결합을 포함하는 선택적으로 절단가능한 결합은 예를 들면, TCEP 또는 다른 환원제들을 사용하고/하거나 광분해에 의해 절단시킬 수 있다. 에스테르 결합을 포함하는 선택적으로 절단가능한 결합은 예를 들면, 산성 또는 염기성 가수분해에 의해 절단시킬 수 있다.
페이로드
본원에 기술된 방법들 및 조성물들은 페이로드를 생물학적 표적에 전달하는데 유용하다. 페이로드는 예를 들면, 표지화(예를 들면, 검출가능한 제제, 예를 들면, 플루오로포어), 또는 치료학적 목적들(예를 들면, 세포독소 및 다른 치료제)을 위해 사용할 수 있다.
페이로드: 치료제들
일부 실시형태에서 페이로드는 세포독소, 방사활성 이온, 화학치료제, 또는 다른 치료제와 같은 치료제이다. 세포독소 또는 세포독성제는 세포들에 유해한 어떠한 제제도 포함한다. 예들은 탁솔, 사이토칼라신 B, 그라미시딘 D, 에티디움 브로마이드, 에메틴, 미토마이신, 에토포시드, 테노포시드, 빈크리스틴, 빈블리스틴, 콜치신, 독소루비신, 다우노루비신, 디하이드록시 안트라신 디온, 미톡산트론, 미트라마이신, 악티노마이신 D, 1-데하이드로테스토스테론, 글루코코르티코이드들, 프로카인, 테트라카인, 리도카인, 프로프로놀롤, 푸로마이신, 마이탄시노이드들, 예를 들면, 마이탄시놀(참조: 미국 특허 제5,208,020호), CC-1065(참조: 미국 특허 제5,475,092호, 제5,585,499호, 제5,846,545호) 및 이의 유사체들 또는 동족체들을 포함한다. 방사활성 이온들은 요오드(예를 들면, 요오드 125 또는 요오드 131), 스트론튬 89, 인, 팔라듐, 세슘, 이리듐, 포스페이트, 코발트, 이트륨 90, 사마륨 153 및 프라세오듐을 포함하나, 이에 한정되지 않는다. 다른 치료제들은 항대사제들(예를 들면, 메토트렉세이트, 6-머캅토퓨린, 6-티오구아닌, 사이타라빈, 5-플루오로우라실 데카르바진), 알킬화제들(예를 들면, 메클로르에타민, 티오에파 클로람부실, CC-1065, 멜팔란, 카르무스틴(BSNU) 및 로무스틴(CCNU), 사이클로포스파미드, 부설판, 디브로모만니톨, 스트렙토조토신, 미토마이신 C, 및 시스-디클로로디아민 플라티늄(II)(DDP) 시스플라틴), 안트라사이클린들(예를 들면, 다우노루비신(이전에는 다우노마이신) 및 독소루비신), 항생제들(예를 들면, 닥티노마이신(이전에는 악티노마이신), 블레오마이신, 미트라마이신, 및 안트라마이신(AMC)), 및 항-유사분열제들(예를 들면, 빈크리스틴, 빈블라스틴, 탁솔 및 마이탄시노이드들)을 포함한다.
페이로드: 검출가능한 제제들
검출가능한 물질들의 예들은 각종 유기 소 분자들, 무기 화합물들, 나노입자들, 효소들 또는 효소 기질들, 형광 물질들, 발광 물질들, 생물발광성 무질들,, 화학발광성 물질들, 방사활성 물질들, 및 조영제들을 포함한다. 이러한 광학적으로 검출가능한 표지들은 예를 들면, 4-아세트아미도-4'-이소티오시아네이토스틸벤-2,2'디설폰산; 아크리딘 및 유도체들: 아크리딘, 아크리딘 이소티오시아네이트; 5-(2'-아미노에틸)아미노나프탈렌-1-설폰산(EDANS); 4-아미노-N-[3-비닐설포닐)페닐]나프탈이미드-3,5 디설포네이트; N-(4-아닐리노-1-나프틸)말레이미드; 안트라닐아미드; BODIPY; 브릴리언트 옐로우(Brilliant Yellow); 코우마린 및 유도체들, 코우마린, 7-아미노-4-메틸코우마린(AMC, 코우마린 120), 7-아미노-4-트리플루오로메틸코울루아린(코우마린 151); 시아닌 염료들; 시아노신; 4',6-디아미니디노-2-페닐인돌(DAPI); 5'5"-디브로모피로갈롤-설포나프탈레인(브로모피로갈롤 레드); 7-디에틸아미노-3-(4'-이소티오시아네이토페닐)-4-메틸코우마린; 디에틸렌트리아민 펜타아세테이트; 4,4'-디이소티오시아네이토디하이드로-스틸벤-2,2'-디설폰산; 4,4'-디이소티오시아네이토스틸벤-2,2'-디설폰산; 5-[디메틸아미노]-나프탈렌-1-설포닐 클로라이드(DNS, 단실클로라이드); 4-디메틸아미노페닐아조페닐-4'-이소티오시아네이트(DABITC); 에오신 및 유도체들; 에오신, 에오신 이소티오시아네이트, 에리트로신 및 유도체들; 에리트로신 B, 에리트로신, 이소티오시아네이트; 에티디움; 플루오레세인 및 유도체들; 5-카복시플루오레세인(FAM), 5-(4,6-디클로로트리아진-2-일)아미노플루오레세인(DTAF), 2',7'-디메톡시-4'5'-디클로로-6-카복시플루오레세인, 플루오레세인, 플루오레세인 이소티오시아네이트, QFITC, (XRITC); 플루오레스카민; IR144; IR1446; 말라키트 그린(Malachite Green) 이소티오시아네이트; 4-메틸움벨리페론오르토 크레솔프탈레인; 니트로타이로신; 파라로사닐린; 페놀 레드; B-피코에리트린; o-프탈디알데하이드; 피렌 및 유도체들: 피렌, 피렌 부티레이트, 석신이미딜 1-피렌; 부티레이트 콴텀 도트들(butyrate quantμM dots); 반응성 레드(Reactive Red) 4(CibacronTM 브릴리언트 레드(Brilliant Red) 3B-A) 로다민 및 유도체들: 6-카복시-X-로다민(ROX), 6-카복시로다민(R6G), 리쓰아민 로다민 B 설포닐 클로라이드 로다르닌(Rhod), 로다민 B, 로다민 123, 로다민 X 이소티오시아네이트, 설포로다민 B, 설포로다민 101, 설포로다민 101의 설포닐 클로라이드 유도체[텍사스 레드(Texas Red)]; N,N,N',N'테트라메틸-6-카복시로다민(TAMRA); 테트라메틸 로다민; 테트라메틸 로다민 이소티오시아네이트(TRITC); 리보플라빈; 로솔산; 테르븀 킬레이트 유도체들; 시아닌-3(Cy3); 시아닌-5(Cy5); 시아닌-5.5(Cy5.5), 시아닌-7(Cy7); IRD 700; IRD 800; 알렉사(Alexa) 647; 라 졸타 블루(La Jolta Blue); 프탈로시아닌; 및 나프탈로시아닌을 포함하나, 이에 한정되지 않는다. 일부 실시형태에서, 검출가능한 표지는 형광성 염료, 예를 들면, Cy5 및 Cy3이다.
발광성 물질의 예들은 루미놀을 포함하며; 생물발광성 물질들의 예들은 루시퍼라제, 루시페린, 및 에쿠오린을 포함한다.
적합한 방사활성 물질의 예들은 18F, 67Ga, 81mKr, 82Rb, 111In, 123I, 133Xe, 201Tl, 125I, 35S, 14C, 또는 3H, 99mTc(예를 들면, 직접 또는 간접적으로 페르테크네테이트(테크네테이트(VII), TcO4 -)로서, 또는 방사선방출(radioemission)의 직접적인 계수에 의해 또는 신틸레이션 카운팅(scintillation counting)에 의해 검출가능한 다른 방사선동위원소를 포함한다.
또한, 조영제들, 예를 들면, MRI 또는 NMR용, X-선 CT, 라만 영상(Raman imaging), 광간섭단층촬영장치, 흡수 영상, 초음파 영상, 또는 열 영상용 조영제를 사용할 수 있다. 예시적인 조영제들은 금(예를 들면, 금 나노입자들), 가돌리늄(예를 들면, 킬레이트된 Gd), 철 산화물들(예를 들면, 초상자성 산화철(SP1O), 단일결정성 산화철 나노입자들(MIONs), 및 미세 초상자성 산화철(USP1O)), 망간 킬레이트제(예를 들면, Mn-DPDP), 황산바륨, 요오드처리된 조영 매질(이오헥솔), 미세버블들(microbubbles), 또는 퍼플루오로탄소들을 또한 사용할 수 있다.
일부 실시형태에서, 검출가능한 제제는 활성화시 검출가능하게 되는 비-검출가능한 전구체이다. 예들은 형광원 테트라진-형광단 구조물들(예를 들면, 테트라진-BODIPY FL, 테트라진-오레곤 그린(테트라zine-Oregon Green) 488, 또는 테트라진-BODIPY TMR-X) 또는 효소 활성화가능한 형광성 제제들[예를 들면, PROSENSE(제조원: 비스엔 메디칼(VisEn Medical))]을 포함한다.
화합물들이 예를 들면, 서양고추냉이 퍼옥시다제, 알칼린 포스파타제, 또는 루시페라제로 효소적으로 표지되는 경우, 효소 표지는 적절한 기질의, 생성물로의 전환을 측정하여 검출한다.
이들 조성물들이 사용될 수 있는 시험관내 검정들은 효소 연결된 면역흡착 검정들(ELISAs), 면역침전들, 면역형광성, 효소 면역검정(EIA), 방사면역검정(RIA), 및 웨스턴 블롯 분석(Western b로트 analysis)을 포함한다.
본원에 기술된 것들 이외의 표지들, 예를 들면, 다른 광학적으로-검출가능한 표지들이 본 개시에 의해 고려된다. 표지들은 본 개시의 변형된 뉴클레오타이드에 어떠한 위치에서도 표준 화학들을 사용하여 부착시킴으로써 표지가 절단가능한 링커의 절단 시 혼입된 염기로부터 제거될 수 있도록 할 수 있다.
페이로드: 세포 침투성 페이로드들
일부 실시형태에서, 변형된 뉴클레오타이드들 및 변형된 핵산들은 또한 조성물들의 세포내 전달을 향상시키는 세포 침투성 잔기 또는 제제를 포함할 수 있다. 예를 들면, 조성물들은 세포내 공간으로의 전달을 촉진시키는 세포-침투성 펩타이드 서열, 예를 들면, HIV-기원한 TAT 펩타이드, 페너트라틴들, 트랜스포르탄들, 또는 hCT 기원한 세포-침투성 펩타이드들을 포함할 수 있다[참조: 예를 들면, Caron et al., (2001) Mol Ther. 3(3):310-8; Lan겔, Cell-Penetrating Peptides: Processes and Applications(CRC Press, Boca Raton FL 2002); El-Andaloussi et al., (2005) Curr Pharm Des. 11(28):3597-611; 및 Deshayes et al., (2005) Cell Mol Life Sci. 62(16):1839-49]. 당해 조성물들은 또한 세포 침투제, 예를 들면, 세포간 공간으로 조성물들의 전달을 향상시키는 리포좀들을 포함하도록 제형화될 수 있다.
페이로드
: 생물학적 표적들
본원에 기술된 변형된 뉴클레오타이드들 및 변형된 핵산들을 사용하여 페이로드를 특이적인 리간드가 존재하거나 생성될 수 있는 어떠한 생물학적 표적으로도 전달할 수 있다. 리간드는 생물학적 표적에 공유결합적으로 또는 비-공유결합적으로 결합할 수 있다.
예시적인 생물학적 표적들은 생물중합체들, 예를 들면, 항체들, RNA 및 DNA와 같은 핵산들, 단백질들, 효소들을 포함하며; 예시적인 단백질들은 효소들, 수용체들, 및 이온 채널들(ion channels)을 포함한다. 일부 실시형태에서 표적은 조직- 또는 세포-유형 특이적인 마커, 예를 들면, 선택된 조직 또는 세포 유형에서 특이적으로 발현되는 단백질이다. 일부 실시형태에서, 표적은 수용체, 예를 들면, 혈장막 수용체들 및 핵 수용체들이나, 이에 한정되지 않으며; 보다 구체적인 예들은 G-단백질-커플링된 수용체들, 세포 공극 단백질들, 트랜스포터 단백질들(transporter 단백질들), 표면-발현된 항체들, HLA 단백질들, MHC 단백질들 및 성장 인자 수용체들을 포함한다.
변형된 뉴클레오타이드들의 합성
본원에 기재된 변형된 뉴클레오사이드들 및 뉴클레오타이드들은 다음의 일반적인 방법들 및 과정들을 사용하여 용이하게 이용가능한 출발 물질들로부터 제조할 수 있다. 대표적이고 바람직한 공정 조건들(즉, 반응 온도들, 시간들, 반응제들의 몰 비들, 용매들, 압력들 등)이 제공된 경우; 달리 기술하지 않는 한 다른 공정 조건들 또한 사용될 수 있음이 이해된다. 최적의 반응 조건들은 사용된 특수한 반응물들 또는 용매를 사용하여 변경시킬 수 있으나, 이러한 조건들은 정규의 최적화 과정들에 의해 당해 분야의 숙련가에 의해 결정될 수 있다.
본원에 기술된 과정들은 당해 분야에 공지된 어떠한 적합한 방법에 따라서도 모니터링될 수 있다. 예를 들면, 생성물 형성은 분광분석 수단, 예를 들면, 핵 자기 공명 분광분석법(예를 들면, 1H 또는 13C) 적외선 분광분석법, 분광광도법(예를 들면, UV-가시광), 또는 질량분광법에 의해, 또는 크로마토그래피, 예를 들면, 고 성능 액체 크로마토그래피(HPLC) 또는 박층 크로마토그래피에 의해 모니터링할 수 있다.
변형된 뉴클레오사이드들 및 뉴클레오타이드들의 제조는 각종 화학 그룹들의 보호 및 탈보호를 포함할 수 있다. 적절한 보호 그룹들의 보호 및 탈보호, 및 선택에 대한 필요성은 당해 분야의 숙련가에 의해 용이하게 결정될 수 있다. 보호 그룹들의 화학은 예를 들면, 이의 전문이 참조로 본원에 혼입된 문헌(참조: Greene, et al., Protective Groups in Organic Synthesis, 2d. Ed., Wiley & Sons, 1991)에서 찾을 수 있다.
본원에 기술된 공정들의 반응들은 유기 합성 분야에서의 기술자에 의해 용이하게 선택될 수 있는 적합한 용매들 속에서 수행할 수 있다. 적합한 용매들은 출발 물질들(반응물들), 중간체들, 또는 생성물들과, 반응들이 수행되는 온도들, 즉, 용매의 동결 온도 내지 용매의 비등 온도 범위일 수 있는 온도들에서 실질적으로 비반응성일 수 있다. 제공된 반응은 하나의 용매 또는 하나 이상의 용매의 혼합물 속에서 수행할 수 있다. 특수한 반응 단계에 따라, 특수한 반응 단계용으로 적합한 용매들을 선택할 수 있다.
변형된 뉴클레오사이드들 및 뉴클레오타이드들의 분해는 당해 분야에 공지된 다수의 방법들 중 임의의 것에 의해서도 수행될 수 있다. 예시적인 방법은 광학적으로 활성인, 염-형성 유기 산인 "키랄 분해성 산"을 사용하는 분별 재결정을 포함한다. 분별 재결정 방법들용으로 적합한 분해제들은, 예를 들면, 광학적으로 활성인 산들, 예를 들면, 타르타르산, 디아세틸타르타르산, 디벤조일타르타르산, 만델산, 말산, 락트산 또는 각종의 광학적으로 활성인 캄포르설폰산들의 D 및 L 형태들이다. 라세믹 혼합물들의 분해는 광학적으로 활성인 분해제(예를 들면, 디니트로벤조일페닐글리신)이 채워진 컬럼 상에서의 용출에 의해 또한 수행될 수 있다. 적합한 용출 용매 조성물은 당해 분야의 기술자에 의해 결정될 수 있다.
폴리뉴클레오타이드들, 예를 들면, RNA 또는 mRNA내로 혼입되는, 변형된 뉴클레오타이드들의 예시적인 합성들은 하기 반응식 2 내지 반응식 12에 제공된다. 반응식 2는, 변형된 뉴클레오사이드들을 포함하는, 뉴클레오사이드들의 포스포릴화를 위한 일반적인 방법을 제공한다.
[반응식 2]
각종 보호 그룹들을 사용하여 반응을 조절할 수 있다. 예를 들면, 반응식 3은 2' 및 3' 하이드록실 그룹들보다는 오히려, 당의 5' 위치에서 포스포릴화를 촉진함하기 위한 다수의 보호 및 탈보호 단계들의 사용을 제공한다.
[반응식 3]
변형된 뉴클레오타이드들은 어떠한 유용한 방식으로도 합성할 수 있다. 반응식들 4, 5, 및 8은 변형된 퓨린 핵염기를 갖는 변형된 뉴클레오타이드들을 합성하는 예시적인 방법을 제공하며; 반응식들 6 및 7은 변형된 슈도우리딘 또는 슈도이소사이티딘을 갖는 변형된 뉴클레오타이드들 각각을 합성하는 예시적인 방법들을 제공한다.
[반응식 4]
[반응식 5]
[반응식 6]
[반응식 7]
[반응식 8]
반응식들 9 및 10은 변형된 뉴클레오타이드들의 예시적인 합성을 제공한다. 반응식 11은 뉴클레오타이드들을 생산하기 위한 비-제한적인 생물촉매 방법을 제공한다.
[반응식 9]
[반응식 10]
[반응식 11]
반응식 12는, 변형된 우라실의 예시적인 합성을 제공하며, 여기서, 주요 그루브 페이스 위에서 N1 위치는 어느 곳에 제공된 것으로서 R12b로 변형되고, 리보스의 5'-위치는 포스포릴화된다. T1, T2, R12a, R12b, 및 r은 본원에 제공된 바와 같다. 당해 합성, 및 또한 이의 최적화된 버젼들을 사용하여 피리미딘 핵염기들 및 퓨린 핵염기들의 주요 그루브 페이스를 변형[참조: 예를 들면, 화학식들 (b1) 내지 (b43)]시키고/시키거나 하나 이상의 포스페이트 그룹들을 설치할 수 있다(예를 들면, 당의 5' 위치에서). 이러한 알킬화 반응을 또한 사용하여 본원에 기술된 어떠한 핵염기내 어떠한 반응성 그룹(예: 아미노 그룹)[예를 들면, 사이토신, 우라실, 아데닌, 및 구아닌에 대한 왓슨-클락 염기-쌍 형성 페이스(Watson-Crick base-pai환 face)] 내에서 하나 이상의 임의로 치환된 알킬 그룹을 포함할 수 있다
[반응식 12]
변형된 뉴클레오사이드들 및 뉴클레오타이드들은, 또한 각각 이들의 전문이 참조로 혼입된 문헌[참조: Ogata et al. Journal of Organic Chemistry 74:2585-2588, 2009; Purmal et al. Nucleic Acids Research 22(1): 72-78, 1994; Fukuhara et al. Biochemistry 1(4): 563-568, 1962; 및 Xu et al. 테트라hedron 48(9): 1729-1740, 1992]에 기술된 합성 방법들에 따라 제조할 수 있다.
변형된 핵산들
본 개시는 본원에 기술된 바와 같은 하나 이상의 변형된 뉴클레오사이드들("변형된 핵산들"로 명명됨) 또는 뉴클레오타이드들을 함유하는 mRNA와 같은 RNA들을 포함하는 핵산들(또는 폴리뉴클레오타이드들)을 제공하며, 이들은, mRNA가 도입되는 세포의 선천적 면역 반응의 실질적인 유도의 결여를 포함하는 유용한 특성들을 갖는다. 이들 변형된 핵산들은 단백질 생산 효율, 핵산들의 세포내 보유, 및 접촉한 세포들의 생존능을 향상시키고, 감소된 면역원성을 지니므로, 이들 특성들을 가진 이들 핵산들은 또한 본원에서 "향상된 핵산들"로 명명된다.
또한, 본 개시는 주요 그루브 상호작용, 예를 들면, 결합하는 파트너에 대한 결합 친화성이 감소된, 핵산들을 제공한다. 예를 들면, 핵산들은 본원에 기술된 바와 같은 주요 그루브 페이스 위에서 화학적으로 변형된 적어도 하나의 뉴클레오타이드로 이루어진다.
용어 "핵산"은, 이의 광의적인 의미에서, 올리고뉴클레오타이드 쇄이거나 당해 쇄내로 혼입될 수 있는 어떠한 화합물 및/또는 물질도 포함한다. 이와 관련하여, 용어 핵산은 폴리뉴클레오타이드와 동의어로 사용된다. 본 개시에 따라 사용하기 위한 예시적인 핵산들은 본원에 상세히 기술된 바와 같은, DNA, 전령 mRNA(mRNA)를 포함하는 RNA, 이의 하이브리드들, RNAi-유도제들, RNAi 제제들, siRNA들, shRNA들, miRNA들, 안티센스 RNA들, 리보자임들, 촉매적 DNA, 삼중 나선 형성을 유도하는 RNA들, 압타머들(aptamers), 벡터들 등을 포함하나, 이에 한정되지 않는다.
번역가능한 영역 및 1개, 2개, 또는 2개 이상의 상이한 뉴클레오사이드 변형들을 함유하는 변형된 핵산들이 제공된다. 일부 실시형태에서, 변형된 핵산은, 핵산이 도입되는 세포내에서, 상응하는 변형되지 않은 핵산과 비교하여 감소된 분해를 나타낸다. 예시적인 핵산들은 리보핵산들(RNAs), 데옥시리보핵산들(DNAs), 트레오스 핵산들(TNAs), 글리콜 핵산들(GNAs), 또는 이의 하이브리드를 포함한다. 바람직한 실시형태에서, 변형된 핵산은 전령 RNA들(mRNA들)을 포함한다. 본원에 기술된 바와 같이, 본 개시의 핵산들은, mRNA가 도입되는 세포내에서의 선천적 면역 반응을 실질적으로 유도하지 않는다.
특정 실시형태에서, 예를 들면, 단백질 생산의 정밀한 시기조절이 요구되는 경우, 세포내로 도입된 변형된 핵산을 세포내적으로 분해하는 것이 바람직하다. 따라서, 본 개시는 세포내에서 지시된 방식으로 작용할 수 있는, 분해 도메인을 함유하는 변형된 핵산을 제공한다.
핵산의 다른 성분들은 임의적이며, 일부 실시형태에서 유리하다. 예를 들면, 5' 번역되지 않은 영역(UTR) 및/또는 3' UTR이 제공되며, 여기서, 이들 각각 또는 둘 다는 하나 이상의 상이한 뉴클레오사이드 변형들을 함유할 수 있다. 이러한 실시형태에서, 뉴클레오사이드 변형들은 또한 번역가능한 영역내에 존재할 수 있다. 또한 코작 서열을 함유하는 핵산들이 제공된다.
추가로, 핵산으로부터 제거될 수 있는 하나 이상의 인트론(intronic) 뉴클레오타이드 서열들을 함유하는 핵산들이 제공된다.
추가로, 내부 리보소옴 도입 부위(IRES)를 함유하는 핵산들이 제공된다. IRES는 mRNA의 단독의 리보소옴 결합 부위로서 작용할 수 있거나, mRNA의 다수의 리보소옴 결합 부위들 중 하나로 제공될 수 있다. 하나 이상의 기능성 리보소옴 결합 부위를 함유하는 mRNA는 리보소옴들에 의해 독립적으로 번역되는 수개의 펩타이드들 또는 폴리펩타이드들을 암호화할 수있다["다중시스트론성 (mμLticistronic) mRNA"]. 핵산들이 IRES와 함께 제공되는 경우, 제2의 번역가능한 영역이 또한 임의로 제공된다. 본 개시에 따라 사용될 수 있는 IRES 서열들의 예는 피코르나바이러스들(picornaviruses)(예를 들면, FMDV), 해충 바이러스들(pest viruses)(CFFV), 소아마비 바이러스들(PV), 뇌척수심근염 바이러스들(ECMV), 수족구병 바이러스들(foot-and-mouth 질병 viruses)(FMDV), C형 간염 바이러스들(HCV), 전통적인 돼지 콜레라 바이러스들(swine fever viruses)(CSFV), 쥐 백혈병 바이러스(MLV), 원숭이 면역 결핍성 바이러스들(SIV) 또는 귀뚜라미 마비 바이러스들(CrPV)로부터의 것들을 포함하나, 이에 한정되지 않는다.
다른 양상에서, 본 개시는 적어도 2개의 뉴클레오타이드들을 포함하는 핵산 서열들을 제공하며, 당해 핵산 서열은 주요 그루브 결합 파트너와 핵산 서열의 결합을 방해하는 하나의 뉴클레오타이드를 포함하고, 여기서, 뉴클레오타이드는, 주요 그루브 결합 파트너에 대한 결합 친화성이 감소되어 있다.
일부 실시형태에서, 핵산은 화학식 XI-a의 화합물이다:
[화학식 XI-a]
여기서:
A는 H, OH, 포스포릴, 피로포스페이트, 설페이트, -NH2, -SH, 아미노산, 2 내지 12개의 아미노산들을 포함하는 펩타이드이고;
X는 O 또는 S이며;
각각의 Y1는 -ORa1, -NRa1Rb1, 및 -SRa1 중에서 독립적으로 선택되고;
각각의 Y2 및 Y3은 O, -CRaRb-, NRc, S, 또는 C, O, N 및 S로 이루어진 그룹으로부터 선택되는 하나 이상의 원자들을 포함하는 링커이며;
Ra 및 Rb는 각각 독립적으로 H, C1-12 알킬, C2-12 알케닐, C2-12 알키닐, 또는 C6-20 아릴이고;
Rc는 H, C1-12 알킬, C2-12 알케닐, 페닐, 벤질, 폴리에틸렌 글리콜 그룹, 또는 아미노-폴리에틸렌 글리콜 그룹이며;
Ra1 및 Rb1는 각각 독립적으로 H 또는 반대이온이고;
-ORc1은 약 1의 pH에서 OH이거나 또는 -ORc1는 생리학적 pH에서 O-이며;
B는 핵염기이고;
단 변수들 A, B, D, U, Z, Y2 및 Y3을 포함하는 환은 리보스일 수 없다.
일부 실시형태에서, B는 화학식 XII-a, XII-b, 또는 XII-c의 핵염기이고:
[화학식 XII-a]
[화학식 XII-b]
[화학식 XII-c]
여기서:
X는 O 또는 S이며;
U 및 W는 각각 독립적으로 C 또는 N이고;
V는 O, S, C 또는 N이며;
여기서, V가 C인 경우 R1은 H, C1-6 알킬, C1-6 알케닐, C1-6 알키닐, 할로, 또는 -ORc이고, 여기서, C1-20 알킬, C2-20 알케닐, C2-20 알키닐은 -OH, -NRaRb, -SH, -C(O)Rc, -C(O)ORc, -NHC(O)Rc, 또는 -NHC(O)ORc로 임의로 치환되며;
여기서, V가 O, S, 또는 N인 경우 R1은 부재하고;
R2는 H, -ORc, -SRc, -NRaRb, 또는 할로이거나;
V가 C인 경우 R1 및 R2는 이들이 부착된 탄소 원자들과 함께 할로, -OH, -SH, -NRaRb, C1 -20 알킬, C2 -20 알케닐, C2 -20 알키닐, C1 -20 알콕시, 또는 C1 -20 티오알킬로부터 선택되는 1 내지 4개의 치환체들로 임의로 치환된 5- 또는 6-원 환을 형성할 수 있고;
R3은 H 또는 C1-20 알킬이며;
R4는 H 또는 C1-20 알킬이고; 여기서, 가 이중 결합을 나타내는 경우 R4는 부재하거나, N-R4가 함께, C1 -20 알킬로 치환된 양으로 하전된 N을 형성하고;
Ra 및 Rb 는 각각 독립적으로 H, C1-20 알킬, C2-20 알케닐, C2-20 알키닐, 또는 C6-20 아릴이며;
Rc는 H, C1-20 알킬, C2-20 알케닐, 페닐, 벤질, 폴리에틸렌 글리콜 그룹, 또는 아미노-폴리에틸렌 글리콜 그룹이다.
일부 실시형태에서, B는 화학식 XII-a1, XII-a2, XII-a3, XII-a4, 또는 XII-a5의 핵염기이다:
[화학식 XII-a1]
[화학식 XII-a2]
[화학식 XII-a3]
[화학식 XII-a4]
[화학식 XII-a5]
일부 실시형태에서, 핵염기는 피리미딘 또는 이의 유도체이다.
일부 실시형태에서, 핵산은 화학식 XI-a의 구조적으로 유일한 화합물들 다수를 함유한다.
일부 실시형태에서, 사이토신들 중의 적어도 25%는 화학식 XI-a의 화합물(예를 들면, 적어도 약 30%, 적어도 약 35%, 적어도 약 40%, 적어도 약 45%, 적어도 약 50%, 적어도 약 55%, 적어도 약 60%, 적어도 약 65%, 적어도 약 70%, 적어도 약 75%, 적어도 약 80%, 적어도 약 85%, 적어도 약 90%, 적어도 약 95%, 또는 약 100%)로 대체된다.
일부 실시형태에서, 우라실들 중의 적어도 25%는 화학식 XI-a의 화합물(예를 들면, 적어도 약 30%, 적어도 약 35%, 적어도 약 40%, 적어도 약 45%, 적어도 약 50%, 적어도 약 55%, 적어도 약 60%, 적어도 약 65%, 적어도 약 70%, 적어도 약 75%, 적어도 약 80%, 적어도 약 85%, 적어도 약 90%, 적어도 약 95%, 또는 약 100%)로 대체된다.
일부 실시형태에서, 사이토신들 중의 적어도 25% 및 우라실들 중의 25%는 화학식 XI-a의 화합물(예를 들면, 적어도 약 30%, 적어도 약 35%, 적어도 약 40%, 적어도 약 45%, 적어도 약 50%, 적어도 약 55%, 적어도 약 60%, 적어도 약 65%, 적어도 약 70%, 적어도 약 75%, 적어도 약 80%, 적어도 약 85%, 적어도 약 90%, 적어도 약 95%, 또는 약 100%)로 대체된다.
일부 실시형태에서, 핵산은 번역가능하다.
일부 실시형태에서, 핵산이 예를 들면, 본원에 기술된 바와 같이, 링커 및 페이로드로 변형된 뉴클레오타이드를 포함하는 경우, 링커 및 페이로드로 변형된 뉴클레오타이드는 핵산의 3' 말단 위에 존재한다.
주요 그루브 상호작용 파트너들
본원에 기술된 바와 같은, 어구 "주요 그루브 상호작용 파트너"는 상호작용들, 예를 들면, 뉴클레오타이드 또는 핵산의 주요 그루브 페이스와의 결합을 통해 RNA 리간드들을 검출하고 반응하는 RNA 인지 수용체들을 말한다. 이와 같이, 본원에 기술된 바와 같은 변형된 뉴클레오타이드들 또는 핵산들을 포함하는 RNA 리간드들은 주요 그루브 결합 파트너들과의 상호작용들을 감소시킴으로써 염증성 사이토카인들의 선천성 면역 반응, 또는 발현 및 분비, 또는 둘 다를 감소시킨다.
주요 그루브 상호작용, 예를 들면, 결합 파트너들의 예는 다음의 뉴클레아제 및 헬리카제들을 포함하나, 이에 한정되지 않는다. 막들내에서, TLRs[톨-유사 수용체들(Toll-like Receptors)] 3, 7, 및 8은 단일- 및 이중-가닥 RNA들에 반응할 수 있다. 세포질내에서, DEX(D/H) 헬리카제들 및 ATP아제들의 상과 제2 부류의 구성원들은 RNAs를 감지하여 항바이러스 반응들을 개시할 수 있다. 이들 헬리카제들은 RIG-I[레티노산-유도성 유전자(retinoic acid-inducible gene) I] 및 MDA5[흑색종 분화-관련 유전자(melanoma differentiation-associated gene) 5]을 포함한다. 다른 예들은 유전학들 및 생리학 2의 실험실 (laboratory of genetics and physiology 2)(LGP2), 단백질들, 또는 헬리카제-도메인 함유 단백질들을 함유하는HIN-200 도메인을 포함한다.
선천성 세포 면역 반응의 예방 또는 감소
용어 "선천성 면역 반응"은 사이토카인 발현 및 방출, 특히 인터페론들의 유도, 및 세포 사멸을 포함하는, 일반적으로 바이러스 또는 세균 기원의 외인성 일본쇄 핵산들(exogenous single stranded nucleic acids)에 대한 세포 반응을 포함한다. 단백질 합성은 또한 선천성 세포 면역 반응 동안 감소한다. 외인성 핵산들의 유도에 의해 개시되는 세포내 선천성 면역 반응을 제거하는 것이 유리하다고 해도, 본 개시는 인터페론 신호전달을 포함하는 면역 반응을 전체적으로 제거하지 않고, 실질적으로 감소시키는 mRNA들과 같은 변형된 핵산들을 제공한다. 일부 실시형태에서, 면역 반응은 상응하는 변형되지 않은 핵산에 의해 유도된 면역 반응과 비교하여 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99%, 99.9%, 또는 99.9% 이상까지 감소된다. 이러한 감소는 제1형 인터페론들의 발현 또는 활성 수준에 의해 또는 톨-유사 수용체들(예를 들면, TLR7 및 TLR8)과 같은 인터페론-조절된 유전자들의 발현에 의해 측정될 수 있다. 선천성 면역 반응의 유도의 감소 또는 결여는 세포 집단에 변형된 RNA들을 1회 이상 투여한 후 감소된 세포 사멸에 의해 측정될 수 있는데, 예를 들면, 세포 사멸은 상응하는 변형되지 않은 핵산으로 관찰된 세포 사멸 빈도의 10%, 25%, 50%, 75%, 85%, 90%, 95%, 또는 95% 이상 더 적다. 더욱이, 세포 사멸은 변형된 핵산들과 접촉된 세포들의 50%, 40%, 30%, 20%, 10%, 5%, 1%, 0.1%, 0.01% 또는 0.01%보다 더 적게 영향을 미칠 수 있다.
일부 실시형태에서, 폴리뉴클레오타이드들 및/또는 mRNA 분자들을 포함하는 변형된 핵산들은 수용체 세포 또는 기관에 의한 면역 반응을 유도시키지 않거나, 단지 최소로 유도시키는 방식으로 변형된다. 면역 반응 시발점(trigger) 및 활성화의 이러한 방지 또는 회피는 본 발명의 변형된 폴리뉴클레오타이드들의 신규 특징이다.
본 개시는 예를 들면, 시험관내, 생체외, 또는 생체내에서 변형된 핵산들의 표적 세포 집단내로의 반복된 도입(예를 들면, 형질감염)을 제공한다. 세포 집단을 접촉시키는 단계는 1회 이상(예를 들면, 2, 3, 4 또는 5회 이상) 반복될 수있다. 일부 실시형태에서, 세포 집단과 변형된 핵산들을 접촉시키는 단계는 세포 집단내 단백질 번역의 예정된 효능이 달성되도록 하기에 충분한 회수들을 반복한다. 핵산 변형들에 의해 제공된 표적 세포 집단의 세포독성이 감소되면, 이러한 반복된 형질감염들은 시험관내 및/또는 생체내에서 세포 유형들의 다양한 배열로 달성될 수 있다.
폴리펩타이드 변이체들
참조 폴리펩타이드 서열과 특정의 동일성(identity)을 갖는 변이체 폴리펩타이드들을 암호화하는 핵산들이 제공된다. 당해 분야에 공지된 것으로서, 용어 "동일성"은 서열들을 비교하여 측정된 것으로서, 2개 이상의 펩타이드들의 서열들 사이의 관계를 말한다. 당해 분야에서, 동일성"은 또한 2개 이상의 아미노산 잔기들의 스트링(string)들 사이의 매치들(matches)의 수로써 측정된 것으로서, 펩타이드들 사이의 서열 관련성의 정도를 의미한다. "동일성"은 특수한 수학적 모델 또는 컴퓨터 프로그램(즉, "알고리즘들")에 의해 초점이 맞추어진 갭 정렬들(gap alignments)(존재하는 경우)을 지닌 보다 작은 2개 이상의 서열들 사이의 동일한 매치들의 퍼센트를 측정한다. 이러한 방법들은 문헌[참조: Computational MolecμLar Biology, Lesk, A. M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D. W., ed., Academic Press, New York, 1993; Computer Analysis of 서열 Data, Part 1, Griffin, A. M., and Griffin, H. G., eds., 사람a Press, New Jersey, 1994; 서열 Analysis in MolecμLar Biology, von Heinje, G., Academic Press, 1987; 서열 Analysis Primer, Gribskov, M. and Devereux, J., eds., M. Stockton Press, New York, 1991; and Carillo et al., SIAM J. Applied Math. 48, 1073(1988)]에 기술된 것들을 포함하나, 이에 한정되지 않는다.
일부 실시형태에서, 폴리펩타이드 변이체는 참조 폴리펩타이드와 동일하거나 유사한 활성을 갖는다. 달리는, 변이체는 참조 폴리펩타이드에 대해 변경된 활성(예를 들면, 증가되거나 감소된)을 갖는다. 일반적으로, 본 개시의 특수한 폴리뉴클레오타이드 또는 폴리펩타이드의 변이체들은 본원에 기술되고 당해 분야의 숙련가에게 공지된 서열 정렬 프로그램들 및 매개변수들에 의해 측정된 것으로서 x특별한 참조 폴리뉴클레오타이드 또는 폴리펩타이드에 대해 적어도 약 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 이상의 서열 동일성을 가질 것이다.
당해 분야의 숙련가가 인식하는 바와 같이, 단백질 단편들, 기능적 단백질 도메인들 및 동족 단백질들이 본 개시의 범위 내에 속하는 것으로 고려된다. 예를 들면, 길이가 10, 20, 30, 40, 50, 60, 70, 80, 90, 100개 또는 100개 이상의 아미노산들인 참조 단백질(참조 폴리펩타이드 서열보다 더 짧지만 기타의 경우 동일한 적어도 하나의 아미노산 잔기에서의 폴리펩타이드 서열을 의미한다)의 특정 단백질 단편이 본원에 제공된다. 다른 예로서, 본원에 기술된 서열 중 임의의 것에 대해 약 40%, 약 50%, 약 60%, 약 70%, 약 80%, 약 90%, 약 95%, 또는 약 100% 동일한, 약 20, 약 30, 약 40, 약 50, 또는 약 100개 아미노산들의 신장(stretch)을 포함하는 어떠한 단백질도 본 개시에 따라 활용될 수 있다. 특정 실시형태에서, 본 개시에 따라 활용될 단백질 서열은 본원에서 제공되거나 참조된 서열들 중 임의의 것에 나타낸 바와 같은 2, 3, 4, 5, 6, 7, 8, 9, 10개 이상의 돌연변이들을 포함한다.
폴리펩타이드 라이브러리들
뉴클레오사이드 변형들을 함유하는 폴리뉴클레오타이드 라이브러리들이 또한 제공되며, 여기서, 폴리뉴클레오타이드들은 항체, 단백질 결합 파트너, 스캐폴드 단백질(scaffold protein), 및 당해 분야에 공지된 다른 폴리펩타이드들과 같은 폴리펩타이드를 암호화하는 제1 핵산 서열을 개별적으로 함유한다. 바람직하게는, 폴리뉴클레오타이드들은 표적 숙주 세포내로 직접적인 도입되어, 최종적으로 암호화된 폴리펩타이드를 합성하는데 적합한 형태의 mRNA이다.
특정 실시형태에서, 각각 상이한 아미노산 변형(들)을 갖는, 단백질의 다중 변이체들이 생산되어 시험됨으로써 약동학, 안정성, 생물적합능, 및/또는 발현 수준과 같은 생물학적 활성의 측면에서 가장 우수한 변이체를 측정한다. 이러한 라이브러리는 10, 102, 103, 104, 105, 106, 107, 108, 109, 또는 109 초과의 가능한 변이체들(하나 이상의 잔기들의 치환들, 결실들, 및 하나 이상의 잔기들의 삽입을 포함)을 함유할 수 있다.
폴리펩타이드-핵산 복합체들
적절한 단백질 번역은 mRNA와 관련된 다수의 폴리펩타이드들 및 핵산들의 물리적 응집을 포함한다. 본 개시에 의해 하나 이상의 뉴클레오사이드 변형들(예를 들면, 적어도 2개의 상이한 뉴클레오사이드 변형들), 및 mRNA에 결합된 하나 이상의 폴리펩타이드들을 갖는 번역가능한 mRNA를 함유하는 단백질-핵산 복합체들이 제공된다. 일반적으로, 단백질들은, 복합체가 도입되는 세포의 선천성 면역 반응을 예방하거나 감소시키기에 효과적인 양으로 제공된다.
번역불가능한 변형된 핵산들
본원에 기술된 바와 같이, 실질적으로 번역불가능한 서열들을 갖는 mRNA들이 제공된다. 이러한 mRNA는 포유동물 대상체에게 투여되는 경우 백신으로서 효과적이다.
또한 하나 이상의 비암호화 영역들을 함유하는 변형된 핵산들이 제공된다. 이러한 변형된 핵산들은 일반적으로 번역되지 않으나 리보소옴 단백질 또는 트랜스퍼 RNA(tRNA)와 같은 하나 이상의 번역 기구 성분들에 결합하여 봉쇄(sequester)함으로써 세포내에서 단백질 발현을 효과적으로 감소시킬 수 있다. 변형된 핵산은 작은 핵 RNA(sno-RNA), 마이크로(micro) RNA(miRNA), 작은 간섭(small interference) RNA(siRNA) 또는 피위-상호작용(Piwi-interacting) RNA(piRNA)를 함유할 수 있다.
변형된 핵산들의 합성
본 개시에 따라 사용하기 위한 핵산들은 일반적으로 시험관내 전사, 보다 긴 전구체의 효소적 또는 화학적 절단 등으로 명명되는, 화학적 합성, 효소적 합성을 포함하나, 이에 한정되지 않는 어떠한 이용가능한 기술에 따라 제조될 수 있다. RNA들을 합성하는 방법들은 당해 분야에 공지되어 있다[참조: 예를 들면, Gait, M.J.(ed.) Oligonucleotide synthesis: practical approach, Oxford [Oxfordshire], Washington, DC: IRL Press, 1984; 및 Herdewijn, P.(ed.) Oligonucleotide synthesis: methods and applications, Methods in MolecμLar Biology, v. 288(Clifton, N.J.) Totowa, N.J.: 사람a Press, 2005; 이들 둘 다는 참조로 본원에 혼입된다].
변형된 핵산들은 분자의 전체 길이에 따라 균일하게 변형될 필요가 없다. 상이한 뉴클레오타이드 변형들 및/또는 골격 구조들이 핵산내 다양한 위치들에 존재할 수 있다. 당해 분야의 숙련가는, 뉴클레오타이드 동족체들 또는 다른 변형(들)이 핵산의 어떠한 위치(들)에 위치함으로써 핵산의 기능이 실질적으로 감소되지 않음을 인지할 것이다. 변형은 또한 5' 또는 3' 말단 변형일 수 있다. 핵산들은 최소 1 및 최대 100%의 변형된 뉴클레오타이드들, 또는 어떠한 개재 퍼센트(intervening percentage), 예를 들면, 적어도 5% 변형된 뉴클레오타이드들, 적어도 10% 변형된 뉴클레오타이드들, 적어도 25% 변형된 뉴클레오타이드들, 적어도 50% 변형된 뉴클레오타이드들, 적어도 80% 변형된 뉴클레오타이드들, 또는 적어도 90% 변형된 뉴클레오타이드들을 함유할 수 있다. 예를 들면, 핵산들은 변형된 피리미딘, 예를 들면, 우라실 또는 사이토신을 함유할 수 있다. 일부 실시형태에서, 핵산 중의 적어도 5%, 적어도 10%, 적어도 25%, 적어도 50%, 적어도 80%, 적어도 90% 또는 100%가 변형된 우라실로 대체된다. 변형된 우라실은 단일의 유일한 구조를 갖는 화합물로 대체될 수 있거나 상이한 구조들(예를 들면, 2, 3, 4개 이상의 유일한 구조들)을 갖는 다수의 화합물들로 대체될 수 있다. 일부 실시형태에서, 핵산 중의 사이토신의 적어도 5%, 적어도 10%, 적어도 25%, 적어도 50%, 적어도 80%, 적어도 90% 또는 100%는 변형된 사이토신으로 대체된다. 변형된 사이토신은 단일의 유일한 구조를 갖는 화합물로 대체될 수 있거나, 또는 상이한 구조들(예를 들면, 2, 3, 4개 이상의 유일한 구조들)을 갖는 다수의 화합물들로 대체될 수 있다.
일반적으로, 본 개시의 변형된 mRNA의 가장 짧은 길이는 디펩타이드를 암호화하기에 충분한 길이의 mRNA 서열일 수 있다. 다른 실시형태에서, mRNA 서열의 길이는 트리펩타이드를 암호화하기에 충분하다. 다른 실시형태에서, mRNA 서열의 길이는 테트라펩타이드를 암호화하기에 충분하다. 다른 실시형태에서, mRNA 서열의 길이는 펜타펩타이드를 암호화하기에 충분하다. 다른 실시형태에서, mRNA 서열의 길이는 헥사펩타이드를 암호화하기에 충분하다. 다른 실시형태에서, mRNA 서열의 길이는 헵타펩타이드를 암호화하기에 충분하다. 다른 실시형태에서, mRNA 서열의 길이는 옥타펩타이드를 암호화하기에 충분하다. 다른 실시형태에서, mRNA 서열의 길이는 노나펩타이드를 암호화하기에 충분하다. 다른 실시형태에서, mRNA 서열의 길이는 데카펩타이드를 암호화하기에 충분하다.
변형된 핵산 서열들이 암호화할 수 있는 디펩타이드들의 예들은 카르노신 및 안세린을 포함하나, 이에 한정되지 않는다.
추가의 실시형태에서, mRNA는, 길이가 30개 이상인 뉴클레오타이드들이다. 다른 실시형태에서, RNA 분자는, 길이가 35개 이상인 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 40개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 45개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 55개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 60개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 80개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 90개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 100개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 120개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 140개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 160개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 180개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 200개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 250개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 300개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 350개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 400개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 450개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 500개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 600개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 700개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 800개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 900개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 1000개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 1100개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 1200개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 1300개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 1400개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 1500개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 1600개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 1800개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 2000개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 2500개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 3000개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 4000개 뉴클레오타이드들이다. 다른 실시형태에서, 길이는 적어도 5000개 뉴클레오타이드들 또는 5000개 이상의 뉴클레오타이드들이다.
예를 들면, 본원에 기술된 변형된 핵산들은 핵산 합성 분야에서 숙련가에게 공지된 방법들을 사용하여 제조할 수 있다.
일부 실시형태에서, 본 개시는 주요 그루브 결합 파트너와 핵산 서열의 결합을 방해하는 뉴클레오타이드를 포함하는 핵산 서열들 제조하는, 예를 들면, 효소적 방법들을 제공하며, 여기서, 핵산 서열은 화학식 XI-a의 화합물을 포함하고:
[화학식 XI-a]
[여기서:
뉴클레오타이드는 주요 그루브 결합 파트너에 대한 결합 친화성이 감소되어 있고;
A는 H, OH, 포스포릴, 피로포스페이트, 설페이트, -NH2, -SH, 아미노산, 2 내지 12개의 아미노산들을 포함하는 펩타이드이고;
X는 O 또는 S이며;
각각의 Y1은 -ORa1, -NRa1Rb1, 및 -SRa1 중에서 독립적으로 선택되고;
각각의 Y2 및 Y3는 O, -CRaRb-, NRc, S, 또는 C, O, N 및 S로 이루어진 그룹으로부터 선택되는 하나 이상의 원자들을 포함하는 링커 중에서 독립적으로 선택되며;
Ra 및 Rb는 각각 독립적으로 H, C1-12 알킬, C2-12 알케닐, C2-12 알키닐, 또는 C6-20 아릴이고;
Rc는 H, C1-12 알킬, C2-12 알케닐, 페닐, 벤질, 폴리에틸렌 글리콜 그룹, 또는 아미노-폴리에틸렌 글리콜 그룹이고;
Ra1 및 Rb1 는 각각 독립적으로 H 또는 반대이온이고;
-ORc1은 약 1의 pH에서 OH이거나 또는 -ORc1은 생리학적 pH에서 O-이며;
B는 핵염기이고;
단, 변수들 A, B, D, U, Z, Y2 및 Y3을 포함하는 환은 리보스일 수 없다], 당해 방법은 화학식 XIII:
[화학식 XIII]
의 화합물을 RNA 폴리머라제, 및 cDNA 주형과 반응시킴을 포함한다.
일부 실시형태에서, 당해 반응은 1 내지 약 7,000회 반복된다.
일부 실시형태에서, B는 화학식 XII-a, XII-b, 또는 XII-c의 핵염기이다:
[화학식 XII-a]
[화학식 XII-b]
[화학식 XII-c]
여기서:
X는 O 또는 S이며;
U 및 W 는 각각 독립적으로 C 또는 N이고;
V는 O, S, C 또는 N이며;
여기서, V가 C인 경우 R1은 H, C1 -6 알킬, C1 -6 알케닐, C1 -6 알키닐, 할로, 또는 -ORc이고, 여기서, C1 -20 알킬, C2 -20 알케닐, C2 -20 알키닐은 각각, -OH, -NRaRb, -SH, -C(O)Rc, -C(O)ORc, -NHC(O)Rc, 또는 -NHC(O)ORc로 임의로 치환되며;
여기서, V가 O, S, 또는 N인 경우 R1은 부재하고;
R2는 H, -ORc, -SRc, -NRaRb, 또는 할로이거나;
V가 C인 경우 R1 및 R2는, 이들이 부착된 탄소 원자들과 함께 할로, -OH, -SH, -NRaRb, C1 -20 알킬, C2 -20 알케닐, C2 -20 알키닐, C1 -20 알콕시, 또는 C1 -20 티오알킬로부터 선택되는 1 내지 4개의 치환체들로 임의로 치환된 5- 또는 6-원 환을 형성할 수 있고;
R3은 H 또는 C1-20 알킬이며;
R4는 H 또는 C1-20 알킬이고; 여기서, 이 이중 결합을 나타내는 경우 R4는 부재하거나, N-R4가 함께, C1 -20 알킬로 치환된 양으로 하전된 N을 형성하며;
Ra 및 Rb는 각각 독립적으로 H, C1-20 알킬, C2-20 알케닐, C2-20 알키닐, 또는 C6-20 아릴이고;
Rc는 H, C1-20 알킬, C2-20 알케닐, 페닐, 벤질, 폴리에틸렌 글리콜 그룹, 또는 아미노-폴리에틸렌 글리콜 그룹이다.
일부 실시형태에서, B는 화학식 XII-a1, XII-a2, XII-a3, XII-a4, 또는 XII-a5의 핵염기이다:
[화학식 XII-a1]
[화학식 XII-a2]
[화학식 XII-a3]
[화학식 XII-a4]
[화학식 XII-a5]
일부 실시형태에서, 당해 방법들은 아데노신, 사이토신, 구아노신, 및 우라실로 이루어진 그룹으로부터 선택되는 뉴클레오타이드를 추가로 포함한다.
일부 실시형태에서, 핵염기는 피리미딘 또는 이의 유도체이다.
다른 양상에서, 본 개시는 주요 그루브 결합 파트너와 핵산 서열의 결합을 방해하는 뉴클레오타이드를 포함하는 핵산 서열을 증폭시키는 방법들을 제공하며, 당해 방법은 하기 화학식 XI-d의 화합물과, 프라이머, cDNA 주형, 및 RNA 폴리머라제를 반응시킴을 포함한다:
[화학식 XI-d]
여기서:
뉴클레오타이드는 주요 그루브 결합 파트너에 대한 결합 친화성이 감소되어 있고;
Z는 -CRaRb-일 수 있고 A와 결합을 형성하며;
A는 H, OH, 포스포릴, 피로포스페이트, 설페이트, -NH2, -SH, 아미노산, 또는 1 내지 12개의 아미노산들을 포함하는 펩타이드이고;
X는 O 또는 S이며;
각각의 Y1는 -ORa1, -NRa1Rb1, 및 -SRa1 중에서 독립적으로 선택되고;
각각의 Y2 및 Y3은 O, -CRaRb-, NRc, S, 또는 C, O, N 및 S로 이루어진 그룹으로부터 선택되는 하나 이상의 원자들을 포함하는 링커이며;
n은 0, 1, 2, 또는 3이고;
m은 0, 1, 2 또는 3이며;
B는 핵염기이고;
Ra 및 Rb는 각각 독립적으로 H, C1-12 알킬, C2-12 알케닐, C2-12 알키닐, 또는 C6-20 아릴이며;
Rc는 H, C1-12 알킬, C2-12 알케닐, 페닐, 벤질, 폴리에틸렌 글리콜 그룹, 또는 아미노-폴리에틸렌 글리콜 그룹이고;
Ra1 및 Rb1는 각각 독립적으로 H 또는 반대이온이고;
-ORc1은 약 1의 pH에서 OH이거나 또는 -ORc1은 생리학적 pH에서 O-이고;
단, 변수들 A, B, D, U, Z, Y2 및 Y3을 포함하는 환은 리보스일 수 없다.
일부 실시형태에서, B는 화학식 XII-a, XII-b, 또는 XII-c의 핵염기이다:
[화학식 XII-a]
[화학식 XII-b]
[화학식 XII-c]
여기서:
X는 O 또는 S이며;
U 및 W 는 각각 독립적으로 C 또는 N이고;
V는 O, S, C 또는 N이며;
여기서, V가 C인 경우 R1은 H, C1-6 알킬, C1-6 알케닐, C1-6 알키닐, 할로, 또는 -ORc이고, 여기서, C1 -20 알킬, C2 -20 알케닐, C2 -20 알키닐은 각각, -OH, -NRaRb, -SH, -C(O)Rc, -C(O)ORc, -NHC(O)Rc, 또는 -NHC(O)ORc로 임의로 치환되고;
여기서, V가 O, S, 또는 N인 경우 R1은 부재하고;
R2는 H, -ORc, -SRc, -NRaRb, 또는 할로이거나;
V가 C인 경우 R1 및 R2는, 이들이 부착된 탄소 원자들과 함께 할로, -OH, -SH, -NRaRb, C1 -20 알킬, C2 -20 알케닐, C2 -20 알키닐, C1 -20 알콕시, 또는 C1 -20 티오알킬로부터 선택되는 1 내지 4개의 치환체들로 임의로 치환된 5- 또는 6-원 환을 형성할 수 있고;
R3은 H 또는 C1-20 알킬이며;
Ra 및 Rb는 각각 독립적으로 H, C1-20 알킬, C2-20 알케닐, C2-20 알키닐, 또는 C6-20 아릴이며;
Rc는 H, C1-20 알킬, C2-20 알케닐, 페닐, 벤질, 폴리에틸렌 글리콜 그룹, 또는 아미노-폴리에틸렌 글리콜 그룹이다.
일부 실시형태에서, B는 화학식 XII-a1, XII-a2, XII-a3, XII-a4, 또는 XII-a5의 핵염기이다:
[화학식 XII-a1]
[화학식 XII-a2]
[화학식 XII-a3]
[화학식 XII-a4]
[화학식 XII-a5]
일부 실시형태에서, 당해 방법들은 아데노신, 사이토신, 구아노신, 및 우라실로 이루어진 그룹으로부터 선택되는 뉴클레오타이드 를 추가로 포함한다.
일부 실시형태에서, 핵염기는 피리미딘 또는 이의 유도체이다.
일부 실시형태에서, 본 개시는
a) 목적한 약제학적 단백질을 암호화하는 상보성 데옥리보핵산(cDNA)을제공하는 단계;
b) 주요 그루브 결합 파트너와 핵산의 결합을 방해하는 것으로 알려지고, 주요 그루브 결합 파트너에 대한 결합 친화성이 감소되어 있는 뉴클레오타이드를 선택하는 단계; 및
c) 제공된 cDNA와 선택된 뉴클레오타이드를 RNA 폴리머라제와 약제학적 핵산이 합성되는 조건들 하에서 접촉시키는 단계를 포함하여, 약제학적 핵산을 합성하는 방법들이 제공된다.
추가의 실시형태에서, 약제학적 핵산은 리보핵산(RNA)이다.
본 개시의 여전히 추가의 양상에서, 변형된 핵산들은 고체상 합성 방법들을 사용하여 제조할 수 있다.
일부 실시형태에서, 본 개시는 하기 화학식 XI-a의 화합물을 포함하는 핵산을 합성하는 방법들을 제공하며:
[화학식 XI-a]
[여기서:
A는 H, OH, 포스포릴, 피로포스페이트, 설페이트, -NH2, -SH, 아미노산, 2 내지 12개의 아미노산들을 포함하는 펩타이드이며;
X는 O 또는 S이고;
각각의 Y1는 -ORa1, -NRa1Rb1, 및 -SRa1 중에서 독립적으로 선택되고;
각각의 Y2 및 Y3은 O, -CRaRb-, NRc, S, 또는 C, O, N 및 S로 이루어진 그룹으로부터 선택되는 하나 이상의 원자들을 포함하는 링커 중에서 독립적으로 선택되며;
Ra 및 Rb 는 각각 독립적으로 H, C1-12 알킬, C2-12 알케닐, C2-12 알키닐, 또는 C6-20 아릴이고;
Rc는 H, C1-12 알킬, C2-12 알케닐, 페닐, 벤질, 폴리에틸렌 글리콜 그룹, 또는 아미노-폴리에틸렌 글리콜 그룹이며;
Ra1 및 Rb1 는 각각 독립적으로 H 또는 반대이온이고;
-ORc1은 약 1의 pH에서 OH이거나 또는 -ORc1은 생리학적 pH에서 O-이고;
B는 핵염기이며;
단, 변수들 A, B, U, Z, Y2 및 Y3을 포함하는 환은 리보스일 수 없다]; 당해 방법은:
a) 화학식 XIII-a의 뉴클레오타이드:
[화학식 XIII-a]
를 화학식 XIII-b의 포스포르아미디트 화합물:
[화학식 XIII-b]
[화학식 XIV-a]
의 핵산을 제공하는 단계;
b) 화학식 XIV-a의 핵산을 산화시키거나 황화시켜 화학식 XIVb:
[화학식 XIV-b]
의 핵산을 수득하는 단계; 및
c) 보호 그룹들을 제거하여 화학식 XI-a의 핵산을 수득하는 단계를 포함한다.
일부 실시형태에서, 당해 방법은 아데노신, 사이토신, 구아노신, 및 우라실로 이루어진 그룹으로부터 선택되는 뉴클레오타이드를 추가로 포함한다.
일부 실시형태에서, B는 화학식 XIII의 핵염기이다:
[화학식 XIII]
여기서:
V는 N 또는 양으로 하전된 NRc이고;
R3은 NRcRd, -ORa, 또는 -SRa이며;
R4는 H이거나 Y3과 임의로 결합을 형성할 수 있고;
R5는 H, -NRcRd, 또는 -ORa이며;
Ra 및 Rb는 각각 독립적으로 H, C1 -12 알킬, C2 -12 알케닐, C2 -12 알키닐, 또는 C6-20 아릴이고;
Rc는 H, C1-12 알킬, C2-12 알케닐, 페닐, 벤질, 폴리에틸렌 글리콜 그룹, 또는 아미노-폴리에틸렌 글리콜 그룹이다.
일부 실시형태에서, 단계들 a) 및 b)는 1 내지 약 10,000회 반복된다.
변형된 핵산들의 용도들
치료학적 제제들
본원에 기술된 변형된 핵산들은 치료학적 제제들로 사용될 수 있다. 예를 들면, 본원에 기술된 변형된 핵산은 동물 또는 피검자에게 투여될 수 있으며, 여기서, 변형된 핵산은 생체내에서 번역되어 동물 또는 피검자내에서 치료학적 펩타이드를 생산한다. 따라서, 사람들 및 다른 동물들에서의 질병 또는 상태들을 치료하거나 에방하기 위한 조성물들, 방법들, 키트들, 및 시약들이 본원에 제공된다. 본 개시의 활성 치료학적 제제들은 변형된 핵산들, 변형된 핵산들 또는 변형된 핵산들로부터 번역된 폴리펩타이드들을 함유하는 세포들, 변형된 핵산들로부터 번역된 폴리펩타이드들, 변형된 핵산들 또는 변형된 핵산들로부터 번역된 폴리펩타이드들과 접촉된 세포들, 변형된 핵산들을 함유하는 세포들을 함유하는 조직들 및 변형된 핵산들을 함유하는 세포들을 함유하는 조직들을 함유하는 기관들을 포함한다.
합성 또는 재조합체 폴리뉴클레오타이드의 번역을 유도함으로써 본원에 기술된 변형된 핵산들을 사용하여 세포 집단 속에서 폴리펩타이드를 생산하는 방법들이 제공된다. 이러한 번역은 생체내, 생체외, 배양물 속, 또는 시험관내의 것일 수 있다. 세포 집단은 적어도 하나의 뉴클레오사이드 변형, 및 폴리펩타이드를 암호화하는 번역가능한 영역을 갖는 핵산을 함유하는 조성물의 유효량과 접촉된다. 당해 집단은, 핵산이 세포 집단의 하나 이상의 세포들내로 국재화되고 재조합체 폴리펩타이드가 핵산으로부터 세포내로 번역되도록 하는 조건들하에서 접촉된다.
유효량의 조성물은 적어도 부분적으로, 표적 조직, 표적 세포 유형, 투여 수단, 핵산의 생리학적 특성들(예를 들면, 변형된 뉴클레오사이드들의 크기, 및 정도), 및 다른 결정인자들을 기본으로 하여 제공된다. 일반적으로, 유효량의 조성물은 세포내에서 효율적인 단백질 생산을 제공하며, 바람직하게는 상응하는 변형되지 않은 핵산을 함유하는 조성물보다 더 효율적이다. 증가된 효능은 증가된 세포 형질감염(즉, 핵산으로 형질감염된 세포들의 퍼센트), 핵산으로부터의 증가된 단백질 번역, 감소된 핵산 분해(예를 들면, 변형된 핵산으로부터 단백질 번역의 증가된 지속에 의해 입증됨), 또는 숙주 세포의 감소된 선천성 면역 반응 또는 개선된 치료학적 활용에 의해 입증될 수 있다.
본 개시의 양상들은 이를 필요로 하는 포유동물 대상체내에서 재조합체 폴리펩타이드의 생체내 번역을 유도하는 방법들에 관한 것이다. 여기서, 적어도 하나의 뉴클레오사이드 변형 및 폴리펩타이드를 암호화하는 번역가능한 영역을 갖는 핵산을 함유하는 유효량의 조성물은 본원에 기술된 전달 방법들을 사용하여 대상체에게 투여된다. 핵산은, 당해 핵산이 대상체의 세포 또는 세포들내로 국재화되고 재조합체 폴리펩타이드가 핵산으로부터 세포내에서 번역되는 다른 조건들하에서 및 양으로 제공된다. 핵산이 국재화되는 세포, 또는 세포가 존재하는 조직은 핵산 투여의 1회 또는 1회 이상의 라운드들로 표적화될 수 있다.
본 개시의 다른 양상들은 포유동물 대상체에게 변형된 핵산들을 함유하는 세포들의 이식(transplantation)시키는 것에 관한 것이다. 포유동물 대상체에게 세포들을 투여하는 것은, 약제학적으로 허용되는 담체 속에 세포들의 제형이 존재하므로, 국소 이식(llocal implantation)(예를 들면, 국소 또는 피하 투여), 기관 전달 또는 전신계 주사(예를 들면, 정맥내 주사 또는 흡입)과 같이, 당해 분야의 숙련가에게 공지되어 있다. 변형된 핵산들을 함유하는 조성물들은 근육내, 경동맥으로, 복강내로, 정맥내로, 비강내로, 피하로, 내시경적으로(endoscopically), 경피로, 또는 척수내로 투여하기 위해 제형화된다. 일부 실시형태에서, 조성물은 연장된 방출을 위해 제형화된다.
치료학적 제제가 투여되는 대상체는 질병, 질환, 또는 위험항 상태로 고생하거나 진행될 위험이 있다. 임상적 진단, 생물마커 수준들, 전장유전체 연관 연구(genome-wide association studies: GWAS), 및 당해 분야에 공지된 다른 방법들을 포함할 수 있는, 이들 염기들에 있어서 대상체들을 확인하고, 진단하며, 분류하는 방법들이 제공된다.
특정 실시형태에서, 투여된 변형된 핵산은,재조합체 폴리펩타이드가 번역되는 세포내에 실질적으로 부재하는 기능적 활성을 제공하는 하나 이상의 재조합체 폴리펩타이드들의 생산을 지시한다. 예를 들면, 기능적 활성을 상실하는 것은 특성상 효소적, 구조적 또는 유전자 조절성일 수 있다.
기타 실시형태에서, 투여된 변형된 핵산은, 재조합체 폴리펩타이드가 번역되는 세포내에 실질적으로 부재하는 폴리펩타이드(또는 다수의 폴리펩타이드)를 대체하는 하나 이상의 재조합체 폴리펩타이드들의 생산을 지시한다. 이러한 부재는 암호화 유전자 또는 이의 조절 경로의 유전적 돌연변이에 기인할 수 있다. 다른 실시형태에서, 투여된 변형된 핵산은, 재조합체 폴리펩타이드가 번역되는 세포내에 존재하는 폴리펩타이드(또는 다수의 폴리펩타이드들)의 양을 보충하기 위한 하나 이상의 재조합체 폴리펩타이드들의 생산을 지시한다. 달리는, 재조합체 폴리펩타이드는 세포내에, 세포의 표면 상에 존재하거나, 또는 세포로부터 분비된 내인성 단백질의 활성을 길항하기 위해 기능한다. 일반적으로, 내인성 단백질의 활성은 예를 들면, 변경된 활성 또는 국재화를 생성하는 내인성 단백질의 돌연변이로 인하여, 대상체에 대해 유해하다. 추가로, 재조합체 폴리펩타이드는 세포내에, 세포의 표면상에 존재하거나, 또는 세포로부터 분비된 생물학적 잔기의 활성을 직접 또는 간접적으로 길항한다. 길항된 생물학적 잔기들의 예들은 지질들(예를 들면, 콜레스테롤), 지단백질(예를 들면, 저 밀도 지단백질), 핵산, 탄수화물, 또는 소 분자 독소를 포함한다.
본원에 기술된 재조합체 단백질들은 세포, 잠재적으로는 핵과 같은 특수한 구획 속에 국재화시키기 위해 가공되거나, 세포로부터의 분비 또는 세포의 혈장막으로의 전좌를 위해 가공된다.
본원에 기술된 바와 같이, 본 개시의 변형된 핵산들의 유용한 특징은 외인성 핵산에 대한 세포의 선천성 면역 반응을 감소시키거나, 기피하거나, 모면하거나 제거하는 능력이다. 세포 또는 세포들의 집단에서 면역 반응의 적정, 감소 또는 제거를 수행하는 방법들이 제공된다. 일부 실시형태에서, 세포는 번역 영역 및 적어도 하나의 뉴클레오사이드 변형을 포함하는 제1의 외인성 핵산의 제1 용량을 함유하는 제1의 조성물과 접촉되며, 제1의 외인성 핵산에 대한 세포의 선천성 면역 반응의 수준이 측정된다. 후속적으로, 세포는, 제1의 용량과 비교하여 제1의 외인성 핵산의 보다 적은 양을 함유하는 제2의 용량의 제1의 외인성 핵산을 포함하는 제2의 조성물과 접촉된다. 달리는, 세포는 제2의 외인성 핵산의 제1의 용량과 접촉된다. 제2의 외인성 핵산은, 제1의 외인성 핵산과 동일하거나 상이할 수 있는 하나 이상의 변형된 뉴클레오사이드들을 함유할 수 있거나, 달리는, 제2의 외인성 핵산은 변형된 뉴클레오사이드들을 함유하지 않을 수 있다. 세포를 제1의 조성물 및/또는 제2의 조성물과 접촉시키는 단계들은 1회 이상 반복될 수 있다. 추가로, 세포속에서 단백질 생산(예를 들면, 단백질 번역)의 효능은 임의로 측정되며, 세포는, 표적 단백질 생산 효능이 달성될 때까지 반복적으로 제1의 및/또는 제2의 조성물로 재-형질감염될 수 있다.
질병 및 상태들의 치료
비정상적인 단백질 활성을 손실시킴으로써, 손실된 단백질 활성을 대체시킴으로써 또는 비정상적인 단백질 활성을 극복함으로써 특징화된 질병들의 증상을 치료하거나 예방하는 방법들이 제공된다. 바이러스 DNA 벡터들과 비교한 것으로서, 변형된 mRNA들의 도입 후 단백질 생산의 신속한 개시로 인하여, 본 개시의 화합물들은 패혈증, 뇌졸중, 및 심근경색과 같은 급성 질병들을 치료하는 데 있어서 특히 유리하다. 더욱이, 본 개시의 변형된 mRNA들의 전사적 조절의 결여는, 단백질 생산의 정밀한 적정이 달성된다는 점에서 유리하다. 다수의 질병들은 단백질 활성을 손실하는 것(또는 실질적으로 약해짐으로써 적절한 단백질 기능이 일어나지 않는 것)을 특징으로 한다. 이러한 단백질들은 존재하지 않을 수 있거나, 매우 적은 양들로 존재하거나 필수적으로 비-기능성이다. 본 개시는, 본원에 제공된 핵산, 또는 변형된 핵산들을 함유하는 세포-계 치료제들을 도입함으로서 대상체에서 이러한 상태들 또는 질병들을 치료하는 방법을 제공하며, 여기서, 변형된 핵산들은 대상체의 표적 세포들로부터 손실된 단백질 활성을 대체하는 단백질을 암호화한다.
기능이상 또는 비정상적인 단백질 활성으로 특징화되는 질병들은 암 및 증식성 질병들, 유전적 질병들(예를 들면, 낭성 섬유증), 자가면역병들, 당뇨병들, 신경변성병들, 심혈관 질병들, 및 대사 질병들을 포함하나, 이에 한정되지 않는다. 본 개시는 본원에 제공된 핵산, 또는 변형된 핵산들을 함유하는 세포-계 치료제들을 도입시킴으로써 대상체내에서 이러한 상태들 또는 질병들을 치료하는 방법을 제공하며, 여기서, 변형된 핵산들은 대상체의 세포속에 존재하는 비정상적인 단백질을 길항하거나 달리는 극복하는 단백질을 암호화한다.
기능장애 단백질의 구체적인 예들은 낭성 섬유증을 유발하는, CFTR 단백질의 각각 기능이상 또는 비기능성 단백질 변이체를 생산하는, 낭성 섬유증 막관통 전도 조절인자(cystic fibrosis transmembrane conductance regμLator: CFTR)의 미스센스(missense) 또는 넌센스(nonsense) 돌연변이 변이체들이다.
따라서, 대상체의 세포와, 기능적 CFTR 폴리펩타이드를 암호화하는 번역가능한 영역을 갖는 변형된 핵산을, CTFR 폴리펩타이드의 유효량이 세포속에 존재하도록 하는 조건들하에 접촉시킴으로써 포유 대상체내에서 낭성 섬유증을 치료하는 방법들이 제공된다. 바람직한 표적 세포들은 상피 세포들, 예를 들면, 폐이며, 투여 방법들은 표적 조직, 즉, 폐 전달의 측면에서 결정되고, RNA 분자들은 흡입에 의한 투여를 위해 제형화된다.
다른 실시형태에서, 본 개시는 대상체의 세포 집단내로 게놈 연구들에 의해 최근에 특성화된 단백질인, 소르틸린을 암호화함으로써 대상체내에서 과지질혈증을 완화시키는 변형된 mRNA 분자를 도입시킴으로써, 대상체에서 고지질혈증을 치료하는 방법들을 제공한다. 당해 SORT1 유전자는 소르틸린이라고 명명된 트랜스-골지 네트워크(trans-Golgi network: TGN) 막관통 단백질을 암호화한다. 유전 연구들은, 5명의 개인들 중 한명이 이들을 낮은 수준들의 저-밀도 지단백질(LDL) 및 초-저-밀도 지단백질(VLDL)을 갖도록 하는 SORT1 유전자의 1p13 유전자자리(locus)내에서 단일의 뉴클레오타이드 다형성, rs12740374를 가짐을 밝혔다. 사람들 중 약 30%에서 존재하는, 마이너 대립형질(minor allele)의 각각의 카피는 LDL 콜레스테롤을 8 mg/dL까지 변경시키는 반면, 집단의 약 5%로 존재하는 마이너 대립형질의 2개의 카피들은 LDL 콜레스테롤을 16 mg/dL로 저하시킨다. 마이너 대립형질의 담체들은 또한 심근경색의 약 40% 감소된 위험을 갖는 것으로 밝혀졌다. 마우스들에서 기능적 생체내 연구들은, 마우스 간 조직내에서 SORT1의 과발현이 유의적으로 보다 낮은, 즉, 80% 만큼 더 낮은 LDL-콜레스테롤 수준들을 가져왔으며, 사일런싱(silencing) SORT1은 LDL 콜레스테롤을 대략 200% 증가시켰음을 기술한다(참조: Musunuru K et al. From noncoding variant to phenotype via SORT1 at the 1p13 cholesterol locus. Nature 2010; 466: 714-721).
세포 핵산 전달의 방법들
본 개시의 방법들은 생체내, 생체외, 또는 배양물 속에서 세포 집단내로 핵산 전달을 향상시킨다. 예를 들면, 다수의 숙주 세포들(예를 들면, 효모 및 포유동물 세포들과 같은 진핵 세포들)을 함유하는 세포 배양물을 적어도 하나의 뉴클레오사이드 변형, 및 임의로, 번역가능한 영역을 갖는 향상된 핵산을 함유하는 조성물과 접촉시킨다. 당해 조성물은 또한 숙주 세포들내로 향상된 핵산 흡수의 효능을 증가시키는 형질감염 시약 또는 다른 화합물을 일반적으로 함유한다. 향상된 핵산은 상응하는 변형되지 않은 핵산에 비해, 세포 집단내에서 향상된 보유를 나타낸다. 향상된 핵산의 보유는 변형되지 않은 핵산의 보유보다 더 크다. 일부 실시형태에서, 이는 변형되지 않은 핵산의 보유보다 적어도 약 50%, 75%, 90%, 95%, 100%, 150%, 200% 또는 200% 이상이다. 이러한 보유 이점은 향상된 핵산을 사용한 1회 라운드의 형질감염으로 달성될 수 있거나, 형질감염의 반복된 라운드들 후 수득될 수 있다.
일부 실시형태에서, 향상된 핵산은 하나 이상의 추가의 핵산들을 갖는 표적 세포 집단에 전달된다. 이러한 전달은 동시에 이루어질 수 있거나, 향상된 핵산은 하나 이상의 추가의 핵산들의 전달 전에 전달된다. 추가의 하나 이상의 핵산들은 변형된 핵산들 또는 변형되지 않는 핵산들일 수 있다. 향상된 핵산들의 초기의 존재는 세포 집단의 선천성 면역 반응을 실질적으로 유도하지 않으며, 더욱이, 선천성 면역 반응은 변형되지 않은 핵산들의 이후 존재에 의해 활성화되지 않을 것임이 이해된다. 이와 관련하여, 표적 세포 집단 속에 존재하는 것이 바람직한 단백질이 변형되지 않은 핵산들로부터 번역되는 경우, 향상된 핵산은 자체로 번역가능한 영역을 함유하지 않을 수 있다.
표적화 잔기들
본 개시의 실시형태에서, 변형된 핵산들은 구체적인 조직 공간에 대해 세포를 표적화시키기 위해 또는 생체내 또는 시험관내에서 특이적인 잔기와 상호작용하기 위해 기능하는, 세포의 표면 위에 단백질-결합 파트너 또는 수용체를 발현하기 위해 제공된다. 적합한 단백질-결합 파트너들은 항체들 및 이의 기능성 단편들, 스캐폴드 단백질들, 또는 펩타이드들을 포함한다. 추가로, 변형된 핵산들을 사용하여 지질들, 탄수화물들, 또는 다른 생물학적 잔기들의 합성 및 세포외 국재화를 지시할 수 있다.
영구적인 유전자 발현 사일런싱(Silencing)
포유동물 대상체내에서 유전자 발현을 후성적으로 사일런싱시키는 방법은, 번역가능한 영역이 서열-특이적인 히스톤 H3 메틸화를 지시하여 헤테로크로마틴 형성을 개시하고 유전자를 사일런싱할 목적으로 구체적인 유전자들 주변에 유전자 전사를 감소시킬 수 있는 폴리펩타이드 또는 폴리펩타이드들을 암호화하는 핵산을 포함한다. 예를 들면, 자누스 키나제(Janus Kinase) 2 유전자내 기능 획득(gain-of-function) 돌연변이는 골수증식 질환들의 계열에 관여한다.
검출가능한 제제 또는 치료학적 제제의 생물학적 표적으로의 전달
본원에 기술된 변형된 뉴클레오사이드, 변형된 뉴클레오타이드, 및 변형된 핵산은, 생물학적 표적으로의 물질("페이로드")의 전달, 예를 들면, 표적의 검출을 위한 검출가는한 물질들의 전달, 또는 치료학적 제제의 전달이 바람직한 다수의 상이한 시나리오들에서 사용될 수 있다. 검출 방법들은 시험관내 및 생체내 영상 방법들 둘 다의 영상, 예를 들면, 면역조직화학, 생물방광 영상(BLI), 자기 공명 영상(MRI), 양전자 방사 단층촬영(PET), 전자 현미경, X-선 컴퓨터처리된 단층촬영(X-ray computed tomography), 라만 영상, 광간섭 단층촬영(optical coherence tomography), 흡수 영상, 열 영상, 형광 반사 영상, 형광 현미경, 형광성 분자 단층촬영 영상(fluorescence molecμLar tomographic imaging), 핵 자기 공명 영상, X-선 영상, 초음파 영상, 광음향 영상, 실험실 검정들(lab assays), 또는 태그화(tagging)/염색/영상이 요구되는 어떠한 상황도 포함한다.
예를 들면, 본원에 기술된 변형된 뉴클레오사이드, 변형된 뉴클레오타이드, 및 변형된 핵산은 유도된 다능성 줄기 세포들(iPS 세포들)을 재프로그램하는데 사용될수 있으며, 당해 줄기 세포들은 이후 사용되어 집단내에서 전체 세포들과 비교하여 형질감염된 세포들을 직접 추적할 수 있다. 다른 예에서, 링커를 통해 변형된 핵산에 부착되고 형광적으로 표지된 약물을 사용하여 약물을 생체내에서, 예를 들면, 세포내적으로 추적할 수 있다. 다른 예들은 세포들내로의 가역성 약물 전달에 있어 변형된 핵산의 사용을 포함한다.
본원에 기술된 변형된 뉴클레오사이드, 변형된 뉴클레오타이드, 및 변형된 핵산은 페이로드, 예를 들면, 검출가능한 제제 또는 치료학적 제제들을 구체적인 세포기관으로 세포내 표적화하는데 사용될 수 있다. 예시적인 세포내 표적들은 억제제를 포함하는 mRNA에 연결된 핵 국재화 서열(NLS), 또는 진전된 mRNA 프로세싱을 위한 핵 국제화를 포함할 수 있다.
또한, 본원에 기재된 변형된 뉴클레오사이드, 변형된 뉴클레오타이드, 및 변형된 핵산을 사용하여 치료학적 제제들을 세포들 또는 조직들로, 예를 들면, 살아있는 동물들에서 전달할 수 있다 예를 들면, 본원에 기술된 변형된 뉴클레오사이드, 변형된 뉴클레오타이드, 및 변형된 핵산을 사용하여 고도로 극성인 화학치료학적 제제들을 전달하여 암 세포들을 사멸할 수 있다. 링커를 통해 치료학적 제제들에 부착된 변형된 핵산들은 구성원 침투를 촉진시켜 치료학적 제제가 세포내로 이동하도록 함으로써 세포내 표적에 도달하도록 할 수 있다.
다른 예에서, 변형된 뉴클레오사이드, 변형된 뉴클레오타이드, 및 변형된 핵산을 절단가능한 링커를 통해 바이러스 억제성 펩타이드(VIP)에 부착시킬 수 있다. 절단가능한 링커는 VIP 및 염료를 세포내로 방출할 것이다. 다른 예에서, 변형된 뉴클레오사이드, 변형된 뉴클레오타이드, 및 변형된 핵산은 링커를 통해 콜레라 독소, 디프테리아 독소, 및 백일해 독소와 같은 일부 세균 독소들의 작용들에 관여하는 ADP-리보실레이트에 부착시킬 수 있다. 이들 독소 단백질들은 사람 세포들 속에서 표적 단백질들을 변형시키는 ADP-리보실트랜스퍼라제들이다. 예를 들면, 콜레라 독소는 G 단백질을 ADP-리보실화시켜 소장의 내층(lining)으로부터 거대한 유액 분비를 유발하여 생명을 위협하는 설사를 일으킨다.
약제학적 조성물들
본 개시는, 변형된 mRNA들로부터 생성된 단백질들을 제공한다. 약제학적 조성물들은 하나 이상의 추가의 치료학적으로 활성인 물질들을 임의로 포함할 수 있다. 일부 실시형태들에 따라서, 이를 필요로 하는 대상체에게 전달될 하나 이상의 단백질들을 암호화하는 변형된 핵산들을 포함하는 약제학적 조성물들을 투여하는 방법이 제공된다. 일부 실시형태에서, 조성물들은 사람들에게 투여된다. 본 개시의 목적을 위해, 어구 "활성 성분"은 일반적으로 본원에 기술된 바와 같은 단백질, 단백질 암호화 또는 단백질-함유 복합체를 말한다.
본원에 제공된 약제학적 조성물들의 기술들이 원칙적으로 사람들에게 투여하기에 적합한 약제학적 조성물들에 관한 것이라고 해도, 당해 분야의 숙련가는, 이러한 조성물들이 일반적으로 모든 종류의 동물들에게 투여하기 적합함을 이해할 것이다. 조성물들이 다양한 동물들에 투여하기에 적합하도록 하기 위해서 사람들에게 투여하기 적합한 약제학적 조성물들을 변형시키는 것은 잘 이해되며, 통상의 숙련된 기술을 가진 가축 약리학자는 단지 통상의, 경우에 따라, 실험을 설계하고/하거나 수행할 수 있다. 약제학적 조성물들의 투여가 고려되는 대상체들은 사람 및/또는 다른 영장류들; 소, 돼지들, 말들, 양, 고양이들, 개들, 마우스들, 및/또는 랫트들과 같은 시판되는 관련 포유동물들; 및/또는 닭들, 오리들, 거위들 및/또는 칠면조들과 같은 시판되는 관련 조류들을 포함하는 조류들을 포함하는 포유동물들을 포함하나,이에 한정되지 않는 것으로 고려된다.
본원에 기술된 약제학적 조성물들의 제형들은 약리학 분야에서 공지되거나 이후 개발된 어떠한 방법에 의해서도 제조할 수 있다. 일반적으로,이러한 제조 방법들은 활성 성분을 부형제 및/또는 하나 이상의 다른 보조 성분들과 연합시키는 단계, 및 이후에, 필요할 경우 및/또는 바람직할 경우, 생성물을 바람직한 단일- 또는 다중-용량 단위로 성형(shaping)하고/하거나 포장하는 단계를 포함한다.
본 개시에 따르는 약제학적 조성물은 단일 단위 용량으로서, 및/또는 다수의 단일 단위 용량들로서 벌크(bulk)로 제조되고/되거나, 포장되고/되거나 시판될 수 있다. 본원에 사용된 것으로서, "단위 용량"은 소정의 양의 활성 성분을 포함하는 약제학적 조성물의 별개의 양이다. 활성 성분의 양은 일반적으로 대상체에게 투여될 수 있는 활성 성분의 용량과 동일하고/하거나 예를 들면, 이러한 용량의 1/2 또는1/3과 같이, 이러한 용량의 편리한 분획이다.
본 개시에 따른 약제학적 조성물 중의 활성 성분, 약제학적으로 허용되는 부형제, 및/또는 어떠한 추가의 성분들의 상대적인 양들은 치료된 대상체의 실체, 크기 및/또는 상태에 따라서 및 추가로 당해 조성물이 투여되는 경로에 따라서 변할 것이다.
약제학적 제형들은 본원에 사용된 것으로서 바람직한 특정 용량형에 적합한 것으로서, 어떠한 및 모든 용매들, 분산 매질들, 희석제들, 또는 다른 액체 비히클들, 분산제들, 현탁 보조제들, 표면 활성제들, 등장성 제제들, 증점제들, 유화제들, 방부제들, 고체 결합제들, 윤활제들 등을 포함한다. 문헌[참조: Remington's The Science and Practice of Pharmacy, 21st Edition, A. R. Gennaro(Lippincott, Williams & Wilkins, Baltimore, MD, 2006; 본원에 참조로 혼입됨]은 약제학적 조성물들을 제형화하는데 사용되고 이의 제조를 위한 공지된 기술들에서 사용된 각종 부형제들을 기재하고 있다. 어떠한 통상의 부형제 매질이 어떠한 바람직하지 않은 생물학적 효과를 생산하거나 또는 달리는 약제학적 조성물의 어떠한 다른 성분(들)과 유해한 방식으로 상호작용함에 의한 것과 같이, 물질 또는 이의 유도체와 비혼화성인 것을 제외하고는, 이의 용도는 본 개시의 범위 내에 있는 것으로 고려된다.
일부 실시형태에서, 약제학적으로 허용되는 부형제는 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 또는 100% 순수하다. 일부 실시형태에서, 부형제는 사람들용으로 및 수의학용으로 승인되어 있다. 일부 실시형태에서, 부형제는 미국 식품의약국(United States Food and Drug Administration)에 의해 승인되어 있다. 일부 실시형태에서, 부형제는 약제학적 등급이다. 일부 실시형태에서, 부형제는 미국 약전(USP), 유럽 약전(EP), 영국 약전, 및/또는 국제 약전의 표준들을 충족한다.
약제학적 조성물들의 제조 시 사용된 약제학적으로 허용되는 부형제들은 불활성 희석제들, 분산 및/또는 과립화제들, 표면 활성제들 및/또는 유화제들, 붕해제들, 결합제들, 방부제들, 완충제들, 윤활제들, 및/또는 오일들을 포함하나, 이에 한정되지 않는다. 이러한 부형제들은 약제학적 제형들 속에 임의로 포함될 수 있다. 코코아 버터 및 좌제 왁스들과 같은 부형제들, 착색제들, 피복제들, 감미제들, 풍미제들 및/또는 향미제들은 제형업자들의 판단에 따라서, 조성물 속에 존재할 수 있다.
예시적인 희석제들은 탄산칼슘, 탄산나트륨, 인산칼슘, 인산이칼슘, 황산칼슘, 인산수소칼슘, 인산나트륨 락토즈, 슈크로즈, 셀룰로즈, 미세결정성 셀룰로즈, 카올린, 만니톨, 소르비톨, 이노시톨, 염화나트륨, 무수 전분, 옥수수 전분, 분말화된 당 등, 및/또는 이들의 조합들을 포함하나, 이에 한정되지 않는다.
예시적인 과립화제 및/또는 분산제들은 감자 전분, 옥수수 전분, 타피오카 전분, 나트륨 전분 글리콜레이트, 점토들, 알긴산, 구아 검, 감귤 펄프(citus pμLp), 한천, 벤토나이트, 셀룰로즈 및 나무 제품들, 천연 스폰지, 양이온-교환 수지들, 탄산칼슘, 실리케이트들, 탄산나트륨, 가교결합된 폴리(비닐-피롤리돈)(크로스포비돈), 나트륨 카복시메틸 전분(나트륨 전분 글리콜레이트), 카복시메틸 셀룰로즈, 가교결합된 나트륨 카복시메틸 셀룰로즈(크로스카멜로즈), 메틸셀룰로즈, 예비젤라틴화된 전분(전분 1500), 미세결정성 전분, 수 불용성 전분, 칼슘 카복시메틸 셀룰로즈, 마그네슘 알루미늄 실리케이트[비굼(VeegμM)], 나트륨 라우릴 설페이트, 4급 암모늄 화합물들 등, 및/또는 이들의 조합들을 포함하나, 이에 한정되지 않는다.
예시적인 표면 활성제들 및/또는 유화제들은 천연 유화제들(예를 들면, 아카시아, 한천, 알긴산, 알긴산나트륨, 트라가칸트, 콘드럭스(chondrux), 콜레스테롤, 크산탄, 펙틴, 젤라틴, 난황, 카제인, 모 지방, 콜레스테롤, 왁스, 및 레시틴), 콜로이드 점토들(예를 들면, 벤토나이트[알루미늄 실리케이트] 및 VeegμM®[마그네슘 알루미늄 실리케이트]), 장쇄 아미노산 유도체들, 고분자량 알코올들(예를 들면, 스테아릴 알코올, 세틸 알코올, 올레일 알코올, 트리아세틴 모노스테아레이트, 에틸렌 글리콜 디스테아레이트, 글리세릴 모노스테아레이트, 및 프로필렌 글리콜 모노스테아레이트, 폴리비닐 알코올), 카보머들(예를 들면, 카복시 폴리메틸렌, 폴리아크릴산, 아크릴산 중합체, 및 카복시비닐 중합체), 카라기난, 셀룰로즈성 유도체들(예를 들면, 카복시메틸셀룰로즈 나트륨, 분말화된 셀룰로즈, 하이드록시메틸 셀룰로즈, 하이드록시프로필 셀룰로즈, 하이드록시프로필 메틸셀룰로즈, 메틸셀룰로즈), 소르비탄 지방산 에스테르들(예를 들면, 폴리옥시에틸렌 소르비탄 모노라우레이트[Tween®20], 폴리옥시에틸렌 소르비탄 [Tween®60], 폴리옥시에틸렌 소르비탄 모노올레에이트[Tween®80], 소르비탄 모노팔미테이트[Span®40], 소르비탄 모노스테아레이트[Span®60], 소르비탄 트리스테아레이트[Span®65], 글리세릴 모노올레에이트, 소르비탄 모노올레에이트[Span®80]), 폴리옥시에틸렌 에스테르들(예를 들면, 폴리옥시에틸렌 모노스테아레이트 [Myrj®45], 폴리옥시에틸렌 수소화된 피마자 오일, 폴리에톡실화된 피마자 오일, 폴리옥시메틸렌 스테아레이트, 및 Solutol®), 슈크로즈 지방산 에스테르들, 폴리에틸렌 글리콜 지방산 에스테르들(예를 들면, Cremophor®, 폴리옥시에틸렌 에테르들, (예를 들면, 폴리옥시에틸렌 라우릴 에테르[Brij®30]), 폴리(비닐-피롤리돈), 디에틸렌 글리콜 모노라우레이트, 트리에탄올아민 올레에이트, 나트륨 올레에이트, 칼륨 올레에이트, 에틸 올레에이트, 올레산, 에틸 라우레이트, 나트륨 라우릴 설페이트, Pluronic®F 68, Poloxamer®188, 브롬화세트리모늄, 염화세틸피리디늄, 염화벤즈알코늄, 도쿠세이트 나트륨 등 및/또는 이들의 조합들을 포함하나, 이에 한정되지 않는다.
예시적인 결합제들은 전분(예를 들면, 옥수수 전분 및 전분 페이스트; 젤라틴; 당들(예를 들면, 슈크로즈, 글루코즈, 덱스트로즈, 덱스트린, 몰라쎄스, 락토즈, 락티톨, 만니톨); 천연 및 합성 검들(예를 들면, 아카시아, 알긴산나트륨, 아일랜드 이끼(Irish moss)의 추출물, 판와 검(panwar gμM), 가티 검(ghatti gμM), 이사폴 후스크들(isapol husks)의 점액, 카복시메틸셀룰로즈, 메틸셀룰로즈, 에틸셀룰로즈, 하이드록시에틸셀룰로즈, 하이드록시프로필 셀룰로즈, 하이드록시프로필 메틸셀룰로즈, 미세결정성 셀룰로즈, 셀룰로즈 아세테이트, 폴리(비닐-피롤리돈), 알긴산마그네슘 실리케이트(VeegμM®), 및 라크 아라보갈락탄; 알기네이트들; 폴리에틸렌 옥사이드; 폴리에틸렌 글리콜; 무기 칼슘 염들; 규산; 폴리메타크릴레이트들; 왁스들; 물; 알코올; 등; 및 이의 조합들을 포함하나, 이에 한정되지 않는다.
예시적인 방부제들은 항산화제들, 킬레이팅제들, 항미생물 방부제들, 항진균 방부제들, 알코올 방부제들, 산성 방부제들, 및/또는 다른 방부제들을 포함하나, 이에 한정되지 않는다. 예시적인 항산화제들은 알파 토코페롤, 아스코르브산, 아코르빌 팔미테이트, 부틸화된 하이드록시아니솔, 부틸화된 하이드록시톨루엔, 모노티오글리세롤, 칼륨 메타비스설파이트, 프로피온산, 프로필 갈레이트, 아스코르브산나트륨, 아황산수소나트륨, 나트륨 메타비스설파이트, 및/또는 아황나트륨을 포함하나, 이에 한정되지 않는다. 예시적인 킬레이트제들은 에틸렌디아민테트라아세트산(EDTA), 시트르산 일수화물, 이나트륨 에데테이트, 이칼륨 에데테이트, 에데트산, 푸마르산, 말산, 인산, 나트륨 에데테이트, 타르타르산, 및/또는 삼나트륨 에데테이트를 포함하나, 이에 한정되지 않는다. 예시적인 항미생물 방부제들은 벤즈알코늄 클로라이드, 벤즈토늄 클로라이드, 벤질 알코올, 브로노폴, 세트리마이드, 세틸피리듐 클로라이드, 클로르헥시딘, 클로부탄올, 클로로크레졸, 클로로크실레놀, 크레졸, 에틸 알코올, 글리세린, 헥세티딘, 이미두레아, 페놀, 페녹시에탄올, 페닐에틸 알코올, 페닐머큐릭 니트레이트, 프로필렌 글리콜, 및/또는 티메로살을 포함하나, 이에 한정되지 않는다. 예시적인 항진균 방부제들은 부틸 파라벤, 메틸 파라벤, 에틸 파라벤, 프로필 파라벤, 벤조산, 하이드록시벤조산, 칼륨 벤조에이트, 칼륨 소르베이트, 나트륨 벤조에이트, 나트륨 프로피오네이트, 및/또는 소르브산을 포함하나, 이에 한정되지 않는다. 예시적인 알코올 방부제들은 에탄올, 폴리에틸렌 글리콜, 페놀, 페놀성 화합물들, 비스페놀, 클로로부탄올, 하이드록시벤조에이트, 및/또는 페닐에틸 알코올을 포함하나, 이에 한정되지 않는다. 예시적인 산성 방부제들은 비타민 A, 비타민 C, 비타민 E, 베타-카로텐, 시트르산, 아세트산, 데하이드로아세트산, 아스코르브산, 소르브산, 및/또는 파이트산을 포함하나, 이에 한정되지 않는다. 다른 방부제들은 토코페롤, 토코페롤 아세테이트, 데테록심 메실레이트, 세트리마이드, 부틸화된 하이드록시아니솔(BHA), 부틸화된 하이드록시톨루엔(BHT), 에틸렌디아민, 나트륨 라우릴 설페이트(SLS), 나트륨 라우릴 에테르 설페이트(SLES), 아황산수소나트륨, 나트륨 메타비설파이트, 아황산칼륨, 칼륨 메타비설파이트, Glydant Plus®, Phenonip®, 메틸파라벤, Germall®115, Germaben®II, NeoloneTM, KathonTM, 및/또는 Euxyl®을 포함하나, 이에 한정되지 않는다.
예시적인 완충제들은 시트레이트 완충제 용액들, 아세테이트 완충액 용액들, 포스파이트 완충제 용액들 염화암모늄, 탄산칼슘, 염화칼슘, 시트르산칼슘, 칼슘글루비오네이트, 칼슘 글루셉테이트, 칼슘 글루코네이트, d-글루콘산, 칼슘 글리세로포스페이트, 칼슘 락테이트, 프로파노산, 칼슘 레불리네이트, 펜타노산, 이염기성 칼슘 포스페이트, 인산, 삼염기성 칼슘 포스페이트, 칼슘 하이드록사이드 포스페이트, 아세트산칼륨, 염화칼륨, 칼륨 글루코네이트, 칼륨 혼합물들, 이염기성 인산칼륨, 일염기성 인산칼륨, 인산칼륨 혼합물들, 아세트산나트륨, 중탄산나트륨, 염화나트륨, 시트르산나트륨, 락트산나트륨, 이염기성 인산나트륨, 일염기성 인산나트륨, 인산나트륨 혼합물들, 트로메타민, 수산화마그네슘, 수산화알루미늄, 알긴산, 발열물이 없는 물, 등장성 염수, 링거액(환er's solution), 에틸 알코올 등, 및/또는 이들의 조합들을 포함하나, 이에 한정되지 않는다.
예시적인 윤활제들은 스테아르산마그네슘, 스테아르산칼슘, 스테아르산, 실리카, 활석, 맥아, 글리세릴 베헤네이트, 수소화된 야채 오일들, 폴리에틸렌 글리콜, 벤조산나트륨, 아세트산나트륨, 염화나트륨, 루이신, 마그네슘 라우릴 설페이트, 나트륨 라우릴 설페이트 등, 및 이들의 조합들을 포함하나, 이에 한정되지 않는다.
예시적인 오일들은 알몬드, 행인(apricot kernel), 아보카도, 바바쑤(babassu), 베르가못(bergamot), 블랙 커런트 종자(black current seed), 서양지치, 두송(cade), 카모밀레(camomile), 카놀라, 캐러웨이(caraway), 카르나우바(carnauba), 피마자, 신나몬, 코코아 버터, 코코넛, 대구 간, 커피, 옥수수, 면화씨, 에뮤(emu), 유칼립투스, 달맞이꽃, 어류, 아마씨, 게라니올(geraniol), 박, 포도씨, 개암(hazel nut), 히솝풀(hyssop), 이소프로필 미리스테이트, 호호바(jojoba), 쿠쿠이 너트(kukui nut), 라반딘(lavandin), 라벤더, 레몬, 릿세아 쿠베바(litsea cubeba), 마카데미아 견과(macademia nut), 아욱, 망고 종자, 메도우폼 종자(meadowfoam seed), 밍크, 육두구(nutmeg), 올리브, 오렌지, 오렌지 러피(orange roughy), 야자, 야자핵, 복숭아 핵, 땅콩, 양귀비 종자, 호박 종자, 평지씨, 쌀겨, 로즈마리, 잇꽃, 백단, 사스쿠아나(sasquana), 사보우리(savoury), 산자나무, 참깨, 시어 버터(shea butter), 실리콘, 대두, 해바라기꽃, 차 나무, 엉겅퀴, 동백, 베티베르풀(vetiver), 호두, 및 맥아 오일들을 포함하나, 이에 한정되지 않는다. 예시적인 오일들은 부틸 스테아레이트, 카프릴릭 트리글리세라이드, 카프릭 트리글리세라이트, 사이클로메티콘, 디에틸 세바케이트, 디메티콘 360, 이소프로필 미리스테이트, 광 오일, 옥틸도데카놀, 올레일 알코올, 실리콘 오일, 및/또는 이들의 조합들을 포함하나, 이에 한정되지 않는다.
경구 및 비경구 투여용의 액체 용량형들은 약제학적으로 허용되는 유제들, 미세유제들, 액제들, 현탁제들, 시럽들, 및/또는 엘릭서르들(elixirs)을 포함하나, 이에 한정되지 않는다. 활성 성분들 외에, 액체 용량형들은 예를 들면, 물 또는 다른 용매들, 가용화제들, 및 에틸 알코올, 이소프로필 알코올, 에틸 카보네이트, 에틸 아세테이트, 벤질 알코올, 벤질 벤조에이트, 프로필렌 글리콜, 1,3-부틸렌 글리콜, 디메틸포름아미드, 오일들(특히, 목화씨, 땅콩(groundnut), 옥수수, 미생물(germ), 올리브, 피마자, 및 참깨 오일들), 글리세롤, 테트라하이드로푸르푸릴 알코올, 폴리에틸렌 글리콜들 및 소르비탄의 지방산 에스테르들, 및 이들의 혼합물들과 같은 유화제들과 같이 당해 분야에서 일반적으로 사용된 불활성 희석제들을 포함할 수 있다. 불활성 희석제들 외에, 경구 조성물들은 습윤제들, 유화 및 현탁화제들, 감미제, 풍미제 및/또는 향미제와 같은 보조제들을 포함할 수 잇다. 비경구 투여용의 특정 실시형태에서, 조성물들은 Cremophor®, 알코올들, 오일들, 변형된 오일들, 글리콜들, 폴리소르베이트들, 사이클로덱스트린들, 중합체들, 및/또는 이의 조합들과 같은 가용화제들과 혼합된다.
주사가능한 제제들, 예를 들면, 멸균 주사가능한 수성 또는 유성 현탁액들은 적합한 분산제들, 습윤제들, 및/또는 현탁제들을 사용하여 공지된 기술에 따라 제형화될 수 있다. 멸균 주사가능한 제제들은, 예를 들면, 1,3-부탄디올 중 용액으로서 비독성의 비경구적으로 허용되는 희석제들 및/또는 용매들 중의 멸균 주사가능한 액제들, 현탁제들, 및/또는 유제들일 수 있다. 사용될 수 있는 허용되는 비히클들 및 용매들 중에는, 물, 링거액, U.S.P., 및 등장성 염화나트륨 용액이 있다. 멸균성의, 고정 오일들은 용매 또는 현탁 매질로서 편리하게 사용된다. 당해 목적을 위해 합성 모노- 또는 디글리세라이드들을 포함하는 어떠한 배합물 고정된 오일도 사용할 수 있다. 올레산과 같은 지방산들도 주사가능한 제제에서 사용될 수 있다.
주사가능한 제형들은 예를 들면, 세균 보유 여과기를 통한 여과에 의해, 및/또는 사용 전에 멸균수 또는 다른 멸균 주사가능한 매질 속에 용해되거나 분산될 수 있는 멸균 고체 조성물들의 형태인 멸균화제들을 혼입시킴으로써 멸균시킬 수 있다.
활성 성분의 효과를 연장시키기 위하여, 피하 또는 근육내 주사로부터 활성 성분의 흡수를 늦추는 것이 흔히 바람직하다. 이는 수 용해도가 불량한 결정성 또는 무정형 물질의 액체 현탁액의 사용으로 달성할 수 있다. 이후에, 약물의 흡수율은 최종적으로 결정 크기 및 결정성 형태에 의존할 수 있는, 이의 용해율에 의존한다. 달리는, 비경구적으로 투여된 약물 형태의 지연된 흡수는 약물을 오일 비히클(oil vehicle) 속에 용해시키거나 현탁시킴으로써 달성한다. 주사가능한 데포트 형태(depot form)들은 약물의 미세봉입 매트릭스(microencapsule matrix)들을 폴리락타이드-폴리글리콜라이드와 같은 생분해성 중합체들 속에 형성시킴으로써 제조된다. 중합체에 대한 약물의 비 및 사용된 특정 중합체의 특성에 따라, 약물 방출의 비가 조절될 수 있다. 다른 생분해가능한 중합체들의 예들은 폴리(오르토에스테르들) 및 폴리(무수물들)을 포함한다. 데포트 주사가능한 제형들은 약물을 체조직들과 혼화성인 리포좀들 또는 미세유제들 속에 포괄(entrapping)시켜 제조한다.
직장 또는 질 투여용 조성물들은 대표적으로 조성물들을 적합한 비-자극성 부형제들, 예를 들면, 코코아 버터, 폴리에틸렌 글리콜 또는 주위 온도에서 고체이지만 체온에서는 액체여서 직장 또는 질강 속에서 용융되어 활성 성분을 방출하는 좌제 왁스와 같은 적합한 비-자극성 부형제들과 혼합시켜 제조할 수 있는 좌제들이다.
경구 투여용의 고체 용량형들은 캅셀제들, 정제들, 환제들, 산제들, 및 입제들(granules)을 포함한다. 이러한 고체 용량 형들에서, 활성 성분은 적어도 하나의 불활성의, 약제학적으로 허용되는 부형제, 예를 들면, 시트르산나트륨 또는 인산이칼슘 및/또는 충전제들 또는 증량제들(예를 들면, 전분들, 락토즈, 슈크로즈, 글루코즈, 만니톨, 및 실릭산), 결합제들(예를 들면, 카복시메틸셀룰로즈, 알기네이트들, 젤라틴, 폴리비닐피롤리돈, 슈크로즈, 및 아카시아), 습윤제들(예를 들면, 글리세롤), 붕해제들(예를 들면, 한천, 탄산칼슘, 감자 또는 타피오카 전분, 알긴산, 특정의 실리케이트들, 및 탄산나트륨), 용액 지연제들(예를 들면, 파라핀), 흡수 가속화제들(예를 들면, 4급 암모늄 화합물들), 습윤제들(예를 들면, 세틸 알코올 및 글리세롤 모노스테아레이트), 흡수제들(예를 들면, 카올린 및 벤토나이트 점토), 및 윤활제들(예를 들면, 활석, 스테아르산칼슘, 스테아르산마그네슘, 고체 폴리에틸렌 글리콜들, 나트륨 라우릴 설페이트), 및 이들의 혼합물들과 혼합된다. 캅셀제, 정제들 및 환제들의 경우에, 용량형은 완충제들을 포함할 수 있다.
유사한 유형의 고체 조성물들은 락토즈 또는 유당 및 또한 고 분자량 폴리에틸렌 글리콜들 등과 같은 부형제들을 사용하여 연질- 및 경질-충전된 젤라틴 캅셀제들 속에 충전제들로서 사용될 수 있다. 정제들, 당의정제들, 캅셀제들, 환제들, 및 입제들의 고체 용량형들은 장용성 피복물들 및 약제학적 제형 분야에 잘 공지된 다른 피복물들과 같은 피복물들 및 쉘(shell)들을 사용하여 제조할 수 있다. 이들은 불투명화제들을 임의로 포함할 수 있으며, 이들이 활성성분(들)만을, 우선적으로는, 장관의 특정 부분에서, 임의로 지연된 방식으로 방출하는 조성물일 수 있다. 사용될 수 있는 봉매 조성물(embedding composition)의 예들은 중합체성 물질들 및 왁스들을 포함한다. 유사한 유형의 고체 조성물들은 락토즈 또는 유당 및 또한 고분자량 폴리에틸렌 글리콜 등과 같은 부형제들을 사용하여 연질 및 경질-충전된 젤라틴 캅셀들 속에 충전제들로서 사용될 수 있다.
조성물의 국소 및/또는 경피 투여의 용량형들은 연고제들, 페이스트제들, 크림제들, 로션제들, 겔제들, 산제들, 액제들, 스프레이들, 흡입제들 및/또는 패취제들을 포함할 수 있다. 일반적으로, 활성 성분은 필요할 수 있는 약제학적으로 허용되는 부형제 및/또는 어떠한 필요한 방부제들 및/또는 완충제들과 멸균 조건들하에 혼합한다. 추가로, 본 기개내용은 경피 패취들의 사용을 고려하며, 이는 흔히 체내로 화합물의 조절된 전달을 제공하는 추가된 장점을 갖는다. 이러한 용량형들은 예를 들면, 화합물을 적절한 매질 속에 용해시키고/시키거나 분산시켜 제조할 수 있다. 달리는 또는 추가로, 비는 비 조절 막을 제공하고/하거나 화합물을 중합체 매트릭스 및/또는 겔 속에 분삭시켜 조절할 수 있다.
본원에 기술된 경피 약제학적 조성물들을 전달하는데 사용하기에 적합한 장치들은 미국 특허들 제4,886,499호; 제5,190,521호; 제5,328,483호; 제5,527,288호; 제4,270,537호; 제5,015,235호; 제5,141,496호; 및 제5,417,662호에 기술된 것들과 같은 짧은 바늘 장치들(short needle devices)을 포함한다. 경피 조성물들은 PCT 공보 제WO 99/34850호에 기술된 것들 및 이의 기능성 등가물들과 같은, 피부내로의 침의 효과적인 침투길이를 제한하는 장치들에 의해 투여될 수 있다. 액체 조성물들을 액체 제트 주사기(jet injector) 및/또는 각질층을 뚫는 침을 통해 피부에 전달하고 피부에 도달하는 제트를 생산하는 제트 주사 장치들이 적합하다. 제트 주사 장치들은 예를 들면, 미국 특허들 제5,480,381호; 제5,599,302호; 제5,334,144호; 제5,993,412호; 제5,649,912호; 제5,569,189호; 제5,704,911호; 제5,383,851호; 제5,893,397호; 제5,466,220호; 제5,339,163호; 제5,312,335호; 제5,503,627호; 제5,064,413호; 제5,520,639호; 제4,596,556호; 제4,790,824호; 제4,941,880호; 제4,940,460호; 및 PCT 공보들 제WO 97/37705호 및 제WO 97/13537호에 기술되어 있다. 압축 가스를 사용하여 분말 형의 백신을 피부(skin)의 외부 층들을 통해 진피(dermis)로 가속화시키는 탄도 분말(Ballistic powder)/입자 전달 장치가 적합하다. 달리는 또는 추가로, 통상의 주사기들을 피내 투여의 전통적인 망투 방법(mantoux method)에서 사용할 수 있다.
국소 투여에 적합한 제형들은 연고제, 로션제, 수중유 및/또는 유중수 유액들, 예를 들면, 크림제들, 연고제들 및/또는 페이스트제들, 및/또는 액제들 및/또는 현탁제들과 같은 액체 및/또는 반액체 제제들을 포함하나, 이에 한정되지 않는다. 국소 투여가능한 제형들은, 활성 성분의 농도가 용매 속에서 활성 성분의 용해도 한계와 같이 높을 수 있다고 해도, 예를 들면, 약 1% 내지 약 10%(w/w)의 활성 성분을 포함할 수 있다. 국소 투여용 제형들은 본원에 기술된 추가의 성분들 하나 이상을 추가로 포함할 수 있다.
약제학적 조성물은 볼 내강(buccal cavity)을 통해 폐 투여용으로 적합한 제형 속에서 제조되고/되거나, 포장되고/되거나 시판될 수 있다. 이러한 제형은 활성 성분을 포함하고 직경이 약 0.5 nm 내지 약 7 nm 또는 약 1 nm 내지 약 6 nm 범위인 무수 입자들을 포함할 수 있다. 이러한 조성물들은 편리하게는, 추진제의 스트림(stream)이 분말을 분산하도록 지시하는 무수 분말 저장기(reservoir)를 포함하는 장치를 사용하고/하거나 밀봉된 용기 속에서 저-비등 추진제 속에 용해되고/되거나 현탁된 활성 성분을 포함하는 장치와 같은 자가 추진 용매/분말 분산 용기를 사용하는 투여용 무수 분말들의 형태로 존재한다. 이러한 분말들은, 입자들의 적어도 98 중량%가 0.5 nm 이상의 직경을 갖고 입자들의 적어도 95 수 %(% by number)가 7 nm 미만의 직경을 갖는 입자들을 포함한다. 달리는, 적어도 입자들의 95 중량%가, 직경이 1 nm 이상이고 입자들의 적어도 90 수 %가, 직경이 6 nm 미만이다. 무수 분말 조성물들은 당과 같은 고체 미세 분말 희석제를 포함할 수 있으며 편리하게는 단위 용량 형태로 제공된다.
저 비등 추진제들은 일반적으로, 대기압에서 비점이 65℉ 이하인 액체 주진제들을 포함한다. 일반적으로 추진제는 조성물의 50% 내지 99.9%(w/w)를 구성할 수 있으며, 활성 성분은 조성물의 0.1% 내지 20%(w/w)를 구성할 수 있다. 추진제는 액체 비-이온성 및/또는 고체 음이온성 표면활성제 및/또는 고체 희석제(이는 활성 성분을 포함하는 입자들과 동일한 정도의 입자크기를 가질 수 있다)와 같은 추가의 성분들을 또한 포함할 수 있다.
폐 전달용으로 제형화된 약제학적 조성물들은 액제 및/또는 현탁제의 소적(droplet)들 형태의 활성 성분을 제공할 수 있다. 이러한 제형들은 활성 성분을 포함하는, 임의로 멸균된 수성 및/또는 희석 알코올성 액제들 및/또는 현탁제들로서 제조되고/되거나, 포장되고/되거나 시판될 수 있으며, 편리하게는 어떠한 분무 및/또는 미립자화 장치를 사용하여 투여될 수 있다. 이러한 제형들은 사카린 나트륨, 휘발성 오일, 완충제, 표면 활성제, 및/또는 메틸하이드록시벤조에이트와 같은 방부제와 같은 풍미제를 포함하나, 이에 한정되지 않는 하나 이상의 추가의 성분들을 추가로 포함할 수있다. 이러한 투여 경로에 의해 제공된 소적들은, 평균 직경이 약 0.1 nm 내지 약 200 nm의 범위일 수 있다.
폐 전달용으로 유용한 본원에 기술된 제형들은 약제학적 조성물의 비강 전달용으로 유용하다. 비강 투여용으로 적합한 다른 제형은 활성 성분을 포함하고 평균 입자 크기가 약 0.2 μm 내지 500 μm인 조악한 분말이다. 이러한 제형은, 코가 취하는 방식, 즉, 코에 근접하게 유지된 분말의 용기로부터 비강 통로를 통한 신속한 흡입에 의해 투여된다.
비강 투여용으로 적합한 제형들은 예를 들면, 0.1%(w/w)로 적은 및 100%(w/w)로 많은 활성 성분을 포함할 수 있으며, 본원에 기술된 하나 이상의 추가의 성분들을 포함할 수 있다. 약제학적 조성물은 볼내 투여용으로 적합한 제형으로 제조되고/되거나, 포장되고/되거나 시판된다. 이러한 제형들은 예를 들면, 통상의 방법들을 사용하여 제조된 정제들 및/또는 로젠지제들(lozenges)의 형태일 수 있고, 경구적으로 용해가능하고/하거나 분해가능한 조성물, 및 임의로 본원에 기술된 하나 이상의 추가의 성분들을 균형량으로 포함하는, 예를 들면, 0.1% 내지 20%(w/w)의 활성 성분일 수 있다. 달리는, 볼 투여용으로 적합한 제형들은 활성 성분을 포함하는 산제 및/또는 에어로졸화되고/되거나 미립자화된 용액 및/또는 현탁액을 포함할 수 있다. 이러한 분말화되고/되거나, 에어로졸화되고/되거나 에어로졸화된 제형들은, 분산되는 경우, 평균 입자 크기 및/또는 소적 크기가 약 0.1 nm 내지 약 200 nm의 범위일 수 있고, 본원에 기술된 어떠한 추가의 성분들 중 하나 이상을 추가로 포함할 수 있다.
약제학적 조성물은 안과 투여용으로 적합한 제형으로 제조되고/되거나, 포장되고/되거나 시판될 수 있다. 이러한 제형들은 예를 들면, 수성 또는 유성 액체 부형제 속의 활성 성분의 0.1/1.0%(w/w) 용액 및/또는 현탁액을 포함하는 눈 점적제들의 형태일 수 있다. 이러한 점적제들은 완충제들, 염들, 및/또는 본원에 기술된 하나 이상의 다른 어떠한 추가의 성분들을 추가로 포함할 수 있다. 유용한 다른 안과적으로 투여가능한 제형들은 미세결정성 형태 및/또는 리포좀 제제들 속에 활성 성분을 포함하는 것들을 포함한다. 귀 점적제 및/또는 눈 점적제들이 본 개시의 범위 내에 있는 것으로 고려된다.
제형 및/또는 약제학적 제제들의 제조에 있어서 일반적인 고려사항들은 예를 들면, 문헌[참조: Remington : The Science and Practice of Pharmacy 21st ed., Lippincott Williams & Wilkins, 2005(본원에 참조로 혼입된)]에서 찾을 수 있다.
투여
본 개시는 이를 필요로 하는 대상체에게 본 개시에 따른 단백질들 또는 복합체들을 투여함을 포함하는 방법들을 제공한다. 단백질들 또는 복합체들, 또는 이들의 약제학적, 영상, 진단, 또는 예방학적 조성물들은 질병, 질환, 및/또는 상태(예를 들면, 작업 기억 결손들과 관련된 질병, 질환, 및/또는 상태)를 예방하거나, 치료하거나, 진단하거나, 영상화하는데 효과적인 어떠한 투여 경로 및 어떠한 양을 사용하여 대상체에게 투여될 수 있다. 요구되는 정확한 양은 대상체의 종들, 연령, 및 일반적인 상태, 질병의 중증도, 특정 조성물, 이의 투여 방식, 이의 활성 방식 등에 따라, 대상체마다 변할 것이다. 본 개시에 따른 조성물들은 용량의 투여 및 균일성을 용이하게 하기 위한 용량 단위 형태로 전형적으로 제형화된다. 그러나, 본 개시의 조성물들의 전체 1일 사용은 건전한 의학적 판단(sound medical judgment)의 영역내에서 주치의에 의해 결정될 것이다. 어떠한 특정 환자에 대한 구체적인 치료학적으로 효과적이거나, 예방학적으로 효과적이거나, 또는 적절한 영상 용량 수준은 치료되는 질환 및 질환의 중증도; 사용된 구체적인 화합물의 활성; 사용된 구체적인 조성물; 환자의 연령, 체중, 일반적인 건강, 성별 및 식이; 투여 시간, 투여 경로; 및 사용된 구체적인 화합물의 배출율; 치료 기간; 사용된 구체적인 화합물과 함께 또는 동시에 사용된 약물들; 및 의학 분야에 잘 공지된 유사 인자들을 포함하는 각종 인자들에 의존할 것이다.
전달될 단백질들 및/또는 이들의 약제학적, 예방학적, 또는 영상 조성물들은 포유동물들(예를 들면, 사람들, 애완 동물들, 고양이들, 개들, 마우스들, 랫트들 등)과 같은 동물들에게 투여될 수 있다. 일부 실시형태에서, 이들의 약제학적, 예방학적, 진단학적, 또는 영상 조성물들은 사람들에게 투여된다.
본 개시에 따라서 전달될 단백질들 및/또는 이들의 약제학적, 예방학적, 진단학적, 또는 영상 조성물들은 어떠한 경로에 의해서도 투여될 수 있다. 일부 실시형태에서, 단백질들 및/또는 이들의 약제학적, 예방학적, 진단학적, 또는 영상 조성물들은 경구, 정맥내, 근육내, 동맥내, 골수내, 동맥내, 피하, 심실내, 경피, 피내, 직장, 질내, 복강내, 국소(예를 들면, 산제들, 연고제들, 크림제들, 겔제들, 로션제들, 및/또는 점적제들에 의해), 점막, 비강, 볼내, 장내, 유리체내, 종양내, 설하를 포함하는 각종 경로들 중 하나 이상에 의해; 기관내 설치(intratracheal instillation), 기관지 설치(bronchial instillation), 및/또는 흡입에 의해; 경구 스프레이, 비강 스프레이 및/또는 에어로졸로서, 및/또는 문맥 카테테르(portal vein catheter)를 통해 투여된다. 일부 실시형태에서, 단백질들 또는 복합체들, 및/또는 이들의 약제학적, 예방학적, 진단학적, 또는 영상 조성물들은 전신계 정맥내 주사에 의해 투여된다. 구체적인 실시형태에서, 단백질들 또는 복합체들 및/또는 이들의 약제학적, 예방학적, 진단학적, 또는 영상 조성물들은 정맥내로 및/또는 경구적으로 투여된다. 구체적인 실시형태에서, 단백질들 또는 복합체들, 및/또는 이들의 약제학적, 예방학적, 진단학적, 또는 영상 조성물들은, 단백질 또는 복합체가 혈액-뇌 장벽, 혈관 장벽, 또는 다른 상피 장벽을 횡단하도록 하는 방식으로 투여될 수 있다.
그러나, 본 개시는, 단백질들 또는 복합체들, 및/또는 이들의 약제학적, 예방학적, 진단학적, 또는 영상 조성물들이 약물 전달 과학들에서 그럴듯하게 진보한 것으로 고려되는 어떠한 적절한 경로에 의해 전달되는 것을 포함한다
일반적으로, 가장 적절한 투여 경로는 전달될 적어도 하나의 제제과 관련된 단백질들 또는 단백질들을 포함하는 복합체의 특성(예를 들면, 위장관의 환경에서의 이의 안전성, 혈류 등), 환자의 상태(예를 들면, 환자가 특정한 투여 경로들을 견딜 수 있는지의 여부) 등을 포함하는 각종의 인자들에 의존할 것이다. 본 개시는 약물 전달 과학들에서 진전된 것으로 고려되는 어떠한 적절한 경로에 의한 약제학적, 예방학적, 진단학적, 또는 영상 조성물들의 전달을 포함한다.
특정 실시형태에서, 본 기내내용에 따른 조성물들은 1일에 대상체의 체중 당 약 0.0001 mg/kg 내지 약 100 mg/kg, 약 0.01 mg/kg 내지 약 50 mg/kg, 약 0.1 mg/kg 내지 약 40 mg/kg, 약 0.5 mg/kg 내지 약 30 mg/kg, 약 0.01 mg/kg 내지 약 10 mg/kg, 약 0.1 mg/kg 내지 약 10 mg/kg, 또는 약 1 mg/kg 내지 약 25 mg/kg를 전달하기에 충분한 용량 수준들에서 하루에 1회 이상 투여함으로써 바람직한 치료학적, 진단학적, 예방학적, 또는 영상 효과를 수득할 수 있다. 바람직한 용량은 1일에 3회, 1일에 2회, 1일에 1회, 격일로, 매 3일마다, 매주, 매 2주마다, 매 3주마다, 또는 매 4주마다 전달될 수 있다. 특정 실시형태에서, 바람직한 용량은 다수의 투여들(예를 들면, 2회, 3회, 4회, 5회, 6회, 7회, 8회, 9회, 10회, 11회, 12회, 13회, 14회 이상의 투여들)을 사용하여 전달될 수 있다.
단백질들 또는 복합체들은 하나 이상의 다른 치료학적, 예방학적, 진단학적, 또는 영상 제제들과 함께 사용할 수 있다. "과 함께"는, 이들 전달 방법들이 본 기내내용의 범위 내에 있다고 해도, 제제들이 동일한 시간에 투여되어야만 하고/하거나 함께 전달하기 위해 제형화되어야 함을 함시하고자 하는 것은 아니다. 조성물들은 하나 이상의 다른 바람직한 치료제들 또는 의학 과정들과 동시에, 전에, 또는 후속적으로 투여될 수 있다. 일반적으로, 각각의 제제는 이러한 제제에 대해 결정된 용량 및/또는 시간 계획으로 투여될 것이다. 일부 실시형태에서, 본 기내내용은 이들의 생이용능을 개선시키고/시키거나, 이들의 대사를 감소시키고/시키거나 변형시키고, 이들의 배출을 억제하고/하거나 체내 이들의 분포를 변형시키는 제제들과 함께 약제학적, 예방학적, 진단학적, 또는 영상 조성물들의 전달을 포함한다.
함께 사용될 치료학적으로, 예방학적으로, 진단학적으로, 또는 영상 활성 제제들은 단일 조성물로 함께 투여되거나 상이한 조성물들 속에 별도로 투여될 수 있음이 또한 이해될 것이다. 일반적으로, 제제들은, 이들이 개별적으로 활용된 수준들을 초과하지 않는 수준들에서 이용되는 조합으로 활용됨이 예상된다. 일부 실시형태에서, 함께 활용될 수준들은 개별적으로 활용된 것들보다 낮을 것이다.
조합 치료요법에서 사용하기 위한 치료제들(치료제들 또는 과정들)의 특정 조합은 바람직한 치료제들 및/또는 과정들 및 달성될 바람직한 치료 효과의 혼용성을 고려할 것이다. 사용된 치료요법은 동일한 질환에 대해 바람직한 효과를 달성할 수 있거나(예를 들면, 본 기내내용에 따라 암을 치료하는데 유용한 조성물은 화학치료제와 동시에 투여될 수 있다), 이들은 상이한 효과들(예를 들면, 어떠한 부작용들의 조절)을 달성할 수 있음이 또한 이해될 것이다.
키트들(
kits
)
본 개시는 본 기내내용의 방법들을 편리하게 및/또는 효과적으로 수행하기 위한 각종 키트들을 제공한다. 전형적으로 키트들은, 사용자가 대상체(들)의 다중치료를 수행하도록 하고/하거나 다중 실험들을 수행하도록 하기에 충분한 양 및/또는 수의 성분들을 포함할 것이다.
한 양상에서, 본 개시는 번역가능한 영역 및 핵산 변형을 포함하는 제1의 분리된 핵산, 및 포장재 및 지시들을 포함하는, 단백질 생산용 키트들을 제공하며, 여기서, 핵산은, 제1의 분리된 핵산이 도입되는 세포의 선천성 면역 반응의 유도를 모면하거나 피할 수 있다.
한 양상에서, 당해 개시는: 번역가능한 영역을 포함하는 제1의 분리되고 변형된 핵산(단, 표적 세포내로 도입되는 경우 번역가능한 영역에 의해 암호화된 단백질의 바람직한 양을 생산하기에 효과적인 양으로 제공된다); 억제성 핵산을 포함하는 제2의 핵산(단, 세포의 선천성 면역 반응을 실질적으로 억제하는데 효과적인 양으로 제공된다); 및 포장재 및 지시들을 포함하는, 단백질 생산용 키트들을 제공한다.
한 양상에서, 본 개시는 번역가능한 영역 및 뉴클레오사이드 변형을 포함하는 제1의 분리된 핵산(여기서, 당해 핵산은 세포 뉴클레아제에 의한 감소된 분해를 나타낸다), 및 포장재 및 지시들을 포함하는, 단백질 생산용 키트들을 제공한다.
한 양상에서, 본 개시는 번역가능한 영역 및 적어도 2개의 상이한 뉴클레오사이드 변형들을 포함하는 제1의 분리된 핵산(여기서, 당해 핵산은 세포 뉴클레아제에 의한 감소된 분해를 나타낸다), 및 포장재 및 지시들을 포함하는, 단백질 생산용 키트들을 제공한다.
한 양상에서, 본 개시는 번역가능한 영역 및 적어도 하나의 뉴클레오사이드 변형들을 포함하는 제1의 분리된 핵산(여기서, 당해 핵산은 세포 뉴클레아제에 의한 감소된 분해를 나타낸다); 억제성 핵산을 포함하는 제2의 핵산; 포장재 및 지시들을 포함하는 단백질 생산용 키트들을 제공한다.
일부 실시형태에서, 제1의 분리된 핵산은 전령 RNA(mRNA)를 포함한다. 일부 실시형태에서 mRNA는 피리딘-4-온 리보뉴클레오사이드, 5-아자-우리딘, 2-티오-5-아자-우리딘, 2-티오우리딘, 4-티오-슈도우리딘, 2-티오-슈도우리딘, 5-하이드록시우리딘, 3-메틸우리딘, 5-카복시메틸-우리딘, 1-카복시메틸-슈도우리딘, 5-프로피닐-우리딘, 1-프로피닐-슈도우리딘, 5-타우리노메틸우리딘, 1-타우리노메틸-슈도우리딘, 5-타우리노메틸-2-티오-우리딘, 1-타우리노메틸-4-티오-우리딘, 5-메틸-우리딘, 1-메틸-슈도우리딘, 4-티오-1-메틸-슈도우리딘, 2-티오-1-메틸-슈도우리딘, 1-메틸-1-데아자-슈도우리딘, 2-티오-1-메틸-1-데아자-슈도우리딘, 디하이드로우리딘, 디하이드로슈도우리딘, 2-티오-디하이드로우리딘, 2-티오-디하이드로슈도우리딘, 2-메톡시우리딘, 2-메톡시-4-티오-우리딘, 4-메톡시-슈도우리딘, 4-메톡시-2-티오-슈도우리딘 또는 본원에 기재된 임의의 것으로 이루어진 그룹으로부터 선택되는 적어도 하나의 뉴클레오사이드를 포함한다.
일부 실시형태에서, mRNA는 5-아자-사이티딘, 슈도이소사이티딘, 3-메틸-사이티딘, N4-아세틸사이티딘, 5-포르밀사이티딘, N4-메틸사이티딘, 5-하이드록시메틸사이티딘, 1-메틸-슈도이소사이티딘, 피롤로-사이티딘, 피롤로-슈도이소사이티딘, 2-티오-사이티딘, 2-티오-5-메틸-사이티딘, 4-티오-슈도이소사이티딘, 4-티오-1-메틸-슈도이소사이티딘, 4-티오-1-메틸-1-데아자-슈도이소사이티딘, 1-메틸-1-데아자-슈도이소사이티딘, 제불라린, 5-아자-제불라린, 5-메틸-제불라린, 5-아자-2-티오-제불라린, 2-티오-제불라린, 2-메톡시-사이티딘, 2-메톡시-5-메틸-사이티딘, 4-메톡시-슈도이소사이티딘, 4-메톡시-1-메틸-슈도이소사이티딘 또는 본원에 기재된 임의의 것으로 이루어진 그룹으로부터 선택되는 적어도 하나의 뉴클레오사이드를 포함한다.
일부 실시형태에서, mRNA는 2-아미노퓨린, 2,6-디아미노퓨린, 7-데아자-아데닌, 7-데아자-8-아자-아데닌, 7-데아자-2-아미노퓨린, 7-데아자-8-아자-2-아미노퓨린, 7-데아자-2,6-디아미노퓨린, 7-데아자-8-아자-2,6-디아미노퓨린, 1-메틸아데노신, N6-메틸아데노신, N6-이소펜테닐아데노신, N6-(시스-하이드록시이소펜테닐)아데노신, 2-메틸티오-N6-(시스-하이드록시이소펜테닐) 아데노신, N6-글리시닐카바모일아데노신, N6-트레오닐카바모일아데노신, 2-메틸티오-N6-트레오닐 카바모일아데노신, N6,N6-디메틸아데노신, 7-메틸아데닌, 2-메틸티오-아데닌, 2-메톡시-아데닌 또는 본원에 기재된 임의의 것으로 이루어진 그룹으로부터 선택되는 적어도 하나의 뉴클레오사이드를 포함한다.
일부 실시형태에서, mRNA는 이노신, 1-메틸-이노신, 와이오신, 와이부토신, 7-데아자-구아노신, 7-데아자-8-아자-구아노신, 6-티오-구아노신, 6-티오-7-데아자-구아노신, 6-티오-7-데아자-8-아자-구아노신, 7-메틸-구아노신, 6-티오-7-메틸-구아노신, 7-메틸이노신, 6-메톡시-구아노신, 1-메틸구아노신, N2-메틸구아노신, N2,N2-디메틸구아노신, 8-옥소-구아노신, 7-메틸-8-옥소-구아노신, 1-메틸-6-티오-구아노신, N2-메틸-6-티오-구아노신, N2,N2-디메틸-6-티오-구아노신 또는 본원에 기재된 임의의 것으로 이루어진 그룹으로부터 선택되는 적어도 하나의 뉴클레오사이드를 포함한다.
다른 양상에서, 본 개시는 번역가능한 영역 및 뉴클레오사이드 변형을 포함하는 제1의 분리된 핵산, 및 제1의 핵산의 번역가능한 영역의 번역에 적합한 포유동물 세포를 포함하는, 단백질 생산용 조성물들을 제공하며, 여기서, 핵산은 세포 뉴클레아제에 의한 감소된 분해를 나타낸다.
정의들
본 명세서에서의 다양한 위치들에서, 본 개시의 화합물들의 치환체들은 그룹들 또는 범위들로 기재되어 있다. 본 개시는 이러한 그룹들 및 범위들의 구성원들의 각각의 및 모든 개개 소조합을 포함하는 것으로 구체적으로 의도된다. 예를 들면, 용어 "C1-6 알킬"은 메틸, 에틸, C3 알킬, C4 알킬, C5 알킬, 및 C6 알킬을 개별적으로 기재하는 것으로 구체적으로 의도된다.
약: 본원에 사용된 것으로서, 용어 "약"은 언급된 값의 +/- 10%를 의미한다.
함게 투여된: 본원에 사용된 것으로서, 용어 "함께 투여된" 또는 "조합된 투여"는, 2개 이상의 제제들이 대상체에게 동시에 또는 환자에서 각각의 제제의 효과가 오우버랩(overlap)될 수 있도록 하는 간격내에서 투여됨을 의미한다. 일부 실시형태에서,이들은 서로 약 60, 30, 15, 10, 5, 또는 1분내에 투여된다. 일부 실시형태에서, 제제들의 투여들은 함께 충분히 근접하게 간격을 두어 조합(예를 들면, 상승) 효과가 달성되도록 한다.
동물: 본원에 사용된 것으로서, 용어 "동물"은 동물계의 어떠한 구성원을 말한다. 일부 실시형태에서, "동물"은 발달의 어느 단계에서의 사람들을 말한다. 일부 실시형태에서, "동물"은 발달의 어느 단계에서의 비-사람 동물들을 말한다. 특정의 실시형태에서, 비-사람 동물은 포유동물(예를 들면, 설치류, 마우스, 랫트, 토끼, 원숭이, 개, 고양이, 양, 소, 영장류, 또는 돼지)이다. 일부 실시형태에서, 동물들은 포유동물들, 조류들, 파충류들, 양서류들, 어류, 및 벌레들을 포함하나, 이에 한정되지 않는다. 일부 실시형태에서, 동물은 유전자삽입 동물, 일반적으로-가공된 동물, 또는 클론(clone)이다.
목적한 항원들 또는 바람직한 항원들: 본원에 사용된 것으로서, 용어들 "목적한 항원들" 또는 "바람직한 항원들"은 본원에 기술된 항체들 및 단편들, 돌연변이체들, 변이체들, 및 이의 변형들에 의해 면역특이적으로 결합된 본원에 제공된 단백질들 및 다른 생물분자들을 포함한다. 목적한 항원들의 예들은 인슐린, 인슐린-유사 성장 인자, hGH, tPA, 사이토카인들, 예를 들면, 인터루킨들(IL), 예를 들면, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, 인터페론(IFN) 알파, IFN 베타, IFN 감마, IFN 오메가 또는 IFN 타우(tau), 종양 괴사 인자(TNF), 예를 들면, TNF 알파 및 TNF 베타, TNF 감마, TRAIL; G-CSF, GM-CSF, M-CSF, MCP-1 및 VEGF를 포함하나, 이에 한정되지 않는다.
대략적으로: 본원에 사용된 것으로서, 용어 목적한 하나 이상의 값들에 적용된 것으로서 "대략적으로" 또는 "약"은 기술된 참조 값과 유사한 값을 말한다. 특정 실시형태에서, 용어 "대략적으로" 또는 "약"은 달리 또한 기술되지 않거나 내용으로부터 다른 증거가 없는 한(이러한 수가 가능한 값의 100%를 초과할 수 있는 경우는 제외) 25%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 또는 그 이하내에 속하는 값들의 범위를 말한다.
와 관련된: 본원에 사용된 것으로서, 용어들 "과 관련된", "접합된", "연결된", "부착된" 및 "테써드(TETHERED)"는 2개 이상의 잔기들과 관련하여 사용되는 경우, 당해 잔기들이 직접적으로 또는 연결제로서 제공되는 하나 이상의 추가의 잔기들을 통해 물리적으로 연합되거나 연결됨으로써, 당해 잔기들이 당해 구조가 사용되는 조건들, 예를 들면, 생리학적 조건들하에서 물리적으로 연합되어 잔존하도록 하기에 충분히 안정한 구조를 형성함을 의미한다. "연합"은 직접적인 공유결합적 화학 결합을 통해 엄격할 필요는 없다. 이온성 또는 수소 결합 또는 하이브리드화 계 연결성이 충분히 안정하여 "연합된" 실체들이 생리학적으로 연합되어 잔존함이 또한 제안될 수 있다.
생체적합성: 본원에 사용된 것으로서, 용어 "생체적합성"은 손상, 독성 또는 면역 시스템에 의한 거부의 위험이 거의 없거나 없으면서 살아있는 세포들, 조직들, 기관들 또는 시스템들과 혼화성임을 의미한다.
생물분해성: 본원에 사용된 것으로서, 용어 "생물분해성"은 살아있는 것들의 작용에 의해 무해한 생성물들로 분해될 수 있음을 의미한다.
생물학적으로 활성인: 본원에 사용된 것으로서, 어구 "생물학적으로 활성인"은 생물학적 시스템 및/또는 기관내에서 활성을 갖는 특정 물질의 특성을 말한다. 예를 들어, 기관에 투여되는 경우, 당해 유기체에서 생물학적 효과를 갖는 물질은 생물학적으로 활성인 것으로 고려된다. 특정 실시형태에서, 본 발명의 뉴클레오타이드는, 폴리뉴클레오타이드 중의 일부가 생물학적으로 활성이거나 또는 생물학적으로 관련된 것으로 고려된 활성을 모사하는 경우에도 생물학적으로 활성인 것으로 고려될 수 있다.
화학적 용어들: 다음은 "아실"로부터 "티올"까지의 다양한 화학적 용어들의 정의를 제공한다.
본원에 사용된 것으로서, 용어 "아실"은, 본원에 정의된 바와 같은 카보닐 그룹을 통해 모 분자 그룹에 부착된, 본원에 정의된 것으로서, 수소 또는 알킬 그룹(예를 들면, 할로알킬 그룹)을 나타내며 포르밀(즉, 카복시알데하이드 그룹), 아세틸, 트리플루오로아세틸, 프로피오닐, 부타노일 등으로 예시된다. 예시적인 치환되지 않은 아실 그룹들은 1 내지 7, 1 내지 11, 또는 1 내지 21 탄소들을 포함한다. 일부 실시형태에서, 알킬 그룹은 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체들로 추가로 치환된다.
본원에 사용된 것으로서, 용어 "아실아미노"는, 본원에 정의된 바와 같은 아미노 그룹[즉, N(RN1)-C(O)-R, 여기서, R is H 또는 임의로 치환된 C1 -6, C1 -10, 또는 C1-20 알킬 그룹(예를 들면, 할로알킬)이고 RN1는 본원에 정의된 바와 같다]을 통해 모 분자 그룹에 부착된, 본원에 정의된 바와 같은, 아실 그룹을 나타낸다. 예시적인 치환되지 않은 아실아미노 그룹들은 1 내지 41개의 탄소들(예를 들면, 1 내지 7, 1 내지 13, 1 내지 21, 2 내지 7, 2 내지 13, 2 내지 21, 또는 2 내지 41개의 탄소들)을 포함한다. 일부 실시형태에서, 알킬 그룹은 본원에 기술된 바와 같은, 1개, 2개, 3개, 또는 4개의 치환체들로 추가로 치환되고/되거나 아미노 그룹은 -NH2 또는 -NHRN1이고, 여기서, RN1는, 독립적으로, OH, NO2, NH2, NRN2 2, SO2ORN2, SO2RN2, SORN2, 알킬, 아릴, 아실(예를 들면, 아세틸, 트리플루오로아세틸, 또는 본원에 기술된 다른 것들), 또는 알콕시카보닐알킬이며, 각각의 RN2는 H, 알킬, 또는 아릴일 수 있다.
본원에 사용된 것으로서, 용어 "아실아미노알킬"은, 본원에 정의된 바와 같은 알킬 그룹[즉, -알킬-N(RN1)-C(O)-R, 여기서, R은 H 또는 임의로 치환된 C1-6, C1-10, 또는 C1-20 알킬 그룹(예를 들면, 할로알킬)이고 RN1은 본원에 정의된 바와 같다]을 통해 모 분자 그룹에 최종적으로 부착된 아미노 그룹에 부착된, 본원에 정의된 바와 같은, 아실 그룹을 나타낸다. 예시적인 치환되지 않은 아실아미노 그룹들은 1 내지 41개의 탄소들(예를 들면, 1 내지 7, 1 내지 13, 1 내지 21, 2 내지 7, 2 내지 13, 2 내지 21, 또는 2 내지 41개의 탄소들)을 포함한다. 일부 실시형태에서, 알킬 그룹은 본원에 기술된 바와 같은, 1개, 2개, 3개, 또는 4개의 치환체들로 추가로 치환되고/되거나 아미노 그룹은 -NH2 또는 -NHRN1[여기서, RN1는, 독립적으로, OH, NO2, NH2, NRN2 2, SO2ORN2, SO2RN2, SORN2, 알킬, 아릴, 아실(예를 들면, 아세틸, 트리플루오로아세틸, 또는 본원에 기술된 다른 것들), 또는 알콕시카보닐알킬이고, 각각의 RN2은 H, 알킬, 또는 아릴일 수 있다]이다.
본원에 사용된 것으로서, 용어 "아실옥시"는 산소 원자(즉, -O-C(O)-R, 여기서, R은 H 또는 임의로 치환된 C1 -6, C1 -10, 또는 C1 -20 알킬 그룹이다)를 통해 모 분자 그룹에 부착된, 본원에 정의된 바와 같은, 아실 그룹을 나타낸다. 예시적인 치환되지 않은 아실옥시 그룹들은 1 내지 21개의 탄소들(예를 들면, 1 내지 7 또는 1 내지 11개의 탄소들)을 포함한다. 일부 실시형태에서, 알킬 그룹은 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체들로 추가로 치환된다.
본원에 사용된 것으로서, 용어 "아실옥시알킬"은 알킬 그룹(즉, -알킬-O-C(O)-R, 여기서, R은 H 또는 임의로 치환된 C1-6, C1-10, 또는 C1-20 알킬 그룹이다)을 통해 모 분자 그룹에 최종적으로 부착된 산소 원자에 부착된, 본원에 정의된 바와 같은, 아실 그룹을 나타낸다. 예시적인 치환되지 않은 아실옥시알킬 그룹들은, 1 내지 21개의 탄소들(예를 들면, 1 내지 7개 또는 1 내지 11개)을 포함한다. 일부 실시형태에서, 알킬 그룹은 독립적으로, 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체들에 의해 추가로 치환된다.
본원에 사용된 것으로서, 용어 "알크아릴"은 본원에 정의된 바와 같은 알킬렌 그룹을 통해 모 분자 그룹에 부착된, 본원에 정의된 바와 같은, 아릴 그룹을 나타낸다. 예시적인 치환되지 않은 알크아릴 그룹들은, 탄소수가 7 내지 30(예를 들면, 탄소수 7 내지 16 또는 7 내지 20, 예를 들면, C1 -6 알크-C6 -10 아릴, C1 -10 알크-C6 -10 아릴, 또는 C1-20 알크-C6-10 아릴)이다. 일부 실시형태에서, 알킬렌 및 아릴 각각은 각각의 그룹들에 대해 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다. 접두사 "알크-"는 이러한 방식으로 정의되며, 여기서, "알크"는 달리 나타내지 않는 한, C1 -6 알킬렌을 나타내며, 부착된 화학 구조식은 본원에 정의된다.
용어 "알크사이클로알킬"은 본원에 정의된 바와 같은 알킬렌 그룹(예를 들면, 탄소수 1 내지 4, 1 내지 6, 1 내지 10, 또는 1 내지 20의 알킬렌 그룹)을 통해 모 분자 그룹에 부착된, 본원에 정의된 바와 같은, 사이클로알킬 그룹을 나타낸다. 일부 실시형태에서, 알킬렌 및 사이클로알킬 각각은 각각의 그룹에 대해 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "알케닐"은 달리 정의하지 않는 한, 하나 이상의 탄소-탄소 이중 결합들을 함유하는 탄소수 2 내지 20(예를 들면, 탄소수 2 내지 6 또는 탄소수 2 내지 10)의 1가의 직쇄 또는 측쇄 그룹들을 나타내며 에테닐, 1-프로페닐, 2-프로페닐, 2-메틸-1-프로페닐, 1-부테닐, 2-부테닐 등을 나타낸다. 알케닐들은 시스 및 트랜스 이성체들 둘 다를 포함한다. 알케닐 그룹들은 본원에 정의된 바와 같은, 아미노, 아릴, 사이클로알킬, 또는 헤테로사이클릴(예를 들면, 헤테로아릴), 또는 본원에 기술된 예시적인 알킬 치환체 그룹들 중 임의의 것 중에서 독립적으로 선택된 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 임의로 치환될 수 있다.
용어 "알케닐옥시"는 달리 나타내지 않는 한, 화학식 -OR[여기서, R은 C2 -20 알케닐 그룹(예를 들면, C2 -6 또는 C2 -10 알케닐)이다]의 화학적 치환체를 나타낸다. 예시적인 알케닐옥시 그룹들은 에테닐옥시, 프로페닐옥시 등을 포함한다. 일부 실시형태에서, 알케닐 그룹은 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹(예를 들면, 하이드록시 그룹)들로 추가로 치환될 수 있다.
용어 "알크헤테로아릴"은 본원에 정의된 바와 같은 알킬렌 그룹을 통해 모 분자 그룹에 부착된, 본원에 정의된 바와 같은, 헤테로아릴 그룹을 말한다. 예시적인 치환되지 않은 알크헤테로아릴 그룹들은, 탄소수가 2 내지 32(예를 들면, 2 내지 22, 2 내지 18, 2 내지 17, 2 내지 16, 3 내지 15, 2 내지 14, 2 내지 13, 또는 2 내지 12 탄소들, 예를 들면, C1-6 알크-C1-12 헤테로아릴, C1-10 알크-C1-12 헤테로아릴, 또는 C1-20 알크-C1-12 헤테로아릴)이다. 일부 실시형태에서, 알킬렌 및 헤테로아릴 각각은 각각의 그룹에 대해 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다. 알크헤테로아릴 그룹들은 알크헤테로사이클릴 그룹들의 소세트이다.
용어 "알크헤테로사이클릴"은 본원에 정의된 바와 같은, 알킬렌 그룹을 통해 모 분자 그룹에 부착된, 본원에 정의된 바와 같은, 헤테로사이클릴 그룹을 나타낸다. 예시적인 치환되지 않은 알크헤테로사이클릴 그룹들은, 탄소수가 2 내지 32(예를 들면, 2 내지 22, 2 내지 18, 2 내지 17, 2 내지 16, 3 내지 15, 2 내지 14, 2 내지 13, 또는 2 내지 12 탄소들, 예를 들면, C1-6 알크-C1-12 헤테로사이클릴, C1-10 알크-C1-12 헤테로사이클릴, 또는 C1-20 알크-C1-12 헤테로사이클릴)이다. 일부 실시형태에서, 알킬렌 및 헤테로사이클릴 각각은 각각의 그룹에 대해 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다.
용어 "알콕시"는 달리 나타내지 않는 한, 화학식 -OR[여기서, R은 C1-20 알킬 그룹(예를 들면, C1 -6 또는 C1 -10 알킬이다)이다]의 화학적 치환체를 나타낸다. 예시적인 알콕시 그룹들은 메톡시, 에톡시, 프로폭시(예를 들면, n-프로폭시 및 이소프로폭시), t-부톡시 등을 포함한다. 일부 실시형태에서, 알킬 그룹은 본원에 정의된 바와 같은, 1개, 2개, 3개, 또는 4개의 치환체 그룹들(예를 들면, 하이드록시 또는 알콕시)로 추가로 치환될 수 있다.
용어 "알콕시알콕시"는 알콕시 그룹으로 치환된 알콕시 그룹을 나타낸다. 예시적인 치환되지 않은 알콕시알콕시 그룹들은, 탄소수가 2 내지 40(예를 들면, 탄소수 2 내지 12 또는 2 내지 20, 예를 들면, C1-6 알콕시-C1-6 알콕시, C1-10 알콕시-C1-10 알콕시, 또는 C1-20 알콕시-C1-20 알콕시)이다. 일부 실시형태에서, 각각의 알콕시 그룹은 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다.
용어 "알콕시알킬"은 알콕시 그룹으로 치환된 알킬 그룹을 나타낸다. 예시적인 치환되지 않은 알콕시알킬 그룹들은, 2 내지 40개의 탄소들(예를 들면, 2 내지 12 또는 2 내지 20개의 탄소들, 예를 들면, C1-6 알콕시-C1-6 알킬, C1-10 알콕시-C1-10 알킬, 또는 C1-20 알콕시-C1-20 알킬)을 포함한다. 일부 실시형태에서, 알킬 및 알콕시는 각각 각각의 그룹에 대해 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환된다.
본원에 사용된 것으로서, 용어 "알콕시카보닐"은 카보닐 원자(예를 들면, -C(O)-OR, 여기서, R은 H 또는 임의로 치환된 C1-6, C1-10, 또는 C1-20 알킬 그룹이다)를 통해 모 분자 그룹에 부착된, 본원에 정의된 바와 같은, 알콕시를 나타낸다. 예시적인 치환되지 않은 알콕시카보닐은 1 내지 21개의 탄소들(예를 들면, 1 내지 11 또는 1 내지 7 탄소들)을 포함한다. 일부 실시형태에서, 알콕시 그룹은 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체들로 추가로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "알콕시카보닐아실"은 본원에 정의된 바와 같은 알콕시카보닐 그룹(예를 들면, -C(O) -알킬-C(O)-OR, 여기서, R은 임의로 치환된 C1-6, C1-10, 또는 C1-20 알킬 그룹이다)으로 치환된, 본원에 정의된 바와 같은, 아실 그룹을 나타낸다. 예시적인 치환되지 않은 알콕시카보닐아실은 3 내지 41개의 탄소들(예를 들면, 3 내지 10, 3 내지 13, 3 내지 17, 3 내지 21, 또는 3 내지 31개의 탄소들, 예를 들면, C1-6 알콕시카보닐-C1-6 아실, C1-10 알콕시카보닐-C1-10 아실, 또는 C1-20 알콕시카보닐-C1-20 아실)을 포함한다. 일부 실시형태에서, 각각의 알콕시 및 알킬 그룹은 각각의 그룹에 대해 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체들(예를 들면, 하이드록시 그룹)으로 추가로 독립적으로 치환된다.
본원에 사용된 것으로서, 용어 "알콕시카보닐알콕시"는 본원에 정의된 바와 같은 알콕시카보닐 그룹(예를 들면, -O-알킬-C(O)-OR, 여기서, R은 임의로 치환된 C1-6, C1-10, 또는 C1 -20 알킬 그룹이다)로 치환된, 본원에 정의된 바와 같은, 알콕시 그룹을 나타낸다. 예시적인 치환되지 않은 알콕시카보닐알콕시는 3 내지 41개의 탄소들(예를 들면, 3 내지 10, 3 내지 13, 3 내지 17, 3 내지 21, 또는 3 내지 31개의 탄소들, 예를 들면, C1-6 알콕시카보닐-C1-6 알콕시, C1-10 알콕시카보닐-C1-10 알콕시, 또는 C1 -20 알콕시카보닐-C1 -20 알콕시)을 포함한다. 일부 실시형태에서, 각각의 알콕시 그룹은 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체들(예를 들면, 하이드록시 그룹)로 추가로 독립적으로 치환된다.
본원에 사용된 것으로서, 용어 "알콕시카보닐알킬"은 본원에 정의된 바와 같은 알콕시카보닐 그룹(예를 들면, -알킬-C(O)-OR, 여기서, R은 임의로 치환된 C1-20, C1-10, 또는 C1 -6 알킬 그룹이다)으로 치환된, 본원에 정의된 바와 같은, 알킬 그룹을 나타낸다. 예시적인 치환되지 않은 알콕시카보닐알킬은 3 내지 41개의 탄소들(예를 들면, 3 내지 10, 3 내지 13, 3 내지 17, 3 내지 21, 또는 3 내지 31개의 탄소들, 예를 들면, C1-6 알콕시카보닐-C1-6 알킬, C1-10 알콕시카보닐-C1-10 알킬, 또는 C1-20 알콕시카보닐-C1-20 알킬)을 포함한다. 일부 실시형태에서, 각각의 알킬 및 알콕시 그룹은 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체들(예를 들면, 하이드록시 그룹)로 추가로 독립적으로 치환된다.
본원에 사용된 것으로서, 용어 "알콕시카보닐알케닐"은 본원에 정의된 바와 같은 알콕시카보닐 그룹(예를 들면, -알케닐-C(O)-OR, 여기서, R은 임의로 치환된 C1-20, C1-10, 또는 C1-6 알킬 그룹이다)으로 치환된, 본원에 정의된 바와 같은, 알케닐 그룹을 나타낸다. 예시적인 치환되지 않은 알콕시카보닐알케닐은 4 내지 41개의 탄소들(예를 들면, 4 내지 10, 4 내지 13, 4 내지 17, 4 내지 21, 또는 4 내지 31개의 탄소들, 예를 들면, C1-6 알콕시카보닐-C2-6 알케닐, C1-10 알콕시카보닐-C2-10 알케닐, 또는 C1-20 알콕시카보닐-C2-20 알케닐)을 포함한다. 일부 실시형태에서, 각각의 알킬, 알케닐, 및 알콕시 그룹은 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체들(예를 들면, 하이드록시 그룹)로 추가로 독립적으로 치환된다.
본원에 사용된 것으로서, 용어 "알콕시카보닐알키닐"은 본원에 정의된 바와 같은 알콕시카보닐 그룹(예를 들면, -알키닐-C(O)-OR, 여기서, R은 임의로 치환된 C1-20, C1-10, 또는 C1-6 알킬 그룹이다)으로 치환된, 본원에 정의된 바와 같은, 알키닐 그룹을 나타낸다. 예시적인 치환되지 않은 알콕시카보닐알키닐은 4 내지 41개의 탄소들(예를 들면, 4 내지 10, 4 내지 13, 4 내지 17, 4 내지 21, 또는 4 내지 31개의 탄소들, 예를 들면, C1-6 알콕시카보닐-C2-6 알키닐, C1-10 알콕시카보닐-C2-10 알키닐, 또는 C1-20 알콕시카보닐-C2-20 알키닐)을 포함한다. 일부 실시형태에서, 각각의 알킬, 알키닐, 및 알콕시 그룹은 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체들(예를 들면, 하이드록시 그룹)로 추가로 독립적으로 치환된다.
본원에 사용된 것으로서, 용어 "알킬"은, 달리 나타내지 않는 한, 탄소수 1 내지 20(예를 들면, 1 내지 10 또는 1 내지 6)의 직쇄 또는 측쇄의 포화된 그룹들 둘 다를 포함한다. 알킬 그룹들은 메틸, 에틸, n- 및 이소-프로필, n-, 2급-, 이소- 및 3급-부틸, 네오펜틸 등으로 예시되며, (1) C1 -6 알콕시; (2) C1 -6 알킬설피닐; (3) 본원에 정의된 바와 같은, 아미노[예를 들면, 치환되지 않은 아미노(즉, -NH2) 또는 치환된 아미노(즉, -N(RN1)2, 여기서, RN1는 아미노에 대해 정의된 바와 같다]; (4) C6-10 아릴-C1-6 알콕시; (5) 아지도; (6) 할로; (7)(C2-9 헤테로사이클릴)옥시; (8) O-보호 그룹으로 임의로 치환된 하이드록시; (9) 니트로; (10) 옥소(예를 들면, 카복시알데하이드 또는 아실); (11) C1-7 스피로사이클릴; (12) 티오알콕시; (13) 티올; (14) O-보호 그룹으로 임의로 치환된 -CO2RA'{여기서, RA'은 (a) C1-20 알킬(예를 들면, C1-6 알킬), (b) C2-20 알케닐(예를 들면, C2-6 알케닐), (c) C6-10 아릴, (d) 수소, (e) C1-6 알크-C6-10 아릴, (f) 아미노-C1-20 알킬, (g) -(CH2)s2(OCH2CH2)s1(CH2)s3OR'[여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3는, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, R'은 H 또는 C1-20 알킬이다]의 폴리에틸렌 글리콜, 및 (h) -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1[여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3는, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, 각각의 RN1은, 독립적으로, 수소 또는 임의로 치환된 C1-6 알킬이다]의 아미노-폴리에틸렌 글리콜로 이루어진 그룹으로부터 선택된다}; (15) -C(O)NRB'RC'[여기서, 각각의 RB' 및 RC'은, 독립적으로, (a) 수소, (b) C1 -6 알킬, (c) C6-10 아릴, 및 (d) C1-6 알크-C6-10 아릴로 이루어진 그룹으로부터 선택된다]; (16) -SO2RD'[여기서, RD는 (a) C1-6 알킬, (b) C6-10 아릴, (c) C1-6 알크-C6-10 아릴, 및 (d) 하이드록시로 이루어진 그룹으로부터 선택된다]; (17) -SO2NRE'RF'[여기서, 각각의 RE' 및 RF'은, 독립적으로, (a) 수소, (b) C1-6 알킬, (c) C6-10 아릴 및 (d) C1-6 알크-C6-10 아릴로 이루어진 그룹으로부터 선택된다]; (18) -C(O)RG'{여기서, RG'은 (a) C1-20 알킬(예를 들면, C1-6 알킬), (b) C2-20 알케닐(예를 들면, C2-6 알케닐), (c) C6-10 아릴, (d) 수소, (e) C1-6 알크-C6-10 아릴, (f) 아미노-C1-20 알킬, (g) -(CH2)s2(OCH2CH2)s1(CH2)s3OR'[여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이고, R'은 H 또는 C1-20 알킬이다]의 폴리에틸렌 글리콜, 및 (h) -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1[여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, 각각의 RN1은, 독립적으로, 수소 또는 임의로 치환된 C1-6 알킬이다]의 아미노-폴리에틸렌 글리콜로 이루어진 그룹으로부터 선택된다}; (19) -NRH'(O)RI'{여기서, RH'은 (a1) 수소 및 (b1) C1-6 알킬로 이루어진 그룹 중에서 선택되고, RI'은 (a2) C1-20 알킬(예를 들면, C1-6 알킬), (b2) C2-20 알케닐(예를 들면, C2-6 알케닐), (c2) C6-10 아릴, (d2) 수소, (e2) C1-6 알크-C6-10 아릴, (f2) 아미노-C1-20 알킬, (g2) -(CH2)s2(OCH2CH2)s1(CH2)s3OR'[여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, R'은 H 또는 C1-20 알킬이다]의 폴리에틸렌 글리콜, 및 (h2) -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1[여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3는, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, 각각의 RN1은, 독립적으로, 수소 또는 임의로 치환된 C1-6 알킬로 이루어진 그룹으로부터 선택된다]의 아미노-폴리에틸렌 글리콜로 이루어진 그룹으로부터 선택된다}; (20) -NRJ'C(O)ORK'{여기서, RJ'은 (a1) 수소 및 (b1) C1-6 알킬로 이루어진 그룹 중에서 선택되고, RK'은 (a2) C1-20 알킬(예를 들면, C1-6 알킬), (b2) C2-20 알케닐(예를 들면, C2-6 알케닐), (c2) C6-10 아릴, (d2) 수소, (e2) C1-6 알크-C6-10 아릴, (f2) 아미노-C1-20 알킬, (g2) -(CH2)s2(OCH2CH2)s1(CH2)s3OR'[여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, R'은 H 또는 C1-20 알킬이다]의 폴리에틸렌 글리콜, 및 (h2) -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1[여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, 각각의 NN1은, 독립적으로, 수소 또는 임의로 치환된 C1-6 알킬이다];로 이루어진 그룹으로부터 선택된다}; 및 (21) 아미딘으로 이루어진 그룹으로부터 선택되는 1, 2, 3개, 또는 탄소수 2 이상의 알킬 그룹들의 경우에 4개의 치환체들로 임의로 치환될 수 있다. 일부 실시형태에서, 각각의 이들 그룹들은 본원에 기술된 바와 같이 추가로 치환될 수 있다. 예를 들면, C1-알크아릴의 알킬렌 그룹은 옥소 그룹으로 추가로 치환되어 각각의 아릴로일 치환체를 생성한다.
본원에 사용된 것으로서, 용어 "알킬렌" 및 접두사 "알크-"는, 2개의 수소 원자들의 제거에 의해 직쇄 또는 측쇄의 포화된 탄화수소로부터 기원한 포화된 2가 탄화수소 그룹을 나타내며, 메틸렌, 에틸렌, 이소프로필렌 등으로 예시된다. 용어 "Cx-y 알킬렌" 및 접두사 "Cx -y 알크-"는 x와 y 사이에 탄소들을 갖는 알킬렌 그룹들을 나타낸다. x에 대한 예시적인 값들은 1, 2, 3, 4, 5, 및 6이고, y에 대한 예시적인 값들은 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 또는 20(예를 들면, C1-6, C1-10, C2-20, C2-6, C2-10, 또는 C2-20 알킬렌)이다. 일부 실시형태에서, 알킬렌은 알킬 그룹에 대해 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "알킬설피닐"은 -S(O)- 그룹을 통해 모 분자 그룹에 부착된 알킬 그룹을 나타낸다. 예시적인 치환되지 않은 알킬설피닐 그룹들은, 탄소수가 1 내지 6, 1 내지 10, 또는 1 내지 20이다. 일부 실시형태에서, 알킬 그룹은 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "알킬설피닐알킬"은 알킬설피닐 그룹으로 치환된, 본원에 정의된 바와 같은 알킬 그룹을 나타낸다. 예시적인 치환되지 않은 알킬설피닐알킬 그룹들은, 탄소수가 2 내지 12, 2 내지 20, 또는 2 내지 40이다. 일부 실시형태에서, 각각의 알킬 그룹은 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "알키닐"은, 탄소-탄소 삼중 결합을 함유하는 탄소수가 2 내지 20(예를 들면, 2 내지 4, 2 내지 6, 또는 2 내지 10)인 1가의 직쇄 또는 측쇄 그룹들을 나타내며 에티닐, 1-프로피닐 등으로 예시될 수 있다. 알키닐 그룹들은 본원에 정의된 바와 같은, 아릴, 사이클로알킬, 또는 헤테로사이클릴(예를 들면, 헤테로아릴), 또는 본원에 기술된 예시적인 알킬 치환체 그룹들 중의 어느 하나 중에서 독립적으로 선택된, 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 임의로 치환될 수 있다.
용어 "알키닐옥시"는 화학식 -OR[여기서, R은 달리 나타내지 않는 한, C2-20 알키닐 그룹(예를 들면, C2-6 또는 C2-10 알키닐)이다]의 화학적 치환체를 나타낸다. 예시적인 알키닐옥시 그룹들은 에티닐옥시, 프로피닐옥시 등을 나타낸다. 일부 실시형태에서, 알키닐 그룹은 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들(예를 들면, 하이드록시 그룹)로 추가로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "아미딘"은 -C(=NH)NH2 그룹을 나타낸다.
본원에 사용된 것으로서, 용어 "아미노"는 -N(RN1)2[여기서, 각각의 RN1은, 독립적으로, H, OH, NO2, N(RN2)2, SO2ORN2, SO2RN2, SORN2, N-보호 그룹, 알킬, 알케닐, 알키닐, 알콕시, 아릴, 알크아릴, 사이클로알킬, 알크사이클로알킬, 카복시알킬(예를 들면, O-보호 그룹로 임의로 치환됨, 예를 들면, 임의로 치환된 아릴알콕시카보닐 그룹들 또는 본원에 기술된 임의의 것), 설포알킬, 아실(예를 들면, 아세틸, 트리플루오로아세틸, 또는 본원에 기술된 다른 것들), 알콕시카보닐알킬(예를 들면, O-보호 그룹임의 치환됨, 예를 들면, 임의로 치환된 아릴알콕시카보닐 그룹들 또는 본원에 기술된 임의의 것), 헤테로사이클릴(예를 들면, 헤테로아릴), 또는 알크헤테로사이클릴(예를 들면, 알크헤테로아릴)이며, 여기서, 각각의 이들 언급된 RN1 그룹들은 각각의 그룹에 대해 본원에 정의된 바와 같이 임의로 치환될 수 있거나; 또는 2개의 RN1은 결합하여 헤테로사이클릴 또는 N-보호 그룹을 형성하고, 여기서, 각각의 RN2는, 독립적으로, H, 알킬, 또는 아릴이다]을 나타낸다. 본 발명의 아미노 그룹들은 치환되지 않은 아미노(즉, -NH2) 또는 치환된 아미노(즉, -N(RN1)2)일 수 있다. 바람직한 실시형태에서, 아미노는 -NH2 또는 -NHRN1[여기서, RN1는, 독립적으로, OH, NO2, NH2, NRN2 2, SO2ORN2, SO2RN2, SORN2, 알킬, 카복시알킬, 설포알킬, 아실(예를 들면, 아세틸, 트리플루오로아세틸, 또는 본원에 기술된 다른 것들), 알콕시카보닐알킬(예를 들면, t-부톡시카보닐알킬) 또는 아릴이고, 각각의 RN2는 H, C1 -20 알킬(예를 들면, C1 -6 알킬), 또는 C6 -10 아릴일 수 있다]이다.
본원에 기술된 바와 같은, 용어 "아미노산'은 측쇄, 아미노 그룹, 및 산 그룹(예를 들면, -CO2H의 카복시 그룹 또는 -SO3H의 설포 그룹)을 갖는 분자를 말하고, 아미노산은 측쇄, 아미노 그룹, 또는 산 그룹(예를 들면, 측쇄)에 의해 모 분자 그룹에 부착된다. 일부 실시형태에서, 아미노산은 카보닐 그룹에 의해 모 분자 그룹에 부착되고, 여기서, 측쇄 또는 아미노 그룹은 카보닐 그룹에 부착된다. 예시적인 측쇄들은 임의로 치환된 알킬, 아릴, 헤테로사이클릴, 알크아릴, 알크헤테로사이클릴, 아미노알킬, 카바모일알킬, 및 카복시알킬을 포함한다. 예시적인 아미노산들은 알라닌, 아르기닌, 아스파라긴, 아스파르트산, 시스테인, 글루탐산, 글루타민, 글리신, 히스티딘, 하이드록시노르발린, 이소루이신, 루이신, 라이신, 메티오닌, 노르발린, 오르니틴, 페닐알라닌, 피롤린, 피롤라이신, 셀레노시스테인, 세린, 타우린, 트레오닌, 트립토판, 타이로신 및 발린을 포함한다. 아미노산 그룹들은: (1) C1-6 알콕시; (2) C1-6 알킬설피닐; (3) 본원에 정의된 바와 같은 아미노{예를 들면, 치환되지 않은 아미노(즉, -NH2) 또는 치환된 아미노[즉, -N(RN1)2(여기서, RN1 은 아미노에 대해 정의된 바와 같다)]}; (4) C6-10 아릴-C1-6 알콕시; (5) 아지도; (6) 할로; (7)(C2-9 헤테로사이클릴)옥시; (8) 하이드록시; (9) 니트로; (10) 옥소(예를 들면, 카복시알데하이드 또는 아실); (11) C1-7 스피로사이클릴; (12) 티오알콕시; (13) 티올; (14) -CO2RA'[여기서, RA'은 (a) C1-20 알킬(예를 들면, C1-6 알킬), (b) C2-20 알케닐(예를 들면, C2-6 알케닐), (c) C6-10 아릴, (d) 수소, (e) C1-6 알크-C6-10 아릴, (f) 아미노-C1-20 알킬, (g) -(CH2)s2(OCH2CH2)s1(CH2)s3OR'[여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3, 독립적으로 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이고, R'은 H 또는 C1-20 알킬이다]의 폴리에틸렌 글리콜, 및 (h) -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1[여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, 각각의 NN1은, 독립적으로, 수소 또는 임의로 치환된 C1-6 알킬로 이루어진 그룹으로부터 선택된다]의 아미노-폴리에틸렌 글리콜; (15) -C(O)NRB'C'[여기서, 각각의 RB' 및 RC'은, 독립적으로, (a) 수소, (b) C1-6 알킬, (c) C6-10 아릴, 및 (d) C1-6 알크-C6-10 아릴로 이루어진 그룹으로부터 선택된다]; (16) -SO2RD'[여기서, RD'은 (a) C1-6 알킬, (b) C6-10 아릴, (c) C1-6 알크-C6-10 아릴, 및 (d) 하이드록시로 이루어진 그룹으로부터 선택된다]; (17) -SO2NRE'F'[여기서, 각각의 RE' 및 RF'은, 독립적으로, (a) 수소, (b) C1-6 알킬, (c) C6-10 아릴 및 (d) C1-6 알크-C6-10 아릴로 이루어진 그룹으로부터 선택된다]; (18) -C(O)RG'{여기서, RG'은 (a) C1-20 알킬(예를 들면, C1-6 알킬), (b) C2-20 알케닐(예를 들면, C2-6 알케닐), (c) C6-10 아릴, (d) 수소, (e) C1-6 알크-C6-10 아릴, (f) 아미노-C1-20 알킬, (g) -(CH2)s2(OCH2CH2)s1(CH2)s3OR'[여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3는, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, R'은 H 또는 C1-20 알킬이다]의 폴리에틸렌 글리콜, 및 (h) -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1[여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, 각각의 NN1은, 독립적으로, 수소 또는 임의로 치환된 C1-6 알킬로 이루어진 그룹으로부터 선택된다]의 아미노-폴리에틸렌 글리콜; (19) -NRH'(O)RI'[여기서, RH'은 (a1) 수소 및 (b1) C1-6 알킬로 이루어진 그룹 중에서 선택되고, RI'은 (a2) C1-20 알킬(예를 들면, C1-6 알킬), (b2) C2-20 알케닐(예를 들면, C2-6 알케닐), (c2) C6-10 아릴, (d2) 수소, (e2) C1-6 알크-C6-10 아릴, (f2) 아미노-C1-20 알킬, (g2) -(CH2)s2(OCH2CH2)s1(CH2)s3OR'[여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, R'은 H 또는 C1-20 알킬이다]의 폴리에틸렌 글리콜, 및 (h2) -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1[여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정쉬고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, 각각의 NN1은, 독립적으로, 수소 또는 임의로 치환된 C1-6 알킬로 이루어진 그룹으로부터 선택된다]의 아미노-폴리에틸렌 글리콜; (20) -NRJ'(O)ORK'[여기서, RJ'은 (a1) 수소 및 (b1) C1-6 알킬로 이루어진 그룹 중에서 선택되고, RK'은 (a2) C1-20 알킬(예를 들면, C1-6 알킬), (b2) C2-20 알케닐(예를 들면, C2-6 알케닐), (c2) C6-10 아릴, (d2) 수소, (e2) C1-6 알크-C6-10 아릴, (f2) 아미노-C1-20 알킬, (g2) -(CH2)s2(OCH2CH2)s1(CH2)s3OR'[여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, R'은 H 또는 C1-20 알킬이다]의 폴리에틸렌 글리콜, 및 (h2) -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1[여기서, s1은 1 내지 10(예를 들면, 1 내지 6 또는 1 내지 4)의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10(예를 들면, 0 내지 4, 0 내지 6, 1 내지 4, 1 내지 6, 또는 1 내지 10)의 정수이며, 각각의 NN1은, 독립적으로, 수소 또는 임의로 치환된 C1-6 알킬로 이루어진 그룹으로부터 선택된다]의 아미노-폴리에틸렌 글리콜; 및 (21) 아미딘으로 이루어진 그룹 중에서 독립적으로 선택된 1개, 2개, 3개, 또는 탄소수가 2 이상인 아미노산 그룹들의 경우에 4개의 치환체들로 임의로 치환될 수 있다. 일부 실시형태에서, 각각의 이들 그룹들은 본원에 기술된 바와 같이 추가로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "아미노알콕시"는 본원에 정의된 바와 같은, 아미노 그룹으로 치환된, 본원에 정의된 바와 같은, 알콕시 그룹을 나타낸다. 알킬 및 아미노 각각은 각각의 그룹[예를 들면, CO2RA'(여기서, RA'은 (a) C1-6 알킬, (b) C6-10 아릴, (c) 수소, 및 (d) C1-6 알크-C6-10 아릴, 예를 들면, 카복시로 이루어진 그룹으로부터 선택된다]에 대해 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "아미노알킬"은 본원에 정의된 바와 같은 아미노 그룹으로 치환된, 본원에 정의된 바와 같은, 알킬 그룹을 나타낸다. 알킬 및 아미노 각각은 각각의 그룹[예를 들면, CO2RA'(여기서, RA'은 (a) C1-6 알킬, (b) C6-10 아릴, (c) 수소, 및 (d) C1-6 알크-C6-10 아릴, 예를 들면, 카복시, 및/또는 N-보호 그룹으로 이루어진 그룹으로부터 선택된다]에 대해 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "아미노알케닐"은 본원에 정의된 바와 같은 아미노 그룹에 의해 치환된, 본원에 정의된 바와 같은 알케닐 그룹을 나타낸다. 알케닐 및 아미노 각각은 각각의 그룹[예를 들면, CO2RA'(여기서, RA'은 (a) C1-6 알킬, (b) C6-10 아릴, (c) 수소, 및 (d) C1-6 알크-C6-10 아릴, 예를 들면, 카복시, 및/또는 N-보호 그룹으로 이루어진 그룹으로부터 선택된다)]에 대해 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "아미노알키닐"은 본원에 정의된 바와 같은 아미노 그룹에 의해 치환된, 본원에 정의된 바와 같은 알키닐 그룹을 나타낸다. 알키닐 및 아미노 각각은 각각의 그룹[예를 들면, CO2RA'(여기서, RA'은 (a) C1-6 알킬, (b) C6-10 아릴, (c) 수소, 및 (d) C1-6 알크-C6-10 아릴, 예를 들면, 카복시, 및/또는 N-보호 그룹으로 이루어진 그룹으로부터 선택된다)]에 대해 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "아릴"은 1개 또는 2개의 방향족 환들을 갖는 모노-, 비사이클릭, 또는 다사이클릭 카보사이클릭 환 시스템을 나타내며 페닐, 나프틸, 1,2-디하이드로나프틸, 1,2,3,4-테트라하이드로나프틸, 안트라세닐, 페난트레닐, 플루오레닐, 인다닐, 인데닐 등으로 예시되며, (1) C1 -7 아실(예를 들면, 카복시알데하이드); (2) C1 -20 알킬(예를 들면, C1 -6 알킬, C1 -6 알콕시-C1 -6 알킬, C1 -6 알킬설피닐-C1-6 알킬, 아미노-C1-6 알킬, 아지도-C1-6 알킬, (카복시알데하이드)-C1-6 알킬, 할로-C1-6 알킬(예를 들면, 퍼플루오로알킬), 하이드록시-C1-6 알킬, 니트로-C1-6 알킬, 또는 C1-6 티오알콕시-C1-6 알킬); (3) C1-20 알콕시(예를 들면, C1-6 알콕시, 예를 들면, 퍼플루오로알콕시); (4) C1-6 알킬설피닐; (5) C6-10 아릴; (6) 아미노; (7) C1-6 알크-C6-10 아릴; (8) 아지도; (9) C3-8 사이클로알킬; (10) C1-6 알크-C3-8 사이클로알킬; (11) 할로; (12) C1-12 헤테로사이클릴(예를 들면, C1-12 헤테로아릴); (13) (C1-12 헤테로사이클릴)옥시; (14) 하이드록시; (15) 니트로; (16) C1-20 티오알콕시(예를 들면, C1-6 티오알콕시); (17) -(CH2)qCO2RA'[여기서, q는 0 내지 4의 정수이고 RA'은 (a) C1-6 알킬, (b) C6-10 아릴, (c) 수소, 및 (d) C1-6 알크-C6-10 아릴로 이루어진 그룹으로부터 선택된다]; (18) -(CH2)qCONRB'C'[여기서, q는0 내지 4의 정수이고, 여기서, RB' 및 RC'은 (a) 수소, (b) C1-6 알킬, (c) C6-10 아릴, 및 (d) C1-6 알크-C6-10 아릴로 이루어진 그룹 중에서 독립적으로 선택된다]; (19) -(CH2)qSO2RD' {여기서, q는 0 내지 4의 정수이고 여기서, RD'은 (a) 알킬, (b) C6 -10 아릴, 및 (c) 알크-C6 -10 아릴로 이루어진 그룹으로부터 선택된다]; (20) -(CH2)qSO2NRE'F'[여기서, q는 0 내지 4의 정수이고, 여기서, 각각의 RE' 및 RF'은 (a) 수소, (b) C1 -6 알킬, (c) C6 -10 아릴, 및 (d) C1 -6 알크-C6 -10 아릴로 이루어진 그룹 중에서 독립적으로 선택된다]; (21) 티올; (22) C6-10 아릴옥시; (23) C3-8 사이클로알콕시; (24) C6-10 아릴-C1-6 알콕시; (25) C1-6 알크-C1-12 헤테로사이클릴(예를 들면, C1-6 알크-C1-12 헤테로아릴); (26) C2-20 알케닐; 및 (27) C2-20 알키닐로 이루어진 그룹으로부터 선택되는 1, 2, 3, 4, 또는 5개의 치환체들로 임의로 치환될 수 있다. 일부 실시형태에서, 각각의 이들 그룹들은 본원에 기술된 바와 같이 추가로 치환될 수 있다. 예를 들면, C1-알크아릴 또는 C1-알크헤테로사이클릴의 알킬렌 그룹은 옥소 그룹으로 추가로 치환되어 각각의 아릴로일 및 (헤테로사이클릴)로일 치환체 그룹을 생성할 수 있다.
본원에 사용된 것으로서, 용어 "아릴알콕시"는 산소 원자를 통해 모 분자 그룹에 부착된, 본원에 정의된 바와 같은 알크아릴 그룹을 나타낸다. 예시적인 치환되지 않은 아릴알콕시 그룹들은 7 내지 30개의 탄소들(예를 들면, 7 내지 16 또는 7 내지 20개의 탄소들, 예를 들면, C6 -10 아릴-C1 -6 알콕시, C6 -10 아릴-C1 -10 알콕시, 또는 C6-10 아릴-C1 -20 알콕시)을 함유한다. 일부 실시형태에서, 당해 아릴알콕시 그룹은 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체들로 치환될 수 있다.
본원에 사용된 것으로서, "아릴알콕시카보일"은 카보닐(예를 들면, -C(O)-O-알킬-아릴)을 통해 모 분자 그룹에 부착된, 본원에 정의된 바와 같은 아릴알콕시 그룹을 나타낸다. 예시적인 치환되지 않은 아릴알콕시 그룹들은 8 내지 31개의 탄소들(예를 들면, 8 내지 17 또는 8 내지 21 탄소들, 예를 들면, C6-10 아릴-C1-6 알콕시-카보닐, C6-10 아릴-C1-10 알콕시-카보닐, 또는 C6-10 아릴-C1-20 알콕시-카보닐)을 함유한다. 일부 실시형태에서, 당해 아릴알콕시카보닐 그룹은 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체들로 치환될 수 있다.
용어 "아릴옥시"는 화학식 -OR'(여기서, R'은, 달리 나타내지 않는 한, 탄소수 6 내지 18의 아릴 그룹이다)의 화학적 치환체를 나타낸다. 일부 실시형태에서, 아릴 그룹은 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체들로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "아릴로일"은 카보닐 그룹을 통해 모 분자 그룹에 부착된, 본원에 정의된 바와 같은 아릴 그룹을 나타낸다. 예시적인 치환되지 않은 아릴로일 그룹들은, 탄소수가 7 내지 11이다. 일부 실시형태에서, 아릴 그룹은 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체들로 치환될 수 있다.
용어 "아지도"는 -N3 그룹을 나타내며, 이는 또한 -N=N=N로서 나타낼 수 있다.
본원에 사용된 것으로서, 용어 "비사이클릭"은 방향족 또는 비-방향족일 수 있는, 2개의 환들을 갖는 구조를 말한다. 비사이클릭 구조들은 본원에 정의된 바와 같은 스피로사이클릴 그룹들, 및 하나 이상의 브릿지(bridge)들을 공유하는 2개의 환들을 포함하며, 여기서, 이러한 브릿지들은 1개의 원자 또는 2개, 3개 이상의 원자들을 포함하는 쇄를 포함할 수 있다. 예시적인 비사이클릭 그룹들은 비사이클릭 카보사이클릴 그룹을 포함하며, 여기서, 제1 및 제2의 환들은 본원에 정의된 바와 같은 카보사이클릴 그룹들; 비사이클릭 아릴 그룹들(여기서, 제1 및 제2의 환들은 본원에 정의된 바와 같은 아릴 그룹들이다); 비사이클릭 헤테로사이클릴 그룹들(여기서, 제1의 환은 헤테로사이클릴 그룹이고 제2의 환은 카보사이클릴(예를 들면, 아릴) 또는 헤테로사이클릴(예를 들면, 헤테로아릴) 그룹이다); 및 비사이클릭 헤테로아릴 그룹들(여기서, 제1의 환은 헤테로아릴 그룹이고 제2의 환은 카보사이클릴(예를 들면, 아릴) 또는 헤테로사이클릴(예를 들면, 헤테로아릴) 그룹이다)을 포함한다. 일부 실시형태에서, 비사이클릭 그룹은 사이클로알킬, 헤테로사이클릴, 및 아릴 그룹들에 대해 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체들로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "보라닐"은 -B(RB1)3(여기서, 각각의 RB1은, 독립적으로, H 및 임의로 치환된 알킬로 이루어진 그룹으로부터 선택된다)을 나타낸다. 일부 실시형태에서, 보라닐 그룹은 알킬에 대해 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체들로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "카보사이클릭" 및 "카보사이클릴"은 임의로 치환된 C3 -12 모노사이클릭, 비사이클릭, 또는 트리사이클릭 구조를 말하며, 여기서, 방향족 또는 비-방향족일 수 있는 환들은 탄소 원자들에 의해 형성된다. 카보사이클릭 구조들은 사이클로알킬, 사이클로알케닐, 및 아릴 그룹들을 포함한다.
본원에 사용된 것으로서, 용어 "카보닐"은 -C(O)-N(RN1)2(여기서, 각각의 NN1의 의미는 본원에 제공된 "아미노"의 정의에서 발견된다)을 나타낸다.
본원에 사용된 것으로서, 용어 "카바모일알킬"은 본원에 정의된 바와 같은 카바모일 그룹으로 치환된, 본원에 정의된 바와 같은 알킬 그룹을 나타낸다. 알킬 그룹은 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "카바밀"은 구조 -NRN1C(=O)OR 또는 -OC(=O)N(RN1)2[여기서, 각각의 NN1의 의미는 본원에 제공된 "아미노"의 정의에서 발견되며 R은 본원에 정의된 바와 같은 알킬, 사이클로알킬, 알크사이클로알킬, 아릴, 알크아릴, 헤테로사이클릴(예를 들면, 헤테로아릴), 또는 알크헤테로사이클릴(예를 들면, 알크헤테로아릴)이다]를 갖는 카바메이트 그룹을 말한다.
본원에 사용된 것으로서, 용어 "카보닐"은 C(O) 그룹을 나타내며, 이는 또한 C=O로 나타낼 수 있다.
용어 "카복시알데하이드"는 구조 -CHO를 갖는 아실 그룹을 나타낸다.
본원에 사용된 것으로서, 용어 "카복시"는 -CO2H를 나타낸다.
본원에 사용된 것으로서, 용어 "카복시알콕시"는, 본원에 정의된 바와 같은 카복시 그룹으로 치환된, 본원에 정의된 바와 같은 알콕시 그룹을 나타낸다. 알콕시 그룹은 알킬 그룹에 대해 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있으며, 카복시 그룹은 하나 이상의 O-보호 그룹들로 임의로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "카복시알킬"은 본원에 정의된 바와 같은 카복시 그룹으로 치환된, 본원에 정의된 바와 같은 알킬 그룹을 나타낸다. 알킬 그룹은 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있고, 카복시 그룹은 하나 이상의 O-보호 그룹들로 임의로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "카복시아미노알킬"은 본원에 정의된 바와 같은, 카복시로 치환된, 본원에 정의된 바와 같은 아미노알킬 그룹을 나타낸다. 카복시, 알킬, 및 아미노 각각은 대표적인 그룹[예를 들면, CO2RA'(여기서, RA'은 (a) C1-6 알킬, (b) C6-10 아릴, (c) 수소, 및 (d) C1-6 알크-C6-10 아릴, 예를 들면, 카복시, 및/또는 N-보호 그룹, 및/또는 O-보호 그룹으로 이루어진 그룹으로부터 선택된다]에 대해 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "시아노"는 -CN 그룹을 나타낸다.
용어 "사이클로알콕시"는 화학식 -OR(여기서, R은 달리 나타내지 않는 한, 본원에 정의된 바와 같은 C3-8 사이클로알킬 그룹이다)의 화학적 치환체를 나탠다. 사이클로알킬 그룹은 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다. 예시적인 치환되지 않은 사이클로알콕시 그룹들은 탄소수는 3 내지 8이다. 일부 실시형태에서, 사이클로알킬 그룹은 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다.
본원에 사용된 것으로서 용어 "사이클로알킬"은 달리 나타내지 않는 한 탄소수 3 내지 8의 1가의 포화되거나 불포화된 비-방향족 사이클릭 탄화수소 그룹을 나타내며, 사이클로프로필, 사이클로부틸, 사이클로펜틸, 사이클로헥실, 사이클로헵틸, 비사이클 헵틸 등으로 예시된다. 사이클로알킬 그룹이 하나의 탄소-탄소 이중 결합을 포함하는 경우, 당해 사이클로알킬 그룹은 "사이클로알케닐" 그룹으로 언급될 수 있다. 예시적인 사이클로알케닐 그룹들은 사이클로펜테닐, 사이클로헥세닐 등을 포함한다. 본 발명의 사이클로알킬 그룹들은: (1) C1 -7 아실(예를 들면, 카복시알데하이드); (2) C1-20 알킬(예를 들면, C1-6 알킬, C1-6 알콕시-C1-6 알킬, C1-6 알킬설피닐-C1-6 알킬, 아미노-C1-6 알킬, 아지도-C1-6 알킬, (카복시알데하이드)-C1-6 알킬, 할로-C1-6 알킬(예를 들면, 퍼플루오로알킬), 하이드록시-C1-6 알킬, 니트로-C1-6 알킬, 또는 C1-6 티오알콕시-C1-6 알킬); (3) C1-20 알콕시(예를 들면, C1-6 알콕시, 예를 들면, 퍼플루오로알콕시); (4) C1-6 알킬설피닐; (5) C6-10 아릴; (6) 아미노; (7) C1-6 알크-C6-10 아릴; (8) 아지도; (9) C3-8 사이클로알킬; (10) C1-6 알크-C3-8 사이클로알킬; (11) 할로; (12) C1-12 헤테로사이클릴(예를 들면, C1-12 헤테로아릴); (13) (C1-12 헤테로사이클릴)옥시; (14) 하이드록시; (15) 니트로; (16) C1-20 티오알콕시(예를 들면, C1-6 티오알콕시); (17) -(CH2)qCO2RA'[여기서, q는 0 내지 4의 정수이고, RA'은 (a) C1-6 알킬, (b) C6-10 아릴, (c) 수소, 및 (d) C1-6 알크-C6-10 아릴로 이루어진 그룹으로부터 선택된다]; (18) -(CH2)qCONRB'C'[여기서, q는 0 내지 4의 정수이고, 여기서, RB' 및 RC'은 (a) 수소, (b) C6 -10 알킬, (c) C6 -10 아릴, 및 (d) C1 -6 알크-C6-10 아릴로 이루어진 그룹 중에서 독립적으로 선택된다]; (19) -(CH2)qSO2RD'[여기서, q는 0 내지 4의 정수이고, 여기서, RD'은 (a) C6 -10 알킬, (b) C6 -10 아릴, 및 (c) C1 -6 알크-C6 -10 아릴로 이루어진 그룹으로부터 선택된다]; (20) -(CH2)qSO2NRE'F'[여기서, q는 0 내지 4의 정수이고, 여기서, 각각의 RE' 및 RF'은, (a) 수소, (b) C6 -10 알킬, (c) C6-10 아릴, 및 (d) C1 -6 알크-C6 -10 아릴로 이루어진 그룹 중에서 독립적으로 선택된다]; (21) 티올; (22) C6-10 아릴옥시; (23) C3-8 사이클로알콕시; (24) C6-10 아릴-C1-6 알콕시; (25) C1-6 알크-C1-12 헤테로사이클릴(예를 들면, C1-6 알크-C1-12 헤테로아릴); (26) 옥소; (27) C2-20 알케닐; 및 (28) C2-20 알키닐로 임의로 치환될 수 있다. 일부 실시형태에서, 각각의 이들 그룹들은 본원에 기술된 바와 같이 추가로 치환될 수 있다. 예를 들면, C1-알크아릴 또는 C1-알크헤테로사이클릴의 알킬렌 그룹은 옥소 그룹으로 추가로 치환되어 각각의 아릴로일 및 (헤테로사이클릴)로일 치환체 그룹을 생성한다.
본원에 사용된 것으로서, 용어 "부분입체이성체"는 서로 거울 상들이 아니고 서로 겹쳐지지 않는(non-superimposable) 입체이성체들을 의미한다.
본원에 사용된 것으로서, 용어 제제의 "유효량"은, 유리하거나 바람직한 결과들, 예를 들면, 임상 결과들을 달성하기에 충분한 양이며, 이와 같이, "유효량"은, 이것이 적용되는 내용에 의존한다. 예를 들면, 암을 치료하는 제제를 투여하는 것과 관련하여, 제제의 유효량은, 예를 들면, 제제의 투여없이 수득된 반응과 비교한 것으로서, 암의 본원에 정의된 바와 같은, 치료를 달성하기에 충분한 양이다.
본원에 사용된 것으로서, 용어 "거울상이성체"는 광학적 순도 또는 적어도 80%(즉, 적어도 90%의 하나의 거울상이성체 및 대부분 10%의 다른 거울상이성체), 바람직하게는 적어도 90% 및 보다 바람직하게는 적어도 98%의 거울상이성체성 과량(당해 분야에 표준 방법들로 측정한 것으로서)을 갖는, 본 발명의 화합물의 각각 개개의 광학적으로 활성인 형태를 의미한다.
본원에 사용된 것으로서, 용어 "할로"는 브롬, 염소, 요오드, 또는 불소로부터 선택되는 할로겐을 나타낸다.
본원에 사용된 것으로서, 용어 "할로알콕시"는 할로겐 그룹(즉, F, Cl, Br, 또는 I)으로 치환된, 본원에 정의된 바와 같은 알콕시 그룹을 나타낸다. 할로알콕시는 1개, 2개, 3개, 또는 탄소수가 2 이상인 알킬 그룹들의 경우에, 4개의 할로겐들로 치환될 수 있다. 할로알콕시 그룹들은 퍼플루오로알콕시들(예를 들면, -OCF3), -OCHF2, -OCH2F, -OCCl3, -OCH2CH2Br, -OCH2CH(CH2CH2Br)CH3, 및 -OCHICH3을 포함한다. 일부 실시형태에서, 할로알콕시 그룹은 알킬 그룹들의 경우 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "할로알킬"은 할로겐 그룹(즉, F, Cl, Br, 또는 I)으로 치환된, 본원에 정의된 바와 같은 알킬 그룹을 나타낸다. 할로알킬은 1개, 2개, 3개, 또는 탄소수가 2 이상인 알킬 그룹들의 경우에 4개의 할로겐들로 치환될 수 있다. 할로알킬 그룹들은 퍼플루오로알킬들(예를 들면, -CF3), -CHF2, -CH2F, -CCl3, -CH2CH2Br, -CH2CH(CH2CH2Br)CH3, 및 -CHICH3을 포함한다. 일부 실시형태에서, 할로알킬 그룹은 알킬 그룹들에 대해 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "헤테로알킬렌"은 본원에 정의된 바와 같은 알킬렌 그룹을 말하며, 여기서, 치환체 탄소 원자들 중 1개 또는 2개는 각각 질소, 산소, 또는 황으로 대체되어 있다. 일부 실시형태에서, 헤테로알킬렌 그룹은 알킬렌 그룹들의 경우 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "헤테로아릴"은 방향족인, 본원에 정의된 바와 같은 헤테로사이클릴들의 소세트를 나타내는데: 즉, 이들은 모노- 또는 다중사이클릭 환 시스템내에 4n+2 pi 전자들을 함유한다. 예시적인 치환되지 않은 헤테로아릴 그룹들은 탄소수가 1 내지 12(예를 들면, 1 내지 11, 1 내지 10, 1 내지 9, 2 내지 12, 2 내지 11, 2 내지 10, 또는 2 내지 9)이다. 일부 실시형태에서, 헤테로아릴은 헤테로사이클릴그룹에 대해 정의된 바와 같이 1개, 2개, 3개, 또는 4개의 치환체들 그룹들로 치환된다.
본원에 사용된 것으로서, 용어 "헤테로사이클릴"은 달리 명시하지 않는 한, 질소, 산소, 및 황으로 이루어진 그룹 중에서 독립적으로 선택된. 1개, 2개, 3개 또는 4개의 헤테로원자들을 함유하는 5-, 6- 또는 7-원 환을 나타낸다. 5-원 환은 0 내지 2개의 이중 결합들을 가지며, 6- 및 7-원 환들은 0 내지 3개의 이중 결합들을 가진다. 예시적인 치환되지 않은 헤테로사이클릴 그룹들은, 탄소수가 1 내지 12(예를 들면, 1 내지 11, 1 내지 10, 1 내지 9, 2 내지 12, 2 내지 11, 2 내지 10, 또는 2 내지 9)이다. 용어 "헤테로사이클릴"은 또한, 하나 이상의 탄소들 및/또는 헤테로원자들이 모노사이클릭 환, 예를 들면, 퀴누클리디닐 그룹의 2개의 인접하지 않은 구성원들을 브릿지하는 브릿지된 다중사이클릭 구조를 갖는 헤테로사이클릭 화합물을 나타낸다. 용어 "헤테로사이클릴"은 비사이클릭, 트리사이클릭, 및 테트라사이클릭 그룹들을 포함하며, 여기서, 상기 헤테로사이클릭 환들 중의 어느 하나는 1개, 2개, 또는 3개의 카보사이클릭 환들, 예를 들면, 아릴 환, 사이클로헥산 환, 사이클로헥센 환, 사이클로펜탄 환, 사이클로펜텐 환, 또는 다른 모노사이클릭 헤테로사이클릭 환, 예를 들면, 인돌릴, 퀴놀릴, 이소퀴놀릴, 테트라하이드로퀴놀릴, 벤조푸릴, 벤조티에닐 등에 융합된 비사이클릭, 트리사이클릭, 및 테트라사이클릭 그룹들을 포함한다. 융합된 헤테로사이클릴들의 예는 트로판들 및 1,2,3,5,8,8a-헥사하이드로인돌리진을 포함한다. 헤테로사이클들은 피롤릴, 피롤리닐, 피롤리디닐, 피라졸릴, 피라졸리닐, 피라졸리디닐, 이미다졸릴, 이미다졸리닐, 이미다졸리디닐, 피리딜, 피페리디닐, 호모피페리디닐, 피라지닐, 피페라지닐, 피리미디닐, 피리다지닐, 옥사졸릴, 옥사졸리디닐, 이속사졸릴, 이속사졸리디닐, 모르폴리닐, 티오모르폴리닐, 티아졸릴, 티아졸리디닐, 이소티아졸릴, 이소티아졸리디닐, 인돌릴, 인다졸릴, 퀴놀릴, 이소퀴놀릴, 퀴녹살리닐, 디하이드로퀴녹살리닐, 퀴나졸리닐, 신놀리닐, 프탈라지닐, 벤즈이미다졸릴, 벤조티아졸릴, 벤족사졸릴, 벤조티아디아졸릴, 푸릴, 티에닐, 티아졸리디닐, 이소티아졸릴, 트리아졸릴, 테트라졸릴, 옥사디아졸릴(예를 들면, 1,2,3-옥사디아졸릴), 푸리닐, 티아디아졸릴(예를 들면, 1,2,3-티아디아졸릴), 테트라하이드로푸라닐, 디하이드로푸라닐, 테트라하이드로티에닐, 디하이드로티에닐, 디하이드로인돌릴, 디하이드로퀴놀릴, 테트라하이드로퀴놀릴, 테트라하이드로이소퀴놀릴, 디하이드로이소퀴놀릴, 피라닐, 디하이드로피라닐, 디티아졸릴, 벤조푸라닐, 이소벤조푸라닐, 벤조티에닐 등, 예를 들면, 이의 디하이드로 및 테트라하이드로 형태들을 포함하며, 여기서, 하나 이상의 이중 결합들은 환원되고 수소들로 대체된다. 여전히 다른 예시적인 헤테로사이클릴들은 2,3,4,5-테트라하이드로-2-옥소-옥사졸릴; 2,3-디하이드로-2-옥소-1H-이미다졸릴; 2,3,4,5-테트라하이드로-5-옥소-1H-피라졸릴(예를 들면, 2,3,4,5-테트라하이드로-2-페닐-5-옥소-1H-피라졸릴); 2,3,4,5-테트라하이드로-2,4-디옥소-1H-이미다졸릴(예를 들면, 2,3,4,5-테트라하이드로-2,4-디옥소-5-메틸-5-페닐-1H-이미다졸릴); 2,3-디하이드로-2-티옥소-1,3,4-옥사디아졸릴(예를 들면, 2,3-디하이드로-2-티옥소-5-페닐-1,3,4-옥사디아졸릴); 4,5-디하이드로-5-옥소-1H-트리아졸릴(예를 들면, 4,5-디하이드로-3-메틸-4-아미노 5-옥소-1H-트리아졸릴); 1,2,3,4-테트라하이드로-2,4-디옥소피리디닐(예를 들면, 1,2,3,4-테트라하이드로-2,4-디옥소-3,3-디에틸피리디닐); 2,6-디옥소-피페리디닐(예를 들면, 2,6-디옥소-3-에틸-3-페닐피페리디닐); 1,6-디하이드로-6-옥소피리미디닐; 1,6-디하이드로-4-옥소피리미디닐(예를 들면, 2-(메틸티오)-1,6-디하이드로-4-옥소-5-메틸피리미딘-1-일); 1,2,3,4-테트라하이드로-2,4-디옥소피리미디닐(예를 들면, 1,2,3,4-테트라하이드로-2,4-디옥소-3-에틸피리미디닐); 1,6-디하이드로-6-옥소-피리다지닐(예를 들면, 1,6-디하이드로-6-옥소-3-에틸피리다지닐); 1,6-디하이드로-6-옥소-1,2,4-트리아지닐(예를 들면, 1,6-디하이드로-5-이소프로필-6-옥소-1,2,4-트리아지닐); 2,3-디하이드로-2-옥소-1H-인돌릴(예를 들면, 3,3-디메틸-2,3-디하이드로-2-옥소-1H-인돌릴 및 2,3-디하이드로-2-옥소-3,3'-스피로프로판-1H-인돌-1-일); 1,3-디하이드로-1-옥소-2H-이소-인돌릴; 1,3-디하이드로-1,3-디옥소-2H-이소-인돌릴; 1H-벤조피라졸릴(예를 들면, 1-(에톡시카보닐)- 1H-벤조피라졸릴); 2,3-디하이드로-2-옥소-1H-벤즈이미다졸릴(예를 들면, 3-에틸-2,3-디하이드로-2-옥소-1H-벤즈이미다졸릴); 2,3-디하이드로-2-옥소-벤족사졸릴(예를 들면, 5-클로로-2,3-디하이드로-2-옥소-벤족사졸릴); 2,3-디하이드로-2-옥소-벤족사졸릴; 2-옥소-2H-벤조피라닐; 1,4-벤조디옥사닐; 1,3-벤조디옥사닐; 2,3-디하이드로-3-옥소,4H-1,3-벤조티아지닐; 3,4-디하이드로-4-옥소-3H-퀴나졸리닐(예를 들면, 2-메틸-3,4-디하이드로-4-옥소-3H-퀴나졸리닐); 1,2,3,4-테트라하이드로-2,4-디옥소-3H-퀴나졸릴(예를 들면, 1-에틸-1,2,3,4-테트라하이드로-2,4-디옥소-3H-퀴나졸릴); 1,2,3,6-테트라하이드로-2,6-디옥소-7H-푸리닐(예를 들면, 1,2,3,6-테트라하이드로-1,3-디메틸-2,6-디옥소-7H-푸리닐); 1,2,3,6-테트라하이드로-2,6-디옥소-1H-푸리닐(예를 들면, 1,2,3,6-테트라하이드로-3,7-디메틸-2,6-디옥소-1H -푸리닐); 2-옥소벤즈[c,d]인돌릴; 1,1-디옥소-2H-나프트[1,8-c,d]이소티아졸릴; 및 1,8-나프틸렌디카복스미도를 포함한다. 추가의 헤테로하이클릭들은 3,3a,4,5,6,6a-헥사하이드로-피롤로[3,4-b]피롤-(2H)-일, 및 2,5-디아자비사이클로[2.2.1]헵탄-2-일, 호모피페라지닐(또는 디아제파닐), 테트라하이드로피라닐, 디티아졸릴, 벤조푸라닐, 벤조티에닐, 옥세파닐, 티에파닐, 아조카닐, 옥세카닐, 및 티오카닐을 포함한다. 헤테로사이클릭 그룹들은 또한 하기 화학식의 그룹들을 포함하며:
여기서
E'은 -N- 및 -CH-로 이루어진 그룹 중에서 선택되고;
F'은 -N=CH-, -NH-CH2-, -NH-C(O)-, -NH-, -CH=N-, -CH2-NH-, -C(O)-NH-, -CH=CH-, -CH2-, -CH2CH2-, -CH2O-, -OCH2-, -O-, 및 -S-로 이루어진 그룹 중에서 선택되며;
G'은 -CH- 및 -N-으로 이루어진 그룹으로부터 선택된다. 본원에 언급된 헤테로사이클릴 그룹들 중의 임의의 것도 : (1) C1 -7 아실(예를 들면, 카복시알데하이드 ); (2) C1-20 알킬(예를 들면, C1-6 알킬, C1-6 알콕시-C1-6 알킬, C1-6 알킬설피닐-C1-6 알킬, 아미노-C1-6 알킬, 아지도-C1-6 알킬, (카복시알데하이드)-C1-6 알킬, 할로-C1-6 알킬(예를 들면, 퍼플루오로알킬), 하이드록시-C1-6 알킬, 니트로-C1-6 알킬, 또는 C1-6 티오알콕시-C1-6 알킬); (3) C1-20 알콕시(예를 들면, C1-6 알콕시, 예를 들면, 퍼플루오로알콕시); (4) C1-6 알킬설피닐; (5) C6-10 아릴; (6) 아미노; (7) C1-6 알크-C6-10 아릴; (8) 아지도; (9) C3-8 사이클로알킬; (10) C1-6 알크-C3-8 사이클로알킬; (11) 할로; (12) C1-12 헤테로사이클릴(예를 들면, C2-12 헤테로아릴); (13) (C1-12 헤테로사이클릴)옥시; (14) 하이드록시; (15) 니트로; (16) C1-20 티오알콕시(예를 들면, C1-6 티오알콕시); (17) -(CH2)qCO2RA'[여기서, q는 0 내지 4의 정수이고, RA'은 (a) C1-6 알킬, (b) C6-10 아릴, (c) 수소, 및 (d) C1-6 알크-C6-10 아릴로 이루어진 그룹으로부터 선택된다]; (18) -(CH2)qCONRB'C'[여기서, q는 0 내지 4의 정수이고 여기서, RB' 및 RC'은 (a) 수소, (b) C1-6 알킬, (c) C6-10 아릴, 및 (d) C1-6 알크-C6-10 아릴로 이루어진 그룹 중에서 독립적으로 선택된다]; (19) -(CH2)qSO2RD'[여기서, q는 0 내지 4의 정수이고 여기서, RD'은 (a) C1-6 알킬, (b) C6-10 아릴, 및 (c) C1-6 알크-C6-10 아릴로 이루어진 그룹으로부터 선택된다]; (20) -(CH2)qSO2NRE'F'[여기서, q는 0 내지 4의 정수이고, 여기서, 각각의 RE' 및 RF'은, 독립적으로, (a) 수소, (b) C1-6 알킬, (c) C6-10 아릴, 및 (d) C1-6 알크-C6-10 아릴로 이루어진 그룹으로부터 선택된다]; (21) 티올; (22) C6-10 아릴옥시; (23) C3-8 사이클로알콕시; (24) 아릴알콕시; (25) C1-6 알크-C1-12 헤테로사이클릴(예를 들면, C1-6 알크-C1-12 헤테로아릴); (26) 옥소; (27)(C1-12 헤테로사이클릴)이미노; (28) C2-20 알케닐; 및 (29) C2-20 알키닐로 이루어진 그룹 중에서 독립적으로 선택된 1개, 2개, 3개, 4개 또는 5개의 치환체들로 임의로 치환될 수 있다. 일부 실시형태에서, 각각의 이들 그룹들은 본원에 기술된 바와 같이 추가로 치환될 수 있다. 예를 들면, C1-알크아릴 또는 C1-알크헤테로사이클릴의 알킬렌 그룹은 옥소 그룹을 추가로 치환되어 각각의 아릴로일 및 (헤테로사이클릴)로일 치환체 그룹을 생성할 수 있다.
본원에 사용된 것으로서, 용어 "(헤테로사이클릴)이미노"는 이미노 그룹을 통해 모 분자 그룹에 부착된, 본원에 정의된 바와 같은 헤테로사이클릴 그룹을 나타낸다. 일부 실시형태에서, 헤테로사이클릴 그룹은 본원에 정의된 바와 같은, 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "(헤테로사이클릴)옥시"는 산소 원자를 통해 모 분자 그룹에 부착된, 본원에 정의된 바와 같은 헤테로사이클릴 그룹을 나타낸다. 일부 실시형태에서, 헤테로사이클릴 그룹은 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "(헤테로사이클릴)로일"은 카보닐 그룹을 통해 모 분자 그룹에 부착된, 본원에 정의된 바와 같은 헤테로사이클릴 그룹을 나타낸다. 일부 실시형태에서, 헤테로사이클릴 그룹은 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "탄화수소"는 탄소 및 수소 원자들만으로 이루어진 그룹을 나타낸다.
본원에 사용된 것으로서, 용어 "하이드록시"는 -OH 그룹을 나타낸다. 일부 실시형태에서, 하이드록시 그룹은 알킬에 대해 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들(예를 들면, O-보호 그룹들)로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "하이드록시알케닐"은 1 내지 3개의 하이드록시 그룹들로 치환된, 본원에 정의된 바와 같은 알케닐 그룹을 나타내며, 단 1개 이하의 하이드록시 그룹은 알킬 그룹의 단일 탄소 원자에 부착될 수 있으며, 디하이드록시프로페닐, 하이드록시이소펜테닐 등으로 예시된다. 일부 실시형태에서, 하이드록시알케닐 그룹은 알킬에 대해 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들(예를 들면, O-보호 그룹들)로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "하이드록시알킬"은 1 내지 3개의 하이드록시 그룹들로 치환된, 본원에 정의된 바와 같은 알킬 그룹을 나타내며, 단 1개 이하의 하이드록시 그룹은 알킬 그룹의 단일 탄소 원자에 부착할 수 있으며 하이드록시메틸, 디하이드록시프로필 등으로 예시된다. 일부 실시형태에서, 하이드록시알킬 그룹은 알킬에 대해 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들(예를 들면, O-보호 그룹들)로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "하이드록시알키닐"은 1 내지 3개의 하이드록시 그룹들로 치환된, 본원에 정의된 바와 같은 알키닐 그룹을 나타내며, 단, 1개 이하의 하이드록시 그룹은 알킬 그룹의 단일 탄소 원자에 부착될 수 있다. 일부 실시형태에서, 하이드록시알키닐 그룹은 알킬에 대해 본원에 정의된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들(예를 들면, O-보호 그룹들)로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "이성체"는 본 발명의 어떠한 화합물의 어떠한 토우토머, 입체이성체, 거울상이성체, 또는 부분입체이성체를 의미한다. 본 발명의 화합물들은 하나 이상의 키랄 중심들 및/또는 이중 결합들을 가질 수 있으므로, 이중-결합 이성체들(즉, 기하학적 E/Z 이성체들) 또는 부분입체이성체들(예를 들면, 거울상이성체들[즉, (+) 또는 (-)) 또는 시스/트랜스 이성체들]로 존재할 수 있다. 본 발명에 따라서, 본원에 나타낸 화학 구조들, 및 따라서 본 발명의 화합물들은 모든 상응하는 입체이성체들, 즉, 입체이성체적으로 순수한 형태(예를 들면, 기하학적으로 순수한, 거울상이성체적으로 순수한, 또는 부분입체이성체적으로 순수한) 및 거울상이성체성 및 입체이성체성 혼합물들, 예를 들면, 라세메이트들 둘 다를 포함한다. 본 발명의 화합물들의 거울상이성체성 및 입체이성체성 혼합물들은 잘 공지된 방법들, 예를 들면, 키랄-상 가스 크로마토그래피, 키랄-상 고 성능 액체 크로마토그래피, 키랄 염 복합체로서의 화합물의 결정화, 또는 키랄성 용매 속의 화합물의 결정화에 의해 이들의 성분 거울상이성체들 또는 입체이성체들로 전형적으로 분해될 수 있다. 거울상이성체들 및 입체이성체들은 또한 입체이성체적으로 또는 거울상이성체적으로 순수한 중간체들, 반응제들, 및 촉매들로부터 잘-공지된 비대칭 합성 방법들에 의해 수득될 수 있다.
본원에 사용된 것으로서, 용어 "N-보호된 아미노"는, 여기에 본원에 정의된 바와 같은 1개 또는 2개의 N-보호 그룹들이 부착된, 본원에 정의된 바와 같은 아미노 그룹을 말한다.
본원에 사용된 것으로서, 용어 "N-보호 그룹"은 합성 과정들 동안 바람직하지 않은 반응들에 대해 아미노 그룹을 보호하도록 의도된 그룹들을 나타낸다. 일반적으로 사용된 N-보호 그룹들은 문헌[참조: Greene, "Protective Groups in Organic Synthesis" 3rd Edition(John Wiley & Sons, New York, 1999), 이는 참조로 본원에 혼입된다]에 기재되어 있다. N-보호 그룹들은 아실, 아릴로일, 또는 카바밀 그룹들, 예를 들면, 포르밀, 아세틸, 프로피오닐, 피발로일, t-부틸아세틸, 2-클로로아세틸, 2-브로모아세틸, 트리플루오로아세틸, 트리클로로아세틸, 프탈릴, o-니트로페녹시아세틸, α-클로로부티릴, 벤조일, 4-클로로벤조일, 4-브로모벤조일, 4-니트로벤조일, 및 키랄성 보조제들, 예를 들면, 보호되거나 보호되지 않은 D, L 또는 D, L-아미노산들, 예를 들면, 알라닌, 루이신, 페닐알라닌 등; 설포닐-함유 그룹들 예를 들면, 벤젠설포닐, p-톨루엔설포닐 등; 카바메이트 형성 그룹들, 예를 들면, 벤질옥시카보닐, p-클로로벤질옥시카보닐, p-메톡시벤질옥시카보닐, p-니트로벤질옥시카보닐, 2-니트로벤질옥시카보닐, p-브로모벤질옥시카보닐, 3,4-디메톡시벤질옥시카보닐, 3,5-디메톡시벤질옥시카보닐, 2,4-디메톡시벤질옥시카보닐, 4-메톡시벤질옥시카보닐, 2-니트로-4,5-디메톡시벤질옥시카보닐, 3,4,5-트리메톡시벤질옥시카보닐, 1-(p-비페닐릴)-1-메틸에톡시카보닐, α,α-디메틸-3,5-디메톡시벤질옥시카보닐, 벤즈하이드릴옥시 카보닐, t-부틸옥시카보닐, 디이소프로필메톡시카보닐, 이소프로필옥시카보닐, 에톡시카보닐, 메톡시카보닐, 알릴옥시카보닐, 2,2,2,-트리클로로에톡시카보닐, 페녹시카보닐, 4-니트로페녹시 카보닐, 플루오레닐-9-메톡시카보닐, 사이클로펜틸옥시카보닐, 아다만틸옥시카보닐, 사이클로헥실옥시카보닐, 페닐티오카보닐 등, 알크아릴 그룹들, 예를 들면, 벤질, 트리페닐메틸, 벤질옥시메틸 등 및 실릴 그룹들, 예를 들면, 트리메틸실릴 등을 포함한다. 바람직한 N-보호 그룹들은 포르밀, 아세틸, 벤조일, 피발로일, t-부틸아세틸, 알라닐, 페닐설포닐, 벤질, t-부틸옥시카보닐(Boc), 및 벤질옥시카보닐(Cbz)을 포함한다.
본원에 사용된 것으로서, 용어 "니트로"는 -NO2 그룹을 나타낸다.
본원에 사용된 것으로서, 용어 "O-보호 그룹"은 합성 과정들 동안에 바람직하지 않은 반응들에 대해 산소 함유(예를 들면, 페놀, 하이드록실, 또는 카보닐) 그룹을 보호하도록 의도된 그룹들을 나타낸다. 일반적으로 사용된 O-보호 그룹들은 문헌[참조: Greene, "Protective Groups in Organic Synthesis," 3rd Edition(John Wiley & Sons, New York, 1999), 이는 참조로 본원에 인용된다]에 기재되어 있다. 예시적인 O-보호 그룹들은 아실, 아릴로일, 또는 카바밀 그룹들, 예를 들면, 포르밀, 아세틸, 프로피오닐, 피발로일, t-부틸아세틸, 2-클로로아세틸, 2-브로모아세틸, 트리플루오로아세틸, 트리클로로아세틸, 프탈릴, o-니트로페녹시아세틸, α-클로로부티릴, 벤조일, 4-클로로벤조일, 4-브로모벤조일, t-부틸디메틸실릴, 트리-이소-프로필실릴옥시메틸, 4,4'-디메톡시트리틸, 이소부티릴, 페녹시아세틸, 4-이소프로필페헤녹시아세틸, 디메틸포름아미디노, 및 4-니트로벤조일; 알킬카보닐 그룹들, 예를 들면, 아실, 아세틸, 프로피오닐, 피발로일 등; 임의로 치환된 아릴카보닐 그룹들, 예를 들면, 벤조일; 실릴 그룹들, 예를 들면, 트리메틸실릴(TMS), 3급-부틸디메틸실릴(TBDMS), 트리-이소-프로필실릴옥시메틸(TOM), 트리이소프로필실릴(TIPS) 등; 하이드록실과의 에테르-형성 그룹들, 예를 들면, 메틸, 메톡시메틸, 테트라하이드로피라닐, 벤질, p-메톡시벤질, 트리틸 등; 알콕시카보닐들, 예를 들면, 메톡시카보닐, 에톡시카보닐, 이소프로폭시카보닐, n-이소프로폭시카보닐, n-부틸옥시카보닐, 이소부틸옥시카보닐, sec-부틸옥시카보닐, t-부틸옥시카보닐, 2-에틸헥실옥시카보닐, 사이클로헥실옥시카보닐, 메틸옥시카보닐 등; 알콕시알콕시카보닐 그룹들, 예를 들면, 메톡시메톡시카보닐, 에톡시메톡시카보닐, 2-메톡시에톡시카보닐, 2-에톡시에톡시카보닐, 2-부톡시에톡시카보닐, 2-메톡시에톡시메톡시카보닐, 알릴옥시카보닐, 프로파르길옥시카보닐, 2-부텐옥시카보닐, 3-메틸-2-부텐옥시카보닐 등; 할로알콕시카보닐들, 예를 들면, 2-클로로에톡시카보닐, 2-클로로에톡시카보닐, 2,2,2-트리클로로에톡시카보닐 등; 임의로 치환된 아릴알콕시카보닐 그룹들, 예를 들면, 벤질옥시카보닐, p-메틸벤질옥시카보닐, p-메톡시벤질옥시카보닐, p-니트로벤질옥시카보닐, 2,4-디니트로벤질옥시카보닐, 3,5-디메틸벤질옥시카보닐, p-클로로벤질옥시카보닐, p-브로모벤질옥시-카보닐, 플루오레닐메틸옥시카보닐 등; 및 임의로 치환된 아릴옥시카보닐 그룹들, 예를 들면, 페녹시카보닐, p-니트로페녹시카보닐, o-니트로페녹시카보닐, 2,4-디니트로페녹시카보닐, p-메틸-페녹시카보닐, m-메틸페녹시카보닐, o-브로모페녹시카보닐, 3,5-디메틸페녹시카보닐, p-클로로페녹시카보닐, 2-클로로-4-니트로페녹시-카보닐 등); 치환된 알킬, 아릴, 및 알크아릴 에테르들(예를 들면, 트리틸; 메틸티오메틸; 메톡시메틸; 벤질옥시메틸; 실록시메틸; 2,2,2,-트리클로로에톡시메틸; 테트라하이드로피라닐; 테트라하이드로푸라닐; 에톡시에틸; 1-[2-(트리메틸실릴)에톡시]에틸; 2-트리메틸실릴에틸; t-부틸 에테르; p-클로로페닐, p-메톡시페닐, p-니트로페닐, 벤질, p-메톡시벤질, 및 니트로벤질); 실릴 에테르들(예를 들면, 트리메틸실릴; 트리에틸실릴; 트리이소프로필실릴; 디메틸이소프로필실릴; t-부틸디메틸실릴; t-부틸디페닐실릴; 트리벤질실릴; 트리페닐실릴; 및 디페닐메틸실릴); 탄산염들(예를 들면, 메틸, 메톡시메틸, 9-플루오레닐메틸; 에틸; 2,2,2-트리클로로에틸; 2-(트리메틸실릴)에틸; 비닐, 알릴, 니트로페닐; 벤질; 메톡시벤질; 3,4-디메톡시벤질; 및 니트로벤질); 카보닐-보호 그룹들(예를 들면, 아세탈 및 케날 그룹들, 예를 들면, 디메틸 아세탈, 1,3-디옥솔란 등; 아실랄 그룹들; 및 디티안 그룹들, 예를 들면, 1,3-디티안들, 1,3-디티올란 등); 카복실산-보호 그룹들(예를 들면, 에스테르 그룹들, 예를 들면, 메틸 에스테르, 벤질 에스테르, t-부틸 에스테르, 오르토에스테르들 등; 및 옥사졸린 그룹들을 포함한다.
본원에 사용된 것으로서, 용어 "옥소"는 =O를 나타낸다.
본원에 사용된 것으로서, 용어 "퍼플루오로알킬"은 본원에 정의된 바와 같은 알킬 그룹을 나타내며, 여기서, 알킬 그룹에 결합된 각각의 수소 라디칼은 불화물 라디칼로 대체되어 있다. 퍼플루오로알킬 그룹들은 트리플루오로메틸, 펜타플루오로에틸 등으로 예시된다.
본원에 사용된 것으로서, 용어 "퍼플루오로알콕시"는 본원에 정의된 바와 같은 알콕시 그룹을 나타내며, 여기서, 알콕시 그룹에 결합된 각각의 수소 라디칼은 불화물 라디칼로 대체되어 있다. 퍼플루오로알콕시 그룹들은 트리플루오로메톡시, 펜타플루오로에톡시 등으로 예시된다.
본원에 사용된 것으로서, 용어 "스피로사이클릴"은, 이의 말단들 둘다가 모 그룹의 동일한 탄소 원자에 결합하여 스피로사이클릭 그룹을 형성하는 C2-7 알킬렌 디라디칼, 및 또한 이의 말단들 둘다가 동일한 원자에 결합한 C1 -6 헤테로알킬렌 디라디칼을 나타낸다. 스피로사이클릴 그룹을 형성하는 헤테로알킬렌 라디칼은 질소, 산소, 및 황으로 이루어진 그룹 중에서 독립적으로 선택된 1개, 2개, 3개 또는 4개의 헤테로원자들을 함유할 수 있다. 일부 실시형태에서, 스피로사이클릴 그룹은 1 내지 7개의 탄소들을 포함하며, 디라디칼이 부착된 탄소 원자는 배제된다. 본 발명의 스피로사이클릴 그룹들은 사이클로알킬 및/또는 헤테로사이클릴 그룹들에 대한 임의의 치환체들로서 본원에 제공된 1개, 2개, 3개, 또는 4개의 치환체들로 임의로 치환된다.
본원에 사용된 것으로서, 용어 "입체이성체"는 모든 가능한 상이한 이성체 및 또한, 화합물이 소유할 수 있는 구조적 형태들(예를 들면, 본원에 기술된 어떠한 화학식의 화합물), 특히 기본 분자 구조의 모든 가능한 입체화학적으로 및 구조적으로 이성체인 형태들, 모든 부분입체이성체들, 거울상이성체들 및/또는 이형태체들(conformers)을 말한다. 본 발명의 일부 화합물들은 상이한 토우토머 형태들로 존재할 수 있으며, 이들 형태들 모두는 본 발명의 범위 내에 포함된다.
본원에 사용된 것으로서, 용어 "설포알킬"은 -SO3H의 설포 그룹으로 치환된, 본원에 정의된 바와 같은 알킬 그룹을 나타낸다. 일부 실시형태에서, 알킬 그룹은 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있으며, 설포 그룹은 하나 이상의 O-보호 그룹들(예를 들면, 본원에 기술된 바와 같은)로 추가로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "설포닐"은 -S(O)2- 그룹을 나타낸다.
본원에 사용된 것으로서, "티오알크아릴"은 화학식 -SR(여기서, R은 알크아릴 그룹이다)의 화학적 치환체를 나타낸다. 일부 실시형태에서, 알크아릴 그룹은 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 치환된다.
본원에 사용된 것으로서, 용어 "티오알크헤테로사이클릴"은 화학식 -SR(여기서, R은 알크헤테로사이클릴 그룹이다)의 화학적 치환체를 나타낸다. 일부 실시형태에서, 알크헤테로사이클릴 그룹은 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다.
본원에 사용된 것으로서, 용어 "티오알콕시"는 화학식 -SR(여기서, R은 본원에 정의된 바와 같은 알킬 그룹이다)의 화학적 치환체를 나타낸다. 일부 실시형태에서, 알킬 그룹은 본원에 기술된 바와 같은 1개, 2개, 3개, 또는 4개의 치환체 그룹들로 추가로 치환될 수 있다.
화합물; 본원에 사용된 것으로서, 용어 "화합물"은 나타낸 구조식들의 모든 입체이성체들, 기하학적 이성체들, 토우토머들, 및 동위 원소들을 포함함을 의미한다.
본원에 기술된 화합물들은 비대칭(예를 들면, 1개 또는 2개의 입체중심들을 갖는)일 수 있다. 달리 나타내지 않는 한, 모든 입체이성체들, 예를 들면, 거울상이성체들 및 부분입체이성체들이 의도된다. 비대칭적으로 치환된 탄소 원자들을 함유한 본 개시의 화합물들은 광학적으로 활성이거나 라세미 형태들로 분리될 수 있다. 광학적으로 활성인 출발 물질들로부터 광학적으로 활성인 형태들을 제조하는 방법들은 당해 분야에 공지되어 있으며, 예를 들면, 라세미 혼합물들의 분해 또는 입체선택적 합성에 의한다. 올레핀들의 많은 기하학적 이성체들, C=N 이중 결합들 등이 또한 본원에 기술된 화합물들에 존재할 수 있으며, 모든 이러한 이성체들은 본 개시에서 고려된다. 본 개시의 화합물들의 시스 및 트랜스 기하학적 이성체들이 기술되어 있으며 이성체들의 혼합물로서 또는 분리된 이성체 형태들로서 분리될 수 있다.
본 개시의 화합물들은 토우토머 형태들을 또한 포함한다. 토우토머 형태들은 인접한 이중 결합과 단일 결합의 스와핑(swapping) 및 양성자의 동시 이주로부터 생성된다. 토우토머 형태들은 동일한 실험식 및 총 전하를 갖는 이성체성 양성자화 상태들인 양성자성 토우토머들을 포함한다. 양성자성 토우토머들의 예들은 케톤-에놀 쌍들, 아미드-이미드산 쌍들, 락탐-락팀 쌍들, 아미드-이미드산 쌍들, 에나민-이민 쌍들, 및 고리 모양 형태들을 포함하며, 여기서, 양성자는 헤테로사이클릭 시스템의 2개 이상의 위치들, 예를 들면, 1H- 및 3H-이미다졸, 1H-, 2H- 및 4H-1,2,4-트리아졸, 1H- 및 2H- 이소인돌, 및 1H- 및 2H-피라졸을 점유할 수 있다. 토우토머 형태들은 평형일 수 있거나 적절한 치환에 의해 1개 형태로 입체적으로 잠금(locking)된다.
본 개시의 화합물들은 중간체 또는 최종 화합물들 속에 존재하는 원자들의 동위원소들 모두를 또한 포함한다. "동위원소들"은 동일한 원자수를 가지지만 핵내 중성자들의 상이한 수로 초래되는 상이한 질량수들을 갖는 원자들을 말한다. 예를 들면, 수소의 동위원소들은 삼중수소 및 중수소를 포함한다.
본 개시의 화합물들 및 염들은 용매 또는 물 분자들과 함께 제조되어 통상의 방법들에 의해 용매화물들 및 수화물들을 형성할 수 있다.
보존된: 본원에 사용된 것으로서, 용어 "보존된"은 비교하는 2개 이상의 서열들의 동일한 부위내에서 변경되지 않는 것들인 폴리뉴클레오타이드 서열 또는 폴리펩타이드 서열의 뉴클레오타이드들 또는 아미노산 잔기들 각각을 말한다. 비교적 보존된 뉴클레오타이드들 또는 아미노산들은 서열들내 어디에서도 존재하는 뉴클레오타이드들 또는 아미노산들보다 더 관련된 서열들 중에서 보존된 것들이다.
일부 실시형태에서, 2개 이상의 서열들은, 이들이 서로 100% 동일한 경우, "완전히 보존된" 것으로 일컬어진다. 일부 실시형태에서, 2개 이상의 서열들은, 이들이 서로에 대해 적어도 70% 동일하거나, 적어도 80% 동일하거나, 적어도 90% 동일하거나, 또는 적어도 95% 동일한 경우, "고도로 보존된"으로 일컬어진다. 일부 실시형태에서, 2개 이상의 서열들은, 이들이 서로에 대해 약 70% 동일하거나, 약 80% 동일하거나, 약 90% 동일하거나, 약 95%, 약 98%, 또는 약 99% 동일한 경우, "고도로 보존된"으로 일컬어진다. 일부 실시형태에서, 2개 이상의 서열들은, 이들이 서로에 대해 적어도 30% 동일하거나, 적어도 40% 동일하거나, 적어도 50% 동일하거나, 적어도 60% 동일하거나, 적어도 70% 동일하거나, 적어도 80% 동일하거나, 적어도 90% 동일하거나, 또는 적어도 95% 동일한 경우, "보존된"으로 일컬어진다. 일부 실시형태에서, 2개 이상의 서열들은, 이들이 서로에 대해 약 30% 동일하거나, 약 40% 동일하거나, 약 50% 동일하거나, 약 60% 동일하거나, 약 70% 동일하거나, 약 80% 동일하거나, 약 90% 동일하거나, 약 95% 동일하거나, 약 98% 동일하거나, 또는 약 99% 동일한 경우, "보존된"으로 일컬어진다. 서열의 보존은 올리고뉴클레오타이드 또는 폴리펩타이드의 전체 길이에 적용될 수 있거나 이의 일부, 영역 또는 특징에 적용될 수 있다.
사이클릭 또는 폐환된: 본원에 사용된 것으로서, 용어 "사이클릭"은 연속된 루프(loop)의 존재를 말한다. 사이클릭 분자들은 원형일 필요가 없으며, 단지 결합하여 소단위들의 깨지지 않은 쇄를 형성한다. 본 발명의 mRNA와 같은 사이클릭 분자들은 단일 단위들 또는 다합체들(mμLtimer)일 수 있거나 복합체의 하나 이상의 성분 또는 보다 높은 차수의 구조를 포함한다.
세포정지성: 본원에 사용된 것으로서, "세포정지성"은 세포[예를 들면, 포유동물 세포(예를 들면, 사람 세포)], 세균, 바이러스, 진균, 원생동물, 기생충, 프리온(prion), 또는 이의 조합의 성장, 분할, 또는 증식을 억제하거나, 감소시키거나, 제어함을 말한다.
세포독성: 본원에 사용된 것으로서, "세포독성"은 세포[예를 들면, 포유동물 세포(예를 들면, 사람 세포)], 세균, 바이러스, 진균, 원생동물, 기생충, 프리온(prion), 또는 이의 조합의 사멸, 또는 손상, 독성, 또는 치명적인 효과를 유발함을 말한다.
전달: 본원에 사용된 것으로서, "전달"은 화합물, 물질, 실체, 잔기, 카르고(cargo) 또는 페이로드를 전달하는 작용 또는 방식을 말한다.
전달제: 본원에 사용된 것으로서, "전달제"는 표적된 세포들로 폴리뉴클레오타이드의 생체내 전달을 적어도 부분적으로 촉진하는 특정 물질을 말한다.
탈안정화된: 본원에 사용된 것으로서, 용어 "탈안정화", "탈안정화하다", 또는 "탈안정화 영역"은 동일한 영역 또는 분자의 출발, 야생형 또는 천연 형태보다 덜 안정한 영역 또는 분자를 의미한다.
검출가능한 표지: 본원에 사용된 것으로서, "검출가능한 표지"는 방사선촬영, 형광성, 화학발광성, 효소 활성, 흡광도 등을 포함하는 당해 분야에 공지된 방법들로 용이하게 검출되는 다른 실체와 함께 부착되거나, 혼입되거나 연합된 하나 이상의 마커들, 신호들, 또는 잔기들을 말한다. 검출가능한 표지들은 방사선동위원소들, 형광단들, 발색단들, 효소들, 염료들, 금속 이온들, 리간드들, 예를 들면, 바이오틴, 아비딘, 스트렙타비딘 및 합텐들, 양자점들 등을 포함한다. 검출가능한 표지들은 본원에 기재된 펩타이드들 또는 단백질들의 어떠한 위치에도 위치할 수 있다. 이들은 아미노산들, 펩타이드들, 또는 단백질들내에 존재할 수 있거나, N- 또는 C- 말단에 위치할 수 있다.
소화(하다): 본원에 사용된 것으로서, 용어 "소화(하다)"는 보다 작은 조각들 또는 성분들로 파괴됨을 의미한다. 폴리펩타이드들 또는 단백질들을 언급하는 경우, 소화는 펩타이드들의 생산을 초래한다.
먼( distal ): 본원에 사용된 것으로서, 용어 "먼"은 목적한 지점 또는 영역으로부터 멀거나 중심으로부터 멀리 위치함을 의미한다.
암호화된 단백질 절단 신호: 본원에 사용된 것으로서, "암호화된 단백질 절단 신호"는 단백질 절단 신호를 암호화하는 뉴클레오타이드 서열을 말한다.
가공된: 본원에 사용된 것으로서, 본 발명의 실시형태들은, 출발점, 야생형 또는 천연 분자로부터 변하는 구조 또는 화학물질에 상관없이, 특징 또는 특성을 갖도록 설계되는 경우 "가공된"이다.
발현: 본원에 사용된 것으로서, 핵산 서열의 "발현"은 다음 현상들 중의 하나 이상을 말한다: (1) DNA 서열로부터 RNA 주형의 생산(예를 들면, 전사에 의한); (2) RNA 전사체의 프로세싱[예를 들면, 스플라이싱(splicing), 에디팅(editing), 5' 캡(cap) 형성, 및/또는 3' 말단 프로세싱에 의한]; (3) RNA의 폴리펩타이드 또는 단백질내로의 번역; 및 (4) 폴리펩타이드 또는 단백질의 번역후 변형.
특징: 본원에 사용된 것으로서, "특징"은 특징, 특성 또는 명백한 요소를 말한다.
제형: 본원에 사용된 것으로서, "제형"은 적어도 폴리뉴클레오타이드 및 전달제를 포함한다.
단편: 본원에 사용된 것으로서, "단편"은 부위를 말한다. 예를 들면, 단백질들의 단편들은 배양된 세포들로부터 분리된 완전한 길이의 단백질을 분해하여 수득된 폴리펩타이드들을 포함할 수 있다.
기능적: 본원에 사용된 것으로서, "기능적" 생물학적 분자는, 이것이 특징화된 특성 및/또는 활성을 나타내는 형태의 생물학적 분자이다.
상동성: 본원에 사용된 것으로서, 용어 "상동성"은 중합체 분자들, 예를 들면, 핵산 분자들(예를 들면, DNA 분자들 및/또는 RNA 분자들) 사이의 및/또는 폴리펩타이드 분자들 사이의 전체적인 관련성을 말한다. 일부 실시형태에서, 중합체 분자들은, 이들의 서열들이 적어도 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 또는 99% 동일하거나 또는 유사한 경우 서로에 대해 "상동성"인 것으로 고려된다. 용어 "상동성"은 필수적으로 적어도 2개의 서열들(폴리뉴클레오타이드 또는 폴리펩타이드 서열들) 사이의 비교를 말한다. 본 발명에 따라서, 2개의 폴리뉴클레오타이드 서열들은, 이들이 암호화하는 폴리펩타이드들이 적어도 약 20개 아미노산들의 적어도 하나의 신장에 대해 적어도 약 50%, 60%, 70%, 80%, 90%, 95%, 또는 심지어 99%인 경우 상동성인 것으로 고려된다. 일부 실시형태에서, 상동성 폴리뉴클레오타이드 서열들은 적어도 4 내지 5개의 유일하게 명시된 아미노산들의 신장을 암호화하는 능력으로 특징화된다. 길이가 60개 미만의 뉴클레오타이드인 폴리뉴클레오타이드 서열들의 경우, 상동성은 적어도 4 내지 5개의 유일하게 명시된 아미노산들의 신장을 암호화하는 능력으로 측정된다. 본 발명에 따라서, 2개의 단배질 서열들은, 단백질들이 적어도 약 20개 아미노산들의 적어도 하나의 신장에 대해 적어도 약 50%, 60%, 70%, 80%, 또는 90% 동일한 경우 상동성인 것으로 고려된다.
동일성: 본원에 사용된 것으로서, 용어 "동일성"은 중합체 분자들, 예를 들면, 올리고뉴클레오타이드 분자들(예를 들면, DNA 분자들 및/또는 RNA 분자들) 및/또는 폴리펩타이드 분자들 사이의 전체 관련성을 말한다. 2개의 폴리뉴클레오타이드 서열들의 동일성 퍼센트의 계산은, 예를 들면, 최적의 비교 목적들을 위해 2개 서열들을 정렬함으로써 수행할 수 있다(예를 들면, 갭(gap)들을 최적의 정렬을 위해 제1의 및 제2의 핵산 서열들 중 하나 또는 둘 다내로 도입시킬 수 있고 동일하지 않은 서열들은 비교 목적들을 위해 무시할 수 있다). 특정 실시형태에서, 비교 목적들을 위해 정렬된 서열의 길이는 참조 서열의 길이의 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 적어도 95%, 또는 100%이다. 상응하는 뉴클레오타이드 위치들에서 뉴클레오타이드들을 이후 비교한다. 제1의 서열내 위치가 제2의 서열내 상응하는 위치로서 동일한 뉴클레오타이드에 의해 점유되는 경우, 분자는 당해 위치에서 동일하다. 2개의 서열들 사이의 동일성 퍼센트는 2개의 서열들의 최적의 정렬을 위해 도입될 필요가 있는, 각각의 갭의 길이, 및 갭들의 수를 고려하여, 서열들에 의해 공유된 동일한 위치들의 수의 기능이다. 서열들의 비교 및 2개 서열들 사이의 동일성 퍼센트의 측정은 수학적 알고리즘을 사용하여 달성할 수 있다. 예를 들면, 2개의 뉴클레오타이드 서열들 사이의 동일성 퍼센트는 문헌(참조: Computational MolecμLar Biology, Lesk, A. M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D. W., ed., Academic Press, New York, 1993; Sequence Analysis in MolecμLar Biology, von Heinje, G., Academic Press, 1987; Computer Analysis of Sequence Data, Part I, Griffin, A. M., and Griffin, H. G., eds., 사람a Press, New Jersey, 1994; and Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M Stockton Press, New York, 1991; 이들 각각은 참조로 본원에 인용된다)에 기술된 것들과 같은 방법들을 사용하여 측정할 수 있다. 예를 들면, 2개의 뉴클레오타이드 서열들 사이의 동일성 퍼센트는 PAM120 중량 잔기 표, 12의 갭 길이 패널티 및 4의 갭 패널티를 사용하는 ALIGN 프로그램(버젼 2.0)내로 혼입된, 메이어스(Meyers) 및 밀러(Miller)의 문헌(참조: CABIOS, 1989, 4:11-17)의 알고리즘을 사용하여 측정할 수 있다. 달리는, 2개의 뉴클레오타이드 서열들 사이의 동일성 퍼센트는 NWSgapdna.CMP 매트릭스를 사용하는 GCG 소프트웨어 패키지에서 GAP 프로그램을 사용하여 측정할 수 있다. 서열들 사이의 동일성 퍼센트를 측정하기 위해 일반적으로 사용된 방법들은 본원에 참조로 혼입된 문헌[참조: Carillo, H., and Lipman, D., SIAM J Applied Math., 48:1073(1988)]에 기재된 것들을 포함하나, 이에 한정되지 않는다. 동일성을 측정하기 위한 기술들은 공공 이용가능한 컴퓨터 프로그램들에서 암호화되어 있다. 2개의 서열들 사이의 상동성을 측정하기 위한 예시적인 컴퓨터 소프트웨어는 GCG 프로그램 패키지[참조: Devereux, J., et al., Nucleic Acids Research, 12(1), 387(1984)), BLASTP, BLASTN, 및 FASTA Altschμl S. F. et al., J. Molec. Biol., 215, 403(1990)]를 포함하나, 이에 한정되지 않는다.
유전자의 발현을 억제하다: 본원에 사용된 것으로서, 어구 "유전자의 발현을 억제하다"는 유전자의 발현 생성물의 양에 있어서의 감소를 유발함을 의미한다. 발현 생성물은 유전자로부터 전사된 RNA(예를 들면, mRNA) 또는 유전자로부터 전사된 mRNA로부터 번역된 폴리펩타이드일 수 있다. 전형적으로 mRNA의 수준에 있어서의 감소는 이로부터 번역된 폴리펩타이드 수준에 있어서의 감소를 생성한다. 발현 수준은 mRNA 또는 단백질을 측정하기 위한 표준 기술들을 사용하여 측정할 수 있다.
시험관내: 본원에 사용된 것으로서, 용어 "시험관내"는 유기체(예를 들면, 동물, 식물 또는 미생물)내가 아닌 인공 환경, 예를 들면, 시험 튜브 또는 반응 용기, 세포 배양물, 페트리 디쉬(petri dish) 등에서 발생하는 현상들을 말한다.
생체내: 본원에 사용된 것으로서, 용어 "생체내"는 유기체(예를 들면, 동물, 식물, 또는 미생물 또는 이의 세포 또는 조직)내에서 발생하는 현상들을 말한다.
분리된: 본원에 사용된 것으로서, 용어 "분리된"은, 이것이 관련되었던(천연 또는 실험 셋팅에 상관없이) 성분들 중 적어도 일부로부터 분리된 물질 또는 실체를 말한다. 분리된 물질들은, 이들이 초기에 관련되었던 다른 성분들 중 적어도 약 10%, 약 20%, 약 30%, 약 40%, 약 50%, 약 60%, 약 70%, 약 80%, 약 90% 이상으로부터 분리될 수 있다. 일부 실시형태에서, 분리된 제제들은 약 80%, 약 85%, 약 90%, 약 91%, 약 92%, 약 93%, 약 94%, 약 95%, 약 96%, 약 97%, 약 98%, 약 99% 이상, 또는 약 99% 이상 순수하다. 본원에 사용된 것으로서, 물질은, 다른 성분들을 실질적으로 함유하지 않는 경우 "순수"하다.
실질적으로 순수한: "실질적으로 순수한"은, 화합물이 형성되거나 검출되었던 환경으로부터 실질적으로 분리됨을 의미한다. 부분 분리는 예를 들면, 본 개시의 화합물 속에 풍부한 조성물을 포함할 수 있다. 실질적인 분리는 본 개시의 화합물을 적어도 약 50 중량%, 적어도 약 60중량%, 적어도 약 70중량%, 적어도 약 80중량%, 적어도 약 90중량%, 적어도 약 95중량%, 적어도 약 97중량%, 또는 적어도 약 99중량 함유하는 조성물들을 포함할 수 있다. 화합물들 및 이들의 염들을 분리하는 방법들은 당해 분야에서 통상적이다.
링커: 본원에 사용된 것으로서, 링커는 원자들, 예를 들면, 10 내지 1,000개의 원자들의 그룹을 말하며, 탄소, 아미노, 알킬아미노, 산소, 황, 설폭사이드, 설포닐, 카보닐, 및 이민과 같은, 그러나 이에 한정되지 않는 원자들 또는 그룹들을 포함할 수 있다. 링커는 제1 말단에서 핵염기 또는 당 모이어티 상의 변형된 뉴클레오사이드 또는 뉴클레오타이드, 및 제2 말단에서 페이로드, 예를 들면, 제2의 검출가능한 제제 또는 치료학적 제제에 부착될 수 있다. 링커는 핵산 서열내로의 혼입을 방해하지 않기에 충분한 길이일 수 있다. 링커는 어떠한 유용한 목적, 예를 들면, 본원에 기술된 바와 같이, 다량체들(예를 들면, 2개 이상의 폴리뉴클레오타이드들의 연결을 통해) 또는 접합체들을 형성하기 위해, 및 페이로드를 투여하기 위해 사용될 수 있다. 링커내로 혼입시킬 수 있는 화학 그룹들의 예들은 알킬, 알케닐, 알키닐, 아미도, 아미노, 에테르, 티오에테르, 에스테르, 알킬렌, 헤테로알킬렌, 아릴, 또는 헤테로사이클릴을 포함하나, 이에 한정되지 않으며, 이들 각각은 본원에 기술된 바와 같이 임의로 치환된다. 링커들의 예들은 불포화된 알칸들, 폴리에틸렌 글리콜들(예를 들면, 에틸렌 또는 프로필렌 글리콜 단량체 단위들, 예를 들면, 디에틸렌 글리콜, 디프로필렌 글리콜, 트리에틸렌 글리콜, 트리프로필렌 글리콜, 테트라에틸렌 글리콜, 또는 테트라에틸렌 글리콜), 및 덱스트란 중합체들을 포함하나, 이에 한정되지 않는다. 다른 예들은 예를 들면, 이황화물 결합(-S-S-) 또는 아조 결합(-N=N-)과 같은, 링커내 절단가능한 잔기들을 포함하나, 이에 한정되지 않으며, 이들은 환원제 또는 광분해로 분해할 수 있다. 선택적으로 절단가능한 결합의 비-제한적 예들은 예를 들면, 트리스(2-카복시에틸)포스핀(TCEP), 또는 다른 환원제들, 및/또는 광분해의 사용에 의해 절단될 수 있는 아미도 결합을 포함하고, 에스테르 결합은 예를 들면, 산성 또는 염기성 가수분해에 의해 절단될 수 있다.
변형된: 본원에 사용된 것으로서 "변형된"은 본 발명의 분자의 변화된 상태 또는 구조를 말한다. 분자들은 화학적으로, 구조적으로, 및 기능적으로를 포함하는 많은 방식들로 변형될 수 있다. 한 실시형태에서, 본 발명의 mRNA 분자들은 비-천연 뉴클레오사이드들 및/또는 뉴클레오타이드들의 도입으로 변형되는데, 예를 들어, 이들은 천연 리보뉴클레오타이드들 A, U, G, 및 C에 관한 것이기 때문이다. 비캐노니칼(Noncanonical) 뉴클레오타이드들, 예를 들어, 캡 구조들은, A, C, G, U 리보뉴클레오타이드들의 화학 구조와는 상이하다고 해도, "변형된" 것으로 고려되지 않는다.
천연적으로 존재하는: 본원에 사용된 것으로서, "천연적으로 존재하는"은 인공 보조제없이 천연에 존재함을 의미한다.
비-사람 척추동물: 본원에 사용된 것으로서, "비 사람 척추동물"은 야생 종들 및 사육된 종들을 포함하는, 호모 사피엔스(Homo sapiens)를 제외한 모든 척추동물들을 포함한다. 비-사람 척추동물들의 예들은 알파카(alpaca), 반텡(banteng), 비손(bison), 낙타, 고양이, 소, 사슴, 개, 당나귀, 가얄(gayal), 염소, 기니아 피그, 말, 라마(llama), 노새, 돼지, 토끼, 순록, 양, 물소(sheep water buffalo), 및 야크(yak)와 같은 포유동물들을 포함하나, 이에 한정되지 않는다.
오프-표적(off-target): 본원에 사용된 것으로서, "오프 표적"은 하나 이상의 표적, 유전자, 또는 세포 전사체 상에서 어떠한 의도되지 않은 효과를 말한다.
개방 판독 프레임(open reading frame): 본원에 사용된 것으로서, "개방 판독 프레인" 또는 "ORF"은 제공된 판독 프레임내에서 정지 코돈을 함유하지 않는 서열을 말한다.
작동적으로 연결된: 본원에 사용된 것으로서, 어구 "작동적으로 연결된"은 2개 이상의 분자들, 작제물들, 전사체들, 실체들, 잔기들 등의 사이의 기능적 연결을 말한다.
파라토프 ( Paratope ): 본원에 사용된 것으로서, "파라토프"는 항체의 항원-결합 부위를 말한다.
환자: 본원에 사용된 것으로서, "환자"는 치료를 추구할 수 있거나 치료가 요구되거나, 치료를 필요로 하거나, 치료를 받는 중이거나, 치료를 받을 예정인 대상체, 또는 특수한 질병 또는 상태에 대해 숙련된 전문가에 의한 관리하에 있는 대상체를 말한다.
임의로 치환된: 본원에서 형태 "임의로 치환된 X"의 어구(예를 들면, 임의로 치환된 알킬)은 "X, 여기서, X는 임의로 치환된"(예를 들면, "알킬, 여기서, 당해 알킬은 임의로 치환된다")과 동등한 것으로 의도된다. 특징 "X"(예를 들면, 알킬) 자체는 임의적인 것을 의미하는 것으로 의도되지 않는다.
펩타이드: 본원에 사용된 것으로서, "펩타이드"는 50개 이하의 아미노산 길이, 예를 들면, 약 5, 10, 15, 20, 25, 30, 35, 40, 45, 또는 50 아미노산들의 길이이다.
약제학적으로 허용되는: 어구 "약제학적으로 허용되는"은 본원에서, 이상적인 이익/위험 비와 비례하게, 과도한 독성, 자극, 알레르기 반응, 또는 다른 문제점 또는 합병증 없이 사람들 및 동물들의 조직들과 접촉해서 사용하기에 적합한, 건전한 의학적 판단의 영역내에 있는 화합물들, 물질들, 조성물들 및/또는 용량 형태들을 말한다.
약제학적으로 허용되는 부형제: 본원에 사용된 것으로서, 어절 "약제학적으로 허용되는 부형제"는 본원에 기술된 화합물들 이외의 어떠한 성분(예를 들면, 활성 화합물을 현탁시키거나 용해시킬 수 있는 비히클)을 말하며 환자에서 실질적으로 무독성이고 비-염증성인 특성들을 갖는다. 부형제들은, 예를 들면: 항부착제들, 항산화제들, 결합제들, 피복제들, 압착 보조제들, 붕해제들, 염료들(착색제들), 유연제들, 유화제들, 충전제들(희석제들), 필름 형성제들 또는 피복제들, 풍미제들, 향수들, 활주제들(유동 증진제들), 윤활제들, 방부제들, 인쇄 잉크들, 흡수제들, 현탁제들, 분산화제들, 감미제들, 및 수화용 수(waters of hydration)를 말한다. 예시적인 부형제들은 부틸화된 하이드록시톨루엔(BHT), 탄산칼슘, 인산칼슘(이염기성), 스테아르산칼슘, 크로스카멜로즈, 가교결하된 폴리비닐 피롤리돈, 시트르산, 크로스포비돈, 시스테인, 에틸셀룰로즈, 젤라틴, 하이드록시프로필 셀룰로즈, 하이드록시프로필 메틸셀룰로즈, 락토즈, 스테아르산마그네슘, 만티톨, 만니톨, 메티오닌, 메틸셀룰로즈, 메틸 파라벤, 미세결정성 셀룰로즈, 폴리에틸렌 글리콜, 폴리비닐 피롤리돈, 포비돈, 예비젤라틴화된 전분, 프로필 파라벤, 레티닐 팔미테이트, 쉘락, 이산화규소, 나트륨 카복시메틸 셀룰로즈, 시트르산나트륨, 나트륨 전분 글리콜레이트, 소르비톨, 전분(옥수수), 스테아르산, 슈크로즈, 활석, 이산화티탄, 비타민 A, 비타민 E, 비타민 C, 및 크실리톨을 포함하나, 이에 한정되지 않는다.
약제학적으로 허용되는 염들: 본 개시는 또한 본원에 기술된 화합물들의 약제학적으로 허용되는 염들을 포함한다. 본원에 사용된 것으로서, "약제학적으로 허용되는 염들"은 기재된 화합물들의 유도체들을 말하며, 여기서, 모 화합물은 존재하는 산 또는 염기 잔기를 이의 염 형태로 전환시킴으로써(예를 들면, 유리 염기 그룹을 적합한 유기 산과 반응시킴으로써) 변형시킨다. 약제학적으로 허용되는 염들의 예들은 아민들과 같은 염기성 잔기들의 광산 또는 유기산 염들; 카복실산과 같은 산성 잔기들의 알칼리 또는 유기 염들; 등을 포함하나, 이에 한정되지 않는다. 대표적인 산 부가 염들은 아세테이트, 아디페이트, 알기네이트, 아스코르베이트, 아스파테이트, 벤젠설포네이트, 벤조에이트, 비설페이트, 보레이트, 부티레이트, 캄포레이트, 캄포르설포네이트, 시트레이트, 사이클로펜탄프로피오네이트, 디글루코네이트, 도데실설페이트, 에탄설포네이트, 푸마레이트, 글루코헵토네이트, 글리세로포스페이트, 헤미설페이트, 헵토네이트,헥사노에이트, 하이드로브로마이드, 하이드로브로마이드, 하이드로클로라이드, 하이드로요오다이드, 2-하이드록시-에탄설포네이트, 락토비오네이트, 락테이트, 라우릴 설페이트, 말레이트, 말로네이트, 메탄설포네이트, 2-나프탈렌설포네이트, 니코티네이트, 니트레이트, 올레에이트, 옥살레이트, 팔미테이트, 파모에이트, 펙티네이트, 퍼설페이트, 3-페닐프로피오네이트, 포스페이트, 피크레이트, 피발레이트, 프로피오네이트, 스테아레이트, 석시네이트, 설페이트, 타르트레이트, 티오시아네이트, 톨루엔설포네이트, 운데카노에이트, 발러레이트 염들 등을 포함한다. 대표적인 알칼리 또는 알칼리 토금속 염들은 나트륨, 리튬, 칼륨, 칼슘, 마그네슘 등, 및 또한 무독성 암모늄, 4급 암모늄, 및 아민 양이온들, 예를 들면, 암모늄, 테트라메틸암모늄, 테트라에틸암모늄, 메틸아민, 디메틸아민, 트리메틸아민, 트리에틸아민, 에틸아민 등을 포함한다. 본 개시의 약제학적으로 허용되는 염들은 형성된 모 화합물, 예를 들면, 무-독성 무기 또는 유기 산들로부터의 통상적인 무-독성 염들을 포함한다. 본 개시의 약제학적으로 허용되는 염들은 통상의 화학적 방법들에 의해 염기성 또는 산성 잔기를 함유하는 모 화합물로부터 합성될 수 있다. 일반적으로, 이러한 염들은 이들 화합물들의 유리 산 또는 염기 형태들을 화학량론적 양의 적절한 염기 또는 산과 물 또는 유기 용매, 또는 2개의 혼합물 속에서 반응시켜 제조할 수 있으며; 일반적으로 에테르, 에틸 아세테이트, 에탄올, 이소프로판올, 또는 아세토니트릴과 같은 비수성 매질들이 바람직하다. 적합한 염들의 목록들은 문헌[참조: Remington ? Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, Pa., 1985, p. 1418, Pharmaceutical Salts: Properties, Selection, and Use, P.H. Stahl and C.G. Wermuth(eds.), Wiley-VCH, 2008, 및 Berge et al., Journal of Pharmaceutical Science, 66, 1-19(1977), 이들 각각은 참조로 본원에 인용된다]에서 발견된다.
약동학: 본원에 사용된 것으로서, "약동학"은 살아있는 유기체에 투여된 물질의 수명의 측정과 관련되므로, 분자 또는 화합물의 어떠한 하나 이상의 특성들을 말한다. 약동학은 흡수, 분포, 물질대사 및 분비의 정도 및 속도를 포함하는, 수개의 영역들로 나누어진다. 이는 일반적으로 ADME으로 언급되며, 여기서: (A) 흡수는 물질이 혈류로 도입되는 공정이며; (D) 분포는 신체의 유액들 및 조직들을 통한 물질들의 분산 또는 보급을 말하고; (M) 물질대사(또는 생물전환)은 모 화합물들의 딸 대사산물들로의 비가역적인 변한이고; (E) 배출(제거)는 신체로부터 물질들의 제거를 말한다. 드믄 경우들에서, 일부 약물들은 체 조직 속에 비가역적으로 축적된다.
약제학적으로 허용되는 용매화물: 본원에 사용된 것으로서, 용어 "약제학적으로 허용되는 용매화물"은, 적합한 용매의 분자들이 결정 결자내에 혼입된 본 발명의 화합물을 의미한다. 적합한 용매는 투여된 용량에서 생리학적으로 내성이다. 예를 들면, 용매화물들은 유기 용매들, 물, 또는 이들의 혼합물을 포함하는 용액으로부터 결정화, 재결정화, 또는 침전에 의해 제조될 수 있다. 적합한 용매들의 예들은 에탄올, 물(예를 들면, 일-, 이-, 및 삼-수화물들), N-메틸피롤리디논(NMP), 디메틸 설폭사이드(DMSO), N,N'-디메틸포름아미드(DMF), N,N'-디메틸아세트아미드(DMAC), 1,3-디메틸-2-이미다졸리디논(DMEU), 1,3-디메틸-3,4,5,6-테트라하이드로-2-(1H)-피리미디논(DMPU), 아세토니트릴(ACN), 프로필렌 글리콜, 에틸 아세테이트, 벤질 알코올, 2-피롤리돈, 벤질 벤조에이트 등이다. 물이 용매인 경우, 용매화물은 "수화물"로서 언급된다.
생화학적: 본원에 사용된 것으로서, "생화학적"은 물리적 및/또는 화학적 특성과 관련됨을 의미한다.
예방하는: 본원에 사용된 것으로서, 용어 "예방하는"은 감염, 질병, 질환 및/또는 상태의 발병을 부분적으로 또는 완전히 지연시키고/시키거나; 특수한 감염, 질병, 질환, 및/또는 상태의 하나 이상의 증상들, 특징들, 또는 임상적 만연들이 발병을 부분적으로 또는 완전히 지연시키고/시키거나; 특수한 감염, 질병, 질환, 및/또는 상태의 하나 이상의 증상들, 특징들, 또는 만연들이 발병을 부분적으로 또는 완전히 지연시키고/시키거나; 감염, 특수한 질병, 질환, 및/또는 상태로부터의 진행을 부분적으로 또는 완전히 지연시키고/시키거나; 감염, 질병, 질환, 및/또는 상태와 관련된 병리학의 발전 위험성을 감소시킴을 말한다.
전구약물 ( prodrug ): 본 개시는 또한 본원에 기술된 화합물들의 전구약물들을 포함한다. 본원에 사용된 것으로서, "전구약물들"은 화학적 또는 물리적 변경 시 치료제로서 작용하기 위한 물질, 분자 또는 실체에 대해 예견된 형태의 어떠한 물질, 분자 또는 실체를 말한다. 전구약물들은 일부 방식으로 공유결합적으로 결합되거나 봉쇄될 수 있으며, 이는 포유동물 대상체에게 투여되기 전, 투여 시 또는 투여 후에 활성 약물 잔기로 방출되거나 전환된다. 전구약물들은, 변형들이 통상의 조작 또는 시험관내에서 모 화합물들로 절단되는 방식으로 화합물들 속에 존재하는 기능성 그룹들을 변경시킴으로써 제조할 수 있다. 전구약물들은, 하이드록실, 아미노, 설프하이드릴, 또는 카복실 그룹들이 포유동물 대상체에게 투여되는 경우, 하이드록실, 아미노, 설프하이드릴, 또는 카복실 그룹이 없는 형태로 절단되는 어떠한 그룹에도 결합된는 화합물들을 포함한다. 전구약물들의 제조 및 용도는 문헌[참조: T. Higuchi and V. Stella, "Pro-drugs as Novel Delivery Systems," Vol. 14 of the A.C.S. SymposiμM Series, 및 in Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987, 이들 둘 다는, 이들의 전문이 참조로 본원에 혼입되어 있다]에 논의되어 있다.
증식하다: 본원에 사용된 것으로서, 용어 "증식하다"는 성장하거나, 확장하거나 또는 신속하게 증가하거나 성장하도록, 확장하도록 또는 증가하도록 함을 의미한다. "증식성"은 증식하는 능력을 가짐을 의미한다. "항-증식성"은 증식성 특성들에 반대되거나 적절하지 않은 특성들을 가짐을 의미한다.
단백질 절단 부위: 본원에 사용된 것으로서, "단백질 절단 부위"는, 아미노산 쇄의 조절된 절단이 화학적, 효소적 또는 광화학적 수단들에 의해 달성될 수 있는 부위를 말한다.
단백질 절단 신호: 본원에 사용된 것으로서, "단백질 절단 신호"는 절단용 폴리펩타이드를 플래그(flag)하거나 표시하는 적어도 하나의 아미노산을 말한다.
목적한 단백질: 본원에 사용된 것으로서, 용어들 "목적한 단백질들" 또는 "바람직한 단백질들"은 본원에 제공된 것들 및 이들의 단편들, 돌연변이체들, 변이체들, 및 변형들을 포함한다.
근접한: 본원에 사용된 것으로서, 용어 "근접한"은 중심 또는 목적한 지점 또는 영역에 대해 가장 가까이 위치함을 의미한다.
정제된: 본원에 사용된 것으로서, "정제하다", "정제된", "정제"는 원치않은 성분들, 물질 오염, 혼합물 또는 결함으로부터 실질적으로 순수하게 하거나 청소함을 의미한다.
샘플: 본원에 사용된 것으로서, 용어 "샘플" 또는 "생물학적 샘플"은 이의 조직들, 세포들 또는 성분 부분들(예를 들면, 혈액, 점액, 림프액, 관절 낭액, 뇌 척수액, 타액, 양수, 양막제대혈, 뇨, 질액 및 정액을 포함하는 체액들)의 소세트를 말한다. 샘플은 또한 전체 유기체 또는 이의 조직들, 세포들 또는 성분 부분들의 소세트, 또는 예를 들면, 혈장, 혈청, 척수액, 림프액, 피부, 호흡기, 창자, 및 비뇨생식기관들의 외부 단면들을 포함하나, 이에 한정되지 않는 이의 분획 또는 부위로부터의 분해물 또는 추출물, 눈물, 타액, 유액, 혈액 세포들, 종양들, 기관들을 포함할 수 있다. 샘플들은 또한 영양 브로쓰(nutrient broth) 또는 겔과 같은 배지를 말하며, 이는 단백질들 또는 핵산 분자와 같은 세포 성분들을 함유할 수 있다.
신호 서열들: 본원에 사용된 것으로서, 어구 "신호 서열들"은 단백질의 수송 또는 국재화를 지시할 수 있는 서열을 말한다.
유의적인 또는 유의적으로: 본원에 사용된 것으로서, 용어들 "유의적인" 또는 "유의적으로"는 용어 "실질적으로"과 동의어로 사용된다.
단일 단위 용량: 본원에 사용된 것으로서, "단일 단위 용량"은 1회 용량/1회로/단일 경로/ 단일 접촉점, 즉, 단일 투여 현상으로 투여된 어떠한 치료제의 용량이다.
유사성: 본원에 사용된 것으로서, 용어 "유사성"은 중합체 분자들 사이, 예를 들면, 폴리뉴클레오타이드 분자들(예를 들면, DNA 분자들 및/또는 RNA 분자들) 사이 및/또는 폴리펩타이드 분자들 사이의 전체적인 관련성을 말한다. 서로에 대한 중합체 분자들의 유사성 퍼센트의 계산은, 유사성 퍼센트의 계산이 당해 분야에 이해되는 바와 같이 보존적 치환들을 고려하는 것을 제외하고는, 동일성 퍼센트의 계산과 동일한 방식으로 수행할 수 있다.
분할 용량: 본원에 사용된 것으로서, "분할 용량"은 단일 단위 용량 또는 총 1일 용량의 2회 이상의 용량들로의 분할이다.
안정한: 본원에 사용된 것으로서 "안정한"은 반응 혼합물로부터 유용한 정도의 순도로의 분리에 견디기에 충분히 강하고, 바람직하게는 유효한 치료제로 제형화될 수 있는 화합물을 말한다.
안정화된: 본원에 사용된 것으로서, 용어 "안정화하다", "안정화된", "안정화된 영역"은 안정하게 만들거나 안정화됨을 의미한다.
대상체 : 본원에 사용된 것으로서, 용어 "대상체" 또는 "환자"는, 본 발명에 따르는 조성물이 예를 들면, 실험적, 진단적, 예방적 및/또는 치료학적 목적들을 위해 투여될 수 있는 어떠한 유기체를 말한다. 대표적인 대상체들은 동물들(예를 들면, 마우스들, 랫트들, 토끼들, 비-사람 영장류들, 및 사람들) 및/또는 식물들을 포함한다.
실질적으로: 본원에 사용된 것으로서, 용어 "실질적으로"는 목적한 특징 또는 특성의 전체 또는 전체에 근접한 한도 또는 정도를 나타내는 정성적 상태를 말한다. 생물학적 분야에서 통상의 기술자는, 생물학적 및 화학적 현상이 설사 드믈게 완성으로 완료되고/되거나 진행되는 경우 또는 절대적인 결과를 달성하거나 피하는 것으로 이해할 것이다. 용어 "실질적으로"는 따라서 많은 생물학적 및 화학적 현상들에서 고유한 완성도의 잠재적인 결여를 포착하기 위해 사용된다.
실질적으로 동일한: 본원에 사용된 것으로서, 이는 용량들 사이에 시간 차이들에 관한 것이므로, 당해 용어는 +/- 2%를 의미한다.
실질적으로 동시에: 본원에 사용된 것으로서 및 이것이 다수의 용량들에 관련되므로, 당해 용어는 2초내를 의미한다.
로 고생하는: 질병, 질환, 및/또는 상태 "로 고생하는" 개인은 질병, 질환, 및/또는 상태의 하나 이상의 증상들을 지닌 것으로 진단되거나 나타낸다.
에 대해 민감한: 질병, 질환, 및/또는 상태에 대해 민감한 개인은 질병, 질환, 및/또는 상태를 지닌 것으로 진단되지 않고/않거나 이들의 증상들을 나타내지 않을 수 있다. 일부 실시형태에서, 질병, 질환, 및/또는 상태(예를 들면, 암)에 대해 민감한 개인은 다음 중의 하나 이상으로 특성화될 수 있다: (1) 질병, 질환, 및/또는 상태와 관련된 유전적 돌연변이; (2) 질병, 질환, 및/또는 상태와 관련된 유전적 다형태; (3) 질병, 질환, 및/또는 상태와 관련된 단백질 및/또는 핵산의 증가되고/되거나 감소된 발현 및/또는 활성; (4) 질병, 질환, 및/또는 상태의 발달과 고나련된 습관들 및/또는 생활방식들; (5) 질병, 질환, 및/또는 상태의 가계 이력(family history); 및 (6) 질병, 질환, 및/또는 상태의 발달과 관련된 미생물에 대한 노출 및/또는 이의 감염. 일부 실시형태에서, 질병, 질환, 및/또는 상태에 대해 민감한 개인은 질병, 질환, 및/또는 상태로 진행될 것이다. 일부 실시형태에서, 질병, 질환, 및/또는 상태에 대해 민감한 개인은 질병, 질환, 및/또는 상태로 진행되지 않을 것이다.
합성: 용어 "합성"은 사람의 손으로 생산되고/되거나, 제조되고/되거나, 제작됨을 의미한다. 본 발명의 폴리뉴클레오타이드 또는 폴리펩타이드 또는 다른 분자의 합성은 화학적 또는 효소적일 수 있다.
표적화된 세포들: 본원에 사용된 것으로서, "표적화된 세포들"은 특정의 목적한 하나 이상의 세포들을 말한다. 당해 세포들은 시험관내, 생체내, 반응계내 또는 유기체의 조직 또는 기관내에서 발견될 수 있다. 유기체는 동물, 바람직하게는 포유동물, 보다 바람직하게는 사람 및 가장 바람직하게는 환자일 수 있다.
치료제: 용어 "치료제"는, 대상체에게 투여되는 경우, 치료학적, 진단적, 및/또는 예방적 효과를 가지고/가지거나 바람직한 생물학적 및/또는 약리학적 효과를 유발하는 어떠한 제제도 말한다.
치료학적 유효량: 본원에 사용된 것으로서, 용어 "치료학적 유효량"은 감염, 질병, 질환, 및/또는 상태로 고생하거나 이에 대해 민감한 대상체에게 투여시 감염, 질병, 질환, 및/또는 상태를 치료하고/하거나, 이의 증상들을 개선시키고/시키거나 이의 발병을 진단하고/하거나, 예방하고/하거나 지연시키기에 충분한 전달될 제제(예를 들면, 핵산, 약물, 치료제, 진단제, 예방제 등)의 양을 의미한다.
치료학적으로 효과적인 결과: 본원에 사용된 것으로서, 용어 "치료학적으로 효과적인 결과"는 감염, 질병, 질환, 및/또는 상태로 고생하거나 이에 대해 민감한 대상체내에서 감염, 질병, 질환, 및/또는 상태를 치료하고/하거나 이의 증상들을 개선시키고/시키거나, 진단하고/하거나, 예방하고/하거나 이의 발병을 지연시키기에 충분한 결과를 의미한다.
총 1일 용량: 본원에 사용된 것으로서, "총 1일 용량"은 24시간내에 제공되거나 처방된 양이다. 이는 단일 단위 용량으로 투여될 수 있다.
전사 인자: 본원에 사용된 것으로서, 용어 "전사 인자"는 예를 들면, 전사의 활성화 또는 회귀에 의해, DNA의 RNA로의 전사를 조절하는 DNA-결합 단백질을 말한다. 일부 전사 인자들은 전사만을 조절하는 반면, 다른 것들은 다른 단백질과 관련하여 작용한다. 일부 전사 인자는 특정 조건들하에서 전사를 활성화하고 억제(repress)하는 것들 둘 다를 할 수 있다. 일반적으로, 전사 인자들은 표적 유전자의 조절 영역내에서 특이적인 콘센수스 서열(consensus sequence)과 매우 유사한 특이적인 표적 서열 또는 서열들에 결합한다. 전사 인자들은 표적 유전자만의 전사를 조절하거나 다른 분자들과의 복합체로 조절할 수 있다.
치료하는: 본원에 사용된 것으로서, 용어 "치료하는"은 특수한 감염, 질병, 질환, 및/또는 상태의 하나 이상의 증상들 또는 특징들의 발병을 부분적으로 또는 완전히 완화시키고/시키거나, 개선시키고/시키거나, 경감시키고/시키거나, 지연시키고/시키거나, 이의 진행을 억제하고/하거나, 이의 중증도를 감소시키고/시키거나, 이의 발생을 감소시킴을 말한다. 예를 들어, 암을 "치료하는"은 종양의 생존, 성장, 및/또는 확산을 억베함을 말할 수 있다. 치료는 질병, 질환, 및/또는 상태의 신호들을 나타내지 않는 대상체 및/또는 질병, 질환, 및/또는 상태와 관련된 병리학으로 진행될 위험을 감소시킬 목적으로 질병, 질환, 및/또는 상태의 조기 신호들만을 나타내는 대상체에게 투여될 수 있다.
변형되지 않은: 본원에 사용된 것으로서, "변형되지 않은"은 어떠한 방식으로도 변화되기 전의 어떠한 물질, 화합물 또는 분자를 말한다. 변형되지 않은은 항상은 아니지만, 생물분자의 야생형 또는 천연형을 말한다. 분자들은 일련의 변형들을 겪음으로써 각각의 변형된 분자가 후속적인 변형에 대한 "변형되지 않은" 출발 분자로서 제공될 수 있다.
등가물들 및 범위
당해 분야의 숙련가들은 통상적인 실험, 본원에 기술된 본 발명에 따른 구체적인 실시형태들에 대한 많은 등가물들을 사용하여 인식하거나, 추정할 수 있을 것이다. 본 발명의 범위는 상기 상세한 설명으로 제한되는 것으로 의도되지 않지만, 오히려 첨부된 특허청구범위에 설정된다.
특허청구범위에서, 단수형 "하나"("a", "an") 및 "그"("the")와 같은 정관사는, 반대로 나타내거나 달리 내용으로부터 명백하지 않는 한, 하나 이외의 하나 이상을 의미할 수 있다. 그룹의 하나 이상의 구성원들 사이에 "또는"을 포함하는 특허청구범위 또는 설명들은, 그 그룹 구성원들 중의 하나, 하나 이상, 또는 모두가, 달리 나타내지 않는 한 또는 내용으로부터 명백하지 않는 한, 제공된 생성물 또는 공정에 사용되거나,달리는 이와 관련되는 경우 만족되는 것으로 고려된다. 본 발명은, 그룹의 정확히 하나의 구성원이 제공된 생성물 또는 공정에, 또는 달리는 이와 관련하여 존재하는 실시형태들을 포함한다. 본 발명은, 그룹 구성원들의 하나 이상, 또는 모두가 제공된 생성물 또는 공정에 존재하거나, 사용되거나, 또는 달리는 이와 관련되는 실시형태들을 포함한다.
용어 "포함하는"은 추가의 성분들 또는 단계들의 포괄을 개방하고 허용하지만 필요로 하지는 않는 것으로 의도된다. 용어 "포함하는"이 본원에 사용된 경우, 용어 "로 이루어진"은 따라서, 또한 포함되고 기재된다.
범위들이 제공된 경우, 종점들이 포함된다. 또한, 달리 나타내거나 달리는 당해 분야의 통상의 기술자의 이해 및 내용으로부터 명백한 경우를 제외하고, 범위들로 나타낸 값들은, 내용이 달리 명확하게 나타내지 않는 한, 본 발명의 상이한 실시형태에서 기술된 범위들내에서 어떠한 구체적인 값 또는 소범위 내지 그 범위의 하한치의 단위의 10분의 1까지 추정할 수 있다.
또한, 당해 분야에 속하는 본 발명의 어떠한 특정 실시형태도 특허청구범위 중 어느 하나 이상으로부터 명확하게 배제될 수 있음이 이해되어야 한다. 이러한 실시형태들은 당해 분야의 통상의 기술자에게 공지된 것으로 고려되므로, 이들은, 배제가 본원에 명확하게 설정되지 않는 경우에도, 배제될 수 있다. 본 발명의 조성물들의 어느 특수항 실시형태(예를 들면, 이에 의해 암호하된 어떠한 핵산 또는 단백질; 어떠한 생산 방법; 어떠한 사용 방법 등)은 어떠한 하나 이상의 특허청구범위로부터 어떠한 이유에서도, 선행 기술의 존재와의 관련 여부와 상관없이 배제될 수 있다.
모든 인용된 공급원들, 예를 들면, 본원에 인용된 참조문헌들, 공보들, 데이터베이스들, 데이터베이스 실체들, 및 기술은, 심지어 인용에서 표현하여 기술되지 않는 경우에도, 참조로 본 출원에 혼입된다. 인용된 공급원과 본 출원의 기술들이 상충되는 경우에, 본 출원의 기술이 조절할 것이다.
실시예들
본 개시는, 하기의 실시예들에서 추가로 기술되고, 이는, 특허청구범위에 기술된 본 개시의 범위를 제한하지 않는다.
실시예
1. 변형된
mRNA
시험관내
전사
A. 재료 및 방법
뉴클레오타이드 혼합물이, 변형된 뉴클레오타이드를 함유하는 것을 제외하고는 본 발명에 따라 변형된 mRNA는 시험관내 전사를 위한 표준 실험실 방법 및 재료를 사용하여 제조한다. 목적한 유전자의 개방 판독 프레임(ORF), 강력한 코작 번역 개시 신호를 함유하는 5' 번역되지 않는 영역(UTR) 및 아데노신 유사체들이 혼입되지 않은 mRNA들을 위한 폴리A 테일(polyA tail)의 주형화된 첨가를 위해 올리고(dT) 서열로 종결되는 알파-글로빈 3' UTR로 플랭킹(flanking)한다. 아데노신-함유 mRNA들을 올리고(dT) 서열의 부재 하에 합성하여 전사-후 폴리(A) 폴리머라제 폴리-(A) 테일링(tailing)을 가능하게 한다.
변형된 mRNA는, 세포의 선천성 면역 반응을 감소시키기 위해 변형될 수 있다. 세포 반응을 감소시키기 위한 변형들은 슈도우리딘(Ψ) 및 5-메틸-사이티딘(5meC, 5mc 또는 m5C)을 포함할 수 있다. [참조: Kariko K et al. Immunity 23:165-75(2005), Kariko K et al. Mol Ther 16:1833-40(2008), Anderson BR et al. NAR(2010); 본원에 참조로 혼입됨].
ORF는 또한 다양한 상류(upstream) 또는 하류(downstream) 첨가물들(예를 들면, β-글로빈, 태그 등)을 포함할 수 있으며, DNA2.0(캘리포니아주 멘로 파크 소재)와 같은, 그러나 이에 한정되지 않는 최적화 서비스로부터 주문할 수 있고, XbaI 인식을 가질 수 있는 다중 클로닝 부위들을 함유할 수 있다. 작제물의 수령 시, 이는 재구성되어 화학적으로 적격성(competent)인 이. 콜라이(E. coli) 내로 형질전환될 수 있다.
본 발명의 경우, NEB DH5-알파 적격성인 이. 콜라이가 사용된다. 형질전환들은 100 ng의 플라스미드를 사용하는 NEB 지시들에 따라 수행된다. 프로토콜은 하기와 같다.
NEB 5-알파 적격성인 이. 콜라이 세포들의 튜브를 빙상에서 10분 동안 해동시킨다.
1pg 내지 100 ng의 플라스미드 DNA를 함유하는 1 내지 5μl를 세포 혼합물에 가한다. 튜브를 4 내지 5회 조심스럽게 튀겨서 세포들과 DNA를 혼합한다. 와동시키지 않는다.
혼합물을 빙상에 30분 동안 둔다. 혼합하지 않는다.
42℃에서 정확히 30분 동안 열 쇼크(heat shock)시킨다. 혼합하지 않는다.
빙상에 5분 동안 둔다. 혼합하지 않는다.
실온의 950μl의 SOC를 혼합물 내로 피펫팅한다.
37℃에서 60분 동안 둔다. 격렬하게(250rpm) 진탕시키거나 회전시킨다.
선택 플레이트들을 37℃로 가온한다.
튜브를 튀기고 뒤집어서 세포들을 완전히 혼합한다.
50 내지 100μl의 각각의 희석물을 선택 플레이트 상에 분무하고 37℃에서 밤새 항온배양한다. 대안으로, 30℃에서 24 내지 36 시간 동안 또는 25℃에서 48시간 동안 항온배양한다.
이어서, 단일 콜로니를 사용하여 적절한 항생제를 사용하는 5 ml의 LB 성장 배지에 접종한 후 5시간 동안 성장(250RPM, 37℃)하도록 한다. 이어서, 이를 사용하여 200 ml의 배양 배지에 접종하고 동일한 조건 하에 밤새 성장시킨다.
플라스미드(850㎍ 이하)를 단리하기 위해, 제조업자의 지침에 따라 인비트로겐 퓨어링크 하이퓨어 맥시프렙 키트(Invitrogen PURELINKTM HiPure Maxiprep Kit)(캘리포니아주 칼스바드 소재)를 사용하여 맥시 프렙(maxi prep)을 수행한다.
시험관내 전사(IVT)를 위한 cDNA를 생성시키기 위해, 플라스미드(이의 예는 도 3에 나타낸다)를 우선 XbaI와 같은 제한 효소를 사용하여 선형화한다. XbaI를 사용한 전형적인 제한 분해는 다음을 포함할 것이다: 플라스미드 1.0㎍; 10x 완충액 1.0μl; XbaI 1.5μl; 10μl 이하의 dH20; 37℃에서 1시간 동안 항온배양함. 실험실 규모(<5㎍)에서 수행하는 경우, 반응물을 인비트로겐(Invitrogen)의 PURELINKTM PCR 마이크로 키트(캘리포니아주 칼스바드 소재)를 사용하여 제조업자의 지침에 따라 세정한다. 보다 큰 규모의 정제는 인비트로겐의 표준 PURELINKTM PCR 키트(캘리포니아주 칼스바드 소재)와 같은 보다 큰 부하 용량을 갖는 제품을 사용하여 수행하는 것이 필요할 수 있다. 세정 후, 선형화된 벡터를 NanoDrop을 사용하여 정량화하고 분석하여 아가로스 겔 전기영동을 사용한 선형화를 확인한다.
B. 변형된 mRNA의 아가로스 겔 전기영동
개개의 변형된 mRNA들(20μl의 용적 중 200 내지 400ng)을 웰(well) 내로 변성되지 않은 1.2% 아가로스 E-겔[제조원: 인비트로겐(Invitrogen), 캘리포니아주 칼스버드 소재] 상에 로딩하고 제조업자의 프로토콜에 따라서 12 내지 15분 동안 이동시켰다.
C. RT-PCR 생성물들의 아가로스 겔 전기영동
개개의 역 전사된-PCR 생성물들(200 내지 400ng)을 변성되지 않은 1.2% 아가로스 E-겔(제조원: 인비트로겐, 캘리포니아주 칼스바드 소재)의 웰 내로 로딩하고 제조업자의 프로토콜에 따라서 12 내지 15분 동안 이동시켰다.
D.
미량소적
(
Nanodrop
) 변형된
mRNA
정량화 및
UV
스펙트럼
데이터
TE 완충액(1μl) 중의 변형된 mRNA들을 미량소적 UV 흡광도 판독들에 사용하여 시험관내 전사 반응(UV 흡광도 자취들(traces)은 나타내지 않음)으로부터 각각의 변형된 mRNA의 수율을 정량화한다.
실시예 2. 변형된 mRNA 형질감염
A. 역 형질감염
24-웰 콜라겐-피복된 조직 배양 플레이트 내에서 수행된 실험들에 대해, 케라틴세포(Keratinocyte)들을 1 x 105의 세포 밀도로 식종(seeding)하였다. 96-웰 콜라겐-피복된 조직 배양 플레이트 내에서 수행된 실험들에 대해, 케라틴세포들을 0.5 x 105의 세포 밀도로 식종하였다. 형질감염될 각각의 변형된 mRNA를 위해, 변형된 mRNA: RNAIMAXTM을 기술한 바와 같이 제조하고, 세포들이 조직 배양 플레이트에 부착하기 전에 세포 식종 6시간 이내에 다중-웰 플레이트내의 세포들과 혼합하였다.
B. 전방 형질감염
24-웰의 콜라겐-피복된 조직 배양 플레이트에서, 케라틴세포들을 0.7 x 105의 세포 밀도로 식종한다. 96-웰 콜라겐-피복된 조직 배양 플레이트에서 수행된 실험들에 대해 케라틴세포들을 0.3 x 105의 세포 밀도로 식종한다. 이어서, 케라틴세포들을 24시간에 걸쳐 >70%의 합치성(confluency)까지 성장시킨다. 형질감염될 각각의 변형된 mRNA에 대해, 변형된 mRNA: RNAIMAXTM을 기술한 바와 같이 제조하고, 세포 식종 및 조직 배양 플레이트에 대한 부착 후 24시간에 걸쳐 다중-웰 플레이트 속에서 세포 상에 형질감염시킨다.
C. 변형된 mRNA 번역 스크린: G-CSF ELISA
케라틴세포들을 보충물 S7(제조원: 인비트로겐)을 갖는 에피라이프(EpiLife) 배지에서 >70%의 합치성으로 성장시킨다. 케라틴세포들을 RNAIMAXTM(제조원: 인비트로겐)과 복합체화된 300 ng의 표시된 화학적으로 변형된 mRNA를 사용하여 역 형질감염시킨다. 대안으로, 케라틴세포들을 RNAIMAXTM(제조원: 인비트로겐)과 복합체화된 300 ng의 변형된 mRNA를 사용하여 전방 형질감염시킨다. RNA: RNAIMAXTM 복합체는, 우선 RNA를, 보충물이 포함되어 있지 않은 EPILIFE® 배지와 함께 5X 용적의 희석물 중에서 10분 동안 실온에서 항온배양함으로써 형성된다.
제2 바이알(vial)에서, RNAIMAXTM 시약을 보충물 불포함 EPILIFE® 배지와 함께 10X 용적의 희석물 중에서 10분 동안 실온에서 항온배양하였다. 이어서, RNA 바이알을 RNAIMAXTM 바이알과 혼합하고 20 내지 30분 동안 실온에서 항온배양한 후 세포에 적가 방식으로 가한다. 배양물 배지 중의 분비된 huG-CSF 농도는, 각각의 화학적으로 변형된 mRNA들에 대해 형질감염 후 18시간째에 3회 측정한다. 형질감염된 사람 케라틴세포들로부터의 사람 과립구-콜로니 자극 인자(G-CSF)의 분비는, 제조업자의 추천된 지침에 따라서, [제조원: 인비트로겐 또는 R&D 시스템스(R&D Systems)(미네소타주 미네아폴리스 소재)]로부터의 ELISA 키트를 사용하여 정량화한다.
D. 변형된 mRNA 용량 및 지속기간: G-CSF ELISA
케라틴세포들을 보충물 S7(제조원: 인비트로겐)을 갖는 EPILIFE® 배지 중에서 >70%의 합치성으로 성장시킨다. 케라틴세포들을 0ng, 46.875ng, 93.75ng, 187.5ng, 375ng, 750ng, 또는 1500ng의, RNAIMAXTM(제조원: 인비트로겐)과 복합체화된 변형된 mRNA로 역 형질감염시킨다. 변형된 mRNA: RNAIMAXTM 복합체가 기술된 바와 같이 형성된다. 배양 배지 중에 분비된 huG-CSF 농도는 각각의 변형된 mRNA의 각각의 농도에 대해 형질감염 후 0, 6, 12, 24, 및 48 시간째에 3회 측정된다. 형질감염된 사람 케라틴세포들로부터의 사람 과립구-콜로니 자극 인자(G-CSF)의 분비는 제조업자의 추천된 지침에 따라서 인비트로겐 또는 R&D 시스템스로부터의 ELISA 키트를 사용하여 정량화한다.
실시예 3. 변형된 핵산에 대한 세포의 선천적 면역 반응: IFN-베타 ELISA 및 TNF-알파 ELISA
시험관내-형질감염된 사람 케라틴세포 세포들로부터 분비된 사람 종양 괴사 인자-α(TNF-α), 사람 인터페론-β(IFN-β) 및 사람 과립구-콜로니 자극 인자(G-CSF)에 대한 효소-연결된 면역흡착 검정(ELISA)을 세포 선천적 면역 반응의 검출에 대해 시험한다.
케라틴세포들은, 인비트로겐으로부터의 하이드로코르티손의 부재 하에 사람 케라틴세포 성장 보충물을 갖는 EPILIFE® 배지 중에서 >70%의 합치성으로 성장시킨다. 케라틴세포들은 기술한 바와 같이 0ng, 93.75ng, 187.5ng, 375ng, 750ng, 1500ng 또는 3000ng의, RNAIMAXTM(제조원: 인비트로겐)과 복합체화된 표시된(indicated) 화학적으로 변형된 mRNA로 3회 역 형질감염시킨다. 배양 배지에 분비된 TNF-α를 각각의 화학적으로 변형된 mRNA들에 대해 형질감염 후 24시간째에 ELISA 키트(제조원: 인비트로겐)를 사용하여 제조업자의 프로토콜들에 따라서 측정한다.
분비된 IFN-β를, 각각의 화학적으로 변형된 mRNA들에 대해 형질감염 후 24시간째에 ELISA 키트(제조원: 인비트로겐)를 사용하여 제조업자의 프로토콜들에 따라서 측정한다. 분비된 hu-G-CSF 농도는 형질감염 후 24시간째에 각각의 화학적으로 변형된 mRNA들에 대해 측정한다. 형질감염된 사람 케라틴세포들로부터의 사람 과립구-콜로니 자극 인자(G-CSF)의 분비를, ELISA 키트[제조원: 인비트로겐 또는 R&D 시스템스(미네소타주 미네아폴리스 소재)]를 사용하여 제조업자들의 추천된 지침에 따라서 정량화한다. 이들 데이터는, 예시적인 제1형 사이토카인들 TNF-알파 및 IFN-베타를 측정함으로써 변형된 mRNA가 천연 및 다른 화학적으로 변형된 폴리뉴클레오타이드들 또는 참조 화합물들과 비교하여, 감소된 세포 선천성 면역 반응을 유발시킬 수 있음을 나타낸다.
실시예 4. 사람 과립구-콜로니 자극 인자-변형된 mRNA-유도된 세포 증식 검정
사람 케라틴세포들을 보충물 S7(제조원: 인비트로겐)을 갖는 EPILIFE® 배지 중에서 >70%의 합치성으로 24-웰 콜라겐-피복된 TRANSWELL®[제조원: 코닝(Corning), 매사츄세츠주 로웰 소재] 공동-배양 조직 배양 플레이트에서 성장시킨다. 케라틴세포들을 기술한 바와 같이 RNAIMAXTM(제조원: 인비트로겐)과 복합체화된 750ng의 표시된 화학적으로 변형된 mRNA로 3회 역 형질감염시킨다. 변형된 mRNA: RNAIMAXTM 복합체를 기술한 바와 같이 형성시킨다. 케라틴세포 배지를 형질감염 후 6 내지 8 시간째에 교환한다. 형질감염 후 42시간째에, 0.4㎛-공극 반-투과성 폴리에스테르 막을 갖는 24-웰 TRANSWELL® 플레이트 삽입물을 hu-G-CSF 변형된 mRNA-형질감염된 케라틴세포 함유 배양 플레이트 내에 둔다.
사람 골수아세포 세포들, Kasumi-1 세포들 또는 KG-1(0.2 x 105 세포들)을 삽입물 웰 내로 식종하고, 세포 증식을 공동-배양 개시 후 42시간째에 CyQuant Direct Cell Proliferation Assay(제조원: 인비트로겐)를 사용하여 100 내지 120μl의 용적으로 96-웰 플레이트 중에서 정량화한다. 변형된 mRNA를 암호화하는 hu-G-CSF-유도된 골수아세포 세포 증식은 형질감염되지 않은 케라틴세포/골수아세포 공동-배양 대조군 웰들에 대해 표준화된 세포 증식 퍼센트로 나타낸다. 케라틴세포 및 골수아세포 삽입물 공동-배양 웰들 둘 다의 내에 분비된 hu-G-CSF 농도를 각각의 변형된 mRNA에 대해 공동-배양 개시 후 42시간째에 2회 측정한다. 사람 과립구-콜로니 자극 인자(G-CSF)의 분비는 ELISA 키트(제조원: 인비트로겐)를 사용하여 제조업자의 추천된 지침에 따라서 정량화한다.
사람 케라틴세포 공급기 세포들 및 형질감염되지 않은 사람 골수아세포 세포들 속에서 형질감염된 hu-G-CSF 변형된 mRNA를 RT-PCR로 검출한다. 샘플 세포들로부터 총 RNA를 추출하고 RNAEASY® 키트[제조원: 퀴아젠(Qiagen), 캘리포니아주 발렌시아가 소재]를 사용하여 제조업자의 지침에 따라 분해한다. 추출된 총 RNA를 변형된 mRNA-G-CSF의 특이적인 증식을 위해 PROTOSCRIPT® M-MuLV Taq RT-PCR 키트[제조원: 뉴 잉글랜드 바이오랩스(New England BioLabs), 매사츄세츠주 입스위치 소재]를 사용하여 hu-G-CSF-특이적인 프라이머들과 함께 제조업자의 지침에 따라서 RT-PCR에 제공한다. RT-PCR 생성물들을 1.2% 아가로스 겔 전기영동에 의해 가시화한다.
실시예 5. 세포독성 및 아폽토시스(Apoptosis)
당해 실험은, 명확하게 변형된 mRNA-시험관내 형질감염된 사람 케라틴세포 세포들에 대한 세포 생존능, 세포독성 및 아폽토시스를 입증한다. 케라틴세포들을사람 케라틴세포 성장 보충물을 갖는 EPILIFE® 배지에서 하이드로코르티손(제조원: 인비트로겐)의 부재 하에 >70%의 합치성으로 성장시킨다. 케라틴세포들을 0ng, 46.875ng, 93.75ng, 187.5ng, 375ng, 750ng, 1500ng, 3000ng, 또는 6000ng의, RNAIMAXTM (제조원: 인비트로겐)으로 복합체화된 변형된 mRNA로 역 형질감염시킨다. 변형된 mRNA: RNAIMAXTM 복합체가 형성된다. 배양 배지 속에 분비된 huG-CSF 농도는 각각의 변형된 mRNA의 각각의 농도에 대해 형질감염 후 0, 6, 12, 24, 및 48 시간째에 3회 측정한다. 형질감염된 사람 케라틴세포들로부터의 사람 과립구-콜로니 자극 인자(G-CSF)의 분비는 ELISA 키트(제조원: 인비트로겐 또는 R&D 시스템스)를 사용하여 제조업자의 추천된 지침에 따라서 정량화한다. 세포 생존능, 세포독성 및 아폽토시스를 형질감염 후 0, 12, 48, 96, 및 192시간째에 APOTOX-GLOTM 키트[제조원: 프로메가(Promega), 위스콘신주 매디슨 소재]를 사용하여 제조업자의 지침에 따라 측정한다.
실시예 6. 공동-배양 환경
사람 과립구-콜로니 자극 인자(G-CSF)를 암호화하는 화학적으로-명확히 변형된 뉴클레오타이드들로 구성된 변형된 mRNA는, 공동-배양 환경 속에서 형질감염 비적격 세포의 세포 증식을 자극시킬 수 있다. 공동-배양물은 사람 케라틴세포 및 형질감염 비적격 세포 유형, 예를 들면, 백혈구 세포(WBC)와 같은 고도로 형질감염될 수 있는 세포 유형을 포함한다. G-CSF를 암호화하는 변형된 mRNA를, 고도로 형질감염될 수 있는 세포 내로 형질감염시켜 G-CSF 단백질의 생산 및 세포외 환경으로의 분비를 가능하게 할 수 있으며, 여기서, G-CSF는 췌장-유사 방식으로 작용하여 G-CSF 수용체를 발현하는 백혈구를 자극하여 증식한다. 증가된 WBC 집단을 사용하여 면역-약화된 환자들을 치료하거나 면역억제된 환자들의 WBC 집단을 부분적으로 재구성함으로써 기회 감염의 위험을 감소시킬 수 있다.
다른 예에서, 섬유아세포와 같은 고도로 형질감염될 수 있는 세포를 소정 성장 인자들로 형질감염시켜 불량하게 형질감염될 수 있는 배아 줄기 세포들의 성장, 유지, 또는 분화를 지지하고 자극하거나 다능성 줄기 세포들을 유도할 수 있다.
실시예 7. 변형된 핵산(변형된 mRNA)에 대한 5'-구아노신 캡핑(Capping)
A. 재료 및 방법
클로닝, 유전자 합성 및 벡터 서열분석을 DNA2.0 Inc.(캘리포니아주 멘로 파크 소재)에 의해 수행하였다. ORF를 XbaI를 사용하여 제한 분해하고 테일드(tailed)- 또는 테일이 없는(tail-less)-PCR을 사용하는 cDNA 합성에 사용하였다. 테일드-PCR cDNA 생성물은, 25mM의 각각의 변형된 뉴클레오타이드 혼합물[모든 변형된 뉴클레오타이드들은 통상적으로 합성되었거나 트리링크 바이오테크(TriLink Biotech)(캘리포니아주 샌 디에고 소재)로부터 구매하였으며, 단, 피롤로-C 트리포스페이트는 글렌 리서치(Glen Research)(버지니아주 스털링 소재)로부터 구매하였고; 변형되지않은 뉴클레오타이드들은 에피센터 바이오테크놀로지스(Epicenter Biotechnologies)(위스콘신주 매디슨 소재)로 부터 구매하였다] 및 Cellcript MEGASCRIPTTM[제조원: 에피센터 바이오테크놀로지스(Epicenter Biotechnologies), 위스콘신주 매디슨 소재] 완전 mRNA 합성 키트를 사용하는 변형된 mRNA 합성 반응을 위한 주형으로 사용하였다. 시험관내 전사 반응을 37℃에서 4시간 동안 수행하였다. 아데노신 유사체들을 혼입하는 변형된 mRNA들은 효모 폴리(A) 폴리머라제[제조원: 아피메트릭스(Affymetrix), 캘리포니아주 산타 클라라 소재]를 사용하여 폴리(A) 테일화하였다. PCR 반응물은 HiFi PCR 2X MASTER MIXTM[제조원: 카파 바이오시스템스(Kapa Biosystems), 매사츄세츠주 워번 소재]을 사용하였다. 변형된 mRNA들을 재조합체 백시니아 바이러스 캡핑 효소(제조원: 뉴잉글랜드 바이오랩스, 매사츄세츠주 입스위치 소재) 및 재조합체 2'-o-메틸트랜스퍼라제(제조원: 에피센터 바이오테크놀로지스, 위스콘신주 매디슨 소재)를 사용하여 후-전사적으로 캡핑하여 5'-구아노신 캡 1 구조를 생성하였다. 캡 2 구조 및 캡 2 구조들은 추가의 2'-o-메틸트랜스퍼라제들을 사용하여 생성시킬 수 있다. 시험관내 전사된 mRNA 생성물을 아가로스 겔 상에 이동시키고 가시화하였다. 변형된 mRNA를 암비온(Ambion)/어플라이드 바이오시스템스(Applied Biosystems)(텍사스주 오스틴 소재) MEGAClear RNATM정제 키트를 사용하여 정제하였다. PCR은 PURELINKTM PCR 정제 키트(제조원: 인비트로겐, 캘리포니아주 칼스바드 소재)를 사용하였다. 생성물을 NANODROPTM UV 흡광도[제조원: 써모피셔(ThermoFisher), 매사츄세츠주 왈탐 소재] 상에서 정량화하였다. 생성물의 품질, UV 흡광도 품질 및 가시화를 1.2% 아가로스 겔 상에서 수행하였다. 생성물을 TE 완충액 중에 재현탁시켰다.
B. 5' 캡핑 변형된 핵산(mRNA) 구조
변형된 mRNA의 5' 캡핑은, 다음의 화학적 RNA 캡 유사체들을 사용하는 시험관내 전사 반응 동안 동시 완료시켜 제조업자의 프로토콜들에 따라 5'-구아노신 캡 구조를 생성시킬 수 있다: 3'-0-Me-m7G(5')ppp(5')G(ARCA cap); G(5')ppp(5')A; G(5')ppp(5')G; m7G(5')ppp(5')A; m7G(5')ppp(5')G(제조원: 뉴 잉글랜드 바이오랩스, 매사츄세츠주 입스위치 소재). 변형된 mRNA의 5'-캡핑을 백시니아 바이러스 캡핑 효소를 사용하여 후-전사적으로 완료시켜 "캡 0" 구조: m7G(5')ppp(5')G(제조원: 뉴 잉글랜드 바이오랩스, 매사츄세츠주 입스위치 소재)를 생성시킬 수 있다. 캡 1 구조는 백시니아 바이러스 캡핑 효소 및 2'-O 메틸-트랜스퍼라제 둘 다를 사용하여 생성시켜 m7G(5')ppp(5')G-2'-O-메틸을 생성시킬 수 있다. 캡 2 구조는, 2'-O 메틸-트랜스퍼라제를 사용하여 캡 1 구조로부터, 5'-뒤에서 세번째 뉴클레오타이드를 2'-o-메틸화시킨 후 생성시킬 수 있다. 캡 3 구조는 캡 2 구조로부터 5'-뒤에서 세번째 전(preantepenultimate) 뉴클레오타이드를 2'-O 메틸-트랜스퍼라제를 사용하여 2'O-메틸화시킨 후 생성하였다. 효소들은 바람직하게는 재조합체 공급원으로부터 유도된다.
포유동물 세포들 내로 형질감염된 경우, 변형된 mRNA들은 12 내지 18 시간 또는 18시간 이상, 예를 들면, 24, 36, 48, 60, 72 또는 72 시간 이상의 안정성을 갖는다.
실시예 8. N4-메틸 사이티딘(화합물 1) 및 N4-메틸 CTP(상기 화합물의 NTP)의 합성
우리딘을 실릴화하여 트리실릴화된 화합물을 제공하였고, 이를 컬럼에 의해 정제하였고, 재-증류된 POCl3/트리아졸을 사용하여 무수 조건 하에 활성화시킨 후, 40% 메틸아민 수용액을 사용한 친핵 치환시켰다. 따라서, N4-메틸-2',3',5'-트리-O-TBDMS-사이티딘은 크로마토그래피 정제 후 수득하였다. 수득되는 생성물을 TBAF로 탈보호시킨 후 에탄올-에틸 아세테이트(3:1) 용매 시스템으로 정제하여 화합물 1을 수득하였다. 최종 생성물을 (DMSO 중의) NMR로 특징확인하였다; MS: 258(M + H)+, 280(M + Na)+, 및 296(M + K)+; 및 HPLC: 순도, 99.35%(도 1a 내지 도 1d). HPLC, 순도 98%(도 2).
실시예 9. 2'-OMe-N,N-디-Me-사이티딘(화합물 2) 및 2'-OMe-N,N-디-Me-CTP(상기 화합물의 NTP)의 합성
2'-O-메틸우리딘을 실릴화하여 디-실릴화 화합물을 수득하였다. 정제된 2'-O-메틸-3',5'-디-O-TBDMS 우리딘을 재-증류된 POCl3 및 이미다졸을 사용하여 무수 조건 하에 활성화시킨 후, 트리에틸아민 환경 하에 디메틸아민 하이드로클로라이드를 사용하여 친핵성 치환시켜 HCl을 트랩(trap)하였다. 중간체 화합물 N4,N4,2'-트리-O-메틸-3',5'-비스-O-TBDMS 우리딘을 섬광 크로마토그래피에 의해 정제하여 백색 발포체로서 수득하였다. 수득된 화합물을 TBAF로 탈보호시킨 후 정제하여 약 400mg의 최종 생성물 화합물 2를 백색 발포체로서 제공하였다. ES MS: m/z 308(M + Na)+, 386(M + H)+; HPLC: 순도, 99.49%(도 3a 내지 도 3c).
상응하는 NTP를 합성하기 위해, 70mg의 뉴클레오사이드 화합물 2를 이온-교환 및 역상 컬럼들을 통한 정제 후 23mg의 2'-OMe-N,N-디-Me-CTP를 제공하였다. HPLC: 순도, 95%(도 4).
실시예 10. 5-메톡시카보닐메톡시 우리딘(화합물 3) 및 5-메톡시카보닐메톡시-UTP(상기 화합물의 NTP)의 합성
물 중의 우리딘 3-a를 과량의 브롬으로 처리한 후 공기로 플러싱(flushing)하여 브롬을 제거하였다. 반응 혼합물을, 제어된 속도 및 온도에서 피리딘으로 처리하였다. 반응 동안, 불안정한 브로모-중간체 3-b는 디-하이드록실 중간체 3-c로 서서히 전환되었으며, 이는 아마도 안정한 5-하이드록시우리딘 3-d로 탈수되었다. 이어서, 5-하이드록시우리딘을 2',3'-이소프로필리덴 그룹으로 보호하여 화합물 3-g를 제공하였다. 화합물 3-f와 반응시켜 화합물 3을 제공하였다.
60 내지 70 mg의 뉴클레오사이드는 2회의 HPLC 컬럼 정제 및 2회의 동결건조 단계들 후에 >21 mg의 바람직한 트리포스페이트를 제공하였다. HPLC: 순도, 98%(도 5).
실시예 11. 3-메틸 슈도우리딘(화합물 4) 및 3-메틸 슈도-UTP(상기 화합물의 NTP)의 합성
슈도우리딘 4-a를 Ac2O와 반응시켜 아세틸-보호된 슈도우리딘 4-b를 제공하였다. 이어서, N1을 POM으로 선택적으로 보호하여 화합물 4-c를 제공하였다. N3의 메틸화에 이어서, 탈보호 후, 화합물 4(약 400mg)를 제공하였다. 분자식: C10H14N2O6, 분자량: 258.23g/mol; 외형: 백색 고체; 저장 조건: 25℃에서 저장; HPLC: 순도, 98.51%; 1H NMR(DMSO-d6): δ 11.17(d, 1H, J = 3.0 Hz), 7.56(d, 1H, J = 3.6 Hz), 4.91(d, 1H, J = 3.6 Hz), 4.79(t, 1H, J = 4.2Hz), 4.70(d, 1H, J = 4.2Hz), 4.49(d, 1H, J = 3.0Hz), 3.82-3.88(m, 2H), 3.66-3.67(m, 1H), 3.57-3.61(m, 1H), 3.40-3.47(m, 1H), 3.09(s, 3H); MS: 281(M + Na)+)(도 6a 및 도 6b).
대안의 경로들을 적용하여 화합물 4를 수득할 수 있었다. 예를 들면, 슈도우리딘은 O-보호 그룹(예를 들면, 본원에 기술된 바와 같음, 예를 들면, TMS)과 반응시키고 N-보호 그룹(예를 들면, 본원에 기술된 바와 같음, 예를 들면, N1에서 아세틸)과 반응시킬 수 있다. 이어서, 핵염기의 N3를 알킬화제(예를 들면, 디메틸아민/디메톡시메틸)와 반응시켜 N- 및 O-보호 그룹들을 갖는 화합물 4를 제공할 수 있었다. 최종적으로, 수득된 화합물을 탈보호시켜(예를 들면, 염기성 조건 하에, 예를 들면, NH3/MeOH 하에) 화합물 4를 제공할 수 있다.
실시예
12. N-
Ac
, 5-
Ac
-
OCH
2
-
사이티딘(화합물 5)의
합성
우리딘 5-a를 보호시켜 이소프로필리덴 화합물 5-b을 수득하였고, 이를 (CHCO)n과 반응시켰다. 촉매량의 TFA를 갖는 아세트산을 사용하여 바람직한 선택적으로 아실화된 화합물 5-f(30% 수율)을 수득하였다. 5'-OH 그룹의 추가의 트리실릴화로 바람직한 직교형으로 보호된 화합물 5-g를 생성시켰다.
화합물 5-g를 POCl3 및 트리아졸로 처리하여 화합물 5-h를 탈-아실화된 화합물 5-i와 함께 제공하였다. 이들 2개 화합물들의 아세틸화는 디-아실화된, 완전히 보호된 화합물 5-j를 제공하였다. 가열 조건 하에 화합물 5-j를 아세트산으로 탈보호시켜 3개의 생성물들을 생성시켰으며, 이들 중 하나는 화합물 5이었다.
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있었다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, Sephadex DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
대안의 경로들을 적용하여, 예를 들면, 출발 물질로서 사이티딘으로 시작함으로써 화합물 5를 수득할 수 있었다. 이러한 벙법들에서, 5-위치는 할로겐 또는 할로겐화제(예를 들면, 본원에 기술된 임의의 것, 예를 들면, I2/메타-클로로퍼옥시벤조산)와 반응시킬 수 있었으며, 이는 알킬화제로 대체시킬 수 있다. 또한, 이러한 방법들은 하나 이상의 N- 또는 O-보호 그룹들(예를 들면, 본원에 기술된 임의의 것, 예를 들면, 실릴화 또는 아세틸화)을 사용하여 당 모이어티의 사이티딘 및/또는 하이드록실 그룹들의 아미노 그룹을 보호할 수 있었다.
실시예 13. 5-TBDMS-OCH
2
-사이티딘(화합물 6)의 합성
5-하이드록시우라실 화합물'-b를 글리코실화시켜 화합물 6'-d(28% 수율)을 수득하였고, 이를 실릴화하여 화합물 6'-e를 제공하였다. 보호된 우리딘의 활성화로 추가의 아민화 및 탈보호(800mg의 최종 화합물) 후 목적한 화합물 6을 제공하였다. 분자식: C16H29N3O6Si; 분자량: 387.50g/mol; 외형: 백색 고체; 저장 조건: 25℃에서 저장됨; HPLC: 순도, 97.57%; 1H NMR(CDCl3): δ 7.81(s, 1H), 7.40(bs, 1H), 6.49(bs, 1H), 5.79(d, 1H, J = 2.4 Hz), 5.3-5.32(m, 1H), 5.00-5.07(m, 2H), 4.30-4.45(m, 2H), 3.90-3.94(m, 2H), 3.80-3.83(m, 1H), 3.50-3.70(m, 2H), 0.87(s, 9H), 0.05(S, 6H); MS: 388(M + H)+, 410(M + Na)+)(도 7a 내지 도 7c).
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있었다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 (예를 들면, 세파덱스 DEAE-A25 컬럼을 사용하여) 정제하거나, 동결건조시키거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 14. 5-트리플루오로메틸 사이티딘(화합물 7)의 합성
화합물 7-A를 글리코실화하여 화합물 7-B를 제공하였고, 이를 2,4,6-트리이소프로필벤젠 설포닐 클로라이드(TPSCl)로 처리하여 카보닐 그룹을 활성화시키고 환원성 아민화를 촉진하였다. 탈보호로 화합물 7을 제공하였다. 대안의 활성화제들을 TPSCl 대신에, 예를 들면, 2,4,6-트리메틸벤젠 설포닐 클로라이드를 사용할 수 있었다.
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 15. 5-트리플루오로메틸 우리딘(화합물 8)의 합성
5-트리플루오로메틸우라실 8-A를 테트라-O-아세틸 리보스로 글리코실화하였고, 목적한 3보호된 5-트리플루오로메틸우리딘 8-B를 우수한 수율로 수득하였다. 추가의 탈보호로 바람직한 화합물 8을 제공하였고, 이는 NMR, MS 및 HPLC 결과들로 특징확인하였다. MS: 313(M + H)+, 335(M + Na)+; HPLC: 순도, 98.87%, (도 8a 내지 도 8c).
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 16. 5-(메톡시카보닐)메틸 우리딘(화합물 9)의 합성
우리딘 9-a를 보호하여 화합물 9-b(98% 수율)를 제공하였다. 당해 화합물을 과량의 브롬으로 아세트산 무수물 및 아세트산의 존재 하에 브롬화하였다. 5-브로모 유사체 9-c를 수득하였고(60% 수율) 추가로 벤조일화하여 바람직한 화합물 9-d(64% 수율)를 제공하였다. 5-브로모 화합물 9-d를 염기성 조건 하에 디메틸 말로네이트로 농축시켜 아릴화된 말로네이트 및 완전히 보호된 디에스테르 9-e(50% 수율)를 수득하였다. 탈-카복실화 및 탈보호 후, 화합물 9를 수득하였고 NMR(도 9)로 확인하였다.
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 17. 5-(메톡시카보닐)메틸-2'-O-메틸 우리딘(2-OMe-MCM5U)(화합물 10)의 합성
상기 화합물 9의 합성과 유사한 전략으로, 2'-O-메틸우리딘 10-a를 아실화하고 브롬화하여 화합물 10-c를 수득하였다. 추가의 벤조일화로 5-브로모 유사체 10-d를 제공하였고, 이를 디메틸 말로네이트로 농축시켜 목적한 생성물 10-e(45% 수율)를 제공하였다. 탈카복실화 및 탈보호하여 화합물 10을 제공하였다.
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP를 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 18. 5-트리플루오로아세틸-아미노메틸-2-티오우리딘(화합물 11)의 합성
2-티오우라실 11-a를 글리코실화하여 화합물 11-c를 제공하였고, 이는 임의의 유용한 탈보호제로 탈보호할 수 있다. 특히, LiOH는 바람직한 생성물 11-d(80 내지 90%의 수율)를 제공하였다. 이소프로필리덴 보호로 화합물 11-e(90% 수율)를 제공하였다. 추가의 5-하이드록실메틸화로 화합물 11-f를 제공하였다. 염소화, 아지드화, 및 추가의 환원으로 메틸아민 화합물 11-i를 제공하였고, 이를 아세틸화하여 화합물 11을 제공하였다.
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP를 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 19. 5-메틸아미노메틸-2-우리딘(화합물 12)의 합성
화합물 12는 임의의 유용한 방법[예를 들면, 상기 반응식 (i) 및 반응식 (ii) 참조)으로 수득할 수 있다. 예를 들면, 보호된 우라실을 글리코실화하고 후속적으로 아민화하여 화합물 12를 제공할 수 있었다. 추가의 보호, 탈보호, 및 활성화 단계들을 필요에 따라 수행할 수 있다. 상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 20. 5-TFA-메틸아미노메틸-2-우리딘 (화합물 13)의 합성
우리딘 13-a를 이소프로필리덴으로 보호하여 화합물 13-b를 제공한 후 5-하이드록시메틸화하여 화합물 13-c를 제공하였다. 염소화 및 후속적인 아민화로 화합물 13-e를 제공하였고, 이를 보호하여 13-f를 제공할 수 있다. 후속적인 탈보호로 화합물 13을 제공하였다.
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 21. 5-카복시메틸아미노메틸 우리딘(화합물 14)의 합성
우리딘 14-a를 이소프로필리덴으로 보호하여 화합물 14-b를 제공한 후 만니히(Mannich) 반응으로 5-아미노알킬화하여 화합물 14-c를 제공하였다. 메틸화하여 4급 아민 14-d를 제공하였다. 후속적인 아민화 및 탈보호 단계들을 사용하여 화합물 14를 제공할 수 있다. 상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 22. 5-메틸아미노메틸-2-우리딘(화합물 12) 및 5-카복시메틸아미노메틸-2-우리딘(화합물 14)의 대안의 합성
화합물 12 및 화합물 14에 대해 상기 제공된 전략들 이외에, 다음의 전략도 시행할 수 있다. 5-메틸우리딘 A를 실릴화하여 화합물 B를 제공할 수 있다. 라디칼 일브롬화 후, 수득된 중간체 브로마이드 C를 화합물 12 및 화합물 14 유사체들의 제조에 사용할 수 있다. 브로마이드 화합물 C의 후속적인 알킬화로 화합물 D 및 화합물 E를 제공하고, 이를 탈보호시켜 화합물 14 및 화합물 12를 각각 제공할 수 있다. 상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 23. 디메틸-슈도우리딘(화합물 15) 및 디메틸-슈도-UTP(상기 화합물의 NTP)의 합성
뉴클레오사이드는 임의의 유용한 방법에 의해 포스포릴화할 수 있다. 예를 들면, 상기에 나타낸 바와 같이, 뉴클레오사이드들을 옥시염화 인과 반응시키고, 후속적으로 모노포스페이트 중간체와 비스(트리부틸암모늄)피로포스페이트(TBAPP)로 처리하여 트리포스페이트를 수득할 수 있다.
실시예 24. 2'-C-메틸 아데노신(화합물 16) 및 2'-C-메틸 ATP(상기 화합물의 NTP)의 합성
약 5g의 화합물 16-2를 5g의 화합물 16-1로부터 데쓰-마틴 퍼요오단 반응(Dess-Martin periodane reaction)을 통해 제조하였다. 화합물 16-2를 MeMgI/TiCl4/-78℃와 반응시켜 화합물 16-3을 제공하였고, 조 화합물 16-3(6g)을 벤질클로라이드와 직접 반응시켜 화합물 16-4를 제조하였다. 핵염기와 반응시키고 탈보호하여 화합물 16(0.56g)을 제공하였다.
실시예
25. 2'-C-
메틸
-
사이티딘
이성체(화합물 17 및 화합물 18) 및 2'-C-메틸
UTP
(상기 화합물들의
NTP
)의 합성
약 17.4g의 화합물 17-3을 20g의 화합물 17-1로부터 제조하였다. 이어서, 2'-산화 및 MeMgI를 사용한 알킬화로 300mg의 화합물 17-5a 및 80mg의 화합물 17-5b를 제공하였다. 약 9g의 화합물 17-5a(약 90% 순수) 및 2.1g의 화합물 17-5b(순수)를 17.4g의 화합물 17-3으로부터 2개 배치(batch)에서 제조하였다. N- 및 O-탈보호로 화합물 17 및 화합물 18을 제공하였다.
실시예 26. 2'-C-메틸 구아노신(화합물 19) 및 2'-C-메틸 GTP(상기 화합물의 NTP)의 합성
보호된 리보스 19-1의 2'-산화 및 MeMgCl을 사용한 후속적인 알킬화로 화합물 19-3을 제공하였다. 수득된 화합물을 추가로 보호하여 화합물 19-4를 제공하였고, 1.56g의 화합물 19-5a를 3.1g의 화합물 19-4로부터 제조하였다. 후속적인 산화 및 탈보호로 화합물 19(약 90% 순수, 50mg)를 제공하였다.
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 27. 2'-C-메틸 우리딘(화합물 20) 및 2'-C-메틸 UTP(상기 화합물의 NTP)의 합성
보호된 리보스 20-1의 2'-산화 및 MeMgCl를 사용한 후속적인 알킬화로 화합물 20-3을 제공하였다. 수득된 화합물을 추가로 보호하여 화합물 20-4를 제공하였다. 우라실과의 반응 및 탈보호로 순수한 화합물 20(50mg)을 제공하였다.
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 28. (S)-2'-C-메틸 아데노신(화합물 21) 및 (S)-2'-C-메틸 ATP(상기 화합물의 NTP)의 합성
화합물 21-1(5g)을 보호하여 화합물 21-2a를 형성하였고, 크롬 산화로 화합물 21-3a를 제공하였다. 경로 [i](-50℃에서 에테르 중의 5당량 MeMgI)를 통한 알킬화로 화합물 21-4를 제공하였다. 임의로, 수율은 경로 [ii]를 통해 아미노 그룹을 보호함으로써 개선시켜 화합물 21-3b를 제공한 후 2'-C 위치에서 알킬화하여 화합물 21-4a를 제공할 수 있었다. 화합물 21-3a를 알킬화하여 조 화합물 21-4(3g, 당해 조 생성물 중 20%의 화합물 3a)를 제공하였으며, 여기서, 당해 생성물은 임의로 정제할 수 있다. 화합물 21-4를 탈보호시켜 화합물 21(50% 수율)을 수득하였다.
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 29. (S)-2'-C-메틸 구아노신(화합물 22) 및 (S)-2'-메틸 GTP(상기 화합물의 NTP)의 합성
약 30g의 화합물 22-1을 실릴화하여 화합물 22-2를 3개의 단계들로 제공하였다. 추가의 보호로 화합물 22-3을 제공하였고, 데쓰-마틴 퍼요오단 산화로 화합물 22-4(1.6g)를 2개의 배치들로 제공하였다. 2'-C 알킬화(에테르 중의 5당량의 MeMgI, -50℃ 내지 RT)로 화합물 22-5를 제공하였고, 추가로 탈보호 단계들로 화합물 22를 제공하였다.
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 30. (S)-2'-C-메틸 우리딘(화합물 23) 및 (S)-2'-C-메틸 UTP(상기 화합물의 NTP)의 합성
우리딘 23-1(2.0g)을 TIPDSCl2 (1,3-디클로로-1,1,3,3-테트라이소프로필디실록산)으로 보호하여 화합물 23-2를 제공하였다. 산화시켜 화합물 23-3을 제공하고, 2'-C 알킬화로 화합물 23-4를 제공하였으며, 이를 다음 단계 전에 프렙(Prep)-HPLC로 임의로 정제할 수 있었다. 이어서, 탈보호로 바람직한 화합물 23을 제공하였다.
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 31. 4'-C-메틸 아데노신(화합물 24) 및 4'-C-메틸 ATP(상기 화합물의 NTP)의 합성
1,2:5,6-디-O-이소프로필리덴-α-D-글루코푸라노스 24-1을 순차적인 산화, 환원, 및 보호 단계들을 통해 전환시켜 화합물 24-4를 제공하였다. 화합물 24-2를 제공하는 제1 산화 단계는, 임의의 유용한 시약들, 예를 들면, 0.75당량의 피리디늄 디크로메이트(PDC)와 1당량의 Ac2O 또는 1.2당량의 데쓰-마틴 퍼요오단을 이용하여 수행할 수 있다. 후속적인 탈보호, 포르밀화, 및 환원으로 화합물 24-7를 제공하였고, 이를 보호 및 탈산화 단계들을 수행하여 화합물 24-10을 제공하였다. 약 0.4g의 화합물 24-14를 1g의 화합물 24-10으로부터 순차적인 보호 및 탈보호 단계들을 통해 제조하였다. N6-벤조일아데닌의 첨가 및 후속적인 탈보호로 화합물 24를 제공하였다.
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 32. 4'-C-메틸 사이티딘(화합물 25) 및 4'-C-메틸 CTP(상기 화합물의 NTP)의 합성
화합물 24에 대해 상기 제공된 전략과 유사하게, 화합물 25-14를 화합물 25-1로 제조하였다. 사이티딘의 첨가 및 후속적인 탈보호로 화합물 25를 제공하였다.
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 33. 4'-C-메틸 구아노신(화합물 26) 및 4'-C-메틸 GTP(상기 화합물의 NTP)의 합성
화합물 24에 대해 상기 제공된 전략과 유사하게, 화합물 26-14를 화합물 26-1을 사용하여 제조하였다. 2-아미노-6-클로로퓨린의 첨가, 후속적인 산화, 및 이어서 탈보호로 화합물 26을 제공하였다.
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 34. 4'-C-메틸 우리딘(화합물 27) 및 4'-C-메틸 UTP(상기 화합물의 NTP)의 합성
화합물 24에 대해 상기 제공된 전략과 유사하게, 화합물 27-14를 화합물 27-1로 제조하였다. 우라실의 첨가 및 후속적인 탈보호로 화합물 27을 제공하였다.
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 35. 2'-O,4'-C-메틸렌 아데노신(화합물 28) 및 2'-O,4'-C-메틸렌 ATP(상기 화합물의 NTP)의 합성
화합물 24에 대해 상기 제공된 전략과 유사하게, 화합물 28-7을 화합물 28-1로 제조하였다. 후속적인 메실화, 탈보호, 및 아세틸화로 화합물 28-10을 제공하였고, 그 후 N6-벤조일아데닌을 첨가하였고, 후속적으로 내부 폐환시켰다. 다양한 보호 및 탈보호 단계로 화합물 28을 제공하였다.
실시예 36. 5-메틸-2'-O,4'-C-메틸렌 사이티딘(화합물 29) 및 5-메틸-2'-O,4'-C-메틸렌 CTP(상기 화합물의 NTP)의 합성
알도푸라노스 화합물 29-1을 각종 보호 단계들을 통해 반응시킨 후, 5-메틸우라실을 가하여 화합물 29-5를 제공하였다. 후속적인 내부 폐환, 탈보호, 보호, 및 아민화 단계들로 화합물 29를 제공하였다.
실시예 37. 2'-O,4'-C-메틸렌 구아노신(화합물 30) 및 2'-O,4'-C-메틸렌 GTP(상기 화합물의 NTP)의 합성
화합물 29에 대해 상기 제공된 전략과 유사하게, 알도푸라노스 화합물 30-1을 각종 보호 단계들을 통해 반응시킨 후, 2-아미노-6-클로로퓨린을 가하여 화합물 30-5를 제공하였다. 후속적인 내부 폐환, 아민화, 및 탈보호 단계들로 화합물 30을 제공하였다.
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 38. 2'-O,4'-C-메틸렌 우리딘(화합물 31) 및 2'-O,4'-C-메틸렌 UTP(상기 화합물의 NTP)의 합성
화합물 24에 대해 상기 제공된 전략과 유사하게, 화합물 31-7을 화합물 31-1로 제조하였다. 후속적인 메실화, 탈보호, 및 아세틸화로 화합물 30-10을 제공하였다. 우라실의 첨가 및 후속적인 내부 폐환으로 화합물 31-12를 제공하였고, 각종 보호 및 탈보호 단계들로 화합물 31을 제공하였다. 후속적인 트리포스페이트 반응(예를 들면, 본원에 기술된 바와 같은)으로 화합물 31의 NTP를 제공하였고, 이를 임의로 정제(예를 들면, HPLC 사용)할 수 있다.
실시예 39. 2'-클로로 아데노신(화합물 32) 및 2'-클로로 ATP(상기 화합물의 NTP)의 합성
아라비노아데노신 32-1을 단계 1 및 단계 2를 통해 보호한 후 염소화하여 화합물 32-4를 제공하였다. 후속적인 탈보호로 화합물 32를 제공하였고, 트리포스페이트 반응으로 화합물 32의 NTP를 제공하였다.
실시예 40. 2'-요오도 아데노신(화합물 33) 및 2'-요오도 ATP(상기 화합물의 NTP)의 합성
아라비노아데노신 33-1을 단계 1 및 단계 2를 통해 보호한 후 요오드화시켜 화합물 33-4를 제공하였다. 후속적인 탈보호로 화합물 33을 제공하였고, DMF 중의 트리포스페이트 반응으로 화합물 33의 NTP를 제공하였다.
실시예 41. 2'-브로모 사이티딘(화합물 34) 및 2'-브로모 CTP(상기 화합물의 NTP)의 합성
아라비노사이티딘 34-1을 각종 조건 하에 보호한 후 브롬화하여 화합물 34-4를 제공하였다. 임의로, 반응은 화합물 34-3a를 통해 (i) DCM(10mL) 중 1.5당량의 Et3N, 1당량의 DMAP, 1.2당량의 TfCl; (ii) DCM(15mL) 중 3당량의 DMAP, 1.2당량의 TfCl; 또는 (iii) DCM(15mL) 중 15당량의 DMAP, 1.5당량의 Tf2O 하에 -10℃ 내지 0℃에서 2시간 동안과 같은 임의의 유용한 보호 반응들 하에 화합물 34-4를 제공할 수 있다. 특히, 55mg의 화합물 34-3a를 반응 조건 (iii)으로부터 수득하였다. 후속적인 탈보호로 화합물 34를 제공하였고, DMF 중 트리포스페이트 반응으로 화합물 34의 NTP를 제공하였다. 조 생성물 34는 포스포릴화 전에 임의로 정제시킬 수 있었다.
실시예 42. 2'-클로로 구아노신(화합물 35) 및 2'-클로로 GTP(상기 화합물의 NTP)의 합성
구아노신 35-1을 각종 조건들 하에 보호한 후 아세틸화하여 화합물 35-4를 제공하였다. 화합물 35-2로부터 화합물 35-3으로의 반응을 1,2-디클로로에탄(10mL) 중 2당량의 DMAP, 2당량의 Et3N, 3당량의 Tf2O로 40℃에서 4시간 동안 수행하였다. 정제 후, 약 55mg의 화합물 35-3을 수득하였다.
바람직한 화합물 35는 임의의 유용한 방법으로도 수득할 수 있다. 예를 들면, 상기 나타낸 바와 같이, 화합물 35-4를 후속적인 보호, 염소화, 및 탈보호 단계들로 처리하여 화합물 35를 제공하였다. 상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 43. 2'-요오도 우리딘(화합물 36) 및 2'-요오도 UTP(상기 화합물의 NTP)의 합성
O2,2'-사이클로우리딘 36-1을 보호하여 화합물 36-2를 제공하였다. 셀레늄과 임의로 매개된 후속적인 요오드화로 화합물 36을 제공하였다. 트리포스페이트 반응을 수행하여 화합물 36의 NTP를 제공하였다. 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 44. 2'-O,4'-C-메틸렌 아데노신(화합물 37) 및 2'-O,4'-C-메틸렌 ATP(상기 화합물의 NTP)의 합성
화합물 24에 대해 상기 제공된 전략과 유사하게, 화합물 37-7을 화합물 37-1로 제조하였다. 후속적인 메실화, 탈보호, 및 아세틸화로 화합물 37-10을 제공하였다. 우라실의 첨가 및 후속적인 내부 폐환으로 화합물 37-12을 제공하였다. 각종 보호 및 탈보호 단계들로 화합물 37을 제공하였다.
상응하는 NTP를 수득하기 위하여, 트리포스페이트 반응을 수행할 수 있다(예를 들면, 본원에 기술된 임의의 것). 임의로, NTP는 정제하거나(예를 들면, 세파덱스 DEAE-A25 컬럼을 사용), 동결건조하거나, 또는 증발(예를 들면, EtOH로부터)시킬 수 있다.
실시예 45. 사이클로펜텐 디올 사이티딘(화합물 38) 및 사이클로펜텐 디올 CTP(상기 화합물의 NTP)의 합성
D-리보스를 보호한 후 알릴화하여 화합물 38-4를 제공하였고, 이를 후속적으로 폐환시키고 환원시켜 화합물 38-7을 제공하였다. 올레핀 전이 및 후속적인 산화로 화합물 38-9를 제공하였고, 추가의 환원 반응들 및 N-벤조일우라실의 첨가로 화합물 38-14를 제공하였다. 추가의 탈보호 및 보호 반응들로 화합물 38을 제공하였고, 트리포스페이트 반응(예를 들면, 임의의 유용한 반응 조건, 예를 들면, 본원에 기술된 것들 또는 본원에 참조로 혼입된 미국 특허 제7,893,227호에 기술된 것들)으로 화합물 38의 NTP를 제공하였다.
실시예 46. 2'-메틸 우리딘(화합물 39) 및 2'-메틸 UTP(상기 화합물의 NTP)의 합성
우리딘 39-1을 보호한 후 2당량의 데쓰-마틴 퍼요오단으로 산화하여 화합물 39-3을 제공하였다. 후속적인 비티히 반응(Wittig reaction), 수소화, 및 탈보호 단계들로 화합물 39를 제공하였다.
실시예
47. 2'-
메틸
사이티딘
(화합물 40) 및 2'-
메틸
CTP(상기 화합물의 NTP)의 합성
사이티딘 40-1을 보호한 후 산화시켜 화합물 40-3을 제공하였다. 후속적인 비티히 반응, 수소화, 및 탈보호 단계들로 화합물 40을 제공하였다.
실시예 48. N-아세틸 사이티딘(화합물 41) 및 N-아세틸 CTP(상기 화합물의 NTP)의 합성
N-아세틸-사이티딘(화합물 41)(103.0mg, 0.36mmol)의 용액을 1.0mL의 트리메틸포스페이트(TMP) 및 1.0mL의 무수 테트라하이드로푸란(THF) 중 양자 스폰지(115.72mg, 0.54mmol, 1.50당량)에 가하였다. 당해 용액을 0℃에서 10분 동안 교반하였다. 옥시염화 인(POCl3)(67.2μl 0.72mmol, 2.0당량)을 당해 용액에 적가한 후 2시간 동안 N2 대기 하에 계속 교반하였다. 2시간 후, 당해 용액을 2.5ml의 디메틸포름아미드 중 비스트리부틸암모늄 피로포스페이트(TBAPP 또는 (n-Bu3NH)2H2P2O7)(1.28g, 2.34mmol, 6.5당량) 및 트리부틸아민(350.0μl 1.45mmol, 4.0당량)의 혼합물과 반응시켰다. 대략 15분 후, 반응물을 24.0ml의 0.2M 트리에틸암모늄 중탄산염(TEAB)으로 퀀칭(quenching)시켰고, 투명한 용액을 실온에서 1시간 동안 교반하였다. 반응 혼합물을 밤새 동결건조시켰고, 조 반응 혼합물을 HPLC(Shimadzu, Kyoto Japan, Phenomenex C18 분취용 컬럼, 250 x 21.20 mm, 10.0 마이크론; 구배: 3.0분 동안 100% A, 이후에 1% B/분, A = 100 mM TEAB 완충액, B = ACN; 유속: 10.0mL/분; 보유 시간: 16.81 내지 17.80분)에 의해 정제하였다. 목적한 화합물을 함유하는 분획들을 혼주(pooling)하고 동결건조시켜 화합물 41의 NTP를 제조하였다. 트리포스포릴화 반응들을 화염-건조시킨 2-목 플라스크 속에서 N2 대기 하에 수행하였다. 뉴클레오사이드들 및 단백질 스폰지를 사용하기 전에 밤새 진공 하에 P2O5에 걸쳐 건조시켰다. 모노포스페이트의 형성은 LCMS에 의해 모니터링하였다.
실시예
49. 5-
메톡시
우리딘
(화합물 42) 및 5-
메톡시
UTP(상기 화합물의 NTP)의 합성
5-메톡시 우리딘(화합물 42)(69.0mg, 0.25mmol, 가열하여 이를 용해시킴)을 0.7mL의 트리메틸포스페이트(TMP) 중 양자 스폰지(80.36mg, 0.375mmol, 1.50당량)에 가하고 0℃에서 10분 동안 교반하였다. 옥시염화 인(POCl3)(46.7μl 0.50mmol, 2.0당량)을 용액에 적가한 후 2시간 동안 N2 대기 하에 계속해서 교반하였다. 2시간 후, 용액을 2.0ml의 디메틸포름아미드 중 비스트리부틸암모늄 피로포스페이트(TBAPP 또는 (n-Bu3NH)2H2P2O7)(894.60mg, 1.63mmol, 6.50당량) 및 트리부틸아민(243.0μl 1.00mmol, 4.0당량)의 혼합물과 반응시켰다. 대략 15분 후, 반응물을 17.0ml의 0.2M 트리에틸암모늄 중탄산염(TEAB)으로 퀀칭시키고 투명한 용액을 실온에서 1시간 동안 교반하였다. 반응 혼합물을 밤새 동결건조시키고 조 반응 혼합물을 HPLC(Shimadzu, Kyoto Japan, Phenomenex C18 분취용 컬럼, 250 x 21.20 mm, 10.0 마이크론; 구배: 3.0분 동안 100% A, 이후에 1% B/분, A = 100 mM TEAB 완충액, B = ACN; 유속: 10.0 mL/분; 보유 시간: 16.57 내지 17.51분)에 의해 정제하였다. 목적한 화합물을 함유하는 분획들을 혼주시키고 동결건조시켜 화합물 42의 NTP를 제조하였다. 트리포스포릴화 반응들을 화염 건조시킨 2-목 플라스크에서 N2 대기 하에 수행하였다. 뉴클레오사이드들 및 단백질 스폰지를 사용하기 전에 밤새 진공 하에 P2O5에 걸쳐 건조시켰다. 모노포스페이트의 형성을 LCMS에 의해 모니터링하였다.
실시예 50. 5-포르밀 사이티딘(화합물 43) 및 5-포르밀 CTP(상기 화합물의 NTP)의 합성
5-포르밀 사이티딘(화합물 43)(48.4mg, 0.18mmol, 가열하여 이를 용해시킴)의 용액을 0.7mL 트리메틸포스페이트(TMP) 중 단백질 스폰지(57.86mg, 0.27mmol, 1.50당량)에 가하고 0℃에서 10분 동안 교반하였다. 옥시염화 인(POCl3)(33.6μl 0.36mmol, 2.0당량)을 용액에 적가한 후 2시간 동안 N2 대기 하에 계속 교반하였다. 2시간 후, 당해 용액을 1.7ml의 디메틸포름아미드 중 비스트리부틸암모늄 피로포스페이트(TBAPP 또는 (n-Bu3NH)2H2P2O7)(642.0mg, 1.17mmol, 6.50당량) 및 트리부틸아민(175.0μl 0.72mmol, 4.0당량)의 혼합물과 반응시켰다. 대략 15분 후, 반응물을 12.0ml의 0.2M 트리에틸암모늄 중탄산염(TEAB)으로 퀀칭시켰고, 투명한 용액을 실온에서 1시간 동안 교반하였다. 반응 혼합물을 밤새 동결건조시키고 조 반응 혼합물을 HPLC(Shimadzu, Kyoto Japan, Phenomenex C18 분취용 컬럼, 250 x 21.20mm, 10.0 마이크론; 구배: 3.0분 동안 100% A, 이후 1% B/분, A = 100mM TEAB 완충액, B = ACN; 유속: 10.0mL/분; 보유 시간: 17.04 내지 17.87 분)로 정제하였다. 목적한 화합물을 함유하는 분획들을 혼주시키고 동결건조시켜 화합물 43의 NTP를 제공하였다. 트리포스포릴화 반응들을 화염-건조시킨 2목 플라스크에서 N2 대기 하에 수행하였다. 뉴클레오사이드들 및 단백질 스폰지를 사용하기 전에 밤새 진공 하에 P2O5에 걸쳐 건조시켰다. 모노포스페이트들의 형성을 LCMS에 의해 모니터링하였다.
실시예 51. 3-메틸 우리딘(화합물 44) 및 3-메틸 UTP(상기 화합물의 NTP)의 합성
3-메틸 우리딘(화합물 44)(45.80mg, 0.18mmol)의 용액을 0.5mL의 트리메틸포스페이트(TMP) 중 양자 스폰지(57.86mg, 0.27mmol, 1.50당량)에 가하고 0℃에서 10분 동안 교반하였다. 옥시염화 인(POCl3)(33.6μl 0.36mmol, 2.0당량)을 용액에 적가한 후 2시간 동안 N2 대기 하에 계속 교반하였다. 2시간 후, 용액을 1.3ml의 디메틸포름아미드 중 비스트리부틸암모늄 피로포스페이트(TBAPP 또는 (n-Bu3NH)2H2P2O7)(652.0mg, 1.19mmol, 6.60당량) 및 트리부틸아민(175.0μl 0.72mmol, 4.0당량)의 혼합물과 반응시켰다. 대략 15분 후, 반응물을 12.0ml의 0.2M 트리에틸암모늄 중탄산염(TEAB)으로 퀀칭시키고, 투명한 용액을 실온에서 1시간 동안 교반하였다. 반응 혼합물을 밤새 동결건조시키고 조 반응 혼합물을 HPLC(Shimadzu, Kyoto Japan, Phenomenex C18 분취용 컬럼, 250 x 21.20 mm, 10.0 마이크론; 구배: 3.0분 동안 100% A, 이후에 1% B/분, A = 100 mM TEAB 완충액, B = ACN; 유속: 10.0 mL/분; 보유 시간: 18.52 내지 19.57분)에 의해 정제하였다. 목적한 화합물을 함유하는 분획들을 혼주시키고 동결건조시켜 화합물 44의 NTP를 제공하였다. 트리포스포릴화 반응들을 화염-건조시킨 2목 플라스크 속에서 N2 대기 하에 수행하였다. 뉴클레오사이드들 및 단백질 스폰지를 사용하기 전에 밤새 진공 하에 P2O5에 걸쳐 건조시켰다. 모노포스페이트의 형성을 LCMS에 의해 모니터링하였다.
실시예 52. N1-메틸 슈도우리딘(화합물 45) 및 N1-메틸 슈도UTP(상기 화합물의 NTP)의 합성
N1-메틸 슈도우리딘(화합물 45)(96.6mg, 0.374mmol, 가열하여 이를 용해시킴)의 용액을 0.8mL 트리메틸포스페이트(TMP) 중의 양자 스폰지(120.0mg, 0.56mmol, 1.50당량)에 가하였고, 0℃에서 10분 동안 교반하였다. 옥시염화 인(POCl3)(70.0μl 0.75mmol, 2.0당량)을 용액에 적가한 후 2시간 동안 N2 대기 하에 계속 교반하였다. 2시간 후, 용액을 2.5ml의 디메틸포름아미드 중의 비스트리부틸암모늄 피로포스페이트(TBAPP 또는 (n-Bu3NH)2H2P2O7)(1.36g, 2.47mmol, 6.60당량) 및 트리부틸아민(362.0μl 1.5mmol, 4.0당량)의 혼합물과 반응시켰다. 대략 15분 후, 반응물을 17.0ml의 0.2M 트리에틸암모늄 중탄산염(TEAB)으로 퀀칭시키고 투명한 용액을 실온에서 1시간 동안 교반하였다. 반응 혼합물을 밤새 동결건조시키고 조 반응 혼합물을 HPLC(Shimadzu, Kyoto Japan, Phenomenex C18 분취용 컬럼, 250 x 21.20 mm, 10.0 마이크론; 구배: 3.0분 동안 100% A, 이어서 1% B/분, A = 100mM TEAB 완충액, B = ACN; 유속: 10.0 mL/분; 보유 시간: 15.91 내지 17.01분)에 의해 정제하였다. 목적한 화합물을 함유하는 분획들을 혼주시키고 동결건조시켜 트리포스포릴화 반응에 적용시킴으로써 화합물 45의 NTP를 제공하였다. 트리포스포릴화 반응들을 화염-건조시킨 2목 플라스크에서 N2 대기 하에 교반하였다. 뉴클레오사이드 및 단백질 스폰지를 사용하기 전에 밤새 진공 하에 P2O5에 걸쳐 건조시켰다. 모노포스페이트들의 형성을 LCMS에 의해 모니터링하였다.
실시예 53. 5-메톡시카보닐에테닐 우리딘(화합물 46) 및 5-메톡시카보닐에테닐 UTP(상기 화합물의 NTP)의 합성
5-메톡시카보닐에테닐 우리딘(화합물 46)(102.0mg, 0.31mmol)의 용액을 0.8mL의 트리메틸포스페이트(TMP) 중 양자 스폰지(99.65mg, 0.46mmol, 1.50당량)에 가하고 0℃에서 10분 동안 교반하였다. 옥시염화 인(POCl3)(57.8μl 0.62mmol, 2.0당량)을 당해 용액에 적가한 후 2시간 동안 N2 대기 하에 교반하였다. 2시간 후, 당해 용액을 2.5ml의 디메틸포름아미드 중 비스트리부틸암모늄 피로포스페이트(TBAPP 또는 (n-Bu3NH)2H2P2O7)(1.12g, 2.05mol, 6.60당량) 및 트리부틸아민(300.0μl 1.24mmol, 4.0당량)의 혼합물과 반응시켰다. 대략 15분 후, 반응물을 20.0ml의 0.2M 트리에틸암모늄 중탄산염(TEAB)으로 퀀칭시켰고 투명한 용액을 실온에서 1시간 동안 교반하였다. 반응 혼합물을 밤새 동결건조시키고 조 반응 혼합물을 HPLC(Shimadzu, Kyoto Japan, Phenomenex C18 분취용 컬럼, 250 x 21.20mm, 10.0 마이크론; 구배: 3.0분 동안 100% A, 이후에 1% B/분, A = 100mM TEAB 완충액, B = ACN; 유속: 10.0 mL/분; 보유 시간: 21.56 내지 23.21분)에 의해 정제하였다. 목적한 화합물을 함유하는 분획들을 혼주시키고 동결건조시켜 화합물 46의 NTP를 제공하였다. 트리포스포릴화 반응들을 화염-건조시킨 2목 플라스크에서 N2 대기 하에 수행하였다. 뉴클레오사이드들 및 단백질 스폰지를 사용하기 전에 밤새 진공 하에 P2O5에 걸쳐 건조시켰다. 모노포스페이트들의 형성을 LCMS에 의해 모니터링하였다.
실시예
54. 5-
아미노프로페닐
우리딘
(화합물 47) 및 5-
아미노프로페닐
UTP(상기 화합물의
NTP
)의 합성
5-아미노프로페닐 우리딘 47을 보호하고 보호된 화합물 47(86.0 mg, 0.22 mmol)의 용액을 0.7mL의 트리메틸포스페이트(TMP) 중 양자 스폰지(70.7mg, 0.33mmol, 1.50당량)에 가하고 0℃에서 10분 동안 교반하였다. 옥시염화 인(POCl3)(41.1μl 0.44mmol, 2.0당량)을 당해 용액에 적가한 후 2시간 동안 N2 대기 하에 교반하였다. 2시간 후, 용액을 1.6ml의 디메틸포름아미드 중 비스트리부틸암모늄 피로포스페이트(TBAPP 또는 (n-Bu3NH)2H2P2O7)(784.6mg, 1.43mmol, 6.50당량) 및 트리부틸아민(213.0μl 0.88mmol, 4.0당량)의 혼합물과 반응시켰다. 대략 15분 후, 반응물을 15.0ml의 0.2M 트리에틸암모늄 중탄산염(TEAB)으로 퀀칭시키고 투명한 용액을 실온에서 1시간 동안 교반하였다. 18.0ml의 농축된 수산화 암모늄을 반응 혼합물에 가하여 트리플루오로아세틸 그룹을 제거하였다. 이어서, 이를 밤새 교반하면서 저장하였다. 반응 혼합물을 밤새 동결건조시키고 조 반응 혼합물을 HPLC(Shimadzu, Kyoto Japan, Phenomenex C18 분취용 컬럼, 250 x 21.20 mm, 10.0 마이크론; 구배: 3.0분 동안 100% A, 이후에 1% B/분, A = 100 mM TEAB 완충액, B = ACN; 유속: 10.0 mL/분; 보유 시간: 16.14-17.02 분)에 의해 정제하였다. 목적한 화합물을 함유하는 분획들을 혼주시키고 동결건조시켜 화합물 47의 NTP를 제공하였다. 트리포스포릴화 반응들을 화염-건조시킨 2목 플라스크 속에서 N2 대기 하에 수행하였다. 뉴클레오사이드들 및 단백질 스폰지를 사용하기 전에 밤새 진공 하에 P2O5에 걸쳐 건조시켰다. 모노포스페이트들의 형성을 LCMS에 의해 모니터링하였다.
실시예
55. N-
PEG
아데노신(화합물 48) 및 N-
PEG
ATP
(상기 화합물의
NTP
)의 합성
N-PEG 아데노신 48을 보호하고 보호된 화합물 48(100.0 mg, 0.15 mmol)의 용액을 0.65mL의 트리메틸포스페이트(TMP) 중 양자 스폰지(49.3mg, 0.23mmol, 1.50당량)에 가하고 0℃에서 10분 동안 교반하였다. 옥시염화 인(POCl3)(28.0μl 0.3mmol, 2.0당량)을 당해 용액에 적가한 후 2시간 동안 N2 대기 하에 교반하였다. 2시간 후, 당해 용액을 1.2ml의 디메틸포름아미드 중 비스트리부틸암모늄 피로포스페이트(TBAPP 또는 (n-Bu3NH)2H2P2O7)(537.7mg, 0.98mmol, 6.50당량) 및 트리부틸아민(146.0μl 0.6mmol, 4.0당량)의 혼합물과 반응시켰다. 대략 15분 후, 반응물을 10.0ml의 0.2M 트리에틸암모늄 중탄산염(TEAB)으로 퀀칭시키고 투명한 용액을 실온에서 1시간 동안 교반하였다. 18.0 ml의 농축된 수산화 암모늄을 반응 혼합물에 가하여 트리플루오로아세틸 그룹을 제거하였다. 이어서, 이를 밤새 교반하면서 저장하였다. 반응 혼합물을 밤새 동결건조시키고 조 반응 혼합물을 HPLC(Shimadzu, Kyoto Japan, Phenomenex C18 분취용 컬럼, 250 x 21.20 mm, 10.0 마이크론; 구배: 3.0분 동안 100% A, 이후에 1% B/분, A = 100 mM TEAB 완충액, B = ACN; 유속: 10.0 mL/분; 보유 시간: 24.5-25.5 분)에 의해 정제하였다. 목적한 화합물을 함유하는 분획들을 혼주시키고 동결건조시켜 화합물 48의 NTP를 제공하였다. 트리포스포릴화 반응들을 화염-건조시킨 2목 플라스크 속에서 N2 대기하에 수행하였다. 뉴클레오사이드들 및 단백질 스폰지를 사용하기 전에 밤새 진공 하에 P2O5에 걸쳐 건조시켰다. 모노포스페이트들의 형성을 LCMS에 의해 모니터링하였다.
실시예 56. N-메틸 아데노신(화합물 49) 및 N-메틸 ATP(상기 화합물의 NTP)의 합성
N-메틸 아데노신(화합물 49)(70.0mg, 0.25mmol)의 용액을 0.7 mL 트리메틸포스페이트(TMP) 중 양자 스폰지(79.29mg, 0.37mmol, 1.50당량)에 가하고 0℃에서 10분 동안 교반하였다. 옥시염화 인(POCl3)(46.66μl 0.50mmol, 2.0당량)을 당해 용액에 적가한 후 2시간 동안 N2 대기 하에 교반하였다. 2시간 후, 용액을 1.3ml의 디메틸포름아미드 중 비스트리부틸암모늄 피로포스페이트(TBAPP 또는 (n-Bu3NH)2H2P2O7)(888.85mg, 1.62mmol, 6.50당량) 및 트리부틸아민(241.0μl 1.0mmol, 4.0당량)의 혼합물과 반응시켰다. 대략 15분 후, 반응물을 16.0 ml의 0.2 M 트리에틸암모늄 중탄산염(TEAB)으로 퀀칭시키고 투명한 용액을 실온에서 1시간 동안 교반하였다. 반응 혼합물을 밤새 동결건조시키고 조 반응 혼합물을 HPLC(Shimadzu, Kyoto Japan, Phenomenex C18 분취용 컬럼, 250 x 21.20 mm, 10.0 마이크론; 구배: 3.0분 동안 100% A, 이후에 1% B/분, A = 100 mM TEAB 완충액, B = ACN; 유속: 10.0 mL/분; 보유 시간: 19.62 내지 20.14분)에 의해 정제하였다. 목적한 화합물을 함유하는 분획들을 혼주시키고 동결건조시켜 화합물 49의 NTP를 제공하였다. 트리포스포릴화 반응들을 화염-건조시킨 2목 플라스크 속에서 N2 대기하에 수행하였다. 뉴클레오사이드들 및 단백질 스폰지를 사용하기 전에 밤새 진공 하에 P2O5에 걸쳐 건조시켰다. 모노포스페이트들의 형성을 LCMS에 의해 모니터링하였다.
실시예
57. N,N-디메틸
구아노신
(화합물 50) 및 N,N-디메틸 GTP(상기 화합물의
NTP
)의 합성
N,N-디메틸 구아노신(화합물 50)(65.8mg, 0.21mmol)의 용액을 0.7 mL의 트리메틸포스페이트(TMP) 중 양자 스폰지(68.58mg, 0.32mmol, 1.50당량)에 가하고 0℃에서 10분 동안 교반하였다. 옥시염화 인(POCl3)(39.20μl 0.42mmol, 2.0당량)을 용액에 적가한 후 2시간 동안 N2 대기 하에 교반하였다. 2시간 후, 용액을 1.5ml의 디메틸포름아미드 중 비스트리부틸암모늄 피로포스페이트(TBAPP 또는 (n-Bu3NH)2H2P2O7)(751.67mg, 1.37mmol, 6.50당량) 및 트리부틸아민(204.0μl 0.84mmol, 4.0당량)의 혼합물과 반응시켰다. 대략 15분 후, 반응물을 14.0ml의 0.2M 트리에틸암모늄 중탄산염(TEAB)으로 퀀칭시키고 투명한 용액을 실온에서 1시간 동안 교반하였다. 반응 혼합물을 밤새 동결건조시키고 조 반응 혼합물을 HPLC(Shimadzu, Kyoto Japan, Phenomenex C18 분취용 컬럼, 250 x 21.20 mm, 10.0 마이크론; 구배: 3.0분 동안 100% A, 이후에 1% B/분, A = 100 mM TEAB 완충액, B = ACN; 유속: 10.0 mL/분; 보유 시간: 19.27 내지 19.95분)에 의해 정제하였다. 목적한 화합물을 함유하는 분획들을 혼주시키고 동결건조시켜 화합물 50의 NTP를 제공하였다. 트리포스포릴화 반응들을 화염-건조시킨 2목 플라스크에서 N2 대기 하에 수행하였다. 뉴클레오사이드들 및 단백질 스폰지를 사용하기 전에 밤새 진공 하에 P2O5에 걸쳐 건조시켰다. 모노포스페이트들의 형성을 LCMS에 의해 모니터링하였다.
실시예
58.
NTPS
의
트리포스페이트
합성을 위한 일반적인 방법
뉴클레오사이드 i는 임의의 유용한 방법에 의해 포스포릴화시켜 트리포스페이트 화합물 ii를 제공할 수 있다. 예를 들면, 뉴클레오사이드를 양자 스폰지 및 트리메틸포스페이트(TMP)에 가하고 냉각시킬 수 있다(예를 들면, -40℃까지). 옥시염화 인(POCl3)을 적가한 후 비스트리부틸암모늄 피로포스페이트(TBAPP 또는 (n-Bu3NH)2H2P2O7) 및 트리부틸아민과 반응시킬 수 있다. 이어서, 반응물을 트리에틸암모늄 중탄산염(TEAB)으로 신속하게 퀀칭시켰다. 예시적인 조건들은 미국 특허 제7,893,227호에 제공되며, 이는 인용에 의해 본원에 포함된다.
포스포릴화 반응 후, 반응 혼합물을 임의로 동결건조하거나, 정제(예를 들면, 이온-교환 크로마토그래피 및/또는 HPLC에 의해)하거나, 또는 (예를 들면, MeOH에 용해시키고 아세톤 중 나트륨 퍼클로레이트에 용해시킴으로써) 나트륨염으로 전환시킬 수 있다.
실시예 59: cDNA 생산을 위한 PCR
cDNA의 제조를 위한 PCR 절차들을 2x KAPA HIFITM HotStart ReadyMix[제조원: 카파 바이오시스템스(Kapa Biosystems), 매사츄세츠주 워번 소재]를 사용하여 수행한다. 당해 시스템은 2x KAPA ReadyMix 12.5μl; 전방 프라이머(10μM) 0.75μl; 역 프라이머(10 μM) 0.75μl; 주형 cDNA 100ng; 및 25.0μl로 희석된 dH20를 포함한다. 반응 조건들은 95℃에서 5분 동안 및 98℃에서 20초 동안, 이어서, 58℃에서 15초 동안, 이어서, 72℃에서 45초 동안, 이어서, 72℃에서 5분 동안, 이어서, 4℃에서 종결하는 것이다.
본 발명의 역 프라이머는 mRNA에 폴리-A120을 위한 폴리-T120을 혼입한다. 보다 길거나 보다 짧은 폴리-T 트랙트(tract)를 갖는 다른 역 프라이머들을 사용하여 mRNA 중 폴리-A 테일의 길이를 조절할 수 있다.
반응물을 인비트로겐의 PURELINKTM PCR Micro Kit(캘리포니아주 칼스바드 소재)를 사용하여 제조업자의 지침(5㎍ 이하)에 따라 세정하였다. 보다 긴 반응은 용량이 보다 큰 생성물을 사용한 세정을 필요로 할 것이다. 세정에 이어서, cDNA를 NanoDrop을 사용하여 정량화하고, 아가로스 겔 전기영동에 의해 분석하여 cDNA가 예측된 크기임을 확인한다. 이어서, cDNA를 서열 분석을 위해 제공한 후 시험관내 전사 반응을 진행시킨다.
실시예 60. 시험관내 전사(IVT)
시험관내 전사 반응은, 변형된 뉴클레오타이드들 또는 변형된 RNA를 함유하는 mRNA를 생성한다. 도입 뉴클레오타이드 트리포스페이트(NTP) 혼합물은 천연 및 비-천연 NTP들을 사용하여 내부적으로 제조한다.
전형적인 시험관내 전사 반응은 하기를 포함한다:
37℃에서 3 내지 5시간 동안 항온배양한다.
조 IVT 혼합물을 다음날 세정을 위해 4℃에서 밤새 저장할 수 있다. 이어서, 1U의 RNase-불포함 DNase을 사용하여 원래의 주형을 분해한다. 37℃에서 15분의 항온배양 후, mRNA를 Ambion의 MEGACLEARTM 키트(텍사스주 오스틴 소재)를 사용하여 제조업자의 지침에 따라서 정제한다. 당해 키트는 500㎍ 이하의 RNA를 정제할 수 있다. 세정 후, RNA를 NanoDrop을 사용하여 정량화하고 아가로스 겔 전기영동에 의해 분석하여 RNA가 적절한 크기임을, 그리고 RNA의 분해가 일어나지 않았음을 확인한다.
T7 RNA 폴리머라제는, T7 RNA 폴리머라제, T3 RNA 폴리머라제, 및 대안의 프로모터들을 인식하는 돌연변이체 폴리머라제들{예를 들면, 변형된 NTP들을 혼입시킬 수 있는 신규 폴리머라제들 및 또한 류(Liu)의 문헌[참조: Esvelt et al.(Nature(2011) 472(7344):499-503 및 미국 공보 제20110177495호], 2'-O-메틸 RNA를 전사시키기 위한 T7 RNA 폴리머라제 변이체를 기술하는 엘링톤(Ellington)의 문헌[참조: Chelliserrykattil and Ellington, Nature Biotechnology (2004) 22(9):1155-1160] 및 T7 RNA 폴리머라제 이중 돌연변이체를 기술하는 소우사(Sousa)의 문헌[참조: Padilla and Sousa, Nucleic Acids Research (2002) 30(24): e128]에 기재된 폴리머라제들로부터 선택될 수 있지만, 이들에 한정되지 않고; 이들 문헌의 전문은 인용에 의해 본원에 포함된다.
실시예 61. mRNA의 효소적 캡핑
mRNA의 캡핑은 다음과 같이 수행하며, 여기서, 혼합물은 다음을 포함한다: IVT RNA 60㎍ 내지 180㎍ 및 72μl 이하의 dH20. 혼합물을 65℃에서 5분 동안 항온배양하여 RNA를 변성시킨 후, 빙상으로 즉시 이동시킨다.
이어서, 프로토콜은, 10x 캡핑 완충액(0.5M 트리스-HCl(pH 8.0), 60mM KCl, 12.5mM MgCl2)(10.0μl); 20mM GTP(5.0μl); 20mM S-아데노실 메티오닌(2.5μl); RNase 억제제(100U); 2'-O-메틸트랜스퍼라제(400U); 백시니아 캡핑 효소(구아닐릴 트랜스퍼라제)(40U); dH20(28μl 이하)의 혼합; 및 60㎍의 RNA의 경우 37℃에서 30분 동안 또는 180㎍의 RNA의 경우 2시간 이하의 항온배양을 포함한다.
이어서, mRNA를 Ambion의 MEGACLEARTM 키트(텍사스주 오스틴 소재)를 사용하여 제조업자의 지침에 따라서 정제한다. 세정 후, RNA를 NANODROPTM[제조원: 써모피셔(ThermoFisher), 매사츄세츠주 왈탐 소재]을 사용하여 정제하고, 아가로스 겔 전기영동으로 분석하여 RNA가 적절한 크기임을, 그리고 RNA의 분해가 일어나지 않았음을 확인한다. 또한, RNA 생성물을 역-전사-PCR에 이동시켜 서열분석함으로써 서열분석용 cDNA를 생성할 수 있다.
실시예 62. 폴리A 테일링 반응
cDNA 중 폴리-T의 부재 하에, 폴리-A 테일링 반응은 최종 생성물의 세정 전에 수행하여야 한다. 이는 캡핑된 IVT RNA(100μl); RNase 억제제 (20U); 10x 테일링 완충액(0.5M 트리스-HCl(pH 8.0), 2.5M NaCl, 100mM MgCl2)(12.0μl); 20mM ATP(6.0μl); 폴리-A 폴리머라제(20U); 123.5μl 이하의 dH20의 혼합 및 37℃에서 30분 동안 항온배양으로 수행한다. 폴리-A 테일이 전사체 내에 이미 존재하는 경우, 테일링 반응을 생략하고 직접 Ambion의 MEGACLEARTM 키트(텍사스주 오스틴 소재)(500㎍ 이하)로 진행할 수 있다. 폴리-A 폴리머라제는 바람직하게는 효모 내에서 발현된 재조합체 효소이다.
본원에서 수행되고 기술된 연구들의 경우, 폴리-A 테일은 IVT 주형에 암호화되어 길이가 160인 뉴클레오타이드들을 포함한다. 그러나, 폴리-A 테일링 반응의 진행성 또는 통합성은 항상 정확하게 160개 뉴클레오타이드들을 생성하지는 않는다. 따라서, 대략 160개 뉴클레오타이드들, 예를 들면, 약 150 내지 165, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164 또는 165개의 폴리-A 테일들이 본 발명의 범위 내이다.
실시예
63. 단백질 발현을 위한 스크리닝 방법
A. 전자분무 이온화
대상체에게 투여된 변형된 RNA에 의해 암호화된 단백질들을 함유할 수 있는 생물학적 샘플들을 제조하여 1, 2, 3 또는 4개의 질량 분석기들을 사용하여 전자분무 이온화(ESI)용 제조업자 프로토콜에 따라 분석한다. 또한, 생물학적 샘플을 탄뎀(tandem) ESI 질량 분광분석법 시스템을 사용하여 분석할 수 있다.
단백질 단편들, 또는 전체 단백질들의 패턴들을, 제공된 단백질에 대해 공지된 대조군들과 비교하고 동일성을 비교에 의해 측정한다.
B. 매트릭스-보조된 레이저 탈착/이온화
대상체에게 투여된 변형된 RNA에 의해 암호화된 단백질들을 함유할 수 있는 생물학적 샘플을 제조하여 매트릭스-보조된 레이저 탈착/이온화(MALDI)를 위한 제조업자 프로토콜에 따라 분석한다.
단백질 단편들, 또는 전체 단백질들의 패턴들은, 제공된 단백질에 대한 공지된 대조군들과 비교하고 동일성을 비교에 의해 측정한다.
C. 액체 크로마토그래피-질량 분광분석법-질량 분광분석법
변형된 RNA에 의해 암호화된 단백질들을 함유할 수 있는 생물학적 샘플을 트립신 효소로 처리하여 이들 내에 함유된 단백질들을 분해할 수 있다. 수득된 펩타이드를 액체 크로마토그래피-질량 분광분석법-질량 분광분석법(LC/MS/MS)으로 분석한다. 펩타이드를 질량 분광분석계에서 단편화하여 컴퓨터 알고리즘을 통해 단백질 서열 데이터베이스에 매칭될 수 있는 진단 패턴을 수득한다. 분해된 샘플을 희석하여 1ng 이하의 출발 물질을 제공된 단백질에 대해 달성할 수 있다. 단순한 완충액 배경(예를 들면, 물 또는 휘발성 염들)을 함유하는 생물학적 샘플들을 용액 내 분해를 지시할 수 있으며; 보다 복잡한 배경들(예를 들면, 세제, 비-휘발성 염들, 글리세롤)은 샘플 분석을 촉진시키기 위한 추가의 세정을 필요로 한다.
단백질 단편들, 또는 전체 단백질들의 패턴을, 제공된 단백질에 대한 공지된 대조군들과 비교하고 동일성을 비교에 의해 측정한다.
실시예 64. 사이토카인 연구: PBMC
A. PBMC 단리 및 배양
2명의 공여자들로부터의 50 ml의 사람 혈액을 나트륨 헤파린 튜브들 속의Research Blood Components(로트 KP30928 및 KP30931)로부터 제공받았다. 각각의 공여자에 대해, 혈액을 혼주시키고 DPBS(SAFC Bioscience 59331C, 로트 071M8408)를 사용하여 70 mL로 희석시키고 2개의 50mL 원뿔형 튜브들에 균일하게 나누었다. 10ml의 피콜 파크(Ficoll Paque)(GE Healthcare 17-5442-03, 로트 10074400)를 혈액층 아래에 균일하게 분배하였다. 튜브들을 2000rpm에서 30분 동안 낮은 가속 및 브레이킹(braking)으로 원심분리하였다. 튜브들을 제거하고 버피 코트(buffy coat) PBMC 층들을 신선한 50 mL 원뿔형 튜브에 이동시키고 DPBS로 세척하였다. 튜브들을 1450rpm으로 10분 동안 원심분리하였다.
상청액을 흡인하고 PBMC 펠렛들을 재현탁시키고 50 ml의 DPBS 속에서 세척하였다. 당해 튜브들을 1250rpm으로 10분 동안 원심분리하였다. 당해 세척 단계를 반복하고, PBMC 펠렛들을 19 ml의 Optimem I(Gibco 11058, 로트 1072088)에 재현탁하여 계수하였다. 세포 현탁액을 3.0 x 106개 세포들/mL의 생 세포들의 농도로 조절하였다.
이어서, 이들 세포들을 공여자당 5개의 96 웰 조직 배양물로 처리된 환저 플레이트들(Costar 3799) 상에 웰당 50μL로 플레이팅하였다. 30분내에, 형질감염 혼합물들을 각각의 웰에 웰당 50μL의 용적으로 가하였다. 형질감염 후 4시간째에, 배지에 10μL의 소 태아 혈청(Gibco 10082, 로트 1012368)을 보충하였다.
B. 형질감염 제제
사람 G-CSF을 암호화하는 변형된 mRNA(서열번호 1에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리A 테일은 서열에 나타나 있지 않다; 5' 캡, 캡 1) [(1) 천연의 NTP, (2) 5-메틸 사이티딘 및 슈도우리딘을 사용한 100% 치환, 또는 (3) 5-메틸 사이티딘 및 N1-메틸 슈도우리딘을 사용한 100% 치환; 루시퍼라제(서열번호 2에 나타낸 IVT cDNA 서열; 서열번호 3에 나타낸 mRNA 서열, 대략 160개 뉴클레오타이드들의 폴리 A 테일은 서열 내에 나타나 있지 않음, 5' 캡, 캡 1, 각각의 사이토신에서 5-메틸사이토신으로 완전하게 변형됨, 및 각각의 우리딘 부위에서의 슈도우리딘 대체)를 암호화하는 mRNA를 함유][(1) 천연 NTP 또는 (2) 5-메틸 사이티딘 및 슈도우리딘을 사용한 100% 치환) 및 TLR 효능제 R848(Invivogen tlrl-r848)를 함유]을 2500μL의 Optimem I의 최종 용적으로 38.4 ng/μL로 희석하였다.
별도로, 110μL의 Lipofectamine 2000(Invitrogen 11668-027, 로트 1070962)을 6.76mL Optimem I으로 희석시켰다. 96 웰 플레이트에서 135μL의 각각의 mRNA, 양성 대조군(R-848) 또는 음성 대조군(Optimem I)의 9개 분취량들을 135μL의 희석된 리포펙타민 2000에 가하였다. 형질감염될 물질을 함유하는 플레이트를 20분 동안 항온배양하였다. 이어서, 형질감염 혼합물들을 각각의 사람 PBMC 플레이트들에 웰당 50μL로 이동시켰다. 이어서, 플레이트들을 37℃에서 항온배양하였다. 2, 4, 8, 20, 및 44시간째에, 각각의 플레이트를 항온배양기로부터 제거하였고, 상청액들을 동결시켰다.
마지막 플레이트를 제거한 후, 상청액들을 사람 G-CSF ELISA 키트(Invitrogen KHC2032) 및 사람 IFN-알파 ELISA 키트(Thermo Scientific 41105-2)를 사용하여 분석하였다. 각각의 조건을 2회 수행하였다.
C. 단백질 및 선천적 면역 반응 분석
암호화된 단백질을 생산하는 변형되지 않은 mRNA 및 변형된 mRNA의 능력을, 인터페론-알파 생산에 의해 측정된 것으로서 선천적 면역 인식을 촉발하는 mRNA의 능력으로서 시간에 걸쳐 평가(G-CSF 생산)하였다. 시험관내 PBMC 배양물들의 사용은 올리고뉴클레오타이드들의 면역자극성 잠재능을 측정하기 위한 허용된 방법이다(참조: Robbins et al., Oligonucleotides 2009 19:89-102).
결과들은 각각의 ELISA 플레이트의 표준 곡선에 대해 4개의 매개변수 산정 곡선 피트(logistic curve fit)를 사용하여 보간하였다. 표 4 및 표 5에, 특이적인 ELISA에 측정된 것으로서 시간에 따른 G-CSF, 인터페론-알파(IFN-알파) 및 종양 괴사 인자 알파(TNF-알파) 생산에 대한 3명의 별도의 PBMC 공여자로부터의 평균을 나타낸다.
G-CSF ELISA에서, 리포펙타민 2000(LF2000) 처리되지 않은 조건으로부터의 배경 신호를 각각의 시점에서 감하였다. 데이터는, 사람 말초 혈액 단핵에 의한 사람 G-CSF 단백질의 특이적인 생산이 천연의 NTP들, 5-메틸 사이티딘 및 슈도우리딘을 사용한 100% 치환, 또는 5-메틸 사이티딘 및 N1-메틸 슈도우리딘을 사용한 100% 치환을 함유하는 G-CSF mRNA로 관찰됨을 입증하였다. G-CSF의 생산은 5-메틸 사이티딘 및 슈도우리딘 변형된 mRNA에 비해 5-메틸 사이티딘 및 N1-메틸 슈도우리딘 변형된 mRNA의 사용을 통해 유의적으로 증가하였다.
선천적 면역 인식과 관련하여, 변형된 mRNA 화학물질들이 IFN-알파 및 TNF-알파 생산을 양성 대조군들(R848, p(I)p(C))과 비교하여 크게 방지하지만, 유의적인 차이들이 화학물질들 사이에서 존재하였다. 5-메틸 사이티딘 및 슈도우리딘 변형된 mRNA는 낮지만 검출가능한 수준의 IFN-알파 및 TNF-알파 생산을 초래하고, 한편, 5-메틸 사이티딘 및 N1-메틸 슈도우리딘 변형된 mRNA는 검출가능한 IFN-알파 및 TNF-알파 생산을 초래하지 않았다.
결과적으로, 선천적 면역 반응의 활성화의 하나 이상의 사이토카인 마커를 관찰하기 위한 필요성 외에, 변형들의 조합들이 상이한 수준들의 세포 반응(단백질 생산 및 면역 활성화)를 제공함이 놀랍게도 밝혀졌다. 당해 연구에서, 변형, N1-메틸 슈도우리딘은 다른 것들로 실험된 5-메틸사이티딘/슈도우리딘의 표준 조합보다 추가된 보호를 전달하여 2배로 많은 단백질 및 면역 활성화(TNF-알파)에 있어서 거의 150배 감소를 생성함이 밝혀졌다.
PBMC는 선천적 면역 RNA 인식 센서들의 큰 배열을 함유하며 또한 단백질 번역을 할 수 있다는 점에서, 이는 이들 2개 경로들과의 상호의존성을 시험하기 위한 유용한 시스템을 제공한다. mRNA 번역은 이러한 선천적 면역 경로들의 활성화에 의해 부정적으로 영향받을 수 있음이 알려져 있다[참조: Kariko et al. Immunity (2005) 23:165-175; Warren et al. Cell Stem Cell (2010) 7:618-630]. 시험관내 검정 시스템에서와 같은 PBMC를 사용하여 번역(이 경우 G-CSF 단백질 생산) 및 사이토카인 생산(이 경우 IFN-알파 및 TNF-알파 단백질 생산으로 예시됨) 사이의 관계를 확립할 수 있다. 보다 우수한 단백질 생산은 선천적 면역 활성화 경로의 보다 낮은 유도와 상호관련되어 있으며, 신규한 화학물질들은 당해 비를 기준으로 양호하게 판단될 수 있다(표 6).
당해 연구에서, 2개의 화학적 변형들, 슈도우리딘 및 N1-메틸 슈도우리딘 둘다와 5-메틸 사이토신에 대한 PC 비는 사이토카인 IFN-알파에 대한 9944/1=9944와 비교하여 4742/141=34이었다. 사이토카인, TNF-알파의 경우, 2개의 화학물질들은 각각 153 및 1243의 PC 비들을 가졌으며, 이는 각각 사이토카인, N1-메틸슈도우리딘이 우수한 변형임을 제안한다. 표 4 및 표 5에서 "NT"는 시험되지 않음을 의미한다.
실시예
65. 변형된
mRNA
의 화학적 변형 범위
이들에 한정되지 않지만 5-메틸사이토신 및 슈도우리딘과 같은 화학적 변형들, 변형된 뉴클레오사이드들은, 선천적 면역 반응을 저하시키며 포유동물 세포들내에서 RNA의 발현을 증가시키는 것으로 밝혀졌다. 놀랍게도 및 이미 알려져 있지 않은, 이들 화학적 변형들에 의해 나타난 당해 효과들은, 특정 뉴클레오타이드의 화학적 변형의 양이 100% 미만인 경우 적정될 수 있다. 앞서, 화학적 변형의 이점은 변형된 뉴클레오사이드의 완전한 대체 미만을 사용하여 유도시킬 수 있는 것으로 여겨졌으며, 발표된 보고서들은, 변형된 뉴클레오사이드를 사용한 치환 수준이 50% 미만일 때까지 이점의 손실이 없음을 제안한다[참조: Kariko et al., Immunity (2005) 23:165-175].
그러나, 본 발명에 이르러, 화학적 변형의 이점들이 화학적 변형의 정도와 직접 상호관련되며 면역 반응의 단일 척도 이상의 관점에서 고려되어야 함이 밝혀졌다. 이러한 이점들은 향상된 단백질 생산 또는 mRNA 번역 및 사이토카인 프로파일들 및 면역 반응 촉발인자들의 계량법들에 의해 측정된 것으로서 선천적 면역 반응의 감소된 자극 또는 자극 회피를 포함한다.
향상된 mRNA 번역 및 감소된 또는 결핍된 선천적 면역 자극은, 변형된 뉴클레오사이드를 사용한 100% 치환으로 관찰된다. 보다 낮은 퍼센트들의 치환은 mRNA 번역을 거의 생성하지 않으며, 보다 더 선천적 면역 자극을 생성하며, 변형되지 않은 mRNA는 최저의 번역 및 최대의 선천적 면역 자극을 나타낸다.
시험관내
PBMC
연구들: 변형 퍼센트
5-메틸사이토신(5mC) 및 슈도우리딘(pseudoU)으로 변형된 또는 변형되지 않은 G-CSF mRNA로 변형된 480 ng의 G-CSF mRNA를 0.4 μL의 리포펙타민 2000을 사용하여 3명의 정상 혈액 공여자들(D1, D2, 및 D3)로부터의 말초 혈액 단핵 세포들(PBMC)로 형질감염시켰다. G-CSF mRNA(서열 1; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다 5'캡, 캡 1)를 5mC 및 pseudo로 변형시키거나(100% 변형), 5mC 및 pseudo로 변형시키지 않거나(0% 변형) 또는 5mC 및 pseudoU로 부분 변형시켜 mRNA가 75% 변형, 50% 변형 또는 25% 변형을 함유할 수 있도록 하였다. 루시퍼라제(서열 3에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1; 완전히 변형된 5meC 및 pseudoU)를 G-CSF 발현에 대해 분석하였다. 리포펙타민2000의 TNF-알파 및 IFN-알파 대조군 샘플들의 경우, LPS, R-848, 루시퍼라제(서열 3에 나타낸 mRNA; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1; 완전히 변형된 5mC 및 pseudo), 및 P(I)P(C)를 또한 분석하였다. 상청액을 수거하고 형질감염 후 22시간 째에 ELISA로 이동시켜 단백질 발현을 측정하였다. G-CSF의 발현은 표 7에 나타내며 IFN-알파 및 TNF-알파의 발현은 표 8에 나타낸다. IFN-알파 및 TNF-알파의 발현은 G-CSF mRNA의 형질감염으로부터의 부차적인 효과일 수 있다. 표 7, 8 및 도 10은, G-CSF, 인터페론 알파(IFN-알파) 및 종양 괴사 인자-알파(TNF-알파)의 화학적 변형의 양이, mRNA가 완전히 변형되지 않은 경우 적정될 수 있으며, 적정가능한 경향은 각각의 표적에 대해 동일하지 않음을 나타낸다.
위에서 나타낸 바와 같이, 시험관내 검정 시스템에서 PBMC을 사용하여 번역(이 경우 G-CSF 단백질 생산)과 사이토카인 생산(이 경우 IFN-알파 단백질 생산으로 예시) 사이에 상관관계를 확립하는 것이 가능하다. 보다 우수한 단백질 생산은 선천적 면역 활성화 경로의 보다 낮은 유도와 관련되며, 화학물질의 변형 퍼센트는 당해 비를 기준으로 양호하게 판단할 수 있다(표 9). 표 7 및 8로부터 계산되고 표 9에 나타낸 바와 같이, 5-메틸사이티딘 및 슈도우리딘을 사용한 완전한 변형은 어떠한 변형(천연의 G-CSF mRNA)의 부재하에 훨씬 더 우수한 비의 단백질/사이토카인생산을 나타낸다(IFN-알파의 경우 100배 및 TNF-알파의 경우 27배). 부분적인 변형은 증가되게 적은 변형이 낮은 단백질/사이토카인 비를 생성하는 선형 관계를 나타낸다.
실시예 66. PBMC에서 형질감염된 변형된 RNA
5-메틸사이토신(5mC) 및 슈도우리딘(pseudoU)으로 변형된 500ng의 G-CSF mRNA 또는 변형되지 않은 G-CSF mRNA를 0.4 μL의 리포펙타민 2000을 사용하여 3명의 정상 혈액 공여자들(D1, D2, 및 D3)로부터의 말초 혈액 단핵 세포들(PBMC)로 형질감염시켰다. G-CSF mRNA(서열 1; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)를 5mC 및 pseudo로 변형시키거나(100% 변형), 5mC 및 pseudo로 변형시키지 않거나(0% 변형) 또는 5mC 및 pseudoU로 부분 변형시켜 mRNA가 50% 변형, 25% 변형, 10% 변형, 5% 변형, 1% 변형 또는 0.1% 변형을 함유할 수 있도록 하였다. mCherry의 대조군 샘플(서열 6에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1; 완전히 변형된 5meC 및 슈도우리딘) 및 5-메틸사이토신 및 슈도우리딘으로 완전히 변형시킨 G-CSG(대조군 G-CSF)를 G-CSF 발현에 대해 분석하였다. 리포펙타민 2000의 종양-괴사 인자(TNF-알파) 및 인터페론-알파(IFN-알파) 대조군 샘플들의 경우, LPS, R-848, 루시퍼라제(서열 3에 나타낸 mRNA 서열 3; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1; 완전히 변형된 5mC 및 pseudo), 및 P(I)P(C)를 또한 분석하였다. 상청액을 형질감염 후 6시간 및 18시간째에 수거하고 ELISA로 이동시켜 단백질 발현을 측정하였다. 공여자 1에 대한 G-CSF, IFN-알파, 및 TNF-알파의 발현은 표 10에 나타내며, 공여자 2는 표 11에 나타내고 공여자 3은 표 12에 나타낸다.
5-메틸사이티딘 및 슈도우리딘을 사용한 완전한 100% 변형은 대부분 단백질 번역(G-CSF)을 생성하였으며 최저량의 사이토카인이 모든 3명의 사람 PBMC 공여자들에 따라 생산되었다. 변형의 감소하는 양들은 보다 많은 사이토카인 생산(IFN-알파 및 TNF-알파)을 생성하므로, 사이토카인들을 감소시키고 단백질 번역을 개선시키기 위한 완전한 변형의 중요성을 추가로 강조한다(본원에서 G-CSF 생산으로 입증됨).
실시예 67. 변형들의 microAMES 역 돌연변이 스크린(Microames Reverse Mutation Screen)
배경 및 방법들
microAMES 스크린은 완전한 Ames 예비항온배양 검정의 버젼이다. 이는 프레임쉬프트(frameshift) 및 염기-쌍 치환 변형들 둘다를 4개의 살모넬라(Salmonella) 테스터 균주들(TA97a, TA98, TA100 및 TA1535) 및 하나의 에스케리키아 콜라이(Escherichia coli) 균주(WP2 uvrA pKM101)를 사용하여 검출한다. 균주들 TA97a 및 TA98은 프레임쉬프트 돌연변이들을 검출하며, TA100, TA1535 및 WP2 uvrA pKM101은 염기-쌍 치환 돌연변이들을 검출한다. 이러한 규모가 축소된(scaled-down ) Ames 시험은 최소 화합물을 사용하며 대사 활성화(S9 분획)의 존재 및 부재하에 수행되고 다중웰 플레이트들을 사용한다. 당해 시험은 시험 화합물들의 돌연변이유발원성 잠재능을 검출하는 미생물 검정이다.
5-메틸사이티딘, 슈도우리딘 또는 N'-메틸슈도우리딘 시험 제품에 대한 microAMES 스크린을 균주들 TA97a, TA98, TA100, TA1535 및 WP2 uvrA pKM101을 사용하여 대사 활성화 시스템(랫트 간 S9 마이크로솜 분획으로 유도된 AROCLOR TM 1254)의 존재 또는 부재하에 0.25, 2.5, 12.5, 25, 75, 및 250㎍/웰에서 2회 시험하였다. 양성 대조군 화합물들을 4개의 상이한 농도들에서 사용하여 검정 시스템이 공지된 돌연변이유발원성 화합물들에 대해 민감하도록 보증하였다. DMSO는 비히클 대조군으로서 사용하였다. 양성 및 비히클 대조군들은 예측된 결과를 생성하였으며, 이는 microAMES 스크린이 돌연변이유발원들에 대해 충분히 민감함을 입증한다.
결과들
5-메틸사이토신의 경우, 침전물들은 대사 활성화의 존재 또는 부재하에 어떠한 테스터 균주로 관측되지 않았다. 세포독성[배경 론(background lawn)에서의 감소 및/또는 복귀돌연변이체(revertant)들의 수]은 대사 활성화의 존재 또는 부재하에서 어떠한 균주에서도 관측되지 않았다. 대사 활성화의 존재 또는 부재하에서 어떠한 균주에서도 비히클 대조군과 비교하여 복귀돌연변이체 콜로니들의 수에 있어서 증가는 없었다. 따라서, 5-메틸사이티딘은 microAMES 스크린 상태하에 ㄱ규균주들 TA97a, TA98, TA100, TA1535 및 WP2 uvrA pKM101에서 250㎍/웰까지 돌연변이성이 아니었다.
침전물들은 대사 활성화의 존재 또는 부재하에 어떠한 테스터 균주로 관측되지 않았다. 세포독성(복귀돌연변이체들의 수에 있어서의 감소)은 대사 활성화의 부재하에서 균주 TA100으로 관찰되었다. 세포독성(배경 론에서의 감소 및/또는 복귀돌연변이체들의 수)은 대사 활성화의 존재 또는 부재하에 어떠한 다른 균주에서도 관측되지 않았다. 대사 활성화의 존재 또는 부재하에서 어떠한 균주에서도 비히클 대조군과 비교하여 복귀돌연변이체 콜로니들의 수에 있어서 증가는 없었다. 따라서, 슈도우리딘은 대사 활성화의 부재하에 균주 TA100 속에서 75㎍/웰까지 및 microAMES 스크린 상태들하에 대사 활성화의 부재하에 균주들 TA97a, TA98, TA100, TA1535 and WP2 uvrA pKM101에서 250㎍/웰까지 돌연변이성이 아니었다.
변형의 경우, N1-메틸슈도우리딘 침전물들은 대사 활성화의 존재 또는 부재하에서 어떠한 테스터 균주로도 관측되지 않았다. 세포독성(배경 론에서의 감소 및/또는 복귀돌연변이체들의 수)은 대사 활성화의 존재 또는 부재하에서 어떠한 균주에서도 관측되지 않았다. 대사 활성화의 존재 또는 부재하에서 어떠한 균주에서도 비히클 대조군과 비교하여 복귀돌연변이체 콜로니들의 수에 있어서 증가는 없었다. N1-메틸슈도우리딘은 당해 microAMES의 스크린 상태들하에 대사 활성화의 존재 또는 부재하에서 균주들 TA97a, TA98, TA100, TA1535 및 WP2 uvrA pKM101에서 250㎍/웰까지 돌연변이성이 아니었다.
5 메틸 사이티딘, 슈도우리딘, 및 N1-메틸슈도우리딘의 당해 microAMES 시험에서의 비교는 이들이 일반적으로 돌연변이유발원성이 아님을 나타낸다. 그러나, 특히, 슈도우리딘과 N1-메틸슈도우리딘 사이의 차이에 주목하며, 여기서, 슈도우리딘은 하나의 세균 균주에서 세포독성 반응을 나타내지 않았고, 여기서, N1-메틸슈도우리딘은 그렇지 않았다. 이들 microAMES 시험들은 화합물 안전성의 전-임상 평가의 일부로서 통상적으로 사용되며 N1-메틸슈도우리딘과 슈도우리딘 사이의 중요한 차이를 강조한다.
실시예 68. 뉴클레오사이드 트리포스페이트들(NTPs)의 독성
천연 및 변형된 뉴클레오사이드 트리포스페이트들(NTPs) 단독 또는 다른 염기들과의 조합의 세포독성을 사람 배아 신장 293(HEK293) 세포들 속에서 형질감염 시약의 부재하에 분석하였다. HEK293 세포들을 96-웰 플레이트들 위에 웰당 0.75μL의 RNAiMAX TM(제조원: 인비트로겐, 캘리포니아주 칼스바드 소재)를 갖는 웰당 30,000개 세포들의 밀도에서 100μL의 총 웰 용적으로 식종하였다. 표 12에 요약한 10 μL의 NTPs를 10 μL의 지질 희석액과 합하고 30분 동안 항온배양하여 복합체를 형성시킨 후 80 μL의 HEK293 세포 현탁액을 NTP 복합체에 가하였다.
천연 및 변형된 NTPs를 2.1 nM, 21 nM, 210 nM, 2.1 μM, 21 μM, 210 μM 또는 2.1 mM의 농도에서 형질감염시켰다. 조합물 중 NTPs를 8.4 nM, 84 nM, 840 nM, 8.4 μM, 84 μM, 840 μM 및 8.4 mM의 NTPs의 총 농도에서 형질감염시켰다. 대조군으로서 변형된 G-CSF mRNA(서열 1; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1; 완전히 변형된 5-메틸사이토신 및 슈도우리딘)를 HEK293 세포들 속에서 8.4 nM의 농도로 형질감염시켰다. NTP들 및 변형된 G-CSF mRNA의 세포독성을 HEK293 세포들의 첨가 후 4, 24, 48 및 72시간째에 CYTO TOX-GLOTM 검정[제조원: 프로메가(Promega), 위스콘신주 매디슨 소재]을 사용하여 제조업자의 프로토콜에 따라 검정하였으며, 단 플레이트들을 와동(shaking)시키는 대신 세포들을 분해시키기 위해 피펫팅(pippeting)을 사용하여 검정하였다.
표 13 및 14는 시험한 각각의 NTPs, NTP 조합들 및 대조군들에 대한 생존하는 세포들의 존재를 나타낸다. 처리되지 않은 세포들과 비교하여 개개의 NTPs를 사용하는 경우 독성은 관찰되지 않았다. 이들 데이터는, 5-메틸사이티딘, 슈도우리딘, 및 N1-메틸슈도우리딘을 포함하는 개개의 NTPs를 포유동물 세포들내로 도입시키는 것은 변형된 mRNA로서 도입되는 경우 유효 용량의 1,000,000배의 용량에서 독성이 아님을 입증한다.
실시예 69. BJ 섬유아세포들에서 선천적 면역 반응 연구
사람 원시 포피 섬유아세포들(BJ 섬유아세포들)을 아메리칸 타입 컬쳐 컬렉션[American Type Culture Collection(ATCC)(제품 번호 CRL-2522)에서 입수하여 10% 태아 송아지 혈청이 보충된 이글 최소 필수 배지(Eagle's Minimum Essential Medium(ATCC, 제품 번호 30-2003)] 속에서 37℃로 5% CO2하에 성장시켰다. BJ 섬유아세포들을 24-웰 플레이트 위에 웰당 300,000 세포들의 밀도로 0.5 ml의 배양 배지 속에서 식종하였다. 5-메틸사이토신 및 슈도우리딘(Gen1)으로 완전히 변형되거나 또는 캡 0, 캡 1을 갖거나 또는 캡을 갖지 않는 5-메틸사이토신 및 N1-메틸슈도우리딘(Gen2)으로 완전히 변형된 250 ng의 변형된 G-CSF mRNA(서열 1에 나타낸 mRNA 서열 1; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)를 리포펙타민 2000(제조원: 인비트로겐, 제품 번호 11668-019)으로 제조업자의 프로토콜에 따라 형질감염시켰다. 폴리 I:C(PIC), 리포펙타민 2000(Lipo), 천연의 루시퍼라제 mRNA(서열 3에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1) 및 천연의 G-CSF mRNA를 또한 형질감염시켰다. 세포들을 18시간 후 수거하고, 총 RNA를 분리하고 DNASE®을 RNeasy 마이크로 키트(제품 번호74004)를 사용하여 제조업자의 프로토콜에 따라 처리하였다. 100 ng의 총 RNA를 cDNA 합성에 고 용량(capacity) cDNA 역전사 키트(제품 번호4368814)를 사용하여 제조업자의 프로토콜에 따라 사용하였다. 이후에, cDNA를 선천적 면역 반응 유전자들의 발현에 대해 바이오라드(Biorad) CFX 384 장치 속에서 SybrGreen을 사용하는 정량적 실시간 PCR 의해 제조업자의 프로토콜에 따라 분석하였다. 표 15는 하우스-키핑 유전자(house-keeping gene) HPRT(하이포크산틴 포스포리보실트랜스퍼라제)에 대해 상대적인 선천적 면역 반응 전사체들의 발현 수준을 나타내며 HPRT에 대해 배-유도(fold-induction)로 나타낸다. 표에서, 표준 계량법들의 패널은 다음을 포함한다: RIG-I은 레티노산 유도성 유전자 1이고, IL6은 인터루킨-6이며, OAS-1은 올리도아데닐레이트 신타제 1이고, IFNb는 인터페론-베타이며, AIM2는 흑색종-2에서 부재하며, IFIT-1은 테트라트리코펩타이드 반복체들 1을 지닌 인터페론-유도된 단백질이고, PKR는 단백질 키나제 R이며, TNFα는 종양 괴사 인자 알파이고 IFNα는 인터페론 알파이다.
실시예 70. 선천적 면역 반응의 시험관내 검출
생체내 단백질 생산 및 생체내 사이토카인 반응에 있어서 mRNA의 상이한 화학적 변형의 중요성을 구별하기 위한 노력에서, 암컷 BALB/C 마우스들(n=5)에게 표 16에 나타낸 바와 같이, 캡 1의 5'캡을 지닌 G-CSF mRNA(GCSF mRNA unmod)(서열 1에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다), 5-메틸사이토신 및 슈도우리딘(GCSF mRNA 5mc/pU)으로 완전히 변형된 G-CSF mRNA, 5'캡을 지니거나(GCSF mRNA 5mc/N1pU) 또는 지니지 않은(GCSF mRNA 5mc/N1 pU no cap) 5-메틸사이토신 및 N1-메틸슈도우리딘으로 완전히 변형된 G-CSF mRNA, 또는 R848 또는 5% 슈크로즈의 대조군을 근육내 주사한다.
혈액을 투여 후 8시간째에 수집한다. ELISA를 사용하여 G-CSF, TNF-알파 및 IFN-알파의 단백질 수준들을 ELISA로 측정한다. 투여후 8시간째에, 근육을 주사 부위로부터 수집하고 정량적인 실시간 폴리머라제 쇄 반응(QPCR)을 사용하여 근육내 RIG-I, PKR, AIM-2, IFIT-1, OAS-2, MDA-5, IFN-베타, TNF-알파, IL-6, G-CSF, CD45의 mRNA 수준을 측정한다.
실시예 71. 선천적 면역 반응 연구의 생체내 검출
암컷 BALB/C 마우스들(n=5)에게 표 17에 나타낸 바와 같이, 캡 1의 5'캡을 지닌 G-CSF mRNA(GCSF mRNA unmod)(서열 1에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다), 5-메틸사이토신 및 슈도우리딘으로 완전히 변형된 G-CSF mRNA(GCSF mRNA 5mc/pU), 5'캡을 지닌(GCSF mRNA 5mc/N1pU) 또는 지니지 않은(GCSF mRNA 5mc/N1 pU no cap) 5-메틸사이토신 및 N1-메틸슈도우리딘으로 완전히 변형된 G-CSF mRNA, 또는 R848 또는 5% 슈크로즈의 대조군을 근육내 주사하였다. 혈액을 투여 후 8시간째에 수집하고 ELISA를 사용하여 G-CSF 및 인터페론-알파(IFN-알파)의 단백질 수준들을 ELISA로 측정하여 표 17에 나타낸다.
표 17에 나타낸 바와 같이, 변형되지 않은, 5mc/pU, 및 5mc/N1pU 변형된 G-CSF mRNA는 마우스 혈청 속에서 사람 G-CSF 발현을 생성하였다. 캡핑되지 않은 5mC/N1pU 변형된 G-CSF mRNA는 혈청에서 사람 G-CSF 발현을 나타내지 않았으며, 이는 단백질 번역을 위한 5' 캡을 갖는 것의 중요성을 강조한다.
예측한 바와 같이, 사람 G-CSF 단백질은 R848, 5% 슈크로즈만에서, 및 처리되지 않은 그룹들에서 발현되지 않았다. 중요하게도, 유의적인 차이들이 혈청 속에서 마우스 IFN-알파에 의해 측정된 것으로서 사이토카인 생산에서 관찰되었다. 예측한 바와 같이, 변형되지 않은 G-CSF mRNA는, 생체내 풍부한 사이토카인 반응(R848 양성 대조군보다 훨씬 큼)을 입증하였다. 5mc/pU의 변형된 G-CSF mRNA는 생체내에서 낮지만 검출가능한 사이토카인 반응을 나타낸 반면, 5mc/N1pU 변형된 mRNA는 혈청속에서 검출가능한 IFN-알파를 나타내지 않았다(및 비히클 또는 처리되지 않은 동물들에서와 동일).
또한, 5mc/N1pU의 변형된 mRNA의 반응은, 이것이 캡핑되어 있는지의 여부에 상관없이 동일하였다. 이들 생체내 결과들은 1) 변형되지 않은 mRNA가 풍부한 선천적 면역 반응을 생성하고, 2) 이는 5mc/pU의 변형의 100% 혼입들 통해 감소하지만, 소멸되지는 않고, 3) 5mc/N1pU 변형들의 혼입은 검출가능한 사이토카인 반응을 생성하지 않는다는 결론을 강화한다.
최종적으로, 이들 주사들이 5% 슈크로즈(이는 자체로서는 효과가 없다) 속에 존재한다는 점에서, 이들 결과는 이들 변형들의 면역자극 효능을 정확하게 반영하여야 한다.
당해 데이터로부터 N1pU 변형된 분자들이 보다 많은 단백질을 생산하지만 동시에 IFN-알파 발현에 있어 효과는 거의 없거나 전혀 없음이 명백하다. 캡핑이 이러한 화학적 변형을 위한 단백질 생산에 요구됨은 또한 명백하다. 변형되지 않은 mRNA(PC=9)에 대한 PC 비와 비교한 것으로서 748의 단백질 : 사이토카인의 비는, 당해 화학적 변형이 IFN-알파와 관련된 효과들 또는 생물학적 영향들과 관련된 바와 같이 훨씬 우수함을 의미한다.
실시예 72: 피포플렉스들을 사용한 생체내 전달
A. 사람 G-CSF 변형된 RNA
변형된 사람 G-CSF mRNA(서열 1에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, Cap1) (5-메틸사이토신 및 슈도우리딘(G-CSF)으로 완전히 변형된 G-CSF 또는 5-메틸사이토신 및 N1-메틸-슈도우리딘(G-CSF-N1)으로 완전히 변형된 G-CSF)의 2개의 버젼들 중 하나를 100㎍ 함유하는 제형을 30 용적%의 RNAIMAXTM으로 리포플렉싱(lipoplexing)하고 150 μL로 근육내(I.M.) 및 225μL으로 정맥내(I.V.)로 C57/BL6 마우스들에게 전달하였다.
이들 대조군 그룹들에게 100㎍의 변형된 루시퍼라제 mRNA(서열 2에 나타낸 IVT cDNA 서열; 서열 3에 나타낸 mRNA 서열, 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1, 각각의 사이토신에서 5-메틸사이토신으로 및 각각의 우리딘 부위에서 슈도우리딘 대체로 완전히 변형됨)를 근육내로(Luc-unsp I.M.) 또는 150㎍의 변형된 루시퍼라제 mRNA를 정맥내로(Luc-unsp I.V.) 또는 150 μL의 제형 완충액을 근육내로(완충액 I.M.) 투여하였다. 제형의 투여 후 6시간 째에 혈청을 수집하여 사람 G-CSF ELISA에 의해 마우스 혈청 속에서 사람 G-CSF 단백질의 양을 측정하고 결과들을 표 18에 나타낸다.
이들 결과들은, 5-메틸사이토신/슈도우리딘 및 5-메틸사이토신/N1-메틸슈도우리딘 변형된 사람 G-CSF mRNA 둘 다가 리포플렉스 제형으로 I.V. 또는 I.M. 투여 경로로 전달되는 경우 혈청 속에서 특이적인 사람 G-CSF 단백질 발현을 생성할수 있음을 입증한다.
B. 사람 G-
CSF
변형된
RNA
비교
5-메틸사이토신(5mc) 및 슈도우리딘(Ψ) 변형들을 지닌 30 용적%의 RNAIMAXTM으로 리포플렉싱된 변형된 사람 G-CSF mRNA(G-CSF-Gen1-리포플렉스), 염수 속에 5mc 및 Ψ 변형을 지닌 변형된 사람 G-CSF mRNA (G-CSF-Gen1-염수), 30 용적%의 RNAIMAXTM로 리포플렉싱된 N1-5-메틸사이토신(N1-5mc) 및 Ψ 변형을 지닌 변형된 사람 G-CSF mRNA(G-CSF-Gen2-리포플렉스), 염수 속에 N1-5mc 및 Ψ 변형을 지닌 변형된 사람 G-CSF mRNA(G-CSF-Gen2-염수), 30 용적%의 RNAIMAXTM으로 리포플렉싱된 5mc 및 Ψ 변형을 지닌 변형된 루시퍼라제(Luc-리포플렉스), 또는 염수 속에 5mc 및 Ψ 변형들로 완전히 변형된 루시퍼라제 mRNA(Luc-염수) 100㎍을 함유하는 제형을 근육내(I.M.) 또는 피하(S.C.)로 전달하고 각각의 투여 방법에 대한 대조군 그룹에서 80μL 용량의 제형 완충액(F. 완충액)을 C57/BL6 마우스들에게 제공하였다. 주입 후 13시간 째에, 주사 부위로부터 혈청 및 조직을 각각의 마우스로부터 수집하고 G-CSF ELISA로 분석하여 사람 G-CSF 단백질 수준들을 비교하였다. 근육내 투여 및 피하 투여 결과들로부터 마우스 혈청중 사람 G-CSF 단백질의 결과들을 표 19에 나타낸다.
이들 결과들은, 5-메틸사이토신/슈도우리딘 및 5-메틸사이토신/N1-메틸슈도우리딘 변형된 사람 G-CSF mRNA가 염수 제형 또는 리포플렉스 제형에 상관없이 I.M. 또는 S.C. 투여 경로로 전달되는 경우 혈청속에서 특이적인 사람 G-CSF 단백질 발현을 생성시킬 수 있음을 입증한다. 표 19에 나타낸 바와 같이, 5-메틸사이토신/N1-메틸슈도우리딘 변형된 사람 G-CSF mRNA는 5-메틸사이토신/슈도우리딘 변형된 사람 G-CSF mRNA와 비교하여 일반적으로 증가된 사람 G-CSF 단백질 생산을 입증한다.
실시예 73. 다중-부위 투여: 근육내 및 피하
Gen1 또는 Gen2로서 변형된[5-메틸사이토신(5mc) 및 슈도우리딘(Ψ) 변형, G-CSF-Gen1; 또는 N1-5-메틸사이토신(N1-5mc) 및 Ψ 변형, G-CSF-Gen2]으로서 변형되고 염수 속에 제형화된 사람 G-CSF 변형된 mRNA(서열 1에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)을 마우스들에게 근육내(IM) 또는 피하(SC) 주사로 전달하였다. 1일에 4개 용량들 또는 2x 50㎍(2개 부위들)을 3일 동안(24시간 간격) 수행하였다. 4번째 용량을 혈액 수집 및 CBC 분석 전 6시간째에 투여하였다. 대조군들은 루시퍼라제(서열 2에 나타낸 IVT의 cDNA 서열; 서열 3에 나타낸 mRNA 서열, 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1, 각각의 사이토신에서 5-메틸사이토신으로 완전히 변형되고 각각의 우리딘 부위에서 슈도우리딘 대체됨) 또는 제형 완충액(F.완충액)을 포함하였다. 마우스들을 제1의 mRNA 주사 후 72시간째에(마지막 mRNA 용량 후 6시간째)에 방혈시켜 호중구 수에 있어서 mRNA-암호화된 사람 G-CSF의 효과를 측정하였다. 투여 용법은 수득되는 호중구 수들(수천/μL)에서와 같이 표 20에 나타낸다. 표 20에서, 별표(*)들은 p<0.05에서의 통계적 유의성을 나타낸다.
근육내 투여의 경우, 데이터는 Gen1 G-CSF mRNA의 경우 3일째에 호중구 수에 있어서 상기 대조군보다 4배 증가를 나타내고 Gen2 G-CSF mRNA의 경우 2배 증가를 나타낸다. 피하 투여의 경우, 당해 데이터는 호중구 수에 있어서 상기 대조군보다 2배 증가를 나타낸다.
이들 데이터는, 5-메틸사이티딘/슈도우리딘 및 5-메틸사이티딘/N1-메틸슈도우리딘-변형된 mRNA 둘 다가 혈액 호중구 수들에 있어서 구체적인 증가들로 증명되는 바와 같이, 생물학적으로 활성일 수 있음을 입증한다.
실시예 74. 정맥내 투여
5-메틸사이토신(5mc) 및 슈도우리딘(Ψ) 변형(Gen1)으로 변형되거나; 또는 변형들을 갖지 않고 10% 리포플렉스(RNAIMAXTM) 속에 제형화된 사람 G-CSF 변형된 mRNA(서열 1에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)를 마우스들에게 50㎍의 RNA의 용량 및 100 μL의 용적으로 정맥내(IV) 주사를 통해 0, 2 및 4일째에 전달하였다. 호중구들을 1, 5 및 8일째에 측정하였다. 대조군들은 비-특이적인 포유동물 RNA 또는 제형 완충액 만(F.완충액)을 포함하였다. 마우스들을 1, 5 및 8일째에 방혈시켜 mRNA-암호화된 사람 G-CSF가 호중구 수를 증가시키는 효과를 측정하였다. 용량 용법은 수득되는 호중구 수들에서와 같이 표 21에 나타낸다(수천/μL; K/μL).
정맥내 투여의 경우, 당해 데이터는 G-CSF 변형된 mRNA를 사용하는 경우 5일째에 호중구 수에 있어서 상기 대조군의 4 내지 5배 증가를 나타내지만 변형되지 않은 G-CSF mRNA 또는 비-특이적인 대조군들의 경우에는 그렇지 않았다. 혈액 수는 최종 주사 후 4일째에 기본선으로 복귀하였다. 백혈구 집단들에 있어서 다른 변화들은 관찰되지 않았다.
표 21에서, 별표(*)는 완충액과 비교하여 p<0.001에서 통계적인 유의성을 나타낸다.
이들 데이터는, 리포플렉스-제형화된 5-메틸사이티딘/슈도우리딘-변형된 mRNA가 혈액 호중구 수들에 있어서의 구체적인 증가들로 입증되는 바와 같이, 정맥내 투여 경로를 통해 전달되는 경우, 생물학적으로 활성일 수 있음을 입증한다. 다른 세포 소세트들은 유의적으로 변경되지 않았다. 유사하게 투여된 변형되지 않은 G-CSF mRNA는 호중구 수들에 있어서 약리학적 효과를 나타내지 않았다.
실시예
75: 투여 경로들
연구들을 수행하여 상이한 투여 경로들을 사용한 분할 용량을 시험하였다. 1회 시점에서 다중 피하 또는 근육내 주사 부위들을 활용하는 연구들을 설계하고 수행하여 변형된 mRNA 약물 노출을 증가시키고 단백질 생산을 개선시키기 위한 방법들을 조사하였다. 발현된 단백질 생성물의 검출 외에, 단백질들의 생리학적 기능의 평가는 또한 시험한 동물로부터의 샘플들의 분석을 통해 측정하였다.
놀랍게도, 변형된 mRNA의 분할 용량은 단일 단위 용량 또는 다중-용량 개략도들에 의해 생산된 것들보다도 더 큰 단백질 생산 및 표현형적 반응들을 생성함이 측정되었다.
분할 용량 실험의 설계는 단지 완충액 속에서 투여되거나 30% 리포플렉스(RNAIMAXTM)와 함께 제형화된 사람 에리트로포이에틴(EPO) 변형된 mRNA(서열 5에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1) 또는 루시퍼라제 변형된 mRNA(서열 3에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)을 사용함을 포함하였다. 투여 비히클(완충액)은 150mM NaCl, 2 mM CaCl2, 2 mM Na+-포스페이트(1.4mM 일염기성 나트륨 포스페이트; 0.6mM 이염기성 나트륨 포스페이트), 및 0.5 mM EDTA, pH 6.5로 이루어진다. pH는 수산화나트륨을 사용하여 조절하였으며 최종 용액을 멸균기 여과하였다. mRNA는 각각의 사이토신에서 5메틸C(5meC)로 변형되고 각각의 우리딘 부위에서 슈도우리딘 대체되었다.
그룹당 4마리의 마우스들에게 표 22에 요약한 투약 챠트에 의해 근육내(I.M.), 정맥내(I.V.) 또는 피하내(S.C.) 투여하였다. 혈청을 13시간 후 모든 마우스들로부터 수집하고, 조직은 근육내 및 피하 그룹으로부터의 주사 부위에서 수집하였으며 비장, 간 및 신장들을 정맥내 그룹으로부터 수집하였다. 근육내 그룹 및 피하 그룹으로부터의 결과들을 표 23에 나타낸다.
실시예 76: 다양한 지질 비들을 사용한 생체내 전달
변형된 mRNA를 C57/BL6 마우스들에게 전달하여 다양한 지질 비들 및 수득되는 단백질 발현을 평가하였다. 10%, 30% 또는 50% RNAIMAXTM로 리포플렉싱된 변형된 사람 EPO mRNA(서열 5에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1; 5-메틸사이토신 및 슈도우리딘으로 완전히 변형됨) 100㎍, 10%, 30% 또는 50% RNAIMAXTM 또는 제형 완충액으로 리포플렉싱된 변형된 루시퍼라제 mRNA(서열 2에 나타낸 IVT cDNA 서열; 서열 3에 나타낸 mRNA 서열, 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1, 각각의 사이토신에서 5-메틸사이토신으로 완전히 변형되고 각각의 우리딘 부위에서 슈도우리딘 대체로 변형됨) 100㎍의 제형을 마우스들에게 단일의 70μl 용량으로 근육내 투여하였다. 주사 후 13시간째에 혈청을 수집하여 사람 EPO ELISA를 수행함으로써 각각의 마우스내에서 사람 EPO 단백질 수준을 측정하였다. 표 24에 나타낸, 사람 EPO ELISA의 결과들은, 근육내에서 발현된 변형된 사람 EPO가 RNAIMAXTM의 상이한 퍼센트 각각에 대해 혈청내로 분비됨을 나타낸다.
실시예 77: 랫트들에서 변형된 RNA의 생체내 전달
변형된 mRNA의 단백질 생산은 변형된 G-CSF mRNA 또는 변형된 인자 IX mRNA를 암컷 스프라그 다울리 랫트들(Sprague Dawley rats)(n=6)에 전달함으로써 평가하였다. 랫트들에게, 5-메틸사이토신 및 슈도우리딘(G-CSF Gen1)으로 완전히 변형된 G-CSF mRNA(서열 1에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1), 5% 슈크로즈 속에서 동결건조된 형태로부터 재구성된 5-메틸사이토신 및 N1-메틸슈도우리딘(G-CSF Gen2)으로 완전히 변형된 G-CSF mRNA 또는 5-메틸사이토신 및 슈도우리딘(인자 IX Gen1)으로 완전히 변형된 인자 IX mRNA(서열 6에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1) 100 μL 중 400㎍으로 주사하였다. 혈액을 주사 후 8시간째에 수집하여 혈청 중 G-CSF 단백질 수준을 ELISA로 측정하였다. 표 25는 8시간 후 혈청 속에서 G-CSF 단백질 수준들을 나타낸다.
이들 결과들은, G-CSF Gen 1 및 G-CSF Gen 2 변형된 mRNA 둘 다가 단일이 근육내 주사 후 랫트내에서 사람 G-CSF 단백질을 생산할 수 있으며, 사람 G-CSF 단백질 생산이 Gen 2 화학물질을 사용하는 경우 Gen 1 화학물질보다 개선됨을 입증한다.
실시예
78. 화학적 변형:
시험관내
연구들
A. PBMC 속에서 시험관내 스크리닝
표 26 및 27에 요약된 화학적 변형으로 완전히 변형된 500 ng의 G-CSF(서열 1에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1) mRNA를 0.4 μL의 리포펙타민 2000과 함께 3명의 정상 공여자들로부터의 말초 혈액 단핵 세포들(PBMC)내로 형질감염시켰다. LPS, R848, P(I)P(C) 및 mCherry(서열 4에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1; 5-메틸사이토신 및 슈도우리딘으로 완전히 변형됨)의 대조군 샘플들을 또한 분석하였다. 상청액을 수거하고 ELISA로 분석하여 G-CSF 단백질 발현, 및 사이토카인들 인터페론-알파(IFN-α 및 종양 괴사 인자 알파(TNF-α)의 유도를 측정할 때까지 동결시켜 저장하였다. G-CSF의 단백질 발현은 표 26에 나타내며, IFN-α 및 TNF-α의 발현은 표 27에 나타낸다.
표 26의 데이터는, 많은, 그러나 전부는 아닌, 화학적 변형들을 사용하여 PBMC 속에서 사람 G-CSF를 생산적으로 생산할 수 있음을 입증한다. 중요하게도, 100%의 N1-메틸슈도우리딘 치환은 최고 수준의 사람 G-CSF 생산(슈도우리딘 자체보다 거의 10배 더 높음)을 입증한다. N1-메틸슈도우리딘이 5-메틸사이티딘과 함께 사용되는 경우, 높은 수준의 사람 G-CSF 단백질이 또한 생산된다(이는, 또한 슈도우리딘이 5 메틸사이티딘과 함께 사용되는 경우보다 더 높다).
PBMC 속에서 단백질 생산과 사이토카인 생산 사이의 역 관계를 고려할 때, 유사한 경향을 또한 표 27에서 알 수 있으며, 여기서, N1-메틸슈도우리딘으로의 100% 치환은 사이토카인 유도를 생성하지 않으며(대조군들만으로의 형질감염과 유사) 슈도우리딘은 배경보다 높은 검출가능한 사이토카인 생산을 나타낸다.
N6-메틸아데노신 및 α-티오사이티딘과 같은 다른 변형들도 사이토카인 자극을 증가시키는 것으로 여겨진다.
B. HeLa 세포들 속에서 시험관내 스크리닝
형질감염 전날에, 20,000개의 HeLa 세포들(ATCC 제CCL-2호; 버지니아주 마나사스 소재)를 트립신-EDTA 용액[제조원: 라이프테크놀로지즈(LifeTechnologies), 뉴욕주 그랜드 아이슬랜드 소재]으로 처리하여 수거하고 96-웰 세포 배양 플레이트[제조원: 코닝(Corning), 버지니아주 마나사스 소재] 중 웰 당 100μL의 총 용적의 EMEM 배지(10%의 FCS 및 1x 글루타막스가 보충됨)에 식종하였다. 세포들을 37℃에서 5% CO2 대기 속에서 밤새 성장시켰다. 다음날, 표 28에 기술된 화학적 변형을 지닌 루시퍼라제 변형된 83 ng의 RNA(서열 3에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)을 10μL의 최종 용적의 OPTI-MEM(제조원: 라이프테크놀로지즈, 뉴욕주 그랜드 아이슬랜드 소재) 속에서 희석시켰다. 리포펙타민 2000(제조원: 라이프테크놀로지즈, 뉴욕주 그랜드 아이슬랜드 소재)를 형질감염제로 사용하였으며 0.2μl를 10μl의 최종 용적의 OPTI-MEM으로 희석시켰다. 실온에서 5분간 항온배양 후, 용액들 둘다를 합하여 추가로 15분 동안 실온에서 항온배양하였다. 이후에, 20μl의 합한 용액을 HeLa 세포들을 함유하는 100μL의 세포 배양 배지에 가하고 실온에서 항온배양하였다.
항온배양한 지 18 내지 22 시간 후, 루시퍼라제를 함유하는 세포들을 100μl의 수동 분해 완충액(Passive Lysis buffer)(제조원: 프로메가, 위스콘신주 매디슨 소재)으로 제조업자의 지침에 따라 분해하였다. 분취량들의 분해물들을 백색의 불투명한 폴리스티렌 96-웰 플레이트들(제조원: 코닝, 버지니아주 마나사스 소재)에 이전시키고 100μl의 완전 루시퍼라제 검정 용액(제조원: 프로메가, 위스콘신주 매디슨 소재)과 합하였다. 분해물 용적들을 웰 당 2 mio 이하의 상대적인 광 단위들(RLU)이 가장 강력한 신호 생산 샘플들에 대해 검출될 때까지 조절하거나 희석시키고 시험한 각각의 화학물질들에 대한 RLU들을 표 28에 나타낸다. 플레이트 판독기는 BioTek Synergy H1[제조원: 바이오테크(BioTek), 버몬트주 위누스키 소재]이었다. 시약이 들어있지 않은 플레이트들의 배경 신호는 웰당 약 200개의 상대적인 광 단위들이었다.
이들 결과들은, 많은, 그러나 모두가 아닌, 화학적 변형들을 사용하여 HeLa 세포들 속에서 사람 G-CSF를 생산적으로 생산할 수 있음을 입증한다. 중요하게도, 100%의 N1-메틸슈도우리딘 치환은 최고 수준의 사람 G-CSF 생산을 입증한다.
C. 토끼 망상적혈구 분해물들 속에서 시험관내 스크리닝
루시퍼라제 mRNA(서열 3에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)를 표 29에 나열한 화학적 변형으로 변형시키고 멸균 뉴클레아제-유리된 물 속에서 10μl 중 250 ng의 최종 양으로 희석시켰다. 희석된 루시퍼라제를 40μl의 새로이 제조된 토끼 망상적혈구 분해물에 가하고 시험관내 번역 반응을 표준 1.5mL의 폴리프로필렌 반응 튜브[제조원: 써모 피셔 사이언티픽(Thermo Fisher Scientific), 매사츄세츠주 왈탐 소재] 속에서 30℃로 무수 가열 블록내에서 수행하였다. 번역 검정은 토끼 망상적혈구 분해물(뉴클레아제-처리된) 키트(제조원: 프로메가, 위스콘신주 매디슨 소재)를 사용하여 제조업자의 지침에 따라 수행하였다. 반응 완충액을 루이신 또는 메티오닌이 제거된 제공된 아미노산 스톡 용액(stock solution)들의 1-대-1 배합물로 보충하여 충분한 양의 아미노산들 둘다를 함유하는 반응 혼합물이 생성되도록 함으로써 시험관내 번역이 효과적이도록 하였다.
항온배양한 지 60분 후, 반응 튜브들을 빙상에 두어 반응을 중지시켰다. 루시퍼라제 변형된 RNA를 함유하는 시험관내 번역 반응물의 분취량들을 백색의 불투명한 폴리스티렌 96-웰 플레이트들(제조원: 코닝, 버지니아주 마나사스 소재)에 이전시키고 100μL의 완전 루시퍼라제 검정 용액(제조원: 프로메가, 위스콘신주 매디슨 소재)과 합하였다. 시험관내 번역 반응물들의 용적들은, 웰 당 2 mio 이하의 상대적인 광 단위들(RLU)이 가장 강력한 신호 생산 샘플들에 대해 검출될 때까지 조절하거나 희석시키고 시험한 각각의 화학물질에 대한 RLU들을 표 29에 나타낸다. 플레이트 판독기는 BioTek Synergy H1(제조원: 바이오테크, 버몬트주 위누스키 소재)이었다. 시약이 들어있지 않은 플레이트들의 배경 신호는 웰당 약 200개의 상대적인 광 단위들이었다.
이들 세포-유리된 번역 결과들은 시스템들 둘 다에서 일반적으로 작업하거나 작업하지 않는 동일한 변형들을 지닌, HeLa 속에서의 단백질 생산 결과들과 매우 우수하게 관련된다. 한가지 주목할만한 예외는, 5-포르밀사이티딘 변형된 루시퍼라제 mRNA가 세포-유리된 번역 시스템에서 작업하지만 HeLa 세포-계 형질감염 시스템에서는 작업하지 않는다는 것이다. 2개 검정들 사이의 유사한 차이가 또한 5-포르밀사이티딘 변형된 G-CSF mRNA의 사용 시 관찰되었다.
실시예 79. 화학적 변형: 생체내 연구들
A.
G-CSF 변형된 mRNA의 생체내 스크리닝
Balb-C 마우스들(n=4)의 각각의 다리에 표 30에 요약한 화학적 변형들로 완전히 변형시키고 1x PBS 속에 제형화시킨, 변형된 G-CSF mRNA(서열 1에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)를 근육내 주사한다. 루시퍼라제 변형된 mRNA(서열 3에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1; 슈도우리딘 및 5-메틸사이토신으로 완전히 변형됨)의 대조군 및 PBS의 대조군을 또한 시험한다. 8시간 후 혈청을 수집하여 G-CSF 단백질 수준들 사이토카인 수준들을 ELISA로 측정한다.
A.
루시퍼라제 변형된 mRNA의 생체내 스크리닝
Balb-C 마우스들(n=4)에게, 표 31에 요약된 화학적 변형들로 완전히 변형시키고 1xPBS 속에 제형화시킨 42 내지 103㎍의 변형된 루시퍼라제 mRNA(서열 3에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)를 함유하는 200μl를 피하 주사하였다. PBS의 대조군을 또한 시험하였다. 변형된 루시퍼라제 mRNA의 용량들을 또한 표 31에 요약한다. 투여 후 8 시간째에 마우스들을 영상화하여 루시퍼라제 발현을 측정하였다. 영상화하기 20분 전에, 마우스들에게 D-루시페린 용액을 150 mg/kg으로 복강내 주사하였다. 동물들을 이후에 마취시키고 영상들을 IVIS Lumina II 영상 시스템(제조원: 퍼킨 엘머)으로 획득하였다. 생물발광은 전체 마우스의 총 플럭스(양성자들/초)로서 측정하였다.
표 31에서 입증되는 바와 같이, 모든 루시퍼라제 mRNA 변형된 화합물질들은, 2'-플루오로우리딘을 제외하고는 생체내 활성을 입증하였다. 또한, 1-메틸슈도우리딘 변형된 mRNA은 루시퍼라제의 매우 높은 발현(슈도우리딘 함유 mRNA보다 5-배 더 높은 발현)을 입증하였다.
실시예 80. 조합 루시퍼라제 변형된 mRNA의 생체내 스크리닝
Balb-C 마우스들(n=4)에게 표 32에 요약된 화학적 변형들로 완전히 변형시키고, 1x PBS 속에 제형화시킨 100㎍의 변형된 루시퍼라제 mRNA(서열 3에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1) 200μl를 피하 주사하였다. PBS의 대조군을 또한 시험하였다. 변형된 루시퍼라제 mRNA의 용량들은 또한 표 29에 요약한다. 투여한 지 8 시간 후, 마우스들을 영상화하여 루시퍼라제 발현을 측정하였다. 영상화 20분 전에, 마우스들에게 D-루시페린 용액을 150 mg/kg으로 복강내 주사하였다. 동물들을 이후에 마취시키고 영상들을 IVIS Lumina II 영상 시스템(제조원: 퍼킨 엘머)으로 획득하였다. 생물발광은 전체 마우스의 총 플럭스(양성자들/초)로서 측정하였다.
표 32에서 입증되는 바와 같이, 모든 루시퍼라제 mRNA 변형된 화학물질들(조합된)은, 생체내 활성을 입증하였다. 또한, 변형된 mRNA(N4-아세틸사이티딘 또는 5 메틸사이티딘을 지닌) 속에서 N1-메틸슈도우리딘의 존재는, 슈도우리딘을 사용하여 시험한 동일한 조합물들의 경우보다 더 높은 발현을 입증하였다. 이를 함께 고려할 때, 이들 데이터는, N1-메틸슈도우리딘 함유 루시퍼라제 mRNA가 단독으로 사용되는 경우(표 31) 또는 다른 변형된 뉴클레오타이드들과 함께 사용되는 경우(표 32)에 상관없이 개선된 단백질 발현을 생성함을 입증한다.
실시예 81. 변형된 RNA의 안정성
A. 변형된 RNA의 저장
안정성 실험들을 수행하여 변형된 RNA의 통합성을 유지하기 위한 저장 조건들의 보다 우수한 이해를 수득하였다. 변형되지 않은 G-CSF mRNA(서열 1에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1), 5-메틸사이토신 및 슈도우리딘으로 완전히 변형된 G-CSF mRNA 및 0.75 용적%의 RNAIMAXTM으로 리포플렉싱된 슈도우리딘 및 5-메틸사이토신으로 완전히 변형된 G-CSF mRNA를 50℃, 40℃, 37℃, 25℃, 4℃ 또는 -20℃에서 저장하였다. mRNA를 0시간, 2시간, 6시간, 24시간, 48시간, 5일 및 14일 동안 저장한 후, mRNA를 겔 전기영동에 의해 Bio-Rad EXPERIONTM 시스템을 사용하여 분석하였다. 변형된, 변형되지 않은 및 리포플렉싱된 G-CSF mRNA를 또한 RNASTABLE®[제조원: 바이오매트리카, 인코포레이션(Biomatrica, Inc), 캘리포니아주 샌 디에고 소재] 속에 40℃에서 또는 물 속에 -80℃ 또는 40℃에서 35일 동안 저장한 후 겔 전기영동으로 분석하였다.
안정화제의 부재하에서 모든 mRNA 샘플들은 4℃ 또는 -20℃에서 저장 2주 후에 안정하였다. 리포플렉스를 지니거나 지니지 않은 변형된 G-CSF mRNA는 25℃(5일 대 48시간까지 안정), 37℃(24시간 대 6시간까지 안정) 및 50℃(6시간 대 2시간까지 안정)에서 저장 시 변형되지 않은 G-CSF보다 더 안정하였다. 변형되지 않은 G-CSF mRNA, 리포플렉스를 지니거나 지니지 않은 변형된 G-CSF mRNA는 12회 동결/해동 주기들을 견뎠다.
40℃에서 안정화기 속에 저장된 mRNA 샘플들은 35일 후 -80℃에서 물 속에 저장된 mRNA 샘플들과 유사한 안정성을 나타내었지만 40℃에서 물 속에 저장된 mRNA는 18일 후 큰 분해를 나타내었다.
실시예 82. BJ 섬유아세포들에서 세포 생존능
사람 원시 포피 섬유아세포들(BJ 섬유아세포들)을 아메리칸 타입 컬쳐 컬렉션(ATCC)(제품 번호 CRL-2522)으로부터 수득하여 10% 태아 송아지 혈청이 보충된 이글 최소 필수 배지(ATCC, 제품 번호 30-2003) 속에서 37℃로, 5% CO2하에 성장시켰다. BJ 섬유아세포들을 24-웰 플레이트에 웰 당 130,000개 세포들의 밀도에서 0.5 ml의 배양 배지 속에 식종하였다. 5-메틸사이토신 및 슈도우리딘(Gen1)으로 완전히 변형시키거나 5-메틸사이토신 및 N1-메틸슈도우리딘(Gen2)으로 완전히 변형시킨 250ng의 변형된 G-CSF mRNA(서열 1에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)을 리포펙타민 2000(제조원: 인비트로겐, 제품 번호 11668-019)을 사용하여 제조업자의 프로토콜에 따라 형질감염시켰다. 리포펙타민 2000(LF2000) 및 변형되지 않은 G-CSF mRNA의 대조군 샘플들을 또한 형질감염시켰다. 변형된 mRNA 또는 대조군 샘플들을 4일 동안 매일 형질감염시켰다. 형질감염 후 세포들의 생존능을 제1의 형질감염 후 6 시간 및 24 시간째에(T1, 6 시간 또는 T1, 24 시간), 및 제2의 형질감염 후 24 시간째에(T2, 24 시간) 및 제4의 형질감염 후 24 시간째에(T4, 24 시간) 평가하였다.
세포 생존능을 평가하기 위해, 배양 배지를 완전히 제거하고 세포들을 Ca2+/Mg2+[제조원: 기브코/라이프 테크롤로지즈(Gibco/Life Technologies), 버지니아주 마나사스 소재]가 들어있지 않은 600μl의 멸균 PBS로 1회 세척하여 느슨하게 부착된 세포들을 세정하여 제거하였다. PBS를 제거하고 버렸다. 각각의 웰 속의 세정된 섬유아세포들에게 220μl의 희석된 CELL TITER GLO®(제조원: 프로메가, 제품 번호 G7570) 스톡 용액(당해 CELL TITER GLO® 스톡 용액을 동량의 멸균 PBS로 1:1 추가 희석하였다)으로 처리하였다. 멸균 피펫 팁을 사용하여 플레이트에서 세포들을 긁어내어 분해 공정을 가속화시켰다.
2개의 시간 간격들, T1, 24시간 및 T2, 24 시간에 대해, 대안의 프로토콜을 적용하였다. 세포들을 위에서 기술한 바와 같이, PBS로 세척하고, 후속적으로 트립신/EDTA 용액(기브코/라이프 테크롤로지즈, 버지니아주 마나사스 소재)으로 트립신처리하였다. 세포들을 탈착시키고 트립신 억제제를 함유하는 500μL의 배지 속에 수집하였다. 세포들을 1200 rcf에서 5분 동안 원심분리로 수거하였다. 세포 펠렛을 500μl의 PBS속에 재현탁시켰다. 당해 세포 현탁액을 빙수에 유지시키고, 이의 100μl를 100μl의 희석되지 않은 세포 역가 Glo 용액과 합하였다.
모든 CELL TITER GLO® 분해물들을 이후에 실온에서 20분 동안 항온배양하였다. 20μl의 분해물들을 백색의 불투명한 폴리스티렌 96-웰 플레이트(제조원: 코닝, 버지니아주 마나사스 소재)로 이전시키고 100μl의 희석된 CELL TITER GLO® 용액과 합하였다. 사용된 플레이트 판독기는 BioTek Synergy H1(제조원: 바이오테크, 버몬트주 위누스키 소재)이었으며, 절대값들을 100% 세포 생존능에 대한 처리되지 않은 BJ 섬유모세포들의 신호에 대해 표준화하였다. BJ 섬유모세포들에 대한 생존능 퍼센트는 표 33에 나타낸다.
중요하게도, 이들 실험들 모두는 어떠한 인터페론 또는 다른 사이토카인 억제제들의 부재하에 수행되므로 상이한 mRNA의 세포독성의 정밀한 척도를 나타낸다.
이들 결과들은, 변형되지 않은 mRNA를 사용한 BJ 섬유모세포들의 반복된 형질감염이 제1 형질감염 후 24시간째(T1, 24 시간)로 일찍이 나타나는 세포 생존능의 손실을 초래하며 후속적인 시점들에서 지속적으로 명백해지고 더 현저해짐을 입증한다.
제4의 매일 형질감염 후 24시간째(T4, 24 시간)에 명백해지는 5메틸사이티딘 및 슈도우리딘 변형된 mRNA 반복된 형질감염으로 생존능이 또한 손실된다. 당해 실험의 과정에 걸친 세포 생존능의 손실은 5메틸사이티딘 및 N1-메틸슈도우리딘 변형된 mRNA의 사용으로 관찰되지 않는다. 이들 결과들은, 5메틸사이티딘 및 N1-메틸슈도우리딘 함유 mRNA가 반복된 형질감염하에 분석되는 경우 개선된 세포 생존능을 가짐을 입증한다. 변형된 mRNA를 반복적으로 투여하기 위한 능력은 대부분의 치료학적 적용들에서 중요하며, 이와 같이, 세포 독성의 부재하에 이를 수행하는 이러한 능력 또한 중요하다. 이론에 얽메이는 것을 원하지는 않지만, 단일의 형질감염 후 반응 유전자들은 단백질 생산, 사이토카인 유도에 있어서 감소, 및 궁극적으로 세포 생존능의 손실을 초래할 수 있다. 이들 결과들은 변형되지 않은 mRNA 및 슈도우리딘-변형된 mRNA 둘다와 비교하여 이러한 측면에서 개선된 프로파일을 나타내는 N1-메틸슈도우리딘-함유 mRNA와 일치한다.
실시예 83. BJ 섬유모세포들에서 선천적 면역 반응
사람 원시 포피 섬유모세포들(BJ 섬유모세포들)을 아메리칸 타입 컬쳐 컬렉션(ATCC)(제품 번호 CRL-2522)에서 입수하여 10% 태아 송아지 혈청이 보충된 이글 최소 필수 배지(Eagle's Minimum Essential Medium(ATCC, 제품 번호 30-2003)] 속에서 37℃로 5% CO2하에 성장시켰다. BJ 섬유아세포들을 24-웰 플레이트 위에 웰당 130,000 세포들의 밀도로 0.5 ml의 배양 배지 속에서 식종하였다. 5-메틸사이토신 및 슈도우리딘(Gen1)으로 완전히 변형되거나 또는 5-메틸사이토신 및 N1-메틸슈도우리딘(Gen2)으로 완전히 변형된, 250 ng의 변형된 G-CSF mRNA(서열 1에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)를 리포펙타민 2000(제조원: 인비트로겐, 제품 번호 11668-019)을 사용하여 제조업자의 프로토콜에 따라 형질감염시킨다. 리포펙타민 2000 및 변형되지 않은 G-CSF mRNA(천연의 G-CSF)의 대조군 샘플들을 또한 형질감염시킨다. 당해 세포들을 5회 연속일 동안 형질감염시킨다. 당해 형질감염 복합체들을 형질감염의 각각의 라운드 후 4시간째에 제거한다.
배양물 상청액을 분비된 GCSF(R&D 시스템스, 제품 번호 DCS50), 종양 괴사 인자-알파(TNF-알파) 및 인터페론 알파(IFN-알파)에 대해 ELISA로 형질감염 후 매일 제조업자의 프로토콜들에 따라 검정한다. 당해 세포들을 CELL TITER GLO®(프로메가, 제품 번호 G7570)을 사용하여 제1의 형질감염 라운드 후 6시간 및 18시간째에 및 이후 매 격일로 생존능에 대해 분석하였다. 수거된 세포들로부터 동일한 시간에, 전체 RNA를 분리하여 DNASE®로 RNAEASY 마이크로 키트(제품 번호 74004)를 사용하여 제조업자의 프로토콜에 따라 처리하였다. 100 ng의 전체 RNA를 cDNA 합성을 위해 고 용량 cDNA 역전사 키트(제조원: 어플라이드 바이오시스템스, 제품 번호 4368814)를 사용하여 제조업자의 프로토콜에 따라 사용한다. 이후에 cDNA를 제조업자의 프로토콜에 따라 바이오라드 CFX 384 장치 속에서 SybrGreen을 사용하는 정량적인 실시간 PCR에 의해 선천적 면역 반응 유전자들의 발현에 대해 분석한다.
실시예 84. 야생형 T7 폴리머라제를 사용한 시험관내 전사
루시퍼라제 mRNA(서열 3에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1) 및 G-CSF mRNA(서열 1에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)을 앞서 기술한 바와 같이 야생형 T7 폴리머라제를 사용하여 표 34 내지 37에 나타낸 상이한 화합물질들 및 화학 조합들로 완전히 변형시켰다.
번역 반응들의 수율을 분광광도계적 측정(OD260)으로 측정하고 루시퍼라제에 대한 수율은 표 34에 나타내며 G-CSF에 대한 수율은 표 36에 나타낸다.
루시퍼라제 및 G-CSF 변형된 mRNA를 또한 효소적 캡핑 반응에 적용시키고 각각의 변형된 mRNA 캡핑 반응을 분광광도계적 측정(OD260)에 의해 수율에 대해 평가하였고 정확한 크기를 생물분석기를 사용하여 평가하였다. 루시퍼라제에 대한 캡핑 반응으로부터의 수율은 표 35에 나타내고 G-CSF에 대한 수율은 표 37에 나타낸다.
실시예 85. 돌연변이체 T7 폴리머라제를 사용한 시험관내 전사
루시퍼라제 mRNA(서열 3에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1) 및 G-CSF mRNA(서열 1에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, Cap1)를 표 38 내지 41에 나열한 상이한 화학물질들 및 화학물질 조합들로 돌연변이체 T7 폴리머라제(Durascribe® T7 전사 키트(제품 번호 DS010925)(Epicentre® 위스콘신주 매디슨 소재)를 사용하여 완전히 변형시켰다.
번역 반응들의 수율을 분광광도계적 측정(OD260)으로 측정하고 루시퍼라제에 대한 수율은 표 38에 나타내며 G-CSF에 대한 수율은 표 40에 나타낸다.
루시퍼라제 및 G-CSF 변형된 mRNA를 또한 효소적 캡핑 반응에 적용시키고 각각의 변형된 mRNA 캡핑 반응을 분광광도계적 측정(OD260)에 의해 수율에 대해 평가하고 정확한 크기를 생물분석기로 평가하였다. 루시퍼라제에 대한 캡핑 반응으로부터의 수율은 표 39에 나타내고 G-CSF는 표 41에 나타낸다.
실시예 86. 2'O-메틸 및 2'플루오로 화합물들
루시퍼라제 mRNA(서열 3에 나타낸 mRNA 서열 3; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)를 표 42에서의 화학물질들로 완전히 변형된 버젼들로서 생산하고 돌연변이체 T7 폴리머라제(Durascribe®T7 전사 키트(제품번호 DS010925)(Epicentre® 위스콘신주 매디슨 소재)를 사용하여 전사하였다. 2'플루오로-함유 mRNA를 Durascribe T7을 사용하여 제조하였으나, 2'O메틸-함유 mRNA는 Durascribe T7을 사용하여 전사시킬 수 없었다.
2'O메틸 변형된 mRNA의 혼입은 다른 돌연변이체 T7 폴리머라제들을 사용하여 가능하게 달성할 수 있었다[참조: Nat Biotechnol.(2004) 22:1155-1160; Nucleic Acids Res.(2002) 30:e138). 달리는, 2'OMe 변형들은 효소적 수단들을 사용하여 후-전사적으로 도입시킬 수 있었다.
당의 2' 그룹 위에서 변형들의 도입은 많은 잠재적인 장점들을 갖는다. 2'플루오로 치환들과 같이, 2'OMe 치환들은 뉴클레아제들에 대해 보호하며 또한 siRNA 및 안티-센스와 같은 다른 핵산들내로 혼입되는 경우 선천적 면역 인식을 무효화시키는 것으로 밝혀졌다(참조: 이의 전문이 혼입되어 있는, Crooke, ed. Antisense Drug Technology, 2nd edition; Boca Raton: CRC press).
2'플루오로-변형된 mRNA를 이후에 HeLa 세포들내로 형질감염시켜 세포 측면에서 단백질 생산을 평가하고 동일한 mRNA를 세포-유리된 토끼 망상적혈구 시스템 속에서 평가하였다. 변형되지 않은 루시퍼라제(천연 루시퍼라제) 대조군을 전사 실험들 둘다에 사용하였으며, 처리되지 않은 대조군 및 형질감염된 모형(mock)(리포펙타민 2000 단독)을 또한 HeLa 형질감염에 대해 분석하고 RNA가 없는 대조군을 토끼 망상적혈구들에 대해 분석하였다.
HeLa 형질감염 실험들의 경우, 형질감염 전날에, 20,000개의 HeLa 세포들(ATCC 제CCL-2호; 버지니아주 마나사스 소재)를 트립신-EDTA 용액(라이프테크놀로지즈, 뉴욕주 그랜드 아이슬랜드 소재)으로 처리하여 수거하고 웰당 100μl의 총 용적의 EMEM 배지(10% FCS 및 1x 글루타막스가 보충됨)를 96-웰 세포 배양 플레이트(제조원: 코닝, 버지니아주 마나사스 소재) 속에서 식종하였다. 세포들을 37℃에서 5% CO2 대기하에 밤새 성장시켰다. 다음날, 표 42에 기술된 화학적 변형을 지닌 83 ng의 2'플루오로-함유 루시퍼라제 변형된 RNA(서열 3에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)을 10μl의 최종 용적의 OPTI-MEM(라이프테크놀로지즈, 뉴욕주 그랜드 아이슬랜드 소재) 속에서 희석시켰다. 리포펙타민 2000(라이프테크놀로지즈, 뉴욕주 그랜드 아이슬랜드 소재)을 형질감염 시약으로서 사용하고 0.2μl를 10μl의 최종 용적의 OPTI-MEM 속에서 희석시켰다. 실온에서 5분의 항온배양 후, 용액들 둘다를 합하여 추가로 15분 동안 실온에서 항온배양하였다. 이후에, 20μl의 합해진 용액을 HeLa 세포들을 함유하는 100μl의 세포 배양 배지에 가하고 실온에서 항온배양하였다. 18 내지 22 시간의 항온배양 후 루시퍼라제를 발현하는 세포들을 100μl의 수동적 분해 완충액(제조원: 프로메가, 위스콘신주 매디슨 소재)으로 제조업자의 지침에 따라 분해하였다. 분취량들의 분해물들을 백색의 불투명한 폴리스티렌 96-웰 플레이트들(제조원: 코닝, 버지니아주 마나사스 소재)에 이전시키고 100μl의 완전 루시퍼라제 검정 용액(제조원: 프로메가, 위스콘신주 매디슨 소재)과 합하였다. 분해물 용적들을 웰 당 2 mio 이하의 상대적인 광 단위들(RLU)이 가장 강력한 신호 생산 샘플들에 대해 검출될 때까지 조절하거나 희석시키고 시험한 각각의 화학물질들에 대한 RLU들을 표 42에 나타낸다. 플레이트 판독기는 BioTek Synergy H1[제조원: 바이오테크(BioTek), 버몬트주 위누스키 소재]이었다. 시약이 들어있지 않은 플레이트들의 배경 신호는 웰당 약 200개의 상대적인 광 단위들이었다.
토끼 망상적혈구 분해물 검정을 위해, 2'-플루오로-함유 루시퍼라제 mRNA를 멸균 뉴클레아제-유리된 물 속에서 10μl중 250 ng의 최종 양으로 희석시키고 40μl의 새로이 제조된 토끼 망상적혈구 분해물에 가하고 시험관내 번역 반응을 표준 1.5mL의 폴리프로필렌 반응 튜브(제조원:써모피셔 사이언티픽, 매사츄세츠주 왈탐 소재) 속에서 30℃로 무수 가열 블록 속에서 수행하였다. 번역 검정은 토끼 망상적혈구 분해물(뉴클레아제-처리된) 키트(제조원: 프로메가, 위스콘신주 매디슨 소재)를 사용하여 제조업자의 지침에 따라 수행하였다. 반응 완충액을 루이신 또는 메티오닌이 제거된 제공된 아미노산 스톡 용액들의 1-대-1 배합물로 보충하여 충분한 양의 아미노산들 둘 다를 함유하는 반응 혼합물이 생성되도록 함으로써 시험관내 번역이 효과적이도록 하였다. 배양한 지 60분 후에, 반응물을 빙상에 위치시켜서 반응을 중지시켰다.
루시퍼라제 변형된 RNA를 함유하는 시험관내 번역 반응물의 분취량들을 백색의 불투명한 폴리스티렌 96-웰 플레이트들(제조원: 코닝, 버지니아주 마나사스 소재)에 이전시키고 100μL의 완전한 루시퍼라제 검정 용액(제조원: 프로메가, 위스콘신주 매디슨 소재)과 합하였다. 시험관내 번역 반응물들의 용적들은, 웰 당 2 mio 이하의 상대적인 광 단위들(RLU)이 가장 강력한 신호 생산 샘플들에 대해 검출될 때까지 조절하거나 희석시키고 시험한 각각의 화학물질들에 대한 RLU들을 표 43에 나타낸다. 플레이트 판독기는 BioTek Synergy H1(제조원: 바이오테크, 버몬트주 위누스키 소재)이었다. 시약이 들어있지 않은 플레이트들의 배경 신호는 웰당 약 160개의 상대적인 광 단위들이었다.
표 42 및 43에서 알 수 있는 바와 같이, 다수의 2'플루오로-함유 화합물들은 시험관내에서 활성이며 루시퍼라제 단백질을 생산한다.
실시예 87. 변형들의 조합을 사용한 HeLa 세포들 속의 루시퍼라제
다른 변형과 함께 2'플루오로-변형된 mRNA를 사용하는 것을 평가하기 위하여, 일련의 mRNA를 야생형 T7 폴리머라제(플루오로-비함유 화합물들) 또는 돌연변이체 T7 폴리머라제들(플루오로-함유 화합물들)을 실시예 86에 기술된 바와 같이 전사시켰다. 모든 변형된 mRNA를 시험관내 형질감염으로 HeLa 세포들내에서 시험하였다.
형질감염 전날에, 20,000개의 HeLa 세포들(ATCC 제CCL-2호; 버지니아주 마나사스 소재)를 트립신-EDTA 용액[제조원: 라이프테크놀로지즈(LifeTechnologies), 뉴욕주 그랜드 아이슬랜드 소재]으로 처리하여 수거하고 96-웰 세포 배양 플레이트(제조원: 코닝, 버지니아주 마나사스 소재) 중 웰 당 100μl의 총 용적의 EMEM 배지(10%의 FCS 및 1x 글루타막스가 보충됨)에 식종하였다. 세포들을 37℃에서 5% CO2 대기 속에서 밤새 성장시켰다. 다음날, 표 44에 기술된 화학적 변형을 지닌 83 ng의 루시퍼라제 변형된 RNA(서열 3에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)을 10μl의 최종 용적의 OPTI-MEM(제조원: 라이프테크놀로지즈, 뉴욕주 그랜드 아이슬랜드 소재) 속에서 희석시켰다. 리포펙타민 2000(제조원: 라이프테크놀로지즈, 뉴욕주 그랜드 아이슬랜드 소재)를 형질감염제로 사용하였으며 0.2μl를 10μl의 최종 용적의 OPTI-MEM으로 희석시켰다. 실온에서 5분간 항온배양한 후, 용액들 둘다를 합하여 추가로 15분 동안 실온에서 항온배양하였다. 이후에, 20μl의 합한 용액을 HeLa 세포들을 함유하는 100μl의 세포 배양 배지에 가하고 실온에서 항온배양하였다.
항온배양한 지 18 내지 22 시간 후, 루시퍼라제를 발현하는 세포들을 100μl의 수동 분해 완충액(제조원: 프로메가, 위스콘신주 매디슨 소재)으로 제조업자의 지침에 따라 분해하였다. 분취량들의 분해물들을 백색의 불투명한 폴리스티렌 96-웰 플레이트들(제조원: 코닝, 버지니아주 마나사스 소재)에 이전시키고 100μl의 완전한 루시퍼라제 검정 용액(제조원: 프로메가, 위스콘신주 매디슨 소재)과 합하였다. 분해물 용적들을 웰 당 2 mio 이하의 상대적인 광 단위들(RLU)가 가장 강력한 신호 생산 샘플들에 대해 검출될 때까지 조절하거나 희석시키고 시험한 각각의 화학물질들에 대한 RLU들을 표 44에 나타낸다. 플레이트 판독기는 BioTek Synergy H1(제조원: 바이오테크, 버몬트주 위누스키 소재)이었다. 시약이 들어있지 않은 플레이트들의 배경 신호는 웰당 약 200개의 상대적인 광 단위들이었다.
표 44에서 입증되는 바와 같이, 모든 플루오로-비함유 화합물들 및 2'플루오로 변형들을 함유하는 많은 조합물들을 포함하는, 변형들의 대부분의 조합들은 기능성 루시퍼라제 단백질을 생산한 mRNA를 생성하였다.
실시예 88. G-CSF 시험관내 전사
제2의 개방 판독 프레임과 관련하여 본 발명자들의 상이한 화학적 변형들 모두의 활성을 평가하기 위하여, 본 발명자들은 사람 G-CSF mRNA를 지닌 루시퍼라제 mRNA를 사용하여 실험들을 미리 반복하였다. G-CSF mRNA(서열 1에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)를 표 45 및 46에 나타낸 화학물질들로 야생형 T7 폴리머라제(모든 플루오로-비함유 화합물들의 경우) 또는 돌연변이체 T7 폴리머라제(모든 플루오로-함유 화합물들의 경우)를 사용하여 완전히 변형시켰다. 돌연변이체 T7 폴리머라제는 상업적으로 수득하였다(Durascribe® T7 전사 키트(제품 번호 DS010925)(Epicentre®, 위스콘신주 매디슨 소재),
표 45 및 46에서 변형된 RNA를 HeLa 세포들 속에서 시험관내 형질감염시키거나 토끼 망상적혈구들(250ng의 변형된 mRNA)에 나타낸 바와 같이 가하였다. 처리되지 않은, 대조군, 형질감염된 모형(형질감염 시약 단독), 5-메틸사이토신 및 N1-메틸슈도우리딘으로 완전히 변형된 G-CSF, 또는 5-메틸사이토신 및 N1-메틸슈도우리딘으로 완전히 변형된 루시퍼라제 대조군(서열 3에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)을 또한 분석하였다. G-CSF 단백질의 발현은 ELISA로 측정하였으며, 값들은 표 45 및 46에 나타낸다. 표 45에서 "NT"는 시험되지 않았음을 의미한다.
표 45에 나타낸 바와 같이, 많은, 그러나 전부는 아닌, 화학적 변형들은 사람 G-CSF 단백질을 생산을 생성하였다. 세포-계 및 세포-유리된 번역 시스템들로부터의 이들 결과들은 시스템들 둘 다에서 일반적으로 작업하거나 작업하지 않는 동일한 변형들과 매우 우수하게 연관된다. 한 가지 주목할만한 예외는 세포-유리된 번역 시스템 속에서 작업하지만 HeLa 세포-계 형질감염 시스템에서는 작업하지 않는 5-포르밀사이티딘 변형된 G-CSF mRNA이다. 2개의 검정들 사이의 유사한 차이가 또한 5-포르밀사이티딘 변형된 루시퍼라제 mRNA에서 관찰되었다.
표 46에서 입증되는 바와 같이, 많은, 그러나 모두가 아닌, G-CSF mRNA 변형된 화학물질들(함께 사용되는 경우)는 생체내 활성을 입증하였다. 또한, 변형된 mRNA(N4-아세틸사이티딘 또는 5 메틸사이티딘으로)내 N1-메틸슈도우리딘의 존재는, 슈도우리딘을 사용하여 시험된 동일한 조합들의 경우보다 더 높은 발현을 입증하였다. 함게 고려하는 경우, 이들 데이터는, N1-메틸슈도우리딘 함유 G-CSF mRNA가 시험관내에서 개선된 단백질 발현을 생성함을 입증한다.
실시예 89. 화학물질들의 스크리닝
하기 나열한 표들(표 47 내지 49)은, 앞서의 실시예들에 나타낸 상이한 화합물들을 사용한 시험관내 및 생체내 스크리닝 데이터 중 많은 것을 요약한다. 우수한 상간관계가 세포-계와 세포-유리된 번역 검정들 사이에 존재한다. 동일한 화학물질 치환들은, 루시퍼라제 또는 G-CSF mRNA와 관련하여 시험하는 것에 상관없이 우수한 일치를 일반적으로 나타낸다. 마지막으로, N1-메틸슈도우리딘 함유 mRNA는 시험관내 및 생체내에서 거의 검출가능하지 않거나 검출불가능한 사이토카인 자극을 사용한 단백질 발현의 매우 높은 수준을 나타내며 시험관내 및 생체내 둘 다에서 슈도우리딘을 함유하는 mRNA보다 더 우수하다.
루시퍼라제 mRNA(서열 3에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1) 및 G-CSF mRNA(서열 1에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)을 표 47 및 48에 기술된 천연적으로 및 비-천연적으로 존재하는 화학물질들 또는 표 48에 기술된 조합 화학물질들로 변형시키고 본원에 기술된 방법들을 사용하여 시험하였다.
표 47 및 48에서, "*"는 돌연변이체 T7 폴리머라제(제조원: Durascribe® T7 전사 키트(제품 번호 DS010925)(Epicentre®, 위스콘신주 매디슨 소재)를 사용한 시험관내 전사 반응을 말하며; "**"은 돌연변이체 T7 폴리머라제(Durascribe®T7 전사 키트(Cat. No. DS010925)(Epicentre®, 위스콘신주 매디슨 소재)을 사용한 제2의 결과인 시험관내 전사 반응을 말하고; "***"은 세포 유리된 번역물들(토끼 망상적혈구 분해물들)에서 관찰된 생산을 말하며; HeLa의 단백질 생산은 "+", "+/-" 및 "-"로 판단하며; G-CSF PBMC를 언급하는 경우, "++++"은 6,000 pg/ml 초과의 G-CSF를 의미하고, "+++"은 3,000pg/ml 초과의 G-CSF를 의미하며, "++"은 1,500pg/ml 초과의 G-CSF를 의미하고, "+"은 300pg/ml 초과의 G-CSF를 의미하며, "+/-"은 150 내지 300pg/ml의 G-CSF를 의미하고; 배경은 약 110pg/ml을 의미하며; 사이토카인 PBMC를 언급하는 경우 "++++"은 1,000pg/ml 초과의 인터페론-알파(IFN-알파)를 의미하고, "+++"은 600pg/ml 초과의 IFN-알파를 의미하며, "++"은 300pg/ml 초과의 IFN-알파를 의미하고; "+"은 100pg/ml 초과의 IFN-알파를 의미하며, "-"은 100pg/ml 미만을 의미하고 배경은 약 70 pg/ml이었으며 "NT"는 시험되지 않았음을 의미한다. 표 48에서, 단백질 생산은 돌연변이체 T7 폴리머라제(Durascribe® T7 전사 키트(제품 번호 DS010925)(제조원: Epicentre®, 위스콘신주 매디슨 소재)을 사용하여 평가하였다.
표 49에서, HeLa의 단백질 생산은 "+", "+/-" 및 "-"로 판단하며, G-CSF PBMC를 언급하는 경우, "++++"은 6,000 pg/ml 초과의 G-CSF를 의미하고, "+++"은 3,000pg/ml 초과의 G-CSF를 의미하며, "++"은 1,500pg/ml 초과의 G-CSF를 의미하고, "+"은 300pg/ml 초과의 G-CSF를 의미하며, "+/-"은 150 내지 300pg/ml의 G-CSF를 의미하고; 배경은 약 110pg/ml을 의미하며; 사이토카인 PBMC를 언급하는 경우 "++++"은 1,000pg/ml 초과의 인터페론-알파(IFN-알파)를 의미하고, "+++"은 600pg/ml 초과의 IFN-알파를 의미하며, "++"은 300pg/ml 초과의 IFN-알파를 의미하고; "+"은 100pg/ml 초과의 IFN-알파를 의미하며, "-"은 100pg/ml 미만을 의미하고 배경은 약 70 pg/ml이었으며; "WT"는 야생형 T7 폴리머라제를 말하고, "MT"는 돌연변이체 T7 폴리머라제(Durascribe® T7 전사 키트(제품 번호 DS010925)(제조원: Epicentre®, 위스콘신주 매디슨 소재)을 말하며 "NT"은 시험되지 않았음을 의미한다.
실시예 90. PBMC에서 2'플루오로 화학물질들
면역 반응을 선천적으로 개시하는 G-CSF 변형된 mRNA(서열 1에 나타낸 mRNA 서열; 대략 160개의 뉴클레오타이드들의 폴리 A 테일은 서열에 나타내지 않는다; 5'캡, 캡 1)의 능력은 인터페론-알파(IFN-알파) 및 종양 괴사 인자-알파(TNF-알파) 생산을 측정함으로써 측정하였다. 시험관내 PBMC 배양물들의 사용은 올리고뉴클레오타이드들의 면역자극성 잠재능을 측정하는 허용된 방법이고(참조: Robbins et al., Oligonucleotides 2009 19:89-102) 형질감염 방법들은 본원에 기술되어 있다. 표 50에는 특이적인 ELISA로 측정한 것으로서 시간에 따른 인터페론-알파(IFN-알파) 및 종양 괴사 인자 알파(TNF-알파) 생산의 2 또는 3명의 별도의 PBMC 공여자들로부터의 평균이다. R848, P(I)P(C), LPS 및 리포펙타민 2000(L2000)의 대조군들을 또한 분석하였다.
선천적 면역 인식과 관련하여, 변형된 mRNA 화학물질들 둘다가 양성 대조군들(R848, P(I)P(C))에 비해 IFN-알파 및 TNF-알파 생산을 크게 방지하였지만, 2'플루오로 화합물들은 사이토카인 프로파일을 상승시킨 다른 조합들 및 N4-아세틸사이티딘 조합들보다 훨씬 더 낮게 IFN-알파 및 TNF-알파 생산을 감소시킨다.
다른 실시형태들
본 개시는 이의 상세한 설명과 함께 기술되었지만, 앞선 설명은 첨부된 특허청구범위의 범위에 의해 정의되는, 앞서의 기술은 본 개시의 범위를 나열하는 것이며 제한하지 않는 것으로 의도된다. 다른 양상들, 이점들, 및 변형들은 다음의 특허청구범위의 범위 내에 있다.
SEQUENCE LISTING
<110> MODERNA THERAPEUTICS, INC.
<120> MODIFIED NUCLEOSIDES, NUCLEOTIDES, AND NUCLEIC ACIDS, AND USES THEREOF
<130> M009.20/2030.1009PCT
<150> US 61/542,533
<151> 2011-10-03
<160> 6
<170> KopatentIn 1.71
<210> 1
<211> 758
<212> RNA
<213> Homo Sapiens
<400> 1
gggaaauaag agagaaaaga agaguaagaa gaaauauaag agccaccaug gccggucccg 60
cgacccaaag ccccaugaaa cuuauggccc ugcaguugcu gcuuuggcac ucggcccucu 120
ggacagucca agaagcgacu ccucucggac cugccucauc guugccgcag ucauuccuuu 180
ugaagugucu ggagcaggug cgaaagauuc agggcgaugg agccgcacuc caagagaagc 240
ucugcgcgac auacaaacuu ugccaucccg aggagcucgu acugcucggg cacagcuugg 300
ggauucccug ggcuccucuc ucguccuguc cgucgcaggc uuugcaguug gcagggugcc 360
uuucccagcu ccacuccggu uuguucuugu aucagggacu gcugcaagcc cuugagggaa 420
ucucgccaga auugggcccg acgcuggaca cguugcagcu cgacguggcg gauuucgcaa 480
caaccaucug gcagcagaug gaggaacugg ggauggcacc cgcgcugcag cccacgcagg 540
gggcaaugcc ggccuuugcg uccgcguuuc agcgcagggc ggguggaguc cucguagcga 600
gccaccuuca aucauuuuug gaagucucgu accgggugcu gagacaucuu gcgcagccgu 660
gaagcgcugc cuucugcggg gcuugccuuc uggccaugcc cuucuucucu cccuugcacc 720
uguaccucuu ggucuuugaa uaaagccuga guaggaag 758
<210> 2
<211> 1838
<212> DNA
<213> Homo Sapiens
<400> 2
taatacgact cactataggg aaataagaga gaaaagaaga gtaagaagaa atataagagc 60
caccatggaa gatgcgaaga acatcaagaa gggacctgcc ccgttttacc ctttggagga 120
cggtacagca ggagaacagc tccacaaggc gatgaaacgc tacgccctgg tccccggaac 180
gattgcgttt accgatgcac atattgaggt agacatcaca tacgcagaat acttcgaaat 240
gtcggtgagg ctggcggaag cgatgaagag atatggtctt aacactaatc accgcatcgt 300
ggtgtgttcg gagaactcat tgcagttttt catgccggtc cttggagcac ttttcatcgg 360
ggtcgcagtc gcgccagcga acgacatcta caatgagcgg gaactcttga atagcatggg 420
aatctcccag ccgacggtcg tgtttgtctc caaaaagggg ctgcagaaaa tcctcaacgt 480
gcagaagaag ctccccatta ttcaaaagat catcattatg gatagcaaga cagattacca 540
agggttccag tcgatgtata cctttgtgac atcgcatttg ccgccagggt ttaacgagta 600
tgacttcgtc cccgagtcat ttgacagaga taaaaccatc gcgctgatta tgaattcctc 660
gggtagcacc ggtttgccaa agggggtggc gttgccccac cgcactgctt gtgtgcggtt 720
ctcgcacgct agggatccta tctttggtaa tcagatcatt cccgacacag caatcctgtc 780
cgtggtacct tttcatcacg gttttggcat gttcacgact ctcggctatt tgatttgcgg 840
tttcagggtc gtacttatgt atcggttcga ggaagaactg tttttgagat ccttgcaaga 900
ttacaagatc cagtcggccc tccttgtgcc aacgcttttc tcattctttg cgaaatcgac 960
acttattgat aagtatgacc tttccaatct gcatgagatt gcctcagggg gagcgccgct 1020
tagcaaggaa gtcggggagg cagtggccaa gcgcttccac cttcccggaa ttcggcaggg 1080
atacgggctc acggagacaa catccgcgat ccttatcacg cccgagggtg acgataagcc 1140
gggagccgtc ggaaaagtgg tccccttctt tgaagccaag gtcgtagacc tcgacacggg 1200
aaaaaccctc ggagtgaacc agaggggcga gctctgcgtg agagggccga tgatcatgtc 1260
aggttacgtg aataaccctg aagcgacgaa tgcgctgatc gacaaggatg ggtggttgca 1320
ttcgggagac attgcctatt gggatgagga tgagcacttc tttatcgtag atcgacttaa 1380
gagcttgatc aaatacaaag gctatcaggt agcgcctgcc gagctcgagt caatcctgct 1440
ccagcacccc aacattttcg acgccggagt ggccgggttg cccgatgacg acgcgggtga 1500
gctgccagcg gccgtggtag tcctcgaaca tgggaaaaca atgaccgaaa aggagatcgt 1560
ggactacgta gcatcacaag tgacgactgc gaagaaactg aggggagggg tagtctttgt 1620
ggacgaggtc ccgaaaggct tgactgggaa gcttgacgct cgcaaaatcc gggaaatcct 1680
gattaaggca aagaaaggcg ggaaaatcgc tgtctgataa gctgccttct gcggggcttg 1740
ccttctggcc atgcccttct tctctccctt gcacctgtac ctcttggtct ttgaataaag 1800
cctgagtagg aaggcggccg ctcgagcatg catctaga 1838
<210> 3
<211> 1796
<212> RNA
<213> Homo sapiens
<400> 3
gggaaauaag agagaaaaga agaguaagaa gaaauauaag agccaccaug gaagaugcga 60
agaacaucaa gaagggaccu gccccguuuu acccuuugga ggacgguaca gcaggagaac 120
agcuccacaa ggcgaugaaa cgcuacgccc ugguccccgg aacgauugcg uuuaccgaug 180
cacauauuga gguagacauc acauacgcag aauacuucga aaugucggug aggcuggcgg 240
aagcgaugaa gagauauggu cuuaacacua aucaccgcau cguggugugu ucggagaacu 300
cauugcaguu uuucaugccg guccuuggag cacuuuucau cggggucgca gucgcgccag 360
cgaacgacau cuacaaugag cgggaacucu ugaauagcau gggaaucucc cagccgacgg 420
ucguguuugu cuccaaaaag gggcugcaga aaauccucaa cgugcagaag aagcucccca 480
uuauucaaaa gaucaucauu auggauagca agacagauua ccaaggguuc cagucgaugu 540
auaccuuugu gacaucgcau uugccgccag gguuuaacga guaugacuuc guccccgagu 600
cauuugacag agauaaaacc aucgcgcuga uuaugaauuc cucggguagc accgguuugc 660
caaagggggu ggcguugccc caccgcacug cuugugugcg guucucgcac gcuagggauc 720
cuaucuuugg uaaucagauc auucccgaca cagcaauccu guccguggua ccuuuucauc 780
acgguuuugg cauguucacg acucucggcu auuugauuug cgguuucagg gucguacuua 840
uguaucgguu cgaggaagaa cuguuuuuga gauccuugca agauuacaag auccagucgg 900
cccuccuugu gccaacgcuu uucucauucu uugcgaaauc gacacuuauu gauaaguaug 960
accuuuccaa ucugcaugag auugccucag ggggagcgcc gcuuagcaag gaagucgggg 1020
aggcaguggc caagcgcuuc caccuucccg gaauucggca gggauacggg cucacggaga 1080
caacauccgc gauccuuauc acgcccgagg gugacgauaa gccgggagcc gucggaaaag 1140
ugguccccuu cuuugaagcc aaggucguag accucgacac gggaaaaacc cucggaguga 1200
accagagggg cgagcucugc gugagagggc cgaugaucau gucagguuac gugaauaacc 1260
cugaagcgac gaaugcgcug aucgacaagg augggugguu gcauucggga gacauugccu 1320
auugggauga ggaugagcac uucuuuaucg uagaucgacu uaagagcuug aucaaauaca 1380
aaggcuauca gguagcgccu gccgagcucg agucaauccu gcuccagcac cccaacauuu 1440
ucgacgccgg aguggccggg uugcccgaug acgacgcggg ugagcugcca gcggccgugg 1500
uaguccucga acaugggaaa acaaugaccg aaaaggagau cguggacuac guagcaucac 1560
aagugacgac ugcgaagaaa cugaggggag ggguagucuu uguggacgag gucccgaaag 1620
gcuugacugg gaagcuugac gcucgcaaaa uccgggaaau ccugauuaag gcaaagaaag 1680
gcgggaaaau cgcugucuga uaagcugccu ucugcggggc uugccuucug gccaugcccu 1740
ucuucucucc cuugcaccug uaccucuugg ucuuugaaua aagccugagu aggaag 1796
<210> 4
<211> 854
<212> RNA
<213> Homo sapiens
<400> 4
gggaaauaag agagaaaaga agaguaagaa gaaauauaag agccaccaug guauccaagg 60
gggaggagga caacauggcg aucaucaagg aguucaugcg auucaaggug cacauggaag 120
guucggucaa cggacacgaa uuugaaaucg aaggagaggg ugaaggaagg cccuaugaag 180
ggacacagac cgcgaaacuc aaggucacga aagggggacc acuuccuuuc gccugggaca 240
uucuuucgcc ccaguuuaug uacgggucca aagcauaugu gaagcauccc gccgauauuc 300
cugacuaucu gaaacucagc uuucccgagg gauucaagug ggagcggguc augaacuuug 360
aggacggggg uguagucacc guaacccaag acucaagccu ccaagacggc gaguucaucu 420
acaaggucaa acugcggggg acuaacuuuc cgucggaugg gccggugaug cagaagaaaa 480
cgaugggaug ggaagcguca ucggagagga uguacccaga agauggugca uugaaggggg 540
agaucaagca gagacugaag uugaaagaug ggggacauua ugaugccgag gugaaaacga 600
cauacaaagc gaaaaagccg gugcagcuuc ccggagcgua uaaugugaau aucaaguugg 660
auauuacuuc acacaaugag gacuacacaa uugucgaaca guacgaacgc gcugagggua 720
gacacucgac gggaggcaug gacgaguugu acaaaugaua agcugccuuc ugcggggcuu 780
gccuucuggc caugcccuuc uucucucccu ugcaccugua ccucuugguc uuugaauaaa 840
gccugaguag gaag 854
<210> 5
<211> 725
<212> RNA
<213> Homo sapiens
<400> 5
gggaaauaag agagaaaaga agaguaagaa gaaauauaag agccaccaug ggagugcacg 60
agugucccgc gugguugugg uugcugcugu cgcucuugag ccucccacug ggacugccug 120
ugcugggggc accacccaga uugaucugcg acucacgggu acuugagagg uaccuucuug 180
aagccaaaga agccgaaaac aucacaaccg gaugcgccga gcacugcucc cucaaugaga 240
acauuacugu accggauaca aaggucaauu ucuaugcaug gaagagaaug gaaguaggac 300
agcaggccgu cgaagugugg caggggcucg cgcuuuuguc ggaggcggug uugcgggguc 360
aggcccuccu cgucaacuca ucacagccgu gggagccccu ccaacuucau gucgauaaag 420
cggugucggg gcuccgcagc uugacgacgu ugcuucgggc ucugggcgca caaaaggagg 480
cuauuucgcc gccugacgcg gccuccgcgg caccccuccg aacgaucacc gcggacacgu 540
uuaggaagcu uuuuagagug uacagcaauu uccuccgcgg aaagcugaaa uuguauacug 600
gugaagcgug uaggacaggg gaucgcugau aagcugccuu cugcggggcu ugccuucugg 660
ccaugcccuu cuucucuccc uugcaccugu accucuuggu cuuugaauaa agccugagua 720
ggaag 725
<210> 6
<211> 1536
<212> RNA
<213> Homo sapiens
<400> 6
gggaaauaag agagaaaaga agaguaagaa gaaauauaag agccaccaau gcagcgcguc 60
aacaugauua uggccgaauc gccgggacuc aucacaaucu gccucuuggg uuaucucuug 120
ucggcagaau guaccguguu cuuggaucac gaaaacgcga acaaaauucu uaaucgcccg 180
aagcgguaua acuccgggaa acuugaggag uuugugcagg gcaaucuuga acgagagugc 240
auggaggaga aaugcuccuu ugaggaggcg agggaagugu uugaaaacac agagcgaaca 300
acggaguuuu ggaagcaaua cguagauggg gaccagugug agucgaaucc gugccucaau 360
gggggaucau guaaagauga caucaauagc uaugaaugcu ggugcccguu uggguuugaa 420
gggaagaacu gugagcugga ugugacgugc aacaucaaaa acggacgcug ugagcaguuu 480
uguaagaacu cggcugacaa uaagguagua ugcucgugca cagagggaua ccggcuggcg 540
gagaaccaaa aaucgugcga gcccgcaguc ccguucccuu gugggagggu gagcguguca 600
cagacuagca aguugacgag agcggagacu guauuccccg acguggacua cgucaacagc 660
accgaagccg aaacaauccu cgauaacauc acgcagagca cucaguccuu caaugacuuu 720
acgagggucg uaggugguga ggacgcgaaa cccggucagu uccccuggca ggugguauug 780
aacggaaaag ucgaugccuu uuguggaggu uccauuguca acgagaagug gauugucaca 840
gcggcacacu gcguagaaac aggagugaaa aucacgguag uggcgggaga gcauaacauu 900
gaagagacag agcacacgga acaaaagcga aaugucauca gaaucauucc acaccauaac 960
uauaacgcgg caaucaauaa guacaaucac gacaucgcac uuuuggagcu ugacgaaccu 1020
uuggugcuua auucguacgu caccccuauu uguauugccg acaaagagua uacaaacauc 1080
uucuugaaau ucggcuccgg guacguaucg ggcuggggca gaguguucca uaaggguaga 1140
uccgcacugg uguugcaaua ccucagggug ccccucgugg aucgagccac uugucugcgg 1200
uccaccaaau ucacaaucua caacaauaug uucugugcgg gauuccauga aggugggaga 1260
gauagcugcc agggagacuc aggggguccc cacgugacgg aagucgaggg gacgucauuu 1320
cugacgggaa uuaucucaug gggagaggaa ugugcgauga aggggaaaua uggcaucuac 1380
acuaaagugu cacgguaugu caauuggauc aaggaaaaga cgaaacucac gugaucagcc 1440
agcgcugccu ucugcggggc uugccuucug gccaugcccu ucuucucucc cuugcaccug 1500
uaccucuugg ucuuugaaua aagccugagu aggaag 1536
Claims (72)
- 목적하는 폴리펩타이드를 암호화하는 단리된 폴리뉴클레오타이드로서, 상기 단리된 폴리뉴클레오타이드는,
(a) A, G, U 또는 C 뉴클레오사이드 또는 뉴클레오타이드의 화학 구조와 비교하여 하나 이상의 변형된 뉴클레오사이드들 또는 뉴클레오타이드들을 포함하는, n개의 연결된 뉴클레오사이드들 또는 뉴클레오타이드들의 서열,
(b) 하나 이상의 코작(Kozak) 서열을 포함하는 5' UTR,
(c) 3' UTR, 및
(d) 하나 이상의 5' 캡 구조(cap structure)
를 포함하는, 목적하는 폴리펩타이드를 암호화하는 단리된 폴리뉴클레오타이드. - 제1항에 있어서, 폴리-A 테일(tail)을 추가로 포함하는, 단리된 폴리뉴클레오타이드.
- 제2항에 있어서, 정제되는, 단리된 폴리뉴클레오타이드.
- 제3항에 있어서, 상기 하나 이상의 5' 캡 구조가, 캡 0, 캡 1, ARCA, 이노신, N1-메틸-구아노신, 2'플루오로-구아노신, 7-데아자-구아노신, 8-옥소-구아노신, 2-아미노-구아노신, LNA-구아노신, 및 2-아지도-구아노신으로 이루어진 그룹으로부터 선택되는, 단리된 폴리뉴클레오타이드.
- 제4항에 있어서, 상기 뉴클레오사이드의 변형이 뉴클레오사이드 염기 및/또는 뉴클레오사이드의 당 부분에 위치하는, 단리된 폴리뉴클레오타이드.
- 제5항에 있어서, 상기 변형이 뉴클레오타이드 염기에 위치하고, 상기 뉴클레오사이드 염기는 하기 화학식을 갖는, 단리된 폴리뉴클레오타이드:
[화학식 XII-a]
[화학식 XII-b]
[화학식 XII-c]
상기 화학식 XII-a 내지 화학식 XIIc에서,
는 단일 결합 또는 이중 결합을 나타내고;
X는 O 또는 S이며;
U 및 W는 각각 독립적으로 C 또는 N이고;
V는 O, S, C 또는 N이며;
여기서, V가 C인 경우에 R1은 H, C1 -6 알킬, C1 -6 알케닐, C1 -6 알키닐, 할로, 또는 -ORc이고, 여기서, C1 -20 알킬, C2 -20 알케닐, C2 -20 알키닐은 각각, -OH, -NRaRb, -SH, -C(O)Rc, -C(O)ORc, -NHC(O)Rc, 또는 -NHC(O)ORc로 임의로 치환되며;
여기서, V가 O, S, 또는 N인 경우에 R1은 부재하고;
R2는 H, -ORc, -SRc, -NRaRb, 또는 할로이거나;
V가 C인 경우에 R1 및 R2는, 이들이 부착된 탄소 원자들과 함께, 할로, -OH, -SH, -NRaRb, C1 -20 알킬, C2 -20 알케닐, C2 -20 알키닐, C1 -20 알콕시, 또는 C1 -20 티오알킬로부터 선택되는 1 내지 4개의 치환체들로 임의로 치환된 5- 또는 6-원 환을 형성할 수 있고;
R3은 H 또는 C1-20 알킬이며;
R4는 H 또는 C1 -20 알킬이고; 여기서, 가 이중 결합을 나타내는 경우에 R4는 부재하거나, N-R4가 함께, C1 -20 알킬로 치환된 양으로 하전된 N을 형성하고;
Ra 및 Rb 는 각각 독립적으로 H, C1-20 알킬, C2-20 알케닐, C2-20 알키닐, 또는 C6-20 아릴이며;
Rc는 H, C1-20 알킬, C2-20 알케닐, 페닐, 벤질, 폴리에틸렌 글리콜 그룹, 또는 아미노-폴리에틸렌 글리콜 그룹이다. - 제7항에 있어서, 상기 R3이 C1 -4 알킬인, 단리된 폴리뉴클레오타이드.
- 제7항에 있어서, 상기 R3이 CH3인, 단리된 폴리뉴클레오타이드.
- 제1항에 있어서, 상기 변형된 뉴클레오사이드가 슈도우리딘(Ψ) 또는 5-메틸-사이티딘(m5C)이 아닌, 단리된 폴리뉴클레오타이드.
- 제6항의 단리된 폴리뉴클레오타이드 및 약제학적으로 허용되는 부형제를 포함하는, 약제학적 조성물.
- 제11항에 있어서, 상기 부형제가, 용매, 수성 용매, 비-수성 용매, 분산 매질, 희석제, 분산제, 현탁 보조제, 계면 활성제, 등장성 제제, 증점제 또는 유화제, 방부제, 지질, 리피도이드(lipidoid), 리포좀, 지질 나노입자, 코어-쉘 나노입자(core-shell nanoparticle), 중합체, 리포플렉스 펩타이드(lipoplexe peptide), 단백질, 세포, 히알루로니다제, 및 이들의 혼합물로부터 선택되는, 약제학적 조성물.
- 제6항의 단리된 폴리뉴클레오타이드를 포유동물 대상체에게 투여함을 포함하는, 포유동물 대상체에서 목적한 폴리펩타이드의 수준을 증가시키는 방법.
- 제13항에 있어서, 상기 폴리뉴클레오타이드가 제형화되는, 방법.
- 제13항에 있어서, 상기 단리된 폴리뉴클레오타이드가 TNF-알파 또는 IFN-알파에 대해 100 초과의 단백질:사이토카인 비를 갖는, 방법.
- 제13항에 있어서, 상기 단리된 폴리뉴클레오타이드가 1㎍ 내지 150㎍의 총 1일 용량으로 투여되는, 방법.
- 제16항에 있어서, 상기 투여가 주사에 의해 것인, 방법.
- 제16항에 있어서, 상기 투여가 피내 또는 피하 또는 근육내인, 방법.
- 제13항에 있어서, 상기 포유동물의 혈청 내의 목적한 폴리펩타이드의 수준이 투여 후 적어도 2시간째에 50pg/mL 이상인, 방법.
- 제19항에 있어서, 상기 포유동물의 혈청 내의 목적한 폴리펩타이드의 수준이 투여 후 적어도 72시간 동안 50pg/mL 초과로 잔존하는, 방법.
- 제20항에 있어서, 상기 포유동물의 혈청 내의 목적한 폴리펩타이드의 수준이 투여 후 적어도 72시간 동안 60pg/mL 초과로 잔존하는, 방법.
- 제13항에 있어서, 상기 투여가, 2회 이상의 동등하거나 동등하지 않은 분할 용량들로 이루어지는, 방법.
- 제22항에 있어서, 상기 분할 용량들의 폴리펩타이드를 투여함으로써 대상체에 의해 생산된 폴리펩타이드의 수준이, 단일 투여로서 폴리뉴클레오타이드의 동일한 총 1일 용량을 투여함으로써 생산된 수준보다 더 큰, 방법.
- 제13항에 있어서, 상기 포유동물 대상체가, 목적한 폴리펩타이드의 증가된 수준을 필요로 하는 사람 환자인, 방법.
- 제24항에 있어서, 상기 목적한 폴리펩타이드의 증가된 수준이, 상기 환자의 체액 내에서 검출가능한, 방법.
- 제53항에 있어서, 상기 체액이, 말초 혈액, 혈청, 혈장, 복수액, 뇨, 뇌척수액(CSF), 객담, 타액, 골수, 윤활액, 수성 체액, 양수, 귀지(cerumen), 모유, 기관지 폐포 세척액, 정액, 전립선액, 쿠퍼액(cowper's fluid) 또는 전-사정액(pre-ejaculatory fluid), 땀, 대변, 모발, 눈물, 낭액(cyst fluid), 흉막액 및 복막액, 심막액, 림프, 미즙(chyme), 암죽(chyle), 담즙, 간질액, 월경, 고름, 피지, 구토, 질 분비액, 점막 분비액, 대변 물, 췌액, 비강 세척액, 기관지폐 흡인물들, 배난강액(blastocyl cavity fluid), 및 제대혈로 이루어진 그룹으로부터 선택되는, 방법.
- 제24항에 있어서, 상기 투여가, 시간, 일, 주, 달, 또는 년의 과정에 걸쳐 일어나는 투약 용법(dosing regimen)에 따른 것인, 방법.
- 제17항에 있어서, 상기 주사가, 다중-니들 주사 시스템, 카테터(catheter) 또는 내강 시스템(lumen system), 및 초음파, 전기 또는 방사선 기반 시스템으로부터 선택되는 하나 이상의 장치들을 사용함으로써 달성되는, 방법.
- 제22항에 있어서, 임의의 용량으로 투여된 폴리뉴클레오타이드의 양이 실질적으로 동등한, 방법.
- 제22항에 있어서, 복수 용량들 중 제1 용량, 제2 용량 또는 어느 용량이 실질적으로 동시에 투여되는, 방법.
- 제13항에 있어서, 상기 투여가 약 10mg/kg 내지 약 500mg/kg의 단일 단위 용량을 포함하는, 방법.
- 제13항에 있어서, 상기 투여가 약 1.0mg/kg 내지 약 10mg/kg의 단일 단위 용량을 포함하는, 방법.
- 제13항에 있어서, 상기 투여가 약 0.001mg/kg 내지 약 1.0mg/kg의 단일 단위 용량을 포함하는, 방법.
- 제4항에 있어서, 상기 뉴클레오사이드의 변형이, 피리미딘 핵염기의 원자를 아민, SH, 메틸 또는 에틸, 또는 클로로 또는 플루오로로 대체하거나 치환함을 포함하는, 단리된 폴리뉴클레오타이드.
- 제1항에 있어서, 상기 n개의 연결된 뉴클레오사이드들이, 하기 화학식 Ia의 화합물, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체를 포함하는, 단리된 폴리뉴클레오타이드:
[화학식 Ia]
상기 화학식 Ia에서,
U는 O, S, N(RU)nu, 또는 C(RU)nu이고, 여기서, nu는 0 내지 2의 정수이고, 각각의 RU는 독립적으로 H, 할로, 또는 임의로 치환된 알킬이며;
는 단일 결합 또는 이중 결합이고;
는 단일 결합이거나, 부재하며;
각각의 R1', R2', R1 ", R2", R1, R2, R3, R4, 및 R5는, 존재하는 경우, 독립적으로, H, 할로, 하이드록시, 티올, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시, 임의로 치환된 하이드록시알콕시, 임의로 치환된 아미노, 아지도, 임의로 치환된 아릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐이거나, 부재하고; 여기서, R3과, R1', R1 ", R2', R2 ", 또는 R5 중 하나 이상과의 조합은 함께 결합하여, 임의로 치환된 알킬렌 또는 임의로 치환된 헤테로알킬렌을 형성할 수 있고, 상기 조합은, 이들이 부착된 탄소들과 함께, 임의로 치환된 헤테로사이클릴을 제공하며; 여기서, R5와, R1', R1 ", R2', 또는 R2" 중 하나 이상과의 조합은 함께 결합하여, 임의로 치환된 알킬렌 또는 임의로 치환된 헤테로알킬렌을 형성할 수 있으며, 상기 조합은, 이들이 부착된 탄소들과 함께, 임의로 치환된 헤테로사이클릴을 제공하며; 여기서, R4와, R1', R1 ", R2', R2 ", R3, 또는 R5 중 하나 이상과의 조합은 함께 결합하여, 임의로 치환된 알킬렌 또는 임의로 치환된 헤테로알킬렌을 형성할 수 있으며, 상기 조합은, 이들이 부착된 탄소들과 함께, 임의로 치환된 헤테로사이클릴을 제공하고;
각각의 m' 및 m"은 독립적으로 0 내지 3의 정수이고;
각각의 Y1, Y2, 및 Y3은, 독립적으로, O, S, Se, -NRN1-, 임의로 치환된 알킬렌, 또는 임의로 치환된 헤테로알킬렌이며, 여기서, RN1은 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 아릴이거나, 부재하고;
각각의 Y4는, 독립적으로, H, 하이드록시, 티올, 보라닐, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 티오알콕시, 임의로 치환된 알콕시알콕시, 또는 임의로 치환된 아미노이며;
각각의 Y5는, 독립적으로, O, S, Se, 임의로 치환된 알킬렌, 또는 임의로 치환된 헤테로알킬렌이고;
n은 1 내지 100,000의 정수이며;
B는 핵염기이다. - 제35항에 있어서, B가 슈도우리딘(Ψ) 또는 5-메틸-사이티딘(m5C)가 아닌, 단리된 폴리뉴클레오타이드.
- 제35항 또는 제36항에 있어서,
U가 O 또는 C(RU)nu이고, 여기서, nu는 1 내지 2의 정수이고, 각각의 RU는, 독립적으로, H, 할로, 또는 임의로 치환된 알킬이고;
각각의 R1, R1', R1", R2, R2', 및 R2"은, 존재하는 경우, 독립적으로, H, 할로, 하이드록시, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시, 임의로 치환된 아미노, 아지도, 임의로 치환된 아릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 또는 임의로 치환된 아미노알키닐이며;
각각의 R3 및 R4는, 독립적으로, H, 할로, 하이드록시, 임의로 치환된 알킬, 또는 임의로 치환된 알콕시알콕시이고;
각각의 Y1, Y2, 및 Y3은, 독립적으로, O, S, Se, -NRN1-, 임의로 치환된 알킬렌, 또는 임의로 치환된 헤테로알킬렌이고, 여기서, RN1은 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 또는 임의로 치환된 알키닐이며;
각각의 Y4는, 독립적으로, H, 하이드록시, 티올, 보라닐, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 티오알콕시, 또는 임의로 치환된 아미노이고;
각각의 Y5는, 독립적으로 O 또는 임이 치환된 알킬렌이며;
n은 1 내지 10,000의 정수이다. - 제37항에 있어서, 각각의 R1, R1' 및 R1"이, 존재하는 경우, H인, 단리된 폴리뉴클레오타이드.
- 제38항에 있어서, 각각의 R2, R2' 및 R2 "이, 존재하는 경우, 독립적으로 H, 할로, 하이드록시, 임의로 치환된 알콕시, 또는 임의로 치환된 알콕시알콕시인, 단리된 폴리뉴클레오타이드.
- 제39항에 있어서, 각각의 R2, R2' 및 R2"이, 존재하는 경우, H인, 단리된 폴리뉴클레오타이드.
- 제40항에 있어서, 각각의 R1, R1' 및 R1"이, 존재하는 경우, 독립적으로, H, 할로, 하이드록시, 임의로 치환된 알콕시, 또는 임의로 치환된 알콕시알콕시인, 단리된 폴리뉴클레오타이드.
- 제43항에 있어서, 상기 n개의 연결된 뉴클레오사이드들이 하기 화학식 IIb-1, 화학식 IIb-2, 또는 화학식 IIc-1 내지 화학식 IIc-4의 화합물을 포함하는, 단리된 폴리뉴클레오타이드.
- 제48항에 있어서, 상기 n개의 연결된 뉴클레오사이드들이 하기 화학식 IIm의 화합물, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체를 포함하는, 단리된 폴리뉴클레오타이드:
[화학식 IIm]
상기 화학식 IIm에서,
각각의 R1', R1", R2', 및 R2"은, 독립적으로, H, 할로, 하이드록시, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시이거나, 또는 부재하고; 여기서, R2'과 R3의 조합 또는 R2 "과 R3의 조합은 함께, 임의로 치환된 알킬렌 또는 임의로 치환된 헤테로알킬렌을 형성할 수 있다. - 제38항 내지 제50항 중 어느 한 항에 있어서,
U가 O 또는 C(RU)nu이고, 여기서, nu는 1 내지 2의 정수이며, 각각의 RU는, 독립적으로, H, 할로, 또는 임의로 치환된 알킬이고;
각각의 R1 및 R2는, 독립적으로, H, 할로, 하이드록시, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시, 임의로 치환된 아미노, 아지도, 임의로 치환된 아릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 또는 임의로 치환된 아미노알키닐이며;
각각의 R3 및 R4는, 독립적으로, H 또는 임의로 치환된 알킬이고;
각각의 Y1, Y2, 및 Y3은, 독립적으로, O, S, Se, -NRN1-, 임의로 치환된 알킬렌, 또는 임의로 치환된 헤테로알킬렌이고, 여기서, RN1은 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 또는 임의로 치환된 알키닐이며,
각각의 Y4는, 독립적으로, H, 하이드록시, 티올, 보라닐, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 티오알콕시, 또는 임의로 치환된 아미노이며;
각각의 Y5는, 독립적으로, O 또는 임의로 치환된 알킬렌이고;
n은 10 내지 10,000의 정수인, 단리된 폴리뉴클레오타이드. - 제35항에 있어서, 상기 n개의 연결된 폴리뉴클레오사이드들이 하기 화학식 IIn의 화합물, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체를 포함하는, 단리된 폴리뉴클레오타이드:
[화학식 IIn]
상기 화학식 IIn에서,
U는 O 또는 C(RU)nu이고, 여기서, nu는 1 내지 2의 정수이며, 각각의 RU는 독립적으로, H, 할로, 또는 임의로 치환된 알킬이고;
각각의 R1 및 R4는, 독립적으로, H, 할로, 하이드록시, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시, 임의로 치환된 아미노, 아지도, 임의로 치환된 아릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 또는 임의로 치환된 아미노알키닐이고;
R3'은 O, S, 또는 -NRN1-이고, 여기서, RN1은 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 또는 임의로 치환된 아릴이며;
R3"은 임의로 치환된 알킬렌 또는 임의로 치환된 헤테로알킬렌이고;
각각의 Y1, Y2, 및 Y3는, 독립적으로, O, S, Se, -NRN1-, 임의로 치환된 알킬렌, 또는 임의로 치환된 헤테로알킬렌이고, 여기서, RN1은 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 또는 임의로 치환된 알키닐이며;
각각의 Y4는, 독립적으로, H, 하이드록시, 티올, 보라닐, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 티오알콕시, 또는 임의로 치환된 아미노이고;
각각의 Y5는, 독립적으로, O, S, 임의로 치환된 알킬렌(예를 들면, 메틸렌), 또는 임의로 치환된 헤테로알킬렌이며;
n은 10 내지 10,000의 정수이다. - 제35항에 있어서, 상기 n개의 연결된 폴리뉴클레오사이드들이 화학식 IIn-1 또는 화학식 II-n2의 화합물을 포함하는, 단리된 폴리뉴클레오타이드.
- 제35항 내지 제53항 중 어느 한 항에 있어서, 각각의 B가, 하기 화학식 b1 내지 화학식 b5로부터 선택되는 화학식의 화합물, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체를 갖는, 단리된 폴리뉴클레오타이드, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체:
[화학식 b1]
[화학식 b2]
[화학식 b3]
[화학식 b4]
[화학식 b5]
상기 화학식 b1 내지 화학식 b5에서,
는 단일 결합 또는 이중 결합이고;
각각의 T1', T1", T2', 및 T2"은, 독립적으로, H, 임의로 치환된 알킬, 임의로 치환된 알콕시, 또는 임의로 치환된 티오알콕시이거나, 또는 T1'과 T1 "의 조합이 함께 결합하여 또는 T2'과 T2 "의 조합이 함께 결합하여(예를 들면, T2에서와 같이), O(옥소), S(티오), 또는 Se(셀레노)를 형성하고;
각각의 V1 및 V2는, 독립적으로, O, S, N(RVb)nv, 또는 C(RVb)nv이고, 여기서, nv는 0 내지 2의 정수이며, 각각의 RVb는, 독립적으로, H, 할로, 임의로 치환된 아미노산, 임의로 치환된 알킬, 임의로 치환된 할로알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐, 임의로 치환된 아실아미노알킬, 임의로 치환된 알콕시카보닐알킬, 임의로 치환된 알콕시카보닐알케닐, 임의로 치환된 알콕시카보닐알키닐, 또는 임의로 치환된 알콕시카보닐알콕시이며;
R10은 H, 할로, 임의로 치환된 아미노산, 하이드록시, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 아미노알킬, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐, 임의로 치환된 알콕시, 임의로 치환된 알콕시카보닐알킬, 임의로 치환된 알콕시카보닐알케닐, 임의로 치환된 알콕시카보닐알키닐, 임의로 치환된 알콕시카보닐알콕시, 임의로 치환된 카복시알콕시, 임의로 치환된 카복시알킬, 또는 임의로 치환된 카바모일알킬이고;
R11은 H 또는 임의로 치환된 알킬이며;
R12a는 H, 임의로 치환된 알킬, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 또는 임의로 치환된 아미노알키닐, 임의로 치환된 카복시알킬, 임의로 치환된 카복시알콕시, 임의로 치환된 카복시아미노알킬, 또는 임의로 치환된 카바모일알킬이고;
R12c는 H, 할로, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 티오알콕시, 임의로 치환된 아미노, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 또는 임의로 치환된 아미노알키닐이다. - 제35항 내지 제54항 중 어느 한 항에 있어서, B가 하기 화학식 b6 내지 b9의 화합물, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체를 포함하는, 단리된 폴리뉴클레오타이드:
[화학식 b6]
[화학식 b7]
[화학식 b8]
[화학식 b9]
상기 화학식 b6 내지 화학식 b9에서,
는 단일 결합 또는 이중 결합이고;
각각의 T1', T1", T2', 및 T2"은, 독립적으로, H, 임의로 치환된 알킬, 임의로 치환된 알콕시, 또는 임의로 치환된 티오알콕시이거나, T1'과 T1 "의 조합이 함께 결합하여 또는 T2'과 T2 "의 조합이 함께 결합하여, O(옥소), S(티오), 또는 Se(셀레노)를 형성하거나, 각각의 T1 및 T2는, 독립적으로, O(옥소), S(티오), 또는 Se(셀레노)이며;
각각의 W1 및 W2는, 독립적으로, N(RWa)nw 또는 C(RWa)nw이고, 여기서, nw는 0 내지 2의 정수이며, 각각의 RWa는, 독립적으로, H, 임의로 치환된 알킬, 또는 임의로 치환된 알콕시이고;
각각의 V3는, 독립적으로, O, S, N(RVa)nv, 또는 C(RVa)nv이며, 여기서, nv는 0 내지 2의 정수이고 각각의 RVa는, 독립적으로, H, 할로, 임의로 치환된 아미노산, 임의로 치환된 알킬, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 헤테로사이클릴, 임의로 치환된 알크헤테로사이클릴, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 또는 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐, 임의로 치환된 아실아미노알킬, 임의로 치환된 알콕시카보닐알킬, 임의로 치환된 알콕시카보닐알케닐, 임의로 치환된 알콕시카보닐알키닐, 임의로 치환된 알콕시카보닐아실, 임의로 치환된 알콕시카보닐알콕시, 임의로 치환된 카복시알킬, 임의로 치환된 카복시알콕시, 임의로 치환된 카복시아미노알킬, 또는 임의로 치환된 카바모일알킬이고, 여기서, RVa 및 R12c는 이들이 부착된 탄소 원자들과 함께, 임의로 치환된 사이클로알킬, 임의로 치환된 아릴, 또는 임의로 치환된 헤테로사이클릴을 형성할 수 있고;
R12a는 H, 임의로 치환된 알킬, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐, 임의로 치환된 카복시알킬, 임의로 치환된 카복시알콕시, 임의로 치환된 카복시아미노알킬, 임의로 치환된 카바모일알킬이거나, 부재하며;
R12b는 H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐, 임의로 치환된 알크아릴, 임의로 치환된 헤테로사이클릴, 임의로 치환된 알크헤테로사이클릴, 임의로 치환된 아미노산, 임의로 치환된 알콕시카보닐아실, 임의로 치환된 알콕시카보닐알콕시, 임의로 치환된 알콕시카보닐알킬, 임의로 치환된 알콕시카보닐알케닐, 임의로 치환된 알콕시카보닐알키닐, 임의로 치환된 알콕시카보닐알콕시, 임의로 치환된 카복시알킬, 임의로 치환된 카복시알콕시, 임의로 치환된 카복시아미노알킬, 또는 임의로 치환된 카바모일알킬이고,
여기서, R12b와 T1'의 조합 또는 R12b와 R12c의 조합은 함께 결합하여, 임의로 치환된 헤테로사이클릴을 형성할 수 있고;
R12c는 H, 할로, 임의로 치환된 알킬, 임의로 치환된 알콕시, 임의로 치환된 티오알콕시, 임의로 치환된 아미노, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 또는 임의로 치환된 아미노알키닐이다. - 제55항에 있어서, R12a, R12b, R12c, 또는 RVa가, -(CH2)s2(OCH2CH2)s1(CH2)s3OR'[여기서, s1은 1 내지 10의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10의 정수이고, R'은 H 또는 C1 -20 알킬이다]; 또는 -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1[여기서, s1은 1 내지 10의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10의 정수이며, 각각의 RN1은, 독립적으로, 수소 또는 임의로 치환된 C1 -6 알킬이다]로 치환되는, 단리된 폴리뉴클레오타이드.
- 제55항에 있어서, B가 화학식 b28 내지 화학식 b31의 화합물을 포함하는, 단리된 폴리뉴클레오타이드.
- 제35항 내지 제57항 중 어느 한 항에 있어서, B가 하기 화학식 b10 내지 화학식 b14의 화합물, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체를 포함하는, 단리된 폴리뉴클레오타이드:
[화학식 b10]
[화학식 b11]
[화학식 b12]
[화학식 b13]
[화학식 b14]
상기 화학식 b10 내지 화학식 b14에서,
각각의 T3' 및 T3 "은, 독립적으로, H, 임의로 치환된 알킬, 임의로 치환된 알콕시, 또는 임의로 치환된 티오알콕시이거나, T3'과 T3'의 조합은 함께 결합하여 O(옥소), S(티오), 또는 Se(셀레노)를 형성하고;
각각의 V4는, 독립적으로, O, S, N(RVc)nv, 또는 C(RVc)nv이고, 여기서, nv는 0 내지 2의 정수이며, 각각의 RVc는, 독립적으로, H, 할로, 임의로 치환된 아미노산, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 헤테로사이클릴, 임의로 치환된 알크헤테로사이클릴, 또는 임의로 치환된 알키닐옥시이고, 여기서, R13b와 RVc의 조합은 함께, 임의로 치환된 헤테로사이클릴을 형성할 수 있고;
각각의 V5는, 독립적으로, N(RVd)nv, 또는 C(RVd)nv이며, 여기서, nv는 0 내지 2의 정수이고, 각각의 RVd는, 독립적으로, H, 할로, 임의로 치환된 아미노산, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 헤테로사이클릴, 임의로 치환된 알크헤테로사이클릴, 또는 임의로 치환된 알키닐옥시이며;
각각의 R13a 및 R13b는, 독립적으로, H, 임의로 치환된 아실, 임의로 치환된 아실옥시알킬, 임의로 치환된 알킬, 또는 임의로 치환된 알콕시이고, 여기서, R13b와 R14의 조합은 함께, 임의로 치환된 헤테로사이클릴을 형성할 수 있고;
각각의 R14는, 독립적으로, H, 할로, 하이드록시, 티올, 임의로 치환된 아실, 임의로 치환된 아미노산, 임의로 치환된 알킬, 임의로 치환된 할로알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 아미노알콕시, 임의로 치환된 알콕시알콕시, 임의로 치환된 아실옥시알킬, 임의로 치환된 아미노, 아지도, 임의로 치환된 아릴, 임의로 치환된 헤테로사이클릴, 임의로 치환된 알크헤테로사이클릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 또는 임의로 치환된 아미노알키닐이고;
각각의 R15 및 R16은, 독립적으로, H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 또는 임의로 치환된 알키닐이다. - 제58항에 있어서, B가 화학식 b32 내지 화학식 b36의 화합물을 포함하는, 단리된 폴리뉴클레오타이드.
- 제35항 내지 제59항 중 어느 한 항에 있어서, B가 다음 화학식 b15 내지 화학식 b17의 화합물, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체를 포함하는, 단리된 폴리뉴클레오타이드:
[화학식 b15]
[화학식 b16]
[화학식 b17]
상기 화학식 b15 내지 화학식 b17에서,
각각의 T4' , T4 ", T5', T5 ", T6' 및 T6 "은, 독립적으로, H, 임의로 치환된 알킬, 또는 임의로 치환된 알콕시이고, 여기서, T4'과 T4 "의 조합 또는 T5'과 T5 "의 조합이 함께 결합하여 또는 T6'과 T6 "의 조합이 함께 결합하여, O(옥소), S(티오), 또는 Se(셀레노)를 형성하고;
각각의 V5 및 V6은, 독립적으로, O, S, N(RVd)nv, 또는 C(RVd)nv이고, 여기서, nv는 0 내지 2의 정수이고, 각각의 RVd는, 독립적으로, H, 할로, 티올, 임의로 치환된 아미노산, 시아노, 아미딘, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 임의로 치환된 알키닐옥시, 임의로 치환된 티오알콕시, 또는 임의로 치환된 아미노이며;
각각의 R17, R18, R19a, R19b, R21, R22, R23, 및 R24는, 독립적으로, H, 할로, 티올, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 티오알콕시, 임의로 치환된 아미노, 또는 임의로 치환된 아미노산이다. - 제60항에 있어서, B가 화학식 b37 내지 화학식 b40의 화합물을 포함하는, 단리된 폴리뉴클레오타이드.
- 제35항 내지 제59항 중 어느 한 항에 있어서, B가 화학식 b18 내지 화학식 b20의 화합물, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체를 포함하는, 단리된 폴리뉴클레오타이드:
[화학식 b18]
[화학식 b19]
[화학식 b20]
상기 화학식 b18 내지 화학식 b20에서,
각각의 V7은, 독립적으로, O, S, N(RVe)nv, 또는 C(RVe)nv이고, 여기서, nv는 0 내지 2의 정수이며, 각각의 RVe는, 독립적으로, H, 할로, 임의로 치환된 아미노산, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 알케닐옥시, 또는 임의로 치환된 알키닐옥시이고;
각각의 R25는, 독립적으로, H, 할로, 티올, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 티오알콕시, 또는 임의로 치환된 아미노이며;
각각의 R26a 및 R26b는, 독립적으로, H, 임의로 치환된 아실, 임의로 치환된 아미노산, 임의로 치환된 카바모일알킬, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 하이드록시알키닐, 임의로 치환된 알콕시, 또는 폴리에틸렌 글리콜 그룹, 또는 아미노-폴리에틸렌 글리콜 그룹이고;
각각의 R27은, 독립적으로, H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 알콕시, 임의로 치환된 티오알콕시, 또는 임의로 치환된 아미노이며;
각각의 R28은, 독립적으로, H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 또는 임의로 치환된 알키닐이고;
각각의 R29는, 독립적으로, H, 임의로 치환된 아실, 임의로 치환된 아미노산, 임의로 치환된 카바모일알킬, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 하이드록시알킬, 임의로 치환된 하이드록시알케닐, 임의로 치환된 알콕시, 또는 임의로 치환된 아미노이다. - 제62항에 있어서, B가 화학식 b41 내지 화학식 b43의 화합물을 포함하는, 단리된 폴리뉴클레오타이드.
- 제62항에 있어서, R26a, R26b, 또는 R29가 -(CH2)s2(OCH2CH2)s1(CH2)s3OR'(여기서, s1은 1 내지 10의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10의 정수이며, R'은 H 또는 C1 -20 알킬이다); 또는 -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1(여기서, s1은 1 내지 10의 정수이고, 각각의 s2 및 s3은, 독립적으로, 0 내지 10의 정수이며, 각각의 RN1은, 독립적으로, 수소 또는 임의로 치환된 C1 -6 알킬이다)로 치환되는, 단리된 폴리뉴클레오타이드.
- 제35항 내지 제65항 중 어느 한 항에 있어서, B가 하기 화학식 b22의 화합물, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체를 포함하는, 단리된 폴리뉴클레오타이드:
[화학식 b22]
상기 화학식 b22에서,
R10'은, 독립적으로, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 아릴, 임의로 치환된 헤테로사이클릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐, 임의로 치환된 알콕시, 임의로 치환된 알콕시카보닐알킬, 임의로 치환된 알콕시카보닐알케닐, 임의로 치환된 알콕시카보닐알키닐, 임의로 치환된 알콕시카보닐알콕시, 임의로 치환된 카복시알콕시, 임의로 치환된 카복시알킬, 또는 임의로 치환된 카바모일알킬이며; R11은 H 또는 임의로 치환된 알킬이고; R12a는 H, 임의로 치환된 알킬, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐이거나, 또는 부재하며; 각각의 T1 및 T2는 독립적으로, O, S 또는 Se이다. - 제35항 내지 제67항 중 어느 한 항에 있어서, B가 하기 화학식 b24 또는 화학식 b25의 화합물을 포함하는, 단리된 폴리뉴클레오타이드:
[화학식 b24]
[화학식 b25]
상기 화학식 b24 또는 화학식 b25에서,
T3은 O, S, 또는 Se이고;
각각의 R13a 및 R13b는, 독립적으로, H, 임의로 치환된 아실, 임의로 치환된 알킬, 또는 임의로 치환된 알콕시이고, 여기서, R13b 및 R14의 조합은 함께, 임의로 치환된 헤테로사이클릴을 형성할 수 있으며;
R14'은, 독립적으로, 임의로 치환된 알킬, 임의로 치환된 알케닐, 임의로 치환된 알키닐, 임의로 치환된 아릴, 임의로 치환된 헤테로사이클릴, 임의로 치환된 알크헤테로사이클릴, 임의로 치환된 알크아릴, 임의로 치환된 아미노알킬, 임의로 치환된 아미노알케닐, 임의로 치환된 아미노알키닐, 임의로 치환된 알콕시, 임의로 치환된 알콕시카보닐알킬, 임의로 치환된 알콕시카보닐알케닐, 임의로 치환된 알콕시카보닐알키닐, 임의로 치환된 알콕시카보닐알콕시, 임의로 치환된 카복시알콕시, 임의로 치환된 카복시알킬, 또는 임의로 치환된 카바모일알킬이며;
각각의 R15는, 독립적으로, H, 임의로 치환된 알킬, 임의로 치환된 알케닐, 또는 임의로 치환된 알키닐이다. - 제35항 내지 제69항 중 어느 한 항에 있어서, B가 화학식 b28 내지 화학식 b43의 화합물을 포함하는, 단리된 폴리뉴클레오타이드.
- 제35항에 있어서, 상기 단리된 폴리뉴클레오타이드가, BB-1 내지 BB-274로부터 선택되는 하나 이상의 빌딩 블록(building block)들, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체로부터 제조되는, 단리된 폴리뉴클레오타이드.
- 제35항에 있어서, 상기 단리된 폴리뉴클레오타이드가, 화합물 1 내지 50으로부터 선택되는 하나 이상의 빌딩 블록, 또는 이의 약제학적으로 허용되는 염 또는 입체이성체로부터 제조되는, 단리된 폴리뉴클레오타이드.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161542533P | 2011-10-03 | 2011-10-03 | |
| US61/542,533 | 2011-10-03 | ||
| PCT/US2012/058519 WO2013052523A1 (en) | 2011-10-03 | 2012-10-03 | Modified nucleosides, nucleotides, and nucleic acids, and uses thereof |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197023887A Division KR20190099538A (ko) | 2011-10-03 | 2012-10-03 | 변형된 뉴클레오사이드, 뉴클레오타이드, 및 핵산, 및 이들의 용도 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20140068245A true KR20140068245A (ko) | 2014-06-05 |
| KR102014061B1 KR102014061B1 (ko) | 2019-08-28 |
Family
ID=48044115
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197023887A KR20190099538A (ko) | 2011-10-03 | 2012-10-03 | 변형된 뉴클레오사이드, 뉴클레오타이드, 및 핵산, 및 이들의 용도 |
| KR1020147011467A KR102014061B1 (ko) | 2011-10-03 | 2012-10-03 | 변형된 뉴클레오사이드, 뉴클레오타이드, 및 핵산, 및 이들의 용도 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197023887A KR20190099538A (ko) | 2011-10-03 | 2012-10-03 | 변형된 뉴클레오사이드, 뉴클레오타이드, 및 핵산, 및 이들의 용도 |
Country Status (25)
| Country | Link |
|---|---|
| US (4) | US9428535B2 (ko) |
| EP (4) | EP3682905B1 (ko) |
| JP (6) | JP6113737B2 (ko) |
| KR (2) | KR20190099538A (ko) |
| CN (2) | CN103974724B (ko) |
| AU (5) | AU2012318752B2 (ko) |
| BR (1) | BR112014007852B1 (ko) |
| CA (1) | CA2850624A1 (ko) |
| CY (1) | CY1125029T1 (ko) |
| DE (1) | DE19216461T1 (ko) |
| DK (1) | DK3682905T3 (ko) |
| ES (1) | ES2911677T3 (ko) |
| HK (1) | HK1200730A1 (ko) |
| HR (1) | HRP20220250T1 (ko) |
| HU (1) | HUE057725T2 (ko) |
| IL (2) | IL231808B (ko) |
| LT (1) | LT3682905T (ko) |
| MX (1) | MX354267B (ko) |
| PL (1) | PL3682905T3 (ko) |
| PT (1) | PT3682905T (ko) |
| RS (1) | RS62993B1 (ko) |
| RU (2) | RU2648950C2 (ko) |
| SG (2) | SG11201401196WA (ko) |
| SI (1) | SI3682905T1 (ko) |
| WO (1) | WO2013052523A1 (ko) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20180131577A (ko) * | 2016-03-31 | 2018-12-10 | 에트리스 게엠베하 | 신규의 최소 utr 서열 |
| US11878991B2 (en) | 2015-09-21 | 2024-01-23 | Trilink Biotechnologies, Llc | Compositions and methods for synthesizing 5′-Capped RNAs |
Families Citing this family (301)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE10229872A1 (de) | 2002-07-03 | 2004-01-29 | Curevac Gmbh | Immunstimulation durch chemisch modifizierte RNA |
| DE10347710B4 (de) | 2003-10-14 | 2006-03-30 | Johannes-Gutenberg-Universität Mainz | Rekombinante Impfstoffe und deren Verwendung |
| DE102005046490A1 (de) | 2005-09-28 | 2007-03-29 | Johannes-Gutenberg-Universität Mainz | Modifikationen von RNA, die zu einer erhöhten Transkriptstabilität und Translationseffizienz führen |
| PL3243526T3 (pl) | 2010-07-06 | 2020-05-18 | Glaxosmithkline Biologicals S.A. | Dostarczanie rna w celu wyzwolenia wielu szlaków immunologicznych |
| JP5940064B2 (ja) | 2010-07-06 | 2016-06-29 | ノバルティス アーゲー | 低用量のrnaを用いた大型哺乳動物の免疫化 |
| SI2590626T1 (sl) | 2010-07-06 | 2016-01-29 | Glaxosmithkline Biologicals S.A. | Liposomi z lipidi, ki imajo koristno pKa vrednost, za dostavo RNA |
| US8822663B2 (en) | 2010-08-06 | 2014-09-02 | Moderna Therapeutics, Inc. | Engineered nucleic acids and methods of use thereof |
| LT3970742T (lt) | 2010-08-31 | 2022-08-10 | Glaxosmithkline Biologicals S.A. | Pegilintos liposomos, skirtos imunogeną koduojančios rnr pristatymui |
| SG190679A1 (en) | 2010-10-01 | 2013-07-31 | Jason Schrum | Engineered nucleic acids and methods of use thereof |
| AU2011316707A1 (en) | 2010-10-11 | 2013-05-09 | Novartis Ag | Antigen delivery platforms |
| DE12722942T1 (de) | 2011-03-31 | 2021-09-30 | Modernatx, Inc. | Freisetzung und formulierung von manipulierten nukleinsäuren |
| HRP20230443T1 (hr) | 2011-05-24 | 2023-09-15 | BioNTech SE | Individualizirana cjepiva protiv raka |
| KR20200084048A (ko) | 2011-06-08 | 2020-07-09 | 샤이어 휴먼 지네틱 테라피즈 인크. | Mrna 전달을 위한 지질 나노입자 조성물 및 방법 |
| WO2013006838A1 (en) | 2011-07-06 | 2013-01-10 | Novartis Ag | Immunogenic combination compositions and uses thereof |
| US9464124B2 (en) | 2011-09-12 | 2016-10-11 | Moderna Therapeutics, Inc. | Engineered nucleic acids and methods of use thereof |
| KR20190099538A (ko) | 2011-10-03 | 2019-08-27 | 모더나 세라퓨틱스, 인코포레이티드 | 변형된 뉴클레오사이드, 뉴클레오타이드, 및 핵산, 및 이들의 용도 |
| EP3260140B1 (en) | 2011-12-05 | 2021-02-03 | Factor Bioscience Inc. | Methods and products for transfecting cells |
| CA2859387A1 (en) | 2011-12-16 | 2013-06-20 | Moderna Therapeutics, Inc. | Modified nucleoside, nucleotide, and nucleic acid compositions |
| WO2013143555A1 (en) | 2012-03-26 | 2013-10-03 | Biontech Ag | Rna formulation for immunotherapy |
| US9572897B2 (en) | 2012-04-02 | 2017-02-21 | Modernatx, Inc. | Modified polynucleotides for the production of cytoplasmic and cytoskeletal proteins |
| US9283287B2 (en) | 2012-04-02 | 2016-03-15 | Moderna Therapeutics, Inc. | Modified polynucleotides for the production of nuclear proteins |
| US9303079B2 (en) | 2012-04-02 | 2016-04-05 | Moderna Therapeutics, Inc. | Modified polynucleotides for the production of cytoplasmic and cytoskeletal proteins |
| US10501513B2 (en) | 2012-04-02 | 2019-12-10 | Modernatx, Inc. | Modified polynucleotides for the production of oncology-related proteins and peptides |
| US9192651B2 (en) | 2012-04-02 | 2015-11-24 | Moderna Therapeutics, Inc. | Modified polynucleotides for the production of secreted proteins |
| US9890364B2 (en) | 2012-05-29 | 2018-02-13 | The General Hospital Corporation | TAL-Tet1 fusion proteins and methods of use thereof |
| CA2877644A1 (en) | 2012-07-03 | 2014-01-09 | Prosensa Technologies B.V. | Oligonucleotide for the treatment of muscular dystrophy patients |
| EP2885419A4 (en) | 2012-08-14 | 2016-05-25 | Moderna Therapeutics Inc | ENZYMES AND POLYMERASES FOR RNA SYNTHESIS |
| US20150307542A1 (en) * | 2012-10-03 | 2015-10-29 | Moderna Therapeutics, Inc. | Modified nucleic acid molecules and uses thereof |
| EP2909222B1 (en) | 2012-10-22 | 2021-05-26 | Idenix Pharmaceuticals LLC | 2',4'-bridged nucleosides for hcv infection |
| KR20230154283A (ko) | 2012-11-01 | 2023-11-07 | 팩터 바이오사이언스 인크. | 세포에서 단백질을 발현시키는 방법들과 생성물들 |
| RS63237B1 (sr) | 2012-11-26 | 2022-06-30 | Modernatx Inc | Terminalno modifikovana rnk |
| WO2014082729A1 (en) | 2012-11-28 | 2014-06-05 | Biontech Ag | Individualized vaccines for cancer |
| EP2946014A2 (en) | 2013-01-17 | 2015-11-25 | Moderna Therapeutics, Inc. | Signal-sensor polynucleotides for the alteration of cellular phenotypes |
| WO2014159813A1 (en) | 2013-03-13 | 2014-10-02 | Moderna Therapeutics, Inc. | Long-lived polynucleotide molecules |
| CA2904151C (en) | 2013-03-14 | 2023-09-12 | Shire Human Genetic Therapies, Inc. | Cftr mrna compositions and related methods and uses |
| WO2014152211A1 (en) | 2013-03-14 | 2014-09-25 | Moderna Therapeutics, Inc. | Formulation and delivery of modified nucleoside, nucleotide, and nucleic acid compositions |
| CA2902884C (en) | 2013-03-14 | 2021-05-25 | Shire Human Genetic Therapies, Inc. | Ribonucleic acids with 4'-thio-modified nucleotides and related methods |
| SG11201507425RA (en) * | 2013-03-14 | 2015-10-29 | Shire Human Genetic Therapies | Methods for purification of messenger rna |
| RS62565B1 (sr) | 2013-03-14 | 2021-12-31 | Translate Bio Inc | Metode i kompozicije za isporuku antitela kodiranih od strane irnk |
| SI2972360T1 (en) | 2013-03-15 | 2018-08-31 | Translate Bio, Inc. | Synergistic improvement in the delivery of nucleic acids via mixed formulations |
| US11377470B2 (en) | 2013-03-15 | 2022-07-05 | Modernatx, Inc. | Ribonucleic acid purification |
| US10138507B2 (en) | 2013-03-15 | 2018-11-27 | Modernatx, Inc. | Manufacturing methods for production of RNA transcripts |
| WO2014144767A1 (en) | 2013-03-15 | 2014-09-18 | Moderna Therapeutics, Inc. | Ion exchange purification of mrna |
| WO2014152030A1 (en) | 2013-03-15 | 2014-09-25 | Moderna Therapeutics, Inc. | Removal of dna fragments in mrna production process |
| US8980864B2 (en) | 2013-03-15 | 2015-03-17 | Moderna Therapeutics, Inc. | Compositions and methods of altering cholesterol levels |
| JP2016520051A (ja) | 2013-05-03 | 2016-07-11 | セレクタ バイオサイエンシーズ インコーポレーテッドSelecta Biosciences,Inc. | I型およびiv型過敏症を低減させる寛容原性の合成ナノ担体の局所的な併用投与 |
| WO2014180490A1 (en) | 2013-05-10 | 2014-11-13 | Biontech Ag | Predicting immunogenicity of t cell epitopes |
| HUE052233T2 (hu) | 2013-06-04 | 2021-04-28 | Selecta Biosciences Inc | Nem immunszuppresszív, antigénre specifikus immunterápiás ágensek ismételt beadása |
| CN103254253B (zh) * | 2013-06-06 | 2015-11-18 | 济南卡博唐生物科技有限公司 | 一种制备双丙酮-d-阿洛糖的方法 |
| EP3013964B1 (en) | 2013-06-28 | 2020-05-06 | ethris GmbH | Compositions for introducing rna into cells |
| ES2896755T3 (es) | 2013-07-11 | 2022-02-25 | Modernatx Inc | Composiciones que comprenden polinucleótidos sintéticos que codifican proteínas relacionadas con CRISPR y ARNsg sintéticos y procedimientos de uso |
| EP3041938A1 (en) | 2013-09-03 | 2016-07-13 | Moderna Therapeutics, Inc. | Circular polynucleotides |
| WO2015034928A1 (en) | 2013-09-03 | 2015-03-12 | Moderna Therapeutics, Inc. | Chimeric polynucleotides |
| EP3043826A4 (en) * | 2013-09-13 | 2017-05-24 | Moderna Therapeutics, Inc. | Polynucleotide compositions containing amino acids |
| CN103467509A (zh) * | 2013-09-27 | 2013-12-25 | 成都爱博协诺化学技术有限公司 | 肿瘤药物中间体的合成方法 |
| US10023626B2 (en) | 2013-09-30 | 2018-07-17 | Modernatx, Inc. | Polynucleotides encoding immune modulating polypeptides |
| WO2015051173A2 (en) * | 2013-10-02 | 2015-04-09 | Moderna Therapeutics, Inc | Polynucleotide molecules and uses thereof |
| WO2015051169A2 (en) * | 2013-10-02 | 2015-04-09 | Moderna Therapeutics, Inc. | Polynucleotide molecules and uses thereof |
| BR112016007255A2 (pt) | 2013-10-03 | 2017-09-12 | Moderna Therapeutics Inc | polinucleotídeos que codificam receptor de lipoproteína de baixa densidade |
| WO2015062738A1 (en) | 2013-11-01 | 2015-05-07 | Curevac Gmbh | Modified rna with decreased immunostimulatory properties |
| EP3542802A1 (en) | 2013-11-01 | 2019-09-25 | CureVac AG | Modified rna with decreased immunostimulatory properties |
| JP6621409B2 (ja) | 2013-11-22 | 2019-12-18 | ミナ セラピューティクス リミテッド | C/EBPα小分子活性化RNA組成物 |
| US20150167017A1 (en) * | 2013-12-13 | 2015-06-18 | Moderna Therapeutics, Inc. | Alternative nucleic acid molecules and uses thereof |
| EP3082760A1 (en) | 2013-12-19 | 2016-10-26 | Novartis AG | LEPTIN mRNA COMPOSITIONS AND FORMULATIONS |
| CN105940110A (zh) | 2014-01-31 | 2016-09-14 | 菲克特生物科学股份有限公司 | 用于核酸产生和递送的方法和产品 |
| CA2940199A1 (en) | 2014-02-26 | 2015-09-03 | Ethris Gmbh | Compositions for gastrointestinal administration of rna |
| CN103784422B (zh) * | 2014-02-28 | 2016-03-02 | 重庆医科大学附属第二医院 | 一种载rtPA纳米粒及其制备方法 |
| RS63050B1 (sr) | 2014-04-23 | 2022-04-29 | Modernatx Inc | Vakcine nukleinske kiseline |
| EP3521456B1 (en) | 2014-06-10 | 2023-01-04 | CureVac Manufacturing GmbH | Methods and means for enhancing rna production |
| WO2015196128A2 (en) | 2014-06-19 | 2015-12-23 | Moderna Therapeutics, Inc. | Alternative nucleic acid molecules and uses thereof |
| EA033966B1 (ru) * | 2014-06-24 | 2019-12-13 | Транслейт Био, Инк. | Стереохимически обогащенные композиции для доставки нуклеиновых кислот |
| JP2017522028A (ja) | 2014-07-16 | 2017-08-10 | モデルナティエックス インコーポレイテッドModernaTX,Inc. | 環状ポリヌクレオチド |
| EP4159741A1 (en) | 2014-07-16 | 2023-04-05 | ModernaTX, Inc. | Method for producing a chimeric polynucleotide encoding a polypeptide having a triazole-containing internucleotide linkage |
| US20170210788A1 (en) | 2014-07-23 | 2017-07-27 | Modernatx, Inc. | Modified polynucleotides for the production of intrabodies |
| CN104211740B (zh) * | 2014-08-20 | 2016-10-26 | 济南尚博生物科技有限公司 | 一种n4-苯甲酰基-d-胞苷的制备方法 |
| WO2016045732A1 (en) | 2014-09-25 | 2016-03-31 | Biontech Rna Pharmaceuticals Gmbh | Stable formulations of lipids and liposomes |
| EP3212793B1 (en) | 2014-11-02 | 2020-01-08 | Arcturus Therapeutics, Inc. | Messenger una molecules and uses thereof |
| EP3218508A4 (en) | 2014-11-10 | 2018-04-18 | Modernatx, Inc. | Multiparametric nucleic acid optimization |
| EP3461904A1 (en) | 2014-11-10 | 2019-04-03 | ModernaTX, Inc. | Alternative nucleic acid molecules containing reduced uracil content and uses thereof |
| EP3034539A1 (en) | 2014-12-19 | 2016-06-22 | Ethris GmbH | Compositions for introducing nucleic acid into cells |
| WO2016128060A1 (en) | 2015-02-12 | 2016-08-18 | Biontech Ag | Predicting t cell epitopes useful for vaccination |
| EP4406585A3 (en) | 2015-02-13 | 2024-10-23 | Factor Bioscience Inc. | Nucleic acid products and methods of administration thereof |
| SG11201708681SA (en) | 2015-04-30 | 2017-11-29 | Curevac Ag | Method for in vitro transcription using an immobilized restriction enzyme |
| RU2742993C2 (ru) | 2015-05-15 | 2021-02-12 | Куревак Аг | РЕЖИМЫ ПРАЙМ-БУСТ, ВКЛЮЧАЮЩИЕ ВВЕДЕНИЕ ПО МЕНЬШЕЙ МЕРЕ ОДНОЙ КОНСТРУКЦИИ мРНК |
| EP4098743A1 (en) | 2015-05-29 | 2022-12-07 | CureVac AG | Method for adding cap structures to rna using immobilized enzymes |
| EP4108769B1 (en) | 2015-05-29 | 2023-08-30 | CureVac Manufacturing GmbH | A method for producing and purifying rna, comprising at least one step of tangential flow filtration |
| ES2837100T3 (es) | 2015-08-10 | 2021-06-29 | Curevac Real Estate Gmbh | Método de aumento de la replicación de una molécula de ADN circular |
| WO2017049286A1 (en) | 2015-09-17 | 2017-03-23 | Moderna Therapeutics, Inc. | Polynucleotides containing a morpholino linker |
| EP4101930A1 (en) | 2015-09-17 | 2022-12-14 | ModernaTX, Inc. | Polynucleotides containing a stabilizing tail region |
| EP3359670B2 (en) | 2015-10-05 | 2024-02-14 | ModernaTX, Inc. | Methods for therapeutic administration of messenger ribonucleic acid drugs |
| WO2017059902A1 (en) | 2015-10-07 | 2017-04-13 | Biontech Rna Pharmaceuticals Gmbh | 3' utr sequences for stabilization of rna |
| ES2914225T3 (es) | 2015-10-16 | 2022-06-08 | Modernatx Inc | Análogos de cap de ARNm con enlace de fosfato modificado |
| US11866754B2 (en) | 2015-10-16 | 2024-01-09 | Modernatx, Inc. | Trinucleotide mRNA cap analogs |
| WO2017066791A1 (en) * | 2015-10-16 | 2017-04-20 | Modernatx, Inc. | Sugar substituted mrna cap analogs |
| EP4349405A3 (en) | 2015-10-22 | 2024-06-19 | ModernaTX, Inc. | Respiratory virus vaccines |
| CA3002819A1 (en) * | 2015-10-22 | 2017-04-27 | Modernatx, Inc. | Sexually transmitted disease vaccines |
| ES2763822T3 (es) | 2015-12-09 | 2020-06-01 | Novartis Ag | Análisis exento de marcas de la eficacia de la adición de caperuzas al arn utilizando rnasa h, sondas y cromatografía líquida/espectrometría de masas |
| RS63135B1 (sr) | 2015-12-23 | 2022-05-31 | Modernatx Inc | Postupci upotrebe polinukleotida koji kodiraju ox40 ligand |
| EP3394280A1 (en) | 2015-12-23 | 2018-10-31 | CureVac AG | Method of rna in vitro transcription using a buffer containing a dicarboxylic acid or tricarboxylic acid or a salt thereof |
| EP3400023A1 (en) | 2016-01-10 | 2018-11-14 | ModernaTX, Inc. | Therapeutic mrnas encoding anti ctla-4 antibodies |
| WO2017140345A1 (en) | 2016-02-15 | 2017-08-24 | Curevac Ag | Method for analyzing by-products of rna in vitro transcription |
| EP3423595A1 (en) | 2016-03-03 | 2019-01-09 | CureVac AG | Rna analysis by total hydrolysis |
| WO2017162297A1 (en) | 2016-03-24 | 2017-09-28 | Curevac Ag | Immobilized inorganic pyrophosphatase (ppase) |
| ES2844180T3 (es) | 2016-04-08 | 2021-07-21 | Translate Bio Inc | Acido nucleico codificante multimérico y usos del mismo |
| EP3443001A4 (en) | 2016-04-11 | 2020-04-29 | Obsidian Therapeutics, Inc. | REGULATED BIOCIRCUIT SYSTEMS |
| US20190167811A1 (en) | 2016-04-13 | 2019-06-06 | Modernatx, Inc. | Lipid compositions and their uses for intratumoral polynucleotide delivery |
| MY201498A (en) | 2016-05-18 | 2024-02-27 | Modernatx Inc | Polynucleotides encoding citrin for the treatment of citrullinemia type 2 |
| CA3024624A1 (en) | 2016-05-18 | 2017-11-23 | Modernatx, Inc. | Polynucleotides encoding porphobilinogen deaminase for the treatment of acute intermittent porphyria |
| SI3458083T1 (sl) | 2016-05-18 | 2023-03-31 | Modernatx, Inc. | Polinukleotidi, ki kodirajo interlevkin-12 (IL12) in njihova uporaba |
| US11001861B2 (en) | 2016-05-18 | 2021-05-11 | Modernatx, Inc. | Polynucleotides encoding galactose-1-phosphate uridylyltransferase for the treatment of galactosemia type 1 |
| US20190298657A1 (en) | 2016-05-18 | 2019-10-03 | Modernatx, Inc. | Polynucleotides Encoding Acyl-CoA Dehydrogenase, Very Long-Chain for the Treatment of Very Long-Chain Acyl-CoA Dehydrogenase Deficiency |
| EP3458107B1 (en) | 2016-05-18 | 2024-03-13 | ModernaTX, Inc. | Polynucleotides encoding jagged1 for the treatment of alagille syndrome |
| WO2017201328A1 (en) | 2016-05-18 | 2017-11-23 | Modernatx, Inc. | POLYNUCLEOTIDES ENCODING α-GALACTOSIDASE A FOR THE TREATMENT OF FABRY DISEASE |
| HRP20221135T8 (hr) | 2016-05-18 | 2023-02-03 | Modernatx, Inc. | KOMBINACIJE mRNK KOJE KODIRAJU IMUNOMODULIRAJUĆE POLIPEPTIDE I NJIHOVE UPOTREBE |
| KR102533456B1 (ko) | 2016-05-18 | 2023-05-17 | 모더나티엑스, 인크. | 릴랙신을 인코딩하는 폴리뉴클레오타이드 |
| KR101892086B1 (ko) | 2016-05-19 | 2018-08-27 | 주식회사 삼양사 | 옥심에스테르 유도체 화합물, 이를 포함하는 광중합 개시제, 및 감광성 조성물 |
| WO2017218524A1 (en) | 2016-06-13 | 2017-12-21 | Rana Therapeutics, Inc. | Messenger rna therapy for the treatment of ornithine transcarbamylase deficiency |
| KR20190026819A (ko) | 2016-07-07 | 2019-03-13 | 루비우스 테라퓨틱스, 아이엔씨. | 외인성 rna를 발현하는 치료용 세포 시스템과 관련된 조성물 및 방법 |
| CA3030701A1 (en) | 2016-07-11 | 2018-01-18 | Translate Bio Ma, Inc. | Nucleic acid conjugates and uses thereof |
| CA3033788A1 (en) | 2016-08-17 | 2018-02-22 | Factor Bioscience Inc. | Nucleic acid products and methods of administration thereof |
| WO2018096179A1 (en) | 2016-11-28 | 2018-05-31 | Curevac Ag | Method for purifying rna |
| AU2018207440B2 (en) | 2017-01-11 | 2022-06-02 | The Board Of Trustees Of The Leland Stanford Junior University | R-spondin (RSPO) surrogate molecules |
| WO2018140821A1 (en) | 2017-01-26 | 2018-08-02 | Surrozen, Inc. | Tissue-specific wnt signal enhancing molecules and uses thereof |
| US10093706B2 (en) | 2017-01-30 | 2018-10-09 | Indiana University Research And Technology Corporation | Dominant positive hnRNP-E1 polypeptide compositions and methods |
| WO2018141371A1 (en) | 2017-01-31 | 2018-08-09 | Curevac Ag | Purification and/or formulation of rna |
| MA47438A (fr) * | 2017-02-01 | 2019-12-11 | Modernatx Inc | Structure secondaire de polynucléotide |
| KR20180090135A (ko) | 2017-02-02 | 2018-08-10 | 주식회사 삼양사 | 신규한 옥심에스테르 비페닐 화합물, 이를 포함하는 광중합 개시제 및 감광성 조성물 |
| WO2018154387A1 (en) | 2017-02-22 | 2018-08-30 | Crispr Therapeutics Ag | Compositions and methods for gene editing |
| MA47603A (fr) | 2017-02-27 | 2020-01-01 | Translate Bio Inc | Nouvel arnm cftr à codons optimisés |
| US11407800B2 (en) | 2017-02-28 | 2022-08-09 | Arcturus Therapeutics, Inc. | Translatable molecules and synthesis thereof |
| TW202428301A (zh) | 2017-02-28 | 2024-07-16 | 法商賽諾菲公司 | 治療性rna |
| CN110678548A (zh) | 2017-03-31 | 2020-01-10 | 埃吉诺维亚公司 | 抗病毒治疗剂 |
| AU2018268859B2 (en) | 2017-05-16 | 2024-07-25 | Translate Bio, Inc. | Treatment of cystic fibrosis by delivery of codon-optimized mrna encoding CFTR |
| EP3625345B1 (en) | 2017-05-18 | 2023-05-24 | ModernaTX, Inc. | Modified messenger rna comprising functional rna elements |
| US11421011B2 (en) | 2017-05-18 | 2022-08-23 | Modernatx, Inc. | Polynucleotides encoding tethered interleukin-12 (IL12) polypeptides and uses thereof |
| JP7284101B2 (ja) | 2017-05-31 | 2023-05-30 | ウルトラジェニクス ファーマシューティカル インク. | 糖原病iii型のための治療薬 |
| MA49395A (fr) | 2017-06-14 | 2020-04-22 | Modernatx Inc | Polynucléotides codant pour le facteur viii de coagulation |
| US20200131498A1 (en) | 2017-06-14 | 2020-04-30 | Modernatx, Inc. | Polynucleotides encoding methylmalonyl-coa mutase |
| US10034951B1 (en) | 2017-06-21 | 2018-07-31 | New England Biolabs, Inc. | Use of thermostable RNA polymerases to produce RNAs having reduced immunogenicity |
| GB201714430D0 (en) * | 2017-09-07 | 2017-10-25 | Micol Romain | Compositions and processes for targeted delivery and expression and modulation of therapeutic components in tissue |
| US20200208152A1 (en) | 2017-09-08 | 2020-07-02 | Mina Therapeutics Limited | Stabilized sarna compositions and methods of use |
| US11162099B2 (en) | 2017-09-08 | 2021-11-02 | Mina Therapeutics Limited | HNF4A saRNA compositions and methods of use |
| US20210180053A1 (en) | 2017-11-01 | 2021-06-17 | Novartis Ag | Synthetic rnas and methods of use |
| US20220265856A1 (en) | 2017-11-22 | 2022-08-25 | Modernatx, Inc. | Polynucleotides encoding propionyl-coa carboxylase alpha and beta subunits for the treatment of propionic acidemia |
| US11939601B2 (en) | 2017-11-22 | 2024-03-26 | Modernatx, Inc. | Polynucleotides encoding phenylalanine hydroxylase for the treatment of phenylketonuria |
| CA3079428A1 (en) | 2017-11-22 | 2019-05-31 | Modernatx, Inc. | Polynucleotides encoding ornithine transcarbamylase for the treatment of urea cycle disorders |
| KR101991903B1 (ko) | 2017-12-07 | 2019-10-01 | 주식회사 삼양사 | 카바졸 옥심에스테르 유도체 화합물 및 이를 포함하는 광중합 개시제와 감광성 조성물 |
| US20200325532A1 (en) | 2017-12-15 | 2020-10-15 | Novartis Ag | Polya tail length analysis of rna by mass spectrometry |
| WO2019126593A1 (en) | 2017-12-20 | 2019-06-27 | Translate Bio, Inc. | Improved composition and methods for treatment of ornithine transcarbamylase deficiency |
| MA51523A (fr) | 2018-01-05 | 2020-11-11 | Modernatx Inc | Polynucléotides codant pour des anticorps anti-virus du chikungunya |
| FI3773689T3 (fi) | 2018-04-11 | 2023-01-31 | Antigeenisiä peptidejä syövän ehkäisyyn ja hoitoon | |
| EP3775211B1 (en) | 2018-04-12 | 2023-04-05 | MiNA Therapeutics Limited | Sirt1-sarna compositions and methods of use |
| JP7399876B2 (ja) * | 2018-04-16 | 2023-12-18 | ジョージア テック リサーチ コーポレーション | 病態治療のためのRNAエディターのmRNA駆動型発現 |
| EP3781689A1 (en) | 2018-04-19 | 2021-02-24 | Checkmate Pharmaceuticals, Inc. | Synthetic rig-i-like receptor agonists |
| CA3098262A1 (en) | 2018-04-25 | 2019-10-31 | Ethris Gmbh | Cryoprotective agents for particulate formulations |
| EP3806888B1 (en) | 2018-06-12 | 2024-01-31 | Obsidian Therapeutics, Inc. | Pde5 derived regulatory constructs and methods of use in immunotherapy |
| AU2019293286A1 (en) | 2018-06-28 | 2021-01-07 | Crispr Therapeutics Ag | Compositions and methods for genomic editing by insertion of donor polynucleotides |
| WO2020023390A1 (en) | 2018-07-25 | 2020-01-30 | Modernatx, Inc. | Mrna based enzyme replacement therapy combined with a pharmacological chaperone for the treatment of lysosomal storage disorders |
| AU2019333315B2 (en) | 2018-08-30 | 2022-09-29 | Tenaya Therapeutics, Inc. | Cardiac cell reprogramming with myocardin and ASCL1 |
| MA53545A (fr) | 2018-09-02 | 2021-07-14 | Modernatx Inc | Polynucléotides codant pour l'acyl-coa déshydrogénase à très longue chaîne pour le traitement de l'insuffisance en acyl-coa déshydrogénase à très longue chaîne |
| US20220243182A1 (en) | 2018-09-13 | 2022-08-04 | Modernatx, Inc. | Polynucleotides encoding branched-chain alpha-ketoacid dehydrogenase complex e1-alpha, e1-beta, and e2 subunits for the treatment of maple syrup urine disease |
| CA3112208A1 (en) | 2018-09-13 | 2020-03-19 | Modernatx, Inc. | Polynucleotides encoding glucose-6-phosphatase for the treatment of glycogen storage disease |
| WO2020056239A1 (en) | 2018-09-14 | 2020-03-19 | Modernatx, Inc. | Polynucleotides encoding uridine diphosphate glycosyltransferase 1 family, polypeptide a1 for the treatment of crigler-najjar syndrome |
| WO2020069169A1 (en) | 2018-09-27 | 2020-04-02 | Modernatx, Inc. | Polynucleotides encoding arginase 1 for the treatment of arginase deficiency |
| US11072808B2 (en) | 2018-10-04 | 2021-07-27 | New England Biolabs, Inc. | Methods and compositions for increasing capping efficiency of transcribed RNA |
| CN113166737A (zh) | 2018-10-04 | 2021-07-23 | 新英格兰生物实验室公司 | 提高转录的rna的加帽效率的方法和组合物 |
| EP3870600A1 (en) | 2018-10-24 | 2021-09-01 | Obsidian Therapeutics, Inc. | Er tunable protein regulation |
| JP7445657B2 (ja) | 2018-12-06 | 2024-03-07 | アークトゥラス・セラピューティクス・インコーポレイテッド | オルニチントランスカルバミラーゼ欠損症を処置するための組成物および方法 |
| KR102228630B1 (ko) | 2018-12-28 | 2021-03-16 | 주식회사 삼양사 | 카바졸 멀티 베타 옥심에스테르 유도체 화합물 및 이를 포함하는 광중합 개시제와 포토레지스트 조성물 |
| GB2580963B (en) | 2019-02-01 | 2021-03-31 | Hemispherian As | Cancer therapies |
| JP2022524081A (ja) | 2019-03-08 | 2022-04-27 | オブシディアン セラピューティクス, インコーポレイテッド | 調整可能な制御のためのヒトカルボニックアンヒドラーゼ2組成物及び方法 |
| AU2020245548A1 (en) * | 2019-03-25 | 2021-10-21 | Flagship Pioneering Innovations Vi, Llc | Compositions comprising modified circular polyribonucleotides and uses thereof |
| EP3953473A1 (en) | 2019-04-12 | 2022-02-16 | MiNA Therapeutics Limited | Sirt1-sarna compositions and methods of use |
| JP2022532078A (ja) | 2019-05-08 | 2022-07-13 | アストラゼネカ アクチボラグ | 皮膚及び創傷のための組成物並びにその使用の方法 |
| WO2020252404A1 (en) | 2019-06-12 | 2020-12-17 | Obsidian Therapeutics, Inc. | Ca2 compositions and methods for tunable regulation |
| MX2021015097A (es) | 2019-06-12 | 2022-04-01 | Obsidian Therapeutics Inc | Composiciones de ca2 y metodos para regulación ajustable. |
| EP3997226A1 (en) | 2019-07-11 | 2022-05-18 | Tenaya Therapeutics, Inc. | Cardiac cell reprogramming with micrornas and other factors |
| US10501404B1 (en) | 2019-07-30 | 2019-12-10 | Factor Bioscience Inc. | Cationic lipids and transfection methods |
| CN112390838A (zh) * | 2019-08-14 | 2021-02-23 | 斯微(上海)生物科技有限公司 | 一种改性核苷及其合成方法 |
| EP4017539A1 (en) | 2019-08-19 | 2022-06-29 | MiNA Therapeutics Limited | Oligonucleotide conjugate compositions and methods of use |
| CN114555822A (zh) | 2019-08-22 | 2022-05-27 | 新英格兰生物实验室公司 | 具有修饰核苷酸的单链dna的切割 |
| EP4017995A1 (en) | 2019-08-23 | 2022-06-29 | New England Biolabs, Inc. | Enzymatic rna capping method |
| US20230092895A1 (en) | 2019-08-30 | 2023-03-23 | Obsidian Therapeutics, Inc. | Tandem cd19 car-based compositions and methods for immunotherapy |
| KR20220051401A (ko) | 2019-09-06 | 2022-04-26 | 크리스퍼 테라퓨틱스 아게 | 배양 중 개선된 지속성을 갖는 유전적으로 조작된 t 세포 |
| US20220348937A1 (en) | 2019-09-06 | 2022-11-03 | Obsidian Therapeutics, Inc. | Compositions and methods for dhfr tunable protein regulation |
| BR112022007437A2 (pt) * | 2019-10-18 | 2022-10-11 | Daiichi Sankyo Co Ltd | Método para a produção de fosforamidita bicíclica |
| CN114746112A (zh) | 2019-11-15 | 2022-07-12 | 恩特罗姆公司 | 用于预防和治疗b细胞恶性肿瘤的抗原肽 |
| WO2021151001A1 (en) | 2020-01-22 | 2021-07-29 | Outpace Bio, Inc. | Chimeric polypeptides |
| CN115552034A (zh) | 2020-01-31 | 2022-12-30 | 瑞泽恩制药公司 | 液相色谱法和质谱法用于表征寡核苷酸的用途 |
| US20240277830A1 (en) | 2020-02-04 | 2024-08-22 | CureVac SE | Coronavirus vaccine |
| EP4114421A1 (en) | 2020-03-02 | 2023-01-11 | Tenaya Therapeutics, Inc. | Gene vector control by cardiomyocyte-expressed micrornas |
| WO2021202788A2 (en) * | 2020-04-03 | 2021-10-07 | Ionis Pharmaceuticals, Inc. | Modified oligomeric compounds and uses thereof |
| JP2021185136A (ja) | 2020-04-22 | 2021-12-09 | ビオエンテッヒ・アールエヌエイ・ファーマシューティカルズ・ゲゼルシャフト・ミット・ベシュレンクテル・ハフツング | コロナウイルスワクチン |
| WO2021247507A1 (en) | 2020-06-01 | 2021-12-09 | Modernatx, Inc. | Phenylalanine hydroxylase variants and uses thereof |
| CN116368226A (zh) * | 2020-09-04 | 2023-06-30 | 维乎医疗有限公司 | 用于加帽rna的组合物和方法 |
| EP4397321A3 (en) | 2020-09-23 | 2024-09-04 | CRISPR Therapeutics AG | Genetically engineered t cells with regnase-1 and/or tgfbrii disruption have improved functionality and persistence |
| WO2022090752A1 (en) | 2020-10-26 | 2022-05-05 | Pécsi Tudományegyetem | Vaccine platform |
| WO2022101307A1 (en) | 2020-11-12 | 2022-05-19 | Intervet International B.V. | Recombinant vectors encoding chimeric coronavirus spike proteins and use thereof |
| EP4243776A1 (en) | 2020-11-13 | 2023-09-20 | Modernatx, Inc. | Polynucleotides encoding cystic fibrosis transmembrane conductance regulator for the treatment of cystic fibrosis |
| WO2022106860A1 (en) | 2020-11-20 | 2022-05-27 | Pécsi Tudományegyetem | Recombinant peptides for use in therapy |
| CA3199189A1 (en) * | 2020-11-25 | 2022-06-02 | Gudrun Stengel | Multiplexed profiling of rna and dna modifications |
| BR112023012303A2 (pt) | 2020-12-22 | 2024-02-15 | CureVac SE | Vacina de rna contra variantes de sars-cov-2 |
| US20220193134A1 (en) | 2020-12-23 | 2022-06-23 | Crispr Therapeutics Ag | Co-use of lenalidomide with car-t cells |
| CN112725346A (zh) * | 2021-01-22 | 2021-04-30 | 青岛大学 | 一种增加尿酸排泄的修饰mRNA序列及其应用 |
| US11028379B1 (en) | 2021-01-27 | 2021-06-08 | New England Biolabs, Inc. | FCE mRNA capping enzyme compositions, methods and kits |
| WO2022164428A1 (en) | 2021-01-27 | 2022-08-04 | New England Biolabs, Inc. | Faustovirus capping enzyme, mrna capping enzyme compositions, methods and kits |
| US20240156729A1 (en) | 2021-02-26 | 2024-05-16 | Ethris Gmbh | Formulations for aerosol formation and aerosols for the delivery of nucleic acid |
| KR20230150319A (ko) | 2021-03-01 | 2023-10-30 | 사이롬 게임베하 | iRhom2에 대한 인간화 항체 |
| EP4305153A1 (en) | 2021-03-09 | 2024-01-17 | CRISPR Therapeutics AG | Genetically engineered t cells with ptpn2 knockout have improved functionality and anti-tumor activity |
| WO2022204369A1 (en) | 2021-03-24 | 2022-09-29 | Modernatx, Inc. | Polynucleotides encoding methylmalonyl-coa mutase for the treatment of methylmalonic acidemia |
| US20240216288A1 (en) | 2021-03-24 | 2024-07-04 | Modernatx, Inc. | Lipid nanoparticles containing polynucleotides encoding propionyl-coa carboxylase alpha and beta subunits and uses thereof |
| WO2022204370A1 (en) | 2021-03-24 | 2022-09-29 | Modernatx, Inc. | Lipid nanoparticles and polynucleotides encoding ornithine transcarbamylase for the treatment of ornithine transcarbamylase deficiency |
| US20240207444A1 (en) | 2021-03-24 | 2024-06-27 | Modernatx, Inc. | Lipid nanoparticles containing polynucleotides encoding phenylalanine hydroxylase and uses thereof |
| US20240207374A1 (en) | 2021-03-24 | 2024-06-27 | Modernatx, Inc. | Lipid nanoparticles containing polynucleotides encoding glucose-6-phosphatase and uses thereof |
| AU2022246144A1 (en) | 2021-03-26 | 2023-09-21 | Mina Therapeutics Limited | Tmem173 sarna compositions and methods of use |
| US20240174744A1 (en) | 2021-03-29 | 2024-05-30 | Scirhom Gmbh | Methods of treatment using protein binders to irhom2 epitopes |
| CN112979721B (zh) * | 2021-03-29 | 2023-05-09 | 江苏集萃分子工程研究院有限公司 | 一种高纯度抗肿瘤药曲氟胞苷的制备方法 |
| KR20230167405A (ko) | 2021-04-09 | 2023-12-08 | 셀렉타 바이오사이언시즈, 인크. | 면역 관용을 증진시키기 위해 고친화도 il-2 수용체 효능제와 조합된 면역억제제를 포함하는 합성 나노담체 |
| WO2022214664A1 (en) | 2021-04-09 | 2022-10-13 | Philogen S.P.A. | Improved interferon-gamma mutant |
| WO2022251644A1 (en) | 2021-05-28 | 2022-12-01 | Lyell Immunopharma, Inc. | Nr4a3-deficient immune cells and uses thereof |
| US20230052243A1 (en) | 2021-06-02 | 2023-02-16 | Lyell Immunopharma, Inc. | Nr4a-deficient cells expressing c-jun and uses thereof |
| CN113372432A (zh) * | 2021-06-15 | 2021-09-10 | 深圳市臻质医疗科技有限公司 | 一种基于化学修饰mRNA编码蛋白因子诱导和/或增强软骨损伤修复的方法 |
| WO2022271776A1 (en) | 2021-06-22 | 2022-12-29 | Modernatx, Inc. | Polynucleotides encoding uridine diphosphate glycosyltransferase 1 family, polypeptide a1 for the treatment of crigler-najjar syndrome |
| EP4376873A1 (en) | 2021-07-26 | 2024-06-05 | CRISPR Therapeutics AG | Methods for manufacturing genetically engineered car-t cells |
| CN113651865A (zh) * | 2021-08-19 | 2021-11-16 | 上海兆维科技发展有限公司 | 一种去除四丁基氟化铵的方法 |
| AU2022336209A1 (en) | 2021-09-03 | 2024-01-18 | CureVac SE | Novel lipid nanoparticles for delivery of nucleic acids |
| WO2023042079A1 (en) | 2021-09-14 | 2023-03-23 | Crispr Therapeutics Ag | Genetically engineered immune cells having a disrupted cd83 gene |
| EP4408871A1 (en) | 2021-10-01 | 2024-08-07 | ModernaTX, Inc. | Polynucleotides encoding relaxin for the treatment of fibrosis and/or cardiovascular disease |
| JP2024539512A (ja) | 2021-10-22 | 2024-10-28 | セイル バイオメディシンズ インコーポレイテッド | Mrnaワクチン組成物 |
| EP4422698A1 (en) | 2021-10-29 | 2024-09-04 | CureVac SE | Improved circular rna for expressing therapeutic proteins |
| EP4426340A1 (en) | 2021-11-01 | 2024-09-11 | ModernaTX, Inc. | Polynucleotides encoding integrin beta-6 and methods of use thereof |
| WO2023084399A1 (en) | 2021-11-09 | 2023-05-19 | Crispr Therapeutics Ag | Genetically engineered immune cells expressing masked chimeric antigen receptors specific to protein tyrosine kinase 7 |
| EP4436588A1 (en) | 2021-11-23 | 2024-10-02 | Sail Biomedicines, Inc. | A bacteria-derived lipid composition and use thereof |
| CA3238871A1 (en) * | 2021-11-24 | 2023-06-01 | Alida Biosciences, Inc. | Rna and dna analysis using engineered surfaces |
| WO2023099884A1 (en) | 2021-12-01 | 2023-06-08 | Mina Therapeutics Limited | Pax6 sarna compositions and methods of use |
| EP4444345A2 (en) | 2021-12-08 | 2024-10-16 | ModernaTX, Inc. | Herpes simplex virus mrna vaccines |
| WO2023111913A1 (en) | 2021-12-15 | 2023-06-22 | Crispr Therapeutics Ag | Engineered anti-liv1 cell with regnase-1 and/or tgfbrii disruption |
| KR20240134324A (ko) | 2021-12-20 | 2024-09-09 | 세일 바이오메디슨스, 인크. | mRNA 치료 조성물 |
| WO2023119201A2 (en) | 2021-12-22 | 2023-06-29 | Crispr Therapeutics Ag | Genetically engineered t cells with disrupted casitas b-lineage lymphoma proto-oncogene-b (cblb) and uses thereof |
| CA3241414A1 (en) * | 2021-12-23 | 2023-06-29 | Robert F. PAGELS | Nanoparticles and methods of production for the encapsulation of nucleic acids |
| US20230263906A1 (en) | 2022-01-10 | 2023-08-24 | Selecta Biosciences, Inc. | High affinity il-2 receptor agonists and synthetic nanocarrier dose sparing |
| WO2023144330A1 (en) | 2022-01-28 | 2023-08-03 | CureVac SE | Nucleic acid encoded transcription factor inhibitors |
| WO2023159197A1 (en) | 2022-02-18 | 2023-08-24 | Modernatx, Inc. | Mrnas encoding checkpoint cancer vaccines and uses thereof |
| AU2023227443A1 (en) | 2022-03-01 | 2024-10-10 | Crispr Therapeutics Ag | Methods and compositions for treating angiopoietin-like 3 (angptl3) related conditions |
| WO2023170435A1 (en) | 2022-03-07 | 2023-09-14 | Mina Therapeutics Limited | Il10 sarna compositions and methods of use |
| WO2023172628A1 (en) | 2022-03-09 | 2023-09-14 | Selecta Biosciences, Inc. | Immunosuppressant in combination with high affinity il-2 receptor agonists and related dosing |
| US20230287376A1 (en) | 2022-03-11 | 2023-09-14 | New England Biolabs, Inc. | Immobilized enzyme compositions and methods |
| AU2023240501A1 (en) | 2022-03-21 | 2024-10-31 | Crispr Therapeutics Ag | Methods and compositions for treating lipoprotein-related diseases |
| WO2023180967A1 (en) | 2022-03-23 | 2023-09-28 | Crispr Therapeutics Ag | Anti-cd83 car-t cells with regnase-1 and/or tgfbrii disruption |
| WO2023180968A1 (en) | 2022-03-23 | 2023-09-28 | Crispr Therapeutics Ag | Anti-cd19 car-t cells with multiple gene edits and therapeutic uses thereof |
| WO2023183568A1 (en) | 2022-03-25 | 2023-09-28 | Selecta Biosciences, Inc. | Synthetic nanocarriers comprising an immunosuppressant in combination with high affinity il-2 receptor agonists and anti-igm agents |
| WO2023183909A2 (en) | 2022-03-25 | 2023-09-28 | Modernatx, Inc. | Polynucleotides encoding fanconi anemia, complementation group proteins for the treatment of fanconi anemia |
| CN114656511B (zh) * | 2022-03-29 | 2024-04-16 | 上海吉量医药工程有限公司 | 乙酰化胞嘧啶三磷酸盐及其中间体的制备方法 |
| CN114736260B (zh) * | 2022-03-29 | 2024-08-23 | 上海吉量医药工程有限公司 | 一种三磷酸核苷酸盐的制备方法 |
| AU2023246941A1 (en) | 2022-03-31 | 2024-10-24 | Enterome S.A. | Antigenic peptides for prevention and treatment of cancer. |
| WO2023196399A1 (en) | 2022-04-06 | 2023-10-12 | Modernatx, Inc. | Lipid nanoparticles and polynucleotides encoding argininosuccinate lyase for the treatment of argininosuccinic aciduria |
| WO2023196950A1 (en) | 2022-04-07 | 2023-10-12 | New England Biolabs, Inc. | Methods of higher fidelity rna synthesis |
| WO2023196566A1 (en) | 2022-04-08 | 2023-10-12 | Selecta Biosciences, Inc. | High affinity il-2 receptor agonists and immunosuppressants to enhance immune tolerance |
| WO2023223183A1 (en) | 2022-05-16 | 2023-11-23 | Crispr Therapeutics Ag | Picornaviral vectors for gene editing |
| WO2023225665A1 (en) | 2022-05-19 | 2023-11-23 | Lyell Immunopharma, Inc. | Polynucleotides targeting nr4a3 and uses thereof |
| WO2023227608A1 (en) | 2022-05-25 | 2023-11-30 | Glaxosmithkline Biologicals Sa | Nucleic acid based vaccine encoding an escherichia coli fimh antigenic polypeptide |
| WO2023242827A2 (en) | 2022-06-17 | 2023-12-21 | Crispr Therapeutics Ag | LIPID NANOPARTICLES (LNPs)-BASED OCULAR DELIVERY |
| WO2023248110A1 (en) | 2022-06-20 | 2023-12-28 | Crispr Therapeutics Ag | Base editing proteins and uses thereof |
| WO2023248145A1 (en) | 2022-06-21 | 2023-12-28 | Crispr Therapeutics Ag | Compositions and methods for treating human immunodeficiency virus |
| WO2023248147A1 (en) | 2022-06-21 | 2023-12-28 | Crispr Therapeutics Ag | Methods and compositions for in vivo editing of stem cells |
| WO2024002985A1 (en) | 2022-06-26 | 2024-01-04 | BioNTech SE | Coronavirus vaccine |
| WO2024003786A1 (en) | 2022-06-29 | 2024-01-04 | Crispr Therapeutics Ag | Chimeric antigen receptor targeting gpc-3 and immune cells expressing such for therapeutic uses |
| WO2024023246A1 (en) | 2022-07-28 | 2024-02-01 | Philogen S.P.A. | Antibody binding to pd1 |
| WO2024023804A2 (en) | 2022-07-29 | 2024-02-01 | Crispr Therapeutics Ag | Genetically engineered immune cells having disrupted transporter associated with antigen processing binding protein (tapbp) gene |
| WO2024023801A2 (en) | 2022-07-29 | 2024-02-01 | Crispr Therapeutics Ag | Genetically engineered immune cells having disrupted transporter associated with antigen processing-1 (tap-1) gene |
| WO2024023802A2 (en) | 2022-07-29 | 2024-02-01 | Crispr Therapeutics Ag | Genetically engineered immune cells having disrupted transporter associated with antigen processing-2 (tap-2) gene |
| WO2024031087A2 (en) * | 2022-08-05 | 2024-02-08 | Modernatx, Inc. | Internal ribosome entry sites for improved polynucleotide translation |
| WO2024033362A1 (en) | 2022-08-08 | 2024-02-15 | Atb Therapeutics | Humanized antibodies against cd79b |
| WO2024042236A1 (en) | 2022-08-26 | 2024-02-29 | Ethris Gmbh | Stable lipid or lipidoid nanoparticle suspensions |
| EP4327829A1 (en) | 2022-08-26 | 2024-02-28 | Ethris GmbH | Stabilization of lipid or lipidoid nanoparticle suspensions |
| WO2024050483A1 (en) | 2022-08-31 | 2024-03-07 | Modernatx, Inc. | Variant strain-based coronavirus vaccines and uses thereof |
| WO2024062388A2 (en) | 2022-09-20 | 2024-03-28 | Crispr Therapeutics Ag | Genetically engineered immune cells expressing chimeric antigen receptor targeting cd20 |
| DE202023106198U1 (de) | 2022-10-28 | 2024-03-21 | CureVac SE | Impfstoff auf Nukleinsäurebasis |
| WO2024097875A1 (en) * | 2022-11-02 | 2024-05-10 | Shattuck Labs, Inc. | Fusion proteins for the treatment of nonalcoholic steatohepatitis |
| WO2024102434A1 (en) | 2022-11-10 | 2024-05-16 | Senda Biosciences, Inc. | Rna compositions comprising lipid nanoparticles or lipid reconstructed natural messenger packs |
| WO2024130158A1 (en) | 2022-12-16 | 2024-06-20 | Modernatx, Inc. | Lipid nanoparticles and polynucleotides encoding extended serum half-life interleukin-22 for the treatment of metabolic disease |
| WO2024134199A1 (en) | 2022-12-22 | 2024-06-27 | Mina Therapeutics Limited | Chemically modified sarna compositions and methods of use |
| WO2024141786A2 (en) | 2022-12-29 | 2024-07-04 | Popvax Private Limited | Multitarget vaccines and therapeutics |
| WO2024141784A2 (en) | 2022-12-29 | 2024-07-04 | Popvax Private Limited | Broadly protective betacoronavirus vaccines and compositions |
| WO2024151811A1 (en) | 2023-01-11 | 2024-07-18 | Modernatx, Inc. | Personalized cancer vaccines |
| WO2024153166A1 (zh) * | 2023-01-20 | 2024-07-25 | 石药集团中奇制药技术(石家庄)有限公司 | 一种经修饰的核苷单体及双链核糖核酸 |
| WO2024157194A1 (en) | 2023-01-25 | 2024-08-02 | Crispr Therapeutics Ag | Methods and assays for off-target analysis |
| WO2024159172A1 (en) | 2023-01-27 | 2024-08-02 | Senda Biosciences, Inc. | A modified lipid composition and uses thereof |
| WO2024163465A1 (en) | 2023-01-30 | 2024-08-08 | Modernatx, Inc. | Epstein-barr virus mrna vaccines |
| WO2024182301A2 (en) | 2023-02-27 | 2024-09-06 | Modernatx, Inc. | Lipid nanoparticles and polynucleotides encoding galactose-1-phosphate uridylyltransferase (galt) for the treatment of galactosemia |
| WO2024184500A1 (en) | 2023-03-08 | 2024-09-12 | CureVac SE | Novel lipid nanoparticle formulations for delivery of nucleic acids |
| WO2024192108A1 (en) | 2023-03-14 | 2024-09-19 | Evolveimmune Therapeutics, Inc. | Genetically modified car t cells and methods of making and using the same |
| WO2024206329A1 (en) | 2023-03-27 | 2024-10-03 | Modernatx, Inc. | Nucleic acid molecules encoding bi-specific secreted engagers and uses thereof |
| WO2024200820A1 (en) | 2023-03-30 | 2024-10-03 | Ose Immunotherapeutics | Method of synthesis of targeted lipid nanoparticle and uses thereof |
| WO2024200823A1 (en) | 2023-03-30 | 2024-10-03 | Ose Immunotherapeutics | Lipid-based nanoparticle targeted at activated immune cells for the expression of immune cell enhancing molecule and use thereof |
| WO2024215721A1 (en) | 2023-04-10 | 2024-10-17 | Modernatx, Inc. | Lyme disease vaccines |
| WO2024220625A1 (en) | 2023-04-19 | 2024-10-24 | Sail Biomedicines, Inc. | Delivery of polynucleotides from lipid nanoparticles comprising rna and ionizable lipids |
| WO2024220712A2 (en) | 2023-04-19 | 2024-10-24 | Sail Biomedicines, Inc. | Vaccine compositions |
| WO2024220752A2 (en) | 2023-04-19 | 2024-10-24 | Sail Biomedicines, Inc. | Rna therapeutic compositions |
| CN116284189B (zh) * | 2023-05-16 | 2023-08-08 | 深圳赛陆医疗科技有限公司 | 一种合成MANT-GTPγS的方法 |
| GB202406294D0 (en) | 2024-05-06 | 2024-06-19 | Thermo Fisher Scientific Baltics Uab | Methods and compositions for producing capped mRNA |
Family Cites Families (1117)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2008526A (en) | 1932-11-03 | 1935-07-16 | Wappler Frederick Charles | Method and means for treating living tissue |
| US3467096A (en) | 1966-04-12 | 1969-09-16 | Ferrell S Horn | Multiple hypodermic syringe arrangement |
| BE757653A (fr) | 1969-10-21 | 1971-04-16 | Ugine Kuhlmann | Nouveaux medicaments derives d'acides nucleiques et procedes pour leur preparation |
| BE786542A (fr) | 1971-07-22 | 1973-01-22 | Dow Corning | Dispositif d'aspiration permettant d'obtenir des echantillons de cellules |
| US3906092A (en) | 1971-11-26 | 1975-09-16 | Merck & Co Inc | Stimulation of antibody response |
| US4270537A (en) | 1979-11-19 | 1981-06-02 | Romaine Richard A | Automatic hypodermic syringe |
| US4399216A (en) | 1980-02-25 | 1983-08-16 | The Trustees Of Columbia University | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| US5132418A (en) | 1980-02-29 | 1992-07-21 | University Patents, Inc. | Process for preparing polynucleotides |
| US4458066A (en) | 1980-02-29 | 1984-07-03 | University Patents, Inc. | Process for preparing polynucleotides |
| US4500707A (en) | 1980-02-29 | 1985-02-19 | University Patents, Inc. | Nucleosides useful in the preparation of polynucleotides |
| US4411657A (en) | 1980-05-19 | 1983-10-25 | Anibal Galindo | Hypodermic needle |
| US4415732A (en) | 1981-03-27 | 1983-11-15 | University Patents, Inc. | Phosphoramidite compounds and processes |
| US4668777A (en) | 1981-03-27 | 1987-05-26 | University Patents, Inc. | Phosphoramidite nucleoside compounds |
| US4973679A (en) | 1981-03-27 | 1990-11-27 | University Patents, Inc. | Process for oligonucleo tide synthesis using phosphormidite intermediates |
| US4401796A (en) | 1981-04-30 | 1983-08-30 | City Of Hope Research Institute | Solid-phase synthesis of polynucleotides |
| US4373071A (en) | 1981-04-30 | 1983-02-08 | City Of Hope Research Institute | Solid-phase synthesis of polynucleotides |
| US4474569A (en) | 1982-06-28 | 1984-10-02 | Denver Surgical Developments, Inc. | Antenatal shunt |
| US4588585A (en) | 1982-10-19 | 1986-05-13 | Cetus Corporation | Human recombinant cysteine depleted interferon-β muteins |
| US4737462A (en) | 1982-10-19 | 1988-04-12 | Cetus Corporation | Structural genes, plasmids and transformed cells for producing cysteine depleted muteins of interferon-β |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4579849A (en) | 1984-04-06 | 1986-04-01 | Merck & Co., Inc. | N-alkylguanine acyclonucleosides as antiviral agents |
| US4957735A (en) | 1984-06-12 | 1990-09-18 | The University Of Tennessee Research Corporation | Target-sensitive immunoliposomes- preparation and characterization |
| US4959314A (en) | 1984-11-09 | 1990-09-25 | Cetus Corporation | Cysteine-depleted muteins of biologically active proteins |
| US5036006A (en) | 1984-11-13 | 1991-07-30 | Cornell Research Foundation, Inc. | Method for transporting substances into living cells and tissues and apparatus therefor |
| US5116943A (en) | 1985-01-18 | 1992-05-26 | Cetus Corporation | Oxidation-resistant muteins of Il-2 and other protein |
| CA1288073C (en) | 1985-03-07 | 1991-08-27 | Paul G. Ahlquist | Rna transformation vector |
| US4596556A (en) | 1985-03-25 | 1986-06-24 | Bioject, Inc. | Hypodermic injection apparatus |
| EP0204401A1 (en) | 1985-04-09 | 1986-12-10 | Biogen, Inc. | Method of improving the yield of polypeptides produced in a host cell by stabilizing mRNA |
| US5017691A (en) | 1986-07-03 | 1991-05-21 | Schering Corporation | Mammalian interleukin-4 |
| US5153319A (en) | 1986-03-31 | 1992-10-06 | University Patents, Inc. | Process for preparing polynucleotides |
| US4879111A (en) | 1986-04-17 | 1989-11-07 | Cetus Corporation | Treatment of infections with lymphokines |
| US4886499A (en) | 1986-12-18 | 1989-12-12 | Hoffmann-La Roche Inc. | Portable injection appliance |
| GB8704027D0 (en) | 1987-02-20 | 1987-03-25 | Owen Mumford Ltd | Syringe needle combination |
| US4941880A (en) | 1987-06-19 | 1990-07-17 | Bioject, Inc. | Pre-filled ampule and non-invasive hypodermic injection device assembly |
| US4790824A (en) | 1987-06-19 | 1988-12-13 | Bioject, Inc. | Non-invasive hypodermic injection device |
| US4940460A (en) | 1987-06-19 | 1990-07-10 | Bioject, Inc. | Patient-fillable and non-invasive hypodermic injection device assembly |
| US6090591A (en) | 1987-07-31 | 2000-07-18 | The Board Of Trustees Of The Leland Stanford Junior University | Selective amplification of target polynucleotide sequences |
| CA1340843C (en) | 1987-07-31 | 1999-12-07 | J. Lawrence Burg | Selective amplification of target polynucleotide sequences |
| ATE92538T1 (de) | 1988-01-21 | 1993-08-15 | Genentech Inc | Verstaerkung und nachweis von nukleinsaeuresequenzen. |
| JP2650159B2 (ja) | 1988-02-24 | 1997-09-03 | アクゾ・ノベル・エヌ・ベー | 核酸増幅方法 |
| CA1340807C (en) | 1988-02-24 | 1999-11-02 | Lawrence T. Malek | Nucleic acid amplification process |
| ATE123652T1 (de) | 1988-03-04 | 1995-06-15 | Cancer Res Campaign Tech | Antigene. |
| US5339163A (en) | 1988-03-16 | 1994-08-16 | Canon Kabushiki Kaisha | Automatic exposure control device using plural image plane detection areas |
| AU631545B2 (en) | 1988-04-15 | 1992-12-03 | Protein Design Labs, Inc. | Il-2 receptor-specific chimeric antibodies |
| US5168038A (en) | 1988-06-17 | 1992-12-01 | The Board Of Trustees Of The Leland Stanford Junior University | In situ transcription in cells and tissues |
| US5021335A (en) | 1988-06-17 | 1991-06-04 | The Board Of Trustees Of The Leland Stanford Junior University | In situ transcription in cells and tissues |
| US5130238A (en) | 1988-06-24 | 1992-07-14 | Cangene Corporation | Enhanced nucleic acid amplification process |
| US5759802A (en) | 1988-10-26 | 1998-06-02 | Tonen Corporation | Production of human serum alubumin A |
| FR2638359A1 (fr) | 1988-11-03 | 1990-05-04 | Tino Dalto | Guide de seringue avec reglage de la profondeur de penetration de l'aiguille dans la peau |
| US5047524A (en) | 1988-12-21 | 1991-09-10 | Applied Biosystems, Inc. | Automated system for polynucleotide synthesis and purification |
| US5262530A (en) | 1988-12-21 | 1993-11-16 | Applied Biosystems, Inc. | Automated system for polynucleotide synthesis and purification |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| US5693622A (en) | 1989-03-21 | 1997-12-02 | Vical Incorporated | Expression of exogenous polynucleotide sequences cardiac muscle of a mammal |
| US6673776B1 (en) | 1989-03-21 | 2004-01-06 | Vical Incorporated | Expression of exogenous polynucleotide sequences in a vertebrate, mammal, fish, bird or human |
| US6867195B1 (en) | 1989-03-21 | 2005-03-15 | Vical Incorporated | Lipid-mediated polynucleotide administration to reduce likelihood of subject's becoming infected |
| US5703055A (en) | 1989-03-21 | 1997-12-30 | Wisconsin Alumni Research Foundation | Generation of antibodies through lipid mediated DNA delivery |
| AU5344190A (en) | 1989-03-21 | 1990-10-22 | Vical, Inc. | Expression of exogenous polynucleotide sequences in a vertebrate |
| US6214804B1 (en) | 1989-03-21 | 2001-04-10 | Vical Incorporated | Induction of a protective immune response in a mammal by injecting a DNA sequence |
| US5012818A (en) | 1989-05-04 | 1991-05-07 | Joishy Suresh K | Two in one bone marrow surgical needle |
| IE66597B1 (en) | 1989-05-10 | 1996-01-24 | Akzo Nv | Method for the synthesis of ribonucleic acid (RNA) |
| US5240855A (en) | 1989-05-12 | 1993-08-31 | Pioneer Hi-Bred International, Inc. | Particle gun |
| US5332671A (en) | 1989-05-12 | 1994-07-26 | Genetech, Inc. | Production of vascular endothelial cell growth factor and DNA encoding same |
| CA2020958C (en) | 1989-07-11 | 2005-01-11 | Daniel L. Kacian | Nucleic acid sequence amplification methods |
| US5545522A (en) | 1989-09-22 | 1996-08-13 | Van Gelder; Russell N. | Process for amplifying a target polynucleotide sequence using a single primer-promoter complex |
| US5208020A (en) | 1989-10-25 | 1993-05-04 | Immunogen Inc. | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US5064413A (en) | 1989-11-09 | 1991-11-12 | Bioject, Inc. | Needleless hypodermic injection device |
| US5215899A (en) | 1989-11-09 | 1993-06-01 | Miles Inc. | Nucleic acid amplification employing ligatable hairpin probe and transcription |
| US5312335A (en) | 1989-11-09 | 1994-05-17 | Bioject Inc. | Needleless hypodermic injection device |
| NO904633L (no) | 1989-11-09 | 1991-05-10 | Molecular Diagnostics Inc | Amplifikasjon av nukleinsyrer ved transkriberbar haarnaalsprobe. |
| US5633076A (en) | 1989-12-01 | 1997-05-27 | Pharming Bv | Method of producing a transgenic bovine or transgenic bovine embryo |
| US5697901A (en) | 1989-12-14 | 1997-12-16 | Elof Eriksson | Gene delivery by microneedle injection |
| US5194370A (en) | 1990-05-16 | 1993-03-16 | Life Technologies, Inc. | Promoter ligation activated transcription amplification of nucleic acid sequences |
| EP0542874A4 (en) | 1990-07-25 | 1994-05-11 | Syngene Inc | Circular extension for generating multiple nucleic acid complements |
| US5190521A (en) | 1990-08-22 | 1993-03-02 | Tecnol Medical Products, Inc. | Apparatus and method for raising a skin wheal and anesthetizing skin |
| US6140496A (en) | 1990-10-09 | 2000-10-31 | Benner; Steven Albert | Precursors for deoxyribonucleotides containing non-standard nucleosides |
| US5527288A (en) | 1990-12-13 | 1996-06-18 | Elan Medical Technologies Limited | Intradermal drug delivery device and method for intradermal delivery of drugs |
| US6100024A (en) | 1991-02-08 | 2000-08-08 | Promega Corporation | Methods and compositions for nucleic acid detection by target extension and probe amplification |
| ATE201234T1 (de) | 1991-03-18 | 2001-06-15 | Univ New York | Für menschlichen tumornekrose-faktor spezifische monoklonale und chimäre antikörper |
| US5426180A (en) | 1991-03-27 | 1995-06-20 | Research Corporation Technologies, Inc. | Methods of making single-stranded circular oligonucleotides |
| EP0628639B1 (en) | 1991-04-25 | 1999-06-23 | Chugai Seiyaku Kabushiki Kaisha | Reconstituted human antibody against human interleukin 6 receptor |
| US5169766A (en) | 1991-06-14 | 1992-12-08 | Life Technologies, Inc. | Amplification of nucleic acid molecules |
| US5199441A (en) | 1991-08-20 | 1993-04-06 | Hogle Hugh H | Fine needle aspiration biopsy apparatus and method |
| GB9118204D0 (en) | 1991-08-23 | 1991-10-09 | Weston Terence E | Needle-less injector |
| SE9102652D0 (sv) | 1991-09-13 | 1991-09-13 | Kabi Pharmacia Ab | Injection needle arrangement |
| US5298422A (en) | 1991-11-06 | 1994-03-29 | Baylor College Of Medicine | Myogenic vector systems |
| US5824307A (en) | 1991-12-23 | 1998-10-20 | Medimmune, Inc. | Human-murine chimeric antibodies against respiratory syncytial virus |
| WO1993014778A1 (en) | 1992-01-23 | 1993-08-05 | Vical, Inc. | Ex vivo gene transfer |
| US5328483A (en) | 1992-02-27 | 1994-07-12 | Jacoby Richard M | Intradermal injection device with medication and needle guard |
| JP3368603B2 (ja) | 1992-02-28 | 2003-01-20 | オリンパス光学工業株式会社 | 遺伝子治療用処置具 |
| CA2076465C (en) | 1992-03-25 | 2002-11-26 | Ravi V. J. Chari | Cell binding agent conjugates of analogues and derivatives of cc-1065 |
| US6174666B1 (en) | 1992-03-27 | 2001-01-16 | The United States Of America As Represented By The Department Of Health And Human Services | Method of eliminating inhibitory/instability regions from mRNA |
| US6132419A (en) | 1992-05-22 | 2000-10-17 | Genetronics, Inc. | Electroporetic gene and drug therapy |
| US5514545A (en) | 1992-06-11 | 1996-05-07 | Trustees Of The University Of Pennsylvania | Method for characterizing single cells based on RNA amplification for diagnostics and therapeutics |
| US6670178B1 (en) | 1992-07-10 | 2003-12-30 | Transkaryotic Therapies, Inc. | In Vivo production and delivery of insulinotropin for gene therapy |
| US5383851A (en) | 1992-07-24 | 1995-01-24 | Bioject Inc. | Needleless hypodermic injection device |
| EP0652973B1 (en) | 1992-07-31 | 1997-04-23 | BEHRINGWERKE Aktiengesellschaft | Method for introducing defined sequences at the 3' end of polynucleotides |
| US5273525A (en) | 1992-08-13 | 1993-12-28 | Btx Inc. | Injection and electroporation apparatus for drug and gene delivery |
| US5569189A (en) | 1992-09-28 | 1996-10-29 | Equidyne Systems, Inc. | hypodermic jet injector |
| US5334144A (en) | 1992-10-30 | 1994-08-02 | Becton, Dickinson And Company | Single use disposable needleless injector |
| AU5665694A (en) | 1992-11-04 | 1994-05-24 | Denver Biomaterials Inc. | Apparatus for removal of pleural effusion fluid |
| ES2091684T3 (es) | 1992-11-13 | 1996-11-01 | Idec Pharma Corp | Aplicacion terapeutica de anticuerpos quimericos y radiomarcados contra el antigeno de diferenciacion restringida de los linfocitos b humanos para el tratamiento del linfoma de las celulas b. |
| US5736137A (en) | 1992-11-13 | 1998-04-07 | Idec Pharmaceuticals Corporation | Therapeutic application of chimeric and radiolabeled antibodies to human B lymphocyte restricted differentiation antigen for treatment of B cell lymphoma |
| DE69419721T2 (de) | 1993-01-12 | 2000-04-27 | Biogen, Inc. | Rekombinante anti-vla4 antikörpermoleküle |
| FR2703253B1 (fr) | 1993-03-30 | 1995-06-23 | Centre Nat Rech Scient | Applicateur d'impulsions electriques pour traitement de tissus biologiques. |
| US7135312B2 (en) | 1993-04-15 | 2006-11-14 | University Of Rochester | Circular DNA vectors for synthesis of RNA and DNA |
| US5773244A (en) | 1993-05-19 | 1998-06-30 | Regents Of The University Of California | Methods of making circular RNA |
| US5851829A (en) | 1993-07-16 | 1998-12-22 | Dana-Farber Cancer Institute | Method of intracellular binding of target molecules |
| US5672491A (en) | 1993-09-20 | 1997-09-30 | The Leland Stanford Junior University | Recombinant production of novel polyketides |
| US6432711B1 (en) | 1993-11-03 | 2002-08-13 | Diacrin, Inc. | Embryonic stem cells capable of differentiating into desired cell lines |
| US6096503A (en) | 1993-11-12 | 2000-08-01 | The Scripps Research Institute | Method for simultaneous identification of differentially expresses mRNAs and measurement of relative concentrations |
| US5840299A (en) | 1994-01-25 | 1998-11-24 | Athena Neurosciences, Inc. | Humanized antibodies against leukocyte adhesion molecule VLA-4 |
| US7435802B2 (en) | 1994-01-25 | 2008-10-14 | Elan Pharaceuticals, Inc. | Humanized anti-VLA4 immunoglobulins |
| DK0668350T4 (da) | 1994-02-16 | 2009-02-23 | Us Gov Health & Human Serv | Melanomassocieret antigen, epitoper deraf samt vacciner mod melanom |
| IL112820A0 (en) | 1994-03-07 | 1995-05-26 | Merck & Co Inc | Coordinate in vivo gene expression |
| WO1995024176A1 (en) | 1994-03-07 | 1995-09-14 | Bioject, Inc. | Ampule filling device |
| US5466220A (en) | 1994-03-08 | 1995-11-14 | Bioject, Inc. | Drug vial mixing and transfer device |
| AU704549B2 (en) | 1994-03-18 | 1999-04-29 | Lynx Therapeutics, Inc. | Oligonucleotide N3'-P5' phosphoramidates: synthesis and compounds; hybridization and nuclease resistance properties |
| WO1995026204A1 (en) | 1994-03-25 | 1995-10-05 | Isis Pharmaceuticals, Inc. | Immune stimulation by phosphorothioate oligonucleotide analogs |
| US5457041A (en) | 1994-03-25 | 1995-10-10 | Science Applications International Corporation | Needle array and method of introducing biological substances into living cells using the needle array |
| US6074642A (en) | 1994-05-02 | 2000-06-13 | Alexion Pharmaceuticals, Inc. | Use of antibodies specific to human complement component C5 for the treatment of glomerulonephritis |
| CA2190149C (en) | 1994-05-18 | 2011-01-04 | Jens Kossmann | Dna sequences coding for enzymes capable of facilitating the synthesis of linear .alpha.-1,4 glucans in plants, fungi and microorganisms |
| EP0802980A1 (en) | 1994-06-02 | 1997-10-29 | Chiron Corporation | Nucleic acid immunization using a virus-based infection/transfection system |
| GB9412230D0 (en) | 1994-06-17 | 1994-08-10 | Celltech Ltd | Interleukin-5 specific recombiant antibodies |
| US6239116B1 (en) | 1994-07-15 | 2001-05-29 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| AU3272695A (en) | 1994-08-12 | 1996-03-07 | Immunomedics Inc. | Immunoconjugates and humanized antibodies specific for b-cell lymphoma and leukemia cells |
| US5641665A (en) | 1994-11-28 | 1997-06-24 | Vical Incorporated | Plasmids suitable for IL-2 expression |
| US5665545A (en) | 1994-11-28 | 1997-09-09 | Akzo Nobel N.V. | Terminal repeat amplification method |
| US5588960A (en) | 1994-12-01 | 1996-12-31 | Vidamed, Inc. | Transurethral needle delivery device with cystoscope and method for treatment of urinary incontinence |
| US5807718A (en) | 1994-12-02 | 1998-09-15 | The Scripps Research Institute | Enzymatic DNA molecules |
| ATE373094T1 (de) | 1995-01-06 | 2007-09-15 | Plant Res Int Bv | Für kohlenhydratpolymere-bildende enzyme- kodierende dna-sequenzen und verfahren zur herstellung transgener pflanzen |
| US5599302A (en) | 1995-01-09 | 1997-02-04 | Medi-Ject Corporation | Medical injection system and method, gas spring thereof and launching device using gas spring |
| US5795587A (en) | 1995-01-23 | 1998-08-18 | University Of Pittsburgh | Stable lipid-comprising drug delivery complexes and methods for their production |
| US5824497A (en) | 1995-02-10 | 1998-10-20 | Mcmaster University | High efficiency translation of mRNA molecules |
| EP0727187B1 (en) | 1995-02-15 | 2003-08-06 | Joseph Eldor | Multiple hole spinal needle |
| EP0735144B1 (en) | 1995-03-28 | 2002-06-05 | Japan Science and Technology Corporation | Method for molecular indexing of genes using restriction enzymes |
| US5869230A (en) | 1995-03-30 | 1999-02-09 | Beth Israel Hospital Association | Gene transfer into the kidney |
| US5986054A (en) | 1995-04-28 | 1999-11-16 | The Hospital For Sick Children, Hsc Research And Development Limited Partnership | Genetic sequences and proteins related to alzheimer's disease |
| FR2733762B1 (fr) | 1995-05-02 | 1997-08-01 | Genset Sa | Methode de couplage specifique de la coiffe de l'extremite 5' d'un fragment d'arnm et preparation d'arnm et d'adnc complet |
| US5700642A (en) | 1995-05-22 | 1997-12-23 | Sri International | Oligonucleotide sizing using immobilized cleavable primers |
| US5730723A (en) | 1995-10-10 | 1998-03-24 | Visionary Medical Products Corporation, Inc. | Gas pressured needle-less injection device and method |
| US6111095A (en) | 1995-06-07 | 2000-08-29 | Merck & Co., Inc. | Capped synthetic RNA, analogs, and aptamers |
| US6051429A (en) | 1995-06-07 | 2000-04-18 | Life Technologies, Inc. | Peptide-enhanced cationic lipid transfections |
| US5889136A (en) | 1995-06-09 | 1999-03-30 | The Regents Of The University Of Colorado | Orthoester protecting groups in RNA synthesis |
| US5766903A (en) | 1995-08-23 | 1998-06-16 | University Technology Corporation | Circular RNA and uses thereof |
| US6265389B1 (en) | 1995-08-31 | 2001-07-24 | Alkermes Controlled Therapeutics, Inc. | Microencapsulation and sustained release of oligonucleotides |
| AU7073096A (en) | 1995-09-19 | 1997-04-09 | University Of Massachusetts | Inhibited biological degradation of oligodeoxynucleotides |
| US5830879A (en) | 1995-10-02 | 1998-11-03 | St. Elizabeth's Medical Center Of Boston, Inc. | Treatment of vascular injury using vascular endothelial growth factor |
| US6265387B1 (en) | 1995-10-11 | 2001-07-24 | Mirus, Inc. | Process of delivering naked DNA into a hepatocyte via bile duct |
| US6132988A (en) | 1995-10-27 | 2000-10-17 | Takeda Chemical Industries, Ltd. | DNA encoding a neuronal cell-specific receptor protein |
| CU22584A1 (es) | 1995-11-17 | 1999-11-03 | Centro Inmunologia Molecular | Composiciones farmacéuticas que contienen un anticuerpo monoclonal que reconoce el antígeno de diferenciación leucocitario humano cd6 y sus usos para el diagnóstico y tratamiento de la psoriasis |
| US6090382A (en) | 1996-02-09 | 2000-07-18 | Basf Aktiengesellschaft | Human antibodies that bind human TNFα |
| US5962271A (en) | 1996-01-03 | 1999-10-05 | Cloutech Laboratories, Inc. | Methods and compositions for generating full-length cDNA having arbitrary nucleotide sequence at the 3'-end |
| US5893397A (en) | 1996-01-12 | 1999-04-13 | Bioject Inc. | Medication vial/syringe liquid-transfer apparatus |
| US6261584B1 (en) | 1996-02-02 | 2001-07-17 | Alza Corporation | Sustained delivery of an active agent using an implantable system |
| US6395292B2 (en) | 1996-02-02 | 2002-05-28 | Alza Corporation | Sustained delivery of an active agent using an implantable system |
| WO1997030064A1 (en) | 1996-02-16 | 1997-08-21 | Stichting Rega Vzw | Hexitol containing oligonucleotides and their use in antisense strategies |
| US6534312B1 (en) | 1996-02-22 | 2003-03-18 | Merck & Co., Inc. | Vaccines comprising synthetic genes |
| US6090391A (en) | 1996-02-23 | 2000-07-18 | Aviron | Recombinant tryptophan mutants of influenza |
| US6300487B1 (en) | 1996-03-19 | 2001-10-09 | Cell Therapuetics, Inc. | Mammalian lysophosphatidic acid acyltransferase |
| SE9601245D0 (sv) | 1996-03-29 | 1996-03-29 | Pharmacia Ab | Chimeric superantigens and their use |
| TW517061B (en) | 1996-03-29 | 2003-01-11 | Pharmacia & Amp Upjohn Ab | Modified/chimeric superantigens and their use |
| GB9607549D0 (en) | 1996-04-11 | 1996-06-12 | Weston Medical Ltd | Spring-powered dispensing device |
| US5712127A (en) | 1996-04-29 | 1998-01-27 | Genescape Inc. | Subtractive amplification |
| US5853719A (en) | 1996-04-30 | 1998-12-29 | Duke University | Methods for treating cancers and pathogen infections using antigen-presenting cells loaded with RNA |
| US7329741B2 (en) | 1996-06-05 | 2008-02-12 | Chiron Corporation | Polynucleotides that hybridize to DP-75 and their use |
| ATE438717T1 (de) | 1996-06-05 | 2009-08-15 | Novartis Vaccines & Diagnostic | Dp-75 kodierende dna und verfahren zu ihrer verwendung |
| EP0912607A2 (en) | 1996-06-21 | 1999-05-06 | Merck & Co., Inc. | Vaccines comprising synthetic genes |
| EP0925088A2 (en) | 1996-06-28 | 1999-06-30 | Sontra Medical, L.P. | Ultrasound enhancement of transdermal transport |
| US5677124A (en) | 1996-07-03 | 1997-10-14 | Ambion, Inc. | Ribonuclease resistant viral RNA standards |
| US5939262A (en) | 1996-07-03 | 1999-08-17 | Ambion, Inc. | Ribonuclease resistant RNA preparation and utilization |
| US7288266B2 (en) | 1996-08-19 | 2007-10-30 | United States Of America As Represented By The Secretary, Department Of Health And Human Services | Liposome complexes for increased systemic delivery |
| US5849546A (en) | 1996-09-13 | 1998-12-15 | Epicentre Technologies Corporation | Methods for using mutant RNA polymerases with reduced discrimination between non-canonical and canonical nucleoside triphosphates |
| US6114148C1 (en) | 1996-09-20 | 2012-05-01 | Gen Hospital Corp | High level expression of proteins |
| AU737323B2 (en) | 1996-09-24 | 2001-08-16 | Genentech, Inc. | A family of genes encoding apoptosis-related peptides, peptides encoded thereby and methods of use thereof |
| US6214966B1 (en) | 1996-09-26 | 2001-04-10 | Shearwater Corporation | Soluble, degradable poly(ethylene glycol) derivatives for controllable release of bound molecules into solution |
| WO1998016247A1 (en) | 1996-10-11 | 1998-04-23 | The Regents Of The University Of California | Immunostimulatory polynucleotide/immunomodulatory molecule conjugates |
| EP0839912A1 (en) | 1996-10-30 | 1998-05-06 | Instituut Voor Dierhouderij En Diergezondheid (Id-Dlo) | Infectious clones of RNA viruses and vaccines and diagnostic assays derived thereof |
| GB9623051D0 (en) | 1996-11-06 | 1997-01-08 | Schacht Etienne H | Delivery of DNA to target cells in biological systems |
| US5980887A (en) | 1996-11-08 | 1999-11-09 | St. Elizabeth's Medical Center Of Boston | Methods for enhancing angiogenesis with endothelial progenitor cells |
| US5759179A (en) | 1996-12-31 | 1998-06-02 | Johnson & Johnson Medical, Inc. | Needle and valve assembly for use with a catheter |
| EP0971946B1 (en) | 1997-01-21 | 2006-07-05 | The General Hospital Corporation | Selection of proteins using rna-protein fusions |
| EP0855184A1 (en) | 1997-01-23 | 1998-07-29 | Grayson B. Dr. Lipford | Pharmaceutical composition comprising a polynucleotide and an antigen especially for vaccination |
| US6251665B1 (en) | 1997-02-07 | 2001-06-26 | Cem Cezayirli | Directed maturation of stem cells and production of programmable antigen presenting dentritic cells therefrom |
| US6696291B2 (en) | 1997-02-07 | 2004-02-24 | Merck & Co., Inc. | Synthetic HIV gag genes |
| US6228640B1 (en) | 1997-02-07 | 2001-05-08 | Cem Cezayirli | Programmable antigen presenting cell of CD34 lineage |
| IL131131A0 (en) | 1997-02-07 | 2001-01-28 | Merck & Co Inc | Synthetic hiv gag genes |
| US6406705B1 (en) | 1997-03-10 | 2002-06-18 | University Of Iowa Research Foundation | Use of nucleic acids containing unmethylated CpG dinucleotide as an adjuvant |
| US6306393B1 (en) | 1997-03-24 | 2001-10-23 | Immunomedics, Inc. | Immunotherapy of B-cell malignancies using anti-CD22 antibodies |
| US6261281B1 (en) | 1997-04-03 | 2001-07-17 | Electrofect As | Method for genetic immunization and introduction of molecules into skeletal muscle and immune cells |
| US5914269A (en) | 1997-04-04 | 1999-06-22 | Isis Pharmaceuticals, Inc. | Oligonucleotide inhibition of epidermal growth factor receptor expression |
| AU6972798A (en) | 1997-04-18 | 1998-11-13 | University Of Medicine And Dentistry Of New Jersey | Inhibition of hiv-1 replication by a tat rna-binding domain peptide analog |
| US5958688A (en) | 1997-04-28 | 1999-09-28 | The Trustees Of The University Of Pennsylvania | Characterization of mRNA patterns in neurites and single cells for medical diagnosis and therapeutics |
| US6235883B1 (en) | 1997-05-05 | 2001-05-22 | Abgenix, Inc. | Human monoclonal antibodies to epidermal growth factor receptor |
| US5989911A (en) | 1997-05-09 | 1999-11-23 | University Of Massachusetts | Site-specific synthesis of pseudouridine in RNA |
| US5993412A (en) | 1997-05-19 | 1999-11-30 | Bioject, Inc. | Injection apparatus |
| US6124091A (en) | 1997-05-30 | 2000-09-26 | Research Corporation Technologies, Inc. | Cell growth-controlling oligonucleotides |
| US6589940B1 (en) | 1997-06-06 | 2003-07-08 | Dynavax Technologies Corporation | Immunostimulatory oligonucleotides, compositions thereof and methods of use thereof |
| DK1003850T3 (da) | 1997-06-06 | 2009-09-07 | Univ California | Inhibitorer af DNA-immunstimulatorisk sekvensaktivitet |
| DE69834038D1 (de) | 1997-07-01 | 2006-05-18 | Isis Pharmaceutical Inc | Zusammensetzungen und verfahren zur verabreichung von oligonukleotiden über die speiseröhre |
| US5994511A (en) | 1997-07-02 | 1999-11-30 | Genentech, Inc. | Anti-IgE antibodies and methods of improving polypeptides |
| ATE361102T1 (de) | 1997-07-21 | 2007-05-15 | Active Biotech Ab | Zytolyse der geeigneten zielzellen mit superantigen konjugate mittels der induktion von t-zell aktivierung |
| CA2298811A1 (en) | 1997-07-31 | 1999-02-11 | St. Elizabeth's Medical Center Of Boston, Inc. | Method for the treatment of grafts |
| AU752725B2 (en) | 1997-09-18 | 2002-09-26 | Trustees Of The University Of Pennsylvania, The | Attenuated vif DNA immunization cassettes for genetic vaccines |
| AU9319398A (en) | 1997-09-19 | 1999-04-05 | Sequitur, Inc. | Sense mrna therapy |
| US6004573A (en) | 1997-10-03 | 1999-12-21 | Macromed, Inc. | Biodegradable low molecular weight triblock poly(lactide-co-glycolide) polyethylene glycol copolymers having reverse thermal gelation properties |
| WO1999018221A1 (en) | 1997-10-07 | 1999-04-15 | University Of Maryland Biotechnology Institute | Method for introducing and expressing rna in animal cells |
| BR9813110A (pt) | 1997-10-20 | 2000-08-15 | Genzyme Transgenics Corp | Sequências de ácido nucléico de msp-1 modificada e métodos para o aumento de nìveis de mrna e de expressão de proteìnas em sistemas de células |
| US6019747A (en) | 1997-10-21 | 2000-02-01 | I-Flow Corporation | Spring-actuated infusion syringe |
| AU1275899A (en) | 1997-10-24 | 1999-05-17 | Megabios Corporation | Methods for preparing polynucleotide transfection complexes |
| CA2309766C (en) | 1997-11-20 | 2008-09-30 | Vical Incorporated | Treatment of cancer using cytokine-expressing polynucleotides and compositions therefor |
| US7655777B2 (en) | 1997-11-24 | 2010-02-02 | Monsanto Technology Llc | Nucleic acid molecules associated with the tocopherol pathway |
| ZA9811377B (en) | 1997-12-12 | 1999-08-27 | Expression Genetics Inc | Positively charged poly[alpha-(omega-aminoalkyl) glycolic acid[ for the delivery of a bioactive agent via tissue and cellular uptake. |
| US6517869B1 (en) | 1997-12-12 | 2003-02-11 | Expression Genetics, Inc. | Positively charged poly(alpha-(omega-aminoalkyl)lycolic acid) for the delivery of a bioactive agent via tissue and cellular uptake |
| JP2002500010A (ja) | 1997-12-23 | 2002-01-08 | カイロン コーポレイション | ヒト遺伝子および遺伝子発現産物i |
| US6383811B2 (en) | 1997-12-30 | 2002-05-07 | Mirus Corporation | Polyampholytes for delivering polyions to a cell |
| JP2002500201A (ja) | 1998-01-05 | 2002-01-08 | ユニバーシティ オブ ワシントン | 膜破壊剤を使用する増強された輸送 |
| US8287483B2 (en) | 1998-01-08 | 2012-10-16 | Echo Therapeutics, Inc. | Method and apparatus for enhancement of transdermal transport |
| IT1298087B1 (it) | 1998-01-08 | 1999-12-20 | Fiderm S R L | Dispositivo per il controllo della profondita' di penetrazione di un ago, in particolare applicabile ad una siringa per iniezioni |
| US6190315B1 (en) | 1998-01-08 | 2001-02-20 | Sontra Medical, Inc. | Sonophoretic enhanced transdermal transport |
| US6365346B1 (en) | 1998-02-18 | 2002-04-02 | Dade Behring Inc. | Quantitative determination of nucleic acid amplification products |
| US5955310A (en) | 1998-02-26 | 1999-09-21 | Novo Nordisk Biotech, Inc. | Methods for producing a polypeptide in a bacillus cell |
| US6432925B1 (en) | 1998-04-16 | 2002-08-13 | John Wayne Cancer Institute | RNA cancer vaccine and methods for its use |
| US6429301B1 (en) | 1998-04-17 | 2002-08-06 | Whitehead Institute For Biomedical Research | Use of a ribozyme to join nucleic acids and peptides |
| GB9808327D0 (en) | 1998-04-20 | 1998-06-17 | Chiron Spa | Antidiotypic compounds |
| CN1177931C (zh) | 1998-04-23 | 2004-12-01 | 宝生物工程株式会社 | Dna的合成方法 |
| US6395253B2 (en) | 1998-04-23 | 2002-05-28 | The Regents Of The University Of Michigan | Microspheres containing condensed polyanionic bioactive agents and methods for their production |
| US20020064517A1 (en) | 1998-04-30 | 2002-05-30 | Stewart A. Cederholm-Williams | Fibrin sealant as a transfection/transformation vehicle for gene therapy |
| US20090208418A1 (en) | 2005-04-29 | 2009-08-20 | Innexus Biotechnology Internaltional Ltd. | Superantibody synthesis and use in detection, prevention and treatment of disease |
| EP1083882B1 (en) | 1998-05-20 | 2008-10-15 | Expression Genetics, Inc. | Poly-l-lysine grafted with lactose or galactose-polyethylene glycol as polymeric gene carrier |
| US6503231B1 (en) | 1998-06-10 | 2003-01-07 | Georgia Tech Research Corporation | Microneedle device for transport of molecules across tissue |
| US7091192B1 (en) | 1998-07-01 | 2006-08-15 | California Institute Of Technology | Linear cyclodextrin copolymers |
| EP1117720A4 (en) | 1998-07-13 | 2001-11-14 | Expression Genetics Inc | POLY-L-LYSINE ANALOG POLYESTER AS SOLUBLE Biodegradable Gene Transfer Carriers |
| CA2337652C (en) | 1998-07-13 | 2013-03-26 | Genetronics, Inc. | Skin and muscle-targeted gene therapy by pulsed electrical field |
| US6222030B1 (en) | 1998-08-03 | 2001-04-24 | Agilent Technologies, Inc. | Solid phase synthesis of oligonucleotides using carbonate protecting groups and alpha-effect nucleophile deprotection |
| KR101023367B1 (ko) | 1998-08-11 | 2011-03-18 | 바이오겐 아이덱 인크. | B-세포 림프종을 치료하기 위한 항-cd20 항체를 포함하는 약제 |
| GB9817662D0 (en) | 1998-08-13 | 1998-10-07 | Crocker Peter J | Substance delivery |
| US20090148906A1 (en) | 1998-09-29 | 2009-06-11 | Shire Human Genetic Therapies, Inc. A Delaware Corporation | Optimized messenger rna |
| US6924365B1 (en) | 1998-09-29 | 2005-08-02 | Transkaryotic Therapies, Inc. | Optimized messenger RNA |
| JP2002528109A (ja) | 1998-11-03 | 2002-09-03 | エール ユニバーシティ | マルチドメインポリヌクレオチド分子センサ |
| TR200101302T2 (tr) | 1998-11-09 | 2001-10-22 | Idec Pharmaceuticals Corporation | BMT yada PBSC transplantı alan hastalarda in vitro ya da in vivo temizleyici madde olarak kimerik anti-CD20 antikorunun kullanımı. |
| PT2055313E (pt) | 1998-11-09 | 2015-08-25 | Biogen Idec Inc | Tratamento de malignidades hematológicas associadas a células tumorais em circulação utilizando anticorpo quimérico anti-cd20 |
| AU2023400A (en) | 1998-11-12 | 2000-05-29 | Children's Medical Center Corporation | Compositions and methods for inhibiting angiogenesis using trna and fragments thereof |
| US6210931B1 (en) | 1998-11-30 | 2001-04-03 | The United States Of America As Represented By The Secretary Of Agriculture | Ribozyme-mediated synthesis of circular RNA |
| US20040171980A1 (en) | 1998-12-18 | 2004-09-02 | Sontra Medical, Inc. | Method and apparatus for enhancement of transdermal transport |
| AU3128000A (en) | 1998-12-23 | 2000-07-31 | Human Genome Sciences, Inc. | Peptidoglycan recognition proteins |
| US6255476B1 (en) | 1999-02-22 | 2001-07-03 | Pe Corporation (Ny) | Methods and compositions for synthesis of labelled oligonucleotides and analogs on solid-supports |
| AU2685200A (en) | 1999-02-22 | 2000-09-14 | European Molecular Biology Laboratory | Translation system |
| US7629311B2 (en) | 1999-02-24 | 2009-12-08 | Edward Lewis Tobinick | Methods to facilitate transmission of large molecules across the blood-brain, blood-eye, and blood-nerve barriers |
| ATE297190T1 (de) | 1999-02-26 | 2005-06-15 | Chiron Corp | Mikroemulsionen mit adsorbierten makromolekülen und mikropartikeln |
| CA2369119A1 (en) | 1999-03-29 | 2000-05-25 | Statens Serum Institut | Nucleotide construct with optimised codons for an hiv genetic vaccine based on a primary, early hiv isolate and synthetic envelope |
| EP1177231B1 (en) | 1999-04-09 | 2009-08-19 | Invitrogen Dynal AS | Process for the preparation of monodisperse polymer particles |
| CA2904259C (en) | 1999-05-07 | 2016-11-15 | Genentech, Inc. | Use of rituximab to treat vasculitis |
| KR20020011985A (ko) | 1999-05-07 | 2002-02-09 | 파르마솔 게엠베하 | 액상 및 고체상 지질 혼합물에 기초한 지질입자들 및 그의제조방법 |
| US6346382B1 (en) | 1999-06-01 | 2002-02-12 | Vanderbilt University | Human carbamyl phosphate synthetase I polymorphism and diagnostic methods related thereto |
| US6611707B1 (en) | 1999-06-04 | 2003-08-26 | Georgia Tech Research Corporation | Microneedle drug delivery device |
| WO2000075356A1 (en) | 1999-06-04 | 2000-12-14 | Lin Shi Lung | Rna polymerase chain reaction |
| US6743211B1 (en) | 1999-11-23 | 2004-06-01 | Georgia Tech Research Corporation | Devices and methods for enhanced microneedle penetration of biological barriers |
| US6303573B1 (en) | 1999-06-07 | 2001-10-16 | The Burnham Institute | Heart homing peptides and methods of using same |
| EP1196558A1 (fr) | 1999-06-08 | 2002-04-17 | Aventis Pasteur | Oligonucleotide immunostimulant |
| CA2375912C (en) | 1999-06-09 | 2014-03-11 | Immunomedics, Inc. | Immunotherapy of autoimmune disorders using antibodies which target b-cells |
| US6949245B1 (en) | 1999-06-25 | 2005-09-27 | Genentech, Inc. | Humanized anti-ErbB2 antibodies and treatment with anti-ErbB2 antibodies |
| NZ516236A (en) | 1999-06-30 | 2004-12-24 | Advanced Cell Tech Inc | Altering life span of a recipient cell by transferring cell cytoplasm from a donor cell for use in gene therapy and cloning |
| US6514948B1 (en) | 1999-07-02 | 2003-02-04 | The Regents Of The University Of California | Method for enhancing an immune response |
| MXPA01013462A (es) | 1999-07-09 | 2002-07-02 | Wyeth Corp | Metodos y composiciones para prevenir la formacion de arn aberrante durante la transcripcion de una secuencia plasmidica. |
| US8557244B1 (en) | 1999-08-11 | 2013-10-15 | Biogen Idec Inc. | Treatment of aggressive non-Hodgkins lymphoma with anti-CD20 antibody |
| NZ517202A (en) | 1999-08-24 | 2004-05-28 | Medarex Inc | Human CTLA-4 antibodies and their uses |
| US20050112141A1 (en) | 2000-08-30 | 2005-05-26 | Terman David S. | Compositions and methods for treatment of neoplastic disease |
| US20040106567A1 (en) | 1999-09-07 | 2004-06-03 | Hagstrom James E. | Intravascular delivery of non-viral nucleic acid |
| EP1619254B1 (en) | 1999-09-09 | 2010-12-22 | CureVac GmbH | Transfer of mRNA using polycationic compounds |
| WO2001021810A1 (en) | 1999-09-17 | 2001-03-29 | Aventis Pasteur Limited | Chlamydia antigens and corresponding dna fragments and uses thereof |
| US6623457B1 (en) | 1999-09-22 | 2003-09-23 | Becton, Dickinson And Company | Method and apparatus for the transdermal administration of a substance |
| WO2002064799A2 (en) | 1999-09-28 | 2002-08-22 | Transkaryotic Therapies, Inc. | Optimized messenger rna |
| US6528262B1 (en) | 1999-10-06 | 2003-03-04 | Quark Biotech, Inc. | Method for enrichment of natural antisense messenger RNA |
| US7060291B1 (en) | 1999-11-24 | 2006-06-13 | Transave, Inc. | Modular targeted liposomal delivery system |
| US6613026B1 (en) | 1999-12-08 | 2003-09-02 | Scimed Life Systems, Inc. | Lateral needle-less injection apparatus and method |
| US6277974B1 (en) | 1999-12-14 | 2001-08-21 | Cogent Neuroscience, Inc. | Compositions and methods for diagnosing and treating conditions, disorders, or diseases involving cell death |
| US6245929B1 (en) | 1999-12-20 | 2001-06-12 | General Electric Company | Catalyst composition and method for producing diaryl carbonates, using bisphosphines |
| JP4758583B2 (ja) | 1999-12-22 | 2011-08-31 | バセル テクノロジー カンパニー ビー.ブイ. | 芳香族シラン化合物を含むα−オレフィン重合触媒系 |
| AU2764801A (en) | 2000-01-07 | 2001-07-24 | University Of Washington | Enhanced transport of agents using membrane disruptive agents |
| WO2001051661A2 (en) | 2000-01-13 | 2001-07-19 | Amsterdam Support Diagnostics B.V. | A universal nucleic acid amplification system for nucleic acids in a sample |
| WO2001055341A2 (en) | 2000-01-31 | 2001-08-02 | The Regents Of The University Of California | Immunomodulatory polynucleotides in treatment of an infection by an intracellular pathogen |
| WO2001055306A2 (en) | 2000-01-31 | 2001-08-02 | Human Genome Sciences, Inc. | Nucleic acids, proteins, and antibodies |
| US6602498B2 (en) | 2000-02-22 | 2003-08-05 | Shearwater Corporation | N-maleimidyl polymer derivatives |
| SI1481992T1 (sl) | 2000-02-24 | 2017-01-31 | Washington University St. Louis | Humanizirana protitelesa, ki vežejo amiloidni peptid beta |
| WO2001066149A2 (en) | 2000-03-03 | 2001-09-13 | Valentis, Inc. | Nucleic acid formulations for gene delivery and methods of use |
| AU2001287291B2 (en) | 2000-03-31 | 2006-08-10 | Biogen Idec Inc. | Combined use of anti-cytokine antibodies or antagonists and anti-CD20 for the treatment of B cell lymphoma |
| JP2003529774A (ja) | 2000-03-31 | 2003-10-07 | ジェネンテック・インコーポレーテッド | 遺伝子発現を検出し定量するための構成物及び方法 |
| US6565572B2 (en) | 2000-04-10 | 2003-05-20 | Sdgi Holdings, Inc. | Fenestrated surgical screw and method |
| DK2236152T3 (da) | 2000-04-12 | 2014-07-07 | Novozymes Biopharma Dk As | Albuminfusionsproteiner |
| US6368801B1 (en) | 2000-04-12 | 2002-04-09 | Molecular Staging, Inc. | Detection and amplification of RNA using target-mediated ligation of DNA by RNA ligase |
| US20010046496A1 (en) | 2000-04-14 | 2001-11-29 | Brettman Lee R. | Method of administering an antibody |
| US6375972B1 (en) | 2000-04-26 | 2002-04-23 | Control Delivery Systems, Inc. | Sustained release drug delivery devices, methods of use, and methods of manufacturing thereof |
| US20040229271A1 (en) | 2000-05-19 | 2004-11-18 | Williams Richard B. | Compositions and methods for the identification and selection of nucleic acids and polypeptides |
| WO2001092523A2 (en) | 2000-05-30 | 2001-12-06 | Curagen Corporation | Human polynucleotides and polypeptides encoded thereby |
| US20040052763A1 (en) | 2000-06-07 | 2004-03-18 | Mond James J. | Immunostimulatory RNA/DNA hybrid molecules |
| DE60124098T2 (de) | 2000-06-23 | 2007-04-05 | Wyeth Holdings Corp. | Modifiziertes Morbillivirus V Proteine |
| EP2166019A3 (en) | 2000-07-03 | 2010-06-09 | Novartis Vaccines and Diagnostics S.r.l. | Immunisation against Chlamydia Pneumoniae |
| US6440096B1 (en) | 2000-07-14 | 2002-08-27 | Becton, Dickinson And Co. | Microdevice and method of manufacturing a microdevice |
| HUP0300745A3 (en) | 2000-07-21 | 2010-01-28 | Glaxo Group Ltd | Codon-optimized papilloma virus sequences |
| US6902734B2 (en) | 2000-08-07 | 2005-06-07 | Centocor, Inc. | Anti-IL-12 antibodies and compositions thereof |
| US20040142474A1 (en) | 2000-09-14 | 2004-07-22 | Expression Genetics, Inc. | Novel cationic lipopolymer as a biocompatible gene delivery agent |
| US6696038B1 (en) | 2000-09-14 | 2004-02-24 | Expression Genetics, Inc. | Cationic lipopolymer as biocompatible gene delivery agent |
| WO2002024873A1 (en) | 2000-09-20 | 2002-03-28 | Christopher Ralph Franks | Stem cell therapy |
| CA2424216A1 (en) | 2000-10-04 | 2002-04-11 | The Trustees Of The University Of Pennsylvania | Compositions and methods of using capsid protein from flaviviruses and pestiviruses |
| US6998115B2 (en) | 2000-10-10 | 2006-02-14 | Massachusetts Institute Of Technology | Biodegradable poly(β-amino esters) and uses thereof |
| US7202226B2 (en) | 2000-10-23 | 2007-04-10 | Detroit R & D | Augmentation of wound healing by elF-4E mRNA and EGF mRNA |
| US20030077604A1 (en) | 2000-10-27 | 2003-04-24 | Yongming Sun | Compositions and methods relating to breast specific genes and proteins |
| US20020132788A1 (en) | 2000-11-06 | 2002-09-19 | David Lewis | Inhibition of gene expression by delivery of small interfering RNA to post-embryonic animal cells in vivo |
| WO2002040545A2 (en) | 2000-11-17 | 2002-05-23 | The Government Of The United States, As Represented By The Secretary Of The Department Of Health And Human Services | Reduction of the nonspecific animal toxicity of immunotoxins by mutating the framework regions of the fv to lower the isoelectric point |
| EP1415005B1 (en) | 2000-12-07 | 2012-11-21 | Novartis Vaccines and Diagnostics, Inc. | Endogenous retroviruses up-regulated in prostate cancer |
| US20020130430A1 (en) | 2000-12-29 | 2002-09-19 | Castor Trevor Percival | Methods for making polymer microspheres/nanospheres and encapsulating therapeutic proteins and other products |
| US7708915B2 (en) | 2004-05-06 | 2010-05-04 | Castor Trevor P | Polymer microspheres/nanospheres and encapsulating therapeutic proteins therein |
| SG149684A1 (en) | 2001-01-19 | 2009-02-27 | Vironovative Bv | A virus causing respiratory tract illness in susceptible animals |
| EP1224943A1 (en) | 2001-01-19 | 2002-07-24 | Crucell Holland B.V. | Fibronectin as a tumor marker detected by phage antibodies |
| US20040110191A1 (en) | 2001-01-31 | 2004-06-10 | Winkler Matthew M. | Comparative analysis of nucleic acids using population tagging |
| EP1366196A4 (en) | 2001-02-14 | 2004-07-07 | Baylor College Medicine | METHOD AND COMPOSITIONS FOR AMPLIFICATING RNA |
| US6652886B2 (en) | 2001-02-16 | 2003-11-25 | Expression Genetics | Biodegradable cationic copolymers of poly (alkylenimine) and poly (ethylene glycol) for the delivery of bioactive agents |
| DE10109897A1 (de) | 2001-02-21 | 2002-11-07 | Novosom Ag | Fakultativ kationische Liposomen und Verwendung dieser |
| US7232425B2 (en) | 2001-03-02 | 2007-06-19 | Sorenson Development, Inc. | Apparatus and method for specific interstitial or subcutaneous diffusion and dispersion of medication |
| JP2004530425A (ja) | 2001-03-09 | 2004-10-07 | ジーン ストリーム プロプライエトリー リミティッド | 新規な発現ベクター |
| JP2002262882A (ja) | 2001-03-12 | 2002-09-17 | Nisshinbo Ind Inc | Rnaの増幅法 |
| FR2822164B1 (fr) | 2001-03-19 | 2004-06-18 | Centre Nat Rech Scient | Polypeptides derives des arn polymerases, et leurs utilisations |
| US6520949B2 (en) | 2001-04-02 | 2003-02-18 | Martin St. Germain | Method and apparatus for administering fluid to animals subcutaneously |
| DE10119005A1 (de) | 2001-04-18 | 2002-10-24 | Roche Diagnostics Gmbh | Verfahren zur Proteinexpression ausgehend von stabilisierter linearer kurzer DNA in zellfreien in vitro-Transkription/Translations-Systemen mit Exonuklease-haltigen Lysaten oder in einem zellulären System enthaltend Exonukleasen |
| US20030171253A1 (en) | 2001-04-19 | 2003-09-11 | Averil Ma | Methods and compositions relating to modulation of A20 |
| EP1390518B1 (de) | 2001-04-23 | 2004-10-06 | Amaxa GmbH | Pufferlössung für die elektroporation und verfahren umfassend die verwendung derselben |
| US7560424B2 (en) | 2001-04-30 | 2009-07-14 | Zystor Therapeutics, Inc. | Targeted therapeutic proteins |
| US6777187B2 (en) | 2001-05-02 | 2004-08-17 | Rubicon Genomics, Inc. | Genome walking by selective amplification of nick-translate DNA library and amplification from complex mixtures of templates |
| WO2002090225A2 (en) | 2001-05-08 | 2002-11-14 | Magnatech International, L.P. | Electronic length control wire pay-off system and method |
| US20050137155A1 (en) | 2001-05-18 | 2005-06-23 | Sirna Therapeutics, Inc. | RNA interference mediated treatment of Parkinson disease using short interfering nucleic acid (siNA) |
| US8137911B2 (en) | 2001-05-22 | 2012-03-20 | Cellscript, Inc. | Preparation and use of single-stranded transcription substrates for synthesis of transcription products corresponding to target sequences |
| MXPA03010893A (es) | 2001-05-30 | 2004-10-28 | Univ Leland Stanford Junior | Sistema de suministro para acidos nucleicos. |
| EP2842964A1 (de) | 2001-06-05 | 2015-03-04 | Curevac GmbH | Virtuelles Verfahren zur Ermittlung einer modifzierten mRNA-Sequenz |
| AU2002317824A1 (en) | 2001-06-18 | 2003-01-02 | Novartis Pharma Gmbh | Novel g-protein coupled receptors and dna sequences thereof |
| US7547551B2 (en) | 2001-06-21 | 2009-06-16 | University Of Antwerp. | Transfection of eukaryontic cells with linear polynucleotides by electroporation |
| US7785610B2 (en) | 2001-06-21 | 2010-08-31 | Dynavax Technologies Corporation | Chimeric immunomodulatory compounds and methods of using the same—III |
| JP2005503137A (ja) | 2001-06-26 | 2005-02-03 | ノバルティス アクチエンゲゼルシャフト | Gタンパク質共役レセプターおよびそのdna配列 |
| SE0102327D0 (sv) | 2001-06-28 | 2001-06-28 | Active Biotech Ab | A novel engineered superantigen for human therapy |
| US20040236092A1 (en) | 2001-07-13 | 2004-11-25 | Roman Dziarski | Peptidologlycan recognition protein encoding nucleic acids and methods of use thereof |
| US6586524B2 (en) | 2001-07-19 | 2003-07-01 | Expression Genetics, Inc. | Cellular targeting poly(ethylene glycol)-grafted polymeric gene carrier |
| US7169750B2 (en) | 2001-07-31 | 2007-01-30 | Anormed, Inc. | Methods to mobilize progenitor/stem cells |
| DE60237696D1 (de) | 2001-08-01 | 2010-10-28 | Univ Utah | Am n-terminus trunkierte isoformen von zyklischen phosphodiesterasen pde3a |
| US20050106659A1 (en) | 2001-08-27 | 2005-05-19 | Klemens Kaupmann | Novel g-protein coupled receptor and dna sequences thereof |
| US20040142325A1 (en) | 2001-09-14 | 2004-07-22 | Liat Mintz | Methods and systems for annotating biomolecular sequences |
| AR045702A1 (es) | 2001-10-03 | 2005-11-09 | Chiron Corp | Composiciones de adyuvantes. |
| DE10148886A1 (de) | 2001-10-04 | 2003-04-30 | Avontec Gmbh | Inhibition von STAT-1 |
| US7276489B2 (en) | 2002-10-24 | 2007-10-02 | Idera Pharmaceuticals, Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by optimal presentation of 5′ ends |
| US7384739B2 (en) | 2001-11-14 | 2008-06-10 | Toyo Boseki Kabushiki Kaisha | Compositions for enhancing DNA synthesis, DNA polymerase-related factors and utilization thereof |
| AU2002361642A1 (en) | 2001-11-16 | 2003-06-10 | The University Of Tennessee Research Corporation | Recombinant antibody fusion proteins and methods for detection of apoptotic cells |
| US20050032062A1 (en) | 2001-11-29 | 2005-02-10 | Salah-Dine Chibout | Methods for the assessment and prognosis of sarcoidosis |
| CA2409775C (en) | 2001-12-03 | 2010-07-13 | F. Hoffmann-La Roche Ag | Reversibly modified thermostable enzymes for dna synthesis and amplification in vitro |
| JP4822490B2 (ja) | 2001-12-07 | 2011-11-24 | ノバルティス バクシンズ アンド ダイアグノスティックス,インコーポレーテッド | 腫瘍形成形質転換に関連する内因性レトロウイルスポリペプチド |
| DE60235413D1 (de) | 2001-12-07 | 2010-04-01 | Novartis Vaccines & Diagnostic | Bei prostatakrebs hochreguliertes endogenes retrovirus |
| US20060275747A1 (en) | 2001-12-07 | 2006-12-07 | Hardy Stephen F | Endogenous retrovirus up-regulated in prostate cancer |
| AU2002361429A1 (en) | 2001-12-17 | 2003-06-30 | Novartis Ag | Novel g-protein coupled receptors and dna sequences thereof |
| DE10162480A1 (de) | 2001-12-19 | 2003-08-07 | Ingmar Hoerr | Die Applikation von mRNA für den Einsatz als Therapeutikum gegen Tumorerkrankungen |
| PT1474109E (pt) | 2001-12-21 | 2010-10-25 | Alcon Inc | Utilização de nanopartículas inorgânicas sintéticas como veículos em medicamentos oftálmicos |
| WO2003059381A2 (en) | 2002-01-18 | 2003-07-24 | Curevac Gmbh | Immunogenic preparations and vaccines on the basis of mrna |
| US7741297B2 (en) | 2002-02-04 | 2010-06-22 | Oncothyreon Inc. | Immunostimulatory, covalently lipidated oligonucleotides |
| CA2473144C (en) | 2002-02-05 | 2013-05-28 | Genentech, Inc. | Protein purification |
| FR2835749B1 (fr) | 2002-02-08 | 2006-04-14 | Inst Nat Sante Rech Med | Composition pharmaceutique ameliorant le transfert de gene in vivo |
| DE10207178A1 (de) | 2002-02-19 | 2003-09-04 | Novosom Ag | Komponenten für die Herstellung amphoterer Liposomen |
| AR038568A1 (es) | 2002-02-20 | 2005-01-19 | Hoffmann La Roche | Anticuerpos anti-a beta y su uso |
| US7354742B2 (en) | 2002-02-22 | 2008-04-08 | Ortho-Mcneil Pharmaceutical, Inc. | Method for generating amplified RNA |
| NZ535690A (en) | 2002-02-26 | 2009-04-30 | Maxygen Inc | Novel flavivirus antigens |
| JP2005526506A (ja) | 2002-03-04 | 2005-09-08 | イムクローン システムズ インコーポレイティド | Kdrに特異的なヒト抗体及びその利用 |
| AU2003221497A1 (en) | 2002-03-13 | 2003-09-22 | Novartis Ag | Pharmaceutical microparticles |
| US7074596B2 (en) | 2002-03-25 | 2006-07-11 | Board Of Supervisors Of Louisiana State University And Agricultural And Mechanical College | Synthesis and use of anti-reverse mRNA cap analogues |
| CA2480775C (en) | 2002-04-04 | 2016-05-31 | Coley Pharmaceutical Gmbh | Immunostimulatory g,u-containing oligoribonucleotides |
| EP1497327A2 (en) | 2002-04-17 | 2005-01-19 | Novartis AG | Method for the identification of inhibitors of the binding of are-containing mrna and an hur protein |
| GB0209539D0 (en) | 2002-04-26 | 2002-06-05 | Avecia Ltd | Monomer Polymer and process |
| EP1361277A1 (en) | 2002-04-30 | 2003-11-12 | Centre National De La Recherche Scientifique (Cnrs) | Optimization of transgene expression in mammalian cells |
| EP1507556B1 (en) | 2002-05-02 | 2016-07-27 | Wyeth Holdings LLC | Calicheamicin derivative-carrier conjugates |
| US20040018525A1 (en) | 2002-05-21 | 2004-01-29 | Bayer Aktiengesellschaft | Methods and compositions for the prediction, diagnosis, prognosis, prevention and treatment of malignant neoplasma |
| US7374930B2 (en) | 2002-05-21 | 2008-05-20 | Expression Genetics, Inc. | GLP-1 gene delivery for the treatment of type 2 diabetes |
| DE10224200C1 (de) | 2002-05-31 | 2003-08-21 | Artus Ges Fuer Molekularbiolog | Vermehrung von Ribonukleinsäuren |
| US7198899B2 (en) | 2002-06-03 | 2007-04-03 | Chiron Corporation | Use of NRG4, or inhibitors thereof, in the treatment of colon and pancreatic cancers |
| ATE485031T1 (de) | 2002-06-28 | 2010-11-15 | Protiva Biotherapeutics Inc | Verfahren und vorrichtung zur herstellung von liposomen |
| WO2004003176A2 (en) | 2002-07-01 | 2004-01-08 | The Kenneth S. Warren Institute, Inc. | Recombinant tissue protective cytokines and encoding nucleic acids thereof for protection, restoration, and enhancement of responsive cells, tissues, and organs |
| DE10229872A1 (de) | 2002-07-03 | 2004-01-29 | Curevac Gmbh | Immunstimulation durch chemisch modifizierte RNA |
| GB0215509D0 (en) | 2002-07-04 | 2002-08-14 | Novartis Ag | Marker genes |
| WO2004007678A2 (en) | 2002-07-16 | 2004-01-22 | Advisys, Inc. | Codon optimized synthetic plasmids |
| CA2493808A1 (en) | 2002-07-24 | 2004-01-29 | Ptc Therapeutics, Inc. | Methods for identifying small molecules that modulate premature translation termination and nonsense mediated mrna decay |
| EP1393745A1 (en) | 2002-07-29 | 2004-03-03 | Hybridon, Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by optimal presentation of 5'ends |
| EP1386925A1 (en) | 2002-07-31 | 2004-02-04 | Girindus AG | Method for preparing oligonucleotides |
| US6653468B1 (en) | 2002-07-31 | 2003-11-25 | Isis Pharmaceuticals, Inc. | Universal support media for synthesis of oligomeric compounds |
| EP1873180B1 (en) | 2002-08-14 | 2014-05-07 | Novartis AG | Ophthalmic device made from a radiation-curable prepolymer |
| CA2497792C (en) | 2002-09-06 | 2014-08-05 | Insert Therapeutics, Inc. | Cyclodextrin-based polymers for therapeutics delivery |
| ES2315526T3 (es) | 2002-09-09 | 2009-04-01 | Nektar Therapeutics Al, Corporation | Metodo para preparar derivados polimericos solubles en agua que llevan un acido carboxilico terminal. |
| US7534872B2 (en) | 2002-09-27 | 2009-05-19 | Syngen, Inc. | Compositions and methods for the use of FMOC derivatives in DNA/RNA synthesis |
| US8529902B2 (en) | 2002-10-17 | 2013-09-10 | Genmab A/S | Human monoclonal antibodies against CD20 |
| US7622270B2 (en) | 2002-10-22 | 2009-11-24 | Eisai R&D Management Co., Ltd. | Methods of isolating dopaminergic neuron precursor cells |
| AU2003294447A1 (en) | 2002-11-21 | 2004-06-18 | Epicentre Technologies | Preparation and use of single-stranded transcription substrates for synthesis of transcription products corresponding to target sequences |
| US7491234B2 (en) | 2002-12-03 | 2009-02-17 | Boston Scientific Scimed, Inc. | Medical devices for delivery of therapeutic agents |
| DK2289936T3 (en) | 2002-12-16 | 2017-07-31 | Genentech Inc | IMMUNGLOBULIN VARIATIONS AND APPLICATIONS THEREOF |
| AU2003302743B2 (en) | 2002-12-23 | 2008-09-04 | Dynavax Technologies Corporation | Branched immunomodulatory compounds and methods of using the same |
| US7169892B2 (en) | 2003-01-10 | 2007-01-30 | Astellas Pharma Inc. | Lipid-peptide-polymer conjugates for long blood circulation and tumor specific drug delivery systems |
| US20080227085A1 (en) | 2003-01-17 | 2008-09-18 | Pellegrini Matthew C | Methods and Systems for the Identification of Rna Regulatory Sequences and Compounds that Modulate their Function |
| US8426194B2 (en) | 2003-01-21 | 2013-04-23 | Ptc Therapeutics, Inc. | Methods and agents for screening for compounds capable of modulating VEGF expression |
| EP2500437B1 (en) | 2003-01-21 | 2016-11-30 | PTC Therapeutics, Inc. | Methods for identifying compounds that modulate untranslated region-dependent gene expression and methods of using same |
| US9068234B2 (en) | 2003-01-21 | 2015-06-30 | Ptc Therapeutics, Inc. | Methods and agents for screening for compounds capable of modulating gene expression |
| US20040147027A1 (en) | 2003-01-28 | 2004-07-29 | Troy Carol M. | Complex for facilitating delivery of dsRNA into a cell and uses thereof |
| MY162623A (en) | 2003-02-10 | 2017-06-30 | Biogen Ma Inc | Immunoglobulin formulation and method of preparation thereof |
| US20040167090A1 (en) | 2003-02-21 | 2004-08-26 | Monahan Sean D. | Covalent modification of RNA for in vitro and in vivo delivery |
| CA2450289A1 (en) | 2003-03-20 | 2005-05-19 | Imclone Systems Incorporated | Method of producing an antibody to epidermal growth factor receptor |
| US7320961B2 (en) | 2003-03-24 | 2008-01-22 | Abbott Laboratories | Method for treating a disease, disorder or adverse effect caused by an elevated serum concentration of an UGT1A1 substrate |
| AU2004225520A1 (en) | 2003-03-25 | 2004-10-14 | Stratagene | DNA polymerase fusions and uses thereof |
| CA2522213A1 (en) | 2003-04-08 | 2004-10-28 | Dante J. Marciani | Semi-synthetic saponin analogs with carrier and immune stimulatory activities for dna and rna vaccines |
| SI1613350T1 (sl) | 2003-04-09 | 2009-08-31 | Genentech Inc | Zdravljenje avtoimunske bolezni pri bolniku z neustreznim odzivom na inhibitor TNF-alfa |
| WO2004098669A1 (en) | 2003-05-05 | 2004-11-18 | Ben-Gurion University Of The Negev Research And Development Authority | Injectable cross-linked polymeric preparations and uses thereof |
| US7348004B2 (en) | 2003-05-06 | 2008-03-25 | Syntonix Pharmaceuticals, Inc. | Immunoglobulin chimeric monomer-dimer hybrids |
| ATE497783T1 (de) | 2003-05-06 | 2011-02-15 | Syntonix Pharmaceuticals Inc | Gerinnungsfaktor vii-fc chimäre proteine zur behandlung von hämostatischen krankheiten |
| TWI353991B (en) | 2003-05-06 | 2011-12-11 | Syntonix Pharmaceuticals Inc | Immunoglobulin chimeric monomer-dimer hybrids |
| US9567591B2 (en) | 2003-05-15 | 2017-02-14 | Mello Biotechnology, Inc. | Generation of human embryonic stem-like cells using intronic RNA |
| GB0313132D0 (en) | 2003-06-06 | 2003-07-09 | Ich Productions Ltd | Peptide ligands |
| WO2005009346A2 (en) | 2003-06-24 | 2005-02-03 | Mirus Corporation | Inhibition of gene function by delivery of polynucleotide-based gene expression inhibitors to mammalian cells in vivo |
| GB0316089D0 (en) | 2003-07-09 | 2003-08-13 | Xo Bioscience Ltd | Differentiation method |
| US8592197B2 (en) | 2003-07-11 | 2013-11-26 | Novavax, Inc. | Functional influenza virus-like particles (VLPs) |
| US7575572B2 (en) | 2003-07-15 | 2009-08-18 | Spinal Generations, Llc | Method and device for delivering medicine to bone |
| US20050013870A1 (en) | 2003-07-17 | 2005-01-20 | Toby Freyman | Decellularized extracellular matrix of conditioned body tissues and uses thereof |
| TWI476206B (zh) | 2003-07-18 | 2015-03-11 | Amgen Inc | 對肝細胞生長因子具專一性之結合劑 |
| DE10335833A1 (de) | 2003-08-05 | 2005-03-03 | Curevac Gmbh | Transfektion von Blutzellen mit mRNA zur Immunstimulation und Gentherapie |
| US8668926B1 (en) | 2003-09-15 | 2014-03-11 | Shaker A. Mousa | Nanoparticle and polymer formulations for thyroid hormone analogs, antagonists, and formulations thereof |
| US7135010B2 (en) | 2003-09-30 | 2006-11-14 | Damage Control Surgical Technologies, Inc. | Method and apparatus for rapid deployment chest drainage |
| PT1673473E (pt) | 2003-10-06 | 2011-09-19 | Novartis Ag | Utilização de polimorfismos genéticos associados à eficácia do tratamento de doenças inflamatórias |
| DE10347710B4 (de) | 2003-10-14 | 2006-03-30 | Johannes-Gutenberg-Universität Mainz | Rekombinante Impfstoffe und deren Verwendung |
| US20050130201A1 (en) | 2003-10-14 | 2005-06-16 | Dharmacon, Inc. | Splint-assisted enzymatic synthesis of polyribounucleotides |
| ES2341009T3 (es) | 2003-11-05 | 2010-06-14 | Roche Glycart Ag | Anticuerpos cd20 con afinidad de union a receptores fc y funcion efectora. |
| WO2005047536A2 (en) | 2003-11-13 | 2005-05-26 | Novartis Ag | Detection of genomic amplification and deletion in cancer |
| US20070054278A1 (en) | 2003-11-18 | 2007-03-08 | Applera Corporation | Polymorphisms in nucleic acid molecules encoding human enzyme proteins, methods of detection and uses thereof |
| US7699852B2 (en) | 2003-11-19 | 2010-04-20 | Zimmer Spine, Inc. | Fenestrated bone tap and method |
| US20050153333A1 (en) | 2003-12-02 | 2005-07-14 | Sooknanan Roy R. | Selective terminal tagging of nucleic acids |
| US8304183B2 (en) | 2005-11-30 | 2012-11-06 | Cellscript, Inc. | Selective terminal tagging of nucleic acids |
| US8529939B2 (en) | 2003-12-08 | 2013-09-10 | Gel-Del Technologies, Inc. | Mucoadhesive drug delivery devices and methods of making and using thereof |
| US7674884B2 (en) | 2003-12-10 | 2010-03-09 | Novimmune S.A. | Neutralizing antibodies and methods of use thereof |
| US8034619B2 (en) | 2003-12-19 | 2011-10-11 | University Of Cincinnati | Polyamides for nucleic acid delivery |
| DK1711528T3 (da) | 2003-12-23 | 2012-08-20 | Genentech Inc | Behandling af cancer med hidtil ukendte anti-il 13 monoklonale antistoffer |
| WO2005072710A2 (en) | 2004-01-28 | 2005-08-11 | Johns Hopkins University | Drugs and gene carrier particles that rapidly move through mucous barriers |
| WO2005073375A1 (en) | 2004-01-30 | 2005-08-11 | Maxygen Holdings Ltd. | Regulated stop codon readthrough |
| US7309487B2 (en) | 2004-02-09 | 2007-12-18 | George Inana | Methods and compositions for detecting and treating retinal diseases |
| EP3101034A1 (en) | 2004-02-12 | 2016-12-07 | Morphotek, Inc. | Monoclonal antibodies that specifically bind to folate receptor alpha |
| US20070265220A1 (en) | 2004-03-15 | 2007-11-15 | City Of Hope | Methods and compositions for the specific inhibition of gene expression by double-stranded RNA |
| EP3269738A1 (en) | 2004-03-24 | 2018-01-17 | Chugai Seiyaku Kabushiki Kaisha | Subtypes of humanized antibody against interleukin-6 receptor |
| WO2005098433A2 (en) | 2004-04-01 | 2005-10-20 | Novartis Ag | Diagnostic assays for alzheimer’s disease |
| EP1740946B1 (en) | 2004-04-20 | 2013-11-06 | Genmab A/S | Human monoclonal antibodies against cd20 |
| ES2246694B1 (es) | 2004-04-29 | 2007-05-01 | Instituto Cientifico Y Tecnologico De Navarra, S.A. | Nanoparticulas pegiladas. |
| US20080119645A1 (en) | 2004-05-05 | 2008-05-22 | Isis Pharmaceuticals, Inc. | Amidites and Methods of Rna Synthesis |
| JP2007537284A (ja) | 2004-05-12 | 2007-12-20 | バクスター インターナショナル インコーポレイテッド | 核酸マイクロスフェア、その生成および送達 |
| WO2005117557A2 (en) | 2004-06-01 | 2005-12-15 | San Diego State University Foundation | Expression system |
| EP1781593B1 (en) | 2004-06-07 | 2011-12-14 | Protiva Biotherapeutics Inc. | Cationic lipids and methods of use |
| EP1766035B1 (en) | 2004-06-07 | 2011-12-07 | Protiva Biotherapeutics Inc. | Lipid encapsulated interfering rna |
| WO2005123114A2 (en) | 2004-06-11 | 2005-12-29 | Trustees Of Tufts College | Silk-based drug delivery system |
| WO2006046978A2 (en) | 2004-06-28 | 2006-05-04 | Argos Therapeutics, Inc. | Cationic peptide-mediated transformation |
| KR101146160B1 (ko) | 2004-06-30 | 2012-07-16 | 넥타르 테라퓨틱스 | 중합체인자 ix 부분의 접합체 |
| US7579451B2 (en) | 2004-07-21 | 2009-08-25 | Alnylam Pharmaceuticals, Inc. | Oligonucleotides comprising a modified or non-natural nucleobase |
| DE102004035227A1 (de) | 2004-07-21 | 2006-02-16 | Curevac Gmbh | mRNA-Gemisch zur Vakzinierung gegen Tumorerkrankungen |
| US7603349B1 (en) | 2004-07-29 | 2009-10-13 | Yahoo! Inc. | User interfaces for search systems using in-line contextual queries |
| GB0417487D0 (en) | 2004-08-05 | 2004-09-08 | Novartis Ag | Organic compound |
| US7291208B2 (en) | 2004-08-13 | 2007-11-06 | Gore Enterprise Holdings, Inc. | Grooved active and passive adsorbent filters |
| SE0402025D0 (sv) | 2004-08-13 | 2004-08-13 | Active Biotech Ab | Treatment of hyperproliferative disease with superantigens in combination with another anticancer agent |
| CA2478458A1 (en) | 2004-08-20 | 2006-02-20 | Michael Panzara | Treatment of pediatric multiple sclerosis |
| US8691963B2 (en) | 2004-08-26 | 2014-04-08 | Engeneic Molecular Delivery Pty. Ltd. | Delivering functional nucleic acids to mammalian cells via bacterially-derived, intact minicells |
| DE102004042546A1 (de) | 2004-09-02 | 2006-03-09 | Curevac Gmbh | Kombinationstherapie zur Immunstimulation |
| US7501486B2 (en) | 2004-09-07 | 2009-03-10 | Burnham Institute For Medical Research | Peptides that selectively home to heart vasculature and related conjugates and methods |
| US8663599B1 (en) | 2004-10-05 | 2014-03-04 | Gp Medical, Inc. | Pharmaceutical composition of nanoparticles |
| US20080075698A1 (en) | 2004-10-12 | 2008-03-27 | Tissue Targeting Japan Inc. | Brain-Localizing Bone Marrow Progenitor cells |
| SG156641A1 (en) | 2004-10-13 | 2009-11-26 | Ptc Therapeutics Inc | Compounds for nonsense suppression, and methods for their use |
| US8057821B2 (en) | 2004-11-03 | 2011-11-15 | Egen, Inc. | Biodegradable cross-linked cationic multi-block copolymers for gene delivery and methods of making thereof |
| US20080261905A1 (en) | 2004-11-08 | 2008-10-23 | K.U. Leuven Research And Development | Modified Nucleosides for Rna Interference |
| JP2008520741A (ja) | 2004-11-23 | 2008-06-19 | ピーティーシー セラピューティクス, インコーポレイテッド | 翻訳制御によるvegf生成を阻害するための活性因子としてのテトラヒドロカルバゾール |
| US7838657B2 (en) * | 2004-12-03 | 2010-11-23 | University Of Massachusetts | Spinal muscular atrophy (SMA) treatment via targeting of SMN2 splice site inhibitory sequences |
| US7964571B2 (en) | 2004-12-09 | 2011-06-21 | Egen, Inc. | Combination of immuno gene therapy and chemotherapy for treatment of cancer and hyperproliferative diseases |
| WO2006063249A2 (en) | 2004-12-10 | 2006-06-15 | Justin Hanes | Functionalized poly (ether-anhydride) block copolymers |
| WO2006071903A2 (en) | 2004-12-28 | 2006-07-06 | Ptc Therapeutics, Inc. | Cell based methods and systems for the identification of rna regulatory sequences and compounds that modulate their functions |
| US8535702B2 (en) | 2005-02-01 | 2013-09-17 | Boston Scientific Scimed, Inc. | Medical devices having porous polymeric regions for controlled drug delivery and regulated biocompatibility |
| EP2287608B1 (en) | 2005-03-11 | 2014-01-08 | Firalis SAS | Biomarkers for cardiovascular side-effects induced by cox-2 inhibitory compounds |
| US8415325B2 (en) | 2005-03-31 | 2013-04-09 | University Of Delaware | Cell-mediated delivery and targeted erosion of noncovalently crosslinked hydrogels |
| CA2604885A1 (en) | 2005-04-07 | 2006-10-19 | Guoying Yu | Cacna1e in cancer diagnosis, detection and treatment |
| WO2006110585A2 (en) | 2005-04-07 | 2006-10-19 | Novartis Vaccines And Diagnostics Inc. | Cancer-related genes (prlr) |
| EP1885403B1 (en) | 2005-04-12 | 2013-05-08 | Nektar Therapeutics | Poly(ethyleneglycol) conjugates of Lysostaphin |
| CA2609788A1 (en) | 2005-04-26 | 2006-11-02 | Coley Pharmaceutical Gmbh | Modified oligoribonucleotide analogs with enhanced immunostimulatory activity |
| EP2161336B2 (en) | 2005-05-09 | 2017-03-29 | ONO Pharmaceutical Co., Ltd. | Human monoclonal antibodies to programmed death 1(PD-1) and methods for treating cancer using anti-PD-1 antibodies alone or in combination with other immunotherapeutics |
| US20070072175A1 (en) | 2005-05-13 | 2007-03-29 | Biogen Idec Ma Inc. | Nucleotide array containing polynucleotide probes complementary to, or fragments of, cynomolgus monkey genes and the use thereof |
| US20060265771A1 (en) | 2005-05-17 | 2006-11-23 | Lewis David L | Monitoring microrna expression and function |
| DE102005023170A1 (de) | 2005-05-19 | 2006-11-23 | Curevac Gmbh | Optimierte Formulierung für mRNA |
| EP1888638A2 (en) | 2005-06-03 | 2008-02-20 | Genentech, Inc. | Method of producing antibodies with modified fucosylation level |
| US7550264B2 (en) | 2005-06-10 | 2009-06-23 | Datascope Investment Corporation | Methods and kits for sense RNA synthesis |
| BRPI0611872B8 (pt) | 2005-06-16 | 2021-05-25 | Nektar Therapeutics | reagente polimérico, conjugado, método para preparação de um conjugado e composição farmacêutica |
| US8202835B2 (en) | 2005-06-17 | 2012-06-19 | Yitzchak Hillman | Disease treatment via antimicrobial peptides or their inhibitors |
| US20110182805A1 (en) | 2005-06-17 | 2011-07-28 | Desimone Joseph M | Nanoparticle fabrication methods, systems, and materials |
| EP1907590B1 (en) | 2005-06-30 | 2012-09-19 | Archemix LLC | T7 rna polymerase and methods for the generation of fully 2'-modified nucleic acid transcripts |
| US8101385B2 (en) | 2005-06-30 | 2012-01-24 | Archemix Corp. | Materials and methods for the generation of transcripts comprising modified nucleotides |
| US20080220471A1 (en) | 2005-07-27 | 2008-09-11 | Genentech, Inc. | Vectors and Methods Using Same |
| HUE043492T2 (hu) | 2005-08-23 | 2019-08-28 | Univ Pennsylvania | Módosított nukleozidokat tartalmazó RNS és eljárások az alkalmazására |
| US9012219B2 (en) * | 2005-08-23 | 2015-04-21 | The Trustees Of The University Of Pennsylvania | RNA preparations comprising purified modified RNA for reprogramming cells |
| US20070048741A1 (en) | 2005-08-24 | 2007-03-01 | Getts Robert C | Methods and kits for sense RNA synthesis |
| US8007807B2 (en) | 2005-09-01 | 2011-08-30 | Novartis Vaccines And Diagnostics Gmbh | Multiple vaccination including serogroup C meningococcus |
| CA2621136C (en) | 2005-09-01 | 2014-10-14 | Celgene Corporation | Immunological uses of immunomodulatory compounds for vaccine and anti-infectious disease therapy |
| US8420605B2 (en) | 2005-09-07 | 2013-04-16 | The University Of Strathclyde | Hydrogel compositions |
| US20120021042A1 (en) | 2005-09-15 | 2012-01-26 | Steffen Panzner | Efficient Method For Loading Amphoteric Liposomes With Nucleic Acid Active Substances |
| DE102005046490A1 (de) | 2005-09-28 | 2007-03-29 | Johannes-Gutenberg-Universität Mainz | Modifikationen von RNA, die zu einer erhöhten Transkriptstabilität und Translationseffizienz führen |
| US20070087437A1 (en) | 2005-10-14 | 2007-04-19 | Jifan Hu | Methods for rejuvenating cells in vitro and in vivo |
| US20070105124A1 (en) | 2005-11-08 | 2007-05-10 | Getts Robert C | Methods and kits for nucleic acid amplification |
| US20090170090A1 (en) | 2005-11-18 | 2009-07-02 | Bioline Limited | Method for Enhancing Enzymatic DNA Polymerase Reactions |
| AU2006317242A1 (en) | 2005-11-28 | 2007-05-31 | Genmab A/S | Recombinant monovalent antibodies and methods for production thereof |
| TWI389709B (zh) | 2005-12-01 | 2013-03-21 | Novartis Ag | 經皮治療系統 |
| US8603457B2 (en) | 2005-12-02 | 2013-12-10 | University Of Rochester | Nonsense suppression and genetic codon alteration by targeted modification |
| EP1954252B1 (en) | 2005-12-02 | 2016-02-03 | GlaxoSmithKline Biologicals SA | Nanoparticles for use in immunogenic compositions |
| US7579318B2 (en) | 2005-12-06 | 2009-08-25 | Centre De La Recherche De La Scientifique | Cell penetrating peptides for intracellular delivery of molecules |
| US8242081B2 (en) | 2005-12-06 | 2012-08-14 | Centre National De La Recherche Scientifique | Cell penetrating peptides for intracellular delivery of molecules |
| JP2009523410A (ja) | 2005-12-08 | 2009-06-25 | ノバルティス アクチエンゲゼルシャフト | 遺伝子転写に対するfgfr3の阻害剤の効果 |
| EP2206778B1 (en) | 2005-12-13 | 2018-08-01 | Kyoto University | Nuclear reprogramming factor |
| JP2009519033A (ja) | 2005-12-16 | 2009-05-14 | ディアト | 核酸を細胞に送達するための細胞貫通ペプチド結合体 |
| KR101421745B1 (ko) | 2006-01-13 | 2014-07-22 | 더 트러스티스 오브 더 유니버시티 오브 펜실바니아 | 코돈 최적화된 il―15를 사용하는 백신 및 면역치료제, 및 그의 사용 방법 |
| US20070178103A1 (en) | 2006-01-30 | 2007-08-02 | Fey Georg H | CD19-specific immunotoxin and treatment method |
| US8946155B2 (en) | 2006-02-03 | 2015-02-03 | Opko Biologics Ltd. | Long-acting polypeptides and methods of producing and administering same |
| US9458444B2 (en) | 2006-02-03 | 2016-10-04 | Opko Biologics Ltd. | Long-acting coagulation factors and methods of producing same |
| US8476234B2 (en) | 2006-02-03 | 2013-07-02 | Prolor Biotech Inc. | Long-acting coagulation factors and methods of producing same |
| DE102006007433A1 (de) | 2006-02-17 | 2007-08-23 | Curevac Gmbh | Adjuvanz in Form einer Lipid-modifizierten Nukleinsäure |
| JP5295785B2 (ja) | 2006-02-20 | 2013-09-18 | エファ・ユニバーシティ・インダストリー・コラボレイション・ファウンデイション | 細胞膜透過性ペプチド |
| JP5312050B2 (ja) | 2006-02-21 | 2013-10-09 | ネクター セラピューティクス | 分割型の分解性重合体とそれから生成される複合体 |
| US20080038278A1 (en) | 2006-02-24 | 2008-02-14 | Jingsong Cao | GPAT3 encodes a mammalian, microsomal acyl-coa:glycerol 3- phosphate acyltransferase |
| US8431160B2 (en) | 2006-02-24 | 2013-04-30 | Novartis Ag | Microparticles containing biodegradable polymer and cationic polysaccharide for use in immunogenic compositions |
| US20070207141A1 (en) | 2006-02-28 | 2007-09-06 | Ivan Lieberburg | Methods of treating inflammatory and autoimmune diseases with natalizumab |
| US7910152B2 (en) | 2006-02-28 | 2011-03-22 | Advanced Cardiovascular Systems, Inc. | Poly(ester amide)-based drug delivery systems with controlled release rate and morphology |
| GB0605217D0 (en) | 2006-03-15 | 2006-04-26 | Novartis Ag | Method and compositions for assessing acute rejection |
| WO2007109244A2 (en) | 2006-03-21 | 2007-09-27 | Morehouse School Of Medicine | Novel nanoparticles for delivery of active agents |
| ES2776100T3 (es) | 2006-03-31 | 2020-07-29 | Massachusetts Inst Technology | Sistema para el suministro dirigido de agentes terapéuticos |
| AU2007240986A1 (en) | 2006-04-04 | 2007-11-01 | Stc.Unm | Swellable particles for drug delivery |
| EP1852127A1 (en) | 2006-05-02 | 2007-11-07 | Charité - Universitätsmedizin Berlin | Use of a B-cell-depleting antibody for treatment of polyoma virus infections |
| EP2019691B1 (en) | 2006-05-15 | 2020-08-12 | Massachusetts Institute of Technology | Polymers for functional particles |
| KR20090019810A (ko) | 2006-05-24 | 2009-02-25 | 라보라뚜와르 세로노 에스. 에이. | 다발성 경화증 치료를 위한 클라드리빈 요법 |
| WO2007143574A1 (en) | 2006-06-02 | 2007-12-13 | President And Fellows Of Harvard College | Protein surface remodeling |
| EP2046383B1 (en) | 2006-07-04 | 2014-11-19 | Genmab A/S | Cd20 binding molecules for the treatment of copd |
| DK2037899T3 (da) | 2006-07-07 | 2011-05-09 | Univ Aarhus | Nanopartikler til nukleinsyreafgivelse |
| DK2038310T3 (da) | 2006-07-12 | 2010-09-27 | Novartis Ag | Aktinisk tværbindelige copolymerer til fremstilling af kontaktlinser |
| KR20090039748A (ko) | 2006-07-20 | 2009-04-22 | 노파르티스 아게 | 암의 치료, 진단 또는 검출을 위한 amigo-2 억제제 |
| US8728527B2 (en) | 2006-07-24 | 2014-05-20 | Luminus Biosciences, Inc. | Solid nanoparticle formulation of water insoluble pharmaceutical substances with reduced ostwald ripening |
| US8304529B2 (en) | 2006-07-28 | 2012-11-06 | Life Technologies Corporation | Dinucleotide MRNA cap analogs |
| DE102006035618A1 (de) | 2006-07-31 | 2008-02-07 | Curevac Gmbh | Nukleinsäure der Formel (I): GlXmGn, insbesondere als immunstimulierendes Adjuvanz |
| WO2008014979A2 (en) | 2006-07-31 | 2008-02-07 | Curevac Gmbh | NUCLEIC ACID OF FORMULA (I): GIXmGn, OR (II): CIXmCn, IN PARTICULAR AS AN IMMUNE-STIMULATING AGENT/ADJUVANT |
| RU2009108289A (ru) | 2006-08-07 | 2010-09-20 | Джензим Корпорейшн (Us) | Комбинированная терапия |
| US20080076701A1 (en) | 2006-08-18 | 2008-03-27 | Nastech Pharmaceutical Company Inc. | Dicer substrate rna peptide conjugates and methods for rna therapeutics |
| US8658211B2 (en) | 2006-08-18 | 2014-02-25 | Arrowhead Madison Inc. | Polyconjugates for in vivo delivery of polynucleotides |
| CA2957056A1 (en) | 2006-09-06 | 2008-03-13 | C3 Jian, Inc. | Selectively targeted antimicrobial peptides and the use thereof |
| WO2008028946A2 (en) | 2006-09-07 | 2008-03-13 | Crucell Holland B.V. | Human binding molecules capable of neutralizing influenza virus h5n1 and uses thereof |
| WO2008030557A2 (en) | 2006-09-08 | 2008-03-13 | Johns Hopkins University | Compositions and methods for enhancing transport through mucus |
| US8454948B2 (en) | 2006-09-14 | 2013-06-04 | Medgenics Medical Israel Ltd. | Long lasting drug formulations |
| GB0619182D0 (en) | 2006-09-29 | 2006-11-08 | Leuven K U Res & Dev | Oligonucleotide arrays |
| MX2009003548A (es) | 2006-10-03 | 2009-04-15 | Alnylam Pharmaceuticals Inc | Formulaciones que contienen lipidos. |
| CA2665343C (en) | 2006-10-05 | 2014-12-16 | The Johns Hopkins University | Water-dispersible oral, parenteral, and topical formulations for poorly water soluble drugs using smart polymeric nanoparticles |
| DE102006051516A1 (de) | 2006-10-31 | 2008-05-08 | Curevac Gmbh | (Basen-)modifizierte RNA zur Expressionssteigerung eines Proteins |
| US8414927B2 (en) | 2006-11-03 | 2013-04-09 | Boston Scientific Scimed, Inc. | Cross-linked polymer particles |
| US7999087B2 (en) | 2006-11-15 | 2011-08-16 | Agilent Technologies, Inc. | 2′-silyl containing thiocarbonate protecting groups for RNA synthesis |
| US8242258B2 (en) | 2006-12-03 | 2012-08-14 | Agilent Technologies, Inc. | Protecting groups for RNA synthesis |
| US8399007B2 (en) | 2006-12-05 | 2013-03-19 | Landec Corporation | Method for formulating a controlled-release pharmaceutical formulation |
| US7893227B2 (en) | 2006-12-05 | 2011-02-22 | Lasergen, Inc. | 3′-OH unblocked nucleotides and nucleosides base modified with non-cleavable, terminating groups and methods for their use in DNA sequencing |
| SG177141A1 (en) | 2006-12-06 | 2012-01-30 | Novartis Ag | Vaccines including antigen from four strains of influenza virus |
| US9034348B2 (en) | 2006-12-11 | 2015-05-19 | Chi2Gel Ltd. | Injectable chitosan mixtures forming hydrogels |
| KR20180019768A (ko) | 2006-12-18 | 2018-02-26 | 악셀레론 파마 인코포레이티드 | 액티빈-actrii 길항물질과 적혈구 수준을 증가시키기 위한 이의 용도 |
| EP2120859B1 (en) | 2006-12-21 | 2013-11-20 | Stryker Corporation | Sustained-release formulations comprising bmp-7 crystals |
| WO2008140615A2 (en) | 2006-12-21 | 2008-11-20 | Novozymes, Inc. | Modified messenger rna stabilizing sequences for expressing genes in bacterial cells |
| EP2207891B1 (en) | 2006-12-22 | 2012-07-25 | Archemix LLC | Materials and methods for the generation of transcripts comprising modified nucleotides |
| DE102006061015A1 (de) | 2006-12-22 | 2008-06-26 | Curevac Gmbh | Verfahren zur Reinigung von RNA im präparativen Maßstab mittels HPLC |
| US8338166B2 (en) | 2007-01-04 | 2012-12-25 | Lawrence Livermore National Security, Llc | Sorting, amplification, detection, and identification of nucleic acid subsequences in a complex mixture |
| DE102007001370A1 (de) | 2007-01-09 | 2008-07-10 | Curevac Gmbh | RNA-kodierte Antikörper |
| WO2008091799A2 (en) | 2007-01-22 | 2008-07-31 | The Trustees Of Columbia University In The City Of New York | Cell-based methods for identifying inhibitors of parkinson's disease-associated lrrk2 mutants |
| CA2677073C (en) | 2007-01-30 | 2016-03-15 | Epivax, Inc. | Regulatory t cell epitopes, compositions and uses thereof |
| US8859229B2 (en) | 2007-02-02 | 2014-10-14 | Yale University | Transient transfection with RNA |
| TWI782836B (zh) | 2007-02-02 | 2022-11-01 | 美商艾瑟勒朗法瑪公司 | 衍生自ActRIIB的變體與其用途 |
| WO2008096370A2 (en) | 2007-02-05 | 2008-08-14 | Natco Pharma Limited | An efficient and novel purification method of recombinant hg-csf |
| US8333799B2 (en) | 2007-02-12 | 2012-12-18 | C. R. Bard, Inc. | Highly flexible stent and method of manufacture |
| US8242087B2 (en) | 2007-02-27 | 2012-08-14 | K.U.Leuven Research & Development | Phosphate modified nucleosides useful as substrates for polymerases and as antiviral agents |
| EP1964922A1 (en) | 2007-03-02 | 2008-09-03 | Boehringer Ingelheim Pharma GmbH & Co. KG | Improvement of protein production |
| EA018190B1 (ru) | 2007-03-02 | 2013-06-28 | Бёрингер Ингельхайм Фарма Гмбх Унд Ко. Кг | Улучшение производства белков |
| JP5249248B2 (ja) | 2007-03-05 | 2013-07-31 | ワシントン ユニバーシティー | 膜組み込みペプチドのためのナノ粒子輸送システム |
| WO2008115504A2 (en) | 2007-03-20 | 2008-09-25 | Millennium Pharmaceuticals, Inc. | Nucleic acids encoding humanized immunoglobulin that binds a4b7 integrin |
| US8386027B2 (en) | 2007-04-27 | 2013-02-26 | Echo Therapeutics, Inc. | Skin permeation device for analyte sensing or transdermal drug delivery |
| DK2152290T3 (da) | 2007-04-30 | 2014-08-18 | Glaxosmithkline Llc | Fremgangsmåder til indgivelse af anti-il-5-antistoffer |
| WO2008135855A2 (en) | 2007-05-03 | 2008-11-13 | Pfizer Products Inc. | Nanoparticles comprising a cholesteryl ester transfer protein inhibitor and a nonionizable polymer |
| US7682789B2 (en) | 2007-05-04 | 2010-03-23 | Ventana Medical Systems, Inc. | Method for quantifying biomolecules conjugated to a nanoparticle |
| CN101674853B (zh) | 2007-05-04 | 2013-03-27 | 玛瑞纳生物技术有限公司 | 氨基酸脂质及其用途 |
| WO2009023311A2 (en) | 2007-05-07 | 2009-02-19 | Alba Therapeutics Corporation | Transcutaneous delivery of therapeutic agents |
| JP5296328B2 (ja) | 2007-05-09 | 2013-09-25 | 独立行政法人理化学研究所 | 1本鎖環状rnaおよびその製造方法 |
| KR101625363B1 (ko) | 2007-05-10 | 2016-05-30 | 애질런트 테크놀로지스, 인크. | Rna 합성을 위한 티오카본-보호기 |
| MX2020011303A (es) | 2007-05-14 | 2021-12-17 | Astrazeneca Ab | Metodos para reducir niveles de eosinofilos. |
| WO2008144365A2 (en) | 2007-05-17 | 2008-11-27 | Novartis Ag | Method for making dry powder compositions containing ds-rna based on supercritical fluid technology |
| BRPI0812384A2 (pt) | 2007-05-22 | 2014-12-02 | Novartis Ag | Métodos de tratamento, diagnóstico e detecção de distúrbios associados a fgf21 |
| MX2009013046A (es) | 2007-05-30 | 2010-02-17 | Univ Northwestern | Nanoparticulas con grupo funcional de acido nucleico para aplicaciones terapeuticas. |
| WO2008151058A2 (en) | 2007-05-30 | 2008-12-11 | The General Hospital Corporation | Methods of generating pluripotent cells from somatic cells |
| AU2008265683B2 (en) | 2007-06-19 | 2013-08-29 | Board Of Supervisors Of Louisiana State University And Agricultural And Mechanical College | Synthesis and use of anti-reverse phosphorothioate analogs of the messenger RNA cap |
| WO2009006438A2 (en) | 2007-06-29 | 2009-01-08 | Epicentre Technologies Corporation | Copy dna and sense rna |
| US8367318B2 (en) | 2007-07-23 | 2013-02-05 | Dharmacon, Inc. | Screening of micro-RNA cluster inhibitor pools |
| US20090042825A1 (en) | 2007-08-06 | 2009-02-12 | Majed Matar | Composition, method of preparation & application of concentrated formulations of condensed nucleic acids with a cationic lipopolymer |
| US9144546B2 (en) | 2007-08-06 | 2015-09-29 | Clsn Laboratories, Inc. | Nucleic acid-lipopolymer compositions |
| AU2008290545A1 (en) | 2007-08-23 | 2009-02-26 | Novartis Ag | Methods for detecting oligonucleotides |
| WO2009030368A1 (en) | 2007-09-05 | 2009-03-12 | F. Hoffmann-La Roche Ag | Combination therapy with type i and type ii anti-cd20 antibodies |
| WO2009030254A1 (en) | 2007-09-04 | 2009-03-12 | Curevac Gmbh | Complexes of rna and cationic peptides for transfection and for immunostimulation |
| US8506928B2 (en) | 2007-09-07 | 2013-08-13 | The Regents Of The University Of California | Methods and compounds for targeting tissues |
| HUE031422T2 (en) | 2007-09-26 | 2017-07-28 | Intrexon Corp | Artificial 5'UTRs, expression vectors, and methods for increasing transgene expression |
| EP2195009B1 (en) | 2007-09-26 | 2014-07-30 | Oregon Health and Science University | Cyclic undecapeptides and derivatives as multiple sclerosis therapies |
| EP2644192B1 (en) | 2007-09-28 | 2017-05-10 | Pfizer Inc | Cancer Cell Targeting Using Nanoparticles |
| EP2042193A1 (en) | 2007-09-28 | 2009-04-01 | Biomay AG | RNA Vaccines |
| US8470560B2 (en) | 2007-10-03 | 2013-06-25 | The United States Of America As Represented By The Secretary Of The Army | CR-2 binding peptide P28 as molecular adjuvant for DNA vaccines |
| WO2009046738A1 (en) | 2007-10-09 | 2009-04-16 | Curevac Gmbh | Composition for treating lung cancer, particularly of non-small lung cancers (nsclc) |
| WO2009046739A1 (en) | 2007-10-09 | 2009-04-16 | Curevac Gmbh | Composition for treating prostate cancer (pca) |
| EP2217269B1 (en) | 2007-10-12 | 2017-04-12 | Massachusetts Institute of Technology | Vaccine nanotechnology |
| US20090098118A1 (en) | 2007-10-15 | 2009-04-16 | Thomas Friess | Combination therapy of a type ii anti-cd20 antibody with an anti-bcl-2 active agent |
| EP2205277B1 (en) | 2007-10-22 | 2017-07-26 | Genmab A/S | Novel antibody therapies |
| EP2209908B1 (en) | 2007-11-01 | 2014-09-03 | University Of Rochester | Recombinant factor viii having increased stability |
| RU2491095C2 (ru) | 2007-11-09 | 2013-08-27 | Новартис Аг | Применения анти-cd40-антител |
| EP2223934B1 (en) | 2007-11-14 | 2012-10-03 | Institute Of Microbiology, Chinese Academy Of Sciences | Polypeptides for inhibiting influenza virus infection |
| MX2010005927A (es) | 2007-11-30 | 2010-06-15 | Glaxo Group Ltd | Construcciones de union de antigenos. |
| EP2617828B1 (en) | 2007-12-10 | 2014-09-24 | Alnylam Pharmaceuticals Inc. | Compositions and methods for inhibiting expression of factor VII gene |
| SG10201408164XA (en) | 2007-12-11 | 2015-01-29 | Scripps Research Inst | Compositions and methods related to mrna translational enhancer elements |
| WO2009076679A2 (en) | 2007-12-13 | 2009-06-18 | Alnylam Pharmaceuticals Inc. | Methods and compositions for prevention or treatment of rsv infection |
| EP2072618A1 (en) | 2007-12-14 | 2009-06-24 | Johannes Gutenberg-Universität Mainz | Use of RNA for reprogramming somatic cells |
| WO2009086072A2 (en) | 2007-12-21 | 2009-07-09 | Genentech, Inc. | Therapy of rituximab-refractory rheumatoid arthritis patients |
| BRPI0906795A2 (pt) | 2008-01-23 | 2015-08-18 | Ajinomoto Kk | Método para produzir um l-aminoácido |
| US20100297750A1 (en) | 2008-01-24 | 2010-11-25 | Toru Natsume | Polynucleotide or analogue thereof, and gene expression regulation method using the polynucleotide or the analogue thereof |
| BRPI0907087B1 (pt) | 2008-01-31 | 2021-08-17 | Curevac Ag | Molécula de rna, composição farmacêutica e seus usos no tratamento de doenças |
| EP2250252A2 (en) | 2008-02-11 | 2010-11-17 | Cambridge Enterprise Limited | Improved reprogramming of mammalian cells, and the cells obtained |
| EP2240155B1 (en) | 2008-02-13 | 2012-06-06 | Intarcia Therapeutics, Inc | Devices, formulations, and methods for delivery of multiple beneficial agents |
| DE102008009920A1 (de) | 2008-02-15 | 2009-08-20 | Aj Innuscreen Gmbh | Mobiles Gerät für die Nukleinsäureisolierung |
| US20120027813A1 (en) | 2008-02-22 | 2012-02-02 | Novartis Vaccines And Diagnostics Srl | Adjuvanted influenza vaccines for pediatric use |
| US8506966B2 (en) | 2008-02-22 | 2013-08-13 | Novartis Ag | Adjuvanted influenza vaccines for pediatric use |
| US20100004313A1 (en) | 2008-02-29 | 2010-01-07 | Tbd | Modified Poloxamers for Gene Expression and Associated Methods |
| EA201001467A1 (ru) | 2008-03-14 | 2011-06-30 | Биокон Лимитед | Моноклональное антитело и способ его использования |
| CA2717370A1 (en) | 2008-03-14 | 2009-09-17 | Egen, Inc. | Biodegradable cross-linked branched poly (alkylene imines) |
| BRPI0910854A2 (pt) | 2008-03-28 | 2015-10-06 | Glaxosmithkline Llc | métodos de tratamento |
| PL2279254T3 (pl) | 2008-04-15 | 2017-11-30 | Protiva Biotherapeutics Inc. | Nowe preparaty lipidowe do dostarczania kwasów nukleinowych |
| WO2010005721A2 (en) | 2008-06-16 | 2010-01-14 | Bind Biosciences, Inc. | Drug loaded polymeric nanoparticles and methods of making and using same |
| WO2009127230A1 (en) | 2008-04-16 | 2009-10-22 | Curevac Gmbh | MODIFIED (m)RNA FOR SUPPRESSING OR AVOIDING AN IMMUNOSTIMULATORY RESPONSE AND IMMUNOSUPPRESSIVE COMPOSITION |
| KR20110042152A (ko) | 2008-04-25 | 2011-04-25 | 노쓰웨스턴유니버시티 | 콜레스테롤을 격리시키기에 적합한 나노구조 |
| WO2009134808A2 (en) | 2008-04-28 | 2009-11-05 | President And Fellows Of Harvard College | Supercharged proteins for cell penetration |
| AU2009241354B2 (en) | 2008-04-30 | 2014-06-12 | The Government Of The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services, Centers For Disease Control And Prevention | Chimeric West Nile/Dengue viruses |
| US9394538B2 (en) | 2008-05-07 | 2016-07-19 | Shi-Lung Lin | Development of universal cancer drugs and vaccines |
| ES2603027T3 (es) | 2008-05-08 | 2017-02-23 | Minipumps, Llc | Métodos de fabricación de bombas de administración de fármacos |
| US8697098B2 (en) | 2011-02-25 | 2014-04-15 | South Dakota State University | Polymer conjugated protein micelles |
| CA2972694C (en) | 2008-05-13 | 2020-02-11 | University Of Washington | Diblock copolymers and polynucleotide complexes thereof for delivery into cells |
| JP5689413B2 (ja) | 2008-05-21 | 2015-03-25 | ライニッシュ フリードリッヒ−ウィルヘルムズ−ユニバーシタット ボン | 平滑末端を有する5’三リン酸オリゴヌクレオチドおよびその使用 |
| JP2011520472A (ja) | 2008-05-29 | 2011-07-21 | ハナル バイオファーマ カンパニー リミテッド | 増加されたタンパク質分解酵素抵抗性を表す修飾型エリスロポエチン(epo)ポリペプチド及びその医薬組成物 |
| FR2931824B1 (fr) | 2008-05-29 | 2014-11-28 | Centre Nat Rech Scient | Procede de synthese d'arn par voie chimique. |
| US20100086922A1 (en) | 2008-05-30 | 2010-04-08 | Millennium Pharmaceuticals, Inc. | Assessment of chromosomal alterations to predict clinical outcome of bortezomib treatment |
| PL215513B1 (pl) | 2008-06-06 | 2013-12-31 | Univ Warszawski | Nowe boranofosforanowe analogi dinukleotydów, ich zastosowanie, czasteczka RNA, sposób otrzymywania RNA oraz sposób otrzymywania peptydów lub bialka |
| TWI451876B (zh) | 2008-06-13 | 2014-09-11 | Lilly Co Eli | 聚乙二醇化之離脯胰島素化合物 |
| US20100104645A1 (en) | 2008-06-16 | 2010-04-29 | Bind Biosciences, Inc. | Methods for the preparation of targeting agent functionalized diblock copolymers for use in fabrication of therapeutic targeted nanoparticles |
| WO2010005726A2 (en) | 2008-06-16 | 2010-01-14 | Bind Biosciences Inc. | Therapeutic polymeric nanoparticles with mtor inhibitors and methods of making and using same |
| US20100009424A1 (en) | 2008-07-14 | 2010-01-14 | Natasha Forde | Sonoporation systems and methods |
| WO2010009065A2 (en) | 2008-07-15 | 2010-01-21 | Novartis Ag | Amphipathic peptide compositions |
| EP2313085A2 (en) | 2008-07-15 | 2011-04-27 | Novartis AG | Immunogenic amphipathic peptide compositions |
| NZ590795A (en) * | 2008-07-24 | 2012-11-30 | Meiji Seika Pharma Co Ltd | Pyripyropene a biosynthetic gene |
| WO2010025510A1 (en) | 2008-09-03 | 2010-03-11 | Xenome Ltd | Libraries of peptide conjugates and methods for making them |
| CA3059768A1 (en) | 2008-09-05 | 2010-03-11 | President And Fellows Of Harvard College | Continuous directed evolution of proteins and nucleic acids |
| WO2010027512A2 (en) | 2008-09-06 | 2010-03-11 | Chemgenes Corporation | Rna synthesis - phosphoramidites for synthetic rna in the reverse direction, and application in convenient introduction of ligands, chromophores and modifications of synthetic rna at the 3' - end |
| US20120100558A1 (en) | 2008-09-08 | 2012-04-26 | Hanash Samir M | Lung cancer diagnosis |
| WO2010030763A2 (en) | 2008-09-10 | 2010-03-18 | Bind Biosciences, Inc. | High throughput fabrication of nanoparticles |
| AR073295A1 (es) | 2008-09-16 | 2010-10-28 | Genentech Inc | Metodos para tratar la esclerosis multiple progresiva. articulo de fabricacion. |
| US20120021519A1 (en) | 2008-09-19 | 2012-01-26 | Presidents And Fellows Of Harvard College | Efficient induction of pluripotent stem cells using small molecule compounds |
| WO2010037408A1 (en) | 2008-09-30 | 2010-04-08 | Curevac Gmbh | Composition comprising a complexed (m)rna and a naked mrna for providing or enhancing an immunostimulatory response in a mammal and uses thereof |
| WO2010042490A1 (en) | 2008-10-06 | 2010-04-15 | Boston Medical Center Corporation | A single lentiviral vector system for induced pluripotent (ips) stem cells derivation |
| WO2010042877A1 (en) | 2008-10-09 | 2010-04-15 | Tekmira Pharmaceuticals Corporation | Improved amino lipids and methods for the delivery of nucleic acids |
| US8535655B2 (en) | 2008-10-10 | 2013-09-17 | Polyactiva Pty Ltd. | Biodegradable polymer—bioactive moiety conjugates |
| US8343498B2 (en) | 2008-10-12 | 2013-01-01 | Massachusetts Institute Of Technology | Adjuvant incorporation in immunonanotherapeutics |
| US8603532B2 (en) | 2008-10-20 | 2013-12-10 | Massachusetts Institute Of Technology | Nanostructures for drug delivery |
| WO2010047839A1 (en) | 2008-10-25 | 2010-04-29 | Aura Biosciences | Modified plant virus particles and uses therefor |
| JP6087504B2 (ja) | 2008-11-07 | 2017-03-01 | マサチューセッツ インスティテュート オブ テクノロジー | アミノアルコールリピドイドおよびその使用 |
| CN105709229B (zh) | 2008-11-10 | 2020-07-28 | 阿布特斯生物制药公司 | 用于递送治疗剂的新型脂质和组合物 |
| CA2780482A1 (en) | 2008-11-17 | 2010-05-10 | Anil K. Sood | Hdl particles for delivery of nucleic acids |
| EP2191840A1 (en) | 2008-11-28 | 2010-06-02 | Sanofi-Aventis | Antitumor combinations containing antibodies recognizing specifically CD38 and melphalan |
| AU2009324534B2 (en) | 2008-12-10 | 2015-07-30 | Alnylam Pharmaceuticals, Inc. | GNAQ targeted dsRNA compositions and methods for inhibiting expression |
| EP2196476A1 (en) | 2008-12-10 | 2010-06-16 | Novartis Ag | Antibody formulation |
| EP2376091A4 (en) | 2008-12-12 | 2012-08-01 | Univ California | NEW TARGETS FOR THE TREATMENT OF HYPERCHOLESTEROLEMIA |
| US8563041B2 (en) | 2008-12-12 | 2013-10-22 | Bind Therapeutics, Inc. | Therapeutic particles suitable for parenteral administration and methods of making and using same |
| US20100216804A1 (en) | 2008-12-15 | 2010-08-26 | Zale Stephen E | Long Circulating Nanoparticles for Sustained Release of Therapeutic Agents |
| JP2012515217A (ja) | 2009-01-16 | 2012-07-05 | グラクソスミスクライン・リミテッド・ライアビリティ・カンパニー | ベンダムスチンおよび抗−cd20抗体の組合せを用いた癌治療 |
| WO2010084371A1 (en) | 2009-01-26 | 2010-07-29 | Mitoprod | Novel circular interfering rna molecules |
| CA3036963A1 (en) | 2009-01-29 | 2010-08-05 | Arbutus Biopharma Corporation | Lipid formulations comprising cationic lipid and a targeting lipid comprising n-acetyl galactosamine for delivery of nucleic acid |
| WO2010088927A1 (en) | 2009-02-09 | 2010-08-12 | Curevac Gmbh | Use of pei for the improvement of endosomal release and expression of transfected nucleic acids, complexed with cationic or polycationic compounds |
| US20140141089A1 (en) | 2009-02-11 | 2014-05-22 | Colorado School Of Mines | Nanoparticles, Compositions Thereof, and Methods of Use, and Methods of Making the Same |
| SG174150A1 (en) | 2009-02-24 | 2011-10-28 | Scripps Research Inst | Reengineering mrna primary structure for enhanced protein production |
| WO2010102065A1 (en) | 2009-03-05 | 2010-09-10 | Bend Research, Inc. | Pharmaceutical compositions of dextran polymer derivatives |
| WO2010141135A2 (en) | 2009-03-05 | 2010-12-09 | Trustees Of Boston University | Bacteriophages expressing antimicrobial peptides and uses thereof |
| CN102625842A (zh) | 2009-03-13 | 2012-08-01 | 艾根股份有限公司 | 用于输送生物活性rna的组合物和方法 |
| CN102438978B (zh) | 2009-03-20 | 2017-02-22 | Clsn实验室股份有限公司 | 聚胺衍生物 |
| WO2010111290A1 (en) | 2009-03-23 | 2010-09-30 | University Of Utah Research Foundation | Methods and compositions related to modified guanine bases for controlling off-target effects in rna interference |
| JP5622254B2 (ja) | 2009-03-31 | 2014-11-12 | 国立大学法人東京大学 | 二本鎖リボ核酸ポリイオンコンプレックス |
| SI2414387T1 (sl) | 2009-04-03 | 2016-01-29 | University Of Chicago | KOMPOZICIJE IN POSTOPKI, POVEZANI Z VARIANTAMI PROTEINA A (SpA) |
| CN102481378A (zh) | 2009-04-13 | 2012-05-30 | 法国健康和医学研究院 | Hpv颗粒及其用途 |
| AU2010236257A1 (en) | 2009-04-17 | 2011-11-03 | Biogen Idec Ma Inc. | Compositions and methods to treat acute myelogenous leukemia |
| EP2421563B1 (en) | 2009-04-22 | 2017-04-12 | Massachusetts Institute of Technology | Innate immune suppression enables repeated delivery of long rna molecules |
| SI2424895T1 (en) | 2009-04-27 | 2018-01-31 | Novartis Ag | Ingredients and procedures for increasing muscle growth |
| WO2010127159A2 (en) | 2009-04-30 | 2010-11-04 | Intezyne Technologies, Incorporated | Polymeric micelles for polynucleotide encapsulation |
| US8715736B2 (en) | 2009-04-30 | 2014-05-06 | Florida Agricultural And Mechanical University | Nanoparticle formulations for skin delivery |
| SG10201402054UA (en) | 2009-05-05 | 2014-09-26 | Muthiah Manoharan | Lipid compositions |
| DE202009007116U1 (de) | 2009-05-18 | 2010-10-14 | Amoena Medizin-Orthopädie-Technik GmbH | Antidekubituskissen |
| US8574835B2 (en) | 2009-05-29 | 2013-11-05 | Life Technologies Corporation | Scaffolded nucleic acid polymer particles and methods of making and using |
| EP2440556A1 (en) | 2009-06-10 | 2012-04-18 | Vertex Pharmaceuticals Incorporated | Inhibitors of phosphatidylinositol 3-kinase |
| CN104873464B (zh) | 2009-06-10 | 2018-06-22 | 阿布特斯生物制药公司 | 改进的脂质制剂 |
| WO2010148013A2 (en) | 2009-06-15 | 2010-12-23 | Alnylam Pharmaceuticals, Inc. | Lipid formulated dsrna targeting the pcsk9 gene |
| US20110097329A1 (en) | 2009-06-26 | 2011-04-28 | Massachusetts Institute Of Technology | Compositions and methods for treating cancer and modulating stress granule formation |
| WO2011000107A1 (en) | 2009-07-01 | 2011-01-06 | Protiva Biotherapeutics, Inc. | Novel lipid formulations for delivery of therapeutic agents to solid tumors |
| US8569256B2 (en) | 2009-07-01 | 2013-10-29 | Protiva Biotherapeutics, Inc. | Cationic lipids and methods for the delivery of therapeutic agents |
| WO2011005799A2 (en) | 2009-07-06 | 2011-01-13 | Novartis Ag | Self replicating rna molecules and uses thereof |
| DE102009033507A1 (de) * | 2009-07-15 | 2011-01-20 | Niro-Plan Ag | Vorrichtung und Verfahren zum Erzeugen von gekühltem Kaffee |
| DK3165234T3 (da) | 2009-07-31 | 2019-06-24 | Ethris Gmbh | Rna med en kombination af umodificerede og modificerede nukleotider til proteinekspression |
| EP2281579A1 (en) | 2009-08-05 | 2011-02-09 | BioNTech AG | Vaccine composition comprising 5'-Cap modified RNA |
| US20110053829A1 (en) | 2009-09-03 | 2011-03-03 | Curevac Gmbh | Disulfide-linked polyethyleneglycol/peptide conjugates for the transfection of nucleic acids |
| US20110070227A1 (en) | 2009-09-18 | 2011-03-24 | Anna-Marie Novotney-Barry | Treatment of Autoimmune and Inflammatory Diseases |
| US8859284B2 (en) | 2009-10-22 | 2014-10-14 | The United States Of America, As Represented By The Secretary Of The Navy | Delivery of nanoparticles to neurons |
| US8449916B1 (en) | 2009-11-06 | 2013-05-28 | Iowa State University Research Foundation, Inc. | Antimicrobial compositions and methods |
| WO2011060250A1 (en) | 2009-11-13 | 2011-05-19 | Bend Research, Inc. | Cationic dextran polymer derivatives |
| WO2011062965A2 (en) | 2009-11-18 | 2011-05-26 | University Of Washington Through Its Center For Commercialization | Targeting monomers and polymers having targeting blocks |
| US8530429B2 (en) | 2009-11-24 | 2013-09-10 | Arch Cancer Therapeutics, Inc. | Brain tumor targeting peptides and methods |
| ES2734973T3 (es) | 2009-12-01 | 2019-12-13 | Translate Bio Inc | Administración de ARNm para el aumento de proteínas y enzimas en enfermedades genéticas humanas |
| US20110245756A1 (en) | 2009-12-03 | 2011-10-06 | Rishi Arora | Devices for material delivery, electroporation, sonoporation, and/or monitoring electrophysiological activity |
| EP3326643B1 (en) | 2009-12-06 | 2021-04-07 | Bioverativ Therapeutics Inc. | Factor viii-fc chimeric and hybrid polypeptides, and methods of use thereof |
| WO2011071860A2 (en) | 2009-12-07 | 2011-06-16 | Alnylam Pharmaceuticals, Inc. | Compositions for nucleic acid delivery |
| NO2510099T3 (ko) | 2009-12-07 | 2018-01-06 | ||
| US20130189741A1 (en) | 2009-12-07 | 2013-07-25 | Cellscript, Inc. | Compositions and methods for reprogramming mammalian cells |
| WO2011069528A1 (en) | 2009-12-09 | 2011-06-16 | Curevac Gmbh | Lyophilization of nucleic acids in lactate-containing solutions |
| WO2011069529A1 (en) | 2009-12-09 | 2011-06-16 | Curevac Gmbh | Mannose-containing solution for lyophilization, transfection and/or injection of nucleic acids |
| US8357401B2 (en) | 2009-12-11 | 2013-01-22 | Bind Biosciences, Inc. | Stable formulations for lyophilizing therapeutic particles |
| EP2512487A4 (en) | 2009-12-15 | 2013-08-07 | THERAPEUTIC POLYMERNANOPARTICLES WITH CORTICOSTEROIDS AND METHOD FOR THE PRODUCTION AND USE THEREOF | |
| US9295649B2 (en) | 2009-12-15 | 2016-03-29 | Bind Therapeutics, Inc. | Therapeutic polymeric nanoparticle compositions with high glass transition temperature or high molecular weight copolymers |
| DE102009058769A1 (de) | 2009-12-16 | 2011-06-22 | MagForce Nanotechnologies AG, 10589 | Temperaturabhängige Aktivierung von katalytischen Nukleinsäuren zur kontrollierten Wirkstofffreisetzung |
| US20130017265A1 (en) | 2009-12-16 | 2013-01-17 | Massachusetts Institute Of Technology | Particles for multiple agent delivery |
| EP3494963A1 (en) | 2009-12-18 | 2019-06-12 | The University of British Columbia | Methods and compositions for delivery of nucleic acids |
| EP2516010A2 (en) | 2009-12-23 | 2012-10-31 | Novartis AG | Lipids, lipid compositions, and methods of using them |
| WO2011088309A1 (en) | 2010-01-14 | 2011-07-21 | Regulus Therapeutics Inc. | Microrna compositions and methods |
| PL2539451T3 (pl) | 2010-02-24 | 2016-08-31 | Arrowhead Res Corporation | Kompozycje do ukierunkowanego dostarczania siRNA |
| CA2791278C (en) | 2010-02-25 | 2015-11-24 | The Johns Hopkins University | Sustained delivery of therapeutic agents to an eye compartment |
| WO2011112608A1 (en) | 2010-03-08 | 2011-09-15 | University Of Rochester | Synthesis of nanoparticles using reducing gases |
| EP2547715A4 (en) | 2010-03-16 | 2013-10-30 | Univ Utah Res Found | SPLICABLE MODIFICATIONS FOR REDUCABLE POLY (AMID ETHYLENIMINE) FOR REINFORCED NUCLEOTIDE DELIVERY |
| WO2011116072A1 (en) | 2010-03-16 | 2011-09-22 | Escape Therapeutics, Inc. | Hybrid hydrogel scaffold compositions and methods of use |
| US20110230816A1 (en) | 2010-03-18 | 2011-09-22 | Tyco Healthcare Group Lp | Gels for Transdermal Delivery |
| US9149432B2 (en) | 2010-03-19 | 2015-10-06 | Massachusetts Institute Of Technology | Lipid vesicle compositions and methods of use |
| JP2013521994A (ja) | 2010-03-24 | 2013-06-13 | ユナイテッド ステイツ エンドスコピー グループ,インコーポレイテッド | マルチプル生体検査装置 |
| GB201005005D0 (en) | 2010-03-25 | 2010-05-12 | Angeletti P Ist Richerche Bio | New vaccine |
| US8207290B2 (en) | 2010-03-26 | 2012-06-26 | Cerulean Pharma Inc. | Methods and systems for generating nanoparticles |
| CA2794307A1 (en) | 2010-03-26 | 2011-09-29 | Mersana Therapeutics, Inc. | Modified polymers for delivery of polynucleotides, method of manufacture, and methods of use thereof |
| US20110247090A1 (en) | 2010-04-02 | 2011-10-06 | Intrexon Corporation | Synthetic 5'UTRs, Expression Vectors, and Methods for Increasing Transgene Expression |
| JP2013523818A (ja) | 2010-04-05 | 2013-06-17 | ザ・ユニバーシティー・オブ・シカゴ | 免疫反応のエンハンサーとしてのプロテインA(SpA)抗体に関連する組成物および方法 |
| US20130037977A1 (en) | 2010-04-08 | 2013-02-14 | Paul A. Burke | Preparation of Lipid Nanoparticles |
| EP2555752B1 (en) | 2010-04-09 | 2019-06-26 | Pacira Pharmaceuticals, Inc. | Method for formulating multivesicular liposomes |
| WO2011125469A1 (ja) | 2010-04-09 | 2011-10-13 | 国立大学法人東京大学 | マイクロrna制御組換えワクシニアウイルス及びその使用 |
| KR101196667B1 (ko) | 2010-04-15 | 2012-11-02 | 포항공과대학교 산학협력단 | 피에이치 민감성 금속 나노 입자를 이용한 항암제 전달 시스템 |
| EP3072961A1 (en) | 2010-04-16 | 2016-09-28 | Children's Medical Center Corporation | Sustained polypeptide expression from synthetic, modified rnas and uses thereof |
| EP2377938A1 (en) | 2010-04-16 | 2011-10-19 | Eukarys | Capping-prone RNA polymerase enzymes and their applications |
| LT2558577T (lt) | 2010-04-16 | 2019-03-12 | Nuevolution A/S | Bifunkciniai kompleksai ir tokių kompleksų gamybos ir naudojimo būdai |
| WO2011133868A2 (en) | 2010-04-22 | 2011-10-27 | Alnylam Pharmaceuticals, Inc. | Conformationally restricted dinucleotide monomers and oligonucleotides |
| MX2012012567A (es) | 2010-04-28 | 2012-11-21 | Kimberly Clark Co | Metodo para aumentar la permeabilidad de una barrera epitelial. |
| WO2011139911A2 (en) | 2010-04-29 | 2011-11-10 | Isis Pharmaceuticals, Inc. | Lipid formulated single stranded rna |
| MA34263B1 (fr) | 2010-04-30 | 2013-05-02 | Novartis Ag | Marqueurs de prédiction utiles dans traitement du syndrome de l'x fragile (fxs) |
| US9254327B2 (en) | 2010-05-10 | 2016-02-09 | Alnylam Pharmaceuticals, Inc. | Methods and compositions for delivery of active agents |
| US10077232B2 (en) | 2010-05-12 | 2018-09-18 | Arbutus Biopharma Corporation | Cyclic cationic lipids and methods of use |
| CA2799091A1 (en) | 2010-05-12 | 2011-11-17 | Protiva Biotherapeutics, Inc. | Cationic lipids and methods of use thereof |
| EP2387999A1 (en) | 2010-05-21 | 2011-11-23 | CureVac GmbH | Histidine-containing solution for transfection and/or injection of nucleic acids and uses thereof |
| JP2013531634A (ja) | 2010-05-24 | 2013-08-08 | メルク・シャープ・エンド・ドーム・コーポレイション | オリゴヌクレオチド送達のための新規なアミノアルコールカチオン性脂質 |
| JP5957646B2 (ja) | 2010-06-04 | 2016-07-27 | サーナ・セラピューティクス・インコーポレイテッドSirna Therapeutics,Inc. | オリゴヌクレオチド送達のための新規な低分子量カチオン性脂質 |
| CN103096932B (zh) | 2010-06-14 | 2016-10-12 | 弗·哈夫曼-拉罗切有限公司 | 细胞穿透肽及其用途 |
| WO2011163121A1 (en) | 2010-06-21 | 2011-12-29 | Alnylam Pharmaceuticals, Inc. | Multifunctional copolymers for nucleic acid delivery |
| WO2011161653A1 (en) | 2010-06-25 | 2011-12-29 | Novartis Ag | Combinations of meningococcal factor h binding proteins |
| CN103079592B (zh) | 2010-07-01 | 2015-10-21 | 浦项工科大学校产学协力团 | 使用来自细胞的微泡治疗和诊断癌症的方法 |
| KR20130093084A (ko) | 2010-07-02 | 2013-08-21 | 더 유니버시티 오브 시카고 | 단백질 A(SpA) 변이체와 관련된 조성물 및 방법 |
| AU2011276236B2 (en) | 2010-07-06 | 2016-03-10 | Glaxosmithkline Biologicals S.A. | Cationic oil-in-water emulsions |
| WO2012006376A2 (en) | 2010-07-06 | 2012-01-12 | Novartis Ag | Virion-like delivery particles for self-replicating rna molecules |
| US9770463B2 (en) | 2010-07-06 | 2017-09-26 | Glaxosmithkline Biologicals Sa | Delivery of RNA to different cell types |
| JP5940064B2 (ja) | 2010-07-06 | 2016-06-29 | ノバルティス アーゲー | 低用量のrnaを用いた大型哺乳動物の免疫化 |
| US9192661B2 (en) | 2010-07-06 | 2015-11-24 | Novartis Ag | Delivery of self-replicating RNA using biodegradable polymer particles |
| PL3243526T3 (pl) | 2010-07-06 | 2020-05-18 | Glaxosmithkline Biologicals S.A. | Dostarczanie rna w celu wyzwolenia wielu szlaków immunologicznych |
| SI2590626T1 (sl) | 2010-07-06 | 2016-01-29 | Glaxosmithkline Biologicals S.A. | Liposomi z lipidi, ki imajo koristno pKa vrednost, za dostavo RNA |
| NZ605348A (en) | 2010-07-09 | 2015-01-30 | Biogen Idec Hemophilia Inc | Factor ix polypeptides and methods of use thereof |
| WO2012006623A1 (en) | 2010-07-09 | 2012-01-12 | Biogen Idec Hemophilia Inc. | Systems for factor viii processing and methods thereof |
| US20130177523A1 (en) | 2010-07-13 | 2013-07-11 | University Of Utah Research Foundation | Gold particles and methods of making and using the same in cancer treatment |
| GB201012410D0 (en) | 2010-07-23 | 2010-09-08 | Medical Res Council | Intracellular immunity |
| CN107648604A (zh) | 2010-07-30 | 2018-02-02 | 库瑞瓦格股份公司 | 聚合物载体运载物复合物及聚合物载体的用途 |
| US8822663B2 (en) | 2010-08-06 | 2014-09-02 | Moderna Therapeutics, Inc. | Engineered nucleic acids and methods of use thereof |
| US9121065B2 (en) | 2010-08-09 | 2015-09-01 | The Trustees Of The University Of Pennsylvania | Nanoparticle-oligonucleotide hybrid structures and methods of use thereof |
| WO2012019630A1 (en) | 2010-08-13 | 2012-02-16 | Curevac Gmbh | Nucleic acid comprising or coding for a histone stem-loop and a poly(a) sequence or a polyadenylation signal for increasing the expression of an encoded protein |
| CA2808901A1 (en) | 2010-08-20 | 2012-02-23 | Cerulean Pharma Inc. | Conjugates, particles, compositions, and related methods |
| WO2012024595A2 (en) | 2010-08-20 | 2012-02-23 | University Of Washington | Circumferential aerosol device for delivering drugs to olfactory epithelium and brain |
| AU2011290471B2 (en) | 2010-08-20 | 2015-08-20 | Novartis Ag | Soluble needle arrays for delivery of influenza vaccines |
| EP3542789A3 (en) | 2010-08-31 | 2020-01-01 | GlaxoSmithKline Biologicals SA | Lipids suitable for liposomal delivery of protein-coding rna |
| EP3178489B1 (en) | 2010-08-31 | 2019-11-27 | Theraclone Science, Int. | Human immunodeficiency virus (hiv)-neutralizing antibodies |
| ES2908978T3 (es) | 2010-08-31 | 2022-05-04 | Sirna Therapeutics Inc | Nuevas entidades químicas simples y métodos para la administración de oligonucleótidos |
| RU2671482C2 (ru) | 2010-08-31 | 2018-10-31 | Новартис Аг | Маленькие липосомы для доставки кодирующей иммуноген рнк |
| LT3970742T (lt) | 2010-08-31 | 2022-08-10 | Glaxosmithkline Biologicals S.A. | Pegilintos liposomos, skirtos imunogeną koduojančios rnr pristatymui |
| US9549901B2 (en) | 2010-09-03 | 2017-01-24 | The Brigham And Women's Hospital, Inc. | Lipid-polymer hybrid particles |
| US20130236419A1 (en) | 2010-09-09 | 2013-09-12 | The University Of Chicago | Compositions and methods related to attenuated staphylococcal strains |
| JP5793194B2 (ja) | 2010-09-09 | 2015-10-14 | ザ・ユニバーシティ・オブ・シカゴThe University Of Chicago | 感染防御ブドウ球菌抗原が関与する方法および組成物 |
| WO2012039979A2 (en) | 2010-09-10 | 2012-03-29 | The Johns Hopkins University | Rapid diffusion of large polymeric nanoparticles in the mammalian brain |
| US8466122B2 (en) | 2010-09-17 | 2013-06-18 | Protiva Biotherapeutics, Inc. | Trialkyl cationic lipids and methods of use thereof |
| BR112013004585B1 (pt) | 2010-09-20 | 2021-09-08 | Merck Sharp & Dohme Corp | Lipídeo catiônico, composição de lnp, e, uso de um lipídeo catiônico |
| US20130183718A1 (en) | 2010-09-21 | 2013-07-18 | RibpxX GmbH | Method for Synthesizing RNA using DNA Template |
| EP3412279B1 (en) | 2010-09-24 | 2021-02-17 | The Brigham and Women's Hospital, Inc. | Nanostructured gels capable of controlled release of encapsulated agents |
| WO2012050975A2 (en) | 2010-09-29 | 2012-04-19 | The University Of North Carolina At Chapel Hill | Novel circular mammalian rna molecules and uses thereof |
| KR20130114115A (ko) | 2010-09-30 | 2013-10-16 | 머크 샤프 앤드 돔 코포레이션 | 올리고뉴클레오티드 전달을 위한 저분자량 양이온성 지질 |
| SG190679A1 (en) | 2010-10-01 | 2013-07-31 | Jason Schrum | Engineered nucleic acids and methods of use thereof |
| US10078075B2 (en) | 2011-12-09 | 2018-09-18 | Vanderbilt University | Integrated organ-on-chip systems and applications of the same |
| EP3485913A1 (en) | 2010-10-21 | 2019-05-22 | Sirna Therapeutics, Inc. | Low molecular weight cationic lipids for oligonucleotide delivery |
| MX344596B (es) | 2010-10-29 | 2016-12-20 | Merck Sharp & Dohme | Vacuna de subunidad recombinante del virus del dengue. |
| CA3054532C (en) | 2010-11-05 | 2022-07-12 | The Johns Hopkins University | Compositions and methods relating to reduced mucoadhesion |
| US8518871B2 (en) | 2010-11-09 | 2013-08-27 | The Regents Of The University Of California | Skin permeating and cell entering (SPACE) peptides and methods of use thereof |
| CN103314002B (zh) | 2010-11-12 | 2016-09-07 | 宾夕法尼亚大学托管会 | 共有前列腺抗原、编码所述抗原的核酸分子以及包含所述核酸分子的疫苗及其用途 |
| WO2012068295A1 (en) | 2010-11-16 | 2012-05-24 | Selecta Biosciences, Inc. | Immunostimulatory oligonucleotides |
| CA2818353A1 (en) | 2010-11-17 | 2012-05-24 | Aduro Biotech | Methods and compositions for inducing an immune response to egfrviii |
| US8486908B2 (en) | 2010-11-19 | 2013-07-16 | Idera Pharmaceuticals, Inc. | Immune regulatory oligonucleotide (IRO) compounds to modulate toll-like receptor based immune response |
| US8853377B2 (en) | 2010-11-30 | 2014-10-07 | Shire Human Genetic Therapies, Inc. | mRNA for use in treatment of human genetic diseases |
| WO2012072096A1 (en) | 2010-12-03 | 2012-06-07 | Biontech Ag | Method for cellular rna expression |
| EP2651445A2 (en) | 2010-12-16 | 2013-10-23 | SPRNA GmbH | Pharmaceutical composition consisting of rna having alkali metal as counter ion and formulated with dications |
| US8501930B2 (en) | 2010-12-17 | 2013-08-06 | Arrowhead Madison Inc. | Peptide-based in vivo siRNA delivery system |
| CA2825370A1 (en) | 2010-12-22 | 2012-06-28 | President And Fellows Of Harvard College | Continuous directed evolution |
| WO2012089225A1 (en) | 2010-12-29 | 2012-07-05 | Curevac Gmbh | Combination of vaccination and inhibition of mhc class i restricted antigen presentation |
| CN104328121A (zh) | 2010-12-29 | 2015-02-04 | 弗·哈夫曼-拉罗切有限公司 | 用于细胞内递送核酸的小分子缀合物 |
| EP2661255B1 (en) | 2011-01-04 | 2021-03-10 | Brown University | Nanotubes as carriers of nucleic acids into cells |
| WO2012094574A2 (en) | 2011-01-06 | 2012-07-12 | The Johns Hopkins University | Stabilized polyribonucleotide nanoparticles |
| US20140080766A1 (en) | 2011-01-07 | 2014-03-20 | Massachusetts Institute Of Technology | Compositions and methods for macromolecular drug delivery |
| EP3202760B1 (en) | 2011-01-11 | 2019-08-21 | Alnylam Pharmaceuticals, Inc. | Pegylated lipids and their use for drug delivery |
| WO2012099805A2 (en) | 2011-01-19 | 2012-07-26 | Ocean Nanotech, Llc | Nanoparticle based immunological stimulation |
| US20140065172A1 (en) | 2011-01-26 | 2014-03-06 | Cenix Bioscience Gmbh | Delivery system and conjugates for compound delivery via naturally occurring intracellular transport routes |
| US10363309B2 (en) | 2011-02-04 | 2019-07-30 | Case Western Reserve University | Targeted nanoparticle conjugates |
| US20140066363A1 (en) | 2011-02-07 | 2014-03-06 | Arun K. Bhunia | Carbohydrate nanoparticles for prolonged efficacy of antimicrobial peptide |
| WO2012116715A1 (en) | 2011-03-02 | 2012-09-07 | Curevac Gmbh | Vaccination in newborns and infants |
| US20120207840A1 (en) | 2011-02-10 | 2012-08-16 | Aura Biosciences, Inc. | Virion Derived Protein Nanoparticles For Delivering Diagnostic Or Therapeutic Agents For The Treatment Of Non-Melanoma Skin Cancer |
| WO2012112582A2 (en) | 2011-02-14 | 2012-08-23 | Swift Biosciences, Inc. | Polynucleotide primers and probes |
| WO2012112689A1 (en) | 2011-02-15 | 2012-08-23 | The University Of North Carolina At Chapel Hill | Nanoparticle, liposomes, polymers, agents and proteins modified with reversible linkers |
| WO2012112730A2 (en) | 2011-02-15 | 2012-08-23 | Merrimack Pharmaceuticals, Inc. | Compositions and methods for delivering nucleic acid to a cell |
| EP2489371A1 (en) | 2011-02-18 | 2012-08-22 | Instituto Nacional de Investigacion y Tecnologia Agraria y Alimentaria | Carrier peptides for drug delivery |
| WO2012113413A1 (en) | 2011-02-21 | 2012-08-30 | Curevac Gmbh | Vaccine composition comprising complexed immunostimulatory nucleic acids and antigens packaged with disulfide-linked polyethyleneglycol/peptide conjugates |
| JP6091435B2 (ja) | 2011-02-22 | 2017-03-08 | カリフォルニア インスティチュート オブ テクノロジー | アデノ随伴ウイルス(aav)ベクターを用いたタンパク質の送達 |
| US8696637B2 (en) | 2011-02-28 | 2014-04-15 | Kimberly-Clark Worldwide | Transdermal patch containing microneedles |
| WO2012116714A1 (en) | 2011-03-02 | 2012-09-07 | Curevac Gmbh | Vaccination in elderly patients |
| WO2012117377A1 (en) | 2011-03-02 | 2012-09-07 | Novartis Ag | Combination vaccines with lower doses of antigen and/or adjuvant |
| WO2012122318A2 (en) | 2011-03-07 | 2012-09-13 | Massachusetts Institute Of Technology | Methods for transfecting cells with nucleic acids |
| WO2012125680A1 (en) | 2011-03-16 | 2012-09-20 | Novartis Ag | Methods of treating vasculitis using an il-17 binding molecule |
| US20140212503A1 (en) | 2011-03-17 | 2014-07-31 | Hyukjin Lee | Delivery system |
| US20130345234A1 (en) | 2011-03-17 | 2013-12-26 | Humphrey Athelstan Roy Gardner | Fgfr and ligands thereof as biomarkers for breast cancer in hr positive subjects |
| US10357568B2 (en) | 2011-03-24 | 2019-07-23 | Glaxosmithkline Biologicals S.A. | Adjuvant nanoemulsions with phospholipids |
| DK2691443T3 (da) | 2011-03-28 | 2021-05-03 | Massachusetts Inst Technology | Konjugerede lipomerer og anvendelser af disse |
| US20140005070A1 (en) | 2011-03-28 | 2014-01-02 | Novartis Ag | Markers associated with cyclin-dependent kinase inhibitors |
| DE12722942T1 (de) | 2011-03-31 | 2021-09-30 | Modernatx, Inc. | Freisetzung und formulierung von manipulierten nukleinsäuren |
| US10086043B2 (en) | 2011-04-03 | 2018-10-02 | The General Hospital Corporation | Efficient protein expression in vivo using modified RNA (MOD-RNA) |
| ES2587512T3 (es) | 2011-04-04 | 2016-10-25 | The U.S.A. As Represented By The Secretary, Department Of Health And Human Services | Derivados de 2'-O-aminooximetil nucleósido para su uso en la síntesis y modificación de nucleósidos, nucleótidos y oligonucleótidos |
| WO2012142132A1 (en) | 2011-04-11 | 2012-10-18 | Life Technologies Corporation | Polymer particles and methods of making and using same |
| US11135174B2 (en) | 2011-04-13 | 2021-10-05 | The Trustees Of The University Of Pennsylvania | Coated mesoporous nanoparticles |
| WO2013158127A1 (en) | 2012-04-16 | 2013-10-24 | Molecular Transfer, Inc. | Agents for improved delivery of nucleic acids to eukaryotic cells |
| US20140178894A1 (en) | 2011-04-20 | 2014-06-26 | Novartis Forschungsstiftung, Zweigniederlassung | Culture medium suitable for the culture of undifferentiated cells |
| WO2012149045A2 (en) | 2011-04-26 | 2012-11-01 | Molecular Express, Inc. | Liposomal formulations |
| AU2012249474A1 (en) | 2011-04-28 | 2013-11-07 | Stc.Unm | Porous nanoparticle-supported lipid bilayers (protocells) for targeted delivery and methods of using same |
| US20160272697A2 (en) | 2011-04-28 | 2016-09-22 | The Henry M. Jackson Foundation For The Advancement Of Military Medicine, Inc. | Neutralizing Antibodies to Nipah and Hendra Virus |
| WO2012149405A2 (en) | 2011-04-29 | 2012-11-01 | Selecta Biosciences, Inc. | Tolerogenic synthetic nanocarriers for regulating innate immune responses |
| EP2702408A1 (en) | 2011-04-29 | 2014-03-05 | Novartis AG | Methods of treating squamous cell carcinoma related applications |
| UA116189C2 (uk) | 2011-05-02 | 2018-02-26 | Мілленніум Фармасьютікалз, Інк. | КОМПОЗИЦІЯ АНТИ-α4β7 АНТИТІЛА |
| ES2957478T3 (es) | 2011-05-02 | 2024-01-19 | Univ Wayne State | Una tecnología de células madre pluripotentes inducidas por proteínas y usos de las mismas |
| US8945588B2 (en) | 2011-05-06 | 2015-02-03 | The University Of Chicago | Methods and compositions involving protective staphylococcal antigens, such as EBH polypeptides |
| US9650745B2 (en) | 2011-05-10 | 2017-05-16 | Basf Se | Oil-in-water emulsions |
| US9283279B2 (en) | 2011-05-11 | 2016-03-15 | Ramot At Tel-Aviv University Ltd. | Targeted polymeric conjugates and uses thereof |
| CA2834918C (en) | 2011-05-12 | 2020-03-24 | Yissum Research Development Company Of The Hebrew University Of Jerusam Ltd. | Liposomes comprising polymer-conjugated lipids and related uses |
| US20140072657A1 (en) | 2011-05-12 | 2014-03-13 | Helmut Vockner | Novel pharmaceutical formulation |
| ES2782119T3 (es) | 2011-05-13 | 2020-09-10 | Glaxosmithkline Biologicals Sa | Antígenos de F de prefusión del VRS |
| US8691750B2 (en) | 2011-05-17 | 2014-04-08 | Axolabs Gmbh | Lipids and compositions for intracellular delivery of biologically active compounds |
| AU2012255913A1 (en) | 2011-05-17 | 2013-11-21 | Moderna Therapeutics, Inc. | Engineered nucleic acids and methods of use thereof for non-human vertebrates |
| US8978170B2 (en) | 2011-05-20 | 2015-03-17 | Kohler Co. | Toilet installation system and method |
| RU2013157589A (ru) | 2011-05-25 | 2015-06-27 | Новартис Аг | Биомаркеры для рака легкого |
| WO2012166923A2 (en) | 2011-05-31 | 2012-12-06 | Bind Biosciences | Drug loaded polymeric nanoparticles and methods of making and using same |
| EP2714017B1 (en) | 2011-06-02 | 2018-08-01 | The Regents of The University of California | Membrane encapsulated nanoparticles and method of use |
| MX349011B (es) | 2011-06-02 | 2017-07-05 | Novartis Ag | Biomarcadores para terapia de inhibidor de hedgehog. |
| WO2012168259A1 (en) | 2011-06-06 | 2012-12-13 | Novartis Forschungsstiftung, Zweigniederlassung | Protein tyrosine phosphatase, non-receptor type 11 (ptpn11) and triple-negative breast cancer |
| CA2838063C (en) | 2011-06-08 | 2023-07-11 | Shire Human Genetic Therapies, Inc. | Cleavable lipids |
| KR20200084048A (ko) | 2011-06-08 | 2020-07-09 | 샤이어 휴먼 지네틱 테라피즈 인크. | Mrna 전달을 위한 지질 나노입자 조성물 및 방법 |
| US8636696B2 (en) | 2011-06-10 | 2014-01-28 | Kimberly-Clark Worldwide, Inc. | Transdermal device containing microneedles |
| WO2012170607A2 (en) | 2011-06-10 | 2012-12-13 | Novartis Ag | Use of pcsk9 antagonists |
| WO2012168491A1 (en) | 2011-06-10 | 2012-12-13 | Novartis Ag | Pharmaceutical formulations of pcsk9 antagonists |
| US8916696B2 (en) | 2011-06-12 | 2014-12-23 | City Of Hope | Aptamer-mRNA conjugates for targeted protein or peptide expression and methods for their use |
| WO2012172495A1 (en) | 2011-06-14 | 2012-12-20 | Novartis Ag | Compositions and methods for antibodies targeting tem8 |
| AU2012270015A1 (en) | 2011-06-15 | 2014-01-16 | Chrontech Pharma Ab | Injection needle and device |
| JP2014519338A (ja) | 2011-06-16 | 2014-08-14 | ノバルティス アーゲー | 治療薬として使用される可溶性タンパク質 |
| KR20140047069A (ko) | 2011-06-20 | 2014-04-21 | 유니버시티 오브 피츠버그 - 오브 더 커먼웰쓰 시스템 오브 하이어 에듀케이션 | 계산에 최적화된 광범위 반응을 나타내는 h1n1 인플루엔자를 위한 항원 |
| US9862926B2 (en) | 2011-06-27 | 2018-01-09 | Cellscript, Llc. | Inhibition of innate immune response |
| WO2013066427A1 (en) | 2011-06-28 | 2013-05-10 | Inovio Pharmaceuticals, Inc. | A miniminally invasive dermal electroporation device |
| ES2692519T3 (es) | 2011-07-01 | 2018-12-04 | Novartis Ag | Método para tratar trastornos metabólicos |
| US20150024488A1 (en) | 2011-07-04 | 2015-01-22 | Commonwealth Scientific And Industrial Research Organisation | Nucleic acid complex |
| RU2606846C2 (ru) | 2011-07-06 | 2017-01-10 | Новартис Аг | Эмульсии типа "масло в воде", которые содержат нуклеиновые кислоты |
| JP2014520807A (ja) | 2011-07-06 | 2014-08-25 | ノバルティス アーゲー | 免疫原性組成物およびその使用 |
| CA2840977A1 (en) | 2011-07-06 | 2013-01-10 | Novartis Ag | Liposomes having useful n:p ratio for delivery of rna molecules |
| EP2729124B1 (en) | 2011-07-06 | 2018-10-24 | GlaxoSmithKline Biologicals SA | Cationic oil-in-water emulsions |
| WO2013006838A1 (en) | 2011-07-06 | 2013-01-10 | Novartis Ag | Immunogenic combination compositions and uses thereof |
| EP2729501A2 (en) | 2011-07-07 | 2014-05-14 | Life Technologies Corporation | Polymer particles, nucleic acid polymer particles and methods of making and using the same |
| WO2013009717A1 (en) | 2011-07-10 | 2013-01-17 | Elisabet De Los Pinos | Virion derived protein nanoparticles for delivering diagnostic or therapeutic agents for the treatment of skin-related diseases |
| US20130012566A1 (en) | 2011-07-10 | 2013-01-10 | Aura Biosciences, Inc. | Virion Derived Protein Nanoparticles For Delivering Diagnostic Or Therapeutic Agents For The Treatment of Alopecia |
| EP2758458A4 (en) | 2011-07-10 | 2015-10-21 | Harvard College | COMPOSITIONS AND METHODS FOR SELF-ASSEMBLING POLYMERS WITH COMPLEMENTARY MACROSCOPIC AND MICROSCOPIC SCALE UNITS |
| WO2013012921A2 (en) | 2011-07-20 | 2013-01-24 | University Of Iowa Research Foundation | Nucleic acid aptamers |
| GB2492999A (en) | 2011-07-20 | 2013-01-23 | Univ Central Lancashire | Neutron detector |
| US10376461B2 (en) | 2011-07-21 | 2019-08-13 | Croda International Plc | Branched polyether-polyamide block copolymers and methods of making and using the same |
| US9493549B2 (en) | 2011-07-25 | 2016-11-15 | The Rockefeller University | Antibodies directed toward the HIV-1 GP120 CD4 binding site with increased potency and breadth |
| ES2687129T3 (es) | 2011-07-25 | 2018-10-23 | Glaxosmithkline Biologicals Sa | Composiciones y métodos para evaluar la inmunogenicidad funcional de vacunas contra parvovirus |
| AU2012290306B2 (en) | 2011-07-29 | 2017-08-17 | Selecta Biosciences, Inc. | Synthetic nanocarriers that generate humoral and cytotoxic T lymphocyte (CTL) immune responses |
| BR112014003315A2 (pt) | 2011-08-15 | 2017-03-01 | Univ Chicago | composições e métodos relacionados a anticorpos para a proteína a estafilocócica |
| MX2014001971A (es) | 2011-08-26 | 2014-03-31 | Arrowhead Res Corp | Polimeros de poli(vinilester) para suministro de acido nucleico in vivo. |
| RU2628705C2 (ru) | 2011-08-31 | 2017-08-21 | Новартис Аг | Пегилированные липосомы для доставки кодирующей иммуноген рнк |
| US8889657B2 (en) | 2011-08-31 | 2014-11-18 | Mallinckrodt Llc | Nanoparticle PEG modification with H-phosphonates |
| US9126966B2 (en) | 2011-08-31 | 2015-09-08 | Protiva Biotherapeutics, Inc. | Cationic lipids and methods of use thereof |
| MX2014002486A (es) | 2011-09-01 | 2014-12-08 | Irm Llc | Compuestos y composiciones como inhibidores de cinasa pdgfr. |
| WO2013030778A2 (en) | 2011-09-02 | 2013-03-07 | Novartis Ag | Organic compositions to treat hsf1-related diseases |
| WO2013039857A1 (en) | 2011-09-12 | 2013-03-21 | modeRNA Therapeutics | Engineered nucleic acids and methods of use thereof |
| EP3384938A1 (en) | 2011-09-12 | 2018-10-10 | Moderna Therapeutics, Inc. | Engineered nucleic acids and methods of use thereof |
| WO2013038375A2 (en) | 2011-09-14 | 2013-03-21 | Novartis Ag | Methods for making saccharide-protein glycoconjugates |
| EP2747761A1 (en) | 2011-09-22 | 2014-07-02 | Bind Therapeutics, Inc. | Methods of treating cancers with therapeutic nanoparticles |
| WO2013072929A2 (en) | 2011-09-23 | 2013-05-23 | Indian Institute Of Technology | Nanop article based cosmetic composition |
| US9006400B2 (en) | 2011-09-26 | 2015-04-14 | Novartis Ag | Fibroblast growth factor-21-Fc fusion proteins |
| US9458214B2 (en) | 2011-09-26 | 2016-10-04 | Novartis Ag | Dual function fibroblast growth factor 21 proteins |
| AU2012315965A1 (en) | 2011-09-27 | 2014-04-03 | Alnylam Pharmaceuticals, Inc. | Di-aliphatic substituted PEGylated lipids |
| WO2013045505A1 (en) | 2011-09-28 | 2013-04-04 | Novartis Ag | Biomarkers for raas combination therapy |
| KR20190099538A (ko) | 2011-10-03 | 2019-08-27 | 모더나 세라퓨틱스, 인코포레이티드 | 변형된 뉴클레오사이드, 뉴클레오타이드, 및 핵산, 및 이들의 용도 |
| WO2013055971A1 (en) | 2011-10-11 | 2013-04-18 | Arizona Board Of Regents For And On Behalf Of Arizona State University | Polymers for delivering a substance into a cell |
| MX2014004214A (es) | 2011-10-11 | 2014-05-07 | Novartis Ag | Moleculas de acido ribonucleico policistronicas auto-replicantes recombinantes. |
| WO2014066811A1 (en) | 2012-10-25 | 2014-05-01 | The Johns Hopkins University | Bioreducible poly (b-amino ester)s for sirna delivery |
| EP2766407B1 (en) | 2011-10-12 | 2018-06-27 | The Curators Of The University Of Missouri | Pentablock polymers |
| CN104023711A (zh) | 2011-10-14 | 2014-09-03 | Stc.Unm公司 | 用于靶向递送(包括负载物的透皮递送)的多孔纳米颗粒支撑的脂质双层(原始细胞)及其方法 |
| CN104080471B (zh) | 2011-10-14 | 2018-08-10 | 诺华股份有限公司 | 用于Wnt途径相关疾病的抗体和方法 |
| PL3597644T3 (pl) | 2011-10-18 | 2022-01-17 | Dicerna Pharmaceuticals, Inc. | Aminowe lipidy kationowe i ich zastosowania |
| US20140371717A1 (en) | 2011-10-18 | 2014-12-18 | Micell Technologies, Inc. | Drug delivery medical device |
| CN103930112B (zh) | 2011-10-20 | 2018-11-09 | 诺华股份有限公司 | 预测对α7烟碱型乙酰胆碱受体激活剂疗法的响应的生物标志物 |
| WO2013057715A1 (en) | 2011-10-20 | 2013-04-25 | Novartis Ag | Adjuvanted influenza b virus vaccines for pediatric priming |
| CA2853316C (en) | 2011-10-25 | 2018-11-27 | The University Of British Columbia | Limit size lipid nanoparticles and related methods |
| WO2013061290A1 (en) | 2011-10-26 | 2013-05-02 | Nanopass Technologies Ltd. | Microneedle intradermal drug delivery device with auto-disable functionality |
| AU2012328037B2 (en) | 2011-10-27 | 2017-11-02 | Vivasor, Inc. | Transdermal delivery of high viscosity bioactive agents |
| CA2853522C (en) | 2011-10-27 | 2021-07-13 | Massachusetts Institute Of Technology | Amino acid derivatives functionalized on the n-terminal capable of forming drug encapsulating microspheres |
| WO2013062140A1 (en) | 2011-10-28 | 2013-05-02 | Kyoto University | Method for efficiently inducing differentiation of pluripotent stem cells into hepatic lineage cells |
| SG10201508662SA (en) | 2011-10-28 | 2015-11-27 | Presage Biosciences Inc | Methods for drug delivery |
| CN104023748B (zh) | 2011-10-28 | 2018-03-02 | 诚信生物公司 | 含有氨基酸的蛋白质制剂 |
| US9370489B2 (en) | 2011-10-31 | 2016-06-21 | Mallinckrodt Llc | Combinational liposome compositions for cancer therapy |
| KR20140084078A (ko) | 2011-10-31 | 2014-07-04 | 제넨테크, 인크. | 항체 제제 |
| CN103906503B (zh) | 2011-11-04 | 2016-12-14 | 日东电工株式会社 | 用于无菌制备脂质-核酸颗粒的单次使用系统 |
| WO2013067537A1 (en) | 2011-11-04 | 2013-05-10 | Univertiy Of Notre Dame Du Lac | Nanoparticle-based drug delivery |
| US10449257B2 (en) | 2011-11-04 | 2019-10-22 | Agency For Science, Technology And Research | Self-assembled composite ultrasmall peptide-polymer hydrogels |
| US9579338B2 (en) | 2011-11-04 | 2017-02-28 | Nitto Denko Corporation | Method of producing lipid nanoparticles for drug delivery |
| CN104039830A (zh) | 2011-11-04 | 2014-09-10 | 诺华股份有限公司 | 低密度脂蛋白相关蛋白6(lrp6)-半寿期延长物构建体 |
| US20130115247A1 (en) | 2011-11-05 | 2013-05-09 | Aura Biosciences, Inc. | Virion Derived Protein Nanoparticles For Delivering Radioisotopes For The Diagnosis And Treatment Of Malignant And Systemic Disease And The Monitoring Of Therapy |
| US20130116408A1 (en) | 2011-11-05 | 2013-05-09 | Aura Biosciences, Inc. | Virion Derived Protein Nanoparticles For Delivering Radioisotopes For The Diagnosis And Treatment Of Malignant And Systemic Disease And The Monitoring Of Therapy |
| US20140294732A1 (en) | 2011-11-08 | 2014-10-02 | Novartis Forschungsstiftung, Zweigniederlassung, Friedrich Miescher Institute | Early diagnostic of neurodegenerative diseases |
| WO2013070872A1 (en) | 2011-11-08 | 2013-05-16 | The Board Of Trustees Of The University Of Arkansas | Methods and compositions for x-ray induced release from ph sensitive liposomes |
| WO2013068413A1 (en) | 2011-11-08 | 2013-05-16 | Novartis Forschungsstiftung, Zweigniederlassung, Friedrich Miescher Institute For Biomedical Research | Rod cell-specific promoter |
| WO2013068431A1 (en) | 2011-11-08 | 2013-05-16 | Novartis Forschungsstiftung, Zweigniederlassung, Friedrich Miescher Institute For Biomedical Research | New treatment for neurodegenerative diseases |
| WO2013070653A1 (en) | 2011-11-09 | 2013-05-16 | Board Of Trustees Michigan State University | Metallic nanoparticle synthesis with carbohydrate capping agent |
| WO2013071047A1 (en) | 2011-11-11 | 2013-05-16 | Children's Medical Center Corporation | Compositions and methods for in vitro transcription of rna |
| BR112014011229B1 (pt) | 2011-11-11 | 2021-10-13 | Variation Biotechnologies, Inc | Partículas vírus-like (vlp), composição farmacêutica compreendendo a referida partícula, método de produção e uso da mesma |
| EP2780035A1 (en) | 2011-11-14 | 2014-09-24 | Novartis AG | Immunogenic complexes of polyanionic carbomers and env polypeptides and methods of manufacture and use thereof |
| AU2012338869A1 (en) | 2011-11-15 | 2014-06-05 | Novartis Ag | Combination of a phosphoinositide 3-kinase inhibitor and a modulator of the Janus Kinase 2-Signal Transducer and Activator of Transcription 5 pathway |
| PT3384903T (pt) | 2011-11-18 | 2020-06-25 | Regeneron Pharma | Micropartícula contendo proteína terapêutica revestida com polímero biodegradável para uso médico |
| WO2013077907A1 (en) | 2011-11-21 | 2013-05-30 | Novartis Ag | Methods of treating psoriatic arthritis (psa) using il-17 antagonists and psa response or non- response alleles |
| WO2013078199A2 (en) | 2011-11-23 | 2013-05-30 | Children's Medical Center Corporation | Methods for enhanced in vivo delivery of synthetic, modified rnas |
| WO2013082111A2 (en) | 2011-11-29 | 2013-06-06 | The University Of North Carolina At Chapel Hill | Geometrically engineered particles and methods for modulating macrophage or immune responses |
| US9364549B2 (en) | 2011-11-30 | 2016-06-14 | Andreas Voigt | Hydrophobic drug-delivery material, method for manufacturing thereof and methods for delivery of a drug-delivery composition |
| WO2013082418A1 (en) | 2011-11-30 | 2013-06-06 | 3M Innovative Properties Company | Microneedle device having a peptide therapeutic agent and an amino acid, methods of making and using the same |
| WO2013082529A1 (en) | 2011-12-02 | 2013-06-06 | Yale University | Enzymatic synthesis of poly(amine-co-esters) and methods of use thereof for gene delivery |
| BR112014013175B1 (pt) | 2011-12-02 | 2022-08-09 | Pegasus Laboratories, Inc | Processo para preparar comprimidos de composição de liberação prolongada |
| WO2013082590A1 (en) | 2011-12-02 | 2013-06-06 | Invivo Therapeutics Corporation | Peg based hydrogel for peripheral nerve injury applications and compositions and method of use of synthetic hydrogel sealants |
| US8497124B2 (en) | 2011-12-05 | 2013-07-30 | Factor Bioscience Inc. | Methods and products for reprogramming cells to a less differentiated state |
| EP3260140B1 (en) | 2011-12-05 | 2021-02-03 | Factor Bioscience Inc. | Methods and products for transfecting cells |
| EP2788439A4 (en) | 2011-12-05 | 2015-09-02 | Nano Prec Medical Inc | DEVICE HAVING A MEMBRANE FOR TITANIUM DIOXIDE NANOTUBE FOR DRUG DELIVERY |
| EP2788316B1 (en) | 2011-12-07 | 2019-04-24 | Alnylam Pharmaceuticals, Inc. | Branched alkyl and cycloalkyl terminated biodegradable lipids for the delivery of active agents |
| GB201121070D0 (en) | 2011-12-07 | 2012-01-18 | Isis Innovation | composition for delivery of biotherapeutics |
| US9061063B2 (en) | 2011-12-07 | 2015-06-23 | Alnylam Pharmaceuticals, Inc. | Biodegradable lipids for the delivery of active agents |
| US20140308304A1 (en) | 2011-12-07 | 2014-10-16 | Alnylam Pharmaceuticals, Inc. | Lipids for the delivery of active agents |
| WO2013086486A1 (en) | 2011-12-09 | 2013-06-13 | President And Fellows Of Harvard College | Integrated human organ-on-chip microphysiological systems |
| US10087422B2 (en) | 2011-12-09 | 2018-10-02 | President And Fellows Of Harvard College | Organ chips and uses thereof |
| EP2787977A4 (en) | 2011-12-09 | 2015-05-06 | Univ California | LIPOSOMAL ACTIVE INVERTING |
| EP2792368A4 (en) | 2011-12-12 | 2015-09-30 | Kyowa Hakko Kirin Co Ltd | LIPID NANOPARTICLES WITH COMBINATIONS OF CATIONIC LIPIDES |
| WO2013090294A1 (en) | 2011-12-12 | 2013-06-20 | The Trustees Of The University Of Pennsylvania | Proteins comprising mrsa pbp2a and fragments thereof, nucleic acids encoding the same, and compositions and their use to prevent and treat mrsa infections |
| JP6182457B2 (ja) | 2011-12-12 | 2017-08-16 | 協和発酵キリン株式会社 | カチオン性脂質を含有するドラックデリバリーシステムのための脂質ナノ粒子 |
| EP2604253A1 (en) | 2011-12-13 | 2013-06-19 | Otto Glatter | Water-in-oil emulsions and methods for their preparation |
| US20150000936A1 (en) | 2011-12-13 | 2015-01-01 | Schlumberger Technology Corporation | Energization of an element with a thermally expandable material |
| SG11201403062YA (en) | 2011-12-13 | 2014-07-30 | Engeneic Molecular Delivery Pty Ltd | Bacterially derived, intact minicells for delivery of therapeutic agents to brain tumors |
| EP2791364A4 (en) | 2011-12-14 | 2015-11-11 | Moderna Therapeutics Inc | METHODS OF RESPONSE TO A BIOLOGICAL THREAT |
| WO2013090897A1 (en) | 2011-12-15 | 2013-06-20 | The Trustees Of The University Of Pennsylvania | Using adaptive immunity to detect drug resistance |
| US9636414B2 (en) | 2011-12-15 | 2017-05-02 | Biontech Ag | Particles comprising single stranded RNA and double stranded RNA for immunomodulation |
| WO2013090601A2 (en) | 2011-12-16 | 2013-06-20 | Massachusetts Institute Of Technology | Compact nanoparticles for biological applications |
| AU2012351948A1 (en) | 2011-12-16 | 2014-07-10 | Allergan, Inc. | Ophthalmic compositions comprising polyvinyl capralactam - polyvinyl acetate - polyethylene glycol graft copolymer |
| CA2858247A1 (en) | 2011-12-16 | 2013-06-20 | Novartis Ag | Aerosolization apparatus for inhalation profile-independent drug delivery |
| US9580501B2 (en) | 2011-12-16 | 2017-02-28 | Synthon Biopharmaceuticals B.V. | Anti-TNF alpha monoclonal secretory IgA antibodies and methods for treating inflammatory diseases |
| BR112014014599A2 (pt) | 2011-12-16 | 2017-06-13 | Massachusetts Inst Technology | polímeros de alfa-aminoamidina e uso dos mesmos |
| CA2859387A1 (en) | 2011-12-16 | 2013-06-20 | Moderna Therapeutics, Inc. | Modified nucleoside, nucleotide, and nucleic acid compositions |
| WO2013091001A1 (en) | 2011-12-19 | 2013-06-27 | The University Of Sydney | A peptide-hydrogel composite |
| US9241829B2 (en) | 2011-12-20 | 2016-01-26 | Abbott Medical Optics Inc. | Implantable intraocular drug delivery apparatus, system and method |
| CA2859691A1 (en) | 2011-12-21 | 2013-06-27 | Moderna Therapeutics, Inc. | Methods of increasing the viability or longevity of an organ or organ explant |
| WO2013096812A1 (en) | 2011-12-23 | 2013-06-27 | Genentech, Inc. | Articles of manufacture and methods for co-administration of antibodies |
| US10814115B2 (en) | 2011-12-27 | 2020-10-27 | Massachusetts Institute Of Technology | Microneedle devices and uses thereof |
| WO2013098589A1 (en) | 2011-12-29 | 2013-07-04 | Novartis Ag | Adjuvanted combinations of meningococcal factor h binding proteins |
| CN110025608A (zh) | 2012-01-06 | 2019-07-19 | 燿石治疗公司 | 降低心血管疾病风险的方法 |
| US20150017703A1 (en) | 2012-01-26 | 2015-01-15 | Life Technologies Corporation | Methods for increasing the infectivity of viruses |
| EP2807252B1 (en) | 2012-01-26 | 2017-05-10 | Life Technologies Corporation | Methods for increasing the infectivity of viruses |
| EP2623121A1 (en) | 2012-01-31 | 2013-08-07 | Bayer Innovation GmbH | Pharmaceutical composition comprising a polymeric carrier cargo complex and an antigen |
| WO2013113326A1 (en) | 2012-01-31 | 2013-08-08 | Curevac Gmbh | Pharmaceutical composition comprising a polymeric carrier cargo complex and at least one protein or peptide antigen |
| WO2013113325A1 (en) | 2012-01-31 | 2013-08-08 | Curevac Gmbh | Negatively charged nucleic acid comprising complexes for immunostimulation |
| CN104245745B (zh) | 2012-02-09 | 2017-03-29 | 生命技术公司 | 亲水性聚合物颗粒及其制备方法 |
| EP2817345A1 (en) | 2012-02-22 | 2014-12-31 | Cerulean Pharma Inc. | Conjugates, particles, compositions, and related methods |
| US20130243867A1 (en) | 2012-02-23 | 2013-09-19 | University Of South Florida (A Florida Non-Profit Corporation) | Micelle compositions and methods for their use |
| WO2013130535A1 (en) | 2012-02-27 | 2013-09-06 | Newgen Biopharma Corporation | Topical delivery of hormonal and non hormonal nano formulations, methods of making and using the same |
| US20150037334A1 (en) | 2012-03-01 | 2015-02-05 | Amgen Research (Munich) Gmbh | Long life polypeptide binding molecules |
| DE112013001457T5 (de) | 2012-03-13 | 2014-12-04 | University Of Kwazulu-Natal | Transdermales Applikationssystem |
| US10322089B2 (en) | 2012-03-14 | 2019-06-18 | The Board Of Trustees Of The Leland Stanford Junior University | Nanoparticles, nanoparticle delivery methods, and systems of delivery |
| AU2013232297B2 (en) | 2012-03-16 | 2016-01-14 | The Johns Hopkins University | Controlled release formulations for the delivery of HIF-1 inhibitors |
| RU2654210C2 (ru) | 2012-03-16 | 2018-05-17 | Мерк Патент Гмбх | Нацеливающие аминокислотные липиды |
| AU2013232300B2 (en) | 2012-03-16 | 2015-12-17 | The Johns Hopkins University | Non-linear multiblock copolymer-drug conjugates for the delivery of active agents |
| US9610346B2 (en) | 2012-03-23 | 2017-04-04 | International Aids Vaccine Initiative | Recombinant viral vectors |
| WO2013142349A1 (en) | 2012-03-23 | 2013-09-26 | University Of Chicago | Compositions and methods related to staphylococcal sbi |
| WO2013148186A1 (en) | 2012-03-26 | 2013-10-03 | President And Fellows Of Harvard College | Lipid-coated nucleic acid nanostructures of defined shape |
| WO2013143555A1 (en) | 2012-03-26 | 2013-10-03 | Biontech Ag | Rna formulation for immunotherapy |
| US9683233B2 (en) | 2012-03-27 | 2017-06-20 | Curevac Ag | Artificial nucleic acid molecules for improved protein or peptide expression |
| JP6298039B2 (ja) | 2012-03-27 | 2018-03-20 | キュアバック アーゲー | 人工核酸分子 |
| AU2013240051B2 (en) | 2012-03-27 | 2017-11-30 | Sirna Therapeutics, Inc. | Diether based biodegradable cationic lipids for siRNA delivery |
| ES2660129T3 (es) | 2012-03-27 | 2018-03-20 | Curevac Ag | Moléculas de ácido nucleico artificiales que comprenden un 5'UTR-TOP |
| US9877919B2 (en) | 2012-03-29 | 2018-01-30 | Translate Bio, Inc. | Lipid-derived neutral nanoparticles |
| US9303079B2 (en) | 2012-04-02 | 2016-04-05 | Moderna Therapeutics, Inc. | Modified polynucleotides for the production of cytoplasmic and cytoskeletal proteins |
| US9192651B2 (en) | 2012-04-02 | 2015-11-24 | Moderna Therapeutics, Inc. | Modified polynucleotides for the production of secreted proteins |
| CN104411338A (zh) | 2012-04-02 | 2015-03-11 | 现代治疗公司 | 用于产生与人类疾病相关的生物制剂和蛋白质的修饰多核苷酸 |
| US20150064115A1 (en) | 2012-04-05 | 2015-03-05 | University Of Florida Research Foundation, Inc. | Neurophilic nanoparticles |
| EP3563872A1 (en) | 2012-04-05 | 2019-11-06 | Massachusetts Institute Of Technology | Immunostimulatory compositions and methods of use thereof |
| WO2013152351A2 (en) | 2012-04-06 | 2013-10-10 | The Trustees Of Columbia University In The City Of New York | Fusion polypeptides and methods of use thereof |
| RU2635466C2 (ru) | 2012-04-08 | 2017-11-13 | Теракоат Лтд | Препараты термообратимого гидрогеля для применения при лечении нарушений уротелия |
| CN104487481B (zh) | 2012-04-11 | 2016-11-16 | 茵肽锌科技公司 | 用于稳定的胶束的嵌段共聚物 |
| CA2869748C (en) | 2012-04-12 | 2017-10-24 | Yale University | Vehicles for controlled delivery of different pharmaceutical agents |
| WO2013154766A1 (en) | 2012-04-13 | 2013-10-17 | New York University | Microrna control of ldl receptor pathway |
| WO2013155513A1 (en) | 2012-04-13 | 2013-10-17 | President And Fellows Of Harvard College | Devices and methods for in vitro aerosol delivery |
| JP2015515530A (ja) | 2012-04-18 | 2015-05-28 | アローヘッド リサーチ コーポレイション | インビボ核酸送達のためのポリ(アクリラート)ポリマー |
| AU2013249548A1 (en) | 2012-04-19 | 2014-11-06 | Sirna Therapeutics, Inc. | Novel diester and triester based low molecular weight, biodegradable cationic lipids for oligonucleotide delivery |
| US10278927B2 (en) | 2012-04-23 | 2019-05-07 | Massachusetts Institute Of Technology | Stable layer-by-layer coated particles |
| SG11201406931XA (en) | 2012-04-25 | 2014-11-27 | Regulus Therapeutics Inc | Microrna compounds and methods for modulating mir-21 activity |
| AU2013256130B2 (en) | 2012-05-03 | 2017-12-21 | Alcon Inc. | Pharmaceutical nanoparticles showing improved mucosal transport |
| CA2872519C (en) | 2012-05-04 | 2017-09-05 | The Johns Hopkins University | Lipid-based drug carriers for rapid penetration through mucus linings |
| US20150087671A1 (en) | 2012-05-16 | 2015-03-26 | Micell Technologies, Inc. | Low burst sustained release lipophilic and biologic agent compositions |
| US9399672B2 (en) | 2012-05-17 | 2016-07-26 | The United States Of America, As Represented By The Secretary Department Of Health And Human Services | Hepatitis C virus neutralizing antibody |
| WO2013173693A1 (en) | 2012-05-18 | 2013-11-21 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Nanoparticles with enhanced entry into cancer cells |
| WO2013177421A2 (en) | 2012-05-23 | 2013-11-28 | The Ohio State University | Lipid-coated albumin nanoparticle compositions and methods of making and method of using the same |
| EP2854857B1 (en) | 2012-05-25 | 2018-11-28 | CureVac AG | Reversible immobilization and/or controlled release of nucleic acid containing nanoparticles by (biodegradable) polymer coatings |
| ES2811798T3 (es) | 2012-06-06 | 2021-03-15 | Loma Vista Medical Inc | Dispositivos médicos inflables |
| WO2013182683A1 (en) | 2012-06-08 | 2013-12-12 | Ethris Gmbh | Pulmonary delivery of messenger rna |
| DK2858974T3 (en) | 2012-06-08 | 2018-12-03 | Nitto Denko Corp | LIPIDS FOR THERAPEUTIC MEDICINE DELIVERY FORMULATIONS |
| EP3884949A1 (en) | 2012-06-08 | 2021-09-29 | Translate Bio, Inc. | Pulmonary delivery of mrna to non-lung target cells |
| CA2877051C (en) | 2012-06-20 | 2021-09-21 | Frank Gu | Mucoadhesive nanoparticle delivery system |
| US20150218252A1 (en) | 2012-06-20 | 2015-08-06 | President And Fellows Of Harvard College | Self-assembling peptides, peptide nanostructures and uses thereof |
| US9803010B2 (en) | 2012-06-27 | 2017-10-31 | Merck Sharp & Dohme Corp. | Crystalline anti-human IL-23p19 antibodies |
| US9956291B2 (en) | 2012-07-10 | 2018-05-01 | Shaker A. Mousa | Nanoformulation and methods of use of thyroid receptor beta1 agonists for liver targeting |
| WO2014014890A1 (en) | 2012-07-16 | 2014-01-23 | Nanoderm Sciences, Inc. | Targeted therapeutic nanoparticles |
| EP2687252A1 (en) | 2012-07-17 | 2014-01-22 | Sanofi-Aventis Deutschland GmbH | Drug delivery device |
| EP2687251A1 (en) | 2012-07-17 | 2014-01-22 | Sanofi-Aventis Deutschland GmbH | Drug delivery device |
| CN112587658A (zh) | 2012-07-18 | 2021-04-02 | 博笛生物科技有限公司 | 癌症的靶向免疫治疗 |
| WO2014015334A1 (en) | 2012-07-20 | 2014-01-23 | Brown University | System and methods for nanostructure protected delivery of treatment agent and selective release thereof |
| JP6596336B2 (ja) | 2012-07-24 | 2019-10-23 | プレジデント アンド フェローズ オブ ハーバード カレッジ | 核酸ナノ構造の自己集合 |
| WO2014015422A1 (en) | 2012-07-27 | 2014-01-30 | Ontario Institute For Cancer Research | Cellulose-based nanoparticles for drug delivery |
| GB201213624D0 (en) | 2012-07-27 | 2012-09-12 | Univ Ulster The | Method and system for production of conjugated nanoparticles |
| US9931418B2 (en) | 2012-08-07 | 2018-04-03 | Northeastern University | Compositions for the delivery of RNA and drugs into cells |
| WO2014024193A1 (en) | 2012-08-07 | 2014-02-13 | Prodel Pharma Ltd. | Compositions and methods for rapid transmucosal delivery of pharmaceutical ingredients |
| EP2882465B1 (en) | 2012-08-08 | 2019-05-08 | Nanyang Technological University | Methods of manufacturing hydrogel microparticles having living cells, and compositions for manufacturing a scaffold for tissue engineering |
| JP2015533522A (ja) | 2012-08-08 | 2015-11-26 | プレサージュ バイオサイエンシズ,インコーポレイテッド | 薬物送達のための押出し方法およびデバイス |
| JP2015525799A (ja) | 2012-08-10 | 2015-09-07 | ユニバーシティ・オブ・ノース・テキサス・ヘルス・サイエンス・センターUniversity of North Texas Health Science Center | ターゲティングポリアミノ酸および脂肪酸のコンジュゲートを含む薬物送達ビークル |
| WO2014027006A1 (en) | 2012-08-13 | 2014-02-20 | Edko Pazarlama Tanitim Ticaret Limited Sirketi | Bioadhesive formulations for use in drug delivery |
| EP2882706A1 (en) | 2012-08-13 | 2015-06-17 | Massachusetts Institute of Technology | Amine-containing lipidoids and uses thereof |
| WO2014028209A1 (en) | 2012-08-14 | 2014-02-20 | The Trustees Of The University Of Pennsylvania | Stabilizing shear-thinning hydrogels |
| CA2881605A1 (en) | 2012-08-14 | 2014-02-20 | Aaron FROESE | Internal structured self assembling liposomes |
| EP2885414B1 (en) | 2012-08-15 | 2020-09-23 | The University of Chicago | Exosome-based therapeutics against neurodegenerative disorders |
| WO2014039185A1 (en) | 2012-09-05 | 2014-03-13 | Creighton University | Polymeric nanoparticles in a thermosensitive gel for coital-independent vaginal prophylaxis of hiv |
| US8703197B2 (en) | 2012-09-13 | 2014-04-22 | International Business Machines Corporation | Branched polyamines for delivery of biologically active materials |
| PT2895156T (pt) | 2012-09-17 | 2019-06-28 | Pfizer | Processo para a preparação de nanopartículas terapêuticas |
| WO2014047649A1 (en) | 2012-09-24 | 2014-03-27 | The Regents Of The University Of California | Methods for arranging and packing nucleic acids for unusual resistance to nucleases and targeted delivery for gene therapy |
| CA2925687A1 (en) | 2012-09-27 | 2014-04-03 | The University Of North Carolina At Chapel Hill | Lipid coated nanoparticles containing agents having low aqueous and lipid solubilities and methods thereof |
| WO2014053879A1 (en) | 2012-10-04 | 2014-04-10 | Centre National De La Recherche Scientifique | Cell penetrating peptides for intracellular delivery of molecules |
| US20140100178A1 (en) | 2012-10-04 | 2014-04-10 | Aslam Ansari | Composition and methods for site-specific drug delivery to treat malaria and other liver diseases |
| WO2014054026A1 (en) | 2012-10-04 | 2014-04-10 | University Of The Witwatersrand, Johannesburg | Liposomal drug delivery system |
| EP2716655A1 (en) | 2012-10-04 | 2014-04-09 | Institut Pasteur | Neutralizing antibodies directed against Hepatitis C virus ectodomain glycoprotein E2 |
| WO2014053881A1 (en) | 2012-10-04 | 2014-04-10 | Centre National De La Recherche Scientifique | Cell penetrating peptides for intracellular delivery of molecules |
| WO2014053880A1 (en) | 2012-10-04 | 2014-04-10 | Centre National De La Recherche Scientifique | Cell penetrating peptides for intracellular delivery of molecules |
| WO2014053882A1 (en) | 2012-10-04 | 2014-04-10 | Centre National De La Recherche Scientifique | Cell penetrating peptides for intracellular delivery of molecules |
| WO2014064534A2 (en) | 2012-10-05 | 2014-05-01 | Chrontech Pharma Ab | Injection needle, device, immunogenic compositions and method of use |
| EP2716689A1 (en) | 2012-10-05 | 2014-04-09 | National University of Ireland, Galway | Polymer comprising a plurality of branches having at least one disulfide group and/or at least one vinyl group |
| US9931410B2 (en) | 2012-10-09 | 2018-04-03 | The Brigham And Women's Hospital, Inc. | Nanoparticles for targeted delivery of multiple therapeutic agents and methods of use |
| US20140106260A1 (en) | 2012-10-11 | 2014-04-17 | The Trustees Of The University Of Pennsylvania | Core-shell nanoparticulate compositions and methods |
| KR20150070318A (ko) | 2012-10-16 | 2015-06-24 | 엔도사이트, 인코포레이티드 | 비천연 아미노산을 함유하는 약물 전달 컨쥬게이트 및 사용 방법 |
| LT2908912T (lt) | 2012-10-18 | 2020-09-25 | The Rockefeller University | Plačiai neutralizuojantys anti-živ antikūnai |
| EP2908864B1 (en) | 2012-10-22 | 2019-12-11 | Sabag-Rfa Ltd. | Phosphate compounds for delivering therapeutic agents into living cells and cells nuclei |
| US20140315795A1 (en) | 2012-10-26 | 2014-10-23 | Nlife Therapeutics, S.L. | Compositions and Methods for Selective Delivery of Oligonucleotide Molecules to Cell Types |
| WO2014066912A1 (en) | 2012-10-26 | 2014-05-01 | Vanderbilt University | Polymeric nanoparticles |
| US20150272900A1 (en) | 2012-10-26 | 2015-10-01 | The Johns Hopkins University | Layer-By-Layer Approach to Co-Deliver DNA and siRNA via AuNPs: A Potential Platform for Modifying Release Kinetics |
| WO2014067551A1 (en) | 2012-10-29 | 2014-05-08 | Technische Universität Dortmund | T7 rna polymerase variants and methods of using the same |
| KR20230154283A (ko) | 2012-11-01 | 2023-11-07 | 팩터 바이오사이언스 인크. | 세포에서 단백질을 발현시키는 방법들과 생성물들 |
| WO2014071072A2 (en) | 2012-11-02 | 2014-05-08 | Pungente Michael D | Novel cationic carotenoid-based lipids for cellular nucleic acid uptake |
| EP2914723B1 (en) | 2012-11-05 | 2018-06-13 | Fondazione Centro San Raffaele | Novel targets in multiple myeloma and other disorders |
| US9975916B2 (en) | 2012-11-06 | 2018-05-22 | President And Fellows Of Harvard College | Compositions and methods relating to complex nucleic acid nanostructures |
| AU2013341646B2 (en) | 2012-11-06 | 2017-08-31 | Rochal Technologies, Llc | Delivery of biologically-active agents using volatile, hydrophobic solvents |
| EP2916873B1 (en) | 2012-11-07 | 2017-07-26 | Council of Scientific & Industrial Research | Nanocomplex containing amphipathic peptide useful for efficient transfection of biomolecules |
| EP2916874B1 (en) | 2012-11-07 | 2018-08-29 | Council of Scientific and Industrial Research | Nanocomplex containing cationic peptide for biomolecule delivery |
| JP6487328B2 (ja) | 2012-11-08 | 2019-03-20 | アルブミディクス リミティド | アルブミン変異体 |
| CN110893188A (zh) | 2012-11-08 | 2020-03-20 | 克莱尔塞德生物医学股份有限公司 | 用于在人类受试者中治疗眼部疾病的方法和装置 |
| EP3489258A1 (en) | 2012-11-08 | 2019-05-29 | Eleven Biotherapeutics, Inc. | Il-6 antagonists and uses thereof |
| TW201428101A (zh) | 2012-11-08 | 2014-07-16 | Inviragen Inc | 登革熱病毒血清型4型之建構物的組成物、方法及用途 |
| US9200119B2 (en) | 2012-11-09 | 2015-12-01 | Momentive Performance Materials Inc. | Silicon-containing zwitterionic linear copolymer composition |
| ES2676470T3 (es) | 2012-11-09 | 2018-07-19 | Biontech Rna Pharmaceuticals Gmbh | Método para la expresión de ARN en células |
| WO2014072468A1 (en) | 2012-11-09 | 2014-05-15 | Velin-Pharma A/S | Compositions for pulmonary delivery |
| WO2014071963A1 (en) | 2012-11-09 | 2014-05-15 | Biontech Ag | Method for cellular rna expression |
| KR20150083121A (ko) | 2012-11-12 | 2015-07-16 | 레드우드 바이오사이언스 인코포레이티드 | 화합물, 및 컨쥬게이트의 제조방법 |
| GB201220354D0 (en) | 2012-11-12 | 2012-12-26 | Medpharm Ltd | Dermal compositions |
| US9833502B2 (en) | 2012-11-12 | 2017-12-05 | Genvec, Inc. | Malaria antigens and methods of use |
| WO2014078399A1 (en) | 2012-11-13 | 2014-05-22 | Baylor College Of Medicine | Multi-arm biodegradable polymers for nucleic acid delivery |
| US9310374B2 (en) | 2012-11-16 | 2016-04-12 | Redwood Bioscience, Inc. | Hydrazinyl-indole compounds and methods for producing a conjugate |
| WO2014078636A1 (en) | 2012-11-16 | 2014-05-22 | President And Fellows Of Harvard College | Nucleic acid hydrogel self-assembly |
| EP2732825B1 (en) | 2012-11-19 | 2015-07-01 | Invivogen | Conjugates of a TLR7 and/or TLR8 agonist and a TLR2 agonist |
| CN104853747B (zh) | 2012-11-19 | 2020-06-19 | 理工研究与开发基金公司 | 用于体内递送的脂质体 |
| WO2014081849A1 (en) | 2012-11-20 | 2014-05-30 | Phasebio Pharmaceuticals, Inc. | Formulations of active agents for sustained release |
| WO2014081300A1 (en) | 2012-11-22 | 2014-05-30 | Tagworks Pharmaceuticals B.V. | Channel protein activatable liposomes |
| WO2014081299A1 (en) | 2012-11-22 | 2014-05-30 | Tagworks Pharmaceuticals B.V. | Activatable liposomes |
| EP4245744A3 (en) | 2012-11-22 | 2024-05-01 | Tagworks Pharmaceuticals B.V. | Chemically cleavable group |
| RS63237B1 (sr) | 2012-11-26 | 2022-06-30 | Modernatx Inc | Terminalno modifikovana rnk |
| WO2014152211A1 (en) | 2013-03-14 | 2014-09-25 | Moderna Therapeutics, Inc. | Formulation and delivery of modified nucleoside, nucleotide, and nucleic acid compositions |
| US8980864B2 (en) | 2013-03-15 | 2015-03-17 | Moderna Therapeutics, Inc. | Compositions and methods of altering cholesterol levels |
| RS63050B1 (sr) | 2014-04-23 | 2022-04-29 | Modernatx Inc | Vakcine nukleinske kiseline |
-
2012
- 2012-10-03 KR KR1020197023887A patent/KR20190099538A/ko not_active Application Discontinuation
- 2012-10-03 KR KR1020147011467A patent/KR102014061B1/ko active IP Right Review Request
- 2012-10-03 EP EP19216461.4A patent/EP3682905B1/en active Active
- 2012-10-03 SG SG11201401196WA patent/SG11201401196WA/en unknown
- 2012-10-03 BR BR112014007852-1A patent/BR112014007852B1/pt active IP Right Grant
- 2012-10-03 EP EP21210754.4A patent/EP4015005A1/en active Pending
- 2012-10-03 CN CN201280059453.0A patent/CN103974724B/zh active Active
- 2012-10-03 EP EP12838676.0A patent/EP2763701B1/en active Active
- 2012-10-03 PT PT192164614T patent/PT3682905T/pt unknown
- 2012-10-03 US US13/644,072 patent/US9428535B2/en active Active
- 2012-10-03 RS RS20220208A patent/RS62993B1/sr unknown
- 2012-10-03 EP EP18213451.0A patent/EP3492109B1/en not_active Revoked
- 2012-10-03 PL PL19216461T patent/PL3682905T3/pl unknown
- 2012-10-03 RU RU2014117701A patent/RU2648950C2/ru active
- 2012-10-03 AU AU2012318752A patent/AU2012318752B2/en active Active
- 2012-10-03 HU HUE19216461A patent/HUE057725T2/hu unknown
- 2012-10-03 JP JP2014534647A patent/JP6113737B2/ja active Active
- 2012-10-03 CA CA2850624A patent/CA2850624A1/en active Pending
- 2012-10-03 ES ES19216461T patent/ES2911677T3/es active Active
- 2012-10-03 CN CN201910822228.1A patent/CN110511939A/zh active Pending
- 2012-10-03 HR HRP20220250TT patent/HRP20220250T1/hr unknown
- 2012-10-03 SG SG10201602654SA patent/SG10201602654SA/en unknown
- 2012-10-03 LT LTEP19216461.4T patent/LT3682905T/lt unknown
- 2012-10-03 WO PCT/US2012/058519 patent/WO2013052523A1/en active Application Filing
- 2012-10-03 DK DK19216461.4T patent/DK3682905T3/da active
- 2012-10-03 RU RU2018104839A patent/RU2707251C2/ru active
- 2012-10-03 MX MX2014003979A patent/MX354267B/es active IP Right Grant
- 2012-10-03 SI SI201231984T patent/SI3682905T1/sl unknown
- 2012-10-03 DE DE19216461.4T patent/DE19216461T1/de active Pending
-
2013
- 2013-01-17 US US13/743,518 patent/US20130123481A1/en not_active Abandoned
-
2014
- 2014-03-30 IL IL231808A patent/IL231808B/en active IP Right Grant
-
2015
- 2015-02-06 HK HK15101342.6A patent/HK1200730A1/xx unknown
-
2016
- 2016-01-04 US US14/987,231 patent/US20170056528A1/en not_active Abandoned
-
2017
- 2017-03-15 JP JP2017049969A patent/JP6388977B2/ja active Active
- 2017-08-10 AU AU2017213503A patent/AU2017213503B2/en active Active
-
2018
- 2018-08-15 JP JP2018152801A patent/JP6574032B2/ja active Active
- 2018-10-29 IL IL262667A patent/IL262667B/en active IP Right Grant
-
2019
- 2019-08-14 JP JP2019148703A patent/JP7019639B2/ja active Active
- 2019-08-23 AU AU2019219843A patent/AU2019219843A1/en not_active Abandoned
-
2020
- 2020-09-25 US US17/032,657 patent/US20210308283A1/en not_active Abandoned
-
2021
- 2021-03-10 AU AU2021201508A patent/AU2021201508A1/en not_active Abandoned
-
2022
- 2022-02-02 JP JP2022014572A patent/JP2022060269A/ja active Pending
- 2022-02-28 CY CY20221100168T patent/CY1125029T1/el unknown
-
2023
- 2023-01-11 AU AU2023200127A patent/AU2023200127A1/en not_active Abandoned
-
2024
- 2024-02-09 JP JP2024018741A patent/JP2024036694A/ja active Pending
Non-Patent Citations (1)
| Title |
|---|
| Molecularr Therapy, 16(11), 1833-1840 (2008. 11. 1.) * |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11878991B2 (en) | 2015-09-21 | 2024-01-23 | Trilink Biotechnologies, Llc | Compositions and methods for synthesizing 5′-Capped RNAs |
| US12103944B2 (en) | 2015-09-21 | 2024-10-01 | Trilink Biotechnologies, Llc | Compositions and methods for synthesizing 5′-capped RNAs |
| KR20180131577A (ko) * | 2016-03-31 | 2018-12-10 | 에트리스 게엠베하 | 신규의 최소 utr 서열 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6574032B2 (ja) | 修飾型のヌクレオシド、ヌクレオチドおよび核酸、ならびにそれらの使用方法 | |
| US20240165267A1 (en) | Modified nucleic acid molecules and uses thereof | |
| JP2017500034A (ja) | 修飾核酸分子及びその使用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| J204 | Request for invalidation trial [patent] |