KR20140048877A - 자가면역 질환의 치료를 위한 조성물 및 방법 - Google Patents
자가면역 질환의 치료를 위한 조성물 및 방법 Download PDFInfo
- Publication number
- KR20140048877A KR20140048877A KR1020137031178A KR20137031178A KR20140048877A KR 20140048877 A KR20140048877 A KR 20140048877A KR 1020137031178 A KR1020137031178 A KR 1020137031178A KR 20137031178 A KR20137031178 A KR 20137031178A KR 20140048877 A KR20140048877 A KR 20140048877A
- Authority
- KR
- South Korea
- Prior art keywords
- interferon
- antibody
- patient
- ism
- lupus
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/249—Interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/57—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone
- A61K31/573—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone substituted in position 21, e.g. cortisone, dexamethasone, prednisone or aldosterone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6854—Immunoglobulins
- G01N33/686—Anti-idiotype
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Epidemiology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Analytical Chemistry (AREA)
- Biophysics (AREA)
- Biomedical Technology (AREA)
- Urology & Nephrology (AREA)
- Biotechnology (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Physics & Mathematics (AREA)
- Pathology (AREA)
- Mycology (AREA)
- Endocrinology (AREA)
- Heart & Thoracic Surgery (AREA)
- Rheumatology (AREA)
- Neurology (AREA)
- Cardiology (AREA)
- Orthopedic Medicine & Surgery (AREA)
Abstract
본 발명은 다양한 자가면역 질환 (예컨대, 전신 홍반성 루푸스)를 인터페론 억제제 (예컨대, 항-인터페론-알파 모노클로날 항체)로 치료하기 위한 방법 및 조성물을 제공한다. 보다 구체적으로, 본 발명은 인터페론 시그너쳐 측정값 (인터페론 반응 유전자 측정 값), 특정 항-dsDNA 항체 역가 또는 ENA- (건강한 사람의 수준보다 낮은 추출가능한 핵 항원의 수준)에 의해 이러한 환자의 치료를 진단, 모니터링 및 조정하는 방법을 제공한다. 또한, 본 발명은 이러한 진단과 연관된 제조품을 제공한다.
Description
관련 특허 출원에 대한 상호 참조
본 출원은 2011년 4월 26일에 출원된 미국 가출원 번호 61/479,314 및 2011년 12월 30일에 출원된 61/582,179를 우선권 주장하며, 이들은 그 전문이 본원에 참고로 도입된다.
발명의 분야
본 발명은 다양한 자가면역 질환 (예를 들어, 루푸스)를 인터페론 억제제 (예를 들어, 항-유형 I 인터페론 항체)로 치료하기 위한 방법 및 조성물을 포함한다.
자가면역 질환, 예컨대 전신 홍반성 루푸스 (SLE), 중증 근무력증 (MG) 및 특발성 혈소판감소성 자반증 (ITP)은 다른 것들 중에서도 인간에서 임상적으로 중요한 질환으로 남아있다. 명칭이 의미하는 바와 같이, 자가면역 질환은 신체 자체의 면역계를 파괴한다. 병리학적 메카니즘은 자가면역 질환의 개별 유형들 사이에서 상이하지만, 한 일반적인 메카니즘은 환자의 혈청에 존재하는 특정 항체 (본원에서 자가-반응성 항체 또는 자가항체로 지칭됨)의 자기-핵 또는 세포 항원에 대한 결합을 포함한다.
루푸스는 결합 조직을 공격하는 항체가 관여하는 자가면역 질환이다. 이 질환은 거의 1백만 명의 미국인, 주로 20-40세 사이의 여성이 걸리는 것으로 추정된다. 루푸스의 주요 형태는 전신성인 것 (전신 홍반성 루푸스; SLE)이다. SLE는 항핵 항체, 순환 면역 복합체, 및 보체계의 활성화의 생성과 연관된다. SLE는 20 내지 60세 사이의 여성 700명 중 약 1명의 발병률을 갖는다. SLE는 임의의 기관계에 영향을 미칠 수 있고, 중증 조직 손상을 유발할 수 있다. 상이한 특이성의 다수의 자가항체가 SLE에 존재한다. SLE 환자는 종종 항-DNA, 항-Ro, 항-La, 항-Sm, 항-RNP, 및 항-혈소판 특이성을 갖고, 질환의 임상적 특징, 예컨대 사구체신염, 관절염, 장막염, 신생아에서 완전 심장 차단, 및 혈액 이상을 개시할 수 있는 자가항체를 생산한다. 이들 자가항체는 또한 아마도 중추신경계 장애와 관련될 것이다. 아버클(Arbuckle) 등은 SLE의 임상적 발병 전에 자가항체의 발생을 기재한다 (문헌 [Arbuckle et al. N. Engl. J. Med. 349(16): 1526-1533 (2003)]).
치료되지 않은 루푸스는 이것이 피부 및 관절의 공격으로부터 폐, 심장 및 신장 (신질환이 주요 관심사임)을 포함하는 내부 기관으로 진행하기 때문에 치명적일 수 있다. 루푸스는 주로 질환 징후가 거의 또는 전혀 없는 개재 기간이 있는 일련의 플레어-업(flare-up)으로 나타난다.
소변 중 단백뇨의 양에 의해 측정된 신장 손상은 SLE에서 병원성과 연관된 손상의 가장 급성인 영역 중 하나이고, 질환의 사망률 및 이환율의 적어도 50%를 차지한다.
이중-가닥 천연 DNA와 면역반응성인 항체의 존재는 SLE를 위한 진단 마커로 사용된다.
현재, SLE로 진단된 환자를 위해 실제로 치유력이 있는 치료법이 존재하지 않는다. 실시 관점으로부터, 의사는 일반적으로 다수의 강력한 면역억제 약물, 예컨대 고용량 코르티코스테로이드, 예를 들어 프레드니손 또는 아자티오프린 또는 시클로포스파미드 (플레어-업 기간 동안 주어짐)를 사용하지만, 또한 빈번한 플레어-업을 경험한 이들을 위해 영구적으로 주어질 수 있다. 증상을 감소시키고 삶을 연장하는 효과적인 치료에도 불구하고, 다수의 이러한 약물은 치료되는 환자에게 잠재적으로 유해한 부작용을 나타낸다. 또한 이들 면역억제 약물은 단지 자기-반응성 항-DNA 항체가 아니라, 모든 항체를 생산하는 사람의 능력을 방해한다. 면역억제제는 또한 다른 잠재적 병원체에 대한 신체의 방어를 약화시켜, 환자를 감염 및 다른 잠재적으로 치명적인 질환, 예컨대 암에 매우 걸리기 쉽게 한다. 이들 경우 중 일부에서, 질환의 지속적인 낮은 수준의 징후와 함께 현재 치료 양식의 부작용이 심각한 손상 및 조기 사망의 원인이 될 수 있다. 최근 치료 요법은 시클로포스파미드, 메토트렉세이트, 항말라리아제, 호르몬 치료 (예를 들어, DHEA) 및 항호르몬 요법 (예를 들어, 항프로락틴제 브로모크립틴)을 포함한다.
항체를 포함하는 SLE의 치료 방법이 또한 기재되어 있다. 디아몬드(Diamond) 등 (미국 특허 번호 4,690,905)의 방법은 항-DNA 항체에 대한 모노클로날 항체 (여기서 항-이디오타입 항체로 언급되는 모노클로날 항체)를 생성하는 것, 및 이어서 이들 항-이디오타입 항체를 사용하여 환자의 계로부터 병원성 항-DNA 항체를 제거하는 것으로 이루어진다. 그러나, 치료를 위한 다량의 혈액의 제거는 위험하고 복잡한 과정일 수 있다. 미국 특허 번호 6,726,909는 환자에게 투여되는 항체 조성물이 정제된 항-DNA 항-이디오타입 항체를 포함하고, 투여는 주사 또는 다른 동등한 투여 방식을 요구하는 SLE의 치료를 개시하고 있다.
고용량 정맥내 면역 글로불린 (IVIG) 주입은 또한 특정 자가면역 질환을 치료하는데 사용되어 왔다. 현재까지, IVIG로의 SLE의 치료는 루푸스 신염의 해결 (문헌 [Akashi et al., J. Rheumatology 17:375-379 (1990)]), 및 몇몇 경우에, 단백뇨 및 신장 손상의 악화 (문헌 [Jordan et al., Clin. Immunol. Immunopathol. 53: S164-169 (1989)])를 둘 다 포함하는 복합적 결과를 제공하였다.
루푸스를 앓는 사람, 예컨대 루푸스 신염에 대한 임상적 증거를 나타내는 SLE을 앓는 사람 및 루푸스 신염을 갖는 사람은 결국에는 신부전을 초래하는 조직 손상의 개선을 도울 비용-효율적이고 안전한 치료를 필요로 하고, 만성 혈액투석 및/또는 신장 이식에 대한 필요는 이러한 상태에 의해 유발된다. 환자는 전형적으로 코르티코스테로이드, 비-스테로이드성 항염증 약물, 및 항체-기재 약물을 포함하는, 이들에게 이용가능한 여러 치료 옵션을 갖는다. 상이한 치료 요법으로부터 이익을 얻을 가능성이 있는 환자를 확인하는데 유용한 진단 방법은 이들 환자의 임상적 관리에 매우 유익할 것이다.
따라서, 각각의 환자를 위한 최적의 진단 및/또는 치료 요법을 위한 객관적이고 재현가능한 방법이 요구되고 있다. 본 발명은 이들 및 다른 필요를 충족시킨다.
본 발명은 적어도 부분적으로 유형 I 인터페론 항체로 전신 홍반성 루푸스 (SLE) 환자를 치료하는 방법을 포함한다. 한 측면에서, 본 발명은 인터페론 억제제 (예를 들어, 항-유형 I 인터페론 항체)로 다양한 자가면역 질환 (예를 들어, 루푸스)을 치료하기 위한 방법 및 조성물을 포함한다. 본원에 개시된 임의의 실시양태에서서, 인터페론 억제제는 항-유형 I 인터페론 항체이다.
따라서, 본 발명의 한 실시양태는 루푸스로 진단된 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 포함하며, 여기서 환자는 ENA-의 ENA 상태를 갖는 것인, 환자에서 루푸스를 치료하는 방법을 제공한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 β에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 ω에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 및 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 ω에 특이적으로 결합하지만 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 λ 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 λ에 특이적으로 결합하지만 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 β에 특이적으로 결합하지만 인터페론 ω 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 λ에 특이적으로 결합하지만 인터페론 β 또는 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 론탈리주맙이다. 일부 실시양태에서, 환자는 ENA-인 것으로 결정된다. 일부 실시양태에서, 환자의 ENA 상태는 환자로부터의 샘플에서 자가항체를 검출함으로써 결정되며, 여기서 자가항체는 항-Ro, 항-La, 항-SM, 항-RNP 및 그의 조합으로부터 선택된다. 일부 실시양태에서, 샘플은 전혈, 혈액-유래 세포, 혈장, 혈청 및 그의 조합으로부터 선택된다. 일부 실시양태에서, 항체는 정맥내로 투여된다. 일부 실시양태에서, 항체는 피하로 투여된다. 일부 실시양태에서, 루푸스는 전신 홍반성 루푸스이다. 일부 실시양태에서, 환자는 건강한 개체의 인터페론 시그너쳐 측정값 (ISM) 이상의 기준선 ISM을 갖는다. 일부 실시양태에서, 환자는 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는다. 일부 실시양태에서, ISM은 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, ISM은 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, 방법은 대상체에게 제2 의약을 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 제2 의약은 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로부터 선택된다.
본 발명의 추가 실시양태는 루푸스 환자의 ENA 상태를 결정하는 것을 포함하며, 여기서 ENA-의 ENA 상태를 갖는 것으로 결정된 환자가 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 수 있는 환자로 확인되는 것인, 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 수 있는 루푸스 환자를 확인하는 방법을 제공한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 β에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 ω에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω 및 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 ω에 특이적으로 결합하지만, 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론, 인터페론 λ, 및 인터페론 ω에 특이적으로 결합하지만, 인터페론 β에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 및 인터페론 λ에 특이적으로 결합하지만, 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 β에 특이적으로 결합하지만 인터페론 ω 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 λ에 특이적으로 결합하지만 인터페론 β 또는 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 론탈리주맙이다. 일부 실시양태에서, 환자의 ENA 상태는 환자로부터의 샘플에서 자가항체를 검출함으로써 결정되며, 여기서 자가항체는 항-Ro, 항-La, 항-SM, 항-RNP 및 그의 조합으로부터 선택된다. 일부 실시양태에서, 샘플은 전혈, 혈액-유래 세포, 혈장, 혈청 및 그의 조합으로부터 선택된다. 일부 실시양태에서, 방법은 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 항체는 정맥내로 투여된다. 일부 실시양태에서, 항체는 피하로 투여된다. 일부 실시양태에서, 항체는 적어도 24주 동안 투여된다. 일부 실시양태에서, 환자는 건강한 개체의 인터페론 시그너쳐 측정값 (ISM) 이상의 기준선 ISM을 갖는다. 일부 실시양태에서, 환자는 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는다. 일부 실시양태에서, ISM은 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, ISM은 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, 방법은 대상체에게 제2 의약을 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 제2 의약은 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로부터 선택된다.
본 발명의 또 다른 실시양태는 루푸스 환자의 ENA 상태를 결정하는 것을 포함하며, 여기서 ENA-의 ENA 상태를 갖는 것으로 결정된 환자는 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 증가된 가능성을 갖는 것인, 루푸스의 치료를 위한 치료 효능을 최적화하는 방법을 제공한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 β에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 ω에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 및 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 및 인터페론 ω에 특이적으로 결합하지만, 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 λ, 및 인터페론 ω에 특이적으로 결합하지만, 인터페론 β에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 및 인터페론 λ에 특이적으로 결합하지만, 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 β에 특이적으로 결합하지만 인터페론 ω 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 λ에 특이적으로 결합하지만 인터페론 β 또는 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 론탈리주맙이다. 일부 실시양태에서, 환자의 ENA 상태는 환자로부터의 샘플에서 자가항체를 검출함으로써 결정되며, 여기서 자가항체는 항-Ro, 항-La, 항-SM, 항-RNP 및 그의 조합으로부터 선택된다. 일부 실시양태에서, 샘플은 전혈, 혈액-유래 세포, 혈장, 혈청 및 그의 조합으로부터 선택된다. 일부 실시양태에서, 방법은 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 항체는 정맥내로 투여된다. 일부 실시양태에서, 항체는 피하로 투여된다. 일부 실시양태에서, 항체는 적어도 24주 동안 투여된다. 일부 실시양태에서, 환자는 건강한 개체의 인터페론 시그너쳐 측정값 (ISM) 이상의 기준선 ISM을 갖는다. 일부 실시양태에서, 환자는 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는다. 일부 실시양태에서, ISM은 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, ISM은 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, 방법은 대상체에게 제2 의약을 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 제2 의약은 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로부터 선택된다.
본 발명의 또 다른 실시양태는 루푸스 환자의 ENA 상태를 결정하는 것을 포함하며, 여기서 ENA-의 ENA 상태를 갖는 것으로 결정된 환자가 인터페론 유형 I 항체로의 치료에 반응할 가능성이 있는 환자로 확인되는 것인, 인터페론 유형 I 항체로의 치료에 대한 루푸스 환자의 반응성을 예측하는 방법을 제공한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 β에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 ω에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 및 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 및 인터페론 ω에 특이적으로 결합하지만; 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 λ, 및 인터페론 ω에 특이적으로 결합하지만, 인터페론 β에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 및 인터페론 λ에 특이적으로 결합하지만, 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 β에 특이적으로 결합하지만 인터페론 ω 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 λ에 특이적으로 결합하지만 인터페론 β 또는 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 론탈리주맙이다. 일부 실시양태에서, 환자의 ENA 상태는 환자로부터의 샘플에서 자가항체를 검출함으로써 결정되며, 여기서 자가항체는 항-Ro, 항-La, 항-SM, 항-RNP 및 그의 조합으로부터 선택된다. 일부 실시양태에서, 샘플은 전혈, 혈액-유래 세포, 혈장, 혈청 및 그의 조합으로부터 선택된다. 일부 실시양태에서, 방법은 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 항체는 정맥내로 투여된다. 일부 실시양태에서, 항체는 피하로 투여된다. 일부 실시양태에서, 항체는 적어도 24주 동안 투여된다. 일부 실시양태에서, 환자는 건강한 개체의 인터페론 시그너쳐 측정값 (ISM) 이상의 기준선 ISM을 갖는다. 일부 실시양태에서, 환자는 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는다. 일부 실시양태에서, ISM은 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, ISM은 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, 방법은 대상체에게 제2 의약을 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 제2 의약은 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로부터 선택된다.
본 발명의 또 다른 실시양태는 루푸스 환자의 ENA 상태를 결정하는 것을 포함하며, 여기서 ENA-의 ENA 상태를 갖는 것으로 결정된 환자가 인터페론 유형 I 항체로의 치료에 반응할 가능성이 있는 환자로 확인되는 것인, 루푸스 환자가 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 가능성을 결정하는 방법을 제공한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 β에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 ω에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 및 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 및 인터페론 ω에 특이적으로 결합하지만 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 λ, 및 인터페론 ω에 특이적으로 결합하지만, 인터페론 β에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 및 인터페론 λ에 특이적으로 결합하지만 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 β에 특이적으로 결합하지만 인터페론 ω 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 λ에 특이적으로 결합하지만 인터페론 β 또는 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 론탈리주맙이다. 일부 실시양태에서, 환자의 ENA 상태는 환자로부터의 샘플에서 자가항체를 검출함으로써 결정되며, 여기서 자가항체는 항-Ro, 항-La, 항-SM, 항-RNP 및 그의 조합으로부터 선택된다. 일부 실시양태에서, 샘플은 전혈, 혈액-유래 세포, 혈장, 혈청 및 그의 조합으로부터 선택된다. 일부 실시양태에서, 방법은 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 항체는 정맥내로 투여된다. 일부 실시양태에서, 항체는 피하로 투여된다. 일부 실시양태에서, 항체는 적어도 24주 동안 투여된다. 일부 실시양태에서, 환자는 건강한 개체의 인터페론 시그너쳐 측정값 (ISM) 이상의 기준선 ISM을 갖는다. 일부 실시양태에서, 환자는 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는다. 일부 실시양태에서, ISM은 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, ISM은 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, 방법은 대상체에게 제2 의약을 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 제2 의약은 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로부터 선택된다.
따라서, 본 발명의 한 실시양태는 자가면역 질환 (예를 들어, 루푸스)으로 진단된 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 포함하며, 여기서 환자는 낮은 (예를 들어, ≤ 200 IU) 항-dsDNA 항체 상태를 갖는 것인, 환자에서 자가면역 질환 (예를 들어, 루푸스)을 치료하는 방법을 제공한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 β에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 ω에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω 및 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 ω에 특이적으로 결합하지만 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 λ 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 λ에 특이적으로 결합하지만 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 β에 특이적으로 결합하지만 인터페론 ω 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 λ에 특이적으로 결합하지만 인터페론 β 또는 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 론탈리주맙이다. 일부 실시양태에서, 환자의 항-dsDNA 항체 상태는 면역검정에 의해 환자로부터의 샘플에서 자가항체를 검출함으로써 결정된다. 일부 실시양태에서, 샘플은 전혈, 혈액-유래 세포, 혈장, 혈청 및 그의 조합으로부터 선택된다. 일부 실시양태에서, 항체는 정맥내로 투여된다. 일부 실시양태에서, 루푸스는 전신 홍반성 루푸스이다. 일부 실시양태에서, 환자는 건강한 개체의 인터페론 시그너쳐 측정값 (ISM) 이상의 기준선 ISM을 갖는다. 일부 실시양태에서, 환자는 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는다. 일부 실시양태에서, ISM은 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, ISM은 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, 인터페론 억제제로의 치료 전에, 환자의 IRG 상태가 결정된다. 한 실시양태에서, 확장된 ISM, 확장된 ISM-A, 24-유전자 ISM 또는 3-유전자 ISM의 IRG 중 어느 하나 또는 그의 조합 또는 모두가 IRG 상태를 평가하는데 사용된다. 일부 실시양태에서, 인터페론 억제제로의 치료 전에, 환자는 항-dsDNA 항체 낮음 상태 및 ISMlo인 IRG 상태를 갖는다. 일부 실시양태에서, 인터페론 억제제로의 치료 전에, 환자는 항-dsDNA 항체 낮음 상태 및 ISMhi인 IRG 상태를 갖는다. 일부 실시양태에서, 방법은 대상체에게 제2 의약을 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 제2 의약은 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로부터 선택된다.
본 발명의 추가 실시양태는, 자가면역 질환 환자 (예를 들어, 루푸스 환자)의 항-dsDNA 항체 상태를 결정하는 것을 포함하며, 여기서 낮은 (예를 들어, ≤ 200 IU) 항-dsDNA 항체 상태를 갖는 것으로 결정된 환자가 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 수 있는 환자로 확인되는 것인, 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 수 있는 자가면역 질환 환자 (예를 들어, 루푸스 환자)를 확인하는 방법을 제공한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 β에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 ω에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω 및 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 ω에 특이적으로 결합하지만 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 λ 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 λ에 특이적으로 결합하지만 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 β에 특이적으로 결합하지만 인터페론 ω 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 λ에 특이적으로 결합하지만 인터페론 β 또는 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 론탈리주맙이다. 일부 실시양태에서, 환자의 항-dsDNA 항체 상태는 면역검정에 의해 환자로부터의 샘플에서 자가항체를 검출함으로써 결정된다. 일부 실시양태에서, 샘플은 전혈, 혈액-유래 세포, 혈장, 혈청 및 그의 조합으로부터 선택된다. 일부 실시양태에서, 방법은 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 항체는 정맥내로 투여된다. 일부 실시양태에서, 항체는 피하로 투여된다. 일부 실시양태에서, 항체는 적어도 24주 동안 투여된다. 일부 실시양태에서, 환자는 건강한 개체의 인터페론 시그너쳐 측정값 (ISM) 이상의 기준선 ISM을 갖는다. 일부 실시양태에서, 환자는 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는다. 일부 실시양태에서, ISM은 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, ISM은 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, 인터페론 억제제로의 치료 전에, 환자의 IRG 상태가 결정된다. 한 실시양태에서, 확장된 ISM, 확장된 ISM-A, 24-유전자 ISM 또는 3-유전자 ISM의 IRG 중 어느 하나 또는 그의 조합 또는 모두가 IRG 상태를 평가하는데 사용된다. 일부 실시양태에서, 인터페론 억제제로의 치료 전에, 환자는 항-dsDNA 항체 낮음 상태 및 ISMlo인 IRG 상태를 갖는 것으로 결정된다. 일부 실시양태에서, 인터페론 억제제로의 치료 전에, 환자는 항-dsDNA 항체 낮음 상태 및 ISMhi인 IRG 상태를 갖는 것으로 결정된다. 일부 실시양태에서, 방법은 대상체에게 제2 의약을 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 제2 의약은 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로부터 선택된다.
본 발명의 또 다른 실시양태는 루푸스 환자의 항-dsDNA 항체 상태를 결정하는 것을 포함하며, 여기서 낮은 (예를 들어, ≤ 200 IU) 항-dsDNA 항체 상태를 갖는 것으로 결정된 환자는 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 증가된 가능성을 갖는 것인, 루푸스의 치료를 위한 치료 효능을 최적화하는 방법을 제공한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 β에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 ω에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω 및 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 ω에 특이적으로 결합하지만 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 λ 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 λ에 특이적으로 결합하지만 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 β에 특이적으로 결합하지만 인터페론 ω 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 λ에 특이적으로 결합하지만 인터페론 β 또는 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 론탈리주맙이다. 일부 실시양태에서, 환자의 항-dsDNA 항체 상태는 면역검정에 의해 결정된다. 일부 실시양태에서, 샘플은 전혈, 혈액-유래 세포, 혈장, 혈청 및 그의 조합으로부터 선택된다. 일부 실시양태에서, 방법은 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 항체는 정맥내로 투여된다. 일부 실시양태에서, 항체는 피하로 투여된다. 일부 실시양태에서, 항체는 적어도 24주 동안 투여된다. 일부 실시양태에서, 환자는 건강한 개체의 인터페론 시그너쳐 측정값 (ISM) 이상의 기준선 ISM을 갖는다. 일부 실시양태에서, 환자는 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는다. 일부 실시양태에서, ISM은 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, 인터페론 억제제로의 치료 전에, 환자의 IRG 상태가 결정된다. 한 실시양태에서, 확장된 ISM, 확장된 ISM-A, 24-유전자 ISM 또는 3-유전자 ISM의 IRG 중 어느 하나 또는 그의 조합 또는 모두가 IRG 상태를 평가하는데 사용된다. 일부 실시양태에서, 인터페론 억제제로의 치료 전에, 환자는 항-dsDNA 항체 낮음 상태 및 ISMlo인 IRG 상태를 갖는 것으로 결정된다. 일부 실시양태에서, 인터페론 억제제로의 치료 전에, 환자는 항-dsDNA 항체 낮음 상태 및 ISMhi인 IRG 상태를 갖는 것으로 결정된다. 일부 실시양태에서, ISM은 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, 방법은 대상체에게 제2 의약을 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 제2 의약은 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로부터 선택된다.
본 발명의 또 다른 실시양태는 자가면역 환자 (예를 들어, 루푸스 환자)의 항-dsDNA 항체 상태를 결정하는 것을 포함하며, 여기서 낮은 (예를 들어, ≤ 200 IU) 항-dsDNA 항체 상태를 갖는 것으로 결정된 환자가 인터페론 유형 I 항체로의 치료에 반응할 가능성이 있는 환자로 확인되는 것인, 인터페론 유형 I 항체로의 치료에 대한 자가면역 환자 (예를 들어, 루푸스 환자)의 반응성을 예측하는 방법을 제공한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 β에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 ω에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω 및 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 ω에 특이적으로 결합하지만 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 λ 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 λ에 특이적으로 결합지만; 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 β에 특이적으로 결합하지만 인터페론 ω 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 λ에 특이적으로 결합하지만 인터페론 β 또는 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 론탈리주맙이다. 일부 실시양태에서, 환자의 항-dsDNA 항체 상태는 면역검정에 의해 결정된다. 일부 실시양태에서, 샘플은 전혈, 혈액-유래 세포, 혈장, 혈청 및 그의 조합으로부터 선택된다. 일부 실시양태에서, 방법은 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 항체는 정맥내로 투여된다. 일부 실시양태에서, 항체는 피하로 투여된다. 일부 실시양태에서, 항체는 적어도 24주 동안 투여된다. 일부 실시양태에서, 환자는 건강한 개체의 인터페론 시그너쳐 측정값 (ISM) 이상의 기준선 ISM을 갖는다. 일부 실시양태에서, 환자는 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는다. 일부 실시양태에서, ISM은 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, ISM은 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, 인터페론 억제제로의 치료 전에, 환자의 IRG 상태가 결정된다. 한 실시양태에서, 확장된 ISM, 확장된 ISM-A, 24-유전자 ISM 또는 3-유전자 ISM의 IRG 중 어느 하나 또는 그의 조합 또는 모두가 IRG 상태를 평가하는데 사용된다. 일부 실시양태에서, 인터페론 억제제로의 치료 전에, 환자는 항-dsDNA 항체 낮음 상태 및 ISMlo인 IRG 상태를 갖는 것으로 결정되며, 이 상태는 어느 자가면역 환자가 인터페론 억제제에 반응할 가능성이 보다 높은지를 예측하는데 추가로 유용할 수 있다. 일부 실시양태에서, 인터페론 억제제로의 치료 전에, 환자는 항-dsDNA 항체 낮음 상태 및 ISMhi인 IRG 상태를 갖는 것으로 결정되며, 이 상태는 어느 자가면역 환자가 인터페론 억제제에 반응할 가능성이 보다 높은지를 확인하는데 추가로 유용할 수 있다. 일부 실시양태에서, 방법은 대상체에게 제2 의약을 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 제2 의약은 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로부터 선택된다.
본 발명의 또 다른 실시양태는 루푸스 환자의 항-dsDNA 항체 상태를 결정하는 것을 포함하며, 여기서 낮은 (예를 들어, ≤ 200 IU) 항-dsDNA 항체 상태를 갖는 것으로 결정된 환자가 인터페론 유형 I 항체로의 치료에 반응할 가능성이 있는 환자로 확인되는 것인, 루푸스 환자가 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 가능성을 결정하는 방법을 제공한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 β에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 ω에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω 및 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 ω에 특이적으로 결합하지만 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 λ 및 인터페론 ω에 특이적으로 결합하지만; 인터페론 β에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 λ에 특이적으로 결합하지만 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 β에 특이적으로 결합하지만 인터페론 ω 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 λ에 특이적으로 결합하지만 인터페론 β 또는 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 론탈리주맙이다. 일부 실시양태에서, 환자의 항-dsDNA 항체 상태는 면역검정에 의해 결정된다. 일부 실시양태에서, 샘플은 전혈, 혈액-유래 세포, 혈장, 혈청 및 그의 조합으로부터 선택된다. 일부 실시양태에서, 방법은 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 항체는 정맥내로 투여된다. 일부 실시양태에서, 항체는 피하로 투여된다. 일부 실시양태에서, 항체는 적어도 24주 동안 투여된다. 일부 실시양태에서, 환자는 건강한 개체의 인터페론 시그너쳐 측정값 (ISM) 이상의 기준선 ISM을 갖는다. 일부 실시양태에서, 환자는 ISMlo의 IRG 상태를 갖는다. 일부 실시양태에서, 환자는 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는다. 일부 실시양태에서, ISM은 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, ISM은 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, 인터페론 억제제로의 치료 전에, 환자의 IRG 상태가 결정된다. 한 실시양태에서, 확장된 ISM, 확장된 ISM-A, 24-유전자 ISM 또는 3-유전자 ISM의 IRG 중 어느 하나 또는 그의 조합 또는 모두가 IRG 상태를 평가하는데 사용된다. 일부 실시양태에서, 인터페론 억제제로의 치료 전에, 환자는 항-dsDNA 항체 낮음 상태 및 ISMlo인 IRG 상태를 갖는 것으로 결정되며, 이 상태는 어느 자가면역 환자가 인터페론 억제제로의 치료로부터 이익을 얻을 가능성이 보다 높은지를 예측하는데 추가로 유용할 수 있다. 일부 실시양태에서, 인터페론 억제제로의 치료 전에, 환자는 항-dsDNA 항체 낮음 상태 및 ISMhi인 IRG 상태를 갖는 것으로 결정되며, 이 상태는 어느 자가면역 환자가 인터페론 억제제로의 치료로부터 이익을 얻을 가능성이 보다 높은지를 확인하는데 추가로 유용할 수 있다. 일부 실시양태에서, 방법은 대상체에게 제2 의약을 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 제2 의약은 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로부터 선택된다.
본 발명의 또 다른 실시양태는 자가면역 질환 (예를 들어, 루푸스)으로 진단된 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 포함하며, 여기서 환자는 건강한 개체의 인터페론 시그너쳐 측정값 (ISM) 이상의 기준선 ISM을 갖는 것인, 환자에서 자가면역 질환 (예를 들어, 루푸스)을 치료하는 방법을 제공한다. 본 발명의 또 다른 실시양태는 자가면역 질환 (예를 들어, 루푸스)으로 진단된 환자에게 유효량의 인터페론 억제제를 투여하는 것을 포함하며, 여기서 자가면역 환자의 IRG 상태는 건강한 사람의 IRG 상태와 동일하거나 또는 ISMlo인 것으로 결정되는 것인, 환자에서 자가면역 질환 (예를 들어, 루푸스)을 치료하는 방법을 제공한다. 일부 실시양태에서, 환자는 ISMlo의 IRG 상태를 갖는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 β에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 ω에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω 및 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 ω에 특이적으로 결합하지만 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 λ 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 λ에 특이적으로 결합하지만 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 β에 특이적으로 결합하지만 인터페론 ω 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 λ에 특이적으로 결합하지만 인터페론 β 또는 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 론탈리주맙이다. 일부 실시양태에서, 항체는 정맥내로 투여된다. 일부 실시양태에서, 항체는 피하로 투여된다. 일부 실시양태에서, 항체는 적어도 24주 동안 투여된다. 일부 실시양태에서, ISM은 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, ISM은 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 한 실시양태에서, 확장된 ISM, 확장된 ISM-A, 24-유전자 ISM 또는 3-유전자 ISM의 IRG 중 어느 하나 또는 그의 조합 또는 모두가 IRG 상태를 평가하는데 사용된다. 일부 실시양태에서, 방법은 대상체에게 제2 의약을 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 제2 의약은 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로부터 선택된다.
본 발명의 또 다른 실시양태는 루푸스로 진단된 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 포함하며, 여기서 환자는 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는 것인, 환자에서 루푸스를 치료하는 방법을 제공한다. 또 다른 실시양태에서, 본 발명은 자가면역 질환으로 진단된 환자에게 유효량의 인터페론 억제제를 투여하는 것을 포함하며, 여기서 IRG 중 어느 하나, 그의 조합 또는 모두가 인터페론 억제제로 환자를 치료한 후에 약역학 마커로 모니터링되는 것인, 환자에서 자가면역 질환을 치료하는 방법을 제공한다. 한 실시양태에서, IRG는 CMPK2, EPSTI1, HERC5, IFI27, IFI44, IFIT1, MX1, OAS1, OAS2 및 OAS3이다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 β에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 ω에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω 및 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 ω에 특이적으로 결합하지만 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 λ 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 λ에 특이적으로 결합하지만 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 β에 특이적으로 결합하지만 인터페론 ω 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 λ에 특이적으로 결합하지만 인터페론 β 또는 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 론탈리주맙이다. 일부 실시양태에서, 항체는 정맥내로 투여된다. 일부 실시양태에서, 항체는 피하로 투여된다. 일부 실시양태에서, 항체는 적어도 24주 동안 투여된다. 일부 실시양태에서, ISM은 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, ISM은 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, 방법은 대상체에게 제2 의약을 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 제2 의약은 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로부터 선택된다.
본 발명의 다른 추가 실시양태는 자가면역 환자 (예를 들어, 루푸스 환자)의 기준선 ISM 상태를 결정하는 것을 포함하며, 여기서 건강한 개체의 ISM 이상의 기준선 ISM을 갖는 환자가 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 수 있는 환자로 확인되는 것인, 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 수 있는 자가면역 환자 (예를 들어, 루푸스 환자)를 확인하는 방법을 제공한다. 본 발명의 또 다른 실시양태는 자가면역 환자 (예를 들어, 루푸스 환자)의 IRG 상태를 결정하는 것을 포함하며, 여기서 건강한 개체의 IRG 상태와 동일하거나 또는 ISM 낮음의 IRG 상태를 갖는 환자가 인터페론 억제제로의 치료로부터 이익을 얻을 가능성이 있는 환자로 확인되는 것인, 인터페론 억제제로의 치료로부터 이익을 얻을 수 있는 자가면역 환자 (예를 들어, 루푸스 환자)를 확인하는 방법을 제공한다. 일부 실시양태에서, 환자는 ISMlo의 IRG 상태를 갖는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 β에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 ω에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω 및 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 ω에 특이적으로 결합하지만 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 λ 및 인터페론 ω에 특이적으로 결합하지만; 인터페론 β에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 λ에 특이적으로 결합하지만 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 β에 특이적으로 결합하지만 인터페론 ω 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 λ에 특이적으로 결합하지만 인터페론 β 또는 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 론탈리주맙이다. 일부 실시양태에서, 방법은 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 항체는 정맥내로 투여된다. 일부 실시양태에서, 항체는 피하로 투여된다. 일부 실시양태에서, 항체는 적어도 24주 동안 투여된다. 일부 실시양태에서, 환자는 건강한 개체의 인터페론 시그너쳐 측정값 (ISM) 이상의 기준선 ISM을 갖는다. 일부 실시양태에서, 환자는 ISMlo의 IRG 상태를 갖는다. 일부 실시양태에서, 환자는 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는다. 일부 실시양태에서, ISM은 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, ISM은 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 한 실시양태에서, 확장된 ISM, 확장된 ISM-A, 24-유전자 ISM 또는 3-유전자 ISM의 IRG 중 어느 하나 또는 그의 조합 또는 모두가 IRG 상태를 평가하는데 사용된다. 일부 실시양태에서, 방법은 대상체에게 제2 의약을 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 제2 의약은 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로부터 선택된다.
본 발명의 또 다른 실시양태는 환자의 기준선 ISM 상태를 결정하는 것을 포함하며, 여기서 건강한 개체의 ISM 이상의 기준선 ISM을 갖는 환자는 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 증가된 가능성을 갖는 것인, 루푸스의 치료를 위한 치료 효능을 최적화하는 방법을 제공한다. 일부 실시양태에서, 환자는 ISMlo의 IRG 상태를 갖는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 β에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 ω에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω 및 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 ω에 특이적으로 결합하지만 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 λ 및 인터페론 ω에 특이적으로 결합하지만; 인터페론 β에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 λ에 특이적으로 결합하지만; 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 β에 특이적으로 결합하지만 인터페론 ω 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 λ에 특이적으로 결합하지만 인터페론 β 또는 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 방법은 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 항체는 정맥내로 투여된다. 일부 실시양태에서, 항체는 피하로 투여된다. 일부 실시양태에서, 항체는 적어도 24주 동안 투여된다. 일부 실시양태에서, 환자는 건강한 개체의 인터페론 시그너쳐 측정값 (ISM) 이상의 기준선 ISM을 갖는다. 일부 실시양태에서, 환자는 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는다. 일부 실시양태에서, ISM은 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, ISM은 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, 방법은 대상체에게 제2 의약을 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 제2 의약은 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로부터 선택된다.
본 발명의 다른 추가 실시양태는 루푸스 환자의 ISM 상태를 결정하는 것을 포함하며, 여기서 건강한 개체의 ISM 이상의 ISM을 갖는 환자가 인터페론 유형 I 항체로의 치료에 반응할 가능성이 있는 환자로 확인되는 것인, 인터페론 유형 I 항체로의 치료에 대한 루푸스 환자의 반응성을 예측하는 방법을 제공한다. 또 다른 실시양태에서, 본 발명은 자가면역 환자의 IRG 상태를 결정하는 것을 포함하며, 여기서 건강한 개체의 IRG 상태와 동일하거나 또는 ISM 낮음의 IRG 상태를 갖는 환자가 인터페론 억제제로의 치료에 반응할 가능성이 있는 환자로 확인되는 것인, 인터페론 억제제로의 치료에 대한 자가면역 환자의 반응성을 예측하는 방법을 제공한다. 일부 실시양태에서, 환자는 ISMlo의 IRG 상태를 갖는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 β에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 ω에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω 및 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 ω에 특이적으로 결합하지만; 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 λ 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β; 및 인터페론 λ에 특이적으로 결합하지만; 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 β에 특이적으로 결합하지만 인터페론 ω 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 λ에 특이적으로 결합하지만 인터페론 β 또는 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 론탈리주맙이다. 일부 실시양태에서, 방법은 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 항체는 정맥내로 투여된다. 일부 실시양태에서, 항체는 피하로 투여된다. 일부 실시양태에서, 항체는 적어도 24주 동안 투여된다. 일부 실시양태에서, 환자는 건강한 개체의 인터페론 시그너쳐 측정값 (ISM) 이상의 기준선 ISM을 갖는다. 일부 실시양태에서, 환자는 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는다. 일부 실시양태에서, ISM은 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, ISM은 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 한 실시양태에서, 확장된 ISM, 확장된 ISM-A, 24-유전자 ISM 또는 3-유전자 ISM의 IRG 중 어느 하나 또는 그의 조합 또는 모두가 IRG 상태를 평가하는데 사용된다. 일부 실시양태에서, 방법은 대상체에게 제2 의약을 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 제2 의약은 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로부터 선택된다.
본 발명의 또 다른 실시양태는 루푸스 환자의 ISM 상태를 결정하는 것을 포함하며, 여기서 건강한 개체의 ISM 이상의 ISM을 갖는 환자가 인터페론 유형 I 항체로의 치료에 반응할 가능성이 있는 환자로 확인되는 것인, 루푸스 환자가 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 가능성을 결정하는 방법을 제공한다. 본 발명의 또 다른 실시양태는 자가면역 환자의 IRG 상태를 결정하는 것을 포함하며, 여기서 건강한 개체의 IRG 상태와 동일하거나 또는 ISM 낮음의 IRG 상태를 갖는 환자가 인터페론 억제제로의 치료로부터의 이익에 반응할 가능성이 있는 환자로 확인되는 것인, 자가면역 환자가 인터페론 억제제로의 치료로부터 이익을 얻을 가능성을 결정하는 방법을 제공한다. 일부 실시양태에서, 환자는 ISMlo의 IRG 상태를 갖는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 β에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 ω에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω 및 인터페론 λ에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 ω에 특이적으로 결합하지만; 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 λ 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β 및 인터페론 λ에 특이적으로 결합하지만 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 β에 특이적으로 결합하지만 인터페론 ω 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 ω에 특이적으로 결합하지만 인터페론 β 또는 인터페론 λ에는 결합하지 않는다. 일부 실시양태에서, 항체는 인터페론 α 및 인터페론 λ에 특이적으로 결합하지만 인터페론 β 또는 인터페론 ω에는 결합하지 않는다. 일부 실시양태에서, 항체는 론탈리주맙이다. 일부 실시양태에서, 방법은 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 항체는 정맥내로 투여된다. 일부 실시양태에서, 항체는 피하로 투여된다. 일부 실시양태에서, 항체는 적어도 24주 동안 투여된다. 일부 실시양태에서, 환자는 건강한 개체의 인터페론 시그너쳐 측정값 (ISM) 이상의 기준선 ISM을 갖는다. 일부 실시양태에서, 환자는 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는다. 일부 실시양태에서, ISM은 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, ISM은 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정된다. 한 실시양태에서, 확장된 ISM, 확장된 ISM-A, 24-유전자 ISM 또는 3-유전자 ISM의 IRG 중 어느 하나 또는 그의 조합 또는 모두가 IRG 상태를 평가하는데 사용된다. 일부 실시양태에서, 방법은 대상체에게 제2 의약을 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 제2 의약은 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로부터 선택된다.
본 발명의 방법의 한 실시양태에서, IRG 상태는 하기 IRG (예를 들어, 확장된 ISM) 중 하나, 그의 조합 또는 모두의 발현 수준을 측정함으로써 결정된다: CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1, PARP9, IFI27, SIGLEC1, DNAPTP6, USP18, IFI6, HSXIAPAF1 및 LAMP3. 본 발명의 방법의 또 다른 실시양태에서, IRG 상태는 하기 IRG (예를 들어, 확장된 ISM-A) 중 하나, 그의 조합 또는 모두의 발현 수준을 측정함으로써 결정된다: IFI27, CIG5, IFI44L, IFI44, OAS1, OAS3, IFIT1, G1P2, HERC5, MX1, EPSTI1, IFIT3 및 IFI6. 본 발명의 방법의 또 다른 실시양태에서, IRG 상태는 하기 IRG (예를 들어, 24-유전자 ISM) 중 하나, 그의 조합 또는 모두의 발현 수준을 측정함으로써 결정된다: CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP 및 ZBP1. 본 발명의 방법의 또 다른 실시양태에서, IRG 상태는 하기 IRG (예를 들어, 3-유전자 ISM) 중 하나, 그의 조합 또는 모두의 발현 수준을 측정함으로써 결정된다: EPSTI1, HERC5 및 TYK1 (CMPK2). 본원에 기재된 방법의 일부 실시양태에서, IRG 상태는 qPCR을 이용하여 측정된다. 추가의 한 실시양태에서, qPCR은 로슈 코바스(Roche Cobas)® 시스템 상에서 수행된다.
또 다른 측면에서, 본 발명은 환자에게 유효량의 인터페론 억제제를 투여하는 것을 포함하며, 여기서 환자는 자가면역 질환으로 진단되고 ISMlo인 것으로 결정되거나 또는 ISMlo인 것에 기초한 치료를 위해 선택된 것인, 환자에서 자가면역 질환을 치료하는 방법을 제공한다. 일부 실시양태에서, ISMlo는 RT-PCR에 의해 환자로부터의 샘플에서 하나 이상의 인터페론 반응 유전자 (IRG)의 mRNA 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, ISMlo는 qPCR에 의해 환자로부터의 샘플에서 하나 이상의 인터페론 반응 유전자 (IRG)의 mRNA 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, qPCR은 로슈 코바스® 시스템 상에서 수행된다. 일부 실시양태에서, 샘플은 혈액 샘플이다. 일부 실시양태에서, IRG 상태는 하기 IRG (예를 들어, 확장된 ISM) 중 하나, 그의 조합 또는 모두의 mRNA 발현 수준을 측정함으로써 결정된다: CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1, PARP9, IFI27, SIGLEC1, DNAPTP6, USP18, IFI6, HSXIAPAF1 및 LAMP3. 일부 실시양태에서, IRG 상태는 하기 IRG (예를 들어, 24-유전자 ISM) 중 하나, 그의 조합 또는 모두의 mRNA 발현 수준을 측정함으로써 결정된다: CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP 및 ZBP1. 일부 실시양태에서, EPSTI1, HERC5 및/또는 TYK1 (CMPK2)의 mRNA 발현 수준이 결정된다. 일부 실시양태에서, IRG의 mRNA 발현 수준은 하우스키핑 유전자의 mRNA 발현 수준에 대해 정규화된다. 일부 실시양태에서, EPSTI1, HERC5 및/또는 TYK1 (CMPK2)의 mRNA 발현 수준은 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화된다.
또 다른 측면에서, 본 발명은 환자에게 유효량의 인터페론 억제제를 투여하는 것을 포함하며, 여기서 환자는 자가면역 질환으로 진단되고 면역검정에 의해 측정시에 200 IU 이하의 치료전 항-이중 가닥 DNA 항체 역가 (항-dsDNA)를 갖는 것으로 결정되거나 또는 면역검정에 의해 측정시에 200 IU 이하의 치료전 항-이중 가닥 DNA 항체 역가 (항-dsDNA)를 갖는 것에 기초한 치료에 대해 선택되는 것인, 환자에서 자가면역 질환을 치료하는 방법을 제공한다. 일부 실시양태에서, 면역검정은 ELISA이다. 일부 실시양태에서, 환자는 200 IU 이하의 항-dsDNA 역가를 갖고 ISMhi이다. 일부 실시양태에서, ISMhi는 RT-PCR에 의해 환자로부터의 샘플에서 하나 이상의 IRG의 mRNA 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, ISMhi는 qPCR에 의해 환자로부터의 샘플에서 하나 이상의 IRG의 mRNA 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, qPCR은 로슈 코바스® 시스템 상에서 수행된다. 일부 실시양태에서, 샘플은 혈액 샘플이다. 일부 실시양태에서, IRG 상태는 하기 IRG (예를 들어, 확장된 ISM) 중 하나, 그의 조합 또는 모두의 mRNA 발현 수준을 측정함으로써 결정된다: CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1, PARP9, IFI27, SIGLEC1, DNAPTP6, USP18, IFI6, HSXIAPAF1 및 LAMP3. 일부 실시양태에서, IRG 상태는 하기 IRG (예를 들어, 24-유전자 ISM) 중 하나, 그의 조합 또는 모두의 mRNA 발현 수준을 측정함으로써 결정된다: CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP 및 ZBP1. 일부 실시양태에서, EPSTI1, HERC5 및/또는 TYK1 (CMPK2)의 mRNA 발현 수준이 결정된다. 일부 실시양태에서, IRG의 mRNA 발현 수준은 하우스키핑 유전자의 mRNA 발현 수준에 대해 정규화된다. 일부 실시양태에서, EPSTI1, HERC5 및/또는 TYK1 (CMPK2)의 mRNA 발현 수준은 TFRC에 대해 정규화된다.
일부 실시양태에서, 자가면역 질환은 루푸스, 류마티스 관절염, 건선, 건선성 관절염, 인슐린-의존성 당뇨병 (IDDM), 다발성 경화증 (MS), 근염, 피부근염, 혈관염, 아테롬성동맥경화증, 강직성 척추염 및 쇼그렌 증후군으로 이루어진 군으로부터 선택된다. 일부 실시양태에서, 환자는 중등도 내지 중증 활성 루푸스 (예컨대, 중등도 내지 중증 활성 SLE)를 갖는다. 일부 실시양태에서, 환자는 루푸스 신염을 갖는다. 일부 실시양태에서, 환자는 클래스 III-V 루푸스 신염을 갖고 ISMlo이다. 일부 실시양태에서, 환자는 소아 루푸스를 갖는다.
일부 실시양태에서, 본원에 기재된 방법에서의 인터페론 억제제는 항-인터페론 유형 I 항체이다. 일부 실시양태에서, 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α에 특이적으로 결합한다. 일부 실시양태에서, 항체는 적어도 IFNα 하위유형 1, 2, 4, 5, 8, 10 및 21에 결합한다. 일부 실시양태에서, 항체는 아미노산 서열 RASQSVSTSSYSYMH (서열 1)를 포함하는 HVR-L1, 아미노산 서열 YASNLES (서열 2)를 포함하는 HVR-L2, 및 아미노산 서열 QHSWGIPRTF (서열 3)를 포함하는 HVR-L3을 포함하는 경쇄; 및/또는 아미노산 서열 GYTFTEYIIH (서열 4)를 포함하는 HVR-H1, 아미노산 서열 SINPDYDITNYNQRFKG (서열 5)를 포함하는 HVR-H2, 및 아미노산 서열 WISDFFDY (서열 6)를 포함하는 HVR-H3을 포함하는 중쇄를 포함한다. 일부 실시양태에서, 항체는 서열 7의 아미노산 서열에 대해 적어도 95% 서열 동일성의 중쇄 가변 영역 서열; 및/또는 서열 8의 아미노산 서열에 대해 적어도 95% 서열 동일성의 경쇄 가변 영역 서열을 포함한다. 일부 실시양태에서, 항체는 서열 7의 아미노산 서열을 포함하는 중쇄 가변 영역; 및/또는 서열 8의 아미노산 서열을 포함하는 경쇄 가변 영역을 포함한다. 일부 실시양태에서, 항체는 CAS 등록 번호 948570-30-7을 갖는 론탈리주맙이다. 일부 실시양태에서, 항체는 CAS 1006877-41-3에 개시된 바와 같은 아미노산 서열을 갖는다.
일부 실시양태에서, 항-인터페론 유형 I 항체는 정맥내로 또는 피하로 투여된다. 일부 실시양태에서, 항체는 100 내지 2000 mg의 균일 용량으로 투여된다. 일부 실시양태에서, 항체는 100-500 mg 매주, 200-1000 mg 격주, 또는 400-2000 mg 매월의 균일 용량으로 투여된다. 일부 실시양태에서, 항체는 150 mg 또는 300 mg 매주, 300 mg 또는 600 mg 격주, 또는 600 mg, 750 mg 또는 1200 mg 매월의 균일 용량으로 투여된다. 일부 실시양태에서, 항체는 150 mg 또는 300 mg 매주의 균일 용량으로 피하로 투여된다.
일부 실시양태에서, 항체의 투여는 (1) 루푸스 플레어의 수 및/또는 중증도의 감소, (2) 루푸스 플레어의 예방, (3) 루푸스 신염 플레어의 감소, (4) 루푸스 신염 플레어의 예방, (5) 루푸스 신염의 완화 유도, (6) 루푸스 신염 완화의 유지, (7) 소아 루푸스 플레어의 수 및/또는 중증도의 감소, (8) 소아 루푸스 플레어의 예방, (9) 소아 루푸스 신염 플레어의 감소, (10) 소아 루푸스 신염 플레어의 예방, (11) 소아 루푸스 신염의 완화 유도, 및 (12) 소아 루푸스 신염 완화의 유지 중 하나 이상에서 효과적이다. 일부 실시양태에서, 항체의 투여는 환자에서 항-dsDNA 항체 역가를 저하시키는데 효과적이다. 일부 실시양태에서, 항체의 투여는 환자에서 플레어(들)의 감소에 효과적이다. 일부 실시양태에서, 상기 플레어(들)는 중등도 또는 중증이다. 일부 실시양태에서, 항체의 투여는 환자에서 Selena 플레어 인덱스 (SFI) 스코어 또는 Selena 플레어 인덱스-개정판 (SFI-R) 스코어의 감소에 효과적이다. 일부 실시양태에서, 항체의 투여는 모든 치료전 BILAG A 및 B 도메인을 감소시키는데 효과적이다. 일부 실시양태에서, 환자는 항체의 투여 후에 새로운 BILAG A 기관 도메인 스코어를 갖지 않거나 또는 1 이하의 새로운 BILAG B 기관 도메인 스코어를 갖는다. 일부 실시양태에서, 항체의 투여는 SELENA-SLEDAI 스코어를 환자의 치료전 스코어로부터 적어도 4점 감소시키는데 효과적이다. 일부 실시양태에서, 항체의 투여 후에 환자에서 의사의 전반적 평가 (PGA)가 치료전 스코어로부터 0.3점 이하 증가한다. 일부 실시양태에서, 상기 환자는 하기 평가 도구: SRI, BILAG, SELENA-SLEDAI 또는 의사의 전반적 평가 (PGA) 중 어느 하나에 의해 측정시에 치료 전에 중등도 또는 중증 질환 활성을 갖는 기관계에서 질환 활성의 치료후 감소를 나타낸다. 일부 실시양태에서, 환자는 항체의 투여에 대해 SRI-4, SRI-5, SRI-6 또는 SRI-7 반응을 갖는다.
일부 실시양태에서, 본원에 기재된 방법은 환자에게 제2 의약을 투여하는 것을 추가로 포함한다. 일부 실시양태에서, 제2 의약은 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 면역억제, 항말라리아제, 스타틴 및 그의 조합으로 이루어진 군으로부터 선택된다. 일부 실시양태에서, 제2 의약은 루푸스에 대한 표준 진료이다.
일부 실시양태에서, 항체의 투여는 상기 항체의 상기 투여 전에 코르티코스테로이드를 투여한 환자에서 코르티코스테로이드 절약 (CS)을 발생시킨다. 일부 실시양태에서, 항체의 투여는 스테로이드를 사용하는 요법 및/또는 면역억제제 요법에 대한 필요의 감소를 발생시킨다. 일부 실시양태에서, 환자는 항체의 투여 후에 10 mg/일의 프레드니손 등량까지 그의 코르티코스테로이드 용량의 점감을 발생시킨다. 일부 실시양태에서, 항체의 투여는 항체 투여 약 24 내지 약 52주 후에 코르티코스테로이드 사용의 적어도 50% 감소를 발생시킨다. 일부 실시양태에서, 항체의 투여는 SELENA SLEDAI 스코어 및/또는 의사의 전반적 평가에 의해 측정시에 중등도 및/또는 중증 플레어의 발생률 감소; 중증 플레어까지 유의하게 지연된 시간; BILAG A (중증) 기관 플레어 또는 1 초과의 BILAG B (중등도) 기관 플레어 중 하나 이상을 발생시킨다.
또 다른 측면에서, 본 발명은 인터페론 억제제의 투여를 포함하는, 치료를 필요로 하는 ISMlo SLE 환자의 치료를 위한 치료 요법을 제공한다. 일부 실시양태에서, 인터페론 억제제는 항-IFNα 항체이다. 일부 실시양태에서, 항체는 100-2000 mg의 균일 용량으로 투여된다. 일부 실시양태에서, 항체는 100-500 mg 매주, 200-1000 mg 격주, 또는 400-2000 mg 매월의 균일 용량으로 투여된다. 일부 실시양태에서, 항체는 150 mg 또는 300 mg 매주, 300 mg 또는 600 mg 격주, 또는 600 mg, 750 mg 또는 1200 mg 매월의 균일 용량으로 투여된다. 일부 실시양태에서, 항체는 정맥내로 또는 피하로 투여된다. 일부 실시양태에서, 항체는 150 mg 또는 300 mg 매주의 균일 용량으로 피하로 투여된다. 일부 실시양태에서, 항체는 아미노산 서열 RASQSVSTSSYSYMH (서열 1)를 포함하는 HVR-L1, 아미노산 서열 YASNLES (서열 2)를 포함하는 HVR-L2, 및 아미노산 서열 QHSWGIPRTF (서열 3)를 포함하는 HVR-L3을 포함하는 경쇄; 및/또는 아미노산 서열 GYTFTEYIIH (서열 4)를 포함하는 HVR-H1, 아미노산 서열 SINPDYDITNYNQRFKG (서열 5)를 포함하는 HVR-H2, 및 아미노산 서열 WISDFFDY (서열 6)를 포함하는 HVR-H3을 포함하는 중쇄를 포함한다. 일부 실시양태에서, 항체는 서열 7의 아미노산 서열에 대해 적어도 95% 서열 동일성의 중쇄 가변 영역 서열; 및/또는 서열 8의 아미노산 서열에 대해 적어도 95% 서열 동일성의 경쇄 가변 영역 서열을 포함한다. 일부 실시양태에서, 항체는 서열 7의 아미노산 서열을 포함하는 중쇄 가변 영역; 및/또는 서열 8의 아미노산 서열을 포함하는 경쇄 가변 영역을 포함한다. 일부 실시양태에서, 항체는 CAS 등록 번호 948570-30-7을 갖는 론탈리주맙이다. 일부 실시양태에서, 항체는 CAS 1006877-41-3에 개시된 바와 같은 아미노산 서열을 포함한다.
또 다른 측면에서, 본 발명은 루푸스 환자로부터의 샘플에서 IRG 상태를 결정하는 것을 포함하며, 여기서 ISMlo인 환자가 인터페론 억제제 치료로부터 이익을 얻을 수 있는 환자로 확인되는 것인, 인터페론 억제제 치료로부터 이익을 얻을 수 있는 루푸스 환자를 확인하는 방법을 제공한다. 또 다른 측면에서, 본 발명은 루푸스 환자로부터의 샘플에서 IRG 상태를 결정하는 것을 포함하며, 여기서 ISMlo인 환자가 인터페론 억제제 치료에 대해 반응할 가능성이 있는 환자로 확인되는 것인, 인터페론 억제제 치료에 대한 루푸스 환자의 반응성을 예측하는 방법을 제공한다. 일부 실시양태에서, ISMlo은 RT-PCR에 의해 환자로부터의 샘플에서 하나 이상의 인터페론 반응 유전자 (IRG)의 mRNA 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, ISMlo은 qPCR에 의해 환자로부터의 샘플에서 하나 이상의 인터페론 반응 유전자 (IRG)의 mRNA 발현 수준을 측정함으로써 결정된다. 일부 실시양태에서, qPCR은 로슈 코바스® 시스템 상에서 수행된다. 일부 실시양태에서, 샘플은 혈액 샘플이다. 일부 실시양태에서, IRG 상태는 하기 IRG (예를 들어, 확장된 ISM) 중 하나, 그의 조합 또는 모두의 mRNA 발현 수준을 측정함으로써 결정된다: CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1, PARP9, IFI27, SIGLEC1, DNAPTP6, USP18, IFI6, HSXIAPAF1 및 LAMP3. 일부 실시양태에서, IRG 상태는 하기 IRG (예를 들어, 24-유전자 ISM) 중 하나, 그의 조합 또는 모두의 mRNA 발현 수준을 측정함으로써 결정된다: CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP 및 ZBP1. 일부 실시양태에서, EPSTI1, HERC5 및/또는 TYK1 (CMPK2)의 mRNA 발현 수준이 결정된다. 일부 실시양태에서, IRG의 mRNA 발현 수준은 하우스키핑 유전자의 mRNA 발현 수준에 대해 정규화된다. 일부 실시양태에서, EPSTI1, HERC5 및/또는 TYK1 (CMPK2)의 mRNA 발현 수준은 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화된다. 일부 실시양태에서, 이익은 하기 중 어느 하나에 의해 평가시에 질환 활성 스코어에서의 임의의 감소를 포함한다: BILAG, SELENA-SLEDAI, SRI, PGA, SFI 또는 SFI-R.
또 다른 측면에서, 본 발명은 루푸스 환자로부터의 샘플에서 항-dsDNA 항체 상태를 결정하는 것을 포함하며, 여기서 면역검정에 의해 측정시에 200 IU 이하의 항-dsDNA 항체 역가를 갖는 환자가 인터페론 억제제 치료로부터 이익을 얻을 수 있는 환자로 확인되는 것인, 인터페론 억제제 치료로부터 이익을 얻을 수 있는 루푸스 환자를 확인하는 방법을 제공한다. 또 다른 측면에서, 본 발명은 루푸스 환자로부터의 샘플에서 항-dsDNA 항체 상태를 결정하는 것을 포함하며, 여기서 면역검정에 의해 측정시에 200 IU 이하의 항-dsDNA 항체 역가를 갖는 환자가 인터페론 억제제 치료에 대해 반응할 가능성이 있는 환자로 확인되는 것인, 인터페론 억제제 치료에 대한 루푸스 환자의 반응성을 예측하는 방법을 제공한다. 일부 실시양태에서, 면역검정은 ELISA이다. 일부 실시양태에서, 이익은 하기 중 어느 하나에 의해 평가시에 질환 활성 스코어에서의 임의의 감소를 포함한다: BILAG, SELENA-SLEDAI, SRI, PGA, SFI 또는 SFI-R.
일부 실시양태에서, 인터페론 억제제는 항-인터페론 유형 I 항체이다. 항체는 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합한다. 일부 실시양태에서, 항체는 인터페론 α에 특이적으로 결합한다. 일부 실시양태에서, 항체는 적어도 IFNα 하위유형 1, 2, 4, 5, 8, 10 및 21에 결합한다. 일부 실시양태에서, 항체는 아미노산 서열 RASQSVSTSSYSYMH (서열 1)를 포함하는 HVR-L1, 아미노산 서열 YASNLES (서열 2)를 포함하는 HVR-L2, 및 아미노산 서열 QHSWGIPRTF (서열 3)를 포함하는 HVR-L3을 포함하는 경쇄; 및/또는 아미노산 서열 GYTFTEYIIH (서열 4)를 포함하는 HVR-H1, 아미노산 서열 SINPDYDITNYNQRFKG (서열 5)를 포함하는 HVR-H2, 및 아미노산 서열 WISDFFDY (서열 6)를 포함하는 HVR-H3을 포함하는 중쇄를 포함한다. 일부 실시양태에서, 항체는 서열 7의 아미노산 서열에 대해 적어도 95% 서열 동일성의 중쇄 가변 영역 서열; 및/또는 서열 8의 아미노산 서열에 대해 적어도 95% 서열 동일성의 경쇄 가변 영역 서열을 포함한다. 일부 실시양태에서, 항체는 서열 7의 아미노산 서열을 포함하는 중쇄 가변 영역; 및/또는 서열 8의 아미노산 서열을 포함하는 경쇄 가변 영역을 포함한다. 일부 실시양태에서, 항체는 CAS 등록 번호 948570-30-7을 갖는 론탈리주맙이다. 일부 실시양태에서, 항체는 CAS 1006877-41-3에 개시된 바와 같은 아미노산 서열을 포함한다.
또 다른 측면에서, 본 발명은 루푸스 환자의 IRG 상태를 결정하는 것을 포함하며, 여기서 IRG의 발현 수준의 유의한 증가는 환자가 이후 3 내지 5주 내에 플레어를 가질 가능성이 있음을 나타내는 것인, 루푸스 환자에서 플레어의 가능성을 예측하는 방법을 제공한다. 일부 실시양태에서, 환자의 IRG 상태는 기준선 및/또는 인터페론 억제제 (예컨대, 본원에 기재된 항-인터페론 유형 I 항체)의 투여 후에 모니터링되고, 투여 후에 환자의 샘플에서 동일한 IRG의 최저 수준에 비해 IRG 중 하나 이상의 발현 수준의 유의한 증가는 환자가 이후 3 내지 5주 내에 플레어를 가질 가능성이 있음을 나타낸다. 일부 실시양태에서, 증가는 적어도 약 50%, 적어도 약 75%, 적어도 약 100%, 또는 적어도 약 150%이다. 일부 실시양태에서, 상기 IRG는 EPSTI1, HERC5, TYK1 (CMPK2), IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된다. 일부 실시양태에서, 플레어는 SELENA-SLEDAI 플레어 인덱스 (SFI) 및/또는 SFI-개정판에 의해 결정된다. 일부 실시양태에서, 플레어는 SELENA-SLEDAI 플레어 인덱스 (SFI) 및/또는 SFI-개정판에 기초하여 경증, 중등도 또는 중증이다.
또 다른 측면에서, 본 발명은 환자에게 항-인터페론 α 항체의 균일 용량을 전달하며, 여기서 균일 용량은 항-인터페론 α 항체의 50 mg 내지 2000 mg의 범위인, 피하 투여 장치를 포함하는 제조품을 제공한다. 일부 실시양태에서, 균일 용량은 100-500 mg 매주, 200-1000 mg 격주, 또는 400-2000 mg 매월이다. 일부 실시양태에서, 균일 용량은 150 mg 또는 300 mg 매주, 300 mg 또는 600 mg 격주, 또는 600 mg, 750 mg 또는 1200 mg 매월이다. 일부 실시양태에서, 균일 용량은 150 mg 또는 300 mg 매주이다. 일부 실시양태에서, 장치에서 항체의 농도는 약 50 내지 250 mg/mL이다. 또 다른 측면에서, 본 발명은 항-인터페론 α 항체를 약 50 내지 250 mg/mL의 농도로 포함하는 제조품을 제공한다. 일부 실시양태에서, 항체는 아미노산 서열 RASQSVSTSSYSYMH (서열 1)를 포함하는 HVR-L1, 아미노산 서열 YASNLES (서열 2)를 포함하는 HVR-L2, 및 아미노산 서열 QHSWGIPRTF (서열 3)를 포함하는 HVR-L3을 포함하는 경쇄; 및/또는 아미노산 서열 GYTFTEYIIH (서열 4)를 포함하는 HVR-H1, 아미노산 서열 SINPDYDITNYNQRFKG (서열 5)를 포함하는 HVR-H2, 및 아미노산 서열 WISDFFDY (서열 6)를 포함하는 HVR-H3을 포함하는 중쇄를 포함한다. 일부 실시양태에서, 항체는 서열 7의 아미노산 서열에 대해 적어도 95% 서열 동일성의 중쇄 가변 영역 서열; 및/또는 서열 8의 아미노산 서열에 대해 적어도 95% 서열 동일성의 경쇄 가변 영역 서열을 포함한다. 일부 실시양태에서, 항체는 서열 7의 아미노산 서열을 포함하는 중쇄 가변 영역; 및/또는 서열 8의 아미노산 서열을 포함하는 경쇄 가변 영역을 포함한다. 일부 실시양태에서, 항체는 CAS 등록 번호 948570-30-7을 갖는 론탈리주맙이다. 일부 실시양태에서, 항체는 CAS 1006877-41-3에 개시된 바와 같은 아미노산 서열을 포함한다. 일부 실시양태에서, 피하 투여 장치는 예비-충전 시린지, 자동주사기 또는 대용량 주입 장치이다.
또 다른 측면에서, 본 발명은 생물학적 샘플로부터 하나 이상의 IRG의 유전자 발현을 검출하기 위한 생물-검정 모듈 및 유전자의 발현을 계산하고 유전자의 계산값을 컷오프 값에 대해 스코어링하여 진단을 제공하기 위한 프로세서 모듈을 포함하는 전산화 시스템을 포함하며, 여기서 컷오프 값은 (1) 건강한 사람 (또는 대조군)의 IRG의 발현 수준의 값의 1.5배 미만 또는 (2) 건강한 사람 (또는 대조군)에서의 IRG의 발현 수준의 중간 값에 비해 2 표준 편차 미만인 제조품을 제공한다. 일부 실시양태에서, 생물-검정 모듈은 코바스 z480 분석기이다.
또 다른 측면에서, 본 발명은 자가면역 환자로부터의 혈액 샘플을 수집하기 위한 바이알 및 자가면역 환자가 ISMlo인지 여부를 결정하기 위한 지침서를 포함하는, 인터페론 억제제 치료에 대한 이익을 받을 수 있는 자가면역 환자를 확인하기 위한 키트를 제공한다. 일부 실시양태에서, EPSTI1, HERC5, TYK1 (CMPK2), IFI27, IFI44, IFIT1, MX1, OAS1, OAS2 및 OAS3으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준은 자가면역 환자가 ISMlo인지 여부를 결정하는데 사용된다. 일부 실시양태에서, 자가면역 질환은 루푸스이다. 일부 실시양태에서, 인터페론 억제제는 항-인터페론 α 항체이다.
또 다른 측면에서, 본 발명은 약 50 내지 약 250 mg/mL의 양으로 항-인터페론 α 항체, 약 50 내지 약 200 mM의 양으로 아르기닌-HCl, 약 5 내지 약 100 mM의 양으로 히스티딘, 약 0.01% 내지 약 0.1%의 양으로 폴리소르베이트를 포함하며, pH 약 5.5 내지 약 7.0을 갖는 안정한 액체 조성물을 제공한다.
한 실시양태에서, ISM 낮음 스코어의 상부 경계를 결정하기 위한 컷오프는 건강한 사람 (또는 대조군)의 평균 역치 순환, 또는 Ct의 값의 약 1.5배 또는 건강한 사람 (또는 대조군)의 평균 값에 비해 2 표준 편차이다. 한 실시양태에서, 컷 오프 미만의 평균 IRG DCt 값을 갖는 자가면역 환자는 컷 오프 초과의 평균 DCt 값을 갖는 루푸스 환자보다 본 발명의 치료제 (예를 들어, 인터페론 억제제)에 반응할 가능성이 보다 높을 것이다. 본 발명의 한 측면에서, 이중 가닥 데옥시리보핵산 (dsDNA)에 특이적인 항체의 양은 아테나 멀티-라이트(AtheNa Multi-Lyte) ANA 테스트 시스템 및 아테나 멀티-라이트® ANA-II 플러스 테스트 시스템 키트 (인버네스 메디칼 인크.(Inverness Medical Inc., 뉴저지주 래리탄)에 의해 제작됨)를 이용하여 결정된다. 또 다른 측면에서, IRG 상태는 코바스 z480 분석기 (로슈 다이아그노스틱스(Roche Diagnostics))를 사용하는 RT-PCT를 이용함으로써 결정될 수 있다. 한 실시양태에서, ISM, 확장된 ISM, 확장된 ISM-A, 24-유전자 ISM 시그너쳐, 3-유전자 ISM 시그너쳐의 IRG가 IRG 상태를 결정하는데 사용된다.
본원에 기재된 다양한 실시양태의 특성 중 하나, 일부 또는 모두가 조합되어 본 발명의 다른 실시양태를 형성할 수 있다는 것이 이해된다. 본 발명의 이들 및 다른 측면은 당업자에게 명백해질 것이다. 본 발명의 이들 및 다른 실시양태가 하기 상세한 설명에 추가로 기재된다.
도 1은 하기 실시예 1에 기재된 시험에 대한 연구 설계의 다이어그램을 도시한다.
도 2는 실시예 1에 기재된 시험으로부터 환자 특성을 요약한 표이다.
도 3a 및 3b는 ISM 수준에 의해 환자 특성을 요약한 표이다.
도 4a 및 4b는 ENA 상태에 의해 환자 특성을 요약한 표이다.
도 5는 시간이 경과함에 따라 ENA 상태 및 반응에 의해 루푸스 환자에서의 IFI27 발현의 평균 감소를 도시한다. 회색 박스는 건강한 개체에서의 IFI27 발현을 나타낸다.
도 6a 및 6b는 ENA 상태 및 시간에 의해 평균 BILAG 전반적 스코어 및 BILAG 기준선으로부터 변화를 도시한다.
도 7a 및 7b는 ENA 상태 및 시간에 의해 평균 SLEDAI 스코어 및 SLEDAI 기준선으로부터의 변화를 도시한다.
도 8a 및 8b는 ENA 상태 및 시간에 의해 BILAG 전반적 스코어 및 SLEDAI 스코어의 평균 변화 퍼센트를 도시한다.
도 9는 다양한 연구로부터 건강한 대조군 및 SLE 환자에 대한 IFN 시그너쳐 측정값 (ISM)을 보여준다. 환자 집단의 양봉 분포는 항-유형 I 인터페론 항체에 보다 반응성인 ISMlo 루푸스 환자의 특이적 집단 (또는 하위집단)의 선택을 허용한다. "Ph I 항-IFNa"는 론탈리주맙을 사용하는 I상 연구를 나타낸다.
도 10은 환자가 ISM 및 dsDNA 항체 역가에 의해 규정된 ROSE 연구에서 3개 집단의 플롯을 보여준다. 본원에 추가로 상세히 기재된 바와 같이, ISMlo 환자 뿐만 아니라 200 IU 이하의 기준선 이중 가닥 DNA 항체 역가 (항-dsDNA)를 갖는 환자는 항-유형 I 인터페론 항체를 이용하는 치유적 치료를 위한 우수한 후보로 확인될 수 있다.
도 11은 IRG 발현 (-DCT) 및 중등도/중증 SLE 플레어 (활성 ISMlo + ISMHi)에 대한 그래프를 보여준다. 상부 곡선은 F=플레어, n=23을 보여준다. 상부 좌측 그래프는 IFI27을 도시한다. 상부 우측 그래프는 IFI44를 도시한다. 하부 좌측 그래프는 MX1을 도시한다. 하부 우측 그래프는 IFIT1을 보여준다. 환자는 다음과 같은 상황이 일어난다면 중등도/중증 플레어를 갖는 것으로 간주하였다: 방문시에 중증 플레어가 SELENA 플레어 인덱스 (SFi) 상에 기록되거나, 중등도 또는 중증 플레어가 SELENA 플레어 인덱스-개정판 (SFI-R) 상에 기록되거나, 또는 새로운 BILAG A 또는 2개의 새로운 BILAG B 스코어가 기록되었다.
도 12-21은 다양한 IRG에 대한 유전자 발현 수준을 보여준다. 상부 선 (비충전된 사각형)은 제16주 중등도/중증 플레어를 갖는 환자를 나타낸다. 인터페론 조절 유전자 발현 수준 (-델타 CT 또는 -DCT 단위)을 정량적 PCR에 의해 투여전 및 투여후 시점에 측정하였다. 환자를 2가지 카테고리로 분리하였다; 제16주에 중등도 내지 중증 플레어를 갖는 환자 (n=23, 상부/비충전된 사각형 선) 및 플레어가 존재하지 않는 나머지 환자 (하부/충전된 원형 선). 제16주에서의 플레어 전에, 평균 IRG 발현 수준이 상승하였고, 이들 유전자는 IFI27, IFI44, MX1, IFIT1, HERC5, EPSTI1, 및 CMPK2를 포함하나 이에 제한되지는 않는다. 나타낸 선은 전방 기준선으로부터의 발현의 평균 및 평균의 표준 오차를 나타내고, 오직 활성 군만의 IV 및 SC 코호트로부터의 환자를 포함한다.
도 12는 HERC5에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 13은 EPSTI1에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 14는 CMPK2에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 15는 IFI27에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 16은 IFI44에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 17은 IFIT1에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 18은 MX1에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 19는 OAS1에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 20은 OAS2에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 21은 OAS3에 대한 -Dct의 평균 (+/- SE)를 보여준다.
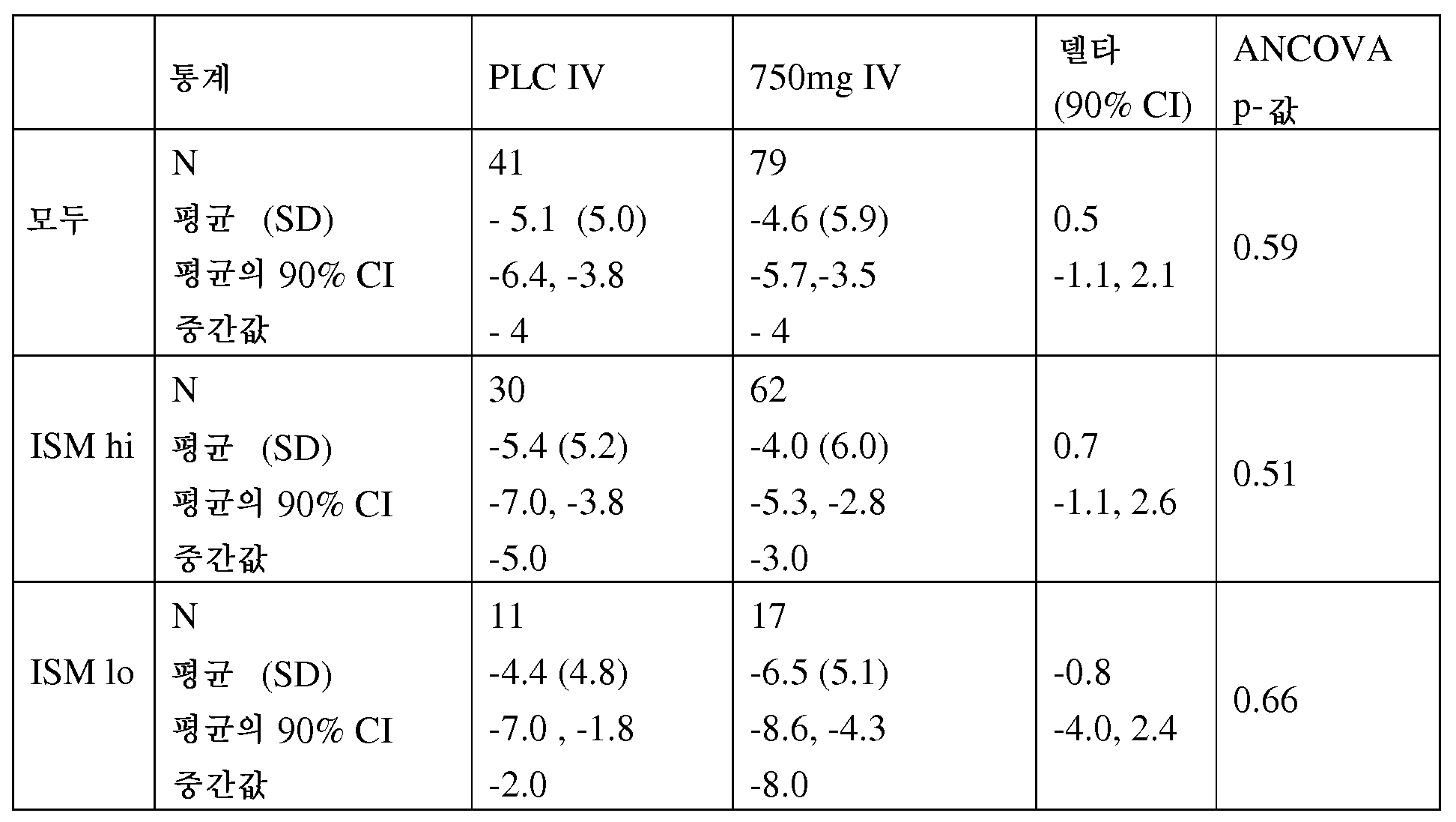
도 22a는 종점에서의 효과가 SRI에 기초한 결과를 지지한다는 것을 보여준다. 이러한 데이터는 시간 경과에 따라 (제8-24주) 스테로이드 사용의 감소 및 치료시의 플레어 비율을 보여준다. 스테로이드 사용의 감소는 특히 ISMlo 집단에서 두드러졌다. 도 22b는 종점에서의 치료 효과가 SRI에 기초한 결과, 특히 SELENA-SLEDAI 플레어 비율의 감소를 지지한다는 것을 보여준다.
도 23은 SRI 종점을 이용하여 론탈리주맙이 ISMlo 집단에서 유의한 치료 효과를 나타낸다는 것을 보여준다. 사용된 SRI는 SRI-4였다. BILAG를 이용하여, 모든 신청자 및 ISM 하위세트에 결정적이지 못한 치료 차이(<10%)가 존재한다. SRI를 이용하여, 모든 신청자 및 ISMhi 집단에 대한 활성 사이에 결정적이지 못한 치료 차이가 존재한다. ISMlo 환자에서의 높은 SRI 반응률의 경우에 (IV+SC의 경우), 치료 차이는 35% (p=0.014)였다.
도 24는 ISMlo 집단에서의 반응이 보다 높은 막대 SRI 역치를 이용하여 유지된다는 것을 보여준다. 기준선 SELENA-SLEDAI의 ≥ X점 감소 (시험된 범위: 4-7); SRI는 SELENA-SLEDAI에서 ≥4점 감소를 이용한다. 치료 차이는 투여 방식 (IV 또는 SC); CMH p-값에 의해 조정하였다.
도 25는 항-dsDNAlo이 양성 치료 효과를 갖는 또 다른 환자 집단을 확인한다는 것을 보여준다. ISMlo 군 (25%)에 비해 ISMhi/dsDNAlo 군 (50%)에 2배 많은 환자가 존재한다. 나머지 25%는 론탈리주맙 처리로부터 이익을 얻을 것으로 보이지 않는 dsDNAhi 환자이다 (슬라이드 22 상의 상부 우측 패널).
도 2는 실시예 1에 기재된 시험으로부터 환자 특성을 요약한 표이다.
도 3a 및 3b는 ISM 수준에 의해 환자 특성을 요약한 표이다.
도 4a 및 4b는 ENA 상태에 의해 환자 특성을 요약한 표이다.
도 5는 시간이 경과함에 따라 ENA 상태 및 반응에 의해 루푸스 환자에서의 IFI27 발현의 평균 감소를 도시한다. 회색 박스는 건강한 개체에서의 IFI27 발현을 나타낸다.
도 6a 및 6b는 ENA 상태 및 시간에 의해 평균 BILAG 전반적 스코어 및 BILAG 기준선으로부터 변화를 도시한다.
도 7a 및 7b는 ENA 상태 및 시간에 의해 평균 SLEDAI 스코어 및 SLEDAI 기준선으로부터의 변화를 도시한다.
도 8a 및 8b는 ENA 상태 및 시간에 의해 BILAG 전반적 스코어 및 SLEDAI 스코어의 평균 변화 퍼센트를 도시한다.
도 9는 다양한 연구로부터 건강한 대조군 및 SLE 환자에 대한 IFN 시그너쳐 측정값 (ISM)을 보여준다. 환자 집단의 양봉 분포는 항-유형 I 인터페론 항체에 보다 반응성인 ISMlo 루푸스 환자의 특이적 집단 (또는 하위집단)의 선택을 허용한다. "Ph I 항-IFNa"는 론탈리주맙을 사용하는 I상 연구를 나타낸다.
도 10은 환자가 ISM 및 dsDNA 항체 역가에 의해 규정된 ROSE 연구에서 3개 집단의 플롯을 보여준다. 본원에 추가로 상세히 기재된 바와 같이, ISMlo 환자 뿐만 아니라 200 IU 이하의 기준선 이중 가닥 DNA 항체 역가 (항-dsDNA)를 갖는 환자는 항-유형 I 인터페론 항체를 이용하는 치유적 치료를 위한 우수한 후보로 확인될 수 있다.
도 11은 IRG 발현 (-DCT) 및 중등도/중증 SLE 플레어 (활성 ISMlo + ISMHi)에 대한 그래프를 보여준다. 상부 곡선은 F=플레어, n=23을 보여준다. 상부 좌측 그래프는 IFI27을 도시한다. 상부 우측 그래프는 IFI44를 도시한다. 하부 좌측 그래프는 MX1을 도시한다. 하부 우측 그래프는 IFIT1을 보여준다. 환자는 다음과 같은 상황이 일어난다면 중등도/중증 플레어를 갖는 것으로 간주하였다: 방문시에 중증 플레어가 SELENA 플레어 인덱스 (SFi) 상에 기록되거나, 중등도 또는 중증 플레어가 SELENA 플레어 인덱스-개정판 (SFI-R) 상에 기록되거나, 또는 새로운 BILAG A 또는 2개의 새로운 BILAG B 스코어가 기록되었다.
도 12-21은 다양한 IRG에 대한 유전자 발현 수준을 보여준다. 상부 선 (비충전된 사각형)은 제16주 중등도/중증 플레어를 갖는 환자를 나타낸다. 인터페론 조절 유전자 발현 수준 (-델타 CT 또는 -DCT 단위)을 정량적 PCR에 의해 투여전 및 투여후 시점에 측정하였다. 환자를 2가지 카테고리로 분리하였다; 제16주에 중등도 내지 중증 플레어를 갖는 환자 (n=23, 상부/비충전된 사각형 선) 및 플레어가 존재하지 않는 나머지 환자 (하부/충전된 원형 선). 제16주에서의 플레어 전에, 평균 IRG 발현 수준이 상승하였고, 이들 유전자는 IFI27, IFI44, MX1, IFIT1, HERC5, EPSTI1, 및 CMPK2를 포함하나 이에 제한되지는 않는다. 나타낸 선은 전방 기준선으로부터의 발현의 평균 및 평균의 표준 오차를 나타내고, 오직 활성 군만의 IV 및 SC 코호트로부터의 환자를 포함한다.
도 12는 HERC5에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 13은 EPSTI1에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 14는 CMPK2에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 15는 IFI27에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 16은 IFI44에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 17은 IFIT1에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 18은 MX1에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 19는 OAS1에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 20은 OAS2에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 21은 OAS3에 대한 -Dct의 평균 (+/- SE)를 보여준다.
도 22a는 종점에서의 효과가 SRI에 기초한 결과를 지지한다는 것을 보여준다. 이러한 데이터는 시간 경과에 따라 (제8-24주) 스테로이드 사용의 감소 및 치료시의 플레어 비율을 보여준다. 스테로이드 사용의 감소는 특히 ISMlo 집단에서 두드러졌다. 도 22b는 종점에서의 치료 효과가 SRI에 기초한 결과, 특히 SELENA-SLEDAI 플레어 비율의 감소를 지지한다는 것을 보여준다.
도 23은 SRI 종점을 이용하여 론탈리주맙이 ISMlo 집단에서 유의한 치료 효과를 나타낸다는 것을 보여준다. 사용된 SRI는 SRI-4였다. BILAG를 이용하여, 모든 신청자 및 ISM 하위세트에 결정적이지 못한 치료 차이(<10%)가 존재한다. SRI를 이용하여, 모든 신청자 및 ISMhi 집단에 대한 활성 사이에 결정적이지 못한 치료 차이가 존재한다. ISMlo 환자에서의 높은 SRI 반응률의 경우에 (IV+SC의 경우), 치료 차이는 35% (p=0.014)였다.
도 24는 ISMlo 집단에서의 반응이 보다 높은 막대 SRI 역치를 이용하여 유지된다는 것을 보여준다. 기준선 SELENA-SLEDAI의 ≥ X점 감소 (시험된 범위: 4-7); SRI는 SELENA-SLEDAI에서 ≥4점 감소를 이용한다. 치료 차이는 투여 방식 (IV 또는 SC); CMH p-값에 의해 조정하였다.
도 25는 항-dsDNAlo이 양성 치료 효과를 갖는 또 다른 환자 집단을 확인한다는 것을 보여준다. ISMlo 군 (25%)에 비해 ISMhi/dsDNAlo 군 (50%)에 2배 많은 환자가 존재한다. 나머지 25%는 론탈리주맙 처리로부터 이익을 얻을 것으로 보이지 않는 dsDNAhi 환자이다 (슬라이드 22 상의 상부 우측 패널).
I. 도입
본 발명은 특히 루푸스 환자를 유형 I 인터페론 항체로 치료하는 방법 및 이러한 치료로부터 이익을 얻을 가능성이 있는 환자를 확인하는 방법 뿐만 아니라 플레어를 예측하는 방법을 제공한다. 본 발명은 또한 인터페론 억제제, 예컨대 항-유형 I 인터페론 항체 (예를 들어, 론탈리주맙)로의 치료를 위한 자가면역 환자 (예를 들어, 루푸스)의 특정 집단을 선택하기 위한 방법 및 조성물을 제공한다.
II. 정의
본원에 사용된 "루푸스"는 결합 조직을 공격하는 항체를 포함하는 자가면역 질환 또는 장애이다. 루푸스의 주요 형태는 피부 전신 홍반성 루푸스 (SLE) 및 아급성 피부 SLE, 뿐만 아니라 다른 유형의 루푸스 (신염, 신장외, 뇌염, 소아, 비-신장, 원판상 및 탈모증 포함)를 비롯한 전신성의 것, 즉 전신 홍반성 루푸스 (SLE)이다.
"루푸스 신염"은 루푸스 환자의 최대 30%에서 발생하는 신장의 루푸스-연관 염증에 의해 유발되는 말초 기관 손상의 심각한 결과이다. 루푸스 신염 환자에서, 신장 관련성은 소변 시편에서의 단백뇨 (> 0.5 g/24시간) 및/또는 적혈구 또는 원주에 의해 특성화된다. 국제 신장 학회 및 신장 병리 학회에 의해 개발된 개정 분류 기준에 기초한 루푸스 신염의 조직학적 분류는 클래스 I-V를 포함한다: 혈관간 (I, II), 증식성 (III, IV) 및 막성 (V) 병변. 신장 조직학은 질환의 하나 초과의 클래스의 특징을 가질 수 있다. 클래스 III 및 IV는 나타난 이상의 활성 또는 만성에 따라 추가로 세분된다. 클래스 VI는 확산된 경화성 질환에 대해 마련된다.
"소아 루푸스"는 성인 루푸스와 동일한 ACR 기준 (11개 도메인 중 4개)으로 진단된다. 소아- 및 성인-발병 루푸스의 임상적 특징을 비교하여 유사성 뿐만 아니라 차이를 밝혀내었다. 일반적으로, 루푸스를 앓는 소아는 성인 SLE 환자보다 중증이고 보다 공격성인 질환을 갖는 경향이 있고, 소아-발병 SLE는 종종 신장 및 신경정신병성 질환을 포함하여, 주요 기관계 관련성을 나타낸다.
본원에서 용어 "항체"는 가장 넓은 의미로 사용되고, 구체적으로 모노클로날 항체, 폴리클로날 항체, 적어도 2개의 무손상 항체로 형성된 다중특이적 항체 (예를 들어, 이중특이적 항체) 및 원하는 생물학적 활성을 나타내는 한 항체 단편을 포함한다.
"항체 단편"은 무손상 항체의 일부, 바람직하게 그의 항원-결합 영역을 포함한다. 항체 단편의 예는 Fab, Fab', F(ab')2 및 Fv 단편; 디아바디; 선형 항체; 단일-쇄 항체 분자; 및 항체 단편으로부터 형성된 다중특이적 항체를 포함한다.
본원에서의 목적을 위해, "무손상 항체"는 중쇄 및 경쇄 가변 도메인, 뿐만 아니라 Fc 영역을 포함하는 항체이다.
본원에 사용된 용어 "유형 I 인터페론" 및 "인간 유형 I 인터페론"은 인간 및 합성 인터페론-α, 인터페론-ω 및 인터페론-β 부류 내에 속하고, 공통의 세포 수용체에 결합하는 천연 인간 및 합성 인터페론의 모든 종으로 정의된다. 천연 인간 인터페론-α는 고도의 구조적 상동성을 갖는 특징적인 유전자에 의해 코딩되는 23가지 이상의 밀접하게 관련된 단백질을 포함한다 (문헌 [Weissmann and Weber, Prog. Nucl. Acid. Res. Mol. Biol., 33: 251 (1986); J. Interferon Res., 13: 443-444 (1993)]). 인간 IFN-α 로커스는 2가지 서브패밀리를 포함한다. 제1 서브패밀리는 IFN-αA (IFN-α2), IFN-αB (IFN-α8), IFN-α (IFN-α10), IFN-αD (IFN-α1), IFN-αE (IFN-α22), IFN-αF (IFN-α21), IFN-αG (IFN-α5), IFN-α16, IFN-α17, IFN-α4, IFN-α6, IFN-α7, 및 IFN-αH (IFN-α14)를 코딩하는 유전자, 및 적어도 80% 상동성을 갖는 유사유전자를 포함하여, 적어도 14개의 기능적, 비-대립유전자로 이루어진다. 제2 서브패밀리, αII 또는 ω는 IFN-α 유전자와 70% 상동성을 나타내는 적어도 5개의 유사유전자 및 1개의 기능성 유전자 (본원에서 "IFN-αsII1" 또는 "IFN-ω"로 지칭됨)를 함유한다 (문헌 [Weissmann and Weber (1986)]). 인간 IFN-β는 일반적으로 단일 카피 유전자에 의해 코딩되는 것으로 생각된다.
본원에 사용된 용어 "인간 인터페론-α (hIFN-α) 수용체 1", "IFN-αR", "hIFNAR1", "IFNAR1", 및 "Uze 쇄"는 문헌 [Uze et al., Cell, 60: 225-234 (1990)]의 페이지 229의 도 5에 나타난 바와 같이 409개 잔기의 세포외 도메인, 21개 잔기의 막횡단 도메인, 및 100개 잔기의 세포내 도메인을 포함하는, 문헌 [Uze et al.]에서 클로닝된 557개 아미노산 수용체 단백질로 정의된다. 한 실시양태에서, 상기 용어는 IFNAR1의 세포외 도메인 (ECD) (또는 ECD의 단편)을 함유하는 IFNAR1의 단편을 포함한다.
본원에 사용된 용어 "인간 인터페론-α (hIFN-α) 수용체 2", "IFN-αβR", "hIFNAR2", "IFNAR2", 및 "Novick 쇄"는 또한 문헌 [Domanski et al., J. Biol. Chem., 37: 21606-21611 (1995)]의 페이지 21608의 도 1에 나타난 바와 같이 217개 잔기의 세포외 도메인, 21개 잔기의 막횡단 도메인, 및 250개 잔기의 세포내 도메인을 포함하는, 문헌 [Domanski et al.]에서 클로닝된 515개 아미노산 수용체 단백질을 포함한다. 한 실시양태에서, 상기 용어는 IFNAR2의 세포외 도메인 (ECD) (또는 ECD의 단편), 및 IFNAR2의 가용성 형태, 예컨대 적어도 이뮤노글로불린 서열의 부분에 융합된 IFNAR2 ECD를 함유하는 IFNAR2의 단편을 포함한다.
본원에 사용된 용어 "인터페론 억제제" 또는 "유형 I 인터페론 억제제"는 야생형 또는 돌연변이된 유형 1 인터페론의 생물학적 기능을 억제하는 능력을 갖는 분자를 지칭한다. 따라서, 용어 "억제제"는 유형 1 인터페론의 생물학적 역할과 관련하여 정의된다. 한 실시양태에서, 본원에 지칭된 인터페론 억제제는 구체적으로 유형 1 인터페론/인터페론 수용체 경로를 통해 세포 신호전달을 억제한다. 예를 들어, 인터페론 억제제는 인터페론 알파 수용체, 또는 통상적으로 인터페론 수용체에 결합하는 유형 1 인터페론과 상호작용 (예를 들어, 이에 결합)할 수 있다. 한 실시양태에서, 인터페론 억제제는 인터페론 알파 수용체의 세포외 도메인에 결합한다. 한 실시양태에서, 인터페론 억제제는 인터페론 알파 수용체의 세포내 도메인에 결합한다. 한 실시양태에서, 인터페론 억제제는 유형 1 인터페론에 결합한다. 한 실시양태에서, 유형 1 인터페론은 인터페론 알파 하위유형이다. 한 실시양태에서, 유형 1 인터페론은 인터페론 베타가 아니다. 한 실시양태에서, 유형 1 인터페론은 인터페론 오메가가 아니다. 한 실시양태에서, 유형 1 인터페론은 인터페론 람다가 아니다. 한 실시양태에서, 유형 1 인터페론은 인터페론 베타 또는 인터페론 오메가가 아니다. 한 실시양태에서, 유형 1 인터페론은 인터페론 오메가 또는 인터페론 람다가 아니다. 한 실시양태에서, 유형 1 인터페론은 인터페론 베타 또는 인터페론 람다가 아니다. 한 실시양태에서, 유형 1 인터페론은 인터페론 알파, 인터페론 베타 또는 인터페론 람다가 아니다. 한 실시양태에서, 인터페론 억제제에 의해 억제되는 인터페론 생물학적 활성은 면역 장애, 예컨대 자가면역 장애와 연관된다. 인터페론 억제제는 인터페론/수용체 활성을 억제할 수 있는 한 임의의 형태일 수 있고; 억제제는 항체 (예를 들어, 본원에서 하기에 정의되고, 미국 특허 번호 7,087,726 및 7,741,449 및 미국 특허 공개 번호 2009-0214565에 기재된 바와 같은 모노클로날 항체), 소형 유기/무기 분자, 안티센스 올리고뉴클레오티드, 압타머, 억제 펩티드/폴리펩티드, 억제 RNA (예를 들어, 소형 간섭 RNA), 그의 조합 등을 포함한다.
본원에 사용된 용어 "바이오마커"는 일반적으로, 포유동물 조직 또는 세포 중에서 또는 그 상에서의 발현이 표준 방법 (또는 본원에 개시된 방법)에 의해 검출될 수 있고, 인터페론, 예를 들어 유형 1 인터페론의 억제에 기초한 치료 요법에 대한 포유동물 세포 또는 조직의 감수성에 대해 예측, 진단 및/또는 예후하는 것인, 유전자, 단백질, 탄수화물 구조체, 또는 당지질을 포함하는 분자를 나타낸다. 임의로, 이러한 바이오마커의 발현은 대조군/참조 조직 또는 세포 샘플에 대해서 관찰되는 것보다 더 높게 결정된다. 임의로, 예를 들어 이러한 바이오마커의 발현은 PCR 또는 FACS 검정에서 대조 조직 또는 세포 샘플에서 관찰된 것보다 시험 조직 또는 세포 샘플에서 적어도 약 5배, 적어도 약 10배, 적어도 약 20배, 적어도 약 30배, 적어도 약 40배, 적어도 약 50배, 또는 바람직하게는 적어도 약 100배 더 높은 것으로 결정될 것이다. 임의로, 상기 바이오마커의 발현은 IHC 분석에서 염색 강도에 대해 적어도 2 이상의 스코어로 결정될 것이다. 임의로, 이러한 바이오마커의 발현은 유전자 칩-기반 검정을 이용하여 결정될 것이다.
본원에 사용된 용어 "ENA"는 문헌 [McNeilage et al., J., Clin. Lab. Immunol. 15:1-17 (1984); Whittingham, Ann. Acad. Med. 17(2):195-200 (1988); Wallace and Hahn, Dubois' lupus erythematosus, 7th ed. Lippincott (2007); Tang et al., Medicine 89(1): 62-67 (2010)]에 기재된 바와 같이, 예를 들어 RNP, Ro/SS-A, La/ SS-B, Sm, SCL-70, Jo-1을 포함하는 일군의 핵 항원인 추출가능한 핵 항원을 지칭한다. ENA에 대한 항체는 루푸스와 관련이 있다. 문헌 [McNeilage et al., 1984; Whittingham 1988; Asherson et al., Medicine 68(6): 366-374 (1989); 및 Tang et al., 2010]. 본원에 사용된 용어 "ENA 상태"는 개체로부터의 샘플에서 ENA 항체의 수준을 지칭한다. 본원에 사용된 용어 "ENA+"는 건강한 개체에서 발견되는 ENA 항체의 수준 초과의 수준의 ENA 항체를 갖는 환자를 지칭한다. 본원에 사용된 용어 "ENA-"는 건강한 개체에서 발견되는 ENA 항체의 수준 이하의 수준의 ENA 항체를 갖는 환자를 지칭한다.
본원에 사용된 "IRG" 또는 "인터페론 반응 유전자" 또는 "인터페론 반응성 유전자"는 미국 특허 공개 번호 20080057503의 표 1, 2, 3 및/또는 4에 수록된 하나 이상의 유전자, 및 상응하는 유전자 산물을 지칭한다. 여기에 나타난 바와 같이, 이러한 유전자 중 하나 이상의 이상 발현 수준/양은 다양한 자가면역 장애와 관련된다. 당업자에게 명백한 바와 같이, 문맥에 따라, 용어 IRG는 미국 특허 공개 번호 20080057503의 표 1, 2, 3 및/또는 4에 수록된 명칭 또는 고유 식별자를 갖는 핵산 (예를 들어, 유전자) 또는 폴리펩티드 (예를 들어, 단백질)를 지칭할 수 있다.
본원에 사용된 "ISM" 또는 "인터페론 시그너쳐 측정값"은 1, 2, 3, 4, 5, 6, 7개 또는 그 초과의 인터페론 반응 유전자의 발현 수준의 측정값을 지칭한다. 유전자는, 예를 들어 CMPK2, EPST1, HERC5, IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합을 포함한다. ISM은 기준선, 즉 유형 I 인터페론 억제제로의 임의의 치료 전에, 또는 투여 후 임의의 시점에 결정될 수 있다. 유전자 발현은 개체 (예를 들어, 루푸스 환자 또는 건강한 개체)로부터의 생물학적 샘플에서 표준 방법 (또는 본원에 개시된 방법)에 의해 검출될 수 있다. 예를 들어, 유전자 발현은 mRNA, cDNA, 단백질, 및/또는 단백질 단편을 포함하나 이에 제한되지는 않는 당업계에 공지된 임의의 안정한 기준에 기초하여 정성적으로 및/또는 정량적으로 결정될 수 있다.
본원에 사용된 "확장된 ISM" 또는 "확장된 ISM 시그너쳐"는 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13개 또는 그 초과의 인터페론 반응성 유전자의 발현 수준의 측정값을 지칭하며, 여기서 인터페론 반응성 유전자 중 적어도 하나는 CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1, PARP9, IFI27, SIGLEC1, DNAPTP6, USP18, IFI6, HSXIAPAF1 및 LAMP3, 및 그의 임의의 이소형이다.
[표 A]
한 실시양태에서, 확장된 ISM은 인터페론 반응성 유전자 IFI27, CIG5, IFI44L, IFI44, OAS1, OAS3, IFIT1, G1P2, HERC5, MX1, EPSTI1, IFIT3 및 IFI6 중 적어도 하나, 또는 그의 조합 또는 모든 이러한 인터페론 반응성 유전자 ("확장된 ISM-A")의 발현 수준의 측정값을 포함한다.
본원에 사용된 "24-유전자 ISM 시그너쳐" 또는 "24-유전자 ISM"은 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23개 또는 모든 인터페론 반응성 유전자의 발현 수준의 측정값을 지칭하며, 여기서 인터페론 반응성 유전자 중 적어도 하나는 CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1, 또는 이러한 인터페론 반응성 유전자의 조합 또는 모두이다.
본원에 사용된 "3-유전자 ISM 시그너쳐" 또는 "3-유전자 ISM"은 1, 2 또는 3개의 인터페론 반응성 유전자의 발현 수준의 측정값을 지칭하며, 여기서 인터페론 반응성 유전자 중 적어도 하나는 EPSTI1, HERC5 또는 TYK1 (CMPK2)이다. 한 실시양태에서, 3-유전자 ISM 시그너쳐는 EPSTI1, HERC5 및 TYK1의 발현 수준의 측정값을 포함한다. 또 다른 실시양태에서, 3-유전자 ISM 시그너쳐는 EPSTI1 및 HERC5의 발현 수준의 측정값을 포함한다. 또 다른 실시양태에서, 3-유전자 ISM 시그너쳐는 EPSTI1 및 TYK1의 발현 수준의 측정값을 포함한다. 또 다른 실시양태에서, 3-유전자 ISM 시그너쳐는 HERC5 및 TYK1의 발현 수준의 측정값을 포함한다. 또 다른 실시양태에서, 3-유전자 ISM 시그너쳐는 TYK1, HERC5 또는 EPSTI1의 발현 수준의 측정값을 포함한다.
본원에 사용된 "IRG 상태"는 환자에서 하나 이상의 IRG의 유전자 발현 수준을 반영한 환자에서의 IRG의 생물학적 상태를 지칭한다. 환자는 ISMlo 또는 ISMhi일 수 있다.
본원에 사용된 "ISMlo" 또는 "ISM 낮음"은 건강한 사람(들) 또는 대조군에서 동일한 IRG의 발현 수준과 비교하여 그의 IRG의 발현 수준을 반영한 자가면역 질환 환자의 IRG 상태를 지칭하며, 여기서 ISM 낮음 자가면역 환자의 IRG 발현 수준은 일반적으로 (1) 건강한 사람 (또는 대조군)의 IRG의 발현 수준의 평균 값의 1.5배 미만 또는 (2) 건강한 사람 (또는 대조군)에서의 동일한 IRG의 발현 수준의 평균 값에 비해 2 표준 편차 미만이다. 달리 명시되지 않는 한 ISM 낮음의 명칭은 특정한 검정 또는 IRG의 특정한 세트에 의존하지 않는다. 한 실시양태에서, 인터페론 시그너쳐 측정값, 확장된 ISM, 확장된 ISM-A, 24-유전자 ISM 또는 3-유전자 ISM의 IRG 중 어느 하나 또는 그의 조합은 자가면역 환자의 IRG 상태를 평가하는데 사용된다. 한 실시양태에서, ISM 낮음은 건강한 사람 (또는 대조군)의 IRG의 발현 수준의 평균 값의 1.4배 미만이다. 다른 실시양태에서, ISM 낮음은 건강한 사람 (또는 대조군)의 IRG의 발현 수준의 평균 값의 1.3, 1.2, 또는 1.1배 미만이다. 다른 실시양태에서, ISM 낮음은 건강한 사람 (또는 대조군)의 IRG의 발현 수준과 동일한 값이다. 다른 실시양태에서, ISM 낮음은 건강한 사람 (또는 대조군)에서의 동일한 IRG의 발현 수준의 평균 값에 비해 1.9, 1.8, 1.7, 1.6, 1.5, 1.4, 1.3, 1.2, 또는 1.1 표준 편차 미만이다.
본원에 사용된 "ISMhi" 또는 "ISM 높음"은 건강한 사람(들) 또는 대조군에서 동일한 IRG 발현 수준의 발현 수준과 비교하여 그의 IRG의 발현 수준을 반영한 자가면역 환자의 생물학적 상태를 지칭하며, 여기서 ISM 높음 자가면역 질환 환자의 IRG 발현 수준은 일반적으로 (1) 건강한 사람 (또는 대조군)의 IRG의 발현의 평균 값의 1.5배 이상 또는 (2) 건강한 사람 (또는 대조군)에서의 동일한 IRG의 발현 수준의 평균 값에 비해 2 표준 편차 이상이다.
용어 "하우스키핑 유전자"는 그의 활성이 세포 기능의 유지에 필수적인 단백질을 코딩하는 유전자 군을 지칭한다. 이러한 유전자는 전형적으로 모든 세포 유형에서 유사하게 발현된다. 하우스키핑 유전자는 트랜스페린 수용체 (TFRC), 리보솜 단백질 L19 (NP--000972), 글리세르알데히드-3-포스페이트 데히드로게나제 (GAPDH), Cypl, 알부민, 액틴 (예를 들어β-액틴), 튜불린, 시클로필린, 하이포크산틴 포스포리보실트랜스퍼라제 (HRPT), 리보솜 단백질 L32 (NP--001007075), 및 리보솜 단백질/유전자 28S (예를 들어, Q9Y399) 및 18S를 포함하나 이에 제한되지는 않는다.
본원에 사용된 용어 "샘플" 또는 "시험 샘플"은 예를 들어 물리적, 생화학적, 화학적 및/또는 생리학적 특징에 기초하여 특성화 및/또는 확인되는 세포성 및/또는 다른 분자 엔티티를 함유하는 관심 대상체로부터 얻거나 상기 대상체로부터 유래된 조성물을 지칭한다. 한 실시양태에서, 상기 정의는 생물학적 기원의 혈액 및 다른 액체 샘플 및 조직 샘플, 예를 들어 생검 시편 또는 조직 배양물 또는 그로부터 유래된 세포를 포함한다. 조직 샘플의 공급원은 신선하고/거나 냉동되고/되거나 보존된 기관 또는 조직 샘플 또는 생검 또는 흡인물로부터의 고체 조직, 혈액 또는 임의의 혈액 구성성분, 체액, 및 대상체의 임신 또는 발생 중 임의의 시점으로부터의 세포 또는 혈장일 수 있다. 용어 "샘플" 또는 "시험 샘플"은 공급 후에 시약으로 처리하거나 가용화하거나, 특정 성분, 예컨대 단백질 또는 폴리뉴클레오티드를 풍부하게 하거나 또는 절편화를 목적으로 반-고체 또는 고체 매트릭스 중에 포매시키는 것과 같은 임의의 방식으로 조작된 생물학적 샘플을 포함한다. 본원에서의 목적을 위해, 조직 샘플의 "절편"은 조직 샘플의 단일 부분 또는 조각, 예를 들어 조직 샘플로부터 절단한 조직의 박편 또는 세포를 의미한다. 샘플은 전혈, 혈액-유래 세포, 혈청, 혈장, 림프액, 활액, 세포 추출물 및 그의 조합을 포함하나, 이에 제한되지는 않는다. 한 실시양태에서, 샘플은 임상 샘플이다. 또 다른 실시양태에서, 샘플은 진단 검정에 사용된다.
한 실시양태에서, 샘플은 유형 I 인터페론 억제제로의 치료 전에 대상체 또는 환자로부터 수득한다. 또 다른 실시양태에서, 샘플은 유형 I 인터페론 억제제로의 적어도 하나의 치료 후에 대상체 또는 환자로부터 수득한다.
본원에 사용된 "참조 샘플"은 비교 목적으로 사용되는 임의의 샘플, 표준물, 또는 수준을 지칭한다. 한 실시양태에서, 참조 샘플은 동일한 대상체 또는 환자 신체의 건강하고/거나 질환에 걸리지 않은 부분 (예를 들어, 조직 또는 세포)으로부터 수득한다. 또 다른 실시양태에서, 참조 샘플은 동일한 대상체 또는 환자 신체의 비처리 조직 및/또는 세포로부터 수득한다. 또 다른 실시양태에서, 참조 샘플은 대상체 또는 환자가 아닌 개체의 신체의 건강하고/거나 질환에 걸리지 않은 부분 (예를 들어, 조직 또는 세포)으로부터 수득한다. 또 다른 실시양태에서, 참조 샘플은 대상체 또는 환자가 아닌 개체의 신체의 비처리 조직 및/또는 세포 부분으로부터 수득한다.
특정 실시양태에서, 참조 샘플은 시험 샘플이 수득된 때와 상이한 하나 이상의 시점에서 동일한 대상체 또는 환자로부터 수득된 단일 샘플 또는 조합된 다중 샘플이다. 예를 들어, 참조 샘플은 시험 샘플이 수득된 때보다 더 이른 시점에 동일한 대상체 또는 환자로부터 수득한다. 특정 실시양태에서, 참조 샘플은 대상체 또는 환자가 아닌 하나 이상의 개체로부터 수득한, 용어 "샘플" 하에 상기 정의된 바와 같은 생물학적 샘플의 모든 유형을 포함한다. 특정 실시양태에서, 참조 샘플은 대상체 또는 환자가 아닌, 혈관신생 장애 (예를 들어, 암)를 갖는 하나 이상의 개체로부터 수득한다.
특정 실시양태에서, 참조 샘플은 대상체 또는 환자가 아닌 하나 이상의 건강한 개체로부터의 조합된 다중 샘플이다. 특정 실시양태에서, 참조 샘플은 대상체 또는 환자가 아닌 질환 또는 장애 (예를 들어, 혈관신생 장애, 예를 들어 암)를 갖는 하나 이상의 개체로부터의 조합된 다중 샘플이다. 특정 실시양태에서, 참조 샘플은 정상 조직으로부터 모은 RNA 샘플 또는 대상체 또는 환자가 아닌 하나 이상의 개체로부터 모은 혈장 또는 혈청 샘플이다.
루푸스 관리에서 표준 진료는 류마티스 학회 (예를 들어, 미국 류마티스 학회, 유럽 류마티스 학회) 및 치료 의사의 판단에 의해 개발된 현재 승인된 의료 행위 패턴에 기초한다. 따라서, 본원에 사용된 "표준 진료"는 루푸스 환자의 특정한 집단 및 질환 활성의 중증도에 의존하는 징후 및 증상의 평가 및 관리를 의미한다. 루푸스 환자는 적절한 관리에도 불구하고 진단을 받은 후에도 오랫 동안 질환 활성이 계속 나타났으며, 종종 새로운 기관계 또는 특정 기관계 손상이 나타났다. 루푸스에 3가지 패턴의 질환 활성이 존재한다: 플레어 (또는 이장성, 재발성 질환 활성), 만성 활성 질환, 및 장기 휴지. 이러한 질환 패턴은 체계적 임상 평가, 통상적인 실험실 시험, 질환 활성의 표준화된 측정, 및 이들 평가와 환자 자신의 건강 상태 및 삶의 질에 대한 지각의 통합을 이용하여 특성화된다. 플레어의 환자 징후 및 증상이 지속되거나 악화되기 때문에, 의사는 의약 및/또는 투여량의 변화가 보장된다는 것을 알 수 있다. 루푸스를 제어하는데 사용되는 의약은 하기를 포함하나 이에 제한되지는 않는다: (1) NSAID (일반 NSAID 포함), 예를 들어 나프록센 (알레브) 및 이부프로펜 (애드빌, 모트린, 기타), 및 처방에 의해 이용가능한 보다 강한 NSAID; (2) 항말라리아 약물, 예를 들어 히드록시클로로퀸 (플라퀘닐); (3) 코르티코스테로이드, 예를 들어 프레드니손 및 다른 유형의 코르티코스테로이드, 및 (4) 면역 억제제, 예를 들어 시클로포스파미드 (시톡산), 아자티오프린 (이뮤란, 아자산), 미코페놀레이트 (셀셉트), 레플루노미드 (아라바) 및 메토트렉세이트 (트렉살).
"항체-의존성 세포-매개 세포독성" 및 "ADCC"는 Fc 수용체 (FcR)를 발현하는 비특이적 세포독성 세포 (예를 들어, 자연 킬러 (NK) 세포, 호중구, 및 대식세포)가 표적 세포 상의 결합된 항체를 인식한 후에 이러한 표적 세포의 용해를 유발하는 세포-매개 반응을 지칭한다. ADCC를 매개하는 1차 세포인 NK 세포는 FcγRIII만을 발현하는 반면, 단핵구는 FcγRI, FcγRII 및 FcγRIII를 발현한다. 조혈 세포 상에서의 FcR 발현은 문헌 [Ravetch and Kinet Annu. Rev. Immunol 9:457-92 (1991)]의 페이지 464, 표 3에 요약되어 있다. 관심 분자의 ADCC 활성을 평가하기 위하여, 미국 특허 번호 5,500,362 또는 5,821,337에 기재된 바와 같은 시험관내 ADCC 검정을 수행할 수 있다. 이러한 검정에 유용한 이펙터 세포는 말초 혈액 단핵 세포 (PBMC) 및 자연 킬러 (NK) 세포를 포함한다. 대안적으로 또는 추가로, 관심 분자의 ADCC 활성은 생체내에서, 예를 들어 문헌 [Clynes et al. PNAS (USA) 95:652-656 (1998)]에 개시된 바와 같은 동물 모델에서 평가할 수 있다.
"인간 이펙터 세포"는 하나 이상의 FcR을 발현하고 이펙터 기능을 수행하는 백혈구이다. 바람직하게는, 세포는 적어도 FcγRIII를 발현하고 ADCC 이펙터 기능을 수행한다. ADCC를 매개하는 인간 백혈구의 예는 말초 혈액 단핵 세포 (PBMC), 자연 킬러 (NK) 세포, 단핵구, 세포독성 T 세포 및 호중구를 포함하며, PBMC 및 NK 세포가 바람직하다.
용어 "Fc 수용체" 또는 "FcR"은 항체의 Fc 영역에 결합하는 수용체를 기재하기 위해 사용된다. 바람직한 FcR은 천연 서열 인간 FcR이다. 또한, 바람직한 FcR은 IgG 항체에 결합하는 수용체 (감마 수용체)이고, FcγRI, FcγRII 및 FcγRIII 하위부류의 수용체를 포함하며, 여기에는 이들 수용체의 대립유전자 변이체 및 달리 스플라이싱된 형태가 포함된다. FcγRII 수용체는 FcγRIIA ("활성화 수용체") 및 FcγRIIB ("억제 수용체")를 포함하고, 이들은 주로 그의 세포질 도메인에 상이한 유사한 아미노산 서열을 갖는다. 활성화 수용체 FcγRIIA는 그의 세포질 도메인에 면역수용체 티로신-기재 활성화 모티프 (ITAM)를 함유한다. 억제 수용체 FcγRIIB는 세포질 도메인 내에 면역수용체 티로신-기재 억제 모티프 (ITIM)를 함유한다 (문헌 [Daeron Annu. Rev. Immunol. 15:203-234 (1997)] 참조). FcR은 문헌 [Ravetch and Kinet Annu. Rev. Immunol 9:457-92 (1991); Capel et al. Immunomethods 4:25-34 (1994); 및 de Haas et al. J. Lab. Clin. Med. 126:330-41 (1995)]에서 검토된다. 추후로 확인될 것을 포함하는 다른 FcR이 본원의 용어 "FcR"에 포함된다. 이 용어에는 또한, 모계의 IgG를 태아로 전달하는 것을 담당하는 신생아 수용체인 FcRn이 포함된다 (문헌 [Guyer et al., J. Immunol. 117:587 (1976) 및 Kim et al. J. Immunol. 24:249 (1994)]).
"보체-의존성 세포독성" 또는 "CDC"는 보체의 존재 하에 표적을 용해시키는 분자의 능력을 지칭한다. 보체 활성화 경로는 동족 항원과 복합체를 형성한 분자 (예를 들어, 항체)에 보체계의 제1 성분 (C1q)이 결합하는 것에 의해 개시된다. 보체 활성화를 평가하기 위해, 예를 들어 문헌 [Gazzano-Santoro et al. J. Immunol. Methods 202:163 (1996)]에 기재된 바와 같은 CDC 검정을 수행할 수 있다.
"성장-억제" 항체는 항체가 결합하는 항원을 발현하는 세포의 증식을 방지하거나 감소시키는 항체이다. 예를 들어, 항체는 B 세포의 증식을 시험관내 및/또는 생체내에서 방지하거나 감소시킬 수 있다.
"아폽토시스를 유도하는" 항체는 아넥신 V의 결합, DNA의 단편화, 세포 수축, 세포질 세망의 확장, 세포 단편화 및/또는 막 소포 (아폽토시스체라 불림)의 형성과 같은 표준 아폽토시스 검정에 의해 결정되는 바와 같이, 예를 들어 B 세포의 프로그램화된 세포 사멸을 유도하는 항체이다.
"천연 항체"는 통상적으로 2개의 동일한 경쇄 (L) 및 2개의 동일한 중쇄 (H)로 구성된 약 150,000 달톤의 이종사량체 당단백질이다. 각각의 경쇄는 1개의 공유 디술피드 결합에 의해 중쇄에 연결되는 한편, 디술피드 연결의 수는 상이한 이뮤노글로불린 이소형의 중쇄마다 달라진다. 또한, 각각의 중쇄 및 경쇄는 일정하게 이격된 쇄내 디술피드 가교를 갖는다. 각각의 중쇄는 한쪽 말단에 가변 도메인 (VH)을 갖고, 그 뒤에는 다수의 불변 도메인이 존재한다. 각각의 경쇄는 한쪽 말단에 가변 도메인 (VL) 및 다른쪽 말단에 불변 도메인을 가지며; 경쇄의 불변 도메인은 중쇄의 제1 불변 도메인과 정렬되고, 경쇄 가변 도메인은 중쇄의 가변 도메인과 정렬된다. 특정 아미노산 잔기는 경쇄 가변 도메인과 중쇄 가변 도메인 사이에서 인터페이스를 형성한다고 여겨진다.
용어 "가변"은 가변 도메인의 특정 부분이 항체마다 서열에서 광범위하게 상이하며, 각각의 특정한 항체의 그의 특정한 항원에 대한 결합 및 특이성에 이용된다는 사실을 지칭한다. 그러나, 가변성이 항체의 가변 도메인 전반에 걸쳐 고르게 분포되어 있는 것은 아니다. 경쇄 및 중쇄 가변 도메인, 둘 다에서 초가변 영역으로 불리는 3개의 절편에 집중된다. 가변 도메인의 보다 고도로 보존된 부분은 프레임워크 영역 (FR)으로 지칭된다. 천연 중쇄 및 경쇄의 가변 도메인은 3개의 초가변 영역에 의해 연결되고 주로 β-시트 배위를 취하는 4개의 FR을 각각 포함하며, 이들 초가변 영역은 상기 β-시트 구조를 연결하고 일부 경우에는 그의 일부를 형성하는 루프를 형성한다. 각 쇄 내의 초가변 영역은 FR에 의해 아주 근접하게 함께 유지되어 있고, 다른 쇄로부터의 초가변 영역은 항체의 항원-결합 부위 형성에 기여한다 (문헌 [Kabat et al. Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)] 참조). 불변 도메인은 항원에 대한 항체 결합에 직접적으로 관여하지 않지만, 다양한 이펙터 기능, 예컨대 ADCC에 있어서의 항체 참여를 나타낸다.
항체를 파파인으로 소화시키면 "Fab" 단편으로 지칭되는, 각각 단일 항원-결합 부위를 갖는 2개의 동일한 항원-결합 단편과, 나머지 "Fc" 단편이 생성되며, 이러한 명칭은 그의 용이하게 결정화되는 능력을 반영한 것이다. 펩신 처리는 2개의 항원-결합 부위를 갖고 여전히 항원을 가교시킬 수 있는 F(ab')2 단편을 생성한다.
"Fv"는 완전한 항원-인식 및 항원-결합 부위를 함유하는 최소 항체 단편이다. 이 영역은 치밀한 비-공유 결합으로 결합된, 1개의 중쇄 가변 도메인과 1개의 경쇄 가변 도메인으로 이루어진 이량체로 구성된다. 이러한 배위에서는 각 가변 도메인의 3개의 초가변 영역이 상호작용하여 VH-VL 이량체 표면 상의 항원-결합 부위를 한정한다. 포괄적으로, 6개의 초가변 영역은 항체에 항원-결합 특이성을 부여한다. 그러나, 단일 가변 도메인 (또는 항원에 특이적인 초가변 영역을 단지 3개만 포함하는 Fv의 절반)일지라도 전체 결합 부위보다 친화도가 낮긴 하지만 항원을 인식하고 결합하는 능력을 갖고 있다.
Fab 단편은 또한 경쇄의 불변 도메인 및 중쇄의 제1 불변 도메인 (CH1)을 함유한다. Fab' 단편은 항체 힌지 영역으로부터의 1개 이상의 시스테인을 포함하는 중쇄 CH1 도메인의 카르복시 말단에 몇 개의 잔기가 부가되었다는 점에서 Fab 단편과 상이하다. 본원에서, Fab'-SH는 불변 도메인의 시스테인 잔기(들)가 적어도 1개의 유리 티올 기를 보유하는 Fab'의 명칭이다. F(ab')2 항체 단편은 본래 가운데에 힌지 시스테인을 갖는 Fab' 단편의 쌍으로 생성된다. 항체 단편의 다른 화학적 커플링이 또한 공지되어 있다.
임의의 척추동물 종으로부터의 항체 (이뮤노글로불린)의 "경쇄"는 불변 도메인의 아미노산 서열에 기초하여, 카파 (κ) 및 람다 (γ)로 지칭되는 명백하게 상이한 2가지 유형 중의 하나로 지정될 수 있다.
이들 중쇄의 불변 도메인의 아미노산 서열에 따라, 항체는 상이한 부류로 지정될 수 있다. 5가지 주요 부류의 무손상 항체: IgA, IgD, IgE, IgG 및 IgM이 존재하고, 이중 몇 가지는 하위부류 (이소형), 예를 들어 IgG1, IgG2, IgG3, IgG4, IgA 및 IgA2로 추가로 나뉠 수 있다. 상이한 부류의 항체에 상응하는 중쇄 불변 도메인은 각각 α, δ, ε, γ 및 μ로 불린다. 상이한 부류의 이뮤노글로불린의 서브유닛 구조 및 3차원 배위는 널리 공지되어 있다.
"단일-쇄 Fv" 또는 "scFv" 항체 단편은 단일 폴리펩티드 쇄 내에 존재하는 항체의 VH 및 VL 도메인을 포함한다. 바람직하게, Fv 폴리펩티드는 scFv가 항원 결합을 위한 원하는 구조를 형성할 수 있도록 하는, VH 및 VL 도메인 사이에 폴리펩티드 링커를 추가로 포함한다. scFv의 검토를 위해, 문헌 [Plueckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994)]을 참조한다.
용어 "디아바디"는 동일한 폴리펩티드 쇄 (VH - VL) 내의 경쇄 가변 도메인 (VL)에 연결된 중쇄 가변 도메인 (VH)을 포함하는, 2개의 항원-결합 부위를 갖는 소형 항체 단편을 지칭한다. 동일 쇄 상의 2개의 도메인 사이에서 쌍 형성을 허용하기에는 지나치게 짧은 링커를 사용함으로써, 상기 도메인은 또 다른 쇄의 상보적 도메인과 쌍을 형성하게 되어 2개의 항원-결합 부위를 생성하게 된다. 디아바디는 예를 들어 EP 404,097; WO 1993/11161; 및 문헌 [Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)]에 보다 상세하게 기재되어 있다.
본원에 사용된 용어 "모노클로날 항체"는 실질적으로 균질한 항체 집단, 즉 집단을 차지하고 있는 개별 항체가 모노클로날 항체의 생성 동안 유발될 수 있는 가능한 변이체 (이러한 변이체는 일반적으로 미량으로 존재함)를 제외하고는 동일하고/거나 동일한 에피토프와 결합하는 집단으로부터 수득한 항체를 지칭한다. 전형적으로 상이한 결정자 (에피토프)에 대해 지시된 상이한 항체를 포함하는 폴리클로날 항체 제제와는 달리, 각각의 모노클로날 항체는 항원 상의 단결정기에 대해 지시된다. 그의 특이성 뿐만 아니라, 모노클로날 항체는 다른 이뮤노글로불린에 의해 오염되지 않은 점에서 유익하다. 수식어 "모노클로날"은 항체의 특징이 실질적으로 균질한 항체 집단으로부터 수득된 것임을 나타내며, 임의의 특정한 방법을 통한 항체 생산이 필요하다는 것으로 해석되어서는 안된다. 예를 들어, 본 발명에 따라 사용될 모노클로날 항체는 문헌 [Kohler et al., Nature, 256:495 (1975)]에 최초로 기재되었던 하이브리도마 방법으로 제조될 수 있거나, 또는 재조합 DNA 방법 (예를 들어, 미국 특허 번호 4,816,567 참조)으로 제조될 수 있다. "모노클로날 항체"는 또한 예를 들어 문헌 [Clackson et al., Nature, 352:624-628 (1991) 및 Marks et al., J. Mol. Biol., 222:581-597 (1991)]에 기재된 기술을 사용하여 파지 항체 라이브러리로부터 단리할 수 있다.
본원에서 모노클로날 항체는 구체적으로 중쇄 및/또는 경쇄의 일부가 특정한 종으로부터 유래되거나 특정한 항체 부류 또는 하위부류에 속하는 항체의 상응하는 서열과 동일하거나 상동성이고, 쇄(들)의 나머지 부분은 또 다른 종으로부터 유래되거나 또 다른 항체 부류 또는 하위부류에 속하는 항체의 상응하는 서열과 동일하거나 상동성인 "키메라" 항체 (이뮤노글로불린), 뿐만 아니라 원하는 생물학적 활성을 나타내는 한 이러한 항체의 단편을 포함한다 (미국 특허 번호 4,816,567; 문헌 [Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)] 참조). 본원에서 관심 키메라 항체는 비-인간 영장류 (예를 들어, 구세계 원숭이, 예컨대 개코원숭이, 레서스 또는 시노몰구스 원숭이)로부터 유래한 가변-도메인 항원-결합 서열, 및 인간 불변 영역 서열을 포함하는 "영장류화" 항체를 포함한다 (미국 특허 번호 5,693,780).
비-인간 (예를 들어, 뮤린) 항체의 "인간화" 형태는 비-인간 이뮤노글로불린으로부터 유래된 최소 서열을 함유하는 키메라 항체이다. 대부분의 경우, 인간화 항체는 수용자의 초가변 영역의 잔기가 원하는 특이성, 친화도 및 능력을 갖는 마우스, 래트, 토끼 또는 비인간 영장류와 같은 비-인간 종 (공여자 항체)의 초가변 영역의 잔기로 대체된 인간 이뮤노글로불린 (수용자 항체)이다. 일부 경우에, 인간 이뮤노글로불린의 프레임워크 영역 (FR) 잔기가 상응하는 비-인간 잔기로 대체된다. 또한, 인간화 항체는 수용자 항체 또는 공여자 항체에서는 발견되지 않는 잔기를 포함할 수 있다. 이러한 변형은 항체 성능이 추가로 개선되도록 한다. 일반적으로, 인간화 항체는 적어도 1개, 전형적으로는 2개의 가변 도메인을 실질적으로 모두 포함할 것이며, 여기서 모든 또는 실질적으로 모든 초가변 루프는 비인간 이뮤노글로불린의 것에 상응하고 모든 또는 실질적으로 모든 FR은 상기 언급된 FR 치환(들)은 제외하고, 인간 이뮤노글로불린 서열의 것이다. 또한, 인간화 항체는 임의로 이뮤노글로불린 불변 영역의 적어도 일부, 전형적으로 인간 이뮤노글로불린의 적어도 일부를 포함할 것이다. 보다 상세한 내용은 문헌 [Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); 및 Presta, Curr. Op. Struct. Biol. 2:593-596 (1992)]을 참조한다.
"프레임워크" 또는 "FR"은 초가변 영역 (HVR) 잔기 이외의 가변 도메인 잔기를 지칭한다. 가변 도메인의 FR은 일반적으로 4개의 FR 도메인: FR1, FR2, FR3 및 FR4로 구성된다. 따라서, HVR 및 FR 서열은 일반적으로 VH (또는 VL)에서 하기 순서로 나타난다: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
본원에 사용된 용어 "초가변 영역" 또는 "HVR"은 서열이 초가변성이고/거나 구조적으로 한정된 루프 ("초가변 루프")를 형성하는 항체 가변 도메인의 각각의 영역을 지칭한다. 일반적으로, 천연 4-쇄 항체는 6개의 HVR; VH 내의 3개 (H1, H2, H3) 및 VL 내의 3개 (L1, L2, L3)를 포함한다. HVR은 일반적으로 초가변 루프로부터의 및/또는 "상보성 결정 영역" (CDR)으로부터의 아미노산 잔기를 포함하며, 후자는 서열 변동성이 가장 높고/거나 항원 인식과 관련된다. 본원에 사용된 HVR 영역은 위치 24-36 (L1에 대해), 46-56 (L2에 대해), 89-97 (L3에 대해), 26-35B (H1에 대해), 47-65 (H2에 대해) 및 93-102 (H3에 대해) 내에 위치한 임의의 번호의 잔기를 포함한다. 따라서, HVR은 이전에 기재된 위치에서의 잔기를 포함한다:
A) 24-34 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (H2), 및 96-101 (H3) (문헌 [Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987)]);
B) L1의 24-34, L2의 50-56, L3의 89-97, H1의 31-35B, H2의 50-65, 및 H3의 95-102 (문헌 [Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)]).
C) 30-36 (L1), 46-55 (L2), 89-96 (L3), 30-35 (H1), 47-58 (H2), 93-100a-j (H3) (문헌 [MacCallum et al. J. Mol. Biol. 262:732-745 (1996)]).
달리 나타내지 않는 한, HVR 잔기 및 가변 도메인에서의 다른 잔기 (예를 들어, FR 잔기)는 본원에서 문헌 [Kabat et al., 상기 문헌]에 따라 넘버링된다.
"네이키드 항체"는 세포독성 모이어티 또는 방사성표지와 같은 이종 분자에 접합되지 않은 항체 (본원에서 정의된 바와 같음)이다.
"단리된" 항체는 자연 환경의 성분으로부터 확인되고 분리 및/또는 회수된 것이다. 그의 자연 환경의 오염 성분은 항체의 진단 또는 치료 용도를 방해하는 물질이며, 이러한 오염 성분은 효소, 호르몬, 및 다른 단백질성 또는 비-단백질성 용질을 포함할 수 있다. 바람직한 실시양태에서, 항체는 (1) 로우리(Lowry) 방법으로 측정시에 항체의 95 중량%를 초과하는 정도, 가장 바람직하게는 99 중량%를 초과하는 정도로, (2) 스피닝 컵 시쿼네이터를 사용하여 N-말단 또는 내부 아미노산 서열의 적어도 15개의 잔기를 얻기에 충분한 정도로, 또는 (3) 쿠마시 블루 또는 바람직하게는 은 염색을 이용하여 환원 또는 비환원 조건하에 SDS-PAGE에 의해 균질한 것으로 나타날 정도로 정제될 것이다. 단리된 항체는 재조합 세포 내의 계내 항체를 포함하는데, 이는 항체의 자연 환경의 적어도 하나의 성분이 존재하지 않을 것이기 때문이다. 그러나, 통상적으로, 단리된 항체는 적어도 1회의 정제 단계에 의해 제조될 것이다.
참조 폴리펩티드 서열에 대한 "아미노산 서열 동일성 퍼센트(%)"는 서열을 정렬시키고 필요한 경우에는 최대 서열 동일성 퍼센트 달성을 위해 갭을 도입한 후 임의의 보존적 치환을 서열 동일성의 일부로 간주하지 않으면서 참조 폴리펩티드 서열 내의 아미노산 잔기와 동일한 후보 서열 내의 아미노산 잔기의 백분율로서 정의된다. 아미노산 서열 동일성 퍼센트를 결정하기 위한 정렬은 당업계 기술 범위 내의 다양한 방법, 예를 들어 공개적으로 이용가능한 컴퓨터 소프트웨어, 예컨대 BLAST, BLAST-2, ALIGN 또는 메갈린(Megalign) (DNASTAR) 소프트웨어를 이용하여 달성할 수 있다. 당업자는 비교할 전장 서열에 대한 최대 정렬을 달성하는데 필요한 임의의 알고리즘을 포함하여 서열 정렬에 적절한 파라미터를 정할 수 있다. 그러나, 본원의 목적상, 아미노산 서열 동일성 % 값은 서열 비교 컴퓨터 프로그램 ALIGN-2를 이용하여 생성된다. ALIGN-2 서열 비교 컴퓨터 프로그램은 제넨테크, 인크.(Genentech, Inc.) 소유로서, 소스 코드는 미국 저작권청 (20559 워싱턴 디.씨.)에 사용자 문서로 제출되어 있고, 미국 저작권 등록 번호 TXU510087로 등록되어 있다. ALIGN-2 프로그램은 제넨테크, 인크. (캘리포니아주 사우스 샌프란시스코)를 통해 공개적으로 이용가능하거나, 소스 코드로부터 컴파일링될 수 있다. ALIGN-2 프로그램은 디지털 UNIX V4.0D를 비롯한 UNIX 운영 시스템에서 사용되도록 컴파일링되어야 한다. 모든 서열 비교 파라미터는 ALIGN-2 프로그램에 의해 설정되어 있으며 변하지 않는다.
ALIGN-2가 아미노산 서열 비교를 위해 사용되는 상황에서, 주어진 아미노산 서열 B에, 주어진 아미노산 서열 B와, 또는 주어진 아미노산 서열 B에 대한 주어진 아미노산 서열 A의 아미노산 서열 동일성 % (대안적으로, 주어진 아미노산 서열 B에, 주어진 아미노산 서열 B와, 또는 주어진 아미노산 서열 B에 대해 특정 아미노산 서열 동일성 %를 갖거나 또는 이를 포함하는 주어진 아미노산 서열 A라는 어구로 기재될 수 있음)는 하기와 같이 계산된다:
X/Y의 분율 x 100
여기서, X는 서열 정렬 프로그램 ALIGN-2에 의한 A 및 B의 프로그램 정렬시에 상기 프로그램에 의해 동일한 매치로 스코어링된 아미노산 잔기의 수이고, Y는 B의 아미노산 잔기의 전체 수이다. 아미노산 서열 A의 길이가 아미노산 서열 B의 길이와 동일하지 않은 경우에는 B에 대한 A의 아미노산 서열 동일성 %가 A에 대한 B의 아미노산 서열 동일성 %와 동일하지 않을 것임을 이해할 것이다. 달리 구체적으로 언급되지 않는 한, 본원에 사용된 모든 아미노산 서열 동일성 % 값은 ALIGN-2 컴퓨터 프로그램을 이용하여 상기 단락에 기재한 바와 같이 수득한다.
용어 "제약 제제"는 그 안에 함유된 활성 성분의 생물학적 활성이 효과적이도록 하는 형태로 존재하며, 제제가 투여될 대상체에게 허용되지 않는 독성인 추가의 성분을 함유하지 않는 제제를 지칭한다.
"제약상 허용되는 담체"는 대상체에게 비독성인, 활성 성분 이외의 다른 제약 제제 내의 성분을 지칭한다. 제약상 허용되는 담체는 완충제, 부형제, 안정화제 또는 보존제를 포함하나 이에 제한되지는 않는다.
"중화 항체"는 이에 결합하는 표적 항원의 이펙터 기능을 제거하거나 유의하게 감소시킬 수 있는 항체 분자이다. 따라서, "중화" 항-IFN-α 항체는 IFN-α의 이펙터 기능, 예컨대 수용체 결합 및/또는 세포 반응의 유도를 제거하거나 또는 유의하게 감소시킬 수 있다.
예시적인 검정은 항-IFN-α 항체가 IFN-α의 수용체 활성화 활성을 중화하는 능력을 모니터링하는 것이다. 예를 들어, 1995년 6월 1일에 공개된 WO 95/14930에 기재된 바와 같은 키나제 수용체 활성화 (KIRA) 검정을 참조하고, 이에 의해 중화는 후보 항체가 IFNAR1/R2 수용체 복합체의 티로신 인산화 (리간드 결합으로부터 생성)를 감소시키는 능력에 의해 측정된다.
대안적으로, 항-IFN-α 항체가 IFN-α에 의한 세포 반응의 유도를 중화하는 능력은 문헌 [Kawade, J. Interferon Res. 1:61-70 (1980), 또는 Kawade and Watanabe, J. Interferon Res. 4:571-584 (1984), 또는 Yousefi, et al., Am. J. Clin. Pathol. 83: 735-740 (1985)]에 기재된 바와 같이 IFN-α의 항바이러스 활성의 중화를 모니터링함으로써, 또는 문헌 [Kurabayashi et al., Mol. Cell Biol., 15: 6386 (1995)]에 기재된 바와 같이 전기영동 이동성 변화 검정에서 인터페론-자극 반응 요소 (ISRE)로부터 유래된 올리고뉴클레오티드에 대한 신호전달 분자, 인터페론-자극 인자 3 (ISGF3)의 결합을 활성화하는 IFN-α의 능력을 중화하는 항-IFN-α 항체의 능력을 시험함으로써 시험될 수 있다.
"유의한" 감소는 표적 항원 (예를 들어, IFN-α)의 이펙터 기능, 예컨대 수용체 (예를 들어, IFNAR2) 결합 및/또는 세포 반응의 유도의 적어도 약 60%, 또는 적어도 약 70%, 바람직하게는 적어도 약 75%, 보다 바람직하게는 적어도 약 80%, 보다 더 바람직하게는 적어도 약 85%, 보다 더 바람직하게는 적어도 약 90%, 보다 더 바람직하게는 적어도 약 95%, 가장 바람직하게는 적어도 약 99% 감소를 의미한다. 바람직하게는, 본원에 정의된 바와 같은 "중화" 항체는 문헌 [Kawade (1980), 상기 문헌, 또는 Yousefi (1985), 상기 문헌]의 항-바이러스 검정에 의해 결정시에 IFN-α의 항-바이러스 활성의 적어도 약 60%, 또는 적어도 약 70%, 바람직하게는 적어도 약 75%, 보다 바람직하게는 적어도 약 80%, 보다 더 바람직하게는 적어도 약 85%, 보다 더 바람직하게는 적어도 약 90%, 보다 더 바람직하게는 적어도 약 95%, 가장 바람직하게는 적어도 약 99%를 중화할 수 있을 것이다. 또 다른 바람직한 실시양태에서, 본원에서 "중화" 항체는 상기 참조된 KIRA 검정에서 결정된 바와 같이 IFN-α 결합으로 인해 IFNAR1/IFNAR2 수용체 복합체의 티로신 인산화를 적어도 약 60%, 또는 적어도 약 70%, 바람직하게는 적어도 약 75%, 보다 바람직하게는 적어도 약 80%; 보다 더 바람직하게는 적어도 약 85%, 보다 더 바람직하게는 적어도 약 90%, 보다 더 바람직하게는 적어도 약 95%, 가장 바람직하게는 적어도 약 99% 감소시킬 수 있을 것이다. 특히 바람직한 실시양태에서, 본원에서 중화 항-IFN-α 항체는 IFN-α의 모든, 또는 실질적으로 모든 하위유형을 중화할 수 있을 것이며, IFN-β는 중화할 수 없을 것이다. 이러한 문맥에서, 용어 "실질적으로 모든"은 중화 항-IFN-α 항체가 적어도 IFN-α1, IFN-α2, IFN-α4, IFN-α5, IFN-α8, IFN-α10, 및 IFN-α21을 중화할 것임을 의미한다.
본원에서 "대상체" 또는 "환자"는 인간 대상체 또는 환자이다. 일반적으로, 이러한 대상체 또는 환자는 루푸스를 위한 치료에 적격이다. 한 실시양태에서, 이러한 적격 대상체 또는 환자는 루푸스의 하나 이상의 징후, 증상 또는 다른 지표를 경험하고 있거나 또는 경험한 적이 있거나, 또는 루푸스로 진단되거나 (예를 들어, 새로 진단되거나, 이전에 새로운 플레어로 진단되거나, 또는 새로운 플레어가 나타나고 임상적으로 스테로이드 의존성인 경우를 모두 포함), 또는 루푸스가 발생할 위험이 있는 환자이다. 또 다른 실시양태에서, 치료될 환자는 자가항체, 예컨대 하기 언급된 것을 검출하기 위한 검정을 이용하여 스크리닝될 수 있으며, 여기서 자가항체 생산은 정성적으로, 바람직하게는 정량적으로 평가된다. SLE와 연관된 예시적인 이러한 자가항체는 항-핵 항체 (ANA), 항-이중-가닥 DNA (dsDNA) 항체, 항-Sm 항체, 항-핵 리보핵단백질 항체, 항-인지질 항체, 항-리보솜 P 항체, 항-Ro/SS-A 항체, 항-Ro 항체, 항-RNP 항체, 및 항-La 항체이다.
"안정한" 제제는 보관시에 내부의 단백질이 본질적으로 그의 물리적 안정성 및/또는 화학적 안정성 및/또는 생물학적 활성을 유지하는 제제이다. 바람직하게는, 제제는 저장시 그의 물리적 및 화학적 안정성 뿐만 아니라 그의 생물학적 활성을 본질적으로 유지한다. 저장 기간은 일반적으로 제제의 의도된 저장 수명에 기초하여 선택된다. 단백질 안정성을 측정하는 다양한 분석 기술이 당업계에서 이용가능하며, 이는 예를 들어 문헌 [Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, New York, Pubs. (1991) 및 Jones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993)]에 검토되어 있다. 안정성은 선택된 기간 동안 선택된 온도에서 측정될 수 있다. 바람직하게는, 제제는 적어도 약 2-4주 동안 약 40℃에서 안정하고/거나 적어도 3개월 동안 약 5℃ 및/또는 15℃에서 안정하고/거나 적어도 3개월 또는 적어도 1, 2, 3, 또는 4년 동안 약 -20℃에서 안정하다. 또한, 제제는 바람직하게는 제제의 냉동 (예를 들어, -70℃로) 및 해동 후에, 예를 들어 냉동 및 해동의 1, 2 또는 3 순환 후에 안정하다. 안정성은 응집 형성의 평가 (예를 들어, 크기 배제 크로마토그래피를 이용하여, 탁도 측정에 의해, 및/또는 육안 검사에 의해); 양이온 교환 크로마토그래피 또는 모세관 구역 전기영동을 이용한 전하 이종성 평가; 아미노-말단 또는 카르복시-말단 서열 분석; 질량 분광측정 분석; 환원된 항체와 무손상 항체를 비교하기 위한 SDS-PAGE 분석; 펩티드 맵 (예를 들어, 트립신 또는 LYS-C) 분석; 항체의 생물학적 활성 또는 항원 결합 기능 평가 등을 포함하는 다양한 상이한 방식으로 정성적으로 및/또는 정량적으로 평가될 수 있다. 불안정성은 응집, 탈아미드화 (예를 들어, Asn 탈아미드화), 산화 (예를 들어, Met 산화), 이성질체화 (예를 들어, Asp 이성질체화), 클리핑/가수분해/단편화 (예를 들어, 힌지 영역 단편화), 숙신이미드 형성, 쌍을 형성하지 않은 시스테인(들), N-말단 연장, C-말단 프로세싱, 글리코실화 차이 등 중 어느 하나 이상과 관련될 수 있다.
"히스티딘 완충제"는 히스티딘 이온을 포함하는 완충제이다. 히스티딘 완충제의 예는 히스티딘 클로라이드, 히스티딘 아세테이트, 히스티딘 포스페이트, 히스티딘 술페이트를 포함한다. 본원의 실시예에서 확인된 바람직한 히스티딘 완충제는 히스티딘 클로라이드인 것으로 밝혀졌다. 한 실시양태에서, 히스티딘 클로라이드 완충제는 염산 (액체)으로 L-히스티딘 (유리 염기, 고체)을 적정함으로써 제조된다. 또 다른 실시양태에서, 히스티딘 완충제는 바람직한 pH를 달성하기 위해 히스티딘 및 히스티딘-히드로클로라이드 염의 혼합물에 의해 제조된다. 바람직하게는, 히스티딘 완충제 또는 히스티딘 클로라이드 완충제는 pH 5.5 내지 6.5, 적절하게는 pH 5.8 내지 6.2이다.
본원에서 "사카라이드"는 모노사카라이드, 디사카라이드, 트리사카라이드, 폴리사카라이드, 당 알콜, 환원당, 비환원당 등을 포함하는 일반 조성물 (CH2O)n 및 그의 유도체를 포함한다. 본원에서 사카라이드의 예는 글루코스, 수크로스, 트레할로스, 락토스, 프룩토스, 말토스, 덱스트란, 글리세린, 덱스트란, 에리트리톨, 글리세롤, 아라비톨, 실리톨, 소르비톨, 만니톨, 멜리비오스, 멜레지토스, 라피노스, 만노트리오스, 스타키오스, 말토스, 락툴로스, 말툴로스, 글루시톨, 말티톨, 락티톨, 이소-말툴로스 등을 포함한다.
본원에서 "계면활성제"는 표면-활성 작용제, 바람직하게는 비이온성 계면활성제를 지칭한다. 본원에서 계면활성제의 예는 폴리소르베이트 (예를 들어, 폴리소르베이트 20 및 폴리소르베이트 80); 폴록사머 (예를 들어, 폴록사머 188); 트리톤; 나트륨 도데실 술페이트 (SDS); 나트륨 라우렐 술페이트; 나트륨 옥틸 글리코시드; 라우릴-, 미리스틸-, 리놀레일- 또는 스테아릴-술포베타인; 라우릴-, 미리스틸-, 리놀레일- 또는 스테아릴-사르코신; 리놀레일-, 미리스틸- 또는 세틸-베타인; 라우로아미도프로필-, 코카미도프로필-, 리놀레아미도프로필-, 미리스트아미도프로필-, 팔미도프로필- 또는 이소스테아르아미도프로필-베타인 (예를 들어, 라우로아미도프로필); 미리스트아미도프로필-, 팔미도프로필- 또는 이소스테아르아미도프로필-디메틸아민; 나트륨 메틸 코코일- 또는 이나트륨 메틸 올레일-타우레이트; 및 모나쿼트(MONAQUAT)™ 시리즈 (모나 인더스트리즈, 인크.(Mona Industries, Inc.), 뉴저지주 패터슨); 폴리에틸 글리콜, 폴리프로필 글리콜, 및 에틸렌과 프로필렌 글리콜의 공중합체 (예를 들어, 플루로닉스(Pluronics), PF68 등) 등을 포함한다. 본원에서 바람직한 계면활성제는 폴리소르베이트 20이다.
플레어는 새로운 또는 악화된 임상 징후 및 증상, 및/또는 실험실 측정값을 포함하는 하나 이상의 기관계에서의 질환 활성의 측정가능한 증가이다. 이는 평가자에 의해 임상적으로 유의한 것으로 간주되어야 하고, 통상적으로는 적어도 치료에서의 변화 또는 증가를 고려할 것이다. (문헌 [Ruperto et al., International consensus for a definition of disease flare in lupus. Lupus (2011) 20: 453-462] 참조.) "플레어"는 면역 장애로 진단된 환자에서 질환 활성의 개시를 지칭하고; SLE에서, 경증 플레어는 그 환자에서의 이전의 스코어에 비해 ≥4 유닛까지의 전신 홍반성 루푸스 질환 활성 인덱스 (SLEDAI)의 증가로 정의되고, 중증 플레어는 ≥12 유닛까지의 SLEDAI의 증가로 정의된다. SLEDAI는 0 내지 105의 가능한 전반적 스코어 범위를 갖는 2가지 면역학적 시험을 비롯하여, 16가지 임상 징후 및 8가지 실험실 측정값에 기초한 질환 활성의 복합적 평가를 나타낸다.
"루푸스 플레어의 감소" 또는 "플레어의 감소" 및 그의 문법적 등가물은 문맥에 따라 SELENA 플레어 인덱스-개정판 (SFI-R) (2009)을 이용하여 평가된 바와 같이 위약/대조군에 비한 플레어의 수의 감소, 플레어까지의 시간의 감소, 또는 플레어의 중증도의 감소를 지칭한다.
SLE의 진단은 현재의 미국 류마티스 학회 (ACR) 기준에 따를 수 있다. 활성 질환은 하기 실시예에서 언급되고 문헌 [Furie et al., Arthritis Rheum. 61(9):1143-51 (2009)]에 기재된 바와 같이 1개의 영국 연방 루푸스 활성 군 (BILAG) "A" 기준 또는 2개의 BILAG "B" 기준; SLE 질환 활성 인덱스 (SLEDAI); 또는 전신 홍반성 루푸스 (SLE) 반응자 인덱스 (SRI)에 의해 정의될 수 있다. 문헌 [Tan et al. "The Revised Criteria for the Classification of SLE" Arth Rheum 25 (1982)]으로부터 채택된 SLE 진단에 사용되는 일부 징후, 증상, 또는 다른 지표는 협부 발진, 예컨대 뺨 상의 발진, 원판상 발진, 또는 융기한 적색 반점, 감광성, 예컨대 피부 발진의 발생 또는 증가를 유발하는 일광에 대한 반응, 경구 궤양, 예컨대 코 또는 입 안의 궤양, 통상적으로 무통의, 관절염, 예컨대 2개 이상의 말초 관절을 포함하는 비-미란 관절염 (관절 주위의 뼈가 파괴되지 않은 관절염), 장막염, 흉막염 또는 심막염, 신장 장애, 예컨대 소변 내의 과도한 단백질 (0.5 g/일 또는 시험 막대에서 3+ 초과) 및/또는 세포 원주 (소변 및/또는 백혈구 및/또는 신장 세뇨관 세포로부터 유도된 비정상 성분), 신경학적 징후, 증상, 또는 다른 지표, 발작 (경련), 및/또는 이러한 효과를 발생시키는 것으로 공지된 약물 또는 대사 장애의 부재 하의 정신병, 및 혈액학적 징후, 증상, 또는 다른 지표, 예컨대 용혈성 빈혈 또는 백혈구감소증 (4,000개 세포/세제곱밀리미터 미만의 백혈구 수) 또는 림프구감소증 (1,500개 림프구/세제곱밀리미터 미만) 또는 혈소판감소증 (100,000개 혈소판/세제곱밀리미터 미만)일 수 있다. 백혈구감소증 및 림프구감소증은 2회 이상 검출되어야 한다. 혈소판감소증은 그를 유발하는 것으로 공지된 약물의 부재 하에 검출되어야 한다. 본 발명은 루푸스의 이러한 징후, 증상, 또는 다른 지표로 제한되지는 않는다.
본원에서 대상체의 "치료"는 치유적 치료 및 예방 또는 예방적 조치를 의미한다. 치료를 필요로 하는 것은 이미 루푸스가 있는 것 뿐만 아니라 루푸스를 예방하고자 하는 것을 포함한다. 따라서, 대상체는 루푸스를 갖는 것으로서 진단될 수 있거나, 루푸스에 걸리기 쉽거나 영향을 받기 쉬울 수 있다.
루푸스의 "증상"은 대상체가 경험한 구조, 기능 또는 감각의 정상으로부터의 임의의 병적 현상 또는 그의 개시, 또는 질환 지표이다.
표현 "유효량"은 루푸스의 예방, 개선 또는 치료에 효과적인 항체의 양을 지칭한다.
"중등도 내지 중증 활성 SLE"를 갖는 환자는 적어도 1개의 도메인에서의 BILAG A 스코어, 또는 적어도 2개의 도메인에서의 BILAG B 스코어에 의해 정의된다. 하기 도메인에서의 BILAG B 스코어의 경우에, 추가의 기준이 적용된다: 1) 구조적 도메인: 기여한 식욕부진이 가입 요건에 고려되지 않는 BILAG B 스코어; 2) 근골격 도메인: 기여한 관절염 (중등도)/건염/건막염이 염증의 타각 징후 (즉, 압통, 종창 또는 삼출액)가 3개 이상의 관절에서 관찰되지 않는 한 가입 요건에 고려되지 않는 BILAG B 스코어. 관절염의 환자-보고된 병력은 충분하지 않음; 및 3) 신경정신병성 도메인: 기여한 루푸스 두통이 가입 요건에 고려되지 않는 BILAG B 스코어. 인지 기능장애는 이것이 적절한 인지 시험을 이용하여 확립되고 원문서에 보고되지 않는 한 B 스코어에 기여할 수 없다.
일부 실시양태에서, 환자는 적어도 1의 BILAG A 스코어 또는 3 이상의 BILAG B 스코어를 갖는다. 일부 실시양태에서, 환자는 1 또는 2의 BILAG B 스코어를 갖는다.
BILAG 2004 인덱스가 BILAG 스코어를 결정하기 위해 이용된다. 문헌 [Yee, et al. Arthritis& Rheumatism 54:3300-3305, 2006; Isenberg et al., Rheumatology 44:902-906; 2005]. BILAG 2004 인덱스는 9개의 기관계 도메인: 구조적, 점막피부, 신경정신병성, 근골격, 심폐, 위장, 안구, 신장, 및 혈액에 걸쳐 97가지 임상적 징후, 증상, 및 실험실 파라미터를 평가한다. 97가지 증상이 이전 달 (4주)에 걸친 중증도에 대해 및 이전의 검사로부터의 임의의 변화 (신규, 개선, 안정화, 악화, 부재)에 대해 평가된다. 이어서, 각각의 9개 도메인에 대한 단일 알파벳 스코어 (A 내지 E)가 각각의 기관 카테고리에서의 검사 결과에서 유래된다.
카테고리 A-E로의 SLE 질환 활성의 스코어링은 치료를 위해 의사가 의도한 원칙에 기초한다. 임상적 발견이 오직 SLE에 기인하는 경우에만 스코어링된다는 것이 필수적이다. BILAG 평가는 SLE에서 전문 지식을 갖고 기구의 사용에서 적절한 훈련을 입증할 수 있는 임상의에 의해 수행되어야 한다. BILAG 평가는 일관된 방식으로 및/또는 각각의 방문시에 동일한 평가자에 의해 수행되어야 한다. 하기 표 1을 참조한다. 하기 표 1을 참조한다.
[표 1]
"SELENA-SLEDAI 인덱스"가 질환 활성을 평가하기 위한 기구로 사용된다. 하기 표 2는 SELENA-SLEDAI 스코어를 결정하기 위한 기준을 보여준다. 총 스코어는 존재하는 표시된 설명어 옆의 점수의 합이다.
[표 2]
의사의 전반적 평가는 또한 질환 활성을 평가하는데 사용되었다. 의사는 지난 28일에 걸쳐 환자 질환 활성을 평가하고, "없음"에서 "중증"까지 표시하고 0 내지 3으로 등급을 매긴 100-mm 상사 척도 상에 수직 틱 마크를 두었다. 환자 병력, 신체 검사의 결과 뿐만 아니라 적절한 실험실 값이 환자 질환 활성을 평가할 때 고려되어야 한다. 의사는 또한 이전의 방문에서 기록된 값을 참조하여야 하고, 적절한 경우에 틱 마크를 이동시켜야 한다.
SLE 반응자 인덱스 (SRI)는 임의의 기관계에서 악화가 일어나지 않고 전반적 환자 상태를 확인하면서 SLE 질환 활성에서의 개선을 측정하는 임상적으로 의미있는 종점이다. SRI는 SELENA-SLEDAI, BILAG 2004 인덱스, 및 의사의 전반적 평가 (PGA)를 도입한 복합적 종점이다.
"SRI-4" 반응은 각각의 하기 기준이 충족될 것을 요구한다: 1) SELENA-SLEDAI 스코어의 ≥4점 감소; 2) 새로운 BILAG A 기관 도메인 스코어 없음 또는 1 이하의 새로운 BILAG B 기관 도메인 스코어; 3) PGA가 악화되지 않음 (10% 미만 증가); 및 4) 치료 실패 없음.
"SRI-5" 반응은 각각의 하기 기준이 충족될 것을 요구한다: 1) SELENA-SLEDAI 스코어의 ≥5점 감소; 2) 새로운 BILAG A 기관 도메인 스코어 없음 또는 1 이하의 새로운 BILAG B 기관 도메인 스코어; 3) PGA가 악화되지 않음 (10 미만% 증가); 및 4) 치료 실패 없음.
"SRI-6" 반응은 각각의 하기 기준이 충족될 것을 요구한다: 1) SELENA-SLEDAI 스코어의 ≥6점 감소; 2) 새로운 BILAG A 기관 도메인 스코어 없음 또는 1 이하의 새로운 BILAG B 기관 도메인 스코어; 3) PGA가 악화되지 않음 (10% 미만 증가); 및 4) 치료 실패 없음.
"SRI-7" 반응은 각각의 하기 기준이 충족될 것을 요구한다: 1) SELENA-SLEDAI 스코어의 ≥7점 감소; 2) 새로운 BILAG A 기관 도메인 스코어 없음 또는 1 이하의 새로운 BILAG B 기관 도메인 스코어; 3) PGA가 악화되지 않음 (10% 미만 증가); 및 4) 치료 실패 없음.
특정 용량 및 지속기간을 초과하는 추가의 스테로이드가 요구되거나 면역억제제 요법의 재개/개시가 요구되는 환자는 "치료 실패"로 간주된다. 하기 스테로이드 용량을 초과하는 환자는 치료 실패로 간주된다:
1) 스테로이드의 점감을 완료할 수 없는 환자 (제8주 말까지 10 mg/일 이하의 표적 용량에 도달하지 않음). 점감 계획에 따라 제6주 말까지 ≤ 10 mg/일의 목표에 도달할 수 없으나 제8주 말까지 이 목표를 달성한 환자는 치료 실패로 간주되지 않는다.
2) 제20주 이전
적어도 14일 동안 20 mg 이상까지 최저 달성된 용량을 초과하는 스테로이드의 임의의 증가;
적어도 28일 동안 10 mg 이상까지 최저 달성된 용량을 초과하는 스테로이드의 임의의 증가.
3) 제20주 내지 제24주
이 4주 기간 동안 임의의 날에 20 mg 이상의 프레드니손 등량을 제공받음;
7일 초과 (누적) 동안 10 초과 그러나 20 mg/일 미만의 프레드니손 등량을 제공받음.
문헌 [Lupus [1999] 8(8):685-91]에 공개된 SELENA-SLEDAI 플레어 인덱스 (SFI) 및 문헌 [Arthritis & Rheumatology [2011] 63(12): 3918-30]에 공개된 SELENA-SLEDAI 플레어 인덱스-개정판 (SFI-R)을 플레어를 결정하기 위한 기준으로 이용한다.
"SFI-R"은 하기 표에 나타난 바와 같은 8개의 기관계: 점막피부, 근골격, 심폐, 혈액, 구조적, 신장, 신경 및 위장 내에서 SLE 질환 활성의 증가를 평가한다. 각각의 기관계 내에서, 연구자는 임상적 징후 및 치료 권장사항을 평가하여 플레어를 플레어 없음, 경증 플레어, 중등도 플레어, 또는 중증 플레어로 분류한다. 임상적 징후 및 치료 변화에 대한 권장사항의 평가가 모순되는 경우에, 치료 선택이 (보다 높은 플레어 정의의 방향으로) 우선한다. 불내성, 독성, 또는 안전성 때문에 권장된 치료 변화는 플레어 정의에 포함되지 않는다.
"항체 노출"은 약 1일 내지 약 5주의 기간에 걸쳐 하나 이상의 용량으로 투여되는 본원의 항체와의 접촉 또는 이에 대한 노출을 지칭한다. 용량은 한번에 또는 이러한 노출 기간에 걸쳐 고정된 또는 불규칙적인 시간 간격으로, 예컨대 예를 들어 4주 동안 매주 1회 용량 또는 약 13-17일의 시간 간격으로 분리된 2회 용량으로 제공될 수 있다. 초기 및 후기 항체 노출은 본원에 상세하게 기재된 바와 같이 서로 시간상 분리된다.
본원에 사용된 용어 보조 요법을 위한 "면역억제제"는 본원에서 치료되는 포유동물의 면역계를 억제하거나 차폐시키는 역할을 하는 물질을 의미한다. 이것은 시토카인 생성을 억제하거나 자기-항원 발현을 하향 조절 또는 억제하거나 MHC 항원을 차폐시키는 물질을 포함한다. 이러한 작용제의 예는 2-아미노-6-아릴-5-치환된 피리미딘 (미국 특허 번호 4,665,077 참조), 비스테로이드성 항염증 약물 (NSAID), 간시클로비르, 타크롤리무스, 글루코코르티코이드, 예컨대 코르티솔 또는 알도스테론, 항염증제, 예컨대 시클로옥시게나제 억제제, 5-리폭시게나제 억제제, 또는 류코트리엔 수용체 길항제, 퓨린 길항제, 예컨대 아자티오프린 또는 미코페놀레이트 모페틸 (MMF), 알킬화제, 예컨대 시클로포스파미드, 브로모크립틴, 다나졸, 답손, 글루타르알데히드 (미국 특허 번호 4,120,649에 기재된 바와 같이, MHC 항원을 차폐시킴), MHC 항원 및 MHC 단편에 대한 항-이디오타입 항체, 시클로스포린 A, 스테로이드, 예컨대 코르티코스테로이드 또는 글루코코르티코스테로이드 또는 글루코코르티코이드 유사체, 예를 들어 프레드니손, 메틸프레드니솔론 및 덱사메타손, 디히드로폴레이트 리덕타제 억제제, 예컨대 메토트렉세이트 (경구 또는 피하), 히드록시클로로퀸, 술파살라진, 레플루노미드, 시토카인 또는 시토카인 수용체 항체, 예를 들어 항-인터페론-알파, -베타 또는 -감마 항체, 항-종양 괴사 인자-알파 항체 (인플릭시맙 또는 아달리무맙), 항-TNF-알파 이뮤노어드헤신 (에타네르셉트), 항-종양 괴사 인자-베타 항체, 항-인터류킨-2 항체 및 항-IL-2 수용체 항체, 항-LFA-1 항체, 예를 들어 항-CD11a 및 항-CD18 항체, 항-L3T4 항체, 이종 항-림프구 글로불린, pan-T 항체, 바람직하게는 항-CD3 또는 항-CD4/CD4a 항체, LFA-3 결합 도메인을 함유하는 가용성 펩티드 (7/26/90에 공개된 WO 1990/08187), 스트렙토키나제, TGF-베타, 스트렙토도르나제, 숙주로부터의 RNA 또는 DNA, FK506, RS-61443, 데옥시스페르구알린, 라파마이신, T-세포 수용체 (미국 특허 번호 5,114,721 (Cohen et al.)), T-세포 수용체 단편 (문헌 [Offner et al., Science, 251: 430-432 (1991)]; WO 1990/11294; [Ianeway, Nature, 341: 482 (1989)]; 및 WO 1991/01133) 및 T-세포-수용체 항체 (EP 340,109), 예컨대 T10B9를 포함한다.
본원에 사용된 용어 "세포독성제"는 세포의 기능을 억제 또는 방지하고/거나 세포의 파괴를 유발하는 물질을 지칭한다. 이 용어는 방사성 동위원소 (예를 들어, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, 및 Lu의 방사성 동위원소), 화학요법제, 및 박테리아, 진균, 식물 또는 동물 기원의 효소적으로 활성인 독소 또는 소형-분자 독소와 같은 독소, 또는 그의 단편을 포함하도록 의도된다.
"화학요법제"는 암의 치료에 유용한 화학적 화합물이다. 화학요법제의 예는 알킬화제, 예를 들어 티오테파 및 시톡산(CYTOXAN)® 시클로스포스파미드; 알킬 술포네이트, 예를 들어 부술판, 임프로술판 및 피포술판; 아지리딘, 예를 들어 벤조도파, 카르보쿠온, 메트우레도파 및 우레도파; 에틸렌이민 및 메틸아멜라민, 예를 들어 알트레타민, 트리에틸렌멜라민, 트리에틸렌포스포르아미드, 트리에틸렌티오포스포르아미드 및 트리메틸올로멜라민; 아세토게닌 (특히 불라타신 및 불라타시논); 캄프토테신 (합성 유사체 토포테칸 포함); 브리오스타틴; 칼리스타틴; CC-1065 (그의 아도젤레신, 카르젤레신 및 비젤레신 합성 유사체 포함); 크립토피신 (특히 크립토피신 1 및 크립토피신 8); 돌라스타틴; 두오카르마이신 (합성 유사체 KW-2189 및 CB1-TM1 포함); 엘레우테로빈; 판크라티스타틴; 사르코딕티인; 스폰지스타틴; 질소 머스타드, 예컨대 클로람부실, 클로르나파진, 클로로포스파미드, 에스트라무스틴, 이포스파미드, 메클로레타민, 메클로레타민 옥시드 히드로클로라이드, 멜팔란, 노벰비킨, 페네스테린, 프레드니무스틴, 트로포스파미드, 우라실 머스타드; 니트로스우레아, 예를 들어 카르무스틴, 클로로조토신, 포테무스틴, 로무스틴, 니무스틴 및 라니무스틴; 항생제, 예를 들어 에네디인 항생제 (예를 들어, 칼리케아미신, 특히 칼리케아미신 감마1I 및 칼리케아미신 오메가I1 (예를 들어, 문헌 [Agnew, Chem Intl. Ed. Engl., 33: 183-186 (1994)] 참조); 디네미신, 예를 들어 디네미신 A; 비스포스포네이트, 예를 들어 클로드로네이트; 에스페라미신; 뿐만 아니라 네오카르지노스타틴 발색단 및 관련 색소단백질 에네디인 항생 발색단), 아클라시노마이신, 악티노마이신, 아우트라마이신, 아자세린, 블레오마이신, 칵티노마이신, 카라비신, 카르미노마이신, 카르지노필린, 크로모마이신, 닥티노마이신, 다우노루비신, 데토루비신, 6-디아조-5-옥소-L-노르류신, 아드리아마이신(ADRIAMYCIN)® 독소루비신 (모르폴리노-독소루비신, 시아노모르폴리노-독소루비신, 2-피롤리노-독소루비신 및 데옥시독소루비신 포함), 에피루비신, 에소루비신, 이다루비신, 마르셀로마이신, 미토마이신, 예컨대 미토마이신 C, 미코페놀산, 노갈라마이신, 올리보마이신, 페플로마이신, 포트피로마이신, 퓨로마이신, 쿠엘라마이신, 로도루비신, 스트렙토니그린, 스트렙토조신, 투베르시딘, 우베니멕스, 지노스타틴, 조루비신; 항대사물, 예를 들어 메토트렉세이트 및 5-플루오로우라실 (5-FU); 폴산 유사체, 예를 들어 데노프테린, 메토트렉세이트, 프테로프테린, 트리메트렉세이트; 퓨린 유사체, 예를 들어 플루다라빈, 6-메르캅토퓨린, 티아미프린, 티오구아닌; 피리미딘 유사체, 예를 들어 안시타빈, 아자시티딘, 6-아자우리딘, 카르모푸르, 시타라빈, 디데옥시우리딘, 독시플루리딘, 에노시타빈, 플록수리딘; 안드로겐, 예를 들어 칼루스테론, 드로모스타놀론 프로피오네이트, 에피티오스타놀, 메피티오스탄, 테스토락톤; 항-아드레날, 예를 들어 아미노글루테티미드, 미토탄, 트릴로스탄; 폴산 보충제, 예를 들어 프롤린산; 아세글라톤; 알도포스파미드 글리코시드; 아미노레불린산; 에닐우라실; 암사크린; 베스트라부실; 비산트렌; 에다트락세이트; 데포파민; 데메콜신; 디아지쿠온; 엘포르니틴; 엘립티늄 아세테이트; 에포틸론; 에토글루시드; 갈륨 니트레이트; 히드록시우레아; 렌티난; 로니다이닌; 메이탄시노이드, 예를 들어 메이탄신 및 안사미토신; 미토구아존; 미톡산트론; 모피단몰; 니트라에린; 펜토스타틴; 페나메트; 피라루비신; 로속산트론; 포도필린산; 2-에틸히드라지드; 프로카르바진; PSK® 폴리사카라이드 복합체 (JHS 내츄럴 프로덕츠 (JHS Natural Products, 미국 오레곤주 유진)); 라족산; 리족신; 시조피란; 스피로게르마늄; 테누아존산; 트리아지쿠온; 2,2',2"-트리클로로트리에틸아민; 트리코테센 (특히 T-2 독소, 베라큐린 A, 로리딘 A 및 안구이딘); 우레탄; 빈데신; 다카르바진; 만노무스틴; 미토브로니톨; 미토락톨; 피포브로만; 가시토신; 아라비노시드 ("Ara-C"); 시클로포스파미드; 티오테파; 탁소이드, 예를 들어 탁솔(TAXOL)® 파클리탁셀 (브리스톨-마이어스 스큅 온콜로지 (Bristol-Myers Squibb Oncology, 미국 뉴저지주 프린스톤)); 아브락산(ABRAXANE)™ 파클리탁셀의 크레모포르-무함유, 알부민-조작 나노입자 제제 (아메리칸 파마슈티칼 파트너스 (American Pharmaceutical Partners, 미국 일리노이주 샤움버그)), 및 탁소테레(TAXOTERE)® 독세탁셀 (롱-프랑 로러 (Rhone-Poulenc Rorer, 프랑스 안토니)); 클로란부실; 겜자르(GEMZAR)® 겜시타빈; 6-티오구아닌; 메르캅토퓨린; 메토트렉세이트; 백금 유사체, 예를 들어 시스플라틴 및 카르보플라틴; 빈블라스틴; 백금; 에토포시드 (VP-16); 이포스파미드; 미톡산트론; 빈크리스틴; 나벨빈(NAVELBINE)® 비노렐빈; 노반트론; 테니포시드; 에다트렉세이트; 다우노마이신; 아미노프테린; 젤로다; 이반드로네이트; CPT-11; 토포이소머라제 억제제 RFS 2000; 디플루오로메틸오르니틴 (DMFO); 레티노이드, 예컨대 레티노산; 카페시타빈; 임의의 상기의 제약상 허용되는 염, 산 또는 유도체를 포함한다.
또한, 상기 정의에는 종양에 대한 호르몬 작용을 조절하거나 억제하는 작용을 하는 항호르몬제, 예컨대 항-에스트로겐 및 선택적 에스트로겐 수용체 조절제 (SERM), 예를 들어 타목시펜 (놀바덱스(NOLVADEX)® 타목시펜 포함), 랄록시펜, 드롤록시펜, 4-히드록시타목시펜, 트리옥시펜, 케옥시펜, LY117018, 오나프리스톤 및 파레스톤(FARESTON)® 토레미펜; 효소 아로마타제를 억제하는 아로마타제 억제제 (부신에서 에스트로겐 생성을 조절함), 예컨대 예를 들어 4(5)-이미다졸, 아미노글루테티미드, 메가세(MEGASE)® 메게스트롤 아세테이트, 아로마신(AROMASIN)® 엑세메스탄, 포르메스타니, 파드로졸, 리비소르(RIVISOR)® 보로졸, 페마라(FEMARA)® 레트로졸 및 아리미덱스(ARIMIDEX)® 아나스트로졸; 및 항-안드로겐, 예컨대 플루타미드, 닐루타미드, 비칼루타미드, 류프롤리드 및 고세렐린; 뿐만 아니라 트록사시타빈 (1,3-디옥솔란 뉴클레오시드 시토신 유사체); 안티센스 올리고뉴클레오티드, 특히 이상 세포 증식과 관련된 신호전달 경로에서 유전자의 발현을 억제하는 것, 예컨대 예를 들어, PKC-알파, Raf 및 H-Ras; 백신, 예컨대 유전자-요법 백신, 예를 들어 알로벡틴(ALLOVECTIN)® 백신, 류벡틴(LEUVECTIN)® 백신과 박시드(VAXID)® 백신; 프로류킨(PROLEUKIN)® rIL-2; 루르토테칸(LURTOTECAN)® 토포이소머라제 1 억제제; 아바렐릭스(ABARELIX)® rmRH; 및 임의의 상기의 제약상 허용되는 염, 산 또는 유도체가 포함된다.
용어 "시토카인"은 또 다른 세포 상에서 세포간 매개자로서 작용하는 하나의 세포 집단에 의해 방출되는 단백질에 대한 일반적 명칭이다. 이러한 시토카인의 예는 림포카인, 모노카인; 인터류킨 (IL), 예컨대 IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-11, IL-12, IL-15; 종양 괴사 인자, 예를 들어 TNF-α 또는 TNF-β; 및 기타 폴리펩티드 인자 (LIF 및 kit 리간드 (KL) 포함)이다. 본원에서 사용되는 용어 시토카인은 천연 공급원 또는 재조합 세포 배양물로부터의 단백질 및 천연 서열 시토카인의 생물학적 활성 등가물 (그의 합성에 의해 생산된 소분자 엔티티 및 제약상 허용되는 유도체 및 염 포함)을 포함한다.
용어 "호르몬"은 폴리펩티드 호르몬을 지칭하고, 이는 일반적으로 관이 있는 선상 기관에 의해 분비된다. 호르몬 중에서, 예를 들어 성장 호르몬 예컨대 인간 성장 호르몬, N-메티오닐 인간 성장 호르몬, 및 소 성장 호르몬; 부갑상선 호르몬; 티록신; 인슐린; 프로인슐린; 렐락신; 프로렐락신; 당단백질 호르몬, 예컨대 여포-자극 호르몬 (FSH), 갑상선-자극 호르몬 (TSH), 및 황체화 호르몬 (LH); 프로락틴, 태반 락토겐, 마우스 고나도트로핀-연관 펩티드, 인히빈; 액티빈; 뮬러관-억제 물질; 및 트롬보포이에틴을 포함한다. 본원에 사용된 용어 호르몬은 천연 공급원으로부터 또는 재조합 세포 배양물로부터의 단백질 및 천연 서열 호르몬의 생물학적 활성 등가물 (그의 합성에 의해 생산된 소분자 엔티티 및 제약상 허용되는 유도체 및 염 포함)을 포함한다.
용어 "성장 인자"는 성장을 촉진하는 단백질을 지칭하고, 예를 들어 간 성장 인자; 섬유모세포 성장 인자; 혈관 내피 성장 인자; 신경 성장 인자, 예컨대 NGF-β; 혈소판-유래 성장 인자; 형질전환 성장 인자 (TGF), 예컨대 TGF-α 및 TGF-β; 인슐린-유사 성장 인자-I 및 -II; 에리트로포이에틴 (EPO); 골유도 인자; 인터페론, 예컨대 인터페론-α, -β, 및 -γ; 및 콜로니-자극 인자 (CSF), 예컨대 대식세포-CSF (M-CSF), 과립구-대식세포-CSF (GM-CSF), 및 과립구-CSF (G-CSF)를 포함한다. 본원에서 사용된 용어 성장 인자는 천연 공급원으로부터 또는 재조합 세포 배양물로부터의 단백질 및 천연 서열 성장 인자의 생물학적 활성 등가물 (그의 합성에 의해 생산된 소분자 엔티티 및 제약상 허용되는 유도체 및 염 포함)을 포함한다.
용어 "인테그린"은 세포가 세포외 매트릭스에 결합하여 반응하도록 하고, 다양한 세포 기능, 예컨대 상처 치유, 세포 분화, 종양 세포의 귀소 및 아폽토시스에 수반되는 수용체 단백질을 지칭한다. 이들은 세포-세포외 매트릭스 및 세포-세포 상호작용에서 수반되는 세포 부착 수용체의 거대 패밀리의 일부이다. 기능성 인테그린은 비-공유결합적으로 결합된, 알파 및 베타로 불리는 2개의 막횡단 당단백질 서브유닛으로 구성된다. 알파 서브유닛 모두는 서로 약간의 상동성을 공유하고, 베타 서브유닛도 마찬가지이다. 수용체는 항상 1개의 알파 쇄 및 1개의 베타 쇄를 함유한다. 예는 알파6베타1, 알파3베타1, 알파7베타1, LFA-1 등을 포함한다. 본원에 사용된 용어 인테그린은 천연 공급원으로부터 또는 재조합 세포 배양물로부터의 단백질 및 천연 서열 인테그린의 생물학적 활성 등가물 (그의 합성에 의해 생산된 소분자 엔티티 및 제약상 허용되는 유도체 및 염 포함)을 포함한다.
본원에서의 목적을 위해, "종양 괴사 인자-알파 (TNF-알파)"는 문헌 [Pennica et al., Nature, 312:721 (1984) 또는 Aggarwal et al., JBC, 260:2345 (1985)]에 기재된 바와 같은 아미노산 서열을 포함하는 인간 TNF-알파 분자를 지칭한다.
본원에서 "TNF-알파 억제제"는 일반적으로 TNF-알파에 결합하여 그의 활성을 중화함으로써 TNF-알파의 생물학적 기능을 어느 정도 억제시키는 작용제이다. 본원에서 특히 고려되는 TNF 억제제의 예는 에타네르셉트 (엔브렐(ENBREL)®), 인플릭시맙 (레미케이드(REMICADE)®) 및 아달리무맙 (휴미라(HUMIRA)™)이다.
"질환-변형 항-류마티스 약물" 또는 "DMARD"의 예는 히드록시클로로퀸, 술파살라진, 메토트렉세이트, 레플루노미드, 에타네르셉트, 인플릭시맙 (경구 및 피하 메토트렉세이트 포함), 아자티오프린, D-페니실라민, 금 염 (경구), 금 염 (근육내), 미노시클린, 시클로스포린, 스타필로코쿠스 단백질 A, 면역흡착제 (그의 염 및 유도체 포함) 등을 포함한다.
"비스테로이드성 항염증 약물" 또는 "NSAID"의 예는 아세틸살리실산, 이부프로펜, 나프록센, 인도메타신, 술린닥, 톨메틴 (그의 염 및 유도체 포함) 등이다.
본원에서 "인테그린 길항제 또는 항체"의 예는 LFA-1 항체, 예컨대 제넨테크로부터 상업적으로 입수가능한 에팔리주맙 (랍티바(RAPTIVA)®), 또는 알파 4 인테그린 항체, 예컨대 비오젠(Biogen)으로부터 입수가능한 나탈리주맙 (안테그렌(ANTEGREN)®), 또는 디아자시클릭 페닐알라닌 유도체 (WO 2003/89410), 페닐알라닌 유도체 (WO 2003/70709, WO 2002/28830, WO 2002/16329 및 WO 2003/53926), 페닐프로피온산 유도체 (WO 2003/10135), 엔아민 유도체 (WO 2001/79173), 프로판산 유도체 (WO 2000/37444), 알칸산 유도체 (WO 2000/32575), 치환된 페닐 유도체 (미국 특허 번호 6,677,339 및 6,348,463), 방향족 아민 유도체 (미국 특허 번호 6,369,229), ADAM 디스인테그린 도메인 폴리펩티드 (미국 2002/0042368), 알파v베타3 인테그린에 대한 항체 (EP 633945), 아자-가교 비시클릭 아미노산 유도체 (WO 2002/02556) 등을 포함한다.
"코르티코스테로이드"는 자연 발생 코르티코스테로이드의 효과를 모방하거나 증대시키는, 스테로이드의 일반적 화학 구조를 갖는 여러 합성 또는 자연 발생 물질 중 임의의 것을 지칭한다. 합성 코르티코스테로이드의 예는 프레드니손, 프레드니솔론 (메틸프레드니솔론 포함), 덱사메타손, 트리암시놀론 및 베타메타손을 포함한다.
용어 "코르티코스테로이드 절약" 또는 "CS"는 또 다른 치료제의 투여로 인한 질환의 치료를 위한, 코르티코스테로이드를 제공받은 환자에서 질환을 치료하기 위해 사용된 코르티코스테로이드의 빈도 및/또는 양의 감소, 또는 그의 제거를 의미한다. "CS 작용제"는 코르티코스테로이드를 제공받은 환자에서 CS를 유발할 수 있는 치료제를 지칭한다.
"포장 삽입물"은, 적응증, 용법, 투여량, 투여, 금기, 포장된 제품과 조합되는 기타 치료 제품, 및/또는 이러한 치료 제품의 사용에 관한 경고 등에 관한 정보를 함유하는, 치료 제품의 상업용 패키지에 관례상 포함되는 지침서를 지칭하기 위해 사용된다.
"초기 노출로부터" 또는 임의의 이전 노출로부터의 특정 시간까지 투여되거나 제공되지 않은 노출은 하나 초과의 용량이 해당 노출에서 투여된다면 제2 또는 이후의 노출을 위한 시간이 이전 노출로부터의 임의의 용량이 투여되는 시간으로부터 측정된다는 것을 의미한다. 예를 들어, 2회 용량이 초기 노출에서 투여되는 경우에, 제2 노출은 제1 또는 제2 용량이 이전 노출 이내에 투여되는 시간으로부터 측정시에 적어도 약 16-54주까지 제공되지 않는다. 유사하게, 3회 용량이 투여되는 경우에, 제2 노출은 이전 노출 이내에 제1, 제2 또는 제3 투여의 시간으로부터 측정될 수 있다. 바람직하게는, "초기 노출로부터"는 제1 투여의 시간으로부터 측정된다.
"의약"은 루푸스 또는 그의 증상 또는 부작용을 치료하기 위한 활성 약물이다.
III. 방법
본 발명은 인터페론 억제제(들)로의 치료를 위해 우수한 후보가 될 자가면역 환자 집단의 진단 및/또는 선택을 위한 조성물 및 방법을 제공한다. 한 실시양태에서, 본 발명은 유효량의 유형 I 인터페론에 결합하는 항체를 투여하는 것을 포함하는 환자에서 루푸스 (예를 들어, SLE)를 치료하는 방법을 제공하며, 여기서 환자는 ENA-이다. 일부 실시양태에서, 본 발명은 유형 I 인터페론에 결합하는 특정 항체를 특정한 투여 요법에 따라 투여하는 것을 포함하는 환자에서 자가면역 질환 (예를 들어, SLE)을 치료하는 방법을 제공한다. 일부 실시양태에서, 본 발명은 유효량의 유형 I 인터페론에 결합하는 항체를 투여하는 것을 포함하는 환자에서 루푸스 (예를 들어, SLE)를 치료하는 방법을 제공하며, 여기서 환자의 기준선 ISM은 건강한 개체의 ISM 이상이다. 일부 실시양태에서, 환자는 ISMlo의 IRG 상태를 갖는다. 항체는 네이키드 항체일 수 있거나 또는 또 다른 분자, 예컨대 방사성 화합물과 같은 세포독성제와 접합될 수 있다. 한 실시양태에서, 본원의 항체는 론탈리주맙이다.
본 발명은 부분적으로 유형 I 인터페론 억제제 (예를 들어, 유형 I 인터페론 항체)의 효능과 관련된 특정한 유전자 (예를 들어, CMPK2, EPSTI1, HERC5, IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합 중 하나 이상) 또는 바이오마커 (예를 들어, 임의의 ENA 또는 dsDNA에 대한 자가항체)의 사용에 기초한다. 따라서, 개시된 방법은 환자를 치료하는데 있어 적절하거나 효과적인 요법을 평가하는데 유용한 데이터 및 정보를 수득하기 위한, 편리하고, 효율적이며, 잠재적으로는 비용면에서도 효과적인 수단을 제공한다. 예를 들어, 샘플을 루푸스 환자로부터 수득할 수 있고, 샘플을 다양한 시험관내 검정으로 검사하여 하나 이상의 바이오마커의 발현 수준이 참조 샘플에서 발현 수준과 비교하여 증가 또는 감소되는지 여부를 결정할 수 있다. 한 실시양태에서, 환자가 ENA-이면, 환자는 유형 I 인터페론 억제제 (예를 들어, 유형 I 인터페론 항체, 예컨대 론탈리주맙)를 포함하는 요법으로의 치료로부터 이익을 얻을 가능성이 있다. 또 다른 실시양태에서, 환자로부터의 샘플에서 CMPK2, EPSTI1, HERC5, IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, 또는 OAS3 중 적어도 1, 2, 3, 4, 5, 6, 7개, 또는 그 초과의 발현 수준이 건강한 개체에서의 발현 수준 이하라면, 환자는 유형 I 인터페론 억제제 (예를 들어, 유형 I 인터페론 항체, 예컨대 론탈리주맙)를 포함하는 요법으로의 치료로부터 이익을 얻을 가능성이 있다.
유전자 또는 바이오마커의 발현 수준/양은 mRNA, cDNA, 단백질, 단백질 단편 및/또는 유전자 카피수를 포함하나 이에 제한되지는 않는, 당업계에 공지된 임의의 적합한 기준에 기초하여 결정될 수 있다.
샘플에서 다양한 유전자 또는 바이오마커의 발현을 여러가지 방법으로 분석할 수 있는데, 이러한 방법 중 많은 것들이 당업계에 공지되어 있고 당업자가 이해하고 있는 것이고, 면역조직화학 및/또는 웨스턴 블롯 분석, 면역침전, 분자 결합 검정, ELISA, ELIFA, 형광 활성화 세포 분류 (FACS) 등, 정량적 혈액 기반 검정 (예를 들어, 혈청 ELISA) (예를 들어, 단백질 발현 수준을 검사하기 위함), 생화학적 효소 활성 검정, 계내 혼성화, 노던 분석 및/또는 mRNA의 PCR 분석 뿐만 아니라 유전자 및/또는 조직 어레이 분석으로 수행될 수 있는 매우 다양한 검정들 중 임의의 1종을 포함하지만 이에 제한되지는 않는다. 유전자 및 유전자 산물의 상태를 평가하기 위한 통상적인 프로토콜은 예를 들어 문헌 [Ausubel et al. eds., 1995, Current Protocols In Molecular Biology] (유닛 2 (노던 블롯팅), 4 (서던 블롯팅), 15 (이뮤노블롯팅) 및 18 (PCR 분석))에서 찾아볼 수 있다. 멀티플렉스화 면역검정, 예컨대 룰즈 베이스드 메디슨(Rules Based Medicine) 또는 메조 스케일 디스커버리(Meso Scale Discovery) (MSD)로부터 입수가능한 것도 사용될 수 있다.
특정 실시양태에서, 샘플에서 유전자 또는 바이오마커의 발현 수준/양이 참조 샘플에서 유전자 또는 바이오마커의 발현 수준/양보다 더 높은 경우, 샘플에서 유전자 또는 바이오마커의 발현 수준/양은 참조 샘플 중의 발현/양과 비교하여 증가된 것이다. 유사하게, 샘플에서 유전자 또는 바이오마커의 발현 수준/양이 참조 샘플에서 유전자 또는 바이오마커의 발현 수준/양보다 낮은 경우, 샘플에서 유전자 또는 바이오마커의 발현 수준/양은 참조 샘플 중의 발현/양과 비교하여 감소된 것이다.
특정 실시양태에서, 샘플은 검정한 RNA 또는 단백질의 양에 있어서의 차이 및 사용된 RNA 또는 단백질 샘플의 품질에 있어서의 변동 둘 다에 대해 정규화된다. 널리 공지된 하우스키핑 유전자, 예컨대 ACTB, GAPDH 등을 비롯한, 특정의 정규화 유전자의 발현을 측정하고 그를 도입함으로써 상기와 같은 정상화를 달성할 수 있다. 대안적으로, 정규화는 분석된 유전자 또는 그의 보다 큰 하위세트 모두의 평균 또는 중간 신호를 기초로 할 수 있다 (전역 정규화 접근법). 유전자마다, 환자 종양 mRNA 또는 단백질의 측정된 정규화 양을 참조 세트에서 확인된 양과 비교한다. 각 환자마다 시험된 종양당 각 mRNA 또는 단백질에 대해 정규화된 발현 수준은 참조 세트에서 측정된 발현 수준의 백분율로서 표현될 수 있다. 분석할 특정한 환자 샘플에서 측정된 발현 수준은 이러한 범위 내의 일부 백분위수에 포함될 것이며, 이는 당업계에 널리 공지된 방법으로 결정될 수 있다.
관심 IRG 및 하우스키핑 유전자의 발현 수준은 자가면역 환자로부터의 생물학적 샘플로부터 측정할 수 있다. IRG의 생성된 검출 데이터 (예를 들어, Ct 데이터)는 DCt 값 (DCt = Ct(ISM 유전자) - Ct (하우스키핑 유전자)을 생성하는 하우스키핑 유전자에 대한 검출 데이터에 대해 정규화될 수 있다. 시험된 IRG의 DCt 값의 평균 값이 계산될 수 있다 (예를 들어, Herc5, Tyk1 및 EPST1에 대한 DCt 값의 3배를 더하고, 9로 나눔). 2명 이상의 건강한 사람으로부터의 생물학적 샘플로부터 동일한 관심 IRG의 발현 수준은 동일한 방법을 이용하여 검출될 수 있고, 건강한 사람 데이터에 대한 평균 값 및 표준 편차가 계산될 수 있다. 대안적으로, 치환 값 (예를 들어, 대조군(들))이 동일한 방법에 대해 발생하였다면, 이러한 값이 건강한 사람을 시험하는 대신에 사용될 수 있다.
자가면역 환자의 평균 DCt 값은 다음과 같이 건강한 사람의 평균 Ct 값과 비교할 수 있다: (1) 역치 값이 설정될 수 있고, 역치 값을 초과한 경우에, 환자는 ISM 높음 스코어 (즉, 1 이상)를 갖는 것으로 간주될 것이고, 역치 값 미만인 경우에, 환자는 ISM 낮음 스코어 (즉, 1 미만)를 갖는 것으로 간주될 것이다; (2) 한 실시양태에서, 역치 값은 건강한 사람 (또는 대조군)의 평균 Ct 값의 값의 1.5배 또는 건강한 사람 (또는 대조군(들))의 평균 값에 비해 2 표준 편차이다.
Ct는 역치 사이클이다. Ct는 반응 내에서 생성된 형광이 미리 정의된 역치 선을 넘는 사이클 수이다.
한 실시양태에서, 모든 실험은 다양한 조직 공급원 (예를 들어, 클론테크(Clontech) (미국 캘리포니아주 마운틴 뷰)로부터의 참조 RNA #636538)으로부터 RNA의 포괄적 혼합물인 참조 RNA에 대해 정규화된다. 또 다른 실시양태에서, 참조 RNA는 트랜스페린 수용체 (TFRC)이다. 동일한 참조 RNA를 각각의 qRT-PCR 운행에 포함시켜서 상이한 실험 운행 사이의 결과 비교를 허용한다.
표적 유전자 또는 바이오마커를 포함하는 샘플은 당업계에 널리 공지된 방법에 의해 수득될 수 있다. 정의 부분을 참조한다. 또한, 요법의 진행은 이러한 신체 샘플을 표적 유전자 또는 유전자 생성물에 대해 시험함으로써 보다 용이하게 모니터링될 수 있다.
특정 실시양태에서, 샘플 내 단백질의 발현은 면역조직화학 ("IHC") 및 염색 프로토콜을 이용하여 검사한다. 조직 절편의 면역조직화학 염색은 샘플 내 단백질의 존재를 평가 또는 검출하기 위한 신뢰할 수 있는 방법으로 밝혀졌다. 면역조직화학 기술은 프로브에 대한 항체를 사용하고, 일반적으로는 발색 또는 형광 방법을 통해 계내에서 세포 항원을 시각화한다.
2가지 일반적 방법; 즉 직접 및 간접 검정을 이용할 수 있다. 첫번째 검정에 따라, 표적 항원에 대한 항체의 결합을 직접 결정한다. 이러한 직접 검정은 추가의 항체 상호작용 없이도 시각화될 수 있는 표지된 시약, 예를 들어 형광 태그 또는 효소-표지된 1차 항체를 사용한다. 전형적인 간접 검정에서는, 미접합 1차 항체가 항원에 결합한 후, 표지된 2차 항체가 상기 1차 항체에 결합한다. 2차 항체가 효소 표지에 접합된 경우, 항원이 시각화되도록 발색 또는 형광 기질을 첨가한다. 여러 2차 항체가 1차 항체 상의 상이한 에피토프와 반응할 수 있기 때문에 신호 증폭이 발생한다.
1차 및/또는 2차 항체는 전형적으로 검출가능한 모이어티로 표지될 것이다. 다수의 표지가 이용가능하고, 이들은 일반적으로 하기 카테고리로 분류될 수 있다:
(a) 방사성동위원소, 예컨대 35S, 14C, 125I, 3H 및 131I. 항체는 예를 들어 문헌 [Current Protocols in Immunology, Volumes 1 and 2, Coligen et al., Ed. Wiley-Interscience, New York, New York, Pubs. (1991)]에 기재된 기술을 이용하여 방사성동위원소로 표지할 수 있고, 방사능은 섬광 계수를 이용하여 측정할 수 있다.
(b) 콜로이드성 금 입자.
(c) 희토류 킬레이트 (유로퓸 킬레이트), 텍사스 레드, 로다민, 플루오레세인, 단실, 리사민, 움벨리페론, 피코크리테린, 피코시아닌 또는 상업적으로 입수가능한 형광단, 이러한 스펙트럼 오렌지7(SPECTRUM ORANGE7) 및 스펙트럼 그린7(SPECTRUM GREEN7) 및/또는 상기 중 임의의 하나 이상의 유도체를 포함하나 이에 제한되지는 않는 형광 표지. 형광 표지는 예를 들어 문헌 [Current Protocols in Immunology, 상기 문헌]에 개시된 기술을 이용하여 항체에 접합될 수 있다. 형광은 형광계를 이용하여 정량화될 수 있다.
(d) 다양한 효소-기질 표지가 이용가능하고, 미국 특허 번호 4,275,149는 이들 중 일부에 대한 개관을 제공한다. 효소는 일반적으로 발색 기질의 화학적 변경을 촉매하며, 이는 다양한 기술을 이용하여 측정할 수 있다. 예를 들어, 효소는 기질에서의 색 변화를 촉매할 수 있고, 이는 분광학적으로 측정할 수 있다. 대안적으로, 효소는 기질의 형광 또는 화학발광을 변경시킬 수 있다. 형광의 변화를 정량화하는 기술은 상기 기재되어 있다. 화학발광 기질은 화학적 반응에 의해 전자적으로 여기된 후에, 측정 (예를 들어, 화학발광계 사용)할 수 있는 광을 방출하거나 또는 에너지를 형광 수용자에게 제공할 수 있다. 효소 표지의 예는 루시페라제 (예를 들어, 반딧불이 루시페라제 및 박테리아 루시페라제; 미국 특허 번호 4,737,456), 루시페린, 2,3-디히드로프탈라진디온, 말레이트 데히드로게나제, 우레아제, 퍼옥시다제, 예컨대 양고추냉이 퍼옥시다제 (HRPO), 알칼리성 포스파타제, β-갈락토시다제, 글루코아밀라제, 리소자임, 사카라이드 옥시다제 (예를 들어, 글루코스 옥시다제, 갈락토스 옥시다제, 및 글루코스-6-포스페이트 데히드로게나제), 헤테로시클릭 옥시다제 (예컨대, 우리카제 및 크산틴 옥시타제), 락토퍼옥시다제, 마이크로퍼옥시다제 등을 포함한다. 효소를 항체에 접합시키는 기술이 [O'Sullivan et al., Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay, in Methods in Enzym. (ed. J. Langone & H. Van Vunakis), Academic press, New York, 73:147-166 (1981)]에 기재되어 있다.
효소-기질 조합의 예는 예를 들어 다음을 포함한다:
(i) 양고추냉이 퍼옥시다제 (HRPO)와 기질로서의 수소 퍼옥시다제 (여기서, 수소 퍼옥시다제는 염료 전구체 (예를 들어, 오르토페닐렌 디아민 (OPD) 또는 3,3',5,5'-테트라메틸 벤지딘 히드로클로라이드 (TMB)를 산화시킴);
(ii) 알칼리성 포스파타제 (AP)와 발색 기질로서의 파라-니트로페닐 포스페이트; 및
(iii) β-D-갈락토시다제 (β-D-Gal)와 발색 기질 (예를 들어, p-니트로페닐-β-D-갈락토시다제) 또는 형광발생 기질 (예를 들어, 4-메틸움벨리페릴-β-D-갈락토시다제).
다수의 다른 효소-기질 조합이 당업자에게 이용가능하다. 이들의 일반적인 검토를 위해, 미국 특허 번호 4,275,149 및 4,318,980을 참조한다. 때때로, 표지는 항체와 간접적으로 접합된다. 당업자는 이를 달성하기 위한 다양한 기술을 알 것이다. 예를 들어, 항체는 비오틴과 접합될 수 있고, 상기 언급된 4가지 넓은 카테고리의 표지 중 임의의 것이 아비딘과 접합될 수도 있고, 또는 그 반대의 경우도 가능하다. 비오틴은 아비딘에 선택적으로 결합하며, 이에 따라 표지는 이러한 간접 방식으로 항체와 접합될 수 있다. 다르게는, 표지와 항체의 간접 접합을 달성하기 위해, 항체는 작은 합텐과 접합되고, 상기 언급된 표지의 상이한 유형 중 하나가 항-합텐 항체와 접합된다. 이에 따라, 표지와 항체의 간접 접합이 달성될 수 있다.
임의적 차단 단계에 따라, 1차 항체가 샘플 중의 표적 단백질 항원에 결합하도록 하기에 충분한 기간 동안 및 적합한 조건 하에 샘플을 1차 항체에 노출시킨다. 이를 달성하기에 적절한 조건은 통상적인 실험으로 결정될 수 있다. 샘플에 대한 항체의 결합 정도는 상기 논의된 검출가능한 표지 중 어느 하나를 사용하여 결정된다. 특정 실시양태에서, 표지는 발색 기질, 예컨대 3,3'-디아미노벤지딘 발색체의 화학적 변경을 촉매하는 효소 표지 (예를 들어, HRPO)이다. 한 실시양태에서, 효소 표지는 1차 항체에 특이적으로 결합하는 항체에 접합된다 (예를 들어, 1차 항체는 토끼 폴리클로날 항체이고, 2차 항체는 염소 항-토끼 항체임).
일부 실시양태에서, 샘플을 항체-바이오마커 복합체 형성에 충분한 조건 하에 상기 바이오마커에 특이적인 항체 (예를 들어, ENA 항원에 대해 자가항체)와 접촉시킨 후에 상기 복합체를 검출할 수 있다. 바이오마커의 존재는 다수의 방법, 예를 들어 혈장 및 혈청을 포함하는 다양한 조직 및 샘플을 검정하기 위한 웨스턴 블롯팅 및 ELISA 절차로 검출할 수 있다. 이러한 검정 포맷을 이용한 광범위한 면역검정 기술이 이용가능하고, 예를 들어 미국 특허 번호 4,016,043, 4,424,279 및 4,018,653을 참조한다. 이들은 비-경쟁적 유형의 단일-부위 및 2-부위 또는 "샌드위치" 검정 뿐만 아니라, 통상적인 경쟁적 결합 검정을 둘 다 포함한다. 또한, 이러한 검정은 표적 바이오마커에 대한 표지된 항체의 직접 결합을 포함한다.
샌드위치 검정은 가장 유용하고 일반적으로 이용되는 검정 중 하나이다. 샌드위치 검정 기술의 수많은 변형이 존재하고, 모두가 본 발명에 포함된다. 간략하게, 전형적인 전방향 검정에서, 비표지된 항체를 고체 기질에 고정시키고, 시험할 샘플을 결합된 분자와 접촉시킨다. 항체-항원 복합체 형성에 충분한 기간 동안의 적합한 인큐베이션 기간 후, 검출가능한 신호를 생성할 수 있는 리포터 분자로 표지되고 항원에 특이적인 2차 항체를 첨가하고, 항체-항원-표지된 항체의 또 다른 복합체 형성에 충분한 시간 동안 인큐베이션한다. 임의의 미반응 물질을 세척해 내고, 항원의 존재를 리포터 분자에 의해 생성된 신호를 관찰하여 결정한다. 결과는 가시적인 신호의 단순 관찰에 의해 정성적일 수도 있고, 또는 공지된 양의 바이오마커를 함유하는 대조군 샘플과의 비교로 정량화할 수도 있다.
정방향 검정의 변형은 결합된 항체에 샘플 및 표지된 항체 둘 다를 동시에 첨가하는 동시 검정을 포함한다. 이들 기술은 용이하게 명백해질 임의의 근소한 변형을 포함하여 당업자에게 공지되어 있다. 전형적인 정방향 샌드위치 검정에서, 바이오마커에 특이성을 갖는 1차 항체는 고체 표면에 공유 또는 수동 결합된다. 고체 표면은 전형적으로 유리 또는 중합체이고, 가장 일반적으로 사용되는 중합체는 셀룰로스, 폴리아크릴아미드, 나일론, 폴리스티렌, 폴리비닐 클로라이드 또는 폴리프로파일렌이다. 고체 지지체는 튜브, 비드, 마이크로플레이트의 디스크의 형태, 또는 면역검정 수행에 적합한 임의의 다른 표면일 수 있다. 결합 과정은 당업계에 공지되어 있고, 일반적으로 가교 공유 결합 또는 물리적 흡착으로 이루어지고, 중합체-항체 복합체는 시험 샘플 제조시에 세척하였다. 이어서, 시험할 샘플의 분취액을 고체 상 복합체에 첨가하고, 항체에 존재하는 임의의 서브유닛의 결합을 허용하기에 적합한 조건 (예를 들어, 실온 내지 40℃, 예컨대 25℃ 내지 32℃ 포함) 하에 충분한 기간 동안 (예를 들어, 2-40분 또는 보다 편리하게는 밤새) 인큐베이션한다. 인큐베이션 기간 후, 항체 서브유닛 고체 상을 세척하여 건조시키고, 바이오마커의 일부에 특이적인 2차 항체와 함께 인큐베이션한다. 2차 항체는 분자 마커에 대한 2차 항체의 결합을 표시하는데 사용되는 리포터 분자에 연결된다.
대안적 방법은 샘플 중의 표적 바이오마커를 고정시킨 후, 상기 고정된 표적을 리포터 분자로 표지될 수도 있고 표지되지 않을 수도 있는 특이적 항체에 노출시키는 것을 포함한다. 표적의 양 및 리포터 분자 신호의 강도에 따라, 결합된 표적은 항체로 직접 표지함으로써 검출할 수 있다. 대안적으로, 1차 항체에 특이적인 제2 표지된 항체를 표적-1차 항체 복합체에 노출시켜 표적-1차 항체-2차 항체의 3원 복합체를 형성시킨다. 상기 복합체는 리포터 분자에 의해 방출되는 신호에 의해 검출된다. 본 명세서에서 사용된 "리포터 분자"는 그의 화학적 성질에 의해 항원 결합된 항체의 검출을 허용하는 분석적으로 확인가능한 신호를 제공하는 분자를 나타낸다. 이러한 유형의 검정에서 가장 일반적으로 사용되는 리포터 분자는 효소, 형광단 또는 방사선핵종 함유 분자 (즉, 방사성동위원소) 및 화학발광 분자이다.
효소 면역검정의 경우에, 효소는 일반적으로 글루타르알데히드 또는 퍼아이오데이트에 의해 2차 항체에 접합된다. 그러나, 용이하게 인지될 바와 같이, 당업자가 용이하게 이용가능한 다양한 여러가지 접합 기술이 존재한다. 통상적으로 사용되는 효소는 특히 양고추냉이 퍼옥시다제, 글루코스 옥시다제, -갈락토시다제 및 알칼리성 포스파타제를 포함한다. 특이적 효소와 함께 사용될 기질은 일반적으로 상응하는 효소에 의한 가수분해시에 검출가능한 색상 변화가 생성되는 것으로서 선택된다. 적합한 효소의 예는 알칼리성 포스파타제 및 퍼옥시다제를 포함한다. 상기한 발색 기질 보다는 형광 생성물을 생성하는 형광 기질을 사용하는 것이 또한 가능하다. 모든 경우에서, 효소 표지된 항체를 1차 항체-분자 마커 복합체에 첨가하여 결합시킨 후에 잉여 시약을 세척해 낸다. 이어서, 적절한 기질을 함유하는 용액을 상기 항체-항원-항체의 복합체에 첨가한다. 기질은 2차 항체에 연결된 효소와 반응하여 정성적인 가시적 신호를 생성할 것이고, 이는 샘플 내에 존재하는 바이오마커의 양을 표시하도록 일반적으로는 분광학적으로 추가로 정량화될 수 있다. 대안적으로, 플루오레세인 및 로다민과 같은 형광 화합물이 이들의 결합 능력을 변경시키지 않으면서 항체에 화학적으로 커플링될 수 있다. 특정한 파장의 광을 사용한 조명으로 활성화될 때, 형광색소 표지 항체는 광 에너지를 흡수하여 분자를 여기가능 상태로 유도한 후, 광학 현미경으로 가시적으로 검출가능한 특징적인 색상의 광을 방출한다. EIA에서와 같이, 형광 표지된 항체는 1차 항체-분자 마커 복합체에 결합하게 된다. 결합되지 않은 시약을 세척해 낸 후, 남아있는 3원 복합체를 적절한 파장의 광에 노출시키고, 관찰된 형광은 관심 분자 마커의 존재를 나타낸다. 면역형광 및 EIA 기술 둘 다 당업계에 널리 확립되어 있다. 그러나, 다른 리포터 분자, 예를 들어 방사성동위원소, 화학발광 또는 생물발광 분자를 사용할 수도 있다.
본 발명의 방법은 또한 샘플에서 CMPK2, EPSTI1, HERC5, IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, 또는 OAS3 및 그의 조합 중 적어도 1, 2, 3, 4, 5, 6, 7개 또는 그 초과의 mRNA의 존재 및/또는 발현을 검사하는 프로토콜을 포함한다. 세포 내의 mRNA의 평가 방법은 널리 공지되어 있고, 예를 들어 상보적 DNA 프로브를 사용하는 혼성화 검정 (예컨대, 하나 이상의 유전자에 특이적인 표지된 리보프로브를 사용하는 계내 혼성화, 노던 블롯 및 관련 기술) 및 다양한 핵산 증폭 검정 (예컨대, 하나 이상의 유전자에 특이적인 상보성 프라이머를 사용하는 RT-PCR, 및 다른 증폭 유형의 검출 방법, 예를 들어 분지형 DNA, SISBA, TMA 등)을 포함한다.
포유동물로부터의 조직 또는 다른 샘플을 노던, 도트 블롯 또는 PCR 분석을 이용하여 mRNA에 대해 편리하게 검정할 수 있다. 예를 들어, RT-PCR 검정, 예컨대 정량적 PCR 검정은 당업계에 널리 공지되어 있다. 일부 실시양태에서, qPCR은 로슈 코바스® 시스템으로 수행된다. 본 발명의 예시적 실시양태에서, 생물학적 샘플에서 표적 mRNA를 검출하는 방법은 적어도 하나의 프라이머를 사용한 역전사에 의해 샘플로부터 cDNA를 생성하는 것; 표적 폴리뉴클레오티드를 센스 및 안티센스 프라이머로서 사용하여 상기와 같이 생산된 cDNA를 증폭시킴으로써 그안의 표적 cDNA를 증폭시키는 것을 포함한다. 또한, 이러한 방법은 생물학적 샘플에서 표적 mRNA의 수준을 결정 (예를 들어, "하우스키핑" 유전자, 예컨대 액틴 패밀리 구성원 또는 GAPDH의 비교 대조군 mRNA 서열 수준을 동시에 검사하여 결정함)하는 하나 이상의 단계를 포함할 수 있다. 임의로, 증폭된 표적 cDNA의 서열을 결정할 수 있다.
본 발명의 임의의 방법은 마이크로어레이 기술에 의해 조직 또는 세포 샘플 중의 mRNA, 예컨대 표적 mRNA를 검사 또는 검출하는 프로토콜을 포함한다. 핵산 마이크로어레이를 이용하여, 시험 및 대조 조직 샘플로부터의 시험 및 대조 mRNA 샘플을 역전사시키고, 표지하여 cDNA 프로브를 생성하였다. 이후, 프로브를 고체 지지체에 고정된 핵산의 어레이에 혼성화시킨다. 어레이는 어레이의 각각의 구성원의 서열 및 위치를 알 수 있도록 구성된다. 예를 들어, 그의 발현이 항혈관신생 요법이 보이는 증가된 또는 감소된 임상적 이익과 서로 관련성이 있는 것인 유전자의 선택물을 고체 지지체 상에 배열할 수 있다. 특정한 어레이 구성원을 갖는 표지된 프로브의 혼성화는 프로브가 유래된 샘플이 그 유전자를 발현한다는 것을 나타낸다. 질환 조직의 차등 유전자 발현 분석은 가치있는 정보를 제공할 수 있다. 마이크로어레이 기술에서는 단일 실험 내에서 수천 개 유전자의 mRNA 발현 프로파일을 평가하기 위해 핵산 혼성화 기술 및 전산화 기술을 이용한다. (예를 들어, 2001년 10월 11일에 공개된 WO 01/75166 참조; (예를 들어, 어레이 제작의 논의에 대해 U.S. 5,700,637, 미국 특허 5,445,934, 및 미국 특허 5,807,522, 문헌 [Lockart, Nature Biotechnology, 14:1675-1680 (1996); Cheung, V.G. et al., Nature Genetics 21(Suppl):15-19 (1999)] 참조)). DNA 마이크로어레이는, 유리 또는 다른 기판에서 직접 합성되거나 이것으로 스팟팅되는 유전자 단편을 함유하는 소형 어레이이다. 수천개의 유전자는 통상적으로 단일 어레이로 나타낸다. 통상적인 마이크로어레이 실험은 1) 샘플로부터 단리된 RNA로부터 형광 표지된 표적의 제조 단계, 2) 표지된 표적의 마이크로어레이로의 혼성화 단계, 3) 어레이의 세척, 염색 및 스캐닝 단계, 4) 스캐닝된 영상의 분석 단계, 및 5) 유전자 발현 프로파일의 생성 단계를 포함한다. 현재, 2가지 주요 유형의 DNA 마이크로어레이가 사용된다: 올리고뉴클레오티드 (통상적으로, 25 내지 70량체) 어레이 및 cDNA로부터 제조된 PCR 생성물을 함유하는 유전자 발현 어레이. 어레이를 형성하는 경우, 올리고뉴클레오티드는 미리 제작되어 표면에 스팟팅되거나, 또는 표면에서 직접 합성될 수 있다 (계내).
아피메트릭스 진칩(Affymetrix GeneChip)® 시스템은, 유리 표면 상에서 올리고뉴클레오티드를 직접 합성하여 제작되는 어레이를 포함하는 상업적으로 입수가능한 마이크로어레이 시스템이다. 프로브/유전자 어레이: 올리고뉴클레오티드 (통상적으로 25량체)는 반도체-기반 포토리소그래피 및 고체 상 화학적 합성 기술의 조합에 의해 유리 웨이퍼 상에서 직접 합성된다. 각각의 어레이는 400,000개 이하의 상이한 올리고를 함유하고, 각각의 올리고는 수백만개의 카피로 존재한다. 올리고뉴클레오티드 프로브는 어레이 상의 공지된 위치에서 합성되기 때문에, 혼성화 패턴 및 신호 강도는 아피메트릭스 마이크로어레이 스위트(Affymetrix Microarray Suite) 소프트웨어에 의해 유전자 동일성 및 상대적인 발현 수준의 면으로 해석될 수 있다. 각각의 유전자는 어레이에서 일련의 상이한 올리고뉴클레오티드 프로브에 의해 나타난다. 각각의 프로브 쌍은 완전 매치 올리고뉴클레오티드 및 미스매치 올리고뉴클레오티드로 이루어진다. 완전 매치 프로브는 특정 유전자에 대해 정확하게 상보적인 서열을 갖기 때문에 유전자 발현을 결정한다. 미스매치 프로브는 중심 염기 위치에서의 단일 염기 치환에 의해 완전 매치 프로브과 상이하여 표적 유전자 전사체의 결합을 방해한다. 이것은 완전 매치 올리고에 대해 측정된 신호에 기여하는 백그라운드 및 비-특이적 혼성화를 결정하는 것을 돕는다. 마이크로어레이 스위트 소프트웨어는 완전 매치 프로브의 혼성화 강도로부터 미스매치 프로브의 혼성화 강도를 감하여 각 프로브 세트에 대한 절대 강도 값 또는 특이적 강도 값을 결정한다. 프로브는 진뱅크 및 다른 뉴클레오티드 정보보관소의 최근 정보를 기초로 선택한다. 서열은 유전자의 3' 말단의 특유한 영역을 인식하는 것으로 생각된다. 진칩 혼성화 오븐 ("회전식" 오븐)은 한번에 64개 이하의 어레이의 혼성화를 수행하기 위해 사용된다. 플루딕스 스테이션은 프로브 어레이의 세척 및 염색을 수행한다. 이는 완벽하게 자동화되어 있고, 4가지 모듈을 함유하며, 각 모듈에는 하나의 프로브 어레이가 들어간다. 각 모듈은 미리 프로그램화 플루딕스 프로토콜을 이용하여 마이크로어레이 스위트 소프트웨어를 통해 독립적으로 제어된다. 스캐너는 공초점 레이저 형광 스캐너이며, 이는 프로브 어레이에 결합된 표지된 cRNA에 의해 방출되는 형광 강도를 측정한다. 마이크로어레이 스위트 소프트웨어에 의한 컴퓨터 워크스테이션은 플루딕스 스테이션 및 스캐너를 제어한다. 마이크로어레이 스위트 소프트웨어는 프로브 어레이에 대해 미리 프로그램화 혼성화, 세척 및 염색 프로토콜을 이용하여 최대 8개의 플루딕스 스테이션을 제어할 수 있다. 또한, 상기 소프트웨어는 혼성화 강도 데이터를 수득하고 이것을 적절한 알고리즘을 이용하여 각 유전자에 대한 존재/부재 신호로 전환한다. 마지막으로, 상기 소프트웨어는 실험들 사이의 비교 분석에 의해 유전자 발현의 변화를 검출하고, 결과를 .txt 파일 형식으로 구성하며, 이를 사용하여 다른 소프트웨어 프로그램으로 추가의 데이터 분석을 수행할 수 있다.
조직 또는 세포 샘플에서 선택된 유전자 또는 바이오마커의 발현은 또한 기능적 또는 활성-기반 검정으로 검사될 수 있다. 예를 들어, 바이오마커가 효소인 경우, 당업계에 공지된 검정을 수행함으로써 조직 또는 세포 샘플에서 주어진 효소 활성의 존재를 결정 또는 검출할 수 있다.
시험 결과에 기초하여 환자의 IRG 상태 (ISMlo 또는 ISMhi)가 보고서에 제공될 수 있다. 보고서는 임의의 형태의 서면 자료 (예를 들어, 종이 또는 디지털 형태, 또는 인터넷) 또는 구두 발표(들) (예를 들어, 사람 (육성) 또는 녹음)일 수 있다. 보고서는 또한 건강 전문가 (예를 들어, 의사)에게 환자가 인터페론 억제제 치료로부터 이익을 얻을 수 있거나 이에 반응할 가능성이 있음을 보여줄 수 있다.
본 발명의 키트는 다수의 실시양태를 갖는다. 특정 실시양태에서, 키트는 용기, 상기 용기 상의 라벨, 및 상기 용기 내에 함유된 조성물을 포함하고; 여기서 조성물은 ENA 항원에 대한 자가항체에 상응하는 하나 이상의 표적 폴리펩티드 서열에 결합하는 하나 이상의 1차 항체, 조성물이 적어도 하나의 유형의 포유동물 세포 중 하나 이상의 표적 단백질의 존재를 평가하는데 사용될 수 있음을 나타내는 용기 상의 라벨, 및 적어도 하나의 유형의 포유동물 세포 중 하나 이상의 표적 단백질의 존재를 평가하는데 항체를 사용하기 위한 지침서를 포함한다. 키트는 조직 샘플을 제조하고 항체 및 프로브를 조직 샘플의 동일한 절편에 적용하기 위한 지시서 및 물질의 세트를 추가로 포함할 수 있다. 키트는 1차 및 2차 항체 둘 다를 포함할 수 있으며, 여기서 2차 항체는 표지, 예를 들어 효소 표지에 접합된다.
한 실시양태에서, 대상체는 루푸스를 치료하기 위한 약물(들), 예컨대 면역억제제(들)로 이전에 치료를 받지 않았고/거나 유형 I 인터페론에 대한 항체로 이전에 치료를 받지 않았다. 또 다른 실시양태에서, 대상체는 루푸스를 치료하기 위한 약물(들)로 이전에 치료를 받았고/거나 이러한 항체로 이전에 치료를 받았다. 또 다른 실시양태에서, 유형 I 인터페론 항체는 루푸스를 치료하기 위해 대상체에게 투여되는 유일한 의약이다. 또 다른 실시양태에서, 유형 I 인터페론 항체는 루푸스를 치료하기 위해 사용되는 의약 중 하나이다. 추가 실시양태에서, 대상체는 류마티스 관절염을 갖지 않는다. 다른 추가 실시양태에서, 대상체는 다발성 경화증을 갖지 않는다. 또 다른 실시양태에서, 대상체는 루푸스 이외의 자가면역 질환을 갖지 않는다. 이 마지막 진술의 목적을 위해, 본원에서 "자가면역 질환"은 개체 자신의 조직 또는 기관으로부터 발생하거나 이에 대해 지시된 질환 또는 장애 또는 그의 증상 또는 징후 또는 이로부터 발생한 상태이다. 한 실시양태에서, 이는 정상 신체 조직 및 항원과 반응성인 항체의 B 세포에 의한 생산으로부터 초래되거나 또는 이에 의해 악화된 상태를 지칭한다. 다른 실시양태에서, 자가면역 질환은 자기 항원 (예를 들어, 핵 항원)으로부터의 에피토프에 특이적인 자가항체의 분비를 수반하는 것이다.
항체는 임의의 적합한 수단, 예컨대 비경구, 국소, 피하, 복강내, 폐내, 비강내, 및/또는 병변내 투여에 의해 투여한다. 비경구 주입은 근육내, 정맥내, 동맥내, 복강내 또는 피하 투여를 포함한다. 경막내 투여가 또한 고려된다. 또한, 항체는 펄스 주입에 의해, 예를 들어 항체의 용량을 감소시키면서 투여하는 것이 적합할 수 있다. 바람직하게는, 투약은 정맥내 또는 피하 및 보다 바람직하게는 정맥내 주입(들)에 의해 이루어진다. 각각의 노출은 동일한 또는 상이한 투여 수단을 이용하여 제공될 수 있다. 한 실시양태에서, 각각의 노출은 정맥내 투여에 의한다. 또 다른 실시양태에서, 각각의 노출은 피하 투여에 의해 제공된다. 또 다른 실시양태에서, 노출은 정맥내 및 피하 투여 둘 다에 의해 제공된다.
한 실시양태에서, 유형 I 인터페론 항체는 정맥내 푸쉬 또는 볼루스 보다는 느린 정맥내 주입으로 투여된다. 예를 들어, 메틸프레드니솔론 (예를 들어, 약 80-120 mg i.v., 보다 바람직하게는 약 100 mg i.v.)은 유형 I 인터페론 항체의 임의의 주입 약 30분 전에 투여된다. 유형 I 인터페론 항체는, 예를 들어 전용 선을 통해 주입된다.
항말라리아제, 면역억제제, 코르티코스테로이드, NSAID, 스타틴, 세포독성제, 화학요법제, 시토카인, 시토카인 길항제 또는 항체, 성장 인자, 호르몬, 인테그린, 인테그린 길항제, 또는 항체와 같은 제2 의약을 유형 I 인터페론 항체와 투여할 수 있다.
예를 들어, 항체는 화학요법제, 인터페론 부류 약물, 예컨대 IFN-베타-1a (레비프(REBIF)® 및 아보넥스(AVONEX)®) 또는 IFN-베타-1b (베타세론(BETASERON)®), 올리고펩티드, 예컨대 글라티라머 아세테이트 (코팍손(COPAXONE)®), 세포독성제 (예컨대, 미톡산트론 (노반트론(NOVANTRONE)®), 메토트렉세이트, 시클로포스파미드, 클로람부실 및 아자티오프린), 정맥내 이뮤노글로불린 (감마 글로불린), 림프구-고갈 요법 (예를 들어, 미톡산트론, 시클로포스파미드, 캄파트(CAMPATH)™ 항체, 항-CD4, 클라드리빈, 전신 조사, 골수 이식), 코르티코스테로이드 (예를 들어, 메틸프레드니솔론, 프레드니손, 예컨대 저용량 프레드니손, 덱사메타손, 또는 글루코코르티코이드, 예를 들어 관절 주사를 통함, 전신 코르티코스테로이드 요법 포함), 비-림프구-고갈 면역억제제 요법 (예를 들어, MMF 또는 시클로스포린), "스타틴" 부류의 콜레스테롤-저하 약물 (세리바스타틴 (베이콜(BAYCOL)™), 플루바스타틴 (레스콜(LESCOL)™), 아토르바스타틴 (리피토르(LIPITOR)™), 로바스타틴 (메바코르(MEVACOR)™), 프라바스타틴 (프라바콜(PRAVACHOL)™), 및 심바스타틴 (조코르(ZOCOR)™) 포함), 에스트라디올, 테스토스테론 (임의로 상승된 투여량; 문헌 [Stuve et al. Neurology 8:290-301 (2002)]), 호르몬-대체 요법, 항말라리아 약물, 예컨대 예를 들어 히드록시클로로퀸, 클로로퀸, 또는 퀴나크린, 속발성 또는 루푸스와 관련된 증상 (예를 들어, 경직, 실금, 통증, 피로)에 대한 치료, TNF 억제제, DMARD, NSAID, 항-인테그린 항체 또는 길항제, 혈장분리반출술, 레보티록신, 시클로스포린 A, 소마타스타틴 유사체, 시토카인, 항-시토카인 길항제 또는 항체, 항대사물, 면역억제제, 재활 수술, 방사성아이오딘, 갑상선절제술, 또 다른 B-세포 표면 길항제/항체 등과 조합될 수 있다.
이러한 제2 의약의 보다 구체적인 예는, 유형 I 인터페론 항체이 제1 의약으로 불리는 경우에, 화학요법제, 세포독성제, 항-인테그린, 항말라리아 약물, 예컨대 예를 들어 히드록시클로로퀸, 클로로퀸 또는 퀴나크린, 감마 글로불린, 항-CD4, 클라드리빈, 코르티코스테로이드, MMF, 시클로스포린, 스타틴 부류의 콜레스테롤-저하 약물, 에스트라디올, 테스토스테론, 호르몬-대체 약물, TNF 억제제, DMARD, NSAID, 레보티록신, 시클로스포린 A, 소마타스타틴 유사체, 시토카인 길항제 또는 시토카인-수용체 길항제, 항대사물, 및/또는 면역억제제를 포함한다.
이러한 제2 의약은 일반적으로 동일한 투여량으로 상기 사용된 투여 경로로 사용되거나 또는 약 1 내지 99%의 상기 사용된 투여량으로 사용된다. 이러한 제2 의약이 일단 사용된다면, 이에 의해 유발되는 부작용을 없애거나 감소시키기 위해, 이들은 IFN 항체가 존재하지 않는 경우보다 더 적은 양으로 사용되거나, 특히 항체와의 초기 투여를 지나 후속 투여로 사용되는 것이 바람직하다.
제2 의약이 항체 노출과 함께 유효량으로 투여되는 경우에, 이는 임의의 노출과 함께, 예를 들어 오직 1회의 노출과 함께, 또는 1회 초과의 노출과 함께 투여할 수 있다. 한 실시양태에서, 제2 의약은 초기 노출과 함께 투여된다. 또 다른 실시양태에서, 제2 의약은 초기 및 제2 노출과 함께 투여된다. 추가 실시양태에서, 제2 의약은 모든 노출과 함께 투여된다.
조합 투여는 개별 제제 또는 단일 제약 제제를 사용하는 공-투여 (공동 투여), 및 임의의 순서로의 연속 투여를 포함하고, 이 경우에 바람직하게는 양쪽 (또는 모든) 활성제가 동시에 생물학적 활성을 발휘하는 기간이 존재한다. 바람직한 실시양태에서, 초기 노출 후에, 프레드니손 및 시클로포스파미드와 같은 부작용을 갖는 작용제가 대상체에게 노출되는 것을 감소시키기 위해 (특히, 작용제가 코르티코스테로이드인 경우에) 이러한 작용제의 양은 감소되거나 제거된다. 또 다른 실시양태에서, 제2 의약의 양은 감소되거나 제거되지 않는다.
한 실시양태에서, 항말라리아제 또는 화학요법제는 초기 노출, 보다 바람직하게는 코르티코스테로이드, 메토트렉세이트, 시클로포스파미드, 히드록시클로로퀸, 클로로퀸, 퀴나크린, 아자티오프린, 미코페놀레이트 모페틸 또는 6-메르캅토퓨린과 함께 투여된다. 또 다른 측면에서, 면역억제제, 항말라리아제 또는 화학요법제는 후속 노출과 함께 투여되지 않거나, 초기 노출보다 적은 양으로 투여된다. 그러나, 이러한 작용제는 임의로 초기 노출에서와 동일하거나 유사한 양으로, 모든 노출을 포함하여 1회 초과의 노출과 함께 투여된다.
코르티코스테로이드, 예컨대 메틸프레드니솔론 및/또는 프레드니손은 유형 I 인터페론 항체 전에 및/또는 이와 함께 대상체에게 투여될 수 있다. 추가로 또는 대안적으로, MMF는 바람직하게는 초기 항체 노출과 함께, MMF의 병행 투여로 투여되고, 코르티코스테로이드가 특히 바람직하다. 바람직하게는, MMF는 초기에 분할 용량 (3x/일)으로 약 1500 mg/일에 유형 I 인터페론 항체와 제공되고, 대상체는 허용되는 바와 같이 약 제4주까지 분할 용량 (3x/일)으로 약 3g/일의 표적 용량까지 적정된다. 용량의 감소가 필요하면, 감소는 약 250-500 mg 감량으로 허용될 것이다. 또 다른 측면에서, 시클로포스파미드는 초기 항체 노출과 함께 코르티코스테로이드의 존재 또는 부재 하에 대상체에게 투여될 수 있다. 시클로포스파미드가 투여된다면, 이는 바람직하게는 제2 노출과 함께 투여되지 않거나, 초기 노출과 함께 사용되는 것보다 낮은 양으로 제2 노출과 함께 투여된다. 시클로포스파미드가 제3 또는 이후의 노출과 함께 투여되지 않는 것이 또한 바람직하다.
IV. 유형 I 인터페론에 대해 지시된 항체
당업계에 공지된 임의의 유형 I 인터페론 항체가 본원에 기재된 방법에 사용될 수 있다. 예를 들어, 인터페론 α의 여러 하위유형에 결합하는 항체는 당업계에 공지되어 있다. 이러한 항체의 비제한적 예는 예를 들어, 미국 특허 번호 7,087,726 (제넨테크, 인크.) 및 미국 특허 출원 공개 번호 2007/0014724 (메다렉스(Medarex))에서 찾아볼 수 있다. 예를 들어, 한 실시양태에서, 본 발명에 사용될 수 있는 항-IFNα 항체는 미국 특허 번호 7,087,726의 실시예 1 및 실시예 2에 개시된 임의의 것 (예를 들어, 표 3 및 표 4에 개시된 것, 및/또는 칼럼 56 제25-54행 상의 표제 "물질의 기탁"에 개시된 것 포함)이고, 미국 특허 번호 7,087,726에 개시된 바와 같은 서열 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 및/또는 14를 포함할 수 있고, (이미 키메라, 인간화 또는 인간 버전이 아닌 경우에) 이들 항체의 키메라, 인간화 또는 인간 버전을 추가로 포함할 수 있고, 그의 단편 또는 유도체를 추가로 포함할 수 있다.
다른 실시양태에서, 본 발명에 사용될 수 있는 항-IFNα 항체는 미국 특허 출원 공개 번호 2007/0014724에 개시된 임의의 것 (예를 들어, 실시예 1 및/또는 11에 개시된 것, 및/또는 미국 특허 출원 공개 번호 2007/0014724에 개시된 바와 같은 서열 1 내지 30에 개시된 것 포함)이고, (이미 키메라, 인간화 또는 인간 버전이 아닌 경우에) 이들 항체의 키메라, 인간화 또는 인간 버전을 추가로 포함할 수 있고, 그의 단편 또는 유도체를 추가로 포함할 수 있다. 예를 들어, 일부 실시양태에서, 항-IFNα 항체는 13H5의 IgG1 항체 이소형 및 그의 친화도 성숙 변이체 (예를 들어, 미국 특허 WO 2008/070135 (메드이뮨(MedImmune)) 참조)일 수 있다.
일부 실시양태에서, 항-인간 IFN-α 모노클로날 항체는 적어도 인간 IFN-α 하위유형 IFN-α1, IFN-α 2, IFN-α4, IFN-α5, IFN-α8, IFN-α10 및 IFN-α21에 결합하여 그의 생물학적 활성을 중화한다. 추가 측면에서, 항-인간 IFN-α 모노클로날 항체는 모든 인간 IFN-α 하위유형에 결합하여 그의 생물학적 활성을 중화한다. 특정 실시양태에서, 인간 IFN-α 모노클로날 항체는 해당 인간 IFN-α의 생물학적 활성을 유의하게 감소시키거나 제거할 수 있다. 한 실시양태에서, 인간 IFN-α 모노클로날 항체는 대상체 인간 IFN-α의 생물학적 활성의 적어도 60%, 또는 적어도 70%, 바람직하게는 적어도 75%, 보다 바람직하게는 적어도 80%, 보다 더 바람직하게는 적어도 85%, 보다 더 바람직하게는 적어도 90%, 보다 더 바람직하게는 적어도 95%, 가장 바람직하게는 적어도 99%를 중화할 수 있다. 또 다른 실시양태에서, 인간 IFN-α 생물학적 활성-중화 모노클로날 항체는 인간 IFN-β의 상응하는 생물학적 활성을 중화하지 않는다. 검정 및 중화 검정은 당업계에 널리 공지되어 있다. 예를 들어, 원하는 결합 및 중화 특성을 갖는 항체에 대한 스크리닝에 유용한 검정에 대해 미국 특허 번호 7,087,726을 참조한다.
특정 실시양태에서, 인터페론 α의 특정 하위유형, 또는 하위유형의 조합의 활성을 변경하는 것이 바람직할 수 있다. 따라서, 한 실시양태에서, 항-인터페론 α 항체는 α2a 및/또는 α2b 하위유형을 포함할 수 있는, 적어도 인터페론 α 하위유형 α2에 선택적으로 결합한다. 또 다른 실시양태에서, 항-인터페론 α 항체는 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14, α16, α17 또는 α21로부터 선택된 적어도 하나의 인터페론 α 하위유형에 선택적으로 결합한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α 14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14, α16 및 α17에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14 및 α16에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13 및 α14에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10 및 α13에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8 및 α10에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7 및 α8에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6 및 α7에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5 및 α6에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4 및 α5에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2 및 α4에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1 및 α2에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 및 α1에 선택적으로 결합한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α2, α4, α5, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α4, α5, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α5, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α21에 선택적으로 결합한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α4, α5, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α5, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14, α16 및 α21에 선택적으로 결합한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α4, α5, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α5, α6, α7, α8, α10, α13, α 14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1 및 α21에 선택적으로 결합한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1 및 α2에 선택적으로 결합한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α10, α13, α14, α 6, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2 및 α4에 선택적으로 결합한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4 및 α5에 선택적으로 결합한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α14, α16, α17 및 α21에 선택적으로 결합한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α17 및 α21에 선택적으로 결합한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5 및 α6에 선택적으로 결합한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6 및 α7에 선택적으로 결합한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7 및 α8에 선택적으로 결합한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8 및 α10에 선택적으로 결합한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10 및 α13에 선택적으로 결합한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14, α17 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13 및 α14에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14, α16 및 α21에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14 및 α16에 선택적으로 결합한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α8, α10 및 α21에 선택적으로 결합한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α2에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α4에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α5에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α6에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α7에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α8에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α10에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α13에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α14에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α16에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α17에 선택적으로 결합한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α21에 선택적으로 결합한다.
특정 실시양태에서, 특정 IFNa 하위유형, 또는 IFNα 하위유형의 조합에 선택적으로 결합하여 중화하는 본 발명의 항-IFNα 항체를 갖는 것인 바람직할 것이다. 인터페론 중화 검정은 당업계에 널리 공지되어 있다.
일부 실시양태에서, 항-IFN-α 항체가 IFN-α의 수용체에 대한 결합을 차단하는 능력은 검정에서 동일한 농도의 비관련 대조군 항체의 IFNAR2에의 IFN-α 결합에 대한 효과와 비교하여 특정 농도의 항체가 경쟁 결합 검정에서 IFNAR2에 대한 IFN-α의 결합을 감소시키거나 제거하는 특성 또는 능력으로 정의된다. 바람직하게는, 항-IFN-α 항체의 차단이 IFN-α의 IFNAR2에 대한 결합을 비관련 대조군 항체와 비교하여 적어도 약 50%, 또는 적어도 약 55%, 또는 적어도 약 60%, 또는 적어도 약 65%, 또는 적어도 약 70%, 또는 적어도 약 75%, 또는 적어도 약 80%, 또는 적어도 약 85%, 또는 적어도 약 90%, 또는 적어도 약 95%, 또는 적어도 약 99% 감소시킨다.
따라서, 한 실시양태에서, 항-인터페론 α 항체는 α2a 및/또는 α2b 하위유형을 포함할 수 있는 적어도 인터페론 α 하위유형 α2에 선택적으로 결합하여 중화한다. 또 다른 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14, α16, α17 또는 α21에 선택적으로 결합하여 중화한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14, α16 및 α17에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14 및 α16에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13 및 α14에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10 및 α13에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8 및 α10에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7 및 α8에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6 및 α7에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5 및 α6에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4 및 α5에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2 및 α4에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1 및 α2에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 및 α1에 선택적으로 결합하여 중화한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α2, α4, α5, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α4, α5, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α5, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α21에 선택적으로 결합하여 중화한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α4, α5, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α5, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14, α16 및 α21에 선택적으로 결합하여 중화한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α4, α5, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α5, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1 및 α21에 선택적으로 결합하여 중화한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1 및 α2에 선택적으로 결합하여 중화한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2 및 α4에 선택적으로 결합하여 중화한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4 및 α5에 선택적으로 결합하여 중화한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α14, α1, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5 및 α6에 선택적으로 결합하여 중화한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6 및 α7에 선택적으로 결합하여 중화한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2. α4, α5, α6, α7, α8, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7 및 α8에 선택적으로 결합하여 중화한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8 및 α10에 선택적으로 결합하여 중화한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10 및 α13에 선택적으로 결합하여 중화한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14, α16, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14, α17 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13 및 α14에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14, α16 및 α21에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α6, α7, α8, α10, α13, α14 및 α16에 선택적으로 결합하여 중화한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1, α2, α4, α5, α8, α10 및 α21에 선택적으로 결합하여 중화한다.
한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α1에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α2에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α4에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α5에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α6에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α7에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α8에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α10에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α13에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α14에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α16에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α17에 선택적으로 결합하여 중화한다. 한 실시양태에서, 항-인터페론 α 항체는 적어도 인터페론 α 하위유형 α21에 선택적으로 결합하여 중화한다.
특정 실시양태에서, 항-인터페론 α 항체는 KIRA 검정에 의해 결정시에 IFN-α 결합으로 인한 IFNAR1/IFNAR2 수용체 복합체의 티로신 인산화를 적어도 약 60%, 또는 적어도 70%, 바람직하게는 적어도 75%, 보다 바람직하게는 적어도 80%, 보다 더 바람직하게는 적어도 85%, 보다 더 바람직하게는 적어도 90%, 보다 더 바람직하게는 적어도 95%, 가장 바람직하게는 적어도 99% 감소시킬 수 있다.
일부 실시양태에서, 항-인간 IFN-α 모노클로날 항체는 하기 HVR을 포함한다:
(a) 식 RASQSVSTSSYSYMH (서열 1)의 L1;
(b) 식 YASNLES (서열 2)의 L2; 및
(c) 식 QHSWGIPRTF (서열 3)의 L3; 및/또는
(d) 식 GYTFTEYIIH (서열 4)의 H1;
(e) 식 SINPDYDITNYNQRFKG (서열 5)의 H2; 및
(f) 식 WISDFFDY (서열 6)의 H3.
특정 실시양태에서, 항-인간 IFN-α 모노클로날 항체는 그의 중쇄 및 경쇄 가변 도메인에 하기의 아미노산 서열을 포함한다: 각각
일부 실시양태에서, 항-인간 IFN-α 모노클로날 항체는 론탈리주맙으로 지칭되는 USAN 협회에 의해 채택된 일반명을 갖는 항-인간 IFN-α 모노클로날 항체와 동일한 아미노산 서열을 갖는다. 다른 실시양태에서, 항-인간 IFN-α 모노클로날 항체는 론탈리주맙에 대해 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 또는 적어도 99%인 아미노산 서열 동일성을 갖는다. 미국 특허 번호 7,087,726을 참조한다. 특정 실시양태에서, 항-인간 IFN-α 모노클로날 항체는 론탈리주맙이다. 일부 실시양태에서, 항-인간 IFN-α 모노클로날 항체는 CAS 948570-30-7에 개시된 바와 같은 아미노산 서열을 갖는다.
일부 실시양태에서, 항-인간 IFN-α 모노클로날 항체는 하기 서열에 의해 코딩되는 HVR을 포함한다:
(a) 식 AGGGCCAGTC AGAGTGTTAG CAGCACCTAC TTAGCC (서열 9)의 L1;
(b) 식 GGTGCATCCA GCAGGGCCAC T (서열 10)의 L2;
(c) 식 CAGCAGTATG GTAGCTCACC TCGGACG (서열 11)의 L3;
(d) 식 AGCTATAGTA TCAGC (서열 12)의 H1;
(e) 식 AATGGTAACA CAAACTATGC ACAGAAGTTC CAGGGC (서열 13)의 H2; 및
(f) 식 GATCCCATAG CAGCAGGCTA C (서열 14)의 H3.
일부 실시양태에서, 항-인간 IFN-α 모노클로날 항체는 하기 서열의 HVR을 포함한다:
(a) 식 RASQSVSSTYLA (서열 15)의 L1;
(b) 식 GASSRAT (서열 16)의 L2;
(c) 식 QQYGSSPRT (서열 17)의 L3;
(d) 식 SYSIS (서열 18)의 H1;
(e) 식 WISVYNGNTNYAQKFQG (서열 19)의 H2; 및
(f) 식 DPIAAGY (서열 20)의 H3.
일부 실시양태에서, 항-인간 IFN-α 모노클로날 항체는 US2007-0014724의 도 1a 및 b에 도시된 바와 같은 HVR (그 안에서 CDR로 라벨링됨)을 포함한다.
특정 실시양태에서, 항-인간 IFN-α 모노클로날 항체는 그의 중쇄 및 경쇄 가변 도메인에서 하기의 아미노산 서열을 포함한다: 각각
일부 실시양태에서, 항-인간 IFN-α 모노클로날 항체는 시팔리무맙으로 지칭되는 USAN 협회에 의해 채택된 일반명을 갖는 항-인간 IFN-α 모노클로날 항체와 동일한 아미노산 서열을 갖는다. 다른 실시양태에서, 항-인간 IFN-α 모노클로날 항체는 시팔리무맙에 대해 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 또는 적어도 99%인 아미노산 서열 동일성을 갖는다. 특정 실시양태에서, 항-인간 IFN-α 모노클로날 항체는 시팔리무맙이다. 일부 실시양태에서, 항-인간 IFN-α 모노클로날 항체는 CAS 1006877-41-3에 개시된 바와 같은 아미노산 서열을 갖는다.
V. 항체의 생산
본 발명의 방법 및 제조품은 유형 I 인터페론 (예를 들어, 인터페론 α 포함)에 결합하는 항체를 사용하거나 혼입시킬 수 있다. 따라서, 이러한 항체를 생성하기 위한 방법은 여기에 기재될 것이다.
항체(들)의 생산 또는 스크리닝에 사용될 유형 I 인터페론 항원은 예를 들어 원하는 에피토프를 함유하는, 가용성 형태의 유형 I 인터페론, 또는 그의 부분일 수 있다. 대안적으로 또는 추가로, 그의 세포 표면에서 유형 I 인터페론을 발현하는 세포는 항체(들)의 생성 또는 스크리닝에 사용될 수 있다. 항체의 생성에 유용한 다른 형태의 유형 I 인터페론은 당업자에게 명백할 것이다.
본 발명에 따라 사용되는 항체의 생산을 위한 예시적인 기술을 이어서 설명한다.
(i) 폴리클로날 항체
폴리클로날 항체는 바람직하게는 관련 항원 및 아주반트의 다중 피하 (sc) 또는 복강내 (ip) 주사에 의해 동물에서 생성시킬 수 있다. 이관능성 또는 유도체화제, 예를 들어 말레이미도벤조일 술포숙신이미드 에스테르 (시스테인 잔기를 통한 접합), N-히드록시숙신이미드 (리신 잔기를 통함), 글루타르알데히드, 숙신산 무수물, SOCl2, 또는 R1N=C=NR (여기서, R 및 R1은 상이한 알킬 기임)을 사용하여, 면역화될 종에서 면역원성인 단백질, 예를 들어 키홀 림펫 헤모시아닌, 혈청 알부민, 소 티로글로불린 또는 대두 트립신 억제제에 관련 항원을 접합시키는 것이 유용할 수 있다.
예를 들어 단백질 또는 접합체 100 μg 또는 5 μg (각각, 토끼 또는 마우스의 경우)을 3 부피의 프로인트 완전 아주반트와 합하고, 상기 용액을 다중 부위에 피내로 주사함으로써, 동물을 항원, 면역원성 접합체 또는 유도체에 대해 면역화한다. 1개월 후에 프로인트 완전 아주반트 내의 펩티드 또는 접합체를 원래 양의 1/5 내지 1/10으로 다중 부위에 피하 주사하여 동물을 부스팅한다. 7 내지 14일 후, 동물에서 채혈하여, 혈청을 항체 역가에 대해 검정한다. 역가가 정체기에 도달할 때까지 동물을 부스팅한다. 바람직하게는, 상이한 단백질에 및/또는 상이한 가교 시약을 통해 접합되었으나 동일한 항원의 접합체로 동물을 부스팅한다. 접합체는 또한 재조합 세포 배양에서 단백질 융합체로서 제조될 수 있다. 또한, 명반과 같은 응집제를 적절하게 사용하여 면역 반응을 증진시킨다.
(ii) 모노클로날 항체
모노클로날 항체는 실질적으로 균질한 항체 집단, 즉 이러한 집단을 구성하는 개별 항체는 모노클로날 항체의 생산 동안에 유발될 수 있는 가능한 변이체 (이러한 변이체는 일반적으로 미량으로 존재함)를 제외하고는 동일하고/거나 동일한 에피토프와 결합하는 집단으로부터 수득한다. 따라서, 수식어 "모노클로날"은 개별적인 또는 폴리클로날 항체의 혼합물이 아닌 것으로서의 항체의 특징을 나타낸다.
예를 들어, 모노클로날 항체는 문헌 [Kohler et al., Nature, 256:495 (1975)]에 처음 기재된 하이브리도마 방법에 의해 제조할 수도 있고, 또는 재조합 DNA 방법 (미국 특허 번호 4,816,567)으로 제조할 수도 있다.
하이브리도마 방법에서, 마우스 또는 다른 적절한 숙주 동물, 예를 들어 햄스터는 면역화에 사용된 단백질에 특이적으로 결합하는 항체를 생성하거나 생성할 수 있는 림프구를 유발하기 위해 상기 기재된 바와 같이 면역화된다. 대안적으로, 림프구를 시험관내에서 면역화시킬 수 있다. 이어서, 적합한 융제, 예컨대 폴리에틸렌 글리콜을 사용하여 림프구를 골수종 세포와 융합시켜 하이브리도마 세포를 형성한다 (문헌 [Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)]).
이와 같이 제조된 하이브리도마 세포를, 바람직하게는 융합되지 않은 모 골수종 세포의 성장 또는 생존을 억제하는 하나 이상의 물질을 함유하는 적합한 배양 배지에 시딩하여 성장시킨다. 예를 들어, 모 골수종 세포에 하이포크산틴 구아닌 포스포리보실 트랜스퍼라제 (HGPRT 또는 HPRT) 효소가 결핍된 경우에, 하이브리도마용 배양 배지는 전형적으로 하이포크산틴, 아미노프테린 및 티미딘을 포함할 것이며 (HAT 배지), 이러한 물질들은 HGPRT-결핍 세포의 성장을 방지한다.
바람직한 골수종 세포는 효율적으로 융합되고, 선택된 항체-생산 세포에 의한 항체의 안정한 고수준 생산을 지지하고, 배지, 예컨대 HAT 배지에 감수성인 것이다. 특히 바람직한 골수종 세포주는 뮤린 골수종 세포주, 예컨대 미국 캘리포니아주 샌디에고 소재의 솔크 인스티튜트 셀 디스트리뷰션 센터(Salk Institute Cell Distribution Center)로부터 입수가능한 MOPC-21 및 MPC-11 마우스 종양 및 미국 메릴랜드주 록빌 소재의 아메리칸 타입 컬쳐 콜렉션(American Type Culture Collection)으로부터 입수가능한 SP-2 또는 X63-Ag8-653 세포로부터 유래된 것이다. 인간 골수종 및 마우스-인간 이종골수종 세포주는 또한 인간 모노클로날 항체 생산과 관련하여 기재된 바와 같다 (문헌 [Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)]).
하이브리도마 세포가 성장하는 배양 배지를 항원에 대해 지시된 모노클로날 항체의 생산에 대해 검정한다. 바람직하게는, 하이브리도마 세포에 의해 생산되는 모노클로날 항체의 결합 특이성을 면역침전 또는 시험관내 결합 검정, 예컨대 방사성면역검정 (RIA) 또는 효소-연결된 면역흡착 검정 (ELISA)에 의해 결정한다.
모노클로날 항체의 결합 친화도는 예를 들어 문헌 [Munson et al., Anal. Biochem., 107:220 (1980)]의 스캐차드(Scatchard) 분석으로 결정할 수 있다.
바람직한 특이성, 친화도 및/또는 활성의 항체를 생산하는 하이브리도마 세포를 확인한 후, 클론을 한계 희석 절차에 의해 서브클로닝하고, 표준 방법에 의해 성장시킬 수 있다 (문헌 [Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)]). 이러한 목적에 적합한 배양 배지는 예를 들어 D-MEM 또는 RPMI-1640 배지를 포함한다. 또한, 하이브리도마 세포가 동물에서 복수 종양으로서 생체내에서 성장될 수 있다.
서브클론에 의해 분비된 모노클로날 항체는 종래의 이뮤노글로불린 정제 절차, 예컨대 예를 들어, 단백질 A-세파로스(A-SEPHAROSE)™ 가교 아가로스, 히드록실아파타이트 크로마토그래피, 겔 전기영동, 투석, 또는 친화성 크로마토그래피에 의해 배양 배지, 복수액 또는 혈청으로부터 적합하게 분리된다.
모노클로날 항체를 코딩하는 DNA는 통상의 절차 (예를 들어, 뮤린 항체의 중쇄 및 경쇄를 코딩하는 유전자에 특이적으로 결합할 수 있는 올리고뉴클레오티드 프로브 사용)를 이용하여 용이하게 단리 및 서열분석된다. 하이브리도마 세포는 이러한 DNA의 바람직한 공급원으로 제공된다. 일단 단리되면, DNA를 발현 백터 내로 넣을 수 있고, 이후에 이를 달리 이뮤노글로불린 단백질을 생산하지 않는 숙주 세포, 예컨대 이. 콜라이(E. coli) 세포, 원숭이 COS 세포, 차이니즈 햄스터 난소 (CHO) 세포 또는 골수종 세포 내로 형질감염시켜, 재조합 숙주 세포에서의 모노클로날 항체의 합성을 달성한다. 항체를 코딩하는 DNA의 박테리아 내 재조합 발현에 대한 종설 논문은 문헌 [Skerra et al., Curr. Opinion in Immunol., 5:256-262 (1993) 및 Plueckthun, Immunol. Revs., 130:151-188 (1992)]을 포함한다.
추가 실시양태에서, 항체 또는 항체 단편을 문헌 [McCafferty et al., Nature, 348:552-554 (1990)]에 기재된 기술을 이용하여 생성된 항체 파지 라이브러리로부터 단리할 수 있다. 문헌 [Clackson et al., Nature, 352:624-628 (1991) 및 Marks et al., J. Mol. Biol., 222:581-597 (1991)]에는 파지 라이브러리를 사용하여 뮤린 및 인간 항체를 각각 단리하는 방법이 기재되어 있다. 이후의 간행물은 쇄 셔플링에 의한 고친화도 (nM 범위) 인간 항체의 생산 (문헌 [Marks et al., Bio/Technology, 10:779-783 (1992)]), 뿐만 아니라 매우 큰 파지 라이브러리를 구축하기 위한 전략으로서의 조합 감염 및 생체내 재조합 (문헌 [Waterhouse et al., Nuc. Acids. Res., 21:2265-2266 (1993)])을 기재한다. 따라서, 이러한 기술은 모노클로날 항체의 단리를 위한 전통적인 모노클로날 항체 하이브리도마 기술에 대한 실행가능한 대안이다.
DNA는 또한 예를 들어 상동성 뮤린 서열 대신에 인간 중쇄 및 경쇄 불변 도메인에 대한 코딩 서열을 치환시키거나 (미국 특허 번호 4,816,567; 문헌 [Morrison, et al., Proc. Natl Acad. Sci. USA, 81:6851 (1984)]), 또는 이뮤노글로불린 코딩 서열에 비-이뮤노글로불린 폴리펩티드에 대한 코딩 서열의 전부 또는 일부를 공유 연결함으로써 변형시킬 수 있다.
전형적으로, 이같은 비-이뮤노글로불린 폴리펩티드가 항체의 불변 도메인을 치환하거나, 또는 항체의 한 항원-결합 부위의 가변 도메인을 치환하여 항원에 대한 특이성을 갖는 한 항원-결합 부위 및 상이한 항원에 대해 특이성을 갖는 또 다른 항원-결합 부위를 포함하는 키메라 2가 항체가 생성된다.
(iii) 인간화 항체
비-인간 항체를 인간화하는 방법은 당업계에 기재되어 있다. 바람직하게는, 인간화 항체는 비-인간 공급원으로부터 도입된 1개 이상의 아미노산 잔기를 갖는다. 이들 비-인간 아미노산 잔기는 종종 "유입" 잔기라 지칭되고, 전형적으로는 "유입" 가변 도메인으로부터의 것이다. 인간화는 본질적으로 인간 항체의 상응하는 서열을 초가변 영역 서열로 대체함으로써 윈터(Winter) 및 동료들의 방법 (문헌 [Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)])에 따라 수행될 수 있다. 따라서, 이같은 "인간화" 항체는 무손상 인간 가변 도메인보다 실질적으로 더 적은 서열이 비-인간 종으로부터의 상응하는 서열로 치환된 키메라 항체 (미국 특허 번호 4,816,567)이다. 실제로, 전형적으로 인간화 항체는 일부 초가변 영역 잔기 및 아마도 일부 FR 잔기가 설치류 항체의 유사한 부위로부터의 잔기로 치환된 인간 항체이다.
인간화 항체의 제조에 사용될 인간 가변 도메인 경쇄 및 중쇄 둘 다의 선택은 항원성 감소에 매우 중요하다. 소위 "최적-적합" 방법에 따라, 설치류 항체의 가변 도메인 서열을 공지의 인간 가변-도메인 서열의 전체 라이브러리에 대해 스크리닝한다. 이어서, 설치류의 서열에 가장 근접한 인간 서열이 인간화 항체에 대한 인간 프레임워크 영역 (FR)으로 수용된다 (문헌 [Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987)]). 또 다른 방법은 경쇄 또는 중쇄 가변 영역의 특정한 하위군의 모든 인간 항체의 컨센서스 서열로부터 유래된 특정한 프레임워크 영역을 이용한다. 여러 상이한 인간화 항체에 대해 동일한 프레임워크를 사용할 수 있다 (문헌 [Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol., 151:2623 (1993)]).
또한, 항체가 항원에 대해 높은 친화도를 보유하고 다른 유리한 생물학적 특성을 보유하도록 인간화하는 것이 중요하다. 이 목적을 달성하기 위해, 바람직한 방법에 따라, 인간화 항체는 모 서열 및 인간화 서열의 3차원 모델을 이용하는 모 서열 및 다양한 개념적 인간화 생성물의 분석 과정에 의해 제조된다. 3차원 이뮤노글로불린 모델은 통상적으로 이용가능하고, 당업자에게 익숙하다. 선택된 후보 이뮤노글로불린 서열의 가능한 3차원 입체형태적 구조를 설명하고 디스플레이하는 컴퓨터 프로그램을 이용할 수 있다. 이러한 디스플레이를 조사하면 후보 이뮤노글로불린 서열의 기능에 있어서 잔기의 가능한 역할의 분석, 즉 후보 이뮤노글로불린이 그의 항원에 결합하는 능력에 영향을 미치는 잔기의 분석이 가능하다. 이러한 방식으로, FR 잔기는 수용자 서열 및 유입 서열로부터 선택 및 조합되어 원하는 항체 특성, 예컨대 표적 항원(들)에 대한 친화도 증가를 달성할 수 있다. 일반적으로, 항원 결합에 대한 영향에는 초가변 영역 잔기가 직접적이고 가장 실질적으로 관여한다.
(iv) 인간 항체
인간화에 대한 대안으로서 인간 항체를 생성할 수 있다. 예를 들어, 면역화시, 내인성 이뮤노글로불린 생산의 부재 하에 인간 항체의 전체 레퍼토리를 생산할 수 있는 트랜스제닉 동물 (예를 들어, 마우스)을 생산하는 것이 현재 가능하다. 예를 들어, 키메라 및 배선 돌연변이체 마우스에서 항체 중쇄 연결 영역 (JH) 유전자를 동형접합 결실시키면 내인성 항체 생산이 완전히 억제된다는 것이 기재되어 있다. 인간 배선 이뮤노글로불린 유전자 어레이를 이같은 배선 돌연변이체 마우스에게 전달하면, 항원 접종시에 인간 항체가 생산될 것이다. 예를 들어, 문헌 [Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immuno., 7:33 (1993)]; 및 미국 특허 번호 5,591,669, 5,589,369 및 5,545,807을 참조한다.
대안적으로, 파지-디스플레이 기술 (문헌 [McCafferty et al., Nature 348:552-553 (1990)])을 이용하여, 면역화되지 않은 공여자로부터의 이뮤노글로불린 가변 (V)-도메인 유전자 레퍼토리로부터 인간 항체 및 항체 단편을 시험관내에서 생산할 수 있다. 이러한 기술에 따라, 항체 V-도메인 유전자를 필라멘트형 박테리오파지, 예컨대 M13 또는 fd의 주요 또는 소수의 외피 폴리펩티드 유전자로 프레임에 맞게 클로닝하고, 파지 입자의 표면 상에 기능적 항체 단편으로서 디스플레이한다. 필라멘트형 입자는 파지 게놈의 단일-가닥 DNA 카피를 함유하기 때문에, 항체의 기능적 특성을 기반으로 한 선택에 의해 이러한 특성을 나타내는 항체를 코딩하는 유전자도 선택된다. 따라서, 파지는 B 세포의 특성의 일부를 모방한다. 파지 디스플레이는 다양한 포맷으로 수행될 수 있고, 이에 대한 검토를 위해 예를 들어 문헌 [Johnson, Kevin S. and Chiswell, David J., Current Opinion in Structural Biology 3:564-571 (1993)]을 참조한다. V-유전자 절편의 여러 공급원이 파지 디스플레이에 사용될 수 있다. 문헌 [Clackson et al., Nature, 352:624-628 (1991)]에서는 면역화된 마우스의 비장으로부터 유래된 V 유전자의 소형 무작위 조합 라이브러리로부터 항-옥사졸론 항체의 다양한 어레이가 단리된다. 본질적으로 문헌 [Marks et al., J. Mol. Biol. 222:581-597 (1991), 또는 Griffith et al., EMBO J.12:725-734 (1993)]에 기재된 기술에 따라, 면역화되지 않은 인간 공여자로부터의 V 유전자의 레퍼토리가 구축될 수 있고, 다양한 어레이의 항원 (자가-항원 포함)에 대한 항체를 단리할 수 있다. 또한, 미국 특허 번호 5,565,332 및 5,573,905를 참조한다.
인간 항체는 또한 시험관내-활성화 B 세포 (미국 특허 번호 5,567,610 및 5,229,275 참조)에서 생성될 수 있다.
(v) 항체 단편
항체 단편 생산을 위한 다양한 기술이 개발되었다. 전통적으로, 이들 단편은 무손상 항체의 단백질분해적 소화를 통해 유래되었다 (예를 들어, 문헌 [Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992) 및 Brennan et al., Science, 229:81 (1985)] 참조). 그러나, 현재 이러한 단편이 재조합 숙주 세포에 의해 직접적으로 생산될 수 있다. 예를 들어, 상기 논의된 항체 파지 라이브러리로부터 항체 단편이 단리될 수 있다. 대안적으로, Fab'-SH 단편은 이. 콜라이로부터 직접 회수되고 화학적으로 커플링되어 F(ab')2 단편을 형성할 수 있다 (문헌 [Carter et al., Bio/Technology 10:163-167 (1992)]). 또 다른 접근법에 따라, F(ab')2 단편은 재조합 숙주 세포 배양물로부터 직접 단리될 수 있다. 항체 단편의 생산을 위한 다른 기술이 숙련된 진료의에게 명백할 것이다. 다른 실시양태에서, 선택되는 항체는 단일-쇄 Fv 단편 (scFv)이다. WO 1993/16185 및 미국 특허 번호 5,571,894 및 5,587,458을 참조한다. 항체 단편은 또한, 예를 들어 미국 특허 번호 5,641,870에 기재된 바와 같은 "선형 항체"일 수 있다. 이러한 선형 항체 단편은 단일특이적 또는 이중특이적일 수 있다.
(vi) 이중특이적 항체
이중특이적 항체는 적어도 2개의 상이한 에피토프에 대한 결합 특이성을 갖는 항체이다. 예시적인 이중특이적 항체는 유형 I 인터페론 항원의 2개의 상이한 에피토프에 결합할 수 있다. 다른 이러한 항체는 제1 유형 I 인터페론에 결합하고, 추가로 제2 유형 I 인터페론에 결합할 수 있다. 대안적으로, 항-유형 I 인터페론-결합 아암은 백혈구 상의 유발 분자, 예컨대 T-세포 수용체 분자 (예를 들어, CD2 또는 CD3), 또는 IgG에 대한 Fc 수용체 (FcγR), 예컨대 FcγRI (CD64), FcγRII (CD32) 및 FcγRIII (CD16)에 결합하는 아암과 조합될 수 있다. 이중특이적 항체는 또한 세포독성제를 국재화시키는데 사용될 수 있다. 이러한 항체는 유형 I 인터페론-결합 아암, 및 세포독성제 (예를 들어, 사포린, 항-인터페론-α, 빈카 알칼로이드, 리신 A 쇄, 메토트렉세이트 또는 방사성 동위원소 합텐)에 결합하는 아암을 갖는다. 이중특이적 항체는 전장 항체 또는 항체 단편 (예를 들어, F(ab')2 이중특이적 항체)으로 제조될 수 있다.
이중특이적 항체의 제조 방법이 당업계에 공지되어 있다. 전장 이중특이적 항체의 전통적인 생산은 2개의 이뮤노글로불린 중쇄-경쇄 쌍의 공발현에 기초하고, 이 때 2개의 쇄는 특이성이 상이하다 (문헌 [Millstein et al., Nature, 305:537-539 (1983)]). 이뮤노글로불린 중쇄 및 경쇄의 무작위 분류로 인해, 이들 하이브리도마 (쿼드로마)는 10가지 상이한 항체 분자들의 잠재적 혼합물을 생산하며, 이 중에서 오직 하나만이 정확한 이중특이적 구조를 갖는다. 일반적으로 친화성 크로마토그래피 단계에 의해 이루어지는 올바른 분자의 정제는 다소 번거롭고, 생성물 수율이 낮다. 유사한 절차가 WO 1993/08829, 및 문헌 [Traunecker et al., EMBO J., 10:3655-3659 (1991)]에 개시되어 있다.
다른 접근법에 따라, 원하는 결합 특이성 (항체-항원 결합 부위)이 있는 항체 가변 도메인이 이뮤노글로불린 불변 도메인 서열에 융합된다. 융합은 바람직하게는 힌지, CH2 및 CH3 영역의 적어도 일부를 포함하는 이뮤노글로불린 중쇄 불변 도메인에 의해 이루어진다. 경쇄 결합에 필요한 부위를 함유하는 제1 중쇄 불변 영역 (CH1)이 융합체 중 적어도 하나에 존재하는 것이 바람직하다. 이뮤노글로불린 중쇄 융합체 및, 원하는 경우에, 이뮤노글로불린 경쇄를 코딩하는 DNA는 개별 발현 벡터 내로 삽입되고, 적합한 숙주 유기체 내로 동시-형질감염된다. 이것은 구축에 사용된 3종의 폴리펩티드 쇄의 동일하지 않은 비가 최적의 수율을 제공하는 실시양태에서 상기 3종의 폴리펩티드 단편의 상호 비를 조절하는데 있어서 큰 유연성을 제공한다. 그러나, 동일한 비의 적어도 2종의 폴리펩티드 쇄의 발현으로 높은 수율이 수득되는 경우, 또는 비가 특별한 유의성을 갖지 않는 경우, 2종 또는 모든 3종의 폴리펩티드 쇄에 대한 코딩 서열을 1개의 발현 벡터에 삽입할 수 있다.
이러한 접근법의 바람직한 실시양태에서, 이중특이적 항체는 한쪽 아암에 제1 결합 특이성을 갖는 하이브리드 이뮤노글로불린 중쇄, 및 다른 쪽 아암에 하이브리드 이뮤노글로불린 중쇄-경쇄 쌍 (제2 결합 특이성을 제공함)으로 이루어진다. 이중특이적 분자의 절반에만 이뮤노글로불린 경쇄가 존재하는 것이 용이한 분리 방법을 제공하기 때문에, 이러한 비대칭 구조는 원치않는 이뮤노글로불린 쇄 조합물로부터 원하는 이중특이적 화합물의 분리를 용이하게 하는 것으로 밝혀졌다. 이러한 접근법이 WO 1994/04690에 개시되어 있다. 이중특이적 항체의 생성에 대한 추가의 세부사항에 대해서는 예를 들어 문헌 [Suresh et al., Methods in Enzymology, 121:210 (1986)]을 참조한다.
미국 특허 번호 5,731,168에 기재된 또 다른 접근법에 따라, 한 쌍의 항체 분자 사이의 인터페이스는 재조합 세포 배양물로부터 회수되는 이종이량체의 백분율을 최대화하도록 조작될 수 있다. 바람직한 인터페이스는 항체 불변 도메인의 CH3 도메인의 적어도 일부를 포함한다. 이러한 방법에서, 제1 항체 분자의 인터페이스로부터 하나 이상의 작은 아미노산 측쇄가 보다 큰 측쇄 (예를 들어, 티로신 또는 트립토판)로 대체된다. 큰 아미노산 측쇄를 보다 작은 것 (예를 들어, 알라닌 또는 트레오닌)으로 대체함으로써 큰 측쇄(들)에 대해 동일하거나 유사한 크기의 보상 "함몰부"가 제2 항체 분자의 인터페이스 상에 생성된다. 이는 동종이량체와 같은 다른 원치않는 최종-생성물에 비해 이종이량체의 수율을 증가시키는 메카니즘을 제공한다.
이중특이적 항체는 가교된 또는 "이종접합체" 항체를 포함한다. 예를 들어, 이종접합체 내의 항체 중 하나는 아비딘에 커플링되고, 다른 하나는 비오틴에 커플링될 수 있다. 이러한 항체들은, 예를 들어 원치않는 세포에 대한 면역계 세포의 표적화 (미국 특허 번호 4,676,980), 및 HIV 감염의 치료 (WO 1991/00360, WO 1992/200373 및 EP 03089)를 위해 제안되었다. 이종접합체 항체는 임의의 편리한 가교 방법을 이용하여 제조될 수 있다. 적합한 가교제는 당업계에 널리 공지되어 있고, 다수의 가교 기술과 함께 예를 들어 미국 특허 번호 4,676,980에 개시되어 있다.
항체 단편으로부터 이중특이적 항체를 생성시키는 기술이 또한 문헌에 기재되어 있다. 예를 들어, 화학적 연결을 이용하여 이중특이적 항체를 제조할 수 있다. 문헌 [Brennan et al., Science, 229: 81 (1985)]은 무손상 항체를 단백질 분해로 절단하여 F(ab')2 단편을 생성하는 절차를 기재한다. 이러한 단편을 디티올 착화제인 아비산나트륨의 존재 하에 환원시켜, 인접한 디티올을 안정화시키고 분자간 디술피드 형성을 방지한다. 이어서 생성된 Fab' 단편을 티오니트로벤조에이트 (TNB) 유도체로 전환시킨다. 이어서 Fab'-TNB 유도체 중 하나를 메르캅토에틸아민으로의 환원에 의해 Fab'-티올로 재전환시키고 등몰량의 다른 Fab'-TNB 유도체와 혼합하여 이중특이적 항체를 형성시킨다. 생산된 이중특이적 항체를 효소의 선택적 고정화를 위한 작용제로서 사용할 수 있다.
재조합 세포 배양물로부터 직접적으로 이중특이적 항체 단편을 제조 및 단리하기 위한 다양한 기술이 또한 기재되었다. 예를 들어, 류신 지퍼를 사용하여 이중특이적 항체가 생산된다. 문헌 [Kostelny et al., J. Immunol., 148(5):1547-1553 (1992)]. Fos 및 Jun 단백질로부터의 류신 지퍼 펩티드가 2개의 상이한 항체의 Fab' 부분에 유전자 융합체에 의해 연결된다. 항체 동종이량체가 힌지 영역에서 환원되어 단량체가 형성된 후에 재산화되어 항체 이종이량체가 형성된다. 이러한 방법은 항체 동종이량체의 생산에 또한 이용될 수 있다. 문헌 [Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)]에 기재된 "디아바디" 기술은 이중특이적 항체 단편의 제조를 위한 대안적인 메카니즘을 제공한다. 이 단편은 동일한 쇄 상의 2개의 도메인이 쌍을 형성하기에는 너무 짧은 링커에 의해 경쇄 가변 도메인 (VL)에 연결된 중쇄 가변 도메인 (VH)을 포함한다. 따라서, 한 단편의 VH 및 VL 도메인이 또 다른 단편의 상보적인 VL 및 VH 도메인과 쌍을 형성하여, 2개의 항원-결합 부위가 형성된다. 단일-쇄 Fv (sFv) 이량체를 사용하여 이중특이적 항체 단편을 제조하기 위한 또 다른 전략이 또한 보고되었다. 문헌 [Gruber et al., J. Immunol., 152:5368 (1994)]을 참조한다.
2 초과의 원자가를 갖는 항체가 고려된다. 예를 들어, 삼중특이적 항체를 제조할 수 있다. 문헌 [Tutt et al. J. Immunol. 147: 60 (1991)].
IV. 접합체 및 항체의 다른 변형
본원에서 방법에 사용되거나 제조품에 포함된 항체는 임의로 세포독성제에 접합된다. 예를 들어, (유형 I 인터페론) 항체는 WO 2004/032828에서 기재된 바와 같이 약물에 접합될 수 있다.
이러한 항체-세포독성제 접합체의 생성에 유용한 화학요법제는 상기 기재되어 있다.
항체 및 하나 이상의 소분자 독소, 예컨대 칼리케아미신, 메이탄신 (미국 특허 번호 5,208,020), 트리코텐 및 CC1065의 접합체도 또한 본원에서 고려된다. 본 발명의 한 실시양태에서, 항체는 하나 이상의 메이탄신 분자에 접합된다 (예를 들어, 항체 분자당 약 1 내지 약 10개의 메이탄신 분자). 메이탄신은 예를 들어, May-SS-Me로 전환될 수 있고, 이는 May-SH3으로 환원되고 변형된 항체와 반응하여 (문헌 [Chari et al. Cancer Research 52: 127-131 (1992)]) 메이탄시노이드-항체 면역접합체를 생성할 수 있다.
대안적으로, 항체는 하나 이상의 칼리케아미신 분자에 접합된다. 칼리케아미신 패밀리의 항생제는 이중-가닥 DNA 절단물을 피코몰 미만의 농도로 생성시킬 수 있다. 사용될 수 있는 칼리케아미신의 구조 유사체는 γ1 I, α2 I, α3 I, N-아세틸-γ1 I, PSAG 및 θI 1을 포함하나 이에 제한되지는 않는다 (문헌 [Hinman et al. Cancer Research 53: 3336-3342 (1993) 및 Lode et al. Cancer Research 58: 2925-2928 (1998)]).
사용될 수 있는 효소 활성 독소 및 그의 단편은 디프테리아 A 쇄, 디프테리아 독소의 비결합 활성 단편, 외독소 A 쇄 (슈도모나스 아에루기노사(Pseudomonas aeruginosa)로부터 유래됨), 리신 A 쇄, 아브린 A 쇄, 모데신 A 쇄, 알파-사르신, 알레우리테스 포르디이(Aleurites fordii) 단백질, 디안틴 단백질, 피토라카 아메리카나(Phytolaca americana) 단백질 (PAPI, PAPII 및 PAP-S), 모모르디카 카란티아(momordica charantia) 억제제, 쿠르신, 크로틴, 사파오나리아 오피시날리스(sapaonaria officinalis) 억제제, 겔로닌, 미토겔린, 레스트릭토신, 페노마이신, 에노마이신 및 트리코테센을 포함한다. 예를 들어, 1993년 10월 28일에 공개된 WO 1993/21232를 참조한다.
본 발명은 핵산분해 활성을 갖는 화합물 (예를 들어, 리보뉴클레아제 또는 DNA 엔도뉴클레아제, 예컨대 데옥시리보뉴클레아제; DNase)과 접합된 항체를 추가로 고려한다.
다양한 방사성 동위원소가 방사성접합된 항체의 생산을 위해 이용가능하다. 그 예는 At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, 및 Lu의 방사성 동위원소를 포함한다.
항체 및 세포독성제의 접합체는 다양한 이관능성 단백질-커플링 작용제, 예컨대 N-숙신이미딜-3-(2-피리딜디티올) 프로피오네이트 (SPDP), 숙신이미딜-4-(N-말레이미도메틸) 시클로헥산-1-카르복실레이트, 이미노티올란 (IT), 이미도에스테르의 이관능성 유도체 (예컨대, 디메틸 아디피미데이트 HCl), 활성 에스테르 (예컨대, 디숙신이미딜 수베레이트), 알데히드 (예컨대, 글루타르알데히드), 비스-아지도 화합물 (예컨대, 비스(p-아지도벤조일) 헥산디아민), 비스-디아조늄 유도체 (예컨대, 비스-(p-디아조늄벤조일)-에틸렌디아민), 디이소시아네이트 (예컨대, 톨리엔 2,6-디이소시아네이트) 및 비스-활성 플루오린 화합물 (예컨대, 1,5-디플루오로-2,4-디니트로벤젠)을 사용하여 제조된다. 예를 들어 리신 면역독소는 문헌 [Vitetta et al. Science 238:1098 (1987)]에 기재된 바와 같이 제조될 수 있다. 탄소-14-표지된 1-이소티오시아네이토벤질-3-메틸디에틸렌 트리아민펜타아세트산 (MX-DTPA)은 방사성뉴클레오티드를 항체에 접합시키기 위한 예시적인 킬레이트화제이다. WO 1994/11026을 참조한다. 링커는 세포 내에서 세포독성 약물의 방출을 용이하게 하는 "절단가능한 링커"일 수 있다. 예를 들어, 산-불안정성 링커, 펩티다제-감수성 링커, 디메틸 링커 또는 디술피드 함유 링커 (문헌 [Chari et al. Cancer Research 52: 127-131 (1992)])를 사용할 수 있다.
대안적으로, 항체 및 세포독성제를 포함하는 융합 단백질은 예를 들어 재조합 기술 또는 펩티드 합성에 의해 제조할 수 있다.
또 다른 실시양태에서, 항체를 종양 예비표적화에 이용하기 위해 "수용체" (예컨대, 스트렙타비딘)에 접합시킬 수 있으며, 여기서 항체-수용체 접합체를 대상체에게 투여한 후에 세정제를 사용하여 순환계로부터 미결합 접합체를 제거한 후, 세포독성제 (예를 들어, 방사성뉴클레오티드)에 접합된 "리간드" (예를 들어, 아비딘)를 투여한다.
본 발명의 항체는 또한 전구약물 (예를 들어, 펩티딜 화학요법제, WO 1981/01145 참조)을 활성 항암 약물로 전환시키는 전구약물-활성화 효소에 접합시킬 수 있다. 예를 들어 WO 1988/07378 및 미국 특허 번호 4,975,278을 참조한다.
이러한 접합체의 효소 성분은 이를 그의 보다 활성인 세포독성 형태로 전환시키도록 하는 방식으로 전구약물에 작용할 수 있는 임의의 효소를 포함한다.
본 발명의 방법에 유용한 효소는 포스페이트-함유 전구약물을 유리 약물로 전환시키는데 유용한 알칼리성 포스파타제; 술페이트-함유 전구약물을 유리 약물로 전환시키는데 유용한 아릴술파타제; 비-독성 5-플루오로시토신을 항암 약물인 5-플루오로우라실로 전환시키는데 유용한 시토신 데아미나제; 펩티드-함유 전구약물을 유리 약물로 전환시키는데 유용한 프로테아제, 예컨대 세라티아 프로테아제, 써모리신, 서브틸리신, 카르복시펩티다제 및 카텝신 (예컨대, 카텝신 B 및 L); D-아미노산 치환기를 함유하는 전구약물을 전환시키는데 유용한 D-알라닐카르복시펩티다제; 글리코실화 전구약물을 유리 약물로 전환시키는데 유용한 탄수화물-절단 효소, 예컨대 β-갈락토시다제 및 뉴라미니다제; β-락탐으로 유도체화된 약물을 유리 약물로 전환시키는데 유용한 β-락타마제; 및 아민 질소에서 각각 페녹시아세틸 또는 페닐아세틸 기로 유도체화된 약물을 유리 약물로 전환시키는데 유용한 페니실린 아미다제, 예컨대 페니실린 V 아미다제 또는 페니실린 G 아미다제를 포함하나 이에 제한되지는 않는다. 대안적으로, 효소 활성을 갖는 항체 (당업계에서 "아브자임"으로도 알려짐)가 본 발명의 전구약물을 유리 활성 약물로 전환시키기 위해 사용될 수 있다 (예를 들어, 문헌 [Massey, Nature 328: 457-458 (1987)] 참조). 항체-아브자임 접합체는 종양 세포 집단에 아브자임을 전달하기 위해 본원에 기재된 바와 같이 제조될 수 있다.
본 발명의 효소는 당업계에 널리 공지된 기술에 의해, 예컨대 상기 논의된 이종이관능성 가교 시약을 사용하여 항체에 공유 결합될 수 있다. 대안적으로, 적어도 본 발명의 효소의 기능적 활성 부분에 연결된 본 발명의 항체의 항원-결합 영역을 적어도 포함하는 융합 단백질은 당업계에 널리 공지된 재조합 DNA 기술을 이용하여 구축될 수 있다 (예를 들어, 문헌 [Neuberger et al., Nature, 312: 604-608 (1984)] 참조).
항체의 다른 변형이 본원에서 고려된다. 예를 들어, 항체는 다양한 비단백질성 중합체, 예를 들어 폴리에틸렌 글리콜 (PEG), 폴리프로필렌 글리콜, 폴리옥시알킬렌 또는 폴리에틸렌 글리콜과 폴리프로필렌 글리콜의 공중합체 중 하나에 연결될 수 있다. 하나 이상의 PEG 분자에 연결된 항체 단편, 예컨대 Fab'는 본 발명의 특히 바람직한 실시양태이다.
본원에 개시된 항체는 또한 리포솜으로서 제제화될 수도 있다. 항체를 함유하는 리포솜은 문헌 [Epstein et al., Proc. Natl. Acad. Sci. USA, 82:3688 (1985); Hwang et al., Proc. Natl. Acad. Sci. USA, 77:4030 (1980)]; 미국 특허 번호 4,485,045 및 4,544,545; 및 WO 1997/38731 (1997년 10월 23일 공개)에 기재된 것과 같은 당업계에 공지된 방법에 의해 제조된다. 순환 시간이 증진된 리포솜은 미국 특허 번호 5,013,556에 개시되어 있다.
특히 유용한 리포솜은 포스파티딜콜린, 콜레스테롤, 및 PEG-유도체화된 포스파티딜에탄올아민 (PEG-PE)을 포함하는 지질 조성물을 사용하여 역상 증발 방법에 의해 생성될 수 있다. 리포솜을 규정된 기공 크기의 필터를 통해 추출하여 원하는 직경을 갖는 리포솜을 생성한다. 본 발명의 항체의 Fab' 단편은 디술피드 상호교환 반응을 통해 문헌 [Martin et al. J. Biol. Chem. 257: 286-288 (1982)]에 기재된 바와 같이 리포솜에 접합시킬 수 있다. 임의로, 화학요법제를 리포솜 내에 함유시킨다. 문헌 [Gabizon et al. J. National Cancer Inst. 81(19)1484 (1989)]을 참조한다.
본원에 기재된 단백질 또는 펩티드 길항제의 아미노산 서열 변형(들)이 고려된다. 예를 들어, 항체의 결합 친화도 및/또는 다른 생물학적 특성을 개선시키는 것이 바람직할 수 있다. 항체의 아미노산 서열 변이체들은 적절한 뉴클레오티드 변화를 항체 핵산 내에 도입함으로써, 또는 펩티드 합성에 의해 제조된다. 이러한 변형은 예를 들어 항체의 아미노산 서열 내 잔기의 결실 및/또는 삽입 및/또는 치환을 포함한다. 최종 구축물이 바람직한 특성을 갖는다는 조건 하에 결실, 삽입 및 치환의 임의 조합이 이루어져 최종 구축물에 도달된다. 아미노산 변화는 또한 항체의 번역후 프로세싱을 변경시킬 수 있으며, 예컨대 글리코실화 부위의 수 또는 위치를 변화시킬 수 있다.
돌연변이유발에 바람직한 위치인 항체의 특정 잔기 또는 영역의 확인에 유용한 방법은 문헌 [Cunningham and Wells Science, 244:1081-1085 (1989)]에 기재된 바와 같이 "알라닌 스캐닝 돌연변이유발"이라 불린다. 여기서, 잔기 또는 표적 잔기 군이 확인되고 (예를 들어, 하전된 잔기, 예컨대 arg, asp, his, lys 및 glu), 중성 또는 음으로 하전된 아미노산 (가장 바람직하게는 알라닌 또는 폴리알라닌)에 의해 대체되어 아미노산과 항원과의 상호작용에 영향을 미친다. 그 후, 치환에 대해 기능적 감수성을 나타내는 아미노산 위치가 치환 부위에 또는 치환 부위에 대해 추가의 또는 다른 변이체를 도입함으로써 개선된다. 따라서, 아미노산 서열 변이를 도입하기 위한 부위는 미리 결정되지만, 돌연변이 그 자체의 성질을 미리 결정할 필요는 없다. 예를 들어, 주어진 부위에서의 돌연변이의 성능을 분석하기 위해, ala 스캐닝 또는 무작위 돌연변이유발을 표적 코돈 또는 영역에서 수행하고, 발현된 항체 변이체를 바람직한 활성에 대해 스크리닝한다.
아미노산 서열 삽입은 길이 범위가 1개의 잔기 내지 100개 이상의 잔기를 함유하는 폴리펩티드에 이르는 아미노- 및/또는 카르복실-말단 융합, 뿐만 아니라 단일 또는 다수 아미노산 잔기의 서열내 삽입을 포함한다. 말단 삽입의 예는 N-말단 메티오닐 잔기가 있는 항체 또는 세포독성 폴리펩티드에 융합된 항체를 포함한다. 항체 분자의 다른 삽입 변이체는 효소 또는 항체의 혈청 반감기를 증가시키는 폴리펩티드의 항체의 N- 또는 C-말단에 대한 융합체를 포함한다.
또 다른 유형의 변이체는 아미노산 치환 변이체이다. 이러한 변이체에서는 항체 분자 내의 적어도 1개의 아미노산 잔기가 상이한 잔기로 대체된다. 치환적 돌연변이유발에서 가장 관심이 높은 부위는 초가변 영역을 포함하지만, FR 변경 또한 고려된다. 보존적 치환은 "바람직한 치환"의 표제 하에 표 3에 나타낸다. 이러한 치환이 생물학적 활성의 변화를 초래하면, 표 3에서 "예시적인 치환"으로 명명되거나, 아미노산 부류에 대해 하기 추가로 기재된 바와 같은 보다 실질적인 변화를 도입하고 생성물을 스크리닝할 수 있다.
[표 3]
항체의 생물학적 특성에 있어서의 실질적인 변형은 (a) 예를 들어 시트 또는 나선형 입체형태로서, 치환 영역 내의 폴리펩티드 백본의 구조, (b) 표적 부위에서의 분자의 전하 또는 소수성, 또는 (c) 측쇄 벌크를 유지하는 것에 대한 효과가 현저하게 상이한 치환을 선택함으로써 달성된다. 아미노산은 그의 측쇄 특성의 유사성에 따라 하기 군으로 나뉠 수 있다 (문헌 [A. L. Lehninger, in Biochemistry, second ed., pp. 73-75, Worth Publishers, New York (1975)]):
(1) 비-극성: Ala (A), Val (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M)
(2) 비하전 극성: Gly (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gln (Q)
(3) 산성: Asp (D), Glu (E)
(4) 염기성: Lys (K), Arg (R), His(H)
대안적으로, 자연 발생 잔기는 공통적인 측쇄 특성에 따라 하기 군으로 나뉠 수 있다:
(1) 소수성: 노르류신, Met, Ala, Val, Leu, Ile;
(2) 중성 친수성: Cys, Ser, Thr, Asn, Gln;
(3) 산성: Asp, Glu;
(4) 염기성: His, Lys, Arg;
(5) 쇄 배향에 영향을 미치는 잔기: Gly, Pro;
(6) 방향족: Trp, Tyr, Phe.
비-보존적 치환은 이들 부류 중의 하나의 구성원을 또 다른 부류로 교환하는 것을 포함할 것이다.
또한, 항체의 적절한 입체형태 유지에 관여하지 않는 임의의 시스테인 잔기가 일반적으로 세린으로 치환되어 분자의 산화 안정성을 개선시키고 이상 가교를 방지할 수 있다. 역으로, 시스테인 결합(들)이 항체에 부가되어 그의 안정성을 개선시킬 수 있다 (특히, 항체가 Fv 단편과 같은 항체 단편인 경우).
특히 바람직한 유형의 치환 변이체는 모 항체의 1개 이상의 초가변 영역 잔기를 치환하는 것을 수반한다. 일반적으로, 추가적인 개발용으로 선택된 생성된 변이체(들)는 이들이 생성되는 모 항체에 비해 생물학적 특성이 개선될 것이다. 이같은 치환 변이체를 생성하는 간편한 방법은 파지 디스플레이를 이용한 친화도 성숙이다. 간략하게, 여러 초가변 영역 부위 (예를 들어, 6-7개 부위)를 각 부위에서 모든 가능한 아미노산 치환이 생성되도록 돌연변이시킨다. 이와 같이 생성된 항체 변이체를 필라멘트형 파지 입자로부터 각 입자 내에 패키지된 M13의 유전자 III 생성물에 대한 융합체로서 1가 방식으로 디스플레이시킨다. 이어서, 파지-디스플레이된 변이체를 본원에 개시된 바와 같이 이들의 생물학적 활성 (예를 들어, 결합 친화도)에 대해 스크리닝한다. 변형을 위한 후보 초가변 영역 부위를 확인하기 위해, 알라닌-스캐닝 돌연변이유발을 수행하여 항원 결합에 유의하게 기여하는 초가변 영역 잔기를 확인할 수 있다. 대안적으로 또는 추가로, 항체 및 항원 사이의 접촉 지점을 확인하기 위해 항원-항체 복합체의 결정 구조를 분석하는 것이 유익할 수 있다. 이러한 접촉 잔기 및 인접 잔기는 본원에서 상기 기재된 기술에 따른 치환을 위한 후보이다. 일단 이러한 변이체가 생성되면, 변이체들의 패널을 본원에 기재된 바와 같이 스크리닝하고, 하나 이상의 관련 검정에서 우수한 특성을 갖는 항체를 추가적인 개발을 위해 선택할 수 있다.
항체의 아미노산 변이체의 또 다른 유형은 항체의 원래의 글리코실화 패턴을 변경시킨다. 이러한 변경은 항체에서 발견되는 하나 이상의 탄수화물 모이어티를 결실시키는 것 및/또는 항체 내에 존재하지 않는 하나 이상의 글리코실화 부위를 부가하는 것을 포함한다.
폴리펩티드의 글리코실화는 전형적으로 N-연결되거나 O-연결된다. N-연결은 탄수화물 모이어티가 아스파라긴 잔기의 측쇄에 부착된 것을 나타낸다. 트리펩티드 서열, 아스파라긴-X-세린 및 아스파라긴-X-트레오닌 (여기서, X는 프롤린을 제외한 임의의 아미노산임)이 아스파라긴 측쇄로 탄수화물 모이어티를 효소적으로 부착시키기 위한 인식 서열이다. 따라서, 이러한 트리펩티드 서열 중 어느 하나가 폴리펩티드에 존재함으로써 잠재적인 글리코실화 부위가 생성된다. O-연결된 글리코실화는 당 N-아세틸갈락토사민, 갈락토스 또는 크실로스 중의 하나가 히드록시아미노산, 가장 통상적으로는 세린 또는 트레오닌에 부착되는 것을 지칭하지만, 5-히드록시프롤린 또는 5-히드록시리신 또한 사용될 수 있다.
항체에 글리코실화 부위를 부가하는 것은 하나 이상의 상기 기재된 트리펩티드 서열을 함유하도록 아미노산 서열을 변경시킴으로써 편리하게 달성된다 (N-연결 글리코실화 부위의 경우). 변경은 원래의 항체의 서열에 대한 하나 이상의 세린 또는 트레오닌 잔기의 부가 또는 치환에 의해 또한 달성될 수 있다 (O-연결 글리코실화 부위의 경우).
항체가 Fc 영역을 포함하는 경우에, 이에 부착된 탄수화물이 변경될 수 있다. 예를 들어, 항체의 Fc 영역에 부착된 푸코스가 결핍된 성숙 탄수화물 구조를 갖는 항체가 US 2003/0157108 (Presta, L.)에 기재되어 있다. 또한, US 2004/0093621 (교와 핫코 고교 캄파니, 리미티드(Kyowa Hakko Kogyo Co., Ltd.))을 참조한다. 항체의 Fc 영역에 부착된 탄수화물 내에 이분지 N-아세틸글루코사민 (GlcNAc)을 갖는 항체는 WO 2003/011878 (Jean-Mairet et al.) 및 미국 특허 번호 6,602,684 (Umana et al.)에 언급되어 있다. 항체의 Fc 영역에 부착된 올리고사카라이드 내에 적어도 1개의 갈락토스 잔기를 갖는 항체가 WO 1997/30087 (Patel et al.)에 보고되어 있다. 또한, 항체의 Fc 영역에 부착된 탄수화물이 변경된 항체에 관한 WO 1998/58964 (Raju, S.) 및 WO 1999/22764 (Raju, S.)를 참조한다.
본원에서의 바람직한 글리코실화 변이체는 Fc 영역에 부착된 탄수화물 구조에 푸코스가 없는 Fc 영역을 포함한다. 이러한 변이체는 ADCC 기능이 개선된다. 임의로, Fc 영역은 ADCC를 더욱 개선하는 하나 이상의 아미노산 치환, 예를 들어 Fc 영역의 위치 298, 333 및/또는 334 (잔기의 Eu 넘버링)에서의 치환을 추가로 포함한다. "탈푸코실화" 또는 "푸코스-결핍" 항체와 관련된 공개의 예는 US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; 문헌 [Okazaki et al. J. Mol. Biol. 336:1239-1249 (2004); 및 Yamane-Ohnuki et al. Biotech. Bioeng.87: 614 (2004)]을 포함한다. 탈푸코실화 항체를 생산하는 세포주의 예는 단백질 푸코실화가 결핍된 Lec13 CHO 세포 (문헌 [Ripka et al. Arch. Biochem. Biophys. 249:533-545 (1986)]; US 2003/0157108 (Presta, L); 및 WO 2004/056312 (Adams et al.), 특히 실시예 11), 및 녹아웃 세포주, 예컨대 알파-1,6-푸코실트랜스퍼라제 유전자 FUT8-녹아웃 CHO 세포 (문헌 [Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004)])를 포함한다.
항체의 아미노산 서열 변이체를 코딩하는 핵산 분자는 당업계에 공지된 다양한 방법에 의해 제조된다. 이러한 방법은 천연 공급원으로부터의 단리 (자연 발생 아미노산 서열 변이체의 경우), 또는 항체의 앞서 제조된 변이체 또는 비-변이체 버전의 올리고뉴클레오티드-매개 (또는 부위-지정) 돌연변이유발, PCR 돌연변이유발 및 카세트 돌연변이유발에 의한 제조를 포함하나, 이에 제한되지는 않는다.
이펙터 기능과 관련하여 본 발명의 항체를, 예를 들어 항체의 ADCC 및/또는 CDC를 증진시키기 위해 변형시키는 것이 바람직할 수 있다. 이것은 항체의 Fc 영역에 하나 이상의 아미노산 치환을 도입함으로써 달성될 수 있다. 대안적으로 또는 추가로, 시스테인 잔기(들)를 Fc 영역 내에 도입하여, 이 영역 내에서의 쇄간 디술피드 결합 형성을 허용할 수 있다. 이와 같이 생성된 동종이량체 항체는 개선된 내재화 능력 및/또는 증가된 보체-매개 세포 사멸 및 ADCC를 가질 수 있다. 문헌 [Caron et al., J. Exp Med. 176:1191-1195 (1992) 및 Shopes, B. J. Immunol.148:2918-2922 (1992)]을 참조한다. 항종양 활성이 증진된 동종이량체 항체는 문헌 [Wolff et al. Cancer Research 53:2560-2565 (1993)]에 기재된 바와 같이 이종이관능성 가교-링커를 사용하여 제조할 수도 있다. 대안적으로, 이중 Fc 영역이 있는 항체를 조작할 수 있고, 이에 의해 항체의 보체 용해 및 ADCC 능력이 증진될 수 있다. 문헌 [Stevenson et al. Anti-Cancer Drug Design 3:219-230 (1989)]을 참조한다.
WO 2000/42072 (Presta, L.)는 인간 이펙터 세포의 존재 하에 개선된 ADCC 기능을 갖는 항체를 기재하고 있으며, 여기서 항체는 그의 Fc 영역 내에 아미노산 치환을 포함한다. 바람직하게는, 개선된 ADCC를 갖는 항체는 Fc 영역의 위치 298, 333 및/또는 334에 치환을 포함한다. 바람직하게는, 변경된 Fc 영역은 상기 위치 중 1, 2 또는 3개에서의 치환을 포함하거나 이러한 치환으로 이루어진 인간 IgG1 Fc 영역이다.
변경된 C1q 결합 및/또는 CDC를 갖는 항체는 WO 1999/51642 및 미국 특허 번호 6,194,551, 6,242,195, 6,528,624 및 6,538,124 (Idusogie et al.)에 기재되어 있다. 항체는 그의 Fc 영역의 아미노산 위치 270, 322, 326, 327, 329, 313, 333 및/또는 334 중 하나 이상에서 아미노산 치환을 포함한다.
항체의 혈청 반감기를 증가시키기 위해, 예를 들어 미국 특허 5,739,277에 기재된 바와 같이 샐비지 수용체 결합 에피토프를 항체 (특히, 항체 단편) 내로 혼입할 수 있다. 본원에 사용된 용어 "샐비지 수용체 결합 에피토프"는 IgG 분자 (예를 들어, IgG1, IgG2, IgG3 또는 IgG4)의 생체내 혈청 반감기 증가를 담당하는 상기 IgG 분자의 Fc 영역의 에피토프를 지칭한다. Fc 영역이 치환되고 증가된 혈청 반감기를 갖는 항체는 또한 WO 2000/42072 (Presta, L.)에 기재되어 있다.
3개 이상 (바람직하게는 4개)의 기능적 항원-결합 부위를 갖는 조작된 항체가 또한 고려된다 (US 2002/0004587 A1, Miller et al.).
V. 제약 제제
본 발명에 따라 사용되는 항체의 치료 제제는 원하는 정도의 순도를 갖는 항체를 임의의 제약상 허용되는 담체, 부형제 또는 안정화제 (문헌 [Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)])와 혼합함으로써 동결건조 제제 또는 수용액의 형태로 저장용으로 제조된다. 허용되는 담체, 부형제 또는 안정화제는 사용되는 투여량 및 농도에서 수용자에게 비독성이고, 완충제, 예컨대 포스페이트, 시트레이트, 및 기타 유기 산; 항산화제, 예를 들어 아스코르브산 및 메티오닌; 보존제 (예컨대, 옥타데실디메틸벤질 암모늄 클로라이드; 헥사메토늄 클로라이드; 벤즈알코늄 클로라이드, 벤제토늄 클로라이드; 페놀, 부틸 또는 벤질 알콜; 알킬 파라벤, 예컨대 메틸 또는 프로필 파라벤; 카테콜; 레조르시놀; 시클로헥산올; 3-펜탄올; 및 m-크레졸); 저분자량 (약 10개 미만의 잔기) 폴리펩티드; 단백질, 예컨대 혈청 알부민, 젤라틴 또는 이뮤노글로불린; 친수성 중합체, 예컨대 폴리비닐피롤리돈; 아미노산, 예컨대 글리신, 글루타민, 아스파라긴, 히스티딘, 아르기닌 또는 리신; 모노사카라이드, 디사카라이드 및 기타 탄수화물, 예를 들어 글루코스, 만노스 또는 덱스트린; 킬레이트화제, 예컨대 EDTA; 당, 예컨대 수크로스, 만니톨, 트레할로스 또는 소르비톨; 염 형성 반대이온, 예컨대 나트륨; 금속 착체 (예를 들어, Zn-단백질 착체); 및/또는 비-이온성 계면활성제, 예컨대 트윈(TWEEN)™, 플루로닉스(PLURONICS)™ 또는 PEG를 포함한다.
예시적인 항-유형 I 항체 제제는 미국 특허 번호 7,087,726, 7,741,449, 및 미국 특허 공개 번호 2009/0214565에 기재되어 있다.
피하 투여에 적합한 동결건조 제제는 예를 들어 미국 특허 번호 6,267,958 (Andya et al.)에 기재되어 있다. 이러한 동결건조 제제는 적합한 희석제를 사용하여 높은 단백질 농도로 재구성될 수 있고, 재구성된 제제가 본원에서 치료될 포유동물에게 피하 투여될 수 있다.
항체의 동결 건조 형태가 또한 고려된다. 예를 들어, US 2002/0136719A1 (Shenoy et al.)을 참조한다.
본원에서 제제는 또한 치료될 특정한 징후에 대해 필요에 따라 하나 초과의 활성 화합물 (제2 의약), 바람직하게는 서로에게 유해한 영향을 미치지 않는 보완적 활성을 갖는 것을 함유할 수 있다. 예를 들어, 세포독성제 (예를 들어, 미톡산트론 (노반트론®), 메토트렉세이트, 시클로포스파미드, 클로람부실 또는 아자티오프린), 화학요법제, 면역억제제, 시토카인, 시토카인 길항제 또는 항체, 성장 인자, 호르몬 (예를 들어, 테스토스테론 또는 호르몬 대체 요법), 인테그린, 인테그린 길항제 또는 항체 (예를 들어, 제넨테크로부터 상업적으로 입수가능한 LFA-1 항체, 예컨대 에팔리주맙/랍티바®, 또는 비오젠으로부터 입수가능한 알파 4 인테그린 항체, 예컨대 나탈리주맙/안테그렌®, 또는 상기 언급된 바와 같은 기타), 인터페론 부류 약물, 예컨대 IFN-베타-1a (레비프® 및 아보넥스®) 또는 IFN-베타-1b (베타세론®), 올리고펩티드, 예컨대 글라티라머 아세테이트 (코팍손®), 정맥내 이뮤노글로불린 (감마 글로불린), 림프구-고갈 약물 (예를 들어, 미톡산트론, 시클로포스파미드, 캄파트™ 항체, 항-CD4, 또는 클라드리빈), 비-림프구-고갈 면역억제제 약물 (예를 들어, MMF 또는 시클로스포린), "스타틴" 부류의 콜레스테롤-저하 약물, 에스트라디올, 속발성 또는 루푸스와 관련된 증상 (예를 들어, 경직, 실금, 통증, 피로)을 치료하는 약물, TNF 억제제, DMARD, NSAID, 코르티코스테로이드 (예를 들어, 메틸프레드니솔론, 프레드니손, 덱사메타손, 또는 글루코코르티코이드), 레보티록신, 시클로스포린 A, 소마타스타틴 유사체, 항대사물, 또 다른 B-세포 표면 길항제/항체 등을 제제에서 추가로 제공하는 것이 바람직할 수 있다. 이러한 다른 작용제 (본원에서 제2 의약으로 지칭됨, 여기서 제1 의약은 유형 I 인터페론 항체임)의 유형 및 유효량은 예를 들어 제제에 존재하는 항체의 양, 치료될 루푸스의 유형, 및 대상체의 임상적 파라미터에 따라 달라진다.
활성 성분은 예를 들어 콜로이드성 약물-전달 시스템 (예를 들어, 리포솜, 알부민 마이크로구체, 마이크로에멀젼, 나노입자 및 나노캡슐)에서 또는 마크로에멀젼에서 코아세르베이션 기술 또는 계면 중합에 의해 제조되는 마이크로캡슐, 예를 들어 각각 히드록시메틸셀룰로스 또는 젤라틴-마이크로캡슐 및 폴리-(메틸메타크릴레이트) 마이크로캡슐 내에 봉입될 수 있다. 이러한 기술은 예를 들어 문헌 [Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)]에 개시되어 있다.
지속-방출 제제를 제조할 수 있다. 지속-방출 제제의 적합한 예는 항체를 함유하는 고체 소수성 중합체의 반투과성 매트릭스를 포함하고, 이 매트릭스는 성형품, 예를 들어 필름 또는 마이크로캡슐의 형태이다. 지속-방출 매트릭스의 예는 폴리에스테르, 히드로겔 (예를 들어, 폴리(2-히드록시에틸-메타크릴레이트) 또는 폴리(비닐알콜)), 폴리락티드 (미국 특허 번호 3,773,919), L-글루탐산 및 γ 에틸-L-글루타메이트의 공중합체, 비-분해성 에틸렌-비닐 아세테이트, 분해성 락트산-글리콜산 공중합체, 예컨대 루프론 데포(LUPRON DEPOT)™ (락트산-글리콜산 공중합체 및 류프롤리드 아세테이트로 이루어진 주사가능한 마이크로구체), 및 폴리-D-(-)-3-히드록시부티르산을 포함한다.
생체내 투여에 사용될 제제는 멸균되어야 한다. 이는 멸균 여과 막을 통한 여과에 의해 용이하게 달성된다.
VI. 제조품
다양한 제조품이 본 발명의 범위 내에서 고려된다. 본 발명의 또 다른 실시양태에서, 상기 기재된 루푸스의 치료에 유용한 물질을 함유하는 제조품이 제공된다. 바람직하게는, 제조품은 (a) 용기 내에 유형 I 인터페론 항체 및 제약상 허용되는 담체 또는 희석제를 포함하는 조성물을 포함하는 용기; 및 (b) 대상체에서 루푸스를 치료하기 위한 지침서를 갖는 포장 삽입물을 포함하며, 여기서 지침서는 약 0.5 내지 4 그램의 초기 항체 노출에 이어 약 0.5 내지 4 그램의 제2 항체 노출을 제공하는데 효과적인 항체의 양을 대상체에게 투여하는 것을 지시하며, 여기서 제2 노출은 초기 노출로부터 약 16 내지 54주까지 제공되지 않고, 각각의 항체 노출은 단일 용량으로 또는 항체의 2 또는 3회의 개별 용량으로 대상체에게 제공된다.
포장 삽입물은 용기 상에 존재하거나 용기와 연결된다. 적합한 용기는 예를 들어 병, 바이알, 시린지 등을 포함한다. 다양한 물질, 예컨대 유리 또는 플라스틱으로부터 용기가 형성될 수 있다. 용기는 루푸스를 치료하는데 효과적인 조성물을 보유 또는 함유하고, 멸균 접근 포트를 가질 수 있다 (예를 들어, 용기는 피하 주사 바늘로 관통가능한 스토퍼가 존재하는 정맥내 용액 백 또는 바이알일 수 있다). 조성물 내 적어도 하나의 활성제는 항체이다. 라벨 또는 포장 삽입물은 조성물이 치료에 적격인 대상체에서 루푸스를 치료하는데 사용됨을 나타내며, 제공되는 항체 및 임의의 다른 약물의 투여량 및 간격에 대한 구체적 지침을 포함한다. 제조품은 제약상 허용되는 희석제 완충제, 예컨대 정박테리아 주사용수 (BWFI), 포스페이트-완충 염수, 링거액 및 덱스트로스 용액을 포함하는 제2 용기를 추가로 포함할 수 있다. 제조품은 제2 의약을 포함하는 제2 또는 제3 용기를 추가로 포함할 수 있으며, 여기서 유형 I 인터페론 항체가 제1 의약이며, 여기서 제조품은 대상체를 제2 의약으로 치료하기 위한 포장 삽입물 상의 지침서를 추가로 포함한다. 예시적인 제2 의약은 화학요법제, 면역억제제, 항말라리아제, 세포독성제, 인테그린 길항제, 시토카인 길항제 또는 호르몬을 포함한다. 일부 실시양태에서, 제2 의약은 예를 들어 히드록시클로로퀸, 클로로퀸, 퀴나크린, 시클로포스파미드, 프레드니손, 미코페놀레이트 모페틸, 메토트렉세이트, 아자티오프린 또는 6-메르캅토퓨린; 코르티코스테로이드, 예컨대 프레드니손 (임의로 메토트렉세이트, 히드록시클로로퀸, 클로로퀸, 퀴나크린, MMF, 또는 6-메르캅토퓨린의 존재 또는 부재 하의 아자티오프린과 함께); 또는 코르티코스테로이드, 예컨대 프레드니손 뿐만 아니라 MMF 또는 시클로포스파미드를 포함하는, 화학요법제, 항말라리아제 또는 면역억제제이다. 제조품은 상업적 및 사용자 관점에서 바람직한 다른 물질, 예를 들어 다른 완충제, 희석제, 필터, 바늘 및 시린지를 추가로 포함할 수 있다.
또 다른 측면에서, 본 발명은 생물학적 샘플로부터의 하나 이상의 IRG의 유전자 발현을 검출하기 위한 생물-검정 모듈 및 유전자의 발현을 계산하고 유전자 또는 단백질 합성의 계산값을 컷오프 값에 대해 스코어링하여 진단을 제공하기 위한 프로세서 모듈을 포함하는 전산화 시스템을 포함하나 이에 제한되지는 않는 제조품을 고려하며, 여기서 컷오프 값은 (1) 건강한 사람 (또는 대조군)의 IRG의 발현 수준의 값의 1.5배 미만 또는 (2) 건강한 사람 (또는 대조군)에서의 IRG의 발현 수준의 중간 값에 비해 2 표준 편차 미만이다.
또 다른 측면에서, 본 발명은 환자에게 고정 용량의 항-인터페론 α 항체를 전달하며, 여기서 고정 용량은 항-인터페론 α 항체의 약 50 mg 내지 약 2000 mg 범위인, 피하 투여 장치를 포함하는 제조품을 제공한다. 일부 실시양태에서, 고정 용량은 약 100-500 mg 매주, 약 200-1000 mg 격주, 또는 약 400-2000 mg 매월이다. 일부 실시양태에서, 고정 용량은 약 150 mg, 200 mg, 250 mg, 300 mg, 350 mg, 400 mg, 450 mg, 또는 500 mg이다. 일부 실시양태에서, 고정 용량은 약 150 mg 또는 약 300 mg 매주, 약 300 mg 또는 약 600 mg 격주, 또는 약 600 mg, 약 750 mg 또는 약 1200 mg 매월이다. 일부 실시양태에서, 장치 내의 항체의 농도는 약 50 내지 250 mg/mL이다. 또 다른 측면에서, 본 발명은 항-인터페론 α 항체를 약 50 내지 250 mg/mL의 농도로 포함하는 제조품을 제공한다. 일부 실시양태에서, 항-인터페론 α 항체는 아미노산 서열 RASQSVSTSSYSYMH (서열 1)를 포함하는 HVR-L1, 아미노산 서열 YASNLES (서열 2)를 포함하는 HVR-L2, 및 아미노산 서열 QHSWGIPRTF (서열 3)를 포함하는 HVR-L3을 포함하는 경쇄; 및/또는 아미노산 서열 GYTFTEYIIH (서열 4)를 포함하는 HVR-H1, 아미노산 서열 SINPDYDITNYNQRFKG (서열 5)를 포함하는 HVR-H2, 및 아미노산 서열 WISDFFDY (서열 6)를 포함하는 HVR-H3을 포함하는 중쇄를 포함한다. 일부 실시양태에서, 항체는 서열 7의 아미노산 서열에 대해 적어도 95% 서열 동일성의 중쇄 가변 영역 서열; 및/또는 서열 8의 아미노산 서열에 대해 적어도 95% 서열 동일성의 경쇄 가변 영역 서열을 포함한다. 일부 실시양태에서, 항체는 서열 7의 아미노산 서열을 포함하는 중쇄 가변 영역; 및/또는 서열 8의 아미노산 서열을 포함하는 경쇄 가변 영역을 포함한다. 일부 실시양태에서, 항체는 CAS 등록 번호 948570-30-7을 갖는 론탈리주맙이다. 일부 실시양태에서, 피하 투여 장치는 예비-충전 시린지, 자동주사기, 또는 대용량 주입 장치이다. 예를 들어, 대용량 액체 의약의 피하 투여를 가능하게 하는 단일 사용 주입 장치인 로슈로부터의 마이도즈(MyDose) 제품이 투여 장치로 이용될 수 있다.
VII. 전형적 실시양태
1. 환자에게 유효량의 인터페론 억제제를 투여하는 것을 포함하며, 여기서 환자는 자가면역 질환으로 진단되고 ISMlo인 것으로 결정되거나 또는 ISMlo인 것에 기초한 치료를 위해 선택된 것인, 환자에서 자가면역 질환을 치료하는 방법.
2. 제1실시양태에 있어서, ISMlo가 환자로부터의 샘플에서 하나 이상의 인터페론 반응 유전자 (IRG)의 mRNA 발현 수준을 측정함으로써 결정되는 것인 방법.
3. 제2실시양태에 있어서, 샘플에서의 mRNA 발현 수준이 RT-PCR에 의해 결정되는 것인 방법.
4. 제2실시양태 또는 제3실시양태에 있어서, 하나 이상의 IRG의 mRNA 발현 수준이 하우스키핑 유전자 (예컨대, 트랜스페린 수용체 (TFRC), 리보솜 단백질 L19, 글리세르알데히드-3-포스페이트 데히드로게나제 (GAPDH) 등)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
5. 제2실시양태 내지 제4실시양태 중 어느 한 실시양태에 있어서, 샘플이 혈액 샘플인 방법.
6. 제2실시양태 내지 제5실시양태 중 어느 한 실시양태에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1, IFI27, SIGLEC1, DNAPTP6, USP18, IF16, HSXIAPAF1 및 LAMP3으로 이루어진 군으로부터 선택된 IRG 중 하나 이상 (표 A에 수록된 IRG 중 하나, 그의 조합 또는 모두)의 mRNA 발현 수준이 결정되는 것인 방법.
7. 제6실시양태에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1, IFI27, SIGLEC1, DNAPTP6, USP18, IF16, HSXIAPAF1 및 LAMP3으로 이루어진 군으로부터 선택된 IRG 중 하나 이상의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
8. 제2실시양태 내지 제5실시양태 중 어느 한 실시양태에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP 및 ZBP1로 이루어진 군으로부터 선택된 IRG 중 하나 이상 (24-유전자 ISM 시그너쳐의 IRG 중 하나, 그의 조합 또는 모두)의 mRNA 발현 수준이 결정되는 것인 방법.
9. 제8실시양태에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1로 이루어진 군으로부터 선택된 IRG 중 하나 이상의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
10. 제2실시양태 내지 제5실시양태 중 어느 한 실시양태에 있어서, EPSTI1, HERC5 및/또는 TYK1 (CMPK2)의 mRNA 발현 수준이 결정되는 것인 방법.
11. 제10실시양태에 있어서, EPSTI1, HERC5 및/또는 TYK1 (CMPK2)의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
12. 환자에게 유효량의 인터페론 억제제를 투여하는 것을 포함하며, 여기서 환자는 자가면역 질환으로 진단되고 면역검정에 의해 측정시에 200 IU 이하의 치료전 항-이중 가닥 DNA 항체 역가 (항-dsDNA)를 갖는 것으로 결정되거나 또는 면역검정에 의해 측정시에 200 IU 이하의 치료전 항-이중 가닥 DNA 항체 역가 (항-dsDNA)를 갖는 것에 기초한 치료를 위해 선택된 것인, 환자에서 자가면역 질환을 치료하는 방법.
13. 제12실시양태에 있어서, 면역검정이 ELISA인 방법.
14. 제12실시양태 또는 제13실시양태에 있어서, 환자가 200 IU 이하의 항-dsDNA 역가를 갖고 ISMhi인 방법.
15. 제14실시양태에 있어서, ISMhi가 환자로부터의 샘플에서 하나 이상의 IRG의 mRNA 발현 수준을 측정함으로써 결정되는 것인 방법.
16. 제15실시양태에 있어서, mRNA 발현 수준이 RT-PCR에 의해 결정되는 것인 방법.
17. 제15실시양태 또는 제16실시양태에 있어서, 하나 이상의 IRG의 mRNA 발현 수준이 하우스키핑 유전자 (예컨대, 트랜스페린 수용체 (TFRC), 리보솜 단백질 L19, 글리세르알데히드-3-포스페이트 데히드로게나제 (GAPDH) 등)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
18. 제15실시양태 내지 제17실시양태 중 어느 한 실시양태에 있어서, 샘플이 혈액 샘플인 방법.
19. 제15실시양태 내지 제18실시양태 중 어느 한 실시양태에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1, IFI27, SIGLEC1, DNAPTP6, USP18, IF16, HSXIAPAF1 및 LAMP3으로 이루어진 군으로부터 선택된 IRG 중 하나 이상 (표 A에 수록된 IRG 중 하나, 그의 조합 또는 모두)의 mRNA 발현 수준이 결정되는 것인 방법.
20. 제19실시양태에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1, IFI27, SIGLEC1, DNAPTP6, USP18, IF16, HSXIAPAF1 및 LAMP3으로 이루어진 군으로부터 선택된 IRG 중 하나 이상의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
21. 제15실시양태 내지 제18실시양태 중 어느 한 실시양태에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP 및 ZBP1로 이루어진 군으로부터 선택된 IRG 중 하나 이상 (24-유전자 ISM 시그너쳐의 IRG 중 하나, 그의 조합 또는 모두)의 mRNA 발현 수준이 결정되는 것인 방법.
22. 제21실시양태에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1로 이루어진 군으로부터 선택된 IRG 중 하나 이상의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
23. 제15실시양태 내지 제18실시양태 중 어느 한 실시양태에 있어서, EPSTI1, HERC5 및/또는 TYK1 (CMPK2)의 mRNA 발현 수준이 결정되는 것인 방법.
24. 제23실시양태에 있어서, EPSTI1, HERC5 및/또는 TYK1 (CMPK2)의 mRNA 발현 수준이 TFRC에 대해 정규화되는 것인 방법.
25. 제1실시양태 내지 제24실시양태 중 어느 한 실시양태에 있어서, 자가면역 질환이 루푸스, 류마티스 관절염, 건선, 건선성 관절염, 인슐린-의존성 당뇨병 (IDDM), 다발성 경화증 (MS), 근염, 피부근염, 혈관염, 아테롬성동맥경화증, 강직성 척추염 및 쇼그렌 증후군으로 이루어진 군으로부터 선택되는 것인 방법.
26. 제25실시양태에 있어서, 환자가 전신 홍반성 루푸스 (SLE)를 갖는 것인 방법.
27. 제25실시양태에 있어서, 환자가 중등도 내지 중증 활성 루푸스를 갖는 것인 방법.
28. 제25실시양태에 있어서, 환자가 중등도 내지 중증 활성 SLE를 갖는 것인 방법.
29. 제25실시양태에 있어서, 환자가 루푸스 신염을 갖는 것인 방법.
30. 제1실시양태 내지 제13실시양태 중 어느 한 실시양태에 있어서, 환자가 클래스 III-V 루푸스 신염을 갖고 ISMlo인 방법.
31. 제25실시양태에 있어서, 환자가 소아 루푸스를 갖는 것인 방법.
32. 제1실시양태 내지 제31실시양태 중 어느 한 실시양태에 있어서, 인터페론 억제제가 항-인터페론 유형 I 항체인 방법.
33. 제32실시양태에 있어서, 항체가 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합하는 것인 방법.
34. 제32실시양태에 있어서, 항체가 인터페론 α에 특이적으로 결합하는 것인 방법.
35. 제34실시양태에 있어서, 항체가 적어도 IFNα 하위유형 1, 2, 4, 5, 8, 10 및 21에 결합하는 것인 방법.
36. 제34실시양태에 있어서, 항체가 아미노산 서열 RASQSVSTSSYSYMH (서열 1)를 포함하는 HVR-L1, 아미노산 서열 YASNLES (서열 2)를 포함하는 HVR-L2, 및 아미노산 서열 QHSWGIPRTF (서열 3)를 포함하는 HVR-L3을 포함하는 경쇄; 및/또는 아미노산 서열 GYTFTEYIIH (서열 4)를 포함하는 HVR-H1, 아미노산 서열 SINPDYDITNYNQRFKG (서열 5)를 포함하는 HVR-H2, 및 아미노산 서열 WISDFFDY (서열 6)를 포함하는 HVR-H3을 포함하는 중쇄를 포함하는 것인 방법.
37. 제34실시양태에 있어서, 항체가 서열 7의 아미노산 서열에 대해 적어도 95% 서열 동일성의 중쇄 가변 영역 서열; 및/또는 서열 8의 아미노산 서열에 대해 적어도 95% 서열 동일성의 경쇄 가변 영역 서열을 포함하는 것인 방법.
38. 제34실시양태에 있어서, 항체가 서열 7의 아미노산 서열을 포함하는 중쇄 가변 영역; 및/또는 서열 8의 아미노산 서열을 포함하는 경쇄 가변 영역을 포함하는 것인 방법.
39. 제34실시양태에 있어서, 항체가 CAS 등록 번호 948570-30-7을 갖는 론탈리주맙인 방법.
40. 제32실시양태 내지 제39실시양태 중 어느 한 실시양태에 있어서, 항체가 정맥내로 투여되는 것인 방법.
41. 제32실시양태 내지 제39실시양태 중 어느 한 실시양태에 있어서, 항체가 피하로 투여되는 것인 방법.
42. 제32실시양태 내지 제39실시양태 중 어느 한 실시양태에 있어서, 항체가 100 내지 2000 mg의 균일 용량으로 투여되는 것인 방법.
43. 제42실시양태에 있어서, 항체가 100-500 mg 매주, 200-1000 mg 격주, 또는 400-2000 mg 매월의 균일 용량으로 투여되는 것인 방법.
44. 제42실시양태 또는 제43실시양태에 있어서, 항체가 150 mg 또는 300 mg 매주, 300 mg 또는 600 mg 격주, 또는 600 mg, 750 mg 또는 1200 mg 매월의 균일 용량으로 투여되는 것인 방법.
45. 제32실시양태 내지 제44실시양태 중 어느 한 실시양태에 있어서, 항체의 투여가 (1) 루푸스 플레어의 수 및/또는 중증도의 감소, (2) 루푸스 플레어의 예방, (3) 루푸스 신염 플레어의 감소, (4) 루푸스 신염 플레어의 예방, (5) 루푸스 신염의 완화 유도, (6) 루푸스 신염 완화의 유지, (7) 소아 루푸스 플레어의 수 및/또는 중증도의 감소, (8) 소아 루푸스 플레어의 예방, (9) 소아 루푸스 신염 플레어의 감소, (10) 소아 루푸스 신염 플레어의 예방, (11) 소아 루푸스 신염의 완화 유도, 및 (12) 소아 루푸스 신염 완화의 유지 중 하나 이상에서 효과적인 것인 방법.
46. 제32실시양태 내지 제44실시양태 중 어느 한 실시양태에 있어서, 항체의 투여가 환자에서 항-dsDNA 항체 역가를 저하시키는데 효과적인 것인 방법.
47. 제32실시양태 내지 제44실시양태 중 어느 한 실시양태에 있어서, 항체의 투여가 환자에서 플레어(들)의 감소에 효과적인 것인 방법.
48. 제47실시양태에 있어서, 상기 플레어(들)가 중등도 또는 중증인 것인 방법.
49. 제32실시양태 내지 제44실시양태 중 어느 한 실시양태에 있어서, 항체의 투여가 환자에서 Selena 플레어 인덱스 (SFI) 스코어 또는 Selena 플레어 인덱스-개정판 (SFI-R) 스코어의 감소에 효과적인 것인 방법.
50. 제32실시양태 내지 제44실시양태 중 어느 한 실시양태에 있어서, 항체의 투여가 모든 치료전 BILAG A 및 B 도메인을 감소시키는데 효과적인 것인 방법.
51. 제32실시양태 내지 제44실시양태 중 어느 한 실시양태에 있어서, 환자가 항체의 투여 후에 새로운 BILAG A 기관 도메인 스코어를 갖지 않거나 또는 1 이하의 새로운 BILAG B 기관 도메인 스코어를 갖는 것인 방법.
52. 제32실시양태 내지 제44실시양태 중 어느 한 실시양태에 있어서, 항체의 투여가 SELENA-SLEDAI 스코어를 환자의 치료전 스코어로부터 적어도 4점 감소시키는데 효과적인 것인 방법.
53. 제32실시양태 내지 제44실시양태 중 어느 한 실시양태에 있어서, 항체의 투여 후에 환자에서 의사의 전반적 평가 (PGA)가 치료전 스코어로부터 0.3점 이하 증가를 갖는 것인 방법.
54. 제32실시양태 내지 제44실시양태 중 어느 한 실시양태에 있어서, 상기 환자가 하기 평가 도구: SRI, BILAG, SELENA-SLEDAI 또는 의사의 전반적 평가 (PGA) 중 어느 하나에 의해 측정시에 치료 전에 중등도 또는 중증 질환 활성을 갖는 기관계에서 질환 활성의 치료후 감소를 나타내는 것인 방법.
55. 제32실시양태 내지 제44실시양태 중 어느 한 실시양태에 있어서, 환자가 항체의 투여에 대한 SRI-4, SRI-5, SRI-6 또는 SRI-7 반응을 갖는 것인 방법.
56. 제1실시양태 내지 제55실시양태 중 어느 한 실시양태에 있어서, 환자에게 제2 의약을 투여하는 것을 추가로 포함하는 방법.
57. 제56실시양태에 있어서, 제2 의약이 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 면역억제제, 항말라리아제, 스타틴 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
58. 제56실시양태에 있어서, 제2 의약이 루푸스에 대한 표준 진료인 방법.
59. 제32실시양태 내지 제44실시양태 중 어느 한 실시양태에 있어서, 항체의 투여가 상기 항체의 상기 투여 전에 코르티코스테로이드를 투여한 환자에서 코르티코스테로이드 절약 (CS)을 발생시키는 것인 방법.
60. 제32실시양태 내지 제44실시양태 중 어느 한 실시양태에 있어서, 항체의 투여가 스테로이드 및/또는 면역억제제 요법을 이용하는 요법에 대한 필요의 감소를 발생시키는 것인 방법.
61. 제32실시양태 내지 제44실시양태 중 어느 한 실시양태에 있어서, 항체의 투여 후에 환자에서 그의 코르티코스테로이드 용량이 10 mg/일의 프레드니손 등량까지 점감되는 것인 방법.
62. 제32실시양태 내지 제44실시양태 중 어느 한 실시양태에 있어서, 항체의 투여가 항체 투여 약 24 내지 약 52주 후에 코르티코스테로이드 사용의 적어도 50% 감소를 발생시키는 것인 방법.
63. 제32실시양태 내지 제44실시양태 중 어느 한 실시양태에 있어서, 항체의 투여가 SELENA SLEDAI 스코어 및/또는 의사의 전반적 평가에 의해 측정시에 중등도 및/또는 중증 플레어의 발생률의 감소; 중증 플레어까지의 유의하게 지연된 시간; 종창 또는 압통 관절의 수의 감소; 및 1 BILAG A (중증) 기관 플레어 또는 1 초과의 BILAG B (중등도) 기관 플레어의 위험의 유의한 감소 중 하나 이상을 발생시키는 것인 방법.
64. 인터페론 억제제를 투여하는 것을 포함하는, 치료를 필요로 하는 ISMlo 루푸스 환자의 치료를 위한 치료 요법.
65. 제64실시양태에 있어서, 환자가 SLE 또는 루푸스 신염을 갖는 것인 요법.
66. 제64실시양태 또는 제65실시양태에 있어서, 인터페론 억제제가 항-IFNα 항체인 요법.
67. 제66실시양태에 있어서, 항체가 100-2000 mg의 균일 용량으로 투여되는 것인 요법.
68. 제66실시양태에 있어서, 항체가 100-500 mg 매주, 200-1000 mg 격주, 또는 400-2000 mg 매월의 균일 용량으로 투여되는 것인 요법.
69. 제66실시양태에 있어서, 항체가 150 mg 또는 300 mg 매주, 300 mg 또는 600 mg 격주, 또는 600 mg, 750 mg 또는 1200 mg 매월의 균일 용량으로 투여되는 것인 요법.
70. 제66실시양태 내지 제69실시양태 중 어느 한 실시양태에 있어서, 항체가 정맥내로 또는 피하로 투여되는 것인 요법.
71. 제66실시양태 내지 제70실시양태 중 어느 한 실시양태에 있어서, 항체가 아미노산 서열 RASQSVSTSSYSYMH (서열 1)를 포함하는 HVR-L1, 아미노산 서열 YASNLES (서열 2)를 포함하는 HVR-L2, 및 아미노산 서열 QHSWGIPRTF (서열 3)를 포함하는 HVR-L3을 포함하는 경쇄; 및/또는 아미노산 서열 GYTFTEYIIH (서열 4)를 포함하는 HVR-H1, 아미노산 서열 SINPDYDITNYNQRFKG (서열 5)를 포함하는 HVR-H2, 및 아미노산 서열 WISDFFDY (서열 6)를 포함하는 HVR-H3을 포함하는 중쇄를 포함하는 것인 요법.
72. 제66실시양태 내지 제70실시양태 중 어느 한 실시양태에 있어서, 항체가 서열 7의 아미노산 서열에 대해 적어도 95% 서열 동일성의 중쇄 가변 영역 서열; 및/또는 서열 8의 아미노산 서열에 대해 적어도 95% 서열 동일성의 경쇄 가변 영역 서열을 포함하는 것인 요법.
73. 제66실시양태 내지 제70실시양태 중 어느 한 실시양태에 있어서, 항체가 서열 7의 아미노산 서열을 포함하는 중쇄 가변 영역; 및/또는 서열 8의 아미노산 서열을 포함하는 경쇄 가변 영역을 포함하는 것인 요법.
74. 제66실시양태 내지 제70실시양태 중 어느 한 실시양태에 있어서, 항체가 CAS 등록 번호 948570-30-7을 갖는 론탈리주맙인 요법.
75. 루푸스 환자로부터의 샘플에서 IRG 상태를 결정하는 것을 포함하며, 여기서 ISMlo인 환자가 인터페론 억제제 치료로부터 이익을 얻을 수 있는 환자로 확인되는 것인, 인터페론 억제제 치료로부터 이익을 얻을 수 있는 루푸스 환자를 확인하는 방법.
76. 루푸스 환자로부터의 샘플에서 IRG 상태를 결정하는 것 및 상기 환자의 IRG 상태에 대한 보고서를 제공하는 것을 포함하며, 여기서 보고서는 환자가 ISMlo 또는 ISMhi임을 나타내는 것인, 인터페론 억제제 치료로부터 이익을 얻을 수 있는 루푸스 환자를 확인하는 방법.
77. 제76실시양태에 있어서, 보고서가, 환자가 ISMlo인 경우에 환자가 인터페론 억제제 치료로부터 이익을 얻을 수 있음을 추가로 나타내는 것인 방법.
78. 루푸스 환자로부터의 샘플에서 IRG 상태를 결정하는 것을 포함하며, 여기서 ISMlo인 환자가 인터페론 억제제 치료에 대해 반응할 가능성이 있는 환자로 확인되는 것인, 인터페론 억제제 치료에 대한 루푸스 환자의 반응성을 예측하는 방법.
79. 제75실시양태 내지 제78실시양태 중 어느 한 실시양태에 있어서, IRG 발현 수준이 건강한 사람 또는 대조군의 동일한 IRG의 발현 수준의 평균 값의 1.5, 1.4, 1.3, 1.2 또는 1.1배 미만인 경우에 환자가 ISMlo인 것으로 간주되는 것인 방법.
80. 제75실시양태 내지 제78실시양태 중 어느 한 실시양태에 있어서, IRG 발현 수준이 건강한 사람 또는 대조군의 동일한 IRG의 발현 수준의 평균 값에 비해 2, 1.9, 1.8, 1.7, 1.6, 1.5, 1.4, 1.3, 1.2 또는 1.1 표준 편차 미만인 경우에 환자가 ISMlo인 것으로 간주되는 것인 방법.
81. 루푸스 환자로부터의 샘플에서 IRG의 발현 수준을 결정하는 것 및 환자의 IRG 발현 수준을 건강한 사람(들)에서의 동일한 IRG의 발현 수준의 평균 값과 비교하는 것을 포함하며, 여기서 환자의 IRG 발현 수준이 (1) 건강한 사람 또는 대조군의 동일한 IRG의 발현 수준의 평균 값의 1.5, 1.4, 1.3, 1.2 또는 1.1배 미만 또는 (2) 건강한 사람 또는 대조군에서 동일한 IRG의 발현 수준의 평균 값에 비해 2, 1.9, 1.8, 1.7, 1.6, 1.5, 1.4, 1.3, 1.2 또는 1.1 표준 편차 미만인 경우에 환자가 인터페론 억제제 치료에 대해 반응할 가능성이 있는 환자로 확인되는 것인, 인터페론 억제제 치료에 대한 루푸스 환자의 반응성을 예측하는 방법.
82. 제75실시양태 내지 제81실시양태 중 어느 한 실시양태에 있어서, ISMlo 또는 IRG 발현 수준이 환자로부터의 샘플에서 하나 이상의 인터페론 반응 유전자 (IRG)의 mRNA 발현 수준을 측정함으로써 결정되는 것인 방법.
83. 제82실시양태에 있어서, 샘플에서 하나 이상의 IRG의 mRNA 발현 수준이 RT-PCR에 의해 측정되는 것인 방법.
84. 제82실시양태 또는 제83실시양태에 있어서, 하나 이상의 IRG의 mRNA 발현 수준이 하우스키핑 유전자 (예컨대, 트랜스페린 수용체 (TFRC), 리보솜 단백질 L19, 글리세르알데히드-3-포스페이트 데히드로게나제 (GAPDH) 등)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
85. 제75실시양태 내지 제84실시양태 중 어느 한 실시양태에 있어서, 샘플이 혈액 샘플인 방법.
86. 제75실시양태 내지 제85실시양태 중 어느 한 실시양태에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1, IFI27, SIGLEC1, DNAPTP6, USP18, IF16, HSXIAPAF1 및 LAMP3으로 이루어진 군으로부터 선택된 IRG 중 하나 이상 (표 A에 수록된 IRG 중 하나, 그의 조합 또는 모두)의 mRNA 발현 수준이 결정되는 것인 방법.
87. 제86실시양태에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1, IFI27, SIGLEC1, DNAPTP6, USP18, IF16, HSXIAPAF1 및 LAMP3으로 이루어진 군으로부터 선택된 IRG 중 하나 이상의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
88. 제75실시양태 내지 제85실시양태 중 어느 한 실시양태에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP 및 ZBP1로 이루어진 군으로부터 선택된 IRG 중 하나 이상 (24-유전자 ISM 시그너쳐의 IRG 중 하나, 그의 조합 또는 모두)의 mRNA 발현 수준이 결정되는 것인 방법.
89. 제88실시양태에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1로 이루어진 군으로부터 선택된 IRG 중 하나 이상의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
90. 제75실시양태 내지 제85실시양태 중 어느 한 실시양태에 있어서, EPSTI1, HERC5 및/또는 TYK1 (CMPK2)의 mRNA 발현 수준이 결정되는 것인 방법.
91. 제90실시양태에 있어서, EPSTI1, HERC5 및/또는 TYK1 (CMPK2)의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
92. 루푸스 환자로부터의 샘플에서 항-dsDNA 항체 상태를 결정하는 것을 포함하며, 여기서 면역검정에 의해 측정시에 200 IU 이하의 항-dsDNA 항체 역가를 갖는 환자가 인터페론 억제제 치료로부터 이익을 얻을 수 있는 환자로 확인되는 것인, 인터페론 억제제 치료로부터 이익을 얻을 수 있는 루푸스 환자를 확인하는 방법.
93. 루푸스 환자로부터의 샘플에서 항-dsDNA 항체 상태를 결정하는 것 및 항-dsDNA 항체 역가가 면역검정에 의해 측정시에 200 IU 이하인 경우에 환자가 인터페론 억제제 치료로부터 이익을 얻을 수 있음을 나타내는 보고서를 제공하는 것을 포함하는, 인터페론 억제제 치료로부터 이익을 얻을 수 있는 루푸스 환자를 확인하는 방법.
94. 루푸스 환자로부터의 샘플에서 항-dsDNA 항체 상태를 결정하는 것을 포함하며, 여기서 면역검정에 의해 측정시에 200 IU 이하의 항-dsDNA 항체 역가를 갖는 환자가 인터페론 억제제 치료에 대해 반응할 가능성이 있는 환자로 확인되는 것인, 인터페론 억제제 치료에 대한 루푸스 환자의 반응성을 예측하는 방법.
95. 제92실시양태 내지 제94실시양태 중 어느 한 실시양태에 있어서, 면역검정이 ELISA인 방법.
96. 루푸스 환자의 IRG 상태를 결정하는 것을 포함하며, 여기서 IRG의 발현 수준의 유의한 증가는 환자가 이후 3 내지 5주 내에 플레어를 가질 가능성이 있음을 나타내는 것인, 루푸스 환자에서 플레어의 가능성을 예측하는 방법.
97. 제96실시양태에 있어서, 상기 IRG가 EPSTI1, HERC5, TYK1 (CMPK2), IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
98. 제96실시양태에 있어서, 플레어가 SELENA-SLEDAI 플레어 인덱스 (SFI) 및/또는 SFI-개정판에 의해 결정되는 것인 방법.
99. 제96실시양태에 있어서, 플레어가 SELENA-SLEDAI 플레어 인덱스 (SFI) 및/또는 SFI-개정판에 기초하여 경증, 중등도 또는 중증인 것인 방법.
100. 제75실시양태 내지 제95실시양태 중 어느 한 실시양태에 있어서, 인터페론 억제제가 항-인터페론 유형 I 항체인 방법.
101. 제100실시양태에 있어서, 항체가 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합하는 것인 방법.
102. 제100실시양태에 있어서, 항체가 인터페론 α에 특이적으로 결합하는 것인 방법.
103. 제100실시양태에 있어서, 항체가 적어도 IFNα 하위유형 1, 2, 4, 5, 8, 10 및 21에 결합하는 것인 방법.
104. 제102실시양태에 있어서, 항체가 아미노산 서열 RASQSVSTSSYSYMH (서열 1)를 포함하는 HVR-L1, 아미노산 서열 YASNLES (서열 2)를 포함하는 HVR-L2, 및 아미노산 서열 QHSWGIPRTF (서열 3)를 포함하는 HVR-L3을 포함하는 경쇄; 및/또는 아미노산 서열 GYTFTEYIIH (서열 4)를 포함하는 HVR-H1, 아미노산 서열 SINPDYDITNYNQRFKG (서열 5)를 포함하는 HVR-H2, 및 아미노산 서열 WISDFFDY (서열 6)를 포함하는 HVR-H3을 포함하는 중쇄를 포함하는 것인 방법.
105. 제102실시양태에 있어서, 항체가 서열 7의 아미노산 서열에 대해 적어도 95% 서열 동일성의 중쇄 가변 영역 서열; 및/또는 서열 8의 아미노산 서열에 대해 적어도 95% 서열 동일성의 경쇄 가변 영역 서열을 포함하는 것인 방법.
106. 제102실시양태에 있어서, 항체가 서열 7의 아미노산 서열을 포함하는 중쇄 가변 영역; 및/또는 서열 8의 아미노산 서열을 포함하는 경쇄 가변 영역을 포함하는 것인 방법.
107. 제102실시양태에 있어서, 항체가 CAS 등록 번호 948570-30-7을 갖는 론탈리주맙인 방법.
108. 환자에게 항-인터페론 α 항체의 균일 용량을 전달하며, 여기서 균일 용량은 항-인터페론 α 항체의 50 mg 내지 2000 mg의 범위인, 피하 투여 장치를 포함하는 제조품.
109. 제108실시양태에 있어서, 균일 용량이 100-500 mg 매주, 200-1000 mg 격주, 또는 400-2000 mg 매월인 제조품.
110. 제108실시양태에 있어서, 균일 용량이 150 mg 또는 300 mg 매주, 300 mg 또는 600 mg 격주, 또는 600 mg, 750 mg 또는 1200 mg 매월인 제조품.
111. 제108실시양태에 있어서, 장치 내의 항체의 농도가 약 50 내지 250 mg/mL인 제조품.
112. 항-인터페론 α 항체를 약 50 내지 250 mg/mL의 농도로 포함하는 제조품.
113. 제108실시양태 내지 제112실시양태 중 어느 한 실시양태에 있어서, 항체가 아미노산 서열 RASQSVSTSSYSYMH (서열 1)를 포함하는 HVR-L1, 아미노산 서열 YASNLES (서열 2)를 포함하는 HVR-L2, 및 아미노산 서열 QHSWGIPRTF (서열 3)를 포함하는 HVR-L3을 포함하는 경쇄; 및/또는 아미노산 서열 GYTFTEYIIH (서열 4)를 포함하는 HVR-H1, 아미노산 서열 SINPDYDITNYNQRFKG (서열 5)를 포함하는 HVR-H2, 및 아미노산 서열 WISDFFDY (서열 6)를 포함하는 HVR-H3을 포함하는 중쇄를 포함하는 것인 제조품.
114. 제108실시양태 내지 제112실시양태 중 어느 한 실시양태에 있어서, 항체가 서열 7의 아미노산 서열에 대해 적어도 95% 서열 동일성의 중쇄 가변 영역 서열; 및/또는 서열 8의 아미노산 서열에 대해 적어도 95% 서열 동일성의 경쇄 가변 영역 서열을 포함하는 것인 제조품.
115. 제108실시양태 내지 제112실시양태 중 어느 한 실시양태에 있어서, 항체가 서열 7의 아미노산 서열을 포함하는 중쇄 가변 영역; 및/또는 서열 8의 아미노산 서열을 포함하는 경쇄 가변 영역을 포함하는 것인 제조품.
116. 제108실시양태 내지 제112실시양태 중 어느 한 실시양태에 있어서, 항체가 CAS 등록 번호 948570-30-7을 갖는 론탈리주맙인 제조품.
117. 제108실시양태에 있어서, 피하 투여 장치가 예비-충전 시린지, 자동주사기 또는 대용량 주입 장치인 제조품.
118. 생물학적 샘플로부터 하나 이상의 IRG의 유전자 발현을 검출하기 위한 생물-검정 모듈 및 유전자의 발현을 계산하고 유전자의 계산값을 컷오프 값에 대해 스코어링하여 진단을 제공하기 위한 프로세서 모듈을 포함하는 전산화 시스템을 포함하며, 여기서 컷오프 값은 (1) 건강한 사람 또는 대조군의 IRG의 발현 수준의 값의 1.5, 1.4, 1.3, 1.2 또는 1.1배 미만 또는 (2) 건강한 사람 또는 대조군의 IRG의 발현 수준의 중간 값에 비해 2, 1.9, 1.8, 1.7, 1.6, 1.5, 1.4, 1.3, 1.2 또는 1.1 표준 편차 미만인 제조품.
119. 제118실시양태에 있어서, 생물-검정 모듈이 코바스 z480 분석기인 제조품.
120. 자가면역 환자로부터 혈액 샘플을 수집하기 위한 바이알 및 자가면역 환자가 ISMlo인지 여부를 결정하기 위한 지침서를 포함하는, 인터페론 억제제 치료에 대해 이익을 얻을 수 있는 자가면역 환자를 확인하기 위한 키트.
121. 제120실시양태에 있어서, EPSTI1, HERC5, TYK1 (CMPK2), IFI27, IFI44, IFIT1, MX1, OAS1, OAS2 및 OAS3으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 이용하여 자가면역 환자가 ISMlo인지 여부를 결정하는 것인 키트.
122. 제121실시양태에 있어서, 자가면역 질환이 루푸스인 키트.
123. 제120실시양태에 있어서, 인터페론 억제제가 항-인터페론 α 항체인 키트.
124. 약 50 내지 약 250 mg/mL 양의 항-인터페론 α 항체, 약 50 내지 약 200 mM 양의 아르기닌-HCl, 약 5 내지 약 100 mM 양의 히스티딘, 약 0.01 내지 약 0.1% 양의 폴리소르베이트를 포함하고, 약 5.5 내지 약 7.0의 pH를 갖는 안정한 액체 조성물.
125. 루푸스로 진단된 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 포함하며, 여기서 환자는 ENA-인, 환자에서 루푸스를 치료하는 방법.
126. 제125실시양태에 있어서, 항체가 인터페론 α; 인터페론 β; 인터페론 ω; 인터페론 λ; 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합하는 것인 방법.
127. 제125실시양태에 있어서, 항체가 인터페론 α에 특이적으로 결합하는 것인 방법.
128. 제127실시양태에 있어서, 항체가 론탈리주맙인 방법.
129. 제125실시양태에 있어서, 환자의 ENA 상태가 환자로부터의 샘플에서 자가항체를 검출함으로써 결정되며, 여기서 자가항체가 항-Ro, 항-La, 항-SM, 항-RNP 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
130. 제129실시양태에 있어서, 샘플이 전혈, 혈액-유래 세포, 혈장, 혈청 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
131. 제125실시양태에 있어서, 항체가 정맥내로 투여되는 것인 방법.
132. 제125실시양태에 있어서, 루푸스가 전신 홍반성 루푸스인 방법.
133. 제125실시양태에 있어서, 환자가 건강한 개체의 인터페론 시그너쳐 측정값 (ISM) 이상의 기준선 ISM을 갖는 것인 방법.
134. 제125실시양태에 있어서, 환자가 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는 것인 방법.
135. 제133실시양태 또는 제134실시양태에 있어서, ISM이 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정되는 것인 방법.
136. 제133실시양태 또는 제134실시양태에 있어서, ISM이 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정되는 것인 방법.
137. 제125실시양태에 있어서, 대상체에게 제2 의약을 투여하는 것을 추가로 포함하는 방법.
138. 제137실시양태에 있어서, 제2 의약이 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
139. 루푸스 환자의 ENA 상태를 결정하는 것을 포함하며, 여기서 ENA-의 ENA 상태를 갖는 것으로 결정된 환자가 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 수 있는 환자로 확인되는 것인, 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 수 있는 루푸스 환자를 확인하는 방법.
140. 루푸스 환자의 ENA 상태를 결정하는 것을 포함하며, 여기서 ENA-의 ENA 상태를 갖는 것으로 결정된 환자는 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 증가된 가능성을 갖는 것인, 루푸스의 치료에 대한 치료 효능을 최적화하는 방법.
141. 루푸스 환자의 ENA 상태를 결정하는 것을 포함하며, 여기서 ENA-의 ENA 상태를 갖는 것으로 결정된 환자가 인터페론 유형 I 항체로의 치료에 반응할 가능성이 있는 환자로 확인되는 것인, 인터페론 유형 I 항체로의 치료에 대한 루푸스 환자의 반응성을 예측하는 방법.
142. 루푸스 환자의 ENA 상태를 결정하는 것을 포함하며, 여기서 ENA-의 ENA 상태를 갖는 것으로 결정된 환자가 인터페론 유형 I 항체로의 치료에 반응할 가능성이 있는 환자로 확인되는 것인, 루푸스 환자가 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 가능성을 결정하는 방법.
143. 제139실시양태 내지 제142실시양태 중 어느 한 실시양태에 있어서, ENA 상태가 환자로부터의 샘플에서 자가항체를 검출함으로써 결정되며, 여기서 자가항체가 항-Ro, 항-La, 항-SM, 항-RNP 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
144. 제139실시양태 내지 제142실시양태 중 어느 한 실시양태에 있어서, 샘플이 전혈, 혈액-유래 세포, 혈장, 혈청 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
145. 제139실시양태 내지 제142실시양태 중 어느 한 실시양태에 있어서, 루푸스가 전신 홍반성 루푸스인 방법.
146. 제139실시양태 내지 제142실시양태 중 어느 한 실시양태에 있어서, 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 추가로 포함하는 방법.
147. 제146실시양태에 있어서, 항체가 정맥내로 투여되는 것인 방법.
148. 제146실시양태에 있어서, 항체가 인터페론 α에 특이적으로 결합하는 것인 방법.
149. 제148실시양태에 있어서, 항체가 론탈리주맙인 방법.
150. 제146실시양태에 있어서, 항체가 적어도 24주 동안 투여되는 것인 방법.
151. 제139실시양태 내지 제142실시양태 중 어느 한 실시양태에 있어서, 환자가 건강한 개체의 인터페론 시그너쳐 측정값 (ISM) 이상의 기준선 ISM을 갖는 것인 방법.
152. 제139실시양태 내지 제142실시양태 중 어느 한 실시양태에 있어서, 환자가 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는 것인 방법.
153. 제151실시양태 또는 제152실시양태에 있어서, ISM이 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적얻 하나의 유전자의 발현 수준을 측정함으로써 결정되는 것인 방법.
154. 제151실시양태 또는 제152실시양태에 있어서, ISM이 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정되는 것인 방법.
155. 제146실시양태에 있어서, 대상체에게 제2 의약을 투여하는 것을 추가로 포함하는 방법.
156. 제155실시양태에 있어서, 제2 의약이 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
157. 루푸스로 진단된 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 포함하며, 여기서 환자는 건강한 개체의 인터페론 시그너쳐 측정값 (ISM) 이상의 기준선 ISM을 갖는 것인, 환자에서 루푸스를 치료하는 방법. 일부 실시양태에서, ISM은 환자로부터의 샘플 (예를 들어, 혈액)에서 하나 이상의 IRG의 mRNA 발현 수준을 측정함으로써 결정된다.
158. 루푸스로 진단된 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 포함하며, 여기서 환자는 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는 것인, 환자에서 루푸스를 치료하는 방법. 일부 실시양태에서, ISM은 환자로부터의 샘플 (예를 들어, 혈액)에서 하나 이상의 IRG의 mRNA 발현 수준을 측정함으로써 결정된다.
159. 제157실시양태 또는 제158실시양태에 있어서, 항체가 인터페론 α; 인터페론 β; 인터페론 ω; 인터페론 λ; 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합하는 것인 방법.
160. 제157실시양태 또는 제158실시양태에 있어서, 항체가 인터페론 α에 특이적으로 결합하는 것인 방법.
161. 제160실시양태에 있어서, 항체가 론탈리주맙인 방법.
162. 제157실시양태 또는 제158실시양태에 있어서, ISM이 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정되는 것인 방법.
163. 제157실시양태 또는 제158실시양태에 있어서, ISM이 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정되는 것인 방법.
164. 제157실시양태 또는 제158실시양태에 있어서, 항체가 정맥내로 투여되는 것인 방법.
165. 제157실시양태 또는 제158실시양태에 있어서, 루푸스가 전신 홍반성 루푸스인 방법.
166. 제157실시양태 또는 제158실시양태에 있어서, 대상체에게 제2 의약을 투여하는 것을 추가로 포함하는 방법.
167. 제166실시양태에 있어서, 제2 의약이 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
168. 루푸스 환자의 기준선 ISM 상태를 결정하는 것을 포함하며, 여기서 건강한 개체의 ISM 이상의 기준선 ISM을 갖는 환자가 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 수 있는 환자로 확인되는 것인, 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 수 있는 루푸스 환자를 확인하는 방법.
169. 환자의 기준선 ISM 상태를 결정하는 것을 포함하며, 여기서 건강한 개체의 ISM 이상의 기준선 ISM을 갖는 환자는 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 증가된 가능성을 갖는 것인, 루푸스의 치료에 대한 치료 효능을 최적화하는 방법.
170. 루푸스 환자의 ISM 상태를 결정하는 것을 포함하며, 여기서 건강한 개체의 ISM 이상의 ISM을 갖는 환자가 인터페론 유형 I 항체로의 치료에 반응할 가능성이 있는 환자로 확인되는 것인, 인터페론 유형 I 항체로의 치료에 대한 루푸스 환자의 반응성을 예측하는 방법.
171. 루푸스 환자의 ISM 상태를 결정하는 것을 포함하며, 여기서 건강한 개체의 ISM 이상의 ISM을 갖는 환자가 인터페론 유형 I 항체로의 치료에 반응할 가능성이 있는 환자로 확인되는 것인, 루푸스 환자가 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 가능성을 결정하는 방법.
172. 제168실시양태 내지 제171실시양태 중 어느 한 실시양태에 있어서, 루푸스가 전신 홍반성 루푸스인 방법.
173. 제168실시양태 내지 제171실시양태 중 어느 한 실시양태에 있어서, 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 추가로 포함하는 방법.
174. 제173실시양태에 있어서, 항체가 정맥내로 투여되는 것인 방법.
175. 제173실시양태에 있어서, 항체가 인터페론-α에 특이적으로 결합하는 것인 방법.
176. 제175실시양태에 있어서, 항체가 론탈리주맙인 방법.
177. 제173실시양태에 있어서, 항체가 적어도 24주 동안 투여되는 것인 방법.
178. 제168실시양태 내지 제171실시양태 중 어느 한 실시양태에 있어서, 환자가 항체의 투여 후에 기준선 ISM에 비해 보다 낮은 ISM을 갖는 것인 방법.
179. 제168실시양태 내지 제171실시양태 중 어느 한 실시양태에 있어서, ISM이 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정되는 것인 방법.
180. 제168실시양태 내지 제171실시양태 중 어느 한 실시양태에 있어서, ISM이 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정되는 것인 방법.
181. 제173실시양태에 있어서, 대상체에게 제2 의약을 투여하는 것을 추가로 포함하는 방법.
182. 제181실시양태에 있어서, 제2 의약이 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
본 발명이 하기의 비제한적 실시예에 의해 추가로 상세하게 설명된다. 본 명세서 내의 모든 인용문헌의 개시내용은 명백히 본원에 참고로 포함된다.
실시예
실시예 1 - SLE 임상 연구
1. 개요
2-부분 II상, 무작위, 이중-맹검, 위약-제어 다중심 연구를 수행하여 중등도 내지 중증 활성 SLE를 갖는 환자에서 위약과 비교하여 론탈리주맙의 효능 및 안정성을 평가하였다. 1차 효능 종점을 제24주에 평가하였다.
부분 1에서, 환자를 2:1 비 (활성:위약)로 무작위로 분류하여 론탈리주맙 750 mg을 매월 정맥내 (IV) 주입을 통해 투여하거나 또는 상응하는 위약을 투여하였다. 부분 2는 부분 1에 대한 동원이 완료되면 개시하였다. 부분 2에서, 환자를 2:1 비 (활성:위약)로 무작위로 분류하여 론탈리주맙 300 mg을 14일마다 피하 (SC) 주사를 통해 투여하거나 또는 상응하는 위약을 투여하였다.
시험 설계의 개요는 표 4에 있다.
[표 4]
연구에서의 환자 집단은 94% 여성을 포함하였고, 평균 연령은 39세이다. 연구 집단의 인종/민족 분포는 46% 백인, 37% 아메리카 인디언/알래스카 원주민, 14% 흑인 인종, 및 49% 히스패닉이었다. 인구통계, 기준선 특성은 일반적으로 중등도 내지 중증 질환 활성 (~ 10의 평균 SELENA SLEDAI, & ≥ 1 BILAG A, 또는 2 B 도메인, 평균 질환 지속기간 ~6.5년)을 반영하면서 각각의 코호트 내에서 균형을 이룬다. 모든 환자의 76%는 기준선에서 ISMhi였다 (ISM 스코어 ≥1). 보다 낮은 ISM 스코어는 기준선 (즉, 치료전)에서 보다 낮은 질환 활성과 연관되지 않는다. ISMlo 환자 및 ISMHi 환자는 대등한 평균 SELENA-SLEDAI, BILAG, CLASI 활성 스코어, 종창/압통 관절 카운트, 조조 강직 지속시간을 나타낸다.
스크리닝 기간에서 출발하여, 무작위 분류 후에 처음 14일 동안, 환자는 0.25 내지 0.5 mg/kg 프레드니손 등량 범위의 스테로이드 요법을 받을 수 있다. 연구자는 연구자의 판단으로 질환 증상의 적절한 제어를 나타낼 가능성이 있는 이러한 범위 내의 최저 프레드니손 용량을 선택하였다. 연구 제15일에 시작하여, 이 요법은 제6주 말까지 10 mg/일 프레드니손 등량 또는 그 미만의 표적 용량까지 점감시켰다 (섹션 3.3.2 참조). 이 초기 스테로이드 요법은 연구자 또는 환자가 그 위험이 잠재적 이익을 능가한다고 여기면 요구되지 않는다.
임상적으로 적절한 경우에, 보다 빠른 스테로이드의 점감이 권장되었다. 보고된 스테로이드 독성 또는 불내성의 경우에, 스테로이드의 점감은 제15일 전에 시작할 것이다. 스크리닝 기간이 연장되고, 스크리닝 동안 스테로이드 노출이 14일 이상 동안 20 mg 프레드니손 (또는 등량)을 초과하는 경우에, 스테로이드의 점감은 제15일 전에 시작할 것이다. 10 mg의 1일 스테로이드 용량에 도달한 후에, 환자는 가능한 경우에 스테로이드 중단을 목표로 하여 허용되는 대로 스테로이드를 계속 점감시켰다.
환자는 스크리닝 동안, 그러나 제1일 이전에 모든 면역억제제 요법 (예를 들어, 아자티오프린, 메토트렉세이트, 미코페놀레이트 모페틸, 시클로스포린, 타크롤리무스)을 중단하였다 (섹션 3.3.2 참조). 항말라리아제 (예를 들어, 히드록시클로로퀸)의 사용을 허용하였으나, 연구 기간 동안 도입하지 않거나 용량을 변경시켰다. 환자가 연구 동안 임의의 시점에 지속적이거나 또는 증가하는 질환 활성을 경험하였다면, 연구자의 임상적 판단으로 스테로이드를 증가시키고/거나 면역억제제 요법을 재개 또는 개시할 수 있다. 연구자는 지속적인 질환 활성 또는 플레어로 인해 필요한 경우에 임의의 시점에서 이들의 임상적 판단으로 추가의 치료/구조 요법을 자유롭게 투여하였다. 스테로이드 요법에서 특정 역치를 초과하는 증가가 요구되거나 (섹션 3.3.2 참조) 또는 면역억제제 요법의 개시 또는 재개가 요구되는 환자는 대부분의 상황 하에 연구에 남도록 허용되고 연구 제품을 계속 제공받을 것이지만, 분석 동안 치료 실패를 경험한 것으로 분류될 것이다. 예외는 섹션 3.3.2에 상세하게 기재된다.
SLE 질환 활성을 제36주까지 매월, 이어서 제72주까지 12주마다 BILAG 2004 인덱스, 홍반성 루푸스에서의 에스트로겐의 안정성에 대한 국립 평가-전신 홍반성 루푸스 질환 활성 인덱스 (SELENA-SLEDAI), SELENA 플레어 인덱스-개정판 (SFI-R), 및 의사의 전반적 평가 (PGA)를 이용하여 평가하였다. 무작위 분류 시점 또는 24주 전에 임의의 시점에서의 관절염 환자에 대해, 매월 (제36주까지) 28 관절 카운트를 수행하였고, 조조 강직의 지속시간을 기록하였다. 무작위 분류 시점 또는 제24주 전에 임의의 시점에서의 점막 또는 피부 질환 환자에 대해, 매월 (제36주까지) 평가를 피부 홍반성 루푸스 질환 면적 및 중증도 인덱스 (CLASI)를 이용하여 수행하고, 디지털 사진을 수득하였다. 또한, 특정 환자-보고된 결과 (PRO)를 측정하였다.
이 시험에 대한 1차 효능 종점은 제24주에 1 이상의 새로운 BILAG A 또는 2 이상의 새로운 BILAG B 징후를 나타내지 않고, 제24주 전에 치료 실패 (예를 들어, 추가의 치료로 인함)로 분류되지 않으면서 제24주에 무작위 분류시에 존재하는 모든 BILAG A 도메인의 BILAG B 또는 보다 양호한 상태로의 감소, 및 무작위 분류시에 존재하는 모든 BILAG B 도메인의 BILAG C 또는 보다 양호한 상태로의 감소를 달성한 환자의 비율이었다. 추가의 2차 및 탐색적 종점은 섹션 2.2에 수록된다.
유해 사례, 심각한 유해 사례, 및 실험실 이상을 포함하는 안전성 데이터를 연구 전반에 걸쳐 모니터링하였다.
2. 결과 측정
2.1 1차 결과 측정
이 시험에 대한 1차 종점은 제24주에 1 이상의 새로운 BILAG A 또는 2 이상의 새로운 BILAG B 징후를 나타내지 않고, 제24주 전에 치료 실패 (예를 들어, 추가의 치료로 인함)로 분류되지 않으면서 제24주에 무작위 분류시에 존재하는 모든 BILAG A 도메인의 BILAG B 또는 보다 양호한 상태로의 감소, 및 기준선에 존재하는 모든 BILAG B 도메인의 BILAG C 또는 보다 양호한 상태로의 감소를 달성한 환자의 비율이었다. 제24주 전에 연구에서 빠지거나 또는 그의 반응 상태를 결정할 수 없는 환자는 1차 분석의 목적에서 비-반응자로 간주하였다. BILAG 2004 질환 활성 인덱스를 주요 기구로 사용하여 본 시험에서의 질환 활성의 변화를 포착하였다.
본 연구에서 SLE 질환 활성을 포착하는데 사용되는 추가의 기구는 SELENA-SLEDAI, SFI-R, 및 의사의 전반적 평가를 포함한다. 기관계-특이적 종점, 예컨대 28 관절 카운트 (관절염 환자의 경우) 및 CLASI (점막 또는 피부 징후를 갖는 환자의 경우)를 이용하여 SLE 질환 활성 기구를 보충하였다. 또한, 가능한 경우에, 대표적인 점막피부 병변의 디지털 사진은 제28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68 및 72주 (+/- 7일)에 수득하여야 한다 (이는 임의적이고, 장비의 이용가능성에 따름).
2.2 2차 결과 측정
2차 결과 측정은 하기를 포함하였다: 1) 24주에 걸친 BILAG 인덱스 전반적 스코어의 시간-조정된 곡선하 면적 (AUC); 2) 치료 실패 상태 (참조 약물, 섹션 3.3.2 참조); 3) 치료 실패까지의 시간; 4) 제24주에서의 BILAG 인덱스 전반적 스코어; 5) 24주에 걸친 모든 기준선 BILAG A 스코어의 B 또는 보다 양호한 상태로의 지속적인 감소, 및 모든 기준선 BILAG B 스코어의 C 또는 보다 양호한 상태로의 지속적인 감소까지의 시간 (적어도 2회 연속 방문 동안); 6) 24주에 걸친 시간-조정된 SELENA-SLEDAI AUC; 7) 제24주에서의 SELENA-SLEDAI 스코어; 8) 제24주에서의 조합된 SELENA-SLEDAI, PGA, 및 BILAG 반응 (하기 기준에 의해 규정됨: SELENA-SLEDAI 스코어의 기준선으로부터의 적어도 4점의 감소; PGA의 악화 없음 (악화는 기준선으로부터 0.3점 초과의 PGA 증가로 정의됨); 기준선과 제24주 사이의 임의의 시점에 새로운 BILAG A 기관 도메인 스코어 없음, 및 1 이하의 새로운 BILAG B 기관 도메인 스코어).
2.3 추가의 결과 측정
추가의 탐색적 결과 측정은 하기를 포함하였다: a) 스테로이드 부담 (제8주 및 제24주 사이의 코르티코스테로이드 용량의 시간-조정된 AUC에 의해 측정된 평균 코르티코스테로이드 부담); b) SLE 플레어 (SELENA-SLEDAI 플레어 인덱스 및 SFI-R을 이용하는 제8주 및 제24주 사이에 경증, 중등도, 및 중증 질환 플레어를 갖는 환자의 비율; SELENA-SLEDAI 플레어 인덱스 및 SFI-R을 이용하는 경증, 중등도 및 중증 질환 플레어까지의 시간); c) PRO (단답식-36 (SF-36) 건강 설문조사의 신체 성분 요약에서 기준선으로부터 제24주까지의 변화; 만성 질병 요법의 기능적 평가 (FACIT)-피로 스코어에서 기준선으로부터 제24주까지의 변화; 질환 활성의 대상체의 전반적 평가에서 기준선으로부터 제24주까지의 변화); d) 진단적 (기준선에서 ISM 시그너쳐 양성으로 분류된 환자에서 1차 결과 측정에 의해 정의된 바와 같은 제24주에서의 반응; 기준선에서 ISM-시그너쳐 양성으로 분류된 환자에서의 치료 실패 상태).
2.4 약동학 및 약역학적 결과 측정
PK 및 PD 결과 측정은 하기와 같다: 항-론탈리주맙 항체의 발생; 시간 경과에 따른 선택된 인터페론 조절 유전자 (IRG)의 발현의 변화; 론탈리주맙의 PK 파라미터; 인터페론-유도 단백질 및 다른 혈청/혈장 분석물의 수준의 변화.
2.5 안전성 계획
IFN알파는 선천적 및 후천적 면역 방어에 기여하는 중요한 시토카인이다. 따라서, 이 경로에 길항하는 것이 감염, 특히 바이러스 감염에 걸릴 가능성을 증가시킬 수 있다는 것이 가능하다. 또한, SLE를 갖는 환자는 기저 질환 뿐만 아니라 병용 치료, 예컨대 코르티코스테로이드 및 면역억제제로 인해 감염에 대한 위험이 증가한다.
본 시험을 위한 안전성 계획은 3가지 핵심 요소로 이루어진다: 환자 선택, 치료 및 모니터링.
환자 선택: 감염 위험이 높은 환자 (예를 들어, 헤르페스 바이러스 재활성화의 다수의 재발, 최근 감염 또는 입원 및/또는 IV 항생제의 투여를 필요로 하는 다수의 심각한 감염의 병력, 또는 면역결핍을 갖는 환자)는 본 시험으로부터 제외하였다. 스크리닝의 5년 이내의 계내 악성종양 또는 암종의 병력을 갖는 환자가 제외되고, 절제되고 치유된 것으로 간주된 피부의 기저 또는 편형 세포 암종은 예외이다. 만성 골수성 백혈병, 모발상 세포 백혈병, 흑색종, 신세포 암종 또는 카포시 육종의 병력을 갖는 환자는 스크리닝 전에 지속 기간에 관계없이 제외되었다. 여성 환자는 미국 암 학회 (문헌 [Saslow et al. 2002]) 또는 적용가능한 미국외 지방/국가 지침에 의해 제안된 기간 이내의 자궁경부 표본을 가져야 하지만, 무작위 분류 전 3년을 초과할 수는 없으며, 결과는 검토를 위해 무작위 분류 전에 이용가능하여야 한다 (자궁절제술을 받은 환자는 자궁경부 표본이 요구되지 않음). 자궁경부 표본이 인간 유두종 바이러스로의 지시된 감염, 계내 선암종 (AIS)의 존재, 편평 상피내 병변 (HSIL), 또는 자궁경부 상피내 신생물 (CIN) 등급 > 1을 갖는다면 환자는 시험으로부터 제외된다.
치료: 본 시험은 감염의 위험을 증가시키는 병용 치료 요법, 특히 고용량 코르티코스테로이드 및 면역억제제에 대한 환자 노출을 최소화시키도록 설계된다. 프로토콜은 빠른 스테로이드의 점감 (제6주 말까지 10 mg 이하의 1일 프레드니손 등량의 용량을 달성함) 뿐만 아니라 병용 면역억제제 요법의 중단을 상세히 기재한다. 고용량 스테로이드 및 특정 면역억제제 요법에 최근에 노출된 환자는 제외되었다. 연구 동안 매우 고용량의 스테로이드 또는 세포독성 치료를 포함하는 구조 요법을 필요로 하는 환자는, 이들이 연구자에 의해 안전하고 적절한 것으로 간주되는 경우에 안전성 및 효능 평가를 위한 연구에 남도록 권장되더라도, 추가의 용량의 연구 제품은 제공받지 못하였다.
이러한 제공은 감염의 위험을 감소시키고, 시험 과정 동안 관찰된 임의의 감염성 사례의 귀인을 용이하게 할 것으로 예상되었다.
모니터링: 악성종양을 암시할 수 있는 임의의 신호 또는 증상은 신속하고 적극적으로 평가되고, 후원자에게 보고된다. 갑작스러운 혈액 이상 (예를 들어, 새로운 또는 악화된 호중구감소증, 빈혈, 혈소판감소증, 대적혈구증, WBC 분화에서의 비정형 세포)을 주의깊게 평가하였다. 연구 동안 악성종양 또는 심각하거나 생명을 위협하는 감염이 발생한 환자는 추가의 용량의 연구 제품이 제공되지 않아야 한다.
3. 물질 및 방법
3.1 환자
3.1.1 및 3.1.2에서의 하기 환자 선택 기준은 본 시험에서 초기 등록 (즉, 부분 1 또는 2)에 적용된다.
3.1.1 포함 기준
환자는 연구 가입을 위해 하기 기준을 충족시켜야 한다:
1. 서면 사전 동의서를 제공하고, 프로토콜에 정의된 바와 같은 연구 절차를 따르기 위한 능력 및 의향.
2. 연령 18-65세.
3. 현재 ACR 기준 (문헌 [Hochberg et al., Arthritis Rheum 40:1725, 1997])에 따른 SLE의 진단. 적어도 4개의 기준이 스크리닝 전에 임의의 시점에 충족되어야 한다. 스크리닝의 시점에서 4개 기준의 존재가 요구되지 않는다.
4. 스크리닝의 시점에서 1:80의 최소 역가를 갖는 양성 ANA. 적어도 1:80의 이전에 보고된 ANA 역가를 갖지만 스크리닝의 시점에서 1:80 미만의 역가를 갖는 환자는 오직 모든 이용가능한 데이터 (임상적, 혈청학적 또는 다른 진단적 발견 포함)에 기초한 등록 판정 과정 동안 활성 루푸스가 스크리닝 시점에 존재하는 것으로 결정되는 경우에만 등록할 수 없었다.
5. 적어도 하나의 기관계에서의 BILAG A 스코어 또는 적어도 2개의 기관계에서의 BILAG B 스코어의 존재에 의해 정의된, 스크리닝의 시점에서의 활성 질환. 하기 3개의 도메인에서의 BILAG B 스코어의 경우에, 추가의 기준이 적용된다:
구조적 도메인: 식욕부진이 기여하는 BILAG B 스코어는 가입 요건에 고려되지 않았다.
근골격 도메인: 관절염 (중등도)/건염/건막염이 기여하는 BILAG B 스코어는 염증 (즉 압통, 종창 또는 삼출액)의 타각 징후가 3개 이상의 관절에서 관찰되지 않는 한 가입 요건에 고려되지 않았다. 관절염의 환자-보고된 병력은 충분하지 않았다.
신경정신병성 도메인: 루푸스 두통이 기여하는 BILAG B 스코어는 가입 요건에 고려되지 않았다. 인지 기능장애는 적절한 인지 시험을 이용하여 확립되고 원문서에 보고되지 않는 한 B 스코어에 기여하지 않았다.
이러한 추가의 요건이 단지 적합성을 결정하는데 적용되고, BILAG 2004 기구에 대한 변화를 나타내지 않는다는 것에 주목하여야 한다. 이 연구에 가입하기에 적합한 질환 징후는 발열 (> 37.5℃ / > 99.5℉), 의도하지 않은 체중 감소, 림프절병증, 비장비대증, 피부 발진, 혈관부종 (중증), 점막 궤양화 (중증), 지방층염 / 수포성 루푸스, 피부 혈관염, 탈모증 (중증), 말초 경색, 결절성 혈관염, 무균성 수막염, 단일신경병증, 신경총병증, 다발신경병증, 두개 신경병증, 인지 기능장애, 발작 장애, 운동 장애, 자율신경 장애, 소뇌 운동실조, 두개내 고혈압,(배제 기준, 섹션 3.1.2 참조), 근염, 관절염, 건염 / 건활막염 (배제 기준, 섹션 3.1.2 참조), 심근염, 심막염, 심장 판막 기능장애 (신규), 흉막염, 호흡곤란이 있는 흉막 삼출, 간질성 폐포염/폐렴, 심장압전, 폐 출혈/혈관염, 부정맥, 수축성 폐 증후군, 심내막염, 대동맥염, 관상 동맥 혈관염, 복부 장막염, 복수, 루푸스 장염/결장염, 장 가성-폐색, 흡수장애, 루푸스 간염, 단백질-소실성 장병증, 급성 루푸스 췌장염, 급성 루푸스 담낭염, 안와 염증, 근염, 안구돌출, 망막 또는 맥락막의 각막염 혈관-폐쇄성 질환, 시신경염, 전부 또는 후부 포도막염, 망막 혈관염, 공막염, 단백뇨, 가속성 고혈압, 상승된 크레아티닌 (정량적 컷오프에 대한 BILAG 2004 매뉴얼; sle-관련 배제 기준, 섹션 3.1.2 참조), 혈구감소증, 빈혈, 및 용혈을 포함한다. 각각의 경우에 징후는 연구자의 숙고 후의 견해에서 수반되는 의학적 상태보다는 환자의 SLE에 기인하여야 한다. 특정 징후는 포함 기준: 식욕부진, 중등도 관절염/건염/건활막염 (타각 염증이 3개 이상 부위에서 관찰되지 않는 한), 루푸스 두통 및 인지 장애 (공식적 인지 시험에 의해 보고되지 않는 한)를 만족시키기 위한 목적을 위해 BILAG B 스코어에 포함되지 않았다.
응급 표준 진료 요법이 적용되는 특정 중증 징후를 갖는 환자는 명백하게 제외되었다 (활성 증식성 신염, 불안정성 중증 신경정신병성 루푸스, 및 중증 항-인지질 증후군; 섹션 3.1.2 참조).
생식 능력이 있는 환자 (남성 및 여성)는 이들의 연구 참여 전반에 걸쳐 및 연구 제품의 마지막 투여 후 적어도 24주 동안 신뢰할만한 피임 수단 (예를 들어, 호르몬 피임제, 패치, 질 고리, 자궁내 피임장치, 물리적 장벽, 외과적 불임수술, 금욕)의 사용에 동의하였다. 폐경후 상태가 최근 1년 동안 지속되었거나 자궁절제술을 받은 환자를 제외한 모든 여성 환자의 경우에, 음성 혈청 임신 테스트가 스크리닝시에 보고되었다. 또한, 각각의 연구 약물 투여 전에 음성 소변 임신 테스트가 보고되었다.
3.1.2 배제 기준
임의의 하기 기준을 충족시키는 환자는 연구 가입에서 제외하였다:
a. SLE-관련 배제
1. 스크리닝의 시점에서 월경 혈뇨 또는 요로 감염의 부재 하에 단백뇨 > 1 g/24시간 또는 뇨 단백질/크레아티닌 비 (UPC) > 1의 존재 또는 > 10 RBC/HPF 또는 RBC 원주의 존재에 의해 증명된 바와 같은 활성 루푸스 신염. 연구자의 견해로 활성 증식성 루푸스 신염으로 인한 것이 아닌, UPC > 1.0 또는 단백질 > 1g/24시간 그러나 UPC < 3.0 또는 단백질 ≤ 3 g/24시간에 의해 특성화된 단백뇨를 갖는 환자는 의학적 모니터와의 사전 협의 후에 적격화될 수 있었다.
2. 잘 제어되지 않는 발작 장애 정신병 또는 급성 착란 상태, 횡단성 척수염, 졸중 또는 졸중 증후군을 포함하는, 불안정성 신경정신병성 SLE.
3. 스크리닝 1년 이내의 중증 항-인지질 항체 증후군 (졸중, 동맥 또는 정맥 혈전색전증, 파종성 혈관내 응고)의 병력 및 스크리닝의 시점에 적절하고 안정한 항응고 요법을 받지 않음. 아스피린 단독은 일반적으로 적절한 요법으로 간주되지 않는다. 항-인지질 항체만의 존재 (혈전색전증의 병력 없음)는 배제 요건이 아니다.
b. 전반적 건강과 관련된 배제
4. 임신 또는 모유수유
5. 말초 정맥 접근의 결여
6. 모노클로날 항체 또는 IV 이뮤노글로불린에 대한 중증 알레르기성 또는 아나필락시스성 반응의 병력
7. 연구자의 견해로 환자의 참여를 금지하는, SLE와 관련되지 않은 임의의 기관계에서의 유의하고 제어되지 않는 의학적 질환 (예를 들어, 잘 제어되지 않는 만성 폐쇄성 폐 질환 또는 천식, 심혈관 질환, 가속성 고혈압, 주요 우울증)
8. 스크리닝 전 1년 이내에 전신 코르티코스테로이드 사용을 필요로 하는 수반되는 상태 (예를 들어, 천식, 크론병 등). 국소, 관절내 또는 흡입용 코르티코스테로이드의 사용은 배제되지 않는다.
9. 스크리닝의 5년 이내의 혈액 악성종양, 고형 종양 및 상피내 암종을 포함하는 암의 병력. 절제되고 치유된 것으로 간주된 피부의 기저 또는 편평 세포 암종은 배제되지 않는다. 만성 골수성 백혈병, 모발상 세포 백혈병, 흑색종, 신세포 암종 또는 카포시 육종의 병력은 스크리닝 전에 지속 시간에 관계없이 배제된다. 여성 환자는 미국 암 학회 또는 적용가능한 미국외 지방/국가 지침에 의해 권장된 기간 이내의 자궁경부 표본을 가져야 하지만, 이는 무작위 방문 전 3년을 초과할 수 없다. 환자는 자궁경부 표본이 인간 유두종 바이러스의 지시된 감염, 상피내 선암종 (AIS), 편평 상피내 병변 (HSIL), 또는 자궁경부 상피내 신생물 (CIN) 등급 > 1의 존재를 갖는다면 시험으로부터 배제된다.
10. 스크리닝 전 1년 이내의 알콜 또는 약물 남용의 병력
c. 감염성 질환과 관련된 배제
11. 하기를 제외한, 임의의 현재 또는 최근 (스크리닝의 4주 내)의 감염의 징후 또는 증상:
연구자의 판단으로 무작위 분류 전에 완전하게 해결된 경미한 감염 (예를 들어, 감기, 바이러스성 위장염)
손발톱 바닥의 진균 감염
무작위 분류 전에 치료의 존재 또는 부재 하에 해결된 경구 또는 질 칸디다증
12. 스크리닝 전 6개월 이내의 중증 전신 박테리아, 진균, 바이러스, 또는 기생충 감염의 병력 (2회 이상의 입원 또는 IV 항생제의 2회 이상의 과정)
13. 연구자의 판단으로 중증 및/또는 파종성 바이러스 감염, 특히 헤르페스 바이러스, 예컨대 HSV-1, HSV-2, VZV, CMV (예를 들어, 헤르페스 뇌염, 안구 대상포진, 파종성 대상포진, CMV 결장염)의 병력
14. 스크리닝의 3개월 이내의 대상포진의 에피소드, 또는 스크리닝 전 2년 이내의 2가지 초과의 에피소드
15. HIV, B형 간염 (HBsAg, 항-HBc), C형 간염에 대한 양성 시험. 양성 스크리닝 시험의 경우에, 환자는 확인 시험이 음성인 경우에 등록할 수 있다.
16. 활성 결핵의 병력 또는 잠재성 미코박테리움 투베르쿨로시스(Mycobacterium tuberculosis) 감염에 대한 양성 스크리닝 검사 (정제된 단백질 유도체 [PPD] 피부 검사 및 퀀티페론(QuantiFERON)®-TB 골드가 허용가능한 스크리닝 검정임). 음성 결핵 스크리닝 검사가 스크리닝의 3개월 이내에 보고되면, 어떠한 새로운 시험도 요구되지 않았다. 바실루스 칼메트-게랑 (BCG) 백신접종 이력이 있는 환자는 오직 퀀티페론®-TB 골드 검사를 이용하여 스크리닝하였다. 이 검사는 중앙 실험실을 통해 이용 가능하였다. 불확정 퀀티페론®-TB 골드 결과를 결핵 감염의 징후 및 증상에 대한 확인, 흉부 X선, 또는 연구자의 판단으로 적절한 경우에 미코박테리움 투베르쿨로시스로의 감염을 배제하기 위한 다른 조사에 의해 추가로 분석하였다. 적절하고 증명된 과정의 요법을 받은 잠재성 TB 감염의 병력이 있는 환자는 스크리닝의 3개월 이내에 수행된 스크리닝 시험 및 흉부 X선에서 현재 활성 감염의 증거가 전혀 밝혀지지 않는다면 포함될 수 있다. 이러한 경우에, TB 스크리닝 시험이 요구되지 않았다.
17. 선천성 또는 후천성 면역결핍의 병력
d. 의약과 관련된 배제
18. 지정된 기간 이내에 하기 의약 중 어느 것을 제공받음:
스크리닝 전 12개월 이내의 B 세포-고갈 요법 (예를 들어, 항-CD20, 항-CD22) 또는 항-BLYS 요법
스크리닝 전 3개월 이내의 시클로포스파미드 또는 다른 알킬화제
스크리닝 전 6개월 이내의 탈리도미드 또는 탈리도미드 유도체
스크리닝 전 3개월 이내의 종양 괴사 인자 (TNF)-길항제
스크리닝의 3개월 또는 5 반감기 (이들 중 보다 긴 기간) 이내의 임의의 연구 약물
스크리닝 전 6주 내의 혈액, 포장된 적혈구, 혈소판 또는 정맥내 이뮤노글로불린의 수혈 또는 혈장분리반출술 또는 혈장 교환을 이용하는 치료
스크리닝 전 3개월 이내의 아자티오프린 > 200 mg/일
스크리닝 전 3개월 이내의 메토트렉세이트 > 25 mg/주
스크리닝 전 3개월 이내의 미코페놀레이트 > 3 g/일
무작위 분류 전 30 일 이내의 생백신
스크리닝 전 30일 이내의 펄스 IV 메틸프레드니솔론 (≥ 500 mg)
스크리닝 전 30일 이내의 7일 초과 동안 > 0.5 mg/kg/일 또는 스크리닝 전 90일 이내의 30일 초과 동안 > 0.25 mg/일의 용량의 경구 프레드니손 (또는 등량의 전신 코르티코스테로이드). 상기 정의된 바와 같이 장기적으로 중간 내지 높은 용량의 스테로이드를 투여 중인 환자는 프로토콜-정의된 스테로이드의 점감 목표를 달성할 가능성이 적으며, 이에 따라 본 시험에 적격이지 않다. 격일로 투여하는, 비경구 코르티코스테로이드 등의 간헐적 투여를 포함하는 코르티코스테로이드 요법의 경우에, 가장 근접한 1일 프레드니손 등량을 하기 전환 표에 따라 계산하여 적합성을 결정하였다.
[표 5]
e. 실험실 시험과 관련된 배제
19. AST 또는 ALT > 2.5 x 정상 상한치 (ULN). 상승된 트랜스아미나제가 루푸스 (예를 들어, 루푸스 간염)으로 인한 것이고, 다른 원인이 제외되었다면, 환자는 의학적 모니터와의 논의 후에 적격일 수 있다.
20. 리파제 > 2 x ULN. 상승된 리파제가 루푸스 (예를 들어, 루푸스 췌장염)으로 인한 것이고, 다른 원인이 제외되었다면, 환자는 의학적 모니터와의 논의 후에 적격일 수 있다.
21. 계산된 사구체 여과율 < 30 mL/분
22. 헤모글로빈 < 8 g/dL. 헤모글로빈이 < 8 g/dL 그러나 > 7 g/dL이고, 빈혈이 SLE에 기인한 것이라면, 환자는 의학적 모니터와의 논의 후에 적격일 수 있다.
23. 호중구 카운트 < 1500/μL 또는 혈소판 카운트 < 50,000/μL. 호중구 카운트가 < 1,500/μL 그러나 > 500/μL이거나 또는 혈소판 카운트가 < 50,000/μL 그러나 > 15,000/μL이고, SLE에 기인한다면, 환자는 의학적 모니터와의 논의 후에 적격일 수 있다.
3.3 연구 치료
3.3.1 시험 약물
론탈리주맙 또는 대응하는 위약은 어떠한 보존제도 함유하지 않는 멸균 액체 용액으로 공급되었다. 각각의 단일-사용, 2-cc 바이알은 명목상 30 mM 히스티딘, 200 mM 아르기닌 히드로클로라이드, pH 5.5 중에 180 mg 론탈리주맙을 0.04% 폴리소르베이트 20과 함유하였다. 시험의 부분 1에서, 론탈리주맙 750 mg 또는 상응하는 위약은 IV 주입에 의해 제공되고, 100-cc 생리 염수 백에 희석되고, 총 6회 용량에 대해 4주마다 1회 대략 60분에 걸쳐 투여된다. 론탈리주맙은 희석하지 않고, 빠른 IV 주사에 의해 투여하지 않아야 한다.
시험의 부분 2에서, 론탈리주맙 300 mg 또는 상응하는 위약은 총 12회 용량에 대해 2주마다 1회 각각 1 mL을 팔, 대퇴부 또는 복부의 뒷면에 2회 SC 주사로 제공되었다.
3.3.2 참조 약물
a. 코르티코스테로이드
스크리닝 전 30일 이내의 7일 초과 (누적) 동안 > 0.5 mg/kg/일의 프레드니손 또는 등량의 1일 전신 (경구 또는 비경구) 코르티코스테로이드 용량을 제공받은 환자 및 스크리닝 전 90일 이내의 누적 30일 초과 동안 > 0.25 mg/kg/일의 프레드니손 또는 등량의 1일 코르티코스테로이드 용량을 제공받은 환자는 본 시험에 적격이지 않았다.
스크리닝 기간 동안 및 무작위 분류 이후 14일까지 동안, 0.5 mg/kg까지 (최대, 40 mg/일)의 1일 프레드니손 (또는 등량) 요법을 개시하여 스크리닝시에 존재하는 중등도 내지 중증 질환 환성을 치료할 수 있다. BILAG A 징후를 갖는 환자를 0.5 mg/kg/일까지 (최대 40 mg/일 또는 등량)의 프레드니손으로 치료하였다. BILAG B 징후를 갖는 환자 (BILAG A 징후는 갖지 않음)는 프레드니손 ≤ 0.25 mg/kg/일 (또는 등량)로 치료할 수 있다. 초기 스테로이드 요법은 연구자 또는 환자가 그 위험이 잠재적 이익을 능가할 것으로 여긴다면 요구되지 않았다. 스크리닝 동안 및 무작위 분류 전에 > 7일 동안 40 mg/일을 초과하는 스테로이드 용량을 제공받은 환자를 무작위로 분류하였다.
스테로이드를 제6주 말 (제41일)까지 프레드니손의 10 mg/일 이하 (또는 등량)의 표적 용량까지 점감시켰다. 스테로이드 요법을 가능한 안전하게 빨리 점감시켰다. 최적의 스테로이드의 점감 계획은 연구자에 의해 결정되며, 단 10 mg/일 이하의 표적 용량에는 제6주 말까지 도달한다. 제6주 후에, 환자는 스테로이드 치료의 중단을 목표로 하여 허용되는 바와 같이 1-2.5 mg/주의 증분으로 스테로이드를 계속 점감시켰다. 질환 활성 때문에 제8주 말 (제62일)까지 10 mg 이하의 1일 프레드니손 용량에 도달할 수 없는 환자는 치료 실패로 분류하였다 (하기 참조). 이러한 환자는 연구자의 판단으로 이것이 안전하고 임상적으로 적절하다면 연구에 남도록 허용되었다.
플레어/치료 실패에 대한 스테로이드 용량의 증가
하기 스테로이드 용량을 초과한 환자는 치료 실패로 간주하였다.
● 스테로이드의 점감을 완료할 수 없는 환자 (제8주 말까지 10 mg/일 이하의 표적 용량에 도달하지 못함).
● 제20주 이전
적어도 14일 동안 20 mg 이상까지의 최저 달성된 용량을 초과하는 스테로이드의 임의의 증가
적어도 28일 동안 10 mg 이상까지의 최저 달성된 용량을 초과하는 스테로이드의 임의의 증가
● 제20주 내지 제24주
이 4주 기간 동안 임의의 날에 20 mg 이하의 프레드니손 등량을 제공받음
7일 초과 (누적) 동안 10 초과 그러나 20 mg/일 미만의 프레드니손 등량을 제공받음
스테로이드 구조 치료를 받고, 치료 실패로 분류된 환자는 연구자의 판단으로 하기 상황을 제외하고 안전하고 임상적으로 적절하다면 연구에 남아서 연구 치료를 계속 받을 수 있다:
● 환자는 14일 초과 동안 > 60 mg의 1일 프레드니손 (또는 등량)의 용량을 제공받음
● 환자는 > 1000 mg 메틸프레드니솔론의 IV 펄스 스테로이드를 제공받음
3.3.3 면역억제제 요법
스크리닝 시점에 면역억제제 요법 (예를 들어, 아자티오프린, 미코페놀레이트 모페틸, 메토트렉세이트)을 받고 있는 적격 환자는 스크리닝 기간 동안, 그러나 제1일 (무작위 분류 당일) 이전에 이들 요법을 중단하였다. 하기 명시된 바와 같은 구조 치료에 요구되지 않는 한 어떠한 면역억제제 의약도 제1일 또는 그 후에 투여되지 않았다. 질환 활성을 치료하기 위해, 스테로이드 요법은 상기 기재된 바와 같이 개시될 것이다.
a. 면역억제제 요법에 대한 변화
연구 동안 임의의 시점에 환자가 스테로이드로의 치료에 반응하지 않는 지속성 질환 활성 또는 질환 플레어를 경험하였다면, 면역억제제 요법이 연구자의 판단으로 재시 또는 재개될 수 있다. 제24주 전에 면역억제제 요법의 재개/개시가 요구되는 환자를 치료 실패로 분류되었다.
면역억제제 요법의 재개/개시가 요구되는 환자는 이것이 연구자의 판단으로 하기 상황을 제외하고는 둘 다 안전하고 임상적으로 적절하다면 연구에 남아 연구 제품을 계속 제공받았다: 환자는 임의의 용량의 시클로포스파미드 또는 다른 알킬화제를 제공받음; 환자는 생물학적 작용제 (예를 들어, 항-CD20, 항-TNF)를 제공받음; 환자는 > 2 g/일의 용량의 미코페놀레이트 모페틸을 제공받음; 환자는 > 200 mg/일의 용량의 아자티오프린을 제공받음; 환자는 > 25 mg/주의 용량의 메토트렉세이트를 제공받음; 환자는 전신 칼시뉴린 억제제 (예를 들어, 시클로스포린)를 제공받음; 환자는 또 다른 연구 제품을 제공받음.
이러한 경우에서, 환자는 추가의 용량의 연구 약물을 제공받지 않았으나, 연구자의 판단으로 이것이 안전하고 임상적으로 적절하다면 연구에 남아 프로토콜당 연구 평가를 완수하였다.
3.4 다른 치료
3.4.1 비-스테로이드성 항염증 약물
NSAID/Cox-2 억제제의 사용이 본 시험에서 허용되었다. 하나 초과의 NSAID 또는 Cox-2 억제제의 조합은 허용되지 않았다 (심혈관 예방을 위해 주어진 저용량 아스피린은 제외함). NSAID/Cox-2 억제제로의 장기 치료를 받고 있는 환자의 경우에, 용량은 독성 또는 불내성의 경우를 제외하고 가능한 경우에 제24주까지 시험 전반에 걸쳐 안정하게 유지되었다. NSAID의 사용에 있어 임의의 변화는 원문서에 주의깊게 보고되어 있다. 사용 이유 및 루푸스와 관련이 있는지 또는 없는지의 여부 (예를 들어, 루푸스 심막염 vs. 월경통)를 보고하는 것이 필수적이다. 위장 예방을 위한 H2-수용체 길항제 또는 양성자 펌프 억제제의 사용이 허용되었다.
3.4.2 항말라리아제
하나의 항말라리아 약물 (예를 들어, 히드록시클로로퀸, 클로로퀸, 퀴나크린)을 제공받고 있는 환자는 연구에 가입하는 것이 허용되었다. 항말라리아제 요법은 관찰되거나 의심되는 독성 또는 불내성에 의해 위임되는 경우를 제외하고 제24주까지 변화되지 않았다. 항말라리아제는 임상적으로 권한이 주어지지 않는 한 의학적 모니터와의 사전 논의 후에 시험 동안 개시하지 않았다. 변화는 적절한 원문서에 보고되어 있다.
3.4.3 HMG-CoA 리덕타제 억제제 (스타틴)
스타틴의 사용이 허용되었다. 용량은 가능한 경우에 안정하게 유지하였다 (독성/불내성의 경우는 제외). 변화가 적절한 원문서에 보고되어 있다.
3.4.4 골다공증 예방
스테로이드를 제공받은 모든 환자는 연구자의 견해로 적절한 경우에 칼슘 및 비타민 D 보충제 및/또는 비스포스포네이트를 포함하는, 스테로이드-유도 골다공증의 방지를 돕기 위한 적절한 요법을 받았다. 요법은 가능한 경우에 연구 동안 안정하게 유지하였다.
3.4.5 다른 병용 치료
임의의 다른 병용 의약 (전문 또는 일반)의 임의의 개시, 중단 또는 용량의 변화는 적절한 원문서에서 주의깊게 보고되어야 하는 것이 필수적이다. 임의의 병용 치료는 유해 사례를 유발할 수 있고, 연구 치료 vs. 병용 치료에 대한 유해 사례의 적절한 귀인이 시도된 것으로 보고된 것이 중요하다.
3.5 연구 평가
BILAG 2004 인덱스를 본 연구에 이용되는 주요 루푸스 질환 활성 기구로 이용하였다. BILAG 평가를 스크리닝시에, 무작위 분류시에, 이어서 제36주까지 매월 1회 및 그 이후에 12주마다 각각의 환자에 대해 수행하였다. 관절염 환자의 경우에, 28 관절 카운트를 수행하였다. 기준선 또는 제24주 전 임의의 시점에 피부 징후를 갖는 환자의 경우에, CLASI를 스크리닝시에, 무작위 분류시에, 이어서 제36주까지 매월 1회 각각의 환자에서 완수하였다. 또한, 가능한 경우에, 대표적인 점막피부 병변의 디지털 사진을 수득하였다. PRO를 포착하기 위해, 대상체의 전반적 평가, SF-36 건강 설문조사, v2, 및 FACIT-피로 스케일을 스크리닝시에, 무작위 분류시에, 제14일경에, 이어서 제36주까지 매월 1회 수집하였다.
3.5.1 연구 평가의 정의
연구 평가는 하기 상세하게 기재되어 있고, 다양한 연구 방문에서 수행하였다.
a. SLE 질환 활성 평가
가능한 경우에 모든 적용가능한 SLE 질환 활성 평가 (BILAG 인덱스, Selena-SLEDAI, SELENA 플레어 인덱스-개정판 (SFI-R), PGA, CLASI 및 관절 카운트)를 동일한 날에 수행하였다.
BILAG 2004 인덱스
본원에서 BILAG 2004 인덱스로 지칭되는 BILAG 질환 활성 인덱스 (2004 버전)를 본 연구에서 질환 활성을 평가하기 위한 1차 방법으로 이용하였다.
BILAG 2004 인덱스는 9가지 기관계 도메인: 구조적, 점막피부, 신경정신병성, 근골격, 심폐, 위장, 안구, 신장, 및 혈액에 걸쳐 97가지 임상적 징후, 증상, 및 실험실 파라미터를 평가한다. 97가지 증상은 이전 달 (4주)에 걸친 중증도 및 이전의 조사로부터의 임의의 변화 (신규, 개선, 안정화, 악화, 부재)와 관련하여 평가된다. 이어서, 각각의 9개의 도메인에 대한 단일 알파벳 스코어 (A 내지 E)가 각각의 기관 카테고리에서의 시험 결과로부터 유래된다.
연구자는 오직 환자의 적합성을 결정하기 위한 스크리닝에서 각각의 도메인에서의 활성을 스코어링하도록 요구되었다. 그 후에, 연구자는 단지 루푸스 특이적 항목의 존재 또는 부재를 BILAG 워크시트에 기록하도록 요구되었고, eCRF를 사이트에 제공하였다. 후원자는 무작위 분류 후에 스코어링을 담당하였다 (즉 A, B, C, D 및 E).
SELENA-SLEDAI
SELENA-SLEDAI를 질환 활성을 평가하기 위한 추가의 기구로 이용하였다. 이 시험에서, SELENA-SLEDAI를 이전 28일에 걸쳐 질환 활성을 평가하는데 이용하였고, SELENA-SLEDAI 플레어 도구 및 SFI-R을 이용하였다.
의사의 전반적 평가
PGA는 시각적 상사 척도이다. 이는 또한 SELENA 플레어 도구의 일부이다. 의사는 지난 28일에 걸쳐 환자 질환 활성을 평가하고, 0 내지 3으로 단계화된 100-mm 상사 척도 상에 수직 틱 마크를 두었다. 환자 병력, 신체 검사의 결과 뿐만 아니라 적절한 실험실 값이 환자 질환 활성을 평가할 때 고려되어야 한다. 의사는 또한 이전 방문에서 기록된 값을 참조하고, 적절한 경우에 틱 마크를 이동시킬 수 있다.
CLASI
CLASI는 SLE-특이적 점막피부 질환 징후를 포착하도록 설계된 기구이다. 이는 질환의 활성에 대한 스코어 및 질환에 의해 유발된 손상에 대한 스코어를 포함한다. CLASI는 주어진 연구 방문 및 모든 후속 방문시에 SLE의 피부점막 징후를 갖는 임의의 환자에서 적절한 간격으로 완수하였다. CLASI를 이용하여 피부점막 징후가 처음 관찰된 방문에서 시작하여, 그 후에는 매월 간격으로 피부점막 질환 징후를 갖는 임의의 환자에서 피부점막 질환을 포착하였다.
오직 SLE-특이적 병변을 이 평가에 포함시키는 것이 중요하였다. 가능한 경우에 병변의 디지털 영상을 적절한 사전 동의를 받은 후에 수득하였다. 동일한 영역의 후속 검사 사진을 수득하였다. 가능한 한 사진 영상의 해석에 영향을 미칠 수 있는 조명 및 다른 조건은 각각의 후속 방문시의 사진촬영에서 정확하게 재현되어야 한다.
SELENA 플레어 인덱스-개정판 (SFI-R)
SELENA 플레어 인덱스의 2009 개정판은 8개의 기관계: 점막피부, 근골격, 심폐, 혈액, 구조적, 신장, 신경, 및 위장 내의 SLE 질환 활성의 증가를 평가한다. 각각의 기관계 내에서, 연구자는 임상적 징후 및 치료 권장사항을 평가하여 플레어를 플레어 없음, 경증 플레어, 중등도 플레어, 또는 중증 플레어로 분류하였다. 임상적 징후 및 치료 변화에 대한 권장사항의 평가가 모순되는 경우에, 치료 선택이 (보다 높은 플레어 정의의 방향으로) 우선된다. 불내성, 독성 또는 안전성 때문에 권장된 치료 변화는 플레어 정의에 포함되지 않았다.
관절 카운트
모든 관절염 환자의 경우에, 28-관절 카운트를 적절한 간격으로 수행하였다. 조조 강직의 지속시간 (분)은 각각의 이러한 방문시에 기록하였다.
e. 실험실 평가
후전방 흉부 X선 (CXR)은 스크리닝 방문 후에 가능한 빨리 모든 환자에 대해 수행하였다. X선은 환자가 이전 6개월 이내에 X선 촬영을 하여, 결과가 보고되었고, 임상적으로 유의한 이상이 나타나지 않거나, 또는 환자가 다른 흉부 영상화 방식 (예를 들어, CT, MRI)으로 촬영하여 임상적으로 유의한 이상이 밝혀지지 않는다면 요구되지 않았다.
12-리드 심전도 (ECG)를 연구 동안 다양한 시점에 수득하였다.
다른 시험실 평가는 연구 동안 다양한 시점에서 수행하였다. 적혈구 침강 속도 (ESR), 소변 시험지검사, 소변 현미경검사 시험 및 소변 임신 테스트를 제외하고는, 모든 실험실 연구가 중앙 실험실에 의해 수행되었다. 혈액학 실험실은 헤모글로빈, 적혈구용적률, 적혈구, 자동 계산된 적혈구 인덱스 (평균 세포 부피, 평균 세포 헤모글로빈, 평균 세포 헤모글로빈 농도, 적혈구 분포 폭), 혈소판, 백혈구 및 백분율을 이용한 백혈구 분화율 및 호중구, 단핵구, 림프구, 호염기구, 호산구, 및 밴드의 절대 수를 포함하였다. 미성숙 백혈구의 존재는 보고될 것이다. 비정상적 적혈구 형태의 존재는 보고될 것이다. ESR은 지역 실험실에서 측정하였다.
화학 패널은 전해질 (나트륨, 칼륨, 칼슘, 클로라이드, 비카르보네이트 및 포스페이트), 우레아, 크레아티닌, 추정된 사구체 여과율 (eGFR), 글루코스, 트리글리세리드, 총 콜레스테롤, HDL, LDL, 알라닌 아미노트랜스퍼라제, 아스파르테이트 아미노트랜스퍼라제, 아밀라제, 리파제, 총 및 직접적 빌리루빈, 알칼리성 포스파타제, 감마 글루타밀 트랜스펩티다제, 크레아틴 포스포키나제, 락테이트 데히드로게나제, 요산, 알부민, 글로불린 및 총 단백질 농축물을 포함하였다. C-반응성 단백질은 높은 감수성 CRP에 대해 검정을 이용하는 면역검정에 의해 측정하였다.
응고 패널은 스크리닝 방문시에 수행하고, 연구 동안 다양한 시점에서 반복하며, 프로트롬빈 시간, 부분적 트롬보플라스틴 시간 및 국제 정규화 비를 포함하였다. 임상적으로 발생한다면 (예를 들어, 의심되는 항-인지질 항체 증후군의 경우에), 추가의 기능적 응고 검정이 임상적으로 지시되고 연구자에 의해 결정된 바와 같이 지역 실험실에서 또는 전문 실험실에서 수행되어야 한다. 이러한 연구의 결과는 원문서에 기록되어야 한다.
총 이뮤노글로불린 (Ig), IgG, IgM 및 IgA의 혈청 수준은 연구 동안 다양한 시점에서 면역검정에 의해 결정되었다.
임신 가능성이 있는 모든 여성은 (외과적 불임수술을 받지 않았거나 또는 폐경후 적어도 1년이 지나지 않은 한) 스크리닝시에 혈청 임신 테스트를 받았다. 소변 임신 테스트는 연구 동안 다양한 시점에서 수행하였다. 소변 임신 테스트가 양성이라면, 이를 혈청 임신 테스트로 확인하였다.
요분석은 스크리닝 방문시에 및 연구 동안 다양한 시점에 지역 실험실에 의해 수행되었다. 가능한 경우에, 첫번째 오전 보이드를 수득하였다. 소변은 혈액, 단백질, 글루코스, 및 니트라이트, 및 백혈구 에스테라제의 존재에 대해 시험지검사에 의해 분석하고; 존재한다면 반-정량적으로 보고하였다. 2+ 이상의 수준을 갖는 단백질이 시험지검사 분석 상에서 검출되면 요 샘플을 이 시편에 및 모든 후속 요분석 샘플 상에 UPC로 보고된 단백질 및 크레아티닌의 정량적 측정을 위해 제출하였다. 주 연구자에 의해 필요한 것으로 간주되면 UPC의 보다 정확한 결정을 위해 24시간 수집을 수행하였다. 혈액, 니트라이트 또는 백혈구 에스테라제가 시험지검사 시험 상에서 검출되거나, 또는 WBC 또는 RBC (> 5개 세포/HPF)가 현미경검사 상에서 존재한다면 박테리아 배양 및 감수성을 위한 소변을 보냈다. 소변 현미경검사는 지역 실험실에서 수행하였고, 고배율 시야당 적혈구 및 백혈구의 수는 원주의 수 및 유형과 함께 보고되었다.
간염 및 인간 면역결핍 바이러스 (HIV) 혈청검사는 스크리닝 방문시에 수행하였다. B형 간염 표면 항원 (HBsAg) 및 B형 간염 코어 항원에 대한 항체, C형 간염 바이러스 항체, HIV-1 및 HIV-2의 존재를 면역검정에 의해 결정하였다. 스크리닝 검정이 양성으로 보고되었으나 확인 검정이 음성일 경우에, 검정은 음성으로 간주되었다.
미코박테리움 투베르쿨로시스로의 잠재적 감염에 대한 스크리닝은 스크리닝 방문시에 추출한 전혈로 퀀티페론® 골드 시험관내 IFN감마 방출 검정을 이용하여 중앙 실험실에 의해 수행되었다. 샘플 처리는 중앙 실험실로 보내기 전에 지역 실험실에 요구되었고; 세부사항은 실험 매뉴얼에 제공되어 있다. 대안적으로, BCG 백신접종을 받지 않은 환자의 경우에, PPD 피부 검사를 그 부위에서 수행하였다.
혈청 보체 C3 및 C4 성분의 수준은 면역검정에 의해 결정하였다. 보체의 50% 총 용혈성 용량 (CH50)은 감작화된 적혈구의 용해에 의해 결정하였다. 보체 샘플에 대한 처리 지침은 실험 매뉴얼에 제공되어 있다.
스크리닝 방문시에 ANA의 존재 및 역가는 중앙 실험실에서 간접 면역형광 현미경검사에 의해 평가하였다. 다른 적절한 자가항체는 스크리닝시에 및 연구 동안 다양한 시점에서 면역검정에 의해 중앙 실험실에서 측정하였고, dsDNA에 대해 지시된 항체 및 추출가능한 경우에 리보핵단백질 Ro (SSA), La (SSB), Sm 및 RNP를 포함하였다. 항-인지질 자가항체 패널은 카르디올리핀 (개별적으로 보고된 IgG 및 IgM 특이성을 가짐) 및 항-베타-2-당단백질 (IgG 및 IgM)에 대해 지시된 항체의 측정을 포함하였다.
PK 분석의 경우에, 론탈리주맙의 혈청 수준은 유효 면역검정을 이용하는 연구 동안 다양한 시점에서 측정하였다. 샘플을 연구 약물의 투여 전에 채취하였다. 론탈리주맙에 대한 항체는 유효 면역검정을 이용하는 연구 동안 다양한 시점에서 측정하였다.
연구 제품의 생체내 약역학 효과를 평가하기 위해, 안정화된 전혈을 연구 동안 다양한 시점에서 중요 IRG의 RNA 추출 및 발현 측정용으로 수집하였다. 검정을 위한 충분한 RNA (PD 샘플 RNA)를 확보하기 위해 각각의 시점에서 수집한 2개의 샘플이 있었다. SLE 또는 론탈리주맙 (탐색적 RNA)의 작용 메카니즘과 관련될 수 있는 다른 유전자의 발현 측정을 위해, 추가의 2개의 전혈 샘플을 연구 동안 다양한 시점에서 RNA 추출용으로 수득하였다. PD 바이오마커 혈청 및 혈장 샘플은 후속 단백질 분석을 위한 연구 동안 다양한 시점에서 채취하였다. 연구자 소재의 지역 실험실에 의한 정맥절개술 및 RNA, 혈청 및 혈장의 처리에 대한 지침은 실험 매뉴얼에 제공되어 있다.
론탈리주맙 연구 IFN4575g와 연합된 DNA 저장소 하위연구에 참가하는데 동의한 환자의 경우에, 전혈 샘플을 무작위 방문에서 수득하여 게놈 DNA의 추출에 사용하였다. 샘플의 사용에 대한 추가의 세부사항은 하위-연구 프로토콜에서 찾아볼 수 있다. 이 샘플의 수집은 추가의 사전 동의 절차에 따른다.
말초 혈액 림프구 하위세트에 대한 론탈리주맙의 잠재적 효과를 결정하기 위해 전혈 샘플을 유동 세포측정법에 의해 수집하였다. 표준 면역표현형분석을 위해, 혈액을 연구 동안 다양한 시점에서 트루카운트(TruCount) 바큐테이너에서 T 세포 카운트 (CD3+, CD4+, CD8+), B-세포 카운트 (CD19+), 및 NK 세포 카운트 (CD16+, CD56+)용으로 수집하고, 중앙 실험실에서 유동 세포측정법에 의해 분석하였다. 결과는 총 림프구 카운트의 백분율 및 부피의 혈액당 절대 세포 수로 보고하였다. 이러한 동일한 시간 간격에서 추가의 하위세트 및 활성화 마커의 평가는 이뮨 톨러런스 네트워크(Immune Tolerance Network)와 계약한 전문 실험실에 의해 수행될 것이다. 이러한 추가의 유동 세포측정법 연구는 북미 내에 위치한 연구자 소재지의 환자로 제한되었으며, 여기서 혈액 샘플을 정맥천자 24시간 이내에 전문 실험실로 보낼 수 있다. 어떠한 치료전 기준선 샘플도 수집되지 않은 경우에 (예를 들어, 오류, 샘플 취급오류 등으로 인함), 후속 탐색적 유동 세포측정법 샘플은 수득하지 않았다.
3.5.3 치료 동안의 평가
연구 제품의 투여를 위한 방문을 연구의 부분 1 (IV 투여) 동안 4주마다 및 연구의 부분 2 (SC 투여) 동안 2주마다 수행하였다. 스케줄 문제 (예를 들어, 환자 또는 연구자 직위 직원의 휴가) 때문에 명시된 간격을 넘어설 필요가 있다면, 이는 후원자의 의학적 모니터 또는 설계자의 사전 승인에 의해 허용되었다.
3.5.4 치료후 및 조기 종결 평가
연구의 치료 단계가 완료된 환자 (제24주)는 4주 간격 (제28, 32 및 36주)의 3회의 후속 방문에서 안전성 및 효능을 추가로 평가하기 위해 복귀하였다. 제36주 후에, 심각한 유해 사례, 병용 의약, 지속적인 질환 활성 측정, 안전성 실험실 모니터링, ATA, 및 PK 및 PD 샘플링의 평가를 위한 제48, 60 및 72주에서의 추가 3회의 방문을 위해 12주마다 병원으로 복귀하였다. 제24주 전에 치료 기간 중에 중단한 환자에게 연구 제품의 마지막 투여후 4주 내에 병원으로 복귀하도록 요청하였으며; 이러한 방문시에 조기 종결을 위한 평가를 수행하였다. 이 연구에 참여하기로 한 동의를 철회한 경우를 제외하고, 제24주 전에 치료 단계를 중단한 환자는 다양한 평가를 수행할 6회의 후속 방문을 위해 복귀하였다.
3.9 검정 방법
통상적인 안전성 실험실 샘플 뿐만 아니라, 하기 샘플을 연구 전반에 걸쳐 다양한 시점에서 모든 환자에서 수집하였다:
● PK, ATA, 및 바이오마커 분석을 위한 혈청 및 혈장 샘플. 론탈리주맙 수준을 ELISA에 의해 측정하였다. ATA 수준을 가교 면역검정에 의해 측정하였다. 탐색적 바이오마커를 면역검정을 이용하여 측정하였다.
● 전혈 샘플을 PD 및 바이오마커 분석을 위한 RNA 추출을 위해 수집하였다. RNA를 전혈 팍스젠(PAXgene) 샘플로부터 추출하였다. 상보적 DNA를 각각의 IRG에 대한 프라이머-프로브를 함유하는 주문제작된 택맨(TaqMan)® 저밀도 어레이 카드 상에서 수행될 수 있는, 역전사를 통한 후에 정량적 PCR에 의해 생성하였다.
● 약물유전체 분석을 위한 DNA 추출에 사용되는 전혈 샘플 (옵션; 론탈리주맙 [rhuMAb IFNalpha] 연구 IFN4575g와 연합된 DNA 저장소 하위연구에 참여하기로 동의한 환자에게 적용함).
● 유동 세포측정법 분석을 위한 전혈 샘플
3.10 통계적 방법
효능 분석은 무작위 분류에 포함되고, 적어도 하나의 용량의 연구 치료를 받고, 적어도 하나의 기준선후 효능 평가를 받은 모든 환자를 포함하였으며, 이들을 무작위로 분류한 치료 아암에 환자를 할당하였다.
안정성 분석은 무작위 분류에 포함되고, 적어도 하나의 용량의 연구 치료를 받은 모든 환자를 포함하였으며, 실제로 제공받은 요법과 연관된 치료 아암에 환자를 할당하였다.
3.10.2 치료군 비교가능성의 분석
인구통계 및 기준선 특성, 예컨대 연령, 성별, 인종/민족, 체중, 신장, SLE의 지속기간, BILAG 2004 인덱스 스코어, SELENA-SLEDAI 스코어를 치료군에 의해 요약하였다. 연속적 데이터 (예를 들어, 연령, 체중, 및 신장)를 기술 통계학 (평균, 표준 편차, 중간값, 최소값, 및 최대값)을 이용하여 요약하였다. 범주형 데이터 (예를 들어, 인종/민족, 및 성별)의 경우에, 각각의 카테고리에서 참가자의 수 및 백분율을 치료군 옆에 제시하였다.
3.10.3 효능 분석
a. 1차 효능 종점
각각 정맥내로 및 피하로 투여된 론탈리주맙의 2가지 용량 요법이 중등도 내지 중증 SLE 환자에서 징후 및 증상을 개선하는 능력을 1차 종점 섹션 (섹션 2.1 참조)에 정의된 바와 같은 제24주에서의 BILAG 인덱스 반응에 의해 평가하였다.
제24주에 소정의 용량의 론탈리주맙 또는 위약으로의 치료에 대한 반응자의 비율의 차이로 정의된 치료 효과 크기의 점 추정값을 90% 양측 신뢰 구간과 함께 결정하였다. 통계적 유의성을 α = 0.1 수준에서 판단하면서 탐색적 가설 시험을 수행하였다.
일차 종점의 탐색적 분석으로서, 로지스틱 회귀 모델을 이용하여 론탈리주맙 아암을 조합된 (IV 및 SC) 위약 아암과 비교하였다. 모델은 치료, 인종, 면역억제제의 이전의 사용 (예/아니오), 및 기준선 ISM 스코어를 공변량으로서 포함하였다. 통계적 유의성을 α = 0.10 수준에서 판단하였다.
b. 2차 효능 종점
2차 효능 종점은 하기를 포함하였다:
● 기준선으로부터 제24주 또는 연구 중단까지의 BILAG 인덱스 전반적 스코어의 시간-조정된 AUC. 조정된 치료 차이는 ANCOVA 모델을 이용하여 추정하였다.
● 치료 실패 상태
활성 아암 vs. 조합된 위약 아암에서 치료 실패로 분류된 환자 집단 사이의 조정되지 않은 차이에 대한 95% 신뢰 구간을 계산하였다. 치료 실패로 분류된 환자 집단에서 조정된 차이를 또한 로지스틱 회귀 모델을 이용하여 추정하였다.
● 치료 실패까지의 시간
계층화된 Cox 비례 위험 모델을 이용하여 위약군과 관련하여 각각의 론탈리주맙 아암에 대한 위험 비의 점 추정값을 95% 신뢰 구간과 함께 계산하였다.
다른 2차 또는 탐색적 종점은 상기에 제시된 것과 유사한 방법에 의해 분석하였다.
3.10.5 약동학 및 약역학적 분석
론탈리주맙 및 ATA의 약동학의 결정 및 특성화를 위해 모든 환자로부터 혈청 샘플을 수득하였다. 샘플을 연구 동안 다양한 시점에서 수득하였다. 환자가 조기에 연구를 중단하기로 결정하였다면, 혈액 샘플을 ATA 및 PK 결정용으로 수득하였다.
IFN 조절 유전자의 측정값은 전혈 RNA 제제로부터 투여전 및 투여후 시점에 정량적 RT-PCR 분석을 이용하여 평가하였다. 유전자 발현의 변화를 PK 데이터 및 임상적 데이터와 관련하여 평가하였다. 적절한 경우에 추가의 PK 및 PD 분석을 수행하였다.
3.10.6 누락 데이터의 취급
제24주에서의 치료 반응을 결정하기 위해, 조기에 (제24주 전에) 연구를 중단한 환자를 비-반응자로 간주하였다. 연속적 종점에 대한 누락 값을 다른 대치 기술의 사용에 앞서 또는 이러한 사용을 통해 마지막 이용가능한 관찰을 수행함으로써 대치하였다. 충분하지 않은 양의 기준선후 측정을 갖는 환자를 제24주 효능 종점의 분석에서 배제할 수 있다.
실시예 2 중간 분석
론탈리주맙 또는 위약을 정맥내로 투여한 환자로부터의 제24주에서의 치료 효과가 하기 표 6-12에서 수록되어 있다. 표 6은 SRI 인덱스를 이용하여 ISM 상태에 따라 치료 효과를 (응답자 %에 의해) 설명한다. 표 7은 SRI 인덱스를 이용하여 ENA 상태에 따라 치료 효과를 (응답자 %에 의해) 설명한다. 표 8은 ISM 상태에 따라 치료 효과를 (기준선으로부터의 BILAG 전반적 스코어의 변화에 의해) 설명한다. 표 9는 ISM 상태에 따라 치료 효과를 (기준선으로부터의 SELENA-SLEDAI 스코어의 변화에 의해) 설명한다. 표 10은 관절염의 존재에 기초하고, SELENA-SLEDAI 및 BILAG 인덱스를 이용하여 ENA 상태에 따라 치료 효과를 설명한다. 표 11은 종창 관절 카운트의 변화에 기초하고, ENA 상태에 따라 치료 효과를 설명한다. 표 12는 점막피부 발진의 변화에 기초하고, SELENA-SLEDAI및 BILAG 인덱스를 이용하여 ENA 상태에 따라 치료 효과를 설명한다.
[표 6]
[표 7]
[표 8]
[표 9]
[표 10]
[표 11]
[표 12]
실시예 3 - 환자에서의 ISM 시그너쳐
하기 프로토콜은 환자가 ISMlo 또는 ISMhi인지 결정하기 위한 다양한 IRG 유전자를 측정하기 위해 채택할 수 있는 단계의 예로서 제공된다.
물질
본 실시예에서, IRG 유전자 Herc5, Tyk1 및 EPSTI1 및 하우스키핑 유전자 트랜스페린 수용체 (TRFC)의 RT-PCR을 위한 프라이머가 사용될 수 있다.
올리고뉴클레오티드 서열
사용된 정방향 및 역방향 프라이머 및 염료-접합된 프로브의 올리고뉴클레오티드 서열이 하기 제시된다.
모든 서열은 5' - 3' 배향으로 나타낸다.
EPSTI-1 (NM_001002264)
프로브: TGCTCTTGCTGCTGCCGTTTCAGT (서열 23)
정방향: AGGCAGAAGAAAACAGAAAATTGC (서열 24)
역방향: GTGTTCAGTCTGGTGGATTTTGG (서열 25)
HERC5 (NM_016323)
프로브: CTGCCGGAGAAGCCCACAGCATGG (서열 26)
정방향: ACCTCGCAGGAGTACCCTTG (서열 27)
역방향: GCCACCACAAGCGACAAATTC (서열 28)
TYKI 또는 CMPK2 (NM_207315)
프로브: CGAAGGACTGGATGCCACGGGTAAA (서열 29)
정방향: GAAAGTTCCAGGTTGTTGCCA (서열 30)
역방향: TGAATCTGCCACTGACTGGG (서열 31)
RNA 단리
SLE 환자 RNA를 제조업체의 프로토콜에 따라 RNeasy 미니 키트 (퀴아젠(Qiagen), #74124)를 이용하여 PBMC로부터 또는 팍스젠 혈액 RNA 키트 (퀴아젠, #762164)를 이용하여 팍스젠 튜브에 수집한 전혈로부터 단리할 수 있다. 온-칼럼 DNase 처리를 양쪽 프로토콜에 사용할 수 있다. RNA는 나노드롭(NanoDrop)® ND-1000 분광광도계를 이용하여 정량화할 수 있다.
cDNA 합성
1ug 투입 RNA를 아이스크립트(iScript) cDNA 합성 키트 (바이오-라드(Bio-Rad), #170-8890)를 제조업체의 프로토콜에 따라 사용하여 제1 가닥 합성에 사용할 수 있다.
qPCR (RT-PCR) 프로토콜:
10ul PCR 반응을 ABI 프리즘(ABI PRISM)® 7900HT 서열 검출 시스템 상에서 384-웰 플레이트 포맷을 이용하여 2벌식으로 수행하였다. cDNA를 출발 RNA 농도에 기초하여 5ng/ml의 농도로 희석할 수 있었고, 10ul 반응당 10ng을 사용할 수 있었다 (1ng/ul의 최종 주형 농도). 택맨® 유니버셜 PCR 마스터 믹스 (ABI, #4304437)를 디폴트 열 순환 조건을 이용하는 제조업체의 프로토콜에 따라 사용하였다. 프라이머 및 택맨 프로브는 비콘 디자이너 6.0(Beacon Designer 6.0)으로 설계하고, 100nM의 최종 농도로 사용할 수 있었다.
분석:
IRG 검출 데이터는 하우스키핑 유전자에 대해 정규화될 수 있다. 본 실시예에서, 델타 Ct (DCt)는 TFRC와 관련하여 각각의 유전자에 대해 계산할 수 있다. ISM 스코어는 본원에 기재된 바와 같이 계산할 수 있다.
대안적 방법:
대안적으로, 전혈을 팍스젠® 혈액 튜브를 이용하여 루푸스 환자로부터 수집하고, 팍스젠® 혈액 RNA 키트 IVD (프리어날리틱스(PreAnalytix))를 이용하여 추출할 수 있다. 이어서, RNA 샘플을 코바스 z 480 분석기 (로슈 다이아그노스틱스)를 사용하는 실시간 PCR 열순환에 의해 분석할 수 있다. 예를 들어, Tyk1, EPSTI1 및 HERC5에 대한 mRNA는 각각의 IRG 반응에 대해 정규화하는데 사용되는 하우스키핑 유전자 TRFC의 mRNA 수준을 이용하여 이러한 방식으로 분석할 수 있다.
실시예 4 - 항-ds DNA 및 ISM 분석의 결과
론탈리주맙 치료 주기의 시작 전에, 실시예 1에 기재된 II상 연구 (ROSE 시험)에 참여하는 루푸스 환자로부터의 생물학적 샘플을 수득하고, TYK1, HERC5 및 EPST1 및 하우스키핑 유전자 TRFC의 IRG 유전자 발현에 대해 및 항-dsDNA 항체에 대해 분석하였다. 건강한 환자로부터의 생물학적 샘플을 유사하게 처리하였다.
항-ds DNA IgG 시험은 아테나 멀티-라이트® ANA-II 플러스 테스트 시스템 키트 (인버네스 메디칼 인크. (뉴저지주 래리탄)에 의해 제작됨)를 이용하여 혈청 샘플 상에서 수행하였다. IRG를 코바스 z 480 분석기 (로슈 다이아그노스틱스)를 이용하여 qPCR에 의해 3벌식으로 분석하였다. 생성된 IRG Ct 데이터를 하우스키핑 유전자 (예를 들어, TFRC)에 대해 생성된 Ct 데이터에 대해 정규화하여 DCt 값을 생성하였다. (DCt = 반응당 Ct(ISM 유전자) - Ct(하우스키핑 유전자). 모든 DCt의 평균 값을 해당 환자에 대해 계산하였다.
IRG 유전자 발현의 양 (평균 DCt)에 기초하여 환자의 양봉 분포가 관찰되었고, 이 분포는 환자의 보다 낮은 및 보다 높은 IRG 발현 군 사이에 차별화된 컷오프에 대해 추가로 특성화하였다 ("1"로 표시됨) (도 9). 이러한 경우에 보다 낮은 발현 IRG 집단은 일반적으로 (1) 건강한 사람의 IRG의 발현 수준의 값의 1.5배 미만 또는 (2) 건강한 환자에서 동일한 IRG의 발현 수준의 중간 값에 비해 2 표준 편차 미만인 평균 DCt를 갖는 것으로 기재될 수 있다. 보다 낮은 발현 IRG 집단은 일반적으로 "ISMlo"로 지칭되고, 보다 높은 발현 ISM 집단은 일반적으로 "ISMhi"로 지칭된다.
인터페론 알파 억제제로의 치료 전의 환자의 ISMlo 또는 ISMhi 상태와 관계없이, ISMlo 또는 ISMhi 환자는 일반적으로 유사한 SRI, BILAG 및/또는 SLEDAI 임상 스코어를 갖는 것으로 관찰되었다.
BILAG 반응 인덱스/SRI 스코어에 기초한 론탈리주맙 치료에 대한 개별 반응률을 개체의 IRG 발현 상태 (즉, ISMlo 또는 ISMhi)와 대응시켜 하기 관찰 결과를 얻었다.
[표 13]
결과는 ISM 낮음 환자에서 IV 및 SC의 경우에 가능한 증가된 SRI 반응률을 제안하였고, 결과를 하기에 보다 상세하게 분석하였다. 또한, 그의 ISM 스코어 및 dsDNA 항체 역가에 기초한 환자의 추가의 분석은 3개의 환자 집단 - ISMlo, ISMhi/dsDNA lo ≤200IU), 또는 ISMhi/dsDNA hi이 존재함을 나타낸다 (도 10 및 25). 이들 환자 집단의 추가의 분석은 ISMlo 뿐만 아니라, ISMhi/dsDNA lo (≤200 IU) 시그너쳐가 론탈리주맙 및 다른 인터페론 억제제에 대한 반응성을 예측할 수 있다는 것을 제안한다. 도 25 및 표 14를 참조한다.
환자의 78 퍼센트는 200 IU 미만의 항-dsDNA 역가 또는 ISMlo를 갖는 것으로 분류되었다. 이러한 환자는 ISM 높음이고 200 IU 초과의 항-dsDNA 역가를 갖는 환자보다 양호하게 반응하였다. 표 14를 참조한다.
[표 14]
Rose 연구로부터의 제24주에서의 SRI-4 반응률은 하기 표에 제시된다.
실시예 5 - 론탈리주맙 요법 후의 SRI의 감소
실시예 1에 기재된 2상 연구로부터의 환자 반응률을 다양한 반응 기준으로 평가하였다. 하기 표 15 및 16은 SRI-4, SRI-5, SRI-6 및 SRI-7로 정의된 바와 같은 반응 기준 및 위약과 비교하여 300 mg/2w SC 치료군의 반응률을 보여준다. 하기 나타난 바와 같이, SC 치료군에서의 반응은 보다 엄격한 반응 기준으로 보다 명백하게 검출하였다.
[표 15]
[표 16]
또한, 하기 표 17은 ISM 낮음 하위군이 보다 높은 반응률을 나타내었다는 것을 보여준다. 또한, 도 23 및 24를 참조한다.
[표 17]
실시예 6 플레어의 예측
플레어는 새로운 또는 악화된 임상 징후 및 증상을 포함하는 하나 이상의 기관계에서의 질환 활성의 급성 측정가능한 증가 및/또는 실험실 측정에 의해 확인될 수 있다. 이는 평가자에 의해 임상적으로 유의한 것으로 간주되어야 하며, 통상적으로는 적어도 치료에서의 변화 또는 증가를 고려할 것이다. (문헌 [Ruperto et al., International consensus for a definition of disease flare in lupus. Lupus (2011) 20: 453-462] 참조.) 따라서, 플레어는 면역 장애로 진단된 환자의 질환 활성의 개시를 지칭하고; SLE의 임상적 개입 시험에서, 플레어는 문헌 [Lupus [1999] 8(8):685-91]의 SELENA-SLEDAI 플레어 인덱스 (SFI) 및 문헌 [Arthritis & Rheumatology [2011] 63(12): 3918-30]의 개정판 (SFI-R)으로 공개된 기준에 기초하여 경증, 중등도 또는 중증으로 분류된다. 실시예 1에 기재된 프로토콜에 따라, SELENA-SLEDAI는 0 내지 105의 가능한 전반적 스코어 범위를 갖는 2가지 면역학적 시험을 비롯하여, 16가지 임상 징후 및 8가지 실험실 측정값에 기초한 질환 활성의 복합적 평가에 사용하였다.
도 11-21에 나타난 바와 같이, 인터페론 조절 유전자 발현 수준 (-델타 CT 또는 -DCT 단위)은 정량적 PCR에 의해 투여전 및 투여후 시점에 측정하였다. 환자는 2가지 카테고리로 분리하였다; 제16주에 중등도 내지 중증 플레어를 갖는 환자 (n=23, 적색 선) 및 플레어가 나타나지 않은 나머지 환자 (흑색 선). 제16주에서 플레어 전에, 평균 IRG 발현 수준이 상승하였고, 이들 유전자는 HERC5, EPSTI1, CMPK2, IFI27, IFI44, MX1, IFIT1, OAS1, OAS2 및 OAS3을 포함하나 이에 제한되지는 않는다. 도시된 선은 전방 기준선으로부터 발현의 평균 및 평균의 표준 오차를 나타내고, 오직 활성 군의 IV 및 SC 코호트로부터의 환자를 포함한다. 따라서, 본 실시예는 IRG가 환자에서 플레어의 발생을 예측하는데 사용될 수 있다는 것을 보여준다.
실시예
7 - 2차 결과
본 실시예는 코르티코스테로이드 절약 및 플레어의 감소에 대한 론탈리주맙의 이익을 설명한다.
코르티코스테로이드 절약
중등도 또는 중증 질환의 갖는 환자에서 장기 이환율의 원인이 되고, 조기 심혈관성 사망률에 기여할 수 있는 코르티코스테로이드를 완전하게 점감시키는 것은 종종 어렵다. (문헌 [Hahn, BH. Systemic lupus erythematosus and accelerated atherosclerosis. N Engl J Med 2003 Dec 18: 349(25):2379-80]). 장기간 코르티코스테로이드 치료와 관련된 이환율은 골다공증, 골의 무혈관성 괴사, 쿠싱양 특징, 피부 변화, 근육 소모 및 심약, 잦은 멍 및 다수의 다른 합병증을 포함한다. 따라서, 론탈리주맙 치료의 코르티코스테로이드 절약 효과를 연구하였다.
예를 들어 연구 종료까지 1일당 < 10 mg 프레드니손까지 의미있는 임상적 반응을 달성한 환자의 비율에 의해 측정된 바와 같은, 론탈리주맙을 제공받은 대상체에서의 코르티코스테로이드-절약. 환자에서 이들의 사용을 본원에 기재된 바와 같이 점감시켰다. 도 22a에 나타난 바와 같이, 1일당 <10 mg 프레드니손 또는 프레드니손 등량을 사용하여 SRI-4 반응을 달성한 환자의 퍼센트가 모든 신청자에서 달성되었고, 위약에 비해 ISMlo 군에서 확실하였다.
플레어의 감소
플레어 비율 또는 플레어까지의 시간의 감소는 임상적으로 중요한 결과인 것으로 간주된다. 예를 들어, 루푸스 신염의 플레어의 빈도 및 중증도의 증가는 악화된 결과와 관련된다. 따라서, 플레어의 비율 및/또는 플레어까지의 시간의 감소를 효능 종점으로서 평가하였다. 환자를 본원에 기재된 바와 같이 플레어에 대해 평가하였다. 도 22b에 나타난 바와 같이 론탈리주맙으로의 치료 (IV 또는 SC)는 치료 기간에 걸쳐 위약과 비교하여 SELENA-SLEDAI 플레어 비율을 감소시키고 플레어까지의 시간을 연장시켰다.
실시예 8 유해 사례
본 항-IFNa 항체와의 가장 통상적인 유해 반응은 피하 투여로의 주사 부위 반응이었다.
유해 사례로 인해 치료를 중단한 환자의 비율은 본 항-IFNa 항체를 제공받은 환자의 경우에 4% 및 위약-치료된 환자의 경우에 5%였다. 유해 사례의 개요는 표 18에 제시된다. 위약 및 활성 군 사이에 전반적인 유해 사례는 대등하였다.
[표 18]
SEQUENCE LISTING
<110> Genentech, Inc.
DRAPPA, Jorn
MORIMOTO, Alyssa M.
MCBRIDE, Jacqueline
BOISMENU, Richard
MACIUCA, Romeo
KENNEDY, William D.
TOWNSEND, Michael J.
<120> COMPOSITIONS AND METHOD FOR TREATING
AUTOIMMUNE DISEASES
<130> 146392012540
<140> PCT/US2012/35313
<141> 2012-04-26
<150> US 61/479,314
<151> 2011-04-26
<150> US 61/582,179
<151> 2011-12-30
<160> 31
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 1
Arg Ala Ser Gln Ser Val Ser Thr Ser Ser Tyr Ser Tyr Met His
1 5 10 15
<210> 2
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 2
Tyr Ala Ser Asn Leu Glu Ser
1 5
<210> 3
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 3
Gln His Ser Trp Gly Ile Pro Arg Thr Phe
1 5 10
<210> 4
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 4
Gly Tyr Thr Phe Thr Glu Tyr Ile Ile His
1 5 10
<210> 5
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 5
Ser Ile Asn Pro Asp Tyr Asp Ile Thr Asn Tyr Asn Gln Arg Phe Lys
1 5 10 15
Gly
<210> 6
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 6
Trp Ile Ser Asp Phe Phe Asp Tyr
1 5
<210> 7
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 7
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Thr Ser Gly Tyr Thr Phe Thr Glu Tyr
20 25 30
Ile Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ser Ile Asn Pro Asp Tyr Asp Ile Thr Asn Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Ile Ser Leu Asp Lys Ser Lys Arg Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Trp Ile Ser Asp Phe Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser
115
<210> 8
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 8
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Ser Thr Ser
20 25 30
Ser Tyr Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Val Leu Ile Ser Tyr Ala Ser Asn Leu Glu Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His Ser Trp
85 90 95
Gly Ile Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val
<210> 9
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 9
agggccagtc agagtgttag cagcacctac ttagcc 36
<210> 10
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 10
ggtgcatcca gcagggccac t 21
<210> 11
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 11
cagcagtatg gtagctcacc tcggacg 27
<210> 12
<211> 15
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 12
agctatagta tcagc 15
<210> 13
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 13
aatggtaaca caaactatgc acagaagttc cagggc 36
<210> 14
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 14
gatcccatag cagcaggcta c 21
<210> 15
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 15
Arg Ala Ser Gln Ser Val Ser Ser Thr Tyr Leu Ala
1 5 10
<210> 16
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 16
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 17
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 17
Gln Gln Tyr Gly Ser Ser Pro Arg Thr
1 5
<210> 18
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 18
Ser Tyr Ser Ile Ser
1 5
<210> 19
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 19
Trp Ile Ser Val Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 20
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 20
Asp Pro Ile Ala Ala Gly Tyr
1 5
<210> 21
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 21
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Ser Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Val Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Pro Ile Ala Ala Gly Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 22
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 22
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Thr
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 23
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 23
tgctcttgct gctgccgttt cagt 24
<210> 24
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 24
aggcagaaga aaacagaaaa ttgc 24
<210> 25
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 25
gtgttcagtc tggtggattt tgg 23
<210> 26
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 26
ctgccggaga agcccacagc atgg 24
<210> 27
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 27
acctcgcagg agtacccttg 20
<210> 28
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 28
gccaccacaa gcgacaaatt c 21
<210> 29
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 29
cgaaggactg gatgccacgg gtaaa 25
<210> 30
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 30
gaaagttcca ggttgttgcc a 21
<210> 31
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 31
tgaatctgcc actgactggg 20
Claims (182)
- 환자에게 유효량의 인터페론 억제제를 투여하는 것을 포함하며, 여기서 환자는 자가면역 질환으로 진단되고 ISMlo인 것으로 결정되거나 또는 ISMlo인 것에 기초한 치료를 위해 선택된 것인, 환자에서 자가면역 질환을 치료하는 방법.
- 제1항에 있어서, ISMlo가 환자로부터의 샘플에서 하나 이상의 인터페론 반응 유전자 (IRG)의 mRNA 발현 수준을 측정함으로써 결정되는 것인 방법.
- 제2항에 있어서, 샘플에서의 mRNA 발현 수준이 RT-PCR에 의해 결정되는 것인 방법.
- 제2항 또는 제3항에 있어서, 하나 이상의 IRG의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
- 제2항 내지 제4항 중 어느 한 항에 있어서, 샘플이 혈액 샘플인 방법.
- 제2항 내지 제5항 중 어느 한 항에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1, IFI27, SIGLEC1, DNAPTP6, USP18, IF16, HSXIAPAF1 및 LAMP3으로 이루어진 군으로부터 선택된 IRG 중 하나 이상의 mRNA 발현 수준이 결정되는 것인 방법.
- 제6항에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1, IFI27, SIGLEC1, DNAPTP6, USP18, IF16, HSXIAPAF1 및 LAMP3으로 이루어진 군으로부터 선택된 IRG 중 하나 이상의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
- 제2항 내지 제5항 중 어느 한 항에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP 및 ZBP1로 이루어진 군으로부터 선택된 IRG 중 하나 이상의 mRNA 발현 수준이 결정되는 것인 방법.
- 제8항에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1로 이루어진 군으로부터 선택된 IRG 중 하나 이상의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
- 제2항 내지 제5항 중 어느 한 항에 있어서, EPSTI1, HERC5 및/또는 TYK1 (CMPK2)의 mRNA 발현 수준이 결정되는 것인 방법.
- 제10항에 있어서, EPSTI1, HERC5 및/또는 TYK1 (CMPK2)의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
- 환자에게 유효량의 인터페론 억제제를 투여하는 것을 포함하며, 여기서 환자는 자가면역 질환으로 진단되고 면역검정에 의해 측정시에 200 IU 이하의 치료전 항-이중 가닥 DNA 항체 역가 (항-dsDNA)를 갖는 것으로 결정되거나 또는 면역검정에 의해 측정시에 200 IU 이하의 치료전 항-이중 가닥 DNA 항체 역가 (항-dsDNA)를 갖는 것에 기초한 치료를 위해 선택된 것인, 환자에서 자가면역 질환을 치료하는 방법.
- 제12항에 있어서, 면역검정이 ELISA인 방법.
- 제12항 또는 제13항에 있어서, 환자가 200 IU 이하의 항-dsDNA 역가를 갖고 ISMhi인 방법.
- 제14항에 있어서, ISMhi가 환자로부터의 샘플에서 하나 이상의 IRG의 mRNA 발현 수준을 측정함으로써 결정되는 것인 방법.
- 제15항에 있어서, mRNA 발현 수준이 RT-PCR에 의해 결정되는 것인 방법.
- 제15항 또는 제16항에 있어서, 하나 이상의 IRG의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
- 제15항 내지 제17항 중 어느 한 항에 있어서, 샘플이 혈액 샘플인 방법.
- 제15항 내지 제18항 중 어느 한 항에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1, IFI27, SIGLEC1, DNAPTP6, USP18, IF16, HSXIAPAF1 및 LAMP3으로 이루어진 군으로부터 선택된 IRG 중 하나 이상의 mRNA 발현 수준이 결정되는 것인 방법.
- 제19항에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1, IFI27, SIGLEC1, DNAPTP6, USP18, IF16, HSXIAPAF1 및 LAMP3으로 이루어진 군으로부터 선택된 IRG 중 하나 이상의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
- 제15항 내지 제18항 중 어느 한 항에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP 및 ZBP1로 이루어진 군으로부터 선택된 IRG 중 하나 이상의 mRNA 발현 수준이 결정되는 것인 방법.
- 제21항에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1로 이루어진 군으로부터 선택된 IRG 중 하나 이상의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
- 제15항 내지 제18항 중 어느 한 항에 있어서, EPSTI1, HERC5 및/또는 TYK1 (CMPK2)의 mRNA 발현 수준이 결정되는 것인 방법.
- 제23항에 있어서, EPSTI1, HERC5 및/또는 TYK1 (CMPK2)의 mRNA 발현 수준이 TFRC에 대해 정규화되는 것인 방법.
- 제1항 내지 제24항 중 어느 한 항에 있어서, 자가면역 질환이 루푸스, 류마티스 관절염, 건선, 건선성 관절염, 인슐린-의존성 당뇨병 (IDDM), 다발성 경화증 (MS), 근염, 피부근염, 혈관염, 아테롬성동맥경화증, 강직성 척추염 및 쇼그렌 증후군으로 이루어진 군으로부터 선택되는 것인 방법.
- 제25항에 있어서, 환자가 전신 홍반성 루푸스 (SLE)를 갖는 것인 방법.
- 제25항에 있어서, 환자가 중등도 내지 중증 활성 루푸스를 갖는 것인 방법.
- 제25항에 있어서, 환자가 중등도 내지 중증 활성 SLE를 갖는 것인 방법.
- 제25항에 있어서, 환자가 루푸스 신염을 갖는 것인 방법.
- 제1항 내지 제13항 중 어느 한 항에 있어서, 환자가 클래스 III-V 루푸스 신염을 갖고 ISMlo인 방법.
- 제25항에 있어서, 환자가 소아 루푸스를 갖는 것인 방법.
- 제1항 내지 제31항 중 어느 한 항에 있어서, 인터페론 억제제가 항-인터페론 유형 I 항체인 방법.
- 제32항에 있어서, 항체가 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합하는 것인 방법.
- 제32항에 있어서, 항체가 인터페론 α에 특이적으로 결합하는 것인 방법.
- 제34항에 있어서, 항체가 적어도 IFNα 하위유형 1, 2, 4, 5, 8, 10 및 21에 결합하는 것인 방법.
- 제34항에 있어서, 항체가 아미노산 서열 RASQSVSTSSYSYMH (서열 1)를 포함하는 HVR-L1, 아미노산 서열 YASNLES (서열 2)를 포함하는 HVR-L2, 및 아미노산 서열 QHSWGIPRTF (서열 3)를 포함하는 HVR-L3을 포함하는 경쇄; 및/또는 아미노산 서열 GYTFTEYIIH (서열 4)를 포함하는 HVR-H1, 아미노산 서열 SINPDYDITNYNQRFKG (서열 5)를 포함하는 HVR-H2, 및 아미노산 서열 WISDFFDY (서열 6)를 포함하는 HVR-H3을 포함하는 중쇄를 포함하는 것인 방법.
- 제34항에 있어서, 항체가 서열 7의 아미노산 서열에 대해 적어도 95% 서열 동일성의 중쇄 가변 영역 서열; 및/또는 서열 8의 아미노산 서열에 대해 적어도 95% 서열 동일성의 경쇄 가변 영역 서열을 포함하는 것인 방법.
- 제34항에 있어서, 항체가 서열 7의 아미노산 서열을 포함하는 중쇄 가변 영역; 및 서열 8의 아미노산 서열을 포함하는 경쇄 가변 영역을 포함하는 것인 방법.
- 제34항에 있어서, 항체가 CAS 등록 번호 948570-30-7을 갖는 론탈리주맙인 방법.
- 제32항 내지 제39항 중 어느 한 항에 있어서, 항체가 정맥내로 투여되는 것인 방법.
- 제32항 내지 제39항 중 어느 한 항에 있어서, 항체가 피하로 투여되는 것인 방법.
- 제32항 내지 제39항 중 어느 한 항에 있어서, 항체가 100 내지 2000 mg의 균일 용량으로 투여되는 것인 방법.
- 제42항에 있어서, 항체가 100-500 mg 매주, 200-1000 mg 격주, 또는 400-2000 mg 매월의 균일 용량으로 투여되는 것인 방법.
- 제42항 또는 제43항에 있어서, 항체가 150 mg 또는 300 mg 매주, 300 mg 또는 600 mg 격주, 또는 600 mg, 750 mg 또는 1200 mg 매월의 균일 용량으로 투여되는 것인 방법.
- 제32항 내지 제44항 중 어느 한 항에 있어서, 항체의 투여가 (1) 루푸스 플레어(flare)의 수 및/또는 중증도의 감소, (2) 루푸스 플레어의 예방, (3) 루푸스 신염 플레어의 감소, (4) 루푸스 신염 플레어의 예방, (5) 루푸스 신염의 완화 유도, (6) 루푸스 신염 완화의 유지, (7) 소아 루푸스 플레어의 수 및/또는 중증도의 감소, (8) 소아 루푸스 플레어의 예방, (9) 소아 루푸스 신염 플레어의 감소, (10) 소아 루푸스 신염 플레어의 예방, (11) 소아 루푸스 신염의 완화 유도, 및 (12) 소아 루푸스 신염 완화의 유지 중 하나 이상에서 효과적인 것인 방법.
- 제32항 내지 제44항 중 어느 한 항에 있어서, 항체의 투여가 환자에서 항-dsDNA 항체 역가를 저하시키는데 효과적인 것인 방법.
- 제32항 내지 제44항 중 어느 한 항에 있어서, 항체의 투여가 환자에서 플레어(들)의 감소에 효과적인 것인 방법.
- 제47항에 있어서, 상기 플레어(들)가 중등도 또는 중증인 것인 방법.
- 제32항 내지 제44항 중 어느 한 항에 있어서, 항체의 투여가 환자에서 Selena 플레어 인덱스 (SFI) 스코어 또는 Selena 플레어 인덱스-개정판 (SFI-R) 스코어의 감소에 효과적인 것인 방법.
- 제32항 내지 제44항 중 어느 한 항에 있어서, 항체의 투여가 모든 치료전 BILAG A 및 B 도메인을 감소시키는데 효과적인 것인 방법.
- 제32항 내지 제44항 중 어느 한 항에 있어서, 환자가 항체의 투여 후에 새로운 BILAG A 기관 도메인 스코어를 갖지 않거나 또는 1 이하의 새로운 BILAG B 기관 도메인 스코어를 갖는 것인 방법.
- 제32항 내지 제44항 중 어느 한 항에 있어서, 항체의 투여가 SELENA-SLEDAI 스코어를 환자의 치료전 스코어로부터 적어도 4점 감소시키는데 효과적인 것인 방법.
- 제32항 내지 제44항 중 어느 한 항에 있어서, 항체의 투여 후에 환자에서 의사의 전반적 평가 (PGA)가 치료전 스코어로부터 0.3점 이하 증가를 갖는 것인 방법.
- 제32항 내지 제44항 중 어느 한 항에 있어서, 상기 환자가 하기 평가 도구: SRI, BILAG, SELENA-SLEDAI 또는 의사의 전반적 평가 (PGA) 중 어느 하나에 의해 측정시에 치료 전에 중등도 또는 중증 질환 활성을 갖는 기관계에서 질환 활성의 치료후 감소를 나타내는 것인 방법.
- 제32항 내지 제44항 중 어느 한 항에 있어서, 환자가 항체의 투여에 대한 SRI-4, SRI-5, SRI-6 또는 SRI-7 반응을 갖는 것인 방법.
- 제1항 내지 제55항 중 어느 한 항에 있어서, 환자에게 제2 의약을 투여하는 것을 추가로 포함하는 방법.
- 제56항에 있어서, 제2 의약이 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 면역억제제, 항말라리아제, 스타틴 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
- 제56항에 있어서, 제2 의약이 루푸스에 대한 표준 진료인 방법.
- 제32항 내지 제44항 중 어느 한 항에 있어서, 항체의 투여가 상기 항체의 상기 투여 전에 코르티코스테로이드를 투여한 환자에서 코르티코스테로이드 절약 (CS)을 발생시키는 것인 방법.
- 제32항 내지 제44항 중 어느 한 항에 있어서, 항체의 투여가 스테로이드 및/또는 면역억제제 요법을 이용하는 요법에 대한 필요의 감소를 발생시키는 것인 방법.
- 제32항 내지 제44항 중 어느 한 항에 있어서, 항체의 투여 후에 환자에서 그의 코르티코스테로이드 용량이 10 mg/일의 프레드니손 등량까지 점감되는 것인 방법.
- 제32항 내지 제44항 중 어느 한 항에 있어서, 항체의 투여가 항체 투여 약 24 내지 약 52주 후에 코르티코스테로이드 사용의 적어도 50% 감소를 발생시키는 것인 방법.
- 제32항 내지 제44항 중 어느 한 항에 있어서, 항체의 투여가 SELENA SLEDAI 스코어 및/또는 의사의 전반적 평가에 의해 측정시에 중등도 및/또는 중증 플레어의 발생률의 감소; 중증 플레어까지의 유의하게 지연된 시간; 종창 또는 압통 관절의 수의 감소; 및 1 BILAG A (중증) 기관 플레어 또는 1 초과의 BILAG B (중등도) 기관 플레어 위험의 유의한 감소 중 하나 이상을 발생시키는 것인 방법.
- 인터페론 억제제를 투여하는 것을 포함하는, 치료를 필요로 하는 ISMlo 루푸스 환자의 치료를 위한 치료 요법.
- 제64항에 있어서, 환자가 SLE 또는 루푸스 신염을 갖는 것인 요법.
- 제64항 또는 제65항에 있어서, 인터페론 억제제가 항-IFNα 항체인 요법.
- 제66항에 있어서, 항체가 100-2000 mg의 균일 용량으로 투여되는 것인 요법.
- 제66항에 있어서, 항체가 100-500 mg 매주, 200-1000 mg 격주, 또는 400-2000 mg 매월의 균일 용량으로 투여되는 것인 요법.
- 제66항에 있어서, 항체가 150 mg 또는 300 mg 매주, 300 mg 또는 600 mg 격주, 또는 600 mg, 750 mg 또는 1200 mg 매월의 균일 용량으로 투여되는 것인 요법.
- 제66항 내지 제69항 중 어느 한 항에 있어서, 항체가 정맥내로 또는 피하로 투여되는 것인 요법.
- 제66항 내지 제70항 중 어느 한 항에 있어서, 항체가 아미노산 서열 RASQSVSTSSYSYMH (서열 1)를 포함하는 HVR-L1, 아미노산 서열 YASNLES (서열 2)를 포함하는 HVR-L2, 및 아미노산 서열 QHSWGIPRTF (서열 3)를 포함하는 HVR-L3을 포함하는 경쇄; 및/또는 아미노산 서열 GYTFTEYIIH (서열 4)를 포함하는 HVR-H1, 아미노산 서열 SINPDYDITNYNQRFKG (서열 5)를 포함하는 HVR-H2, 및 아미노산 서열 WISDFFDY (서열 6)를 포함하는 HVR-H3을 포함하는 중쇄를 포함하는 것인 요법.
- 제66항 내지 제70항 중 어느 한 항에 있어서, 항체가 서열 7의 아미노산 서열에 대해 적어도 95% 서열 동일성의 중쇄 가변 영역 서열; 및/또는 서열 8의 아미노산 서열에 대해 적어도 95% 서열 동일성의 경쇄 가변 영역 서열을 포함하는 것인 요법.
- 제66항 내지 제70항 중 어느 한 항에 있어서, 항체가 서열 7의 아미노산 서열을 포함하는 중쇄 가변 영역; 및 서열 8의 아미노산 서열을 포함하는 경쇄 가변 영역을 포함하는 것인 요법.
- 제66항 내지 제70항 중 어느 한 항에 있어서, 항체가 CAS 등록 번호 948570-30-7을 갖는 론탈리주맙인 요법.
- 루푸스 환자로부터의 샘플에서 IRG 상태를 결정하는 것을 포함하며, 여기서 ISMlo인 환자가 인터페론 억제제 치료로부터 이익을 얻을 수 있는 환자로 확인되는 것인, 인터페론 억제제 치료로부터 이익을 얻을 수 있는 루푸스 환자를 확인하는 방법.
- 루푸스 환자로부터의 샘플에서 IRG 상태를 결정하는 것 및 상기 환자의 IRG 상태에 대한 보고서를 제공하는 것을 포함하며, 여기서 보고서는 환자가 ISMlo 또는 ISMhi임을 나타내는 것인, 인터페론 억제제 치료로부터 이익을 얻을 수 있는 루푸스 환자를 확인하는 방법.
- 제76항에 있어서, 보고서가, 환자가 ISMlo인 경우에 환자가 인터페론 억제제 치료로부터 이익을 얻을 수 있음을 추가로 나타내는 것인 방법.
- 루푸스 환자로부터의 샘플에서 IRG 상태를 결정하는 것을 포함하며, 여기서 ISMlo인 환자가 인터페론 억제제 치료에 대해 반응할 가능성이 있는 환자로 확인되는 것인, 인터페론 억제제 치료에 대한 루푸스 환자의 반응성을 예측하는 방법.
- 제75항 내지 제78항 중 어느 한 항에 있어서, IRG 발현 수준이 건강한 사람의 동일한 IRG의 발현 수준의 평균 값의 1.4배 미만인 경우에 환자가 ISMlo인 것으로 간주되는 것인 방법.
- 제75항 내지 제78항 중 어느 한 항에 있어서, IRG 발현 수준이 건강한 사람의 동일한 IRG의 발현 수준의 평균 값에 비해 2 표준 편차 미만인 경우에 환자가 ISMlo인 것으로 간주되는 것인 방법.
- 루푸스 환자로부터의 샘플에서 IRG의 발현 수준을 결정하는 것 및 환자의 IRG 발현 수준을 건강한 사람(들)에서의 동일한 IRG의 발현 수준의 평균 값과 비교하는 것을 포함하며, 여기서 환자의 IRG 발현 수준이 (1) 건강한 사람의 동일한 IRG의 발현 수준의 평균 값의 1.4배 미만 또는 (2) 건강한 사람에서의 동일한 IRG의 발현 수준의 평균 값에 비해 2 표준 편차 미만인 경우에 환자가 인터페론 억제제 치료에 대해 반응할 가능성이 있는 환자로 확인되는 것인, 인터페론 억제제 치료에 대한 루푸스 환자의 반응성을 예측하는 방법.
- 제75항 내지 제81항 중 어느 한 항에 있어서, ISMlo 또는 IRG 발현 수준이 환자로부터의 샘플에서 하나 이상의 인터페론 반응 유전자 (IRG)의 mRNA 발현 수준을 측정함으로써 결정되는 것인 방법.
- 제82항에 있어서, 샘플에서 하나 이상의 IRG의 mRNA 발현 수준이 RT-PCR에 의해 측정되는 것인 방법.
- 제82항 또는 제83항에 있어서, 하나 이상의 IRG의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
- 제75항 내지 제84항 중 어느 한 항에 있어서, 샘플이 혈액 샘플인 방법.
- 제75항 내지 제85항 중 어느 한 항에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1, IFI27, SIGLEC1, DNAPTP6, USP18, IF16, HSXIAPAF1 및 LAMP3으로 이루어진 군으로부터 선택된 IRG 중 하나 이상의 mRNA 발현 수준이 결정되는 것인 방법.
- 제86항에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1, IFI27, SIGLEC1, DNAPTP6, USP18, IF16, HSXIAPAF1 및 LAMP3으로 이루어진 군으로부터 선택된 IRG 중 하나 이상의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
- 제75항 내지 제85항 중 어느 한 항에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP 및 ZBP1로 이루어진 군으로부터 선택된 IRG 중 하나 이상의 mRNA 발현 수준이 결정되는 것인 방법.
- 제88항에 있어서, CHMP5, CIG5, EPSTI1, G1P2, HERC5, IFI44, IFI44L, IFIT1, IFIT4, IFIT5, IRF7, MX1, OAS1, OAS2, OAS3, OASL, PARP9, RIG1, RIGE, SAMD9L, SP110, TYK1 (CMPK2), XIAP, ZBP1로 이루어진 군으로부터 선택된 IRG 중 하나 이상의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
- 제75항 내지 제85항 중 어느 한 항에 있어서, EPSTI1, HERC5 및/또는 TYK1 (CMPK2)의 mRNA 발현 수준이 결정되는 것인 방법.
- 제90항에 있어서, EPSTI1, HERC5 및/또는 TYK1 (CMPK2)의 mRNA 발현 수준이 트랜스페린 수용체 (TFRC)의 mRNA 발현 수준에 대해 정규화되는 것인 방법.
- 루푸스 환자로부터의 샘플에서 항-dsDNA 항체 상태를 결정하는 것을 포함하며, 여기서 면역검정에 의해 측정시에 200 IU 이하의 항-dsDNA 항체 역가를 갖는 환자가 인터페론 억제제 치료로부터 이익을 얻을 수 있는 환자로 확인되는 것인, 인터페론 억제제 치료로부터 이익을 얻을 수 있는 루푸스 환자를 확인하는 방법.
- 루푸스 환자로부터의 샘플에서 항-dsDNA 항체 상태를 결정하는 것 및 항-dsDNA 항체 역가가 면역검정에 의해 측정시에 200 IU 이하인 경우에 환자가 인터페론 억제제 치료로부터 이익을 얻을 수 있음을 나타내는 보고서를 제공하는 것을 포함하는, 인터페론 억제제 치료로부터 이익을 얻을 수 있는 루푸스 환자를 확인하는 방법.
- 루푸스 환자로부터의 샘플에서 항-dsDNA 항체 상태를 결정하는 것을 포함하며, 여기서 면역검정에 의해 측정시에 200 IU 이하의 항-dsDNA 항체 역가를 갖는 환자가 인터페론 억제제 치료에 대해 반응할 가능성이 있는 환자로 확인되는 것인, 인터페론 억제제 치료에 대한 루푸스 환자의 반응성을 예측하는 방법.
- 제92항 내지 제94항 중 어느 한 항에 있어서, 면역검정이 ELISA인 방법.
- 루푸스 환자의 IRG 상태를 결정하는 것을 포함하며, 여기서 IRG의 발현 수준의 유의한 증가는 환자가 이후 3 내지 5주 내에 플레어를 가질 가능성이 있음을 나타내는 것인, 루푸스 환자에서 플레어의 가능성을 예측하는 방법.
- 제96항에 있어서, 상기 IRG가 EPSTI1, HERC5, TYK1 (CMPK2), IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
- 제96항에 있어서, 플레어가 SELENA-SLEDAI 플레어 인덱스 (SFI) 및/또는 SFI-개정판에 의해 결정되는 것인 방법..
- 제96항에 있어서, 플레어가 SELENA-SLEDAI 플레어 인덱스 (SFI) 및/또는 SFI-개정판에 기초하여 경증, 중등도 또는 중증인 것인 방법.
- 제75항 내지 제95항 중 어느 한 항에 있어서, 인터페론 억제제가 항-인터페론 유형 I 항체인 방법.
- 제100항에 있어서, 항체가 인터페론 α, 인터페론 β, 인터페론 ω, 인터페론 λ 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합하는 것인 방법.
- 제100항에 있어서, 항체가 인터페론 α에 특이적으로 결합하는 것인 방법.
- 제100항에 있어서, 항체가 적어도 IFNα 하위유형 1, 2, 4, 5, 8, 10 및 21에 결합하는 것인 방법.
- 제102항에 있어서, 항체가 아미노산 서열 RASQSVSTSSYSYMH (서열 1)를 포함하는 HVR-L1, 아미노산 서열 YASNLES (서열 2)를 포함하는 HVR-L2, 및 아미노산 서열 QHSWGIPRTF (서열 3)를 포함하는 HVR-L3을 포함하는 경쇄; 및/또는 아미노산 서열 GYTFTEYIIH (서열 4)를 포함하는 HVR-H1, 아미노산 서열 SINPDYDITNYNQRFKG (서열 5)를 포함하는 HVR-H2, 및 아미노산 서열 WISDFFDY (서열 6)를 포함하는 HVR-H3을 포함하는 중쇄를 포함하는 것인 방법.
- 제102항에 있어서, 항체가 서열 7의 아미노산 서열에 대해 적어도 95% 서열 동일성의 중쇄 가변 영역 서열; 및/또는 서열 8의 아미노산 서열에 대해 적어도 95% 서열 동일성의 경쇄 가변 영역 서열을 포함하는 것인 방법.
- 제102항에 있어서, 항체가 서열 7의 아미노산 서열을 포함하는 중쇄 가변 영역; 및 서열 8의 아미노산 서열을 포함하는 경쇄 가변 영역을 포함하는 것인 방법.
- 제102항에 있어서, 항체가 CAS 등록 번호 948570-30-7을 갖는 론탈리주맙인 방법.
- 환자에게 항-인터페론 α 항체의 균일 용량을 전달하며, 여기서 균일 용량은 항-인터페론 α 항체의 50 mg 내지 2000 mg의 범위인, 피하 투여 장치를 포함하는 제조품.
- 제108항에 있어서, 균일 용량이 100-500 mg 매주, 200-1000 mg 격주, 또는 400-2000 mg 매월인 제조품.
- 제108항에 있어서, 균일 용량이 150 mg 또는 300 mg 매주, 300 mg 또는 600 mg 격주, 또는 600 mg, 750 mg 또는 1200 mg 매월인 제조품.
- 제108항에 있어서, 장치 내의 항체의 농도가 약 50 내지 250 mg/mL인 제조품.
- 항-인터페론 α 항체를 약 50 내지 250 mg/mL의 농도로 포함하는 제조품.
- 제108항 내지 제112항 중 어느 한 항에 있어서, 항체가 아미노산 서열 RASQSVSTSSYSYMH (서열 1)를 포함하는 HVR-L1, 아미노산 서열 YASNLES (서열 2)를 포함하는 HVR-L2, 및 아미노산 서열 QHSWGIPRTF (서열 3)를 포함하는 HVR-L3을 포함하는 경쇄; 및/또는 아미노산 서열 GYTFTEYIIH (서열 4)를 포함하는 HVR-H1, 아미노산 서열 SINPDYDITNYNQRFKG (서열 5)를 포함하는 HVR-H2, 및 아미노산 서열 WISDFFDY (서열 6)를 포함하는 HVR-H3을 포함하는 중쇄를 포함하는 것인 제조품.
- 제108항 내지 제112항 중 어느 한 항에 있어서, 항체가 서열 7의 아미노산 서열에 대해 적어도 95% 서열 동일성의 중쇄 가변 영역 서열; 및/또는 서열 8의 아미노산 서열에 대해 적어도 95% 서열 동일성의 경쇄 가변 영역 서열을 포함하는 것인 제조품.
- 제108항 내지 제112항 중 어느 한 항에 있어서, 항체가 서열 7의 아미노산 서열을 포함하는 중쇄 가변 영역; 및 서열 8의 아미노산 서열을 포함하는 경쇄 가변 영역을 포함하는 것인 제조품.
- 제108항 내지 제112항 중 어느 한 항에 있어서, 항체가 CAS 등록 번호 948570-30-7을 갖는 론탈리주맙인 제조품.
- 제108항에 있어서, 피하 투여 장치가 예비-충전 시린지, 자동주사기 또는 대용량 주입 장치인 제조품.
- 생물학적 샘플로부터 하나 이상의 IRG의 유전자 발현을 검출하기 위한 생물-검정 모듈 및 유전자의 발현을 계산하고 유전자의 계산을 컷오프 값에 대해 스코어링하여 진단을 제공하기 위한 프로세서 모듈을 포함하는 전산화 시스템을 포함하며, 여기서 컷오프 값은 (1) 건강한 사람의 IRG의 발현 수준의 값의 1.4배 미만 또는 (2) 건강한 사람에서의 IRG의 발현 수준의 중간 값에 비해 2 표준 편차 미만인 제조품.
- 제118항에 있어서, 생물-검정 모듈이 코바스(cobas) z480 분석기인 제조품.
- 자가면역 환자로부터 혈액 샘플을 수집하기 위한 바이알 및 자가면역 환자가 ISMlo인지 여부를 결정하기 위한 지침서를 포함하는, 인터페론 억제제 치료에 대해 이익을 얻을 수 있는 자가면역 환자를 확인하기 위한 키트.
- 제120항에 있어서, EPSTI1, HERC5, TYK1 (CMPK2), IFI27, IFI44, IFIT1, MX1, OAS1, OAS2 및 OAS3으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 이용하여 자가면역 환자가 ISMlo인지 여부를 결정하는 것인 키트.
- 제121항에 있어서, 자가면역 질환이 루푸스인 키트.
- 제120항에 있어서, 인터페론 억제제가 항-인터페론 α 항체인 키트.
- 약 50 내지 약 250 mg/mL 양의 항-인터페론 α 항체, 약 50 내지 약 200 mM 양의 아르기닌-HCl, 약 5 내지 약 100 mM 양의 히스티딘, 약 0.01 내지 약 0.1% 양의 폴리소르베이트를 포함하며, 약 5.5 내지 약 7.0의 pH를 갖는 안정한 액체 조성물.
- 루푸스로 진단된 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 포함하며, 여기서 환자는 ENA-인, 환자에서 루푸스를 치료하는 방법.
- 제125항에 있어서, 항체가 인터페론 α; 인터페론 β; 인터페론 ω; 인터페론 λ; 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합하는 것인 방법.
- 제125항에 있어서, 항체가 인터페론 α에 특이적으로 결합하는 것인 방법.
- 제127항에 있어서, 항체가 론탈리주맙인 방법.
- 제125항에 있어서, 환자의 ENA 상태가 환자로부터의 샘플에서 자가항체를 검출함으로써 결정되며, 여기서 자가항체가 항-Ro, 항-La, 항-SM, 항-RNP 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
- 제129항에 있어서, 샘플이 전혈, 혈액-유래 세포, 혈장, 혈청 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
- 제125항에 있어서, 항체가 정맥내로 투여되는 것인 방법.
- 제125항에 있어서, 루푸스가 전신 홍반성 루푸스인 방법.
- 제125항에 있어서, 환자가 건강한 개체의 인터페론 시그너쳐 측정값 (ISM)과 동일한 기준선 ISM을 갖는 것인 방법.
- 제125항에 있어서, 환자가 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는 것인 방법.
- 제133항 또는 제134항에 있어서, ISM이 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정되는 것인 방법.
- 제133항 또는 제134항에 있어서, ISM이 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정되는 것인 방법.
- 제125항에 있어서, 대상체에게 제2 의약을 투여하는 것을 추가로 포함하는 방법.
- 제137항에 있어서, 제2 의약이 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
- 루푸스 환자의 ENA 상태를 결정하는 것을 포함하며, 여기서 ENA-의 ENA 상태를 갖는 것으로 결정된 환자가 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 수 있는 환자로 확인되는 것인, 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 수 있는 루푸스 환자를 확인하는 방법.
- 루푸스 환자의 ENA 상태를 결정하는 것을 포함하며, 여기서 ENA-의 ENA 상태를 갖는 것으로 결정된 환자는 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 증가된 가능성을 갖는 것인, 루푸스의 치료에 대한 치료 효능을 최적화하는 방법.
- 루푸스 환자의 ENA 상태를 결정하는 것을 포함하며, 여기서 ENA-의 ENA 상태를 갖는 것으로 결정된 환자가 인터페론 유형 I 항체로의 치료에 반응할 가능성이 있는 환자로 확인되는 것인, 인터페론 유형 I 항체로의 치료에 대한 루푸스 환자의 반응성을 예측하는 방법.
- 루푸스 환자의 ENA 상태를 결정하는 것을 포함하며, 여기서 ENA-의 ENA 상태를 갖는 것으로 결정된 환자가 인터페론 유형 I 항체로의 치료에 반응할 가능성이 있는 환자로 확인되는 것인, 루푸스 환자가 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 가능성을 결정하는 방법.
- 제139항 내지 제142항 중 어느 한 항에 있어서, ENA 상태가 환자로부터의 샘플에서 자가항체를 검출함으로써 결정되며, 여기서 자가항체가 항-Ro, 항-La, 항-SM, 항-RNP 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
- 제139항 내지 제142항 중 어느 한 항에 있어서, 샘플이 전혈, 혈액-유래 세포, 혈장, 혈청 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
- 제139항 내지 제142항 중 어느 한 항에 있어서, 루푸스가 전신 홍반성 루푸스인 방법.
- 제139항 내지 제142항 중 어느 한 항에 있어서, 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 추가로 포함하는 방법.
- 제146항에 있어서, 항체가 정맥내로 투여되는 것인 방법.
- 제146항에 있어서, 항체가 인터페론 α에 특이적으로 결합하는 것인 방법.
- 제148항에 있어서, 항체가 론탈리주맙인 방법.
- 제146항에 있어서, 항체가 적어도 24주 동안 투여되는 것인 방법.
- 제139항 내지 제142항 중 어느 한 항에 있어서, 환자가 건강한 개체의 인터페론 시그너쳐 측정값 (ISM)과 동일한 기준선 ISM을 갖는 것인 방법.
- 제139항 내지 제142항 중 어느 한 항에 있어서, 환자가 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는 것인 방법.
- 제151항 또는 제152항에 있어서, ISM이 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정되는 것인 방법.
- 제151항 또는 제152항에 있어서, ISM이 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정되는 것인 방법.
- 제146항에 있어서, 대상체에게 제2 의약을 투여하는 것을 추가로 포함하는 방법.
- 제155항에 있어서, 제2 의약이 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
- 루푸스로 진단된 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 포함하며, 여기서 환자는 건강한 개체의 인터페론 시그너쳐 측정값 (ISM)과 동일한 기준선 ISM을 갖는 것인, 환자에서 루푸스를 치료하는 방법.
- 루푸스로 진단된 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 포함하며, 여기서 환자는 항체의 투여 후에 환자의 기준선 ISM에 비해 보다 낮은 ISM을 갖는 것인, 환자에서 루푸스를 치료하는 방법.
- 제157항 또는 제158항에 있어서, 항체가 인터페론 α; 인터페론 β; 인터페론 ω; 인터페론 λ; 및 그의 조합으로 이루어진 군으로부터 선택된 인터페론에 특이적으로 결합하는 것인 방법.
- 제157항 또는 제158항에 있어서, 항체가 인터페론 α에 특이적으로 결합하는 것인 방법.
- 제160항에 있어서, 항체가 론탈리주맙인 방법.
- 제157항 또는 제158항에 있어서, ISM이 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정되는 것인 방법.
- 제157항 또는 제158항에 있어서, ISM이 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정되는 것인 방법.
- 제157항 또는 제158항에 있어서, 항체가 정맥내로 투여되는 것인 방법.
- 제157항 또는 제158항에 있어서, 루푸스가 전신 홍반성 루푸스인 방법.
- 제157항 또는 제158항에 있어서, 대상체에게 제2 의약을 투여하는 것을 추가로 포함하는 방법.
- 제166항에 있어서, 제2 의약이 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제, 스타틴 및 그의 조합으로 이루어진 군으로부터 선택되는 것인 방법.
- 루푸스 환자의 기준선 ISM 상태를 결정하는 것을 포함하며, 여기서 건강한 개체의 ISM과 동일한 기준선 ISM을 갖는 환자가 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 수 있는 환자로 확인되는 것인, 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 수 있는 루푸스 환자를 확인하는 방법.
- 환자의 기준선 ISM 상태를 결정하는 것을 포함하며, 여기서 건강한 개체의 ISM과 동일한 기준선 ISM을 갖는 환자는 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 증가된 가능성을 갖는 것인, 루푸스의 치료에 대한 치료 효능을 최적화하는 방법.
- 루푸스 환자의 ISM 상태를 결정하는 것을 포함하며, 여기서 건강한 개체의 ISM과 동일한 ISM을 갖는 환자가 인터페론 유형 I 항체로의 치료에 반응할 가능성이 있는 환자로 확인되는 것인, 인터페론 유형 I 항체로의 치료에 대한 루푸스 환자의 반응성을 예측하는 방법.
- 루푸스 환자의 ISM 상태를 결정하는 것을 포함하며, 여기서 건강한 개체의 ISM과 동일한 ISM을 갖는 환자가 인터페론 유형 I 항체로의 치료에 반응할 가능성이 있는 환자로 확인되는 것인, 루푸스 환자가 인터페론 유형 I 항체로의 치료로부터 이익을 얻을 가능성을 결정하는 방법.
- 제168항 내지 제171항 중 어느 한 항에 있어서, 루푸스가 전신 홍반성 루푸스인 방법.
- 제168항 내지 제171항 중 어느 한 항에 있어서, 환자에게 유효량의 인터페론 유형 I 항체를 투여하는 것을 추가로 포함하는 방법.
- 제173항에 있어서, 항체가 정맥내로 투여되는 것인 방법.
- 제173항에 있어서, 항체가 인터페론-α에 특이적으로 결합하는 것인 방법.
- 제175항에 있어서, 항체가 론탈리주맙인 방법.
- 제173항에 있어서, 항체가 적어도 24주 동안 투여되는 것인 방법.
- 제168항 내지 제171항 중 어느 한 항에 있어서, 환자가 항체의 투여 후에 기준선 ISM에 비해 보다 낮은 ISM을 갖는 것인 방법.
- 제168항 내지 제171항 중 어느 한 항에 있어서, ISM이 CMPK2, EPST1, HERC5 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정되는 것인 방법.
- 제168항 내지 제171항 중 어느 한 항에 있어서, ISM이 IFI27, IFI44, IFIT1, MX1, OAS1, OAS2, OAS3 및 그의 조합으로 이루어진 군으로부터 선택된 적어도 하나의 유전자의 발현 수준을 측정함으로써 결정되는 것인 방법.
- 제173항에 있어서, 대상체에게 제2 의약을 투여하는 것을 추가로 포함하는 방법.
- 제181항에 있어서, 제2 의약이 코르티코스테로이드, 비-스테로이드성 항염증 약물 (NSAID), 항말라리아제로 이루어진 군으로부터 선택되는 것인 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161479314P | 2011-04-26 | 2011-04-26 | |
| US61/479,314 | 2011-04-26 | ||
| US201161582179P | 2011-12-30 | 2011-12-30 | |
| US61/582,179 | 2011-12-30 | ||
| PCT/US2012/035313 WO2012149228A1 (en) | 2011-04-26 | 2012-04-26 | Compositions and method for treating autoimmune diseases |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140048877A true KR20140048877A (ko) | 2014-04-24 |
Family
ID=47072761
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137031178A KR20140048877A (ko) | 2011-04-26 | 2012-04-26 | 자가면역 질환의 치료를 위한 조성물 및 방법 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US20140056889A1 (ko) |
| EP (1) | EP2701742A4 (ko) |
| JP (1) | JP6211513B2 (ko) |
| KR (1) | KR20140048877A (ko) |
| AR (1) | AR086074A1 (ko) |
| AU (1) | AU2012249601A1 (ko) |
| CA (1) | CA2834203A1 (ko) |
| WO (1) | WO2012149228A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20170106476A (ko) * | 2015-01-30 | 2017-09-20 | 유씨비 바이오파마 에스피알엘 | Cd154 항체를 이용한 자가면역 질환의 치료 |
Families Citing this family (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101473045B (zh) | 2006-04-24 | 2016-08-03 | 健泰科生物技术公司 | 用于检测自身免疫性病症的方法和组合物 |
| KR20140043402A (ko) * | 2011-05-25 | 2014-04-09 | 메디뮨 엘엘씨 | 인터페론-알파에 대한 항체를 사용하여 전신홍반루푸스, 피부경화증 및 근육염을 치료하는 방법 |
| WO2013101771A2 (en) * | 2011-12-30 | 2013-07-04 | Genentech, Inc. | Compositions and method for treating autoimmune diseases |
| EP2844295A1 (en) | 2012-05-03 | 2015-03-11 | Kala Pharmaceuticals, Inc. | Pharmaceutical nanoparticles showing improved mucosal transport |
| US11596599B2 (en) | 2012-05-03 | 2023-03-07 | The Johns Hopkins University | Compositions and methods for ophthalmic and/or other applications |
| AU2013256064B2 (en) | 2012-05-03 | 2018-01-04 | Alcon Inc. | Pharmaceutical nanoparticles showing improved mucosal transport |
| US9827191B2 (en) | 2012-05-03 | 2017-11-28 | The Johns Hopkins University | Compositions and methods for ophthalmic and/or other applications |
| CA2900652C (en) | 2013-02-15 | 2021-05-04 | Kala Pharmaceuticals, Inc. | Therapeutic compounds and uses thereof |
| US9688688B2 (en) | 2013-02-20 | 2017-06-27 | Kala Pharmaceuticals, Inc. | Crystalline forms of 4-((4-((4-fluoro-2-methyl-1H-indol-5-yl)oxy)-6-methoxyquinazolin-7-yl)oxy)-1-(2-oxa-7-azaspiro[3.5]nonan-7-yl)butan-1-one and uses thereof |
| WO2014130612A1 (en) | 2013-02-20 | 2014-08-28 | Kala Pharmaceuticals, Inc. | Therapeutic compounds and uses thereof |
| US9890173B2 (en) | 2013-11-01 | 2018-02-13 | Kala Pharmaceuticals, Inc. | Crystalline forms of therapeutic compounds and uses thereof |
| MX355330B (es) | 2013-11-01 | 2018-04-16 | Kala Pharmaceuticals Inc | Formas cristalinas de compuestos terapeuticos y sus usos. |
| KR20240017421A (ko) | 2016-03-10 | 2024-02-07 | 비엘라 바이오, 인크. | Ilt7 결합 분자 및 이의 사용 방법 |
| EP3509422A4 (en) | 2016-09-08 | 2020-05-20 | Kala Pharmaceuticals, Inc. | CRYSTALLINE FORMS OF THERAPEUTIC COMPOUNDS AND USES THEREOF |
| EP3509423A4 (en) | 2016-09-08 | 2020-05-13 | Kala Pharmaceuticals, Inc. | CRYSTALLINE FORMS OF THERAPEUTIC COMPOUNDS AND USES THEREOF |
| CN109688818A (zh) | 2016-09-08 | 2019-04-26 | 卡拉制药公司 | 治疗化合物的晶型及其用途 |
| WO2018136625A2 (en) * | 2017-01-20 | 2018-07-26 | Children's Medical Center Corporation | Compositions and methods for treating diseases characterized by reactive microglia mediated synapse loss |
| US11769592B1 (en) | 2018-10-07 | 2023-09-26 | Cerner Innovation, Inc. | Classifier apparatus with decision support tool |
| US11749404B1 (en) * | 2018-10-08 | 2023-09-05 | Cerner Innovation, Inc. | Decision support tool for venous thromboembolism (VTE) |
| EA202191133A1 (ru) * | 2018-10-26 | 2021-07-12 | Янссен Байотек, Инк. | Сигнатуры интерферона типа i и способы их применения |
| KR102308865B1 (ko) * | 2019-02-08 | 2021-10-05 | 서울대학교산학협력단 | 전신 홍반 루푸스 산모의 임신 위험도를 평가하는 방법 |
| JP7494416B2 (ja) * | 2019-10-31 | 2024-06-04 | 義知 本田 | 血管老化予測方法、疾患リスク予測方法、血管老化予測用バイオマーカー、疾患用バイオマーカー、測定キット、及び、診断装置 |
| JP2023505203A (ja) * | 2019-12-06 | 2023-02-08 | ビエラ バイオ インコーポレイテッド | Ilt7結合タンパク質を使用した治療方法 |
| CN114836534A (zh) * | 2021-06-08 | 2022-08-02 | 中国医学科学院北京协和医院 | Samd9l基因突变作为i型干扰素病诊断的标志物及其应用 |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3773919A (en) | 1969-10-23 | 1973-11-20 | Du Pont | Polylactide-drug mixtures |
| US7087726B2 (en) * | 2001-02-22 | 2006-08-08 | Genentech, Inc. | Anti-interferon-α antibodies |
| MX2007009466A (es) * | 2005-02-10 | 2007-12-07 | Baylor Res Inst | Anticuerpos monoclonales de anti-interferon alfa y metodos para su uso. |
| US9168286B2 (en) * | 2005-10-13 | 2015-10-27 | Human Genome Sciences, Inc. | Methods and compositions for use in treatment of patients with autoantibody positive disease |
| CN101473045B (zh) * | 2006-04-24 | 2016-08-03 | 健泰科生物技术公司 | 用于检测自身免疫性病症的方法和组合物 |
| EP2073844A4 (en) * | 2006-12-06 | 2011-06-01 | Medimmune Llc | METHOD FOR TREATING SYSTEMIC LUPUS ERYTHEMATODES |
| EP2068924A4 (en) * | 2007-05-03 | 2011-07-20 | Medimmune Llc | INTERFERON ALPHA INDUCED PHARMACODYNAMIC MARKERS |
| KR20110128333A (ko) * | 2009-03-06 | 2011-11-29 | 제넨테크, 인크. | 항체 제제 |
| MX2012002640A (es) * | 2009-09-03 | 2012-06-25 | Medimmune Llc | Diagnostico de interferon tipo 1. |
| WO2013101771A2 (en) * | 2011-12-30 | 2013-07-04 | Genentech, Inc. | Compositions and method for treating autoimmune diseases |
-
2012
- 2012-04-26 CA CA2834203A patent/CA2834203A1/en not_active Abandoned
- 2012-04-26 JP JP2014508569A patent/JP6211513B2/ja not_active Expired - Fee Related
- 2012-04-26 AU AU2012249601A patent/AU2012249601A1/en not_active Abandoned
- 2012-04-26 WO PCT/US2012/035313 patent/WO2012149228A1/en active Application Filing
- 2012-04-26 KR KR1020137031178A patent/KR20140048877A/ko not_active Application Discontinuation
- 2012-04-26 AR ARP120101446A patent/AR086074A1/es unknown
- 2012-04-26 EP EP12777107.9A patent/EP2701742A4/en not_active Withdrawn
- 2012-04-26 US US14/113,575 patent/US20140056889A1/en not_active Abandoned
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20170106476A (ko) * | 2015-01-30 | 2017-09-20 | 유씨비 바이오파마 에스피알엘 | Cd154 항체를 이용한 자가면역 질환의 치료 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2834203A1 (en) | 2012-11-01 |
| EP2701742A1 (en) | 2014-03-05 |
| WO2012149228A1 (en) | 2012-11-01 |
| JP6211513B2 (ja) | 2017-10-11 |
| AR086074A1 (es) | 2013-11-13 |
| JP2014519487A (ja) | 2014-08-14 |
| EP2701742A4 (en) | 2015-03-18 |
| US20140056889A1 (en) | 2014-02-27 |
| AU2012249601A1 (en) | 2013-05-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6211513B2 (ja) | 自己免疫疾患の治療のための組成物及び方法 | |
| US20210207219A1 (en) | Compositions and Method for Treating Complement-Associated Conditions | |
| ES2526616T3 (es) | Método para el tratamiento de lesión articular | |
| KR102148063B1 (ko) | 베타7 인테그린 길항제를 투여하는 방법 | |
| JP2018064566A6 (ja) | 補体関連病態を治療するための組成物及び方法 | |
| KR20070122543A (ko) | 항-cd20 항체에 의한 염증성 장 질환 (ibd)의 치료방법 | |
| MX2007000748A (es) | Metodos para tratar el sindrome de sjogren. | |
| KR20070100228A (ko) | 혈관염의 치료 방법 | |
| CN104159919A (zh) | 使用抗干扰素γ抗体的治疗方法 | |
| EP2714080A1 (en) | Methods of treating systemic lupus erythematosus, scleroderma, and myositis with an antibody against interferon-alpha | |
| WO2013101771A2 (en) | Compositions and method for treating autoimmune diseases | |
| AU2013204880B2 (en) | Compositions and method for treating autoimmune diseases | |
| US20200405851A1 (en) | Method of diagnosis and treatment of rheumatoid arthritis | |
| US20200179486A1 (en) | Method of treating pediatric disorders | |
| JP2018521661A (ja) | 炎症性腸疾患の診断及び治療方法 | |
| IL311911A (en) | Methods and preparations for soil regeneration and improving soil hydrology | |
| AU2012258819A1 (en) | Methods of treating systemic lupus erythematosus, scleroderma, and myositis with an antibody against interferon-alpha | |
| MX2007003857A (en) | Method for treating vasculitis |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |