KR20140032424A - 개인화된 요법 관리를 위한 질환 활성 프로파일링 방법 - Google Patents
개인화된 요법 관리를 위한 질환 활성 프로파일링 방법 Download PDFInfo
- Publication number
- KR20140032424A KR20140032424A KR1020137032638A KR20137032638A KR20140032424A KR 20140032424 A KR20140032424 A KR 20140032424A KR 1020137032638 A KR1020137032638 A KR 1020137032638A KR 20137032638 A KR20137032638 A KR 20137032638A KR 20140032424 A KR20140032424 A KR 20140032424A
- Authority
- KR
- South Korea
- Prior art keywords
- therapy
- mucosal healing
- markers
- ati
- tnf
- Prior art date
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/563—Immunoassay; Biospecific binding assay; Materials therefor involving antibody fragments
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/564—Immunoassay; Biospecific binding assay; Materials therefor for pre-existing immune complex or autoimmune disease, i.e. systemic lupus erythematosus, rheumatoid arthritis, multiple sclerosis, rheumatoid factors or complement components C1-C9
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6893—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids related to diseases not provided for elsewhere
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/106—Pharmacogenomics, i.e. genetic variability in individual responses to drugs and drug metabolism
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/156—Polymorphic or mutational markers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/06—Gastro-intestinal diseases
- G01N2800/065—Bowel diseases, e.g. Crohn, ulcerative colitis, IBS
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A90/00—Technologies having an indirect contribution to adaptation to climate change
- Y02A90/10—Information and communication technologies [ICT] supporting adaptation to climate change, e.g. for weather forecasting or climate simulation
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Biomedical Technology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Analytical Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Microbiology (AREA)
- Pathology (AREA)
- Biotechnology (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Food Science & Technology (AREA)
- Cell Biology (AREA)
- General Physics & Mathematics (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Genetics & Genomics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Biophysics (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Pharmacology & Pharmacy (AREA)
- Mycology (AREA)
- Endocrinology (AREA)
- Rehabilitation Therapy (AREA)
- Rheumatology (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Abstract
본 발명은 요법의 최적화 및/또는 치료 효능의 모니터링을 위한 질환의 개인화된 치료적 관리 방법을 제공한다. 특히, 본 발명은 요법 선별, 요법 최적화, 독성 감소, 및/또는 치료적 처리의 효능의 모니터링을 위해 치료제를 이용하는 요법의 과정 동안 복수의 시점에서 하나 또는 복수의 바이오마커의 어레이를 측정하여 점막 치유 지수를 결정하는 것을 포함한다. 특정 경우에, 치료제는 TNFα-매개 질환 또는 장애의 치료를 위한 TNFα 저해인자이다.
Description
관련 출원에 대한 교차 참조
본 출원은 2011 년 5 월 10 일에 제출된 미국 가 특허 출원 번호 61/484,607, 2011 년 7 월 6 일에 제출된 미국 가 특허 출원 번호 61/505,026, 2011 년 10 월 31 일에 제출된 미국 가 출원 번호 61/553,909, 2011 년 12 월 2 일에 출원된 미국 가 출원 번호 61/566,509, 및 2012 년 4 월 20 일에 제출된 미국 가 출원 번호 61/636,575 에 대한 우선권을 주장하며, 이들의 공개물은 전문이 모든 목적을 위해 본원에 참조로 포함된다.
발명의 배경
크론병 (Crohn's Disease: CD) 및 궤양성 대장염 (Ulverative Colitis: UC) 을 포함하는 염증성 장 질환 (Inflammatory Bowel Disease: IBD) 은 위장관에서 발생하는 만성 특발성 염증 장애이다. CD 및 UC 의 질환 진행은 장 염증 및 궤양화의 반복적 발생을 포함하여, 입원, 수술 및 요법의 단계적 확대를 요구하는 합병증을 초래한다 (Peyrin-Biroulet 등, Am. J. Gastroenterol,. 105: 289-297 (2010); Langholz E., Dan. Med. Bull., 46: 400-415 (1999)). 현재의 치료제 예컨대 항-종양 괴사 인자-알파 (TNF-α) 생물제제 (예를 들어, 인플릭시맙 (IFX), 에타네르셉트, 아달리무맙 (ADL) 및 세르톨리주맙 페골), 티오퓨린 약물 (예를 들어, 아자티오프린 (AZA), 6-메르캅토퓨린 (6-MP)), 항-염증 약물 (예를 들어, 메살라진), 및 스테로이드 (예를 들어, 코르티코스테로이드) 는 질환 활성을 감소시키는 것으로 밝혀졌다. CD 의 일부 임상 시험에서, 코르티코스테로이드, IFX 및 ADL 의 조합 요법 중인 환자에서 장 궤양의 부재로서 기술되는 점막 치유가 유도되었다. 게다가, IFX 을 받고 있는 환자에서 점막 치유 (Mucosal Healing: MH) 가 유지되었다.
다른 연구들은 점막 치유가 장 염증의 억제의 특징이고 장기 (long-term) 질환 차도를 예측할 수 있음을 밝혔다 (Froslie 등, Gastroenterology, 133: 412-422 (2007); Baert 등, Gastroenterology, (2010)). 장기 점막 치유는 UC 환자에서 결장절제술 및 결장직장암 위험의 감소, CD 환자에서 코르티코스테로이드 처리에 대한 필요의 감소, 및 아마도 입원에 대한 필요의 감소와 연관지어졌다 (Dave 등, Gastroenterology & Hepatology, 8(1): 29-38 (2012)).
국제적 염증성 장 질환의 연구 조직 (International Organization for the Study of Inflammatory Bowel Disease) 은 UC 에서의 점막 치유를 소화관 점막의 모든 시각화된 부분 중 파쇄성, 혈액, 짓무름 및 궤양의 부재로서 정의할 것을 제안했다 (D'Haens et al,. Gastroenterology, 132: 763-786 (2007)). CD 에서의 점막 치유 (MH) 는 궤양의 부재라고 제안되었다. 크론병 활성의 측정에 대한 황금 표준은 중증도의 크론병 내시경 지수 (Crohn's Disease Endoscopic Index of Severity: CDEIS) 이다. 이러한 질환 지수 점수는 여러 변수 예컨대 표재 및 심부 궤양화, 궤양화 및 비궤양화 협착증, 및 궤양화된 질환 부분의 표면적으로부터 확립된다. 단순화된 버전의 지수는 궤양 크기, 궤양화된 표면, 영향받은 표면 및 협착의 존재를 포함하는 질환 변수를 고려하는 크론병에 대한 단순 내시경 점수 (Simple Endoscopic Score for Crohn's Disease) 이다. 두 가지 지수 모두 CD 의 임상 징후를 평가하지만, 질환의 근본 원인 (예를 들어, 염증) 또는 질환의 해소 (예를 들어, 점막 치유) 를 측정하는데 실패했다. 점막 치유의 측정을 사용하여 질환 유도 뿐만 아니라 질환 진행 및 해소를 평가할 수 있다.
점막 치유 과정은 출혈 (예를 들어, 혈관 내피 층의 붕괴) 및 염증으로 시작된 후, 세포 및 조직 증식, 및 마지막으로 조직 재형성로 진행된다. 염증 시기에서, 염증 마커 및 항-염증 마커, 예컨대, 이에 제한되는 것은 아니나, IL-1, IL-2, IL-6, IL-14, IL-17, TGFβ, 및 TNFα 가 발현된다. 재형성 동안, 조직 복구 및 재형성 성장 인자, 예컨대, 이에 제한되는 것은 아니나, AREG, EREG, HB-EGF, HGF, NRG1-4, BTC, EGF, IGF, TGF-α, VEGFs, FGFs, 및 TWEAK 가 발현된다. 장 상피의 복구는 세포 생존, 증식, 및 이주에 필수적인 다중 신호 전달 경로를 요구한다. 우리는 질환 악화 위험 및 질환 차도를 예측하는 신규한 점막 치유 마커를 식별했다. 점막 치유의 측정을 사용하여 요법 양생법을 받고 있는 환자의 질환 상태를 주기적으로 평가할 수 있다.
점막 치유는 전형적으로 내시경검사로 평가된다. 침습적 절차는 저위험으로 여겨지지만, 그것의 비용 및 환자 불편 및 수용은 여전히 점막 치유 평가를 위한 빈번한 정기적 내시경검사에 장애가 된다. 환자의 점막 치유를 비-침습적으로 확인하는 방법에 대한 기술적 필요가 충족되지 않았다.
요법 최적화 및 효능 모니터링을 위해 개별화된 접근법을 사용하는 자가면역 장애와 같은 질환의 치료적 관리 방법에 대한 기술적 필요가 존재한다. 그 방법은 질환 과정 및 임상 파라미터 예컨대 약물동태학, 질환 활성 지수, 질환 부담, 및 점막 상태의 평가를 포함해야 한다. 본 발명은 이러한 필요를 충족시키고, 관련 이점도 제공한다.
본 발명은 요법 최적화 및/또는 치료 효능 모니터링을 위한 질환의 개인화된 치료적 관리 방법을 제공한다. 특히, 본 발명은 치료제를 이용하는 요법의 과정 동안 하나 또는 복수의 시점에서 하나 또는 복수의 점막 치유 바이오마커의 어레이를 측정하여, 요법 선별, 요법 최적화, 독성 감소, 및/또는 치료적 처리의 효능 모니터링을 위한 점막 치유 지수를 결정하는 것을 포함한다. 일부 구현예에서, 요법은 항-TNF 요법, 면역억제제, 코르티코스테로이드, 상이한 메카니즘을 표적화하는 약물, 영양 요법 및 그들의 조합이다. 특정 경우에, 항-TNF 요법은 TNFα-매개 질환 또는 장애의 치료를 위한 TNF 저해인자 (예를 들어, 항-TNF 약물, 항-TNFα 항체) 이다.
TNFα 는 염증성 질환, 자가면역 질환, 바이러스, 박테리아 및 기생충 감염, 악성종양, 및/또는 신경병성 질환에 연루되는 것으로 밝혀졌고, 류머티스성 관절염 및 크론병과 같은 질환의 특이적 생물학적 요법의 유용한 표적이다. TNF 저해인자 예컨대 항-TNFα 항체는 치료제의 중요한 부류이다. 일부 구현예에서, 본 발명의 방법은 유리하게는 요법 최적화 및/또는 항-TNF 약물 예컨대 항-TNFα 치료 항체에 대한 치료 효능의 모니터링에 의해 TNFα-매개 질환 또는 장애를 갖는 환자의 치료적 관리를 개선한다.
그와 같이, 하나의 양상에서, 본 발명은 요법 양생법을 받고 있는 염증성 장 질환 (IBD) 으로 진단된 개체에서의 점막 치유의 비-침습적 측정 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 개체로부터의 샘플 중 점막 치유 마커의 어레이의 수준을 측정하는 단계;
(b) 개체 중 점막 치유 마커의 어레이의 수준을 대조군의 그것과 비교하여 개체의 점막 치유 지수를 산출하는 단계로서, 점막 치유 지수가 점막 치유의 규모의 표시를 포함하는 단계; 및
(c) 점막 치유를 겪고 있는 개체가 요법 양생법을 유지해야 하는지 여부를 결정하는 단계.
그와 같이, 하나의 양상에서, 본 발명은 요법을 받고 있는 IBD 를 갖는 개체에서의 치료적 효율의 모니터링 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 치료 항체를 이용하는 요법의 과정 동안 복수의 시점에서 개체로부터의 샘플 중 점막 치유 마커의 어레이의 수준을 측정하는 단계;
(b) 단계 (a) 에서 측정된 하나 이상의 마커의 수준에 통계적 알고리즘을 적용하여 점막 치유 지수를 생성하는 단계;
(c) 개체의 점막 치유 지수를 대조군의 그것과 비교하는 단계; 및
(d) 요법이 개체가 점막 치유를 촉진하기에 적당한지 여부를 결정하는 단계.
또다른 양상에서, 본 발명은 IBD 를 갖는 개체에서의 요법 양생법의 선별 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 요법의 과정 동안 복수의 시점에서 개체로부터의 샘플 중 점막 치유 마커의 어레이의 수준을 측정하는 단계로서, 개체가 치료 항체를 받고 있는 단계;
(b) 단계 (a) 에서 측정된 하나 이상의 마커의 수준에 통계적 알고리즘을 적용하여 점막 치유 지수를 생성하는 단계;
(c) 개체의 점막 치유 지수를 대조군의 그것과 비교하는 단계; 및
(d) 개체를 위한 적당한 요법 양생법을 선별하는 단계로서, 요법 양생법이 점막 치유를 촉진하는 단계.
그와 같이, 또다른 양상에서, 본 발명은 요법 양생법이 투여되고 있는 IBD 로 진단된 개체에서의 수술 위험의 감소 또는 최소화 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 치료 항체를 이용하는 요법의 과정 동안 복수의 시점에서 점막 치유 마커의 어레이를 측정하는 단계;
(b) 시간의 흐름에 따른 각각의 마커의 존재 및/또는 농도 수준의 표시를 포함하는 개체의 점막 치유 지수를 생성하는 단계;
(c) 개체의 점막 치유 지수를 대조군의 그것과 비교하는 단계; 및
(d) 수술 위험을 감소 또는 최소화하는 적당한 요법 양생법을 선별하는 단계.
그와 같이, 또다른 양상에서, 본 발명은 IBD 로 진단된 개체에서 점막 치유를 촉진하기 위한 요법 양생법의 선별 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 시점 t0 에서 점막 치유 마커의 패널의 수준을 측정하여 t0 에서의 점막 치유 지수를 생성하는 단계;
(b) 시점 t1 에서 점막 치유 마커의 패널의 수준을 측정하여 t1 에서의 점막 치유 지수를 생성하는 단계;
(c) t0 으로부터 t1 까지의 점막 치유 지수의 변화를 비교하는 단계; 및
(d) 개체를 위한 점막 치유를 촉진하는 요법 양생법을 선별하는 단계.
그와 같이, 하나의 양상에서, 본 발명은 항-TNF 요법 양생법을 받고 있는 크론병으로 진단된 개체에서의 점막 치유의 비-침습적 측정 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 개체로부터의 샘플 중 점막 치유 마커의 어레이의 수준을 측정하는 단계;
(b) 개체 중 점막 치유 마커의 어레이의 수준을 대조군의 그것과 비교하여 개체의 점막 치유 지수를 산출하는 단계로서, 점막 치유 지수가 점막 치유의 규모의 표시를 포함하는 단계; 및
(c) 점막 치유를 겪고 있는 개체가 항-TNF 요법 양생법을 유지해야 하는지 여부를 결정하는 단계.
그와 같이, 또다른 양상에서, 본 발명은 항-TNF 요법을 받고 있는 크론병을 갖는 개체에서의 치료적 효율의 모니터링 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 치료 항체를 이용하는 요법의 과정 동안 복수의 시점에서 개체로부터의 샘플 중 점막 치유 마커의 어레이의 수준을 측정하는 단계;
(b) 단계 (a) 에서 측정된 하나 이상의 마커의 수준에 통계적 알고리즘을 적용하여 점막 치유 지수를 생성하는 단계;
(c) 개체의 점막 치유 지수를 대조군의 그것과 비교하는 단계; 및
(d) 항-TNF 요법이 개체가 점막 치유를 촉진하기에 적당한지 여부를 확인하는 단계.
그와 같이, 또다른 양상에서, 본 발명은 크론병을 갖는 개체에서의 항-TNF 요법 양생법의 선별 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 요법의 과정 동안 복수의 시점에서 개체로부터의 샘플 중 점막 치유 마커의 어레이의 수준을 측정하는 단계로서, 개체가 치료 항체를 받고 있는 단계;
(b) 단계 (a) 에서 측정된 하나 이상의 마커의 수준에 통계적 알고리즘을 적용하여 점막 치유 지수를 생성하는 단계;
(c) 개체의 점막 치유 지수를 대조군의 그것과 비교하는 단계; 및
(d) 개체를 위한 적당한 항-TNF 요법 양생법을 선별하는 단계로서, 항-TNF 요법은 점막 치유를 촉진하는 단계.
그와 같이, 또다른 양상에서, 본 발명은 항-TNF 항체 요법 양생법이 투여되고 있는 크론병으로 진단된 개체에서의 수술 위험의 감소 또는 최소화 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 치료 항체를 이용하는 요법의 과정 동안 복수의 시점에서 점막 치유 마커의 어레이를 측정하는 단계;
(b) 시간의 흐름에 따른 각각의 마커의 존재 및/또는 농도 수준의 표시를 포함하는 개체의 점막 치유 지수를 생성하는 단계;
(c) 개체의 점막 치유 지수를 대조군의 그것과 비교하는 단계; 및
(d) 개체를 위한 수술 위험을 감소 또는 최소화하는 적당한 항-TNF 항체 요법 양생법을 선별하는 단계.
그와 같이, 또다른 양상에서, 본 발명은 크론병으로 진단된 개체에서의 점막 치유를 촉진하기 위한 항-TNF 항체 요법 양생법의 선별 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 시점 t0 에서 점막 치유 마커의 패널의 수준을 측정하여 t0 에서의 점막 치유 지수를 생성하는 단계;
(b) 시점 t1 에서 점막 치유 마커의 패널의 수준을 측정하여 t1 에서의 점막 치유 지수를 생성하는 단계;
(c) t0 으로부터 t1 까지의 점막 치유 지수의 변화를 비교하는 단계; 및
(d) 개체를 위한 점막 치유를 촉진하는 항-TNF 항체 요법 양생법을 선별하는 단계.
일부 구현예에서, 질환은 위장 질환 또는 자가면역 질환이다. 특정 경우에, 대상은 크론병 (CD) 또는 류머티스성 관절염 (RA) 을 갖는다. 다른 구현예에서, 치료 항체는 항-TNFα 항체이다. 일부 구현예에서, 항-TNFα 항체는 REMICADE™ (인플릭시맙), ENBREL™ (에타네르셉트), HUMIRA™ (아달리무맙), CIMZIA® (세르톨리주맙 페골), 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원이다. 바람직한 구현예에서, 대상은 인간이다.
일부 구현예에서, 마커의 어레이는 점막 치유 마커를 포함한다. 일부 구현예에서, 점막 마커는 AREG, EREG, HB-EGF, HGF, NRG1, NRG2, NRG3, NRG4, BTC, EGF, IGF, TGF-α, VEGF-A, VEGF-B, VEGF-C, VEGF-D, FGF1, FGF2, FGF7, FGF9, TWEAK 및 그들의 조합을 포함한다.
다른 구현예에서, 마커의 어레이는 항-TNFα 항체, 항-약물 항체 (ADA), 염증 마커, 항-염증 마커, 조직 복구 마커 (예를 들어, 성장 인자), 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원을 추가로 포함한다. 특정 경우에, 항-TNFα 항체는 REMICADE™ (인플릭시맙), ENBREL™ (에타네르셉트), HUMIRA™ (아달리무맙), CIMZIA® (세르톨리주맙 페골), 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원이다. 특정 다른 경우에, 항-약물 항체 (ADA) 는 인간 항-키메라 항체 (HACA), 인간 항-인간화 항체 (HAHA), 인간 항-마우스 항체 (HAMA), 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원이다. 또다른 경우에, 염증 마커는 GM-CSF, IFN-γ, IL-1β, IL-2, IL-6, IL-8, TNF-α, sTNF RII, 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원이다. 추가의 경우에, 항-염증 마커는 IL-12p70, IL-10, 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원이다.
특정 구현예에서, 어레이는 2 이상, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 또는 그 이상의 마커를 포함한다. 일부 구현예에서, 마커는 혈청, 혈장, 전혈, 대변, 말초 혈액 단핵 세포 (PBMC), 다형핵 (PMN) 세포, 및 조직 생검 (예를 들어, 염증의 자리 예컨대 위장관 또는 활액 조직의 부분으로부터의) 으로 이루어지는 군으로부터 선택되는 생물학적 샘플 중에서 측정된다.
특정 구현예에서, 복수의 시점은 2 이상, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 또는 그 이상의 시점을 포함한다. 일부 경우에, 복수의 시점 중 최초의 시점은 치료 항체를 이용하는 요법의 과정 전이다. 다른 경우에, 복수의 시점 중 최초의 시점은 치료 항체를 이용하는 요법의 과정 동안이다. 비제한적 예로서, 각각의 마커는 치료 항체를 이용하는 요법 전에 및/또는 요법의 과정 동안 하나 이상 (예를 들어, 복수) 의 하기 주에 측정될 수 있다: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 80, 90, 100, 등
일부 구현예에서, 적당한 요법의 선별은 대상을 위한 요법의 과정의 후속 투여량의 유지, 증가, 또는 감소를 포함한다. 다른 구현예에서, 방법은 대상을 위한 요법의 상이한 과정의 결정을 추가로 포함한다. 특정 경우에, 요법의 상이한 과정은 상이한 항-TNFα 항체를 이용하는 처리를 포함한다. 다른 경우에, 요법의 상이한 과정은 현재의 요법의 과정과 함께 또다른 치료제, 예컨대, 이에 제한되는 것은 아니나 항-TNF 요법, 면역억제제, 코르티코스테로이드, 상이한 메카니즘을 표적화하는 약물, 영양 요법 및 기타 조합 처리를 포함한다.
일부 구현예에서, 적당한 요법의 선별은 초기 처리를 위한 적당한 요법의 선별을 포함한다. 일부 경우에, 요법은 항-TNFα 항체 요법을 포함한다.
특정 구현예에서, 본원에 개시된 방법은 제안된 새로운 약물 또는 치료제가 승인된 약물 제품과 동일 또는 충분히 유사하여, 제안된 새로운 약물이 "바이오시밀러 치료제" 로서 사용될 수 있음의 확인하는데 사용될 수 있다. 예를 들어, 제안된 새로운 약물이 브랜드 있는 약물 제품과 비교시 오직 약간 상이한 질환 활성 프로파일을 갖는 경우, 이는 본원에 개시된 방법을 사용하여 명백할 것이다. 제안된 새로운 약물이 브랜드 있는 약물 제품과 비교시 유의하게 상이한 질환 활성 프로파일을 갖는 경우, 그때 새로운 약물은 바이오시밀러가 아닐 것이다. 유리하게는, 본원에 개시된 방법은 제안된 새로운 약물의 임상 시험에서 약물의 효과적 치료 효능 또는 가치를 평가하기 위해 사용될 수 있다.
따라서, 일부 양상에서, 발명의 방법은, 예를 들어, 초기 처리를 위한 적당한 항-TNF 요법을 선별함으로써, 언제 또는 어떻게 항-TNF 약물의 후속 투여량을 조정 또는 수정 (예를 들어, 증가 또는 감소) 할지를 결정함으로써, 언제 또는 어떻게 항-TNF 약물 (예를 들어, 초기, 증가된, 감소된, 또는 동일한 투여량에서) 을 하나 이상의 면역억제제 예컨대 메토트렉세이트 (MTX) 또는 아자티오프린 (AZA) 과 조합할지를 결정함으로써, 및/또는 언제 또는 어떻게 현재의 요법의 과정을 변화 (예를 들어, 상이한 항-TNF 약물로 또는 상이한 메카니즘을 표적화하는 약물 예컨대 IL-6 수용체-저해 모노클로날항체, 항-인테그린 분자 (예를 들어, 티사브리, 베달루주맙), JAK-2 저해인자, 및 티로신 키나제 저해인자로, 또는 영양 요법 (예를 들어, 특별 탄수화물식) 으로 전환) 시킬지를 결정함으로써, 항-TNF 약물 요법을 받고 있는 또는 이제 막 받으려는 환자를 위해 치료 결정을 안내하는데 유용한 정보를 제공한다.
다른 구현예에서, 본 발명의 방법을 사용하여 자가면역 장애 (예를 들어, 류머티스성 관절염, 크론병, 궤양성 대장염 등) 를 갖는 대상에서 TNFα 저해인자에 대한, 특히 항-TNFα 항체에 대한 응답성을 예측할 수 있다. 이 방법에서, 대상을 항-TNFα 항체의 적절한 또는 치료적 투여량, 즉, 치료적 농도 수준에 대해 검정함으로써, 개체가 요법에 응답성일지 여부를 예측하는 것이 가능하다.
또다른 구현예에서, 본 발명은 IBD 장애를 갖는 대상에서의 IBD (예를 들어, 크론병 및 궤양성 대장염) 의 모니터링 방법으로서, 시간의 흐름에 따라, 대상을 항-TNFα 항체의 적절한 또는 치료적 투여량, 즉, 치료적 농도 수준에 대해 검정하는 것을 포함하는 방법을 제공한다. 이러한 방식으로, 소정의 기간 동안 개체가 요법에 응답성일지 여부를 예측하는 것이 가능하다.
본 발명의 다른 목적, 특색, 및 이점은 하기 상세한 설명 및 도면으로부터 당업자에게 명백할 것이다.
도 1 은 실시예 1 에 기술된 개인화된 IBD 활성 프로파일을 보여준다.
도 2A 는 다양한 환자 인플릭시맙 농도를 처리 시간의 함수로서 보여준다. 도 2B 는 처리 과정 동안 사건 (인플릭시맙이 역치 농도 미만으로 하락) 발생에 의한 환자 순위를 보여준다.
도 3A 는 다양한 환자 HACA (ATI) 농도를 처리 시간의 함수로서 보여준다. 도 3B 는 처리 과정 동안 사건 (HACA 탐지 또는 출현) 발생에 의한 환자 순위를 보여준다.
도 4A 는 환자 샘플 중 ATI 의 존재 및 IFX 의 수준 사이의 연관성을 나타낸다. ATI 가 탐지가능한 샘플과 비교시, ATI 수준이 탐지불가능한 샘플은 유의하게 더 높은 IFX 중간 농도를 가졌다. 도 4B 는 ATI 의 존재가 더 높은 CDAI 와 상관관계가 있음을 나타낸다. 도 4C 는 동시 면역억제제 요법 (예를 들어, MTX) 이 ATI 의 존재를 억제할 가능성이 더 높음을 보여준다.
도 5A 는 ATI 가 존재하는 환자가 처리에 불량한 응답을 발달시킬 가능성이 더 높음을 보여준다. 도 5B 는 염증 마커 CRP 가 증가된 수준의 ATI 와 연관됨을 보여준다.
도 6 은 하나 이상의 염증 및 조직 복구 마커의 어레이의 단백질 수준이 IFX 에 대한 항체의 형성과 상관관계가 있음을 나타낸다.
도 7A 는 염증 마커의 어레이를 사용하여 ATI 의 존재 및/또는 질환 진행과 상관관계가 있는 염증 지수를 확립할 수 있음을 나타낸다. 도 7B 는 ATI 가 존재하는 샘플 중 PII 및 IFX 농도 사이의 관계를 보여준다. 도 7C 는 COMMIT 연구의 환자 샘플에서 예시적 PRO 염증 지수 (PRO Inflammatory Index: PII) 가 IFX 의 수준과 상관관계가 있음을 나타낸다 (p<0.0001 및 R2 = -0.129).
도 8A 는 임상 연구 #1 의 다수의 환자의 크론병 활성 지수 (CDAI) 점수 및 혈청 중 인플릭시맙의 농도 사이의 상관관계를 나타낸다. 도 8B 는 샘플 중 IFX 의 존재가 더 높은 CDAI 와 상관관계가 있음을 보여준다.
도 9A 는 분석된 샘플 중 IFX 농도 및 인플릭시맙에 대한 항약물 항체의 존재 사이의 연관성을 나타낸다. 도 9B 는 고농도의 ATI 가 중화 항체의 존재 및 IFX 의 탐지불가능한 수준을 초래할 수 있음을 나타낸다. 도 9C 는 앞선 시점에 ATI 양성으로 확인된 샘플이 후속 시점에 더 높은 CDAI 를 초래하고, 이에 비해 ATI 음성 샘플은 더 낮은 CDAI 수준을 초래함을 나타낸다. "V1"= 방문 (visit) 1; "V3"= 방문 3. 도 9D 는 임상 연구 #1 에서, 환자가 인플릭시맙 및 면역억제제 (예를 들어, MTX 및 AZA) 의 조합 요법을 받고 있는 경우 ATI 를 발달시킬 공산이 더 낮았음을 나타낸다.
도 10A 는 임상 연구 #2A 의 샘플 중 IFX 농도 및 ATI 의 존재 사이의 상관관계를 보여준다. 도 10B 는 연구에서의 면역억제제 (ImmunoSuppressant Agent: ISA) 요법 및 ATI 의 존재 사이의 관계를 나타낸다. 도 10C 는 CRP 농도 및 ATI (ATI 및/또는 중화 ATI) 의 존재 사이의 관계를 나타낸다. 도 10D 는 연구에서의 IFX 요법에 대한 응답성의 상실 및 ATI 의 존재 사이의 관계를 나타낸다.
도 11 은 ATI 및 중화 항체의 수준이 다양한 환자로부터의 일련의 샘플에서 시간의 흐름에 따라 측정될 수 있음을 나타낸다.
도 12A 는 CRP 수준과 IFX 의 존재의 비교를 나타낸다. 도 12B 는 ATI 의 존재 및 주입 반응 사이의 관계를 나타낸다. 도 12C 는 임상 연구 #2B 에서의 IFX 농도 및 ATI 의 존재 사이의 관계를 나타낸다. 도 12D 는 ATI 의 존재 및 특정 정해진 날짜에서의 ISA 요법의 철회 사이의 상관관계를 나타낸다.
도 13A 는 ATI 및 염증 마커 CRP 사이의 관계를 나타낸다. 우리의 분석은 임의의 시점에서 ATI 양성으로 확인된 환자에서 IFX 에 대한 응답의 상실을 경험할 공산이 더 높았음을 보여줬다. 도 13B 는 임의의 시점에서의 ATI 의 존재 및 IFX 처리에 대한 응답성 사이의 상관관계를 나타낸다. 도 13C 는 응답의 상실이 CRP 의 증가와 관련될 수 있음을 보여준다. 도 13D 는 IFX 의 존재 및 CRP 수준 사이의 연관성을 보여준다.
도 14A 는 임상 연구 #2C 에서 더 낮은 IFX 수준이 ATI 의 존재와 연관됨을 보여준다. 도 14B 는 임상 연구 #3 에서 더 낮은 IFX 수준이 ATI 의 존재와 연관됨을 보여준다. 도 14C 는 IFX 수준 및 ATI 사이의 동일한 상관관계가 연구 데이타, 추적 연구 및 약물동태학 연구에서도 존재했음을 나타낸다.
도 15A 는 ATI 수준 및 IFX 사이의 관계를 나타낸다. ATI 농도가 높은 샘플이 IFX 을 중화시킴이 확인되었고, 따라서 IFX 농도는 0 ㎍/㎖ 로 확인되었다. 도 15B 는 환자 샘플 중 ADL 농도 및 ATA 의 존재 사이의 연관성을 나타낸다.
도 16A 는 예시적 PRO 염증 지수의 세부사항을 기술한다. 도 16B 는 ADL 이 단독으로 또는 다른 약물과의 조합으로 존재하는 샘플의 어레이에서 PII 및 ADL 의 농도 사이에 명백한 관계가 존재하지 않음을 보여준다.
도 17 은 Humira 및 다른 약물 예컨대 Remicade, Cimzia, 아자티오프린 및 메토트렉세이트와 조합된 Humira 를 받고 있는 환자에 대한 PII 점수의 도표를 보여준다.
도 18 은 CD 및/또는 UC 환자의 개선된 관리 방법의 세부사항을 보여준다.
도 19 는 상이한 세포 유형, 세포 메카니즘 및 질환 (예를 들어, 크론병 (CD), 류머티스성 관절염 (RA) 및 건선 (Ps)) 에 대한 TNF-α 경로 및 관련 경로의 효과를 보여준다.
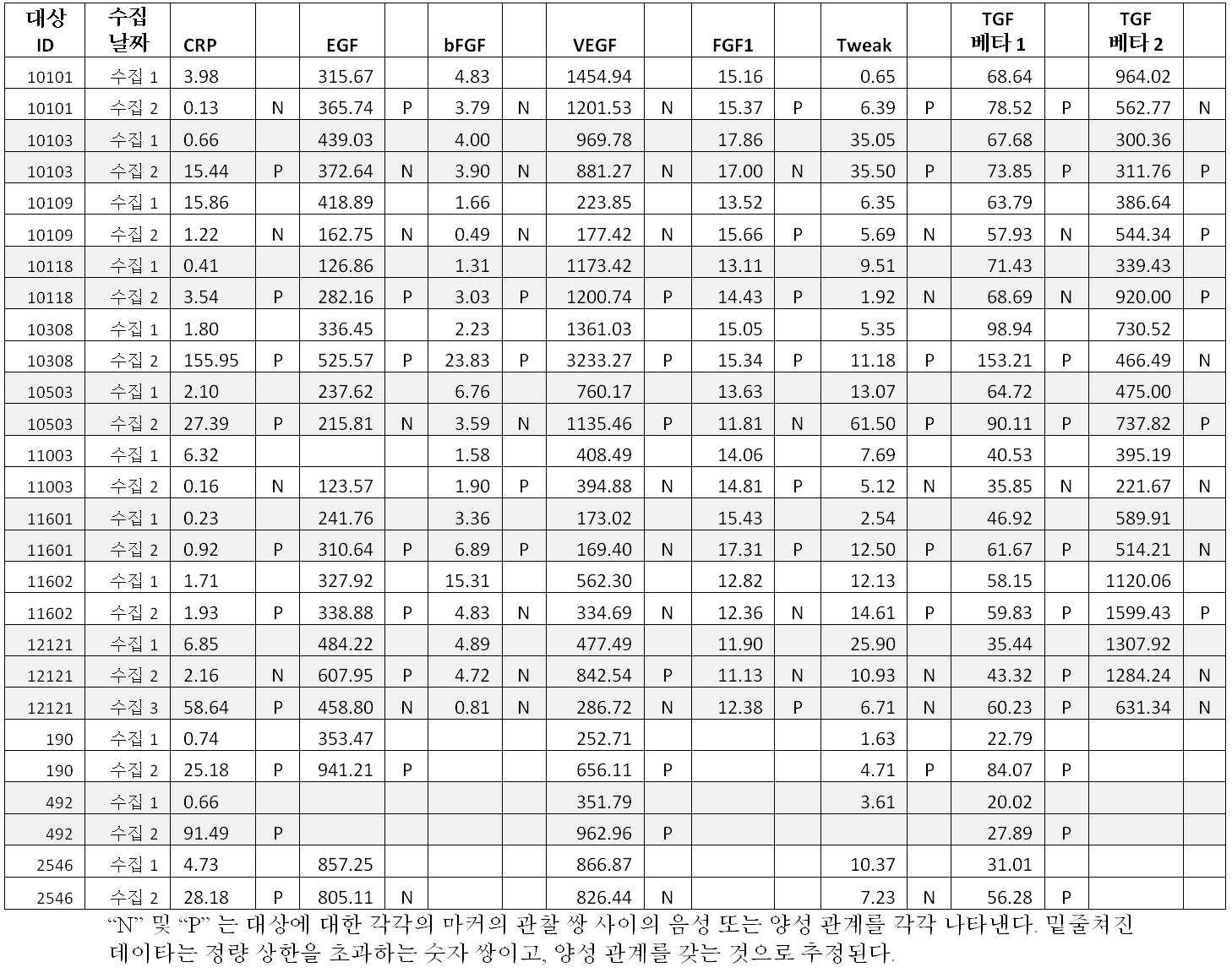
도 20 은 예시적 CEER 다중 성장 인자 어레이를 나타낸다.
도 21A-G 는 CEER 성장 인자 어레이를 사용하는 환자 샘플의 다중 성장 인자 프로파일링을 나타낸다.
도 22 는 질환 차도의 확인에 있어서 CRP 수준 및 성장 인자 지수 점수 사이의 연관성을 나타낸다.
도 23 은 경도, 중등도, 또는 중증 질환 활성을 갖는 IBD 환자를 위한 개인화된 환자 치료법 개발을 보조하는 본 발명의 구현예를 나타낸다.
도 24 는 환자 치료를 개인화하는 치료 패러다임을 나타낸다. 질환 부담 및 점막 치유의 모니터링은 치료 선택, 투여량 선택, 및 초기 약물 응답 확인을 보조할 수 있다.
도 25 는 CRP 및 IFX 저점 역치의 ROC 분석을 보여준다.
도 26 은 순차적 시점에서의 CRP, 혈청 IFX 농도 및 ATI 의 관계를 보여준다. 도 26A 는 쌍의 첫번째 데이타 점에서의 IFX 및 ATI 및 후속 측정에서의 CRP 의 존재를 보여준다. 도 26B 는 하나의 샘플에 대한 순차적 시점에서의 CRP 수준, IFX 혈청 농도 및 ATI 상태를 보여준다. 이 샘플에서 CRP 수준은 환자가 ATI- 이고 역치보다 높은 혈청 IFX 농도를 가질 때 최저이다.
도 27 은 ATI+ 환자에서 역치보다 높은 IFX 수준 및 CRP 사이에 연관성이 존재하지 않았음을 보여준다. 그러나, ATI- 환자에서 CRP 수준은 IFX 수준이 역치 (3 ㎍/㎖) 미만인 환자에서 유의하게 더 높았다.
도 2A 는 다양한 환자 인플릭시맙 농도를 처리 시간의 함수로서 보여준다. 도 2B 는 처리 과정 동안 사건 (인플릭시맙이 역치 농도 미만으로 하락) 발생에 의한 환자 순위를 보여준다.
도 3A 는 다양한 환자 HACA (ATI) 농도를 처리 시간의 함수로서 보여준다. 도 3B 는 처리 과정 동안 사건 (HACA 탐지 또는 출현) 발생에 의한 환자 순위를 보여준다.
도 4A 는 환자 샘플 중 ATI 의 존재 및 IFX 의 수준 사이의 연관성을 나타낸다. ATI 가 탐지가능한 샘플과 비교시, ATI 수준이 탐지불가능한 샘플은 유의하게 더 높은 IFX 중간 농도를 가졌다. 도 4B 는 ATI 의 존재가 더 높은 CDAI 와 상관관계가 있음을 나타낸다. 도 4C 는 동시 면역억제제 요법 (예를 들어, MTX) 이 ATI 의 존재를 억제할 가능성이 더 높음을 보여준다.
도 5A 는 ATI 가 존재하는 환자가 처리에 불량한 응답을 발달시킬 가능성이 더 높음을 보여준다. 도 5B 는 염증 마커 CRP 가 증가된 수준의 ATI 와 연관됨을 보여준다.
도 6 은 하나 이상의 염증 및 조직 복구 마커의 어레이의 단백질 수준이 IFX 에 대한 항체의 형성과 상관관계가 있음을 나타낸다.
도 7A 는 염증 마커의 어레이를 사용하여 ATI 의 존재 및/또는 질환 진행과 상관관계가 있는 염증 지수를 확립할 수 있음을 나타낸다. 도 7B 는 ATI 가 존재하는 샘플 중 PII 및 IFX 농도 사이의 관계를 보여준다. 도 7C 는 COMMIT 연구의 환자 샘플에서 예시적 PRO 염증 지수 (PRO Inflammatory Index: PII) 가 IFX 의 수준과 상관관계가 있음을 나타낸다 (p<0.0001 및 R2 = -0.129).
도 8A 는 임상 연구 #1 의 다수의 환자의 크론병 활성 지수 (CDAI) 점수 및 혈청 중 인플릭시맙의 농도 사이의 상관관계를 나타낸다. 도 8B 는 샘플 중 IFX 의 존재가 더 높은 CDAI 와 상관관계가 있음을 보여준다.
도 9A 는 분석된 샘플 중 IFX 농도 및 인플릭시맙에 대한 항약물 항체의 존재 사이의 연관성을 나타낸다. 도 9B 는 고농도의 ATI 가 중화 항체의 존재 및 IFX 의 탐지불가능한 수준을 초래할 수 있음을 나타낸다. 도 9C 는 앞선 시점에 ATI 양성으로 확인된 샘플이 후속 시점에 더 높은 CDAI 를 초래하고, 이에 비해 ATI 음성 샘플은 더 낮은 CDAI 수준을 초래함을 나타낸다. "V1"= 방문 (visit) 1; "V3"= 방문 3. 도 9D 는 임상 연구 #1 에서, 환자가 인플릭시맙 및 면역억제제 (예를 들어, MTX 및 AZA) 의 조합 요법을 받고 있는 경우 ATI 를 발달시킬 공산이 더 낮았음을 나타낸다.
도 10A 는 임상 연구 #2A 의 샘플 중 IFX 농도 및 ATI 의 존재 사이의 상관관계를 보여준다. 도 10B 는 연구에서의 면역억제제 (ImmunoSuppressant Agent: ISA) 요법 및 ATI 의 존재 사이의 관계를 나타낸다. 도 10C 는 CRP 농도 및 ATI (ATI 및/또는 중화 ATI) 의 존재 사이의 관계를 나타낸다. 도 10D 는 연구에서의 IFX 요법에 대한 응답성의 상실 및 ATI 의 존재 사이의 관계를 나타낸다.
도 11 은 ATI 및 중화 항체의 수준이 다양한 환자로부터의 일련의 샘플에서 시간의 흐름에 따라 측정될 수 있음을 나타낸다.
도 12A 는 CRP 수준과 IFX 의 존재의 비교를 나타낸다. 도 12B 는 ATI 의 존재 및 주입 반응 사이의 관계를 나타낸다. 도 12C 는 임상 연구 #2B 에서의 IFX 농도 및 ATI 의 존재 사이의 관계를 나타낸다. 도 12D 는 ATI 의 존재 및 특정 정해진 날짜에서의 ISA 요법의 철회 사이의 상관관계를 나타낸다.
도 13A 는 ATI 및 염증 마커 CRP 사이의 관계를 나타낸다. 우리의 분석은 임의의 시점에서 ATI 양성으로 확인된 환자에서 IFX 에 대한 응답의 상실을 경험할 공산이 더 높았음을 보여줬다. 도 13B 는 임의의 시점에서의 ATI 의 존재 및 IFX 처리에 대한 응답성 사이의 상관관계를 나타낸다. 도 13C 는 응답의 상실이 CRP 의 증가와 관련될 수 있음을 보여준다. 도 13D 는 IFX 의 존재 및 CRP 수준 사이의 연관성을 보여준다.
도 14A 는 임상 연구 #2C 에서 더 낮은 IFX 수준이 ATI 의 존재와 연관됨을 보여준다. 도 14B 는 임상 연구 #3 에서 더 낮은 IFX 수준이 ATI 의 존재와 연관됨을 보여준다. 도 14C 는 IFX 수준 및 ATI 사이의 동일한 상관관계가 연구 데이타, 추적 연구 및 약물동태학 연구에서도 존재했음을 나타낸다.
도 15A 는 ATI 수준 및 IFX 사이의 관계를 나타낸다. ATI 농도가 높은 샘플이 IFX 을 중화시킴이 확인되었고, 따라서 IFX 농도는 0 ㎍/㎖ 로 확인되었다. 도 15B 는 환자 샘플 중 ADL 농도 및 ATA 의 존재 사이의 연관성을 나타낸다.
도 16A 는 예시적 PRO 염증 지수의 세부사항을 기술한다. 도 16B 는 ADL 이 단독으로 또는 다른 약물과의 조합으로 존재하는 샘플의 어레이에서 PII 및 ADL 의 농도 사이에 명백한 관계가 존재하지 않음을 보여준다.
도 17 은 Humira 및 다른 약물 예컨대 Remicade, Cimzia, 아자티오프린 및 메토트렉세이트와 조합된 Humira 를 받고 있는 환자에 대한 PII 점수의 도표를 보여준다.
도 18 은 CD 및/또는 UC 환자의 개선된 관리 방법의 세부사항을 보여준다.
도 19 는 상이한 세포 유형, 세포 메카니즘 및 질환 (예를 들어, 크론병 (CD), 류머티스성 관절염 (RA) 및 건선 (Ps)) 에 대한 TNF-α 경로 및 관련 경로의 효과를 보여준다.
도 20 은 예시적 CEER 다중 성장 인자 어레이를 나타낸다.
도 21A-G 는 CEER 성장 인자 어레이를 사용하는 환자 샘플의 다중 성장 인자 프로파일링을 나타낸다.
도 22 는 질환 차도의 확인에 있어서 CRP 수준 및 성장 인자 지수 점수 사이의 연관성을 나타낸다.
도 23 은 경도, 중등도, 또는 중증 질환 활성을 갖는 IBD 환자를 위한 개인화된 환자 치료법 개발을 보조하는 본 발명의 구현예를 나타낸다.
도 24 는 환자 치료를 개인화하는 치료 패러다임을 나타낸다. 질환 부담 및 점막 치유의 모니터링은 치료 선택, 투여량 선택, 및 초기 약물 응답 확인을 보조할 수 있다.
도 25 는 CRP 및 IFX 저점 역치의 ROC 분석을 보여준다.
도 26 은 순차적 시점에서의 CRP, 혈청 IFX 농도 및 ATI 의 관계를 보여준다. 도 26A 는 쌍의 첫번째 데이타 점에서의 IFX 및 ATI 및 후속 측정에서의 CRP 의 존재를 보여준다. 도 26B 는 하나의 샘플에 대한 순차적 시점에서의 CRP 수준, IFX 혈청 농도 및 ATI 상태를 보여준다. 이 샘플에서 CRP 수준은 환자가 ATI- 이고 역치보다 높은 혈청 IFX 농도를 가질 때 최저이다.
도 27 은 ATI+ 환자에서 역치보다 높은 IFX 수준 및 CRP 사이에 연관성이 존재하지 않았음을 보여준다. 그러나, ATI- 환자에서 CRP 수준은 IFX 수준이 역치 (3 ㎍/㎖) 미만인 환자에서 유의하게 더 높았다.
I. 서론
본 발명은 IBD, CD 및/또는 UC 환자에서의 점막 치유의 측정 방법을 제공한다. 특히, 본 발명은 점막 치유 마커의 측정 방법으로서, 상기 마커가 장 조직 복구, 및 질환 해소 또는 차도의 지표인 방법을 제공한다.
본 발명은 IBD (예를 들어, 크론병 및 궤양성 대장염) 환자에서의 점막 치유의 모니터링과 연관되는 현재의 한계를 다루고 극복하기 때문에 유리하다. 본 발명은 항-TNF 요법을 받고 있는 환자에서의 점막 치유의 비-침습적 모니터링 방법을 제공한다. 또한, 본 발명은 IBD (예를 들어, 크론병 및 궤양성 대장염) 환자에서의 치료적 응답, 악화 위험, 및 수술 위험의 예측 방법을 제공한다. 특히, 본 발명의 방법은 초기 처리를 위한 적당한 항-TNF 요법의 선별, 언제 또는 어떻게 항-TNF 약물의 후속 투여량을 치료 효능 최적화 및/또는 독성 감소를 위해 조정 또는 수정 (예를 들어, 증가 또는 감소) 할지의 결정, 언제 또는 어떻게 항-TNF 약물 (예를 들어, 초기, 증가된, 감소된, 또는 동일한 투여량에서) 을 하나 이상의 면역억제제 예컨대 메토트렉세이트 (MTX) 또는 아자티오프린 (AZA) 과 조합할지의 결정, 및/또는 언제 또는 어떻게 현재의 요법의 과정을 변화 (예를 들어, 상이한 항-TNF 약물로 또는 상이한 메카니즘을 표적화하는 약물로 전환) 시킬지의 결정에서 유용하다. 본 발명은 또한 CD 로 진단된 환자를 위한 적당한 요법의 선별 방법으로서, 요법이 점막 치유를 촉진하는 방법을 제공한다.
II. 정의
본원에서 사용되는 하기 용어들은 다르게 명시되지 않으면 그들에게 부여된 의미를 갖는다.
구절 "점막 치유 지수" 는 복수의 점막 치유 마커의 분석에 기초하는 경험적으로 유래된 지수를 포함한다. 하나의 양상에서, 마커의 농도 또는 그들의 측정된 농도 값은 컴퓨터에 상주하는 알고리즘에 의해 지수로 변환된다. 특정 양상에서, 지수는 생물학적 데이타를 수치적 용어로 표현하는 합성 또는 인간 유래 아웃풋, 점수, 또는 컷오프 값(들)이다. 지수를 사용하여 임상 결정을 내리거나 확정 또는 지원할 수 있다. 점막 치유 지수는 시간의 흐름에 따라 여러 번 측정될 수 있다. 하나의 양상에서, 알고리즘은 알려진 샘플로 훈련된 후, 알려진 동일성의 샘플로 검정될 수 있다.
구절 "점막 치유 지수 대조군" 은 건강한 개체, 또는 질환 상태로부터 건강한 상태로 진행한 개체에서 유래된 점막 치유 지수를 포함한다. 대안적으로는, 대조군은 심한 질환 상태의 덜 심한 질환 상태 또는 건강한 상태로의 시간 경과를 나타내는 지수일 수 있다.
구절 "요법의 과정의 결정" 등은 경험적으로 유래된 지수, 점수 또는 분석을 사용하는 선택 예를 들어, 약물 투여량의 선택, 적당한 약물, 또는 요법의 과정 또는 길이, 요법 양생법, 또는 기존 약물 또는 투여량의 유지의 선택을 포함한다. 특정 양상에서, 유래된 또는 측정된 지수를 사용하여 요법의 과정을 결정할 수 있다.
본원에서 사용되는 용어 "TNF 저해인자", "TNF-α 저해인자" 및 "TNFα 저해인자" 는, 예컨대 TNF-α 와 TNF-α 에 대한 세포 표면 수용체의 상호작용을 저해, TNF-α 단백질 생산을 저해, TNF-α 유전자 발현을 저해, 세포로부터 TNFα 분비를 저해, TNF-α 수용체 신호전달을 저해함으로써, TNF α 활성을 직접적으로 또는 간접적으로 저해하는, 단백질, 항체, 항체 조각, 융합 단백질 (예를 들어, Ig 융합 단백질 또는 Fc 융합 단백질), 다가 결합 단백질 (예를 들어, DVD Ig), 소분자 TNF-α 길항물질 및 유사한 자연- 또는 비자연 발생적 분자, 및/또는 그의 재조합 및/또는 조작된 형태를 포함하는 물질, 또는 대상에서 감소된 TNF-α 활성을 초래하는 임의의 다른 수단을 포괄하는 것으로 의도된다. 용어 "TNFα 저해인자" 는 바람직하게는 TNF-α 활성을 방해하는 물질을 포함한다. TNF-α 저해인자의 예는 에타네르셉트 (ENBREL™, Amgen), 인플릭시맙 (REMICADE™, Johnson and Johnson), 인간 항-TNF 모노클로날항체 아달리무맙 (D2E7/HUMIRA™, Abbott Laboratories), CDP 571 (Celltech), 및 CDP 870 (Celltech), 뿐만 아니라, TNF-α 활성이 해로운 장애 (예를 들어, RA) 를 겪고 있는 또는 겪을 위험에 처한 대상에게 투여될 때 장애가 치료되게 하는, TNF-α 활성을 저해하는 기타 화합물을 포함한다.
본원에서 사용되는 용어 "TNFα 저해인자에 대한 응답성의 예측" 은 TNF 저해인자에 의한 대상의 처리가 대상에서 효과적이거나 (예를 들어, 측정가능한 유익을 제공하거나) 또는 그렇지 않을 가능성을 평가하는 능력을 언급하는 것으로 의도된다. 특히, 처리가 효과적이거나 또는 그렇지 않을 가능성을 평가하는 능력은 전형적으로 처리가 시작되고, 유효성의 지표 (예를 들어, 측정가능한 유익의 지표) 가 대상에서 관찰된 후에 발휘된다. 특히 바람직한 TNFα 저해인자는 인간의 류머티스성 관절염 치료 용도에 대해 FDA 승인된 생물학적 제제이며, 아달리무맙 (HUMIRA™), 인플릭시맙 (REMICADE™) 및 에타네르셉트 (ENBREL™), 가장 바람직하게는 아달리무맙 (HUMIRA™) 을 포함한다.
용어 "요법의 과정" 은 TNFα-매개 질환 또는 장애와 연관되는 하나 이상의 징후를 경감 또는 방지하기 위해 취해지는 임의의 치료적 접근법을 포함한다. 상기 용어는 TNFα-매개 질환 또는 장애를 갖는 개체의 건강 개선에 유용한 임의의 화합물, 약물, 절차, 및/또는 양생법을 투여하는 것을 포괄하고, 본원에 기재된 임의의 치료제를 포함한다. 당업자는 본 발명의 방법을 사용하여 TNF, 항-TNF 약물, 및/또는 항-약물 항체의 존재 또는 농도 수준에 기초하여 요법의 과정 또는 현재의 요법의 과정의 투여량이 변화 (예를 들어, 증가 또는 감소) 될 수 있음을 인식할 것이다.
용어 "면역억제제 (ImmunoSuppressant Agent: ISA)" 는 방사선조사에 의해 또는 약물 예컨대 항-대사물질, 항-림프구 혈청, 항체 등의 투여에 의해 면역억제 효과, 예를 들어, 면역 응답의 방지 또는 축소를 야기할 수 있는 임의의 물질을 포함한다. 적합한 면역억제제의 예는 티오퓨린 약물 예컨대 아자티오프린 (AZA) 및 그의 대사물질; 항-대사물질 예컨대 메토트렉세이트 (MTX); 시롤리무스 (라파마이신); 템시롤리무스; 에베롤리무스; 타크롤리무스 (FK-506); FK-778; 항-림프구 글로불린 항체, 항-흉선세포 글로불린 항체, 항-CD3 항체, 항-CD4 항체, 및 항체-독소 접합체; 시클로스포린; 마이코페놀레이트; 미조리빈 모노포스페이트; 스코파론; 글라티라메르 아세테이트; 그의 대사물질; 그의 약학적으로 허용가능한 염; 그의 유도체; 그의 전구약물; 및 그들의 조합을, 제한 없이, 포함한다.
용어 "티오퓨린 약물" 은 아자티오프린 (AZA), 6-메르캅토퓨린 (6-MP), 또는 치료 효능을 갖고, 6-티오구아닌 (6-TG), 6-메틸메르캅토퓨린 리보시드, 6-티오이노신 뉴클레오티드 (예를 들어, 6-티오이노신 모노포스페이트, 6-티오이노신 디포스페이트, 6-티오이노신 트리포스페이트), 6-티오구아닌 뉴클레오티드 (예를 들어, 6-티오구아노신 모노포스페이트, 6-티오구아노신 디포스페이트, 6-티오구아노신 트리포스페이트), 6-티오크산토신 뉴클레오티드 (예를 들어, 6-티오크산토신 모노포스페이트, 6-티오크산토신 디포스페이트, 6-티오크산토신 트리포스페이트), 그의 유도체, 그의 유사체, 및 그들의 조합을, 제한 없이, 포함하는 임의의 그의 대사물질을 포함한다.
본원에서 사용되는 용어 "샘플" 은 환자로부터 수득된 임의의 생물학적 시편을 포함한다. 샘플은 전혈, 혈장, 혈청, 적혈구, 백혈구 (예를 들어, 말초 혈액 단핵 세포 (PBMC), 다형핵 (PMN) 세포), 도관 세척액, 유두 흡인물, 림프 (예를 들어, 림프절의 파종성 종양 세포), 골수 흡인물, 타액, 소변, 대변 (즉, 배설물), 가래, 기관지 세척액, 눈물, 미세 바늘 흡인물 (예를 들어 무작위 유륜주위 미세 바늘 흡인에 의해 수확됨), 임의의 기타 체액, 조직 샘플 예컨대 염증 자리의 생검 (예를 들어 바늘 생검), 및 이의 세포 추출물을 제한 없이 포함한다. 일부 구현예에서, 샘플은 전혈 또는 그의 부분 구성요소 예컨대 혈장, 혈청, 또는 세포 펠렛이다. 다른 구현예에서, 샘플은 당업계에 알려진 임의의 기술을 사용하여 PBMCs 및/또는 PMN 세포를 단리함으로써 수득된다. 또다른 구현예에서, 샘플은, 예를 들어, 염증의 자리 예컨대 위장관 또는 활액 조직의 부분으로부터의, 조직 생검이다.
용어 "크론병 활성 지수" 또는 "CDAI" 는 크론병 (CD) 환자의 징후를 정량화하는데 사용되는 연구 도구를 포함한다. CDAI 는 일반적으로 CD 의 응답 또는 차도를 정의하는데 사용된다. CDAI 는 8 개의 인자로 이루어지며, 이들 인자 각각은 가중 인자로 조정 후에 합산된다. CDAI 의 구성요소 및 가중 인자는 다음과 같다:
각 세트의 합병증에 각각 1 점이 더해진다:
ㆍ 관절 통증 (관절통) 또는 명백한 (frank) 관절염의 존재;
ㆍ 홍채의 염증 또는 포도막염;
ㆍ 결절성 홍반, 괴저성농피증, 또는 아프타성 궤양의 존재;
ㆍ 열항, 누공 또는 농양;
ㆍ 기타 누공; 및/또는
ㆍ 이전 주 동안 열.
크론병의 차도는 전형적으로 150 점 미만의 CDAI 의 하락으로서 정의된다. 중증 질환은 전형적으로 450 점 초과의 값으로서 정의된다. 특정 양상에서, 크론병 환자에서 특정 약제에 대한 응답은 70 점 초과의 CDAI 의 하락으로서 정의된다.
용어 "점막 부상" 또는 "점막 손상" 은 장 내에서 내시경검사 동안 탐지가능한 장 내의 육안으로 보이는 점막 병변의 형성, 미시적 조직 수준에서 육아종 형성 및 근육층의 파괴, 세포 수준에서 상피 세포자멸사 및 활성화된 염증성 및 림프구 세포의 침윤, 세포 이하 수준에서 증가된 상피 투과성, 및 분자 수준에서 간극 연접 파괴를 포함한다. IBD 예컨대 크론병에서, 장 상피는 염증 환경에 의해 손상되며, 이는 불응성 궤양 및 병변의 형성을 초래한다.
용어 "점막 치유" 는 이전에 염증이 생긴 영역의 정상적 점막 출현의 회복, 및 내시경 및 현미경 수준에서 궤양화 및 염증의 완전한 부재를 언급한다. 점막 치유는 점막, 점막하, 및 근육 층의 복구 및 회복을 포함한다. 점막 치유는 또한 장 벽의 신경 및 림프혈관신생 요소를 포함한다.
용어 "영양-기반 요법 " 은 부티레이트, 프로바이오틱스 (예를 들어, VSL#3, E. coli Nissle 1917, 박테리움 바실러스 폴리퍼멘티쿠스), 비타민, 단백질, 거대분자, 및/또는 점막 치유 예컨대 장 점막의 성장 및 교체를 촉진하는 화학물질을 포함한다.
III. 구현예의 설명
본 발명은 요법의 최적화 및/또는 치료 효능의 모니터링을 위한 질환의 개인화된 치료적 관리 방법을 제공한다. 특히, 본 발명은 치료제를 이용하는 요법의 과정 동안 하나 또는 복수의 시점에서 하나 또는 복수의 점막 치유 바이오마커의 어레이를 측정하여, 요법 선별, 요법 최적화, 독성 감소, 및/또는 치료적 처리의 효능 모니터링을 위한 점막 치유 지수를 결정하는 것을 포함한다. 특정 경우에, 치료제는 TNFα-매개 질환 또는 장애의 치료를 위한 TNFα 저해인자이다. 일부 구현예에서, 본 발명의 방법은 유리하게는 요법 최적화 및/또는 항-TNF 약물 예컨대 항-TNFα 치료 항체에 대한 치료 효능의 모니터링에 의해 TNFα-매개 질환 또는 장애를 갖는 환자의 치료적 관리를 개선한다.
그와 같이, 하나의 양상에서, 본 발명은 대상에서 요법 최적화 또는 치료 효능 모니터링을 위한 질환의 개인화된 치료적 관리 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 치료 항체를 이용하는 요법의 과정 동안 복수의 시점에서 점막 치유 마커의 어레이를 측정하는 단계;
(b) 시간의 흐름에 따른 각각의 마커의 존재 및/또는 농도 수준의 표시를 포함하는 대상의 점막 치유 지수를 생성하는 단계;
(c) 대상의 점막 치유 지수를 대조군의 그것과 비교하는 단계; 및
(d) 대상을 위한 적당한 요법을 선별하여, 대상에서 질환의 개인화된 치료적 관리를 달성하는 단계.
그와 같이, 또다른 양상에서, 본 발명은 대상에서의 요법 선별을 위한 질환의 개인화된 치료적 관리 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 점막 치유 마커의 어레이를 측정하는 단계;
(b) 각각의 마커의 존재 및/또는 농도 수준의 표시를 포함하는 대상의 점막 치유 지수를 생성하는 단계;
(c) 대상의 점막 치유 지수를 대조군의 그것과 비교하는 단계; 및
(d) 대상을 위한 적당한 요법을 선별하여, 대상에서 질환의 개인화된 치료적 관리를 달성하는 단계.
그와 같이, 하나의 양상에서, 본 발명은 대상에서의 요법 최적화 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 치료 항체를 이용하는 요법의 과정 동안 복수의 시점에서 점막 치유 마커의 어레이를 측정하는 단계;
(b) 단계 (a) 에서 측정된 하나 이상의 마커의 수준에 통계적 알고리즘을 적용하여 점막 치유 지수를 생성하는 단계;
(c) 대상의 점막 치유 지수를 대조군의 그것과 비교하는 단계; 및
(d) 점막 치유 지수에 기초하여 대상을 위한 요법의 과정의 후속 투여량 또는 대상에게 요법의 상이한 과정이 투여되어야 하는지 여부를 결정하는 단계.
그와 같이, 하나의 양상에서, 본 발명은 대상에서의 요법 선별 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 치료 항체를 이용하는 요법의 과정 동안 복수의 시점에서 점막 치유 마커의 어레이를 측정하는 단계;
(b) 단계 (a) 에서 측정된 하나 이상의 마커의 수준에 통계적 알고리즘을 적용하여 점막 치유 지수를 생성하는 단계;
(c) 대상의 점막 치유 지수를 대조군의 그것과 비교하는 단계; 및
(d) 점막 치유 지수에 기초하여 대상을 위한 적당한 요법의 과정을 선별하는 단계.
그와 같이, 또다른 양상에서, 본 발명은 요법 양생법 (예를 들어, 항-TNF 항체 요법 양생법) 이 투여되고 있는 IBD (예를 들어, 크론병) 으로 진단된 대상에서의 수술 위험의 감소 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 치료 항체를 이용하는 요법의 과정 동안 복수의 시점에서 점막 치유 마커의 어레이를 측정하는 단계;
(b) 단계 (a) 에서 측정된 하나 이상의 마커의 수준에 통계적 알고리즘을 적용하여 점막 치유 지수를 생성하는 단계;
(c) 대상의 점막 치유 지수를 대조군의 그것과 비교하는 단계; 및
(d) 요법 양생법이 대상의 수술 위험을 감소시키는지 여부를 확인하는 단계.
그와 같이, 하나의 양상에서, 본 발명은 요법 (예를 들어, 항-TNF 요법) 을 받고 있는 대상에서의 치료적 효율의 모니터링 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 치료 항체를 이용하는 요법의 과정 동안 복수의 시점에서 점막 치유 마커의 어레이를 측정하는 단계;
(b) 단계 (a) 에서 측정된 하나 이상의 마커의 수준에 통계적 알고리즘을 적용하여 점막 치유 지수를 생성하는 단계;
(c) 대상의 점막 치유 지수를 대조군의 그것과 비교하는 단계; 및
(d) 점막 치유 지수에 기초하여 현재의 요법의 과정이 대상에게 적당한지 여부를 확인하는 단계.
일부 구현예에서, 질환은 위장 질환 또는 자가면역 질환이다. 특정 경우에, 대상은 염증성 장 질환 (IBD, 예를 들어, 크론병 (CD) 또는 궤양성 대장염 (UC)) 을 갖는다. 다른 경우에, 대상은 류머티스성 관절염 (RA) 을 갖는다. 바람직한 구현예에서, 대상은 인간이다.
일부 구현예에서, 요법은 항-TNF 요법, 면역억제제, 코르티코스테로이드, 상이한 메카니즘을 표적화하는 약물, 영양 요법 또는 그들의 조합을 포함하는 군으로부터 선택된다. 특정 경우에, 항-TNF 요법은 TNF 저해인자 (예를 들어, 항-TNF 약물, 항-TNFα 항체) 이다.
다른 구현예에서, 항-TNF 요법은 항-TNFα 항체이다. 일부 구현예에서, 항-TNFα 항체는 REMICADE™ (인플릭시맙), ENBREL™ (에타네르셉트), HUMIRA™ (아달리무맙), CIMZIA® (세르톨리주맙 페골), 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원이다. 바람직한 구현예에서, 대상은 인간이다.
일부 구현예에서, 요법은 면역억제제이다. 면역억제제의 비제한적 예는 티오퓨린 약물 예컨대 아자티오프린 (AZA), 6-메르캅토퓨린 (6-MP), 및/또는 치료 효능을 갖고, 6-티오구아닌 (6-TG), 6-메틸메르캅토퓨린 리보시드, 6-티오이노신 뉴클레오티드 (예를 들어, 6-티오이노신 모노포스페이트, 6-티오이노신 디포스페이트, 6-티오이노신 트리포스페이트), 6-티오구아닌 뉴클레오티드 (예를 들어, 6-티오구아노신 모노포스페이트, 6-티오구아노신 디포스페이트, 6-티오구아노신 트리포스페이트), 6-티오크산토신 뉴클레오티드 (예를 들어, 6-티오크산토신 모노포스페이트, 6-티오크산토신 디포스페이트, 6-티오크산토신 트리포스페이트), 그의 유도체, 그의 유사체, 및 그들의 조합; 항-대사물질 예컨대 메토트렉세이트 (MTX); 시롤리무스 (라파마이신); 템시롤리무스; 에베롤리무스; 타크롤리무스 (FK-506); FK-778; 항-림프구 글로불린 항체, 항-흉선세포 글로불린 항체, 항-CD3 항체, 항-CD4 항체, 및 항체-독소 접합체; 시클로스포린; 마이코페놀레이트; 미조리빈 모노포스페이트; 스코파론; 글라티라메르 아세테이트; 그의 대사물질; 그의 약학적으로 허용가능한 염; 그의 유도체; 그의 전구약물; 및 그들의 조합을 제한 없이 포함하는 임의의 그의 대사물질을 포함한다.
다른 구현예에서, 요법은 코르티코스테로이드이다. 또다른 구현예에서, 요법은 상이한 메카니즘을 표적화하는 약물 (예를 들어, TNFα 경로에 의해 매개되지 않는 메카니즘) 이다. 상이한 메카니즘을 표적화하는 약물의 비제한적 예는 IL-6 수용체 저해 모노클로날항체, 항-인테그린 분자 (예를 들어, 나탈리주맙 (Tysabri), 베돌루주맙), JAK-2 저해인자, 티로신 키나제 저해인자, 및 그들의 조합을 포함한다.
다른 구현예에서, 요법은 영양 요법이다. 특정 구현예에서, 영양 요법은 특별 탄수화물식이다. 특별 탄수화물식 (Special Carbohydrate Diet: SCD) 은 IBD 예컨대 크론병 및 궤양성 대장염의 징후를 감소시키도록 고안된 엄격한 무곡물, 무락토스, 및 무수크로스 영양 양생법이다. SCD 가 IBD (예를 들어, 크론병 또는 궤양성 대장염) 환자에서 점막 치유를 촉진 및/또는 유지할 수 있다는 것이 밝혀졌다. 전형적으로, SCD 는 복합 탄수화물의 사용을 제한하고, 식사로부터 정제당, 곡물 및 전분을 제거한다. IBD 환자의 미세융모는 특정 유형의 복합 탄수화물의 분해 능력을 결여하여, 유해 박테리아의 과도성장 및 장 점막의 자극을 초래한다고 기술되었다. SCD 가 IBD (예를 들어, 크론병 또는 궤양성 대장염) 에 대한 요법으로 추천되어 온 이유는 SCD 가 장이 점막 치유를 겪는 것을 가능하게 해주기 때문이다.
일부 구현예에서, 마커의 어레이는 점막 치유 마커를 포함한다. 일부 구현예에서, 점막 마커는 AREG, EREG, HB-EGF, HGF, NRG1, NRG2, NRG3, NRG4, BTC, EGF, IGF, TGF-α, VEGF-A, VEGF-B, VEGF-C, VEGF-D, FGF1, FGF2, FGF7, FGF9, TWEAK 및 그들의 조합을 포함한다.
다른 구현예에서, 마커의 어레이는 항-TNFα 항체, 항-약물 항체 (ADA), 염증 마커, 항-염증 마커, 조직 복구 마커 (예를 들어, 성장 인자), 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원을 추가로 포함한다. 특정 경우에, 항-TNFα 항체는 REMICADE™ (인플릭시맙), ENBREL™ (에타네르셉트), HUMIRA™ (아달리무맙), CIMZIA® (세르톨리주맙 페골), 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원이다. 특정 다른 경우에, 항-약물 항체 (ADA) 는 인간 항-키메라 항체 (HACA), 인간 항-인간화 항체 (HAHA), 인간 항-마우스 항체 (HAMA), 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원이다. 또다른 경우에, 염증 마커는 GM-CSF, IFN-γ, IL-1β, IL-2, IL-6, IL-8, TNF-α, sTNF RII, 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원이다. 추가의 경우에, 항-염증 마커는 IL-12p70, IL-10, 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원이다.
특정 구현예에서, 어레이는 2 이상, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 또는 그 이상의 마커를 포함한다. 일부 구현예에서, 마커는 혈청, 혈장, 전혈, 대변, 말초 혈액 단핵 세포 (PBMC), 다형핵 (PMN) 세포, 및 조직 생검 (예를 들어, 염증의 자리 예컨대 위장관 또는 활액 조직의 부분으로부터의) 으로 이루어지는 군으로부터 선택되는 생물학적 샘플 중에서 측정된다.
특정 구현예에서, 복수의 시점은 2 이상, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 또는 그 이상의 시점을 포함한다. 일부 경우에, 복수의 시점 중 최초의 시점은 치료 항체를 이용하는 요법의 과정 전이다. 다른 경우에, 복수의 시점 중 최초의 시점은 치료 항체를 이용하는 요법의 과정 동안이다. 비제한적 예로서, 각각의 마커는 치료 항체를 이용하는 요법 전에 및/또는 요법의 과정 동안 하나 이상 (예를 들어, 복수) 의 하기 주에 측정될 수 있다: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 80, 90, 100, 등.
추가의 구현예에서, 점막 치유의 평가 또는 측정 방법은 샘플에 존재하는 점막 치유 마커의 수준을 지수 값 또는 컷오프 값 또는 참조 값 또는 역치 값에 비교하는 것을 추가로 포함하며, 상기 값보다 높은 또는 낮은 점막 치유 마커의 수준은 대상이 점막 치유를 겪을 또는 점막 치유를 겪지 않을 가능성이 증가됨 또는 더 높음을 예측 또는 시사한다. 당업자는 지수 값 또는 컷오프 값 또는 참조 값 또는 역치 값의 단위가 측정되고 있는 관심의 마커에 따라 예컨대 ㎎/㎖, ㎍/㎖, ng/㎖, pg/㎖, fg/㎖, EU/㎖, 또는 U/㎖ 임을 이해할 것이다.
일부 구현예에서, 점막 치유 지수는 복수의 점막 치유 마커의 분석에 기초하는 경험적으로 유래된 지수를 포함한다. 하나의 양상에서, 마커의 농도 또는 그들의 측정된 농도 값은 컴퓨터에 상주하는 알고리즘에 의해 지수로 변환된다. 특정 양상에서, 지수는 생물학적 데이타를 수치적 용어로 표현하는 합성 또는 인간 유래 아웃풋, 점수, 또는 컷오프 값(들)이다. 지수를 사용하여 임상 결정을 내리거나 확정 또는 지원할 수 있다. 점막 치유 지수는 시간의 흐름에 따라 여러 번 측정될 수 있다. 하나의 양상에서, 알고리즘은 알려진 샘플로 훈련된 후, 알려진 동일성의 샘플로 검정될 수 있다.
일부 구현예에서, 점막 치유 지수 대조군은 건강한 개체, 또는 질환 상태로부터 건강한 상태로 진행한 개체에서 유래된 점막 치유 지수이다. 대안적으로는, 대조군은 심한 질환 상태의 덜 심한 질환 상태 또는 건강한 상태로의 시간 경과를 나타내는 지수일 수 있다.
일부 구현예에서, 요법의 과정의 결정 등은 경험적으로 유래된 지수, 점수 또는 분석을 사용하는 선택 예를 들어, 약물 투여량의 선택, 적당한 약물, 또는 요법의 과정 또는 길이, 요법 양생법, 또는 기존 약물 또는 투여량의 유지의 선택을 포함한다. 특정 양상에서, 유래된 또는 측정된 지수를 사용하여 요법의 과정을 결정할 수 있다.
일부 구현예에서, 점막 치유는 내시경검사에 의해 평가 또는 모니터링될 수 있다. 내시경검사의 비제한적 예는 비디오 캡슐 내시경검사 (캡슐 내시경검사), 일회용 내시경검사, 및 3D 내시경검사를 포함한다. 다른 구현예에서, 점막 치유 지수는 내시경검사에 의해 모니터링 또는 확인된다.
일부 구현예에서, 적당한 요법의 선별은 대상을 위한 요법의 과정의 후속 투여량의 유지, 증가, 또는 감소를 포함한다. 다른 구현예에서, 방법은 대상을 위한 요법의 상이한 과정의 결정을 추가로 포함한다. 특정 경우에, 요법의 상이한 과정은 상이한 항-TNFα 항체를 이용하는 처리를 포함한다. 다른 경우에, 요법의 상이한 과정은 현재의 요법의 과정과 함께 또다른 치료제, 예컨대, 이에 제한되는 것은 아니나, 면역억제제, 코르티코스테로이드, 상이한 메카니즘을 표적화하는 약물, 영양 요법, 및 그들의 조합을 포함한다.
일부 구현예에서, 적당한 요법의 선별은 초기 처리를 위한 적당한 요법의 선별을 포함한다. 일부 경우에, 요법은 항-TNFα 항체 요법을 포함한다.
특정 구현예에서, 본원에 개시된 방법은 제안된 새로운 약물 또는 치료제가 승인된 약물 제품과 동일 또는 충분히 유사하여, 제안된 새로운 약물이 "바이오시밀러 치료제" 로서 사용될 수 있음의 확인하는데 사용될 수 있다. 예를 들어, 제안된 새로운 약물이 브랜드 있는 약물 제품과 비교시 오직 약간 상이한 질환 활성 프로파일을 갖는 경우, 이는 본원에 개시된 방법을 사용하여 명백할 것이다. 제안된 새로운 약물이 브랜드 있는 약물 제품과 비교시 유의하게 상이한 질환 활성 프로파일을 갖는 경우, 그때 새로운 약물은 바이오시밀러가 아닐 것이다. 유리하게는, 본원에 개시된 방법은 제안된 새로운 약물의 임상 시험에서 약물의 효과적 치료 효능 또는 가치를 평가하기 위해 사용될 수 있다.
따라서, 일부 양상에서, 발명의 방법은, 예를 들어, 초기 처리를 위한 적당한 항-TNF 요법을 선별함으로써, 언제 또는 어떻게 항-TNF 약물의 후속 투여량을 조정 또는 수정 (예를 들어, 증가 또는 감소) 할지를 결정함으로써, 언제 또는 어떻게 항-TNF 약물 (예를 들어, 초기, 증가된, 감소된, 또는 동일한 투여량에서) 을 하나 이상의 면역억제제 예컨대 메토트렉세이트 (MTX) 또는 아자티오프린 (AZA) 과 조합할지를 결정함으로써, 및/또는 언제 또는 어떻게 현재의 요법의 과정을 변화 (예를 들어, 상이한 항-TNF 약물로 또는 상이한 메카니즘을 표적화하는 약물 예컨대 IL-6 수용체-저해 모노클로날항체, 항-인테그린 분자 (예를 들어, 티사브리, 베달루주맙), JAK-2 저해인자, 및 티로신 키나제 저해인자로, 또는 영양 요법 (예를 들어, 특별 탄수화물식) 으로 전환) 시킬지를 결정함으로써, 항-TNF 약물 요법을 받고 있는 또는 이제 막 받으려는 환자를 위해 치료 결정을 안내하는데 유용한 정보를 제공한다.
다른 구현예에서, 본 발명의 방법을 사용하여 자가면역 장애 (예를 들어, 류머티스성 관절염, 크론병, 궤양성 대장염 등) 를 갖는 대상에서 TNFα 저해인자에 대한, 특히 항-TNFα 항체에 대한 응답성을 예측할 수 있다. 이 방법에서, 대상을 항-TNFα 항체의 적절한 또는 치료적 투여량, 즉, 치료적 농도 수준에 대해 검정함으로써, 개체가 요법에 응답성일지 여부를 예측하는 것이 가능하다.
또다른 구현예에서, 본 발명은 IBD 장애를 갖는 대상에서의 IBD (예를 들어, 크론병 및 궤양성 대장염) 의 모니터링 방법으로서, 시간의 흐름에 따라, 대상을 항-TNFα 항체의 적절한 또는 치료적 투여량, 즉, 치료적 농도 수준에 대해 검정하는 것을 포함하는 방법을 제공한다. 이러한 방식으로, 소정의 기간 동안 개체가 요법에 응답성일지 여부를 예측하는 것이 가능하다.
특정 구현예에서, 단계 (a) 는 샘플 중 2 이상, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40, 50, 또는 그 이상의 마커의 존재 및/또는 수준의 확인을 포함한다.
다른 구현예에서, 알고리즘은 학습 통계 분류기 시스템을 포함한다. 일부 경우에, 학습 통계 분류기 시스템은 랜덤 포레스트, 분류 및 회귀 트리, 부스티드 트리, 신경 네트워크, 서포트 벡터 머신, 일반 카이 제곱 자동 상호작용 디텍터 모델, 인터랙티브 트리, 다중적응식 회귀 스플라인, 기계 학습 분류기, 및 그들의 조합으로 이루어지는 군으로부터 선택된다. 특정 경우에, 통계적 알고리즘은 단일 학습 통계 분류기 시스템을 포함한다. 특정 다른 경우에, 통계적 알고리즘은 둘 이상의 학습 통계 분류기 시스템의 조합을 포함한다. 일부 경우에, 둘 이상의 학습 통계 분류기 시스템은 직렬로 적용된다. 본 발명에 사용하기에 적합한 통계적 알고리즘 및 분석의 비제한적 예는 2011 년 10 월 18 일자에 출원된 국제 출원 번호 PCT/US2011/056777 에 기술되어 있으며, 상기의 공개는 모든 목적을 위해 전문이 참조로 본원에 포함된다.
다른 구현예에서, 단계 (b) 는 요법의 과정 동안 더 이른 시간에 측정된 하나 이상의 점막 치유 마커의 존재 및/또는 수준에 통계적 알고리즘을 적용하여 더 이른 점막 치유 지수를 생성하는 것을 추가로 포함한다. 일부 경우에, 더 이른 점막 치유 지수는 단계 (b) 에서 생성된 점막 치유 지수와 비교되어 요법의 과정의 후속 투여량 또는 요법의 상이한 과정이 투여되어야 하는지 여부가 결정된다. 특정 구현예에서, 요법의 과정의 후속 투여량은 단계 (b) 에서 생성된 점막 치유 지수에 기초하여 증가, 감소, 또는 유지된다. 일부 경우에, 요법의 상이한 과정은 상이한 항-TNFα 항체를 포함한다. 다른 경우에, 요법의 상이한 과정은 현재의 요법의 과정과 함께 면역억제제를 포함한다.
일부 구현예에서, 단계 (b) 는 더 이른 시간에 측정된 하나 이상의 점막 치유 마커의 존재 및/또는 수준에 통계적 알고리즘을 적용하여 더 이른 질환 활성/중증도 지수를 생성하는 것을 추가로 포함한다. 특정 경우에, 점막 치유 지수는 단계 (b) 에서 생성된 점막 치유 지수와 비교되어 TNF-매개 질환 또는 장애의 과정이 예측된다.
일부 구현예에서, 방법은 단계 (d) 의 선택 또는 결정으로부터의 결과를 임상의에게 보내는 것을 추가로 포함한다. 다른 구현예에서, 단계 (d) 는 대상을 위해 초기 요법의 과정의 선별을 포함한다.
일단 본원에 기재된 방법에 따라 TNF 가 병리생리학에 연루되었음이 시사된 질환 및 장애, 예를 들어, 이에 제한되는 것은 아니나, 쇼크, 패혈증, 감염, 자가면역 질환, RA, 크론병, 이식 거부 및 이식편 대 숙주 질환으로 진단된 대상에서 항-TNF 약물 요법을 받고 있는 대상의 진단 또는 예후가 확인되거나 또는 항-TNF 약물에 대한 응답의 가능성 예측되면, 본 발명은 진단, 예후, 또는 예측에 기초하여 요법의 과정을 추천하는 것을 추가로 포함할 수 있다. 특정 경우에, 본 발명은 TNF-매개 질환 또는 장애와 연관되는 하나 이상의 징후의 치료에 유용한 치료적 유효량의 항-TNFα 약물을 대상에게 투여하는 것을 추가로 포함할 수 있다. 치료적 적용을 위해, 항-TNF 약물은 단독으로 투여되거나 또는 하나 이상의 부가적 항-TNF 약물 및/또는 항-TNF 약물과 연관되는 부작용을 감소시키는 하나 이상의 약물 (예를 들어, 면역억제제) 과 조합되어 동시투여될 수 있다. 그와 같이, 본 발명은 유리하게는 올바른 약물이 올바른 환자에게 올바른 시간에 제공되도록 치료 결정을 안내하고 요법 선택 및 항-TNFα 약물에 대한 최적화를 통지함으로써 임상의가 "개인화된 약제" 를 실행하는 것을 가능하게 해준다.
본 발명이 유리한 이유는 항-TNF 약물 요법을 받고 있는 또는 이제 막 받으려는 환자에 대한 치료 결정을 안내하는데 유용한 정보를 제공함으로써, 부분적으로,항-TNF 약물 예컨대 인플릭시맙의 투여와 연관되는 현재의 제한을 다루고 극복하기 때문이 유리하다. 특히, 본 발명의 방법은 초기 처리를 위한 적당한 항-TNF 요법의 선별, 언제 또는 어떻게 항-TNF 약물의 후속 투여량을 치료 효능 최적화 및/또는 독성 감소를 위해 조정 또는 수정 (예를 들어, 증가 또는 감소) 할지의 결정, 언제 또는 어떻게 항-TNF 약물 (예를 들어, 초기, 증가된, 감소된, 또는 동일한 투여량에서) 을 하나 이상의 면역억제제 예컨대 메토트렉세이트 (MTX) 또는 아자티오프린 (AZA) 과 조합할지의 결정, 및/또는 언제 또는 어떻게 현재의 요법의 과정을 변화 (예를 들어, 상이한 항-TNF 약물로 또는 상이한 메카니즘을 표적화하는 약물로 전환) 시킬지의 결정에서 유용하다.
따라서, 본 발명은 치료 결정을 안내함으로써 환자 관리를 개선하는 하기 방법에 특히 유용하다:
1. 크론병 예측: 요법으로부터 이익을 얻을 가능성이 가장 높은 환자를 치료
2. 항-치료 항체 모니터링 (ATM) + 바이오마커-기반 질환 활성 프로파일링
3. ATM 하위-계층화
4. 약물동태학적 모델링에 의한 ATM
5. 응답을 모니터링하고 악화 위험을 예측:
a. 재발 위험이 낮은 환자에서 만성 유지 요법을 회피
b. 점막 치유의 마커
c. 요법 선택: 항-TNF 약물 요법을 면역억제제 예컨대 MTX 또는 AZA 와 조합할지 여부
6. 생물제제에 대한 환자 선택.
일부 구현예에서, 본 발명은 개체를 위한 크론병 관리에 대한 염증 지수를 측정하여 요법을 최적화하고, 항-TNF 치료제에 대한 응답을 예측하는 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 개체로부터의 샘플 중 항-TNF 치료제 및 자가항체를 크로마토그래피로 측정하여 그들의 농도 수준을 확인하는 단계;
(b) 개체로부터의 샘플 중 항-TNF 치료제 및 자가항체를 크로마토그래피로 측정하여 그들의 농도 수준을 확인하는 단계;
(c) 측정된 값을 효능 스케일에 비교하여 요법을 최적화하고, 항-TNF 치료제에 대한 응답을 예측하는 단계.
일부 구현예에서, 본 발명은 처리 과정 동안 항-TNF 치료제의 농도가 역치 값 미만으로 하락할 가능성의 예측 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 1) GM-CSF; 2) IL-2; 3) TNF-α; 4) sTNFRII; 및 5) 소장에 위치하는 질환으로 이루어지는 군으로부터 선택되는 마커의 패널을 측정하는 단계; 및
(b) 마커의 농도에 기초하여 항-TNFα 치료제의 농도가 역치 미만으로 하락할 가능성을 예측하는 단계.
오직 설명을 목적으로, 실시예 5 는 본 발명의 예시적 구현예를 들어, 특히 항-TNF 치료제의 농도가 역치 값 미만으로 하락할 가능성의 예측 방법을 보여준다.
일부 구현예에서, 본 발명은 처리 과정 동안 항-TNF 치료제의 농도가 역치 값 미만으로 하락할 가능성의 예측 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 1) GM-CSF; 2) IL-2; 3) TNF-α; 4) sTNFRII; 및 5) 소장에 위치하는 질환으로 이루어지는 군으로부터 선택되는 마커의 패널을 측정하는 단계; 및
(b) 마커의 농도에 기초하여 항-TNF 치료제의 농도가 역치 미만으로 하락할 가능성을 예측하는 단계.
다른 구현예에서, 본 발명은 항-TNF 요법 중인 개체에서 항-약물 항체가 발생할 가능성의 예측 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) t EGF, VEGF, IL-8, CRP 및 VCAM-1 로 이루어지는 군으로부터 선택되는 마커의 패널을 측정하는 단계; 및
(b) 마커 수준의 농도에 기초하여 항-TNF 요법 중인 개체에서 항-약물 항체가 발생할 가능성을 예측하는 단계.
오직 설명을 목적으로, 실시예 4 는 본 발명의 예시적 구현예이고, 인플릭시맙 (ATI) 에 대한 항-약물 항체의 탐지를 보여준다.
다른 구현예에서, 본 발명은 인플릭시맙 치료 양생법의 모니터링 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) 인플릭시맙 및 인플릭시맙에 대한 항약물 항체 (ATI) 를 측정하는 단계;
(b) 염증 마커 CRP, SAA, ICAM, VCAM 을 측정하는 단계;
(c) 조직 복구 마커 VEGF 를 측정하는 단계; 및
(d) 측정과 치료 효능의 상관관계를 보여주는 단계.
오직 설명을 목적으로, 실시예 5 는 본 발명의 예시적 구현예이고, IFX 치료 양생법의 모니터링 방법을 보여준다.
다른 구현예에서, 본 발명은 개체가 조합 요법에 대한 후보인지 여부를 결정하는 방법으로서, 상기 개체에게 인플릭시맙이 투여되고 있고, 하기 단계를 포함하는 방법을 제공한다:
(a) 상기 개체 중 ATI 의 존재 또는 부재를 측정하는 단계; 및
(b) 유의한 수준의 ATI 를 갖는 개체에게 면역억제제 (예를 들어, MTX) 를 투여하는 단계.
또다른 구현예에서, 방법은 ATI 의 존재를 시사하는 CRP 의 농도 수준을 측정하는 것을 또한 포함한다. 오직 설명을 목적으로, 실시예 6 및 7 은 ATI 의 존재 및 부재가 Remicade 요법의 응답자 및 비-응답자를 예측함을 보여준다. 실시예 6 및 7 은 예시적 구현예이다.
또다른 구현예에서, 본 발명은 크론병 활성의 모니터링 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
(a) VEGF (pg/㎖), CRP (ng/㎖), SAA (ng/㎖), ICAM (ng/㎖) 및 VCAM (ng/㎖) 을 포함하는 마커의 패널의 측정을 포함하는 염증 지수를 결정하는 단계; 및
(b) 지수를 효능 스케일에 비교하여 질환을 모니터링 및 관리하는 단계.
오직 설명을 목적으로, 실시예 9 는 예시적 구현예이고, 염증 지수의 용도를 보여준다.
특정 구현예에서, 본 발명은 C-반응성 단백질 (CRP) 수준에 의해 측정되는 질환 활성을 가장 잘 구별할 수 있는 항-TNF 약물 예컨대 IFX 의 역치를 결정하는 방법을 제공한다. 오직 설명을 목적으로, 실시예 12 는 3 ㎍/㎖ 의 역치에서 분기된 IFX 가 CRP 에 의해 구별될 수 있음을 보여준다. 특정 경우에, 랜덤 IFX < 3 및 IFX ≥ 3 ㎍/㎖ 혈청 샘플은 74 % 비율로 IFX < 3 ㎍/㎖ 에서 더 높은 CRP 를 갖는다 (ROC AUC). 실시예 12 는 또한 ATI+ 샘플 쌍에서, IFX 군 (3 ㎍/㎖ 초과 및 미만) 사이에 CRP 의 유의한 차이가 관찰되지 않았음을 보여준다. 특히, CRP 수준은 일반적으로 ATI+ 샘플 쌍에서 더 높았고, CRP 수준은 ATI- 샘플에 대한 IFX < 3 ㎍/㎖ 에서 더 높았다. 회귀는 CRP 가 ATI 와 양성적으로 관련되고, IFX 와 음성적으로 관련됨을 확인해줬다. 그와 같이, 상호작용은 ATI+ 및 ATI- 사이에 상이한 CRP-IFX 관계에 해당한다.
IV. 점막 치유 지수
본 발명의 방법은 요법 응답의 모니터링 및 악화 위험의 예측을 포함한다. 일부 구현예에서, 방법은 점막 치유 마커의 존재 및/또는 수준을 탐지, 측정 및/또는 확인하는 것을 포함한다.
장 점막은 영양분 소화, 흡수 및 대사에 더하여 장벽 방어에 있어서 핵심 역할을 수행한다. 장 상피 세포 증식, 이주, 및 세포자멸사의 동적 과정은 전반적 영양 상태, 급식 경로, 및 식사 중 특정 영양분의 적정성에 의해 크게 영향을 받는다. 그러나, 장의 염증성 질환으로, 점막 세포 장애는 점막 손상 또는 상해를 초래할 수 있고, 이로써 거대분자에 대한 증가된 투과성, 내강으로부터 증가된 박테리아 위치변경, 및 상피 세포 세포자멸사의 자극을 초래한다.
점막 손상은 거시적 수준에서부터 분자 수준에까지 이르는 다면적인 생리적 과정이다. 점막 손상은 내시경검사 동안 탐지가능한 육안으로 보이는 점막 병변의 형성, 미시적 조직 수준에서 육아종 형성 및 근육층의 파괴, 세포 수준에서 상피 세포자멸사 및 활성화된 염증성 및 림프구 세포의 침윤, 세포 이하 수준에서 증가된 상피 투과성, 및 분자 수준에서 간극 연접 파괴를 포함한다.
점막 손상은 아마도 내생적 및 환경 인자의 조합에 의해 개시될 것이다. 첫번째 시기에서, 식품-유래 화합물, 바이러스 및 박테리아-유래 인자, 뿐만 아니라 숙주-유래 인자는 상피 세포 파괴 및 선천 및 적응 면역의 활성화를 야기할 수 있다고 여겨진다. 손상된 점막은 초기에 호중구, 호산구, 비만 세포, 염증성 단핵구, 활성화된 마크로파지 및 수지상 세포로 이루어지는 다양한 염증 세포 에 의해 침윤된다. 장내 세균총에 대한 특이적 적응 면역 응답이 발생되어, 염증이 생긴 점막에 대한 활성화된 B 세포, CD4+ 및 CD8+ T 세포의 더 늦은 동원을 초래한다. 호중구는 세포외 기질 붕괴를 초래할 수 있 엘라스타제를 분비한다. 마찬가지로, T 세포, 마크로파지 및 장 섬유아세포는 염증 인자 예컨대 IL-1, IL-2, IL-6, IL-14, IL-17, TGFβ 및 TNFα 를 발현하며, 이들은 세포외 기질 붕괴, 상피 손상, 내피 활성화, 및/또는 섬유증 협착 형성을 초래한다. 점막 손상의 마커의 비제한적 예는 기질 메탈로프로테아제 (MMPs) 및 산화 스트레스의 마커 (예를 들어, iNOS, 반응성 산소 대사물질) 를 포함한다.
A. 점막 치유 마커의 어레이
성장 인자를 포함하는 여러 가지 점막 마커가 요법 선별, 요법 최적화, 독성 감소, 및/또는 하나 이상의 치료제 예컨대 생물제제 (예를 들어, 항-TNF 약물) 를 사용하는 치료적 처리의 효능의 모니터링에 의한 본 발명에서의 개인화된 치료적 관리 방법에서 특히 유용하다. 특정 구현예에서, 본원에 기재된 방법은 하나 이상의 (복수의) 점막 치유 마커 예컨대 성장 인자 (예를 들어, 단독으로 또는 다른 범주로부터의 바이오마커와의 조합으로) 에 기초하는 점막 치유 지수의 확인을 이용하여 질환 과정의 예측, 적당한 항-TNF 약물 요법의 선별, 항-TNF 약물 요법의 최적화, 항-TNF 약물 요법과 연관되는 독성의 감소, 및/또는 항-TNF 약물을 이용하는 치료적 처리의 효능의 모니터링을 지원 또는 보조한다.
그와 같이, 특정 구현예에서, 본 발명에서 샘플 중 하나 이상의 성장 인자의 존재 및/또는 수준의 확인이 유용하다. 본원에서 사용되는 용어 "성장 인자" 는 세포 증식 및/또는 세포 분화를 자극할 수 있는 임의의 여러 가지 펩티드, 폴리펩티드, 또는 단백질을 포함한다.
일부 구현예에서, 점막 치유 마커는 성장 인자, 염증 마커, 세포 부착 마커, 사이토카인, 항-염증 마커, 매트릭스 메탈로프로티나제, 산화 스트레스 마커, 및/또는 스트레스 응답 마커를 포함하나, 이에 제한되는 것은 아니다.
일부 구현예에서, 점막 치유 마커는 성장 인자를 포함한다. 성장 인자의 비제한적 예는 암피레굴린 (AREG), 에피레굴린 (EREG), 헤파린 결합 표피 성장 인자 (HB-EGF), 간세포 성장 인자 (HGF), 헤레굴린-β1 (HRG) 및 동종형, 뉴레굴린 (NRG1, NRG2, NRG3, NRG4), 베타셀룰린 (BTC), 표피 성장 인자 (EGF), 인슐린 성장 인자-1 (IGF-1), 형질전환 성장 인자 (TGF), 혈소판-유래 성장 인자 (PDGF), 혈관 내피 성장 인자 (VEGF-A, VEGF-B, VEGF-C, VEGF-D), 줄기 세포 인자 (SCF), 혈소판 유래 성장 인자 (PDGF), 가용성 fms-유사 티로신 키나제 1 (sFlt1), 태반 성장 인자 (PIGF, PLGF 또는 PGF), 섬유아세포 성장 인자 (FGF1, FGF2, FGF7, FGF9), 및 그들의 조합을 포함한다. 다른 구현예에서, 점막 치유 마커는 색소 상피-유래 인자 (PEDF, 또한 SERPINF1 로서도 알려짐), 엔도텔린-1 (ET-1), 케라티노사이트 성장 인자 (KGF; 또한 FGF7 로서도 알려짐), 뼈형성 단백질 (예를 들어, BMP1-BMP15), 혈소판-유래 성장 인자 (PDGF), 신경 성장 인자 (NGF), β-신경 성장 인자 (β-NGF), 신경영양 인자 (예를 들어, 뇌-유래 신경영양 인자 (BDNF), 뉴로트로핀 3 (NT3), 뉴로트로핀 4 (NT4), 등), 성장 분화 인자-9 (GDF-9), 과립구-콜로니 자극 인자 (G-CSF), 과립구-마크로파지 콜로니 자극 인자 (GM-CSF), 미오스타틴 (GDF-8), 에리트로포이에틴 (EPO), 트롬보포이에틴 (TPO), 및 그들의 조합을 또한 포함한다.
다른 구현예에서, 점막 치유 마커는 사이토카인을 또한 포함한다. 점막 치유 지수를 확립하는데 사용될 수 있는 사이토카인의 비제한적 예는 bFGF, TNF-α, IL-10, IL-12(p70), IL-1β, IL-2, IL-6, GM-CSF, IL-13, IFN-γ, TGF-β1, TGF-β2, TGF-β3, 및 그들의 조합을 포함한다. 세포 부착 마커의 비제한적 예는 SAA, CRP, ICAM, VCAM, 및 그들의 조합을 포함한다. 항-염증 마커의 비제한적 예는 IL-12p70, IL-10, 및 그들의 조합을 포함한다.
일부 구현예에서, 점막 치유 마커는 본원에 기술된 염증 마커 및 혈청학 마커를 포함하는 위장관에 특이적인 마커를 포함한다. 비제한적 예는 박테리아 항원 예컨대, 예를 들어, OmpC, 플라젤린 (cBir-1, Fla-A, Fla-X, 등), I2, 및 기타 (pANCA, ASCA, 등) 에 대한 항체; 항-호중구 항체, 항-사카로마이세스 세레비시애 항체, 및 항-미생물 항체를 포함한다.
샘플 중 산화 스트레스 마커의 확인이 또한 본 발명에서 유용하다. 산화 스트레스 마커의 비제한적 예는 단백질-기반 또는 DNA-기반의 것을 포함하며, 이들은 각각 단백질 산화 및 DNA 분절화 측정으로 탐지될 수 있다. 산화 스트레스 마커의 기타 예는 유기 화합물 예컨대 말론디알데히드를 포함한다.
산화 스트레스는 반응성 산소 종들의 생산 및 출현 및, 반응성 중간체들을 즉시 해독하고 결과적인 손상을 복구하는 생물학적 시스템의 능력 사이의 불균형을 나타낸다. 조직의 정상적인 산화환원 상태의 교란은 단백질, 지질 및 DNA 를 포함하는 세포의 모든 성분을 손상시키는 과산화물 및 자유 라디칼의 생산을 통해 독성 효과를 초래할 수 있다. 일부 응답성 산화 종들은 심지어 산화환원 신호전달로 호칭되는 현상을 통해 메신저로 작용할 수 있다.
특정 구현예에서, 응답성 산화 대사물들의 유도체 (DROM), 환원된 글루타티온으로 산화되는 비율 (Eh GSH), 및/또는 환원된 시스테인의 비율 (Eh CySH) 이 산화 스트레스의 정량화에 이용될 수 있다. 참고, 예를 들어 Neuman et al, Clin. Chem., 53: 1652-1657 (2007). 티로신 포스파타아제 및 티오레옥신-관련 단백질과 같은 단백질 중 고반응성 시스테인 잔기의 산화적 수식이 또한 예를 들어 질량 분광법 (MS) 와 같은 기법을 이용해 탐지 또는 측정될 수 있다. 참고, 예를 들어 Naito et al, Anti-Aging Medicine, 7 (5):36-44 (2010). 산화 스트레스의 기타 마커는 예를 들어, Uchida 등, PNAS, 95 (9) 4882-4887 (1998) 에 기술된 바와 같은 단백질-결합 아크롤레인, 유기 히드로퍼옥시드의 수준을 반영하는 자유 산소 라디칼 테스트 (FORT), 및 환원된 글루타티온/글루타티온 디설파이드 커플의 산화환원 퍼텐셜, (Eh) GSH/GSSG 를 포함한다. 참고, 예를 들어 Abramson 등, Atherosclerosis, 178(1): 115-21 (2005)..
일부 구현예에서, 매트릭스 메탈로프로티나제 (MMPs) 는 모든 유형의 ECM 단백질을 붕괴하는 능력이 있는 Zn2+-의존적 세포외 기질 (ECM) 붕괴 엔도펩티다제의 패밀리의 구성원을 포함한다. MMP 의 비제한적 예는 MMP-1, MMP-2, MMP-3, MMP-7, MMP-8, MMP-9, MMP-12, MMP-13, MT1-MMP-1, 및 그들의 조합을 포함한다. MMP-3 및 MMP-9 가 CD 환자에서의 점막 손상 및 누공과 연관됨이 밝혀졌다 (Baugh 등, Gastroenterology, 117: 814-822, (1999); Bailey 등, J. Clin. Pathol., 47: 113-116 (1994)). 일부 구현예에서, 스트레스 응답 마커는 산화 스트레스의 마커, 예컨대 반응성 산소 종 (ROS), 슈퍼옥사이드 디스뮤테이스 (SOD), 카탈라제 (CAT), 및 글루타티온, 및 소포체 (ER) 스트레스의 마커를 포함한다. 산화 스트레스의 마커의 비제한적 예는 단백질-기반 또한 DNA-기반인 것을 포함하며, 이들은 각각 단백질 산화 및 DNA 분절화를 측정함으로써 탐지될 수 있다. 다른 구현예에서, 점막 치유 마커는 산화적 DNA 및/또는 단백질 손상의 마커를 추가로 포함한다. ER 스트레스 마커의 비제한적 예는 접히지 않은 단백질 응답의 마커 (예를 들어, ATF6, HSPA5, PDIA4, XBP1, IRE1, PERK, EIF2A, GADD34, GRP-78, 인산화된 JNK, 카스파제-12, 카스파제-3, 및 그들의 조합) 를 포함한다.
인간 암피레굴린 (AREG) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_001648.1 및 XP_001125684.1 에 제시되어 있다. 인간 AREG mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_001657.2 및 XM_001125684.3 에 제시되어 있다. 당업자는 AREG 이 또한 AR, 결장직장 세포-유래 성장 인자, CRDGF, SDGF, 및 AREGB 로서 알려져 있음을 인식할 것이다.
인간 에피레굴린 (EREG) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_001423.1 에 제시되어 있다. 인간 EREG mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_001432.2 에 제시되어 있다. 당업자는 EREG 이 또한 EPR 로서 알려져 있음을 인식할 것이다.
인간 헤파린-결합 EGF-유사 성장 인자 (HB-EGF) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_001936.1 에 제시되어 있다. 인간 HB-EGF mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_001945.2 에 제시되어 있다. 당업자는 HB-EGF 이 또한 디프테리아 독소 수용체, DT-R, HBEGF, DTR, DTS, 및 HEGFL 로서 알려져 있음을 인식할 것이다.
인간 간세포 성장 인자 (HGF) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_000592.3, NP_001010931.1, NP_001010932.1, NP_001010933.1, 및 NP_001010934.1 에 제시되어 있다. 인간 HGF mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_000601.4, NM_001010931.1, NM_001010932.1, NM_001010933.1 및 NM_001010934.1 에 제시되어 있다. 당업자는 HGF 이 또한 산란 인자, SF, HPTA 및 헤파토포이에틴-A 로서 알려져 있음을 인식할 것이다. 당업자는 또한 HGF 이 모든 동종형 변이체를 포함함을 인식할 것이다.
인간 뉴레굴린-1 (NRG1) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호, NP_001153467.1, NP_001153471.1, NP_001153473.1, NP_001153477.1, NP_039250.2, NP_039251.2, NP_039252.2, NP_039253.1, NP_039254.1, NP_039256.2, 및 NP_039258.1 에 제시되어 있다. 인간 NRG1 mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_001159995.1, NM_001159999.1, NM_001160001.1, NM_001160005.1, NM_013956.3, NM_013957.3, NM_013958.3, NM_013959.3, NM_013960.3, NM_013962.2, 및 NM_013964.3 에 제시되어 있다. 당업자는 NRG1 이 또한 GGF, HGL, HRGA, NDF, SMDF, ARIA, 아세틸콜린 수용체-유도 활성, 유방암 세포 분화 인자 p45, 신경교 성장 인자, 헤레굴린, HRG, neu 분화 인자, 및 감각 및 운동 뉴런-유래 인자로서 알려져 있음을 인식할 것이다. 당업자는 또한 NRG1 이 모든 동종형 변이체를 포함함을 인식할 것이다.
인간 뉴레굴린-2 (NRG2) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_001171864.1, NP_004874.1, NP_053584.1, NP_053585.1 및 NP_053586.1 에 제시되어 있다. 인간 NRG2 mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_001184935.1, NM_004883.2, NM_013981.3, NM_013982.2 및 NM_013983.2 에 제시되어 있다. 당업자는 NRG2 이 또한 NTAK, ERBB 키나제에 대한 신경- 및 흉선-유래 활성인자, DON-1, 및 뉴레굴린-1 의 분지로서 알려져 있음을 인식할 것이다. 당업자는 또한 NRG2 가 모든 동종형 변이체를 포함함을 인식할 것이다.
인간 뉴레굴린-3 (NRG3) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_001010848.2 및 NP_001159445.1 에 제시되어 있다. 인간 NRG3 mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_001010848.3 및 NM_001165973.1. 에 제시되어 있다. 당업자는 NRG2 가 모든 동종형 변이체를 포함함을 인식할 것이다.
인간 뉴레굴린-4 (NRG4) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_612640.1 에 제시되어 있다. 인간 NRG4 mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_138573.3 에 제시되어 있다. 당업자는 NRG4 이 모든 동종형 변이체를 포함함을 인식할 것이다.
인간 베타셀룰린 (BTC) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_001720.1 에 제시되어 있다. 인간 BTC mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_001729.2 에 제시되어 있다. 당업자는 BTC 가 모든 동종형 변이체를 포함함을 인식할 것이다.
인간 표피 성장 인자 (EGF) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_001954.2 및 NP_001171602.1 에 제시되어 있다. 인간 EGF mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_001963.4 및 NM_001178131.1 에 제시되어 있다. 당업자는 EGF 이 또한 베타-우로가스트론, 우로가스트론, URG, 및 HOMG4 로서 알려져 있음을 인식할 것이다.
인간 인슐린-유사 성장 인자 (IGF) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_000609.1 및 NP_001104755.1 에 제시되어 있다. 인간 IGF mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_000618.3 및 NM_001111285.1 에 제시되어 있다. 당업자는 IGF 가 모든 동종형 변이체를 포함함을 인식할 것이다. 당업자는 또한 IGF 가 또한 메카노 성장 인자, MGF 및 소마토메딘-C 로서 알려져 있음을 인식할 것이다.
인간 형질전환 성장 인자 알파 (TGF-α) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_003227.1 및 NP_001093161.1 에 제시되어 있다. 인간 TGF-α mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_003236.3 및 NM_001099691.2 에 제시되어 있다. 당업자는 TGF-α 이 모든 동종형 변이체를 포함함을 인식할 것이다. 당업자는 또한 TGF-α 이 또한 EGF-유사 TGF, ETGF, 및 TGF 타입 1 로서 알려져 있음을 인식할 것이다.
인간 혈관 내피 성장 인자 (VEGF-A) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_001020537, NP_001020538, NP_001020539, NP_001020540, NP_001020541, NP_001028928, 및 NP_003367 에 제시되어 있다. 인간 VEGF-A mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_001025366, NM_001025367, NM_001025368, NM_001025369, NM_001025370, NM_001033756, 및 NM_003376 에 제시되어 있다. 당업자는 VEGF-A 이 또한 VPF, VEGFA, VEGF, 및 MGC70609 로서 알려져 있음을 인식할 것이다. 당업자는 VEGF-A 이 모든 동종형 변이체를 포함함을 인식할 것이다.
인간 혈관 내피 성장 인자 (VEGF-B) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_001230662, 및 NP_003368 에 제시되어 있다. 인간 VEGF-B mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_001243733 및 NM_003377 에 제시되어 있다. 당업자는 VEGF-B 이 또한 VEGFB, VEGF-관련 인자, 및 VRF 로서 알려져 있음을 인식할 것이다. 당업자는 VEGF-B 이 모든 동종형 변이체를 포함함을 인식할 것이다.
인간 혈관 내피 성장 인자 (VEGF-C) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_005420 에 제시되어 있다. 인간 VEGF-C mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_005429 에 제시되어 있다. 당업자는 VEGF-C 가 또한 Flt4 리간드, Flt4-L, VRP 및 혈관 내피 성장 인자-관련 단백질로서 알려져 있음을 인식할 것이다. 당업자는 VEGF-C 가 모든 동종형 변이체를 포함함을 인식할 것이다.
인간 섬유아세포 성장 인자 1 (FGF1) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_000791, NP_001138364, NP_001138406, NP_001138407, NP_001138407, NP_149127, 및 NP_149128 에 제시되어 있다. 인간 FGF1 mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_000800, NM_001144892, NM_001144934, NM_001144934, NM_001144935, NM_033136 및 NM_033137 에 제시되어 있다. 당업자는 FGF1 이 또한 FGFA, FGF-1, 산성 섬유아세포 성장 인자, aFGF, 내피 세포 성장 인자, ECGF, 헤파린-결합 성장 인자 1, 및 HB-EGF1 로서 알려져 있음을 인식할 것이다. 당업자는 FGF1 이 모든 동종형 변이체를 포함함을 인식할 것이다.
인간 염기성 섬유아세포 성장 인자 (bFGF) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_001997.5 에 제시되어 있다. 인간 bFGF mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_002006.4 에 제시되어 있다. 당업자는 bFGF 이 또한 FGF2, FGFB, 및 HBGF-2 로서 알려져 있음을 인식할 것이다.
인간 섬유아세포 성장 인자 7 (FGF7) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_002000.1 에 제시되어 있다. 인간 FGF7 mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_002009.3 에 제시되어 있다. 당업자는 FGF7 이 또한 FGF-7, HBGF-7 및 케라티노사이트 성장 인자로서 알려져 있음을 인식할 것이다.
인간 섬유아세포 성장 인자 9 (FGF9) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_002001.1 에 제시되어 있다. 인간 FGF9 mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_002010.2 에 제시되어 있다. 당업자는 FGF9 이 또한 FGF-9, GAF, 및 HBGF-9 로서 알려져 있음을 인식할 것이다.
인간 TNF-관련 세포자멸사의 약한 유도인자 (TWEAK) 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_003800.1 에 제시되어 있다. 인간 TWEAK mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_003809.2 에 제시되어 있다. 당업자는 TWEAK 이 또한 TNF12, APO3 리간드, APO3L, DR3LG, 및 UNQ181/PRO207 로서 알려져 있음을 인식할 것이다.
특정 경우에, 특정 점막 치유 마커 예컨대 성장 인자의 존재 또는 수준이, 예를 들어, 혼성화 검정 또는 증폭-기반 검정과 같은 검정으로 mRNA 발현의 수준에서 탐지된다. 특정 다른 경우에, 특정 성장 인자의 존재 또는 수준이, 예를 들어, 면역검정 (예를 들어, ELISA) 또는 면역조직화학 검정을 사용하여, 단백질 발현의 수준에서 탐지된다. 예시적 구현예에서, 특정 성장 인자의 존재 또는 수준이 다중 면역어레이, 예컨대 또한 합동 근접 면역검정 (COPIA) 으로서도 알려진 합동 효소 강화 반응 면역검정 (CEER) 을 사용하여 탐지된다. CEER 은 하기 특허 문헌에 기술되어 있으며, 이들은 모든 목적을 위해 그 전문이 참조로 본원에 포함된다: PCT 공개 번호 WO 2008/036802; PCT 공개 번호 WO 2009/012140; PCT 공개 번호 WO 2009/108637; PCT 공개 번호 WO 2010/132723; PCT 공개 번호 WO 2011/008990; 및 2010 년 10 월 20 일에 제출된 PCT 출원 번호 PCT/US2010/053386. 혈청, 혈장, 타액, 또는 소변 샘플 중 성장 인자의 존재 또는 수준의 측정에 적합한 ELISA 키트는, 예를 들어, Antigenix America Inc. (Huntington Station, NY), Promega (Madison, WI), R&D Systems, Inc. (Minneapolis, MN), Invitrogen (Camarillo, CA), CHEMICON International, Inc. (Temecula, CA), Neogen Corp. (Lexington, KY), PeproTech (Rocky Hill, NJ), Alpco Diagnostics (Salem, NH), Pierce Biotechnology, Inc. (Rockford, IL), 및/또는 Abazyme (Needham, MA) 으로부터 입수가능하다.
특정 구현예에서, 적어도 하나 또는 복수 (예를 들어, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 ,15 , 16, 17, 18, 19, 20, 또는 21, 예컨대, 예를 들어, 패널 또는 어레이) 의 하기 성장 인자 마커가 (예를 들어, 단독으로 또는 다른 범주로부터의 바이오마커와의 조합으로) 탐지되어 질환 과정의 예측, 및/또는 요법 선별, 요법 최적화, 독성 감소, 및/또는 항-TNF 약물 요법에 대한 치료적 처리의 효능의 모니터링의 정확도의 개선을 지원 또는 보조할 수 있다: AREG, EREG, HB-EGF, HGF, NRG1, NRG2, NRG3, NRG4, BTC, EGF, IGF, TGF-α, VEGF-A, VEGF-B, VEGF-C, VEGF-D, FGF1, FGF2, FGF7, FGF9, TWEAK 및 그들의 조합.
B. 점막 치유 지수
특정 양상에서, 본 발명은 요법 선별, 요법 최적화, 독성 감소, 및/또는 항-TNFα 약물 요법에 대한 치료적 처리의 효능의 모니터링의 정확도 개선을 위한 하나 또는 복수의 (예를 들어, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 또는 그 이상의) 점막 치유 마커의 알고리즘-기반 분석을 제공한다.
샘플 중 탐지, 측정, 또는 확인된 점막 치유 마커의 존재 또는 농도 수준에 본원에 기술된 단일 통계적 알고리즘 또는 둘 이상의 통계적 알고리즘의 조합이 적용되어 요법을 선별, 요법을 최적화, 독성을 감소, 또는 항-TNFα 약물을 사용하는 치료적 처리의 효능을 모니터링할 수 있다. 그와 같이, 발명의 방법은 환자 면역 상태를 확인함으로써 환자 관리를 결정함에 있어서 유용하다.
일부 구현예에서, 통계적 알고리즘은 학습 통계 분류기 시스템을 포함한다. 일부 경우에, 학습 통계 분류기 시스템은 랜덤 포레스트, 분류 및 회귀 트리, 부스티드 트리, 신경 네트워크, 서포트 벡터 머신, 일반 카이 제곱 자동 상호작용 디텍터 모델, 인터랙티브 트리, 다중적응식 회귀 스플라인, 기계 학습 분류기, 및 그들의 조합으로 이루어지는 군으로부터 선택된다. 특정 경우에, 통계적 알고리즘은 단일 학습 통계 분류기 시스템을 포함한다. 다른 구현예에서, 통계적 알고리즘은 둘 이상의 학습 통계 분류기 시스템의 조합을 포함한다. 일부 경우에, 둘 이상의 학습 통계 분류기 시스템이 직렬로 적용된다. 본 발명에 사용하기에 적합한 통계적 알고리즘 및 분석의 비제한적 예는 2011 년 10 월 18 일에 제출된 국제 출원 번호 PCT/US2011/056777 에 기술되어 있으며, 상기의 공개는 모든 목적을 위해 전문이 참조로 본원에 포함된다.
바람직하게는, 점막 치유 지수는 경험적으로 유래된 실험적으로 준비된 값의 지수이다. 일부 경우에, 값의 지수는 실험적으로 확인된 대조군 측정의 어레이로부터 변환된다. 하나의 양상에서, 마커의 농도 또는 그들의 측정된 농도 값은 컴퓨터에 상주하는 알고리즘에 의해 지수로 변환된다. 특정 양상에서, 지수는 생물학적 데이타를 수치적 용어로 표현하는 합성 또는 인간 유래 아웃풋, 점수, 또는 컷오프 값(들)이다. 지수를 사용하여 임상 결정을 내리거나 확정 또는 지원할 수 있다. 점막 치유 지수는 시간의 흐름에 따라 여러 번 측정될 수 있다. 하나의 양상에서, 알고리즘은 알려진 샘플로 훈련된 후, 알려진 동일성의 샘플로 검정될 수 있다.
추가의 구현예에서, 점막 치유의 평가 또는 측정 방법은 샘플에 존재하는 점막 치유 마커의 수준을 지수 값 또는 컷오프 값 또는 참조 값 또는 역치 값에 비교하는 것을 추가로 포함하며, 상기 값보다 높은 또는 낮은 점막 치유 마커의 수준은 대상이 점막 치유를 겪을 또는 점막 치유를 겪지 않을 가능성이 증가됨 또는 더 높음을 예측 또는 시사한다. 당업자는 지수 값 또는 컷오프 값 또는 참조 값 또는 역치 값의 단위가 측정되고 있는 관심의 마커에 따라 예컨대 ㎎/㎖, ㎍/㎖, ng/㎖, pg/㎖, fg/㎖, EU/㎖, 또는 U/㎖ 임을 이해할 것이다.
일부 구현예에서, 점막 치유 지수 대조군은 건강한 개체, 또는 질환 상태로부터 건강한 상태로 진행한 개체에서 유래된 점막 치유 지수이다. 대안적으로는, 대조군은 심한 질환 상태의 덜 심한 질환 상태 또는 건강한 상태로의 시간 경과를 나타내는 지수일 수 있다.
일부 구현예에서, 요법의 과정의 결정 등은 경험적으로 유래된 지수, 점수 또는 분석을 사용하는 선택 예를 들어, 약물 투여량의 선택, 적당한 약물, 또는 요법의 과정 또는 길이, 요법 양생법, 또는 기존 약물 또는 투여량의 유지의 선택을 포함한다. 특정 양상에서, 유래된 또는 측정된 지수를 사용하여 요법의 과정을 결정할 수 있다.
질환의 임상 과정의 이해는 의사가 염증성 질환 환자 (예를 들어, IBD, 크론병 또는 궤양성 대장염) 를 위한 치료 결정을 더 잘 알고 내릴 수 있게 해줄 것이고, 장래에 새로운 약물 개발을 지도하는 것을 도울 수 있다. 본원에 기술된 점막 치유 지수에 사용하기 위한 이상적 점막 치유 마커(등)은 그 질환의 위험에 처한 개체를 식별할 수 있어야 하고, 질환-특이적이어야 한다. 더욱이, 점막 치유 마커(등)은 질환 활성을 탐지하고 처리의 효과를 모니터링할 수 있어야 하고; 질환의 악화 또는 재발에 대한 예측값을 가져야 한다. 질환 과정의 예측은, 그러나, 이제 질환 재발을 넘어서 확장되었지만, 더욱 중요하게는 수술을 포함하는 질환 합병증의 예측인자를 포함할 것이다. 본 발명이 특히 유리한 이유는 점막 치유의 지표를 제공하고 차도가 있는 환자에서 악화 위험의 예측을 가능하게 해주기 때문이다. 또한, 본 발명의 점막 치유 마커 및 점막 치유 지수는 환자 관리 뿐만 아니라 치료적 결정에 큰 영향을 미치고, 치료로부터 가장 이익을 얻을 환자에게 적당한 요법을 지도하는 것을 지원 또는 보조하고, 재발 위험이 낮은 환자에서 만성 유지 요법의 비용 및 잠재적 독성을 회피할 것이다.
I. 질환 활성 프로파일
본원에 기술된 바와 같은, 본 발명의 질환 활성 프로파일 (DAP) 은 유리하게는 요법의 최적화 및/또는 치료 효능의 모니터링을 위한 질환의 개인화된 치료적 관리 방법에서 사용될 수 있다. 특정 구현예에서, 발명의 방법은 요법 선별, 요법 최적화, 독성 감소, 및/또는 항-TNF 약물 요법에 대한 치료적 처리의 효능의 모니터링의 정확도를 개선할 수 있다. 특정 구현예에서, DAP 은 치료 항체 (예를 들어, 항-TNF 약물) 를 이용하는 요법의 과정 동안 복수의 시점에서 하나 또는 복수의 (예를 들어, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 또는 그 이상의) 마커의 어레이를 측정하여 DAP 을 확인함으로써 확인되며, DAP 은 시간의 흐름에 따른 각각의 마커의 농도 수준의 표시를 포함한다. 특정 구현예에서, DAP 은 시간의 흐름에 따른 각각의 마커의 존재 또는 부재, 농도 (예를 들어, 발현) 수준, 활성화 (예를 들어, 인산화) 수준, 및/또는 속도 값 (예를 들어, 특정 마커의 수준의 기울기 변화) 의 표시를 포함할 수 있다. 그와 같이, 본 발명의 방법은 환자 면역 상태를 확인함으로써 환자 관리를 결정하는데 유용하다.
특정 경우에, 단일 통계적 알고리즘 또는 둘 이상의 통계적 알고리즘의 조합이 요법의 과정에 걸친 각각의 마커의 농도 수준에 또는 DAP 자체에 적용돌 수 있다.
질환의 임상 과정의 이해는 의사가 염증성 질환 환자 (예를 들어, IBD (예를 들어, 크론병), 류머티스성 관절염 (RA), 기타) 를 위한 치료 결정을 더 잘 알고 내릴 수 있게 해주고, 새로운 약물 개발을 지도하는 것을 돕는다. 본원에 기술된 질환 활성 프로파일에 사용하기 위한 이상적 바이오마커(등)은 그 질환의 위험에 처한 개체를 식별할 수 있고, 질환-특이적이다. 더욱이, 바이오마커(등)은 질환 활성을 탐지하고 처리의 효과를 모니터링할 수 있고; 질환의 악화 또는 재발에 대한 예측값을 갖는다. 질환 과정의 예측은, 그러나, 이제 질환 재발을 넘어서 확장되었지만, 더욱 중요하게는 수술을 포함하는 질환 합병증의 예측인자를 포함할 것이다. 본 발명이 특히 유리한 이유는 질환 활성 및/또는 중증도의 지표를 제공하고, 차도가 있는 환자에서 악화 위험의 예측을 가능하게 해주기 때문이다. 또한, 본 발명의 바이오마커 및 질환 활성 프로파일은 환자 관리 뿐만 아니라 치료적 결정에 큰 영향을 미치고, 치료로부터 가장 이익을 얻을 환자에게 적당한 요법을 지도하는 것을 지원 또는 보조하고, 재발 위험이 낮은 환자에서 만성 유지 요법의 비용 및 잠재적 독성을 회피한다.
비-제한적 예로서, 하나의 구현예에서 질환 활성 프로파일 (DAP) 은 하나 이상의 하기 바이오마커 범주 중 하나 이상의 특정 바이오마커의 존재, 수준 (농도 (예를 들어, 총) 및/또는 활성화 (예를 들어, 인산화)), 또는 유전자형의 탐지, 측정, 또는 확인을 포함한다:
(1) 약물 수준 (예를 들어, 항-TNF 약물 수준);
(2) 항-약물 항체 (ADA) 수준 (예를 들어, 항-TNF 약물에 대한 자가항체의 수준);
(3) 염증 마커;
(4) 항-염증 마커; 및/또는
(5) 조직 복구 마커.
존재, 수준 (농도 (예를 들어, 총) 및/또는 활성화 (예를 들어, 인산화)), 또는 유전자형이 측정될 수 있는 부가적 및/또는 대안적 마커의 비제한적 예는 하기를 포함한다:
(6) 혈청학 (예를 들어, 면역 마커);
(7) 산화 스트레스의 마커;
(8) 세포 표면 수용체 (예를 들어, CD64, 기타);
(9) 신호전달 경로;
(10) 약물 예컨대 치료 항체 (예를 들어, 인플릭시맙) 의 kel 또는 제거 속도 상수; 및/또는
(11) 다른 마커 (예를 들어, 유전자 마커 예컨대 염증 경로 유전자).
A. 항-TNF 약물 수준 & 항-약물 항체 (ADA) 수준
일부 구현예에서, 질환 활성 프로파일 (DAP) 은 다중 시점에서, 예를 들어, 요법의 과정 전, 동안, 및/또는 후에 환자 샘플 (예를 들어, 항-TNF 약물 요법 중인 환자로부터의 혈청 샘플) 중 항-TNF 약물 (예를 들어, 자유 항-TNFα 치료 항체 예컨대 인플릭시맙의 수준) 및/또는 항-약물 항체 (ADA) (예를 들어, 항-TNF 약물에 대한 자가항체 예컨대 HACA 의 수준) 의 존재 및/또는 수준의 확인을 포함한다.
특정 구현예에서, 항-TNF 약물 및/또는 ADA 의 존재 및/또는 수준은 크기 배제 크로마토그래피를 사용하는 균일 이동성 변위 검정으로 확인된다. 2010 년 10 월 26 일에 제출된 PCT 출원 번호 PCT/US2010/054125 에 기술되어 있는 (상기의 공개는 모든 목적을 위해 전문이 참조로 본원에 포함됨), 이 방법은 특히 TNFα 저해인자 뿐만 아니라 그에 대항하여 생성되는 자가항체 (예를 들어, HACA, HAHA, 등) 의 존재 또는 수준의 측정에 유리하다.
하나의 구현예에서, 샘플 중 항-TNFα 항체의 존재의 탐지 방법은 하기 단계를 포함한다:
(a) 라벨링된 TNFα 를 항-TNFα 항체를 갖는 또는 갖는 것으로 의심되는 샘플과 접촉시켜 항-TNFα 항체와의 라벨링된 복합체를 형성하는 단계;
(b) 라벨링된 복합체를 크기 배제 크로마토그래피에 적용하여 라벨링된 복합체를 분리하는 단계; 및
(c) 라벨링된 복합체를 탐지하여, 항-TNFα 항체를 탐지하는 단계.
특정 경우에, 상기 방법은 특히 하기 항-TNFα 항체에 유용하다: REMICADE™ (인플릭시맙), ENBREL™ (에타네르셉트), HUMIRA™ (아달리무맙), 및 CIMZIA® (세르톨리주맙 페골).
종양 괴사 인자 α (TNFα) 는 전신 여증에 연루되는 사이토카인이고, 급성기 반응을 자극하는 사이토카인의 그룹의 구성원이다. TNFα 의 주된 역할은 면역 세포의 조절이다. TNFα 는 또한 세포자멸사를 유도하고, 염증을 유도하고, 종양발생 및 바이러스 복제를 저해할 수 있다. TNF 는 주로 안정적 동형삼량체로 배열된 212-아미노산-길이의 타입 II 막관통 단백질로서 생산된다.
본원에서 사용되는 용어 "TNF", "TNFα" 및 "TNF-α" 는 17 kDa 의 분비된 형태 및, 17 kDa 분비된 형태 및 26 kDa 의 막 결합 형태로서 존재하는, 비공유적으로 결합된 17 kDa 분자들의 삼량체로 이루어지 생물학적 활성 형태인 인간 싸이토카인을 포함하는 것으로 의도된다. TNFα 의 구조는 예를 들어 Jones 등, Nature, 338:225-228 (1989) 에 추가로 기재되어 있다. 용어 TNFα 는 인간 TNFα, 재조합 인간 TNFα (rhTNF-a), 또는 인간 TNFα 단백질과 약 80% 이상의 동일성을 갖는 TNFα 를 포함하는 것으로 의도된다. 인간 TNFα 는 35 아미노산 (aa) 세포질 도메인, 21 aa 막통과 분절, 및 177 aa 세포외 도메인 (ECD) 으로 이루어진다 (Pennica, D. 등 (1984) Nature 312:724). ECD 에서는, 인간 TNFα 는 붉은털원숭이 TNFα 와는 97% aa 서열 동일성을, 소, 개, 코튼 랫트, 말, 고양이, 마우스, 돼지 및 랫트 TNFα 와는 71% 내지 92% 의 동일성을 공유한다. TNFα 는 표준 재조합 발현 방법으로 제조될 수 있거나 또는 상업적으로 입수가능하다 (R & D Systems, Catalog No. 210-TA, Minneapolis, Minn.).
특정 경우에, TNF α 항체가 탐지된 후, TNF α 항체는 표준 곡선을 사용하여 측정된다.
또다른 구현예에서, 샘플 중 항-TNFα 항체에 대한 자가항체의 탐지 방법은 하기 단계를 포함한다:
(a) 라벨링된 항-TNFα 항체를 샘플과 접촉시켜 자가항체와의 라벨링된 복합체를 형성하는 단계;
(b) 라벨링된 복합체를 크기 배제 크로마토그래피에 적용하여 라벨링된 복합체를 분리하는 단계; 및
(c) 라벨링된 복합체를 탐지하여, 자가항체를 탐지하는 단계.
특정 경우에, 자가항체는 인간 항-키메라 항체 (HACA), 인간 항-인간화 항체 (HAHA), 및 인간 항-마우스 항체 (HAMA) 를 포함한다.
항-TNF 약물 및/또는 항-약물 항체 (ADA) 의 존재 및/또는 수준의 다른 탐지 방법의 비제한적 예는 효소-연결 면역흡착 검정 (ELISA) 예컨대 가교 ELISA 를 포함한다. 예를 들어, Matriks Biotek Laboratories 로부터의 인플릭시맙 ELISA 는 혈청 및 혈장 샘플 중 자유 인플릭시맙을 탐지하고, PeaceHealth Laboratories 로부터의 HACA ELISA 는 혈청 샘플 중 HACA 를 탐지한다.
B. 염증 마커
염증성 질환의 질환 과정은 전형적으로 백혈구 세포 계수를 사용하는 비침습적 시험에 의해 염증 활성의 측면에서 측정되지만, 이러한 방법은 낮은 특이도를 갖고 질환 활성과 제한된 상관관계를 보인다.
그와 같이, 특정 구현예에서, 생화학적 마커, 혈청학적 마커, 단백질 마커, 유전자 마커, 및/또는 다른 임상 또는 초음파검사 상의 특징을 포함하는 여러 가지 염증 마커는 요법 선별, 요법 최적화, 독성 감소, 및/또는 하나 이상의 치료제 예컨대 생물제제 (예를 들어, 항-TNF 약물) 를 사용하는 치료적 처리의 효능 모니터링에 의한 본 발명에서의 개인화된 치료적 관리 방법에서 특히 유용하다. 특정 구현예에서, 본원에 기재된 방법은 하나 이상의 (복수의) 염증 마커 (예를 들어, 단독으로 또는 다른 범주로부터의 바이오마커와의 조합으로) 에 기초하는 질환 활성 프로파일 (DAP) 의 확인을 이용하여 질환 과정의 예측, 적당한 항-TNF 약물 요법의 선별, 항-TNF 약물 요법의 최적화, 항-TNF 약물 요법과 연관되는 독성의 감소, 및/또는 항-TNF 약물을 이용하는 치료적 처리의 효능의 모니터링을 지원 또는 보조한다.
염증 마커의 비제한적 예는 사이토카인, 케모카인, 급성기 단백질, 세포 부착 분자, S100 단백질, 및/또는 다른 염증 마커를 포함한다. 바람직한 구현예에서, 염증 마커는 1 이상, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 또는 그 이상의 사이토카인을 포함한다. 하나의 특정 구현예에서, 사이토카인은 하기 중 1 개 이상, 2, 3, 4, 5, 6, 7, 또는 모든 8 개를 포함한다: GM-CSF, IFN-γ, IL-1β, IL-2, IL-6, IL-8, TNF-α, 및 sTNF RII.
1. 사이토카인 및 케모카인
샘플 중 하나 이상의 사이토카인 또는 케모카인의 존재 또는 수준의 확인이 특히 본 발명에서 유용하다. 본원에서 사용되는 용어 "사이토카인" 은 다양한 면역계 기능을 조절하는 면역 세포에 의해 분비되는 여러 가지 폴리펩티드 또는 단백질 중 임의의 것을 포함하고, 소형 사이토카인 예컨대 케모카인을 포괄한다. 용어 "사이토카인" 은 아디포사이토카인을 또한 포함하는데, 아디포사이토카인은, 예를 들어, 체중 조절, 조혈, 혈관생성, 상처 치유, 인슐린 저항성, 면역 응답, 및 염증 응답에서 기능하는 지방세포에 의해 분비되는 싸이토카인의 군을 포함한다.
특정 구현예에서, 과립구-마크로파지 콜로니-자극 인자 (GM-CSF), IFN-γ, IL-1β, IL-2, IL-6, IL-8, TNF-α, 가용성 종양 괴사 인자-α 수용체 II (sTNF RII), TNF-관련 세포자멸사의 약한 유도인자 (TWEAK), 오스테오프로테게린 (OPG), IFN-α, IFN-β, IL-1α, IL-1 수용체 길항물질 (IL-1ra), IL-4, IL-5, 가용성 IL-6 수용체 (sIL-6R), IL-7, IL-9, IL-12, IL-13, IL-15, IL-17, IL-23, 및 IL-27 을 포함하나 이에 제한되지 않는, 하나 이상의 사이토카인의 존재 또는 수준이 샘플 중에서 확인된다.
특정 다른 구현예에서, 하나 이상의 케모카인 예컨대, 예를 들어, CXCL1/GRO1/GROα, CXCL2/GRO2, CXCL3/GRO3, CXCL4/PF-4, CXCL5/ENA-78, CXCL6/GCP-2, CXCL7/NAP-2, CXCL9/MIG, CXCL10/IP-10, CXCL11/I-TAC, CXCL12/SDF-1, CXCL13/BCA-1, CXCL14/BRAK, CXCL15, CXCL16, CXCL17/DMC, CCL1, CCL2/MCP-1, CCL3/MIP-1α, CCL4/MIP-1β, CCL5/RANTES, CCL6/C10, CCL7/MCP-3, CCL8/MCP-2, CCL9/CCL10, CCL11/Eotaxin, CCL12/MCP-5, CCL13/MCP-4, CCL14/HCC-1, CCL15/MIP-5, CCL16/LEC, CCL17/TARC, CCL18/MIP-4, CCL19/MIP-3β, CCL20/MIP-3α, CCL21/SLC, CCL22/MDC, CCL23/MPIF1, CCL24/Eotaxin-2, CCL25/TECK, CCL26/Eotaxin-3, CCL27/CTACK, CCL28/MEC, CL1, CL2, 및 CX3CL1 의 존재 또는 수준이 샘플 중에서 확인된다. 특정 추가의 구현예에서, 렙틴, 아디포넥틴, 레시스틴, 활성 또는 총 플라스미노겐 활성인자 저해인자-1 (PAI-1), 비스파틴, 및 레티놀 결합 단백질 4 (RBP4) 을 포함하나 이에 제한되지 않는 하나 이상의 아디포사이토카인의 존재 또는 수준이 샘플 중에서 확인된다. 바람직하게는, GM-CSF, IFN-γ, IL-1β, IL-2, IL-6, IL-8, TNF-α, sTNF RII, 및/또는 다른 사이토카인 또는 케모카인의 존재 또는 수준이 확인된다.
특정 경우에, 특정 사이토카인 또는 케모카인의 존재 또는 수준이 mRNA 발현의 수준에서, 예를 들어, 혼성화 검정 또는 증폭-기반 검정과 같은 검정으로 탐지된다. 특정 다른 경우에, 특정 사이토카인 또는 케모카인의 존재 또는 수준이 단백질 발현의 수준에서, 예를 들어, 면역검정 (예를 들어, ELISA) 또는 면역조직화학 검정을 사용하여 탐지된다. 혈청, 혈장, 타액, 또는 소변 샘플 중 관심의 사이토카인 또는 케모카인의 존재 또는 수준의 확인에 적합한 ELISA 키트는, 예를 들어, R&D Systems, Inc. (Minneapolis, MN), Neogen Corp. (Lexington, KY), Alpco Diagnostics (Salem, NH), Assay Designs, Inc. (Ann Arbor, MI), BD Biosciences Pharmingen (San Diego, CA), Invitrogen (Camarillo, CA), Calbiochem (San Diego, CA), CHEMICON International, Inc. (Temecula, CA), Antigenix America Inc. (Huntington Station, NY), QIAGEN Inc. (Valencia, CA), Bio-Rad Laboratories, Inc. (Hercules, CA), 및/또는 Bender MedSystems Inc. (Burlingame, CA) 로부터 입수가능하다.
인간 IL-6 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_000591 에 제시되어 있다. 인간 IL-6 mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_000600 에 제시되어 있다. 당업자는 IL-6 이 또한 인터페론 베타 2 (IFNB2), HGF, HSF, 및 BSF2 로서 알려져 있음을 인식할 것이다.
인간 IL-1 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_000567 에 제시되어 있다. 인간 IL-1 mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_000576 에 제시되어 있다. 당업자는 IL-1 이 또한 IL1F2 및 IL-1베타로서 알려져 있음을 인식할 것이다.
인간 IL-8 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_000575 (SEQ ID NO:1) 에 제시되어 있다. 인간 IL-8 mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_000584 (SEQ ID NO:2) 에 제시되어 있다. 당업자는 IL-8 이 또한 CXCL8, K60, NAF, GCP1, LECT, LUCT, NAP1, 3-10C, GCP-1, LYNAP, MDNCF, MONAP, NAP-1, SCYB8, TSG-1, AMCF-I, 및 b-ENAP 로서 알려져 있음을 인식할 것이다.
인간 TWEAK 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_003800 및 AAC51923 에 제시되어 있다. 인간 TWEAK mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_003809 및 BC104420 에 제시되어 있다. 당업자는 TWEAK 이 또한 종양 괴사 인자 리간드 슈퍼패밀리 구성원 12 (TNFSF12), APO3 리간드 (APO3L), CD255, DR3 리간드, 성장 인자-유도성 14 (Fn14) 리간드, 및 UNQ181/PRO207 로서 알려져 있음을 인식할 것이다.
2. 급성기 단백질
샘플 중 하나 이상의 급성기 단백질의 존재 또는 수준의 확인이 또한 본 발명에서 유용하다. 급성기 단백질은 염증에 응답하여 혈장 농도가 증가 (양성 급성기 단백질) 또는 감소 (음성 급성기 단백질) 하는 단백질의 부류이다. 이러한 응답은 급성기 반응으로 호칭된다 (또한 급성기 응답으로 호칭됨). 양성 급성기 단백질의 예는, C-반응성 단백질 (CRP), D-이합체 단백질, 만노스-결합 단백질, 알파 1-안티트립신, 알파 1-안티키모트립신, 알파 2-마크로글로불린, 피브리노겐, 프로트롬빈, 인자 VIII, 폰 빌레브란트 인자, 플라스미노겐, 보체 인자, 페리틴, 혈청 아밀로이드 P 성분, 혈청 아밀로이드 A (SAA), 오로소뮤코이드 (알파 1-산 당단백질, AGP), 세룰로플라스민, 하프토글로빈, 및 그들의 조합을 포함하나, 이에 제한되는 것은 아니다. 음성 급성기 단백질의 비제한적 예는 알부민, 프랜스페린, 트랜스티레틴, 트랜스코르틴, 레티놀-결합 단백질, 및 그들의 조합을 포함한다. 바람직하게는, CRP 및/또는 SAA 의 존재 또는 수준이 확인된다.
특정 경우에, 특정 급성기 단백질의 존재 또는 수준은 mRNA 발현의 수준에서, 예를 들어, 혼성화 검정 또는 증폭-기반 검정과 같은 검정으로 탐지된다. 특정 다른 경우에, 특정 급성기 단백질의 존재 또는 수준은 단백질 발현의 수준에서, 예를 들어, 면역검정 (예를 들어, ELISA) 또는 면역조직화학 검정을 사용하여 탐지된다. 예를 들어, Alpco Diagnostics (Salem, NH) 로부터 입수가능한 샌드위치 비색 ELISA 검정이 사용되어 혈청, 혈장, 소변, 또는 대변 샘플 중 CRP 의 수준을 확인할 수 있다. 유사하게, Biomeda Corporation (Foster City, CA) 로부터 입수가능한 ELISA 키트가 사용되어 샘플 중 CRP 수준을 탐지할 수 있다. 샘플 중 CRP 수준의 다른 확인 방법이, 예를 들어, 미국 특허 번호 6,838,250 및 6,406,862; 및 미국 특허 공개 번호 20060024682 및 20060019410 에 기술되어 있다. CRP 수준의 부가적 확인 방법은, 예를 들어, 면역혼탁도측정 검정, 급속 면역확산 검정, 및 시각적 응집 검정을 포함한다. 샘플 예컨대 혈청, 혈장, 타액, 소변, 또는 대변 중 SAA 의 존재 또는 수준의 확인에 적합한 ELISA 키트는, 예를 들어, Antigenix America Inc. (Huntington Station, NY), Abazyme (Needham, MA), USCN Life (Missouri City, TX), 및/또는 U.S. 생물제제al (Swampscott, MA) 로부터 입수가능하다.
C-반응성 단백질 (CRP) 은 염증에 응답하여 혈액 중에서 발견되는 단백질이다 (급성기 단백질). CRP 는 전형적으로 간 및 지방 세포 (아디포싸이트) 에 의해 생산된다. CRP 는 단백질의 펜트락신 패밀리의 구성원이다. 인간 CRP 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_000558 에 제시되어 있다. 인간 CRP mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_000567 에 제시되어 있다. 당업자는 CRP 가 또한 PTX1, MGC88244, 및 MGC149895 로서 알려져 있음을 인식할 것이다.
혈청 아밀로이드 A (SAA) 단백질은 혈장 중 고밀도 리포단백질 (HDL) 과 연관되는 아포리포단백질의 패밀리이다. SAA 의 상이한 동종형은 상이한 수준으로 구성적으로 (구성적 SAA) 또는 염증성 자극에 응답하여 (급성기 SAA) 발현된다. 이들 단백질들은 주로 간에서 생산된다. 무척추동물 및 척추동물 전체에 걸친 이들 단백질들의 보존은 SAA 가 모든 동물에서 매우 핵심적인 역할을 수행함을 시사한다. 급성기 혈청 아밀로이드 A 단백질 (A-SAA) 은 염증의 급성기 동안 분비된다. 인간 SAA 폴리펩티드 서열은, 예를 들어, Genbank 접근 번호 NP_000322 에 제시되어 있다. 인간 SAA mRNA (코딩) 서열은, 예를 들어, Genbank 접근 번호 NM_000331 에 제시되어 있다. 당업자는 SAA 이 또한 PIG4, TP53I4, MGC111216, 및 SAA1 로서 알려져 있음을 인식할 것이다.
3. 세포 부착 분자 (IgSF CAMs)
샘플 중 하나 이상의 면역글로불린 슈퍼패밀리 세포 부착 분자의 존재 또는 수준의 확인이 또한 본 발명에서 유용하다. 본원에서 사용되는 용어 "면역글로불린 슈퍼패밀리 세포 부착 분자" (IgSF CAM) 는 하나 이상의 면역글로불린-유사 폴드 도메인을 갖고, 세포간 부착 및/또는 신호 전달에서 기능하는 세포 표면에 위치하는 임의의 여러 가지 폴리펩티드 또는 단백질을 포함한다. 많은 경우에, IgSF CAM 은 막관통 단백질이다. IgSF CAM 의 비제한적 예는 신경 세포 부착 분자 (NCAMs; 예를 들어, NCAM-120, NCAM-125, NCAM-140, NCAM-145, NCAM-180, NCAM-185, 등), 세포간 부착 분자 (ICAMs, 예를 들어, ICAM-1, ICAM-2, ICAM-3, ICAM-4, 및 ICAM-5), 혈관 세포 부착 분자-1 (VCAM-1), 혈소판-내피 세포 부착 분자-1 (PECAM-1), L1 세포 부착 분자 (L1CAM), L1CAM 과 상동성을 갖는 세포 부착 분자 (L1 의 가까운 상동체) (CHL1), 시알산 결합 Ig-유사 렉틴 (SIGLECs; 예를 들어, SIGLEC-1, SIGLEC-2, SIGLEC-3, SIGLEC-4, 등), 넥틴 (예를 들어, 넥틴-1, 넥틴-2, 넥틴-3, 등), 및 넥틴-유사 분자 (예를 들어, Necl-1, Necl-2, Necl-3, Necl-4, 및 Necl-5) 를 포함한다. 바람직하게는, ICAM-1 및/또는 VCAM-1 의 존재 또는 수준이 확인된다.
ICAM-1 은 백혈구 및 내피 세포의 막에 낮은 농도로 지속적으로 존재하는 막관통 세포의 부착 단백질이다. 싸이토카인 자극시, 그 농도는 급격히 증가한다. ICAM-1 은 IL-1 및 TNFα 에 의해 유도될 수 있고, 혈관 내피, 마크로파지 및 림프구에 의해 발현된다. IBD 에서, 전염증성 싸이토카인은 ICAM-1 및 VCAM-1 와 같은 부착 분자들의 발현을 상향조절하여 염증을 야기한다. 부착 분자들의 증가된 발현은 감염된 조직에 더 많은 림프구들을 동원하여, 조직 염증을 초래한다 (참고, Goke 등, J., Gastroenterol., 32:480 (1997); 및 Rijcken 등, Gut, 51:529 (2002)). ICAM-1 은 세포간 부착 분자 1 유전자 (ICAM1; Entrez GeneID:3383; Genbank 접근 번호 NM_000201) 에 의해 인코딩되고, 세포간 부착 분자 1 전구체 폴리펩티드 (Genbank 접근 번호 NP_000192) 의 가공 후 생산된다.
VCAM-1 은 림프구, 단핵구, 호산구 및 호염기구의 부착을 매개하는 세포의 부착 단백질이다. 싸이토카인에 의한 내피 세포에서의 VCAM-1 의 상향조절은 증가된 유전자 전사 (예를 들어, 종양 괴사 인자-알파 (TNFα) 및 인터류킨-1 (IL-1) 에 응답하여) 의 결과로서 발생한다. VCAM-1 은 혈관 세포부착 분자 1 유전자 (VCAM1; Entrez GeneID:7412) 에 의해 인코딩되고, 전사물 (Genbank 접근 번호 NM_001078 (변이체 1) 또는 NM_080682 (변이체 2)) 의 차별적 스플라이싱, 및 전구체 폴리펩티드 스플라이스 동종형 (Genbank 접근 번호 NP_001069 (동종형 a) 또는 NP_542413 (동종형 b)) 의 가공 후에 생산된다.
특정 경우에, IgSF CAM 의 존재 또는 수준은 mRNA 발현의 수준에서, 예를 들어, 혼성화 검정 또는 증폭-기반 검정과 같은 검정으로 탐지된다. 특정 다른 경우에, IgSF CAM 의 존재 또는 수준은 단백질 발현의 수준에서, 예를 들어, 면역검정 (예를 들어, ELISA) 또는 면역조직화학 검정을 사용하여 탐지된다. 샘플 예컨대 조직 샘플, 생검, 혈청, 혈장, 타액, 소변, 또는 대변 중 ICAM-1 및/또는 VCAM-1 의 존재 또는 수준의 확인에 적합한 항체 및/또는 ELISA 키트는, 예를 들어, Invitrogen (Camarillo, CA), Santa Cruz Biotechnology, Inc. (Santa Cruz, CA), 및/또는 Abcam Inc. (Cambridge, MA) 로부터 입수가능하다.
4. S100 단백질
샘플 중 하나 이상의 S100 단백질의 존재 또는 수준의 확인이 또한 본 발명에서 유용하다. 본원에서 사용되는 용어 "S100 단백질" 은 2 EF-핸드 칼슘-결합 도메인의 존재 및 세포-유형-특이적 발현이 특징인 저분자량 산성 단백질 패밀리의 임의의 구성원을 포함한다. 인간에서는 21 가지 이상의 상이한 유형의 S100 단백질이 존재한다. 그 명칭은 S100 단백질이 중성 pH 에서 암모늄 설페이트에 100% 가용성인 사실로부터 유래된다. 대부분의 S100 단백질은 비공유 결합에 의해 함께 취해지는 2 개의 동일한 폴리펩티드로 이루어지는 동종이합체이다. S100 단백질은 칼모듈린과 구조적으로 유사하지만, 이들은 환경 인자에 따라 상이한 수준으로 특별한 세포에서 세포-특이적으로 발현된다는 점에서 상이하다. S-100 단백질은 보통은 신경관으로부터 유도되는 세포 (예를 들어, 슈반 세포, 멜라노사이트, 신경교 세포), 연골 세포, 지방 세포, 근상피 세포, 마크로파지, 랑게르한스 세포, 수지상 세포, 및 케라티노사이트에 존재한다. S100 단백질은 단백질 인산화, 전사 인자, Ca2+ 항상성유지, 세포골격 성분의 동역학, 효소 활성, 세포 성장 및 분화, 및 염증 응답의 조절과 같은 다양한 세포내 및 세포외 기능에 연루됨이 시사되었다.
칼그라눌린 (칼그라눌린) 은 신장 상피 세포 및 호중구를 포함하는 여러 세포 유형에서 발현되고, 만성 염증 상태 하에서 침윤하는 단핵구 및 과립구에 풍부한 S100 단백질이다. 칼그라눌린의 예는 칼그라눌린 A (또한 S100A8 또는 MRP-8 로서도 알려짐), 칼그라눌린 B (또한 S100A9 또는 MRP-14 로서도 알려짐), 및 칼그라눌린 C (또한 S100A12 로서도 알려짐) 를 제한 없이 포함한다.
특정 경우에, 특정 S100 단백질의 존재 또는 수준은 mRNA 발현의 수준에서, 예를 들어, 혼성화 검정 또는 증폭-기반 검정과 같은 검정으로 탐지된다. 특정 다른 경우에, 특정 S100 단백질의 존재 또는 수준은 단백질 발현의 수준에서, 예를 들어, 면역검정 (예를 들어, ELISA) 또는 면역조직화학 검정을 사용하여 탐지된다. 혈청, 혈장, 또는 소변 샘플 중 S100 단백질 예컨대 칼그라눌린 A (S100A8), 칼그라눌린 B (S100A9), 또는 칼그라눌린 C (S100A12) 의 존재 또는 수준의 확인에 적합한 ELISA 키트는, 예를 들어, Peninsula Laboratories Inc. (San Carlos, CA) 및 Hycult biotechnology b.v. (Uden, Netherlands) 로부터 입수가능하다.
칼프로텍틴은, S100A8 및 S100A9 의 복합체로서, 호중구, 단핵구, 및 케라티노사이트의 세포기질 중 칼슘- 및 아연-결합 단백질이다. 칼프로텍틴은 호중구성 과립구 및 마크로파지에서 주된 단백질이고, 이들 세포의 세포기질 분획 중 총 단백질의 60% 를 차지한다. 칼프로텍틴은 그러므로 호중구 턴오버의 대리 마커이다. 대변 중 칼프로텍틴의 농도는 장 점막의 호중구 침윤의 강도 및 염증의 중증도과 상관관계가 있다. 일부 경우에, 칼프로텍틴은 소량의 (50-100 mg) 대변 샘플을 사용하여 ELISA 로 측정될 수 있다 (참고, 예를 들어, Johne 등, Scand J Gastroenterol., 36:291-296 (2001)).
5. 기타 염증 마커
샘플 중 락토페린의 존재 또는 수준의 확인이 또한 본 발명에서 유용하다. 특정 경우에, 락토페린의 존재 또는 수준은 mRNA 발현의 수준에서, 예를 들어, 혼성화 검정 또는 증폭-기반 검정과 같은 검정으로 탐지된다. 특정 다른 경우에, 락토페린의 존재 또는 수준은 단백질 발현의 수준에서, 예를 들어, 면역검정 (예를 들어, ELISA) 또는 면역조직화학 검정을 사용하여 탐지된다. Calbiochem (San Diego, CA) 로부터 입수가능한 락토페린 ELISA 키트가 사용되어 혈장, 소변, 기관지폐포 세척액, 또는 뇌척수액 샘플 중 인간 락토페린을 탐지할 수 있다. 유사하게, U.S. 생물제제al (Swampscott, MA) 로부터 입수가능한 ELISA 키트가 사용되어 혈장 샘플 중 락토페린의 수준을 확인할 수 있다. 미국 특허 공개 번호 20040137536 은 대변 샘플 중 상승된 락토페린 수준의 존재를 확인하기 위한 ELISA 검정을 기술한다. 마찬가지로, 미국 특허 공개 번호 20040033537 은 대변, 점액, 또는 담즙 샘플 중 내생적 락토페린의 농도를 확인하기 위한 ELISA 검정을 기술한다. 일부 구현예에서, 이때 항-락토페린 항체의 존재 또는 수준은, 예를 들어, 락토페린 단백질 또는 그의 조각을 사용하여 샘플 중 탐지될 수 있다.
샘플 중 하나 이상의 피루베이트 키나제 아이소자임 예컨대 M1-PK 및 M2-PK 의 존재 또는 수준의 확인이 또한 본 발명에서 유용하다. 특정 경우에, M1-PK 및/또는 M2-PK 의 존재 또는 수준은 mRNA 발현의 수준에서, 예를 들어, 혼성화 검정 또는 증폭-기반 검정과 같은 검정으로 탐지된다. 특정 다른 경우에, M1-PK 및/또는 M2-PK 의 존재 또는 수준은 단백질 발현의 수준에서, 예를 들어, 면역검정 (예를 들어, ELISA) 또는 면역조직화학 검정을 사용하여 탐지된다. 피루베이트 키나제 아이소자임 M1/M2 는 또한 피루베이트 키나제 근육 아이소자임 (PKM), 피루베이트 키나제 타입 K, 세포기질 갑상선 호르몬-결합 단백질 (CTHBP), 갑상선 호르몬-결합 단백질 1 (THBP1), 또는 opa-상호작용 단백질 3 (OIP3) 으로서도 알려져 있다.
추가의 구현예에서, 샘플 중 하나 이상의 성장 인자의 존재 또는 수준의 확인이 또한 본 발명에서 유용하다. 성장 인자의 비제한적 예는 하기에 더욱 상세히 기술되어 있는 형질전환 성장 인자 (TGF) 예컨대 TGF-α, TGF-β, TGF-β2, TGF-β3 등을 포함한다.
6. 염증 마커의 예시적 세트
특정 구현예에서, 적어도 하나 또는 복수 (예를 들어, 2, 3, 4, 5, 6, 7, 또는 모든 8, 예컨대, 예를 들어, 패널 또는 어레이) 의 하기 염증 마커가 (예를 들어, 단독으로 또는 다른 범주로부터의 바이오마커와의 조합으로) 탐지되어 질환 과정의 예측, 및/또는 요법 선별, 요법 최적화, 독성 감소, 및/또는 항-TNF 약물 요법에 대한 치료적 처리의 효능의 모니터링의 정확도의 개선을 지원 또는 보조할 수 있다: (1) GM-CSF; (2) IFN-γ; (3) IL-1β; (4) IL-2; (5) IL-6; (6) IL-8; (7) TNF-α; 및 (8) sTNF RII.
C. 항-염증 마커
특정 구현예에서, 여러 가지 항-염증 마커는 특히 요법 선별, 요법 최적화, 독성 감소, 및/또는 하나 이상의 치료제 예컨대 생물제제 (예를 들어, 항-TNF 약물) 를 사용하는 치료적 처리의 효능의 모니터링에 의하는 본 발명에서의 개인화된 치료적 관리 방법에서 유용하다. 특정 구현예에서, 본원에 기재된 방법은 하나 이상의 (복수의) 항-염증 마커 (예를 들어, 단독으로 또는 다른 범주로부터의 바이오마커와의 조합으로) 에 기초하는 질환 활성 프로파일 (DAP) 의 확인을 이용하여 질환 과정의 예측, 적당한 항-TNF 약물 요법의 선별, 항-TNF 약물 요법의 최적화, 항-TNF 약물 요법과 연관되는 독성의 감소, 및/또는 항-TNF 약물을 이용하는 치료적 처리의 효능의 모니터링을 지원 또는 보조한다.
항-염증 마커의 비제한적 예는 IL-12p70 및 IL-10 을 포함한다. 바람직한 구현예에서, IL-12p70 및 IL-10 둘다의 존재 및/또는 농도 수준이 확인된다.
특정 경우에, 특정 항-염증 마커의 존재 또는 수준은 mRNA 발현의 수준에서, 예를 들어, 혼성화 검정 또는 증폭-기반 검정과 같은 검정으로 탐지된다. 특정 다른 경우에, 특정 항-염증 마커의 존재 또는 수준은 단백질 발현의 수준에서, 예를 들어, 면역검정 (예를 들어, ELISA) 또는 면역조직화학 검정을 사용하여 탐지된다.
인간 IL-12p70 폴리펩티드는 IL-12 단백질의 2 개의 서브유닛으로 구성되는 이종이합체이다: 하나는 40kDa (IL-12p40) 이고, 하나는 35kDa (IL-12p35) 이다. 혈청, 혈장, 타액, 또는 소변 샘플 중 IL-12p70 의 존재 또는 수준의 확인에 적합한 ELISA 키트는, 예를 들어, Gen-Probe Diaclone SAS (France), Abazyme (Needham, MA), BD Biosciences Pharmingen (San Diego, CA), 세포 Sciences (Canton, MA), eBioscience (San Diego, CA), Invitrogen (Camarillo, CA), R&D Systems, Inc. (Minneapolis, MN), 및 Thermo Scientific Pierce Protein Research Products (Rockford, IL) 로부터 입수가능하다.
인간 IL-10 폴리펩티드는 또한 인간 사이토카인 합성 저해인자 인자 (CSIF) 로서 알려져 있는 항-염증 사이토카인이다. 혈청, 혈장, 타액, 또는 소변 샘플 중 IL-12p70 의 존재 또는 수준의 확인에 적합한 ELISA 키트는, 예를 들어, Antigenix America Inc. (Huntington Station, NY), BD Biosciences Pharmingen (San Diego, CA), 세포 Sciences (Canton, MA), eBioscience (San Diego, CA), Gen-Probe Diaclone SAS (France), Invitrogen (Camarillo, CA), R&D Systems, Inc. (Minneapolis, MN), 및 Thermo Scientific Pierce Protein Research Products (Rockford, IL) 로부터 입수가능하다.
D. 혈청학 (면역 마커)
샘플 (예를 들어, 혈청 샘플) 중 자가항체와 같은 혈청학적 또는 면역 마커의 확인이 또한 본 발명에 유용하다. IL-10, TGF-β 등과 같은 항염증 분자에 대한 항체들은 염증을 제어하는 신체의 능력을 억제할 수 있고, 환자에서 이들 항체들의 존재 또는 수준은 항-TNFα 약물과 같은 강력한 면역억제 의약의 사용을 지시한다. 점막 치유는 예를 들어 OmpC, 플라젤린 (cBir-1, Fla-A, Fla-X 등), I2, 및 기타 (pANCA, ASCA 등) 와 같은 박테리아 항원에 대한 항체의 항체 역가의 감소를 초래할 수 있다.
그와 같이, 특정 양상에서, 본원에 기재된 방법은 하나 이상의 (복수의) 혈청학적 또는 면역 마커 (예를 들어, 단독으로 또는 다른 범주로부터의 바이오마커와의 조합으로) 에 기초하는 질환 활성 프로파일 (DAP) 의 확인을 이용하여 질환 과정의 예측, 적당한 항-TNF 약물 요법의 선별, 항-TNF 약물 요법의 최적화, 항-TNF 약물 요법과 연관되는 독성의 감소, 및/또는 항-TNF 약물을 이용하는 치료적 처리의 효능의 모니터링을 지원 또는 보조한다.
본 발명에서의 사용에 적합한 혈청학적 면역 마커의 비제한적 예는 항-호중구 항체, 항-사카로마이세스 세레비시애 항체, 및/또는 다른 항-미생물 항체를 포함한다.
1. 항-호중구 항체
샘플 중 ANCA 수준 및/또는 pANCA 의 존재 또는 부재의 확인은 본 발명의 방법에 유용하다. 본원에서 사용되는 용어 "항-호중구 세포질 항체" 또는 "ANCA" 는 호중구의 세포질 및/또는 핵 성분에 대한 항체를 포함한다. ANCA 활성은 호중구에서의 ANCA 염색 패턴에 기초하여 여러 넓은 범주로 분류될 수 있다: (1) 핵주위 강조 없이 세포질 호중구 염색 (cANCA); (2) 핵의 외부 테두리 주위의 핵주위 염색 (pANCA); (3) 핵의 내부 테두리 주위의 핵주위 염색 (NSNA); 및 (4) 전체 호중구에 걸쳐 반점이 있는 확산 염색 (SAPPA). 특정 경우에, pANCA 염색은 DNase 처리에 민감하다. 용어 ANCA 는 cANCA, pANCA, NSNA, 및 SAPPA 를 포함하나 이에 제한되지 않는 모든 종류의 항-호중구 반응성을 망라한다. 유사하게, 용어 ANCA 는 면역글로불린 A 및 G 를 제한 없이 포함하는 모든 면역글로불린 동형을 망라한다.
개체로부터의 샘플 중 ANCA 수준은, 예를 들어, 면역검정 예컨대 알코올-고정된 호중구를 사용하는 효소-연결 면역흡착 검정 (ELISA) 을 사용하여 확인될 수 있다. 특정 범주의 ANCA 예컨대 pANCA 의 존재 또는 부재는, 예를 들어, 면역조직화학 검정 예컨대 간접 형광 항체 (IFA) 검정을 사용하여 확인될 수 있다. 바람직하게는, 샘플 중 pANCA 의 존재 또는 부재는 DNase-처리된, 고정된 호중구를 사용하는 면역형광 검정을 사용하여 확인된다. 고정된 호중구에 더하여, ANCA 수준의 확인에 적합한 ANCA 에 특이적인 항원은 정제되지 않은 또는 부분적으로 정제된 호중구 추출물; 정제된 단백질, 단백질 조각, 또는 합성 펩티드 예컨대 히스톤 H1 또는 그의 ANCA-반응성 조각 (참고, 예를 들어 미국 특허 번호 6,074,835); 히스톤 H1-유사 항원, 포린 항원, 박테로이드 항원, 또는 그의 ANCA-반응성 조각 (참고, 예를 들어 미국 특허 번호 6,033,864); 분비성 소포 항원 또는 그의 ANCA-반응성 조각 (참고, 예를 들어 미국 특허 출원 번호 08/804,106); 및 항-ANCA 인자형 (idiotypic) 항체를 포함하나, 이에 제한되지 않는다. 당업자는 ANCA 에 특이적인 부가적 항원의 사용이 본 발명의 범위에 속함을 인식할 것이다.
2. 항-사카로마이세스 세레비시애 항체
샘플 중 ASCA (예를 들어, ASCA-IgA 및/또는 ASCA-IgG) 수준의 확인은 본 발명에서 유용하다. 본원에서 사용되는 용어 "항-사카로마이세스 세레비시애 면역글로불린 A" 또는 "ASCA-IgA" 는 사카로마이세스 세레비시애와 특이적으로 반응하는 면역글로불린 A 동형의 항체를 포함한다. 유사하게, 용어 "항-사카로마이세스 세레비시애 면역글로불린 G" 또는 "ASCA-IgG" 는 사카로마이세스 세레비시애와 특이적으로 반응하는 면역글로불린 G 동형의 항체를 포함한다.
샘플이 ASCA-IgA 또는 ASCA-IgG 에 대해 양성인지 여부의 확인은 ASCA 에 특이적인 항원을 사용하여 이루어진다. 그러한 항원은 ASCA-IgA 및/또는 ASCA-IgG 에 의해 특이적으로 결합되는 임의의 항원 또는 항원들의 혼합물일 수 있다. ASCA 항체들은 초기에는 사카로마이세스 세레비시애에 결합하는 그의 능력에 의해 특징지어졌지만, 당업자는 ASCA 에 의해 특이적으로 결합되는 항원이 사카로마이세스 세레비시애로부터 또는 항원이 ASCA 항체에 특이적으로 결합할 수 있는 한 여러 가지 다른 공급원으로부터 수득될 수 있음을 이해할 것이다. 따라서, 샘플 중 ASCA-IgA 및/또는 ASCA-IgG 의 수준의 확인에 사용될 수 있는 ASCA 에 특이적인 항원의 예시적 공급원은 전체 사멸된 효모 세포 예컨대 사카로마이세스 또는 칸디다 세포; 효모 세포 벽 만난 예컨대 포스포펩티도만난 (PPM); 올리고당 예컨대 올리고만노사이드; 네오글리코리피드; 항-ASCA 인자형 항체; 등을 제한 없이 포함한다. 효모의 상이한 종 및 균주 예컨대 사카로마이세스 세레비시애 균주 Su1, Su2, CBS 1315, 또는 BM 156, 또는 칸디다 알비칸스 (Candida albicans) 균주 VW32 가 ASCA-IgA 및/또는 ASCA-IgG 에 특이적인 항원으로 사용하기에 적합하다. ASCA 에 특이적인 정제된 합성 항원이 또한 샘플 중 ASCA-IgA 및/또는 ASCA-IgG 의 수준을 확인하는데 사용하기에 적합하다. 정제된 항원의 예는, 정제된 올리고당 항원 예컨대 올리고만노사이드를 포함하나 이에 제한되지 않는다. 합성 항원의 예는, 합성 올리고만노사이드 예컨대 미국 특허 공개 번호 20030105060 에 기술된 것, 예를 들어 D-Man β(1-2) D-Man β(1-2) D-Man β(1-2) D-Man-OR, D-Man α(1-2) D-Man α(1-2) D-Man α(1-2) D-Man-OR, 및 D-Man α(1-3) D-Man α(1-2) D-Man α(1-2) D-Man-OR (여기서, R 은 수소 원자, C1 내지 C20 알킬 또는 임의로 라벨링된 커넥터 기임) 을 포함하나, 이에 제한되지 않는다.
효모 세포벽 만난의 제제, 예를 들어 PPM 은 샘플 중 ASCA-IgA 및/또는 ASCA-IgG 의 수준 확인에 사용될 수 있다. 그러한 수용성 표면 항원은, 예를 들어 오토클레이브에 의하는 방법을 포함하는 당업계에 알려진 임의의 적당한 추출 기술로 제조될 수 있거나, 또는 상업적으로 수득될 수 있다 (참고, 예를 들어 Lindberg 등, Gut, 33:909-913 (1992)). PPM 의 산-안정성 분획이 또한 본 발명에서 유용하다 (Sendid 등, Clin. Diag. Lab. Immunol., 3:219-226 (1996)). 샘플 중 ASCA 수준 확인에 유용한 예시적 PPM 은 사카로마이세스 우바룸 (S. uvarum) 균주 ATCC #38926 로부터 유래된다.
올리고만노사이드와 같은 정제된 올리고당 항원이 또한 샘플 중 ASCA-IgA 및/또는 ASCA-IgG 의 수준 확인에 유용할 수 있다. 정제된 올리고만노사이드 항원은 바람직하게는 예를 들어 Faille 등, Eur. J. Microbiol. Infect. Dis., 11 :438-446 (1992) 에 기술된 바와 같이 네오글리코리피드로 변환된다. 당업자는 그러한 올리고만노사이드 항원의 ASCA 와의 반응성이 만노실 사슬 길이 (Frosh 등, Proc Natl. Acad. Sci. USA, 82: 1194-1198 (1985)); 아노머 (anomeric) 구조배치 (Fukazawa 등, In "Immunology of Fungal Disease," E. Kurstak (ed.), Marcel Dekker Inc., New York, pp. 37-62 (1989); Nishikawa 등, Microbiol. Immunol., 34:825-840 (1990); Poulain 등, Eur. J. Clin. Microbiol., 23:46-52 (1993); Shibata 등, Arch. Biochem. Biophys., 243:338-348 (1985); Trinel 등, Infect. Immun., 60:3845-3851 (1992)); 또는 연결 위치 (Kikuchi 등, Planta, 190:525-535 (1993)) 의 다변화에 의해 최적화될 수 있음을 이해한다.
본 발명의 방법에 사용하기에 적합한 올리고만노사이드는 만노테트라오스 Man(1-3) Man(1-2) Man(1-2) Man 을 갖는 올리고만노사이드를 제한 없이 포함한다. 그러한 올리고만노사이드는 예를 들어 Faille 등의 상기 문헌에 기술된 바와 같이 PPM 으로부터 정제될 수 있다. ASCA 에 특이적인 예시적 네오글리코리피드는 그의 각각의 PPM 으로부터 올리고만노사이드를 방출한 후, 방출된 올리고만노사이드를 4-헥사데실아닐린 등에 커플링함으로써 구축될 수 있다.
3. 항-미생물 항체
샘플 중 항-OmpC 항체 수준의 확인이 또한 본 발명에서 유용하다. 본원에서 사용되는 용어 "항-외막 단백질 C 항체" 또는 "항-OmpC 항체" 는, 예를 들어, PCT 특허 공개 번호 WO 01/89361 에 기술된 박테리아 외막 포린에 대한 항체를 포함한다. 용어 "외막 단백질 C" 또는 "OmpC" 는 항-OmpC 항체와 면역반응성인 박테리아 포린을 언급한다.
개체로부터의 샘플 중 존재하는 항-OmpC 항체의 수준은 OmpC 단백질 또는 그의 조각 예컨대 그의 면역반응성 조각을 사용하여 확인될 수 있다. 샘플 중 항-OmpC 항체 수준 확인에 유용한 적합한 OmpC 항원은 OmpC 단백질, OmpC 단백질 단백질과 실질적으로 동일한 아미노산 서열을 갖는 OmpC 폴리펩티드, 또는 그의 조각 예컨대 그의 면역반응성 조각을 포함하나 이에 제한되지는 않는다. 본원에 사용되는, OmpC 폴리펩티드는 일반적으로 OmpC 단백질과 약 50% 초과의 동일성, 바람직하게는 약 60% 초과의 동일성, 더욱 바람직하게는 약 70% 초과의 동일성, 더욱더 바람직하게는 약 80%, 85%, 90%, 95%, 96%, 97%, 98%, 또는 99% 초과의 아미노산 서열 동일성을 갖는 아미노산 서열을 갖는 폴리펩티드를 기술하며, 여기서 아미노산 서열 동일성은 CLUSTALW 와 같은 서열 정렬 프로그램을 사용하여 확인된다. 그러한 항원은, 예를 들어, 대장균 (E. coli) 과 같은 장 박테리아로부터의 정제에 의해, Genbank 접근 번호 K00541 와 같은 핵산의 재조합 발현에 의해, 용액 또는 고체 상 펩티드 합성과 같은 합성 수단에 의해, 또는 파지 디스플레이에 의해 제조될 수 있다.
샘플 중 항-I2 항체 수준의 확인이 또한 본 발명에 유용하다. 본원에서 사용되는 용어 "항-I2 항체" 는 예를 들어 미국 특허 번호 6,309,643 에 기술된 바와 같은 박테리아 전사 조절인자와 상동성을 공유하는 미생물 항원에 대한 항체를 포함한다. 용어 "I2" 는 항-I2 항체와 면역반응성인 미생물 항원을 언급한다. 미생물 I2 단백질은 미코박테리움 튜베르쿨로시스 (Mycobacterium tuberculosis) 유래의 클로스트리디움 파스퇴리아눔 (C. pasteurianum), Rv3557c 로부터의 예측된 단백질 4, 및 아퀴펙스 아에올리쿠스 (Aquifex aeolicus) 로부터의 전사 조절인자와 약간의 유사성 약한 상동성을 공유하는 100 개 아미노산의 폴리펩티드이다. I2 단백질에 대한 핵산 및 단백질 서열은, 예를 들어, 미국 특허 번호 6,309,643 에 기술되어 있다.
개체로부터의 샘플 중 존재하는 항-I2 항체의 수준은 I2 단백질 또는 그의 조각 예컨대 그의 면역반응성 조각을 사용하여 확인될 수 있다. 샘플 중 항-I2 항체 수준 확인에 유용한 적합한 I2 항원은 I2 단백질, I2 단백질과 실질적으로 동일한 아미노산 서열을 갖는 I2 폴리펩티드, 또는 그의 조각 예컨대 그의 면역반응성 조각을 포함하나, 이에 제한되지 않는다. 상기 I2 폴리펩티드는 클로스트리디움 파스퇴리아눔 (C. pasteurianum) 단백질 4 보다는 I2 단백질에 대해 더 큰 서열 유사성을 보이고, 그의 동형 변이체 및 상동체를 포함한다. 본원에서 사용되는, I2 폴리펩티드는 일반적으로 자연 발생적 I2 단백질과 약 50% 초과의 동일성, 바람직하게는 약 60% 초과의 동일성, 더욱 바람직하게는 약 70% 초과의 동일성, 더욱더 바람직하게는 약 80%, 85%, 90%, 95%, 96%, 97%, 98%, 또는 99% 초과의 아미노산 서열 동일성을 갖는 아미노산 서열을 갖는 폴리펩티드를 기술하며, 여기서 아미노산 동일성은 CLUSTALW 와 같은 서열 정렬 프로그램을 사용하여 확인된다. 그러한 I2 항원은, 예를 들어, 미생물로부터의 정제에 의해, I2 항원을 인코딩하는 핵산의 재조합 발현에 의해, 용액 또는 고체 상 펩티드 합성과 같은 합성 수단에 의해, 또는 파지 디스플레이에 의해 제조될 수 있다.
샘플 중 항-플라젤린 항체 수준의 확인이 또한 본 발명에서 유용하다. 본원에서 사용되는 용어 "항-플라젤린 항체" 는 예를 들어, PCT 특허 공개 번호 WO 03/053220 및 미국 특허 공개 번호 20040043931 에 기술된 바와 같은 박테리아 플라젤라의 단백질 성분에 대한 항체를 포함한다. 용어 "플라젤린" 은 항-플라젤린 항체와 면역반응성인 박테리아 플라젤룸 단백질을 언급한다. 미생물 플라젤린은 중공 원통에서 스스로 정렬하여 필라멘트를 형성하는 박테리아 플라젤룸에서 발견되는 단백질이다.
개체로부터의 샘플 중 존재하는 항-플라젤린 항체의 수준은 플라젤린 단백질 또는 그의 조각 예컨대 그의 면역반응성 조각을 사용하여 확인될 수 있다. 샘플 중 항-플라젤린 항체 수준 확인에 유용한 적합한 플라젤린 항원은 플라젤린 단백질 예컨대 Cbir-1 플라젤린, 플라젤린 X, 플라젤린 A, 플라젤린 B, 그의 조각, 및 이들의 조합, 플라젤린 단백질과 실질적으로 동일한 아미노산 서열을 갖는 플라젤린 폴리펩티드, 또는 그의 조각 예컨대 그의 면역반응성 조각을 포함하나, 이에 제한되지는 않는다. 본원에 사용되는, 플라젤린 폴리펩티드는 일반적으로 자연 발생적 플라젤린 단백질과 약 50% 초과의 동일성, 바람직하게는 약 60% 초과의 동일성, 더욱 바람직하게는 약 70% 초과의 동일성, 더욱더 바람직하게는 약 80%, 85%, 90%, 95%, 96%, 97%, 98% 또는 99% 초과의 아미노산 서열 동일성을 갖는 폴리펩티드를 기술하며, 여기서 아미노산 동일성은 CLUSTALW 와 같은 서열 정렬 프로그램을 사용하여 확인된다. 상기 플라젤린 항원은, 예를 들어, 박테리아 예컨대 헬리코박터 빌리스 (Helicobacter Bills), 헬리코박터 무스텔라에 (Helicobacter mustelae), 헬리코박터 파일로리 (Helicobacter pylori), 부티를블브를로 피브리솔벤스 (Butyrlvlbrlo fibrisolvens) 및 맹장에서 발견되는 박테리아로부터의 정제에 의해, 플라젤린 항원을 인코딩하는 핵산의 재조합 발현에 의해, 용액 또는 고체 상 펩티드 합성과 같은 합성 수단에 의해, 또는 파지 디스플레이에 의해 제조될 수 있다.
E. 세포 표면 수용체
샘플 중 세포 표면 수용체의 확인이 또한 본 발명에서 유용하다. 항-TNF 약물 예컨대 Remicade 및 Humira 의 반감기는 높은 수준의 염증을 갖는 환자에서 유의하게 감소된다. 면역글로불린 (Ig) G1 및 IgG3 에 대한 고친화성 수용체인 CD64 는 주로 단핵 식세포에 의해 발현된다. 휴지 중인 다형핵 (PMN) 세포는 CD64 를 거의 발현하지 않으나, 이러한 마커의 발현은 골수 중의 미엘로이드 전구체에 작용하는 인터페론및 과립구-콜로니-자극 인자에 의해 상향조절된다. IgG 복합체를 이용하는 CD64 의 가교는 엔도사이토시스에 의한 면역 복합체의 내재화, 옵소닌 작용받은 입자들의 파고사이토시스, 탈과립, 산화 파열의 활성화, 및 사이토카인의 방출을 포함하는 다수의 세포 응답을 발휘한다.
그와 같이, 특정 양상에서, 본원에 기재된 방법은 하나 이상의 (복수의) 세포 표면 수용체 예컨대 CD64 (예를 들어, 단독으로 또는 다른 범주로부터의 바이오마커와의 조합으로) 에 기초하는 질환 활성 프로파일 (DAP) 의 확인을 이용하여 질환 과정의 예측, 적당한 항-TNF 약물 요법의 선별, 항-TNF 약물 요법의 최적화, 항-TNF 약물 요법과 연관되는 독성의 감소, 및/또는 항-TNF 약물을 이용하는 치료적 처리의 효능의 모니터링을 지원 또는 보조한다.
F. 신호전달 경로
샘플 중 신호전달 경로의 확인이 또한 본 발명에서 유용하다. 다형핵 (PMN) 세포 활성화에 뒤따르는, 장점막 (RA 에 대해서는 활막) 내로의 침윤 및 소낭선 상피를 통과하는 이주는 IBD 의 핵심 특색으로서 간주된다. 대변 인듐-111-라벨링된 백혈구 분비에 의해, IBD 환자에서 PMN 세포의 순환으로부터 장의 병든 부분으로의 이주가 10 배 이상 증가되는 것으로 추정되었다. 따라서, 본원에 기술된 합동 효소 강화 반응 면역검정 (CEER) 과 같은 검정을 사용하여 신호전달 경로를 측정하여 조직 염증 또는 혈액으로부터 PMN 세포의 활성화를 측정하는 것이 염증성 질환을 이해하기 위한 이상적 방안이다.
그와 같이, 특정 양상에서, 본원에 기재된 방법은 하나 이상의 신호전달 경로 내의 하나 이상의 (복수의) 신호 전달 분자 (예를 들어, 단독으로 또는 다른 범주로부터의 바이오마커와의 조합으로) 에 기초하는 질환 활성 프로파일 (DAP) 의 확인을 이용하여 질환 과정의 예측, 적당한 항-TNF 약물 요법의 선별, 항-TNF 약물 요법의 최적화, 항-TNF 약물 요법과 연관되는 독성의 감소, 및/또는 항-TNF 약물을 이용하는 치료적 처리의 효능의 모니터링을 지원 또는 보조한다. 바람직한 구현예에서, 하나 이상의 신호전달 경로 내의 하나 이상의 신호 전달 분자의 총 (예를 들어, 발현) 수준 및/또는 활성화 (예를 들어, 인산화) 수준이 측정된다.
용어 "신호 전달 분자" 또는 "신호 전달인자" 는, 전형적으로 세포 내부에서 순서 있는 생화학적 반응을 수반하는, 세포가 세포외 신호 또는 자극을 응답으로 변환시키는 과정을 수행하는 단백질 및 기타 분자들을 포함한다. 신호 전달 분자의 예는 수용체 티로신 키나제 예컨대 EGFR (예를 들어, EGFR/HER1/ErbB1, HER2/Neu/ErbB2, HER3/ErbB3, HER4/ErbB4), VEGFR1/FLT1, VEGFR2/FLK1/KDR, VEGFR3/FLT4, FLT3/FLK2, PDGFR (예를 들어, PDGFRA, PDGFRB), c-KIT/SCFR, INSR (인슐린 수용체), IGF-IR, IGF-IIR, IRR (인슐린 수용체-관련 수용체), CSF-1R, FGFR 1-4, HGFR 1-2, CCK4, TRK A-C, c-MET, RON, EPHA 1-8, EPHB 1-6, AXL, MER, TYRO3, TIE 1-2, TEK, RYK, DDR 1-2, RET, c-ROS, V-카드헤린, LTK (백혈구 티로신 키나제), ALK (악성 림프종 키나제), ROR 1-2, MUSK, AATYK 1-3, 및 RTK 106; 수용체 티로신 키나제의 절두된 형태 예컨대 아미노-말단 세포외 도메인이 결손된 절두된 HER2 수용체 (예를 들어, p95ErbB2 (p95m), p110, p95c, p95n, 등), 아미노-말단 세포외 도메인이 결손된 절두된 cMET 수용체, 및 아미노-말단 세포외 도메인이 결손된 절두된 HER3 수용체; 수용체 티로신 키나제 이합체 (예를 들어, p95HER2/HER3; p95HER2/HER2; HER1, HER2, HER3, 또는 HER4 를 갖는 절두된 HER3 수용체; HER2/HER2; HER3/HER3; HER2/HER3; HER1/HER2; HER1/HER3; HER2/HER4; HER3/HER4; 등); 비-수용체 티로신 키나제 예컨대 BCR-ABL, Src, Frk, Btk, Csk, Abl, Zap70, Fes/Fps, Fak, Jak, Ack, 및 LIMK; 티로신 키나제 신호전달 캐스케이드 성분 예컨대 AKT (예를 들어, AKT1, AKT2, AKT3), MEK (MAP2K1), ERK2 (MAPK1), ERK1 (MAPK3), PI3K (예를 들어, PIK3CA (p110), PIK3R1 (p85)), PDK1, PDK2, 포스파타제 및 텐신 동족체 (PTEN), SGK3, 4E-BP1, P70S6K (예를 들어, p70 S6 키나제 스플라이스 변이체 알파 I), 단백질 티로신 포스파타제 (예를 들어, PTP1B, PTPN13, BDP1, 등), RAF, PLA2, MEKK, JNKK, JNK, p38, Shc (p66), Ras (예를 들어, K-Ras, N-Ras, H-Ras), Rho, Rac1, Cdc42, PLC, PKC, p53, 사이클린 D1, STAT1, STAT3, 포스파티딜이노시톨 4,5-비스포스페이트 (PIP2), 포스파티딜이노시톨 3,4,5-트리스포스페이트 (PIP3), mTOR, BAD, p21, p27, ROCK, IP3, TSP-1, NOS, GSK-3 β, RSK 1-3, JNK, c-Jun, Rb, CREB, Ki67, 팍실린, NF-kB, 및 IKK; 핵 호르몬 수용체 예컨대 에스트로겐 수용체 (ER), 프로게스테론 수용체 (PR), 안드로겐 수용체, 글루코코르티코이드 수용체, 미네랄로코르티코이드 수용체, 비타민 A 수용체, 비타민 D 수용체, 레티노이드 수용체, 갑상선 호르몬 수용체, 및 고아 (orphan) 수용체; 핵 수용체 보조활성인자 및 억제인자 예컨대 유방암-1 에서 증폭되는 것 (AIB1) 및 핵 수용체 보조억제인자 1 (NCOR), 각각; 및 그들의 조합을 포함하나, 이에 제한되는 것은 아니다.
용어 "활성화 상태" 는 특정 신호 전달 분자가 활성화되어 있는지 여부를 언급한다. 유사하게, 용어 "활성화 수준" 은 특정 신호 전달 분자가 활성화되어 있는 정도를 언급한다. 활성화 상태는 전형적으로 하나 이상의 신호 전달 분자의 인산화, 유비퀴틴화 및/또는 복합체화 상태에 해당한다. 활성화 상태의 비제한적 예 (괄호 안에 열거됨) 는 하기를 포함한다: HER1/EGFR (EGFRvIII, 인산화된 (p-) EGFR, EGFR:Shc, 유비퀴틴화된 (u-) EGFR, p-EGFRvIII); ErbB2 (p-ErbB2, p95HER2 (절두된 ErbB2), p-p95HER2, ErbB2:Shc, ErbB2:PI3K, ErbB2:EGFR, ErbB2:ErbB3, ErbB2:ErbB4); ErbB3 (p-ErbB3, 절두된 ErbB3, ErbB3:PI3K, p-ErbB3:PI3K, ErbB3:Shc); ErbB4 (p-ErbB4, ErbB4:Shc); c-MET (p-c-MET, 절두된 c-MET, c-Met:HGF 복합체); AKT1 (p-AKT1); AKT2 (p-AKT2); AKT3 (p-AKT3); PTEN (p-PTEN); P70S6K (p-P70S6K); MEK (p-MEK); ERK1 (p-ERK1); ERK2 (p-ERK2); PDK1 (p-PDK1); PDK2 (p-PDK2); SGK3 (p-SGK3); 4E-BP1 (p-4E-BP1); PIK3R1 (p-PIK3R1); c-KIT (p-c-KIT); ER (p-ER); IGF-1R (p-IGF-1R, IGF-1R:IRS, IRS:PI3K, p-IRS, IGF-1R:PI3K); INSR (p-INSR); FLT3 (p-FLT3); HGFR1 (p-HGFR1); HGFR2 (p-HGFR2); RET (p-RET); PDGFRA (p-PDGFRA); PDGFRB (p-PDGFRB); VEGFR1 (p-VEGFR1, VEGFR1:PLCγ, VEGFR1:Src); VEGFR2 (p-VEGFR2, VEGFR2:PLCγ, VEGFR2:Src, VEGFR2:헤파린 설페이트, VEGFR2:VE-카드헤린); VEGFR3 (p-VEGFR3); FGFR1 (p-FGFR1); FGFR2 (p-FGFR2); FGFR3 (p-FGFR3); FGFR4 (p-FGFR4); TIEl (p-TIEl); TIE2 (p-TIE2); EPHA (p-EPHA); EPHB (p-EPHB); GSK-3β (p-GSK-3β); NF-kB (p-NF-kB, NF-kB-IkB 알파 복합체 등), IkB (p-IkB, p-P65:IkB); IKK (포스포 IKK); BAD (p-BAD, BAD:14-3-3); mTOR (p-mTOR); Rsk-1 (p-Rsk-1); Jnk (p-Jnk); P38 (p-P38); STAT1 (p-STAT1); STAT3 (p-STAT3); FAK (p-FAK); RB (p-RB); Ki67; p53 (p-p53); CREB (p-CREB); c-Jun (p-c-Jun); c-Src (p-c-Src); 팍실린 (p-팍실린); GRB2 (p-GRB2), Shc (p-Shc), Ras (p-Ras), GAB1 (p-GAB1), SHP2 (p-SHP2), GRB2 (p-GRB2), CRKL (p-CRKL), PLCγ (p-PLCγ), PKC (예를 들어, p-PKCα, p-PKCβ, p-PKCδ, 아듀신 (p-아듀신), RB1 (p-RB1), 및 PYK2 (p-PYK2).
하기 표는 총 수준 및/또는 활성화 (예를 들어, 인산화) 수준이 샘플 중에서 측정되어 (예를 들어, 단독으로 또는 다른 범주로부터의 바이오마커와의 조합으로) 질환 과정의 예측, 적당한 항-TNF 약물 요법의 선별, 항-TNF 약물 요법의 최적화, 항-TNF 약물 요법과 연관되는 독성의 감소, 또는 항-TNF 약물을 이용하는 치료적 처리의 효능의 모니터링을 지원 또는 보조할 수 있는 신호 전달 분자의 부가적 예를 제공한다.
합동 효소 강화 반응 면역검정 (CEER) 은, 또한 합동 근접 면역검정 (COPIA) 으로서도 알려져 있으며, 모든 목적을 위해 그 전문이 참조로 본원에 포함되는 하기 특허 문헌에 기술되어 있다: PCT 공개 번호 WO 2008/036802; PCT 공개 번호 WO 2009/012140; PCT 공개 번호 WO 2009/108637; PCT 공개 번호 WO 2010/132723; PCT 공개 번호 WO 2011/008990; 및 2010 년 10 월 20 일에 제출된 PCT 출원 번호 PCT/US2010/053386.
G. 제거 속도 상수
특정 구현예에서, 질환 활성 프로파일 (DAP) 에 대한 마커는 kel, 또는 항체 예컨대 항-TNF 항체 (예를 들어, 인플릭시맙) 의 제거 속도 상수이다. 제거 속도 상수 예컨대 kel 의 확인은 요법 선별, 요법 최적화, 독성 감소, 및/또는 하나 이상의 치료제 예컨대 생물제제 (예를 들어, 항-TNF 약물) 를 사용하는 치료적 처리의 효능 모니터링에 의하는 발명의 개인화된 치료적 관리 방법에서 특히 유용하다.
특정 경우에, 미분 방정식이 사용되어 환자로부터의 약물 제거를 모델링할 수 있다. 특정 경우에, 2-구획 PK 모델이 사용될 수 있다. 이 경우에, 정맥내 볼러스 투여에 뒤따르는 중심 구획 중 약물에 대한 방정식은 다음과 같다:
kelㆍX1 용어는 중심 구획으로부터의 약물의 제거를 기술하며, 한편 k12ㆍX1 및 k21ㆍX2 용어는 중심 및 주변 구획 사이에서의 약물의 분포를 기술한다.
H. 유전자 마커
샘플 중 하나 이상의 유전자 마커 (예를 들어, 단독으로 또는 다른 범주로부터의 바이오마커와의 조합으로) 중 대립형질 변이체 (예를 들어, SNPs) 의 존재 또는 부재의 확인은 또한 질환 과정의 예측, 적당한 항-TNF 약물 요법의 선별, 항-TNF 약물 요법의 최적화, 항-TNF 약물 요법과 연관되는 독성의 감소, 또는 항-TNF 약물을 이용하는 치료적 처리의 효능의 모니터링을 지원 또는 보조하는 본 발명의 방법에서 유용하다.
유전자 마커의 비제한적 예는 표 1 에 제시된 유전자형 (예를 들어, NOD2/CARD15 유전자, IL12/IL23 경로 유전자, 등) 일 수 있는 임의의 염증 경로 유전자 및 상응하는 SNP 를 포함하나 이에 제한되지 않는다. 바람직하게는, NOD2/CARD15 유전자 및/또는 IL12/IL23 경로 내의 하나 이상의 유전자 중 하나 이상의 대립형질 변이체, 예를 들어, 단일 뉴클레오티드 다형성 (SNP) 의 존재 또는 부재가 확인된다. 참고, 예를 들어, Barrett 등, Nat. Genet., 40:955-62 (2008) 및 Wang 등, Amer. J. Hum. Genet., 84:399-405 (2009).
표 1
본 발명에서 유용한 부가적 SNP 는, 예를 들어, rs2188962, rs9286879, rs11584383, rs7746082, rs1456893, rs1551398, rs17582416, rs3764147, rs1736135, rs4807569, rs7758080, 및 rs8098673 을 포함한다. 참고, 예를 들어, Barrett 등, Nat. Genet., 40:955-62 (2008).
특정 구현예에서, 하나 이상의 하기 유전자 마커 중 하나 이상의 돌연변이의 존재 또는 부재가 확인된다: 염증 경로 유전자, 예를 들어, 하나 이상의 염증 마커 예컨대, 예를 들어, NOD2/CARD15 (예를 들어, 미국 특허 번호 7,592,437 에 기술된 SNP 8, SNP 12, 및/또는 SNP 13), ATG16L1 (예를 들어, Lakatos 등, Digestive and Liver Disease, 40 (2008) 867-873 에 기술된 rs2241880 (T300A) SNP), IL23R (예를 들어, Lakatos 등에 기술된 rs11209026 (R381Q) SNP), 예를 들어, Gasche 등 (Eur. J. Gastroenterology & Hepatology, (2003) 15:599-606) 에 기술된 인간 백혈구 항원 (HLA) 유전자 및/또는 사이토카인 유전자, 및 IBD5 유전자좌로부터의 DLG5 및/또는 OCTN 유전자 중 변이체 대립형질 (예를 들어, SNPs) 의 존재 또는 부재.
1. NOD2/CARD15
NOD2/CARD15 유전자에서의 대립형질 변이체 예컨대 SNP 의 존재 또는 부재 여부의 확인이 본 발명에 특히 유용하다. 본원에서 사용되는 용어 "NOD2/CARD15 변이체" 또는 "NOD2 변이체" 는 야생형 NOD2 유전자에 비해 하나 이상의 변화를 함유하는 NOD2 유전자의 뉴클레오티드 서열 또는 야생형 NOD2 폴리펩티드 서열에 비해 하나 이상의 변화를 함유하는 NOD2 폴리펩티드의 아미노산 서열을 포함한다. NOD2 는 또한 CARD 15 로서도 알려져 있으며, 16 번 염색체 상의 IBD1 유전자좌에 국소화되고, 위치추적 클로닝 (Hugot 등, Nature, 411 : 599-603 (2001)) 및 위치추적 후보자 유전자 전략 (Ogura 등, Nature, 411: 603-606 (2001); Hampe 등, Lancet, 357: 1925-1928 (2001)) 으로 동정된다. IBD1 유전자좌는 염증성 장 질환에 대해 높은 다지점 연관 점수 (MLS) 를 갖는다 (16q12 에서 마커 D16S411 에서 MLS=5.7). 참고, 예를 들어, Cho 등, Inflamm. Bowel Dis., 3:186-190 (1997); Akolkar 등, Am. J. Gastroenterol., 96:1127-1132 (2001); Ohmen 등, Hum. Mol. Genet., 5:1679-1683 (1996); Parkes 등, Lancet, 348:1588 (1996); Cavanaugh 등, Ann. Hum. Genet., 62:291-8 (1998); Brant 등, Gastroenterology, 115:1056-1061 (1998); Curran 등, Gastroenterology, 115:1066-1071 (1998); Hampe 등, Am. J. Hum. Genet., 64:808-816 (1999); 및 Annese 등, Eur. J. Hum. Genet., 7:567-573 (1999).
인간 NOD2 의 mRNA (코딩) 및 폴리펩티드 서열은, 예를 들어, 각각 Genbank 접근 번호 NM_022162 및 NP_071445 에 제시되어 있다. 또한, NOD2 를 포함하는 인간 염색체 16 클론 RP11-327F22 의 완전 서열은, 예를 들어, Genbank 접근 번호 AC007728 에 제시되어 있다. 게다가, 다른 종으로부터의 NOD2 의 서열은 GenBank 데이타베이스에서 찾을 수 있다.
NOD2 단백질은 NF-카파 B (NF-kB), 및 여러 카르복시-말단 류신-풍부 반복 도메인을 활성화시킬 수 있는 (Ogura 등, J. Biol. Chem., 276:4812-4818 (2001)) 아미노-말단 카스파제 동원 도메인 (CARDs) 을 함유한다. NOD2 는 세포자멸사 조절인자 Apaf-1/CED-4 및 식물 질환 저항성 유전자 산물의 부류와 구조적 상동성을 갖는다 (Ogura 등, 상기 문헌). 식물 질환 저항성 유전자 산물과 유사하게, NOD2 는 아미노-말단 효과기 도메인, 뉴클레오티드-결합 도메인 및 류신 풍부 반복 (LRRs) 을 갖는다. 야생형 NOD2 는 핵 인자 NF-카파 B 를 활성화시켜, 그것이 박테리아 지질다당류에 응답성이 되도록 한다 (LPS; Ogura 등, supra; Inohara 등, J. Biol. Chem., 276:2551-2554 (2001). NOD2 는 LPS 에 대한 세포간 수용체로서 작용할 수 있으며, 응답성에 필요한 류신 풍부 반복부를 갖고 있다.
NOD2 의 코딩 영역 내 3 개의 단일 뉴클레오티드 다형성에서의 변이는 이전에 기술된 바 있다. 이들 3 개의 SNP 는 R702W ("SNP 8"), G908R ("SNP 12") 및 1007fs ("SNP 13") 로 지정되며, NOD2 유전자의 카르복시-말단 영역에 위치한다 (Hugot 등, 상기 문헌). 본 발명에 사용하기에 적합한 NOD2 유전자 내 SNP 8, SNP 12, 및 SNP 13, 뿐만 아니라 부가적 SNP 에 대한 추가의 설명을, 예를 들어, 미국 특허 번호 6,835,815; 6,858,391; 및 7,592,437; 및 미국 특허 공개 번호 20030190639, 20050054021, 및 20070072180 에서 찾을 수 있다.
일부 구현예에서, NOD2 변이체는 예를 들어, NOD2 폴리펩티드의 카르복시-말단 부분 내의 몇가지 류신-풍부 반복부를 인코딩하는 영역 내의 NOD2 유전자좌의 코딩 영역에 위치한다. NOD2 의 류신-풍부 반복 영역에 위치하는 그러한 NOD2 변이체들은 R702W ("SNP 8") 및 G908R ("SNP 12") 를 제한 없이 포함한다. 본 발명에 유용한 NOD2 변이체는 야생형 NOD2 폴리펩티드에 의한 NF-카파 B 활성화에 비해 NF-카파 B 를 활성화하는 능력이 감소된 NOD2 폴리펩티드를 또한 인코딩할 수 있다. 비제한적 예로서, NOD2 변이체 1007fs ("SNP 13") 는 LPS 자극에 대한 응답으로 NF-카파 B 를 유도하는 능력이 감소된 절두된 NOD2 폴리펩티드를 산출한다 (Ogura 등, Nature, 411:603-606 (2001)).
본 발명에 유용한 NOD2 변이체는 예를 들어 R702W, G908R 또는 1007fs 일 수 있다. R702W, G908R 및 1007fs 는 NOD2 의 코딩 영역 내에 위치한다. 하나의 구현예에서, 본 발명의 방법은 R702W NOD2 변이체를 이용하여 실시된다. 본원에서 사용되는 용어 "R702W" 는 NOD2 유전자의 엑손 4 내에 단일 뉴클레오티드 다형성을 포함하는데, 이는 NOD2 단백질의 아미노산 702 를 인코딩하는 트리플렛 내에 있다. 야생형 NOD2 대립형질은 AC007728 서열의 위치 138,991 에 시토신 (c) 잔기를 함유하는데, 이는 아미노산 702 에 아르기닌을 인코딩하는 트리플렛 내에 있다. R702W NOD2 변이체는 AC007728 서열의 위치 138,991 에 티민 (t) 잔기를 함유하여, NOD2 단백질의 아미노산 702 에서 아르기닌 (R) 이 트립토판 (W) 으로 치환된다. 따라서, 이러한 NOD2 변이체는 "R702W" 또는 "702 W" 로 표시되고, 또한 Hugot 등의 상기 문헌의 초기 번호지정 시스템에 기초하여 "R675W" 로도 표시될 수 있다. 또한, R702W 변이체는 "SNP 8" 대립형질 또는 SNP 8 에서의 "2" 대립형질로도 알려져 있다. R702W 또는 SNP 8 에 대한 NCBI SNP 번호는 rs2066844 이다. R702W NOD2 변이체 및 기타 NOD2 변이체의 존재는 예를 들어 대립형질 구별 검정 또는 서열 분석에 의해 편리하게 탐지될 수 있다.
본 발명의 방법은 또한 G908R NOD2 변이체를 사용하여 실시될 수 있다. 본원에서 사용되는 용어 "G908R" 은 NOD2 유전자의 엑손 8 내에 단일 뉴클레오티드 다형성을 포함하는데, 이는 NOD2 단백질의 아미노산 908 을 인코딩하는 트리플렛 내에 있다. 아미노산 908 은 NOD2 유전자의 류신 풍부 반복 영역 내에 위치한다. 야생형 NOD2 대립형질은 AC007728 서열의 위치 128,377 에 구아닌 (g) 잔기를 함유하는데, 이는 아미노산 908 에 글라이신을 인코딩하는 트리플렛 내에 있다. G908R NOD2 변이체는 AC007728 서열의 위치 128,377 에 시토신 (c) 잔기를 함유하여, NOD2 단백질의 아미노산 908 에서 글라이신 (G) 이 아르기닌 (R) 으로 치환된다. 따라서, 이러한 NOD2 변이체는 "G908R" 또는 "908R" 로 표시되고, 또한 Hugot 등의 상기 문헌의 초기 번호지정 시스템에 기초하여 "G881R" 로도 나타낼 수 있다. 또한, G908R 변이체는 "SNP 12" 대립형질 또는 SNP12 에서의 "2" 대립형질로도 공지되어 있다. G908R SNP 12 에 대한 NCBI SNP ID 번호는 rs2066845 이다.
본 발명의 방법은 또한 1007fs NOD2 변이체를 사용하여 실시될 수도 있다. 상기 변이체는 NOD2 단백질의 10 번째 류신-풍부 반복부에서의 프레임 변위를 초래하고 그에 뒤이어 조숙 정지 코돈이 위치하는 단일 뉴클레오티드의 삽입이다. 결과로서 수득되는 NOD2 단백질의 절두는 박테리아 지질다당류에 대한 응답으로 NF-카파B 의 활성화를 방지하는 것으로 보인다 (Ogura 등, 상기 문헌). 본원에서 사용되는 용어 "1007fs" 는 NOD2 유전자의 엑손 11 내에 단일 뉴클레오티드 다형성을 포함하는데, 이는 NOD2 단백질의 아미노산 1007 을 인코딩하는 트리플렛 내에 있다. 1007fs 변이체는 AC007728 서열의 위치 121,139 에 부가된 시토신을 함유하여, 아미노산 1007 에서 프레임 변위 돌연변이를 초래한다. 따라서, 이러한 NOD2 변이체는 "1007fs" 로 표시되고, 또한 Hugot 등의 상기 문헌의 초기 번호지정 시스템에 기초하여 "3020insC" 또는 "980fs" 로도 표시될 수 있다. 또한, 1007fs NOD2 변이체는 "SNP 13" 대립형질 또는 SNP 13 에서의 "2" 대립형질로도 알려져 있다. 1007fs 또는 SNP 13 에 대한 NCBI SNP ID 번호는 rs2066847 이다.
당업자는 특정 NOD2 변이체 대립형질 또는 기타 다형성 대립형질이 예를 들어 Centre d'Etude du Polymorphisme Humain (CEPH) 기준 개체 예컨대 1347-02 로 표시되는 개체 (Dib 등, Nature, 380: 152-154 (1996)) 와 비교하여 예를 들어 PE Biosystems 로부터 수득되는 상업적으로 입수가능한 기준 DNA (Foster City, CA) 를 이용하여 편리하게 정해질 수 있다는 점을 인지할 것이다. 또한, SNP 에 대한 구체적인 정보는 National Center for Biotechnology Information (NCBI) 의 dbSNP 로부터 입수가능하다.
NOD2 변이체는 또한 NOD2 유전자좌의 비-코딩 영역에 위치할 수 있다. 비-코딩 영역은 예를 들어 인트론 서열 뿐만 아니라 5' 및 3' 비번역 서열을 포함한다. NOD2 유전자의 비-코딩 영역에 위치하는 NOD2 변이체 대립형질의 비제한적 예는 JW1 변이체이며, 이는 Sugimura 등, Am. J. Hum. Genet., 72:509-518 (2003) 및 미국 특허 공개 번호 20070072180 에 기술되어 있다. NOD2 유전자의 3' 비번역 영역에 위치하는 NOD2 변이체 대립형질의 예는 미국 특허 공개 번호 20070072180 에 기술되어 있는 JW15 및 JW16 변이체 대립형질을 제한 없이 포함한다. NOD2 유전자의 5' 비번역 영역 (예를 들어, 프로모터 영역) 에 위치하는 NOD2 변이체 대립형질의 예는 미국 특허 공개 번호 20070072180 에 기술되어 있는 JW17 및 JW18 변이체 대립형질을 포함하나, 이에 제한되지 않는다.
본원에서 사용되는 용어 "JW1 변이체 대립형질" 은 NOD2 유전자의 개입 서열 8 (인트론 8) 의 뉴클레오티드 158 에서 유전자 변이를 포함한다. AC007728 서열과 관련하여, JW1 변이체 대립형질이 위치 128,143 에 위치한다. 인트론 8 의 뉴클레오티드 158 에서의 유전자 변이는 단일 뉴클레오티드 치환, 다중 뉴클레오티드 치환, 또는 하나 이상의 뉴클레오티드의 결실 또는 삽입을 포함하나, 이제 제한되지 않는다. 인트론 8 의 야생형 서열은 위치 158 에 시토신을 갖는다. 비제한적 예로서, JW1 변이체 대립형질은 인트론 8 의 뉴클레오티드 158 에서 시토신 (c) 에서 아데닌 (a) 으로, 시토신 (c) 에서 구아닌 (g) 으로, 또는 시토신 (c) 에서 티민 (t) 으로 치환될 수 있다. 하나의 구현예에서, JW1 변이체 대립형질은 NOD2 인트론 8 의 뉴클레오티드 158 에서 시토신 (c) 으로부터 티민 (t) 으로의 변화이다.
용어 "JW15 변이체 대립형질" 은 AC007728 서열의 뉴클레오티드 위치 118,790 에서 NOD2 의 3' 비번역 영역에 유전자 변이를 포함한다. 뉴클레오티드 118,790 에서의 유전자 변이는 단일 뉴클레오티드 치환, 다중 뉴클레오티드 치환, 또는 하나 이상의 뉴클레오티드의 결실 또는 삽입일 수 있으나, 이에 제한되지 않는다. 야생형 서열은 위치 118,790 에서 아데닌 (a) 을 갖는다. 비제한적 예로서, JW15 변이체 대립형질은 뉴클레오티드 118,790 에서 아데닌 (a) 에서 시토신 (c) 으로, 아데닌 (a) 에서 구아닌 (g) 으로, 또는 아데닌 (a) 에서 티민 (t) 으로 치환될 수 있다. 하나의 구현예에서, JW15 변이체 대립형질은 뉴클레오티드 118,790 에서 아데닌 (a) 에서 시토신 (c) 으로의 변화이다.
본원에서 사용되는 용어 "JW16 변이체 대립형질" 은 AC007728 서열의 뉴클레오티드 위치 118,031 에서 NOD2 의 3' 비번역 영역에 유전자 변이를 포함한다. 뉴클레오티드 118,031 에서의 유전자 변이는 단일 뉴클레오티드 치환, 다중 뉴클레오티드 치환, 또는 하나 이상의 뉴클레오티드의 결실 또는 삽입일 수 있으나, 이에 제한되지 않는다. 야생형 서열은 위치 118,031 에서 구아닌 (g) 을 갖는다. 비제한적 예로서, JW16 변이체 대립형질은 뉴클레오티드 118,031 에서 구아닌 (g) 에서 시토신 (c) 으로, 구아닌 (g) 에서 아데닌 (a) 으로, 또는 구아닌 (g) 에서 티민 (t) 으로 치환될 수 있다. 하나의 구현예에서, JW16 변이체 대립형질은 뉴클레오티드 118,031 에서 구아닌 (g) 으로부터 아데닌 (a) 으로의 변화이다.
용어 "JW17 변이체 대립형질" 은 AC007728 서열의 뉴클레오티드 위치 154,688 에서 NOD2 의 5' 비번역 영역에 유전자 변이를 포함한다. 뉴클레오티드 154,688 에서의 유전자 변이는 단일 뉴클레오티드 치환, 다중 뉴클레오티드 치환, 또는 하나 이상의 뉴클레오티드의 결실 또는 삽입일 수 있으나, 이에 제한되지 않는다. 야생형 서열은 위치 154,688 에서 시토신 (c) 을 갖는다. 비제한적 예로서, JW17 변이체 대립형질은 뉴클레오티드 154,688 에서 시토신 (c) 에서 아데닌 (a) 으로, 시토신 (c) 에서 구아닌 (g) 으로, 또는 시토신 (c) 에서 티민 (t) 으로 치환될 수 있다. 하나의 구현예에서, JW17 변이체 대립형질은 뉴클레오티드 154,688 에서 시토신 (c) 에서 티민 (t) 으로의 변화이다.
본원에서 사용되는 용어 "JW18 변이체 대립형질" 은 AC007728 서열의 뉴클레오티드 위치 154,471 에서 NOD2 의 5' 미번역 영역에 유전자 변이를 포함한다. 뉴클레오티드 154,471 에서의 유전자 변이는, 단일 뉴클레오티드 치환, 다중 뉴클레오티드 치환, 또는 하나 이상의 뉴클레오티드의 결실 또는 삽입을 포함하나, 이에 제한되지 않는다. 야생형 서열은 위치 154,471 에서 시토신 (c) 을 갖는다. 비제한적 예로서, JW18 변이체 대립형질은 뉴클레오티드 154,471 에서 시토신 (c) 에서 구아닌 (g) 으로, 시토신 (c) 에서 아데닌 (a) 으로, 또는 시토신 (c) 에서 티민 (t) 으로 치환될 수 있다. 하나의 구현예에서, JW18 변이체 대립형질은 뉴클레오티드 154,471 에서 시토신 (c) 으로부터 티민 (t) 로의 변화를 갖는다.
본 발명의 방법이 NOD2 유전자좌의 코딩 영역 또는 비-코딩 영역 (예를 들어, 인트론 또는 프로모터 영역) 에 위치하는 상기 또는 기타 NOD2 변이체 대립형질을 사용하여 실시될 수 있다고 이해된다. 추가로, 본 발명의 방법이 SNP 8, SNP 12 및 SNP 13 대립형질, 및 기타 코딩 뿐만 아니라 비-코딩 영역 변이체를 포함하나, 이에 제한되지 않는, 1, 2, 3, 4, 또는 그 이상의 NOD2 변이체의 존재 확인을 수반할 수 있다고 이해된다.
II. 통계 분석
일부 양상에서, 본 발명은 하나 이상의 (예를 들어, 2, 3, 4, 5, 6, 7, 또는 그 이상의 조합의) 생화학적 마커, 혈청학적 마커, 및/또는 유전자 마커에 통계적 알고리즘을 적용하여 질환 활성 프로파일 (DAP) 을 생성하는 것에 의하는 항-TNF 약물 요법의 선별, 항-TNF 약물 요법의 최적화, 항-TNF 약물 요법과 연관되는 독성의 감소, 및/또는 항-TNF 약물 처리의 효능의 모니터링 방법을 제공한다. 특정 구현예에서, 변위치 분석이 하나 이상의 마커의 존재, 수준, 및/또는 유전자형에 적용되어, 항-TNF 약물 요법을 받고 있는 환자를 위한 치료 결정을 안내한다. 다른 구현예에서, 하나 또는 둘 이상의 학습 통계 분류기 시스템의 조합이 하나 이상의 마커의 존재, 수준, 및/또는 유전자형에 적용되어, 항-TNF 약물 요법을 받고 있는 환자를 위한 치료 결정을 안내한다. 본 발명의 방법의 통계 분석은 유리하게는 초기 항-TNF 약물 요법의 선별 및 언제 또는 어떻게 항-TNF 약물의 후속 투여량을 조정 또는 수정 (예를 들어, 증가 또는 감소) 할지, 항-TNF 약물 (예를 들어, 증가된, 감소된, 또는 동일한 투여량에서) 을 하나 이상의 면역억제제 예컨대 메토트렉세이트 (MTX) 또는 아자티오프린 (AZA) 과 조합할지, 및/또는 현재의 요법의 과정을 변화 (예를 들어, 상이한 항-TNF 약물로 전환) 시킬지의 결정을 위한 개선된 민감도, 특이도, 음성 예측값, 양성 예측값, 및/또는 전체적 정확도를 제공한다.
용어 "통계 분석" 또는 "통계적 알고리즘" 또는 "통계적 과정" 은 변수 사이의 관계를 결정하는데 사용되는 임의의 여러 가지 통계적 방법 및 모델을 포함한다. 본 발명에서, 변수는 관심의 하나 이상의 마커의 존재, 수준, 또는 유전자형이다. 본원에 기술된 통계 분석을 사용하여 임의의 수의 마커가 분석될 수 있다. 예를 들어, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55, 60, 또는 그 이상의 마커의 존재 또는 수준이 통계 분석에 포함될 수 있다. 하나의 구현예에서, 로지스틱 회귀가 사용된다. 또다른 구현예에서, 선형 회귀가 사용된다. 또다른 구현예에서, 정규 최소 제곱 회귀 또는 무조건 로지스틱 회귀가 사용된다. 특정 바람직한 구현예에서, 본 발명의 통계 분석은, 예를 들어, 변수로서, 소정의 집단 내에서, 하나 이상의 마커의 변위치 측정을 포함한다. 변위치는 데이타의 샘플을 (가능한 한) 동일한 수의 관찰을 함유하는 그룹으로 분류하는 "컷 포인트" 의 세트이다. 예를 들어, 사분위수는 데이타의 샘플을 (가능한 한) 동일한 수의 관찰을 함유하는 4 개의 그룹으로 분류하는 값이다. 더 낮은 사분위수는 순서 있는 데이타 세트의 아래서 위로 4분의 1 에 해당하는 데이타 값이다; 더 높은 사분위수는 순서 있는 데이타 세트의 위에서 아래로 4분의 1 에 해당하는 데이타 값이다. 오분위수는 데이타의 샘플을 (가능한 한) 동일한 수의 관찰을 함유하는 5 개의 그룹으로 분류하는 값이다. 본 발명은 통계 분석에서의 변수로서 (연속적 변수와 같이) 마커 수준의 백분위수 범위 (예를 들어, 삼분위수, 사분위수, 오분위수, 등), 또는 그들의 누적 지수 (예를 들어, 사분위수 합계 점수 (QSS) 를 수득하는 마커 수준의 사분위수 합계, 등) 의 사용을 또한 포함할 수 있다.
특정 구현예에서, 본 발명은 사분위수 분석을 사용하는 하나 이상의 관심의 마커의 존재, 수준 (예를 들어, 규모), 및/또는 유전자형의 탐지 또는 확인을 수반한다. 이러한 유형의 통계 분석에서, 관심의 마커의 수준은 샘플의 레퍼런스 데이타베이스에 대한 첫번째 사분위수 (<25%), 두번째 사분위수 (25-50%), 세번째 사분위수 (51%-<75%), 또는 네번째 사분위수 (75-100%) 안에 있는 것으로서 정의된다. 이들 사분위수에는 사분위수 점수 1, 2, 3, 및 4 가 각각 부여될 수 있다. 특정 경우에, 샘플 중 탐지되지 않는 마커에는 사분위수 점수 0 또는 1 이 부여되며, 한편 샘플 (예를 들어, 샘플이 마커에 대해 양성임) 중 탐지되는 (예를 들어, 존재하는) 마커에는 사분위수 점수 4 가 부여된다. 일부 구현예에서, 사분위수 1 은 마커 수준이 최저인 샘플을 나타내고, 한편 사분위수 4 는 마커 수준이 최고인 샘플을 나타낸다. 다른 구현예에서, 사분위수 1 은 특정 마커 유전자형 (예를 들어, 야생형 대립형질) 을 갖는 샘플을 나타내고, 한편 사분위수 4 는 또다른 특정 마커 유전자형 (예를 들어, 대립형질 변이체) 을 갖는 샘플을 나타낸다. 샘플의 레퍼런스 데이타베이스는 광범위한 TNFα-매개 질환 또는 장애 예컨대, 예를 들어, IBD 환자를 포함할 수 있다. 그러한 데이타베이스로부터, 사분위수 컷-오프가 확립될 수 있다. 본 발명에서 사용하기에 적합한 사분위수 분석의 비-제한적 예가, 예를 들어, Mow 등, Gastroenterology, 126:414-24 (2004) 에 기술되어 있다.
일부 구현예에서, 본 발명의 통계 분석은 하나 이상의 학습 통계 분류기 시스템을 포함한다. 본원에서 사용되는 용어 "학습 통계 분류기 시스템" 은 복합 데이타 세트 (예를 들어, 관심의 마커의 패널) 에 적응하고 그러한 데이타 세트에 기초하여 결정을 내리는 능력이 있는 기계 학습 알고리즘 기술을 포함한다. 일부 구현예에서, 단일 학습 통계 분류기 시스템 예컨대 결정/분류 트리 (예를 들어, 랜덤 포레스트 (RF) 또는 분류 및 회귀 트리 (C&RT)) 가 사용된다. 다른 구현예에서, 2, 3, 4, 5, 6, 7, 8, 9, 10, 또는 그 이상의 학습 통계 분류기 시스템의 조합이, 바람직하게는 질렬로, 사용된다. 학습 통계 분류기 시스템의 예는 귀납적 학습을 사용하는 것 (예를 들어, 결정/분류 트리 예컨대 랜덤 포레스트, 분류 및 회귀 트리 (C&RT), 부스티드 트리, 등), 개연적 근사 정확 (Probably Approximately Correct) (PAC) 학습, 연결주의 학습 (예를 들어, 신경 네트워크 (NN), 인공 신경 네트워크 (ANN), 뉴로 퍼지 네트워크 (NFN), 네트워크 구조, 콕스 비례-해저드 모델 (CPHM), 퍼셉트론 예컨대 다층 퍼셉트론, 다층 피드-포워드 네트워크, 신경 네트워크의 응용, 신념 네트워크에서의 베이지안 학습, 등), 강화 학습 (예를 들어, 알려진 환경에서의 수동 학습 예컨대 나이브 학습, 적응 동적 학습, 및 일시적 차이 학습, 미지 환경에서의 수동 학습, 미지 환경에서의 능동 학습, 학습 행동-가치 함수, 강화 학습의 응용, 등), 및 유전자 알고리즘 및 진화 프로그래밍을 포함하나, 이에 제한되는 것은 아니다. 다른 학습 통계 분류기 시스템은 서포트 벡터 머신 (예를 들어, Kernel 방법), 다변량 적응 회귀 스플라인 (MARS), 레벤버그 마쿼트 (Levenberg-Marquardt) 알고리즘, 가우스-뉴턴 (Gauss-Newton) 알고리즘, 가우시안 (Gaussians) 의 혼합, 기울기 강하 알고리즘, 및 학습 벡터 양자화 (LVQ) 를 포함한다.
랜덤 포레스트는 Leo Breiman 및 Adele Cutler 에 의해 개발된 알고리즘을 사용하여 구축되는 학습 통계 분류기 시스템이다. 랜덤 포레스트는 다수의 개체 결정 트리를 사용하고, 개별 트리에 의해 확인되는 클래스의 모드 (즉, 가장 빈번히 발생하는 것) 를 선택함으로써 클래스를 결정한다. 랜덤 포레스트 분석은, 예를 들어, Salford Systems (San Diego, CA) 으로부터 입수가능한 RandomForests 소프트웨어를 사용하여 수행될 수 있다. 랜덤 포레스트의 설명에 대해, 예를 들어, Breiman, Machine Learning, 45:5-32 (2001); and https://stat-www.berkeley.edu/users/breiman/RandomForests/cc_home.htm 을 참고한다.
분류 및 회귀 트리는 적합 고전 회귀 모델에 대한 컴퓨터 집약형 대안에 해당하고, 전형적으로 하나 이상의 예측인자에 기초하여 관심의 범주 또는 연속 응답에 대한 최선의 가능한 모델을 결정하는데 사용된다. 분류 및 회귀 트리 분석은, 예를 들어, Salford Systems 로부터 입수가능한 C&RT 소프트웨어 또는 StatSoft, Inc. (Tulsa, OK) 로부터 입수가능한 Statistica 데이타 분석 소프트웨어를 사용하여, 수행될 수 있다. 분류 및 회귀 트리의 설명은, 예를 들어, Breiman et al. "Classification and Regression Trees," Chapman and Hall, New York (1984); 및 Steinberg et al., "CART: Tree-Structured Non-Parametric Data Analysis," Salford Systems, San Diego, (1995) 에서 찾을 수 있다.
신경 네트워크는 계산에 대한 연결주의 접근법에 기초하는 정보 가공을 위한 수학 또는 컴퓨터 모델을 사용하는 인공 뉴런의 상호연결된 그룹이다. 전형적으로, 신경 네트워크는 네트워크를 통과하는 외부 또는 내부 정보에 기초하여 그의 구조를 변화시키는 적응 시스템이다. 신경 네트워크의 구체적 예는 피드-포워드 신경 네트워크 예컨대 퍼셉트론, 단층 퍼셉트론, 다층 퍼셉트론, 역전파 네트워크, ADALINE 네트워크, MADALINE 네트워크, Learnmatrix 네트워크, 방사 기초 함수 (RBF) 네트워크, 및 자기 조직화 지도 또는 Kohonen 자기 조직화 네트워크; 재귀형 신경 네트워크 예컨대 단순 재귀형 네트워크 및 Hopfield 네트워크; 추계학적 신경 네트워크 예컨대 Boltzmann 기계; 모듈형 신경 네트워크 예컨대 기계의 집합 (committee) 및 연합 신경 네트워크; 및 기타 유형의 네트워크 예컨대 순간적으로 훈련된 신경 네트워크, 스파이킹 (spiking) 신경 네트워크, 동적 신경 네트워크, 및 연쇄 (cascading) 신경 네트워크를 포함한다. 신경 네트워크 분석은, 예를 들어, StatSoft, Inc 로부터 입수가능한 Statistica 데이타 분석 소프트웨어를 사용하여, 수행될 수 있다. 신경 네트워크의 설명에 대해, 예를 들어, Freeman et al., In "Neural Networks: Algorithms, Applications and Programming Techniques," Addison-Wesley Publishing Company (1991); Zadeh, "Information and Control, 8:338-353 (1965); Zadeh, "IEEE Trans. on Systems, Man and Cybernetics," 3:28-44 (1973); Gersho et al., In "Vector Quantization and Signal Compression," Kluywer Academic Publishers, Boston, Dordrecht, London (1992); 및 Hassoun, "Fundamentals of Artificial Neural Networks," MIT Press, Cambridge, Massachusetts, London (1995) 를 참고한다.
서포트 벡터 머신은 분류 및 회귀에 사용되는 관련된 지도 학습 기술의 세트이고, 예를 들어, Cristianini et al., "An Introduction to Support Vector Machines and Other Kernel-Based Learning Methods," Cambridge University Press (2000) 에 기술되어 있다. 서포트 벡터 머신 분석은, 예를 들어, Thorsten Joachims (Cornell University) 에 의해 개발된 SVM light 소프트웨어 또는 Chih-Chung Chang 및 Chih-Jen Lin (National Taiwan University) 에 의해 개발된 LIBSVM 소프트웨어를 사용하여 수행될 수 있다.
본원에 기술된 다양한 통계적 방법 및 모델은 건강한 개체 및 TNFα-매개 질환 또는 장애 예컨대, 예를 들어, IBD (예를 들어, CD 및/또는 UC) 환자로부터의 샘플 (예를 들어, 혈청학적 및/또는 게놈 샘플) 의 코호트를 사용하여 훈련 및 시험될 수 있다. 예를 들어, 의사, 바람직하게는 위장병학자에 의해, 예를 들어, 미국 특허 번호 6,218,129 에 기술된, 생검, 대장내시경검사, 또는 면역검정을 사용하여, IBD 또는 그의 임상 아형을 갖는 것으로 진단된 환자로부터의 샘플이 본 발명의 통계적 방법 및 모델의 훈련 및 시험에 사용하기에 적합하다. IBD 로 진단된 환자로부터의 샘플은 또한, 예를 들어, 미국 특허 번호 5,750,355 및 5,830,675 에 기술된, 면역검정을 사용하여 크론병 또는 궤양성 대장염으로 계층화될 수 있다. 건강한 개체로부터의 샘플은 IBD 샘플로 식별되지 않았던 것들을 포함할 수 있다. 당업자는 본 발명의 통계적 방법 및 모델의 훈련 및 시험에 사용될 수 있는 환자 샘플의 코호트를 수득하기 위한 부가적 기술 및 진단 기준을 알 것이다.
본원에서 사용되는 용어 "민감도" 는 샘플이 양성일 때, 예를 들어, 항-TNF 약물 요법에 대한 예측된 치료적 응답 또는 항-TNF 약물 요법과 연관되는 독성을 가질 때 항-TNF 약물 요법의 선별, 항-TNF 약물 요법의 최적화, 항-TNF 약물 요법과 연관되는 독성의 감소, 및/또는 항-TNF 약물 처리의 효능의 모니터링을 위한 본 발명의 방법이 양성 결과를 제공할 개연성을 포함한다. 민감도는 참 양성 결과를 참 양성 및 거짓 음성의 합계로 나눈 수로서 계산된다. 민감도는 본질적으로 얼마나 잘 본 발명이 항-TNF 약물 요법에 대한 예측된 치료적 응답 또는 항-TNF 약물 요법과 연관되는 독성을 갖는 자를 예측된 치료적 응답 또는 독성을 갖지 않는 자로부터 정확하게 식별하는지의 척도이다. 통계적 방법 및 모델은 민감도가 약 60% 이상, 예를 들어, 적어도 약 65%, 70%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 일 수 있도록 선택될 수 있다.
용어 "특이도" 는 샘플이 양성이 아닐 때, 예를 들어, 항-TNF 약물 요법에 대한 예측된 치료적 응답 또는 항-TNF 약물 요법과 연관되는 독성을 갖지 않을 때 항-TNF 약물 요법의 선별, 항-TNF 약물 요법의 최적화, 항-TNF 약물 요법과 연관되는 독성의 감소, 및/또는 항-TNF 약물 처리의 효능의 모니터링을 위한 본 발명의 방법이 음성 결과를 제공할 개연성을 포함한다. 특이도는 참 음성 결과를 참 음성 및 거짓 양성의 합계로 나눈 수로서 계산된다. 특이도는 본질적으로 얼마나 잘 본 발명이 항-TNF 약물 요법에 대한 예측된 치료적 응답 또는 항-TNF 약물 요법과 연관되는 독성을 갖지 않는 자를 예측된 치료적 응답 또는 독성로부터 배제하는지의 척도이다. 통계적 방법 및 모델은 특이도가 약 60% 이상, 예를 들어, 적어도 약 65%, 70%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 일 수 있도록 선택될 수 있다.
용어 "음성 예측값" 또는 "NPV" 는 항-TNF 약물 요법에 대한 예측된 치료적 응답 또는 항-TNF 약물 요법과 연관되는 독성을 갖지 않는 것으로 식별된 개체가 실제로 예측된 치료적 응답 또는 독성을 갖지 않을 개연성을 포함한다. 음성 예측값은 참 음성을 참 음성 및 거짓 음성의 합계로 나눈 수로서 계산될 수 있다. 음성 예측값은 본 발명의 방법의 특징 뿐만 아니라 분석되는 집단 중 질환의 출현율에 의해 결정된다. 통계적 방법 및 모델은 질환이 출현한 집단에서 음성 예측값이 약 70% ~ 약 99% 범위, 예를 들어, 적어도 약 70%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 일 수 있도록 선택될 수 있다.
용어 "양성 예측값" 또는 "PPV" 는 항-TNF 약물 요법에 대한 예측된 치료적 응답 또는 항-TNF 약물 요법과 연관되는 독성을 갖는 것으로 식별된 개체가 실제로 예측된 치료적 응답 또는 독성을 가질 개연성을 포함한다. 양성 예측값은 참 양성을 참 양성 및 거짓 양성의 합계로 나눈 수로서 계산될 수 있다. 양성 예측값은 본 발명의 방법의 특징 뿐만 아니라 분석되는 집단 중 질환의 출현율에 의해 결정된다. 통계적 방법 및 모델은 질환이 출현한 집단에서 양성 예측값이 약 70% ~ 약 99% 범위, 예를 들어, 적어도 약 70%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 일 수 있도록 선택될 수 있다.
음성 및 양성 예측값을 포함하는 예측값은 분석되는 집단 중 질환의 출현율에 의해 영향을 받는다. 본 발명에서, 통계적 방법 및 모델은 TNFα-매개 질환 또는 장애 예컨대, 예를 들어, IBD 에 대한 특정 출현율을 갖는 임상 집단에 대해 원하는 임상 파라미터를 생성하도록 선택될 수 있다. 비-제한적 예로서, 통계적 방법 및 모델은, 예를 들어, 임상의의 진료실 예컨대 위장병학자의 진료실 또는 가정의의 진료실에서 볼 수 있는, IBD 출현율 약 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 또는 70% 까지에 대해 선택되될 수 있다.
본원에서 사용되는 용어 "전체적 일치" 또는 "전체적 정확도" 는 본 발명의 방법이 항-TNF 약물 요법을 선별, 항-TNF 약물 요법을 최적화, 항-TNF 약물 요법과 연관되는 독성을 감소, 및/또는 항-TNF 약물 처리의 효능을 모니터링할 때의 정확도를 포함한다. 전체적 정확도는 참 양성 및 참 음성의 합계를 샘플 결과의 총수로 나눈 값으로서 계산되고, 분석되는 집단 중 질환의 출현율에 의해 영향을 받는다. 예를 들어, 통계적 방법 및 모델은 질환이 출현한 집단에서 전체적 정확도가 약 40% 이상, 예를 들어, 적어도 약 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 일 수 있도록 선택될 수 있다.
III. 실시예
본 발명은 구체적 구현예에 의해 더욱 상세히 기술될 것이다. 하기 실시예는 설명을 목적으로 제공되고, 어떠한 식으로든 본 발명을 제한하려는 것이 아니다. 당업자는 변화 또는 수정되어 본질적으로 동일한 결과를 산출할 수 있는 여러 가지 중요하지 않은 파라미터를 용이하게 인식할 것이다.
2011 년 2 월 17 일에 제출된 미국 가 출원 번호 61/444,097, 및 2010 년 10 월 26 월에 제출된 PCT 출원 번호 PCT/US2010/054125 에 제시된 실시예가 모든 목적을 위해 그 전문이 본원에 참조로 포함된다.
실시예 1. 항-TNFα 생물제제에 대한 응답자 및 비-응답자를 식별하기 위한 질환 활성 프로파일링.
이 실시예는 대상을 항-TNF 약물 요법에 대한 응답자 또는 비-응답자로서 식별하는 본 발명의 질환 활성 프로파일링을 사용하는, 대상에서 요법을 최적화 또는 치료 효능을 모니터링하기 위한 TNFα-매개 질환의 개인화된 치료적 관리 방법을 기술한다.
도 1 은 상처 진행이 염증, 증식, 및 재형성 기로 분류되는 예시적 IBD 상처 응답 프로파일을 보여준다. 비제한적 예로서, 시험된 염증 응답기 마커는 하기를 포함한다: 항-TNF 약물 예컨대 Remicade (인플릭시맙); 항-약물 항체 (ADA) 예컨대 HACA; 염증 마커 예컨대 GM-CSF, IFN-γ, IL-1β, IL-2, IL-6, IL-8, TNF-α, 및 sTNF RII; 및 항-염증 마커 예컨대 IL-12p70 및 IL-10. 시험된 증식 응답기 마커의 비제한적 예는 조직 복구/재형성 인자 (또한 점막 치유 마커로도 언급됨) 예컨대 AREG, EREG, HB-EGF, HGF, NRG1, NRG2, NRG3, NRG4, BTC, EGF, IGF, TGF-α, VEGF-A, VEGF-B, VEGF-C, VEGF-D, FGF1, FGF2, FGF7, FGF9, 및 TWEAK 를 포함한다.
COMMIT (유지 메토트렉세이트-인플릭시맙 시험의 조합 (Combination Of Maintenance Methotrexate-Infliximab Trial)) 연구를 수행하여 크론병 (CD) 의 장기 치료를 위한 메토트렉세이트와 조합된 Remicade (인플릭시맙) 의 안전성 및 효능을 평가했다. 치료 성공을 주 14 에 임상 차도 (즉, 프레드니손 요법의 완전 중지 및 크론병 활성 지수 (CDAI) 점수 <150), 및 연구 주 14 및 주 50 사이에 임상 차도의 유지를 보이는 대상의 비율에 의해 정의했다. 특히, CDAI 를 이용한 임상 평가를 주 0, 주 46, 주 50 및 주 66 에 수행했다. CDAI > 150 인 대상을 비-응답자로서 식별했다. COMMIT 연구에 대한 부가적 정보는 https://www.clinicaltrials.gov/ct2/show/NCT00132899 에 제공되어 있으며, 상기의 공개는 모든 목적을 위해 그 전문이 참조로 포함됨다.
질환 활성 프로파일링을 COMMIT 연구의 다수의 대상에 대해 수행했다. 특히, 하기 마커의 어레이를 Remicade (인플릭시맙) 단독 처리 또는 Remicade (인플릭시맙) 와 메토트렉세이트의 조합 처리 동안 다양한 시점에서 측정했다: (1) Remicade (인플릭시맙) 및 HACA; (2) 염증 마커 GM-CSF, IFN-γ, IL-1β, IL-2, IL-6, IL-8, TNF-α, 및 sTNF RII; (3) 항-염증 마커 IL-12p70 및 IL-10; 및 (4) 조직 복구 마커 EGF, bFGF, PIGF, sFlt1, 및 VEGF. 이들 대상 중 7 명에 대한 질환 활성 프로파일 (DAP) 은 응답자 및 비-응답자 프로파일 사이의 비교를 제공하며, 여기에서 설명된다. 이들 환자 예는 선택된 활성 CD 환자에서 염증 및 조직 복구에 대한 마커가 인플릭시맙 및 HACA 수준과 상관관계가 있었고, 특정 마커는 질환 활성 프로파일을 예측할 수 있고, 질환 활성 프로파일링은 추가로 환자 요법을 안내하고 점막 치유 마커를 식별할 것임을 보여준다. 또한, 이들 환자 예는 항-염증 사이토카인 예컨대 IL-12p70 및 IL-10 이 상승될 때마다 환자가 응답하고 (이는 그들이 점막 치유의 마커일 수 있음을 시사함), 조직 복구 마커 (TRM) 가 비-응답자에서 상승함을 보여준다.
개인화된 질환 활성 프로파일링의 표: IFX, HACA, 염증 마커, 항-염증 마커, 및 점막 치유 마커의 수준
환자 12209: 인플릭시맙 + 메토트렉세이트 (MTX) 처리됨.
시간 0 에서 CDAI 는 202 였다. 주 46 에서, CDAI 는 183 이었다 ("델타 19" 또는 202-19=183). 주 66 에서, CDAI 는 152 였다 ("델타 50" 또는 202-50=152). 비-응답자로서 임상 정의되었다. 질환 활성 프로파일 (DAP) 은 이 환자를 정확히 식별했다. 특히, DAP 은 이 환자가 저점 ("T"; 주 14) 에서 낮은 인플릭시맙 (IFX) 수준, 탐지가능한 농도 수준의 HACA ("HACA +"), 높은 염증 마커 수준, 낮은 항-염증 마커 수준, 및 중간 조직 복구 마커 (TRM) 수준의 존재를 가졌음을 보여줬다. 제안되는 대안적 처리 옵션은, 예를 들어, IFX 투여량의 증가, 아달리무맙 (HUMIRA™) 을 이용하는 요법으로의 전환, 상이한 면역억제 약물 예컨대 아자티오프린 (AZA) 을 이용하는 처리, 및/또는 상이한 메카니즘을 표적화하는 약물 (예를 들어, 항-INFγ 항체 예컨대 폰톨리주맙) 을 이용하는 요법으로의 전환을 포함할 수 있다.
환자 11010: 인플릭시맙 처리됨.
주 0 에서 CDAI 는 262 였다. 주 46 에서, CDAI 는 85 였다 ("델타 177" 또는 262-177=85). 응답자로서 임상 정의되었다. 질환 활성 프로파일 (DAP) 은 이 환자를 정확히 식별했다. 특히, DAP 은 이 환자가 저점 ("T"; 주 14) 에서 높은 인플릭시맙 (IFX) 수준, 탐지가능하지 않은 수준의 HACA ("HACA--"), 낮은 염증 마커 수준, 높은 항-염증 마커 수준, 및 높은 조직 복구 마커 (TRM) 수준을 가졌음을 보여줬다. 예를 들어, 항-염증 사이토카인 IL-12p70 및 IL-10 이 높았다. 이 실시예의 환자에서 보여지는 바와 같이, 항-염증 사이토카인이 높았을 때마다, 환자는 대부분 점막 치유로 응답했다. 또한, 다른 TRM 수준은 높았지만, bFGF 농도 수준은 모든 시점에서 낮았으며, 이는 조직 성장이 줄어들어서, 조직 복구가 이미 일어났음을 시사한다.
환자 10118: 인플릭시맙 처리됨.
주 0 에서 CDAI 는 251 이었다. 주 46 에서, CDAI 는 109 였다 ("델타 142" 또는 251-142=109). 응답자로서 임상 정의되었다. 질환 활성 프로파일 (DAP) 은 이 환자를 정확히 식별했다. 특히, DAP 은 이 환자가 저점 ("T"; 주 14) 에서 높은 인플릭시맙 (IFX) 수준, 탐지가능하지 않은 수준의 HACA ("HACA--"), 중간 염증 마커 수준, 높은 항-염증 마커 수준, 및 높은 조직 복구 마커 (TRM) 수준을 가졌음을 보여줬다. 예를 들어, 항-염증 사이토카인 IL-12p70 및 IL-10 이 높았다. 다시, 이 실시예의 환자에서 보여지는 바와 같이, 항-염증 사이토카인이 높았을 때마다, 환자는 대부분 점막 치유로 응답했다. 또한, 다른 TRM 수준은 더 높았지만, bFGF 농도 수준은 모든 시점에서 낮았고 요법의 과정 동안 낮게 유지되었으며, 이는 조직 성장이 줄어들어서, 조직 복구가 이미 일어났음을 시사한다.
환자 11602: 인플릭시맙 + 메토트렉세이트 (MTX) 처리됨.
주 0 에서 CDAI 는 217 이었다. 주 46 에서, CDAI 는 68 이었다 ("델타 149" 또는 217-149=68). 응답자로서 임상 정의되었다. 질환 활성 프로파일 (DAP) 은 이 환자를 정확히 식별했다. 특히, DAP 은 이 환자가 저점 ("T"; 주 14) 에서 높은 인플릭시맙 (IFX) 수준, 탐지가능하지 않은 수준의 HACA ("HACA--"), 낮은 염증 마커 수준, 높은 항-염증 마커 수준, 및 높은 조직 복구 마커 (TRM) 수준을 가졌음을 보여줬다. 예를 들어, 항-염증 사이토카인 IL-12p70 및 IL-10 이 높았다. 다시, 이 실시예의 환자에서 보여지는 바와 같이, 항-염증 사이토카인이 높았을 때마다, 환자는 대부분 점막 치유로 응답했다. 또한, bFGF 농도 수준은 다른 TRM 수준에 비해 모든 시점에서 더 낮았으며, 이는 조직 성장이 줄어들어서, 조직 복구가 이미 일어났음을 시사한다.
환자 11505: 인플릭시맙 처리됨.
시간 0 에서 CDAI 는 272 였다. 주 46 에서, CDAI 는 145 였다 ("델타 127" 또는 272-127 = 145). 주 66 에서, CDAI 는 195 였다. 비-응답자로서 임상 정의되었다. 질환 활성 프로파일 (DAP) 은 이 환자를 정확히 식별했다. 특히, DAP 은 이 환자가 저점 ("T"; 주 14) 에서 매우 낮은 인플릭시맙 (IFX) 수준, 높은 농도 수준의 HACA ("HACA ++"), 중간 염증 마커 수준, 낮은 항-염증 마커 수준, 및 높은 조직 복구 마커 (TRM) 수준을 가졌음을 보여줬다. 비-응답자에서, TRM 예컨대 bFGF 의 수준은 상승하지만, 응답자에서 그들은 하강하거나 변함 없다. 제안되는 대안적 처리 옵션은, 예를 들어, IFX 투여량의 증가, 아달리무맙 (HUMIRA™) 을 이용하는 요법으로의 전환, 면역억제 약물 예컨대 MTX 또는 아자티오프린 (AZA) 을 이용하는 처리, 및/또는 상이한 메카니즘을 표적화하는 약물 (예를 들어, 항-INFγ 항체 예컨대 폰톨리주맙) 을 이용하는 요법으로의 전환을 포함할 수 있다.
환자 11601: 인플릭시맙 + 메토트렉세이트 (MTX) 처리됨.
주 0 에서 CDAI 는 207 이었다. 주 46 에서, CDAI 는 0 이었다 ("델타 207" 또는 207-207=0). 환자는 응답자로서 임상 정의되었다. 질환 활성 프로파일 (DAP) 은 이 환자를 정확히 식별했다. 특히, DAP 은 이 환자가 저점 ("T"; 주 14) 에서 높은 인플릭시맙 (IFX) 수준, 낮은 HACA 수준 ("HACA +"), 높은 염증 마커 수준, 높은 항-염증 마커 수준, 및 중간 조직 복구 마커 (TRM) 수준을 가졌음을 보여줬다. 예를 들어, 항-염증 사이토카인 IL-12p70 및 IL-10 이 높았다. 다시, 이 실시예의 환자에서 보여지는 바와 같이, 항-염증 사이토카인이 높았을 때마다, 환자는 대부분 점막 치유로 응답했으며, 이는 항-염증 마커가 매우 중요함을 분명히 시사한다. 높은 염증의 존재는 합병증 때문일 수 있다.
환자 10113: 인플릭시맙 처리됨.
시간 0 에서 CDAI 는 150 이었다. 주 46 에서, CDAI 는 96 이었다 ("델타 54" 또는 150-54=96). 방문 10 ("V10") 에서, CDAI 는 154 였고, 방문 11 ("V11") 에서, CDAI 는 169 였다. 그와 같이, CDAI 는 150 에서 시작했고, 150 근처에서 유지되었다. 환자는 비-응답자로서 임상 정의되었다. 질환 활성 프로파일 (DAP) 은 이 환자를 정확히 식별했다. 특히, DAP 은 이 환자가 저점 ("T"; 주 14) 에서 낮은 인플릭시맙 (IFX) 수준, 탐지가능한 농도 수준의 HACA ("HACA +"), 중간 염증 마커 수준, 낮은 항-염증 마커 수준, 및 중간 조직 복구 마커 (TRM) 수준을 가졌음을 보여줬다. 다시, TRM 수준은 비-응답자에서 상승했지만, 응답자에서 그들은 하강하거나 변함 없다. 제안되는 대안적 처리 옵션은, 예를 들어, IFX 투여량의 증가, 아달리무맙 (HUMIRA™) 을 이용하는 요법으로의 전환, 면역억제 약물 예컨대 MTX 또는 아자티오프린을 이용하는 처리, 및/또는 상이한 메카니즘을 표적화하는 약물 (예를 들어, 항-INFγ 항체 예컨대 폰톨리주맙) 을 이용하는 요법으로의 전환을 포함할 수 있다.
실시예 2. 질환 활성 프로파일링 모델링.
본 발명의 질환 활성 프로파일 (DAP) 을 제공하는 예시적 3-차원 그래프는 마커의 어레이에 존재하는 상이한 마커를 x-축에, 정규화된 마커 수준을 y-축에, 그리고 시간 (예를 들어, 샘플이 취해지고, 마커 수준이 측정되는 시점) 을 z-축에 각각 포함한다. 본 발명의 DAP (또한 본원에서 개인화된 질환 프로파일로도 언급됨) 의 예시적 지형도는 마커의 어레이에 존재하는 상이한 마커를 y-축에, 시간 (예를 들어, 샘플이 취해지고, 마커 수준이 측정되는 시점) 을 x-축에, 그리고 상대적 마커 수준을 그레이스케일로 각각 포함한다.
여기에서 기술되는 3D 모델은 개별화되고 적정가능하여 투여량 조정이 개인화된 방식으로 이루어질 수 있기 때문에 새로운 치료 패러다임을 제시한다. 예를 들어, 염증, 증식, 및 재형성 마커와 같은 마커를 포함하는 마커 패널은, 예를 들어, CD 또는 RA 치료를 위해, 항-TNF 약물 요법과 같은 요법 중인 환자를 위한 최선의 치료 과정을 실시간으로 결정할 수 있게 해준다. 결과적으로, 시간 경과 및 마커의 패널 또는 어레이 중 마커의 농도 수준 둘다가 요법 조정 및 모니터링으로 요법을 개인화 및 개별화하고 최적 투여량을 결정하거나 투여량을 조정하는데 중요하다. 특정 경우에, 시간의 흐름에 따른 하나 이상의 마커 수준의 변화가 요법 조정 및 모니터링에 중요한 고려사항이다. 특정 구현예에서, 어레이 또는 패널 중 마커의 세트 또는 서브세트에 대한 바람직한 치료 존 (therapeutic zone) 은 3D 그래프 또는 지형도에서 한정된 범위 내에 있다.
실시예
3. 인플릭시맙 비-탐지
이 실시예는 "사건-까지의-시간 (time-to-event)" 에 대한 모델을 제시한다. 다시 말해서, 이 실시예는 콕스 비례-해저드 모델 (Cox Proportional-Hazards Model: CPHM) 을 사용하여 "사건 (event)" 이 발생하기까지 걸리는 시간 및 그러한 사건이 발생할 위험을 모델링한다. 상기 모델은 응답 변수인 "사건-까지의-시간" 을 Y 축에, 그리고 "예측인자 변수" 를 X 축에 포함하는 회귀 분석이다. 이 실시예에서, 인플릭시맙의 비-탐지 (즉, 인플릭시맙의 농도가 탐지 역치 미만으로 떨어짐) 가 사건이며, 그러한 사건의 잠재적 예측인자는 바이오마커: 예를 들어, CRP, IL-2, VEGF 등 및 또는 임상 정보 예컨대 연령, MTX 처리, 성별 등이다.
이 실시예에서, "해저드 (Hazard)" 는 분석 검정 예컨대 이동성 변위 검정에 의해 인플릭시맙이 탐지되지 않을 (예를 들어, 비-탐지) 위험이다. 예를 들어, 도 11 은 치료 과정 동안 다양한 환자에 대한 인플릭시맙 농도 수준을 보여준다. 이 실시예에서 인플릭시맙의 농도가 예정된 탐지 역치 미만으로 떨어질 때 사건이 발생한다. 특정 경우에, CPHM 가 사용되어 사건 발생 (인플릭시맙 비-탐지) 의 위험을 예측한다. 이 실시예는 또한 그러한 위험 발생의 지표인 바이오마커를 식별한다.
CPHM 을 사용하여, 이동성 변위 검정에 의해 인플릭시맙이 탐지가능하지 않을 때까지 시간이 모델링된다. 상기 모델에서, 예정된 역치는 0.67 ㎍/㎖ 이며, 이는 레퍼런스 범위의 하한이다. 시간 "t" 에서 인플릭시맙 농도 수준이 역치 미만인 경우, 시간 "t" 에서 사건이 발생한 것이다. 도 12 에서, 환자는 그들의 사건까지 걸린 시간에 의해 순위가 매겨졌다. 사건은 다양한 환자에게 치료 동안 상이한 시점에서 발생했고, 불릿 포인트로 표시되어 있다.
초기 모델에서, 해저드 또는 이동성 변위 검정에 의한 인플릭시맙 비-탐지의 위험을 예측하는데 사용된 다양한 마커 및 임상 정보가 존재했다. 이들 마커는 하기 표의 마커를 포함했다:
초기 마커 목록으로부터, 사건의 지표인 바람직한 마커의 하기 목록이 유래되었다:
하기 표는 인플릭시맙 비-탐지 위험 또는 해저드의 유의한 예측인자를 열거한다:
상기 표의 결과는 하기가 해저드 즉, 인플릭시맙 비-탐지 위험의 예측인자임을 나타낸다:
GM-CSF: 모든 다른 변수를 일정하게 유지할 때, 추가 ng/㎕ 의 GM-CSF 는 인플릭시맙 비-탐지의 주간 해저드를 0.826 배, 또는 17.4 % 감소시킨다.
IL-2: 부가적 1 ng/㎕ 의 IL-2 는 해저드를 1.153 배, 또는 15.3 % 증가시킨다.
TNF-α: 1 ng/㎕ 의 TNF-α 는 해저드를 1.024 배 / 2.4 % 증가시킨다.
sTNFRII: 1 ng/㎕ 의 sTNFRII 는 해저드를 1.429 배 / 42.9 % 증가시킨다.
SAA: 1 ng/㎕ 의 SAA 는 해저드를 1.000006 배/ 0.0006 % 증가시키며, 이는 매우 작으나, 여전히 탐지가능한 효과이다 (작은 SE).
진단 이후 개월수: 진단 이후 부가적 개월수는 각각 해저드를 0.997 배, 또는 0.3 % 감소시킨다.
소장에서의 질환 자리 (범주형 변수): 질환이 소장에 위치하는 경우, 해저드는 2.995 배, 또는 거의 200 % 증가된다.
성공 (범주형 변수): 또한 해저드의 예측인자임; 비-성공적 환자에서 해저드는 2.421 배 또는 142 % 증가된다.
요약하면, 하기 마커는 인플릭시맙 "청소"/또는 비-탐지의 양호한 예측인자로 보인다: 1) GM-CSF; 2) IL-2; 3) TNF-α; 4) sTNFRII; 및 5) 소장에 위치하는 질환.
그와 같이, 하나의 구현예에서, 본 발명은 하기를 제공한다:
처리 과정 동안 항-TNF 치료제 또는 항체의 농도가 역치 값 미만으로 하락할 가능성을 예측하는 방법으로서, 하기 단계를 포함하는 방법:
1) GM-CSF; 2) IL-2; 3) TNF-α; 4) sTNFRII; 및 5) 소장에 위치하는 질환으로 이루어지는 군으로부터 선택되는 마커의 패널을 측정하는 단계; 및
마커의 농도에 기초하여 항-TNF 치료제 또는 항체의 농도가 역치 미만으로 하락할 가능성을 예측하는 단계.
실시예 4. 인플릭시맙에 대한 항약물 항체의 탐지 ("ATI" 또는 "HACA")
이 실시예는 콕스 비례-해저드 모델 (CPHM) 을 사용하여 사건이 발생하기까지 걸리는 시간을 모델링한다. 이는 상기 실시예 3 과 유사한 분석이나, ATI 또는 HACA 로서도 알려진 항-약물 항체의 출현을 사건으로서, 그리고 ATI 형성 (탐지) 의 위험을 해저드로서 여긴다는 점이 다르다. 도 13 은 치료 과정 동안 다양한 환자 중 ATI (HACA) 의 농도를 보여준다. 도 14 에서, 환자는 그들의 사건까지 걸린 시간에 의해 순위가 매겨졌다. 사건은 다양한 환자에게 치료 동안 상이한 시점에서 발생했고, 불릿 포인트로 표시되어 있다. ATI 탐지의 위험이 해저드이다. 해저드의 유의한 예측인자는 하기를 포함한다:
상기 표의 데이타는 EGF, VEGF, IL-8, CRP 및 VCAM-1 모두가 해저드에 매우 작으나, 유의한 영향을 미침을 시사한다.
GM-CSF: 모든 다른 변수를 일정하게 유지할 때, 추가 ng/㎕ 의 GM-CSF 는 ATI 탐지의 주간 해저드를 0.762 배, 또는 27.4 % 감소시킨다.
IL-2: IL-2 의 1 ng/㎕ 증가는 해저드를 1.85 배, 또는 85 % 증가시킨다.
TNF-α: TNF-α 의 1 ng/㎕ 증가는 해저드를 1.024 배, 또는 2.4 % 증가시킨다.
요약하면, ATI 탐지 해저드의 예측인자는 GM-CSF, IL-2 및 TNF-α 이다.
그와 같이, 하나의 구현예에서, 본 발명은 항-TNF 요법 또는 항체를 받고 있는 개체에서 항-약물 항체가 발생할 가능성을 예측하는 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
EGF, VEGF, IL-8, CRP 및 VCAM-1 로 이루어지는 군으로부터 선택되는 마커의 패널을 측정하는 단계; 및
마커 수준의 농도에 기초하여 항-TNF 요법 중인 개체에서 항-약물 항체가 발생할 가능성을 예측하는 단계.
실시예 5. COMMIT 연구 샘플을 사용하는 크론병 예후를 위한 질환 활성 프로파일링.
이 실시예는 본 발명의 질환 활성 프로파일링을 사용하여 대상에서 요법을 최적화 또는 치료 효능을 모니터링하기 위한 TNFα-매개 질환의 개인화된 치료적 관리 방법을 설명한다. 이 실시예는 하나 이상의 특이적 바이오마커 (예를 들어, 약물 수준, 항-약물 항체 수준, 염증 마커, 항-염증 마커, 및 조직 복구 마커) 의 존재, 수준 및 또는 활성화의 탐지, 측정, 또는 확인을 포함하는 질환 활성 프로파일링을 설명한다.
이 실시예는 COMMIT 연구의 다수의 샘플에 대한 질환 활성 프로파일링을 기술한다. 실시예 1 에서 기술된 바와 같이, COMMIT (유지 메토트렉세이트-인플릭시맙 시험의 조합) 연구를 수행하여 크론병 (CD) 의 장기 치료를 위한 메토트렉세이트 (MTX) 와 조합된 Remicade (인플릭시맙) 의 안전성 및 효능을 평가했다. 특히, 하기 마커의 어레이를 Remicade (인플릭시맙; IFX) 단독 처리 또는 Remicade 와 MTX 의 조합 처리 동안 다양한 시점에서 측정했다: (1) Remicade (인플릭시맙) 및 인플릭시맙에 대한 항약물 항체 (ATI); (2) 염증 마커 CRP, SAA, ICAM, VCAM; 및 (3) 조직 복구 마커 VEGF. 이 실시예는 선택된 TNF-α 매개 질환 (예를 들어, 크론병 및 궤양성 대장염) 환자에서 염증 및 조직 복구 마커가 IFX 및 ATI 수준과 상관관계가 있었음을 보여준다. 일부 경우에, 마커의 어레이는 질환 활성 지수 (예를 들어, 크론병 활성 지수) 를 예측할 수 있다. COMMIT 연구의 분석이 여기에서 설명된다.
ATI 의 존재 및 IFX 농도의 혈청 수준 사이의 관계를 조사했다. 평가를 위해, 정량 수준 미만 (BLOQ) 인 총 ATI 수준은 3.13 U/㎖ 였고, 0 으로 설정되었다. 탐지 수준 미만 (BLOD) 인 IFX 농도를 0 으로 설정했다. 샘플 비교 마다, 오직 저점 샘플을 사용했고, 총 219 개를 평가에 사용했다. 24 개의 샘플이 ATI 양성 (ATI+) 인 것으로 확인되었다. ATI+ 샘플에서는 IFX 의 중간 수준이 0 ㎍/㎖ 이고, 한편 ATI 음성 (ATI-) 샘플에서는 IFX 의 중간 수준이 8.373 ㎍/㎖ 인 것으로 확인되었다 (p=3.71 x 10-9, 만 휘트니 U 검정에 의함). 도 4A 는 환자 샘플 중 ATI 의 존재 및 IFX 의 수준 사이의 연관성을 보여준다. ATI 수준이 탐지불가능한 환자 샘플은 ATI+ 샘플에 비해 유의하게 더 높은 IFX 중간 농도를 가졌다.
CDAI 및 ATI 의 존재 사이의 관계를 평가했다. 분석에서 3.13 U/㎖ 의 ATI 를 컷-오프로서 설정했다; 오직 저점 샘플을 평가했고, ATI BLOQ 를 0 으로 설정했다. 195 개의 샘플이 ATI- 였고, 한편 총 4 명의 환자로부터의 24 개의 샘플이 ATI+ 였다. 결과는 ATI+ 샘플의 중간 CDAI 는 121.5 였고, 한편 ATI- 샘플의 중간 CDAI 는 82 였음을 보여줬다 (p=0.0132, 만 휘트니 U 검정에 의함). 도 4B 는 ATI 의 존재가 더 높은 CDAI 와 상관관계가 있음을 보여준다. 결과는 ATI+ 샘플이 ATI- 샘플보다 유의하게 더 높은 CDAI 가짐을 보여준다.
ATI 의 존재 및 IFX 및 면역억제제 (예를 들어, MTX) 의 조합 요법 사이의 관계를 조사했다. 임의의 저점 시점에서의 ATI+ 샘플을 분석했다. 결과는 IFX 단독 요법 및 IFX+MTX 조합 요법 사이에 ATI 를 가질 공산 (odds) 에 유의한 차이가 없었음을 보여줬다. 높은 공산비 (odds r에서 3.13 U/㎖ 의 ATI 를 컷-오프로서 설정했다; 오직 저점 샘플을 평가했고, ATI BLOQ 를 0 으로 설정했다. 195 개의 샘플이 ATI- 였고, 한편 총 4 명의 환자로부터의 24 개의 샘플이 ATI+ 였다. 결과는 ATI+ 샘플의 중간 CDAI 는 121.5 였고, 한편 ATI- 샘플의 중간 CDAI 는 82 였음을 보여줬다 (p=0.0132, 만 휘트니 U 검정에 의함). 도 4B 는 ATI 의 존재가 더 높은 CDAI 와 상관관계가 있음을 보여준다. 결과는 ATI+ 샘플이 ATI- 샘플보다 유의하게 더 높은 CDAI 가짐을 보여준다.
ATI 의 존재 및 IFX 및 면역억제제 (예를 들어, MTX) 의 조합 요법 사이의 관계를 조사했다. 임의의 저점 시점에서의 ATI+ 샘플을 분석했다. 결과는 IFX 단독 요법 및 IFX+MTX 조합 요법 사이에 ATI 를 가질 공산 (odds) 에 유의한 차이가 없었음을 보여줬다. 높은 공산비 (odds ratio) (예를 들어, 2.851) 는 MTX 가 환자가 치료적 생물제제에 대한 면역 응답을 발달시키는 것을 방지할 수 있음을 시사한다. 도 4C 는 동시 면역억제제 요법 (예를 들어, MTX) 이 ATI 의 존재를 억제할 가능성이 높음을 보여준다.
ATI 및 추적시 임상 결과 사이의 관계를 또한 조사했다. 임의의 저점 시점에서의 ATI+ 샘플을 분석했다. 연구로 얻은 임상 데이타로부터의 기술된 임상 결과가 "성공" 또는 "비-성공" 으로서 분석되었다. 치료 양생법에 상관 없이 ATI+ 일 공산에 유의한 차이가 보이지 않았다. 낮은 공산비 (예를 들어, 0.1855, p=0.1459) 는 ATI+ 환자가 불량한 임상 결과를 갖는 경향이 있음을 시사한다. 도 5A 는 ATI 를 갖는 환자가 처리에 불량한 응답을 발달시킬 가능성이 더 높음을 보여준다.
이 실시예는 또한 예시적 PRO 염증 지수 및 인플릭시맙 (IFX) 의 혈청 수준 또는 환자 샘플 중 IFX 에 대한 항체 (ATI) 의 존재의 연관성을 보여준다. 도 5B 는 염증 마커 CRP 가 증가된 수준의 ATI 와 연관됨을 보여준다. 데이타는 중간 CRP 수준이 ATI+ 샘플에서 8.11 ㎍/㎖ 였고, ATI- 샘플에서 1.73 ㎍/㎖ 였음을 보여준다 (p = 2.67 x 10-6, 만 휘트니 U 검정에 의함). 다른 염증 및 조직 복구 마커를 평가했다. 도 6 은 하나 이상의 염증 및 조직 복구 마커의 어레이의 단백질 수준이 IFX 에 대한 항체의 형성과 상관관계가 있음을 보여준다. 데이타는 5 가지 마커의 조합 (예를 들어, CRP, SAA, ICAM, VCAM, VEGF 및 하나 이상의 염증 마커를 포함함) 이 ATI 양성 샘플 24 개 중 23 개에서 발현되었음을 보여준다 (도 7A, 회색 박스). 염증 마커 SAA 는 "높은 염증" 을 갖는 것으로도 임상 기술된 ATI 양성 샘플 24 개 중 19 개에서 양성인 것으로 밝혀졌다. 결과는 또한 VEGF 및 CRP 가 분석에서 가장 비-중첩적인 마커임을 보여준다.
이 실시예는 예시적 PRO 염증 지수 (PII) 를 추가로 보여준다. 염증 지수 점수는 복수의 마커의 확인된 발현 수준을 나타내는 값의 조합을 로그 변환하여 생성된다 (예를 들어, PII = log(CRP + SAA + ICAM + VCAM + VEGF)). 도 7B 는 COMMIT 연구의 환자 샘플에서 예시적 PRO 염증 지수 (PII) 가 IFX 의 수준과 상관관계가 있음을 보여준다 (p<0.0001 및 R2 = -0.129). 결과는 ATI 양성 샘플이 ATI 음성 샘플에 비해 유의하게 더 높은 염증 지수 점수를 가짐을 보여준다 (P = 6.4x10-8; 도 7C 참고).
그와 같이, 하나의 구현예에서, 본 발명은 인플릭시맙 치료 양생법의 모니터링 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
a) 인플릭시맙 및 인플릭시맙에 대한 항약물 항체 (ATI) 를 측정하는 단계;
b) 염증 마커 CRP, SAA, ICAM, VCAM 을 측정하는 단계;
c) 조직 복구 마커 VEGF 를 측정하는 단계; 및
d) 측정치와 치료 효능의 상관관계를 분석하는 단계.
실시예 6. 임상 연구 #1 샘플을 사용하는 TNF-α 매개 질환 예후를 위한
질환 활성 프로파일링.
이 실시예는 대상을 항-TNF 약물 요법에 대한 응답자 또는 비-응답자로서 식별하는 본 발명의 질환 활성 프로파일링을 사용하여 대상에서 치료 효능을 모니터링하는 방법을 기술한다. 이 실시예는 크론병 임상 시험 #1 로부터의 다수의 환자 샘플을 사용하는 질환 활성 프로파일링을 보여준다.
특히, 하기 마커의 어레이를 Remicade (인플릭시맙; IFX) 단독 처리 또는 Remicade 와 MTX 의 조합 처리 동안 다양한 시점에서 측정했다: Remicade (인플릭시맙), 인플릭시맙에 대한 항체 (ATI), 및 IFX 에 대한 중화 항체. 이 실시예는 질환 활성 프로파일이 ATI, IFX 및 중화 항체 사이의 관계를 보여줄 수 있음을 보여준다. 임상 연구 #1 의 분석이 여기에서 설명된다.
도 8A-B 는 임상 연구 #1 의 다수의 환자의 크론병 활성 지수 (CDAI) 점수 및 혈청 중 인플릭시맙의 농도 사이의 상관관계를 보여준다. 간략히, 894 개의 샘플을 분석했다. IFX 농도 ≥ 0.1 ㎍/㎖ (탐지 한계 (LOD)) 를 "존재" 로 정의했다. 결과는 IFX 음성 (IFX-) 샘플이 또한 IFX 양성 샘플 (IFX+) 에 비해 유의하게 더 높은 CDAI 를 가짐을 보여줬다 (p= 0.0254, 만-휘트니 U 검정에 의해 계산됨).
추가의 분석은 ATI 의 존재가 더 낮은 IFX 농도와 상관관계가 있음을 보여줬다. 3.13 U/㎖ 의 정량 수준 미만 (BLOQ) 인 총 ATI 가 0 으로 설정되고, 탐지 수준 미만 (BLOD) 인 IFX 농도가 0 으로 설정된 것으로 추정했다. 연구에 속한 환자의 24% (62/258) 가 ATI+ 임이 확인되었으며, ATI+ 는 셋 중 하나의 시점에서 양성 총 ATI 수준으로서 정의했다. 894 개의 샘플의 분석은 IFX 농도 및 ATI 수준 사이의 상관관계를 보여줬다. 특히, ATI+ 샘플의 중간 IFX 는 0 ㎍/㎖ 이고, ATI- 샘플의 중간 IFX 는 7.95 ㎍/㎖ 였다 (p < 2.2 x 10-16, 만-휘트니 U 검정에 의함). 도 9A 는 분석된 샘플 중 IFX 농도 및 인플릭시맙에 대한 항약물 항체의 존재 사이의 연관성을 나타낸다.
분석은 샘플 중 고농도의 ATI 가 TNF-α 생물제제를 표적화는 중화 항체의 존재와 상관관계가 있음을 보여준다. 일부 구현예에서, 검정을 사용하여 중화 항체를 탐지할 수 있다. 중화 항체를 최고 농도의 ATI 를 갖는 환자 샘플에서 탐지했다. 도 9B 는 고농도의 ATI 가 중화 항체의 존재 및 IFX 의 탐지불가능한 수준을 초래할 수 있음을 보여준다.
283 명의 환자로부터 병원 방문 #1 및 #3 에 수집된 샘플에서 CDAI 와 ATI 존재 사이의 관계의 종적 분석을 평가했다. 방문 #1 (V1) 의 ATI 존재와 방문 #3 (V3) 의 CDAI 사이의 상관관계를 설정했다. ATI+ 샘플에서 중간 CDAI 는 V1 에 109 였고, 한편 ATI- 샘플에서 중간 CDAI 는 78 였다 (p=0.027, 만 휘트니 U 검정에 의함). 결과는 ATI 양성 및 CDAI 사이의 인과 관계를 시사한다. 도 9C 는 앞선 시점에 확인된 ATI+ 샘플이 후속 시점에 더 높은 CDAI 를 가질 가능성이 더 높았음을 보여준다. 결과는 앞선 시점의 질환 활성 프로파일링이 후속 시점의 CDAI 를 예측할 수 있음을 시사한다. 도 9D 는 임상 연구 #1 에서, 환자가 인플릭시맙 (IFX) 및 면역억제제 (예를 들어, MTX 및 AZA) 의 조합 요법을 받는 경우 ATI 를 발달시킬 공산이 더 낮았음을 보여준다. 공산비는 0.320 이었다 (p = 0.0009, 피셔의 정확도 검정에 의함). 이 분석에서, ATI 양성 (ATI+) 을 총 ATI ≥ 3.13 U/㎖ 로서 정의했다.
실시예 7. 임상 연구 #2 샘플을 사용하는 TNF-α 매개 질환 예후를 위한 질환 활성 프로파일링.
A. 임상 연구 #2A
이 실시예는 Remicade (인플릭시맙) 단독 또는 면역억제제 (예를 들어, 메토트렉세이트, 아자티오프린 및/또는 코르티코스테로이드) 와의 조합을 받는 환자에서 치료 효능을 모니터링하는 방법의 사용을 보여준다. 이 실시예는 본 발명의 방법을 사용하여 일련의 임상 시험으로부터 샘플의 질환 활성 프로파일을 확인하는 것을 기술한다.
분석에서, 우리는 코호트 내의 인플릭시맙에 대한 항약물 항체 (ATI) 및 IFX 농도 사이의 관계를 조사했다. 환자의 90.6% 가 ATI+ (58/64) 로 확인되었으며, 이 때 ATI+ 샘플을 하나 이상의 시점에서 총 ATI > 3.13 U/㎖ 인 것으로서 정의했다. IFX 의 중간 농도는 ATI 양성 샘플에서 0 ㎍/㎖ 이고, ATI 음성 샘플에서 3.74 ㎍/㎖ 였다 (P<2.2x10-16, 만 휘트니 U 검정에 의함). 중화 항체의 농도는 ATI+ 샘플에서 0 이었다. 결과는 IFX 요법 중인 환자에서 ATI 의 존재가 IFX 농도를 감소시킴을 시사한다. ATI- 샘플에서 IFX 농도 범위는 0.0-67.28 ㎍/㎖ 였다. ATI+ 샘플에서 IFX 농도 범위는 0.0-26.15 ㎍/㎖ 였다. 중화 항체 (Neutralizing antibody: Nab) 를 갖는 ATI+ 샘플에서 IFX 농도 범위는 0-1.07 ㎍/㎖ 였다. 도 10A 는 임상 연구 #2A 의 샘플에서의 IFX 농도 및 ATI 의 존재 사이의 상관관계를 보여준다. 결과는 또한 ATI 양성 대 ATI 음성의 공산이 면역억제제 (ISA, 예를 들어, 메토트렉세이트, 아자티오프린, 코르티코스테로이드, 및 그들의 조합) 로 처리된 샘플에서 유의하게 더 낮음을 입증했다. 이 분석에서 814 개의 샘플을 평가했다. ISA-처리 샘플에서 ATI+ 일 공산이 ATI- 일 공산보다 유의하게 더 낮았다 (공산비 = 0.564; p < 0.00001, 피셔의 정확도 검정에 의함). 또한, 적은 양의 ISA 로 처리된 샘플은 중화 ATI 를 발현했다. 중화 항체를 발현한 것으로 분석된 ATI+ 샘플 34 개 중, 9 개가 ISA-처리 샘플이었고, 25 개가 ISA-비처리 샘플이었다. 이는 ISA 요법이 ATI, 및 심지어 IFX 에 대한 중화 항체로의 진행을 감소시킬 수 있음을 시사한다. 도 10B 는 연구에서의 ISA 요법 및 ATI 의 존재 사이의 관계를 나타낸다.
다음으로, 우리는 ATI 및 염증 마커 사이의 관계를 조사했다. 본원에 기술된 바와 같이, 총 ATI BLOQ 를 0 으로 설정했다. CRP 농도는 CEER 검정과 같은 방법으로 확인했다. 결과는 CRP 의 중간 농도가 ATI- 샘플에서 가장 낮고 (5.0 ㎍/㎖), ATI+ 샘플에서 더 높음 (10.0 ㎍/㎖) 을 보여준다. 중화 ATI 를 발현하는 샘플은 CRP 의 중간 농도가 더 높았다 (10.0 ㎍/㎖). CRP 농도 및 ATI 상태 사이의 모든 쌍별 비교는 그 값들이 유의하게 상이했음을 보여준다 (p < 0.0001, 만 휘트니 U 검정에 의함). 도 10C 는 CRP 농도 및 ATI (ATI 및/또는 중화 ATI) 의 존재 사이의 관계를 나타낸다.
우리는 또한 ATI 및 요법에 대한 응답의 상실 사이의 관계를 조사했다. 코호트 내에서, 샘플은 IFX 요법에 관해 "응답", "응답의 상실" 및 "정보 부재" 를 갖는 것으로 표시되었다. 샘플을 응답의 상실을 갖는 경우 "참" 또는 응답의 상실을 갖지 않는 경우 "거짓" 으로 추가 분류했다. 총 777 개의 샘플을 분석했다. 결과는 "참" 으로 표시된 샘플에서, 또한 ATI 양성일 공산비가 유의하게 더 높았음을 보여줬다 (공산비 = 2.254, p<0.0001, 피셔의 정확도 검정에 의함). 놀랍게도, IFX 에 대한 중화 항체에 양성인 샘플에서, IFX 에 대해 응답성인 샘플의 수가 더이상 응답성이 아닌 샘플의 수보다 더 많은 것으로 확인되었다. 중화 ATI+ 샘플 34 개 중, 21 개가 "응답" 으로 표시되었고, 8 개가 "응답의 상실" 로 표시되었다. 도 10D 는 연구에서 IFX 요법에 대한 응답성의 상실 및 ATI 의 존재 사이의 관계를 나타낸다. 도 11 은 ATI 및 중화 항체의 수준이 다양한 환자로부터의 일련의 샘플에서 시간의 흐름에 따라 측정될 수 있음을 보여준다.
우리는 IFX 의 농도를 염증 마커 CRP 의 존재와 비교했다. IFX ≥ 0.1 ㎍/㎖ (검정의 LOD) 인 경우, 우리는 샘플에 대한 "IFX 존재" 를 "참" 으로서 정의했다. 결과는 IFX 가 존재하는 샘플 또는 IFX 가 부재하는 샘플 사이에 중간 CRP 농도가 상이하지 않았음을 시사한다. IFX 가 존재하는 샘플에서 중간 CRP 수준은 7.40 ㎍/㎖ 였고, 한편 IFX 가 부재하는 샘플에서 중간 CRP 는 7.55 ㎍/㎖ 였다 (p = 0.591, 만 휘트니 U 검정에 의함). 도 12A 는 CRP 수준과 IFX 의 존재의 비교를 보여준다.
우리는 또한 주입 반응과 ATI 의 존재 사이의 관계를 비교했다. 분석은 총 797 개의 샘플을 포함했고; 30 개의 샘플이 주입 반응을 갖는 것으로 분류되었고 ("유"), 767 개의 샘플이 주입 반응을 갖지 않는 것으로 분류되었다 ("무"). 주입 반응을 가졌던 29 개의 샘플은 또한 ATI+ 였다 (공산비 = 35.54, p<0.0001, 피셔의 정확도 검정에 의함). 도 12B 는 ATI 의 존재 및 주입 반응 사이의 관계를 나타낸다. ATI 를 발현하는 샘플은 주입 반응을 가질 가능성이 더 높았다. 그러나, 중화 ATI 를 갖는 샘플 27 개 중, 22 개의 샘플에서 주입 반응이 관찰되지 않았다. 나머지 5 개의 중화 ATI 를 갖는 샘플은 주입 반응을 가졌다.
B. 임상 연구 #2B
임상 연구 #2B 의 이 분석에서, 우리는 ATI 의 존재, IFX 농도, ISA 의 투여, 염증 마커 (예를 들어, CRP) 의 발현, 및 IFX 처리에 대한 응답의 상실 사이의 관계를 연구했다. 우리는 항약물 항체를 발현하지 않는 샘플에 비해 ATI 를 발현하는 샘플에서 중간 IFX 농도가 더 높았음을 확인했다. 환자의 15.2% (105 명 중 16 명) 가 하나 이상의 시점에서 총 ATI >3.13 U/㎖ 로 ATI+ 였다. 분석된 샘플 489 개에서, 중간 IFX 농도는 ATI+ 샘플에서 0.59 ㎍/㎖ 였고, ATI- 샘플에서 7.78 ㎍/㎖ 였다 (p <2.2 x 10-16, 만 휘트니 U 검정에 의함). 도 12C 는 코호트 내의 IFX 농도 및 ATI 의 존재 사이의 관계를 나타낸다. 분석은 면역억제제를 철회할 때 IFX 에 대한 항체를 발달시킬 공산이 높음을 보여줬다 (공산비 = 0.412, p = 0.0367, 피셔의 정확도 검정에 의함). 도 12D 는 ATI 의 존재 및 특정 정해진 날짜에서의 ISA 요법의 철회 사이의 상관관계를 보여준다. 우리는 ATI 음성 샘플 (중간 CRP = 1.5 ㎍/㎖) 에 비해, ATI 양성 샘플의 CRP 의 중간 농도 (9.6 ㎍/㎖) 가 더 높았음을 확인했다 (p = 1.25 x 10-12, 만 휘트니 U 검정에 의함). 도 13A 는 ATI 및 염증 마커 CRP 사이의 관계를 나타낸다. 우리의 분석은 임의의 시점에서 ATI 양성으로 확인된 환자에서 IFX 에 대한 응답의 상실을 경험할 공산이 더 높았음을 보여줬다 (공산비 = 3.967, p = 0.0374, 피셔의 정확도 검정에 의함). 도 13B 는 임의의 시점에서의 ATI 의 존재 및 IFX 처리에 대한 응답성 사이의 상관관계를 나타낸다. IFX 에 대한 응답의 상실은 또한 염증 마커 CRP 의 더 높은 중간 농도와 상관관계가 있었다. 분석에서, 추적시 응답을 상실한 샘플 14 개 및 응답자로부터의 샘플 91 개가 존재했다. 중간 CRP 수준은 응답을 상실한 샘플에서 11.767 ㎍/㎖ 및 응답이 있는 샘플에서 2.585 ㎍/㎖ 였다. IFX 에 대한 응답을 상실한 환자의 중간 평균 CRP 가 유의하게 더 높았다 (p = 7.45 x 10-5, 만 휘트니 U 검정에 의함). 도 13C 는 응답의 상실이 CRP 의 증가와 관련될 수 있음을 보여준다. CRP 는 또한 IFX 가 탐지불가능했던 샘플에서 유의하게 더 높았다. 샘플에 대한 IFX 의 수준이 ≥ 0.1 ㎍/㎖ (예를 들어, 검정의 LOD) 였던 경우, 샘플은 IFX 를 갖는 것으로 확인되었다 ("IFX 존재"). 중간 CRP 는 IFX 존재 샘플에서 1.6 ㎍/㎖ 이고, IFX 부재 샘플에서 13 ㎍/㎖ 였다 (p = 3.69x10-5, 만 휘트니 U 검정에 의함). 도 13D 는 IFX 의 존재 및 CRP 수준 사이의 연관성을 나타낸다. 이 연구에서 "ATI+" 를 하나 이상의 시점에서 총 ATI >3.13 U/㎖ 인 샘플로서 정의했다.
C. 임상 연구 #2C
임상 연구 #2C 의 이 분석에서, 우리는 IFX 수준 및 ATI 의 존재 사이의 관계를 조사했다. ATI- 샘플의 중간 IFX 3.28 ㎍/㎖ 에 비해, ATI+ 샘플의 중간 IFX 0.43 ㎍/㎖ 가 유의하게 더 낮음이 확인되었다 (p = 1.95x10-4, 만 휘트니 U 검정에 의함). 도 14A 는 더 낮은 IFX 수준이 ATI 의 존재와 연관됨을 보여준다.
그와 같이, 하나의 구현예에서, 본 발명은 개체가 조합 요법의 후보인지 여부를 확인하는 방법으로서, 상기 개체에게는 인플릭시맙이 투여되고 있고, 하기 단계를 포함하는 방법을 제공한다: 상기 개체 중 ATI 의 존재 또는 부재를 측정하는 단계; 및 유의한 수준의 ATI 를 갖는 개체에게 면역억제제 (예를 들어, MTX) 를 투여하는 단계. 특정 양상에서, CRP 의 농도 수준은 ATI 의 존재에 대한 지표이다.
실시예 8. 임상 연구 #3 으로부터의 환자 샘플을 사용하는 TNF-α 매개 질환 예후를 위한 질환 활성 프로파일링.
이 실시예는 본 발명의 방법을 사용하여 항-TNF 약물 요법의 치료 효능을 모니터링하는 것을 보여준다. 특히, 임상 연구 #3 의 연구 데이타, 약물동태학 데이타, 추적 연구 데이타를 포함하는 취합된 (pooled) 데이타를 분석했다. 결과는 ATI 음성 샘플의 IFX 농도 12.21 ㎍/㎖ 에 비해, ATI 양성 샘플의 중간 IFX 농도 0.0 ㎍/㎖ 가 더 낮음을 보여줬다 (P < 2.2 x 10-16, 만 휘트니 U 검정에 의함). 도 14B 는 이들 임상 샘플에서 더 낮은 IFX 수준이 ATI 의 존재와 연관됨을 보여준다. 도 14C 는 IFX 수준 및 ATI 사이의 동일한 상관관계가 연구 데이타, 추적 연구 및 약물동태학 연구에서도 존재했음을 보여준다 (p< 0.05, 만 휘트니 U 검정에 의함). 우리는 또한 본 발명의 방법을 사용하여 샘플 중 고농도의 ATI 가 IFX 에 중화 효과를 가짐을 확인했다. 특히, 고농도의 ATI 는 인플릭시맙에 중화 항체로서 작용한다. ATI 농도가 높은 샘플은 IFX 수준이 0 ㎍/㎖ 였다. 도 15A 는 중화 ATI 를 포함하는 ATI 수준 및 IFX 사이의 관계를 나타낸다.
실시예 9. Humira 를 받고 있는 환자에서의 PRO 염증 지수를 포함하는 질환 활성 프로파일링.
이 실시예는 환자 샘플 중 TNF-α 생물제제 (예를 들어, 아달리무맙 (Humira); ADL) 의 수준 및 TNF-α 생물제제에 대한 항-약물 항체 (예를 들어, ATA) 의 존재를 확인하는 것을 포함하는 본 발명의 방법을 설명한다. 이 분석에서, 1 개의 샘플은 1 명의 환자에 해당하고, 총 98 개의 CD 샘플을 평가했다. 샘플의 2.04% (CD 환자 98 명 중 2 명) 가 ATA 에 대해 양성이었으며, 이때 ATA 양성을 총 ATA> 0 로서 설정했다. 놀랍게도, 2 개의 ATA 양성 샘플은 또한 ADL 농도가 최고였다. 도 15B 는 환자 샘플 중 ADL 농도 및 ATA 의 존재 사이의 연관성을 보여준다.
이 실시예는 예시적 PRO 염증 지수 (PII) 를 기술한다. 이 실시예는 또한 Humira (아달리무맙) 및 상이한 약물 조합을 받고 있는 환자 샘플에서의 PII 의 사용을 설명한다. 도 16A 는 예시적 PRO 염증 지수의 세부사항을 기술한다. PII 는 5 가지 바이오마커에 기초하여 염증 수준을 기술하는 샘플에 대한 단일 점수에 해당한다. 점수는 5 가지 바이오마커의 합계를 로그 변환하여 수득된다. 일부 구현예에서, 바이오마커는 VEGF (pg/㎖), CRP (ng/㎖), SAA (ng/㎖), ICAM (ng/㎖) 및 VCAM (ng/㎖) 을 포함한다. 도 16B 는 ADL 이 단독으로 또는 다른 약물과의 조합으로 존재하는 샘플의 어레이에서 PII 및 ADL 의 농도 사이에 명백한 관계가 존재하지 않음을 보여준다. 이것은 샘플 코호트 내에 높은 ADL 저점 혈청 농도의 출현으로 인한 것일 수 있다. PII 및 ADL 농도 사이에 유의한 음성 상관관계가 존재한다 (p=1.66x10-5 및 스페어만의 Rho =-0.459). 유사한 음성 상관관계가 IFX 및 PII 사이에서 발견되었다.
우리는 또한 PII 및 TNF-α 매개 질환의 치료에 사용된 치료제의 존재 사이의 관계를 비교했다. ADL 양성 샘플을 ADL 농도가 0 ㎍/㎖ 초과인 샘플로서 정의했다. 결과는 Remicade 및 Humira 를 받고 있는 환자에 비해 Humira 만 받고 있는 환자에서 더 높은 PII 가 탐지되었음을 보여줬다. 도 17 은 Humira 및, Remicade, Cimzia, 아자티오프린 및 메토트렉세이트와 같은 다른 약물과 조합된 Humira 를 받고 있는 환자에 대한 PII 점수의 도표를 보여준다.
그와 같이, 하나의 구현예에서, 본 발명은 크론병 활성을 모니터링하는 방법으로서, 하기 단계를 포함하는 방법을 제공한다:
VEGF (pg/㎖), CRP (ng/㎖), SAA (ng/㎖), ICAM (ng/㎖) 및 VCAM (ng/㎖) 을 포함하는 마커의 패널의 측정을 포함하는 염증 지수를 결정하는 단계;
지수를 효능 스케일 또는 지수에 비교하여 질환을 모니터링 및 관리하는 단계.
실시예 10. 환자 관리 개선 방법.
이 실시예는 개인화된 환자 치료법 개발을 보조하는 환자 관리 개선 방법을 기술한다.
일부 구현예에서, 활성 CD 및 UC 환자를 이동성 변위 검정 (참고, 예를 들어, PCT 공개 번호 WO 2011/056590, 상기의 공개는 모든 목적을 위해 전문이 참조로 본원에 포함됨) 과 함께 질환 활성 프로파일링을 사용하여 분석할 수 있다. 도 18 은 CD 및/또는 UC 환자의 관리를 개선하기 위한 본 발명의 방법의 세부사항을 제시한다. 일부 구현예에서, 질환 활성 프로파일링 방법은 약물동태학, 및 질환 활성 프로파일 마커 및/또는 점막 치유 마커의 존재 및/또는 수준의 확인을 포함한다.
일부 구현예에서, 질환 활성 프로파일링은 바이오마커, 사이토카인, 및/또는 성장 인자의 존재 및/또는 수준의 탐지, 측정, 및 확인 방법을 포함한다. 질환 활성 프로파일링에 사용될 수 있는 사이토카인의 비제한적 예는 bFGF, TNF-α, IL-10, IL-12p70, IL-1β, IL-2, IL-6, GM-CSF, IL-13, IFN-γ, TGF-β1, TGF-β2, TGF-β3, 및 그들의 조합을 포함한다. 염증 마커의 비제한적 예는 SAA, CRP, ICAM, VCAM, 및 그들의 조합을 포함한다. 항-염증 마커의 비제한적 예는 TGF-β, IL-10, 및 그들의 조합을 포함한다. 성장 인자의 비제한적 예는 암피레굴린 (AREG), 에피레굴린 (EREG), 헤파린 결합 표피 성장 인자 (HB-EGF), 간세포 성장 인자 (HGF), 헤레굴린-β1 (HRG) 및 동종형, 뉴레굴린 (NRG1, NRG2, NRG3, NRG4), 베타셀룰린 (BTC), 표피 성장 인자 (EGF), 인슐린 성장 인자-1 (IGF-1), 형질전환 성장 인자 (TGF), 혈소판-유래 성장 인자 (PDGF), 혈관 내피 성장 인자 (VEGF), 줄기 세포 인자 (SCF), 혈소판 유래 성장 인자 (PDGF), 가용성 fms-유사 티로신 키나제 1 (sFlt1), 태반 성장 인자 (PIGF), 섬유아세포 성장 인자 (FGFs), 및 그들의 조합을 포함한다.
다른 구현예에서, 질환 활성 프로파일링은 약물동태학 및 점막 치유의 탐지, 측정 및 확인을 포함한다. 일부 양상에서, 점막 치유는 선택된 바이오마커의 존재 및/또는 수준 및/또는 내시경검사에 의해 평가될 수 있다. 일부 경우에, 점막 치유는 장 점막의 모든 가시화된 부분에서의 파쇄성 (friability), 혈액, 짓무름 및 궤양의 부재로서 정의될 수 있다. 일부 구현예에서, 점막 치유의 바이오마커는 AREG, EREG, HG-EGF, HGF, NRG1, NRG2, NRG3, NRG4, BTC, EGF, IGF-1, HRG, FGF1, FGF2 (bFGF), FGF7, FGF9, SCF, PDGF, TWEAK, GM-CSF, TNF-α, IL-12p70, IL-1β, Il-2, IL-6, IL-10, IL-13, IFN-γ, TGF-α, TGF-β1, TGF-β2, TGF-β3, SAA, CRP, ICAM, VCAM, 및 그들의 조합을 포함하나, 이에 제한되는 것은 아니다. 일부 구현예에서, 성장 인자 지수는 점막 치유 바이오마커의 탐지된 수준의 통계 분석을 사용하여 확립될 수 있다. 일부 경우에, 성장 인자 지수는 다른 질환 활성 마커와 연합되어, 본 발명의 환자 치료 개인화 방법에서 이용될 수 있다.
도 19 는 상이한 세포 유형, 세포 메카니즘 및 질환 (예를 들어, 크론병 (CD), 류머티스성 관절염 (RA) 및 건선 (Ps)) 에 대한 TNF-α 경로 및 관련 경로의 효과를 보여준다. 도 20 은 예시적 CEER 다중 성장 인자 어레이의 도해를 나타낸다. 특정 구현예에서, 본 발명의 방법은 이러한 어레이를 이용할 수 있다. 비제한적 예로서, 도 21A-F 는 이러한 어레이를 사용하는 환자 샘플의 다중 성장 인자 프로파일링을 보여준다. 특히, 성장 인자, 예컨대 AREG, EREG, HB-EGF, HGF, HRG, BTC, EGF, IGF, TGFα, 및 VEGF 의 종적 분석을 환자 샘플의 수집물에 대해 수행했다. 도 21B 및 E 는 환자 10109, 환자 10118 및 환자 10308 로부터의 샘플 중 혈청학적 및 면역 마커, 예컨대 ASCA-a, ASCA-g, Cbir1 및 OmpC 의 수준의 확인을 보여준다. 도 21G 는 건강한 대조군, IBS-C 환자, 및 IBS-D 환자로부터의 샘플에 대해 수행된 예시적 성장 인자 어레이를 보여준다.
일련의 다중 CEER 성장 인자 및 CRP 어레이를 환자 샘플에 대해 수행했다. 표 A-D (아래) 는 환자 샘플 중 점막 치유의 종적 분석을 강조한다. 하기 표 (A) 는 CRP 및 성장 인자가 점막 치유를 예측할 수 있음을 보여준다:
하기 표 B 는 점막 치유를 예측하는 CRP 및 성장 인자를 열거한다:
하기 표 C 는 CRP 및 성장 인자가 점막 치유를 예측할 수 있음을 보여준다:
하기 표 D 는 CRP 및 성장 인자가 점막 치유를 예측할 수 있음을 보여준다:
표 A, B, C 및 D 는 마커 값 및 CRP 및 성장 인자 데이타에서의 관찰 쌍 사이의 관계를 보여준다. α= 0.1 의 기준을 사용하여, 우리는 3 가지 성장 인자 및 CRP 사이의 연관성을 식별했다. 하기 표 (E) 는 두 변인 분할표 (two-by-two contingency table) 로서, AREG, HRG 및 TGF 의 증가 또는 감소가 CRP 의 증가 또는 감소와 유의하게 연관됨이 밝혀진 것을 강조한다:
도 22 는 질환 차도의 확인에 있어서 CRP 수준 및 성장 인자 지수 점수 사이의 연관성을 나타낸다.
점막 치유의 예측 마커를 식별하기 위한 추가의 연구는 여러 임상 연구로부터의 샘플을 포함할 수 있다. 하나의 비-제한적 예로서, 임상 연구 A 는 413 개의 샘플을 포함할 수 있다 (쌍을 이룬 샘플, 환자 1 명 당 샘플 1-5 개). 임상 데이타는 환자 연령, 성별, 체중, 진단 날짜, 질환 위치, 샘플 수집 날짜, 투여량, 대장내시경검사, 점막의 개선, 점막 치유의 존재, 및/또는 동시 의약 사용을 상세히 나타낼 수 있다. 임상 연구 A 에서, 대장내시경검사를 첫번째 약물 주입에 앞서 실시할 수 있다. 또다른 비-제한적 예로서, 임상 연구 B 에서, 212 개의 UC 샘플을 분석할 수 있다 (110 개의 샘플이 추적시 CD 에 대해 진단되었고, 102 개의 샘플이 점막 치유에 기초하여 UC 에 대해 진단되었다). 임상 데이타는 환자 연령, 성별, 체중, 진단 날짜, 질환 위치, 샘플 수집 날짜, IFX 투여량, 대장내시경검사 결과 (내시경 활성 점수), 알부민 수준, CRP 수준, 및/또는 Mayo 점수를 상세히 나타낼 수 있다. 임상 연구 A 및 B 에서, 3 회의 주입을 유도 동안 주 0, 2 및 6 에 실시할 수 있다. 6 회의 부가적 약물 주입을 유지기 동안 주 14, 22, 30, 38, 46 및 52 에 실시할 수 있다. 두번째 대장내시경검사를 유지기 동안 실시할 수 있다. 세번째 대장내시경검사를 추적 동안 실시할 수 있고, 환자는 약물에 응답성인 경우 치료를 지속할 수 있다.
본 발명의 방법을 사용하여 TNFα-매개 질환의 개인화된 치료적 관리를 창출할 수 있다. IBD 로 진단된 환자를 위한 개인화된 치료적 양생법은, 크론 예후 시험 (참고, 예를 들어, PCT 공개 번호 WO 2010/120814, 상기의 공개는 모든 목적을 위해 전문이 참조로 본원에 포함됨), 질환 활성 프로파일 (예를 들어, 질환 부담), 점막 상태 지수, 및/또는 실시예 5 에 기술된 바와 같은 PRO 염증 지수를 포함하나 이에 제한되지 않는, 본원에 기술된 바와 같은 질환 상태 및/또는 장기 결과의 예측인자에 기초하여 선택할 수 있다. 본 발명의 방법을 사용하여, 환자가 경도 질환 활성을 갖는 것이 확인될 수 있고, 임상의는 영양-기반 요법을 권장, 처방, 및/또는 투여할 수 있다 (도 23A). 그러나, 환자가 공격적 표현형의 경도 질환 활성을 갖는 것이 확인되는 경우, 티오퓨린에 더하여 영양-기반 요법이 권장, 처방, 및/또는 투여될 수 있다. 환자가 중등도 질환 활성을 갖는 것이 확인되는 경우, 유사한 요법이 권장, 처방, 및/또는 투여될 수 있다 (도 23B). 환자가 공격적 표현형의 중등도 질환 활성을 갖는 것이 확인되는 경우, 티오퓨린 및 영양 요법 (Nx) 의 조합 또는 적당한 항-TNF 약물이 권장, 처방, 및/또는 투여될 수 있다. 일부 경우에, 항-TNF 모니터링 시험 (참고, 예를 들어, PCT 공개 번호 WO 2011/056590, 상기의 공개는 모든 목적을 위해 전문이 참조로 본원에 포함됨) 을 사용하여 환자가 요법에 응답성일 가능성이 있는지를 확인할 수 있다. 중증 질환 활성이 확인되는 경우, 최적화된 투여량으로 투여되는 적당한 항-TNF 약물이 권장 및/또는 처방될 수 있다 (도 23C). 그러한 경우에, 항-TNF 모니터링 시험 (참고, 예를 들어, PCT 공개 번호 WO 2011/056590, 상기의 공개는 모든 목적을 위해 전문이 참조로 본원에 포함됨) 을 사용하여 환자가 요법에 응답성일 가능성이 있는지를 예측할 수 있다. 다른 경우에, 중증 질환 활성을 갖는 환자가 영양-기반 요법도 받을 것이 권장 및/또는 처방될 수 있다.
일부 구현예에서, 본 발명의 방법은 환자 치료를 개인화하는 치료 패러다임에 사용될 수 있다 (도 24). 첫째로, 점막 상태 마커의 발현에 기초하여 처리를 선택할 수 있다. 그 다음에, 질환 부담 (예를 들어, 질환 활성 지수) 에 기초하여 약물 투여량을 선택할 수 있다. 치료적 약물을 투여한 후, 점막 치유의 마커의 발현으로부터 초기 응답을 확인할 수 있다. ATM 모니터링을 사용하여 요법에 응답성 또는 비-응답성인 환자를 식별할 수 있다. 비-응답성 환자는 그 후 적당한 항-TNF 약물을 처방받을 수 있다.
실시예 11. 신규한 인플릭시맙 (IFX) 및 인플릭시맙에 대한 항체 (ATI) 검정은 크론병 (CD) 환자에서 질환 활성을 예측함.
이전 연구는 유지 투여 동안 IFX 의 저점 농도가 더 높은 CD 환자가 처리로부터 유익을 얻을 가능성이 더 높음을 시사한다. 그러나, ATI 의 발달은 증가된 약물 청소 및 응답의 상실을 초래할 수 있다. 치료적 약물 모니터링은 임상의가 효과적 약물 농도를 유지하게 할 수 있다. 이전 ATI 검정은 약물 존재시 ATI 측정 불능으로 제한되었지만, 유체상 IFX 및 ATI 검정은 이러한 문제를 극복했다 (참고, 예를 들어, PCT 공개 번호 WO 2011/056590, 상기의 공개는 모든 목적을 위해 전문이 참조로 본원에 포함됨). 우리는 이들 검정을 사용하여 혈청 IFX 농도, ATI 및 질환 활성 사이의 관계를 평가했다.
방법: IFX 처리의 유지기를 평가한 4 개의 전향적 CD RCT 또는 코호트 연구 (COMMIT, Leuven 투여량 최적화 연구, 캐나다 다센터 및 IMEDEXl) 의 참가자 532 명으로부터의 혈청 샘플 2021 개를 사용했고, 데이타를 분석을 위해 조합했다. IFX 및 ATI 혈청 수준을 HPLC-기반 유체상 검정을 사용하여 측정했다. ELISA 로 측정된, CRP 를 사용하여 질환 활성을 평가했다. ROC 분석으로, CRP 로 측정되는, 질환 활성을 가장 잘 구분한 IFX 역치를 확인했다. 우리는 순차적 시점에 걸쳐 취해진 샘플 쌍들을 조사하여, 쌍의 첫번째 데이타 점에서의 IFX 및 ATI 존재와 후속 측정에서의 CRP 사이의 관계를 평가했다. 1205 개의 그러한 관찰이 존재했다. 우리는 4 개의 구별되는 환자 군, 즉 IFX ≥ 역치 및 ATI-, IFX < 역치 및 ATI-, IFX ≥ 역치 및 ATI+, 및 IFX < 역치 및 ATI+ 을 식별했다. 회귀 분석으로 CRP 의 예측인자로서의 IFX 및 ATI 사이의 잠재적 상호작용을 평가했다.
결과: CRP 는 3 ㎍/㎖ (ROC AUC = 74 %) 의 IFX 농도 역치로 IFX 상태를 가장 잘 구별할 수 있다. 쌍을 이룬 순차적 샘플을 사용하여 ATI 및 IFX 둘다를 중간 CRP 와 연관지었다 (표 2). ATI+ 환자가 전반적으로 더 높은 CRP 수준을 가졌지만, 이 군 내에서 역치보다 더 높은 IFX 및 후속 CRP 사이에 연관성이 없었다. ATI- 환자에서, CRP 는 IFX 수준 < 3 ㎍/㎖ 인 환자에서 유의하게 더 높았다. 회귀 분석에서 ATI 양성, IFX ≥ 3 ㎍/㎖ 및 상호작용 기간 (interaction term) 이 CRP 의 모든 유의한 예측인자였다. CRP 는 ATI 음성 환자에서보다 ATI 양성 환자에서 31 % 더 높았고, IFX < 3 ㎍/㎖ 인 환자에 비해 IFX 수준 ≥ 3 ㎍/㎖ 인 환자에서 62 % 더 낮았다.
결론: 우리는 ATI 양성은 증가된 질환 활성을 예측하지만, 3 ㎍/㎖ 의 역치 값을 초과하는 IFX 농도는 유의하게 더 낮은 질환 활성을 예측함을 밝혔다. ATI+ 환자에서, 3 ㎍/㎖ 를 초과하는 IFX 농도는 CRP 에 영향을 미치지 않았으며, 이는 IFX 의 유익이 최적 약물 농도의 존재에도 불구하고 ATI 의 존재시에 감소됨을 시사한다. 이들 발견은 치료적 약물 모니터링이 IFX 요법 최적화에 중요한 도구라는 개념을 지지한다. 쌍을 이룬 순차적 샘플 및 회귀 분석을 사용하여, ATI 및 IFX 둘다를 중간 CRP 와 연관지었고, 하기 표에 나타냈다:
실시예 12. 신규한 인플릭시맙 (IFX) 및 인플릭시맙에 대한 항체 (ATI) 검정은 크론병 (CD) 환자에서 질환 활성을 예측함.
이 실시예는 인플릭시맙 (IFX) 및 인플릭시맙에 대한 항체 (ATI) 검정을 사용하여 크론병 (CD) 환자에서 질환 활성을 예측하는 것을 설명한다. 이 실시예는 또한 C-반응성 단백질 (CRP) 수준으로 측정되는 질환 활성을 가장 잘 구별할 수 있는 IFX 의 역치를 확인하는 방법을 설명한다. 이 실시예는 또한 ATI 및 IFX 둘다와 CD 및 CRP 수준 (이는 질환 활성의 척도로서의 역할을 할 수 있음) 의 연관성을 설명한다.
이전 연구는 유지 투여 동안 IFX 의 저점 농도가 더 높은 CD 환자가 처리로부터 유익을 얻을 가능성이 더 높음을 시사했다. 그러나, ATI 의 발달은 증가된 약물 청소 및 응답의 상실을 초래할 수 있다. 치료적 약물 모니터링은 임상의가 효과적 약물 농도를 유지하게 할 수 있다. 이전 ATI 검정은 약물 존재시 ATI 측정 불능으로 제한되었지만, PCT 공개 번호 WO 2011/056590 (상기의 공개는 모든 목적을 위해 전문이 참조로 본원에 포함됨) 에 기술된 유체상 IFX 및 ATI 검정은 이러한 문제를 극복했다.
이 연구에서 우리는 유체-상 IFX 및 ATI 검정을 사용하여 혈청 IFX 농도, ATI, 및 CRP 로 측정되는 질환 활성 사이의 관계를 평가했다. 우리는 4 개의 전향적 CD 무작위 대조군 시험 (RCT) 또는 코호트 연구 (COMMIT, Leuven 투여량 최적화 연구, 캐나다 다센터 및 IMEDEXl 를 포함) 의 참가자 532 명으로부터의 혈청 샘플 2,021 개를 분석했다. 조합된 분석은 IFX 처리의 유지 동안 샘플에 제한되었다. 취합된 CRP 중에 비-이질성의 증거가 존재했다.
IFX 및 ATI 혈청 수준을 HPLC-기반 유체상 검정을 사용하여 측정했다. CRP 를 ELISA 로 측정하고, 질환 활성 평가에 사용했다. 수신자-연산자 곡선 (Receiver-Operator Curve: ROC) 분석을 수행하여, 질환 활성을 가장 잘 구별할 수 있는 (예를 들어, 높은 및 낮은 CRP 값 사이에서) IFX 저점 역치 (예를 들어, 양 또는 농도) 를 확인했다. 도 25 는 ROC 분석을 보여준다. CRP 및 9 개의 IFX 저점 역치를 분석했고, 수신자-연산자 특성 곡선 아래 ROC 면적 (AUC) 은 다음과 같다:
ROC 분석으로 CRP 가 3 ㎍/㎖ (ROC AUC = 74 %) 의 IFX 농도 역치로 IFX 상태를 가장 잘 구별할 수 있음을 밝혔다. 예를 들어, 3.0 ㎍/㎖ 의 IFX 저점 농도 역치에서, IFX 혈청 농도가 "낮은" 무작위 선택된 샘플은 IFX 혈청 농도가 "높은" 무작위 선택된 샘플보다 더 높은 CRP 수준을 가질 것이다 (시간의 74.3%). IFX, ATI 및 CRP 연관성 분석에서, 3.0 ㎍/㎖ 의 혈청 IFX 저점 역치를 사용했다.
시간의 흐름에 따른 혈청 IFX 농도, ATI, 및 CRP 수준의 연관성을 확인하기 위해, 우리는 순차적 시점에 걸쳐 취해진 샘플 쌍들을 조사했다. 100-일 시간 공백 (gap) 한계를 시점들에 부과했다. 우리는 쌍의 첫번째 데이타 점에서의 IFX 및 ATI 의 존재와 후속 측정에서의 CRP 사이의 관계를 평가했다 (도 26A). 도 26B 는 하나의 샘플에 대한 순차적 시점에서의 CRP 수준, IFX 혈청 농도 및 ATI 상태를 보여준다. 총, 1,205 개의 관찰을 조사했다.
회귀 분석 (예를 들어, 보통 최소 제곱 회귀) 을 사용하여 질환 (즉, CRP 수준) 의 예측인자로서의 선행 IFX 및 선행 ATI 사이의 잠재적 상호작용을 평가했다. 특히, CRP 를 두번째 시점 관찰에서 로그 변환했다. 선행 IFX 는 IFX 농도가 계산된 저점 역치 3 ㎍/㎖ 초과 또는 미만인 최초의 시점이다. 선행 ATI 는 ATI 가 탐지 한계 (LOD) 3.13 U/㎖ 초과 또는 미만인 최초의 시점이다. 쌍을 이룬 순차적 샘플 및 회귀 분석을 사용하여, ATI 및 IFX 둘다를 중간 CRP 와 연관지었으며, 하기 표에 나타냈다:
결과는 인자들 및 인자들 사이의 상호작용이 유의함을 보여준다. 회귀 계수는 ATI+ 샘플에 대해 0.272 및 IFX ≥ 3 ㎍/㎖ 에 대해 -0.979 로 계산되었다.
우리는 하기 4 개의 구별되는 환자 군을 식별했다: (1) IFX ≥ 역치 및 ATI-, (2) IFX < 역치 및 ATI-, (3) IFX ≥ 역치 및 ATI+, 및 (4) IFX < 역치 및 ATI+. 분석에 사용한 1,205 개의 관찰 중에서, 605 개는 IFX ≥ 역치 및 ATI- 였고; 196 개는 IFX < 역치 및 ATI- 였고; 41 개는 IFX ≥ 역치 및 ATI+ 였고; 363 개는 IFX < 역치 및 ATI+ 였다.
ATI+ 환자가 전반적으로 더 높은 CRP 수준을 가졌지만, 이 군 내에서 역치보다 더 높은 IFX 수준 및 CRP 사이에 연관성이 없었다 (도 27). ATI- 환자에서, CRP 수준은 IFX 수준이 역치 미만인 환자에서 유의하게 더 높았다 (도 27).
회귀 분석에서, ATI 양성, IFX ≥ 3 ㎍/㎖ 및 그들의 상호작용이 CRP 수준의 모든 유의한 예측인자였다. CRP 는 ATI- 환자에서보다 ATI+ 환자에서 31 % 더 높았고, IFX < 3 ㎍/㎖ 인 환자에 비해 IFX 수준 ≥ 3 ㎍/㎖ 인 환자에서 62 % 더 낮았다. IFX 농도 및 CRP 수준 사이의 관계는 ATI+ 및 ATI- 환자 군 사이에 상이하다.
이 연구에서 우리는 ATI 양성이 CRP 로 측정되는 증가된 질환 활성을 예측함을 밝혔다. 우리는 또한 3 ㎍/㎖ 의 역치 값을 초과하는 IFX 농도가 유의하게 더 낮은 질환 활성을 예측함을 밝혔다. ATI+ 환자에서, 3 ㎍/㎖ 를 초과하는 IFX 농도는 CRP 수준에 영향을 미치지 않았으며, 이는 IFX 의 유익이 최적 약물 농도의 존재에도 불구하고 ATI 의 존재시에 감소됨을 시사한다.
우리는 큰 조합된 데이타 세트에서 CRP 로 측정되는 질환 활성이 IFX 및 ATI 둘다와 강하게 연관됨을 밝혔다. 따라서, 활성 크론병 환자는 저점에서의 IFX 및 ATI 수준 둘다의 지식으로부터 유익을 얻을 수 있다. 이들 관계의 실험적 유도에 기초하여, 하기 치료 패러다임을 창출했다. 예를 들어, IFX< 저점에서의 역치 및 ATI- 인 크론병 징후를 보이는 환자는 증가된 IFX 의 투여량 요법으로부터 유익을 얻을 수 있다. IFX > 역치 및 ATI- 인 환자는 내시경검사 수령 또는 요법 전환으로부터 유익을 얻을 수 있다. IFX< 저점에서의 역치 및 ATI+ 인 징후를 보이는 환자는 ATI 가 높은 경우 요법 전환 또는 ATI 가 낮은 경우 요법 투여량 최적화로부터 유익을 얻을 수 있다. IFX ≥ 역치 및 ATI+ 인 환자는 질환 활성 (예를 들어, CRP 수준) 이 높은 경우 요법 전환으로부터 유익을 얻을 수 있다. 대안적으로는, 그 환자에서 질환 활성 (예를 들어, CRP 수준) 이 낮은 경우, 추가의 모니터링이 권장된다. 치료 패러다임이 하기 표에 기재되어 있다:
이들 발견은 본 발명의 방법을 사용하는 치료적 약물 모니터링이 IFX 요법 최적화에 중요한 도구임을 입증한다.
전술한 발명이 명확한 이해를 위해 설명 및 실시예에 의해 다소 상세히 기재되었지만, 당업자는 첨부된 청구범위 안에서 일정한 변화 및 수정이 이루어질 수 있음을 인식할 것이다. 또한, 본원에 제공된 각각의 참고문헌은 마치 각각의 참고문헌이 개별적으로 참조로 포함되는 것과 동일한 정도로 그 전문이 참조로 포함된다.
Claims (37)
- 요법 양생법을 받고 있는 염증성 장 질환 (IBD) 으로 진단된 개체에서의 점막 치유의 비-침습적 측정 방법으로서, 하기 단계를 포함하는 방법:
(a) 개체로부터의 샘플 중 점막 치유 마커의 어레이의 수준을 측정하는 단계;
(b) 개체 중 점막 치유 마커의 어레이의 수준을 대조군의 그것과 비교하여 개체의 점막 치유 지수를 산출하는 단계로서, 점막 치유 지수가 점막 치유의 규모의 표시를 포함하는 단계; 및
(c) 점막 치유를 겪고 있는 개체가 요법 양생법을 유지해야 하는지 여부를 결정하는 단계. - 요법을 받고 있는 염증성 장 질환 (IBD) 을 갖는 개체에서의 치료적 효율의 모니터링 방법으로서, 하기 단계를 포함하는 방법:
(a) 치료 항체를 이용하는 요법의 과정 동안 복수의 시점에서 개체로부터의 샘플 중 점막 치유 마커의 어레이의 수준을 측정하는 단계;
(b) 단계 (a) 에서 측정된 하나 이상의 마커의 수준에 통계적 알고리즘을 적용하여 점막 치유 지수를 생성하는 단계;
(c) 개체의 점막 치유 지수를 대조군의 그것과 비교하는 단계; 및
(d) 요법이 개체가 점막 치유를 촉진하기에 적당한지 여부를 결정하는 단계. - 염증성 장 질환 (IBD) 을 갖는 개체를 위한 요법 양생법의 선별 방법으로서, 하기 단계를 포함하는 방법:
(a) 요법의 과정 동안 복수의 시점에서 개체로부터의 샘플 중 점막 치유 마커의 어레이의 수준을 측정하는 단계로서, 개체가 치료 항체를 받고 있는 단계;
(b) 단계 (a) 에서 측정된 하나 이상의 마커의 수준에 통계적 알고리즘을 적용하여 점막 치유 지수를 생성하는 단계;
(c) 개체의 점막 치유 지수를 대조군의 그것과 비교하는 단계; 및
(d) 개체를 위한 적당한 요법 양생법을 선별하는 단계로서, 요법 양생법이 점막 치유를 촉진하는 단계. - 제 1 항 내지 제 3 항 중 어느 한 항에 있어서, IBD 가 크론병 또는 궤양성 대장염을 포함하는 방법.
- 제 1 항 내지 제 3 항 중 어느 한 항에 있어서, IBD 가 크론병을 포함하는 방법.
- 제 1 항 내지 제 5 항 중 어느 한 항에 있어서, 점막 치유 마커가 AREG, EREG, HB-EGF, HGF, NRG1, NRG2, NRG3, NRG4, BTC, EGF, IGF, TGF-α, VEGF-A, VEGF-B, VEGF-C, VEGF-D, FGF1, FGF2, FGF7, FGF9, TWEAK 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원인 방법.
- 제 1 항 내지 제 6 항 중 어느 한 항에 있어서, 마커가 혈청, 혈장, 전혈, 대변, 말초 혈액 단핵 세포 (PBMC), 다형핵 (PMN) 세포, 및 조직 생검으로 이루어지는 군으로부터 선택되는 샘플 중에서 측정되는 방법.
- 제 1 항 내지 제 7 항 중 어느 한 항에 있어서, 요법이 TNFα 저해인자 요법, 면역억제제, 코르티코스테로이드, 상이한 메카니즘을 표적화하는 약물, 영양 요법, 및 그들의 조합으로 이루어지는 군으로부터 선택되는 방법.
- 제 8 항에 있어서, TNFα 저해인자 요법이 항-TNFα 항체를 포함하는 방법.
- 제 9 항에 있어서, 항-TNFα 항체가 REMICADE™ (인플릭시맙), ENBREL™ (에타네르셉트), HUMIRA™ (아달리무맙), CIMZIA® (세르톨리주맙 페골), 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원인 방법.
- 제 8 항에 있어서, 면역억제제가 아자티오프린, 6-메르캅토퓨린, 메토트렉세이트, 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원인 방법.
- 제 8 항에 있어서, 상이한 메카니즘을 표적화하는 약물이 IL-6 수용체 저해 항체, 항-인테그린 분자, JAK-2 저해인자, 티로신 키나제 저해인자, 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원인 방법.
- 제 8 항에 있어서, 영양 요법이 특별 탄수화물식을 포함하는 방법.
- 제 1 항 내지 제 13 항 중 어느 한 항에 있어서, 점막 치유 마커의 어레이가 항-TNFα 항체, 항-약물 항체 (ADA), 염증 마커, 항-염증 마커, 점막 치유 마커, 및 그들의 조합으로 이루어지는 군으로부터 선택되는 하나 이상의 구성원을 추가로 포함하는 방법.
- 제 14 항에 있어서, 항-TNFα 항체가 REMICADE™ (인플릭시맙), ENBREL™ (에타네르셉트), HUMIRA™ (아달리무맙), CIMZIA® (세르톨리주맙 페골), 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원인 방법.
- 제 14 항에 있어서, 항-약물 항체 (ADA) 가 인간 항-키메라 항체 (HACA), 인간 항-인간화 항체 (HAHA), 인간 항-마우스 항체 (HAMA), 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원인 방법.
- 제 14 항에 있어서, 점막 치유 마커가 AREG, EREG, HB-EGF, HGF, NRG1, NRG2, NRG3, NRG4, BTC, EGF, IGF, TGF-α, VEGF-A, VEGF-B, VEGF-C, VEGF-D, FGF1, FGF2, FGF7, FGF9, TWEAK 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원인 방법.
- 제 14 항에 있어서, 염증 마커가 GM-CSF, IFN-γ, IL-1β, IL-2, IL-6, IL-8, TNF-α, sTNF RII, 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원인 방법.
- 제 14 항에 있어서, 항-염증 마커가 IL-12p70, IL-10, 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원인 방법.
- 요법 양생법이 투여되고 있는 염증성 장 질환 (IBD) 으로 진단된 개체에서의 수술 위험의 감소 또는 최소화 방법으로서, 하기 단계를 포함하는 방법:
(a) 치료 항체를 이용하는 요법의 과정 동안 복수의 시점에서 점막 치유 마커의 어레이를 측정하는 단계;
(b) 시간의 흐름에 따른 각각의 마커의 존재 및/또는 농도 수준의 표시를 포함하는 개체의 점막 치유 지수를 생성하는 단계;
(c) 개체의 점막 치유 지수를 대조군의 그것과 비교하는 단계; 및
(d) 수술 위험을 감소 또는 최소화하는 적당한 요법 양생법을 선별하는 단계. - 제 20 항에 있어서, 점막 치유 마커가 AREG, EREG, HB-EGF, HGF, NRG1, NRG2, NRG3, NRG4, BTC, EGF, IGF, TGF-α, VEGF-A, VEGF-B, VEGF-C, VEGF-D, FGF1, FGF2, FGF7, FGF9, TWEAK 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원인 방법.
- 제 20 항 또는 제 21 항에 있어서, 대조군이 건강한 대조군인 방법.
- 제 20 항 내지 제 22 항 중 어느 한 항에 있어서, 치료 항체가 항-TNF 항체를 포함하는 방법.
- 제 23 항에 있어서, 항-TNF 항체가 REMICADE™ (인플릭시맙), ENBREL™ (에타네르셉트), HUMIRA™ (아달리무맙), CIMZIA® (세르톨리주맙 페골), 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원인 방법.
- 제 20 항 내지 제 24 항 중 어느 한 항에 있어서, 마커가 혈청, 혈장, 전혈, 대변, 말초 혈액 단핵 세포 (PBMC), 다형핵 (PMN) 세포, 및 조직 생검으로 이루어지는 군으로부터 선택되는 샘플 중에서 측정되는 방법.
- 제 20 항 내지 제 25 항 중 어느 한 항에 있어서, 복수의 시점이 2 이상, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 또는 그 이상의 시점을 포함하는 방법.
- 제 20 항 내지 제 26 항 중 어느 한 항에 있어서, IBD 가 크론병 또는 궤양성 대장염을 포함하는 방법.
- 제 20 항 내지 제 27 항 중 어느 한 항에 있어서, 복수의 시점 중 최초의 시점이 치료 항체를 이용하는 요법의 과정 전인 방법.
- 제 20 항 내지 제 27 항 중 어느 한 항에 있어서, 복수의 시점 중 최초의 시점이 치료 항체를 이용하는 요법의 과정 동안인 방법.
- 염증성 장 질환 (IBD) 으로 진단된 개체에서 점막 치유를 촉진하기 위한 요법 양생법의 선별 방법으로서, 하기 단계를 포함하는 방법:
(a) 시점 t0 에서 점막 치유 마커의 어레이의 수준을 측정하여 t0 에서의 점막 치유 지수를 생성하는 단계;
(b) 시점 t1 에서 점막 치유 마커의 어레이의 수준을 측정하여 t1 에서의 점막 치유 지수를 생성하는 단계;
(c) t0 으로부터 t1 까지의 점막 치유 지수의 변화를 비교하는 단계; 및
(d) 개체를 위한 점막 치유를 촉진하는 요법 양생법을 선별하는 단계. - 제 30 항에 있어서, 점막 치유 마커가 AREG, EREG, HB-EGF, HGF, NRG1, NRG2, NRG3, NRG4, BTC, EGF, IGF, TGF-α, VEGF-A, VEGF-B, VEGF-C, VEGF-D, FGF1, FGF2, FGF7, FGF9, TWEAK 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원인 방법.
- 제 30 항 또는 제 31 항에 있어서, 점막 치유 지수가 통계적 알고리즘을 사용하여 결정되는 방법.
- 제 30 항 내지 제 32 항 중 어느 한 항에 있어서, 요법 양생법이 항-TNF 항체를 포함하는 방법.
- 제 33 항에 있어서, 항-TNF 항체가 REMICADE™ (인플릭시맙), ENBREL™ (에타네르셉트), HUMIRA™ (아달리무맙), CIMZIA® (세르톨리주맙 페골), 및 그들의 조합으로 이루어지는 군으로부터 선택되는 구성원인 방법.
- 제 30 항 내지 제 34 항 중 어느 한 항에 있어서, 마커가 혈청, 혈장, 전혈, 대변, 말초 혈액 단핵 세포 (PBMC), 다형핵 (PMN) 세포, 및 조직 생검으로 이루어지는 군으로부터 선택되는 샘플 중에서 측정되는 방법.
- 제 30 항 내지 제 35 항 중 어느 한 항에 있어서, 점막 치유 마커의 어레이의 수준이 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 또는 그 이상의 부가적 시점에서 측정되는 방법.
- 제 30 항 내지 제 36 항 중 어느 한 항에 있어서, IBD 가 크론병 또는 궤양성 대장염을 포함하는 방법.
Applications Claiming Priority (11)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161484607P | 2011-05-10 | 2011-05-10 | |
| US61/484,607 | 2011-05-10 | ||
| US201161505026P | 2011-07-06 | 2011-07-06 | |
| US61/505,026 | 2011-07-06 | ||
| US201161553909P | 2011-10-31 | 2011-10-31 | |
| US61/553,909 | 2011-10-31 | ||
| US201161566509P | 2011-12-02 | 2011-12-02 | |
| US61/566,509 | 2011-12-02 | ||
| US201261636575P | 2012-04-20 | 2012-04-20 | |
| US61/636,575 | 2012-04-20 | ||
| PCT/US2012/037375 WO2012154987A1 (en) | 2011-05-10 | 2012-05-10 | Methods of disease activity profiling for personalized therapy management |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140032424A true KR20140032424A (ko) | 2014-03-14 |
Family
ID=46147068
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137032638A KR20140032424A (ko) | 2011-05-10 | 2012-05-10 | 개인화된 요법 관리를 위한 질환 활성 프로파일링 방법 |
Country Status (14)
| Country | Link |
|---|---|
| US (3) | US10086072B2 (ko) |
| EP (1) | EP2707504A1 (ko) |
| JP (3) | JP2014517279A (ko) |
| KR (1) | KR20140032424A (ko) |
| CN (2) | CN103649336A (ko) |
| AU (1) | AU2012253422B2 (ko) |
| BR (1) | BR112013028808A2 (ko) |
| CA (1) | CA2839792A1 (ko) |
| IL (1) | IL229120B (ko) |
| MX (2) | MX362132B (ko) |
| RU (1) | RU2013154566A (ko) |
| SG (1) | SG194710A1 (ko) |
| WO (1) | WO2012154987A1 (ko) |
| ZA (1) | ZA201309258B (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20200086627A (ko) * | 2017-11-13 | 2020-07-17 | 더 멀티플 마이얼로머 리서치 파운데이션, 인크. | 통합된, 분자, 체학, 면역요법, 대사, 후성적, 및 임상 데이터베이스 |
Families Citing this family (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20110229471A1 (en) | 2008-11-26 | 2011-09-22 | Cedars-Sinai Medical Center | Methods of determining responsiveness to anti-tnf alpha therapy in inflammatory bowel disease |
| WO2012154987A1 (en) | 2011-05-10 | 2012-11-15 | Nestec Sa | Methods of disease activity profiling for personalized therapy management |
| US20140205613A1 (en) * | 2013-01-21 | 2014-07-24 | Abbvie Inc. | Anti-tnf and anti-il 17 combination therapy biomarkers for inflammatory disease |
| JP6565121B2 (ja) | 2013-03-21 | 2019-08-28 | ザ リージェンツ オブ ザ ユニヴァシティ オブ ミシガン | 代謝障害を治療する方法 |
| WO2015010108A1 (en) | 2013-07-19 | 2015-01-22 | Cedars-Sinai Medical Center | Signature of tl1a (tnfsf15) signaling pathway |
| WO2015110989A1 (en) | 2014-01-23 | 2015-07-30 | Nestec S.A. | Biomarker panel for assessment of mucosal healing |
| WO2015155766A1 (en) * | 2014-04-10 | 2015-10-15 | Yissum Research Development Company Of The Hebrew University Of Jerusalem Ltd. | Methods and kits for determining a personalized treatment regimen for a subject suffering from a pathologic disorder |
| WO2015166461A1 (en) | 2014-05-01 | 2015-11-05 | Nestec S.A. | Methods of selecting treatment regimen using tnf alpha and anti-tnf alpha drug levels |
| MX2016014624A (es) * | 2014-05-09 | 2017-05-25 | Nogra Pharma Ltd | Metodos para el tratamiento de enfermedad inflamatoria del intestino. |
| US20170105647A1 (en) * | 2014-05-15 | 2017-04-20 | Children's Medical Center Corporation | Systems and methods for identifying neurobiological biomarkers using eeg |
| WO2016063204A1 (en) | 2014-10-20 | 2016-04-28 | Nestec S.A. | Methods for prediction of anti-tnf alpha drug levels and autoantibody formation |
| WO2016088068A1 (en) | 2014-12-02 | 2016-06-09 | Nestec S.A. | Methods for establishing a vedolizumab dosing regimen to treat patients with irritable bowel disease |
| MX2017007232A (es) | 2014-12-05 | 2017-10-16 | Nestec Sa | Ensayos de desplazamiento por movilidad homogeneos indirectos para la deteccion de productos biologicos en muestras de pacientes. |
| US20180224464A1 (en) * | 2015-06-09 | 2018-08-09 | Osaka University | Method of predicting and determining therapeutic effect on rheumatoid arthritis due to biological formulation |
| WO2017027709A1 (en) | 2015-08-11 | 2017-02-16 | Cognoa, Inc. | Methods and apparatus to determine developmental progress with artificial intelligence and user input |
| US11972336B2 (en) | 2015-12-18 | 2024-04-30 | Cognoa, Inc. | Machine learning platform and system for data analysis |
| KR20240095481A (ko) | 2016-03-17 | 2024-06-25 | 세다르스-신나이 메디칼 센터 | Rnaset2를 통한 염증성 장 질환의 진단 방법 |
| CN109414461A (zh) * | 2016-04-26 | 2019-03-01 | 曲生物制品公司 | 治疗性地触发靶组织中的先天性免疫应答 |
| CN117286238A (zh) | 2016-05-20 | 2023-12-26 | 西达-赛奈医疗中心 | 基于基因的炎性肠病诊断 |
| GB201611738D0 (en) * | 2016-07-05 | 2016-08-17 | Cambridge Entpr Ltd | Biomarkers for inflammatory bowel disease |
| WO2018081175A1 (en) | 2016-10-24 | 2018-05-03 | Habit, Llc | System and method for implementing meal selection based on vitals, genotype, and phenotype |
| WO2018085937A1 (en) * | 2016-11-14 | 2018-05-17 | Qu Biologics Inc. | Managing site specific ibd immunotherapies |
| GB2575740A (en) * | 2017-02-09 | 2020-01-22 | Congoa Inc | Platform and system for digital personalized medicine |
| AU2018277256A1 (en) | 2017-05-31 | 2020-01-30 | Prometheus Biosciences, Inc. | Methods for assessing mucosal healing in Crohn's disease patients |
| SG11202003216QA (en) | 2017-10-10 | 2020-05-28 | Prometheus Biosciences Inc | Methods for monitoring vedolizumab treatment |
| US11270800B1 (en) * | 2017-11-09 | 2022-03-08 | Aptima, Inc. | Specialized health care system for selecting treatment paths |
| EP3765634A4 (en) | 2018-03-16 | 2021-12-01 | Scipher Medicine Corporation | METHODS AND SYSTEMS FOR PREDICTING THE RESPONSE TO ANTI-TNF THERAPIES |
| JP2020028278A (ja) * | 2018-08-24 | 2020-02-27 | 国立大学法人九州大学 | 被検体に生じるイベントを予測するための判別器の生成方法、及び前記判別器を用いた被検体の層別化方法 |
| AU2020248351A1 (en) | 2019-03-22 | 2021-11-11 | Cognoa, Inc. | Personalized digital therapy methods and devices |
| CN109998488B (zh) * | 2019-04-13 | 2022-08-02 | 中国医学科学院北京协和医院 | 克罗恩病和肠道溃疡型淋巴瘤的鉴别模型及构建方法 |
| MX2021013974A (es) | 2019-05-14 | 2022-02-10 | Prometheus Biosciences Inc | Metodos, sistemas y dispositivos de seleccion de pacientes tl1a. |
| MX2022000128A (es) * | 2019-06-27 | 2022-04-27 | Scipher Medicine Corp | Desarrollo de clasificadores para estratificar pacientes. |
| WO2021097074A1 (en) * | 2019-11-13 | 2021-05-20 | New York University | Intestinal organoid co-culture systems and methods for treating or preventing a disease or disorder associated with immune response-mediated tissue injury |
| WO2023055955A1 (en) * | 2021-09-30 | 2023-04-06 | Prometheus Laboratories Inc. | Patient centric precision model for anti-tnf therapy |
| WO2023064437A1 (en) * | 2021-10-15 | 2023-04-20 | The Trustees Of Indiana University | Methods for detecting fracture-related infection (fri) |
| CN114859060A (zh) * | 2022-05-06 | 2022-08-05 | 广州市胸科医院 | 一种细胞因子组及其应用 |
| US11887720B1 (en) * | 2023-01-23 | 2024-01-30 | Kpn Innovations, Llc | Apparatus and method for using a feedback loop to optimize meals |
Family Cites Families (79)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0670849B1 (en) | 1992-10-29 | 2003-08-27 | Bayer Corporation | Diagnostic assay for latent matrix metalloproteinase no. 9 |
| DK0615129T3 (da) | 1993-03-10 | 2000-08-07 | Cedars Sinai Medical Center | Fremgangsmåder til selektiv påvisning af perinukleært anti-neutrophilt cytoplasmatisk antistof fra ulcerativ colitis eller |
| US5830675A (en) | 1993-03-10 | 1998-11-03 | Cedars-Sinai Medical Center | Methods for selectively detecting perinuclear anti-neutrophil cytoplasmic antibody of ulcerative colitis, primary sclerosing cholangitis, or type 1 autoimmune hepatitis |
| US20020025553A1 (en) | 1996-01-04 | 2002-02-28 | Ying-Fei Wei | Transforming growth factor alpha HIII |
| US6033864A (en) | 1996-04-12 | 2000-03-07 | The Regents Of The University Of California | Diagnosis, prevention and treatment of ulcerative colitis, and clinical subtypes thereof, using microbial UC pANCA antigens |
| US6074835A (en) | 1996-04-12 | 2000-06-13 | Regents Of The Univ. Of California | Diagnosis, prevention and treatment of ulcerative colitis, and clinical subtypes thereof, using histone H1 |
| US6319899B1 (en) | 1997-09-17 | 2001-11-20 | The Nemours Foundation | Method and composition for the treatment of inflammatory bowel disease |
| US6218129B1 (en) | 1998-05-15 | 2001-04-17 | Prometheus Laboratories, Inc. | Inflammatory bowel disease first step assay system |
| RU2141332C1 (ru) | 1998-06-24 | 1999-11-20 | Научно-исследовательский институт фармакологии Томского научного центра РАМН | Противоязвенное средство и способ его получения |
| US6406862B1 (en) | 1998-10-06 | 2002-06-18 | The United States Of America As Represented By The Secretary Of The Army | Dip-stick assay for C-reactive protein |
| US6309643B1 (en) | 1999-04-30 | 2001-10-30 | The Regents Of The University Of California | IBD-associated microbial antigens and methods of using same |
| FR2802536B1 (fr) | 1999-11-23 | 2003-06-13 | Chru Lille | Oligomannosides de synthese, leur preparation et leur utilisation a la detection d'anticorps et a la prevention d'infections |
| FR2806739B1 (fr) | 2000-03-27 | 2005-02-18 | Fond Jean Dausset Ceph | Genes impliques dans les maladies inflammatoires de l'intestin et leur utilisation |
| US6838250B2 (en) | 2000-03-31 | 2005-01-04 | Ortho-Clinical Diagnostics, Inc. | Immunoassay for C-reactive protein |
| US7138237B1 (en) | 2000-05-19 | 2006-11-21 | Cedars-Sinai Medical Center | Diagnosis, prevention and treatment of Crohn's disease using the OmpC antigen |
| AU1169702A (en) | 2000-10-13 | 2002-04-22 | Childrens Medical Center | Non-invasive enzyme screen for tissue remodelling-associated conditions |
| DK1330525T3 (da) | 2000-10-30 | 2013-03-04 | Univ Michigan | NOD2-nukleinsyrer og proteiner |
| WO2002044426A2 (en) | 2000-10-30 | 2002-06-06 | Regents Of The University Of Michigan | Nod2 nucleic acids and proteins |
| AU2002220029B2 (en) | 2000-11-14 | 2007-09-06 | Techlab, Inc. | Method for differentiating between irritable bowel syndrome and inflammatory bowel disease using lactoferrin as marker |
| EP1432984A4 (en) | 2001-08-30 | 2009-01-14 | Univ Pittsburgh | ALGORITHM FOR ASSESSING THE RESULTS OF INFLAMMATION FOR INJURY OR INFECTION |
| US20050154536A1 (en) | 2001-08-30 | 2005-07-14 | The University Of Pittsburgh - Of The Commonwealth System Of Higher Education | Two-part drug discovery system |
| EP2224012B1 (en) | 2001-12-17 | 2013-01-30 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of inflammatory bowel disease |
| US20040053263A1 (en) | 2002-08-30 | 2004-03-18 | Abreu Maria T. | Mutations in NOD2 are associated with fibrostenosing disease in patients with Crohn's disease |
| ES2306902T3 (es) | 2002-10-25 | 2008-11-16 | Techlab, Inc. | Panel de diagnostico ibd-first chek para la enfermedad inflamatoria del intestino y el sindrome del colon irritable. |
| US20040197304A1 (en) | 2003-04-01 | 2004-10-07 | The Procter & Gamble Company And Alimentary Health, Ltd. | Methods of determining efficacy of treatments of inflammatory diseases of the bowel |
| US7662569B2 (en) | 2003-04-11 | 2010-02-16 | Cedars-Sinai Medical Center | Methods of assessing Crohn's disease patient phenotype by I2 serologic response |
| WO2005009339A2 (en) | 2003-05-30 | 2005-02-03 | Pathway Diagnostics Corporation, Inc. (a Delaware Corporation) | Inflammatory bowel diseases |
| KR20060022289A (ko) | 2003-06-23 | 2006-03-09 | 제네틱스 인스티튜트, 엘엘씨 | 인터류킨-22 에 대한 항체 및 그의 용도 |
| CA2549971A1 (en) | 2003-11-03 | 2005-05-12 | Duke University | Methods of identifying individuals at risk of perioperative bleeding, renal dysfunction or stroke |
| DOP2005000002A (es) | 2004-01-09 | 2005-08-15 | Pfizer | "anticuerpos contra madcam" |
| FI119572B (fi) | 2004-03-05 | 2008-12-31 | Biohit Oyj | Menetelmä vatsan limakalvon tilan ennustamiseksi |
| US20060019410A1 (en) | 2004-07-21 | 2006-01-26 | Qualyst, Inc. | Apparatus, kits and methods for evaluating binding interactions, for detecting and quantifying binding molecules, and for sample preparation |
| WO2006027321A1 (en) | 2004-09-09 | 2006-03-16 | Universite De Liege | Identification and use of biomarkers for the diagnosis and the prognosis of inflammatory diseases. |
| AR051444A1 (es) | 2004-09-24 | 2007-01-17 | Centocor Inc | Proteinas derivadas de inmunoglobulina especifica de il-23p40, composiciones, epitopos, metodos y usos |
| US7462446B2 (en) | 2005-03-18 | 2008-12-09 | University Of Washington | Magnetic nanoparticle compositions and methods |
| DK2848258T3 (en) | 2005-10-26 | 2018-03-19 | Novartis Ag | Treatment of familial Mediterranean fever with anti-IL-1beta antibodies |
| AU2007261019A1 (en) | 2006-06-19 | 2007-12-27 | Wyeth | Methods of modulating IL-22 and IL-17 |
| US20080085524A1 (en) * | 2006-08-15 | 2008-04-10 | Prometheus Laboratories Inc. | Methods for diagnosing irritable bowel syndrome |
| WO2011008990A1 (en) | 2009-07-15 | 2011-01-20 | Prometheus Laboratories Inc. | Drug selection for gastric cancer therapy using antibody-based arrays |
| ES2398596T3 (es) | 2006-09-21 | 2013-03-20 | Nestec S.A. | Matrices a base de anticuerpos para detectar transductores de señales múltiples en células de rara circulación |
| US8165819B2 (en) | 2006-10-10 | 2012-04-24 | The University of Pittsburgh—Of the Commonwealth System of Higher Education | Modeling wound healing |
| US8293489B2 (en) | 2007-01-31 | 2012-10-23 | Henkin Robert I | Methods for detection of biological substances |
| US20100255513A1 (en) | 2007-03-30 | 2010-10-07 | Denson Lee A | Serological markers of inflammatory bowel disease phenotype and disease progression |
| GB2447865A (en) | 2007-03-30 | 2008-10-01 | Ethicon Inc | Diagnostic markers of wound infection |
| WO2008147869A2 (en) * | 2007-05-22 | 2008-12-04 | Centocor, Inc. | Markers and methods for assessing and treating crohn's disease and related disorders |
| CN101802618B (zh) | 2007-07-13 | 2015-02-25 | 雀巢产品技术援助有限公司 | 利用基于抗体的阵列选择肺癌治疗药物 |
| AU2009219437B2 (en) | 2008-02-25 | 2014-10-16 | Nestec S.A. | Drug selection for breast cancer therapy using antibody-based arrays |
| CA2719625C (en) | 2008-03-26 | 2019-02-26 | Theranos, Inc. | Methods and systems for assessing clinical outcomes |
| EP2307563B1 (en) * | 2008-03-28 | 2014-08-06 | Katholieke Universiteit Leuven KU Leuven Research & Development | Mucosal gene signatures |
| ES2445892T3 (es) * | 2008-08-25 | 2014-03-05 | Janssen Biotech, Inc. | Biomarcadores para el tratamiento anti-TNF en colitis ulcerosa y trastornos relacionados |
| CN102165315B (zh) * | 2008-08-29 | 2014-06-18 | 森托科尔奥索生物科技公司 | 用于使用20基因群组评估及治疗溃疡性结肠炎和相关疾病的标记物和方法 |
| CA2758531C (en) | 2009-04-14 | 2018-11-13 | Derren Barken | Inflammatory bowel disease prognostics |
| WO2010127057A2 (en) | 2009-05-01 | 2010-11-04 | Meso Scale Technologies, Llc. | Biomarkers of therapeutic responsiveness |
| EP2430443B1 (en) | 2009-05-14 | 2018-06-27 | Pierian Holdings, Inc. | Biomarkers for determining sensitivity of breast cancer cells to her2-targeted therapy |
| AU2010266028B2 (en) | 2009-06-25 | 2015-04-30 | Société des Produits Nestlé S.A. | Methods for diagnosing irritable bowel syndrome |
| SG178954A1 (en) | 2009-09-02 | 2012-04-27 | Novartis Ag | Immunogenic compositions including tlr activity modulators |
| KR20120105444A (ko) * | 2009-10-15 | 2012-09-25 | 오클라호마 메디컬 리써치 화운데이션 | 염증성 질병의 활성 측정 및 모니터링을 위한 바이오마커 및 방법 |
| CA2777934A1 (en) | 2009-10-20 | 2011-04-28 | Prometheus Laboratories Inc. | Proximity-mediated assays for detecting oncogenic fusion proteins |
| MX343328B (es) | 2009-10-26 | 2016-11-01 | Nestec Sa | Analisis para la deteccion de farmacos anti-tnf y anticuerpos. |
| MX2012005995A (es) | 2009-11-25 | 2012-08-08 | Prometheus Lab Inc | Novedosos biomarcadores genomicos para diagnostico del sindrome de intestino irritable. |
| US20130071860A1 (en) | 2010-02-24 | 2013-03-21 | Matthew B. Hale | Methods for autoimmune disease diagnosis, prognosis, and treatment` |
| EP2576838A4 (en) | 2010-06-04 | 2019-05-15 | Nestec S.A. | METHOD FOR IMPROVING DIAGNOSIS OF INFLAMMATORY ENDURANCE |
| US20140148350A1 (en) | 2010-08-18 | 2014-05-29 | David Spetzler | Circulating biomarkers for disease |
| CN103384828A (zh) | 2010-12-23 | 2013-11-06 | 雀巢产品技术援助有限公司 | 使用基于抗体的阵列进行恶性癌症疗法的药物选择 |
| EP2908132B8 (en) | 2011-03-02 | 2019-06-12 | Nestec S.A. | Prediction of drug sensitivity of lung tumors based on molecular and genetic signatures |
| WO2012154987A1 (en) | 2011-05-10 | 2012-11-15 | Nestec Sa | Methods of disease activity profiling for personalized therapy management |
| JP6186575B2 (ja) | 2011-09-02 | 2017-08-30 | ダイアテック ホールディングス, インコーポレイテッドDiaTech Holdings, Inc. | 治療有効性を判定するためのシグナル経路タンパク質のプロファイリング |
| CA2852954A1 (en) | 2011-10-21 | 2013-04-25 | Nestec S.A. | Methods for improving inflammatory bowel disease diagnosis |
| CN104271156B (zh) | 2012-02-29 | 2017-06-16 | 吉利德生物制剂公司 | 抗基质金属蛋白酶9的抗体 |
| JP2015532425A (ja) | 2012-10-05 | 2015-11-09 | ネステク ソシエテ アノニム | 粘膜治癒を予測及びモニタリングするための方法 |
| US20140113306A1 (en) | 2012-10-17 | 2014-04-24 | Rutgers, The State University Of New Jersey | Diagnostic and screening methods for inflammation |
| CA3170609A1 (en) | 2013-01-03 | 2014-07-10 | Meso Scale Technologies, Llc | Assay panels for a multiplexed analysis of a set of cytokines |
| US20140236166A1 (en) | 2013-02-15 | 2014-08-21 | The Board Of Trustees Of The Leland Stanford Junior University | Biomarkers for distinguishing benign, pre-malignant, and malignant pancreatic cysts |
| WO2015110989A1 (en) | 2014-01-23 | 2015-07-30 | Nestec S.A. | Biomarker panel for assessment of mucosal healing |
| WO2016105572A1 (en) | 2014-12-24 | 2016-06-30 | Millennium Pharmaceuticals, Inc. | PREDICTING OUTCOME OF TREATMENT WITH AN ANTI-α4β7 INTEGRIN ANTIBODY |
| CA2973433A1 (en) | 2015-01-23 | 2016-07-28 | Nestec S.A. | Nutritional composition useful in the treatment of ibd patients |
| CA2972099A1 (en) | 2015-02-26 | 2016-09-01 | Genentech, Inc. | Integrin beta7 antagonists and methods of treating crohn's disease |
| AU2018277256A1 (en) | 2017-05-31 | 2020-01-30 | Prometheus Biosciences, Inc. | Methods for assessing mucosal healing in Crohn's disease patients |
| WO2020117795A1 (en) | 2018-12-04 | 2020-06-11 | Prometheus Biosciences, Inc. | Assessment and monitoring of mucosal healing in children and adults with crohn's disease |
-
2012
- 2012-05-10 WO PCT/US2012/037375 patent/WO2012154987A1/en active Application Filing
- 2012-05-10 AU AU2012253422A patent/AU2012253422B2/en not_active Ceased
- 2012-05-10 RU RU2013154566/15A patent/RU2013154566A/ru unknown
- 2012-05-10 CN CN201280034138.2A patent/CN103649336A/zh active Pending
- 2012-05-10 BR BR112013028808A patent/BR112013028808A2/pt not_active Application Discontinuation
- 2012-05-10 JP JP2014510475A patent/JP2014517279A/ja active Pending
- 2012-05-10 CA CA2839792A patent/CA2839792A1/en active Pending
- 2012-05-10 SG SG2013080585A patent/SG194710A1/en unknown
- 2012-05-10 KR KR1020137032638A patent/KR20140032424A/ko not_active Application Discontinuation
- 2012-05-10 CN CN201910821596.4A patent/CN110544517A/zh active Pending
- 2012-05-10 MX MX2013013096A patent/MX362132B/es active IP Right Grant
- 2012-05-10 EP EP12722621.5A patent/EP2707504A1/en not_active Ceased
-
2013
- 2013-10-28 IL IL229120A patent/IL229120B/en active IP Right Grant
- 2013-11-05 US US14/072,746 patent/US10086072B2/en active Active
- 2013-11-08 MX MX2018008324A patent/MX2018008324A/es unknown
- 2013-12-09 ZA ZA2013/09258A patent/ZA201309258B/en unknown
-
2017
- 2017-11-22 JP JP2017225123A patent/JP2018072349A/ja not_active Ceased
-
2018
- 2018-08-24 US US16/112,242 patent/US11160863B2/en active Active
-
2020
- 2020-01-17 JP JP2020006298A patent/JP2020098213A/ja active Pending
-
2021
- 2021-09-24 US US17/484,786 patent/US20220096629A1/en active Pending
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20200086627A (ko) * | 2017-11-13 | 2020-07-17 | 더 멀티플 마이얼로머 리서치 파운데이션, 인크. | 통합된, 분자, 체학, 면역요법, 대사, 후성적, 및 임상 데이터베이스 |
Also Published As
| Publication number | Publication date |
|---|---|
| IL229120A0 (en) | 2013-12-31 |
| NZ617009A (en) | 2015-09-25 |
| MX2018008324A (es) | 2021-11-16 |
| JP2018072349A (ja) | 2018-05-10 |
| AU2012253422B2 (en) | 2015-08-13 |
| US20190060449A1 (en) | 2019-02-28 |
| CA2839792A1 (en) | 2012-11-15 |
| SG194710A1 (en) | 2013-12-30 |
| CN110544517A (zh) | 2019-12-06 |
| IL229120B (en) | 2018-05-31 |
| JP2020098213A (ja) | 2020-06-25 |
| US10086072B2 (en) | 2018-10-02 |
| US11160863B2 (en) | 2021-11-02 |
| CN103649336A (zh) | 2014-03-19 |
| BR112013028808A2 (pt) | 2016-09-06 |
| US20140141983A1 (en) | 2014-05-22 |
| AU2012253422A1 (en) | 2013-05-02 |
| US20220096629A1 (en) | 2022-03-31 |
| WO2012154987A1 (en) | 2012-11-15 |
| NZ711144A (en) | 2017-01-27 |
| JP2014517279A (ja) | 2014-07-17 |
| EP2707504A1 (en) | 2014-03-19 |
| MX362132B (es) | 2019-01-07 |
| ZA201309258B (en) | 2016-08-31 |
| RU2013154566A (ru) | 2015-06-20 |
| MX2013013096A (es) | 2014-07-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20220096629A1 (en) | Methods of disease activity profiling for personalized therapy management | |
| EP2630495B1 (en) | Methods for determining anti-drug antibody isotypes | |
| DK2676137T3 (en) | TESTS TO DETECT AUTO ANTIBODIES FOR ANTI-TNF PHARMACEUTICALS | |
| EP2904405B1 (en) | Methods for predicting and monitoring mucosal healing | |
| NZ617009B2 (en) | Methods of disease activity profiling for personalized therapy management | |
| NZ711144B2 (en) | Methods of disease activity profiling for personalized therapy management | |
| RU2574976C2 (ru) | Способы определения изотипа антител против лекарственных препаратов |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |