KR20110031152A - Il-6에 대한 항체 및 그의 용도 - Google Patents
Il-6에 대한 항체 및 그의 용도 Download PDFInfo
- Publication number
- KR20110031152A KR20110031152A KR1020107024395A KR20107024395A KR20110031152A KR 20110031152 A KR20110031152 A KR 20110031152A KR 1020107024395 A KR1020107024395 A KR 1020107024395A KR 20107024395 A KR20107024395 A KR 20107024395A KR 20110031152 A KR20110031152 A KR 20110031152A
- Authority
- KR
- South Korea
- Prior art keywords
- seq
- antibody
- ser
- amino acid
- thr
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
- C07K16/248—IL-6
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/567—Framework region [FR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Physical Education & Sports Medicine (AREA)
- Rheumatology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Diabetes (AREA)
- Neurosurgery (AREA)
- Pulmonology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Pain & Pain Management (AREA)
- Urology & Nephrology (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Vascular Medicine (AREA)
- Hematology (AREA)
- Cardiology (AREA)
- Endocrinology (AREA)
- Dermatology (AREA)
- Heart & Thoracic Surgery (AREA)
- Emergency Medicine (AREA)
Abstract
인간 IL-6에 결합하는 항체 및 그의 항원 결합 부분을 제공한다. 그러한 항체 및 항원 결합 부분을 코딩하는 핵산, 그러한 항체 및 항원 결합 부분의 제조 방법, 그러한 항체 또는 항원 결합 부분을 포함하는 조성물, 및 그러한 항체 또는 항원 결합 부분의 용도를 또한 제공한다.
Description
<관련 특허 및 특허 출원에 대한 교차 참조>
본원은 그 전문이 본원에 참조로 포함되는 미국 특허 가출원 61/073430 (2008년 6월 18일 출원)을 기초로 한 우선권을 주장한다.
<공동 연구 협약>
본원의 개시내용 및 특허청구범위는 특허 청구된 발명이 이루어진 날 또는 그 이전에 화이자 인크. (Pfizer Inc.)와 메다렉스, 인크. (Medarex, Inc.) 사이에 효력이 발생한 공동 연구 협약의 범위 하에 취해진 활동을 통해 이루어졌다.
본 발명은 인간 IL-6에 결합하는 항체 및 그의 항원 결합 부분에 관한 것이다. 본 발명은 또한 그러한 항체 및 그의 항원 결합 부분을 코딩하는 핵산; 그러한 항체 및 그의 항원 결합 부분의 제조 방법; 그러한 항체 또는 그의 항원 결합 부분을 포함하는 조성물; 및 그러한 항체 또는 그의 항원 결합 부분의 용도에 관한 것이다.
인터페론 B2 (IFNB2)으로도 공지된 인터류킨-6 (IL-6)은 gp130 리간드의 패밀리에 속하는 다면발현 시토킨이고, T 림프구, 섬유모세포 및 단핵구를 포함한 많은 세포 종류에서 생산된다. IL-6은 낮은 수준에서 구성적으로 생산되고, 감염성 자극 또는 염증성 시토킨에 의해 쉽게 유도된다. IL-6은 특이적 수용체 IL-6R (gp80)에 결합하고, 이는 세포-결합형 또는 가용형 gp130과 이종이량체화하여 기능적 수용체 복합체를 형성한다. 그의 수용체에 대한 IL-6의 결합은 JAK-STAT3 경로의 활성화 및 ras-매개된 MAP 키나제 신호전달을 포함한 세포성 사건을 개시한다. IL-6은 B 세포 및 단핵구의 증식 및 분화, T 세포 활성화, 조혈, 파골세포 활성화, 각질세포 성장, 신경원 성장, 간세포 활성화, 및 간세포로부터 급성기 단백질 유도와 같은 광범위한 효과를 유발할 수 있다.
IL-6은 전신 홍반성 루푸스, 다발성 골수종 및 림프구증식 질환에서 나타난 바와 같이 B 세포 이상에서 중요한 역할을 한다. 유사하게, IL-6은 또한 자가면역 및 염증성 질병, 예를 들어 류마티스 관절염 및 골관절염의 발병기전에 연루된다. 최근에, 간접적인 증거는 IL-6과 만성 폐쇄성 폐 질환 및 제2형 당뇨병에서 인슐린 저항성 사이의 연관성을 제안한다. IL-6은 면역계에서 전-염증성 및 항염증성 효과를 모두 갖고, 이는 상기 시토킨이 아마도 질병에 대한 생리학적 반응을 조절하는데 중심 역할을 하는 것을 나타낸다. 따라서, IL-6을 표적화하는 것은 다양한 질병 영역에서 잠재적으로 치료 이익을 제공할 수 있다.
알츠하이머 (Alzheimer) 병, 자가면역 질병, 예를 들어 류마티스 관절염, 염증, 심근경색, 파제트 (Paget) 병, 골다공증, 간 섬유증, 고형 종양 (신세포 암종), 전립선 및 방광 암, 신경학적 암, 및 B-세포 악성종양 (예를 들어, 캐슬만 (Castleman) 병, 특정 림프종, 만성 림프구성 백혈병 및 다발성 골수종)을 포함한 많은 질병에서 IL-6의 생산 증가가 관찰되었다. 연구에서는 IL-6이 이들 많은 질병, 특히, 암 및 류마티스 관절염의 발병기전과 연관되는 것을 나타냈고, 따라서, IL-6을 차단하는 것은 임상에서 이로운 것으로 해석될 것이다.
<개요>
IL-6에 특이적으로 결합하고 IL-6 수용체 길항제로서 작용할 수 있는 단리된 항체 또는 그의 항원 결합 부분, 및 항체 또는 부분을 포함하는 조성물이 생산된다.
(i) 항-IL-6 항체의 중쇄 및/또는 경쇄, 그의 가변 도메인 또는 그의 항원 결합 부분, 또는 그를 코딩하는 핵산 분자; 및 (ii) 제약상 허용되는 담체를 포함하는 조성물을 제공한다. 조성물은 다른 성분, 예를 들어 치료제 또는 진단제를 추가로 포함할 수 있다.
진단 및 치료 방법을 또한 제공한다. 유사하게, 염증성 및 비-염증성 질환을 치료하기 위한 의약의 제조를 위한 항-IL-6 항체 및 그의 항원 결합 부분을 제공한다.
핵산 분자를 포함하는 벡터 및 숙주 세포, 및 핵산 분자에 의해 코딩되는 폴리펩티드를 재조합 방식으로 제조하는 방법을 제공한다.
도 1은 각각의 항-IL-6 항체 9C8, 9C8 N68T T83S 및 22B5 중쇄 및 경쇄 가변 구역에 비교하여 중쇄 및 경쇄 가변 구역의 생식계열 (germline) 아미노산 서열의 정렬을 보여준다 (미스매치 (mismatch)는 단지 9C8, 9C8 N68T T83S, 및 22B5 항체)에 대해 보여진다). CDR을 밑줄치고, 미스매치된 갭(들)은 파운드 부호 (#)로 표시된다.
도 2는 전기화학발광 면역분석 (Electrochemiluminescence Immuno-Assay)에 의해 결정된, 비히클 및 9C8 N68T T83S IgG2 항체에 대한 총 혈청 C-반응성 단백질 (CRP)을 보여준다. 각각의 점은 비히클 또는 항-IL-6 항체 9C8 N68T T83S IgG2를 0.5 mg/kg 및 5.0 mg/kg로 투여한 3마리의 사이노몰거스 원숭이로부터의 혈청 CRP의 평균값 (± SE)을 나타낸다. 혈청 CRP는 메조 스케일 디스커버리(Meso Scale Discovery; MSD)에 의해 측정하였다. LPS는 0시간 시점에서 투여되었다.
도 2는 전기화학발광 면역분석 (Electrochemiluminescence Immuno-Assay)에 의해 결정된, 비히클 및 9C8 N68T T83S IgG2 항체에 대한 총 혈청 C-반응성 단백질 (CRP)을 보여준다. 각각의 점은 비히클 또는 항-IL-6 항체 9C8 N68T T83S IgG2를 0.5 mg/kg 및 5.0 mg/kg로 투여한 3마리의 사이노몰거스 원숭이로부터의 혈청 CRP의 평균값 (± SE)을 나타낸다. 혈청 CRP는 메조 스케일 디스커버리(Meso Scale Discovery; MSD)에 의해 측정하였다. LPS는 0시간 시점에서 투여되었다.
상세한 설명
정의 및 일반적인 기술
용어 "항체"는 면역글로불린과 동의어이고, 당업계에 통상적으로 공지된 바와 같이 이해된다. 특히, 용어 항체는 임의의 특정한 항체 생산 방법에 의해 한정되지 않는다. 예를 들어, 용어 항체는 재조합 항체, 모노클로날 항체 및 폴리클로날 항체를 특히 포함한다.
기본적인 항체 구조 단위는 사량체이다. 각각의 사량체는 2개의 동일한 쌍의 폴리펩티드 사슬로 구성되고, 각각의 쌍에는 1개의 "경쇄" (약 25 kDa) 및 1개의 "중쇄" (약 50-70 kDa)가 있다. 각각의 사슬의 아미노-말단 부분은 항원 인식을 주로 담당하는 약 100개 내지 120개 이상의 아미노산의 가변 구역을 포함한다. 각각의 사슬의 카르복시-말단 부분은 효과기 기능을 주로 담당하는 불변 구역을 규정한다. 인간 경쇄는 카파 및 람다 경쇄로 분류된다. 중쇄는 뮤, 델타, 감마, 알파 또는 엡실론으로 분류되고, 항체의 이소형을 각각 IgM, IgD, IgG, IgA, 및 IgE로 규정한다. 경쇄 및 중쇄 내에서, 가변 및 불변 구역이 약 12개 이상의 아미노산의 "J" 구역에 의해 연결되고, 중쇄는 약 3개 이상의 아미노산의 "D" 구역을 또한 포함한다.
각각의 중쇄/경쇄 쌍의 가변 구역 (VH 및 VL)이 항원 결합 부위를 형성한다. 따라서, 무손상 IgG 항체는 예를 들어 2개의 결합 부위를 갖는다. 이중기능성 또는 이중특이적 항체를 제외하고는, 2개의 결합 부위는 동일하다.
중쇄 및 경쇄의 가변 구역은 3개의 초가변 구역 (상보성 결정 구역 또는 CDR로도 칭해짐)에 의해 연결된 비교적 보존된 프레임워크 구역 (FR)의 동일한 일반적인 구조를 나타낸다. 용어 "가변"은 가변 도메인의 특정 부분이 항체들 간에 서열 면에서 광범위하게 상이하고 각각의 특정 항체의 그의 특정 항원에 대한 결합 및 특이성에서 사용된다는 사실을 나타낸다. 그러나, 가변성은 항체의 가변 도메인 전반에 걸쳐 균일하게 분포되지 않고, CDR에 집중되며, 이들은 보다 고도로 보존된 FR에 의해 분리된다. 각각의 쌍의 2개의 사슬로부터의 CDR은 FR에 의해 정렬되어, 특이적 에피토프에 결합할 수 있도록 한다. N-말단에서 C-말단으로, 경쇄 및 중쇄 모두는 도메인 FR1, CDR1, FR2, CDR2, FR3, CDR3 및 FR4를 포함한다. 각각의 도메인에 대한 아미노산의 할당은 그 개시내용이 본원에 참조로 포함되는 문헌 [Kabat Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md. (1987 & 1991))], 또는 [Chothia & Lesk J. Mol. Biol. 196:901-917 (1987)]; [Chothia et al. Nature 342:878-883 (1989)]의 정의에 따른다.
본원에서 사용되는 바와 같이, 번호로 지칭되는 항체는 동일한 번호의 하이브리도마 (hybridoma)에 의해 수득된 모노클로날 항체와 동일하다. 예를 들어, 항-IL-6 모노클로날 항체 9C8은 하이브리도마 9C8, 또는 그의 서브클론으로부터 수득된 것과 동일한 항체이다.
용어 "유사체" 또는 "폴리펩티드 유사체"는 일부 참조 아미노산 서열과 실질적으로 동일하고 참조 아미노산 서열과 실질적으로 동일한 기능 또는 활성이 있는 세그먼트를 포함하는 폴리펩티드를 의미한다. 전형적으로, 폴리펩티드 유사체는 참조 서열에 대해 하나 이상의 보존적 아미노산 치환 (또는 삽입 또는 결실)을 포함한다. 유사체의 길이는 적어도 20 또는 25개의 아미노산일 수 있거나, 또는 적어도 50, 60, 70, 80, 90, 100, 150 또는 200개의 아미노산 또는 그 이상일 수 있으며, 종종 전장 폴리펩티드만큼 길 수 있다. 일부 실시태양은 참조 아미노산 서열로부터 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 또는 17개의 치환이 있는 폴리펩티드 유사체를 포함한다. 일부 예에서, 참조 아미노산 서열은 생식계열 서열이다. 항체 또는 면역글로불린 분자의 유사체는 당업자에 의해 쉽게 제조될 수 있다.
본원에서 논의되는 바와 같이, IL-6 항체 또는 그의 항원 결합 부분에 대한 아미노산 치환은 (1) 단백질 분해에 대한 감수성을 감소시키거나, (2) 산화에 대한 감수성을 감소시키거나, (3) 단백질 복합체를 형성하기 위한 결합 친화도를 변경시키거나, (4) 글리코실화 부위를 결실 또는 생성시키거나, 또는 (5) 상기 유사체의 다른 물리화학적 또는 기능적 성질을 부여하거나 변형시키지만, IL-6에 대한 특이적 결합은 여전히 유지시키는 치환이다.
유사체는 정상적으로 발생하는 펩티드 서열에 대한 다양한 치환을 포함할 수 있다. 예를 들어, 단일 또는 다중 아미노산 치환, 바람직하게는 보존적 아미노산 치환이 정상적으로 발생하는 서열에서 이루어질 수 있다. 보존적 아미노산 치환은 모 서열의 구조적 특성을 실질적으로 변화시키지 않아야 한다.
용어 항체의 "항원 결합 부분"은 항원 (예를 들어, IL-6)에 특이적으로 결합하는 능력을 보유하는 항체의 단편을 의미한다. 항체의 항원-결합 기능이 전장 항체의 단편에 의해 수행될 수 있음이 밝혀졌다. 용어 항체의 "항원 결합 부분"에 포함되는 결합 단편의 예는 다음을 포함한다: (i) VL, VH, CL 및 CH1 도메인으로 구성되는 1가 단편인 Fab 단편; (ii) 힌지 구역에서 디술피드 다리에 의해 연결된 2개의 Fab 단편을 포함하는 2가 단편인 F(ab')2 단편; (iii) VH 및 CH1 도메인으로 구성되는 Fd 단편; (iv) 항체의 단일 아암 (arm)의 VL 및 VH 도메인으로 구성된 Fv 단편; (v) VH 도메인으로 구성된 도메인 항체 (dAb) (Ward et al., (1989) Nature 341:544-546); 및 (vi) 단리된 상보성 결정 구역 (CDR). 또한, Fv 단편의 2개의 도메인인 VL 및 VH는 별개의 유전자에 의해 코딩되지만, 이들은 VL 및 VH 구역이 쌍을 이루어 1가 분자 (단일쇄 Fv (scFv)로 알려짐)를 형성하는 단일 단백질 사슬로서 이루어지도록 하는 합성 링커에 의해 재조합 방법을 사용하여 연결될 수 있다. 또한, 상기 단일쇄 항체는 용어 항체의 "항원 결합 부분" 내에 포함되는 것으로 의도된다. 다른 형태의 단일쇄 항체, 예를 들어 디아바디 (diabody)도 포함된다. 디아바디는 VH 및 VL 도메인이 단일 폴리펩티드 사슬 상에서 발현되지만, 동일한 사슬 상의 두 도메인 간에 쌍을 이루도록 하기에는 너무 짧은 링커를 사용함으로써, 도메인들이 또다른 사슬 상의 상보성 도메인과 쌍을 이루도록 강제하여 2개의 항원 결합 부위가 생성된 2가의 이중특이적 항체이다. 또한, 항체로부터의 하나 이상의 CDR은 더 큰 폴리펩티드 사슬 내로 통합될 수 있고, 이들은 서로 공유 또는 비-공유 연결될 수 있다. 하나 이상의 결합 부위를 갖는 실시태양에서, 결합 부위는 서로 동일할 수 있거나 상이할 수 있다.
또한, 항체 또는 그의 항원 결합 부분은 항체 또는 항체 부분과 하나 이상의 다른 단백질 또는 펩티드의 공유 또는 비공유 회합에 의해 형성된 더 큰 면역어드헤신 분자의 일부일 수 있다. 이같은 면역어드헤신 분자의 예로는 사량체 scFv 분자를 제조하기 위해 스트렙타비딘 코어 (core) 영역을 사용하는 것 및 2가의 비오티닐화 scFv 분자를 제조하기 위해 시스테인 잔기, 마커 펩티드 및 C-말단 폴리히스티딘 태그를 사용하는 것이 포함된다. 또다른 예로는 항체로부터의 하나 이상의 CDR이 공유 또는 비공유 방식으로 분자 내로 통합되어, 분자를 IL-6과 같은 관심있는 항원에 특이적으로 결합하는 면역어드헤신으로 만드는 경우가 포함된다. 상기 실시태양에서, CDR(들)은 더 큰 폴리펩티드 사슬의 일부로서 통합될 수 있거나, 또다른 폴리펩티드 사슬에 공유 연결될 수 있거나, 또는 비공유 방식으로 통합될 수 있다. 임의의 적합한 기술, 예를 들어 각각 파파인 또는 펩신 소화를 사용하여 항체 부분, 예를 들어 Fab 및 F(ab')2 단편이 전체 항체로부터 제조될 수 있다. 또한, 상이한 재조합 DNA 기술을 사용하여 항체, 항체 부분 및 면역어드헤신 분자를 수득할 수 있다.
용어 "키메라 항체"는 상이한 종으로부터의 항체를 포함하는, 2개 이상의 상이한 항체로부터의 구역을 포함하는 항체를 의미한다. 예를 들어, 키메라 항체의 CDR들 중 하나 이상이 인간 IL-6 항체로부터 유래될 수 있다. 한 예에서, 인간 항체로부터의 CDR이 비-인간 항체, 예를 들어 마우스 또는 래트로부터의 CDR과 조합될 수 있다. 다른 예에서, 모든 CDR이 인간 IL-6 항체로부터 유래될 수 있다. 다른 예에서, 1 초과의 인간 IL-6 항체로부터의 CDR이 키메라 항체에서 조합될 수 있다. 예를 들어, 키메라 항체가 제1 인간 IL-6 항체의 경쇄로부터의 CDR1, 제2 인간 IL-6 항체의 경쇄로부터의 CDR2 및 제3 인간 IL-6 항체의 경쇄로부터의 CDR3을 포함할 수 있고, 중쇄로부터의 CDR은 하나 이상의 다른 IL-6 항체로부터 유래될 수 있다. 추가로, 프레임워크 구역은, 하나 이상의 CDR이 그로부터 취해진 IL-6 항체 중 하나로부터 또는 하나 이상의 상이한 인간 항체로부터 유래될 수 있다. 추가로, 용어 "키메라 항체"는 인간 및 비-인간 항체가 포함하는 임의의 상기 언급된 조합을 포함하는 것으로 의도된다.
용어 "경쟁하다"는 제1 항체 또는 그의 항원 결합 부분이 결합을 위해 제2 항체 또는 그의 항원 결합 부분과 경쟁하고, 이때 제1 항체와 그의 동족 (cognate) 에피토프의 결합이 제2 항체의 부재 하의 제1 항체의 결합과 비교하여 제2 항체의 존재 하에 검출가능하게 감소된다는 것을 의미한다. 제2 항체의 그의 에피토프에 대한 결합이 제1 항체의 존재 하에 또한 검출가능하게 감소되는 다른경우가 있을 수 있지만 반드시 그럴 필요는 없다. 즉, 제2 항체가 제1 항체의 그의 각각의 에피토프에 대한 결합을 억제하지 않으면서 제1 항체가 제2 항체의 그의 에피토프에 대한 결합을 억제할 수 있다. 그러나, 각각의 항체가 동일한 정도, 더 큰 정도, 또는 더 낮은 정도 여부와 상관없이 다른 항체와 그의 동족 에피토프 또는 리간드의 결합을 검출가능하게 억제하는 경우, 이러한 항체들은 이들의 각각의 에피토프(들)의 결합에 대해 서로 "교차-경쟁"하는 것으로 언급된다. 이같은 경쟁 또는 교차-경쟁이 발생하는 메커니즘 (예를 들어, 입체 장애, 입체형태적 변화, 또는 공통 에피토프 또는 그의 일부에 대한 결합)과 상관없이, 본원에서 제공된 교시내용을 기초로, 당업자는 이같은 경쟁 및/또는 교차-경쟁 항체가 본원에 개시된 방법에 유용할 수 있다는 것을 이해할 것이다.
용어 "보존적 아미노산 치환"은 아미노산 잔기가 화학적 특성 (예를 들어, 전하 또는 소수성)이 유사한 측쇄 R기가 있는 다른 아미노산 잔기로 치환됨을 의미한다. 일반적으로, 보존적 아미노산 치환은 단백질의 기능적 특성을 실질적으로 변화시키지 않을 것이다. 2개 이상의 아미노산 서열이 보존적 치환에 의해 서로 상이한 경우, 치환의 보존적 성질을 수정하기 위해 서열 동일성 비율이 상향 조정될 수 있다. 이와 같이 조정하는 수단은 당업자에게 공지되어 있다. 유사한 화학적 특성을 갖는 측쇄를 갖는 아미노산의 기의 예는 다음을 포함한다: 1) 지방족 측쇄: 글라이신, 알라닌, 발린, 류신, 및 이소류신; 2) 지방족-히드록실 측쇄: 세린 및 트레오닌; 3) 아미드-함유 측쇄: 아스파라긴 및 글루타민; 4) 방향족 측쇄: 페닐알라닌, 타이로신, 및 트립토판; 5) 염기성 측쇄: 라이신, 아르기닌, 및 히스티딘; 6) 산성 측쇄: 아스파르트산 및 글루탐산; 및 7) 황-함유 측쇄: 시스테인 및 메티오닌. 보존적 아미노산 치환기는 예를 들어 발린-류신-이소류신, 페닐알라닌-타이로신, 라이신-아르기닌, 알라닌-발린, 글루타메이트-아스파르테이트, 및 아스파라긴-글루타민일 수 있다.
또한 보존적 교체는 본원에 참조로 포함되는 문헌 [Gonnet et al., Science 256:1443-45 (1992)]에 개시된 PAM250 로그 (log)-가능도 매트릭스에서 양성 값을 갖는 임의의 변화일 수 있다. "중간 정도의 보전적인" 교체는 PAM250 로그-가능도 매트릭스에서 음성이 아닌 값을 갖는 임의의 변화이다.
"접촉"은 항체 또는 그의 항원 결합 부분과 표적 IL-6 또는 그의 에피토프를 항체가 IL-6의 생물학적 활성에 영향을 미칠 수 있는 방식으로 접합시키는 것을 지칭한다. 상기 "접촉"은 "시험관 내에서", 예를 들어 시험관, 페트리접시 등에서 달성될 수 있다. 시험관에서, 접촉은 항체 또는 이의 항원 결합 부분 및 IL-6 또는 그의 에피토프만을 수반할 수 있거나, 또는 전체 세포를 수반할 수 있다. 또한, 세포 배양 접시에서 세포가 유지 또는 성장되고, 이러한 환경에서 항체 또는 이의 항원 결합 부분과 접촉될 수 있다. 이러한 정황에서, 더욱 복잡한 살아 있는 유기체와 함께 생체 내에서 항체를 사용하기 전에 IL-6-관련 질환에 영향을 미치는 특정 항체 또는 그의 항원 결합 부분의 능력, 즉, 항체의 IC50을 결정할 수 있다. 유기체 외부의 세포에 대해, IL-6을 항체 또는 그의 항원 결합 부분과 접촉시키기 위한 여러 방법이 존재하고, 당업자에게 공지되어 있다.
용어 "ELISA"는 효소-결합 면역흡착 분석을 의미한다. 상기 종류의 분석은 당업자에게 공지되어 있다.
용어 "에피토프"는 면역글로불린 또는 T-세포 수용체에 특이적으로 결합하거나 또는 분자와 달리 상호작용할 수 있는 임의의 단백질 결정자를 포함한다. 에피토프 결정자는 일반적으로 분자의 화학적으로 활성인 표면기, 예를 들어 아미노산 또는 탄수화물 또는 당 측쇄로 구성되고, 일반적으로 특이적인 3차원 구조적 특징, 및 특이적인 전하 특성을 갖는다. 에피토프는 "선형" 또는 "입체형태적" 에피토프일 수 있다. 선형 에피토프에서, 단백질과 상호작용 분자 (예를 들어 항체) 간의 상호작용의 모든 지점은 단백질의 1차 아미노산 서열을 따라 선형으로 발생한다. 입체형태적 에피토프에서, 상호작용 지점들이 단백질 상의 서로 떨어진 아미노산 잔기들에 걸쳐 발생한다. 일단 항원 상의 원하는 에피토프가 결정되면, 에피토프에 대한 항체가 생성될 수 있다. 이를 달성하기 위한 방법은 서로 경쟁적으로 결합하는 항체, 즉, 항원에 대한 결합을 위해 경쟁하는 항체를 발견하기 위한 교차-경쟁 연구를 수행하는 것이다. 교차-경쟁을 기초로 하여 항체를 "비닝 (binning)"하기 위한 고처리량 방법이 국제 특허 출원 공개 WO 03/48731에 기재되어 있다.
본원에서 사용되는 바와 같은 용어 "발현 제어 서열"은 그에 대해 자신이 라이게이션되는 코딩 서열의 발현 및 프로세싱을 실행시키는데 필요한 폴리뉴클레오티드 서열을 의미한다. 발현 제어 서열에는 적합한 전사 개시, 종결, 프로모터 및 인핸서 서열; 효율적인 RNA 프로세싱 신호, 예를 들어 스플라이싱 및 폴리아데닐화 신호; 세포질 mRNA를 안정화시키는 서열; 번역 효율을 향상시키는 서열 (즉, 코작 (Kozak) 컨센서스 (consensus) 서열); 단백질 안정성을 향상시키는 서열; 및 필요한 경우, 단백질 분비를 향상시키는 서열이 포함된다. 상기 제어 서열의 특성은 숙주 유기체에 따라 상이하다; 원핵생물에서, 이같은 제어 서열에는 일반적으로 프로모터, 리보좀 결합 부위, 및 전사 종결 서열이 포함되고, 진핵생물에서는, 일반적으로 상기 제어 서열에는 프로모터 및 전사 종결 서열이 포함된다. 용어 "제어 서열"은 최소한, 그의 존재가 발현 및 프로세싱에 필수적인 모든 성분을 포함하도록 의도되고, 그의 존재가 유리한 추가적인 성분, 예를 들어, 리더 서열 및 융합 파트너 서열을 또한 포함할 수 있다.
용어 "생식계열"은 생식 세포를 통해 어버이로부터 자손으로 계대되는 항체 유전자 및 유전자 세그먼트의 뉴클레오티드 서열을 나타낸다. 상기 생식계열 서열은 B 세포 성숙 과정 동안 재조합 및 과다돌연변이 사건에 의해 변경된 성숙 B 세포 내의 항체를 코딩하는 뉴클레오티드 서열과 구별된다.
용어 "인간 항체"는 가변 도메인 및 불변 도메인 서열이 인간 서열인 임의의 항체를 의미한다. 이 용어는, 예를 들어, 가능한 면역원성의 감소, 친화도 증가, 바람직하지 않은 폴딩 (folding)을 야기할 수 있는 시스테인 잔기의 제거 등을 위해 변경된 것들을 포함하여, 인간 유전자로부터 유래된 서열을 갖는 항체를 포함한다. 이 용어는 또한 비-인간 세포에서 재조합 방식으로 생산된 항체를 포함하고, 이는 인간 세포에서 전형적이지 않은 글리코실화를 부여할 수 있다. 이들 항체는 다양한 방식으로 제조될 수 있다.
용어 "인간화 항체"는 비-인간 종의 항체 서열의 특징적인 아미노산 잔기가 인간 항체의 상응하는 위치에서 발견되는 잔기로 교체된 비-인간 기원의 항체를 지칭한다. 상기 "인간화" 과정은 생성된 항체의 인간에서의 면역원성을 감소시킬 수 있다. 당업계에 공지된 임의의 적합한 기술을 사용하여 비-인간 기원의 항체가 인간화될 수 있다. CH1, CH2, CH3, 힌지 도메인, 및/또는 프레임워크 도메인을 상응하는 인간 서열로 치환하는 재조합 DNA 기술에 의해 관심있는 항체가 조작될 수 있다. 용어 "인간화 항체"는 키메라 인간 항체 및 CDR-그라프팅된 항체를 그의 의미 내에 추가로 포함한다. 키메라 인간 항체는 비-인간 종의 항체의 VH 및 VL, 및 인간 항체의 CH 및 CL 도메인을 포함한다. CDR-이식 항체는 인간 항체의 VH 및 VL의 CDR을 각각 인간 이외의 동물의 항체의 VH 및 VL의 것으로 교체하는 것으로부터 발생한다.
본원에서 사용되는 바와 같은 용어 "단리된 폴리뉴클레오티드"는 "단리된 폴리뉴클레오티드"가 그의 기원에 의해 (1) "단리된 폴리뉴클레오티드"가 천연에서 그와 함께 발견되는 폴리뉴클레오티드의 전부 또는 일부분과 회합되지 않거나, (2) 천연에서는 그에 대해 연결되지 않는 폴리뉴클레오티드에 작동가능하게 연결되거나, 또는 (3) 더 큰 서열의 일부로서 천연에서 발생하지 않는, 게놈, cDNA, 또는 합성 기원의 폴리뉴클레오티드 또는 이들의 조합을 의미한다.
용어 "단리된 단백질", "단리된 폴리펩티드" 또는 "단리된 항체"는 그의 기원 또는 유도 공급원에 의해, (1) 그의 천연 상태에서 수반되는 천연적으로 회합되는 성분들과 회합되지 않거나, (2) 동일한 종으로부터의 다른 단백질이 없거나, (3) 상이한 종으로부터의 세포에 의해 발현되거나, 또는 (4) 천연에서 발생하지 않는 단백질, 폴리펩티드 또는 항체이다. 따라서, 예를 들어, 화학적으로 합성되거나, 자신이 그로부터 천연적으로 유래되는 세포와 상이한 세포 시스템에서 합성되는 폴리펩티드는 그의 천연적으로 회합되는 성분들로부터 "단리될" 것이다. 임의의 적합한 단백질 정제 기술을 사용하여, 단리에 의해 천연적으로 회합되는 성분들이 단백질에 실질적으로 없게 만들 수도 있다.
단리된 항체의 예는 IL-6을 사용하여 친화도 정제된 IL-6 항체, 및 시험관 내에서 세포주에 의해 합성된 IL-6 항체를 포함한다.
용어 "KD"는 특정 항체-항원 상호작용의 결합 친화도 평형 상수를 나타낸다. KD가 ≤ 1 mM, 바람직하게는 ≤ 100 nM, 가장 바람직하게는 ≤ 10 nM인 경우에 항체가 항원에 특이적으로 결합하는 것으로 언급된다. 예를 들어 실시예 7에서 논의되는 BIACORE™ 시스템을 사용하여, 표면 플라즈몬 공명에 의해 KD 결합 친화도 상수를 측정할 수 있다.
용어 "koff"는 특정 항체-항원 상호작용의 해리 속도 상수를 나타낸다. koff 해리 속도 상수는 예를 들어 실시예 7에서 논의되는 BIACORE™ 시스템을 사용하여 표면 플라즈몬 공명에 의해 측정할 수 있다.
본원에서 사용되는 바와 같은 용어 "천연 발생 뉴클레오티드"는 데옥시리보뉴클레오티드 및 리보뉴클레오티드를 포함한다. 본원에서 사용되는 바와 같은 용어 "변형된 뉴클레오티드"는 예를 들어 변형된 또는 치환된 당기를 갖는 뉴클레오티드를 포함한다. 본원에서 언급되는 용어 "올리고뉴클레오티드 연결"은 올리고뉴클레오티드 연결, 예를 들어 포스포로티오에이트, 포스포로디티오에이트, 포스포로셀레노에이트, 포스포로디셀레노에이트, 포스포로아닐로티오에이트, 포스포르아닐라데이트, 포스포로아미데이트를 포함한다. 올리고뉴클레오티드는 필요한 경우, 검출을 위한 표지를 포함할 수 있다.
"작동가능하게 연결된" 서열은 관심있는 유전자와 인접한 발현 제어 서열 및 트랜스로 (in trans) 또는 거리를 두고 작용하여 관심있는 유전자를 제어하는 발현 제어 서열 모두를 포함한다.
핵산 서열의 측면에서의 용어 "서열 동일성 비율"은 최대로 대응하도록 정렬될 때 동일한 2개의 서열 내의 잔기를 의미한다. 서열 동일성 비교의 길이는 적어도 약 9개의 뉴클레오티드, 일반적으로는 적어도 약 18개의 뉴클레오티드, 보다 일반적으로는 적어도 약 24개의 뉴클레오티드, 전형적으로는 적어도 약 28개의 뉴클레오티드, 보다 전형적으로는 적어도 약 32개의 뉴클레오티드, 및 적어도 약 36개, 48개 또는 그 이상의 뉴클레오티드에 걸칠 수 있다. 뉴클레오티드 서열 동일성을 측정하는데 사용될 수 있는 많은 상이한 알고리즘이 당업계에 공지되어 있다. 예를 들어, 폴리뉴클레오티드 서열은 지네틱스 컴퓨터 그룹 (Genetics Computer Group (GCG), 미국 위스콘신주 메디슨)의 Wisconsin Package 버전 10.0 내의 프로그램인 FASTA, Gap 또는 Bestfit를 사용하여 비교할 수 있다. 예를 들어 FASTA2 및 FASTA3 프로그램을 포함하는 FASTA는 질의 서열과 검색 서열 간의 최상으로 중첩되는 영역들의 정렬 및 서열 동일성 비율을 제공한다 (본원에 참조로 포함되는 문헌 ([Pearson, Methods Enzymol. 183:63-98 (1990)]; [Pearson, Methods Mol. Biol. 132:185-219 (2000)]; [Pearson, Methods Enzymol. 266:227-258 (1996)]; [Pearson, J. Mol. Biol. 276:71-84 (1998)]). 달리 특정되지 않으면, 특정 프로그램 또는 알고리즘에 대한 디폴트 파라미터가 일반적으로 사용된다. 예를 들어, FASTA를 그의 디폴트 파라미터 (단어 크기 6 및 채점 매트릭스에 대한 NOPAM 인자)와 함께 사용하여 또는 Gap을 GCG 버전 6.1에서 제공된 그의 디폴트 파라미터와 함께 사용하여 핵산 서열들 간의 서열 동일성 비율을 결정할 수 있다.
뉴클레오티드 서열에 대한 언급은 달리 특정되지 않는 한 그의 상보체를 포함한다. 따라서, 특정 서열을 갖는 핵산에 대한 언급은 그의 상보성 서열을 갖는 상보성 가닥을 포함하는 것으로 이해되어야 한다.
아미노산 서열의 측면에서의 용어 "서열 동일성 비율"은 최대로 대응하도록 정렬될 때 동일한 2개의 서열 내의 잔기를 의미한다. 서열 동일성 비교의 길이는 적어도 약 5개의 아미노산, 일반적으로 적어도 약 20개의 아미노산, 보다 일반적으로는 적어도 약 30개의 아미노산, 전형적으로 적어도 약 50개의 아미노산, 보다 전형적으로는 적어도 약 100개의 아미노산, 훨씬 더 전형적으로는 약 150개, 200개 또는 그 이상의 아미노산에 걸칠 수 있다. 아미노산 서열 동일성을 측정하는데 사용될 수 있는 다수의 상이한 알고리즘이 당업계에 공지되어 있다. 예를 들어, 아미노산 서열은 지네틱스 컴퓨터 그룹 (GCG)의 Wisconsin Package 버전 10.0 내의 프로그램인 FASTA, Gap 또는 Bestfit를 사용하여 비교할 수 있다.
폴리펩티드의 서열 동일성은 일반적으로 서열 분석 소프트웨어를 사용하여 측정된다. 단백질 분석 소프트웨어는 상이한 치환, 결실 및 기타 변형 (보존적 아미노산 치환 포함)에 할당된 유사성의 척도를 사용하여 서열들을 매치시킨다. 예를 들어, GCG는 밀접하게 관련된 폴리펩티드, 예를 들어 상이한 종의 유기체로부터의 상동성 폴리펩티드들 간의 서열 상동성 또는 서열 동일성, 또는 야생형 단백질과 그의 유사체 간의 서열 상동성 또는 서열 동일성을 결정하기 위해 프로그램에 의해 특정된 디폴트 파라미터와 함께 사용될 수 있는 "Gap" 및 "Bestfit"와 같은 프로그램을 포함한다. 예를 들어, GCG 버전 6.1 (유니버시티 오브 위스콘신 (University of Wisconsin, 미국 위스콘신주)) 참조. 디폴트 파라미터 또는 권장 파라미터를 사용하여 FASTA를 사용하여 폴리펩티드 서열을 또한 비교할 수 있다 (GCG 버전 6.1 참조). FASTA (예를 들어, FASTA2 및 FASTA3)는 질의 서열과 검색 서열 간의 최상으로 중첩되는 영역들의 정렬 및 서열 동일성 비율을 제공한다 ([Pearson, Methods Enzymol. 183:63-98 (1990)]; [Pearson, Methods Mol. Biol. 132:185-219 (2000)]). 서열을 상이한 유기체로부터의 다수의 서열을 함유하는 데이터베이스와 비교할 때, 다른 알고리즘은 컴퓨터 프로그램 BLAST, 특히 blastp 또는 tblastn이고, 이때 프로그램에서 공급된 디폴트 파라미터가 사용된다. 예를 들어, 문헌 [Altschul et al., J. Mol. Biol. 215:403-410 (1990)]; [Altschul et al., Nucleic Acids Res. 25:3389-402 (1997)]을 참조한다.
본원에서 사용되는 바와 같은 용어 "재조합 숙주 세포" (또는 간단히 "숙주 세포")는 재조합 발현 벡터가 그 내부에 도입된 세포를 의미한다. "재조합 숙주 세포" 및 "숙주 세포"는 특정 대상 세포를 의미할 뿐만 아니라, 상기 세포의 자손체를 또한 의미하는 것으로 이해되어야 한다. 돌연변이 또는 환경적 영향으로 인해 후속 세대에서 특정 변형이 일어날 수 있기 때문에, 이같은 자손체는 실제로는 어버이 세포와 동일하지 않을 수 있지만, 여전히 본원에서 사용되는 용어 "숙주 세포"의 범주 내에 포함된다.
샘플의 적어도 약 60% 내지 75%가 단일 종의 폴리펩티드를 나타내는 경우 단백질 또는 폴리펩티드는 "실질적으로 순수"하거나, "실질적으로 균질"하거나, 또는 "실질적으로 정제"된 것이다. 폴리펩티드 또는 단백질은 단량체 또는 다량체일 수 있다. 실질적으로 순수한 폴리펩티드 또는 단백질은 전형적으로 단백질 샘플의 약 50%, 60%, 70%, 80% 또는 90% w/w, 보다 일반적으로는 약 95%를 이룰 것이고, 바람직하게는 99%를 초과하여 순수할 수 있다. 임의의 적합한 수단에 의해, 예를 들어 단백질 샘플의 폴리아크릴아미드 겔 전기영동, 이어서 염료로 겔의 염색시에 단일 폴리펩티드 밴드를 가시화함으로써 단백질 순도 또는 균질성이 지시될 수 있다. 당업자가 이해할 바와 같이, HPLC 또는 정제를 위한 다른 수단을 사용함으로써 더 높은 분해능이 제공될 수 있다.
핵산 또는 그의 단편을 나타낼 때의 용어 "실질적인 유사성" 또는 "실질적인 서열 유사성"은 적절한 뉴클레오티드 삽입 또는 결실과 함께 다른 핵산 (또는 그의 상보성 가닥)과 최적으로 정렬될 때, 상기 논의된 바와 같이, 임의의 공지된 서열 동일성 알고리즘, 예를 들어 FASTA, BLAST 또는 Gap에 의해 측정시에 뉴클레오티드 염기의 적어도 약 85%, 적어도 약 90%, 및 적어도 약 95%, 96%, 97%, 98% 또는 99%의 뉴클레오티드 서열 동일성이 있다는 것을 의미한다.
폴리펩티드에 적용되는 경우, 용어 "실질적인 동일성" 또는 "실질적인 유사성"은 예를 들어 프로그램과 함께 공급된 디폴트 갭 가중치를 사용하여 프로그램 GAP 또는 BESTFIT에 의해 최적으로 정렬되었을 때, 2개의 아미노산 서열이 적어도 70%, 75% 또는 80%의 서열 동일성, 바람직하게는 적어도 90% 또는 95%의 서열 동일성, 보다 바람직하게는 적어도 97%, 98% 또는 99%의 서열 동일성을 공유한다는 것을 의미한다. 특정 실시태양에서, 동일하지 않은 잔기 위치들은 보존적 아미노산 치환에 의해 상이하다.
용어 "표면 플라즈몬 공명"은 예를 들어 BIACORE™ 시스템 (파마시아 바이오센서 아베 (Pharmacia Biosensor AB, 스웨덴 웁살라 및 미국 뉴저지주 프스카타웨이))을 사용하여 바이오센서 매트릭스 내의 단백질 농도 변경을 검출함으로써 생체특이적 상호작용을 실시간으로 분석하도록 하는 광학 현상을 의미한다. 추가의 설명에 대해서는, 문헌 [Jonsson U. et al., Ann. Biol. Clin. 51:19-26 (1993)]; [Jonsson U. et al., Biotechniques 11:620-627 (1991)]; [Jonsson B. et al., J. Mol. Recognit. 8:125-131 (1995)]; 및 [Johnsson B. et al., Anal. Biochem. 198:268-277 (1991)]을 참조한다.
"치료 유효량"은 치료되는 질환의 증상 중 하나 이상을 어느 정도 완화시킬, 투여되는 치료제의 양을 지칭한다. 류머티스성 관절염의 치료와 관련하여, 치료 유효량은 하기의 효과들 중 하나 이상을 갖는 양을 지칭한다: 관절의 구조적 손상을 감소시킴; 관절 영역 내의 체액 축적을 억제함 (즉, 어느 정도 느리게 하고, 바람직하게는 정지시킴); 및 류머티스성 관절염과 관련된 하나 이상의 증상을 어느 정도 완화시킴 (또는, 바람직하게는 제거함).
"치료하다", "치료하는" 및 "치료"는 생물학적 질환 및/또는 이의 부수적인 증상을 경감시키거나 폐지하는 방법을 지칭한다.
특정 유전자와 관련하여 용어 "이용하다"는 항체 내의 특정 영역의 아미노산 서열이 B-세포 성숙 동안 유전자로부터 궁극적으로 유래되었음을 의미한다. 예를 들어, "인간 VH-3 패밀리 유전자를 이용하는 중쇄 가변 구역 아미노산 서열"이라는 문구는 항체의 VH 영역이 B-세포 성숙 동안 유전자 세그먼트의 VH-3 패밀리로부터 유래된 상황을 지칭한다. 인간 B-세포에서, 그와 함께 항체를 생성하기 위해서 30가지를 초과하는 별개의 기능성 중쇄 가변 유전자들이 존재한다. 따라서, 특정 중쇄 가변 유전자의 사용은 항원에 대한 결합 및 기능적 활성의 조합된 특성과 관련하여 항체-항원 상호작용의 바람직한 결합 모티프를 가리킨다. 이해되는 바와 같이, 유전자 이용 분석은 항체 구조의 한정된 개관만을 제공한다. 인간 B-세포는 확률적으로 V-D-J 중쇄 또는 V-J 카파 경쇄 전사체를 생성하기 때문에, 다수의 2차 과정이 발생하고, 여기에는 체세포 과다돌연변이, 부가, 및 CDR3 확장이 비제한적으로 포함된다. 예를 들어, 문헌 [Mendez et al. Nature Genetics 15:146-156 (1997)] 참조.
본원에서 사용되는 바와 같은 용어 "벡터"는 자신이 그에 대해 연결된 다른 핵산을 전달할 수 있는 핵산 분자를 의미한다. 몇몇 경우에, 벡터는 추가적인 DNA 세그먼트가 그 내부로 라이게이션될 수 있는 플라스미드, 즉, DNA의 원형 이중가닥 조각이다. 한 실시태양에서, 벡터는 바이러스 벡터이고, 이때 추가적인 DNA 세그먼트는 바이러스 게놈 내로 라이게이션될 수 있다. 다른 경우에, 벡터는 자신이 그 내부로 도입되는 숙주 세포 내에서 자가 복제할 수 있다 (예를 들어, 세균 복제 기점이 있는 세균 벡터, 및 에피좀 포유동물 벡터). 또다른 실시태양에서, 벡터 (예를 들어, 비-에피좀 포유동물 벡터)는 숙주 세포 내로의 도입 시 숙주 세포의 게놈 내로 통합될 수 있고, 이에 의해 숙주 게놈과 함께 복제된다. 또한, 특정 벡터는 자신이 작동가능하게 연결된 유전자의 발현을 지시할 수 있다. 상기 벡터는 "재조합 발현 벡터" (또는 간단히 "발현 벡터")로 본원에서 지칭된다.
용어 "표지" 또는 "표지된"은 항체 내의 다른 분자의 혼입을 의미한다. 예를 들어, 표지는 검출가능한 마커, 예를 들어, 방사성 표지된 아미노산의 혼입 또는 마킹(marking)된 아비딘 (예를 들어, 광학 또는 비색 방법에 의해 검출될 수 있는 형광 마커 또는 효소 활성을 함유하는 스트렙타비딘)에 의해 검출될 수 있는 비오티닐 모이어티의 폴리펩티드에 대한 부착이다. 또다른 실시태양에서, 표지 또는 마커는 치료제, 예를 들어, 약물 접합체 또는 독소일 수 있다. 폴리펩티드 및 당단백질을 표지하는 다양한 방법이 당업계에 공지되어 있고, 사용될 수 있다. 폴리펩티드용 표지의 예는 다음을 포함하고, 이로 제한되지 않는다: 방사성 동위원소 또는 방사성 핵종 (예를 들어, 3H, 14C, 15N, 35S, 90Y, 99Tc, 111In, 125I, 131I), 형광 표지 (예를 들어, FITC, 로다민, 란탄계열 인광체), 효소 표지 (예를 들어, 양고추냉이 퍼옥시다제, β-갈락토시다제, 루시퍼라제, 알칼리성 포스파타제), 화학발광 마커, 비오티닐기, 2차 리포터에 의해 인식되는 미리 정해진 폴리펩티드 에피토프 (예를 들어, 류신 지퍼 쌍 서열, 2차 항체에 대한 결합 부위, 금속 결합 도메인, 에피토프 태그), 자성 물질, 예를 들어 가돌리늄 킬레이트, 독소, 예를 들어 백일해 독소, 탁솔, 시토칼라신 B, 그라미시딘 D, 브롬화에티듐, 에메틴, 미토마이신, 에토포시드, 테노포시드, 빈크리스틴, 빈블라스틴, 콜히친, 독소루비신, 다우노루비신, 디히드록시 안트라신 디온, 미톡산트론, 미트라마이신, 악티노마이신 D, 1-데히드로테스토스테론, 글루코코르티코이드, 프로카인, 테트라카인, 리도카인, 프로프라놀롤 및 푸로마이신, 및 이의 유사체 또는 상동체. 일부 실시태양에서, 잠재적인 입체 장애를 감소시키기 위해, 다양한 길이의 스페이서 아암에 의해 표지가 부착된다.
치료 목적의 사용 방법
또한, 본 발명은 그를 필요로 하는 환자에게 IL-6 항체를 투여함으로써 IL-6 활성을 억제하는 방법을 제공한다. 본원에 설명된 임의의 항체 또는 그의 항원 결합 부분이 치료 목적으로 사용될 수 있다. 바람직한 실시태양에서, IL-6 항체는 인간, 키메라 또는 인간화 항체이다. 다른 바람직한 실시태양에서, IL-6은 인간 IL-6이고, 환자는 인간 환자이다. 별법으로, 환자는 IL-6 항체가 교차-반응하는 IL-6을 발현하는 포유동물일 수 있다. 항체는 IL-6을 발현하는 비-인간 포유동물에게, 예를 들어 인간 질환의 동물 모델에게 투여될 수 있다. 상기 동물 모델은 본 발명의 항체의 치료 효능의 증명을 위해 사용될 수 있다.
비정상적으로 높은 수준의 IL-6을 발현하는 환자에게 IL-6 항체 또는 그의 항체 부분이 투여될 수 있다. 항체는 1회 투여될 수 있거나, 다수회 투여된다. 항체는 1일 3회 내지 6개월마다 1회 또는 이보다 긴 간격으로 투여될 수 있다. 1일 3회, 1일 2회, 1일 1회, 2일마다 1회, 3일마다 1회, 1주일마다 1회, 2주일마다 1회, 1개월마다 1회, 2개월마다 1회, 3개월마다 1회 및 6개월마다 1회와 같은 스케쥴로 투여될 수 있다. 또한, 미니펌프를 통해 지속적으로 항체가 투여될 수 있다. 점막, 구강, 비내, 흡입, 정맥내, 피하, 근내, 비경구 또는 종양내 경로를 통해 항체가 투여될 수 있다. 항체는 1회, 2회 이상, 또는 적어도 병태가 치료, 완화 또는 치유될 때까지의 기간 동안 투여될 수 있다. 일반적으로 병태가 존재하는 한 계속 항체가 투여될 것이다. 일반적으로 항체는 상기 설명된 바와 같이 제약 조성물의 일부로서 투여될 것이다. 일반적으로 항체의 투여량은 0.1 내지 100 ㎎/㎏, 0.5 내지 50 ㎎/㎏, 1 내지 20 ㎎/㎏, 또는 1 내지 10 ㎎/㎏의 범위일 것이다. 임의의 적합한 방법에 의해 항체의 혈청 농도를 측정할 수 있다.
또한, 비정상적인 세포 침윤의 치료에 효과적인, 치료 유효량의 본원에 설명된 바와 같은 IL-6 항체 또는 그의 항원 결합 부분을 포유동물에게 투여하는 것을 포함하는, 인간을 포함하는 포유동물에서 비정상적인 세포 침윤을 치료하는 방법이 제공된다.
IL-6 항체 또는 그의 항원 결합 부분은 류마티스 관절염을 치료하기 위해 사용될 수 있다. 이들은 또한 IL-6이 연루되는 다른 질병을 치료하기 위해 사용될 수 있다. IL-6 항체 또는 그의 항원 결합 부분을 사용하여 치료될 수 있는 다른 질병의 예는 골관절염, 특히 골관절염과 연관된 통증, 캐슬만 병, 연소성 특발성 관절염, 성인 발병형 스틸 (Still) 병, 골다공증, 패혈증, 다발성 골수종, 신세포 암종, 및 크론 (Crohn) 병을 포함한다.
항체 또는 그의 항원 결합 부분으로 치료될 수 있는 질병의 일부를 아래에서 논의한다.
류마티스 관절염 (RA)은 염증이 생긴 관절을 생성시키는 만성 자가면역 및 염증성 질병으로 여겨지고, 이는 궁극적으로 붓고, 통증성으로 되고, 관절의 연골, 뼈 및 인대의 파괴를 경험한다. RA의 결과는 관절의 변형, 불안정성 및 경직, 및 관절 내의 흉터형성이다. 관절은 매우 가변적인 속도로 악화한다. 유전적 소인을 포함한 많은 인자가 질병의 패턴에 영향을 미칠 수 있다. 류마티스 관절염이 있는 사람들은 가벼운 과정, 질병이 없는 장기간의 완화 기간이 있는 때때로 급격한 재발 (flare-up), 또는 꾸준하게 진행성인 질병이 있을 수 있고, 이는 느리거나 빠를 수 있다. 류마티스 관절염은 급작스럽게 시작할 수 있고, 여기서 많은 관절이 동시에 염증이 생긴다. 보다 종종, 은근하게 시작하여 상이한 관절에 점진적으로 침범한다. 대체로, 염증은 대칭적이고, 여기서 신체의 양 측면 상의 관절이 영향을 받는다. 일반적으로, 손가락, 발가락, 손, 발, 손목, 팔꿈치 및 발목 내의 작은 관절이 먼저 염증이 생기고, 이어서 무릎 및 고관절에 염증이 생긴다.
류마티스 관절염 통증은 대개 신체 통각반응성 관절 통증이다. 부은 손목은 신경을 죄여, 손목 터널 증후군으로 인한 무감각 또는 따끔거림을 일으킬 수 있다. 낭종이 이환된 무릎 뒤쪽에 발달할 수 있고, 파열하여 하지에 통증 및 부기를 일으킬 수 있다.
골관절염은 관절 연골의 상실 및 뼈의 비대를 특징으로 한다. 골관절염의 발병은 대체로 점진적이고, 여기서 통증은 일반적인 초기 증상이다. 골관절염이 진행함에 따라, 관절 운동이 감소하고, 압통 및 삐걱거리는 감각이 생길 수 있다. 골관절염은 일반적으로 손, 발, 척추, 및 체중을 지지하는 큰 관절, 예를 들어 고관절 및 무릎에 침범한다. 골관절염의 진단은 대개 증상에 기초하거나, 관절 공간 협소화, 연골하 뼈의 밀도 증가, 관절의 주변부에서 골돌기체의 형성, 및 연골하 골수에서 가성낭종의 형성를 보여줄 수 있는 X-선에 의한다. 골관절염을 흉내낼 수 있는 다른 병태를 배제하기 위해 혈액 시험을 수행한다. 또한, 골관절염을 진단하는데 있어서, 관절천자를 수행할 수 있고, 그에 의해 멸균 바늘을 사용하여 관절액을 제거한다. 관절액 분석은 통풍, 감염 및 관절염의 다른 원인을 배제하는데 유용하다. 골관절염은 퇴행성 관절 질병, 퇴행성 관절염, 또는 골관절염으로도 알려져 있다.
라이터 (Reiter) 증후군 (반응성 관절염)은 종종 눈 결막 및 점막, 예를 들어 입 및 비뇨생식관의 점막의 염증, 및 독특한 발진을 동반하는 관절 및 관절에서 힘줄 부착의 염증이다. 관절 염증이 장관 또는 생식관에서 기원하는 감염에 대한 반응인 것으로 보이기 때문에, 라이터 증후군은 또한 반응성 관절염으로 불린다. 이 증후군은 20에서 40세의 남성에서 가장 흔하다. 2가지 형태의 라이터 증후군이 존재한다: 하나는 성 매개 질병, 예를 들어 클라미디아 감염에서 발생하고, 다른 것은 대체로 시겔라증 또는 살모넬라증과 같은 장 감염 후에 발생한다. (이들 감염이 있는 사람의 대부분은 라이터 증후군을 발병하지 않는다.) 이들 감염에 노출 후에 라이터 증후군을 발병한 사람은 부분적으로 강직성 척추염이 있는 사람에서 발견되는 것과 동일한 유전자에 관련된, 상기 종류의 반응에 대한 유전적 소인을 갖는 것으로 보인다.
감염성 관절염은 윤활막 또는 관절주위 조직의 세균, 진균, 또는 바이러스 감염으로 인한 관절 내의 염증이다. 감염성 관절염에 대한 위험 인자는 고령 (즉, 60세 초과); 알콜중독; 빈혈; 관절천자 또는 수술; 만성 의학적 병 (예를 들어, 폐 또는 간 질병); 당뇨병; 혈우병; 면역결핍증, 예를 들어 HIV; 면역억제 요법, 예를 들어 코르티코스테로이드; IV 약물 사용; 악성종양; 인공보철 관절 이식물; 신부전; 류마티스 관절염; 겸상적혈구 질병; 피부 감염; 및 전신 홍반성 루푸스를 포함한다. 류마티스 관절염의 환자는 세균성 관절염에 대한 위험이 특히 증가한다. 관절 감염은 관절 통증 및 부기의 돌연 발생 (예를 들어, 수시간 내지 수일 내에)이 있는 급성, 또는 보다 경증 증상의 느린 발병이 있는 만성일 수 있다. 급성 세균성 관절염은 중정도 내지 중증 관절 통증, 열감, 압통, 및 제한된 운동이 일반적으로 동반된다. 만성 세균성 관절염은 점진적인 부기, 가벼운 열감, 관절 영역의 발적이 최소이거나 없음, 및 경증일 수 있는 쑤시는 통증이 일반적으로 동반된다.
건선성 관절염은 소수의 건선 환자에서 및 더 많이 일부 후천성 면역 결핍 증후군 (AIDS) 환자에서 발생하는, 관절에 침범하는 염증성 관절염이다. 건선성 관절염은 경증일 수 있거나, 류마티스 관절염에서 발견되는 관절 변화와 닮은 중증 관절 변형을 일으킬 수 있다. 건선성 관절염이 침범할 수 있는 관절은 손가락 및 발가락의 원위 지간 (DIP) 관절, 및 일반적으로 큰 및 작은 관절, 예를 들어 천장관절 (sacroiliac) 및 척추의 비대칭적 관여를 포함한다. 피부 또는 손발톱의 건선은 관절 관여에 앞서거나 뒤이을 수 있다. 건선성 관절염의 시간 과정은 피부 악화 및 완화와 동시에 일어날 수 있거나 동시에 일어나지 않을 수 있는 관절염 악화 및 완화를 특징으로 하고, 만성 관절염으로의 진행이 일어날 수 있다. 진단은 건선의 진단, 건선의 가족력, DIP 관절 관여를 보여주는 X-선 판독, 비대칭적 큰 관절 관여, 류마티스 관절염을 배제하기 위해 류마티스 인자에 대한 음성 혈액 시험, 및 일부 환자에서 특히 척추가 관여될 때 HLA-B27 항원의 존재를 포함한다.
다발성 관절염은 5개 이상의 관절을 수반한 임의의 종류의 관절염이다. 2, 3 또는 4개의 관절의 관절염은 빈발성 관절염 또는 소수관절염으로 불린다. 다발성 관절염은 가장 종종 자가면역 질환, 예를 들어 류마티스 관절염, 건선성 관절염 또는 홍반성 루푸스에 의해 유발되지만, 감염에 의해 또한 유발될 수 있다. 다발성 관절염은 임의의 연령에 경험할 수 있고, 성별 특이적이지 않다.
연소성 관절염은 16세 이전에 시작하는 관절염이다. 몇몇 상이한 종류의 연소성 관절염이 존재한다. 가장 일반적인 종류는 연소성 특발성 관절염으로도 알려져 있는 연소성 류마티스 관절염 (JRA)이다. JRA는 전신 발병 JRA, 소수관절 JRA (5개 미만의 관절 수반), 및 다관절성 JRA (5개 이상의 관절에 침범함)를 포함한다. JRA의 진단은 증상을 고려하고, x-선 사진을 취하고, 혈액 분석을 수행하는 것을 포함한다. JRA를 진단하기 위해 의사가 이용할 수 있는 특이적인 시험은 완전 혈액 계수, 감염에 대한 혈액 배양, 골수 검사, 적혈구 침강 속도의 검사, 류마티스 인자 항체 결정, 항행 항체 결정, 및 뼈 스캔 (scan)을 포함한다.
연소성 류마티스 관절염은 류마티스 관절염에 유사하지만 16세 이전에 시작하는 관절의 지속적인 또는 재발하는 염증이고, 관절 또는 결합 조직의 염증을 특징으로 한다. 몇몇 종류의 연소성 류마티스 관절염이 존재하고, 이는 질병의 첫 번째 달 동안 발병하는 증상 및 침범되는 관절의 수에 의해 결정된다. 이들 종류는 소수관절 연소성 류마티스 관절염, 다발성 관절염, 및 전신성 질병 (스틸 병)을 포함한다. 소수관절 연소성 류마티스 관절염에서, 4개 이하의 관절, 대체로 다리의 관절이 침범된다. 다발성 관절염에서, 5개 이상의 (때때로 20 내지 40 정도로 많은) 관절이 침범된다. 전신성 질병 (스틸 병)에서, 임의의 수의 관절이 관여될 수 있다.
연소성 반응성 관절염은 반응성 관절염에 유사하지만 16세 이전에 시작하는 관절의 지속적인 또는 재발하는 염증이다.
연소성 건선성 관절염은 환자에서 16세 이전에 시작하는 건선성 관절염이고, 만성 관절염 및 건선; 또는 만성 관절염 및 다음 중 적어도 2개: 손발가락염, 손발톱 이상 (예를 들어, 소와 손발톱 (pitting) 또는 손발톱박리증), 및 적어도 1명의 근친에서 건선의 가족력의 존재를 특징으로 한다. 건선성 관절염의 성인에서와 같이, 관절염이 피부 병태에 앞설 수 있다. 연소성 건선성 관절염의 발생에서 우세한 패턴은 종종 손발가락염이 있는 작은 및 큰 관절의 비대칭적 빈발성 관절염이다.
한 측면에서, IL-6 매개된 질환은 섬유증을 특징으로 한다. 용어 "섬유증"은 본원에서 사용되는 바와 같이 조직 손상에 반응하여 섬유성 물질 (예를 들어, 세포외 기질)의 과도한 침착 및 대사를 특징으로 하는 병리 상태를 나타낸다. 많은 경우에, 섬유증은 섬유모세포 또는 별세포 활성화 및 증식과 콜라겐 축적을 일으키는 만성 또는 과도한 조직 상해로 인해 빗나간 정상 수복 과정 (즉, 상처 치유)을 나타낸다. 섬유증 병태는 혈관 질병, 예를 들어 심장병, 뇌 질병 및 말초 혈관 질병, 및 모든 주요 조직 및 장기 시스템, 예를 들어 눈, 피부, 신장, 폐, 장 및 간과 연관된 섬유증식 질환을 포함한다 ([Wynn, Nature Reviews 4:583-594 (2004)]; [Bataller, R and Brenner, D., J. Clin. Invest. 115:209-218 (2005)]). 다른 원인은 화학치료 약물, 방사선-유발 섬유증, 및 손상 및 화상을 포함한다. 섬유증 병태는 광범위한 군의 병리학을 포함하지만, 대부분의 이들 병태에 대해, 섬유성 조직 축적을 일으키는 일반적 기전들은 공통으로 많은 요소를 갖는 것으로 생각된다. 종종, 병태는 염증성 세포의 유입에 반응하여 개시되고, 침윤성 세포 (예를 들어, 대식세포, T 세포)와 조직 내의 거주 세포 (예를 들어, 별세포, 근섬유모세포. 쿠퍼 (Kupffer) 세포) 사이의 후속적인 시토킨 신호전달 경로에 의해 영구화된다. 또한, 혈관주위세포는 피부경화증의 발병에 관여하는 핵심 섬유생성 세포 종류이고, PDGF 수용체 타이로신 키나제 억제제 (RTKI)는 상기 진행성 질병의 환자에서 혈관주위세포의 증식을 느리게 하고 피부 병변을 억제하는 것으로 나타났다. 신장에서, 백혈구 침윤은 만성 신장 질병에서 요세관간질성 염증 및 섬유증을 매개하는데 주요 역할을 한다.
본원에서 사용될 때, 용어 "섬유증"은 또한 "섬유모세포 축적 및 콜라겐 침착"과 동의어로 사용된다. 섬유모세포는 결합 조직 세포이고, 이는 신체 전체에서 결합 조직 내에 분산되어 있다. 섬유모세포는 I형 및/또는 III형 콜라겐을 함유하는 비경질 (nonrigid) 세포외 기질을 분비한다. 조직에 대한 손상에 반응하여, 인근 섬유모세포 또는 별세포는 상처 내로 이동하고, 증식하고, 다량의 콜라겐성 세포외 기질을 생성한다. 콜라겐은 세포외 기질 및 결합 조직, 연골, 및 뼈의 주요 성분인, 글라이신 및 프롤린이 풍부한 섬유성 단백질이다. 콜라겐 분자는 서로 밧줄 유사 나선으로 감고 있는 α-사슬로 불리는 3중-가닥의 나선 구조이다. 콜라겐은 몇 가지 형태 또는 종류로 존재하고; 이들 중에서 가장 흔한 II형은 피부, 힘줄 및 뼈에서 발견되고; III형은 피부, 혈관 및 내부 장기에서 발견된다. 예시적인 섬유증 병태는 다음을 포함하고 이로 제한되지 않는다:
(I) 섬유증과 연관된 폐 질병, 예를 들어, 특발성 폐 섬유증, 방사선 유발 섬유증, 만성 폐쇄성 폐 질환 (COPD), 피부경화증, 블레오마이신 유발 폐 섬유증, 만성 천식, 규폐증, 석면 유발 폐 섬유증, 급성 폐 손상 및 급성 호흡 곤란 (세균성 폐렴 유발, 외상 유발, 바이러스성 폐렴 유발, 인공호흡기 (ventilator) 유발, 비-폐성 패혈증 유발, 및 흡인 유발성 포함);
(II) 손상/섬유증 (신장 섬유증)과 연관된 만성 신장병증, 예를 들어, 루푸스, 당뇨병, 피부경화증, 사구체 신장염, 국소성 분절성 사구체 경화증, IgA 신장병증, 고혈압, 동종이식, 루푸스, 및 알포트 (Alport);
(III) 장 섬유증, 예를 들어, 피부경화증 및 방사선 유발 장 섬유증;
(IV) 간 섬유증, 예를 들어, 간경화증, 알콜 유발 간 섬유증, 비-알콜성 지방간염 (NASH), 담관 손상, 원발성 담관 간경화증, 감염 또는 바이러스 유발 간 섬유증 (예를 들어, 만성 HCV 감염), 및 자가면역 간염;
(V) 두경부 섬유증, 예를 들어, 방사선 유발;
(VI) 각막 흉터형성, 예를 들어, LASIX™, 각막 이식, 및 섬유주절제 (trabeculectomy);
(VII) 비대성 흉터형성 및 켈로이드, 예를 들어, 화상 유발 및 수술적; 및 다른 섬유성 질병, 예를 들어, 사르코이드증 (sarcoidosis), 피부경화증, 척수 손상/섬유증, 골수섬유증, 혈관 재협착, 죽상경화증, 베게너 (Wegener) 육아종증, 혼합형 결합 조직 질병, 및 페이로니 (Peyronie) 병.
용어 "섬유근통증"은 섬유근통증 증후군으로도 알려져 있다. 섬유근통증에 대한 American College of Rheumatology (ACR) 1990 분류 기준은 3개월 초과 동안 만성의 광범위한 통증의 병력, 및 신체 검사 시에 18개의 압통점 중 11개 (이상)에서 통증의 존재를 포함하고, 여기서 압통점은 허리 위아래 모두에 및 신체의 양측면 모두에 분포한다 (예를 들어, [Wolfe et al., Arthritis Rheum., 1990;33: 160-172] 참조). 섬유근통증 환자는 일반적으로 이질통 (정상적으로 비-통증성 자극에 반응하는 통증) 및 통각과민 (통증성 자극에 대한 증가된 감수성)의 형태로 통증 인지 이상을 보인다. 인간 환자에서 섬유근통증의 영향은 ACR 기준, 섬유근통 영향 척도 (FIQ: Fibromyalgia Index Questionnaire) 총 스코어, 통증 중증도의 지수 (예를 들어, VAS 또는 라이커트 (Likert) 통증 척도) 및 간섭, 압통점의 수, 또는 통증 역치 평가를 이용하여 평가할 수 있다.
만성의 광범위한 통증이 섬유근통증의 특징 증상이지만, 환자는 일반적으로 다음 중 하나 이상을 포함한 다른 증상을 또한 보인다: 피로, 수면 장애, 편두통 또는 긴장성 두통, 과민성 장 증후군, 뇨 빈도의 변화, 아침 경직, 무감각 또는 따끔거림, 월경통, 화학물질 과민성, 집중 곤란, 및 피부의 작은 혈관에 침범하는 순환계 문제 (레이노 (Raynaud) 현상). 만성 통증을 유발하는 많은 상태에서와 같이, 섬유근통증 환자는 섬유근통증-유발 불안, 우울 또는 둘 모두를 또한 경험할 수 있다. 일부 섬유근통증 환자는 춥고 습한 날씨, 감정적 스트레스, 과로 및 다른 요인이 증상을 악화시킴을 발견한다.
섬유근통증과 연관된 통증은 섬유근통증의 특징인 만성의 광범위한 통증 및 섬유근통증의 다른 증상과 연관된 통증을 포함한, 섬유근통증 증후군과 연관된 임의의 통증을 나타낸다.
강직성 척추염은 척추 관절 및 천장관절의 관절염을 일으키는 류마티스성 질병이다. 이는 생애 내내 일어나는 등 통증의 간헐적인 에피소드에서 척추, 말초 관절 및 다른 신체 장기를 공격하는 중증 만성 질병까지 다양하다. 일반적으로, 최초의 증상은 하배부 및 엉덩이의 빈번한 통증 및 경직이고, 이는 수주 또는 수개월 과정에 걸쳐 점진적으로 나타난다. 통증은 국소화되기보다는 대체로 둔하고 확산성이다. 강직성 척추염은 대개 신체 검사, 예를 들어 x-선, 개체 의료력, 및 강직성 척추염의 가족력, 및 혈액 작업, 예를 들어 HLA-B27에 대한 시험을 통해 진단된다.
건선은 모든 연령의 사람을 괴롭힐 수 있는 만성 염증성 피부 질환이다. 임상적으로, 건선은 가장 빈번하게 팔꿈치, 무릎, 두피, 요추천골 영역, 볼기사이 틈새, 또는 음경 귀두의 피부에 침범한다. 건선에 걸린 피부는 대개 특징적인 은백색의 느슨하게 부착된 비늘이 덮인 잘 구별된 분홍 내지 연어색 판으로 이루어진 하나 이상의 건조한 병변을 포함한다. 건선 환자의 약 30%에서, 손발톱에는 또한 예를 들어 소와 손발톱 또는 손발톱박리증이 침범한다. 환상 건선 (윤상 건선으로도 알려져 있음); 관절병성 건선; 미만 건선 또는 미만성 건선; 박탈성 건선; 굴축성 건선; 지도상 건선; 우곡상 (gyrate) 건선; 화폐상 건선; 손바닥 건선; 점상 건선; 및 잠부쉬 (Zambusch)의 전신성 농포성 건선으로서 공지된 희귀 변이 형태 또는 단순히 농포성 건선을 포함한 모든 형태의 건선이 고려된다. 형태학상으로, 건선의 확립된 병변은 잘 알려진 조직학적 특징, 예를 들어 표피 비후화 및 부전각화성 (parakeratotic) 비늘을 갖는다. 병리학상으로, 건선은 현재 T-세포 매개 자가면역 질환인 것으로 생각된다. 건선의 발병은 대체로 점진적이고, 전형적인 시간 과정은 만성 완화 및 재발과 때때로 급성 악화를 특징으로 한다. 건선의 진단은 환자의 임상 징후 및 증상과 건선의 가족력을 평가함으로써 이루어진다. 환자의 피부 병변을 시각적으로 검사함으로써 건선을 진단하는 것은 어렵지 않고, 대체로 이것이 완전한 진단을 위해 요구되는 전부이다. 그러나, 때때로, 건선의 증후를 찾기 위해 피부 생검을 조직학적으로 분석한다.
전신 홍반성 루푸스 ("SLE") (파종 홍반성 루푸스로도 불림)은 관절, 신장, 장액성 표면 및 혈관벽이 연루될 수 있고, 주로 젊은 여성에서, 그러나 아동에서도 또한 발생하는 원인이 알려지지 않은 만성 염증성 결합 조직 질환이다. SLE 사례의 90%는 여성에서 발생한다. SLE는 급성 감염처럼 보이는, 열과 함께 갑자기 시작할 수 있거나, 열 및 권태감 에피소드와 함께 수개월 또는 수년에 걸쳐 서서히 발병할 수 있다. 혈관성 두통, 간질, 또는 정신병이 초기 결과일 수 있다. 임의의 장기 시스템에 관련가능한 소견이 보일 수 있다. 간헐적 관절통에서 급성 다발성 관절염까지의 관절 증상이 환자의 약 90%에서 발생하고, 다른 소견이 나타나기 전에 수년 동안 존재할 수 있다. 오래된 질병에서, 현저한 2차 관절 변형이 있는 중수지절 (metacarpophalangeal) 관절에서 피막 삽입 미란 (erosion)이 명백한 모서리 미란의 x-선 증거없이 발생할 수 있다 (자쿠드 (Jaccoud) 관절염). 그러나, 대부분의 루푸스 다발성 관절염은 비파괴성이고 비변형성이다.
전신 홍반성 루푸스는 5세 미만에서는 드물고, 대부분의 SLE의 아동은 청소년기 동안 질병을 발병한다. 연소성 SLE의 징후 및 증상은 성인에서와 유사하다. 그러나, 아동은 원반모양에서 전신성 질병으로 특히 높은 수준으로 이행한다.
통풍 (통풍 관절염으로도 알려짐)은 관절에 침착하여 염증을 일으키는 결정을 형성하는, 너무 많은 요산의 체내 증가로 인해 발생하는 말초 관절의 재발성 급성 또는 만성 관절염이다. 통풍의 급성 발작 동안, 관절, 종종 큰 발가락의 관절에서 부기, 염증 및 극심한 통증이 존재한다. 만성 통풍은 발작의 수년 후에 시작하여, 관절을 영구적으로 손상 및 변형시키고, 신장의 세포를 파괴할 수 있다. 대부분의 사례는 남성에서 발생하고, 최초의 발작은 30세 이전에는 거의 발생하지 않는다.
미분화 척추관절증 (USpA)은 강직성 척추염 또는 관련 질병의 확정적 진단에 대한 기준을 만족하지 않는 사람에서 척추염의 증상 및 증후를 설명하기 위해 사용되는 용어이다. 강직성 척추염, 건선성 관절염, 염증성 장 질병의 관절염, 라이터 증후군, 만성 반응성 관절염 및 골부착부염 (enthesitis) 관련 연소성 관절염을 포함한 많은 잘 확립된 증후군이 척추관절증 패밀리 내에 포함된다. 시간이 지남에 따라, USpA이 있는 일부 사람들은 잘 규정된 형태의 척추염, 예를 들어 강직성 척추염을 발병할 수 있다.
연소성-발병 천추관절염 (JSpA) (연소성 척추관절증으로도 알려져 있음)은 16세 이전에 관절염을 일으키고 성인 수명 동안 이어질 수 있는, 일군의 아동기 류마티스성 질병에 대한 의학 용어이다. 연소성 척추관절병증은 미분화 척추관절증, 연소성 강직성 척추염, 연소성 건선성 관절염, 염증성 장 질병과 연관된 관절염 (장병원성 관절염), 반응성 관절염 (라이터 증후군은 일종의 반응성 관절염이다) 및 SEA 증후군 (혈청반응음성, 골부착부병증, 관절병증)을 포함한다. JSpA는 대개 신체의 하부 부위, 예를 들어, 골반, 고관절, 무릎 및 발목에서 관절의 통증 및 염증을 일으킨다. 신체의 다른 영영, 예를 들어 척추, 눈, 피부 및 창자가 또한 영향을 받을 수 있다. 피로 및 기면증이 또한 발생할 수 있다.
크론병은 가장 일반적으로 원위 회장 및 결장에 침범하지만 GI관의 어는 부위에서나 생길 수 있는 비특이적 만성 경벽성 염증성 질병이다. 복통이 있는 만성 설사, 열, 식욕부진, 체중 감소 및 우측 하복부 종괴 또는 충만이 크론병의 가장 일반적인 증상이다. 덜 일반적인 증상은 식욕 감소, 열, 도한, 직장 통증 및 직장 출혈을 포함한다. 크론병은 결장, 직장 및 소장과 드문 경우에는 위, 입 및 식도에 또한 침범할 수 있다. 크론병 병리학의 가장 일반적인 패턴은 (1) 우측 하복부 복통 및 압통을 특징으로 하는 염증; (2) 장 협착증에 의해 유발되고 중증 산통 (colic), 복부 팽만, 변비 및 구토를 일으키는 재발성 부분 폐쇄; (3) 영양실조 및 만성 쇠약을 일으키는 염증 및 폐쇄가 있는 미만 공회장염; 및 (4) 대체로 후기에 발병하고, 종종 열, 통증성 복부 종괴 및 전신성 소모를 일으키는 복부 누공 및 농양이다. 크론병은 상기 설명된 염증 또는 폐쇄 증상이 있는 환자에서 및 현저한 GI 증상이 있지만 항문주위 치루 또는 농양이 있거나 달리 설명되지 않는 관절염, 결절 홍반, 열, 빈혈 또는 발육 저해된 성장 (아동에서)이 있는 환자에서 의심되어야 한다. 실험실 결과는 비특이적이고, 빈혈, 백혈구증가증, 저알부민혈증, 및 상승된 ESR, C-반응성 단백질 또는 오로소뮤코이드 (orosomucoid)에서 반영되는 증가된 수준의 급성기 반응물을 포함할 수 있다. 상승된 알칼리성 포스파타제 및 γ-글루타밀 트랜스펩티다제를 동반하는 결장 질병은 종종 원발성 경화 담관염을 반영한다. 진단은 대체로 x-선에 의해 이루어진다.
진행된 사례에서, 선상 (string) 징후는 현저한 회장 협착 및 창자 루프의 분리와 함께 보일 수 있다. 보다 초기 사례에서, x-선 진단은 때때로 어려울 수 있지만, 공기 이중-조영 바륨 관장 및 고위관장법 (enteroclysis)은 얕은 아프타성 및 선형 궤양을 보여줄 수 있다. 대장내시경 및 생검은 크론 대장염의 진단을 확정하는 것을 도울 수 있고, 말단 회장의 직접 시각화 및 생검을 허용한다. 상부 GI 내시경은 상부 GI 증상이 있는 크론병 환자에서 위십이지장 관련을 확인할 수 있다.
궤양성 대장염은 가장 종종 피가 섞인 설사를 특징으로 하는, 결장 점막에서 생기는 만성, 염증성 및 궤양성 질병이다. 무증상성 기간이 산재하는, 강도 및 지속시간이 변하는 피가 섞인 설사가 궤양성 대장염의 가장 일반적인 증상이다. 대체로 발작은 증가된 절박 배변, 가벼운 하복부 경련, 및 대변 내의 혈액 및 점액이 있으면서 서서히 시작한다. 그러나, 발작은 급박한 격렬한 설사, 고열, 복막염의 징후 및 극심한 독소혈증이 있으면서 급성 및 전격성일 수 있다. 일부 사례는 입증된 감염 (예를 들어, 아메바증, 세균성 이질) 후에 발병한다. 궤양형성이 직장S상결장에 한정될 때, 대변은 정상이거나 단단하고 건조할 수 있지만, 적혈구 및 백혈구가 로딩된 점액의 직장 분비물이 배변에 동반하거나 그 사이에 생긴다. 전신 증상은 가볍거나 없다. 궤양형성이 인접하게 확장할 때, 대변은 물러지고, 환자는 1일에 배변이 10회를 초과할 수 있고, 종종 중증 경련 및 괴로운 직장 후중감이 있고, 야간에 누그러지지 않는다. 대변은 물설사일 수 있고, 점액을 포함할 수 있고, 종종 거의 전적으로 혈액 및 고름으로 이루어진다. 권태감, 열, 빈혈, 식욕부진, 체중 감소, 백혈구증가증 및 저알부민혈증은 광범한 활동성 궤양성 대장염과 함께 존재할 수 있다. 환자의 병력 및 대변 검사는 항상 질병 활성의 직접적이고 즉각적인 표시를 제공하는 S자결장경검사에 의해 확인해야 하는 궤양성 대장염의 추정적 진단을 허용한다. 초기 사례에서, 점막은 미세한 과립상이고 유약하고, 여기서 정상 혈관상 패턴이 상실되고, 종종 출혈 영역이 산재하고; 최소 외상 (유약성)이 다수의 점에서 출혈을 일으킨다. 점막은 곧 파괴되어, 많은 작은 혈액- 및 고름-삼출 궤양이 점재하는 적색 해면상 표면으로 된다. 점막이 점차 관련됨에 따라, 염증 및 출혈은 창자 근육으로 확장한다. 막대한 화농성 삼출물이 있는 큰 점막 궤양이 중증 질병의 특징이다. 비교적 정상이거나 증식성 염증성 점막 (가성폴립)의 섬이 궤양이 형성된 점막의 영역 위로 돌출한다. 생검은 비특이적일 수 있고, 때때로 급성 감염성 (자기-한정) 대장염을 배제할 수 없지만; 만성을 제안하는 특징 (예를 들어, 왜곡된 움 (crypt) 구조, 움 위축, 만성 염증성 침윤물)은 궤양성 대장염의 진단을 지지한다. 무증상성 기간 동안에도, S자결장경검사 외관은 거의 정상이 아니고; 일부 정도의 유약성 또는 과립성은 거의 항상 지속한다. 정상 혈관상 패턴이 손실되고, 생검은 만성 염증의 증거를 보여준다. 복부의 단순 x-선은 때때로 질병에 걸린 창자에서 팽기 (haustration)의 상실, 점막 부종, 및 형성된 대변 부재를 보여줌으로써 대장염의 중증도 및 근위 정도를 판단하는 것을 돕는다. 그러나, 질병 과정에서 더 나중에, 관련 정도를 결정하기 위해 전체 결장이 평가되어야 한다. 총 대장내시경은 가장 민감하고 널리 사용되는 방법이지만, 바륨 관장이 정보를 제공할 수 있다. 생검과 함께 대장내시경은 협착의 성질을 평가하기 위해 필수적이다. 생검은 또한 염증이 고도고 국소적인 경우에 또는 육아종이 보이는 경우에 궤양성 대장염을 크론병으로부터 구분하는 것을 도울 수 있다.
과민성 장 증후군 (IBS)은 가변적인 정도의 복통, 변비 및/또는 설사, 및 복부 팽만감을 포함하는 재발성의 상부 및 하부 GI 증상을 유발시키는 전체 GI관이 관여되는 운동성 질환이다. 과민성 장 증후군 (IBS)의 원인은 알려져 있지 않다. 해부학적인 원인은 발견될 수 없다. 감정적 인자, 식이, 약물, 또는 호르몬이 상승된 GI 운동성을 촉진하거나 악화시킬 수 있다. IBS의 특징은 배변에 의해 경감되는 통증, 교대하는 패턴의 배변 습관, 복부 팽만, 대변 내의 점액, 및 배변 후에 불완전한 배설의 감각이다. 일반적으로, 통증의 특성 및 위치, 촉진 인자, 및 배변 패턴이 각각의 환자에 대해 구분된다. IBS의 환자는 또는 장외 증상 (예를 들어, 섬유근통증, 두통, 성교통증, 측두하악 관절 증후군)이 있을 수 있다. 2가지 주요 임상 종류의 IBS가 설명되었다. 변비-우세형 IBS에서, 변비가 일반적이지만, 배변 습관은 다양하다. 대부분의 환자는 보다 정상적인 대변 빈도와 교대하는 주기적인 변비와 연관된, 대장의 적어도 하나의 영역 상에 통증이 있다. 대변에는 종종 투명하거나 백색의 점액이 포함된다. 통증은 산통이거나, 발작적으로 생기거나, 연속적인 둔통이고; 배변에 의해 경감될 수 있다. 식사는 보통 증상을 촉발시킨다. 팽만감, 고창, 구역, 소화불량, 및 가슴쓰림이 또한 일어날 수 있다. 설사-우세형 IBS는 기립시에 또는 식사 동안 또는 식사 직후에 즉시 발생하는 황급한 설사를 특징으로 한다. 야간 설사는 흔하지 않다. 통증, 팽만감 및 대변 절박이 일반적이고, 실금이 일어날 수 있다. IBS의 진단은 특징적인 장 패턴, 통증의 시간 및 특성, 및 신체 검사 및 일상적인 진단 시험을 통한 다른 질병 과정의 배제에 기초한다. 이 증후군에는 쉽게 확인가능한 구조적 또는 생화학적 이상이 결여되므로, 의학계에서는 IBS의 진단을 돕기 위해 Rome 기준으로 알려진 컨센서스 정의 및 기준을 개발하였다. Rome 기준에 따르면, IBS는 (1) 배변에 의해 경감되고/되거나 (2) 대변의 빈도 또는 일관성의 변화와 연관되는 복통 또는 불쾌감, 및 다음 중 2개 이상에 의해 나타내어 진다: 변경된 대변 빈도, 변경된 대변 형성, 변경된 대변 통과, 점액의 통과, 및 팽만감 또는 복부 팽만의 느낌. 복부의 촉진으로 때때로 촉진가능한 압통이 있는 S자결장과 연관되는, 특히 좌측 하복부에서 압통을 밝힐 수 있다. 모든 환자에 대해 일상적인 수지 직장 검사 및 여성에 대해 골반 검사를 수행해야 한다.
과민성 장 질병 (IBD) (염증성 장 질병으로도 알려짐)은 GI관 내의 상이한 부위에서 만성 염증을 특징으로 한다. IBD는 2가지 공지된 임상 아형, 즉, 크론병 (CD) 및 궤양성 대장염 (UC)을 포함한다. 질병 패턴에서 특정 차이가 크론병 및 궤양성 대장염 사이의 구분을 해명한다.
IBD 및 IBS와 연관된 통증은 만성 또는 급성 통증으로서 존재할 수 있다. 예를 들어, IBS의 특징은 배변에 의해 경감되는 급성 통증이지만, 만성 복통은 크론병의 전형이다. IBD 및 IBS와 연관된 통증은 장외 또는 내장외에서 일어날 수 있지만, 일반적으로 이들 질병은 내장통을 일으킨다. 내장통은 복강의 장기를 포함하는 내장과 연관되는 통증이다. 이들 장기는 생식 기관, 비장, 결장, 직장 및 소화기계의 다른 장기를 포함한다. 내장통은 5개의 중요한 임상 특징이 있다: (1) 이는 모든 내장으로부터 유발되지 않고 (간, 신장, 대부분의 고형 내장, 및 폐 실질과 같은 장기는 통증에 민감하지 않다); (2) 항상 내장 손상과 연관되지는 않고; (3) 확산성이고 거의 국소화되지 않고; (4) 다른 위치에 관련되고; (5) 운동신경 및 자율신경 반사, 예를 들어 구역, 구토, 및 신장 산통에서 일어나는 하부 등 근육 긴장이 동반된다.
통증은 외부 환경으로부터 잠재적으로 손상성인 자극으로부터 위험을 경고하기 위해 설계된 중요한 생리학적 보호 기전이다. 이 시스템은 일차 감각 뉴런의 특이적인 세트를 통해 작동하고, 말초 신호전달 기전을 통한 유해한 자극에 의해 활성화된다 (검토를 위해 문헌 [Millan, 1999, Prog. Neurobiol., 57, 1-164] 참조). 이들 감각 섬유는 통각수용기로서 알려져 있고, 느린 전도 속도를 갖는 특징적으로 작은 직경의 액손이다. 통각수용기는 자극의 위치인 척수를 향해 그들의 국소해부적으로 조직화된 돌출부에 의해 유해한 자극의 강도, 지속시간 및 질을 암호화한다. 통각수용기는 2가지 주요 종류, 즉, A-델타 섬유 (유수신경 (myelinated)) 및 C 섬유 (무수신경)가 존재하는 통각반응 신경 섬유 상에서 발견된다. 통각수용기 입력에 의해 생성된 활성은 후각 (dorsal horn) 내에서 복잡한 처리 후에 직접적으로 또는 뇌 줄기 중계 핵 (relay nuclei)을 통해 시상의 복측기저부, 이어서, 통증의 감각이 생성되는 피질 상으로 전달된다.
통증은 일반적으로 급성 또는 만성으로 분류될 수 있다. 급성 통증은 급작스럽게 시작되고, 단기간 지속한다 (대체로 12주 이하). 이는 대체로 특이적인 원인, 예를 들어 특이적인 손상과 연관되고, 종종 날카롭고 중증이다. 이는 수술, 치과 작업, 과도긴장 또는 염좌로부터 생성되는 특이적인 손상 후에 일어날 수 있는 통증의 종류이다. 급성 통증은 일반적으로 임의의 지속적인 심리적 반응을 일으키지 않는다. 이와 반대로, 만성 통증은 장기간의 통증이고, 대개 3개월 초과 동안 지속하여 유의한 심리적 및 정서적 문제를 일으킨다. 만성 통증의 일반적인 예는 신경병성 통증 (예를 들어, 통증성 당뇨성 신경병증, 대상포진후 신경통), 손목 터널 증후군, 등 통증, 두통, 암 통증, 관절염 통증 및 만성 수술후 통증이다.
질병 또는 외상을 통해 신체 조직에 실질적인 손상이 일어나면, 통각수용기 활성화의 특징이 변경되고, 주변부에서 국소적으로 손상 둘레에서 및 통각수용기가 끝나는 중심에서 감작이 일어난다. 이들 효과는 통증의 감각을 높인다. 급성 통증에서, 이들 기전은 수복 과정이 보다 잘 일어나도록 할 수 있는 보호 행동을 촉진하는데 유용할 수 있다. 정상적으로는, 일단 손상이 치유되면 감수성이 정상으로 되돌아가는 것이 기대될 것이다. 그러나, 많은 만성 통증 상태에서, 과민성이 치유 과정보다 아주 오래가고, 종종 신경계 손상에서 기인한다. 이러한 손상은 종종 부적응 및 이상 활성과 연관되는 감각 신경 섬유의 이상을 일으킨다 (Woolf & Salter, 2000, Science, 288, 1765-1768).
임상적으로, 환자 증상들 사이에 불쾌감 및 비정상적인 감수성이 특징이 될 때 통증이 존재한다. 환자는 매우 비균질성인 경향이 있고, 상이한 통증 증상을 보일 수 있다. 그러한 증상은 1) 둔하거나 타는 또는 찌르는 듯할 수 있는 자발 통증; 2) 유해한 자극에 대한 과장된 통증 반응 (통각과민); 및 3) 정상적으로 무해한 자극에 의해 생성된 통증 (이질통 - [Meyer et al., 1994, Textbook of Pain, 13-44])을 포함한다. 상이한 형태의 급성 및 만성 통증으로 고통받는 환자는 유사한 증상이 있을 수 있지만, 근원적인 기전은 상이할 수 있고, 따라서, 상이한 치료 전략을 필요로 할 수 있다. 따라서, 통증은 또한 상이한 병태생리학에 따라 많은 상이한 아형, 예를 들어 통각반응성, 염증성 및 신경병성 통증으로 나누어질 수 있다.
통각반응성 통증은 조직 손상에 의해 또는 손상을 일으킬 가능성이 있는 강렬한 자극에 의해 유발된다. 통증 구심신경은 손상의 부위에서 통각수용기에 의한 자극의 전달에 의해 활성화되고, 그들의 종결 수준에서 척수 내의 뉴런을 활성화시킨다. 이어서, 통증은 척수로 위로 뇌까지 중계되고, 뇌에서 통증이 인지된다 (Meyer et al., 1994, Textbook of Pain, 13-44). 통각수용기의 활성화는 2가지 종류의 구심성 신경 섬유를 활성화시킨다. 유수신경 A-델타 섬유는 빠르게 전달하고, 날카롭고 찌르는 통증 감각을 담당하는 반면, 무수신경 C 섬유는 보다 느린 속도로 전달하고, 둔하거나 쑤시는 통증을 운반한다. 중정도 내지 중증의 급성 통각반응성 통증은 중추 신경계 외상, 과도긴장/염좌, 화상, 심근경색 및 급성 췌장염으로부터의 통증, 수술후 통증 (임의의 유형의 수술 절차 후의 통증), 외상후 통증, 신장 산통, 암 통증 및 등 통증의 주된 특징이다. 암 통증은 만성 통증, 예를 들어 종양 관련 통증 (예를 들어 뼈 통증, 두통, 안면 통증 또는 내장통) 또는 암 요법과 연관된 통증 (예를 들어 화학요법후 증후군, 만성 수술후 통증 증후군 또는 방사선요법후 증후군)일 수 있다. 암 통증은 또한 화학요법, 면역요법, 호르몬 요법 또는 방사선 요법에 반응하여 일어날 수 있다. 등 통증은 헤르니아성 또는 파열성 추간판, 또는 요부 척추후 관절, 천장관절 관절, 척추주위 근육 또는 후종 인대의 이상으로 인할 수 있다. 등 통증은 자연적으로 해소될 수 있지만, 일부 환자에서 12주를 넘어 지속하는 경우에 특히 쇠약성일 수 있는 만성 병태가 될 수 있다.
신경병성 통증은 현재 신경계 내의 원발성 병변 또는 기능 장애에 의해 개시되거나 유발된 통증으로서 규정된다. 신경 손상은 외상 및 질병에 의해 유발될 수 있고, 따라서 용어 '신경병성 통증'은 다양한 병인의 많은 질환을 포함한다. 이들은 말초 신경병증, 당뇨성 신경병증, 대상포진후 신경통, 삼차 신경통, 등 통증, 암 신경병증, HIV 신경병증, 환상 사지 통증, 손목 터널 증후군, 중추성 뇌졸중후 통증, 및 만성 알콜중독, 갑상선기능저하증, 요독증, 다발성 경화증, 척수 손상, 파킨슨 (Parkinson) 병, 간질 및 비타민 결핍과 연관된 통증을 포함하고 이로 제한되지 않는다. 신경병성 통증은 보호 역할이 없으므로 병리학적이다. 이는 종종 원래 원인이 소산된 후에도 꽤 존재하여, 일반적으로 수년 동안 지속하고 환자 삶의 질을 심각하게 감소시킨다 (Woolf and Mannion, 1999, Lancet, 353, 1959-1964). 신경병성 통증의 증상은 동일한 질병이 있는 환자들 사이에서도 종종 비균질성이므로 치료하기 어렵다 ([Woolf & Decosterd, 1999, Pain Supp., 6, S141-S147]; [Woolf and Mannion, 1999, Lancet, 353, 1959-1964]). 이는 연속적이고, 발작 또는 비정상적 유발 통증, 예를 들어 통각과민 (유해한 자극에 대한 증가된 감수성) 및 이질통 (정상적으로 무해한 자극에 대한 감수성)일 수 있는 자발 통증을 포함한다.
염증 과정은 부기 및 통증을 일으키는, 조직 손상 또는 외부 물질의 존재에 반응하여 활성화되는 복잡한 일련의 생화학적 및 세포성 사건이다 (Levine and Taiwo, 1994, Textbook of Pain, 45-56). 관절염 통증은 가장 일반적인 염증성 통증이다. 류마티스성 질병은 개발국에서 가장 흔한 만성 염증성 병태 중 하나이고, 류마티스 관절염은 장애의 일반적인 원인이다. 류마티스 관절염의 정확한 병인은 알려져 있지 않지만, 현재의 가설은 유전적 및 미생물학적 인자가 모두 중요할 수 있음을 제안한다 (Grennan & Jayson, 1994, Textbook of Pain, 397-407). 거의 천육백만 명의 미국인이 증상성 골관절염 (OA) 또는 퇴행성 관절 질병이 있고, 이들 중 대부분은 60세를 넘은 것으로 추산되었고, 집단의 연령이 증가함에 따라 사천만 명으로 증가할 것으로 예상되어, 막대한 크기의 공중 보건 문제가 된다 ([Houge & Mersfelder, 2002, Ann Pharmacother., 36, 679-686]; [McCarthy et al., 1994, Textbook of Pain, 387-395]). 대부분의 골관절염 환자는 연관된 통증 때문에 의학적 치료를 추구한다. 관절염은 심리사회적 및 신체적 기능에 심각한 영향을 미치고, 이후의 삶에서 선도하는 장애 원인인 것으로 알려져 있다. 강직성 척추염은 또한 척추 관절 및 천장관절의 관절염을 일으키는 류마티스성 질병이다. 이는 생애 내내 일어나는 등 통증의 간헐적인 에피소드에서 척추, 말초 관절 및 다른 신체 장기를 공격하는 중증 만성 질병까지 다양하다.
다른 종류의 염증성 통증은 염증성 장 질병 (IBD)과 연관된 통증을 포함하는 내장통이다. 내장통은 복강의 장기를 포함하는 내장과 연관되는 통증이다. 이들 장기는 생식 기관, 비장 및 소화기계의 일부를 포함한다. 내장과 연관된 통증은 소화기 내장 통증 및 비-소화기 내장 통증으로 나누어질 수 있다. 통증을 일으키는 일반적으로 마주치는 위장관 (GI) 질환은 기능성 장 질병 (FBD) 및 염증성 장 질병 (IBD)을 포함한다. 이들 GI 질환은 FBD에 관하여 위-식도 역류, 소화불량, 과민성 장 증후군 (IBS) 및 기능성 복통 증후군 (FAPS), 및 IBD에 관하여 크론병, 회장염 및 궤양성 대장염 (이들은 모두 정기적으로 내장통을 일으킨다)을 포함하는, 현재 중정도로만 제어되는 광범위한 질병 상태를 포함한다. 다른 종류의 내장통은 월경통, 방광염 및 췌장염과 연관된 통증 및 골반 통증을 포함한다.
몇몇 종류의 통증은 다수의 병인을 갖고, 따라서 하나 초과의 영역에서 분류될 수 있음을 알아야 하고, 예를 들어 등 통증 및 암 통증은 통각반응성 및 신경병성 성분을 모두 갖는다.
다른 종류의 통증은 다음을 포함한다:
- 근육통, 섬유근통증, 척추염, 혈청-음성 (비-류마티스성) 관절병증, 비-관절 류마티즘, 근이영양증, 글리코겐증, 다발성 근염 및 화농성 근염을 포함한 근골격 질환으로부터 생기는 통증;
- 심장 및 혈관 통증, 예를 들어 협심증, 심근경색, 승모판 협착증, 심장막염, 레이노 현상, 경화부종 및 골격근 허혈에 의해 유발된 통증;
- 두통, 예를 들어 편두통 (예를 들어, 전조가 있는 편두통 및 전조가 없는편두통), 군집성 두통, 긴장형 두통 혼합형 두통 및 혈관 질환과 연관된 두통; 및
- 구강안면 통증, 예를 들어 치통, 귀 통증, 구강 작열감 증후군 및 측두하악 근막 통증.
IL-6 항체 또는 그의 항원 결합 부분은 하나 이상의 다른 치료제와 조합으로 사용될 수 있다. 예를 들어, 항체 또는 그의 항원 결합 부분은 류마티스 관절염, 골관절염 및 통증과 같은 질병의 치료를 위해 COX-2 억제제, 예를 들어 셀레콕시브와 함께 사용될 수 있다. IL-6 항체 또는 그의 항원 결합 부분 및 다른 치료제는 동일한 투여형으로 또는 상이한 투여형으로 환자에게 투여될 수 있다. 또한, 이들은 동시에 또한 상이한 시간에 투여될 수 있다. 항-IL-6 항체 또는 그의 항원 결합 부분과 조합으로 사용될 수 있는 치료제의 일부 예를 아래에 제시한다.
류마티스
관절염
IL-6 항체 및 그의 항원 결합 부분은 복합요법으로 또한 사용할 수 있다. 적합한 소염 복합요법 화합물은 다음을 포함한다:
시클로스포린, 졸레드론산, 에팔리주맙, 알레파셉트, 에토돌락, 로르녹시캄, OM-89, 발데콕시브, 토실리주맙, 아바타셉트, 멜록시캄, 에타네르셉트, 남부메톤, 리멕솔론, 153Sm-EDTMP, 프로소르바, 이미다졸 살리실레이트, 오프렐베킨, 히알루론산, 나프록센, 피록시캄, 디아세레인, 루메리콕시브, 타크로리무스, 아세클로페낙, 아크타리트, 테녹시캄, 로시글리타존, 데플라자코르트, 아달리무맙, 레플루노미드, 리세드로네이트 나트륨, 미소프로스톨 및 디클로페낙, SK-1306X, 인플릭시맙, 아나킨라, 셀레콕시브, 디클로페낙, 에토리콕시브 및 펠비낙, 류마콘, 골리무맙, 데노수맙, 오파투무맙, 10rT1 항체, 펠루비프로펜, 리코펠론, 템시로리무스, 에쿨리주맙, 이구라티모드 및 프레드니손. 다른 적합한 소염제는 CP-481715, ABN-912, MLN-3897, HuMax-IL-15, RA-1, 파클리탁셀, Org-37663, Org 39141, AED-9056, AMG-108, 폰톨리주맙, 페그수네르셉트, 프랄나카산, 아필리모드, GW-274150, AT-001, 681323 (GSK) K-832, R-1503, 오크렐리주맙, DE-096, Cpn10, THC+CBD (지더블유 파마 (GW Pharma)), 856553 (GSK), ReN-1869, 면역글로불린, mm-093, 아멜루반트, SCIO-469, ABT-874, LenkoVAX, LY-2127399, TRU-015, KC-706, 아목사피네트 및 디피리다몰, TAK-715, PG 760564, VX-702, 프레드니솔론 및 디피리다몰, PMX-53, 벨리무맙, 프리나베렐, CF-101, tgAAV-TNFR:Fc, R-788, 프레드니솔론 및 SSRI, CP-690550 및 PMI-001을 포함한다.
골관절염
IL-6 항체 및 그의 항원 결합 부분은 골관절염의 치료를 위해 골관절염의 하나 이상의 표시를 치료하기 위해 유용한 물질과 함께 추가로 동시투여될 수 있다. 항-IL-6 항체 또는 그의 항원 결합 부분과 조합으로 사용될 골관절염의 하나 이상의 표시를 치료하기 위해 유용한 물질의 예는 매트릭스 메탈로프로테이나제 (MMP) 억제제, 아그레카나제 억제제, 유도가능 산화질소 (iNOS) 억제제, 인슐린-유사 성장 인자 (IGF) 발현 또는 활성의 억제제, 섬유모세포 성장 인자 (FGF) 발현 또는 활성의 억제제, CD 44 발현 또는 활성의 억제제, 인터류킨 (IL) 발현 또는 활성의 억제제, 종양 괴사 인자 알파 (TNF-알파) 발현 또는 활성의 억제제, 종양 괴사 인자-유도가능 단백질 6 (TSG-6) 발현 또는 활성의 억제제, 비쿠닌 발현 또는 활성의 억제제, 베타-세크레타제 (BACE)의 억제제, PACE-4의 억제제, 핵 수용체 rev-ErbA 알파 (NR1D1) 발현 또는 활성의 억제제, 내피 분화 스핑고지질 G-단백질-결합 수용체 1 (EDG-1) 발현 또는 활성의 억제제, 프로테이나제-활성화된 수용체 (PAR) 발현 또는 활성의 억제제, 연골-유래된 레티노산-감수성 단백질 (CD-RAP) 발현 또는 활성의 억제제, 단백질 키나제 C 제타 (PKCz)의 억제제, 레시스틴 발현 또는 활성의 억제제, 디스인테그린 및 메탈로프로테이나제 8 (ADAM8)의 억제제, 보체 성분 1s 아성분 (C1s) 발현 또는 활성의 억제제, 포르밀 펩티드 수용체-유사 1 (FPRL1) 발현 또는 활성의 억제제를 포함한다.
IL-6 항체 및 그의 항원 결합 부분과 조합으로 사용될 수 있는 물질의 추가의 예는 MMP-2, -3, -9, 또는 -13의 억제제; 아그레카나제-1 또는 -2의 억제제; IGF-1 또는 -2 발현 또는 활성의 억제제; FGF-2, - 18, 또는 -9 발현 또는 활성의 억제제; 및 IL-1, -4 또는 -6 발현 또는 활성의 억제제를 포함한다.
IL-6 항체 및 그의 항원 결합 부분과 조합으로 사용될 수 있는 물질의 추가의 예는 IGF-1 또는 -2 항체; FGF 수용체-2 또는 -3 길항제, CD 44 항체, IL-1, -4 또는 -6 항체, TNF-알파 항체; TSG-6 항체; 비쿠닌 항체; NR1D1 길항제; EDG-1 길항제; PAR 길항제, CD-RAP 항체, 레지스틴 항체, C1s 항체, 및 FPRL1 항체를 포함한다.
통증
IL-6 항체 또는 그의 항원 결합 부분은 통증의 치료를 위해 하나 이상의 추가의 약물 활성 화합물과 조합으로 투여될 수 있다. 화합물은 단일 투여형으로 동시에 또는 동일하거나 상이할 수 있는 투여형으로 따로 투여될 수 있다. 별법으로, 화합물은 순차적으로 투여될 수 있다. 약물 활성 화합물의 제약상 허용되는 염을 또한 조합제에서 사용할 수 있다.
IL-6 항체 또는 그의 항원 결합 부분과 함께 투여될 수 있는 화합물의 예는 다음을 포함한다:
시클로옥시게나제-2 (COX-2) 선택적 억제제, 예를 들어 셀레콕시브, 로페콕시브, 파레콕시브, 발데콕시브, 데라콕시브, 에토리콕시브, 및 루미라콕시브; 아편유사제 진통제, 예를 들어 몰핀, 히드로모르폰, 옥시모르폰, 펜타닐, 코데인, 디히드로코데인, 옥시코돈, 히드로코돈, 부프레노르핀, 트라마돌 및 날부핀; 비스테로이드성 소염 약물 (NSAID), 예를 들어 아스피린, 디클로페낙, 디플루니살, 이부프로펜, 페노프로펜, 나프록센, 네파페낙 및 아세트아미노펜; 포스포디에스테라제 V 억제제 (PDEV), 예를 들어 실데나필; 알파-2-델타 리간드, 예를 들어 가바펜틴 및 프레가발린; 및 국소 마취제, 예를 들어 벤조카인, 리도카인, 로피바카인, 멘톨, 캄포르 및 메틸 살리실레이트.
IL-6 항체 및 그의 항원 결합 부분과 조합으로 사용될 수 있는 다른 종류의 화합물 및 화합물의 클래스의 예는 다음을 포함한다: 바르비투레이트 진정제; 벤조디아제핀; 진정 작용이 있는 히스타민 H1 길항제; 진정제; 골격근 이완제; N-메틸-D-아스파르트산 (NMDA) 수용체 길항제; 알파-아드레날린성약; 삼환계 항우울제; 항경련제, 예를 들어 카르바마제핀; 타키키닌 (NK) 길항제, 특히 NK-3, NK-2 또는 NK-1 길항제; 무스카린성 길항제; 신경이완제; 바닐로이드 수용체 작용제 또는 길항제; 베타-아드레날린성약; 코르티코스테로이드; 세로토닌 (5-HT) 수용체 작용제 또는 길항제, 예를 들어 5-HT1B /1D, 5-HT2A, 및 5-HT3 수용체 길항제; 콜린작용성 (니코틴성) 진통제; 카나비노이드; 대사자극성 글루타메이트 아형 1 수용체 (mGluRI) 길항제; 세로토닌 재흡수 억제제, 예를 들어 세르트랄린; 노르아드레날린 (노르에피네프린) 재흡수 억제제, 예를 들어 레복세틴, 특히 (S,S)-레복세틴; 이중 세로토닌-노르아드레날린 재흡수 억제제, 예를 들어 둘록세틴; 유도가능 산화질소 합성효소 (iNOS) 억제제, 예를 들어 S-[2-[(1-이미노에틸)아미노]에틸]-L-호모시스테인, S-[2-[(1-이미노에틸)-아미노]에틸]-4,4-디옥소-L-시스테인, S-[2-[(1-이미노에틸)아미노]에틸]-2-메틸-L-시스테인, (2S,5Z)-2-아미노-2-메틸-7-[(1-이미노에틸)아미노]-5-헵텐산, 2-[[(1R,3S)-3-아미노-4-히드록시-1-(5-티아졸릴)-부틸]티오]-5-클로로-3-피리딘카르보니트릴; 2-[[(1R,3S)-3-아미노-4-히드록시-1-(5-티아졸릴)부틸]티오]-4-클로로벤조니트릴, (2S,4R)-2-아미노-4-[[2-클로로-5-(트리플루오로메틸)페닐]티오]-5-티아졸부탄올, 2-[[(1R,3S)-3-아미노-4-히드록시-1-(5-티아졸릴)부틸]티오]-6-(트리플루오로메틸)-3-피리딘카르보니트릴, 2-[[(1R,3S)-3-아미노-4-히드록시-1-(5-티아졸릴)부틸]티오]-5-클로로벤조니트릴, N-[4-[2-(3-클로로벤질아미노)에틸]페닐]티오펜-2-카르복사미딘, 및 구아니디노에틸디술피드; 아세틸콜린에스테라제 억제제; 프로스타글란딘 E2 아형 4 (EP4) 길항제, 예를 들어 N-[({2-[4-(2-에틸-4,6-디메틸-1H-이미다조[4,5-c]피리딘-1-일)페닐]에틸}아미노)-카르보닐]-4-메틸벤젠술폰아미드 또는 4-[(1S)-1-({[5-클로로-2-(3-플루오로페녹시)피리딘-3-일]카르보닐}아미노)에틸]벤조산; 류코트리엔 B4 길항제, 예를 들어 1-(3-비페닐-4-일메틸-4-히드록시-크로만-7-일)-시클로펜탄카르복실산; 5-리폭시게나제 억제제; 및 나트륨 채널 차단제.
섬유근통증
증후군
제품: 진통제, 예를 들어 아세트아미노펜, 나프록센 나트륨, 이부프로펜, 트라마돌, 트라조돈; 시클로벤자프린; 아스피린, 셀레콕시브, 발데콕시브, 인도메타신, 및 다른 NSAID; 항우울제, 예를 들어 삼환계 항우울제 및 선택적 세로토닌 재흡수 억제제, 예를 들어 항우울제, 예를 들어 아미트립틸린, 이미프라민, 노르트립틸린, 독세핀, 플루옥세틴, 세르트랄린 및 파록세틴; 근육 이완제, 예를 들어 시클로벤자프린; 수면 보조제, 예를 들어 졸피뎀.
클래스: 노르에피네프린-세로토닌 재흡수 억제제 (NSRI 및 SNRI); 노르에피네프린 재흡수 억제제 (NRI); 선택적 세로토닌 재흡수 억제제 (SSRI); 삼환계 항우울제; 선택적 시클로옥시게나제-2 (COX-2) 억제제; 비스테로이드성 소염 약물 (NSAID); 진통제.
강직성 척추염
제품: 진통제, 예를 들어 아세트아미노펜, 나프록센 나트륨, 이부프로펜, 트라마돌, 아스피린, 셀레콕시브, 발데콕시브, 인도메타신 및 다른 NSAID; 질병-변형 항류마티스 약물 (DMARD), 예를 들어 술파살라진 또는 메토트렉세이트; 코르티코스테로이드; 및 종양 괴사 인자 (TNF) 차단제, 예를 들어 에타네르셉트 및 인플릭시맙.
클래스: 진통제; NSAID; COX-2 억제제; DMARD; 코르티코스테로이드; TNF 차단제.
건선
제품: 광선요법, 예를 들어 소랄렌 자외선 A (소랄렌 UVA 또는 PUVA) 요법, 협범위 자외선 B (UVB) 요법, 및 조합 광선 요법; 국소 코르티코스테로이드; 비타민 D 유사체, 예를 들어 칼시포트리엔; 안트랄린; 국소 레티노이드 (즉, 비타민 A 유도체), 예를 들어 아시트레틴 및 타자로텐; 클로베타솔 프로피오네이트; 메토트렉세이트; 아자티오프린; 시클로스포린; 히드록시우레아; 및 면역 조절 약물, 예를 들어 알레파셉트, 에팔리주맙 및 에타네르셉트.
클래스: 광선요법; 코르티코스테로이드; 비타민 D 유사체; 비타민 A 유도체.
통풍
제품: NSAID, 예를 들어 아세트아미노펜, 나프록센 나트륨, 이부프로펜, 트라마돌, 아스피린, 셀레콕시브, 발데콕시브 및 인도메타신; 및 코르티코스테로이드, 예를 들어 프레드니존.
클래스: 진통제; NSAID; COX-2 억제제; 및 코르티코스테로이드.
크론병
제품: 진통제, 예를 들어 아세트아미노펜, 나프록센 나트륨, 이부프로펜, 트라마돌, 아스피린, 셀레콕시브, 발데콕시브, 인도메타신 및 다른 NSAID; 소염 약물; 술파살라진, 메살라민, 발살라지드 및 올살라진; 및 코르티코스테로이드, 예를 들어 프레드니존 및 부데소니드; 면역억제 약물, 예를 들어 아자티오프린, 머캅토퓨린, TNF 차단제, 예를 들어 인플릭시맙 및 아달리무맙, 메토트렉세이트 및 시클로스포린; 항생제, 예를 들어 메트로니다졸 및 시프로플록사신; 지사제, 예를 들어 로페라미드; 및 완하제.
클래스: 진통제; NSAID; COX-2 억제제; 소염 약물; TNF 차단제; 항생제; 지사제; 및 완하제.
궤양성 대장염
클래스: 진통제, 예를 들어 아세트아미노펜, 나프록센 나트륨, 이부프로펜, 트라마돌, 아스피린, 셀레콕시브, 발데콕시브, 인도메타신 및 다른 NSAID; 소염 약물; 술파살라진, 메살라민, 발살라지드 및 올살라진; 코르티코스테로이드; 면역억제 약물, 예를 들어 아자티오프린, 머캅토퓨린, TNF 차단제, 예를 들어 인플릭시맙 및 아달리무맙, 메토트렉세이트 및 시클로스포린; 지사제, 예를 들어 로페라미드; 및 완하제.
클래스: NSAID; COX-2 억제제; 소염 약물; TNF 차단제; 코르티코스테로이드; 면역억제제; 자누스 (Janus) 키나제-3 (Jak-3) 억제제; TNF 차단제; 지사제; 및 완하제.
과민성 장 증후군
제품: 지사제, 예를 들어 로페라미드; 완하제; 항콜린성 약물; 항우울제, 예를 들어 삼환계 항우울제 및 선택적 세로토닌 재흡수 억제제, 예를 들어 항우울제, 예를 들어 아미트립틸린, 이미프라민, 노르트립틸린, 독세핀, 플루옥세틴, 세르트랄린 및 파록세틴; 알로세트론; 및 테가세로드.
클래스: 지사제; 완하제; 항콜린성 약물; 노르에피네프린-세로토닌 재흡수 억제제 (NSRI 및 SNRI); 노르에피네프린 재흡수 억제제 (NRI); 선택적 세로토닌 재흡수 억제제 (SSRI); 삼환계 항우울제.
제약 조성물 및 투여
또한, 비정상적인 세포 침윤을 치료하는데 효과적인 양의 본원에 설명된 바와 같은 IL-6 항체 또는 그의 항원 결합 부분, 및 제약상 허용되는 담체를 포함하는, 인간을 포함하는 포유동물에서의 비정상적인 세포 침윤의 치료를 위한 제약 조성물도 제공된다. 조성물은 하나 이상의 다양한 염증성 및 자가면역 질병, 예를 들어 류머티스성 관절염, 죽상경화증, 육아종성 질환, 다발성 경화증, 천식 및 암이 있는 환자에게 치료 이익을 제공한다.
IL-6 항체 및 그의 항원 결합 부분은 대상에 투여하기 적합한 제약 조성물 내로 혼입될 수 있다. 전형적으로, 제약 조성물은 IL-6 항체 또는 항원 결합 부분, 및 제약상 허용되는 담체를 포함한다. "제약상 허용되는 담체"는 생리학적으로 상용성인 임의의 모든 용매, 분산매, 코팅제, 항균제 및 항진균제, 등장성 및 흡수 지연 작용제 등을 의미한다. 제약상 허용되는 담체의 일부 예는 물, 염수, 포스페이트 완충 염수, 덱스트로스, 글리세롤, 에탄올 등 및 이들의 조합물이다. 다수의 경우에, 등장성 물질, 예를 들어, 당, 폴리알콜, 예를 들어 만니톨, 소르비톨, 또는 염화나트륨이 조성물 내에 포함되는 것이 바람직할 것이다. 제약상 허용되는 물질의 추가의 예는 항체의 보관 기간 또는 유효성을 향상시키는 강화시키는 습윤제 또는 미량의 보조 물질, 예를 들어 습윤제 또는 유화제, 방부제, 또는 버퍼이다.
본 발명의 조성물은 다양한 형태, 예를 들어, 액체, 반-고체 및 고체 투여 형태, 예를 들어 액체 용액 (예를 들어, 주사가능 및 주입가능 용액), 분산액 또는 현탁액, 정제, 알약, 분말, 리포좀 및 좌제일 수 있다. 형태는 의도된 투여 방식 및 치료 용도에 좌우된다. 전형적인 조성물은 주사가능 또는 주입가능 용액, 예를 들어 인간의 수동 면역화에 사용되는 것들과 유사한 조성물의 형태이다. 한 경우에, 투여 방식은 비경구 투여 (예를 들어, 정맥내, 피하, 복강내, 근내)이다. 다른 경우에, 항체는 정맥내 주입 또는 주사에 의해 투여된다. 다른 경우에, 항체는 근내 또는 피하 주사에 의해 투여된다. 주사용 제형은 방부제가 첨가되거나 첨가되지 않은 단위 투여 형태, 예를 들어, 앰퓰 또는 다중-용량 용기 내에서 제시될 수 있다. 조성물은 유성 또는 수성 비히클 내의 현탁액, 용액 또는 에멀전과 같은 형태를 취할 수 있고, 현탁, 안정화 및/또는 분산제와 같은 제형제를 함유할 수 있다. 별법으로, 활성 성분은 사용 전에 적합한 비히클, 예를 들어 발열원이 없는 멸균수로 재구성시키기 위한 분말 형태일 수 있다. 필요한 양의 IL-6 항체를, 필요에 따라 상기 열거된 성분 중의 하나 또는 이들의 조합물과 함께 적합한 용매 내에 혼입시킨 후, 여과 멸균시킴으로써 멸균 주사가능 용액이 제조될 수 있다. 하나의 경우에, 본 발명의 항체 또는 항체 부분은 pH가 약 5.0 내지 약 6.5 범위이고, 약 1 ㎎/ml 내지 약 200 ㎎/ml의 항체, 약 1 mM 내지 약 100 mM의 히스티딘 버퍼, 약 0.01 ㎎/ml 내지 약 10 ㎎/ml의 폴리소르베이트 80 또는 폴리소르베이트 20, 트레할로스 및 수크로스로부터 선택되고 이로 제한되지 않는 약 100 mM 내지 약 400 mM의 비환원당, 약 0.01 mM 내지 약 1.0 mM의 이나트륨 EDTA 이수화물을 포함하고 킬레이팅제와 함께 제약상 허용되는 항산화제를 임의로 포함하는 멸균 수용액으로서 제형으로 투여된다. 적합한 항산화제에는 메티오닌, 소듐 티오술페이트, 카탈라제, 및 백금이 포함되고, 이로 제한되지 않는다. 예를 들어, 조성물은 1 mM 내지 약 100 mM 범위, 특히 약 27 mM인 농도의 메티오닌을 함유할 수 있다. 몇몇 경우에, 제형은 20 mM 시트르산나트륨 (pH 5.5)의 버퍼 내의 5 mg/ml의 항체, 140 mM NaCl 및 0.2 mg/ml 폴리소르베이트 80을 함유한다. 투여량 값은 완화될 병태의 유형 및 중증도에 따라 변할 수 있다는 것을 주지하여야 한다. 멸균 주사가능 용액의 제조를 위한 멸균 분말의 경우, 적합한 제조 방법은 그의 사전에 멸균-여과된 용액으로부터 활성 성분 + 임의의 추가의 요구되는 성분의 분말이 생산되는 진공 건조 및 동결 건조이다. 용액의 적합한 유동성은, 예를 들어 코팅제, 예를 들어 레시틴을 사용함으로써, 분산액의 경우 필요한 입자 크기를 유지함으로써, 및 계면활성제를 사용함으로써 유지될 수 있다. 조성물 내에 흡수를 지연시키는 물질, 예를 들어, 모노스테아레이트 염 및 젤라틴을 포함시킴으로써 주사가능 조성물의 장기 흡수를 유지할 수 있다.
IL-6 항체 또는 항원 결합 부분은 다양한 방법으로 투여될 수 있지만, 다수의 치료 용도에 대해, 투여 경로/방식은 피하, 근내 또는 정맥내 주입일 수 있다. 당업자가 이해할 바와 같이, 투여 경로 및/또는 방식은 원하는 결과에 따라 변할 것이다.
특정 경우에, IL-6 항체 조성물은 이식물, 경피 패치 및 마이크로캡슐화 전달 시스템이 포함되는 제어 방출 제형과 같이, 급속한 방출에 대해 항체를 보호하는 담체와 함께 제조될 수 있다. 생분해성, 생체적합성 중합체, 예를 들어 에틸렌 비닐 아세테이트, 폴리무수물, 폴리글리콜산, 콜라겐, 폴리오르토에스테르, 및 폴리락트산이 사용될 수 있다. 상기 제형의 제조를 위한 다수의 방법이 사용될 수 있다. 예를 들어, 그 전문이 본원에 참조로 포함되는 문헌 [Sustained and Controlled Release Drug Delivery Systems, J. R. Robinson, ed., Marcel Dekker, Inc., New York, 1978] 참조.
추가의 활성 화합물이 또한 조성물 내로 혼입될 수 있다. 몇몇 경우에, 억제성 IL-6 항체가 하나 이상의 추가의 치료제와 함께 공동-제형 및/또는 공동-투여된다. 상기 치료제에는 또다른 표적에 결합하는 항체, 항-종양용제, 항-혈관형성제, 신호 전달 억제제, 항-증식제, 화학치료제, 또는 IL-6을 억제하는 펩티드 유사체가 비제한적으로 포함된다. 상기 조합 요법은 억제성 IL-6 항체뿐만 아니라 공동으로 투여되는 물질의 보다 낮은 투여량을 필요로 하여, 상이한 단독요법과 관련된 가능한 독성 또는 합병증을 피할 수 있다.
조성물은 "치료 유효량" 또는 "예방 유효량"의 항체 또는 항원 결합 부분을 포함할 수 있다. "치료 유효량"은 요구되는 치료 결과를 달성하는데 필요한 투여량에서 그리고 기간 동안 이를 달성하는데 효과적인 양을 지칭한다. 항체 또는 항원 결합 부분의 치료 유효량은 개체의 질병 상태, 연령, 성별 및 체중, 및 개체에서 요구되는 반응을 유도하는 항체 또는 항체 부분의 능력과 같은 인자에 따라 변할 수 있다. 또한, 치료 유효량은 치료상 이로운 효과가 항체 또는 항원 결합 부분의 임의의 독성 또는 유해 효과를 능가하는 양이다. "예방 유효량"은 요구되는 예방 결과를 달성하는데 필요한 투여량에서 그리고 기간 동안 이를 달성하는데 효과적인 양을 지칭한다. 전형적으로, 예방 용량은 질환 발생 전에 또는 질환의 초기 단계에 대상에서 사용되기 때문에, 예방 유효량은 치료 유효량보다 적을 수 있다.
최적의 원하는 반응 (예를 들어, 치료 목적의 또는 예방 목적의 반응)을 제공하도록 투약 방법이 조정될 수 있다. 예를 들어, 단일 볼러스가 투여될 수 있거나, 수회의 분할 용량이 경시적으로 투여될 수 있거나, 또는 치료 상황의 긴급성에 따라 용량이 비례적으로 감소 또는 증가될 수 있다. 투여 용이성 및 투여량의 균일성을 위해 투여 단위 형태로 비경구 조성물을 제형화하는 것이 특히 유리하다. 본원에서 사용되는 투여 단위 형태는 치료될 포유동물 대상에 대한 단위 투여량으로서 적합한 물리적으로 구분된 단위를 지칭하고; 각각의 단위는 필요한 제약 담체와 함께 요구되는 치료 효과를 일으키도록 계산된 미리 결정된 양의 IL-6 항체 또는 그의 항원 결합 부분을 함유한다.
IL-6 항체 또는 항체 부분의 치료 또는 예방 유효량에 대한 예시적인 비-제한적 범위는 0.025 내지 50 ㎎/㎏, 0.1 내지 50 ㎎/㎏, 0.1-25, 0.1 내지 10 또는 0.1 내지 3 ㎎/㎏이다. 한 경우에, IL-6 항체 또는 항체 부분은 pH가 약 5.0 내지 약 6.5 범위이고, 약 1 ㎎/㎖ 내지 약 200 ㎎/㎖의 항체, 약 1 mM 내지 약 100 mM의 히스티딘 버퍼, 약 0.01 ㎎/㎖ 내지 약 10 ㎎/㎖의 폴리소르베이트 80, 약 100 mM 내지 약 400 mM의 트레할로스, 및 약 0.01 mM 내지 약 1.0 mM의 이나트륨 EDTA 이수화물을 포함하는 멸균 수용액으로서 제형으로 투여된다. 투여량 값은 완화되는 병태의 유형 및 중증도에 따라 변할 수 있다는 것을 주지하여야 한다. 임의의 특정 대상에 대해, 개별적인 요구 및 조성물을 투여하거나 투여를 감독하는 사람의 전문적인 판단에 따라 시간에 따라 특정 투약 방법이 조정되어야 하고, 본원에 제시된 투여량 범위는 단지 예시적인 것이고 청구된 조성물의 범위 또는 실행을 제한하도록 의도되지 않는 것으로 이해되어야 한다.
본 발명의 다른 측면은 IL-6 항체 또는 항원 결합 부분 또는 상기 항체 또는 항원 결합 부분을 포함하는 조성물을 포함하는 키트를 제공한다. 키트는 항체 또는 조성물에 이외에, 진단제 또는 치료제를 포함할 수 있다. 키트는 진단 또는 치료 방법에서의 사용을 위한 사용 설명서를 또한 포함할 수 있다. 하나의 경우에, 키트는 항체 또는 이를 포함하는 조성물, 및 하기 설명되는 방법에서 사용될 수 있는 진단제를 포함한다. 다른 경우에, 키트는 항체 또는 이를 포함하는 조성물, 및 하기 설명되는 방법에서 사용될 수 있는 하나 이상의 치료제를 포함한다.
진단 목적의 사용 방법
본원에서 제시되는 다른 측면은 진단 방법을 제공한다. 항-IL-6 항체 또는 그의 항원 결합 부분을 사용하여 시험관 내에서 또는 생체 내에서 생물학적 샘플 내의 IL-6을 검출할 수 있다. 한 측면은 항체를 대상 내로 주사하는 단계, 항체가 결합한 곳을 국소화함으로써 대상에서 IL-6의 발현을 결정하는 단계, 대상에서의 발현을 정상적인 참조 대상 또는 표준물의 발현과 비교하는 단계, 및 세포의 존재 또는 위치를 진단하는 단계를 포함하는, 그를 필요로 하는 대상에서 IL-6 발현 세포의 존재 또는 위치를 진단하는 방법을 제공한다. 항-IL-6 항체는 염증에 대한 마커 및/또는 면역 세포, 예를 들어 단핵구 및 T 세포의 조직 내로의 침윤에 대한 마커로서도 사용될 수 있다.
ELISA, RIA, 유동 세포측정, 조직 면역조직화학, 웨스턴 블롯 또는 면역침전을 포함하고 이로 제한되지 않는 임의의 적합한 면역분석에 항-IL-6 항체를 사용할 수 있다. 항-IL-6 항체 또는 그의 항원 결합 부분을 사용하여, 인간으로부터 IL-6을 검출할 수 있다. 다른 경우에, 항-IL-6 항체를 사용하여, 사이노몰거스 원숭이, 붉은털 원숭이 및 설치류, 예를 들어 마우스 및 래트로부터 IL-6을 검출할 수 있다.
생물학적 샘플 내의 IL-6을 검출하는 방법은 생물학적 샘플을 항-IL-6 항체 또는 그의 항원 결합 부분과 접촉시키는 단계 및 결합된 항체를 검출하는 단계를 포함한다. 한 경우에, 항-IL-6 항체 또는 그의 항원 결합 부분은 검출가능한 표지로 직접적으로 표지된다. 다른 경우에, 항-IL-6 항체 (제1 항체)는 표지되지 않고, 제2 항체 또는 항-IL-6 항체에 결합할 수 있는 다른 분자가 표지된다. 특정 종 및 클래스의 제1 항체에 특이적으로 결합할 수 있는 제2 항체가 선택된다. 예를 들어, 항-IL-6 항체가 인간 IgG이면, 제2 항체는 항-인간-IgG 항체일 수 있다. 항체에 결합할 수 있는 다른 분자에는 단백질 A 및 단백질 G (예를 들어, 둘 모두 피어스 케미칼 컴퍼니 (Pierce Chemical Co.)로부터 상업적으로 이용가능함)가 비제한적으로 포함된다.
항체 또는 2차 항체에 대한 적합한 표지는 본원에서 개시되고, 상이한 효소, 보조군, 형광 물질, 발광 물질 및 방사성 물질을 포함한다. 적합한 효소의 예는 양고추냉이 퍼옥시다제, 알칼리성 포스파타제, β-갈락토시다제, 또는 아세틸콜린에스테라제를 포함하고; 적합한 보조군 복합체의 예는 스트렙타비딘/비오틴 및아비딘/비오틴을 포함하고; 적합한 형광 물질의 예는 움벨리페론, 플루오레세인, 플루오레세인 이소티오시아네이트, 로다민, 디클로로트리아지닐아민 플루오레세인, 단실 클로라이드 또는 피코에리트린을 포함하고; 발광 물질의 예는 루미놀을 포함하고; 적합한 방사성 물질의 예는 125I, 131I, 35S 또는 3H를 포함한다.
또한, IL-6은 검출가능한 물질로 표지된 IL-6 표준물 및 표지되지 않은 항-IL-6 항체를 사용하는 경쟁 면역분석에 의해 생물학적 샘플에서 분석될 수 있다. 이러한 분석법에서, 생물학적 샘플, 표지된 IL-6 표준물 및 항-IL-6 항체가 조합되고, 표지되지 않은 항체에 결합된 표지된 IL-6 표준물의 양이 결정된다. 생물학적 샘플 내의 IL-6의 양은 항-IL-6 항체에 결합된 표지된 IL-6 표준물의 양에 반비례한다.
많은 목적을 위해 상기 면역분석을 사용할 수 있다. 예를 들어, 배양된 세포 내의 IL-6를 검출하기 위해 항-IL-6 항체 또는 그의 항원 결합 부분이 사용될 수 있다. 한 경우에, 상이한 화합물로 처리된 세포의 표면 상의 IL-6의 양을 결정하기 위해 항-IL-6 항체 또는 그의 항원 결합 부분이 사용된다. 이러한 방법을 사용하여, IL-6 단백질 수준을 조정하는 화합물을 확인할 수 있다. 이러한 방법에 따르면, 하나의 세포 샘플을 일정 기간 동안 시험 화합물로 처리하고, 다른 샘플은 처리하지 않은 상태로 유지한다. 총 IL-6 발현을 측정하려는 경우, 세포를 용해시키고, 총 IL-6 발현을 임의의 적합한 면역분석을 사용하여 측정한다. 처리된 세포 대 처리되지 않은 세포에서의 총 IL-6 발현을 비교하여, 시험 화합물의 효과를 결정한다.
총 IL-6 발현을 측정하기 위한 면역분석은 유동 세포측정 또는 면역조직화학을 포함한다. 세포 표면 IL-6 발현을 측정하려는 경우, 세포를 용해시키지 않고, IL-6의 세포 표면 수준을 상기 설명된 면역분석 중의 하나를 사용하여 측정한다. IL-6의 세포 표면 수준을 결정하기 위한 바람직한 면역분석은 세포 표면 단백질을 검출가능한 표지, 예를 들어 비오틴 또는 125I로 표지하는 단계, IL-6를 항-IL-6 항체로 면역침전시키는 단계 및 이어서 표지된 IL-6를 검출하는 단계를 포함한다.
IL-6의 국소화, 예를 들어, 세포 표면 수준을 결정하기 위한 다른 면역분석은 면역조직화학의 사용에 의한 방법이다. IL-6의 세포 표면 수준을 검출하기 위한 면역분석은 적절한 형광단, 예를 들어 플루오레세인 또는 피코에리트린으로 표지된 항-IL-6 항체의 결합, 및 유동 세포측정을 사용한 1차 항체의 검출을 포함한다. 다른 예에서, 항-IL-6 항체는 표지되지 않고, 제2 항체 또는 항-IL-6 항체에 결합할 수 있는 다른 분자가 표지된다. ELISA, RIA, 유동 세포측정, 웨스턴 블롯, 면역조직화학, 통합 막 단백질의 세포 표면 표지, 및 면역침전과 같은 방법이 당업계에 공지되어 있다 (예를 들어, 문헌 [Harlow and Lane, 상기 문헌] 참조). 또한, IL-6의 활성화 또는 억제에 대해 매우 많은 화합물을 시험하기 위한 초고속 스크리닝을 위해 면역분석의 규모를 확대할 수 있다.
또한, 항-IL-6 항체 또는 그의 항원 결합 부분은 조직 또는 조직으로부터 유래된 세포 내의 IL-6의 수준을 결정하기 위해 사용될 수 있다. 일부 예에서, 조직은 질병 조직 또는 조직 생검이다. 조직 또는 생검을 면역분석에서 사용하여, 예를 들어 상기 논의된 방법에 의해 총 IL-6 발현, IL-6의 세포 표면 수준 또는 IL-6의 국소화를 예를 들어 결정한다. 이같은 방법은 조직이 높은 수준의 IL-6을 발현하는지의 여부를 결정하는데 사용될 수 있고, 이러한 높은 수준은 조직이 항-IL-6 항체를 사용한 치료를 대한 표적이라는 것을 나타낼 수 있다.
또한, IL-6를 발현하는 조직 또는 기관을 확인하기 위해 IL-6 항체 및 그의 항원 결합 부분이 생체 내에서 사용될 수 있다. 몇몇 경우에, 항-IL-6 항체가 IL-6-발현 세포를 확인하는데 사용된다. 인간 항-IL-6 항체는 비-인간 기원의 항체 또는 인간화 또는 키메라 항체와 달리, 투여시 항체에 대한 실질적인 면역 반응을 유발하지 않으면서 생체 내에서 안전하게 사용될 수 있다.
상기 방법은 검출가능하게 표지된 항-IL-6 항체 또는 이를 포함하는 조성물을 상기 진단 시험을 필요로 하는 환자에게 투여하는 단계 및 환자에게 영상화 분석을 수행하여 IL-6-발현 조직의 위치를 결정하는 단계를 포함한다. 영상화 분석은 의료 분야에 공지되어 있고, x선 분석, 자기 공명 영상화 (MRI) 또는 전산화 단층촬영술 (CT)이 비제한적으로 포함된다. 생체내 영상화에 적합한 임의의 물질, 예를 들어 x선 분석에 사용될 수 있는 조영제, 예를 들어 바륨, 또는 MRI 또는 CT에 사용될 수 있는 자기 조영제, 예를 들어 가돌리늄 킬레이트로 항체가 표지될 수 있다. 다른 표지제는 방사성 동위원소, 예를 들어 99Tc를 비제한적으로 포함한다. 다른 경우에, 항-IL-6 항체는 표지되지 않고, 검출가능하고 항-IL-6 항체에 결합할 수 있는 제2 항체 또는 다른 분자를 투여함으로써 항-IL-6 항체가 영상화될 것이다. 한 예에서, 관심있는 조직이 IL-6을 발현하는지의 여부를 결정하기 위해 환자로부터 생검을 수득한다.
검출가능하게 표지된 항-IL-6은 형광단을 포함할 수 있다. 특정한 경우에, 형광단은 근적외선 형광 염료, 디니트로페닐, 플루오레세인 및 그의 유도체, 로다민, 로다민의 유도체, 피코에리트린, 피코시아닌, 알로피코시아닌, o-프탈데히드 및 플루오레스카민, 텍사스 레드 (Texas red), 로다민 그린, 오레곤 그린 (Oregon green), 케스케이드 블루 (Cascade blue), 피코에리트린, CY3, CY5, CY2, CY7, 쿠마린, 적외선 40, MR 200, IRD 40, 알렉사 플루오르 (Alexa Fluor), 케스케이드 블루, 테트라메틸로다민, 퍼시픽 블루 (Pacific Blue), SYBR, 및 BODIPY로 이루어지는 군 중에서 선택된다. 다른 예에서, 형광단은 다음 화합물 (그의 최대 방출 파장은 괄호 내에 nm로 표시함) 중의 하나를 포함한다: Cy2.TM. (506), GFP (적색 편이됨) (507), YO-PRO®-1 (509), YOYO®-1 (509), 칼세인 (517), FITC (518), FluorX® (519), 알렉사® (520), 로다민 110 (520), 5-FAM (522), 오레곤 그린® 500 (522), 오레곤 그린® 488 (524), 리보그린 (RiboGreen)® (525), 로다민 그린® (527), 로다민 123 (529), 마그네슘 그린 (Magnesium Green)® (531), 칼슘 그린 (Calcium Green® (533), TO-PRO®-1 (533), TOTO®-1 (533), JOE (548), BODIPY® 530/550 (550), Dil (565), BODIPY® (568), BODIPY® 558/568 (568), BODIPY® 564/570 (570), Cy3® (570), 알렉사® 546 (570), TRITC (572), 마그네슘 오렌지 (Magnesium Orange)® (575), 피코에리트린 R&B (575), 로다민 팔로이딘 (575), 칼슘 오렌지 (Calcium Orange)® (576), 피로닌 Y (580), 로다민 B (580), TAMRA (582), 로다민 레드® (590), Cy3.5® (596), ROX (608), 칼슘 크림슨 (Calcium Crimson).TM. (615), 알렉사® 594 (615), 텍사스 레드.RTM. (615), 나일 레드 (Nile Red) (628), YO-PRO®-3 (631), YOYO®-3 (631), R-피코시아닌 (642), C-피코시아닌 (648), TO-PRO®-3 (660), TOTO®-3 (660), DiD DilC(5) (665), Cy5.TM. (670), 티아디키르보시아닌 (671) 및 Cy5.5 (694).
또다른 예에서, 항-IL-6 항체는 또한 세포, 예를 들어, 림프구 또는 단핵구 상의 IL-6의 표면 세포 발현의 감소를 결정하기 위해 사용될 수 있다.
인간 항-IL-6 항체 또는 그의 항원 결합 부분은 비-인간 또는 비-인간-유도체화된 모노클로날 항체 (Mab)에 고유한 면역 및 알레르기 반응을 최소화시켜 투여된 항체 또는 그의 항원 결합 부분의 효능 및 안전성을 증가시킨다.
다른 측면은 부분적으로 인간 생식계열 서열에 의해 코딩되는 인간 항-IL-6 항체를 제공한다. VH, Vκ, Vλ 유전자는 서열 상동성을 기초로 하여 패밀리로 분류된다. 2개의 VH, Vκ, Vλ 유전자는 80% 초과의 위치에서 동일한 뉴클레오티드 서열을 공유할 경우 동일한 패밀리에 속한다. 항-IL-6 항체는 인간 카파 경쇄 (Vκ) 또는 인간 람다 경쇄 (Vλ) 또는 그로부터 유도되는 아미노산 서열을 포함할 수 있다. 람다 경쇄를 포함하는 몇몇 경우에, 경쇄 가변 도메인 (VL)은 부분적으로 인간 Vλ1, Vλ2, Vλ3, Vλ4, Vλ5, Vλ6, Vλ7, Vλ8, Vλ9, 또는 Vλ10 패밀리 유전자에 의해 코딩된다 (Williams S.C. et al. J. Mol. Bio. 264:220-232, 1996). 카파 경쇄를 포함하는 몇몇 경우에, 경쇄 가변 도메인 (VL)은 부분적으로 인간 VκI, VκII, VκIII, VκIV, VκV, 또는 VκVI 패밀리 유전자 (Cox J. P. L., et al, Eur. J. Immunol 24:827-836, 1994), 바람직하게는 VκI, VκII, VκIII, 또는 VκIV 패밀리 유전자, 바람직하게는 VκI 또는 VκVI 패밀리 유전자에 의해 코딩된다. 몇몇 경우에, 경쇄 생식계열 서열은 A1, A10, A11, A14, A17, A18, A19, A2, A20, A23, A26, A27, A3, A30, A5, A7, B2, B3, L1, L10, L11, L12, L14, L15, L16, L18, L19, L2, L20, L22, L23, L24, L25, L4/18a, L5, L6, L8, L9, O1, O11, O12, O14, O18, O2, O4, 및 O8을 포함하고 이로 제한되지 않는 인간 Vκ 서열로부터 선택된다. 특정한 경우에, 상기 경쇄 인간 생식계열 프레임워크는 V1-11, V1-13, V1-16, V1-17, V1-18, V1-19, V1-2, V1-20, V1-22, V1-3, V1-4, V1-5, V1-7, V1-9, V2-1, V2-11, V2-13, V2-14, V2-15, V2-17, V2-19, V2-6, V2-7, V2-8, V3-2, V3-3, V3-4, V4-1, V4-2, V4-3, V4-4, V4-6, V5-1, V5-2, V5-4, 및 V5-6으로부터 선택된다. 항-IL-6 항체는 인간 VH1, VH2, VH3, VH4, VH5, VH6 또는 VH7 패밀리 유전자에 의해 코딩되는 중쇄 가변 도메인 (VH)을 포함할 수 있다. 특정 예에서, 상기 중쇄 인간 생식계열 프레임워크는 VH1-18, VH1-2, VH1-24, VH1-3, VH1-45, VH1-46, VH1-58, VH1-69, VH1-8, VH2-26, VH2-5, VH2-70, VH3-11, VH3-13, VH3-15, VH3-16, VH3-20, VH3-21, VH3-23, VH3-30, VH3-33, VH3-35, VH3-38, VH3-43, VH3-48, VH3-49, VH3-53, VH3-64, VH3-66, VH3-7, VH3-72, VH3-73, VH3-74, VH3-9, VH4-28, VH4-31, VH4-34, VH4-39, VH4-4, VH4-59, VH4-61, VH5-51, VH6-1, 및 VH7-81로부터 선택된다. 특정 경우에, 경쇄 가변 구역 및/또는 중쇄 가변 구역은 프레임워크 구역 또는 적어도 프레임워크 구역의 일부 (예를 들어, 2 또는 3개의 하위구역, 예를 들어 FR2 및 FR3을 함유하는)를 포함한다. 특정한 경우에, 적어도 FRL1, FRL2, FRL3, 또는 FRL4는 완전 인간이다. 다른 예에서, 적어도 FRH1, FRH2, FRH3, 또는 FRH4는 완전 인간이다. 몇몇 경우에, 적어도 FRL1, FRL2, FRL3, 또는 FRL4는 생식계열 서열 (예를 들어, 인간 생식계열)이거나 또는 특정 프레임워크에 대한 인간 컨센서스 서열 (본원에서 설명되는 공지의 인간 Ig 서열의 공급원으로부터 쉽게 이용가능함)을 포함한다. 다른 예에서, 적어도 FRH1, FRH2, FRH3, 또는 FRH4는 생식계열 서열 (예를 들어, 인간 생식계열)이거나 또는 특정 프레임워크에 대한 인간 컨센서스 서열을 포함한다.
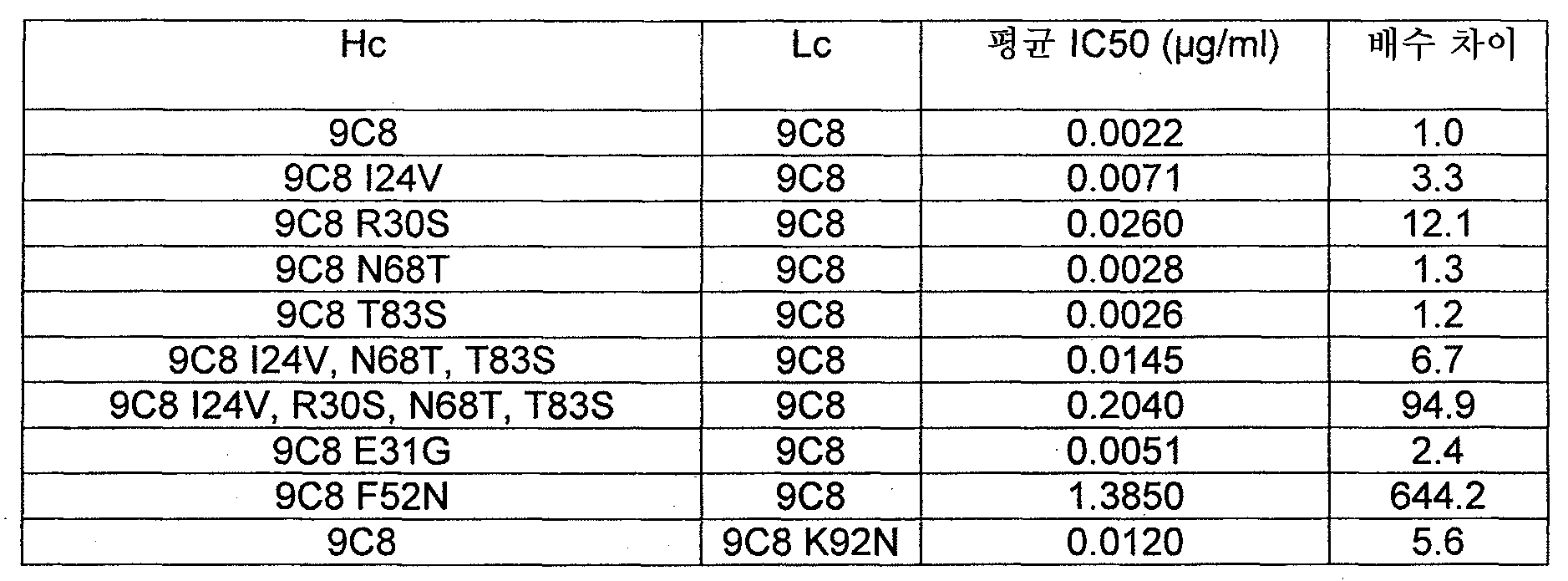
IL-6 항체의 VL은 인간 유전자의 생식계열 아미노산 서열에 비해 하나 이상의 아미노산 치환을 포함할 수 있다. 몇몇 경우에, IL-6 항체의 VL은 생식계열 아미노산 서열에 비해 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개의 아미노산 치환을 포함한다. 한 예에서, 생식계열로부터의 하나 이상의 상기 치환은 경쇄의 CDR 구역에서 이루어진다. 한 예에서, 생식계열에 비해 아미노산의 치환은 항체 9C8 IgG1, 9C8 IgG2, 9C8 N68T T83S IgG1, 9C8 N68T T83S IgG2, 9C8 E31G N68T T83S IgG1, 9C8 E31G N68T T83S IgG2, 9C8 I24V N68T T83S IgG1, 9C8 I24V N68T T83S IgG2 및 22B5 IgG1의 임의의 하나 이상의 VL 내의 생식계열에 비해 치환과 동일한 위치의 하나 이상에서 이루어진다. 예를 들어, IL-6 항체의 VL은 항체 9C8 IgG1의 VL에서 발견되는 생식계열에 비해 하나 이상의 아미노산 치환을 함유할 수 있다. 몇몇 경우에, 아미노산 변경은 하나 이상의 동일한 위치에서 이루어지지만, 참조 항체에서보다 상이한 치환을 포함한다.
몇몇 경우에, 생식계열에 비해 아미노산 변경은 항체 9C8 IgG1, 9C8 IgG2, 9C8 N68T T83S IgG1, 9C8 N68T T83S IgG2, 9C8 E31G N68T T83S IgG1, 9C8 E31G N68T T83S IgG2, 9C8 I24V N68T T83S IgG1, 9C8 I24V N68T T83S IgG2 및 22B5 IgG1의 임의의 VL과 동일한 위치의 하나 이상에서 발생하지만, 변경은 참조 항체의 아미노산에 비해 상기 위치(들)에서의 보존적 아미노산 치환을 나타낼 수 있다. 예를 들어, 이들 항체 중의 하나 내의 특정 위치가 생식계열에 비해 변경되고 글루타메이트일 경우, 상기 위치에서 아스파르테이트로 치환할 수 있다. 유사하게, 생식계열에 비해 아미노산 치환이 세린일 경우, 상기 위치에서 세린을 트레오닌으로 보존적으로 치환할 수 있다.
몇몇 경우에, 인간 항-IL-6 항체의 경쇄는 항체 9C8 IgG1, 9C8 IgG2, 9C8 N68T T83S IgG1, 9C8 N68T T83S IgG2, 9C8 E31G N68T T83S IgG1, 9C8 E31G N68T T83S IgG2, 9C8 I24V N68T T83S IgG1, 9C8 I24V N68T T83S IgG2 및 22B5 IgG1의 VL 아미노산 서열 또는 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개 이하의 보존적 아미노산 치환 및/또는 총 3개 이하의 비-보존적 아미노산 치환을 갖는 아미노산 서열을 포함한다. 몇몇 경우에, 경쇄는 CDR1의 개시부로부터 임의의 하나의 상기 항체의 CDR3의 종결부까지의 아미노산 서열을 포함한다.
몇몇 경우에, 경쇄는 각각 항체 9C8 IgG1, 9C8 IgG2, 9C8 N68T T83S IgG1, 9C8 N68T T83S IgG2, 9C8 E31G N68T T83S IgG1, 9C8 E31G N68T T83S IgG2, 9C8 I24V N68T T83S IgG1, 9C8 I24V N68T T83S IgG2 및 22B5 IgG1의 경쇄 CDR1, CDR2 및 CDR3으로부터 독립적으로 선택되는 CDR1, CDR2 및 CDR3 구역, 또는 각각 4개 미만 또는 3개 미만의 보존적 아미노산 치환 및/또는 총 3개 이하의 비-보존적 아미노산 치환을 갖는 CDR 구역을 포함할 수 있다. 몇몇 경우에, 항-IL-6 항체의 경쇄는 각각 모노클로날 항체 9C8 IgG1, 9C8 IgG2, 9C8 N68T T83S IgG1, 9C8 N68T T83S IgG2, 9C8 E31G N68T T83S IgG1, 9C8 E31G N68T T83S IgG2, 9C8 I24V N68T T83S IgG1, 9C8 I24V N68T T83S IgG2 및 22B5 IgG1의 경쇄 CDR1, CDR2 및 CDR3 구역으로부터 독립적으로 선택되는 경쇄 CDR1, CDR2, 및 CDR3을 포함한다. 특정한 경우에, 항-IL-6 항체의 경쇄는 9C8 IgG1, 9C8 IgG2, 9C8 N68T T83S IgG1, 9C8 N68T T83S IgG2, 9C8 E31G N68T T83S IgG1, 9C8 E31G N68T T83S IgG2, 9C8 I24V N68T T83S IgG1, 9C8 I24V N68T T83S IgG2 및 22B5 IgG1로부터 선택되는 항체의 VL 구역의 아미노산 서열을 포함하는 항체의 경쇄 CDR1, CDR2 및 CDR3 구역 또는 각각 4개 미만 또는 3개 미만의 보존적 아미노산 치환 및/또는 총 3개 이하의 비-보존적 아미노산 치환을 갖는 CDR 구역을 포함한다.
몇몇 경우에, 가변 도메인 (VH)은 적어도 부분적으로 인간 유전자에 의해 코딩된다. 몇몇 경우에, IL-6 항체의 VH 서열은 생식계열 아미노산 서열에 비해 하나 이상의 아미노산 치환, 결실 또는 삽입 (부가)을 포함한다. 몇몇 경우에, 중쇄의 가변 도메인은 생식계열 아미노산 서열로부터 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 또는 17개의 돌연변이를 포함한다. 몇몇 경우에, 돌연변이(들)은 생식계열 아미노산 서열에 비해 비-보존적 치환, 결실 또는 삽입이다. 일부 예에서, 돌연변이는 중쇄의 CDR 구역 내에 존재한다. 일부 예에서, 아미노산 변경은 항체 9C8 IgG1, 9C8 IgG2, 9C8 N68T T83S IgG1, 9C8 N68T T83S IgG2, 9C8 E31G N68T T83S IgG1, 9C8 E31G N68T T83S IgG2, 9C8 I24V N68T T83S IgG1, 9C8 I24V N68T T83S IgG2 및 22B5 IgG1의 임의의 하나 이상의 VH 내의 생식계열로부터의 돌연변이와 동일한 위치의 하나 이상에서 이루어진다. 다른 예에서, 아미노산 변경은 하나 이상의 동일한 위치에서 이루어지지만, 참조 항체에서보다 상이한 돌연변이를 포함한다.
몇몇 경우에, 중쇄는 항체 9C8 IgG1, 9C8 IgG2, 9C8 N68T T83S IgG1, 9C8 N68T T83S IgG2, 9C8 E31G N68T T83S IgG1, 9C8 E31G N68T T83S IgG2, 9C8 I24V N68T T83S IgG1, 9C8 I24V N68T T83S IgG2 및 22B5 IgG1의 VH 아미노산 서열을 포함하고, 상기 VH 아미노산 서열은 1, 2, 3, 4, 6, 8, 또는 10개 이하의 보존적 아미노산 치환 및/또는 총 3개 이하의 비-보존적 아미노산 치환을 갖는다. 일부 예에서, 중쇄는 CDR1의 개시부로부터 임의의 하나의 상기 항체의 CDR3의 종결부까지의 아미노산 서열을 포함한다.
몇몇 경우에, 중쇄는 항체 9C8 IgG1, 9C8 IgG2, 9C8 N68T T83S IgG1, 9C8 N68T T83S IgG2, 9C8 E31G N68T T83S IgG1, 9C8 E31G N68T T83S IgG2, 9C8 I24V N68T T83S IgG1, 9C8 I24V N68T T83S IgG2 및 22B5 IgG1의 중쇄 CDR1, CDR2 및 CDR3 구역 또는 각각 8개 미만, 6개 미만, 4개 미만, 또는 3개 미만의 보존적 아미노산 치환 및/또는 총 3개 이하의 비-보존적 아미노산 치환을 갖는 CDR 구역을 포함한다.
몇몇 경우에, 중쇄 CDR 구역은 항체 9C8 IgG1, 9C8 IgG2, 9C8 N68T T83S IgG1, 9C8 N68T T83S IgG2, 9C8 E31G N68T T83S IgG1, 9C8 E31G N68T T83S IgG2, 9C8 I24V N68T T83S IgG1, 9C8 I24V N68T T83S IgG2 및 22B5 IgG1의 CDR 구역으로부터 독립적으로 선택된다. 다른 경우에, 중쇄는 9C8 IgG1, 9C8 IgG2, 9C8 N68T T83S IgG1, 9C8 N68T T83S IgG2, 9C8 E31G N68T T83S IgG1, 9C8 E31G N68T T83S IgG2, 9C8 I24V N68T T83S IgG1, 9C8 I24V N68T T83S IgG2 및 22B5 IgG1로부터 선택되는 2 이상의 VH 구역으로부터 독립적으로 선택되는 CDR 구역을 포함한다.
다른 경우에, 항체는 경쇄 및 중쇄를 포함한다. 다른 예에서, 경쇄 CDR 및 중쇄 CDR은 동일한 항체로부터 유래한 것이다.
실시될 수 있는 한 종류의 아미노산 치환은 화학적으로 반응성일 수 있는 항체 내의 하나 이상의 시스테인을, 다른 잔기, 예를 들어 비제한적으로 알라닌 또는 세린으로 변경하는 것이다. 한 예에서, 비-정규 (canonical) 시스테인의 치환이 존재한다. 치환은 가변 도메인의 CDR 또는 프레임워크 구역 또는 항체의 불변 도메인 내에서 이루어질 수 있다. 몇몇 경우에, 시스테인은 정규 시스테인이다.
실시될 수 있는 다른 종류의 아미노산 치환은 항체 내의 임의의 잠재적인 단백질 분해 부위를 변경하는 것이다. 상기 부위는 가변 도메인의 CDR 또는 프레임워크 구역 또는 항체의 불변 도메인 내에서 발생할 수 있다. 시스테인 잔기의 치환 및 단백질 분해 부위의 제거는 항체 생성물 내의 임의의 불균일성의 위험을 감소시켜 그의 균일성을 증가시킬 수 있다. 다른 종류의 아미노산 치환은 잔기의 하나 또는 둘 모두를 변경시킴으로써, 잠재적인 탈아미드화 부위를 형성하는 아스파라긴-글라이신쌍을 제거하는 것이다.
특정한 경우에, IL-6 항체의 중쇄 및 경쇄는 임의로 신호 서열을 포함할 수 있다.
몇몇 경우에, 항체는 모노클로날 항체 9C8 IgG1, 9C8 IgG2, 9C8 N68T T83S IgG1, 9C8 N68T T83S IgG2, 9C8 E31G N68T T83S IgG1, 9C8 E31G N68T T83S IgG2, 9C8 I24V N68T T83S IgG1, 9C8 I24V N68T T83S IgG2 및 22B5 IgG1의 중쇄 및 경쇄 변이체를 포함한다. 실시예 3에서 보다 상세하게 논의되는 바와 같이, 생식계열 CDR 구역 내의 것과 매치되도록 많은 중쇄 및 경쇄 변이체 돌연변이가 이루어졌다. 생식계열 버전에 대응하도록 돌연변이된 특정 아미노산은 생식계열 대 비-생식계열 항체의 서열을 비교함으로써 당업자가 쉽게 알 수 있다. 예를 들어, 한 아미노산 치환이 항체 9C8의 중쇄에 제시되고, 여기서 잔기 24의 이소류신은 발린으로 변경되고, 9C8 I24V으로 언급된다. 예시적인 다른 아미노산 치환은 항체 9C8의 경쇄에 존재하고, 잔기 92의 라이신을 아스파라긴으로 치환하고, 9C8 K92N으로 언급된다.
이해되는 바와 같이, 유전자 이용 분석은 항체 구조의 한정된 개관만을 제공한다. 인간 B-세포는 확률적으로 V-D-J 중쇄 또는 V-J 카파 경쇄 전사체를 생성하기 때문에, 다수의 2차 과정이 발생하고, 여기에는 체세포 과다돌연변이, 부가, 및 CDR3 확장이 비제한적으로 포함된다. 따라서, 항체 구조를 추가로 조사하기 위해, 항체의 예상 아미노산 서열을 클론으로부터 수득된 cDNA로부터 생성하였다. 또한, N-말단 아미노산 서열을 단백질 서열결정을 통해 수득하였다.
항-
IL
-6 항체의 클래스 및 서브클래스
IL-6 항체의 클래스 (예를 들어, IgG, IgM, IgE, IgA, 또는 IgD) 및 서브클래스 (예를 들어 IgG1, IgG2, IgG3, 또는 IgG4)를 임의의 적합한 방법에 의해 결정할 수 있다. 일반적으로, 항체의 클래스 및 서브클래스를 항체의 특정 클래스 및 서브클래스에 특이적인 항체를 사용하여 결정할 수 있다. 이같은 항체는 상업적으로 이용가능하다. ELISA, 또는 웨스턴 블롯 및 다른 기술에 의해 클래스 및 서브클래스를 결정할 수 있다.
별법으로, 항체의 중쇄 및/또는 경쇄의 불변 도메인의 전체 또는 일부를 서열결정하는 단계, 이들의 아미노산 서열을 면역글로불린의 상이한 클래스 및 서브클래스의 공지된 아미노산 서열과 비교하는 단계, 및 항체의 클래스 및 서브클래스를 결정하는 단계에 의해 클래스 및 서브클래스를 결정할 수 있다. IL-6 항체는 IgG, IgM, IgE, IgA, 또는 IgD 분자일 수 있다. 예를 들어, IL-6 항체는 IgG1, IgG2, IgG3, 또는 IgG4 서브클래스인 IgG일 수 있다. 한 예에서, IL-6 항체는 IgG2 서브클래스이다. 다른 예에서, IL-6 항체는 IgG1 서브클래스이다.
한 측면에서, IL-6 항체의 클래스 또는 서브클래스를 다른 클래스 또는 서브클래스로 전환시키는 방법이 제공된다. 몇몇 경우에, CL 또는 CH를 코딩하는 서열을 포함하지 않는 VL 또는 VH를 코딩하는 핵산 분자가 임의의 적합한 방법을 사용하여 단리된다. 이어서, 핵산 분자는 요구되는 면역글로불린 클래스 또는 서브클래스로부터의 CL 또는 CH를 코딩하는 핵산 서열에 작동가능하게 연결된다. 이는 상기 설명된 바와 같이 CL 또는 CH 사슬을 포함하는 벡터 또는 핵산 분자를 사용하여 달성될 수 있다. 예를 들어, 원래는 IgM인 IL-6 항체를 IgG로 클래스를 전환시킬 수 있다. 또한, 클래스 전환을 사용하여 한 IgG 서브클래스를 다른 IgG 서브클래스로, 예를 들어, IgG1에서 IgG2로 변환시킬 수 있다. 요구되는 이소형을 포함하는 항체를 생산하는 다른 방법은 IL-6 항체의 중쇄를 코딩하는 핵산 및 IL-6 항체의 경쇄를 코딩하는 핵산을 단리하는 단계, VH 구역을 코딩하는 서열을 단리하는 단계, VH 서열을 요구되는 이소형의 중쇄 불변 도메인을 코딩하는 서열에 라이게이션시키는 단계, 경쇄 유전자 및 중쇄 구성체를 세포에서 발현시키는 단계, 및 요구되는 이소형의 IL-6 항체를 수집하는 단계를 포함한다.
IL
-6에 대한
IL
-6 항체의 결합 친화도
IL-6에 대한 항-IL-6 항체의 결합 친화도 및 해리 속도는 임의의 적합한 방법에 의해 결정될 수 있다. ELISA, RIA, 유동 세포측정 및 표면 플라즈몬 공명, 예를 들어 BIACORE™에 의해 결합 친화도를 측정할 수 있다. 해리 속도는 표면 플라즈몬 공명에 의해 측정될 수 있다. 임의의 적합한 방법을 사용하여 한 항체의 KD가 항-IL-6 항체와 실질적으로 동일한 지의 여부를 결정할 수 있다. 실시예 7은 항-IL-6 모노클로날 항체의 친화도 상수를 결정하기 위한 방법을 예시한다.
항-
IL
-6 항체에 의해 인식되는
IL
-6
에피토프의
확인
임의의 적합한 방법을 사용하여 항체가 IL-6 항체와 동일한 에피토프에 결합하는지 또는 결합을 위해 이와 교차-경쟁하는지 여부를 결정할 수 있다. 한 예에서, IL-6 항체를 포화 조건 하에 IL-6에 결합하도록 한 후, IL-6에 결합하는 시험 항체의 능력을 측정한다. 시험 항체가 IL-6 항체와 동시에 IL-6에 결합할 수 있다면, 시험 항체는 IL-6 항체와 상이한 에피토프에 결합한다. 그러나, 시험 항체가 동시에 IL-6에 결합할 수 없으면, 시험 항체는 동일한 에피토프, 중첩 에피토프, 또는 인간 IL-6 항체에 의해 결합된 에피토프에 아주 근접하는 에피토프에 결합한다. 상기 실험은 ELISA, RIA, BIACORE™, 또는 유동 세포측정 (FACS)을 사용하여 수행할 수 있다.
IL-6 항체가 다른 IL-6 항체와 교차-경쟁하는지의 여부를 시험하기 위해, 상기 설명된 경쟁 방법을 2가지 방향으로 사용할 수 있다. 즉, 참조 항체가 시험 항체를 차단하는지 및 시험 항체가 참조 항체를 차단하는지를 결정할 수 있다. 한 예에서, 실험은 ELISA를 사용하여 수행한다.
항체의 생산 방법
통상적인 모노클로날 항체 방법, 예를 들어 문헌 [Kohler and Milstein (1975) Nature 256: 495]의 표준 체세포 혼성화 기술을 포함하는 다양한 기술에 의해 IL-6 항체 또는 그의 항원 결합 부분을 생산할 수 있다. 모노클로날 항체를 생산하기 위한 다른 기술, 예를 들어, B 림프구의 바이러스성 또는 종양발생성 형질전환을 사용할 수 있다.
하이브리도마를 제조하기 위한 예시적인 동물 시스템은 쥐 시스템이다. 면역화 프로토콜, 및 융합을 위한 면역화된 비장세포의 단리를 위한 기술이 당업계에 공지되어 있다. 융합 파트너 (예를 들어, 쥐 골수종 세포) 및 융합 절차도 공지되어 있다.
키메라 또는 인간화 항체를 상기 설명된 바와 같이 제조된 쥐 모노클로날 항체의 서열을 기초로 제조할 수 있다. 중쇄 및 경쇄 면역글로불린을 코딩하는 DNA를 관심있는 쥐 하이브리도마로부터 수득하여, 비-쥐 (예를 들어, 인간) 면역글로불린 서열을 함유하도록 표준 분자 생물학 기술을 사용하여 조작할 수 있다. 예를 들어, 키메라 항체를 생성시키기 위해, 쥐 가변 구역을 당업계에 공지된 방법을 사용하여 인간 불변 구역에 연결시킬 수 있다 (예를 들어, 미국 특허 4,816,567 (Cabilly et al.) 참조). 인간화 항체를 생성시키기 위해, 쥐 CDR 구역을 당업계에 공지된 방법을 사용하여 인간 프레임워크 내로 삽입할 수 있다 (예를 들어, 미국 특허 5,225,539, 및 미국 특허 5,530,101; 5,585,089; 5,693,762; 및 6,180,370 참조).
하나의 경우에, 항-IL-6 항체는 인간 모노클로날 항체이다. 마우스 면역계보다는 인간 면역계의 일부를 보유하는 트랜스제닉 (transgenic) 또는 트랜스크로모좀 (transchromosomic) 마우스를 사용하여, IL-6에 대해 작용하는 상기 인간 모노클로날 항체가 생성될 수 있다. 이들 트랜스제닉 및 트랜스크로모좀 마우스에는 각각 HuMAb 마우스® 및 KM 마우스®로 본원에서 지칭되는 마우스가 포함되고, 이들은 본원에서 "인간 Ig 마우스"로 총괄적으로 지칭된다.
HuMAb 마우스® (메다렉스, 인크.)는 내인성 μ 및 κ 사슬 로커스를 불활성화시키는 표적화된 돌연변이와 함께, 재배열되지 않은 인간 중쇄 (μ 및 γ) 및 κ 경쇄 면역글로불린 서열을 코딩하는 인간 면역글로불린 유전자 미니로커스 (minilocus)를 함유한다 (예를 들어, 문헌 [Lonberg, et al. (1994) Nature 368: 856-859] 참조). 따라서, 마우스는 마우스 IgM 또는 κ의 감소된 발현을 나타내고, 면역화에 반응하여, 도입된 인간 중쇄 및 경쇄 트랜스진 (transgene)에 클래스 전환 및 체세포 돌연변이가 진행되어, 고친화도 인간 IgGκ 모노클로날 항체가 생성된다 ([Lonberg, N. et al. (1994)]; [Lonberg, N. (1994) Handbook of Experimental Pharmacology 113:49-101]에서 검토됨; [Lonberg, N. and Huszar, D. (1995) Intern. Rev. Immunol. 13: 65-93], 및 [Harding, F. and Lonberg, N. (1995) Ann. N.Y. Acad. Sci. 764:536-546]). HuMAb 마우스®의 제조 및 사용, 및 상기 마우스가 보유하는 게놈 변형은 그 내용이 모두 본원에 구체적으로 참조로 포함되는 문헌 [Taylor, L. et al. (1992) Nucleic Acids Research 20:6287-6295]; [Chen, J. et al. (1993) International Immunology 5: 647-656]; [Tuaillon et al. (1993) Proc. Natl. Acad. Sci. USA 90:3720-3724]; [Choi et al. (1993) Nature Genetics 4:117-123]; [Chen, J. et al. (1993) EMBO J. 12: 821-830]; [Tuaillon et al. (1994) J. Immunol. 152:2912-2920]; [Taylor, L. et al. (1994) International Immunology 6: 579-591]; 및 [Fishwild, D. et al. (1996) Nature Biotechnology 14:845-851]에 추가로 설명되어 있다. 추가로, 미국 특허 5,545,806; 5,569,825; 5,625,126; 5,633,425; 5,789,650; 5,877,397; 5,661,016; 5,814,318; 5,874,299; 및 5,770,429; 미국 특허 5,545,807; PCT 특허 공개 WO 92/03918, WO 93/12227, WO 94/25585, WO 97/13852, WO 98/24884 및 WO 99/45962; 및 WO 01/14424를 참조한다.
다른 측면에서, 트랜스진 및 트랜스크로모좀 상의 인간 면역글로불린 서열을 보유하는 마우스, 예를 들어 인간 중쇄 트랜스진 및 인간 경쇄 트랜스크로모좀을 보유하는 마우스를 사용하여 인간 항-IL-6 항체가 생성될 수 있다. "KM 마우스™"로 본원에서 지칭되는 상기 마우스는 PCT 특허 공개 WO 02/43478에 상세하게 설명되어 있다.
또한, 인간 면역글로불린 유전자를 발현하는 별도의 트랜스제닉 동물 시스템이 당업계에서 이용가능하고, IL-6 항체를 생성시키기 위해 사용될 수 있다. 예를 들어, Xenomouse™ (아브게닉스, 인크. (Abgenix, Inc.))로 지칭되는 별도의 트랜스제닉 시스템이 사용될 수 있고; 예를 들어, 미국 특허 5,939,598; 6,075,181; 6,114,598; 6,150,584; 및 6,162,963에 상기 마우스가 설명되어 있다.
또한, 인간 면역글로불린 유전자를 발현하는 별도의 트랜스크로모좀 동물 시스템이 당업계에서 이용가능하고, IL-6 항체를 생성시키기 위해 사용될 수 있다. 예를 들어, "TC 마우스"로 지칭되는, 인간 중쇄 트랜스크로모좀 및 인간 경쇄 트랜스크로모좀을 모두 보유하는 마우스가 사용될 수 있고; 문헌 [Tomizuka et al. (2000) Proc. Natl. Acad. Sci. USA 97:722-727]에 상기 마우스가 설명되어 있다. 또한, 인간 중쇄 및 경쇄 트랜스크로모좀을 보유하는 소가 당업계에 설명된 바 있고 ([Kuroiwa et al. (2002) Nature Biotechnology 20:889-894]), IL-6 항체를 생성시키기 위해 사용될 수 있다.
또한, 면역화시 인간 항체 반응이 생성될 수 있도록 인간 면역 세포가 그 내부로 재구성된 SCID 마우스를 사용하여 인간 모노클로날 항체를 제조할 수 있다. 예를 들어, 미국 특허 5,476,996; 및 5,698,767에 상기 마우스가 설명되어 있다.
인간
Ig
마우스의 면역화
항체 및 항체-생산 세포주의 생산
동물을 IL-6 항원으로 면역화시킨 후에, 항체 및/또는 항체-생산 세포를 동물로부터 얻을 수 있다. 몇몇 경우에, IL-6 항체-함유 혈청은 동물을 출혈 또는 희생시킴으로써 동물로부터 얻는다. 동물로부터 얻은 상태의 혈청을 사용할 수 있거나, 혈청으로부터 면역글로불린 분획을 수득할 수 있거나, 또는 IL-6 항체를 혈청으로부터 정제할 수 있다.
몇몇 경우에, 항체-생산 불멸화 세포주가 면역화된 동물로부터 단리된 세포로부터 제조된다. 면역화 후, 동물을 희생시키고, 림프절 및/또는 비장 B 세포를 당업계에 공지된 임의의 방법에 의해 불멸화시킨다. 세포를 불멸화시키는 방법은 종양유전자로 형질감염시키는 것, 세포를 종양발생성 바이러스로 감염시키고 세포를 불멸화 세포를 선택하는 조건 하에 배양하는 것, 세포에 발암성 또는 돌연변이 유발 화합물을 적용하는 것, 세포를 불멸화 세포, 예를 들어, 골수종 세포와 융합시키는 것, 및 종양 억제인자 유전자를 불활성화시키는 것을 포함하고 이로 제한되지 않는다. 골수종 세포와의 융합이 사용되는 경우, 골수종 세포는 바람직하게는 면역글로불린 폴리펩티드를 분비하지 않는다 (비-분비성 세포주). IL-6, 그의 일부, 또는 IL-6을 발현하는 세포를 사용하여 불멸화 세포를 스크리닝한다. 몇몇 경우에, 초기 스크리닝은 효소-결합 면역분석 (ELISA) 또는 방사성 면역분석을 사용하여 수행한다. ELISA 스크리닝의 예는 본원에 참조로 포함되는 PCT 특허 공개 WO 00/37504에 제공된다.
강한 성장, 높은 항체 생산 및 바람직한 항체 특징을 포함하는 바람직한 특성에 대해 항-IL-6 항체-생산 세포, 예를 들어, 하이브리도마가 선택되고, 클로닝되고, 추가로 스크리닝된다. 하이브리도마는 생체 내에서 동계 (syngeneic) 동물에서, 면역계가 없는 동물, 예를 들어, 누드 마우스에서, 또는 시험관 내 세포 배양에서 확장될 수 있다. 하이브리도마의 선택, 클로닝 및 확장 방법은 당업자에게 공지되어 있다.
한 예에서, 면역화되는 동물은 인간 면역글로불린 유전자를 발현하는 비-인간 동물이고, 지라 B 세포가 비-인간 동물과 동일한 종으로부터의 골수종 세포주에 융합된다. 상기 면역화되는 동물의 하나는 키린 (Kirin) TC 마우스™ 마우스이고, 골수종 세포주는 비-분비성 마우스 골수종이다. 추가의 예에서, 골수종 세포주는 Sp2/0-Ag14 (아메리칸 타입 컬쳐 컬렉션 (American Type Culture Collection; ATCC) CRL-1581)이다.
또한, (a) 본원에 기재된 비-인간 트랜스제닉 동물을 IL-6, IL-6의 일부, 또는 IL-6를 발현하는 세포 또는 조직으로 면역화시키는 단계; (b) 트랜스제닉 동물이 IL-6에 대한 면역 반응을 개시하도록 하는 단계; (c) 트랜스제닉 동물로부터 항체-생산 세포를 단리하는 단계; (d) 항체-생산 세포를 불멸화시키는 단계; (e) 불멸화된 항체-생산 세포의 개별적인 모노클로날 집단을 생성시키는 단계; 및 (f) 불멸화된 항체-생산 세포를 스크리닝하여, IL-6에 대해 작용하는 항체를 확인하는 단계를 포함하는, IL-6에 대해 작용하는 인간 모노클로날 항체 또는 그의 항원 결합 부분을 생산하는 세포주의 생산 방법이 제공된다.
다른 측면에서, 인간 IL-6 항체를 생산하는 하이브리도마가 제공된다. 하이브리도마에 의해 생산된 인간 IL-6 항체는 IL-6의 길항제일 수 있다. 하이브리도마는 비-인간, 비-마우스 종, 예를 들어, 래트, 양, 돼지, 염소, 소 또는 말에서 생산될 수 있다.
하나의 경우에, 항체-생산 세포가 단리되어, 숙주 세포, 예를 들어 골수종 세포에서 발현된다. 다른 예에서, 트랜스제닉 동물이 IL-6으로 면역화되고, 1차 세포 (예를 들어, 비장 또는 말초 혈액 세포)가 면역화된 트랜스제닉 동물로부터 단리되고, 요구되는 항원에 특이적인 항체를 생산하는 개별적인 세포들이 확인된다. 각각의 개별적인 세포로부터의 폴리아데닐화 mRNA가 단리되고, 가변 구역 서열에 어닐링(annealing)되는 센스 프라이머, 예를 들어, 인간 중쇄 및 경쇄 가변 구역 유전자의 FR1 영역의 대부분 또는 전부를 인식하는 축퇴성 프라이머, 및 불변 또는 연결 영역 서열에 어닐링되는 안티센스 프라이머를 사용하여 역전사 중합효소 연쇄 반응 (RT-PCR)이 수행된다. 이어서, 중쇄 및 경쇄 가변 도메인의 cDNA가 클로닝되고, 임의의 적합한 숙주 세포, 예를 들어, 골수종 세포에서 각각의 면역글로불린 불변 구역, 예를 들어 중쇄 및 κ 또는 λ 불변 도메인이 있는 키메라 항체로서 발현된다. 본원에 참조로 포함되는 문헌 [Babcook, J.S. et al. (1996) Proc. Natl. Acad. Sci. USA 93: 7843-48] 참조. 이어서, IL-6 항체를 확인하고 단리할 수 있다.
항체의 재조합 생산 방법
숙주 세포에서의 면역글로불린 경쇄 및 중쇄 유전자의 재조합 발현에 의해 IL-6 항체 또는 그의 항원 결합 부분을 제조할 수 있다. 예를 들어, 항체를 재조합 방식으로 발현시키기 위해, 숙주 세포를 항체의 면역글로불린 경쇄 및 중쇄를 코딩하는 DNA 단편을 보유하는 하나 이상의 재조합 발현 벡터로 형질감염시켜, 경쇄 및 중쇄가 숙주 세포에서 발현되고, 바람직하게는, 숙주 세포가 배양되는 배지 내로 분비되고, 이러한 배지로부터 항체를 회수할 수 있다. 상이한 재조합 DNA 방법을 사용하여 항체 중쇄 및 경쇄 유전자를 수득하고, 이러한 유전자들을 재조합 발현 벡터 내로 혼입시키고, 벡터를 숙주 세포, 예를 들어 문헌 [Sambrook, Fritsch and Maniatis (eds), Molecular Cloning; A Laboratory Manual, Second Edition, Cold Spring Harbor, N.Y., (1989)], [Ausubel, F. M. et al. (eds.) Current Protocols in Molecular Biology, Greene Publishing Associates, (1989)] 및 미국 특허 4,816,397에 기재된 것들 내로 도입할 수 있다.
돌연변이 및 변형
IL-6 항체를 발현시키기 위해, 임의의 상기 논의된 방법을 사용하여 VH 및 VL 영역을 코딩하는 DNA 단편을 먼저 수득할 수 있다. 또한, 상이한 적합한 방법을 사용하여 상이한 돌연변이, 결실, 및/또는 부가를 DNA 서열 내로 도입할 수 있다. 예를 들어, 돌연변이 유발은 표준 방법, 예를 들어 PCR-매개 돌연변이 유발을 사용하여 수행할 수 있고, 이때 돌연변이된 뉴클레오티드는 PCR 프라이머 내로 혼입되어, PCR 생성물이 원하는 요구되는 돌연변이 또는 부위 지정 돌연변이를 함유한다. 예를 들어, 이루어질 수 있는 한가지 유형의 치환은 화학적으로 반응성일 수 있는 항체 내의 하나 이상의 시스테인을 다른 잔기, 예를 들어 비제한적으로 알라닌 또는 세린으로 변화시키는 것이다. 예를 들어, 비-정규 또는 정규 시스테인의 치환이 있을 수 있다. 치환은 가변 도메인의 CDR 또는 프레임워크 구역에서 또는 항체의 불변 도메인에서 이루어질 수 있다. 또한, 항체는 예를 들어 항체의 결합 특성을 변경시키기 위해 중쇄 및/또는 경쇄의 가변 도메인에서 돌연변이될 수 있다. 예를 들어, IL-6에 대한 항체의 KD를 증가 또는 감소시키기 위해, koff를 증가 또는 감소시키기 위해, 또는 항체의 결합 특이성을 변경시키기 위해, CDR 구역 중 하나 이상에서 돌연변이가 이루어질 수 있다. 부위 지정 돌연변이 유발 기술은 예를 들어 본원에 참조로 포함되는 문헌 ([Sambrook et al.] 및 [Ausubel et al.])에 기재된 것을 포함한다.
또한, IL-6 항체의 반감기를 증가시키기 위해 프레임워크 구역 또는 불변 도메인에서 돌연변이가 이루어질 수 있다. 예를 들어, 본원에 참조로 포함되는 PCT 특허 공개 WO 00/09560 참조. 항체의 면역원성을 변경시키기 위해, 다른 분자에 대한 공유 또는 비-공유 결합을 위한 부위를 제공하기 위해, 또는 보체 고정, FcR 결합 및 항체-의존성 세포 매개 세포독성 (ADCC)과 같은 특성을 변경시키기 위해, 프레임워크 구역 또는 불변 도메인에서의 돌연변이가 또한 이루어질 수 있다. 단일 항체는 가변 도메인의 CDR 또는 프레임워크 구역 중 어느 하나 이상에서 또는 불변 도메인에서 돌연변이를 보유할 수 있다.
"생식계열화 (germlining)"로 공지된 과정에서, VH 및 VL 서열 내의 특정 아미노산이 생식계열 VH 및 VL 서열에서 천연에서 발견되는 것들과 매치하도록 돌연변이될 수 있다. 특히, VH 및 VL 서열 내의 프레임워크 구역의 아미노산 서열은 항체가 투여될 때 면역원성의 위험을 감소시키기 위해 생식계열 서열과 매치하도록 돌연변이될 수 있다. 인간 VH 및 VL 유전자에 대한 생식계열 DNA 서열은 당업계에 공지되어 있다 (예를 들어, "Vbase" 인간 생식계열 서열 데이터베이스 참조; 또한 각각의 내용이 본원에 참조로 포함되는 문헌 [Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242]; [Tomlinson et al. (1992) J. Mol. Biol. 227:776-798]; 및 [Cox et al., (1994) Eur. J. Immunol. 24:827-836]을 또한 참조한다).
이루어질 수 있는 다른 유형의 아미노산 치환은 항체 내의 잠재적인 단백질분해 부위를 제거하는 것이다. 상기 부위는 가변 도메인의 CDR 또는 프레임워크 구역에서 또는 항체의 불변 도메인에서 발생할 수 있다. 시스테인 잔기의 치환 및 단백질 분해 부위의 제거는 항체 생성물 내의 불균일성의 위험을 감소시킬 수 있고, 따라서 이의 균일성을 증가시킬 수 있다. 또다른 유형의 아미노산 치환은 잔기의 하나 또는 둘 모두를 변경시킴으로써 잠재적인 탈아미드화 부위를 형성하는 아스파라긴-글리신 쌍을 제거하는 것이다. 다른 예에서, IL-6 항체의 중쇄의 C-말단 라이신이 절단될 수 있다. 상이한 예에서, IL-6 항체의 중쇄 및 경쇄는 신호 서열을 임의로 포함할 수 있다. 몇몇 경우에, 항-IL-6 항체의 중쇄의 C-말단 라이신이 단백질 분해에 의해 절단될 수 있다.
일단 VH 및 VL 세그먼트를 코딩하는 DNA 단편이 수득되면, 예를 들어 가변 구역 유전자를 전장 항체 사슬 유전자, Fab 단편 유전자, 또는 scFv 유전자로 전환시키기 위해, 이러한 DNA 단편을 표준 재조합 DNA 기술에 의해 추가로 조작할 수 있다. 이러한 조작에서, VL- 또는 VH-코딩 DNA 단편이 또다른 단백질, 예를 들어 항체 불변 구역 또는 가요성 링커를 코딩하는 또다른 DNA 단편에 작동가능하게 연결된다. 이러한 측면에서 사용된 용어 "작동가능하게 연결된"은 2개의 DNA 단편에 의해 코딩되는 아미노산 서열이 인-프레임 (in-frame)으로 유지되도록 2개의 DNA 단편이 연결되는 것을 의미하도록 의도된다.
VH 구역을 코딩하는 단리된 DNA는 VH-코딩 DNA를 중쇄 불변 구역 (CH1, CH2 및 CH3)을 코딩하는 또다른 DNA 분자에 작동가능하게 연결시킴으로써 전장 중쇄 유전자로 전환될 수 있다. 인간 중쇄 불변 구역 유전자의 서열은 당업계에 공지되어 있고 (예를 들어, 문헌 [Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242]), 이러한 구역을 포함하는 DNA 단편을 표준 PCR 증폭에 의해 수득할 수 있다. 중쇄 불변 구역은 IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM 또는 IgD 불변 구역일 수 있지만, 가장 바람직하게는 IgG1 또는 IgG2 불변 구역이다. IgG1 불변 구역 서열은 여러 개체 간에 발생하는 것으로 공지된 상이한 대립유전자 및 동종이형 (allotype), 예를 들어 Gm(1), Gm(2), Gm(3), 및 Gm(17) 중 임의의 것일 수 있다. 이러한 동종이형은 IgG1 불변 구역에서의 천연 발생 아미노산 치환을 나타낸다. Fab 단편 중쇄 유전자에 대해, VH-코딩 DNA가 중쇄 CH1 불변 구역만을 코딩하는 또다른 DNA 분자에 작동가능하게 연결될 수 있다. CH1 중쇄 불변 구역은 임의의 중쇄 유전자로부터 유래될 수 있다.
VL 구역을 코딩하는 단리된 DNA는 VL-코딩 DNA를 경쇄 불변 구역 CL을 코딩하는 또다른 DNA 분자에 작동가능하게 연결시킴으로써 전장 경쇄 유전자 (및 Fab 경쇄 유전자)로 전환될 수 있다. 인간 경쇄 불변 구역 유전자의 서열은 당업계에 공지되어 있고 (예를 들어, 문헌 [Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242]), 이러한 구역을 포함하는 DNA 단편을 표준 PCR 증폭에 의해 수득할 수 있다. 경쇄 불변 구역은 카파 또는 람다 불변 구역일 수 있다. 카파 불변 구역은 여러 개체 간에 발생하는 것으로 공지된 다양한 대립유전자, 예를 들어 Inv(1), Inv(2), 및 Inv(3) 중 임의의 것일 수 있다. 람다 불변 구역은 3개의 람다 유전자 중 임의의 것으로부터 유래될 수 있다.
scFv 유전자를 생성시키기 위해, VH- 및 VL-코딩 DNA 단편이 가요성 링커를 코딩하는 다른 단편, 예를 들어, 아미노산 서열 (Gly4-Ser)3을 코딩하는 단편에 작동가능하게 연결되어, VL 및 VH 구역이 가요성 링커에 의해 연결되면서 VH 및 VL 서열이 연속적인 단일쇄 단백질로서 발현될 수 있다 (예를 들어, 문헌 [Bird et al. Science 242:423-426 (1988)]; [Huston et al. Proc. Natl. Acad. Sci. USA 85:5879-5883 (1988)]; [McCafferty et al., Nature 348:552-554 (1990)] 참조). 단일쇄 항체는 단일 VH 및 VL만이 사용될 경우 1가일 수 있거나, 2개의 VH 및 VL이 사용될 경우 2가일 수 있거나, 2개를 초과하는 VH 및 VL이 사용될 경우 다가일 수 있다. IL-6 및 또다른 분자에 특이적으로 결합하는 이중특이적 또는 다가 항체가 생성될 수 있다.
다른 경우에, 또다른 폴리펩티드에 연결된 IL-6 항체의 전부 또는 일부를 포함하는 융합 항체가 제조될 수 있다. 다른 경우에, IL-6 항체의 가변 도메인만이 폴리펩티드에 연결된다. 또다른 경우에, IL-6 항체의 VH 도메인이 제1 폴리펩티드에 연결되는 한편, IL-6 항체의 VL 도메인이 제2 폴리펩티드에 연결되고, VH 및 VL 도메인이 서로 상호작용하여 항원 결합 부위를 형성할 수 있는 방식으로 상기 제2 폴리펩티드가 제1 폴리펩티드와 회합한다. 다른 경우에, VH 및 VL 도메인이 서로 상호작용할 수 있도록 VH 도메인이 링커에 의해 VL 도메인으로부터 분리된다. 이어서, VH-링커-VL 항체가 관심있는 폴리펩티드에 연결된다. 또한, 2개 (또는 그 이상)의 단일쇄 항체가 서로 연결된 융합 항체가 생성될 수 있다. 단일 폴리펩티드 사슬 상에 2가 또는 다가 항체를 생성시키기를 원하는 경우 또는 이중특이적 항체를 생성시키기를 원하는 경우 이러한 항체가 유용하다.
다른 경우에, IL-6 항체 코딩 핵산 분자를 사용하여 다른 변형 항체가 제조될 수 있다. 예를 들어, 본원에서 논의되는 교시 내용에 따라 적합한 분자 생물학 기술을 사용하여 "카파 바디 (Kappa body)" ([Ill et al., Protein Eng. 10: 949-57 (1997)]), "미니바디 (Minibody)" ([Martin et al., EMBO J. 13: 5303-9] (1994)), "디아바디" ([Holliger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993)]), 또는 "자누신 (Janusin)" ([Traunecker et al., EMBO J. 10:3655-3659 (1991)] 및 [Traunecker et al., Int. J. Cancer (Suppl.) 7:51-52 (1992)])이 제조될 수 있다.
하이브리도마의 융합 또는 Fab' 단편의 연결을 포함하는 다양한 방법에 의해 이중특이적 항체 또는 항원-결합 단편이 생산될 수 있다. 예를 들어, 문헌 [Songsivilai & Lachmann, Clin. Exp. Immunol. 79:315-321 (1990)], [Kostelny et al., J. Immunol. 148:1547-1553 (1992)] 참조. 또한, "디아바디" 또는 "자누신"으로서 이중특이적 항체가 형성될 수 있다. 몇몇 경우에, 이중특이적 항체는 IL-6의 2개의 상이한 에피토프에 결합한다. 몇몇 경우에, 본원에서 설명되는 변형된 항체는 인간 IL-6 항체로부터의 하나 이상의 가변 도메인 또는 CDR 구역을 사용하여 제조된다.
벡터 및 숙주 세포
IL-6 항체 및 그의 항원 결합 부분을 발현시키기 위해, 본원에서 설명된 바와 같이 수득된, 부분적인 또는 전장 경쇄 및 중쇄를 코딩하는 DNA를, 유전자가 전사 및 번역 제어 서열에 작동가능하게 연결되도록 발현 벡터 내로 삽입한다. 이러한 측면에서, 용어 "작동가능하게 연결된"은 벡터 내의 전사 및 번역 제어 서열이 항체 유전자의 전사 및 번역을 조절하는 이들의 의도된 기능을 수행하도록 항체 유전자가 벡터 내로 라이게이션되는 것을 의미하도록 의도된다. 발현 벡터 및 발현 제어 서열은 사용된 발현 숙주 세포와 상용성이도록 선택된다. 발현 벡터에는, 예를 들어, 플라스미드, 레트로바이러스, 아데노바이러스, 아데노-연관 바이러스 (AAV), 식물 바이러스, 예를 들어 콜리플라워 모자이크 바이러스, 담배 모자이크 바이러스, 코스미드, YAC, EBV-유래 에피좀이 포함된다. 벡터 내의 전사 및 번역 제어 서열이 항체 유전자의 전사 및 번역을 조절하는 이들의 의도된 기능을 수행하도록 항체 유전자가 벡터 내로 라이게이션된다. 발현 벡터 및 발현 제어 서열은 사용된 발현 숙주 세포와 상용성이도록 선택된다. 항체 경쇄 유전자 및 항체 중쇄 유전자가 별도의 벡터 내로 삽입될 수 있거나, 양쪽 유전자가 동일한 발현 벡터 내로 삽입된다. 상이한 방법 (예를 들어, 항체 유전자 단편 및 벡터 상의 상보성 제한 부위의 라이게이션, 또는 제한 부위가 존재하지 않는 경우 블런트 (blunt) 말단 라이게이션)에 의해 항체 유전자가 발현 벡터 내로 삽입된다.
편리한 벡터는 상기 설명된 바와 같이, 임의의 VH 또는 VL 서열이 쉽게 삽입 및 발현될 수 있도록 조작된 적절한 제한 부위와 함께, 기능적으로 완전한 인간 CH 또는 CL 면역글로불린 서열을 코딩하는 벡터이다. 상기 벡터에서, 삽입된 J 구역 내의 스플라이스 공여자 부위와 인간 C 도메인에 선행하는 스플라이스 수용자 부위 사이에서 스플라이싱이 일반적으로 발생하고, 인간 CH 엑손 내에서 발생하는 스플라이스 구역에서도 발생한다. 폴리아데닐화 및 전사 종결이 코딩 구역의 하류의 천연 염색체 부위에서 발생한다. 재조합 발현 벡터는 숙주 세포로부터의 항체 사슬의 분비를 용이하게 하는 신호 펩티드를 또한 코딩할 수 있다. 신호 펩티드가 면역글로불린 사슬의 아미노 말단에 인-프레임으로 연결되도록 항체 사슬 유전자가 벡터 내로 클로닝될 수 있다. 신호 펩티드는 면역글로불린 신호 펩티드 또는 이종성 신호 펩티드 (즉, 비-면역글로불린 단백질로부터의 신호 펩티드)일 수 있다.
항체 사슬 유전자 이외에, 재조합 발현 벡터는 숙주 세포에서의 항체 사슬 유전자의 발현을 제어하는 조절 서열을 보유한다. 조절 서열의 선택을 포함하는 발현 벡터의 디자인은 형질전환될 숙주 세포의 선택, 요구되는 단백질의 발현 수준과 같은 인자에 의해 결정될 수 있다. 포유동물 숙주 세포 발현을 위한 조절 서열에는 포유동물 세포에서 높은 수준의 단백질 발현을 지시하는 바이러스 요소, 예를 들어 레트로바이러스 LTR, 사이토메갈로바이러스 (CMV) (예를 들어 CMV 프로모터/인핸서), 원숭이 바이러스 40 (SV40) (예를 들어 SV40 프로모터/인핸서), 아데노바이러스 (예를 들어, 아데노바이러스 주요 후기 프로모터 (AdMLP)), 폴리오마로부터 유래된 프로모터 및/또는 인핸서, 및 강력한 포유동물 프로모터, 예를 들어 천연 면역글로불린 및 액틴 프로모터가 포함된다. 바이러스 조절 요소 및 그의 서열에 대한 추가의 설명을 위해, 예를 들어, 미국 특허 5,168,062, 4,510,245 및 4,968,615 참조. 식물에서 항체를 발현시키기 위한 방법 (프로모터 및 벡터의 설명 포함), 및 식물의 형질전환은 당업계에 공지되어 있다. 예를 들어, 본원에 참조로 포함되는 미국 특허 6,517,529 참조.
항체 사슬 유전자 및 조절 서열 이외에, 재조합 발현 벡터는 추가의 서열, 예를 들어 숙주 세포에서 벡터의 복제를 조절하는 서열 (예를 들어, 복제 기점) 및 선택가능 마커 유전자를 보유할 수 있다. 선별가능 마커 유전자는 벡터가 도입된 숙주 세포의 선택을 용이하게 한다 (예를 들어, 본원에 참조로 포함되는 미국 특허 4,399,216, 4,634,665 및 5,179,017 참조). 예를 들어, 전형적으로, 선택가능 마커 유전자는 벡터가 그 내부에 도입된 숙주 세포에 대해 약물, 예를 들어 G418, 히그로마이신 또는 메토트렉세이트에 대한 저항성을 부여한다. 바람직한 선택가능 마커 유전자에는 디히드로폴레이트 환원효소 (DHFR) 유전자 (메토트렉세이트 선택/증폭으로 dhfr- 숙주 세포에서 사용하기 위한 것) 및 네오마이신 포스포트랜스퍼라제 유전자 (G418 선택용), 및 글루타메이트 신테타제 유전자가 포함된다.
IL-6 항체를 코딩하는 핵산 분자 및 이러한 핵산 분자를 포함하는 벡터를 적절한 포유동물, 식물, 세균 또는 효모 숙주 세포의 형질감염에 사용할 수 있다. 형질전환은 폴리뉴클레오티드를 숙주 세포 내로 도입하기 위한 임의의 적합한 방법에 의해 이루어질 수 있다. 이종성 폴리뉴클레오티드를 포유동물 세포 내로 도입하는 방법은 덱스트란-매개 형질감염, 인산칼슘 침전, 폴리브렌-매개 형질감염, 원형질체 융합, 전기천공, 폴리뉴클레오티드(들)의 리포좀 내 봉입, 및 핵 내로의 DNA의 직접적인 미세주사를 포함한다. 또한, 핵산 분자는 바이러스 벡터에 의해 포유동물 세포 내로 도입될 수 있다. 세포를 형질전환시키는 방법은 당업계에 공지되어 있다. 예를 들어, 본원에 참조로 포함되는 미국 특허 4,399,216, 4,912,040, 4,740,461, 및 4,959,455 참조. 예를 들어 아그로박테리움 (Agrobacterium)-매개 형질전환, 바이오리스틱 (biolistic) 형질전환, 직접적인 주사, 전기천공 및 바이러스 형질전환을 포함하는, 식물 세포를 형질전환시키는 방법이 당업계에 공지되어 있다. 세균 및 효모 세포를 형질전환시키는 방법도 당업계에 공지되어 있다.
발현용 숙주로서 이용가능한 포유동물 세포주가 당업계에 공지되어 있고, 아메리칸 타입 컬쳐 컬렉션 (ATCC)으로부터 입수가능한 다수의 불멸화 세포주를 포함한다. 여기에는, 예를 들어, 차이니즈 햄스터 난소 (CHO) 세포, NSO 세포, SP2 세포, HEK-293T 세포, NIH-3T3 세포, HeLa 세포, 베이비 햄스터 신장 (BHK) 세포, 아프리카 녹색 원숭이 신장 세포 (COS), 인간 간세포성 암종 세포 (예를 들어, Hep G2), A549 세포, 및 다수의 기타 세포주가 포함된다. 어느 세포주에서 발현 수준이 높은지를 결정하는 것을 통해 특히 바람직한 세포주가 선택된다. 사용될 수 있는 다른 세포주는 곤충 세포주, 예를 들어 Sf9 또는 Sf21 세포이다. 항체 유전자를 코딩하는 재조합 발현 벡터가 포유동물 숙주 세포 내로 도입되는 경우, 숙주 세포 내에서 항체가 발현되도록 하는데 충분한 시간, 보다 바람직하게는 숙주 세포가 성장되는 항체가 배양 배지 내로 분비되도록 하는데 충분한 시간 동안 숙주 세포를 배양함으로써 항체가 생산된다. 항체는 상이한 단백질 정제 방법을 사용하여 배양 배지로부터 회수할 수 있다. 세균 숙주 세포에는 이. 콜라이 (E. coli) 및 스트렙토마이세스 (Streptomyces) 종이 포함된다. 효모 숙주 세포에는 스키조사카로마이세스 폼베 (Schizosaccharomyces pombe), 사카로마이세스 세레비지애 (Saccharomyces cerevisiae) 및 피치아 파스토리스 (Pichia pastoris)가 포함된다.
또한, 임의의 적합한 기술을 사용하여 생산 세포주로부터의 항체의 발현을 향상시킬 수 있다. 예를 들어, 글루타민 신테타제 (GS 시스템) 및 DHFR 유전자 발현 시스템은 특정 조건 하에서의 발현을 향상시키기 위한 통상적인 방법이다. 통상적인 기술, 예를 들어 제한 희석 클로닝 및 마이크로드랍 (Microdrop) 기술을 사용하여 고발현 세포 클론을 확인할 수 있다. 유럽 특허 EP 0 216 846, EP 0 256 055, EP 0 323 997 및 EP 0338 841에 GS 시스템이 논의되어 있다.
상이한 세포주에 의해 또는 트랜스제닉 동물에서 발현된 항체들은 글리코실화가 서로 상이할 것이다. 그러나, 본원에서 제공된 핵산 분자에 의해 코딩되거나, 본원에서 제공된 아미노산 서열을 포함하는 모든 항체는 항체의 글리코실화와 관계 없이 본 발명의 일부이다.
파지 디스플레이 라이브러리
본 발명은 파지 상에 인간 항체의 라이브러리를 합성하는 단계, 라이브러리를 IL-6 또는 그의 일부로 스크리닝하는 단계, IL-6에 결합하는 파지를 단리하는 단계, 및 파지로부터 항체를 수득하는 단계를 포함하는, 항-IL-6 항체 또는 그의 항원 결합 부분을 생산하는 방법을 제공한다. 예를 들어, 파지 디스플레이 기술에서 사용하기 위한 항체의 라이브러리를 제조하는 한 방법은 인간 면역글로불린 로커스를 포함하는 비-인간 동물을 IL-6 또는 그의 항원성 부분으로 면역화시켜, 면역 반응을 일으키는 단계, 면역화된 동물로부터 항체-생산 세포를 추출하는 단계, 추출된 세포로부터 항체의 중쇄 및 경쇄를 코딩하는 RNA를 단리하는 단계, RNA를 역전사시켜 cDNA를 생산하는 단계, 프라이머를 사용하여 cDNA를 증폭시키는 단계, 및 항체가 파지 상에서 발현되도록 cDNA를 파지 디스플레이 벡터 내로 삽입하는 단계를 포함한다. 재조합 IL-6 항체는 상기 방식으로 수득될 수 있다.
재조합 조합 항체 라이브러리를 스크리닝함으로써 재조합 항-IL-6 인간 항체가 단리될 수 있다. 바람직하게는, 라이브러리는 B 세포로부터 단리된 mRNA로부터 제조된 인간 VL 및 VH cDNA를 사용하여 생성된, scFv 파지 디스플레이 라이브러리이다. 이같은 라이브러리의 제조 및 스크리닝 방법은 당업계에 공지되어 있다. 파지 디스플레이 라이브러리를 생성시키기 위한 키트는 상업적으로 이용가능하다 (예를 들어, 파마시아 Recombinant Phage Antibody System, 카탈로그 번호 27-9400-01; 및 스트라타젠 (Stratagene) SurfZAP™ 파지 디스플레이 키트, 카탈로그 번호 240612). 또다른 방법 및 시약이 항체 디스플레이 라이브러리를 생성시키고 스크리닝하는데 사용될 수 있다 (예를 들어, 모두 본원에 참조로 포함되는 미국 특허 5,223,409; PCT 특허 공개 WO 92/18619, WO 91/17271, WO 92/20791, WO 92/15679, WO 93/01288, WO 92/01047, WO 92/09690; [Fuchs et al., Bio/Technology 9:1370-1372 (1991)]; [Hay et al., Hum. Antibod. Hybridomas 3:81-85 (1992)]; [Huse et al., Science 246:1275-1281 (1989)]; [McCafferty et al., Nature 348:552-554 (1990)]; [Griffiths et al., EMBO J. 12:725-734 (1993)]; [Hawkins et al., J. Mol. Biol. 226:889-896 (1992)]; [Clackson et al., Nature 352:624-628 (1991)]; [Gram et al., Proc. Natl. Acad. Sci. USA 89:3576-3580 (1992)]; [Garrad et al., Bio/Technology 9:1373-1377 (1991)]; [Hoogenboom et al., Nuc. Acid Res. 19:4133-4137 (1991)]; 및 [Barbas et al., Proc. Natl. Acad. Sci. USA 88:7978-7982 (1991)] 참조).
요구되는 특성이 있는 인간 IL-6 항체를 단리 및 생산하기 위해, 먼저 인간 IL-6 항체를 사용하여, IL-6에 대한 결합 활성이 유사한 인간 중쇄 및 경쇄 서열을 본원에 참조로 포함되는 PCT 특허 공개 WO 93/06213에 설명된 에피토프 각인 (imprinting) 방법을 사용하여 선택한다. 바람직하게는, 이러한 방법에서 사용된 항체 라이브러리는 모두 본원에 참조로 포함되는 PCT 특허 공개 WO 92/01047, 문헌 [McCafferty et al., Nature 348:552-554 (1990)]; 및 [Griffiths et al., EMBO J. 12:725-734 (1993)]에 설명된 바와 같이 제조 및 스크리닝된 scFv 라이브러리이다.
일단 초기의 인간 VL 및 VH 도메인들이 선택되면, 여러 쌍의 초기에 선택된 VL 및 VH 세그먼트를 IL-6 결합에 대해 스크리닝하여 바람직한 VL/VH 쌍 조합을 선택하는 "믹스 및 매치" 실험을 수행한다. 추가로, 항체의 품질을 더욱 개선시키기 위해, 바람직한 VL/VH 쌍(들)의 VL 및 VH 세그먼트를 천연 면역 반응 동안 항체의 친화도 증진을 담당하는 생체내 체세포 돌연변이 과정과 유사한 과정에서 무작위로 돌연변이시킬 수 있고, 바람직하게는 VH 및/또는 VL의 CDR3 구역 내에서 돌연변이시킬 수 있다. 생성되는 PCR 생성물이, 무작위 돌연변이가 VH 및/또는 VL CDR3 구역 내로 도입된 VH 및 VL 세그먼트를 코딩하도록 특정 위치에서 4가지 뉴클레오티드 염기의 무작위 혼합물로 "스파이킹 (spiking)"된, 각각 VH CDR3 또는 VL CDR3에 상보성인 PCR 프라이머를 사용하여 VH 및 VL 도메인을 증폭시킴으로써 상기 시험관내 친화도 증진이 달성될 수 있다. 이러한 무작위로 돌연변이된 VH 및 VL 세그먼트를 IL-6에 대한 결합에 대해 다시 스크리닝할 수 있다.
재조합 면역글로불린 디스플레이 라이브러리로부터 IL-6 항체의 스크리닝 및 단리 후에, 선택된 항체를 코딩하는 핵산을 디스플레이 패키지로부터 (예를 들어, 파지 게놈으로부터) 회수하여, 표준 재조합 DNA 기술에 의해 다른 발현 벡터 내로 서브클로닝할 수 있다. 요구되는 경우, 본원에서 설명되는 바와 같이, 핵산을 다른 항체 형태를 생성시키기 위해 추가로 조작할 수 있다. 조합 라이브러리의 스크리닝에 의해 단리된 재조합 인간 항체를 발현시키기 위해, 상기 설명된 바와 같이, 항체를 코딩하는 DNA가 재조합 발현 벡터 내로 클로닝되어 포유동물 숙주 세포 내로 도입된다.
면역제거 (
deimmunized
) 항체
다른 측면에서, 예를 들어 PCT 특허 공개 WO98/52976 및 WO00/34317 (본원에 참조로 포함됨)에 설명된 기술을 사용하여 IL-6 항체 또는 그의 항원 결합 부분의 면역원성을 감소시키기 위해 이들을 면역제거시킬 수 있다.
유도체화
및
표지된
항체
IL-6 항체 또는 항원 결합 부분이 유도체화되거나 또는 다른 분자 (예를 들어, 다른 펩티드 또는 단백질)에 연결될 수 있다. 일반적으로, IL-6 결합이 유도체화 또는 표지에 의해 불리하게 영향을 받지 않도록 항체 또는 그의 항원 결합 부분이 유도체화된다. 따라서, 본 발명의 항체 및 항원 결합 부분은 본원에 설명된 인간 IL-6 항체의 무손상 형태 및 변형된 형태 모두를 포함하도록 의도된다. 예를 들어, 본 발명의 항체 또는 항원 결합 부분이 하나 이상의 또다른 분자성 본체, 예를 들어 또다른 항체 (예를 들어, 이중특이적 항체 또는 디아바디), 검출제, 표지, 세포독성제, 약제, 및/또는 항체 또는 항원 결합 부분과 또다른 분자 (예를 들어 스트렙타비딘 코어 구역 또는 폴리히스티딘 태그)의 회합을 매개할 수 있는 단백질 또는 펩티드에 기능적으로 연결될 수 있다 (화학적 커플링, 유전자 융합, 비-공유 회합 등에 의해).
한 유형의 유도체화 항체는 2개 이상의 항체 (동일한 종류, 또는 예를 들어 이중특이적 항체를 생성시키기 위한 상이한 종류의)를 가교결합시킴으로써 생산된다. 적절한 가교결합제에는 적절한 스페이서에 의해 분리된 2개의 별개로 반응성인 기를 갖는 이종이관능성 가교결합제 (예를 들어, m-말레이미도벤조일-N-히드록시숙신이미드 에스테르), 또는 동종이관능성 가교결합제 (예를 들어, 디숙신이미딜 수베레이트)가 포함된다. 이같은 링커들은 피어스 케미칼 컴퍼니 (미국 일리노이주 록포드)로부터 시판된다.
또다른 유형의 유도체화 항체는 표지된 항체이다. 항체 또는 항원 결합 부분이 이와 함께 유도체화될 수 있는 유용한 검출제에는 예를 들어 플루오레세인, 플루오레세인 이소티오시아네이트, 로다민, 5-디메틸아민-1-나프탈렌-술포닐 클로라이드, 피코에리트린, 란탄계열 인광체를 포함하는 형광 화합물이 포함된다. 또한, 항체는 검출에 유용한 효소, 예를 들어, 양고추냉이 퍼옥시다제, β-갈락토시다제, 루시퍼라제, 알칼리성 포스파타제, 글루코스 옥시다제로 표지될 수 있다. 항체가 검출가능한 효소로 표지되는 경우, 식별될 수 있는 반응 생성물을 생산하기 위해 효소가 이용하는 추가적인 시약을 첨가함으로써 항체가 검출된다. 예를 들어, 양고추냉이 퍼옥시다제가 존재하는 경우, 과산화수소 및 디아미노벤지딘을 첨가하면 검출가능한 유색 반응이 생성된다. 또한, 항체는 비오틴으로 표지되어, 아비딘 또는 스트렙타비딘 결합의 간접적인 측정을 통해 검출될 수 있다. 또한, 항체는 2차 리포터에 의해 인식되는 소정의 폴리펩티드 에피토프 (예를 들어, 류신 지퍼 쌍 서열, 2차 항체에 대한 결합 부위, 금속 결합 도메인, 에피토프 태그)로 표지될 수 있다. 몇몇 경우에, 잠재적인 입체 장애를 감소시키기 위해 다양한 길이의 스페이서 아암에 의해 표지가 부착된다. IL-6 항체는 화학기, 예를 들어 폴리에틸렌 글리콜 (PEG), 메틸 또는 에틸기, 또는 탄수화물기로도 유도체화될 수 있다. 이러한 기들은 항체의 생물학적 특성을 개선시키는데, 예를 들어, 혈청 반감기를 증가시키는데 유용하다.
본원에 제시된 구체적인 실시예는 개시문의 특정 측면을 예시하도록 의도되고, 청구항의 범위를 제한하려고 의도되지 않는다.
실시예 1
항-
IL
-6 항체를 생산하는
하이브리도마의
생성
본원에 따른 예시적인 항체를 다음과 같이 제조하고 선택하고 분석하였다:
마우스 품종
인간 Ig 트랜스제닉 마우스 품종 HCo7 및 HCo12, 및 인간 트랜스크로모좀/트랜스제닉 품종, KM (메다렉스, 인크.)을 사용하여 인간 IL-6에 대한 완전 인간 모노클로날 항체를 제조하였다. 이들 품종은 모두 인간으로부터 단리된 항체와 구분가능하지 않은 완전 인간 항체를 발현한다.
3개의 모든 품종에서, 내인성 마우스 카파 경쇄 유전자 및 내인성 마우스 중쇄 유전자는 각각 문헌 [Chen et al. (1993) EMBO J. 12:811-820] 및 PCT 특허 공개 WO 01/09187의 실시예 1에 설명된 바와 같이 동형접합식으로 파괴되었다. 또한, 3개 모두는 문헌 [Fishwild et al. (1996) Nature Biotechnology 14:845-851]에 설명된 바와 같이 인간 카파 경쇄 트랜스젠 KCo5를 보유한다. 이와 반대로, 3개의 품종은 그들의 인간 중쇄 유전자의 측면에서 구분된다. HCo7 품종은 미국 특허 5,545,806, 5,625,825, 및 5,545,807에 설명된 바와 같이 HCo7 인간 중쇄 트랜스젠을 보유하고; HCo12 품종은 PCT 특허 공개 WO 01/09187의 실시에 2에 설명된 바와 같이 HCo12 인간 중쇄 트랜스젠을 보유하고; KM 품종은 문헌 [Ishida et al., (2002), Cloning and Stem Cells, 4: 91-102]에 설명된 바와 같이 인간 미니-염색체 (mini-chromosome)를 보유한다.
IL
-6 항원을 사용한 면역화 및 항-
IL
-6
모노클로날
항체를 생산하는
HuMab
마우스의 선택
HuMab 마우스에 대한 일반적인 면역화 계획은 문헌 ([Lonberg et al (1994) Nature 368(6474): 856-859]; [Fishwild et al. (1996) Nature Biotechnology 14: 845-851]) 및 PCT 특허 공개 WO 98/24884에 설명되어 있다. 본 경우에, HCo7, HCo12 및 KM 품종의 총 81마리의 HuMab 마우스를 6-16주령에서 시작하여 Ribi 어쥬번트 (adjuvant) 내의 5-25 ㎍의 정제된 인간 IL-6으로 면역화시켰다. 인간 IL-6을 배지 내로 IL-6을 내인성으로 분비하는 인간 골수-유래된 기질 세포, HS-5 (ATCC CRL-11882, [Roecklein B. A. & Torok-Storb B., Blood 85: 997-1005, 1995])로부터 단리하였다. 인간 IL-6을 IL-6 발현 HS-5 배지로부터 정제하고, 이를 한외여과에 이어 Q Sepharose 음이온 교환 크로마토그래피 단계 및 마우스 항-hIL-6 MAb (알앤디 시스템즈 (R&D Systems), 카탈로그 번호 MAB2061, 클론 1936)를 사용하는 친화도 크로마토그래피 단계에 의해 농축시켰다. 정제된 인간 IL-6은 순도가 SDS-PAGE에 의해 약 90%이었다. 주요 밴드를 SDS-PAGE 겔로부터 절제하고, 트립신으로 소화시키고, 추출된 겔 정제된 트립신에 의한 펩티드를 MALDI/MS를 통해 4700 TOF/TOF 프로테오믹스(Proteomics) 분석기 상에서 분석하였고, 인간 IL-6임을 확인하였다. 별법으로, 상업적인 공급원으로부터 재조합 인간 IL-6을 사용할 수 있다 (예를 들어, 재조합 인간 IL-6, 카탈로그 번호 206-IL-6/CF. 알앤디 시스템 인크. (R&D System Inc. 미국 미네소타주 55413 미네아폴리스 맥킨리 플레이스 NE 614). 투여는 총 8회 면역화까지 3-14일 간격으로 복강내, 피하 또는 발바닥 내로 주사에 의한다. 면역 반응은 아래 설명된 바와 같이 ELISA 스크리닝을 통해 모니터링하였다.
항-
IL
-6 항체를 생산하는
HuMab
마우스의 선택
상기 설명된 트랜스제닉 마우스로부터의 혈액을 후안와 출혈을 통해 얻고, 문헌 [Fishwild et al. (1996), Nature Biotechnology 14: 845-851]에 설명된 바와 같이 정제된 인간 IL-6 재조합 단백질에 대한 특이적 결합에 대해 ELISA에 의해 분석하였다.
간단히 설명하면, 미세적정 플레이트를 PBS 내에 1 ㎍/ml을 함유하는 정제된 재조합 IL-6 용액 50 ㎕/웰을 사용하여 코팅하고, 4℃에서 밤새 인큐베이팅하였다. 이어서, 웰을 PBS/Tween 중 200 ㎕/웰의 5% 닭 혈청 (0.05%)을 사용하여 차단하였다. IL-6-면역화된 마우스로부터 혈장의 희석액을 각각의 웰에 첨가하고, 1시간 동안 주변 온도에서 인큐베이팅하였다. 플레이트를 PBS/Tween으로 세척한 후, 양고추냉이 퍼옥시다제 (HRP)와 컨쥬게이팅된 염소-항-인간 IgG Fc 폴리클로날 항체와 함께 1시간 동안 실온에서 인큐베이팅하였다. 세척한 후에, 플레이트를 ABTS 기질 (모스 인크 (Moss Inc), 제품#: ABTS-1000 mg/ml)로 발색시키고 분광광도계에 의해 OD 415-495에서 분석하였다. 최고 역가의 항-IL-6 항체를 나타낸 마우스 (총 22마리 동물)를 융합을 위해 사용하였다.
IL -6에 대한 인간 모노클로날 항체를 생산하는 하이브리도마의 생성:
상기 선택된 마우스에게 3일에 및 이어서 2일에 다시 IL-6을 정맥내 추가 접종한 후, 희생시키고 비장 및/또는 림프절을 제거하였다. 총 17의 융합을 수행하였다.
면역화된 HuMab 또는 KM 마우스로부터 단리된 마우스 비장세포 및/또는 림프절 림프구를 표준 또는 제조자 권장 프로토콜에 따라 전기융합 (E-fusion, Cyto Pulse™ 기술, (사이토 펄스 사이언시즈, 인크. (Cyto Pulse™ Sciences, Inc., 미국 메릴랜드주 글렌 버니))을 이용하여 SP2/0 비-분비 마우스 골수종 세포 (ATCC, CRL-1581, ATCC 아메리칸 타입 컬쳐 컬렉션, 미국 20110-2209 버지니아주 매나사스 10801 유니버시티 불러바드)에 융합시켰다.
간단히 설명하면, 면역화된 마우스로부터 비장세포 및/또는 림프절 림프구의 단세포 현탁액을 제조한 후, 동일 수의 Sp2/0 비-분비 마우스 골수종 세포와 합한 후; E-융합을 수행하였다.
이어서, 세포를 2x104 세포/웰로 평저 미세적정 플레이트에 플레이팅하고, 10% 태소 혈청, 10% P388D1 (ATCC, CRL-TIB-63) 조건화 배지, DMEM 중 3-5% (IGEN) (미디어테크 (Mediatech, 미국 버지니아주 헌돈), Cat. No. CRL 10013, 고 글루코스, L-글루타민 및 피루브산나트륨 함유), 5 mM HEPES, 0.055 mM 2-머캅토에탄올, 50 mg/ml 겐타마이신 및 1x HAT (시그마 (Sigma), Cat. No. CRL-P-7185)를 함유하는 선택 배지 내에서 10-14일 동안 인큐베이팅하였다.
1-2주 후에, 세포를 HAT를 HT로 교체한 배지 내에서 배양하였다. 세포를 플레이팅한 지 약 10-14일 후에, 개별 웰로부터의 상등액을 인간 감마, 카파 항체의 존재에 대해 스크리닝하였다. 이어서, 인간 감마, 카파에 대해 양성으로 스코어링된 상등액을 인간 항-IL-6 모노클로날 IgG 항체에 대해 (상기한 프로토콜을 사용하여) ELISA에 의해 스크리닝하였다. 항체-분비 하이브리도마를 24 웰 플레이트에 옮기고, 다시 스크리닝하고, 인간 항-IL-6 IgG 모노클로날 항체에 대해 양성이 확인되면, 제한 희석에 의해 적어도 2회 서브클로닝하였다. 이어서, 안정한 서브클론을 시험관 내에서 배양하여, 추가의 특성결정을 위해 조직 배양 배지 내에 소량의 항체를 생성하였다.
실시예 2
IL
-6 항체의 서열 결정
전장 항-IL-6 항체를 클로닝하고, 다음과 같이 하이브리도마로부터 서열을 입증하였다: Poly(A)+ mRNA를 RNeasy 미니 키트 (퀴아겐 (Qiagen))을 사용하여 단리하고, 올리고(dT) 프라이밍을 이용하여 어드밴티지(Advantage) RT-for-PCR 키트 (비디 바이오사이언시즈 (BD Biosciences))를 사용하여 mRNA로부터 cDNA를 합성하였다. 클론 9C8에 대한 올리고(dT) 프라이밍된 cDNA를, 각각 표 1에 나열된 축퇴성 프라이머를 사용하여 증폭시켰다.
[표 1]
증폭은 다음과 같은 사이클링으로 고충실도 (High Fidelity) 중합효소 (로슈 (Roche)) 및 PTC-200 DNA 엔진 (엠제이 리서치 (MJ Research))를 사용하여 달성하였다: 95℃에서 2분; 25x (95℃에서 20초, 52℃에서 30초, 72℃에서 2분); 72℃에서 10분. PCR 앰플리콘을 표준 프로토콜을 이용하여 pCR2.1 TOPO 내로 클로닝하고 TOP10 화학적 전능 세포 (인비트로겐 (Invitrogen)) 내로 형질전환시켰다. 클론을 Grills 16th BDTv3.1/dGTP 화학 (어플라이드 바이오시스템즈 인크 (Applied Biosystems Inc)) 및 3730xI DNA 분석기 (어플라이드 바이오시스템즈 인크)를 이용하여 서열 입증하였다. 모든 서열을 'V BASE 서열 디렉토리'에 대한 정렬에 의해 분석하였다 ([Tomlinson, et al, J. Mol. Biol., 227, 776-798 (1992)]; [Hum. Mol. Genet, 3, 853-860 (1994)]; [EMBO J., 14, 4628-4638 (1995)]). 예시적인 항-IL-6 항체의 생식계열 유전자 세그먼트 용도를 표 2에 나열한다.
[표 2]
항- IL -6 항체 가변 도메인을 다음과 같이 발현 벡터 내로 클로닝하였다:
가변 도메인을 표 3에 나열된 프라이머를 사용하여 pCR2.1 클로닝된 cDNA로부터 증폭시켰다. 증폭은 다음과 같은 사이클링으로 Pfx 플래티넘 중합효소 (인비트로겐) 및 PTC-200 DNA Engine (엠제이 리서치)를 사용하여 달성하였다: 94℃에서 2분; 20x (94℃에서 30초, 55℃에서 45초, 68℃에서 1분); 68℃에서 5분. 이어서, 가변 도메인을 적절한 이소형의 불변 도메인을 함유하는 발현 벡터 내로 클로닝하였다. 이들 클론을 Grills 16th BDTv3.1/dGTP 화학 (어플라이드 바이오시스템즈 인크) 및 3730xI DNA 분석기 (어플라이드 바이오시스템즈 인크)를 사용하여 서열 입증하였다.
[표 3]
실시예 3
항- IL -6 항체의 돌연변이 유발:
중쇄 가변 도메인 내의 항-IL-6 항체 9C8의 아미노산 치환 변이체를 위치 24 (I24V), 30 (R30S), 31 (E31G), 52 (F52N), 68 (N68T), 83 (T83S)에서 IgG1 또는 IgG2 형식의 배경 모두에서 단독으로 또는 조합으로 제조하였다. 경쇄 가변 도메인 내의 항-IL-6 항체 9C8의 아미노산 치환 변이체를 92 (K92N)에서 IgG1 또는 IgG2 형식으로서 제조하였다. 중쇄 가변 도메인 및 경쇄 가변 도메인 변이체를 모두 갖는 항체를 제조하였다. 다양한 돌연변이 조합의 일부를 표 6a 및 6b에 제시한다. 클론 9C8의 VH (I24V), VH (E31G), VH (N68T) 및 VH (T83S) 구역에서 돌연변이 유발을 표 4에 제시된 프라이머 (센스 가닥을 제시함; 표적화된 잔기를 굵은 글씨체로 제시함) 및 퀵체인지(QuickChange) 키트 (스트라타젠)를 제조자의 지시에 따라 사용하여 수행하였다. 돌연변이된 변이체를 표준 절차에 의해 서열 입증하고 발현 벡터 내로 클로닝하였다.
[표 4]
CMV 프로모터를 함유하는 발현 벡터를 시판자 프로토콜에 따라 293 Freestyle (인비트로겐) 세포 내로 형질감염시켰다. 이들 세포로부터의 상등액을 원심분리에 의해 모으고, 표준 단백질-A 친화도 크로마토그래피에 의해 정제하여 재조합 면역글로불린을 단리하였다. 이어서, 이들 단백질을 SDS-PAGE, 광 산란에 의해, 및 분광광도계로 특성 결정하였다.
표 5에 표시된 항-IL-6 항체의 중쇄 및 경쇄를 부다페스트 조약 (Budapest Treaty)에 따라 아메리칸 타입 컬쳐 컬렉션 (ATCC)(미국 20110-2209 버지니아주 매나사스 10801 유니버시티 불러바드)에 기탁하였다. 중쇄 및 경쇄에 다음 수탁 번호가 지정되었다:
[표 5]
실시예 4
TF
-1 증식
인간 세포, TF-1 세포 (아메리칸 타입 컬쳐 컬렉션 (ATCC))를 입수하고, 2 ng/ml 재조합 인간 GM-CSF와 함께 10% 열 불활성화 태소 혈청 (FBS) (인비트로겐, 미국 캘리포니아주 칼스바드)를 함유하는 RPMI-1640 배지 내에 유지하였다. TF-1 세포를 다음날 사용을 위해 1-2x105로 나누었다. 플레이팅 전에, 세포를 RPMI-1640으로 3회 세척하고, 계수하고, 분석 배지로 부피를 조정하여 2x105 세포/ml을 얻었다. 각각의 웰에, 50 ㎕의 세척된 세포를 첨가하고, 37℃에서 5% CO2를 사용하여 밤새 인큐베이팅하였다. 모든 조건은 96-웰 조직 배양액 처리된 플레이트 (코닝 (Corning, 미국 뉴욕주 코닝))에서 삼중으로 수행하였다. 각각의 웰에, 25 ㎕의 부피 중의 25 ng/ml 또는 2.5 ng/ml IL-6, 및 시험 또는 대조 항체를 인산나트륨 버퍼 (10 mM 인산나트륨 및 150 mM 염화나트륨, pH 7.4) 내에 25 ㎕의 부피 내에 상이한 농도에서 100 ㎕의 최종 부피로 첨가하였다. 항체를 단독으로 및 인간 IL-6과 함께 시험하였다. 플레이트를 48시간 (hrs) 동안 37℃에서 5% CO2를 사용하여 인큐베이팅하였다. 48시간 후에, 10 ㎕/웰의 0.5 μCi 3H-티미딘 (아머샴 바이오사이언시즈 (Amersham Biosciences, 미국 뉴저지주 피츠카타웨이))을 첨가하고, 세포로 3 hrs 동안 펄싱하였다. 통합된 티미딘의 양을 검출하기 위해, 세포를 미리 적셔둔 유니필터 GF/C 필터플레이트 (패카드 (Packard, 미국 코넥티컷주 메리덴)) 상으로 수확하고 물로 10회 세척하였다. 플레이트를 밤새 건조시켰다. 필터플레이트에 저변 밀봉을 첨가하였다. 이어서, 웰당 45 ㎕ 마이크로신트 20 (패카드, 미국 코넥티컷주 메리덴)을 첨가하였다. 상단 밀봉을 첨가한 후, 플레이트를 트리룩스 마이크로베타 계수기 (월락 (Wallac, 미국 오하이오주 노턴))에서 계수하고, 데이타를 CPM (분당 계수)으로 기록한다. 표 6a 및 6b에서는 9C8 항체 및 아미노산 치환이 있는 다양한 항체의 TF-1 증식 분석에서 IC50을 보여준다. 표 6a 및 표 6b에 제시된 결과는 2개의 별개의 상황에서 수행된 분석으로부터의 것이다.
[표 6a]
[표 6b]
실시예 5
LPS
-원숭이 연구로부터의 C-반응성 단백질
본 연구의 생체내 부분은 찰스 리버 래보래토리스 프리클리니컬 서비스즈 (Charles River Laboratories Preclinical Services)에 의해 그들의 미국 매사추세츠주 워체스터 시험 시설에서 수행되었다. 간단히 설명하면, 연구는 15마리의 수컷 사이노몰거스 원숭이 (5개의 군; 3 원숭이/군)으로 이루어졌다. 제1일에, 제1 군의 동물에게 비히클을 투여하고; 제2 및 제3 군의 동물에게 항체 9C8 N68T T83S IgG1을 각각 0.5 및 5 mg/kg의 용량으로 투여하고; 제4 및 제5 군의 동물에게 9C8 N68T T83S IgG2를 각각 0.5 및 5 mg/kg의 용량으로 투여하였다. 모든 처리제는 각각 1 mL/kg의 용량 부피에서 IV 볼러스 주사로 투여하였다. 처리 약 2시간 후에, 모든 동물에게 10 ㎍/kg 세균 지질다당류 (LPS)를 1 mL/kg의 부피에서 느린 IV 볼러스 주사에 의해 시험접종하였다. 제1일에, 혈액을 기준선 (처리 전); 처리 직후; 처리 2시간 후 (LPS 투여 직전); 및 LPS 시험접종의 30분 및 1, 2, 3, 4, 6, 8 및 22시간 후에 말초 혈관으로부터 모았다. 혈액 샘플은 또한 제3, 4, 5, 6 및 7일에 모았다. 전체 혈액 샘플을 혈청으로 가공하고, 혈청 샘플을 동결 저장하였다. C-반응성 단백질 (CRP)은 메조 스케일 디스커버리 (MSD®, 미국 매릴랜드주 게이터스버그)로부터 인간 혈관 손상 패널 II 멀티-스팟(Multi-Spot)® 분석 키트를 사용하여 측정하였다. 분석은 MSD로부터의 인쇄된 키트 지시서에 개략된 바와 같이 수행하였다. 도 2는 9C8 N68T T83S IgG2 항체에 대한 총 혈청 CRP를 보여준다.
실시예 6
유동 세포측정에 의한
pSTAT3
분석
시험관내 분석을 재조합 인간 IL-6 (rhIL-6)으로 자극시킨 인간 전체 혈액 및 인간 말초 혈액 단핵 세포 (PBMC)에서 수행하여, 항-IL-6 항체의 존재 하에 인산화된 STAT3 (pSTAT3) 수준을 측정하였다.
전체 혈액 분석
새로 모은 헤파린처리된 인간 전체 혈액을 항-IL-6 항체 또는 비히클 대조군 (15 mL 폴리프로필렌 튜브 내에서 최종 부피 300 ㎕)과 함께 15분 동안 37℃에서 인큐베이팅하였다. 샘플을 재조합 인간 (rh) IL-6으로 25 ng/mL의 최종 농도에 대해 자극하고, 10분 동안 37℃에서 인큐베이팅하였다. 이어서, 적혈구 (RBC)를 4 mL RBC 용해 버퍼 (시그마)로 용해시키고, 샘플을 10분 동안 37℃에서 부드럽게 혼합하였다. 샘플을 400 x g로 5 분 동안 원심분리하여 세포를 펠렛화하였다. 상등액을 제거하였다. 2 ml의 세척 버퍼 (PBS 중 4% BSA, 깁코 (Gibco))를 각각의 튜브에 첨가한 후, 샘플을 400 x g에서 5 분 동안 원심분리하여 세포를 펠렛화하였다. 상등액을 제거하고, 세포 펠렛을 200 ㎕의 예열시킨 (37℃) 투과화 버퍼 (PBS 중 2% 포름알데히드, 폴리사이언시즈, 인크. (Polysciences, Inc.)) 내에 재현탁시키고, 37℃에서 10분 동안 인큐베이팅하였다. 3 ml의 빙냉 MeOH를 각각의 샘플에 첨가하여 세포를 고정시켰다. 샘플을 혼합하고 적어도 30 분 동안 얼음 상에 놓았다. 샘플을 원심분리하고 (5 분 동안 400x g), 상등액을 제거하였다. 펠렛을 세척 버퍼로 1회 세척하였다. 이어서, 세포 펠렛을 세척 버퍼 내에 희석시킨 알렉사 플루오르 488 (비디 파밍엔 (BD Pharmingen))에 컨쥬게이팅된 항-인산화된 STAT3 (Y705) 항체로 염색하였다 (최종 부피 100 ㎕). 샘플을 얼음 상에서 30분 동안 인큐베이팅한 후, 세척 버퍼 내에서 2X 세척하였다. 최종 세포 펠렛을 400 ㎕ IF 버퍼 (행크 (Hank) 완충 염수 용액, 2% 태소 혈청, 10 mM Hepes, 0.2% 나트륨 아지드, 깁코) 내에 재현탁하였다. 셀퀘스트(CellQuest) 소프트웨어를 이용하는 FACSCalibur 기기 (비디 바이오사이언시즈)를 이용하여 데이타를 수집하고 분석하였다. 표 7은 인간 전체 혈액에서 측정될 때 항-IL-6 항체의 존재 하에 pSTAT3 수준을 보여준다.
[표 7]
PBMC
분석
말초 혈액 단핵 세포 (PBMC)를 제조자의 프로토콜에 따라 아쿠스핀 시스템-히스토파크 (Accuspin System-Histopaque) 1077 컬럼 (시그마-알드리치 (Sigma-Aldrich) A7054)을 사용하여 새로 모은 헤파린처리된 인간 전체 혈액으로부터 단리하고, (대식세포 SFM 배지 내의 0.1% 페니실린 스트렙토마이신, 깁코) 내에 넣었다. 약 2x106 PBMC를 항-IL-6 항체 또는 비히클 대조군 (최종 부피 300 ㎕)과 함께 15 분 동안 37℃에서 인큐베이팅하였다. PBMC를 25 ng/mL의 최종 농도에 대해 rhIL-6으로 자극하고, 10 분 동안 37℃에서 인큐베이팅하였다. 샘플을 400 x g로 5 분 동안 원심분리하여 세포를 펠렛화하였다. 상등액을 제거하였다. 2 ml의 세척 버퍼 (PBS 중 4% BSA)를 각각의 튜브에 첨가하였다. 샘플을 400 x g에서 5 분 동안 원심분리하여 세포를 펠렛화하였다. 상등액을 제거하고, 세포 펠렛을 200 ㎕의 예열시킨 (37℃) 투과화 버퍼 (PBS 중 2% 포름알데히드, 폴리사이언시즈, 인크.) 내에 재현탁시키고, 37℃에서 10분 동안 인큐베이팅하였다. 3 ml의 빙냉 MeOH를 각각의 샘플에 첨가하여 세포를 고정시켰다. 샘플을 혼합하고 적어도 30 분 동안 얼음 상에 놓았다. 샘플을 400 x g에서 5 분 동안 원심분리하고, 상등액을 제거하였다. 세포 펠렛을 세척 버퍼로 1회 세척한 후, 전체 혈액 분석에 설명된 바와 같이 염색하고 분석하였다. 표 8은 인간 말초 혈액 단핵 세포에서 측정될 때 항-IL-6 항체의 존재 하에 pSTAT3 수준을 보여준다.
[표 8]
실시예 7
결합 친화도
BIAcore
칩의 준비
항-IL-6 항체 9C8 N68T T83S IgG2를 문헌 [Lofas & Johnsson (J. Chem. Soc. Chem. Commun. (1990); 21:pp1526-1528)]에 설명된 바와 같이 칩의 덱스트란 매트릭스에 부착된 카르복시메틸셀룰로스 (CM)에 아민 커플링시킴으로써 BIAcore CM5 칩 (지이 바이오사이언시즈 (GE Biosciences - 이전에 비아코어 인크. (BIAcore Inc), 미국 뉴저지주 피츠카타웨이)) 상으로 고정시켰다. 칩을 커플링 전에 1 M NaCl 및 50 mM NaOH로 예비처리하였다. 아민 커플링은 EDC (1-에틸-3-(3-디메틸아미노프로필)카르보디이미드 및 NHS (N-히드록시숙신이미드)를 조합하고, 칩을 가로질러 통과시켜 CM기를 활성화시킴으로써 달성하였다. 10 mM 아세테이트 버퍼 (pH 5) 내의 리간드를 칩 표면을 가로질러 통과시키고, 활성화된 CM기에 공유방식으로 결합되었다. 칩 표면 상의 나머지 활성 CM은 1M 에탄올아민 (pH 8.5)을 칩을 가로질러 통과시킴으로써 켄칭시켰다. EDC, NHS 및 에탄올아민은 지이 바이오사이언시즈로부터 입수한 아민 커플링 키트의 일부로서 입수하였다. 커플링은 비아콘트롤 (BiaControl) 소프트웨어 V3.2에 포함된 자동화 표면 준비 마법사 (Surface Preparation Wizard)를 이용하여 수행하였다.
결합
친화도의
결정
모든 SPR 측정은 BIAcore 3000 기기 (지이 바이오사이언시즈) 상에서 수행하였다. BIAcore 소프트웨어 - BIAcore 3000 제어 소프트웨어 V3.2을 BIAcore 3000 기기의 작동 및 제어를 위해 사용하였다. BIAcore 3000 기기로부터 SPR 데이타의 분석을 위해 BiaEvaluation 소프트웨어 V4.1을 이용하였고, 데이타를 Graph Pad Prism 소프트웨어 버전 5를 사용하여 플로팅하였다. 모노클로날 항체 (mAb)에 대한 IL-6의 결합 친화도를 HBS-EP 버퍼 (10 mM HEPES, 150 mM NaCl, 3.4 mM EDTA, 0.005% P20) 내에서 25℃에서 측정하였다. 대량 수송 효과를 최소화하기 위해 친화도 연구를 위한 유속은 40 ㎕/분이었다 (Myszka, D. G., et al., Biophysical chemistry. 64, 127-137, 1997). 인간 IgGΚ를 칩의 참조 채널 제작을 위한 리간드로서 사용하였다. 고정시킨 리간드 (9C8 N68T T83S IgG2)에 결합한 분석물 (rhIL-6; 알앤디 시스템즈, 미국 미네소타주 미네아폴리스, 206-IL)을 이중으로 측정하고, IL-6의 농도는 0 내지 25 nM 범위였다. IL-6에 대한 주사 시간은 6분이고, 해리 시간은 25분이었다. 표면은 사이클 사이에 10 mM 글라이신 (pH 1.7)에 의해 30초 동안 30 ㎕/분의 유속에서 재생시켰다. 재생 조건은 재생 연구 후에 최적이 되도록 확립되었다 (데이타를 제시하지 않음). 데이타를 1:1 랭뮈어 (Langmuir) 모델을 이용하여 둘 모두 BiaEvaluation 소프트웨어 V4.1 내에 포함되는 운동학 마법사 (Kinetics Wizard) 및 수동 피팅 프로그램을 사용함으로써 분석하였다 (Karlson R & Falt A., J. Immunol. Methods. 200: pp121-133, 1997). 항-IL-6 항체 9C8 N68T T83S IgG2는 ka= 9.95E+05 (Ms)-1, kd= 1.34E-04 s-1 및 KD= 1.35E-10 M 또는 135 pM인 것으로 나타났다.
SEQUENCE LISTING
<110> Pfizer Inc
Medarex, Inc
<120> ANTIBODIES TO IL-6 AND THEIR USES
<130> PC030394
<160> 60
<170> PatentIn version 3.5
<210> 1
<211> 1338
<212> DNA
<213> homo sapien
<400> 1
caggtgcagc tacagcagtg gggcgcagga ctgttgaagc cttcggagac cctgtccctc 60
acctgcgcta tctatggtgg gtccttcagg gagtactact ggagctggat ccgccagccc 120
ccagggaagg ggctggagtg gattggggaa atctttcata gtggaagcac caactacaac 180
ccgtccctca agagtcgagt caacatatca gtagacacgt ccaagaacca gttctccctg 240
aagctgacct ctgtgaccgc cgcggacacg gctgtgtatt actgtgcgag agaggaatta 300
gatgattttg atatctgggg ccaagggaca atggtcaccg tctcttcagc ctccaccaag 360
ggcccatcgg tcttccccct ggcaccctcc tccaagagca cctctggggg cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tggtgaccgt gccctccagc agcttgggca cccagaccta catctgcaac 600
gtgaatcaca agcccagcaa caccaaggtg gacaagagag ttgagcccaa atcttgtgac 660
aaaactcaca catgcccacc gtgcccagca cctgaactcc tggggggacc gtcagtcttc 720
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc 780
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc 840
gtggaggtgc ataatgccaa gacaaagccg cgggaggagc agtacaacag cacgtaccgt 900
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc 960
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggg 1020
cagccccgag aaccacaggt gtacaccctg cccccatccc gggatgagct gaccaagaac 1080
caggtcagcc tgacctgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg 1140
gagagcaatg ggcagccgga gaacaactac aagaccacgc ctcccgtgct ggactccgac 1200
ggctccttct tcctctacag caagctcacc gtggacaaga gcaggtggca gcaggggaac 1260
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacacgca gaagagcctc 1320
tccctgtctc cgggtaaa 1338
<210> 2
<211> 348
<212> DNA
<213> homo sapien
<400> 2
caggtgcagc tacagcagtg gggcgcagga ctgttgaagc cttcggagac cctgtccctc 60
acctgcgcta tctatggtgg gtccttcagg gagtactact ggagctggat ccgccagccc 120
ccagggaagg ggctggagtg gattggggaa atctttcata gtggaagcac caactacaac 180
ccgtccctca agagtcgagt caacatatca gtagacacgt ccaagaacca gttctccctg 240
aagctgacct ctgtgaccgc cgcggacacg gctgtgtatt actgtgcgag agaggaatta 300
gatgattttg atatctgggg ccaagggaca atggtcaccg tctcttca 348
<210> 3
<211> 446
<212> PRT
<213> homo sapien
<400> 3
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Tyr Gly Gly Ser Phe Arg Glu Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Phe His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Asn Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Thr Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Glu Leu Asp Asp Phe Asp Ile Trp Gly Gln Gly Thr Met Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 4
<211> 116
<212> PRT
<213> homo sapien
<400> 4
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Tyr Gly Gly Ser Phe Arg Glu Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Phe His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Asn Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Thr Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Glu Leu Asp Asp Phe Asp Ile Trp Gly Gln Gly Thr Met Val
100 105 110
Thr Val Ser Ser
115
<210> 5
<211> 5
<212> PRT
<213> homo sapien
<400> 5
Glu Tyr Tyr Trp Ser
1 5
<210> 6
<211> 16
<212> PRT
<213> homo sapien
<400> 6
Glu Ile Phe His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 7
<211> 8
<212> PRT
<213> homo sapien
<400> 7
Glu Glu Leu Asp Asp Phe Asp Ile
1 5
<210> 8
<211> 30
<212> PRT
<213> homo sapien
<400> 8
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Tyr Gly Gly Ser Phe Arg
20 25 30
<210> 9
<211> 14
<212> PRT
<213> homo sapien
<400> 9
Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
1 5 10
<210> 10
<211> 31
<212> PRT
<213> homo sapien
<400> 10
Arg Val Asn Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu Lys
1 5 10 15
Leu Thr Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
20 25 30
<210> 11
<211> 11
<212> PRT
<213> homo sapien
<400> 11
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
1 5 10
<210> 12
<211> 642
<212> DNA
<213> homo sapien
<400> 12
gacatccaga tgacccagtc tccatcctca ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgtc gggcgagtca gggtattagc agctggttag cctggtatca gcagaaacca 120
gagaaagccc ctaagtccct gatctatgct gcatccagtt tgcaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagat ttcactctca ccatcagtag cctgcagcct 240
gaagattttg caacttatta ctgccaacag tataaaagtt accctcggac gttcggccaa 300
gggaccaagg tggaaatcaa acgaactgtg gctgcaccat ctgtcttcat cttcccgcca 360
tctgatgagc agttgaaatc tggaactgcc tctgttgtgt gcctgctgaa taacttctat 420
cccagagagg ccaaagtaca gtggaaggtg gataacgccc tccaatcggg taactcccag 480
gagagtgtca cagagcagga cagcaaggac agcacctaca gcctcagcag caccctgacg 540
ctgagcaaag cagactacga gaaacacaaa gtctacgcct gcgaagtcac ccatcagggc 600
ctgagctcgc ccgtcacaaa gagcttcaac aggggagagt gt 642
<210> 13
<211> 321
<212> DNA
<213> homo sapien
<400> 13
gacatccaga tgacccagtc tccatcctca ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgtc gggcgagtca gggtattagc agctggttag cctggtatca gcagaaacca 120
gagaaagccc ctaagtccct gatctatgct gcatccagtt tgcaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagat ttcactctca ccatcagtag cctgcagcct 240
gaagattttg caacttatta ctgccaacag tataaaagtt accctcggac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 14
<211> 214
<212> PRT
<213> homo sapien
<400> 14
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Glu Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Lys Ser Tyr Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 15
<211> 107
<212> PRT
<213> homo sapien
<400> 15
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Glu Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Lys Ser Tyr Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 16
<211> 11
<212> PRT
<213> homo sapien
<400> 16
Arg Ala Ser Gln Gly Ile Ser Ser Trp Leu Ala
1 5 10
<210> 17
<211> 7
<212> PRT
<213> homo sapien
<400> 17
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 18
<211> 9
<212> PRT
<213> homo sapien
<400> 18
Gln Gln Tyr Lys Ser Tyr Pro Arg Thr
1 5
<210> 19
<211> 23
<212> PRT
<213> homo sapien
<400> 19
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys
20
<210> 20
<211> 15
<212> PRT
<213> homo sapien
<400> 20
Trp Tyr Gln Gln Lys Pro Glu Lys Ala Pro Lys Ser Leu Ile Tyr
1 5 10 15
<210> 21
<211> 32
<212> PRT
<213> homo sapien
<400> 21
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys
20 25 30
<210> 22
<211> 10
<212> PRT
<213> homo sapien
<400> 22
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 23
<211> 1326
<212> DNA
<213> homo sapien
<400> 23
caggtgcagc tacagcagtg gggcgcagga ctgttgaagc cttcggagac cctgtccctc 60
acctgcgcta tctatggtgg gtccttcagg gagtactact ggagctggat ccgccagccc 120
ccagggaagg ggctggagtg gattggggaa atctttcata gtggaagcac caactacaac 180
ccgtccctca agagtcgagt caacatatca gtagacacgt ccaagaacca gttctccctg 240
aagctgacct ctgtgaccgc cgcggacacg gctgtgtatt actgtgcgag agaggaatta 300
gatgattttg atatctgggg ccaagggaca atggtcaccg tctcttcagc ctccaccaag 360
ggcccatcgg tcttccccct ggcgccctgc tccaggagca cctccgagag cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gctctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tagtgaccgt gccctccagc aacttcggca cccagaccta cacctgcaac 600
gtagatcaca agcccagcaa caccaaggtg gacaagacag ttgagcgcaa atgttgtgtc 660
gagtgcccac cgtgcccagc accacctgtg gcaggaccgt cagtcttcct cttcccccca 720
aaacccaagg acaccctcat gatctcccgg acccctgagg tcacgtgcgt ggtggtggac 780
gtgagccacg aagaccccga ggtccagttc aactggtacg tggacggcgt ggaggtgcat 840
aatgccaaga caaagccacg ggaggagcag ttcaacagca cgttccgtgt ggtcagcgtc 900
ctcaccgtcg tgcaccagga ctggctgaac ggcaaggagt acaagtgcaa ggtctccaac 960
aaaggcctcc cagcccccat cgagaaaacc atctccaaaa ccaaagggca gccccgagaa 1020
ccacaggtgt acaccctgcc cccatcccgg gaggagatga ccaagaacca ggtcagcctg 1080
acctgcctgg tcaaaggctt ctaccccagc gacatcgccg tggagtggga gagcaatggg 1140
cagccggaga acaactacaa gaccacacct cccatgctgg actccgacgg ctccttcttc 1200
ctctacagca agctcaccgt ggacaagagc aggtggcagc aggggaacgt cttctcatgc 1260
tccgtgatgc atgaggctct gcacaaccac tacacacaga agagcctctc cctgtctccg 1320
ggtaaa 1326
<210> 24
<211> 442
<212> PRT
<213> homo sapien
<400> 24
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Tyr Gly Gly Ser Phe Arg Glu Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Phe His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Asn Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Thr Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Glu Leu Asp Asp Phe Asp Ile Trp Gly Gln Gly Thr Met Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe
180 185 190
Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro
210 215 220
Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
340 345 350
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
420 425 430
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 25
<211> 642
<212> DNA
<213> homo sapien
<400> 25
gacatccaga tgacccagtc tccatcctca ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgtc gggcgagtca gggtattagc agctggttag cctggtatca gcagaaacca 120
gagaaagccc ctaagtccct gatctatgct gcatccagtt tgcaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagat ttcactctca ccatcagtag cctgcagcct 240
gaagattttg caacttatta ctgccaacag tataaaagtt accctcggac gttcggccaa 300
gggaccaagg tggaaatcaa acgaactgtg gctgcaccat ctgtcttcat cttcccgcca 360
tctgatgagc agttgaaatc tggaactgcc tctgttgtgt gcctgctgaa taacttctat 420
cccagagagg ccaaagtaca gtggaaggtg gataacgccc tccaatcggg taactcccag 480
gagagtgtca cagagcagga cagcaaggac agcacctaca gcctcagcag caccctgacg 540
ctgagcaaag cagactacga gaaacacaaa gtctacgcct gcgaagtcac ccatcagggc 600
ctgagctcgc ccgtcacaaa gagcttcaac aggggagagt gt 642
<210> 26
<211> 214
<212> PRT
<213> homo sapien
<400> 26
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Glu Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Lys Ser Tyr Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 27
<211> 1326
<212> DNA
<213> homo sapien
<400> 27
caggtgcagc tacagcagtg gggcgcagga ctgttgaagc cttcggagac cctgtccctc 60
acctgcgcta tctatggtgg gtccttcagg gagtactact ggagctggat ccgccagccc 120
ccagggaagg ggctggagtg gattggggaa atctttcata gtggaagcac caactacaac 180
ccgtccctca agagtcgagt caccatatca gtagacacgt ccaagaacca gttctccctg 240
aagctgagct ctgtgaccgc cgcggacacg gctgtgtatt actgtgcgag agaggaatta 300
gatgattttg atatctgggg ccaagggaca atggtcaccg tctcctcagc ctccaccaag 360
ggcccatcgg tcttccccct ggcgccctgc tccaggagca cctccgagag cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gctctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tagtgaccgt gccctccagc aacttcggca cccagaccta cacctgcaac 600
gtagatcaca agcccagcaa caccaaggtg gacaagacag ttgagcgcaa atgttgtgtc 660
gagtgcccac cgtgcccagc accacctgtg gcaggaccgt cagtcttcct cttcccccca 720
aaacccaagg acaccctcat gatctcccgg acccctgagg tcacgtgcgt ggtggtggac 780
gtgagccacg aagaccccga ggtccagttc aactggtacg tggacggcgt ggaggtgcat 840
aatgccaaga caaagccacg ggaggagcag ttcaacagca cgttccgtgt ggtcagcgtc 900
ctcaccgtcg tgcaccagga ctggctgaac ggcaaggagt acaagtgcaa ggtctccaac 960
aaaggcctcc cagcccccat cgagaaaacc atctccaaaa ccaaagggca gccccgagaa 1020
ccacaggtgt acaccctgcc cccatcccgg gaggagatga ccaagaacca ggtcagcctg 1080
acctgcctgg tcaaaggctt ctaccccagc gacatcgccg tggagtggga gagcaatggg 1140
cagccggaga acaactacaa gaccacacct cccatgctgg actccgacgg ctccttcttc 1200
ctctacagca agctcaccgt ggacaagagc aggtggcagc aggggaacgt cttctcatgc 1260
tccgtgatgc atgaggctct gcacaaccac tacacgcaga agagcctctc cctgtctccg 1320
ggtaaa 1326
<210> 28
<211> 442
<212> PRT
<213> homo sapien
<400> 28
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Tyr Gly Gly Ser Phe Arg Glu Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Phe His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Glu Leu Asp Asp Phe Asp Ile Trp Gly Gln Gly Thr Met Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe
180 185 190
Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro
210 215 220
Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
340 345 350
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
420 425 430
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 29
<211> 116
<212> PRT
<213> homo sapien
<400> 29
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Tyr Gly Gly Ser Phe Arg Glu Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Phe His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Glu Leu Asp Asp Phe Asp Ile Trp Gly Gln Gly Thr Met Val
100 105 110
Thr Val Ser Ser
115
<210> 30
<211> 32
<212> PRT
<213> homo sapien
<400> 30
Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu Lys
1 5 10 15
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg
20 25 30
<210> 31
<211> 1338
<212> DNA
<213> homo sapien
<400> 31
caggtgcagc tacagcagtg gggcgcagga ctgttgaagc cttcggagac cctgtccctc 60
acctgcgcta tctatggtgg gtccttcagg gagtactact ggagctggat ccgccagccc 120
ccagggaagg ggctggagtg gattggggaa atctttcata gtggaagcac caactacaac 180
ccgtccctca agagtcgagt caccatatca gtagacacgt ccaagaacca gttctccctg 240
aagctgagct ctgtgaccgc cgcggacacg gctgtgtatt actgtgcgag agaggaatta 300
gatgattttg atatctgggg ccaagggaca atggtcaccg tctcctcagc ctccaccaag 360
ggcccatcgg tcttccccct ggcaccctcc tccaagagca cctctggggg cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tagtgaccgt gccctccagc agcttgggca cccagaccta catctgcaac 600
gtgaatcaca agcccagcaa caccaaggtg gacaagaaag ttgagcccaa atcttgtgac 660
aaaactcaca catgcccacc gtgcccagca cctgaactcc tggggggacc gtcagtcttc 720
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc 780
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc 840
gtggaggtgc ataatgccaa gacaaagccg cgggaggagc agtacaacag cacgtaccgt 900
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc 960
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggg 1020
cagccccgag aaccacaggt gtacaccctg cccccatccc gggaggagat gaccaagaac 1080
caggtcagcc tgacctgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg 1140
gagagcaatg ggcagccgga gaacaactac aagaccacgc ctcccgtgct ggactccgac 1200
ggctccttct tcctctatag caagctcacc gtggacaaga gcaggtggca gcaggggaac 1260
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacacgca gaagagcctc 1320
tccctgtctc cgggtaaa 1338
<210> 32
<211> 446
<212> PRT
<213> homo sapien
<400> 32
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Tyr Gly Gly Ser Phe Arg Glu Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Phe His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Glu Leu Asp Asp Phe Asp Ile Trp Gly Gln Gly Thr Met Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 33
<211> 348
<212> DNA
<213> homo sapien
<400> 33
caggtgcagc tacagcagtg gggcgcagga ctgttgaagc cttcggagac cctgtccctc 60
acctgcgcta tctatggtgg gtccttcagg gggtactact ggagctggat ccgccagccc 120
ccagggaagg ggctggagtg gattggggaa atctttcata gtggaagcac caactacaac 180
ccgtccctca agagtcgagt caccatatca gtagacacgt ccaagaacca gttctccctg 240
aagctgagct ctgtgaccgc cgcggacacg gctgtgtatt actgtgcgag agaggaatta 300
gatgattttg atatctgggg ccaagggaca atggtcaccg tctcctca 348
<210> 34
<211> 116
<212> PRT
<213> homo sapien
<400> 34
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Tyr Gly Gly Ser Phe Arg Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Phe His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Glu Leu Asp Asp Phe Asp Ile Trp Gly Gln Gly Thr Met Val
100 105 110
Thr Val Ser Ser
115
<210> 35
<211> 5
<212> PRT
<213> homo sapien
<400> 35
Gly Tyr Tyr Trp Ser
1 5
<210> 36
<211> 348
<212> DNA
<213> homo sapien
<400> 36
caggtgcagc tacagcagtg gggcgcagga ctgttgaagc cttcggagac cctgtccctc 60
acctgcgctg tctatggtgg gtccttcagg gagtactact ggagctggat ccgccagccc 120
ccagggaagg ggctggagtg gattggggaa atctttcata gtggaagcac caactacaac 180
ccgtccctca agagtcgagt caccatatca gtagacacgt ccaagaacca gttctccctg 240
aagctgagct ctgtgaccgc cgcggacacg gctgtgtatt actgtgcgag agaggaatta 300
gatgattttg atatctgggg ccaagggaca atggtcaccg tctcctca 348
<210> 37
<211> 116
<212> PRT
<213> homo sapien
<400> 37
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Arg Glu Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Phe His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Glu Leu Asp Asp Phe Asp Ile Trp Gly Gln Gly Thr Met Val
100 105 110
Thr Val Ser Ser
115
<210> 38
<211> 30
<212> PRT
<213> homo sapien
<400> 38
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Arg
20 25 30
<210> 39
<211> 348
<212> DNA
<213> homo sapien
<400> 39
caggtgcagc tacagcagtg gggcgcagga ctgttgaagc cttcggagac cctgtccctc 60
acctgcgctg tctatggtgg gtcattcaga ggttactact ggagctggat ccgccagccc 120
ccaggaaagg ggctggagtg gattggggaa atctttcata gtggaagcac caactacaac 180
ccgtccctca agagtcgagt caccatatca gtagacacgt ccaagaacca gttctccctg 240
aaactgaggt ctgtgaccgc cgcggacacg gctgtgtatt actgtgcgag agaagatatt 300
gatgattttg atatctgggg ccaagggaca atggtcaccg tctcttca 348
<210> 40
<211> 116
<212> PRT
<213> homo sapien
<400> 40
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Arg Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Phe His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Arg Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Asp Ile Asp Asp Phe Asp Ile Trp Gly Gln Gly Thr Met Val
100 105 110
Thr Val Ser Ser
115
<210> 41
<211> 8
<212> PRT
<213> homo sapien
<400> 41
Glu Asp Ile Asp Asp Phe Asp Ile
1 5
<210> 42
<211> 321
<212> DNA
<213> homo sapien
<400> 42
gacatccaga tgacccagtc tccatcctca ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgtc gggcgagtca gggtattagc agctggttag cctggtatca gcagaaacca 120
gagaaagccc ctaagtccct gatctatgct gcatccagtt tgcaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagat ttcactctca ccatcagcag cctgcagcct 240
gaagactttg caacttatta ttgccaacag tataagagtt accctcggac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 43
<211> 107
<212> PRT
<213> homo sapien
<400> 43
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Glu Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Lys Ser Tyr Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 44
<211> 9
<212> PRT
<213> homo sapien
<220>
<221> MISC_FEATURE
<222> (2)..()
<223> X = D, E, N, or Q
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> X = D, E, N, or Q
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> X = I, L, V, or M
<400> 44
Glu Xaa Xaa Leu Asp Asp Phe Asp Ile
1 5
<210> 45
<211> 9
<212> PRT
<213> homo sapien
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> X = D or E
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> X = I or L
<400> 45
Glu Xaa Xaa Leu Asp Asp Phe Asp Ile
1 5
<210> 46
<211> 112
<212> PRT
<213> homo sapien
<400> 46
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
100 105 110
<210> 47
<211> 107
<212> PRT
<213> homo sapien
<400> 47
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Glu Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 48
<211> 212
<212> PRT
<213> homo sapien
<400> 48
Met Asn Ser Phe Ser Thr Ser Ala Phe Gly Pro Val Ala Phe Ser Leu
1 5 10 15
Gly Leu Leu Leu Val Leu Pro Ala Ala Phe Pro Ala Pro Val Pro Pro
20 25 30
Gly Glu Asp Ser Lys Asp Val Ala Ala Pro His Arg Gln Pro Leu Thr
35 40 45
Ser Ser Glu Arg Ile Asp Lys Gln Ile Arg Tyr Ile Leu Asp Gly Ile
50 55 60
Ser Ala Leu Arg Lys Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser
65 70 75 80
Ser Lys Glu Ala Leu Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala
85 90 95
Glu Lys Asp Gly Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys Leu
100 105 110
Val Lys Ile Ile Thr Gly Leu Leu Glu Phe Glu Val Tyr Leu Glu Tyr
115 120 125
Leu Gln Asn Arg Phe Glu Ser Ser Glu Glu Gln Ala Arg Ala Val Gln
130 135 140
Met Ser Thr Lys Val Leu Ile Gln Phe Leu Gln Lys Lys Ala Lys Asn
145 150 155 160
Leu Asp Ala Ile Thr Thr Pro Asp Pro Thr Thr Asn Ala Ser Leu Leu
165 170 175
Thr Lys Leu Gln Ala Gln Asn Gln Trp Leu Gln Asp Met Thr Thr His
180 185 190
Leu Ile Leu Arg Ser Phe Lys Glu Phe Leu Gln Ser Ser Leu Arg Ala
195 200 205
Leu Arg Gln Met
210
<210> 49
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> sequencing primer
<400> 49
ctttctgaga stcmtggakc tcmtg 25
<210> 50
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> sequencing primer
<400> 50
tacgtgccaa gcatcctcgc 20
<210> 51
<211> 26
<212> DNA
<213> Artificial Sequence
<220>
<223> sequencing primer
<400> 51
gsartcagwc ycwvycagga cacagc 26
<210> 52
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> sequencing primer
<400> 52
aggctggaac tgaggagcag gtg 23
<210> 53
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> cloning primer
<400> 53
ttacagtgcg cgcactccca ggtgcagcta cagcagtgg 39
<210> 54
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> cloning primer
<400> 54
ttacagtgtg cactccgaca tccagatgac ccagtctcc 39
<210> 55
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> cloning primer
<400> 55
gaagaccgat gggcccttgg 20
<210> 56
<211> 51
<212> DNA
<213> Artificial Sequence
<220>
<223> cloning primer
<400> 56
tatattcctt aattaagtta ttctactcac gtttgatttc caccttggtc c 51
<210> 57
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> mutagenesis primer
<400> 57
cctcacctgc gctgtctatg gtgggtcc 28
<210> 58
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> mutagenesis primer
<400> 58
gggtccttca gggggtacta ctggagctg 29
<210> 59
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> mutagensis primer
<400> 59
cctcaagagt cgagtcacca tatcagtaga cacg 34
<210> 60
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> mutagenesis primer
<400> 60
ctccctgaag ctgagctctg tgaccgcc 28
Claims (26)
- a) 서열 5에 제시된 VH CDR1, 서열 6에 제시된 VH CDR2, 및 서열 7에 제시된 VH CDR3;
b) 서열 35에 제시된 VH CDR1, 서열 6에 제시된 VH CDR2, 및 서열 7에 제시된 VH CDR3;
c) 서열 5에 제시된 VH CDR1, 서열 6에 제시된 VH CDR2, 및 서열 41에 제시된 VH CDR3;
d) 서열 5에 제시된 VH CDR1, 서열 6에 제시된 VH CDR2, 및 서열 44에 제시된 VH CDR3; 및
e) 서열 5에 제시된 VH CDR1, 서열 6에 제시된 VH CDR2, 및 서열 45에 제시된 VH CDR3
으로 이루어진 군 중에서 선택되는 CDR1, CDR2, 및 CDR3 구역을 포함하는 중쇄 가변 (VH) 도메인 아미노산 서열을 포함하고, 인간 IL-6에 특이적으로 결합하는 단리된 인간 모노클로날 항체 또는 그의 항원 결합 부분. - 제1항에 있어서, 서열 16에 제시된 VL CDR1, 서열 17에 제시된 VL CDR2, 및 서열 18에 제시된 VL CDR3을 포함하는 경쇄 가변 (VL) 도메인 아미노산 서열을 추가로 포함하는 단리된 인간 항체 또는 그의 항원 결합 부분.
- 서열 16에 제시된 VL CDR1, 서열 17에 제시된 VL CDR2, 및 서열 18에 제시된 VL CDR3을 포함하는 경쇄 가변 (VL) 도메인 아미노산 서열을 포함하고, 인간 IL-6에 특이적으로 결합하는 단리된 인간 항체 또는 그의 항원 결합 부분.
- 제2항에 있어서, 서열 5에 제시된 VH CDR1, 서열 6에 제시된 VH CDR2, 서열 7에 제시된 VH CDR3, 서열 16에 제시된 VL CDR1, 서열 17에 제시된 VL CDR2, 및 서열 18에 제시된 VL CDR3을 포함하는 단리된 항체 또는 그의 항원 결합 부분.
- 서열 4, 서열 29, 서열 34, 서열 37 및 서열 40으로 이루어진 군 중에서 선택되거나 또는 적어도 하나의 보존적 아미노산 치환을 가짐으로써 서열 4, 서열 29, 서열 34, 서열 37 및 서열 40 중 임의의 하나와 상이하거나, 또는 서열 46에 비해 적어도 하나의 생식계열 아미노산 치환을 가짐으로써 서열 4, 서열 29, 서열 34, 서열 37 및 서열 40 중 임의의 하나와 상이한 중쇄 가변 (VH) 도메인 아미노산 서열을 포함하고, 인간 IL-6에 특이적으로 결합하는 단리된 인간 모노클로날 항체 또는 그의 항원 결합 부분.
- 제5항에 있어서, VH 도메인이 서열 4, 서열 29, 서열 34, 서열 37 및 서열 40 중 임의의 하나와 아미노산 서열에서 적어도 90% 동일한 항체 또는 그의 항원 결합 부분.
- 서열 15로 이루어진 군 중에서 선택되거나, 또는 보존적 아미노산 치환을 가짐으로써 서열 15와 상이하거나, 또는 서열 47에 비해 생식계열 아미노산 치환을 가짐으로써 서열 15와 상이한 경쇄 가변 (VL) 도메인 아미노산 서열을 포함하고, 인간 IL-6에 특이적으로 결합하는 단리된 인간 모노클로날 항체 또는 그의 항원 결합 부분.
- 제7항에 있어서, 서열 15와 아미노산 서열에서 적어도 90% 동일한 VL 도메인을 포함하는 항체 또는 그의 항원 결합 부분.
- 제5항에 있어서, 서열 15로 이루어진 군 중에서 선택되거나, 또는 보존적 아미노산 치환을 가짐으로써 서열 15와 상이하거나, 또는 서열 47로 이루어진 군 중에서 선택되는 그의 각각의 생식계열 서열에 비해 생식계열 아미노산 치환을 가짐으로써 서열 15와 상이한 경쇄 가변 (VL) 도메인 아미노산 서열을 추가로 포함하는 단리된 인간 모노클로날 항체 또는 그의 항원 결합 부분.
- 각각 항체 9C8, 9C8 N68T T83S, 9C8 E31G N68T T83S, 9C8 I24V N68T T83S, 및 22B5의 VL 및 VH 도메인과 아미노산 서열에서 적어도 90% 동일한 VL 및 VH 도메인을 포함하고, 인간 IL-6에 특이적으로 결합하는 단리된 인간 모노클로날 항체 또는 그의 항원 결합 부분.
- a) 모노클로날 항체 9C8 IgG1, 9C8 IgG2, 9C8 N68T T83S IgG1, 9C8 N68T T83S IgG2, 9C8 E31G N68T T83S IgG1, 9C8 E31G N68T T83S IgG2, 9C8 I24V N68T T83S IgG1, 9C8 I24V N68T T83S IgG2 및 22B5 IgG1로 이루어진 군 중에서 선택되는 항체의 중쇄로부터 독립적으로 선택되는 적어도 하나의 중쇄 CDR1, CDR2 및/또는 CDR3; 또는
b) 모노클로날 항체 9C8 IgG1, 9C8 IgG2, 9C8 N68T T83S IgG1, 9C8 N68T T83S IgG2, 9C8 E31G N68T T83S IgG1, 9C8 E31G N68T T83S IgG2, 9C8 I24V N68T T83S IgG1, 9C8 I24V N68T T83S IgG2 및 22B5 IgG1로 이루어진 군 중에서 선택되는 항체의 경쇄로부터 독립적으로 선택되는 적어도 하나의 경쇄 CDR1, CDR2 및/또는 CDR3; 또는
c) 모노클로날 항체 9C8 IgG1, 9C8 IgG2, 9C8 N68T T83S IgG1, 9C8 N68T T83S IgG2, 9C8 E31G N68T T83S IgG1, 9C8 E31G N68T T83S IgG2, 9C8 I24V N68T T83S IgG1, 9C8 I24V N68T T83S IgG2 및 22B5 IgG1로 이루어진 군 중에서 선택되는 항체의 중쇄로부터 독립적으로 선택되는 적어도 하나의 중쇄 CDR1, CDR2 및/또는 CDR3 및 모노클로날 항체 9C8 IgG1, 9C8 IgG2, 9C8 N68T T83S IgG1, 9C8 N68T T83S IgG2, 9C8 E31G N68T T83S IgG1, 9C8 E31G N68T T83S IgG2, 9C8 I24V N68T T83S IgG1, 9C8 I24V N68T T83S IgG2 및 22B5 IgG1로 이루어진 군 중에서 선택되는 항체의 경쇄로부터 독립적으로 선택되는 적어도 하나의 경쇄 CDR1, CDR2 및/또는 CDR3
을 포함하고, 인간 IL-6에 특이적으로 결합하는 단리된 인간 모노클로날 항체 또는 그의 항원 결합 부분. - 서열 3, 서열 24, 서열 28, 및 서열 32로 이루어진 군 중에서 선택되거나, 또는 보존적 아미노산 치환을 가짐으로써 서열 3, 서열 24, 서열 28, 및 서열 32 중 임의의 하나와 상이하거나, 또는 서열 46으로 이루어진 군 중에서 선택되는 그의 각각의 생식계열 서열에 비해 생식계열 아미노산 치환을 가짐으로써 서열 3, 서열 24, 서열 28, 및 서열 32 중 임의의 하나와 상이한 아미노산 서열을 갖는 중쇄를 포함하고, 인간 IL-6에 특이적으로 결합하는 단리된 인간 모노클로날 항체 또는 그의 항원 결합 부분.
- 서열 14, 서열 26 및 서열 43으로 이루어진 군 중에서 선택되거나, 또는 보존적 아미노산 치환을 가짐으로써 서열 14, 서열 26 및 서열 43 중 임의의 하나와 상이하거나, 또는 서열 47로 이루어진 군 중에서 선택되는 상응하는 생식계열 서열에 비해 생식계열 아미노산 치환을 가짐으로써 서열 14, 서열 26 및 서열 43 중 임의의 하나와 상이한 아미노산 서열을 갖는 경쇄를 포함하고, 인간 IL-6에 특이적으로 결합하는 단리된 인간 모노클로날 항체 또는 그의 항원 결합 부분.
- a) 서열 3의 아미노산 서열을 갖는 중쇄 및 서열 14의 아미노산 서열을 갖는 경쇄;
b) 서열 24의 아미노산 서열을 갖는 중쇄 및 서열 26의 아미노산 서열을 갖는 경쇄;
c) 서열 28의 아미노산 서열을 갖는 중쇄 및 서열 26의 아미노산 서열을 갖는 경쇄; 및
d) 서열 31의 아미노산 서열을 갖는 중쇄 및 서열 14의 아미노산 서열을 갖는 경쇄
로 이루어진 군 중에서 선택되는 중쇄 및 경쇄를 포함하는 단리된 인간 모노클로날 항체 또는 그의 항원 결합 부분. - 제14항에 있어서, 중쇄 아미노산 서열이 서열 28이고 경쇄 아미노산 서열이 서열 26인 단리된 인간 모노클로날 항체 또는 그의 항원 결합 부분.
- 제1항, 2항, 3항, 4항 및 11항 중 어느 한 항에 있어서, 9C8, 9C8 N68T T83S, 9C8 E31G N68T T83S, 9C8 I24V N68T T83S, 및 22B5로 이루어진 군 중에서 선택되는 항체의 하나 이상의 VH FR1, FR2, FR3 또는 FR4 및/또는 VL FR1, FR2, FR3 또는 FR4 아미노산 서열을 추가로 포함하는 단리된 인간 모노클로날 항체 또는 그의 항원 결합 부분.
- 제1항 내지 16항 중 어느 한 항에 따른 항체 또는 그의 항원 결합 부분 및 제약상 허용되는 담체를 포함하는 제약 조성물.
- 제1항 내지 16항 중 어느 한 항에 따른 항체 또는 그의 항원 결합 부분 또는 상기 항체 또는 상기 항원 결합 부분의 중쇄 또는 경쇄를 생산하는 단리된 세포주.
- 제1항 내지 16항 중 어느 한 항에 따른 항체를 코딩하는 뉴클레오티드 서열을 포함하는 단리된 핵산 분자.
- 제19항에 따른 핵산 분자를 포함하고, 핵산 분자에 작동가능하게 연결된 발현 제어 서열을 임의로 포함하는 벡터.
- 제20항에 따른 벡터 또는 제19항에 따른 핵산 분자를 포함하는 숙주 세포.
- 제1항 내지 16항 중 어느 한 항에 따른 항체 또는 그의 항원 결합 부분 또는 제17항에 따른 제약 조성물을 그를 필요로 하는 대상에게 투여하는 것을 포함하는, 상기 대상에서 IL-6 매개된 질환의 증상을 치료하거나, 예방하거나 또는 완화시키는 방법.
- 제22항에 있어서, 대상이 염증성 질환, 알레르기성 질환, 자가면역 질환, 이식 거부 질환, 죽상경화증, 골다공증, 신경병성 통증, 제2형 당뇨병, 만성 폐쇄성 폐 질환, 다발성 경화증, 패혈증, 암, 및 섬유성 병태로 이루어지는 군 중에서 선택되는 하나 이상의 병태 또는 질환으로 고통받는 것인 방법.
- 제23항에 있어서, 상기 염증성 질환이 류마티스 관절염, 연소성 특발성 관절염, 골관절염, 전신 홍반성 루푸스, 강직성 척추염, 건선, 캐슬만 (Castleman) 병, 크론 (Crohn) 병, 및 성인 발병형 스틸 (Still) 병으로 이루어지는 군 중에서 선택되는 것인 방법.
- 제23항에 있어서, 상기 섬유성 병태가 간 섬유증, 신장 섬유증, 및 폐 섬유증으로 이루어지는 군 중에서 선택되는 것인 방법.
- 제23항에 있어서, 상기 암이 다발성 골수종, 신세포 암종, 및 캐슬만 병으로 이루어지는 군 중에서 선택되는 것인 방법.
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US7343008P | 2008-06-18 | 2008-06-18 | |
| US61/073,430 | 2008-06-18 | ||
| US12/480,991 US8188235B2 (en) | 2008-06-18 | 2009-06-09 | Antibodies to IL-6 and their uses |
| US12/480,991 | 2009-06-09 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20110031152A true KR20110031152A (ko) | 2011-03-24 |
Family
ID=41431517
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107024395A KR20110031152A (ko) | 2008-06-18 | 2009-06-10 | Il-6에 대한 항체 및 그의 용도 |
Country Status (23)
| Country | Link |
|---|---|
| US (4) | US8188235B2 (ko) |
| EP (1) | EP2291404A1 (ko) |
| JP (2) | JP2011524750A (ko) |
| KR (1) | KR20110031152A (ko) |
| CN (2) | CN104387471A (ko) |
| AR (1) | AR072167A1 (ko) |
| AU (1) | AU2009260320B2 (ko) |
| BR (1) | BRPI0914943A2 (ko) |
| CA (1) | CA2724257A1 (ko) |
| CO (1) | CO6351748A2 (ko) |
| HK (1) | HK1155184A1 (ko) |
| IL (2) | IL208532A0 (ko) |
| MX (1) | MX2010012272A (ko) |
| NZ (1) | NZ588469A (ko) |
| PA (1) | PA8830701A1 (ko) |
| PE (2) | PE20110561A1 (ko) |
| PH (1) | PH12013502205A1 (ko) |
| RU (1) | RU2011101589A (ko) |
| SG (1) | SG194358A1 (ko) |
| TW (1) | TW201002348A (ko) |
| UY (1) | UY31904A (ko) |
| WO (1) | WO2009155180A1 (ko) |
| ZA (1) | ZA201006979B (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20150085816A (ko) * | 2012-10-22 | 2015-07-24 | 파운테인 바이오파마 인크. | 인터류킨-6에 대한 항체 및 그의 용도 |
Families Citing this family (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8188235B2 (en) | 2008-06-18 | 2012-05-29 | Pfizer Inc. | Antibodies to IL-6 and their uses |
| EP2349331A4 (en) | 2008-11-13 | 2012-12-12 | Femta Pharmaceuticals Inc | HUMANIZED ANTIBODIES TO IL-6 |
| CN102573873B (zh) | 2009-07-16 | 2014-10-08 | 太阳星光齿磨公司 | 蛋白多糖含有物 |
| JP2013522311A (ja) | 2010-03-15 | 2013-06-13 | ステルス ペプチドズ インターナショナル インコーポレイテッド | シクロスポリンおよび芳香族カチオン性ペプチドを用いた併用療法 |
| WO2011133748A1 (en) * | 2010-04-21 | 2011-10-27 | University Of Medicine And Dentistry Of New Jersey | Treatments for cellular proliferative disorders and identification thereof |
| CN103261222B (zh) | 2010-09-10 | 2017-07-28 | 医疗免疫有限公司 | 抗体衍生物 |
| CN103429608B (zh) | 2011-01-19 | 2016-08-03 | 国立大学法人弘前大学 | 蛋白多糖的大量制备方法 |
| TWI452688B (zh) | 2011-12-27 | 2014-09-11 | Ind Tech Res Inst | 可撓式輻射感測器 |
| WO2013175276A1 (en) * | 2012-05-23 | 2013-11-28 | Argen-X B.V | Il-6 binding molecules |
| ES2769850T3 (es) * | 2012-07-25 | 2020-06-29 | Univ Hirosaki | Composición para prevenir o tratar la osteoartrosis |
| WO2014186350A1 (en) * | 2013-05-15 | 2014-11-20 | Medimmune Limited | Purification of recombinantly produced polypeptides |
| TWI562343B (en) | 2014-05-12 | 2016-12-11 | Ind Tech Res Inst | Electrical radiography imaging system and method thereof |
| US20150342943A1 (en) * | 2014-06-03 | 2015-12-03 | Gilead Sciences, Inc. | Methods of treating liver disease |
| CA2916283A1 (en) | 2015-01-09 | 2016-07-09 | Pfizer Inc. | Dosage regimen for madcam antagonists |
| ES2877708T3 (es) | 2015-07-31 | 2021-11-17 | Medimmune Ltd | Antagonistas de IL-6 para su uso en el tratamiento de trastornos mediados por hepcidina |
| US10053515B2 (en) * | 2016-01-22 | 2018-08-21 | Merck Sharp & Dohme Corp. | Anti-coagulation factor XI antibodies |
| MY201852A (en) | 2016-06-14 | 2024-03-20 | Merck Sharp & Dohme Llc | Anti-coagulation factor xi antibodies |
| EP3576790A4 (en) | 2017-02-01 | 2020-12-23 | Yale University | TREATMENT OF DIURETIC RESISTANCE |
| CN109867723B (zh) * | 2017-12-05 | 2022-06-17 | 南京金斯瑞生物科技有限公司 | 抗人il6单克隆抗体及其制备方法和用途 |
| EA202091640A1 (ru) * | 2018-01-05 | 2020-10-26 | Корвидиа Терапьютикс, Инк. | Способы лечения опосредованного il-6 воспаления без иммунодепрессии |
| CN110655576A (zh) * | 2019-11-13 | 2020-01-07 | 武汉华美生物工程有限公司 | Il-6重组单克隆抗体及其制备方法和应用 |
| WO2024102732A1 (en) * | 2022-11-11 | 2024-05-16 | Tourmaline Bio, Inc. | Methods for the treatment of cardiovascular disease |
| WO2024112561A1 (en) * | 2022-11-23 | 2024-05-30 | Tourmaline Bio, Inc. | Methods for the treatment of myasthenia gravis |
| WO2024112527A2 (en) * | 2022-11-23 | 2024-05-30 | Tourmaline Bio, Inc. | Methods for the treatment of thyroid eye disease |
| WO2024129468A1 (en) * | 2022-12-16 | 2024-06-20 | Tourmaline Bio, Inc. | Methods for the treatment of noninfectious uveitis |
Family Cites Families (74)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5326859A (en) | 1979-10-30 | 1994-07-05 | Juridical Foundation, Japanese Foundation For Cancer Research | DNA and recombinant plasmid |
| US5554513A (en) | 1979-11-21 | 1996-09-10 | Yeda Research & Development Co. Ltd. | Production of recombinant human interferon-beta2 |
| IL58765A (en) | 1979-11-21 | 1986-09-30 | Yeda Res & Dev | Process for the production of essentially pure messenger rna of human fibroblast interferon and process for the production of interferon beta |
| US5001116A (en) | 1982-12-20 | 1991-03-19 | The Children's Medical Center Corporation | Inhibition of angiogenesis |
| US5807715A (en) | 1984-08-27 | 1998-09-15 | The Board Of Trustees Of The Leland Stanford Junior University | Methods and transformed mammalian lymphocyte cells for producing functional antigen-binding protein including chimeric immunoglobulin |
| US5618920A (en) | 1985-11-01 | 1997-04-08 | Xoma Corporation | Modular assembly of antibody genes, antibodies prepared thereby and use |
| JP2598666B2 (ja) | 1987-10-19 | 1997-04-09 | 忠三 岸本 | 抗ヒトbcdfモノクローナル抗体 |
| US5210116A (en) * | 1988-01-19 | 1993-05-11 | Yazaki Corporation | Resin composite material containing graphite fiber |
| CA1341588C (en) | 1988-01-26 | 2009-01-06 | Michel Revel | Human ifn-beta2/i1-6, its purification and use |
| IL88375A (en) | 1988-11-14 | 1995-07-31 | Yeda Res & Dev | Monoclonal antibodies that specifically bind interferon-bia 2 natural and recombinant and a natural and recombinant interferon-beta 2 purification method and method |
| US6682896B1 (en) | 1988-10-14 | 2004-01-27 | Schering Aktiengesellschaft | Peptides representing epitopic sites on r-IFN-β, antibodies thereto and uses thereof |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| EP0399429A1 (en) | 1989-05-22 | 1990-11-28 | Toray Industries, Inc. | Anti-human interleukin-6 monoclonal antibody |
| JP2881311B2 (ja) | 1989-07-28 | 1999-04-12 | 味の素株式会社 | 抗ヒトbcdfモノクローナル抗体及びそれを用いたヒトbcdfの定量法 |
| DE3939706C1 (ko) | 1989-12-01 | 1991-03-21 | Centre Regional De Transfusion Sanguine, Besancon, Fr | |
| DE69006221T2 (de) | 1989-12-04 | 1994-05-05 | Fletcher Starnes H | Verfahren zur behandlung von septischem schock. |
| AU7160391A (en) | 1989-12-15 | 1991-07-18 | Lucien A Aarden | Cytokine antibody for the treatment of sepsis |
| US5859205A (en) * | 1989-12-21 | 1999-01-12 | Celltech Limited | Humanised antibodies |
| US5942220A (en) | 1990-03-16 | 1999-08-24 | Chiron Corporation | Inhibitor of cytokine activity and applications thereof |
| US5210075A (en) | 1990-02-16 | 1993-05-11 | Tanabe Seiyaku Co., Ltd. | Interleukin 6 antagonist peptides |
| HU218140B (hu) | 1991-04-25 | 2000-06-28 | Chugai Seiyaku Kabushiki Kaisha | Humán interleukin-6-receptorral szembeni átalakított humán antitest |
| JPH05304986A (ja) | 1992-04-28 | 1993-11-19 | Tosoh Corp | gp130蛋白質に対するモノクロ−ナル抗体 |
| WO1994009138A1 (en) | 1992-10-20 | 1994-04-28 | Cetus Oncology Corporation | Interleukin-6 receptor antagonists |
| JP3525221B2 (ja) | 1993-02-17 | 2004-05-10 | 味の素株式会社 | 免疫抑制剤 |
| US5888511A (en) | 1993-02-26 | 1999-03-30 | Advanced Biotherapy Concepts, Inc. | Treatment of autoimmune diseases, including AIDS |
| ZA943778B (en) | 1993-05-31 | 1995-02-21 | Chugai Seiyaku Kagushiki Kaish | Reshaped human antibody to human interleukin-6 |
| US5789552A (en) | 1993-06-23 | 1998-08-04 | Istituto Di Ricerche Di Biologica Molecolare P. Angeletti S.P.A. | Interleukin-6 receptor antagonists |
| PT2226085E (pt) | 1993-07-19 | 2014-03-04 | Angiotech Pharm Inc | Composições anti-angiogénicas e métodos de utilização |
| US5888510A (en) | 1993-07-21 | 1999-03-30 | Chugai Seiyaku Kabushiki Kaisha | Chronic rheumatoid arthritis therapy containing IL-6 antagonist as effective component |
| FR2707882B1 (fr) | 1993-07-23 | 1997-08-01 | Immunotech Sa | Nouveaux kits thérapeutiques anti-médiateurs protéiques, procédé de préparation et compositions pharmaceutiques les renfermant. |
| US5641657A (en) | 1994-05-19 | 1997-06-24 | Human Genome Sciences, Inc. | DNA encoding an interleukin-6 splice variant |
| JPH10503179A (ja) | 1994-06-24 | 1998-03-24 | イミュネックス・コーポレーション | 放出制御性ポリペプチド組成物および炎症性腸疾患の治療方法 |
| US8017121B2 (en) | 1994-06-30 | 2011-09-13 | Chugai Seiyaku Kabushika Kaisha | Chronic rheumatoid arthritis therapy containing IL-6 antagonist as effective component |
| US5738931A (en) | 1994-09-16 | 1998-04-14 | Kabushiki Kaisha Toshiba | Electronic device and magnetic device |
| PT783893E (pt) | 1994-10-07 | 2012-05-24 | Chugai Pharmaceutical Co Ltd | Inibição do crescimento anormal das células sinoviais usando antagonistas de il-6 como componente ativo |
| IT1274782B (it) | 1994-12-14 | 1997-07-24 | Angeletti P Ist Richerche Bio | Metodo per selezionare superagonisti, antagonisti e superantagonisti di ormoni del cui complesso recettoriale fa parte gp 130 |
| EP0800829B2 (en) | 1994-12-29 | 2012-07-25 | Chugai Seiyaku Kabushiki Kaisha | Use of a pm-1 antibody or of a mh 166 antibody for enhancing the anti-tumor effect of cisplatin or carboplatin |
| EP0811384B1 (en) | 1995-02-13 | 2006-06-21 | Chugai Seiyaku Kabushiki Kaisha | Muscle protein decomposition inhibitor containing il-6 receptor antibody |
| IT1276555B1 (it) | 1995-04-28 | 1997-11-03 | Angeletti P Ist Richerche Bio | Antagonisti di interluchina-6 umana del tutto incapaci di formare un legame con gp 130, e loro uso per la preparazione di composizioni |
| US5871723A (en) | 1995-06-06 | 1999-02-16 | The Regent Of The University Of Michigan | CXC chemokines as regulators of angiogenesis |
| US5854398A (en) | 1996-07-25 | 1998-12-29 | The Trustees Of Columbia University In The City Of New York | Kaposi's sarcoma-associated herpesvirus (KSHV) interleukin 6 (IL-6) and uses thereof |
| US6461604B1 (en) | 1996-08-16 | 2002-10-08 | Genetics Institute, Llc | Crystalline IL-6 and models of the molecular structure of IL-6 |
| WO1999013092A1 (en) | 1997-09-11 | 1999-03-18 | The Public Health Research Institute Of The City Of New York, Inc. | Enhancement of mucosal antibody responses by interleukin-6 |
| AU754006B2 (en) | 1998-03-17 | 2002-10-31 | Chugai Seiyaku Kabushiki Kaisha | Preventives or remedies for inflammatory intestinal diseases containing as the active ingredient IL-6 antagonists |
| DK1108435T3 (da) | 1998-08-24 | 2007-02-05 | Chugai Pharmaceutical Co Ltd | Forebyggende midler eller midler mod pancreatitis indeholdende anti-IL-6-receptor-antistoffer som den aktive bestanddel |
| WO2001016180A2 (en) | 1999-08-27 | 2001-03-08 | Board Of Regents, The University Of Texas System | Cd40 agonist compositions and methods of use |
| CA2800450A1 (en) | 2000-02-10 | 2001-08-16 | Abbott Laboratories | Antibodies that bind human interleukin-18 and methods of making and using |
| JP5485489B2 (ja) | 2000-08-11 | 2014-05-07 | 中外製薬株式会社 | 抗体含有安定化製剤 |
| CN1259973C (zh) | 2000-10-25 | 2006-06-21 | 中外制药株式会社 | 含有il-6拮抗剂作为有效成分的牛皮癣的预防或治疗剂 |
| US20030017150A1 (en) | 2001-03-14 | 2003-01-23 | Torphy Theodore J. | Chronic obstructive pulmonary disease-related immunglobulin derived proteins, compositions, methods and uses |
| MXPA04004671A (es) | 2001-11-14 | 2005-08-25 | Johnson & Johnson | Anticuerpos anti-interleucina-6, composiciones, metodos y usos. |
| AU2003225976A1 (en) | 2002-03-26 | 2003-10-13 | Centocor, Inc. | Anti-tnf antibodies, compositions, methods and uses |
| DE10228103A1 (de) | 2002-06-24 | 2004-01-15 | Bayer Cropscience Ag | Fungizide Wirkstoffkombinationen |
| AU2003261787B2 (en) | 2002-08-30 | 2008-11-06 | Juridical Foundation The Chemo-Sero-Therapeutic Research Institute | Human antihuman interleukin-6 antibody and fragment of the antibody |
| AU2003290682A1 (en) | 2002-11-15 | 2004-06-15 | Centocor, Inc. | Anti-angiogenic uses of il-6 antagonists |
| US7772188B2 (en) | 2003-01-28 | 2010-08-10 | Ironwood Pharmaceuticals, Inc. | Methods and compositions for the treatment of gastrointestinal disorders |
| EP1594897A4 (en) | 2003-02-04 | 2006-11-08 | Centocor Inc | USE OF IL-6 ANTAGONISTS IN COMBINATION WITH STEROIDS FOR INCREASED APOPTOSIS |
| GB2401040A (en) | 2003-04-28 | 2004-11-03 | Chugai Pharmaceutical Co Ltd | Method for treating interleukin-6 related diseases |
| US7563748B2 (en) | 2003-06-23 | 2009-07-21 | Cognis Ip Management Gmbh | Alcohol alkoxylate carriers for pesticide active ingredients |
| WO2005005604A2 (en) | 2003-06-30 | 2005-01-20 | Centocor, Inc. | Engineered anti-target immunoglobulin derived proteins, compositions, methods and uses |
| WO2005028514A1 (en) | 2003-09-22 | 2005-03-31 | Biovation Gmbh & Co. Kg. | Use of a compound for reducing the biological effectiveness of il-6 |
| RU2346996C2 (ru) | 2004-06-29 | 2009-02-20 | ЮРОПИЭН НИКЕЛЬ ПиЭлСи | Усовершенствованное выщелачивание основных металлов |
| FI20050753A (fi) | 2004-09-03 | 2006-03-04 | Licentia Oy | Uudet peptidit |
| US20080267971A1 (en) | 2004-12-21 | 2008-10-30 | Green Larry L | Antibodies Directed to Angiopoietin-2 and Uses Thereof |
| SI2567976T1 (sl) * | 2005-03-23 | 2017-11-30 | Genmab A/S | Protitelesa usmerjena proti cd38 za zdravljenje multiplega mieloma |
| PE20061324A1 (es) | 2005-04-29 | 2007-01-15 | Centocor Inc | Anticuerpos anti-il-6, composiciones, metodos y usos |
| DK1960434T3 (da) | 2005-12-08 | 2012-10-15 | Medarex Inc | Monoklonale, humane antistoffer mod Fucosyl-GM1 og fremgangsmåder til anvendelse af anti-Fucosyl-GM1 |
| PL1966244T3 (pl) | 2005-12-30 | 2012-08-31 | Merck Patent Gmbh | Przeciwciała anty-il-6 zapobiegające wiązaniu il-6 skompleksowanego z il-6ralpha do gp130 |
| TW200801513A (en) | 2006-06-29 | 2008-01-01 | Fermiscan Australia Pty Ltd | Improved process |
| WO2008019061A2 (en) | 2006-08-03 | 2008-02-14 | Vaccinex, Inc. | Anti-il-6 monoclonal antibodies and uses thereof |
| TW200831528A (en) * | 2006-11-30 | 2008-08-01 | Astrazeneca Ab | Compounds |
| CN101754772B (zh) | 2007-05-21 | 2015-08-19 | 奥尔德生物控股有限责任公司 | 针对il-6的抗体及其用途 |
| WO2008144753A2 (en) | 2007-05-21 | 2008-11-27 | Alder Biopharmaceuticals, Inc. | Antibodies to tnf alpha and use thereof |
| US8188235B2 (en) | 2008-06-18 | 2012-05-29 | Pfizer Inc. | Antibodies to IL-6 and their uses |
-
2009
- 2009-06-09 US US12/480,991 patent/US8188235B2/en not_active Expired - Fee Related
- 2009-06-10 AU AU2009260320A patent/AU2009260320B2/en not_active Ceased
- 2009-06-10 JP JP2011514702A patent/JP2011524750A/ja active Pending
- 2009-06-10 MX MX2010012272A patent/MX2010012272A/es active IP Right Grant
- 2009-06-10 SG SG2013070511A patent/SG194358A1/en unknown
- 2009-06-10 NZ NZ588469A patent/NZ588469A/xx unknown
- 2009-06-10 WO PCT/US2009/046837 patent/WO2009155180A1/en active Application Filing
- 2009-06-10 CA CA2724257A patent/CA2724257A1/en not_active Abandoned
- 2009-06-10 EP EP09767490A patent/EP2291404A1/en not_active Withdrawn
- 2009-06-10 PE PE2010001057A patent/PE20110561A1/es not_active Application Discontinuation
- 2009-06-10 BR BRPI0914943-0A2A patent/BRPI0914943A2/pt not_active Application Discontinuation
- 2009-06-10 CN CN201410698311.XA patent/CN104387471A/zh active Pending
- 2009-06-10 KR KR1020107024395A patent/KR20110031152A/ko not_active Application Discontinuation
- 2009-06-10 RU RU2011101589/10A patent/RU2011101589A/ru not_active Application Discontinuation
- 2009-06-10 CN CN200980119821.4A patent/CN102083860B/zh not_active Expired - Fee Related
- 2009-06-10 PE PE2013002176A patent/PE20140825A1/es not_active Application Discontinuation
- 2009-06-16 UY UY0001031904A patent/UY31904A/es not_active Application Discontinuation
- 2009-06-17 PA PA20098830701A patent/PA8830701A1/es unknown
- 2009-06-17 AR ARP090102194A patent/AR072167A1/es unknown
- 2009-06-18 TW TW098120543A patent/TW201002348A/zh unknown
-
2010
- 2010-09-30 ZA ZA2010/06979A patent/ZA201006979B/en unknown
- 2010-10-07 IL IL208532A patent/IL208532A0/en unknown
-
2011
- 2011-01-18 CO CO11004914A patent/CO6351748A2/es active IP Right Grant
- 2011-09-06 HK HK11109402.0A patent/HK1155184A1/xx not_active IP Right Cessation
-
2012
- 2012-04-24 US US13/454,296 patent/US8436158B2/en not_active Expired - Fee Related
-
2013
- 2013-04-05 US US13/857,867 patent/US8846037B2/en not_active Expired - Fee Related
- 2013-10-24 PH PH12013502205A patent/PH12013502205A1/en unknown
-
2014
- 2014-04-28 IL IL232276A patent/IL232276A0/en unknown
- 2014-08-29 US US14/473,997 patent/US20150203574A1/en not_active Abandoned
-
2015
- 2015-05-07 JP JP2015094577A patent/JP2015166366A/ja active Pending
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20150085816A (ko) * | 2012-10-22 | 2015-07-24 | 파운테인 바이오파마 인크. | 인터류킨-6에 대한 항체 및 그의 용도 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20110031152A (ko) | Il-6에 대한 항체 및 그의 용도 | |
| KR101770429B1 (ko) | 인간 c-fms 항원 결합 단백질 | |
| KR101158959B1 (ko) | 항-il-17 항체 | |
| US9469688B2 (en) | Therapeutic DLL4 binding proteins | |
| US9469689B2 (en) | Therapeutic DLL4 binding proteins | |
| KR101652609B1 (ko) | 인간 il-23 항원 결합 단백질 | |
| AU2009218693B2 (en) | Monoclonal antibodies against the RGM a protein and uses thereof | |
| US8101184B2 (en) | Treatment methods using Dkk-1 antibodies | |
| CN101835489B (zh) | Il-18受体抗原结合蛋白 | |
| AU2015200423A1 (en) | Antibodies to IL-6 and their uses | |
| CN113710316A (zh) | 适合于il23拮抗剂疗法的患者群体 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |