KR20080066949A - 바이러스 복제 억제제 - Google Patents
바이러스 복제 억제제 Download PDFInfo
- Publication number
- KR20080066949A KR20080066949A KR1020087011224A KR20087011224A KR20080066949A KR 20080066949 A KR20080066949 A KR 20080066949A KR 1020087011224 A KR1020087011224 A KR 1020087011224A KR 20087011224 A KR20087011224 A KR 20087011224A KR 20080066949 A KR20080066949 A KR 20080066949A
- Authority
- KR
- South Korea
- Prior art keywords
- optionally substituted
- compound
- alkyl
- formula
- alkoxy
- Prior art date
Links
- 0 *C(*)(C(N1*)=O)N(*)C1=O Chemical compound *C(*)(C(N1*)=O)N(*)C1=O 0.000 description 3
- IJYIYVGINFAVTH-GQCTYLIASA-N CN(C)c1ccc(/C=C/C(N(CC2)CCN2C(c2c[o]cc2)=O)=O)c(Cl)c1 Chemical compound CN(C)c1ccc(/C=C/C(N(CC2)CCN2C(c2c[o]cc2)=O)=O)c(Cl)c1 IJYIYVGINFAVTH-GQCTYLIASA-N 0.000 description 1
- QPWDZBBZIVDASP-VQHVLOKHSA-N COc(cccc1)c1Sc(ccc(/C=C/C(N(CC1)CCC1C(O)=O)=O)c1Cl)c1Cl Chemical compound COc(cccc1)c1Sc(ccc(/C=C/C(N(CC1)CCC1C(O)=O)=O)c1Cl)c1Cl QPWDZBBZIVDASP-VQHVLOKHSA-N 0.000 description 1
- PGNGCRBYALCIGM-FPYGCLRLSA-N Cc(cc(/C=C/C(OC)=O)c(Cl)c1)c1Sc(cc1)ccc1F Chemical compound Cc(cc(/C=C/C(OC)=O)c(Cl)c1)c1Sc(cc1)ccc1F PGNGCRBYALCIGM-FPYGCLRLSA-N 0.000 description 1
- YYGNVGWBFMUFTN-UHFFFAOYSA-N Cc(cc(c(Cl)c1)[N+]([O-])=O)c1Sc(cc1)ccc1F Chemical compound Cc(cc(c(Cl)c1)[N+]([O-])=O)c1Sc(cc1)ccc1F YYGNVGWBFMUFTN-UHFFFAOYSA-N 0.000 description 1
- AWSZTZMQPCCNAO-UHFFFAOYSA-N O=C(C1N2c3ccccc3NC1)N(c1ccc[s]1)C2=O Chemical compound O=C(C1N2c3ccccc3NC1)N(c1ccc[s]1)C2=O AWSZTZMQPCCNAO-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C233/00—Carboxylic acid amides
- C07C233/01—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms
- C07C233/02—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having nitrogen atoms of carboxamide groups bound to hydrogen atoms or to carbon atoms of unsubstituted hydrocarbon radicals
- C07C233/11—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having nitrogen atoms of carboxamide groups bound to hydrogen atoms or to carbon atoms of unsubstituted hydrocarbon radicals with carbon atoms of carboxamide groups bound to carbon atoms of an unsaturated carbon skeleton containing six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C233/00—Carboxylic acid amides
- C07C233/01—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms
- C07C233/16—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by singly-bound oxygen atoms
- C07C233/17—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by singly-bound oxygen atoms with the substituted hydrocarbon radical bound to the nitrogen atom of the carboxamide group by an acyclic carbon atom
- C07C233/22—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by singly-bound oxygen atoms with the substituted hydrocarbon radical bound to the nitrogen atom of the carboxamide group by an acyclic carbon atom having the carbon atom of the carboxamide group bound to an acyclic carbon atom of a carbon skeleton containing six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/50—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton
- C07C323/62—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atom of at least one of the thio groups bound to a carbon atom of a six-membered aromatic ring of the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D205/00—Heterocyclic compounds containing four-membered rings with one nitrogen atom as the only ring hetero atom
- C07D205/02—Heterocyclic compounds containing four-membered rings with one nitrogen atom as the only ring hetero atom not condensed with other rings
- C07D205/04—Heterocyclic compounds containing four-membered rings with one nitrogen atom as the only ring hetero atom not condensed with other rings having no double bonds between ring members or between ring members and non-ring members
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/04—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D207/08—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon radicals, substituted by hetero atoms, attached to ring carbon atoms
- C07D207/09—Radicals substituted by nitrogen atoms, not forming part of a nitro radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/18—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having one double bond between ring members or between a ring member and a non-ring member
- C07D207/22—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having one double bond between ring members or between a ring member and a non-ring member with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D207/24—Oxygen or sulfur atoms
- C07D207/26—2-Pyrrolidones
- C07D207/263—2-Pyrrolidones with only hydrogen atoms or radicals containing only hydrogen and carbon atoms directly attached to other ring carbon atoms
- C07D207/27—2-Pyrrolidones with only hydrogen atoms or radicals containing only hydrogen and carbon atoms directly attached to other ring carbon atoms with substituted hydrocarbon radicals directly attached to the ring nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/56—Nitrogen atoms
- C07D211/58—Nitrogen atoms attached in position 4
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/60—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D211/62—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals attached in position 4
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/12—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/56—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/66—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D233/72—Two oxygen atoms, e.g. hydantoin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/66—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D233/72—Two oxygen atoms, e.g. hydantoin
- C07D233/74—Two oxygen atoms, e.g. hydantoin with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, attached to other ring members
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/66—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D233/72—Two oxygen atoms, e.g. hydantoin
- C07D233/76—Two oxygen atoms, e.g. hydantoin with substituted hydrocarbon radicals attached to the third ring carbon atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/66—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D233/72—Two oxygen atoms, e.g. hydantoin
- C07D233/76—Two oxygen atoms, e.g. hydantoin with substituted hydrocarbon radicals attached to the third ring carbon atom
- C07D233/78—Radicals substituted by oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D235/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings
- C07D235/02—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings condensed with carbocyclic rings or ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D249/00—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms
- C07D249/02—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms not condensed with other rings
- C07D249/08—1,2,4-Triazoles; Hydrogenated 1,2,4-triazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/04—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D295/12—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by singly or doubly bound nitrogen atoms
- C07D295/125—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by singly or doubly bound nitrogen atoms with the ring nitrogen atoms and the substituent nitrogen atoms attached to the same carbon chain, which is not interrupted by carbocyclic rings
- C07D295/13—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by singly or doubly bound nitrogen atoms with the ring nitrogen atoms and the substituent nitrogen atoms attached to the same carbon chain, which is not interrupted by carbocyclic rings to an acyclic saturated chain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/16—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms
- C07D295/18—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms by radicals derived from carboxylic acids, or sulfur or nitrogen analogues thereof
- C07D295/182—Radicals derived from carboxylic acids
- C07D295/185—Radicals derived from carboxylic acids from aliphatic carboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/02—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings
- C07D307/34—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D307/56—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D307/68—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/04—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/06—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Public Health (AREA)
- Virology (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Molecular Biology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Indole Compounds (AREA)
- Furan Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Pyrrole Compounds (AREA)
- Hydrogenated Pyridines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
실시태양은 화학식 I-IV의 화합물, 및 본 발명의 화합물을 포함하는 제약 조성물을 포함하는 조성물을 제공한다. 실시태양은 C형 간염 바이러스 감염을 치료하는 방법 및 간 섬유증을 치료하는 방법을 포함하는 치료 방법을 추가로 제공하고, 상기 방법은 일반적으로 그를 필요로 하는 개체에게 유효량의 본 발명의 화합물 또는 조성물을 투여하는 것을 포함한다.
바이러스 복제, 억제제, C형 간염 바이러스, 간 섬유증, 화합물, 조성물, 감염, 치료
Description
관련 출원
그 전체 내용이 본원에 참고로 포함된, 2005년 10월 11일 출원된 미국 가출원 60/725,584를 기초로 한 우선권을 주장한다.
본 발명은 C형 간염 바이러스 (HCV) 감염의 치료를 위한 화합물, 그의 합성 방법, 치료를 위한 조성물 및 치료 방법에 관한 것이다.
C형 간염 바이러스 (HCV) 감염은 미국에서 가장 흔한 만성 혈액-매개 감염이다. 새로운 감염자의 수는 줄어들었지만, 만성 감염에 대한 부담이 실재하고 있으며, 질병 통제 센타 (Centers for Disease Control)는 미국에서 390만 (1.8%)명이 감염되었을 것으로 추정하고 있다. 미국에서 만성 간 질환은 성인의 10번째로 주요한 사망 원인이며, 연간 약 25,000명의 사망, 즉 모든 사망의 약 1%를 차지한다. 만성 간 질환의 40%가 HCV-관련 질환이며, 그 결과 매년 8,000 내지 10,000명이 사망하는 것으로 추정된다고 연구들은 지적한다. 성인의 간 이식은 HCV-관련 말기 간 질환에서 가장 흔한 조치이다.
만성 C형 간염의 항바이러스 치료법이 지난 10년에 걸쳐 빠르게 발전되었으며, 치료 효능에서도 상당한 개선을 보였다. 그럼에도, PEG화된 (pegylated) IFN- α와 리바비린을 사용한 조합 치료법에 의해서도 40% 내지 50%의 환자는 치료법에 실패하는데, 이들은 비-반응자이거나 재발병자이다. 이들 환자에 대해서는 현재 효과적인 치료적 대안이 없다. 특히, 간 생체검사에서 진행된 섬유증이나 경화증을 나타낸 환자는, 복수, 황달, 정맥류 출혈, 뇌병증, 및 진행성 간 기능상실을 포함하는 진행된 간 질환의 합병증이 발생할 상당한 위험이 있을 뿐만 아니라, 간세포암종의 위험도 현저히 증가된다.
미국에서 만성 HCV 감염의 높은 유병율은 미래의 만성 간 질환 부담에 대해서 중요한 공중보건적 의미를 가진다. 내셔날 헬쓰 앤드 뉴트리션 이그제미네이션 서베이 (National Health and Nutrition Examination Survey: NHANES III)로부터의 데이타는 새로운 HCV 감염율이 1960년대 후반에서 1980년대 초반에, 특히 20 내지 40세의 사람들에서 크게 증가했다는 것을 보여준다. 20년 이상 오랜 기간에 걸쳐서 HCV에 감염된 사람들의 수는 1990년에서 2015년까지 750,000명에서 300만명 이상으로 4배 이상 증가할 수 있을 것으로 추정된다. 30년 또는 40년 동안 감염된 사람들의 증가는 이에 비례하여 훨씬 클 것이다. HCV-관련 만성 간 질환의 위험이 감염 기간과 관련되고, 경화증의 위험은 20년 이상 감염된 사람들에서 점진적으로 증가하므로, 이것은 1965년에서 1985년 사이에 감염된 환자들에서 경화증-관련 이환율 및 사망률의 실질적인 증가를 가져올 것이다.
HCV는 플라비바이러스과 (Flaviviridae) 중 외피로 둘러싸인 양성 가닥 RNA 바이러스이다. 단일 가닥 HCV RNA 게놈은 대략 뉴클레오티드 9500개 길이이며, 약 3000개의 아미노산으로 이루어진 단일 거대 다중단백질 (polyprotein)을 코딩하는 단일 오픈 리딩 프레임 (ORF)을 갖는다. 감염된 세포에서, 이러한 다중단백질은 여러 부위에서 세포 및 바이러스 프로테아제에 의해 절단되어 상기 바이러스의 구조 및 비-구조 (NS) 단백질을 생성시킨다. HCV의 경우, 성숙한 비-구조 단백질 (NS2, NS3, NS4, NS4A, NS4B, NS5A, 및 NS5B)의 생성은 두 가지 바이러스 프로테아제에 의해 수행된다. 제1 바이러스 프로테아제는 다중단백질의 NS2-NS3 연결부 (junction)에서 절단한다. 제2 바이러스 프로테아제는 NS3의 N-말단 영역 내에 함유된 세린 프로테아제 (본원에서, "NS3 프로테아제"라고 함)이다. NS3 프로테아제는 다중단백질에서 NS3의 위치에 대해 하류에 있는 부위 (즉, NS3의 C-말단과 다중단백질의 C-말단 사이에 위치한 부위)에서 모든 후속 절단 반응을 매개한다. NS3 프로테아제는 NS3-NS4 절단 부위에서 시스 (cis)로, 나머지 NS4A-NS4B, NS4B-NS5A 및 NS5A-NS5B 부위의 경우에는 트랜스 (trans)로 활성을 나타낸다. NS4A 단백질은, NS3 프로테아제에 대한 보조인자로서 작용하고, 가능하게는 NS3 및 다른 바이러스 레플리카제 성분의 막 위치화 (localization)를 보조하는 것과 같은 여러 기능을 수행하는 것으로 생각된다. 분명한 것은, NS3과 NS4A 사이의 복합체 형성은 NS3-매개된 프로세싱 반응에 필수적이며, NS3에 의해 인식되는 모든 부위에서 단백질분해 효율을 증대시킨다는 것이다. 또한, NS3 프로테아제는 뉴클레오시드 트리포스파타제 및 RNA 헬리카제 활성을 나타낸다. NS5B는 HCV RNA의 복제에 관여하는 RNA-의존적 RNA 폴리머라제이다.
참고문헌
METAVIR (1994) Hepatology 20:15-20; Brant (2000) Hepatol. 31:241-246; Alpini (1997) J. Hepatol. 27:371-380; Baroni et al. (1996) Hepatol. 23:1189-1199; Czaja et al. (1989) Hepatol. 10:795-800; Grossman et al. (1998) J. Gastroenterol. Hepatol. 13:1058-1060; Rockey and Chung (1994) J. Invest. Med. 42:660-670; Sakaida et al. (1998) J. Hepatol. 28:471-479; Shi et al. (1997) Proc. Natl. Acad. Sci. USA 94:10663-10668; Baroni et al. (1999) Liver 19:212-219; Lortat-Jacob et al. (1997) J. Hepatol. 26:894-903; Llorent et al. (1996) J. Hepatol. 24:555-563; 미국 특허 5,082,659; 유럽 특허 출원 EP 294,160; 미국 특허 4,806,347; Balish et al. (1992) J. Infect. Diseases 166:1401-1403; Katayama et al. (2001) J. Viral Hepatitis 8:180-185; 미국 특허 5,082,659; 미국 특허 5,190,751; 미국 특허 4,806,347; Wandl et al. (1992) Br. J. Haematol. 81:516-519; 유럽 특허 출원 294,160; 캐나다 특허 1,321,348; 유럽 특허 출원 276,120; Wandl et al. (1992) Sem. Oncol. 19:88-94; Balish et al. (1992) J. Infectious Diseases 166:1401-1403; Van Dijk et al. (1994) Int. J. Cancer 56:262-268; Sundmacher et al. (1987) Current Eye Res. 6:273-276; 미국 특허 6,172,046; 6,245,740; 5,824,784; 5,372,808; 5,980,884; 국제 특허 출원 공개 WO 96/21468; WO 96/11953; WO 00/59929; WO 00/66623; WO2003/064416; WO2003/064455; WO 2003/064456; WO 97/06804; WO 98/17679; WO 98/22496; WO 97/43310; WO 98/46597; WO 98/46630; WO 99/07733; WO 99/07734, WO 00/09543; WO 00/09558; WO 99/38888; WO 99/64442; WO 99/50230; WO 95/33764; Torre et al. (2001) J. Med. Virol. 64:455-459; Bekkering et al. (2001) J. Hepatol. 34:435- 440; Zeuzem et al. (2001) Gastroenterol. 120:1438-1447; Zeuzem (1999) J. Hepatol. 31:61-64; Keeffe and Hollinger (1997) Hepatol. 26:101S-107S; Wills (1990) Clin. Pharmacokinet. 19:390-399; Heathcote et al. (2000) New Engl. J. Med. 343:1673-1680; Husa and Husova (2001) Bratisl. Let Listy 102:248-252; Glue et al. (2000) Clin. Pharmacol. 68:556-567; Bailon et al. (2001) Bioconj. Chem. 12:195-202; 및 Neumann et al. (2001) Science 282:103; Zalipsky (1995) Adv. Drug Delivery Reviews S. 16, 157-182; Mann et al. (2001) Lancet 358:958-965; Zeuzem et al. (2000) New Engl. J. Med. 343:1666-1672; 미국 특허 5,633,388; 5,866,684; 6,018,020; 5,869,253; 6,608,027; 5,985,265; 5,908,121; 6,177,074; 5,985,263; 5,711,944; 5,382,657; 및 5,908,121; Osborn et al. (2002) J. Pharmacol. Exp. Therap. 303:540-548; Sheppard et al. (2003) Nat. Immunol. 4:63-68; Chang et al. (1999) Nat. Biotechnol. 17:793-797; Adolf (1995) Multiple Sclerosis 1 Suppl. 1:S44-S47; Chu et al., Tet. Lett. (1996), 7229-7232; Ninth Conference on Antiviral Research, Urabandai, Fukyshima, Japan (1996) (Antiviral Research, (1996), 30: 1, A23 (abstract 19)); Steinkuhler et al., Biochem., 37:8899-8905; Ingallinella et al., Biochem., 37:8906-8914; 및 그 전체 내용이 본원에 참고로 포함된 미국 특허 6,183,121.
<발명의 개요>
바람직한 실시태양은 하기 화학식 I의 화합물을 제공한다:
상기 식 중,
R1은 임의로 치환된 아릴, 적어도 하나의 N, O 또는 S를 포함하는 임의로 치환된 헤테로시클릴, 임의로 치환된 아릴알킬, 또는 헤테로시클릴계 내에 적어도 하나의 N, O 또는 S를 포함하는 임의로 치환된 헤테로시클릴알킬이고;
R2, R3 및 R4는 각각 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C6 내지 C20 아릴알킬, 임의로 치환된 C3 내지 C20 시클로알킬알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 할로, 시아노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 술파밀, 술포닐, 술피닐, 티오카르보닐, 티오카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되거나;
R2, R3 및 R4 중 적어도 2개가 연결되어 비치환 또는 치환된 3 내지 20원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 및 황으로 이루어진 군 중에서 선택되고;
단, 화학식 I은 하기 구조를 포함하지 않는다:
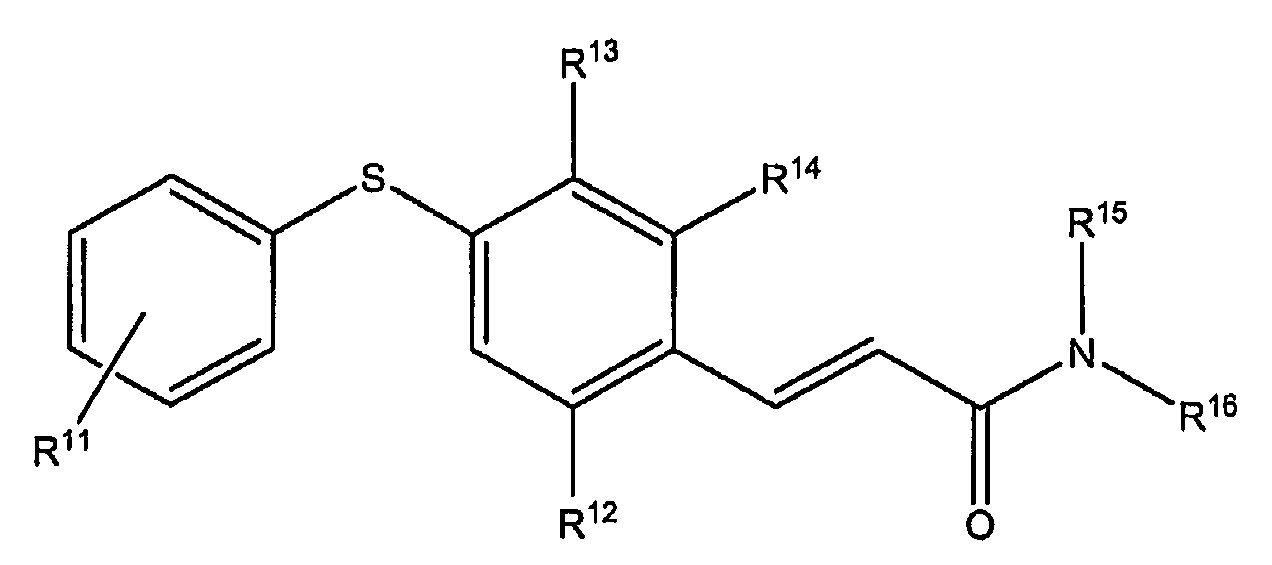
바람직한 실시태양은 하기 화학식 II의 화합물을 제공한다:
상기 식 중,
R12, R13, R14 및 R17은 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 할로, 시아노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 술파밀, 술포닐, 술피닐, 티오카르보닐, 티오카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되고; 단, R12, R13, R14 및 R17 모두가 H는 아니고;
R15 및 R16은 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 모노- 및 디-(C1 내지 C20)알킬아미노, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 및 이들의 조합으로 이루어진 군 중에서 선택되거나;
R15 및 R16이 함께 비치환 또는 치환된 3 내지 7원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 또는 황으로 이루어진 군 중에서 선택되고;
단, 화학식 II는 하기 구조를 포함하지 않는다:
바람직한 실시태양은 하기 화학식 IV의 화합물을 제공한다:
상기 식 중,
R12, R13, R14 및 R17은 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 할로, 시아노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 술파밀, 술포닐, 술피닐, 티오카르보닐, 티오카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되고; 단, R12, R13, R14 및 R17 모두가 H는 아니고;
R15는 H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C1 내지 C20 헤테로시클릴알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 모노- 및 디-(C1 내지 C20)알킬아미노, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 및 이들의 조합으로 이루어진 군 중에서 선택되고;
R18은 H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알콕시, 모노- 및 디-(C1 내지 C20)알킬아미노, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 및 이들의 조합으로 이루어진 군 중에서 선택된다.
바람직한 실시태양은 NS3 단백질을 본원에 개시된 화합물과 접촉시키는 것을 포함하는, NS3 활성을 조절하는 방법을 제공한다.
바람직한 실시태양은 NS3 헬리카제를 본원에 개시된 화합물과 접촉시키는 것 을 포함하는, NS3 헬리카제를 조절함으로써 간염을 치료하는 방법을 제공한다.
바람직한 실시태양은 NS3 헬리카제의 부위에 결합하고 핵산 기질의 풀림(unwinding)을 억제하여, NS3 헬리카제의 활성을 조절할 수 있는 화합물을 제공한다.
<정의>
본원에 사용된 바와 같이, 용어 "간 (liver) 섬유증"과 서로 바꾸어 쓸 수 있는 용어 "간의 (hepatic) 섬유증"은 만성 간염 감염의 경우에 일어날 수 있는, 간의 반흔 조직의 성장을 지칭한다.
본원에서 용어 "개체", "숙주", "대상" 및 "환자"는 서로 바꾸어 쓸 수 있으며, 원숭이 및 인간을 비롯한 영장류를 포함하지만 이에 제한되지 않는 포유동물을 지칭한다.
본원에서 사용되는 바와 같이, 용어 "간 기능"은 단백질, 예를 들어 혈청 단백질 (예, 알부민, 응고 인자, 알칼리 포스파타제, 아미노트랜스퍼라제 (예, 알라닌 트랜스아미나제, 아스파르테이트 트랜스아미나제), 5'-뉴클레오시다제, γ-글루타미닐 트랜스펩티다제 등)의 합성, 빌리루빈의 합성, 콜레스테롤의 합성, 및 담즙산의 합성을 포함하지만 이에 제한되지 않는 합성 기능; 탄수화물 대사, 아미노산 및 암모니아 대사, 호르몬 대사 및 지질 대사를 포함하지만 이에 제한되지 않는 간 대사 기능; 외인성 약물의 해독; 및 내장 및 문맥 혈류역학을 비롯한 혈류역학적 기능 등을 포함하지만 이에 제한되지 않는 간의 정상 기능을 지칭한다.
용어 "지속된 바이러스 반응" (SVR; 또한, "지속된 반응" 또는 "지속성 반응"이라고도 함)은, 본원에 사용된 바와 같이, HCV 감염에 관한 치료 요법에 대하여 개체가 혈청 HCV 역가 측면에서 나타내는 반응을 지칭한다. 일반적으로, "지속된 바이러스 반응"은 치료 중단 후 적어도 약 1 개월, 적어도 약 2 개월, 적어도 약 3 개월, 적어도 약 4 개월, 적어도 약 5 개월 또는 적어도 약 6 개월의 기간 동안 환자의 혈청에서 검출가능한 HCV RNA가 발견되지 않음 (예, 혈청 1 ml 당 게놈 카피수가 약 500 미만, 약 200 미만 또는 약 100 미만임)을 의미한다.
"치료에 실패한 환자"는 본원에 사용된 바와 같이 일반적으로, HCV에 대한 기존 요법에 반응하지 않는 HCV-감염 환자 ("비-반응자"라고 함), 또는 처음에는 기존 요법에 반응하지만 치료 반응이 유지되지 않는 HCV-감염 환자 ("재발병자"라고 함)를 지칭한다. 일반적으로, 기존 요법은 IFN-α 단일 요법 또는 IFN-α 조합 요법을 이용한 치료를 포함할 수 있으며, 여기서 조합 요법은 IFN-α 및 항바이러스제, 예를 들어 리바비린의 투여를 포함할 수 있다.
본원에 사용된 바와 같이, 용어 "치료" 및 "치료하는" 등은 원하는 약리학적 및/또는 생리학적 효과를 얻는 것을 의미한다. 이러한 효과는 질병 또는 그의 증상을 완전히 또는 부분적으로 억제하는 측면에서 예방 효과일 수 있고/있거나 질병 및/또는 질병이 그 원인이 되는 악영향을 부분적으로 또는 완전히 치유하는 측면에서는 치료 효과일 수 있다. "치료"는, 본원에 사용된 바와 같이, 포유동물, 특히 인간의 질병에 대한 임의의 치료를 망라하며, (a) 질병에 걸리기 쉽지만 아직 질병에 걸린 것으로 진단되지 않은 대상에서 질병이 발병하는 것을 방지하는 것; (b) 질병을 억제, 즉 질병의 발병을 저지하는 것; 및 (c) 질병을 완화, 즉 질병의 퇴행을 유발하는 것을 포함한다.
본원에서 용어 "개체", "숙주", "대상체" 및 "환자"는 서로 바꾸어 쓸 수 있으며, 쥐, 원숭이, 인간, 포유동물인 농장 동물, 포유동물인 경기용 동물, 및 포유동물인 애완동물을 포함하지만 이에 제한되지 않는 포유동물을 지칭한다.
용어 "투여 처리"는, 본원에 사용된 바와 같이, 그를 필요로 하는 환자에게 항바이러스제를 투여하는 것을 지칭하며, 이 반응은 약물 분배 장치로부터 항바이러스제를 1회 이상 방출시키는 것을 포함할 수 있다. 따라서, 용어 "투여 처리"는, 본원에 사용된 바와 같이, 연속적인 전달 장치 (예, 펌프 또는 다른 조절 방출 주사가능 시스템)의 설치, 및 단일 피하 주사에 이어서 연속 전달 시스템의 설치를 포함하지만 이에 제한되지 않는다.
"연속 전달"은, 본원에 사용된 바와 같이 (예, "물질을 조직으로 연속 전달하는" 경우), 선택된 시간 동안 원하는 양의 물질을 조직으로 전달하는 방식으로 약물을 전달 부위, 예를 들어 조직으로 이동시키며, 선택된 시간 동안 매분 환자가 거의 동일량의 약물을 수용하는 것을 지칭하는 의미이다.
"조절 방출"은, 본원에 사용된 바와 같이 (예, "조절된 약물 방출"의 경우), 선택된 또는 다른 조절가능한 속도, 간격 및/또는 양으로 물질 (예, 타입 I 또는 타입 III 인터페론 수용체 작용제, 예, IFN-α)을 방출시키는 것을 포함하는 의미이며, 이는 사용 환경에 의해서는 실질적으로 영향받지 않는다. 따라서, "조절 방출"은 실질적으로 연속적인 전달, 및 패턴화된 전달 (예, 규칙적인 또는 불규칙적인 시간 간격에 의해 중단되는 시간에 걸친 간헐적인 전달)을 포함하지만, 반드시 이들로 한정되는 것은 아니다.
"패턴화된" 또는 "시간적인"은, 약물 전달의 경우에 사용된 바와 같이, 약물을 패턴, 일반적으로 실질적으로 규칙적인 패턴으로, 미리 선택된 시간 (예, 볼러스 주사와 관련된 시간 이외의) 동안 전달하는 것을 의미한다. "패턴화된" 또는 "시간적인" 약물 전달은 증가하는, 감소하는, 실질적으로 일정한, 또는 박동성 속도 또는 속도 범위 (예, 단위 시간당 약물의 양 또는 단위 시간 동안 약물 제제의 부피)로 약물을 전달하는 것을 포함하는 의미이며, 추가로 약물을 연속적으로 또는 실질적으로 연속적으로, 또는 만성적으로 전달하는 것을 포함한다.
용어 "조절된 약물 전달 장치"는 약물 또는 약물에 함유된 다른 원하는 물질의 방출 (예, 방출 속도, 시간)이 장치 자체에 의해 조절되거나 결정되고, 사용 환경에 의해 실질적으로 영향받지 않거나 또는 사용 환경 내에서 재현가능한 속도로 방출되는 임의의 장치를 포함하는 의미이다.
"실질적으로 연속적인"은 예를 들어 "실질적으로 연속적인 주입" 또는 "실질적으로 연속적인 전달"의 경우에서 사용된 바와 같이, 미리 선택된 약물 전달 기간 동안 실질적으로 방해받지 않는 방식으로, 미리 선택된 기간 내에 임의의 8시간의 간격 동안 환자가 수용하는 약물의 양이 0이 되지 않도록 약물을 전달하는 것을 지칭하는 의미이다. 또한, "실질적으로 연속적인" 약물 전달은 미리 선택된 약물 전달 기간 동안 실질적으로 방해받지 않고 실질적으로 일정한 미리 선택된 속도 또는 속도 범위 (예, 단위 시간당 약물의 양 또는 단위 시간 동안 약물 제제의 부피)로 약물을 전달하는 것을 포함할 수도 있다.
"실질적으로 항정 상태"는, 시간의 함수로서 달라질 수 있는 생물학적 파라미터의 경우에서 사용된 바와 같이, 생물학적 파라미터가 시간 과정 동안 실질적으로 일정한 값을 나타낸다는 의미이며, 여기서 시간 과정 동안 임의의 8시간 동안 시간의 함수로서 생물학적 파라미터의 값에 의해 정의되는 곡선 아래의 면적 (AUC8hr)은 시간 과정 동안 8시간의 기간에 걸친 생물학적 파라미터의 곡선 아래의 평균 면적 (AUC8hr 평균)에 비해 약 20% 이하로 초과하거나 약 20% 이하로 더 작고, 바람직하게는 약 15% 이하로 초과하거나 약 15% 이하로 더 작고, 더 바람직하게는 약 10% 이하로 초과하거나 약 10% 이하로 더 작다. AUC8hr 평균은 전체 시간 과정 동안 생물학적 파라미터의 곡선 아래의 면적 (AUC전체)을 시간 과정에서 8시간 간격의 수 (전체/3일)로 나눈 몫 (q)으로서 정의된다. 즉, q는 (AUC전체)/(전체/3일)이다. 예를 들어, 약물의 혈청 농도의 경우, 시간 과정 동안 임의의 8시간의 기간 동안 혈청 약물 농도의 곡선 아래의 면적 (AUC8hr)이 시간 과정에서 8시간의 기간 동안 혈청 약물 농도의 곡선 아래의 평균 면적 (AUC8hr 평균)에 비해 약 20% 이하로 초과하거나 약 20% 이하로 더 작은 경우, 즉 AUC8hr이 시간 과정 동안 혈청 약물 농도에 대한 AUC8hr 평균에 비해 20% 이하로 초과하거나 20% 이하로 더 작은 경우, 약물의 혈청 농도는 시간 과정 동안 실질적으로 항정 상태로 유지된다.
본원에서 사용될 때, 단백질과 관련하여 용어 "상동성" 또는 "변이체"는 서열 유사성 또는 동일성을 나타내고, 동일성이 바람직하다. 당업계에 공지된 바와 같이, 많은 상이한 프로그램이 단백질 (또는 아래 논의된 핵산)이 공지의 서열에 서열 동일성 또는 유사성을 갖는지 확인하기 위해 사용될 수 있다. 따라서, 바람직한 실시태양에서, 약 40% 이하의 잔기가 야생형 서열과 상이할 수 있는 아미노산 서열을 갖는 상동성 단백질 또는 변이체는 약 60% 상동성을 갖는다. 다른 바람직한 실시태양에서, 상동성 단백질은 약 65, 70, 75, 80, 85, 90, 95, 96, 97, 98, 또는 99% 상동성을 가질 수 있다.
본원에서 사용한 용어 "알킬"은 1 내지 20개의 탄소 원자로 된 1가 직쇄 또는 분지쇄 라디칼을 의미하며, 메틸, 에틸, n-프로필, 이소프로필, n-부틸, 이소부틸, tert-부틸, n-헥실 등을 포함하지만 이에 제한되지 않는다.
본원에서 사용한 용어 "할로"는 플루오로, 클로로, 브로모 또는 요오도를 의미한다.
본원에서 사용한 용어 "알콕시"는 직쇄 또는 분지쇄 알킬 라디칼이 --O-- 결합을 통해 주 분자에 공유 결합된 것을 의미한다. 알콕시 기의 예는, 메톡시, 에톡시, 프로폭시, 이소프로폭시, 부톡시, n-부톡시, sec-부톡시, t-부톡시 등을 포함하지만 이에 제한되지 않는다.
본원에서 사용한 용어 "알케닐"은 탄소 이중결합을 포함하는 2개 내지 20개의 탄소 원자로 된 1가 직쇄 또는 분지쇄 라디칼을 의미하며, 1-프로페닐, 2-프로페닐, 2-메틸-1-프로페닐, 1-부테닐, 2-부테닐 등을 포함하지만 이에 제한되지 않는다.
본원에서 사용한 용어 "알키닐"은 탄소 삼중결합을 포함하는 2개 내지 20개의 탄소 원자로 된 1가 직쇄 또는 분지쇄 라디칼을 의미하며, 1-프로피닐, 1-부티닐, 2-부티닐 등을 포함하지만 이에 제한되지 않는다.
본원에서 사용한 용어 "아릴"은 융합되거나 융합되지 않은 호모시클릭 방향족 라디칼을 의미한다. 아릴기의 예는 페닐, 나프틸, 비페닐, 페난트레닐, 나프타세닐 등을 포함하지만 이에 제한되지 않는다.
본원에서 사용되는 용어 "시클로알킬"은 3개 내지 20개의 탄소 원자로 된 포화 지방족 고리계 라디칼을 의미하고, 시클로프로필, 시클로펜틸, 시클로헥실, 시클로헵틸 등을 포함하지만 이에 제한되지 않는다.
본원에서 사용되는 용어 "시클로알케닐"은 적어도 하나의 탄소-탄소 이중 결합을 고리에 갖는, 3개 내지 20개의 탄소 원자로 된 지방족 고리계 라디칼을 의미한다. 시클로알케닐기의 예는 시클로프로페닐, 시클로펜테닐, 시클로헥세닐, 시클로헵테닐 등을 포함하지만 이에 제한되지 않는다.
본원에서 사용되는 용어 "폴리시클로알킬"은 교두보 (bridgehead) 탄소와 융합되거나 융합되지 않은 적어도 2개의 고리를 갖는 포화 지방족 고리계 라디칼을 의미한다. 폴리시클로알킬기의 예는 비시클로[4.4.0]데카닐, 비시클로[2.2.1]헵타닐, 아다만틸, 노르보르닐 등을 포함하지만 이에 제한되지 않는다.
본원에서 사용되는 용어 "폴리시클로알케닐"은 고리의 적어도 하나가 탄소-탄소 이중 결합을 갖는, 교두보 탄소와 융합되거나 융합되지 않은 적어도 2개의 고리를 갖는 지방족 고리계 라디칼을 의미한다. 폴리시클로알케닐기의 예는 노르보르닐레닐, 1,1'-비시클로펜테닐 등을 포함하지만 이에 제한되지 않는다.
본원에서 사용되는 용어 "폴리시클릭 탄화수소"는 모든 고리원이 탄소 원자인 고리계 라디칼을 의미한다. 폴리시클릭 탄화수소는 방향족일 수 있거나 또는 최대수 미만의 비-누적성의 이중 결합을 함유할 수 있다. 폴리시클릭 탄화수소의 예는 나프틸, 디히드로나프틸, 인데닐, 플루오레닐 등을 포함하지만 이에 제한되지 않는다.
본원에서 사용되는 용어 "헤테로시클릭" 또는 "헤테로시클릴"은 하나 이상의 고리 원자가 탄소가 아닌, 즉 헤테로원자인 적어도 하나의 고리계를 갖는 시클릭 고리계 라디칼을 의미한다. 헤테로사이클은 비방향족 또는 방향족일 수 있다. 헤테로시클릭기의 예는 모르폴리닐, 테트라히드로푸라닐, 디옥솔라닐, 피롤리디닐, 옥사졸릴, 피라닐, 피리딜, 피리미디닐, 피롤릴 등을 포함하지만 이에 제한되지 않는다.
본원에서 사용되는 용어 "헤테로아릴"은 방향족계를 유지하는 방식으로 하나 이상의 메틴 및/또는 비닐렌기를 각각 3가 또는 2가 헤테로원자로 치환시켜 아렌으로부터 공식적으로 유도된 헤테로시클릭기를 의미힌다. 헤테로아릴기의 예는 피리딜, 피롤릴, 옥사졸릴, 인돌릴 등을 포함하지만 이에 제한되지 않는다.
본원에서 사용되는 용어 "아릴알킬"은 하나 이상의 아릴기가 알킬 라디칼에 부가된 (appended) 것을 의미한다. 아릴알킬기의 예는 벤질, 펜에틸, 펜프로필, 펜부틸 등을 포함하지만 이에 제한되지 않는다.
본원에서 사용되는 용어 "시클로알킬알킬"은 하나 이상의 시클로알킬기가 알킬 라디칼에 부가된 것을 의미한다. 시클로알킬알킬의 예는 시클로헥실메틸, 시클로헥실에틸, 시클로펜틸메틸, 시클로펜틸에틸 등을 포함하지만 이에 제한되지 않는다.
본원에서 사용되는 용어 "헤테로아릴알킬"은 하나 이상의 헤테로아릴기가 알킬 라디칼에 부가된 것을 의미한다. 헤테로아릴알킬의 예는 피리딜메틸, 푸라닐메틸, 티오페닐에틸 등을 포함하지만 이에 제한되지 않는다.
본원에서 사용되는 용어 "헤테로시클릴알킬"은 하나 이상의 헤테로시클릴기가 알킬 라디칼에 부가된 것을 의미한다. 헤테로시클릴알킬의 예는 모르폴리닐메틸, 모르폴리닐에틸, 모르폴리닐프로필, 테트라히드로푸라닐메틸, 피롤리디닐프로필 등을 포함하지만 이에 제한되지 않는다.
본원에서 사용되는 용어 "아릴옥시"는 아릴 라디칼이 --O-- 결합을 통해 주 분자에 공유 결합된 것을 의미한다.
본원에서 사용되는 용어 "알킬티오"는 직쇄 또는 분지쇄 알킬 라디칼이 --S-- 결합을 통해 주 분자에 공유 결합된 것을 의미한다.
본원에서 사용되는 용어 "아릴티오" 아릴 라디칼이 --S-- 결합을 통해 주 분자에 공유 결합된 것을 의미한다.
본원에서 사용되는 용어 "알킬아미노"는 하나 이상의 알킬기가 부착되어 있는 질소 라디칼을 의미한다. 따라서, 모노알킬아미노는 하나의 알킬기가 부착되어 있는 질소 라디칼을 의미하고, 디알킬아미노는 두개의 알킬기가 부착되어 있는 질소 라디칼을 의미한다.
본원에서 사용되는 용어 "시아노아미노"는 니트릴기가 부착되어 있는 질소 라디칼을 의미한다.
본원에서 사용되는 용어 "카르바밀"은 RNHCOO-를 의미한다.
본원에서 사용되는 용어 "케토" 및 "카르보닐"은 C=O를 의미한다.
본원에서 사용되는 용어 "카르복시"는 -COOH를 의미한다.
본원에서 사용되는 용어 "술파밀"은 -SO2NH2를 의미한다.
본원에서 사용되는 용어 "술포닐"은 -SO2-를 의미한다.
본원에서 사용되는 용어 "술피닐"은 -SO-를 의미한다.
본원에서 사용되는 용어 "티오카르보닐"은 C=S를 의미한다.
본원에서 사용되는 용어 "티오카르복시"는 CSOH를 의미한다.
본원에서 사용되는 바와 같이, 라디칼은 그 라디칼을 함유하는 물질종이 다른 물질종에 공유 결합될 수 있도록 하나의 비페어링된 전자를 갖는 물질종을 나타낸다. 따라서, 이러한 맥락에서, 라디칼이 반드시 유리 라디칼인 것은 아니다. 오히려, 라디칼은 보다 큰 분자의 특정 부분을 나타낸다. 용어 "라디칼"은 용어 "기"와 서로 교환가능하게 사용될 수 있다.
본원에서 사용되는 바와 같이, 치환되는 기는 하나 이상의 수소 원자가 다른 원자 또는 기로 대체된 비치환 모 구조로부터 유도된다. 치환될 때, 치환기(들)은 C1-C20 알킬, C1-C6 알케닐, C1-C20 알키닐, C3-C20 시클로알킬, C3-C20 헤테로시클로알킬 (예를 들어, 테트라히드로푸릴), 아릴, 헤테로아릴, 할로 (예를 들어, 클로로, 브로모, 요오도 및 플루오로), 시아노, 히드록시, C1-C20 알콕시, 아릴옥시, 술프히드릴 (머캅토), C1-C20 알킬티오, 아릴티오, 모노- 및 디-(C1-C20)알킬 아미노, 4급 암모늄 염, 아미노(C1-C20)알콕시, 히드록시(C1-C20)알킬아미노, 아미노(C1-C20)알킬티오, 시아노아미노, 니트로, 카르바밀, 케토 (옥시), 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐, 술파밀, 술포닐, 술피닐, 티오카르보닐, 티오카르복시, 및 이들의 조합으로부터 개별적으로 및 독립적으로 선택되는 하나 이상의 기(들)이다. 상기 치환체의 보호 유도체를 형성할 수 있는 보호기는 당업자에게 공지되어 있고, 예를 들어 문헌 [Greene and Wuts Protective Groups in Organic Synthesis; John Wiley and Sons: New York, 1999]에서 찾아볼 수 있다. 치환체가 "임의로 치환된"으로 설명된 경우, 이 치환체는 상기 치환체로 치환될 수 있다.
비대칭 탄소 원자가 설명된 화합물 내에 존재할 수 있다. 입체이성질체 및 에난티오머 및 이들의 혼합물을 포함하는 모든 이성질체가 언급된 화합물의 범위에 포함된다. 특정 경우에, 화합물은 토토머 (tautomer) 형태로 존재할 수 있다. 모든 토토머 형태는 언급된 화합물의 범위에 포함된다. 유사하게, 화합물이 알케닐 또는 알케닐렌기를 포함할 경우, 시스 및 트랜스 이성질체 형태의 화합물이 존재할 가능성이 있다. 시스 및 트랜스 이성질체 및 시스 및 트랜스 이성질체의 혼합물이 모두 고려된다. 따라서, 본원에서 화합물에 대한 언급은 분명히 다르게 나타낸 경우를 제외하고는 상기 언급된 모든 이성질체 형태를 포함한다.
다형체 (polymorph), 용매화물, 수화물, 이형태체 (conformer), 염, 및 전구약물 유도체를 포함하여 다양한 형태가 실시태양에 포함된다. 다형체는 동일한 화학식을 갖지만 상이한 구조를 갖는 조성물이다. 용매화물은 용매화 (용매 분자와 용질의 분자 또는 이온의 조합)에 의해 형성된 조성물이다. 수화물은 물의 혼입에 의해 형성된 화합물이다. 이형태체는 입체형태 이성체의 구조이다. 입체형태 이성체 형성은 회전하는 결합 주위에서 원자의 동일한 구조식을 갖지만 상이한 입체형태 (이형태체)를 갖는 분자의 현상을 의미한다. 화합물의 염은 당업자에게 공지된 방법에 의해 제조할 수 있다. 예를 들어, 화합물의 염은 적절한 염기 또는 산을 화학양론적 당량의 화합물과 반응시켜 제조할 수 있다. 전구약물은 생체 변환 (화학적 전환)을 거친 후 그의 약리 효과를 보이는 화합물이다. 따라서, 전구약물은 예를 들어 주 분자에서 바람직하지 않은 특성을 변경하거나 제거하기 위해 일시적으로 방식으로 사용되는 특수 보호기를 포함하는 약물로서 설명될 수 있다. 따라서, 본원에서 화합물에 대한 언급은 분명히 다르게 나타낸 경우를 제외하고는 상기 언급된 모든 형태를 포함한다.
수치 범위가 제공된 경우, 문맥이 명시적으로 달리 나타내지 않는다면, 해당 범위의 상한 및 하한 사이에 들어 있는, 하한 단위의 1/10까지에 대한 각각의 값 및 상기 정해진 범위 내의 임의의 다른 정해진 값 또는 사이에 들어 있는 다른 값은 실시태양에 포함되는 것으로 이해된다. 또한, 이들 작은 범위의 상한 및 하한은 독립적으로 더 작은 범위 내에 포함될 수 있으며, 또한 이 정해진 범위 내에 어떤 보다 명확히 배제된 한계가 있다면, 본 발명의 범위에 포함된다. 정해진 범위가 한계들 중 어느 하나 또는 둘 모두를 포함하는 경우, 이와 같이 포함된 한계를 모두 배제하는 범위가 또한 실시태양에 포함된다.
달리 정의하지 않는다면, 본원에 사용된 모든 기술 및 과학 용어들은 본 발명이 속하는 당업계의 통상의 숙련자에 의해 통상적으로 이해되는 것과 동일한 의미를 갖는다. 본 발명을 실시 또는 시험하는데 있어서 본원에 기재된 것들과 유사하거나 동등한 임의의 방법 및 물질들을 사용할 수도 있지만, 바람직한 방법 및 물질들이 하기에 기재되어 있다. 본원에서 언급된 모든 간행물들은 이 간행물들에 언급된 방법 및/또는 물질들을 개시 및 기술할 목적으로 본원에 참고로 포함된다.
본원 및 첨부된 청구의 범위에서 사용된 바와 같이, 단수 형태인 "하나", "및", "그"는 문맥이 명시적으로 달리 나타내지 않는다면 복수의 지시 대상을 포함한다는 것을 유의해야 한다. 따라서, 예를 들어, "하나의 방법"의 언급은 이러한 방법의 복수를 포함하며, "하나의 용량"의 언급은 1회 이상의 용량 및 당업자에게 공지된 동등한 용량을 포함한다.
본 실시태양은 화학식 I-IV의 화합물, 및 화학식 I-IV의 임의의 화합물을 포함하는 제약 조성물 및 제제를 제공한다. 본 발명의 화합물은 아래에 논의되는 바와 같이 HCV 감염 및 다른 질환 치료에 유용하다.
조성물
본 실시태양은 하기 화학식 I을 갖는 화합물을 제공한다:
<화학식 I>
상기 식 중,
R1은 임의로 치환된 아릴, 적어도 하나의 N, O 또는 S를 포함하는 임의로 치환된 헤테로시클릴, 임의로 치환된 아릴알킬, 또는 헤테로시클릴계 내에 적어도 하나의 N, O 또는 S를 포함하는 임의로 치환된 헤테로시클릴알킬이고;
R2, R3 및 R4는 각각 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C6 내지 C20 아릴알킬, 임의로 치환된 C3 내지 C20 시클로알킬알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 할로, 시아노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 술파밀, 술포닐, 술피닐, 티오카르보닐, 티오카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되거나;
R2, R3 및 R4 중 적어도 2개가 연결되어 비치환 또는 치환된 3 내지 20원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 및 황으로 이루어진 군 중에서 선택되고;
단, 화학식 I은 하기 구조를 포함하지 않는다:
본 실시태양은 하기 화학식 II를 갖는 화합물을 제공한다:
<화학식 II>
상기 식 중,
R12, R13, R14 및 R17은 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 할로, 시아노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 술파밀, 술포닐, 술피닐, 티오카르보닐, 티오카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되고; 단, R12, R13, R14 및 R17 모두가 H는 아니고;
R15 및 R16은 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 모노- 및 디-(C1 내지 C20)알킬아미노, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 및 이들의 조합으로 이루어진 군 중에서 선택되거나;
R15 및 R16이 함께 비치환 또는 치환된 3 내지 7원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 또는 황으로 이루어진 군 중에서 선택되고;
단, 화학식 II는 하기 구조를 포함하지 않는다:
본 실시태양은 하기 화학식 III을 갖는 화합물을 제공한다:
상기 식 중,
R11은 H, 할로, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 또는 임의로 치환된 C1 내지 C20 알콕시이고;
R12, R13 및 R14는 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 할로, 시아노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드 라지노, 구아닐릴, 술파밀, 술포닐, 술피닐, 티오카르보닐, 티오카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되고; 단, R12, R13 및 R14 모두가 H는 아니고;
R15 및 R16은 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 모노- 및 디-(C1 내지 C20)알킬아미노, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 및 이들의 조합으로 이루어진 군 중에서 선택되거나;
R15 및 R16이 함께 비치환 또는 치환된 3 내지 7원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 또는 황으로 이루어진 군 중에서 선택된다.
본 실시태양은 하기 화학식 IV를 갖는 화합물을 제공한다:
<화학식 IV>
상기 식 중,
R12, R13, R14 및 R17은 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 할로, 시아노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 술파밀, 술포닐, 술피닐, 티오카르보닐, 티오카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되고; 단, R12, R13, R14 및 R17 모두가 H는 아니고;
R15는 H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 모노- 및 디-(C1 내지 C20)알킬아미노, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 및 이들의 조합으로 이루어진 군 중에서 선택되고;
R18은 H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알콕시, 모노- 및 디-(C1 내지 C20)알킬아미노, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 및 이들의 조합으로 이루어진 군 중에서 선택된다.
화학식 I의 화합물의 예를 하기 표 1에 나타낸다.
화학식 II-IV의 화합물의 예를 하기 표 2에 나타낸다.
바람직한 실시태양에서, 하기 화학식 I의 화합물을 제공한다:
<화학식 I>
상기 식 중,
R1은 임의로 치환된 아릴, 적어도 하나의 N, O 또는 S를 포함하는 임의로 치환된 헤테로시클릴, 임의로 치환된 아릴알킬, 또는 헤테로시클릴계 내에 적어도 하나의 N, O 또는 S를 포함하는 임의로 치환된 헤테로시클릴알킬이고;
R2, R3 및 R4는 각각 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C6 내지 C20 아릴알킬, 임의로 치환된 C3 내지 C20 시클로알킬알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 할로, 시아노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 술파밀, 술포닐, 술피닐, 티오카르보닐, 티오카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되거나;
R2, R3 및 R4 중 적어도 2개가 연결되어 비치환 또는 치환된 3 내지 20원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 및 황으로 이루어진 군 중에서 선택되고;
단, 화학식 I은 하기 구조를 포함하지 않는다:
바람직한 실시태양에서, R1이 임의로 치환된 아릴 또는 적어도 하나의 N, O 또는 S를 포함하는 임의로 치환된 헤테로시클릴인 화학식 I의 화합물을 제공한다.
바람직한 실시태양에서, R2, R3 및 R4가 각각 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C6 내지 C20 아릴알킬, 임의로 치환된 C3 내지 C20 시클로알킬알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 카르바밀, 케토, 카르보닐, 카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되는 화학식 I의 화합물을 제공한다.
바람직한 실시태양에서, R2, R3 및 R4 중 적어도 2개는 연결되어 비치환 또는 치환된 3 내지 7원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 또는 황으로 이루어진 군 중에서 선택되는 것인 화학식 I의 화합물을 제공한다.
바람직한 실시태양에서, R1이 티오펜인 화학식 I의 화합물을 제공한다.
바람직한 실시태양에서, R1이 임의로 치환된 페닐인 화학식 I의 화합물을 제공한다.
바람직한 실시태양에서, R1이 티오펜 또는 임의로 치환된 페닐이고, R2, R3 및 R4가 각각 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C6 내지 C20 아릴알킬, 임의로 치환된 C3 내지 C20 시클로알킬알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 카르바밀, 케토, 카르보닐, 카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되는 화학식 I의 화합물을 제공한다.
바람직한 실시태양에서, R1이 티오펜 또는 임의로 치환된 페닐이고, R2, R3 및 R4 중 적어도 2개가 연결되어 비치환 또는 치환된 3 내지 7원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 또는 황으로 이루어진 군 중에서 선택되는 것인 화학식 I의 화합물을 제공한다.
한 실시태양은 하기 화학식 Ia, Ib 및 Ic의 화합물을 제공한다:
화학식 Ia, Ib 및 Ic에서, Ar은 아릴 (예를 들어, 페닐, 티오페닐 등)을 나타내고, n은 1 또는 2로서, 표시된 위치에서 고리 내의 탄소 원자의 수를 나타낸다. 예를 들어, n = 1인 경우에, 고리는 4개의 탄소 원자 및 1개의 질소 원자를 함유하고; n = 2인 경우에, 고리는 5개의 탄소 원자 및 1개의 질소 원자를 함유한 다. 화학식 Ia, Ib 및 Ic의 화합물은 화학식 I의 화합물의 예이다.
바람직한 실시태양에서, 하기 화학식 II의 화합물을 제공한다:
<화학식 II>
상기 식 중,
R12, R13, R14 및 R17은 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 할로, 시아노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 술파밀, 술포닐, 술피닐, 티오카르보닐, 티오카르복시, 및 이 들의 조합으로 이루어진 군 중에서 선택되고; 단, R12, R13, R14 및 R17 모두가 H는 아니고;
R15 및 R16은 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 모노- 및 디-(C1 내지 C20)알킬아미노, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 및 이들의 조합으로 이루어진 군 중에서 선택되거나;
R15 및 R16이 함께 비치환 또는 치환된 3 내지 7원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 또는 황으로 이루어진 군 중에서 선택되고;
단, 화학식 II는 하기 구조를 포함하지 않는다:
바람직한 실시태양에서, R12, R13, R14 및 R17이 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C1 내지 C20 알킬티오, 할로, 시아노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 및 카르복시로 이루어진 군 중에서 선택되는 화학식 II의 화합물을 제공한다.
바람직한 실시태양에서, R15 및 R16이 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 모노- 및 디-(C1 내지 C20)알킬아미노, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 카르바밀, 케토, 카르보닐, 카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되는 화학식 II의 화합물을 제공한다.
바람직한 실시태양에서, R15 및 R16이 함께 비치환 또는 치환된 4 내지 6원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 및 황으로 이루어진 군 중에서 선택되는 것인 화학식 II의 화합물을 제공한다.
바람직한 실시태양에서, 하기 화학식 II를 갖는 화합물을 제공한다:
<화학식 II>
본 실시태양은 하기 화학식 III을 갖는 화합물을 제공한다:
<화학식 III>
상기 식 중,
R11은 H, 할로, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 또는 임의로 치환된 C1 내지 C20 알콕시이고;
R12, R13 및 R14는 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 할로, 시아노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 술파밀, 술포닐, 술피닐, 티오카르보닐, 티오카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되고; 단, R12, R13 및 R14 모두가 H는 아니고;
R15 및 R16은 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 모노- 및 디-(C1 내지 C20)알킬아미노, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 및 이들의 조합으로 이루어진 군 중에서 선택되거나;
R15 및 R16이 함께 비치환 또는 치환된 3 내지 7원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 또는 황으로 이루어진 군 중에서 선택된다.
바람직한 실시태양에서, R11이 H, 할로, 임의로 치환된 C1 내지 C20 알킬, 또는 임의로 치환된 C1 내지 C20 알콕시인 화학식 III의 화합물을 제공한다.
바람직한 실시태양에서, R12, R13 및 R14가 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C1 내지 C20 알킬티오, 할로, 시아노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히 드라지노, 구아닐릴, 술파밀, 술포닐, 술피닐, 티오카르보닐, 티오카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되고; 단 R12, R13 및 R14 모두가 H는 아닌 화학식 III의 화합물을 제공한다.
바람직한 실시태양에서, R12, R13 및 R14가 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C1 내지 C20 알킬티오, 할로, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 및 이들의 조합으로 이루어진 군 중에서 선택되고; 단 R12, R13 및 R14 모두가 H는 아닌 화학식 III의 화합물을 제공한다.
바람직한 실시태양에서, R15 및 R16이 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C2 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 모노- 및 디-(C1 내지 C20)알킬아미노, 카르바밀, 케토, 카르보닐, 카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되는 화학식 III의 화합물을 제공한다.
바람직한 실시태양에서, R15 및 R16이 함께 비치환 또는 치환된 4 또는 6원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 또는 황으로 이루어진 군 중에서 선택되는 것인 화학식 III의 화합물을 제공한다.
바람직한 실시태양에서, R11이 플루오로이고, R12, R13 및 R14가 개별적으로, H, 알킬, 및 할로로 이루어진 군 중에서 선택되는 화학식 III의 화합물을 제공한다.
본 실시태양은 하기 화학식 IV를 갖는 화합물을 제공한다:
<화학식 IV>
상기 식 중,
R12, R13, R14 및 R17은 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 할로, 시아노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 술파밀, 술포닐, 술피닐, 티오카르보닐, 티오카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되고; 단, R12, R13, R14 및 R17 모두가 H는 아니고;
R15는 H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 모노- 및 디-(C1 내지 C20)알킬아미노, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 및 이들의 조합으로 이루어진 군 중에서 선택되고;
R18은 H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알콕시, 모노- 및 디-(C1 내지 C20)알킬아미노, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 및 이들의 조합으로 이루어진 군 중에서 선택된다.
바람직한 실시태양은 개체에게 유효량의 바람직한 화합물을 포함하는 조성물을 투여하는 것을 포함하는, 개체에서 C형 간염 바이러스 감염을 치료하는 방법을 제공한다.
바람직한 실시태양은 개체에게 유효량의 바람직한 화합물을 포함하는 조성물을 투여하는 것을 포함하는, 개체에서 간 섬유증을 치료하는 방법을 제공한다.
바람직한 실시태양은 개체에게 유효량의 바람직한 화합물을 포함하는 조성물을 투여하는 것을 포함하는, C형 간염 바이러스에 감염된 개체에서 간 기능을 증가시키는 방법을 제공한다.
본 실시태양은 화학식 I-IV의 화합물, 및 그의 염, 에스테르 또는 다른 유도체를 포함하는 조성물, 예를 들어 제약 조성물을 추가로 제공한다. 본 발명의 제약 조성물은 본 발명의 화합물; 및 제약상 허용되는 부형제를 포함한다. 매우 다양한 제약상 허용되는 부형제가 당업계에 공지되어 있으며, 본원에서 상세하게 논의될 필요는 없다. 제약상 허용되는 부형제는 예를 들어 문헌 [A. Gennaro (2000) "Remington: The Science and Practice of Pharmacy," 20th edition, Lippincott, Williams, & Wilkins; Pharmaceutical Dosage Forms and Drug Delivery Systems (1999) H.C. Ansel et al., eds., 7th ed., Lippincott, Williams, & Willcins; 및 Handbook of Pharmaceutical Excipients (2000) A. H. Kibbe et al., eds., 3rd eds. Amer. Pharmaceutical Assoc.]을 비롯한 다양한 간행물들에 충분히 기술되어 있다.
제약상 허용되는 부형제, 예를 들어 비히클, 어쥬번트 (adjuvant), 담체 또는 희석제는 공개적으로 쉽게 이용할 수 있다. 게다가, 제약상 허용되는 보조 물질, 예를 들어 pH 조정제 및 완충제, 등장성 조절제, 안정화제 및 습윤제 등도 공개적으로 쉽게 이용할 수 있다.
많은 실시태양에서, 본 발명의 화합물은 HCV NS3 헬리카제의 효소 활성을 약 50 μM 미만의 IC50으로 억제하는데, 예를 들어 본 발명의 화합물은 HCV NS3 프로테아제를 약 40 μM 미만, 약 25 μM 미만, 약 10 μM 미만, 약 1 μM 미만, 약 100 nM 미만, 약 80 nM 미만, 약 60 nM 미만, 약 50 nM 미만, 약 25 nM 미만, 약 10 nM 미만, 또는 약 1 nM 미만, 또는 그보다 작은 IC50으로 억제한다.
많은 실시태양에서, 본 발명의 화합물은 HCV 바이러스 복제를 억제한다. 예를 들어, 본 발명의 화합물은 HCV 바이러스 복제를 화합물의 부재 하에 HCV 바이러스 복제에 비해 적어도 약 10%, 적어도 약 15%, 적어도 약 20%, 적어도 약 25%, 적어도 약 30%, 적어도 약 40%, 적어도 약 50%, 적어도 약 60%, 적어도 약 70%, 적어도 약 80%, 또는 적어도 약 90% 또는 그 이상으로 억제한다. 본 발명 의 화합물이 HCV 바이러스 복제를 억제하는지 여부는 당업계에 공지된 방법, 예를 들어 시험관내 바이러스 복제 분석을 이용하여 결정할 수 있다.
NS3
헬리카제
HCV는 양성 가닥 RNA 바이러스이다. 감염 시, 그의 게놈 RNA는 바이러스성 및 세포성 단백질에 의해 적어도 10개의 상이한 바이러스 단백질로 처리되는 큰 다중단백질 (polyprotein)을 생산한다. 다른 양성 가닥 RNA 바이러스와 마찬가지로, 양성 가닥의 복제는 음성 가닥 RNA의 초기 합성을 포함한다. 복제 중간체인 상기 음성 가닥 RNA는 자손체 게놈 RNA의 생산을 위한 템플레이트로서 역할을 한다. 상기 공정은 2개 이상의 바이러스 코딩된 효소, 예를 들어 RNA-의존 RNA 폴리머라제 및 RNA 헬리카제에 의해 수행되는 것으로 생각된다. RNA 폴리머라제는 자손체 RNA의 생산을 위해 템플레이트 RNA를 복제한다. 상기 효소는 DNA 템플레이트로부터 RNA 분자를 합성하지 않는다.
RNA 헬리카제는 단일 가닥 RNA 분자 내에 존재하는 2차 구조를 푼다. 헬리카제는 또한 이중체 RNA를 단일 가닥 형태로 푼다. 게놈 HCV RNA 분자는 광범한 2차 구조를 갖는다. HCV RNA의 복제 중간체는 양성 및 음성 가닥 RNA 분자로 이루어지는 이중체 RNA로서 존재하는 것으로 생각된다. RNA 헬리카제의 활성은 템플레이트로서 단일 가닥 RNA 분자를 푸는 것으로 생각되는 RNA 의존 RNA 폴리머라제의 활성을 촉진하는 것으로 생각된다. 따라서, 헬리카제의 생물학적 활성은 HCV 복제에 중요한 것으로 생각된다.
NS3
헬리카제
활성의 조절
NS3 헬리카제는 3개의 도메인: 도메인 1, 도메인 2, 및 도메인 3을 포함하는 약 631개 아미노산 (서열 1)을 포함한다. NS3 헬리카제의 상동성 구조는 실시태양의 일부로서 고려된다. 도메인 1은 서열 1에 표시된 잔기 190 내지 잔기 324까지의 잔기 또는 그의 변이체의 구역을 포함한다. 도메인 2는 서열 1에 표시된 잔기 328 내지 잔기 483까지의 잔기 또는 그의 변이체의 구역을 포함한다. 도메인 1 및 2는 α-나선으로 둘러싸인 평행한 β-시트를 형성한다.
본원에 기재된 화합물 (예를 들어, 화학식 I-IV)은 NS3 헬리카제에 도메인 1 및/또는 도메인 2에서 결합하는 것으로 생각된다. 도메인 1 상에서 NS3 헬리카제에 대한 화합물의 결합은 서열 1에 표시된 잔기 209 내지 221; 잔기 286 내지 288; 잔기 317 내지 319, 및/또는 잔기 214 내지 218 중 하나 이상과의 상호작용을 포함하는 것으로 생각된다.
도메인 2 상에서 NS3 헬리카제에 대한 화합물의 결합은 서열 1에 표시된 잔기 412 내지 423; 잔기 363; 잔기 365; 잔기 406; 잔기 408; 잔기 391; 잔기 397; 잔기 400; 및 잔기 400 내지 404 중 하나 이상과의 상호작용을 포함하는 것으로 생각된다.
상기 설명된 바와 같은 도메인 1 및/또는 도메인 2에서 NS3 헬리카제에 대한 화합물의 결합은 잔기 412 내지 423 중 하나 이상의 이동을 야기할 수 있다. NS3 헬리카제의 추가의 이동이 일어날 수 있다. 화합물의 결합으로 인한 이동(들)은 NS3 헬리카제의 먼 부위에서 핵산 기질의 결합이 억제될 수 있도록 NS3 헬리카제의 알로스테리 (allosteric) 이동을 일으킬 수 있다. 바람직한 실시태양에서, 핵산 기질은 DNA 또는 RNA이다. 핵산 기질 결합을 억제함으로써, NS3 헬리카제의 활성이 조절될 수 있다. 바람직한 실시태양에서, NS3 헬리카제 활성의 조절은 NS3 헬리카제 활성의 억제이다. 바람직한 실시태양에서, 조절되는 NS3 헬리카제 활성은 HCV의 복제이다. NS3 헬리카제 활성의 조절은 생체 내에서 또는 생체 외에서 일어날 수 있다.
실시태양은 화합물과 NS3 헬리카제의 결합이 용이하도록 구성된 관능기를 적어도 하나 포함하는 화합물을 제공하고, 상기 결합은 NS3 헬리카제 활성을 조절하기에 (예를 들어, 억제하기에) 효과적이다. 화학식 I-IV의 화합물은 상기한 구성의 관능기를 포함하는 화합물의 예이다. 예를 들어, 화합물은 상기 표 1 및 표 2에 기재된 I-1 내지 I-183 또는 II-1 내지 II-82 중 임의의 하나 이상의 화합물일 수 있다. 한 실시태양에서, 결합은 NS3 헬리카제에 의한 핵산 기질 (예를 들어, DNA 및/또는 RNA)의 풀림 억제에 효과적이다. 결합은 NS3 헬리카제의 알로스테리 이동을 용이하게 할 수 있어서, NS3 헬리카제 활성을 조절한다. 관능기는 NS3 헬리카제 도메인 1, 예를 들어, NS3 헬리카제 도메인 1의 하나 이상의 잔기와 화합물의 결합이 용이하도록 구성된다. 예를 들어, 잔기는 잔기 209 내지 221, 잔기 286 내지 288, 잔기 317 내지 319, 또는 잔기 214 내지 218 중 어느 한 잔기일 수 있다. 또다른 실시태양에서, 관능기는 NS3 헬리카제 도메인 2, 예를 들어, NS3 헬리카제 도메인 2 내의 하나 이상의 잔기와 화합물의 결합이 용이하도록 구성된다. 예를 들어, 잔기는 잔기 412 내지 423, 잔기 363, 잔기 365, 잔기 406, 잔기 408, 잔기 391, 잔기 397, 잔기 400, 또는 잔기 400 내지 404 중 어느 한 잔기일 수 있 다.
또다른 실시태양은 화합물 및 제약상 허용되는 담체를 포함하는 제약 조성물을 제공하고, 여기서 화합물은 화합물과 NS3 헬리카제의 결합이 용이하도록 구성된 관능기를 적어도 하나 포함하고, 상기 결합은 상기한 바와 같이 NS3 헬리카제 활성을 조절하기에 효과적이다. 예를 들어, 조성물 내의 화합물은 화학식 I-IV의 화합물일 수 있고, 따라서 하기 표 1 및 표 2에 기재된 화합물 I-1 내지 I-183 또는 II-1 내지 II-82 중 임의의 하나 이상의 화합물일 수 있다.
또다른 실시태양은 NS3 단백질을 화합물 또는 화합물을 포함하는 조성물과 접촉시키는 것을 포함하는 NS3 헬리카제 활성을 조절하는 방법을 제공하고, 여기서 화합물은, 화합물과 NS3 헬리카제의 결합이 용이하도록 구성된 관능기를 적어도 하나 포함하고, 상기 결합은 상기한 바와 같이 NS3 헬리카제 활성을 조절하기에 효과적이다. 접촉은 생체 외에서 또는 생체 내에서 일어날 수 있다. 생체내의 경우에, 접촉은 인체 내에서 일어날 수 있다. 한 실시태양에서, 방법은 본원에 개시된 의학적 병태 또는 질환, 예를 들어, 간 질환 또는 병태, 예를 들어 HCV에 걸린 사람을 확인하는 것을 포함한다.
간염 바이러스 감염 치료
본원에 기재된 방법 및 조성물은 일반적으로 HCV 감염 치료에서 유용하다.
본 발명의 방법이 HCV 감염을 치료하는데 효과적인지의 여부는 바이러스 로드 (load)의 감소, 혈청전환에 대한 시간 감소 (환자 혈청에서 검출가능하지 않은 바이러스), 요법에 대한 지속된 바이러스 반응 속도의 증가, 임상 결과에서 이환율 또는 사망율의 감소, 또는 질병 반응의 다른 표시자에 의해 결정할 수 있다.
일반적으로, 유효량의 화학식 I-IV의 화합물, 및 임의로 하나 이상의 추가의 항바이러스제의 유효량이란 바이러스 로드를 감소시키거나 요법에 대한 지속된 바이러스 반응을 달성하는데 효과적인 양이다.
본 발명의 방법이 HCV 감염을 치료하는데 효과적인지의 여부는 바이러스 로드를 측정하거나 또는 간 섬유증을 포함하지만 이에 제한되지 않는 HCV 감염과 관련된 파라미터, 혈청 트랜스아미나제 수준의 상승, 및 간에서의 괴사염증 활성을 측정함으로써 결정할 수 있다. 간 섬유증의 표시자는 아래에 상세하게 논의된다.
방법은 유효량의 화학식 I-IV의 화합물을, 임의로 유효량의 하나 이상의 추가의 항바이러스제와 조합하여 투여하는 것을 포함한다. 일부 실시태양에서, 화학식 I-IV의 화합물, 및 임의로 하나 이상의 추가의 항바이러스제의 유효량은 바이러스 역가를 검출가능하지 않은 수준, 예를 들어 혈청 mL 당 게놈 카피수 약 1000 내지 약 5000, 약 500 내지 약 1000, 또는 약 100 내지 약 500으로 감소시키는데 효과적인 양이다. 일부 실시태양에서, 화학식 I-IV의 화합물 및 임의로 하나 이상의 추가의 항바이러스제의 유효량은 바이러스 로드를 혈청 mL 당 게놈 카피수 100 미만으로 감소시키는데 효과적인 양이다.
일부 실시태양에서, 화학식 I-IV의 화합물, 및 임의로 하나 이상의 추가의 항바이러스제의 유효량은 개체의 혈청에서 바이러스 역가의 1.5-로그, 2-로그, 2.5-로그, 3-로그, 3.5-로그, 4-로그, 4.5-로그, 또는 5-로그 감소를 달성하는데 효과적인 양이다.
많은 실시태양에서, 화학식 I-IV의 화합물 및 임의로 하나 이상의 추가의 항바이러스제의 유효량은 지속된 바이러스 반응을 달성하는데 효과적인 양이며, 예를 들어, 요법 중단 후 적어도 약 1 개월, 적어도 약 2 개월, 적어도 약 3 개월, 적어도 약 4 개월, 적어도 약 5 개월, 또는 적어도 약 6 개월의 기간 동안 환자의 혈청에서 검출가능한 HCV RNA가 발견되지 않거나 실질적으로 발견되지 않는다 (예를 들어, 혈청 mL 당 게놈 카피수는 약 500 미만, 약 400 미만, 약 200 미만 또는 약 100 미만임).
상기 언급한 바와 같이, 본 발명의 방법이 HCV 감염을 치료하는데 효과적인지의 여부는 간 섬유증과 같은 HCV 감염과 관련된 파라미터를 측정함으로써 결정할 수 있다. 간 섬유증의 정도를 측정하는 방법은 아래에 상세하게 논의되어 있다. 일부 실시태양에서, 간 섬유증의 혈청 마커 수준은 간 섬유증의 정도를 나타낸다.
하나의 비제한적 예로서, 혈청 알라닌 아미노트랜스퍼라제 (ALT)의 수준은 표준 분석을 이용해서 측정한다. 일반적으로, 약 45 국제 단위 (international unit) 미만의 ALT 수준은 정상인 것으로 고려된다. 일부 실시태양에서, 화학식 I-IV의 화합물 및 임의로 하나 이상의 추가의 항바이러스제의 유효량은 ALT 수준을 혈청 ml 당 약 45 IU 미만으로 감소시키는데 효과적인 양이다.
화학식 I-IV의 화합물 및 임의로 하나 이상의 추가의 항바이러스제의 치료 유효량은 간 섬유증 마커의 혈청 수준을 비처리 개체에서의 마커 수준 또는 위약 처리 개체에 비해 적어도 약 10%, 적어도 약 20%, 적어도 약 25%, 적어도 약 30%, 적어도 약 35%, 적어도 약 40%, 적어도 약 45%, 적어도 약 50%, 적어도 약 55%, 적어도 약 60%, 적어도 약 65%, 적어도 약 70%, 적어도 약 75%, 또는 적어도 약 80%, 또는 그 이상으로 감소시키는데 효과적인 양이다. 혈청 마커를 측정하는 방법은 주어진 혈청 마커에 대해 특이적인 항체를 사용하는 면역학 기반 방법, 예를 들어 효소-연결된 면역흡착 분석 (ELISA), 방사성 면역 분석 등을 포함한다.
많은 실시태양에서, 화학식 I-IV의 화합물 및 추가의 항바이러스제의 유효량이란 상승작용성 양이다. 본원에 사용된 바와 같이, 화학식 I-IV의 화합물 및 추가의 항바이러스제의 "상승작용성 조합" 또는 "상승작용성 양"은 HCV 감염의 치료 또는 예방 처치에 있어서 (i) 단제요법으로서 동일 투여량으로 투여될 때의 화학식 I-IV의 화합물의 치료 또는 예방 이익 및 (ii) 단제요법으로서 동일 투여량으로 투여될 때 추가의 항바이러스제의 치료 또는 예방 이익의 단순한 상가적 조합으로부터 예견되거나 예상될 수 있는 치료 결과의 증가 개선보다 더 효과적인 조합 투여량이다.
일부 실시태양에서, 선택된 양의 화학식 I-IV의 화합물 및 선택된 양의 추가의 항바이러스제는 질환에 대하여 조합요법으로 사용되는 경우에는 효과적이지만, 선택된 양의 화학식 I-IV의 화합물 및/또는 선택된 양의 추가의 항바이러스제는 질환에 대하여 단제요법으로 사용되는 경우에는 효과적이지 않다. 따라서, 실시태양은 (1) 선택된 양의 추가의 항바이러스제가 질환에 대하여 조합요법으로 사용되는 경우에 선택된 양의 화학식 I-IV의 화합물의 치료 이익을 증대시키며, 선택된 양의 추가의 항바이러스제가 질환에 대하여 단제요법으로 사용되는 경우에 치료 이익을 제공하지 않는 요법, (2) 선택된 양의 화학식 I-IV의 화합물이 질환에 대하여 조합요법으로 사용되는 경우에 선택된 양의 추가의 항바이러스제의 치료 이익을 증대시키며, 선택된 양의 화학식 I-IV의 화합물이 질환에 대하여 단제요법으로 사용되는 경우에 치료 이익을 제공하지 않는 요법, 및 (3) 선택된 양의 화학식 I-IV의 화합물 및 선택된 양의 추가의 항바이러스제가 질환에 대하여 조합요법으로 사용되는 경우에 치료 이익을 제공하며, 선택된 양의 화학식 I-IV의 화합물 및 추가의 항바이러스제 각각은 질환에 대하여 단제요법으로 사용되는 경우에 치료 이익을 제공하지 않는 요법을 포함한다. 본원에 사용된 바와 같이, 화학식 I-IV의 화합물 및 추가의 항바이러스제 및 그의 문법적 균등물의 "상승작용성 유효량"은 상기 (1) 내지 (3) 중 어떤 것에 의해 포함되는 임의의 요법을 포함하는 것으로 이해될 것이다.
섬유증
실시태양은 일반적으로 치료량의 화학식 I-IV의 화합물, 및 임의로 하나 이상의 추가의 항바이러스제를 투여하는 것을 포함하는, 간 섬유증 (HCV 감염으로 인한 또는 그와 관련된 간 섬유증 형태 포함)의 치료 방법을 제공한다. 하나 이상의 추가의 항바이러스제의 존재 또는 부재 하의 화학식 I-IV의 화합물의 유효량, 및 투여 요법은 이후 논의되는 바와 같다.
화학식 I-IV의 화합물, 및 임의로 하나 이상의 추가의 항바이러스제를 이용하는 치료가 간 섬유증을 감소시키는데 효과적인지의 여부는, 간 섬유증 및 간 기능을 측정하는 널리 정립된 임의의 많은 기술에 의해 결정된다. 간 섬유증 감소는 간 생검 샘플을 분석함으로써 측정된다. 간 생검의 분석은 2가지 주요 요소, 즉 심도 및 진행중인 질환 활성의 척도로서 "등급 (grade)"에 의해 평가되는 괴사성 염증, 및 장기간의 질환 진행을 반영하는 "기 (stage)"로서 평가되는 섬유증 및 실질 또는 혈관 리모델링의 병변에 대한 평가를 포함한다 (예를 들어, 문헌 [Brunt (2000) Hepatol. 31:241-246] 및 [METAVIR (1994) Hepatology 20:15-20] 참조). 간 생검의 분석을 기초로 하여, 점수를 매긴다. 섬유증의 정도 및 심도를 정량적으로 평가하는 많은 표준화된 점수 시스템이 있다. 그 예로는 METAVIR, 크노델 (Knodell), 쇼이어 (Scheuer), 루드빅 (Ludwig) 및 이샤크 (Ishak) 점수 시스템이 있다.
METAVIR 점수 시스템은 섬유증 (문맥 섬유증, 중심소엽성 섬유증, 및 경화증); 괴사 (단편성 및 소엽성 괴사, 호산성 수축, 및 풍선 (ballooning) 변성); 염증 (문맥관 염증, 문맥 림프성 응집, 및 문맥 염증의 분포); 담관 변화; 및 크노델 지수 (문맥 주위 괴사, 소엽성 괴사, 문맥 염증, 섬유증, 및 총 질환 활성의 점수)를 비롯한 간 생검의 다양한 특성 분석을 기초로 한다. METAVIR 시스템에서 각 기의 정의는 다음과 같다: 점수 0: 섬유증 없음; 점수 1: 문맥관의 성상 비대, 그러나 중격 형성은 없음; 점수 2: 문맥관의 비대, 중격 형성이 드물게 있음; 점수 3: 경화증 없이 수많은 중격; 및 점수 4: 경화증.
간염 활성 지수로도 지칭되는 크노델 점수 시스템은 하기 4가지 부류의 조직학적 특징의 점수를 기초로 하여 시편을 분류한다: I. 문맥 주위 및/또는 가교성 괴사; II. 소엽내 분해 및 국소적 괴사; III. 문맥 염증; 및 IV. 섬유증. 크노델 단계 시스템에서는, 점수가 다음과 같다: 점수 0: 섬유증 없음; 점수 1: 가벼운 섬 유증 (섬유성 문맥 팽창); 점수 2: 중간 정도의 섬유증; 점수 3: 중증의 섬유증 (가교성 섬유증); 및 점수 4: 경화증. 점수가 높을수록 간 조직의 손상이 더욱 심각하다 (문헌 [Knodell (1981) Hepatol. 1:431]).
쇼이어 점수 시스템에서는, 점수가 다음과 같다: 점수 0: 섬유증 없음; 점수 1: 비대된 섬유증 문맥관; 점수 2: 문맥 주위 또는 문맥-문맥 중격, 그러나 구조는 손상되지 않음; 점수 3: 구조가 붕괴된 섬유증, 그러나 명백한 경화증은 아님; 점수 4: 가능한 또는 명백한 경화증 (문헌 [Scheuer (1991) J. Hepatol. 13: 372] 참조).
이샤크 점수 시스템은 문헌 [Ishak (1995) J. Hepatol. 22: 696-699]에 기재되어 있다. 기 0: 섬유증 없음; 기 1: 일부 문맥 영역의 섬유성 팽창, 짧은 섬유성 중격이 있거나 없음; 기 2: 대부분의 문맥 영역에서 섬유성 팽창, 짧은 섬유성 중격이 있거나 없음; 기 3: 대부분의 문맥 영역에서 섬유성 팽창, 때때로 문맥-문맥 (P-P) 가교; 기 4: 문맥 영역에서 섬유성 팽창, 현저한 가교 (P-P), 및 문맥-중심 (P-C) 가교; 기 5: 현저한 가교 (P-P 및/또는) P-C), 때때로 결절 (불완전한 경화증); 기 6: 가능한 또는 명백한 경화증.
항-섬유증 치료 요법의 잇점은 또한 혈청 빌리루빈 수준, 혈청 알부민 수준, 프로트롬빈 시간, 복수의 존재 및 심도, 및 뇌병증의 존재 및 심도에서의 비정상을 기준으로 하는 다중 성분 포인트 시스템을 포함하는 차일드-퓨 (Child-Pugh) 점수 시스템을 이용하여 측정되고 평가될 수 있다. 상기 파라미터의 이상의 존재 및 심도를 기초로 하여, 환자는 임상 질환의 심도가 증가하는 3개의 카테고리, 즉 A, B, 또는 C 중 하나로 분류될 수 있다.
일부 실시태양에서, 화학식 I-IV의 화합물, 및 임의로 하나 이상의 추가의 항바이러스제의 치료 유효량은 치료요법 전후의 간 생검을 기준으로 하여 섬유증 기에서 한 단위 이상의 변화를 달성하는 양이다. 특정 실시태양에서, 화학식 I-IV의 화합물, 및 임의로 하나 이상의 추가의 항바이러스제의 치료 유효량은 METAVIR, 크노델, 쇼이어, 루드빅 또는 이샤크 점수 시스템에서 간 섬유증을 적어도 한 단위 감소시킨다.
간 기능의 이차적인 또는 간접적인 지수를 이용하여 화학식 I-IV의 화합물을 사용하는 치료의 효능을 평가할 수도 있다. 콜라겐의 특이적 염색 및/또는 간 섬유증의 혈청 마커를 기준으로 한 간 섬유증의 정량적인 정도의 형태계측학적 컴퓨터화 반자동식 평가도 본 발명의 치료 방법의 효능의 척도로서 측정될 수 있다. 간 기능의 이차적인 지수로는 혈청 트랜스아미나제 수준, 프로트롬빈 시간, 빌리루빈, 혈소판 개수, 문맥압, 알부민 수준, 및 차일드-퓨 점수의 평가를 포함하지만 이에 제한되지 않는다.
화학식 I-IV의 화합물, 및 임의로 하나 이상의 추가의 항바이러스제의 유효량은 비처리된 개체 또는 위약 처리된 개체에서의 간 기능 지수에 비해 간 기능 지수를 적어도 약 10%, 적어도 약 20%, 적어도 약 25%, 적어도 약 30%, 적어도 약 35%, 적어도 약 40%, 적어도 약 45%, 적어도 약 50%, 적어도 약 55%, 적어도 약 60%, 적어도 약 65%, 적어도 약 70%, 적어도 약 75%, 또는 적어도 약 80%, 또는 이보다 더 크게 증가시키는데 효과적인 양이다. 당업자라면 이러한 간 기능 지수를 표준 분석 방법을 이용하여 용이하게 측정할 수 있으며, 그러한 여러 분석 방법은 상업적으로 입수가능하고, 임상적으로 일반적으로 이용된다.
간 섬유증의 혈청 마커가 또한 본 발명의 치료 방법의 효능의 척도로서 측정될 수 있다. 간 섬유증의 혈청 마커로는 히알루로네이트, N-말단 프로콜라겐 III 펩티드, 제IV형 콜라겐의 7S 도메인, C-말단 프로콜라겐 I 펩티드, 및 라미닌이 있고 이로 제한되지 않는다. 간 섬유증의 추가의 생화학적 마커로는 α-2-마크로글로불린, 합토글로빈, 감마 글로빈, 아포지단백질 A, 및 감마 글루타밀 트랜스펩티다제가 있다.
화학식 I-IV의 화합물, 및 임의로 하나 이상의 추가의 항바이러스제의 치료 유효량은 비처리된 개체 또는 위약 처리된 개체에서의 간 섬유증 마커의 혈청 수준에 비해 상기 마커 수준을 적어도 약 10%, 적어도 약 20%, 적어도 약 25%, 적어도 약 30%, 적어도 약 35%, 적어도 약 40%, 적어도 약 45%, 적어도 약 50%, 적어도 약 55%, 적어도 약 60%, 적어도 약 65%, 적어도 약 70%, 적어도 약 75%, 또는 적어도 약 80%, 또는 이보다 더 크게 감소시키는데 효과적인 양이다. 당업자라면 이러한 간 섬유증의 혈청 마커를 표준 분석 방법을 이용하여 용이하게 측정할 수 있으며, 그러한 많은 분석 방법은 상업적으로 입수가능하고, 임상적으로 일반적으로 이용된다. 혈청 마커를 측정하는 방법으로는 주어진 혈청 마커에 대해 특이적인 항체를 이용하는 면역학 기반 방법, 예를 들어 효소-연결된 면역흡착 분석 (ELISA), 방사성 면역 분석 등을 포함한다.
인터페론 수용체 작용제 및 피르페니돈 (또는 피르페니돈 유사체)를 사용하 는 치료의 효능을 평가하기 위해 간 기능 보유에 대한 정량적인 시험을 또한 이용할 수 있다. 그 예로는 인도시아닌 그린 (ICG) 청소율, 갈락토스 제거 용적 (GEC), 아미노피린 호흡 검사 (ABT), 안티피린 청소율, 모노에틸글리신-자일리디드 (MEG-X) 청소율, 및 카페인 청소율이 있다.
본원에 사용된 "간 경화증과 관련된 합병증"은 비대상성 (decompensated) 간 질환의 후유증, 즉, 간 섬유증의 발병 이후에 그 결과로서 발생하는 장애를 나타내며, 그 예로는 복수 발생, 정맥류 출혈, 문맥 고혈압, 황달, 진행성 간 기능 부전, 뇌병증, 간세포암종, 간 이식을 요하는 간 기능 부전, 및 간 관련 사망이 있으나 이로 제한되지 않는다.
화학식 I-IV의 화합물, 및 임의로 하나 이상의 추가의 항바이러스제의 치료 유효량은 비처리된 개체 또는 위약-처리된 개체에 비해 간 경화증과 관련된 질환의 발병율 (예를 들어 개체가 병에 걸릴 가능성)을 적어도 약 10%, 적어도 약 20%, 적어도 약 25%, 적어도 약 30%, 적어도 약 35%, 적어도 약 40%, 적어도 약 45%, 적어도 약 50%, 적어도 약 55%, 적어도 약 60%, 적어도 약 65%, 적어도 약 70%, 적어도 약 75%, 또는 적어도 약 80%, 또는 이보다 더 크게 감소시키는데 효과적인 양이다.
화학식 I-IV의 화합물, 및 임의로 하나 이상의 추가의 항바이러스제를 이용하는 치료가 간 경화증과 관련된 질환의 발병율을 감소시키는데 효과적인지의 여부는 당업자에 의해 용이하게 측정될 수 있다.
간 섬유증의 감소는 간 기능을 증진시킨다. 따라서, 실시태양은 일반적으로 치료 유효량의 화학식 I-IV의 화합물, 및 임의로 하나 이상의 추가의 항바이러스제를 투여하는 것을 수반하는 간 기능을 증진시키는 방법을 제공한다. 간 기능은 단백질, 예를 들어 혈청 단백질 (예, 알부민, 응고 인자, 알칼리 포스파타제, 아미노트랜스퍼라제 (예, 알라닌 트랜스아미나제, 아스파르테이트 트랜스아미나제), 5'-뉴클레오시다제, γ-글루타미닐 트랜스펩티다제 등)의 합성, 빌리루빈의 합성, 콜레스테롤의 합성, 및 담즙산의 합성; 탄수화물 대사, 아미노산 및 암모니아 대사, 호르몬 대사 및 지질 대사를 포함하지만 이에 제한되지 않는 간 대사 기능; 외인성 약물의 해독; 및 내장 및 문맥 혈류역학을 비롯한 혈류역학적 기능 등을 포함하지만 이에 제한되지 않는다.
간 기능이 증가되는지의 여부는 잘 확립된 간 기능 검사를 이용하여 당업자가 용이하게 평가할 수 있다. 따라서, 간 기능 마커, 예컨대 알부민, 알칼리 포스파타제, 알라닌 트랜스아미나제, 아스파르테이트 트랜스아미나제, 빌리루빈 등의 합성은 표준 면역학적 및 효소 분석을 이용하여 혈청 중 상기 마커의 수준을 측정함으로써 평가될 수 있다. 내장 순환 및 문맥 혈류역학은 표준 방법을 이용하여 문맥 쐐기압 및/또는 저항에 의해 측정될 수 있다. 대사 기능은 혈청 중 암모니아 수준을 측정함으로써 측정될 수 있다.
간에서 정상적으로 분비된 혈청 단백질이 정상 범위에 있는지의 여부는 표준 면역학적 및 효소 분석을 이용하여 상기 단백질의 수준을 측정함으로써 결정될 수 있다. 당업자는 상기 혈청 단백질의 정상 수준을 알고 있다. 비제한적인 예를 아래에 제시한다. 알라닌 트랜스아미나제의 정상 수준은 약 45 IU /㎖ 혈청이다. 아스파르테이트 트랜스아미나제의 정상 범위는 약 5 내지 약 40 유닛/ℓ 혈청이다. 빌리루빈은 표준 분석에 의해 측정된다. 정상 빌리루빈 수준은 보통 약 1.2 mg/dL 미만이다. 혈청 알부민 수준은 표준 분석에 의해 측정된다. 혈청 알부민의 정상 수준은 약 35 내지 약 55 g/L이다. 프로트롬빈 시간의 연장은 표준 분석에 의해 측정된다. 정상 프로트롬빈 시간은 대조군보다 약 4초 미만까지 더 길다.
화학식 I-IV의 화합물, 및 임의로 하나 이상의 추가의 항바이러스제의 치료 유효량은 간 기능을 적어도 약 10%, 적어도 약 20%, 적어도 약 30%, 적어도 약 40%, 적어도 약 50%, 적어도 약 60%, 적어도 약 70%, 적어도 약 80%, 또는 이보다 더 크게 증가시키는데 효과적인 양이다. 예를 들어, 화학식 I-IV의 화합물, 및 임의로 하나 이상의 추가의 항바이러스제의 치료 유효량은 간 기능의 혈청 마커의 상승된 수준을 적어도 약 10%, 적어도 약 20%, 적어도 약 30%, 적어도 약 40%, 적어도 약 50%, 적어도 약 60%, 적어도 약 70%, 적어도 약 80%, 또는 이보다 더 크게 감소시키는데, 또는 간 기능의 혈청 마커의 수준을 정상 범위 내로 감소시키는데 효과적인 양이다. 화학식 I-IV의 화합물, 및 임의로 하나 이상의 추가의 항바이러스제의 치료 유효량은 또한 간 기능의 혈청 마커의 감소된 수준을 적어도 약 10%, 적어도 약 20%, 적어도 약 30%, 적어도 약 40%, 적어도 약 50%, 적어도 약 60%, 적어도 약 70%, 적어도 약 80%, 또는 이보다 더 크게 증가시키는데, 또는 간 기능의 혈청 마커의 수준을 정상 범위 내로 증가시키는데 효과적인 양이다.
투여량, 제형, 및 투여 경로
본 발명의 방법에서, 활성제(들) (예, 화학식 I-IV의 화합물, 및 임의로 하나 이상의 추가의 항바이러스제)는 목적하는 치료 효과를 달성할 수 있는 임의의 편리한 수단을 이용하여 숙주에게 투여될 수 있다. 따라서, 활성제는 치료 투여를 위한 다양한 제제에 혼입될 수 있다. 보다 특히, 실시태양의 작용제는 적절한 제약상 허용되는 담체 또는 희석제와 조합함으로써 제약 조성물로 제제화될 수 있고, 고체, 반고체, 액체 또는 기체 형태의 제제, 예컨대 정제, 캡슐, 분말, 과립, 연고, 용액, 좌약, 주사제, 흡입제 및 에어로졸로 제제화될 수 있다.
제제
상기 논의된 활성제(들)는 널리 공지된 시약 및 방법을 이용하여 제제화될 수 있다. 조성물은 제약상 허용되는 부형제(들)와 함께 제제화될 수 있다. 매우 다양한 제약상 허용되는 부형제가 당업계에 공지되어 있으므로, 본원에서 상세하게 논의될 필요는 없다. 제약상 허용되는 부형제는 다양한 간행물, 예를 들어 문헌 [A. Gennaro (2000) "Remington: The Science and Practice of Pharmacy," 20th edition, Lippincott, Williams, & Wilkins], [Pharmaceutical Dosage Forms and Drug Delivery Systems (1999) H.C. Ansel et al., eds., 7th ed., Lippincott, Williams, & Wilkins] 및 [Handbook of Pharmaceutical Excipients (2000) A.H. Kibbe et al., eds., 3rd ed. Amer. Pharmaceutical Assoc.]에 충분히 기재되어 있다.
제약상 허용되는 부형제, 예컨대 비히클, 어쥬번트, 담체 또는 희석제는 공 개적으로 용이하게 입수가능하다. 또한, 제약상 허용되는 보조 물질, 예컨대 pH 조정제 및 완충제, 등장성 조절제, 안정화제, 습윤제 등 또한 대중적으로 용이하게 입수가능하다.
일부 실시태양에서, 제제는 수성 완충액 중에서 제제화된다. 적합한 수성 완충액으로는 5 mM 내지 100 mM의 다양한 농도의 아세테이트, 숙시네이트, 시트레이트 및 포스페이트 완충액을 들 수 있고 이로 제한되지 않는다. 일부 실시태양에서, 수성 완충액은 등장성 용액을 제공하는 시약을 포함한다. 이러한 시약으로는 염화나트륨 및 당, 예를 들어 만니톨, 덱스트로스, 수크로스 등이 있고 이로 제한되지 않는다. 일부 실시태양에서, 수성 완충액은 비-이온성 계면활성제, 예컨대 폴리소르베이트 20 또는 80을 추가로 포함한다. 임의로, 제제는 보존제를 더 포함할 수 있다. 적합한 보존제로는 벤질 알콜, 페놀, 클로로부탄올, 벤즈알코늄 클로라이드 등이 있고 이로 제한되지 않는다. 여러 경우, 제제는 약 4℃에서 저장된다. 제제는 또한 동결건조될 수 있으며, 이 경우에는 일반적으로 동결보호제, 예컨대 수크로스, 트레할로스, 락토스, 말토스, 만니톨 등을 포함한다. 동결건조 제제는 심지어 주위 온도에서도 장기간 동안 저장될 수 있다.
따라서, 활성제의 투여는 경구, 구강, 직장, 비경구, 복강내, 피내, 피하, 근육내, 경피, 기관내 투여 등의 다양한 방식으로 이루어질 수 있다. 다수의 실시태양에서, 투여는 볼러스 주사, 예를 들어 피하 볼러스 주사, 근육내 볼러스 주사 등에 의해 이루어질 수 있다.
본 발명의 제약 조성물은 경구, 비경구 또는 이식된 저장소를 통해 투여될 수 있다. 경구 투여 또는 주사 투여가 바람직하다.
한 실시태양의 제약 조성물의 피하 투여는 표준 방법 및 장치, 예를 들어 주사기, 피하 주사 포트 전달 시스템 등을 이용하여 이루어질 수 있다. 예를 들어, 미국 특허 3,547,119, 4,755,173, 4,531,937, 4,311,137 및 6,017,328을 참조한다. 피하 주사 포트와 상기 포트를 통해 환자에게 본 실시태양의 제약 조성물을 투여하기 위한 장치의 조합은 본원에서 "피하 주사 포트 전달 시스템"으로 지칭된다. 다수의 실시태양에서, 피하 투여는 주사기에 의한 볼러스 전달에 의해 이루어진다.
제약 투여 형태에서, 활성제는 그들의 제약상 허용되는 염 형태로 투여될 수 있거나, 또한 단독으로 또는 다른 제약 활성 화합물과 적절하게 회합되거나 조합되어 투여될 수 있다. 하기 방법 및 부형제는 단지 예시적인 것이며, 어떠한 방식으로도 본 발명을 제한하지 않는다.
경구용 제제의 경우, 활성제는 단독으로, 또는 정제, 분말, 과립 또는 캡슐을 만드는 적절한 첨가제, 예를 들어 통상적인 첨가제, 예컨대 락토스, 만니톨, 옥수수 전분 또는 감자 전분; 결합제, 예컨대 결정질 셀룰로스, 셀룰로스 유도체, 아카시아, 옥수수 전분 또는 젤라틴; 붕해제, 예컨대 옥수수 전분, 감자 전분 또는 나트륨 카르복시메틸셀룰로스; 윤활제, 예컨대 활석 또는 스테아르산마그네슘; 및 경우에 따라, 희석제, 완충제, 보습제, 보존제 및 향미제와의 조합물로서 투여될 수 있다.
활성제는 수성 또는 비수성 용매, 예컨대 식물성 오일 또는 다른 유사한 오일, 합성 지방산 글리세리드, 고급 지방산의 에스테르 또는 프로필렌 글리콜 중에, 경우에 따라, 통상적인 첨가제, 예컨대 가용화제, 등장화제, 현탁화제, 유화제, 안정화제 및 보존제와 함께 용해, 현탁 또는 유화시킴으로써 주사용 제제로 제제화될 수 있다.
또한, 활성제는 다양한 베이스, 예컨대 유화 베이스 또는 수용성 베이스와 혼합함으로써 좌약으로 제조될 수 있다. 본 발명의 화합물은 좌약을 통해 직장으로 투여될 수 있다. 좌약은 체온에서는 용융되나 실온에서는 고화되는 비히클, 예컨대 코코아 버터, 카르보왁스 및 폴리에틸렌 글리콜을 포함할 수 있다.
경구 또는 직장 투여를 위한 단위 투여 형태, 예컨대 시럽, 엘릭시르 및 현탁액은, 티스푼 양, 테이블스푼 양, 정제 또는 좌약과 같은 각각의 투여 단위가 하나 이상의 억제제를 함유하는 소정량의 조성물을 함유하도록 제공될 수 있다. 마찬가지로, 주사 또는 정맥내 투여를 위한 단위 투여 형태는 멸균수, 보통 염수 또는 또다른 제약상 허용되는 담체 중의 용액으로서 조성물 중에 억제제(들)를 포함할 수 있다.
본원에서 사용되는 용어 "단위 투여 형태"는 인간 및 동물 대상에 대한 단위 투여에 적합한 물리적으로 구별된 단위를 나타내며, 각각의 단위는 제약상 허용되는 희석제, 담체 또는 비히클과 함께 목적하는 효과를 제공하기에 충분한 양으로 계산된 소정량의 본 발명의 화합물을 함유한다. 본 발명의 신규 단위 투여 형태에 대한 구체적인 사항은 사용되는 특정 화합물, 달성하고자 하는 효과, 및 숙주에서 각 화합물과 관련된 약동학에 따라 달라진다.
비히클, 어쥬번트, 담체 또는 희석제와 같은 제약상 허용되는 부형제는 공중 에게 용이하게 이용가능하다. 더욱이, pH 조정제 및 완충제, 등장성 조절제, 안정화제, 습윤제 등과 같은 제약상 허용되는 보조 물질은 공중에게 이용가능하다.
다른 항바이러스제 또는
항섬유증제와의
동시투여
본 발명의 방법은 일부 실시태양에서 화학식 I-IV의 화합물인 NS3 억제제 및 임의로 하나 이상의 추가의 항바이러스제(들)을 투여함으로써 수행될 것이다.
일부 실시태양에서, 방법은 하나 이상의 인터페론 수용체 작용제(들)의 투여를 추가로 포함한다. 다른 실시태양에서, 상기 방법은 피르페니돈 또는 피르페니돈 유사체의 투여를 추가로 포함한다.
조합 요법에 사용하기 적합한 추가의 항바이러스제는 뉴클레오티드 및 뉴클레오시드 유사체를 포함하지만 이에 제한되지 않는다. 비제한적인 예는 아지도티미딘 (AZT) (지도부딘), 및 그의 유사체 및 유도체; 2',3'-디데옥시이노신 (DDI) (디다노신), 및 그의 유사체 및 유도체; 2',3'-디데옥시시티딘 (DDC) (디데옥시시티딘), 및 그의 유사체 및 유도체; 2',3'-디데히드로-2',3'-디데옥시티미딘 (D4T) (스타부딘), 및 그의 유사체 및 유도체; 콤비비르; 아바카비르; 아데포비르 디폭실; 시도포비르; 리바비린; 리바비린 유사체 등을 포함한다.
일부 실시태양에서, 방법은 리바비린의 투여를 추가로 포함한다. 리바비린, 즉, 1-β-D-리보푸라노실-1H-1,2,4-트리아졸-3-카르복사미드 (아이씨엔 파마슈티칼스, 인크. (ICN Pharmaceuticals, Inc., 미국 캘리포니아주 코스타 메사)로부터 입수가능함)는 문헌 [Merck Index, compound No. 8199, Eleventh Edition]에 기재되어 있다. 그의 제조 및 제제화는 미국 특허 4,211,771에 기재되어 있다. 일부 실 시태양은 또한 리바비린 유도체의 사용을 포함한다 (예를 들어, 미국 특허 6,277,830 참조). 리바비린은 캡슐 또는 정제 형태로 경구로, 또는 인터페론 수용체 작용제와 동일하거나 상이한 투여형으로 동일하거나 상이한 경로로 투여될 수 있다. 물론, 비내 스프레이에 의해, 경피로, 정맥 내로, 좌약에 의해, 서방 투여 형태 등과 같은, 시판되는 두 의약의 다른 투여 방식이 고려된다. 활성 성분을 파괴하지 않으면서 적절한 투여량이 전달되는 한 어떠한 형태의 투여도 가능할 것이다.
일부 실시태양에서, NS3 억제제 화합물 치료의 전체 과정 동안 추가의 항바이러스제가 투여된다. 다른 실시태양에서, 추가의 항바이러스제는 NS3 억제제 화합물 치료와 중복되는 기간 동안 투여되고, 예를 들어, 추가의 항바이러스제 치료는 NS3 억제제 화합물 치료가 시작하기 전에 시작하고, NS3 억제제 화합물 치료가 끝나기 전에 끝날 수 있거나; 추가의 항바이러스제 치료는 NS3 억제제 화합물 치료가 시작한 후에 시작하고, NS3 억제제 화합물 치료가 끝난 후에 끝날 수 있거나; 추가의 항바이러스제 치료는 NS3 억제제 화합물 치료가 시작한 후 시작하고, NS3 억제제 화합물 치료가 끝나기 전에 끝날 수 있거나; 추가의 항바이러스제 치료는 NS3 억제제 화합물 치료가 시작하기 전에 시작하고, NS3 억제제 화합물 치료가 끝난 후에 끝날 수 있다.
치료 방법
단일 요법
본원에 기재된 NS3 억제제 화합물은 HCV 질환에 대한 급성 또는 만성 요법에 서 사용될 수 있다. 많은 실시태양에서, NS3 억제제 화합물은 약 1일 내지 약 7일, 또는 약 1주 내지 약 2주, 또는 약 2주 내지 약 3주, 또는 약 3주 내지 약 4주, 또는 약 1개월 내지 약 2개월, 또는 약 3개월 내지 약 4개월, 또는 약 4개월 내지 약 6개월, 또는 약 6개월 내지 약 8개월, 또는 약 8개월 내지 약 12개월, 또는 적어도 1년 동안 투여되고, 보다 긴 기간에 걸쳐 투여될 수 있다. NS3 억제제 화합물은 1일 5회, 1일 4회, tid, bid, qd, qod, biw, tiw, qw, qow, 1개월 3회, 또는 1개월 1회 투여될 수 있다. 다른 실시태양에서, NS3 억제제 화합물은 연속 주입으로서 투여된다.
많은 실시태양에서, 실시태양의 NS3 억제제 화합물은 경구로 투여된다.
환자에서 HCV 질환의 치료를 위한 상기한 방법과 관련하여, 본원에 기재된 NS3 억제제 화합물은 약 0.01 mg 내지 약 100 mg/kg 환자 체중/일의 투여량으로 1일 1 내지 5회 분할 용량으로 환자에게 투여될 수 있다. 일부 실시태양에서, NS3 억제제 화합물은 약 0.5 mg 내지 약 75 mg/kg 환자 체중/일의 투여량으로 1일 1 내지 5회 분할 용량으로 투여된다.
담체 물질과 배합되어 투여 형태를 생성할 수 있는 활성 성분의 양은 치료할 숙주 및 특정 투여 방식에 따라 변할 수 있다. 전형적인 제약 제제는 약 5% 내지 약 95% 활성 성분 (w/w)을 함유할 수 있다. 다른 실시태양에서, 제약 제제는 약 20% 내지 약 80% 활성 성분을 함유할 수 있다.
당업자는 용량 수준이 특정 NS3 억제제 화합물, 증상의 심도 및 부작용에 대한 대상의 감수성의 함수로서 변할 수 있음을 쉽게 이해할 것이다. 주어진 NS3 억 제제 화합물에 대한 바람직한 투여량은 다양한 수단에 의해 당업자에 의해 쉽게 결정된다. 바람직한 수단은 주어진 인터페론 수용체 작용제의 생리학상 효능을 측정하는 것이다.
많은 실시태양에서, NS3 억제제 화합물의 다수 용량이 투여된다. 예를 들어, NS3 억제제 화합물은 약 1일 내지 약 1주, 약 2주 내지 약 4주, 약 1개월 내지 약 2개월, 약 2개월 내지 약 4개월, 약 4개월 내지 약 6개월, 약 6개월 내지 약 8개월, 약 8개월 내지 약 1년, 약 1년 내지 약 2년, 또는 약 2년 내지 약 4년, 또는 그 이상의 기간에 걸쳐 1개월 1회, 1개월 2회, 1개월 3회, 격주로 (qow), 1주 1회 (qw), 1주 2회 (biw), 1주 3회 (tiw), 1주 4회, 1주 5회, 1주 6회, 격일로 (qod), 매일 (qd), 1일 2회 (qid), 또는 1일 3회 (tid) 투여된다.
환자 확인
특정 실시태양에서, HCV 환자의 치료에서 사용된 약물 요법의 특정 요법은 환자가 나타내는 특정 질환 파라미터, 예를 들어 초기 바이러스 로드, 환자에서 HCV 감염의 유전자형, 환자에서 간 조직학 및/또는 간 섬유증의 단계에 따라 선택된다.
따라서, 일부 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 치료에 실패한 환자를 48주의 지속기간 동안 치료하도록 변형된다.
다른 실시태양은 HCV에 대한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 비-반응자 환자를 치료하도록 변형되고, 여기서 환자는 48주 치료 과 정을 받는다.
다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 재발병자 환자를 치료하도록 변형되고, 여기서 환자는 48주 치료 과정을 받는다.
다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 HCV 유전자형 1로 감염된 비치료 환자를 치료하도록 변형되고, 여기서 환자는 48주 치료 과정을 받는다.
다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 HCV 유전자형 4로 감염된 비치료 환자를 치료하도록 변형되고, 여기서 환자는 48주 치료 과정을 받는다.
다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 HCV 유전자형 1로 감염된 비치료 환자를 치료하도록 변형되고, 여기서 환자는 높은 바이러스 로드 (HVL)를 갖고, 여기서 "HVL"은 HCV 바이러스 로드가 2 x 106 HCV 게놈 카피/mL 혈청을 초과하는 것을 나타내고, 환자는 48주 치료 과정을 받는다.
하나의 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 (1) 크노델 점수 3 또는 4에 의해 측정된 바와 같은 진행된 또는 중증기 간 섬유증에 걸린 환자를 확인하고, 이어서 (2) 환자에게 본 발명의 방법의 약물 요법을 약 24주 내지 약 60주, 또는 약 30주 내지 약 1년, 또는 약 36주 내지 약 50주, 또는 약 40주 내지 약 48주, 또는 적어도 약 24주, 또는 적어도 약 30주, 또는 적어도 약 36주, 또는 적어도 약 40주, 또는 적어도 약 48주, 또는 적어도 약 60주의 기간 동안 투여하는 단계를 포함하도록 변형된다.
또다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 (1) 크노델 점수 3 또는 4에 의해 측정된 바와 같은 진행된 또는 중증기 간 섬유증에 걸린 환자를 확인하고, 이어서 (2) 환자에게 본 발명의 방법의 약물 요법을 약 40주 내지 약 50주, 또는 약 48주의 기간 동안 투여하는 단계를 포함하도록 변형된다.
또다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 (1) HCV 유전자형 1 감염에 걸리고 초기 바이러스 로드가 2백만 바이러스 게놈 카피/ml 환자 혈청을 초과하는 환자를 확인하고, 이어서 (2) 환자에게 본 발명의 방법의 약물 요법을 약 24주 내지 약 60주, 또는 약 30주 내지 약 1년, 또는 약 36주 내지 약 50주, 또는 약 40주 내지 약 48주, 또는 적어도 약 24주, 또는 적어도 약 30주, 또는 적어도 약 36주, 또는 적어도 약 40주, 또는 적어도 약 48주, 또는 적어도 약 60주의 기간 동안 투여하는 단계를 포함하도록 변형된다.
또다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 (1) HCV 유전자형 1 감염에 걸리고 초기 바이러스 로드가 2백만 바이러스 게놈 카피/ml 환자 혈청을 초과하는 환자를 확인하고, 이어서 (2) 환자에게 본 발명의 방법의 약물 요법을 약 40주 내지 약 50주, 또는 약 48주의 기 간 동안 투여하는 단계를 포함하도록 변형된다.
또다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 (1) HCV 유전자형 1 감염에 걸리고 초기 바이러스 로드가 2백만 바이러스 게놈 카피/ml 환자 혈청을 초과하고, 크노델 점수 0, 1, 또는 2에 의해 측정된 바와 같은 간 섬유증이 없거나 초기 간 섬유증의 환자를 확인하고, 이어서 (2) 환자에게 본 발명의 방법의 약물 요법을 약 24주 내지 약 60주, 또는 약 30주 내지 약 1년, 또는 약 36주 내지 약 50주, 또는 약 40주 내지 약 48주, 또는 적어도 약 24주, 또는 적어도 약 30주, 또는 적어도 약 36주, 또는 적어도 약 40주, 또는 적어도 약 48주, 또는 적어도 약 60주의 기간 동안 투여하는 단계를 포함하도록 변형된다.
또다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 (1) HCV 유전자형 1 감염에 걸리고 초기 바이러스 로드가 2백만 바이러스 게놈 카피/ml 환자 혈청을 초과하고, 크노델 점수 0, 1, 또는 2에 의해 측정된 바와 같은 간 섬유증이 없거나 초기 간 섬유증의 환자를 확인하고, 이어서 (2) 환자에게 본 발명의 방법의 약물 요법을 약 40주 내지 약 50주, 또는 약 48주의 기간 동안 투여하는 단계를 포함하도록 변형된다.
또다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 (1) HCV 유전자형 1 감염에 걸리고 초기 바이러스 로드가 2백만 바이러스 게놈 카피/ml 환자 혈청 이하인 환자를 확인하고, 이어서 (2) 환자에게 본 발명의 방법의 약물 요법을 약 20주 내지 약 50주, 또는 약 24주 내지 약 48주, 또는 약 30주 내지 약 40주, 또는 약 20주까지, 또는 약 24주까지, 또는 약 30주까지, 또는 약 36주까지, 또는 약 48주까지의 기간 동안 투여하는 단계를 포함하도록 변형된다.
또다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 (1) HCV 유전자형 1 감염에 걸리고 초기 바이러스 로드가 2백만 바이러스 게놈 카피/ml 환자 혈청 이하인 환자를 확인하고, 이어서 (2) 환자에게 본 발명의 방법의 약물 요법을 약 20주 내지 약 24주의 기간 동안 투여하는 단계를 포함하도록 변형된다.
다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 (1) HCV 유전자형 1 감염에 걸리고 초기 바이러스 로드가 2백만 바이러스 게놈 카피/ml 환자 혈청 이하인 환자를 확인하고, 이어서 (2) 환자에게 본 발명의 방법의 약물 요법을 약 24주 내지 약 48주의 기간 동안 투여하는 단계를 포함하도록 변형된다.
또다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 (1) HCV 유전자형 2 또는 3 감염에 걸린 환자를 확인하고, 이어서 (2) 환자에게 본 발명의 방법의 약물 요법을 약 24주 내지 약 60주, 또는 약 30주 내지 약 1년, 또는 약 36주 내지 약 50주, 또는 약 40주 내지 약 48주, 또는 적어도 약 24주, 또는 적어도 약 30주, 또는 적어도 약 36주, 또는 적어도 약 40주, 또는 적어도 약 48주, 또는 적어도 약 60주의 기간 동안 투여하는 단계를 포함하도록 변형된다.
또다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 (1) HCV 유전자형 2 또는 3 감염에 걸린 환자를 확인하고, 이어서 (2) 환자에게 본 발명의 방법의 약물 요법을 약 20주 내지 약 50주, 또는 약 24주 내지 약 48주, 또는 약 30주 내지 약 40주, 또는 약 20주까지, 또는 약 24주까지, 또는 약 30주까지, 또는 약 36주까지, 또는 약 48주까지의 기간 동안 투여하는 단계를 포함하도록 변형된다.
또다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 (1) HCV 유전자형 2 또는 3 감염에 걸린 환자를 확인하고, 이어서 (2) 환자에게 본 발명의 방법의 약물 요법을 약 20주 내지 약 24주의 기간 동안 투여하는 단계를 포함하도록 변형된다.
또다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 (1) HCV 유전자형 2 또는 3 감염에 걸린 환자를 확인하고, 이어서 (2) 환자에게 본 발명의 방법의 약물 요법을 적어도 약 24주의 기간 동안 투여하는 단계를 포함하도록 변형된다.
또다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 (1) HCV 유전자형 1 또는 4 감염에 걸린 환자를 확인하고, 이어서 (2) 환자에게 본 발명의 방법의 약물 요법을 약 24주 내지 약 60주, 또는 약 30주 내지 약 1년, 또는 약 36주 내지 약 50주, 또는 약 40주 내지 약 48주, 또는 적어도 약 24주, 또는 적어도 약 30주, 또는 적어도 약 36주, 또는 적어도 약 40주, 또는 적어도 약 48주, 또는 적어도 약 60주의 기간 동안 투여하는 단계를 포 함하도록 변형된다.
또다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 (1) 임의의 HCV 유전자형 5, 6, 7, 8 및 9를 특징으로 하는 HCV에 감염된 환자를 확인하고, 이어서 (2) 환자에게 본 발명의 방법의 약물 요법을 약 20주 내지 약 50주의 기간 동안 투여하는 단계를 포함하도록 변형된다.
또다른 실시태양은 HCV 감염의 치료를 위한 임의의 상기한 방법을 제공하고, 여기서 본 발명의 방법은 (1) 임의의 HCV 유전자형 5, 6, 7, 8 및 9를 특징으로 하는 HCV에 감염된 환자를 확인하고, 이어서 (2) 환자에게 본 발명의 방법의 약물 요법을 적어도 약 24주 내지 약 48주까지의 기간 동안 투여하는 단계를 포함하도록 변형된다.
치료에 적합한 대상
임의의 상기 치료 요법은 HCV 감염으로 진단받은 개체에게 투여될 수 있다. 임의의 상기 치료 요법은 HCV 감염에 대한 선행 치료에 실패한 개체 (비-반응자 및 재발병자를 포함하는 "치료에 실패한 환자")에게 투여될 수 있다.
HCV로 감염된 것으로 임상적으로 진단된 개체는 많은 실시태양에서 특히 중요하다. HCV로 감염된 개체는 그들의 혈액 내에 HCV RNA를 갖고/갖거나 그들의 혈청 내에 항-HCV 항체를 갖는 것으로 확인된다. 상기 개체는 항-HCV ELISA-양성 개체, 및 양성 재조합 면역블롯 검정 (RIBA)을 갖는 개체를 포함한다. 상기 개체는 또한 상승된 혈청 ALT 수준을 가질 수 있지만 그러할 필요는 없다.
HCV로 감염된 것으로 임상적으로 진단된 개체는 비치료 개체 (예를 들어, HCV에 대해 앞서 치료받지 않은 개체, 특히 앞서 IFN-α-기반 및/또는 리바비린-기반 요법을 받지 않은 개체) 및 HCV에 대한 이전의 치료에 실패한 개체 ("치료에 실패한" 환자)를 포함한다. 치료에 실패한 환자는 비-반응자 (즉, HCV 역가가 HCV에 대한 선행 치료, 예를 들어, 선행 IFN-α 단일 요법, 선행 IFN-α와 리바비린 조합 요법, 또는 선행 PEG화된 IFN-α와 리바비린 조합 요법에 의해 유의하게 또는 충분하게 감소되지 않은 개체); 및 재발병자 (즉, HCV에 대해 앞서 치료되었고, 예를 들어, 선행 IFN-α 단일 요법, 선행 IFN-α와 리바비린 조합 요법, 또는 선행 PEG화된 IFN-α와 리바비린 조합 요법을 받았고, 그의 HCV 역가가 감소된 후 후속적으로 증가한 개체)를 포함한다.
중요한 특정 실시태양에서, 개체는 HCV 역가가 적어도 약 105, 적어도 약 5 x 105, 또는 적어도 약 106, 또는 적어도 약 2 x 106의 HCV의 게놈 카피/ml 혈청이다. 환자는 임의의 HCV 유전자형 (유전자형 1, 예를 들어 1a 및 1b, 2, 3, 4, 6 등과 아형 (예, 2a, 2b, 3a 등)), 특히 치료하기 어려운 유전자형, 예를 들어 HCV 유전자형 1 및 특정 HCV 아형 및 유사종으로 감염될 수 있다.
중증 섬유증 또는 초기 경화증 (비-비대상성, 차일드-퓨 클래스 A 이하), 또는 만성 HCV 감염으로 인한 보다 진행된 경화증 (비대상성, 차일드-퓨 클래스 B 또는 C)을 나타내고, IFN-α-기반 요법을 사용하는 이전의 항바이러스 치료에도 불구하고 바이러스혈증이거나, IFN-α-기반 요법을 견딜 수 없거나, 상기 요법이 금지되는 HCV-양성 개체 (상기 설명된)가 또한 중요하다. 중요한 특정 실시태양에서, METAVIR 점수 시스템에 따라 3기 또는 4기 간 섬유증의 HCV-양성 개체가 본원에 기재된 방법을 사용하는 치료에 적합하다. 다른 실시태양에서, 실시태양의 방법을 사용하는 치료에 적합한 개체는 임상 소견을 갖는 비대상성 경화증이 있는 환자, 예를 들어 말기 간 경화증의 환자, 예를 들어 간 이식을 기다리는 환자이다. 또 다른 실시태양에서, 본원에 기재된 방법을 사용하는 치료에 적합한 개체는 보다 경한 정도의 섬유증의 환자, 예를 들어 초기 섬유증 (METAVIR, 루드빅, 및 쇼이어 점수 시스템에서 1기 및 2기; 또는 이샤크 점수 시스템에서 1기, 2기 또는 3기)의 환자를 포함한다.
NS3
억제제의 제조
하기 섹션에서 NS3 억제제는 각각의 섹션에 도시된 과정 및 반응식에 따라 제조할 수 있다. 각각의 NS3 억제제의 제조 섹션에서 숫자는 단지 특정 섹션에 대한 것을 의미하고, 다른 섹션에서 동일한 숫자로서 해석되거나 혼동되지 않아야 한다.
방법
NS3
억제제의 제조
HCV 헬리카제 억제제는 아래 나타낸 과정 및 반응식에 따라 제조할 수 있다.
화학식 I을 갖는 NS3 헬리카제 억제제의 합성을 반응식 1에 요약한다. 하기 일반적인 과정은 상기 화합물의 합성에 대한 반응 조건을 설명한다. R3은 알킬기, 예를 들어 메틸 또는 에틸기일 수 있다.
화학식 I의 화합물의 합성을 위한 일반적인 과정
2-이소시아나토티오펜 1 (THF 중 0.125 mmol/L)의 용액을 적절한 양의 클로로포름 중 아미노 에스테르 2 (1.2 당량) 및 DIEA (1 ml/mmol의 2)의 용액에 첨가한다. 반응물을 실온에서 모든 이소시아네이트가 소모될 때까지 (대개 2-24h) 진탕한다. 실리카 상 이소시아네이트 (5 당량)를 첨가하고, 반응물을 실온에서 과량의 아미노 에스테르가 포획될 때까지 (대개 6-24h) 진탕한다. 반응물을 여과하고, 여액을 진공에서 농축시킨다. 수득한 잔기를 적절한 양의 2-메톡시에탄올에 용해시키고, DIEA (1 ml/mmol의 1)를 첨가한다. 반응물을 실온에서 24-36h 동안 진탕한다. 이 시점에서, 반응 혼합물은 LC-MS에 의해 남아있는 비고리화 생성물 3에 대해 검토한다. 유의한 양의 3이 발견되면, 반응 혼합물을 고리화 반응이 완료될 때까지 60℃로 가열한다. 중간체 3이 검출되지 않으면, 반응물을 진공에서 농축시켜 조 생성물을 얻는다. 조 생성물이 충분히 순수하지 않으면, 정상 또는 역상 크로마토그래피를 이용하여 정제할 수 있다.
표 3에 나타낸 화학식 I을 갖는 NS3 헬리카제 억제제를 상기 설명된 바와 같이 제조하였다.
화학식
II
의 화합물의 합성을 위한 일반적인 과정
치환된 아릴 신남아미드 유사체 5는 문헌 (WO/00139081, Marty Winn et al, J. Med. Chem. 2001, 44(25), 4393-4403)에 공개된 프로토콜을 이용하여 반응식-1에 예시된 방법에 따라 제조할 수 있다.
디아릴술피드 중간체 3은 극성 용매 (예를 들어 DMF, DMA, 아세톤, 메탄올 등) 중에서 적합한 염기, 예를 들어 탄산칼륨, 탄산나트륨, 트리에틸아민 등의 존재 하에 다양한 치환된 할로 벤즈알데히드 (2 또는 4-플루오로벤즈알데히드, 2 또는 4-클로로벤즈알데히드)를 다양한 치환 티오페놀 (예, 4-플루오로티오페놀, 2-메톡시 티오페놀 등)과 반응시켜 제조할 수 있다. 생성되는 디아릴술피드 알데히드 3을 아세테이트 동등체, 예를 들어 말론산 또는 트리에톡시포스포노아세테이트 또는 다른 유사한 시약과 반응시켜 신남산 4 또는 상응하는 에스테르를 제공할 수 있다. 에스테르의 경우에, 알콜 (예를 들어 에탄올, 메탄올) 및 물의 혼합물 중에서 무기 염기 (예를 들어 LiOH, NaOH, KOH 등)로 가수분해시켜 산 4를 제공할 수 있다. 표준 아미드 결합 형성 조건 (티오닐 클로라이드, 또는 디시클로헥실카르보디이미드 및 N-히드록시숙신이미드 등을 사용한 산의 활성화 포함) 하에 신남산 4를 1차 또는 2차 아민과 커플링시켜 최종 신남아미드 유사체 5를 제공할 수 있다.
별법으로, 화합물 8은 반응식 3에 나타낸 순서로부터 제조할 수 있다.
치환된 파라-니트로 할로 벤젠 유사체 1을 극성 용매 (예를 들어 DMF, DMA, 아세톤, 메탄올 등) 중에서 적합한 염기, 예를 들어 탄산칼륨, 탄산나트륨, 트리에틸아민 등의 존재 하에 치환된 아릴티올 2 (예를 들어 4-플루오로벤젠티올, 2-메톡시벤젠 티올 등)와 반응시켜 중간체 3을 제공할 수 있다. 중간체 3은 촉매, 예를 들어 Pd/C, Pt/C, Pd(OH)2, Pd(OAc)2 등을 사용하는 수소화에 의해 또는 Zn/EtOH, SnCl2 등을 사용하여 상응하는 아닐린 4로 전환시킬 수 있다. 아닐린 4는 문헌에 공개된 표준 샌드마이어 (Sandmeyer) 반응 조건에 의해 상응하는 요오도 또는 브로모 유사체 5로 전환될 수 있다. 신남아미드 유사체 6은 5를 아세테이트 동등체, 예를 들어 트리에톡시포스포노아세테이트 또는 다른 유사한 시약과 반응시켜 제조할 수 있다. 생성되는 에스테르 6을 알콜 (예를 들어 에탄올, 메탄올)과 물의 혼합물 중에서 무기 염기 (예를 들어 LiOH, NaOH, KOH 등)을 사용하여 상응하는 산 7로 가수분해할 수 있다. 최종 디아릴술피드 화합물 8은 산 7을 표준 아미드 결합 형성 조건 (티오닐 클로라이드, 또는 디시클로헥실카르보디이미드 및 N-히드록시숙신이미드 등을 사용한 산의 활성화 포함) 하에 1차 또는 2차 아민과 반응시켜 제조할 수 있다.
반응식 4는 아미노 치환된 신남아미드 4의 제조를 보여준다. 할로치환된 벤즈알데히드 1 (예를 들어 2 또는 4-플루오로 벤즈알데히드, 2 또는 4-클로로벤즈알데히드)을 극성 용매 (예를 들어 DMF, DMA, 아세톤, 메탄올 등) 중에서 적합한 염기 (예를 들어 탄산칼륨, 탄산나트륨, 트리에틸아민 등)의 존재 하에 1차 또는 2차 아민 (예를 들어 메틸아민, 디메틸아민, 모르폴린, 피페리딘, 치환된 피페라진 등)과 반응시킬 수 있다. 생성되는 알데히드 2를 아세테이트 동등체, 예를 들어 말론산 또는 트리에톡시포스포노아세테이트 또는 다른 유사한 시약과 반응시켜 신남산 3 또는 상응하는 에스테르를 제공할 수 있다. 에스테르의 경우에, 알콜 (예를 들어 에탄올, 메탄올)과 물의 혼합물 중에서 무기 염기 (예를 들어 LiOH, NaOH, KOH 등)를 사용하여 가수분해하여 산 3을 제공할 수 있다. 신남산 3을 표준 아미드 결합 형성 조건 (티오닐 클로라이드, 또는 디시클로헥실카르보디이미드 및 N-히드록시숙신이미드 등을 사용한 산의 활성화 포함) 하에 1차 또는 2차 아민과 커플링시키면 최종 신남아미드 유사체 4를 제공할 수 있다.
2,3-디클로로 치환된 디아릴술피드 8은 문헌 (WO/00139081)에 기재된 반응 순서로부터 제조할 수 있다. 브로마이드 2는 페놀 1을 저온 (0℃ 내지 실온)에서 비극성 용매, 예를 들어 CH2Cl2 또는 CHCl3 중에서 Br2를 사용하여 브롬화하여 제조할 수 있다. 이어서, 상기 중간체를 알킬 아크릴레이트와 헥크 (Heck) 커플링시키면 중간체 3을 제공할 것이다. 페놀 3은 염기, 예를 들어 휴니그 (Hunig) 염기, 트리에틸아민, 루티딘 등의 존재 하에 저온 (0℃ 내지 -20℃)에서 CH2Cl2 또는 CHCl3 중에서 트리플릭안하이드라이드를 사용하여 트리플레이트 4로 전환될 수 있다. 트리플레이트 4의 티오페놀 5와의 커플링 반응은 극성 용매 (DMF, NMP 등) 중에서 염기 (LiOtBu, KOtBu 등)의 존재 하에 수행하여 디아릴술피드 유사체 6을 제공할 수 있다. 에스테르 6의 가수분해는 용매의 혼합물 (예를 들어 EtOH/물, MeOH/물, THF:MeOH/물 또는 유사한 용매계) 내에서 염기, 예를 들어 LiOH, NaOH, KOH 등을 사용하여 달성할 수 있다. 신남산 7을 표준 아미드 결합 형성 조건 (티오닐 클로라이드, 또는 디시클로헥실카르보디이미드 및 N-히드록시숙신이미드 등을 사용한 산의 활성화 포함) 하에 1차 또는 2차 아민과 커플링시켜 최종 신남아미드 유사체 8을 제공할 수 있다.
실시예
1
(E)-3-(2-
클로로
-4-(4-
플루오로페닐티오
)
페닐
)-1-(4-(푸란-3-카르보닐)피페라진-1-일)
프로프
-2-엔-1-온
실시예
1A
(E)-3-(2-
클로로
-4-(4-
플루오로페닐티오
)-
페닐
)아크릴산
실시예 1A는 문헌 [Marty Winn et al., J. Med. Chem. 2001, 44(25), 4393-4403)에 설명된 과정에 따라 4-플루오로벤젠티올을 2-클로로-4-플루오로벤즈알데히드와 반응시킨 후, 말론산과 축합시켜 제조하였다.
실시예
1B
(E)-3-(2-
클로로
-4-(4-
플루오로페닐티오
)
페닐
)-1-(4-(푸란-3-카르보닐)피페라진-1-일)
프로프
-2-엔-1-온
DMF (1 mL) 중 실시예 1A (60 mg, 0.194 mmol), HOBt.H2O (44.64 mg, 0.2915 mmol), N-메틸모르폴린 (64 μM, 0.583 mmol), 및 푸란-3-일(피페라진-1-일)메타논 (42 mg, 0.233 mmol)의 용액을 EDCI (56 mg, 0.292 mmol)로 처리하고, 주변 온도에서 교반하였다. 18 h 후, 혼합물을 CH2Cl2 (2 mL)로 희석하고 물 (2 mL)로 세척하였다. CH2Cl2 층을 분리하고, 30% EtOAc/헥산의 단계 구배를 사용하여 용출시키는 실리카 겔 (5 g Alltech SEP 팩 (pack)) 상의 플래시 크로마토그래피에 의해 직접 정제하여 표제 화합물 (38 mg, 42% 수율)을 백색 고체로서 제공하였다. LCMS (APCI)- m/z 469 (M-H)-.
실시예
2
(E)-3-(2-
클로로
-4-(4-
플루오로페닐티오
)
페닐
)-1-(피페리딘-1-일)
프로프
-2-엔-1-온
실시예 2는 푸란-3-일(피페라진-1-일)메타논을 피페리딘으로 치환한 것을 제외하고는 실시예 1A (60 mg, 0.194 mmol)에 대해 설명된 바와 같이 제조하였다. 생성물을 실리카 겔 플래시 크로마토그래피 후 68% 수율 (49 mg)로 단리하였다. LCMS (APCI)- m/z 374 (M-H)-, Rt = 4.32 min.
실시예
3
(E)-3-(2-
클로로
-4-(4-
플루오로페닐티오
)
페닐
)-1-
모르폴리노프로프
-2-엔-1-온
실시예 3은 푸란-3-일(피페라진-1-일)메타논을 모르폴린으로 치환한 것을 제외하고는 실시예 1B에 대해 설명된 방법에 따라 실시예 1A (60 mg, 0.194 mmol)로부터 제조하였다. LCMS (APCI)- m/z 378 (M-H)-, Rt = 3.82 min.
실시예
4
(E)-3-(2-
클로로
-4-(4-
플루오로페닐티오
)
페닐
-N,N-
디에틸아크릴아미드
실시예 4 (37 mg)는 푸란-3-일(피페라진-1-일)메타논을 디에틸아민으로 치환한 것을 제외하고는 실시예 1B에 대해 설명된 방법에 따라 실시예 1A (60 mg, 0.194 mmol)로부터 제조하였다. LCMS (APCI)- m/z 362 (M-H)-, Rt = 4.25 min.
실시예
5
(E)-
메틸
1-(3-(2-
클로로
-4-(4-
플루오로페닐티오
)
페닐
)아크릴로일)피페리딘-4-
카르복실레이트
실시예 5 (46 mg)는 푸란-3-일(피페라진-1-일)메타논을 메틸 이소니페코테이 트로 치환한 것을 제외하고는 실시예 1B에 대해 설명된 방법에 따라 실시예 1A (60 mg, 0.194 mmol)로부터 제조하였다. LCMS (APCI)- m/z 432 (M-H)-, Rt = 4.08 min.
실시예
6
(E)-1-(3-(2-
클로로
-4-(4-
플루오로페닐티오
)
페닐
)아크릴로일)피페리딘-4-
카르복실산
실시예 5 (40 mg, 0.095 mmol)를 LiOH.H2O로 가수분해하는 것은 문헌 [J. Med. Chem. 2001, 44(25), 4393-4403, Marty Winn et al.)에 기재된 과정에 따라 수행하여 표제 화합물을 백색 분말로서 제공하였다. LCMS (APCI)- m/z 426 (M-H)-, Rt = 2.99 min.
실시예
7
(E)-
메틸
3-(3-(2-
클로로
-4-(4-
플루오로페닐티오
)
페닐
)
아크릴아미도
)
벤조에이트
표제 화합물은 푸란-3-일(피페라진-1-일)메타논을 메틸 3-아미노 벤조에이트로 치환한 것을 제외하고는 실시예 1B에 대해 설명된 바와 같이 실시예 1A로부터 제조하였다. 실시예 7을 백색 분말로서 단리하였다. LCMS (APCI)- m/z 441 (M-H)-.
실시예
8
(E)-3-(3-(2-
클로로
-4-(4-
플루오로페닐티오
)
페닐
)
아크릴아미도
)벤조산
실시예 8은 실시예 6에 대해 설명된 방법에 따라 실시예 7로부터 제조하였다. 표제 화합물은 백색 분말로서 수득하였다. LCMS (APCI)- m/z 418 (M-H)-, Rt = 2.79 min.
실시예
9
(E)-1-(4-
아세틸피페라진
-1-일)-3-(2-
클로로
-4-(디메틸아미노)
페닐
)
프로프
-2-엔-1-온
실시예
9A
(E)-3-(2-
클로로
-4-(디메틸아미노)
페닐
)아크릴산
실시예 9A는 실시예 1A에 대해 설명된 바와 같이 2-클로로-4-플루오로벤즈알데히드를 디메틸아민과 반응시킨 후 후속적으로 말론산과 축합시켜 제조하였다.
실시예
9B
(E)-1-(4-
아세틸피페라진
-1-일)-3-(2-
클로로
-4-(디메틸아미노)
페닐
)
프로프
-2-엔-1-온
표제 화합물 (115 mg)은 푸란-3-일(피페라진-1-일)메타논을 1-(피페라진-1-일)에타논으로 치환한 것을 제외하고는 실시예 1B에 대해 설명된 방법에 따라 실시예 9A로부터 제조하였다. LCMS (APCI)+ m/z 336 (M+H)+, Rt = 2.73 min.
실시예
10
(E)-3-(2-
클로로
-4-(디메틸아미노)
페닐
)-N-(2-
모르폴리노에틸
)
아크릴아미드
실시예 10은 푸란-3-일(피페라진-1-일)메타논을 2-모르폴리노에탄아민으로 치환한 것을 제외하고는 실시예 1B에서와 같이 제조하여 표제 화합물 (27.4 mg)을 제공하였다. LCMS (APCI)+ m/z 338 (M+H)+, Rt = 2.64 min.
실시예
11
(E)-N-(3-(1H-
이미다졸
-1-일)프로필)-3-(2-
클로로
-4-(디메틸아미노)
페닐
)
아크릴아미드
실시예 11 (15 mg)은 푸란-3-일(피페라진-1-일)메타논을 3-(1H-이미다졸-1-일)프로판-1-아민으로 치환한 것을 제외하고는 실시예 1B에 대해 설명된 바와 같이 실시예 9A로부터 제조하였다. LCMS (APCI)+ m/z 333 (M+H)+, Rt = 2.62 min.
실시예
12
(E)-3-(2-
클로로
-4-(디메틸아미노)
페닐
)-1-(4-(푸란-3-카르보닐)피페라진-1-일)
프로프
-2-엔-1-온
실시예 12 (69 mg)는 실시예 1B에 대해 설명된 방법에 따라 실시예 9A로부터 제조하였다. LCMS (APCI)+ m/z 388 (M+H)+, Rt = 3.81 min.
실시예
13
(E)-3-(2-
클로로
-4-(디메틸아미노)
페닐
)-1-
모르폴리노프로프
-2-엔-1-온
실시예 13 (51.9 mg)은 푸란-3-일(피페라진-1-일)메타논을 모르폴린으로 치환한 것을 제외하고는 실시예 1B에 대해 설명된 방법에 따라 제조하였다. LCMS (APCI)+ m/z 295 (M+H)+, Rt = 3.01 min.
실시예
14
(E)-
메틸
1-(3-(2-
클로로
-4-(디메틸아미노)
페닐
)아크릴로일)피페리딘-4-
카르복실레이트
표제 화합물 (73 mg)은 실시예 5에 대해 설명된 바와 같이 실시예 9A로부터 제조하였다. LCMS (APCI)+ m/z 351 (M+H)+, Rt = 3.32 min.
실시예
15
(E)-1-(3-(2-
클로로
-4-(디메틸아미노)
페닐
)아크릴로일)피페리딘-4-
카르복실산
실시예 15 (24 mg)는 실시예 6에 대해 설명된 바와 같이 실시예 14로부터 제조하였다. LCMS (APCI)+ m/z 335 (M-H)-, Rt = 2.19 min.
실시예
16
(E)-3-(2-
클로로
-4-(4-
플루오로페닐티오
)-5-
메틸페닐
)-1-(피페리딘-1-일)
프로프
-2-엔-1-온
실시예
16A
1-
클로로
-5-
요오도
-4-
메틸
-2-니트로벤젠
실시예 16A는 문헌 [Tetrahedron Letters, 2005, 46 (18), 3197]에 설명된 방법에 따라 5-클로로-2-메틸-4-니트로아닐린으로부터 제조하였다. 1H NMR (400 MHz, DMSO d6) δ 8.267 (s, 1H), 8.062 (s, 1H), 2.434 (s, 3H).
실시예
16B
(5-
클로로
-2-
메틸
-4-
니트로페닐
)(4-
플루오로페닐
)술판
실시예 16A를 문헌 [Organic Letters, 2002, P(20), 3517]에 설명된 바와 같이 4-플루오로벤젠티올로 처리하여 표제 화합물을 87% 수율로 제공하였다. 1H NMR (400 MHz, DMSO d6) δ 8.073 (s, 1H), 7.687-7.647 (m, 2H), 7.45-7.40 (m, 2H), 6.79 (s, 1H), 2.38 (s, 3H).
실시예
16C
2-
클로로
-4-(4-
플루오로페닐티오
)-5-
메틸아닐린
실시예 16B를 문헌 [Bioorganic & Medicinal Chemistry Letters, 2005, 15(8), 2033-2039]에 설명된 방법에 따라 환원시켜 표제 화합물을 무색 오일 (99% 수율)로서 제공하였다. 1H NMR (400 MHz, DMSO d6) δ 7.32 (s, 1H), 7.15-7.11 (m, 2H), 7.05-7.02 (m, 2H), 6.77 (s, 1H), 5.71 (br s, 2H), 2.15 (s, 3H).
실시예
16D
(5-
클로로
-4-
요오도
-2-
메틸페닐
)(4-
플루오로페닐
)술판
실시예 16D는 실시예 16A에 대해 설명된 방법에 따라 실시예 16C (1.8 g, 6.723 mmol)로부터 제조하였다. 1H NMR (400 MHz, DMSO d6) δ 7.85 (s, 1H), 7.4-7.41 (m, 2H), 7.29-7.24 (m, 2H), 6.99 (s, 1H), 2.22 (s, 3H).
실시예
16E
(E)-
메틸
3-(2-
클로로
-4-(4-
플루오로페닐티오
)-5-
메틸페닐
)
아크릴레이트
실시예 16E는 WO/00139081에 설명된 과정에 따라 실시예 16D를 메틸 아크릴레이트와 반응시켜 제조하였다. 1H NMR (400 MHz, DMSO d6) δ 7.89 (s, 1H), 7.77 (d, J= 16.01 Hz, 1H), 7.54-7.51 (m, 2H), 7.35-7.31 (m, 2H), 6.79 (s, 1H), 6.69 (d, J= 16.01 Hz, 1H), 3.71 (s, 3H), 2.29 (s, 3H).
실시예
16F
(E)-3-(2-
클로로
-4-(4-
플루오로페닐티오
)-5-
메틸페닐
)아크릴산
실시예 16E (400 mg, 1.188 mmol)를 실시예 6에 대해 설명된 바와 같이 LiOH.H2O로 처리하여 표제 화합물을 93% 수율 (300 mg)로 제공하였다. 1H NMR (400 MHz, DMSO d6) δ 12.61 (s, 1H), 7.89 (s, 1H), 7.75 (d, J= 16.01 Hz, 1H), 7.56-7.53 (m, 2H), 7.37-7.33 (m, 2H), 6.83 (s, 1H), 6.61 (d, J= 16.01 Hz, 1H), 2.32 (s, 3H).
실시예
16G
(E)-3-(2-
클로로
-4-(4-
플루오로페닐티오
)-5-
메틸페닐
)-1-(피페리딘-1-일)
프로프
-2- 엔-1-온
실시예 16G (53 mg)는 3-일(피페라진-1-일)메타논을 피페리딘으로 치환한 것을 제외하고는 실시예 1B에 대해 설명된 방법에 따라 실시예 16F로부터 제조하였다. LCMS (APCI)+ m/z 390 (M+H)+, Rt = 4.56 min.
실시예
17
(E)-3-(2-
클로로
-4-(4-
플루오로페닐티오
)-5-
메틸페닐
)-1-(4-(푸란-3-카르보닐)피페라진-1-일)
프로프
-2-엔-1-온
표제 화합물 (34 mg)은 실시예 1B에 대해 설명된 바와 같이 실시예 16F로부터 제조하였다. LCMS (APCI)+ m/z 485 (M+H)+, Rt = 4.02 min.
실시예
18
(E)-3-(2-
클로로
-4-(4-
플루오로페닐티오
)-5-
메틸페닐
)-N,N-
디에틸아크릴아미드
실시예 16F를 실시예 4에서와 같이 처리하여 표제 화합물 (49 mg)을 제공하였다. LCMS (APCI)+ m/z 378 (M+H)+, Rt = 4.44 min.
실시예
19
(E)-에틸 3-(3-(2-
클로로
-4-(4-
플루오로페닐티오
)-5-
메틸페닐
)
아크릴아미도
)
프로파노에이트
실시예 19는 푸란-3-일(피페라진-1-일)메타논을 에틸 3-아미노프로파노에이트로 치환한 것을 제외하고는 실시예 1B에 대해 설명된 방법에 따라 실시예 16F로부터 제조하였다. LCMS (APCI)+ m/z 421 (M+H)+, Rt = 4.21 min.
실시예
20
(E)-3-(3-(2-
클로로
-4-(4-
플루오로페닐티오
)-5-
메틸페닐
)
아크릴아미도
)프로판산
실시예 20은 실시예 6에서와 같이 처리하여 표제 화합물 (39 mg)을 제공하였다. LCMS (APCI)- m/z 392 (M-H)-, Rt = 2.74 min.
실시예
21
(E)-3-(3-(2-
클로로
-4-(4-
플루오로페닐티오
)-5-
메틸페닐
)
아크릴아미도
)벤조산
실시예 21 (12 mg)은 실시예 8의 제조에 대해 설명된 방법에 따라 실시예 16F 및 메틸 3-아미노벤조에이트로부터, 이어서 LiOH.H2O의 처리하여 제조하였다. LCMS (APCI)- m/z 440 (M-H)-, Rt = 3.12 min.
실시예
22
(E)-1-(3-(2-
클로로
-4-(4-
플루오로페닐티오
)-5-
메틸페닐
)아크릴로일)피페리딘-4-카르복실산
실시예 22 (47 mg)는 실시예 6에 대해 설명된 바와 같이 실시예 16F로부터 제조하였다. LCMS (APCI)- m/z 432 (M-H)-, Rt = 2.88 min.
실시예
23
(E)-3-(2-
클로로
-4-(4-
플루오로페닐티오
)-5-
메틸페닐
)-1-
모르폴리노프로프
-2-엔-1-온
실시예 23 (52 mg)은 실시예 3에 대해 설명된 과정에 따라 실시예 16F로부터 제조하였다. LCMS (APCI)+ m/z 392 (M+H)+, Rt = 4.05 min.
실시예
24
(E)-3-(2-
클로로
-4-(2-
메톡시페닐티오
)
페닐
)-N-(3-(디메틸아미노)프로필)
아크릴아미드
실시예
24A
(E)-3-(2-
클로로
-4-(2-
메톡시페닐티오
)
페닐
)아크릴산
실시예 24는 문헌 [Marty Winn et al., J. Med. Chem. 2001, 44(25), 4393-4403]에 설명된 과정에 따라 2-메톡시벤젠티올 및 2-클로로-4-플루오로벤즈알데히드를 반응시킨 후 말론산과 축합시켜 제조하였다.
실시예
24B
(E)-3-(2-
클로로
-4-(2-
메톡시페닐티오
)
페닐
)-N-(3-(디메틸아미노)프로필)
아크릴아미드
실시예 24B는 푸란-3-일(피페라진-1-일)메타논을 N1,N1-디메틸프로판-1,3-디 아민으로 치환한 것을 제외하고는 실시예 1B에 대해 설명된 바와 같이 실시예 24A로부터 제조하였다. LCMS (APCI)+ m/z 405 (M+H)+, Rt = 2.456 min.
실시예
25
(E)-3-(2-
클로로
-4-(2-
메톡시페닐티오
)
페닐
)-N-(2-(1-
메틸피롤리딘
-3-일)에틸)
아크릴아미드
표제 화합물은 푸란-3-일(피페라진-1-일)메타논을 2-(1-메틸피롤리딘-3-일)에탄아민으로 치환한 것을 제외하고는 실시예 1B의 제조에 대해 설명된 바와 같이 실시예 24A로부터 제조하였다. LCMS (APCI)+ m/z 431 (M+H)+, Rt = 2.515 min.
실시예
26
(E)-1-(3-(2-
클로로
-4-(2-
메톡시페닐티오
)
페닐
)아크릴로일)피페리딘-4-
카르복실산
실시예 26 (49 mg)은 실시예 6에 대해 설명된 바와 같이 실시예 24A로부터 제조하였다. LCMS (APCI)- m/z 430 (M-H)-, Rt = 2.84 min.
실시예
27
(E)-3-(2-
클로로
-4-(2-
메톡시페닐티오
)
페닐
)-1-(4-(푸란-3-카르보닐)피페라진-1-일)
프로프
-2-엔-1-온
실시예 24A를 실시예 1B에서와 같이 처리하여 표제 화합물을 제공하였다. LCMS (APCI)- m/z 483 (M-H)-, Rt = 3.65 min.
실시예
28
(E)-3-(2-
클로로
-4-(2-
메톡시페닐티오
)
페닐
)-N,N-
디에틸아크릴아미드
실시예 28은 실시예 18에 대해 설명된 방법에 따라 제조하였다. LCMS (APCl)- m/z 376 (M-H)-, Rt = 4.08 min.
실시예
29
(E)-3-(3-(2-
클로로
-4-(2-
메톡시페닐티오
)
페닐
)
아크릴아미도
)프로판산
실시예 29는 실시예 20에 설명된 과정에 따라 실시예 24A로부터 제조하였다. LCMS (APCI)- m/z 390 (M-H)-, Rt = 2.54 min.
실시예
30
(E)-3-(2-
클로로
-4-(2-
메톡시페닐티오
)
페닐
)-1-(4-(
피롤리딘
-1-일)피페리딘-1-일)프로프-2-엔-1-온
실시예 30은 푸란-3-일(피페라진-1-일)메타논을 4-(피롤리딘-1-일)피페리딘으로 치환한 것을 제외하고는 실시예 1B에 대해 설명된 바와 같이 실시예 24A로부터 제조하였다. LCMS (APCI)+ m/z 457, 459 (M+H)+, Rt = 2.94 min.
실시예
31
(E)-1-(3-(4-(4-
플루오로페닐티오
)-2-(
트리플루오로메틸
)
페닐
)아크릴로일)피페리딘-4-
카르복실산
실시예
31A
(E)-3-(4-(4-
플루오로페닐티오
)-2-(
트리플루오로메틸
)
페닐
)아크릴알데히드
실시예 31A는 실시예 1A에 설명된 과정에 따라 4-플루오로벤젠티올을 4-플루오로-2-(트리플루오로메틸)벤즈알데히드와 반응시킨 후 말론산과 축합시켜 제조하였다.
실시예
31B
(E)-1-(3-(4-(4-
플루오로페닐티오
)-2-(
트리플루오로메틸
)
페닐
)아크릴로일)피페리딘-4-
카르복실산
표제 화합물 (47 mg)은 실시예 6에 대해 설명된 과정에 따라 실시예 31A로부터 제조하였다. LCMS (APCI)- m/z 452 (M-H)-, Rt = 2.88 min.
실시예
32
(E)-1-(3-(2,3-
디클로로
-4-(2-
메톡시페닐티오
)
페닐
)아크릴로일)피페리딘-4-
카르복실산
실시예
32A
4-
브로모
-2,3-
디클로로페놀
2,3-디클로로페놀을 WO/00139081에 설명된 방법에 따라 CH2Cl2 중에서 Br2로 처리하였다. LCMS (APCI-) m/e 241 (M+H)+.
실시예
32B
(E)-
메틸
3-(2,3-
디클로로
-4-
히드록시페닐
)
아크릴레이트
실시예 32A를 WO/00139081에 설명된 바와 같이 무수 DMF (300 mL) 중에서 Pd2(dba)3, (Tol)3P, 트리에틸아민의 존재 하에 메틸아크릴레이트로 처리하였다. 1H NMR (400 MHz, DMSO-d6) δ 11.27 (s, 1H), 7.83 (d, J= 16.01 Hz, 1H), 7.77 (d, J = 8.98 Hz, 1H), 6.97 (d, J= 8.98 Hz, 1H), 6.53 (d, J= 16.01 Hz, 1H), 3.69 (s, 3H).
실시예
32C
(E)-3-(2,3-
디클로로
-4-(2-
메톡시페닐티오
)
페닐
)아크릴산
실시예 32B를 문헌 프로토콜 (WO/00139081)에 따라 2,2,2-트리플루오로아세트산 무수물로 처리하여 상응하는 트리플레이트를 얻었다. 이어서, 단리된 생성물을 WO/00139081에 설명된 바와 같이 2-메톡시벤젠티올로 처리하였다. 이어서, 단리된 생성물을 실시예 16F에서와 같이 처리하여 표제 화합물을 제공하였다. 1H NMR (400 MHz, DMSO-d6) δ 12.65 (br s, 1H), 7.83 (d, J = 16.01 Hz, 1H), 7.74 (d, J= 8.59 hz, 1H), 7.61-7.56 (m, 1H), 7.53-7.51 (m, 1H), 7.25 (d, J = 8.20 Hz, 1H), 7.11-7.07 (m, 1H), 6.53-6.50 (m, 1H), 6.51 (d, J= 167.01 Hz, 1H).
실시예
32D
(E)-1-(3-(2,3-
디클로로
-4-(2-
메톡시페닐티오
)
페닐
)아크릴로일)피페리딘-4-
카르복실산
실시예 32C를 실시예 5에 대해 설명된 과정에 따라 이소니페코틴산으로 처리하였다. 이어서, 단리된 생성물을 실시예 6에서와 같이 LiOH.H2O로 처리하여 표제 화합물을 제공하였다. (400 MHz, DMSO-d6) δ 12.26 (br s, 1H), 7.79 (d, J = 8.59 Hz, 1H), 7.69 (d, J = 16.01 Hz, 1H), 7.56-7.51 (m, 1H), 7.45-7.43 (m, 1H), 7.23-7.20 (m, 2H), 7.06-7.03 (m, 1H), 6.51 (d, J = 8.98 Hz, 1H), 4.27-4.21 (m, 1H), 4.10-4.04 (m, 1H), 3.76 (m, 3H), 3.27 (m, 1H), 3.18-3.08 (m, 1H), 2.85-2.78 (m, 1H), 1.83-1.77 (m, 2H), 1.45-1.35 (m, 2H).
일반적인 과정:
CH2Cl2 (2 ml) 중 치환된 페닐아크릴로일 클로라이드 (2.50 mmol)의 용액에 아민 (2.75 mmol)에 이어 PS-DMAP (2.50 mmol)을 첨가하고 주말 동안 주변 온도에서 교반하였다. 반응 혼합물을 여과하고 농축시켜 표제 화합물을 고순도로 70-90% 수율로 제공하였다.
실시예
33
(E)-3-(2-
클로로페닐
)-N-(2-
히드록시에틸
)
아크릴아미드
LC-MS: m/z 226.959 (M+1)
실시예
34
(E)-3-(2-
클로로페닐
)-1-(
이소인돌린
-2-일)
프로프
-2-엔-1-온
LC-MS: m/z 285.197 (M+1)
실시예
35
(E)-3-(2-
클로로페닐
)-N-
페닐아크릴아미드
LC-MS: m/z 259.133 (M+1)
*A=50-10 μM
B <10 μM
HCV
헬리카제
TR
-
FRET
풀림 분석
화합물 효력은 시험관내 균질 시간차 (time-resolved) 형광 켄치 분석으로 DNA 풀림을 억제하는 화합물의 능력을 결정함으로써 평가하였다. 헬리카제 기질 (퍼킨 엘머 (Perkin Elmer), TruPoint 헬리카제 기질)은 부분 이중가닥 DNA로 이루어졌고, 여기서 하나의 올리고뉴클레오티드 가닥은 형광 유로퓸 킬레이트로 표지되고 다른 가닥은 QSY™ 7 켄처 (quencher)로 표지된다. 헬리카제 및 ATP의 존재 하에, 상기 DNA는 풀리게 되고 큰 형광 증가가 관찰된다. 유로퓸 및 QSY-표지된 가닥의 재어닐링을 방지하기 위해, 켄처 가닥에 상보성인 과량의 표지되지 않은 올리고뉴클레오티드 (또한 퍼킨 엘머 제품, TruPoint 헬리카제 포획 가닥)가 분석에 포함되었다.
분석 버퍼는 25 mM MOPS (pH 7.0), 500 μM MgCl2, 및 0.005% (v/v) Triton X-100으로 이루어졌고, DMSO는 2% (v/v)의 최종 농도로 존재하였다. 정제된 재조합 전장 NS3 (1-631) 단백질은 상기 분석에 2.5 nM의 최종 농도로 포함되었다. 화합물을 NS3 단백질과 함께 5분 동안 384-웰 백색 프록시플레이트 (Proxiplate)™ (퍼킨 엘머) 내에서 인큐베이션한 후, TruPoint 헬리카제 기질 (4 nM 최종 농도), TruPoint 헬리카제 포획 가닥 (15 nM 최종 농도), 및 ATP (100 μM 최종 농도)를 첨가하였다. 최종 반응 부피는 20 ㎕이었다. 기질 및 포획 가닥의 첨가 직후에, 풀림 반응의 초기 속도를 실온에서 Envision (퍼킨 엘머) 플레이트 판독기를 통해 결정하였다. 화합물 효력을 평가하기 위해, 시험 화합물을 함유하는 반응의 속도를 시험 화합물이 없는 반응의 속도와 비교하였다. IC50 값은 곡선-피팅 소프트웨어 XLfit (IDBS)를 사용하여 결정하였다.
NS3
-
NS4
프로테아제 분석
NS4A
-2와의
NS3
복합체 형성
재조합 이. 콜라이 (E. coli) 또는 바큘로바이러스 전장 NS3을 분석 버퍼로 3.33 μM로 희석하고, 물질을 에펜도르프관에 옮기고 4℃ 냉장고 내의 수조에 넣었다. 분석 버퍼 중의 8.3 mM로 적절한 양의 NS4A-2를 단계 2.1.1에서 NS3의 부피와 동일하도록 첨가하였다 (전환 인수 - 3.8 mg/272 ㎕ 분석 버퍼). 물질을 에펜도르프관에 옮기고, 4℃ 냉장고 내의 수조에 넣었다.
4℃에서 평형화시킨 후, 등부피의 NS3 및 NS4A-2 용액을 에펜도르프관에서 합하고, 수동 피펫터로 부드럽게 혼합하고, 혼합물을 4℃ 수조 내에서 15분 동안 인큐베이션하였다. 혼합물 내의 최종 농도는 1.67 μM NS3, 4.15 mM NS4A-2이었다 (2485배 몰 과량의 NS4A-2).
4℃에서 15분 후에, NS3/NS4A-2 에펜도르프관을 제거하고, 실온 수조에서 10분 동안 정치하였다. NS3/NS4A-2를 적절한 부피로 분액하고, -80℃에서 저장하였다 (이. 콜라이 NS3은 분석에 2 nM로 사용하고, 25 ㎕로 분액한다. BV NS3은 분석에 3 nM로 사용하고, 30 ㎕로 분액한다).
NS3
억제 분석
단계 2.2.5. 샘플 화합물을 DMSO 중에 1O mM로 용해시킨 후, DMSO로 2.5 mM (1:4)로 희석하였다. 일반적으로, 화합물을 분석 플레이트에 2.5 mM 농도로 첨가하고, 희석시 분석 억제 곡선에서 50 μM의 출발 농도를 얻었다. 화합물을 분석 버퍼 중에 계열 희석하여 보다 낮은 농도에서 시험 용액을 제공하였다.
단계 2.2.6. 이. 콜라이 NS3/NS4A-2를 4 nM NS3으로 희석하였다 (1:417.5의 1.67 μM 원액 - 18 ㎕ 1.67 μM 원액 + 7497 ㎕ 분석 버퍼).
BV NS3/NS4A-2를 6 nM NS3으로 희석하였다 (1:278.3의 1.67 μM 원액 - 24 ㎕ 1.67 μM 원액 + 6655 ㎕ 분석 버퍼).
단계 2.2.7. 수동 멀티채널 피펫터를 사용하고, 플레이트 내로 기포가 도입되지 않도록 조심하여, 50 ㎕ 분석 버퍼를 흑색 Costar 96-웰 폴리프로필렌 저장 플레이트의 웰 AO1-HO1에 첨가하였다.
단계 2.2.8. 수동 멀티채널 피펫터를 사용하고, 플레이트 내로 기포가 도입되지 않도록 조심하여, 50 ㎕의 단계 2.2.6의 희석된 NS3/NS4A-2를 단계 2.2.7에서 플레이트의 웰 A02-H12에 첨가하였다.
단계 2.2.9. 수동 멀티채널 피펫터를 사용하고, 플레이트 내로 기포가 도입되지 않도록 조심하여, 단계 2.2.5의 약물 희석 플레이트 내의 25 ㎕의 웰을 단계 2.2.8의 분석 플레이트 내의 상응하는 웰에 옮겼다. 옮겨진 각각의 열의 화합물에 대해 멀티채널 피펫터 상의 팁 (tip)을 교환하였다.
단계 2.2.10. 수동 멀티채널 피펫터를 사용하고, 플레이트 내로 기포가 도입되지 않도록 조심하여, 단계 2.2.9의 분석 플레이트로부터의 웰을 각각의 웰 내의 75 ㎕ 중 35 ㎕을 5회 흡인하고 분배함으로써 혼합하였다. 혼합된 각각의 열의 웰에 대해 멀티채널 피펫터 상의 팁을 교환하였다.
단계 2.2.11. 플레이트를 폴리스티렌 플레이트 덮개로 덮고, NS3 프로테아제 및 샘플 화합물을 함유하는 단계 2.2.10의 플레이트를 실온에서 10분 동안 예비-인큐베이션하였다.
단계 2.2.11의 플레이트를 예비-인큐베이션하면서, RETS1 기질을 15 mL 폴리프로필렌 원심분리관 내에 희석하였다. RETS1 기질을 8 μM로 희석하였다 (1:80.75의 646 μM 원액 - 65 ㎕ 646 μM 원액 + 5184 ㎕ 분석 버퍼).
단계 2.2.11의 플레이트의 예비-인큐베이션한 후, 수동 멀티채널을 사용하여, 25 ㎕의 기질을 플레이트 상의 모든 웰에 첨가하였다. 웰의 내용물을 단계 2.2.10에서와 같이, 그러나 웰 내의 100 ㎕ 중 65 ㎕를 혼합함으로써 신속하게 혼합하였다.
플레이트를 몰레큘라 디바이시스 스펙트라맥스 제미니 (Molecular Devices SpectraMax Gemini) XS 플레이트 판독기 상에서 동적 모드로 판독하였다. 판독기 세팅: 판독 시간: 30분, 간격: 36초, 판독: 51, 여기 λ: 335 nm, 방출 λ: 495 nm, 컷오프: 475 nm, 자동혼합: 미실행 (off), 검정: 1회, PMT: 고 (high), 판독/웰: 6, Vmax pts: 반응의 선형성의 길이에 따라 21 또는 28/51.
IC5은 4변수 곡선 피트 식을 이용하여 결정하고, 다음 Km을 이용하여 Ki로 전환시켰다:
전장 이. 콜라이 NS3 - 2.03 μM
전장 BV NS3 - 1.74 μM
여기서, Ki = IC50/(1+[S]/Km))
HCV
서브-게놈
레플리콘
,
GS4
.3 내의 선택가능한
마커
단백질, 네오마이신
포스포트랜스퍼라제
II
(
NPTII
)의
ELISA
에 의한 정량
HuH-7 간암 세포 내에 안정하게 유지된 HCV 서브-게놈 레플리콘 (I377/NS3-3', 기탁 번호 AJ242652)은 문헌 [Lohmann et al. Science 285: 110-113 (1999)]에 의해 생성하였다. 레플리콘-함유 세포 배양액 (GS4.3으로 명명)을 크리스토프 시거 박사 (Dr. Christoph Seeger, the Institute for Cancer Research, Fox Chase Cancer Center, 미국 펜실배니아주 필라델피아)로부터 입수하였다.
GS4.3 세포를 L-글루타민 20O mM (100X) (깁코(Gibco) 25030-081), 비-필수 아미노산 (NEAA) (바이오휘태커 (Biowhittaker) 13-114E), 열-불활성화 (HI) 소 태아 혈청 (FBS) (하이클론 (Hyclone) SH3007.03) 및 750 ㎍/ml 게네티신 (G418) (깁코 10131-035)으로 보충한 DMEM (깁코 11965-092) 중에서 37℃, 5% CO2에서 유지하였다. 세포를 2-3일마다 1:3 또는 4로 나누었다.
분석 24시간 전에, GS4.3 세포를 수집하고, 계수하고, 100 ㎕ 표준 유지 배지 (상기) 내에 96-웰 플레이트 (Costar 3585)에 7500 세포/웰로 플레이팅하고, 상기 조건에서 인큐베이션하였다. 분석을 개시하기 위해, 배양 배지를 제거하고, 세포를 PBS (깁코 10010-023)로 1회 세척하고, 90 ㎕ 분석 배지 (DMEM, L-글루타민, NEAA, 10% HI FBS; G418 없음)를 첨가하였다. 억제제를 분석 배지 중 10X 원액으로서 제조하고 (10 μM로부터 56 pM의 최종 농도로 3배 희석, 최종 DMSO 농도 1%), 10 ㎕을 2개의 웰에 첨가하고, 플레이트를 흔들어 혼합하고, 72h 동안 상기한 바와 같이 인큐베이션하였다.
NPTII ELISA 키트를 아그디아, 인크. (AGDIA, Inc. (네오마이신 포스포트랜스퍼라제 II에 대한 화합물 지정 ELISA 시험 시스템, PSP 73000/4800)로부터 입수하였다. 제조사의 지시를 따르되, 일부 변형하였다. 10X PEB-1 용해 완충액을 500 μM PMSF (시그마 (Sigma) P7626, 이소프로판올 중 50 mM 원액)를 포함하도록 제조하였다. 72h 인큐베이션 후, 세포를 PBS로 1회 세척하고, PMSF를 갖는 150 ㎕ PEB-1을 웰마다 첨가하였다. 플레이트를 15분 동안 실온에서 격렬하게 교반한 후, -70℃에서 동결시켰다. 플레이트를 해동시키고, 용해물을 완전히 혼합하고, 100 ㎕을 NPTII Elisa 플레이트에 적용하였다. 표준 곡선을 작성하였다. DMSO-처리 대조 세포로부터의 용해물을 모으고, PMSF를 갖는 PEB-1로 계열 희석하고, ELISA 플레이트의 2개의 웰에 150 ㎕-2.5 ㎕의 초기 용해물 양의 범위로 적용하였다. 또한, 100 ㎕ 완충액만을 블랭크로서 2개 적용하였다. 플레이트를 밀봉하고 실온에서 2h 동안 가볍게 진탕하였다. 포획 인큐베이션 후, 플레이트를 PBS-T로 5X 300 ㎕ 세척하였다 (0.5% Tween-20, PBS-T를 ELISA 키트에 공급하였다). 검출을 위해, 효소 컨쥬게이트 희석제 MRS-2 (5X)의 1X 희석액을 PBS-T 내에 제조하였고, 여기에 효소 컨쥬게이트 A 및 B의 1:100 희석액을 지시에 따라 첨가하였다. 플레이트를 다시 밀봉하고, 실온에서 2h 동안 덮은 상태에서 교반하면서 인큐베이션하였다. 이어서, 세척을 반복하고, 100 ㎕의 실온 TMB 기질을 첨가하였다. 약 30분 인큐베이션 (실온, 교반, 덮은 상태) 후, 50 ㎕의 3M 황산으로 반응을 중지시켰다. 플레이트를 450 nm에서 몰레큘라 디바이시스 버사맥스 (Molecular Devices Versamax) 플레이트 판독기 상에서 판독하였다.
억제제 효과는 DMSO-처리 대조 신호의 백분율로서 표현되고, 억제 곡선은 4-변수 식을 이용하여 계산하였다: y=A+((B-A)/(1+((C/x)D))). 여기서 C는 최대 활성의 절반 또는 EC50이다.
여기서, A는 50 μM 미만의 표시된 바와 같은 IC50 또는 EC50을 나타내고,
B는 10 μM 미만의 표시된 바와 같은 IC50 또는 EC50을 나타내고,
C는 1 μM 미만의 표시된 바와 같은 IC50 또는 EC50을 나타내고
D는 0.1 μM 미만의 표시된 바와 같은 IC50 또는 EC50을 나타낸다.
결론
HCV NS3 헬리카제의 강력한 소분자 억제제가 개발되었다.
본 발명은 그의 구체적인 실시태양을 참조로 설명되었지만, 당업자는 본 발명의 진정한 취지 및 범위로부터 벗어나지 않으면서 다양한 변화가 이루어질 수 있고 동등물이 대체될 수 있음을 이해해야 한다. 또한 정 상황, 물질, 해당 조성물, 공정, 공정 단계(들)을 본 발명의 목적, 취지 및 범위에 맞도록 하기 위해 많은 변형이 이루어질 수 있다. 상기 모든 변형은 본원에 첨부된 청구의 범위 내에 있는 것으로 의도된다.
SEQUENCE LISTING
<110> INTERMUNE, INC.
Beigelman, Leonid
Andrews, Steven W.
Condroski, Kevin R.
Gunawaradana, Indrani
<120> INHIBITORS OF VIRAL REPLICATOIN
<130> INTMU.021VPC
<150> 60/725,584
<151> 2005-10-11
<160> 1
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 631
<212> PRT
<213> Hepatitis C virus
<400> 1
Ala Pro Ile Thr Ala Tyr Ala Gln Gln Thr Arg Gly Leu Leu Gly Cys
1 5 10 15
Ile Ile Thr Ser Leu Thr Gly Arg Asp Lys Asn Gln Val Glu Gly Glu
20 25 30
Val Gln Ile Val Ser Thr Ala Thr Gln Thr Phe Leu Ala Thr Cys Ile
35 40 45
Asn Gly Val Cys Trp Thr Val Tyr His Gly Ala Gly Thr Arg Thr Ile
50 55 60
Ala Ser Pro Lys Gly Pro Val Ile Gln Met Tyr Thr Asn Val Asp Gln
65 70 75 80
Asp Leu Val Gly Trp Pro Ala Pro Gln Gly Ser Arg Ser Leu Thr Pro
85 90 95
Cys Thr Cys Gly Ser Ser Asp Leu Tyr Leu Val Thr Arg His Ala Asp
100 105 110
Val Ile Pro Val Arg Arg Arg Gly Asp Ser Arg Gly Ser Leu Leu Ser
115 120 125
Pro Arg Pro Ile Ser Tyr Leu Lys Gly Ser Ser Gly Gly Pro Leu Leu
130 135 140
Cys Pro Ala Gly His Ala Val Gly Leu Phe Arg Ala Ala Val Cys Thr
145 150 155 160
Arg Gly Val Ala Lys Ala Val Asp Phe Ile Pro Val Glu Asn Leu Glu
165 170 175
Thr Thr Met Arg Ser Pro Val Phe Thr Asp Asn Ser Ser Pro Pro Ala
180 185 190
Val Pro Gln Ser Phe Gln Val Ala His Leu His Ala Pro Thr Gly Ser
195 200 205
Gly Lys Ser Thr Lys Val Pro Ala Ala Tyr Ala Ala Gln Gly Tyr Lys
210 215 220
Val Leu Val Leu Asn Pro Ser Val Ala Ala Thr Leu Gly Phe Gly Ala
225 230 235 240
Tyr Met Ser Lys Ala His Gly Val Asp Pro Asn Ile Arg Thr Gly Val
245 250 255
Arg Thr Ile Thr Thr Gly Ser Pro Ile Thr Tyr Ser Thr Tyr Gly Lys
260 265 270
Phe Leu Ala Asp Gly Gly Cys Ser Gly Gly Ala Tyr Asp Ile Ile Ile
275 280 285
Cys Asp Glu Cys His Ser Thr Asp Ala Thr Ser Ile Leu Gly Ile Gly
290 295 300
Thr Val Leu Asp Gln Ala Glu Thr Ala Gly Ala Arg Leu Val Val Leu
305 310 315 320
Ala Thr Ala Thr Pro Pro Gly Ser Val Thr Val Ser His Pro Asn Ile
325 330 335
Glu Glu Val Ala Leu Ser Thr Thr Gly Glu Ile Pro Phe Tyr Gly Lys
340 345 350
Ala Ile Pro Leu Glu Val Ile Lys Gly Gly Arg His Leu Ile Phe Cys
355 360 365
His Ser Lys Lys Lys Cys Asp Glu Leu Ala Ala Lys Leu Val Ala Leu
370 375 380
Gly Ile Asn Ala Val Ala Tyr Tyr Arg Gly Leu Asp Val Ser Val Ile
385 390 395 400
Pro Thr Ser Gly Asp Val Val Val Val Ser Thr Asp Ala Leu Met Thr
405 410 415
Gly Phe Thr Gly Asp Phe Asp Ser Val Ile Asp Cys Asn Thr Cys Val
420 425 430
Thr Gln Thr Val Asp Phe Ser Leu Asp Pro Thr Phe Thr Ile Glu Thr
435 440 445
Thr Thr Leu Pro Gln Asp Ala Val Ser Arg Thr Gln Arg Arg Gly Arg
450 455 460
Thr Gly Arg Gly Lys Pro Gly Ile Tyr Arg Phe Val Ala Pro Gly Glu
465 470 475 480
Arg Pro Ser Gly Met Phe Asp Ser Ser Val Leu Cys Glu Cys Tyr Asp
485 490 495
Ala Gly Cys Ala Trp Tyr Glu Leu Thr Pro Ala Glu Thr Thr Val Arg
500 505 510
Leu Arg Ala Tyr Met Asn Thr Pro Gly Leu Pro Val Cys Gln Asp His
515 520 525
Leu Glu Phe Trp Glu Gly Val Phe Thr Gly Leu Thr His Ile Asp Ala
530 535 540
His Phe Leu Ser Gln Thr Lys Gln Ser Gly Glu Asn Phe Pro Tyr Leu
545 550 555 560
Val Ala Tyr Gln Ala Thr Val Cys Ala Arg Ala Gln Ala Pro Pro Pro
565 570 575
Ser Trp Asp Gln Met Trp Lys Cys Leu Ile Arg Leu Lys Pro Thr Leu
580 585 590
His Gly Pro Thr Pro Leu Leu Tyr Arg Leu Gly Ala Val Gln Asn Glu
595 600 605
Val Thr Leu Thr His Pro Ile Thr Lys Tyr Ile Met Thr Cys Met Ser
610 615 620
Ala Asp Leu Glu Val Val Thr
625 630
Claims (65)
- 하기 화학식 I의 화합물.<화학식 I>상기 식 중,R1은 임의로 치환된 아릴, 적어도 하나의 N, O 또는 S를 포함하는 임의로 치환된 헤테로시클릴, 임의로 치환된 아릴알킬, 또는 헤테로시클릴계 내에 적어도 하나의 N, O 또는 S를 포함하는 임의로 치환된 헤테로시클릴알킬이고;R2, R3 및 R4는 각각 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C6 내지 C20 아릴알킬, 임의로 치환된 C3 내지 C20 시클로알킬알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 할로, 시아노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 술파밀, 술포닐, 술피닐, 티오카르보닐, 티오카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되거나;R2, R3 및 R4 중 적어도 2개가 연결되어 비치환 또는 치환된 3 내지 20원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 및 황으로 이루어진 군 중에서 선택되고;단, 화학식 I은 하기 구조를 포함하지 않는다.
- 제1항에 있어서, R1이 임의로 치환된 아릴, 또는 적어도 하나의 N, O 또는 S를 포함하는 임의로 치환된 헤테로시클릴인 화합물.
- 제1항에 있어서, R2, R3 및 R4가 각각 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C6 내지 C20 아릴알킬, 임의로 치환된 C3 내지 C20 시클로알킬알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 카르바밀, 케토, 카르보닐, 카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되는 것인 화합물.
- 제1항에 있어서, R2, R3 및 R4 중 적어도 2개가 연결되어 비치환 또는 치환된 3 내지 7원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 또는 황으로 이루어진 군 중에서 선택되는 것인 화합물.
- 제2항에 있어서, R1이 티오펜인 화합물.
- 제5항에 있어서, R2, R3 및 R4가 각각 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C6 내지 C20 아릴알킬, 임의로 치환된 C3 내지 C20 시클로알킬알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 카르바밀, 케토, 카르보닐, 카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되는 것인 화합물.
- 제5항에 있어서, R2, R3 및 R4 중 적어도 2개가 연결되어 비치환 또는 치환된 3 내지 7원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 또는 황으로 이루어진 군 중에서 선택되는 것인 화합물.
- 제2항에 있어서, R1이 임의로 치환된 페닐인 화합물.
- 제8항에 있어서, R2, R3 및 R4가 각각 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C6 내지 C20 아릴알킬, 임의로 치환된 C3 내지 C20 시클로알킬알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 카르바밀, 케토, 카르보닐, 카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되는 것인 화합물.
- 제8항에 있어서, R2, R3 및 R4 중 적어도 2개가 연결되어 비치환 또는 치환된 3 내지 7원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 또는 황으로 이루어진 군 중에서 선택되는 것인 화합물.
- 제1항에 있어서, I-1 내지 I-183 중에서 선택되는 화학식을 갖는 화합물.
- 하기 화학식 II의 화합물.<화학식 II>상기 식 중,R12, R13, R14 및 R17은 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의 로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 할로, 시아노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 술파밀, 술포닐, 술피닐, 티오카르보닐, 티오카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되고; 단, R12, R13, R14 및 R17 모두가 H는 아니고;R15 및 R16은 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 모노- 및 디-(C1 내지 C20)알킬아미노, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 및 이들의 조합으로 이루어진 군 중에서 선택되거나;R15 및 R16이 함께 비치환 또는 치환된 3 내지 7원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 또는 황으로 이루어진 군 중에서 선택되고;단, 화학식 II는 하기 구조를 포함하지 않는다.
- 제12항에 있어서, R12, R13, R14 및 R17이 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C1 내지 C20 알킬티오, 할로, 시아 노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 및 카르복시로 이루어진 군 중에서 선택되는 것인 화합물.
- 제12항에 있어서, R15 및 R16이 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 모노- 및 디-(C1 내지 C20)알킬아미노, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 카르바밀, 케토, 카르보닐, 카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되는 것인 화합물.
- 제12항에 있어서, R15 및 R16이 함께 비치환 또는 치환된 4 내지 6원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 및 황으로 이루어진 군 중에서 선택되는 것인 화합물.
- 제12항에 있어서, 하기 화학식 III의 화합물.<화학식 III>상기 식 중,R11은 H, 할로, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 또는 임의로 치환된 C1 내지 C20 알콕시이고;R12, R13 및 R14는 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 할로, 시아노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드 라지노, 구아닐릴, 술파밀, 술포닐, 술피닐, 티오카르보닐, 티오카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되고; 단, R12, R13 및 R14 모두가 H는 아니고;R15 및 R16은 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 모노- 및 디-(C1 내지 C20)알킬아미노, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 및 이들의 조합으로 이루어진 군 중에서 선택되거나;R15 및 R16이 함께 비치환 또는 치환된 3 내지 7원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 또는 황으로 이루어진 군 중에서 선택된다.
- 제16항에 있어서, R11이 H, 할로, 임의로 치환된 C1 내지 C20 알킬, 또는 임의 로 치환된 C1 내지 C20 알콕시인 화합물.
- 제16항에 있어서, R12, R13, 및 R14가 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C1 내지 C20 알킬티오, 할로, 시아노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 술파밀, 술포닐, 술피닐, 티오카르보닐, 티오카르복시, 및 이들의 조합으로 이루어지는 군 중에서 선택되고; 단, R12, R13, 및 R14 모두가 H는 아닌 것인 화합물.
- 제16항에 있어서, R12, R13, 및 R14가 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C1 내지 C20 알킬티오, 할로, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 및 이들의 조합으로 이루어지는 군 중에서 선택되고; 단, R12, R13, 및 R14 모두가 H는 아닌 것인 화합물.
- 제16항에 있어서, R15 및 R16이 개별적으로, H, 임의로 치환된 C1 내지 C20 알 킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C3 내지 C20 헤테로시클릴알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 모노- 및 디-(C1 내지 C20)알킬아미노, 카르바밀, 케토, 카르보닐, 카르복시, 및 이들의 조합으로 이루어지는 군 중에서 선택되는 것인 화합물.
- 제16항에 있어서, R15 및 R16이 함께 비치환 또는 치환된 4 또는 6원 고리를 형성하며, 고리의 구성원은 탄소, 질소, 산소, 또는 황으로 이루어진 군 중에서 선택되는 것인 화합물.
- 제16항에 있어서, R11이 플루오로이고, R12, R13, 및 R14가 개별적으로, H, 알킬, 및 할로로 이루어진 군 중에서 선택되는 것인 화합물.
- 제16항에 있어서, II-1 내지 II-82 중에서 선택된 화학식을 갖는 화합물.
- 제24항에 있어서, II-1 내지 II-82 중에서 선택된 화학식을 갖는 화합물.
- 하기 화학식 IV의 화합물.<화학식 IV>상기 식 중,R12, R13, R14 및 R17은 개별적으로, H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 할로, 시아노, 머캅토, 히드록시, 모노- 및 디-(C1 내지 C20)알킬아미노, 시아노아미노, 니트로, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 술파밀, 술포닐, 술피닐, 티오카르보닐, 티오카르복시, 및 이들의 조합으로 이루어진 군 중에서 선택되고; 단, R12, R13, R14 및 R17 모두가 H는 아니고;R15는 H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알케닐, 임의로 치환된 C1 내지 C20 알키닐, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 시클로알킬, 임의로 치환된 C3 내지 C20 부분 포화 또는 완전 포화 헤테로시클릭, 임의로 치환된 C5 내지 C20 아릴, 임의로 치환된 C2 내지 C20 헤테로아릴, 임의로 치환된 C1 내지 C20 헤테로시클릴알킬, 임의로 치환된 C5 내지 C20 헤테로아릴알킬, 임의로 치환된 C1 내지 C20 알콕시, 임의로 치환된 C5 내지 C20 아릴옥시, 임의로 치환된 C1 내지 C20 알킬티오, 임의로 치환된 C1 내지 C20 아릴티오, 모노- 및 디-(C1 내지 C20)알킬아미노, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 및 이들의 조합으로 이루어진 군 중에서 선택되고;R18은 H, 임의로 치환된 C1 내지 C20 알킬, 임의로 치환된 C1 내지 C20 알콕시, 모노- 및 디-(C1 내지 C20)알킬아미노, 카르바밀, 케토, 카르보닐, 카르복시, 글리콜릴, 글리실, 히드라지노, 구아닐릴, 및 이들의 조합으로 이루어진 군 중에서 선택된다.
- 제약상 허용되는 부형제 및 제1 내지 26항 중 어느 한 항의 화합물을 포함하는 제약 조성물.
- NS3 단백질을 유효량의 제1 내지 26항 중 어느 한 항의 화합물 또는 제27항의 제약 조성물과 접촉시키는 것을 포함하는, NS3 활성을 조절하는 방법.
- 제28항에 있어서, 접촉이 생체 외에서 일어나는 것인 방법.
- 제28항에 있어서, 접촉이 생체 내에서 일어나는 것인 방법.
- 제30항에 있어서, 접촉이 인체 내에서 일어나는 것인 방법.
- 제31항에 있어서, C형 간염에 걸린 사람을 확인하는 것을 추가로 포함하는 방법.
- 제28항에 있어서, NS3 단백질이 NS3 헬리카제 도메인을 포함하는 것인 방법.
- 제28항에 있어서, NS3 헬리카제 활성을 억제하는 것을 포함하는 방법.
- 화합물과 NS3 헬리카제의 결합이 용이하도록 구성된 관능기를 적어도 하나 포함하며, 상기 결합이 NS3 헬리카제 활성 조절에 효과적인 것인 화합물.
- 제35항에 있어서, 결합이 NS3 헬리카제에 의한 핵산 기질의 풀림(unwinding) 억제에 효과적인 것인 화합물.
- 제36항에 있어서, 핵산 기질이 DNA 또는 RNA인 화합물.
- 제35항에 있어서, 결합이 NS3 헬리카제의 알로스테리 이동 (allosteric movement)을 용이하게 하는 것인 화합물.
- 제35항에 있어서, 관능기가, 화합물과 NS3 헬리카제 도메인 1의 결합이 용이하도록 구성된 것인 화합물.
- 제39항에 있어서, 관능기가, 화합물과 NS3 헬리카제 도메인 1 내의 적어도 하나의 잔기의 결합이 용이하도록 구성된 것인 화합물.
- 제40항에 있어서, 잔기가 잔기 209 내지 221, 잔기 286 내지 288, 잔기 317 내지 319, 또는 잔기 214 내지 218 중 어느 한 잔기인 화합물.
- 제35항에 있어서, 관능기가, 화합물과 NS3 헬리카제 도메인 2의 결합이 용이하도록 구성된 것인 화합물.
- 제42항에 있어서, 관능기가, 화합물과 NS3 헬리카제 도메인 2 내의 적어도 하나의 잔기의 결합이 용이하도록 구성된 것인 화합물.
- 제43항에 있어서, 잔기가 잔기 412 내지 423, 잔기 363, 잔기 365, 잔기 406, 잔기 408, 잔기 391, 잔기 397, 잔기 400, 또는 잔기 400 내지 404 중 어느 한 잔기인 화합물.
- 제35항에 있어서, 조절 활성이 억제인 화합물.
- 제35항에 있어서, 명세서에 기재된 I-1 내지 I-183 및 II-1 내지 II-82 중 어느 한 화합물.
- 제35항의 화합물 및 제약상 허용되는 담체를 포함하는 제약 조성물.
- 제47항에 있어서, 화합물이 명세서에 기재된 I-1 내지 I-183 및 II-1 내지 II-82 중 어느 한 화합물인 제약 조성물.
- NS3 단백질을 제35항의 화합물과 접촉시키는 것을 포함하는, NS3 헬리카제 활성을 조절하는 방법.
- 제49항에 있어서, 접촉이 생체 외에서 일어나는 것인 방법.
- 제49항에 있어서, 접촉이 생체 내에서 일어나는 것인 방법.
- 제51항에 있어서, 접촉이 인체 내에서 일어나는 것인 방법.
- 제52항에 있어서, C형 간염에 걸린 사람을 확인하는 단계를 추가로 포함하는 방법.
- NS3 단백질의 NS3 활성을 조절하는데 사용하기 위한, 제1항 내지 제26항 중 어느 한 항의 화합물 또는 제27항의 제약 조성물.
- 제54항에 있어서, 단백질이 생체 외에 존재하는 것인 화합물 또는 제약 조성물.
- 제54항에 있어서, 단백질이 생체 내에 존재하는 것인 화합물 또는 제약 조성물.
- 제56항에 있어서, 단백질이 인체 내에 존재하는 것인 화합물 또는 제약 조성물.
- 제54항에 있어서, C형 간염을 치료하는데 사용하기 위한 화합물 또는 제약 조성물.
- 제54항에 있어서, NS3 단백질이 NS3 헬리카제 도메인을 포함하는 것인 화합물 또는 제약 조성물.
- 제54항에 있어서, NS3 헬리카제 활성을 억제하는데 사용하기 위한 화합물 또는 제약 조성물.
- NS3 단백질의 NS3 헬리카제 활성을 조절하는데 사용하기 위한, 제35항의 화합물.
- 제61항에 있어서, 단백질이 생체 외에 존재하는 것인 화합물.
- 제61항에 있어서, 단백질이 생체 내에 존재하는 것인 화합물.
- 제63항에 있어서, 단백질이 인체 내에 존재하는 것인 화합물.
- 제61항에 있어서, C형 간염을 치료하는데 사용하기 위한 화합물.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US72558405P | 2005-10-11 | 2005-10-11 | |
| US60/725,584 | 2005-10-11 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20080066949A true KR20080066949A (ko) | 2008-07-17 |
Family
ID=37890668
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020087011224A KR20080066949A (ko) | 2005-10-11 | 2006-10-10 | 바이러스 복제 억제제 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US20090099186A1 (ko) |
| EP (1) | EP1943228A2 (ko) |
| JP (1) | JP2009513576A (ko) |
| KR (1) | KR20080066949A (ko) |
| CN (2) | CN102304075A (ko) |
| AU (1) | AU2006303955A1 (ko) |
| BR (1) | BRPI0617271A2 (ko) |
| CA (1) | CA2624166A1 (ko) |
| WO (1) | WO2007047146A2 (ko) |
Families Citing this family (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8168667B2 (en) | 2006-05-31 | 2012-05-01 | Galapagos Nv | Imidazolidine derivatives, uses therefor, preparation thereof and compositions comprising such |
| CN101687789A (zh) * | 2007-02-12 | 2010-03-31 | 因特蒙公司 | C型肝炎病毒复制的新颖抑制剂 |
| GB0707051D0 (en) * | 2007-04-12 | 2007-05-30 | Istituto Di Ricerche D Biolog | Antiviral agents |
| GB2463514C (en) | 2008-09-11 | 2018-09-26 | Galapagos Nv | Imidazolidine compounds and uses therefor |
| CN104803986A (zh) | 2008-12-23 | 2015-07-29 | 哈佛大学校长及研究员协会 | 坏死性凋亡的小分子抑制剂 |
| CN102939284A (zh) * | 2010-06-15 | 2013-02-20 | 卫材R&D管理有限公司 | Hcv感染症治疗剂 |
| EP2664616A1 (en) * | 2012-05-15 | 2013-11-20 | Vivalis | Hydantoin and thiohydantoin derivatives as antiviral drugs |
| CN105189456B (zh) * | 2013-03-15 | 2017-12-19 | 亚瑞克西斯制药公司 | Kras g12c的共价抑制剂 |
| WO2014145022A1 (en) | 2013-03-15 | 2014-09-18 | President And Fellows Of Harvard College | Hybrid necroptosis inhibitors |
| UY35464A (es) | 2013-03-15 | 2014-10-31 | Araxes Pharma Llc | Inhibidores covalentes de kras g12c. |
| JO3805B1 (ar) | 2013-10-10 | 2021-01-31 | Araxes Pharma Llc | مثبطات كراس جي12سي |
| KR20170123607A (ko) | 2014-12-11 | 2017-11-08 | 프레지던트 앤드 펠로우즈 오브 하바드 칼리지 | 세포 괴사 억제제 및 관련 방법 |
| JP2018513853A (ja) | 2015-04-10 | 2018-05-31 | アラクセス ファーマ エルエルシー | 置換キナゾリン化合物およびその使用方法 |
| JP6789239B2 (ja) | 2015-04-15 | 2020-11-25 | アラクセス ファーマ エルエルシー | Krasの縮合三環系インヒビターおよびその使用の方法 |
| US10144724B2 (en) | 2015-07-22 | 2018-12-04 | Araxes Pharma Llc | Substituted quinazoline compounds and methods of use thereof |
| EP3356353A1 (en) | 2015-09-28 | 2018-08-08 | Araxes Pharma LLC | Inhibitors of kras g12c mutant proteins |
| US10689356B2 (en) | 2015-09-28 | 2020-06-23 | Araxes Pharma Llc | Inhibitors of KRAS G12C mutant proteins |
| WO2017058807A1 (en) | 2015-09-28 | 2017-04-06 | Araxes Pharma Llc | Inhibitors of kras g12c mutant proteins |
| US10730867B2 (en) | 2015-09-28 | 2020-08-04 | Araxes Pharma Llc | Inhibitors of KRAS G12C mutant proteins |
| US10975071B2 (en) | 2015-09-28 | 2021-04-13 | Araxes Pharma Llc | Inhibitors of KRAS G12C mutant proteins |
| EP3356351A1 (en) | 2015-09-28 | 2018-08-08 | Araxes Pharma LLC | Inhibitors of kras g12c mutant proteins |
| WO2017058792A1 (en) | 2015-09-28 | 2017-04-06 | Araxes Pharma Llc | Inhibitors of kras g12c mutant proteins |
| MX2018005967A (es) | 2015-11-16 | 2018-08-29 | Araxes Pharma Llc | Compuestos de quinazolina 2-sustituida que comprenden un grupo heterociclico sustituido y metodos de uso de los mismos. |
| US10646488B2 (en) | 2016-07-13 | 2020-05-12 | Araxes Pharma Llc | Conjugates of cereblon binding compounds and G12C mutant KRAS, HRAS or NRAS protein modulating compounds and methods of use thereof |
| JP2019529484A (ja) | 2016-09-29 | 2019-10-17 | アラクセス ファーマ エルエルシー | Kras g12c変異体タンパク質の阻害剤 |
| CN110312711A (zh) | 2016-10-07 | 2019-10-08 | 亚瑞克西斯制药公司 | 作为ras抑制剂的杂环化合物及其使用方法 |
| US11279689B2 (en) | 2017-01-26 | 2022-03-22 | Araxes Pharma Llc | 1-(3-(6-(3-hydroxynaphthalen-1-yl)benzofuran-2-yl)azetidin-1 yl)prop-2-en-1-one derivatives and similar compounds as KRAS G12C modulators for treating cancer |
| US11358959B2 (en) | 2017-01-26 | 2022-06-14 | Araxes Pharma Llc | Benzothiophene and benzothiazole compounds and methods of use thereof |
| EP3573954A1 (en) | 2017-01-26 | 2019-12-04 | Araxes Pharma LLC | Fused bicyclic benzoheteroaromatic compounds and methods of use thereof |
| JP7327802B2 (ja) | 2017-01-26 | 2023-08-16 | アラクセス ファーマ エルエルシー | 縮合ヘテロ-ヘテロ二環式化合物およびその使用方法 |
| EP3573970A1 (en) | 2017-01-26 | 2019-12-04 | Araxes Pharma LLC | 1-(6-(3-hydroxynaphthalen-1-yl)quinazolin-2-yl)azetidin-1-yl)prop-2-en-1-one derivatives and similar compounds as kras g12c inhibitors for the treatment of cancer |
| TW201900633A (zh) | 2017-05-25 | 2019-01-01 | 美商亞瑞克西斯製藥公司 | Kras之共價抑制劑 |
| US11639346B2 (en) | 2017-05-25 | 2023-05-02 | Araxes Pharma Llc | Quinazoline derivatives as modulators of mutant KRAS, HRAS or NRAS |
| JP2020521741A (ja) | 2017-05-25 | 2020-07-27 | アラクセス ファーマ エルエルシー | がんの処置のための化合物およびその使用の方法 |
| CA3107168A1 (en) | 2018-08-01 | 2020-02-06 | Araxes Pharma Llc | Heterocyclic spiro compounds and methods of use thereof for the treatment of cancer |
| AR116635A1 (es) * | 2018-10-15 | 2021-05-26 | Servier Lab | Proceso para la síntesis de derivados de piperazinil-etoxi-bromofenilo y su aplicación en la producción de compuestos que los contienen |
| WO2022229458A1 (en) * | 2021-04-30 | 2022-11-03 | Carlsson Jens | Substituted hydantoin compounds, methods for preparation thereof and use thereof in the treatment and/or prevention of a corona virus disease |
Family Cites Families (50)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE945510C (de) * | 1953-06-24 | 1956-07-12 | Thomae Gmbh Dr K | Verfahren zur Herstellung von 5, 5-Dipyridyl-(2')-hydantoinen |
| DE1018261B (de) * | 1956-06-20 | 1957-10-24 | Basf Ag | Mittel zur Bekaempfung unerwuenschten Pflanzenwuchses |
| GB879217A (en) * | 1957-07-23 | 1961-10-04 | Geigy Ag J R | Substituted hydantoin derivatives, processes of preparing them and herbicidal compositions containing them |
| US3134663A (en) * | 1957-07-23 | 1964-05-26 | Geigy Chem Corp | Herbicidal composition and method employing hydantoins |
| FR1389841A (fr) * | 1964-03-20 | 1965-02-19 | Gen Electric | Chélates métalliques de 5-carboxy-hydantoïnes, et procédés pour leur préparation et celle de dérivés hydrolysables en alpha-amino-acides |
| FR1074999A (fr) * | 1964-12-16 | 1954-10-11 | Paul Hug Ets | Appareil pour le contrôle de la hauteur des dents de scies et outils similaires |
| US3448116A (en) * | 1966-04-25 | 1969-06-03 | American Home Prod | Preparation of 1-hydroxyhydantoins and 1-hydroxythiohydantoins |
| US3494932A (en) * | 1967-06-26 | 1970-02-10 | American Cyanamid Co | Aminoalkyl substituted aryl hydantoins |
| NO124370B (ko) * | 1968-03-28 | 1972-04-10 | Ciba Geigy Ag | |
| DK123717B (da) * | 1968-11-25 | 1972-07-24 | Sumitomo Chemical Co | 3-(3',5'-Dihalogenphenyl)-imidazolidin-2,4-dionderivater med mirobicid virkning. |
| US3948939A (en) * | 1970-06-02 | 1976-04-06 | Sterling Drug Inc. | 9-Acyl-1,2,3,4-tetrahydrocarbazole-3 and 4-carboxylic acids |
| JPS5136332B1 (ko) * | 1970-12-09 | 1976-10-07 | ||
| CH544491A (de) * | 1971-03-16 | 1973-11-30 | Ciba Geigy Ag | Herbizides Mittel |
| US3939177A (en) * | 1972-11-22 | 1976-02-17 | Sterling Drug Inc. | 4-Aminomethyl-9-benzyl-1,2,3,4-tetrahydrocarbazoles |
| US3979391A (en) * | 1972-11-22 | 1976-09-07 | Sterling Drug Inc. | 1,2,3,4-Tetrahydrocarbazoles |
| IL45459A (en) * | 1973-09-03 | 1978-01-31 | Ciba Geigy Ag | 1-(dichlorofluoromethylthio)-3-phenyl-imidazolidine-2,4-dione derivatives their preparation and their use as bactericides and fungicides |
| JPS5195134A (ko) * | 1975-02-10 | 1976-08-20 | ||
| US4536505A (en) * | 1983-05-17 | 1985-08-20 | Ciba-Geigy Corporation | Certain N-(pyridyl) indoles |
| JPH0653719B2 (ja) * | 1986-12-26 | 1994-07-20 | 住友化学工業株式会社 | 不斉シアンヒドリンの製造法 |
| US5354866A (en) * | 1989-05-23 | 1994-10-11 | Abbott Laboratories | Retroviral protease inhibiting compounds |
| US5539122A (en) * | 1989-05-23 | 1996-07-23 | Abbott Laboratories | Retroviral protease inhibiting compounds |
| US5310562A (en) * | 1989-11-22 | 1994-05-10 | Margolin Solomon B | Composition and method for reparation and prevention of fibrotic lesions |
| US5716632A (en) * | 1989-11-22 | 1998-02-10 | Margolin; Solomon B. | Compositions and methods for reparation and prevention of fibrotic lesions |
| US5518729A (en) * | 1989-11-22 | 1996-05-21 | Margolin; Solomon B. | Compositions and methods for reparation and prevention of fibrotic lesions |
| US5130430A (en) * | 1990-10-31 | 1992-07-14 | Neurogen Corporation | 2-substituted imidazoquinoxaline diones, a new class of gaba brain receptor ligands |
| US5324483B1 (en) * | 1992-10-08 | 1996-09-24 | Warner Lambert Co | Apparatus for multiple simultaneous synthesis |
| EP1090914B1 (en) * | 1992-12-29 | 2003-01-02 | Abbott Laboratories | Retroviral protease inhibiting compounds |
| US6090822A (en) * | 1995-03-03 | 2000-07-18 | Margolin; Solomon B. | Treatment of cytokine growth factor caused disorders |
| PL192280B1 (pl) * | 1996-10-18 | 2006-09-29 | Vertex Pharma | Inhibitory proteaz serynowych, a zwłaszcza proteazy wirusa NS3 zapalenia wątroby C, kompozycja farmaceutyczna i zastosowania |
| US6232333B1 (en) * | 1996-11-21 | 2001-05-15 | Abbott Laboratories | Pharmaceutical composition |
| EA199900758A1 (ru) * | 1997-03-03 | 2000-04-24 | Бёрингер Ингельхайм Фармасьютиклс, Инк. | Малые молекулы, полезные при лечении воспалительных заболеваний |
| WO1999032489A1 (en) * | 1997-12-23 | 1999-07-01 | Alcon Laboratories, Inc. | Muscarinic agents and use thereof to treat glaucoma, myopia and various other conditions |
| WO2000024725A1 (en) * | 1998-10-26 | 2000-05-04 | Vertex Pharmaceuticals Incorporated | Pentacyclic compounds useful as inhibitors of hepatitis c virus ns3 helicase |
| WO2001007027A2 (en) * | 1999-07-22 | 2001-02-01 | Vertex Pharmaceuticals Incorporated | Pyrimidine derivatives for the treatment of viral diseases |
| US7256005B2 (en) * | 1999-08-10 | 2007-08-14 | The Chancellor, Masters And Scholars Of The University Of Oxford | Methods for identifying iminosugar derivatives that inhibit HCV p7 ion channel activity |
| WO2001046195A1 (en) * | 1999-12-21 | 2001-06-28 | Gpi Nil Holdings, Inc. | Hydantoin derivative compounds, pharmaceutical compositions, and methods of using same |
| US7371397B2 (en) * | 2000-01-18 | 2008-05-13 | Albemarle Corporation | Methods for microbiological control in aqueous systems |
| US6482829B2 (en) * | 2000-06-08 | 2002-11-19 | Hoffmann-La Roche Inc. | Substituted heterocyclic siprodecane compound active as an antagonist of neurokinin 1 receptor |
| US20030114420A1 (en) * | 2000-06-28 | 2003-06-19 | Salvati Mark E. | Fused cyclic modulators of nuclear hormone receptor function |
| EP1432700B1 (en) * | 2001-10-01 | 2009-11-04 | Bristol-Myers Squibb Company | Spiro-hydantoin compounds useful as anti-inflammatory agents |
| AU2003288198A1 (en) * | 2002-11-28 | 2004-06-18 | Schering Aktiengesellschaft | CHK-,PDK- and AKT-inhibitory pyrimidines, their production and use as pharmaceutical agents |
| US7223785B2 (en) * | 2003-01-22 | 2007-05-29 | Boehringer Ingelheim International Gmbh | Viral polymerase inhibitors |
| US7199125B2 (en) * | 2003-10-02 | 2007-04-03 | Bristol-Myers Squibb Company | Spiro-cyclic compounds useful as anti-inflammatory agents |
| KR20070083484A (ko) * | 2004-07-14 | 2007-08-24 | 피티씨 테라퓨틱스, 인크. | C형 간염 치료 방법 |
| TW200616634A (en) * | 2004-10-01 | 2006-06-01 | Bristol Myers Squibb Co | Crystalline forms and process for preparing spiro-hydantoin compounds |
| US20060142319A1 (en) * | 2004-12-14 | 2006-06-29 | Bang-Chi Chen | Pyridyl-substituted spiro-hydantoin crystalline forms and process |
| US7186727B2 (en) * | 2004-12-14 | 2007-03-06 | Bristol-Myers Squibb Company | Pyridyl-substituted spiro-hydantoin compounds and use thereof |
| UA95788C2 (en) * | 2005-12-15 | 2011-09-12 | Ф. Хоффманн-Ля Рош Аг | Fused pyrrole derivatives |
| US7687459B2 (en) * | 2006-08-11 | 2010-03-30 | Enanta Pharmaceuticals, Inc. | Arylalkoxyl hepatitis C virus protease inhibitors |
| CN101687789A (zh) * | 2007-02-12 | 2010-03-31 | 因特蒙公司 | C型肝炎病毒复制的新颖抑制剂 |
-
2006
- 2006-10-10 CA CA002624166A patent/CA2624166A1/en not_active Abandoned
- 2006-10-10 US US12/089,903 patent/US20090099186A1/en not_active Abandoned
- 2006-10-10 CN CN2011101158610A patent/CN102304075A/zh active Pending
- 2006-10-10 AU AU2006303955A patent/AU2006303955A1/en not_active Abandoned
- 2006-10-10 CN CNA2006800380292A patent/CN101304976A/zh active Pending
- 2006-10-10 EP EP06816360A patent/EP1943228A2/en not_active Withdrawn
- 2006-10-10 KR KR1020087011224A patent/KR20080066949A/ko not_active Application Discontinuation
- 2006-10-10 WO PCT/US2006/039044 patent/WO2007047146A2/en active Application Filing
- 2006-10-10 BR BRPI0617271-7A patent/BRPI0617271A2/pt not_active IP Right Cessation
- 2006-10-10 JP JP2008535577A patent/JP2009513576A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| JP2009513576A (ja) | 2009-04-02 |
| CN101304976A (zh) | 2008-11-12 |
| AU2006303955A1 (en) | 2007-04-26 |
| BRPI0617271A2 (pt) | 2011-07-19 |
| CN102304075A (zh) | 2012-01-04 |
| WO2007047146A3 (en) | 2007-11-01 |
| EP1943228A2 (en) | 2008-07-16 |
| WO2007047146A2 (en) | 2007-04-26 |
| CA2624166A1 (en) | 2007-04-26 |
| US20090099186A1 (en) | 2009-04-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20080066949A (ko) | 바이러스 복제 억제제 | |
| US7781474B2 (en) | Inhibitors of hepatitis C virus replication | |
| US7932277B2 (en) | Peptide inhibitors of hepatitis C virus replication | |
| JP5249028B2 (ja) | C型肝炎ウイルス複製の新規大環状阻害剤 | |
| US8119592B2 (en) | Compounds and methods for inhibiting hepatitis C viral replication | |
| WO2012047764A1 (en) | Therapeutic antiviral peptides | |
| WO2012037259A1 (en) | Novel inhibitors of hepatitis c virus replication | |
| MX2008004749A (en) | Inhibitors of viral replication | |
| BLATT et al. | Patent 2657035 Summary | |
| US20110110890A1 (en) | Novel Inhibitors of Hepatitis C Virus Replication |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E601 | Decision to refuse application |