KR20070106716A - 위치 규칙성 중합체의 제조 방법 - Google Patents
위치 규칙성 중합체의 제조 방법 Download PDFInfo
- Publication number
- KR20070106716A KR20070106716A KR1020077018332A KR20077018332A KR20070106716A KR 20070106716 A KR20070106716 A KR 20070106716A KR 1020077018332 A KR1020077018332 A KR 1020077018332A KR 20077018332 A KR20077018332 A KR 20077018332A KR 20070106716 A KR20070106716 A KR 20070106716A
- Authority
- KR
- South Korea
- Prior art keywords
- polymer
- thiophene
- magnesium
- alkyl
- formula
- Prior art date
Links
- 229920000642 polymer Polymers 0.000 title claims abstract description 102
- 238000000034 method Methods 0.000 title claims abstract description 90
- 230000008569 process Effects 0.000 title claims abstract description 31
- 229930192474 thiophene Natural products 0.000 claims abstract description 51
- 239000000463 material Substances 0.000 claims abstract description 30
- 239000004065 semiconductor Substances 0.000 claims abstract description 19
- 230000003287 optical effect Effects 0.000 claims abstract description 9
- 230000005669 field effect Effects 0.000 claims abstract description 7
- 150000003577 thiophenes Chemical class 0.000 claims abstract description 7
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Divinylene sulfide Natural products C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 claims description 95
- -1 organomagnesium halide Chemical class 0.000 claims description 69
- 239000011777 magnesium Substances 0.000 claims description 49
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 claims description 48
- 229910052749 magnesium Inorganic materials 0.000 claims description 47
- 125000000217 alkyl group Chemical group 0.000 claims description 40
- 125000004432 carbon atom Chemical group C* 0.000 claims description 39
- 239000003054 catalyst Substances 0.000 claims description 28
- 239000000543 intermediate Substances 0.000 claims description 26
- 229910052801 chlorine Inorganic materials 0.000 claims description 24
- 239000002904 solvent Substances 0.000 claims description 24
- 238000006116 polymerization reaction Methods 0.000 claims description 21
- 239000011541 reaction mixture Substances 0.000 claims description 21
- 239000000203 mixture Substances 0.000 claims description 19
- 239000000243 solution Substances 0.000 claims description 19
- 229910052731 fluorine Inorganic materials 0.000 claims description 18
- 229910052794 bromium Inorganic materials 0.000 claims description 13
- 150000004820 halides Chemical class 0.000 claims description 12
- 125000001072 heteroaryl group Chemical group 0.000 claims description 12
- PXHVJJICTQNCMI-UHFFFAOYSA-N nickel Substances [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 claims description 12
- 125000003118 aryl group Chemical group 0.000 claims description 11
- 238000010168 coupling process Methods 0.000 claims description 11
- 238000005859 coupling reaction Methods 0.000 claims description 11
- 238000004519 manufacturing process Methods 0.000 claims description 11
- 230000008878 coupling Effects 0.000 claims description 10
- 229910052740 iodine Inorganic materials 0.000 claims description 10
- 239000010408 film Substances 0.000 claims description 9
- 150000008282 halocarbons Chemical class 0.000 claims description 8
- 229910052736 halogen Inorganic materials 0.000 claims description 8
- 229910052739 hydrogen Inorganic materials 0.000 claims description 8
- 239000000126 substance Substances 0.000 claims description 8
- 150000002367 halogens Chemical class 0.000 claims description 7
- 238000010992 reflux Methods 0.000 claims description 7
- 125000003545 alkoxy group Chemical group 0.000 claims description 6
- 230000003197 catalytic effect Effects 0.000 claims description 6
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 6
- 125000003107 substituted aryl group Chemical group 0.000 claims description 6
- 125000004001 thioalkyl group Chemical group 0.000 claims description 6
- 125000003342 alkenyl group Chemical group 0.000 claims description 5
- 125000001153 fluoro group Chemical group F* 0.000 claims description 5
- 125000004434 sulfur atom Chemical group 0.000 claims description 5
- 239000000725 suspension Substances 0.000 claims description 5
- SNRUBQQJIBEYMU-UHFFFAOYSA-N Dodecane Natural products CCCCCCCCCCCC SNRUBQQJIBEYMU-UHFFFAOYSA-N 0.000 claims description 4
- 229920001400 block copolymer Polymers 0.000 claims description 4
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 4
- 125000003438 dodecyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 4
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 4
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 4
- 238000002347 injection Methods 0.000 claims description 4
- 239000007924 injection Substances 0.000 claims description 4
- 125000001400 nonyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 4
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 4
- 239000003960 organic solvent Substances 0.000 claims description 4
- 125000004430 oxygen atom Chemical group O* 0.000 claims description 4
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 claims description 4
- 239000000758 substrate Substances 0.000 claims description 4
- 239000010409 thin film Substances 0.000 claims description 4
- 125000002948 undecyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 4
- QFMZQPDHXULLKC-UHFFFAOYSA-N 1,2-bis(diphenylphosphino)ethane Chemical compound C=1C=CC=CC=1P(C=1C=CC=CC=1)CCP(C=1C=CC=CC=1)C1=CC=CC=C1 QFMZQPDHXULLKC-UHFFFAOYSA-N 0.000 claims description 3
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 3
- 125000000304 alkynyl group Chemical group 0.000 claims description 3
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 3
- 229910052799 carbon Inorganic materials 0.000 claims description 3
- 238000001514 detection method Methods 0.000 claims description 3
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 3
- 230000003647 oxidation Effects 0.000 claims description 3
- 238000007254 oxidation reaction Methods 0.000 claims description 3
- 230000000379 polymerizing effect Effects 0.000 claims description 3
- LVEYOSJUKRVCCF-UHFFFAOYSA-N 1,3-Bis(diphenylphosphino)propane Substances C=1C=CC=CC=1P(C=1C=CC=CC=1)CCCP(C=1C=CC=CC=1)C1=CC=CC=C1 LVEYOSJUKRVCCF-UHFFFAOYSA-N 0.000 claims description 2
- 125000003860 C1-C20 alkoxy group Chemical group 0.000 claims description 2
- 229920001577 copolymer Polymers 0.000 claims description 2
- XXECWTBMGGXMKP-UHFFFAOYSA-L dichloronickel;2-diphenylphosphanylethyl(diphenyl)phosphane Chemical compound Cl[Ni]Cl.C=1C=CC=CC=1P(C=1C=CC=CC=1)CCP(C=1C=CC=CC=1)C1=CC=CC=C1 XXECWTBMGGXMKP-UHFFFAOYSA-L 0.000 claims description 2
- VHZAFVKQNYAKRA-UHFFFAOYSA-L dichloronickel;phenyl(3-phenylphosphanylpropyl)phosphane Chemical compound Cl[Ni]Cl.C=1C=CC=CC=1PCCCPC1=CC=CC=C1 VHZAFVKQNYAKRA-UHFFFAOYSA-L 0.000 claims description 2
- 239000007772 electrode material Substances 0.000 claims description 2
- 150000002148 esters Chemical class 0.000 claims description 2
- 125000001181 organosilyl group Chemical group [SiH3]* 0.000 claims description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 2
- 238000003860 storage Methods 0.000 claims description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 claims 1
- 125000001246 bromo group Chemical group Br* 0.000 claims 1
- 125000001309 chloro group Chemical group Cl* 0.000 claims 1
- 239000011737 fluorine Substances 0.000 claims 1
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 24
- 238000006243 chemical reaction Methods 0.000 description 18
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 12
- 239000000178 monomer Substances 0.000 description 12
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 12
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 11
- 238000000746 purification Methods 0.000 description 11
- 239000003153 chemical reaction reagent Substances 0.000 description 10
- 229920002848 poly(3-alkoxythiophenes) Polymers 0.000 description 10
- GZUXJHMPEANEGY-UHFFFAOYSA-N bromomethane Chemical compound BrC GZUXJHMPEANEGY-UHFFFAOYSA-N 0.000 description 9
- 239000002019 doping agent Substances 0.000 description 8
- 150000004795 grignard reagents Chemical class 0.000 description 8
- 239000002800 charge carrier Substances 0.000 description 7
- 229920000123 polythiophene Polymers 0.000 description 7
- 238000002360 preparation method Methods 0.000 description 7
- 239000007818 Grignard reagent Substances 0.000 description 6
- 239000006227 byproduct Substances 0.000 description 6
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 6
- 150000001875 compounds Chemical class 0.000 description 6
- 238000003747 Grignard reaction Methods 0.000 description 5
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 5
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 125000000962 organic group Chemical group 0.000 description 5
- 125000006239 protecting group Chemical group 0.000 description 5
- 230000035484 reaction time Effects 0.000 description 5
- 238000003786 synthesis reaction Methods 0.000 description 5
- 238000005160 1H NMR spectroscopy Methods 0.000 description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 4
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 4
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 4
- 150000001350 alkyl halides Chemical group 0.000 description 4
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 4
- 125000000524 functional group Chemical group 0.000 description 4
- 229940102396 methyl bromide Drugs 0.000 description 4
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 4
- 230000004048 modification Effects 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- 239000011877 solvent mixture Substances 0.000 description 4
- 238000003756 stirring Methods 0.000 description 4
- JWUJQDFVADABEY-UHFFFAOYSA-N 2-methyltetrahydrofuran Chemical compound CC1CCCO1 JWUJQDFVADABEY-UHFFFAOYSA-N 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 3
- 125000001931 aliphatic group Chemical group 0.000 description 3
- 150000004292 cyclic ethers Chemical class 0.000 description 3
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 3
- 125000003709 fluoroalkyl group Chemical group 0.000 description 3
- 238000005755 formation reaction Methods 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- 125000005843 halogen group Chemical group 0.000 description 3
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 3
- 229910052759 nickel Inorganic materials 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 229920000301 poly(3-hexylthiophene-2,5-diyl) polymer Polymers 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 238000010791 quenching Methods 0.000 description 3
- 125000006850 spacer group Chemical group 0.000 description 3
- 238000010561 standard procedure Methods 0.000 description 3
- 229910052725 zinc Inorganic materials 0.000 description 3
- 239000011701 zinc Substances 0.000 description 3
- NAMYKGVDVNBCFQ-UHFFFAOYSA-N 2-bromopropane Chemical compound CC(C)Br NAMYKGVDVNBCFQ-UHFFFAOYSA-N 0.000 description 2
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 2
- 229910020366 ClO 4 Inorganic materials 0.000 description 2
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- 208000033962 Fontaine progeroid syndrome Diseases 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 2
- 101150003085 Pdcl gene Proteins 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- 229910018286 SbF 6 Inorganic materials 0.000 description 2
- 125000003277 amino group Chemical group 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- 150000002170 ethers Chemical class 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 238000002290 gas chromatography-mass spectrometry Methods 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 150000002500 ions Chemical group 0.000 description 2
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 2
- 238000011031 large-scale manufacturing process Methods 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 239000004973 liquid crystal related substance Substances 0.000 description 2
- 229920002521 macromolecule Polymers 0.000 description 2
- NXPHGHWWQRMDIA-UHFFFAOYSA-M magnesium;carbanide;bromide Chemical compound [CH3-].[Mg+2].[Br-] NXPHGHWWQRMDIA-UHFFFAOYSA-M 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 150000002739 metals Chemical class 0.000 description 2
- 125000001421 myristyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 2
- 239000011368 organic material Substances 0.000 description 2
- 229910052763 palladium Inorganic materials 0.000 description 2
- 125000002958 pentadecyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 238000001556 precipitation Methods 0.000 description 2
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 2
- 230000000171 quenching effect Effects 0.000 description 2
- 239000000376 reactant Substances 0.000 description 2
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 125000002889 tridecyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 229920002554 vinyl polymer Polymers 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 238000010626 work up procedure Methods 0.000 description 2
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 1
- SGZPMDDSWZJHEC-UHFFFAOYSA-L 1,1-diphenylpropylphosphane;nickel(2+);dichloride Chemical compound [Cl-].[Cl-].[Ni+2].C=1C=CC=CC=1C(P)(CC)C1=CC=CC=C1 SGZPMDDSWZJHEC-UHFFFAOYSA-L 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- 125000001140 1,4-phenylene group Chemical group [H]C1=C([H])C([*:2])=C([H])C([H])=C1[*:1] 0.000 description 1
- DURPTKYDGMDSBL-UHFFFAOYSA-N 1-butoxybutane Chemical compound CCCCOCCCC DURPTKYDGMDSBL-UHFFFAOYSA-N 0.000 description 1
- NSYFIAVPXHGRSH-UHFFFAOYSA-N 2,5-dibromo-3-hexylthiophene Chemical compound CCCCCCC=1C=C(Br)SC=1Br NSYFIAVPXHGRSH-UHFFFAOYSA-N 0.000 description 1
- KBVDUUXRXJTAJC-UHFFFAOYSA-N 2,5-dibromothiophene Chemical compound BrC1=CC=C(Br)S1 KBVDUUXRXJTAJC-UHFFFAOYSA-N 0.000 description 1
- MCWCGKXVHNPXFA-UHFFFAOYSA-N 2,5-diiodo-3,4-dimethylthiophene Chemical compound CC=1C(C)=C(I)SC=1I MCWCGKXVHNPXFA-UHFFFAOYSA-N 0.000 description 1
- 125000004200 2-methoxyethyl group Chemical group [H]C([H])([H])OC([H])([H])C([H])([H])* 0.000 description 1
- 125000005916 2-methylpentyl group Chemical group 0.000 description 1
- 125000004975 3-butenyl group Chemical group C(CC=C)* 0.000 description 1
- KPOCSQCZXMATFR-UHFFFAOYSA-N 3-butylthiophene Chemical compound CCCCC=1C=CSC=1 KPOCSQCZXMATFR-UHFFFAOYSA-N 0.000 description 1
- JAYBIBLZTQMCAY-UHFFFAOYSA-N 3-decylthiophene Chemical compound CCCCCCCCCCC=1C=CSC=1 JAYBIBLZTQMCAY-UHFFFAOYSA-N 0.000 description 1
- RSTAGBXOIVTHHT-UHFFFAOYSA-N 3-hexyl-2,5-diiodothiophene Chemical compound CCCCCCC=1C=C(I)SC=1I RSTAGBXOIVTHHT-UHFFFAOYSA-N 0.000 description 1
- 125000005917 3-methylpentyl group Chemical group 0.000 description 1
- 229910017008 AsF 6 Inorganic materials 0.000 description 1
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical group [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 229910021589 Copper(I) bromide Inorganic materials 0.000 description 1
- 229910021591 Copper(I) chloride Inorganic materials 0.000 description 1
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 1
- 229910052693 Europium Inorganic materials 0.000 description 1
- 229910002422 La(NO3)3·6H2O Inorganic materials 0.000 description 1
- 239000002841 Lewis acid Substances 0.000 description 1
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 1
- 229910019800 NbF 5 Inorganic materials 0.000 description 1
- LYXFCGCYJQCSRL-UHFFFAOYSA-N OOSO Chemical compound OOSO LYXFCGCYJQCSRL-UHFFFAOYSA-N 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 229910018287 SbF 5 Inorganic materials 0.000 description 1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- 229910000831 Steel Inorganic materials 0.000 description 1
- DHXVGJBLRPWPCS-UHFFFAOYSA-N Tetrahydropyran Chemical compound C1CCOCC1 DHXVGJBLRPWPCS-UHFFFAOYSA-N 0.000 description 1
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 1
- 238000005874 Vilsmeier-Haack formylation reaction Methods 0.000 description 1
- 229910007926 ZrCl Inorganic materials 0.000 description 1
- DHKHKXVYLBGOIT-UHFFFAOYSA-N acetaldehyde Diethyl Acetal Natural products CCOC(C)OCC DHKHKXVYLBGOIT-UHFFFAOYSA-N 0.000 description 1
- 150000001241 acetals Chemical class 0.000 description 1
- OIPILFWXSMYKGL-UHFFFAOYSA-N acetylcholine Chemical compound CC(=O)OCC[N+](C)(C)C OIPILFWXSMYKGL-UHFFFAOYSA-N 0.000 description 1
- 229960004373 acetylcholine Drugs 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 125000003172 aldehyde group Chemical group 0.000 description 1
- 150000001335 aliphatic alkanes Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 1
- 125000004448 alkyl carbonyl group Chemical group 0.000 description 1
- 125000002947 alkylene group Chemical group 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 150000001450 anions Chemical class 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 150000001491 aromatic compounds Chemical class 0.000 description 1
- 150000001502 aryl halides Chemical class 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- 229910052788 barium Inorganic materials 0.000 description 1
- AGEZXYOZHKGVCM-UHFFFAOYSA-N benzyl bromide Chemical compound BrCC1=CC=CC=C1 AGEZXYOZHKGVCM-UHFFFAOYSA-N 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 229910052796 boron Inorganic materials 0.000 description 1
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 1
- RDHPKYGYEGBMSE-UHFFFAOYSA-N bromoethane Chemical compound CCBr RDHPKYGYEGBMSE-UHFFFAOYSA-N 0.000 description 1
- INLLPKCGLOXCIV-UHFFFAOYSA-N bromoethene Chemical compound BrC=C INLLPKCGLOXCIV-UHFFFAOYSA-N 0.000 description 1
- 244000309464 bull Species 0.000 description 1
- 125000005569 butenylene group Chemical group 0.000 description 1
- 229910052792 caesium Inorganic materials 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000003990 capacitor Substances 0.000 description 1
- 238000001460 carbon-13 nuclear magnetic resonance spectrum Methods 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 238000002485 combustion reaction Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- OXBLHERUFWYNTN-UHFFFAOYSA-M copper(I) chloride Chemical compound [Cu]Cl OXBLHERUFWYNTN-UHFFFAOYSA-M 0.000 description 1
- 238000006880 cross-coupling reaction Methods 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 150000001983 dialkylethers Chemical class 0.000 description 1
- 229920000359 diblock copolymer Polymers 0.000 description 1
- IZWRXCGNSVOSAT-UHFFFAOYSA-L dichloronickel;diphenyl(propyl)phosphane Chemical compound Cl[Ni]Cl.C=1C=CC=CC=1P(CCC)C1=CC=CC=C1 IZWRXCGNSVOSAT-UHFFFAOYSA-L 0.000 description 1
- POLCUAVZOMRGSN-UHFFFAOYSA-N dipropyl ether Chemical compound CCCOCCC POLCUAVZOMRGSN-UHFFFAOYSA-N 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- HKNRNTYTYUWGLN-UHFFFAOYSA-N dithieno[3,2-a:2',3'-d]thiophene Chemical compound C1=CSC2=C1SC1=C2C=CS1 HKNRNTYTYUWGLN-UHFFFAOYSA-N 0.000 description 1
- 230000005611 electricity Effects 0.000 description 1
- 238000005401 electroluminescence Methods 0.000 description 1
- 239000011532 electronic conductor Substances 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 125000005678 ethenylene group Chemical group [H]C([*:1])=C([H])[*:2] 0.000 description 1
- ZMMJGEGLRURXTF-UHFFFAOYSA-N ethidium bromide Chemical compound [Br-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 ZMMJGEGLRURXTF-UHFFFAOYSA-N 0.000 description 1
- 125000005745 ethoxymethyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])* 0.000 description 1
- LYCAIKOWRPUZTN-UHFFFAOYSA-N ethylene glycol Natural products OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 125000005842 heteroatom Chemical group 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 230000005525 hole transport Effects 0.000 description 1
- 229920001519 homopolymer Polymers 0.000 description 1
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- QWPPOHNGKGFGJK-UHFFFAOYSA-N hypochlorous acid Chemical compound ClO QWPPOHNGKGFGJK-UHFFFAOYSA-N 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000002329 infrared spectrum Methods 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000005468 ion implantation Methods 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- LZKLAOYSENRNKR-LNTINUHCSA-N iron;(z)-4-oxoniumylidenepent-2-en-2-olate Chemical compound [Fe].C\C(O)=C\C(C)=O.C\C(O)=C\C(C)=O.C\C(O)=C\C(C)=O LZKLAOYSENRNKR-LNTINUHCSA-N 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 229910052747 lanthanoid Inorganic materials 0.000 description 1
- 150000002602 lanthanoids Chemical class 0.000 description 1
- 150000007517 lewis acids Chemical class 0.000 description 1
- 238000000622 liquid--liquid extraction Methods 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 238000001819 mass spectrum Methods 0.000 description 1
- 229910052987 metal hydride Inorganic materials 0.000 description 1
- 150000004681 metal hydrides Chemical class 0.000 description 1
- 238000005649 metathesis reaction Methods 0.000 description 1
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 239000012454 non-polar solvent Substances 0.000 description 1
- 238000002414 normal-phase solid-phase extraction Methods 0.000 description 1
- NIHNNTQXNPWCJQ-UHFFFAOYSA-N o-biphenylenemethane Natural products C1=CC=C2CC3=CC=CC=C3C2=C1 NIHNNTQXNPWCJQ-UHFFFAOYSA-N 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 125000001979 organolithium group Chemical group 0.000 description 1
- 125000002524 organometallic group Chemical group 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 238000012856 packing Methods 0.000 description 1
- 125000005010 perfluoroalkyl group Chemical group 0.000 description 1
- 238000005424 photoluminescence Methods 0.000 description 1
- 239000003880 polar aprotic solvent Substances 0.000 description 1
- 239000002798 polar solvent Substances 0.000 description 1
- 229920006254 polymer film Polymers 0.000 description 1
- 239000002954 polymerization reaction product Substances 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 230000001376 precipitating effect Effects 0.000 description 1
- 125000006410 propenylene group Chemical group 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000006479 redox reaction Methods 0.000 description 1
- 239000013557 residual solvent Substances 0.000 description 1
- 229910052701 rubidium Inorganic materials 0.000 description 1
- MABNMNVCOAICNO-UHFFFAOYSA-N selenophene Chemical compound C=1C=C[se]C=1 MABNMNVCOAICNO-UHFFFAOYSA-N 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 238000000638 solvent extraction Methods 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 238000004528 spin coating Methods 0.000 description 1
- 229940071182 stannate Drugs 0.000 description 1
- 125000005402 stannate group Chemical group 0.000 description 1
- 239000010959 steel Substances 0.000 description 1
- 229910052712 strontium Inorganic materials 0.000 description 1
- 229920002994 synthetic fiber Polymers 0.000 description 1
- URMVZUQDPPDABD-UHFFFAOYSA-N thieno[2,3-f][1]benzothiole Chemical compound C1=C2SC=CC2=CC2=C1C=CS2 URMVZUQDPPDABD-UHFFFAOYSA-N 0.000 description 1
- VJYJJHQEVLEOFL-UHFFFAOYSA-N thieno[3,2-b]thiophene Chemical compound S1C=CC2=C1C=CS2 VJYJJHQEVLEOFL-UHFFFAOYSA-N 0.000 description 1
- 125000004862 thiobutyl group Chemical group 0.000 description 1
- 125000004055 thiomethyl group Chemical group [H]SC([H])([H])* 0.000 description 1
- 229910052723 transition metal Inorganic materials 0.000 description 1
- 150000003623 transition metal compounds Chemical class 0.000 description 1
- 150000003624 transition metals Chemical class 0.000 description 1
- 229920000428 triblock copolymer Polymers 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G61/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G61/12—Macromolecular compounds containing atoms other than carbon in the main chain of the macromolecule
- C08G61/122—Macromolecular compounds containing atoms other than carbon in the main chain of the macromolecule derived from five- or six-membered heterocyclic compounds, other than imides
- C08G61/123—Macromolecular compounds containing atoms other than carbon in the main chain of the macromolecule derived from five- or six-membered heterocyclic compounds, other than imides derived from five-membered heterocyclic compounds
- C08G61/126—Macromolecular compounds containing atoms other than carbon in the main chain of the macromolecule derived from five- or six-membered heterocyclic compounds, other than imides derived from five-membered heterocyclic compounds with a five-membered ring containing one sulfur atom in the ring
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/10—Organic polymers or oligomers
- H10K85/111—Organic polymers or oligomers comprising aromatic, heteroaromatic, or aryl chains, e.g. polyaniline, polyphenylene or polyphenylene vinylene
- H10K85/113—Heteroaromatic compounds comprising sulfur or selene, e.g. polythiophene
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G75/00—Macromolecular compounds obtained by reactions forming a linkage containing sulfur with or without nitrogen, oxygen, or carbon in the main chain of the macromolecule
- C08G75/02—Polythioethers
- C08G75/06—Polythioethers from cyclic thioethers
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G75/00—Macromolecular compounds obtained by reactions forming a linkage containing sulfur with or without nitrogen, oxygen, or carbon in the main chain of the macromolecule
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K10/00—Organic devices specially adapted for rectifying, amplifying, oscillating or switching; Organic capacitors or resistors having potential barriers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K10/00—Organic devices specially adapted for rectifying, amplifying, oscillating or switching; Organic capacitors or resistors having potential barriers
- H10K10/40—Organic transistors
- H10K10/46—Field-effect transistors, e.g. organic thin-film transistors [OTFT]
- H10K10/462—Insulated gate field-effect transistors [IGFETs]
- H10K10/466—Lateral bottom-gate IGFETs comprising only a single gate
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K71/00—Manufacture or treatment specially adapted for the organic devices covered by this subclass
- H10K71/10—Deposition of organic active material
- H10K71/191—Deposition of organic active material characterised by provisions for the orientation or alignment of the layer to be deposited
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E10/00—Energy generation through renewable energy sources
- Y02E10/50—Photovoltaic [PV] energy
- Y02E10/549—Organic PV cells
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P70/00—Climate change mitigation technologies in the production process for final industrial or consumer products
- Y02P70/50—Manufacturing or production processes characterised by the final manufactured product
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Polyoxymethylene Polymers And Polymers With Carbon-To-Carbon Bonds (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
- Materials For Medical Uses (AREA)
- Liquid Crystal (AREA)
- Electroluminescent Light Sources (AREA)
Abstract
본 발명은 위치 규칙성 중합체, 특히 고도의 위치 규칙성을 갖는 머리-꼬리(HT) 폴리-(3-치환된)티오펜의 제조 방법, 상기 방법에 의해 제조된 신규의 중합체, 및 전계 효과 트랜지스터(FET), 전기발광, 광전지 및 센서 장치를 포함한 광학, 전기광학 또는 전자 장치에서 반도체 또는 전하 운반 물질로서 상기 신규 중합체의 용도, 상기 신규 중합체를 포함하는 FET 및 다른 반전도 성분 또는 물질에 관한 것이다.
Description
본 발명은 위치 규칙성 중합체, 특히 고도의 위치 규칙성을 갖는 머리-꼬리(HT) 폴리-(3-치환된)티오펜의 제조 방법, 및 상기 방법에 의해 제조된 신규의 중합체에 관한 것이다. 본 발명은 또한 전계 효과 트랜지스터(FET), 전기발광, 광전지 및 센서 장치를 포함한 광학, 전기광학 또는 전자 장치에서 반도체 또는 전하 운반 물질로서 상기 신규 중합체의 용도에 관한 것이다. 본 발명은 또한 상기 신규 중합체를 포함하는 FET 및 다른 반전도 성분 또는 물질에 관한 것이다.
유기 물질은 최근에 유기 기재 박막 트랜지스터 및 유기 전계 효과 트랜지스터(OFET) 중의 활성층으로서 유망한 것으로 나타났다(문헌[H.E. Katz, Z. Bao and S.L. Gilat, Acc. Chem. Res., 2001, 34, 5, 359]). 상기와 같은 장치는 스마트 카드, 보안 태그 및 평면 디스플레이의 스위칭 소자에 잠재적인 용도를 갖는다. 유기 물질은 이들이 용액으로부터 침착될 수 있는 경우, 빠르고 큰 면적의 제작 경로를 가능하게 하므로, 그의 규소 동족체에 비해 상당한 비용 이점을 갖는 것으로 예견된다.
상기 장치의 성능은 주로 상기 반전도 물질의 전하 캐리어 이동성 및 전류 온/오프 비율에 근거하며, 따라서 이상적인 반도체는 높은 전하 캐리어 이동성(>1 x 10-3 ㎠V-1s-1)과 함께, 오프 상태에서 낮은 전도성을 가져야 한다. 또한, 상기 반전도 물질은, 산화가 장치 성능을 감소시키므로, 산화에 비교적 안정한 것, 즉 높은 이온화 전위를 갖는 것이 중요하다.
종래 기술에서 위치 규칙성 머리-꼬리(HT) 폴리(3-알킬티오펜), 특히 폴리-(3-헥실티오펜)은, 1 x 10-5 내지 0.1 ㎠V-1s-1의 전하 캐리어 이동성을 나타내므로, 반전도 물질로서 사용할 것이 제안되어 왔다. 또한, 폴리-(3-알킬티오펜)은 유기 용매에 대해 양호한 용해도를 나타내며 큰 면적 필름의 제작을 위해 용액 가공가능하다.
상기 폴리-(3-알킬티오펜)의 고도의 위치 규칙성은 개선된 패킹 및 최적화된 미세구조를 유도하여 개선된 전하 캐리어 이동성을 야기하므로 그의 전자 및 광자 성질에 중요하다(미국 특허 제 6,166,172 호, H. Sirringhaus et al., Science, 1998, 280, 1741-1744; H. Sirringhaus et al., Nature, 1999, 401, 685-688; 및 H. Sirringhaus et al., Synthetic Metals, 2000, 111-112, 129-132 참조). 위치 규칙성은 중합체의 제조 방법에 의해 크게 영향을 받는다.
고도의 위치 규칙성 HT-폴리-(3-알킬티오펜)의 여러 가지 제조 방법들이 종래 기술, 예를 들어 문헌[R.D. McCullough, Adv. Mater., 1998, 10(2), 93-116] 및 상기 중에 인용된 참고문헌에 보고되었다.
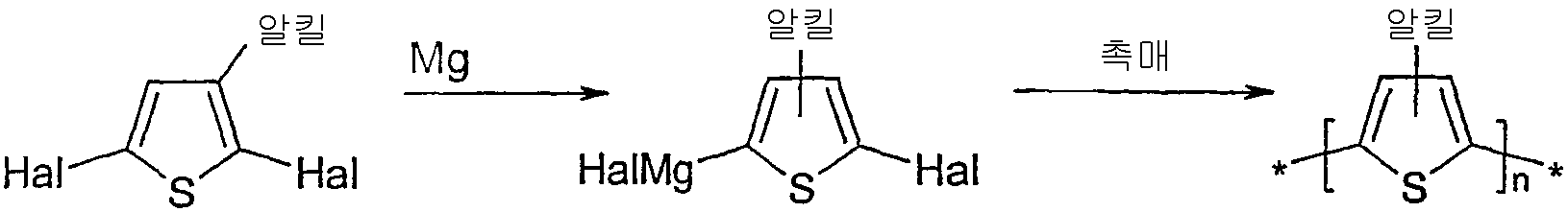
2,5-다이브로모-3-알킬티오펜으로부터 출발하여 ≥90%의 위치 규칙성을 갖는 HT-폴리(3-알킬티오펜)을 제조하는 공지된 방법은 예를 들어 하기에 예시된 바와 같이 유리체(여기에서 R은 알킬이다)를 THF 중에서 매우 반응성인 아연과 반응시키는 "리케(Rieke) 방법"을 포함한다.
또한, 문헌[McCullough et al., Adv. Mater., 1999, 11(3), 250-253] 및 EP 1 028 136 및 미국 특허 제 6,166,172 호에 개시된 방법이 공지되어 있으며, 이들 문헌의 전체 내용은 본 발명에 참고로 인용된다. 상기 경로에 따라, 유리체를 하기 나타낸 바와 같이 THF 중에서 메틸마그네슘 브로마이드와 반응시킨다.
또한 하기 예시한 바와 같이 "스틸(Stille) 방법"(문헌[Stille, Iraqi, Barker et al., J. Mater. Chem., 1998, 8, 25] 참조):
또는 "스즈키(Suzuki) 방법"(문헌[Suzuki, Guillerez, Bidan et al., Synth. Met., 1998, 93, 123] 참조)에 의해 위치 규칙성 폴리(3-알킬티오펜)을 제조함이 보고되었다:
그러나, 종래 기술에 개시된 방법들은 여러 가지 단점들을 갖는다. 따라서, 예를 들어 상기 리케 방법은 제조가 어렵고 비용이 많이 드는 고도로 활성인 "리케 아연"을 필요로 한다. 상기 스틸 및 스즈키 방법은 별도의 가공 단계를 요하며 이는 공정 효율을 감소시킨다. 상기 맥쿨로프(McCullough) 방법은 비용이 많이 드는 그리냐드 시약인 메틸마그네슘 브로마이드를 필요로 한다. 또한, 이는 부산물로서 화학량론적 양의 메틸 브로마이드를 생성시키며, 이는 특히 대규모 생산에서 환경 문제를 야기한다. 메틸 브로마이드는 기체 세척기에 의해 배기 가스로부터 제거될 수 없으므로, 배기 가스 공기 연소에 비용이 많이 드는 기법 및 수단이 필요하다.
종래 기술은 또한 2,5-다이할로겐화된 티오펜과 마그네슘과의 반응으로부터 형성되는 그리냐드 시약의 니켈-촉매화된 커플링에 의한 치환되지 않은 폴리티오펜의 제조를 보고한다.
상기 경로는 1984년에 처음 보고되었다(문헌[J.P. Montheard; T. Pascal, Synth. Met, 1984, 9, 389 및 M. Kobayashi; J. Chen; T.-C. Chung; F. Moraes; A.J. Heeger; F. Wudl, Synth. Met, 1984, 9, 77]). 그러나, 상기 방법은 단지 낮은 분자량만을 제공하였다. 또한 상기 중합체는 3-알킬 치환된 폴리티오펜에 비해 용해도가 낮다.
하기 예시하는 바와 같이 2,5-다이할로겐화된 3-알킬티오펜과 마그네슘으로부터 형성되는 그리냐드 시약의 니켈 촉매화된 커플링을 사용하는 폴리(3-알킬 티 오펜)의 제조가 또한 보고되어 있다.
문헌[T. Yamamoto; K.-I. Sanechika; A. Yamamoto, Bull. Chem. Soc. Jpn., 1983, 56, 1497] 및 미국 특허 제 4,521,589 호에는 THF 중의 2,5-다이할로-3-알킬티오펜의 그리냐드 커플링이 개시되어 있으며, 여기에서 상기 알킬 그룹은 메틸과 같은, 탄소수 1 내지 4의 저급 알킬이다. 그러나, 생성되는 중합체는 낮은 분자량(1,370 또는 2,300) 및 낮은 위치 규칙성(1H-NMR 스펙트럼으로부터 알 수 있다)을 갖는 것으로 보고되고 있다. 미국 특허 제 4,521,589 호는 또한 IR 스펙트럼으로부터 추정되는 바와 같이 96의 중합도를 갖는 보다 높은 중량 분획을 언급하지만, 분자량 측정 데이터는 제공하지 않는다. 일련의 문헌[R.L. Elsenbaumer; K.Y. Jen; R. Oboodi, Synth. Met, 1986, 15, 169; 또한 K.Y. Jen; R. Oboodi; R.L. Elsenbaumer, Polym. Mater. Sci. Eng., 1985, 53, 79 및 K.-Y. Jen; G.G. Miller; R.L. Elsenbaumer, J Chem Soc, Chem Commun, 1986, 1346]들에는 또한 그리냐드 커플링에 의한 폴리(3-알킬 티오펜)의 합성이 개시되어 있다. 그러나, 상기 중합체들은 대개, 2,5-다이요오도-3,4-다이메틸티오펜으로부터 수득된 단독중합체 및 2,5-다이요오도-3-메틸- 및 2,5-다이요오도-3-n-부틸티오펜으로부터 수득된 공중합체(이들은 각각 26,000 및 35,000의 분자량을 갖는 것으로 보고되어 있다)를 제외하고, 3,000 내지 8,000 범위의 분자량(Mn)을 갖는다. 미국 특허 제 4,711,742 호(Elsenbaumer et al.)는 2-메틸-테트라하이드로퓨란에서 다이요오도 단량체의 그리냐드 커플링에 의한 폴리(3-부틸티오펜)의 합성을 보고하며, 이에 의해 300의 중합도에 상응하는 41,400의 분자량이 제공된다. 그러나, 상기 문헌에 개시된 폴리(3-알킬 티오펜)은 위치 무작위성으로, 목적하는 머리-꼬리 머리-꼬리(HT-HT)의 3 개 한 조(3 개조, triad)를 비교적 소량으로 갖는다(예를 들어 문헌[K.-Y. Jen; G.G. Miller; R.L. Elsenbaumer, J Chem Soc, Chem Commun, 1986, 1346] 참조).
3 개의 상이한 경로에 의해 제조된 폴리(3-데실 티오펜)의 연구에서(문헌[P.C. Stein; C. Botta; A. Bolognesi; M. Catellani, Synth. Met, 1995, 69, 305]), 상기 다이요오도 단량체의 그리냐드 중합을 사용하여 제조한 샘플은 1H-NMR에 의해 70%의 위치 규칙성을 갖는 것으로 밝혀졌다. 에테르 중의 마그네슘과 2,5-다이요오도-3-헥실티오펜과의 그리냐드 반응을 사용한 폴리(3-헥실 티오펜)의 합성에 관한 연구(문헌[H. Mao; S. Holdcroft, Macromolecules, 1992, 25, 554] 참조)는 5,200의 분자량(Mn)을 생성시켰다. 직접적인 위치 규칙성 데이터는 제공되지 않지만 1H-NMR은 4 개의 가능한 3 개조 모두로부터의 피크를 보이며, 이는 비교적 낮은 위치 규칙성을 암시한다. 같은 저자의 또 다른 연구(문헌[H. Mao; S. Holdcroft, Macromolecules, 1993, 26, 1163])는 낮은 위치 규칙성(HT-HT 3 개조의 경우 58% 이하 또는 HT 2 개조의 경우 80% 이하)을 갖는 폴리(3-헥실 티오펜)만을 보고하였다.
결론적으로, 마그네슘과의 그리냐드 반응에 의한 폴리(3-알킬 티오펜)의 제 조가 문헌에 개시되었지만, 합성된 중합체들은 낮은 분자량 및/또는 낮거나 랜덤한 위치 규칙성을 갖는 것으로 보고되어 있다.
따라서, 산업상 대규모 생산에 특히 적합한, 경제적이고, 유효하며 환경상 유리한 방식으로 고도의 위치 규칙성, 고 분자량, 고순도 및 고수율을 갖는 중합체, 특히 폴리-(3-치환된)티오펜을 제조하는 개선된 제조 방법이 여전히 필요하다.
본 발명의 목적은 이러한 이점들을 갖지만, 상기 언급한 종래 기술 방법의 단점은 갖지 않는 중합체의 개선된 제조 방법을 제공하는 것이었다.
본 발명의 다른 목적들은 하기 상세한 설명으로부터 당해 분야의 숙련가들에게 바로 자명하다.
본 발명의 발명자들은 하기 개시하는 바와 같이 본 발명에 따른 중합체, 특히 폴리-(3-치환된)티오펜의 제조 방법을 제공함으로써 상기 목적들을 성취할 수 있고 상기 문제들을 해결할 수 있음을 발견하였다. 상기 방법에 따라, 2 개 이상의 그룹(이때 상기 그룹들은 마그네슘과 반응할 수 있는 이탈 그룹이다)을 갖는 3-치환된 티오펜 단량체를 촉매 량의 유기할라이드 또는 유기마그네슘 할라이드의 존재 하에 적합한 용매 중에서 마그네슘과 반응시켜 중간체를 제조하고, 이어서 이를 적합한 촉매의 존재 하에서 중합시킨다. 놀랍게도, 상기 방법을 사용함으로써, 제거가 필요한 다량의 유해 부산물을 피하면서 고도의 위치 규칙성, 고 분자량 및 고 순도의 중합체, 특히 폴리-(3-치환된)티오펜을 양호한 수율로 수득할 수 있음을 발견하였다.
본 발명에 따른 방법에 의해 제조된 중합체는 반도체 또는 발광 물질, 소자 또는 장치에 대한 전하 운반 물질로서 특히 유용하다.
발명의 요약
본 발명은 마그네슘과 반응할 수 있는 2 개 이상의 그룹을 갖는 임의로 치환된 티오펜을 촉매 량의 유기할라이드 또는 유기마그네슘 할라이드의 존재 하에서 마그네슘과 반응시켜 위치화학적 그리냐드 중간체 또는 위치 화학적 그리냐드 중간체들의 혼합물을 제조하고, 상기 그리냐드 중간체를 적합한 촉매의 존재 하에서 중합시킴으로써, 상기 티오펜으로부터 중합체를 제조하는 방법에 관한 것이다.
상기 및 하기에 사용된 바와 같은 "촉매 량"이란 용어는 티오펜 단량체와 같은 다른 공-시약들의 명백히 1 당량 미만, 바람직하게는 티오펜 단량체의 >0 내지 0.5, 매우 바람직하게는 >0 내지 0.1, 가장 바람직하게는 >0 내지 0.05 당량인 유기할라이드 또는 유기마그네슘 할라이드의 양을 지칭한다.
본 발명은 또한 상기 및 하기에 개시하는 바와 같은 방법에 관한 것이며, 이때 상기 티오펜은 2- 및 5-번 위치에 마그네슘과 반응할 수 있는 그룹들을 갖는 3-치환된 용해성 티오펜이다.
본 발명은 또한 상기 및 하기에 개시하는 바와 같은 방법에 관한 것이며, 이때 상기 중합체는 ≥90%, 바람직하게는 ≥95%, 매우 바람직하게는 ≥98%의 위치 규칙성을 갖는 위치 규칙성 머리-꼬리(HT) 중합체이다.
본 발명은 또한 상기 및 하기에 개시하는 바와 같이
a) 유기 용매 중의 마그네슘의 현탁액을, 바람직하게는 실온에서 또는 실온 미만의 온도로 냉각시켜 제공하고,
b) 용매 또는 용매들의 혼합물 중에 임의로 용해된, 마그네슘과 반응할 수 있는 2 개의 그룹을 갖는 티오펜을 첨가하고,
c) 유기할라이드 또는 유기마그네슘 할라이드를 상기 티오펜의 >0 내지 0.5 당량의 양으로 가하여, 상기 티오펜이 마그네슘과 반응하여 위치 화학적 그리냐드 중간체 또는 위치화학적 그리냐드 중간체들의 혼합물을 형성시키고, 추가의 상기 티오펜 또는 티오펜 용액을 임의로 가하고,
d) 촉매를 가하거나, 또는 반응 혼합물을 상기 촉매에 가하고, 생성 혼합물을 임의로 교반하여 중합체를 형성시키고,
e) 상기 혼합물로부터 상기 중합체를 회수하고, 여기에서
임의로 상기 티오펜과 유기할라이드 또는 유기마그네슘 할라이드를 상기 마그네슘에 함께 가하고, 즉 단계 b) 및 c)를 병행하고,
임의로 단계 c)를 단계 b) 전에 수행하고, 즉 상기 유기할라이드 또는 유기마그네슘 할라이드를 상기 티오펜 전에 상기 마그네슘에 가하고,
단계 d)에서 임의로 상기 반응 혼합물을 촉매 첨가 전에 실온으로 또는 보다 높은 온도로 가온하는 방법에 관한 것이다.
본 발명은 또한 상기 및 하기에 개시하는 바와 같은 방법에 의해 수득할 수 있거나 수득되는 신규의 중합체, 특히 신규의 폴리-3-치환된 티오펜에 관한 것이다.
본 발명은 또한 상기 및 하기에 개시하는 바와 같은 하나 이상의 중합체를 포함하는 반도체 또는 전하 운반 물질, 소자 또는 장치에 관한 것이다.
본 발명은 또한 광학, 전기광학 또는 전자 소자 또는 장치, 유기 전계 효과 트랜지스터(OFET), 집적 회로(IC), 박막 트랜지스터(TFT), 평면 디스플레이, 무선 주파수 인식(RFID) 태그, 전기발광 또는 광발광 장치 또는 소자, 유기 발광 다이오드(OLED), 디스플레이의 역광, 광전지 또는 센서 장치, 전하 주입 층, 쇼트키 다이오드, 편광 층, 정전기 방지 필름, 전도성 기판 또는 패턴, 배터리에서의 전극 물질, 광전도체, 전기 진단 사진 용도, 전기 진단 사진 기록, 유기 기억 장치, 정렬 층에서, 또는 DNA 서열의 검출 및 식별용의 전하 운반, 반전도, 전기 전도, 광전도 또는 발광 물질로서의 본 발명에 따른 중합체의 용도에 관한 것이다.
본 발명은 또한 본 발명에 따른 반전도 또는 전하 운반 물질, 소자 또는 장치를 포함하는 광학, 전기광학 또는 전자 장치, FET, 집적 회로(IC), TFT, OLED 또는 정렬 층에 관한 것이다.
본 발명은 또한 본 발명에 따른 반전도 또는 전하 운반 물질, 소자 또는 장치, 또는 FET, IC, TFT 또는 OLED를 포함하는, 평면 디스플레이, 무선 주파수 인식(RFID) 태그, 전기발광 디스플레이 또는 역광용 TFT 또는 TFT 배열에 관한 것이다.
본 발명은 또한 본 발명에 따른 FET 또는 RFID 태그를 포함하는 보안 마킹 또는 장치에 관한 것이다.
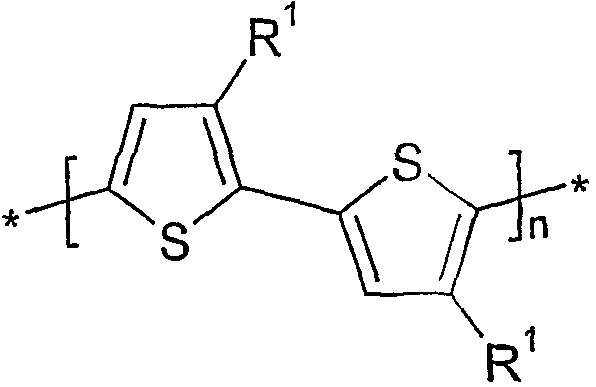
본 발명에 따른 방법에 의해 제조된 중합체는 바람직하게는 하기 화학식 I 중에서 선택된다:
상기 식에서,
n은 >1의 정수이고,
R1은 상기 및 하기에서 본 발명에 따른 방법에 대해 개시된 바와 같은 조건 하에서 마그네슘과 반응하지 않는 그룹이다.
바람직하게는 R1은 치환되지 않고 변경되지 않은 직쇄 또는 분지된 알킬인 경우 5 이상의 C 원자를 갖는 유기 그룹이다. 매우 바람직하게는 R1은 5 이상의 C 원자를 갖는 유기 그룹이다.
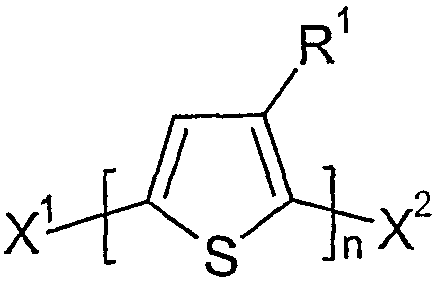
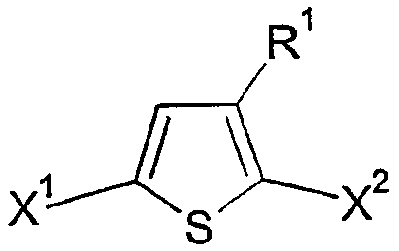
본 발명에 따른 방법에서 유리체로서 사용되는 티오펜은 바람직하게는 하기 화학식 II 중에서 선택된다:
상기 식에서,
R1은 화학식 I에 제공된 의미를 가지며,
X1 및 X2는 서로 독립적으로 마그네슘과 반응할 수 있는 그룹이다.
특히 바람직하게는 X1 및 X2는 Cl 및/또는 Br이고, 가장 바람직하게는 Br이다.
본 발명에 따른 방법에 사용되는 유기할라이드 또는 유기마그네슘 할라이드는 바람직하게는 하기 화학식 III의 알킬- 또는 아릴할라이드이다:
상기 식에서,
R3은 하나 이상의 그룹 L에 의해 임의로 치환된 아릴 또는 헤테로아릴, 또는 F, Cl, Br 또는 I에 의해 임의로 일- 또는 다중 치환된 탄소수 1 내지 20의 직쇄, 분지 또는 환상 알킬이고, 이때 하나 이상의 인접하지 않은 CH2 그룹은 각각의 경우에 서로 독립적으로 O 및/또는 S 원자가 서로 직접 결합되지 않는 방식으로 -O-, -S-, -NR0-, -SiR0R00-, -CY1=CY2- 또는 -C≡C-에 의해 임의로 치환되며,
L은 F, Cl, Br, I, 또는 탄소수 1 내지 20의 알킬, 알콕시 또는 티오알킬이고, 이때 하나 이상의 H 원자는 F 또는 Cl에 의해 치환될 수 있고,
Y1 및 Y2는 서로 독립적으로 H, F 또는 Cl이고,
R0 및 R00는 서로 독립적으로 H, 탄소수 1 내지 12의 알킬 또는 아릴이고,
X는 Br, Cl 또는 I, 바람직하게는 Br이다.
R3이 아릴 또는 헤테로아릴인 경우, 이는 바람직하게는 페닐, 벤질, 불소화된 페닐, 피리딘, 피리미딘, 바이페닐, 나프탈렌, 티오펜, 셀레노펜, 불소화된 티오펜, 벤조[1,2-b:4,5-b']다이티오펜, 티아졸 및 옥사졸 중에서 선택되며, 이들은 모두 비 치환되거나 또는 상기 정의된 바와 같은 L에 의해 일- 또는 다중치환된다.
R3이 알킬 그룹인 경우, 이는 직쇄이거나 또는 분지될 수 있다. 이는 바람직하게는 직쇄이고, 탄소수 2, 3, 4, 5, 6, 7 또는 8을 가지며, 따라서 바람직하게는 예를 들어 메틸, 에틸, 프로필, 부틸, 펜틸, 헥실, 헵틸, 옥틸, 노닐, 데실, 운데실, 도데실, 트라이데실, 테트라데실 또는 펜타데실이다.
R3이 알킬 그룹이되, 하나 이상의 CH2 그룹이 -CH=CH-에 의해 대체된 경우, 이는 직쇄이거나 분지될 수 있다. 이는 바람직하게는 직쇄이고, 탄소수 2 내지 10을 가지며, 따라서 바람직하게는 비닐, 프로프-1- 또는 프로프-2-에닐, 부트-1-, 2- 또는 부트-3-에닐, 펜트-1-, 2-, 3- 또는 펜트-4-에닐, 헥스-1-, 2-, 3-, 4- 또는 헥스-5-에닐, 헵트-1-, 2-, 3-, 4-, 5- 또는 헵트-6-에닐, 옥트-1-, 2-, 3-, 4-, 5-, 6- 또는 옥트-7-에닐, 논-1-, 2-, 3-, 4-, 5-, 6-, 7- 또는 논-8-에닐, 데크-1-, 2-, 3-, 4-, 5-, 6-, 7-, 8- 또는 데크-9-에닐이다.
R3은 또한 키랄 그룹, 예를 들어 2-부틸(=1-메틸프로필), 2-메틸부틸, 2-메틸펜틸, 3-메틸펜틸, 2-에틸헥실, 2-프로필펜틸, 4-메틸헥실, 2-헥실, 2-옥틸, 2-노닐, 2-데실, 2-도데실, 1,1,1-트라이플루오로-2-옥틸, 1,1,1-트라이플루오로-2- 헥실 또는 비키랄 분지된 그룹, 예를 들어 아이소프로필, 아이소부틸(=메틸프로필) 또는 아이소펜틸(=3-메틸부틸)일 수 있다.
매우 바람직하게는 R3은 탄소수 1 내지 12의 직쇄 또는 분지된 알킬 또는 알케닐, 페닐 또는 벤질이다.
특히 적합하고 바람직한 유기할라이드는 예를 들어 메틸 브로마이드, 에틸 브로마이드, 아이소프로필 브로마이드, 비닐 브로마이드 및 벤질 브로마이드이다.
상기 유기할라이드 또는 유기마그네슘 할라이드를 바람직하게는 티오펜 단량체의 0.001 내지 0.1, 매우 바람직하게는 0.01 내지 0.05 당량의 양으로 첨가한다.
본 발명에 따른 방법은 폴리티오펜을 필적할만하거나 심지어 보다 양호한 수율 및 품질로 제공하면서, 특히 경제적 및 생태적 태양에 관하여 종래 기술에 개시된 방법들보다 현저한 이점을 제공한다.
본 발명에 따른 방법에 의해, 폴리티오펜, 특히 HT-폴리-(3-치환된)티오펜을 90% 이상의 위치 규칙성 및 50% 이상의 수율(티오펜 유리체에 비해)로 제조할 수 있다. 상기 언급한 바와 같이, 이러한 고도로 위치 규칙성인 HT-폴리-(3-치환된) 티오펜은 전자 또는 광학 장치에 전하 운반 또는 반도체 물질로서 사용하기에 특히 적합하다.
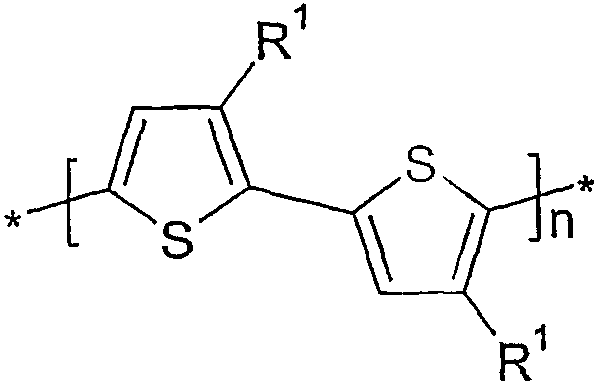
따라서 본 발명의 위치 규칙성 중합체는 다수의 하기 화학식 Ia로 나타낸 바와 같은 HT-결합된 반복 단위들을 가지며, 바람직하게는 이들로만 이루어진다:
더욱 또한, 본 발명에 따른 방법은 비용 효과적이고 안전하며, 특히 하기의 이점들을 갖는다:
-단지 소량의 알킬 할라이드 부산물이 발생한다. 이는 상기 알킬 할라이드 부산물이 중합을 방해하여 바람직하지 못한 단부캡핑과 보다 낮은 분자량을 야기할 수 있으므로 유리하다. 또한, 메틸 브로마이드와 같은 유해 부산물의 다량 방출을 피할 수 있다.
-마그네슘 금속을, 예비형성된 알킬 그리냐드의 공기 민감성 용액보다는 오히려 직접 사용할 수 있다. 더욱이, 상기 반응을 또한 다이에틸 에테르 대신에 THF와 같은 환상 에테르 중에서 실시할 수 있다.
-그리냐드 반응을 저온에서 실시할 수 있다. 이는 티오펜 단량체 상으로의 민감한 작용기들의 포함을 허용한다.
중합 후에 상기 중합체를 바람직하게는 예를 들어 통상적인 후처리에 의해 반응 혼합물로부터 회수하고 정제한다. 이는 숙련가에게 공지되고 문헌에 개시된 표준 방법에 따라 성취될 수 있다.
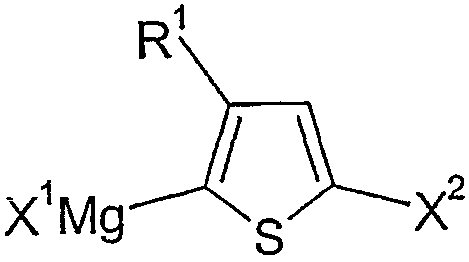
본 발명에 따른 방법의 결과로서, 상기 수득된 폴리티오펜은 대개는 상기 티오펜 단량체 또는 그의 유도체의 2 및 5- 번 위치에서 마그네슘과 반응할 수 있는 이탈 그룹에 의해 종결된다. 화학식 II의 티오펜 유리체를 사용하는 경우에, 상기 수득되는 중합체는 하기 화학식 I1에 상응한다.
상기 식에서,
n, R1, X1 및 X2는 화학식 I 및 II에 제공된 의미를 갖는다.
본 발명의 또 다른 바람직한 실시태양에서, 상기 중합체의 말단 그룹을 중합 도중 또는 중합 후에 화학적으로 개질시킨다('단부캡핑시킨다').
단부캡핑은 상기 중합체를, 관련되는 물질 비용, 시간 및 반응 조건에 관하여 보다 적합하고 보다 유효한 것에 따라 중합 반응 생성물로부터 회수하기 전 또는 후, 상기 중합체의 후처리 전 또는 후, 또는 그의 정제 전 또는 후에 수행될 수 있다. 예를 들어, 값비싼 공 반응물들을 단부캡핑에 사용하는 경우 중합체의 정제 후에 단부캡핑을 수행하는 것이 보다 경제적일 수 있다. 상기 정제 수고가 상기 공 반응물보다 경제적으로 더 중요한 경우 상기 단부캡핑을 정제 전 또는 심지어 중합 반응 혼합물로부터 중합체를 회수하기 전에 수행하는 것이 바람직할 수 있다.
본 발명에 따른 방법의 결과로서, 상기 중합 단계의 끝에서 단부 그룹 X1 및 X2는 할로겐 또는 그리냐드 그룹이다. 또한, 소량의 단부 그룹 R3이 상기 티오펜 중간체의 제조로부터 부산물 R3X3과의 반응의 결과로서 존재할 수 있다. 단부캡핑을 위해서, 전형적으로는 지방족 그리냐드 시약 RMgX 또는 다이알킬 그리냐드 시약 MgR2(여기에서 X는 할로겐이고 R은 지방족 그룹이다) 또는 활성 마그네슘을 가하여 나머지 할로겐 단부 그룹을 그리냐드 그룹으로 전환시킨다. 후속적으로, 예를 들어 알킬 단부 그룹을 제공하기 위해서 과잉의 ω-할로알칸을 가하며, 이는 상기 그리냐드에 커플링할 것이다. 한편으로, 양성자 단부 그룹을 제공하기 위해서, 중합을 알콜과 같은 비-용매로 급냉시킨다.
반응성 작용성 단부 그룹, 예를 들어 하이드록실 또는 아민 그룹 또는 그의 보호된 형태를 제공하기 위해서, 할로겐 단부 그룹을 예를 들어 그리냐드 시약 R'MgX와 반응시키며, 이때 R'는 상기와 같은 반응성 작용기 또는 보호된 반응성 작용기이다.
그리냐드 시약 대신에, 유기 리튬 시약을 사용한 다음 ω-할로알칸을 첨가하여 단부캡핑을 또한 수행할 수 있다.
H 단부 그룹을 또한 예를 들어 미국 특허 제 6,602,974 호에 개시된 방법, 예를 들어 알데하이드 그룹을 도입시킨 다음 금속 하이드라이드로 환원시켜 하이드록실 그룹을 형성시키는 빌스마이어(Vilsmeier) 반응을 사용함으로써 반응성 작용기로 대체시킬 수 있다.
상기 중합체를 단부캡핑 전에 충분히 후 처리한 경우, 상기 중합체를 그리냐드 커플링을 위해 양호한 용매, 예를 들어 다이에틸 에테르 또는 THF에 용해시키는 것이 바람직하다. 이어서 상기 용액을 예를 들어 상기 언급한 유기 그리냐드 시약 RMgX 또는 MgR2 또는 R'MgX 또는 아연 시약, RZnX, R'ZnX 또는 ZnR2로 처리하며, 이때 R 및 R'는 상기 정의한 바와 같다. 이어서 적합한 니켈 또는 팔라듐 촉매를 할로알칸과 함께 가한다.
말단 그룹을 중합 도중 또는 중합 후에 H 또는 알킬 그룹으로 치환시킨 단부 캡핑된 중합체(이후부터 또한 'H 또는 알킬 그룹에 의해 단부 캡핑된 중합체'라 칭한다)가 매우 바람직하다.
바람직하게는 단부 캡핑을 상기 중합체의 정제 전에 수행한다. 더욱 바람직하게는 단부 캡핑을 상기 및 하기에 개시한 바와 같은 방법의 단계 d) 후에 수행한다. 본 발명의 또 다른 바람직한 실시태양에서, 단부 캡핑제를 중합 도중에 가하여 상기 단부 그룹을 제거하고 가능하게는 상기 중합체의 분자량을 조절한다.
바람직하게는, 중합체 샘플 중의 실질적으로 모든 분자들이 본 발명에 따라 단부 캡핑되나, 80% 이상, 바람직하게는 90% 이상, 가장 바람직하게는 98% 이상이 단부 캡핑된다.
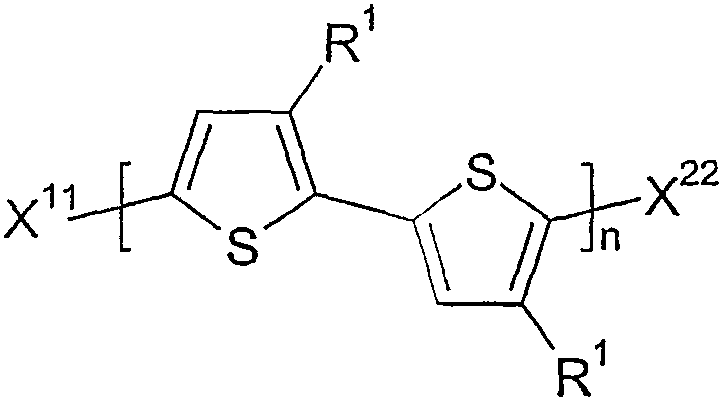
본 발명에 따른 중합체의 말단 그룹의 화학적 개질(단부 캡핑)에 의해, 상이한 말단 그룹을 갖는 신규의 중합체를 제조할 수 있다. 상기 중합체는 바람직하게는 하기 화학식 I2 중에서 선택된다.
상기 식에서,
n 및 R1은 화학식 I 및 II에 제공된 의미를 가지며,
X11 및 X22는 서로 독립적으로 H, 할로겐, 스타네이트, 보로네이트, 또는 하나 이상의 헤테로 원자를 또한 포함할 수 있는 지방족, 지환족 또는 방향족 그룹이다.
특히 바람직하게는 X11 및 X22는 H 및 탄소수 1 내지 20, 바람직하게는 1 내지 12, 매우 바람직하게는 1 내지 6의 직쇄 또는 분지된 알킬, 가장 바람직하게는 아이소프로필 또는 3급 부틸과 같은 직쇄 알킬 및 분지된 알킬 중에서 선택된다. 방향족 그룹 X11 및 X22는 벌키한 경향이 있으며 덜 바람직하다.
상술한 바와 같이, 단부 그룹 X11 및 X22를 바람직하게는 화학식 I1의 중합체와 상술한 바와 같은 그리냐드 시약 MgRX, MgR2 또는 MgR'X를 반응시켜 도입시키며, 이때 R 및 R'는 화학식 I2에서 정의한 바와 같은 X11 또는 X22이다.
적합한 작용성 단부 그룹 X11 및/또는 X22를 도입시킴으로써, 본 발명에 따른 중합체로부터 블록 공중합체를 제조할 수 있다. 예를 들어, 화학식 I2의 중합체 에서 단부 그룹 X11 및 X22 중 하나 또는 둘 다가 반응성 그룹 또는 보호된 반응성 그룹, 예를 들어 임의로 보호된 하이드록시 또는 아민 그룹인 경우, 이를 화학식 I2의 또 다른 중합체의 단부 그룹(예를 들어 상이한 그룹 R1 및/또는 X11 및/또는 X22), 또는 상이한 화학식의 중합체와 반응시킬 수 있다(보호 그룹의 제거 후에). X11 및 X22 중 하나가 반응성 그룹인 경우, 다이블록 공중합체를 형성시킬 수 있다. X11 및 X22가 모두 반응성 그룹인 경우, 트라이블록 공중합체를 형성시킬 수 있다.
한편으로 블록 공중합체를, 반응성 또는 보호된 반응성 그룹 X11 및/또는 X22를 도입시키고, 촉매 및 하나 또는 단량체를 가하고, 그룹 X11 및/또는 X22의 부위로부터 출발하는 새로운 중합 반응을 개시시킴으로써 형성시킬 수 있다.
적합한 작용성 단부 그룹 및 그의 도입 방법을 상기 내용 및 종래 기술로부터 취할 수 있다. 블록 공중합체의 상세한 제조 방법을 또한 예를 들어 미국 특허 제 6,602,974 호로부터 취할 수 있다.
본 발명에 따른 방법을 예시적으로 하기 반응식 1에 예시하며, 여기에서 n, R1, R3, X1, X2 및 X3은 화학식 I, II 및 III의 의미를 갖는다.
R3X3은 바람직하게는 촉매 량, 바람직하게는 (1)의 0.01 내지 0.05 당량으로 첨가되는 유기할라이드, 예를 들어 MeBr, i-PropBr, EtBr이다. R1이 상기 및 하기에 개시하는 바와 같은 공정 조건 하에서 마그네슘과 반응성인 그룹인 경우, 이를 바람직하게는 (2) 및 (3)의 형성 반응에 관여시키지 않기 위해서 보호 그룹으로 전환시키거나 보호 그룹과 커플링시킨다. 적합한 보호 그룹들은 숙련가에게 공지되어 있으며 문헌, 예를 들어 문헌[Greene and Greene, "Protective Groups in Organic Synthesis", John Wiley and Sons, New York(1981)]에 개시되어 있다.
본 발명에 따른 방법에 사용되는 출발 물질 및 시약들은 상업적으로 입수할 수 있거나(예를 들어 알드리치(Aldrich)로부터) 또는 당해 분야의 숙련가들에게 널리 공지되어 있는 방법에 의해 용이하게 합성될 수 있다.
일부의 경우 상기 티오펜 단량체 및 다른 시약을 본 발명의 방법에 사용하기 전에 추가로 정제하는 것이 적합할 수 있다. 정제를 숙련가에게 공지되고 문헌에 개시된 표준 방법에 의해 수행할 수 있다.
반응식 1에 예시적으로 도시된 본 발명에 따른 방법을 바람직하게는 하기와 같이 수행한다:
첫 번째 단계 (a)에서, 예를 들어 THF와 같은 용매 또는 용매 혼합물 중의 마그네슘의 현탁액을 예를 들어 실온(RT)에서 또는 약간 위에서 제공하며, 바람직하게는 RT 미만의 온도, 매우 바람직하게는 +5 ℃ 미만, 가장 바람직하게는 0 ℃ 미만, 특히 0 내지 -5 ℃로 냉각시킨다. 마그네슘을 티오펜 유리체 (1)의 몰 량 이상, 바람직하게는 티오펜 유리체 (1)의 몰 량의 1 내지 3 초과, 바람직하게는 1.01 내지 2.00, 매우 바람직하게는 1.02 내지 1.50, 가장 바람직하게는 1.02 내지 1.20 배 과잉 량으로 제공한다.
두 번째 단계 (b)에서, 바람직하게는 THF와 같은 용매 또는 용매 혼합물 중에 용해된 3-치환된 티오펜 (1), 바람직하게는 3-치환된 2,5-다이할로티오펜, 가장 바람직하게는 3-치환된 2,5-다이브로모티오펜, 예를 들어 2,5-다이브로모-3-알킬티오펜을, 온도를 RT 이하, 바람직하게는 +5 ℃ 미만에서 유지시키면서 마그네슘 현탁액에 가한다.
상기 용매 또는 용매 혼합물은 바람직하게는 하나 이상의 극성 비양성자성 용매로 이루어지며, 이는 상기 유형의 임의의 용매, 예를 들어 다이알킬에테르, 예를 들어 다이에틸 에테르, 다이-n-부틸 에테르, 다이-n-프로필 에테르, 다이-아이소프로필 에테르, 글리콜 에테르, 예를 들어 1,2-다이메톡시에탄, 2 개의 상이한 알킬 그룹을 갖는 에테르, 예를 들어 3급-부틸메틸 에테르, 환상 에테르, 예를 들어 테트라하이드로퓨란(THF), 2-메틸 테트라하이드로퓨란, 테트라하이드로피란 또는 1,4-다이옥산, 또는 이들 용매의 혼합물, 또는 방향족 또는 지방족 용매의 혼합물, 예를 들어 톨루엔과 상기 에테르와의 혼합물일 수 있다.
바람직하게는 상기 용매를 환상 에테르, 특히 바람직하게는 THF 및 2-메틸테트라하이드로퓨란 중에서 선택한다.
상기 용매 중의 티오펜 유리체 (1)의 농도는 바람직하게는 40 내지 200 g/ℓ, 매우 바람직하게는 80 내지 130 g/ℓ이다.
다음 단계(단계 c)에서, 임의로 THF와 같은 유기 용매에 용해된, 촉매 량의 유기할라이드 또는 유기마그네슘 할라이드, 바람직하게는 화학식 III의 화합물을 상기 반응 혼합물에, 바람직하게는 티오펜의 0.01 내지 0.05 당량의 양으로 가한다. 상기는 그리냐드 반응을 개시시킨다. 상기 반응 혼합물을 모든 마그네슘이 소모될 때까지 바람직하게는 -5 내지 +5 ℃의 온도에서 임의로 교반하거나 달리 교반하여 중간체 (2)를 제공한다.
티오펜 및 유기할라이드 또는 유기마그네슘 할라이드를 모두 함유하는 용액을 마그네슘 현탁액에, 바람직하게는 시약들의 총량에 따라 보다 긴 시간 간격(예를 들어 수 시간)에 걸쳐 가함으로써 단계 b) 및 c)를 병행하는 것도 또한 가능하다.
단계 b) 전에 단계 c)를 수행하는 것도 또한 가능하다, 즉 먼저 유기할라이드 또는 유기마그네슘 할라이드를 가하고, 이어서 티오펜 또는 티오펜 용액을 가할 수 있다.
티오펜의 총량은 대략 마그네슘의 1 당량 이하이다. 티오펜 전량을 반응 혼합물에 단계 b)에서 1 회 분취량으로 가할 수 있다. 그러나, 바람직한 실시태양에서, 티오펜 또는 티오펜 용액의 전체 량 중 단지 소량만, 바람직하게는 마그네슘의 >0 내지 50 몰%, 매우 바람직하게는 1 내지 50 몰%, 가장 바람직하게는 5 내지 20%의 양으로 단계 b)에서 반응 혼합물에 가한다. 이어서 상기 유기할라이드 또는 유기마그네슘 할라이드를 단계 c)에 개시된 바와 같이 가하여 그리냐드 반응을 개시시킨다. 상기 반응 혼합물을, 상기 티오펜 또는 티오펜 용액의 나머지를 가하면서 바람직하게는 -5 내지 +5 ℃의 온도에서 임의로 교반하거나 달리 교반한다. 교반을, 상기 마그네슘이 모두 소모될 때까지, 바람직하게는 -5 내지 +5 ℃의 온도에서 계속하여 중간체(2)를 제공한다.
임의의 다음 단계에서 상기 반응하지 않은 마그네슘을 예를 들어 여과에 의해 반응 혼합물로부터 제거한다. 바람직하게는 마그네슘을 제거한다. 상기 용액을 마그네슘의 제거 전에 RT 또는 실온보다 높은 온도로 가온할 수 있다.
다음 단계 (d)에서, 상기 반응 혼합물을 RT 또는 RT보다 높은 온도로 가온하고, 적합한 촉매를 상기 반응 혼합물에 그리냐드 복분해 반응을 통해 중합을 개시시키기에 유효한 양으로 가한다. 대개 상기 촉매는 다른 수단 없이 상기 중합을 개시시키기에 충분히 반응성이나, 실제로 상기 혼합물을 전형적으로는 촉매를 가하면서 교반한다. 이어서 상기 중합 교차 커플링 반응을, 중합체(3)를 제공하기에 충분한 기간 동안 임의로 반응 혼합물의 교반 및/또는 가열, 예를 들어 가열 환류 하에 진행시킨다.
한편으로, 상기 반응 혼합물을 촉매에 가하는 것도 또한 가능하다.
단계 d)에서 촉매는 유기금속 시약, 예를 들어 Ni, Pd 또는 다른 전이 금속 촉매를 수반하는 반응에 적합한 임의의 촉매일 수 있다. 바람직하게는 이를 니켈 촉매, 특히 Ni(II) 촉매, 예를 들어 Ni(dppp)Cl2(1,3-다이페닐포스피노프로판 니켈(II) 클로라이드) 또는 Ni(dppe)Cl2(1,2-비스(다이페닐포스피노)에탄 니켈(II) 클로라이드), 더욱 또한 예를 들어 구리 촉매, 예를 들어 CuI, CuBr 또는 Li2CuCl4 또는 Pd 촉매, 예를 들어 Pd(PPh3), PdCl2(dppe), PdCl2(dppf) 또는 철 촉매, 예를 들어 Fe(acac)3 중에서 선택한다.
상기 촉매를 바람직하게는 티오펜 유리체의 0.1 내지 5%, 바람직하게는 0.5 내지 2 몰%의 양으로 첨가한다.
본 발명에 따른 방법을 충분한 전환 속도를 제공하는 임의의 온도에서 실시할 수 있다. 상기 반응을 -5 ℃ 내지 용매의 환류 온도의 온도, 특히 상기 및 하기에 지정된 온도에서 수행하는 것이 바람직하다. "환류 온도"란 용어는 용매의 비점 또는 이보다 약간 낮은 온도를 포함한다.
적합한 반응 시간의 선택은 개별적인 반응의 실제 속도에 따라 변한다. 바람직하게는 상기 반응 시간은 상기 및 하기에 제공된 바와 같다.
티오펜 유리체와 마그네슘과의 반응의 경우(단계 c), 반응 온도는 바람직하게는 +5 내지 -5 ℃, 가장 바람직하게는 0 내지 -5 ℃의 범위이다. 상기 반응 시간은 15 분 내지 24 시간, 바람직하게는 30 분 내지 6 시간이다.
중합 반응(단계 d)의 경우 상기 온도는 바람직하게는 -5 ℃ 내지 환류 온도, 가장 바람직하게는 실온 내지 환류 온도의 범위이다. 반응 시간은 15 분 내지 48 시간, 바람직하게는 45 분 내지 4 시간이다.
단계 b), c) 및 d)를 임의로 반응 혼합물의 교반 하에서 수행하며, 이는 공지된 방법에 의해 성취될 수 있다.
단계 a) 내지 d), 특히 단계 c) 및 d)를 바람직하게는 무수의 불활성 분위기, 예를 들어 질소 하에서 수행한다.
본 발명에 따른 방법에 의해 제조된 반응 생성물(2) 및 (3)을 당해 분야의 숙련가들에게 널리 공지된 표준 과정을 사용하여 통상적인 후처리 및 정제에 의해 단리할 수 있다.
단계 b)에서 수득한 중간체(2)를 단계 d)에 직접 사용한다. 그러나, 예를 들어 상기 반응 과정의 진행을 조사하거나 생성된 위치 화학적 중간체의 비를 분석하기 위해서, 반응 혼합물을 급냉시키는 것이 적합할 수 있다.
다음 단계 (e)에서 중합체(3)를 반응 혼합물로부터 회수한다. 바람직하게는 상기 중합체를, 상기 반응 혼합물을 알콜 또는 수성 용액으로 급냉시키고/시키거나 중합체를 침전시킴으로써 상기 혼합물로부터 회수한다.
이어서 상기 중합체를 공지된 방법에 의해 정제하여 무기 불순물뿐만 아니라 단량체 및 단쇄 올리고머를 제거하거나, 또는 추가의 정제 없이 사용할 수 있다. 바람직하게는 상기 중합체를 정제시킨다. 적합하고 바람직한 정제 방법은 고상 추출, 액체-액체 추출, 침전, 흡착 및 여과를 포함한다. 바람직하게는 정제 방법들의 조합을 선택하여 용도에 가장 적합한 고 순도 생성물을 수득한다.
예를 들어 바람직한 정제 방법은 예를 들어 클로로폼/물의 혼합물을 사용한 수성 급냉, 임의의 액체/액체 추출 또는 원 용매의 증류, 예를 들어 메탄올과 같은 극성 용매 내로의 침전, 및 예를 들어 헵탄과 같은 비 극성 용매에 의한 세척을 포함한다.
중간체(2)의 중합체(3)에 대한 반응을 포함한 단계 d) 및 e)에 적합한 시약 및 공정 조건들을 또한 문헌으로부터 취할 수 있다.
중간체(2)를 대개는 위치 화학적 이성체(2a) 및 (2b)의 혼합물로서 수득하며, 이는 또한 전형적으로는 소량의 하기 나타낸 바와 같은 이중 그리냐드 생성물(2c)을 포함할 수 있고, 여기에서 X1, X2 및 R1은 화학식 I 및 I1의 의미를 갖는다.
이들 중간체의 비는 예를 들어 마그네슘의 몰 과잉, 용매, 온도 및 반응 시 간에 따라 변한다.
예를 들어, 상기 반응을 상술한 특히 바람직한 실시태양에 따라 수행하는 경우, 중간체 2a, 2b 및 2c를 85/5/10의 비로 수득할 수 있다.
가공 조건, 예를 들어 용매 및 마그네슘의 양에 따라, 이성체 중간체들 2a/2b/2c의 비가 변할 수 있다. 바람직한 방법은 80-90/2-20/0-20의 2a/2b/2c 이성체 중간체 비를 포함한다.
본 발명에 따른 중합체는 위치 규칙성 HT-폴리-(3-치환된)티오펜이 특히 바람직하다. 이들 중합체에서 위치 규칙성(전체 커플링으로 나눈 머리-꼬리 커플링, 퍼센트로서 나타냄)은 바람직하게는 85% 이상, 특히 90% 이상, 매우 바람직하게는 95% 이상, 가장 바람직하게는 98 내지 100%이다.
따라서 높은 퍼센트의 HT-커플링을 갖는 화학식 I, I1 및 I2의 중합체는 상응하는 높은 수의, 하기 나타낸 HT 2 개조 또는 HT-HT 3 개조 화학식 Ia/b, I1a/b 및 I2a/b를 갖는다.
화학식 Ia
상기 식들에서,
R1, X1, X2, X11, X22는 상기 제공된 의미들을 갖는다.
위치 규칙성 폴리-(3-치환된)티오펜은 이들이 강한 쇄간 파이-파이-적층(stacking) 상호작용 및 고도의 결정성을 나타내어, 고도의 캐리어 이동성을 갖는 유효한 전하 운반 물질로 만들므로 유리하다.
본 발명에 따른 중합체는 바람직하게는 2 내지 5,000, 특히 10 내지 5,000 또는 110 내지 5,000, 매우 바람직하게는 50 내지 1,000, 가장 바람직하게는 100 초과 내지 1,000의 중합도(또는 순환 단위의 수 n)를 갖는다.
5,000 내지 300,000, 특히 10,000 내지 100,000, 바람직하게는 15,000 내지 100,000, 매우 바람직하게는 20,000 내지 100,000의 분자량을 갖는 중합체가 더욱 바람직하다.
화학식 I, I1 및 II에서 R1은 바람직하게는 탄소수 5 이상의 유기 그룹, 바람직하게는 비 반응성 또는 보호된 반응성 유기 그룹이다.
특히 바람직하게는 R1은 비 치환되거나, F, Cl, Br 또는 I에 의해 일- 또는 다중 치환될 수 있는, 탄소수 1 이상, 바람직하게는 5 이상, 매우 바람직하게는 1 내지 20의 직쇄, 분지 또는 환상 알킬(이때 하나 이상의 인접하지 않은 CH2 그룹은 각각의 경우에 서로 독립적으로, O 및/또는 S 원자가 서로 직접 결합되지 않는 방식으로 -O-, -S-, -NR0-, -SiR0R00-, -CY1=CY2- 또는 -C≡C-에 의해 임의로 치환된다), 바람직하게는 탄소수 1 내지 30의 임의로 치환된 아릴 또는 헤테로아릴, 또는 P-Sp이고, 이때
R0 및 R00는 서로 독립적으로 H 또는 탄소수 1 내지 12의 알킬이고,
Y1 및 Y2는 서로 독립적으로 H, F 또는 Cl이고,
P는 임의로 보호된 중합성 또는 반응성 그룹이고,
Sp는 이격자 그룹 또는 단일 결합이다.
화학식 I1 및 II에서 X1 및 X2는 바람직하게는 서로 독립적으로 할로겐 중에서 선택되고, 매우 바람직하게는 Cl 또는 Br, 가장 바람직하게는 Br이다.
화학식 I2에서 X11 및 X22는 바람직하게는 서로 독립적으로 H, 할로겐, B(OR')(OR") 및 SnR0R00R000, 및 비 치환되거나, F, Cl, Br, I, -CN 및/또는 -OH에 의해 일- 또는 다중 치환될 수 있는 탄소수 1 내지 20의 직쇄, 분지 또는 환상 알킬(이때 하나 이상의 인접하지 않은 CH2 그룹은 각각의 경우에 서로 독립적으로 O 및/또는 S 원자가 서로 직접 결합되지 않는 방식으로 -O-, -S-, -NH-, -NR0-, -SiR0R00-, -CO-, -COO-, -OCO-, -OCO-O-, -S-CO-, -CO-S-, -CY1=CY2- 또는 -C≡C-에 의해 또한 치환될 수 있다), 임의로 치환된 아릴 또는 헤테로아릴, 및 P-Sp 중에서 선택되고, 이때 R0, R00, Y1, Y2, P 및 Sp는 상기 제공된 의미를 가지며,
R000는 H 또는 탄소수 1 내지 12의 알킬이고,
R' 및 R"는 서로 독립적으로 H 또는 탄소수 1 내지 12의 알킬이거나, 또는 OR' 및 OR"는 붕소 원자와 함께 탄소수 2 내지 10을 갖는 환상 그룹을 또한 형성할 수 있다.
-R1이 탄소수 5 이상의 유기 그룹, 바람직하게는 알킬 그룹이고,
-R1이 탄소수 1 내지 12, 바람직하게는 5 내지 12의 직쇄 알킬 그룹이고,
-R1이 n-헥실이고,
-R1이 하나 이상의 불소 원자에 의해 임의로 치환된 C1-C20-알킬, C1-C20-알케닐, C1-C20-알키닐, C1-C20-알콕시, C1-C20-티오알킬, C1-C20-실릴, C1-C20-아미노, C1-C20-플루오로알킬, 임의로 치환된 아릴 또는 헤테로아릴, 또는 P-Sp-, 특히 C1-C20-알킬 또는 C1-C20-플루오로알킬, 바람직하게는 직쇄 그룹 중에서 선택되고,
-R1이 하나 이상의 불소 원자에 의해 임의로 치환된 알킬, 알케닐, 알키닐, 알콕시, 티오알킬 및 플루오로알킬 중에서 선택되고, 이들이 모두 직쇄이고 1 내지 12, 바람직하게는 5 내지 12 개의 C 원자를 가지며,
-R1이 펜틸, 헥실, 헵틸, 옥틸, 노닐, 데실, 운데실 및 도데실 중에서 선택되고,
-X1 및 X2가 동일한 의미를 갖고,
-X1 및 X2가 Br을 나타내고,
-X11 및 X22가 동일한 의미를 갖고,
-X11 및 X22가 H를 나타내고,
-X11 및 X22가 하나 이상의 불소 원자에 의해 임의로 치환된 알킬, 알케닐, 알키닐, 알콕시, 티오알킬, 실릴, 에스터, 아미노 및 플루오로알킬(이들 그룹은 모두 직쇄이거나 분지되고 1 내지 20, 바람직하게는 1 내지 12, 가장 바람직하게는 1 내지 6 개의 C 원자를 갖는다), 및 임의로 치환된 아릴 또는 헤테로아릴, 및 상기 정의한 바와 같은 P-Sp, 특히 직쇄 또는 분지된 C1-C6-알킬, 가장 바람직하게는 아이소프로필, 3급 부틸 및 2-메틸부틸 중에서 선택되고,
-n이 2 내지 5000, 특히 50 내지 1000의 정수인
화학식 I, II, I1 및 I2의 화합물 및 중합체가 특히 바람직하다.
화학식 I, II, I1 및 I2에서 R1이 알킬 또는 알콕시 라디칼인 경우, 즉 말단 CH2 그룹이 -O-에 의해 대체된 경우, 이는 직쇄이거나 분지될 수 있다. 이는 바람직하게는 직쇄이며, 탄소수 2 내지 8을 갖고, 따라서 바람직하게는 예를 들어 에틸, 프로필, 부틸, 펜틸, 헥실, 헵틸, 옥틸, 에톡시, 프로폭시, 부톡시, 펜톡시, 헥실옥시, 헵톡시, 또는 옥톡시, 더욱 또한 메틸, 노닐, 데실, 운데실, 도데실, 트라이데실, 테트라데실, 펜타데실, 노녹시, 데콕시, 운데콕시, 도데콕시, 트라이데 콕시 또는 테트라데콕시이다. 특히 바람직한 것은 n-헥실 및 n-도데실이다.
화학식 I, II, I1 및 I2에서 R1이 옥사알킬인 경우, 즉 하나의 CH2 그룹이 -O-에 의해 대체된 경우, 이는 바람직하게는 예를 들어 직쇄 2-옥사프로필(=메톡시메틸), 2-(=에톡시메틸) 또는 3-옥사부틸(=2-메톡시에틸), 2-, 3- 또는 4-옥사펜틸, 2-, 3-, 4- 또는 5-옥사헥실, 2-, 3-, 4-, 5- 또는 6-옥사헵틸, 2-, 3-, 4-, 5-, 6- 또는 7-옥사옥틸, 2-, 3-, 4-, 5-, 6-, 7- 또는 8-옥사노닐 또는 2-, 3-, 4-, 5-, 6-, 7-, 8- 또는 9-옥사데실이다.
화학식 I, II 및 I1에서 R1이 티오알킬인 경우, 즉 하나의 CH2 그룹이 -S-에 의해 대체된 경우, 이는 바람직하게는 직쇄 티오메틸(-SCH3), 1-티오에틸(-SCH2CH3), 1-티오프로필(=-SCH2CH2CH3), 1-(티오부틸), 1-(티오펜틸), 1-(티오헥실), 1-(티오헵틸), 1-(티오옥틸), 1-(티오노닐), 1-(티오데실), 1-(티오운데실) 또는 1-(티오도데실)이고, 이때 바람직하게는 sp2 하이브리드화된 비닐 탄소 원자에 인접한 CH2 그룹이 대체된다.
화학식 I, II, I1 및 I2에서 R1이 플루오로알킬인 경우, 이는 바람직하게는 직쇄 퍼플루오로알킬 CiF2i +1(여기에서 i는 1 내지 15의 정수이다), 특히 CF3, C2F5, C3F7, C4F9, C5F11, C6F13, C7F15 또는 C8F17, 매우 바람직하게는 C6F13이다.
-CY1=CY2-는 바람직하게는 -CH=CH-, -CF=CF- 또는 -CH=C(CN)-이다.
아릴 및 헤테로아릴은 바람직하게는 축합된 고리를 또한 포함할 수 있고 하나 이상의 그룹 L(이때 L은 할로겐 또는 탄소수 1 내지 12의 알킬, 알콕시, 알킬카보닐 또는 알콕시카보닐 그룹이고 하나 이상의 H 원자는 F 또는 Cl에 의해 대체될 수 있다)에 의해 임의로 치환된 탄소수 25 이하의 일-, 이- 또는 삼환상 방향족 또는 헤테로방향족 그룹을 나타낸다.
특히 바람직한 아릴 및 헤테로아릴 그룹은 또한 페닐(이때, 하나 이상의 CH 그룹은 N에 의해 대체된다), 나프탈렌, 티오펜, 티에노티오펜, 다이티에노티오펜, 알킬 플루오렌 및 옥사졸이고, 이들은 모두 비 치환되거나, 상기 정의한 바와 같은 L에 의해 일- 또는 다중치환된다.
본 발명의 또 다른 바람직한 실시태양은 3 번 위치가 중합성 또는 반응성 그룹에 의해 치환된 폴리티오펜에 관한 것이며, 상기 그룹은 상기 폴리티오펜의 형성 과정 중에 임의로 보호된다. 상기 유형의 특히 바람직한 중합체는 R1이 P-Sp를 나타내는 화학식 I, I1 또는 I2의 중합체이다. 이들 중합체는 이들이 반도체 소자용 박막으로 가공되는 동안 또는 가공된 후에 예를 들어 동일 반응계 중합에 의해 그룹 P를 통해 가교결합되어, 고도의 전하 캐리어 이동성 및 높은 열, 기계적 및 화학적 안정성을 갖는 가교결합된 중합체 필름을 제공하므로, 반도체 또는 전하 운반 물질로서 특히 유용하다.
바람직하게는 상기 중합성 또는 반응성 그룹 P는 하기 중에서 선택된다:
CH2=CW1-COO-, CH2=CW1-CO, , , , CH2=CW2-(O)k1-, CH3-CH=CH-O-, (CH2=CH)2CH-OCO-, (CH2=CH-CH2)2CH-OCO-, (CH2=CH)2CH-O-, (CH2=CH-CH2)2N-, (CH2=CH-CH2)2N-CO-, HO-CW2W3-, HS-CW2W3-, HW2N-, HO-CW2W3-NH-, CH2=CW1-CO-NH-, CH2=CH-(COO)k1-, Phe-(O)k2-, CH2=CH-(CO)k1-Phe-(O)k2-, Phe-CH=CH-, HOOC-, OCN- 및 W4W5W6Si[여기에서 W1은 H, Cl, CN, CF3, 페닐 또는 탄소수 1 내지 5의 알킬, 특히 H, Cl 또는 CH3이고, W2 및 W3은 서로 독립적으로 H 또는 탄소수 1 내지 5의 알킬, 특히 H, 메틸, 에틸 또는 n-프로필이고, W4, W5 및 W6은 서로 독립적으로 Cl, 탄소수 1 내지 5의 옥사알킬 또는 옥사카보닐알킬이고, W7 및 W8은 서로 독립적으로 H, Cl 또는 탄소수 1 내지 5의 알킬이고, Phe는 상기 정의한 바와 같은 하나 이상의 그룹 L에 의해 임의로 치환된 1,4-페닐렌이고, k1 및 k2는 서로 독립적으로 0 또는 1이다], 또는
본 발명에 따른 방법에 대해 개시된 조건 하에서 마그네슘과 비 반응성인 상기 그룹들의 보호된 유도체. 적합한 보호 그룹들은 숙련가에게 공지되어 있고 문헌, 예를 들어 문헌[Greene and Greene, "Protective Groups in Organic Synthesis", John Wiley and Sons, New York(1981)]에 개시되어 있으며, 예를 들어 아세탈 또는 케탈이다.
그러나, 바람직하게는 상기 중합성 그룹을 중합 후에, 최종 단계로서 본 발명의 중합체에 가한다.
특히 바람직한 그룹 P는 CH2=CH-COO-, CH2=C(CH3)-COO-, CH2=CH-, CH2=CH-O-, (CH2=CH)2CH-OCO-, (CH2=CH)2CH-O-, 및 , 또는 그의 보호된 유도체이다.
그룹 P의 중합을 숙련가에게 공지되고 문헌, 예를 들어 문헌[D.J. Broer; G. Challa; G.N. Mol, Macromol. Chem. 1991, 192, 59]에 개시된 방법에 따라 수행할 수 있다.
이격자 그룹 Sp로서 당해 분야의 숙련가에게 이러한 목적으로 공지된 모든 그룹들을 사용할 수 있다. 상기 이격자 그룹 Sp는 바람직하게는 화학식 Sp'-X'를 가지며, 따라서 P-Sp-는 P-Sp'-X'-이고, 여기에서
Sp'는 비 치환되거나, F, Cl, Br, I 또는 CN에 의해 일- 또는 다중 치환되는 탄소수 30 이하의 알킬렌이고, 이때 하나 이상의 인접하지 않은 CH2 그룹은 각각의 경우에 서로 독립적으로 O 및/또는 S 원자가 서로 직접 결합되지 않는 방식으로 -O-, -S-, -NH-, -NR0-, -SiR0R00-, -CO-, -COO-, -OCO-, -OCO-O-, -S-CO-, -CO-S-, -CH=CH- 또는 -C≡C-에 의해 또한 대체될 수 있고,
X'는 -O-, -S-, -CO-, -COO-, -OCO-, -O-COO-, -CO-NR0-, -NR0-CO-, -NR0-CO-NR00-, -OCH2-, -CH2O-, -SCH2-, -CH2S-, -CF2O-, -OCF2-, -CF2S-, -SCF2-, -CF2CH2-, -CH2CF2-, -CF2CF2-, -CH=N-, -N=CH-, -N=N-, -CH=CR0-, -CY1=CY2-, -C≡C-, -CH=CH-COO-, -OCO-CH=CH- 또는 단일 결합이고,
R0 및 R00는 서로 독립적으로 H 또는 탄소수 1 내지 12의 알킬이고,
Y1 및 Y2는 서로 독립적으로 H, F, Cl 또는 CN이다.
X'는 바람직하게는 -O-, -S-, -OCH2-, -CH2O-, -SCH2-, -CH2S-, -CF2O-, -OCF2-, -CF2S-, -SCF2-, -CH2CH2-, -CF2CH2-, -CH2CF2-, -CF2CF2-, -CH=N-, -N=CH-, -N=N-, -CH=CR0-, -CY1=CY2-, -C≡C- 또는 단일 결합, 특히 -O-, -S-, -C≡C-, -CY1=CY2- 또는 단일 결합이다. 또 다른 바람직한 실시태양에서, X'는 공액 시스템을 형성할 수 있는 그룹, 예를 들어 -C≡C- 또는 -CY1=CY2-, 또는 단일 결합이다.
전형적인 그룹 Sp'는 예를 들어 -(CH2)p-, -(CH2CH2O)q-CH2CH2-, -CH2CH2-S-CH2CH2- 또는 -CH2CH2-NH-CH2CH2- 또는 -(SiR0R00-O)p-이고, 이때 p는 2 내지 12의 정수이고, q는 1 내지 3의 정수이고, R0 및 R00는 상기 주어진 의미를 갖는다.
바람직한 그룹 Sp'는 예를 들어 에틸렌, 프로필렌, 부틸렌, 펜틸렌, 헥실렌, 헵틸렌, 옥틸렌, 노닐렌, 데실렌, 운데실렌, 도데실렌, 옥타데실렌, 에틸렌옥시에틸렌, 메틸렌옥시부틸렌, 에틸렌-티오에틸렌, 에틸렌-N-메틸-이미노에틸렌, 1-메틸알킬렌, 에테닐렌, 프로페닐렌 및 부테닐렌이다.
본 발명의 중합체는 광학, 전자 및 반도체 물질로서, 특히 전계 효과 트랜지스터(FET)에서 전하 운반 물질로서, 예를 들어 집적 회로, ID 태그 또는 TFT 용도의 소자로서 유용하다. 한편으로, 이를 전기발광 디스플레이 용도에서 유기 발광 다이오드(OLED)에 또는 예를 들어 액정 디스플레이의 역광으로서, 광전지 또는 센서 물질로서, 전기 진단 사진 기록 및 다른 반도체 용도에 사용할 수 있다.
본 발명에 따른 중합체는 상기 화합물의 용액을 사용하는 제조 공정들을 허용하는 특히 유리한 용해도 성질을 나타낸다. 따라서, 층 및 코팅층을 포함한 필름을 저렴한 제조 기법, 예를 들어 회전 코팅에 의해 생성시킬 수 있다. 적합한 용매 또는 용매 혼합물은 알칸 및/또는 방향족 화합물, 특히 그의 불소화 또는 염소화된 유도체를 포함한다.
본 발명의 중합체는 FET에서 전하 운반 물질로서 특히 유용하다. 상기와 같은 FET(이 경우 유기 반전도성 물질이 게이트 유전체와 드레인 및 소스 전극 사이에 필름으로서 배열된다)는 예를 들어 미국 특허 제 5,892,244 호, WO 00/79617, 미국 특허 제 5,998,804 호, 및 발명의 배경 및 종래 기술 장에 인용되고 하기에 나열된 참고문헌에 일반적으로 공지되어 있다. 본 발명에 따른 화합물의 용해도 성질 및 따라서 큰 표면의 가공성을 사용하는 저렴한 제조 비용과 같은 이점으로 인해, 상기 FET의 바람직한 용도는 예를 들어 집적 회로, TFT-디스플레이 및 보안 용도이다.
보안 용도에서, 전계 효과 트랜지스터 및 반전도성 물질을 사용하는 다른 장치, 예를 들어 트랜지스터 또는 다이오드를 은행권, 신용 카드 또는 ID 카드, 국가 ID 문헌, 면허증 또는 돈 가치가 있는 임의의 제품, 예를 들어 우표, 티켓, 증권, 수표 등과 같이 가치가 있는 문헌의 위조를 방지하고 보증하기 위한 ID 태그 또는 보안 마킹에 사용할 수 있다.
한편으로, 본 발명에 따른 중합체를 유기 발광 장치 또는 다이오드(OLED), 예를 들어 디스플레이 용도에, 또는 예를 들어 액정 디스플레이의 역광으로서 사용할 수 있다. 통상적인 OLED를 다층 구조를 사용하여 실현시킨다. 방출 층을 일반적으로는 하나 이상의 전자 운반 및/또는 정공 운반 층 사이에 샌드위치시킨다. 전압을 가함으로써 전자와 정공이 전하 캐리어로서 상기 방출 층을 향해 이동하고 여기에서 이들의 재조합은 여기(excitation) 및 따라서 상기 방출 층 중에 함유된 루모포어(lumophor) 유닛들의 발광을 유도한다. 본 발명의 화합물, 물질 및 필름을 그들의 전기 및/또는 광학 성질에 상응하게 전하 운반 층 및/또는 방출 층 중 하나 이상에 사용할 수 있다. 더욱 또한, 상기 방출 층 내에서의 상기의 사용은 본 발명에 따른 중합체가 전기발광 성질 자체를 나타내거나 전기발광 그룹 또는 화합물을 포함하는 경우 특히 유리하다. OLED에 사용하기에 적합한 단량체, 올리고머 및 중합체성 화합물 또는 물질의 선택, 특성화뿐만 아니라 가공은 당해 분야의 숙련가에게 일반적으로 공지되어 있다, 예를 들어 문헌[Meerholz, Synthetic Materials, 111-112, 2000, 31-34, Alcala, J. Appl. Phys., 88, 2000, 7124-7128] 및 상기 중에 인용된 문헌을 참조하시오.
또 다른 용도에 따라, 본 발명에 따른 중합체, 특히 광발광 성질을 나타내는 중합체를 광원의 물질로서, 예를 들어 EP 0 889 350 A1 또는 문헌[C. Weder et al., Science, 279, 1998, 835-837]에 개시된 바와 같은 디스플레이 장치의 물질로서 사용할 수 있다.
본 발명의 추가의 태양은 본 발명에 따른 중합체의 산화 및 환원된 형태 모두에 관한 것이다. 전자의 손실 또는 획득은 고도로 비편재화된 이온 형태를 형성시키며, 이는 높은 전도성을 갖는다. 이는 통상적인 도판트에 노출 시 일어날 수 있다. 적합한 도판트 및 도핑 방법은 당해 분야의 숙련가에게 공지되어 있으며, 예를 들어 EP 0 528 662, 미국 특허 제 5,198,153 호 또는 WO 96/21659로부터 공지되어 있다.
상기 도핑 방법은 전형적으로는 적용된 도판트로부터 유도된 상응하는 상대이온과 함께, 반도체 물질을 산화환원 반응으로 산화 또는 환원제로 처리하여 상기 물질 중에 비편재화된 이온 중심을 형성시킴을 포함한다. 적합한 도핑 방법은 예를 들어 대기압 또는 감압 하에서의 도핑 증기에의 노출, 도판트를 함유하는 용액 중에서의 전기화학적 도핑, 도판트를 반도체 물질과 접촉시켜 열적으로 확산시킴, 및 도판트의 반도체 물질 내로의 이온 주입을 포함한다.
전자가 캐리어로서 사용되는 경우, 적합한 도판트는 예를 들어 할로겐(예를 들어 I2, Cl2, Br2, ICl, ICl3, IBr 및 IF), 루이스 산(예를 들어 PF5, AsF5, SbF5, BF3, BCl3, SbCl5, BBr3 및 SO3), 양성자 산, 유기산, 또는 아미노산(예를 들어 HF, HCl, HNO3, H2SO4, HClO4, FSO3H 및 ClSO3H), 전이 금속 화합물(예를 들어 FeCl3, FeOCl, Fe(ClO4)3, Fe(4-CH3C6H4SO3)3, TiCl4, ZrCl4, HfCl4, NbF5, NbCl5, TaCl5, MoF5, MoCl5, WF5, WCl6, UF6 및 LnCl3(여기에서 Ln은 란타노이드이다), 음이온(예를 들어 Cl-, Br-, I-, I3 -, HSO4 -, SO4 2 -, NO3 -, ClO4 -, BF4 -, PF6 -, AsF6 -, SbF6 -, FeCl4 -, Fe(CN)6 3-, 및 다양한 설폰산의 음이온, 예를 들어 아릴-SO3 -)이다. 정공을 캐리어로서 사용하는 경우, 도판트의 예는 양이온(예를 들어 H+, Li+, Na+, K+, Rb+ 및 Cs+), 알칼리 금속(예를 들어 Li, Na, K, Rb 및 Cs), 알칼리 토 금속(예를 들어 Ca, Sr 및 Ba), O2, XeOF4, (NO2 +)(SbF6 -), (NO2 +)(SbCl6 -), (NO2 +)(BF4 -), AgClO4, H2IrCl6, La(NO3)3·6H2O, FSO2OOSO2F, Eu, 아세틸콜린, R4N+, (R은 알킬 그룹이다), R4P+(R은 알킬 그룹이다), R6As+(R은 알킬 그룹이다), 및 R3S+(R은 알킬 그룹이다)이다.
본 발명의 중합체의 전도성 형태를 여러 용도, 예를 들어 비 제한적으로 유기 발광 다이오드 용도에서 전하 주입 층 및 ITO 평탄화 층, 평면 디스플레이 및 터치 스크린용 필름, 정전기 방지 필름, 인쇄된 전도성 기판, 인쇄 회로 기판 및 콘덴서와 같은 전자 용도의 패턴 또는 트랙에서 유기 "금속"으로서 사용할 수 있 다.
또 다른 용도에 따라 본 발명에 따른 중합체, 특히 그의 수용성 유도체(예를 들어 극성 또는 이온성 측 그룹을 가짐) 또는 이온 도핑된 형태를 DNA 서열의 검출 및 식별용 화학 센서 또는 물질로서 사용할 수 있다. 상기와 같은 용도는 예를 들어 문헌[L. Chen, D.W. McBranch, H. Wang, R. Helgeson, F. Wudl and D.G. Whitten, Proc. Natl. Acad. Sci. U.S.A. 1999, 96, 12287; D. Wang, X. Gong, P. S. Heeger, F. Rininsland, G.C. Bazan and A.J. Heeger, Proc. Natl. Acad. Sci. U.S.A. 2002, 99, 49; N. DiCesare, M.R. Pinot, K.S. Schanze and J.R. Lakowicz, Langmuir 2002, 18, 7785; D.T. McQuade, A.E. Pullen, T.M. Swager, Chem. Rev. 2000, 100, 2537]에 개시되어 있다.
상기 및 하기에서, 모든 온도는 섭씨로 나타내며, 모든 퍼센트는 달리 나타내지 않는 한 중량 기준이다. "실온"은 18 내지 20 ℃를 의미한다.
하기의 실시예들은 본 발명을 제한 없이 예시하기 위한 것이다. 1H- 및 13C-NMR 스펙트럼을 내부 표준으로서 CDCl3의 잔류 용매 공명을 사용하여 브룩커(Bruker) AV-300(300 MHz) 상에 기록하며 ppm으로 제공한다. 질량 스펙트럼을 5973 MSD(EI)를 갖는 6890 시리즈 GC를 사용하여 에이질런트(Agilent) GCMS로부터 획득한다. 분자량 측정을 일련의 2 개의 폴리머 레보라토리즈 믹스드(Polymer Laboratories mixed) B 컬럼을 사용하여 에이질런트 1100 시리즈 HPLC 상에서 클로로벤젠 용액 중에서 수행하며, 상기 시스템은 좁은 중량 PL 폴리스타이렌 눈금 표준에 대해 측정된다.
실시예
1
무수 3-목 플라스크에 질소 하에서 마그네슘 충전제(354 ㎎, 14.6 밀리몰)를 가한다. 무수 THF(45 ㎖) 중의 2,5-다이브로모-3-헥실티오펜(4.41 g, 13.5 밀리몰) 용액을 제조하고 상기 용액 5 ㎖을 5 ℃에서 상기 마그네슘에 가한다. 상기 반응을 2-브로모프로판(80 ㎎, 0.65 밀리몰)을 가하여 개시시킨다. 5 분 후에, 온도를 10 ℃ 미만에서 유지시키면서 2,5-다이브로모티오펜의 나머지 용액을 적가한다. 생성된 황색 용액을 실온으로 가온하고 상기 온도에서 4 시간 동안 교반한다. 분액을 취하고, 묽은 염산으로 가수분해시키고, GCMS에 의해 분석하여 모노그리냐드 시약 98% 및 다이그리냐드 시약 2%의 형성을 밝혀내었다. 출발 물질은 남아있지 않았다. 상기 용액을 캐뉼라를 통해 새로운 반응 용기로 옮기고 가열 환류시킨다. 1,2-비스{다이페닐-포스피노프로판)다이클로로니켈(II)(72 ㎎, 1 몰%)을 고체로서 가하고 반응물을 4 시간 동안 환류시킨다. 상기 반응물을 실온으로 냉각시키고 메탄올에 침전시킨다. 생성 중합체를 여과하고, 추가의 메탄올(속슬렛) 및 헵탄(속슬렛)으로 세척한다. 생성 중합체를 클로로폼에 용해시키고 메탄올에 침전시켜 중합체 0.6 g을 제공한다.
GPC(클로로벤젠): Mn = 10,000; Mw = 15,000.
1H-NMR은 96%의 위치 규칙성을 제공한다.
실시예
2
반응을 0.5%의 비스{다이페닐포스피노프로판)다이클로로니켈(II)을 사용하여 상기와 같이 반복하여 중합체 0.86 g을 제공한다.
GPC(클로로벤젠): Mn = 12,000; Mw = 22,000.
1H-NMR은 95%의 위치 규칙성을 제공한다.
Claims (36)
- 마그네슘과 반응할 수 있는 2 개 이상의 그룹을 갖는 임의로 치환된 티오펜을 촉매 량의 유기할라이드 또는 유기마그네슘 할라이드의 존재 하에서 마그네슘과 반응시켜 위치화학적 그리냐드 중간체 또는 위치화학적 그리냐드 중간체들의 혼합물을 제조하고, 상기 그리냐드 중간체(들)를 적합한 촉매의 존재 하에서 중합시킴으로써, 상기 티오펜으로부터 중합체를 제조하는 방법.
- 2- 및 5-번 위치에 클로로 및/또는 브로모 그룹을 갖는 3-치환된 티오펜을 용매 또는 용매들의 혼합물 중에서 촉매 량의 유기할라이드 또는 유기마그네슘 할라이드의 존재 하에 마그네슘과 반응시켜 위치화학적 그리냐드 중간체 또는 위치화학적 그리냐드 중간체들의 혼합물을 제조하고, 상기 그리냐드 중간체를 적합한 촉매의 존재 하에서 중합시킴으로써, ≥95%의 머리-꼬리(HT) 커플링의 위치 규칙성을 갖는 위치 규칙성 폴리(3-치환된 티오펜)을 제조하는 방법.
- 제 1 항 또는 제 2 항에 있어서,a) 유기 용매 중의 마그네슘의 현탁액을 제공하고,b) 용매 또는 용매들의 혼합물 중에 임의로 용해된, 마그네슘과 반응할 수 있는 2 개의 그룹을 갖는 티오펜을 첨가하고,c) 유기할라이드 또는 유기마그네슘 할라이드를 상기 티오펜의 >0 내지 0.5 당량의 양으로 가하여, 상기 티오펜이 마그네슘과 반응하여 위치화학적 그리냐드 중간체 또는 위치화학적 그리냐드 중간체들의 혼합물을 형성시키고, 추가의 상기 티오펜 또는 티오펜 용액을 임의로 가하고,d) 촉매를 가하거나, 또는 반응 혼합물을 상기 촉매에 가하고, 생성된 혼합물을 임의로 교반하여 중합체를 형성시키고,e) 상기 혼합물로부터 상기 중합체를 회수하고,임의로, 상기 티오펜과 유기할라이드 또는 유기마그네슘 할라이드를 함께 상기 마그네슘에 가함으로써 단계 b)와 c)를 병행하고,임의로, 상기 유기할라이드 또는 유기마그네슘 할라이드를 상기 티오펜 전에 상기 마그네슘에 가함으로써 단계 c)를 단계 b) 전에 수행하는방법.
- 제 1 항 내지 제 3 항 중 어느 한 항에 있어서,상기 3-치환된 티오펜이 3-치환된 2,5-다이브로모-티오펜임을 특징으로 하는 방법.
- 제 1 항 내지 제 4 항 중 어느 한 항에 있어서,상기 폴리(3-치환된 티오펜)이 ≥98%의 위치 규칙성을 가짐을 특징으로 하는 방법.
- 제 1 항 내지 제 5 항 중 어느 한 항에 있어서,상기 용매가 THF임을 특징으로 하는 방법.
- 제 1 항 내지 제 6 항 중 어느 한 항에 있어서,상기 마그네슘의 양이 상기 티오펜 유리체의 몰 량의 1.02 내지 1.20 배임을 특징으로 하는 방법.
- 제 1 항 내지 제 7 항 중 어느 한 항에 있어서,상기 반응하지 않은 마그네슘을 촉매의 첨가 전에 반응 혼합물로부터 제거함을 특징으로 하는 방법.
- 제 1 항 내지 제 8 항 중 어느 한 항에 있어서,상기 촉매가 Ni(II) 촉매임을 특징으로 하는 방법.
- 제 1 항 내지 제 9 항 중 어느 한 항에 있어서,상기 촉매가 Ni(dppp)Cl2(1,3-다이페닐포스피노프로판 니켈(II) 클로라이드) 및 Ni(dppe)Cl2(1,2-비스(다이페닐포스피노)에탄 니켈(II) 클로라이드) 중에서 선택됨을 특징으로 하는 방법.
- 제 1 항 내지 제 10 항 중 어느 한 항에 있어서,상기 위치화학적 그리냐드 중간체의 형성을 +5 내지 -5 ℃의 온도에서 수행함을 특징으로 하는 방법.
- 제 1 항 내지 제 11 항 중 어느 한 항에 있어서,상기 중합을 실온 내지 환류 온도의 온도에서 수행함을 특징으로 하는 방법.
- 제 1 항 내지 제 12 항 중 어느 한 항에 있어서,상기 중합체를 반응 혼합물로부터 회수한 후에 정제함을 특징으로 하는 방법.
- 제 14 항 또는 제 15 항에 있어서,R1이 하나 이상의 불소 원자에 의해 임의로 치환된 C1-C20-알킬; C1-C20-알케닐; C1-C20-알키닐; C1-C20-알콕시; C1-C20-티오알킬; C1-C20-실릴; C1-C20-아미노; C1-C20-플루오로알킬 중에서 선택됨을 특징으로 하는 방법.
- 제 16 항에 있어서,R1이 직쇄 또는 분지된 펜틸, 헥실, 헵틸, 옥틸, 노닐, 데실, 운데실 및 도데실 중에서 선택됨을 특징으로 하는 방법.
- 제 14 항 내지 제 17 항 중 어느 한 항에 있어서,X1 및 X2가 Br임을 특징으로 하는 방법.
- 제 14 항 내지 제 18 항 중 어느 한 항에 있어서,n이 50 내지 1,000의 정수임을 특징으로 하는 방법.
- 제 1 항 내지 제 20 항 중 어느 한 항에 있어서,상기 유기할라이드 또는 유기마그네슘 할라이드가 하기 화학식 III을 가짐을 특징으로 하는 방법:화학식 IIIR3-(Mg)-X3상기 식에서,R3은 하나 이상의 그룹 L에 의해 임의로 치환된 아릴 또는 헤테로아릴, 또는 F, Cl, Br 또는 I에 의해 임의로 일- 또는 다중 치환된 탄소수 1 내지 20의 직쇄, 분지 또는 환상 알킬이고, 이때 하나 이상의 인접하지 않은 CH2 그룹은 각각의 경우에 서로 독립적으로 O 및/또는 S 원자가 서로 직접 결합되지 않는 방식으로 -O-, -S-, -NR0-, -SiR0R00-, -CY1=CY2- 또는 -C≡C-에 의해 임의로 대체되며,L은 F, Cl, Br, I, 또는 탄소수 1 내지 20의 알킬, 알콕시 또는 티오알킬이고, 이때 하나 이상의 H 원자는 F 또는 Cl에 의해 치환될 수 있고,Y1 및 Y2는 서로 독립적으로 H, F 또는 Cl이고,R0 및 R00는 서로 독립적으로 H, 탄소수 1 내지 12의 알킬 또는 아릴이고,X는 Br, Cl 또는 I, 바람직하게는 Br이다.
- 제 1 항 내지 제 21 항 중 어느 한 항에 있어서,R3이 탄소수 1 내지 12의 직쇄 또는 분지된 알킬 또는 알케닐; 페닐; 또는 벤질이고, X3이 Cl 또는 Br임을 특징으로 하는 방법.
- 제 1 항 내지 제 22 항 중 어느 한 항에 있어서,상기 중합체의 말단 그룹들 중 하나 이상을 화학적으로 개질시킴('단부 캡핑시킴')을 특징으로 하는 방법.
- 제 1 항 내지 제 23 항 중 어느 한 항에 있어서,단부 캡핑 후 상기 중합체가 하기 화학식 I2를 가짐을 특징으로 하는 방법:화학식 I2상기 식에서,n 및 R1은 제 1 항 내지 제 23 항 중 어느 한 항의 의미를 가지며,X11 및 X22는 서로 독립적으로 H, 할로겐, Sn(R0)3, 또는 비 치환되거나 F, Cl, Br, I, -CN 및/또는 -OH에 의해 일- 또는 다중 치환될 수 있는 탄소수 1 내지 20의 직쇄, 분지 또는 환상 알킬이되, 이때 하나 이상의 인접하지 않은 CH2 그룹이 각각의 경우에 서로 독립적으로 O 및/또는 S 원자가 서로 직접 결합되지 않는 방식으로 -O-, -S-, -NH-, -NR0-, -SiR0R00-, -CO-, -COO-, -OCO-, -OCO-O-, -S-CO-, -CO-S-, -CY1=CY2- 또는 -C≡C-에 의해 또한 대체될 수 있으며, 또는 X11 및 X22는 임의로 치환된 아릴 또는 헤테로아릴, 또는 P-Sp이고,R0 및 R00는 서로 독립적으로 H 또는 탄소수 1 내지 12의 알킬이고,Y1 및 Y2는 서로 독립적으로 H, F, Cl 또는 CN이다.
- 제 1 항 내지 제 24 항 중 어느 한 항에 있어서,X11 및 X22가 서로 독립적으로, 직쇄이거나 분지되고 탄소수 1 내지 20을 갖는, 하나 이상의 불소 원자에 의해 임의로 치환된 알킬, 알케닐, 알키닐, 알콕시, 티오알킬, 실릴, 에스터, 아미노 또는 플루오로알킬, 또는 임의로 치환된 아릴 또는 헤테로아릴, 또는 제 19 항에 정의된 바와 같은 P-Sp임을 특징으로 하는 방법.
- 제 25 항에 있어서,X11 및 X22가 탄소수 1 내지 6의 직쇄 또는 분지된 알킬을 나타냄을 특징으로 하는 방법.
- 제 25 항에 있어서,X11 및 X22 중 하나 또는 둘 모두 반응성 그룹 또는 보호된 반응성 그룹을 나타냄을 특징으로 하는 방법.
- 제 27 항에 있어서,상기 화학식 I2의 중합체를 동일하거나 상이한 화학식 I2의 중합체, 또는 또 다른 중합체와 단부 그룹 X11 및/또는 X22를 통해 추가로 반응시켜 블록 공중합체를 형성시킴을 특징으로 하는 방법.
- 제 1 항 내지 제 28 항 중 어느 한 항에 따른 방법에 의해 수득된 중합체 또는 공중합체.
- 광학, 전기광학 또는 전자 소자 또는 장치, 유기 전계 효과 트랜지스터(OFET), 집적 회로(IC), 박막 트랜지스터(TFT), 평면 디스플레이, 무선 주파수 인식(RFID) 태그, 전기발광 또는 광발광 장치 또는 소자, 유기 발광 다이오드(OLED), 디스플레이의 역광, 광전지 또는 센서 장치, 전하 주입 층, 쇼트키 다이오드, 편광 층, 정전기 방지 필름, 전도성 기판 또는 패턴, 배터리에서의 전극 물질, 광전도체, 전기 진단 사진 용도, 전기 진단 사진 기록, 유기 기억 장치, 정렬 층에서, 또는 DNA 서열의 검출 및 식별용의 전하 운반, 반전도, 전기 전도, 광전도 또는 발광 물질로서 제 29 항에 따른 중합체의 용도.
- 제 29 항에 따른 하나 이상의 중합체를 포함하는 반도체 또는 전하 운반 물질, 소자 또는 장치.
- 제 29 항 또는 제 31 항에 따른 중합체, 물질, 소자 또는 장치를 포함하는 광학, 전기광학 또는 전자 장치, FET, 집적 회로(IC), TFT, OLED 또는 정렬 층.
- 제 29 항, 제 31 항 및 제 32 항 중 어느 한 항에 따른 중합체, 물질, 소자 또는 장치, FET, IC, TFT 또는 OLED를 포함하는, 평면 디스플레이, 무선 주파수 인식(RFID) 태그, 전기발광 디스플레이 또는 역광용 TFT 또는 TFT 배열.
- 제 33 항에 따른 FET 또는 RFID 태그를 포함하는 보안 마킹 또는 장치.
- 제 29 항에 있어서,산화 또는 환원에 의해 도핑되어 전도성 이온 종들을 형성시키는 중합체.
- 제 35 항에 따른 중합체를 포함하는, 전자 용도 또는 평면 디스플레이용의 전하 주입 층, 평탄화 층, 정전기 방지 필름 또는 전도성 기판 또는 패턴.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP05002918.0 | 2005-02-11 | ||
| EP05002918 | 2005-02-11 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20070106716A true KR20070106716A (ko) | 2007-11-05 |
Family
ID=36123438
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020077018332A KR20070106716A (ko) | 2005-02-11 | 2006-01-17 | 위치 규칙성 중합체의 제조 방법 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US7807776B2 (ko) |
| EP (1) | EP1846472B1 (ko) |
| JP (1) | JP2008537559A (ko) |
| KR (1) | KR20070106716A (ko) |
| CN (1) | CN101115783B (ko) |
| AT (1) | ATE502969T1 (ko) |
| DE (1) | DE602006020841D1 (ko) |
| TW (1) | TW200634045A (ko) |
| WO (1) | WO2006084545A1 (ko) |
Families Citing this family (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4731942B2 (ja) * | 2005-02-16 | 2011-07-27 | 住友化学株式会社 | ポリチオフェン |
| EP1872405B1 (en) * | 2005-04-01 | 2016-02-03 | Carnegie Mellon University | Living synthesis of conducting polymers including regioregular polymers, polythiophenes, and block copolymers |
| JP2009520043A (ja) * | 2005-11-24 | 2009-05-21 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 位置規則性ポリマーの製造方法 |
| US8288508B2 (en) | 2006-09-01 | 2012-10-16 | Carnegie Mellon University | Universal grignard metathesis polymerization |
| KR100847987B1 (ko) * | 2007-02-27 | 2008-07-22 | 삼성전자주식회사 | 탄소나노튜브용 분산제 및 이를 포함하는 탄소나노튜브조성물 |
| US7838624B2 (en) | 2007-05-15 | 2010-11-23 | Plextronics, Inc. | Mixed halogen polymerization |
| TW200916498A (en) * | 2007-05-15 | 2009-04-16 | Plextronics Inc | Aryl-substituted conjugated polymers |
| DE102007033343A1 (de) * | 2007-07-09 | 2009-01-15 | Bayer Technology Services Gmbh | Verfahren zur Synthese von Oligo/Polythiophenen nach einem "Eintopf"-Syntheseweg |
| DE102007036593A1 (de) * | 2007-08-02 | 2009-02-05 | Bayer Technology Services Gmbh | Verfahren zur Herstellung von Poly- und Oligothiophenen in technischem Maßstab |
| DE102007038449A1 (de) * | 2007-08-14 | 2009-02-19 | Bayer Technology Services Gmbh | Verfahren zur Herstellung von Thiophenoligomeren |
| US20100273007A1 (en) * | 2009-04-10 | 2010-10-28 | Plextronics, Inc. | Dehalogenation |
| CN102459399B (zh) * | 2009-06-15 | 2014-06-18 | 巴斯夫欧洲公司 | 制备区域规则的聚-(3-取代的)噻吩和硒吩、聚-(4-取代的)噻唑和硒唑的方法 |
| JP6233918B2 (ja) * | 2013-08-01 | 2017-11-22 | 国立大学法人神戸大学 | ポリ(3−置換チオフェン)化合物並びにその合成中間体及びそれらの製造方法 |
| CN105482082B (zh) * | 2014-09-19 | 2018-11-06 | 中国科学院苏州纳米技术与纳米仿生研究所 | 结构规整聚噻吩及其合成方法 |
| EP3385298B1 (en) * | 2017-04-03 | 2019-10-30 | Qatar Foundation For Education Science And Community Development | Method of making a pyrrolo bisthiazole homopolymer |
| CN112778502B (zh) * | 2020-12-30 | 2023-06-13 | 深圳大学 | 一种粘弹性荧光共轭聚合物及其制备方法 |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2959589A (en) | 1957-11-22 | 1960-11-08 | Metal & Thermit Corp | Heterocyclic magnesium chloridecyclic ether grignard reagents |
| JPS5939447B2 (ja) * | 1982-02-26 | 1984-09-22 | 東京工業大学長 | 線状ポリ(3−アルキル2、5−チエニレン)重合体およびその製造方法 |
| US4711742A (en) | 1985-05-31 | 1987-12-08 | Allied Corporation | Solution processible forms of neutral and electrically conductive poly(substituted heterocycles) |
| EP0203438A1 (en) * | 1985-05-31 | 1986-12-03 | Corporation Allied | Solution processible forms of neutral and electrically conductive poly(substituted heterocycles) |
| US5247062A (en) | 1989-01-31 | 1993-09-21 | Nippon Oil And Fats Cp., Ltd. | Hetero-aromatic polymer containing fluoroalkyl group |
| JP2813428B2 (ja) * | 1989-08-17 | 1998-10-22 | 三菱電機株式会社 | 電界効果トランジスタ及び該電界効果トランジスタを用いた液晶表示装置 |
| EP0705306A1 (en) * | 1992-05-20 | 1996-04-10 | Neste Oy | Electrically conducting liquid-crystal polymer blends and process for the preparation thereof |
| US6166172A (en) * | 1999-02-10 | 2000-12-26 | Carnegie Mellon University | Method of forming poly-(3-substituted) thiophenes |
| US6602974B1 (en) | 2001-12-04 | 2003-08-05 | Carnegie Mellon University | Polythiophenes, block copolymers made therefrom, and methods of forming the same |
| JP2004115695A (ja) * | 2002-09-27 | 2004-04-15 | Japan Science & Technology Corp | ポリ(3−置換チオフェン)の製造方法 |
| JP2004343051A (ja) * | 2003-01-25 | 2004-12-02 | Merck Patent Gmbh | ポリマードーパント |
| DE602004016858D1 (de) * | 2003-08-06 | 2008-11-13 | Merck Patent Gmbh | Verfahren zur herstellung von regioregulären polymeren |
| JP2007501300A (ja) * | 2003-08-06 | 2007-01-25 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフトング | 位置規則性ポリマーの製造方法 |
| US7262264B2 (en) * | 2005-01-12 | 2007-08-28 | Honeywell International Inc. | Halogenated thiophene monomer for the preparation of regioregular polythiophenes |
-
2006
- 2006-01-17 WO PCT/EP2006/000360 patent/WO2006084545A1/en active Application Filing
- 2006-01-17 US US11/816,047 patent/US7807776B2/en not_active Expired - Fee Related
- 2006-01-17 CN CN2006800046066A patent/CN101115783B/zh not_active Expired - Fee Related
- 2006-01-17 AT AT06706262T patent/ATE502969T1/de not_active IP Right Cessation
- 2006-01-17 JP JP2007554454A patent/JP2008537559A/ja active Pending
- 2006-01-17 EP EP06706262A patent/EP1846472B1/en not_active Not-in-force
- 2006-01-17 DE DE602006020841T patent/DE602006020841D1/de active Active
- 2006-01-17 KR KR1020077018332A patent/KR20070106716A/ko not_active Application Discontinuation
- 2006-02-10 TW TW095104647A patent/TW200634045A/zh unknown
Also Published As
| Publication number | Publication date |
|---|---|
| ATE502969T1 (de) | 2011-04-15 |
| EP1846472A1 (en) | 2007-10-24 |
| DE602006020841D1 (de) | 2011-05-05 |
| US7807776B2 (en) | 2010-10-05 |
| JP2008537559A (ja) | 2008-09-18 |
| WO2006084545A1 (en) | 2006-08-17 |
| EP1846472B1 (en) | 2011-03-23 |
| US20090023887A1 (en) | 2009-01-22 |
| TW200634045A (en) | 2006-10-01 |
| CN101115783A (zh) | 2008-01-30 |
| CN101115783B (zh) | 2011-09-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1846472B1 (en) | Process of preparing regioregular polymers | |
| EP1654298B1 (en) | Process of preparing regioregular polymers | |
| KR101295985B1 (ko) | 위치 규칙성 중합체의 제조방법 | |
| US7294288B2 (en) | Process of preparing regioregular polymers | |
| EP2560965B1 (en) | Polymers of benzodithiophene and their use as organic semiconductors | |
| EP1754736B1 (en) | Process for the polymerisation of thiophene or selenophene derivatives | |
| US8501902B2 (en) | Process for the polymerisation of thiophene or selenophene compounds | |
| EP1778695B1 (en) | POLYMERS OF THIENO[2,3-b]THIOPHENE | |
| EP1951787B1 (en) | Regioregular polyselenophenes | |
| US8221652B2 (en) | Process of preparing regioregular polymers |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E601 | Decision to refuse application |