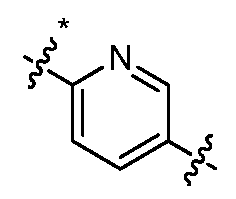
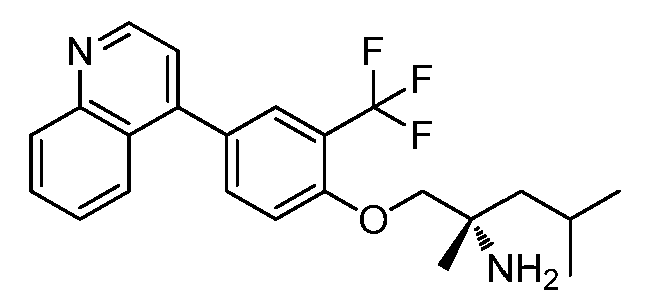
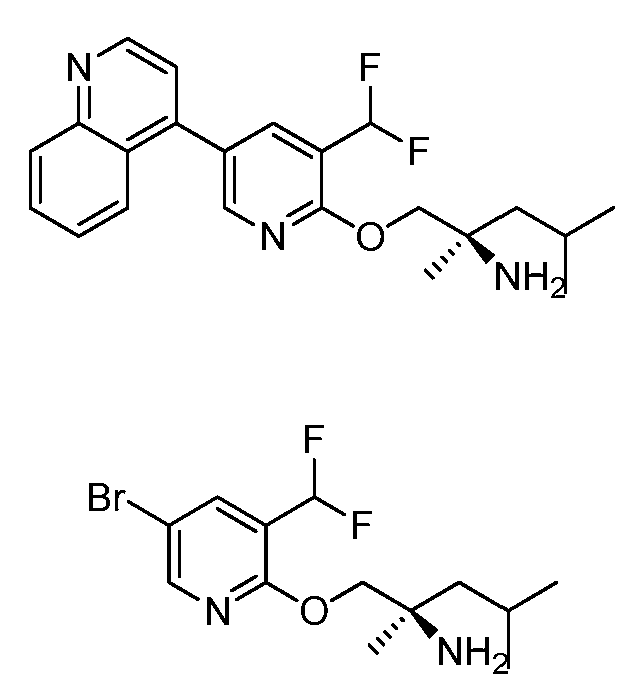
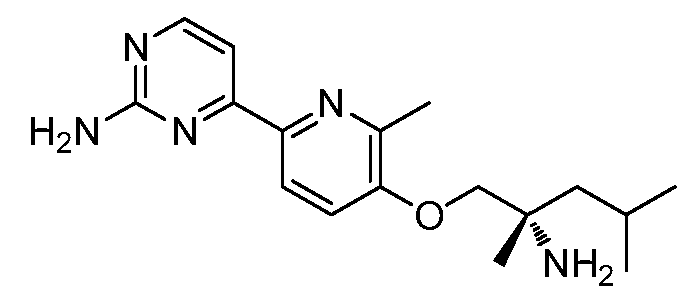
KR102704295B1 - 비아릴 키나제 억제제 - Google Patents
비아릴 키나제 억제제 Download PDFInfo
- Publication number
- KR102704295B1 KR102704295B1 KR1020187011874A KR20187011874A KR102704295B1 KR 102704295 B1 KR102704295 B1 KR 102704295B1 KR 1020187011874 A KR1020187011874 A KR 1020187011874A KR 20187011874 A KR20187011874 A KR 20187011874A KR 102704295 B1 KR102704295 B1 KR 102704295B1
- Authority
- KR
- South Korea
- Prior art keywords
- oxy
- amine
- amino
- methyl
- dimethylpentyl
- Prior art date
Links
- 229940043355 kinase inhibitor Drugs 0.000 title description 2
- 239000003757 phosphotransferase inhibitor Substances 0.000 title description 2
- 125000005841 biaryl group Chemical group 0.000 title 1
- 150000001875 compounds Chemical class 0.000 claims abstract description 67
- 150000003839 salts Chemical class 0.000 claims description 42
- 208000002193 Pain Diseases 0.000 claims description 11
- 239000008194 pharmaceutical composition Substances 0.000 claims description 10
- 201000000980 schizophrenia Diseases 0.000 claims description 8
- VQTSUAUUBDBIPE-UHFFFAOYSA-N 4-methyl-N-[1,1,1-trifluoro-4-methyl-2-[[3-methyl-5-(2-methylpyrimidin-4-yl)pyridin-2-yl]oxymethyl]pentan-2-yl]benzenesulfonamide Chemical compound CC1=CC=C(C=C1)S(=O)(=O)NC(C(F)(F)F)(CC(C)C)COC1=NC=C(C=C1C)C1=NC(=NC=C1)C VQTSUAUUBDBIPE-UHFFFAOYSA-N 0.000 claims description 7
- 208000004296 neuralgia Diseases 0.000 claims description 6
- 208000021722 neuropathic pain Diseases 0.000 claims description 6
- QWACYSBKKPMDNQ-GOSISDBHSA-N (2R)-2,4-dimethyl-1-[3-methyl-5-(2-methylpyrimidin-4-yl)pyridin-2-yl]oxypentan-2-amine Chemical compound C[C@](COC1=NC=C(C=C1C)C1=NC(=NC=C1)C)(CC(C)C)N QWACYSBKKPMDNQ-GOSISDBHSA-N 0.000 claims description 4
- 208000018737 Parkinson disease Diseases 0.000 claims description 4
- MCUCUABNLZIHDX-UHFFFAOYSA-N methyl N-[4-[5-[2-amino-4-methyl-2-(trifluoromethyl)pentoxy]-6-methylpyridin-2-yl]pyridin-2-yl]carbamate Chemical compound NC(COC=1C=CC(=NC=1C)C1=CC(=NC=C1)NC(OC)=O)(CC(C)C)C(F)(F)F MCUCUABNLZIHDX-UHFFFAOYSA-N 0.000 claims description 4
- QWACYSBKKPMDNQ-SFHVURJKSA-N (2S)-2,4-dimethyl-1-[3-methyl-5-(2-methylpyrimidin-4-yl)pyridin-2-yl]oxypentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=NC=C(C=C1C)C1=CC=NC(C)=N1 QWACYSBKKPMDNQ-SFHVURJKSA-N 0.000 claims description 3
- 208000024827 Alzheimer disease Diseases 0.000 claims description 3
- 208000020925 Bipolar disease Diseases 0.000 claims description 3
- QPJZWSYVQPLBTG-KRWDZBQOSA-N 6-[4-[(2S)-2-amino-2,4-dimethylpentoxy]-3-(trifluoromethyl)phenyl]pyrimidin-4-amine Chemical compound N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=N1)N)C(F)(F)F)(CC(C)C)C QPJZWSYVQPLBTG-KRWDZBQOSA-N 0.000 claims description 2
- 208000001640 Fibromyalgia Diseases 0.000 claims description 2
- 208000033808 peripheral neuropathy Diseases 0.000 claims description 2
- KNKGQAHYNCLUIS-UHFFFAOYSA-N 1,1,1-trifluoro-4-methyl-2-[[2-methyl-6-(2-methylpyrimidin-4-yl)pyridin-3-yl]oxymethyl]pentan-2-amine Chemical compound FC(C(CC(C)C)(N)COC=1C(=NC(=CC=1)C1=NC(=NC=C1)C)C)(F)F KNKGQAHYNCLUIS-UHFFFAOYSA-N 0.000 claims 2
- CAMODTUZESZPTO-GOSISDBHSA-N (2R)-2,4-dimethyl-1-[2-methyl-6-(2-methylpyrimidin-4-yl)pyridin-3-yl]oxypentan-2-amine Chemical compound C[C@](COC=1C(=NC(=CC=1)C1=NC(=NC=C1)C)C)(CC(C)C)N CAMODTUZESZPTO-GOSISDBHSA-N 0.000 claims 1
- SXPPKWGLRCJBEG-LJQANCHMSA-N (2R)-2,4-dimethyl-1-[3-methyl-5-[2-(trifluoromethyl)imidazo[1,2-b]pyridazin-8-yl]pyridin-2-yl]oxypentan-2-amine Chemical compound C[C@](COC1=NC=C(C=C1C)C=1C=2N(N=CC=1)C=C(N=2)C(F)(F)F)(CC(C)C)N SXPPKWGLRCJBEG-LJQANCHMSA-N 0.000 claims 1
- ZYXZXZOWIFUVAX-IBGZPJMESA-N (2S)-1-(2,5-difluoro-4-pyrazolo[1,5-a]pyrimidin-7-ylphenoxy)-2,4-dimethylpentan-2-amine Chemical compound FC1=C(OC[C@](CC(C)C)(N)C)C=C(C(=C1)C1=CC=NC=2N1N=CC=2)F ZYXZXZOWIFUVAX-IBGZPJMESA-N 0.000 claims 1
- ANYGFLXRTSCXOQ-IBGZPJMESA-N (2S)-1-(2-chloro-4-imidazo[1,2-b]pyridazin-3-ylphenoxy)-2,4-dimethylpentan-2-amine Chemical compound ClC1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=CN=C2N1N=CC=C2 ANYGFLXRTSCXOQ-IBGZPJMESA-N 0.000 claims 1
- FJSLWMPTBQKJHB-FQEVSTJZSA-N (2S)-1-(4-imidazo[1,2-b]pyridazin-3-yl-2-methylphenoxy)-2,4-dimethylpentan-2-amine Chemical compound N=1C=C(N2N=CC=CC2=1)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C FJSLWMPTBQKJHB-FQEVSTJZSA-N 0.000 claims 1
- XEZNCTPJVVSULY-SFHVURJKSA-N (2S)-1-[2,3-difluoro-4-(2-methylpyrimidin-4-yl)phenoxy]-2,4-dimethylpentan-2-amine Chemical compound FC1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1F)C1=NC(=NC=C1)C XEZNCTPJVVSULY-SFHVURJKSA-N 0.000 claims 1
- FPVSHICNSQNJBD-SFHVURJKSA-N (2S)-1-[2,5-difluoro-4-(6-methylpyrimidin-4-yl)phenoxy]-2,4-dimethylpentan-2-amine Chemical compound FC1=C(OC[C@](CC(C)C)(N)C)C=C(C(=C1)C1=NC=NC(=C1)C)F FPVSHICNSQNJBD-SFHVURJKSA-N 0.000 claims 1
- GPWOFKIENUMEHE-FQEVSTJZSA-N (2S)-1-[2-(difluoromethyl)-4-(2-methoxypyridin-4-yl)phenoxy]-2,4-dimethylpentan-2-amine Chemical compound FC(C1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=CC(=NC=C1)OC)F GPWOFKIENUMEHE-FQEVSTJZSA-N 0.000 claims 1
- BHSGQGNMZWVVIG-IBGZPJMESA-N (2S)-1-[2-(difluoromethyl)-4-(6-methylpyrimidin-4-yl)phenoxy]-2,4-dimethylpentan-2-amine Chemical compound FC(C1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=NC=NC(=C1)C)F BHSGQGNMZWVVIG-IBGZPJMESA-N 0.000 claims 1
- DOIVBOYNRGAHPO-SFHVURJKSA-N (2S)-1-[2-(difluoromethyl)-6-[2-(difluoromethyl)pyrimidin-4-yl]pyridin-3-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound FC(C1=NC(=CC=C1OC[C@](CC(C)C)(N)C)C1=NC(=NC=C1)C(F)F)F DOIVBOYNRGAHPO-SFHVURJKSA-N 0.000 claims 1
- RIHPQFDTJBQUJF-IBGZPJMESA-N (2S)-1-[2-(difluoromethyl)-6-[2-(fluoromethyl)pyridin-4-yl]pyridin-3-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound FC(C1=C(C=CC(=N1)C1=CC(=NC=C1)CF)OC[C@](CC(C)C)(N)C)F RIHPQFDTJBQUJF-IBGZPJMESA-N 0.000 claims 1
- QKPDIUAIDJCKLY-IBGZPJMESA-N (2S)-1-[2-(fluoromethyl)-4-(2-methylpyrimidin-4-yl)phenoxy]-2,4-dimethylpentan-2-amine Chemical compound FCC1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=NC(=NC=C1)C QKPDIUAIDJCKLY-IBGZPJMESA-N 0.000 claims 1
- LBHKHACLJJBTHJ-IBGZPJMESA-N (2S)-1-[2-(fluoromethyl)-6-(2-methylpyridin-4-yl)pyridin-3-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound FCC1=C(C=CC(=N1)C1=CC(=NC=C1)C)OC[C@](CC(C)C)(N)C LBHKHACLJJBTHJ-IBGZPJMESA-N 0.000 claims 1
- VPMWROAPRPMVDL-SFHVURJKSA-N (2S)-1-[2-(fluoromethyl)-6-(2-methylpyrimidin-4-yl)pyridin-3-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound FCC1=NC(=CC=C1OC[C@](CC(C)C)(N)C)C1=NC(=NC=C1)C VPMWROAPRPMVDL-SFHVURJKSA-N 0.000 claims 1
- YIRILFGNIIUPJM-SFHVURJKSA-N (2S)-1-[2-(fluoromethyl)-6-(6-methylpyrimidin-4-yl)pyridin-3-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound FCC1=NC(=CC=C1OC[C@](CC(C)C)(N)C)C1=NC=NC(=C1)C YIRILFGNIIUPJM-SFHVURJKSA-N 0.000 claims 1
- LMXADOVWTGSOCY-IBGZPJMESA-N (2S)-1-[2-(fluoromethyl)-6-[2-(fluoromethyl)pyridin-4-yl]pyridin-3-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=C(CF)N=C(C=C1)C1=CC(CF)=NC=C1 LMXADOVWTGSOCY-IBGZPJMESA-N 0.000 claims 1
- GERJDYOHZAGTPG-QFIPXVFZSA-N (2S)-1-[2-chloro-4-(2-cyclopropylpyrazolo[1,5-a]pyrimidin-7-yl)phenoxy]-2,4-dimethylpentan-2-amine Chemical compound ClC1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=CC=NC=2N1N=C(C=2)C1CC1 GERJDYOHZAGTPG-QFIPXVFZSA-N 0.000 claims 1
- MCNMBNDAUSHJAO-FQEVSTJZSA-N (2S)-1-[2-fluoro-4-(2-methylimidazo[1,2-b]pyridazin-8-yl)phenoxy]-2,4-dimethylpentan-2-amine Chemical compound FC1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C=1C=2N(N=CC=1)C=C(N=2)C MCNMBNDAUSHJAO-FQEVSTJZSA-N 0.000 claims 1
- MAQRLFVZVXAJPA-SFHVURJKSA-N (2S)-1-[2-fluoro-4-(2-methylpyrimidin-4-yl)phenoxy]-2,4-dimethylpentan-2-amine Chemical compound FC1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=NC(=NC=C1)C MAQRLFVZVXAJPA-SFHVURJKSA-N 0.000 claims 1
- SOVPNJLVDSVFLN-FQEVSTJZSA-N (2S)-1-[2-fluoro-4-(2-propan-2-ylpyrimidin-4-yl)phenoxy]-2,4-dimethylpentan-2-amine Chemical compound FC1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=NC(=NC=C1)C(C)C SOVPNJLVDSVFLN-FQEVSTJZSA-N 0.000 claims 1
- RXFKHOFNIOSORD-KRWDZBQOSA-N (2S)-1-[2-fluoro-4-[2-(trifluoromethyl)pyrimidin-4-yl]phenoxy]-2,4-dimethylpentan-2-amine Chemical compound FC1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=NC(=NC=C1)C(F)(F)F RXFKHOFNIOSORD-KRWDZBQOSA-N 0.000 claims 1
- MUBBONNTSFEQLW-KRWDZBQOSA-N (2S)-1-[3-chloro-5-(6-methylpyrimidin-4-yl)pyridin-2-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound ClC=1C(=NC=C(C=1)C1=NC=NC(=C1)C)OC[C@](CC(C)C)(N)C MUBBONNTSFEQLW-KRWDZBQOSA-N 0.000 claims 1
- OCHIFWUMTRVTJX-KRWDZBQOSA-N (2S)-1-[4-(2-chloropyrimidin-4-yl)-2-(trifluoromethyl)phenoxy]-2,4-dimethylpentan-2-amine Chemical compound ClC1=NC=CC(=N1)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F OCHIFWUMTRVTJX-KRWDZBQOSA-N 0.000 claims 1
- CHODUQRWFPOFGC-QFIPXVFZSA-N (2S)-1-[4-(2-cyclopropylimidazo[1,2-b]pyridazin-8-yl)-2-fluorophenoxy]-2,4-dimethylpentan-2-amine Chemical compound C1(CC1)C=1N=C2N(N=CC=C2C2=CC(=C(OC[C@](CC(C)C)(N)C)C=C2)F)C=1 CHODUQRWFPOFGC-QFIPXVFZSA-N 0.000 claims 1
- WJONEHJTOSHKEQ-QFIPXVFZSA-N (2S)-1-[4-(2-cyclopropylpyrazolo[1,5-a]pyrimidin-7-yl)-2-(trifluoromethyl)phenoxy]-2,4-dimethylpentan-2-amine Chemical compound C1(CC1)C1=NN2C(N=CC=C2C2=CC(=C(OC[C@](CC(C)C)(N)C)C=C2)C(F)(F)F)=C1 WJONEHJTOSHKEQ-QFIPXVFZSA-N 0.000 claims 1
- IESWZJXLGRDUCU-QFIPXVFZSA-N (2S)-1-[4-(6-chloro-2-cyclopropylimidazo[1,2-b]pyridazin-8-yl)-2-(trifluoromethyl)phenoxy]-2,4-dimethylpentan-2-amine Chemical compound ClC=1C=C(C=2N(N=1)C=C(N=2)C1CC1)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F IESWZJXLGRDUCU-QFIPXVFZSA-N 0.000 claims 1
- QPZSFYVVDPHNAO-FQEVSTJZSA-N (2S)-1-[4-(6-chloro-2-methylimidazo[1,2-b]pyridazin-8-yl)-2-(trifluoromethyl)phenoxy]-2,4-dimethylpentan-2-amine Chemical compound ClC=1C=C(C=2N(N=1)C=C(N=2)C)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F QPZSFYVVDPHNAO-FQEVSTJZSA-N 0.000 claims 1
- GJWIQWWUGFKKNE-KRWDZBQOSA-N (2S)-1-[4-(6-chloropyrimidin-4-yl)-2-(trifluoromethyl)phenoxy]-2,4-dimethylpentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(Cl)=NC=N1)C(F)(F)F GJWIQWWUGFKKNE-KRWDZBQOSA-N 0.000 claims 1
- AJVXVKZDDMKCHR-SFHVURJKSA-N (2S)-1-[4-(difluoromethyl)-6-(6-methylpyrimidin-4-yl)pyridin-3-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound FC(C1=C(C=NC(=C1)C1=NC=NC(=C1)C)OC[C@](CC(C)C)(N)C)F AJVXVKZDDMKCHR-SFHVURJKSA-N 0.000 claims 1
- NEYPKSYHXQDKLY-IBGZPJMESA-N (2S)-1-[4-[2-(difluoromethyl)pyridin-4-yl]-2,5-difluorophenoxy]-2,4-dimethylpentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=C(F)C=C(C(F)=C1)C1=CC(=NC=C1)C(F)F NEYPKSYHXQDKLY-IBGZPJMESA-N 0.000 claims 1
- JJNGSZHKSVGEOE-IBGZPJMESA-N (2S)-1-[5-(6-ethylpyrimidin-4-yl)-3-methylpyridin-2-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound C(C)C1=CC(=NC=N1)C=1C=C(C(=NC=1)OC[C@](CC(C)C)(N)C)C JJNGSZHKSVGEOE-IBGZPJMESA-N 0.000 claims 1
- QZIRMGCMBPRJPN-IBGZPJMESA-N (2S)-1-[6-[2-(difluoromethyl)pyridin-4-yl]-2-(fluoromethyl)pyridin-3-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=C(CF)N=C(C=C1)C1=CC(=NC=C1)C(F)F QZIRMGCMBPRJPN-IBGZPJMESA-N 0.000 claims 1
- UQSOEMDTCKSGQH-IBGZPJMESA-N (2S)-2,4-dimethyl-1-(2-methyl-6-pyrazolo[1,5-a]pyrimidin-7-ylpyridin-3-yl)oxypentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=CC=C(N=C1C)C1=CC=NC2=CC=NN12 UQSOEMDTCKSGQH-IBGZPJMESA-N 0.000 claims 1
- WLERMVGQYROBCE-INIZCTEOSA-N (2S)-2,4-dimethyl-1-[(5-methyl-2-pyridin-4-yl-1,3-thiazol-4-yl)oxy]pentan-2-amine Chemical compound C[C@@](COC=1N=C(SC=1C)C1=CC=NC=C1)(CC(C)C)N WLERMVGQYROBCE-INIZCTEOSA-N 0.000 claims 1
- ZWBXNHSDBLFMPD-FQEVSTJZSA-N (2S)-2,4-dimethyl-1-[2-methyl-4-[2-(trifluoromethyl)imidazo[1,2-b]pyridazin-8-yl]phenoxy]pentan-2-amine Chemical compound C[C@@](COC1=C(C=C(C=C1)C=1C=2N(N=CC=1)C=C(N=2)C(F)(F)F)C)(CC(C)C)N ZWBXNHSDBLFMPD-FQEVSTJZSA-N 0.000 claims 1
- CAMODTUZESZPTO-SFHVURJKSA-N (2S)-2,4-dimethyl-1-[2-methyl-6-(2-methylpyrimidin-4-yl)pyridin-3-yl]oxypentan-2-amine Chemical compound C[C@@](COC=1C(=NC(=CC=1)C1=NC(=NC=C1)C)C)(CC(C)C)N CAMODTUZESZPTO-SFHVURJKSA-N 0.000 claims 1
- NQSHPCVRRMFJCB-SFHVURJKSA-N (2S)-2,4-dimethyl-1-[2-methyl-6-[2-(trifluoromethyl)pyridin-4-yl]pyridin-3-yl]oxypentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=C(C)N=C(C=C1)C1=CC(=NC=C1)C(F)(F)F NQSHPCVRRMFJCB-SFHVURJKSA-N 0.000 claims 1
- XWVLXABIHUJMKI-SFHVURJKSA-N (2S)-2,4-dimethyl-1-[3-methyl-5-(6-methylpyrimidin-4-yl)pyridin-2-yl]oxypentan-2-amine Chemical compound C[C@@](COC1=NC=C(C=C1C)C1=NC=NC(=C1)C)(CC(C)C)N XWVLXABIHUJMKI-SFHVURJKSA-N 0.000 claims 1
- IJPSSWRNIYOXIB-NRFANRHFSA-N (2S)-2,4-dimethyl-1-[4-(2-methyl-1H-pyrrolo[2,3-b]pyridin-4-yl)-2-(trifluoromethyl)phenoxy]pentan-2-amine Chemical compound C[C@@](COC1=C(C=C(C=C1)C1=C2C(=NC=C1)NC(=C2)C)C(F)(F)F)(CC(C)C)N IJPSSWRNIYOXIB-NRFANRHFSA-N 0.000 claims 1
- IBXFJMPAXJNQCV-FQEVSTJZSA-N (2S)-2,4-dimethyl-1-[4-(2-methylthieno[2,3-d]pyrimidin-4-yl)-2-(trifluoromethyl)phenoxy]pentan-2-amine Chemical compound C[C@@](COC1=C(C=C(C=C1)C=1C2=C(N=C(N=1)C)SC=C2)C(F)(F)F)(CC(C)C)N IBXFJMPAXJNQCV-FQEVSTJZSA-N 0.000 claims 1
- NMIHYGDPGMTIIF-IBGZPJMESA-N (2S)-2,4-dimethyl-1-[4-[2-(trifluoromethyl)imidazo[1,2-b]pyridazin-8-yl]phenoxy]pentan-2-amine Chemical compound C[C@@](COC1=CC=C(C=C1)C=1C=2N(N=CC=1)C=C(N=2)C(F)(F)F)(CC(C)C)N NMIHYGDPGMTIIF-IBGZPJMESA-N 0.000 claims 1
- XVOACXYWAZTIKQ-SFHVURJKSA-N (2S)-2,4-dimethyl-1-[4-methyl-6-(6-methylpyrimidin-4-yl)pyridin-3-yl]oxypentan-2-amine Chemical compound C[C@@](COC=1C=NC(=CC=1C)C1=NC=NC(=C1)C)(CC(C)C)N XVOACXYWAZTIKQ-SFHVURJKSA-N 0.000 claims 1
- GQTXVEHCJGYSSS-SFHVURJKSA-N (2S)-2,4-dimethyl-1-[4-methyl-6-[2-(trifluoromethyl)pyridin-4-yl]pyridin-3-yl]oxypentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=CN=C(C=C1C)C1=CC(=NC=C1)C(F)(F)F GQTXVEHCJGYSSS-SFHVURJKSA-N 0.000 claims 1
- SJTIZWLIWYTKLZ-FQEVSTJZSA-N (2S)-2,4-dimethyl-1-[5-(2-methylpyrimidin-4-yl)-3-(1,3-oxazol-5-yl)pyridin-2-yl]oxypentan-2-amine Chemical compound C[C@@](COC1=NC=C(C=C1C1=CN=CO1)C1=NC(=NC=C1)C)(CC(C)C)N SJTIZWLIWYTKLZ-FQEVSTJZSA-N 0.000 claims 1
- LNUMKTDWDOCBHB-KRWDZBQOSA-N (2S)-2,4-dimethyl-1-[6-(2-methylpyrimidin-4-yl)-2-(trifluoromethyl)pyridin-3-yl]oxypentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=CC=C(N=C1C(F)(F)F)C1=CC=NC(C)=N1 LNUMKTDWDOCBHB-KRWDZBQOSA-N 0.000 claims 1
- VJWWCIIQNAXBRB-FQEVSTJZSA-N (2S)-2,4-dimethyl-1-[6-(2-methylpyrimidin-4-yl)-4-(1,3-oxazol-5-yl)pyridin-3-yl]oxypentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(N=C1)C1=CC=NC(C)=N1)C1=CN=CO1 VJWWCIIQNAXBRB-FQEVSTJZSA-N 0.000 claims 1
- BKEAKMLRGWILBU-UHFFFAOYSA-N 1,1,1-trifluoro-4-methyl-2-[(2-methyl-6-pyrazolo[1,5-a]pyrimidin-7-ylpyridin-3-yl)oxymethyl]pentan-2-amine Chemical compound CC(C)CC(N)(COC1=CC=C(N=C1C)C1=CC=NC2=CC=NN12)C(F)(F)F BKEAKMLRGWILBU-UHFFFAOYSA-N 0.000 claims 1
- DQWVECDZTBHDML-UHFFFAOYSA-N 2-(difluoromethyl)-6-[2-(difluoromethyl)pyridin-4-yl]-3-[[2-(2-methylpropyl)azetidin-2-yl]methoxy]pyridine Chemical compound FC(C1=NC=CC(=C1)C1=NC(=C(C=C1)OCC1(NCC1)CC(C)C)C(F)F)F DQWVECDZTBHDML-UHFFFAOYSA-N 0.000 claims 1
- GPHQKOCUIQONQZ-QHCPKHFHSA-N 2-[(2S)-2-amino-2,4-dimethylpentoxy]-5-(2-cyclopropylimidazo[1,2-b]pyridazin-8-yl)benzonitrile Chemical compound N[C@](COC1=C(C#N)C=C(C=C1)C=1C=2N(N=CC=1)C=C(N=2)C1CC1)(CC(C)C)C GPHQKOCUIQONQZ-QHCPKHFHSA-N 0.000 claims 1
- OLVLZGMMYLQFMV-IBGZPJMESA-N 2-[(2S)-2-amino-2,4-dimethylpentoxy]-5-(2-methoxypyridin-4-yl)pyridine-3-carbonitrile Chemical compound COC1=NC=CC(=C1)C1=CC(C#N)=C(OC[C@@](C)(N)CC(C)C)N=C1 OLVLZGMMYLQFMV-IBGZPJMESA-N 0.000 claims 1
- HPIVVEODRVNBIU-NRFANRHFSA-N 2-[(2S)-2-amino-2,4-dimethylpentoxy]-5-(2-methylimidazo[1,2-b]pyridazin-8-yl)benzonitrile Chemical compound N[C@](COC1=C(C#N)C=C(C=C1)C=1C=2N(N=CC=1)C=C(N=2)C)(CC(C)C)C HPIVVEODRVNBIU-NRFANRHFSA-N 0.000 claims 1
- ILIXSERZCVATSL-QHCPKHFHSA-N 2-[(2S)-2-amino-2,4-dimethylpentoxy]-5-(6-chloro-2-cyclopropylimidazo[1,2-b]pyridazin-8-yl)benzonitrile Chemical compound N[C@](COC1=C(C#N)C=C(C=C1)C=1C=2N(N=C(C=1)Cl)C=C(N=2)C1CC1)(CC(C)C)C ILIXSERZCVATSL-QHCPKHFHSA-N 0.000 claims 1
- RQCZDSOWPMKDBV-IBGZPJMESA-N 2-[(2S)-2-amino-2,4-dimethylpentoxy]-5-(6-methylpyrimidin-4-yl)benzonitrile Chemical compound N[C@](COC1=C(C#N)C=C(C=C1)C1=NC=NC(=C1)C)(CC(C)C)C RQCZDSOWPMKDBV-IBGZPJMESA-N 0.000 claims 1
- VCBNGRWDYBWXKN-IBGZPJMESA-N 2-[(2S)-2-amino-2,4-dimethylpentoxy]-5-[2-(difluoromethyl)pyrimidin-4-yl]benzonitrile Chemical compound N[C@](COC1=C(C#N)C=C(C=C1)C1=NC(=NC=C1)C(F)F)(CC(C)C)C VCBNGRWDYBWXKN-IBGZPJMESA-N 0.000 claims 1
- WBHCPPPSDWCQAE-FQEVSTJZSA-N 2-[(2S)-2-amino-2,4-dimethylpentoxy]-5-[2-(trifluoromethyl)pyrazolo[1,5-a]pyrimidin-7-yl]benzonitrile Chemical compound N[C@](COC1=C(C#N)C=C(C=C1)C1=CC=NC=2N1N=C(C=2)C(F)(F)F)(CC(C)C)C WBHCPPPSDWCQAE-FQEVSTJZSA-N 0.000 claims 1
- YJBWEBYOOJGRQD-QHCPKHFHSA-N 4-[4-[(2S)-2-amino-2,4-dimethylpentoxy]-3-(trifluoromethyl)phenyl]-N-(furan-2-ylmethyl)pyridin-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(NCC2=CC=CO2)=NC=C1)C(F)(F)F YJBWEBYOOJGRQD-QHCPKHFHSA-N 0.000 claims 1
- NLRFTFMASHSWIC-NRFANRHFSA-N 4-[4-[(2S)-2-amino-2,4-dimethylpentoxy]-3-fluorophenyl]-6-methyl-7H-pyrrolo[3,4-b]pyridin-5-one Chemical compound N[C@](COC1=C(C=C(C=C1)C1=C2C(=NC=C1)CN(C2=O)C)F)(CC(C)C)C NLRFTFMASHSWIC-NRFANRHFSA-N 0.000 claims 1
- YDGIKDGVRAZDSF-SFHVURJKSA-N 4-[5-[(2S)-2-amino-2,4-dimethylpentoxy]-6-methylpyridin-2-yl]pyridin-2-amine Chemical compound N[C@](COC=1C=CC(=NC=1C)C1=CC(=NC=C1)N)(CC(C)C)C YDGIKDGVRAZDSF-SFHVURJKSA-N 0.000 claims 1
- QHBJYXAWUZGADH-KRWDZBQOSA-N 4-[5-[(2S)-2-amino-2,4-dimethylpentoxy]-6-methylpyridin-2-yl]pyrimidin-2-amine Chemical compound N[C@](COC=1C=CC(=NC=1C)C1=NC(=NC=C1)N)(CC(C)C)C QHBJYXAWUZGADH-KRWDZBQOSA-N 0.000 claims 1
- CPIXOEHRYRXGDS-SFHVURJKSA-N 5-[(2S)-2-amino-2,4-dimethylpentoxy]-2-(2-methylpyrimidin-4-yl)pyridine-4-carbonitrile Chemical compound N[C@](COC1=CN=C(C=C1C#N)C1=NC(=NC=C1)C)(CC(C)C)C CPIXOEHRYRXGDS-SFHVURJKSA-N 0.000 claims 1
- CBKXQMXUADIAMG-IBGZPJMESA-N 5-[(2S)-2-amino-2,4-dimethylpentoxy]-2-pyrazolo[1,5-a]pyrimidin-7-ylpyridine-4-carbonitrile Chemical compound N[C@](COC1=CN=C(C=C1C#N)C1=CC=NC=2N1N=CC=2)(CC(C)C)C CBKXQMXUADIAMG-IBGZPJMESA-N 0.000 claims 1
- WKBMDESCGNLJAB-IBGZPJMESA-N BrC1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C Chemical compound BrC1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C WKBMDESCGNLJAB-IBGZPJMESA-N 0.000 claims 1
- YBIVTEKYCUSQHU-SFHVURJKSA-N BrC1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)F Chemical compound BrC1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)F YBIVTEKYCUSQHU-SFHVURJKSA-N 0.000 claims 1
- WCFHRUMWKBXQBE-SFHVURJKSA-N BrC1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1F)F Chemical compound BrC1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1F)F WCFHRUMWKBXQBE-SFHVURJKSA-N 0.000 claims 1
- HEPMTGCGKVBUDH-MHZLTWQESA-N C(#N)C1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=C2C(=NC=C1)NC(=C2)C Chemical compound C(#N)C1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=C2C(=NC=C1)NC(=C2)C HEPMTGCGKVBUDH-MHZLTWQESA-N 0.000 claims 1
- UKAIKIISFDOVNA-DEOSSOPVSA-N C(#N)C1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=NC(=NC=C1)C Chemical compound C(#N)C1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=NC(=NC=C1)C UKAIKIISFDOVNA-DEOSSOPVSA-N 0.000 claims 1
- KQAAGMXGJSPEOA-QHCPKHFHSA-N C(#N)C1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=NC(=NC=C1)C(F)(F)F Chemical compound C(#N)C1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=NC(=NC=C1)C(F)(F)F KQAAGMXGJSPEOA-QHCPKHFHSA-N 0.000 claims 1
- JDULUDPUPBZBQH-VWLOTQADSA-N C(#N)C1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=NC=NC(=C1)CC Chemical compound C(#N)C1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=NC=NC(=C1)CC JDULUDPUPBZBQH-VWLOTQADSA-N 0.000 claims 1
- WEXNEGNHJJOXHL-VWLOTQADSA-N C(C)(=O)NC1=CC(=NC=N1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C Chemical compound C(C)(=O)NC1=CC(=NC=N1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C WEXNEGNHJJOXHL-VWLOTQADSA-N 0.000 claims 1
- URVREKSJBNYLND-QHCPKHFHSA-N C(C)(C)(C)OC(N[C@](COC1=C(C=C(C=C1)C1=NC=NC(=C1)C)C(F)(F)F)(CC(C)C)C)=O Chemical compound C(C)(C)(C)OC(N[C@](COC1=C(C=C(C=C1)C1=NC=NC(=C1)C)C(F)(F)F)(CC(C)C)C)=O URVREKSJBNYLND-QHCPKHFHSA-N 0.000 claims 1
- AITAVJSBKBFXKV-DEOSSOPVSA-N C(C)C1=CC(=NC=N1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F Chemical compound C(C)C1=CC(=NC=N1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F AITAVJSBKBFXKV-DEOSSOPVSA-N 0.000 claims 1
- KNKAABYFUJVMAY-QHCPKHFHSA-N CC(C)CC(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@@](C)(N)CC(C)C)C=C1)C(F)(F)F Chemical compound CC(C)CC(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@@](C)(N)CC(C)C)C=C1)C(F)(F)F KNKAABYFUJVMAY-QHCPKHFHSA-N 0.000 claims 1
- GMYPQVTZBYPWLT-DEOSSOPVSA-N CC(C)C[C@@](C)(COC1=C(Cl)C=C(C=C1)B1OC(C)(C)C(C)(C)O1)NC(=O)OC(C)(C)C Chemical compound CC(C)C[C@@](C)(COC1=C(Cl)C=C(C=C1)B1OC(C)(C)C(C)(C)O1)NC(=O)OC(C)(C)C GMYPQVTZBYPWLT-DEOSSOPVSA-N 0.000 claims 1
- SRBGXLVNHFSKKZ-DEOSSOPVSA-N CC(C)C[C@@](C)(COC1=CC=C(C=C1)B1OC(C)(C)C(C)(C)O1)NC(=O)OC(C)(C)C Chemical compound CC(C)C[C@@](C)(COC1=CC=C(C=C1)B1OC(C)(C)C(C)(C)O1)NC(=O)OC(C)(C)C SRBGXLVNHFSKKZ-DEOSSOPVSA-N 0.000 claims 1
- KMFWSWKDRCBYPJ-SANMLTNESA-N CC(C)C[C@@](C)(COC1=CC=C(C=C1C(F)(F)F)C1=NC(NC(=O)OC(C)C)=NC=C1)NC(=O)OC(C)(C)C Chemical compound CC(C)C[C@@](C)(COC1=CC=C(C=C1C(F)(F)F)C1=NC(NC(=O)OC(C)C)=NC=C1)NC(=O)OC(C)(C)C KMFWSWKDRCBYPJ-SANMLTNESA-N 0.000 claims 1
- VALCVENLXBCJPG-SFHVURJKSA-N CC(C)C[C@@](C)(COC1=CC=C(I)N=C1C)NC(=O)OC(C)(C)C Chemical compound CC(C)C[C@@](C)(COC1=CC=C(I)N=C1C)NC(=O)OC(C)(C)C VALCVENLXBCJPG-SFHVURJKSA-N 0.000 claims 1
- XZPFRRCTDKFOLM-SFHVURJKSA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(Cl)=NC=N1)C#N Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(Cl)=NC=N1)C#N XZPFRRCTDKFOLM-SFHVURJKSA-N 0.000 claims 1
- STIBTNSZQHPXMJ-VWLOTQADSA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(NC(=O)C2=NNC(=C2)C(C)C)=NC=C1)C(F)(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(NC(=O)C2=NNC(=C2)C(C)C)=NC=C1)C(F)(F)F STIBTNSZQHPXMJ-VWLOTQADSA-N 0.000 claims 1
- XTEBSQGAAUIYIS-DEOSSOPVSA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(NCC2=CC=CN=C2)=NC=C1)C(F)(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(NCC2=CC=CN=C2)=NC=C1)C(F)(F)F XTEBSQGAAUIYIS-DEOSSOPVSA-N 0.000 claims 1
- OGAIIPYGTBOPMO-SFHVURJKSA-N CC(C)C[C@](C)(N)COC1=C(N=C(C=C1)C1=CC(=NC=C1)C(F)(F)F)C(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(N=C(C=C1)C1=CC(=NC=C1)C(F)(F)F)C(F)F OGAIIPYGTBOPMO-SFHVURJKSA-N 0.000 claims 1
- SECWLUJDTUFUCI-DEOSSOPVSA-N CC1=NC(=CC(=N1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F)C Chemical compound CC1=NC(=CC(=N1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F)C SECWLUJDTUFUCI-DEOSSOPVSA-N 0.000 claims 1
- BGZRQEFPTXZJCN-VWLOTQADSA-N CCOC(=O)NC1=NC=CC(=N1)C1=CC=C(OC[C@](C)(CC(C)C)NC(=O)OC(C)(C)C)C(=C1)C(F)(F)F Chemical compound CCOC(=O)NC1=NC=CC(=N1)C1=CC=C(OC[C@](C)(CC(C)C)NC(=O)OC(C)(C)C)C(=C1)C(F)(F)F BGZRQEFPTXZJCN-VWLOTQADSA-N 0.000 claims 1
- LZKPAXUMWMIBRS-IBGZPJMESA-N COC(=O)NC1=CC(=NC=N1)C1=C(F)C=C(OC[C@@](C)(N)CC(C)C)C(F)=C1 Chemical compound COC(=O)NC1=CC(=NC=N1)C1=C(F)C=C(OC[C@@](C)(N)CC(C)C)C(F)=C1 LZKPAXUMWMIBRS-IBGZPJMESA-N 0.000 claims 1
- SYSNYDVHFNRVOB-IBGZPJMESA-N COC(=O)NC1=NC(=CC=N1)C1=C(F)C=C(OC[C@@](C)(N)CC(C)C)C(F)=C1 Chemical compound COC(=O)NC1=NC(=CC=N1)C1=C(F)C=C(OC[C@@](C)(N)CC(C)C)C(F)=C1 SYSNYDVHFNRVOB-IBGZPJMESA-N 0.000 claims 1
- AZWVRHRVDPXEEY-VWLOTQADSA-N COC(=O)NC1=NC(=CC=N1)C1=CC=C(OC[C@](C)(CC(C)C)NC(=O)OC(C)(C)C)C(C)=C1 Chemical compound COC(=O)NC1=NC(=CC=N1)C1=CC=C(OC[C@](C)(CC(C)C)NC(=O)OC(C)(C)C)C(C)=C1 AZWVRHRVDPXEEY-VWLOTQADSA-N 0.000 claims 1
- CNAFHIKHNXQPGG-FQEVSTJZSA-N COC(=O)NC1=NC=CC(=C1)C1=NC(CF)=C(OC[C@@](C)(N)CC(C)C)C=C1 Chemical compound COC(=O)NC1=NC=CC(=C1)C1=NC(CF)=C(OC[C@@](C)(N)CC(C)C)C=C1 CNAFHIKHNXQPGG-FQEVSTJZSA-N 0.000 claims 1
- YIRVWHXKLZLQNU-VWLOTQADSA-N COC(=O)NC1=NC=CC(=N1)C1=CC=C(OC[C@](C)(CC(C)C)NC(=O)OC(C)(C)C)C(=C1)C#N Chemical compound COC(=O)NC1=NC=CC(=N1)C1=CC=C(OC[C@](C)(CC(C)C)NC(=O)OC(C)(C)C)C(=C1)C#N YIRVWHXKLZLQNU-VWLOTQADSA-N 0.000 claims 1
- PSPYAPHQKNAPFI-DEOSSOPVSA-N COC(=O)NC1=NC=CC(=N1)C1=CC=C(OC[C@](C)(CC(C)C)NC(=O)OC(C)(C)C)C(=C1)C(F)(F)F Chemical compound COC(=O)NC1=NC=CC(=N1)C1=CC=C(OC[C@](C)(CC(C)C)NC(=O)OC(C)(C)C)C(=C1)C(F)(F)F PSPYAPHQKNAPFI-DEOSSOPVSA-N 0.000 claims 1
- AMFMYUMFPDUDSR-DEOSSOPVSA-N COC(=O)NC1=NC=CC(=N1)C1=CC=C(OC[C@](C)(CC(C)C)NC(=O)OC(C)(C)C)C(Cl)=C1 Chemical compound COC(=O)NC1=NC=CC(=N1)C1=CC=C(OC[C@](C)(CC(C)C)NC(=O)OC(C)(C)C)C(Cl)=C1 AMFMYUMFPDUDSR-DEOSSOPVSA-N 0.000 claims 1
- KWFAECYQXWPSHL-DEOSSOPVSA-N COC(=O)NC1=NN=CC(=C1)C1=CC=C(OC[C@](C)(CC(C)C)NC(=O)OC(C)(C)C)C(Cl)=C1 Chemical compound COC(=O)NC1=NN=CC(=C1)C1=CC=C(OC[C@](C)(CC(C)C)NC(=O)OC(C)(C)C)C(Cl)=C1 KWFAECYQXWPSHL-DEOSSOPVSA-N 0.000 claims 1
- UUXQIVZZDGHWGV-VWLOTQADSA-N COC1=NC=CC(=C1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C Chemical compound COC1=NC=CC(=C1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C UUXQIVZZDGHWGV-VWLOTQADSA-N 0.000 claims 1
- JBSIDAOHQJUDKU-QHCPKHFHSA-N C[C@@](COC1=C(C=C(C=C1)C1=NC(=NC=C1)C(F)(F)F)C)(CC(C)C)NC(OC(C)(C)C)=O Chemical compound C[C@@](COC1=C(C=C(C=C1)C1=NC(=NC=C1)C(F)(F)F)C)(CC(C)C)NC(OC(C)(C)C)=O JBSIDAOHQJUDKU-QHCPKHFHSA-N 0.000 claims 1
- NUQKSHNJZFWRGH-QHCPKHFHSA-N C[C@@](COC1=C(C=C(C=C1)C1=NC(=NC=C1)C)C(F)(F)F)(CC(C)C)NC(OC(C)(C)C)=O Chemical compound C[C@@](COC1=C(C=C(C=C1)C1=NC(=NC=C1)C)C(F)(F)F)(CC(C)C)NC(OC(C)(C)C)=O NUQKSHNJZFWRGH-QHCPKHFHSA-N 0.000 claims 1
- YIYOTINRWMDGRF-DEOSSOPVSA-N C[C@@](COC1=C(C=C(C=C1)C1=NC(=NC=C1)C)C)(CC(C)C)NC(OC(C)(C)C)=O Chemical compound C[C@@](COC1=C(C=C(C=C1)C1=NC(=NC=C1)C)C)(CC(C)C)NC(OC(C)(C)C)=O YIYOTINRWMDGRF-DEOSSOPVSA-N 0.000 claims 1
- BXGSILHFQCMUMQ-DEOSSOPVSA-N C[C@@](COC1=C(C=C(C=C1)C1=NC=NC(=C1)C)C)(CC(C)C)NC(OC(C)(C)C)=O Chemical compound C[C@@](COC1=C(C=C(C=C1)C1=NC=NC(=C1)C)C)(CC(C)C)NC(OC(C)(C)C)=O BXGSILHFQCMUMQ-DEOSSOPVSA-N 0.000 claims 1
- KGTXKCSZUJPTDB-FQEVSTJZSA-N C[C@@](COC1=C(C=C(C=C1)C=1C=2N(N=CC=1)C=C(N=2)C)C(F)(F)F)(CC(C)C)N Chemical compound C[C@@](COC1=C(C=C(C=C1)C=1C=2N(N=CC=1)C=C(N=2)C)C(F)(F)F)(CC(C)C)N KGTXKCSZUJPTDB-FQEVSTJZSA-N 0.000 claims 1
- ROAUYVKHNZPXAW-QHCPKHFHSA-N ClC1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=NC(=NC=C1)C Chemical compound ClC1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=NC(=NC=C1)C ROAUYVKHNZPXAW-QHCPKHFHSA-N 0.000 claims 1
- DHUTYOAGXQCKAX-VWLOTQADSA-N ClC1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=NC(=NC=C1)C(C)C Chemical compound ClC1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=NC(=NC=C1)C(C)C DHUTYOAGXQCKAX-VWLOTQADSA-N 0.000 claims 1
- GOTOOCRVDFHYIV-QFIPXVFZSA-N ClC1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=NC(=NC=C1)C(F)(F)F Chemical compound ClC1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=NC(=NC=C1)C(F)(F)F GOTOOCRVDFHYIV-QFIPXVFZSA-N 0.000 claims 1
- DNBFQCHMKIRYSA-QFIPXVFZSA-N ClC1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=NC(=NC=C1)Cl Chemical compound ClC1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=NC(=NC=C1)Cl DNBFQCHMKIRYSA-QFIPXVFZSA-N 0.000 claims 1
- NXZVHVWAAHWQPA-QHCPKHFHSA-N ClC1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=NC=NC(=C1)C Chemical compound ClC1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=NC=NC(=C1)C NXZVHVWAAHWQPA-QHCPKHFHSA-N 0.000 claims 1
- MUBLYAYJEWYQBK-QHCPKHFHSA-N ClC1=CC(=NC=N1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C#N Chemical compound ClC1=CC(=NC=N1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C#N MUBLYAYJEWYQBK-QHCPKHFHSA-N 0.000 claims 1
- QECUFHZZBXEITL-QFIPXVFZSA-N ClC1=CC(=NC=N1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F Chemical compound ClC1=CC(=NC=N1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F QECUFHZZBXEITL-QFIPXVFZSA-N 0.000 claims 1
- OJAKVICODSDBNP-QHCPKHFHSA-N ClC1=NC=CC(=N1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C#N Chemical compound ClC1=NC=CC(=N1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C#N OJAKVICODSDBNP-QHCPKHFHSA-N 0.000 claims 1
- DCPBIRRYZYKVLY-QFIPXVFZSA-N ClC1=NC=CC(=N1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F Chemical compound ClC1=NC=CC(=N1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F DCPBIRRYZYKVLY-QFIPXVFZSA-N 0.000 claims 1
- PGLHOMQXJZWBRS-QFIPXVFZSA-N ClC1=NC=CC(=N1)C1=CC=C(C(=N1)C)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O Chemical compound ClC1=NC=CC(=N1)C1=CC=C(C(=N1)C)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O PGLHOMQXJZWBRS-QFIPXVFZSA-N 0.000 claims 1
- PUMNLDADMRYMKA-QHCPKHFHSA-N FC1=NC=CC(=C1)C1=NC=C(C(=C1)C)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O Chemical compound FC1=NC=CC(=C1)C1=NC=C(C(=C1)C)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O PUMNLDADMRYMKA-QHCPKHFHSA-N 0.000 claims 1
- CJUDEYLRRWEPHI-UCSBTNPJSA-N N-[4-[4-[(2S)-2-amino-2,4-dimethylpentoxy]-3-(trifluoromethyl)phenyl]pyridin-2-yl]-3-methylpentanamide Chemical compound N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(CC(CC)C)=O)C(F)(F)F)(CC(C)C)C CJUDEYLRRWEPHI-UCSBTNPJSA-N 0.000 claims 1
- ZHMYZAQLJIAIML-DEOSSOPVSA-N N-[4-[4-[(2S)-2-amino-2,4-dimethylpentoxy]-3-(trifluoromethyl)phenyl]pyridin-2-yl]-4-methylpentanamide Chemical compound N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(CCC(C)C)=O)C(F)(F)F)(CC(C)C)C ZHMYZAQLJIAIML-DEOSSOPVSA-N 0.000 claims 1
- YNTLLTJBHMDFGR-QHCPKHFHSA-N N-[4-[4-[(2S)-2-amino-2,4-dimethylpentoxy]-3-(trifluoromethyl)phenyl]pyridin-2-yl]-5-methyl-1,2-oxazole-3-carboxamide Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(NC(=O)C2=NOC(C)=C2)=NC=C1)C(F)(F)F YNTLLTJBHMDFGR-QHCPKHFHSA-N 0.000 claims 1
- ISFHPNHSGNEPIB-QHCPKHFHSA-N NC1=NC=CC(=C1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F Chemical compound NC1=NC=CC(=C1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F ISFHPNHSGNEPIB-QHCPKHFHSA-N 0.000 claims 1
- JPFXZFOXTVGRDA-LJQANCHMSA-N N[C@@](COC1=C(C=C(C=N1)C1=NC(=NC=C1)NC(OC)=O)C)(CC(C)C)C Chemical compound N[C@@](COC1=C(C=C(C=N1)C1=NC(=NC=C1)NC(OC)=O)C)(CC(C)C)C JPFXZFOXTVGRDA-LJQANCHMSA-N 0.000 claims 1
- KNIFCKHVVQVHPJ-GOSISDBHSA-N N[C@@](COC1=C(C=C(C=N1)C1=NC(=NC=C1)NC(OC)=O)Cl)(CC(C)C)C Chemical compound N[C@@](COC1=C(C=C(C=N1)C1=NC(=NC=C1)NC(OC)=O)Cl)(CC(C)C)C KNIFCKHVVQVHPJ-GOSISDBHSA-N 0.000 claims 1
- IHZJPJROWHPTCL-GOSISDBHSA-N N[C@@](COC1=C(C=C(C=N1)C1=NC(=NC=C1)NC(OC)=O)F)(CC(C)C)C Chemical compound N[C@@](COC1=C(C=C(C=N1)C1=NC(=NC=C1)NC(OC)=O)F)(CC(C)C)C IHZJPJROWHPTCL-GOSISDBHSA-N 0.000 claims 1
- HQYXPHDJALHZOC-VWLOTQADSA-N N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC1=CC2=C(OCO2)C=C1)C(F)(F)F)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC1=CC2=C(OCO2)C=C1)C(F)(F)F)(CC(C)C)C HQYXPHDJALHZOC-VWLOTQADSA-N 0.000 claims 1
- KBZFWOCHVZRANF-IBGZPJMESA-N N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=N1)NC(OC)=O)C(F)(F)F)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=N1)NC(OC)=O)C(F)(F)F)(CC(C)C)C KBZFWOCHVZRANF-IBGZPJMESA-N 0.000 claims 1
- XHPGNKKCONUHAQ-KRWDZBQOSA-N N[C@](COC1=C(C=C(C=C1)C1=CC(NC=N1)=O)Cl)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=C1)C1=CC(NC=N1)=O)Cl)(CC(C)C)C XHPGNKKCONUHAQ-KRWDZBQOSA-N 0.000 claims 1
- FCDGECJJXGLBJX-KRWDZBQOSA-N N[C@](COC1=C(C=C(C=C1)C1=NC(=NC=C1)O)C(F)(F)F)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=C1)C1=NC(=NC=C1)O)C(F)(F)F)(CC(C)C)C FCDGECJJXGLBJX-KRWDZBQOSA-N 0.000 claims 1
- CEQCSEJIBMRNEN-FQEVSTJZSA-N N[C@](COC1=C(C=C(C=C1)C=1C=C(N=NC=1)NC(OC)=O)C#N)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=C1)C=1C=C(N=NC=1)NC(OC)=O)C#N)(CC(C)C)C CEQCSEJIBMRNEN-FQEVSTJZSA-N 0.000 claims 1
- LWCUISZWGAZAMB-IBGZPJMESA-N N[C@](COC1=C(C=C(C=N1)C1=CC(=NC=N1)NC(OC)=O)C)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=N1)C1=CC(=NC=N1)NC(OC)=O)C)(CC(C)C)C LWCUISZWGAZAMB-IBGZPJMESA-N 0.000 claims 1
- LJEWKSGYSPHRRA-SFHVURJKSA-N N[C@](COC1=C(C=C(C=N1)C1=CC(=NC=N1)NC(OC)=O)Cl)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=N1)C1=CC(=NC=N1)NC(OC)=O)Cl)(CC(C)C)C LJEWKSGYSPHRRA-SFHVURJKSA-N 0.000 claims 1
- JPFXZFOXTVGRDA-IBGZPJMESA-N N[C@](COC1=C(C=C(C=N1)C1=NC(=NC=C1)NC(OC)=O)C)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=N1)C1=NC(=NC=C1)NC(OC)=O)C)(CC(C)C)C JPFXZFOXTVGRDA-IBGZPJMESA-N 0.000 claims 1
- KNIFCKHVVQVHPJ-SFHVURJKSA-N N[C@](COC1=C(C=C(C=N1)C1=NC(=NC=C1)NC(OC)=O)Cl)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=N1)C1=NC(=NC=C1)NC(OC)=O)Cl)(CC(C)C)C KNIFCKHVVQVHPJ-SFHVURJKSA-N 0.000 claims 1
- RATCBMQFWBQWKS-IBGZPJMESA-N N[C@](COC1=CC(=C(C=N1)C1=NC(=NC=C1)NC(OC)=O)C)(CC(C)C)C Chemical compound N[C@](COC1=CC(=C(C=N1)C1=NC(=NC=C1)NC(OC)=O)C)(CC(C)C)C RATCBMQFWBQWKS-IBGZPJMESA-N 0.000 claims 1
- CCRNDRCUVGXVOY-IBGZPJMESA-N N[C@](COC=1C=CC(=NC=1C(F)F)C1=NC(=NC=C1)NC(OC)=O)(CC(C)C)C Chemical compound N[C@](COC=1C=CC(=NC=1C(F)F)C1=NC(=NC=C1)NC(OC)=O)(CC(C)C)C CCRNDRCUVGXVOY-IBGZPJMESA-N 0.000 claims 1
- QHAJPDBDWJDQPA-IBGZPJMESA-N N[C@](COC=1C=CC(=NC=1C)C1=NC(=NC=C1)NC(OC)=O)(CC(C)C)C Chemical compound N[C@](COC=1C=CC(=NC=1C)C1=NC(=NC=C1)NC(OC)=O)(CC(C)C)C QHAJPDBDWJDQPA-IBGZPJMESA-N 0.000 claims 1
- OIXMDUVCOSGJOR-IBGZPJMESA-N N[C@](COC=1C=CC(=NC=1CF)C1=NC(=NC=C1)NC(OC)=O)(CC(C)C)C Chemical compound N[C@](COC=1C=CC(=NC=1CF)C1=NC(=NC=C1)NC(OC)=O)(CC(C)C)C OIXMDUVCOSGJOR-IBGZPJMESA-N 0.000 claims 1
- JLSFIEDKSVOGGY-VWLOTQADSA-N methyl N-[6-[4-[(2S)-2,4-dimethyl-2-[(2-methylpropan-2-yl)oxycarbonylamino]pentoxy]-3-methylphenyl]pyrimidin-4-yl]carbamate Chemical compound CC1=C(C=CC(=C1)C2=CC(=NC=N2)NC(=O)OC)OC[C@](C)(CC(C)C)NC(=O)OC(C)(C)C JLSFIEDKSVOGGY-VWLOTQADSA-N 0.000 claims 1
- 238000000034 method Methods 0.000 abstract description 461
- 239000000203 mixture Substances 0.000 abstract description 163
- 108091000080 Phosphotransferase Proteins 0.000 abstract description 7
- 230000002401 inhibitory effect Effects 0.000 abstract description 7
- 102000020233 phosphotransferase Human genes 0.000 abstract description 7
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 900
- 230000014759 maintenance of location Effects 0.000 description 441
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 419
- 238000005481 NMR spectroscopy Methods 0.000 description 232
- 238000005160 1H NMR spectroscopy Methods 0.000 description 171
- 239000007787 solid Substances 0.000 description 166
- 235000019439 ethyl acetate Nutrition 0.000 description 159
- 239000011734 sodium Substances 0.000 description 155
- 239000000243 solution Substances 0.000 description 139
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 132
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 126
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 124
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 116
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 114
- 238000006243 chemical reaction Methods 0.000 description 105
- 230000002829 reductive effect Effects 0.000 description 103
- 239000010410 layer Substances 0.000 description 89
- 239000011541 reaction mixture Substances 0.000 description 79
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 76
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical class CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 72
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 69
- 229910052757 nitrogen Inorganic materials 0.000 description 64
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 56
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 50
- 238000010898 silica gel chromatography Methods 0.000 description 46
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 41
- DTQVDTLACAAQTR-UHFFFAOYSA-N trifluoroacetic acid Substances OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 40
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 39
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 38
- 238000006069 Suzuki reaction reaction Methods 0.000 description 38
- 239000012267 brine Substances 0.000 description 37
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 37
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 36
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 36
- 238000000746 purification Methods 0.000 description 36
- 239000000725 suspension Substances 0.000 description 36
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 33
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 33
- 239000003921 oil Substances 0.000 description 30
- 239000012044 organic layer Substances 0.000 description 30
- 235000019198 oils Nutrition 0.000 description 29
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 28
- 239000005695 Ammonium acetate Substances 0.000 description 28
- 235000019257 ammonium acetate Nutrition 0.000 description 28
- 229940043376 ammonium acetate Drugs 0.000 description 28
- 239000000543 intermediate Substances 0.000 description 28
- 239000013058 crude material Substances 0.000 description 24
- 239000000047 product Substances 0.000 description 24
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 23
- 201000010099 disease Diseases 0.000 description 23
- 239000002904 solvent Substances 0.000 description 23
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 22
- 239000007858 starting material Substances 0.000 description 22
- 239000012071 phase Substances 0.000 description 21
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 21
- 238000010511 deprotection reaction Methods 0.000 description 20
- -1 methoxy, methyl Chemical group 0.000 description 20
- 239000012230 colorless oil Substances 0.000 description 19
- 229910000029 sodium carbonate Inorganic materials 0.000 description 19
- 235000017550 sodium carbonate Nutrition 0.000 description 19
- 101150003085 Pdcl gene Proteins 0.000 description 18
- 235000011056 potassium acetate Nutrition 0.000 description 18
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 17
- 239000000463 material Substances 0.000 description 17
- 238000002953 preparative HPLC Methods 0.000 description 17
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 16
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 16
- 238000004007 reversed phase HPLC Methods 0.000 description 16
- OKKJLVBELUTLKV-MZCSYVLQSA-N Deuterated methanol Chemical compound [2H]OC([2H])([2H])[2H] OKKJLVBELUTLKV-MZCSYVLQSA-N 0.000 description 14
- NXQGGXCHGDYOHB-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloropalladium;iron(2+) Chemical compound [Fe+2].Cl[Pd]Cl.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 NXQGGXCHGDYOHB-UHFFFAOYSA-L 0.000 description 14
- 239000001257 hydrogen Substances 0.000 description 14
- 229910052739 hydrogen Inorganic materials 0.000 description 14
- 238000011282 treatment Methods 0.000 description 14
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 13
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 13
- IPWKHHSGDUIRAH-UHFFFAOYSA-N bis(pinacolato)diboron Chemical compound O1C(C)(C)C(C)(C)OB1B1OC(C)(C)C(C)(C)O1 IPWKHHSGDUIRAH-UHFFFAOYSA-N 0.000 description 13
- 208000035475 disorder Diseases 0.000 description 13
- 239000000843 powder Substances 0.000 description 13
- 238000003756 stirring Methods 0.000 description 13
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 12
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 12
- 239000000706 filtrate Substances 0.000 description 12
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 11
- HRAHSHBSDCCHEO-UHFFFAOYSA-N [2-(methoxycarbonylamino)pyridin-4-yl]boronic acid Chemical compound COC(=O)NC1=NC=CC(=C1)B(O)O HRAHSHBSDCCHEO-UHFFFAOYSA-N 0.000 description 11
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 11
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 10
- 239000003153 chemical reaction reagent Substances 0.000 description 10
- 239000003795 chemical substances by application Substances 0.000 description 10
- CSJLBAMHHLJAAS-UHFFFAOYSA-N diethylaminosulfur trifluoride Chemical compound CCN(CC)S(F)(F)F CSJLBAMHHLJAAS-UHFFFAOYSA-N 0.000 description 10
- 150000002431 hydrogen Chemical class 0.000 description 10
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 10
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 10
- 229910052938 sodium sulfate Inorganic materials 0.000 description 10
- 235000011152 sodium sulphate Nutrition 0.000 description 10
- YEMAIZYKPDFKNU-ZETCQYMHSA-N (2s)-2-amino-2,4-dimethylpentan-1-ol Chemical compound CC(C)C[C@](C)(N)CO YEMAIZYKPDFKNU-ZETCQYMHSA-N 0.000 description 9
- NFTPBBCMDGZSHJ-MHZLTWQESA-N FC1=CC=C2C(=CC=NC2=C1)C1=CC(=C(C=N1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C Chemical compound FC1=CC=C2C(=CC=NC2=C1)C1=CC(=C(C=N1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C NFTPBBCMDGZSHJ-MHZLTWQESA-N 0.000 description 9
- 239000004480 active ingredient Substances 0.000 description 9
- 150000001414 amino alcohols Chemical class 0.000 description 9
- NMMPMZWIIQCZBA-UHFFFAOYSA-M chloropalladium(1+);dicyclohexyl-[2-[2,4,6-tri(propan-2-yl)phenyl]phenyl]phosphane;2-phenylethanamine Chemical compound [Pd+]Cl.NCCC1=CC=CC=[C-]1.CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 NMMPMZWIIQCZBA-UHFFFAOYSA-M 0.000 description 9
- 239000006260 foam Substances 0.000 description 9
- 125000005843 halogen group Chemical group 0.000 description 9
- 230000001225 therapeutic effect Effects 0.000 description 9
- IQYGVKOYWYNKLG-QFIPXVFZSA-N BrC1=CC=C(C2=CC=CC=C12)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O Chemical compound BrC1=CC=C(C2=CC=CC=C12)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O IQYGVKOYWYNKLG-QFIPXVFZSA-N 0.000 description 8
- QMZGHZOFPCTDQS-LBPRGKRZSA-N CC(C)C[C@@]1(C)COS(=O)(=O)N1C(=O)OC(C)(C)C Chemical compound CC(C)C[C@@]1(C)COS(=O)(=O)N1C(=O)OC(C)(C)C QMZGHZOFPCTDQS-LBPRGKRZSA-N 0.000 description 8
- 239000005909 Kieselgur Substances 0.000 description 8
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 8
- JJNHJOVVASIHIL-INIZCTEOSA-N N[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)F)CC(C)C Chemical compound N[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)F)CC(C)C JJNHJOVVASIHIL-INIZCTEOSA-N 0.000 description 8
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 8
- 230000015572 biosynthetic process Effects 0.000 description 8
- 238000007872 degassing Methods 0.000 description 8
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical compound [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 description 8
- 229910052760 oxygen Inorganic materials 0.000 description 8
- 239000001301 oxygen Chemical group 0.000 description 8
- 238000002360 preparation method Methods 0.000 description 8
- 239000003039 volatile agent Substances 0.000 description 8
- BCCBYNRARKBZBS-ZDUSSCGKSA-N BrC1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F Chemical compound BrC1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F BCCBYNRARKBZBS-ZDUSSCGKSA-N 0.000 description 7
- KPYMRFGAAXFXIK-UHFFFAOYSA-N NC(COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)Cl)(CC(C)C)C Chemical compound NC(COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)Cl)(CC(C)C)C KPYMRFGAAXFXIK-UHFFFAOYSA-N 0.000 description 7
- 210000004027 cell Anatomy 0.000 description 7
- 230000000694 effects Effects 0.000 description 7
- 239000000825 pharmaceutical preparation Substances 0.000 description 7
- HXEWMTXDBOQQKO-UHFFFAOYSA-N 4,7-dichloroquinoline Chemical compound ClC1=CC=NC2=CC(Cl)=CC=C21 HXEWMTXDBOQQKO-UHFFFAOYSA-N 0.000 description 6
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 6
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 6
- JJNGXNQWEOMKHY-UHFFFAOYSA-N BrC1=CC(=C(OCC(CC(C)C)(C)NC(OCC2=CC=CC=C2)=O)C=C1)C Chemical compound BrC1=CC(=C(OCC(CC(C)C)(C)NC(OCC2=CC=CC=C2)=O)C=C1)C JJNGXNQWEOMKHY-UHFFFAOYSA-N 0.000 description 6
- YRVKTWYTSXETSB-HNNXBMFYSA-N BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)C1=CC=NO1 Chemical compound BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)C1=CC=NO1 YRVKTWYTSXETSB-HNNXBMFYSA-N 0.000 description 6
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 6
- NZFQPJZRKOFDHS-QHCPKHFHSA-N ClC1=NC=CC(=C1F)C1=NC(=C(C=C1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C Chemical compound ClC1=NC=CC(=C1F)C1=NC(=C(C=C1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C NZFQPJZRKOFDHS-QHCPKHFHSA-N 0.000 description 6
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 6
- LFYHQHOSMHERPO-UHFFFAOYSA-N NC(COC1=C(C(=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)C)C)(CC(C)C)C Chemical compound NC(COC1=C(C(=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)C)C)(CC(C)C)C LFYHQHOSMHERPO-UHFFFAOYSA-N 0.000 description 6
- QWEXPXGCXPEXGZ-UHFFFAOYSA-N NC(COC1=CC=C(C=N1)C1=CC(=NC=C1)NC(OC)=O)(CC(C)C)C Chemical compound NC(COC1=CC=C(C=N1)C1=CC(=NC=C1)NC(OC)=O)(CC(C)C)C QWEXPXGCXPEXGZ-UHFFFAOYSA-N 0.000 description 6
- IDRGFNPZDVBSSE-UHFFFAOYSA-N OCCN1CCN(CC1)c1ccc(Nc2ncc3cccc(-c4cccc(NC(=O)C=C)c4)c3n2)c(F)c1F Chemical compound OCCN1CCN(CC1)c1ccc(Nc2ncc3cccc(-c4cccc(NC(=O)C=C)c4)c3n2)c(F)c1F IDRGFNPZDVBSSE-UHFFFAOYSA-N 0.000 description 6
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 6
- 239000002253 acid Substances 0.000 description 6
- 150000001412 amines Chemical class 0.000 description 6
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 6
- 229910000024 caesium carbonate Inorganic materials 0.000 description 6
- 238000001816 cooling Methods 0.000 description 6
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 description 6
- 239000003112 inhibitor Substances 0.000 description 6
- 239000002244 precipitate Substances 0.000 description 6
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 6
- 238000002560 therapeutic procedure Methods 0.000 description 6
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 6
- SISQPPCZDPNKAD-SFHVURJKSA-N (2S)-1-[6-(2-chloro-5-fluoropyridin-4-yl)-4-(difluoromethyl)pyridin-3-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=CN=C(C=C1C(F)F)C1=CC(Cl)=NC=C1F SISQPPCZDPNKAD-SFHVURJKSA-N 0.000 description 5
- JXELFIJBSANELN-UHFFFAOYSA-N 4-(6-fluoro-5-methylpyridin-3-yl)-2-methylpyrimidine Chemical compound FC1=C(C=C(C=N1)C1=NC(=NC=C1)C)C JXELFIJBSANELN-UHFFFAOYSA-N 0.000 description 5
- IVPHNMMNLBTDRQ-UHFFFAOYSA-N 4-bromo-7-chloroquinoline Chemical compound BrC1=CC=NC2=CC(Cl)=CC=C21 IVPHNMMNLBTDRQ-UHFFFAOYSA-N 0.000 description 5
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical compound CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 description 5
- RQPMGZHKGGZUMV-SFHVURJKSA-N BrC=1C=C(C(=NC1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C#N Chemical compound BrC=1C=C(C(=NC1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C#N RQPMGZHKGGZUMV-SFHVURJKSA-N 0.000 description 5
- LYFLTEPWMHZJSA-ZDUSSCGKSA-N BrC=1C=C(C(=NC1)OC[C@](CC(C)C)(N)C)C(F)F Chemical compound BrC=1C=C(C(=NC1)OC[C@](CC(C)C)(N)C)C(F)F LYFLTEPWMHZJSA-ZDUSSCGKSA-N 0.000 description 5
- PTHYXHFJBQIEOE-DEOSSOPVSA-N CC(C)C[C@@](C)(COC1=C(C=C(C=C1)B1OC(C)(C)C(C)(C)O1)C(F)(F)F)NC(=O)OC(C)(C)C Chemical compound CC(C)C[C@@](C)(COC1=C(C=C(C=C1)B1OC(C)(C)C(C)(C)O1)C(F)(F)F)NC(=O)OC(C)(C)C PTHYXHFJBQIEOE-DEOSSOPVSA-N 0.000 description 5
- RVJJUOGIXQTZRV-SANMLTNESA-N ClC1=C(C=NC(=C1)C1=CC=NC2=CC(=CC=C12)F)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O Chemical compound ClC1=C(C=NC(=C1)C1=CC=NC2=CC(=CC=C12)F)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O RVJJUOGIXQTZRV-SANMLTNESA-N 0.000 description 5
- JUSKTTQYHPHBQN-SANMLTNESA-N ClC1=C(C=NC(=C1)C1=CC=NC2=CC=C(C=C12)F)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O Chemical compound ClC1=C(C=NC(=C1)C1=CC=NC2=CC=C(C=C12)F)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O JUSKTTQYHPHBQN-SANMLTNESA-N 0.000 description 5
- NZYDJZSDSQDTKX-QFIPXVFZSA-N ClC1=CC(=NC=C1OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C1=CC=NC=C1 Chemical compound ClC1=CC(=NC=C1OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C1=CC=NC=C1 NZYDJZSDSQDTKX-QFIPXVFZSA-N 0.000 description 5
- IQJQVNJMMUZATP-QFIPXVFZSA-N ClC1=NC=CC(=C1)C1=NC=C(C(=C1)Cl)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O Chemical compound ClC1=NC=CC(=C1)C1=NC=C(C(=C1)Cl)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O IQJQVNJMMUZATP-QFIPXVFZSA-N 0.000 description 5
- VHXNBVOHECAUTO-SANMLTNESA-N ClC=1C(=NC=C(C1)C1=CC=NC2=CC(=CC=C12)F)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O Chemical compound ClC=1C(=NC=C(C1)C1=CC=NC2=CC(=CC=C12)F)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O VHXNBVOHECAUTO-SANMLTNESA-N 0.000 description 5
- MSDPFDQNEGSXTB-MHZLTWQESA-N FC=1C=C2C(=CC=NC2=CC1)C1=CC(=C(C=N1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C Chemical compound FC=1C=C2C(=CC=NC2=CC1)C1=CC(=C(C=N1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C MSDPFDQNEGSXTB-MHZLTWQESA-N 0.000 description 5
- AHVYPIQETPWLSZ-UHFFFAOYSA-N N-methyl-pyrrolidine Natural products CN1CC=CC1 AHVYPIQETPWLSZ-UHFFFAOYSA-N 0.000 description 5
- XEBLYMQXQWZRAQ-UHFFFAOYSA-N NC(COC=1C=CC(=NC1)C1=CC(=NC=C1)NC(OC)=O)(CC(C)C)C Chemical compound NC(COC=1C=CC(=NC1)C1=CC(=NC=C1)NC(OC)=O)(CC(C)C)C XEBLYMQXQWZRAQ-UHFFFAOYSA-N 0.000 description 5
- YPICVZJBBZPDDD-FQEVSTJZSA-N N[C@](COC=1C(=CC(=NC1)C1=CC(=NC=C1)NC(OC)=O)OC)(CC(C)C)C Chemical compound N[C@](COC=1C(=CC(=NC1)C1=CC(=NC=C1)NC(OC)=O)OC)(CC(C)C)C YPICVZJBBZPDDD-FQEVSTJZSA-N 0.000 description 5
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- 230000005587 bubbling Effects 0.000 description 5
- GPAYUJZHTULNBE-UHFFFAOYSA-N diphenylphosphine Chemical compound C=1C=CC=CC=1PC1=CC=CC=C1 GPAYUJZHTULNBE-UHFFFAOYSA-N 0.000 description 5
- 239000003814 drug Substances 0.000 description 5
- 239000003937 drug carrier Substances 0.000 description 5
- 239000000284 extract Substances 0.000 description 5
- 238000004128 high performance liquid chromatography Methods 0.000 description 5
- SKOWZLGOFVSKLB-UHFFFAOYSA-N hypodiboric acid Chemical compound OB(O)B(O)O SKOWZLGOFVSKLB-UHFFFAOYSA-N 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- 238000007726 management method Methods 0.000 description 5
- 239000012299 nitrogen atmosphere Substances 0.000 description 5
- 229910000027 potassium carbonate Inorganic materials 0.000 description 5
- VVWRJUBEIPHGQF-MDZDMXLPSA-N propan-2-yl (ne)-n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)\N=N\C(=O)OC(C)C VVWRJUBEIPHGQF-MDZDMXLPSA-N 0.000 description 5
- 229920006395 saturated elastomer Polymers 0.000 description 5
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 5
- 238000004809 thin layer chromatography Methods 0.000 description 5
- UGOMMVLRQDMAQQ-UHFFFAOYSA-N xphos Chemical group CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 UGOMMVLRQDMAQQ-UHFFFAOYSA-N 0.000 description 5
- HZNVUJQVZSTENZ-UHFFFAOYSA-N 2,3-dichloro-5,6-dicyano-1,4-benzoquinone Chemical compound ClC1=C(Cl)C(=O)C(C#N)=C(C#N)C1=O HZNVUJQVZSTENZ-UHFFFAOYSA-N 0.000 description 4
- CWDOPTSHRUOSOF-JTQLQIEISA-N 2-[(2s)-1-hydroxy-4-methylpentan-2-yl]isoindole-1,3-dione Chemical compound C1=CC=C2C(=O)N([C@H](CO)CC(C)C)C(=O)C2=C1 CWDOPTSHRUOSOF-JTQLQIEISA-N 0.000 description 4
- FEBLUGZKVJAOLT-UHFFFAOYSA-N 4-bromo-6-chloroquinoline Chemical compound N1=CC=C(Br)C2=CC(Cl)=CC=C21 FEBLUGZKVJAOLT-UHFFFAOYSA-N 0.000 description 4
- VKZJYMMUTPHSKG-UHFFFAOYSA-N 4-methyl-N-[1,1,1-trifluoro-2-(hydroxymethyl)-4-methylpentan-2-yl]benzenesulfonamide Chemical compound CC1=CC=C(C=C1)S(=O)(=O)NC(C(F)(F)F)(CC(C)C)CO VKZJYMMUTPHSKG-UHFFFAOYSA-N 0.000 description 4
- SVTLXGSWLGDTDO-UHFFFAOYSA-N 5,7-difluoro-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)quinoline Chemical compound CC1(C)OB(OC1(C)C)C1=CC=NC2=CC(F)=CC(F)=C12 SVTLXGSWLGDTDO-UHFFFAOYSA-N 0.000 description 4
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 4
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 4
- GWMHVOPFSIOUKT-CYBMUJFWSA-N BrC1=CC(=C(C=N1)OC[C@@](CC(C)C)(N)C)C(F)F Chemical compound BrC1=CC(=C(C=N1)OC[C@@](CC(C)C)(N)C)C(F)F GWMHVOPFSIOUKT-CYBMUJFWSA-N 0.000 description 4
- GWMHVOPFSIOUKT-ZDUSSCGKSA-N BrC1=CC(=C(C=N1)OC[C@](CC(C)C)(N)C)C(F)F Chemical compound BrC1=CC(=C(C=N1)OC[C@](CC(C)C)(N)C)C(F)F GWMHVOPFSIOUKT-ZDUSSCGKSA-N 0.000 description 4
- UIDOBGOJLVDHRJ-UHFFFAOYSA-N BrC1=CC=C(C(=N1)C(F)F)F Chemical compound BrC1=CC=C(C(=N1)C(F)F)F UIDOBGOJLVDHRJ-UHFFFAOYSA-N 0.000 description 4
- UAKKZJPWFPEECO-ZDUSSCGKSA-N BrC1=CC=C(C(=N1)C(F)F)OC[C@](CC(C)C)(N)C Chemical compound BrC1=CC=C(C(=N1)C(F)F)OC[C@](CC(C)C)(N)C UAKKZJPWFPEECO-ZDUSSCGKSA-N 0.000 description 4
- OMDKEBKAIAIHLP-ZDUSSCGKSA-N BrC1=CC=C(C(=N1)C)OC[C@](CC(C)C)(N)C Chemical compound BrC1=CC=C(C(=N1)C)OC[C@](CC(C)C)(N)C OMDKEBKAIAIHLP-ZDUSSCGKSA-N 0.000 description 4
- VGYQVXAANOYVQY-UHFFFAOYSA-N BrC1=NC=C(C(=C1)C(F)F)F Chemical compound BrC1=NC=C(C(=C1)C(F)F)F VGYQVXAANOYVQY-UHFFFAOYSA-N 0.000 description 4
- LVIMTQFQMHNBHJ-ZDUSSCGKSA-N BrC=1C=C(C(=NC1)OC[C@](CC(C)C)(N)C)C Chemical compound BrC=1C=C(C(=NC1)OC[C@](CC(C)C)(N)C)C LVIMTQFQMHNBHJ-ZDUSSCGKSA-N 0.000 description 4
- ISCZOKBHGYCADT-VWLOTQADSA-N C(#N)C1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)B1OC(C(O1)(C)C)(C)C Chemical compound C(#N)C1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)B1OC(C(O1)(C)C)(C)C ISCZOKBHGYCADT-VWLOTQADSA-N 0.000 description 4
- SDPZRFIRDDBFJR-NRFANRHFSA-N ClC1=C(C=NC(=C1)C1=CC=NC2=CC=C(C=C12)Cl)OC[C@](CC(C)C)(N)C Chemical compound ClC1=C(C=NC(=C1)C1=CC=NC2=CC=C(C=C12)Cl)OC[C@](CC(C)C)(N)C SDPZRFIRDDBFJR-NRFANRHFSA-N 0.000 description 4
- OSVUOYZAHGVSAY-MHZLTWQESA-N ClC1=CC=C2C(=CC=NC2=C1)C1=CC(=C(C=N1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C Chemical compound ClC1=CC=C2C(=CC=NC2=C1)C1=CC(=C(C=N1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C OSVUOYZAHGVSAY-MHZLTWQESA-N 0.000 description 4
- XTTWARHLEIFGDX-MHZLTWQESA-N ClC1=CC=C2C(=CC=NC2=C1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F Chemical compound ClC1=CC=C2C(=CC=NC2=C1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F XTTWARHLEIFGDX-MHZLTWQESA-N 0.000 description 4
- OKSLIDNQBOADCD-QFIPXVFZSA-N ClC1=CC=C2C(=CC=NC2=C1)C=1C=C(C(=NC1)OC[C@](CC(C)C)(N)C)C(F)F Chemical compound ClC1=CC=C2C(=CC=NC2=C1)C=1C=C(C(=NC1)OC[C@](CC(C)C)(N)C)C(F)F OKSLIDNQBOADCD-QFIPXVFZSA-N 0.000 description 4
- GRLYYFXNPFAHQW-MHZLTWQESA-N ClC=1C=C2C(=CC=NC2=CC1)C1=CC(=C(C=N1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C Chemical compound ClC=1C=C2C(=CC=NC2=CC1)C1=CC(=C(C=N1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C GRLYYFXNPFAHQW-MHZLTWQESA-N 0.000 description 4
- FPQWMUPJDWUBAG-UHFFFAOYSA-N ClC=1C=CC(=NC1)OCC(CC(C)C)(C)NC(OCC1=CC=CC=C1)=O Chemical compound ClC=1C=CC(=NC1)OCC(CC(C)C)(C)NC(OCC1=CC=CC=C1)=O FPQWMUPJDWUBAG-UHFFFAOYSA-N 0.000 description 4
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 description 4
- VIWHCDRFEQOOOX-IBGZPJMESA-N FC(C=1C(=NC=C(C1)B1OC(C(O1)(C)C)(C)C)OC[C@](CC(C)C)(N)C)F Chemical compound FC(C=1C(=NC=C(C1)B1OC(C(O1)(C)C)(C)C)OC[C@](CC(C)C)(N)C)F VIWHCDRFEQOOOX-IBGZPJMESA-N 0.000 description 4
- FLQJORGYEQHMAB-IBGZPJMESA-N FC(C=1C=C(C=NC1OC[C@](CC(C)C)(N)C)C1=CC(=NC=C1)C)F Chemical compound FC(C=1C=C(C=NC1OC[C@](CC(C)C)(N)C)C1=CC(=NC=C1)C)F FLQJORGYEQHMAB-IBGZPJMESA-N 0.000 description 4
- LEDLHCXWMUVUFY-QFIPXVFZSA-N FC1=C2C(=CC=NC2=CC(=C1)F)C=1C=C(C(=NC1)OC[C@](CC(C)C)(N)C)C Chemical compound FC1=C2C(=CC=NC2=CC(=C1)F)C=1C=C(C(=NC1)OC[C@](CC(C)C)(N)C)C LEDLHCXWMUVUFY-QFIPXVFZSA-N 0.000 description 4
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 4
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 4
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 4
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 4
- TXMDTZHAXIIOSY-UHFFFAOYSA-N NC(COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)C)(CC(C)C)C Chemical compound NC(COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)C)(CC(C)C)C TXMDTZHAXIIOSY-UHFFFAOYSA-N 0.000 description 4
- 102000048238 Neuregulin-1 Human genes 0.000 description 4
- 108090000556 Neuregulin-1 Proteins 0.000 description 4
- WWKMPHUYWTYWNM-UHFFFAOYSA-N O1C(C)(C)C(C)(C)OB1C1=CC=NC2=CC(F)=CC=C12 Chemical compound O1C(C)(C)C(C)(C)OB1C1=CC=NC2=CC(F)=CC=C12 WWKMPHUYWTYWNM-UHFFFAOYSA-N 0.000 description 4
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 4
- 229920002472 Starch Polymers 0.000 description 4
- PNRZIRAJNBYBRN-UHFFFAOYSA-N [2-(difluoromethyl)pyridin-4-yl]boronic acid Chemical compound OB(O)C1=CC=NC(C(F)F)=C1 PNRZIRAJNBYBRN-UHFFFAOYSA-N 0.000 description 4
- 150000007513 acids Chemical class 0.000 description 4
- 239000000556 agonist Substances 0.000 description 4
- 239000011230 binding agent Substances 0.000 description 4
- IYYIVELXUANFED-UHFFFAOYSA-N bromo(trimethyl)silane Chemical compound C[Si](C)(C)Br IYYIVELXUANFED-UHFFFAOYSA-N 0.000 description 4
- 239000002775 capsule Substances 0.000 description 4
- 238000000576 coating method Methods 0.000 description 4
- 239000003085 diluting agent Substances 0.000 description 4
- 239000002552 dosage form Substances 0.000 description 4
- 238000009472 formulation Methods 0.000 description 4
- 239000008187 granular material Substances 0.000 description 4
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 4
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 4
- 229960003444 immunosuppressant agent Drugs 0.000 description 4
- 239000003018 immunosuppressive agent Substances 0.000 description 4
- 239000004615 ingredient Substances 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 239000000314 lubricant Substances 0.000 description 4
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 4
- LXSZMGQQXZXQKX-UHFFFAOYSA-N n-[4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pyridin-2-yl]acetamide Chemical compound C1=NC(NC(=O)C)=CC(B2OC(C)(C)C(C)(C)O2)=C1 LXSZMGQQXZXQKX-UHFFFAOYSA-N 0.000 description 4
- 239000000546 pharmaceutical excipient Substances 0.000 description 4
- IUBQJLUDMLPAGT-UHFFFAOYSA-N potassium bis(trimethylsilyl)amide Chemical compound C[Si](C)(C)N([K])[Si](C)(C)C IUBQJLUDMLPAGT-UHFFFAOYSA-N 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- FVSKHRXBFJPNKK-UHFFFAOYSA-N propionitrile Chemical compound CCC#N FVSKHRXBFJPNKK-UHFFFAOYSA-N 0.000 description 4
- 238000000926 separation method Methods 0.000 description 4
- 239000008107 starch Substances 0.000 description 4
- 235000019698 starch Nutrition 0.000 description 4
- 238000004808 supercritical fluid chromatography Methods 0.000 description 4
- 208000024891 symptom Diseases 0.000 description 4
- FEFYIRXZOKLABI-IBGZPJMESA-N tert-butyl N-[(2S)-1-(4-bromo-2-cyanophenoxy)-2,4-dimethylpentan-2-yl]carbamate Chemical compound BrC1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C#N FEFYIRXZOKLABI-IBGZPJMESA-N 0.000 description 4
- AQRLNPVMDITEJU-UHFFFAOYSA-N triethylsilane Chemical compound CC[SiH](CC)CC AQRLNPVMDITEJU-UHFFFAOYSA-N 0.000 description 4
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 4
- 229910000404 tripotassium phosphate Inorganic materials 0.000 description 4
- 235000019798 tripotassium phosphate Nutrition 0.000 description 4
- CXNIUSPIQKWYAI-UHFFFAOYSA-N xantphos Chemical compound C=12OC3=C(P(C=4C=CC=CC=4)C=4C=CC=CC=4)C=CC=C3C(C)(C)C2=CC=CC=1P(C=1C=CC=CC=1)C1=CC=CC=C1 CXNIUSPIQKWYAI-UHFFFAOYSA-N 0.000 description 4
- ZXGCWGYBIXCFMP-UHFFFAOYSA-N (2-chloro-3-fluoropyridin-4-yl)boronic acid Chemical compound OB(O)C1=CC=NC(Cl)=C1F ZXGCWGYBIXCFMP-UHFFFAOYSA-N 0.000 description 3
- JJHRCHRHBBOCGY-UHFFFAOYSA-N (2-chloro-5-fluoropyridin-4-yl)boronic acid Chemical compound OB(O)C1=CC(Cl)=NC=C1F JJHRCHRHBBOCGY-UHFFFAOYSA-N 0.000 description 3
- WJYRVVDXJMJLTN-UHFFFAOYSA-N (2-chloropyridin-4-yl)boronic acid Chemical compound OB(O)C1=CC=NC(Cl)=C1 WJYRVVDXJMJLTN-UHFFFAOYSA-N 0.000 description 3
- JQZOBLFDUVUUGF-JOCHJYFZSA-N (2R)-1-(2-chloro-6-fluoro-4-quinolin-4-ylphenoxy)-2,4-dimethylpentan-2-amine Chemical compound CC(C)C[C@@](C)(N)COC1=C(Cl)C=C(C=C1F)C1=CC=NC2=C1C=CC=C2 JQZOBLFDUVUUGF-JOCHJYFZSA-N 0.000 description 3
- WVDZBDZXQWXZRA-ZETCQYMHSA-N (2S)-2,4-dimethylpentane-1,2-diol Chemical compound CC(C)C[C@](C)(O)CO WVDZBDZXQWXZRA-ZETCQYMHSA-N 0.000 description 3
- DOMQFIFVDIAOOT-ROUUACIJSA-N (2S,3R)-N-[4-(2,6-dimethoxyphenyl)-5-(5-methylpyridin-3-yl)-1,2,4-triazol-3-yl]-3-(5-methylpyrimidin-2-yl)butane-2-sulfonamide Chemical compound COC1=C(C(=CC=C1)OC)N1C(=NN=C1C=1C=NC=C(C=1)C)NS(=O)(=O)[C@@H](C)[C@H](C)C1=NC=C(C=N1)C DOMQFIFVDIAOOT-ROUUACIJSA-N 0.000 description 3
- AYPTVURLQVNETR-UHFFFAOYSA-N (6-chloro-2-fluoropyridin-3-yl)boronic acid Chemical compound OB(O)C1=CC=C(Cl)N=C1F AYPTVURLQVNETR-UHFFFAOYSA-N 0.000 description 3
- HWJYQTCOTKHICY-UHFFFAOYSA-N 2-[(6-bromo-2-methylpyridin-3-yl)oxymethyl]-1,1,1-trifluoro-4-methylpentan-2-amine Chemical compound BrC1=CC=C(C(=N1)C)OCC(C(F)(F)F)(CC(C)C)N HWJYQTCOTKHICY-UHFFFAOYSA-N 0.000 description 3
- RGWBAZRWPHIOTO-UHFFFAOYSA-N 2-fluoro-4-methyl-6-(2-methylpyridin-4-yl)pyridin-3-ol Chemical compound FC1=C(C(=CC(=N1)C1=CC(=NC=C1)C)C)O RGWBAZRWPHIOTO-UHFFFAOYSA-N 0.000 description 3
- UAVASNPKWXHZJR-UHFFFAOYSA-N 4-(7-chloroquinolin-4-yl)-2-(trifluoromethyl)phenol Chemical compound ClC1=CC=C2C(=CC=NC2=C1)C1=CC(=C(C=C1)O)C(F)(F)F UAVASNPKWXHZJR-UHFFFAOYSA-N 0.000 description 3
- IDCPJMXIWPFVIX-UHFFFAOYSA-N 4-bromo-5,7-difluoroquinoline Chemical compound BrC1=CC=NC2=CC(F)=CC(F)=C21 IDCPJMXIWPFVIX-UHFFFAOYSA-N 0.000 description 3
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 3
- INUFZHHAKHUNOO-UHFFFAOYSA-N 4-methyl-5h-oxathiazole 2,2-dioxide Chemical compound CC1=NS(=O)(=O)OC1 INUFZHHAKHUNOO-UHFFFAOYSA-N 0.000 description 3
- OPLCXLXORZDTMX-UHFFFAOYSA-N 5-bromo-3-(trifluoromethyl)-1h-pyridin-2-one Chemical compound OC1=NC=C(Br)C=C1C(F)(F)F OPLCXLXORZDTMX-UHFFFAOYSA-N 0.000 description 3
- BFQONZCQHGIKIY-UHFFFAOYSA-N 6-bromo-3-fluoro-2-methylpyridine Chemical compound CC1=NC(Br)=CC=C1F BFQONZCQHGIKIY-UHFFFAOYSA-N 0.000 description 3
- LCXREWRBXVHOOY-UHFFFAOYSA-N 6-chloro-2-fluoro-3-(methoxymethoxy)pyridine Chemical compound COCOC1=CC=C(Cl)N=C1F LCXREWRBXVHOOY-UHFFFAOYSA-N 0.000 description 3
- BIMOKDIOLXSHOZ-UHFFFAOYSA-N 6-chloro-2-fluoropyridin-3-ol Chemical compound OC1=CC=C(Cl)N=C1F BIMOKDIOLXSHOZ-UHFFFAOYSA-N 0.000 description 3
- IDNKBPGJDGKPCT-HNNXBMFYSA-N BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)C Chemical compound BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)C IDNKBPGJDGKPCT-HNNXBMFYSA-N 0.000 description 3
- GSZCSGUJQXIZKX-ZDUSSCGKSA-N BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)F Chemical compound BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)F GSZCSGUJQXIZKX-ZDUSSCGKSA-N 0.000 description 3
- LJWUMLKSPLBOFI-ZDUSSCGKSA-N BrC1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)OC(F)(F)F Chemical compound BrC1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)OC(F)(F)F LJWUMLKSPLBOFI-ZDUSSCGKSA-N 0.000 description 3
- WOZHPXGPEOOQIK-UHFFFAOYSA-N BrC1=CC=C(C(=N1)C)OCC1(CN(C1)C(=O)OC(C)(C)C)CC(C)C Chemical compound BrC1=CC=C(C(=N1)C)OCC1(CN(C1)C(=O)OC(C)(C)C)CC(C)C WOZHPXGPEOOQIK-UHFFFAOYSA-N 0.000 description 3
- BMPXRHMVKOFTSU-UHFFFAOYSA-N BrC=1C=C(C(=NC1)F)C(F)F Chemical compound BrC=1C=C(C(=NC1)F)C(F)F BMPXRHMVKOFTSU-UHFFFAOYSA-N 0.000 description 3
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Natural products CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 3
- KYPPABUFZUNHDQ-NDEPHWFRSA-N C(#N)C1=CC=C2C(=CC=NC2=C1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F Chemical compound C(#N)C1=CC=C2C(=CC=NC2=C1)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F KYPPABUFZUNHDQ-NDEPHWFRSA-N 0.000 description 3
- DMZPEZXQZPPSSF-CHQVSRGASA-N C(=O)(OC(C)(C)C)C([C@H](OC1=C(C=C(C=C1)C1=C(C(=NC=C1)NC(OC)=O)F)C#N)N)(CC(C)C)C Chemical compound C(=O)(OC(C)(C)C)C([C@H](OC1=C(C=C(C=C1)C1=C(C(=NC=C1)NC(OC)=O)F)C#N)N)(CC(C)C)C DMZPEZXQZPPSSF-CHQVSRGASA-N 0.000 description 3
- RYWNUEAROUWSAR-UHFFFAOYSA-N C(C(C)C)C1(CN(C1)C(=O)OC(C)(C)C)COC=1C=CC(=NC1C)C1=CC(=NC=C1)NC(=O)OC Chemical compound C(C(C)C)C1(CN(C1)C(=O)OC(C)(C)C)COC=1C=CC(=NC1C)C1=CC(=NC=C1)NC(=O)OC RYWNUEAROUWSAR-UHFFFAOYSA-N 0.000 description 3
- YQTYAJIXVYMFPW-UHFFFAOYSA-N C(C(C)C)C1(CNC1)COC=1C=CC(=NC1C)C1=CC(=NC=C1)NC(OC)=O Chemical compound C(C(C)C)C1(CNC1)COC=1C=CC(=NC1C)C1=CC(=NC=C1)NC(OC)=O YQTYAJIXVYMFPW-UHFFFAOYSA-N 0.000 description 3
- ZIAMUKTTXRPYST-IBGZPJMESA-N C(C)(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)Cl Chemical compound C(C)(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)Cl ZIAMUKTTXRPYST-IBGZPJMESA-N 0.000 description 3
- BPIBFISELREYQL-UHFFFAOYSA-N CC(=C)CC1(C)COS(=O)(=O)N1 Chemical compound CC(=C)CC1(C)COS(=O)(=O)N1 BPIBFISELREYQL-UHFFFAOYSA-N 0.000 description 3
- KQWFRDCGXHGZCO-HNNXBMFYSA-N CC(=C)C[C@@]1(C)COS(=O)(=O)N1C(=O)OCC1=CC=CC=C1 Chemical compound CC(=C)C[C@@]1(C)COS(=O)(=O)N1C(=O)OCC1=CC=CC=C1 KQWFRDCGXHGZCO-HNNXBMFYSA-N 0.000 description 3
- NARKEYDRMQSHAO-UHFFFAOYSA-N CC(C)CC1(C)COS(=O)(=O)N1C(=O)OCC1=CC=CC=C1 Chemical compound CC(C)CC1(C)COS(=O)(=O)N1C(=O)OCC1=CC=CC=C1 NARKEYDRMQSHAO-UHFFFAOYSA-N 0.000 description 3
- XQZNLGHFKDMHNI-ZETCQYMHSA-N CC(C)C[C@@]1(C)COS(=O)(=O)N1 Chemical compound CC(C)C[C@@]1(C)COS(=O)(=O)N1 XQZNLGHFKDMHNI-ZETCQYMHSA-N 0.000 description 3
- POSUBHCVLIQGIR-IBGZPJMESA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=N1)C1=CC(=NC=C1)C(F)F)C#N Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=N1)C1=CC(=NC=C1)C(F)F)C#N POSUBHCVLIQGIR-IBGZPJMESA-N 0.000 description 3
- OZMBCJAUHVADNN-QFIPXVFZSA-N CC(C)C[C@](C)(N)COC1=C(C=C(N=C1)C1=CC=NC2=CC(F)=CC(F)=C12)C(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(N=C1)C1=CC=NC2=CC(F)=CC(F)=C12)C(F)F OZMBCJAUHVADNN-QFIPXVFZSA-N 0.000 description 3
- YIALBHYBYYNMRD-NRFANRHFSA-N CC(C)C[C@](C)(N)COC1=C(Cl)C=C(N=C1)C1=CC=NC2=CC(=CC=C12)C(F)(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(Cl)C=C(N=C1)C1=CC=NC2=CC(=CC=C12)C(F)(F)F YIALBHYBYYNMRD-NRFANRHFSA-N 0.000 description 3
- OAWXJOFGASPGQX-SFHVURJKSA-N CC(C)C[C@](C)(N)COC1=C(Cl)N=C(C=C1)C1=CC(=NC=C1)C(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(Cl)N=C(C=C1)C1=CC(=NC=C1)C(F)F OAWXJOFGASPGQX-SFHVURJKSA-N 0.000 description 3
- ZVUKEHVADHPZQR-NRFANRHFSA-N CC(C)C[C@](C)(N)COC1=CC=C(N=C1Cl)C1=CC=NC2=CC(F)=CC(F)=C12 Chemical compound CC(C)C[C@](C)(N)COC1=CC=C(N=C1Cl)C1=CC=NC2=CC(F)=CC(F)=C12 ZVUKEHVADHPZQR-NRFANRHFSA-N 0.000 description 3
- CIHFEDCEWSFTAE-IBGZPJMESA-N CC(C)C[C@](C)(N)COC1=CN=C(C=C1C)C1=CC(C)=NC=C1 Chemical compound CC(C)C[C@](C)(N)COC1=CN=C(C=C1C)C1=CC(C)=NC=C1 CIHFEDCEWSFTAE-IBGZPJMESA-N 0.000 description 3
- NNXIZBKMOATQJI-QFIPXVFZSA-N CC(C)C[C@](C)(N)COC1=NC=C(C=C1C(F)F)C1=CC=NC2=CC=C(F)C=C12 Chemical compound CC(C)C[C@](C)(N)COC1=NC=C(C=C1C(F)F)C1=CC=NC2=CC=C(F)C=C12 NNXIZBKMOATQJI-QFIPXVFZSA-N 0.000 description 3
- HWLBDVJXAJODQF-VWLOTQADSA-N COC(=O)NC1=C(F)C(=CC=N1)C1=CC=C(OC[C@](C)(CC(C)C)NC(=O)OC(C)(C)C)C(C)=N1 Chemical compound COC(=O)NC1=C(F)C(=CC=N1)C1=CC=C(OC[C@](C)(CC(C)C)NC(=O)OC(C)(C)C)C(C)=N1 HWLBDVJXAJODQF-VWLOTQADSA-N 0.000 description 3
- HDBIRBUHIXXLDF-FQEVSTJZSA-N COC(=O)NC1=NC=CC(=C1)C1=CC(C#N)=C(OC[C@@](C)(N)CC(C)C)N=C1 Chemical compound COC(=O)NC1=NC=CC(=C1)C1=CC(C#N)=C(OC[C@@](C)(N)CC(C)C)N=C1 HDBIRBUHIXXLDF-FQEVSTJZSA-N 0.000 description 3
- MDBWZAGCBGPXST-KRWDZBQOSA-N COC(=O)NC1=NC=CC(=C1)C1=CC(C2=CC=NO2)=C(OC[C@@H](N)CC(C)C)C=C1 Chemical compound COC(=O)NC1=NC=CC(=C1)C1=CC(C2=CC=NO2)=C(OC[C@@H](N)CC(C)C)C=C1 MDBWZAGCBGPXST-KRWDZBQOSA-N 0.000 description 3
- SVNVPNHWFJFRLZ-FQEVSTJZSA-N COC(=O)NC1=NC=CC(=C1)C1=NC(C(F)F)=C(OC[C@@](C)(N)CC(C)C)C=C1 Chemical compound COC(=O)NC1=NC=CC(=C1)C1=NC(C(F)F)=C(OC[C@@](C)(N)CC(C)C)C=C1 SVNVPNHWFJFRLZ-FQEVSTJZSA-N 0.000 description 3
- ZVSNSFQQKSZZMY-IBGZPJMESA-N COC(=O)NC1=NC=CC(=C1)C1=NC(Cl)=C(OC[C@@](C)(N)CC(C)C)C=C1 Chemical compound COC(=O)NC1=NC=CC(=C1)C1=NC(Cl)=C(OC[C@@](C)(N)CC(C)C)C=C1 ZVSNSFQQKSZZMY-IBGZPJMESA-N 0.000 description 3
- ZLLSHIDDPSARBG-FQEVSTJZSA-N COC(=O)NC1=NC=CC(=C1)C1=NC=C(OC[C@@](C)(N)CC(C)C)C(=C1)C(F)F Chemical compound COC(=O)NC1=NC=CC(=C1)C1=NC=C(OC[C@@](C)(N)CC(C)C)C(=C1)C(F)F ZLLSHIDDPSARBG-FQEVSTJZSA-N 0.000 description 3
- QUZSCDQMICQQSZ-UHFFFAOYSA-N COC1=C(C=C(C=C1)C1=CC=NC2=CC=NC=C12)C(F)(F)F Chemical compound COC1=C(C=C(C=C1)C1=CC=NC2=CC=NC=C12)C(F)(F)F QUZSCDQMICQQSZ-UHFFFAOYSA-N 0.000 description 3
- YKGQUBOYHDWACY-KRWDZBQOSA-N COC1=NC=CC(=C1)C1=CC(C#N)=C(OC[C@@H](N)CC(C)C)C=C1 Chemical compound COC1=NC=CC(=C1)C1=CC(C#N)=C(OC[C@@H](N)CC(C)C)C=C1 YKGQUBOYHDWACY-KRWDZBQOSA-N 0.000 description 3
- YXRJMGXKRWHQME-SFHVURJKSA-N C[C@@](COC=1C(=CC(=NC1)C1=CC(=NC=C1)C)C(F)(F)F)(CC(C)C)N Chemical compound C[C@@](COC=1C(=CC(=NC1)C1=CC(=NC=C1)C)C(F)(F)F)(CC(C)C)N YXRJMGXKRWHQME-SFHVURJKSA-N 0.000 description 3
- YXRJMGXKRWHQME-GOSISDBHSA-N C[C@](COC=1C(=CC(=NC=1)C1=CC(=NC=C1)C)C(F)(F)F)(CC(C)C)N Chemical compound C[C@](COC=1C(=CC(=NC=1)C1=CC(=NC=C1)C)C(F)(F)F)(CC(C)C)N YXRJMGXKRWHQME-GOSISDBHSA-N 0.000 description 3
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 3
- XJUZRXYOEPSWMB-UHFFFAOYSA-N Chloromethyl methyl ether Chemical compound COCCl XJUZRXYOEPSWMB-UHFFFAOYSA-N 0.000 description 3
- BHOKOGJZOVMLHI-SFHVURJKSA-N ClC1=C(C=CC(=N1)C1=CC(=NC=C1)C)OC[C@](CC(C)C)(N)C Chemical compound ClC1=C(C=CC(=N1)C1=CC(=NC=C1)C)OC[C@](CC(C)C)(N)C BHOKOGJZOVMLHI-SFHVURJKSA-N 0.000 description 3
- UVGUCFDWIGUTSU-KRWDZBQOSA-N ClC1=C(C=NC(=C1)Cl)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O Chemical compound ClC1=C(C=NC(=C1)Cl)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O UVGUCFDWIGUTSU-KRWDZBQOSA-N 0.000 description 3
- SRZFQYNGDSRTQK-UHFFFAOYSA-N ClC1=C(OCC(CC(C)C)(C)NC(OCC2=CC=CC=C2)=O)C(=CC(=C1)C1=CC=NC2=CC=CC=C12)F Chemical compound ClC1=C(OCC(CC(C)C)(C)NC(OCC2=CC=CC=C2)=O)C(=CC(=C1)C1=CC=NC2=CC=CC=C12)F SRZFQYNGDSRTQK-UHFFFAOYSA-N 0.000 description 3
- FKUOAERHINHGFA-UHFFFAOYSA-N ClC1=CC(=C(C(=N1)F)OCOC)C Chemical compound ClC1=CC(=C(C(=N1)F)OCOC)C FKUOAERHINHGFA-UHFFFAOYSA-N 0.000 description 3
- CUZKVOVUOGJHIW-SFHVURJKSA-N ClC1=CC(=C(C=N1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C Chemical compound ClC1=CC(=C(C=N1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C CUZKVOVUOGJHIW-SFHVURJKSA-N 0.000 description 3
- LNIRVOWUGGOUKM-ZDUSSCGKSA-N ClC1=CC(=C(C=N1)OC[C@](CC(C)C)(N)C)C Chemical compound ClC1=CC(=C(C=N1)OC[C@](CC(C)C)(N)C)C LNIRVOWUGGOUKM-ZDUSSCGKSA-N 0.000 description 3
- JRDYHFFGQIUWAZ-UHFFFAOYSA-N ClC1=CC(=NC=C1CO)NC(C)=O Chemical compound ClC1=CC(=NC=C1CO)NC(C)=O JRDYHFFGQIUWAZ-UHFFFAOYSA-N 0.000 description 3
- BGQQCWHNIRQURN-IBGZPJMESA-N ClC1=CC(=NC=C1OC[C@](CC(C)C)(N)C)C1=C(C(=NC=C1)C)C Chemical compound ClC1=CC(=NC=C1OC[C@](CC(C)C)(N)C)C1=C(C(=NC=C1)C)C BGQQCWHNIRQURN-IBGZPJMESA-N 0.000 description 3
- XWZJJCICBZFART-SFHVURJKSA-N ClC1=CC(=NC=C1OC[C@](CC(C)C)(N)C)C1=CC(=NC=C1)C Chemical compound ClC1=CC(=NC=C1OC[C@](CC(C)C)(N)C)C1=CC(=NC=C1)C XWZJJCICBZFART-SFHVURJKSA-N 0.000 description 3
- MGKSKFKLAZOUJS-UHFFFAOYSA-N ClC1=CC=C2C(=CC=NC2=C1)C1=CC(=C(C=C1)OC)C(F)(F)F Chemical compound ClC1=CC=C2C(=CC=NC2=C1)C1=CC(=C(C=C1)OC)C(F)(F)F MGKSKFKLAZOUJS-UHFFFAOYSA-N 0.000 description 3
- DFOZFPXLACXZBX-NRFANRHFSA-N ClC1=NC(=CC=C1OC[C@](CC(C)C)(N)C)C1=CC=NC2=CC(=CC=C12)F Chemical compound ClC1=NC(=CC=C1OC[C@](CC(C)C)(N)C)C1=CC=NC2=CC(=CC=C12)F DFOZFPXLACXZBX-NRFANRHFSA-N 0.000 description 3
- IDPZXFFXROSQNM-QHCPKHFHSA-N ClC1=NC=C(C(=C1)C1=NC(=C(C=C1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C)F Chemical compound ClC1=NC=C(C(=C1)C1=NC(=C(C=C1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C)F IDPZXFFXROSQNM-QHCPKHFHSA-N 0.000 description 3
- TZOZJFWDYLPJED-SFHVURJKSA-N ClC1=NC=C(C(=C1)C1=NC(=C(C=C1)OC[C@](CC(C)C)(N)C)C)F Chemical compound ClC1=NC=C(C(=C1)C1=NC(=C(C=C1)OC[C@](CC(C)C)(N)C)C)F TZOZJFWDYLPJED-SFHVURJKSA-N 0.000 description 3
- CNRCDRRGADCOAB-INIZCTEOSA-N ClC1=NC=C(C=N1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O Chemical compound ClC1=NC=C(C=N1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O CNRCDRRGADCOAB-INIZCTEOSA-N 0.000 description 3
- ZCHJRHXGHGSPDX-SFHVURJKSA-N ClC1=NC=CC(=C1)C=1C=NC(=C(C1)C(F)F)OC[C@](CC(C)C)(N)C Chemical compound ClC1=NC=CC(=C1)C=1C=NC(=C(C1)C(F)F)OC[C@](CC(C)C)(N)C ZCHJRHXGHGSPDX-SFHVURJKSA-N 0.000 description 3
- HGTSJSXAKIWAET-SANMLTNESA-N ClC=1C(=NC=C(C1)C1=CC=NC2=CC(=CC(=C12)F)F)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O Chemical compound ClC=1C(=NC=C(C1)C1=CC=NC2=CC(=CC(=C12)F)F)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O HGTSJSXAKIWAET-SANMLTNESA-N 0.000 description 3
- IGJJATQUVSNMJD-NRFANRHFSA-N ClC=1C(=NC=C(C1)C1=CC=NC2=CC=CC=C12)OC[C@](CC(C)C)(N)C Chemical compound ClC=1C(=NC=C(C1)C1=CC=NC2=CC=CC=C12)OC[C@](CC(C)C)(N)C IGJJATQUVSNMJD-NRFANRHFSA-N 0.000 description 3
- FXRWQJAEZHTNFX-SFHVURJKSA-N ClC=1C=C(C=NC1OC[C@](CC(C)C)(N)C)C1=CC(=NC=C1)C Chemical compound ClC=1C=C(C=NC1OC[C@](CC(C)C)(N)C)C1=CC(=NC=C1)C FXRWQJAEZHTNFX-SFHVURJKSA-N 0.000 description 3
- PUQWOBSWNJVTHJ-QFIPXVFZSA-N ClC=1C=C2C(=CC=NC2=CC1)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F Chemical compound ClC=1C=C2C(=CC=NC2=CC1)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F PUQWOBSWNJVTHJ-QFIPXVFZSA-N 0.000 description 3
- UNOJLQKTJVHDKW-QFIPXVFZSA-N ClC=1C=C2C(=CC=NC2=CC1)C=1C=C(C(=NC1)OC[C@](CC(C)C)(N)C)C Chemical compound ClC=1C=C2C(=CC=NC2=CC1)C=1C=C(C(=NC1)OC[C@](CC(C)C)(N)C)C UNOJLQKTJVHDKW-QFIPXVFZSA-N 0.000 description 3
- 102000005853 Clathrin Human genes 0.000 description 3
- 108010019874 Clathrin Proteins 0.000 description 3
- HXCGSQCIKQWJGY-QFIPXVFZSA-N FC(C1=C(C=NC(=C1)C1=CC=NC2=CC(=CC=C12)F)OC[C@](CC(C)C)(N)C)F Chemical compound FC(C1=C(C=NC(=C1)C1=CC=NC2=CC(=CC=C12)F)OC[C@](CC(C)C)(N)C)F HXCGSQCIKQWJGY-QFIPXVFZSA-N 0.000 description 3
- LQBIZVPAGIHQBS-QFIPXVFZSA-N FC(C1=C(C=NC(=C1)C1=CC=NC2=CC=C(C=C12)F)OC[C@](CC(C)C)(N)C)F Chemical compound FC(C1=C(C=NC(=C1)C1=CC=NC2=CC=C(C=C12)F)OC[C@](CC(C)C)(N)C)F LQBIZVPAGIHQBS-QFIPXVFZSA-N 0.000 description 3
- XICIZBXLRDHGFN-QFIPXVFZSA-N FC(C1=C(C=NC(=C1)C1=CC=NC2=CC=CC=C12)OC[C@](CC(C)C)(O)C)F Chemical compound FC(C1=C(C=NC(=C1)C1=CC=NC2=CC=CC=C12)OC[C@](CC(C)C)(O)C)F XICIZBXLRDHGFN-QFIPXVFZSA-N 0.000 description 3
- CSISHGRVGRXVKC-QHCPKHFHSA-N FC(C1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=CC=NC2=CC=C(C=C12)F)F Chemical compound FC(C1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=CC=NC2=CC=C(C=C12)F)F CSISHGRVGRXVKC-QHCPKHFHSA-N 0.000 description 3
- ZZHJITDYMFEKBO-QFIPXVFZSA-N FC(C1=NC(=CC=C1OC[C@](CC(C)C)(N)C)C1=CC=NC2=CC=C(C=C12)F)F Chemical compound FC(C1=NC(=CC=C1OC[C@](CC(C)C)(N)C)C1=CC=NC2=CC=C(C=C12)F)F ZZHJITDYMFEKBO-QFIPXVFZSA-N 0.000 description 3
- RKAHOQATMSONTM-IBGZPJMESA-N FC(C1=NC=CC(=C1)C1=NC(=C(C=C1)OC[C@](CC(C)C)(N)C)C(F)F)F Chemical compound FC(C1=NC=CC(=C1)C1=NC(=C(C=C1)OC[C@](CC(C)C)(N)C)C(F)F)F RKAHOQATMSONTM-IBGZPJMESA-N 0.000 description 3
- FOYCJWNMPKZNFD-IBGZPJMESA-N FC(C1=NC=CC(=C1)C1=NC=C(C(=C1)OC)OC[C@](CC(C)C)(N)C)F Chemical compound FC(C1=NC=CC(=C1)C1=NC=C(C(=C1)OC)OC[C@](CC(C)C)(N)C)F FOYCJWNMPKZNFD-IBGZPJMESA-N 0.000 description 3
- FEGPESNEZYWGEQ-QFIPXVFZSA-N FC(C=1C(=NC=C(C1)C1=CC=NC2=CC(=CC=C12)F)OC[C@](CC(C)C)(N)C)F Chemical compound FC(C=1C(=NC=C(C1)C1=CC=NC2=CC(=CC=C12)F)OC[C@](CC(C)C)(N)C)F FEGPESNEZYWGEQ-QFIPXVFZSA-N 0.000 description 3
- VZSXUICSTBAKTM-JOCHJYFZSA-N FC(C=1C(=NC=C(C1)C1=CC=NC2=CC=CC=C12)OC[C@@](CC(C)C)(N)C)F Chemical compound FC(C=1C(=NC=C(C1)C1=CC=NC2=CC=CC=C12)OC[C@@](CC(C)C)(N)C)F VZSXUICSTBAKTM-JOCHJYFZSA-N 0.000 description 3
- DXYXOQGWKCTNOP-UHFFFAOYSA-N FC1=C(C(=CC(=N1)C1=CC(=NC=C1)C)C)OCOC Chemical compound FC1=C(C(=CC(=N1)C1=CC(=NC=C1)C)C)OCOC DXYXOQGWKCTNOP-UHFFFAOYSA-N 0.000 description 3
- QOFCDLBVSHZREJ-DEOSSOPVSA-N FC1=C(C(=CC(=N1)C1=CC(=NC=C1)C)C)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O Chemical compound FC1=C(C(=CC(=N1)C1=CC(=NC=C1)C)C)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O QOFCDLBVSHZREJ-DEOSSOPVSA-N 0.000 description 3
- FMRXHOYDWMZVGT-IBGZPJMESA-N FC1=C(C(=CC(=N1)C1=CC(=NC=C1)C)C)OC[C@](CC(C)C)(N)C Chemical compound FC1=C(C(=CC(=N1)C1=CC(=NC=C1)C)C)OC[C@](CC(C)C)(N)C FMRXHOYDWMZVGT-IBGZPJMESA-N 0.000 description 3
- CTUGJRNJERMRLI-QFIPXVFZSA-N FC1=C2C(=CC=NC2=CC(=C1)F)C1=CC(=C(C=N1)OC[C@](CC(C)C)(N)C)C Chemical compound FC1=C2C(=CC=NC2=CC(=C1)F)C1=CC(=C(C=N1)OC[C@](CC(C)C)(N)C)C CTUGJRNJERMRLI-QFIPXVFZSA-N 0.000 description 3
- SUUWMCAOZYIVCT-NRFANRHFSA-N FC1=C2C(=CC=NC2=CC(=C1)F)C=1C=C(C(=NC1)OC[C@](CC(C)C)(N)C)C(F)(F)F Chemical compound FC1=C2C(=CC=NC2=CC(=C1)F)C=1C=C(C(=NC1)OC[C@](CC(C)C)(N)C)C(F)(F)F SUUWMCAOZYIVCT-NRFANRHFSA-N 0.000 description 3
- UFJRTEOIZHMRHA-QFIPXVFZSA-N FC1=CC=C2C(=CC=NC2=C1)C1=CC=C(C(=N1)C)OC[C@](CC(C)C)(N)C Chemical compound FC1=CC=C2C(=CC=NC2=C1)C1=CC=C(C(=N1)C)OC[C@](CC(C)C)(N)C UFJRTEOIZHMRHA-QFIPXVFZSA-N 0.000 description 3
- 108010010803 Gelatin Proteins 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 3
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 3
- OIEAXTJFYCTXTQ-UHFFFAOYSA-N N-[2-[(6-bromo-2-methylpyridin-3-yl)oxymethyl]-1,1,1-trifluoro-4-methylpentan-2-yl]-4-methylbenzenesulfonamide Chemical compound BrC1=CC=C(C(=N1)C)OCC(C(F)(F)F)(CC(C)C)NS(=O)(=O)C1=CC=C(C=C1)C OIEAXTJFYCTXTQ-UHFFFAOYSA-N 0.000 description 3
- WWMYZCYXSVLCSZ-UHFFFAOYSA-N NC=1C=C(C=CC1)C1=CC(=C(C=C1)OCC(CC(C)C)(C)NC(OCC1=CC=CC=C1)=O)C Chemical compound NC=1C=C(C=CC1)C1=CC(=C(C=C1)OCC(CC(C)C)(C)NC(OCC1=CC=CC=C1)=O)C WWMYZCYXSVLCSZ-UHFFFAOYSA-N 0.000 description 3
- QHQYALYRGRIANP-FQEVSTJZSA-N N[C@@](COC=1C(=CC(=NC1)C1=CC(=NC=C1)NC(OC)=O)C(F)F)(CC(C)C)CF Chemical compound N[C@@](COC=1C(=CC(=NC1)C1=CC(=NC=C1)NC(OC)=O)C(F)F)(CC(C)C)CF QHQYALYRGRIANP-FQEVSTJZSA-N 0.000 description 3
- WJOFSBXUBIUYAS-FQEVSTJZSA-N N[C@@](COC=1C=CC(=NC1C(F)F)C1=CC(=NC=C1)NC(OC)=O)(CC(C)C)CF Chemical compound N[C@@](COC=1C=CC(=NC1C(F)F)C1=CC(=NC=C1)NC(OC)=O)(CC(C)C)CF WJOFSBXUBIUYAS-FQEVSTJZSA-N 0.000 description 3
- TZAOHCCGAGVZHV-INIZCTEOSA-N N[C@H](COC1=C(C#N)C=C(C=C1)C1=CC(=NC=C1)C(F)(F)F)CC(C)C Chemical compound N[C@H](COC1=C(C#N)C=C(C=C1)C1=CC(=NC=C1)C(F)(F)F)CC(C)C TZAOHCCGAGVZHV-INIZCTEOSA-N 0.000 description 3
- WKJAMBKZEXMDNE-KRWDZBQOSA-N N[C@H](COC1=C(C#N)C=C(C=C1)C1=CN=NC(=C1)C)CC(C)C Chemical compound N[C@H](COC1=C(C#N)C=C(C=C1)C1=CN=NC(=C1)C)CC(C)C WKJAMBKZEXMDNE-KRWDZBQOSA-N 0.000 description 3
- HTMZSVARGJGKLE-SFHVURJKSA-N N[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)C#N)CC(C)C Chemical compound N[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)C#N)CC(C)C HTMZSVARGJGKLE-SFHVURJKSA-N 0.000 description 3
- UZGBIRGBWRCWKF-SFHVURJKSA-N N[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)C)CC(C)C Chemical compound N[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)C)CC(C)C UZGBIRGBWRCWKF-SFHVURJKSA-N 0.000 description 3
- DKKCUFUUVDZUCP-KRWDZBQOSA-N N[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)OC)CC(C)C Chemical compound N[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)OC)CC(C)C DKKCUFUUVDZUCP-KRWDZBQOSA-N 0.000 description 3
- BBHRJKOAIBIWDU-HNNXBMFYSA-N N[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)F)CC(C)C Chemical compound N[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)F)CC(C)C BBHRJKOAIBIWDU-HNNXBMFYSA-N 0.000 description 3
- XYXJLVVKIBEGES-HNNXBMFYSA-N N[C@H](COC1=C(C=C(C=C1C(F)(F)F)C1=CC(=NC=C1)NC(C)=O)F)CC(C)C Chemical compound N[C@H](COC1=C(C=C(C=C1C(F)(F)F)C1=CC(=NC=C1)NC(C)=O)F)CC(C)C XYXJLVVKIBEGES-HNNXBMFYSA-N 0.000 description 3
- AKUJIVTZSHCXRK-HNNXBMFYSA-N N[C@H](COC1=C(C=C(C=C1F)C1=CC(=NC=C1)NC(C)=O)Cl)CC(C)C Chemical compound N[C@H](COC1=C(C=C(C=C1F)C1=CC(=NC=C1)NC(C)=O)Cl)CC(C)C AKUJIVTZSHCXRK-HNNXBMFYSA-N 0.000 description 3
- WEWDGPNKOHRMCP-HNNXBMFYSA-N N[C@H](COC1=C(C=C(C=C1F)C1=CC(=NC=C1)NC(C)=O)F)CC(C)C Chemical compound N[C@H](COC1=C(C=C(C=C1F)C1=CC(=NC=C1)NC(C)=O)F)CC(C)C WEWDGPNKOHRMCP-HNNXBMFYSA-N 0.000 description 3
- KCBBDWLXBHSCCC-AWEZNQCLSA-N N[C@H](COC1=CC(=C(C=C1F)C1=CC(=NC=C1)NC(C)=O)F)CC(C)C Chemical compound N[C@H](COC1=CC(=C(C=C1F)C1=CC(=NC=C1)NC(C)=O)F)CC(C)C KCBBDWLXBHSCCC-AWEZNQCLSA-N 0.000 description 3
- SHMBDCWCMCTJGG-SSDOTTSWSA-N N[C@](C(=O)O)(CC(C)C)CF Chemical compound N[C@](C(=O)O)(CC(C)C)CF SHMBDCWCMCTJGG-SSDOTTSWSA-N 0.000 description 3
- AWMPIJASSRBTBA-SSDOTTSWSA-N N[C@](CO)(CC(C)C)CF Chemical compound N[C@](CO)(CC(C)C)CF AWMPIJASSRBTBA-SSDOTTSWSA-N 0.000 description 3
- UMKJJTLACIYHLQ-QFIPXVFZSA-N N[C@](COC1=C(C#N)C=C(C=C1)C1=CC=NC2=CC=NC=C12)(CC(C)C)C Chemical compound N[C@](COC1=C(C#N)C=C(C=C1)C1=CC=NC2=CC=NC=C12)(CC(C)C)C UMKJJTLACIYHLQ-QFIPXVFZSA-N 0.000 description 3
- OWFLPJCMBWRINU-NRFANRHFSA-N N[C@](COC1=C(C#N)C=C(C=N1)C1=CC=NC2=CC=NC=C12)(CC(C)C)C Chemical compound N[C@](COC1=C(C#N)C=C(C=N1)C1=CC=NC2=CC=NC=C12)(CC(C)C)C OWFLPJCMBWRINU-NRFANRHFSA-N 0.000 description 3
- FBMQHXQODDFMAN-NRFANRHFSA-N N[C@](COC1=C(C=C(C=C1)C1=C(C(=NC=C1)NC(OC)=O)F)C#N)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=C1)C1=C(C(=NC=C1)NC(OC)=O)F)C#N)(CC(C)C)C FBMQHXQODDFMAN-NRFANRHFSA-N 0.000 description 3
- KYMVFHAFTDDWKW-NRFANRHFSA-N N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)C#N)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)C#N)(CC(C)C)C KYMVFHAFTDDWKW-NRFANRHFSA-N 0.000 description 3
- JRJSMTAUWDJJIH-FQEVSTJZSA-N N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)C(F)(F)F)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)C(F)(F)F)(CC(C)C)C JRJSMTAUWDJJIH-FQEVSTJZSA-N 0.000 description 3
- YGRDQPIAALDLEG-NRFANRHFSA-N N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)C(F)F)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)C(F)F)(CC(C)C)C YGRDQPIAALDLEG-NRFANRHFSA-N 0.000 description 3
- GRSIRCARZOBGMU-FQEVSTJZSA-N N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)F)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)F)(CC(C)C)C GRSIRCARZOBGMU-FQEVSTJZSA-N 0.000 description 3
- ITANMUHQSHOARC-FQEVSTJZSA-N N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)OC(F)(F)F)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)OC(F)(F)F)(CC(C)C)C ITANMUHQSHOARC-FQEVSTJZSA-N 0.000 description 3
- OATGCXNIMMEKTE-QHCPKHFHSA-N N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)CN(C)C)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)CN(C)C)(CC(C)C)C OATGCXNIMMEKTE-QHCPKHFHSA-N 0.000 description 3
- PUHPMMDUVJJYLS-NRFANRHFSA-N N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)CO)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)CO)(CC(C)C)C PUHPMMDUVJJYLS-NRFANRHFSA-N 0.000 description 3
- IIYCDMHBASPTKO-NRFANRHFSA-N N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)S(=O)(=O)C)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)S(=O)(=O)C)(CC(C)C)C IIYCDMHBASPTKO-NRFANRHFSA-N 0.000 description 3
- UIQAYSMUZYPFQZ-NRFANRHFSA-N N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1CO)NC(C)=O)C(F)(F)F)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1CO)NC(C)=O)C(F)(F)F)(CC(C)C)C UIQAYSMUZYPFQZ-NRFANRHFSA-N 0.000 description 3
- UPNVJHYDVZFZBM-FQEVSTJZSA-N N[C@](COC1=C(C=C(C=C1)C1=CC=NC(=C1C(=O)O)C)C(F)(F)F)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=C1)C1=CC=NC(=C1C(=O)O)C)C(F)(F)F)(CC(C)C)C UPNVJHYDVZFZBM-FQEVSTJZSA-N 0.000 description 3
- CBNLXZBTQVYRAC-QHCPKHFHSA-N N[C@](COC1=C(C=C(C=C1)C1=CC=NC2=CC(=CC=C12)C#N)C(F)(F)F)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=C1)C1=CC=NC2=CC(=CC=C12)C#N)C(F)(F)F)(CC(C)C)C CBNLXZBTQVYRAC-QHCPKHFHSA-N 0.000 description 3
- FFTUIKFDUYMWTI-FQEVSTJZSA-N N[C@](COC1=C(C=C(C=N1)C1=CC(=NC=C1)NC(OC)=O)C)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=N1)C1=CC(=NC=C1)NC(OC)=O)C)(CC(C)C)C FFTUIKFDUYMWTI-FQEVSTJZSA-N 0.000 description 3
- PFMMJDPMFCVRCB-IBGZPJMESA-N N[C@](COC1=C(C=C(C=N1)C1=CC(=NC=C1)NC(OC)=O)Cl)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=N1)C1=CC(=NC=C1)NC(OC)=O)Cl)(CC(C)C)C PFMMJDPMFCVRCB-IBGZPJMESA-N 0.000 description 3
- WHMVCLXEHITTAR-FQEVSTJZSA-N N[C@](COC1=C(C=C(C=N1)C1=CC(=NC=C1)NC(OC)=O)OC)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=N1)C1=CC(=NC=C1)NC(OC)=O)OC)(CC(C)C)C WHMVCLXEHITTAR-FQEVSTJZSA-N 0.000 description 3
- WKLBGGMXGXAZKZ-FQEVSTJZSA-N N[C@](COC1=CC(=C(C=N1)C1=CC(=NC=C1)NC(OC)=O)C)(CC(C)C)C Chemical compound N[C@](COC1=CC(=C(C=N1)C1=CC(=NC=C1)NC(OC)=O)C)(CC(C)C)C WKLBGGMXGXAZKZ-FQEVSTJZSA-N 0.000 description 3
- KKBZHOHHHZMMRS-SFHVURJKSA-N N[C@](COC1=NC=C(C=N1)C1=CC(=NC=C1)NC(OC)=O)(CC(C)C)C Chemical compound N[C@](COC1=NC=C(C=N1)C1=CC(=NC=C1)NC(OC)=O)(CC(C)C)C KKBZHOHHHZMMRS-SFHVURJKSA-N 0.000 description 3
- ZFXGOGALEGXWEL-FQEVSTJZSA-N N[C@](COC=1C(=CC(=NC1)C1=CC(=NC=C1)NC(OC)=O)C)(CC(C)C)C Chemical compound N[C@](COC=1C(=CC(=NC1)C1=CC(=NC=C1)NC(OC)=O)C)(CC(C)C)C ZFXGOGALEGXWEL-FQEVSTJZSA-N 0.000 description 3
- OLZRNCKDWRCSFH-SFHVURJKSA-N N[C@](COC=1C=CC(=NC1C)C1=C(C(=NC=C1)N)F)(CC(C)C)C Chemical compound N[C@](COC=1C=CC(=NC1C)C1=C(C(=NC=C1)N)F)(CC(C)C)C OLZRNCKDWRCSFH-SFHVURJKSA-N 0.000 description 3
- HINOQCZIDBNXEI-FQEVSTJZSA-N N[C@](COC=1C=CC(=NC1C)C1=CC(=NC=C1)NC(OC)=O)(CC(C)C)C Chemical compound N[C@](COC=1C=CC(=NC1C)C1=CC(=NC=C1)NC(OC)=O)(CC(C)C)C HINOQCZIDBNXEI-FQEVSTJZSA-N 0.000 description 3
- QXTIQIBOVMDXNE-FQEVSTJZSA-N N[C@](COC=1C=CC(=NC1C)C1=CC(=NC=C1F)NC(OC)=O)(CC(C)C)C Chemical compound N[C@](COC=1C=CC(=NC1C)C1=CC(=NC=C1F)NC(OC)=O)(CC(C)C)C QXTIQIBOVMDXNE-FQEVSTJZSA-N 0.000 description 3
- DMQUKGCEMCHERU-SFHVURJKSA-N N[C@](COC=1C=NC(=NC1)C1=CC(=NC=C1)NC(OC)=O)(CC(C)C)C Chemical compound N[C@](COC=1C=NC(=NC1)C1=CC(=NC=C1)NC(OC)=O)(CC(C)C)C DMQUKGCEMCHERU-SFHVURJKSA-N 0.000 description 3
- ZOPYQNXBXPYOBE-SFHVURJKSA-N O1CCC(=CC1)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F Chemical compound O1CCC(=CC1)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F ZOPYQNXBXPYOBE-SFHVURJKSA-N 0.000 description 3
- YBETWJGSSWPXMC-SFHVURJKSA-N O1N=CC=C1C1=C(OC[C@H](CC(C)C)N)C=CC(=C1)C1=CC(=NC=C1)C Chemical compound O1N=CC=C1C1=C(OC[C@H](CC(C)C)N)C=CC(=C1)C1=CC(=NC=C1)C YBETWJGSSWPXMC-SFHVURJKSA-N 0.000 description 3
- 239000003472 antidiabetic agent Substances 0.000 description 3
- 235000011089 carbon dioxide Nutrition 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 229930193282 clathrin Natural products 0.000 description 3
- 239000011248 coating agent Substances 0.000 description 3
- 239000012043 crude product Substances 0.000 description 3
- 239000007884 disintegrant Substances 0.000 description 3
- 239000006196 drop Substances 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 3
- 239000008273 gelatin Substances 0.000 description 3
- 229920000159 gelatin Polymers 0.000 description 3
- 235000019322 gelatine Nutrition 0.000 description 3
- 235000011852 gelatine desserts Nutrition 0.000 description 3
- 230000014509 gene expression Effects 0.000 description 3
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 3
- 238000011813 knockout mouse model Methods 0.000 description 3
- 238000004811 liquid chromatography Methods 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- LFMGMKPLBDZJLP-UHFFFAOYSA-N n-(4-bromopyridin-2-yl)acetamide Chemical compound CC(=O)NC1=CC(Br)=CC=N1 LFMGMKPLBDZJLP-UHFFFAOYSA-N 0.000 description 3
- MZRVEZGGRBJDDB-UHFFFAOYSA-N n-Butyllithium Substances [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 3
- 231100000252 nontoxic Toxicity 0.000 description 3
- 230000003000 nontoxic effect Effects 0.000 description 3
- HVAMZGADVCBITI-UHFFFAOYSA-M pent-4-enoate Chemical compound [O-]C(=O)CCC=C HVAMZGADVCBITI-UHFFFAOYSA-M 0.000 description 3
- 239000003208 petroleum Substances 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- 102000005962 receptors Human genes 0.000 description 3
- 108020003175 receptors Proteins 0.000 description 3
- 239000000741 silica gel Substances 0.000 description 3
- 229910002027 silica gel Inorganic materials 0.000 description 3
- 229960001866 silicon dioxide Drugs 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 239000006188 syrup Substances 0.000 description 3
- 235000020357 syrup Nutrition 0.000 description 3
- YIFJQSVIADQGAI-NRFANRHFSA-N tert-butyl N-[(2S)-1-(4-bromo-2-cyclopropylphenoxy)-2,4-dimethylpentan-2-yl]carbamate Chemical compound BrC1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C1CC1 YIFJQSVIADQGAI-NRFANRHFSA-N 0.000 description 3
- KHIQCXVMQUOFCT-IBGZPJMESA-N tert-butyl N-[(2S)-1-(4-bromo-2-formylphenoxy)-2,4-dimethylpentan-2-yl]carbamate Chemical compound BrC1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C=O KHIQCXVMQUOFCT-IBGZPJMESA-N 0.000 description 3
- WQGZXRBBTKWGLG-MHZLTWQESA-N tert-butyl N-[(2S)-1-[6-(5,7-difluoroquinolin-4-yl)-4-methylpyridin-3-yl]oxy-2,4-dimethylpentan-2-yl]carbamate Chemical compound CC(C)C[C@@](C)(COC1=CN=C(C=C1C)C1=C2C(F)=CC(F)=CC2=NC=C1)NC(=O)OC(C)(C)C WQGZXRBBTKWGLG-MHZLTWQESA-N 0.000 description 3
- LQTMEOSBXTVYRM-VIFPVBQESA-N tert-butyl n-[(2s)-1-hydroxy-4-methylpentan-2-yl]carbamate Chemical compound CC(C)C[C@@H](CO)NC(=O)OC(C)(C)C LQTMEOSBXTVYRM-VIFPVBQESA-N 0.000 description 3
- CFOAUYCPAUGDFF-UHFFFAOYSA-N tosmic Chemical compound CC1=CC=C(S(=O)(=O)C[N+]#[C-])C=C1 CFOAUYCPAUGDFF-UHFFFAOYSA-N 0.000 description 3
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 3
- 229940062627 tribasic potassium phosphate Drugs 0.000 description 3
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 3
- 239000001993 wax Substances 0.000 description 3
- CBMFWKBCFLYDDG-UHFFFAOYSA-N (2-ethylpyridin-4-yl)boronic acid Chemical compound CCC1=CC(B(O)O)=CC=N1 CBMFWKBCFLYDDG-UHFFFAOYSA-N 0.000 description 2
- AALSHYORLVJEBZ-GOSISDBHSA-N (2R)-1-[3-(difluoromethyl)-5-(2-methylpyrimidin-4-yl)pyridin-2-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound FC(C=1C(=NC=C(C1)C1=NC(=NC=C1)C)OC[C@@](CC(C)C)(N)C)F AALSHYORLVJEBZ-GOSISDBHSA-N 0.000 description 2
- WIIALNVSHHTFFZ-JOCHJYFZSA-N (2R)-1-[3-(difluoromethyl)-5-(5,7-difluoroquinolin-4-yl)pyridin-2-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound FC(C=1C(=NC=C(C=1)C1=CC=NC2=CC(=CC(=C12)F)F)OC[C@@](CC(C)C)(N)C)F WIIALNVSHHTFFZ-JOCHJYFZSA-N 0.000 description 2
- OKSLIDNQBOADCD-JOCHJYFZSA-N (2R)-1-[5-(7-chloroquinolin-4-yl)-3-(difluoromethyl)pyridin-2-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound ClC1=CC=C2C(=CC=NC2=C1)C=1C=C(C(=NC1)OC[C@@](CC(C)C)(N)C)C(F)F OKSLIDNQBOADCD-JOCHJYFZSA-N 0.000 description 2
- QZNNODQLLRSCHN-VWLOTQADSA-N (2S)-1-(2-cyclopropyl-4-quinolin-4-ylphenoxy)-2,4-dimethylpentan-2-amine Chemical compound C1(CC1)C1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=CC=NC2=CC=CC=C12 QZNNODQLLRSCHN-VWLOTQADSA-N 0.000 description 2
- QJJUZJKHCZFOBJ-IBGZPJMESA-N (2S)-1-[2-(difluoromethyl)-4-(2-methylpyrimidin-4-yl)phenoxy]-2,4-dimethylpentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC=NC(C)=N1)C(F)F QJJUZJKHCZFOBJ-IBGZPJMESA-N 0.000 description 2
- BIQHWJJDUAWYEN-SFHVURJKSA-N (2S)-1-[2-(difluoromethyl)-6-(2-methylpyrimidin-4-yl)pyridin-3-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=CC=C(N=C1C(F)F)C1=CC=NC(C)=N1 BIQHWJJDUAWYEN-SFHVURJKSA-N 0.000 description 2
- APTYRPSOZMZHRQ-QFIPXVFZSA-N (2S)-1-[2-(difluoromethyl)-6-(5,7-difluoroquinolin-4-yl)pyridin-3-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=CC=C(N=C1C(F)F)C1=CC=NC2=CC(F)=CC(F)=C12 APTYRPSOZMZHRQ-QFIPXVFZSA-N 0.000 description 2
- YJVNBILWESXTRQ-SFHVURJKSA-N (2S)-1-[2-(difluoromethyl)-6-(6-methylpyrimidin-4-yl)pyridin-3-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=CC=C(N=C1C(F)F)C1=CC(C)=NC=N1 YJVNBILWESXTRQ-SFHVURJKSA-N 0.000 description 2
- VONWNHVCOBGODO-SFHVURJKSA-N (2S)-1-[2-fluoro-4-(2-fluoropyridin-4-yl)phenoxy]-2,4-dimethylpentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=C(F)C=C(C=C1)C1=CC(F)=NC=C1 VONWNHVCOBGODO-SFHVURJKSA-N 0.000 description 2
- QYLMAGMUZOOXAT-FQEVSTJZSA-N (2S)-1-[4-(difluoromethyl)-6-(2-ethylpyridin-4-yl)pyridin-3-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound CCC1=NC=CC(=C1)C1=NC=C(OC[C@@](C)(N)CC(C)C)C(=C1)C(F)F QYLMAGMUZOOXAT-FQEVSTJZSA-N 0.000 description 2
- CDMSYPKSRHQLQX-SFHVURJKSA-N (2S)-1-[4-(difluoromethyl)-6-(2-methylpyrimidin-4-yl)pyridin-3-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(N=C1)C1=CC=NC(C)=N1)C(F)F CDMSYPKSRHQLQX-SFHVURJKSA-N 0.000 description 2
- VQPKLYXPUPPWOJ-QFIPXVFZSA-N (2S)-1-[4-(difluoromethyl)-6-[6-(trifluoromethoxy)quinolin-4-yl]pyridin-3-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound FC(C1=C(C=NC(=C1)C1=CC=NC2=CC=C(C=C12)OC(F)(F)F)OC[C@](CC(C)C)(N)C)F VQPKLYXPUPPWOJ-QFIPXVFZSA-N 0.000 description 2
- ZFBUEMDJFYDQIE-QFIPXVFZSA-N (2S)-1-[4-(difluoromethyl)-6-[6-(trifluoromethyl)quinolin-4-yl]pyridin-3-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound FC(C1=C(C=NC(=C1)C1=CC=NC2=CC=C(C=C12)C(F)(F)F)OC[C@](CC(C)C)(N)C)F ZFBUEMDJFYDQIE-QFIPXVFZSA-N 0.000 description 2
- KHGSGIDZUJKCPA-QFIPXVFZSA-N (2S)-1-[6-(6-fluoroquinolin-4-yl)-2-methylpyridin-3-yl]oxy-2,4-dimethylpentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=CC=C(N=C1C)C1=CC=NC2=CC=C(F)C=C12 KHGSGIDZUJKCPA-QFIPXVFZSA-N 0.000 description 2
- NOJOTLCVBXCQCU-QHCPKHFHSA-N (2S)-2,4-dimethyl-1-(2-methylsulfonyl-4-quinolin-4-ylphenoxy)pentan-2-amine Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC=NC2=CC=CC=C12)S(C)(=O)=O NOJOTLCVBXCQCU-QHCPKHFHSA-N 0.000 description 2
- PAMIQIKDUOTOBW-UHFFFAOYSA-N 1-methylpiperidine Chemical compound CN1CCCCC1 PAMIQIKDUOTOBW-UHFFFAOYSA-N 0.000 description 2
- GYOVBMLJVOOBQA-UHFFFAOYSA-N 2,4-dimethyl-2-[(2-methylpropan-2-yl)oxycarbonylamino]pentanoic acid Chemical compound CC(C)CC(C)(C(O)=O)NC(=O)OC(C)(C)C GYOVBMLJVOOBQA-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- AQSRRZGQRFFFGS-UHFFFAOYSA-N 2-methylpyridin-3-ol Chemical compound CC1=NC=CC=C1O AQSRRZGQRFFFGS-UHFFFAOYSA-N 0.000 description 2
- QXCAHEXKUMUTRF-UHFFFAOYSA-N 3,6-dihydro-2h-pyran-4-yl trifluoromethanesulfonate Chemical compound FC(F)(F)S(=O)(=O)OC1=CCOCC1 QXCAHEXKUMUTRF-UHFFFAOYSA-N 0.000 description 2
- WNEODWDFDXWOLU-QHCPKHFHSA-N 3-[3-(hydroxymethyl)-4-[1-methyl-5-[[5-[(2s)-2-methyl-4-(oxetan-3-yl)piperazin-1-yl]pyridin-2-yl]amino]-6-oxopyridin-3-yl]pyridin-2-yl]-7,7-dimethyl-1,2,6,8-tetrahydrocyclopenta[3,4]pyrrolo[3,5-b]pyrazin-4-one Chemical compound C([C@@H](N(CC1)C=2C=NC(NC=3C(N(C)C=C(C=3)C=3C(=C(N4C(C5=CC=6CC(C)(C)CC=6N5CC4)=O)N=CC=3)CO)=O)=CC=2)C)N1C1COC1 WNEODWDFDXWOLU-QHCPKHFHSA-N 0.000 description 2
- MQWXDVWVTXQWQR-UHFFFAOYSA-N 3-methyl-5-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pyridazine Chemical compound N1=NC(C)=CC(B2OC(C)(C)C(C)(C)O2)=C1 MQWXDVWVTXQWQR-UHFFFAOYSA-N 0.000 description 2
- WIYHZFQSIRKZSK-UHFFFAOYSA-N 4-(1,6-naphthyridin-4-yl)-2-(trifluoromethyl)phenol Chemical compound N1=CC=C(C2=CN=CC=C12)C1=CC(=C(C=C1)O)C(F)(F)F WIYHZFQSIRKZSK-UHFFFAOYSA-N 0.000 description 2
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 2
- PPHIUCCSQWZQGM-QFIPXVFZSA-N 4-[6-[(2S)-2-amino-2,4-dimethylpentoxy]-5-fluoropyridin-3-yl]quinoline-7-carbonitrile Chemical compound CC(C)C[C@](C)(N)COC1=C(F)C=C(C=N1)C1=CC=NC2=CC(=CC=C12)C#N PPHIUCCSQWZQGM-QFIPXVFZSA-N 0.000 description 2
- KVCQTKNUUQOELD-UHFFFAOYSA-N 4-amino-n-[1-(3-chloro-2-fluoroanilino)-6-methylisoquinolin-5-yl]thieno[3,2-d]pyrimidine-7-carboxamide Chemical compound N=1C=CC2=C(NC(=O)C=3C4=NC=NC(N)=C4SC=3)C(C)=CC=C2C=1NC1=CC=CC(Cl)=C1F KVCQTKNUUQOELD-UHFFFAOYSA-N 0.000 description 2
- OJPQVYZLQGRFSO-UHFFFAOYSA-N 4-bromo-2-methylpyrimidine Chemical compound CC1=NC=CC(Br)=N1 OJPQVYZLQGRFSO-UHFFFAOYSA-N 0.000 description 2
- MLPBCCFSVCUOME-UHFFFAOYSA-N 4-chloro-2-(difluoromethyl)pyridine;hydrochloride Chemical compound Cl.FC(F)C1=CC(Cl)=CC=N1 MLPBCCFSVCUOME-UHFFFAOYSA-N 0.000 description 2
- QLEXHHIUZKQTLU-UHFFFAOYSA-N 6-fluoro-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)quinoline Chemical compound O1C(C)(C)C(C)(C)OB1C1=CC=NC2=CC=C(F)C=C12 QLEXHHIUZKQTLU-UHFFFAOYSA-N 0.000 description 2
- KJIFHCTXFFMUIH-UHFFFAOYSA-N 6-iodo-2-methylpyridin-3-ol Chemical compound CC1=NC(I)=CC=C1O KJIFHCTXFFMUIH-UHFFFAOYSA-N 0.000 description 2
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 2
- 229920001817 Agar Polymers 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 2
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 2
- 229940123208 Biguanide Drugs 0.000 description 2
- LXBWYBSZDWXJLY-ZDUSSCGKSA-N BrC1=CC(=C(C=N1)OC[C@@](CC(C)C)(N)CF)C(F)F Chemical compound BrC1=CC(=C(C=N1)OC[C@@](CC(C)C)(N)CF)C(F)F LXBWYBSZDWXJLY-ZDUSSCGKSA-N 0.000 description 2
- LXBWYBSZDWXJLY-CYBMUJFWSA-N BrC1=CC(=C(C=N1)OC[C@](CC(C)C)(N)CF)C(F)F Chemical compound BrC1=CC(=C(C=N1)OC[C@](CC(C)C)(N)CF)C(F)F LXBWYBSZDWXJLY-CYBMUJFWSA-N 0.000 description 2
- JIBYWKZRBKMPQG-ZDUSSCGKSA-N BrC1=CC(=C(C=N1)OC[C@](CC(C)C)(O)C)C(F)F Chemical compound BrC1=CC(=C(C=N1)OC[C@](CC(C)C)(O)C)C(F)F JIBYWKZRBKMPQG-ZDUSSCGKSA-N 0.000 description 2
- IWDTTWXVJLYAMB-UHFFFAOYSA-N BrC1=CC(=C(OCC(CC(C)C)(C)NC(OCC2=CC=CC=C2)=O)C=C1)Cl Chemical compound BrC1=CC(=C(OCC(CC(C)C)(C)NC(OCC2=CC=CC=C2)=O)C=C1)Cl IWDTTWXVJLYAMB-UHFFFAOYSA-N 0.000 description 2
- QZXUZMFIFXNXTC-LBPRGKRZSA-N BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C(=C1)F)F Chemical compound BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C(=C1)F)F QZXUZMFIFXNXTC-LBPRGKRZSA-N 0.000 description 2
- WQGSKQMHRYFWGH-HNNXBMFYSA-N BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)C#N Chemical compound BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)C#N WQGSKQMHRYFWGH-HNNXBMFYSA-N 0.000 description 2
- YNPPHGUKSUNNMF-ZDUSSCGKSA-N BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)Cl Chemical compound BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)Cl YNPPHGUKSUNNMF-ZDUSSCGKSA-N 0.000 description 2
- BWPVVUSKDJLPRJ-AWEZNQCLSA-N BrC1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)F Chemical compound BrC1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)F BWPVVUSKDJLPRJ-AWEZNQCLSA-N 0.000 description 2
- AIGCXGQMNALLCR-ZDUSSCGKSA-N BrC1=CC=C(C(=N1)C(F)F)OC[C@@](CC(C)C)(N)CF Chemical compound BrC1=CC=C(C(=N1)C(F)F)OC[C@@](CC(C)C)(N)CF AIGCXGQMNALLCR-ZDUSSCGKSA-N 0.000 description 2
- MQLDXIROGUTJLJ-KRWDZBQOSA-N BrC=1C=C(C(=NC1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C(F)(F)F Chemical compound BrC=1C=C(C(=NC1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C(F)(F)F MQLDXIROGUTJLJ-KRWDZBQOSA-N 0.000 description 2
- LYFLTEPWMHZJSA-CYBMUJFWSA-N BrC=1C=C(C(=NC1)OC[C@@](CC(C)C)(N)C)C(F)F Chemical compound BrC=1C=C(C(=NC1)OC[C@@](CC(C)C)(N)C)C(F)F LYFLTEPWMHZJSA-CYBMUJFWSA-N 0.000 description 2
- TYANSYUEOYJCNY-NSHDSACASA-N BrC=1C=NC(=NC1)OC[C@](CC(C)C)(N)C Chemical compound BrC=1C=NC(=NC1)OC[C@](CC(C)C)(N)C TYANSYUEOYJCNY-NSHDSACASA-N 0.000 description 2
- LUYRGJAFFUXZAV-MHZLTWQESA-N C(#N)C=1C(=NC=C(C1)C1=CC=NC2=CC(=CC(=C12)F)F)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O Chemical compound C(#N)C=1C(=NC=C(C1)C1=CC=NC2=CC(=CC(=C12)F)F)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O LUYRGJAFFUXZAV-MHZLTWQESA-N 0.000 description 2
- RLGNUSPUNDUGAY-CHQVSRGASA-N C(=O)(OC(C)(C)C)C([C@H](OC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)CO)N)(CC(C)C)C Chemical compound C(=O)(OC(C)(C)C)C([C@H](OC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)CO)N)(CC(C)C)C RLGNUSPUNDUGAY-CHQVSRGASA-N 0.000 description 2
- CMVLHOJKEJKPDE-CHQVSRGASA-N C(=O)(OC(C)(C)C)C([C@H](OC=1C(CC(=CC1)C1=CC(=NC=C1)NC(OC)=O)=C=O)N)(CC(C)C)C Chemical compound C(=O)(OC(C)(C)C)C([C@H](OC=1C(CC(=CC1)C1=CC(=NC=C1)NC(OC)=O)=C=O)N)(CC(C)C)C CMVLHOJKEJKPDE-CHQVSRGASA-N 0.000 description 2
- UIMVERUETYSZNE-BWDMCYIDSA-N C(=O)(OC(C)(C)C)C([C@H](OC=1C=CC(=NC=1C)C1=CC(=NC=C1F)NC(OC)=O)N)(CC(C)C)C Chemical compound C(=O)(OC(C)(C)C)C([C@H](OC=1C=CC(=NC=1C)C1=CC(=NC=C1F)NC(OC)=O)N)(CC(C)C)C UIMVERUETYSZNE-BWDMCYIDSA-N 0.000 description 2
- FBWZNANAZDZHKM-UHFFFAOYSA-N C(C(C)C)C1(CN(C1)C(=O)OC(C)(C)C)COC Chemical compound C(C(C)C)C1(CN(C1)C(=O)OC(C)(C)C)COC FBWZNANAZDZHKM-UHFFFAOYSA-N 0.000 description 2
- MPIAVUXVKUKWNX-IBGZPJMESA-N C(C)(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)F Chemical compound C(C)(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)F MPIAVUXVKUKWNX-IBGZPJMESA-N 0.000 description 2
- HEFYOZAFMKZRDL-UHFFFAOYSA-N C(C)(=O)NC=1C=C(C=CC=1)C1=CC(=C(C=C1)OCC(CC(C)C)(C)NC(OCC1=CC=CC=C1)=O)C Chemical compound C(C)(=O)NC=1C=C(C=CC=1)C1=CC(=C(C=C1)OCC(CC(C)C)(C)NC(OCC1=CC=CC=C1)=O)C HEFYOZAFMKZRDL-UHFFFAOYSA-N 0.000 description 2
- POPVFGRPUSLVOD-UHFFFAOYSA-N C(C1=CC=CC=C1)ONC(C(=O)O)(CC(=C)C)CF Chemical compound C(C1=CC=CC=C1)ONC(C(=O)O)(CC(=C)C)CF POPVFGRPUSLVOD-UHFFFAOYSA-N 0.000 description 2
- QTZOKBYBNSRILE-MHZLTWQESA-N C1(CC1)C1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=CC(=NC=C1)C(F)F Chemical compound C1(CC1)C1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=CC(=NC=C1)C(F)F QTZOKBYBNSRILE-MHZLTWQESA-N 0.000 description 2
- OWZSSTHDQSTULI-QFIPXVFZSA-N C1(CC1)C1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=CC(=NC=C1)C Chemical compound C1(CC1)C1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=CC(=NC=C1)C OWZSSTHDQSTULI-QFIPXVFZSA-N 0.000 description 2
- YUEONCDQDNXPAO-QFIPXVFZSA-N C1(CC1)C1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=CC(=NC=C1)C(F)F Chemical compound C1(CC1)C1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=CC(=NC=C1)C(F)F YUEONCDQDNXPAO-QFIPXVFZSA-N 0.000 description 2
- KQWFRDCGXHGZCO-UHFFFAOYSA-N CC(=C)CC1(C)COS(=O)(=O)N1C(=O)OCC1=CC=CC=C1 Chemical compound CC(=C)CC1(C)COS(=O)(=O)N1C(=O)OCC1=CC=CC=C1 KQWFRDCGXHGZCO-UHFFFAOYSA-N 0.000 description 2
- WXIMFCRLMYSEFP-DEOSSOPVSA-N CC(C)C[C@@](C)(COC1=NC=C(C=C1C#N)B1OC(C)(C)C(C)(C)O1)NC(=O)OC(C)(C)C Chemical compound CC(C)C[C@@](C)(COC1=NC=C(C=C1C#N)B1OC(C)(C)C(C)(C)O1)NC(=O)OC(C)(C)C WXIMFCRLMYSEFP-DEOSSOPVSA-N 0.000 description 2
- PVCQHASHDIHPLR-LJQANCHMSA-N CC(C)C[C@@](N)(CF)COC1=C(N=C(C=C1)C1=CC(=NC=C1)C(F)F)C(F)F Chemical compound CC(C)C[C@@](N)(CF)COC1=C(N=C(C=C1)C1=CC(=NC=C1)C(F)F)C(F)F PVCQHASHDIHPLR-LJQANCHMSA-N 0.000 description 2
- CVSCNGLMPXLZJZ-LJQANCHMSA-N CC(C)C[C@@](N)(CF)COC1=CN=C(C=C1C(F)F)C1=CC(C)=NC=C1 Chemical compound CC(C)C[C@@](N)(CF)COC1=CN=C(C=C1C(F)F)C1=CC(C)=NC=C1 CVSCNGLMPXLZJZ-LJQANCHMSA-N 0.000 description 2
- JBOFLATULZAPGI-INIZCTEOSA-N CC(C)C[C@H](N)COC1=C(C=C(C=C1)C1=CC(N)=NC=C1)C#N Chemical compound CC(C)C[C@H](N)COC1=C(C=C(C=C1)C1=CC(N)=NC=C1)C#N JBOFLATULZAPGI-INIZCTEOSA-N 0.000 description 2
- CNJHRPBYBRPXPD-IBGZPJMESA-N CC(C)C[C@](C)(N)COC1=C(C)C=C(C=C1)C1=CC(F)=NC=C1 Chemical compound CC(C)C[C@](C)(N)COC1=C(C)C=C(C=C1)C1=CC(F)=NC=C1 CNJHRPBYBRPXPD-IBGZPJMESA-N 0.000 description 2
- XNDCZOZTMJFJKQ-IBGZPJMESA-N CC(C)C[C@](C)(N)COC1=C(C)C=C(C=N1)C1=CC(=NC=C1)C(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C)C=C(C=N1)C1=CC(=NC=C1)C(F)F XNDCZOZTMJFJKQ-IBGZPJMESA-N 0.000 description 2
- XWEOJBWEYOCRJM-QHCPKHFHSA-N CC(C)C[C@](C)(N)COC1=C(C)C=C(C=N1)C1=CC=NC2=CC(=CC=C12)C#N Chemical compound CC(C)C[C@](C)(N)COC1=C(C)C=C(C=N1)C1=CC=NC2=CC(=CC=C12)C#N XWEOJBWEYOCRJM-QHCPKHFHSA-N 0.000 description 2
- NEWVRYGQQWTULU-QFIPXVFZSA-N CC(C)C[C@](C)(N)COC1=C(C)C=C(N=C1)C1=CC=NC2=CC=CC=C12 Chemical compound CC(C)C[C@](C)(N)COC1=C(C)C=C(N=C1)C1=CC=NC2=CC=CC=C12 NEWVRYGQQWTULU-QFIPXVFZSA-N 0.000 description 2
- RBECKKYUEBWTKW-IBGZPJMESA-N CC(C)C[C@](C)(N)COC1=C(C)N=C(C=C1)C1=CC(C)=NC=C1 Chemical compound CC(C)C[C@](C)(N)COC1=C(C)N=C(C=C1)C1=CC(C)=NC=C1 RBECKKYUEBWTKW-IBGZPJMESA-N 0.000 description 2
- ADPRPGQZIJCSOU-FQEVSTJZSA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)B1OC(C)(C)C(C)(C)O1)C(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)B1OC(C)(C)C(C)(C)O1)C(F)F ADPRPGQZIJCSOU-FQEVSTJZSA-N 0.000 description 2
- JUCMMQOAYJUVCF-SFHVURJKSA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=C(Cl)C(F)=NC=C1)C(F)(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=C(Cl)C(F)=NC=C1)C(F)(F)F JUCMMQOAYJUVCF-SFHVURJKSA-N 0.000 description 2
- JHQIXXCRTMLJDW-FQEVSTJZSA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=C(F)C(C)=NC=C1)C#N Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=C(F)C(C)=NC=C1)C#N JHQIXXCRTMLJDW-FQEVSTJZSA-N 0.000 description 2
- BTBPZGLEDPKZBT-SFHVURJKSA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=C(F)C(F)=NC=C1)C(F)(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=C(F)C(F)=NC=C1)C(F)(F)F BTBPZGLEDPKZBT-SFHVURJKSA-N 0.000 description 2
- IZPCBCVMTALJQY-IBGZPJMESA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(=NC=C1)C(F)F)C(F)(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(=NC=C1)C(F)F)C(F)(F)F IZPCBCVMTALJQY-IBGZPJMESA-N 0.000 description 2
- ZEGIDGUPKLLRLV-QHCPKHFHSA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(C)=NC2=CC=CC=C12)C(F)(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(C)=NC2=CC=CC=C12)C(F)(F)F ZEGIDGUPKLLRLV-QHCPKHFHSA-N 0.000 description 2
- WKMRZAXLCSNZFP-FQEVSTJZSA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(C)=NC=C1)C#N Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(C)=NC=C1)C#N WKMRZAXLCSNZFP-FQEVSTJZSA-N 0.000 description 2
- ZWKZNADMYDSXNL-FQEVSTJZSA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(C)=NC=C1F)C#N Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(C)=NC=C1F)C#N ZWKZNADMYDSXNL-FQEVSTJZSA-N 0.000 description 2
- HOWDRBOHTGWTQM-IBGZPJMESA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(F)=NC=C1)C#N Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(F)=NC=C1)C#N HOWDRBOHTGWTQM-IBGZPJMESA-N 0.000 description 2
- GFTQGQCPHUMQSI-SFHVURJKSA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(F)=NC=C1Cl)C(F)(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC(F)=NC=C1Cl)C(F)(F)F GFTQGQCPHUMQSI-SFHVURJKSA-N 0.000 description 2
- OASCKTLABCKTRO-QFIPXVFZSA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC=NC2=CC(=CC=C12)C(F)(F)F)C(F)(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC=NC2=CC(=CC=C12)C(F)(F)F)C(F)(F)F OASCKTLABCKTRO-QFIPXVFZSA-N 0.000 description 2
- XYGVJFRDZWZCCC-DEOSSOPVSA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC=NC2=CC(C)=CC=C12)C#N Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC=NC2=CC(C)=CC=C12)C#N XYGVJFRDZWZCCC-DEOSSOPVSA-N 0.000 description 2
- PTYFBMGSODHWNP-QFIPXVFZSA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC=NC2=CC=C(F)C=C12)C(F)(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC=NC2=CC=C(F)C=C12)C(F)(F)F PTYFBMGSODHWNP-QFIPXVFZSA-N 0.000 description 2
- ADCMENPDHRBNNI-QHCPKHFHSA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC=NC2=CC=CC=C12)C#N Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=CC=NC2=CC=CC=C12)C#N ADCMENPDHRBNNI-QHCPKHFHSA-N 0.000 description 2
- XCERUKWZAADTFE-NRFANRHFSA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=NC=NC2=CC=CC=C12)C(F)(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=C1)C1=NC=NC2=CC=CC=C12)C(F)(F)F XCERUKWZAADTFE-NRFANRHFSA-N 0.000 description 2
- YDCQQXLCXQJVHO-FQEVSTJZSA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=N1)C1=C(C)C(C)=NC=C1)C(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=N1)C1=C(C)C(C)=NC=C1)C(F)F YDCQQXLCXQJVHO-FQEVSTJZSA-N 0.000 description 2
- VNNGZCQZRNCYHO-IBGZPJMESA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=N1)C1=CC(=NC=C1)C(F)F)C(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=N1)C1=CC(=NC=C1)C(F)F)C(F)F VNNGZCQZRNCYHO-IBGZPJMESA-N 0.000 description 2
- UMBMFKNLBDNBNH-IBGZPJMESA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=N1)C1=CC(C)=NC=C1)C#N Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=N1)C1=CC(C)=NC=C1)C#N UMBMFKNLBDNBNH-IBGZPJMESA-N 0.000 description 2
- JQIHRBYOHNTCLX-SFHVURJKSA-N CC(C)C[C@](C)(N)COC1=C(C=C(C=N1)C1=CC(C)=NC=C1)C(F)(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(C=N1)C1=CC(C)=NC=C1)C(F)(F)F JQIHRBYOHNTCLX-SFHVURJKSA-N 0.000 description 2
- XUPPARGHFZPHDP-NRFANRHFSA-N CC(C)C[C@](C)(N)COC1=C(C=C(N=C1)C1=CC=NC2=CC=CC=C12)C(F)(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(N=C1)C1=CC=NC2=CC=CC=C12)C(F)(F)F XUPPARGHFZPHDP-NRFANRHFSA-N 0.000 description 2
- BHTCEAANCMHFIL-QFIPXVFZSA-N CC(C)C[C@](C)(N)COC1=C(C=C(N=C1)C1=CC=NC2=CC=CC=C12)C(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(N=C1)C1=CC=NC2=CC=CC=C12)C(F)F BHTCEAANCMHFIL-QFIPXVFZSA-N 0.000 description 2
- PDOZMUWETOUCIO-SFHVURJKSA-N CC(C)C[C@](C)(N)COC1=C(C=C(N=C1)C1=CN=NC(C)=C1)C(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(N=C1)C1=CN=NC(C)=C1)C(F)F PDOZMUWETOUCIO-SFHVURJKSA-N 0.000 description 2
- MMYXQNLVBPFLSL-NRFANRHFSA-N CC(C)C[C@](C)(N)COC1=C(Cl)C=C(N=C1)C1=CC=NC2=CC=CC=C12 Chemical compound CC(C)C[C@](C)(N)COC1=C(Cl)C=C(N=C1)C1=CC=NC2=CC=CC=C12 MMYXQNLVBPFLSL-NRFANRHFSA-N 0.000 description 2
- YQIQWANGWUKJKT-IBGZPJMESA-N CC(C)C[C@](C)(N)COC1=C(F)C=C(C=C1)C1=CC(C)=NC=C1 Chemical compound CC(C)C[C@](C)(N)COC1=C(F)C=C(C=C1)C1=CC(C)=NC=C1 YQIQWANGWUKJKT-IBGZPJMESA-N 0.000 description 2
- PJYKLDMCKAFIQS-IBGZPJMESA-N CC(C)C[C@](C)(N)COC1=C(N=C(C=C1)C1=C(F)C(C)=NC=C1)C(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(N=C(C=C1)C1=C(F)C(C)=NC=C1)C(F)F PJYKLDMCKAFIQS-IBGZPJMESA-N 0.000 description 2
- HOIUMPKLMLSLGO-SFHVURJKSA-N CC(C)C[C@](C)(N)COC1=C(N=C(C=C1)C1=C(F)C(Cl)=NC=C1)C(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(N=C(C=C1)C1=C(F)C(Cl)=NC=C1)C(F)F HOIUMPKLMLSLGO-SFHVURJKSA-N 0.000 description 2
- NCAHZTSVEOYGOW-QFIPXVFZSA-N CC(C)C[C@](C)(N)COC1=CC=C(N=C1C(F)F)C1=CC=NC2=CC(F)=CC=C12 Chemical compound CC(C)C[C@](C)(N)COC1=CC=C(N=C1C(F)F)C1=CC=NC2=CC(F)=CC=C12 NCAHZTSVEOYGOW-QFIPXVFZSA-N 0.000 description 2
- KQUJMVTULOTQPQ-QFIPXVFZSA-N CC(C)C[C@](C)(N)COC1=CC=C(N=C1C(F)F)C1=CC=NC2=CC=CC=C12 Chemical compound CC(C)C[C@](C)(N)COC1=CC=C(N=C1C(F)F)C1=CC=NC2=CC=CC=C12 KQUJMVTULOTQPQ-QFIPXVFZSA-N 0.000 description 2
- XESNTGKRAJJPIU-SFHVURJKSA-N CC(C)C[C@](C)(N)COC1=CC=C(N=C1C(F)F)C1=CN=NC(C)=C1 Chemical compound CC(C)C[C@](C)(N)COC1=CC=C(N=C1C(F)F)C1=CN=NC(C)=C1 XESNTGKRAJJPIU-SFHVURJKSA-N 0.000 description 2
- SAXBECZYTDBRKR-QFIPXVFZSA-N CC(C)C[C@](C)(N)COC1=CC=C(N=C1C)C1=CC=NC2=CC=CC=C12 Chemical compound CC(C)C[C@](C)(N)COC1=CC=C(N=C1C)C1=CC=NC2=CC=CC=C12 SAXBECZYTDBRKR-QFIPXVFZSA-N 0.000 description 2
- SWKIRCKOMQZZFW-SFHVURJKSA-N CC(C)C[C@](C)(N)COC1=CN=C(C=C1C(F)F)C1=C(F)C(Cl)=NC=C1 Chemical compound CC(C)C[C@](C)(N)COC1=CN=C(C=C1C(F)F)C1=C(F)C(Cl)=NC=C1 SWKIRCKOMQZZFW-SFHVURJKSA-N 0.000 description 2
- RKBMAROJKLHAMI-IBGZPJMESA-N CC(C)C[C@](C)(N)COC1=CN=C(C=C1C(F)F)C1=CC(C)=NC=C1 Chemical compound CC(C)C[C@](C)(N)COC1=CN=C(C=C1C(F)F)C1=CC(C)=NC=C1 RKBMAROJKLHAMI-IBGZPJMESA-N 0.000 description 2
- QHPJIUARPKBLQQ-SFHVURJKSA-N CC(C)C[C@](C)(N)COC1=CN=C(C=C1C(F)F)C1=CC(Cl)=NC=C1 Chemical compound CC(C)C[C@](C)(N)COC1=CN=C(C=C1C(F)F)C1=CC(Cl)=NC=C1 QHPJIUARPKBLQQ-SFHVURJKSA-N 0.000 description 2
- UXXJSPPSOKNICG-QFIPXVFZSA-N CC(C)C[C@](C)(N)COC1=NC=C(C=C1C#N)C1=CC=NC2=CC(F)=CC(F)=C12 Chemical compound CC(C)C[C@](C)(N)COC1=NC=C(C=C1C#N)C1=CC=NC2=CC(F)=CC(F)=C12 UXXJSPPSOKNICG-QFIPXVFZSA-N 0.000 description 2
- AALSHYORLVJEBZ-SFHVURJKSA-N CC(C)C[C@](C)(N)COC1=NC=C(C=C1C(F)F)C1=CC=NC(C)=N1 Chemical compound CC(C)C[C@](C)(N)COC1=NC=C(C=C1C(F)F)C1=CC=NC(C)=N1 AALSHYORLVJEBZ-SFHVURJKSA-N 0.000 description 2
- VTQAPSZSIXWNQK-QHCPKHFHSA-N CC(C)C[C@](C)(N)COC1=NC=C(C=C1C(F)F)C1=CC=NC2=CC(C)=CC=C12 Chemical compound CC(C)C[C@](C)(N)COC1=NC=C(C=C1C(F)F)C1=CC=NC2=CC(C)=CC=C12 VTQAPSZSIXWNQK-QHCPKHFHSA-N 0.000 description 2
- WIIALNVSHHTFFZ-QFIPXVFZSA-N CC(C)C[C@](C)(N)COC1=NC=C(C=C1C(F)F)C1=CC=NC2=CC(F)=CC(F)=C12 Chemical compound CC(C)C[C@](C)(N)COC1=NC=C(C=C1C(F)F)C1=CC=NC2=CC(F)=CC(F)=C12 WIIALNVSHHTFFZ-QFIPXVFZSA-N 0.000 description 2
- CAILPJJGCANYGD-QFIPXVFZSA-N CC(C)C[C@](C)(N)COC1=NC=C(C=C1C)C1=CC=NC2=CC(Cl)=CC=C12 Chemical compound CC(C)C[C@](C)(N)COC1=NC=C(C=C1C)C1=CC=NC2=CC(Cl)=CC=C12 CAILPJJGCANYGD-QFIPXVFZSA-N 0.000 description 2
- FXCDGLZLXUIWGE-NRFANRHFSA-N CC(C)C[C@](C)(N)COC1=NC=C(C=C1Cl)C1=CC=NC2=CC=C(F)C=C12 Chemical compound CC(C)C[C@](C)(N)COC1=NC=C(C=C1Cl)C1=CC=NC2=CC=C(F)C=C12 FXCDGLZLXUIWGE-NRFANRHFSA-N 0.000 description 2
- HKICMTCDBZSOMU-IBGZPJMESA-N CC(C)C[C@](C)(O)COC1=CN=C(C=C1C(F)F)C1=CC(C)=NC=C1 Chemical compound CC(C)C[C@](C)(O)COC1=CN=C(C=C1C(F)F)C1=CC(C)=NC=C1 HKICMTCDBZSOMU-IBGZPJMESA-N 0.000 description 2
- GMVNZQXLTHBDJB-UHFFFAOYSA-N COC(=O)C=1C(=NC=CC1B(O)O)C Chemical compound COC(=O)C=1C(=NC=CC1B(O)O)C GMVNZQXLTHBDJB-UHFFFAOYSA-N 0.000 description 2
- PBBUROCOOQIYJK-NRFANRHFSA-N COC(=O)NC1=NC=C(F)C(=C1)C1=CC(C#N)=C(OC[C@@](C)(N)CC(C)C)C=C1 Chemical compound COC(=O)NC1=NC=C(F)C(=C1)C1=CC(C#N)=C(OC[C@@](C)(N)CC(C)C)C=C1 PBBUROCOOQIYJK-NRFANRHFSA-N 0.000 description 2
- QKEUFTAZOLHEAI-FQEVSTJZSA-N COC(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@@](C)(N)CC(C)C)C=C1)C(F)(F)F Chemical compound COC(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@@](C)(N)CC(C)C)C=C1)C(F)(F)F QKEUFTAZOLHEAI-FQEVSTJZSA-N 0.000 description 2
- MDDAGLPAMLLDGM-IBGZPJMESA-N COC(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@@](C)(N)CC(C)C)N=C1)C(F)(F)F Chemical compound COC(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@@](C)(N)CC(C)C)N=C1)C(F)(F)F MDDAGLPAMLLDGM-IBGZPJMESA-N 0.000 description 2
- LJJCAJZWKRIPDY-NRFANRHFSA-N COC(=O)NC1=NC=CC(=C1)C1=CC(C#N)=C(OC[C@@](C)(N)CC(C)C)C=C1 Chemical compound COC(=O)NC1=NC=CC(=C1)C1=CC(C#N)=C(OC[C@@](C)(N)CC(C)C)C=C1 LJJCAJZWKRIPDY-NRFANRHFSA-N 0.000 description 2
- FXQJMZONPDKEJC-NRFANRHFSA-N COC(=O)NC1=NC=CC(=C1)C1=CC(C(F)F)=C(OC[C@@](C)(N)CC(C)C)C=C1 Chemical compound COC(=O)NC1=NC=CC(=C1)C1=CC(C(F)F)=C(OC[C@@](C)(N)CC(C)C)C=C1 FXQJMZONPDKEJC-NRFANRHFSA-N 0.000 description 2
- LYPCNZGCERKJEG-FQEVSTJZSA-N COC(=O)NC1=NC=CC(=C1)C1=CC(C(F)F)=C(OC[C@@](C)(N)CC(C)C)N=C1 Chemical compound COC(=O)NC1=NC=CC(=C1)C1=CC(C(F)F)=C(OC[C@@](C)(N)CC(C)C)N=C1 LYPCNZGCERKJEG-FQEVSTJZSA-N 0.000 description 2
- KSQKMAYGHCGBRP-FQEVSTJZSA-N COC(=O)NC1=NC=CC(=C1)C1=CC(F)=C(OC[C@@](C)(N)CC(C)C)C=C1 Chemical compound COC(=O)NC1=NC=CC(=C1)C1=CC(F)=C(OC[C@@](C)(N)CC(C)C)C=C1 KSQKMAYGHCGBRP-FQEVSTJZSA-N 0.000 description 2
- HAPXQAGUUXSYBV-FQEVSTJZSA-N COC(=O)NC1=NC=CC(=C1)C1=CC(OC(F)(F)F)=C(OC[C@@](C)(N)CC(C)C)C=C1 Chemical compound COC(=O)NC1=NC=CC(=C1)C1=CC(OC(F)(F)F)=C(OC[C@@](C)(N)CC(C)C)C=C1 HAPXQAGUUXSYBV-FQEVSTJZSA-N 0.000 description 2
- CCSQCFFXUWSLHY-IBGZPJMESA-N COC(=O)NC1=NC=CC(=C1)C1=NC=C(OC[C@@](C)(N)CC(C)C)C(=C1)C(F)(F)F Chemical compound COC(=O)NC1=NC=CC(=C1)C1=NC=C(OC[C@@](C)(N)CC(C)C)C(=C1)C(F)(F)F CCSQCFFXUWSLHY-IBGZPJMESA-N 0.000 description 2
- JYLJLYWRGYOUPG-IBGZPJMESA-N COC(=O)NC1=NC=CC(=C1)C1=NC=C(OC[C@@](C)(N)CC(C)C)C(Cl)=C1 Chemical compound COC(=O)NC1=NC=CC(=C1)C1=NC=C(OC[C@@](C)(N)CC(C)C)C(Cl)=C1 JYLJLYWRGYOUPG-IBGZPJMESA-N 0.000 description 2
- ZKULRVLUDZUZOJ-IBGZPJMESA-N COC1=C(C=CN=C1)C1=CC(=C(OC[C@@](C)(N)CC(C)C)C=C1)C(F)(F)F Chemical compound COC1=C(C=CN=C1)C1=CC(=C(OC[C@@](C)(N)CC(C)C)C=C1)C(F)(F)F ZKULRVLUDZUZOJ-IBGZPJMESA-N 0.000 description 2
- ZHGKDOYOHZJUPD-IBGZPJMESA-N COC1=C(OC[C@@](C)(N)CC(C)C)N=CC(=C1)C1=CC(C)=NC=C1 Chemical compound COC1=C(OC[C@@](C)(N)CC(C)C)N=CC(=C1)C1=CC(C)=NC=C1 ZHGKDOYOHZJUPD-IBGZPJMESA-N 0.000 description 2
- GNLDTFQXTMVJHS-QFIPXVFZSA-N COC=1C(=NC=C(C1)C1=CC=NC2=CC=CC=C12)OC[C@](CC(C)C)(N)C Chemical compound COC=1C(=NC=C(C1)C1=CC=NC2=CC=CC=C12)OC[C@](CC(C)C)(N)C GNLDTFQXTMVJHS-QFIPXVFZSA-N 0.000 description 2
- ULGONQSWPGCYPW-IBGZPJMESA-N C[C@@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)C)C(F)(F)F)(CC(C)C)N Chemical compound C[C@@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)C)C(F)(F)F)(CC(C)C)N ULGONQSWPGCYPW-IBGZPJMESA-N 0.000 description 2
- IAOYSFIEUUJVEC-FQEVSTJZSA-N C[C@@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)C)S(=O)(=O)C)(CC(C)C)N Chemical compound C[C@@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)C)S(=O)(=O)C)(CC(C)C)N IAOYSFIEUUJVEC-FQEVSTJZSA-N 0.000 description 2
- WLAZWTACSHXEGN-QFIPXVFZSA-N C[C@@](COC1=C(C=C(C=C1)C1=CC=NC2=CC=CC=C12)C(F)(F)F)(CC(C)C)N Chemical compound C[C@@](COC1=C(C=C(C=C1)C1=CC=NC2=CC=CC=C12)C(F)(F)F)(CC(C)C)N WLAZWTACSHXEGN-QFIPXVFZSA-N 0.000 description 2
- UJFBQMHGCCSHRP-SFHVURJKSA-N C[C@@](COC1=C(C=C(C=C1)C1=CC=NC=C1)C(F)(F)F)(CC(C)C)N Chemical compound C[C@@](COC1=C(C=C(C=C1)C1=CC=NC=C1)C(F)(F)F)(CC(C)C)N UJFBQMHGCCSHRP-SFHVURJKSA-N 0.000 description 2
- MYJMDFXSTDDBGP-HKBQPEDESA-N C[C@@](COC1=CC=C(C2=CC=CC=C12)C1=CC=NC2=CC=CC=C12)(CC(C)C)NC(OC(C)(C)C)=O Chemical compound C[C@@](COC1=CC=C(C2=CC=CC=C12)C1=CC=NC2=CC=CC=C12)(CC(C)C)NC(OC(C)(C)C)=O MYJMDFXSTDDBGP-HKBQPEDESA-N 0.000 description 2
- DPRYJZGDMSIMLY-NRFANRHFSA-N C[C@@](COC1=NC=C(C=C1C(F)(F)F)C1=CC=NC2=CC=CC=C12)(CC(C)C)N Chemical compound C[C@@](COC1=NC=C(C=C1C(F)(F)F)C1=CC=NC2=CC=CC=C12)(CC(C)C)N DPRYJZGDMSIMLY-NRFANRHFSA-N 0.000 description 2
- OFMWMZVLUNNWMK-FQEVSTJZSA-N C[C@@](COC=1C(=CC(=NC1C)C1=CC(=NC=C1)C)C)(CC(C)C)N Chemical compound C[C@@](COC=1C(=CC(=NC1C)C1=CC(=NC=C1)C)C)(CC(C)C)N OFMWMZVLUNNWMK-FQEVSTJZSA-N 0.000 description 2
- XUPPARGHFZPHDP-OAQYLSRUSA-N C[C@](COC=1C=NC(=CC=1C(F)(F)F)C1=CC=NC2=CC=CC=C12)(CC(C)C)N Chemical compound C[C@](COC=1C=NC(=CC=1C(F)(F)F)C1=CC=NC2=CC=CC=C12)(CC(C)C)N XUPPARGHFZPHDP-OAQYLSRUSA-N 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 2
- HPNKCULQQWRCGT-QHCPKHFHSA-N ClC1=C(C=CC(=N1)C1=CC(=NC=C1)C(F)F)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O Chemical compound ClC1=C(C=CC(=N1)C1=CC(=NC=C1)C(F)F)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O HPNKCULQQWRCGT-QHCPKHFHSA-N 0.000 description 2
- FRQVVRQZTVSSSB-SANMLTNESA-N ClC1=C(C=NC(=C1)C1=CC=NC2=CC(=CC(=C12)F)F)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O Chemical compound ClC1=C(C=NC(=C1)C1=CC=NC2=CC(=CC(=C12)F)F)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O FRQVVRQZTVSSSB-SANMLTNESA-N 0.000 description 2
- SBMOQCYKRCJWFR-DEOSSOPVSA-N ClC1=CC(=NC=C1OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C1=C(C(=NC=C1)C)C Chemical compound ClC1=CC(=NC=C1OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C1=C(C(=NC=C1)C)C SBMOQCYKRCJWFR-DEOSSOPVSA-N 0.000 description 2
- WDVFYUCKASYYKL-QHCPKHFHSA-N ClC1=CC(=NC=C1OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C1=CC(=NC=C1)C Chemical compound ClC1=CC(=NC=C1OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C1=CC(=NC=C1)C WDVFYUCKASYYKL-QHCPKHFHSA-N 0.000 description 2
- VQBFWTSZIQXWTK-QFIPXVFZSA-N ClC1=CC=C2C(=CC=NC2=C1)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F Chemical compound ClC1=CC=C2C(=CC=NC2=C1)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F VQBFWTSZIQXWTK-QFIPXVFZSA-N 0.000 description 2
- QBWQGOBPRRMHEI-NRFANRHFSA-N ClC1=NC(=CC=C1OC[C@](CC(C)C)(N)C)C1=CC=NC2=CC=CC=C12 Chemical compound ClC1=NC(=CC=C1OC[C@](CC(C)C)(N)C)C1=CC=NC2=CC=CC=C12 QBWQGOBPRRMHEI-NRFANRHFSA-N 0.000 description 2
- SISQPPCZDPNKAD-GOSISDBHSA-N ClC1=NC=C(C(=C1)C1=NC=C(C(=C1)C(F)F)OC[C@@](CC(C)C)(N)C)F Chemical compound ClC1=NC=C(C(=C1)C1=NC=C(C(=C1)C(F)F)OC[C@@](CC(C)C)(N)C)F SISQPPCZDPNKAD-GOSISDBHSA-N 0.000 description 2
- CAHWFUWISRRLIM-SFHVURJKSA-N ClC1=NC=CC(=C1)C1=NC(=C(C=C1)OC[C@](CC(C)C)(N)C)C(F)F Chemical compound ClC1=NC=CC(=C1)C1=NC(=C(C=C1)OC[C@](CC(C)C)(N)C)C(F)F CAHWFUWISRRLIM-SFHVURJKSA-N 0.000 description 2
- QHPJIUARPKBLQQ-GOSISDBHSA-N ClC1=NC=CC(=C1)C1=NC=C(C(=C1)C(F)F)OC[C@@](CC(C)C)(N)C Chemical compound ClC1=NC=CC(=C1)C1=NC=C(C(=C1)C(F)F)OC[C@@](CC(C)C)(N)C QHPJIUARPKBLQQ-GOSISDBHSA-N 0.000 description 2
- HJNRYIZUGRFONS-SFHVURJKSA-N ClC1=NC=CC(=C1)C=1C=NC(=C(C1)C)OC[C@](CC(C)C)(N)C Chemical compound ClC1=NC=CC(=C1)C=1C=NC(=C(C1)C)OC[C@](CC(C)C)(N)C HJNRYIZUGRFONS-SFHVURJKSA-N 0.000 description 2
- HGQHQPWLZPQSBJ-DEOSSOPVSA-N ClC1=NC=CC(=C1F)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C#N Chemical compound ClC1=NC=CC(=C1F)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C#N HGQHQPWLZPQSBJ-DEOSSOPVSA-N 0.000 description 2
- ASPJNLYWGAKLTB-KRWDZBQOSA-N ClC=1C(=NC=C(C1)C1=NC(=NC=C1)C)OC[C@](CC(C)C)(N)C Chemical compound ClC=1C(=NC=C(C1)C1=NC(=NC=C1)C)OC[C@](CC(C)C)(N)C ASPJNLYWGAKLTB-KRWDZBQOSA-N 0.000 description 2
- 102000016622 Dipeptidyl Peptidase 4 Human genes 0.000 description 2
- QUSNBJAOOMFDIB-UHFFFAOYSA-N Ethylamine Chemical compound CCN QUSNBJAOOMFDIB-UHFFFAOYSA-N 0.000 description 2
- CQKGLFXBOCVPLN-IBGZPJMESA-N FC(C1=C(C=CC(=N1)C1=CC(=NC=C1)C)OC[C@](CC(C)C)(N)C)F Chemical compound FC(C1=C(C=CC(=N1)C1=CC(=NC=C1)C)OC[C@](CC(C)C)(N)C)F CQKGLFXBOCVPLN-IBGZPJMESA-N 0.000 description 2
- NGBWQVJCOYTGOR-FQEVSTJZSA-N FC(C1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=CC(=NC=C1)C(F)F)F Chemical compound FC(C1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=CC(=NC=C1)C(F)F)F NGBWQVJCOYTGOR-FQEVSTJZSA-N 0.000 description 2
- LLASSJMOZUBNPF-FQEVSTJZSA-N FC(C1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=CC(=NC=C1)C)F Chemical compound FC(C1=C(OC[C@](CC(C)C)(N)C)C=CC(=C1)C1=CC(=NC=C1)C)F LLASSJMOZUBNPF-FQEVSTJZSA-N 0.000 description 2
- DCWNOICLZKGXFR-LJQANCHMSA-N FC(C1=CC(=NC=C1OC[C@@](CC(C)C)(N)C)C1=C(C(=NC=C1)C)F)F Chemical compound FC(C1=CC(=NC=C1OC[C@@](CC(C)C)(N)C)C1=C(C(=NC=C1)C)F)F DCWNOICLZKGXFR-LJQANCHMSA-N 0.000 description 2
- QYLMAGMUZOOXAT-HXUWFJFHSA-N FC(C1=CC(=NC=C1OC[C@@](CC(C)C)(N)C)C1=CC(=NC=C1)CC)F Chemical compound FC(C1=CC(=NC=C1OC[C@@](CC(C)C)(N)C)C1=CC(=NC=C1)CC)F QYLMAGMUZOOXAT-HXUWFJFHSA-N 0.000 description 2
- XSNBBAWHAMAEDA-LJQANCHMSA-N FC(C1=CC(=NC=C1OC[C@@](CC(C)C)(N)C)C1=CC(=NC=C1F)C)F Chemical compound FC(C1=CC(=NC=C1OC[C@@](CC(C)C)(N)C)C1=CC(=NC=C1F)C)F XSNBBAWHAMAEDA-LJQANCHMSA-N 0.000 description 2
- CVSCNGLMPXLZJZ-IBGZPJMESA-N FC(C1=CC(=NC=C1OC[C@@](CC(C)C)(N)CF)C1=CC(=NC=C1)C)F Chemical compound FC(C1=CC(=NC=C1OC[C@@](CC(C)C)(N)CF)C1=CC(=NC=C1)C)F CVSCNGLMPXLZJZ-IBGZPJMESA-N 0.000 description 2
- DCWNOICLZKGXFR-IBGZPJMESA-N FC(C1=CC(=NC=C1OC[C@](CC(C)C)(N)C)C1=C(C(=NC=C1)C)F)F Chemical compound FC(C1=CC(=NC=C1OC[C@](CC(C)C)(N)C)C1=C(C(=NC=C1)C)F)F DCWNOICLZKGXFR-IBGZPJMESA-N 0.000 description 2
- XSNBBAWHAMAEDA-IBGZPJMESA-N FC(C1=CC(=NC=C1OC[C@](CC(C)C)(N)C)C1=CC(=NC=C1F)C)F Chemical compound FC(C1=CC(=NC=C1OC[C@](CC(C)C)(N)C)C1=CC(=NC=C1F)C)F XSNBBAWHAMAEDA-IBGZPJMESA-N 0.000 description 2
- OPLYCHUBAPFARE-IBGZPJMESA-N FC(C1=NC=CC(=C1)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)OC(F)(F)F)F Chemical compound FC(C1=NC=CC(=C1)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)OC(F)(F)F)F OPLYCHUBAPFARE-IBGZPJMESA-N 0.000 description 2
- RKAHOQATMSONTM-LJQANCHMSA-N FC(C1=NC=CC(=C1)C1=NC(=C(C=C1)OC[C@@](CC(C)C)(N)C)C(F)F)F Chemical compound FC(C1=NC=CC(=C1)C1=NC(=C(C=C1)OC[C@@](CC(C)C)(N)C)C(F)F)F RKAHOQATMSONTM-LJQANCHMSA-N 0.000 description 2
- PVCQHASHDIHPLR-IBGZPJMESA-N FC(C1=NC=CC(=C1)C1=NC(=C(C=C1)OC[C@@](CC(C)C)(N)CF)C(F)F)F Chemical compound FC(C1=NC=CC(=C1)C1=NC(=C(C=C1)OC[C@@](CC(C)C)(N)CF)C(F)F)F PVCQHASHDIHPLR-IBGZPJMESA-N 0.000 description 2
- HVHRHDHQHUAOQI-LJQANCHMSA-N FC(C1=NC=CC(=C1)C1=NC=C(C(=C1)C(F)F)OC[C@@](CC(C)C)(N)C)F Chemical compound FC(C1=NC=CC(=C1)C1=NC=C(C(=C1)C(F)F)OC[C@@](CC(C)C)(N)C)F HVHRHDHQHUAOQI-LJQANCHMSA-N 0.000 description 2
- AFMUKAVRUCBENP-IBGZPJMESA-N FC(C1=NC=CC(=C1)C1=NC=C(C(=C1)C(F)F)OC[C@@](CC(C)C)(N)CF)F Chemical compound FC(C1=NC=CC(=C1)C1=NC=C(C(=C1)C(F)F)OC[C@@](CC(C)C)(N)CF)F AFMUKAVRUCBENP-IBGZPJMESA-N 0.000 description 2
- HVHRHDHQHUAOQI-IBGZPJMESA-N FC(C1=NC=CC(=C1)C1=NC=C(C(=C1)C(F)F)OC[C@](CC(C)C)(N)C)F Chemical compound FC(C1=NC=CC(=C1)C1=NC=C(C(=C1)C(F)F)OC[C@](CC(C)C)(N)C)F HVHRHDHQHUAOQI-IBGZPJMESA-N 0.000 description 2
- AFMUKAVRUCBENP-LJQANCHMSA-N FC(C1=NC=CC(=C1)C1=NC=C(C(=C1)C(F)F)OC[C@](CC(C)C)(N)CF)F Chemical compound FC(C1=NC=CC(=C1)C1=NC=C(C(=C1)C(F)F)OC[C@](CC(C)C)(N)CF)F AFMUKAVRUCBENP-LJQANCHMSA-N 0.000 description 2
- OCSUUTZAUNLRDO-DEOSSOPVSA-N FC(C1=NC=CC(=C1)C1=NC=C(C(=C1)C)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)F Chemical compound FC(C1=NC=CC(=C1)C1=NC=C(C(=C1)C)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)F OCSUUTZAUNLRDO-DEOSSOPVSA-N 0.000 description 2
- VYPORTDNBOGDIG-IBGZPJMESA-N FC(C1=NC=CC(=C1)C1=NC=C(C(=C1)C)OC[C@](CC(C)C)(N)C)F Chemical compound FC(C1=NC=CC(=C1)C1=NC=C(C(=C1)C)OC[C@](CC(C)C)(N)C)F VYPORTDNBOGDIG-IBGZPJMESA-N 0.000 description 2
- GSOWBJRJTCLICJ-DEOSSOPVSA-N FC(C1=NC=CC(=C1)C1=NC=C(C(=C1)OC)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)F Chemical compound FC(C1=NC=CC(=C1)C1=NC=C(C(=C1)OC)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)F GSOWBJRJTCLICJ-DEOSSOPVSA-N 0.000 description 2
- CACPZHJCOBROER-QFIPXVFZSA-N FC(C=1C(=NC=C(C1)C1=CC=NC2=CC(=CC=C12)C(F)(F)F)OC[C@](CC(C)C)(N)C)F Chemical compound FC(C=1C(=NC=C(C1)C1=CC=NC2=CC(=CC=C12)C(F)(F)F)OC[C@](CC(C)C)(N)C)F CACPZHJCOBROER-QFIPXVFZSA-N 0.000 description 2
- VZSXUICSTBAKTM-QFIPXVFZSA-N FC(C=1C(=NC=C(C1)C1=CC=NC2=CC=CC=C12)OC[C@](CC(C)C)(N)C)F Chemical compound FC(C=1C(=NC=C(C1)C1=CC=NC2=CC=CC=C12)OC[C@](CC(C)C)(N)C)F VZSXUICSTBAKTM-QFIPXVFZSA-N 0.000 description 2
- RDFGEQJCOJLOPK-ZDUSSCGKSA-N FC1=C(OC[C@](CC(C)C)(N)C)C=CC=C1 Chemical compound FC1=C(OC[C@](CC(C)C)(N)C)C=CC=C1 RDFGEQJCOJLOPK-ZDUSSCGKSA-N 0.000 description 2
- HJBSVLDJABXCTF-QFIPXVFZSA-N FC1=C2C(=CC=NC2=CC(=C1)F)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F Chemical compound FC1=C2C(=CC=NC2=CC(=C1)F)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F HJBSVLDJABXCTF-QFIPXVFZSA-N 0.000 description 2
- NMTQEYYVTDGNQM-MHZLTWQESA-N FC1=C2C(=CC=NC2=CC(=C1)F)C=1C=C(C(=NC1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C Chemical compound FC1=C2C(=CC=NC2=CC(=C1)F)C=1C=C(C(=NC1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C NMTQEYYVTDGNQM-MHZLTWQESA-N 0.000 description 2
- MWEJOUPAUGUIBE-SANMLTNESA-N FC1=C2C(=CC=NC2=CC(=C1)F)C=1C=C(C(=NC1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C(F)(F)F Chemical compound FC1=C2C(=CC=NC2=CC(=C1)F)C=1C=C(C(=NC1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C(F)(F)F MWEJOUPAUGUIBE-SANMLTNESA-N 0.000 description 2
- LFRSZAAWZUOCAR-QFIPXVFZSA-N FC1=CC=C2C(=CC=NC2=C1)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F Chemical compound FC1=CC=C2C(=CC=NC2=C1)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F LFRSZAAWZUOCAR-QFIPXVFZSA-N 0.000 description 2
- KGGRQHXUHUQTBJ-QFIPXVFZSA-N FC1=CC=C2C(=CC=NC2=C1)C=1C=C(C(=NC1)OC[C@](CC(C)C)(N)C)C Chemical compound FC1=CC=C2C(=CC=NC2=C1)C=1C=C(C(=NC1)OC[C@](CC(C)C)(N)C)C KGGRQHXUHUQTBJ-QFIPXVFZSA-N 0.000 description 2
- WYFYLJMUQWYKNM-SFHVURJKSA-N FC1=NC=CC(=C1)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F Chemical compound FC1=NC=CC(=C1)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F WYFYLJMUQWYKNM-SFHVURJKSA-N 0.000 description 2
- GHXIQNNBBSWTNU-SFHVURJKSA-N FC1=NC=CC(=C1)C=1C=NC(=C(C1)C)OC[C@](CC(C)C)(N)C Chemical compound FC1=NC=CC(=C1)C=1C=NC(=C(C1)C)OC[C@](CC(C)C)(N)C GHXIQNNBBSWTNU-SFHVURJKSA-N 0.000 description 2
- GAZUFNTUTKTHDN-IBGZPJMESA-N FC1=NC=CC(=C1C)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F Chemical compound FC1=NC=CC(=C1C)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F GAZUFNTUTKTHDN-IBGZPJMESA-N 0.000 description 2
- KCHNAXACULVLBP-NRFANRHFSA-N FC=1C(=NC=C(C1)C1=CC=NC2=CC=CC=C12)OC[C@](CC(C)C)(N)C Chemical compound FC=1C(=NC=C(C1)C1=CC=NC2=CC=CC=C12)OC[C@](CC(C)C)(N)C KCHNAXACULVLBP-NRFANRHFSA-N 0.000 description 2
- PPHVWFRCKAYPEU-SFHVURJKSA-N FC=1C=C(C=NC=1OC[C@](CC(C)C)(N)C)C1=CC(=NC=C1)C Chemical compound FC=1C=C(C=NC=1OC[C@](CC(C)C)(N)C)C1=CC(=NC=C1)C PPHVWFRCKAYPEU-SFHVURJKSA-N 0.000 description 2
- DIESDROGZNCYLM-QFIPXVFZSA-N FC=1C=C2C(=CC=NC2=CC1)C=1C=C(C(=NC1)OC[C@](CC(C)C)(N)C)C Chemical compound FC=1C=C2C(=CC=NC2=CC1)C=1C=C(C(=NC1)OC[C@](CC(C)C)(N)C)C DIESDROGZNCYLM-QFIPXVFZSA-N 0.000 description 2
- OIQWKZIEKGGAEW-SFHVURJKSA-N FC=1C=NC=CC1C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F Chemical compound FC=1C=NC=CC1C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F OIQWKZIEKGGAEW-SFHVURJKSA-N 0.000 description 2
- GISRWBROCYNDME-PELMWDNLSA-N F[C@H]1[C@H]([C@H](NC1=O)COC1=NC=CC2=CC(=C(C=C12)OC)C(=O)N)C Chemical compound F[C@H]1[C@H]([C@H](NC1=O)COC1=NC=CC2=CC(=C(C=C12)OC)C(=O)N)C GISRWBROCYNDME-PELMWDNLSA-N 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- UGJMXCAKCUNAIE-UHFFFAOYSA-N Gabapentin Chemical compound OC(=O)CC1(CN)CCCCC1 UGJMXCAKCUNAIE-UHFFFAOYSA-N 0.000 description 2
- 101000930822 Giardia intestinalis Dipeptidyl-peptidase 4 Proteins 0.000 description 2
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- DIBOESXDWSIENZ-UHFFFAOYSA-N IC1=CC(=C(C=N1)O)OC Chemical compound IC1=CC(=C(C=N1)O)OC DIBOESXDWSIENZ-UHFFFAOYSA-N 0.000 description 2
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 2
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 2
- 240000007472 Leucaena leucocephala Species 0.000 description 2
- 239000012448 Lithium borohydride Substances 0.000 description 2
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 2
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 2
- JLTDJTHDQAWBAV-UHFFFAOYSA-N N,N-dimethylaniline Chemical compound CN(C)C1=CC=CC=C1 JLTDJTHDQAWBAV-UHFFFAOYSA-N 0.000 description 2
- FFKRQZAKUIVDBX-UHFFFAOYSA-N N-[4-(3-fluoro-4-hydroxyphenyl)pyridin-2-yl]acetamide Chemical compound FC=1C=C(C=CC1O)C1=CC(=NC=C1)NC(C)=O FFKRQZAKUIVDBX-UHFFFAOYSA-N 0.000 description 2
- WJLQUMMDKPAJCH-NRFANRHFSA-N N1=CC=C(C2=CN=CC=C12)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F Chemical compound N1=CC=C(C2=CN=CC=C12)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F WJLQUMMDKPAJCH-NRFANRHFSA-N 0.000 description 2
- QGEJTLQFMDSDBM-FQEVSTJZSA-N N1C=CC=2C1=NC=CC=2C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F Chemical compound N1C=CC=2C1=NC=CC=2C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F QGEJTLQFMDSDBM-FQEVSTJZSA-N 0.000 description 2
- JLLWCFDEQGKZTA-QHCPKHFHSA-N NC1=NC=CC(=C1F)C1=NC(=C(C=C1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C Chemical compound NC1=NC=CC(=C1F)C1=NC(=C(C=C1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C JLLWCFDEQGKZTA-QHCPKHFHSA-N 0.000 description 2
- SHMBDCWCMCTJGG-ZETCQYMHSA-N N[C@@](C(=O)O)(CC(C)C)CF Chemical compound N[C@@](C(=O)O)(CC(C)C)CF SHMBDCWCMCTJGG-ZETCQYMHSA-N 0.000 description 2
- AWMPIJASSRBTBA-ZETCQYMHSA-N N[C@@](CO)(CC(C)C)CF Chemical compound N[C@@](CO)(CC(C)C)CF AWMPIJASSRBTBA-ZETCQYMHSA-N 0.000 description 2
- CCSQCFFXUWSLHY-LJQANCHMSA-N N[C@@](COC=1C(=CC(=NC=1)C1=CC(=NC=C1)NC(OC)=O)C(F)(F)F)(CC(C)C)C Chemical compound N[C@@](COC=1C(=CC(=NC=1)C1=CC(=NC=C1)NC(OC)=O)C(F)(F)F)(CC(C)C)C CCSQCFFXUWSLHY-LJQANCHMSA-N 0.000 description 2
- HINOQCZIDBNXEI-HXUWFJFHSA-N N[C@@](COC=1C=CC(=NC=1C)C1=CC(=NC=C1)NC(OC)=O)(CC(C)C)C Chemical compound N[C@@](COC=1C=CC(=NC=1C)C1=CC(=NC=C1)NC(OC)=O)(CC(C)C)C HINOQCZIDBNXEI-HXUWFJFHSA-N 0.000 description 2
- BSOULHYZJJKVGA-SFHVURJKSA-N N[C@H](COC1=C(C#N)C=C(C=C1)C1=CC(=NC=C1)C)CC(C)C Chemical compound N[C@H](COC1=C(C#N)C=C(C=C1)C1=CC(=NC=C1)C)CC(C)C BSOULHYZJJKVGA-SFHVURJKSA-N 0.000 description 2
- LAHYYLXFCBPDDW-INIZCTEOSA-N N[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)C(F)(F)F)CC(C)C Chemical compound N[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)C(F)(F)F)CC(C)C LAHYYLXFCBPDDW-INIZCTEOSA-N 0.000 description 2
- DPKIBVXNSRPEDN-INIZCTEOSA-N N[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)Cl)CC(C)C Chemical compound N[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)Cl)CC(C)C DPKIBVXNSRPEDN-INIZCTEOSA-N 0.000 description 2
- WSZZLVNYBNWVDL-INIZCTEOSA-N N[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)OC(F)(F)F)CC(C)C Chemical compound N[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)OC(F)(F)F)CC(C)C WSZZLVNYBNWVDL-INIZCTEOSA-N 0.000 description 2
- VWSITUXKTVTAKL-FQEVSTJZSA-N N[C@](COC1=C(C#N)C=C(C=C1)C1=CC(=NC=C1)C(F)F)(CC(C)C)C Chemical compound N[C@](COC1=C(C#N)C=C(C=C1)C1=CC(=NC=C1)C(F)F)(CC(C)C)C VWSITUXKTVTAKL-FQEVSTJZSA-N 0.000 description 2
- JZGADLVQVYPSLJ-QFIPXVFZSA-N N[C@](COC1=C(C#N)C=C(C=C1)C1=CC=NC2=CC=CN=C12)(CC(C)C)C Chemical compound N[C@](COC1=C(C#N)C=C(C=C1)C1=CC=NC2=CC=CN=C12)(CC(C)C)C JZGADLVQVYPSLJ-QFIPXVFZSA-N 0.000 description 2
- WFKGXEHYQJXRJE-QHCPKHFHSA-N N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)C1CC1)(CC(C)C)C Chemical compound N[C@](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)C1CC1)(CC(C)C)C WFKGXEHYQJXRJE-QHCPKHFHSA-N 0.000 description 2
- QHQYALYRGRIANP-HXUWFJFHSA-N N[C@](COC=1C(=CC(=NC1)C1=CC(=NC=C1)NC(OC)=O)C(F)F)(CC(C)C)CF Chemical compound N[C@](COC=1C(=CC(=NC1)C1=CC(=NC=C1)NC(OC)=O)C(F)F)(CC(C)C)CF QHQYALYRGRIANP-HXUWFJFHSA-N 0.000 description 2
- QUAPBONUOLGMAD-NRFANRHFSA-N N[C@](COC=1C(=CC(=NC1C)C1=CC(=NC=C1)NC(OC)=O)C)(CC(C)C)C Chemical compound N[C@](COC=1C(=CC(=NC1C)C1=CC(=NC=C1)NC(OC)=O)C)(CC(C)C)C QUAPBONUOLGMAD-NRFANRHFSA-N 0.000 description 2
- WJOFSBXUBIUYAS-HXUWFJFHSA-N N[C@](COC=1C=CC(=NC1C(F)F)C1=CC(=NC=C1)NC(OC)=O)(CC(C)C)CF Chemical compound N[C@](COC=1C=CC(=NC1C(F)F)C1=CC(=NC=C1)NC(OC)=O)(CC(C)C)CF WJOFSBXUBIUYAS-HXUWFJFHSA-N 0.000 description 2
- IBEBHZDGQHVNEO-NRFANRHFSA-N O1N=CC=C1C1=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=CC=NC2=CC=CC=C12 Chemical compound O1N=CC=C1C1=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=CC=NC2=CC=CC=C12 IBEBHZDGQHVNEO-NRFANRHFSA-N 0.000 description 2
- UUFPYFAYXVSVIH-FQEVSTJZSA-N O=C1N(C(C2=CC=CC=C12)=O)[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)F)CC(C)C Chemical compound O=C1N(C(C2=CC=CC=C12)=O)[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)F)CC(C)C UUFPYFAYXVSVIH-FQEVSTJZSA-N 0.000 description 2
- 108010016731 PPAR gamma Proteins 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 2
- YASAKCUCGLMORW-UHFFFAOYSA-N Rosiglitazone Chemical compound C=1C=CC=NC=1N(C)CCOC(C=C1)=CC=C1CC1SC(=O)NC1=O YASAKCUCGLMORW-UHFFFAOYSA-N 0.000 description 2
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 2
- 239000012391 XPhos Pd G2 Substances 0.000 description 2
- WIQSHWSJFRYKSB-UHFFFAOYSA-N [2-acetamido-5-(hydroxymethyl)pyridin-4-yl]boronic acid Chemical compound C(C)(=O)NC1=NC=C(C(=C1)B(O)O)CO WIQSHWSJFRYKSB-UHFFFAOYSA-N 0.000 description 2
- BUSMBMGODABSIN-UHFFFAOYSA-N [4-methoxy-3-(trifluoromethyl)phenyl]boronic acid Chemical compound COC1=CC=C(B(O)O)C=C1C(F)(F)F BUSMBMGODABSIN-UHFFFAOYSA-N 0.000 description 2
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 2
- 239000012346 acetyl chloride Substances 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 235000010419 agar Nutrition 0.000 description 2
- 229940072056 alginate Drugs 0.000 description 2
- 235000010443 alginic acid Nutrition 0.000 description 2
- 229920000615 alginic acid Polymers 0.000 description 2
- 125000000217 alkyl group Chemical group 0.000 description 2
- 208000026935 allergic disease Diseases 0.000 description 2
- 229940125708 antidiabetic agent Drugs 0.000 description 2
- 239000003524 antilipemic agent Substances 0.000 description 2
- 229910052786 argon Inorganic materials 0.000 description 2
- 125000003118 aryl group Chemical group 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 125000005621 boronate group Chemical group 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- YKPUWZUDDOIDPM-SOFGYWHQSA-N capsaicin Chemical compound COC1=CC(CNC(=O)CCCC\C=C\C(C)C)=CC=C1O YKPUWZUDDOIDPM-SOFGYWHQSA-N 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 125000004432 carbon atom Chemical group C* 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- 239000001768 carboxy methyl cellulose Substances 0.000 description 2
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 2
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 150000001768 cations Chemical class 0.000 description 2
- 229910052801 chlorine Inorganic materials 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- OROGSEYTTFOCAN-DNJOTXNNSA-N codeine Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC OROGSEYTTFOCAN-DNJOTXNNSA-N 0.000 description 2
- 239000003086 colorant Substances 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- 230000002939 deleterious effect Effects 0.000 description 2
- 229910001873 dinitrogen Inorganic materials 0.000 description 2
- 238000010828 elution Methods 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 238000011049 filling Methods 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 239000000796 flavoring agent Substances 0.000 description 2
- 229910052731 fluorine Inorganic materials 0.000 description 2
- 125000004216 fluoromethyl group Chemical group [H]C([H])(F)* 0.000 description 2
- 235000013355 food flavoring agent Nutrition 0.000 description 2
- 235000019253 formic acid Nutrition 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 229960004580 glibenclamide Drugs 0.000 description 2
- 239000003862 glucocorticoid Substances 0.000 description 2
- ZNNLBTZKUZBEKO-UHFFFAOYSA-N glyburide Chemical compound COC1=CC=C(Cl)C=C1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)NC2CCCCC2)C=C1 ZNNLBTZKUZBEKO-UHFFFAOYSA-N 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 125000005842 heteroatom Chemical group 0.000 description 2
- JYGXADMDTFJGBT-VWUMJDOOSA-N hydrocortisone Chemical compound O=C1CC[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 JYGXADMDTFJGBT-VWUMJDOOSA-N 0.000 description 2
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- XLSMFKSTNGKWQX-UHFFFAOYSA-N hydroxyacetone Chemical compound CC(=O)CO XLSMFKSTNGKWQX-UHFFFAOYSA-N 0.000 description 2
- 239000012535 impurity Substances 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- CGIGDMFJXJATDK-UHFFFAOYSA-N indomethacin Chemical compound CC1=C(CC(O)=O)C2=CC(OC)=CC=C2N1C(=O)C1=CC=C(Cl)C=C1 CGIGDMFJXJATDK-UHFFFAOYSA-N 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 230000007794 irritation Effects 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 229910001629 magnesium chloride Inorganic materials 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 2
- 235000019341 magnesium sulphate Nutrition 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- 125000005394 methallyl group Chemical group 0.000 description 2
- 229960000485 methotrexate Drugs 0.000 description 2
- LYPCNZGCERKJEG-HXUWFJFHSA-N methyl N-[4-[6-[(2R)-2-amino-2,4-dimethylpentoxy]-5-(difluoromethyl)pyridin-3-yl]pyridin-2-yl]carbamate Chemical compound N[C@@](COC1=C(C=C(C=N1)C1=CC(=NC=C1)NC(OC)=O)C(F)F)(CC(C)C)C LYPCNZGCERKJEG-HXUWFJFHSA-N 0.000 description 2
- GTCAXTIRRLKXRU-UHFFFAOYSA-N methyl carbamate Chemical compound COC(N)=O GTCAXTIRRLKXRU-UHFFFAOYSA-N 0.000 description 2
- OSWPMRLSEDHDFF-UHFFFAOYSA-N methyl salicylate Chemical compound COC(=O)C1=CC=CC=C1O OSWPMRLSEDHDFF-UHFFFAOYSA-N 0.000 description 2
- HPNSFSBZBAHARI-UHFFFAOYSA-N micophenolic acid Natural products OC1=C(CC=C(C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-UHFFFAOYSA-N 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical compound O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 description 2
- HPNSFSBZBAHARI-RUDMXATFSA-N mycophenolic acid Chemical compound OC1=C(C\C=C(/C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-RUDMXATFSA-N 0.000 description 2
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 2
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 2
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 2
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 2
- 239000012074 organic phase Substances 0.000 description 2
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 2
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 2
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 2
- 239000006072 paste Substances 0.000 description 2
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 2
- 230000026731 phosphorylation Effects 0.000 description 2
- 238000006366 phosphorylation reaction Methods 0.000 description 2
- HYAFETHFCAUJAY-UHFFFAOYSA-N pioglitazone Chemical compound N1=CC(CC)=CC=C1CCOC(C=C1)=CC=C1CC1C(=O)NC(=O)S1 HYAFETHFCAUJAY-UHFFFAOYSA-N 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 2
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- AOJFQRQNPXYVLM-UHFFFAOYSA-N pyridin-1-ium;chloride Chemical compound [Cl-].C1=CC=[NH+]C=C1 AOJFQRQNPXYVLM-UHFFFAOYSA-N 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- WVYADZUPLLSGPU-UHFFFAOYSA-N salsalate Chemical compound OC(=O)C1=CC=CC=C1OC(=O)C1=CC=CC=C1O WVYADZUPLLSGPU-UHFFFAOYSA-N 0.000 description 2
- 239000012047 saturated solution Substances 0.000 description 2
- QZAYGJVTTNCVMB-UHFFFAOYSA-N serotonin Chemical compound C1=C(O)C=C2C(CCN)=CNC2=C1 QZAYGJVTTNCVMB-UHFFFAOYSA-N 0.000 description 2
- 238000009097 single-agent therapy Methods 0.000 description 2
- 238000009491 slugging Methods 0.000 description 2
- 235000017557 sodium bicarbonate Nutrition 0.000 description 2
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 2
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 2
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 2
- 239000007921 spray Substances 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-N succinic acid Chemical compound OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- QAHVHSLSRLSVGS-UHFFFAOYSA-N sulfamoyl chloride Chemical compound NS(Cl)(=O)=O QAHVHSLSRLSVGS-UHFFFAOYSA-N 0.000 description 2
- 229910052717 sulfur Chemical group 0.000 description 2
- 239000011593 sulfur Chemical group 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 238000010189 synthetic method Methods 0.000 description 2
- 229940037128 systemic glucocorticoids Drugs 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- DYHSDKLCOJIUFX-UHFFFAOYSA-N tert-butoxycarbonyl anhydride Chemical compound CC(C)(C)OC(=O)OC(=O)OC(C)(C)C DYHSDKLCOJIUFX-UHFFFAOYSA-N 0.000 description 2
- MAGZVIQXFXJGCI-SANMLTNESA-N tert-butyl N-[(2S)-1-[2-chloro-6-(5,7-difluoroquinolin-4-yl)pyridin-3-yl]oxy-2,4-dimethylpentan-2-yl]carbamate Chemical compound ClC1=NC(=CC=C1OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C1=CC=NC2=CC(=CC(=C12)F)F MAGZVIQXFXJGCI-SANMLTNESA-N 0.000 description 2
- AMHWTAFZMGCDMH-SANMLTNESA-N tert-butyl N-[(2S)-1-[2-chloro-6-(7-fluoroquinolin-4-yl)pyridin-3-yl]oxy-2,4-dimethylpentan-2-yl]carbamate Chemical compound ClC1=NC(=CC=C1OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C1=CC=NC2=CC(=CC=C12)F AMHWTAFZMGCDMH-SANMLTNESA-N 0.000 description 2
- YJCPHQJMODECMS-NRFANRHFSA-N tert-butyl N-[(2S)-1-[4-(2-acetamidopyridin-4-yl)-2-methylphenoxy]-4-methylpentan-2-yl]carbamate Chemical compound C(C)(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)C YJCPHQJMODECMS-NRFANRHFSA-N 0.000 description 2
- CZDYPVPMEAXLPK-UHFFFAOYSA-N tetramethylsilane Chemical compound C[Si](C)(C)C CZDYPVPMEAXLPK-UHFFFAOYSA-N 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- 239000002691 unilamellar liposome Substances 0.000 description 2
- NQPDZGIKBAWPEJ-UHFFFAOYSA-N valeric acid Chemical compound CCCCC(O)=O NQPDZGIKBAWPEJ-UHFFFAOYSA-N 0.000 description 2
- LSPHULWDVZXLIL-UHFFFAOYSA-N (+/-)-Camphoric acid Chemical compound CC1(C)C(C(O)=O)CCC1(C)C(O)=O LSPHULWDVZXLIL-UHFFFAOYSA-N 0.000 description 1
- SFLSHLFXELFNJZ-QMMMGPOBSA-N (-)-norepinephrine Chemical compound NC[C@H](O)C1=CC=C(O)C(O)=C1 SFLSHLFXELFNJZ-QMMMGPOBSA-N 0.000 description 1
- VCGRFBXVSFAGGA-UHFFFAOYSA-N (1,1-dioxo-1,4-thiazinan-4-yl)-[6-[[3-(4-fluorophenyl)-5-methyl-1,2-oxazol-4-yl]methoxy]pyridin-3-yl]methanone Chemical compound CC=1ON=C(C=2C=CC(F)=CC=2)C=1COC(N=C1)=CC=C1C(=O)N1CCS(=O)(=O)CC1 VCGRFBXVSFAGGA-UHFFFAOYSA-N 0.000 description 1
- UFYBTLOLWSABAU-UHFFFAOYSA-N (2-methylpyridin-4-yl)boronic acid Chemical compound CC1=CC(B(O)O)=CC=N1 UFYBTLOLWSABAU-UHFFFAOYSA-N 0.000 description 1
- XUFXOAAUWZOOIT-SXARVLRPSA-N (2R,3R,4R,5S,6R)-5-[[(2R,3R,4R,5S,6R)-5-[[(2R,3R,4S,5S,6R)-3,4-dihydroxy-6-methyl-5-[[(1S,4R,5S,6S)-4,5,6-trihydroxy-3-(hydroxymethyl)-1-cyclohex-2-enyl]amino]-2-oxanyl]oxy]-3,4-dihydroxy-6-(hydroxymethyl)-2-oxanyl]oxy]-6-(hydroxymethyl)oxane-2,3,4-triol Chemical compound O([C@H]1O[C@H](CO)[C@H]([C@@H]([C@H]1O)O)O[C@H]1O[C@@H]([C@H]([C@H](O)[C@H]1O)N[C@@H]1[C@@H]([C@@H](O)[C@H](O)C(CO)=C1)O)C)[C@@H]1[C@@H](CO)O[C@@H](O)[C@H](O)[C@H]1O XUFXOAAUWZOOIT-SXARVLRPSA-N 0.000 description 1
- POPVFGRPUSLVOD-CQSZACIVSA-N (2S)-2-(fluoromethyl)-4-methyl-2-(phenylmethoxyamino)pent-4-enoic acid Chemical compound CC(=C)C[C@](CF)(NOCC1=CC=CC=C1)C(O)=O POPVFGRPUSLVOD-CQSZACIVSA-N 0.000 description 1
- YEMAIZYKPDFKNU-SSDOTTSWSA-N (2r)-2-amino-2,4-dimethylpentan-1-ol Chemical compound CC(C)C[C@@](C)(N)CO YEMAIZYKPDFKNU-SSDOTTSWSA-N 0.000 description 1
- RDJGLLICXDHJDY-NSHDSACASA-N (2s)-2-(3-phenoxyphenyl)propanoic acid Chemical compound OC(=O)[C@@H](C)C1=CC=CC(OC=2C=CC=CC=2)=C1 RDJGLLICXDHJDY-NSHDSACASA-N 0.000 description 1
- GUHPRPJDBZHYCJ-SECBINFHSA-N (2s)-2-(5-benzoylthiophen-2-yl)propanoic acid Chemical compound S1C([C@H](C(O)=O)C)=CC=C1C(=O)C1=CC=CC=C1 GUHPRPJDBZHYCJ-SECBINFHSA-N 0.000 description 1
- MDKGKXOCJGEUJW-VIFPVBQESA-N (2s)-2-[4-(thiophene-2-carbonyl)phenyl]propanoic acid Chemical compound C1=CC([C@@H](C(O)=O)C)=CC=C1C(=O)C1=CC=CS1 MDKGKXOCJGEUJW-VIFPVBQESA-N 0.000 description 1
- QKDRXGFQVGOQKS-CRSSMBPESA-N (2s,3r,4r,5s,6r)-2-[4-chloro-3-[(4-ethoxyphenyl)methyl]phenyl]-6-methylsulfanyloxane-3,4,5-triol Chemical compound C1=CC(OCC)=CC=C1CC1=CC([C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](SC)O2)O)=CC=C1Cl QKDRXGFQVGOQKS-CRSSMBPESA-N 0.000 description 1
- OYNDLOJPYURCJG-UHFFFAOYSA-N (3-fluoro-4-hydroxyphenyl)boronic acid Chemical compound OB(O)C1=CC=C(O)C(F)=C1 OYNDLOJPYURCJG-UHFFFAOYSA-N 0.000 description 1
- ISULOSAJSWGBQR-SSDOTTSWSA-N (3s)-3-amino-5-methylhexan-1-ol Chemical compound CC(C)C[C@H](N)CCO ISULOSAJSWGBQR-SSDOTTSWSA-N 0.000 description 1
- VDXWCRIARMBDOX-UHFFFAOYSA-N (4,6-dichloropyridin-3-yl)methanol Chemical compound OCC1=CN=C(Cl)C=C1Cl VDXWCRIARMBDOX-UHFFFAOYSA-N 0.000 description 1
- XCWIMBMPJGQNHG-UHFFFAOYSA-N (6-fluoro-5-methylpyridin-3-yl)boronic acid Chemical compound CC1=CC(B(O)O)=CN=C1F XCWIMBMPJGQNHG-UHFFFAOYSA-N 0.000 description 1
- JMFIZDLMQQVPLB-UHFFFAOYSA-N (6-methylpyridazin-4-yl)boronic acid Chemical compound CC1=CC(=CN=N1)B(O)O JMFIZDLMQQVPLB-UHFFFAOYSA-N 0.000 description 1
- HMLGSIZOMSVISS-ONJSNURVSA-N (7r)-7-[[(2z)-2-(2-amino-1,3-thiazol-4-yl)-2-(2,2-dimethylpropanoyloxymethoxyimino)acetyl]amino]-3-ethenyl-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid Chemical compound N([C@@H]1C(N2C(=C(C=C)CSC21)C(O)=O)=O)C(=O)\C(=N/OCOC(=O)C(C)(C)C)C1=CSC(N)=N1 HMLGSIZOMSVISS-ONJSNURVSA-N 0.000 description 1
- ZEUITGRIYCTCEM-KRWDZBQOSA-N (S)-duloxetine Chemical compound C1([C@@H](OC=2C3=CC=CC=C3C=CC=2)CCNC)=CC=CS1 ZEUITGRIYCTCEM-KRWDZBQOSA-N 0.000 description 1
- UKGJZDSUJSPAJL-YPUOHESYSA-N (e)-n-[(1r)-1-[3,5-difluoro-4-(methanesulfonamido)phenyl]ethyl]-3-[2-propyl-6-(trifluoromethyl)pyridin-3-yl]prop-2-enamide Chemical compound CCCC1=NC(C(F)(F)F)=CC=C1\C=C\C(=O)N[C@H](C)C1=CC(F)=C(NS(C)(=O)=O)C(F)=C1 UKGJZDSUJSPAJL-YPUOHESYSA-N 0.000 description 1
- ZGYIXVSQHOKQRZ-COIATFDQSA-N (e)-n-[4-[3-chloro-4-(pyridin-2-ylmethoxy)anilino]-3-cyano-7-[(3s)-oxolan-3-yl]oxyquinolin-6-yl]-4-(dimethylamino)but-2-enamide Chemical compound N#CC1=CN=C2C=C(O[C@@H]3COCC3)C(NC(=O)/C=C/CN(C)C)=CC2=C1NC(C=C1Cl)=CC=C1OCC1=CC=CC=N1 ZGYIXVSQHOKQRZ-COIATFDQSA-N 0.000 description 1
- MOWXJLUYGFNTAL-DEOSSOPVSA-N (s)-[2-chloro-4-fluoro-5-(7-morpholin-4-ylquinazolin-4-yl)phenyl]-(6-methoxypyridazin-3-yl)methanol Chemical compound N1=NC(OC)=CC=C1[C@@H](O)C1=CC(C=2C3=CC=C(C=C3N=CN=2)N2CCOCC2)=C(F)C=C1Cl MOWXJLUYGFNTAL-DEOSSOPVSA-N 0.000 description 1
- DIOHEXPTUTVCNX-UHFFFAOYSA-N 1,1,1-trifluoro-n-phenyl-n-(trifluoromethylsulfonyl)methanesulfonamide Chemical compound FC(F)(F)S(=O)(=O)N(S(=O)(=O)C(F)(F)F)C1=CC=CC=C1 DIOHEXPTUTVCNX-UHFFFAOYSA-N 0.000 description 1
- APWRZPQBPCAXFP-UHFFFAOYSA-N 1-(1-oxo-2H-isoquinolin-5-yl)-5-(trifluoromethyl)-N-[2-(trifluoromethyl)pyridin-4-yl]pyrazole-4-carboxamide Chemical compound O=C1NC=CC2=C(C=CC=C12)N1N=CC(=C1C(F)(F)F)C(=O)NC1=CC(=NC=C1)C(F)(F)F APWRZPQBPCAXFP-UHFFFAOYSA-N 0.000 description 1
- BOVGTQGAOIONJV-BETUJISGSA-N 1-[(3ar,6as)-3,3a,4,5,6,6a-hexahydro-1h-cyclopenta[c]pyrrol-2-yl]-3-(4-methylphenyl)sulfonylurea Chemical compound C1=CC(C)=CC=C1S(=O)(=O)NC(=O)NN1C[C@H]2CCC[C@H]2C1 BOVGTQGAOIONJV-BETUJISGSA-N 0.000 description 1
- ABDDQTDRAHXHOC-QMMMGPOBSA-N 1-[(7s)-5,7-dihydro-4h-thieno[2,3-c]pyran-7-yl]-n-methylmethanamine Chemical compound CNC[C@@H]1OCCC2=C1SC=C2 ABDDQTDRAHXHOC-QMMMGPOBSA-N 0.000 description 1
- BTUGGGLMQBJCBN-UHFFFAOYSA-N 1-iodo-2-methylpropane Chemical compound CC(C)CI BTUGGGLMQBJCBN-UHFFFAOYSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- AVFZOVWCLRSYKC-UHFFFAOYSA-N 1-methylpyrrolidine Chemical compound CN1CCCC1 AVFZOVWCLRSYKC-UHFFFAOYSA-N 0.000 description 1
- SECFRXGVLMVUPD-UHFFFAOYSA-N 1-o-tert-butyl 3-o-methyl azetidine-1,3-dicarboxylate Chemical compound COC(=O)C1CN(C(=O)OC(C)(C)C)C1 SECFRXGVLMVUPD-UHFFFAOYSA-N 0.000 description 1
- FUFLCEKSBBHCMO-UHFFFAOYSA-N 11-dehydrocorticosterone Natural products O=C1CCC2(C)C3C(=O)CC(C)(C(CC4)C(=O)CO)C4C3CCC2=C1 FUFLCEKSBBHCMO-UHFFFAOYSA-N 0.000 description 1
- ZESRJSPZRDMNHY-YFWFAHHUSA-N 11-deoxycorticosterone Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 ZESRJSPZRDMNHY-YFWFAHHUSA-N 0.000 description 1
- LXFQSRIDYRFTJW-UHFFFAOYSA-M 2,4,6-trimethylbenzenesulfonate Chemical compound CC1=CC(C)=C(S([O-])(=O)=O)C(C)=C1 LXFQSRIDYRFTJW-UHFFFAOYSA-M 0.000 description 1
- LXQPBCHJNIOMQU-UHFFFAOYSA-N 2,4-dimethylpent-1-ene Chemical compound CC(C)CC(C)=C LXQPBCHJNIOMQU-UHFFFAOYSA-N 0.000 description 1
- OZAIFHULBGXAKX-UHFFFAOYSA-N 2-(2-cyanopropan-2-yldiazenyl)-2-methylpropanenitrile Chemical compound N#CC(C)(C)N=NC(C)(C)C#N OZAIFHULBGXAKX-UHFFFAOYSA-N 0.000 description 1
- CFKUMEAWTPZERA-UHFFFAOYSA-N 2-bromo-5-fluoro-4-(trifluoromethyl)pyridine Chemical compound FC1=CN=C(Br)C=C1C(F)(F)F CFKUMEAWTPZERA-UHFFFAOYSA-N 0.000 description 1
- DDLSIOQASXKYHW-UHFFFAOYSA-N 2-bromo-5-fluoropyridine-4-carbaldehyde Chemical compound FC1=CN=C(Br)C=C1C=O DDLSIOQASXKYHW-UHFFFAOYSA-N 0.000 description 1
- GONULLRFSHKLBS-UHFFFAOYSA-N 2-chloro-3-fluoro-4-iodopyridine Chemical compound FC1=C(I)C=CN=C1Cl GONULLRFSHKLBS-UHFFFAOYSA-N 0.000 description 1
- UUEQDBHKMOFLDP-UHFFFAOYSA-N 2-chloro-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pyridine Chemical compound O1C(C)(C)C(C)(C)OB1C1=CC=NC(Cl)=C1 UUEQDBHKMOFLDP-UHFFFAOYSA-N 0.000 description 1
- LXOHKRGLGLETIJ-UHFFFAOYSA-N 2-chloro-6-fluoropyridine Chemical compound FC1=CC=CC(Cl)=N1 LXOHKRGLGLETIJ-UHFFFAOYSA-N 0.000 description 1
- VKTBILBRBSALKI-UHFFFAOYSA-N 2-cyclopropylphenol Chemical compound OC1=CC=CC=C1C1CC1 VKTBILBRBSALKI-UHFFFAOYSA-N 0.000 description 1
- 229940080296 2-naphthalenesulfonate Drugs 0.000 description 1
- HCDMJFOHIXMBOV-UHFFFAOYSA-N 3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-ethyl-8-(morpholin-4-ylmethyl)-4,7-dihydropyrrolo[4,5]pyrido[1,2-d]pyrimidin-2-one Chemical compound C=1C2=C3N(CC)C(=O)N(C=4C(=C(OC)C=C(OC)C=4F)F)CC3=CN=C2NC=1CN1CCOCC1 HCDMJFOHIXMBOV-UHFFFAOYSA-N 0.000 description 1
- BYHQTRFJOGIQAO-GOSISDBHSA-N 3-(4-bromophenyl)-8-[(2R)-2-hydroxypropyl]-1-[(3-methoxyphenyl)methyl]-1,3,8-triazaspiro[4.5]decan-2-one Chemical compound C[C@H](CN1CCC2(CC1)CN(C(=O)N2CC3=CC(=CC=C3)OC)C4=CC=C(C=C4)Br)O BYHQTRFJOGIQAO-GOSISDBHSA-N 0.000 description 1
- JHDCDEHVUADNKQ-UHFFFAOYSA-N 3-(trifluoromethyl)-1h-pyridin-2-one Chemical compound OC1=NC=CC=C1C(F)(F)F JHDCDEHVUADNKQ-UHFFFAOYSA-N 0.000 description 1
- YGYGASJNJTYNOL-CQSZACIVSA-N 3-[(4r)-2,2-dimethyl-1,1-dioxothian-4-yl]-5-(4-fluorophenyl)-1h-indole-7-carboxamide Chemical compound C1CS(=O)(=O)C(C)(C)C[C@@H]1C1=CNC2=C(C(N)=O)C=C(C=3C=CC(F)=CC=3)C=C12 YGYGASJNJTYNOL-CQSZACIVSA-N 0.000 description 1
- SRVXSISGYBMIHR-UHFFFAOYSA-N 3-[3-[3-(2-amino-2-oxoethyl)phenyl]-5-chlorophenyl]-3-(5-methyl-1,3-thiazol-2-yl)propanoic acid Chemical compound S1C(C)=CN=C1C(CC(O)=O)C1=CC(Cl)=CC(C=2C=C(CC(N)=O)C=CC=2)=C1 SRVXSISGYBMIHR-UHFFFAOYSA-N 0.000 description 1
- MTJGVAJYTOXFJH-UHFFFAOYSA-N 3-aminonaphthalene-1,5-disulfonic acid Chemical compound C1=CC=C(S(O)(=O)=O)C2=CC(N)=CC(S(O)(=O)=O)=C21 MTJGVAJYTOXFJH-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- USEGQJLHQSTGHW-UHFFFAOYSA-N 3-bromo-2-methylprop-1-ene Chemical compound CC(=C)CBr USEGQJLHQSTGHW-UHFFFAOYSA-N 0.000 description 1
- XMIIGOLPHOKFCH-UHFFFAOYSA-M 3-phenylpropionate Chemical compound [O-]C(=O)CCC1=CC=CC=C1 XMIIGOLPHOKFCH-UHFFFAOYSA-M 0.000 description 1
- XJPZKYIHCLDXST-UHFFFAOYSA-N 4,6-dichloropyrimidine Chemical compound ClC1=CC(Cl)=NC=N1 XJPZKYIHCLDXST-UHFFFAOYSA-N 0.000 description 1
- JZGUMSTXLPEMFW-UHFFFAOYSA-N 4,6-dichloroquinoline Chemical compound N1=CC=C(Cl)C2=CC(Cl)=CC=C21 JZGUMSTXLPEMFW-UHFFFAOYSA-N 0.000 description 1
- VJPPLCNBDLZIFG-ZDUSSCGKSA-N 4-[(3S)-3-(but-2-ynoylamino)piperidin-1-yl]-5-fluoro-2,3-dimethyl-1H-indole-7-carboxamide Chemical compound C(C#CC)(=O)N[C@@H]1CN(CCC1)C1=C2C(=C(NC2=C(C=C1F)C(=O)N)C)C VJPPLCNBDLZIFG-ZDUSSCGKSA-N 0.000 description 1
- SWLAMJPTOQZTAE-UHFFFAOYSA-N 4-[2-[(5-chloro-2-methoxybenzoyl)amino]ethyl]benzoic acid Chemical class COC1=CC=C(Cl)C=C1C(=O)NCCC1=CC=C(C(O)=O)C=C1 SWLAMJPTOQZTAE-UHFFFAOYSA-N 0.000 description 1
- YFCIFWOJYYFDQP-PTWZRHHISA-N 4-[3-amino-6-[(1S,3S,4S)-3-fluoro-4-hydroxycyclohexyl]pyrazin-2-yl]-N-[(1S)-1-(3-bromo-5-fluorophenyl)-2-(methylamino)ethyl]-2-fluorobenzamide Chemical compound CNC[C@@H](NC(=O)c1ccc(cc1F)-c1nc(cnc1N)[C@H]1CC[C@H](O)[C@@H](F)C1)c1cc(F)cc(Br)c1 YFCIFWOJYYFDQP-PTWZRHHISA-N 0.000 description 1
- XYWIPYBIIRTJMM-IBGZPJMESA-N 4-[[(2S)-2-[4-[5-chloro-2-[4-(trifluoromethyl)triazol-1-yl]phenyl]-5-methoxy-2-oxopyridin-1-yl]butanoyl]amino]-2-fluorobenzamide Chemical compound CC[C@H](N1C=C(OC)C(=CC1=O)C1=C(C=CC(Cl)=C1)N1C=C(N=N1)C(F)(F)F)C(=O)NC1=CC(F)=C(C=C1)C(N)=O XYWIPYBIIRTJMM-IBGZPJMESA-N 0.000 description 1
- TVZGACDUOSZQKY-LBPRGKRZSA-N 4-aminofolic acid Chemical compound C1=NC2=NC(N)=NC(N)=C2N=C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 TVZGACDUOSZQKY-LBPRGKRZSA-N 0.000 description 1
- AJLIJYGWAXPEOK-UHFFFAOYSA-N 4-bromo-1-fluoro-2-(trifluoromethyl)benzene Chemical compound FC1=CC=C(Br)C=C1C(F)(F)F AJLIJYGWAXPEOK-UHFFFAOYSA-N 0.000 description 1
- VXQZZSWCUVJUEG-UHFFFAOYSA-N 4-bromo-1-fluoro-2-methylsulfonylbenzene Chemical compound CS(=O)(=O)C1=CC(Br)=CC=C1F VXQZZSWCUVJUEG-UHFFFAOYSA-N 0.000 description 1
- CZXKAQGBZPKRHU-UHFFFAOYSA-N 4-bromo-2-(1,2-oxazol-5-yl)phenol Chemical compound Oc1ccc(Br)cc1-c1ccno1 CZXKAQGBZPKRHU-UHFFFAOYSA-N 0.000 description 1
- QEYONPKSDTUPAX-UHFFFAOYSA-N 4-bromo-2-chloro-6-fluorophenol Chemical compound OC1=C(F)C=C(Br)C=C1Cl QEYONPKSDTUPAX-UHFFFAOYSA-N 0.000 description 1
- VIBJPUXLAKVICD-UHFFFAOYSA-N 4-bromo-2-chlorophenol Chemical compound OC1=CC=C(Br)C=C1Cl VIBJPUXLAKVICD-UHFFFAOYSA-N 0.000 description 1
- RYVOZMPTISNBDB-UHFFFAOYSA-N 4-bromo-2-fluorophenol Chemical compound OC1=CC=C(Br)C=C1F RYVOZMPTISNBDB-UHFFFAOYSA-N 0.000 description 1
- WHSIIJQOEGXWSN-UHFFFAOYSA-N 4-bromo-2-methoxyphenol Chemical compound COC1=CC(Br)=CC=C1O WHSIIJQOEGXWSN-UHFFFAOYSA-N 0.000 description 1
- IWJGMJHAIUBWKT-UHFFFAOYSA-N 4-bromo-2-methylphenol Chemical compound CC1=CC(Br)=CC=C1O IWJGMJHAIUBWKT-UHFFFAOYSA-N 0.000 description 1
- GBPCCNWUSHSRTM-UHFFFAOYSA-N 4-bromo-6-methylpyrimidine Chemical compound CC1=CC(Br)=NC=N1 GBPCCNWUSHSRTM-UHFFFAOYSA-N 0.000 description 1
- HKBQHZQGQMDUMR-UHFFFAOYSA-N 4-bromo-7-fluoroquinoline Chemical compound BrC1=CC=NC2=CC(F)=CC=C21 HKBQHZQGQMDUMR-UHFFFAOYSA-N 0.000 description 1
- OUNQUWORSXHSJN-UHFFFAOYSA-N 4-bromonaphthalen-1-ol Chemical compound C1=CC=C2C(O)=CC=C(Br)C2=C1 OUNQUWORSXHSJN-UHFFFAOYSA-N 0.000 description 1
- BAQKUNMKVAPWGU-UHFFFAOYSA-N 4-bromopyridin-2-amine Chemical compound NC1=CC(Br)=CC=N1 BAQKUNMKVAPWGU-UHFFFAOYSA-N 0.000 description 1
- GKEOOUFCVWEWHA-UHFFFAOYSA-N 4-chloro-1,6-naphthyridine Chemical compound C1=NC=C2C(Cl)=CC=NC2=C1 GKEOOUFCVWEWHA-UHFFFAOYSA-N 0.000 description 1
- WDTVJRYCMIZPMX-UHFFFAOYSA-N 4-chloro-2-methylpyrimidine Chemical compound CC1=NC=CC(Cl)=N1 WDTVJRYCMIZPMX-UHFFFAOYSA-N 0.000 description 1
- HQAIROMRVBVWSK-UHFFFAOYSA-N 4-chloro-2-methylquinoline Chemical compound C1=CC=CC2=NC(C)=CC(Cl)=C21 HQAIROMRVBVWSK-UHFFFAOYSA-N 0.000 description 1
- ZJTFMBZVSQOTPA-UHFFFAOYSA-N 4-chloro-5,7-difluoroquinoline Chemical compound ClC1=CC=NC2=CC(F)=CC(F)=C21 ZJTFMBZVSQOTPA-UHFFFAOYSA-N 0.000 description 1
- CKTQPWIDUQGUGG-UHFFFAOYSA-N 4-chloro-6-fluoroquinoline Chemical compound N1=CC=C(Cl)C2=CC(F)=CC=C21 CKTQPWIDUQGUGG-UHFFFAOYSA-N 0.000 description 1
- TTXZTTXOYYOVEV-UHFFFAOYSA-N 4-chloro-7-fluoroquinoline Chemical compound ClC1=CC=NC2=CC(F)=CC=C21 TTXZTTXOYYOVEV-UHFFFAOYSA-N 0.000 description 1
- LINGICLAECZKAW-UHFFFAOYSA-N 4-chloro-8-(trifluoromethyl)quinoline Chemical compound C1=CN=C2C(C(F)(F)F)=CC=CC2=C1Cl LINGICLAECZKAW-UHFFFAOYSA-N 0.000 description 1
- PJJGZPJJTHBVMX-UHFFFAOYSA-N 5,7-Dihydroxyisoflavone Chemical compound C=1C(O)=CC(O)=C(C2=O)C=1OC=C2C1=CC=CC=C1 PJJGZPJJTHBVMX-UHFFFAOYSA-N 0.000 description 1
- IRPVABHDSJVBNZ-RTHVDDQRSA-N 5-[1-(cyclopropylmethyl)-5-[(1R,5S)-3-(oxetan-3-yl)-3-azabicyclo[3.1.0]hexan-6-yl]pyrazol-3-yl]-3-(trifluoromethyl)pyridin-2-amine Chemical compound C1=C(C(F)(F)F)C(N)=NC=C1C1=NN(CC2CC2)C(C2[C@@H]3CN(C[C@@H]32)C2COC2)=C1 IRPVABHDSJVBNZ-RTHVDDQRSA-N 0.000 description 1
- XPGIBDJXEVAVTO-UHFFFAOYSA-N 5-bromo-2-chloropyrimidine Chemical compound ClC1=NC=C(Br)C=N1 XPGIBDJXEVAVTO-UHFFFAOYSA-N 0.000 description 1
- MUYVOGAJRCBWCY-UHFFFAOYSA-N 5-bromo-2-fluoropyridine-3-carbaldehyde Chemical compound FC1=NC=C(Br)C=C1C=O MUYVOGAJRCBWCY-UHFFFAOYSA-N 0.000 description 1
- MKKSTJKBKNCMRV-UHFFFAOYSA-N 5-bromo-2-hydroxybenzaldehyde Chemical compound OC1=CC=C(Br)C=C1C=O MKKSTJKBKNCMRV-UHFFFAOYSA-N 0.000 description 1
- SWTLLSLCDHXNIU-UHFFFAOYSA-N 5-bromo-2-oxo-1h-pyridine-3-carbonitrile Chemical compound BrC1=CNC(=O)C(C#N)=C1 SWTLLSLCDHXNIU-UHFFFAOYSA-N 0.000 description 1
- SZFUWUOHDRMCKD-UHFFFAOYSA-N 5-chloro-1h-pyridin-2-one Chemical compound OC1=CC=C(Cl)C=N1 SZFUWUOHDRMCKD-UHFFFAOYSA-N 0.000 description 1
- HCEQQASHRRPQFE-UHFFFAOYSA-N 5-chloro-n-[2-[4-(cyclohexylcarbamoylsulfamoyl)phenyl]ethyl]-2-methoxybenzamide;3-(diaminomethylidene)-1,1-dimethylguanidine;hydrochloride Chemical compound Cl.CN(C)C(=N)N=C(N)N.COC1=CC=C(Cl)C=C1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)NC2CCCCC2)C=C1 HCEQQASHRRPQFE-UHFFFAOYSA-N 0.000 description 1
- KCBWAFJCKVKYHO-UHFFFAOYSA-N 6-(4-cyclopropyl-6-methoxypyrimidin-5-yl)-1-[[4-[1-propan-2-yl-4-(trifluoromethyl)imidazol-2-yl]phenyl]methyl]pyrazolo[3,4-d]pyrimidine Chemical compound C1(CC1)C1=NC=NC(=C1C1=NC=C2C(=N1)N(N=C2)CC1=CC=C(C=C1)C=1N(C=C(N=1)C(F)(F)F)C(C)C)OC KCBWAFJCKVKYHO-UHFFFAOYSA-N 0.000 description 1
- BFBRCFKSFRYJGE-UHFFFAOYSA-N 6-bromo-3-fluoropyridine-2-carbaldehyde Chemical compound FC1=CC=C(Br)N=C1C=O BFBRCFKSFRYJGE-UHFFFAOYSA-N 0.000 description 1
- DEUUWLAOCJJKBT-UHFFFAOYSA-N 6-chloro-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)quinoline Chemical compound O1C(C)(C)C(C)(C)OB1C1=CC=NC2=CC=C(Cl)C=C12 DEUUWLAOCJJKBT-UHFFFAOYSA-N 0.000 description 1
- VHRSUDSXCMQTMA-PJHHCJLFSA-N 6alpha-methylprednisolone Chemical compound C([C@@]12C)=CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2[C@@H](O)C[C@]2(C)[C@@](O)(C(=O)CO)CC[C@H]21 VHRSUDSXCMQTMA-PJHHCJLFSA-N 0.000 description 1
- KYARBIJYVGJZLB-UHFFFAOYSA-N 7-amino-4-hydroxy-2-naphthalenesulfonic acid Chemical compound OC1=CC(S(O)(=O)=O)=CC2=CC(N)=CC=C21 KYARBIJYVGJZLB-UHFFFAOYSA-N 0.000 description 1
- GZDUYRAAWRRVEY-UHFFFAOYSA-N 7-chloro-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)quinoline Chemical compound O1C(C)(C)C(C)(C)OB1C1=CC=NC2=CC(Cl)=CC=C12 GZDUYRAAWRRVEY-UHFFFAOYSA-N 0.000 description 1
- CYJRNFFLTBEQSQ-UHFFFAOYSA-N 8-(3-methyl-1-benzothiophen-5-yl)-N-(4-methylsulfonylpyridin-3-yl)quinoxalin-6-amine Chemical compound CS(=O)(=O)C1=C(C=NC=C1)NC=1C=C2N=CC=NC2=C(C=1)C=1C=CC2=C(C(=CS2)C)C=1 CYJRNFFLTBEQSQ-UHFFFAOYSA-N 0.000 description 1
- OZAIFHULBGXAKX-VAWYXSNFSA-N AIBN Substances N#CC(C)(C)\N=N\C(C)(C)C#N OZAIFHULBGXAKX-VAWYXSNFSA-N 0.000 description 1
- ZRPZPNYZFSJUPA-UHFFFAOYSA-N ARS-1620 Chemical compound Oc1cccc(F)c1-c1c(Cl)cc2c(ncnc2c1F)N1CCN(CC1)C(=O)C=C ZRPZPNYZFSJUPA-UHFFFAOYSA-N 0.000 description 1
- 101150095401 AURKA gene Proteins 0.000 description 1
- PQSUYGKTWSAVDQ-ZVIOFETBSA-N Aldosterone Chemical compound C([C@@]1([C@@H](C(=O)CO)CC[C@H]1[C@@H]1CC2)C=O)[C@H](O)[C@@H]1[C@]1(C)C2=CC(=O)CC1 PQSUYGKTWSAVDQ-ZVIOFETBSA-N 0.000 description 1
- PQSUYGKTWSAVDQ-UHFFFAOYSA-N Aldosterone Natural products C1CC2C3CCC(C(=O)CO)C3(C=O)CC(O)C2C2(C)C1=CC(=O)CC2 PQSUYGKTWSAVDQ-UHFFFAOYSA-N 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 description 1
- GUBGYTABKSRVRQ-DCSYEGIMSA-N Beta-Lactose Chemical compound OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-DCSYEGIMSA-N 0.000 description 1
- XNCOSPRUTUOJCJ-UHFFFAOYSA-N Biguanide Chemical compound NC(N)=NC(N)=N XNCOSPRUTUOJCJ-UHFFFAOYSA-N 0.000 description 1
- MNIPYSSQXLZQLJ-UHFFFAOYSA-N Biofenac Chemical compound OC(=O)COC(=O)CC1=CC=CC=C1NC1=C(Cl)C=CC=C1Cl MNIPYSSQXLZQLJ-UHFFFAOYSA-N 0.000 description 1
- BIKRITXCTDRQAX-UHFFFAOYSA-N BrC1=CC(=C(OCC(CC(C)C)(C)NC(OCC2=CC=CC=C2)=O)C(=C1)F)Cl Chemical compound BrC1=CC(=C(OCC(CC(C)C)(C)NC(OCC2=CC=CC=C2)=O)C(=C1)F)Cl BIKRITXCTDRQAX-UHFFFAOYSA-N 0.000 description 1
- KZZXXBDSALWCPY-SFHVURJKSA-N BrC1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F Chemical compound BrC1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F KZZXXBDSALWCPY-SFHVURJKSA-N 0.000 description 1
- OZEQTCDMCIEZTK-LBPRGKRZSA-N BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C(=C1)C(F)(F)F)F Chemical compound BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C(=C1)C(F)(F)F)F OZEQTCDMCIEZTK-LBPRGKRZSA-N 0.000 description 1
- NDGMHVSVUPKBTM-ZDUSSCGKSA-N BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F Chemical compound BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F NDGMHVSVUPKBTM-ZDUSSCGKSA-N 0.000 description 1
- QXUKGWBJSSAHJF-ZDUSSCGKSA-N BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)OC(F)(F)F Chemical compound BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)OC(F)(F)F QXUKGWBJSSAHJF-ZDUSSCGKSA-N 0.000 description 1
- KOANABWZEGBSFI-NSHDSACASA-N BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1F)F Chemical compound BrC1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1F)F KOANABWZEGBSFI-NSHDSACASA-N 0.000 description 1
- XRFUTJCXFFCQLK-AWEZNQCLSA-N BrC1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)S(=O)(=O)C Chemical compound BrC1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)S(=O)(=O)C XRFUTJCXFFCQLK-AWEZNQCLSA-N 0.000 description 1
- AIGCXGQMNALLCR-CYBMUJFWSA-N BrC1=CC=C(C(=N1)C(F)F)OC[C@](CC(C)C)(N)CF Chemical compound BrC1=CC=C(C(=N1)C(F)F)OC[C@](CC(C)C)(N)CF AIGCXGQMNALLCR-CYBMUJFWSA-N 0.000 description 1
- FZASLYOWHVURHK-ZDUSSCGKSA-N BrC=1C(=CC(=NC1)OC[C@](CC(C)C)(N)C)C Chemical compound BrC=1C(=CC(=NC1)OC[C@](CC(C)C)(N)C)C FZASLYOWHVURHK-ZDUSSCGKSA-N 0.000 description 1
- GYJUZDKJLHFFGE-SFHVURJKSA-N BrC=1C=C(C(=NC1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C Chemical compound BrC=1C=C(C(=NC1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C GYJUZDKJLHFFGE-SFHVURJKSA-N 0.000 description 1
- UZWVVXHCKWBEFA-KRWDZBQOSA-N BrC=1C=C(C(=NC1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)Cl Chemical compound BrC=1C=C(C(=NC1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)Cl UZWVVXHCKWBEFA-KRWDZBQOSA-N 0.000 description 1
- AABATZWUCNSCNS-ZDUSSCGKSA-N BrC=1C=C(C(=NC1)OC[C@](CC(C)C)(N)C)OC Chemical compound BrC=1C=C(C(=NC1)OC[C@](CC(C)C)(N)C)OC AABATZWUCNSCNS-ZDUSSCGKSA-N 0.000 description 1
- WVKQPRKSZIJLMY-INIZCTEOSA-N BrC=1C=CC(=C(C#N)C1)OC[C@H](CC(C)C)N1C(C2=CC=CC=C2C1=O)=O Chemical compound BrC=1C=CC(=C(C#N)C1)OC[C@H](CC(C)C)N1C(C2=CC=CC=C2C1=O)=O WVKQPRKSZIJLMY-INIZCTEOSA-N 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-M Butyrate Chemical compound CCCC([O-])=O FERIUCNNQQJTOY-UHFFFAOYSA-M 0.000 description 1
- YHPGYEJXBYKEKW-NRFANRHFSA-N C(#N)C1=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=CC(=NC=C1)C Chemical compound C(#N)C1=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=CC(=NC=C1)C YHPGYEJXBYKEKW-NRFANRHFSA-N 0.000 description 1
- RPQJHGNDAJONMT-IBGZPJMESA-N C(#N)C1=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=CC(=NC=C1)C(F)(F)F Chemical compound C(#N)C1=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=CC(=NC=C1)C(F)(F)F RPQJHGNDAJONMT-IBGZPJMESA-N 0.000 description 1
- JUEIFGAFTFSYJR-FQEVSTJZSA-N C(#N)C1=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=CN=NC(=C1)C Chemical compound C(#N)C1=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=CN=NC(=C1)C JUEIFGAFTFSYJR-FQEVSTJZSA-N 0.000 description 1
- RYZBNXIJTGPQQG-LFABVHOISA-N C(#N)C1=C(OC[C@H](CC(C)OC)NC(OC(C)(C)C)=O)C=CC(=C1)C1=CC(=NC=C1)C Chemical compound C(#N)C1=C(OC[C@H](CC(C)OC)NC(OC(C)(C)C)=O)C=CC(=C1)C1=CC(=NC=C1)C RYZBNXIJTGPQQG-LFABVHOISA-N 0.000 description 1
- FUAKTPLRLFSDPQ-QFIPXVFZSA-N C(#N)C=1C=C(C=CC1OC[C@H](CC(C)C)N1C(C2=CC=CC=C2C1=O)=O)C1=CC(=NC=C1)NC(C)=O Chemical compound C(#N)C=1C=C(C=CC1OC[C@H](CC(C)C)N1C(C2=CC=CC=C2C1=O)=O)C1=CC(=NC=C1)NC(C)=O FUAKTPLRLFSDPQ-QFIPXVFZSA-N 0.000 description 1
- YNWFVQOBNCVQOA-JWIMYKKASA-N C(=O)(OC(C)(C)C)C([C@H](OC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)C1=CC=NO1)N)CC(C)C Chemical compound C(=O)(OC(C)(C)C)C([C@H](OC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)C1=CC=NO1)N)CC(C)C YNWFVQOBNCVQOA-JWIMYKKASA-N 0.000 description 1
- NYCAJKDKOQSTGZ-ZZDYIDRTSA-N C(=O)(OC(C)(C)C)C([C@H](OC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)C1CC1)N)(CC(C)C)C Chemical compound C(=O)(OC(C)(C)C)C([C@H](OC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)C1CC1)N)(CC(C)C)C NYCAJKDKOQSTGZ-ZZDYIDRTSA-N 0.000 description 1
- SAOUKJKCCOUAGB-ZZDYIDRTSA-N C(=O)(OC(C)(C)C)C([C@H](OC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)CN(C)C)N)(CC(C)C)C Chemical compound C(=O)(OC(C)(C)C)C([C@H](OC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(OC)=O)CN(C)C)N)(CC(C)C)C SAOUKJKCCOUAGB-ZZDYIDRTSA-N 0.000 description 1
- DKZOWTYGLSSSLQ-BWDMCYIDSA-N C(=O)(OC(C)(C)C)C([C@H](OC=1C=CC(=NC=1C)C1=C(C(=NC=C1)NC(OC)=O)F)N)(CC(C)C)C Chemical compound C(=O)(OC(C)(C)C)C([C@H](OC=1C=CC(=NC=1C)C1=C(C(=NC=C1)NC(OC)=O)F)N)(CC(C)C)C DKZOWTYGLSSSLQ-BWDMCYIDSA-N 0.000 description 1
- BZGKHWDPPDEJHX-QHELBMECSA-N C(=O)(OC(C)(C)C)C([C@H](OC=1C=CC(=NC=1Cl)C1=CC(=NC=C1)NC(OC)=O)N)(CC(C)C)C Chemical compound C(=O)(OC(C)(C)C)C([C@H](OC=1C=CC(=NC=1Cl)C1=CC(=NC=C1)NC(OC)=O)N)(CC(C)C)C BZGKHWDPPDEJHX-QHELBMECSA-N 0.000 description 1
- OVFLVFMXODBADI-UHFFFAOYSA-N C(C(C)C)C1(CN(C1)C(=O)OC(C)(C)C)C(=O)OC Chemical compound C(C(C)C)C1(CN(C1)C(=O)OC(C)(C)C)C(=O)OC OVFLVFMXODBADI-UHFFFAOYSA-N 0.000 description 1
- DKGXQCBKNDGRTI-SFHVURJKSA-N C(C)(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C(=C1)C(F)(F)F)F Chemical compound C(C)(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C(=C1)C(F)(F)F)F DKGXQCBKNDGRTI-SFHVURJKSA-N 0.000 description 1
- PCPVXVIPGUWFCR-SFHVURJKSA-N C(C)(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C(=C1)F)Cl Chemical compound C(C)(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C(=C1)F)Cl PCPVXVIPGUWFCR-SFHVURJKSA-N 0.000 description 1
- DTLAECZYTDRFJT-SFHVURJKSA-N C(C)(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C(=C1)F)F Chemical compound C(C)(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C(=C1)F)F DTLAECZYTDRFJT-SFHVURJKSA-N 0.000 description 1
- VOUWAXDVQTWYIU-IBGZPJMESA-N C(C)(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F Chemical compound C(C)(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F VOUWAXDVQTWYIU-IBGZPJMESA-N 0.000 description 1
- FJRFNTNVLHHCQN-IBGZPJMESA-N C(C)(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)OC(F)(F)F Chemical compound C(C)(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)OC(F)(F)F FJRFNTNVLHHCQN-IBGZPJMESA-N 0.000 description 1
- ONDJBKXJKQEGFY-KRWDZBQOSA-N C(C)(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1F)F Chemical compound C(C)(=O)NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1F)F ONDJBKXJKQEGFY-KRWDZBQOSA-N 0.000 description 1
- URYCFOHMOYRBFO-UHFFFAOYSA-N C(C)N(C(OC=1C(=NC(=CC1OC)I)I)=O)CC Chemical compound C(C)N(C(OC=1C(=NC(=CC1OC)I)I)=O)CC URYCFOHMOYRBFO-UHFFFAOYSA-N 0.000 description 1
- SVDYVBDXCJCKMQ-FTBISJDPSA-N C(N)(O)=O.ClC1=CC=C2C(=CC=NC2=C1)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F Chemical compound C(N)(O)=O.ClC1=CC=C2C(=CC=NC2=C1)C1=CC(=C(OC[C@](CC(C)C)(N)C)C=C1)C(F)(F)F SVDYVBDXCJCKMQ-FTBISJDPSA-N 0.000 description 1
- VAPOJGCOHFONKA-PMERELPUSA-N C1(CC1)C1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=CC=NC2=CC=CC=C12 Chemical compound C1(CC1)C1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=CC=NC2=CC=CC=C12 VAPOJGCOHFONKA-PMERELPUSA-N 0.000 description 1
- STCRBGFALPZXKB-FQEVSTJZSA-N CC(C)C[C@](C)(N)COC1=C(C)C=C(C=C1)C1=CC(C)=NC=C1 Chemical compound CC(C)C[C@](C)(N)COC1=C(C)C=C(C=C1)C1=CC(C)=NC=C1 STCRBGFALPZXKB-FQEVSTJZSA-N 0.000 description 1
- XCEFCAHRWPDBPM-IBGZPJMESA-N CC(C)C[C@](C)(N)COC1=C(C)C=C(C=N1)C1=CC(C)=NC=C1 Chemical compound CC(C)C[C@](C)(N)COC1=C(C)C=C(C=N1)C1=CC(C)=NC=C1 XCEFCAHRWPDBPM-IBGZPJMESA-N 0.000 description 1
- CMXOWFZVGCEAHN-IBGZPJMESA-N CC(C)C[C@](C)(N)COC1=C(C=C(N=C1)B1OC(C)(C)C(C)(C)O1)C(F)F Chemical compound CC(C)C[C@](C)(N)COC1=C(C=C(N=C1)B1OC(C)(C)C(C)(C)O1)C(F)F CMXOWFZVGCEAHN-IBGZPJMESA-N 0.000 description 1
- BGMHWDOSSTVFRW-IBGZPJMESA-N CC(C)C[C@](C)(N)COC1=CC=C(N=C1C(F)F)B1OC(C)(C)C(C)(C)O1 Chemical compound CC(C)C[C@](C)(N)COC1=CC=C(N=C1C(F)F)B1OC(C)(C)C(C)(C)O1 BGMHWDOSSTVFRW-IBGZPJMESA-N 0.000 description 1
- UYCPSVMYMXLCKK-IBGZPJMESA-N CC(C)C[C@](C)(N)COC1=CC=C(N=C1C)B1OC(C)(C)C(C)(C)O1 Chemical compound CC(C)C[C@](C)(N)COC1=CC=C(N=C1C)B1OC(C)(C)C(C)(C)O1 UYCPSVMYMXLCKK-IBGZPJMESA-N 0.000 description 1
- PYJHDXHAQLHRSK-IBGZPJMESA-N CC(C)C[C@](C)(N)COC1=NC=C(C=C1C)B1OC(C)(C)C(C)(C)O1 Chemical compound CC(C)C[C@](C)(N)COC1=NC=C(C=C1C)B1OC(C)(C)C(C)(C)O1 PYJHDXHAQLHRSK-IBGZPJMESA-N 0.000 description 1
- ICTOZMINFMVRCI-DEOSSOPVSA-N CC1=NC=CC(=C1)C1=NC=C(C(=C1)C)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O Chemical compound CC1=NC=CC(=C1)C1=NC=C(C(=C1)C)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O ICTOZMINFMVRCI-DEOSSOPVSA-N 0.000 description 1
- OEOFWZGTXDASRT-FQEVSTJZSA-N COC(=O)NC1=NC=CC(=C1)C1=NC=C(OC[C@@](C)(O)CC(C)C)C(=C1)C(F)F Chemical compound COC(=O)NC1=NC=CC(=C1)C1=NC=C(OC[C@@](C)(O)CC(C)C)C(=C1)C(F)F OEOFWZGTXDASRT-FQEVSTJZSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- RKWGIWYCVPQPMF-UHFFFAOYSA-N Chloropropamide Chemical compound CCCNC(=O)NS(=O)(=O)C1=CC=C(Cl)C=C1 RKWGIWYCVPQPMF-UHFFFAOYSA-N 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- NPEGLUYVPANTJM-UHFFFAOYSA-N ClC1=C(C(=C(OCC(CC(C)C)(C)NC(OCC2=CC=CC=C2)=O)C=C1)C)C Chemical compound ClC1=C(C(=C(OCC(CC(C)C)(C)NC(OCC2=CC=CC=C2)=O)C=C1)C)C NPEGLUYVPANTJM-UHFFFAOYSA-N 0.000 description 1
- SWKIRCKOMQZZFW-GOSISDBHSA-N ClC1=NC=CC(=C1F)C1=NC=C(C(=C1)C(F)F)OC[C@@](CC(C)C)(N)C Chemical compound ClC1=NC=CC(=C1F)C1=NC=C(C(=C1)C(F)F)OC[C@@](CC(C)C)(N)C SWKIRCKOMQZZFW-GOSISDBHSA-N 0.000 description 1
- RKWPQVGIOBPIAE-UHFFFAOYSA-N ClC=1C(=C(C(=NC1)OCC(CC(C)C)(C)NC(OCC1=CC=CC=C1)=O)C)C Chemical compound ClC=1C(=C(C(=NC1)OCC(CC(C)C)(C)NC(OCC1=CC=CC=C1)=O)C)C RKWPQVGIOBPIAE-UHFFFAOYSA-N 0.000 description 1
- MFYSYFVPBJMHGN-ZPOLXVRWSA-N Cortisone Chemical compound O=C1CC[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 MFYSYFVPBJMHGN-ZPOLXVRWSA-N 0.000 description 1
- MFYSYFVPBJMHGN-UHFFFAOYSA-N Cortisone Natural products O=C1CCC2(C)C3C(=O)CC(C)(C(CC4)(O)C(=O)CO)C4C3CCC2=C1 MFYSYFVPBJMHGN-UHFFFAOYSA-N 0.000 description 1
- 229930105110 Cyclosporin A Natural products 0.000 description 1
- PMATZTZNYRCHOR-CGLBZJNRSA-N Cyclosporin A Chemical compound CC[C@@H]1NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)N(C)C(=O)CN(C)C1=O PMATZTZNYRCHOR-CGLBZJNRSA-N 0.000 description 1
- 108010036949 Cyclosporine Proteins 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- VVNCNSJFMMFHPL-VKHMYHEASA-N D-penicillamine Chemical compound CC(C)(S)[C@@H](N)C(O)=O VVNCNSJFMMFHPL-VKHMYHEASA-N 0.000 description 1
- JVHXJTBJCFBINQ-ADAARDCZSA-N Dapagliflozin Chemical compound C1=CC(OCC)=CC=C1CC1=CC([C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)=CC=C1Cl JVHXJTBJCFBINQ-ADAARDCZSA-N 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 208000032131 Diabetic Neuropathies Diseases 0.000 description 1
- BWLUMTFWVZZZND-UHFFFAOYSA-N Dibenzylamine Chemical compound C=1C=CC=CC=1CNCC1=CC=CC=C1 BWLUMTFWVZZZND-UHFFFAOYSA-N 0.000 description 1
- 235000019739 Dicalciumphosphate Nutrition 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- 241000792859 Enema Species 0.000 description 1
- 108010008165 Etanercept Proteins 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- NCIZRXLMOIFXCR-LTCKWSDVSA-N FC(C(=O)O)(F)F.FC(C(=O)O)(F)F.ClC1=C(C=NC(=C1)Cl)OC[C@](CC(C)C)(N)C Chemical compound FC(C(=O)O)(F)F.FC(C(=O)O)(F)F.ClC1=C(C=NC(=C1)Cl)OC[C@](CC(C)C)(N)C NCIZRXLMOIFXCR-LTCKWSDVSA-N 0.000 description 1
- 102000030914 Fatty Acid-Binding Human genes 0.000 description 1
- YCKRFDGAMUMZLT-UHFFFAOYSA-N Fluorine atom Chemical compound [F] YCKRFDGAMUMZLT-UHFFFAOYSA-N 0.000 description 1
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- 241000206672 Gelidium Species 0.000 description 1
- 102000007446 Glucagon-Like Peptide-1 Receptor Human genes 0.000 description 1
- 108010086246 Glucagon-Like Peptide-1 Receptor Proteins 0.000 description 1
- FAEKWTJYAYMJKF-QHCPKHFHSA-N GlucoNorm Chemical compound C1=C(C(O)=O)C(OCC)=CC(CC(=O)N[C@@H](CC(C)C)C=2C(=CC=CC=2)N2CCCCC2)=C1 FAEKWTJYAYMJKF-QHCPKHFHSA-N 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 102000004366 Glucosidases Human genes 0.000 description 1
- 108010056771 Glucosidases Proteins 0.000 description 1
- 102000007390 Glycogen Phosphorylase Human genes 0.000 description 1
- 108010046163 Glycogen Phosphorylase Proteins 0.000 description 1
- 208000031886 HIV Infections Diseases 0.000 description 1
- 208000037357 HIV infectious disease Diseases 0.000 description 1
- 208000007514 Herpes zoster Diseases 0.000 description 1
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 description 1
- 101001059454 Homo sapiens Serine/threonine-protein kinase MARK2 Proteins 0.000 description 1
- LELOWRISYMNNSU-UHFFFAOYSA-N Hydrocyanic acid Natural products N#C LELOWRISYMNNSU-UHFFFAOYSA-N 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- NYXRSMZJEMTFGU-SFHVURJKSA-N IC1=CC(=C(C=N1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)OC Chemical compound IC1=CC(=C(C=N1)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)OC NYXRSMZJEMTFGU-SFHVURJKSA-N 0.000 description 1
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 206010065390 Inflammatory pain Diseases 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 229940122199 Insulin secretagogue Drugs 0.000 description 1
- 229940122355 Insulin sensitizer Drugs 0.000 description 1
- 102000000589 Interleukin-1 Human genes 0.000 description 1
- 108010002352 Interleukin-1 Proteins 0.000 description 1
- 102000051628 Interleukin-1 receptor antagonist Human genes 0.000 description 1
- 108700021006 Interleukin-1 receptor antagonist Proteins 0.000 description 1
- UETNIIAIRMUTSM-UHFFFAOYSA-N Jacareubin Natural products CC1(C)OC2=CC3Oc4c(O)c(O)ccc4C(=O)C3C(=C2C=C1)O UETNIIAIRMUTSM-UHFFFAOYSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- MQHWFIOJQSCFNM-UHFFFAOYSA-L Magnesium salicylate Chemical compound [Mg+2].OC1=CC=CC=C1C([O-])=O.OC1=CC=CC=C1C([O-])=O MQHWFIOJQSCFNM-UHFFFAOYSA-L 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- SBDNJUWAMKYJOX-UHFFFAOYSA-N Meclofenamic Acid Chemical compound CC1=CC=C(Cl)C(NC=2C(=CC=CC=2)C(O)=O)=C1Cl SBDNJUWAMKYJOX-UHFFFAOYSA-N 0.000 description 1
- ZRVUJXDFFKFLMG-UHFFFAOYSA-N Meloxicam Chemical compound OC=1C2=CC=CC=C2S(=O)(=O)N(C)C=1C(=O)NC1=NC=C(C)S1 ZRVUJXDFFKFLMG-UHFFFAOYSA-N 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- IBAQFPQHRJAVAV-ULAWRXDQSA-N Miglitol Chemical compound OCCN1C[C@H](O)[C@@H](O)[C@H](O)[C@H]1CO IBAQFPQHRJAVAV-ULAWRXDQSA-N 0.000 description 1
- 238000006751 Mitsunobu reaction Methods 0.000 description 1
- 229920000715 Mucilage Polymers 0.000 description 1
- RTGDFNSFWBGLEC-UHFFFAOYSA-N Mycophenolate mofetil Chemical compound COC1=C(C)C=2COC(=O)C=2C(O)=C1CC=C(C)CCC(=O)OCCN1CCOCC1 RTGDFNSFWBGLEC-UHFFFAOYSA-N 0.000 description 1
- AYCPARAPKDAOEN-LJQANCHMSA-N N-[(1S)-2-(dimethylamino)-1-phenylethyl]-6,6-dimethyl-3-[(2-methyl-4-thieno[3,2-d]pyrimidinyl)amino]-1,4-dihydropyrrolo[3,4-c]pyrazole-5-carboxamide Chemical compound C1([C@H](NC(=O)N2C(C=3NN=C(NC=4C=5SC=CC=5N=C(C)N=4)C=3C2)(C)C)CN(C)C)=CC=CC=C1 AYCPARAPKDAOEN-LJQANCHMSA-N 0.000 description 1
- ZWMHGEMHVGJJDW-UHFFFAOYSA-N N-[4-(4-hydroxy-3-methoxyphenyl)pyridin-2-yl]acetamide Chemical compound COC=1C=C(C=CC1O)C1=CC(=NC=C1)NC(C)=O ZWMHGEMHVGJJDW-UHFFFAOYSA-N 0.000 description 1
- IFBAXJZYYUHLOW-KRWDZBQOSA-N NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)F Chemical compound NC1=NC=CC(=C1)C1=CC(=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=C1)F IFBAXJZYYUHLOW-KRWDZBQOSA-N 0.000 description 1
- RGCDELVPQMMFJL-DEOSSOPVSA-N NC1=NC=CC(=C1F)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C#N Chemical compound NC1=NC=CC(=C1F)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C#N RGCDELVPQMMFJL-DEOSSOPVSA-N 0.000 description 1
- CSZBWLHHSZSYCN-AWEZNQCLSA-N N[C@](COC1=C(C#N)C=C(C=C1)Br)(CC(C)C)C Chemical compound N[C@](COC1=C(C#N)C=C(C=C1)Br)(CC(C)C)C CSZBWLHHSZSYCN-AWEZNQCLSA-N 0.000 description 1
- 239000007832 Na2SO4 Substances 0.000 description 1
- BLXXJMDCKKHMKV-UHFFFAOYSA-N Nabumetone Chemical compound C1=C(CCC(C)=O)C=CC2=CC(OC)=CC=C21 BLXXJMDCKKHMKV-UHFFFAOYSA-N 0.000 description 1
- CMWTZPSULFXXJA-UHFFFAOYSA-N Naproxen Natural products C1=C(C(C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-UHFFFAOYSA-N 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 1
- AWNJNDPHJHDKRD-NRFANRHFSA-N O1N=CC=C1C1=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=CC(=NC=C1)C Chemical compound O1N=CC=C1C1=C(OC[C@H](CC(C)C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=CC(=NC=C1)C AWNJNDPHJHDKRD-NRFANRHFSA-N 0.000 description 1
- XFHUAPPEUZZARP-NRFANRHFSA-N O=C1N(C(C2=CC=CC=C12)=O)[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)OC)CC(C)C Chemical compound O=C1N(C(C2=CC=CC=C12)=O)[C@H](COC1=C(C=C(C=C1)C1=CC(=NC=C1)NC(C)=O)OC)CC(C)C XFHUAPPEUZZARP-NRFANRHFSA-N 0.000 description 1
- REYJJPSVUYRZGE-UHFFFAOYSA-N Octadecylamine Chemical compound CCCCCCCCCCCCCCCCCCN REYJJPSVUYRZGE-UHFFFAOYSA-N 0.000 description 1
- 102000016979 Other receptors Human genes 0.000 description 1
- BRUQQQPBMZOVGD-XFKAJCMBSA-N Oxycodone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(OC)C2=C5[C@@]13CCN4C BRUQQQPBMZOVGD-XFKAJCMBSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 108010028924 PPAR alpha Proteins 0.000 description 1
- 102000023984 PPAR alpha Human genes 0.000 description 1
- 102000000536 PPAR gamma Human genes 0.000 description 1
- 102100038831 Peroxisome proliferator-activated receptor alpha Human genes 0.000 description 1
- 102100038825 Peroxisome proliferator-activated receptor gamma Human genes 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 108010039918 Polylysine Proteins 0.000 description 1
- 229920001710 Polyorthoester Polymers 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 238000012228 RNA interference-mediated gene silencing Methods 0.000 description 1
- 102100028904 Serine/threonine-protein kinase MARK2 Human genes 0.000 description 1
- 229920001800 Shellac Polymers 0.000 description 1
- BCKXLBQYZLBQEK-KVVVOXFISA-M Sodium oleate Chemical compound [Na+].CCCCCCCC\C=C/CCCCCCCC([O-])=O BCKXLBQYZLBQEK-KVVVOXFISA-M 0.000 description 1
- 229940123518 Sodium/glucose cotransporter 2 inhibitor Drugs 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 229940100389 Sulfonylurea Drugs 0.000 description 1
- 230000006044 T cell activation Effects 0.000 description 1
- QJJXYPPXXYFBGM-LFZNUXCKSA-N Tacrolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1\C=C(/C)[C@@H]1[C@H](C)[C@@H](O)CC(=O)[C@H](CC=C)/C=C(C)/C[C@H](C)C[C@H](OC)[C@H]([C@H](C[C@H]2C)OC)O[C@@]2(O)C(=O)C(=O)N2CCCC[C@H]2C(=O)O1 QJJXYPPXXYFBGM-LFZNUXCKSA-N 0.000 description 1
- 239000004809 Teflon Substances 0.000 description 1
- 229920006362 Teflon® Polymers 0.000 description 1
- 229940123464 Thiazolidinedione Drugs 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- DTQVDTLACAAQTR-UHFFFAOYSA-M Trifluoroacetate Chemical compound [O-]C(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-M 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- LXRZVMYMQHNYJB-UNXOBOICSA-N [(1R,2S,4R)-4-[[5-[4-[(1R)-7-chloro-1,2,3,4-tetrahydroisoquinolin-1-yl]-5-methylthiophene-2-carbonyl]pyrimidin-4-yl]amino]-2-hydroxycyclopentyl]methyl sulfamate Chemical compound CC1=C(C=C(S1)C(=O)C1=C(N[C@H]2C[C@H](O)[C@@H](COS(N)(=O)=O)C2)N=CN=C1)[C@@H]1NCCC2=C1C=C(Cl)C=C2 LXRZVMYMQHNYJB-UNXOBOICSA-N 0.000 description 1
- 101150118144 aak-1 gene Proteins 0.000 description 1
- 229960003697 abatacept Drugs 0.000 description 1
- 239000002250 absorbent Substances 0.000 description 1
- 230000002745 absorbent Effects 0.000 description 1
- 229940124532 absorption promoter Drugs 0.000 description 1
- 229960002632 acarbose Drugs 0.000 description 1
- XUFXOAAUWZOOIT-UHFFFAOYSA-N acarviostatin I01 Natural products OC1C(O)C(NC2C(C(O)C(O)C(CO)=C2)O)C(C)OC1OC(C(C1O)O)C(CO)OC1OC1C(CO)OC(O)C(O)C1O XUFXOAAUWZOOIT-UHFFFAOYSA-N 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 229960004420 aceclofenac Drugs 0.000 description 1
- 229960004892 acemetacin Drugs 0.000 description 1
- FSQKKOOTNAMONP-UHFFFAOYSA-N acemetacin Chemical compound CC1=C(CC(=O)OCC(O)=O)C2=CC(OC)=CC=C2N1C(=O)C1=CC=C(Cl)C=C1 FSQKKOOTNAMONP-UHFFFAOYSA-N 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 229960001138 acetylsalicylic acid Drugs 0.000 description 1
- 229960002964 adalimumab Drugs 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- WNLRTRBMVRJNCN-UHFFFAOYSA-L adipate(2-) Chemical compound [O-]C(=O)CCCCC([O-])=O WNLRTRBMVRJNCN-UHFFFAOYSA-L 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 229960002478 aldosterone Drugs 0.000 description 1
- 230000029936 alkylation Effects 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- AWUCVROLDVIAJX-UHFFFAOYSA-N alpha-glycerophosphate Natural products OCC(O)COP(O)(O)=O AWUCVROLDVIAJX-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 229960003896 aminopterin Drugs 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 229920000469 amphiphilic block copolymer Polymers 0.000 description 1
- 229960004238 anakinra Drugs 0.000 description 1
- 229940121363 anti-inflammatory agent Drugs 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 229940124599 anti-inflammatory drug Drugs 0.000 description 1
- 239000000883 anti-obesity agent Substances 0.000 description 1
- 239000002220 antihypertensive agent Substances 0.000 description 1
- 229940030600 antihypertensive agent Drugs 0.000 description 1
- 229940111133 antiinflammatory and antirheumatic drug oxicams Drugs 0.000 description 1
- 229940125710 antiobesity agent Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 239000002830 appetite depressant Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 239000008122 artificial sweetener Substances 0.000 description 1
- 235000021311 artificial sweeteners Nutrition 0.000 description 1
- 229940009098 aspartate Drugs 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 229960001671 azapropazone Drugs 0.000 description 1
- WOIIIUDZSOLAIW-NSHDSACASA-N azapropazone Chemical compound C1=C(C)C=C2N3C(=O)[C@H](CC=C)C(=O)N3C(N(C)C)=NC2=C1 WOIIIUDZSOLAIW-NSHDSACASA-N 0.000 description 1
- 229960002170 azathioprine Drugs 0.000 description 1
- LMEKQMALGUDUQG-UHFFFAOYSA-N azathioprine Chemical compound CN1C=NC([N+]([O-])=O)=C1SC1=NC=NC2=C1NC=N2 LMEKQMALGUDUQG-UHFFFAOYSA-N 0.000 description 1
- 239000000022 bacteriostatic agent Substances 0.000 description 1
- 229940092705 beclomethasone Drugs 0.000 description 1
- NBMKJKDGKREAPL-DVTGEIKXSA-N beclomethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(Cl)[C@@H]1[C@@H]1C[C@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O NBMKJKDGKREAPL-DVTGEIKXSA-N 0.000 description 1
- 230000003542 behavioural effect Effects 0.000 description 1
- FEJKLNWAOXSSNR-UHFFFAOYSA-N benorilate Chemical compound C1=CC(NC(=O)C)=CC=C1OC(=O)C1=CC=CC=C1OC(C)=O FEJKLNWAOXSSNR-UHFFFAOYSA-N 0.000 description 1
- 229960004277 benorilate Drugs 0.000 description 1
- JUHORIMYRDESRB-UHFFFAOYSA-N benzathine Chemical compound C=1C=CC=CC=1CNCCNCC1=CC=CC=C1 JUHORIMYRDESRB-UHFFFAOYSA-N 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- 229940050390 benzoate Drugs 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- HSDAJNMJOMSNEV-UHFFFAOYSA-N benzyl chloroformate Chemical compound ClC(=O)OCC1=CC=CC=C1 HSDAJNMJOMSNEV-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- XMIIGOLPHOKFCH-UHFFFAOYSA-N beta-phenylpropanoic acid Natural products OC(=O)CCC1=CC=CC=C1 XMIIGOLPHOKFCH-UHFFFAOYSA-N 0.000 description 1
- 229960002537 betamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-DVTGEIKXSA-N betamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-DVTGEIKXSA-N 0.000 description 1
- 150000004283 biguanides Chemical class 0.000 description 1
- 229920002988 biodegradable polymer Polymers 0.000 description 1
- 239000004621 biodegradable polymer Substances 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 239000012455 biphasic mixture Substances 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 1
- 125000005620 boronic acid group Chemical class 0.000 description 1
- 229960003655 bromfenac Drugs 0.000 description 1
- ZBPLOVFIXSTCRZ-UHFFFAOYSA-N bromfenac Chemical compound NC1=C(CC(O)=O)C=CC=C1C(=O)C1=CC=C(Br)C=C1 ZBPLOVFIXSTCRZ-UHFFFAOYSA-N 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 244000309464 bull Species 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- MIOPJNTWMNEORI-UHFFFAOYSA-N camphorsulfonic acid Chemical compound C1CC2(CS(O)(=O)=O)C(=O)CC1C2(C)C MIOPJNTWMNEORI-UHFFFAOYSA-N 0.000 description 1
- 229960001713 canagliflozin Drugs 0.000 description 1
- VHOFTEAWFCUTOS-TUGBYPPCSA-N canagliflozin hydrate Chemical compound O.CC1=CC=C([C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)C=C1CC(S1)=CC=C1C1=CC=C(F)C=C1.CC1=CC=C([C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)C=C1CC(S1)=CC=C1C1=CC=C(F)C=C1 VHOFTEAWFCUTOS-TUGBYPPCSA-N 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 235000017663 capsaicin Nutrition 0.000 description 1
- 229960002504 capsaicin Drugs 0.000 description 1
- FFGPTBGBLSHEPO-UHFFFAOYSA-N carbamazepine Chemical compound C1=CC2=CC=CC=C2N(C(=O)N)C2=CC=CC=C21 FFGPTBGBLSHEPO-UHFFFAOYSA-N 0.000 description 1
- 229960000623 carbamazepine Drugs 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 229940105329 carboxymethylcellulose Drugs 0.000 description 1
- 229960003184 carprofen Drugs 0.000 description 1
- IVUMCTKHWDRRMH-UHFFFAOYSA-N carprofen Chemical compound C1=CC(Cl)=C[C]2C3=CC=C(C(C(O)=O)C)C=C3N=C21 IVUMCTKHWDRRMH-UHFFFAOYSA-N 0.000 description 1
- 239000012876 carrier material Substances 0.000 description 1
- 229960000590 celecoxib Drugs 0.000 description 1
- RZEKVGVHFLEQIL-UHFFFAOYSA-N celecoxib Chemical compound C1=CC(C)=CC=C1C1=CC(C(F)(F)F)=NN1C1=CC=C(S(N)(=O)=O)C=C1 RZEKVGVHFLEQIL-UHFFFAOYSA-N 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 229940107810 cellcept Drugs 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 229960003115 certolizumab pegol Drugs 0.000 description 1
- DGLFSNZWRYADFC-UHFFFAOYSA-N chembl2334586 Chemical compound C1CCC2=CN=C(N)N=C2C2=C1NC1=CC=C(C#CC(C)(O)C)C=C12 DGLFSNZWRYADFC-UHFFFAOYSA-N 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- 229940061627 chloromethyl methyl ether Drugs 0.000 description 1
- WRJWRGBVPUUDLA-UHFFFAOYSA-N chlorosulfonyl isocyanate Chemical compound ClS(=O)(=O)N=C=O WRJWRGBVPUUDLA-UHFFFAOYSA-N 0.000 description 1
- 229960001761 chlorpropamide Drugs 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 229960001265 ciclosporin Drugs 0.000 description 1
- 229940001468 citrate Drugs 0.000 description 1
- 229960004126 codeine Drugs 0.000 description 1
- 230000007278 cognition impairment Effects 0.000 description 1
- 239000008119 colloidal silica Substances 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 229960004544 cortisone Drugs 0.000 description 1
- 229940111134 coxibs Drugs 0.000 description 1
- 229920006037 cross link polymer Polymers 0.000 description 1
- 239000012045 crude solution Substances 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 125000004093 cyano group Chemical group *C#N 0.000 description 1
- 239000003255 cyclooxygenase 2 inhibitor Substances 0.000 description 1
- KFGVRWGDTLZAAO-UHFFFAOYSA-N cyclopenta-1,3-diene dicyclohexyl(cyclopenta-1,3-dien-1-yl)phosphane iron(2+) Chemical compound [Fe++].c1cc[cH-]c1.C1CCC(CC1)P(C1CCCCC1)c1ccc[cH-]1 KFGVRWGDTLZAAO-UHFFFAOYSA-N 0.000 description 1
- 229960003834 dapagliflozin Drugs 0.000 description 1
- ZESRJSPZRDMNHY-UHFFFAOYSA-N de-oxy corticosterone Natural products O=C1CCC2(C)C3CCC(C)(C(CC4)C(=O)CO)C4C3CCC2=C1 ZESRJSPZRDMNHY-UHFFFAOYSA-N 0.000 description 1
- 229940119740 deoxycorticosterone Drugs 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- NEFBYIFKOOEVPA-UHFFFAOYSA-K dicalcium phosphate Chemical compound [Ca+2].[Ca+2].[O-]P([O-])([O-])=O NEFBYIFKOOEVPA-UHFFFAOYSA-K 0.000 description 1
- 229940038472 dicalcium phosphate Drugs 0.000 description 1
- 229910000390 dicalcium phosphate Inorganic materials 0.000 description 1
- 229960001259 diclofenac Drugs 0.000 description 1
- DCOPUUMXTXDBNB-UHFFFAOYSA-N diclofenac Chemical compound OC(=O)CC1=CC=CC=C1NC1=C(Cl)C=CC=C1Cl DCOPUUMXTXDBNB-UHFFFAOYSA-N 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 1
- 229960000616 diflunisal Drugs 0.000 description 1
- HUPFGZXOMWLGNK-UHFFFAOYSA-N diflunisal Chemical compound C1=C(O)C(C(=O)O)=CC(C=2C(=CC(F)=CC=2)F)=C1 HUPFGZXOMWLGNK-UHFFFAOYSA-N 0.000 description 1
- 229940120889 dipyrone Drugs 0.000 description 1
- 230000008034 disappearance Effects 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000000221 dopamine uptake inhibitor Substances 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 229960002866 duloxetine Drugs 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 230000002121 endocytic effect Effects 0.000 description 1
- 230000012202 endocytosis Effects 0.000 description 1
- 239000007920 enema Substances 0.000 description 1
- 229940079360 enema for constipation Drugs 0.000 description 1
- 210000002615 epidermis Anatomy 0.000 description 1
- 229960000403 etanercept Drugs 0.000 description 1
- 229960005293 etodolac Drugs 0.000 description 1
- XFBVBWWRPKNWHW-UHFFFAOYSA-N etodolac Chemical compound C1COC(CC)(CC(O)=O)C2=N[C]3C(CC)=CC=CC3=C21 XFBVBWWRPKNWHW-UHFFFAOYSA-N 0.000 description 1
- 229960004945 etoricoxib Drugs 0.000 description 1
- MNJVRJDLRVPLFE-UHFFFAOYSA-N etoricoxib Chemical compound C1=NC(C)=CC=C1C1=NC=C(Cl)C=C1C1=CC=C(S(C)(=O)=O)C=C1 MNJVRJDLRVPLFE-UHFFFAOYSA-N 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 238000013265 extended release Methods 0.000 description 1
- 108091022862 fatty acid binding Proteins 0.000 description 1
- ZPAKPRAICRBAOD-UHFFFAOYSA-N fenbufen Chemical compound C1=CC(C(=O)CCC(=O)O)=CC=C1C1=CC=CC=C1 ZPAKPRAICRBAOD-UHFFFAOYSA-N 0.000 description 1
- 229960001395 fenbufen Drugs 0.000 description 1
- 229960001419 fenoprofen Drugs 0.000 description 1
- 239000012065 filter cake Substances 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 239000010419 fine particle Substances 0.000 description 1
- 239000005454 flavour additive Substances 0.000 description 1
- 229960002011 fludrocortisone Drugs 0.000 description 1
- AAXVEMMRQDVLJB-BULBTXNYSA-N fludrocortisone Chemical compound O=C1CC[C@]2(C)[C@@]3(F)[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 AAXVEMMRQDVLJB-BULBTXNYSA-N 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 229960002390 flurbiprofen Drugs 0.000 description 1
- SYTBZMRGLBWNTM-UHFFFAOYSA-N flurbiprofen Chemical compound FC1=CC(C(C(O)=O)C)=CC=C1C1=CC=CC=C1 SYTBZMRGLBWNTM-UHFFFAOYSA-N 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 229960002870 gabapentin Drugs 0.000 description 1
- 229960000346 gliclazide Drugs 0.000 description 1
- 229960004346 glimepiride Drugs 0.000 description 1
- WIGIZIANZCJQQY-RUCARUNLSA-N glimepiride Chemical compound O=C1C(CC)=C(C)CN1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)N[C@@H]2CC[C@@H](C)CC2)C=C1 WIGIZIANZCJQQY-RUCARUNLSA-N 0.000 description 1
- 229960001381 glipizide Drugs 0.000 description 1
- ZJJXGWJIGJFDTL-UHFFFAOYSA-N glipizide Chemical compound C1=NC(C)=CN=C1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)NC2CCCCC2)C=C1 ZJJXGWJIGJFDTL-UHFFFAOYSA-N 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229940112611 glucovance Drugs 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- 150000002343 gold Chemical class 0.000 description 1
- 238000005469 granulation Methods 0.000 description 1
- 230000003179 granulation Effects 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- MNWFXJYAOYHMED-UHFFFAOYSA-N heptanoic acid Chemical compound CCCCCCC(O)=O MNWFXJYAOYHMED-UHFFFAOYSA-N 0.000 description 1
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 1
- 208000033519 human immunodeficiency virus infectious disease Diseases 0.000 description 1
- OROGSEYTTFOCAN-UHFFFAOYSA-N hydrocodone Natural products C1C(N(CCC234)C)C2C=CC(O)C3OC2=C4C1=CC=C2OC OROGSEYTTFOCAN-UHFFFAOYSA-N 0.000 description 1
- 229960000890 hydrocortisone Drugs 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical compound OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 1
- XXSMGPRMXLTPCZ-UHFFFAOYSA-N hydroxychloroquine Chemical compound ClC1=CC=C2C(NC(C)CCCN(CCO)CC)=CC=NC2=C1 XXSMGPRMXLTPCZ-UHFFFAOYSA-N 0.000 description 1
- 229960004171 hydroxychloroquine Drugs 0.000 description 1
- 230000000055 hyoplipidemic effect Effects 0.000 description 1
- 229960001680 ibuprofen Drugs 0.000 description 1
- 239000005457 ice water Substances 0.000 description 1
- 230000001861 immunosuppressant effect Effects 0.000 description 1
- 229960000905 indomethacin Drugs 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 229960000598 infliximab Drugs 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 239000002348 inosinate dehydrogenase inhibitor Substances 0.000 description 1
- 239000004026 insulin derivative Substances 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007919 intrasynovial administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- DKYWVDODHFEZIM-UHFFFAOYSA-N ketoprofen Chemical compound OC(=O)C(C)C1=CC=CC(C(=O)C=2C=CC=CC=2)=C1 DKYWVDODHFEZIM-UHFFFAOYSA-N 0.000 description 1
- 229960000991 ketoprofen Drugs 0.000 description 1
- 229960004752 ketorolac Drugs 0.000 description 1
- OZWKMVRBQXNZKK-UHFFFAOYSA-N ketorolac Chemical compound OC(=O)C1CCN2C1=CC=C2C(=O)C1=CC=CC=C1 OZWKMVRBQXNZKK-UHFFFAOYSA-N 0.000 description 1
- VHOGYURTWQBHIL-UHFFFAOYSA-N leflunomide Chemical compound O1N=CC(C(=O)NC=2C=CC(=CC=2)C(F)(F)F)=C1C VHOGYURTWQBHIL-UHFFFAOYSA-N 0.000 description 1
- 229960000681 leflunomide Drugs 0.000 description 1
- 229960004194 lidocaine Drugs 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 239000012280 lithium aluminium hydride Substances 0.000 description 1
- DLEDOFVPSDKWEF-UHFFFAOYSA-N lithium butane Chemical compound [Li+].CCC[CH2-] DLEDOFVPSDKWEF-UHFFFAOYSA-N 0.000 description 1
- OXROWJKCGCOJDO-JLHYYAGUSA-N lornoxicam Chemical compound O=C1C=2SC(Cl)=CC=2S(=O)(=O)N(C)\C1=C(\O)NC1=CC=CC=N1 OXROWJKCGCOJDO-JLHYYAGUSA-N 0.000 description 1
- 229960002202 lornoxicam Drugs 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 229960002373 loxoprofen Drugs 0.000 description 1
- BAZQYVYVKYOAGO-UHFFFAOYSA-M loxoprofen sodium hydrate Chemical compound O.O.[Na+].C1=CC(C(C([O-])=O)C)=CC=C1CC1C(=O)CCC1 BAZQYVYVKYOAGO-UHFFFAOYSA-M 0.000 description 1
- 229960000994 lumiracoxib Drugs 0.000 description 1
- KHPKQFYUPIUARC-UHFFFAOYSA-N lumiracoxib Chemical compound OC(=O)CC1=CC(C)=CC=C1NC1=C(F)C=CC=C1Cl KHPKQFYUPIUARC-UHFFFAOYSA-N 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229940072082 magnesium salicylate Drugs 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000001819 mass spectrum Methods 0.000 description 1
- 238000010907 mechanical stirring Methods 0.000 description 1
- 229960003803 meclofenamic acid Drugs 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 229960003464 mefenamic acid Drugs 0.000 description 1
- 229950004994 meglitinide Drugs 0.000 description 1
- 229960001929 meloxicam Drugs 0.000 description 1
- 239000001525 mentha piperita l. herb oil Substances 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- LVWZTYCIRDMTEY-UHFFFAOYSA-N metamizole Chemical compound O=C1C(N(CS(O)(=O)=O)C)=C(C)N(C)N1C1=CC=CC=C1 LVWZTYCIRDMTEY-UHFFFAOYSA-N 0.000 description 1
- XZWYZXLIPXDOLR-UHFFFAOYSA-N metformin Chemical compound CN(C)C(=N)NC(N)=N XZWYZXLIPXDOLR-UHFFFAOYSA-N 0.000 description 1
- 229960003105 metformin Drugs 0.000 description 1
- VMHZKNURFHSUDO-OQLLNIDSSA-N methyl (2e)-3,3,3-trifluoro-2-(4-methylphenyl)sulfonyliminopropanoate Chemical compound COC(=O)C(\C(F)(F)F)=N/S(=O)(=O)C1=CC=C(C)C=C1 VMHZKNURFHSUDO-OQLLNIDSSA-N 0.000 description 1
- VMHZKNURFHSUDO-DHDCSXOGSA-N methyl (2z)-3,3,3-trifluoro-2-(4-methylphenyl)sulfonyliminopropanoate Chemical compound COC(=O)C(\C(F)(F)F)=N\S(=O)(=O)C1=CC=C(C)C=C1 VMHZKNURFHSUDO-DHDCSXOGSA-N 0.000 description 1
- XGLLQDIWQRQROJ-UHFFFAOYSA-N methyl 3,3,3-trifluoro-2-oxopropanoate Chemical compound COC(=O)C(=O)C(F)(F)F XGLLQDIWQRQROJ-UHFFFAOYSA-N 0.000 description 1
- PMWJYAHNDINWIY-UHFFFAOYSA-N methyl 4-chloro-2-methylpyridine-3-carboxylate Chemical compound COC(=O)C1=C(C)N=CC=C1Cl PMWJYAHNDINWIY-UHFFFAOYSA-N 0.000 description 1
- BKJCDXVGWBWKCL-UHFFFAOYSA-N methyl 4-methyl-2-[(4-methylphenyl)sulfonylamino]-2-(trifluoromethyl)pentanoate Chemical compound CC(CC(C(=O)OC)(C(F)(F)F)NS(=O)(=O)C1=CC=C(C=C1)C)C BKJCDXVGWBWKCL-UHFFFAOYSA-N 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- XMJHPCRAQCTCFT-UHFFFAOYSA-N methyl chloroformate Chemical compound COC(Cl)=O XMJHPCRAQCTCFT-UHFFFAOYSA-N 0.000 description 1
- KZEFCECVTCHENL-UHFFFAOYSA-N methyl n-(4-chloropyridin-2-yl)carbamate Chemical compound COC(=O)NC1=CC(Cl)=CC=N1 KZEFCECVTCHENL-UHFFFAOYSA-N 0.000 description 1
- ZPELTWPNGKKNPZ-UHFFFAOYSA-N methyl n-[4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pyridin-2-yl]carbamate Chemical compound C1=NC(NC(=O)OC)=CC(B2OC(C)(C)C(C)(C)O2)=C1 ZPELTWPNGKKNPZ-UHFFFAOYSA-N 0.000 description 1
- 229960001047 methyl salicylate Drugs 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 229960004584 methylprednisolone Drugs 0.000 description 1
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 1
- 229960001110 miglitol Drugs 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- DYKFCLLONBREIL-KVUCHLLUSA-N minocycline Chemical compound C([C@H]1C2)C3=C(N(C)C)C=CC(O)=C3C(=O)C1=C(O)[C@@]1(O)[C@@H]2[C@H](N(C)C)C(O)=C(C(N)=O)C1=O DYKFCLLONBREIL-KVUCHLLUSA-N 0.000 description 1
- 229960004023 minocycline Drugs 0.000 description 1
- 229960005181 morphine Drugs 0.000 description 1
- 230000000877 morphologic effect Effects 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- RTGDFNSFWBGLEC-SYZQJQIISA-N mycophenolate mofetil Chemical compound COC1=C(C)C=2COC(=O)C=2C(O)=C1C\C=C(/C)CCC(=O)OCCN1CCOCC1 RTGDFNSFWBGLEC-SYZQJQIISA-N 0.000 description 1
- 229960004866 mycophenolate mofetil Drugs 0.000 description 1
- 229960000951 mycophenolic acid Drugs 0.000 description 1
- 229940083410 myfortic Drugs 0.000 description 1
- UQEIFYRRSNJVDO-UHFFFAOYSA-N n,n-dibenzyl-2-phenylethanamine Chemical compound C=1C=CC=CC=1CN(CC=1C=CC=CC=1)CCC1=CC=CC=C1 UQEIFYRRSNJVDO-UHFFFAOYSA-N 0.000 description 1
- PSHKMPUSSFXUIA-UHFFFAOYSA-N n,n-dimethylpyridin-2-amine Chemical compound CN(C)C1=CC=CC=N1 PSHKMPUSSFXUIA-UHFFFAOYSA-N 0.000 description 1
- JOHWCLWPKKPZRF-UHFFFAOYSA-N n-(6-chloropyrimidin-4-yl)acetamide Chemical compound CC(=O)NC1=CC(Cl)=NC=N1 JOHWCLWPKKPZRF-UHFFFAOYSA-N 0.000 description 1
- 229960004270 nabumetone Drugs 0.000 description 1
- PSZYNBSKGUBXEH-UHFFFAOYSA-M naphthalene-1-sulfonate Chemical compound C1=CC=C2C(S(=O)(=O)[O-])=CC=CC2=C1 PSZYNBSKGUBXEH-UHFFFAOYSA-M 0.000 description 1
- KVBGVZZKJNLNJU-UHFFFAOYSA-M naphthalene-2-sulfonate Chemical compound C1=CC=CC2=CC(S(=O)(=O)[O-])=CC=C21 KVBGVZZKJNLNJU-UHFFFAOYSA-M 0.000 description 1
- 229960002009 naproxen Drugs 0.000 description 1
- CMWTZPSULFXXJA-VIFPVBQESA-N naproxen Chemical compound C1=C([C@H](C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-VIFPVBQESA-N 0.000 description 1
- 239000007923 nasal drop Substances 0.000 description 1
- 229940100662 nasal drops Drugs 0.000 description 1
- 229940097496 nasal spray Drugs 0.000 description 1
- 239000007922 nasal spray Substances 0.000 description 1
- 235000021096 natural sweeteners Nutrition 0.000 description 1
- 230000014511 neuron projection development Effects 0.000 description 1
- 230000002981 neuropathic effect Effects 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 229960000965 nimesulide Drugs 0.000 description 1
- HYWYRSMBCFDLJT-UHFFFAOYSA-N nimesulide Chemical compound CS(=O)(=O)NC1=CC=C([N+]([O-])=O)C=C1OC1=CC=CC=C1 HYWYRSMBCFDLJT-UHFFFAOYSA-N 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- 239000002767 noradrenalin uptake inhibitor Substances 0.000 description 1
- 229960002748 norepinephrine Drugs 0.000 description 1
- SFLSHLFXELFNJZ-UHFFFAOYSA-N norepinephrine Natural products NCC(O)C1=CC=C(O)C(O)=C1 SFLSHLFXELFNJZ-UHFFFAOYSA-N 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- XYEOALKITRFCJJ-UHFFFAOYSA-N o-benzylhydroxylamine Chemical compound NOCC1=CC=CC=C1 XYEOALKITRFCJJ-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 229940127240 opiate Drugs 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 229940046781 other immunosuppressants in atc Drugs 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- OFPXSFXSNFPTHF-UHFFFAOYSA-N oxaprozin Chemical compound O1C(CCC(=O)O)=NC(C=2C=CC=CC=2)=C1C1=CC=CC=C1 OFPXSFXSNFPTHF-UHFFFAOYSA-N 0.000 description 1
- 229960002739 oxaprozin Drugs 0.000 description 1
- 229940105606 oxycontin Drugs 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 229960000649 oxyphenbutazone Drugs 0.000 description 1
- HFHZKZSRXITVMK-UHFFFAOYSA-N oxyphenbutazone Chemical compound O=C1C(CCCC)C(=O)N(C=2C=CC=CC=2)N1C1=CC=C(O)C=C1 HFHZKZSRXITVMK-UHFFFAOYSA-N 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 229960004662 parecoxib Drugs 0.000 description 1
- TZRHLKRLEZJVIJ-UHFFFAOYSA-N parecoxib Chemical compound C1=CC(S(=O)(=O)NC(=O)CC)=CC=C1C1=C(C)ON=C1C1=CC=CC=C1 TZRHLKRLEZJVIJ-UHFFFAOYSA-N 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000011236 particulate material Substances 0.000 description 1
- 229960001639 penicillamine Drugs 0.000 description 1
- 235000019477 peppermint oil Nutrition 0.000 description 1
- 108091008725 peroxisome proliferator-activated receptors alpha Proteins 0.000 description 1
- JRKICGRDRMAZLK-UHFFFAOYSA-L peroxydisulfate Chemical compound [O-]S(=O)(=O)OOS([O-])(=O)=O JRKICGRDRMAZLK-UHFFFAOYSA-L 0.000 description 1
- 239000008177 pharmaceutical agent Substances 0.000 description 1
- 230000003285 pharmacodynamic effect Effects 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- ICFJFFQQTFMIBG-UHFFFAOYSA-N phenformin Chemical compound NC(=N)NC(=N)NCCC1=CC=CC=C1 ICFJFFQQTFMIBG-UHFFFAOYSA-N 0.000 description 1
- 229960003243 phenformin Drugs 0.000 description 1
- 229960002895 phenylbutazone Drugs 0.000 description 1
- VYMDGNCVAMGZFE-UHFFFAOYSA-N phenylbutazonum Chemical compound O=C1C(CCCC)C(=O)N(C=2C=CC=CC=2)N1C1=CC=CC=C1 VYMDGNCVAMGZFE-UHFFFAOYSA-N 0.000 description 1
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- WTJKGGKOPKCXLL-RRHRGVEJSA-N phosphatidylcholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCC=CCCCCCCCC WTJKGGKOPKCXLL-RRHRGVEJSA-N 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- LGRFSURHDFAFJT-UHFFFAOYSA-N phthalic anhydride Chemical compound C1=CC=C2C(=O)OC(=O)C2=C1 LGRFSURHDFAFJT-UHFFFAOYSA-N 0.000 description 1
- 229940075930 picrate Drugs 0.000 description 1
- OXNIZHLAWKMVMX-UHFFFAOYSA-M picrate anion Chemical compound [O-]C1=C([N+]([O-])=O)C=C([N+]([O-])=O)C=C1[N+]([O-])=O OXNIZHLAWKMVMX-UHFFFAOYSA-M 0.000 description 1
- 229960005095 pioglitazone Drugs 0.000 description 1
- 229960002702 piroxicam Drugs 0.000 description 1
- QYSPLQLAKJAUJT-UHFFFAOYSA-N piroxicam Chemical compound OC=1C2=CC=CC=C2S(=O)(=O)N(C)C=1C(=O)NC1=CC=CC=N1 QYSPLQLAKJAUJT-UHFFFAOYSA-N 0.000 description 1
- 229950010765 pivalate Drugs 0.000 description 1
- IUGYQRQAERSCNH-UHFFFAOYSA-N pivalic acid Chemical compound CC(C)(C)C(O)=O IUGYQRQAERSCNH-UHFFFAOYSA-N 0.000 description 1
- 101150062613 pkn1 gene Proteins 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 229920001610 polycaprolactone Polymers 0.000 description 1
- 229920002721 polycyanoacrylate Polymers 0.000 description 1
- 239000004626 polylactic acid Substances 0.000 description 1
- 229920000656 polylysine Polymers 0.000 description 1
- 229920006324 polyoxymethylene Polymers 0.000 description 1
- LZMJNVRJMFMYQS-UHFFFAOYSA-N poseltinib Chemical compound C1CN(C)CCN1C(C=C1)=CC=C1NC1=NC(OC=2C=C(NC(=O)C=C)C=CC=2)=C(OC=C2)C2=N1 LZMJNVRJMFMYQS-UHFFFAOYSA-N 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000012041 precatalyst Substances 0.000 description 1
- 229960005205 prednisolone Drugs 0.000 description 1
- OIGNJSKKLXVSLS-VWUMJDOOSA-N prednisolone Chemical compound O=C1C=C[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 OIGNJSKKLXVSLS-VWUMJDOOSA-N 0.000 description 1
- 229960004618 prednisone Drugs 0.000 description 1
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 1
- AYXYPKUFHZROOJ-ZETCQYMHSA-N pregabalin Chemical compound CC(C)C[C@H](CN)CC(O)=O AYXYPKUFHZROOJ-ZETCQYMHSA-N 0.000 description 1
- 229960001233 pregabalin Drugs 0.000 description 1
- 238000012746 preparative thin layer chromatography Methods 0.000 description 1
- GCYXWQUSHADNBF-AAEALURTSA-N preproglucagon 78-108 Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(N)=O)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC=1N=CNC=1)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=CC=C1 GCYXWQUSHADNBF-AAEALURTSA-N 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 238000003825 pressing Methods 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- VVWRJUBEIPHGQF-UHFFFAOYSA-N propan-2-yl n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)N=NC(=O)OC(C)C VVWRJUBEIPHGQF-UHFFFAOYSA-N 0.000 description 1
- 239000011253 protective coating Substances 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 150000003218 pyrazolidines Chemical class 0.000 description 1
- QLULGIRFKAWHOJ-UHFFFAOYSA-N pyridin-4-ylboronic acid Chemical compound OB(O)C1=CC=NC=C1 QLULGIRFKAWHOJ-UHFFFAOYSA-N 0.000 description 1
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 239000000018 receptor agonist Substances 0.000 description 1
- 229940044601 receptor agonist Drugs 0.000 description 1
- 230000010837 receptor-mediated endocytosis Effects 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 238000004064 recycling Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 229960002354 repaglinide Drugs 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 229960004641 rituximab Drugs 0.000 description 1
- 229960000371 rofecoxib Drugs 0.000 description 1
- RZJQGNCSTQAWON-UHFFFAOYSA-N rofecoxib Chemical compound C1=CC(S(=O)(=O)C)=CC=C1C1=C(C=2C=CC=CC=2)C(=O)OC1 RZJQGNCSTQAWON-UHFFFAOYSA-N 0.000 description 1
- 229960004586 rosiglitazone Drugs 0.000 description 1
- 235000019204 saccharin Nutrition 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 229940081974 saccharin Drugs 0.000 description 1
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 1
- 150000003902 salicylic acid esters Chemical class 0.000 description 1
- 229960000953 salsalate Drugs 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- XIIOFHFUYBLOLW-UHFFFAOYSA-N selpercatinib Chemical compound OC(COC=1C=C(C=2N(C=1)N=CC=2C#N)C=1C=NC(=CC=1)N1CC2N(C(C1)C2)CC=1C=NC(=CC=1)OC)(C)C XIIOFHFUYBLOLW-UHFFFAOYSA-N 0.000 description 1
- 229940076279 serotonin Drugs 0.000 description 1
- 239000004208 shellac Substances 0.000 description 1
- 229940113147 shellac Drugs 0.000 description 1
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 1
- 235000013874 shellac Nutrition 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- XGVXKJKTISMIOW-ZDUSSCGKSA-N simurosertib Chemical compound N1N=CC(C=2SC=3C(=O)NC(=NC=3C=2)[C@H]2N3CCC(CC3)C2)=C1C XGVXKJKTISMIOW-ZDUSSCGKSA-N 0.000 description 1
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 1
- 229960002930 sirolimus Drugs 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- AWUCVROLDVIAJX-GSVOUGTGSA-N sn-glycerol 3-phosphate Chemical compound OC[C@@H](O)COP(O)(O)=O AWUCVROLDVIAJX-GSVOUGTGSA-N 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000015424 sodium Nutrition 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- 235000010265 sodium sulphite Nutrition 0.000 description 1
- 239000012321 sodium triacetoxyborohydride Substances 0.000 description 1
- YEXRRCHQJDSEJI-UHFFFAOYSA-M sodium;3-fluoro-2-oxopropanoate Chemical compound [Na+].[O-]C(=O)C(=O)CF YEXRRCHQJDSEJI-UHFFFAOYSA-M 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 229940086735 succinate Drugs 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 239000001384 succinic acid Substances 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 229960001940 sulfasalazine Drugs 0.000 description 1
- NCEXYHBECQHGNR-QZQOTICOSA-N sulfasalazine Chemical compound C1=C(O)C(C(=O)O)=CC(\N=N\C=2C=CC(=CC=2)S(=O)(=O)NC=2N=CC=CC=2)=C1 NCEXYHBECQHGNR-QZQOTICOSA-N 0.000 description 1
- NCEXYHBECQHGNR-UHFFFAOYSA-N sulfasalazine Natural products C1=C(O)C(C(=O)O)=CC(N=NC=2C=CC(=CC=2)S(=O)(=O)NC=2N=CC=CC=2)=C1 NCEXYHBECQHGNR-UHFFFAOYSA-N 0.000 description 1
- 229960000894 sulindac Drugs 0.000 description 1
- MLKXDPUZXIRXEP-MFOYZWKCSA-N sulindac Chemical compound CC1=C(CC(O)=O)C2=CC(F)=CC=C2\C1=C/C1=CC=C(S(C)=O)C=C1 MLKXDPUZXIRXEP-MFOYZWKCSA-N 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 229960004492 suprofen Drugs 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 210000002504 synaptic vesicle Anatomy 0.000 description 1
- 210000003568 synaptosome Anatomy 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 229960002871 tenoxicam Drugs 0.000 description 1
- WZWYJBNHTWCXIM-UHFFFAOYSA-N tenoxicam Chemical compound O=C1C=2SC=CC=2S(=O)(=O)N(C)C1=C(O)NC1=CC=CC=N1 WZWYJBNHTWCXIM-UHFFFAOYSA-N 0.000 description 1
- VFWMQRKYZWKUMN-KRWDZBQOSA-N tert-butyl N-[(2S)-1-(2-chloro-6-iodopyridin-3-yl)oxy-2,4-dimethylpentan-2-yl]carbamate Chemical compound ClC1=NC(=CC=C1OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)I VFWMQRKYZWKUMN-KRWDZBQOSA-N 0.000 description 1
- DUWJKKXZPGRQDP-SANMLTNESA-N tert-butyl N-[(2S)-1-(2-chloro-6-quinolin-4-ylpyridin-3-yl)oxy-2,4-dimethylpentan-2-yl]carbamate Chemical compound ClC1=NC(=CC=C1OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C1=CC=NC2=CC=CC=C12 DUWJKKXZPGRQDP-SANMLTNESA-N 0.000 description 1
- QOHVQGNLTUPCIY-QHCPKHFHSA-N tert-butyl N-[(2S)-1-[2-chloro-6-(2-methylpyridin-4-yl)pyridin-3-yl]oxy-2,4-dimethylpentan-2-yl]carbamate Chemical compound ClC1=C(C=CC(=N1)C1=CC(=NC=C1)C)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O QOHVQGNLTUPCIY-QHCPKHFHSA-N 0.000 description 1
- CTTAAWDFPDOLEF-MHZLTWQESA-N tert-butyl N-[(2S)-1-[2-cyano-4-(1,5-naphthyridin-4-yl)phenoxy]-2,4-dimethylpentan-2-yl]carbamate Chemical compound C(#N)C1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=CC=NC2=CC=CN=C12 CTTAAWDFPDOLEF-MHZLTWQESA-N 0.000 description 1
- CEKPGYRICOJBMG-MHZLTWQESA-N tert-butyl N-[(2S)-1-[2-cyano-4-(1,6-naphthyridin-4-yl)phenoxy]-2,4-dimethylpentan-2-yl]carbamate Chemical compound C(#N)C1=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=CC(=C1)C1=CC=NC2=CC=NC=C12 CEKPGYRICOJBMG-MHZLTWQESA-N 0.000 description 1
- NNKOQEVXZYEUAT-SANMLTNESA-N tert-butyl N-[(2S)-1-[3-cyano-5-(1,6-naphthyridin-4-yl)pyridin-2-yl]oxy-2,4-dimethylpentan-2-yl]carbamate Chemical compound C(#N)C=1C(=NC=C(C1)C1=CC=NC2=CC=NC=C12)OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O NNKOQEVXZYEUAT-SANMLTNESA-N 0.000 description 1
- MBJIIUWBCFYXQX-DEOSSOPVSA-N tert-butyl N-[(2S)-1-[3-cyano-5-[2-(difluoromethyl)pyridin-4-yl]pyridin-2-yl]oxy-2,4-dimethylpentan-2-yl]carbamate Chemical compound C(#N)C=1C=C(C=NC1OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C1=CC(=NC=C1)C(F)F MBJIIUWBCFYXQX-DEOSSOPVSA-N 0.000 description 1
- ZTFCIXOXJLPDCI-SANMLTNESA-N tert-butyl N-[(2S)-2,4-dimethyl-1-[4-(1,6-naphthyridin-4-yl)-2-(trifluoromethyl)phenoxy]pentan-2-yl]carbamate Chemical compound N1=CC=C(C2=CN=CC=C12)C1=CC(=C(OC[C@@](CC(C)C)(C)NC(OC(C)(C)C)=O)C=C1)C(F)(F)F ZTFCIXOXJLPDCI-SANMLTNESA-N 0.000 description 1
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 150000003512 tertiary amines Chemical class 0.000 description 1
- CBXCPBUEXACCNR-UHFFFAOYSA-N tetraethylammonium Chemical compound CC[N+](CC)(CC)CC CBXCPBUEXACCNR-UHFFFAOYSA-N 0.000 description 1
- QEMXHQIAXOOASZ-UHFFFAOYSA-N tetramethylammonium Chemical compound C[N+](C)(C)C QEMXHQIAXOOASZ-UHFFFAOYSA-N 0.000 description 1
- 150000001467 thiazolidinediones Chemical class 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 229960001312 tiaprofenic acid Drugs 0.000 description 1
- 229960001017 tolmetin Drugs 0.000 description 1
- UPSPUYADGBWSHF-UHFFFAOYSA-N tolmetin Chemical compound C1=CC(C)=CC=C1C(=O)C1=CC=C(CC(O)=O)N1C UPSPUYADGBWSHF-UHFFFAOYSA-N 0.000 description 1
- LMYRWZFENFIFIT-UHFFFAOYSA-N toluene-4-sulfonamide Chemical compound CC1=CC=C(S(N)(=O)=O)C=C1 LMYRWZFENFIFIT-UHFFFAOYSA-N 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-M toluene-4-sulfonate Chemical compound CC1=CC=C(S([O-])(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-M 0.000 description 1
- 230000001256 tonic effect Effects 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- 229960005294 triamcinolone Drugs 0.000 description 1
- GFNANZIMVAIWHM-OBYCQNJPSA-N triamcinolone Chemical compound O=C1C=C[C@]2(C)[C@@]3(F)[C@@H](O)C[C@](C)([C@@]([C@H](O)C4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 GFNANZIMVAIWHM-OBYCQNJPSA-N 0.000 description 1
- IMFACGCPASFAPR-UHFFFAOYSA-N tributylamine Chemical compound CCCCN(CCCC)CCCC IMFACGCPASFAPR-UHFFFAOYSA-N 0.000 description 1
- 229940066528 trichloroacetate Drugs 0.000 description 1
- YNJBWRMUSHSURL-UHFFFAOYSA-N trichloroacetic acid Chemical compound OC(=O)C(Cl)(Cl)Cl YNJBWRMUSHSURL-UHFFFAOYSA-N 0.000 description 1
- PQDJYEQOELDLCP-UHFFFAOYSA-N trimethylsilane Chemical compound C[SiH](C)C PQDJYEQOELDLCP-UHFFFAOYSA-N 0.000 description 1
- NHDIQVFFNDKAQU-UHFFFAOYSA-N tripropan-2-yl borate Chemical compound CC(C)OB(OC(C)C)OC(C)C NHDIQVFFNDKAQU-UHFFFAOYSA-N 0.000 description 1
- FQCQGOZEWWPOKI-UHFFFAOYSA-K trisalicylate-choline Chemical compound [Mg+2].C[N+](C)(C)CCO.OC1=CC=CC=C1C([O-])=O.OC1=CC=CC=C1C([O-])=O.OC1=CC=CC=C1C([O-])=O FQCQGOZEWWPOKI-UHFFFAOYSA-K 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- GXPHKUHSUJUWKP-UHFFFAOYSA-N troglitazone Chemical compound C1CC=2C(C)=C(O)C(C)=C(C)C=2OC1(C)COC(C=C1)=CC=C1CC1SC(=O)NC1=O GXPHKUHSUJUWKP-UHFFFAOYSA-N 0.000 description 1
- 229960001641 troglitazone Drugs 0.000 description 1
- GXPHKUHSUJUWKP-NTKDMRAZSA-N troglitazone Natural products C([C@@]1(OC=2C(C)=C(C(=C(C)C=2CC1)O)C)C)OC(C=C1)=CC=C1C[C@H]1SC(=O)NC1=O GXPHKUHSUJUWKP-NTKDMRAZSA-N 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- ZDPHROOEEOARMN-UHFFFAOYSA-N undecanoic acid Chemical compound CCCCCCCCCCC(O)=O ZDPHROOEEOARMN-UHFFFAOYSA-N 0.000 description 1
- 229960002004 valdecoxib Drugs 0.000 description 1
- LNPDTQAFDNKSHK-UHFFFAOYSA-N valdecoxib Chemical compound CC=1ON=C(C=2C=CC=CC=2)C=1C1=CC=C(S(N)(=O)=O)C=C1 LNPDTQAFDNKSHK-UHFFFAOYSA-N 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- 239000000230 xanthan gum Substances 0.000 description 1
- 235000010493 xanthan gum Nutrition 0.000 description 1
- 229920001285 xanthan gum Polymers 0.000 description 1
- 229940082509 xanthan gum Drugs 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- GTLDTDOJJJZVBW-UHFFFAOYSA-N zinc cyanide Chemical compound [Zn+2].N#[C-].N#[C-] GTLDTDOJJJZVBW-UHFFFAOYSA-N 0.000 description 1
- 229930195724 β-lactose Natural products 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/165—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide
- A61K31/167—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide having the nitrogen of a carboxamide group directly attached to the aromatic ring, e.g. lidocaine, paracetamol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/26—Radicals substituted by halogen atoms or nitro radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/28—Radicals substituted by singly-bound oxygen or sulphur atoms
- C07D213/30—Oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/54—Radicals substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/57—Nitriles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/61—Halogen atoms or nitro radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/62—Oxygen or sulfur atoms
- C07D213/63—One oxygen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/62—Oxygen or sulfur atoms
- C07D213/63—One oxygen atom
- C07D213/64—One oxygen atom attached in position 2 or 6
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/62—Oxygen or sulfur atoms
- C07D213/63—One oxygen atom
- C07D213/65—One oxygen atom attached in position 3 or 5
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/72—Nitrogen atoms
- C07D213/73—Unsubstituted amino or imino radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/72—Nitrogen atoms
- C07D213/75—Amino or imino radicals, acylated by carboxylic or carbonic acids, or by sulfur or nitrogen analogues thereof, e.g. carbamates
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/78—Carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/84—Nitriles
- C07D213/85—Nitriles in position 3
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/12—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D215/14—Radicals substituted by oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/18—Halogen atoms or nitro radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/48—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D237/00—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings
- C07D237/02—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings not condensed with other rings
- C07D237/06—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members
- C07D237/10—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D237/20—Nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/26—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/30—Halogen atoms or nitro radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/32—One oxygen, sulfur or nitrogen atom
- C07D239/34—One oxygen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/32—One oxygen, sulfur or nitrogen atom
- C07D239/34—One oxygen atom
- C07D239/36—One oxygen atom as doubly bound oxygen atom or as unsubstituted hydroxy radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/32—One oxygen, sulfur or nitrogen atom
- C07D239/42—One nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D309/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings
- C07D309/16—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member
- C07D309/20—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with hydrogen atoms and substituted hydrocarbon radicals directly attached to ring carbon atoms
- C07D309/22—Radicals substituted by oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/10—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Psychiatry (AREA)
- Hospice & Palliative Care (AREA)
- Psychology (AREA)
- Epidemiology (AREA)
- Pain & Pain Management (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Pyrane Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Pyridine Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Enzymes And Modification Thereof (AREA)
- Quinoline Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Description
본 출원은 2015년 10월 1일 출원된 인도 가출원 일련 3170/DEL/15을 우선권 주장하며, 이는 그 전문이 본원에 참조로 포함된다.
본 개시내용은 일반적으로 어댑터 연관 키나제 1 (AAK1)을 억제할 수 있는 화합물, 이러한 화합물을 포함하는 조성물, 및 AAK1을 억제하는 방법에 관한 것이다.
어댑터 연관 키나제 1 (AAK1)은 세린/트레오닌 키나제의 Ark1/Prk1 패밀리의 구성원이다. AAK1 mRNA는 단형 및 장형으로 명명되는 2종의 스플라이스 형태로 존재한다. 장형은 뇌 및 심장에서 우세하고 고도로 발현된다 (Henderson and Conner, Mol. Biol. Cell. 2007, 18, 2698-2706). AAK1은 시냅토솜 제제 중에 풍부하고, 배양된 세포에서 세포내이입 구조와 공동-국재화된다. AAK1은 시냅스 소포 재순환 및 수용체-매개 세포내이입에서 중요한 과정인 클라트린 코팅된 세포내이입을 조정한다. AAK1은 수용체 화물을 클라트린 코트에 연결하는 이종-사량체인 AP2 복합체와 회합한다. AAK1에 대한 클라트린의 결합은 AAK1 키나제 활성을 자극한다 (Conner et al., Traffic 2003, 4, 885-890; Jackson et al., J. Cell. Biol. 2003, 163, 231-236). AAK1은 AP-2의 mu-2 서브유닛을 인산화하며, 이는 화물 수용체 상의 티로신 함유 분류 모티프에 대한 mu-2의 결합을 촉진한다 (Ricotta et al., J. Cell Bio. 2002, 156, 791-795; Conner and Schmid, J. Cell Bio. 2002, 156, 921-929). Mu2 인산화가 수용체 흡수에 요구되지는 않지만, 인산화는 내재화의 효율을 증진시킨다 (Motely et al., Mol. Biol. Cell. 2006, 17, 5298-5308).
AAK1은 PC12 세포에서 뉴레귤린(Neuregulin)-1/ErbB4 신호전달의 억제제로서 확인된 바 있다. RNA 간섭 매개 유전자 침묵을 통한 AAK1 발현의 손실, 또는 키나제 억제제 K252a (이는 AAK1 키나제 활성을 억제함)로의 처리는 뉴레귤린-1 유발 신경돌기 생장의 강화를 일으킨다. 이들 처리는 형질 막 내 또는 근처에서 ErbB4의 증가된 발현 및 ErbB4의 축적을 일으킨다 (Kuai et al., Chemistry and Biology 2011, 18, 891-906). NRG1 및 ErbB4는 추정 정신분열증 감수성 유전자이다 (Buonanno, Brain Res. Bull. 2010, 83, 122-131). 상기 유전자 둘 다에서의 SNP는 다중 정신분열증 내적표현형과 연관되어 있다 (Greenwood et al., Am. J. Psychiatry 2011, 168, 930-946). 뉴레귤린 1 및 ErbB4 KO 마우스 모델은 정신분열증 관련 형태학적 변화 및 행동 표현형을 제시한 바 있다 (Jaaro-Peled et al., Schizophrenia Bulletin 2010, 36, 301-313; Wen et al., Proc. Natl. Acad. Sci. USA. 2010, 107, 1211-1216). 또한, AAK1 유전자의 인트론에서의 단일 뉴클레오티드 다형성은 파킨슨병의 발병 연령과 연관되어 있다 (Latourelle et al., BMC Med. Genet. 2009, 10, 98). 이들 결과는 AAK1 활성의 억제가 정신분열증, 정신분열증에서의 인지 결핍, 파킨슨병, 신경병증성 통증, 양극성 장애, 및 알츠하이머병의 치료에서 유용성을 가질 수 있음을 시사한다.
제1 측면에서, 본 개시내용은 하기 화학식 (I)의 화합물, 또는 그의 제약상 허용되는 염을 제공하며,
여기서:
A는 하기로부터 선택되며:
B는 하기로부터 선택되며:
여기서 "*"는 R5에 대한 부착 지점을 나타내고, "**"는 고리 A에 대한 부착 지점을 나타내고;
R1은 수소, 아미노, -CO2H, 디플루오로메틸, 에틸, 할로, 히드록시메틸, 메톡시, 메틸, -NHC(O)CH3, -NHCO2CH3, 트리플루오로메톡시, 및 트리플루오로메틸로부터 선택되고;
R2는 수소, 시아노, -CH2OH, 할로 및 메틸로부터 선택되고;
R3은 수소, 시아노, 시클로프로필, 디플루오로메틸, 할로, 히드록시메틸, 메톡시, 메틸, 메틸술포닐, 트리플루오로메톡시, 트리플루오로메틸, -CH2N(CH3)2, 및 질소, 산소, 및 황으로부터 선택된 1, 2, 또는 3개의 헤테로원자를 함유하는 5-원 방향족 고리로부터 선택되고;
R4는 수소, 할로, 및 메틸로부터 선택되고;
R5는 하기로부터 선택되고:
R6은 수소, 에틸, 플루오로메틸, 디플루오로메틸, 메틸 및 트리플루오로메틸로부터 선택되고;
R7은 메틸이다.
제1 측면의 제1 실시양태에서, 본 개시내용은 A가 하기로부터 선택된 것인 화학식 (I)의 화합물, 또는 그의 제약상 허용되는 염을 제공한다.
제1 측면의 제2 실시양태에서, 본 개시내용은 B가 하기로부터 선택된 것인 화학식 (I)의 화합물, 또는 그의 제약상 허용되는 염을 제공한다.
제3 실시양태에서, B는 이다.
제1 측면의 제4 실시양태에서 본 개시내용은 R5가 하기인 화학식 (I)의 화합물, 또는 그의 제약상 허용되는 염을 제공한다.
제2 측면에서, 본 개시내용은 화학식 (II)의 화합물, 또는 그의 제약상 허용되는 염을 제공하며,
여기서:
A는 하기로부터 선택되고:
B는 페닐 및 피리디닐로부터 선택되고;
R1은 수소, 디플루오로메틸, 할로, 메톡시, 메틸, -NHC(O)CH3, -NHCO2CH3, 및 트리플루오로메틸로부터 선택되고;
R2는 수소, -CH2OH, 및 할로로부터 선택되고;
R3은 수소, 시아노, 시클로프로필, 디플루오로메틸, 할로, 히드록시메틸, 메톡시, 메틸, 트리플루오로메톡시, 트리플루오로메틸, 및 질소, 산소, 및 황으로부터 선택된 1, 2, 또는 3개의 헤테로원자를 함유하는 5-원 방향족 고리로부터 선택되고;
R4는 수소, 할로, 및 메틸로부터 선택되고;
R5는 수소, 에틸, 플루오로메틸, 디플루오로메틸, 메틸, 및 트리플루오로메틸로부터 선택된다.
제2 측면의 제1 실시양태에서, 본 개시내용은 A가 하기로부터 선택된 것인 화학식 (II)의 화합물, 또는 그의 제약상 허용되는 염을 제공한다.
제2 측면의 제2 실시양태에서, 본 개시내용은 B가 피리디닐인 화학식 (II)의 화합물, 또는 그의 제약상 허용되는 염을 제공한다. 제3 실시양태에서, B는
제2 측면의 제4 실시양태에서 본 개시내용은 화학식 (II)의 화합물, 또는 그의 제약상 허용되는 염을 제공하며, 여기서
A는 하기로부터 선택되고;
제3 측면에서, 본 개시내용은 제약상 허용되는 양의 화학식 (I)의 화합물, 또는 그의 제약상 허용되는 염, 및 제약상 허용되는 담체를 포함하는 조성물을 제공한다.
제4 측면에서, 본 개시내용은 어댑터 연관 키나제 1 (AAK1)을 화학식 (I)의 화합물, 또는 그의 제약상 허용되는 염과 접촉시키는 것을 포함하는, AAK1 활성을 억제하는 방법을 제공한다.
제5 측면에서, 본 개시내용은 치료 유효량의 화학식 (I)의 화합물, 또는 그의 제약상 허용되는 염을 AAK1 활성에 의해 매개되는 질환 또는 장애의 치료 또는 관리를 필요로 하는 환자에게 투여하는 것을 포함하는, AAK1 활성에 의해 매개되는 질환 또는 장애를 치료 또는 관리하는 방법을 제공한다. 제5 측면의 제1 실시양태에서, 질환 또는 장애는 알츠하이머병, 양극성 장애, 통증, 파킨슨병, 및 정신분열증으로부터 선택된다. 제2 실시양태에서, 통증은 신경병증성 통증이다. 제3 실시양태에서, 신경병증성 통증은 섬유근육통 또는 말초 신경병증이다.
본 개시내용의 다른 측면은 본원에 개시된 실시양태의 적합한 조합을 포함할 수 있다.
또 다른 측면 및 실시양태는 본원에 제공된 기재에서 찾을 수 있다.
개시내용의 측면은 도 1에 예시되어 있으며, 이는 AAK1 동형접합 (-/-) 녹아웃 마우스 및 그의 야생형 (+/+) 한배새끼를 사용하는 포르말린 통증 모델로부터 수득된 결과를 제시한다. AAK1 동형접합 (-/-) 녹아웃 마우스는 그의 야생형 (+/+) 한배새끼와 비교하여 급성 및 긴장성 통증 반응 둘 다에서 명백한 감소를 제시한다.
본 개시내용은 부분적으로 AAK1 녹아웃 마우스가 통증에 대해 높은 내성을 나타낸다는 발견에 기초한다. 그러한 발견은 궁극적으로 AAK1 억제제, 그를 포함하는 조성물, 및 그의 사용 방법의 발견으로 이어지는 연구를 촉발하였다.
본원에서 본 개시내용의 기재는 화학 결합의 법칙 및 원칙과 일치하도록 해석되어야 한다. 일부 경우에, 임의의 주어진 위치에서 치환기를 수용하기 위해 수소 원자를 제거하는 것이 필요할 수 있다.
본 개시내용에 의해 포괄된 화합물은 제약 작용제로서 사용하기에 적합하게 안정한 것들인 것으로 이해되어야 한다.
본 명세서에 사용된 하기 용어는 나타낸 의미를 갖는다:
본 명세서에 인용된 모든 특허, 특허 출원 및 참고 문헌은 그 전문이 본원에 참조로 포함된다. 불일치되는 경우에, 정의를 포함하여 본 개시내용이 우선할 것이다.
본원에 사용된 단수 형태는 문맥이 달리 명백하게 지시하지 않는 한, 복수 지시대상을 포함한다.
일부 경우에, 임의의 특정한 기 내의 탄소 원자의 수는 기의 언급 앞에 나타낸다. 예를 들어, 용어 "C1-6 알킬"은 1 내지 6개의 탄소 원자를 함유하는 알킬 기를 나타낸다. 이들 표기가 있는 경우, 이는 본원에 함유된 모든 다른 정의에 우선한다.
본원에 사용된 용어 "할로"는 Br, Cl, F 및/또는 I를 지칭한다.
비대칭 중심이 본 개시내용의 화합물에 존재할 수 있다. 개시내용은 AAK1을 억제하는 능력을 갖는 모든 입체화학적 이성질체 형태, 또는 그의 혼합물을 포괄하는 것으로 이해되어야 한다. 화합물의 개별 입체이성질체는 키랄 중심을 함유하는 상업적으로 입수가능한 출발 물질로부터 합성적으로 제조될 수 있거나, 또는 거울상이성질체 생성물의 혼합물의 제조에 이은 분리 예컨대 부분입체이성질체의 혼합물로의 전환에 이은 분리 또는 재결정화, 크로마토그래피 기술에 의해, 또는 키랄 크로마토그래피 칼럼 상에서의 거울상이성질체의 직접 분리에 의해 제조될 수 있다. 특정한 입체화학의 출발 화합물은 상업적으로 입수가능하거나 또는 관련 기술분야에 공지된 기술에 의해 제조 및 분해될 수 있다.
본 개시내용의 특정 화합물은 또한, 분리가능할 수 있는 상이한 안정한 입체형태적 형태로 존재할 수 있다. 예를 들어 입체 장애 또는 고리 변형으로 인한 비대칭 단일 결합 주변의 제한된 회전으로 인한 비틀림 비대칭은 상이한 이형태체의 분리를 허용할 수 있다. 본 개시내용은 이들 화합물의 각각의 형태 이성질체 및 그의 혼합물을 포함한다.
용어 "본 개시내용의 화합물" 및 등가의 표현은 화학식 (I)의 화합물, 및 그의 제약상 허용되는 거울상이성질체, 부분입체이성질체 및 염을 포함하도록 의도된다. 유사하게, 중간체에 대한 언급은 문맥상 허용되는 경우에 그의 염을 포괄하도록 의도된다.
본 개시내용은 본 화합물에서 발생하는 원자의 모든 동위원소를 포함하는 것으로 의도된다. 동위원소는 원자 번호는 동일하지만, 질량수는 상이한 원자들을 포함한다. 일반적 예로서 및 비제한적으로, 수소의 동위원소는 중수소 및 삼중수소를 포함한다. 탄소의 동위원소는 13C 및 14C를 포함한다. 동위원소-표지된 개시내용의 화합물은 일반적으로 관련 기술분야의 통상의 기술자에게 공지된 통상적인 기술에 의해 또는 본원에 기재된 것들과 유사한 과정에 의해, 달리 사용되는 비-표지된 시약 대신 적절한 동위원소-표지된 시약을 사용하여 제조될 수 있다. 이러한 화합물은, 예를 들어 생물학적 활성을 결정하는데 있어서 표준물 및 시약으로서의, 다양한 잠재적 용도를 가질 수 있다. 안정한 동위원소의 경우에, 이러한 화합물은 생물학적, 약리학적, 또는 약동학적 특성을 유리하게 변형시키는 잠재력을 가질 수 있다.
본 개시내용의 화합물은 제약상 허용되는 염으로 존재할 수 있다. 본원에 사용된 용어 "제약상 허용되는 염"은 타당한 의학적 판단의 범주 내에서, 합리적인 이익/위험 비에 부합하며 과도한 독성, 자극, 알레르기 반응, 또는 다른 문제 또는 합병증 없이 환자의 조직과 접촉시켜 사용하기에 적합하고, 그의 의도된 용도에 대해 효과적인, 수용성 또는 유용성 또는 수분산성 또는 유분산성인 본 개시내용의 화합물의 염 또는 쯔비터이온 형태를 나타낸다. 염은 화합물의 최종 단리 및 정제 동안 또는 개별적으로 적합한 질소 원자를 적합한 산과 반응시킴으로써 제조될 수 있다. 대표적인 산 부가염은 아세테이트, 아디페이트, 알기네이트, 시트레이트, 아스파르테이트, 벤조에이트, 벤젠술포네이트, 비술페이트, 부티레이트, 캄포레이트, 캄포르술포네이트; 디글루코네이트, 디히드로브로마이드, 디히드로클로라이드, 디히드로아이오다이드, 글리세로포스페이트, 헤미술페이트, 헵타노에이트, 헥사노에이트, 포르메이트, 푸마레이트, 히드로클로라이드, 히드로브로마이드, 히드로아이오다이드, 2-히드록시에탄술포네이트, 락테이트, 말레에이트, 메시틸렌술포네이트, 메탄술포네이트, 나프탈렌술포네이트, 니코티네이트, 2-나프탈렌술포네이트, 옥살레이트, 팔모에이트, 펙티네이트, 퍼술페이트, 3-페닐프로프리오네이트, 피크레이트, 피발레이트, 프로피오네이트, 숙시네이트, 타르트레이트, 트리클로로아세테이트, 트리플루오로아세테이트, 포스페이트, 글루타메이트, 비카르보네이트, 파라-톨루엔술포네이트, 및 운데카노에이트를 포함한다. 제약상 허용되는 부가염을 형성하는데 사용될 수 있는 산의 예는 무기 산 예컨대 염산, 브로민화수소산, 황산 및 인산, 및 유기 산 예컨대 옥살산, 말레산, 숙신산 및 시트르산을 포함한다.
염기성 부가염은 화합물의 최종 단리 및 정제 동안 카르복시 기를 적합한 염기 예컨대 금속 양이온의 수산화물, 탄산염, 또는 중탄산염과 또는 암모니아 또는 유기 1급, 2급, 또는 3급 아민과 반응시킴으로써 제조될 수 있다. 제약상 허용되는 염의 양이온은 리튬, 나트륨, 칼륨, 칼슘, 마그네슘, 및 알루미늄, 뿐만 아니라 비독성 4급 아민 양이온 예컨대 암모늄, 테트라메틸암모늄, 테트라에틸암모늄, 메틸아민, 디메틸아민, 트리메틸아민, 트리에틸아민, 디에틸아민, 에틸아민, 트리부틸아민, 피리딘, N,N-디메틸아닐린, N-메틸피페리딘, N-메틸모르폴린, 디시클로헥실아민, 프로카인, 디벤질아민, N,N-디벤질페네틸아민, 및 N,N'-디벤질에틸렌디아민을 포함한다. 염기 부가염의 형성에 유용한 다른 대표적인 유기 아민은 에틸렌디아민, 에탄올아민, 디에탄올아민, 피페리딘, 및 피페라진을 포함한다.
본 개시내용의 한 실시양태는 어댑터 연관 키나제 1 (AAK1)을 화학식 (I)의 화합물, 또는 그의 제약상 허용되는 염과 접촉시키는 것을 포함하는, 시험관내 및 생체내 둘 다에서 AAK1을 억제하는 방법을 포괄한다.
요법에서 사용하기 위해 치료 유효량의 화학식 (I)의 화합물, 뿐만 아니라 그의 제약상 허용되는 염이 미가공 화학물질로서 투여될 수 있는 것이 가능한 경우에, 활성 성분을 제약 조성물로서 제공하는 것이 가능하다. 따라서, 개시내용은 치료 유효량의 화학식 (I)의 화합물, 또는 그의 제약상 허용되는 염, 및 1종 이상의 제약상 허용되는 담체, 희석제, 또는 부형제를 포함하는 제약 조성물을 추가로 제공한다.
달리 나타내지 않는 한, 화합물의 "치료 유효량"은 질환 또는 상태의 치료 또는 관리에 있어서 치료 이점을 제공하거나 또는 질환 또는 상태와 연관된 하나 이상의 증상을 지연 또는 최소화시키기에 충분한 양이다. 용어 "치료 유효량"은, 전반적인 요법을 개선하거나, 질환 또는 상태의 증상 또는 원인을 감소시키거나 방지하거나, 또는 또 다른 치료제의 치료 효능을 증진시키는 양을 포괄할 수 있다.
본원에 사용된 용어 "치료 유효량"은 질환 또는 상태의 치료 또는 관리에서 치료 이익을 제공하거나, 또는 질환 또는 상태와 연관된 1종 이상의 증상을 지연 또는 최소화시키기에 충분한 화합물 또는 화합물들의 양을 지칭한다. 화합물의 "치료 유효량"은 질환 또는 상태의 치료 또는 관리에 있어서 치료 이점을 제공하는, 단독의 또는 다른 요법과 조합된 치료제의 양을 의미한다. 용어 "치료 유효량"은, 전반적인 요법을 개선하거나, 질환 또는 상태의 증상 또는 원인을 감소시키거나 방지하거나, 또는 또 다른 치료제의 치료 효능을 증진시키는 양을 포괄할 수 있다. 단독으로 투여되는 개별 활성 성분에 적용되는 경우에, 상기 용어는 그 성분 단독을 지칭한다. 조합물에 적용되는 경우에, 조합으로, 연속적으로, 또는 동시에 투여되는 것에 관계없이, 상기 용어는 치료 효과를 발생시키는 활성 성분의 합한 양을 지칭한다. 화학식 (I)의 화합물 및 그의 제약상 허용되는 염은 상기 기재된 바와 같다. 담체(들), 희석제(들), 또는 부형제(들)는 제제의 다른 성분과 상용성이고 그의 수용자에게 유해하지 않다는 관점에서 허용되어야 한다. 본 개시내용의 또 다른 측면에 따라, 화학식 (I)의 화합물, 또는 그의 제약상 허용되는 염을 1종 이상의 제약상 허용되는 담체, 희석제, 또는 부형제와 혼합하는 것을 포함하는, 제약 제제의 제조 방법이 또한 제공된다. 본원에 사용된 용어 "제약상 허용되는"은 타당한 의학적 판단의 범주 내에서, 합리적 이익/위험 비에 부합하며 과도한 독성, 자극, 알레르기 반응, 또는 다른 문제 또는 합병증 없이 환자의 조직과 접촉시켜 사용하기에 적합하고, 그의 의도된 용도에 대해 효과적인 화합물, 물질, 조성물, 및/또는 투여 형태를 지칭한다.
제약 제제는 단위 용량당 미리 결정된 양의 활성 성분을 함유하는 단위 투여 형태로 제공될 수 있다. 1일에 킬로그램 체중당 약 0.01 내지 약 250 mg ("mg/kg"), 바람직하게는 1일에 약 0.05 내지 약 100 mg/kg 체중의 본 개시내용의 화합물의 투여량 수준이 질환의 예방 및 치료를 위한 단독요법에 전형적이다. 전형적으로, 본 개시내용의 제약 조성물은 1일에 약 1 내지 약 5회, 또는 대안적으로 연속 주입으로서 투여될 것이다. 이러한 투여는 만성 또는 급성 요법으로 사용될 수 있다. 단일 투여 형태를 생성하기 위해 담체 물질과 조합될 수 있는 활성 성분의 양은 치료될 상태, 상태의 중증도, 투여 시간, 투여 경로, 사용되는 화합물의 배출 속도, 치료 지속기간, 및 환자의 연령, 성별, 체중, 및 상태에 따라 달라질 것이다. 바람직한 단위 투여 제제는 상기 본원에 언급된 바와 같은 1일 용량 또는 하위-용량, 또는 그의 적절한 분획의 활성 성분을 함유하는 것이다. 치료는 실질적으로 화합물의 최적 용량 미만의 적은 투여량으로 개시될 수 있다. 그 후, 투여량은 상황 하에 최적 효과에 이를 때까지 적은 증분만큼 증가된다. 일반적으로, 화합물은 가장 바람직하게는 일반적으로 어떠한 해롭거나 유해한 부작용도 유발하지 않으면서 효과적인 결과를 제공할 것인 농도 수준으로 투여된다.
본 개시내용의 조성물이 본 개시내용의 화합물 및 1종 이상의 추가의 치료제 또는 예방제의 조합물을 포함하는 경우에, 화합물 및 추가의 작용제 둘 다는 통상적으로 단독치료 요법으로 정상적으로 투여되는 투여량의 약 10 내지 150%, 보다 바람직하게는 약 10 내지 80%의 투여량 수준으로 존재한다.
개시내용의 화합물은 1종 이상의 추가의 치료제 또는 예방제와 조합으로 투여될 수 있다. 예를 들어, 통증의 치료에 사용되는 경우에, 가능한 추가의 작용제는 면역억제제, 항염증제, 및/또는 통증의 치료에 사용되는 다른 작용제를 포함한다.
본 개시내용의 방법 및 조성물에 사용하기에 적합한 면역억제제는 관련 기술분야에 공지된 것들을 포함한다. 예는 아미노프테린, 아자티오프린, 시클로스포린 A, D-페니실라민, 금 염, 히드록시클로로퀸, 레플루노미드, 메토트렉세이트, 미노시클린, 라파마이신, 술파살라진, 타크롤리무스 (FK506), 및 그의 제약상 허용되는 염을 포함한다. 특정한 면역억제제는 메토트렉세이트이다.
면역억제제의 추가의 예는 항-TNF 항체, 예컨대 아달리무맙, 세르톨리주맙 페골, 에타네르셉트, 및 인플릭시맙을 포함한다. 다른 것은 인터류킨-1 차단제, 예컨대 아나킨라를 포함한다. 다른 것은 항-B 세포 (CD20) 항체, 예컨대 리툭시맙을 포함한다. 다른 것은 T 세포 활성화 차단제, 예컨대 아바타셉트를 포함한다.
다른 면역억제제는 이노신 모노포스페이트 데히드로게나제 억제제, 예컨대 미코페놀레이트 모페틸 (셀셉트(CellCept)®) 및 미코페놀산 (마이포르틱(Myfortic)®)을 포함한다.
본 개시내용의 방법 및 조성물에 사용하기에 적합한 항염증 약물은 관련 기술분야에 공지된 것들을 포함한다. 예는 글루코코르티코이드 및 NSAID를 포함한다. 글루코코르티코이드의 예는 알도스테론, 베클로메타손, 베타메타손, 코르티손, 데옥시코르티코스테론, 덱사메타손, 플루드로코르티손, 히드로코르티손, 메틸프레드니솔론, 프레드니솔론, 프레드니손, 트리암시놀론, 및 그의 제약상 허용되는 염을 포함한다.
NSAID의 예는 살리실레이트 (예를 들어, 아스피린, 아목시프린, 베노릴레이트, 콜린 마그네슘 살리실레이트, 디플루니살, 페이슬라민, 메틸 살리실레이트, 마그네슘 살리실레이트, 살리실 살리실레이트, 및 그의 제약상 허용되는 염), 아릴알칸산 (예를 들어, 디클로페낙, 아세클로페낙, 아세메타신, 브롬페낙, 에토돌락, 인도메타신, 나부메톤, 술린닥, 톨메틴, 및 그의 제약상 허용되는 염), 아릴프로피온산 (예를 들어, 이부프로펜, 카프로펜, 펜부펜, 페노프로펜, 플루르비프로펜, 케토프로펜, 케토롤락, 록소프로펜, 나프록센, 옥사프로진, 티아프로펜산, 수프로펜, 및 그의 제약상 허용되는 염), 아릴안트라닐산 (예를 들어, 메클로페남산, 메페남산, 및 그의 제약상 허용되는 염), 피라졸리딘 유도체 (예를 들어, 아자프로파존, 메타미졸, 옥시펜부타존, 페닐부타존, 술핀프라존, 및 그의 제약상 허용되는 염), 옥시캄 (예를 들어, 로르녹시캄, 멜록시캄, 피록시캄, 테녹시캄, 및 그의 제약상 허용되는 염), COX-2 억제제 (예를 들어, 셀레콕시브, 에토리콕시브, 루미라콕시브, 파레콕시브, 로페콕시브, 발데콕시브, 및 그의 제약상 허용되는 염), 및 술폰아닐리드 (예를 들어, 니메술리드 및 그의 제약상 허용되는 염)를 포함한다.
통증 (신경병증성 및 염증성 통증을 포함하나 이에 제한되지는 않음)의 치료에 사용된 다른 작용제는 프레가발린, 리도카인, 둘록세틴, 가바펜틴, 카르바마제핀, 캡사이신, 및 다른 세로토닌/노르에피네프린/도파민 재흡수 억제제, 및 오피에이트 (예컨대 옥시콘틴, 모르핀, 및 코데인)와 같은 작용제를 포함하나, 이에 제한되지는 않는다.
공지된 질환 또는 상태, 예컨대 당뇨병, 감염 (예를 들어, 대상 포진 또는 HIV 감염), 또는 암에 의해 유발된 통증의 치료에서, 개시내용의 화합물은 기저 질환 또는 상태에서 지시된 1종 이상의 추가의 치료제 또는 예방제와 조합으로 투여될 수 있다. 예를 들어, 당뇨병성 신경병증을 치료하는데 사용되는 경우에, 개시내용의 화합물은 1종 이상의 항당뇨병제, 항고혈당제, 혈중지질강하제/지질 강하제, 항비만제, 항고혈압제 및 식욕 억제제와 조합으로 투여될 수 있다. 항당뇨병제의 예는 비구아니드 (예를 들어, 메트포르민, 펜포르민), 글루코시다제 억제제 (예를 들어, 아카르보스, 미글리톨), 인슐린 (인슐린 분비촉진제 및 인슐린 감작제 포함), 메글리티니드 (예를 들어, 레파글리니드), 술포닐우레아 (예를 들어, 글리메피리드, 글리부리드, 글리클라지드, 클로르프로파미드, 및 글리피지드), 비구아니드/글리부리드 조합물 (예를 들어, 글루코반스), 티아졸리딘디온 (예를 들어, 트로글리타존, 로시글리타존, 및 피오글리타존), PPAR-알파 효능제, PPAR-감마 효능제, PPAR 알파/감마 이중 효능제, 글리코겐 포스포릴라제 억제제, 지방산 결합 단백질 (aP2)의 억제제, 글루카곤-유사 펩티드-1 (GLP-1) 또는 GLP-1 수용체의 다른 효능제, 디펩티딜 펩티다제 IV (DPP4) 억제제, 및 소듐-글루코스 공동-수송체 2 (SGLT2) 억제제 (예를 들어, 다파글리플로진, 카나글리플로진, 및 LX-4211)를 포함한다.
제약 제제는 임의의 적절한 경로에 의해, 예를 들어 경구 (협측 또는 설하 포함), 직장, 비강, 국소 (협측, 설하, 또는 경피 포함), 질, 또는 비경구 (피하, 피내, 근육내, 관절내, 활막내, 흉골내, 척수강내, 병변내, 정맥내, 또는 피내 주사 또는 주입 포함) 경로에 의한 투여에 적합화될 수 있다. 이러한 제제는 제약 분야에 공지된 임의의 방법에 의해, 예를 들어 활성 성분을 담체(들) 또는 부형제(들)와 회합시킴으로써 제조될 수 있다. 경구 투여 또는 주사에 의한 투여가 바람직하다.
경구 투여에 적합화된 제약 제제는 이산 단위 예컨대 캡슐 또는 정제; 분말 또는 과립; 수성 또는 비-수성 액체 중의 용액 또는 현탁액; 식용 폼 또는 휩; 또는 수중유 액체 에멀젼 또는 유중수 에멀젼으로서 제공될 수 있다.
예를 들어, 정제 또는 캡슐 형태로의 경구 투여를 위해, 활성 약물 성분은 경구, 비-독성 제약상 허용되는 불활성 담체 예컨대 에탄올, 글리세롤, 물 등과 조합될 수 있다. 분말은 화합물을 적합한 미세 크기로 파분쇄하고, 유사하게 파분쇄된 제약 담체 예컨대 예를 들어 전분 또는 만니톨과 같은 식용 탄수화물과 혼합함으로써 제조된다. 향미제, 보존제, 분산제, 및 착색제가 또한 존재할 수 있다.
캡슐은 상기 기재된 바와 같이 분말 혼합물을 제조하고, 형성된 젤라틴 외피에 충전함으로써 만들어진다. 활택제 및 윤활제 예컨대 콜로이드성 실리카, 활석, 스테아르산마그네슘, 스테아르산칼슘 또는 고체 폴리에틸렌 글리콜이 충전 작업 전에 분말 혼합물에 첨가될 수 있다. 캡슐 섭취 시 의약의 이용가능성을 개선하기 위해 붕해제 또는 가용화제 예컨대 한천-한천, 탄산칼슘 또는 탄산나트륨이 또한 첨가될 수 있다.
더욱이, 원하거나 필요한 경우에, 적합한 결합제, 윤활제, 붕해제 및 착색제가 또한 혼합물에 혼입될 수 있다. 적합한 결합제는 전분, 젤라틴, 천연 당 예컨대 글루코스 또는 베타-락토스, 옥수수 감미제, 천연 및 합성 검 예컨대 아카시아, 트라가칸트 또는 알긴산나트륨, 카르복시메틸셀룰로스, 폴리에틸렌 글리콜 등을 포함한다. 이들 투여 형태에 사용되는 윤활제는 올레산나트륨, 염화나트륨 등을 포함한다. 붕해제는, 비제한적으로, 전분, 메틸 셀룰로스, 한천, 베토나이트, 크산탄 검 등을 포함한다. 정제는, 예를 들어, 분말 혼합물을 제조하고, 과립화하거나 슬러깅하고, 윤활제 및 붕해제를 첨가하고, 정제로 가압함으로써 제제화된다. 분말 혼합물은 적합하게 파분쇄된 화합물을 상기 기재된 바와 같은 희석제 또는 염기, 및 임의로 결합제 예컨대 카르복시메틸셀룰로스, 알기네이트, 젤라틴, 또는 폴리비닐 피롤리돈, 용해 지연제 예컨대 파라핀, 흡수 촉진제 예컨대 4급 염 및/또는 흡수제 예컨대 베토나이트, 카올린, 또는 인산이칼슘과 혼합함으로써 제조된다. 분말 혼합물은 결합제 예컨대 시럽, 전분 페이스트, 아카시아 점액, 또는 셀룰로스 또는 중합체 물질의 용액으로 습윤시키고, 스크린을 통해 밀어넣어 과립화될 수 있다. 과립화에 대한 대안으로서, 분말 혼합물을 정제 기계에 통과시킬 수 있고, 그 결과물은 과립으로 부수어지는 불완전하게 형성된 슬러그이다. 정제 형성 다이에 점착되는 것을 방지하기 위해, 스테아르산, 스테아레이트 염, 활석 또는 미네랄 오일을 첨가함으로써 과립을 윤활화할 수 있다. 윤활화된 혼합물은 이어서 정제로 압축된다. 본 개시내용의 화합물은 또한 자유 유동 불활성 담체와 조합되어, 과립화 또는 슬러깅 단계를 거치지 않고 정제로 직접 압착될 수 있다. 쉘락의 실링 코트, 당 또는 중합체 물질의 코팅, 및 왁스의 광택 코팅으로 이루어진 투명 또는 불투명 보호 코팅이 제공될 수 있다. 염료가 이들 코팅에 첨가되어 상이한 단위 투여량을 구별할 수 있다.
경구 유체 예컨대 용액, 시럽, 및 엘릭시르는 주어진 양이 미리 결정된 양의 화합물을 함유하도록 한 투여 단위 형태로 제조될 수 있다. 시럽은 적합한 향미 수용액 중에 화합물을 용해시킴으로써 제조될 수 있고, 엘릭시르는 비-독성 비히클의 사용을 통해 제조된다. 가용화제 및 유화제 예컨대 에톡실화 이소스테아릴 알콜 및 폴리옥시에틸렌 소르비톨 에테르, 보존제, 향미 첨가제 예컨대 페퍼민트 오일 또는 천연 감미제, 또는 사카린 또는 다른 인공 감미제 등이 또한 첨가될 수 있다.
적절한 경우에, 경구 투여를 위한 투여 단위 제제는 마이크로캡슐화될 수 있다. 제제는 또한 예를 들어 미립자 물질을 중합체, 왁스 등으로 코팅하거나 이에 포매시킴으로써 방출이 연장 또는 지속되도록 제조될 수 있다.
화학식 (I)의 화합물, 및 그의 제약상 허용되는 염은 또한 리포솜 전달 시스템, 예컨대 소형 단층 소포, 대형 단층 소포, 및 다층 소포의 형태로 투여될 수 있다. 리포솜은 다양한 인지질, 예컨대 콜레스테롤, 스테아릴아민, 또는 포스파티딜콜린으로부터 형성될 수 있다.
화학식 (I)의 화합물 및 그의 제약상 허용되는 염은 또한 화합물 분자가 커플링된 개별 담체로서 모노클로날 항체를 사용함으로써 전달될 수 있다. 화합물은 또한 표적화가능한 약물 담체로서의 가용성 중합체와 커플링될 수 있다. 이러한 중합체는 폴리비닐피롤리돈, 피란 공중합체, 폴리히드록시프로필메타크릴아미드페놀, 폴리히드록시에틸아스파르트아미드페놀, 또는 팔리토일 잔기로 치환된 폴리에틸렌옥시드폴리리신을 포함할 수 있다. 추가로, 화합물은 약물의 제어 방출을 달성하는데 유용한 생분해성 중합체 부류, 예를 들어, 폴리락트산, 폴엡실론 카프로락톤, 폴리히드록시 부티르산, 폴리오르토에스테르, 폴리아세탈, 폴리디히드로피란, 폴리시아노아크릴레이트, 및 히드로겔의 가교 또는 양친매성의 블록 공중합체에 커플링될 수 있다.
경피 투여에 적합화된 제약 제제는 장기간 동안 수용자의 표피와 밀접하게 접촉된 채 유지되도록 의도된 별개의 패치로서 제공될 수 있다. 예를 들어, 활성 성분은 문헌 [Pharmaceutical Research 1986, 3(6), 318]에 일반적으로 기재된 바와 같이 이온영동에 의해 패치로부터 전달될 수 있다.
국소 투여에 적합화된 제약 제제는 연고, 크림, 현탁액, 로션, 분말, 용액, 페이스트, 겔, 스프레이, 에어로졸, 또는 오일로 제제화될 수 있다.
직장 투여에 적합화된 제약 제제는 좌제 또는 관장제로 제공될 수 있다.
담체가 고체인 비강 투여에 적합화된 제약 제제는 코로 들이쉬는 방식으로, 즉, 코에 밀착 유지하여 분말 용기로부터 비도를 통해 빠르게 흡입함으로써 투여되는, 예를 들어 20 내지 500 마이크로미터 범위의 입자 크기를 갖는 조대 분말을 포함한다. 비강 스프레이 또는 점비제로서 투여하기 위한, 담체가 액체인 적합한 제제는 활성 성분의 수용액 또는 오일 용액을 포함한다.
흡입에 의한 투여에 적합화된 제약 제제는 다양한 유형의 계량 용량 가압 에어로졸, 네뷸라이저, 또는 취입기에 의해 생성될 수 있는 미립자 분진 또는 미스트를 포함한다.
질 투여에 적합화된 제약 제제는 페사리, 탐폰, 크림, 겔, 페이스트, 발포체, 또는 스프레이 제제로 제공될 수 있다.
비경구 투여에 적합화된 제약 제제는 항산화제, 완충제, 정박테리아제, 및 제제가 의도된 수용자의 혈액과 등장성이 되도록 하는 용질을 함유할 수 있는 수성 및 비-수성 멸균 주사 용액; 및 현탁화제 및 증점제를 포함할 수 있는 수성 및 비-수성 멸균 현탁액을 포함한다. 제제는 단위-용량 또는 다중-용량 용기, 예를 들어 밀봉된 앰플 및 바이알로 제공될 수 있고, 사용 직전에 단지 멸균 액체 담체, 예를 들어 주사용수의 첨가만을 필요로 하는 냉동-건조된 (동결건조된) 상태로 저장될 수 있다. 즉석 주사 용액 및 현탁액은 멸균 분말, 과립 및 정제로부터 제조될 수 있다.
특히 상기 언급된 성분에 더하여, 제제는 해당 제제의 유형과 관련된 분야에서 통상적인 다른 작용제를 포함할 수 있고, 예를 들어 경구 투여에 적합한 것은 향미제를 포함할 수 있는 것으로 이해되어야 한다.
용어 "환자"는 인간 및 다른 포유동물을 둘 다 포함한다.
달리 나타내지 않는 한, 용어 "관리하다", "관리하는" 및 "관리"는 명시된 질환 또는 장애를 이미 앓는 환자에서 상기 질환 또는 장애의 재발을 예방하고/거나, 상기 질환 또는 장애를 앓는 환자가 완화를 유지하는 시간을 연장시키는 것을 포함한다. 상기 용어는 질환 또는 장애의 역치, 발생 및/또는 지속기간을 조정하거나, 또는 환자가 질환 또는 장애에 반응하는 방식을 변화시키는 것을 포괄한다.
용어 "치료하는"은 (i) 질환, 장애 및/또는 상태에 걸리기 쉬울 수 있지만 아직 걸린 것으로 진단되지는 않은 환자에서 질환, 장애 또는 상태가 발생하는 것을 예방하는 것; (ii) 질환, 장애 또는 상태를 억제하는 것, 즉, 그의 진행을 저지하는 것; 및 (iii) 질환, 장애 또는 상태를 경감하는 것, 즉, 질환, 장애 및/또는 상태의 퇴행을 유발하는 것을 지칭한다.
본 개시내용은 합성 공정에 의해, 또는 인간 또는 동물 신체 내 (생체내)에서 발생하는 과정 또는 시험관내에서 발생하는 과정을 포함한 대사 과정에 의해 제조되는 경우에 화학식 (I)을 갖는 화합물을 포괄하도록 의도된다.
실시예
본 개시내용은 이제 특정 실시양태와 관련하여 기재될 것이며, 이는 그의 범주를 제한하고자 하지는 않는다. 반대로, 본 개시내용은 청구범위의 범주 내에 포함될 수 있는 모든 대안, 변형 및 등가물을 포괄한다. 따라서, 구체적 실시양태를 포함하는 하기 실시예는 본 개시내용의 한 실시를 예시할 것이며, 실시예는 특정 실시양태의 예시 목적을 위한 것이고, 그의 절차 및 개념 측면의 가장 유용하고 용이하게 이해되는 기재인 것으로 여겨지는 것을 제공하기 위해 제시되는 것으로 이해된다.
특히 이어지는 예시적인 반응식 및 실시예를 포함한 본 출원에 사용된 약어는 관련 기술분야의 통상의 기술자에게 널리 공지되어 있다. 사용되는 약어 중 일부는 하기와 같다: MeOH는 메탄올; min은 분, EtOAc 또는 ETOAC는 에틸 아세테이트; h 또는 hr 또는 hrs는 시간; Ph3P는 트리페닐포스핀, DIAD는 디이소프로필 아조디카르복실레이트; RT 또는 rt 또는 r.t.는 실온 또는 체류시간 (문맥이 지시할 것임); tR은 체류시간; EtOH는 에탄올; DMSO는 디메틸술폭시드; THF는 테트라히드로푸란; dppf는 디페닐포스피노페로센; TFA는 트리플루오르아세트산; NMP는 N-메틸피롤리딘; CBz 또는 Cbz는 벤질옥시카르보닐; DCM은 디클로로메탄; IPA는 이소프로필 알콜; DMAP는 N,N-디메틸아미노피리딘; BOC 또는 Boc는 tert-부톡시카르보닐; (BOC)2O는 디-tert-부틸 디카르보네이트/ DMF는 N,N-디메틸포름아미드; OAc는 아세테이트; Cbz는 카르보벤질옥시; TMS는 트리메틸실란; LDA는 리튬 디이소프로필아미드; MOM-Cl은 클로로메틸 메틸 에테르; KHMDS는 포타슘 헥사메틸디실라지드; KOtBu는 포타슘 tert-부톡시드; DAST는 디에틸아미노황 트리플루오라이드; BuOH는 n-부탄올; n-BuLi는 n-부틸리튬; 및 NBS는 N-브로모숙신이미드; LAH는 수소화알루미늄리튬; DMF는 N,N-디메틸포름아미드; dppf는 1,1'-비스(디페닐포스피노)페로센; TosMIC 또는 TOSMIC는 토실메틸 이소시아나이드; TEA는 트리에틸아민; PMB는 p-메톡시벤질; Ac는 아세틸; DDQ는 2,3-디클로로-5,6-디시아노-1,4-벤조퀴논; 및 AIBN은 2,2'-아조이소부티로니트릴.
본 개시내용의 화합물은 본 섹션에 기재된 반응 및 기술 뿐만 아니라 관련 기술분야의 통상의 기술자에게 공지된 다른 합성 방법을 사용하여 제조될 수 있다. 반응은 사용된 시약 및 물질에 대해 적절한 용매 중에서 수행되고, 변형이 실시되기에 적합하다. 또한, 하기 기재된 합성 방법의 기재에서, 용매, 반응 온도, 실험 지속기간 및 후처리 절차의 선택을 포함한 모든 제안된 반응 조건은 그 반응에 대해 표준인 조건이도록 선택되며, 이는 관련 기술분야의 통상의 기술자에 의해 용이하게 인지되어야 한다는 것이 이해되어야 한다. 분자의 다양한 부분에 존재하는 관능기는 제안된 시약 및 반응과 상용성이어야 한다는 것은 유기 합성 기술분야의 통상의 기술자에 의해 이해된다. 반응 조건과 상용성인 치환기에 대한 이러한 제한은 관련 기술분야의 통상의 기술자에게 용이하게 명백할 것이고, 그에 따라 대안적 방법이 사용되어야 한다.
화학식 Ia의 화합물은 반응식 I에 따라 합성될 수 있다. 2개의 주요 반응인 스즈키 커플링 및 에테르 형성이 상업적으로 입수가능한 출발 물질에 따라 제시된 바와 같이 교대로 일어날 수 있다. 스즈키 커플링 기재인 보론산/보로네이트는 상업적으로 입수가능하거나 또는 다양한 표준 문헌 조건으로 상응하는 할로겐 중간체 (Cl/Br/I)로부터 제조된다. 에테르 형성은 플루오린 중간체 (화학식 IV)가 이용가능한 경우에 SNAR에 의해, OH가 이용 가능한 경우에 (화학식 III/V) 미츠노부 반응 또는 적합한 아미노 알콜과의 알킬화에 의해, 및 Cl 중간체 (화학식 III/V)가 이용가능한 경우에 부흐발트 Pd-촉매된 에테르 형성 반응에 의해 달성될 수 있다. R5가 H보다 큰 경우에, 아미노 알콜의 활성화 형태 (화학식 VII)를 OH-알킬화 시약으로서 사용하였다. 때때로 NH2 및 OH를 반응 순서 동안 보호 및 탈보호하였다.
반응식 I:
X/Y = Cl, Br, I 또는 보론산/보로네이트; A/B = C 또는 N (페닐 또는 피리딘)
R5가 H가 아닐 경우에, 에테르 형성을 위한 통상의 활성화 아미노 알콜 시약
하기 실시예에서, 양성자 NMR 스펙트럼을 브루커(Bruker) 400 또는 500 MHz NMR 분광계 상에서 기록하였다. 화학적 이동을 테트라메틸실란에 대한 δ 값으로 기록하였다. 액체 크로마토그래피 (LC)/질량 스펙트럼을 하기 방법 중 적어도 하나를 사용하여 워터스 마이크로매스 ZQ(Waters Micromass ZQ)에 커플링된 시마즈(Shimadzu) LC 상에서 실행하였다.
LC/MS 방법 A:
칼럼: 페노메넥스 루나(Phenomenex LUNA) C18, 30x2, 3μm; 용매 A = 5% MeOH: 95% 물:10mM 아세트산암모늄; 용매 B = 95% MeOH:5% 물:10mM 아세트산암모늄; 유량: 1 ml/분; 출발 B = 0%; 최종 B = 100%; 구배시간 = 2분; 실행시간: 3분.
LC/MS 방법 B:
칼럼: 페노메넥스 루나 C18, 30x2, 3μm; 용매 A = 10% MeOH: 90% 물:0.1%TFA; 용매 B = 90% MeOH:10% 물:0.1%TFA; 유량: 1 ml/분; 출발 B = 0%; 최종 B = 100%; 구배시간 = 2분; 실행시간: 3분.
LC/MS 방법 C:
칼럼: 페노메넥스 루나 C18, 30x2, 3μm; 용매 A = 5% MeOH: 95% 물:10mM 아세트산암모늄; 용매 B = 95% MeOH:5% 물:10mM 아세트산암모늄; 유량: 0.8 ml/분; 출발 B = 0%; 최종 B = 100%; 구배시간 = 4분; 실행시간: 5분.
실시예 1
(S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-플루오로페닐)피리딘-2-일)아세트아미드
파트 A: N-(4-브로모피리딘-2-일)아세트아미드
0℃에서 CH2Cl2 (60 mL) 중 4-브로모피리딘-2-아민 (3.11 g, 17.98 mmol)의 혼합물에 아세틸 클로라이드 (1.406 mL, 19.77 mmol) 및 피리딘 (1.745 mL, 21.57 mmol)을 첨가하였다. 혼합물을 실온으로 가온하고, 2시간 동안 교반하였다. 반응물을 물로 켄칭하고, EtOAc로 희석하였다. 층을 분리하였다. 유기 층을 물, 염수로 세척하고, 건조 (Na2SO4)시키고, 감압 하에 농축시켜 N-(4-브로모피리딘-2-일)아세트아미드 (3.82 g, 17.05 mmol, 95% 수율)를 백색 고체로서 수득하였다. 물질을 추가 정제 없이 사용하였다. LCMS (ESI) m/e 215.0 [(M+H)+, 계산치 C7H8Br1N2O1, 215.0]; LC/MS 체류시간 (방법 A): tR = 2.61분.
파트 B: N-(4-(3-플루오로-4-히드록시페닐)피리딘-2-일)아세트아미드
15 mL 바이알에 질소 하에 디옥산 (3 mL) 중 N-(4-브로모피리딘-2-일)아세트아미드 (205.8 mg, 0.957 mmol), (3-플루오로-4-히드록시페닐)보론산 (239 mg, 1.531 mmol), 및 Na2CO3 (1.435 mL, 2.87 mmol)을 첨가하여 무색 용액을 수득하였다. 1,1'-비스(디페닐포스피노)페로센팔라듐(II) 디클로라이드, 톨루엔 (39.4 mg, 0.048 mmol)을 질소 하에 첨가하였다. 바이알을 밀봉하고 130℃ (마이크로웨이브)에서 2시간 동안 가열하였다. 혼합물을 물과 EtOAc 사이에 분배하였다. 층을 분리하였다. 유기 층을 염수로 세척하고, 건조 (Na2SO4)시키고, 감압 하에 농축시켜 N-(4-(3-플루오로-4-히드록시페닐)피리딘-2-일)아세트아미드 (200 mg, 0.812 mmol, 85% 수율)를 황갈색 고체로서 수득하였다. LCMS (ESI) m/e 247.0 [(M+H)+, 계산치 C13H12F1N2O2 247.1]; LC/MS 체류시간 (방법 A): tR = 1.51분.
파트 C: (S)-2-(1-히드록시-4-메틸펜탄-2-일)이소인돌린-1,3-디온
250 mL 둥근 바닥 플라스크에 톨루엔 (60 mL) 중 (S)-3-아미노-5-메틸헥산-1-올 (2.166 g, 16.51 mmol) 및 이소벤조푸란-1,3-디온 (2.445 g, 16.51 mmol)을 첨가하여 무색 현탁액을 수득하였다. 혼합물을 110℃에서 16시간 동안 가열하였다. 휘발성 물질을 고진공 하에 제거하여 (S)-2-(1-히드록시-4-메틸펜탄-2-일)이소인돌린-1,3-디온 (4.08 g, 16.51 mmol, 정량적 수율)을 담황색 고밀도 오일로서 수득하였다. LCMS (ESI) m/e 246.2 [(M-H)+, 계산치 C14H16N1O3, 246.1]; LC/MS 체류시간 (방법 A): tR = 1.88분.
파트 D: (S)-N-(4-(4-((2-(1,3-디옥소이소인돌린-2-일)-4-메틸펜틸)옥시)-3-플루오로페닐)피리딘-2-일)아세트아미드
50 mL 둥근 바닥 플라스크에 테트라히드로푸란 (1 mL) 중 (S)-2-(1-히드록시-4-메틸펜탄-2-일)이소인돌린-1,3-디온 (93 mg, 0.375 mmol), Ph3P (123 mg, 0.468 mmol), 및 (S)-2-(1-히드록시-4-메틸펜탄-2-일)이소인돌린-1,3-디온 (93 mg, 0.375 mmol)을 첨가하여 황갈색 현탁액을 수득하였다. DIAD (0.091 mL, 0.468 mmol)를 실온에서 적가하였다. 생성된 투명한 황갈색 용액을 실온에서 19시간 동안 교반하였다. 용액을 감압 하에 농축시켜 황갈색 오일을 수득하였으며, 이를 후속 반응에 직접 사용하였다. LCMS (ESI) m/e 476.3 [(M+H)+, 계산치 C27H27F1N3O4, 476.2]; LC/MS 체류시간 (방법 A): tR = 2.21분.
파트 E: (S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-플루오로페닐)피리딘-2-일)아세트아미드
50 mL 둥근 바닥 플라스크에 EtOH (2 mL) 중 (S)-N-(4-(4-((2-(1,3-디옥소이소인돌린-2-일)-4-메틸펜틸)옥시)-3-플루오로페닐)피리딘-2-일)아세트아미드 (148 mg, 0.312 mmol)를 첨가하여 황갈색 용액을 수득하였다. 히드라진 (0.049 mL, 1.560 mmol)을 첨가하고, 혼합물을 60℃에서 2시간 동안 가열하였다. 용액을 실온으로 냉각시키고, 감압 하에 농축시켰다. 잔류물을 MeOH 중에 현탁시키고, 여과하고, 정제용 HPLC에 의해 정제하였다 (24 mg, 0.069 mmol, 3 단계에 대해서 22% 수율): 1H NMR (500 MHz, DMSO-d6) δ 10.53 (s, 1H), 8.33 (d, J = 4.9 Hz, 2H), 7.61 (dd, J = 12.5, 2.2 Hz, 1H), 7.52 (dd, J = 8.5, 2.2 Hz, 1H), 7.43 - 7.37 (m, 1H), 7.32 (t, J = 8.7 Hz, 1H), 3.97 (dd, J = 9.5, 4.9 Hz, 1H), 3.90 (dd, J = 9.5, 6.5 Hz, 1H), 3.12 (dt, J = 11.9, 5.4 Hz, 1H), 2.12 (s, 3H), 1.81 (dq, J = 13.0, 6.5 Hz, 1H), 1.33 (ddd, J = 13.5, 8.5, 5.0 Hz, 1H), 1.26 (ddd, J = 13.5, 8.5, 5.5 Hz, 1H), 0.92 (d, J = 6.6 Hz, 3H), 0.88 (d, J = 6.5 Hz, 3H); LCMS (ESI) m/e 346.2 [(M+H)+, 계산치 C19H25F1N3O2, 346.2]; LC/MS 체류시간 (방법 A): tR = 1.89분.
실시예 1의 대안적 합성
(S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-플루오로페닐)피리딘-2-일)아세트아미드
파트 2A: (S)-tert-부틸 (1-(4-브로모-2-플루오로페녹시)-4-메틸펜탄-2-일)카르바메이트
15 mL 바이알에 테트라히드로푸란 (2mL) 중 (S)-tert-부틸 (1-히드록시-4-메틸펜탄-2-일)카르바메이트 (172 mg, 0.792 mmol), Ph3P (260 mg, 0.990 mmol), 및 4-브로모-2-플루오로페놀 (126 mg, 0.660 mmol)을 첨가하여 황갈색 용액을 수득하였다. DIAD (0.180 mL, 0.924 mmol)를 실온에서 첨가하였다. 생성된 투명한 황갈색 용액을 실온에서 16시간 동안 교반하였다. 용액을 감압 하에 농축시켜 황갈색 오일을 수득하였으며, 이를 실리카 겔 칼럼 크로마토그래피 (최대 60% EtOAc/헥산)에 의해 직접 정제하여 무색 오일로서의 (S)-tert-부틸 (1-(4-브로모-2-플루오로페녹시)-4-메틸펜탄-2-일)카르바메이트 (249 mg, 0.638 mmol, 97% 수율)를 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 7.24 (dd, J = 10.5, 2.4 Hz, 1H), 7.21 - 7.16 (m, 1H), 6.90 - 6.81 (m, 1H), 4.83 - 4.69 (m, 1H), 4.08 - 3.92 (m, 3H), 1.71 (dp, J = 13.2, 6.6 Hz, 1H), 1.59 - 1.49 (m, 2H), 1.47 (d, J = 3.8 Hz, 9H), 0.96 (dd, J = 6.6, 4.4 Hz, 6H); LCMS (ESI) m/e 412.1 [(M+Na)+, 계산치 C17H25BrFNNaO3, 412.1]; LC/MS 체류시간 (방법 B): tR = 2.41분.
파트 2B: (S)-tert-부틸 (1-(4-(2-아세트아미도피리딘-4-일)-2-플루오로페녹시)-4-메틸펜탄-2-일)카르바메이트
15 mL 바이알에 질소 하에 디옥산 (2 mL) 중 N-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-2-일)아세트아미드 (208 mg, 0.792 mmol), (S)-tert-부틸 (1-(4-브로모-2-플루오로페녹시)-4-메틸펜탄-2-일)카르바메이트 (258 mg, 0.66 mmol), 및 Na2CO3 (0.990 mL, 1.980 mmol)을 첨가하여 무색 현탁액을 수득하였다. 1,1'-비스(디페닐포스피노)페로센팔라듐(II) 디클로라이드, 톨루엔 (27.1 mg, 0.033 mmol)을 질소 하에 첨가하였다. 바이알을 밀봉하고 130℃ (마이크로웨이브)에서 2시간 동안 가열하였다. 혼합물을 물 및 EtOAc로 희석하였다. 층을 분리하였다. 유기 층을 염수로 세척하고, 건조 (Na2SO4)시키고, 농축시켰다. 잔류물을 실리카 겔 칼럼 크로마토그래피 (최대 70% EtOAc/헥산)에 의해 정제하여 목적 생성물 (200 mg, 0.449 mmol, 2 단계에 대해서 68% 수율)을 무색 오일로서 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 8.79 (s, 1H), 8.46 (s, 1H), 8.29 (d, J = 5.4 Hz, 1H), 7.50 - 7.38 (m, 2H), 7.21 (dd, J = 5.2, 1.7 Hz, 1H), 7.06 (t, J = 8.7 Hz, 1H), 4.81 (d, J = 9.2 Hz, 1H), 4.12 - 3.96 (m, 3H), 2.25 (s, 3H), 1.74 (dq, J = 13.5, 6.5, 6.1 Hz, 1H), 1.63 - 1.52 (m, 2H), 1.47 (s, 9H), 0.98 (dd, J = 6.6, 3.3 Hz, 6H); LCMS (ESI) m/e 446.2 [(M+H)+, 계산치 C24H33F1N3O4, 446.2]; LC/MS 체류시간 (방법 B): tR = 2.11분.
파트 2C: (S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-플루오로페닐)피리딘-2-일)아세트아미드
50 mL 둥근 바닥 플라스크에 디클로로메탄 (2 mL) 중 (S)-tert-부틸 (1-(4-(2-아세트아미도피리딘-4-일)-2-플루오로페녹시)-4-메틸펜탄-2-일)카르바메이트 (202 mg, 0.453 mmol)를 첨가하여 무색 용액을 수득하였다. TFA (0.5 mL)를 첨가하고, 생성된 황갈색 용액을 실온에서 1시간 동안 교반하였다. 휘발성 물질을 감압 하에 제거하였다. 잔류물을 EtOAc로 희석하고, 1N NaOH로 염기성화시켰다. 층을 분리하였다. 유기 층을 염수로 세척하고, 건조 (Na2SO4)시키고, 감압 하에 농축시켜 (S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-플루오로페닐)피리딘-2-일)아세트아미드 (155 mg, 0.449 mmol, 99% 수율)를 약간 황갈색 오일로서 수득하였다: 상기 제조된 물질의 1H NMR 및 LCMS와 일치함; 19F NMR (376 MHz, 클로로포름-d) δ -133.47.
실시예 2
(S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-메톡시페닐)피리딘-2-일)아세트아미드
실시예 1에 기재된 바와 같이 제조하였다.
파트 A: N-(4-(3-메톡시-4-히드록시페닐)피리딘-2-일)아세트아미드
LCMS (ESI) m/e 259.1 [(M+H)+, 계산치 C14H15N2O3, 259.3]; LC/MS 체류시간 (방법 A): tR = 1.51분.
파트 B: (S)-N-(4-(4-((2-(1,3-디옥소이소인돌린-2-일)-4-메틸펜틸)옥시)-3-메톡시페닐)피리딘-2-일)아세트아미드
LCMS (ESI) m/e 488.3 [(M+H)+, 계산치 C28H30N3O5, 488.2]; LC/MS 체류시간 (방법 A): tR = 2.17분.
파트 C: (S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-메톡시페닐)피리딘-2-일)아세트아미드.
(S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-메톡시페닐)피리딘-2-일)아세트아미드 (14.9 mg, 0.042 mmol, 최종 단계에 대해서 80% 수율)를 약간 황갈색 발포체로서 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 10.50 (s, 1H), 8.35 (s, 1H), 8.32 (d, J = 5.2 Hz, 1H), 7.40 (dd, J = 5.2, 1.8 Hz, 1H), 7.32 - 7.22 (m, 2H), 7.12 (d, J = 8.2 Hz, 1H), 3.90 (dd, J = 9.3, 4.6 Hz, 1H), 3.87 (s, 3H), 3.78 (dd, J = 9.4, 6.9 Hz, 1H), 3.09 (p, J = 5.5, 5.1 Hz, 1H), 2.12 (s, 3H), 1.82 (dt, J = 13.4, 6.7 Hz, 1H), 1.32 (ddd, J = 13.5, 8.6, 5.0 Hz, 1H), 1.24 (ddd, J = 13.6, 8.7, 5.5 Hz, 1H), 0.92 (d, J = 6.6 Hz, 3H), 0.89 (d, J = 6.5 Hz, 3H); LCMS (ESI) m/e 358.2 [(M+H)+, 계산치 C20H28N3O3, 358.2]; LC/MS 체류시간 (방법 A): tR = 1.70분.
실시예 3
(S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-시아노페닐)피리딘-2-일)아세트아미드
실시예 1에 기재된 바와 같이 제조하였다.
파트 A: (S)-5-브로모-2-((2-(1,3-디옥소이소인돌린-2-일)-4-메틸펜틸)옥시)벤조니트릴.
1H NMR (400 MHz, 클로로포름-d) δ 7.86 (dd, J = 5.4, 3.0 Hz, 2H), 7.74 (dd, J = 5.5, 3.1 Hz, 2H), 7.63 - 7.55 (m, 2H), 6.87 (d, J = 8.8 Hz, 1H), 4.85 (tdd, J = 9.8, 5.6, 3.9 Hz, 1H), 4.57 (t, J = 9.2 Hz, 1H), 4.32 (dd, J = 9.3, 5.7 Hz, 1H), 2.28 - 2.14 (m, 1H), 1.66 - 1.53 (m, 2H), 1.00 (d, J = 5.8 Hz, 3H), 0.96 (d, J = 6.0 Hz, 3H); LCMS (ESI) m/e 427.1 [(M+H)+, 계산치 C21H20Br1N2O3, 427.1]; LC/MS 체류시간 (방법 B): tR = 2.29분.
파트 B: (S)-N-(4-(3-시아노-4-((2-(1,3-디옥소이소인돌린-2-일)-4-메틸펜틸)옥시)페닐)피리딘-2-일)아세트아미드.
LCMS (ESI) m/e 483.3 [(M+H)+, 계산치 C28H27N4O4, 483.2]; LC/MS 체류시간 (방법 B): tR = 2.06분.
파트 C: (S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-시아노페닐)피리딘-2-일)아세트아미드
아세트아미드를 부분적으로 가수분해하고 (참조: 실시예 4), 2종의 생성물을 분리하고 확인하였다. 무색 발포체로서의 (S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-시아노페닐)피리딘-2-일)아세트아미드 (10.1 mg, 0.028 mmol, 23% 수율)를 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 10.58 (s, 1H), 8.39 - 8.32 (m, 2H), 8.12 (d, J = 2.5 Hz, 1H), 8.00 (dd, J = 8.8, 2.5 Hz, 1H), 7.44 (d, J = 5.4 Hz, 1H), 7.41 (d, J = 8.8 Hz, 1H), 4.05 (dd, J = 9.3, 5.0 Hz, 1H), 3.99 (t, J = 7.9 Hz, 1H), 3.12 (s, 1H), 2.13 (s, 3H), 1.84 (p, J = 6.6 Hz, 1H), 1.42 - 1.31 (m, 1H), 1.27 (dq, J = 14.0, 7.0, 6.2 Hz, 1H), 0.93 (d, J = 6.6 Hz, 3H), 0.89 (d, J = 6.4 Hz, 3H); LCMS (ESI) m/e 353.2 [(M+H)+, 계산치 C20H25N4O2, 353.2]; LC/MS 체류시간 (방법 B): tR = 1.44분.
실시예 4
(S)-2-((2-아미노-4-메틸펜틸)옥시)-5-(2-아미노피리딘-4-일)벤조니트릴
실시예 3으로부터의 가수분해된 물질은 무색 발포체로서의 (S)-2-((2-아미노-4-메틸펜틸)옥시)-5-(2-아미노피리딘-4-일)벤조니트릴 (10.1 mg, 0.030 mmol, 26% 수율)로 확인되었다. 1H NMR (500 MHz, DMSO-d6) δ 8.02 (d, J = 2.4 Hz, 1H), 7.97 (d, J = 5.3 Hz, 1H), 7.93 (dd, J = 8.8, 2.4 Hz, 1H), 7.36 (d, J = 8.9 Hz, 1H), 6.82 (dd, J = 5.3, 1.6 Hz, 1H), 6.70 (s, 1H), 5.97 (s, 2H), 4.03 (dd, J = 9.3, 5.1 Hz, 1H), 3.96 (t, J = 7.7 Hz, 1H), 3.10 (s, 1H), 1.84 (p, J = 6.4 Hz, 1H), 1.35 (q, J = 9.3, 6.6 Hz, 1H), 1.26 (dq, J = 13.7, 6.8, 6.1 Hz, 1H), 0.92 (d, J = 6.6 Hz, 3H), 0.89 (d, J = 6.5 Hz, 3H); LCMS (ESI) m/e 311.2 [(M+H)+, 계산치 C18H23N4O1, 311.2]; LC/MS 체류시간 (방법 B): tR = 1.35분.
실시예 5
(S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-일)아세트아미드
실시예 1에 기재된 바와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-(4-브로모-2-(트리플루오로메틸)페녹시)-4-메틸펜탄-2-일)카르바메이트.
1H NMR (400 MHz, 클로로포름-d) δ 7.67 (d, J = 2.4 Hz, 1H), 7.57 (dd, J = 8.8, 2.5 Hz, 1H), 6.88 (d, J = 8.8 Hz, 1H), 4.71 (d, J = 8.3 Hz, 1H), 4.03 (p, J = 7.2 Hz, 3H), 1.68 (hept, J = 6.7 Hz, 1H), 1.55 - 1.48 (m, 2H), 1.44 (s, 9H), 0.95 (dd, J = 6.6, 4.2 Hz, 6H); LCMS (ESI) m/e 462.1 [(M+Na)+, 계산치 C18H25Br1F3N1Na1O3, 462.1]; LC/MS 체류시간 (방법 B): tR = 2.45분.
파트 B: (S)-tert-부틸 (1-(4-(2-아세트아미도피리딘-4-일)-2-(트리플루오로메틸)페녹시)-4-메틸펜탄-2-일)카르바메이트.
1H NMR (400 MHz, 클로로포름-d) δ 9.50 (s, 1H), 8.48 (s, 1H), 8.29 (d, J = 5.3 Hz, 1H), 7.86 (d, J = 2.4 Hz, 1H), 7.81 (dd, J = 8.5, 2.4 Hz, 1H), 7.21 (dd, J = 5.3, 1.7 Hz, 1H), 7.08 (d, J = 8.6 Hz, 1H), 4.79 (d, J = 8.7 Hz, 1H), 4.13 - 4.04 (m, 3H), 2.25 (s, 3H), 1.70 (dt, J = 13.6, 6.9 Hz, 1H), 1.54 (t, J = 7.2 Hz, 2H), 1.44 (s, 9H), 0.96 (d, J = 2.8 Hz, 3H), 0.95 (d, J = 2.7 Hz, 3H); LCMS (ESI) m/e 496.2 [(M+H)+, 계산치 C25H33F3N3O4, 446.2]; LC/MS 체류시간 (방법 A): tR = 2.28분.
파트 C: (S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-일)아세트아미드
(221 mg, 0.531 mmol, 최종 단계에 대해서 정량적 수율)를 백색 발포체로서 수득하였다. 1H NMR (400 MHz, 클로로포름-d) δ 9.15 (s, 1H), 8.48 (s, 1H), 8.30 (d, J = 5.3 Hz, 1H), 7.88 (d, J = 2.2 Hz, 1H), 7.82 (dd, J = 8.7, 2.3 Hz, 1H), 7.23 (dd, J = 5.3, 1.7 Hz, 1H), 7.07 (d, J = 8.7 Hz, 1H), 4.08 (dd, J = 8.7, 3.6 Hz, 1H), 3.85 (dd, J = 8.7, 7.1 Hz, 1H), 3.32 (qd, J = 7.0, 3.6 Hz, 1H), 2.25 (s, 3H), 1.80 (dp, J = 13.5, 6.7 Hz, 1H), 1.57 (s, 2H), 1.38 (t, J = 7.0 Hz, 2H), 0.98 (d, J = 6.5 Hz, 3H), 0.96 (d, J = 6.6 Hz, 3H); 19F NMR (376 MHz, 클로로포름-d) δ -62.40; LCMS (ESI) m/e 394.2 [(M-H)-, 계산치 C20H23F3N3O2, 394.2]; LC/MS 체류시간 (방법 A): tR = 1.97분.
실시예 6
(S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-(트리플루오로메톡시)페닐)피리딘-2-일)아세트아미드
실시예 1에 기재된 바와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-(4-브로모-2-(트리플루오로메톡시)페녹시)-4-메틸펜탄-2-일)카르바메이트.
1H NMR (400 MHz, 클로로포름-d) δ 7.42 - 7.33 (m, 2H), 6.89 (d, J = 8.8 Hz, 1H), 4.78 - 4.61 (m, 1H), 4.09 - 3.90 (m, 3H), 1.68 (dq, J = 13.3, 6.7 Hz, 1H), 1.51 (t, J = 6.8 Hz, 2H), 1.45 (s, 9H), 0.95 (dd, J = 6.6, 5.4 Hz, 6H); LCMS (ESI) m/e 478.1 [(M+Na)+, 계산치 C18H25Br1F3N1Na1O4, 478.0]; LC/MS 체류시간 (방법 B): tR = 2.45분.
파트 B: (S)-tert-부틸 (1-(4-(2-아세트아미도피리딘-4-일)-2-(트리플루오로메톡시)페녹시)-4-메틸펜탄-2-일)카르바메이트.
1H NMR (400 MHz, 클로로포름-d) δ 9.13 (s, 1H), 8.47 (s, 1H), 8.29 (d, J = 5.3 Hz, 1H), 7.61 (dd, J = 8.5, 2.3 Hz, 1H), 7.56 (q, J = 1.3 Hz, 1H), 7.21 (dd, J = 5.3, 1.7 Hz, 1H), 7.09 (d, J = 8.6 Hz, 1H), 4.77 (d, J = 8.3 Hz, 1H), 4.12 - 3.98 (m, 3H), 2.25 (s, 3H), 1.73 (dq, J = 13.7, 7.1, 6.4 Hz, 1H), 1.55 (t, J = 7.0 Hz, 2H), 1.46 (s, 9H), 0.97 (dd, J = 6.6, 4.1 Hz, 6H); LCMS (ESI) m/e 512.2 [(M+H)+, 계산치 C25H33F3N3O5, 512.2]; LC/MS 체류시간 (방법 A): tR = 2.29분.
파트 C: (S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-(트리플루오로메톡시)페닐)피리딘-2-일)아세트아미드
(225 mg, 0.520 mmol, 최종 단계에 대해서 95% 수율)를 백색 발포체로서 수득하였다.
1H NMR (400 MHz, 클로로포름-d) δ 9.59 (s, 1H), 8.47 (s, 1H), 8.27 (d, J = 5.3 Hz, 1H), 7.58 (dd, J = 8.5, 2.3 Hz, 1H), 7.55 (d, J = 2.0 Hz, 1H), 7.19 (dd, J = 5.4, 1.7 Hz, 1H), 7.04 (d, J = 8.6 Hz, 1H), 4.00 (dd, J = 8.8, 3.7 Hz, 1H), 3.80 (dd, J = 8.8, 7.3 Hz, 1H), 3.31 (qd, J = 7.1, 3.7 Hz, 1H), 2.23 (s, 3H), 1.86 - 1.72 (m, J = 6.9 Hz, 1H), 1.63 (s, 2H), 1.35 (t, J = 7.0 Hz, 2H), 0.95 (dd, J = 9.1, 6.6 Hz, 6H); 19F NMR (376 MHz, 클로로포름-d) δ -58.10; LCMS (ESI) m/e 412.1 [(M+H)+, 계산치 C20H25F3N3O3, 412.2]; LC/MS 체류시간 (방법 A): tR = 1.99분.
실시예 7
(S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-메틸페닐)피리딘-2-일)아세트아미드
파트 A: (S)-tert-부틸 (1-(4-브로모-2-메틸페녹시)-4-메틸펜탄-2-일)카르바메이트
DIAD (0.090 mL, 0.464 mmol)를 THF (1.5 mL) 중 트리페닐포스핀(0.097 g, 0.371 mmol), 4-브로모-2-메틸페놀 (0.069 g, 0.371 mmol) 및 (S)-tert-부틸 (1-히드록시-4-메틸펜탄-2-일)카르바메이트 (0.0672 g, 0.309 mmol)의 용액에 N2 하에 실온에서 첨가하였다. 반응물을 실온에서 밤새 교반하였다. 용매를 감압 하에 제거하였다. 잔류물을 실리카 겔 크로마토그래피 (헥산 중 0에서 25% 에틸 아세테이트)에 의해 정제하였다. NMR 및 LCMS는 생성물이 출발 물질 (4-브로모-2-메톡시페놀)을 함유한다는 것을 나타내었다. 이 혼합물을 에틸 아세테이트에 녹이고, 1N NaOH (2X) 및 물 (1X)로 세척하였다. 에틸 아세테이트 층을 분리하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켜 (S)-tert-부틸 (1-(4-브로모-2-메틸페녹시)-4-메틸펜탄-2-일)카르바메이트 (31.2 mg, 0.081 mmol, 26% 수율)를 무색 왁스로서 수득하였다. LCMS (ESI) m/e 408.1 [(M+Na)+, 계산치 C18H28BrNO3Na, 408.1]; LC/MS 체류시간 (방법 B): tR = 2.44분.
파트 B: (S)-tert-부틸 (1-(4-(2-아세트아미도피리딘-4-일)-2-메틸페녹시)-4-메틸펜탄-2-일)카르바메이트
디옥산 (1 mL) 중 탄산나트륨 (0.061 mL, 0.121 mmol), N-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-2-일)아세트아미드 (0.028 g, 0.105 mmol), (S)-tert-부틸 (1-(4-브로모-2-메틸페녹시)-4-메틸펜탄-2-일)카르바메이트 (0.0312 g, 0.081 mmol)의 혼합물을 질소로 5회 퍼징하였다. PdCl2(dppf) (5.91 mg, 8.08 μmol)를 반응 혼합물에 첨가하고, 반응물을 80℃에서 밤새 가열하였다. 반응물을 실온으로 냉각시키고, 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, 염수 (1X)로 세척하였다. 에틸 아세테이트 층을 분리하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 조 물질을 그대로 후속 반응에 사용하였다. LCMS (ESI) m/e 442.3 [(M+H)+, 계산치 C25H36N3O4, 442.3]; LC/MS 체류시간 (방법 B): tR = 2.13분.
파트 C: (S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-메틸페닐)피리딘-2-일)아세트아미드
CH2Cl2 (4 mL) 중 TFA (1 mL, 12.98 mmol) 및 (S)-tert-부틸 (1-(4-(2-아세트아미도피리딘-4-일)-2-메틸페녹시)-4-메틸펜탄-2-일)카르바메이트 (35.8 mg, 0.081 mmol)의 혼합물을 실온에서 1시간 동안 교반하였다. 용매를 감압 하에 제거하고, 잔류물을 역상 HPLC (아세토니트릴/물/10 mM 아세트산암모늄)를 통해 정제하였다. (S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-메틸페닐)피리딘-2-일)아세트아미드 (9.7 mg, 0.028 mmol, 2 단계에 대해서 35% 수율)를 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 10.50 (s, 1H), 8.34 (br. s., 1H), 8.30 (d, J=5.2 Hz, 1H), 7.53 (br. s., 2H), 7.35 (d, J=4.6 Hz, 1H), 7.08 - 7.03 (m, J=9.2 Hz, 1H), 3.92 - 3.86 (m, 1H), 3.84 - 3.78 (m, 1H), 3.10 (br. s., 1H), 2.26 (s, 3H), 2.12 (s, 3H), 1.87 - 1.79 (m, 1H), 1.40 - 1.31 (m, 1H), 1.27 (d, J=6.4 Hz, 1H), 0.93 (d, J=6.7 Hz, 3H), 0.89 (d, J=6.4 Hz, 3H); LCMS (ESI) m/e 342.2 [(M+H)+, 계산치 C20H28N3O2, 342.2]; LC/MS 체류시간 (방법 B): tR = 1.73분.
실시예 8
(S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-클로로페닐)피리딘-2-일)아세트아미드
파트 A: (S)-tert-부틸 (1-(4-브로모-2-클로로페녹시)-4-메틸펜탄-2-일)카르바메이트
실시예 1, 파트 2A에 기재된 바와 같이 제조하였다. 1H NMR (400MHz, 클로로포름-d) δ 7.52 (d, J=2.5 Hz, 1H), 7.33 (dd, J=8.8, 2.5 Hz, 1H), 6.82 (d, J=8.8 Hz, 1H), 4.08 - 3.95 (m, 3H), 1.77 - 1.66 (m, 1H), 1.57 (br. m, 2H), 1.47 (s, 9H), 0.98 (dd, J=6.5, 3.8 Hz, 6H). LCMS (ESI) m/e 428.0 [(M+Na)+, 계산치 C17H25BrClNO3Na, 428.1]; LC/MS 체류시간 (방법 B): tR = 2.47분.
파트 B: (S)-tert-부틸 (1-(4-(2-아세트아미도피리딘-4-일)-2-클로로페녹시)-4-메틸펜탄-2-일)카르바메이트
디옥산 (1 mL) 중 탄산나트륨 (0.113 mL, 0.226 mmol), N-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-2-일)아세트아미드 (0.051 g, 0.196 mmol), (S)-tert-부틸 (1-(4-브로모-2-클로로페녹시)-4-메틸펜탄-2-일)카르바메이트 (0.0612 g, 0.150 mmol)의 혼합물을 배기시키고 N2로 재충전하였다 (5X). PdCl2(dppf) (0.011 g, 0.015 mmol)를 반응 혼합물에 첨가하고, 반응물을 80℃에서 밤새 가열하였다. 반응물을 에틸 아세테이트로 희석하고, 염수 (1X)로 세척하였다. 에틸 아세테이트 층을 분리하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 조 물질을 실리카 겔 크로마토그래피 (헥산 중 50% 에틸 아세테이트)에 의해 정제하여 (S)-tert-부틸 (1-(4-(2-아세트아미도피리딘-4-일)-2-클로로페녹시)-4-메틸펜탄-2-일)카르바메이트 (51.7mg, 0.112 mmol, 74% 수율)를 수득하였다. LCMS (ESI) m/e 462.2 [(M+H)+, 계산치 C24H33ClN3O4, 462.2]; LC/MS 체류시간 (방법 B): tR = 2.21분.
파트 C: (S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-클로로페닐)피리딘-2-일)아세트아미드
(S)-tert-부틸 (1-(4-(2-아세트아미도피리딘-4-일)-2-클로로페녹시)-4-메틸펜탄-2-일)카르바메이트 (51.7 mg, 0.112 mmol) 및 TFA (1 mL, 12.98 mmol)의 혼합물을 CH2Cl2 (3 mL) 중에서 실온에서 2시간 동안 교반하였다. 용매를 감압 하에 제거하고, 잔류물을 역상 HPLC (아세토니트릴/물/10 mM 아세트산암모늄)를 통해 정제하였다. (42.7 mg, 0.111 mmol, 99% 수율). 1H NMR (500MHz, DMSO-d6) δ 10.58 (br. s., 1H), 8.35 (d, J=4.6 Hz, 2H), 7.81 (s, 1H), 7.70 (d, J=8.9 Hz, 1H), 7.42 (d, J=5.2 Hz, 1H), 7.33 (d, J=8.5 Hz, 1H), 4.18 - 4.12 (m, 1H), 4.08 - 4.01 (m, 1H), 3.39 - 3.35 (m, 1H), 2.13 (s, 3H), 1.86 - 1.74 (m, 1H), 1.50 (d, J=6.1 Hz, 1H), 1.45 - 1.36 (m, 1H), 0.92 (dd, J=10.2, 6.6 Hz, 6H); LCMS (ESI) m/e 362.2 [(M+H)+, 계산치 C19H25ClN3O3, 362.2]; LC/MS 체류시간 (방법 B): tR = 1.69분.
실시예 9
(S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3,5-디플루오로페닐)피리딘-2-일)아세트아미드
실시예 1에 기재된 바와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-(4-브로모-2,6-디플루오로페녹시)-4-메틸펜탄-2-일)카르바메이트.
1H NMR (400 MHz, 클로로포름-d) δ 7.42 - 7.33 (m, 2H), 6.89 (d, J = 8.8 Hz, 1H), 4.78 - 4.61 (m, 1H), 4.09 - 3.90 (m, 3H), 1.68 (dq, J = 13.3, 6.7 Hz, 1H), 1.51 (t, J = 6.8 Hz, 2H), 1.45 (s, 9H), 0.95 (dd, J = 6.6, 5.4 Hz, 6H); LCMS (ESI) m/e 478.1 [(M+Na)+, 계산치 C18H25Br1F3N1Na1O4, 478.0]; LC/MS 체류시간 (방법 B): tR = 2.45분.
파트 B: (S)-tert-부틸 (1-(4-(2-아세트아미도피리딘-4-일)-2,6-디플루오로페녹시)-4-메틸펜탄-2-일)카르바메이트.
1H NMR (400 MHz, 클로로포름-d) δ 9.01 (s, 1H), 8.42 (s, 1H), 8.28 (d, J = 5.3 Hz, 1H), 7.22 (d, J = 8.7 Hz, 2H), 7.15 (dd, J = 5.4, 1.7 Hz, 1H), 4.88 (d, J = 9.0 Hz, 1H), 4.24 - 4.13 (m, 2H), 3.94 (s, 1H), 2.24 (s, 3H), 1.74 (dt, J = 13.5, 6.7 Hz, 1H), 1.55 (t, J = 7.3 Hz, 2H), 1.24 (s, 9H), 0.97 (d, J = 6.5 Hz, 6H); 19F NMR (376 MHz, 클로로포름-d) δ -126.89; LCMS (ESI) m/e 464.2 [(M+H)+, 계산치 C24H32F2N3O4, 464.2]; LC/MS 체류시간 (방법 A): tR = 2.24분.
파트 C: (S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3,5-디플루오로페닐)피리딘-2-일)아세트아미드.
(S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3,5-디플루오로페닐)피리딘-2-일)아세트아미드 (48.4 mg, 0.152 mmol, 최종 단계에 대해서 99% 수율)를 회백색 발포체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 10.62 (s, 1H), 8.37 (d, J = 5.3 Hz, 1H), 8.32 (s, 1H), 7.59 - 7.48 (m, 2H), 7.42 (dd, J = 5.2, 1.8 Hz, 1H), 4.16 (dd, J = 10.0, 4.5 Hz, 1H), 4.07 (dd, J = 9.9, 5.7 Hz, 1H), 3.24 (dq, J = 10.5, 5.8 Hz, 1H), 2.13 (s, 3H), 1.82 - 1.74 (m, 1H), 1.46 (ddd, J = 13.7, 8.1, 5.8 Hz, 1H), 1.35 (ddd, J = 13.9, 8.1, 6.3 Hz, 1H), 0.90 (dd, J = 9.0, 6.5 Hz, 6H); LCMS (ESI) m/e 364.1 [(M+H)+, 계산치 C19H24F2N3O2, 364.2]; LC/MS 체류시간 (방법 A): tR = 1.81분.
실시예 10
(S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-클로로-5-플루오로페닐)피리딘-2-일)아세트아미드
실시예 1에 기재된 바와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-(4-브로모-2,6-디플루오로페녹시)-4-메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 424.2 [(M+H)+, 계산치 C17H25Br1Cl1F1N1O3, 424.1]; LC/MS 체류시간 (방법 A): tR = 2.37분.
파트 B: (S)-tert-부틸 (1-(4-(2-아세트아미도피리딘-4-일)-2-클로로-6-플루오로페녹시)-4-메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 480.2 [(M+H)+, 계산치 C24H32F2N3O4, 480.2]; LC/MS 체류시간 (방법 B): tR = 2.28분.
파트 C: (S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-클로로-5-플루오로페닐)피리딘-2-일)아세트아미드.
(S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-클로로-5-플루오로페닐)피리딘-2-일)아세트아미드 (26.5 mg, 0.066 mmol, 최종 단계에 대해서 56% 수율)를 무색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 10.60 (s, 1H), 8.37 (d, J = 5.2 Hz, 1H), 8.30 (s, 1H), 7.67 (d, J = 9.5 Hz, 2H), 7.43 (d, J = 5.1 Hz, 1H), 4.04 (dd, J = 9.4, 4.7 Hz, 1H), 3.96 (dd, J = 9.5, 6.2 Hz, 1H), 3.11 (dq, J = 10.7, 5.1 Hz, 1H), 2.12 (s, 3H), 1.79 (dq, J = 13.6, 6.4 Hz, 1H), 1.41 (ddd, J = 13.6, 8.5, 5.2 Hz, 1H), 1.26 (ddd, J = 14.1, 8.6, 5.8 Hz, 1H), 0.91 (d, J = 6.5 Hz, 3H), 0.88 (d, J = 6.5 Hz, 3H); LCMS (ESI) m/e 380.2 [(M+H)+, 계산치 C19H24Cl1F1N3O2, 380.2]; LC/MS 체류시간 (방법 B): tR = 1.82분.
실시예 11
(S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-플루오로-5-(트리플루오로메틸)페닐)피리딘-2-일)아세트아미드
실시예 1에 기재된 바와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-(4-브로모-2-플루오로-6-(트리플루오로메틸)페녹시)-4-메틸펜탄-2-일)카르바메이트.
1H NMR (400 MHz, 클로로포름-d) δ 7.52 (t, J = 1.9 Hz, 1H), 7.47 (dd, J = 10.7, 2.4 Hz, 1H), 4.76 (d, J = 9.1 Hz, 1H), 4.19 (s, 2H), 3.96 (d, J = 7.7 Hz, 1H), 1.74 (dq, J = 13.5, 6.7 Hz, 1H), 1.54 (t, J = 7.1 Hz, 2H), 1.47 (s, 9H), 0.98 (d, J = 6.6 Hz, 6H); LCMS (ESI) m/e 480.0 [(M+Na)+, 계산치 C18H24Br1F4N1Na1O3, 480.1]; LC/MS 체류시간 (방법 B): tR = 2.50분.
파트 B: (S)-tert-부틸 (1-(4-(2-아세트아미도피리딘-4-일)-2-플루오로-6-(트리플루오로메틸)페녹시)-4-메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 536.2 [(M+Na)+, 계산치 C25H31F4Na1N3O4, 536.2]; LC/MS 체류시간 (방법 B): tR = 2.34분.
파트 C: (S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-플루오로-5-(트리플루오로메틸)페닐)피리딘-2-일)아세트아미드.
(S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-플루오로-5-(트리플루오로메틸)페닐)피리딘-2-일)아세트아미드 (49 mg, 0.116 mmol, 최종 단계에 대해서 75% 수율)를 무색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 10.63 (s, 1H), 8.39 (d, J = 5.3 Hz, 1H), 8.35 (s, 1H), 8.01 (dd, J = 12.9, 2.2 Hz, 1H), 7.74 (s, 1H), 7.48 (d, J = 5.4 Hz, 1H), 4.06 (p, J = 8.2 Hz, 2H), 3.12 - 3.03 (m, 1H), 2.13 (s, 3H), 1.82 (dt, J = 13.6, 7.2 Hz, 1H), 1.35 (ddd, J = 13.4, 8.9, 4.8 Hz, 1H), 1.22 (ddd, J = 13.8, 9.0, 5.5 Hz, 1H), 0.92 (d, J = 6.6 Hz, 3H), 0.88 (d, J = 6.6 Hz, 3H); LCMS (ESI) m/e 414.2 [(M+H)+, 계산치 C20H24F4N3O2, 414.2]; LC/MS 체류시간 (방법 A): tR = 2.01분.
실시예 12
(S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-2,5-디플루오로페닐)피리딘-2-일)아세트아미드
실시예 1에 기재된 바와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-(4-브로모-2,5-디플루오로페녹시)-4-메틸펜탄-2-일)카르바메이트.
1H NMR (400 MHz, 클로로포름-d) δ 7.29 (t, J = 9.5 Hz, 1H), 6.81 (dd, J = 9.5, 7.3 Hz, 1H), 4.68 (s, 1H), 4.09 - 3.91 (m, 3H), 1.71 (dt, J = 13.4, 7.0 Hz, 1H), 1.53 (dd, J = 15.3, 7.8 Hz, 2H), 1.47 (s, 9H), 0.97 (dd, J = 6.6, 4.5 Hz, 6H); LCMS (ESI) m/e 408.0 [(M+H)+, 계산치 C17H25Br1F2N1O3, 408.1]; LC/MS 체류시간 (방법 A): tR = 2.40분.
파트 B: (S)-tert-부틸 (1-(4-(2-아세트아미도피리딘-4-일)-2,5-디플루오로페녹시)-4-메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 464.2 [(M+H)+, 계산치 C24H32F2N3O4, 464.3]; LC/MS 체류시간 (방법 A): tR = 2.29분.
파트 C: (S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-2,5-디플루오로페닐)피리딘-2-일)아세트아미드.
(S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-2,5-디플루오로페닐)피리딘-2-일)아세트아미드 (46.4 mg, 0.125 mmol, 최종 단계에 대해서 77% 수율)를 무색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 10.59 (s, 1H), 8.37 (d, J = 5.2 Hz, 1H), 8.29 (s, 1H), 7.54 (dd, J = 11.8, 7.3 Hz, 1H), 7.34 (dd, J = 12.3, 7.2 Hz, 1H), 7.26 (d, J = 5.2 Hz, 1H), 4.08 (dd, J = 9.8, 4.5 Hz, 1H), 3.98 (dd, J = 10.0, 6.4 Hz, 1H), 3.24 (p, J = 6.0 Hz, 1H), 2.11 (s, 3H), 1.80 (dq, J = 15.3, 8.4, 7.6 Hz, 1H), 1.35 (qt, J = 13.7, 6.8 Hz, 2H), 0.91 (dd, J = 14.1, 6.6 Hz, 6H); LCMS (ESI) m/e 364.2 [(M+H)+, 계산치 C19H24F2N3O2, 364.2]; LC/MS 체류시간 (방법 A): tR = 1.82분.
실시예 13
(S)-메틸 (4-(4-((2-아미노-4-메틸펜틸)옥시)-3-플루오로페닐)피리딘-2-일)카르바메이트
실시예 1에 기재된 바와 같이 제조하였다.
파트 A: (2-((메톡시카르보닐)아미노)피리딘-4-일)보론산
에탄올 (80 mL) 중 2-(디시클로헥실포스피노)-2',4',6'-트리이소프로필비페닐(0.079 g, 0.166 mmol), 아세트산칼륨(2.446 g, 24.92 mmol), 제2 세대 Xphos 전촉매 (0.065 g, 0.083 mmol), 메틸 (4-클로로피리딘-2-일)카르바메이트 (1.55 g, 8.31 mmol) 및 하이포이붕산 (1.117 g, 12.46 mmol)의 혼합물을 진공/N2 충전 주기를 통해 3회 탈기하였다. 반응 혼합물을 80℃에서 3시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 용매를 감압 하에 제거하고, 고체를 아세톤으로 세척하였다. 나머지 고체를 메탄올 및 CH2Cl2의 혼합물로 현탁시켰다. 현탁액을 여과하고, 여과물을 감압 하에 농축시켜 조 생성물을 고체로서 수득하였다. 고체를 물 중에 현탁시키고, 여과하였다. 고체를 아세톤으로 세척하여 (2-((메톡시카르보닐)아미노)피리딘-4-일)보론산 (702mg, 3.58 mmol, 43% 수율)을 회백색 고체로서 수득하였다. LCMS (ESI) m/e 197.2 [(M+H)+, 계산치 C7H10BN2O4, 197.1]; LC/MS 체류시간 (방법 B): tR = 0.46분.
파트 B: (S)-tert-부틸 (1-(4-(2-아미노피리딘-4-일)-2-플루오로페녹시)-4-메틸펜탄-2-일)카르바메이트.
1H NMR (400 MHz, 클로로포름-d) δ 9.86 (s, 1H), 8.35 (d, J = 5.4 Hz, 1H), 8.31 - 8.24 (m, 1H), 7.52 - 7.39 (m, 2H), 7.17 (dd, J = 5.4, 1.7 Hz, 1H), 7.06 (t, J = 8.6 Hz, 1H), 4.84 (d, J = 8.5 Hz, 1H), 4.15 - 3.99 (m, 3H), 3.87 (s, 3H), 1.80 - 1.67 (m, 1H), 1.56 (dt, J = 13.3, 7.8 Hz, 2H), 1.47 (s, 9H), 0.99 (d, J = 3.7 Hz, 3H), 0.97 (d, J = 3.6 Hz, 3H); 19F NMR (376 MHz, 클로로포름-d) δ -133.39; LCMS (ESI) m/e 462.2 [(M+H)+, 계산치 C24H33F1N3O5, 462.2]; LC/MS 체류시간 (방법 B): tR = 2.20분.
파트 C: (S)-메틸 (4-(4-((2-아미노-4-메틸펜틸)옥시)-3-플루오로페닐)피리딘-2-일)카르바메이트.
(S)-메틸 (4-(4-((2-아미노-4-메틸펜틸)옥시)-3-플루오로페닐)피리딘-2-일)카르바메이트 (33.2 mg, 0.091 mmol, 최종 단계에 대해서 93% 수율)를 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 10.26 (s, 1H), 8.30 (d, J = 5.3 Hz, 1H), 8.09 (s, 1H), 7.63 (dd, J = 12.7, 2.4 Hz, 1H), 7.55 - 7.49 (m, 1H), 7.37 (dd, J = 5.3, 1.9 Hz, 1H), 7.32 (t, J = 8.7 Hz, 1H), 3.97 (dd, J = 9.4, 5.0 Hz, 1H), 3.90 (dd, J = 9.4, 6.5 Hz, 1H), 3.71 (s, 3H), 3.12 (p, J = 5.6 Hz, 1H), 1.83 (dt, J = 14.1, 6.7 Hz, 1H), 1.33 (ddd, J = 13.4, 8.5, 4.9 Hz, 1H), 1.26 (ddd, J = 13.9, 8.7, 5.5 Hz, 1H), 0.92 (d, J = 6.6 Hz, 3H), 0.89 (d, J = 6.5 Hz, 3H); LCMS (ESI) m/e 362.1 [(M+H)+, 계산치 C19H25F1N3O3, 362.2]; LC/MS 체류시간 (방법 A): tR = 1.85분.
실시예 14
(S)-메틸 (4-(4-((2-아미노-4-메틸펜틸)옥시)-3-(이속사졸-5-일)페닐)피리딘-2-일)카르바메이트
실시예 1에 기재된 바와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-(4-브로모-2-(이속사졸-5-일)페녹시)-4-메틸펜탄-2-일)카르바메이트.
1H NMR (400 MHz, 클로로포름-d) δ 8.31 (s, 1H), 8.09 (d, J = 2.4 Hz, 1H), 7.46 (dd, J = 9.1, 2.6 Hz, 1H), 6.88 (d, J = 9.0 Hz, 2H), 4.60 (d, J = 8.9 Hz, 1H), 4.19 (d, J = 7.0 Hz, 1H), 4.02 (qd, J = 9.2, 5.2 Hz, 2H), 1.75 (dq, J = 13.6, 6.7 Hz, 1H), 1.46 (d, J = 12.0 Hz, 11H), 0.98 (d, J = 6.6 Hz, 6H); LCMS (ESI) m/e 461.0 [(M+Na)+, 계산치 C20H27Br1N2Na1O4, 461.1]; LC/MS 체류시간 (방법 B): tR = 2.41분.
파트 B: (S)-메틸 (4-(4-((2-Boc-아미노-4-메틸펜틸)옥시)-3-(이속사졸-5-일)페닐)피리딘-2-일)카르바메이트.
LCMS (ESI) m/e 511.4 [(M+H)+, 계산치 C27H35N4O6, 511.2]; LC/MS 체류시간 (방법 A): tR = 2.27분.
파트 C: (S)-메틸 (4-(4-((2-아미노-4-메틸펜틸)옥시)-3-(이속사졸-5-일)페닐)피리딘-2-일)카르바메이트.
(S)-메틸 (4-(4-((2-아미노-4-메틸펜틸)옥시)-3-(이속사졸-5-일)페닐)피리딘-2-일)카르바메이트 (10.9 mg, 0.027 mmol, 최종 단계에 대해서 34% 수율)를 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.74 (d, J = 1.7 Hz, 1H), 8.34 (d, J = 5.2 Hz, 1H), 8.19 (t, J = 2.4 Hz, 2H), 7.89 (dd, J = 8.7, 2.4 Hz, 1H), 7.44 (d, J = 5.3 Hz, 1H), 7.41 (d, J = 8.8 Hz, 1H), 7.05 (d, J = 1.9 Hz, 1H), 4.18 (dd, J = 9.7, 4.5 Hz, 1H), 4.09 (dd, J = 9.6, 6.3 Hz, 1H), 3.72 (s, 3H), 3.36 (d, J = 4.3 Hz, 1H), 1.83 (dt, J = 13.7, 6.7 Hz, 1H), 1.44 (dt, J = 13.6, 7.0 Hz, 1H), 1.41 - 1.32 (m, 1H), 0.92 (dd, J = 9.4, 6.6 Hz, 6H); LCMS (ESI) m/e 411.1 [(M+H)+, 계산치 C22H27N4O4, 411.2]; LC/MS 체류시간 (방법 B): tR = 1.63분.
실시예 15
(S)-2-((2-아미노-4-메틸펜틸)옥시)-5-(2-메틸피리딘-4-일)벤조니트릴
실시예 1에 기재된 바와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-(4-브로모-2-시아노페녹시)-4-메틸펜탄-2-일)카르바메이트.
1H NMR (400 MHz, 클로로포름-d) δ 7.68 (d, J = 2.5 Hz, 1H), 7.64 (dd, J = 8.9, 2.5 Hz, 1H), 6.91 (d, J = 8.9 Hz, 1H), 4.71 (s, 1H), 4.12 (t, J = 6.1 Hz, 1H), 4.10 - 3.98 (m, 2H), 1.79 - 1.67 (m, 1H), 1.59 (dd, J = 13.8, 6.9 Hz, 2H), 1.47 (s, 9H), 0.98 (dd, J = 6.5, 5.2 Hz, 6H); LCMS (ESI) m/e 397.1 [(M+H)+, 계산치 C18H26Br1N2O3, 397.1]; LC/MS 체류시간 (방법 A): tR = 2.22분.
파트 B: (S)-tert-부틸 (1-(2-시아노-4-(2-메틸피리딘-4-일)페녹시)-4-메틸펜탄-2-일)카르바메이트.
1H NMR (400 MHz, 클로로포름-d) δ 8.56 (d, J = 5.3 Hz, 1H), 7.84 (d, J = 2.3 Hz, 1H), 7.80 (dd, J = 8.8, 2.4 Hz, 1H), 7.31 (d, J = 1.7 Hz, 1H), 7.25 (dd, J = 5.3, 1.8 Hz, 1H), 7.12 (d, J = 8.8 Hz, 1H), 4.81 (d, J = 8.6 Hz, 1H), 4.21 - 4.11 (m, 2H), 4.10 - 4.03 (m, 1H), 2.64 (s, 3H), 1.76 - 1.68 (m, 1H), 1.60 (tt, J = 15.6, 6.2 Hz, 2H), 1.46 (s, 9H), 0.98 (dd, J = 6.5, 5.0 Hz, 6H); LCMS (ESI) m/e 410.2 [(M+H)+, 계산치 C24H32N3O3, 410.2]; LC/MS 체류시간 (방법 A): tR = 2.18분.
파트 C: (S)-2-((2-아미노-4-메틸펜틸)옥시)-5-(2-메틸피리딘-4-일)벤조니트릴.
(48.4 mg, 0.152 mmol, 최종 단계에 대해서 99% 수율)을 회백색 고체로서 수득하였다.
1H NMR (500 MHz, DMSO-d6) δ 8.49 (d, J = 5.3 Hz, 1H), 8.24 (d, J = 2.4 Hz, 1H), 8.11 (dd, J = 8.9, 2.4 Hz, 1H), 7.65 (s, 1H), 7.57 - 7.52 (m, 1H), 7.38 (d, J = 8.9 Hz, 1H), 4.09 (dd, J = 9.5, 5.1 Hz, 1H), 4.01 (dd, J = 9.5, 6.2 Hz, 1H), 3.16 (dq, J = 10.8, 5.4 Hz, 1H), 2.53 (s, 3H), 2.51 (s, 2H), 1.83 (dq, J = 12.8, 6.5 Hz, 1H), 1.39 (ddd, J = 13.5, 8.4, 5.1 Hz, 1H), 1.30 (ddd, J = 13.8, 8.6, 5.9 Hz, 1H), 0.93 (d, J = 6.6 Hz, 3H), 0.89 (d, J = 6.6 Hz, 3H); LCMS (ESI) m/e 310.1 [(M+H)+, 계산치 C19H24N3O1, 310.2]; LC/MS 체류시간 (방법 A): tR = 1.82분.
실시예 16
(S)-2-((2-아미노-4-메틸펜틸)옥시)-5-(2-메톡시피리딘-4-일)벤조니트릴
실시예 1에 기재된 바와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-(2-시아노-4-(2-메틸피리딘-4-일)페녹시)-4-메톡시펜탄-2-일)카르바메이트.
1H NMR (500 MHz, 클로로포름-d) δ 8.20 (dd, J = 5.4, 0.7 Hz, 1H), 7.79 (d, J = 2.3 Hz, 1H), 7.76 (dd, J = 8.7, 2.4 Hz, 1H), 7.11 - 7.05 (m, 1H), 7.00 (dd, J = 5.4, 1.6 Hz, 1H), 6.85 (dd, J = 1.6, 0.7 Hz, 1H), 4.84 (d, J = 8.7 Hz, 1H), 4.20 - 4.14 (m, 1H), 4.11 (ddd, J = 8.7, 4.6, 2.5 Hz, 1H), 4.07 - 4.03 (m, 1H), 3.97 (s, 3H), 1.76 - 1.66 (m, 1H), 1.64 - 1.52 (m, 2H), 1.44 (s, 9H), 0.96 (dd, J = 6.6, 5.7 Hz, 6H); LCMS (ESI) m/e 426.2 [(M+H)+, 계산치 C24H32N3O4, 426.2]; LC/MS 체류시간 (방법 A): tR = 2.27분.
파트 B: (S)-2-((2-아미노-4-메틸펜틸)옥시)-5-(2-메톡시피리딘-4-일)벤조니트릴.
(S)-2-((2-아미노-4-메틸펜틸)옥시)-5-(2-메톡시피리딘-4-일)벤조니트릴 (28.6 mg, 0.088 mmol, 최종 단계에 대해서 60% 수율임)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.23 (dd, J = 6.7, 3.9 Hz, 2H), 8.10 (dd, J = 8.9, 2.4 Hz, 1H), 7.41 - 7.32 (m, 2H), 7.18 (s, 1H), 4.05 (dd, J = 9.3, 5.1 Hz, 1H), 3.98 (dd, J = 9.4, 6.3 Hz, 1H), 3.90 (s, 3H), 3.12 (dq, J = 10.4, 5.4 Hz, 1H), 1.83 (tt, J = 13.3, 6.7 Hz, 1H), 1.36 (ddd, J = 13.4, 8.5, 4.9 Hz, 1H), 1.26 (ddd, J = 13.9, 8.8, 5.7 Hz, 1H), 0.92 (d, J = 6.6 Hz, 3H), 0.89 (d, J = 6.6 Hz, 3H); LCMS (ESI) m/e 326.1 [(M+H)+, 계산치 C19H24N3O2, 326.2]; LC/MS 체류시간 (방법 A): tR = 1.88분.
실시예 17
(S)-2-((2-아미노-4-메틸펜틸)옥시)-5-(2-(트리플루오로메틸)피리딘-4-일)벤조니트릴
실시예 1에 기재된 바와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-(2-시아노-4-(2-(트리플루오로메틸)피리딘-4-일)페녹시)-4-메틸펜탄-2-일)카르바메이트.
1H NMR (400 MHz, 클로로포름-d) δ 8.80 (d, J = 5.1 Hz, 1H), 7.89 (d, J = 2.4 Hz, 1H), 7.86 (dd, J = 8.8, 2.5 Hz, 1H), 7.84 - 7.80 (m, 1H), 7.64 (dd, J = 5.1, 1.8 Hz, 1H), 7.19 (d, J = 8.8 Hz, 1H), 4.79 (d, J = 8.5 Hz, 1H), 4.26 - 4.14 (m, 2H), 4.11 - 4.04 (m, 1H), 1.73 (p, J = 6.5 Hz, 1H), 1.66 - 1.54 (m, 2H), 1.46 (s, 9H), 0.98 (t, J = 6.3 Hz, 6H); 19F NMR (376 MHz, 클로로포름-d) δ -68.06; LCMS (ESI) m/e 486.2 [(M+Na)+, 계산치 C24H28F3Na1N3O3, 486.2]; LC/MS 체류시간 (방법 B): tR = 2.35분.
파트 B: (S)-2-((2-아미노-4-메틸펜틸)옥시)-5-(2-(트리플루오로메틸)피리딘-4-일)벤조니트릴.
(S)-2-((2-아미노-4-메틸펜틸)옥시)-5-(2-(트리플루오로메틸)피리딘-4-일)벤조니트릴 (34.3 mg, 0.093 mmol, 최종 단계에 대해서 93% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.81 (d, J = 5.2 Hz, 1H), 8.46 (d, J = 2.9 Hz, 1H), 8.34 - 8.21 (m, 2H), 8.11 (d, J = 5.1 Hz, 1H), 7.42 (d, J = 8.9 Hz, 1H), 4.08 (dd, J = 9.9, 5.2 Hz, 1H), 4.05 - 3.95 (m, 1H), 3.13 (d, J = 7.5 Hz, 1H), 1.85 (t, J = 7.0 Hz, 1H), 1.43 - 1.32 (m, 1H), 1.27 (q, J = 11.7, 9.8 Hz, 1H), 0.93 (d, J = 6.4 Hz, 3H), 0.89 (d, J = 6.4 Hz, 3H); LCMS (ESI) m/e 364.1 [(M+H)+, 계산치 C19H21F3N3O1, 364.2]; LC/MS 체류시간 (방법 B): tR = 1.97분.
실시예 18
(S)-1-(2-(이속사졸-5-일)-4-(2-메틸피리딘-4-일)페녹시)-4-메틸펜탄-2-아민
실시예 1에 기재된 바와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-(2-(이속사졸-5-일)-4-(2-메틸피리딘-4-일)페녹시)-4-메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 452.1 [(M+H)+, 계산치 C26H34N3O4, 452.2]; LC/MS 체류시간 (방법 B): tR = 2.03분.
파트 B: (S)-1-(2-(이속사졸-5-일)-4-(2-메틸피리딘-4-일)페녹시)-4-메틸펜탄-2-아민.
(S)-1-(2-(이속사졸-5-일)-4-(2-메틸피리딘-4-일)페녹시)-4-메틸펜탄-2-아민 (14.6 mg, 0.041 mmol, 최종 단계에 대해서 49% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.72 (d, J = 1.9 Hz, 1H), 8.49 (d, J = 5.3 Hz, 1H), 8.24 (d, J = 2.4 Hz, 1H), 7.93 (dd, J = 8.8, 2.4 Hz, 1H), 7.65 (s, 1H), 7.59 - 7.52 (m, 1H), 7.37 (d, J = 8.8 Hz, 1H), 7.03 (d, J = 1.9 Hz, 1H), 4.12 (dd, J = 9.6, 4.6 Hz, 1H), 4.04 (dd, J = 9.5, 6.3 Hz, 1H), 3.27 (dq, J = 10.3, 5.3 Hz, 1H), 2.51 (s, 3H), 1.83 (dt, J = 14.0, 6.7 Hz, 1H), 1.40 (ddd, J = 13.4, 8.4, 5.2 Hz, 1H), 1.32 (ddd, J = 13.7, 8.5, 5.7 Hz, 1H), 0.91 (dd, J = 10.5, 6.5 Hz, 6H); LCMS (ESI) m/e 352.1 [(M+H)+, 계산치 C21H26N3O2, 352.2]; LC/MS 체류시간 (방법 B): tR = 1.50분.
실시예 19
(S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-일)아세트아미드
파트 A: (S)-1-(4-브로모-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
50 mL 둥근 바닥 플라스크에 테트라히드로푸란 (1.5 mL) 중 (S)-2-아미노-2,4-디메틸펜탄-1-올 (66.1 mg, 0.504 mmol)을 첨가하여 무색 용액을 수득하였다. 포타슘 tert-부톡시드 (0.604 mL, 0.604 mmol) (THF 중 1.0 M)를 질소 하에 적가하였다. 5분 후, 4-브로모-1-플루오로-2-(트리플루오로메틸)벤젠 (0.079 mL, 0.604 mmol)을 1 부분으로 첨가하였다. 혼합물을 실온에서 2시간 동안 교반하였다. 반응물을 물로 켄칭하고, EtOAc로 추출하였다. 유기 층을 염수로 세척하고, 건조 (Na2SO4)시키고, 감압 하에 농축시켜 조 (S)-1-(4-브로모-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (146 mg, o.412 mmol, 82% 수율)을 황갈색 오일로서 수득하였으며, 이를 그대로 사용하였다. 1H NMR (500 MHz, 클로로포름-d) δ 7.70 (d, J = 2.5 Hz, 1H), 7.59 (dd, J = 8.8, 2.5 Hz, 1H), 6.86 (d, J = 8.8 Hz, 1H), 3.80 - 3.72 (m, 2H), 1.83 - 1.73 (m, 1H), 1.53 - 1.44 (m, 2H), 1.23 (s, 3H), 0.98 (dd, J = 12.2, 6.7 Hz, 6H); 19F NMR (470 MHz, 클로로포름-d) δ -62.61.; LCMS (ESI) m/e 354.0 [(M+H)+, 계산치 C14H20Br1F3N1O1, 354.1]; LC/MS 체류시간 (방법 B): tR = 2.14분.
파트 B: (S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-일)아세트아미드
2 mL 바이알에 질소 하에 디옥산 (0.5 mL) 중 (S)-1-(4-브로모-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (43.5 mg, 0.123 mmol), N-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-2-일)아세트아미드 (26.5 mg, 0.147 mmol) (실시예 1, 파트 A에 기재된 바와 같이 제조됨), 및 Na2CO3 (0.184 mL, 0.368 mmol)을 첨가하여 무색 현탁액을 수득하였다. 1,1'-비스(디페닐포스피노)페로센 팔라듐(II) 디클로라이드, 톨루엔 (5.05 mg, 6.14 μmol)을 질소 하에 첨가하였다. 바이알을 밀봉하고 130℃ (마이크로웨이브)에서 2시간 동안 가열하였다 (2시간 동안의 100℃ 오일 가열이 좋으며, 모든 다른 실시예에 대해 사용함). 혼합물을 실온으로 냉각시키고, EtOAc로 희석한 다음, Na2SO4의 플러그에 통과시켰다. 유기 용액을 감압 하에 농축시켰다. 잔류물을 역상 HPLC (아세토니트릴: 10 mM 암모늄 포함 물)에 의해 정제하여 (S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-일)아세트아미드 (24 mg, 0.057 mmol, 47% 수율)를 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 10.58 (s, 1H), 8.36 (d, J = 5.2 Hz, 2H), 7.97 (t, J = 8.1 Hz, 1H), 7.89 (s, 1H), 7.44 (d, J = 5.4 Hz, 1H), 7.38 (d, J = 8.7 Hz, 1H), 3.86 (q, J = 8.8 Hz, 2H), 2.13 (s, 3H), 1.79 (dq, J = 10.2, 5.2, 4.0 Hz, 1H), 1.39 (d, J = 5.5 Hz, 2H), 1.12 (s, 3H), 0.91 (d, J = 6.6 Hz, 6H); LCMS (ESI) m/e 410.2 [(M-H)-, 계산치 C20H23F3N3O2, 410.2]; LC/MS 체류시간 (방법 B): tR = 1.87분.
실시예 20
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-일)카르바메이트
실시예 19에 기재된 바와 같이 제조하여 회백색 고체로서의 (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-일)카르바메이트 (22.9 mg, 0.051 mmol, 38% 수율)를 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 10.29 (s, 1H), 8.32 (d, J = 5.3 Hz, 1H), 8.11 (s, 1H), 7.99 (d, J = 8.7 Hz, 1H), 7.90 (s, 1H), 7.39 (dd, J = 12.5, 7.0 Hz, 2H), 3.87 (q, J = 8.8 Hz, 2H), 3.71 (s, 3H), 1.79 (dq, J = 10.8, 5.6, 4.8 Hz, 1H), 1.40 (d, J = 5.6 Hz, 2H), 1.13 (s, 3H), 0.91 (d, J = 6.6 Hz, 6H); LCMS (ESI) m/e 426.3 [(M-H)+, 계산치 C21H27F3N3O3, 426.2]; LC/MS 체류시간 (방법 A): tR = 2.23분.
실시예 21
(S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리딘-2-일)아세트아미드
실시예 19에 기재된 바와 같이 제조하였다.
파트 A: (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-브로모벤조니트릴.
1H NMR (400 MHz, 클로로포름-d) δ 7.68 (d, J = 2.5 Hz, 1H), 7.63 (dd, J = 8.9, 2.4 Hz, 1H), 6.86 (d, J = 9.0 Hz, 1H), 3.84 - 3.77 (m, 2H), 1.87 - 1.74 (m, 1H), 1.59 - 1.53 (m, 2H), 1.27 (s, 3H), 1.00 (dd, J = 8.3, 6.6 Hz, 6H); LCMS (ESI) m/e 311.1, 313.1 Br 패턴 [(M+H)+, 계산치 C14H20BrN2O, 311.1]; LC/MS 체류시간 (방법 A): tR = 2.01분.
파트 B: (S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리딘-2-일)아세트아미드.
회백색 고체로서의 (S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리딘-2-일)아세트아미드 (28.9 mg, 0.078 mmol, 70% 수율)를 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 10.58 (s, 1H), 8.44 - 8.29 (m, 2H), 8.12 (s, 1H), 8.00 (d, J = 8.9 Hz, 1H), 7.44 (d, J = 5.3 Hz, 1H), 7.39 (d, J = 8.8 Hz, 1H), 3.91 (t, J = 6.7 Hz, 2H), 2.13 (s, 3H), 1.82 (p, J = 6.2 Hz, 1H), 1.43 (t, J = 5.4 Hz, 2H), 1.15 (s, 3H), 0.93 (dd, J = 6.7, 3.7 Hz, 6H); LCMS (ESI) m/e 367.3 [(M+H)+, 계산치 C21H27N4O2, 367.2]; LC/MS 체류시간 (방법 A): tR = 1.82분.
실시예 22
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리딘-2-일)카르바메이트
실시예 19에 기재된 바와 같이 제조하여 회백색 고체로서의 (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리딘-2-일)카르바메이트 (21.1 mg, 0.053 mmol, 47% 수율)를 제조하였다. 1H NMR (500 MHz, DMSO-d6) δ 10.29 (s, 1H), 8.32 (d, J = 5.3 Hz, 1H), 8.13 (s, 1H), 8.10 (s, 1H), 8.01 (d, J = 9.1 Hz, 1H), 7.40 (dd, J = 11.9, 7.1 Hz, 2H), 3.91 (t, J = 6.5 Hz, 2H), 3.71 (s, 3H), 1.81 (dq, J = 12.5, 6.2 Hz, 1H), 1.42 (q, J = 8.2, 6.6 Hz, 2H), 1.15 (s, 3H), 0.93 (dd, J = 6.8, 3.8 Hz, 6H); LCMS (ESI) m/e 405.2 [(M+Na)+, 계산치 C21H26N4Na1O3, 405.2]; LC/MS 체류시간 (방법 B): tR = 1.87분.
실시예 23
(S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(디플루오로메틸)페닐)피리딘-2-일)아세트아미드
실시예 19에 기재된 바와 같이 제조하였다.
파트 A: (S)-1-(4-브로모-2-(디플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민.
1H NMR (400 MHz, 클로로포름-d) δ 7.67 (dd, J = 2.4, 1.1 Hz, 1H), 7.53 (ddt, J = 8.8, 2.3, 1.1 Hz, 1H), 6.93 - 6.70 (m, 2H), 3.79 - 3.72 (m, 2H), 1.85 - 1.73 (m, 1H), 1.52 - 1.47 (m, 2H), 1.23 (s, 3H), 0.99 (dd, J = 7.6, 6.6 Hz, 6H); 19F NMR (376 MHz, 클로로포름-d) δ -116.21; LCMS (ESI) m/e 336.1 [(M+H)+, 계산치 C14H21Br1F2N1O1, 336.1]; LC/MS 체류시간 (방법 A): tR = 2.18분.
파트 B: (S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(디플루오로메틸)페닐)피리딘-2-일)아세트아미드.
회백색 고체로서의 (S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(디플루오로메틸)페닐)피리딘-2-일)아세트아미드 (13 mg, 0.033 mmol, 32% 수율)를 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 10.56 (s, 1H), 8.45 - 8.29 (m, 2H), 7.87 (d, J = 8.7 Hz, 1H), 7.82 (s, 1H), 7.49 - 7.12 (m, 3H), 3.84 (s, 2H), 2.13 (s, 3H), 1.79 (dt, J = 14.1, 7.3 Hz, 1H), 1.47 - 1.34 (m, 2H), 1.14 (s, 3H), 0.92 (dd, J = 11.3, 6.6 Hz, 6H); LCMS (ESI) m/e 392.3 [(M+H)+, 계산치 C21H28F2N3O2, 392.2]; LC/MS 체류시간 (방법 A): tR = 1.90분.
실시예 24
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(디플루오로메틸)페닐)피리딘-2-일)카르바메이트
실시예 19에 기재된 바와 같이 제조하여 회백색 고체로서의 (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(디플루오로메틸)페닐)피리딘-2-일)카르바메이트 (15.4 mg, 0.037 mmol, 35% 수율)를 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 10.26 (s, 1H), 8.31 (d, J = 5.3 Hz, 1H), 8.11 (s, 1H), 7.91 - 7.85 (m, 1H), 7.83 (s, 1H), 7.42 - 7.13 (m, 3H), 3.84 (s, 2H), 3.70 (s, 3H), 1.79 (dt, J = 12.8, 6.4 Hz, 1H), 1.41 (qd, J = 14.0, 5.6 Hz, 2H), 1.14 (s, 3H), 0.92 (dd, J = 11.4, 6.6 Hz, 6H); LCMS (ESI) m/e 408.3 [(M+H)+, 계산치 C21H28F2N3O3, 408.2]; LC/MS 체류시간 (방법 A): tR = 2.00분.
실시예 25
(S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메톡시)페닐)피리딘-2-일)아세트아미드
실시예 19에 기재된 바와 같이 제조하였다.
파트 A: (S)-1-(4-브로모-2-(트리플루오로메톡시)페녹시)-2,4-디메틸펜탄-2-아민.
1H NMR (400 MHz, 클로로포름-d) δ 7.41 - 7.34 (m, 2H), 6.87 (d, J = 8.6 Hz, 1H), 3.76 - 3.72 (m, 2H), 1.83 - 1.76 (m, 1H), 1.49 - 1.47 (m, 2H), 1.23 (s, 3H), 1.01 - 0.98 (m, 6H); 19F NMR (376 MHz, 클로로포름-d) δ -58.22; LCMS (ESI) m/e 370.1 [(M+H)+, 계산치 C14H20Br1F3N1O2, 370.1]; LC/MS 체류시간 (방법 A): tR = 2.33분.
파트 B: (S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메톡시)페닐)피리딘-2-일)아세트아미드.
회백색 고체로서의 (S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메톡시)페닐)피리딘-2-일)아세트아미드 (14.1 mg, 0.032 mmol, 36% 수율)를 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 10.57 (s, 1H), 8.35 (d, J = 4.6 Hz, 2H), 7.74 (d, J = 8.8 Hz, 1H), 7.70 (s, 1H), 7.41 (d, J = 5.1 Hz, 1H), 7.38 (d, J = 8.6 Hz, 1H), 3.83 (t, J = 7.3 Hz, 2H), 2.12 (s, 3H), 1.81 (dt, J = 13.1, 6.7 Hz, 1H), 1.39 (q, J = 7.6, 6.3 Hz, 2H), 1.13 (s, 3H), 0.92 (t, J = 5.1 Hz, 6H); LCMS (ESI) m/e 426.2 [(M+H)+, 계산치 C21H27F3N3O3, 426.2]; LC/MS 체류시간 (방법 A): tR = 2.08분.
실시예 26
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메톡시)페닐)피리딘-2-일)카르바메이트
실시예 19에 기재된 바와 같이 제조하여 회백색 고체로서의 (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메톡시)페닐)피리딘-2-일)카르바메이트 (11.5 mg, 0.026 mmol, 27% 수율)를 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 10.28 (s, 1H), 8.31 (d, J = 5.2 Hz, 1H), 8.10 (s, 1H), 7.75 (d, J = 8.6 Hz, 1H), 7.71 (s, 1H), 7.43 - 7.34 (m, 2H), 3.86 - 3.80 (m, 2H), 3.71 (s, 3H), 1.81 (dt, J = 12.7, 6.4 Hz, 1H), 1.39 (q, J = 8.2, 6.3 Hz, 2H), 1.13 (s, 3H), 0.92 (dd, J = 6.7, 3.8 Hz, 6H); LCMS (ESI) m/e 442.2 [(M+H)+, 계산치 C21H27F3N3O4, 442.2]; LC/MS 체류시간 (방법 B): tR = 2.00분.
실시예 27
(S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-플루오로페닐)피리딘-2-일)아세트아미드
실시예 19에 기재된 바와 같이 제조하였다.
파트 A: (S)-1-(2-플루오로페녹시)-2,4-디메틸펜탄-2-아민.
LCMS (ESI) m/e 226.3 [(M+H)+, 계산치 C13H21F1N1O1, 226.2]; LC/MS 체류시간 (방법 B): tR = 1.93분.
파트 B: (S)-1-(4-브로모-2-(트리플루오로메톡시)페녹시)-2,4-디메틸펜탄-2-아민
100 mL 둥근 바닥 플라스크에 CHCl3 (2 mL) 중 (S)-1-(2-플루오로페녹시)-2,4-디메틸펜탄-2-아민 (83.4 mg, 0.370 mmol)을 첨가하여 무색 용액을 수득하였다. Br2 (0.021 mL, 0.407 mmol)를 첨가하였다. 혼합물을 45℃에서 15시간 동안 교반하였다. 반응 혼합물을 실온으로 냉각시키고, EtOAc로 희석한 다음, 수성 중아황산나트륨 용액으로 처리하였다. 층을 분리하였다. 유기 층을 물, 염수로 세척하고, 건조 (Na2SO4)시키고, 감압 하에 농축시켜 (S)-1-(4-브로모-2-(트리플루오로메톡시)페녹시)-2,4-디메틸펜탄-2-아민 (84 mg, 0.276 mmol, 75% 수율)을 수득하였다. 조 물질을 그대로 사용하였다. LCMS (ESI) m/e 304.1 [(M+H)+, 계산치 C13H20Br1F1N1O1, 304.1]; LC/MS 체류시간 (방법 A): tR = 2.05분.
파트 C: (S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-플루오로페닐)피리딘-2-일)아세트아미드.
회백색 고체로서의 (S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-플루오로페닐)피리딘-2-일)아세트아미드 (14.5 mg, 0.039 mmol, 31% 수율)를 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 10.55 (s, 1H), 8.33 (d, J = 6.0 Hz, 2H), 7.61 (d, J = 12.3 Hz, 1H), 7.52 (d, J = 8.8 Hz, 1H), 7.39 (d, J = 5.4 Hz, 1H), 7.30 (t, J = 8.8 Hz, 1H), 3.84 - 3.76 (m, 2H), 2.12 (s, 3H), 1.81 (p, J = 6.4 Hz, 1H), 1.38 (q, J = 7.9, 6.8 Hz, 2H), 1.12 (s, 3H), 0.93 (t, J = 6.6 Hz, 6H); LCMS (ESI) m/e 360.2 [(M+H)+, 계산치 C20H27F1N3O2, 360.2]; LC/MS 체류시간 (방법 A): tR = 1.82분.
실시예 28
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-플루오로페닐)피리딘-2-일)카르바메이트
실시예 19에 기재된 바와 같이 제조하여 회백색 고체로서의 (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-플루오로페닐)피리딘-2-일)카르바메이트 (17.1 mg, 0.044 mmol, 30% 수율)를 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 10.25 (s, 1H), 8.29 (d, J = 5.3 Hz, 1H), 8.09 (s, 1H), 7.62 (d, J = 12.4 Hz, 1H), 7.53 (d, J = 8.6 Hz, 1H), 7.36 (d, J = 5.4 Hz, 1H), 7.30 (t, J = 8.7 Hz, 1H), 3.82 (d, J = 2.8 Hz, 2H), 3.70 (s, 3H), 1.86 - 1.74 (m, 1H), 1.46 - 1.33 (m, 2H), 1.13 (s, 3H), 0.93 (t, J = 6.8 Hz, 6H); LCMS (ESI) m/e 376.2 [(M+H)+, 계산치 C20H27F1N3O3, 376.2]; LC/MS 체류시간 (방법 A): tR = 1.92분.
실시예 29
메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리딘-2-일)카르바메이트
파트 A: 벤질 (1-(4-브로모-2-클로로페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
4-브로모-2-클로로페놀 (0.074 g, 0.354 mmol), 탄산칼륨 (0.037 g, 0.266 mmol) 및 벤질 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (0.058 g, 0.177 mmol)의 NMP (0.3 mL) 현탁액을 50℃에서 밤새 가열하였다. 반응물을 에틸 아세테이트로 희석하고, NaOH (1N) (2X) 및 물 (1X)로 세척하였다. 에틸 아세테이트 층을 분리하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 조 물질을 추가 정제 없이 사용하였다. LCMS (ESI) m/e 476.1 [(M+Na)+, 계산치 C21H25BrClNaNO3, 476.1]; LC/MS 체류시간 (방법 B): tR = 2.56분.
파트 B: Cbz 메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리딘-2-일)카르바메이트
디옥산 (1 mL) (탈기됨) 중 탄산나트륨 (0.177 ml, 0.354 mmol), 1,1'-비스(디페닐포스피노)페로센-팔라듐(II)디클로라이드 디클로로메탄 착물 (10.12 mg, 0.012 mmol), (2-((메톡시카르보닐)아미노)피리딘-4-일)보론산 (0.035 g, 0.177 mmol) 및 벤질 (1-(4-브로모-2-클로로페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.080 g, 0.177 mmol)의 혼합물을 85℃에서 밤새 가열하였다. 반응물을 에틸 아세테이트로 희석하고, 물 (3X)로 세척하였다. 수성 층을 에틸 아세테이트로 추출하였다. 에틸 아세테이트 층을 합하고, 염수로 세척하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (헥산 중 0에서 30% 에틸 아세테이트)에 의해 정제하여 Cbz 메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리딘-2-일)카르바메이트 (56.5 mg, 0.107 mmol, 2 단계에 대해서 61% 수율)를 황갈색 발포체로서 수득하였다. (0.565g, 61% 수율). LCMS (ESI) m/e 548.2 [(M+Na)+, 계산치 C28H32ClN3O5Na, 548.2]; LC/MS 체류시간 (방법 B): tR = 2.25분.
파트 C: 메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리딘-2-일)카르바메이트
트리에틸실란(0.026 mL, 0.161 mmol)을 실온에서 아세트산팔라듐 (II)(2.2 mg, 9.80 μmol) 및 트리에틸아민(1 방울)의 CH2Cl2 (0.5 mL) 현탁액에 첨가하였다. 이 용액을 실온에서 10분 동안 교반한 후, Cbz 보호된 메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리딘-2-일)카르바메이트 (0.0565 g, 0.107 mmol) (Cbz 보호된 메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리딘-2-일)카르바메이트 (0.0565 g, 0.107 mmol)를 함유하는 플라스크를 CH2Cl2 (0.5 mL)로 헹구고, 반응 혼합물에 첨가함)의 CH2Cl2 (0.5 mL) 용액을 첨가하였다. 상기 반응물을 실온에서 밤새 교반하였다. 용매를 감압 하에 제거하고, 잔류물을 역상 HPLC (아세토니트릴/물/10 nM 아세트산암모늄)에 의해 정제하여 메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리딘-2-일)카르바메이트 (29.6mg, 0.076 mmol, 70% 수율)를 회백색 고체로서 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 10.27 (br. s., 1H), 8.30 (d, J=5.2 Hz, 1H), 8.08 (s, 1H), 7.79 (s, 1H), 7.68 (d, J=8.2 Hz, 1H), 7.37 (d, J=5.2 Hz, 1H), 7.26 (d, J=8.5 Hz, 1H), 3.82 (d, J=2.4 Hz, 2H), 3.70 (s, 3H), 1.85 - 1.77 (m, 1H), 1.42 (br. s., 2H), 1.14 (s, 3H), 0.92 (m, 6H); LCMS (ESI) m/e 392.2 [(M+H)+, 계산치 C20H27ClN3O3, 392.2]; LC/MS 체류시간 (방법 B): tR = 1.75분.
실시예 30
메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리딘-2-일)카르바메이트
실시예 29에 기재된 바와 같이 제조하였다.
파트 A: 벤질 (1-(4-브로모-2-메틸페녹시)-2,4-디메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 456.1 [(M+Na)+, 계산치 C22H28BrNO3Na, 456.1]; LC/MS 체류시간 (방법 B): tR = 2.56분.
파트 B: Cbz 메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리딘-2-일)카르바메이트.
LCMS (ESI) m/e 506.1 [(M+H)+, 계산치 C29H36N3O5, 506.3]; LC/MS 체류시간 (방법 B): tR = 2.21분.
파트 C: 메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리딘-2-일)카르바메이트.
회백색 고체로서의 메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리딘-2-일)카르바메이트 (3.7 mg, 9.96 umol, 35% 수율)를 수득하였다. 1H NMR (600MHz, DMSO-d6) δ 10.11 (br. s., 1H), 8.26 (d, J=5.1 Hz, 1H), 8.08 (s, 1H), 7.53 (br. s., 2H), 7.34 - 7.27 (m, 1H), 7.03 (d, J=9.2 Hz, 1H), 3.77 - 3.68 (m, 5H), 2.28 (s, 3H), 1.86 - 1.76 (m, 1H), 1.42 (t, J=5.0 Hz, 2H), 1.14 (s, 3H), 0.93 (m, 6H); LCMS (ESI) m/e 372.3 [(M+H)+, 계산치 C21H30N3O3, 372.2]; LC/MS 체류시간 (방법 B): tR = 1.71분.
실시예 31
메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-2,3-디메틸페닐)피리딘-2-일)카르바메이트
실시예 29에 기재된 바와 같이 제조하였다.
파트 A: 벤질 (1-((5-클로로-3,4-디메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 426.3 [(M+Na)+, 계산치 C22H29ClN2O3Na, 427.2]; LC/MS 체류시간 (방법 B): tR = 2.57분.
파트 B: Cbz 메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-2,3-디메틸페닐)피리딘-2-일)카르바메이트.
THF (0.8 mL) 중 제2 세대 Xphos 전촉매 (4 mg, 5.08 μmol), 삼염기성 인산칼륨 (0.5 mL, 0.250 mmol), (2-((메톡시카르보닐)아미노)피리딘-4-일)보론산 (0.044 g, 0.225 mmol) 및 벤질 (1-(4-클로로-2,3-디메틸페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.0385g, 0.095 mmol)의 혼합물을 진공/ N2 충전 주기를 통해 3회 탈기하였다. 반응 혼합물을 80℃에서 밤새 가열하였다. 반응물을 에틸 아세테이트로 희석하고, 물 (2X)에 이어서 염수로 세척하였다. 에틸 아세테이트 층을 분리하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 생성물을 실리카 겔 크로마토그래피 (헥산 중 0-30% 에틸 아세테이트)에 의해 정제하여 Cbz 메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-2,3-디메틸페닐)피리딘-2-일)카르바메이트 (25 mg, 0.025 mmol, 27% 수율)를 백색 고체로서 수득하였다. LCMS (ESI) m/e 520.5 [(M+H)+, 계산치 C30H37N3O5, 520.3]; LC/MS 체류시간 (방법 A): tR = 2.38분.
파트 C: 메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-2,3-디메틸페닐)피리딘-2-일)카르바메이트
에탄올 (4 mL) 중 Pd/C (6 mg, 5.64 μmol) 및 Cbz 보호된 메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-2,3-디메틸페닐)피리딘-2-일)카르바메이트 (0.025 g, 0.048 mmol)의 혼합물을 H2 풍선을 통해 실온에서 밤새 수소화시켰다. 반응 혼합물을 규조토 (셀라이트®) 패드를 통해 여과하고, CH2Cl2로 세척하였다. 여과물을 감압 하에 농축시키고, 잔류물을 역상 HPLC (아세토니트릴/물/10 mM 아세트산암모늄)에 의해 정제하여 메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-2,3-디메틸페닐)피리딘-2-일)카르바메이트 (2.8 mg, 7.26 umol, 15% 수율)를 회백색 고체로서 수득하였다. 1H NMR (600MHz, DMSO-d6) δ 8.26 (d, J=4.8 Hz, 1H), 7.74 (s, 1H), 7.02 (d, J=8.4 Hz, 1H), 6.96 (d, J=5.1 Hz, 1H), 6.86 (d, J=8.8 Hz, 1H), 3.67 (s, 4H), 3.48 (d, J=10.6 Hz, 1H), 2.19 (s, 3H), 1.84 (s, 3H), 1.83 - 1.74 (m, 1H), 1.42 (t, J=6.1 Hz, 2H), 1.14 (s, 3H), 0.92 (t, J=5.9 Hz, 6H). LCMS (ESI) m/e 369.2 [(M-NH2)-, 계산치 C22H29N2O3, 369.2]; LC/MS 체류시간 (방법 B): tR = 1.68분.
실시예 32
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(히드록시메틸)페닐)피리딘-2-일)카르바메이트
파트 A. 4-메틸-5H-1,2,3-옥사티아졸 2,2-디옥시드
단계 1: 술파모일 클로라이드 형성: 기계적 교반 및 첨가 깔때기가 구비된 1000ml 4구 둥근 바닥 플라스크에, DCM (400 mL) 및 클로로술포닐 이소시아네이트 (124 mL, 1430 mmol)를 채웠다. N2 하에, 이 용액을 0℃로 냉각시켰다. 이어서, 포름산 (53.9 mL, 1430 mmol)을 DCM (100 mL)에 첨가하고, 이 용액을 첨가 깔때기로 옮기고, 용액을 격렬히 교반하는 반응 혼합물에 천천히 첨가하였다. 서서히 농후한 슬러리가 형성되었다. 느린 발열이 관찰되었으며, 따라서 추가의 드라이 아이스를 아세톤 조에 첨가하였다. 온도가 안정화되면, 포름산의 첨가를 계속하였다. 첨가를 ~ 25분 내에 행하였다. 혼합물을 서서히 실온으로 가온되도록 하고, 밤새 교반하였다.
단계 2: 개별 5L 4구 반응 플라스크에 히드록시아세톤 (72.5 mL, 953 mmol), 피리딘 (116 mL, 1430 mmol), 및 DCM (2000 mL)을 채웠다. 이 용액을 N2 하에 -5℃로 냉각시켰다. 술파모일 클로라이드 용액을 테플론 튜브를 통해 10분에 걸쳐 천천히 첨가하였다. 첨가한 후, 반응물을 15분 동안 교반한 다음, 빙조를 제거하고, 반응 혼합물을 실온으로 가온되도록 하였다. 반응이 진행되면서, 점착성 물질이 형성되었다. 물질을 실리카 겔 크로마토그래피 (DCM으로 용리시키는 300 g 실리카 겔)를 통해 정제하였다. 무색 고체로서의 4-메틸-5H-1,2,3-옥사티아졸 2,2-디옥시드 (72.4 g, 536 mmol, 56% 수율)를 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 5.09 (s, 2H), 2.44 (s, 3H); LCMS (ESI) m/e 136.0 [(M+H)+, 계산치 C3H6NO3S 136.0].
파트 B. 2-(tert-부톡시카르보닐아미노)-2,4-디메틸펜탄산 4-메틸-4-(2-메틸알릴)-1,2,3-옥사티아졸리딘 2,2-디옥시드
메틸 tert-부틸 에테르 (30 mL) 중 4-메틸-5H-1,2,3-옥사티아졸 2,2-디옥시드 (0.541 g, 4mmol)의 현탁액을 얼음/IPA 조를 사용하여 0℃ 미만으로 냉각시켰다. 냉각된 용액에 THF (9.60 mL, 4.80 mmol) 중 (2-메틸알릴)염화마그네슘, 0.5 M의 용액을 첨가하였다. 반응 혼합물을 밤새 실온으로 가온되도록 하였다. 이어서, 이것을 NH4Cl의 포화 용액 (50 mL)으로 켄칭하고, EtOAc (20 mL)를 첨가하였다. 유기 상을 분리하고, 염수 (50 mL)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 2-(tert-부톡시카르보닐아미노)-2,4-디메틸펜탄산 4-메틸-4-(2-메틸알릴)-1,2,3-옥사티아졸리딘 2,2-디옥시드 (0.567 g, 2.96 mmol, 74% 수율)를 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 5.06 (quin, J=1.5 Hz, 1H), 4.87 (dd, J=1.7, 0.8 Hz, 1H), 4.50 (br. s., 1H), 4.40 (d, J=8.6 Hz, 1H), 4.29 (d, J=8.7 Hz, 1H), 2.56 (d, J=13.8 Hz, 1H), 2.40 - 2.30 (m, 1H), 1.86 (br. s, 3H), 1.49 (s, 3H); LCMS (ESI) m/e 192.1 [(M+H)+, 계산치 C7H14NO3S 192.1].
파트 C. 벤질 4-메틸-4-(2-메틸알릴)-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드
N2 플러싱된, 100 mL 둥근 바닥 플라스크에 THF (10 mL) 중 4-메틸-4-(2-메틸알릴)-1,2,3-옥사티아졸리딘 2,2-디옥시드 (0.55 g, 2.88 mmol)의 용액을 첨가하였다. THF 중 포타슘 tert-부톡시드 (4.31 mL, 4.31 mmol)의 용액을 첨가하였다. 온도가 27℃로 상승하였고, 용액은 현탁액이 되었다. 혼합물을 실온에서 1시간 동안 교반하였다. 벤질 카르보노클로리데이트 (1.026 mL, 7.19 mmol)를 천천히 첨가하였다. 반응 혼합물을 실온에서 2시간 동안 교반하였다. 이어서, 반응 혼합물을 물 (50 mL)로 켄칭하고, EtOAc (2x70 mL)로 추출하였다. 유기 추출물을 염수 (50 mL)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (에틸 아세테이트/헥산)에 의해 정제하여 벤질 4-메틸-4-(2-메틸알릴)-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (0.66 g, 2.028 mmol, 71% 수율)를 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 7.58 - 7.32 (m, 5H), 5.43 - 5.25 (m, 2H), 5.01 (t, J=1.5 Hz, 1H), 4.81 (d, J=0.9 Hz, 1H), 4.63 (d, J=9.5 Hz, 1H), 4.21 (d, J=9.5 Hz, 1H), 2.87 (d, J=14.1 Hz, 1H), 2.56 (d, J=14.1 Hz, 1H), 1.78 (br. s, 3H), 1.64 (s, 3H); LCMS (ESI) m/e 326.1 [(M+H)+, 계산치 C15H20NO5S 326.1].
라세미 화합물을 키랄 초임계 유체 크로마토그래피 (칼럼: OJ-H (3x25cm, 5μm); 이동상: CO2/ MeOH (90/10))에 의해 분리하여 2종의 거울상이성질체를 수득하였다.
분석 초임계 유체 크로마토그래피 조건: 칼럼: OJ-H (0.46x25cm, 5μm); BPR 압력: 100 bar; 온도: 35℃; 유량: 3.0 mL/분; 이동상: CO2/ MeOH (90/10); 검출기 파장: UV 200-400nm
거울상이성질체 1: (S)-벤질 4-메틸-4-(2-메틸알릴)-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 HPLC 체류시간 = 2.53분.
거울상이성질체 2: (R)-벤질 4-메틸-4-(2-메틸알릴)-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 HPLC 체류시간 = 2.97분.
파트 D. (S)-4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘 2,2-디옥시드
MeOH (20 mL) 중 (S)-벤질 4-메틸-4-(2-메틸알릴)-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (800 mg, 2.459 mmol)의 교반 용액에 Pd/C (262 mg, 0.246 mmol)를 질소 분위기 하에 첨가하고, 반응 혼합물을 1 atm 수소 압력 하에 16시간 동안 교반하였다. 반응 혼합물을 규조토 (셀라이트®) 패드에 통과시키고, 패드를 EtOAc (15 mL)로 세척하였다. 유기 층을 감압 하에 증발시켜 (S)-4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘 2,2-디옥시드 (462 mg, 2.39 mmol, 97% 수율, 95% 순도)를 무색 오일로서 수득하였다. 물질을 추가 정제 없이 사용하였다. 1H NMR (400 MHz, DMSO-d6) δ ppm 7.69 (br, 1H) 4.33 (d, J=8.03 Hz, 1 H) 4.17 - 4.26 (m, 1 H) 1.68 - 1.81 (m, 1 H) 1.53 - 1.63 (m, 1 H) 1.43 - 1.51 (m, 1 H) 1.34 (s, 3 H) 0.81 - 1.00 (m, 6 H).
파트 E. (S)-tert-부틸 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드
0℃로 냉각시킨 DCM (70 mL) 중 (S)-4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘 2,2-디옥시드 (7 g, 15.21 mmol)의 교반 용액에 DMAP (1.858 g, 15.21 mmol) 및 (BOC)2O (5.30 mL, 22.82 mmol)를 첨가하였다. 반응 혼합물을 실온에서 12시간 동안 교반하였다. 반응 혼합물을 물 (20 ml)을 함유하는 분리 깔때기로 옮기고, DCM (2 x 60 ml)으로 추출하였다. 합한 유기 층을 염수 (50 mL)로 세척하고, (Na2SO4) 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (석유 에테르 중 30% 에틸 아세테이트)에 의해 정제하여 (S)-tert-부틸 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (4.4 g, 14.70 mmol, 97% 수율)를 무색 오일로서 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 4.45 (d, J=9.0 Hz, 1H), 4.20 (d, J=9.0 Hz, 1H), 2.07 - 1.98 (m, J=8.0 Hz, 1H), 1.83 - 1.69 (m, 2H), 1.59 (s, 3H), 1.56 (s, 9H), 0.99 (dd, J=8.0, 6.5 Hz, 6H).
파트 F: (S)-tert-부틸 (1-(4-브로모-2-포르밀페녹시)-2,4-디메틸펜탄-2-일)카르바메이트.
20 mL 바이알에 DMF (1.2 mL) 중 5-브로모-2-히드록시벤즈알데히드 (81 mg, 0.403 mmol), (S)-tert-부틸 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (107.4 mg, 0.366 mmol), 및 K2CO3 (152 mg, 1.098 mmol)을 첨가하여 백색 현탁액을 수득하였다. 바이알을 밀봉하고, 혼합물을 80℃에서 17시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 물과 EtOAc 사이에 분배하였다. 층을 분리하였다. 유기 층을 물, 염수로 세척하고, 건조 (Na2SO4)시키고, 감압 하에 농축시켰다. 조 잔류물을 실리카 겔 크로마토그래피 (최대 40% EtOAc/헥산)에 의해 정제하여 (S)-tert-부틸 (1-(4-브로모-2-포르밀페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (115 mg, 0.278 mmol, 76%)를 무색 오일로서 수득하였다. 1H NMR (400 MHz, 클로로포름-d) δ 10.43 (s, 1H), 7.89 (d, J = 2.6 Hz, 1H), 7.59 (dd, J = 8.9, 2.6 Hz, 1H), 6.93 (d, J = 8.8 Hz, 1H), 4.58 (s, 1H), 4.29 (d, J = 8.8 Hz, 1H), 4.09 (d, J = 8.8 Hz, 1H), 1.94 - 1.74 (m, 2H), 1.48 (dd, J = 13.9, 4.8 Hz, 1H), 1.39 (s, 3H), 1.37 (s, 9H), 0.98 (dd, J = 6.6, 4.8 Hz, 6H); (ESI) m/e 314.0, 316.0 Br 패턴 [(M-Boc+H)+, 계산치 C14H21BrNO2, 414.1]; LC/MS 체류시간 (방법 B): tR = 2.39분.
파트 G: (S)-메틸 (4-(4-((2-Boc-아미노-2,4-디메틸펜틸)옥시)-3-카르보닐페닐)피리딘-2-일)카르바메이트.
2 mL 바이알에 질소 하에 디옥산 (0.5 mL) 중 (S)-tert-부틸 (1-(4-브로모-2-포르밀페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (27.9 mg, 0.067 mmol), (2-((메톡시카르보닐)아미노)피리딘-4-일)보론산 (19.79 mg, 0.101 mmol), 및 Na2CO3 (0.101 mL, 0.202 mmol)을 첨가하여 무색 현탁액을 수득하였다. 1,1'-비스(디페닐포스피노)페로센팔라듐(II) 디클로라이드, 톨루엔 (2.77 mg, 3.37 μmol)을 질소 하에 첨가하였다. 바이알을 밀봉하고 100℃ (조 온도: 105℃)에서 3시간 동안 가열하였다. LCMS는 목적 생성물로 전환이 되었으나 (M + H = 486), 일부 출발 물질이 남아있음을 나타내었다. 약간의 시약을 더 첨가하고, 가열을 추가로 3시간 동안 계속하였다. LCMS는 더 이상 출발 물질을 나타내지 않았다. 혼합물을 EtOAc로 희석하고, Na2SO4의 플러그에 통과시켰다. 유기 용액을 농축시켰다. (S)-메틸 (4-(4-((2-Boc-아미노-2,4-디메틸펜틸)옥시)-3-카르보닐페닐)피리딘-2-일)카르바메이트를 황갈색 잔류물로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 486.4 [(M+H)+, 계산치 C26H36N3O6, 486.3]; LC/MS 체류시간 (방법 C): tR = 4.23분.
파트 H: (S)-메틸 (4-(4-((2-Boc-아미노-2,4-디메틸펜틸)옥시)-3-(히드록시메틸)페닐)피리딘-2-일)카르바메이트
2 mL 바이알에 MeOH (0.5 mL) 중 조 알데히드 (10.68 mg, 0.022 mmol)를 첨가하여 황갈색 용액을 수득하였다. NaBH4 (5 mg, 0.132 mmol)를 첨가하였다. 혼합물을 실온에서 1시간 동안 교반하였다. 혼합물을 물과 EtOAc 사이에 분배하였다. 층을 분리하였다. 유기 층을 염수로 세척하고, 건조 (Na2SO4)시키고, 감압 하에 농축시켰다. 황갈색 잔류물을 직접 후속 반응에 사용하였다. LCMS (ESI) m/e 488.2 [(M+H)+, 계산치 C26H38N3O6, 488.3]; LC/MS 체류시간 (방법 B): tR = 2.00분.
파트 I: (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(히드록시메틸)페닐)피리딘-2-일)카르바메이트
25 mL 플라스크에 CH2Cl2 (1 mL) 중 (S)-메틸 (4-(4-((2-Boc-아미노-2,4-디메틸펜틸)옥시)-3-(히드록시메틸)페닐)피리딘-2-일)카르바메이트 (10.73 mg, 0.022 mmol)를 첨가하여 황갈색 용액을 수득하였다. TFA (0.5 ml, 6.49 mmol)를 질소 하에 첨가하였다. 혼합물을 실온에서 1시간 동안 교반하였다. 혼합물을 농축시켰다. 잔류물을 MeOH 중에 용해시키고, 여과하고, 역상 HPLC (아세토니트릴/물/10 mM 아세트산암모늄)에 의해 정제하여 (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(히드록시메틸)페닐)피리딘-2-일)카르바메이트 (7.6 mg, 0.019 mmol, 3 단계에 대해서 86% 수율)를 무색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.28 (d, J = 5.2 Hz, 1H), 8.12 (s, 1H), 7.77 (d, J = 2.4 Hz, 1H), 7.61 (dd, J = 8.6, 2.4 Hz, 1H), 7.32 (d, J = 5.2 Hz, 1H), 7.06 (d, J = 8.5 Hz, 1H), 4.63 (s, 2H), 3.77 (s, 2H), 3.70 (s, 3H), 1.79 (td, J = 11.7, 10.6, 5.5 Hz, 1H), 1.42 (qd, J = 14.0, 5.6 Hz, 2H), 1.14 (s, 3H), 0.93 (t, J = 7.2 Hz, 6H); LCMS (ESI) m/e 388.1 [(M+H)+, 계산치 C21H30N3O4, 388.2]; LC/MS 체류시간 (방법 B): tR = 1.55분.
실시예 33
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시클로프로필페닐)피리딘-2-일)카르바메이트
실시예 32에 기재된 바와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-(4-브로모-2-시클로프로필페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
100 mL 둥근 바닥 플라스크에 CH2Cl2 (22 mL) 중 2-시클로프로필페놀 (584 mg, 4.35 mmol)을 첨가하여 무색 용액을 수득하였다. Br2 (0.224 mL, 4.35 mmol)를 0℃에서 적가하였다. 혼합물을 0℃에서 1시간 동안 교반하였다. 혼합물을 감압 하에 농축시켜 (S)-tert-부틸 (1-(4-브로모-2-시클로프로필페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (992 mg, 4.35 mmol, 100% 수율)를 무색 오일로서 수득하였다. 1H NMR (400 MHz, 클로로포름-d) δ 7.24 (dd, J = 8.6, 2.5 Hz, 1H), 7.20 (dd, J = 2.5, 0.9 Hz, 1H), 6.76 (d, J = 8.5 Hz, 1H), 5.43 (s, 1H), 1.82 (tt, J = 8.3, 5.3 Hz, 1H), 1.04 - 0.97 (m, 2H), 0.70 - 0.64 (m, 2H); LC/MS 체류시간 (방법 B): tR = 2.09분.
파트 B: (S)-tert-부틸 (1-(4-브로모-2-시클로프로필페녹시)-2,4-디메틸펜탄-2-일)카르바메이트.
1H NMR (400 MHz, 클로로포름-d) δ 7.21 (dd, J = 8.7, 2.5 Hz, 1H), 6.98 (d, J = 2.5 Hz, 1H), 6.71 (d, J = 8.7 Hz, 1H), 4.67 (s, 1H), 4.10 (d, J = 9.0 Hz, 1H), 3.94 (d, J = 8.8 Hz, 1H), 2.16 - 2.08 (m, 1H), 1.84 (ddt, J = 13.0, 10.9, 6.5 Hz, 2H), 1.69 - 1.59 (m, 1H), 1.43 (s, 3H), 1.42 (s, 9H), 0.99 (dd, J = 6.5, 3.1 Hz, 6H), 0.97 - 0.92 (m, 2H), 0.68 - 0.61 (m, 2H); LCMS (ESI) m/e 447.9 [(M+Na)+, 계산치 C21H32Br1N1Na1O3, 448.2]; LC/MS 체류시간 (방법 B): tR = 2.59분.
파트 C: (S)-메틸 (4-(4-((2-Boc-아미노-2,4-디메틸펜틸)옥시)-3-시클로프로필페닐)피리딘-2-일)카르바메이트.
LCMS (ESI) m/e 498.1 [(M+H)+, 계산치 C28H40N3O5, 498.3]; LC/MS 체류시간 (방법 B): tR = 2.24분.
파트 D: (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시클로프로필페닐)피리딘-2-일)카르바메이트.
1H NMR (500 MHz, DMSO-d6) δ 8.25 (d, J = 5.3 Hz, 1H), 8.05 (s, 1H), 7.50 (dd, J = 8.5, 2.4 Hz, 1H), 7.32 (d, J = 5.4 Hz, 1H), 7.19 (d, J = 2.3 Hz, 1H), 7.04 (d, J = 8.5 Hz, 1H), 3.81 - 3.73 (m, 2H), 3.70 (s, 3H), 2.20 (ddd, J = 13.9, 8.8, 5.4 Hz, 1H), 1.82 (dt, J = 12.8, 6.3 Hz, 1H), 1.49 - 1.38 (m, 2H), 1.16 (s, 3H), 0.94 (q, J = 6.2 Hz, 8H), 0.72 (q, J = 5.1 Hz, 2H); LCMS (ESI) m/e 398.1 [(M+H)+, 계산치 C23H32N3O3, 398.2]; LC/MS 체류시간 (방법 B): tR = 1.73분.
실시예 34
(S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)-5-(히드록시메틸)피리딘-2-일)아세트아미드
실시예 19에 기재된 바와 같이 제조하였다.
파트 A: N-(4-클로로-5-(히드록시메틸)피리딘-2-일)아세트아미드
25 mL 바이알에 1,4-디옥산 (4 mL) 중 (4,6-디클로로피리딘-3-일)메탄올 (125.8 mg, 0.707 mmol), 및 아세트아미드 (62.6 mg, 1.060 mmol)를 첨가하여 무색 용액을 수득하였다. N2로 탈기시키면서, PdOAc2 (7.93 mg, 0.035 mmol), XANTPHOS (30.7 mg, 0.053 mmol), Cs2CO3 (368 mg, 1.131 mmol)을 첨가하였다. 바이알을 질소 하에 밀봉하고 110℃ (조: 112℃)에서 22시간 동안 가열하였다 (1:30pm). 반응 혼합물을 실온으로 냉각시키고, 물과 EtOAc 사이에 분배하였다. 약간의 불용성 고형물이 형성되었으며, 이를 여과에 의해 제거하였다. 층을 분리하였다. 수성 층을 EtOAc로 4회 추출하였다 (수성 층 내에 생성물이 여전히 있었음). 합한 유기 층을 염수로 세척하고, 건조시키고, 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (최대 10% MeOH/CH2Cl2)에 의해 정제하여 N-(4-클로로-5-(히드록시메틸)피리딘-2-일)아세트아미드 (90 mg, 0.449 mmol, 64% 수율)를 백색 고체로서 수득하였다: 1H NMR (400 MHz, 메탄올-d4) δ 8.34 (s, 1H), 8.19 (s, 1H), 4.69 (s, 2H), 2.19 (s, 3H); LCMS (ESI) m/e 201.1 [(M+H)+, 계산치 C8H10ClN2O2, 201.1]; LC/MS 체류시간 (방법 B): tR = 1.73분.
파트 B: (2-아세트아미도-5-(히드록시메틸)피리딘-4-일)보론산
20 mL 바이알에 에탄올 (2.2 mL) 중 N-(4-클로로-5-(히드록시메틸)피리딘-2-일)아세트아미드 (48 mg, 0.239 mmol), 하이포이붕산 (32.2 mg, 0.359 mmol),2-(디시클로헥실포스피노)-2',4',6'-트리이소프로필비페닐 (2.281 mg, 4.79 μmol), Xphos 전촉매 (1.882 mg, 2.393 μmol) 및 아세트산칼륨 (70.4 mg, 0.718 mmol)을 첨가하여 황갈색 현탁액을 수득하였다 (N2로 탈기시킨 후 시약을 첨가함). 병을 마개를 막고, 80℃에서 1.5시간 동안 가열하였다. 혼합물을 실온으로 냉각시키고, 감압 하에 농축시켰다. 조 물질을 정제 없이 사용하였다.
파트 C: (S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)-5-(히드록시메틸)피리딘-2-일)아세트아미드
20 mL 바이알에 (2-아세트아미도-5-(히드록시메틸)피리딘-4-일)보론산 (50.2 mg, 0.239 mmol)을 첨가하고, 삼염기성 인산칼륨 (2 mL, 1.000 mmol)을 첨가하였다. N2로 5분 동안 탈기한 후, 테트라히드로푸란 (2 mL) 중 Xphos 전촉매 (3.76 mg, 4.78 μmol) 및 (S)-1-(4-브로모-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (30 mg, 0.076 mmol) (실시예 19, 파트 A에 기재된 바와 같이 제조됨)을 첨가하였다. 바이알을 밀봉하고, 80℃에서 18시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 휘발성 물질을 감압 하에 제거하였다. 잔류물을 물과 EtOAc 사이에 분배하였다. 유기 층을 건조시키고, 여과하고, 농축시켰다. 잔류물을 MeOH 중에 용해시키고, 역상 HPLC (아세토니트릴/물/10 mM 아세트산암모늄)에 의해 정제하여 (S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)-5-(히드록시메틸)피리딘-2-일)아세트아미드 (27.7 mg, 0.060 mmol, 79% 수율)를 회백색 고체로서 수득하였다. 1H NMR (600 MHz, DMSO-d6) δ 10.57 (s, 1H), 8.38 (s, 1H), 8.02 (s, 1H), 7.80 (s, 1H), 7.78 - 7.71 (m, 1H), 7.35 (d, J = 8.6 Hz, 1H), 4.36 (s, 2H), 3.86 (q, J = 8.8 Hz, 2H), 2.10 (s, 3H), 1.81 (dt, J = 12.6, 6.1 Hz, 1H), 1.45 - 1.37 (m, 2H), 1.13 (s, 3H), 0.92 (dd, J = 6.6, 3.4 Hz, 6H); LCMS (ESI) m/e 440.2 [(M+H)+, 계산치 C22H29F3N3O3, 440.2]; LC/MS 체류시간 (방법 B): tR = 1.67분.
실시예 35
(S)-1-(4-(2-(디플루오로메틸)피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
실시예 19에 기재된 바와 같이 제조하였다. (S)-1-(4-(2-(디플루오로메틸)피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (25.5 mg, 0.062 mmol, 54% 수율)을 회백색 고체로서 수득하였다. 1H NMR (600 MHz, DMSO-d6) δ 8.74 (d, J = 5.1 Hz, 1H), 8.19 (d, J = 8.8 Hz, 1H), 8.11 (s, 1H), 8.06 (s, 1H), 7.96 (d, J = 5.1 Hz, 1H), 7.44 (d, J = 8.7 Hz, 1H), 7.01 (t, J = 54.9 Hz, 1H), 4.05 (q, J = 9.6 Hz, 2H), 1.81 (dt, J = 12.9, 6.6 Hz, 1H), 1.61 - 1.47 (m, 2H), 1.25 (s, 3H), 0.92 (t, J = 6.9 Hz, 6H); LCMS (ESI) m/e 403.4 [(M+H)+, 계산치 C20H24F5N2O1, 403.2]; LC/MS 체류시간 (방법 A): tR = 2.13분.
실시예 36
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-(디플루오로메틸)피리딘-4-일)벤조니트릴
실시예 19에 기재된 바와 같이 제조하였다. (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-(디플루오로메틸)피리딘-4-일)벤조니트릴 (32 mg, 0.086 mmol, 60% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.48 (d, J = 5.2 Hz, 1H), 8.11 (d, J = 2.5 Hz, 1H), 7.95 (dd, J = 9.0, 2.4 Hz, 1H), 7.80 (s, 1H), 7.69 (d, J = 5.2 Hz, 1H), 7.14 (d, J = 8.9 Hz, 1H), 6.73 (t, J = 54.8 Hz, 1H), 3.80 - 3.68 (m, 2H), 1.56 (dp, J = 12.5, 6.4 Hz, 1H), 1.23 (qd, J = 14.0, 5.5 Hz, 2H), 0.95 (s, 3H), 0.68 (dd, J = 6.7, 4.7 Hz, 6H); 19F NMR (376 MHz, DMSO-d6) δ -115.30 (d, J = 54.0 Hz); LCMS (ESI) m/e 360.2 [(M+H)+, 계산치 C20H24F2N3O1, 360.2]; LC/MS 체류시간 (방법 B): tR = 1.69분.
실시예 37
(S)-1-(2-(디플루오로메틸)-4-(2-(디플루오로메틸)피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
실시예 19에 기재된 바와 같이 제조하였다. (S)-1-(2-(디플루오로메틸)-4-(2-(디플루오로메틸)피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민 (31.9 mg, 0.080 mmol, 61% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.48 (d, J = 5.1 Hz, 1H), 7.81 (dd, J = 8.9, 2.4 Hz, 1H), 7.76 (d, J = 3.6 Hz, 2H), 7.67 (d, J = 5.1 Hz, 1H), 7.22 - 6.94 (m, 2H), 6.76 (t, J = 54.9 Hz, 1H), 3.68 (d, J = 2.2 Hz, 2H), 1.54 (dp, J = 12.7, 6.3 Hz, 1H), 1.30 - 1.13 (m, 2H), 0.95 (s, 3H), 0.67 (dd, J = 15.9, 6.6 Hz, 6H); 19F NMR (376 MHz, DMSO-d6) δ -73.65, -115.33; LCMS (ESI) m/e 407.2 [(M+Na)+, 계산치 C20H24F4N2Na1O1, 407.2]; LC/MS 체류시간 (방법 B): tR = 1.89분.
실시예 38
(S)-1-(4-(2-(디플루오로메틸)피리딘-4-일)-2-(트리플루오로메톡시)페녹시)-2,4-디메틸펜탄-2-아민
실시예 19에 기재된 바와 같이 제조하였다. (S)-1-(4-(2-(디플루오로메틸)피리딘-4-일)-2-(트리플루오로메톡시)페녹시)-2,4-디메틸펜탄-2-아민 (21.1 mg, 0.050 mmol, 39% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.55 (d, J = 5.2 Hz, 1H), 7.85 (s, 1H), 7.78 (dd, J = 13.4, 5.4 Hz, 3H), 7.22 (d, J = 8.6 Hz, 1H), 6.83 (t, J = 54.9 Hz, 1H), 3.71 (d, J = 3.6 Hz, 2H), 1.64 (dt, J = 12.7, 6.3 Hz, 1H), 1.26 (dq, J = 14.8, 8.3, 6.9 Hz, 2H), 0.98 (s, 3H), 0.75 (t, J = 5.9 Hz, 6H); LCMS (ESI) m/e 419.3 [(M+H)+, 계산치 C20H24F5N2O2, 419.2]; LC/MS 체류시간 (방법 B): tR = 2.03분.
실시예 39
(S)-1-(4-(3-클로로-2-플루오로피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
실시예 19에 기재된 바와 같이 제조하였다. (S)-1-(4-(3-클로로-2-플루오로피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (14 mg, 0.035 mmol, 42% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.25 (d, J = 5.1 Hz, 1H), 7.88 - 7.79 (m, 2H), 7.53 (d, J = 5.1 Hz, 1H), 7.40 (d, J = 8.5 Hz, 1H), 3.87 (q, J = 8.9 Hz, 2H), 1.80 (hept, J = 6.5 Hz, 1H), 1.39 (d, J = 5.6 Hz, 2H), 1.12 (s, 3H), 0.92 (dd, J = 6.7, 2.4 Hz, 6H); 19F NMR (376 MHz, DMSO-d6) δ -61.18, -71.35; LCMS (ESI) m/e 405.1 [(M+H)+, 계산치 C19H22Cl1F4N2O1, 405.1]; LC/MS 체류시간 (방법 B): tR = 2.04분.
실시예 40
(S)-1-(4-(5-클로로-2-플루오로피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
실시예 19에 기재된 바와 같이 제조하였다. (S)-1-(4-(5-클로로-2-플루오로피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (15.2 mg, 0.037 mmol, 43% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.45 (s, 1H), 7.88 - 7.80 (m, 2H), 7.46 (d, J = 1.9 Hz, 1H), 7.39 (d, J = 8.5 Hz, 1H), 3.93 - 3.82 (m, 2H), 1.80 (dp, J = 12.8, 6.5 Hz, 1H), 1.40 (d, J = 5.5 Hz, 2H), 1.13 (s, 3H), 0.92 (dd, J = 6.6, 2.5 Hz, 6H); 19F NMR (376 MHz, DMSO-d6) δ -61.16, -71.37; LCMS (ESI) m/e 405.1 [(M+H)+, 계산치 C19H22Cl1F4N2O1, 405.1]; LC/MS 체류시간 (방법 B): tR = 2.04분.
실시예 41
(S)-1-(4-(2-플루오로-3-메틸피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
실시예 19에 기재된 바와 같이 제조하였다. (S)-1-(4-(2-플루오로-3-메틸피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (14.1 mg, 0.036 mmol, 42% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.10 (d, J = 5.1 Hz, 1H), 7.72 (dd, J = 8.6, 2.3 Hz, 1H), 7.67 (d, J = 2.2 Hz, 1H), 7.36 (d, J = 8.6 Hz, 1H), 7.29 (d, J = 5.1 Hz, 1H), 3.87 (q, J = 8.8 Hz, 2H), 2.17 (s, 3H), 1.81 (dp, J = 12.7, 6.4 Hz, 1H), 1.46 - 1.35 (m, 2H), 1.13 (s, 3H), 0.92 (dd, J = 6.7, 2.8 Hz, 6H); 19F NMR (376 MHz, DMSO-d6) δ -61.03, -71.80; LCMS (ESI) m/e 385.2 [(M+H)+, 계산치 C20H25F4N2O1, 385.2]; LC/MS 체류시간 (방법 B): tR = 1.99분.
실시예 42
(S)-1-(4-(2,3-디플루오로피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
실시예 19에 기재된 바와 같이 제조하였다. (S)-1-(4-(2,3-디플루오로피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (7 mg, 0.018 mmol, 21% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.10 (d, J = 5.1 Hz, 1H), 7.99 (d, J = 8.7 Hz, 1H), 7.95 (d, J = 2.3 Hz, 1H), 7.66 (t, J = 5.1 Hz, 1H), 7.43 (d, J = 8.8 Hz, 1H), 3.90 (q, J = 8.8 Hz, 2H), 1.79 (dq, J = 12.8, 6.4 Hz, 1H), 1.40 (d, J = 5.5 Hz, 2H), 1.13 (s, 3H), 0.92 (dd, J = 6.6, 2.2 Hz, 6H); 19F NMR (376 MHz, DMSO-d6) δ -61.23, -89.72, -89.79; LCMS (ESI) m/e 389.2 [(M+H)+, 계산치 C19H22F5N2O1, 389.2]; LC/MS 체류시간 (방법 B): tR = 2.01분.
실시예 43
(S)-2,4-디메틸-1-(4-(피리딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민
실시예 19에 기재된 바와 같이 제조하였다. 디옥산 (0.5 mL) (N2로 탈기됨) 중 탄산나트륨(0.068 mL, 0.136 mmol), 1,1'- 비스(디페닐포스피노)페로센-팔라듐(II) 디클로라이드 디클로로메탄 착물(3.89 mg, 4.76 μmol), 피리딘-4-일보론산 (8.36 mg, 0.068 mmol) 및 (S)-1-(4-브로모-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (0.0241 g, 0.068 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 에틸 아세테이트로 희석한 다음, 물 (3X)로 세척하였다. 에틸 아세테이트 층을 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 역상 HPLC (아세토니트릴/물/10 mM 아세트산암모늄)에 의해 정제하였다. 회백색 고체로서의 (S)-2,4-디메틸-1-(4-(피리딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민 (89 mg, 0.088 mmol, 46% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.62 (d, J=5.9 Hz, 2H), 8.09 (d, J=9.2 Hz, 1H), 8.01 (s, 1H), 7.75 (d, J=5.5 Hz, 2H), 7.37 (d, J=8.8 Hz, 1H), 3.87 (d, J=7.0 Hz, 2H), 1.84 - 1.74 (m, 1H), 1.39 (d, J=5.5 Hz, 2H), 1.12 (s, 3H), 0.91 (d, J=6.6 Hz, 6H) LCMS (ESI) m/e 353.2 [(M+H)+, 계산치 C19H24F3N2O, 353.2]; LC/MS 체류시간 (방법 B): tR = 1.48분.
실시예 44
(S)-1-(4-(2-플루오로피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
실시예 43에 기재된 바와 같이 제조하였다. (S)-1-(4-(2-플루오로피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (9.3 mg, 0.025 mmol, 36% 수율)을 회백색 고체로서 수득하였다. 1H NMR (400MHz, 메탄올-d4) δ 8.27 (d, J=5.4 Hz, 1H), 8.10 - 8.04 (m, 2H), 7.63 (d, J=5.4 Hz, 1H), 7.45 - 7.39 (m, 2H), 4.19 (d, J=3.2 Hz, 2H), 1.94 (s, 3H), 1.77 (d, J=5.6 Hz, 2H), 1.71 - 1.63 (m, 1H), 1.45 (s, 2H), 1.04 (d, J=6.6 Hz, 3H), 1.02 (d, J=6.6 Hz, 3H); LCMS (ESI) m/e 371.2 [(M+H)+, 계산치 C19H23F4N2O, 371.2]; LC/MS 체류시간 (방법 B): tR = 1.95분.
실시예 45
(S)-2,4-디메틸-1-(4-(2-메틸피리딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민
실시예 19에 기재된 바와 같이 제조하였다. (S)-2,4-디메틸-1-(4-(2-메틸피리딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민 (16 mg, 0.044 mmol, 50% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.68 (d, J = 5.8 Hz, 1H), 8.26 (dd, J = 8.8, 2.6 Hz, 1H), 8.19 - 8.18 (m, 1H), 8.04 (s, 1H), 7.94 (d, J = 5.9 Hz, 1H), 7.51 (d, J = 8.8 Hz, 1H), 4.26 (q, J = 10.1 Hz, 2H), 2.66 (s, 3H), 1.83 (dq, J = 13.0, 6.5 Hz, 1H), 1.74 (dd, J = 14.3, 5.5 Hz, 1H), 1.62 (dd, J = 14.6, 5.8 Hz, 1H), 1.40 (s, 3H), 0.93 (dd, J = 8.6, 6.4 Hz, 6H); 19F NMR (376 MHz, DMSO-d6) δ -60.51, -73.76 (TFA); LCMS (ESI) m/e 367.2 [(M+H)+, 계산치 C20H26F3N2O1, 367.2]; LC/MS 체류시간 (방법 B): tR = 1.51분.
실시예 46
(S)-1-(4-(3-메톡시피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
실시예 19에 기재된 바와 같이 제조하였다. (S)-1-(4-(3-메톡시피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (8.5 mg, 0.021 mmol, 24% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.47 (s, 1H), 8.28 (d, J = 4.8 Hz, 1H), 7.85 (d, J = 9.0 Hz, 1H), 7.82 (d, J = 2.3 Hz, 1H), 7.41 (d, J = 4.8 Hz, 1H), 7.32 (d, J = 8.6 Hz, 1H), 3.91 (s, 3H), 3.86 (q, J = 8.9 Hz, 2H), 1.80 (hept, J = 6.4 Hz, 1H), 1.40 (d, J = 5.5 Hz, 2H), 1.13 (s, 3H), 0.92 (dd, J = 6.8, 2.5 Hz, 6H); 19F NMR (376 MHz, DMSO-d6) δ -61.00; LCMS (ESI) m/e 383.2 [(M+H)+, 계산치 C20H26F3N2O2, 383.2]; LC/MS 체류시간 (방법 B): tR = 1.58분.
실시예 47
(S)-1-(4-(3-플루오로피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
실시예 19에 기재된 바와 같이 제조하였다. (S)-1-(4-(3-플루오로피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (8.9 mg, 0.023 mmol, 25% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.66 (d, J = 2.6 Hz, 1H), 8.51 (d, J = 4.9 Hz, 1H), 7.96 (d, J = 8.8 Hz, 1H), 7.91 (d, J = 2.3 Hz, 1H), 7.70 (dd, J = 7.1, 4.9 Hz, 1H), 7.41 (d, J = 8.7 Hz, 1H), 3.89 (q, J = 8.9 Hz, 2H), 1.80 (dp, J = 12.7, 6.4 Hz, 1H), 1.40 (d, J = 5.5 Hz, 2H), 1.13 (s, 3H), 0.92 (dd, J = 6.6, 2.3 Hz, 6H); 19F NMR (376 MHz, DMSO-d6) δ -61.17, -133.88; LCMS (ESI) m/e 371.2 [(M+H)+, 계산치 C19H23F4N2O1, 371.2]; LC/MS 체류시간 (방법 B): tR = 1.88분.
실시예 48
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-메틸피리딘-4-일)벤조니트릴
실시예 19에 기재된 바와 같이 제조하였다. (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-메틸피리딘-4-일)벤조니트릴 (39.4 mg, 0.116 mmol, 80% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.49 (d, J = 5.2 Hz, 1H), 8.23 (d, J = 2.4 Hz, 1H), 8.11 (dd, J = 8.9, 2.4 Hz, 1H), 7.64 (s, 1H), 7.54 (dd, J = 5.3, 1.9 Hz, 1H), 7.36 (d, J = 8.9 Hz, 1H), 3.98 - 3.87 (m, 2H), 3.58 (s, 2H), 2.52 (s, 3H), 1.82 (dt, J = 12.8, 6.4 Hz, 1H), 1.50 - 1.37 (m, 2H), 1.16 (s, 3H), 0.93 (dd, J = 6.6, 3.9 Hz, 6H); LCMS (ESI) m/e 324.1 [(M+H)+, 계산치 C20H26N3O1, 324.2]; LC/MS 체류시간 (방법 B): tR = 1.46분.
실시예 49
(S)-1-(2-시클로프로필-4-(2-메틸피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
실시예 19에 기재된 바와 같이 제조하였다. (S)-1-(2-시클로프로필-4-(2-메틸피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민 (13.8 mg, 0.040 mmol, 41% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.42 (d, J = 5.3 Hz, 1H), 7.56 (dd, J = 8.4, 2.3 Hz, 1H), 7.53 (s, 1H), 7.44 (d, J = 5.3 Hz, 1H), 7.25 (d, J = 2.3 Hz, 1H), 7.02 (d, J = 8.5 Hz, 1H), 3.77 (d, J = 2.2 Hz, 2H), 2.22 (ddd, J = 13.9, 8.4, 5.3 Hz, 1H), 1.82 (dq, J = 12.7, 6.4 Hz, 1H), 1.52 - 1.39 (m, 2H), 1.17 (s, 3H), 0.93 (t, J = 6.5 Hz, 8H), 0.77 (q, J = 4.3, 3.5 Hz, 2H). (2-Py-Me은 2.51의 DMSO 피크에 가려진 듯함); LCMS (ESI) m/e 339.1 [(M+H)+, 계산치 C22H31N2O1, 339.2]; LC/MS 체류시간 (방법 B): tR = 1.56분.
실시예 50
(S)-1-(2-(디플루오로메틸)-4-(2-메틸피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
실시예 19에 기재된 바와 같이 제조하였다. (S)-1-(2-(디플루오로메틸)-4-(2-메틸피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민 (22 mg, 0.061 mmol, 69% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.48 (d, J = 5.3 Hz, 1H), 7.96 (d, J = 8.9 Hz, 1H), 7.92 (d, J = 2.4 Hz, 1H), 7.60 (s, 1H), 7.54 - 7.47 (m, 1H), 7.43 - 7.16 (m, 2H), 3.87 (s, 2H), 2.53 (s, 3H), 1.80 (dt, J = 12.8, 6.4 Hz, 1H), 1.43 (qd, J = 14.1, 5.7 Hz, 2H), 1.16 (s, 3H), 0.94 (d, J = 6.6 Hz, 3H), 0.91 (d, J = 6.7 Hz, 3H); LCMS (ESI) m/e 349.0 [(M+H)+, 계산치 C20H27F2N2O1, 349.2]; LC/MS 체류시간 (방법 B): tR = 1.47분.
실시예 51
메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-[3,4'-비피리딘]-2'-일)카르바메이트
실시예 29에 기재된 바와 같이 제조하였다.
파트 A: 벤질 (1-((5-클로로피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
5-클로로피리딘-2-올 (0.023 g, 0.180 mmol), 탄산나트륨 (0.019 g, 0.180 mmol) 및 벤질 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (0.0392 g, 0.120 mmol)의 NMP (0.3 mL) 현탁액을 80℃로 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 에틸 아세테이트로 희석하고, 물 (3X)로 세척하였다. 에틸 아세테이트 층을 분리하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (헥산 중 0-30% 에틸 아세테이트)에 의해 정제하여 벤질 (1-((5-클로로피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.0387g, 0.103 mmol, 86% 수율)를 회백색 고체로서 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.08 (d, J=2.3 Hz, 1H), 7.54 (dd, J=8.8, 2.8 Hz, 1H), 7.37 - 7.32 (m, 5H), 6.71 (d, J=8.8 Hz, 1H), 5.06 (s, 3H), 4.42 (d, J=10.5 Hz, 1H), 4.26 (d, J=10.8 Hz, 1H), 1.87 - 1.74 (m, 2H), 1.72 - 1.63 (m, 1H), 1.43 (s, 3H), 0.96 (dd, J=6.3, 4.8 Hz, 6H); LCMS (ESI) m/e 377.3 [(M+H)+, 계산치 C20H26ClN2O3, 377.2]; LC/MS 체류시간 (방법 A): tR = 2.42분.
파트 B: Cbz 메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-[3,4'-비피리딘]-2'-일)카르바메이트
THF (0.2 mL) 중 제2 세대 XPHOS 전촉매 (1.587 mg, 2.017 μmol), 삼염기성 인산칼륨 (0.403 mL, 0.202 mmol), (2-((메톡시카르보닐)아미노)피리딘-4-일)보론산 (0.020 g, 0.101 mmol) 및 벤질 (1-((5-클로로피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.038 g, 0.101 mmol)의 혼합물을 진공/ N2 충전 주기를 통해 3회 탈기하였다. 반응 혼합물을 70℃에서 밤새 가열하였다. 반응물을 실온으로 냉각시키고, 에틸 아세테이트로 희석하고, 물 (2X)에 이어서 염수로 세척하였다. 에틸 아세테이트 층을 분리하고, 건조 (Na2SO4)시키고, 여과하고, 농축시켰다. 생성물을 실리카 겔 크로마토그래피 (헥산 중 50-100% 에틸 아세테이트)에 의해 정제하여 Cbz 메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-[3,4'-비피리딘]-2'-일)카르바메이트 (0.011.g, 0.022 mmol, 22% 수율)를 백색 고체로서 수득하였다. LCMS (ESI) m/e 493.3 [(M+H)+, 계산치 C27H33N4O5, 493.3]; LC/MS 체류시간 (방법 B): tR = 2.13분.
파트 C: 메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-[3,4'-비피리딘]-2'-일)카르바메이트
에탄올 (4 mL) 중 Pd/C (5 mg, 4.70 μmol) 및 Cbz 메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-[3,4'-비피리딘]-2'-일)카르바메이트 (0.011 g, 0.022 mmol)의 혼합물을 실온에서 H2 풍선으로 밤새 수소화시켰다. 반응물을 여과하고, DCM으로 세척하였다. 여과물을 감압 하에 농축시키고, 잔류물을 역상 HPLC (아세토니트릴/물/ 10 mM 아세트산암모늄)에 의해 정제하여 메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-[3,4'-비피리딘]-2'-일)카르바메이트 (6.6.mg, 0.018 mmol, 82% 수율)를 회백색 고체로서 수득하였다. 1H NMR (600MHz, DMSO-d6) δ 8.53 (s, 1H), 8.32 (d, J=5.1 Hz, 1H), 8.08 (s, 1H), 8.06 (dd, J=8.6, 2.0 Hz, 1H), 7.38 (d, J=5.1 Hz, 1H), 7.00 (d, J=8.4 Hz, 1H), 4.14 - 4.00 (m, 2H), 3.70 (s, 3H), 1.89 (s, 3H), 1.80 (dt, J=12.7, 6.1 Hz, 1H), 1.47 - 1.33 (m, 2H), 0.93 (d, J=6.6 Hz, 3H), 0.91 (d, J=6.6 Hz, 3H); LCMS (ESI) m/e 359.3 [(M+H)+, 계산치 C19H27N4O3, 359.2]; LC/MS 체류시간 (방법 B): tR = 1.55분.
실시예 52
(S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메틸-[3,4'-비피리딘]-2'-일)카르바메이트
실시예 51에서와 같이 제조하였다.
파트 A: (S)-1-((5-브로모-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민.
LCMS (ESI) m/e 323.1 [(M+Na)+, 계산치 C13H21BrN2ONa, 323.1]; LC/MS 체류시간 (방법 B): tR = 1.96분.
파트 B: (S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메틸-[3,4'-비피리딘]-2'-일)카르바메이트.
디옥산 (0.5 mL) (N2로 탈기됨) 중 탄산나트륨 (0.149 mL, 0.299 mmol), 1,1'- 비스(디페닐포스피노)페로센-팔라듐(II) 디클로라이드 디클로로메탄 착물 (6.10 mg, 7.47 μmol), (S)-1-((5-브로모-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (0.045 g, 0.149 mmol) 및 (2-((메톡시카르보닐)아미노)피리딘-4-일)보론산 (0.029 g, 0.149 mmol)의 혼합물을 80℃에서 5시간 동안 가열하였다. 반응물을 에틸 아세테이트로 희석하고, 물 (3X)로 세척하였다. 에틸 아세테이트 층을 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 역상 HPLC (아세토니트릴/물/ 10 mM 아세트산암모늄에 의해 정제하여 (S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메틸-[3,4'-비피리딘]-2'-일)카르바메이트 (11.0 mg, 0.073 mmol, 20% 수율)를 회백색 고체로서 수득하였다. 1H NMR (600MHz, DMSO-d6) δ 10.25 (br. s., 1H), 8.35 (s, 1H), 8.31 (d, J=5.1 Hz, 1H), 8.08 (s, 1H), 7.91 (s, 1H), 7.36 (d, J=5.1 Hz, 1H), 4.20 - 4.09 (m, 2H), 2.51 (br. s., 3H), 2.29 (s, 3H), 1.86 - 1.77 (m, 1H), 1.59 - 1.39 (m, 2H), 1.20 (d, J=5.1 Hz, 3H), 0.93 (d, J=6.6 Hz, 3H), 0.92 (d, J=6.6 Hz, 3H); LCMS (ESI) m/e 373.4 [(M+H)+, 계산치 C20H29N4O3 373.2]; LC/MS 체류시간 (방법 A): tR = 1.89분.
실시예 53
(S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-시아노-[3,4'-비피리딘]-2'-일)카르바메이트
실시예 51에서와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-((5-브로모-3-시아노피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
DMF (4 mL) 중 탄산나트륨 (0.246 g, 2.323 mmol), (S)-tert-부틸 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (0.3408 g, 1.162 mmol) 및 5-브로모-2-히드록시니코티노니트릴 (0.277 g, 1.394 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 반응물을 실온으로 냉각시키고, 에틸 아세테이트로 희석한 다음, NaOH (1N) (2X) 및 물 (1X)로 세척하였다. 에틸 아세테이트 층을 분리하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 생성물을 정제된 실리카 겔 크로마토그래피 (헥산 중 0-25% 에틸 아세테이트)에 의해 정제하여 (S)-tert-부틸 (1-((5-브로모-3-시아노피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.261.g, 0.633 mmol, 55% 수율)를 투명한 오일로서 수득하였다. LCMS (ESI) m/e 436.1 [(M+Na)+, 계산치 C18H26BrN3O3Na, 436.1]; LC/MS 체류시간 (방법 B): tR = 2.38분.
파트 B: Boc-(S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-시아노-[3,4'-비피리딘]-2'-일)카르바메이트.
LCMS (ESI) m/e 484.4 [(M+H)+, 계산치 C25H34N5O5, 484.3]; LC/MS 체류시간 (방법 A): tR = 2.24분.
파트 C: (S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-시아노-[3,4'-비피리딘]-2'-일)카르바메이트.
백색 고체로서의 (S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-시아노-[3,4'-비피리딘]-2'-일)카르바메이트 (13.3 mg, 0.034 mmol, 36% 수율)를 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 10.36 (s, 1H), 8.81 - 8.77 (m, 1H), 8.68 - 8.63 (m, 1H), 8.36 (d, J=5.1 Hz, 1H), 8.09 (s, 1H), 7.43 (d, J=4.0 Hz, 1H), 4.20 (d, J=5.9 Hz, 2H), 3.71 (s, 3H), 3.39 (br. s., 2H), 1.82 (d, J=6.2 Hz, 1H), 1.40 (t, J=5.5 Hz, 2H), 1.14 (s, 3H), 0.95 - 0.90 (m, 6H); LCMS (ESI) m/e 367.2 [(M-NH2), 계산치 C20H23N4O3, 367.2]; LC/MS 체류시간 (방법 B): tR = 1.63분.
실시예 54
(S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-4-메틸-[3,4'-비피리딘]-2'-일)카르바메이트
실시예 51에서와 같이 제조하였다.
파트 A: (S)-1-((5-브로모-4-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민.
LCMS (ESI) m/e 301.2 [(M+H)+, 계산치 C13H22BrN2O, 301.1]; LC/MS 체류시간 (방법 A): tR = 1.77분.
파트 B: (S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-4-메틸-[3,4'-비피리딘]-2'-일)카르바메이트.
회백색 고체로서의 (S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-4-메틸-[3,4'-비피리딘]-2'-일)카르바메이트 (15.3 mg, 0.041 mmol, 32% 수율)를 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.34 - 8.30 (m, 1H), 8.00 (s, 1H), 7.81 (s, 1H), 7.11 - 7.08 (m, 1H), 6.85 (s, 1H), 4.01 (d, J=5.5 Hz, 2H), 3.68 (s, 3H), 2.26 (s, 3H), 1.88 (s, 1H), 1.85 - 1.77 (m, 1H), 1.37 (s, 2H), 1.10 (s, 3H), 0.93 (m, 6H); LCMS (ESI) m/e 373.3 [(M+H)+, 계산치 C20H29N4O3, 373.2]; LC/MS 체류시간 (방법 B): tR = 1.60분.
실시예 55
(S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-클로로-[3,4'-비피리딘]-2'-일)카르바메이트
실시예 51에서와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-((5-브로모-3-클로로피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트.
1H NMR (400MHz, 클로로포름-d) δ 8.07 (d, J=2.3 Hz, 1H), 7.76 (d, J=2.3 Hz, 1H), 4.65 (br. s., 1H), 4.48 (d, J=10.3 Hz, 1H), 4.32 (d, J=10.3 Hz, 1H), 1.90 - 1.75 (m, 2H), 1.67 - 1.53 (m, 1H), 1.41 (s, 9H), 1.39 (s, 3H), 0.99 (d, J=2.0 Hz, 3H), 0.97 (d, J=2.0 Hz, 3H); LCMS (ESI) m/e 443.1 [(M+Na)+, 계산치 C17H26BrClN2O3Na, 443.1]; LC/MS 체류시간 (방법 B): tR = 2.55분.
파트 B: Boc-(S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-클로로-[3,4'-비피리딘]-2'-일)카르바메이트.
LCMS (ESI) m/e 493.4 [(M+H)+, 계산치 C24H34ClN4O5, 493.2]; LC/MS 체류시간 (방법 A): tR = 2.38분.
파트 C: (S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-클로로-[3,4'-비피리딘]-2'-일)카르바메이트.
회백색 고체로서의 (S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-클로로-[3,4'-비피리딘]-2'-일)카르바메이트(19.6 mg, 0.047 mmol, 85% 수율)를 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.49 (d, J=2.2 Hz, 1H), 8.34 (d, J=5.1 Hz, 1H), 8.25 (d, J=2.2 Hz, 1H), 8.07 (s, 1H), 7.42 (dd, J=5.1, 1.5 Hz, 1H), 4.22 - 4.06 (m, 2H), 3.71 (s, 3H), 1.87 - 1.75 (m, 1H), 1.48 - 1.34 (m, 2H), 1.14 (s, 3H), 0.93 (d, J=3.7 Hz, 3H), 0.92 (d, J=3.7 Hz, 3H); LCMS (ESI) m/e 393.3 [(M+H)+, 계산치 C19H26ClN4O3, 393.2]; LC/MS 체류시간 (방법 A): tR = 1.98분.
실시예 56
(S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메톡시-[3,4'-비피리딘]-2'-일)카르바메이트
실시예 51에서와 같이 제조하였다.
파트 A: (S)-1-((5-브로모-3-메톡시피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민.
LCMS (ESI) m/e 338.9 [(M+Na)+, 계산치 C13H21BrN2O2Na, 339.1]; LC/MS 체류시간 (방법 B): tR = 1.87분.
파트 B: (S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메톡시-[3,4'-비피리딘]-2'-일)카르바메이트.
회백색 고체로서의 (S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메톡시-[3,4'-비피리딘]-2'-일)카르바메이트 (8.4 mg, 0.021 mmol, 29% 수율)를 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.32 (d, J=5.1 Hz, 1H), 8.09 (s, 1H), 8.04 (d, J=1.8 Hz, 1H), 7.56 (d, J=1.5 Hz, 1H), 7.41 (d, J=4.0 Hz, 1H), 4.08 (q, J=10.3 Hz, 2H), 3.92 (s, 3H), 3.70 (s, 3H), 3.45 (br. s., 3H), 1.81 (dt, J=13.0, 6.3 Hz, 1H), 1.47 - 1.31 (m, 2H), 1.12 (s, 3H), 0.92 (m, 6H); LCMS (ESI) m/e 389.1 [(M+H)+, 계산치 C20H29N4O4, 389.2]; LC/MS 체류시간 (방법 B): tR = 1.64분.
실시예 57
(S)-1-((2'-클로로-5-메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 51에 기재된 바와 같이 제조하였다. (S)-1-((2'-클로로-5-메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민 (15 mg, 0.044 mmol, 49% 수율)을 회백색 고체로서 수득하였다. 1H NMR (600MHz, DMSO-d6) δ 8.51 (br. s., 1H), 8.44 (d, J=5.1 Hz, 1H), 8.09 (br. s., 1H), 7.87 (s, 1H), 7.76 (d, J=4.0 Hz, 1H), 4.10 - 4.04 (m, 2H), 2.26 (s, 3H), 1.84 - 1.75 (m, 1H), 1.40 (t, J=6.2 Hz, 2H), 1.13 (s, 3H), 0.92 (t, J=6.4 Hz, 6H); LCMS (ESI) m/e 334.3 [(M-NH2)+, 계산치 C18H25ClN3O, 334.2]; LC/MS 체류시간 (방법 B): tR = 1.94분.
실시예 58
(S)-1-((2'-(디플루오로메틸)-5-메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 51에 기재된 바와 같이 제조하였다. (S)-1-((2'-(디플루오로메틸)-5-메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민 (15.1 mg, 0.043 mmol, 81% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.72 (d, J = 5.2 Hz, 1H), 8.53 (d, J = 2.5 Hz, 1H), 8.12 (d, J = 2.5 Hz, 1H), 8.01 (s, 1H), 7.92 (d, J = 5.2 Hz, 1H), 6.99 (t, J = 54.9 Hz, 1H), 4.16 - 4.02 (m, 2H), 2.28 (s, 3H), 1.80 (tt, J = 11.5, 5.7 Hz, 1H), 1.49 - 1.35 (m, 2H), 1.14 (s, 3H), 0.92 (m, 6H); LCMS (ESI) m/e 350.3 [(M+H)+, 계산치 C19H26F2N3O, 350.2]; LC/MS 체류시간 (방법 A): tR = 1.80분.
실시예 59
(S)-6-((2-아미노-2,4-디메틸펜틸)옥시)-2'-(디플루오로메틸)-[3,4'-비피리딘]-5-카르보니트릴
실시예 51에서와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-((3-시아노-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
20 mL 바이알에 질소 버블링을 하며 디옥산 (2 mL) 중 (S)-tert-부틸 (1-((5-브로모-3-시아노피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (73 mg, 0.177 mmol), 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란) (54.0 mg, 0.212 mmol), 및 아세트산칼륨 (52.1 mg, 0.531 mmol)을 첨가하여 무색 현탁액을 수득하였다. PdCl2(dppf) (3.89 mg, 5.31 μmol)를 질소 하에 첨가하였다. 바이알을 밀봉하고, 혼합물을 80℃에서 4시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시켰다. 조 물질을 직접 후속 단계에 사용하였다.
파트 B: (S)-tert-부틸 (1-((5-시아노-2'-(디플루오로메틸)-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
디옥산 (1 mL) (N2로 탈기됨) 중 (S)-tert-부틸 (1-((3-시아노-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.040 g, 0.088 mmol), 1,1'-비스(디페닐포스피노)페로센-팔라듐(II)디클로로메탄 착물 (5.03 mg, 6.16 μmol), 4-클로로-2-(디플루오로메틸)피리딘 히드로클로라이드 (0.018 g, 0.088 mmol) 및 Na2CO3 (0.176 mL, 0.352 mmol)의 혼합물을 120℃에서 16시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 에틸 아세테이트로 희석하고, 물 (3X)로 세척하였다. 에틸 아세테이트 층을 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 직접 후속 반응에 사용하였다. LCMS (ESI) m/e 483.2 [(M+Na)+, 계산치 C24H30F2N4Na1O3, 483.2]; LC/MS 체류시간 (방법 B): tR = 2.30분.
파트 C: (S)-6-((2-아미노-2,4-디메틸펜틸)옥시)-2'-(디플루오로메틸)-[3,4'-비피리딘]-5-카르보니트릴.
실시예 51에 기재된 절차를 사용하여 제조하여 회백색 고체로서의 (S)-6-((2-아미노-2,4-디메틸펜틸)옥시)-2'-(디플루오로메틸)-[3,4'-비피리딘]-5-카르보니트릴 (4.7 mg, 0.013 mmol, 15% 수율)을 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 9.02 (d, J = 2.5 Hz, 1H), 8.95 (d, J = 2.6 Hz, 1H), 8.80 (d, J = 5.1 Hz, 1H), 8.15 (s, 1H), 8.02 (d, J = 5.0 Hz, 1H), 7.01 (t, J = 54.8 Hz, 1H), 4.63 (d, J = 11.6 Hz, 1H), 4.51 (d, J = 11.5 Hz, 1H), 1.86 (dq, J = 12.4, 6.2 Hz, 1H), 1.79 (dd, J = 14.4, 5.5 Hz, 1H), 1.62 (dd, J = 14.3, 5.5 Hz, 1H), 1.41 (s, 3H), 0.98 (dd, J = 6.7, 2.2 Hz, 6H); 19F NMR (376 MHz, DMSO-d6) δ -73.65; LCMS (ESI) m/e 383.3 [(M+Na)+, 계산치 C19H22F2N4Na1O1, 383.2]; LC/MS 체류시간 (방법 B): tR = 1.77분.
실시예 60
(S)-1-((5-클로로-2'-메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 51에서와 같이 제조하였다. (S)-1-((5-클로로-2'-메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민 (2 mg, 5.99 umol, 31% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.59 (d, J=1.8 Hz, 1H), 8.50 (d, J=5.1 Hz, 1H), 8.39 (d, J=1.8 Hz, 1H), 7.67 (s, 1H), 7.57 (d, J=4.4 Hz, 1H), 4.19 - 4.10 (m, 2H), 2.53 (s, 3H), 1.86 - 1.77 (m, 1H), 1.47 - 1.37 (m, 2H), 1.15 (s, 3H), 0.99 - 0.88 (m, 6H); LCMS (ESI) m/e 334.3 [(M+H)+, 계산치 C18H25ClN3O, 334.2]; LC/MS 체류시간 (방법 A): tR = 1.90분.
실시예 61
(S)-1-((2',5-디메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 51에서와 같이 제조하였다. (S)-1-((5-클로로-2'-메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민 (20.5 mg, 0.065 mmol, 41% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.47 (d, J=5.1 Hz, 1H), 8.43 (d, J=2.2 Hz, 1H), 8.01 (s, 1H), 7.59 (s, 1H), 7.50 (d, J=5.5 Hz, 1H), 4.11 - 4.00 (m, 2H), 2.52 (s, 3H), 2.26 (s, 3H), 1.80 (dq, J=12.6, 6.3 Hz, 1H), 1.46 - 1.35 (m, 2H), 1.13 (s, 3H), 0.93 (d, J=4.8 Hz, 3H), 0.92 (d, J=4.8 Hz, 3H); LCMS (ESI) m/e 297.1 [(M-NH2)+, 계산치 C19H25ClN2O, 297.2]; LC/MS 체류시간 (방법 B): tR = 1.51분.
실시예 62
(S)-1-((5-메톡시-2'-메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 51에서와 같이 제조하였다. (S)-1-((5-메톡시-2'-메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민 (20.5 mg, 0.065 mmol, 41% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.48 (d, J=5.1 Hz, 1H), 8.14 (s, 1H), 7.65 (d, J=4.0 Hz, 2H), 7.55 (d, J=3.7 Hz, 1H), 4.06 (q, J=10.1 Hz, 2H), 3.93 (s, 3H), 2.53 (s, 3H), 1.85 - 1.70 (m, 1H), 1.42 - 1.31 (m, 2H), 1.11 (s, 3H), 0.92 (t, J=7.0 Hz, 6H); LCMS (ESI) m/e 330.1 [(M+H)+, 계산치 C19H28N3O2, 330.2]; LC/MS 체류시간 (방법 B): tR = 1.42분.
실시예 63
메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-[2,4'-비피리딘]-2'-일)카르바메이트
실시예 29에서와 같이 제조하였다.
파트 A: 벤질 (1-((5-클로로피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 377.3 [(M+H)+, 계산치 C20H26ClN2O3, 377.2]; LC/MS 체류시간 (방법 A): tR = 2.42분.
파트 B: Cbz 메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-[2,4'-비피리딘]-2'-일)카르바메이트.
LCMS (ESI) m/e 493.0 [(M+H)+, 계산치 C27H33N4O5, 493.2]; LC/MS 체류시간 (방법 B): tR = 2.15분.
파트 C: 메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-[2,4'-비피리딘]-2'-일)카르바메이트
에탄올 (4 mL) 중 Pd/C (4 mg, 3.76 μmol) 및 Cbz 보호된 메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-[2,4'-비피리딘]-2'-일)카르바메이트 (0.0123 g, 0.025 mmol)의 혼합물을 실온에서 H2 풍선 하에 밤새 교반하였다. 반응 혼합물을 여과하고, 플라스크를 CH2Cl2로 헹구었다. 필터 케이크를 CH2Cl2로 세척하였다. 여과물을 감압 하에 농축시키고, 잔류물을 역상 HPLC (아세토니트릴/물/10 mM 아세트산암모늄)에 의해 정제하여 메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-[2,4'-비피리딘]-2'-일)카르바메이트 (12.1 mg, 0.032 mmol, 98% 수율)를 회백색 고체로서 수득하였다. 1H NMR (600MHz, DMSO-d6) δ 10.14 (br. s., 1H), 8.49 (s, 1H), 8.45 (d, J=2.8 Hz, 1H), 8.32 (d, J=5.1 Hz, 1H), 7.97 (d, J=8.8 Hz, 1H), 7.63 (d, J=5.1 Hz, 1H), 7.54 (dd, J=8.7, 2.8 Hz, 1H), 3.84 (s, 2H), 3.71 (s, 3H), 1.82 (tt, J=12.7, 6.5 Hz, 1H), 1.46 - 1.35 (m, 2H), 1.14 (s, 3H), 0.95 (d, J=6.8 Hz, 3H), 0.93 (d, J=6.6 Hz, 3H); LCMS (ESI) m/e 359.3 [(M+H)+, 계산치 C19H27N4O3, 359.2]; LC/MS 체류시간 (방법 A): tR = 1.48분.
실시예 64
(S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-6-메틸-[2,4'-비피리딘]-2'-일)카르바메이트
실시예 19에서와 같이 제조하였다.
파트 A: (S)-1-((6-브로모-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민.
LCMS (ESI) m/e 284.2 [(M-NH2)+, 계산치 C13H19BrNO, 284.1]; LC/MS 체류시간 (방법 A): tR = 1.78분 (SM: tR = 1.61분).
파트 B: (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-6-메틸-[2,4'-비피리딘]-2'-일)카르바메이트.
회백색 고체로서의 (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-6-메틸-[2,4'-비피리딘]-2'-일)카르바메이트 (8.5 mg, 0.022 mmol, 34% 수율)를 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.48 (s, 1H), 8.30 (d, J = 5.3 Hz, 1H), 7.83 (d, J = 8.6 Hz, 1H), 7.67 - 7.60 (m, 1H), 7.43 (d, J = 8.6 Hz, 1H), 3.79 (d, J = 2.0 Hz, 2H), 3. 58 (s, 3H), 2.50 (s, 3H), 1.79 (m, 1H), 1.51 - 1.34 (m, 2H), 1.16 (s, 3H), 0.93 (t, J = 6.4 Hz, 6H); LCMS (ESI) m/e 373.3 [(M+H)+, 계산치 C20H29N4O3, 373.2]; LC/MS 체류시간 (방법 A): tR = 1.82분.
실시예 65
(S)-1-((2',6-디메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 51에서와 같이 제조하였다. ((S)-1-((2',6-디메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (7.2 mg, 0.022 mmol, 29% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.49 (d, J = 5.3 Hz, 1H), 7.92 (d, J = 8.5 Hz, 1H), 7.87 (s, 1H), 7.78 (d, J = 5.3 Hz, 1H), 7.43 (d, J = 8.5 Hz, 1H), 3.78 (s, 2H), 2.54 (s, 3H), 2.51 (s, 3H), 1.83 (dt, J = 12.8, 6.4 Hz, 1H), 1.42 (t, J = 5.2 Hz, 2H), 1.15 (s, 3H), 0.94 (t, J = 6.2 Hz, 6H); LCMS (ESI) m/e 314.4 [(M+H)+, 계산치 C19H28N3O, 314.2]; LC/MS 체류시간 (방법 A): tR = 1.84분.
실시예 66
(S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-6-클로로-[2,4'-비피리딘]-2'-일)카르바메이트
실시예 32에서와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-((2-클로로-6-아이오도피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 490.9 [(M+Na)+, 계산치 C17H26ClIN2NaO3, 491.1]; LC/MS 체류시간 (방법 B): tR = 2.40분.
파트 B: (S)-메틸 (5-((2-Boc-아미노-2,4-디메틸펜틸)옥시)-6-클로로-[2,4'-비피리딘]-2'-일)카르바메이트.
LCMS (ESI) m/e 493.0 [(M+H)+, 계산치 C24H34ClN4O5, 493.2]; LC/MS 체류시간 (방법 B): tR = 2.19분.
파트 C: (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-6-클로로-[2,4'-비피리딘]-2'-일)카르바메이트.
회백색 고체로서의 (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-6-클로로-[2,4'-비피리딘]-2'-일)카르바메이트 (12.6 mg, 0.032 mmol, 69% 수율)를 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.45 (s, 1H), 8.35 (d, J = 5.3 Hz, 1H), 8.04 (d, J = 8.4 Hz, 1H), 7.71 (d, J = 8.4 Hz, 1H), 7.62 (d, J = 5.2 Hz, 1H), 3.93 (s, 2H), 3.71 (s, 3H), 1.81 (dq, J = 13.1, 6.5 Hz, 1H), 1.45 (qd, J = 14.0, 5.5 Hz, 2H), 1.18 (s, 3H), 0.93 (t, J = 6.4 Hz, 6H); LCMS (ESI) m/e 393.0 [(M+H)+, 계산치 C19H26Cl1N4O3, 393.2]; LC/MS 체류시간 (방법 A): tR = 1.66분.
실시예 67
(S)-1-((6-클로로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 32에서와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-((6-클로로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트.
이전 절차를 따라 합성하였다. LCMS (ESI) m/e 434.0 [(M+H)+, 계산치 C23H33Cl1N3O3, 434.2]; LC/MS 체류시간 (방법 B): tR = 1.96분.
파트 B: (S)-1-((6-클로로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민.
회백색 고체로서의 (S)-1-((6-클로로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (4.6 mg, 0.013 mmol, 30% 수율)을 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.53 (d, J = 5.2 Hz, 1H), 8.13 (d, J = 8.4 Hz, 1H), 7.85 (s, 1H), 7.76 (d, J = 5.3 Hz, 1H), 7.72 (d, J = 8.5 Hz, 1H), 3.91 (s, 2H), 2.55 (s, 3H), 1.82 (p, J = 6.4 Hz, 1H), 1.52 - 1.38 (m, 2H), 1.17 (s, 3H), 0.94 (t, J = 6.3 Hz, 6H); LCMS (ESI) m/e 334.1 [(M+H)+, 계산치 C18H25Cl1N3O1, 334.2]; LC/MS 체류시간 (방법 A): tR = 1.48분.
실시예 68
(S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4-메틸-[2,4'-비피리딘]-2'-일)카르바메이트
실시예 32에서와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-((6-클로로-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 357.3 [(M+H)+, 계산치 C18H30ClN2O3, 357.2]; LC/MS 체류시간 (방법 A): tR = 2.23분.
파트 B: (S)-tert-부틸 (1-((6-클로로-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 357.3 [(M+H)+, 계산치 C18H30ClN2O3, 357.2]; LC/MS 체류시간 (방법 A): tR = 2.23분.
파트 C: (S)-1-((6-클로로-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민.
LCMS (ESI) m/e 257.0 [(M+H)+, 계산치 C13H22ClN2O, 257.1]; LC/MS 체류시간 (방법 B): tR = 1.70분.
파트 D: (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4-메틸-[2,4'-비피리딘]-2'-일)카르바메이트.
회백색 고체로서의 (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4-메틸-[2,4'-비피리딘]-2'-일)카르바메이트 (1.1 mg, 2.92 umol, 5% 수율)를 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.49 (s, 1H), 8.36 (s, 1H), 8.32 (d, J=5.1 Hz, 1H), 7.87 (s, 1H), 7.63 (d, J=5.5 Hz, 1H), 3.89 (s, 2H), 3.71 (s, 3H), 2.32 (s, 3H), 1.86 - 1.79 (m, 1H), 1.42 (t, J=5.7 Hz, 2H), 1.15 (s, 3H), 0.93 (t, J=6.6 Hz, 6H);LCMS (ESI) m/e 373.1 [(M+H)+, 계산치 C20H29N4O3, 373.2]; LC/MS 체류시간 (방법 B): tR = 1.67분.
실시예 69
(S)-2,4-디메틸-1-(4-(퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민
실시예 32에서와 같이 제조하였다. (S)-2,4-디메틸-1-(4-(퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민 (50 mg, 0.123 mmol, 17% 수율)을 갈색 고체로서 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.96 (d, J=4.5 Hz, 1H), 8.20 (d, J=8.5 Hz, 1H), 7.87 (dd, J=8.4, 0.9 Hz, 1H), 7.75 (td, J=4.2, 1.4 Hz, 2H), 7.65 (dd, J=8.5, 2.0 Hz, 1H), 7.58 - 7.52 (m, 1H), 7.33 (d, J=4.5 Hz, 1H), 7.14 (d, J=8.5 Hz, 1H), 3.93 - 3.86 (m, 2H), 1.82 (d, J=6.5 Hz, 1H), 1.68 - 1.59 (m, 2H), 1.54 (t, J=5.5 Hz, 2H), 1.28 (s, 3H), 1.06 - 0.98 (m, 6H); 19F NMR (376MHz, 클로로포름-d) δ -62.29 (s, 3F); LCMS (ESI) m/e 403.2 [(M+H)+, 계산치 C23H26F3N2O, 403.2]; LC/MS 체류시간 (방법 B): tR = 1.73분.
실시예 70
(S)-2,4-디메틸-1-(2-(트리플루오로메틸)-4-(7-(트리플루오로메틸)퀴놀린-4-일)페녹시)펜탄-2-아민
실시예 32에서와 같이 제조하였다. 에탄올 (4 mL) 중 2-(디시클로헥실포스피노)-2',4',6'-트리이소프로필비페닐 (2.90 mg, 6.09 μmol), 아세트산칼륨 (0.090 g, 0.913 mmol), 제2 세대 Xphos 전촉매 (2.395 mg, 3.04 μmol), 4-클로로-8-(트리플루오로메틸)퀴놀린 (0.0705 g, 0.304 mmol) 및 하이포이붕산 (0.041 g, 0.457 mmol)의 혼합물을 진공/N2 충전 주기를 통해 3회 탈기하였다. 반응 혼합물을 80℃에서 3시간 동안 가열하였다. 반응물을 실온으로 냉각시켰다. THF (4 mL) 중 (S)-1-(4-브로모-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (0.026 g, 0.073 mmol) 및 제2 세대 Xphos 전촉매 (2.395 mg, 3.04 μmol)를 반응 혼합물에 첨가하고, 이어서 삼염기성 인산칼륨 (3 mL, 1.500 mmol)을 실온에서 첨가하였다. 반응 혼합물을 진공/N2 충전 주기에 3회 적용한 후, 80℃에서 밤새 가열하였다. 반응물을 실온으로 냉각시킨 다음, 에틸 아세테이트로 희석하고, 물 (3X)로 세척하였다. 에틸 아세테이트 층을 분리하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 조 물질을 역상 HPLC (아세토니트릴/물/10 mM 아세트산암모늄)에 의해 정제하여 (S)-2,4-디메틸-1-(2-(트리플루오로메틸)-4-(7-(트리플루오로메틸)퀴놀린-4-일)페녹시)펜탄-2-아민 (8.9 mg, 0.018 mmol, 5% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.11 (d, J=4.3 Hz, 1H), 8.46 (s, 1H), 8.08 (d, J=8.5 Hz, 1H), 7.90 (d, J=8.9 Hz, 1H), 7.86 (d, J=8.2 Hz, 1H), 7.83 (s, 1H), 7.70 (d, J=4.3 Hz, 1H), 7.45 (d, J=8.5 Hz, 1H), 3.94 - 3.87 (m, 2H), 1.82 (d, J=6.1 Hz, 1H), 1.42 (d, J=5.5 Hz, 2H), 1.15 (s, 3H), 0.94 (dd, J=6.4, 2.1 Hz, 6H); LCMS (ESI) m/e 471.3 [(M+H)+, 계산치 C24H25F6N2O, 471.2]; LC/MS 체류시간 (방법 A): tR = 2.28분.
실시예 71
(S)-1-(4-(7-플루오로퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
실시예 32에서와 같이 제조하였다. (S)-1-(4-(7-플루오로퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (4.2 mg, 9.89 umol,2% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.96 (d, J=4.0 Hz, 1H), 7.97 - 7.79 (m, 3H), 7.77 (s, 1H), 7.60 - 7.53 (m, 1H), 7.50 (d, J=4.0 Hz, 1H), 7.43 (d, J=8.5 Hz, 1H), 3.89 (d, J=7.6 Hz, 2H), 1.81 (d, J=6.4 Hz, 1H), 1.41 (d, J=5.2 Hz, 2H), 1.14 (s, 3H), 0.93 (d, J=4.9 Hz, 6H); LCMS (ESI) m/e 404.2 [(M-NH2)+, 계산치 C23H22F4NO, 404.2]; LC/MS 체류시간 (방법 B): tR = 1.88분.
실시예 72
(S)-1-(4-(5,7-디플루오로퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
실시예 32에서와 같이 제조하였다. (S)-1-(4-(5,7-디플루오로퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (17.5 mg, 0.039 mmol, 23% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.02 - 8.96 (m, 1H), 7.82 - 7.76 (m, 1H), 7.73 (br. s., 2H), 7.56 (br. s., 1H), 7.46 (d, J=4.3 Hz, 1H), 7.33 (d, J=8.5 Hz, 1H), 3.88 (d, J=6.4 Hz, 2H), 1.82 (br. s., 1H), 1.42 (d, J=5.2 Hz, 2H), 1.15 (s, 3H), 0.93 (d, J=6.6 Hz, 6H);LCMS (ESI) m/e 439.4 [(M+H)+, 계산치 C23H24F5N2O, 439.2]; LC/MS 체류시간 (방법 A): tR = 2.14분.
실시예 73
(S)-1-(4-(6-플루오로퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
실시예 32에서와 같이 제조하였다. (S)-1-(4-(6-플루오로퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (9.6 mg, 0.023 mmol, 22% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.95 (d, J = 4.4 Hz, 1H), 8.21 (dd, J = 9.2, 5.5 Hz, 1H), 7.85 (d, J = 8.5 Hz, 1H), 7.79 (d, J = 2.6 Hz, 1H), 7.75 (td, J = 8.9, 2.9 Hz, 1H), 7.57 (d, J = 4.4 Hz, 1H), 7.50 (dd, J = 10.3, 3.0 Hz, 1H), 7.44 (d, J = 8.6 Hz, 1H), 3.92 (q, J = 8.9 Hz, 2H), 1.83 (dt, J = 13.1, 6.7 Hz, 1H), 1.43 (d, J = 5.5 Hz, 2H), 1.16 (s, 3H), 0.94 (dd, J = 6.7, 3.2 Hz, 6H); 19F NMR (376 MHz, DMSO-d6) δ -61.01, -244.69; LCMS (ESI) m/e 421.2 [(M+H)+, 계산치 C23H25F4N2O1, 421.2]; LC/MS 체류시간 (방법 B): tR = 1.80분.
실시예 74
(S)-1-(2-시클로프로필-4-(퀴놀린-4-일)페녹시)-2,4-디메틸펜탄-2-아민
실시예 32에서와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-(2-시클로프로필-4-(퀴놀린-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 475.1 [(M+H)+, 계산치 C30H39N2O3, 475.3]; LC/MS 체류시간 (방법 B): tR = 2.21분.
파트 B: (S)-1-(2-시클로프로필-4-(퀴놀린-4-일)페녹시)-2,4-디메틸펜탄-2-아민.
(12.7 mg, 0.032 mmol, 33% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.90 (d, J = 4.4 Hz, 1H), 8.09 (d, J = 8.3 Hz, 1H), 7.90 (d, J = 8.5 Hz, 1H), 7.78 (t, J = 7.6 Hz, 1H), 7.60 (t, J = 7.6 Hz, 1H), 7.42 (d, J = 4.4 Hz, 1H), 7.32 (d, J = 8.2 Hz, 1H), 7.10 (d, J = 8.3 Hz, 1H), 7.03 (s, 1H), 3.82 (s, 2H), 2.27 (p, J = 6.9 Hz, 1H), 1.85 (dt, J = 12.7, 6.6 Hz, 1H), 1.47 (q, J = 8.2, 7.0 Hz, 2H), 1.20 (s, 3H), 0.95 (q, J = 7.9, 7.2 Hz, 8H), 0.71 (t, J = 4.1 Hz, 2H); LCMS (ESI) m/e 375.1 [(M+H)+, 계산치 C25H31N2O1, 375.2]; LC/MS 체류시간 (방법 B): tR = 1.69분.
실시예 75
1-(2-클로로-6-플루오로-4-(퀴놀린-4-일)페녹시)-2,4-디메틸펜탄-2-아민
실시예 29에서와 같이 제조하였다.
파트 A: 벤질 (1-(4-브로모-2-클로로-6-플루오로페녹시)-2,4-디메틸펜탄-2-일)카르바메이트.
4-브로모-2-클로로-6-플루오로페놀 (23.00 mg, 0.102 mmol), 탄산나트륨 (35 mg, 0.330 mmol) 및 벤질 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (0.0334 g, 0.102 mmol)의 NMP (0.3 mL) 현탁액을 50℃에서 밤새 가열하였다. 반응물을 에틸 아세테이트로 희석하고, 물 (3X)로 세척하였다. 에틸 아세테이트 층을 분리하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 조 물질을 추가 정제 없이 사용하였다. LCMS (ESI) m/e 496.0 [(M+Na)+, 계산치 C21H24ClBrFNO3Na, 494.1]; LC/MS 체류시간 (방법 B): tR = 2.59분.
파트 B: 벤질 (1-(2-클로로-6-플루오로-4-(퀴놀린-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 521.4 [(M+H)+, 계산치 C30H31ClFN2O3, 521.2]; LC/MS 체류시간 (방법 A): tR = 2.38분.
파트 C: 1-(2-클로로-6-플루오로-4-(퀴놀린-4-일)페녹시)-2,4-디메틸펜탄-2-아민
트리에틸실란(0.1 ml, 0.626 mmol)을 실온에서 아세트산팔라듐 (II)(2 mg, 8.91 μmol) 및 트리에틸아민(0.1 ml, 0.717 mmol)의 CH2Cl2 (0.2 mL) 현탁액에 첨가하였다. 반응물은 흑색으로 변하였다. 용액을 실온에서 10분 동안 교반한 후, 벤질 (1-(2-클로로-6-플루오로-4-(퀴놀린-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.0441 g, 0.085 mmol) (벤질 (1-(2-클로로-6-플루오로-4-(퀴놀린-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.0441 g, 0.085 mmol)를 함유하는 플라스크를 CH2Cl2 (0.2 mL)로 헹구고, 반응 혼합물에 첨가함)의 CH2Cl2 (0.2 mL) 용액을 첨가하였다. 반응물을 실온에서 밤새 교반하였다. 용매를 감압 하에 제거하고, 조 물질을 역상 HPLC (아세토니트릴/물/10 mM 아세트산암모늄)에 의해 정제하여 1-(2-클로로-6-플루오로-4-(퀴놀린-4-일)페녹시)-2,4-디메틸펜탄-2-아민 (8.9 mg, 0.022 mmol, 26% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.96 (d, J=4.4 Hz, 1H), 8.13 (d, J=8.4 Hz, 1H), 7.88 (s, 1H), 7.83 (s, 1H), 7.66 (s, 1H), 7.60 - 7.50 (m, 3H), 3.98 - 3.90 (m, 2H), 1.89 - 1.81 (m, 1H), 1.44 (dd, J=14.9, 5.7 Hz, 2H), 1.18 (s, 3H), 0.97 (dd, J=9.4, 6.8 Hz, 6H); LCMS (ESI) m/e 387.2 [(M+H)+, 계산치 C22H25FClN2O, 387.2]; LC/MS 체류시간 (방법 B): tR = 1.70분.
실시예 76
(S)-1-((5-(7-플루오로퀴놀린-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
중간체를 실시예 19에 기재된 바와 같이 제조하였다. 디옥산 (1 mL) 중 아세트산칼륨 (0.026 g, 0.266 mmol), (S)-1-((5-브로모-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (0.0267 g, 0.089 mmol), 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란) (0.027 g, 0.106 mmol)의 혼합물을 진공/재충전 N2 (5X)에 적용하였다. PdCl2(dppf) (1.946 mg, 2.66 μmol)를 반응 혼합물에 첨가하고, 반응물을 80℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시켰다. 디옥산 (1.2 mL) 중 PdCl2(dppf) (3.26 mg, 4.45 μmol), 탄산나트륨 (0.089 mL, 0.178 mmol, 2N), 4-클로로-7-플루오로퀴놀린 (16.16 mg, 0.089 mmol) 및 (S)-2,4-디메틸-1-((3-메틸-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-2-일)옥시)펜탄-2-아민 (31.0 mg, 0.089 mmol)을 용기 혼합물에 첨가하고, 혼합물을 진공/ N2 충전 주기를 통해 3회 탈기하였다. 반응 혼합물을 130℃에서 4시간 동안 가열하였다. 반응물을 실온으로 냉각시킨 다음, 에틸 아세테이트로 희석하고, 물 (2X)에 이어서 염수로 세척하였다. 에틸 아세테이트 층을 분리하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 조 물질을 역상 HPLC (아세토니트릴/물/10 mM 아세트산암모늄)에 의해 정제하여 (S)-1-((5-(7-플루오로퀴놀린-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (15.2 mg, 0.041 mmol, 47% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.99 - 8.95 (m, 1H), 8.20 - 8.16 (m, 1H), 7.98 (dd, J=9.2, 6.2 Hz, 1H), 7.88 - 7.83 (m, 1H), 7.81 (s, 1H), 7.59 - 7.53 (m, 1H), 7.49 (d, J=4.4 Hz, 1H), 4.11 (d, J=4.4 Hz, 2H), 3.46 (br. s., 2H), 1.90 (s, 3H), 1.87 - 1.79 (m, 1H), 1.45 (t, J=6.2 Hz, 2H), 1.17 (s, 3H), 0.95 (t, J=6.1 Hz, 6H); LCMS (ESI) m/e 386.2 [(M+H)+, 계산치 C22H27FN3O, 386.2]; LC/MS 체류시간 (방법 B): tR = 1.78분.
실시예 77
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(5,7-디플루오로퀴놀린-4-일)니코티노니트릴
실시예 53에 기재된 바와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-((5-브로모-3-시아노피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 434.1 [(M+Na)+, 계산치 C18H26BrN3O3Na, 434.1]; LC/MS 체류시간 (방법 B): tR = 2.38분.
파트 B: 4-브로모-5,7-디플루오로퀴놀린
20 mL 마이크로웨이브 튜브에 실온에서 4-클로로-5,7-디플루오로퀴놀린 (0.159 g, 0.795 mmol) 및 프로피오니트릴 (1mL)에 이어서 TMS-Br (0.206 mL, 1.59 mmol)을 첨가하였다. 침전물이 형성되었다. 튜브를 밀봉하고, 100℃로 밤새 가열하였다. 반응물을 실온으로 냉각시켰다. 조 혼합물을 빙냉 NaOH (1N, 3 mL)에 붓고, 튜브를 물로 세척하였다. 수성 층을 디에틸 에테르 (3X)로 추출하였다. 디에틸 에테르 층을 합하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켜 4-브로모-5,7-디플루오로퀴놀린 (14.2 mg, 0.582 mmol, 73% 수율)을 황색 고체로서 수득하였다. LCMS (ESI) m/e 243.8 [(M+Na)+, 계산치 C9H5BrNF2, 244.0]; LC/MS 체류시간 (방법 B): tR = 2.04분.
파트 C: 5,7-디플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)퀴놀린
디옥산 (3 mL) 중 아세트산칼륨 (0.122 g, 1.242 mmol), 4-브로모-5,7-디플루오로퀴놀린 (0.1010 g, 0.414 mmol), 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란) (0.126 g, 0.497 mmol)의 혼합물을 진공/질소의 재충전의 주기에 5회 적용하였다. PdCl2(dppf) (9.09 mg, 0.012 mmol)를 반응 혼합물에 실온에서 첨가하고, 반응물을 80℃에서 밤새 가열하였다. 조 물질을 후속 단계에 그대로 사용하였다.
파트 D: (S)-tert-부틸 (1-((3-시아노-5-(5,7-디플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
디옥산 (2 mL) (탈기됨) 중 탄산나트륨 (0.138 mL, 0.276 mmol), 1,1'- 비스(디페닐포스피노)페로센-팔라듐(II) 디클로라이드 디클로로메탄 착물 (7.89 mg, 9.66 μmol), 5,7-디플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)퀴놀린 (0.040 g, 0.138 mmol) 및 (S)-tert-부틸 (1-((5-브로모-3-시아노피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.057 g, 0.138 mmol)의 혼합물을 100℃에서 3시간 동안 가열하였다. 반응물을 에틸 아세테이트로 희석하고, 물 (3X)로 세척하였다. 에틸 아세테이트 층을 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (헥산 중 0-10-25% 에틸 아세테이트)에 의해 정제하여 (S)-tert-부틸 (1-((3-시아노-5-(5,7-디플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.0372g, 0.075 mmol, 54% 수율)를 갈색 고체로서 수득하였다. LCMS (ESI) m/e 519.0 [(M+Na)+, 계산치 C27H30F2N4O3Na, 519.2]; LC/MS 체류시간 (방법 B): tR = 2.38분.
파트 E: (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(5,7-디플루오로퀴놀린-4-일)니코티노니트릴.
1H NMR (500MHz, DMSO-d6) δ 9.04 (d, J=4.4 Hz, 1H), 8.59 (s, 1H), 8.54 (br. s., 1H), 7.82 (d, J=9.2 Hz, 1H), 7.70 - 7.59 (m, 1H), 7.54 (d, J=4.4 Hz, 1H), 4.30 - 4.17 (m, 2H), 3.44 (br. s., 2H), 1.87 - 1.79 (m, 1H), 1.50 - 1.36 (m, 2H), 1.16 (s, 3H), 0.96 (d, J=2.9 Hz, 3H), 0.94 (d, J=2.9 Hz, 3H); LCMS (ESI) m/e 397.2 [(M+H)+, 계산치 C22H23F2N4O, 397.2]; LC/MS 체류시간 (방법 B): tR = 2.39분.
실시예 78
(S)-1-((3-클로로-5-(퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 77에서와 같이 제조하였다.
파트 A: Boc (S)-1-((3-클로로-5-(퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민.
(ESI) m/e 470.4 [(M+H)+, 계산치 C26H33ClN3O3, 470.2]; LC/MS 체류시간 (방법 A): tR = 2.45분.
파트 B: (S)-1-((3-클로로-5-(퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민.
1H NMR (500MHz, DMSO-d6) δ 8.99 (d, J=4.4 Hz, 1H), 8.36 (d, J=1.8 Hz, 1H), 8.25 (d, J=1.8 Hz, 1H), 7.96 (s, 1H), 7.89 - 7.80 (m, 2H), 7.67 (t, J=7.5 Hz, 1H), 7.55 (d, J=4.4 Hz, 1H), 4.59 - 4.42 (m, 2H), 1.94 - 1.61 (m, 3H), 1.43 (s, 3H), 0.98 (t, J=6.4 Hz, 6H); LCMS (ESI) m/e 370.3 [(M+H)+, 계산치 C21H25ClN3O, 370.2]; LC/MS 체류시간 (방법 A): tR = 2.09분.
실시예 79
(S)-1-((3-메톡시-5-(퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 77에서와 같이 제조하였다. (S)-1-((3-메톡시-5-(퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (5.4 mg, 0.014 mmol, 23% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.96 (d, J=4.4 Hz, 1H), 8.12 (d, J=8.4 Hz, 1H), 7.97 (d, J=8.4 Hz, 1H), 7.86 (d, J=1.5 Hz, 1H), 7.82 (t, J=7.5 Hz, 1H), 7.64 (t, J=7.7 Hz, 1H), 7.53 (d, J=4.4 Hz, 1H), 7.51 (d, J=1.5 Hz, 1H), 4.17 - 4.06 (m, 2H), 3.60 (br. s., 3H), 1.84 (dt, J=12.8, 6.4 Hz, 1H), 1.47 - 1.36 (m, 2H), 1.15 (s, 3H), 0.95 (t, J=7.2 Hz, 6H); LCMS (ESI) m/e 366.0 [(M+H)+, 계산치 C22H28N3O2, 366.2]; LC/MS 체류시간 (방법 B): tR = 1.55분.
실시예 80
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(1,6-나프티리딘-4-일)니코티노니트릴
실시예 77에서와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-((3-시아노-5-(1,6-나프티리딘-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 484.2 [(M+Na)+, 계산치 C26H31F2N5Na1O3, 484.2]; LC/MS 체류시간 (방법 B): tR = 2.14분.
파트 B: (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(1,6-나프티리딘-4-일)니코티노니트릴.
회백색 고체로서의 (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(1,6-나프티리딘-4-일)니코티노니트릴 (22 mg, 0.058 mmol, 66% 수율)을 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 9.28 (s, 1H), 9.23 (d, J = 4.4 Hz, 1H), 8.84 (d, J = 5.7 Hz, 1H), 8.78 (d, J = 2.4 Hz, 1H), 8.75 (d, J = 2.5 Hz, 1H), 8.04 (d, J = 5.8 Hz, 1H), 7.74 (d, J = 4.5 Hz, 1H), 4.68 (d, J = 11.6 Hz, 1H), 4.56 (d, J = 11.5 Hz, 1H), 1.89 (dq, J = 12.7, 6.2 Hz, 1H), 1.81 (dd, J = 14.4, 5.5 Hz, 1H), 1.64 (dd, J = 14.4, 5.6 Hz, 1H), 1.44 (s, 3H), 1.01 (d, J = 6.6 Hz, 6H); LCMS (ESI) m/e 362.2 [(M+H)+, 계산치 C21H24N5O1, 362.2]; LC/MS 체류시간 (방법 B): tR = 1.56분.
실시예 81
(S)-2,4-디메틸-1-((2-메틸-6-(퀴놀린-4-일)피리딘-3-일)옥시)펜탄-2-아민
실시예 77에서와 같이 제조하였다. (S)-2,4-디메틸-1-((2-메틸-6-(퀴놀린-4-일)피리딘-3-일)옥시)펜탄-2-아민 (10.3 mg, 0.028 mmol, 43% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.96 (d, J = 4.4 Hz, 1H), 8.25 (d, J = 8.5 Hz, 1H), 8.10 (d, J = 8.5 Hz, 1H), 7.79 (t, J = 7.6 Hz, 1H), 7.65 - 7.56 (m, 3H), 7.51 (d, J = 8.4 Hz, 1H), 3.81 (d, J = 2.2 Hz, 2H), 2.53 (s, 3H), 1.84 (dq, J = 12.6, 6.4 Hz, 1H), 1.50 - 1.38 (m, 2H), 1.17 (s, 3H), 0.96 (t, J = 6.2 Hz, 6H); LCMS (ESI) m/e 350.3 [(M+H)+, 계산치 C22H28N3O1, 350.2]; LC/MS 체류시간 (방법 A): tR = 1.86분.
실시예 82
(S)-2,4-디메틸-1-((4-메틸-6-(퀴놀린-4-일)피리딘-3-일)옥시)펜탄-2-아민
실시예 77에서와 같이 제조하였다. (S)-2,4-디메틸-1-((4-메틸-6-(퀴놀린-4-일)피리딘-3-일)옥시)펜탄-2-아민 (11 mg, 0.030 mmol, 39% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.97 (d, J=4.4 Hz, 1H), 8.44 (s, 1H), 8.25 (d, J=8.8 Hz, 1H), 8.10 (d, J=8.4 Hz, 1H), 7.80 (t, J=7.7 Hz, 1H), 7.67 - 7.57 (m, 3H), 3.94 (s, 2H), 2.34 (s, 3H), 1.87 - 1.81 (m, 1H), 1.52 - 1.40 (m, 2H), 1.18 (s, 3H), 0.96 (t, J=6.8 Hz, 6H); LCMS (ESI) m/e 350.1 [(M+H)+, 계산치 C22H28N3O, 350.2]; LC/MS 체류시간 (방법 B): tR = 1.67분.
실시예 83
(S)-1-((2-클로로-6-(퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 77에서와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-((2-클로로-6-(퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 470.0 [(M+H)+, 계산치 C26H33Cl1N3O3, 470.2]; LC/MS 체류시간 (방법 B): tR = 2.15분.
파트 B: (S)-1-((2-클로로-6-(퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
(6.3 mg, 0.016 mmol, 36% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 9.00 (d, J = 4.4 Hz, 1H), 8.20 (d, J = 8.5 Hz, 1H), 8.13 (d, J = 8.4 Hz, 1H), 7.86 - 7.77 (m, 3H), 7.69 - 7.60 (m, 2H), 3.97 - 3.87 (m, 2H), 1.85 (dt, J = 12.8, 6.5 Hz, 1H), 1.44 (t, J = 4.8 Hz, 2H), 1.17 (s, 3H), 0.96 (t, J = 6.0 Hz, 6H); LCMS (ESI) m/e 370.0 [(M+H)+, 계산치 C21H25Cl1N3O1, 370.2]; LC/MS 체류시간 (방법 B): tR = 1.57분.
실시예 84
(S)-1-(4-(1H-피롤로[2,3-b]피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
실시예 19에서와 같이 제조하여 (S)-1-(4-(1H-피롤로[2,3-b]피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (27 mg, 0.069 mmol, 79% 수율)을 회백색 고체로서 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.36 (d, J=5.0 Hz, 1H), 8.00 (d, J=2.0 Hz, 1H), 7.89 (dd, J=8.5, 2.0 Hz, 1H), 7.41 (d, J=3.5 Hz, 1H), 7.18 - 7.08 (m, 2H), 6.68 (d, J=3.5 Hz, 1H), 3.92 - 3.84 (m, 2H), 1.82 - 1.77 (m, 1H), 1.60 - 1.48 (m, 2H), 1.28 (s, 3H), 1.01 (dd, J=9.0, 6.8 Hz, 6H); 19F NMR (376MHz, 클로로포름-d) δ -62.31 (s, 3F); LCMS (ESI) m/e 392.2 [(M+H)+, 계산치 C21H25F3N3O, 392.2]; LC/MS 체류시간 (방법 B): tR = 1.81분.
실시예 85
(S)-1-(4-(1,6-나프티리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
파트 A: 4-(4-메톡시-3-(트리플루오로메틸)페닐)-1,6-나프티리딘.
20 mL 바이알에 THF (2.5 mL) 중 4-클로로-1,6-나프티리딘 (200 mg, 1.215 mmol), (4-메톡시-3-(트리플루오로메틸)페닐)보론산 (321 mg, 1.458 mmol), 및 삼염기성 인산칼륨 (4.86 mL, 2.430 mmol)을 첨가하여 황색 현탁액을 수득하였다. N2로 5분 동안 탈기한 후, 제2 세대 XPHOS 전촉매 (19.12 mg, 0.024 mmol)를 첨가하였다. 혼합물을 질소 하에 밀봉하고, 40℃에서 2시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 물 및 EtOAc로 희석하였다. 층을 분리하였다. 유기 층을 염수로 세척하고, 건조 (Na2SO4)시키고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (최대 8% MeOH/CH2Cl2)에 의해 정제하여 4-(4-메톡시-3-(트리플루오로메틸)페닐)-1,6-나프티리딘 (369 mg, 1.213 mmol, 정량적 수율)을 담황색 고체로서 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 9.37 (d, J = 0.9 Hz, 1H), 9.14 (d, J = 4.5 Hz, 1H), 8.83 (d, J = 5.9 Hz, 1H), 8.03 (dd, J = 6.0, 0.9 Hz, 1H), 7.80 (d, J = 2.2 Hz, 1H), 7.73 (dd, J = 8.5, 2.2 Hz, 1H), 7.47 (d, J = 4.5 Hz, 1H), 7.23 (d, J = 8.6 Hz, 1H), 4.05 (s, 3H); 19F NMR (376 MHz, 클로로포름-d) δ -62.63; LCMS (ESI) m/e 305.2 [(M+H)+, 계산치 C16H12F3N2O1, 305.1]; LC/MS 체류시간 (방법 A): tR = 1.86분.
파트 B: 4-(1,6-나프티리딘-4-일)-2-(트리플루오로메틸)페놀
250 mL 둥근 바닥 플라스크에 질소 하에 CH2Cl2 (5 mL) 중 4-(4-메톡시-3-(트리플루오로메틸)페닐)-1,6-나프티리딘 (369 mg, 1.213 mmol)을 첨가하여 황색 용액을 수득하였다. BBr3 (12.13 mL, 12.13 mmol)을 천천히 첨가하였다. 혼합물을 질소 하에 5시간 동안 환류하였다. 반응물을 1N NaOH으로 천천히 켄칭하여 pH ~5로 조절하였다. EtOAc을 첨가하였다. 층을 분리하였다. 수성 층을 EtOAc로 추출하였다. 합한 유기 층을 염수로 세척하고, 건조 (Na2SO4)시키고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (최대 8% MeOH/CH2Cl2)에 의해 정제하여 4-(1,6-나프티리딘-4-일)-2-(트리플루오로메틸)페놀 (124 mg, 0.427 mmol, 35%)을 백색 고체로서 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 9.45 (s, 1H), 9.21 (d, J = 4.7 Hz, 1H), 8.84 (d, J = 6.1 Hz, 1H), 8.16 (d, J = 6.1 Hz, 1H), 7.89 - 7.75 (m, 1H), 7.60 (q, J = 3.4 Hz, 2H), 7.34 (d, J = 8.4 Hz, 1H); 19F NMR (376 MHz, 클로로포름-d) δ -62.58; LCMS (ESI) m/e 291.2 [(M+H)+, 계산치 C15H10F3N2O1, 291.2]; LC/MS 체류시간 (방법 B): tR = 1.59분.
파트 C: (S)-tert-부틸 (1-(4-(1,6-나프티리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 526.2 [(M+Na)+, 계산치 C27H32F3N3Na1O3, 526.2]; LC/MS 체류시간 (방법 B): tR = 2.31분.
파트 D: (S)-1-(4-(1,6-나프티리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민.
(35.7 mg, 0.087 mmol, 99% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 9.26 (s, 1H), 9.17 (d, J = 4.5 Hz, 1H), 8.80 (d, J = 5.8 Hz, 1H), 8.01 (d, J = 5.9 Hz, 1H), 7.95 (d, J = 8.7 Hz, 1H), 7.90 (s, 1H), 7.69 (d, J = 4.4 Hz, 1H), 7.47 (d, J = 8.6 Hz, 1H), 3.94 (q, J = 9.0 Hz, 2H), 1.83 (dq, J = 12.9, 6.4 Hz, 1H), 1.44 (dd, J = 5.8, 2.6 Hz, 2H), 1.17 (s, 3H), 0.94 (dd, J = 6.8, 3.3 Hz, 6H); 19F NMR (376 MHz, DMSO-d6) δ -61.02; LCMS (ESI) m/e 404.2 [(M+H)+, 계산치 C22H25F3N3O1, 362.2]; LC/MS 체류시간 (방법 B): tR = 1.79분.
실시예 86
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(1,6-나프티리딘-4-일)벤조니트릴
실시예 51에서와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-(4-브로모-2-시아노페녹시)-2,4-디메틸펜탄-2-일)카르바메이트.
1H NMR (400 MHz, 클로로포름-d) δ 7.63 (d, J = 2.5 Hz, 1H), 7.58 (dd, J = 9.0, 2.5 Hz, 1H), 6.91 (d, J = 9.0 Hz, 1H), 4.57 (s, 1H), 4.31 (d, J = 9.0 Hz, 1H), 4.09 (d, J = 9.0 Hz, 1H), 1.90 (dd, J = 14.0, 6.5 Hz, 1H), 1.86 - 1.75 (m, 1H), 1.47 (dd, J = 14.0, 5.0 Hz, 1H), 1.39 (s, 3H), 1.37 (s, 9H), 0.99 (d, J = 1.9 Hz, 3H), 0.97 (d, J = 1.9 Hz, 3H); LCMS (ESI) m/e 432.9 [(M+Na)+, 계산치 C19H27Br1N2Na1O3, 433.1]; LC/MS 체류시간 (방법 B): tR = 2.38분.
파트 B: (S)-tert-부틸 (1-(2-시아노-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 481.1 [(M+Na)+, 계산치 C25H39BN2NaO5, 481.3]; LC/MS 체류시간 (방법 B): tR = 2.49분.
파트 C: (S)-tert-부틸 (1-(2-시아노-4-(1,6-나프티리딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 483.1 [(M+Na)+, 계산치 C27H32N4Na1O3, 483.2]; LC/MS 체류시간 (방법 B): tR = 2.10분.
파트 D: (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(1,6-나프티리딘-4-일)벤조니트릴.
회백색 고체로서의 (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(1,6-나프티리딘-4-일)벤조니트릴 (6.7 mg, 0.017 mmol, 34% 수율)을 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 9.27 (s, 1H), 9.17 (d, J = 4.5 Hz, 1H), 8.80 (d, J = 5.8 Hz, 1H), 8.11 (d, J = 2.2 Hz, 1H), 8.01 (d, J = 5.8 Hz, 1H), 7.97 (dd, J = 8.7, 2.3 Hz, 1H), 7.67 (d, J = 4.5 Hz, 1H), 7.47 (d, J = 8.8 Hz, 1H), 4.03 - 3.92 (m, 2H), 1.85 (dt, J = 12.6, 6.3 Hz, 1H), 1.51 - 1.40 (m, 2H), 1.18 (s, 3H), 0.96 (dd, J = 6.7, 4.3 Hz, 6H); LCMS (ESI) m/e 361.0 [(M+H)+, 계산치 C22H25N4O1, 361.2]; LC/MS 체류시간 (방법 B): tR = 1.58분.
실시예 87
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(1,5-나프티리딘-4-일)벤조니트릴
실시예 51에서와 같이 제조하였다.
파트 A: (S)-tert-부틸 (1-(2-시아노-4-(1,5-나프티리딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트.
LCMS (ESI) m/e 483.1 [(M+Na)+, 계산치 C27H32N4Na1O3, 483.2]; LC/MS 체류시간 (방법 B): tR = 2.22분.
파트 B: (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(1,5-나프티리딘-4-일)벤조니트릴.
(5.5 mg, 0.015 mmol, 29% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 9.06 (t, J = 4.6 Hz, 2H), 8.51 (d, J = 8.4 Hz, 1H), 8.23 (d, J = 2.3 Hz, 1H), 8.18 - 8.11 (m, 1H), 7.90 - 7.82 (m, 2H), 7.41 (d, J = 8.9 Hz, 1H), 3.65 (s, 2H), 1.84 (dt, J = 12.4, 6.5 Hz, 1H), 1.45 (dd, J = 5.6, 2.5 Hz, 2H), 1.17 (s, 3H), 0.95 (dd, J = 6.7, 3.9 Hz, 6H). (OCH2는 넓은 피크 중에 가려진 듯함); LCMS (ESI) m/e 361.0 [(M+H)+, 계산치 C22H25N4O1, 361.2]; LC/MS 체류시간 (방법 B): tR = 1.68분.
실시예 88
(S)-1-(4-(7-클로로퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
파트 A: 7-클로로-4-(4-메톡시-3-(트리플루오로메틸)페닐)퀴놀린
4,7-디클로로퀴놀린 (810 mg, 4.09 mmol), (4-메톡시-3-(트리플루오로메틸)페닐)보론산 (900 mg, 4.09 mmol), PdCl2(dppf) (150 mg, 0.205 mmol), 탄산세슘 (2000 mg, 6.14 mmol), 및 1,4-디옥산 (10 mL)의 혼합물을 20 mL 압력 정격 바이알에 채우고, 질소의 스트림을 10분 동안 버블링하였다. 바이알을 밀봉하고, 산소로 퍼징하고, 90℃에서 밤새 교반하였다. 생성된 혼합물을 진공 여과하고, 여과물을 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (5-40% 에틸 아세테이트/헥산 구배 용리)에 의해 정제하여 백색 고체로서의 7-클로로-4-(4-메톡시-3-(트리플루오로메틸)페닐)퀴놀린 (1.04 g, 3.08 mmol, 75% 수율)을 수득하였다. 물질을 추가 정제 없이 사용하였다. LCMS (ESI) m/e 338.1 [(M+H)+, 계산치 C17H12ClF3NO, 338.1]; LC/MS 체류시간 (방법 D): tR = 1.13분.
파트 B: 4-(7-클로로퀴놀린-4-일)-2-(트리플루오로메틸)페놀
디클로로메탄 (10 mL) 중 7-클로로-4-(4-메톡시-3-(트리플루오로메틸)페닐)퀴놀린 (0.51 g, 1.510 mmol)의 용액을 0℃에서 BBr3 (3.02 mL, 3.02 mmol)으로 처리하였다. 냉각 조를 제거하고, 반응 용액을 주위 온도에서 밤새 교반하였다. 생성물을 0℃로 냉각시키고, 포화 수성 중탄산나트륨으로 켄칭하였다. 층을 분리하고, 수성 층을 에틸 아세테이트 (2x10 mL)로 추출하였다. 합한 유기부를 황산마그네슘 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 오렌지색 고체를 수득하였다. 조 잔류물을 실리카 겔 상에 흡착시키고, 실리카 겔 크로마토그래피 (10-80% 에틸 아세테이트/헥산)에 의해 정제하여 4-(7-클로로퀴놀린-4-일)-2-(트리플루오로메틸)페놀 (195 mg, 0.271 mmol, 18% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 323.9 [(M+H)+, 계산치 C16H10ClF3NO, 324.0]; LC/MS 체류시간 (방법 D): tR = 1.00분.
파트 C: (S)-tert-부틸 (1-(4-(7-클로로퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
4-(7-클로로퀴놀린-4-일)-2-(트리플루오로메틸)페놀 (195 mg, 0.602 mmol), (S)-tert-부틸 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (194 mg, 0.663 mmol), 탄산세슘 (393 mg, 1.205 mmol), 및 N,N-디메틸포름아미드 (4 mL)의 혼합물을 80℃로 밤새 가열하였다. 생성된 혼합물을 실온으로 냉각시키고, 에틸 아세테이트 (40 mL)로 희석하였다. 유기 층을 염수 (3x15 mL)로 세척하고, 황산마그네슘 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피에 의해 정제하여 (S)-tert-부틸 (1-(4-(7-클로로퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (160 mg, 0.298 mmol, 50% 수율)를 연자주색 오일로서 수득하였다. LCMS (ESI) m/e 537.4 [(M+H)+, 계산치 C28H33ClF3N2O3, 537.2]; LC/MS 체류시간 (방법 A): tR = 2.60분; 1H NMR (400MHz, 클로로포름-d) δ 8.95 (d, J=4.3 Hz, 1H), 8.19 (d, J=2.3 Hz, 1H), 7.81 (d, J=9.0 Hz, 1H), 7.71 (d, J=2.0 Hz, 1H), 7.62 (dd, J=8.5, 2.0 Hz, 1H), 7.50 (dd, J=8.9, 2.1 Hz, 1H), 7.33 (d, J=4.5 Hz, 1H), 7.20 (d, J=8.5 Hz, 1H), 4.39 - 4.17 (m, 2H), 2.00 - 1.79 (m, 3H), 1.44 (s, 3H), 1.42 (s, 9H), 1.03 (d, J=6.5 Hz, 3H), 1.01 (d, J=6.5 Hz, 3H).
파트 D: (S)-1-(4-(7-클로로퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
(S)-tert-부틸 (1-(4-(7-클로로퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (40 mg, 0.074 mmol)를 TFA (1 mL, 12.98 mmol)로 처리하고, 주위 온도에서 30분 동안 교반하였다. 생성물을 감압 하에 농축시켰다. 잔류물을 정제용 LC/MS (칼럼: 엑스브리지 C18, 19 x 200 mm, 5-μm; 이동상 A: 5:95 아세토니트릴: 10-mM 아세트산암모늄 포함 물; 이동상 B: 95:5 아세토니트릴: 10-mM 아세트산암모늄 포함 물; 구배: 15분에 걸쳐 45-85% B에 이어서 100% B에서 5-분 유지; 유량: 20 mL/분)를 통해 정제하였다. 무색 고체로서의 (S)-1-(4-(7-클로로퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 카르바메이트 (160 mg, 0.298 mmol, 50% 수율)를 수득하였다. LCMS (ESI) m/e 437.2 [(M+H)+, 계산치 C23H25ClF3N2O, 437.2]; LC/MS 체류시간 (방법 D): tR = 0.97분; 1H NMR (500MHz, DMSO-d6) δ 8.98 (d, J=4.4 Hz, 1H), 8.17 (d, J=1.8 Hz, 1H), 7.88 (d, J=9.2 Hz, 1H), 7.83 (d, J=8.8 Hz, 1H), 7.78 (s, 1H), 7.66 (dd, J=9.2, 1.8 Hz, 1H), 7.55 (d, J=4.4 Hz, 1H), 7.44 (d, J=8.4 Hz, 1H), 3.96 - 3.83 (m, 2H), 1.86 - 1.77 (m, 1H), 1.41 (d, J=5.5 Hz, 2H), 1.14 (s, 3H), 0.94 (d, J=6.6 Hz, 3H), 0.93 (d, J=6.6 Hz, 3H).
실시예 89
(S)-4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)퀴놀린-7-카르보니트릴
파트 A: (S)-tert-부틸 (1-(4-(7-시아노퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
(S)-tert-부틸 (1-(4-(7-클로로퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (84 mg, 0.156 mmol) (실시예 88에 기재된 바와 같이 제조됨), 시안화아연 (20.20 mg, 0.172 mmol), 1,1'-비스(디페닐포스피노)페로센 (13.01 mg, 0.023 mmol), Pd2(dba)3 (7.16 mg, 7.82 μmol), N,N-디메틸포름아미드 (1 mL), 및 물 (0.10 mL)을 압력 정격 바이알에 채우고, 혼합물을 질소로 5분 동안 폭기하였다. 바이알을 밀봉하고, 산소로 퍼징하고, 질소 하에 115℃에서 밤새 가열하였다. 생성된 혼합물을 주위 온도로 냉각시키고, 진공 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (10-80% 에틸 아세테이트/헥산 구배 용리)에 의해 정제하여 (S)-tert-부틸 (1-(4-(7-시아노퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (22.5 mg, 0.043 mmol, 27% 수율)를 거의 무색 필름으로서 수득하였다. LCMS (ESI) m/e 528.2 [(M+H)+, 계산치 C29H33F3N3O3, 528.3]; LC/MS 체류시간 (방법 D): tR = 1.30분.
파트 B: (S)-4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)퀴놀린-7-카르보니트릴
(S)-tert-부틸 (1-(4-(7-시아노퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (22 mg, 0.042 mmol)를 TFA (964 μL, 12.51 mmol)로 처리하고, 실온에서 30분 동안 교반하였다. 생성물을 감압 하에 농축시켰다. 잔류물을 정제용 LC/MS (칼럼: 엑스브리지 C18, 19 x 200 mm, 5-μm; 이동상 A: 5:95 아세토니트릴: 10-mM 아세트산암모늄 포함 물; 이동상 B: 95:5 아세토니트릴: 10-mM 아세트산암모늄 포함 물; 구배: 15분에 걸쳐 45-85% B에 이어서 100% B에서 5-분 유지; 유량: 20 mL/분)를 통해 정제하였다. 무색 고체로서의 (S)-4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)퀴놀린-7-카르보니트릴 (13.3 mg, 0.031 mmol, 75% 수율)을 수득하였다. LCMS (ESI) m/e 428.2 [(M+H)+, 계산치 C24H25F3N3O, 428.2]; LC/MS 체류시간 (방법 D): tR = 0.97분; 1H NMR (500MHz, DMSO-d6) δ 9.11 (d, J=4.4 Hz, 1H), 8.68 (s, 1H), 8.06 - 7.98 (m, 1H), 7.92 (d, J=8.8 Hz, 1H), 7.84 (d, J=8.8 Hz, 1H), 7.81 (s, 1H), 7.70 (d, J=4.4 Hz, 1H), 7.45 (d, J=8.8 Hz, 1H), 4.00 - 3.77 (m, 2H), 1.82 (dt, J=12.7, 6.3 Hz, 1H), 1.41 (d, J=5.5 Hz, 2H), 1.14 (s, 3H), 0.94 (d, J=6.5 Hz, 3H), 0.93 (d, J=6.5 Hz, 3H).
실시예 90
(S)-2,4-디메틸-1-(2-메틸-4-(2-메틸피리딘-4-일)페녹시)펜탄-2-아민
실시예 32에 기재된 바와 같이 제조하여 (S)-2,4-디메틸-1-(2-메틸-4-(2-메틸피리딘-4-일)페녹시)펜탄-2-아민 카르보니트릴 (17 mg, 0.054 mmol, 최종 단계에 대해서 98% 수율)을 무색 고체로서 수득하였다. LCMS (ESI) m/e 313.1 [(M+H)+, 계산치 C20H29N2O, 313.2]; LC/MS 체류시간 (방법 D): tR = 0.65분; 1H NMR (500MHz, DMSO-d6) δ 8.44 (d, J=5.1 Hz, 1H), 7.67 - 7.60 (m, 2H), 7.54 (s, 1H), 7.45 (d, J=5.1 Hz, 1H), 7.05 (d, J=8.1 Hz, 1H), ), 3.88 - 3.29 (m, 2H), 2.30 (s, 3H), 1.91 (s, 3H), 1.81 (dt, J=12.8, 6.4 Hz, 1H), 1.64 - 1.55 (m, 1H), 1.53 - 1.44 (m, 1H), 1.26 (s, 3H), 0.95 (d, J=6.6 Hz, 3H), 0.92 (d, J=6.6 Hz, 3H).
실시예 91
(S)-1-(2-플루오로-4-(2-메틸피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 제조하여 (S)-1-(2-플루오로-4-(2-메틸피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민 (12 mg, 0.037 mmol, 최종 단계에 대해서 96% 수율)을 무색 고체로서 수득하였다. LCMS (ESI) m/e 317.1 [(M+H)+, 계산치 C19H26FN2O, 317.2]; LC/MS 체류시간 (방법 D): tR = 0.62분; 1H NMR (500MHz, DMSO-d6) δ 8.57 (d, J=5.5 Hz, 1H), 8.13 (br. s., 2H), 7.87 (d, J=12.5 Hz, 1H), 7.80 (s, 1H), 7.74 (d, J=9.2 Hz, 1H), 7.70 (d, J=5.1 Hz, 1H), 7.42 (t, J=8.6 Hz, 1H), 4.23 - 4.08 (m, 2H), 2.58 (s, 3H), 1.82 (dt, J=12.7, 6.1 Hz, 1H), 1.77 - 1.69 (m, 1H), 1.60 (dd, J=14.3, 5.1 Hz, 1H), 1.38 (s, 3H), 0.97 (d, J=6.6 Hz, 3H), 0.93 (d, J=6.2 Hz, 3H).
실시예 92
(S)-1-(4-(2-플루오로피리딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 제조하여 (S)-1-(4-(2-플루오로피리딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-아민 (4.8 mg, 0.015 mmol, 최종 단계에 대해서 90% 수율)을 무색 고체로서 수득하였다. LCMS (ESI) m/e 317.1 [(M+H)+, 계산치 C19H26FN2O, 317.2]; LC/MS 체류시간 (방법 D): tR = 0.96분; 1H NMR (500MHz, DMSO-d6) δ 8.24 (d, J=5.1 Hz, 1H), 7.80 - 7.69 (m, 2H), 7.66 (d, J=5.1 Hz, 1H), 7.47 (s, 1H), 7.03 (d, J=8.1 Hz, 1H), 3.80 - 3.38 (m, 2H), 2.28 (s, 3H), 1.86 - 1.77 (m, 1H), 1.49 - 1.35 (m, 2H), 1.15 (s, 3H), 0.93 (t, J=6.2 Hz, 6H).
실시예 93
(S)-1-(2-플루오로-4-(2-플루오로피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 제조하여 (S)-1-(2-플루오로-4-(2-플루오로피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민 (10.8 mg, 0.034 mmol, 최종 단계에 대해서 75% 수율)을 무색 고체로서 수득하였다. LCMS (ESI) m/e 321.1 [(M+H)+, 계산치 C18H23F2N2O, 321.2]; LC/MS 체류시간 (방법 D): tR = 0.90분; 1H NMR (500MHz, DMSO-d6) δ 8.27 (d, J=5.1 Hz, 1H), 7.86 (dd, J=12.7, 2.0 Hz, 1H), 7.72 (d, J=5.9 Hz, 2H), 7.55 (s, 1H), 7.30 (t, J=8.8 Hz, 1H), 3.88 - 3.75 (m, 2H), 1.81 (dquin, J=12.7, 6.3 Hz, 1H), 1.48 - 1.31 (m, 2H), 1.13 (s, 3H), 0.93 (t, J=7.2 Hz, 6H).
실시예 94
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-플루오로피리딘-4-일)벤조니트릴
실시예 32에 기재된 바와 같이 제조하여 (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-플루오로피리딘-4-일)벤조니트릴 (16.9 mg, 0.051 mmol, 최종 단계에 대해서 80% 수율)을 무색 고체로서 수득하였다. LCMS (ESI) m/e 328.1 [(M+H)+, 계산치 C19H23FN3O, 328.2]; LC/MS 체류시간 (방법 D): tR = 0.94분; 1H NMR (500MHz, DMSO-d6) δ 8.37 (d, J=2.2 Hz, 1H), 8.31 (d, J=5.1 Hz, 1H), 8.22 (dd, J=8.8, 2.2 Hz, 1H), 7.78 (d, J=5.1 Hz, 1H), 7.63 (s, 1H), 7.43 (d, J=9.2 Hz, 1H), 4.12 - 3.99 (m, 2H), 1.83 (dt, J=12.7, 6.3 Hz, 1H), 1.60 - 1.43 (m, 2H), 1.24 (s, 3H), 0.95 (t, J=6.4 Hz, 6H).
실시예 95
(S)-1-((2'-플루오로-5-메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 제조하여 (S)-1-((2'-플루오로-5-메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민 (6.5 mg, 0.020 mmol, 최종 단계에 대해서 57% 수율)을 무색 고체로서 수득하였다. LCMS (ESI) m/e 318.1 [(M+H)+, 계산치 C18H25FN3O, 318.2]; LC/MS 체류시간 (방법 D): tR = 0.95분; 1H NMR (500MHz, DMSO-d6) δ 8.54 (d, J=2.2 Hz, 1H), 8.29 (d, J=5.1 Hz, 1H), 8.12 (s, 1H), 7.73 (d, J=5.1 Hz, 1H), 7.57 (s, 1H), 4.22 - 4.08 (m, 2H), 1.91 (s, 3H), 1.81 (dq, J=12.7, 6.2 Hz, 1H), 1.55 - 1.39 (m, 2H), 1.20 (s, 3H), 0.93 (dd, J=8.8, 6.6 Hz, 6H).
실시예 96
(S)-4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메틸피리딘-3-일)퀴놀린-7-카르보니트릴
실시예 88에 기재된 바와 같이 제조하여 (S)-4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메틸피리딘-3-일)퀴놀린-7-카르보니트릴 (9.9 mg, 0.026 mmol, 최종 단계에 대해서 35% 수율)을 무색 고체로서 수득하였다. LCMS (ESI) m/e 375.1 [(M+H)+, 계산치 C23H27N4O, 375.2]; LC/MS 체류시간 (방법 D): tR = 0.94분; 1H NMR (600MHz, DMSO-d6) δ 9.10 (d, J=4.4 Hz, 1H), 8.68 (s, 1H), 8.18 (s, 1H), 8.07 (d, J=8.8 Hz, 1H), 7.92 (d, J=8.4 Hz, 1H), 7.82 (br. s., 1H), 7.68 (d, J=4.0 Hz, 1H), 4.17 - 4.05 (m, 2H), 2.29 (s, 3H), 1.90 - 1.79 (m, 1H), 1.49 - 1.37 (m, 2H), 1.16 (s, 3H), 0.95 (t, J=6.2 Hz, 6H).
실시예 97
(S)-1-((5-플루오로-2'-메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 제조하여 (S)-1-((5-플루오로-2'-메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민 (4.8 mg, 0.015 mmol, 최종 단계에 대해서 90% 수율)을 무색 고체로서 수득하였다. LCMS (ESI) m/e 318.2 [(M+H)+, 계산치 C18H25FN3O, 318.2]; LC/MS 체류시간 (방법 D): tR = 0.60분; 1H NMR (500MHz, DMSO-d6) δ 8.51 (d, J=5.1 Hz, 1H), 8.48 (s, 1H), 8.23 (d, J=11.4 Hz, 1H), 7.66 (s, 1H), 7.57 (d, J=5.1 Hz, 1H), 4.32 - 4.21 (m, 2H), 1.91 (s, 3H), 1.87 - 1.77 (m, 1H), 1.57 - 1.41 (m, 2H), 1.22 (s, 3H), 0.95 (d, J=6.6 Hz, 3H), 0.93 (d, J=6.6 Hz, 3H).
실시예 98
(S)-1-((3-플루오로-5-(퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 제조하여 (S)-1-((3-플루오로-5-(퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (8.4 mg, 0.024 mmol, 최종 단계에 대해서 59% 수율)을 무색 고체로서 수득하였다. LCMS (ESI) m/e 354.1 [(M+H)+, 계산치 C21H25FN3O, 354.2]; LC/MS 체류시간 (방법 D): tR = 0.74분; 1H NMR (500MHz, DMSO-d6) δ 8.98 (d, J=4.0 Hz, 1H), 8.18 (d, J=1.8 Hz, 1H), 8.14 (d, J=8.4 Hz, 1H), 8.03 (d, J=11.0 Hz, 1H), 7.91 (d, J=8.4 Hz, 1H), 7.84 (t, J=7.5 Hz, 1H), 7.70 - 7.62 (m, 1H), 7.54 (d, J=4.4 Hz, 1H), 4.27 - 4.17 (m, 2H), 1.85 (dt, J=12.7, 6.1 Hz, 1H), 1.53 - 1.38 (m, 2H), 1.19 (s, 3H), 0.96 (t, J=7.0 Hz, 6H).
실시예 99
(S)-4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-플루오로피리딘-3-일)퀴놀린-7-카르보니트릴
실시예 88에 기재된 바와 같이 제조하여 (S)-4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-플루오로피리딘-3-일)퀴놀린-7-카르보니트릴 (5.6 mg, 0.014 mmol, 최종 단계에 대해서 62% 수율)을 무색 고체로서 수득하였다. LCMS (ESI) m/e 379.1 [(M+H)+, 계산치 C22H24FN4O, 379.2]; LC/MS 체류시간 (방법 D): tR = 0.91분; 1H NMR (500MHz, DMSO-d6) δ 9.13 (d, J=4.4 Hz, 1H), 8.70 (s, 1H), 8.19 (d, J=1.8 Hz, 1H), 8.09 (d, J=8.8 Hz, 1H), 8.06 - 8.01 (m, 1H), 7.98 - 7.90 (m, 1H), 7.73 (d, J=4.4 Hz, 1H), 4.22 - 4.10 (m, 2H), 1.85 (dt, J=12.7, 6.3 Hz, 1H), 1.50 - 1.35 (m, 2H), 1.15 (s, 3H), 0.95 (t, J=6.6 Hz, 6H).
실시예 100
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)-3-플루오로피리딘-2-일)카르바메이트
파트 A: (S)-tert-부틸 (1-(4-브로모-2-시아노페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
실시예 32 파트 A-F에서와 같이 제조하여 (S)-tert-부틸 (1-(4-브로모-2-시아노페녹시)-2,4-디메틸펜탄-2-일)카르바메이트를 수득하였다. LC/MS 체류시간 (방법 D): tR = 1.29분.
파트 B: (S)-tert-부틸 (1-(2-시아노-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
(S)-tert-부틸 (1-(4-브로모-2-시아노페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.57 g, 1.386 mmol), 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란) (0.422 g, 1.663 mmol), PdCl2(dppf) (0.051 g, 0.069 mmol), 아세트산칼륨 (0.408 g, 4.16 mmol), 및 디옥산 (5 mL)을 압력 정격 바이알에 채웠다. 바이알을 산소로 퍼징하고, 혼합물을 80℃에서 질소 하에 밤새 교반하였다. 혼합물을 주위 온도로 냉각시키고, 진공 여과하고, 감압 하에 농축시켰다. (S)-tert-부틸 (1-(2-시아노-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (600 mg, 1.30 mmol, 100% 조 수율)를 갈색 오일로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 481.1 [(M+Na)+, 계산치 C25H39BN2NaO5, 481.3]; LC/MS 체류시간 (방법 B): tR = 2.49분.
파트 C: (S)-tert-부틸 (1-(4-(2-클로로-3-플루오로피리딘-4-일)-2-시아노페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
압력 정격 1 드램 바이알 중 톨루엔 (1 mL), 물 (0.050 mL) 및 에탄올 (0.100 mL) 중 2-클로로-3-플루오로-4-아이오도피리딘 (105 mg, 0.408 mmol), (S)-tert-부틸 (1-(2-시아노-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (374 mg, 0.816 mmol), 탄산칼륨 (169 mg, 1.224 mmol), 및 Pd(Ph3P)4 (14.14 mg, 0.012 mmol)의 혼합물을 산소로 퍼징하고, 질소 하에 80℃에서 밤새 교반하였다. 혼합물을 시린지 팁 필터를 통해 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (10-80% 에틸 아세테이트/헥산 구배 용리)에 의해 정제하여 (S)-tert-부틸 (1-(4-(2-클로로-3-플루오로피리딘-4-일)-2-시아노페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (49 mg, 0.106 mmol, 26% 수율)를 담황색 필름으로서 수득하였다. LCMS (ESI) m/e 462.0 (M+H)+, 계산치 C23H30ClFN3O3, 462.2]; LC/MS 체류시간 (방법 D): tR = 1.30분; 1H NMR (400MHz, 클로로포름-d) δ 8.28 (d, J=5.0 Hz, 1H), 7.82 (dd, J=2.0, 1.0 Hz, 1H), 7.77 (dt, J=8.8, 1.9 Hz, 1H), 7.33 - 7.29 (m, 1H), 7.18 (d, J=9.0 Hz, 1H), 4.59 (s, 1H), 4.45 (d, J=8.8 Hz, 1H), 4.22 (d, J=9.0 Hz, 1H), 2.01 - 1.92 (m, 1H), 1.91 - 1.79 (m, 1H), 1.56 - 1.50 (m, 1H), 1.46 (s, 3H), 1.40 (s, 9H), 1.03 (d, J=6.8 Hz, 6H).
파트 D: (S)-메틸 (4-(4-((2-Boc-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)-3-플루오로피리딘-2-일)카르바메이트
(S)-tert-부틸 (1-(4-(2-아미노-3-플루오로피리딘-4-일)-2-시아노페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (40 mg, 0.090 mmol)의 용액을 0℃로 냉각시키고, 메틸 클로로포르메이트 (0.035 mL, 0.452 mmol) 및 피리딘 (0.073 mL, 0.904 mmol)에 이어서 DMAP (1.104 mg, 9.04 μmol)를 첨가하였다. 냉각 조를 제거하고, 혼합물을 밤새 교반하였다. 반응 혼합물을 감압 하에 농축시켰다. (S)-메틸 (4-(4-((2-Boc-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)-3-플루오로피리딘-2-일)카르바메이트 (20 mg, 0.040 mmol, 44% 조 수율)를 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 501.1 (M+H)+, 계산치 C23H30ClFN3O3, 501.3]; LC/MS 체류시간 (방법 D): tR = 1.17분.
파트 E: (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)-3-플루오로피리딘-2-일)카르바메이트
(S)-메틸 (4-(4-((2-Boc-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)-3-플루오로피리딘-2-일)카르바메이트 (20 mg, 0.040 mmol) 및 TFA (1 mL, 12.98 mmol)를 주위 온도에서 2시간 동안 보관하였다. 생성물을 감압 하에 농축시켰다. 잔류물을 정제용 LC/MS (칼럼: 엑스브리지 C18, 19 x 200 mm, 5-μm; 이동상 A: 5:95 아세토니트릴: 10-mM 아세트산암모늄 포함 물; 이동상 B: 95:5 아세토니트릴: 10-mM 아세트산암모늄 포함 물; 구배: 15분에 걸쳐 45-85% B에 이어서 100% B에서 5-분 유지; 유량: 20 mL/분)를 통해 정제하였다. (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)-3-플루오로피리딘-2-일)카르바메이트 (4.1 mg, 10.14 μmol, 2 단계에 대해서 25% 수율)를 무색 고체로서 수득하였다. LCMS (ESI) m/e 401.0 (M+H)+, 계산치 C21H26FN4O3, 401.2]; LC/MS 체류시간 (방법 D): tR = 0.82분; 1H NMR (500MHz, DMSO-d6) δ 8.26 (d, J=4.8 Hz, 1H), 8.05 (s, 1H), 7.95 (d, J=9.5 Hz, 1H), 7.50 (t, J=5.1 Hz, 1H), 7.43 (d, J=8.8 Hz, 1H), 4.13 - 3.99 (m, 2H), 1.91 (s, 3H), 1.86 - 1.78 (m, 1H), 1.60 - 1.44 (m, 2H), 1.24 (s, 3H), 0.94 (t, J=5.9 Hz, 6H).
실시예 101
(S)-6-((2-아미노-2,4-디메틸펜틸)옥시)-2'-메틸-[3,4'-비피리딘]-5-카르보니트릴
실시예 32에 기재된 바와 같이 제조하여 (S)-6-((2-아미노-2,4-디메틸펜틸)옥시)-2'-메틸-[3,4'-비피리딘]-5-카르보니트릴 (16 mg, 0.054 mmol, 최종 단계에 대해서 44% 수율)을 연황색 오일로서 수득하였다. LCMS (ESI) m/e 325.1 [(M+H)+, 계산치 C19H25N4O, 325.2]; LC/MS 체류시간 (방법 D): tR = 0.58분; 1H NMR (500MHz, DMSO-d6) δ 9.02 (d, J=2.2 Hz, 1H), 8.92 (d, J=2.6 Hz, 1H), 8.68 (d, J=5.5 Hz, 1H), 8.42 (br. s., 2H), 7.99 (s, 1H), 7.89 (d, J=4.8 Hz, 1H), 4.74 - 4.47 (m, 2H), 2.64 (s, 3H), 1.89 (dt, J=12.6, 6.4 Hz, 1H), 1.83 - 1.74 (m, 1H), 1.65 (dd, J=14.3, 5.5 Hz, 1H), 1.43 (s, 3H), 0.98 (d, J=1.8 Hz, 3H), 0.96 (d, J=1.8 Hz, 3H).
실시예 102
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(7-메틸퀴놀린-4-일)벤조니트릴
실시예 32에 기재된 바와 같이 제조하여 (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(7-메틸퀴놀린-4-일)벤조니트릴 (76 mg, 0.195 mmol, 최종 단계에 대해서 53% 수율)을 무색 필름으로서 수득하였다. LCMS (ESI) m/e 374.0 [(M+H)+, 계산치 C24H28N3O, 374.2]; LC/MS 체류시간 (방법 D): tR = 0.76분; 1H NMR (600MHz, DMSO-d6) δ 8.90 (d, J=4.0 Hz, 1H), 7.98 (s, 1H), 7.91 (s, 1H), 7.87 (dd, J=8.8, 2.2 Hz, 1H), 7.73 (d, J=8.4 Hz, 1H), 7.48 (dd, J=8.1, 4.8 Hz, 2H), 7.42 (d, J=4.0 Hz, 1H), 4.29 - 4.09 (m, 2H), 2.55 (s, 3H), 1.86 (dt, J=12.3, 6.3 Hz, 1H), 1.72 (dd, J=13.9, 5.1 Hz, 1H), 1.58 (dd, J=14.1, 5.7 Hz, 1H), 1.35 (s, 3H), 0.97 (t, J=6.2 Hz, 6H).
실시예 103
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(3-플루오로-2-메틸피리딘-4-일)벤조니트릴
실시예 32에 기재된 바와 같이 제조하여 (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(3-플루오로-2-메틸피리딘-4-일)벤조니트릴 (7.7 mg, 0.022 mmol, 최종 단계에 대해서 74% 수율)을 무색 필름으로서 수득하였다. LCMS (ESI) m/e 342.0 [(M+H)+, 계산치 C20H25FN3O, 342.2]; LC/MS 체류시간 (방법 D): tR = 0.79분; 1H NMR (600MHz, DMSO-d6) δ 8.35 (d, J=4.8 Hz, 1H), 8.05 (s, 1H), 7.95 (d, J=8.8 Hz, 1H), 7.48 (br. s., 1H), 7.39 (d, J=8.8 Hz, 1H), 3.96 - 3.83 (m, 2H), 2.51 (s, 3H), 1.82 (dt, J=12.1, 6.1 Hz, 1H), 1.52 - 1.37 (m, 2H), 1.15 (s, 3H), 0.93 (t, J=5.0 Hz, 6H).
실시예 104
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(퀴놀린-4-일)벤조니트릴
실시예 32에 기재된 바와 같이 제조하여 (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(퀴놀린-4-일)벤조니트릴 (23 mg, 0.061 mmol, 최종 단계에 대해서 14% 수율)을 무색 필름으로서 수득하였다. LCMS (ESI) m/e 360.0 [(M+H)+, 계산치 C23H26N3O, 360.2]; LC/MS 체류시간 (방법 D): tR = 0.69분; 1H NMR (600MHz, DMSO-d6) δ 8.97 (d, J=4.4 Hz, 1H), 8.13 (d, J=8.4 Hz, 1H), 7.99 (s, 1H), 7.90 - 7.79 (m, 3H), 7.64 (t, J=7.2 Hz, 1H), 7.50 (d, J=4.4 Hz, 1H), 7.47 (d, J=8.8 Hz, 1H), 4.11 - 3.98 (m, 2H), 1.86 (dquin, J=12.5, 6.4 Hz, 1H), 1.63 - 1.45 (m, 2H), 1.25 (s, 3H), 0.97 (t, J=6.2 Hz, 6H).
실시예 105
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(5-플루오로-2-메틸피리딘-4-일)벤조니트릴
실시예 32에 기재된 바와 같이 제조하여 (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(5-플루오로-2-메틸피리딘-4-일)벤조니트릴 (9.5 mg, 0.026 mmol, 최종 단계에 대해서 25% 수율)을 연황색 필름으로서 수득하였다. LCMS (ESI) m/e 342.0 [(M+H)+, 계산치 C20H25FN3O, 342.2]; LC/MS 체류시간 (방법 D): tR = 0.80분; 1H NMR (500MHz, DMSO-d6) δ 8.50 (d, J=2.6 Hz, 1H), 8.08 (d, J=1.8 Hz, 1H), 7.97 (d, J=8.1 Hz, 1H), 7.56 (d, J=6.6 Hz, 1H), 7.40 (d, J=8.8 Hz, 1H), 3.96 - 3.85 (m, 2H), 2.52 (s, 3H), 1.86 - 1.77 (m, 1H), 1.51 - 1.36 (m, 2H), 1.15 (s, 3H), 0.94 (d, J=3.7 Hz, 3H), 0.93 (d, J=3.7 Hz, 3H).
실시예 106
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)-5-플루오로피리딘-2-일)카르바메이트
실시예 100에 기재된 바와 같이 제조하여 (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)-5-플루오로피리딘-2-일)카르바메이트 (20.5 mg, 0.050 mmol, 최종 단계에 대해서 36% 수율)를 무색 필름으로서 수득하였다. LCMS (ESI) m/e 401.0 (M+H)+, 계산치 C21H26FN4O3, 401.2]; LC/MS 체류시간 (방법 D): tR = 0.91분; 1H NMR (500MHz, DMSO-d6) δ 8.38 (s, 1H), 8.02 (s, 1H), 7.97 (d, J=5.9 Hz, 1H), 7.91 (d, J=9.2 Hz, 1H), 7.41 (d, J=8.8 Hz, 1H), 3.96 - 3.84 (m, 2H), 2.52 (s, 3H), 1.82 (dt, J=12.7, 6.3 Hz, 1H), 1.49 - 1.34 (m, 2H), 1.15 (s, 3H), 0.94 (d, J=3.7 Hz, 3H), 0.93 (d, J=3.7 Hz, 3H).
실시예 107
(S)-1-((6-플루오로-2',4-디메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (6-클로로-2-플루오로피리딘-3-일)보론산
LDA의 용액 (THF 중 1M) (8.36 ml, 8.36 mmol)을 -78℃에서 THF (2 mL) 중 2-클로로-6-플루오로피리딘 (1.0 g, 7.60 mmol)의 용액으로 적가 처리하였다. 혼합물을 -78℃에서 1시간 동안 유지한 다음, THF (1 mL) 중 트리이소프로필 보레이트 (1.765 ml, 7.60 mmol)의 용액으로 처리하였다. 반응 혼합물을 물 (4 mL)로 처리하고, 감압 하에 농축시켜 (6-클로로-2-플루오로피리딘-3-일)보론산 (1.33 g, 7.60 mmol, 100% 조 수율)을 연오렌지색 왁스상 고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 176.0 (M+H)+, 계산치 C5H5BClFNO2, 176.0]; LC/MS 체류시간 (방법 D): tR = 0.71분.
파트 B: 6-클로로-2-플루오로피리딘-3-올
NaOH (4.45 ml, 22.24 mmol) 중 (6-클로로-2-플루오로피리딘-3-일)보론산 (1.3 g, 7.41 mmol)의 현탁액을 0℃에서 과산화수소 (0.500 ml, 8.15 mmol)로 한번에 처리하였다. 혼합물을 주위 온도에서 밤새 교반하였다. 생성된 용액을 빙수로 켄칭하고, 3 N 수성 염산을 사용하여 pH = 5로 산성화하고, 에틸 아세테이트로 3회 추출하였다. 합한 유기부를 황산나트륨 상에서 건조시키고, 감압 하에 농축시켜 6-클로로-2-플루오로피리딘-3-올 (1.08 g, 7.32 mmol, 99% 조 수율)을 왁스상 고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 148.0 (M+H)+, 계산치 C5H4ClFNO, 148.0]; LC/MS 체류시간 (방법 D): tR = 0.83분.
파트 C: 6-클로로-2-플루오로-3-(메톡시메톡시)피리딘
아세톤 (20 mL) 중 6-클로로-2-플루오로피리딘-3-올 (0.49 g, 3.32 mmol), MOM-Cl (0.277 mL, 3.65 mmol), 탄산칼륨 (0.551 g, 3.99 mmol)의 용액을 60℃에서 3시간 동안 교반하였다. 혼합물을 주위 온도로 냉각시키고, 진공 여과하였다. 여과물을 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (5-30% 에틸 아세테이트/헥산)에 의해 정제하여 6-클로로-2-플루오로-3-(메톡시메톡시)피리딘 (0.24 g, 1.25 mmol, 3 단계에 대해서 38% 수율)을 거의 무색 오일로서 수득하였다. LCMS (ESI) m/e 192.0 (M+H)+, 계산치 C7H8ClFNO2, 192.0]; LC/MS 체류시간 (방법 D): tR = 1.20분;
1H NMR (400MHz, 클로로포름-d) δ 7.57 (dd, J=9.8, 8.3 Hz, 1H), 7.16 (d, J=8.3 Hz, 1H), 5.24 (s, 2H), 3.56 - 3.52 (m, 3H).
파트 D: 6-클로로-2-플루오로-3-(메톡시메톡시)-4-메틸피리딘
-78℃에서 테트라히드로푸란 (9 mL) 중 6-클로로-2-플루오로-3-(메톡시메톡시)피리딘 (0.24 g, 1.253 mmol)의 용액을 LDA (1.378 mL, 1.378 mmol)로 적가 처리하였다. 생성된 오렌지색 용액을 -78℃에서 1시간 동안 유지한 다음, THF (0.5 mL) 중 메틸 아이오다이드 (0.094 mL, 1.503 mmol)의 용액으로 적가 처리하였다. 생성된 용액을 -78℃에서 30분 동안 교반하였다. 생성된 용액을 주위 온도로 가온하고, 포화 수성 염화암모늄 (5 mL)으로 켄칭하고, 밤새 교반하였다. 층을 분리하고, 수성 층을 에틸 아세테이트로 추출하였다. 합한 유기부를 황산나트륨 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (5-30% 에틸 아세테이트/헥산)에 의해 정제하여 무색 오일로서의 6-클로로-2-플루오로-3-(메톡시메톡시)-4-메틸피리딘 (0.22 g, 1.07 mmol, 85% 수율)을 수득하였다. LCMS (ESI) m/e 206.1 (M+H)+, 계산치 C8H10ClFNO2, 206.0]; LC/MS 체류시간 (방법 D): tR = 1.05분; 1H NMR (400MHz, 클로로포름-d) δ 7.07 (s, 1H), 5.21 - 5.10 (m, 2H), 3.64 - 3.54 (m, 3H), 2.37 (d, J=1.0 Hz, 3H).
파트 E: 6-플루오로-5-(메톡시메톡시)-2',4-디메틸-2,4'-비피리딘
압력 정격 바이알에 6-클로로-2-플루오로-3-(메톡시메톡시)-4-메틸피리딘 (110 mg, 0.535 mmol), (2-메틸피리딘-4-일)보론산 (81 mg, 0.588 mmol), 탄산세슘 (349 mg, 1.070 mmol), 톨루엔 (1 mL), 및 에탄올 (0.200 mL)을 첨가하였다. 용액을 질소의 스트림으로 5분 동안 폭기하였다. 테트라키스(트리페닐포스핀)팔라듐(0) (43.3 mg, 0.037 mmol)을 첨가하고, 바이알을 밀봉하고, 산소로 퍼징하고, 질소 하에 85℃에서 밤새 교반하였다. 생성된 현탁액을 진공 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (5-40% 에틸 아세테이트/헥산 구배 용리)에 의해 정제하여 6-플루오로-5-(메톡시메톡시)-2',4-디메틸-2,4'-비피리딘 (40 mg, 0.153 mmol, 29% 수율)을 거의 무색 오일로서 수득하였다. LCMS (ESI) m/e 263.1 (M+H)+, 계산치 C14H16FN2O2, 263.1]; LC/MS 체류시간 (방법 D): tR = 0.80분; 1H NMR (400MHz, 클로로포름-d) δ 8.59 (d, J=5.3 Hz, 1H), 7.73 (s, 1H), 7.61 (dd, J=5.3, 1.3 Hz, 1H), 7.55 (s, 1H), 5.24 (d, J=1.0 Hz, 2H), 3.63 (s, 3H), 2.65 (s, 3H), 2.47 (s, 3H).
파트 F: 6-플루오로-2',4-디메틸-[2,4'-비피리딘]-5-올
메탄올 (5 mL) 및 HCl (진한) (0.05 mL, 0.600 mmol) 중 6-플루오로-5-(메톡시메톡시)-2',4-디메틸-2,4'-비피리딘 (40 mg, 0.153 mmol)의 용액을 65℃에서 1시간 동안 교반한 다음, 감압 하에 농축시켜 6-플루오로-2',4-디메틸-[2,4'-비피리딘]-5-올 (30 mg, 0.137 mmol, 90% 수율)을 연황갈색 고체로서 수득하였다. 추가 정제 없이 사용하였다. LCMS (ESI) m/e 219.1 (M+H)+, 계산치 C12H12FN2O, 219.1]; LC/MS 체류시간 (방법 D): tR = 0.59분.
파트 G: (S)-tert-부틸 (1-((6-플루오로-2',4-디메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
압력 정격 바이알 중 N,N-디메틸포름아미드 (1 mL) 중 6-플루오로-2',4-디메틸-[2,4'-비피리딘]-5-올 (30 mg, 0.137 mmol), (S)-tert-부틸 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (48.4 mg, 0.165 mmol), 및 탄산세슘 (134 mg, 0.412 mmol)의 용액을 80℃에서 밤새 교반하였다. 혼합물을 주위 온도로 냉각시키고, 시린지 팁 필터를 통해 여과하였다. (S)-tert-부틸 (1-((6-플루오로-2',4-디메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (38.6 mg, 0.089 mmol, 65% 조 수율)를 무색 오일로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 432.2 (M+H)+, 계산치 C24H35FN3O3, 432.3]; LC/MS 체류시간 (방법 D): tR = 1.08분.
파트 H: (S)-1-((6-플루오로-2',4-디메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
DMF (1 mL) 중 (S)-tert-부틸 (1-((6-플루오로-2',4-디메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (38 mg, 0.088 mmol)의 용액을 TFA (1 mL, 12.98 mmol)로 처리하고, 주위 온도에서 밤새 교반하였다. 용액을 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (칼럼: 엑스브리지 C18, 19 x 200 mm, 5-μm; 이동상 A: 5:95 아세토니트릴: 10-mM 아세트산암모늄 포함 물; 이동상 B: 95:5 아세토니트릴: 10-mM 아세트산암모늄 포함 물; 구배: 15분에 걸쳐 20-60% B에 이어서 100% B에서 5-분 유지; 유량: 20 mL/분)를 통해 정제하였다. (S)-1-((6-플루오로-2',4-디메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (20 mg, 0.060 mmol, 68% 조 수율)을 무색 오일로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 332.3 (M+H)+, 계산치 C19H27FN3O, 332.2]; LC/MS 체류시간 (방법 D): tR = 0.64분; 1H NMR (500MHz, DMSO-d6) δ 8.54 (d, J=5.1 Hz, 1H), 7.99 (s, 1H), 7.83 (s, 1H), 7.74 (d, J=4.4 Hz, 1H), 3.84 - 3.80 (m, 2H), 2.55 (s, 3H), 2.41 (s, 3H), 1.88 - 1.75 (m, 1H), 1.49 - 1.31 (m, 2H), 1.15 (s, 3H), 1.00 - 0.90 (m, 6H).
실시예 108
메틸 (5-((3-이소부틸아제티딘-3-일)메톡시)-6-메틸-[2,4'-비피리딘]-2'-일)카르바메이트
파트 A: 1-tert-부틸 3-메틸 3-이소부틸아제티딘-1,3-디카르복실레이트
-78℃에서 테트라히드로푸란 (100 mL) 중 1-tert-부틸 3-메틸 아제티딘-1,3-디카르복실레이트 (5.0 g, 23.23 mmol) 및 1-아이오도-2-메틸프로판 (21.37 g, 116 mmol)의 용액을 KHMDS (69.7 mL, 34.8 mmol)로 적가 처리하였다. 용액을 주위 온도에서 밤새 교반하였다. 생성된 현탁액을 에틸 아세테이트 (500 mL)로 희석하고, 0.5 N 수성 염산 (2x100 mL), 및 염수 (1x100 mL)로 세척하고, 황산나트륨 상에서 건조시키고, 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 정제 (2-20% 에틸 아세테이트/헥산 구배 용리)에 의해 정제하여 1-tert-부틸 3-메틸 3-이소부틸아제티딘-1,3-디카르복실레이트 (3.37 g, 12.42mmol, 54% 수율)를 호박색 오일로서 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 4.22 (d, J=8.8 Hz, 2H), 3.82 - 3.70 (m, 5H), 1.87 (d, J=7.0 Hz, 2H), 1.63 - 1.51 (m, 1H), 1.45 (s, 9H), 0.89 (d, J=6.8 Hz, 6H).
파트 B: tert-부틸 3-이소부틸-3-(메톡시메틸)아제티딘-1-카르복실레이트
주위 온도에서 테트라히드로푸란 (40 mL) 중 1-tert-부틸 3-메틸 3-이소부틸아제티딘-1,3-디카르복실레이트 (2.51 g, 9.25 mmol)의 용액을 수소화붕소리튬 (0.403 g, 18.50 mmol)으로 처리하고, 70℃에서 3시간 동안 교반하였다. TLC는 출발 물질의 50% 소모를 나타내었다. 반응 혼합물을 추가의 수소화붕소리튬 (0.302 g, 13.97 mmol)으로 처리하고, 70℃에서 1.5시간 동안 교반하였다. TLC는 출발 물질의 완전한 소모를 나타내었다. 반응 혼합물을 0℃로 냉각시키고, 0.1N 수성 염산으로 켄칭한 다음, 에틸 아세테이트로 희석하였다. 층을 분리하고, 수층을 에틸 아세테이트 (2x)로 추출하였다. 합한 유기부를 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (10-80% 에틸 아세테이트/헥산 구배 용리)에 의해 정제하여 tert-부틸 3-이소부틸-3-(메톡시메틸)아제티딘-1-카르복실레이트 (2.07 g, 8.51 mmol, 92% 수율)를 무색 오일로서 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 3.81 - 3.70 (m, 4H), 3.64 (d, J=8.5 Hz, 2H), 1.74 (tt, J=13.5, 6.7 Hz, 2H), 1.60 (d, J=7.0 Hz, 2H), 1.46 (s, 9H), 0.91 (d, J=6.5 Hz, 6H).
파트 C: tert-부틸 3-(((6-브로모-2-메틸피리딘-3-일)옥시)메틸)-3-이소부틸아제티딘-1-카르복실레이트
테트라히드로푸란 (4 mL) 중 tert-부틸 3-(히드록시메틸)-3-이소부틸아제티딘-1-카르복실레이트 (0.582 g, 2.392 mmol)의 용액을 압력 정격 바이알에 채우고, KOtBu (THF 중 1M) (2.392 mL, 2.392 mmol)로 적가 처리하였다. 5분 후, THF (2 mL) 중 6-브로모-3-플루오로-2-메틸피리딘 (0.50 g, 2.63 mmol)을 한 번에 모두 첨가하였다. 바이알을 밀봉하고, 80℃로 밤새 가열하였다. 혼합물을 에틸 아세테이트와 염수 사이에 분배하였다. 층을 분리하고, 수층을 에틸 아세테이트 (2x)로 추출하였다. 합한 유기부를 황산나트륨 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피에 의해 정제하여 tert-부틸 3-(((6-브로모-2-메틸피리딘-3-일)옥시)메틸)-3-이소부틸아제티딘-1-카르복실레이트 (50 mg, 0.121 mmol, 5% 수율)를 거의 무색 오일로서 수득하였다. LCMS (ESI) m/e 313.0 (M-Boc+H)+, 계산치 C14H22BrN2O, 313.1]; LC/MS 체류시간 (방법 D): tR = 0.92분.
파트 D: tert-부틸 3-이소부틸-3-(((2'-((메톡시카르보닐)아미노)-6-메틸-[2,4'-비피리딘]-5-일)옥시)메틸)아제티딘-1-카르복실레이트
톨루엔 (1 mL), 및 에탄올 (0.1 mL) 중 (2-((메톡시카르보닐)아미노)피리딘-4-일)보론산 (50 mg, 0.255 mmol), tert-부틸 3-(((6-브로모-2-메틸피리딘-3-일)옥시)메틸)-3-이소부틸아제티딘-1-카르복실레이트 (70.3 mg, 0.170 mmol), Pd(Ph3P)4 (13.76 mg, 0.012 mmol), 및 탄산세슘 (111 mg, 0.340 mmol)의 용액을 압력 정격 바이알에 채우고, 질소의 스트림으로 5분 동안 폭기하였다. 바이알을 밀봉하고, 산소로 퍼징하고, 질소 하에 80℃에서 밤새 교반하였다. 혼합물을 주위 온도로 냉각시키고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (10-80% 에틸 아세테이트/헥산 구배 용리)에 의해 정제하여 tert-부틸 3-이소부틸-3-(((2'-((메톡시카르보닐)아미노)-6-메틸-[2,4'-비피리딘]-5-일)옥시)메틸)아제티딘-1-카르복실레이트 (29 mg, 0.060 mmol, 35% 수율)를 연황색 필름으로서 수득하였다. LCMS (ESI) m/e 485.1 (M+H)+, 계산치 C26H37N4O5, 485.3]; LC/MS 체류시간 (방법 D): tR = 1.14분.
파트 D: 메틸 (5-((3-이소부틸아제티딘-3-일)메톡시)-6-메틸-[2,4'-비피리딘]-2'-일)카르바메이트
tert-부틸 3-이소부틸-3-(((2'-((메톡시카르보닐)아미노)-6-메틸-[2,4'-비피리딘]-5-일)옥시)메틸)아제티딘-1-카르복실레이트 (29 mg, 0.060 mmol) 및 TFA (1 mL, 12.98 mmol)를 주위 온도에서 3시간 동안 교반하였다. 용액을 감압 하에 농축시켰다. 조 물질을 정제용 HPLC (칼럼: 엑스브리지 C18, 19 x 200 mm, 5-μm; 이동상 A: 5:95 메탄올: 10-mM 아세트산암모늄 포함 물; 이동상 B: 95:5 메탄올: 10-mM 아세트산암모늄 포함 물; 구배: 40분에 걸쳐 40-80% B에 이어서 100% B에서 5-분 유지; 유량: 20 mL/분)를 통해 정제하였다. 무색 필름으로서의 메틸 (5-((3-이소부틸아제티딘-3-일)메톡시)-6-메틸-[2,4'-비피리딘]-2'-일)카르바메이트 (11.5 mg, 0.030 mmol, 50% 수율)를 수득하였다. LCMS (ESI) m/e 385.1 (M+H)+, 계산치 C21H29N4O3, 385.3]; LC/MS 체류시간 (방법 D): tR = 0.76분; 1H NMR (500MHz, DMSO-d6) δ 8.49 (s, 1H), 8.31 (d, J=5.1 Hz, 1H), 7.86 (d, J=8.4 Hz, 1H), 7.64 (d, J=4.4 Hz, 1H), 7.56 (d, J=8.4 Hz, 1H), 4.27 (s, 2H), 3.54 - 3.38 (m, 4H), 2.46 (s, 3H), 1.86 (m, 3H), 1.73 - 1.59 (m, 3H), 0.86 (d, J=5.9 Hz, 6H).
실시예 109
(S)-2-((2-아미노-4-메틸펜틸)옥시)-5-(6-메틸피리다진-4-일)벤조니트릴
파트 A: (S)-tert-부틸 (1-(2-시아노-4-(6-메틸피리다진-4-일)페녹시)-4-메틸펜탄-2-일)카르바메이트
2 mL 바이알에 디옥산 (0.5 mL) 중 (6-메틸피리다진-4-일)보론산 (20.56 mg, 0.149 mmol), (S)-tert-부틸 (1-(4-브로모-2-시아노페녹시)-4-메틸펜탄-2-일)카르바메이트 (42.3 mg, 0.106 mmol), 및 Na2CO3 (0.160 mL, 0.319 mmol)을 첨가하여 질소 하에 무색 현탁액을 수득하였다. 1,1'-비스(디페닐포스피노)페로센팔라듐(II) 디클로라이드, 톨루엔 (4.38 mg, 5.32 μmol)을 질소 하에 첨가하였다. 바이알을 밀봉하고 100℃ (조: 108℃)에서 2시간 동안 가열하였다. 혼합물을 EtOAc로 희석하고, Na2SO4로 건조시키고, Na2SO4의 플러그에 통과시켰다. 유기 용액을 농축시켜 목적 생성물 (70 mg, 100% 조 수율)을 황갈색 오일로서 수득하였으며, 이를 직접 후속 단계에 사용하였다. LCMS (ESI) m/e 411.2 [(M+H)+, 계산치 C23H31N4O3, 411.2].
파트 B: (S)-2-((2-아미노-4-메틸펜틸)옥시)-5-(6-메틸피리다진-4-일)벤조니트릴
실시예 7, 파트 B에 사전에 기재된 바와 같이 제조하여 (S)-2-((2-아미노-4-메틸펜틸)옥시)-5-(6-메틸피리다진-4-일)벤조니트릴 (20.8 mg, 2 단계에 대해서 63%)을 무색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 9.51 (d, J = 2.4 Hz, 1H), 8.40 (d, J = 2.4 Hz, 1H), 8.24 (dd, J = 8.9, 2.5 Hz, 1H), 7.96 (d, J = 2.4 Hz, 1H), 7.44 (d, J = 9.0 Hz, 1H), 4.11 (dd, J = 9.7, 5.1 Hz, 1H), 4.04 (dd, J = 9.6, 6.3 Hz, 1H), 3.17 (t, J = 6.6 Hz, 1H), 2.67 (s, 3H), 1.84 (p, J = 6.6 Hz, 1H), 1.38 (ddd, J = 13.5, 8.3, 5.0 Hz, 1H), 1.30 (dq, J = 13.9, 7.0, 6.4 Hz, 1H), 0.93 (d, J = 6.6 Hz, 3H), 0.89 (d, J = 6.6 Hz, 3H); LCMS (ESI) m/e 311.2 [(M+H)+, 계산치 C18H23N4O, 311.2]; LC/MS 체류시간 (방법 B): tR = 1.46분.
실시예 110
(S)-1-(2-(이속사졸-5-일)-4-(퀴놀린-4-일)페녹시)-4-메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-(4-브로모-2-(이속사졸-5-일)페녹시)-4-메틸펜탄-2-일)카르바메이트
15 mL 바이알에 테트라히드로푸란 (3 mL) 중 (S)-tert-부틸 (1-히드록시-4-메틸펜탄-2-일)카르바메이트 (204 mg, 0.939 mmol), Ph3P (320 mg, 1.220 mmol), 및 4-브로모-2-(이속사졸-5-일)페놀 (225 mg, 0.939 mmol)을 첨가하여 황갈색 용액을 수득하였다. DIAD (0.256 mL, 1.314 mmol)를 실온에서 첨가하였다. 생성된 투명한 황갈색 용액을 실온에서 밤새 18시간 동안 교반하였다. 용액을 고밀도 오일로 농축시키고, 실리카 겔 크로마토그래피 (최대 40% EtOAc/헥산)에 의해 직접 정제하여 백색 고체로서의 (S)-tert-부틸 (1-(4-브로모-2-(이속사졸-5-일)페녹시)-4-메틸펜탄-2-일)카르바메이트 (319 mg, 77%)를 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 8.31 (s, 1H), 8.09 (d, J = 2.4 Hz, 1H), 7.46 (dd, J = 9.1, 2.6 Hz, 1H), 6.88 (d, J = 9.0 Hz, 2H), 4.60 (d, J = 8.9 Hz, 1H), 4.19 (d, J = 7.0 Hz, 1H), 4.02 (qd, J = 9.2, 5.2 Hz, 2H), 1.75 (dq, J = 13.6, 6.7 Hz, 1H), 1.46 (d, J = 12.0 Hz, 11H), 0.98 (d, J = 6.6 Hz, 6H).
파트 B: (S)-tert-부틸 (1-(2-(이속사졸-5-일)-4-(퀴놀린-4-일)페녹시)-4-메틸펜탄-2-일)카르바메이트
실시예 109에 사전에 기재된 바와 같이 제조하여 (S)-tert-부틸 (1-(2-(이속사졸-5-일)-4-(퀴놀린-4-일)페녹시)-4-메틸펜탄-2-일)카르바메이트를 수득하였다. LCMS (ESI) m/e 488.4 [(M+H)+, 계산치 C29H34N3O4, 488.2]; LC/MS 체류시간 (방법 A): tR = 2.27분.
파트 C: (S)-1-(2-(이속사졸-5-일)-4-(퀴놀린-4-일)페녹시)-4-메틸펜탄-2-아민
실시예 7, 파트 B에 사전에 기재된 바와 같이 제조하여 (S)-1-(2-(이속사졸-5-일)-4-(퀴놀린-4-일)페녹시)-4-메틸펜탄-2-아민 (12.9 mg, 2 단계에 대해서 44%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.97 (d, J = 4.4 Hz, 1H), 8.72 (d, J = 1.8 Hz, 1H), 8.14 (d, J = 8.5 Hz, 1H), 8.02 (d, J = 2.3 Hz, 1H), 7.95 (d, J = 8.5 Hz, 1H), 7.82 (t, J = 7.6 Hz, 1H), 7.70 (dd, J = 8.5, 2.3 Hz, 1H), 7.64 (t, J = 7.6 Hz, 1H), 7.54 (d, J = 4.4 Hz, 1H), 7.45 (d, J = 8.6 Hz, 1H), 7.06 (d, J = 1.9 Hz, 1H), 4.13 (dd, J = 9.4, 4.9 Hz, 1H), 4.05 (dd, J = 9.4, 6.2 Hz, 1H), 3.25 (dq, J = 10.4, 5.6 Hz, 1H), 1.85 (dt, J = 13.4, 7.5 Hz, 1H), 1.41 (ddd, J = 13.4, 8.4, 4.7 Hz, 1H), 1.32 (ddd, J = 13.8, 8.7, 5.6 Hz, 1H), 0.93 (dd, J = 9.2, 6.6 Hz, 6H); LCMS (ESI) m/e 388.1 [(M+H)+, 계산치 C24H26N3O2, 388.2]; LC/MS 체류시간 (방법 B): tR = 1.59분.
실시예 111
(S)-4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)-2-메틸니코틴산
파트 A: (3-(메톡시카르보닐)-2-메틸피리딘-4-일)보론산
바이알에 에탄올 (2.6 mL) 중 메틸 4-클로로-2-메틸니코티네이트 (52 mg, 0.280 mmol), 하이포이붕산 (37.7 mg, 0.420 mmol), 2-(디시클로헥실포스피노))-2',4',6'-트리이소프로필비페닐 (2.67 mg, 5.60 μmol), Xphos 전촉매 (2.204 mg, 2.80 μmol) 및 아세트산칼륨 (82 mg, 0.840 mmol)을 첨가하여 황갈색 현탁액 (탈기한 후 시약을 첨가함)을 수득하였다. 바이알을 마개를 막고 80℃에서 1시간 동안 가열하였다. LCMS는 출발 물질이 신규한 극성 피크로 전환되는 것을 보였으나, 모 이온은 보이지 않았다. 혼합물을 직접 후속 단계에 사용하였다.
파트 B: (S)-4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)-2-메틸니코틴산
20 mL 바이알에 (3-(메톡시카르보닐)-2-메틸피리딘-4-일)보론산 (48.9 mg, 0.251 mmol) (이전 반응 용기)에 삼염기성 인산칼륨 (2.2 mL, 1.100 mmol)을 첨가하였다. 5분 동안 탈기한 후, Xphos 전촉매 (4.5 mg, 5.72 μmol) 및 (S)-1-(4-브로모-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (33 mg, 0.084 mmol) 및 테트라히드로푸란 (2.2 mL)을 첨가하였다. 바이알을 밀봉하고, 80℃에서 밤새 18시간 동안 가열하였다. 휘발성 물질을 방출시켰다. 잔류물을 EtOAc와 물 사이에 분배하였다. 유기 층을 건조시키고, 여과하고, 농축시켰다. 잔류물을 MeOH 중에 용해시키고, 정제용 HPLC에 의해 정제하여 (S)-4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)-2-메틸니코틴산 (18.8 mg, 53%)을 수득하였다: 1H NMR (600 MHz, DMSO-d6) δ 8.27 (d, J = 5.1 Hz, 1H), 7.88 (s, 1H), 7.83 (d, J = 8.6 Hz, 1H), 7.08 (d, J = 5.2 Hz, 1H), 6.96 (d, J = 8.6 Hz, 1H), 3.99 - 3.92 (m, 2H), 2.47 (s, 3H), 1.88 - 1.72 (m, 1H), 1.60 - 1.45 (m, 2H), 1.24 (s, 3H), 0.89 (d, J = 6.5 Hz, 6H); LCMS (ESI) m/e 433.2 [(M+Na)+, 계산치 C21H25F3N2O3Na, 433.2]; LC/MS 체류시간 (방법 C): tR = 2.60분.
실시예 112
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-((디메틸아미노)메틸)페닐)피리딘-2-일)카르바메이트
파트 A: (S)-메틸 (4-(4-((2-Boc-아미노-2,4-디메틸펜틸)옥시)-3-((디메틸아미노)메틸)페닐)피리딘-2-일)카르바메이트
2 mL 바이알에 CH2Cl2 (0.5 mL) 중 조 (S)-메틸 (4-(4-((2-Boc-아미노-2,4-디메틸펜틸)옥시)-3-카르보닐페닐)피리딘-2-일)카르바메이트 알데히드 (실시예 32, 파트 G에 기재된 바와 같이 제조됨) (10.68 mg, 0.022 mmol)를 첨가하여 황갈색 용액을 수득하였다. 디메틸아민 (0.110 mL, 0.220 mmol) (THF 중 2.0 M, 과량)을 첨가하고, 이어서 소듐 트리아세톡시보로히드라이드 (0.019 g, 0.088 mmol)를 첨가하였다. 혼합물을 실온에서 밤새 16시간 동안 교반하였다. LCMS는 목적 생성물 (M + H = 515.2)로의 완전한 전환을 나타내었다. 혼합물을 물과 EtOAc 사이에 분배하였다. 층을 분리하였다. 유기 층을 염수로 세척하고, 건조시키고, 농축시켰다. 황갈색 잔류물을 직접 후속 반응에 사용하였다.
파트 B: (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-((디메틸아미노)메틸)페닐)피리딘-2-일)카르바메이트
실시예 7, 파트 B에 사전에 기재된 바와 같이 제조하여 (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-((디메틸아미노)메틸)페닐)피리딘-2-일)카르바메이트 (5.5 mg, 3 단계에 대해서 60%)를 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.28 (d, J = 5.3 Hz, 1H), 8.10 (s, 1H), 7.64 (d, J = 6.8 Hz, 2H), 7.32 (d, J = 5.4 Hz, 1H), 7.12 (d, J = 8.8 Hz, 1H), 3.83 (s, 2H), 3.70 (s, 3H), 3.51 (s, 2H), 2.20 (s, 6H), 1.81 (dt, J = 12.6, 6.4 Hz, 1H), 1.46 (qd, J = 14.0, 5.6 Hz, 2H), 1.19 (s, 3H), 0.94 (t, J = 6.1 Hz, 6H); LCMS (ESI) m/e 415.1 [(M+H)+, 계산치 C23H35N4O3, 415.3]; LC/MS 체류시간 (방법 B): tR = 1.43분.
실시예 113
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(메틸술포닐)페닐)피리딘-2-일)카르바메이트
파트 A: (S)-1-(4-브로모-2-(메틸술포닐)페녹시)-2,4-디메틸펜탄-2-아민
5 mL 바이알에 테트라히드로푸란 (1.2 mL) 중 (S)-2-아미노-2,4-디메틸펜탄-1-올 (120 mg, 0.915 mmol)을 첨가하여 무색 용액을 수득하였다. 포타슘 tert-부톡시드 (1.097 mL, 1.097 mmol) (THF 중 1.0 M)를 질소 하에 적가하였다. 5분 후, 4-브로모-1-플루오로-2-(메틸술포닐)벤젠 (243 mg, 0.960 mmol)을 한 번에 첨가하였다. 병을 밀봉하고, 혼합물을 70℃에서 18시간 동안 교반하였다. 혼합물을 물과 EtOAc 사이에 분배하였다. 층을 분리하였다. 수성 층을 EtOAc로 추출하였다. 합한 유기 용액을 염수로 세척하고, 건조시키고 농축시켜 적색 오일 (313 mg, 94%)을 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 8.10 (d, J = 2.6 Hz, 1H), 7.69 (dd, J = 8.8, 2.5 Hz, 1H), 6.94 (d, J = 8.8 Hz, 1H), 3.90 (q, J = 8.5 Hz, 2H), 3.24 (s, 3H), 1.90 - 1.75 (m, 1H), 1.52 (dd, J = 5.7, 3.5 Hz, 2H), 1.28 (s, 3H), 1.01 (dd, J = 10.6, 6.7 Hz, 6H); LCMS (ESI) m/e 363.9 [(M+H)+, 계산치 C14H23BrNO3S, 364.1]; LC/MS 체류시간 (방법 B): tR = 1.64분.
파트 B: (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(메틸술포닐)페닐)피리딘-2-일)카르바메이트
실시예 109에 사전에 기재된 바와 같이 제조하여 (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(메틸술포닐)페닐)피리딘-2-일)카르바메이트 (25.6 mg, 75%)를 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.34 (d, J = 5.2 Hz, 1H), 8.14 (s, 1H), 8.12 - 8.03 (m, 2H), 7.45 (d, J = 8.6 Hz, 1H), 7.38 (d, J = 5.3 Hz, 1H), 3.97 (s, 2H), 3.71 (s, 3H), 3.42 (s, 3H), 1.83 (dt, J = 12.2, 6.2 Hz, 1H), 1.49 - 1.37 (m, 2H), 1.17 (s, 3H), 0.94 (dd, J = 8.7, 6.6 Hz, 6H); LCMS (ESI) m/e 436.0 [(M+H)+, 계산치 C21H30N3O5S, 436.2]; LC/MS 체류시간 (방법 B): tR = 1.52분.
실시예 114
(S)-2,4-디메틸-1-(4-(2-메틸피리딘-4-일)-2-(메틸술포닐)페녹시)펜탄-2-아민
실시예 113에 기재된 바와 같이 제조하여 (S)-2,4-디메틸-1-(4-(2-메틸피리딘-4-일)-2-(메틸술포닐)페녹시)펜탄-2-아민 (19 mg, 0.049 mmol, 83%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.51 (d, J = 5.3 Hz, 1H), 8.17 - 8.10 (m, 2H), 7.59 (s, 1H), 7.52 - 7.46 (m, 1H), 7.43 (d, J = 9.2 Hz, 1H), 3.97 (s, 2H), 3.55 (s, 3H), 2.55 (s, 3H), 1.83 (dt, J = 13.0, 6.3 Hz, 1H), 1.50 - 1.37 (m, 2H), 1.17 (s, 3H), 0.94 (dd, J = 8.8, 6.5 Hz, 6H); LCMS (ESI) m/e 377.0 [(M+H)+, 계산치 C20H29N2O3S, 377.2]; LC/MS 체류시간 (방법 B): tR = 1.32분.
실시예 115
(S)-2,4-디메틸-1-(2-(메틸술포닐)-4-(퀴놀린-4-일)페녹시)펜탄-2-아민
실시예 113에 기재된 바와 같이 제조하여 (S)-2,4-디메틸-1-(2-(메틸술포닐)-4-(퀴놀린-4-일)페녹시)펜탄-2-아민 (12.2 mg, 0.029 mmol, 58%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.97 (d, J = 4.4 Hz, 1H), 8.14 (d, J = 8.3 Hz, 1H), 7.95 - 7.87 (m, 3H), 7.83 (t, J = 7.7 Hz, 1H), 7.65 (t, J = 7.7 Hz, 1H), 7.55 - 7.47 (m, 2H), 4.01 (s, 2H), 3.49 (s, 3H), 1.85 (dt, J = 12.9, 6.5 Hz, 1H), 1.53 - 1.39 (m, 2H), 1.19 (s, 3H), 0.97 (dd, J = 8.4, 6.6 Hz, 6H); LCMS (ESI) m/e 413.0 [(M+H)+, 계산치 C23H29N2O3S, 413.2]; LC/MS 체류시간 (방법 B): tR = 1.41분.
실시예 116
(S)-1-(2-(디플루오로메틸)-4-(6-플루오로퀴놀린-4-일)페녹시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-1-(2-(디플루오로메틸)-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-아민
5 mL 바이알에 디옥산 (0.5 mL) 중 (S)-1-(4-브로모-2-(디플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (16.2 mg, 0.048 mmol), 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란) (14.68 mg, 0.058 mmol), 및 아세트산칼륨 (14.19 mg, 0.145 mmol)을 질소 버블링과 함께 첨가하여 무색 현탁액을 수득하였다. PdCl2(dppf) (1.058 mg, 1.446 μmol)를 질소 하에 첨가하였다. 바이알을 밀봉하고, 혼합물을 80℃에서 4시간 동안 가열하였다. LCMS는 대부분의 출발 물질이 사라졌다는 것과, 여러 피크를 나타내었다. 이것을 직접 후속 단계에 사용하였다.
파트 B: (S)-1-(2-(디플루오로메틸)-4-(6-플루오로퀴놀린-4-일)페녹시)-2,4-디메틸펜탄-2-아민
디옥산 (0.5 mL) (탈기됨) (이전 바이알) 중 (S)-1-(2-(디플루오로메틸)-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-아민 (18.40 mg, 0.048 mmol), 1,1'-비스(디페닐포스피노)페로센팔라듐(II) 디클로라이드, 디클로로메탄 착물 (2.74 mg, 3.36 μmol), Na2CO3 (0.096 mL, 0.192 mmol) 및 4-클로로-6-플루오로퀴놀린 (8.72 mg, 0.048 mmol)의 혼합물을 120℃에서 16시간 동안 가열하였다. 반응 혼합물을 에틸 아세테이트로 희석하고, 건조시키고 (Na2SO4), 여과하고, 농축시켰다. 잔류물을 MeOH 중에 용해시키고, 정제용 HPLC에 의해 정제하여 (S)-1-(2-(디플루오로메틸)-4-(6-플루오로퀴놀린-4-일)페녹시)-2,4-디메틸펜탄-2-아민 (6.7 mg, 2 단계에 대해서 35%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.95 (d, J = 4.5 Hz, 1H), 8.20 (dd, J = 9.2, 5.7 Hz, 1H), 7.74 (ddd, J = 13.0, 8.0, 3.4 Hz, 2H), 7.68 (d, J = 2.3 Hz, 1H), 7.54 (d, J = 4.4 Hz, 1H), 7.50 (dd, J = 10.3, 2.9 Hz, 1H), 7.44 - 7.17 (m, 2H), 3.61 (s, 2H), 1.82 (dq, J = 12.8, 6.4 Hz, 1H), 1.50 - 1.37 (m, 2H), 1.16 (s, 3H), 0.95 (dd, J = 10.2, 6.6 Hz, 6H); LCMS (ESI) m/e 403.0 [(M+H)+, 계산치 C23H26F3N2O, 403.2]; LC/MS 체류시간 (방법 B): tR = 1.78분.
실시예 117
(S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-6-(디플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트
파트 A: 6-브로모-2-(디플루오로메틸)-3-플루오로피리딘
100 mL 둥근 바닥 플라스크에 CH2Cl2 (10 mL) 중 6-브로모-3-플루오로피콜린알데히드 (459.8 mg, 2.254 mmol)를 첨가하여 황갈색 용액을 수득하였다. -20℃로 냉각시킨 후, DAST (0.596 mL, 4.51 mmol)를 질소 하에 적가하였다. 혼합물을 실온으로 서서히 가온하였다. 혼합물을 실온에서 3시간 동안 교반하였다. TLC (3/1 헥산/EtOAc)는 덜 극성의 스폿으로의 완전한 전환을 나타내었다. 반응물을 포화 NaHCO3 용액에 의해 천천히 켄칭하고, 에테르로 희석하였다. 층을 분리하였다. 유기 층을 물, 염수로 세척하고, 건조시키고 농축시켜 6-브로모-2-(디플루오로메틸)-3-플루오로피리딘 (509 mg, 100%)을 황갈색 고체로서 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 7.65 (ddt, J = 8.6, 3.5, 1.0 Hz, 1H), 7.46 (t, J = 8.7 Hz, 1H), 6.73 (t, J = 53.4 Hz, 1H); 19F NMR (376 MHz, 클로로포름-d) δ -116.97, -127.89.
파트 B: (S)-1-((6-브로모-2-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
5 mL 압력 병에 테트라히드로푸란 (1.3 mL) 중 (S)-2-아미노-2,4-디메틸펜탄-1-올 (140 mg, 1.067 mmol)을 첨가하여 무색 용액을 수득하였다. 포타슘 tert-부톡시드 (1.280 mL, 1.280 mmol) (THF 중 1.0 M)를 질소 하에 적가하였다. 5분 후, 6-브로모-2-(디플루오로메틸)-3-플루오로피리딘 (241 mg, 1.067 mmol)을 한 번에 첨가하였다. 병을 밀봉하고, 혼합물을 80℃에서 18시간 동안 교반하였다. 혼합물을 물과 EtOAc 사이에 분배하였다. 층을 분리하였다. 수성 층을 EtOAc로 추출하였다. 합한 유기 용액을 염수로 세척하고, 건조시키고 농축시켜 황갈색 오일 (338 mg, 94%)을 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 7.54 (dt, J = 9.0, 1.1 Hz, 1H), 7.22 (d, J = 8.8 Hz, 1H), 6.74 (t, J = 53.9 Hz, 1H), 3.79 (d, J = 1.7 Hz, 2H), 1.80 (dtd, J = 13.3, 6.7, 1.1 Hz, 1H), 1.54 (s, 2H), 1.52 - 1.47 (m, 2H), 1.25 (s, 3H), 1.00 (dd, J = 8.3, 6.6 Hz, 6H); 19F NMR (376 MHz, 클로로포름-d) δ -117.98.; LCMS (ESI) m/e 336.9 [(M+H)+, 계산치 C13H20BrF2N2O, 337.1]; LC/MS 체류시간 (방법 B): tR = 1.67분.
파트 C: (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-6-(디플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트
2 mL 바이알에 디옥산 (0.6 mL) 중 (S)-1-((6-브로모-2-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (28.4 mg, 0.084 mmol), (2-((메톡시카르보닐)아미노)피리딘-4-일)보론산 (41.3 mg, 0.211 mmol), 및 Na2CO3 (0.126 mL, 0.253 mmol)을 첨가하여 질소 하에 무색 현탁액을 수득하였다. 1,1'-비스(디페닐포스피노)페로센팔라듐(II) 디클로라이드, 톨루엔 (3.46 mg, 4.21 μmol)을 질소 하에 첨가하였다. 바이알을 밀봉하고 100℃ (조 온도: 110℃)에서 3시간 동안 가열하였다. 혼합물을 EtOAc로 희석하고, Na2SO4의 플러그에 통과시켰다. 유기 용액을 농축시켰다. 잔류물을 정제용 HPLC에 의해 2회 정제하여 (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-6-(디플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트 (12.6 mg, 37%)를 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.50 (s, 1H), 8.36 (d, J = 5.2 Hz, 1H), 8.17 (d, J = 8.8 Hz, 1H), 7.78 (d, J = 8.8 Hz, 1H), 7.67 (dd, J = 5.1, 1.7 Hz, 1H), 7.22 (t, J = 53.6 Hz, 1H), 3.88 (s, 2H), 3.52 (s, 3H), 1.86 - 1.73 (m, 1H), 1.47 - 1.33 (m, 2H), 1.13 (s, 3H), 0.93 (dd, J = 10.0, 6.6 Hz, 6H); LCMS (ESI) m/e 409.0 (M+H)+, 계산치 C20H27F2N4O3, 409.2]; LC/MS 체류시간 (방법 B): tR = 1.66분.
실시예 118
(S)-1-((2-(디플루오로메틸)-6-(퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 117에 기재된 바와 같이 제조하여 (S)-1-((2-(디플루오로메틸)-6-(퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (10.6 mg, 0.027 mmol, 3 단계에 대해서 60% 수율)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 9.01 (d, J = 4.4 Hz, 1H), 8.21 (d, J = 8.5 Hz, 1H), 8.13 (d, J = 8.4 Hz, 1H), 7.97 (d, J = 8.7 Hz, 1H), 7.87 (d, J = 8.7 Hz, 1H), 7.82 (t, J = 7.7 Hz, 1H), 7.64 (dd, J = 9.5, 6.0 Hz, 2H), 7.28 (t, J = 53.6 Hz, 1H), 3.53 (s, 2H), 1.83 (dt, J = 13.2, 6.6 Hz, 1H), 1.50 - 1.37 (m, 2H), 1.16 (s, 3H), 0.95 (dd, J = 10.0, 6.7 Hz, 6H); LCMS (ESI) m/e 386.0 [(M+H)+, 계산치 C22H26F2N3O, 386.2]; LC/MS 체류시간 (방법 B): tR = 1.54분.
실시예 119
(S)-1-((6-(디플루오로메틸)-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 117에 기재된 바와 같이 제조하여 (S)-1-((6-(디플루오로메틸)-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (18.3 mg, 0.051 mmol, 3 단계에 대해서 92% 수율)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.54 (d, J = 5.2 Hz, 1H), 8.26 (d, J = 8.8 Hz, 1H), 7.90 (s, 1H), 7.82 (d, J = 5.3 Hz, 1H), 7.78 (d, J = 8.8 Hz, 1H), 7.23 (t, J = 53.6 Hz, 1H), 3.89 (s, 2H), 2.56 (s, 3H), 1.81 (dq, J = 12.8, 6.5 Hz, 1H), 1.50 - 1.34 (m, 2H), 1.14 (s, 3H), 0.92 (dd, J = 10.5, 6.6 Hz, 6H); LCMS (ESI) m/e 350.0 [(M+H)+, 계산치 C19H26F2N3O, 350.2]; LC/MS 체류시간 (방법 B): tR = 1.45분.
실시예 120
(S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4-(디플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트
파트 A: 2-브로모-4-(디플루오로메틸)-5-플루오로피리딘
100 mL 둥근 바닥 플라스크에 CH2Cl2 (12 mL) 중 2-브로모-5-플루오로이소니코틴알데히드 (605 mg, 2.97 mmol)를 첨가하여 황갈색 용액을 수득하였다. -20℃로 냉각시킨 후, DAST (0.705 mL, 5.34 mmol)를 질소 하에 적가하였다. 혼합물을 실온으로 서서히 가온하였다. 혼합물을 실온에서 3시간 동안 교반하였다. TLC (3/1 헥산/EtOAc)는 덜 극성의 스폿로의 완전한 전환을 나타내었다. 반응물을 포화 NaHCO3 용액으로 천천히 켄칭하고, 에테르로 추출하였다. 층을 분리하였다. 유기 층을 물, 염수로 세척하고, 건조시키고, 농축시켜 2-브로모-4-(디플루오로메틸)-5-플루오로피리딘 (639 mg, 95%)을 황갈색 오일로서 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 8.39 (q, J = 1.2 Hz, 1H), 7.77 - 7.68 (m, 1H), 6.86 (t, J = 54.0 Hz, 1H); 19F NMR (376 MHz, 클로로포름-d) δ -117.92, -135.51.
파트 B: (S)-1-((6-브로모-4-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
20 mL 압력 병에 테트라히드로푸란 (1.5 mL) 중 (S)-2-아미노-2,4-디메틸펜탄-1-올 (146 mg, 1.113 mmol) 및 2-브로모-4-(디플루오로메틸)-5-플루오로피리딘 (251 mg, 1.113 mmol)을 첨가하여 황갈색 용액을 수득하였다. 포타슘 tert-부톡시드 (1.335 mL, 1.335 mmol) (THF 중 1.0 M)를 질소 하에 적가하였다. 실온에서 5분 동안 교반한 후, 병을 밀봉하고, 혼합물을 80℃에서 18시간 동안 교반하였다. 혼합물을 물과 EtOAc 사이에 분배하였다. 층을 분리하였다. 수성 층을 EtOAc로 추출하였다. 합한 유기 용액을 염수로 세척하고, 건조시키고 농축시켜 황갈색 오일 (361 mg, 96%)을 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 8.13 (s, 1H), 7.62 (s, 1H), 6.85 (t, J = 54.4 Hz, 1H), 3.87 (s, 2H), 1.80 (dtd, J = 13.2, 6.7, 1.0 Hz, 1H), 1.61 - 1.50 (m, 2H), 1.50 - 1.47 (m, 2H), 1.24 (s, 3H), 1.00 (dd, J = 7.4, 6.7 Hz, 6H); 19F NMR (376 MHz, 클로로포름-d) δ -119.58; LCMS (ESI) m/e 336.9 [(M+H)+, 계산치 C13H20BrF2N2O, 337.1]; LC/MS 체류시간 (방법 B): tR = 1.79분.
파트 C: (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4-(디플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트
실시예 117에 기재된 바와 같이 제조하여 (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4-(디플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트 (2.5 mg, 0.006 mmol, 3 단계에 대해서 6% 수율)를 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.71 (s, 1H), 8.53 (s, 1H), 8.36 (d, J = 5.2 Hz, 1H), 8.08 (s, 1H), 7.71 (d, J = 5.2 Hz, 1H), 7.48 (t, J = 53.9 Hz, 1H), 4.12 (s, 2H), 3.71 (s, 3H), 1.82 (dt, J = 12.9, 6.4 Hz, 1H), 1.53 (dd, J = 14.2, 5.3 Hz, 1H), 1.46 (dd, J = 14.2, 5.8 Hz, 1H), 1.22 (s, 3H), 0.95 (d, J = 6.6 Hz, 3H), 0.91 (d, J = 6.6 Hz, 3H); LCMS (ESI) m/e 408.9 (M+H)+, 계산치 C20H27F2N4O3, 409.2]; LC/MS 체류시간 (방법 B): tR = 1.66분.
실시예 121
(S)-1-((4-(디플루오로메틸)-6-(퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 117에 기재된 바와 같이 제조하여 (S)-1-((4-(디플루오로메틸)-6-(퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (11.7 mg, 0.030 mmol, 3 단계에 대해서 69% 수율)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 9.00 (d, J = 4.4 Hz, 1H), 8.78 (s, 1H), 8.18 (d, J = 8.5 Hz, 1H), 8.13 (d, J = 8.5 Hz, 1H), 7.88 (s, 1H), 7.82 (t, J = 7.6 Hz, 1H), 7.69 - 7.60 (m, 2H), 7.39 (t, J = 53.8 Hz, 1H), 4.06 (s, 2H), 1.84 (dt, J = 12.9, 6.3 Hz, 1H), 1.51 - 1.37 (m, 2H), 1.17 (s, 3H), 0.96 (dd, J = 11.7, 6.7 Hz, 6H); LCMS (ESI) m/e 386.0 [(M+H)+, 계산치 C22H26F2N3O, 386.2]; LC/MS 체류시간 (방법 B): tR = 1.58분.
실시예 122
(S)-1-((4-(디플루오로메틸)-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 117에 기재된 바와 같이 제조하여 (S)-1-((4-(디플루오로메틸)-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (13.6 mg, 0.039 mmol, 3 단계에 대해서 74% 수율)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.68 (s, 1H), 8.54 (d, J = 5.3 Hz, 1H), 8.19 (s, 1H), 7.94 (s, 1H), 7.84 (d, J = 5.2 Hz, 1H), 7.39 (t, J = 53.9 Hz, 1H), 4.06 (s, 2H), 2.56 (s, 3H), 1.81 (dt, J = 12.8, 6.4 Hz, 1H), 1.45 (qd, J = 14.2, 5.7 Hz, 2H), 1.18 (s, 3H), 0.94 (d, J = 6.6 Hz, 3H), 0.91 (d, J = 6.6 Hz, 3H); LCMS (ESI) m/e 350.0 [(M+H)+, 계산치 C19H26F2N3O, 350.2]; LC/MS 체류시간 (방법 B): tR = 1.46분.
실시예 123
(S)-1-((2',6-비스(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (2-(디플루오로메틸)피리딘-4-일)보론산
20 mL 바이알에 에탄올 (8.5 mL) 중 4-클로로-2-(디플루오로메틸)피리딘 히드로클로라이드 (180 mg, 0.900 mmol), 하이포이붕산 (121 mg, 1.350 mmol), 2-(디시클로헥실포스피노))-2',4',6'-트리이소프로필비페닐 (8.58 mg, 0.018 mmol), Xphos 전촉매 (7.08 mg, 9.00 μmol) 및 아세트산칼륨 (265 mg, 2.70 mmol)을 첨가하여 황갈색 현탁액 (탈기한 후 작용제 첨가함)을 수득하였다. 병을 마개를 막고 80℃에서 1.5시간 동안 가열하였다. LCMS는 출발 물질의 소모 및 신규한 스폿의 형성을 나타내었다: (2-(디플루오로메틸)피리딘-4-일)보론산. 혼합물을 부분들로 분할하고, 상이한 반응의 후속 단계에 직접 사용하였다.
파트 B: (S)-1-((2',6-비스(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
5 mL 바이알에 (2-(디플루오로메틸)피리딘-4-일)보론산 (25.9 mg, 0.15 mmol)을 첨가하고 삼염기성 인산칼륨 (1 mL, 0.500 mmol)을 첨가하였다. 5분 동안 탈기한 후, Xphos 전촉매 (4 mg, 5.08 μmol) 및 (S)-1-((6-브로모-2-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (26.5 mg, 0.079 mmol) 및 테트라히드로푸란 (1mL)을 첨가하였다. 바이알을 밀봉하고, 80℃에서 밤새 18시간 동안 가열하였다. 휘발성 물질을 방출시켰다. 잔류물을 EtOAc와 물 사이에 분배하였다. 유기 층을 건조시키고, 여과하고, 농축시켰다. 잔류물을 MeOH 중에 용해시키고, 정제용 HPLC에 의해 정제하여 (S)-1-((2',6-비스(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (29.8 mg, 98%)을 무색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.79 (d, J = 5.2 Hz, 1H), 8.40 (d, J = 8.8 Hz, 1H), 8.32 (s, 1H), 8.21 (d, J = 5.1 Hz, 1H), 7.82 (d, J = 8.9 Hz, 1H), 7.31 (t, J = 53.5 Hz, 1H), 7.04 (t, J = 54.9 Hz, 1H), 3.96 (s, 2H), 3.46 (s, 2H), 1.80 (dp, J = 12.5, 6.7, 6.3 Hz, 1H), 1.45 (qd, J = 14.1, 5.6 Hz, 2H), 1.17 (s, 3H), 0.92 (dd, J = 13.6, 6.6 Hz, 6H); 19F NMR (376 MHz, DMSO-d6) δ -115.43 (d, J = 55.2 Hz), -117.78 - -119.55 (m); LCMS (ESI) m/e 386.0 [(M+H)+, 계산치 C19H24F4N3O, 386.2]; LC/MS 체류시간 (방법 B): tR = 1.85분.
실시예 124
(S)-1-((2',4-비스(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 123에 기재된 바와 같이 제조하여 무색 고체로서의 (S)-1-((2',4-비스(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (25.9 mg, 0.067 mmol, 77% 수율)을 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.79 (d, J = 5.2 Hz, 1H), 8.71 (s, 1H), 8.36 (s, 1H), 8.32 (s, 1H), 8.25 (d, J = 5.1 Hz, 1H), 7.35 (t, J = 53.9 Hz, 1H), 7.04 (t, J = 54.9 Hz, 1H), 4.03 (s, 2H), 1.81 (dt, J = 12.8, 6.4 Hz, 1H), 1.48 - 1.33 (m, 2H), 1.14 (s, 3H), 0.93 (dd, J = 12.3, 6.6 Hz, 6H); 19F NMR (376 MHz, DMSO-d6) δ -115.44 (d, J = 54.7 Hz), -116.34 - -119.67 (m); LCMS (ESI) m/e 386.0 [(M+H)+, 계산치 C19H24F4N3O, 386.2]; LC/MS 체류시간 (방법 B): tR = 1.83분.
실시예 125
(S)-1-((2'-(디플루오로메틸)-4-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((2'-(디플루오로메틸)-4-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
실시예 123에 기재된 바와 같이 제조하여 무색 고체로서의 (S)-tert-부틸 (1-((2'-(디플루오로메틸)-4-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (38.5 mg, 0.086 mmol, 80% 수율)를 수득하였다. 1H NMR (400 MHz, 클로로포름-d) δ 8.71 (d, J = 5.2 Hz, 1H), 8.31 (s, 1H), 8.18 (d, J = 1.7 Hz, 1H), 7.98 (dd, J = 5.2, 1.7 Hz, 1H), 7.66 (s, 1H), 6.72 (t, J = 55.5 Hz, 1H), 4.63 (s, 1H), 4.32 (d, J = 8.7 Hz, 1H), 4.14 (d, J = 8.8 Hz, 1H), 2.36 (s, 3H), 1.96 - 1.77 (m, 2H), 1.65 - 1.54 (m, 1H), 1.44 (s, 3H), 1.42 (s, 9H), 1.01 (dd, J = 6.6, 3.5 Hz, 6H); 19F NMR (376 MHz, 클로로포름-d) δ -115.81; LCMS (ESI) m/e 450.1 [(M+H)+, 계산치 C24H34F2N3O3, 450.2]; LC/MS 체류시간 (방법 B): tR = 2.31분.
파트 B: (S)-1-((2'-(디플루오로메틸)-4-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 7, 파트 B에 사전에 기재된 바와 같이 제조하였다 (34.9 mg, 100%): 1H NMR (500 MHz, DMSO-d6) δ 8.76 (d, J = 5.1 Hz, 1H), 8.42 (s, 1H), 8.31 (s, 1H), 8.22 - 8.15 (m, 1H), 8.12 (s, 1H), 7.03 (t, J = 55.0 Hz, 1H), 4.13 - 4.00 (m, 2H), 2.36 (s, 3H), 1.83 (dp, J = 12.7, 6.5 Hz, 1H), 1.60 (dd, J = 14.1, 5.5 Hz, 1H), 1.52 (dd, J = 14.1, 5.6 Hz, 1H), 1.27 (s, 3H), 0.95 (d, J = 6.6 Hz, 3H), 0.92 (d, J = 6.6 Hz, 3H); 19F NMR (376 MHz, DMSO-d6) δ -115.37 (d, J = 54.8 Hz); LCMS (ESI) m/e 350.0 [(M+H)+, 계산치 C19H26F2N3O, 350.2]; LC/MS 체류시간 (방법 B): tR = 1.80분.
실시예 126
(S)-1-(2-시클로프로필-4-(2-(디플루오로메틸)피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-(2-시클로프로필-4-(2-(디플루오로메틸)피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
실시예 123에 기재된 바와 같이 제조하여 (S)-tert-부틸 (1-(2-시클로프로필-4-(2-(디플루오로메틸)피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (31.4 mg, 0.066 mmol, 79% 수율)를 무색 고체로서 수득하였다. 1H NMR (400 MHz, 클로로포름-d) δ 8.65 (d, J = 5.1 Hz, 1H), 7.79 (d, J = 1.7 Hz, 1H), 7.56 (dd, J = 5.2, 1.8 Hz, 1H), 7.47 (dd, J = 8.4, 2.4 Hz, 1H), 7.23 (d, J = 2.3 Hz, 1H), 6.97 (d, J = 8.4 Hz, 1H), 6.71 (t, J = 55.5 Hz, 1H), 4.73 (s, 1H), 4.21 (d, J = 8.8 Hz, 1H), 4.05 (d, J = 8.8 Hz, 1H), 2.19 (tt, J = 8.6, 5.4 Hz, 1H), 1.87 (ddt, J = 13.1, 11.4, 6.8 Hz, 2H), 1.72 - 1.62 (m, 1H), 1.47 (s, 3H), 1.43 (s, 9H), 1.01 (dt, J = 5.5, 2.7 Hz, 8H), 0.74 (td, J = 5.7, 4.0 Hz, 2H); 19F NMR (376 MHz, 클로로포름-d) δ -115.77; LCMS (ESI) m/e 475.0 [(M+H)+, 계산치 C27H37F2N2O3, 475.3]; LC/MS 체류시간 (방법 B): tR = 2.48분.
파트 B: (S)-1-(2-시클로프로필-4-(2-(디플루오로메틸)피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
실시예 7, 파트 B에 사전에 기재된 바와 같이 제조하여 무색 고체로서의 (25.8 mg, 100%)을 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.66 (d, J = 5.3 Hz, 1H), 7.94 (s, 1H), 7.86 (d, J = 5.3 Hz, 1H), 7.66 (dd, J = 8.6, 2.3 Hz, 1H), 7.32 (d, J = 2.4 Hz, 1H), 7.11 - 6.84 (m, 2H), 3.90 - 3.79 (m, 2H), 2.26 (td, J = 8.5, 4.2 Hz, 1H), 1.82 (hept, J = 6.4 Hz, 1H), 1.50 (qd, J = 14.1, 5.6 Hz, 2H), 1.21 (s, 3H), 0.98 - 0.88 (m, 8H), 0.86 - 0.73 (m, 2H); 19F NMR (376 MHz, DMSO-d6) δ -115.05 (d, J = 54.9 Hz); LCMS (ESI) m/e 375.0 [(M+H)+, 계산치 C22H29F2N2O, 375.2]; LC/MS 체류시간 (방법 B): tR = 1.97분.
실시예 127
(S)-1-((2-(디플루오로메틸)-6-(6-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-1-((2-(디플루오로메틸)-6-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
5 mL 바이알에 디옥산 (2.4 mL) 중 (S)-1-((6-브로모-2-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (79.5 mg, 0.236 mmol), 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란) (71.8 mg, 0.283 mmol), 및 아세트산칼륨 (69.4 mg, 0.707 mmol)을 질소 버블링과 함께 첨가하여 무색 현탁액을 수득하였다. PdCl2(dppf) (5.18 mg, 7.07 μmol)를 질소 하에 첨가하였다. 바이알을 밀봉하고, 혼합물을 80℃에서 20시간 동안 가열하였다. LC/MS는 신규한 피크로의 완전한 전환을 나타내었다. 이것을 부분들로 분할하고, 후속 단계에 직접 사용하였다. LC/MS 체류시간 (방법 B): tR = 1.52분.
파트 B: (S)-1-((2-(디플루오로메틸)-6-(6-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 118에 사전에 기재된 바와 같이 제조하여 (S)-1-((2-(디플루오로메틸)-6-(6-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (5.3 mg, 2 단계에 대해서 16%)을 무색 고체로서 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.97 (d, J=4.5 Hz, 1H), 8.19 (dd, J=9.3, 5.5 Hz, 1H), 7.85 (dd, J=10.4, 2.9 Hz, 1H), 7.73 (d, J=8.5 Hz, 1H), 7.59 - 7.43 (m, 3H), 7.09 - 6.72 (t, J=54.0 Hz, 1H), 4.01 - 3.84 (m, 2H), 1.91 - 1.78 (m, 1H), 1.61 - 1.49 (m, 2H), 1.31 (s, 3H), 1.03 (app t, J=7.0 Hz, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 404.0 [(M+H)+, 계산치 C22H25F3N3O, 404.2]; LC/MS 체류시간 (방법 B): tR = 1.81분.
실시예 128
(S)-1-((2-(디플루오로메틸)-6-(7-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 118에 사전에 기재된 바와 같이 제조하여 (S)-1-((2-(디플루오로메틸)-6-(7-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (11.1 mg, 2 단계에 대해서 35%)을 무색 고체로서 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.98 (d, J=4.5 Hz, 1H), 8.21 (dd, J=9.3, 6.0 Hz, 1H), 7.81 (dd, J=9.9, 2.6 Hz, 1H), 7.72 (d, J=8.5 Hz, 1H), 7.50 (d, J=8.8 Hz, 1H), 7.45 (d, J=4.5 Hz, 1H), 7.35 (ddd, J=9.3, 8.0, 2.8 Hz, 1H), 6.98 (t, J=55.0 Hz, 1H), 3.98 (s, 2H), 1.85 (tt, J=12.7, 6.4 Hz, 1H), 1.68 - 1.56 (m, 2H), 1.36 (s, 3H), 1.03 (d, J=6.8 Hz, 3H), 1.01 (d, J=6.8 Hz, 3H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 404.0 [(M+H)+, 계산치 C22H25F3N3O, 404.2]; LC/MS 체류시간 (방법 B): tR = 1.68분.
실시예 129
(S)-1-((2-(디플루오로메틸)-6-(5,7-디플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 118에 사전에 기재된 바와 같이 제조하여 (S)-1-((2-(디플루오로메틸)-6-(5,7-디플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (25.9 mg, 2 단계에 대해서 75%)을 무색 고체로서 수득하였다. 1H NMR (600 MHz, DMSO-d6) δ 9.13 - 9.02 (m, 1H), 7.93 - 7.73 (m, 3H), 7.56 (dt, J = 23.8, 6.1 Hz, 2H), 7.38 - 7.09 (m, 1H), 3.95 (d, J = 22.2 Hz, 2H), 1.84 (dt, J = 18.4, 6.3 Hz, 1H), 1.45 (dtd, J = 23.9, 14.0, 11.7, 5.4 Hz, 2H), 1.27 - 1.14 (m, 3H), 0.96 (ddd, J = 23.9, 13.5, 6.6 Hz, 6H); LCMS (ESI) m/e 421.9 [(M+H)+, 계산치 C22H24F4N3O, 422.2]; LC/MS 체류시간 (방법 B): tR = 1.82분.
실시예 130
(S)-1-((4-(디플루오로메틸)-6-(5,7-디플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: 5,7-디플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)퀴놀린
실시예 127에 사전에 기재된 바와 같이 제조하였다. 5,7-디플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)퀴놀린을 수득하였으며, 이를 부분들로 분할하고, 후속 단계에 직접 사용하였다. LC/MS 체류시간 (방법 A): tR = 1.93분.
파트 B: (S)-1-((4-(디플루오로메틸)-6-(5,7-디플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 121에 사전에 기재된 바와 같이 제조하여 (S)-1-((4-(디플루오로메틸)-6-(5,7-디플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (14.7 mg, 2 단계에 대해서 49%)을 무색 고체로서 수득하였다. 1H NMR (600 MHz, DMSO-d6) δ 9.04 (d, J = 4.7 Hz, 1H), 8.62 (d, J = 5.7 Hz, 1H), 7.80 (d, J = 9.6 Hz, 1H), 7.75 (d, J = 6.5 Hz, 1H), 7.56 (qd, J = 8.5, 7.9, 4.9 Hz, 2H), 7.36 (t, J = 53.9 Hz, 1H), 4.01 (s, 2H), 1.82 (q, J = 6.5 Hz, 1H), 1.43 (qd, J = 14.0, 5.9 Hz, 2H), 1.16 (s, 3H), 0.94 (dd, J = 14.6, 6.7 Hz, 6H); 19F NMR (376 MHz, DMSO-d6) δ -102.43 (d, J = 9.6 Hz), -107.91 (d, J = 9.0 Hz), -116.03 - -119.87 (m); LCMS (ESI) m/e 422.0 [(M+H)+, 계산치 C22H24F4N3O, 422.2]; LC/MS 체류시간 (방법 B): tR = 1.88분.
실시예 131
(S)-1-((4-(디플루오로메틸)-6-(7-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: 7-플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)퀴놀린
실시예 127에 사전에 기재된 바와 같이 제조하였다. 7-플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)퀴놀린을 수득하였으며, 이를 후속 단계에 직접 사용하였다. LC/MS 체류시간 (방법 A): tR = 1.19분.
파트 B: (S)-1-((4-(디플루오로메틸)-6-(7-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 121에 사전에 기재된 바와 같이 제조하여 (S)-1-((4-(디플루오로메틸)-6-(7-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (11.1 mg, 2 단계에 대해서 39%)을 무색 고체로서 수득하였다. 1H NMR (600 MHz, DMSO-d6) δ 9.02 (d, J = 4.3 Hz, 1H), 8.77 (s, 1H), 8.30 (ddd, J = 9.0, 6.3, 2.4 Hz, 1H), 7.90 (s, 1H), 7.86 (dd, J = 10.2, 2.7 Hz, 1H), 7.67 (d, J = 4.3 Hz, 1H), 7.58 (td, J = 8.8, 2.7 Hz, 1H), 7.37 (t, J = 53.9 Hz, 1H), 4.05 (s, 2H), 1.83 (p, J = 6.5 Hz, 1H), 1.43 (qd, J = 14.0, 5.4 Hz, 2H), 1.16 (s, 3H), 0.95 (ddd, J = 13.9, 6.8, 2.1 Hz, 6H); 19F NMR (376 MHz, DMSO-d6) δ -110.25, -115.90 - -119.14 (m); LCMS (ESI) m/e 404.0 [(M+H)+, 계산치 C22H25F3N3O, 404.2]; LC/MS 체류시간 (방법 B): tR = 1.78분.
실시예 132
(S)-1-((4-(디플루오로메틸)-6-(6-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-1-((4-(디플루오로메틸)-6-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
5 mL 바이알에 디옥산 (2.4 mL) 중 (S)-1-((6-브로모-4-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (82.5 mg, 0.245 mmol), 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란) (74.6 mg, 0.294 mmol), 및 아세트산칼륨 (72.0 mg, 0.734 mmol)을 질소 버블링과 함께 첨가하여 무색 현탁액을 수득하였다. PdCl2(dppf) (5.37 mg, 7.34 μmol)를 질소 하에 첨가하였다. 바이알을 밀봉하고, 혼합물을 80℃에서 20시간 동안 가열하였다. LCMS는 주로 출발 물질 (암적색 혼합물)을 나타내었다. 온도를 100℃로 상승시켰다. 4시간 후, LCMS는 약간 더 우수한 전환율을 나타내었다. 반응물을 100℃에서 추가로 16시간 동안 계속하였다. LCMS는 보다 우수한 전환율을 나타내었으나, 일부 출발 물질이 여전히 존재하였다. 온도를 110℃로 올리고, 반응을 5시간 동안 계속하였다. LCMS는 단지 약간의 출발 물질이 존재함을 나타내었다. 반응물을 110℃에서 추가로 5시간 동안 계속하였다. 냉각시킨 후, 반응 혼합물을 부분들로 분할하고, 후속 단계에 직접 사용하였다.
파트 B: (S)-1-((4-(디플루오로메틸)-6-(6-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 121에 사전에 기재된 바와 같이 제조하여 (S)-1-((4-(디플루오로메틸)-6-(6-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (1.6 mg, 2 단계에 대해서 5%)을 무색 고체로서 수득하였다. 1H NMR (600 MHz, DMSO-d6) δ 8.99 (d, J = 4.4 Hz, 1H), 8.80 (s, 1H), 8.20 (dd, J = 9.3, 5.6 Hz, 1H), 8.01 (dd, J = 11.0, 2.9 Hz, 1H), 7.94 (s, 1H), 7.79 - 7.70 (m, 2H), 7.40 (t, J = 53.9 Hz, 1H), 4.09 (s, 2H), 1.84 (dt, J = 12.8, 6.5 Hz, 1H), 1.46 (qd, J = 14.0, 5.6 Hz, 2H), 1.19 (s, 3H), 0.97 (d, J = 6.6 Hz, 3H), 0.94 (d, J = 6.6 Hz, 3H); 19F NMR (376 MHz, DMSO-d6) δ -112.45, -118.42 (dd, J = 134.0, 57.0 Hz); LCMS (ESI) m/e 404.0 [(M+H)+, 계산치 C22H25F3N3O, 404.2]; LC/MS 체류시간 (방법 B): tR = 1.79분.
실시예 133
((S)-1-((4-(디플루오로메틸)-6-(6-(트리플루오로메틸)퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 132에 사전에 기재된 바와 같이 제조하여 ((S)-1-((4-(디플루오로메틸)-6-(6-(트리플루오로메틸)퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (2.1 mg, 2 단계에 대해서 6%)을 무색 고체로서 수득하였다. 1H NMR (600 MHz, DMSO-d6) δ 9.17 (d, J = 4.4 Hz, 1H), 8.85 (s, 1H), 8.75 (s, 1H), 8.34 (d, J = 8.8 Hz, 1H), 8.08 (dd, J = 8.8, 2.1 Hz, 1H), 8.02 (s, 1H), 7.88 (d, J = 4.3 Hz, 1H), 7.43 (t, J = 53.9 Hz, 1H), 4.13 (d, J = 3.0 Hz, 2H), 1.84 (p, J = 6.2 Hz, 1H), 1.57 - 1.41 (m, 2H), 1.21 (s, 3H), 0.97 (d, J = 6.6 Hz, 3H), 0.94 (d, J = 6.5 Hz, 3H); LCMS (ESI) m/e 454.0 [(M+H)+, 계산치 C23H25F5N3O, 454.2]; LC/MS 체류시간 (방법 B): tR = 2.02분.
실시예 134
(S)-1-((4-(디플루오로메틸)-6-(6-(트리플루오로메톡시)퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 132에 사전에 기재된 바와 같이 제조하여 (S)-1-((4-(디플루오로메틸)-6-(6-(트리플루오로메톡시)퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (1.5 mg, 2 단계에 대해서 4%)을 무색 고체로서 수득하였다. 1H NMR (600 MHz, DMSO-d6) δ 9.07 (d, J = 4.4 Hz, 1H), 8.80 (s, 1H), 8.29 (s, 1H), 8.27 (d, J = 9.2 Hz, 1H), 7.97 (s, 1H), 7.83 (dd, J = 8.7, 3.2 Hz, 2H), 7.38 (t, J = 53.9 Hz, 1H), 4.06 (s, 2H), 1.84 (dt, J = 12.7, 6.3 Hz, 1H), 1.42 (qd, J = 14.0, 5.6 Hz, 2H), 1.16 (s, 3H), 0.96 (d, J = 6.5 Hz, 3H), 0.94 (d, J = 6.6 Hz, 3H); LCMS (ESI) m/e 470.0 [(M+H)+, 계산치 C23H25F5N3O2, 470.2]; LC/MS 체류시간 (방법 B): tR = 2.00분.
실시예 135
(S)-1-((2-클로로-6-(5,7-디플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((2-클로로-6-(5,7-디플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
실시예 66에 사전에 기재된 바와 같이 제조하였다. 중간체를 실시예 66 및 실시예 130에 기재된 바와 같이 하여 (S)-tert-부틸 (1-((2-클로로-6-(5,7-디플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (12.1 mg, 34%)를 무색 고체로서 수득하였다. 1H NMR (400 MHz, 클로로포름-d) δ 8.97 (d, J = 4.4 Hz, 1H), 7.68 (ddd, J = 9.5, 2.6, 1.5 Hz, 1H), 7.42 - 7.32 (m, 3H), 7.05 (ddd, J = 11.5, 8.8, 2.6 Hz, 1H), 4.64 (s, 1H), 4.37 (d, J = 8.9 Hz, 1H), 4.18 (d, J = 8.9 Hz, 1H), 1.96 (dd, J = 13.9, 6.4 Hz, 1H), 1.87 (ddd, J = 13.1, 6.5, 4.9 Hz, 1H), 1.58 (dd, J = 13.9, 4.9 Hz, 1H), 1.47 (s, 3H), 1.42 (s, 9H), 1.04 (s, 3H), 1.02 (s, 3H);19F NMR (376 MHz, 클로로포름-d) δ -102.47, -107.56.; LCMS (ESI) m/e 506.0 [(M+H)+, 계산치 C26H31ClF2N3O3, 506.2]; LC/MS 체류시간 (방법 B): tR = 2.36분.
파트 B: (S)-1-((2-클로로-6-(5,7-디플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 7, 파트 B에 사전에 기재된 바와 같이 제조하여 (S)-1-((2-클로로-6-(5,7-디플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (10.6 mg, 100%)을 무색 고체로서 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.97 (d, J=4.3 Hz, 1H), 7.77 - 7.62 (m, 1H), 7.40 (d, J=4.3 Hz, 1H), 7.38 - 7.34 (m, 1H), 7.33 - 7.28 (m, 1H), 7.05 (ddd, J=11.6, 8.8, 2.6 Hz, 1H), 3.93 - 3.84 (m, 2H), 1.92 - 1.73 (m, 1H), 1.66 - 1.50 (m, 2H), 1.32 (s, 3H), 1.04 (d, J=6.8 Hz, 3H), 1.02 (d, J=6.5 Hz, 3H), 2개의 교환가능한 양성자는 관찰되지 않음; 19F NMR (376 MHz, DMSO-d6) δ -101.38 - -103.03 (m), -105.03 - -107.99 (m); LCMS (ESI) m/e 405.9 [(M+H)+, 계산치 C21H23ClF2N3O, 406.1]; LC/MS 체류시간 (방법 B): tR = 1.84분.
실시예 136
(S)-1-((2-클로로-6-(7-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((2-클로로-6-(7-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
실시예 66에 사전에 기재된 바와 같이 제조하였다. 중간체를 실시예 66 및 실시예 131에 기재된 바와 같이 하여 (S)-tert-부틸 (1-((2-클로로-6-(7-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (12.4 mg, 36%)를 무색 고체로서 수득하였다. 1H NMR (400 MHz, 클로로포름-d) δ 8.98 (d, J = 4.5 Hz, 1H), 8.24 (dd, J = 9.4, 6.1 Hz, 1H), 7.81 (dd, J = 9.9, 2.6 Hz, 1H), 7.53 (d, J = 8.2 Hz, 1H), 7.49 - 7.43 (m, 2H), 7.37 (ddd, J = 9.3, 8.0, 2.7 Hz, 1H), 4.64 (s, 1H), 4.41 (d, J = 9.0 Hz, 1H), 4.21 (d, J = 9.0 Hz, 1H), 2.01 - 1.82 (m, 2H), 1.58 (dd, J = 13.9, 5.0 Hz, 1H), 1.48 (s, 3H), 1.42 (s, 9H), 1.05 (s, 3H), 1.03 (s, 3H);19F NMR (376 MHz, 클로로포름-d) δ -109.85; LCMS (ESI) m/e 488.0 [(M+H)+, 계산치 C26H32ClFN3O3, 488.2]; LC/MS 체류시간 (방법 B): tR = 2.28분.
파트 B: (S)-1-((2-클로로-6-(7-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 7, 파트 B에 사전에 기재된 바와 같이 제조하여 (S)-1-((2-클로로-6-(7-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (11.1 mg, 100%)을 무색 고체로서 수득하였다. 1H NMR (600 MHz, DMSO-d6) δ 9.01 (d, J = 4.4 Hz, 1H), 8.32 (dd, J = 9.4, 6.1 Hz, 1H), 7.88 - 7.77 (m, 3H), 7.63 (d, J = 4.2 Hz, 1H), 7.60 (td, J = 8.8, 2.7 Hz, 1H), 3.98 - 3.89 (m, 2H), 1.85 (dq, J = 12.8, 6.4 Hz, 1H), 1.50 - 1.40 (m, 2H), 1.18 (s, 3H), 0.95 (dd, J = 7.5, 5.4 Hz, 6H); 19F NMR (376 MHz, DMSO-d6) δ -110.18; LCMS (ESI) m/e 388.0 [(M+H)+, 계산치 C21H24ClFN3O, 388.2]; LC/MS 체류시간 (방법 B): tR = 1.76분.
실시예 137
(S)-1-((6-(7-플루오로퀴놀린-4-일)-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-1-((6-브로모-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
20 mL 압력 병에 테트라히드로푸란 (2.2 mL) 중 (S)-2-아미노-2,4-디메틸펜탄-1-올 (214.8 mg, 1.637 mmol)을 첨가하여 무색 용액을 수득하였다. 포타슘 tert-부톡시드 (2.128 mL, 2.128 mmol) (THF 중 1.0 M)를 질소 하에 적가하였다. 5분 후, 6-브로모-3-플루오로-2-메틸피리딘 (311 mg, 1.637 mmol)을 1 부분으로 첨가하였다. 병을 밀봉하고, 혼합물을 80℃에서 20시간 동안 교반하였다. 혼합물을 물과 EtOAc 사이에 분배하였다. 층을 분리하였다. 수성 층을 EtOAc로 추출하였다. 합한 유기 용액을 염수로 세척하고, 건조시키고, 황갈색 오일로 농축시켰다. 이것을 실리카 겔 크로마토그래피 CH2Cl2 중 10% MeOH (2N NH3) 이하에 의해 정제하여 (S)-1-((6-브로모-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (220 mg, 1개의 미지의 불순물-Br에서 치환된 듯함-을 포함한 45%)을 수득하였다. LCMS (ESI) m/e 283.9 [(M-NH2)+, 계산치 C13H19BrNO, 284.1]; LC/MS 체류시간 (방법 B): tR = 1.70분 (불순물: 1.81분).
파트 B: (S)-2,4-디메틸-1-((2-메틸-6-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-3-일)옥시)펜탄-2-아민
5 mL 바이알에 디옥산 (2.8 mL) 중 (S)-1-((6-브로모-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (89.5 mg, 0.267 mmol), 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란) (81 mg, 0.321 mmol), 및 아세트산칼륨 (79 mg, 0.802 mmol)을 질소 버블링과 함께 첨가하여 무색 현탁액을 수득하였다. PdCl2(dppf) (5.87 mg, 8.02 μmol)를 질소 하에 첨가하였다. 바이알을 밀봉하고, 혼합물을 80℃에서 18시간 동안 가열하였다. LCMS는 출발 물질의 실질적인 양이 존재함을 나타내었다. 반응 혼합물을 100℃에서 4시간 동안 가열하였다. LCMS는 대부분의 출발 물질이 사라졌음을 나타내었다 (나머지 이전 반응으로부터의 부산물). 이것을 부분들로 분할하고, 후속 단계에 직접 사용하였다.
파트 C: (S)-1-((6-(7-플루오로퀴놀린-4-일)-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 132에 사전에 기재된 바와 같이 제조하여 무색 고체로서의 (S)-1-((6-(7-플루오로퀴놀린-4-일)-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (1.0 mg, 3%)을 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.99 (d, J = 4.5 Hz, 1H), 8.37 (dd, J = 9.3, 6.4 Hz, 1H), 7.84 (dd, J = 10.4, 2.7 Hz, 1H), 7.65 (d, J = 8.4 Hz, 1H), 7.62 - 7.54 (m, 3H), 3.98 (s, 2H), 2.57 (s, 3H), 1.90 - 1.80 (m, 1H), 1.61 (d, J = 5.3 Hz, 1H), 1.53 (dd, J = 14.0, 5.5 Hz, 1H), 1.30 (s, 3H), 0.98 (d, J = 6.6 Hz, 3H), 0.96 (d, J = 6.7 Hz, 3H). LCMS (ESI) m/e 368.2 [(M+H)+, 계산치 C22H27FN3O, 368.2]
실시예 138
(S)-1-((6-(6-플루오로퀴놀린-4-일)-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 137로부터의 중간체와 함께 실시예 132에 사전에 기재된 바와 같이 제조하여 (S)-1-((6-(6-플루오로퀴놀린-4-일)-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (1.5 mg, 3%, 분석용 HPLC에 의해 64% 순도)을 수득하였다: 1H NMR (500MHz, DMSO-d6) δ 8.96 (d, J=4.4 Hz, 1H), 8.17 (dd, J=9.4, 5.7 Hz, 1H), 8.07 (dd, J=10.8, 2.8 Hz, 1H), 7.78 - 7.51 (m, 5H), 6.70 (dd, J=8.8, 2.6 Hz, 1H), 3.93 - 3.77 (m, 2H), 2.55 (s, 3H), 1.87 - 1.72 (m, 1H), 1.58 - 1.30 (m, 2H), 1.15 (s, 3H), 1.00 - 0.83 (m, 6H) LCMS (ESI) m/e 368.2 [(M+H)+, 계산치 C22H27FN3O, 368.2].
실시예 139
(S)-1-((2-(디플루오로메틸)-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 127에 기재된 바와 같은 중간체 및 4-브로모-2-메틸피리미딘과 함께 실시예 127에 사전에 기재된 바와 같이 제조하여 (S)-1-((2-(디플루오로메틸)-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (15.9 mg, 45%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.82 (d, J = 5.2 Hz, 1H), 8.57 (d, J = 8.9 Hz, 1H), 8.07 (d, J = 5.3 Hz, 1H), 7.83 (d, J = 8.9 Hz, 1H), 7.26 (t, J = 53.6 Hz, 1H), 3.92 (s, 2H), 2.71 (s, 3H), 1.81 (dd, J = 12.9, 6.6 Hz, 1H), 1.47 - 1.36 (m, 2H), 1.15 (s, 3H), 0.93 (dd, J = 11.0, 6.8 Hz, 6H); LCMS (ESI) m/e 373.1 [(M+Na)+, 계산치 C18H24F2N4NaO, 373.2]; LC/MS 체류시간 (방법 B): tR = 1.73분.
실시예 140
(S)-1-((2-(디플루오로메틸)-6-(6-메틸피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 127에 기재된 바와 같은 중간체 및 4-브로모-6-메틸피리미딘과 함께 실시예 127에 사전에 기재된 바와 같이 제조하여 (S)-1-((2-(디플루오로메틸)-6-(6-메틸피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (3.5 mg, 6.8%)을 수득하였다: 1H NMR (400MHz, 클로로포름-d) δ 9.11 (d, J=1.3 Hz, 1H), 8.58 (d, J=8.8 Hz, 1H), 8.21 (s, 1H), 7.43 (d, J=8.8 Hz, 1H), 7.10 - 6.72 (t, J=53.0 Hz, 1H), 3.96 (s, 2H), 2.63 (s, 3H), 1.88 - 1.75 (m, 1H), 1.66 - 1.52 (m, 2H), 1.26 (s, 3H), 1.01 (d, J=6.5 Hz, 3H), 0.98 (d, J=6.8 Hz, 3H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 334.1 [(M-NH2)+, 계산치 C18H22F2N3O, 334.2]; LC/MS 체류시간 (방법 B): tR = 1.78분.
실시예 141
(S)-1-((4-(디플루오로메틸)-2'-에틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 120에 기재된 바와 같은 중간체 및 (2-에틸피리딘-4-일)보론산과 함께 실시예 117에 사전에 기재된 바와 같이 제조하여 (S)-1-((4-(디플루오로메틸)-2'-에틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (8.0 mg, 39%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.67 (s, 1H), 8.57 (d, J = 5.2 Hz, 1H), 8.20 (s, 1H), 7.93 (s, 1H), 7.85 (dd, J = 5.2, 1.6 Hz, 1H), 7.34 (t, J = 53.9 Hz, 1H), 4.01 (s, 2H), 2.84 (q, J = 7.6 Hz, 2H), 1.80 (dq, J = 12.5, 6.2 Hz, 1H), 1.47 - 1.35 (m, 2H), 1.28 (t, J = 7.6 Hz, 3H), 1.14 (s, 3H), 0.93 (dd, J = 12.6, 6.6 Hz, 6H); LCMS (ESI) m/e 364.2 [(M+H)+, 계산치 C20H28F2N3O, 364.2]; LC/MS 체류시간 (방법 B): tR = 1.54분.
실시예 142
(S)-1-((2'-클로로-4-(디플루오로메틸)-3'-플루오로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 120에 기재된 바와 같은 중간체 및 (2-클로로-3-플루오로-피리딘-4-일)보론산과 함께 실시예 117에 사전에 기재된 바와 같이 제조하여 (S)-1-((2'-클로로-4-(디플루오로메틸)-3'-플루오로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (10.8 mg, 13%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.76 (s, 1H), 8.38 (d, J = 5.0 Hz, 1H), 8.05 (s, 1H), 7.97 (t, J = 5.3 Hz, 1H), 7.37 (t, J = 53.9 Hz, 1H), 4.03 (s, 2H), 1.81 (dt, J = 12.8, 6.4 Hz, 1H), 1.45 - 1.35 (m, 2H), 1.14 (s, 3H), 0.93 (dd, J = 12.4, 6.7 Hz, 7H); LCMS (ESI) m/e 371.1 [(M-NH2)+, 계산치 C18H19ClF3N2O, 371.1]; LC/MS 체류시간 (방법 B): tR = 1.98분.
실시예 143
(S)-1-((2'-클로로-4-(디플루오로메틸)-5'-플루오로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 120에 기재된 바와 같은 중간체 및 (2-클로로-5-플루오로-피리딘-4-일)보론산과 함께 실시예 117에 사전에 기재된 바와 같이 제조하여 (S)-1-((2'-클로로-4-(디플루오로메틸)-5'-플루오로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (9.6 mg, 11%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.76 (s, 1H), 8.61 (d, J = 2.6 Hz, 1H), 8.05 (s, 1H), 8.02 (d, J = 5.5 Hz, 1H), 7.37 (t, J = 53.9 Hz, 1H), 4.04 (s, 2H), 1.81 (dt, J = 12.6, 6.4 Hz, 1H), 1.46 - 1.35 (m, 2H), 1.14 (s, 3H), 0.93 (dd, J = 12.8, 6.6 Hz, 6H); LCMS (ESI) m/e 371.1 [(M-NH2)+, 계산치 C18H19ClF3N2O, 371.1]; LC/MS 체류시간 (방법 B): tR = 1.97분.
실시예 144
(S)-2,4-디메틸-1-((2'-메틸-4-(트리플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)펜탄-2-아민
파트 A: (S)-1-((6-브로모-4-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
20 mL 압력 바이알에 테트라히드로푸란 (3.3 mL) 중 (S)-2-아미노-2,4-디메틸펜탄-1-올 (323 mg, 2.462 mmol) 및 2-브로모-5-플루오로-4-(트리플루오로메틸)피리딘 (601 mg, 2.462 mmol)을 첨가하여 황갈색 용액을 수득하였다. 포타슘 tert-부톡시드 (2.95 mL, 2.95 mmol) (THF 중 1.0 M)를 질소 하에 적가하였다. 실온에서 5분 교반 후, 바이알을 밀봉하고, 혼합물을 80℃에서 18시간 동안 교반하였다. 혼합물을 물과 EtOAc 사이에 분배하였다. 층을 분리하였다. 수성 층을 EtOAc로 추출하였다. 합한 유기 용액을 염수로 세척하고, 건조시키고, 황갈색 오일로 농축시켰다. 조 물질을 실리카 겔 크로마토그래피 10% MeOH/CH2Cl2 이하에 의해 정제하여 (S)-1-((6-브로모-4-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (0.42 g, 48%)을 황갈색 오일로서 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 8.19 (s, 1H), 7.64 (s, 1H), 3.95 - 3.86 (m, 2H), 1.80 (dt, J = 12.8, 6.4 Hz, 1H), 1.65 (s, 2H), 1.50 (dd, J = 5.7, 4.0 Hz, 2H), 1.25 (s, 3H), 0.99 (dd, J = 9.1, 6.6 Hz, 6H); 19F NMR (376 MHz, 클로로포름-d) δ -64.37; LCMS (ESI) m/e 338.0 [(M+H)+, 계산치 C13H16BrF3NO, 338.1]; LC/MS 체류시간 (방법 B): tR = 1.88분.
파트 B: (S)-2,4-디메틸-1-((2'-메틸-4-(트리플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)펜탄-2-아민
실시예 117에 기재된 바와 같이 제조하여 (S)-2,4-디메틸-1-((2'-메틸-4-(트리플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)펜탄-2-아민 (25.2 mg, 0.066 mmol, 61% 수율)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.79 (s, 1H), 8.55 (d, J = 5.2 Hz, 1H), 8.28 (s, 1H), 7.96 (s, 1H), 7.87 (d, J = 5.4 Hz, 1H), 4.05 (d, J = 5.5 Hz, 2H), 2.56 (s, 3H), 1.81 (dt, J = 12.6, 6.3 Hz, 1H), 1.45 - 1.33 (m, 2H), 1.12 (s, 3H), 0.92 (dd, J = 6.6, 3.0 Hz, 6H); LCMS (ESI) m/e 368.2 (M+H)+, 계산치 C19H25F3N3O, 368.2]; LC/MS 체류시간 (방법 B): tR = 1.48분.
실시예 145
(S)-2,4-디메틸-1-((6-(퀴놀린-4-일)-4-(트리플루오로메틸)피리딘-3-일)옥시)펜탄-2-아민
실시예 117에 기재된 바와 같이 제조하여 (S)-2,4-디메틸-1-((6-(퀴놀린-4-일)-4-(트리플루오로메틸)피리딘-3-일)옥시)펜탄-2-아민 (16.2 mg, 0.038 mmol, 58% 수율)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 9.01 (d, J = 4.6 Hz, 1H), 8.92 (s, 1H), 8.17 (d, J = 8.3 Hz, 1H), 8.13 (d, J = 8.5 Hz, 1H), 8.03 (s, 1H), 7.82 (t, J = 7.6 Hz, 1H), 7.70 (d, J = 4.4 Hz, 1H), 7.64 (t, J = 7.7 Hz, 1H), 4.20 (d, J = 3.9 Hz, 2H), 1.84 (d, J = 10.3 Hz, 1H), 1.50 (qd, J = 14.1, 5.5 Hz, 2H), 1.23 (s, 3H), 0.95 (t, J = 6.1 Hz, 6H); LCMS (ESI) m/e 404.2 (M+H)+, 계산치 C22H25F3N3O, 404.2]; LC/MS 체류시간 (방법 B): tR = 1.71분.
실시예 146
(S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4-(트리플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트
실시예 117에 기재된 바와 같이 제조하여 (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4-(트리플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트 (4.4 mg, 0.010 mmol, 18% 수율)를 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 10.31 (s, 1H), 8.82 (s, 1H), 8.55 (s, 1H), 8.37 (d, J = 5.5 Hz, 1H), 8.18 (s, 1H), 7.74 (d, J = 5.4 Hz, 1H), 4.12 - 3.99 (m, 2H), 3.71 (s, 3H - 용매 피크 하에 있음), 1.81 (dt, J = 13.2, 6.6 Hz, 1H), 1.39 (d, J = 5.6 Hz, 2H), 1.12 (s, 3H), 0.92 (dd, J = 6.6, 2.9 Hz, 6H); LCMS (ESI) m/e 449.2 (M+Na)+, 계산치 C20H25F3N4NaO3, 449.2]; LC/MS 체류시간 (방법 B): tR = 1.79분.
실시예 147
(S)-1-((2'-클로로-4-(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 120에 기재된 바와 같은 중간체 및 (2-클로로-피리딘-4-일)보론산과 함께 실시예 117에 사전에 기재된 바와 같이 제조하여 (S)-1-((2'-클로로-4-(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (13.5 mg, 53%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.69 (s, 1H), 8.51 (d, J = 5.2 Hz, 1H), 8.30 (s, 1H), 8.17 (s, 1H), 8.09 (d, J = 5.3 Hz, 1H), 7.33 (t, J = 53.8 Hz, 1H), 4.03 (s, 2H), 1.80 (p, J = 6.2 Hz, 1H), 1.41 (qd, J = 14.0, 5.5 Hz, 2H), 1.14 (s, 3H), 0.92 (dd, J = 13.2, 6.6 Hz, 6H); LCMS (ESI) m/e 370.1 [(M+H)+, 계산치 C18H23ClF2N3O, 370.1]; LC/MS 체류시간 (방법 B): tR = 1.91분.
실시예 148
(S)-1-((4-(디플루오로메틸)-5'-플루오로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
2 mL 바이알에 디옥산 (0.2 mL) 및 물 (0.1 mL) 중 (S)-1-((2'-클로로-4-(디플루오로메틸)-5'-플루오로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (실시예 168) (7.42 mg, 0.019 mmol), 2,4,6-트리메틸-1,3,5,2,4,6-트리옥사트리보리난 (2.402 mg, 0.019 mmol), 및 Cs2CO3 (9.35 mg, 0.029 mmol)을 첨가하여 질소 하에 무색 현탁액을 수득하였다 (5분 동안 탈기함). 1,1'-비스(디페닐포스피노)페로센팔라듐(II) 디클로라이드, 톨루엔 (0.787 mg, 0.957 μmol)을 질소 하에 첨가하였다. 바이알을 밀봉하고, 100℃에서 20시간 동안 가열하였다. 혼합물을 건조시키고, MeOH로 희석하고, 여과하고, 정제용 HPLC에 의해 정제하여 (S)-1-((4-(디플루오로메틸)-5'-플루오로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (1.8 mg, 26%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.73 (s, 1H), 8.54 (d, J = 2.9 Hz, 1H), 7.99 (s, 1H), 7.80 (d, J = 6.5 Hz, 1H), 7.38 (t, J = 53.9 Hz, 1H), 4.12 - 4.02 (m, 2H), 2.54 (s, 3H), 1.79 (dq, J = 12.6, 6.2 Hz, 1H), 1.44 (qd, J = 14.0, 5.6 Hz, 2H), 1.17 (s, 3H), 0.94 (d, J = 6.6 Hz, 3H), 0.91 (d, J = 6.6 Hz, 3H); LCMS (ESI) m/e 351.1 [(M-NH2)+, 계산치 C19H22F3N2O, 351.2]; LC/MS 체류시간 (방법 B): tR = 1.81분.
실시예 149
(S)-1-((4-(디플루오로메틸)-3'-플루오로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
출발 물질로서 실시예 142를 사용하여 실시예 148에 사전에 기재된 바와 같이 제조하여 (S)-1-((4-(디플루오로메틸)-3'-플루오로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (2.0 mg, 25%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.74 (s, 1H), 8.39 (d, J = 5.1 Hz, 1H), 8.01 (s, 1H), 7.77 (t, J = 5.5 Hz, 1H), 7.38 (t, J = 53.9 Hz, 1H), 4.06 (d, J = 3.0 Hz, 2H), 2.54 (d, J = 3.4 Hz, 3H), 1.86 - 1.76 (m, 1H), 1.50 - 1.37 (m, 2H), 1.17 (s, 3H), 0.95 (d, J = 6.6 Hz, 3H), 0.92 (d, J = 6.7 Hz, 3H); LCMS (ESI) m/e 351.1 [(M-NH2)+, 계산치 C19H22F3N2O, 351.2]; LC/MS 체류시간 (방법 B): tR = 1.78분.
실시예 150
(S)-1-((4-(디플루오로메틸)-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 132에 사전에 기재된 바와 같이 제조하여 (S)-1-((4-(디플루오로메틸)-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (0.8 mg, 2 단계에 대해서 2.3%)을 무색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.83 (d, J = 5.2 Hz, 1H), 8.71 (s, 1H), 8.53 (s, 1H), 8.10 (d, J = 5.2 Hz, 1H), 7.41 (s, 1H), 4.08 (d, J = 2.2 Hz, 2H), 2.72 (s, 3H), 1.81 (dt, J = 12.9, 6.5 Hz, 1H), 1.44 (qd, J = 14.0, 5.5 Hz, 2H), 1.17 (s, 3H), 0.95 (d, J = 6.6 Hz, 3H), 0.92 (d, J = 6.7 Hz, 3H); LCMS (ESI) m/e 334.1 [(M-NH2)+, 계산치 C18H22F2N3O, 334.2]; LC/MS 체류시간 (방법 B): tR = 1.83분.
실시예 152
(S)-1-(2-(디플루오로메틸)-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
4-브로모-2-메틸피리미딘을 사용하여 실시예 116에 사전에 기재된 바와 같이 제조하여 (S)-1-(2-(디플루오로메틸)-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민 (32.2 mg, 2 단계에 대해서 56%)을 무색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.72 (d, J = 5.4 Hz, 1H), 8.38 (d, J = 2.2 Hz, 1H), 8.35 (dd, J = 8.8, 2.3 Hz, 1H), 7.89 (d, J = 5.4 Hz, 1H), 7.43 - 7.16 (m, 2H), 3.87 (s, 2H), 2.68 (s, 3H), 1.80 (dp, J = 12.8, 6.3 Hz, 1H), 1.48 - 1.35 (m, 2H), 1.14 (s, 3H), 0.93 (d, J = 6.6 Hz, 3H), 0.91 (d, J = 6.7 Hz, 3H); LCMS (ESI) m/e 333.2 [(M-NH2)+, 계산치 C19H23F2N2O, 333.2]; LC/MS 체류시간 (방법 B): tR = 1.85분.
실시예 153
(S)-5-((2-아미노-2,4-디메틸펜틸)옥시)-3'-플루오로-6-메틸-[2,4'-비피리딘]-2'-아민
파트 A: 6-아이오도-2-메틸피리딘-3-올
500 mL 둥근 바닥 플라스크에 물 (100 mL) 중 2-메틸피리딘-3-올 (4.0 g, 36.7 mmol) 및 Na2CO3 (7.8 g, 73.6 mmol)을 첨가하여 약간 황갈색 용액/현탁액을 수득하였다. I2 (9.6 g, 37.8 mmol)를 1 부분으로 첨가하였다. 혼합물을 실온에서 3시간 동안 교반하였다. 주목할만한 I2가 남아있었다. 혼합물을 밤새 교반하고, 여전히 I2가 남아있었다. 반응 혼합물을 42℃ (조 온도)에서 5시간 동안 가열하였다 (대부분의 I2가 사라짐). 반응물을 1N HCl (150 mL)을 사용하여 pH~5로 천천히 중화시켰다. 침전물을 여과에 의해 수집하고, 물, 수성 중아황산나트륨 용액으로 헹구고, 진공 하에 건조시켜 황색빛 회색분말 (7 g)을 수득하였다. 고체를 실리카 겔 크로마토그래피 30% EtOAc/헥산 이하에 의해 정제하여 6-아이오도-2-메틸피리딘-3-올 (4.58 g, 53%)을 담황색 고체로서 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 7.42 (dd, J = 8.3, 0.7 Hz, 1H), 6.81 (d, J = 8.3 Hz, 1H), 2.48 (s, 3H); LCMS (ESI) m/e 235.8 [(M+H)+, 계산치 C6H7INO, 236.0]; LC/MS 체류시간 (방법 B): tR = 1.14분.
파트 B: (S)-tert-부틸 (1-((6-아이오도-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2 일)카르바메이트
실시예 32에 사전에 기재된 바와 같이 제조하여 황갈색 오일로서의 (S)-tert-부틸 (1-((6-아이오도-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2 일)카르바메이트 (528 mg, 100%)를 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 7.46 (d, J = 8.4 Hz, 1H), 6.83 (d, J = 8.4 Hz, 1H), 4.53 (s, 1H), 4.14 (d, J = 8.9 Hz, 1H), 3.96 (d, J = 8.9 Hz, 1H), 2.46 (s, 3H), 1.83 (tdt, J = 13.2, 11.6, 6.5 Hz, 2H), 1.53 (d, J = 4.7 Hz, 1H), 1.40 (s, 9H), 1.39 (s, 3H), 1.00 (d, J = 3.0 Hz, 3H), 0.98 (d, J = 3.0 Hz, 3H); LCMS (ESI) m/e 448.9 [(M+H)+, 계산치 C18H30IN2O3, 449.1]; LC/MS 체류시간 (방법 B): tR = 2.38분.
파트 C: (S)-tert-부틸 (1-((2'-클로로-3'-플루오로-6-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
실시예 66에 사전에 기재된 바와 같이 제조하여 (S)-tert-부틸 (1-((2'-클로로-3'-플루오로-6-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (18.9 mg, 17%)를 수득하였다: LCMS (ESI) m/e 452.2 [(M+H)+, 계산치 C23H32ClFN3O3, 452.2]; LC/MS 체류시간 (방법 B): tR = 2.46분.
파트 D: (S)-tert-부틸 (1-((2'-아미노-3'-플루오로-6-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
20 mL 압력 바이알에 1,4-디옥산 (0.4 mL) 중 (S)-tert-부틸 (1-((2'-클로로-3'-플루오로-6-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (18.9 mg, 0.042 mmol), 및 메틸 카르바메이트 (4.39 mg, 0.059 mmol)를 첨가하여 무색 용액을 수득하였다. 탈기시키면서, PdOAc2 (0.939 mg, 4.18 μmol), XANTPHOS (4.84 mg, 8.36 μmol), Cs2CO3 (20.44 mg, 0.063 mmol)을 첨가하였다. 바이알을 질소 하에 밀봉하고 90℃에서 20시간 동안 가열하였다. LCMS는 부분 전환을 나타내었지만, 카르바메이트가 완전히 가수분해됨을 나타내었다. 혼합물을 EtOAc로 희석하고, 건조시키고, 여과하고, 농축시켰다. 잔류물 (출발 물질 클로라이드 및 가수분해된 아민 생성물의 혼합물을 함유)을 직접 후속 단계에 사용하였다. 아민: LCMS (ESI) m/e 433.3 (M+H)+, 계산치 C23H34FN4O3, 433.3]; LC/MS 체류시간 (방법 B): tR = 1.99분; 클로라이드: LCMS (ESI) m/e 452.1 [(M+H)+, 계산치 C23H32ClFN3O3, 452.2]; LC/MS 체류시간 (방법 B): tR = 2.48분.
파트 E: (S)-5-((2-아미노-2,4-디메틸펜틸)옥시)-3'-플루오로-6-메틸-[2,4'-비피리딘]-2'-아민
실시예 7, 파트 B에 사전에 기재된 바와 같이 제조하여 아민 및 클로라이드의 혼합물을 수득하였다. 혼합물을 정제용 HPLC에 의해 정제하여 (S)-5-((2-아미노-2,4-디메틸펜틸)옥시)-3'-플루오로-6-메틸-[2,4'-비피리딘]-2'-아민 (4.3 mg, 2 단계에 대해서 31%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 7.79 (d, J = 5.3 Hz, 1H), 7.69 (d, J = 8.5 Hz, 1H), 7.45 (d, J = 8.5 Hz, 1H), 7.02 (t, J = 5.2 Hz, 1H), 6.22 (s, 2H), 3.86 (s, 2H), 2.50 (s, 3H), 1.81 (dq, J = 12.8, 6.5 Hz, 1H), 1.56 - 1.42 (m, 2H), 1.21 (s, 3H), 0.94 (dd, J = 10.3, 6.7 Hz, 6H); LCMS (ESI) m/e 333.2 [(M+H)+, 계산치 C18H26FN4O, 333.2]; LC/MS 체류시간 (방법 B): tR = 1.48분.
실시예 154
(S)-1-((2'-클로로-3'-플루오로-6-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((2'-아미노-3'-플루오로-6-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
실시예 153, 파트 D로부터의 아민을 갖는 혼합물을 수득하였다. LCMS (ESI) m/e 452.1 [(M+H)+, 계산치 C23H32ClFN3O3, 452.2]; LC/MS 체류시간 (방법 B): tR = 2.48분.
파트 B: (S)-1-((2'-클로로-3'-플루오로-6-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 153, 파트 D로부터의 조 혼합물을 실시예 7, 파트 B에 사전에 기재된 바와 같이 탈보호하여 아민 및 클로라이드의 혼합물을 수득하였다. 혼합물을 분리하고, 정제용 HPLC에 의해 정제하여 (S)-1-((2'-클로로-3'-플루오로-6-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민: (2 단계 동안 2.6 mg, 17%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.33 (d, J = 5.0 Hz, 1H), 7.99 (t, J = 5.3 Hz, 1H), 7.82 (d, J = 8.3 Hz, 1H), 7.49 (d, J = 8.6 Hz, 1H), 3.83 (s, 2H), 2.51 (s, 3H - DMSO 피크 하에 OCH3 양성자 - 예측 이동 = 2.47 ppm), 1.82 (p, J = 6.2 Hz, 1H), 1.53 - 1.38 (m, 2H), 1.18 (s, 3H), 0.94 (t, J = 7.2 Hz, 6H); LCMS (ESI) m/e 335.1 [(M-NH2)+, 계산치 C18H21ClFN2O, 335.1]; LC/MS 체류시간 (방법 B): tR = 1.91분.
실시예 155
(S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-5'-플루오로-6-메틸-[2,4'-비피리딘]-2'-일)카르바메이트
파트 A: (S)-tert-부틸 (1-((2'-클로로-5'-플루오로-6-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
실시예 153으로부터의 중간체 및 (2-클로로-5-플루오로-피리딘-4일)보론산과 함께 실시예 66에 사전에 기재된 바와 같이 제조하여 (S)-tert-부틸 (1-((2'-클로로-5'-플루오로-6-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (13.4 mg, 13%)를 수득하였다: LCMS (ESI) m/e 452.1 [(M+H)+, 계산치 C23H32ClFN3O3, 452.2]; LC/MS 체류시간 (방법 B): tR = 2.49분.
파트 B: (S)-메틸 (5-((2-Boc-아미노-2,4-디메틸펜틸)옥시)-5'-플루오로-6-메틸-[2,4'-비피리딘]-2'-일)카르바메이트
실시예 153에 사전에 기재된 바와 같이 제조하여 나머지 출발 물질 ((S)-tert-부틸 (1-((2'-클로로-5'-플루오로-6-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트)로 오염된 (S)-메틸 (5-((2-Boc-아미노-2,4-디메틸펜틸)옥시)-5'-플루오로-6-메틸-[2,4'-비피리딘]-2'-일)카르바메이트 (카르바메이트 가수분해는 관찰되지 않음)를 수득하였다. 조 혼합물을 추가 정제 없이 사용하였다. 카르바메이트: LCMS (ESI) m/e 491.2 (M+H)+, 계산치 C25H36FN4O5, 491.3]; LC/MS 체류시간 (방법 B): tR = 2.30분.
파트 C: (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-5'-플루오로-6-메틸-[2,4'-비피리딘]-2'-일)카르바메이트
실시예 7, 파트 B에 사전에 기재된 바와 같이 제조하였다. 조 혼합물을 분리하고, 정제용 HPLC에 의해 정제하여 (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-5'-플루오로-6-메틸-[2,4'-비피리딘]-2'-일)카르바메이트 (0.3 mg, 2 단계에 대해서 2.5%)를 무색 고체로서 수득하였다. 1H NMR (400 MHz, 메탄올-d4) δ 8.45 (d, J = 5.9 Hz, 1H), 8.21 (d, J = 2.7 Hz, 1H), 7.79 - 7.73 (m, 1H), 7.46 (d, J = 8.6 Hz, 1H), 4.07 - 3.96 (m, 2H), 3.80 (s, 3H), 2.61 (s, 3H), 1.87 (dt, J = 12.5, 6.4 Hz, 1H), 1.73 (dd, J = 14.3, 5.6 Hz, 1H), 1.62 (dd, J = 14.2, 5.5 Hz, 1H), 1.39 (s, 3H), 1.04 (dd, J = 10.9, 6.6 Hz, 6H); LCMS (ESI) m/e 391.4 [(M+H)+, 계산치 C20H28FN4O3, 391.2].
실시예 156
(S)-1-((2'-클로로-5'-플루오로-6-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
파트 C: (S)-1-((2'-클로로-5'-플루오로-6-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 155, 파트 C에서의 혼합물로부터 회수하였다. 혼합물을 분리하고, 정제용 HPLC에 의해 정제하여 (S)-1-((2'-클로로-5'-플루오로-6-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (5.2 mg, 2 단계에 대해서 49%)을 무색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 8.54 (d, J = 2.6 Hz, 1H), 8.03 (d, J = 5.5 Hz, 1H), 7.83 (d, J = 8.4 Hz, 1H), 7.48 (d, J = 8.6 Hz, 1H), 3.81 (s, 2H), 2.51 (s, 3H - DMSO 피크 하에 OCH3 양성자 - 예측된 이동 = 2.47 ppm), 1.81 (dq, J = 12.6, 6.5 Hz, 1H), 1.49 - 1.36 (m, 2H), 1.16 (s, 3H), 0.93 (t, J = 6.3 Hz, 6H); LCMS (ESI) m/e 335.1 [(M-NH2)+, 계산치 C18H21ClFN2O, 335.1]; LC/MS 체류시간 (방법 B): tR = 1.93분.
실시예 157
(S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-3'-플루오로-6-메틸-[2,4'-비피리딘]-2'-일)카르바메이트
파트 A: (S)-메틸 (5-((2-Boc-아미노-2,4-디메틸펜틸)옥시)-3'-플루오로-6-메틸-[2,4'-비피리딘]-2'-일)카르바메이트
80℃에서 30시간 동안 반응을 실행하고, 실시예 153에 기재된 바와 같이 제조하여 정제용 HPLC 정제 후 카르바메이트가 생성되었다 (7.1 mg, 19%): LCMS (ESI) m/e 491.4 (M+H)+, 계산치 C25H36FN4O5, 491.3]; LC/MS 체류시간 (방법 A): tR = 1.99분.
파트 B: (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-3'-플루오로-6-메틸-[2,4'-비피리딘]-2'-일)카르바메이트
실시예 7, 파트 B에 사전에 기재된 바와 같이 제조하여 (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-3'-플루오로-6-메틸-[2,4'-비피리딘]-2'-일)카르바메이트 (5.2 mg, 90%)를 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.25 (d, J = 5.1 Hz, 1H), 7.79 (t, J = 5.2 Hz, 1H), 7.74 (d, J = 8.4 Hz, 1H), 7.46 (d, J = 8.7 Hz, 1H), 3.80 (s, 2H), 3.68 (s, 3H), 2.50 (s, 3H), 1.81 (dt, J = 12.5, 6.5 Hz, 1H), 1.48 - 1.38 (m, 2H), 1.15 (s, 3H), 0.93 (t, J = 6.3 Hz, 6H); LCMS (ESI) m/e 413.1 [(M+Na)+, 계산치 C20H27FN4NaO3, 413.2]; LC/MS 체류시간 (방법 B): tR = 1.66분.
실시예 158
(S)-1-((2'-클로로-6-(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 117에 기재된 바와 같이 (2-클로로피리딘-4-일)보론산을 사용하여 제조하여 (S)-1-((2'-클로로-6-(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (26.3 mg, 0.068 mmol, 49%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.52 (d, J = 5.2 Hz, 1H), 8.37 (d, J = 8.8 Hz, 1H), 8.13 (s, 1H), 8.07 (d, J = 5.2 Hz, 1H), 7.81 (d, J = 8.8 Hz, 1H), 7.27 (t, J = 53.6 Hz, 1H), 3.94 (s, 2H), 1.79 (dt, J = 12.6, 6.4 Hz, 1H), 1.43 (qd, J = 14.1, 5.6 Hz, 2H), 1.16 (s, 3H), 0.92 (dd, J = 12.8, 6.6 Hz, 6H); LCMS (ESI) m/e 370.1 [(M+H)+, 계산치 C19H26F2N3O, 370.1]; LC/MS 체류시간 (방법 B): tR = 1.91분.
실시예 159
(S)-1-((2'-클로로-6-(디플루오로메틸)-3'-플루오로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 117에 기재된 바와 같이 (2-클로로-3-플루오로피리딘-4-일)보론산을 사용하여 제조하여 (S)-1-((2'-클로로-6-(디플루오로메틸)-3'-플루오로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (25 mg, 0.064 mmol, 9.6%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.38 (dd, J = 5.3, 2.4 Hz, 1H), 8.12 (d, J = 8.9 Hz, 1H), 7.96 (td, J = 5.3, 2.2 Hz, 1H), 7.83 (d, J = 8.8 Hz, 1H), 7.25 (t, J = 53.5 Hz, 1H), 3.91 (d, J = 2.0 Hz, 2H), 1.86 - 1.75 (m, 1H), 1.40 (t, J = 6.2 Hz, 2H), 1.14 (d, J = 2.2 Hz, 3H), 0.92 (ddd, J = 9.7, 6.8, 2.3 Hz, 6H); LCMS (ESI) m/e 388.1 [(M+H)+, 계산치 C18H22ClF3N3O, 388.1]; LC/MS 체류시간 (방법 B): tR = 1.94분.
실시예 160
(S)-1-((6-(디플루오로메틸)-3'-플루오로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 148에 기재된 바와 같이 제조하여 (S)-1-((6-(디플루오로메틸)-3'-플루오로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (12.8 mg, 0.033 mmol, 55%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.39 (d, J = 5.0 Hz, 1H), 8.07 (d, J = 8.8 Hz, 1H), 7.80 (d, J = 8.9 Hz, 1H), 7.75 (t, J = 5.5 Hz, 1H), 7.24 (t, J = 53.5 Hz, 1H), 3.92 (s, 2H), 2.54 (d, J = 3.3 Hz, 3H), 1.80 (dt, J = 12.6, 6.3 Hz, 1H), 1.50 - 1.36 (m, 2H), 1.15 (s, 3H), 0.92 (dd, J = 11.5, 6.6 Hz, 6H); LCMS (ESI) m/e 368.2 [(M+H)+, 계산치 C19H25F3N3O, 368.2]; LC/MS 체류시간 (방법 B): tR = 1.72분.
실시예 161
((S)-1-((6-클로로-2'-(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((6-클로로-2'-(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
실시예 66에 기재된 바와 같은 중간체 아이오다이드 및 실시예 123에 기재된 바와 같은 (2-(디플루오로메틸)피리딘-4-일)보론산 (농축 건조시키고 그대로 사용함)을 사용하여 실시예 66에 사전에 기재된 바와 같이 제조하여 (S)-tert-부틸 (1-((6-클로로-2'-(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (70 mg, 19%)를 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 8.74 (d, J = 5.2 Hz, 1H), 8.18 (d, J = 1.7 Hz, 1H), 8.04 - 7.97 (m, 1H), 7.77 (d, J = 8.4 Hz, 1H), 7.38 (d, J = 8.5 Hz, 1H), 6.73 (t, J = 55.5 Hz, 1H), 4.59 (s, 1H), 4.38 (d, J = 8.9 Hz, 1H), 4.18 (d, J = 8.8 Hz, 1H), 1.99 - 1.81 (m, 2H), 1.57 - 1.52 (m, 1H), 1.46 (s, 3H), 1.40 (s, 9H), 1.03 (d, J = 6.6 Hz, 6H); 19F NMR (376 MHz, 클로로포름-d) δ -115.83; LCMS (ESI) m/e 470.2 (M+H)+, 계산치 C23H31ClF2N3O3, 470.2]; LC/MS 체류시간 (방법 A): tR = 2.50분.
파트 B: ((S)-1-((6-클로로-2'-(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 7에 사전에 기재된 바와 같이 제조하여 ((S)-1-((6-클로로-2'-(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (40.6 mg, 74%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.77 (d, J = 5.1 Hz, 1H), 8.22 (d, J = 8.1 Hz, 2H), 8.13 (d, J = 5.2 Hz, 1H), 7.72 (d, J = 8.4 Hz, 1H), 7.01 (t, J = 55.0 Hz, 1H), 3.92 (s, 2H), 1.79 (dt, J = 12.5, 6.6 Hz, 1H), 1.44 (qd, J = 14.1, 5.5 Hz, 2H), 1.16 (s, 3H), 0.91 (t, J = 6.2 Hz, 6H); 19F NMR (376 MHz, DMSO-d6) δ -115.46 (d, J = 55.0 Hz); LCMS (ESI) m/e 392.1 [(M+Na)+, 계산치 C18H22ClF2N3NaO, 392.1]; LC/MS 체류시간 (방법 B): tR = 1.94분.
실시예 162
(S)-1-((4-(디플루오로메틸)-6-(6-메틸피리다진-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
3-메틸-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리다진을 사용하여 실시예 117에 기재된 바와 같이 제조하여 (S)-1-((4-(디플루오로메틸)-6-(6-메틸피리다진-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (23.6 mg, 0.066 mmol, 48%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 9.72 (d, J = 2.1 Hz, 1H), 8.72 (s, 1H), 8.34 (s, 1H), 8.19 (d, J = 2.0 Hz, 1H), 7.35 (t, J = 54.0 Hz, 1H), 4.04 (s, 2H), 2.71 (s, 3H), 1.85 - 1.74 (m, 1H), 1.42 (qd, J = 13.7, 5.3 Hz, 2H), 1.15 (s, 3H), 0.92 (dd, J = 13.3, 6.7 Hz, 6H); LCMS (ESI) m/e 373.2 [(M+Na)+, 계산치 C18H24F2N4NaO, 373.2]; LC/MS 체류시간 (방법 B): tR = 1.59분.
실시예 163
(S)-1-((2-(디플루오로메틸)-6-(6-메틸피리다진-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
3-메틸-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리다진을 사용하여 실시예 117에 기재된 바와 같이 제조하여 (S)-1-((2-(디플루오로메틸)-6-(6-메틸피리다진-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (37.2 mg, 0.105 mmol, 85%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 9.71 (d, J = 2.1 Hz, 1H), 8.40 (d, J = 8.8 Hz, 1H), 8.13 (d, J = 2.1 Hz, 1H), 7.84 (d, J = 8.9 Hz, 1H), 7.24 (t, J = 53.6 Hz, 1H), 3.91 (s, 2H), 2.71 (s, 3H), 1.80 (dt, J = 13.2, 6.3 Hz, 1H), 1.46 - 1.34 (m, 2H), 1.13 (s, 3H), 0.92 (dd, J = 10.5, 6.6 Hz, 6H); LCMS (ESI) m/e 373.2 [(M+Na)+, 계산치 C18H24F2N4NaO, 373.2]; LC/MS 체류시간 (방법 B): tR = 1.62분.
실시예 164
(R)-2,4-디메틸-1-((2'-메틸-4-(트리플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)펜탄-2-아민
파트 A: (R)-1-((6-브로모-4-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
아미노 알콜의 R-거울상이성질체를 사용하여 실시예 144에 기재된 바와 같이 제조하여 (R)-1-((6-브로모-4-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (0.58 g, 97%)을 황갈색 오일로서 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 8.19 (s, 1H), 7.64 (s, 1H), 3.97 - 3.83 (m, 2H), 1.85 - 1.73 (m, 1H), 1.49 (dd, J = 5.7, 4.0 Hz, 2H), 1.24 (s, 3H), 0.99 (dd, J = 9.3, 6.6 Hz, 6H); 19F NMR (376 MHz, 클로로포름-d) δ -64.39; LCMS (ESI) m/e 338.0 [(M+H)+, 계산치 C13H16BrF3NO, 338.1]; LC/MS 체류시간 (방법 B): tR = 1.87분.
파트 B: (R)-2,4-디메틸-1-((2'-메틸-4-(트리플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)펜탄-2-아민
실시예 144에 기재된 바와 같이 제조하여 (R)-2,4-디메틸-1-((2'-메틸-4-(트리플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)펜탄-2-아민 (7.6 mg, 0.020 mmol, 23% 수율)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.79 (s, 1H), 8.55 (d, J = 5.2 Hz, 1H), 8.29 (s, 1H), 7.97 (s, 1H), 7.88 (d, J = 5.2 Hz, 1H), 4.11 - 4.02 (m, 2H), 2.56 (s, 3H), 1.81 (dt, J = 12.9, 6.5 Hz, 1H), 1.40 (dd, J = 5.6, 2.8 Hz, 2H), 1.13 (s, 3H), 0.92 (dd, J = 6.6, 3.2 Hz, 6H); LCMS (ESI) m/e 368.2 (M+H)+, 계산치 C19H25F3N3O, 368.2]; LC/MS 체류시간 (방법 B): tR = 1.44분.
실시예 165
(R)-2,4-디메틸-1-((6-(퀴놀린-4-일)-4-(트리플루오로메틸)피리딘-3-일)옥시)펜탄-2-아민
실시예 145에 기재된 바와 같이 제조하여 (R)-2,4-디메틸-1-((6-(퀴놀린-4-일)-4-(트리플루오로메틸)피리딘-3-일)옥시)펜탄-2-아민 (14.9 mg, 0.037 mmol, 45% 수율)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 9.01 (d, J = 4.4 Hz, 1H), 8.90 (s, 1H), 8.18 (d, J = 8.5 Hz, 1H), 8.13 (d, J = 8.5 Hz, 1H), 8.02 (s, 1H), 7.82 (t, J = 7.6 Hz, 1H), 7.70 (d, J = 4.4 Hz, 1H), 7.64 (t, J = 7.7 Hz, 1H), 4.15 - 4.05 (m, 2H), 1.83 (dq, J = 12.6, 6.3 Hz, 1H), 1.42 (dd, J = 5.7, 2.0 Hz, 2H), 1.16 (s, 3H), 0.95 (dd, J = 6.6, 3.5 Hz, 6H); LCMS (ESI) m/e 404.2 (M+H)+, 계산치 C22H25F3N3O, 404.2]; LC/MS 체류시간 (방법 B): tR = 1.66분.
실시예 166
(R)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4-(트리플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트
실시예 144에 기재된 바와 같이 제조하여 (R)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4-(트리플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트 (7.8 mg, 0.018 mmol, 35% 수율)를 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.81 (s, 1H), 8.54 (s, 1H), 8.37 (d, J = 5.2 Hz, 1H), 8.18 (s, 1H), 7.74 (dd, J = 5.3, 1.6 Hz, 1H), 4.10 - 4.00 (m, 2H), 3.71 (s, 3H), 1.81 (hept, J = 6.1 Hz, 1H), 1.41 - 1.34 (m, 2H), 1.12 (s, 3H), 0.92 (dd, J = 6.8, 2.7 Hz, 6H); LCMS (ESI) m/e 449.1 (M+Na)+, 계산치 C20H25F3N4NaO3, 449.2]; LC/MS 체류시간 (방법 B): tR = 1.72분.
실시예 167
(R)-1-((2'-클로로-4-(디플루오로메틸)-3'-플루오로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (R)-1-((6-브로모-4-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
아미노 알콜의 R-거울상이성질체를 사용하여 실시예 142에 사전에 기재된 바와 같이 제조하여 (R)-1-((6-브로모-4-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (740 mg, 95%)을 수득하였다: LCMS (ESI) m/e 336.9 [(M+H)+, 계산치 C13H20BrF2N2O, 337.1]; LC/MS 체류시간 (방법 B): tR = 1.83분. 물질을 그대로 사용하였다.
상기 기재된 바와 같은 중간체 및 (2-클로로-3-플루오로-피리딘-4-일)보론산을 사용하여 실시예 142에 사전에 기재된 바와 같이 제조하였다 (6.7 mg, 11%): 1H NMR (500 MHz, DMSO-d6) δ 8.76 (s, 1H), 8.38 (d, J = 5.0 Hz, 1H), 8.06 (s, 1H), 7.97 (t, J = 5.4 Hz, 1H), 7.38 (t, J = 53.9 Hz, 1H), 4.05 (s, 2H), 1.81 (dt, J = 12.9, 6.4 Hz, 1H), 1.42 (tt, J = 14.1, 6.8 Hz, 2H), 1.15 (d, J = 3.5 Hz, 3H), 0.94 (d, J = 6.6 Hz, 3H), 0.91 (d, J = 6.6 Hz, 3H); LCMS (ESI) m/e 371.1 [(M-NH2)+, 계산치 C18H19ClF3N2O, 371.1]; LC/MS 체류시간 (방법 B): tR = 2.02분.
실시예 168
(R)-1-((2'-클로로-4-(디플루오로메틸)-5'-플루오로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 167에 기재된 바와 같은 중간체 및 (2-클로로-5-플루오로-피리딘-4-일)보론산을 사용하여 실시예 142에 사전에 기재된 바와 같이 제조하여 (R)-1-((2'-클로로-4-(디플루오로메틸)-5'-플루오로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (14 mg, 20%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.75 (s, 1H), 8.60 (d, J = 2.3 Hz, 1H), 8.05 (s, 1H), 8.02 (d, J = 5.5 Hz, 1H), 7.36 (t, J = 53.9 Hz, 1H), 4.04 (s, 2H), 1.81 (hept, J = 6.4 Hz, 1H), 1.48 - 1.35 (m, 2H), 1.14 (d, J = 3.3 Hz, 3H), 0.93 (dd, J = 12.6, 6.6 Hz, 6H); LCMS (ESI) m/e 371.1 [(M-NH2)+, 계산치 C18H19ClF3N2O, 371.1]; LC/MS 체류시간 (방법 B): tR = 1.98분.
실시예 169
(R)-1-((2'-클로로-4-(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 167에 기재된 바와 같은 중간체 및 (2-클로로-피리딘-4-일)보론산을 사용하여 실시예 142에 사전에 기재된 바와 같이 제조하여 (R)-1-((2'-클로로-4-(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (10.2 mg, 49%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.70 (s, 1H), 8.51 (d, J = 5.3 Hz, 1H), 8.31 (s, 1H), 8.18 (s, 1H), 8.11 (d, J = 5.3 Hz, 1H), 7.33 (t, J = 53.9 Hz, 1H), 4.02 (s, 2H), 1.80 (q, J = 6.3 Hz, 1H), 1.40 (tt, J = 14.0, 7.4 Hz, 2H), 1.14 (s, 3H), 0.93 (dd, J = 12.5, 6.6 Hz, 6H); LCMS (ESI) m/e 353.1 [(M-NH2)+, 계산치 C18H20ClF2N2O, 353.1]; LC/MS 체류시간 (방법 B): tR = 1.90분.
실시예 170
(R)-1-((4-(디플루오로메틸)-2'-에틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 167에 기재된 바와 같은 중간체 및 (2-에틸피리딘-4-일)보론산을 사용하여 실시예 141에 사전에 기재된 바와 같이 제조하여 (R)-1-((4-(디플루오로메틸)-2'-에틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (12.3 mg, 60%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.68 (s, 1H), 8.57 (d, J = 5.3 Hz, 1H), 8.20 (s, 1H), 7.94 (s, 1H), 7.88 - 7.84 (m, 1H), 7.35 (t, J = 53.9 Hz, 1H), 4.02 (s, 2H), 2.84 (q, J = 7.6 Hz, 2H), 1.81 (dt, J = 12.7, 6.5 Hz, 1H), 1.42 (qd, J = 14.0, 5.5 Hz, 2H), 1.29 (t, J = 7.6 Hz, 3H), 1.15 (s, 3H), 0.93 (dd, J = 13.5, 6.6 Hz, 6H); LCMS (ESI) m/e 364.2 [(M+H)+, 계산치 C20H28F2N3O, 364.2]; LC/MS 체류시간 (방법 B): tR = 1.48분.
실시예 171
(R)-1-((4-(디플루오로메틸)-5'-플루오로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
출발 물질로서 실시예 168을 사용하여 실시예 148에 사전에 기재된 바와 같이 제조하여 (R)-1-((4-(디플루오로메틸)-5'-플루오로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (1.2 mg, 10%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.74 (s, 1H), 8.55 (d, J = 2.9 Hz, 1H), 7.99 (s, 1H), 7.81 (d, J = 6.5 Hz, 1H), 7.40 (t, J = 53.8 Hz, 1H), 4.15 - 4.05 (m, 2H), 2.54 (s, 3H), 1.81 (dt, J = 12.8, 6.3 Hz, 1H), 1.54 - 1.39 (m, 2H), 1.19 (s, 3H), 0.95 (d, J = 6.6 Hz, 3H), 0.92 (d, J = 6.6 Hz, 3H); LCMS (ESI) m/e 351.1 [(M-NH2)+, 계산치 C19H22F3N2O, 351.2]; LC/MS 체류시간 (방법 B): tR = 1.80분.
실시예 172
(R)-1-((4-(디플루오로메틸)-3'-플루오로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
출발 물질로서 실시예 167을 사용하여 실시예 148에 사전에 기재된 바와 같이 제조하여 (R)-1-((4-(디플루오로메틸)-3'-플루오로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (1.1 mg, 24%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.76 (s, 1H), 8.40 (d, J = 5.0 Hz, 1H), 8.02 (s, 1H), 7.77 (t, J = 5.5 Hz, 1H), 7.43 (t, J = 53.9 Hz, 1H), 4.13 (q, J = 9.5 Hz, 2H), 2.54 (d, J = 3.3 Hz, 3H), 1.81 (dt, J = 12.9, 6.4 Hz, 1H), 1.57 - 1.41 (m, 2H), 1.22 (s, 3H), 0.95 (d, J = 6.6 Hz, 3H), 0.92 (d, J = 6.6 Hz, 3H); LCMS (ESI) m/e 351.1 [(M-NH2)+, 계산치 C19H22F3N2O, 351.2]; LC/MS 체류시간 (방법 B): tR = 1.79분.
실시예 173
(R)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-6-메틸-[2,4'-비피리딘]-2'-일)카르바메이트
아미노 알콜의 R-거울상이성질체를 사용하여 실시예 64에 사전에 기재된 바와 같이 제조하여 (R)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-6-메틸-[2,4'-비피리딘]-2'-일)카르바메이트 (26 mg, 0.050 mmol, 26%)를 연황색 필름으로서 수득하였다. 1H NMR (400MHz, MeOH-d4) δ 8.36 (d, J=6.5 Hz, 1H), 8.24 (d, J=1.3 Hz, 1H), 8.05 (m, 2H), 7.58 (d, J=8.5 Hz, 1H), 4.25 (m, 2H), 3.94 (s, 3H), 3.38 (s, 2 H), 2.66 (s, 3H), 1.95-1.85 (m, 2H), 1.81-1.71 (m, 1H), 1.55 (s, 3H), 1.09 (d, J=6.5 Hz, 3H), 1.04 (d, J=6.4 Hz, 3H); LCMS (ESI) m/e 373.4 (M+H)+, 계산치 C20H29N4O3, 373.2]; LC/MS 체류시간 (방법 D): tR = 1.81분.
실시예 174
(R)-1-((2',6-비스(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
아미노 알콜의 R-거울상이성질체를 사용하여 실시예 123에 사전에 기재된 바와 같이 제조하여 (R)-1-((2',6-비스(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (6.6 mg, 0.017 mmol, 15%)을 필름으로서 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.79 (d, J=5.1 Hz, 1H), 8.40 (d, J=8.8 Hz, 1H), 8.33 (s, 1H), 8.22 (d, J=5.1 Hz, 1H), 7.82 (d, J=8.8 Hz, 1H), 7.25 (t, J=53.5 Hz, 1H), 7.05 (t, J=54.9 Hz, 1H), 3.91 (s, 2H), 3.36 (m 2H), 1.81(m, 1H), 1.40 (m, 2H), 1.13 (s, 3H) 0.94 (d, J=6.5 Hz, 3H), 0.92 (d, J=6.4 Hz, 3H); LCMS (ESI) m/e 386.4 (M+H)+, 계산치 C19H24F4N3O, 386.2]; LC/MS 체류시간 (방법 D): tR = 2.62분.
실시예 175
(R)-1-((2',4-비스(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
아미노 알콜의 R-거울상이성질체를 사용하여 실시예 124에 사전에 기재된 바와 같이 제조하여 (R)-1-((2',4-비스(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (9.3 mg, 0.024 mmol, 21%)을 필름으로서 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.79 (d, J=5.1 Hz, 1H), 8.71 (s, 1H), 8.37 (s, 1H), 8.32 (s, 1H), 8.25 (d, J=4.8 Hz, 1H), 7.33 (t, J=53.5 Hz, 1H), 7.04 (t, J=54.9 Hz, 1H), 4.01 (s, 2H), 3.32 (m, 2H), 1.81(m, 1H), 1.40 (m, 2H), 1.13 (s, 3H) 0.94 (d, J=6.5 Hz, 3H), 0.92 (d, J=6.4 Hz, 3H); LCMS (ESI) m/e 386.4 (M+H)+, 계산치 C19H24F4N3O, 386.2]; LC/MS 체류시간 (방법 D): tR = 2.66분.
실시예 176
(S)-1-((4-(디플루오로메틸)-6-(퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-올
파트 A: (S)-2,4-디메틸펜탄-1,2-디올
500 mL 둥근 바닥 플라스크에 BuOH (13 mL) 및 물 (13 mL) 중 AD-MIX-ALPHA (3.60 g, 2.60 mmol)를 첨가하여 격렬한 교반 하에 황색 용액을 수득하였다. 생성된 혼합물을 실온에서 30분 동안 교반한 다음, 0℃로 냉각시켰다. 침전물이 나타났고, 2,4-디메틸펜트-1-엔 (0.364 mL, 2.60 mmol)을 1 부분으로 첨가하였다. 생성된 혼합물을 0℃에서 6시간 동안 격렬히 교반하고, 아황산나트륨 3.86 g (30.6 mmol)을 첨가하였다. 혼합물을 실온으로 가온되도록 하고, 30분 동안 교반하였다. 이어서, CH2Cl2 (40 mL) 및 물 (80 mL)을 연속적으로 첨가하고, 층을 분리하였다. 수성 층을 CH2Cl2로 2회 추출하였다. 합한 유기 상을 건조시키고, 여과하고, 농축시켜 (S)-2,4-디메틸펜탄-1,2-디올 (308 mg, 90%)을 무색 오일로서 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 3.52 - 3.38 (m, 2H), 1.85 - 1.79 (m, 1H), 1.42 (dd, J = 6.0, 2.0 Hz, 2H), 1.22 (s, 3H), 0.99 (dd, J = 11.7, 6.6 Hz, 6H).
참조: S. J. Leiris et al. Bioorg. Med. Chem. 2010, 18, 3481-3493.
파트 B: (S)-1-((6-브로모-4-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-올
20 mL 압력 병에 테트라히드로푸란 (1.3 mL) 중 (S)-2,4-디메틸펜탄-1,2-디올 (125 mg, 0.946 mmol) 및 2-브로모-4-(디플루오로메틸)-5-플루오로피리딘 (214 mg, 0.946 mmol)을 첨가하여 황갈색 용액을 수득하였다. 포타슘 tert-부톡시드 (1.229 mL, 1.229 mmol) (THF 중 1.0 M)를 질소 하에 적가하였다. 실온에서 5분 교반 후, 병을 밀봉하고, 혼합물을 80℃에서 18시간 동안 교반하였다. 혼합물을 물과 EtOAc 사이에 분배하였다. 층을 분리하였다. 수성 층을 EtOAc로 추출하였다. 합한 유기 용액을 염수로 세척하고, 건조시키고, 농축시켜 (S)-1-((6-브로모-4-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-올 (300 mg, 94%)을 황갈색 오일로서 수득하였다. 물질을 그대로 사용하였다. LCMS (ESI) m/e 338.0 [(M+H)+, 계산치 C13H19BrF2NO2, 338.0]; LC/MS 체류시간 (방법 B): tR = 2.30분.
파트 C: (S)-1-((4-(디플루오로메틸)-6-(퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-올
실시예 117에 사전에 기재된 바와 같이 제조하여 (S)-1-((4-(디플루오로메틸)-6-(퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-올 (3.6 mg, 14%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 9.00 (d, J = 4.4 Hz, 1H), 8.80 (s, 1H), 8.18 (d, J = 8.4 Hz, 1H), 8.13 (d, J = 8.4 Hz, 1H), 7.87 (s, 1H), 7.82 (t, J = 7.7 Hz, 1H), 7.69 - 7.61 (m, 2H), 7.35 (s, 1H), 4.09 (q, J = 9.2 Hz, 2H), 1.86 (dt, J = 12.7, 6.5 Hz, 1H), 1.50 (d, J = 5.9 Hz, 2H), 1.27 (s, 3H), 0.96 (d, J = 6.5 Hz, 6H); LCMS (ESI) m/e 387.1 [(M+H)+, 계산치 C22H25F2N2O2, 387.2]; LC/MS 체류시간 (방법 B): tR = 2.06분.
실시예 177
(S)-메틸 (4-(디플루오로메틸)-5-((2-히드록시-2,4-디메틸펜틸)옥시)-[2,4'-비피리딘]-2'-일)카르바메이트
실시예 176으로부터의 중간체를 사용하여 실시예 117에 사전에 기재된 바와 같이 제조하였다 (1.8 mg, 6.5%): 1H NMR (500 MHz, DMSO-d6) δ 8.71 (s, 1H), 8.53 (s, 1H), 8.36 (d, J = 5.4 Hz, 1H), 8.07 (s, 1H), 7.77 - 7.67 (m, 1H), 7.31 (s, 1H), 4.05 (q, J = 9.3 Hz, 2H), 3.71 (s, 3H), 1.83 (dt, J = 12.6, 6.3 Hz, 1H), 1.47 (d, J = 5.9 Hz, 2H), 1.24 (s, 3H), 0.94 (d, J = 6.6 Hz, 6H); LCMS (ESI) m/e 410.1 [(M+H)+, 계산치 C20H26F2N3O4, 410.2]; LC/MS 체류시간 (방법 B): tR = 2.07분.
실시예 178
(S)-1-((4-(디플루오로메틸)-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-올
실시예 176으로부터의 중간체를 사용하여 실시예 117에 사전에 기재된 바와 같이 제조하여 (S)-1-((4-(디플루오로메틸)-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-올 (2.2 mg, 7.2%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.69 (s, 1H), 8.54 (d, J = 5.3 Hz, 1H), 8.17 (s, 1H), 7.94 (s, 1H), 7.84 (d, J = 5.7 Hz, 1H), 7.30 (t, J = 54.1 Hz, 1H), 4.04 (q, J = 9.2 Hz, 2H), 2.56 (s, 3H), 1.83 (dt, J = 12.8, 6.4 Hz, 1H), 1.46 (d, J = 5.9 Hz, 2H), 1.24 (s, 3H), 0.94 (dd, J = 6.7, 1.6 Hz, 6H); LCMS (ESI) m/e 351.1 [(M+H)+, 계산치 C19H25F2N2O2, 351.2]; LC/MS 체류시간 (방법 B): tR = 1.91분.
실시예 179
(S)-메틸 (5-((2-아미노-2-(플루오로메틸)-4-메틸펜틸)옥시)-6-(디플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트
파트 A: (E/Z)-2-((벤질옥시)이미노)-3-플루오로프로판산
250 mL 둥근 바닥 플라스크에 에탄올 (36 mL) 중 O-벤질히드록실아민 (1.5338 g, 12.45 mmol) 및 소듐 3-플루오로-2-옥소프로파노에이트 (1.595 g, 12.45 mmol)를 첨가하여 백색 현탁액을 수득하였다. 혼합물을 80℃에서 15시간 동안 가열하였다. 에탄올을 스트리핑하였다. 회백색 고체를 EtOAc 및 15 mL 1N HCl 중에 용해시켰다. 층을 분리하였다. 수성 층을 EtOAc로 3회 추출하였다. 합한 유기 용액을 건조시키고, 농축시켜 (E/Z)-2-((벤질옥시)이미노)-3-플루오로프로판산 (2.51 g, 96%)을 황갈색 고체로서 수득하였다. LCMS는 아마 E/Z 이성질체 (약 ¼ 비율)를 나타내었을 것이다. 물질을 그대로 사용하였다.
파트 B: 2-((벤질옥시)아미노)-2-(플루오로메틸)-4-메틸펜트-4-엔산
250 mL 둥근 바닥 플라스크에 THF (10.00 mL) 및 수성 NH4Cl (50 mL) 중 (E/Z)-2-((벤질옥시)이미노)-3-플루오로프로판산 (2.32 g, 10.99 mmol) 및 3-브로모-2-메틸프로펜 (4.43 mL, 43.9 mmol)을 첨가하여 황갈색 용액을 수득하였다. 아연 (3.59 g, 54.9 mmol)을 조금씩 첨가하였다. 혼합물을 실온에서 30분 동안 교반하였다. 혼합물을 물 및 EtOAc로 희석하였다. 층을 분리하였다. 수성 층을 EtOAc로 2회 추출하였다. 합한 유기 층을 염수로 세척하고, 건조시키고, 고밀도 반고체로 농축시켰다. 제1 실리카 겔 크로마토그래피 최대 50% EtOAc/헥산은 목적 생성물을 정제하지 않았고, 제2 실리카 겔 크로마토그래피 10% MeOH/CH2Cl2 (Rf~0.3)이하로 백색 고체로서의 2-((벤질옥시)아미노)-2-(플루오로메틸)-4-메틸펜트-4-엔산 (2.33 g, 76%)을 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 7.44 - 7.31 (m, 5H), 6.94 (s, 1H), 4.98 (p, J = 1.6 Hz, 1H), 4.88 (d, J = 2.3 Hz, 1H), 4.87 - 4.61 (m, 4H), 2.40 (d, J = 1.2 Hz, 2H), 1.77 (s, 3H); 19F NMR (376 MHz, 클로로포름-d) δ -233.34; LCMS (ESI) m/e 290.1 [(M+Na)+, 계산치 C14H18FNNaO3, 290.1]; LC/MS 체류시간 (방법 B): tR = 2.04분.
라세미 화합물 (2 g)을 키랄 초임계 유체 크로마토그래피 (칼럼: 키랄팩 AD-H, 30 x 250mm, 5μm); 이동상: 10% EtOH / 90% CO2에 의해 분리하여 2종의 거울상이성질체를 수득하였다.
분석 초임계 유체 크로마토그래피 조건: 칼럼: 키랄팩 AD-H,4.6 x 250mm, 5μm; BPR 압력: 100 bar; 온도: 35℃; 유량: 2.0 mL/분; 이동상: 20% EtOH / 80% CO2; 검출기 파장: UV 205 nm.
거울상이성질체 1 (0.9 g, 90% 회수율, e.e.% > 99.9%, αD = +7.87° (CHCl3, 3.05 mg/ml)): (S)-벤질 4-메틸-4-(2-메틸알릴)-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 HPLC 체류시간 = 3.00분.
거울상이성질체 2 (0.9 g, 90% 회수율, e.e.% = 92.6%, αD = -9.20° (CHCl3, 3.15 mg/ml)): (R)-벤질 4-메틸-4-(2-메틸알릴)-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 HPLC 체류시간 = 3.52분.
절대 구조는 하기 유리 아미노 알콜과 데스-F 유사체와의 광학 회전의 비교를 기반으로 할당하였고, 최종 실시예의 생물학적 데이터에 의해 추가로 입증되었다 (다른 실시예에서도 볼 수 있는 바와 같이 S-거울상이성질체 (1)로부터 제조된 유사체는 R-거울상이성질체 (2)로부터 제조된 유사체보다 더 강력하였음).
파트 C: (S)-2-아미노-2-(플루오로메틸)-4-메틸펜탄산
1 L 둥근 바닥 플라스크에 MeOH (30 mL) 중 (S)-2-((벤질옥시)아미노)-2-(플루오로메틸)-4-메틸펜트-4-엔산 (0.89 g, 3.33 mmol)을 첨가하여 무색 용액을 수득하였다. Pd-C (0.709 g, 0.666 mmol)를 첨가하였다. 혼합물을 수소 (풍선) 하에 16시간 동안 교반하였다. LCMS는 출발 물질의 완전한 소멸을 나타내었다. 혼합물을 여과하고, MeOH로 헹구었다. 여과된 투명한 용액을 농축시켜 (S)-2-아미노-2-(플루오로메틸)-4-메틸펜탄산 (510 mg, 94%)을 백색 고체로서 수득하였다: 1H NMR (400 MHz, 메탄올-d4) δ 4.62 (ddd, J = 62.0, 47.4, 10.0 Hz, 2H), 1.94 - 1.66 (m, 3H), 1.01 (dd, J = 6.3, 3.9 Hz, 6H); 19F NMR (376 MHz, 메탄올-d4) δ -229.19; αD = +21.61° (MeOH, 2.85 mg/mL).
파트 D: (S)-2-아미노-2-(플루오로메틸)-4-메틸펜탄-1-올
250 mL 둥근 바닥 플라스크에 테트라히드로푸란 (15 mL) 중 (S)-2-아미노-2-(플루오로메틸)-4-메틸펜탄산 (496 mg, 3.04 mmol)을 첨가하여 질소 하에 무색 용액을 수득하였다. BH3.THF (12.16 mL, 12.16 mmol)를 질소 하에 첨가하였다. 혼합물을 실온에서 주말에 걸쳐 66시간 동안 교반하였다. TLC (10% MeOH/CH2Cl2, I2 스테인)는 기준선 위의 신규한 피크를 나타내었다. 반응물을 MeOH로 켄칭하였다. 휘발성 물질을 제거하였다. 잔류물을 30 mL 1N HCl로 처리하고, 50℃에서 1시간 동안 가열하였다. 냉각시킨 후, 이어서 혼합물을 40 mL 1N NaOH로 염기성화시키고, CH2Cl2로 3회 추출하였다. 합한 유기 용액을 건조시키고, 농축시켜 (S)-2-아미노-2-(플루오로메틸)-4-메틸펜탄-1-올 (377 mg, 83%)을 무색 오일로서 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 4.31 (dd, J = 47.7, 0.9 Hz, 2H), 3.53 (dd, J = 10.8, 1.3 Hz, 1H), 3.42 (dd, J = 10.8, 3.0 Hz, 1H), 1.79 (m, 4H), 1.44 - 1.32 (m, 2H), 1.00 (d, J = 1.8 Hz, 3H), 0.99 (d, J = 1.8 Hz, 3H); 19F NMR (376 MHz, 클로로포름-d) δ -227.90; αD = -1.00° (CHCl3, 2.40 mg/mL).
파트 E: (S)-1-((6-브로모-2-(디플루오로메틸)피리딘-3-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민
2 mL 압력 병에 테트라히드로푸란 (0.6 mL) 중 (S)-2-아미노-2-(플루오로메틸)-4-메틸펜탄-1-올 (65.7 mg, 0.440 mmol) 및 6-브로모-2-(디플루오로메틸)-3-플루오로피리딘 (100 mg, 0.440 mmol)을 첨가하여 무색 용액을 수득하였다. 포타슘 tert-부톡시드 (0.528 mL, 0.528 mmol) (THF 중 1.0 M)를 질소 하에 첨가하였다. 병을 밀봉하고, 혼합물을 70℃에서 16시간 동안 교반하였다. 혼합물을 물과 EtOAc 사이에 분배하였다. 층을 분리하였다. 수성 층을 EtOAc로 추출하였다. 합한 유기 용액을 염수로 세척하고, 건조시키고 농축시켜 황갈색 오일 (140 mg, 90%)을 수득하였다: 1H NMR (400 MHz, 클로로포름-d) δ 7.56 (dt, J = 8.7, 1.0 Hz, 1H), 7.26 (d, J = 8.8 Hz, 1H), 6.68 (t, J = 53.8 Hz, 1H), 4.50 - 4.25 (m, 2H), 3.93 (ddd, J = 32.5, 8.5, 1.8 Hz, 2H), 1.87 (dq, J = 12.7, 6.3 Hz, 1H), 1.52 - 1.44 (m, 2H), 1.03 (d, J = 6.7 Hz, 3H), 1.00 (d, J = 6.7 Hz, 3H); 19F NMR (376 MHz, 클로로포름-d) δ -117.34, -225.58; LCMS (ESI) m/e 355.1 [(M+H)+, 계산치 C13H19BrF3N2O, 355.1]; LC/MS 체류시간 (방법 B): tR = 1.69분.
파트 F. (S)-메틸 (5-((2-아미노-2-(플루오로메틸)-4-메틸펜틸)옥시)-6-(디플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트
80℃에서 5시간 동안 한 것을 제외하고, 실시예 117에 사전에 기재된 바와 같이 제조하여 표제 생성물 (9.7 mg, 36%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.50 (s, 1H), 8.36 (d, J = 5.2 Hz, 1H), 8.18 (d, J = 8.8 Hz, 1H), 7.83 (d, J = 8.8 Hz, 1H), 7.67 (d, J = 5.3 Hz, 1H), 7.23 (t, J = 53.5 Hz, 1H), 4.33 (dq, J = 47.8, 8.9 Hz, 2H), 4.07 - 3.92 (m, 2H), 3.71 (s, 3H), 1.89 (dd, J = 12.7, 6.5 Hz, 1H), 1.50 - 1.31 (m, 2H), 0.96 (d, J = 6.6 Hz, 3H), 0.93 (d, J = 6.6 Hz, 3H); LCMS (ESI) m/e 427.3 [(M+H)+, 계산치 C20H26F3N4O3, 427.2]; LC/MS 체류시간 (방법 B): tR = 1.66분.
실시예 180
(R)-메틸 (5-((2-아미노-2-(플루오로메틸)-4-메틸펜틸)옥시)-6-(디플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트
파트 A: (R)-2-아미노-2-(플루오로메틸)-4-메틸펜탄산
실시예 179, 파트 C에 사전에 기재된 바와 같이 제조하여 (R)-2-아미노-2-(플루오로메틸)-4-메틸펜탄산 (512 mg, 94%)을 백색 고체로서 수득하였다. 1H NMR (400 MHz, 메탄올-d4) δ 4.62 (ddd, J = 62.0, 47.4, 10.0 Hz, 2H), 1.94 - 1.66 (m, 3H), 1.01 (dd, J = 6.3, 3.9 Hz, 6H); 19F NMR (376 MHz, 메탄올-d4) δ -229.19; αD = -20.29° (MeOH, 2.70 mg/mL).
파트 B: (R)-2-아미노-2-(플루오로메틸)-4-메틸펜탄-1-올
실시예 179, 파트 D에 사전에 기재된 바와 같이 제조하여 (R)-2-아미노-2-(플루오로메틸)-4-메틸펜탄-1-올 (362 mg, 80%)을 무색 오일로서 수득하였다. 1H NMR (400 MHz, 메탄올-d4) δ 4.31 (d, J = 47.7 Hz, 2H), 3.53 (dd, J = 10.8, 1.3 Hz, 1H), 3.42 (dd, J = 10.8, 3.0 Hz, 1H), 1.79 (tt, J = 12.8, 6.4 Hz, 4H), 1.38 (td, J = 5.6, 1.8 Hz, 2H), 1.00 (d, J = 1.8 Hz, 3H), 0.99 (d, J = 1.9 Hz, 3H); 19F NMR (376 MHz, 클로로포름-d) δ -227.87; αD = +1.11° (CHCl3, 2.70 mg/mL).
파트 C: (R)-1-((6-브로모-2-(디플루오로메틸)피리딘-3-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민
실시예 179, 파트 E에 사전에 기재된 바와 같이 제조하여 (R)-1-((6-브로모-2-(디플루오로메틸)피리딘-3-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민 (145 mg, 96%)을 무색 오일로서 수득하였다. 1H NMR (400 MHz, 메탄올-d4) δ 7.56 (dt, J = 8.6, 1.0 Hz, 1H), 7.26 (d, J = 8.7 Hz, 1H), 6.69 (t, J = 53.8 Hz, 1H), 4.49 - 4.26 (m, 2H), 3.93 (ddd, J = 32.8, 8.6, 1.8 Hz, 2H), 1.88 (dp, J = 12.8, 6.4 Hz, 1H), 1.56 - 1.41 (m, 4H), 1.03 (d, J = 6.6 Hz, 3H), 1.00 (d, J = 6.6 Hz, 3H); 19F NMR (376 MHz, 클로로포름-d) δ -117.50, -225.55; LCMS (ESI) m/e 355.1 [(M+H)+, 계산치 C13H19BrF3N2O, 355.1]; LC/MS 체류시간 (방법 B): tR = 1.68분.
파트 D: (R)-메틸 (5-((2-아미노-2-(플루오로메틸)-4-메틸펜틸)옥시)-6-(디플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트
실시예 179에 사전에 기재된 바와 같이 제조하여 (R)-메틸 (5-((2-아미노-2-(플루오로메틸)-4-메틸펜틸)옥시)-6-(디플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트 (8.8 mg, 33%)를 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.50 (s, 1H), 8.36 (d, J = 5.4 Hz, 1H), 8.18 (d, J = 8.7 Hz, 1H), 7.83 (d, J = 8.8 Hz, 1H), 7.67 (d, J = 5.2 Hz, 1H), 7.23 (t, J = 53.5 Hz, 1H), 4.33 (dq, J = 47.7, 9.0 Hz, 2H), 4.11 - 3.93 (m, 2H), 3.71 (s, 3H), 1.89 (p, J = 6.4 Hz, 1H), 1.50 - 1.32 (m, 2H), 0.96 (d, J = 6.7 Hz, 3H), 0.93 (d, J = 6.6 Hz, 3H); LCMS (ESI) m/e 427.3 [(M+H)+, 계산치 C20H26F3N4O3, 427.2]; LC/MS 체류시간 (방법 B): tR = 1.62분.
실시예 181
(S)-메틸 (5-((2-아미노-2-(플루오로메틸)-4-메틸펜틸)옥시)-4-(디플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트
파트 A: (S)-1-((6-브로모-4-(디플루오로메틸)피리딘-3-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민
실시예 19에 사전에 기재된 바와 같이 제조하여 (S)-1-((6-브로모-4-(디플루오로메틸)피리딘-3-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민 (157 mg, 98%)을 황갈색 오일로서 수득하였다. 1H NMR (400 MHz, 메탄올-d4) δ 8.16 (s, 1H), 7.62 (s, 1H), 6.80 (t, J = 54.4 Hz, 1H), 4.35 (ddd, J = 47.4, 36.8, 9.0 Hz, 2H), 4.01 (qd, J = 8.7, 1.7 Hz, 2H), 1.87 (dp, J = 12.9, 6.4 Hz, 1H), 1.48 - 1.43 (m, 2H), 1.03 (d, J = 6.6 Hz, 3H), 1.00 (d, J = 6.6 Hz, 3H); 19F NMR (376 MHz, 클로로포름-d) δ -119.66, -226.04; LCMS (ESI) m/e 355.1 [(M+H)+, 계산치 C13H19BrF3N2O, 355.1]; LC/MS 체류시간 (방법 B): tR = 1.78분.
파트 B: (S)-메틸 (5-((2-아미노-2-(플루오로메틸)-4-메틸펜틸)옥시)-4-(디플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트
실시예 179에 사전에 기재된 바와 같이 제조하여 표제 생성물 (4.0 mg, 17%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.73 (s, 1H), 8.53 (s, 1H), 8.36 (d, J = 5.2 Hz, 1H), 8.08 (s, 1H), 7.70 (d, J = 5.3 Hz, 1H), 7.35 (t, J = 53.9 Hz, 1H), 4.45 - 4.23 (m, 2H), 4.20 - 4.05 (m, 2H), 3.71 (s, 3H), 1.90 (p, J = 6.5 Hz, 1H), 1.40 (qd, J = 13.9, 5.7 Hz, 2H), 0.96 (d, J = 6.6 Hz, 3H), 0.94 (d, J = 6.6 Hz, 3H); LCMS (ESI) m/e 427.3 [(M+H)+, 계산치 C20H26F3N4O3, 427.2]; LC/MS 체류시간 (방법 B): tR = 1.67분.
실시예 182
(R)-메틸 (5-((2-아미노-2-(플루오로메틸)-4-메틸펜틸)옥시)-4-(디플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트
파트 A: (R)-1-((6-브로모-4-(디플루오로메틸)피리딘-3-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민
실시예 19에 사전에 기재된 바와 같이 제조하여 (R)-1-((6-브로모-4-(디플루오로메틸)피리딘-3-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민 (163 mg, 100%)을 황갈색 오일로서 수득하였다. 1H NMR (400 MHz, 메탄올-d4) δ 8.17 (s, 1H), 7.62 (s, 1H), 6.80 (t, J = 54.4 Hz, 1H), 4.35 (ddd, J = 47.5, 36.9, 9.0 Hz, 2H), 4.01 (qd, J = 8.7, 1.7 Hz, 2H), 1.87 (dp, J = 12.8, 6.4 Hz, 1H), 1.54 - 1.43 (m, 4H), 1.03 (d, J = 6.6 Hz, 3H), 1.00 (d, J = 6.6 Hz, 3H); 19F NMR (376 MHz, 클로로포름-d) δ -119.62, -226.06; LCMS (ESI) m/e 355.1 [(M+H)+, 계산치 C13H19BrF3N2O, 355.1]; LC/MS 체류시간 (방법 B): tR = 1.79분.
파트 B: (R)-메틸 (5-((2-아미노-2-(플루오로메틸)-4-메틸펜틸)옥시)-4-(디플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트
실시예 179에 사전에 기재된 바와 같이 제조하여 (R)-메틸 (5-((2-아미노-2-(플루오로메틸)-4-메틸펜틸)옥시)-4-(디플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트 (3.4 mg, 13%)를 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.73 (s, 1H), 8.53 (s, 1H), 8.36 (d, J = 5.2 Hz, 1H), 8.08 (s, 1H), 7.70 (d, J = 5.3 Hz, 1H), 7.35 (t, J = 53.9 Hz, 1H), 4.43 - 4.24 (m, 2H), 4.20 - 4.04 (m, 2H), 3.71 (s, 3H), 1.90 (dt, J = 12.6, 6.2 Hz, 1H), 1.40 (qd, J = 14.4, 5.7 Hz, 2H), 0.96 (d, J = 6.6 Hz, 3H), 0.94 (d, J = 6.7 Hz, 3H); LCMS (ESI) m/e 427.3 [(M+H)+, 계산치 C20H26F3N4O3, 427.2]; LC/MS 체류시간 (방법 B): tR = 1.65분.
실시예 183
(S)-1-((2',6-비스(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민
3시간 동안 한 것을 제외하고 실시예 179에 사전에 기재된 바와 같이 제조하여 (S)-1-((2',6-비스(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민 (10 mg, 28%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.80 (d, J = 5.1 Hz, 1H), 8.41 (d, J = 8.8 Hz, 1H), 8.33 (s, 1H), 8.22 (d, J = 5.2 Hz, 1H), 7.88 (d, J = 8.9 Hz, 1H), 7.39 - 7.14 (m, 1H), 7.00 (d, J = 54.8 Hz, 1H), 4.43 - 4.23 (m, 2H), 4.10 - 3.96 (m, 2H), 1.90 (dt, J = 12.8, 6.4 Hz, 1H), 1.49 - 1.32 (m, 2H), 0.96 (d, J = 6.6 Hz, 3H), 0.93 (d, J = 6.5 Hz, 3H); LCMS (ESI) m/e 404.3 [(M+H)+, 계산치 C19H23F5N3O, 404.2]; LC/MS 체류시간 (방법 B): tR = 1.90분.
실시예 184
(S)-1-((2',4-비스(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민
3시간 동안 한 것을 제외하고 실시예 179에 사전에 기재된 바와 같이 제조하여 (S)-1-((2',4-비스(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민 (15.1 mg, 45%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.79 (d, J = 5.3 Hz, 1H), 8.76 (s, 1H), 8.37 (s, 1H), 8.33 (s, 1H), 8.26 (d, J = 5.2 Hz, 1H), 7.35 (t, J = 53.8 Hz, 1H), 7.05 (t, J = 54.9 Hz, 1H), 4.43 - 4.25 (m, 2H), 4.21 - 4.04 (m, 2H), 1.90 (dt, J = 12.8, 6.4 Hz, 1H), 1.48 - 1.33 (m, 2H), 0.96 (d, J = 6.6 Hz, 3H), 0.94 (d, J = 6.6 Hz, 3H); LCMS (ESI) m/e 404.3 [(M+H)+, 계산치 C19H23F5N3O, 404.2]; LC/MS 체류시간 (방법 B): tR = 1.86분.
실시예 185
(R)-1-((2',6-비스(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민
3시간 동안 한 것을 제외하고 실시예 179에 사전에 기재된 바와 같이 제조하여 (R)-1-((2',6-비스(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민 (10 mg, 28%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.80 (d, J = 5.1 Hz, 1H), 8.41 (d, J = 8.8 Hz, 1H), 8.33 (s, 1H), 8.22 (d, J = 5.2 Hz, 1H), 7.87 (d, J = 8.8 Hz, 1H), 7.40 - 7.15 (m, 1H), 6.99 (d, J = 54.9 Hz, 1H), 4.44 - 4.23 (m, 2H), 4.11 - 3.95 (m, 2H), 1.90 (dt, J = 12.7, 6.3 Hz, 1H), 1.49 - 1.32 (m, 2H), 0.96 (d, J = 6.7 Hz, 3H), 0.93 (d, J = 6.6 Hz, 3H); LCMS (ESI) m/e 404.3 [(M+H)+, 계산치 C19H23F5N3O, 404.2]; LC/MS 체류시간 (방법 B): tR = 1.87분.
실시예 186
(R)-1-((2',4-비스(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민
실시예 179에 사전에 기재된 바와 같이 제조하여 (R)-1-((2',4-비스(디플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민 (7.7 mg, 16%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.79 (d, J = 5.1 Hz, 1H), 8.76 (s, 1H), 8.37 (s, 1H), 8.33 (s, 1H), 8.26 (d, J = 5.3 Hz, 1H), 7.35 (t, J = 53.8 Hz, 1H), 7.05 (t, J = 54.8 Hz, 1H), 4.45 - 4.24 (m, 2H), 4.21 - 4.03 (m, 2H), 1.90 (p, J = 6.4 Hz, 1H), 1.50 - 1.33 (m, 2H), 0.97 (d, J = 6.6 Hz, 3H), 0.94 (d, J = 6.6 Hz, 3H); LCMS (ESI) m/e 404.3 [(M+H)+, 계산치 C19H23F5N3O, 404.2]; LC/MS 체류시간 (방법 B): tR = 1.87분.
실시예 187
(S)-1-((4-(디플루오로메틸)-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민
실시예 179에 사전에 기재된 바와 같이 제조하여 (S)-1-((4-(디플루오로메틸)-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민 (16.8 mg, 50%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.71 (s, 1H), 8.54 (d, J = 5.4 Hz, 1H), 8.19 (s, 1H), 7.94 (s, 1H), 7.84 (d, J = 5.2 Hz, 1H), 7.34 (t, J = 53.9 Hz, 1H), 4.42 - 4.25 (m, 2H), 4.18 - 4.03 (m, 2H), 2.56 (s, 3H), 1.90 (dt, J = 13.1, 6.5 Hz, 1H), 1.40 (qd, J = 14.3, 5.7 Hz, 2H), 0.96 (d, J = 6.6 Hz, 3H), 0.94 (d, J = 6.7 Hz, 3H); LCMS (ESI) m/e 368.3 [(M+H)+, 계산치 C19H25F3N3O, 368.2]; LC/MS 체류시간 (방법 B): tR = 1.39분.
실시예 188
(R)-1-((4-(디플루오로메틸)-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민
실시예 179에 사전에 기재된 바와 같이 제조하여 (R)-1-((4-(디플루오로메틸)-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2-(플루오로메틸)-4-메틸펜탄-2-아민 (20.5 mg, 59%)을 수득하였다: 1H NMR (500 MHz, DMSO-d6) δ 8.71 (s, 1H), 8.54 (d, J = 5.4 Hz, 1H), 8.19 (s, 1H), 7.94 (s, 1H), 7.84 (d, J = 5.2 Hz, 1H), 7.34 (t, J = 53.9 Hz, 1H), 4.44 - 4.24 (m, 2H), 4.18 - 4.02 (m, 2H), 2.56 (s, 3H), 1.90 (dt, J = 12.9, 6.3 Hz, 1H), 1.40 (qd, J = 14.2, 5.8 Hz, 2H), 0.96 (d, J = 6.6 Hz, 3H), 0.94 (d, J = 6.7 Hz, 3H); LCMS (ESI) m/e 368.3 [(M+H)+, 계산치 C19H25F3N3O, 368.2]; LC/MS 체류시간 (방법 B): tR = 1.47분.
실시예 189
(S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-플루오로페닐)피리딘-2-일)아세트아미드
파트 A: (S)-tert-부틸 (1-((3-클로로-5-(5,7-디플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
실시예 179에 기재된 바와 같이 제조하였다. (S)-tert-부틸 (1-((3-클로로-5-(5,7-디플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (33.4 mg, 48%)를 수득하였다. LCMS (ESI) m/e 506.0 [(M+H)+, 계산치 C26H31F2N3Cl1O3, 506.2]; LC/MS 체류시간 (방법 B): tR = 2.48분.
파트 B: (S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-플루오로페닐)피리딘-2-일)아세트아미드
실시예 32에 기재된 바와 같이 TFA 탈보호를 수행하였다. (S)-N-(4-(4-((2-아미노-4-메틸펜틸)옥시)-3-플루오로페닐)피리딘-2-일)아세트아미드 (27 mg, 100%)를 무색 고체로서 수득하였다. 1H NMR (500 MHz, DMSO-d6) δ 10.53 (s, 1H), 8.33 (d, J = 4.9 Hz, 2H), 7.61 (dd, J = 12.5, 2.2 Hz, 1H), 7.52 (dd, J = 8.5, 2.2 Hz, 1H), 7.43 - 7.37 (m, 1H), 7.32 (t, J = 8.7 Hz, 1H), 3.97 (dd, J = 9.5, 4.9 Hz, 1H), 3.90 (dd, J = 9.5, 6.5 Hz, 1H), 3.12 (dt, J = 11.9, 5.4 Hz, 1H), 2.12 (s, 3H), 1.81 (dq, J = 13.0, 6.5 Hz, 1H), 1.33 (ddd, J = 13.5, 8.5, 5.0 Hz, 1H), 1.26 (ddd, J = 13.5, 8.5, 5.5 Hz, 1H), 0.92 (d, J = 6.6 Hz, 3H), 0.88 (d, J = 6.5 Hz, 3H); LCMS (ESI) m/e 406.0 [(M+H)+, 계산치 C21H23F2N3Cl1O1, 406.1]; LC/MS 체류시간 (방법 B): tR = 2.03분.
실시예 190
(S)-1-((3-클로로-5-(7-플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((3-클로로-5-(7-플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
중간체 7-플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)퀴놀린을 실시예 131, 파트 A에 기재된 바와 같이 제조하였다. 스즈키 커플링을 실시예 131, 파트 D에 기재된 바와 같이 수행하였다. (S)-tert-부틸 (1-((3-클로로-5-(7-플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (10.6 mg, 76% 수율)를 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.97 (d, J=4.3 Hz, 1H), 8.18 (d, J=2.0 Hz, 1H), 7.91 - 7.80 (m, 3H), 7.37 (ddd, J=9.3, 8.0, 2.5 Hz, 1H), 7.30 (d, J=4.0 Hz, 1H), 4.63 (d, J=10.5 Hz, 1H), 4.47 (d, J=10.5 Hz, 1H), 1.93 - 1.83 (m, 2H), 1.68 (d, J=8.8 Hz, 1H), 1.46 (s, 3H), 1.44 (s, 9H), 1.02 (m, 6H). 19F NMR (376MHz, 클로로포름-d) δ -109.18 (s, 1F). LCMS (ESI) m/e 488.0 [(M+H)+, 계산치 C26H32F1N3Cl1O3, 488.2]; LC/MS 체류시간 (방법 B): tR = 2.39분.
파트 B: (S)-1-((3-클로로-5-(7-플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
TFA 탈보호를 실시예 32에 기재된 바와 같이 수행하였다. (S)-1-((3-클로로-5-(7-플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (4.4 mg, 50% 수율)을 수득하였다. 1H NMR (600MHz, DMSO-d6) δ 9.06 - 8.97 (m, 1H), 8.38 - 8.29 (m, 1H), 8.25 - 8.16 (m, 1H), 8.04 - 7.83 (m, 2H), 7.65 - 7.51 (m, 2H), 4.27 - 4.13 (m, 2H), 1.95 - 1.79 (m, 1H), 1.56 - 1.40 (m, 2H), 1.26 - 1.16 (m, 3H), 1.03 - 0.91 (m, 6H). LCMS (ESI) m/e 409.9 [(M+Na)+, 계산치 C21H23F1N3Cl1O1Na1, 410.1]; LC/MS 체류시간 (방법 B): tR = 1.85분.
실시예 191
(S)-1-((3-클로로-5-(6-플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 190에 기재된 바와 같이 제조하여 (S)-1-((3-클로로-5-(6-플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (9.4 mg, 0.024 mmol, 최종 단계에 대해서 50% 수율)을 무색 고체로서 수득하였다. 1H NMR (600MHz, DMSO-d6) δ 9.06 - 8.97 (m, 1H), 8.38 - 8.29 (m, 1H), 8.25 - 8.16 (m, 1H), 8.04 - 7.83 (m, 2H), 7.65 - 7.51 (m, 2H), 4.27 - 4.13 (m, 2H), 1.95 - 1.79 (m, 1H), 1.56 - 1.40 (m, 2H), 1.26 - 1.16 (m, 3H), 1.03 - 0.91 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 388.1 [(M+H)+, 계산치 C21H24FN3ClO, 388.2]; LC/MS 체류시간 (방법 E): tR = 1.82분.
실시예 192
(S)-1-((3-클로로-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 59에서와 같이 제조하여 (S)-1-((3-클로로-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 10.1 mg, 0.030 mmol, 2 단계에서 51% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.94 (d, J=2.2 Hz, 1H), 8.76 (d, J=5.5 Hz, 1H), 8.63 (d, J=1.8 Hz, 1H), 7.95 (d, J=5.5 Hz, 1H), 4.22 - 4.14 (m, 2H), 2.68 (s, 3H), 1.85 - 1.78 (m, 1H), 1.42 (dd, J=9.0, 5.3 Hz, 2H), 1.15 (s, 3H), 0.92 (m, 6H); LCMS (ESI) m/e 318.1 [(M-NH2)+, 계산치 C17H21N3ClO, 318.1]; LC/MS 체류시간 (방법 B): tR = 1.83분.
실시예 193
(S)-1-((2'-클로로-5-(디플루오로메틸)-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: 5-브로모-3-(디플루오로메틸)-2-플루오로피리딘
0℃에서 CH2Cl2 (15 mL) 중 5-브로모-2-플루오로니코틴알데히드 (0.8212 g, 4.03 mmol)의 용액에 DAST (1.064 mL, 8.05 mmol)를 첨가하였다. 반응물을 0℃에서 1시간 동안 교반한 다음, 실온으로 가온하였다. 교반을 3시간 동안 계속하였다. 반응물을 빙냉 1N NaOH 용액에 부었다. 유기 층을 분리하고, 수성 층을 DCM (2x)으로 추출하였다. DCM 층을 합하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켜 조 5-브로모-3-(디플루오로메틸)-2-플루오로피리딘 (0.81 g, 3.58 mmol, 89% 수율)을 갈색 고체로서 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.43 - 8.38 (m, 1H), 8.18 - 8.13 (m, 1H), 6.82 (t, J=52.0 Hz, 1H); 19F NMR (376MHz, 클로로포름-d) δ -74.33 (br. s., 1F), -115.87 (s, 2F); LCMS (ESI) m/e 205.9 [(M-F)+, 계산치 C6H3BrNF2, 205.9]; LC/MS 체류시간 (방법 B): tR = 1.88분.
파트 B: (S)-1-((5-브로모-3-(디플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
실온에서 THF (5 mL) 중 (S)-2-아미노-2,4-디메틸펜탄-1-올 (0.3359 g, 2.56 mmol) 및 5-브로모-3-(디플루오로메틸)-2-플루오로피리딘 (0.579 g, 2.56 mmol)에 포타슘 tert-부톡시드 (3.07 mL, 3.07 mmol)를 첨가하였다. 반응물을 실온에서 밤새 교반하였다. 반응물을 물을 첨가함으로써 켄칭하고, 조 용액을 에틸 아세테이트로 희석하였다. 에틸 아세테이트 층을 분리하고, 물 (3x)로 세척하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 생성물을 실리카 겔 크로마토그래피 (CH2Cl2 중 0-10% 메탄올을 사용하여 용리함)에 의해 정제하여 (S)-1-((5-브로모-3-(디플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (0.63 g, 0.923 mmol, 73% 수율)을 황색 액체로서 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.31 - 8.27 (m, 1H), 7.96 - 7.93 (m, 1H), 6.97 - 6.64 (m, 1H), 4.15 (s, 2H), 1.85 - 1.74 (m, 1H), 1.45 (t, J=5.8 Hz, 2H), 1.20 (s, 3H), 0.98 (m, 6H). 19F NMR (376MHz, 클로로포름-d) δ -117.61 (s, 2F); LCMS (ESI) m/e 320.1 [(M-NH2)+, 계산치 C13H17BrNF2O, 320.1]; LC/MS 체류시간 (방법 B): tR = 1.99분.
파트 C: (S)-1-((2'-클로로-5-(디플루오로메틸)-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민
디옥산 (0.8 mL) (탈기됨) 중 2N 탄산나트륨 용액 (0.050 ml, 0.099 mmol), 1,1'-비스(디페닐포스핀)페로센-팔라듐(II)디클로라이드 디클로로메탄 착물 (2.022 mg, 2.476 μmol), 2-클로로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘 (0.018 g, 0.074 mmol) 및 (S)-1-((5-브로모-3-(디플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (0.0167 g, 0.050 mmol)의 혼합물을 80℃에서 2시간 동안 가열하였다. 반응물을 규조토 (셀라이트®)를 통해 여과하고, 역상 정제용 HPLC에 의해 정제하였다. 회백색 고체로서의 (S)-1-((2'-클로로-5-(디플루오로메틸)-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민 (13.1 mg, 0.035 mmol, 72% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.83 (s, 1H), 8.48 (d, J=5.1 Hz, 1H), 8.43 (s, 1H), 7.98 (s, 1H), 7.84 (d, J=4.8 Hz, 1H), 7.27 (t, J=55.0 Hz, 1H), 4.22 - 4.14 (m, 2H), 1.83 - 1.73 (m, 1H), 1.48 - 1.37 (m, 2H), 1.15 (s, 3H), 0.91 (m, 6H). LCMS (ESI) m/e 353.1 [(M-NH2)+, 계산치 C18H20N2ClF2O, 353.1]; LC/MS 체류시간 (방법 B): tR = 1.96분.
실시예 194
(S)-1-((5-(디플루오로메틸)-2'-메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 193에 기재된 바와 같이 제조하여 (S)-1-((5-(디플루오로메틸)-2'-메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민 (9.2 mg, 0.026 mmol, 최종 단계에 대해서 45% 수율)을 무색 고체로서 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.76 (s, 1H), 8.50 (d, J=5.2 Hz, 1H), 8.33 (s, 1H), 7.66 (s, 1H), 7.57 (d, J=4.9 Hz, 1H), 7.45 - 7.11 (m, 1H), 4.24 - 4.11 (m, 2H), 2.53 (s, 3H), 1.82 - 1.72 (m, 1H), 1.44 (qd, J=13.9, 5.5 Hz, 2H), 1.16 (s, 3H), 0.92 (d, J=6.7 Hz, 3H), 0.89 (d, J=6.4 Hz, 3H) 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 350.0 [(M+H)+, 계산치 C19H26F2N3O, 350.2]; LC/MS 체류시간 (방법 E): tR = 2.62분.
실시예 195
(S)-1-((3-(디플루오로메틸)-5-(7-플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-1-((3-(디플루오로메틸)-5-(7-플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
중간체 7-플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)퀴놀린을 실시예 131, 파트 A에 기재된 바와 같이 제조하였다. 최종 생성물을 실시예 193에 기재된 바와 같이 제조하여 (S)-1-((3-(디플루오로메틸)-5-(7-플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (13.9 mg, 0.034 mmol, 34% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.00 (d, J=4.4 Hz, 1H), 8.51 (s, 1H), 8.15 (s, 1H), 7.97 - 7.85 (m, 2H), 7.59 (td, J=8.8, 2.6 Hz, 1H), 7.56 (d, J=4.4 Hz, 1H), 7.28 (t, J=55.0 Hz, 1H), 4.18 (s, 2H), 1.86 - 1.76 (m, 1H), 1.48 - 1.36 (m, 2H), 1.15 (s, 3H), 0.94 (m, 6H); LCMS (ESI) m/e 387.1 [(M-NH2)+, 계산치 C22H22N2F3O, 387.2]; LC/MS 체류시간 (방법 B): tR = 1.86분.
실시예 196
(S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-(디플루오로메틸)-[3,4'-비피리딘]-2'-일)카르바메이트
실시예 193에 기재된 바와 같이 제조하였다. (S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-(디플루오로메틸)-[3,4'-비피리딘]-2'-일)카르바메이트 (8.0mg, 0.018 mmol, 40% 수율)를 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.56 (br. s., 1H), 8.34 (d, J=4.8 Hz, 1H), 8.24 (br. s., 1H), 8.13 (br. s., 2H), 7.19 (d, J=3.8 Hz, 1H), 7.11 - 6.73 (m, 1H), 4.26 (br. s., 2H), 3.85 (s, 3H), 1.77 (m 1H), 1.50 (br. s., 2H), 1.25 (br. s., 3H), 1.00 (t, J=7.4 Hz, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 431.1 [(M+Na)+, 계산치 C20H26N4F2O3Na, 431.2]; LC/MS 체류시간 (방법 B): tR = 1.78분.
실시예 197
(S)-1-((5-(7-클로로퀴놀린-4-일)-3-(디플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-1-((3-(디플루오로메틸)-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
1,4-디옥산 (0.55 mL) 중 아세트산칼륨 (0.018 g, 0.181 mmol), (S)-1-((5-브로모-3-(디플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (0.0204 g, 0.060 mmol), 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란) (0.023 g, 0.091 mmol)의 혼합물을 질소로 10분 동안 퍼징하였다. PdCl2(dppf) (1.328 mg, 1.815 μmol)를 반응 혼합물에 첨가한 다음, 반응물을 80℃에서 2시간 동안 가열하였다. 조 반응 혼합물을 감압 하에 농축시키고 이를 그대로 사용하였다.
파트 B: 4-브로모-7-클로로퀴놀린
20 mL 마이크로웨이브 튜브에 실온에서 4,7-디클로로퀴놀린 (0.3315 g, 1.674 mmol) 및 프로피오니트릴 (3 mL)에 이어서 TMS-Br (0.434 mL, 3.35 mmol)을 첨가하였다. 침전물이 형성되었다. 튜브를 밀봉하고, 100℃로 12시간 동안 가열하였다. 반응물을 실온으로 냉각시켰다. 조 혼합물을 빙냉 NaOH (1N, 3 mL)에 붓고, 튜브를 물로 헹구었다. 수성 층을 디에틸 에테르 (3x5 mL)로 추출하였다. 디에틸 에테르 층을 합하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켜 4-브로모-7-클로로퀴놀린 (300 mg, 1.126 mmol, 67% 수율)을 황색 고체로서 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.70 (d, J=4.6 Hz, 1H), 8.17 (d, J=8.8 Hz, 1H), 8.14 (d, J=2.0 Hz, 1H), 7.73 (d, J=4.6 Hz, 1H), 7.63 (dd, J=9.0, 2.0 Hz, 1H); LCMS (ESI) m/e 241.9 [(M+H)+, 계산치 C9H5BrClN, 241.9].
파트 C: (S)-1-((5-(7-클로로퀴놀린-4-일)-3-(디플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
4-브로모-7-클로로퀴놀린 (13.34 mg, 0.055 mmol) 및 (S)-1-((3-(디플루오로메틸)-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (21.13 mg, 0.055 mmol) 사이의 스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (S)-1-((5-(7-클로로퀴놀린-4-일)-3-(디플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (7.8 mg, 0.019 mmol, 34% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.02 (d, J=4.6 Hz, 1H), 8.53 (s, 1H), 8.20 (d, J=1.8 Hz, 1H), 8.16 (s, 1H), 7.88 (d, J=9.2 Hz, 1H), 7.69 (dd, J=9.0, 2.0 Hz, 1H), 7.61 (d, J=4.3 Hz, 1H), 7.29 (t, J=55.0 Hz, 1H), 4.22 - 4.16 (m, 2H), 1.83 (dt, J=12.5, 6.3 Hz, 1H), 1.49 - 1.38 (m, 2H), 1.17 (s, 3H), 0.97 - 0.92 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 442.0 [(M+Na)+, 계산치 C22H24ClN3F2ONa, 442.2]; LC/MS 체류시간 (방법 B): tR = 2.09분.
실시예 198
(S)-1-((3-(디플루오로메틸)-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
중간체 (S)-1-((3-(디플루오로메틸)-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민을 실시예 197, 파트 A에 기재된 바와 같이 제조하였다. 스즈키 반응을 실시예 193에 기재된 바와 같이 수행하였다. (S)-1-((3-(디플루오로메틸)-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (7.7 mg, 0.036 mmol, 37% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.13 (s, 1H), 8.78 (d, J=5.2 Hz, 1H), 8.69 (s, 1H), 7.99 (d, J=5.2 Hz, 1H), 7.29 (t, J=55.0 Hz, 1H), 4.19 (d, J=1.8 Hz, 2H), 2.70 (s, 3H), 1.85 - 1.76 (m, 1H), 1.46 - 1.36 (m, 2H), 1.14 (s, 3H), 0.92 (m, 6H); LCMS (ESI) m/e 334.1 [(M-NH2)+, 계산치 C18H22N3F2O, 334.2]; LC/MS 체류시간 (방법 B): tR = 1.91분.
실시예 199
(S)-1-((2',5-비스(디플루오로메틸)-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민
중간체 (S)-1-((3-(디플루오로메틸)-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민을 실시예 197, 파트 A에 기재된 바와 같이 제조하였다. 스즈키 반응을 실시예 193에 기재된 바와 같이 수행하였다. (S)-1-((2',5-비스(디플루오로메틸)-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민 (9.2 mg, 0.023 mmol, 39% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.86 (s, 1H), 8.77 (d, J=5.2 Hz, 1H), 8.45 (s, 1H), 8.10 (s, 1H), 8.00 (d, J=4.6 Hz, 1H), 7.26 (t, J=55.0 Hz, 1H), 7.02 (t, J=55.0 Hz, 1H), 4.18 (d, J=1.8 Hz, 2H), 1.85 - 1.75 (m, 1H), 1.48 - 1.36 (m, 2H), 1.15 (s, 3H), 0.94 (d, J=6.7 Hz, 3H), 0.92 (d, J=6.7 Hz, 3H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 369.1 [(M-NH2)+, 계산치 C19H21N2F4O, 369.2]; LC/MS 체류시간 (방법 B): tR = 1.91분.
실시예 200
(S)-1-((3-(디플루오로메틸)-5-(6-플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: 6-플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)퀴놀린
1,4-디옥산 (2 mL) 중 아세트산칼륨 (0.060 g, 0.610 mmol), 4-브로모-7-플루오로퀴놀린 (0.046 g, 0.203 mmol), 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란) (0.062 g, 0.244 mmol)의 혼합물을 질소로 10분 동안 퍼징하였다. PdCl2(dppf) (4.47 mg, 6.10 μmol)를 첨가하고, 반응물을 80℃에서 5시간 동안 가열하였다. 반응물을 실온으로 냉각시키고 정량적 수율로 가정하여 이를 그대로 사용하였다.
파트 B: (S)-1-((3-(디플루오로메틸)-5-(6-플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
1,4-디옥산 (0.8 ml) (탈기됨) 중 탄산나트륨 (0.171 ml, 0.342 mmol), 1,1'-비스(디페닐포스피노)페로센-팔라듐(II)디클로라이드 디클로로메탄 착물 (6.98 mg, 8.55 μmol), (S)-1-((5-브로모-3-(디플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (0.0272 g, 0.081 mmol) 및 6-플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)퀴놀린 (0.047 g, 0.171 mmol)의 혼합물을 80℃에서 2시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 셀라이트를 통해 여과하였다. 여과물을 감압 하에 농축시켰다. 잔류물을 역상 HPLC (엑스브리지 C18 칼럼, 이동상: 아세토니트릴, 물, 10-mM 아세트산암모늄)에 의해 정제하여 (S)-1-((3-(디플루오로메틸)-5-(6-플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (27.2 mg, 0.067 mmol, 39% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.97 (d, J=4.4 Hz, 1H), 8.52 (s, 1H), 8.22 (dd, J=9.2, 5.9 Hz, 1H), 8.16 (s, 1H), 7.81 - 7.72 (m, 1H), 7.61 (d, J=4.4 Hz, 1H), 7.51 (dd, J=10.1, 2.8 Hz, 1H), 7.28 (t, J=55.0 Hz, 1H), 4.19 (s, 2H), 1.86 - 1.77 (m, 1H), 1.49 - 1.37 (m, 2H), 1.16 (s, 3H), 0.94 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 426.2 [(M+Na)+, 계산치 C22H24N3F3ONa, 426.2]; LC/MS 체류시간 (방법 B): tR = 1.93분.
실시예 201
(S)-1-((3-(디플루오로메틸)-5-(5,7-디플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
중간체 (S)-tert-부틸 (1-((3-클로로-5-(5,7-디플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트를 실시예 189에서와 같이 제조하였다. 스즈키 반응을 실시예 193에 기재된 바와 같이 수행하였다. (S)-1-((3-(디플루오로메틸)-5-(5,7-디플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (13.0 mg, 0.031 mmol, 37% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6)δ 9.02 (d, J=4.4 Hz, 1H), 8.43 (s, 1H), 8.10 (br. s., 1H), 7.80 (d, J=8.4 Hz, 1H), 7.63 - 7.55 (m, 1H), 7.51 (d, J=4.4 Hz, 1H), 7.25 (t, J=55.0 Hz, 1H), 4.16 (s, 2H), 1.81 (dt, J=12.5, 6.2 Hz, 1H), 1.41 (t, J=6.4 Hz, 2H), 1.14 (s, 3H), 0.93 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 405.7 [(M-NH2)+, 계산치 C22H21N2F4O, 405.2]; LC/MS 체류시간 (방법 B): tR = 2.02분.
실시예 202
(S)-1-((3-(디플루오로메틸)-5-(7-(트리플루오로메틸)퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 193에 기재된 바와 같이 제조하였다. (S)-1-((3-(디플루오로메틸)-5-(7-(트리플루오로메틸)퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (25.3 mg, 0.055 mmol, 37% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.14 (d, J=4.4 Hz, 1H), 8.56 (s, 1H), 8.48 (s, 1H), 8.20 (s, 1H), 8.08 (d, J=8.8 Hz, 1H), 7.92 (d, J=8.8 Hz, 1H), 7.75 (d, J=4.4 Hz, 1H), 7.29 (t, J=55.0 Hz, 1H), 4.20 (s, 2H), 1.87 - 1.79 (m, 1H), 1.49 - 1.38 (m, 2H), 1.16 (s, 3H), 0.95 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 437.1 [(M-NH2)+, 계산치 C23H22N2F5O, 437.2]; LC/MS 체류시간 (방법 B): tR = 2.13분.
실시예 203
(S)-1-((5-(디플루오로메틸)-2',3'-디메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 193에 기재된 바와 같이 제조하였다. (S)-1-((5-(디플루오로메틸)-2',3'-디메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민 (20.4 mg, 0.056 mmol, 26% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.32 (d, J=4.0 Hz, 2H), 7.95 (s, 1H), 7.38 - 7.11 (m, 2H), 4.15 (s, 2H), 2.52 (br. s., 3H), 2.17 (s, 3H), 1.84 - 1.75 (m, 1H), 1.42 (dd, J=10.5, 5.3 Hz, 2H), 1.15 (s, 3H), 0.93 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 347.1 [(M-NH2)+, 계산치 C20H25N2F2O, 347.2]; LC/MS 체류시간 (방법 B): tR = 1.48분.
실시예 204
(S)-1-((3-(디플루오로메틸)-5-(퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
스즈키 반응을 실시예 193에 기재된 바와 같이 수행하였다. (S)-1-((3-(디플루오로메틸)-5-(퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (17.4 mg, 0.045 mmol 66% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.05 (d, J=4.0 Hz, 1H), 8.57 (br. s., 1H), 8.34 (br. s., 2H), 8.21 (br. s., 1H), 8.18 (d, J=8.5 Hz, 1H), 7.89 (t, J=7.5 Hz, 1H), 7.85 (d, J=8.5 Hz, 1H), 7.70 (t, J=7.5 Hz, 1H), 7.65 (d, J=4.3 Hz, 1H), 7.63 - 7.40 (m, 1H), 4.64-4.39 (m, 2H), 1.89 - 1.73 (m, 2H), 1.65 (dd, J=13.7, 4.6 Hz, 1H), 1.42 (s, 3H), 0.97 (d, J=6.4 Hz, 3H), 0.93 (d, J=6.1 Hz, 3H); LCMS (ESI) m/e 386.1 [(M+H)+, 계산치 C22H26N3F2O, 386.2]; LC/MS 체류시간 (방법 B): tR = 1.68분.
실시예 205
(S)-1-((3-(디플루오로메틸)-5-(7-메틸퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
디옥산 (1 mL) (탈기됨) 중 2N 탄산나트륨 용액 (0.146 mL, 0.291 mmol), (S)-1-((5-(7-클로로퀴놀린-4-일)-3-(디플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (0.0611 g, 0.146 mmol) (실시예 197), 2,4,6-트리메틸-1,3,5,2,4,6-트리옥사트리보리난 (0.018 g, 0.146 mmol) 및 1,1'- 비스(디페닐포스핀)페로센-팔라듐(II)디클로라이드 디클로로메탄 착물 (5.94 mg, 7.28 μmol)의 혼합물을 110℃에서 3시간 동안 가열하였다. 반응물을 에틸 아세테이트로 희석하고, 물로 3회 세척하였다. 에틸 아세테이트 층을 분리하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 생성물을 역상 정제용 HPLC에 의해 정제하여 (S)-1-((3-(디플루오로메틸)-5-(7-메틸퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (1.1 mg, 2.5 μmol, 2% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.93 (d, J=4.4 Hz, 1H), 8.51 (s, 1H), 8.13 (s, 1H), 7.93 (s, 1H), 7.73 (d, J=8.8 Hz, 1H), 7.53 - 7.47 (m, 2H), 7.32 (t, J=55.0 Hz, 1H), 2.56 (s, 3H), 1.87 - 1.79 (m, 1H), 1.54 - 1.41 (m, 2H), 1.20 (s, 3H), 0.95 (m, 6H). (NMR 물 억제는 또한 OCH2 에테르 신호를 억제함); LCMS (ESI) m/e 400.2 [(M+H)+, 계산치 C23H28N3F2O, 400.2]; LC/MS 체류시간 (방법 B): tR = 1.72분.
실시예 206
(S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4-메톡시-[2,4'-비피리딘]-2'-일)카르바메이트
파트 A: 6-아이오도-4-메톡시피리딘-3-올
n- BuLi (0.319 mL, 0.797 mmol)를 -78℃에서 2,6-디아이오도-4-메톡시피리딘-3-일 디에틸카르바메이트 (0.316 g, 0.664 mmol) (참조: J.Org. Chem. 2002, 67, 3272-3276)의 THF (4 mL) 용액에 첨가하였다. -78℃에서 20분 동안 교반한 후, 반응물을 NH4Cl (포화)의 첨가에 의해 켄칭하였다. 반응물을 실온으로 가온하고, 추가로 30분 동안 교반하였다. 휘발성 물질을 감압 하에 제거하고, 조 물질을 에틸 아세테이트와 물 사이에 분배하였다. 에틸 아세테이트 층을 분리하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (헥산 중 0-25% 에틸 아세테이트를 사용하여 용리함)에 의해 정제하여 6-아이오도-4-메톡시피리딘-3-올 (0.033 g, 0.131 mmol, 20% 수율)을 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 7.95 (s, 1H), 7.14 (s, 1H), 3.92 (s, 3H), 1개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 251.9 [(M+H)+, 계산치 C6H7INO2, 252.0]; LC/MS 체류시간 (방법 B): tR = 0.85분.
파트 B: (S)-tert-부틸 (1-((6-아이오도-4-메톡시피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
실시예 53, 파트 A에 기재된 바와 같이 제조하였다. 조 물질을 추가 정제 없이 사용하였다. LCMS (ESI) m/e 465.0 [(M+H)+, 계산치 C18H30IN2O4, 465.1]; LC/MS 체류시간 (방법 B): tR = 2.24분.
파트 C: Boc 보호된 (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4-메톡시-[2,4'-비피리딘]-2'-일)카르바메이트
스즈키 반응을 실시예 193에 기재된 바와 같이 수행하였다. Boc 보호된 (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4-메톡시-[2,4'-비피리딘]-2'-일)카르바메이트 (2.3 mg, 4.71 μmol, 2 단계에 대해서 22% 수율)를 수득하였다. LCMS (ESI) m/e 489.3 [(M+H)+, 계산치 C25H37N4O6, 489.2]; LC/MS 체류시간 (방법 B): tR = 2.14분.
파트 D: (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4-메톡시-[2,4'-비피리딘]-2'-일)카르바메이트
TFA 탈보호를 실시예 32에 기재된 바와 같이 수행하였다. (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4-메톡시-[2,4'-비피리딘]-2'-일)카르바메이트 (1.2 mg, 3.09 μmol, 66% 수율)를 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.51 (s, 1H), 8.34 (d, J=5.1 Hz, 1H), 8.31 (s, 1H), 7.69 (d, J=5.1 Hz, 1H), 7.59 (s, 1H), 3.99 (s, 3H), 3.83 (s, 2H), 3.70 (s, 3H), 3.41 (br. s., 2H), 1.85 - 1.75 (m, 1H), 1.39 (dd, J=9.0, 5.7 Hz, 2H), 1.12 (s, 3H), 0.93 (m, 6H), 1개의 교환가능한 양성자는 관찰되지 않음. LCMS (ESI) m/e 389.3 [(M+H)+, 계산치 C20H29N4O4, 389.2]; LC/MS 체류시간 (방법 B): tR = 1.56분.
실시예 207
(S)-1-((2'-(디플루오로메틸)-4-메톡시-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((2'-(디플루오로메틸)-4-메톡시-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
스즈키 반응을 실시예 193에 기재된 바와 같이 수행하여 (S)-tert-부틸 (1-((2'-(디플루오로메틸)-4-메톡시-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (12.9 mg, 0.028 mmol, 13% 수율)를 수득하였다. LCMS (ESI) m/e 466.2 [(M+H)+, 계산치 C24H34F2N3O4, 466.2]; LC/MS 체류시간 (방법 B): tR = 2.65분.
파트 B: (S)-1-((2'-(디플루오로메틸)-4-메톡시-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
TFA 탈보호를 실시예 32에 기재된 바와 같이 수행하였다. (S)-1-((2'-(디플루오로메틸)-4-메톡시-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (5.0 mg, 0.014 mmol, 53% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.78 (d, J=4.8 Hz, 1H), 8.38 (s, 2H), 8.26 (d, J=4.8 Hz, 1H), 7.84 (s, 1H), 7.03 (t, J=1.0 Hz, 1H), 4.03 (s, 3H), 3.96 (s, 2H), 1.85 - 1.75 (m, 1H), 1.56 - 1.42 (m, 2H), 1.21 (s, 3H), 0.94 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음. LCMS (ESI) m/e 366.2 [(M+H)+, 계산치 C19H26F2N3O2, 366.2]; LC/MS 체류시간 (방법 B): tR = 1.70분.
실시예 208
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)나프탈렌-1-일)피리딘-2-일)카르바메이트
파트 A: (S)-tert-부틸 (1-((4-브로모나프탈렌-1-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
DMF (1 mL) 중 탄산칼륨 (0.124 g, 0.897 mmol), (S)-tert-부틸 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (0.132 g, 0.448 mmol) 및 4-브로모나프탈렌-1-올 (0.1 g, 0.448 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 반응물을 에틸 아세테이트로 희석하고, NaOH (1N)로 1회에 이어서 물로 2회 세척하였다. 에틸 아세테이트 층을 분리하고, 건조 (Na2SO4)시키고, 여과하고, 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (헥산 중 0에서 5% 에틸 아세테이트)에 의해 정제하여 (S)-tert-부틸 (1-((4-브로모나프탈렌-1-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (37 mg, 0.085 mmol, 19% 수율)를 황색 오일로서 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.29 (dd, J=7.8, 0.8 Hz, 1H), 8.18 (d, J=8.0 Hz, 1H), 7.67 - 7.35 (m, 3H), 6.73 (d, J=8.3 Hz, 1H), 4.28 (d, J=9.0 Hz, 1H), 4.13 (d, J=9.0 Hz, 1H), 1.86 (d, J=6.5 Hz, 2H), 1.69 (dd, J=13.9, 5.1 Hz, 1H), 1.51 (s, 3H), 1.42 - 1.38 (m, 9H), 1.01 (m, 6H); LCMS (ESI) m/e 458.1, 460.1 Br 패턴 [(M+Na)+, 계산치 C22H30BrNNaO3, 458.1]; LC/MS 체류시간 (방법 B): tR = 2.60분.
파트 B: Boc 보호된 (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)나프탈렌-1-일)피리딘-2-일)카르바메이트
1,4-디옥산 (0.3 mL) (탈기됨) 중 탄산나트륨 (0.034 ml, 0.069 mmol), 1,1'-비스(디페닐포스피노)페로센-팔라듐(II)디클로라이드 디클로로메탄 착물 (1.965 mg, 2.406 μmol), (2-((메톡시카르보닐)아미노)피리딘-4-일)보론산 (0.013 g, 0.069 mmol) 및 (S)-tert-부틸 (1-((4-브로모나프탈렌-1-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.015 g, 0.034 mmol)의 혼합물을 80℃에서 2시간 동안 가열하였다. 반응 혼합물을 에틸 아세테이트로 희석하고, 물 (3x)로 세척하였다. 에틸 아세테이트 층을 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (헥산 중 0에서 25% 에틸 아세테이트)에 의해 정제하여 Boc 보호된 (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)나프탈렌-1-일)피리딘-2-일)카르바메이트 (12.0 mg, 0.024 mmol, 69% 수율)를 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.37 (d, J=5.8 Hz, 2H), 8.16 (s, 1H), 7.94 - 7.90 (m, 1H), 7.58 - 7.49 (m, 2H), 7.38 (d, J=8.0 Hz, 1H), 7.15 (dd, J=5.1, 1.4 Hz, 1H), 6.91 (d, J=8.0 Hz, 1H), 4.33 (d, J=9.0 Hz, 1H), 4.22 - 4.17 (m, 1H), 3.82 (s, 3H), 1.94 - 1.83 (m, 1H), 1.73 (br. s., 2H), 1.42 (s, 9H), 1.52 (s, 3H), 1.03 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음. LCMS (ESI) m/e 508.2 [(M+H)+, 계산치 C29H38N3O5, 508.3]; LC/MS 체류시간 (방법 B): tR = 2.30분.
파트 C: (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)나프탈렌-1-일)피리딘-2-일)카르바메이트
TFA 탈보호를 실시예 32에 기재된 바와 같이 수행하였다. (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)나프탈렌-1-일)피리딘-2-일)카르바메이트 (9.2 mg, 0.022 mmol, 95% 수율)를 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.40 (d, J=7.7 Hz, 1H), 8.37 (d, J=4.8 Hz, 1H), 7.95 (s, 1H), 7.85 (d, J=8.4 Hz, 1H), 7.59 (t, J=8.4 Hz, 2H), 7.42 (d, J=7.7 Hz, 1H), 7.16 (d, J=5.1 Hz, 1H), 7.06 (d, J=8.1 Hz, 1H), 3.94 (s, 2H), 3.67 (s, 3H), 1.86 (d, J=6.6 Hz, 1H), 1.54 (dd, J=9.7, 5.7 Hz, 2H), 1.25 (s, 3H), 0.94 (m, 6H), 3개의 교환가능한 양성자는 관찰되지 않음. LCMS (ESI) m/e 408.2 [(M+H)+, 계산치 C24H30N3O3, 408.2]; LC/MS 체류시간 (방법 B): tR = 1.78분.
실시예 209
(S)-2,4-디메틸-1-((4-(퀴놀린-4-일)나프탈렌-1-일)옥시)펜탄-2-아민
실시예 208에 기재된 바와 같이 제조하였다. (S)-2,4-디메틸-1-((4-(퀴놀린-4-일)나프탈렌-1-일)옥시)펜탄-2-아민 (6.3 mg, 0.016 mmol, 98% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.03 (d, J=4.4 Hz, 1H), 8.44 (d, J=6.2 Hz, 1H), 8.15 (d, J=8.4 Hz, 1H), 7.78 (t, J=7.5 Hz, 1H), 7.58 (t, J=7.5 Hz, 1H), 7.52 (d, J=4.0 Hz, 1H), 7.48 - 7.43 (m, 2H), 7.43 - 7.39 (m, 1H), 7.35 (d, J=8.4 Hz, 1H), 7.20 (d, J=8.4 Hz, 1H), 7.13 (d, J=7.7 Hz, 1H), 4.00 (s, 2H), 1.90 - 1.85 (m, 1H), 1.65 - 1.50 (m, 2H), 1.29 (s, 3H), 1.01 - 0.94 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 385.2 [(M+H)+, 계산치 C26H29N2O, 385.2]; LC/MS 체류시간 (방법 B): tR = 1.70분.
실시예 210
(S)-메틸 (4-(5-((2-아미노-2,4-디메틸펜틸)옥시)피리미딘-2-일)피리딘-2-일)카르바메이트
파트 A: (S)-tert-부틸 (1-((2-클로로피리미딘-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
실시예 53, 파트 A에 기재된 바와 같이 제조하였다. (S)-tert-부틸 (1-((2-클로로피리미딘-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (25.0 mg, 0.073 mmol, 49% 수율)를 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.32 (s, 2H), 4.50 (s, 1H), 4.30 (d, J=8.5 Hz, 1H), 4.06 (d, J=8.8 Hz, 1H), 1.93 - 1.74 (m, 2H), 1.44 (dd, J=13.9, 4.9 Hz, 1H), 1.39 (s, 9H), 1.36 (s, 3H), 0.99 (dd, J=6.5, 4.5 Hz, 6H).
파트 B: (S)-메틸 (4-(5-((2-아미노-2,4-디메틸펜틸)옥시)피리미딘-2-일)피리딘-2-일)카르바메이트
디옥산 (1 mL) (탈기됨) 중 2N 탄산나트륨 용액 (0.073 mL, 0.145 mmol), 1,1'- 비스(디페닐포스핀)페로센-팔라듐(II)디클로라이드 디클로로메탄 착물 (2.97 mg, 3.64 μmol), (S)-tert-부틸 (1-((2-클로로피리미딘-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 및 (2-((메톡시카르보닐)아미노)피리딘-4-일)보론산 (0.025 g, 0.128 mmol)의 혼합물을 120℃에서 4시간 동안 가열하였다. 반응물을 에틸 아세테이트로 희석하고, 물로 3회 세척하였다. 에틸 아세테이트 층을 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 조 물질을 DCM (3 mL)으로 희석하고, TFA (2 mL, 26.0 mmol)를 실온에서 첨가하였다. 혼합물을 실온에서 0.5시간 동안 교반하였다. 용매를 감압 하에 제거하고, 조 물질을 역상 정제용 HPLC에 의해 정제하였다. (S)-메틸 (4-(5-((2-아미노-2,4-디메틸펜틸)옥시)피리미딘-2-일)피리딘-2-일)카르바메이트 (1.9 mg, 5.07 μmol, 7% 수율)를 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.76 (s, 1H), 8.73 (s, 2H), 8.39 (d, J=5.5 Hz, 1H), 7.86 (d, J=5.1 Hz, 1H), 3.96 (s, 2H), 3.71 (s, 3H), 1.86 - 1.78 (m, 1H), 1.46 - 1.36 (m, 2H), 1.15 (s, 3H), 0.94 (m, 6H), 3개의 교환가능한 양성자는 관찰되지 않았다. LCMS (ESI) m/e 360.1 [(M+H)+, 계산치 C18H26N5O3, 360.4]; LC/MS 체류시간 (방법 B): tR = 1.55분.
실시예 211
(S)-메틸 (4-(2-((2-아미노-2,4-디메틸펜틸)옥시)피리미딘-5-일)피리딘-2-일)카르바메이트
파트 A: (S)-1-((5-브로모피리미딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
포타슘 tert-부톡시드 (0.242 mL, 0.242 mmol)를 실온에서 THF (0.8 mL) 중 (S)-2-아미노-2,4-디메틸펜탄-1-올 (0.0265 g, 0.202 mmol)의 용액에 첨가하였다. 5분 후, 5-브로모-2-클로로피리미딘 (0.047 g, 0.242 mmol)을 반응 혼합물에 첨가하였다. 반응물을 실온에서 밤새 교반하였다. 반응물을 물을 첨가하여 켄칭하였다. 휘발성 물질을 감압 하에 제거하였다. 잔류물을 에틸 아세테이트 및 물로 희석하였다. 에틸 아세테이트 층을 분리하고, 수성 층을 에틸 아세테이트로 추출하였다. 에틸 아세테이트 층을 합하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (DCM 중 0에서 10% 메탄올로 용리함)를 통해 정제하였다. (S)-1-((5-브로모피리미딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (0.014 g, 0.050 mmol, 25% 수율)을 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.53 (s, 2H), 4.11 (d, J=2.8 Hz, 2H), 1.87 - 1.75 (m, 1H), 1.66 - 1.56 (m, 2H), 1.48 (dd, J=5.6, 3.9 Hz, 2H), 1.22 (s, 3H), 0.98 (m, 6H). LCMS (ESI) m/e 310.1 [(M+Na)+, 계산치 C11H18BrN3ONa, 310.1]; LC/MS 체류시간 (방법 B): tR = 1.67분.
파트 B: (S)-메틸 (4-(2-((2-아미노-2,4-디메틸펜틸)옥시)피리미딘-5-일)피리딘-2-일)카르바메이트
스즈키 반응을 실시예 193에 기재된 바와 같이 수행하였다. (S)-메틸 (4-(2-((2-아미노-2,4-디메틸펜틸)옥시)피리미딘-5-일)피리딘-2-일)카르바메이트 (8.4 mg, 0.023 mmol, 47% 수율)를 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.60 (s, 2H), 8.49 (s, 1H), 8.31 (dd, J=5.3, 0.5 Hz, 1H), 8.18 (s, 1H), 7.11 (dd, J=5.4, 1.6 Hz, 1H), 3.85 (s, 3H), 3.84 - 3.69 (m, 2H), 2.00 - 1.92 (m, 1H), 1.91 - 1.78 (m, 1H), 1.56 (dd, J=14.3, 5.0 Hz, 1H), 1.36 (s, 3H), 1.02 (d, J=6.5 Hz, 3H), 0.92 (d, J=6.5 Hz, 3H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 359.9 [(M+H)+, 계산치 C18H26N5O3, 360.2]; LC/MS 체류시간 (방법 B): tR = 1.76분.
실시예 212
(S)-2,4-디메틸-1-((2',4,6-트리메틸-[2,4'-비피리딘]-5-일)옥시)펜탄-2-아민
스즈키 반응을 실시예 193에 기재된 바와 같이 수행하였다. (S)-2,4-디메틸-1-((2',4,6-트리메틸-[2,4'-비피리딘]-5-일)옥시)펜탄-2-아민 (10.3 mg, 0.031 mmol, 57% 수율)을 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.57 (d, J=5.3 Hz, 1H), 7.75 (s, 1H), 7.62 (dd, J=5.1, 1.4 Hz, 1H), 7.46 (s, 1H), 3.66 - 3.55 (m, 2H), 2.64 (s, 3H), 2.60 (s, 3H), 2.39 (s, 3H), 2.08 (br. S, 2H); 1.88 (tt, J=12.7, 6.4 Hz, 1H), 1.54 (d, J=5.8 Hz, 2H), 1.34 (s, 3H), 1.04 (d, J=6.5 Hz, 3H), 1.02 (d, J=6.8 Hz, 3H); LCMS (ESI) m/e 328.1 [(M+H)+, 계산치 C20H30N3O, 328.2]; LC/MS 체류시간 (방법 B): tR = 1.44분.
실시예 213
(S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4,6-디메틸-[2,4'-비피리딘]-2'-일)카르바메이트
스즈키 반응을 실시예 193에 기재된 바와 같이 수행하였다. (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4,6-디메틸-[2,4'-비피리딘]-2'-일)카르바메이트 (8.0 mg, 0.021 mmol, 38% 수율)를 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.52 (br. s, 2H), 8.33 - 8.17 (m, 1H), 7.68 (dd, J=5.3, 1.5 Hz, 1H), 7.53 (s, 1H), 3.85 (s, 3H), 3.65 - 3.52 (m, 2H), 2.60 (s, 3H), 2.56 (br.s, 2H), 2.38 (s, 3H), 1.88 (dquin, J=12.7, 6.4 Hz, 1H), 1.54 (d, J=5.3 Hz, 2H), 1.34 (s, 3H), 1.04 (d, J=6.8 Hz, 3H), 1.02 (d, J=6.5 Hz, 3H); LCMS (ESI) m/e 387.1 [(M+H)+, 계산치 C21H31N4O3, 387.2]; LC/MS 체류시간 (방법 B): tR = 1.54분.
실시예 214
(S)-2,4-디메틸-1-(4-(퀴나졸린-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민
실시예 19에 기재된 바와 같이 제조하였다. (S)-2,4-디메틸-1-(4-(퀴나졸린-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민 (8.5 mg, 0.020 mmol, 19% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.34 (s, 1H), 8.17 - 8.03 (m, 5H), 7.79 (t, J=7.5 Hz, 1H), 7.47 (d, J=8.4 Hz, 1H), 3.94 (d, J=7.3 Hz, 2H), 1.85 - 1.76 (m, 1H), 1.43 (m, 2H), 1.16 (s, 3H), 0.97 - 0.89 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 404.2 [(M+H)+, 계산치 C22H25F3N3O, 404.4]; LC/MS 체류시간 (방법 B): tR = 2.01분.
실시예 215
(S)-1-(4-(3,6-디히드로-2H-피란-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
파트 A: 3,6-디히드로-2H-피란-4-일 트리플루오로메탄술포네이트
KHMDS (6.66 mL, 3.33 mmol)를 -78℃에서 디히드로-2H-피란-4(3H)-온 (0.2224 g, 2.221 mmol) 및 1,1,1-트리플루오로-N-페닐-N-((트리플루오로메틸)술포닐)메탄술폰아미드 (0.952 g, 2.67 mmol)의 THF (7 mL) 용액에 첨가하였다. 반응물을 30분 동안 교반하였다. 반응물을 디에틸 에테르로 희석하고, 물 (3x)로 세척하였다. 디에틸 에테르 층을 분리하고, 건조 (Na2SO4)시키고, 여과하고, 농축시켰다. 조 물질을 추가 정제 없이 사용하였다.
파트 B: (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트
1,4-디옥산 (100 mL) 중 (S)-tert-부틸 (1-(4-브로모-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (6.5 g, 14.31 mmol), 비스(피나콜레이토)디보론 (7.27 g, 28.6 mmol), 아세트산칼륨 (4.21 g, 42.9 mmol)의 용액을 아르곤으로 5분 동안 퍼징하였다. PdCl2 (dppf)-CH2Cl2 부가물 (1.168 g, 1.431 mmol)을 반응 혼합물에 아르곤 하에 첨가하고, 84℃에서 14시간 동안 가열하였다. 반응 혼합물을 셀라이트를 통해 여과하고, 셀라이트 층을 에틸 아세테이트 (200 mL)로 세척하였다. 유기 층을 물 (100 mL)로 세척하였다. 수성 층을 에틸 아세테이트 (2X100 mL)로 재추출하였다. 유기 층을 수집하고, 염수로 세척하고, Na2SO4 상에서 건조시키고, 농축시켜 조 (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트를 수득하였다. 조 생성물을 회백색 50 mL DCM 중에 용해시키고, 실리카 겔 (60-120) 상에 흡착시키고, 실리카 겔 크로마토그래피 (에틸 아세테이트/헥산 0-15%)에 의해 정제하여 (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (6.01 g, 11.99 mmol, 84% 수율)를 회백색 반고체로서 수득하였다. 1H NMR (400 MHz, DMSO-d6): δ 7.87-7.90 (m, 1H), 7.80 (s, 1H), 7.21 (d, J = 8.40 Hz, 1H), 6.53 (s, 1H), 4.07-4.25 (m, 2H), 1.70-1.79 (m, 2H), 1.45-1.50 (m, 1H), 1.26-1.35 (m, 9H), 1.08-1.20 (m, 12H), 0.82-0.91 (m, 6H) ppm.
파트 C: (S)-1-(4-(3,6-디히드로-2H-피란-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
디옥산 (2 mL) (탈기됨) 중 2N 탄산나트륨 용액 (0.106 mL, 0.212 mmol), 1,1'- 비스(디페닐포스핀)페로센-팔라듐(II)디클로라이드 디클로로메탄 착물 (6.06 mg, 7.42 μmol), 3,6-디히드로-2H-피란-4-일 트리플루오로메탄술포네이트 (98 mg, 0.424 mmol) 및 (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (53.1 mg, 0.106 mmol)의 혼합물을 120℃에서 5시간 동안 가열하였다. 반응물을 에틸 아세테이트로 희석하고, 물로 3회 세척하였다. 에틸 아세테이트 층을 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 DCM (3 mL)으로 희석하고, TFA (2 mL, 26.0 mmol)를 실온에서 첨가하였다. 반응물을 실온에서 0.5시간 동안 교반하였다. 용매를 감압 하에 제거하고, 잔류물을 역상 정제용 HPLC에 의해 정제하여 (S)-1-(4-(3,6-디히드로-2H-피란-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (2.7 mg, 0.213 mmol, 3 단계에 걸쳐 7% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 7.69 (d, J=8.4 Hz, 1H), 7.61 (s, 1H), 7.20 (d, J=8.4 Hz, 1H), 6.24 (m, 1H), 4.21 (d, J=2.6 Hz, 2H), 3.83 - 3.79 (m, 4H), 2.42 (br. s., 2H), 1.80 - 1.72 (m, 1H), 1.42 - 1.37 (m, 2H), 1.12 (s, 3H), 0.89 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 358.3 [(M+H)+, 계산치 C19H27F3NO2, 358.2]; LC/MS 체류시간 (방법 B): tR = 1.99분.
실시예 216
(S)-2,4-디메틸-1-(4-(2-메틸퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민
디옥산 (1 mL) (탈기됨) 중 2N 탄산나트륨 용액 (0.157 mL, 0.314 mmol), 1,1'- 비스(디페닐포스핀)페로센-팔라듐(II)디클로라이드 디클로로메탄 착물 (8.97 mg, 10.99 μmol), (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (0.079 g, 0.157mmol) (실시예 215, 파트 B에서와 같이 제조됨) 및 4-클로로-2-메틸퀴놀린 (0.05 ml, 0.248 mmol)의 혼합물을 120℃에서 5시간 동안 가열하였다. 반응물을 에틸 아세테이트로 희석하고, 물로 3회 세척하였다. 에틸 아세테이트 층을 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 DCM (3 mL)으로 희석하고, 실온에서 TFA (2 mL, 26.0 mmol)를 첨가하였다. 반응물을 실온에서 0.5시간 동안 교반하였다. 용매를 감압 하에 제거하고, 이 물질을 역상 HPLC/MS에 의해 정제하여 (S)-2,4-디메틸-1-(4-(2-메틸퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민 (14.8 mg, 0.035 mmol, 22% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.02 (d, J=8.4 Hz, 1H), 7.83 - 7.73 (m, 4H), 7.55 (t, J=7.5 Hz, 1H), 7.44 - 7.41 (m, 2H), 3.94 - 3.87 (m, 2H), 3.47 (br. s., 2H), 2.70 (s, 3H), 1.87 - 1.79 (m, 1H), 1.42 (d, J=5.5 Hz, 2H), 1.15 (s, 3H), 0.95 (d, J=2.9 Hz, 3H), 0.93 (d, J=2.9 Hz, 3H); LCMS (ESI) m/e 417.3 [(M+H)+, 계산치 C24H28F3N2O, 417.2]; LC/MS 체류시간 (방법 B): tR = 2.26분.
실시예 217
(S)-1-(4-(6-클로로퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
파트 A: 4-브로모-6-클로로퀴놀린
20 mL 마이크로웨이브 튜브에 실온에서 4,7-디클로로퀴놀린 (0.3315 g, 1.674 mmol) 및 프로피오니트릴 (3 mL)에 이어서 TMS-Br (0.434 ml, 3.35 mmol)을 첨가하였다. 침전물이 형성되었다. 튜브를 밀봉하고, 100℃로 16시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시킨 다음, 빙냉 NaOH (1N, 3 mL)에 붓고, 튜브를 물로 헹구었다. 수성 층을 디에틸 에테르 (3x5 mL)로 추출하였다. 디에틸 에테르 층을 합하고, 건조 (Na2SO4)시키고, 여과하고, 농축시켜 조 생성물을 황색 고체로서 수득하였다. 물질을 실리카 겔 크로마토그래피 (헥산 중 EtOAc)에 의해 정제하여 4-브로모-6-클로로퀴놀린 (300 mg, 1.126 mmol, 67% 수율)을 연황색 고체로서 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.70 (d, J=4.6 Hz, 1H), 8.17 (d, J=8.8 Hz, 1H), 8.14 (d, J=2.0 Hz, 1H), 7.73 (d, J=4.6 Hz, 1H), 7.63 (dd, J=9.0, 2.0 Hz, 1H).
파트 B: 6-클로로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)퀴놀린
1,4-디옥산 (0.5 mL) 중 아세트산칼륨 (0.136 g, 1.382 mmol), 4-브로모-7-클로로퀴놀린 (0.1117 g, 0.461 mmol), 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란) (0.140 g, 0.553 mmol)의 혼합물을 질소로 10분 동안 퍼징하였다. PdCl2(dppf) (10.11 mg, 0.014 mmol)를 반응 혼합물에 실온에서 첨가하고, 반응물을 80℃에서 5시간 동안 가열하였다. 반응물을 실온으로 냉각시키고 정량적 수율로 가정하여 이를 정제 없이 사용하였다. LCMS (ESI) m/e 290.1 [(M+H)+, 계산치 C15H18BclNO2, 290.1]; LC/MS 체류시간 (방법 B): tR = 1.17분.
파트 C: (S)-1-(4-(6-클로로퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
실시예 19에서 기재된 바와 같이 제조하였다. (S)-1-(4-(6-클로로퀴놀린-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (3.9 mg, 8.66 μmol, 7% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.98 (d, J=4.4 Hz, 1H), 8.16 (d, J=8.8 Hz, 1H), 7.85 (dd, J=9.0, 2.4 Hz, 2H), 7.79 (d, J=2.6 Hz, 2H), 7.59 (d, J=4.4 Hz, 1H), 7.45 (d, J=8.8 Hz, 1H), 3.97 - 3.89 (m, 2H), 1.83 (dt, J=12.7, 6.1 Hz, 1H), 1.43 (d, J=4.8 Hz, 2H), 1.16 (s, 3H), 0.94 (m, 6H); LCMS (ESI) m/e 419.9 [(M-NH2)+, 계산치 C23H22ClF3NO, 420.1]; LC/MS 체류시간 (방법 B): tR = 2.07분.
실시예 218
(S)-1-((5-(5,7-디플루오로퀴놀린-4-일)-3-(트리플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: 5-브로모-3-(트리플루오로메틸)피리딘-2-올
NBS (2.334 g, 13.11 mmol)를 THF (15 mL) 중 3-(트리플루오로메틸)피리딘-2-올 (1.6449 g, 10.09 mmol)의 용액에 실온에서 조금씩 첨가하였다. 반응물을 실온에서 주말 동안 교반하였다. 반응물을 에틸 아세테이트로 희석하고, 물로 3회 세척하였다. 에틸 아세테이트 층을 분리하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켜 조 5-브로모-3-(트리플루오로메틸)피리딘-2-올 (2.12 g, 6.57 mmol, 65% 수율)을 황색 고체로서 수득하였다. 물질을 추가 정제 없이 사용하였다. LCMS (ESI) m/e 241.8 [(M+H)+, 계산치 C6H4BrF3NO, 241.9]; LC/MS 체류시간 (방법 B): tR = 1.57분.
파트 B: (S)-tert-부틸 (1-((5-브로모-3-(트리플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
DMF (2 mL) 중 탄산칼륨 (0.113 g, 0.814 mmol), (S)-tert-부틸 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (0.1593 g, 0.543 mmol) 및 5-브로모-3-(트리플루오로메틸)피리딘-2-올 (0.197 g, 0.814 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 반응물을 에틸 아세테이트로 희석하고, 물로 3회 세척하였다. 에틸 아세테이트 층을 분리하고, 건조 (Na2SO4)시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (헥산 중 0에서 10% 에틸 아세테이트를 사용하여 용리함)에 의해 정제하여 (S)-tert-부틸 (1-((5-브로모-3-(트리플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.059 g, 0.111 mmol, 20% 수율)를 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.34 (d, J=2.5 Hz, 1H), 7.95 (d, J=2.5 Hz, 1H), 4.59 - 4.52 (m, 2H), 4.39 (d, J=10.3 Hz, 1H), 1.89 - 1.72 (m, 2H), 1.54 (d, J=8.8 Hz, 1H), 1.39 (s, 9H), 1.37 (s, 3H), 0.97 (m, 6H); 19F NMR (376MHz, 클로로포름-d) δ -64.11 (s, 3F). LCMS (ESI) m/e 476.9 [(M+Na)+, 계산치 C18H26BrF3N2O3Na, 477.1]; LC/MS 체류시간 (방법 B): tR = 2.54분.
파트 C: (S)-tert-부틸 (1-((5-(5,7-디플루오로퀴놀린-4-일)-3-(트리플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
실시예 193에 기재된 바와 같이 제조하였다. (S)-tert-부틸 (1-((5-(5,7-디플루오로퀴놀린-4-일)-3-(트리플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (26.0 mg, 0.048 mmol, 80% 수율)를 수득하였다. LCMS (ESI) m/e 540.2 [(M+H)+, 계산치 C27H31F5N3O3, 540.2]; LC/MS 체류시간 (방법 B): tR = 2.53분.
파트 D: (S)-1-((5-(5,7-디플루오로퀴놀린-4-일)-3-(트리플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
TFA 탈보호를 실시예 32에 기재된 바와 같이 수행하였다. (S)-1-((5-(5,7-디플루오로퀴놀린-4-일)-3-(트리플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (12.5 mg, 0.025 mmol, 56% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.34 (s, 1H), 8.17 - 8.03 (m, 5H), 7.79 (t, J=7.5 Hz, 1H), 7.47 (d, J=8.4 Hz, 1H), 3.94 (d, J=7.3 Hz, 2H), 1.85 - 1.76 (m, 1H), 1.43 (m, 2H), 1.16 (s, 3H), 0.97 - 0.89 (m, 6H). LCMS (ESI) m/e 440.1 [(M+H)+, 계산치 C22H23F5N3O, 440.2]; LC/MS 체류시간 (방법 B): tR = 2.04분.
실시예 219
(S)-2,4-디메틸-1-((5-(퀴놀린-4-일)-3-(트리플루오로메틸)피리딘-2-일)옥시)펜탄-2-아민
실시예 218에 기재된 바와 같이 제조하였다. (S)-2,4-디메틸-1-((5-(퀴놀린-4-일)-3-(트리플루오로메틸)피리딘-2-일)옥시)펜탄-2-아민 (6.1 mg, 0.015 mmol, 60% 수율)을 회백색 고체로서 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.99 (d, J=4.4 Hz, 1H), 8.63 (s, 1H), 8.31 (s, 1H), 8.14 (d, J=8.4 Hz, 1H), 7.88 - 7.82 (m, 2H), 7.66 (t, J=7.5 Hz, 1H), 7.60 (d, J=4.4 Hz, 1H), 4.25 - 4.18 (m, 2H), 1.84 (dt, J=12.7, 6.1 Hz, 1H), 1.42 (d, J=5.5 Hz, 2H), 1.15 (s, 3H), 0.94 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 404.0 [(M+H)+, 계산치 C22H25F3N3O, 404.4]; LC/MS 체류시간 (방법 B): tR = 1.77분.
실시예 220
(S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-(트리플루오로메틸)-[3,4'-비피리딘]-2'-일)카르바메이트
실시예 218에 기재된 바와 같이 제조하였다. (S)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-(트리플루오로메틸)-[3,4'-비피리딘]-2'-일)카르바메이트 (13.8 mg, 0.032 mmol, 96% 수율)를 회백색 고체로서 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 10.35 (br. s., 1H), 8.79 (s, 1H), 8.38 - 8.32 (m, 2H), 8.11 (s, 1H), 7.48 (d, J=5.1 Hz, 1H), 4.17 (q, J=10.3 Hz, 2H), 3.38 (br. s., 3H), 1.85 - 1.74 (m, 1H), 1.38 (d, J=5.5 Hz, 2H), 1.11 (s, 3H), 0.91 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 427.0 [(M+H)+, 계산치 C20H26F3N4O3, 427.2]; LC/MS 체류시간 (방법 B): tR = 1.84분.
실시예 221
(S)-2,4-디메틸-1-((2'-메틸-5-(트리플루오로메틸)-[3,4'-비피리딘]-6-일)옥시)펜탄-2-아민
실시예 218에 기재된 바와 같이 제조하였다. (S)-2,4-디메틸-1-((2'-메틸-5-(트리플루오로메틸)-[3,4'-비피리딘]-6-일)옥시)펜탄-2-아민 (4.6 mg, 0.012 mmol, 68% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.87 (s, 1H), 8.52 (d, J=5.1 Hz, 1H), 8.46 (s, 1H), 7.72 (s, 1H), 7.62 (d, J=4.0 Hz, 1H), 4.16 (q, J=10.1 Hz, 2H), 2.54 (s, 3H), 1.84 - 1.75 (m, 1H), 1.37 (d, J=5.5 Hz, 2H), 1.10 (s, 3H), 0.91 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 368.0 [(M+H)+, 계산치 C19H25F3N3O, 368.2]; LC/MS 체류시간 (방법 B): tR = 1.57분.
실시예 222
(S)-1-((5-(6-클로로퀴놀린-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: 4-브로모-6-클로로퀴놀린
20 mL 마이크로웨이브 튜브에 실온에서 4,6-디클로로퀴놀린 (0.3446 g, 1.740 mmol) 및 프로피오니트릴 (1ml)에 이어서 TMS-Br (0.451 ml, 3.48 mmol)을 첨가하였다. 침전물이 형성되었다. 튜브를 밀봉하고, 100℃로 밤새 가열하였다. 반응물을 실온으로 냉각시켰다. 조 물질을 냉각 NaOH(1N, 3 mL) 용액에 붓고, 튜브를 물로 세척하였다. 수층을 디에틸 에테르로 3회 추출하였다. 디에틸 에테르 층을 합하고, 건조 (Na2SO4)시키고, 여과하고, 농축시켜 4-브로모-6-클로로퀴놀린 (0.322 g, 1.33 mmol, 76% 수율)을 황색 고체로서 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.68 (d, J=4.8 Hz, 1H), 8.21 (d, J=2.3 Hz, 1H), 8.07 (d, J=8.8 Hz, 1H), 7.76 - 7.70 (m, 2H). LCMS (ESI) m/e 243.7 [(M+H)+, 계산치 C9H5BrNCl,243.5]; LC/MS 체류시간 (방법 B): tR = 2.07분.
파트 B: 7-클로로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)퀴놀린
1,4-디옥산 (0.5 mL) 중 아세트산칼륨 (0.136 g, 1.382 mmol), 4-브로모-7-클로로퀴놀린 (0.1117 g, 0.461 mmol), 및 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란) (0.140 g, 0.553 mmol)의 혼합물을 질소로 10분 동안 퍼징하였다. PdCl2(dppf) (10.11 mg, 0.014 mmol)를 첨가하고, 반응물을 80℃에서 5시간 동안 가열하였다. 반응물을 실온으로 냉각시키고 정량적 수율로 가정하여 추가 정제 없이 사용하였다. LCMS (ESI) m/e 207.9 [(M-NH2)+, 계산치 C9H7BNClO2, 207.0]; LC/MS 체류시간 (방법 B): tR = 1.21분.
파트 C: (S)-1-((5-(6-클로로퀴놀린-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
중간체 (S)-1-((5-브로모-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민을 실시예 52, 파트 A에서와 같이 제조하였다. 스즈키 반응을 실시예 193에 기재된 바와 같이 수행하였다. (S)-1-((5-(6-클로로퀴놀린-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (56.7 mg, 0.143 mmol, 2 단계에 걸쳐 26% 수율)을 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.94 (d, J=4.5 Hz, 1H), 8.14 (d, J=9.0 Hz, 1H), 8.08 (d, J=1.8 Hz, 1H), 7.82 (d, J=2.3 Hz, 1H), 7.69 (dd, J=8.8, 2.3 Hz, 1H), 7.57 - 7.54 (m, 1H), 7.32 (d, J=4.5 Hz, 1H), 4.64 - 4.42 (m, 2H), 1.93 - 1.75 (m, 3H), 1.54 (s, 3H), 1.03 (d, J=6.3 Hz, 3H), 1.01 (d, J=6.3 Hz, 3H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 366.9 [(M-NH2)+, 계산치 C22H24N2ClO, 367.2]; LC/MS 체류시간 (방법 B): tR = 1.88분.
실시예 223
(S)-1-((5-(6-플루오로퀴놀린-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 193에 기재된 바와 같이 제조하였다. (S)-1-((5-(6-플루오로퀴놀린-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (9.7 mg, 0.026 mmol, 14% 수율)을 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.92 (d, J=4.5 Hz, 1H), 8.31 - 8.16 (m, 1H), 8.12 (d, J=2.0 Hz, 1H), 7.61 - 7.49 (m, 3H), 7.34 (d, J=4.3 Hz, 1H), 4.27 - 4.18 (m, 2H), 2.35 (s, 3H), 1.93 - 1.78 (m, 1H), 1.63 - 1.49 (m, 2H), 1.29 (s, 3H), 1.03 (d, J=6.8 Hz, 3H), 1.01 (d, J=6.8 Hz, 3H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 368.2 [(M+H)+, 계산치 C22H27N3FO, 368.2]; LC/MS 체류시간 (방법 B): tR = 1.78분.
실시예 224
(S)-1-((5-(5,7-디플루오로퀴놀린-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((5-브로모-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
실시예 53, 파트 A에 기재된 바와 같이 제조하였다. (S)-1-((5-(5,7-디플루오로퀴놀린-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (3.06 g, 7.32 mmol, 86% 수율)을 수득하였다. LCMS (ESI) m/e 422.9 [(M+Na)+, 계산치 C18H29BrN2O3Na, 423.1]; LC/MS 체류시간 (방법 B): tR = 2.48분.
파트 B: (S)-tert-부틸 (1-((5-(5,7-디플루오로퀴놀린-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
스즈키 반응을 실시예 193에 기재된 바와 같이 수행하였다. (S)-tert-부틸 (1-((5-(5,7-디플루오로퀴놀린-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (43.8 mg, 0.090 mmol, 59% 수율)를 수득하였다. LCMS (ESI) m/e 486.1 [(M+H)+, 계산치 C27H34N3F2O3, 486.3]; LC/MS 체류시간 (방법 B): tR = 2.44분.
파트 C: (S)-1-((5-(5,7-디플루오로퀴놀린-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
TFA 탈보호를 실시예 32에 기재된 바와 같이 수행하였다. (S)-1-((5-(5,7-디플루오로퀴놀린-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (33.9 mg, 0.088 mmol, 98% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.00 (d, J=4.4 Hz, 1H), 8.10 (s, 1H), 7.79 (d, J=9.5 Hz, 1H), 7.75 (br. s., 1H), 7.61 - 7.52 (m, 1H), 7.45 (d, J=4.4 Hz, 1H), 4.45 - 4.31 (m, 2H), 2.33 (s, 3H), 1.89 - 1.74 (m, 2H), 1.66 (dd, J=14.1, 5.3 Hz, 1H), 1.42 (s, 3H), 0.98 (d, J=6.6 Hz, 3H), 0.94 (d, J=6.6 Hz, 3H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 386.3 [(M+H)+, 계산치 C22H26N3F2O, 386.2]; LC/MS 체류시간 (방법 B): tR = 1.84분.
실시예 225
(S)-1-((5-(7-클로로퀴놀린-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 193에 기재된 바와 같이 제조하였다. (S)-1-((5-(7-클로로퀴놀린-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (22.5 mg, 0.058 mmol, 51% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.98 (d, J=4.4 Hz, 1H), 8.17 (s, 2H), 7.96 - 7.91 (m, 1H), 7.81 (s, 1H), 7.66 (dd, J=9.0, 2.0 Hz, 1H), 7.53 (d, J=4.4 Hz, 1H), 4.15 - 4.07 (m, 2H), 2.30 (s, 3H), 1.87 - 1.79 (m, 1H), 1.45 (t, J=6.4 Hz, 2H), 1.17 (s, 3H), 0.95 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 384.3 [(M+H)+, 계산치 C22H27N3ClO, 384.2]; LC/MS 체류시간 (방법 B): tR = 1.98분.
실시예 226
(S)-1-((6-(5,7-디플루오로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-1-((6-클로로-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
CH2Cl2 (4 mL) 중 TFA (0.4 mL, 5.19 mmol) 및 (S)-tert-부틸 (1-((6-클로로-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.064 g, 0.179 mmol, 0.179 mmol)의 혼합물을 실온에서 4시간 동안 교반하였다. LCMS는 (S)-1-((6-클로로-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민으로의 완전한 전환을 나타내었다. 용매를 진공에 의해 제거하고, 이 물질을 추가 정제 없이 사용하였다. LCMS (ESI) m/e 257.1 [(M+H)+, 계산치 C13H22ClN2O, 257.1]; LC/MS 체류시간 (방법 B): tR = 1.64분.
파트 B: (S)-1-((6-(5,7-디플루오로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (S)-1-((6-(5,7-디플루오로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (12.2 mg, 0.031 mmol, 43% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.01 (d, J=4.4 Hz, 1H), 8.30 (s, 1H), 7.78 (d, J=8.8 Hz, 1H), 7.53 (br. s., 1H), 7.49 (d, J=4.4 Hz, 1H), 7.47 (s, 1H), 3.94 (s, 2H), 2.31 (s, 3H), 1.88 - 1.80 (m, 1H), 1.48 (dd, J=13.0, 5.3 Hz, 2H), 1.20 (s, 3H), 0.95 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 386.0 [(M+H)+, 계산치 C22H26F2N3O, 386.2]; LC/MS 체류시간 (방법 B): tR = 1.79분.
실시예 227
(S)-1-((6-(7-플루오로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 226에 기재된 바와 같이 제조하였다. (S)-1-((6-(7-플루오로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (6.0 mg, 0.016 mmol, 63% 수율)을 수득하였다. 1H NMR (400MHz, DMSO-d6) δ 8.98 (d, J=4.5 Hz, 1H), 8.47 (s, 1H), 8.34 (dd, J=9.3, 6.3 Hz, 1H), 7.82 (dd, J=10.3, 2.8 Hz, 1H), 7.67 (s, 1H), 7.59 (d, J=4.5 Hz, 1H), 7.55 (td, J=8.9, 2.8 Hz, 1H), 4.10 (s, 2H), 2.37 (s, 3H), 1.86 - 1.78 (m, 1H), 1.63 (br. s., 1H), 1.57 - 1.50 (m, 1H), 1.30 (s, 3H), 0.95 (dd, J=11.7, 6.7 Hz, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 368.0 [(M+H)+, 계산치 C22H27FN3O, 368.2]; LC/MS 체류시간 (방법 B): tR = 1.67분.
실시예 228
(S)-1-((2',4-디메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((2',4-디메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. 조 물질을 후속 반응에 정제 없이 사용하였다. LCMS (ESI) m/e 414.0 [(M+H)+, 계산치 C24H36N3O3, 414.3]; LC/MS 체류시간 (방법 B): tR = 2.02분.
파트 B: (S)-1-((2',4-디메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 TFA 탈보호하였다. (S)-1-((2',4-디메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (2.2 mg, 6.95 μmol, 2 단계에 걸쳐 17% 수율)을 수득하였다. 1H NMR (600MHz, DMSO-d6) δ 8.50 (d, J=5.1 Hz, 1H), 8.34 (s, 1H), 7.96 (s, 1H), 7.86 (s, 1H), 7.78 (d, J=5.1 Hz, 1H), 3.88 (br. s., 2H), 2.54 (s, 3H), 2.31 (s, 3H), 1.82 (br. s., 1H), 1.45 - 1.38 (m, 2H), 1.15 (s, 3H), 0.93 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 314.1 [(M+H)+, 계산치 C19H28N3O, 314.2]; LC/MS 체류시간 (방법 B): tR = 1.50분.
실시예 229
(S)-1-((6-(6-클로로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((6-(6-클로로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. 조 물질을 후속 반응에 정제 없이 사용하였다. LCMS (ESI) m/e 483.9 [(M+H)+, 계산치 C27H35ClN3O3, 484.2]; LC/MS 체류시간 (방법 B): tR = 2.24분.
파트 B: (S)-1-((6-(6-클로로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 TFA 탈보호하였다. (S)-1-((6-(6-클로로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (6.8 mg, 0.017 mmol, 2 단계에 걸쳐 16% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.00 (d, J=4.4 Hz, 1H), 8.48 (s, 1H), 8.40 (d, J=2.2 Hz, 1H), 8.12 (d, J=9.2 Hz, 1H), 7.82 (dd, J=8.8, 2.2 Hz, 1H), 7.71 (s, 1H), 7.69 (d, J=4.8 Hz, 1H), 3.95 (s, 2H), 2.35 (s, 3H), 1.84 (d, J=6.2 Hz, 1H), 1.45 (t, J=6.6 Hz, 2H), 1.18 (s, 3H), 0.95 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 383.9 [(M+H)+, 계산치 C22H27ClN3O, 384.2]; LC/MS 체류시간 (방법 B): tR = 1.81분.
실시예 230
(S)-1-((6-(6-플루오로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((6-(6-플루오로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (S)-tert-부틸 (1-((6-(6-플루오로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (33.2 mg, 0.035 mmol, 35% 수율)를 수득하였다. LCMS (ESI) m/e 468.2 [(M+H)+, 계산치 C27H35FN3O3, 468.3]; LC/MS 체류시간 (방법 B): tR = 2.22분.
파트 B: (S)-1-((6-(6-플루오로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 TFA 탈보호하였다. (S)-1-((6-(6-플루오로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (21.7 mg, 0.058 mmol, 82% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.98 (d, J=4.4 Hz, 1H), 8.53 (s, 1H), 8.18 (dd, J=9.2, 5.5 Hz, 1H), 8.07 (dd, J=11.0, 2.9 Hz, 1H), 7.73 (s, 2H), 7.69 (d, J=4.4 Hz, 1H), 4.15 (d, J=4.4 Hz, 2H), 2.39 (s, 3H), 1.89 - 1.81 (m, 1H), 1.66 (d, J=5.1 Hz, 1H), 1.56 (dd, J=14.1, 5.3 Hz, 1H), 1.33 (s, 3H), 0.99 (d, J=6.6 Hz, 3H), 0.96 (d, J=6.6 Hz, 3H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 368.2 [(M+H)+, 계산치 C22H27FN3O, 368.2]; LC/MS 체류시간 (방법 B): tR = 1.67분.
실시예 231
(S)-1-((6-(7-클로로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((6-(7-클로로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. 조 물질을 후속 반응에 정제 없이 사용하였다. LCMS (ESI) m/e 484.2 [(M+H)+, 계산치 C27H35ClN3O3, 484.2]; LC/MS 체류시간 (방법 B): tR = 2.32분.
파트 B: (S)-1-((6-(7-클로로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 TFA 탈보호하였다. (S)-tert-부틸 (1-((6-(7-클로로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (15.5 mg, 0.039 mmol, 2 단계에 걸쳐 34% 수율)를 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.98 (d, J=4.4 Hz, 1H), 8.53 (s, 1H), 8.18 (dd, J=9.2, 5.5 Hz, 1H), 8.07 (dd, J=11.0, 2.9 Hz, 1H), 7.73 (s, 2H), 7.69 (d, J=4.4 Hz, 1H), 4.15 (d, J=4.4 Hz, 2H), 2.39 (s, 3H), 1.89 - 1.81 (m, 1H), 1.66 (d, J=5.1 Hz, 1H), 1.56 (dd, J=14.1, 5.3 Hz, 1H), 1.33 (s, 3H), 0.99 (d, J=6.6 Hz, 3H), 0.96 (d, J=6.6 Hz, 3H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 384.1 [(M+H)+, 계산치 C22H27ClN3O, 384.2]; LC/MS 체류시간 (방법 B): tR = 1.84분.
실시예 232
(S)-1-((6-(7-플루오로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((6-(7-플루오로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (S)-tert-부틸 (1-((6-(7-플루오로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (56 mg, 0.055 mmol, 27% 수율)를 수득하였다. LCMS (ESI) m/e 468.0 [(M+H)+, 계산치 C27H35FN3O3, 468.3]; LC/MS 체류시간 (방법 B): tR = 2.24분.
파트 B: (S)-1-((6-(7-플루오로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 TFA 탈보호하였다. (S)-1-((6-(7-플루오로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (36.4 mg, 0.095 mmol, 89% 수율)을 수득하였다. 1H NMR (400MHz, DMSO-d6) δ 8.98 (d, J=4.5 Hz, 1H), 8.47 (s, 1H), 8.34 (dd, J=9.3, 6.3 Hz, 1H), 7.82 (dd, J=10.3, 2.8 Hz, 1H), 7.67 (s, 1H), 7.59 (d, J=4.5 Hz, 1H), 7.55 (td, J=8.9, 2.8 Hz, 1H), 4.10 (s, 2H), 2.37 (s, 3H), 1.86 - 1.78 (m, 1H), 1.63 (br. s., 1H), 1.57 - 1.50 (m, 1H), 1.30 (s, 3H), 0.95 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 368.0 [(M+H)+, 계산치 C22H27FN3O, 368.2]; LC/MS 체류시간 (방법 B): tR = 1.67분.
실시예 233
(S)-1-((4-클로로-6-(5,7-디플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((4-클로로-6-(5,7-디플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (S)-tert-부틸 (1-((4-클로로-6-(5,7-디플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (50.6 mg, 0.062 mmol, 62% 수율)를 수득하였다. LCMS (ESI) m/e 506.2 [(M+H)+, 계산치 C26H31ClF2N3O3, 506.2]; LC/MS 체류시간 (방법 B): tR = 2.43분.
파트 B: (S)-1-((4-클로로-6-(5,7-디플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 TFA 탈보호하였다. (S)-1-((4-클로로-6-(5,7-디플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (16.2 mg, 0.040 mmol, 40% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.04 (d, J=4.4 Hz, 1H), 8.55 (s, 1H), 7.88 (s, 1H), 7.81 (d, J=9.5 Hz, 1H), 7.61 - 7.53 (m, 2H), 4.04 (s, 2H), 1.88 - 1.77 (m, 1H), 1.52 - 1.40 (m, 2H), 1.20 (s, 3H), 0.95 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 406.1 [(M+H)+, 계산치 C21H23ClF2N3O, 406.1]; LC/MS 체류시간 (방법 A): tR = 1.82분.
실시예 234
(S)-1-((4-클로로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((4-클로로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (S)-tert-부틸 (1-((4-클로로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (24.6 mg, 0.059 mmol, 25% 수율)를 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.72 (br. s., 2H), 8.41 (s, 1H), 7.83 (s, 3H), 4.59 (s, 1H), 4.41 (d, J=8.8 Hz, 1H), 4.21 (d, J=8.8 Hz, 1H), 1.95 - 1.80 (m, 2H), 1.56 (dd, J=13.9, 4.9 Hz, 1H), 1.44 (s, 3H), 1.40 (s, 9H), 1.01 (m, 6H). LCMS (ESI) m/e 420.2 [(M+H)+, 계산치 C22H31ClN3O3, 420.2]; LC/MS 체류시간 (방법 A): tR = 2.07분.
파트 B: (S)-1-((4-클로로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 TFA 탈보호하였다. (S)-1-((4-클로로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (7.2 mg, 0.022 mmol, 96% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.68 (d, J=5.9 Hz, 2H), 8.64 (s, 1H), 8.35 (s, 1H), 8.04 (d, J=5.9 Hz, 2H), 4.18 (s, 2H), 1.85 - 1.77 (m, 1H), 1.66 - 1.60 (m, 1H), 1.52 (dd, J=14.1, 5.3 Hz, 1H), 1.29 (s, 3H), 0.95 (d, J=6.6 Hz, 3H), 0.93 (d, J=6.6 Hz, 3H); LCMS (ESI) m/e 303.1 [(M-NH2)+, 계산치 C17H20ClN2O, 303.1]; LC/MS 체류시간 (방법 B): tR = 1.44분.
실시예 235
(S)-1-((4-클로로-6-(6-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((4-클로로-6-(6-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (S)-tert-부틸 (1-((4-클로로-6-(6-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (62.0 mg, 0.109 mmol, 45% 수율)를 수득하였다. LCMS (ESI) m/e 488.2 [(M+H)+, 계산치 C26H32ClFN3O3, 488.2]; LC/MS 체류시간 (방법 B): tR = 2.37분.
파트 B: (S)-1-((4-클로로-6-(6-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 TFA 탈보호하였다. (S)-1-((4-클로로-6-(6-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (42.3 mg, 0.109 mmol, 86% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.99 (d, J=4.4 Hz, 1H), 8.76 (s, 1H), 8.19 (dd, J=9.2, 5.9 Hz, 1H), 8.07 (s, 1H), 8.03 (dd, J=11.0, 2.9 Hz, 1H), 7.77 - 7.71 (m, 2H), 4.30 (s, 2H), 1.86 (dt, J=12.5, 6.2 Hz, 1H), 1.77 - 1.69 (m, 1H), 1.60 (dd, J=14.1, 5.7 Hz, 1H), 1.37 (s, 3H), 0.97 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 388.1 [(M+H)+, 계산치 C21H24ClFN3O, 388.2]; LC/MS 체류시간 (방법 B): tR = 1.75분.
실시예 236
(S)-1-((4-클로로-6-(퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 233에 기재된 바와 같이 제조하였다. (S)-1-((4-클로로-6-(퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (2.6 mg, 6.82 μmol, 16% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.00 (d, J=4.4 Hz, 1H), 8.70 (s, 1H), 8.21 (d, J=8.4 Hz, 1H), 8.12 (d, J=8.4 Hz, 1H), 8.00 (s, 1H), 7.82 (t, J=7.3 Hz, 1H), 7.69 - 7.56 (m, 2H), 4.09 (s, 2H), 1.86 (dt, J=13.0, 6.3 Hz, 1H), 1.49 (qd, J=13.9, 5.5 Hz, 2H), 1.22 (s, 3H), 0.96 (t, J=6.8 Hz, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 370.0 [(M+H)+, 계산치 C21H25ClN3O, 370.2]; LC/MS 체류시간 (방법 B): tR = 1.75분.
실시예 237
(S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4-클로로-[2,4'-비피리딘]-2'-일)카르바메이트
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-4-클로로-[2,4'-비피리딘]-2'-일)카르바메이트 (8.1 mg, 0.020 mmol, 35% 수율)를 수득하였다. 1H NMR (600MHz, DMSO-d6) δ 8.59 (s, 1H), 8.52 (s, 1H), 8.34 (d, J=5.5 Hz, 1H), 8.19 (s, 1H), 7.67 (d, J=5.5 Hz, 1H), 4.01 - 3.96 (m, 2H), 3.71 (s, 3H), 1.85 - 1.77 (m, 1H), 1.45 - 1.36 (m, 2H), 1.17 - 1.12 (m, 3H), 0.95 - 0.89 (m, 6H), 3개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 393.0 [(M+H)+, 계산치 C19H26ClN4O3, 393.2]; LC/MS 체류시간 (방법 B): tR = 1.63분.
실시예 238
(S)-1-((4-클로로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((4-클로로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (S)-tert-부틸 (1-((4-클로로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (107.4 mg, 0.247 mmol, 49% 수율)를 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.57 (d, J=5.0 Hz, 1H), 8.38 (s, 1H), 7.80 (s, 1H), 7.70 (d, J=0.5 Hz, 1H), 7.59 (dd, J=5.3, 1.3 Hz, 1H), 4.39 (d, J=8.5 Hz, 1H), 4.19 (d, J=8.8 Hz, 1H), 2.64 (s, 3H), 1.95 - 1.77 (m, 2H), 1.55 (dd, J=13.9, 4.9 Hz, 1H), 1.43 (s, 3H), 1.39 (s, 9H), 1.00 (m, 6H), 1개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 434.2 [(M+H)+, 계산치 C23H33ClN3O3, 433.2]; LC/MS 체류시간 (방법 B): tR = 2.07분.
파트 B: (S)-1-((4-클로로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 TFA 탈보호하였다. (S)-1-((4-클로로-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (271.7 mg, 0.806 mmol, 81% 수율)을 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.59 (d, J=5.3 Hz, 1H), 8.35 (s, 1H), 7.82 (s, 1H), 7.72 - 7.69 (m, 1H), 7.60 (dd, J=5.3, 1.3 Hz, 1H), 3.97 - 3.90 (m, 2H), 2.64 (s, 3H), 1.83 (dt, J=12.7, 6.1 Hz, 1H), 1.53 (t, J=5.5 Hz, 2H), 1.28 (s, 3H), 1.04 - 0.96 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 334.3 [(M+H)+, 계산치 C18H25ClN3O, 334.2]; LC/MS 체류시간 (방법 B): tR = 1.49분.
실시예 239
(S)-1-((4-클로로-6-(6-클로로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-1-((4,6-디클로로피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 비스(2,2,2-트리플루오로아세테이트)
TFA (2 mL, 26.0 mmol)를 DCM (4 mL) 중 (S)-tert-부틸 (1-((4,6-디클로로피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.146 g, 0.387 mmol)의 용액에 실온에서 첨가하였다. 반응물을 실온에서 1.5시간 동안 교반하였다. 용매를 감압 하에 제거하고, 조 물질을 추가 정제 없이 사용하였다. LCMS (ESI) m/e 259.9 [(M-NH2)+, 계산치 C12H16Cl2NO, 260.1]; LC/MS 체류시간 (방법 B): tR = 1.73분.
파트 B: (S)-1-((4-클로로-6-(6-클로로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (S)-1-((4-클로로-6-(6-클로로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (8.4 (S)-1-((4-클로로-6-(6-클로로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (mg, 0.020 mmol, 2 단계에 걸쳐 22% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.01 (d, J=4.4 Hz, 1H), 8.71 (s, 1H), 8.35 (d, J=2.2 Hz, 1H), 8.14 (d, J=9.2 Hz, 1H), 8.04 (s, 1H), 7.83 (dd, J=8.8, 2.2 Hz, 1H), 7.74 (d, J=4.4 Hz, 1H), 4.06 (s, 2H), 1.89 - 1.80 (m, 1H), 1.52 - 1.40 (m, 2H), 1.18 (s, 3H), 0.95 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 403.8 [(M+H)+, 계산치 C21H24Cl2N3O, 404.1]; LC/MS 체류시간 (방법 B): tR = 1.91분.
실시예 240
(S)-1-((2',4-디클로로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((2',4-디클로로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (S)-tert-부틸 (1-((2',4-디클로로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (12.6 mg, 0.014 mmol, 7% 수율)를 수득하였다. LCMS (ESI) m/e 476.1 [(M+Na)+, 계산치 C22H29Cl2N3O3Na, 476.2]; LC/MS 체류시간 (방법 A): tR = 2.52분.
파트 B: (S)-1-((2',4-디클로로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 TFA 탈보호하였다. (S)-1-((2',4-디클로로-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (4.9 mg, 0.014 mmol, 100% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.60 (s, 1H), 8.51 (d, J=5.5 Hz, 1H), 8.44 (s, 1H), 8.15 (s, 1H), 8.08 (dd, J=5.1, 1.5 Hz, 1H), 1.82 (dquin, J=12.8, 6.4 Hz, 1H), 1.41 (t, J=5.3 Hz, 2H), 1.14 (s, 3H), 0.93 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 337.0 [(M-NH2)+, 계산치 C17H19Cl2N2O, 337.1]; LC/MS 체류시간 (방법 B): tR = 1.98분.
실시예 241
(S)-1-((4-클로로-6-(7-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((4-클로로-6-(7-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (S)-tert-부틸 (1-((4-클로로-6-(7-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (30.5 mg, 0.021 mmol, 20% 수율)를 수득하였다. LCMS (ESI) m/e 488.2 [(M+H)+, 계산치 C26H32ClFN3O3, 488.2]; LC/MS 체류시간 (방법 B): tR = 2.37분.
파트 B: (S)-1-((4-클로로-6-(7-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 TFA 탈보호하였다. (S)-1-((4-클로로-6-(7-플루오로퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (4.4 mg, 0.011 mmol, 18% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.01 (d, J=4.4 Hz, 1H), 8.68 (s, 1H), 8.33 (dd, J=9.4, 6.4 Hz, 1H), 8.01 (s, 1H), 7.85 (dd, J=10.5, 2.4 Hz, 1H), 7.66 (d, J=4.4 Hz, 1H), 7.60 - 7.53 (m, 1H), 4.04 (s, 2H), 1.85 (dt, J=12.7, 6.5 Hz, 1H), 1.45 (t, J=6.4 Hz, 2H), 1.18 (s, 3H), 0.96 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 388.1 [(M+H)+, 계산치 C21H24ClFN3O, 388.2]; LC/MS 체류시간 (방법 B): tR = 1.82분.
실시예 242
(S)-1-((4-클로로-6-(7-(트리플루오로메틸)퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((4,6-디클로로피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
실시예 53, 파트 A에 기재된 바와 같이 제조하였다. (S)-tert-부틸 (1-((4,6-디클로로피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (765.6 mg, 2.03 mmol, 74% 수율)를 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 8.05 - 8.02 (m, 1H), 7.35 (s, 1H), 4.55 (s, 1H), 4.30 (d, J=8.8 Hz, 1H), 4.11 (d, J=8.8 Hz, 1H), 1.91 - 1.75 (m, 2H), 1.58 - 1.48 (m, 1H), 1.41 - 1.38 (m, 12H), 0.98 (m, 6H). LCMS (ESI) m/e 399.0 [(M+Na)+, 계산치 C17H26Cl2NaN2O3, 399.1]; LC/MS 체류시간 (방법 B): tR = 2.41분.
파트 B: (S)-tert-부틸 (1-((6-(7-플루오로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (S)-tert-부틸 (1-((6-(7-플루오로퀴놀린-4-일)-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (26.3 mg, 0.049 mmol, 33% 수율)를 수득하였다. LCMS (ESI) m/e 538.1 [(M+H)+, 계산치 C27H32ClF3N3O3, 538.2]; LC/MS 체류시간 (방법 B): tR = 2.51분.
파트 C: (S)-1-((4-클로로-6-(7-(트리플루오로메틸)퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 TFA 탈보호하였다. (S)-1-((4-클로로-6-(7-(트리플루오로메틸)퀴놀린-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (17.7 mg, 0.040 mmol, 83% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.14 (d, J=4.3 Hz, 1H), 8.69 (s, 1H), 8.49 (d, J=8.5 Hz, 1H), 8.45 (s, 1H), 8.06 (s, 1H), 7.90 (d, J=8.9 Hz, 1H), 7.85 (d, J=4.6 Hz, 1H), 4.04 (s, 2H), 1.85 (dt, J=12.5, 6.3 Hz, 1H), 1.45 (t, J=5.8 Hz, 2H), 1.18 (s, 3H), 0.95 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 438.3 [(M+H)+, 계산치 C22H24ClF3N3O, 438.1]; LC/MS 체류시간 (방법 A): tR = 1.66분.
실시예 243
(S)-1-((4-클로로-2',3'-디메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((4-클로로-2',3'-디메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (S)-tert-부틸 (1-((4-클로로-2',3'-디메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (23 mg, 0.014 mmol, 7% 수율)를 수득하였다. LCMS (ESI) m/e 448.2 [(M+H)+, 계산치 C24H35ClN3O3, 448.2]; LC/MS 체류시간 (방법 B): tR = 2.14분.
파트 B: (S)-1-((4-클로로-2',3'-디메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 32에 기재된 바와 같이 TFA 탈보호하였다. (S)-1-((4-클로로-2',3'-디메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (1.5 mg, 4.14 μmol, 8% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.46 (d, J=5.1 Hz, 1H), 8.42 (s, 1H), 7.46 (s, 1H), 7.28 (br. s., 1H), 4.08 (br. s., 2H), 2.57 (s, 3H), 2.07 (s, 3H), 1.61 (br. s., 1H), 1.43 - 1.25 (m, 2H), 1.15 (br. s., 3H), 0.91 - 0.66 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 348.2 [(M+H)+, 계산치 C19H27ClN3O, 348.2]; LC/MS 체류시간 (방법 B): tR = 1.34분.
실시예 244
(S)-1-((5-(디플루오로메틸)-2'-메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민
스즈키 반응을 실시예 193에 기재된 바와 같이 수행하였다. (S)-1-((5-(디플루오로메틸)-2'-메틸-[3,4'-비피리딘]-6-일)옥시)-2,4-디메틸펜탄-2-아민 (9.8 mg, 0.028 mmol, 49% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.76 (s, 1H), 8.50 (d, J=5.2 Hz, 1H), 8.33 (s, 1H), 7.66 (s, 1H), 7.57 (d, J=4.9 Hz, 1H), 7.28 (t, J=1.0 Hz, 1H), 4.19 (s, 2H), 1.85 (s, 3H), 1.82 - 1.73 (m, 1H), 1.44 (qd, J=13.9, 5.5 Hz, 2H), 1.16 (s, 3H), 0.92 (d, J=6.7 Hz, 3H), 0.89 (d, J=6.4 Hz, 3H); LCMS (ESI) m/e 333.2 [(M-NH2)+, 계산치 C19H23N2F2O, 333.2]; LC/MS 체류시간 (방법 B): tR = 1.46분.
실시예 245
(R)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-(디플루오로메틸)-[3,4'-비피리딘]-2'-일)카르바메이트
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (R)-메틸 (6-((2-아미노-2,4-디메틸펜틸)옥시)-5-(디플루오로메틸)-[3,4'-비피리딘]-2'-일)카르바메이트 (13.3 mg, 0.032 mmol, 54% 수율)를 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.69 (s, 1H), 8.35 (d, J=5.1 Hz, 1H), 8.22 (s, 1H), 8.11 (s, 1H), 7.44 (d, J=3.7 Hz, 1H), 7.39 - 7.14 (t, J=44.0Hz, 1H), 4.15 (d, J=2.6 Hz, 2H), 3.71 (s, 3H), 1.84 - 1.73 (m, 1H), 1.40 (t, J=6.1 Hz, 2H), 1.13 (s, 3H), 0.92 (m, 6H); LCMS (ESI) m/e 392.2 [(M-NH2)+, 계산치 C20H24F2N3O3, 392.2]; LC/MS 체류시간 (방법 B): tR = 1.70분.
실시예 246
(R)-1-((3-(디플루오로메틸)-5-(퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (R)-1-((5-브로모-3-(디플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 193에 기재된 바와 같이 제조하였다. (R)-1-((5-브로모-3-(디플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (275 mg, 0.465 mmol, 55% 수율)을 수득하였다. LCMS (ESI) m/e 320.1 [(M-NH2)+, 계산치 C13H17BrF2NO, 320.1]; LC/MS 체류시간 (방법 B): tR = 1.95분.
파트 B: (R)-1-((3-(디플루오로메틸)-5-(퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (R)-1-((3-(디플루오로메틸)-5-(퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (6.3 mg, 0.016 mmol, 24% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 8.98 (d, J=4.4 Hz, 1H), 8.52 (s, 1H), 8.16 - 8.12 (m, 2H), 7.87 - 7.80 (m, 2H), 7.69 - 7.62 (m, 1H), 7.56 (d, J=4.4 Hz, 1H), 7.29 (t, J=1.0 Hz, 1H), 4.19 (s, 2H), 1.87 - 1.78 (m, 1H), 1.49 - 1.38 (m, 2H), 1.16 (s, 3H), 0.94 (m, 6H), 2개의 교환가능한 양성자는 관찰되지 않음; LCMS (ESI) m/e 386.2 [(M+H)+, 계산치 C22H26F2N3O, 386.2]; LC/MS 체류시간 (방법 B): tR = 1.65분.
실시예 247
(R)-1-((3-(디플루오로메틸)-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (R)-1-((3-(디플루오로메틸)-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (7.7 mg, 0.022 mmol, 37% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.12 (s, 1H), 8.77 (d, J=5.1 Hz, 1H), 8.68 (s, 1H), 7.98 (d, J=5.5 Hz, 1H), 7.42 - 7.16 (t, J=55.0 Hz, 1H), 4.18 (s, 2H), 2.69 (s, 3H), 1.85 - 1.75 (m, 1H), 1.41 (dd, J=9.0, 5.7 Hz, 2H), 1.14 (s, 3H), 0.92 (m, 6H); LCMS (ESI) m/e 334.1 [(M-NH2)+, 계산치 C18H22F2N3O, 334.2]; LC/MS 체류시간 (방법 B): tR = 1.81분.
실시예 248
(R)-1-((3-(디플루오로메틸)-5-(5,7-디플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (R)-1-((3-(디플루오로메틸)-5-(5,7-디플루오로퀴놀린-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (8.4 mg, 0.020 mmol, 21% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.02 (d, J=4.4 Hz, 1H), 8.44 (s, 1H), 8.12 (br. s., 1H), 7.81 (d, J=9.2 Hz, 1H), 7.61 (ddd, J=12.3, 9.5, 2.4 Hz, 1H), 7.52 (d, J=4.8 Hz, 1H), 7.40 - 7.14 (t, J=55.0 Hz, 1H), 4.16 (s, 2H), 1.86 - 1.77 (m, 1H), 1.42 (dd, J=7.9, 5.7 Hz, 2H), 1.15 (s, 3H), 0.94 (m, 6H); LCMS (ESI) m/e 405.1 [(M-NH2)+, 계산치 C22H21F4N2O, 405.2]; LC/MS 체류시간 (방법 B): tR = 2.01분.
실시예 249
(R)-1-((5-(7-클로로퀴놀린-4-일)-3-(디플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
스즈키 커플링을 실시예 193에 기재된 바와 같이 수행하였다. (R)-1-((5-(7-클로로퀴놀린-4-일)-3-(디플루오로메틸)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (16.9 mg, 0.039 mmol, 34% 수율)을 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.01 (d, J=4.4 Hz, 1H), 8.52 (s, 1H), 8.19 (d, J=2.2 Hz, 1H), 8.16 (s, 1H), 7.87 (d, J=9.2 Hz, 1H), 7.69 (dd, J=9.2, 2.2 Hz, 1H), 7.60 (d, J=4.4 Hz, 1H), 7.42 - 7.16 (t, J=55.0Hz, 1H), 4.19 (s, 2H), 1.85 - 1.77 (m, 1H), 1.49 - 1.37 (m, 2H), 1.16 (s, 3H), 0.94 (m, 6H); LCMS (ESI) m/e 403.1 [(M-NH2)+, 계산치 C22H22ClF2N2O, 403.1]; LC/MS 체류시간 (방법 B): tR = 1.97분.
실시예 250
N-(4'-((2-아미노-2,4-디메틸펜틸)옥시)-3'-메틸-[1,1'-비페닐]-3-일)아세트아미드
파트 A: 벤질 (1-(4-브로모-2-메틸페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
실시예 29, 파트 A에 기재된 바와 같이 제조하였다. 벤질 (1-(4-브로모-2-메틸페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (33 mg, 0.076 mmol, 27% 수율)를 수득하였다. LCMS (ESI) m/e 456.1 [(M+Na)+, 계산치 C22H28BrNO3Na, 456.1]; LC/MS 체류시간 (방법 B): tR = 2.55분.
파트 B: 벤질 (1-((3'-아미노-3-메틸-[1,1'-비페닐]-4-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
스즈키 반응을 실시예 193에 기재된 바와 같이 수행하였다. 벤질 (1-((3'-아미노-3-메틸-[1,1'-비페닐]-4-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (21.1 mg, 0.047 mmol, 62% 수율)를 수득하였다. 1H NMR (400MHz, 클로로포름-d) δ 7.38 - 7.29 (m, 7H), 7.21 (t, J=7.8 Hz, 1H), 6.99 - 6.94 (m, 1H), 6.88 (t, J=1.9 Hz, 2H), 6.65 (ddd, J=7.9, 2.3, 0.9 Hz, 1H), 5.06 (s, 2H), 4.93 (s, 1H), 4.13 (d, J=8.8 Hz, 1H), 3.99 (d, J=8.8 Hz, 1H), 3.73 (br. s., 2H), 2.28 (s, 3H), 1.92 - 1.77 (m, 2H), 1.72 - 1.65 (m, 1H), 1.48 (s, 3H), 0.98 (m, 6H); LCMS (ESI) m/e 447.5 [(M+H)+, 계산치 C28H35N2O3, 447.6]; LC/MS 체류시간 (방법 A): tR = 2.38분.
파트 C: 벤질 (1-((3'-아세트아미도-3-메틸-[1,1'-비페닐]-4-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
아세틸 클로라이드 (1 방울)를 실온에서 CH2Cl2 (2 mL) 중 벤질 (1-((3'-아미노-3-메틸-[1,1'-비페닐]-4-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.0221 g, 0.049 mmol)의 용액에 첨가하였다. 반응물을 실온에서 10분 동안 교반한 후, 트리에틸아민 (1 방울)을 첨가하였다. 반응물을 2시간 동안 교반하고, 감압 하에 농축시켰다. 잔류물을 추가 정제 없이 사용하였다. LCMS (ESI) m/e 489.5 [(M+H)+, 계산치 C30H37N2O4, 489.3]; LC/MS 체류시간 (방법 A): tR = 2.39분.
파트 D: N-(4'-((2-아미노-2,4-디메틸펜틸)옥시)-3'-메틸-[1,1'-비페닐]-3-일)아세트아미드
에탄올 (3 mL) 중 Pd/C (3 mg, 2.82 μmol) 및 벤질 (1-((3'-아세트아미도-3-메틸-[1,1'-비페닐]-4-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (23.94 mg, 0.049 mmol)의 혼합물을 H2 풍선을 통해 실온에서 밤새 수소화하였다. 반응물을 규조토 패드 (셀라이트®)를 통해 여과하고, DCM으로 세척하였다. 여과물을 농축시키고, 잔류물을 역상 정제용 HPLC에 의해 정제하였다. 회백색 고체로서의 N-(4'-((2-아미노-2,4-디메틸펜틸)옥시)-3'-메틸-[1,1'-비페닐]-3-일)아세트아미드 (11.4 mg, 0.031 mmol, 64% 수율)를 수득하였다. 1H NMR (500MHz, DMSO-d6) δ 9.99 (s, 1H), 7.82 (s, 1H), 7.51 (d, J=7.9 Hz, 1H), 7.41 - 7.24 (m, 4H), 6.98 (d, J=8.5 Hz, 1H), 3.72 (d, J=3.1 Hz, 2H), 2.26 (s, 3H), 2.07 (s, 3H), 1.85 - 1.78 (m, 1H), 1.46 - 1.41 (m, 2H), 1.16 (s, 3H), 0.93 (t, J=6.3 Hz, 6H); LCMS (ESI) m/e 338.4 [(M-NH2)+, 계산치 C22H28NO2, 338.2]; LC/MS 체류시간 (방법 A): tR = 2.03분.
실시예 263
(R)-2,4-디메틸-1-((3-메틸-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)펜탄-2-아민
파트 A: 4-(6-플루오로-5-메틸피리딘-3-일)-2-메틸피리미딘
1,4-디옥산 (6 mL) 및 물 (0.5 mL)의 혼합물 중 4-클로로-2-메틸피리미딘 (100 mg, 0.778 mmol), Cs2CO3 (507 mg, 1.556 mmol), (6-플루오로-5-메틸피리딘-3-일)보론산 (121 mg, 0.778 mmol)의 교반 용액을 질소로 3분 동안 퍼징하였다. XPhos 제2 세대 전촉매 (61.2 mg, 0.078 mmol)를 1 부분으로 첨가하고, 반응 혼합물을 80℃로 가열하고, 1시간 동안 교반하였다. 반응 혼합물을 실온으로 냉각되도록 하였다. 물 (20 mL)을 첨가하고, 용액을 EtOAc (2 x 30 mL)로 추출하였다. 합한 유기 추출물을 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (헥산 중 EtOAc)에 의해 정제하여 4-(6-플루오로-5-메틸피리딘-3-일)-2-메틸피리미딘 (115 mg, 0.521 mmol, 67% 수율)을 회백색 고체로서 수득하였다. LCMS (ESI) m/e 204.2 [(M+H)+, 계산치 C11H11FN3, 204.1]; LC/MS 체류시간 (방법 A1) tR = 1.90분.
파트 B: (R)-2,4-디메틸-1-((3-메틸-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)펜탄-2-아민
DMF (0.6 mL) 중 4-(6-플루오로-5-메틸피리딘-3-일)-2-메틸피리미딘 (15 mg, 0.068 mmol) 및 (R)-2-아미노-2,4-디메틸펜탄-1-올 (8.91 mg, 0.068 mmol)의 교반 용액에 질소 분위기 하에 탄산세슘 (22.13 mg, 0.068 mmol)을 첨가하였다. 반응 혼합물을 실온에서 1시간 동안 교반되도록 하였다. 반응 혼합물을 MeOH (2 mL)로 희석하고, MeOH로 세척하면서 규조토 (셀라이트®)를 통해 여과하였다. 여과물을 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS에 의해 방법-A를 사용하여 정제하여 (R)-2,4-디메틸-1-((3-메틸-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)펜탄-2-아민 (3 mg, 8.59 μmol, 13% 수율)을 연황색 고체로서 수득하였다. 1H NMR (400 MHz, 메탄올-d4) δ 8.79 (dd, J = 0.6, 2.4 Hz, 1H), 8.66 (d, J = 5.5 Hz, 1H), 8.37 - 8.27 (m, 1H), 7.77 (dd, J = 0.5, 5.5 Hz, 1H), 4.32 (s, 2H), 2.75 (s, 3H), 2.37 (s, 3H), 1.88 -1.85 (m, 1H), 1.65 (d, J = 5.5 Hz, 1H), 1.62 - 1.54 (m, 1H), 1.33 (s, 3H), 1.02 (m, 6H) ppm. LCMS (ESI) m/e 315.2 [(M+H)+, 계산치 C18H27N4O, 315.2]; LC/MS 체류시간 (방법 I) tR = 1.05분. LCMS (ESI) m/e 315.2 [(M+H)+, 계산치 C18H27N4O, 315.2]; LC/MS 체류시간 (방법 H) tR = 1.26분.
실시예 268
(S)-2,4-디메틸-1-((3-메틸-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)펜탄-2-아민
THF (3 mL) 중 4-(6-플루오로-5-메틸피리딘-3-일)-2-메틸피리미딘 (50 mg, 0.226 mmol) (실시예 263에 기재된 바와 같이 제조됨) 및 (S)-2-아미노-2,4-디메틸펜탄-1-올 (29.7 mg, 0.226 mmol)의 교반 용액에 질소 분위기 하에 포타슘 tert-부톡시드 (THF 중 1M) (0.453 mL, 0.453 mmol)를 적가하였다. 반응 혼합물을 주위 온도에서 5시간 동안 교반되도록 하였다. 용액을 감압 하에 농축시켰다. 잔류물을 MeOH 2 mL 중에 용해시키고, 정제용 LC/MS에 의해 방법-A를 사용하여 정제하여 (S)-2,4-디메틸-1-((3-메틸-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)펜탄-2-아민 (25 mg, 0.053 mmol, 23% 수율)을 연황색 고체로서 수득하였다. 1H NMR (400 MHz, 메탄올-d4) δ 8.78 (d, J = 2.0 Hz, 1H), 8.65 (d, J = 5.5 Hz, 1H), 8.34 - 8.28 (m, 1H), 7.76 (d, J = 5.5 Hz, 1H), 4.27 (s, 2H), 2.74 (s, 3H), 2.36 (s, 3H), 1.86 (s, 1H), 1.58 (dd, J = 5.3, 14.8 Hz, 2H), 1.29 (s, 3H), 1.01 (m, 6H). LCMS (ESI) m/e 315.2 [(M+H)+, 계산치 C18H27N4O, 315.2]; LC/MS 체류시간 (방법 H) tR = 1.94분. LCMS (ESI) m/e 315.2 [(M+H)+, 계산치 C18H27N4O, 315.2]; LC/MS 체류시간 (방법 I) tR = 1.57분.
실시예 273
메틸 5-(2-아미노-4-메틸-2-(트리플루오로메틸)펜틸옥시)-6-메틸-2,4'-비피리딘-2'-일카르바메이트
파트 A: (Z)-메틸 3,3,3-트리플루오로-2-(토실이미노)프로파노에이트
0℃로 냉각시킨 벤젠 (50 mL) 중 4-메틸벤젠술폰아미드 (5.49 g, 32.0 mmol)의 교반 용액에 메틸 3,3,3-트리플루오로-2-옥소프로파노에이트 (5 g, 32.0 mmol)를 첨가하고, 1시간 동안 교반하였다. SOCl2 (2.81 mL, 38.4 mmol)를 질소 분위기 하에 적가하였다. 반응 혼합물을 0℃에서 20분 동안 교반하였다. 벤젠 (5 mL) 중 피리딘 (5.18 mL, 64.1 mmol)의 용액을 반응 혼합물에 0℃에서 적가하고, 반응 혼합물을 실온으로 가온되도록 하고, 교반을 2시간 동안 계속하였다. 피리딘 히드로클로라이드를 여과하고, 용매를 감압 하에 증발시키고, 잔류물을 후속 단계에 정제 없이 사용하였다. (8 g, 25.9 mmol, 81% 수율). 1H NMR (400 MHz, DMSO-d 6): δ 7.71-7.73 (m, 2H), 7.35-7.38 (m, 2H), 3.75 (s, 3H), 2.38 (s, 3H) ppm.
파트 B: 메틸 4-메틸-2-(4-메틸페닐술폰아미도)-2-(트리플루오로메틸) 펜트-4-에노에이트
질소 플러싱된 1L 3구 둥근 바닥 플라스크에 (E)-메틸 3,3,3-트리플루오로-2-(토실이미노)프로피오네이트 (5 g, 16.17 mmol) 및 THF (40 mL)를 첨가하였다. 현탁액을 얼음/IPA 조를 사용하여 -5℃로 냉각시키고, 질소로 5분 동안 퍼징하였다. THF 중 (2-메틸알릴) 염화마그네슘 (42.0 mL, 21.02 mmol)의 용액을 온도를 5℃ 미만으로 유지하며 천천히 첨가하였다. 반응 혼합물을 실온으로 3시간의 기간에 걸쳐 가온되도록 하였다. 반응 혼합물을 NH4Cl의 포화 용액 (100 mL)으로 켄칭하였다. 유기 층을 분리하고, 염수 (100 mL)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 진공 하에 농축시키고, 잔류물을 실리카-겔 크로마토그래피 (0-20% 석유 에테르/에틸 아세테이트)에 의해 정제하여 메틸 4-메틸-2-(4-메틸페닐술폰아미도)-2-(트리플루오로메틸) 펜트-4-에노에이트 (2.5 g, 6.84 mmol, 42% 수율)를 회백색 반고체로서 수득하였으며, 이를 후속 단계에 추가 정제 없이 사용하였다. 1H NMR (400 MHz, DMSO-d6): δ 8.77 (s, 1H), 7.69 (d, J = 8.40 Hz, 2H), 7.38 (d, J = 8.00 Hz, 2H), 4.74-4.85 (m, 2H), 3.63 (s, 3H), 2.64-2.70 (m, 2H), 2.39 (s, 3H), 1.57 (s, 3H) ppm.
파트 C: 4-메틸-2-(4-메틸페닐술폰아미도)-2-(트리플루오로메틸) 펜타노에이트
MeOH (5 mL) 중 메틸 4-메틸-2-(4-메틸페닐술폰아미도)-2-(트리플루오로메틸) 펜트-4-에노에이트 (1 g, 2.63 mmol)의 교반 용액에 Pd/C (0.280 g, 2.63 mmol)를 질소 분위기 하에 반응 혼합물에 조금씩 첨가하였다. 반응 혼합물을 수소 분위기 (1 atm) 하에 실온에서 16시간 동안 교반하였다. 반응 혼합물을 메탄올 (50 mL)로 희석하고, 규조토 (셀라이트®)를 통해 여과하고, 층을 메탄올 (30 mL)로 세척하였다. 여과물을 감압 하에 농축시켜 메틸 4-메틸-2-(4-메틸페닐술폰아미도)-2-(트리플루오로메틸) 펜타노에이트 (0.92 g, 2.454 mmol, 93% 수율)를 무색 오일로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 366.0 [(M-H)-, 계산치 C15H19F3NO4S 366.1]; LC/MS 체류시간 (방법 A2): tR = 2.34분.
파트 D: 4-메틸-N-(1,1,1-트리플루오로-2-(히드록시메틸)-4-메틸펜탄-2-일)벤젠술폰아미드
THF (5 mL) 중 메틸 4-메틸-2-(4-메틸페닐술폰아미도)-2-(트리플루오로메틸)펜타노에이트 (0.15 g, 0.408 mmol)의 용액을 0℃에서 냉각시켰다. THF 중 LAH (0.163 mL, 0.408 mmol)를 적가하고, 혼합물을 10분 동안 교반하였다. 반응 혼합물을 실온으로 가온하고, 4시간 동안 교반하였다. 반응 혼합물을 0℃로 냉각되도록 하고, 발포가 완료될 때까지 포화 황산나트륨 용액을 적가하였다. 반응 혼합물을 여과하고, 여과물을 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 4-메틸-N-(1,1,1-트리플루오로-2-(히드록시메틸)-4-메틸펜탄-2-일)벤젠술폰아미드를 무색 오일로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 338.2 [(M-H)-, C14H19F3NO3S 338.1]; LC/MS 체류시간 (방법 A2): tR = 2.07분.
파트 E: N-(2-(((6-브로모-2-메틸피리딘-3-일)옥시)메틸)-1,1,1-트리플루오로-4-메틸펜탄-2-일)-4-메틸벤젠술폰아미드
0℃에서 냉각시킨 DMF (4 mL) 중 4-메틸-N-(1, 1, 1-트리플루오로-2-(히드록시메틸)-4-메틸펜탄-2 일) 벤젠 술폰아미드 (0.1 g, 0.295 mmol)의 용액에 NaH (7.07 mg, 0.295 mmol)를 첨가하고, 이어서 6-브로모-3-플루오로-2-메틸피리딘 (0.062 g, 0.324 mmol)을 천천히 첨가하였다. 반응 혼합물을 0℃에서 5분 동안 교반한 다음, 80℃에서 4시간 동안 교반되도록 하였다. 반응 혼합물을 물 (20 mL)로 켄칭하였다. 반응 혼합물을 에틸 아세테이트 (20 mL)로 희석하고, 유기 층을 분리하였다. 유기 층을 Na2SO4 상에서 건조시키고, 감압 하에 증발시켜 갈색 고체를 수득하였으며, 이를 실리카-겔 크로마토그래피 (석유 에테르/에틸 아세테이트)에 의해 정제하여 N-(2-(((6-브로모-2-메틸피리딘-3-일)옥시)메틸)-1,1,1-트리플루오로-4-메틸펜탄-2-일)-4-메틸벤젠술폰아미드 (70 mg, 0.137 mmol, 47% 수율)를 갈색 고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 509.1 (브로모 패턴) [(M+H)+, 계산치 C20H25BrF3N2O3S 509.1]; LC/MS 체류시간 (방법 A2): tR = 2.45분.
파트 F: 2-(((6-브로모-2-메틸피리딘-3-일)옥시)메틸)-1,1,1-트리플루오로-4-메틸펜탄-2-아민
N-(2-(((6-브로모-2-메틸피리딘-3-일)옥시)메틸)-1,1,1-트리플루오로-4-메틸펜탄-2-일)-4-메틸벤젠술폰아미드 (45 mg, 0.088 mmol)를 함유하는 50 mL 둥근 바닥 플라스크를 0℃에서 냉각시키고, 황산 (2 mL, 37.5 mmol)을 반응 혼합물에 적가하였다. 반응 혼합물을 0℃에서 2시간 동안 교반되도록 하였다. 반응 혼합물을 포화 중탄산나트륨 용액 (pH~8-9)에 붓고, 에틸 아세테이트(3 x 20 mL)로 추출하였다. 합한 유기 추출물을 Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 조 2-(((6-브로모-2-메틸피리딘-3-일)옥시)메틸)-1,1,1-트리플루오로-4-메틸펜탄-2-아민 (조 수율) (25 mg, 0.070 mmol, 80% 수율)을 갈색 반고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 355.0 [(M+H)+, 계산치 C13H19BrF3N2O 355.1]; LC/MS 체류시간 (방법 A2): tR = 2.84분.
파트 G: 메틸 5-(2-아미노-4-메틸-2-(트리플루오로메틸)펜틸옥시)-6-메틸-2,4'-비피리딘-2'-일카르바메이트
메틸 (4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-2-일)카르바메이트 (30 mg, 0.108 mmol), 2-(((6-브로모-2-메틸피리딘-3-일)옥시)메틸)-1,1,1-트리플루오로-4-메틸펜탄-2-아민 (38.3 mg, 0.108 mmol), 및 물 중 Cs2CO3 (0.108 mL, 0.216 mmol) 및 1,4-디옥산 (5 mL)의 용액을 질소 기체로 10분 동안 퍼징하였다. PdCl2 (dppf)-CH2Cl2 부가물 (8.81 mg, 10.79 μmol)을 반응 혼합물에 첨가하고, 용액을 질소 기체로 다시 10분 동안 퍼징하였다. 반응 혼합물을 80℃에서 12시간 동안 가열하였다. 반응 혼합물을 농축시키고, 에틸 아세테이트 (20 mL) 및 물 (20 mL) 중에 용해시켰다. 2상 혼합물을 규조토 (셀라이트®)를 통해 여과하였다. 층을 에틸 아세테이트 (25 mL)로 세척하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 메틸 5-(2-아미노-4-메틸-2-(트리플루오로메틸)펜틸옥시)-6-메틸-2,4'-비피리딘-2'-일카르바메이트 (11 mg, 0.025 mmol, 24% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 427.2 [(M+H)+, 계산치 C20H26F3N4O3 427.2]; LC/MS 체류시간 (방법 H): tR = 2.68분. 1H NMR(400 MHz, 메탄올: δ 8.33 (d, J = 6.40 Hz, 1H), 8.24 (s, 1H), 7.97-8.02 (m, 2H), 7.59 (d, J = 8.80 Hz, 1H), 4.42-4.53 (m, 2H), 3.91 (s, 3H), 2.61 (s, 3H), 1.96-2.03 (m, 3H), 1.05-1.09 (m, 6H) ppm.
실시예 274
1,1,1-트리플루오로-4-메틸-2-(((3-메틸-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)메틸)펜탄-2-아민
파트 A: 4-메틸-N-(1,1,1-트리플루오로-4-메틸-2-(((3-메틸-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)메틸)펜탄-2-일)벤젠술폰아미드
테트라히드로푸란 (5 mL) 중 4-(6-플루오로-5-메틸피리딘-3-일)-2-메틸피리미딘 (40 mg, 0.197 mmol) (실시예 263에 기재된 바와 같이 제조됨) 및 4-메틸-N-(1,1,1-트리플루오로-2-(히드록시메틸)-4-메틸펜탄-2-일)벤젠술폰아미드 (66.8 mg, 0.197 mmol) (실시예 273에 기재된 바와 같이 제조됨)의 교반 용액에 질소 분위기 하에 포타슘 tert-부톡시드 (44.2 mg, 0.394 mmol)를 첨가하였다. 반응 혼합물을 주위 온도에서 12시간 동안 교반하였다. 용액을 감압 하에 농축시켰다. 물 (15 mL)을 첨가하고, 용액을 EtOAc (2 x 15 mL)로 추출하였다. 합한 유기 추출물을 물 (10 mL) 및 염수 (10 mL)로 세척하였다. 유기 층을 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 정제용 TLC에 의해 (헥산 중 30% EtOAc)의 이동상을 사용하여 정제하였다. 목적 생성물 밴드를 수집하고, DCM (25 mL) 중에서 교반하고, 규조토 (셀라이트®) 패드를 통과시키고, 패드를 DCM (20 mL)으로 세척하였다. 합한 여과물을 감압 하에 증발 건조시켜 4-메틸-N-(1,1,1-트리플루오로-4-메틸-2-(((3-메틸-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)메틸)펜탄-2-일)벤젠술폰아미드 (65 mg, 0.037 mmol, 19% 수율)를 황색 오일로서 수득하였다. 생성물을 추가 정제 없이 사용하였다. LCMS (ESI) m/e 523.6 [(M+H)+, 계산치 C25H30F3N4O3S, 523.2]; LC/MS 체류시간 (방법 B) tR = 1.12분.
파트 B. 1,1,1-트리플루오로-4-메틸-2-(((3-메틸-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)메틸)펜탄-2-아민
황산 (2 mL) 중 4-메틸-N-(1,1,1-트리플루오로-4-메틸-2-(((3-메틸-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)메틸)펜탄-2-일)벤젠술폰아미드 (45 mg, 0.026 mmol)의 교반 용액을 2시간 동안 교반하였다. 반응 혼합물을 천천히 포화 수성 중탄산나트륨 용액에 붓고, pH를 8로 조정하고, 용액을 EtOAc (2 x 15 mL)로 추출하였다. 합한 유기 추출물을 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 정제용 LC/MS에 의해 방법-B를 사용하여 정제하여 1,1,1-트리플루오로-4-메틸-2-(((3-메틸-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)메틸)펜탄-2-아민 (5 mg, 0.013 mmol, 52% 수율)을 연황색 고체로서 수득하였다. 1H NMR (400 MHz, CD3OD) δ ppm 8.76 (s,1H), 8.62 (d, J=5.02 Hz, 1H), 8.29 (s, 1H), 7.74 (d, J=5.52 Hz, 1H), 4.46(m, 2H) 3.7 (s, 3H), 2.2 (s, 3H), 1.9 (m, 1H), 1.8 (m, 1 H), 1.6 (m, 1H) 0.9 - 1.1 (m, 6H) ppm. LCMS (ESI) m/e 369.2 [(M+H)+, 계산치 C18H24F3N4O, 369.2]; LC/MS 체류시간 (방법 I) tR = 2.17분. LCMS (ESI) m/e 369.2 [(M+H)+, 계산치 C18H24F3N4O, 369.2]; LC/MS 체류시간 (방법 H) tR = 2.88분.
실시예 278
(S)-6-(4-((2-아미노-2,4-디메틸펜틸) 옥시)-3-(트리플루오로메틸) 페닐) 피리미딘-4-아민
파트 A. N-(6-클로로피리미딘-4-일) 아세트아미드
1,4-디옥산 (5 mL) 중 4,6-디클로로피리미딘 (1.0 g, 6.71 mmol), 아세트아미드 (0.396 g, 6.71 mmol), Cs2CO3 (4.37 g, 13.42 mmol), PdOAc2 (0.060 g, 0.268 mmol) 및 XANTPHOS (0.350 g, 0.604 mmol)의 혼합물을 75℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시켰다. 잔류물을 물 (15 mL)로 희석하고, 에틸 아세테이트 (2x20 mL)로 추출하였다. 에틸 아세테이트 층을 수집하고, 염수 (15 mL)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 N-(6-클로로피리미딘-4-일)아세트아미드 (0.75 g, 4.24 mmol, 63% 수율)를 갈색 고체로서 수득하였다. LCMS (ESI) m/e 172.0 [(M+H)+, 계산치 C6H7ClN3O 172.0]; LC/MS 체류시간 (방법 B): tR = 0.57분.
파트 B: (S)-tert-부틸 (1-(4-브로모-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
0℃에서 냉각된 DMF (50 mL) 중 4-브로모-2-(트리플루오로메틸) 페놀 (4 g, 16.60 mmol)의 혼합물에 K2CO3 (6.88 g, 49.8 mmol)을 조금씩 첨가한 다음, 10 mL DMF 중 (S)-tert-부틸 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (실시예 32, 파트 A-E에 기재된 바와 같이 제조됨) (5.36 g, 18.26 mmol)를 천천히 첨가하였다. 반응 혼합물을 실온으로 가온되도록 한 다음, 80℃에서 12시간 동안 교반하였다. 반응 혼합물을 0℃로 냉각시키고, 수성 염화암모늄 (100 mL)으로 켄칭하였다. 반응 혼합물을 에틸 아세테이트 (2 x 100 mL)로 추출하였다. 유기 층을 물 (2 x 50 mL), 염수 (50 mL)로 세척하고, Na2SO4 상에서 건조시키고, 농축시켜 조 (S)-tert-부틸 (1-(4-브로모-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (6.5 g, 13.16 mmol, 79% 수율)를 무색 오일로서 수득하였으며, 이를 추가 정제 없이 사용하였다. 1H NMR (400 MHz, DMSO-d6): δ 7.74-7.81 (m, 2H), 7.19 (d, J = 8.80 Hz, 1H), 6.52 (s, 1H), 4.02-4.24 (m, 2H), 1.69-1.80 (m, 2H), 1.41-1.50 (m, 1H), 1.40 (s, 9H), 1.25 (s, 3H), 0.83-0.96 (m, 6H) ppm.
파트 C. (S)-tert-부틸 (1-(4-(6-아세트아미도피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (2 mL) 중 N-(6-클로로피리미딘-4-일)아세트아미드 (0.03 g, 0.175 mmol), (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (실시예 215, 파트 A 및 B에 기재된 바와 같이 제조됨) (0.063 g, 0.125 mmol), PdCl2(dppf)-CH2Cl2 부가물 (10.20 mg, 0.012 mmol) 및 Cs2CO3 (0.122 g, 0.375 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 용액을 실온으로 냉각시키고, 감압 하에 농축시켰다. 물 (50 mL)을 첨가하고, 용액을 EtOAc (2 x 50 mL)로 추출하였다. 합한 유기 추출물을 물 (50 mL) 및 염수 (50 mL)로 세척하고, 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 (S)-tert-부틸(1-(4-(6-아세트아미도피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.05 g, 0.076 mmol, 61% 수율)를 반고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ES-API) m/e 511.2 [(M+H)+, 계산치 C25H34F3N4O4, 511.2]; LC/MS 체류시간 (방법 D): tR = 2.54분.
파트 D: (S)-6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-4-아민
0℃에서 MeOH (2 mL) 중 (S)-tert-부틸 (1-(4-(6-아세트아미도피리미딘-4-일)-2-(트리플루오로메틸) 페녹시)-2,4-디메틸펜탄-2-일) 카르바메이트 (0.05 g, 0.098 mmol)의 교반 용액에, 1,4-디옥산 중 4N HCl (0.245 mL, 0.979 mmol)을 첨가하고, 1시간 동안 교반하였다. 반응 혼합물을 감압 하에 농축시켜 (S)-6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-4-아민 (0.01 g, 0.027 mmol, 27% 수율)을 연황색 고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 369.0 [(M+H)+, 계산치 C18H24F3N4O, 369.2]; LCMS 체류시간 (방법 F): tR = 1.37분; LCMS 체류시간 (방법 G): tR = 0.81분. 1H NMR (400 MHz, CD3OD): δ 8.61 (s, 1H), 8.20 (m, 2H), 7.53 (d, J = 8.80 Hz, 1H), 7.03 (d, J = 0.80 Hz, 1H), 4.29-4.37 (m, 2H), 1.85-1.92 (m, 2H), 1.71-1.77 (m, 1H), 1.55 (s, 3H), 1.02-1.08 (m, 6H) ppm.
실시예 279
(S)-1-((2-(플루오로메틸)-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A. (6-브로모-3-플루오로피리딘-2-일)메탄올
0℃에서 메탄올 (20 mL) 중 6-브로모-3-플루오로피콜린알데히드 (1.7 g, 8.33 mmol)의 용액에 NaBH4 (0.473 g, 12.50 mmol)를 첨가하였다. 반응 혼합물을 실온에서 밤새 교반되도록 하였다. 반응 혼합물을 감압 하에 농축시키고, 물 (10 mL)로 희석하고, 에틸 아세테이트 (2 x 50 mL)로 추출하였다. 에틸 아세테이트 층을 물 (1 x 20 mL), 포화 NaCl (1 x 20 mL)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 (6-브로모-3-플루오로피리딘-2-일)메탄올 (1.6 g, 7.53 mmol, 90% 수율)을 수득하였으며, 이를 갈색 고체로서 단리시켰다. LCMS (ESI) m/e 205.9 (브로모 패턴) [(M+H)+, 계산치 C6H6BrFNO, 205.9]; LC/MS 체류시간 (방법 C): tR = 0.56분.
파트 B. 6-브로모-3-플루오로-2-(플루오로메틸)피리딘
디클로로메탄 (15 mL) 중 (6-브로모-3-플루오로피리딘-2-일)메탄올 (800 mg, 3.88 mmol)의 용액을 -20℃로 냉각시키고, DAST (1.539 mL, 11.65 mmol)를 첨가하였다. 반응 혼합물을 실온에서 밤새 교반되도록 하였다. 반응 혼합물을 0℃로 냉각시키고, 포화 중탄산나트륨 (10 mL)으로 켄칭하고, 디클로로메탄 (2 x 25 mL)으로 추출하였다. 디클로로메탄 층을 물 (1 x 20 mL), 포화 NaCl (1 x 20 mL)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (에틸 아세테이트 중 0-35% 석유 에테르)에 의해 정제하여 6-브로모-3-플루오로-2-(플루오로메틸)피리딘 (500 mg, 2.40 mmol, 62% 수율)을 갈색 고체로서 수득하였다. GCMS (ESI) m/e 207.0 [(M)+, 계산치 C6H7BrF2N, 207.0]; GC/MS 체류시간 (방법 E): tR = 6.52분.
파트 C. 4-(5-플루오로-6-(플루오로메틸)피리딘-2-일)-2-메틸피리미딘
1,4-디옥산 중 4-클로로-2-메틸피리미딘 (100 mg, 0.778 mmol), 헥사메틸이주석 (129 μl, 0.622 mmol), 테트라키스(트리페닐포스핀)팔라듐 (0) (44.9 mg, 0.039 mmol) 및 6-브로모-3-플루오로-2-(플루오로메틸)피리딘 (113 mg, 0.544 mmol)의 용액을 질소로 퍼징하고, 마이크로웨이브로 120℃에서 1시간 동안 조사하였다. 반응 혼합물을 실온으로 냉각되도록 하고, 에틸 아세테이트 (25 mL)로 희석하였다. 흑색 현탁액을 규조토 (셀라이트®)를 통해 여과하고, 층을 에틸 아세테이트 (10 mL)로 세척하였다. 여과물을 감압 하에 농축시켰다. 흑색 잔류물을 실리카 겔 크로마토그래피 (에틸 아세테이트 중 0-25% 석유 에테르)에 의해 정제하여 4-(5-플루오로-6-(플루오로메틸)피리딘-2-일)-2-메틸피리미딘 (35 mg, 0.123 mmol, 16% 수율)을 갈색 반고체로서 수득하였다. LCMS (ESI) m/e 222.9 [(M+H)+, 계산치 C11H10F2N3, 222.1]; LC/MS 체류시간 (방법 C): tR = 0.81분.
파트 D. (S)-1-((2-(플루오로메틸)-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
THF (3 mL) 중 4-(5-플루오로-6-(플루오로메틸)피리딘-2-일)-2-메틸피리미딘 (35 mg, 0.158 mmol)의 용액에 0℃에서 THF 중 1 M 포타슘 tert-부톡시드 (0.237 mL, 0.237 mmol) 및 (S)-2-아미노-2,4-디메틸펜탄-1-올을 첨가하였다. 반응 혼합물을 실온에서 2시간 동안 교반되도록 하였다. 반응 혼합물을 물 (5 mL)로 희석하고, 에틸 아세테이트 (2 x 50 mL)로 추출하였다. 에틸 아세테이트 층을 물 (1 x 10 mL), 포화 NaCl (1 x 10 mL)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 갈색 반고체 잔류물을 실리카 겔 크로마토그래피 (DCM 중 0-10% MeOH)에 의해 정제하여 (S)-1-((2-(플루오로메틸)-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (23 mg, 0.062 mmol, 39% 수율)을 연황색 반고체로서 수득하였다. LCMS (ESI) m/e 333.2[(M+H)+, 계산치 C18H26FN4O 333.41]; LC/MS 체류시간 (방법 G) tR = 1.63분. 1H NMR (400 MHz, 메탄올-d4): δ 8.73 (d, J=5.40 Hz, 1H) 8.57 (dd, J=8.72, 1.69 Hz, 1H) 8.22 (dd, J=5.40, 0.50 Hz, 1H) 7.65 (d, J=8.53 Hz, 1H) 5.70 (d, J=1.95 Hz, 1H) 5.58 (d, J=1.88 Hz, 1H) 3.94 - 4.04 (m, 2H) 2.77 (s, 3H) 1.80 - 1.93 (m, 1H) 1.52 - 1.69 (m, 2H) 1.29 - 1.31 (m, 3H) 0.99 - 1.04 (m, 6H) ppm.
실시예 280
(S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-6-(플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트
실시예 279에 기재된 것과 유사한 방식으로 제조하였다. (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-6-(플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트. TFA (46 mg, 0.089 mmol, 58% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 391.3 [(M+H)+, 계산치 C20H28FN4O3·TFA 391.2]; LC/MS 체류시간 (방법 H): tR = 1.32분; LC/MS 체류시간 (방법 I): tR = 1.36분. 1H NMR(400 MHz, 메탄올-d4): δ 8.43 - 8.29 (m, 2H), 8.22 - 8.14 (m, 1H), 7.98 - 7.89 (m, 1H), 7.71-7.73 (d, J=9.0 Hz, 1H), 5.84 - 5.56 (m, 2H), 4.38 - 4.29 (m, 1H), 4.27 - 4.20 (m, 1H), 3.90 (s, 3H), 1.90 (s, 2H), 1.80 - 1.68 (m, 1H), 1.55 (s, 3H), 1.13 - 1.00 (m, 6H) ppm.
실시예 285
(S)-6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리미딘-4-아민
파트 A. (S)-tert-부틸 (1-(2-클로로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (20 mL) 중 (S)-tert-부틸 (1-(4-브로모-2-클로로페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (1.2 g, 2.85 mmol), 비스(피나콜레이토)디보론 (0.797 g, 3.14 mmol), 아세트산칼륨 (0.840 g, 8.56 mmol 및 PdCl2 (dppf)-CH2Cl2 부가물 (0.116 g, 0.143 mmol)의 혼합물을 90℃에서 밤새 가열하였다. 반응 혼합물을 셀라이트를 통해 여과하고, 셀라이트 층을 에틸 아세테이트 (100 mL)로 세척하였다. 유기 층을 물 (50 mL)로 세척하였다. 수성 층을 에틸 아세테이트 (2x50 mL)로 재추출하였다. 유기 층을 수집하고, 염수로 세척하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켜 (S)-tert-부틸 (1-(2-클로로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (1.2 g, 2.57 mmol, 90% 수율)를 무색 액체로서 수득하였다. 1H NMR (400 MHz, CDCl3): δ 7.78 (d, J = 1.60 Hz, 1H), 7.61-7.63 (m, 1H), 6.91 (d, J = 8.00 Hz, 1H), 4.10-4.19 (m, 1H), 4.63 (s, 1H), 4.02 (d, J = 8.80 Hz, 1H), 1.79-1.87 (m, 2H), 1.57-1.62 (m, 1H), 1.51 (s, 3H), 1.33-1.41 (m, 12H), 0.96-0.98 (m, 6H) ppm.
파트 B. (S)-tert-부틸 (1-(4-(6-아세트아미도피리미딘-4-일)-2-클로로페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (2 mL) 중 N-(6-클로로피리미딘-4-일)아세트아미드 (실시예 278에 기재된 바와 같이 제조됨) (0.03 g, 0.175 mmol), (S)-tert-부틸 (1-(2-클로로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트) (0.058 g, 0.125 mmol), PdCl2(dppf)-CH2Cl2 부가물 (10.20 mg, 0.012 mmol) 및 Cs2CO3 (0.122 g, 0.375 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 용액을 감압 하에 농축시켰다. 물 (15 mL)을 첨가하고, 용액을 EtOAc (2 x 20 mL)로 추출하였다. 합한 유기 추출물을 물 (20 mL) 및 염수 (20 mL)로 세척하고, 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (헥산 중 EtOAc)에 의해 정제하여 (S)-tert-부틸 (1-(4-(6-아세트아미도피리미딘-4-일)-2-클로로페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.05 g, 0.093 mmol, 75% 수율)를 반고체로서 수득하였다. LCMS (ESI) m/e 475.9 [(M-H)-, 계산치 C24H32ClN4O4 475.2]; LC/MS 체류시간 (방법 A2): tR = 2.43분.
파트 C. (S)-6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리미딘-4-아민
0℃로 냉각시킨 MeOH (2 mL) 중 (S)-tert-부틸 (1-(4-(6-아세트아미도피리미딘-4-일)-2-클로로페녹시)-2,4-디메틸펜탄-2-일) 카르바메이트 (0.05 g, 0.105 mmol)의 용액에 1,4-디옥산 중 4N HCl (0.262 mL, 1.048 mmol)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반하였다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리미딘-4-아민 (0.026 g, 0.077 mmol, 73% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 335.0 [(M+H)+, 계산치 C17H24ClN4O 335.2]; LCMS 체류시간 (방법 F): tR = 1.17분; LCMS 체류시간 (방법 G): tR = 0.73분. 1H (400 MHz, CD3OD): δ 8.61 (d, J = 0.80 Hz, 1H), 8.03 (d, J = 2.00 Hz, 1H), 7.87 (d, J = 10.80 Hz, 1H), 7.42 (d, J = 8.80 Hz, 1H), 6.99 (d, J = 0.40 Hz, 1H), 4.25-4.32 (m, 2H), 1.87-1.98 (m, 2H), 1.72-1.76 (m, 1H), 1.55 (s, 3H), 1.03-1.09 (m, 6H) ppm.
실시예 290
(S)-2,4-디메틸-1-(4-(2-메틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민
파트 A: (S)-tert-부틸 (2,4-디메틸-1-(4-(2-메틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트
4-클로로-2-메틸피리미딘 (0.035 g, 0.272 mmol), (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (실시예 215, 파트 A 및 B에 기재된 바와 같이 제조됨) (0.137 g, 0.272 mmol), 인산칼륨 (삼염기성) (0.058 g, 0.272 mmol), 및 KBr (0.032 g, 0.272 mmol)의 혼합물을 1,4-디옥산 (10 mL) 중에 녹였다. 반응 혼합물을 질소 기체로 30분 동안 퍼징하고, PdCl2(dppf)-CH2Cl2 부가물 (0.022 g, 0.027 mmol)을 첨가하였다. 반응 혼합물을 질소 기체로 추가로 10분 동안 다시 퍼징하고, 80℃에서 2시간 동안 가열하였다. 혼합물을 실온으로 냉각시키고, 감압 하에 농축시켰다. 잔류물을 물 (20 mL) 및 에틸 아세테이트 (20 mL)로 희석하였다. 2상 혼합물을 규조토 (셀라이트®)를 통해 여과하였다. 층을 에틸 아세테이트 (25 mL)로 세척하고, 에틸 아세테이트 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 (S)-tert-부틸 (2,4-디메틸-1-(4-(2-메틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (0.06 g, 0.128 mmol, 47% 수율)를 갈색 고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 468.2 [(M+H)+, 계산치 C24H33F3N3O3 468.2]; LC/MS 체류시간 (방법 A1): tR = 3.51분.
파트 B: (S)-2,4-디메틸-1-(4-(2-메틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민
0℃에서 디클로로메탄 (2 mL) 중 (S)-tert-부틸 (2,4-디메틸-1-(4-(2-메틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (0.06 g, 0.128 mmol)의 용액에 TFA (0.198 mL, 2.57 mmol)를 첨가하고, 혼합물을 0℃에서 5분 동안 교반하였다. 반응 혼합물을 실온에서 4시간 동안 교반되도록 한 다음, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 B)에 의해 정제하여 (S)-2,4-디메틸-1-(4-(2-메틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민 (39.2 mg, 0.061 mmol, 47% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 368.0 [(M+H)+, 계산치 C19H25F3N3O 368.2]; LC/MS 체류시간 (방법 H): tR = 1.67분; LC/MS 체류시간 (방법 I): tR = 1.12분. 1H NMR (400 MHz, 메탄올-d4): δ 8.71 (d, J = 5.60 Hz, 1H), 8.46-8.53 (m, 2H), 7.85 (d, J = 5.60 Hz, 1H), 7.43 (d, J = 8.80 Hz, 1H), 4.25-4.33 (m, 2H), 2.76 (s, 3H), 1.84-1.91 (m, 2H), 1.69-1.75 (m, 1H), 1.53 (s, 3H), 1.01-1.06 (m, 6H) ppm.
실시예 297
(S)-4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-아민
파트 A: (S)-tert-부틸 (1-(4-(2-아미노피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
THF (30 mL) 중 4-클로로피리딘-2-아민 (0.2 g, 1.556 mmol)의 용액에 (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (실시예 215, 파트 A 및 B에 기재된 바와 같이 제조됨) (0.780 g, 1.56 mmol) 및 인산칼륨, 이염기성 (2.33 mL, 4.67 mmol)을 첨가하였다. 반응 혼합물을 아르곤으로 10분 동안 퍼징하고, XPhos 제2 세대 전촉매 (0.061 g, 0.078 mmol)를 첨가하였다. 반응 혼합물을 아르곤으로 10분 동안 다시 퍼징하고, 65℃에서 3시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 에틸 아세테이트 (10 mL) 및 물 (10 mL)로 희석하고, 유기 층을 분리하였다. 수성 층을 다시 에틸 아세테이트 (2x18 mL)로 추출하였다. 합한 에틸 아세테이트 층을 염수로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 조 생성물을 정제용 TLC (헥산 중 70% 에틸 아세테이트)에 의해 정제하였다. 요구되는 스폿을 수집하고, DCM 중 5% MeOH 40 mL 중에 용해시키고, 여과하고 감압 하에 농축시켜 (S)-tert-부틸 (1-(4-(2-아미노피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.375 g, 0.798 mmol, 51% 수율)를 회백색 고체로서 수득하였다. LCMS (ESI) m/e 468.4 [(M+H)+, 계산치 C24H33F3N3O3, 468.2]; LC/MS 체류시간 (방법 A1): tR = 2.38분.
파트 B: (S)-4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-아민
0℃에서 디클로로메탄 (1 mL) 중 (S)-tert-부틸 (1-(4-(2-아미노피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.050 g, 0.106 mmol)의 용액에 TFA (0.5 μL, 6.49 μmol)를 첨가하였다. 반응 혼합물을 실온에서 2시간 동안 교반되도록 한 다음, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-아민 (0.019 g, 0.051 mmol, 48% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 368.2 [(M+H)+, 계산치 C19H25F3N3O, 368.2]; LC/MS 체류시간 (방법 H): tR = 1.54분; LC/MS 체류시간 (방법 I): tR = 0.99분. 1H NMR (400 MHz, MeOD): δ 7.95-7.88 (m, 3H), 7.29 (d, J = 8.4 Hz, 1H), 6.88-6.82 (m, 2H), 4.03-3.97 (m, 2H), 1.91-1.88 (m, 1H), 1.86-1.79 (m, 2H), 1.30 (s, 3H), 1.0-0.9 (m, 6H) ppm.
실시예 298
(S)-2,4-디메틸-1-((5-(2-메틸피리미딘-4-일)-3-(옥사졸-5-일)피리딘-2-일)옥시)펜탄-2-아민
파트 A: 5-(5-브로모-2-플루오로피리딘-3-일)옥사졸
메탄올 (1.25 mL) 중 5-브로모-2-플루오로니코틴알데히드 (0.2 g, 0.980 mmol)의 용액에 TOSMIC (0.191 g, 0.980 mmol) 및 K2CO3 (0.135 g, 0.980 mmol)을 첨가하였다. 반응 혼합물을 실온에서 3시간 동안 교반하였다. 반응 혼합물을 고진공에 의해 농축시키고, 잔류물을 물 (2 mL) 및 에틸 아세테이트 (8 mL)로 희석하였다. 유기 층을 분리하고, 수성 층을 다시 에틸 아세테이트 (2x10 mL)로 추출하였다. 합한 에틸 아세테이트 층을 포화 중탄산나트륨 용액, 염수로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 조 물질을 실리카 겔 칼럼 크로마토그래피 (헥산 중 40% 에틸 아세테이트)에 의해 정제하여 5-(5-브로모-2-플루오로피리딘-3-일)옥사졸 (0.189 g, 0.732 mmol, 75% 수율)을 회백색 고체로서 수득하였다. LCMS (ESI) m/e 243.03 [(M+H) +, 계산치 C8H5BrFN2O, 243.0]; LC/MS 체류시간 (방법 A1): tR = 1.79분.
파트 B. 5-(2-플루오로-5-(2-메틸피리미딘-4-일)피리딘-3-일)옥사졸
1,4-디옥산 (0.1 mL) 중 4-클로로-2-메틸피리미딘 (0.050 g, 0.389 mmol), 5-(5-브로모-2-플루오로피리딘-3-일)옥사졸 (0.100 g, 0.389 mmol) 및 헥사메틸이주석 (0.097 mL, 0.467 mmol)의 용액을 아르곤으로 15분 동안 퍼징하고, 테트라키스(트리페닐포스핀)팔라듐 (0) (0.045 g, 0.039 mmol)을 첨가하였다. 반응 혼합물을 아르곤으로 5분 동안 다시 퍼징하고, 마이크로웨이브에서 110℃에서 1시간 동안 가열하였다. 반응 혼합물을 에틸 아세테이트 (8 mL) 및 물 (5 mL)로 희석하고, 유기 층을 분리하였다. 수성 층을 에틸 아세테이트 (2x5 mL)로 다시 추출하였다. 합한 에틸 아세테이트 층을 염수로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 반응 혼합물을 정제용 TLC (헥산 중 70% 에틸 아세테이트)에 의해 정제하였다. 요구되는 스폿을 수집하고, 디클로로메탄 중 5% 메탄올 (30 mL) 중에 용해시키고, 여과하고, 감압 하에 농축시켜 5-(2-플루오로-5-(2-메틸피리미딘-4-일)피리딘-3-일)옥사졸 (0.070 g, 0.098 mmol, 25% 수율)을 회백색 고체로서 수득하였다. LCMS (ESI) m/e 257.0 [(M+H) +, 계산치 C13H10FN4O, 257.1]; LC/MS 체류시간 (방법 B): tR = 0.86분.
파트 C. (S)-2,4-디메틸-1-((5-(2-메틸피리미딘-4-일)-3-(옥사졸-5-일)피리딘-2-일)옥시)펜탄-2-아민
DMF (0.8 mL) 중 5-(2-플루오로-5-(2-메틸피리미딘-4-일)피리딘-3-일)옥사졸 (0.076 g, 0.107 mmol)의 용액에 (S)-2-아미노-2,4-디메틸펜탄-1-올 (0.014 g, 0.107 mmol) 및 Cs2CO3 (0.070 g, 0.214 mmol)을 첨가하고, 반응 혼합물을 80℃에서 16시간 동안 가열하였다. 반응 혼합물에 냉각수 및 에틸 아세테이트 (4 mL)를 첨가하고, 5분 동안 교반하였다. 유기 층을 분리하고, 수성 층을 에틸 아세테이트 (2x3 mL)로 세척하였다. 합한 에틸 아세테이트 층을 염수로 세척하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 B)에 의해 정제하여 (S)-2,4-디메틸-1-((5-(2-메틸피리미딘-4-일)-3-(옥사졸-5-일)피리딘-2-일)옥시)펜탄-2-아민, TFA (0.002 g, 4.04 μmol, 4% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 368.3 [(M+H)+, 계산치 C20H26N5O2, 368.2]; LC/MS 체류시간 (방법 H): tR = 1.25분; LC/MS 체류시간 (방법 I): tR = 0.95분. 1H NMR (400 MHz, MeOD): δ 8.77 (d, J = 2.4 Hz, 1H), 8.73 (d, J = 2.4 Hz, 1H), 8.51 (d, J = 2.4 Hz, 1H), 8.21 (s, 1H), 7.66 (d, J = 1.6 Hz, 1H), 7.52 (s, 1H), 4.62 (m, 2H), 2.56 (s, 3H), 1.80-1.65 (m, 2H), 1.48-1.55 (m, 1H), 1.5 (s, 3H), 0.9 (m, 6H) ppm.
실시예 299
(S)-2,4-디메틸-1-((6-(2-메틸피리미딘-4-일)-4-(옥사졸-5-일)피리딘-3-일)옥시)펜탄-2-아민
파트 A. 5-(2-브로모-5-플루오로피리딘-4-일)옥사졸
MeOH (2.5 mL) 중 2-브로모-5-플루오로이소니코틴알데히드 (0.1 g, 0.490 mmol)의 용액에 TOSMIC (0.096 g, 0.490 mmol) 및 K2CO3 (0.068 g, 0.490 mmol)을 첨가하였다. 반응 혼합물을 실온에서 3시간 동안 교반하였다. 반응 혼합물을 고진공에 의해 농축시키고, 잔류물을 물 (2 mL) 및 에틸 아세테이트 (4 mL)로 희석하였다. 유기 층을 분리하고, 수성 층을 다시 에틸 아세테이트 (2x4 mL)로 추출하였다. 합한 에틸 아세테이트 층을 포화 중탄산나트륨 용액, 염수로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 5-(2-브로모-5-플루오로피리딘-4-일)옥사졸 (0.098 g, 0.382 mmol, 78% 수율)을 회백색 고체로서 수득하였다. LCMS (ESI) m/e 243.0 [(M+H)+, 계산치 C8H5BrFN2O 243.0]; LC/MS 체류시간 (방법 H): tR = 1.87분.
파트 B. 5-(5-플루오로-2-(2-메틸피리미딘-4-일)피리딘-4-일)옥사졸
1,4-디옥산 (0.2 mL) 중 4-클로로-2-메틸피리미딘 (0.050 g, 0.389 mmol), 5-(2-브로모-5-플루오로피리딘-4-일)옥사졸 (0.095 g, 0.389 mmol) 및 헥사메틸이주석 (0.097 mL, 0.467 mmol)의 용액을 아르곤으로 15분 동안 퍼징하고, 테트라키스(트리페닐포스핀)팔라듐 (0) (0.045 g, 0.039 mmol)을 첨가하였다. 반응 혼합물을 아르곤으로 5분 동안 다시 퍼징하고, 마이크로웨이브 바이알에서 110℃에서 1시간 동안 가열하였다. 반응 혼합물을 에틸 아세테이트 (8 mL) 및 물(5 mL)로 희석하고, 유기 층을 분리하고, 수성 층을 에틸 아세테이트 (2x5 mL)로 세척하였다. 합한 에틸 아세테이트 층을 염수로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 반응 혼합물을 정제용 TLC (헥산 중 70% 에틸 아세테이트)에 의해 정제하였다. 요구되는 스폿을 수집하고, 디클로로메탄 중 5% 메탄올 (30 mL) 중에 용해시키고, 여과하고, 감압 하에 농축시켜 5-(5-플루오로-2-(2-메틸피리미딘-4-일)피리딘-4-일)옥사졸 (0.098 g, 0.099 mmol, 26% 수율)을 무색 고체로서 수득하였다. LCMS (ESI) m/e 257.0 [(M+H)+, 계산치 C13H10FN4O 257.1]; LC/MS 체류시간 (방법 B): tR = 1.07분.
파트 C. (S)-2,4-디메틸-1-((6-(2-메틸피리미딘-4-일)-4-(옥사졸-5-일)피리딘-3-일)옥시)펜탄-2-아민
DMF (0.8 mL) 중 5-(5-플루오로-2-(2-메틸피리미딘-4-일)피리딘-4-일)옥사졸 (0.098 g, 0.099 mmol), (S)-2-아미노-2,4-디메틸펜탄-1-올 (0.013 g, 0.099 mmol) 및 Cs2CO3 (0.065 g, 0.199 mmol)의 용액을 80℃에서 16시간 동안 가열하였다. 반응 혼합물에 냉각수 및 에틸 아세테이트 (4 mL)를 첨가하고, 혼합물을 5분 동안 교반하였다. 유기 층을 분리하고, 수성 층을 에틸 아세테이트 (2x3 mL)로 세척하였다. 합한 에틸 아세테이트 층을 염수로 세척하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 C)에 의해 정제하여 (S)-2,4-디메틸-1-((6-(2-메틸피리미딘-4-일)-4-(옥사졸-5-일)피리딘-3-일)옥시)펜탄-2-아민, TFA (.004 g, 7.63 μmol, 8% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 368.3 [(M+H)+, 계산치 C20H26N5O2 368.2]; LC/MS 체류시간 (방법 H): tR = 1.29분; LC/MS 체류시간 (방법 I): tR = 0.91분. 1H NMR (400 MHz, MeOD): δ 8.89 (s, 1H), 8.75 (d, J = 5.6 Hz, 1H), 8.66 (s, 1H), 8.46 (s, 1H), 8.2 (d, J = 5.6 Hz, 1H), 7.87 (s, 1H), 4.32 (s, 2H), 2.79 (s, 3H), 1.90-1.65 (m, 3H), 1.42 (s, 3H), 1.05 (m, 6H) ppm.
실시예 300
(S)-메틸 (5-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리다진-3-일)카르바메이트
파트 A. 메틸 (5-클로로피리다진-3-일)카르바메이트
3,5-디클로로피리다진 (1.5 g, 10.07 mmol), 메틸 카르바메이트 (0.831 g, 11.08 mmol), XANTPHOS (0.466 g, 0.805 mmol), PdOAc2 (0.226 g, 1.007 mmol) 및 Cs2CO3 (6.56 g, 20.14 mmol)의 혼합물을 1,4-디옥산 (40 mL)에 녹이고, 85℃에서 밤새 가열하였다. 반응 혼합물을 농축시키고, 물로 희석하고, 에틸 아세테이트로 추출하였다. 에틸 아세테이트 층을 수집하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 메틸 (5-클로로피리다진-3-일)카르바메이트 (1.71 g, 9.12 mmol, 91% 수율)를 갈색 고체로서 수득하였다. LCMS (ESI) m/e 187.9 [(M+H)+, 계산치 C6H7ClN3O2 188.0]; LC/MS 체류시간 (방법 C): tR = 0.59분.
파트 B. Boc-(S)-메틸 (5-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리다진-3-일)카르바메이트
메틸 (5-클로로피리다진-3-일)카르바메이트 (0.03 g, 0.160 mmol), (S)-tert-부틸 (1-(2-시아노-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 86, 파트 A 및 B에서와 같이 제조됨) (0.073 g, 0.160 mmol), KBr (0.019 g, 0.160 mmol), 삼염기성 인산칼륨 (0.056 g, 0.320 mmol) 및 Pd(Ph3P)4 (0.015 g, 0.013 mmol)의 혼합물을 1,4-디옥산 (1 mL)에 녹이고, 100℃에서 밤새 가열하였다. 냉각시킨 후, 반응 혼합물을 농축시키고, 물로 희석하고, 에틸 아세테이트로 추출하였다. 에틸 아세테이트 층을 수집하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 조 Boc-(S)-메틸 (5-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리다진-3-일)카르바메이트 (70 mg, 0.145 mmol, 90% 수율)를 갈색 고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 484.2 [(M+H)+, 계산치 C25H34N5O5 484.2]; LC/MS 체류시간 (방법 B): tR = 1.02분.
파트 C. (S)-메틸 (5-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리다진-3-일)카르바메이트
0℃에서 디클로로메탄 (1 mL) 중 Boc-(S)-메틸 (5-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리다진-3-일)카르바메이트 (0.07 g, 0.145 mmol)의 용액을 1,4-디옥산 중 4N 염화수소 (0.362 mL, 1.448 mmol)로 처리하였다. 혼합물을 실온에서 1시간 동안 교반하였다. 반응 혼합물을 농축시키고, 10% 수성 NaHCO3 용액 및 에틸 아세테이트 (20 mL)로 켄칭하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 (S)-메틸 (5-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리다진-3-일)카르바메이트 (3.5 mg, 8.67 μmol, 6% 수율)를 갈색 고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 384.2 [(M+H)+, 계산치 C20H26N5O3 384.2]; LC/MS 체류시간 (방법 B): tR = 0.65분; LC/MS 체류시간 (방법 D): tR = 1.17분; LC/MS 체류시간 (방법 E): tR = 0.93분. 1H NMR (400 MHz, 메탄올-d4): δ 9.22 (s, 1H), 8.53 (s, 1H), 8.24 (s, 1H), 8.12 - 8.16 (m, 1H), 7.44-7.47 (d, J = 8.8 Hz, 1H), 4.21-4.24 (s, 2H), 3.86 (s, 3H), 1.81-1.90 (m, 2H), 1.65 -1.71 (m, 1H), 1.46 (s, 3H), 1.02-1.09 (m, 6H) ppm.
실시예 301
(S)-메틸 (5-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리다진-3-일)카르바메이트
파트 A. Boc-(S)-메틸 (5-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리다진-3-일)카르바메이트
메틸 (5-클로로피리다진-3-일)카르바메이트 (실시예 300에 기재된 바와 같이 제조됨) (0.05 g, 0.267 mmol), (S)-tert-부틸 (1-(2-클로로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.137 g, 0.293 mmol) (실시예 285, 파트 A에 기재된 바와 같이 제조됨), Cs2CO3 (0.174 g, 0.533 mmol) 및 PdCl2(dppf) (9.75 mg, 0.013 mmol)의 혼합물을 1,4-디옥산 (3 mL)-물 (0.5 mL)에 녹이고, 90℃에서 5시간 동안 가열하였다. 냉각시킨 후, 반응 혼합물을 농축시키고, 물로 희석하고, 에틸 아세테이트로 추출하였다. 에틸 아세테이트 층을 수집하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 조 Boc-(S)-메틸 (5-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리다진-3-일)카르바메이트 (120 mg, 0.243 mmol, 92% 수율)를 갈색 고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 493.2 [(M+H)+, 계산치 C24H34ClN4O5 493.2]; LC/MS 체류시간 (방법 B): tR = 1.11분.
파트 B. (S)-메틸 (5-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리다진-3-일)카르바메이트
디클로로메탄 (2 mL) 중 Boc-(S)-메틸 (5-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)-피리다진-3-일)카르바메이트 (0.12 g, 0.243 mmol)의 용액을 1,4-디옥산 중 4N 염화수소 (0.61 mL, 2.43 mmol)로 처리하였다. 혼합물을 실온에서 1.5시간 동안 교반하였다. 반응 혼합물을 농축시키고, 10% 수성 NaHCO3 용액으로 희석하고, 에틸 아세테이트로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 (S)-메틸 (5-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리다진-3-일)카르바메이트 (6 mg, 0.015 mmol, 6% 수율)를 갈색 고체로서 수득하였다. LCMS (ESI) m/e 393.1 [(M+H)+, 계산치 C19H26ClN4O3 393.2]; LC/MS 체류시간 (방법 B): tR = 0.69분; LC/MS 체류시간 (방법 D): tR = 1.22분; LC/MS 체류시간 (방법 E): tR = 1.10분. 1H NMR (400 MHz, 메탄올-d4): δ 9.17 (d, J = 2.4 Hz, 1H), 8.49 (d, J = 2.0 Hz, 1H), 7.95 (d, J = 2.4 Hz, 1H), 7.79-7.82 (m, 1H), 7.34-7.36 (d, J = 8.8 Hz, 1H), 4.18-4.27 (m, 2H), 3.84 (s, 3H), 1.85-1.96 (m, 2H), 1.68 -1.74 (m, 1H), 1.53 (s, 3H), 1.02-1.09 (m, 6H) ppm.
실시예 304
(R)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-클로로피리딘-3-일)피리미딘-2-일)카르바메이트
파트 A: 메틸 (4-클로로피리미딘-2-일)카르바메이트
0℃에서 THF (20 mL) 중 4-클로로피리미딘-2-아민 (1 g, 7.72 mmol)의 교반 용액에 포타슘 tert-부톡시드 (2.60 g, 23.16 mmol)를 첨가하고, 30분 동안 교반하였다. 이 혼합물에 메틸 클로로포르메이트 (1.495 mL, 19.30 mmol)를 적가하고, 혼합물을 실온에서 추가로 16시간 동안 교반하였다. 반응 혼합물을 10% 수성 중탄산나트륨 용액 (30 mL)으로 켄칭하고, 에틸 아세테이트 (2 x 50 mL)로 추출하였다. EtOAc 층을 수집하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켜 메틸 (4-클로로피리미딘-2-일)카르바메이트 (900 mg, 4.51 mmol, 58% 수율)를 황색 고체로서 수득하였다. LCMS (ESI) m/e 188.0 [(M+H)+, 계산치 C6H7ClN3O2 188.0]; LC/MS 체류시간 (방법 C): tR = 0.50분.
파트 B: 메틸 (4-(5-클로로-6-플루오로피리딘-3-일)피리미딘-2-일)카르바메이트
1,4-디옥산 (2.5 mL)-물 (02 mL) 중 메틸 (4-클로로피리미딘-2-일)카르바메이트 (75 mg, 0.400 mmol), (5-클로로-6-플루오로피리딘-3-일)보론산 (70.1 mg, 0.400 mmol), PdCl2(dppf)-CH2Cl2 부가물 (16.33 mg, 0.020 mmol) 및 Cs2CO3 (391 mg, 1.199 mmol)의 혼합물을 질소로 퍼징하고, 100℃에서 12시간 동안 가열하였다. 용액을 실온으로 냉각시키고, 감압 하에 농축시켰다. 물 (50 mL)을 첨가하고, 용액을 EtOAc (2 x 50 mL)로 추출하였다. 합한 유기 추출물을 물 (50 mL) 및 염수 (50 mL)로 세척하고, 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (헥산 중 EtOAc)에 의해 정제하여 메틸 (4-(5-클로로-6-플루오로피리딘-3-일)피리미딘-2-일)카르바메이트 (55 mg, 0.144 mmol, 36% 수율)를 갈색 고체로서 수득하였다. LCMS (ESI) m/e 283.0 [(M+H)+, 계산치 C11H9ClFN4O2 283.0]; LC/MS 체류시간 (방법 A1): tR = 2.01분.
파트 C: (R)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-클로로피리딘-3-일)피리미딘-2-일)카르바메이트
0℃에서 DMF (2.5 mL) 중 (R)-2-아미노-2,4-디메틸펜탄-1-올 (23.21 mg, 0.177 mmol)의 교반 용액에 NaH (14.15 mg, 0.354 mmol)에 이어서 0.5 mL DMF 중 메틸 (4-(5-클로로-6-플루오로피리딘-3-일)피리미딘-2-일)카르바메이트 (50 mg, 0.177 mmol)를 첨가하였다. 혼합물을 60℃에서 12시간 동안 가열하였다. 이어서 혼합물을 0℃로 냉각시키고, 물 (10 mL)로 희석하고, 에틸 아세테이트 (2 x 50 mL)로 추출하였다. EtOAc 층을 수집하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 (R)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-클로로피리딘-3-일)피리미딘-2-일)카르바메이트 (3 mg, 0.724 mmol, 4% 수율)를 수득하였다. LCMS (ESI) m/e 394.2 [(M+H)+, 계산치 C18H25ClN5O3 394.2]; LC/MS 체류시간 (방법 A1): tR = 1.23분. 1H NMR (400 MHz, 메탄올-d4): δ 8.94 (d, J=2.13 Hz, 1H), 8.68 (d, J=2.13 Hz, 1H), 8.64 (d, J=5.27 Hz, 1H), 7.65 (d, J=5.33 Hz, 1H), 4.61 (d, J=3.14 Hz, 2H), 3.84 (s, 3H), 1.87 - 1.96 (m, 2H), 1.68 - 1.75 (m, 1H), 1.54 (s, 3H), 1.08 (m, 6H) ppm.
실시예 305
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리미딘-2-일)카르바메이트
파트 A. Boc-(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리미딘-2-일)카르바메이트
메틸 (4-클로로피리미딘-2-일)카르바메이트 (실시예 304에 기재된 바와 같이 제조됨) (0.05 g, 0.267 mmol), (S)-tert-부틸 (1-(2-시아노-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 86, 파트 A 및 B에 기재된 바와 같이 제조됨) (0.122 g, 0.267 mmol), PdCl2(dppf) (0.016 g, 0.021 mmol) 및 Cs2CO3 (0.174 g, 0.533 mmol)의 혼합물을 1,4-디옥산 (2 mL)-물 (0.5 mL)에 녹였다. 혼합물을 80℃에서 밤새 교반하였다. 반응 혼합물을 농축시키고, 염수 및 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 Boc-(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리미딘-2-일)카르바메이트 (110 mg, 85%)를 갈색빛 고체로서 수득하였다. LCMS (ESI) m/e 484.3 [(M+H)+, 계산치 C25H34N5O5 484.2]; LC/MS 체류시간 (방법 B): tR = 1.02분.
파트 B. (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리미딘-2-일)카르바메이트
Boc-(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리미딘-2-일)카르바메이트 (0.1 g, 0.207 mmol)를 1,4-디옥산 중 4N 염화수소 (0.517 mL, 2.068 mmol)로 4시간 동안 처리하였다. 반응 혼합물을 감압 하에 농축시키고, 수성 NaHCO3 용액 및 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 회백색 고체를 조 생성물로서 수득하였다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리미딘-2-일)카르바메이트 (5 mg, 0.013 mmol, 6% 수율)를 백색 고체로서 수득하였다. LCMS (ESI) m/e 384.2 [(M+H)+, 계산치 C20H26N5O3 384.2]; LC/MS 체류시간 (방법 A2): tR = 1.64분. HPLC 체류시간 (방법 A): tR = 5.47분. HPLC 체류시간 (방법 B): tR = 5.93분. 1H NMR (400 MHz, 메탄올-d4): δ 8.59 (d, J = 5.2 Hz, 1H), 8.56 (d, J = 2.0 Hz, 1H), 8.46-8.49 (m, 1H), 7.61 (d, J = 5.2 Hz, 1H), 7.33 (d, J = 9.2 Hz, 1H), 4.09 (m, 2H), 3.82 (s, 3H), 1.82-1.88 (m, 1H), 1.56 -1.72 (m, 2H), 1.34 (s, 3H), 0.98-1.08 (m, 6H) ppm.
실시예 306
(S)-메틸(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트
파트 A. Boc-(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트
메틸 (4-클로로피리미딘-2-일)카르바메이트 (실시예 304에 기재된 바와 같이 제조됨) (0.05 g, 0.267 mmol), (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (실시예 215, 파트 A 및 B에 기재된 바와 같이 제조됨) (0.147 g, 0.293 mmol), Cs2CO3 (0.261 g, 0.800 mmol) 및 PdCl2(dppf) (9.75 mg, 0.013 mmol)의 혼합물을 1,4-디옥산 (2 mL)-물 (0.5 mL)에 녹였다. 혼합물을 80℃에서 밤새 가열하였다. 이것을 농축시키고, 염수 및 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 Boc-(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트 (150 mg, 정량적 수율)를 갈색빛 고체로서 수득하였다. LCMS (ESI) m/e 527.3 [(M+H)+, 계산치 C25H34F3N4O5 527.2]; LC/MS 체류시간 (방법 B): tR = 1.13분.
파트 B. (S)-메틸(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트
Boc-(S)-메틸(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3 (트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트 (150 mg, 0.285 mmol)를 4N 염화수소 (0.712 mL, 2.85 mmol)로 실온에서 밤새 처리하였다. 반응 혼합물을 감압 하에 농축시키고, 수성 NaHCO3 용액 및 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 회백색 고체를 조 생성물로서 수득하였다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트 (35 mg, 0.080 mmol, 28% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 427.3 [(M+H)+, 계산치 C20H26F3N4O3 427.2]; LC/MS 체류시간 (방법 B): tR = 0.70분; LC/MS 체류시간 (방법 D): tR = 1.52분; LC/MS 체류시간 (방법 E): tR = 1.11분. 1H NMR (400 MHz, 메탄올-d4): δ 8.59 (d, J = 5.2 Hz, 1H), 8.52 (s, 1H), 8.41-8.44 (m, 1H), 7.61(d, J = 5.6 Hz, 1H), 7.34 (d, J = 8.8 Hz, 1H), 4.04-4.12 (m, 2H), 3.81 (s, 3H), 1.81-1.86 (m, 1H), 1.55 -1.81 (m, 2H), 1.39 (s, 3H), 1.01-1.08 (m, 6H) ppm.
실시예 307
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리미딘-2-일)카르바메이트
파트 A. Boc-(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리미딘-2-일)카르바메이트
메틸 (4-클로로피리미딘-2-일)카르바메이트 (실시예 304에 기재된 바와 같이 제조됨) (0.05 g, 0.267 mmol), (S)-tert-부틸 (1-(2-클로로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 285, 파트 A에 기재된 바와 같이 제조됨) (0.137 g, 0.293 mmol), Cs2CO3 (0.261 g, 0.800 mmol) 및 PdCl2(dppf) (9.75 mg, 0.013 mmol)의 혼합물을 1,4-디옥산 (2 mL)-물 (0.5 mL)에 녹였다. 혼합물을 80℃에서 밤새 가열하였다. 이것을 농축시키고, 염수 및 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 Boc-(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리미딘-2-일)카르바메이트 (136 mg, 정량적 수율)를 갈색빛 고체로서 수득하였다. LCMS (ESI) m/e 493.2 [(M+H)+, 계산치 C24H34ClN4O5 493.2]; LC/MS 체류시간 (방법 B): tR = 1.09분.
파트 B. (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리미딘-2-일)카르바메이트
Boc-(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리미딘-2-일)카르바메이트 (136 mg, 0.276 mmol)를 4N 염화수소 (0.690 mL, 2.76 mmol)로 밤새 처리하였다. 반응 혼합물을 감압 하에 농축시키고, 수성 NaHCO3 용액 및 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 회백색 고체를 조 생성물로서 수득하였다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-메틸 (4-(4-((2-아미노-2,4 디메틸펜틸)옥시)-3-클로로페닐)피리미딘-2-일)카르바메이트 (24 mg, 0.057 mmol, 21% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 393.2 [(M+H)+, 계산치 C19H26ClN4O3 393.2]; LC/MS 체류시간 (방법 B): tR = 0.66분; LC/MS 체류시간 (방법 D): tR = 1.29분; LC/MS 체류시간 (방법 E): tR = 1.04분. 1H NMR (400 MHz, 메탄올-d4): δ 8.47 (d, J = 5.2 Hz, 1H), 8.22 (s, 1H), 8.02-8.05 (m, 1H), 7.46 (d, J = 5.2 Hz, 1H), 7.14 (d, J = 8.8 Hz, 1H), 3.95-4.02 (m, 2H), 3.71 (s, 3H), 1.65-1.77 (m, 2H), 1.50 - 1.55 (m, 1H), 1.31 (s, 3H), 0.85-1.01 (m, 6H) ppm.
실시예 308
(S)-1-(2-클로로-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
파트 A. (S)-tert-부틸 (1-(2-클로로-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
4-클로로-6-메틸피리미딘 (0.05 g, 0.389 mmol), (S)-tert-부틸 (1-(2-클로로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 285, 파트 A에 기재된 바와 같이 제조됨) (0.182 g, 0.389 mmol), Cs2CO3 (0.253 g, 0.778 mmol) 및 PdCl2(dppf) (0.014 g, 0.019 mmol)의 혼합물을 1,4-디옥산 (3 mL)-물 (0.3 mL)에 녹였다. 혼합물을 90℃에서 3시간 동안 가열하였다. 이것을 농축시키고, 염수 및 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 (S)-tert-부틸 (1-(2-클로로-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (120 mg, 0.277 mmol, 71% 수율)를 갈색빛 고체로서 수득하였다. LCMS (ESI) m/e 434.2 [(M+H)+, 계산치 C23H33ClN3O3 434.2]; LC/MS 체류시간 (방법 B): tR = 1.13분.
파트 B. (S)-1-(2-클로로-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
DCM (2 mL) 중 (S)-tert-부틸 (1-(2-클로로-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.12 g, 0.277 mmol)의 용액을 1,4-디옥산 중 4N 염화수소 (0.691 mL, 2.77 mmol)로 밤새 처리하였다. 반응 혼합물을 감압 하에 농축시키고, 수성 NaHCO3 용액 및 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 회백색 고체를 조 생성물로서 수득하였다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-1-(2-클로로-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민 (16 mg, 0.047 mmol, 17% 수율)을 갈색 고체로서 수득하였다. LCMS (ESI) m/e 334.1 [(M+H)+, 계산치 C18H25ClN3O 334.2]; LC/MS 체류시간 (방법 B): tR = 0.81분; LC/MS 체류시간 (방법 D): tR = 1.50분; LC/MS 체류시간 (방법 E): tR = 1.16분. 1H NMR (400 MHz, DMSO-d6): δ 9.04 (d, J = 1.2 Hz, 1H), 8.29 (d, J = 2.0, 1H), 8.16-8.19 (m, 1H), 8.01 (d, J = 0.8 Hz, 1H), 7.29 (d, J = 8.8 Hz, 1H), 3.82-3.88 (m, 2H), 1.89 (s, 3H), 1.79-1.86 (m, 1H), 1.36-1.43 (m, 2H), 1.14 (s, 3H), 0.90-0.98 (m, 6H) ppm.
실시예 309
(S)-2,4-디메틸-1-(4-(6-메틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민
파트 A. (S)-tert-부틸(2,4-디메틸-1-(4-(6-메틸피리미딘-4-일)-2 (트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트
1,4-디옥산 (3 mL)-물 (0.3 mL) 중 4-클로로-6-메틸피리미딘 (0.05 g, 0.389 mmol), (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2 (트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (실시예 215에 기재된 바와 같이 제조됨) (0.195 g, 0.389 mmol), Cs2CO3 (0.253 g, 0.778 mmol) 및 PdCl2(dppf) (0.014 g, 0.019 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 이것을 농축시키고, 염수 및 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 (S)-tert-부틸(2,4-디메틸-1-(4-(6-메틸피리미딘-4-일)-2 (트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (98 mg, 0.210 mmol, 54% 수율)를 갈색빛 고체로서 수득하였다. LCMS (ESI) m/e 468.2 [(M+H)+, 계산치 C24H33F3N3O3, 468.2]; LC/MS 체류시간 (방법 A1): tR = 2.87분.
파트 B. (S)-2,4-디메틸-1-(4-(6-메틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민
(S)-tert-부틸 (2,4-디메틸-1-(4-(6-메틸피리미딘-4-일)-2 (트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (0.12 g, 0.257 mmol)를 1,4-디옥산 중 4N 염화수소 (0.642 mL, 2.57 mmol)로 12시간 동안 처리하였다. 반응 혼합물을 감압 하에 농축시키고, 수성 NaHCO3 용액 및 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 회백색 고체를 조 생성물로서 수득하였다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-2,4 디메틸-1-(4-(6-메틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민 (6 mg, 0.015 mmol, 6% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 368.1 [(M+H)+, 계산치 C19H25F3N3O, 368.2]; LC/MS 체류시간 (방법 B): tR = 0.96분; LC/MS 체류시간 (방법 D): tR = 1.71분; LC/MS 체류시간 (방법 E): tR = 1.26분. 1H NMR (400 MHz, DMSO-d6): δ 9.08 (d, J = 0.8 Hz, 1H), 8.47-8.51 (m, 2H), 8.08 (d, J = 0.8 Hz, 1H), 7.43 (d, J = 8.8 Hz, 1H), 3.96-4.02 (m, 2H), 2.54 (s, 3H), 1.78-1.86 (m, 1H), 1.41 -1.52 (m, 2H), 1.20 (s, 3H), 0.92-0.98 (m, 6H) ppm.
실시예 310
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-플루오로페닐)피리미딘-2-일)카르바메이트
파트 A. tert-부틸 (S)-(1-(4-브로모-2-플루오로페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
DMF (20 mL) 중 4-브로모-2-플루오로페놀 (1.2 g, 6.28 mmol), K2CO3 (2.60 g, 18.85 mmol), 및 (S)-tert-부틸 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (2.212 g, 7.54 mmol)의 용액을 80℃로 16시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각되도록 하고, 휘발성 물질을 감압 하에 증발 건조시키고, 물 (10 mL)을 첨가하고, 혼합물을 EtOAc (2 x 15 mL)로 추출하였다. 합한 유기 추출물을 10% 수성 수산화나트륨 용액 (10 mL)에 이어서 물 (20 mL)로 세척하였다. 유기 층을 황산나트륨 상에서 건조시키고, 여과하고, 휘발성 물질을 감압 하에 증발 건조시켜 연갈색 오일로서의 (S)-tert-부틸 (1-(4-브로모-2-플루오로페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (210 mg, 0.519 mmol, 83% 수율)를 수득하였으며, 이를 추가 정제 없이 사용하였다. 1H NMR (400MHz, 클로로포름-d) δ 7.24 (dd, J=10.4, 2.4 Hz, 1H), 7.20 - 7.14 (m, 1H), 6.89 (t, J=8.8 Hz, 1H), 4.58 (br. s., 1H), 4.18 (d, J=9.0 Hz, 1H), 4.00 (d, J=9.0 Hz, 1H), 1.95 - 1.73 (m, 2H), 1.58 - 1.50 (m, 1H), 1.39 (s, 3H), 1.00 (d, J=2.8 Hz, 3H), 0.98 (d, J=2.8 Hz, 3H).
파트 B. (S)-tert-부틸 (1-(2-플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (20 mL) 중 (S)-tert-부틸 (1-(4-브로모-2-플루오로페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (1.751 g, 4.33 mmol), 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란) (1.1 g, 4.33 mmol), 및 아세트산칼륨 (0.850 g, 8.66 mmol)의 혼합물을 90℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시켰다. 잔류물을 물 및 에틸 아세테이트로 희석하였다. 에틸 아세테이트 층을 수집하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 황색빛 반고체를 수득하였다. 잔류물을 실리카 겔 크로마토그래피 (5-10% EtOAc-헥산)에 의해 정제하여 (S)-tert-부틸 (1-(2-플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트를 무색 오일 (1.7 g, 3.77 mmol, 87% 수율)로서 수득하였다. LCMS (ESI) m/e 352.2 [(M+H-Boc)+, 계산치 C24H40BFNO5 452.2]; LC/MS 체류시간 (방법 B): tR = 1.33분. De-Boc 질량을 LCMS에 의해 검출하였다. 1H NMR (400 MHz, CDCl3): δ 7.45-7.49 (m, 2H), 6.94-6.98 (m, 1H), 4.60 (bs, NH, 1H), 4.16 (m, 1H), 4.00 (m, 1H), 1.82 (m, 2H), 1.60 (m, 1H), 1.59 (s, 3H), 1.39 (s, 9H), 1.24 (s, 12H), 0.92-0.99 (m, 6H) ppm.
파트 C. Boc-(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-플루오로페닐)피리미딘-2-일)카르바메이트
1,4-디옥산 (3 mL)-물 (0.3 mL) 중 메틸 (4-클로로피리미딘-2-일)카르바메이트 (실시예 304에 기재된 바와 같이 제조됨) (0.05 g, 0.267 mmol), (S)-tert-부틸 (1-(2-플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.120 g, 0.267 mmol), Cs2CO3 (0.174 g, 0.533 mmol) 및 PdCl2(dppf) (9.75 mg, 0.013 mmol)의 혼합물을 90℃에서 6시간 동안 가열하였다. 이것을 농축시키고, 염수 및 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 Boc-(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-플루오로페닐)피리미딘-2-일)카르바메이트 (160 mg, 정량적 수율)를 갈색빛 고체로서 수득하였다. LCMS (ESI) m/e 477.3 [(M+H)+, 계산치 C24H34FN4O5 477.2]; LC/MS 체류시간 (방법 B): tR = 1.09분.
파트 D. (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-플루오로페닐)피리미딘-2-일)카르바메이트
Boc-(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-플루오로페닐)피리미딘-2-일)카르바메이트 (160 mg, 0.336 mmol)를 4N 염화수소 (1.679 mL, 3.36 mmol)로 12시간 동안 처리하였다. 반응 혼합물을 감압 하에 농축시키고, 수성 NaHCO3 용액 및 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 회백색 고체를 조 생성물로서 수득하였다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-플루오로페닐)피리미딘-2-일)카르바메이트 (11 mg, 0.029 mmol, 9% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 377.1 [(M+H)+, 계산치 C19H26FN4O3 377.2]; LC/MS 체류시간 (방법 B): tR = 0.66분; LC/MS 체류시간 (방법 D): tR = 1.81분; LC/MS 체류시간 (방법 E): tR = 1.58분. 1H NMR (400 MHz, DMSO-d6): δ 10.46 (s, NH, 1H), 8.65 (d, J = 5.3 Hz, 1H), 8.13-8.17 (m, 2H), 8.10 (bs, NH2, 2H), 7.72 (d, J = 5.4 Hz, 1H), 7.39-7.44 (m, 1H), 4.14-4.21 (m, 2H), 3.69 (s, 3H), 1.79-1.83 (m, 1H), 1.69-1.75 (m, 1H), 1.56-1.58 (m, 1H), 1.37 (s, 3H), 0.92-0.98 (m, 6H) ppm.
실시예 311
(S)-이소프로필 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트
파트 A. Boc-(S)-이소프로필 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3 (트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트
1,4-디옥산 (3 mL)-물 (0.3 mL) 중 이소프로필 (4-클로로피리미딘-2-일)카르바메이트 (실시예 304에 기재된 바와 같이 제조됨) (0.05 g, 0.232 mmol), (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (실시예 215, 파트 A 및 B에 기재된 바와 같이 제조됨) (0.116 g, 0.232 mmol), Cs2CO3 (0.151 g, 0.464 mmol) 및 PdCl2(dppf) (8.48 mg, 0.012 mmol)의 혼합물을 90℃에서 밤새 가열하였다. 이것을 농축시키고, 염수 및 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 Boc-(S)-이소프로필 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3 (트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트 (84 mg, 0.151 mmol, 65% 수율)를 갈색빛 고체로서 수득하였다. LCMS (ESI) m/e 555.7 [(M+H)+, 계산치 C27H38F3N4O5 555.6]; LC/MS 체류시간 (방법 B): tR = 1.20분.
파트 B. (S)-이소프로필 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트
Boc-(S)-이소프로필 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트 (84 mg, 0.151 mmol)를 1,4-디옥산 중 2N 염화수소 (0.757 mL, 1.515 mmol)로 12시간 동안 처리하였다. 반응 혼합물을 감압 하에 농축시키고, 수성 NaHCO3 용액 및 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 회백색 고체를 조 생성물로서 수득하였다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-이소프로필 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트 (16 mg, 0.033 mmol, 22% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 455.2 [(M+H)+, 계산치 C22H30F3N4O3 455.2]; LC/MS 체류시간 (방법 B): tR = 0.84분; LC/MS 체류시간 (방법 D): tR = 2.61분; LC/MS 체류시간 (방법 E): tR = 1.97분. 1H NMR (400 MHz, CD3OD): δ 8.59 (d, J = 5.2 Hz, 1H), 8.51 (d, J = 2.0 Hz, 1H), 8.41-8.45 (m, 1H), 7.61 (d, J = 5.2 Hz, 1H), 7.32 (d, J = 8.8 Hz, 1H), 5.03-5.10 (m, 1H), 3.98-4.05 (m, 2H), 1.80-1.87 (m, 1H), 1.50-1.64 (m, 2H), 1.35-1.37 (m, 6H), 1.29 (s, 3H), 0.98-1.02 (m, 6H) ppm. 19F NMR (400 MHz, CD3OD): δ -63.58 ppm.
실시예 312
(S)-메틸 (4-(5-((2-아미노-2,4 디메틸펜틸)옥시)-6-메틸피리딘-2-일)피리미딘-2-일)카르바메이트
파트 A. 메틸 (4-(5-플루오로-6-메틸피리딘-2-일)피리미딘-2-일)카르바메이트
-78℃에서 THF (1 mL) 중 6-브로모-3-플루오로-2-메틸피리딘 (0.1 g, 0.526 mmol)의 용액을 n-BuLi (0.289 mL, 0.579 mmol)로 처리하였다. 혼합물을 -78℃에서 1시간 동안 교반한 다음, 브로민화아연 (0.178 g, 0.789 mmol)을 첨가하였다. 혼합물을 추가로 30분 -78℃에서 교반한 다음, 냉각 조로부터 제거하고, 실온에서 1시간 동안 교반하였다. 생성된 혼합물에 THF (0.5 mL) 중 Pd2(dba)3 (0.024 g, 0.026 mmol), 2-디시클로헥실포스피노-2',6'-디-i-프로폭시-1,1'-비페닐 (0.020 g, 0.042 mmol) 및 메틸 (4-클로로피리미딘-2-일)카르바메이트 (실시예 304에 기재된 바와 같이 제조됨) (0.099 g, 0.526 mmol)의 용액을 천천히 첨가하였다. 반응 혼합물을 70℃에서 밤새 가열하였다. 이것을 10% 수성 NaHCO3으로 켄칭하고, 에틸 아세테이트 (20 mL)로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 메틸 (4-(5-플루오로-6-메틸피리딘-2-일)피리미딘-2-일)카르바메이트 (0.124 g, 0.473 mmol, 90% 수율)를 갈색 고체로서 수득하였다. LCMS (ESI) m/e 263.0 [(M+H)+, 계산치 C12H12FN4O2 263.2]; LC/MS 체류시간 (방법 B): tR = 0.79분. 1H NMR (400 MHz, DMSO-d6): δ 10.55 (s, NH, 1H), 8.75 (d, J = 5.2 Hz, 1H), 8.32-8.36 (m, 1H), 7.91 (d, J = 5.2 Hz, 1H), 7.85-7.90 (m, 1H), 3.71 (s, 3H), 2.51 (s, 3H) ppm. 19F NMR (400 MHz, CDCl3): δ -121.22 ppm.
파트 B. (S)-메틸 (4-(5-((2-아미노-2,4 디메틸펜틸)옥시)-6-메틸피리딘-2-일)피리미딘-2-일)카르바메이트
(S)-2-아미노-2,4-디메틸펜탄-1-올 (0.015 g, 0.114 mmol)을 THF (2 mL) 중에 용해시키고, 0℃로 냉각시키고, 수소화나트륨 (7.32 mg, 0.305 mmol)을 첨가하였다. 생성된 혼합물에 THF (1 mL) 중 메틸 (4-(5-플루오로-6 메틸피리딘-2-일)피리미딘-2-일)카르바메이트 (0.02 g, 0.076 mmol)의 용액을 천천히 첨가하였다. 혼합물을 60℃에서 밤새 교반하였다. 반응 혼합물을 실온으로 냉각시킨 다음, 빙수로 켄칭하고, 염수 및 에틸 아세테이트 (20 mL)로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 (S)-메틸 (4-(5-((2-아미노-2,4 디메틸펜틸)옥시)-6-메틸피리딘-2-일)피리미딘-2-일)카르바메이트 (1 mg, 2.62 μmol, 4% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 374.2 [(M+H)+, 계산치 C19H28N5O3 374.2]; LC/MS 체류시간 (방법 A1): tR = 2.02분; LC/MS 체류시간 (방법 D): tR = 1.79분; LC/MS 체류시간 (방법 E): tR = 1.47분. 1H NMR (400 MHz, CD3OD): δ 8.62 (d, J = 5.2 Hz, 1H), 8.38 (d, J = 8.4 Hz, 1H), 7.98 (d, J = 5.6 Hz, 1H), 7.49 (d, J = 8.4 Hz, 1H), 4.14-4.24 (m, 2H), 3.82 (s, 3H), 2.62 (s, 3H), 1.85-1.92 (m, 2H), 1.69-1.73 (m, 1H), 1.53 (s, 3H), 0.90-1.10 (m, 6H) ppm.
실시예 313
(S)-4-(5-((2-아미노-2,4-디메틸펜틸)옥시)-6-메틸피리딘-2-일)피리미딘-2-아민
실시예 312에 기재된 바와 같이 제조하였다. 최종 반응은 또한 카르바메이트 절단된 생성물, (S)-4-(5-((2-아미노-2,4-디메틸펜틸)옥시)-6-메틸피리딘-2-일)피리미딘-2-아민 (7 mg, 0.022 mmol, 28% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 316.2 [(M+H)+, 계산치 C17H26N5O, 316.2]; LC/MS 체류시간 (방법 A1): tR = 1.96분; LC/MS 체류시간 (방법 D): tR = 1.66분; LC/MS 체류시간 (방법 E): tR = 1.29분. 1H NMR (400 MHz, CD3OD): δ 8.33 (d, J = 5.6 Hz, 1H), 8.28 (d, J = 8.8 Hz, 1H), 7.63 (d, J = 5.6 Hz, 1H), 7.50 (d, J = 8.8 Hz, 1H), 4.14-4.24 (m, 2H), 2.62 (s, 3H), 1.87-1.91 (m, 2H), 1.70-1.73 (m, 1H), 1.53 (s, 3H), 0.90-1.09 (m, 6H) ppm.
실시예 314
(S)-에틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트
파트 A. Boc-(S)-에틸(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3 (트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트
1,4-디옥산 (3 mL)-물 (0.3 mL) 중 에틸 (4-클로로피리미딘-2-일)카르바메이트 (실시예 304에 기재된 바와 같이 제조됨) (0.05 g, 0.248 mmol), (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (실시예 215, 파트 A 및 B에 기재된 바와 같이 제조됨) (0.124 g, 0.248 mmol), Cs2CO3 (0.162 g, 0.496 mmol) 및 PdCl2(dppf) (9.07 mg, 0.012 mmol)의 혼합물을 90℃에서 밤새 가열하였다. 이것을 농축시키고, 염수 및 에틸 아세테이트 (20 mL)로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 Boc-(S)-에틸(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3 (트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트 (80 mg, 0.148 mmol, 60% 수율)를 갈색빛 고체로서 수득하였다. LCMS (ESI) m/e 541.2 [(M+H)+, 계산치 C26H36F3N4O5 541.2]; LC/MS 체류시간 (방법 B): tR = 1.18분.
파트 B. (S)-에틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트
Boc-(S)-에틸(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3 (트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트 (80 mg, 0.148 mmol)를 1,4-디옥산 중 2N 염화수소 (0.740 mL, 1.480 mmol)로 12시간 동안 처리하였다. 반응 혼합물을 감압 하에 농축시키고, 수성 NaHCO3 용액 및 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-에틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트 (13 mg, 0.029 mmol, 20% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 441.2 [(M+H)+, 계산치 C21H28F3N4O3 441.2]; LC/MS 체류시간 (방법 B): tR = 0.80분; LC/MS 체류시간 (방법 D): tR = 2.43분; LC/MS 체류시간 (방법 E): tR = 2.04분. 1H NMR (400 MHz, DMSO-d6): δ 10.4 (s, NH, 1H), 8.68 (d, J = 5.2 Hz, 1H), 8.56-8.50 (m, 2H), 8.05 (bs, NH, 2H), 7.79 (d, J = 5.6 Hz, 1H), 7.49 (d, J = 8.8 Hz, 1H), 4.24-4.14 (m, 4H), 1.83-1.80 (m, 1H), 1.76-1.70 (m, 1H),1.64-1.60 (m, 1H), 1.39 (s, 3H), 1.29-1.25 (m, 3H), 0.99-0.90 (m, 6H) ppm. 19F NMR (400 MHz, CD3OD): δ -63.34 및 -63.54 ppm.
실시예 315
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-(디플루오로메틸)피리미딘-4-일)벤조니트릴
파트 A. (S)-tert-부틸 (1-(4-(2-클로로피리미딘-4-일)-2-시아노페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (30 mL) 및 물 (1 mL) 중 2,4-디클로로피리미딘 (1.3 g, 8.73 mmol), (S)-tert-부틸 (1-(2-시아노-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 86, 파트 A 및 B에 기재된 바와 같이 제조됨) (4.00 g, 8.73 mmol), PdCl2(dppf)-CH2Cl2 부가물 (0.356 g, 0.436 mmol) 및 삼염기성 인산칼륨 (4.01 g, 26.2 mmol)의 현탁액을 질소로 퍼징하고, 90℃로 5시간 동안 가열하였다. 반응 혼합물을 에틸 아세테이트 (25 mL)로 희석하였다. 흑색 현탁액을 규조토 (셀라이트®)를 통해 여과하고, 층을 에틸 아세테이트 (10 mL)로 세척하였다. 여과물을 감압 하에 농축시켜 흑색 잔류물을 수득하였으며, 이를 실리카 겔 크로마토그래피 (석유 에테르:에틸 아세테이트)에 의해 정제하여 (S)-tert-부틸 (1-(4-(2-클로로피리미딘-4-일)-2-시아노페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (3.2 g, 5.90 mmol, 67.6% 수율)를 갈색 반고체로서 수득하였다. LCMS (ESI) m/e 445.2 [(M+H)+, 계산치 C23H30ClN4O3 445.2]; LC/MS 체류시간 (방법 G): tR = 3.86분.
파트 B. (S)-tert-부틸 (1-(2-시아노-4-(2-비닐피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트.
1,4-디옥산 (50 mL) 및 물 (1 mL) 중 (S)-tert-부틸 (1-(4-(2-클로로피리미딘-4-일)-2-시아노페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (3.2 g, 7.19 mmol), 2,4,6-트리비닐시클로트리보록산 피리딘 착물 (1.904 g, 7.91 mmol), Cs2CO3 (7.03 g, 21.58 mmol) 및 PdCl2(dppf)-CH2Cl2 부가물 (0.294 g, 0.360 mmol)의 용액을 질소로 퍼징하고, 90℃로 5시간 동안 가열하였다. 반응 혼합물을 에틸 아세테이트 (25 mL)로 희석하였다. 흑색 현탁액을 규조토 (셀라이트®)를 통해 여과하고, 층을 에틸 아세테이트 (50 mL)로 세척하였다. 여과물을 감압 하에 농축시켜 흑색 잔류물을 수득하였으며, 이를 실리카 겔 크로마토그래피 (석유 에테르:에틸 아세테이트)에 의해 정제하여 (S)-tert-부틸 (1-(2-시아노-4-(2-비닐피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (2.4 g, 4.51 mmol, 63% 수율)를 갈색 반고체로서 수득하였다. LCMS (ESI) m/e 437.3 [(M+H)+, 계산치 C25H33N4O3 437.2]; LC/MS 체류시간 (방법 C): tR = 1.27분.
파트 C. (S)-tert-부틸 (1-(2-시아노-4-(2-포르밀피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
0℃에서 1,4-디옥산 (30 mL) 및 물 (10 mL) 중 (S)-tert-부틸 (1-(2-시아노-4-(2-비닐피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (1 g, 2.291 mmol)의 용액에 2,6-루티딘 (0.400 mL, 3.44 mmol) 및 tert-부탄올 중 2.5% 사산화오스뮴 (0.863 mL, 0.069 mmol)을 첨가하였다. 반응 혼합물을 0℃에서 10분 동안 교반하고, 과아이오딘산나트륨 (1.960 g, 9.16 mmol)을 첨가하였다. 반응 혼합물을 실온에서 밤새 교반되도록 하였다. 반응 혼합물을 물 (10 mL)로 희석하고, 에틸 아세테이트 (2 x 50 mL)로 추출하였다. 에틸 아세테이트 층을 물 (1 x 20 mL), 및 포화 NaCl (1 x 20 mL)로 세척하였다. 유기부를 Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (석유 에테르:에틸 아세테이트)에 의해 정제하여 (S)-tert-부틸 (1-(2-시아노-4-(2-포르밀피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (450 mg, 0.954 mmol, 41.7% 수율)를 갈색 반고체로서 수득하였다. LCMS (ESI) m/e 439.2 [(M+H)+, 계산치 C24H31N4O4, 439.2]; LC/MS 체류시간 (방법 G): tR = 2.79분.
파트 D. (S)-tert-부틸 (1-(2-시아노-4-(2-(디플루오로메틸)피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
-70℃에서 디클로로메탄 (20 mL) 중 (S)-tert-부틸 (1-(2-시아노-4-(2-포르밀피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (450 mg, 1.026 mmol)의 용액에 DAST (0.271 mL, 2.052 mmol)를 첨가하였다. 반응 혼합물을 -30℃로 천천히 가온되도록 하고, 1시간 동안 교반하였다. 반응 혼합물을 포화 중탄산나트륨 용액 (25 mL)으로 켄칭하고, 디클로로메탄(2 x 50 mL)으로 추출하였다. 디클로로메탄 층을 물 (1 x 20 mL) 및 포화 NaCl (1 x 20 mL)로 세척하였다. 유기부를 Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (석유 에테르:에틸 아세테이트)에 의해 정제하여 (S)-tert-부틸 (1-(2-시아노-4-(2-(디플루오로메틸)피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (150 mg, 0.322 mmol, 31% 수율)를 연황색 반고체로서 수득하였다. LCMS (ESI) m/e 461.2 [(M+H)+, 계산치 C24H31F2N4O3, 461.2]; LC/MS 체류시간 (방법 G): tR = 3.71분.
파트 E. (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-(디플루오로메틸)피리미딘-4-일)벤조니트릴.
0℃에서 디클로로메탄 (3 mL) 중 (S)-tert-부틸 (1-(2-시아노-4-(2-(디플루오로메틸)피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (150 mg, 0.326 mmol)의 용액에 디에틸 에테르 중 2 M HCl (8.14 mL, 16.29 mmol)을 첨가하였다. 반응 혼합물을 실온에서 1시간 동안 교반하였다. 반응 혼합물을 0℃로 냉각시키고, 포화 중탄산나트륨 용액 (25 mL)으로 켄칭하고, 디클로로메탄 (2 x 50 mL)으로 추출하였다. 디클로로메탄 층을 물 (1 x 20 mL), 및 포화 NaCl (1 x 20 mL)로 세척하였다. 유기부를 Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 황색 점착성 고체를 디에틸 에테르 (2 x 10 mL)로 연화처리하여 (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-(디플루오로메틸)피리미딘-4-일)벤조니트릴 (65 mg, 0.173 mmol, 53% 수율)을 황색 고체로서 수득하였다. LCMS (ESI) m/e 361.2 [(M+H)+, 계산치 C19H23F2N4O, 361.2]; LC/MS 체류시간 (방법 G): tR = 2.66분. 1H NMR (400 MHz, 메탄올-d4): δ 8.96 (d, J=5.3 Hz, 1H), 8.58 - 8.69 (m, 2H), 8.14 (d, J=5.27 Hz, 1H), 7.48 (d, J=8.72 Hz, 1H), 6.64 - 6.96 (m, 1H), 4.36 (s, 2H), 1.85 - 2.02 (m, 2H), 1.74 (dd, J = 13.80, 4.89 Hz, 1H), 1.56 (s, 3H) 1.08 (m, 6H) ppm.
실시예 316
(S)-1-(4-(2-메톡시피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
파트 A. (S)-tert-부틸 (1-(4-(2-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (3 mL) 및 물 (0.3 mL) 중 2,4-디클로로피리미딘 (0.05 g, 0.336 mmol), (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (실시예 215, 파트 A 및 B에 기재된 바와 같이 제조됨) (0.168 g, 0.336 mmol), Cs2CO3 (0.219 g, 0.671 mmol) 및 PdCl2(dppf) (0.012 g, 0.017 mmol)의 용액을 90℃에서 밤새 가열하였다. 반응 혼합물을 농축시키고, 염수 및 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 갈색빛 고체를 수득하였다. 조 생성물을 헥산 (5 x 2 mL)으로 세척하고, 진공 하에 건조시켜 (S)-tert-부틸 (1-(4-(2-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트(176 mg, 정량적 수율)를 수득하였다. LCMS (ESI) m/e 488.6 [(M+H)+, 계산치 C23H30ClF3N3O3 488.2]; LC/MS 체류시간 (방법 B): tR = 1.35분.
파트 B. (S)-1-(4-(2-메톡시피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
50 mL 둥근 바닥 플라스크에서, (S)-tert-부틸 (1-(4-(2-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.05 g, 0.102 mmol)를 메탄올 (2 mL)에 녹였다. 메탄올 중 염산 (0.256 mL, 1.025 mmol)을 첨가하고, 실온에서 18시간 동안 교반하였다. 이것을 10% NaHCO3으로 켄칭하고, 에틸 아세테이트 (20 mL)로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-1-(4-(2-메톡시피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (2 mg, 4.69 μmol, 5% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 384.3 [(M+H)+, 계산치 C19H25F3N3O2 384.2]; LC/MS 체류시간 (방법 H): tR = 1.87분; LC/MS 체류시간 (방법 I): tR = 1.31분. 1H NMR (400 MHz, 메탄올-d4): δ 8.60 (d, J = 5.2 Hz, 1H), 8.45-8.51 (m, 2H), 7.62 (d, J = 5.2 Hz, 1H), 7.37-7.43 (m, 1H), 4.12-4.26 (m, 2H), 3.63 (s, 3H), 1.78-1.90 (m, 2H), 1.65-1.71 (m, 1H), 1.48 (s, 3H), 0.98-1.12 (m, 6H) ppm.
실시예 317
(S)-4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3 (트리플루오로메틸)페닐)피리미딘-2-올
(S)-tert-부틸 (1-(4-(2-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 316에 기재된 바와 같이 제조됨) (0.05 g, 0.102 mmol)를 수성 5N 염화수소 (2.049 mL, 10.25 mmol)에 녹이고, 100℃에서 밤새 가열하였다. 반응 혼합물을 10% NaHCO3으로 켄칭하고, 에틸 아세테이트 (20 mL)로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 (S)-4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-2-올 (35 mg, 0.093 mmol, 91% 수율)을 황색 고체로서 수득하였다. LCMS (ESI) m/e 370.2 [(M+H)+, 계산치 C18H23F3N3O2, 370.2]; LC/MS 체류시간 (방법 B): tR = 0.69분; LC/MS 체류시간 (방법 D): tR = 2.07분; LC/MS 체류시간 (방법 E): tR = 0.87분. 1H NMR (400 MHz, CD3OD): δ 8.50 (d, J = 2.0 Hz, 1H), 8.43-8.46 (m, 1H), 8.03 (d, J = 5.8 Hz, 1H), 7.44 (d, J = 8.8 Hz, 1H), 7.13 (d, J = 5.8 Hz, 1H), 4.27-4.35 (m, 2H), 1.86-1.92 (m, 2H), 1.70-1.76 (m, 1H), 1.55 (s, 3H), 0.90-1.09 (m, 6H) ppm.
실시예 318
(S)-1-((4-(디플루오로메틸)-6-(6-메틸피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A. 4-(4-(디플루오로메틸)-5-플루오로피리딘-2-일)-6-메틸피리미딘
4-클로로-6-메틸피리미딘 (50 mg, 0.389 mmol), 2-브로모-4-(디플루오로메틸)-5-플루오로피리딘 (88 mg, 0.389 mmol), 1,1,1,2,2,2-헥사메틸디스탄난 (127 mg, 0.389 mmol) 및 Pd(Ph3P)4 (22.47 mg, 0.019 mmol)의 혼합물을 마이크로웨이브 중에서 160℃에서 1시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시키고, 염수로 희석하고, 에틸 아세테이트 (20 mL)로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 갈색빛 반고체를 수득하였다. 조 물질을 실리카 겔 크로마토그래피 (20-30% EtOAc-헥산)에 의해 정제하여 4-(4-(디플루오로메틸)-5-플루오로피리딘-2-일)-6-메틸피리미딘 (25 mg, 0.073 mmol, 19% 수율)을 회백색 고체로서 수득하였다. LCMS (ESI) m/e 240.0 [(M+H)+, 계산치 C11H9F3N3, 240.1]; LC/MS 체류시간 (방법 B): tR = 0.88분 및 LC/MS 체류시간 (방법 H): tR = 2.04분. 1H NMR (300 MHz, CDCl3): δ 9.17 (d, J = 1.2 Hz, 1H), 8.75 (d, J = 6.4 Hz, 1H), 8.65 (s, 1H), 8.20 (s, 1H), 6.80-7.08 (m, CHF2, 1H), 2.64 (s, 3H) ppm. 19F NMR (300 MHz, CDCl3): δ -117.21 및 -130.70 ppm.
파트 B. (S)-1-((4-(디플루오로메틸)-6-(6-메틸피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
0℃에서 테트라히드로푸란 (2 mL) 중 (S)-2-아미노-2,4-디메틸펜탄-1-올 (0.016 g, 0.125 mmol)의 용액에 수소화나트륨 (8.03 mg, 0.334 mmol)을 첨가하였다. 생성된 혼합물에, THF 중 4-(4-(디플루오로메틸)-5-플루오로피리딘-2 일)-6-메틸피리미딘 (0.02 g, 0.084 mmol)의 용액을 천천히 첨가하였다. 혼합물을 60℃에서 2시간 동안 교반하였다. 반응 혼합물을 빙수로 켄칭하고, 염수 및 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 (S)-1-((4-(디플루오로메틸)-6-(6-메틸피리미딘-4-일)피리딘-3-일)옥시)-2,4 디메틸펜탄-2-아민 (2 mg, 5.14 μmol, 6% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 351.2 [(M+H)+, 계산치 C18H25F2N4O 351.2]; LC/MS 체류시간 (방법 A1): tR = 1.80분; LC/MS 체류시간 (방법 D): tR = 1.40분; LC/MS 체류시간 (방법 E): tR = 1.08분. 1H NMR (400 MHz, CD3OD): δ 9.09 (d, J = 1.2 Hz, 1H), 8.67 (d, J = 4.4 Hz, 2H), 8.30 (s, 1H), 7.10-7.40 (t, -CHF2, 1H), 4.28-4.37 (m, 2H), 2.64 (s, 3H), 1.63-1.87 (m, 3H), 1.45 (s, 3H), 0.98-1.07 (m, 6H) ppm. 19F NMR (400 MHz, CD3OD): δ -76.936 ppm.
실시예 319
(S)-1-((2-(디플루오로메틸)-6-(2-(디플루오로메틸)피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: 6-브로모-3-플루오로피콜린알데히드
0℃로 냉각시킨 DCM (80 mL) 중 (6-브로모-3-플루오로피리딘-2-일)메탄올 (4 g, 19.42 mmol)의 용액에 데스-마르틴 퍼아이오디난 (12.35 g, 29.1 mmol)을 첨가하였다. 혼합물을 실온으로 가온하고, 14시간 동안 교반하였다. 반응 혼합물을 포화 수성 중탄산나트륨 (50 mL)으로 켄칭하고, DCM (100 mL)으로 희석하였다. 혼합물을 규조토 (셀라이트®)를 통해 여과하였다. 층을 DCM (100 mL)으로 세척하고, 여과물을 분리 깔때기로 옮겼다. 수성 층을 버리고, 유기 층을 염수로 세척하고, 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 6-브로모-3-플루오로피콜린알데히드 (5.5 g, 27.0 mmol, 69.4% 수율)를 무색 오일로서 수득하였다. 1H NMR (400 MHz, CDCl3): δ 10.09 (s, 1H), 7.71 (dd, J = 8.8, 3.6 Hz, 1H), 7.50 - 7.46 (m, 1H).
파트 B: 6-브로모-2-(디플루오로메틸)-3-플루오로피리딘
-20℃로 냉각시킨 DCM (75 mL) 중 6-브로모-3-플루오로피콜린알데히드 (5 g, 24.51 mmol)의 교반 용액에 DAST (6.48 mL, 49.0 mmol)를 10분에 걸쳐 적가하였다. 반응 혼합물을 서서히 실온으로 되게 하고, 3시간 동안 교반하였다. 반응 혼합물을 0℃로 냉각시키고, 포화 수성 중탄산나트륨 용액 (200 mL)으로 조심스럽게 켄칭하였다. 유기 층을 분리하고, 황산나트륨 상에서 건조시키고, 여과하고, 30℃에서 감압 하에 농축시켜 6-브로모-2-(디플루오로메틸)-3-플루오로피리딘 (4.2 g, 18.58 mmol, 76% 수율)을 암황색 고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. 1H NMR (400 MHz, CDCl3): δ 7.64 - 7.61 (m, 1H), 7.48 - 7.41 (m, 1H), 6.71 (t, J = 53.2 Hz, 1H).
파트 C: (S)-1-((6-브로모-2-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
10℃에서 THF (20 mL) 중 6-브로모-2-(디플루오로메틸)-3-플루오로피리딘 (3 g, 13.27 mmol) 및 (S)-2-아미노-2,4-디메틸펜탄-1-올 (1.742 g, 13.27 mmol)의 교반 용액에 THF 중 1M KOtBu (26.5 mL, 26.5 mmol)를 5분에 걸쳐 적가하였다. 냉각 조를 제거하고, 생성된 용액을 실온에서 2시간 동안 교반하였다. 반응 혼합물을 염수 (50 mL)로 켄칭하고, 에틸 아세테이트 (50 mL)로 추출하였다. 유기 층을 분리하고, 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 (S)-1-((6-브로모-2-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (5 g, 9.64 mmol, 72.6% 수율)을 갈색 반고체로서 수득하였다. LCMS (ESI) m/e 337.1 [(M+H)+, 계산치 C13H20BrF2N2O 337.1]; LC/MS 체류시간 (방법 B): tR = 0.84분.
파트 D: (S)-tert-부틸 (1-((6-브로모-2-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
10℃로 냉각시킨 THF (40 mL) 및 물 (40 mL)의 혼합물 중 (S)-1-((6-브로모-2-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (4.5 g, 8.67 mmol)의 교반 용액에 K2CO3 (2.398 g, 17.35 mmol)을 첨가하고, 혼합물을 5분 동안 교반하였다. BOC2O (2.417 mL, 10.41 mmol)를 첨가하고, 반응 혼합물을 실온에서 6시간 동안 교반하였다. 반응 혼합물을 염수 (200 mL)로 켄칭하고, 에틸 아세테이트 (200 mL)로 추출하였다. 유기 층을 분리하고, 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (석유 에테르 중 0-20% EtOAc)에 의해 정제하여 (S)-tert-부틸 (1-((6-브로모-2-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (3.2 g, 7.32 mmol, 84% 수율)를 황색 오일로서 수득하였다. LCMS (ESI) m/e 437.1 [(M+H)+, 계산치 C18H28BrF2N2O3 437.1]; LC/MS 체류시간 (방법 B): tR = 1.29분.
파트 E: (S)-tert-부틸 (1-((6-(2-클로로피리미딘-4-일)-2-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (8 mL) 중 2,4-디클로로피리미딘 (200 mg, 1.342 mmol) 및 (S)-tert-부틸 (1-((6-브로모-2-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (587 mg, 1.342 mmol)의 용액을 질소로 5분 동안 퍼징하였다. Pd(Ph3P)4 (78 mg, 0.067 mmol)를 첨가하고, 이어서 비스(트리부틸주석) (0.677 mL, 1.342 mmol)을 첨가하였다. 반응 혼합물을 마이크로웨이브에서 150℃에서 1시간 동안 가열하였다. 반응 혼합물을 에틸 아세테이트 (10 mL)로 희석하고, 규조토 (셀라이트®)를 통해 여과하고, 감압 하에 농축시켜 흑색 잔류물을 수득하였다. 잔류물을 실리카 겔 크로마토그래피 (석유 에테르 중 15% EtOAc)에 의해 정제하여 (S)-tert-부틸 (1-((6-(2-클로로피리미딘-4-일)-2-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (500 mg, 1.062 mmol, 20% 수율)를 무색 반고체로서 수득하였다. LCMS (ESI) m/e 471.2 [(M+H)+, 계산치 C22H30ClF2N4O3 471.2]; LC/MS 체류시간 (방법 B): tR = 1.20분.
파트 F: (S)-tert-부틸 (1-((2-(디플루오로메틸)-6-(2-비닐피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (12 mL) 중 (S)-tert-부틸 (1-((6-(2-클로로피리미딘-4-일)-2-(디플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (500 mg, 1.062 mmol) 및 2,4,6-트리비닐시클로트리보록산 피리딘 착물 (256 mg, 1.062 mmol)의 용액에 물 (1.2 mL) 중 탄산세슘 (865 mg, 2.65 mmol)을 첨가하였다. 반응 혼합물을 질소로 5분 동안 퍼징하고, PdCl2(dppf)-CH2Cl2 부가물 (87 mg, 0.106 mmol)을 첨가하였다. 반응 혼합물을 90℃로 6시간 동안 가열하였다. 반응 혼합물을 에틸 아세테이트 (25 mL)로 희석하고, 규조토 (셀라이트®)를 통해 여과하고, 여과물을 감압 하에 증발시켜 갈색 잔류물을 수득하였다. 잔류물을 실리카 겔 크로마토그래피 (석유 에테르 중 20% EtOAc)에 의해 정제하여 (S)-tert-부틸 (1-((2-(디플루오로메틸)-6-(2-비닐피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (330 mg, 0.713 mmol, 67% 수율)를 황색 반고체로서 수득하였다. 1H NMR (400 MHz, CDCl3): δ 8.78 (d, J = 5.20 Hz, 1H), 8.63 (d, J = 8.8 Hz, 1H), 8.16 (d, J = 5.20 Hz, 1H), 7.50 (m, 1H), 7.00-6.69 (m, 3H), 5.75 (m, 1H), 4.38-4,36 (m, 1H), 4.16-4.14 (m, 1H), 1.88-1.75 (m, 2H), 1.51-1.54 (m, 1H), 1.40 (s, 3H), 1.0- 0.98 (m, 6H) ppm.
파트 G: (S)-tert-부틸 (1-((2-(디플루오로메틸)-6-(2-포르밀피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (7 mL): 물 (3 mL)의 혼합물 중 (S)-tert-부틸 (1-((2-(디플루오로메틸)-6-(2-비닐피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (330 mg, 0.713 mmol) 및 2,6-루티딘 (0.166 mL, 1.427 mmol)의 용액을 0℃로 냉각시켰다. t-부탄올 중 사산화오스뮴, 2.5% (0.269 mL, 0.021 mmol)를 첨가하였다. 반응 혼합물을 0℃에서 5분 동안 교반하고, 과아이오딘산나트륨 (610 mg, 2.85 mmol)을 첨가하였다. 반응 혼합물을 실온에서 5시간 동안 교반하였다. 반응 혼합물을 에틸 아세테이트 (50 mL)로 희석하고, 규조토 (셀라이트®)를 통해 여과하였다. 여과물을 물 (25 mL) 및 염수 (20 mL)로 세척하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 갈색 오일을 수득하였다. 잔류물을 실리카 겔 크로마토그래피 (석유 에테르 중 0-40% EtOAc)에 의해 정제하여 (S)-tert-부틸 (1-((2-(디플루오로메틸)-6-(2-포르밀피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (200 mg, 0.431 mmol, 60% 수율)를 황색 반고체로서 수득하였다. 1H NMR (400 MHz, CDCl3): δ 10.19 (s, 1H), 9.04 (d, J = 5.20 Hz, 1H), 8.72 (d, J = 8.8 Hz, 1H), 8.52 (d, J = 5.20 Hz, 1H), 7.51 (d, J = 8.8 Hz, 1H), 6.88 (t, J = 54.4 Hz, 3H), 5.75 (m, 1H), 4.41-4.39 (m, 1H), 4.19-4.17 (m, 1H), 1.92-1.77 (m, 2H), 1.51-1.54 (m, 1H), 1.40 (s, 3H), 1.0- 0.98 (m, 6H) ppm.
파트 H: (S)-tert-부틸 (1-((2-(디플루오로메틸)-6-(2-(디플루오로메틸)피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
-78℃로 냉각시킨 DCM (5 mL) 중 (S)-tert-부틸 (1-((2-(디플루오로메틸)-6-(2-포르밀피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (200 mg, 0.431 mmol)의 용액에 DAST (0.114 mL, 0.861 mmol)를 5분에 걸쳐 적가하였다. 반응 혼합물을 서서히 0℃로 되게 하고, 0℃에서 1시간 동안 교반하였다. 반응 혼합물을 포화 수성 중탄산염 용액 (20 mL)으로 켄칭하고, DCM (25 mL)으로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 암적색 잔류물을 수득하였다. 잔류물을 실리카 겔 크로마토그래피 (석유 에테르 중 0-20% EtOAc)에 의해 정제하여 (S)-tert-부틸 (1-((2-(디플루오로메틸)-6-(2-(디플루오로메틸)피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (100 mg, 0.206 mmol, 48% 수율)를 황색 반고체로서 수득하였다. LCMS (ESI) m/e 487.2 [(M+H)+, 계산치 C23H31F4N4O3 487.2]; LC/MS 체류시간 (방법 G): tR = 3.73분.
파트 I: (S)-1-((2-(디플루오로메틸)-6-(2-(디플루오로메틸)피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
DCM (1 mL) 중 (S)-tert-부틸 (1-((2-(디플루오로메틸)-6-(2-(디플루오로메틸)피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (120 mg, 0.247 mmol)의 용액을 0℃로 냉각시키고, 1,4-디옥산 중 4M HCl (0.617 mL, 2.467 mmol)을 첨가하고, 냉각 조를 제거하였다. 반응 혼합물을 실온에서 5시간 동안 교반하였다. 반응 혼합물을 감압 하에 농축시키고, 고체 잔류물을 에테르 (10 mL)로 세척하였다. 잔류물을 포화 수성 중탄산나트륨 용액 (25 mL)으로 염기성화시키고, 에틸 아세테이트 (2x20 mL)로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고 감압 하에 농축시켜 황색 점착성 고체를 수득하였다. 점착성 고체를 아세토니트릴:물 (1:3) 중에 용해시키고, 밤새 동결건조시켜 (S)-1-((2-(디플루오로메틸)-6-(2-(디플루오로메틸)피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (35 mg, 0.087 mmol, 35% 수율)을 황색 점착성 고체로서 수득하였다. LCMS (ESI) m/e 387.2 [(M+H)+, 계산치 C18H23F4N4O 387.2]; LC/MS 체류시간 (방법 H): tR = 1.27분; LC/MS 체류시간 (방법 NA): tR = 2.03분. 1H NMR (400 MHz, 메탄올-d4): δ 8.93 (d, J = 5.20 Hz, 1H), 8.65 (d, J = 11.20 Hz, 1H), 8.44 (d, J = 5.20 Hz, 1H), 8.44 (d, J = 8.80 Hz, 1H), 6.58-7.01 (m, 2H), 3.89 (s, 2H), 1.79-1.82 (m, 1H), 1.51-1.54 (m, 2H), 1.28 (s, 3H), 0.98-1.01 (m, 6H) ppm.
실시예 320
(S)-1-((6-(플루오로메틸)-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A. 5-플루오로-6-(플루오로메틸)-2'-메틸-2,4'-비피리딘
1,4-디옥산 (3 mL) 및 물 (0.3 mL) 중 (2-메틸피리딘-4-일)보론산 (0.05 g, 0.365 mmol), 6-브로모-3-플루오로-2-(플루오로메틸)피리딘 (실시예 279에 기재된 바와 같이 제조됨) (0.076 g, 0.365 mmol), Cs2CO3 (0.238 g, 0.730 mmol)의 혼합물을 질소 기체로 10분 동안 퍼징하였다. PdCl2(dppf) (0.013 g, 0.018 mmol)를 반응 혼합물에 첨가하고, 용액을 질소 기체로 추가로 10분 동안 퍼징하였다. 반응 혼합물을 90℃에서 밤새 가열하였다. 반응 혼합물을 농축시키고, 에틸 아세테이트 (20 mL) 중에 용해시키고, 염수로 세척하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 조 5-플루오로-6-(플루오로메틸)-2'-메틸-2,4'-비피리딘 (62 mg, 0.160 mmol, 44% 수율)을 갈색 고체로서 수득하였다. LCMS (ESI) m/e 221.2 [(M+H)+, 계산치 C12H11F2N2, 221.21]; LC/MS 체류시간 (방법 A1): tR = 1.80분.
파트 B. (S)-1-((6-(플루오로메틸)-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
0℃에서 테트라히드로푸란 (2 mL) 중 (S)-2-아미노-2,4-디메틸펜탄-1-올 (0.045 g, 0.341 mmol)의 용액에 수소화나트륨 (0.022 g, 0.908 mmol)을 첨가하였다. 반응 혼합물에 THF 중 5-플루오로-6-(플루오로메틸)-2'-메틸-2,4'-비피리딘 (0.05 g, 0.227 mmol)의 용액을 천천히 첨가하고, 혼합물을 실온에서 밤새 교반되도록 하였다. 반응 혼합물을 빙수로 켄칭하고, 염수 및 에틸 아세테이트로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-1-((6-(플루오로메틸)-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (17 mg, 0.048 mmol, 21% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 332.3 [(M+H)+, 계산치 C19H27FN3O, 332. 2]; LC/MS 체류시간 (방법 H): tR = 1.43분. 1H NMR (400 MHz, 메탄올-d4): δ 8.48 (d, J = 5.2 Hz, 1H), 8.08-8.10 (m, 1H), 7.97 (s, 1H), 7.86-7.91 (m, 1H), 7.67 (d, J = 8.8 Hz, 1H), 5.56-5.78 (m, 2H), 4.15-4.25 (m, 2H), 2.63 (s, 3H), 1.80-1.93 (m, 2H), 1.65-1.72 (m, 1H), 1.49 (s, 3H), 0.98-1.07 (m, 6H) ppm.
실시예 323
(S)-메틸 (4-(5-((2-아미노-2,4-디메틸펜틸)옥시)-6-(디플루오로메틸)피리딘-2-일)피리미딘-2-일)카르바메이트
파트 A. 4-(6-(디플루오로메틸)-5-플루오로피리딘-2-일)피리미딘-2-아민
1,4-디옥산 (5 mL) 중 메틸 (4-클로로피리미딘-2-일)카르바메이트 (실시예 304에 기재된 바와 같이 제조됨) (0.1 g, 0.533 mmol), 6-브로모-2-(디플루오로메틸)-3-플루오로피리딘 (실시예 322에 기재된 바와 같이 제조됨) (0.120 g, 0.533 mmol) 및 헥사메틸이주석 (0.111 mL, 0.533 mmol)의 용액을 질소로 10분 동안 플러싱하였다. Pd(Ph3P)4 (0.031 g, 0.027 mmol)를 첨가하고, 반응 혼합물을 질소로 5분 동안 플러싱하였다. 반응 혼합물을 마이크로웨이브에서 150℃에서 90분 동안 가열하였다. 이어서, 반응 혼합물을 규조토 (셀라이트®)를 통해 여과하고, 층을 에틸 아세테이트 (100 mL)로 세척하였다. 여과물을 감압 하에 농축시키고, 조 생성물을 실리카-겔 크로마토그래피 (석유 에테르/에틸 아세테이트 (50-100%))에 의해 정제하여 4-(6-(디플루오로메틸)-5-플루오로피리딘-2-일)피리미딘-2-아민 (0.08 g, 0.280 mmol, 52% 수율)을 수득하였다. LCMS (ESI) m/e 241.2 [(M+H)+, 계산치 C10H8F3N4 241.1]; LC/MS 체류시간 (방법 G): tR = 1.66분.
파트 B. 메틸 (4-(6-(디플루오로메틸)-5-플루오로피리딘-2-일)피리미딘-2-일)카르바메이트
CHCl3 (2 mL) 중 4-(6-(디플루오로메틸)-5-플루오로피리딘-2-일)피리미딘-2-아민 (0.08 g, 0.280 mmol)의 용액에 피리딘 (0.226 mL, 2.80 mmol)에 이어서 DMAP (3.42 mg, 0.028 mmol), 및 메틸 클로로포르메이트 (0.043 mL, 0.560 mmol)를 첨가하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 반응 혼합물을 물 (50 mL)로 희석하고, 디클로로메탄 (80 mL)으로 추출하였다. 유기 층을 염수로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 메틸 (4-(6-(디플루오로메틸)-5-플루오로피리딘-2-일)피리미딘-2-일)카르바메이트 (0.09 g, 0.100 mmol, 36% 수율)를 수득하였다. LCMS (ESI) m/e 299.0 [(M+H)+, 계산치 C12H10F3N4O2 299.1]; LC/MS 체류시간 (방법 G): tR = 2.28분.
파트 C. (S)-메틸 (4-(5-((2-아미노-2,4-디메틸펜틸)옥시)-6-(디플루오로메틸)피리딘-2-일)피리미딘-2-일)카르바메이트
0℃로 냉각시킨 DMF (3 mL) 중 메틸 (4-(6-(디플루오로메틸)-5-플루오로피리딘-2-일)피리미딘-2-일)카르바메이트 (0.03 g, 0.049 mmol)의 용액에 NaH (3.94 mg, 0.099 mmol)에 이어서 (S)-2-아미노-2,4-디메틸펜탄-1-올 (6.47 mg, 0.049 mmol)을 첨가하였다. 이어서, 혼합물을 실온에서 밤새 교반하였다. 반응 혼합물을 규조토 (셀라이트®)를 통해 여과하고, 층을 에틸 아세테이트 (20 mL)로 세척하였다. 여과물을 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-메틸 (4-(5-((2-아미노-2,4-디메틸펜틸)옥시)-6-(디플루오로메틸)피리딘-2-일)피리미딘-2-일)카르바메이트 (0.006 g, 0.014 mmol, 28% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 410.3 [(M+H)+, 계산치 C19H26F2N5O3 410.2]; LC/MS 체류시간 (방법 H): tR = 1.25분; LC/MS 체류시간 (방법 I): tR = 1.01분. 1H NMR(400 MHz, 메탄올-d4): δ 8.66-8.69 (m, 2H), 8.04-8.06 (m, 1H), 7.75 (d, J = 8.80 Hz, 1H), 7.03 (t, J = 107.60 Hz, 1H), 4.02-4.09 (m, 2H), 3.84 (s, 3H), 1.86-1.92 (m, 1H), 1.55-1.68 (m, 2H), 1.32 (s, 3H), 1.00-1.04 (m, 6H) ppm.
실시예 324
(S)-1-((2',6-비스(플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A. 4-클로로-2-(플루오로메틸)피리딘
-78℃에서 DCM (40 mL) 중 (4-클로로피리딘-2-일)메탄올 (1 g, 6.97 mmol)의 용액에 디에틸아미노황 트리플루오라이드 (2.245 g, 13.93 mmol)를 천천히 첨가하였다. 반응 혼합물을 -78℃에서 10분 동안 교반하였다. 반응 혼합물을 수성 10% NaHCO3 용액으로 켄칭하고, 디클로로메탄 (50 mL)으로 희석하였다. 유기 층을 분리하고, 디클로로메탄으로 희석하고, 셀라이트를 통해 여과하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 보라색 오일로서의 4-클로로-2-(플루오로메틸)피리딘 (0.5 g)을 수득하였다. LCMS (ESI) m/e 146.4 [(M+H)+, 계산치 C6H6ClFN, 146.0]; LC/MS 체류시간 (방법 B): tR = 0.68분.
파트 B. (S)-tert-부틸 (1-((2',6-비스(플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
DMF (3 mL) 중 4-클로로-2-(플루오로메틸)피리딘 (50 mg, 0.343 mmol), (S)-tert-부틸 (1-((6-브로모-2-(플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (144 mg, 0.343 mmol), 및 1,1,1,2,2,2-헥사메틸디스탄난 (113 mg, 0.343 mmol)의 혼합물을 질소 기체로 10분 동안 퍼징하였다. Pd(Ph3P)4 (19.85 mg, 0.017 mmol)를 반응 혼합물에 첨가하고, 용액을 질소 기체로 추가로 10분 동안 퍼징하였다. 반응 혼합물을 마이크로웨이브로 120℃에서 1시간 동안 조사하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시켰다. 잔류물을 에틸 아세테이트 (20 mL) 중에 용해시키고, 염수로 세척하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 (S)-tert-부틸 (1-((2',6-비스(플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (58 mg, 0.129 mmol, 38% 수율)를 갈색 오일로서 수득하였다. LCMS (ESI) m/e 450.2 [(M+H)+, 계산치 C24H34F2N3O3, 450.3]; LC/MS 체류시간 (방법 G): tR = 3.80분.
파트 C. (S)-1-((2',6-비스(플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
디클로로메탄 (3 mL) 중 (S)-tert-부틸 (1-((2',6-비스(플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (90 mg, 0.200 mmol)의 용액에 염화수소 (0.501 mL, 2.002 mmol)를 첨가하였다. 반응 혼합물을 실온에서 1시간 동안 교반되도록 하였다. 반응 혼합물을 농축시키고, 10% 수성 NaHCO3 용액으로 켄칭하고, 디클로로메탄 (20 mL)으로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-1-((2',6-비스(플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (2 mg, 5.49 μmol, 3% 수율)을 황색 고체로서 수득하였다. LCMS (ESI) m/e 350.3 [(M+H)+, 계산치 C19H26F2N3O, 350.2]; LC/MS 체류시간 (방법 H): tR = 1.39분; LC/MS 체류시간 (방법 I): tR = 0.83분. 1H NMR(400 MHz, 메탄올-d4): δ 8.67 (d, J = 5.2 Hz, 1H), 8.21-8.24 (m, 1H), 8.15 (s, 1H), 8.01 (d, J = 5.6 Hz, 1H), 7.67 (d, J = 8.8 Hz, 1H), 5.49-5.67 (m, 4H), 3.88 (s, 2H), 1.75-1.87 (m, 1H), 1.39-1.46 (m, 2H), 1.16 (s, 3H), 0.89-0.98 (m, 6H) ppm.
실시예 325
(S)-1-((2'-(디플루오로메틸)-6-(플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A. 4-클로로-2-(디플루오로메틸)피리딘
-78℃에서 DCM (30 mL) 중 4-클로로피콜린알데히드 (2 g, 14.13 mmol)의 용액에 디에틸아미노황 트리플루오라이드 (4.55 g, 28.3 mmol)를 천천히 첨가하였다. 반응 혼합물을 -78℃에서 1시간 동안 교반하였다. 반응 혼합물을 수성 10% NaHCO3 용액으로 켄칭하고, 디클로로메탄 (20 mL)으로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 압력 하에 농축시켜 4-클로로-2-(디플루오로메틸)피리딘 (1.8 g, 11.01 mmol, 78% 수율)을 갈색 오일로서 수득하였다. LCMS (ESI) m/e 164.0 [(M+H)+, 계산치 C6H5ClF2N, 164.0]; LC/MS 체류시간 (방법 B): tR = 0.81분.
파트 B. (S)-tert-부틸 (1-((2'-(디플루오로메틸)-6-(플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
DMF (4 mL) 중 4-클로로-2-(디플루오로메틸)피리딘 (50 mg, 0.306 mmol), (S)-tert-부틸 (1-((6-브로모-2-(플루오로메틸)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (128 mg, 0.306 mmol), 및 1,1,1,2,2,2-헥사메틸디스탄난 (100 mg, 0.306 mmol)의 혼합물을 질소 기체로 10분 동안 퍼징하였다. Pd(Ph3P)4 (17.66 mg, 0.015 mmol)를 반응 혼합물에 첨가하고, 용액을 질소 기체로 추가로 10분 동안 퍼징하였다. 반응 혼합물을 마이크로웨이브로 120℃에서 1시간 동안 조사하였다. 반응 혼합물을 농축시키고, 에틸 아세테이트 (20 mL) 중에 용해시키고, 염수로 세척하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카-겔 크로마토그래피 (석유 에테르/에틸 아세테이트 (20-40%))에 의해 정제하여 (S)-tert-부틸 (1-((2'-(디플루오로메틸)-6-(플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (86 mg, 0.184 mmol, 60% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 468.3 [(M+H)+, 계산치 C24H33F3N3O3, 468. 2]; LC/MS 체류시간 (방법 B): tR = 1.18분.
파트 C. (S)-1-((2'-(디플루오로메틸)-6-(플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
디클로로메탄 (3 mL) 중 (S)-tert-부틸 (1-((2'-(디플루오로메틸)-6-(플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (130 mg, 0.278 mmol)의 용액에 염화수소 (0.695 mL, 2.78 mmol)를 첨가하였다. 반응 혼합물을 실온에서 1시간 동안 교반되도록 하였다. 반응 혼합물을 농축시키고, 10% 수성 NaHCO3 용액으로 켄칭하고, 디클로로메탄 (20 mL)으로 희석하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-1-((2'-(디플루오로메틸)-6-(플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민 (6.3 mg, 0.016 mmol, 6% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 368.3 [(M+H)+, 계산치 C19H25F3N3O 368.40]; LC/MS 체류시간 (방법 H): tR = 1.49분; LC/MS 체류시간 (방법 I): tR = 1.19분. 1H NMR (400 MHz, 메탄올-d4): δ 8.76 (d, J = 5.2 Hz, 1H), 8.20-8.33 (m, 2H), 8.19 (d, 1H), 7.69 (d, J = 8.8 Hz, 1H), 6.89-7.17 (t, -CHF2, 1H), 5.55-5.68 (m, 2H), 3.90 (s, 2H), 1.73-1.87 (m, 1H), 1.37-1.48 (m, 2H), 1.16 (s, 3H), 0.89-0.97 (m, 6H) ppm.
실시예 326
2',6-비스(디플루오로메틸)-5-((2-이소부틸아제티딘-2-일)메톡시)-2,4'-비피리딘
파트 A. 메틸 2-((4-메톡시벤질)아미노)-4-메틸펜타노에이트
메탄올 (40 mL) 중 4-메톡시벤즈알데히드 (4.18 mL, 37.2 mmol)의 용액을 0℃로 냉각시키고, TEA (4.32 mL, 31.0 mmol)를 첨가하고, 이어서 4-메톡시벤즈알데히드 (4.18 mL, 37.2 mmol)를 첨가하였다. 반응 혼합물을 실온으로 가온되도록 하고, 90분 동안 교반하였다. 반응 혼합물을 0℃로 냉각시키고, NaBH4 (2.35 g, 62.0 mmol)를 조금씩 첨가하였다. 반응 혼합물을 실온으로 가온하고, 90분 동안 교반하였다. 반응 혼합물을 다시 0℃로 냉각시키고, 추가의 NaBH4 (2.61 g, 68.9 mmol)를 조금씩 첨가하였다. 반응 혼합물을 실온으로 가온하고, 20분 동안 교반하였다. 반응 혼합물을 0℃로 냉각시키고, 포화 수성 염화암모늄 (25 mL)으로 켄칭하였다. 혼합물을 감압 하에 농축시켰다. 잔류물을 물로 희석하고, 에틸 아세테이트 (2 x 50 mL)로 추출하였다. 에틸 아세테이트 층을 물 (1 x 20 mL) 및 염수 (1 x 20 mL)로 세척하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 조 생성물을 실리카 겔 크로마토그래피 (0-20% 석유 에테르:에틸 아세테이트)에 의해 정제하여 메틸 2-((4-메톡시벤질)아미노)-4-메틸펜타노에이트 (4.4 g, 13.76 mmol, 44% 수율)를 갈색 반고체로서 수득하였다. LCMS (ESI) m/e 266.1 [(M+H)+, 계산치 C15H24NO3 266.2]; LC/MS 체류시간 (방법 B): tR = 0.79분.
파트 B. 메틸 2-(2-클로로-N-(4-메톡시벤질)아세트아미도)-4-메틸펜타노에이트
THF (50 mL) 중 메틸 2-((4-메톡시벤질)아미노)-4-메틸펜타노에이트 (8 g, 30.1 mmol)의 용액을 0℃로 냉각시키고, 프로필렌 옥시드 (21.35 mL, 301 mmol)를 첨가하고, 이어서 2-클로로아세틸 클로라이드 (3.60 mL, 45.2 mmol)를 적가하였다. 반응 혼합물을 실온으로 가온되도록 하고, 2시간 동안 교반하였다. 반응 혼합물을 물 (50 mL)로 희석하고, 에틸 아세테이트 (2 x 100 mL)로 추출하였다. 에틸 아세테이트 층을 물 (1 x 20 mL) 및 염수 (1 x 20 mL)로 세척하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켜 메틸 2-(2-클로로-N-(4-메톡시벤질)아세트아미도)-4-메틸펜타노에이트 (10 g, 27.2 mmol, 90% 수율)를 연황색 액체로서 수득하였다. LCMS (ESI) m/e 342.1 [(M+H)+, 계산치 C17H25ClNO4 342.1]; LC/MS 체류시간 (방법 C): tR = 1.09분.
파트 C. 메틸 2-이소부틸-1-(4-메톡시벤질)-4-옥소아제티딘-2-카르복실레이트
아세토니트릴 (30 mL) 중 메틸 2-(2-클로로-N-(4-메톡시벤질)아세트아미도)-4-메틸펜타노에이트 (3.0 g, 8.78 mmol)의 용액에, Cs2CO3 (5.72 g, 17.55 mmol)을 실온에서 첨가하였다. 반응 혼합물을 75℃로 밤새 가열하였다. 반응 혼합물을 물 (30 mL)로 희석하고, 에틸 아세테이트 (2 x 50 mL)로 추출하였다. 에틸 아세테이트 층을 물 (1 x 20 mL), 염수 (1 x 20 mL)로 세척하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 조 생성물을 실리카 겔 크로마토그래피 (20-50% 석유 에테르:에틸 아세테이트)에 의해 정제하여 메틸 2-이소부틸-1-(4-메톡시벤질)-4-옥소아제티딘-2-카르복실레이트 (550 mg, 1.801 mmol, 21% 수율)를 무색 액체로서 수득하였다. LCMS (ESI) m/e 306.1 [(M+H)+, 계산치 C17H24NO4 306.2]; LC/MS 체류시간 (방법 C): tR = 1.03분.
파트 D. (2-이소부틸-1-(4-메톡시벤질)아제티딘-2-일)메탄올
-30℃로 냉각시킨 THF (10 mL) 중 메틸 2-이소부틸-1-(4-메톡시벤질)-4-옥소아제티딘-2-카르복실레이트 (500 mg, 1.637 mmol)의 용액에 THF 중 2.4M LAH (1.364 mL, 3.27 mmol)를 첨가하였다. 반응 혼합물을 실온으로 가온되도록 하고, 2시간 동안 교반하였다. 반응 혼합물을 0℃로 냉각시키고, 포화 염화암모늄 용액 (10 mL)으로 켄칭하고, 에틸 아세테이트 (2 x 50 mL)로 추출하였다. 에틸 아세테이트 층을 물 (1 x 20 mL) 및 염수 (1 x 20 mL)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 (2-이소부틸-1-(4-메톡시벤질)아제티딘-2-일)메탄올 (350 mg, 1.329 mmol, 81% 수율)을 갈색 반고체로서 수득하였다. LCMS (ESI) m/e 264.2 [(M+H)+, 계산치 C16H26NO2 264.2]; LC/MS 체류시간 (방법 G): tR = 1.59분.
파트 E. 2',6-비스(디플루오로메틸)-5-((2-이소부틸-1-(4-메톡시벤질)아제티딘-2-일)메톡시)-2,4'-비피리딘
밀봉된 튜브에 들은 EtOH (20 mL) 및 THF (10 mL) 중 (2-(디플루오로메틸)피리딘-4-일)보론산 (실시예 123에서와 같이 제조됨) (509 mg, 2.94 mmol)의 용액에 물 중 2 M 인산삼칼륨 (2.323 mL, 4.65 mmol)을 첨가하였다. 혼합물을 아르곤으로 5분 동안 퍼징하였다. XPhos 제2 세대 전촉매 (36.6 mg, 0.046 mmol) 및 6-브로모-2-(디플루오로메틸)-3-플루오로피리딘 (실시예 322에 기재된 바와 같이 제조됨) (350 mg, 1.549 mmol)을 첨가하였다. 용기를 밀봉하고, 80℃로 12시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 에틸 아세테이트 (25 mL)로 희석하였다. 용액을 규조토 (셀라이트®)를 통해 여과하고, 여과물을 감압 하에 증발시켜 암갈색 잔류물을 수득하였다. 잔류물을 실리카 겔 크로마토그래피 (0-30% 석유 에테르:에틸 아세테이트)에 의해 정제하여 2',6-비스(디플루오로메틸)-5-플루오로-2,4'-비피리딘 (250 mg, 0.912 mmol, 59% 수율)을 암황색 고체로서 수득하였다. LCMS (ESI) m/e 275.0 [(M+H)+, 계산치 C12H5F5N2 275.1]; LC/MS 체류시간 (방법 G): tR = 2.54분.
파트 F. 2',6-비스(디플루오로메틸)-5-((2-이소부틸-1-(4-메톡시벤질)아제티딘-2-일)메톡시)-2,4'-비피리딘
0℃에서 THF (5 mL) 중 (2-이소부틸-1-(4-메톡시벤질)아제티딘-2-일)메탄올 (192 mg, 0.729 mmol)의 용액에 THF 중 KOt-Bu, 1M (0.729 mL, 0.729 mmol)을 첨가하였다. 이어서, 혼합물을 0℃에서 5분 동안 교반하였다. 2',6-비스(디플루오로메틸)-5-플루오로-2,4'-비피리딘 (200 mg, 0.729 mmol)을 첨가하고, 반응 혼합물을 실온에서 30분 동안 교반하였다. 반응 혼합물을 염수 (25 mL)로 켄칭하고, 에틸 아세테이트 (20 mL)로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (헥산 중 20-60% EtOAc)에 의해 정제하였다. 수득된 생성물을 추가로 정제용 HPLC (물 및 아세토니트릴 중 10 mM 아세트산암모늄)에 의해 정제하여 2',6-비스(디플루오로메틸)-5-((2-이소부틸-1-(4-메톡시벤질)아제티딘-2-일)메톡시)-2,4'-비피리딘 (150 mg, 0.145 mmol, 20% 수율)을 황색 오일로서 수득하였다. LCMS (ESI) m/e 518.2 [(M+H)+, 계산치 C28H32F4N3O2, 518.2]; LC/MS 체류시간 (방법 G): tR = 3.57분.
파트 G. 2',6-비스(디플루오로메틸)-5-((2-이소부틸아제티딘-2-일)메톡시)-2,4'-비피리딘
디클로로메탄 (5 mL)/물 (2 mL) 중 2',6-비스(디플루오로메틸)-5-((2-이소부틸-1-(4-메톡시벤질)아제티딘-2-일)메톡시)-2,4'-비피리딘 (100 mg, 0.097 mmol)의 용액에 DDQ (32.9 mg, 0.145 mmol)를 첨가하였다. 이어서, 혼합물을 실온에서 1시간 동안 교반하였다. 반응 혼합물을 디클로로메탄 (50 mL)으로 희석하고, 10% Na2CO3 용액 (50 mL)으로 켄칭하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (DCM 중 0-10% MeOH)에 의해 정제하여 2',6-비스(디플루오로메틸)-5-((2-이소부틸아제티딘-2-일)메톡시)-2,4'-비피리딘 (17 mg, 0.042 mmol, 44% 수율)을 황색 점착성 고체로서 수득하였다. LCMS (ESI) m/e 398.2 [(M+H)+, 계산치 C20H24F4N3O 398.2]; LC/MS 체류시간 (방법 G): tR = 1.61분. 1H NMR(400 MHz, 메탄올-d4): δ 8.72 (d, J = 5.20 Hz, 1H), 8.37 (s, 1H), 8.28 (d, J = 8.80 Hz, 1H), 8.20-8.22 (m, 1H), 7.82 (d, J = 8.80 Hz, 1H), 6.67-7.12 (m, 2H), 4.30-4.43 (m, 2H), 3.63-3.78 (m, 1H), 3.57-3.61 (m, 1H), 2.43-2.48 (m, 2H), 1.93-1.98 (m, 1H), 1.84-1.89 (m, 1H), 1.72-1.75 (m, 1H), 0.95-0.99 (m, 6H) ppm.
실시예 327
(S)-2,4-디메틸-1-(4-(2-메틸-1H-피롤로[2,3-b]피리딘-4-일)-2-(트리플루오로메틸) 페녹시) 펜탄-2-아민
파트 A: 4-클로로-1-토실-1H-피롤로[2,3-b]피리딘
THF (16 mL) 및 DMF (8.00 mL) 중 4-클로로-1H-피롤로[2,3-b]피리딘 (0.82 g, 5.37 mmol)의 교반 용액에 소듐 tert-부톡시드 (1.291 g, 13.44 mmol) 및 p-톨루엔술포닐 클로라이드 (2.049 g, 10.75 mmol)를 첨가하였다. 혼합물을 실온에서 2.5시간 동안 교반하였다. 반응 혼합물을 포화 염화암모늄 용액 (60 mL)으로 켄칭하고, 에틸 아세테이트 (3 x 60 mL)로 추출하였다. 합한 유기 층을 황산나트륨 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (에틸 아세테이트 및 석유 에테르)에 의해 정제하여 4-클로로-1-토실-1H-피롤로[2,3-b]피리딘 (1.6 g, 4.85 mmol, 90% 수율)을 백색 반고체로서 수득하였다. LCMS (ESI) m/e 307.0 [(M+H)+, 계산치 C14H12ClN2O2S, 307.0]; LC/MS 체류시간 (방법 A2); tR = 2.11분.
파트 B: 4-클로로-1-((4-에틸페닐)술포닐)-2-메틸-1H-피롤로[2,3-b]피리딘
THF (20 mL) 중 4-클로로-1-토실-1H-피롤로[2,3-b]피리딘 (1.5 g, 4.89 mmol)의 용액을 -78℃로 냉각시켰다. LDA (6.11 mL, 12.22 mmol)를 -78℃에서 첨가하고, 이 온도에서 1시간 동안 교반하였다. 이어서, 메틸 아이오다이드 (0.611 mL, 9.78 mmol)를 첨가하고, -78℃에서 1시간 동안 교반하였다. 이어서, 반응 혼합물을 실온으로 가온되도록 하고, 50분 동안 교반하였다. 반응 혼합물을 0℃로 냉각시키고, 포화 염화암모늄 용액 (10 mL)을 첨가하여 켄칭하고, 에틸 아세테이트 (3 x 20 mL)로 추출하였다. 합한 유기부를 황산나트륨 상에서 건조시키고, 감압 하에 농축시켰다. 조 생성물을 역상 HPLC에 의해 정제하여 4-클로로-1-((4-에틸페닐)술포닐)-2-메틸-1H-피롤로[2,3-b]피리딘 (0.68 g, 1.990 mmol, 36% 수율)을 황색 반고체로서 수득하였다. LCMS (ESI) m/e 335.0 [(M+H)+, 계산치 C16H16ClN2O2S, 335.1]; LC/MS 체류시간 (방법 A1); tR = 2.60분.
파트 C: 4-클로로-2-메틸-1H-피롤로[2,3-b]피리딘
MeOH (4 mL) 중 4-클로로-1-((4-에틸페닐)술포닐)-2-메틸-1H-피롤로[2,3-b]피리딘 (0.2 g, 0.585 mmol)의 용액에 실온에서 5M NaOH 용액 (0.585 mL, 2.93 mmol)을 첨가하였다. 전체 혼합물을 70℃에서 5시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시켰다. 잔류물을 에틸 아세테이트 (15 mL) 및 물 (10 mL)로 희석하였다. 유기 층을 에틸 아세테이트 (2 x 10 mL)로 재추출하였다. 합한 유기부를 건조시키고, 농축시켜 4-클로로-2-메틸-1H-피롤로[2,3-b]피리딘 (0.1 g, 0.504 mmol, 86% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 167.2 [(M+H)+, 계산치 C8H8ClN2, 167.03]; LC/MS 체류시간 (방법 A1); tR = 1.82분.
파트 D: (S)-tert-부틸 (2,4-디메틸-1-(4-(2-메틸-1H-피롤로[2,3-b]피리딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트
THF (2 mL) 및 물 (0.667 mL) 중 4-클로로-2-메틸-1H-피롤로[2,3-b]피리딘 (0.028 g, 0.141 mmol), (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (실시예 215, 파트 A 및 B에 기재된 바와 같이 제조됨) (0.071 g, 0.141 mmol), 및 Cs2CO3 (0.069 g, 0.212 mmol)의 혼합물을 질소로 15분 동안 퍼징하였다. XPhos 제2 세대 전촉매 (0.017 g, 0.021 mmol)를 첨가하고, 질소 기체를 반응 혼합물을 통해 5분 동안 버블링하고, 65℃에서 4시간 동안 교반하였다. 반응 혼합물을 실온으로 냉각시키고, THF (10 mL)로 희석하고, 규조토 (셀라이트®)를 통해 여과하였다. 층을 과량의 THF로 세척하였다. 여과물을 감압 하에 농축시켰다. 조 생성물을 실리카 겔 크로마토그래피 (에틸 아세테이트 및 석유 에테르)에 의해 정제하여 (S)-tert-부틸 (2,4-디메틸-1-(4-(2-메틸-1H-피롤로[2,3-b]피리딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (0.032 g, 0.062 mmol, 44% 수율)를 연황색 오일로서 수득하였다. LCMS (ESI) m/e 506.2 [(M+H)+, 계산치 C27H36F3N3O3, 506.26]; LC/MS 체류시간 (방법 A1); tR = 2.80분.
파트 E: (S)-2,4-디메틸-1-(4-(2-메틸-1H-피롤로[2,3-b]피리딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민
MeOH (1.5 mL) 중 (S)-tert-부틸 (2,4-디메틸-1-(4-(2-메틸-1H-피롤로[2,3-b]피리딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (0.032 g, 0.062 mmol)의 용액을 0℃로 냉각시키고, 질소 분위기 하에 10분 동안 교반하였다. TFA (1.5 mL, 19.47 mmol)를 1분의 기간에 걸쳐 적가하고, 혼합물을 실온으로 가온하고, 4시간 동안 교반하였다. 혼합물을 감압 하에 28℃에서 농축시켰다. 화합물을 역상 HPLC 정제 (방법 D)에 의해 정제하여 (S)-2,4-디메틸-1-(4-(2-메틸-1H-피롤로[2,3-b]피리딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민, 2 TFA (0.015 g, 0.022 mmol, 35% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 404.3 [(M-H)+, 계산치 C22H25F3N3O, 404.20]; LC/MS 체류시간 (방법 H); tR = 1.86분. 1H NMR (400 MHz, 메탄올-d4): δ 8.25 (d, J = 5.6 Hz, 1H), 8.12 - 8.08 (m, 2H), 7.52 (d, J = 8.5 Hz, 1H), 7.44 (d, J = 5.6 Hz, 1H), 6.52 (s, 1H), 4.36 (d, J = 10.4 Hz, 1H), 4.28 (d, J = 10.4 Hz, 1H), 2.57 (s, 3H), 1.95 - 1.85 (m, 2H), 1.79 - 1.72 (m, 1H), 1.57 (s, 3H), 1.07 (m, 6H) ppm.
실시예 328
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-메틸-1H-피롤로[2,3-b]피리딘-4-일)벤조니트릴
파트 A: (S)-tert-부틸 (1-(2-시아노-4-(2-메틸-1H-피롤로[2,3-b]피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
THF (2 mL) 및 물 (0.667 mL) 중 4-클로로-2-메틸-1H-피롤로[2,3-b]피리딘 (실시예 327에 기재된 바와 같이 제조됨) (0.029 g, 0.146 mmol), (S)-tert-부틸 (1-(2-시아노-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.074 g, 0.161 mmol) (실시예 86, 파트 A 및 B에 기재된 바와 같이 제조됨), 및 Cs2CO3 (0.071 g, 0.219 mmol)의 혼합물. 혼합물을 질소로 15분 동안 퍼징하였다. XPhos 제2 세대 전촉매 (0.017 g, 0.022 mmol)를 첨가한 다음, 질소 기체로 5분 동안 퍼징하였다. 이어서, 혼합물을 65℃에서 5시간 동안 교반하였다. 반응 혼합물을 실온으로 냉각시키고, THF (10 mL)로 희석하고, 규조토 (셀라이트®)를 통해 여과하였다. 층을 과량의 THF로 세척하였다. 여과물을 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (에틸 아세테이트 및 석유 에테르)에 의해 정제하여 (S)-tert-부틸 (1-(2-시아노-4-(2-메틸-1H-피롤로[2,3-b]피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.065 g, 0.133 mmol, 91% 수율)를 연황색 오일로서 수득하였다. LCMS (ESI) m/e 463.2 [(M+H) +, 계산치 C27H35N4O3, 463.26]; LC/MS 체류시간 (방법 H); tR = 2.65분.
파트 B: (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-메틸-1H-피롤로[2,3-b]피리딘-4-일)벤조니트릴
MeOH (1.5 mL) 중 (S)-tert-부틸 (1-(2-시아노-4-(2-메틸-1H-피롤로[2,3-b]피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.065 g, 0.133 mmol)의 용액을 0℃로 냉각시키고, 질소 분위기 하에 10분 동안 교반하였다. TFA (1.5 mL, 19.47 mmol)를 1분의 기간에 걸쳐 적가하고, 혼합물을 실온으로 가온하고, 4시간 동안 교반되도록 하였다. 혼합물을 감압 하에 28℃에서 농축시켰다. 잔류물을 디에틸 에테르 (2 x 10 mL)로 세척한 다음, 진공 하에 10분 동안 건조시켰다. 생성물을 동결건조시켜 (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-메틸-1H-피롤로[2,3-b]피리딘-4-일)벤조니트릴, TFA (0.025 g, 0.064 mmol, 48% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 363.2 [(M+H) +, 계산치 C22H27N4O, 363.21]; LC/MS 체류시간 (방법 H); tR = 2.01분. 1H NMR (400 MHz, 메탄올-d4): δ 8.13 (d, J = 5.0 Hz, 1H), 8.07 - 8.04 (m, 2H), 7.35 (d, J = 8.5 Hz, 1H), 7.14 (d, J = 5.0 Hz, 1H), 6.38 (s, 1H), 4.08-4.03 (m, 2H), 2.49 (s, 3H), 1.90 - 1.86 (m, 1H), 1.66 - 1.56 (m, 2H), 1.35 - 1.23 (s, 3H), 1.05-1.02 (m, 6H) ppm.
실시예 329
(S)-2,4-디메틸-1-(2-메틸-4-(2-메틸피리미딘-4-일)페녹시)펜탄-2-아민
파트 A: (S)-tert-부틸 (2,4-디메틸-1-(2-메틸-4-(2-메틸피리미딘-4-일)페녹시)펜탄-2-일)카르바메이트
THF (2 mL) 중 (S)-tert-부틸 (2,4-디메틸-1-(2-메틸-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)펜탄-2-일)카르바메이트 (실시예 285에 기재된 절차를 사용하여 제조됨) (0.070 g, 0.156 mmol), 4-클로로-2-메틸피리미딘 (0.02 g, 0.156 mmol), 및 인산삼칼륨 (2M 용액) (0.5 mL, 1.00 mmol)의 혼합물을 질소로 15분 동안 퍼징하였다. XPhos 제2 세대 전촉매 (0.037 g, 0.047 mmol)를 첨가하고, 혼합물을 추가로 5분 동안 퍼징하였다. 이어서, 반응 혼합물을 75℃에서 2.5시간 동안 교반하였다. 반응 혼합물을 실온으로 냉각시키고, THF (15 mL)로 희석하고, 규조토 (셀라이트®)를 통해 여과하였다. 층을 과량의 THF로 세척하였다. 여과물을 감압 하에 농축시켰다. 조 생성물을 실리카 겔 크로마토그래피 (에틸 아세테이트 및 석유 에테르)에 의해 정제하여 (S)-tert-부틸 (2,4-디메틸-1-(2-메틸-4-(2-메틸피리미딘-4-일)페녹시)펜탄-2-일)카르바메이트 (0.018 g, 0.036 mmol, 23% 수율)를 황색 오일로서 수득하였다. LCMS (ESI) m/e 414.4 [(M+H) +, 계산치 C24H36N3O3, 414.26]; LC/MS 체류시간 (방법 A2); tR = 2.30분.
파트 B: (S)-2,4-디메틸-1-(2-메틸-4-(2-메틸피리미딘-4-일)페녹시)펜탄-2-아민
MeOH (1.5 mL) 중 (S)-tert-부틸 (2,4-디메틸-1-(2-메틸-4-(2-메틸피리미딘-4-일)페녹시)펜탄-2-일)카르바메이트 (0.018 g, 0.036 mmol)의 용액을 0℃로 냉각시키고, 질소 분위기 하에 10분 동안 교반하였다. TFA (1.5 mL, 19.47 mmol)를 1분의 기간에 걸쳐 적가하고, 혼합물을 실온으로 가온하고, 4시간 동안 교반되도록 하였다. 혼합물을 감압 하에 농축시켰다. 잔류물을 정제용 HPLC (방법 B)에 의해 정제하여 (S)-2,4-디메틸-1-(2-메틸-4-(2-메틸피리미딘-4-일)페녹시)펜탄-2-아민, TFA (5.5 mg, 0.036 mmol, 43% 수율)를 수득하였다. LCMS (ESI) m/e 314.2 [(M+H)+, 계산치 C19H28N3O,314.21]; LC/MS 체류시간 (방법 E); tR = 1.02분. LC/MS 체류시간 (방법 D); tR = 1.29분. 1H NMR (400 MHz, 메탄올-d4): δ 8.64 (d, J = 5.60 Hz, 1H), 8.07-8.09 (m, 2H), 7.81 (d, J = 5.60 Hz, 1H), 7.12-7.15(m, 1H), 4.12-4.22 (m, 2H), 2.75 (s, 3H), 2.41 (s, 3H), 1.85-1.93 (m, 2H), 1.70-1.73 (m, 1H), 1.52 (s, 3H), 1.01-1.08 (m, 6H) ppm.
실시예 330
(S)-2,4-디메틸-1-(2-메틸-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)펜탄-2-아민
파트 A: (S)-tert-부틸 (2,4-디메틸-1-(2-메틸-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)펜탄-2-일)카르바메이트
1,4-디옥산 (1 mL) 중 4-클로로-2-(트리플루오로메틸)피리미딘 (0.01 g, 0.055 mmol), (S)-tert-부틸 (2,4-디메틸-1-(2-메틸-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)펜탄-2-일)카르바메이트 (실시예 367, 파트 A에 기재된 바와 같이 제조됨) (0.029 g, 0.066 mmol), 및 KBr (6.52 mg, 0.055 mmol)의 혼합물을 질소로 15분 동안 퍼징하였다. PdCl2(dppf)-CH2Cl2 부가물 (4.47 mg, 5.48 μmol)을 첨가하고, 추가로 5분 동안 퍼징한 다음, 반응 혼합물을 80℃ 마이크로웨이브에서 1.3시간 동안 교반하였다. 반응 혼합물을 실온으로 냉각시키고, THF (20 mL)로 희석하고, 규조토 (셀라이트®)를 통해 여과하였다. 층을 과량의 THF로 세척하였다. 여과물을 감압 하에 농축시켰다. 조 생성물을 실리카 겔 크로마토그래피 (석유 에테르 중 에틸 아세테이트 30-40%)에 의해 정제하여 (S)-tert-부틸 (2,4-디메틸-1-(2-메틸-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)펜탄-2-일)카르바메이트 (0.015 g, 0.024 mmol, 44% 수율)를 연황색 오일로서 수득하였다. LCMS (ESI) m/e 468.3 [(M+H) +, 계산치 C24H33F3N3O3, 468.24]; LC/MS 체류시간 (방법 B); tR = 1.29분.
파트 B: (S)-2,4-디메틸-1-(2-메틸-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)펜탄-2-아민
MeOH (1.5 mL) 중 (S)-tert-부틸 (2,4-디메틸-1-(2-메틸-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)펜탄-2-일)카르바메이트 (0.015 g, 0.024 mmol)의 용액을 0℃로 냉각시키고, 질소 분위기 하에 10분 동안 교반하였다. TFA (1.5 mL, 19.47 mmol)를 1분의 기간에 걸쳐 적가하고, 혼합물을 실온으로 가온하고, 4시간 동안 교반되도록 하였다. 혼합물을 감압 하에 농축시켰다. 잔류물을 정제용 HPLC (방법 B)에 의해 정제하여 (S)-2,4-디메틸-1-(2-메틸-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)펜탄-2-아민, TFA ( 9.5 mg, 0.024 mmol, 84% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 368.0 [(M+H) +, 계산치 C19H25F3N3O,368.18]; LC/MS 체류시간 (방법 D); tR = 1.83분. LC/MS 체류시간 (방법 E); tR = 1.47분. 1H NMR (400 MHz, DMSO-d4): δ 9.02 (d, J = 5.20 Hz, 1H), 8.33 (d, J = 5.60 Hz, 1H), 8.13-8.14 (m, 2H), 8.05 (bs, 2H), 7.19 (d, J = 8.40 Hz, 1H), 4.08-4.11 (m, 2H), 2.37 (s, 3H), 1.75-1.83 (m, 2H), 1.58-1.63 (m, 1H), 1.39 (s, 3H), 0.91-0.98 (m, 6H) ppm.
실시예 331
(S)-1-(2-플루오로-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
파트 A: 4-(3-플루오로-4-메톡시페닐)-2-(트리플루오로메틸)피리미딘
1,4-디옥산 (1.8 mL) 중 4-클로로-2-(트리플루오로메틸)피리미딘 (0.06 g, 0.329 mmol), 2-(3-플루오로-4-메톡시페닐)-4,4,5,5-테트라메틸-1,3,2-디옥사보롤란 (0.099 g, 0.394 mmol), Cs2CO3 (0.214 g, 0.657 mmol), 및 KBr (0.039 g, 0.329 mmol)의 혼합물을 질소로 15분 동안 퍼징하였다. PdCl2(dppf)-CH2Cl2 부가물 (0.027 g, 0.033 mmol)을 첨가하고, 혼합물을 추가로 5분 동안 퍼징하였다. 반응 혼합물을 80℃에서 1.3시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, THF (20 mL)로 희석한 다음, 규조토 (셀라이트®)를 통해 여과하였다. 층을 과량의 THF로 세척하였다. 여과물을 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (에틸 아세테이트 및 석유 에테르)에 의해 정제하여 4-(3-플루오로-4-메톡시페닐)-2-(트리플루오로메틸)피리미딘 (0.115 g, 0.275 mmol, 53% 수율)을 무색 반고체로서 수득하였다. LCMS (ESI) m/e 273.0 [(M+H)+, 계산치 C12H9F4N2O, 273.05]; LC/MS 체류시간 (방법 B); tR = 0.98분.
파트 B: 2-플루오로-4-(2-(트리플루오로메틸)피리미딘-4-일)페놀
DCM (1 mL) 중 4-(3-플루오로-4-메톡시페닐)-2-(트리플루오로메틸)피리미딘 (0.01 g, 0.024 mmol)의 냉각 용액에 BBr3 (4.52 μL, 0.048 mmol)을 첨가하였다. 이어서, 반응 혼합물을 실온으로 가온하고, 16시간 동안 교반하였다. 반응 혼합물을 0℃로 냉각시키고, 메탄올로 켄칭하고, 감압 하에 농축시켰다. 잔류물을 디에틸 에테르 (2 x 10 mL)로 세척하고, 고진공 하에 건조시켜 2-플루오로-4-(2-(트리플루오로메틸)피리미딘-4-일)페놀 (0.006 g, 0.022 mmol, 93% 수율)을 갈색 고체로서 수득하였다. 조 생성물을 추가 정제 없이 후속 단계에 그대로 사용하였다. LCMS (ESI) m/e 259.0 [(M+H) +, 계산치 C11H7F4N2O, 259.04]; LC/MS 체류시간 (방법 A1); tR = 2.162.
파트 C: (S)-tert-부틸 (1-(2-플루오로-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
DMF (2 mL) 중 2-플루오로-4-(2-(트리플루오로메틸)피리미딘-4-일)페놀 (0.04 g, 0.130 mmol)의 교반 현탁액을 0℃로 냉각시키고, 10분 동안 교반하였다. K2CO3 (0.180 g, 1.301 mmol)을 첨가하고, 혼합물을 0℃에서 5분 동안 교반한 다음, 실온에서 10분 동안 교반하였다. 반응 혼합물을 0℃로 냉각시키고, DMF (2 mL) 중 (S)-tert-부틸 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (0.038 g, 0.130 mmol)를 첨가하고, 10분 동안 교반하였다. 이어서, 혼합물을 80℃로 16시간 동안 가열하였다. 혼합물을 실온으로 냉각시키고, 물 (10 mL)로 희석하였다. 용액을 에틸 아세테이트 (4 x 20 mL)로 추출하였다. 합한 유기 층을 물 (2x10 mL)에 이어서 염수 (2x5 mL)로 세척하였다. 합한 유기 층을 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (20-40% 에틸 아세테이트 및 석유 에테르)에 의해 정제하여 (S)-tert-부틸 (1-(2-플루오로-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.05 g, 0.062 mmol, 40.8% 수율)를 황색 오일로서 수득하였다. LCMS (ESI) m/e 472.2 [(M+H) +, 계산치 C23H30F4N3O3, 472.2]; LC/MS 체류시간 (방법 B); tR = 1.26분.
파트 D: (S)-1-(2-플루오로-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
MeOH (1.5 mL) 중 (S)-tert-부틸 (1-(2-플루오로-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)-2,4- 디메틸펜탄-2-일)카르바메이트 (0.05 g, 0.062 mmol)의 용액을 0℃로 냉각시키고, 질소 분위기 하에 TFA (1.5 mL, 19.47 mmol)를 1분의 기간에 걸쳐 적가하였다. 이어서, 혼합물을 실온으로 가온하고, 4시간 동안 교반되도록 하였다. 반응 혼합물을 감압 하에 보다 낮은 온도 (28℃)에서 농축시켰다. 조 물질을 정제용 HPLC (방법 B)에 의해 정제하여 (S)-1-(2-플루오로-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민, TFA (0.03 g, 0.059 mmol, 96% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 372.2 [(M+H) +, 계산치 C18H22F4N3O, 372.2]; LC/MS 체류시간 (방법 E); tR = 1.42분. 1H NMR (400 MHz, 메탄올-d4): δ 8.95 (d, J = 5.20 Hz, 1H), 8.11-8.16 (m, 3H), 7.38 (t, J = 8.40 Hz, 1H), 4.29 (d, J = 10.40 Hz, 1H), 4.20 (d, J = 10.00 Hz, 1H), 1.84-1.91 (m, 2H), 1.67-1.72 (m, 1H), 1.51 (s, 3H), 0.96- 1.08 (m, 6H) ppm.
실시예 337
(S)-1-(2-플루오로-4-(2-이소프로필피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
실시예 285에 기재된 바와 같이 제조하여 (S)-1-(2-플루오로-4-(2-이소프로필피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민, TFA (1 mg, 0.017 mmol, 13% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 346.2 [(M+H) +, 계산치 C20H29FN3O, 346.2]; LC/MS 체류시간 (방법 D); tR = 2.53. LC/MS 체류시간 (방법 E); tR = 1.92분. 1H NMR (400 MHz, 메탄올-d4): δ 8.68 (d, J = 5.60 Hz, 1H), 8.07 (t, J = 10.00 Hz, 2H), 7.75 (d, J = 5.60 Hz, 1H), 7.33 (t, J = 8.40 Hz, 1H), 4.27 (d, J = 10.40 Hz, 1H), 4.18 (d, J = 10.40 Hz, 1H), 3.20-3.25 (m, 1H), 1.86-1.88 (m, 2H), 1.67-1.72 (m, 1H), 1.50 (s, 3H), 1.38-1.40 (m, 6H), 1.02-1.08 (m, 6H) ppm.
실시예 343
(S)-6-(5-((2-아미노-2,4-디메틸펜틸)옥시)-6-메틸피리딘-2-일)피리미딘-4-아민
파트 A. (S)-tert-부틸 (1-((6-아이오도-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
DMF (25 mL) 중 6-아이오도-2-메틸피리딘-3-올 (2.0 g, 8.51 mmol), K2CO3 (3.53 g, 25.5 mmol) 및 (S)-tert-부틸 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (실시예 32, 파트 A-E에 기재된 바와 같이 제조됨) (2.75 g, 9.36 mmol)의 혼합물을 80℃로 밤새 16시간 동안 가열하였다. 혼합물을 실온으로 냉각시키고, 물 (10 mL)로 희석하였다. 용액을 에틸 아세테이트 (4 x 20 mL)로 추출하였다. 합한 유기 층을 물 (2x20 mL)에 이어서 염수 (2x20 mL)로 세척하였다. 합한 유기 층을 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (20-40% 에틸 아세테이트 및 석유 에테르)에 의해 정제하여 (S)-tert-부틸 (1-((6-아이오도-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (3.0 g, 6.36 mmol, 75% 수율)를 연한색 반고체로서 수득하였다. 1H NMR (400 MHz, 클로로포름-d): δ 7.43 (s, 1H), 6.78 - 6.85 (m, 1H), 4.46 - 4.53 (m, 1H), 4.08 - 4.17 (m, 1H), 3.92 - 3.99 (m, 1H), 2.44 (s, 3H), 1.74 - 1.88 (m, 2H), 1.56 (s, 3H), 1.47 - 1.53 (m, 1H), 1.34 - 1.44 (m, 9H), 0.97 (m, 6H) ppm.
파트 B. (S)-tert-부틸 (1-((6-(6-아세트아미도피리미딘-4-일)-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (3 mL) 중 N-(6-클로로피리미딘-4-일)아세트아미드 (실시예 278에 기재된 바와 같이 제조됨) (0.03 g, 0.175 mmol), (S)-tert-부틸 (1-((6-아이오도-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.086 g, 0.192 mmol), 헥사메틸이주석 (0.054 mL, 0.262 mmol) 및 Pd(Ph3P)4 (0.020 g, 0.017 mmol)의 혼합물을 마이크로웨이브 하에 150℃에서 90분 동안 가열하였다. 냉각시킨 후, 반응 혼합물을 농축시키고, 물로 희석하고, 에틸 아세테이트로 추출하였다. 에틸 아세테이트 층을 수집하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 조 (S)-tert-부틸 (1-((6-(6-아세트아미도피리미딘-4-일)-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.13 g, 0.121 mmol, 69% 수율)를 황색빛 반고체로서 수득하였다. LCMS (ES-API) m/e 458.3 [(M+H)+, 계산치 C24H36N5O4 458.3]; LC/MS 체류시간 (방법 B): tR = 1.07분.
파트 C. (S)-6-(5-((2-아미노-2,4-디메틸펜틸)옥시)-6-메틸피리딘-2-일)피리미딘-4-아민
0℃로 냉각시킨 MeOH (2 mL) 중 (S)-tert-부틸 (1-((6-(6-아세트아미도피리미딘-4-일)-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.1 g, 0.219 mmol)의 교반 용액에 1,4-디옥산 중 4N HCl (0.546 mL, 2.185 mmol)을 첨가하고, 혼합물을 1시간 동안 교반하였다. 반응 혼합물을 감압 하에 농축시켜 조 (S)-6-(5-((2-아미노-2,4-디메틸펜틸)옥시)-6-메틸피리딘-2-일)피리미딘-4-아민 (0.02 g, 0.062 mmol, 28% 수율)을 황색 고체로서 수득하였다. LCMS (ESI) m/e 316.3 [(M+H)+, 계산치 C17H26N5O 316.2; LCMS 체류시간 (방법 F): tR = 0.92분. 1H (400 MHz, DMSO-d6): δ 8.59 (s, 1H), 8.13-8.15 (br. m, 3H), 7.62 (d, J = 8.40 Hz, 1H), 7.35 (s, 1H), 4.12-4.19 (m, 2H), 2.59 (s, 3H), 1.74-1.86 (m, 2H), 1.60-1.65 (m, 1H), 1.41 (s, 3H), 0.94-0.99 (m, 6H) ppm.
실시예 344
(S)-1-((2'-플루오로-4-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-((2'-플루오로-4-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (1 mL) 및 물 (0.2 mL) 중 (2-플루오로피리딘-4-일)보론산 (0.02 g, 0.142 mmol), (S)-tert-부틸 (1-((6-클로로-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 226에 기재된 것과 유사한 방식으로 제조됨) (0.051 g, 0.142 mmol), 및 Cs2CO3 (0.116 g, 0.355 mmol)의 혼합물. 혼합물을 질소로 15분 동안 퍼징하였다. PdCl2(dppf)-CH2Cl2 부가물 (0.012 g, 0.014 mmol)을 첨가하고, 혼합물을 추가로 5분 동안 퍼징한 다음, 반응 혼합물을 100℃로 14시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 에틸 아세테이트 (20 mL)로 희석하고, 규조토 (셀라이트®)를 통해 여과하였다. 층을 에틸 아세테이트 20 mL로 세척하였다. 여과물을 감압 하에 농축시켜 (S)-tert-부틸 (1-((2'-플루오로-4-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.05 g, 0.089 mmol, 62% 수율)를 황색 반고체로서 수득하였다. LCMS (ESI) m/e 418.7 [(M+H) +, 계산치 C23H33FN3O3, 418.2]; LC/MS 체류시간 (방법 B); tR = 1.18분.
파트 B: (S)-1-((2'-플루오로-4-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
0℃로 냉각시킨 MeOH (2 mL) 중 (S)-tert-부틸 (1-((2'-플루오로-4-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.05 g, 0.089 mmol)의 교반 용액에 1,4-디옥산 중 4N HCl (0.546 mL, 2.185 mmol)을 첨가하고, 혼합물을 1시간 동안 교반하였다. 반응 혼합물을 감압 하에 농축시키고, 정제용 HPLC (방법 B)에 의해 정제하여 (S)-1-((2'-플루오로-4-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민, TFA (13 mg, 0.089 mmol, 30% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 318.2 [(M+H) +, 계산치 C18H25FN3O, 318.2]; LC/MS 체류시간 (방법 D); tR = 2.27. LC/MS 체류시간 (방법 E); tR = 2.02분. 1H NMR (400MHz, 메탄올-d4) δ 8.39 (s, 1H), 8.27 (d, J=5.0 Hz, 1H), 7.94 (s, 1H), 7.89 (td, J=1.5, 5.5 Hz, 1H), 7.66 (s, 1H), 4.34 - 4.23 (m, 2H), 2.45 (s, 3H), 1.93 - 1.83 (m, 2H), 1.74 - 1.68 (m, 1H), 1.53 (s, 3H), 1.09 - 1.00 (m, 6H) ppm.
실시예 348
(S)-2,4-디메틸-1-((6-메틸-2'-(트리플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)펜탄-2-아민
실시예 343에 기재된 바와 같이 제조하였다. 조 물질을 정제용 HPLC (방법 B)에 의해 정제하여 (S)-2,4-디메틸-1-((6-메틸-2'-(트리플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)펜탄-2-아민, 2 TFA (0.040 g, 0.065 mmol, 75%)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 368.3 [(M+H)+, 계산치 C19H25F3N3O 368.2]; LC/MS 체류시간 (방법 H): tR = 1.75분; LC/MS 체류시간 (방법 I): tR = 1.32분. 1H NMR (400 MHz, MeOD): δ 8.76 (d, J=5.02 Hz, 1 H) 8.45 (d, J=1.00 Hz, 1 H) 8.23 (dd, J=5.02, 1.51 Hz, 1 H) 7.97 - 8.01 (m, 1 H) 7.53 (d, J=8.53 Hz, 1 H) 4.15 - 4.26 (m, 2 H) 2.65 (s, 3 H) 1.83 - 1.95 (m, 2 H) 1.69 - 1.78 (m, 1 H) 1.55 (s, 3 H) 1.01 - 1.11 (m, 6 H) ppm.
실시예 349
(S)-2,4-디메틸-1-((4-메틸-2'-(트리플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)펜탄-2-아민
실시예 343에 기재된 바와 같이 제조하였다. 조 물질을 정제용 HPLC (방법 B)에 의해 정제하여 (S)-2,4-디메틸-1-((4-메틸-2'-(트리플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)펜탄-2-아민, 2 TFA (0.042 g, 0.071 mmol, 최종 단계에 대해서 49% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 368.3 [(M+H)+, 계산치 C19H25F3N3O 368.2]; LC/MS 체류시간 (방법 H): tR = 1.68분; LC/MS 체류시간 (방법 I): tR = 1.30분. 1H NMR (400 MHz, MeOD): δ 8.78 (d, J=5.02 Hz, 1 H) 8.44 (s, 2 H) 8.22 (dd, J=5.02, 1.51 Hz, 1H) 8.03 (s, 1H) 4.32 - 4.36 (m, 1H) 4.24 - 4.29 (m, 1H) 2.47 (s, 3H) 1.85 - 1.94 (m, 2H) 1.69 - 1.76 (m, 1H) 1.54 (s, 3H) 1.01 - 1.10 (m, 6H) ppm.
실시예 350
(S)-1-(2-(디플루오로메틸)-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
파트 A. (3-(디플루오로메틸)-4-플루오로페닐)보론산
1,4-디옥산 (20 mL) 중 4-브로모-2-(디플루오로메틸)-1-플루오로벤젠 (1.2 g, 5.33 mmol), 비스(피나콜레이토)디보론 (1.490 g, 5.87 mmol) 및 아세트산칼륨 (1.570 g, 16.00 mmol)의 용액을 질소로 플러싱하였다. PdCl2(dppf)-CH2Cl2 부가물 (0.218 g, 0.267 mmol)을 첨가하고, 반응 혼합물을 90℃에서 밤새 가열하였다. 이어서, 반응 혼합물을 규조토 (셀라이트®)를 통해 여과하고, 에틸 아세테이트 (100 mL)로 세척하였다. 여과물을 감압 하에 농축시키고, 조 생성물을 실리카 겔 크로마토그래피 (헥산 중 0-25% EtOAc)에 의해 정제하여 (3-(디플루오로메틸)-4-플루오로페닐)보론산 (1.2 g, 4.17 mmol, 78% 수율)을 수득하였다. 1H NMR (400 MHz, CDCl3): δ 8.04 (m, 1H), 7.90 (m, 1H), 7.11 (m, 1H), 6.87 (t, J = 15.2 Hz, 1H) ppm.
파트 B. 4-(3-(디플루오로메틸)-4-플루오로페닐)-6-메틸피리미딘
1,4-디옥산 (3 mL) 중 2-(3-(디플루오로메틸)-4-플루오로페닐)-4,4,5,5-테트라메틸-1,3,2-디옥사보롤란 (0.085 g, 0.311 mmol), 4-클로로-6-메틸피리미딘 (0.04 g, 0.311 mmol) 및 인산칼륨, 이염기성 (0.778 mL, 0.778 mmol)의 용액을 N2로 퍼징하고, PdCl2(dppf)-CH2Cl2 부가물 (0.025 g, 0.031 mmol)을 첨가하였다. 반응 혼합물을 N2로 30분 동안 퍼징하고, 80℃에서 3시간 동안 가열하였다. 이어서, 반응 혼합물을 규조토 (셀라이트®)를 통해 여과하고, 층을 에틸 아세테이트 (100 mL)로 세척하였다. 여과물을 감압 하에 농축시켜 4-(3-(디플루오로메틸)-4-플루오로페닐)-6-메틸피리미딘 (0.1 g, 0.252 mmol, 81% 수율)을 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 239.0 [(M+H) +, 계산치 C12H10F3N2 239.1]; LC/MS 체류시간 (방법 G): tR = 2.37분.
파트 C. (S)-1-(2-(디플루오로메틸)-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
테트라히드로푸란 (3 mL) 중 4-(3-(디플루오로메틸)-4-플루오로페닐)-6-메틸피리미딘 (0.1 g, 0.420 mmol), (S)-2-아미노-2,4-디메틸펜탄-1-올 (0.055 g, 0.420 mmol) 및 KOtBu (1.259 mL, 1.259 mmol)의 용액을 실온에서 밤새 교반하였다. 반응 혼합물을 규조토 (셀라이트®)를 통해 여과하고, 층을 에틸 아세테이트 (20 mL)로 세척하였다. 유기 층을 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-1-(2-(디플루오로메틸)-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민 (0.01 g, 0.028 mmol, 7% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 350.3 [(M+H)+, 계산치 C19H26F2N3O 350.2]; LC/MS 체류시간 (방법 H): tR = 1.44분; LC/MS 체류시간 (방법 I): tR = 1.09분. 1H NMR(400 MHz, 메탄올-d4): δ 9.03 (s, 1 H), 8.43 (s, 1 H), 8.36 (dd, J = 8.8, 2.4 Hz, 1 H), 7.91 (s, 1 H), 7.38-7.11 (m, 2H), 4.29 (d, J=10.4 Hz, 1 H), 4.20 (d, J=10.4 Hz, 1 H), 2.59 (s, 3 H), 1.88 (m, 2 H), 1.67 (m, 1 H), 1.49 (s, 3 H), 1.05 (m, 6 H) ppm.
실시예 352
(S)-1-(2-(플루오로메틸)-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
실시예 290에 기재된 바와 같이 제조하였다. 조 최종 생성물을 정제용 HPLC (방법 B)에 의해 정제하여 (S)-1-(2-(플루오로메틸)-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민, TFA (0.01 g, 0.028 mmol, 최종 2 단계에 대해서 8% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 332.3 [(M+H)+, 계산치 C19H27FN3O 332.2]; LC/MS 체류시간 (방법 H): tR = 1.27분; LC/MS 체류시간 (방법 I): tR = 0.93분. 1H NMR (400 MHz, MeOD): δ 8.66 - 8.71 (m, 1H), 8.25 - 8.34 (m, 2H), 7.84 - 7.91 (m, 1H), 7.26 (d, J=8.53 Hz, 1H), 5.63 - 5.74 (m, 1H), 5.51 - 5.62 (m, 1H), 4.14 - 4.30 (m, 2H), 2.79 (m, 3H), 1.80 - 1.93 (m, 2H), 1.64 - 1.75 (m, 1H), 1.51 (s, 3H), 0.97 - 1.10 (m, 6H) ppm.
실시예 354
(R)-2,4-디메틸-1-((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)펜탄-2-아민
파트 A: 4-(5-플루오로-6-메틸피리딘-2-일)-2-메틸피리미딘
1,4-디옥산 (2 mL) 중 4-클로로-2-메틸피리미딘 (100 mg, 0.778 mmol), 6-브로모-3-플루오로-2-메틸피리딘 (148 mg, 0.778 mmol), 및 1,1,1,2,2,2-헥사메틸디스탄난 (255 mg, 0.778 mmol)의 용액을 질소 기체로 10분 동안 퍼징하였다. Pd(Ph3P)4 (90 mg, 0.078 mmol)를 반응 혼합물에 첨가하고, 용액을 질소 기체로 추가로 10분 동안 퍼징하였다. 반응 혼합물을 마이크로웨이브에서 150℃에서 2시간 동안 가열하였다. 반응 혼합물을 농축시킨 다음, 에틸 아세테이트 (20 mL) 및 물 (20 mL) 중에 용해시켰다. 2상 혼합물을 규조토 (셀라이트®)를 통해 여과하였다. 층을 에틸 아세테이트 (25 mL)로 세척하였다. 유기 층을 여과물로부터 분리하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 고체를 실리카 겔 크로마토그래피 (석유 에테르 중 0-40% EtOAc)에 의해 정제하여 4-(5-플루오로-6-메틸피리딘-2-일)-2-메틸피리미딘 (50 mg, 0.246 mmol, 32% 수율)을 회백색 고체로서 수득하였다. LCMS (ESI) m/e 204.2 [(M+H)+, 계산치 C11H11FN3 204.1]; LC/MS 체류시간 (방법 A1): tR = 2.12분.
파트 B: (R)-2,4-디메틸-1-((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)펜탄-2-아민
THF (4 mL) 중 (R)-2-아미노-2,4-디메틸펜탄-1-올 (0.021 g, 0.162 mmol)의 용액을 0℃로 냉각시켰다. KOtBu (0.487 mL, 0.487 mmol)를 반응 혼합물에 첨가하고, 이어서 4-(5-플루오로-6-메틸피리딘-2-일)-2-메틸피리미딘 (0.033 g, 0.162 mmol)을 천천히 첨가하였다. 반응 혼합물을 0℃에서 5분 동안 교반한 다음, 80℃에서 4시간 동안 교반하였다. 반응 혼합물을 실온으로 냉각되도록 하고, 물 (20 mL)로 켄칭하였다. 반응 혼합물을 에틸 아세테이트 (20 mL)로 추출하고, 유기 층을 Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (R)-2,4-디메틸-1-((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)펜탄-2-아민 (31 mg, 0.072 mmol, 44% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 315.3 [(M+H)+, 계산치 C18H27N4O 315.2]; LC/MS 체류시간 (방법 H): tR = 1.26분; LC/MS 체류시간 (방법 I): tR = 0.81분. 1H NMR(400 MHz, 메탄올-d4): δ 8.71 (d, J = 5.60 Hz, 1H), 8.38 (d, J = 8.40 Hz, 1H), 8.18 (d, J = 5.60 Hz, 1H), 7.52 (d, J = 8.40 Hz, 1H), 4.14-4.21 (m, 2H), 2.76 (s, 3H), 2.64 (s, 3H), 1.85-1.91 (m, 2H), 1.71-1.75 (m, 1H), 1.51 (s, 3H), 1.02-1.09 (m, 6H) ppm.
실시예 355
(S)-1-((6-(디플루오로메틸)-2'-(플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 324에 기재된 바와 같이 제조하였다. 조 물질을 정제용 HPLC (방법 B)에 의해 정제하여 (S)-1-((6-(디플루오로메틸)-2'-(플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민, 2 TFA (0.023 g, 0.038 mmol, 마지막 2 단계에 대해서 29% 수율)를 황색 고체로서 수득하였다. LCMS (ESI) m/e 368.3 [(M+H)+, 계산치 C19H25F3N3O 368.2]; LC/MS 체류시간 (방법 H): tR = 1.48분; LC/MS 체류시간 (방법 I): tR = 1.06분. 1H NMR (400 MHz, MeOD): δ 8.64 (d, J=5.0 Hz, 1H), 8.28 - 8.18 (m, 2H), 8.07 (d, J=4.5 Hz, 1H), 7.80 (d, J=9.0 Hz, 1H), 7.29 - 7.00 (m, 1H), 5.60 (s, 1H), 5.48 (s, 1H), 4.33 - 4.21 (m, 2H), 1.90 - 1.82 (m, 2H), 1.74 - 1.66 (m, 1H), 1.52 (s, 3H), 1.10 - 1.03 (m, 6H) ppm.
실시예 356
(S)-1-((6-(디플루오로메틸)-2'-(트리플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민
실시예 343에 기재된 바와 같이 제조하였다. 조 물질을 정제용 HPLC (방법 B)에 의해 정제하여 (S)-1-((6-(디플루오로메틸)-2'-(트리플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민, TFA (0.040 g, 0.073 mmol, 최종 단계에 대해서 73% 수율)를 황색 고체로서 수득하였다. LCMS (ESI) m/e 404.3 [(M+H)+, 계산치 C19H23F5N3O 404.2]; LC/MS 체류시간 (방법 H): tR = 1.82분; LC/MS 체류시간 (방법 I): tR = 1.47분. 1H NMR (400 MHz, MeOD): δ 8.81 (d, J=5.0 Hz, 1H), 8.49 (s, 1H), 8.35 - 8.30 (m, 2H), 7.83 (d, J=8.5 Hz, 1H), 7.31 - 7.02 (m, 1H), 4.35 - 4.23 (m, 2H), 1.91 - 1.82 (m, 2H), 1.75 - 1.68 (m, 1H), 1.53 (s, 3H), 1.09 - 0.99 (m, 6H) ppm.
실시예 359
1,1,1-트리플루오로-4-메틸-2-(((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)메틸)펜탄-2-아민
파트 A: 4-메틸-N-(1,1,1-트리플루오로-2-(히드록시메틸)-4-메틸펜탄-2-일)벤젠술폰아미드
라세미 4-메틸-N-(1,1,1-트리플루오로-2-(히드록시메틸)-4-메틸펜탄-2-일)벤젠술폰아미드 (실시예 273, 파트 A-D에 기재된 바와 같이 제조됨) (500 mg, 1.415 mmol)를 키랄 SFC에 의해 용해시켰다. (방법: 칼럼/치수: 키랄팩 AD-H (250 X 30) mm, 5u; % CO2: 85%; % 공 용매: 15%(메탄올 중 0.25% DEA); 총 유량: 100 g/분; 배압: 100 bar; 온도: 25℃; UV: 226 nm).
이성질체 1을 감압 하에 농축시켜 4-메틸-N-(1,1,1-트리플루오로-2-(히드록시메틸)-4-메틸펜탄-2-일)벤젠술폰아미드 (0.1 g, 0.268 mmol, 12% 수율)를 황색 오일로서 수득하였다. LCMS (ESI) m/e 338.2 [(M-H) +, 계산치 C14H19F3NO3S, 338.1]; LC/MS 체류시간 (방법 G); tR = 2.47분.
이성질체 2를 감압 하에 농축시켜 4-메틸-N-(1,1,1-트리플루오로-2-(히드록시메틸)-4-메틸펜탄-2-일)벤젠술폰아미드 (0.1 g, 0.224 mmol, 10% 수율)를 황색 오일로서 수득하였다. LCMS (ESI) m/e 338.0 [(M-H) +, 계산치 C14H19F3NO3S, 338.3]; LC/MS 체류시간 (방법 G); tR = 2.51분.
파트 B: 4-메틸-N-(1,1,1-트리플루오로-4-메틸-2-(((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)메틸)펜탄-2-일)벤젠술폰아미드.
DMF (2 mL) 중 4-메틸-N-(1,1,1-트리플루오로-2-(히드록시메틸)-4-메틸펜탄-2-일)벤젠술폰아미드, 이성질체 1 (0.025 g, 0.074 mmol)의 교반 용액을 0℃로 냉각시키고, 10분 동안 교반하였다. DMF(1 mL) 중 NaH (8.86 mg, 0.221 mmol)를 첨가하고, 5분 동안 교반하였다. 4-(5-플루오로-6-메틸피리딘-2-일)-2-메틸피리미딘 (실시예 354에 기재된 바와 같이 제조됨) (0.015 g, 0.074 mmol)을 첨가하고, 혼합물을 80℃에서 5시간 동안 교반하였다. 반응 혼합물을 0℃로 냉각시키고, 빙냉수 (10 mL)로 켄칭하고, 에틸 아세테이트 (2 x 20 mL)로 추출하였다. 합한 유기 층을 물 (2x10 mL)에 이어서 염수 (2x10 mL)로 세척하였다. 합한 유기 층을 황산나트륨 상에서 건조시키고, 감압 하에 농축시켜 4-메틸-N-(1,1,1-트리플루오로-4-메틸-2-(((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)메틸)펜탄-2-일)벤젠술폰아미드 (0.04 g, 0.041 mmol, 56% 수율)를 황색 반고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 523.6 [(M+H) +, 계산치 C25H30F3N4O3S, 523.2]; LC/MS 체류시간 (방법 B); tR = 0.99분.
파트 C: 1,1,1-트리플루오로-4-메틸-2-(((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)메틸)펜탄-2-아민
H2SO4 (98%) (1 mL, 18.76 mmol) 중 4-메틸-N-(1,1,1-트리플루오로-4-메틸-2-(((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)메틸)펜탄-2-일)벤젠술폰아미드 (0.04 g, 0.077 mmol)의 용액을 실온에서 45분 동안 교반하였다. 반응 혼합물을 pH~8-9가 될 때까지 냉각 포화 중탄산나트륨 용액에 부었다. 반응 혼합물을 에틸 아세테이트 (3x20 mL)로 추출하였다. 합한 유기 추출물을 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 조 물질을 정제용 HPLC (방법 B)에 의해 정제하여 1,1,1-트리플루오로-4-메틸-2-(((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)메틸)펜탄-2-아민, TFA (0.002 g, 4.02 μmol, 5% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 369.2 [(M+H)+, 계산치 C18H24F3N4O 369.3]; LC/MS 체류시간 (방법 H): tR = 1.98분; LC/MS 체류시간 (방법 I): tR = 1.21분. 1H NMR (400 MHz, MeOD): δ 8.74 (d, J=5.5 Hz, 1H), 8.41 (d, J=8.5 Hz, 1H), 8.24 (d, J=5.5 Hz, 1H), 7.58 (d, J=8.5 Hz, 1H), 4.57 - 4.47 (m, 2H), 2.77 (s, 3H), 2.61 (s, 3H), 2.07 - 1.94 (m, 3H), 1.09-1.08 (m, 6H)
실시예 360
1,1,1-트리플루오로-4-메틸-2-(((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)메틸)펜탄-2-아민
파트 A에서 4-메틸-N-(1,1,1-트리플루오로-4-메틸-2-(((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)메틸)펜탄-2-일)벤젠술폰아미드, 이성질체 2 (0.038 g, 0.073 mmol)를 사용하여 실시예 359에 기재된 바와 같이 제조하여 1,1,1-트리플루오로-4-메틸-2-(((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)메틸)펜탄-2-아민, TFA (0.006 g, 0.016 mmol, 22% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 369.3 [(M+H)+, 계산치 C18H24F3N4O 369.2]; LC/MS 체류시간 (방법 H): tR = 1.96분; LC/MS 체류시간 (방법 I): tR = 1.19분. 1H NMR (400 MHz, MeOD): δ 8.67 (d, J=5.5 Hz, 1H), 8.34 (d, J=8.5 Hz, 1H), 8.15 (d, J=4.5 Hz, 1H), 7.45 (d, J=8.5 Hz, 1H), 4.21 - 4.14 (m, 2H), 2.73 (s, 3H), 2.54 (s, 3H), 2.04 - 1.91 (m, 2H), 1.88 - 1.81 (m, 1H), 1.67-1.64 (m, 1H), 1.08 - 0.95 (m, 6H) ppm.
실시예 367
(S)-1-(4-(2-클로로피리미딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-아민
파트 A. (S)-tert-부틸 (1-(4-브로모-2-메틸페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
DMF (5 mL) 중 4-브로모-2-메틸페놀 (0.2 g, 1.069 mmol), K2CO3 (0.443 g, 3.21 mmol) 및 (S)-tert-부틸 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (실시예 32, 파트 A-E에 기재된 바와 같이 제조됨) (0.376 g, 1.283 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 반응 혼합물을 0℃로 냉각시키고, 수성 염화암모늄 (50 mL)으로 켄칭하였다. 반응 혼합물을 에틸 아세테이트 (2x50 mL)로 추출하였다. 유기 층을 물 (2x50 mL), 염수 (50 mL)로 세척하고, Na2SO4 상에서 건조시키고, 농축시켜 (S)-tert-부틸 (1-(4-브로모-2-메틸페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.3 g, 0.749 mmol, 70% 수율)를 수득하였다. 물질을 추가 정제 없이 사용하였다. LCMS (ESI) m/e 346.0 [(M+H-tBu)+, 계산치 C19H31BrNO3 400.1]; LC/MS 체류시간 (방법 D): tR = 3.27분.
파트 B. (S)-tert-부틸 (2,4-디메틸-1-(2-메틸-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)펜탄-2-일)카르바메이트
1,4-디옥산 (25 mL) 중 (S)-tert-부틸 (1-(4-브로모-2-메틸페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.3 g, 0.749 mmol), 비스(피나콜레이토)디보론 (0.209 g, 0.824 mmol), 아세트산칼륨 (0.221 g, 2.248 mmol) 및 PdCl2 (dppf)-CH2Cl2 부가물 (0.031 g, 0.037 mmol)의 혼합물을 90℃에서 밤새 가열하였다. 반응 혼합물을 셀라이트를 통해 여과하고, 셀라이트 층을 에틸 아세테이트 (100 mL)로 세척하였다. 유기 층을 물 (50 mL)로 세척하였다. 수성 층을 에틸 아세테이트 (2x50 mL)로 재추출하였다. 유기 층을 수집하고, 염수로 세척하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켜 조 (S)-tert-부틸 (2,4-디메틸-1-(2-메틸-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)펜탄-2-일)카르바메이트 (0.2 g, 0.447 mmol, 60% 수율)를 수득하였다. 1H NMR (400 MHz, CDCl3): δ 7.61 (t, J = 14.40 Hz, 2H), 6.81 (d, J = 10.80 Hz, 1H), 4.61 (bs, 1H), 4.08 (d, J = 11.60 Hz, 1H), 3.94 (d, J = 11.60 Hz, 1H), 2.24 (s, 3H), 1.76-1.84 (m, 2H), 1.61-1.66 (m, 1H), 1.51 (s, 3H), 1.33-1.43 (m, 12H), 0.95-0.98 (m, 6H) ppm.
파트 C. (S)-tert-부틸 (1-(4-(2-클로로피리미딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (3 mL)-물 (0.2 mL) 중 2,4-디클로로피리미딘 (50 mg, 0.336 mmol), (S)-tert-부틸 (2,4-디메틸-1-(2-메틸-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)펜탄-2-일)카르바메이트 (150 mg, 0.336 mmol), PdCl2(dppf)-CH2Cl2 부가물 (13.70 mg, 0.017 mmol) 및 2M 수성 삼염기성 인산칼륨 (0.503 mL, 1.007 mmol)의 혼합물을 질소로 퍼징하고, 100℃에서 12시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 에틸 아세테이트로 희석하고, 유기 층을 분리하였다. 수성 층을 에틸 아세테이트 (2x5 mL)로 추출하였다. 에틸 아세테이트 층을 염수로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 조 (S)-tert-부틸 (1-(4-(2-클로로피리미딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (60 mg, 0.130 mmol, 39% 수율)를 갈색 반고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 434.2 [(M+H)+, 계산치 C23H33ClN3O3 434.2]; LC/MS 체류시간 (방법 C): tR = 1.54분.
파트 D. (S)-1-(4-(2-클로로피리미딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-아민
0℃에서 DCM 중 (S)-tert-부틸 (1-(4-(2-클로로피리미딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (25 mg, 0.058 mmol)의 교반 용액에 1,4-디옥산 중 4N HCl (2 mL, 8.00 mmol)을 첨가하고, 용액을 2시간 동안 교반하였다. 반응 혼합물을 감압 하에 농축시켰다. 조 물질을 정제용 HPLC (방법 B)에 의해 정제하여 (S)-1-(4-(2-클로로피리미딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-아민 (3 mg, 0.0872 mmol, 15% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 334.2 [(M+H)+, 계산치 C18H25ClN3O 334.2]; LC/MS 체류시간 (방법 D): tR = 2.38분. 1H NMR (400 MHz, 메탄올-d4): δ 8.60 (d, J=5.40 Hz, 1 H), 8.02 - 8.10 (m, 2H), 7.88 (d, J=5.46 Hz, 1H), 7.08 (d, J=8.47 Hz, 1H), 3.90 - 4.01 (m, 2H), 2.37 (s, 3H), 1.80 - 1.89 (m, 1H), 1.54 - 1.71 (m, 2H), 1.33 (s, 3H), 0.99 - 1.03 (m, 6H) ppm.
실시예 370
(S)-1-(4-(2-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-(4-(2-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (3 mL)-물 (0.3 mL) 중 2,4-디클로로피리미딘 (60 mg, 0.403 mmol), (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (실시예 215, 파트 A 및 B에 기재된 바와 같이 제조됨) (202 mg, 0.403 mmol), PdCl2(dppf)-CH2Cl2 부가물 (16.44 mg, 0.020 mmol), 및 2N 수성 삼염기성 인산칼륨 (0.604 mL, 1.208 mmol)의 혼합물을 질소로 퍼징하고, 80℃에서 12시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 농축시키고, 물로 희석하고, 에틸 아세테이트로 추출하였다. 에틸 아세테이트 층을 수집하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 (S)-tert-부틸 (1-(4-(2-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (55 mg, 0.108 mmol, 27% 수율)를 갈색 반고체로서 수득하였다. LCMS (ESI) m/e 488.2 [(M+H)+, 계산치 C23H30ClF3N3O3 488.2]; LC/MS 체류시간 (방법 B): tR = 1.29분.
파트 B: (S)-1-(4-(2-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
0℃에서 DCM (2 mL) 중 (S)-tert-부틸 (1-(4-(2-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (10 mg, 0.020 mmol)의 교반 용액에, 1,4-디옥산 중 4N HCl (2 mL, 8.00 mmol)을 첨가하고 1시간 동안 실온에서 계속하였다. 반응 혼합물을 감압 하에 농축시켰다. 조 물질을 정제용 HPLC (방법 B)에 의해 정제하여 (S)-1-(4-(2-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (4 mg, 9.90 μmol, 48% 수율)을 회백색 고체로서 수득하였다. LCMS (ESI) m/e 388.2 [(M+H)+, 계산치 C18H22ClF3N3O 388.1]; LC/MS 체류시간 (방법 D): tR = 2.28분. 1H NMR (400 MHz, 메탄올-d4): δ 8.71 (d, J=5.33 Hz, 1H), 8.45 - 8.53 (m, 2H), 7.99 (d, J=5.40 Hz, 1H), 7.42 (d, J=8.72 Hz, 1H), 4.12 - 4.21 (m, 2H), 1.70 - 1.91 (m, 2H), 1.58 - 1.67 (m, 1H), 1.41 (s, 3H), 1.03 (m, 6H) ppm.
실시예 372
(R)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메틸피리딘-3-일)피리미딘-2-일)카르바메이트
파트 A: 메틸 (4-(6-플루오로-5-메틸피리딘-3-일)피리미딘-2-일)카르바메이트
1,4-디옥산 (3 mL)-물 (0.3 mL) 중 메틸 (4-클로로피리미딘-2-일)카르바메이트 (실시예 304에 기재된 바와 같이 제조됨) (65 mg, 0.347 mmol), 2-플루오로-3-메틸피리딘-5-보론산 (53.7 mg, 0.347 mmol), PdCl2(dppf)-CH2Cl2 부가물 (14.15 mg, 0.017 mmol) 및 Cs2CO3 (339 mg, 1.040 mmol)의 혼합물을 질소로 퍼징하고, 100℃에서 6시간 동안 가열하였다. 반응 혼합물을 에틸 아세테이트 (25 mL)로 희석하였다. 흑색 현탁액을 규조토 (셀라이트®)를 통해 여과하고, 층을 에틸 아세테이트 (50 mL)로 세척하였다. 여과물을 감압 하에 농축시켜 흑색 잔류물을 수득하였으며, 이를 실리카 겔 크로마토그래피 (석유 에테르:에틸 아세테이트)에 의해 정제하여 메틸 (4-(6-플루오로-5-메틸피리딘-3-일)피리미딘-2-일)카르바메이트 (60 mg, 0.169 mmol, 49% 수율)를 갈색 고체로서 수득하였다. LCMS (ESI) m/e 263.0 [(M+H)+, 계산치 C12H12FN4O2 263.1]; LC/MS 체류시간 (방법 C): tR = 0.93분.
파트 B: (R)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메틸피리딘-3-일)피리미딘-2-일)카르바메이트
DMF (3 mL) 중 (R)-2-아미노-2,4-디메틸펜탄-1-올 (23.78 mg, 0.181 mmol)의 교반 용액에, 0℃에서 NaH (13.18 mg, 0.329 mmol)에 이어서, 메틸 (4-(6-플루오로-5-메틸피리딘-3-일)피리미딘-2-일)카르바메이트 (60 mg, 0.165 mmol)를 첨가하였다. 혼합물을 60℃에서 12시간 동안 가열하였다. 이어서, 혼합물을 0℃로 냉각시키고, 물 (10 mL)로 희석하고, 에틸 아세테이트 (2 x 50 mL)로 추출하였다. EtOAc 층을 수집하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 조 물질을 정제용 HPLC (방법 B)에 의해 정제하여 (R)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메틸피리딘-3-일)피리미딘-2-일)카르바메이트 (11 mg, 0.028 mmol, 17% 수율)를 황색빛 고체로서 수득하였다. LCMS (ESI) m/e 374.2 [(M+H)+, 계산치 C19H28N5O3 374.2]; LC/MS 체류시간 (방법 D): tR = 1.10분. 1H NMR (400 MHz, 메탄올-d4): δ 8.81 (dd, J=2.38, 0.56 Hz, 1H), 8.58 (d, J=5.33 Hz, 1H), 8.33 (dd, J=2.38, 0.88 Hz, 1H), 7.59 (d, J=5.40 Hz, 1H), 4.29 (s, 2H), 3.83 (s, 3H), 2.36 (s, 3H), 1.81 - 1.90 (m, 1H), 1.52 - 1.69 (m, 2H), 1.31 (s, 3H), 1.00 - 1.04 (m, 6H) ppm.
실시예 373
(R)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-플루오로피리딘-3-일)피리미딘-2-일)카르바메이트
파트 A: 메틸 (4-(6-클로로-5-플루오로피리딘-3-일)피리미딘-2-일)카르바메이트
1,4-디옥산 (1.5 mL)-물 (0.1 mL) 중 메틸 (4-클로로피리미딘-2-일)카르바메이트 (실시예 304에 기재된 바와 같이 제조됨) (65 mg, 0.347 mmol), 2-클로로-3-플루오로피리딘-5-보론산 (60.8 mg, 0.347 mmol), PdCl2(dppf)-CH2Cl2-부가물 (14.15 mg, 0.017 mmol) 및 Cs2CO3 (339 mg, 1.040 mmol)의 혼합물을 질소로 퍼징하고, 100℃에서 6시간 동안 가열하였다. 반응 혼합물을 에틸 아세테이트 (25 mL)로 희석하였다. 흑색 현탁액을 규조토 (셀라이트®)를 통해 여과하고, 층을 에틸 아세테이트 (50 mL)로 세척하였다. 여과물을 감압 하에 농축시켜 흑색 잔류물을 수득하였으며, 이를 실리카 겔 크로마토그래피 (석유 에테르:에틸 아세테이트)에 의해 정제하여 메틸 (4-(6-클로로-5-플루오로피리딘-3-일)피리미딘-2-일)카르바메이트 (50 mg, 0.092 mmol, 27% 수율)를 갈색 고체로서 수득하였다. LCMS (ESI) m/e 283.0 [(M+H)+, 계산치 C11H9ClFN4O2 283.0]; LC/MS 체류시간 (방법 C): tR = 1.00분.
파트 B: (R)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-플루오로피리딘-3-일)피리미딘-2-일)카르바메이트
0℃에서 DMF (2.5 mL) 중 (R)-2-아미노-2,4-디메틸펜탄-1-올 (23.21 mg, 0.177 mmol)의 교반 용액에, NaH (14.15 mg, 0.354 mmol)에 이어서 0.5 mL DMF 중 메틸 (4-(6-클로로-5-플루오로피리딘-3-일)피리미딘-2-일)카르바메이트 (50 mg, 0.177 mmol)를 첨가하였다. 혼합물을 60℃에서 12시간 동안 가열하였다. 이어서 혼합물을 0℃로 냉각시키고, 물 (10 mL)로 희석하고, 에틸 아세테이트 (2 x 50 mL)로 추출하였다. EtOAc 층을 수집하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 조 물질을 정제용 HPLC (방법 B)에 의해 정제하여 (R)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-플루오로피리딘-3-일)피리미딘-2-일)카르바메이트 (2 mg, 0.0525 mmol, 3% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 378.2 [(M+H)+, 계산치 C18H25FN5O3 378.2]; LC/MS 체류시간 (방법 D): tR = 1.77분. 1H NMR (400 MHz, DMSO-d6): δ 8.79 - 8.82 (m, 1H), 8.75 - 8.78 (m, 1H), 8.21 - 8.25 (m, 1H), 7.88 - 7.92 (m, 1H), 3.92 - 3.95 (m, 2H), 3.71 (s, 3H), 1.76 - 1.89 (m, 1H), 1.43 (dd, J=5.52, 2.82 Hz, 2H), 1.17 (s, 3H), 0.91 - 0.96 (m, 6H) ppm.
실시예 374
(S)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-4-메틸피리딘-3-일)피리미딘-2-일)카르바메이트
파트 A: 메틸 (4-(6-플루오로-4-메틸피리딘-3-일)피리미딘-2-일)카르바메이트
1,4-디옥산 (2.5 mL)-물 (0.1 mL) 중 메틸 (4-클로로피리미딘-2-일)카르바메이트 (실시예 304에 기재된 바와 같이 제조됨) (75 mg, 0.400 mmol), 2-플루오로-4-메틸피리딘-5-보론산 (68.1 mg, 0.440 mmol), PdCl2(dppf)-CH2Cl2 부가물 (16.33 mg, 0.020 mmol) 및 Cs2CO3 (391 mg, 1.199 mmol)의 혼합물을 질소로 퍼징하고, 100℃에서 12시간 동안 가열하였다. 반응 혼합물을 에틸 아세테이트 (25 mL)로 희석하고, 규조토 (셀라이트®)를 통해 여과하였다. 여과물을 감압 하에 농축시켜 메틸 (4-(6-플루오로-4-메틸피리딘-3-일)피리미딘-2-일)카르바메이트 (75 mg, 0.117 mmol, 29% 수율)를 갈색 고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 263.5 [(M+H)+, 계산치 C12H12FN4O2 263.1]; LC/MS 체류시간 (방법 B): tR = 0.66분.
파트 B: (S)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-4-메틸피리딘-3-일)피리미딘-2-일)카르바메이트
DMF (3 mL) 중 메틸 (4-(6-플루오로-4-메틸피리딘-3-일)피리미딘-2-일)카르바메이트 (40 mg, 0.063 mmol)의 교반 용액에, 0℃에서 NaH (5.00 mg, 0.125 mmol)에 이어서 (S)-2-아미노-2,4-디메틸펜탄-1-올 (9.03 mg, 0.069 mmol)을 첨가하였다. 혼합물을 실온으로 가온되도록 한 다음, 60℃에서 3시간 동안 가열하였다. 이어서 혼합물을 0℃로 냉각시키고, 물 (10 mL)로 희석하고, 에틸 아세테이트 (2 x 50 mL)로 추출하였다. EtOAc 층을 수집하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 조 물질을 정제용 HPLC (방법 B)에 의해 정제하여 (S)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-4-메틸피리딘-3-일)피리미딘-2-일)카르바메이트 (5 mg, 0.013 mmol, 20% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 374.2 [(M+H)+, 계산치 C19H28N5O3 374.2]; LC/MS 체류시간 (방법 D): tR = 1.64분. 1H NMR (400 MHz, 메탄올-d4): δ 8.65 (d, J=5.21 Hz, 1H), 8.34 (s, 1H), 7.32 (d, J=5.14 Hz, 1H), 6.92 (s, 1H), 4.38 - 4.51 (m, 2H), 3.82 (s, 3H), 2.56 (s, 3H), 1.78 - 1.94 (m, 2H), 1.65 - 1.71 (m, 1H), 1.49 (s, 3H), 1.05 (m, 6H) ppm.
실시예 375
(S)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-클로로피리딘-3-일)피리미딘-2-일)카르바메이트
파트 A: 메틸 (4-(5-클로로-6-플루오로피리딘-3-일)피리미딘-2-일)카르바메이트
1,4-디옥산 (3.5 mL)-물 (0.3 mL) 중 메틸 (4-클로로피리미딘-2-일)카르바메이트 (실시예 304에 기재된 바와 같이 제조됨) (75 mg, 0.400 mmol), (5-클로로-6-플루오로피리딘-3-일)보론산 (77 mg, 0.440 mmol), PdCl2(dppf)-CH2Cl2 부가물 (16.33 mg, 0.020 mmol) 및 Cs2CO3 (391 mg, 1.199 mmol)의 혼합물을 질소로 퍼징하고, 100℃에서 12시간 동안 가열하였다. 반응 혼합물을 에틸 아세테이트 (25 mL)로 희석하고, 규조토 (셀라이트®)를 통해 여과하였다. 여과물을 감압 하에 농축시켜 갈색 잔류물을 수득하였다. 잔류물을 실리카 겔 크로마토그래피 (헥산 중 20% 에틸 아세테이트)에 의해 정제하여 메틸 (4-(5-클로로-6-플루오로피리딘-3-일)피리미딘-2-일)카르바메이트 (50 mg, 0.087 mmol, 22% 수율)를 갈색 고체로서 수득하였다. LCMS (ESI) m/e 283.0 [(M+H)+, 계산치 C11H9ClFN4O2 283.0]; LC/MS 체류시간 (방법 C): tR = 0.76분.
파트 B: (S)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-클로로피리딘-3-일)피리미딘-2-일)카르바메이트
DMF (3 mL) 중 메틸 (4-(5-클로로-6-플루오로피리딘-3-일)피리미딘-2-일)카르바메이트 (40 mg, 0.069 mmol)의 교반 용액에, 0℃에서 NaH (5.55 mg, 0.139 mmol) 및 (S)-2-아미노-2,4-디메틸펜탄-1-올 (10.01 mg, 0.076 mmol)을 첨가하고, 60℃에서 3시간 동안 교반하였다. 이어서, 혼합물을 0℃로 냉각시키고, 물 (10 mL)로 희석하고, 에틸 아세테이트 (2 x 50 mL)로 추출하였다. EtOAc 층을 수집하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 조 물질을 정제용 HPLC (방법 B)에 의해 정제하여 (S)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-클로로피리딘-3-일)피리미딘-2-일)카르바메이트 (10 mg, 0.024 mmol, 35% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 394.2 [(M+H)+, 계산치 C18H25ClN5O3 394.2]; LC/MS 체류시간 (방법 D): tR = 1.92분. 1H NMR (400 MHz, 메탄올-d4): δ 8.93 (d, J=2.13 Hz, 1H), 8.67 (d, J=2.13 Hz, 1H), 8.63 (d, J=5.27 Hz, 1H), 7.64 (d, J=5.33 Hz, 1H), 4.60 (d, J=3.64 Hz, 2H), 3.84 (s, 3H), 1.85 - 1.96 (m, 2H), 1.68 - 1.77 (m, 1H), 1.53 (s, 3H), 1.07 (m, 6H) ppm.
실시예 378
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-클로로피리미딘-4-일)벤조니트릴
파트 A: (S)-tert-부틸 (1-(4-(2-클로로피리미딘-4-일)-2-시아노페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (3 mL)-물 (0.3 mL) 중 2,4-디클로로피리미딘 (70 mg, 0.470 mmol), (S)-tert-부틸 (1-(2-시아노-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 86, 파트 A 및 B에 기재된 바와 같이 제조됨) (215 mg, 0.470 mmol), PdCl2(dppf)-CH2Cl2 부가물 (19.19 mg, 0.023 mmol), 및 삼염기성 인산칼륨 (216 mg, 1.410 mmol)의 혼합물을 질소로 퍼징하고, 80℃에서 12시간 동안 가열하였다. 반응 혼합물을 에틸 아세테이트 (25 mL)로 희석하고, 규조토 (셀라이트®)를 통해 여과하였다. 여과물을 감압 하에 농축시켜 갈색 잔류물을 수득하였다. 잔류물을 실리카 겔 크로마토그래피 (헥산 중 20% 에틸 아세테이트)에 의해 정제하여 (S)-tert-부틸 (1-(4-(2-클로로피리미딘-4-일)-2-시아노페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (130 mg, 0.216 mmol, 46% 수율)를 갈색 반고체로서 수득하였다. LCMS (ESI) m/e 445.6 [(M+H)+, 계산치 C23H30ClN4O3 445.2]; LC/MS 체류시간 (방법 B): tR = 1.25분.
파트 B: (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-클로로피리미딘-4-일)벤조니트릴
0℃에서 DCM 중 (S)-tert-부틸 (1-(4-(2-클로로피리미딘-4-일)-2-시아노페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (25 mg, 0.056 mmol)의 교반 용액에 1,4-디옥산 중 4N HCl (2 mL, 8.00 mmol)을 첨가하고, 혼합물을 1시간 동안 교반하였다. 혼합물을 물 (10 mL)로 희석하고, 에틸 아세테이트 (2 x 50 mL)로 추출하였다. EtOAc 층을 수집하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 조 물질을 정제용 HPLC (방법 A)에 의해 정제하여 (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-클로로피리미딘-4-일)벤조니트릴 (6 mg, 0.016 mmol, 28% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 345.2 [(M+H)+, 계산치 C18H22ClN4O 345.1]; LC/MS 체류시간 (방법 D): tR = 2.26분. 1H NMR (400 MHz, 메탄올-d4): δ 8.71 (d, J=5.33 Hz, 1H), 8.46 - 8.55 (m, 2H), 7.97 (d, J=5.33 Hz, 1H), 7.38 (d, J=8.91 Hz, 1H), 4.07 (d, J=1.69 Hz, 2H), 1.82 - 1.92 (m, 1H), 1.53 - 1.69 (m, 2H), 1.32 (s, 3H), δ 0.98 - 1.05 (m, 6H) ppm.
실시예 379
(S)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메틸피리딘-3-일)피리미딘-2-일)카르바메이트
파트 A. 메틸 (4-(6-플루오로-5-메틸피리딘-3-일)피리미딘-2-일)카르바메이트
1,4-디옥산 (3.5 mL)-물 (0.3 mL) 중 메틸 (4-클로로피리미딘-2-일)카르바메이트 (실시예 304에 기재된 바와 같이 제조됨) (75 mg, 0.400 mmol), 2-플루오로-3-메틸피리딘-5-보론산 (68.1 mg, 0.440 mmol), PdCl2(dppf)-CH2Cl2 부가물 (16.33 mg, 0.020 mmol) 및 Cs2CO3 (391 mg, 1.199 mmol)의 교반 용액을 질소로 퍼징하고, 100℃에서 12시간 동안 가열하였다. 반응 혼합물을 에틸 아세테이트 (25 mL)로 희석하고, 규조토 (셀라이트®)를 통해 여과하였다. 여과물을 감압 하에 농축시켜 갈색 잔류물을 수득하였다. 잔류물을 실리카 겔 크로마토그래피 (헥산 중 20% 에틸 아세테이트)에 의해 정제하여 메틸 (4-(6-플루오로-5-메틸피리딘-3-일)피리미딘-2-일)카르바메이트 (60 mg, 0.133 mmol, 33% 수율)를 갈색 고체로서 수득하였다. LCMS (ESI) m/e 263.1 [(M+H)+, 계산치 C12H12FN4O2 263.1]; LC/MS 체류시간 (방법 B): tR = 0.72분.
파트 B. (S)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메틸피리딘-3-일)피리미딘-2-일)카르바메이트
0℃에서 DMF (3 mL) 중 (S)-2-아미노-2,4-디메틸펜탄-1-올 (60 mg, 0.133 mmol)의 교반 용액에 NaH (10.62 mg, 0.265 mmol)를 첨가하고, 혼합물을 30분 동안 교반하였다. 생성된 혼합물에, 메틸 (4-(6-플루오로-5-메틸피리딘-3-일)피리미딘-2-일)카르바메이트 (19.15 mg, 0.146 mmol)를 첨가하고, 60℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 빙수로 켄칭하고, 에틸 아세테이트 (20 mL)로 희석하였다. 유기 층을 감압 하에 농축시켜 갈색 잔류물을 수득하였으며, 이를 역상 칼럼 크로마토그래피에 의해 정제하여 (S)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메틸피리딘-3-일)피리미딘-2-일)카르바메이트 (3 mg, 0.0723 mmol, 5% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 374.2 [(M+H)+, 계산치 C19H28N5O3 374.2]; LC/MS 체류시간 (방법 D): tR = 0.72분. 1H NMR (400 MHz, 메탄올-d4): δ 8.84 (d, J=1.88 Hz, 1H), 8.57 - 8.63 (m, 1H), 8.37 (d, J=2.32 Hz, 1H), 7.60 (d, J=5.27 Hz, 1H), 4.54 (s, 2H), 3.83 (s, 3H), 2.39 (s, 3H), 1.84 - 1.96 (m, 2H), 1.66 - 1.76 (m, 1H), 1.52 (s, 3H), 1.07 (m, 6H) ppm.
실시예 382
(S)-1-(2-클로로-4-(2-클로로피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
파트 A. (S)-tert-부틸 (1-(2-클로로-4-(2-클로로피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (3 mL)-물 (0.3 mL) 중 2,4-디클로로피리미딘 (75 mg, 0.503 mmol), (S)-tert-부틸 (1-(2-클로로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 285, 파트 A에 기재된 바와 같이 제조됨) (236 mg, 0.503 mmol), PdCl2(dppf)-CH2Cl2 부가물 (20.56 mg, 0.025 mmol) 및 삼염기성 인산칼륨 (232 mg, 1.510 mmol)의 혼합물을 질소로 퍼징하고, 80℃에서 3시간 동안 가열하였다. 반응 혼합물을 에틸 아세테이트 (25 mL)로 희석하고, 규조토 (셀라이트®)를 통해 여과하였다. 여과물을 감압 하에 농축시켜 갈색 잔류물을 수득하였다. 잔류물을 실리카 겔 크로마토그래피 (헥산 중 17% 에틸 아세테이트)에 의해 정제하여 (S)-tert-부틸 (1-(2-클로로-4-(2-클로로피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (130 mg, 0.243 mmol, 48% 수율)를 갈색 반고체로서 수득하였다. LCMS (ESI) m/e 454.1 [(M+H)+, 계산치 C22H30Cl2N3O3 454.2]; LC/MS 체류시간 (방법 C): tR = 1.38분.
파트 B. (S)-1-(2-클로로-4-(2-클로로피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
0℃에서 DCM 중 (S)-tert-부틸 (1-(2-클로로-4-(2-클로로피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (15 mg, 0.033 mmol)의 교반 용액에, 1,4-디옥산 중 4N HCl (2 mL, 8.00 mmol)을 첨가하고, 1시간 동안 교반하였다. 혼합물을 물 (10 mL)로 희석하고, 에틸 아세테이트 (2x25 mL)로 추출하였다. EtOAc 층을 수집하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 조 물질을 정제용 HPLC (방법 A)에 의해 정제하여 (S)-1-(2-클로로-4-(2-클로로피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민 (1 mg, 0.0268 mmol, 8% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 354.0 [(M+H)+, 계산치 C17H22Cl2N3O, 354.1]; LC/MS 체류시간 (방법 D): tR = 2.61분. 1H NMR (400 MHz, 메탄올-d4): δ 8.70 (m, 1H), 8.33 (d, J=2.20 Hz, 1H), 8.16 - 8.23 (m, 1H), 7.95 (d, J=5.40 Hz, 1H), 7.34 (d, J=8.72 Hz, 1H), 4.25 (d, J=12.61 Hz, 2H), 1.85 - 2.02 (m, 2H), 1.68 - 1.79 (m, 1H), 1.54 (s, 3H), 1.03 - 1.10 (m, 6H) ppm.
실시예 383
(S)-1-(2-(디플루오로메틸)-4-(2-메톡시피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
파트 A. 4-(3-(디플루오로메틸)-4-플루오로페닐)-2-메톡시피리딘
1,4-디옥산 (3 mL) 및 물 (0.5 mL) 중 (2-메톡시피리딘-4-일)보론산 (75 mg, 0.490 mmol), 4-브로모-2-(디플루오로메틸)-1-플루오로벤젠 (121 mg, 0.539 mmol), 삼염기성 인산칼륨 (312 mg, 1.471 mmol) 및 PdCl2(dppf)-CH2Cl2 부가물 (20.02 mg, 0.025 mmol)의 용액을 질소로 퍼징하고, 90℃로 4시간 동안 가열하였다. 반응 혼합물을 에틸 아세테이트 (10 mL)로 희석하였다. 흑색 현탁액을 규조토 (셀라이트®)를 통해 여과하고, 층을 에틸 아세테이트 (10 mL)로 세척하였다. 잔류물을 실리카 겔 크로마토그래피 (15% 석유 에테르: 에틸 아세테이트)에 의해 정제하여 4-(3-(디플루오로메틸)-4-플루오로페닐)-2-메톡시피리딘 (100 mg, 0.363 mmol, 74% 수율)을 갈색 고체로서 수득하였다. LCMS (ESI) m/e 254.0 [(M+H)+, 계산치 C13H11F3NO 254.1]; LC/MS 체류시간 (방법 C): tR = 1.02분.
파트 B. (S)-1-(2-(디플루오로메틸)-4-(2-메톡시피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
0℃에서 THF (2 mL) 중 4-(3-(디플루오로메틸)-4-플루오로페닐)-2-메톡시피리딘 (25 mg, 0.099 mmol)의 용액에 (S)-2-아미노-2,4-디메틸펜탄-1-올 (14.25 mg, 0.109 mmol) 및 THF 중 1 M 포타슘 tert-부톡시드 (0.148 mL, 0.148 mmol)를 첨가하였다. 반응 혼합물을 80℃에서 2시간 동안 교반하였다. 반응 혼합물을 물 (5 mL)로 희석하고, 에틸 아세테이트 (2 x 50 mL)로 추출하였다. 에틸 아세테이트 층을 물 (1x10 mL), 염수 (1x10 mL)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 갈색 반고체를 수득하였다. 조 물질을 정제용 LC/MS (방법 B)에 의해 정제하여 (S)-1-(2-(디플루오로메틸)-4-(2-메톡시피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민 (6 mg, 0.016 mmol, 16% 수율)을 수득하였다. LCMS (ESI) m/e 365.3 [(M+H)+, 계산치 C20H27F2N2O2 365.2]; LC/MS 체류시간 (방법 H): tR = 1.75분. 1H NMR(400 MHz, 메탄올-d4): δ 8.20 (dd, J=5.46, 0.56 Hz, 1 H), 7.88 - 7.95 (m, 2 H), 7.20 - 7.40 (m, 3 H), 7.03 - 7.12 (m, 1 H), 4.15 - 4.32 (m, 2 H), 3.98 (s, 3 H), 1.83 - 1.94 (m, 2 H), 1.71 (m, 1 H), 1.54 (br. s., 3 H), 1.01 - 1.09 (m, 6 H) ppm.
실시예 384
(S)-2,4-디메틸-1-(2-메틸-4-(6-메틸피리미딘-4-일)페녹시)펜탄-2-아민
파트 A. (S)-tert-부틸 (2,4-디메틸-1-(2-메틸-4-(6-메틸피리미딘-4-일)페녹시)펜탄-2-일)카르바메이트
1,4-디옥산 (2 mL) 및 물 (0.2 mL) 중 4-클로로-6-메틸피리미딘 (15 mg, 0.117 mmol), (S)-tert-부틸 (2,4-디메틸-1-(2-메틸-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)펜탄-2-일)카르바메이트 (실시예 367, 파트 A에 기재된 바와 같이 제조됨) (52.2 mg, 0.117 mmol), 삼염기성 인산칼륨 (74.2 mg, 0.350 mmol) 및 PdCl2(dppf)-CH2Cl2 부가물 (4.76 mg, 5.83 μmol)의 용액을 질소로 퍼징하고, 80℃에서 4시간 동안 가열하였다. 반응물을 에틸 아세테이트 (20 mL)로 희석하였다. 흑색 현탁액을 규조토 (셀라이트®)를 통해 여과하고, 층을 에틸 아세테이트 (10 mL)로 세척하였다. 여과물을 감압 하에 농축시켜 흑색 잔류물을 수득하였으며, 이를 실리카 겔 크로마토그래피 (석유 에테르 중 0-20% EtOAc)에 의해 정제하여 (S)-tert-부틸 (2,4-디메틸-1-(2-메틸-4-(6-메틸피리미딘-4-일)페녹시)펜탄-2-일)카르바메이트 (30 mg, 0.039 mmol, 34% 수율)를 갈색 반고체로서 수득하였다. LCMS (ESI) m/e 414.2 [(M+H)+, 계산치 C24H36N3O3 414.2]; LC/MS 체류시간 (방법 C): tR = 1.27분.
파트 B. (S)-2,4-디메틸-1-(2-메틸-4-(6-메틸피리미딘-4-일)페녹시)펜탄-2-아민
0℃에서 DCM 중 (S)-tert-부틸 (2,4-디메틸-1-(2-메틸-4-(6-메틸피리미딘-4-일)페녹시)펜탄-2-일)카르바메이트 (30 mg, 0.073 mmol)의 용액에 1,4-디옥산 중 4 M HCl (2 mL, 8.00 mmol)을 첨가하였다. 반응 혼합물을 실온에서 1시간 동안 교반되도록 하였다. 반응 혼합물을 농축시키고, 중탄산나트륨 용액 (5 mL)으로 희석하였다. 반응 혼합물을 에틸 아세테이트 (2x50 mL)로 추출하였다. 에틸 아세테이트 층을 물 (1x10 mL) 및 염수 (1x10 mL)로 세척하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켜 갈색 반고체를 수득하였다. 조 물질을 정제용 LC/MS (방법 B)에 의해 정제하여 (S)-2,4-디메틸-1-(2-메틸-4-(6-메틸피리미딘-4-일)페녹시)펜탄-2-아민 (8 mg, 0.025 mmol, 35% 수율)을 수득하였다. LCMS (ESI) m/e 314.3 [(M+H)+, 계산치 C19H28N3O, 314.2]; LC/MS 체류시간 (방법 H): tR = 1.32분. 1H NMR (400 MHz, 메탄올-d4): δ 9.00 (d, J=1.19 Hz, 1 H), 8.03 - 8.08 (m, 2 H), 7.87 (s, 1 H), 7.14 (d, J=9.04 Hz, 1 H), 4.12 - 4.23 (m, 2 H), 2.60 (s, 3 H), 2.42 (s, 3 H), 1.82 - 1.96 (m, 2 H), 1.69 - 1.78 (m, 1 H), 1.54 (s, 3 H), 1.03 - 1.10 (m, 6 H) ppm.
실시예 385
(S)-6-((2-아미노-2,4-디메틸펜틸)옥시)-2'-메톡시-[3,4'-비피리딘]-5-카르보니트릴
파트 A. 5-브로모-2-플루오로니코틴알데히드 옥심
에탄올 (20 mL) 및 물 (10 mL) 중 히드록실아민 히드로클로라이드 (1.506 g, 21.67 mmol)의 용액에 5-브로모-2-플루오로니코틴알데히드 (3.4 g, 16.67 mmol)를 첨가하였다. 반응 혼합물을 실온에서 1시간 동안 교반하였다. 반응 혼합물을 물 (10 mL)로 희석하고, 에틸 아세테이트 (2 x 50 mL)로 추출하였다. 에틸 아세테이트 층을 물 (1 x 10 mL), 염수 (1 x 10 mL)로 세척하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켜 5-브로모-2-플루오로니코틴알데히드 옥심 (3.5 g, 15.98 mmol, 96% 수율)을 회백색 고체로서 수득하였다. LCMS (ESI) m/e 218.8 [(M+H)+, 계산치 C6H5BrFN2O 218.9]; LC/MS 체류시간 (방법 C): tR = 0.78분.
파트 B. 5-브로모-2-플루오로니코티노니트릴
클로로포름 (40 mL) 중 5-브로모-2-플루오로니코틴알데히드 옥심 (3.5 g, 15.98 mmol)의 용액에 실온에서 POCl3 (11.92 mL, 128 mmol)을 천천히 적가하였다. 반응 혼합물을 75℃에서 5시간 동안 가열하였다. 반응 혼합물을 감압 하에 농축시켰다. 잔류물에 10% 중탄산나트륨 용액 (10 mL)을 첨가하고, 용액을 에틸 아세테이트 (2 x 250 mL)로 추출하였다. 에틸 아세테이트 층을 물 (1 x 10 mL), 염수 (1 x 10 mL)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 5-브로모-2-플루오로니코티노니트릴 (3.1 g, 15.42 mmol, 97% 수율)을 갈색 고체로서 수득하였다. 1H NMR (300 MHz, DMSO-d6): δ 8.92 (dd, J = 7.8, 2.4 Hz, 1 H), 8.75 (dd, J = 2.4 Hz, 1 H) ppm.
파트 C. 6-플루오로-2'-메톡시-[3,4'-비피리딘]-5-카르보니트릴
1,4-디옥산 (3 mL) 및 물 (0.5 mL) 중 (2-메톡시피리딘-4-일)보론산 (75 mg, 0.490 mmol), 5-브로모-2-플루오로니코티노니트릴 (108 mg, 0.539 mmol), 삼염기성 인산칼륨 (312 mg, 1.471 mmol) 및 PdCl2(dppf)-CH2Cl2 부가물 (20.02 mg, 0.025 mmol)의 현탁액을 질소로 퍼징하고, 90℃로 4시간 동안 가열하였다. 반응 혼합물을 에틸 아세테이트 (10 mL)로 희석하였다. 흑색 현탁액을 규조토 (셀라이트®)를 통해 여과하고, 층을 에틸 아세테이트 (10 mL)로 세척하였다. 여과물을 감압 하에 농축시켜 흑색 잔류물을 수득하였으며, 이를 실리카 겔 크로마토그래피 (10-30% 석유 에테르:에틸 아세테이트)에 의해 정제하여 6-플루오로-2'-메톡시-[3,4'-비피리딘]-5-카르보니트릴 (40 mg, 0.150 mmol, 31% 수율)을 갈색 고체로서 수득하였다. LCMS (ESI) m/e 230.5 [(M+H)+, 계산치 C12H9FN3O 230.1]; LC/MS 체류시간 (방법 B): tR = 0.83분.
파트 D. (S)-6-((2-아미노-2,4-디메틸펜틸)옥시)-2'-메톡시-[3,4'-비피리딘]-5-카르보니트릴
0℃에서 THF (3 mL) 중 6-플루오로-2'-메톡시-[3,4'-비피리딘]-5-카르보니트릴 (40 mg, 0.175 mmol)의 용액에 THF 중 1 M 포타슘 tert-부톡시드 (0.262 mL, 0.262 mmol) 및 (S)-2-아미노-2,4-디메틸펜탄-1-올 (25.2 mg, 0.192 mmol)을 첨가하였다. 반응 혼합물을 실온에서 2시간 동안 교반되도록 하였다. 반응 혼합물을 물 (5 mL)로 희석하고, 에틸 아세테이트 (2 x 5 mL)로 추출하였다. 에틸 아세테이트 층을 물 (1 x 10 mL), 염수 (1 x 10 mL)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 갈색 반고체를 수득하였다. 조 물질을 정제용 LC/MS (방법 B)에 의해 정제하여 (S)-6-((2-아미노-2,4-디메틸펜틸)옥시)-2'-메톡시-[3,4'-비피리딘]-5-카르보니트릴 (36 mg, 0.102 mmol, 58% 수율)을 수득하였다. LCMS (ESI) m/e 341.2 [(M+H)+, 계산치 C19H25N4O2 341.2]; LC/MS 체류시간 (방법 H): tR = 2.43분. 1H NMR (400 MHz, 메탄올-d4): δ 8.82 (d, J=2.51 Hz, 1 H), 8.60 (d, J=2.51 Hz, 1 H), 8.26 (dd, J=5.46, 0.63 Hz, 1 H), 7.29 (dd, J=5.46, 1.63 Hz, 1 H), 7.15 (d, J=1.60 Hz, 1 H), 4.60 - 4.75 (m, 2 H), 3.97 - 4.03 (m, 3 H), 1.87 - 2.00 (m, 2 H), 1.67 - 1.78 (m, 1 H), 1.55 (s, 3 H), 1.07 - 1.11 (m, 6 H) ppm.
실시예 386
(S)-1-(4-(2-메톡시피리딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-아민
파트 A. (S)-tert-부틸 (1-(4-(2-메톡시피리딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (3 mL) 및 물 (0.2 mL) 중 (2-메톡시피리딘-4-일)보론산 (40 mg, 0.262 mmol), (S)-tert-부틸 (1-(4-브로모-2-메틸페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 367에 기재된 바와 같이 제조됨) (105 mg, 0.262 mmol), PdCl2(dppf)-CH2Cl2 부가물 (10.68 mg, 0.013 mmol) 및 삼염기성 인산칼륨 (167 mg, 0.785 mmol)의 용액을 질소로 퍼징하고, 90℃로 3시간 동안 가열하였다. 반응 혼합물을 에틸 아세테이트 (25 mL)로 희석하고, 규조토 (셀라이트®)를 통해 여과하였다. 층을 에틸 아세테이트 (10 mL)로 세척하고, 여과물을 감압 하에 농축시켜 흑색 잔류물을 수득하였으며, 이를 실리카 겔 칼럼 (석유 에테르 중 20% EtOAc)에 의해 정제하여 (S)-tert-부틸 (1-(4-(2-메톡시피리딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (65 mg, 0.108 mmol, 41% 수율)를 갈색 반고체로서 수득하였다. LCMS (ESI) m/e 429.7 [(M+H)+, 계산치 C25H37N2O4 429.3]; LC/MS 체류시간 (방법 B): tR = 1.11분.
파트 B. (S)-1-(4-(2-메톡시피리딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-아민
0℃에서 DCM 중 (S)-tert-부틸 (1-(4-(2-메톡시피리딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (65 mg, 0.152 mmol)의 용액에 1,4-디옥산 중 4 M HCl (5 mL, 20.00 mmol)을 첨가하였다. 반응 혼합물을 1시간 동안 교반되도록 하였다. 반응 혼합물을 농축시키고, 중탄산나트륨 용액 (5 mL)으로 희석하였다. 반응 혼합물을 에틸 아세테이트 (2 x 50 mL)로 추출하였다. 에틸 아세테이트 층을 물 (1 x 10 mL), 및 포화 NaCl (1 x 10 mL)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 갈색 반고체를 수득하였다. 조 물질을 정제용 LC/MS (방법 B)에 의해 정제하여 (S)-1-(4-(2-메톡시피리딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-아민(29 mg, 0.086 mmol, 57% 수율)을 연황색 반고체로서 수득하였다. LCMS (ESI) m/e 329.3 [(M+H)+, 계산치 C20H29N2O2 329.2]; LC/MS 체류시간 (방법 H): tR = 1.69분. 1H NMR (400 MHz, 메탄올-d4): δ 8.18 (dd, J=5.77, 0.56 Hz, 1 H), 7.62 - 7.73 (m, 2 H), 7.37 (dd, J=5.77, 1.63 Hz, 1 H), 7.21 (s, 1 H), 7.12 (d, J=9.29 Hz, 1 H), 4.10 - 4.24 (m, 2 H), 4.05 (s, 3 H), 2.41 (s, 3 H), 1.83 - 1.95 (m, 2 H), 1.68 - 1.76 (m, 1 H), 1.54 (s, 3 H), 1.02 - 1.10 (m, 6 H) ppm.
실시예 387
(S)-1-((2-(플루오로메틸)-6-(6-메틸피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A. 4-(5-플루오로-6-(플루오로메틸)피리딘-2-일)-6-메틸피리미딘
1,4-디옥산 중 4-클로로-6-메틸피리미딘 (100 mg, 0.778 mmol), 헥사메틸이주석 (129 μl, 0.622 mmol), 테트라키스(트리페닐포스핀)팔라듐 (0) (44.9 mg, 0.039 mmol) 및 6-브로모-3-플루오로-2-(플루오로메틸)피리딘 (실시예 279에 기재된 바와 같이 제조됨) (113 mg, 0.544 mmol)의 용액을 질소로 퍼징하고, 마이크로웨이브로 120℃에서 1시간 동안 조사하였다. 반응 혼합물을 에틸 아세테이트 (10 mL)로 희석하고, 흑색 현탁액을 규조토 (셀라이트®)를 통해 여과하였다. 층을 에틸 아세테이트 (10 mL)로 세척하였다. 여과물을 감압 하에 농축시켜 흑색 잔류물을 수득하였으며, 이를 실리카 겔 크로마토그래피 (석유 에테르 중 5-20% EtOAc)에 의해 정제하여 4-(5-플루오로-6-(플루오로메틸)피리딘-2-일)-6-메틸피리미딘 (90 mg, 0.224 mmol, 29% 수율)을 갈색 반고체로서 수득하였다. LCMS (ESI) m/e 222.5 [(M+H)+, 계산치 C11H10F2N3 222.1]; LC/MS 체류시간 (방법 B): tR = 0.77분.
파트 B. (S)-1-((2-(플루오로메틸)-6-(6-메틸피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
0℃에서 THF (3 mL) 중 4-(5-플루오로-6-(플루오로메틸)피리딘-2-일)-6-메틸피리미딘 (90 mg, 0.224 mmol)의 용액에 THF 중 1 M 포타슘 tert-부톡시드 (0.336 mL, 0.336 mmol) 및 (S)-2-아미노-2,4-디메틸펜탄-1-올(32.3 mg, 0.246 mmol)을 첨가하였다. 반응 혼합물을 실온에서 2시간 동안 교반하였다. 반응 혼합물을 물 (5 mL)로 희석하고, 에틸 아세테이트 (2 x 50 mL)로 추출하였다. 에틸 아세테이트 층을 물 (1 x 10 mL) 및 염수 (1 x 10 mL)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 갈색 반고체를 수득하였다. 조 물질을 정제용 LC/MS (방법 B)에 의해 정제하여 (S)-1-((2-(플루오로메틸)-6-(6-메틸피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (30 mg, 0.089 mmol, 40% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 333.3 [(M+H)+, 계산치 C18H26FN4O 333.2]; LC/MS 체류시간 (방법 I): tR = 0.99분. 1H NMR (400 MHz, 메탄올-d4): δ 9.05 - 9.12 (m, 1 H), 8.56 - 8.62 (m, 1 H), 8.30 - 8.39 (m, 1 H), 7.69 - 7.78 (m, 1 H), 5.58 - 5.84 (m, 2 H), 4.22 - 4.36 (m, 2 H), 2.65 (s, 3 H), 1.86 - 1.98 (m, 2 H), 1.70 - 1.78 (m, 1 H), 1.55 (s, 3 H), 1.02 - 1.11 (m, 6 H) ppm.
실시예 388
(S)-메틸 (4-(5-((2-아미노-2,4-디메틸펜틸)옥시)-6-(플루오로메틸)피리딘-2-일)피리미딘-2-일)카르바메이트
파트 A. 4-(5-플루오로-6-(플루오로메틸)피리딘-2-일)피리미딘-2-아민
1,4-디옥산 (1.5 mL) 중 메틸 (4-클로로피리미딘-2-일)카르바메이트 (실시예 304에 기재된 바와 같이 제조됨) (200 mg, 1.066 mmol), 6-브로모-3-플루오로-2-(플루오로메틸)피리딘 (실시예 279에 기재된 바와 같이 제조됨) (133 mg, 0.640 mmol), 테트라키스(트리페닐포스핀)팔라듐 (0) (123 mg, 0.107 mmol) 및 비스(트리부틸주석) (619 mg, 1.07 mmol)의 용액을 질소로 퍼징하고, 마이크로웨이브로 150℃에서 1.5시간 동안 조사하였다. 반응 혼합물을 실온으로 냉각되도록 하고, 에틸 아세테이트 (25 mL)로 희석하였다. 흑색 현탁액을 규조토 (셀라이트®)를 통해 여과하고, 층을 에틸 아세테이트 (10 mL)로 세척하였다. 여과물을 감압 하에 농축시켜 흑색 잔류물을 수득하였으며, 이를 실리카 겔 크로마토그래피 (DCM 중 0-10% MeOH)에 의해 정제하여 4-(5-플루오로-6-(플루오로메틸)피리딘-2-일)피리미딘-2-아민 (120 mg, 0.162 mmol, 15% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 223.0 [(M+H)+, 계산치 C10H9F2N4 223.1]; LC/MS 체류시간 (방법 C): tR = 0.72분.
파트 B. 메틸 (4-(5-플루오로-6-(플루오로메틸)피리딘-2-일)피리미딘-2-일)카르바메이트
0℃에서 클로로포름 (2.5 mL) 및 피리딘 (2.5 mL) 중 4-(5-플루오로-6-(플루오로메틸)피리딘-2-일)피리미딘-2-아민 (120 mg, 0.162 mmol)의 용액에 DMAP (1.979 mg, 0.016 mmol) 및 메틸 클로로포르메이트 (0.063 mL, 0.810 mmol)를 첨가하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 반응 혼합물을 물 (10 mL)로 희석하고, 에틸 아세테이트 (2 x 50 mL)로 추출하였다. 에틸 아세테이트 층을 물 (1 x 20 mL), 염수 (1 x 20 mL)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 조 생성물을 실리카 겔 크로마토그래피 (석유 에테르 중 10-40% EtOAc)에 의해 정제하여 메틸 (4-(5-플루오로-6-(플루오로메틸)피리딘-2-일)피리미딘-2-일)카르바메이트 (22 mg, 0.071 mmol, 44% 수율)를 회백색 고체로서 수득하였다. LCMS (ESI) m/e 281.1 [(M+H)+, 계산치 C12H11F2N4O2 281.1]; LC/MS 체류시간 (방법 C): tR = 0.76분.
파트 C. (S)-메틸 (4-(5-((2-아미노-2,4-디메틸펜틸)옥시)-6-(플루오로메틸)피리딘-2-일)피리미딘-2-일)카르바메이트
0℃에서 DMF (3 mL) 중 메틸 (4-(5-플루오로-6-(플루오로메틸)피리딘-2-일)피리미딘-2-일)카르바메이트 (22 mg, 0.079 mmol)의 용액에 NaH (6.28 mg, 0.157 mmol) 및 (S)-2-아미노-2,4-디메틸펜탄-1-올 (11.33 mg, 0.086 mmol)을 첨가하였다. 반응 혼합물을 60℃로 밤새 가열하였다. 반응 혼합물을 0℃로 냉각시키고, 물 (5 mL)로 희석하고, 에틸 아세테이트 (2 x 50 mL)로 추출하였다. 에틸 아세테이트 층을 물 (1 x 10 mL), 및 포화 NaCl (1 x 10 mL)로 세척하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 C)에 의해 정제하여 (S)-메틸 (4-(5-((2-아미노-2,4-디메틸펜틸)옥시)-6-(플루오로메틸)피리딘-2-일)피리미딘-2-일)카르바메이트 (4 mg, 9.50 μmol, 12% 수율)를 황색 고체로서 수득하였다. LCMS (ESI) m/e 392.3 [(M+H)+, 계산치 C19H27FN5O3 392.2]; LC/MS 체류시간 (방법 H): tR = 1.25분; LC/MS 체류시간 (방법 I): tR = 0.83분. 1H NMR (400 MHz, 메탄올-d4): δ 8.67 (d, J=5.27 Hz, 1 H), 8.59 (dd, J=8.72, 1.63 Hz, 1 H), 8.04 (d, J=5.21 Hz, 1 H), 7.67 (d, J=8.72 Hz, 1 H), 5.72 (d, J=11.11 Hz, 1 H), 5.60 (d, J=11.04 Hz, 1 H), 4.09 - 4.21 (m, 2 H), 3.84 (s, 3 H), 1.83 - 1.92 (m, 1 H), 1.74 - 1.82 (m, 1 H), 1.61 - 1.69 (m, 1 H), 1.43 (s, 3 H), 1.02 - 1.07 (m, 6 H) ppm.
실시예 395
(S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-일)-3-메틸부탄아미드
(S)-tert-부틸 (1-(4-(2-아미노피리딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (20 mg, 0.043 mmol) (실시예 297에 기재된 바와 같이 제조됨)를 함유하는 플라스크에 3-메틸부탄산 (0.051 mmol, 1.2 당량), HATU (24.40 mg, 0.064 mmol), DIPEA (0.022 mL, 0.128 mmol) 및 DMF (1 mL)를 첨가하였다. 반응 혼합물을 60℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시키고 감압 하에 농축시켰다. 잔류물에, 0℃에서 DCM 중 30% TFA (1 mL)를 첨가하고, 혼합물을 30분 동안 교반하였다. 용매를 제거하고, 조 물질을 역상 정제용 HPLC (방법 E)에 의해 정제하여 (S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-일)-3-메틸부탄아미드 (6.0 mg, 0.013 mmol, 2 단계에 대해서 31% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 452.2 [(M+H)+, 계산치 C24H33F3N3O2 452.2]; LC/MS 체류시간 (방법 H): tR = 2.81분. 1H NMR (400 MHz, DMSO-d6) δ 10.51 (s, 1H), 8.40 (d, J=1.0 Hz, 1H), 8.37 - 8.34 (m, 1H), 7.99 (dd, J=8.8, 2.3 Hz, 1H), 7.89 (d, J=2.0 Hz, 1H), 7.44 (dd, J=5.3, 1.5 Hz, 1H), 7.39 (d, J=8.8 Hz, 1H), 3.94 - 3.86 (m, 2H), 2.34 - 2.28 (m, 2H), 2.09 (dquin, J=13.6, 6.8 Hz, 1H), 1.80 (dquin, J=12.7, 6.3 Hz, 1H), 1.47 - 1.37 (m, 2H), 1.15 (s, 3H), 0.97 - 0.88 (m, 12H) ppm.
실시예 396
N-(4-(4-(((S)-2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-일)-3-메틸펜탄아미드
실시예 395에 기재된 바와 같이 제조하여 N-(4-(4-(((S)-2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-일)-3-메틸펜탄아미드 (6.0 mg, 0.013 mmol, 2 단계에 대해서 30% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 466.2 [(M+H)+, 계산치 C25H35F3N3O2 466.2]; LC/MS 체류시간 (방법 H): tR = 2.98분. 1H NMR (400 MHz, DMSO-d6) δ 10.52 (s, 1H), 8.40 (d, J=1.0 Hz, 1H), 8.35 (d, J=5.3 Hz, 1H), 7.99 (dd, J=8.5, 2.3 Hz, 1H), 7.89 (d, J=2.0 Hz, 1H), 7.44 (dd, J=5.3, 1.8 Hz, 1H), 7.39 (d, J=8.8 Hz, 1H), 3.92 - 3.85 (m, 2H), 2.43 - 2.38 (m, 1H), 2.28 - 2.21 (m, 1H), 1.94 - 1.75 (m, 2H), 1.46 - 1.31 (m, 3H), 1.26 - 1.17 (m, 1H), 1.14 (s, 3H), 0.94 - 0.85 (m, 12H) ppm.
실시예 397
(S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-일)-4-메틸펜탄아미드
실시예 395에 기재된 바와 같이 제조하여 (S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-일)-4-메틸펜탄아미드 (6.3 mg, 0.014 mmol, 2 단계에 대해서 32% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 466.2 [(M+H)+, 계산치 C25H35F3N3O2 466.2]; LC/MS 체류시간 (방법 H): tR = 3.01분. 1H NMR (400 MHz, DMSO-d6) δ 10.55 (s, 1H), 8.41 - 8.36 (m, 2H), 8.02 (dd, J=8.8, 2.3 Hz, 1H), 7.91 (d, J=2.0 Hz, 1H), 7.46 - 7.41 (m, 2H), 4.02 - 3.96 (m, 2H), 2.46 - 2.41 (m, 2H), 1.82 (dt, J=12.7, 6.1 Hz, 1H), 1.61 - 1.43 (m, 5H), 1.22 (s, 3H), 0.96 - 0.88 (m, 12H) ppm.
실시예 422
(S)-5-((2-아미노-2,4-디메틸펜틸)옥시)-6-메틸-[2,4'-비피리딘]-2'-아민
에탄올 (1 mL)-H2O (1 mL) 중 (S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-6-메틸-[2,4'-비피리딘]-2'-일)카르바메이트 (실시예 64에 기재된 바와 같이 제조됨) (0.025 g, 0.067 mmol)의 용액을 KOH (0.038 g, 0.671 mmol)로 처리하고, 환류 하에 5시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 물 (50 mL)로 희석하였다. 용액을 디클로로메탄 (80 mL)으로 추출하였다. 유기 층을 분리하고, 염수로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 정제용 HPLC (방법 B)에 의해 정제하여 (S)-5-((2-아미노-2,4-디메틸펜틸)옥시)-6-메틸-[2,4'-비피리딘]-2'-아민 (0.005 g, 0.016 mmol, 24% 수율)을 황색 고체로서 수득하였다. LCMS (ESI) m/e 315.2 [(M+H)+, 계산치 C18H27N4O 315.2]; LC/MS 체류시간 (방법 E): tR = 0.71분; LCMS 체류시간 (방법 F): tR = 0.97분. 1H NMR (400 MHz, 메탄올-d4): δ 7.93 (m, 2H), 7.69 (d, J=1.00 Hz, 1H), 7.51 - 7.57 (m, 2H), 4.15 - 4.29 (m, 2H), 2.65 (s, 3H), 1.84 - 1.96 (m, 2H), 1.73 (d, J=9.04 Hz, 1H), 1.55 (s, 3H), 1.00 - 1.13 (m, 6H) ppm.
실시예 431
(S)-6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리미딘-4-아민
파트 A. (S)-tert-부틸 (1-(4-(6-아세트아미도피리미딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (2 mL) 중 N-(6-클로로피리미딘-4-일)아세트아미드 (실시예 278에 기재된 바와 같이 제조됨) (0.03 g, 0.175 mmol), (S)-tert-부틸 (2,4-디메틸-1-(2-메틸-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)펜탄-2-일)카르바메이트 (실시예 367, 파트 A에 기재된 바와 같이 제조됨) (0.056 g, 0.125 mmol), PdCl2(dppf)-CH2Cl2 부가물 (10.20 mg, 0.012 mmol) 및 Cs2CO3 (0.122 g, 0.375 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시키고, 염수로 희석하고, 에틸 아세테이트 (20 mL)로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 (S)-tert-부틸(1-(4-(6-아세트아미도피리미딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-일)카르바메이트를 황색빛 반고체로서 수득하였다. LCMS (ES-API) m/e 457.2 [(M+H)+, 계산치 C25H37N4O4, 457.3]; LC/MS 체류시간 (방법 D): tR = 2.45분.
파트 B. (S)-6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리미딘-4-아민
0℃로 냉각시킨 MeOH (3 mL) 중 (S)-tert-부틸 (1-(4-(6-아세트아미도피리미딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.05 g, 0.110 mmol)의 용액에 1,4-디옥산 중 4N HCl (0.274 mL, 1.095 mmol)을 첨가하였다. 반응 혼합물을 실온에서 1시간 동안 교반하였다. 반응 혼합물을 감압 하에 농축시키고, 정제용 HPLC (방법 B)에 의해 정제하여 (S)-6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리미딘-4-아민 (0.016 g, 0.051 mmol, 46% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 315.2 [(M+H)+, 계산치 C18H26N4O 315.2]; LCMS 체류시간 (방법 F): tR = 1.08분; LCMS 체류시간 (방법 G): tR = 0.73분. 1H NMR (400 MHz, CD3OD): δ 8.60 (d, J = 0.80 Hz, 1H), 7.73-7.76 (m, 2H), 7.24 (d, J = 8.40 Hz, 1H), 6.96 (d, J = 0.80 Hz, 1H), 4.17-4.26 (m, 2H), 2.44 (s, 3H), 1.89-1.95 (m, 2H), 1.71-1.75 (m, 1H), 1.55 (s, 3H), 1.02-1.09 (m, 6H) ppm.
실시예 432
(S)-메틸 (6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-4-일)카르바메이트
파트 A. N-(6-클로로피리미딘-4-일)아세트아미드
1,4-디옥산 (5 mL) 중 4,6-디클로로피리미딘 (0.1 g, 0.671 mmol), 메틸 카르바메이트 (0.050 g, 0.671 mmol), Cs2CO3 (0.437 g, 1.342 mmol), PdOAc2 (6.03 mg, 0.027 mmol) 및 XANTPHOS (0.035 g, 0.060 mmol)의 혼합물을 75℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시켰다. 잔류물을 물 (25 mL)로 희석하고, 에틸 아세테이트 (2x25 mL)로 추출하였다. 에틸 아세테이트 층을 수집하고, 염수 (25 mL)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 메틸 (6-클로로피리미딘-4-일)카르바메이트 (0.08 g, 0.418 mmol, 62% 수율)를 갈색 고체로서 수득하였다. LCMS (ESI) m/e 186.0 [(M-H)-, 계산치 C6H5ClN3O2 186.0]; LC/MS 체류시간 (방법 D): tR = 1.26분.
파트 B. Boc-(S)-메틸 (6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-4-일)카르바메이트
1,4-디옥산 (2 mL) 중 메틸 (6-클로로피리미딘-4-일)카르바메이트 (0.03 g, 0.160 mmol), (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (실시예 215, 파트 A 및 B에 기재된 바와 같이 제조됨) (0.057 g, 0.114 mmol), PdCl2(dppf)-CH2Cl2 부가물 (9.33 mg, 0.011 mmol) 및 Cs2CO3 (0.112 g, 0.343 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시키고, 염수로 희석하고, 에틸 아세테이트 (20 mL)로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 Boc-(S)-메틸 (6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-4-일)카르바메이트 (0.1 g, 0.103 mmol, 90% 수율)를 황색빛 반고체로서 수득하였다. LCMS (ES-API) m/e 527.2 [(M+H)+, 계산치 C25H34F3N4O5 527.2]; LC/MS 체류시간 (방법 D): tR = 2.61분.
파트 C. (S)-메틸 (6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-4-일)카르바메이트
0℃로 냉각시킨 MeOH (2 mL) 중 Boc-(S)-메틸 (6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-4-일)카르바메이트 (0.08 g, 0.082 mmol)의 교반 용액에 1,4-디옥산 중 4N HCl (0.205 mL, 0.820 mmol)을 첨가하고, 혼합물을 1시간 동안 교반하였다. 반응 혼합물을 포화 수성 중탄산나트륨 (20 mL)으로 희석하고, 에틸 아세테이트 (30 mL)로 추출하였다. 유기 층을 분리하고, 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 정제용 HPLC (방법 A)에 의해 정제하여 (S)-메틸 (6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-4-일)카르바메이트 (0.020 g, 0.044 mmol, 54% 수율)를 황색 고체로서 수득하였다. LCMS (ESI) m/e 427.2 [(M+H)+, 계산치 C20H25F3N4O3 427.2]; LCMS 체류시간 (방법 F): tR = 2.34분; LCMS 체류시간 (방법 G): tR = 1.82분. 1H NMR (400 MHz, DMSO-d6): δ 8.88 (d, J=1.00 Hz, 1H), 8.31 - 8.38 (m, 3H), 7.43 (d, J=8.53 Hz, 1H), 3.95 (d, J=4.02 Hz, 2H), 3.76 (s, 3H), 1.76 - 1.87 (m, 1H), 1.44 (m, 2H), 1.13 - 1.20 (m, 3H), 0.88 - 0.97 (m, 6H) ppm.
실시예 433
(S)-메틸 (6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리미딘-4-일)카르바메이트
파트 A. Boc-(S)-메틸 (6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리미딘-4-일)카르바메이트
1,4-디옥산 (2 mL) 중 메틸 (6-클로로피리미딘-4-일)카르바메이트 (실시예 432에 기재된 바와 같이 제조됨) (0.05 g, 0.267 mmol), (S)-tert-부틸 (2,4-디메틸-1-(2-메틸-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)펜탄-2-일)카르바메이트 (실시예 367, 파트 A에 기재된 바와 같이 제조됨) (0.085 g, 0.190 mmol), PdCl2(dppf)-CH2Cl2 부가물 (0.016 g, 0.019 mmol) 및 Cs2CO3 (0.186 g, 0.571 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시키고, 염수로 희석하고, 에틸 아세테이트 (15 mL)로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 Boc-(S)-메틸 (6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리미딘-4-일)카르바메이트 (0.08 g, 0.113 mmol, 60% 수율)를 황색빛 반고체로서 수득하였다. LCMS (ES-API) m/e 471.2 [(M-H)-, 계산치 C25H35N4O5 471.3]; LC/MS 체류시간 (방법 D): tR = 2.59분.
파트 B. (S)-메틸 (6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리미딘-4-일)카르바메이트
MeOH (2 mL) 중 Boc-(S)-메틸 (6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리미딘-4-일)카르바메이트 (0.1 g, 0.142 mmol)의 용액을 0℃로 냉각시키고, 1,4-디옥산 중 4N HCl (0.35 mL, 1.42 mmol)을 첨가하고, 혼합물을 3시간 동안 교반하였다. 반응 혼합물을 포화 수성 중탄산나트륨 (20 mL)으로 희석하고, 에틸 아세테이트 (30 mL)로 추출하였다. 유기 층을 분리하고, 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 정제용 HPLC (방법 A)에 의해 정제하여 (S)-메틸 (6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리미딘-4-일)카르바메이트 (0.01 g, 0.026 mmol, 18% 수율)를 황색 고체로서 수득하였다. LCMS (ESI) m/e 373.2 [(M+H)+, 계산치 C20H29N4O3 373.2]; LCMS 체류시간 (방법 F): tR = 1.36분; LCMS 체류시간 (방법 G): tR = 1.18분. 1H NMR (400 MHz, 메탄올-d4): δ 8.75 (d, J=1.51 Hz, 1H), 8.35 (d, J=1.00 Hz, 1H), 7.91 (s, 2H), 7.08 (d, J=8.03 Hz, 1H), 3.98 (d, J=6.02 Hz, 2H), 3.85 (s, 3H), 2.39 (s, 3H), 1.81 - 1.88 (m, 1H), 1.54 - 1.76 (m, 2H), 1.37 (s, 3H), 1.03 (m, 6H) ppm.
실시예 434
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리미딘-2-일)카르바메이트
파트 A. Boc-(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리미딘-2-일)카르바메이트
1,4-디옥산 (2 mL) 중 메틸 (4-클로로피리미딘-2-일)카르바메이트 (실시예 304에 기재된 바와 같이 제조됨) (0.05 g, 0.267 mmol), (S)-tert-부틸 (2,4-디메틸-1-(2-메틸-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)펜탄-2-일)카르바메이트 (실시예 367, 파트 A에 기재된 바와 같이 제조됨) (0.119 g, 0.267 mmol), PdCl2(dppf)-CH2Cl2 부가물 (0.022 g, 0.027 mmol) 및 Cs2CO3 (0.261 g, 0.800 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시키고, 염수로 희석하고, 에틸 아세테이트 (20 mL)로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 Boc-(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리미딘-2-일)카르바메이트 (0.13 g, 0.203 mmol, 76% 수율)를 연황색 반고체로서 수득하였다. LCMS (ESI) m/e 473.2 [(M+H)+, 계산치 C25H37N4O5 473.3]; LC/MS 체류시간 (방법 A1): tR = 2.53분.
파트 B. (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리미딘-2-일)카르바메이트
0℃로 냉각시킨 MeOH (2 mL) 중 Boc-(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리미딘-2-일)카르바메이트 (0.13 g, 0.275 mmol)의 교반 용액에 1,4-디옥산 중 4N HCl (0.688 mL, 2.75 mmol)을 첨가하고, 혼합물을 4시간 동안 교반하였다. 반응 혼합물을 포화 수성 중탄산나트륨 (20 mL)으로 희석하고, 에틸 아세테이트 (30 mL)로 추출하였다. 유기 층을 분리하고, 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 정제용 HPLC (방법 A)에 의해 정제하여 (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리미딘-2-일)카르바메이트 (0.035 g, 0.091 mmol, 33% 수율)를 황색 고체로서 수득하였다. LCMS (ESI) m/e 373.2 [(M+H)+, 계산치 C20H29N4O3 373.2]; LC/MS 체류시간 (방법 D): tR = 1.89분. LCMS 체류시간 (방법 G): tR = 1.61분. 1H NMR (400 MHz, 메탄올-d4): δ 8.53 (d, J = 5.20 Hz, 1H), 8.05-8.07 (m, 2H), 7.56 (d, J = 5.20 Hz, 1H), 7.05 (d, J = 9.20 Hz, 1H), 3.91-3.94 (m, 2H), 3.83 (s, 3H), 2.37 (s, 3H), 1.84-1.87 (m, 1H), 1.56-1.70 (m, 2H), 1.33 (s, 3H), 1.00-1.04 (m, 6H) ppm.
실시예 435
(S)-1-(2,5-디플루오로-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
파트 A. 4-클로로-6-메틸피리미딘
테트라히드로푸란 (30 mL) 중 4,6-디클로로피리미딘 (1.0 g, 6.71 mmol)의 용액에 1-메틸-2-피롤리디논 (3.2 mL, 6.71 mmol), 철(III) 아세틸아세토네이트 (0.119 g, 0.336 mmol) 및 메틸마그네슘 브로마이드 (2.237 mL, 6.71 mmol)를 첨가하였다. 반응 혼합물을 실온에서 3시간 동안 교반한 다음, 이것을 물로 켄칭하고, 에틸 아세테이트 (100 mL)로 추출하였다. 유기 층을 분리하고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (20% 에틸 아세테이트-헥산)에 의해 정제하여 4-클로로-6-메틸피리미딘 (0.6 g, 3.08 mmol, 46% 수율)을 무색 점착성 액체로서 수득하였다. LCMS (ESI) m/e 129.0 [(M+H)+, 계산치 C5H6ClN2 129.0]; LC/MS 체류시간 (방법 D): tR = 1.36분.
파트 B. (S)-tert-부틸 (1-(2,5-디플루오로-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (2 mL) 중 4-클로로-6-메틸피리미딘 (0.05 g, 0.233 mmol), (S)-tert-부틸 (1-(2,5-디플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.110 g, 0.233 mmol), PdCl2(dppf)-CH2Cl2 부가물 (0.019 g, 0.023 mmol) 및 Cs2CO3 (0.228 g, 0.700 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시키고, 염수로 희석하고, 에틸 아세테이트 (20 mL)로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 (S)-tert-부틸 (1-(2,5-디플루오로-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.03 g, 0.038 mmol, 16% 수율)를 황색빛 반고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 436.2 [(M+H) +, 계산치 C23H32F2N3O3 436.2]; LC/MS 체류시간 (방법 A1): tR = 2.91분.
파트 C. (S)-1-(2,5-디플루오로-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
MeOH (2 mL) 중 (S)-tert-부틸 (1-(2,5-디플루오로-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.03 g, 0.069 mmol)의 교반 용액에, 0℃에서 1,4-디옥산 중 4N HCl (0.172 mL, 0.689 mmol)을 첨가하고, 혼합물을 2시간 동안 교반하였다. 반응 혼합물을 포화 수성 중탄산나트륨 (20 mL)으로 희석하고, 에틸 아세테이트 (30 mL)로 추출하였다. 유기 층을 분리하고, 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 정제용 HPLC (방법 A)에 의해 정제하여 (S)-1-(2,5-디플루오로-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민 (0.007 g, 0.021 mmol, 30% 수율)을 황색 고체로서 수득하였다. LCMS (ESI) m/e 336.2 [(M+H)+, 계산치 C18H24F2N3O, 336.2]; LC/MS 체류시간 (방법 E): tR = 1.69분; LCMS 체류시간 (방법 F): tR = 2.09분. 1H NMR (400 MHz, 메탄올-d4): δ 9.08 (d, J=1.51 Hz, 1H) 8.02 (dd, J=12.30, 7.28 Hz, 1H), 7.85 (s, 1H), 7.19 (dd, J=12.80, 6.78 Hz, 1H), 4.04 - 4.19 (m, 2H), 2.61 (s, 3H), 1.86 (d, J=6.53 Hz, 1H), 1.73 (d, J=5.52 Hz, 1H), 1.63 (dd, J=14.06, 5.52 Hz, 1H), 1.41 (s, 3H), 1.04 (m, 6H) ppm.
실시예 436
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(6-메틸피리미딘-4-일)벤조니트릴
파트 A. (S)-tert-부틸 (1-(2-시아노-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (2 mL) 중 4-클로로-6-메틸피리미딘 (0.05 g, 0.233 mmol), (S)-tert-부틸 (1-(2-시아노-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.107 g, 0.233 mmol) (실시예 86, 파트 A 및 B에 기재된 바와 같이 제조됨), PdCl2(dppf)-CH2Cl2 부가물 (0.019 g, 0.023 mmol) 및 Cs2CO3 (0.228 g, 0.700 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시키고, 염수로 희석하고, 에틸 아세테이트 (20 mL)로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 (S)-tert-부틸 (1-(2-시아노-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.12 g, 0.136 mmol, 58% 수율)를 황색빛 반고체로서 수득하였다. LCMS (ESI) m/e 425.2 [(M+H) +, 계산치 C24H33N4O3 425.2]; LC/MS 체류시간 (방법 A1): tR = 2.23분.
파트 B. (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(6-메틸피리미딘-4-일)벤조니트릴
0℃에서 MeOH (2 mL) 중 (S)-tert-부틸 (1-(2-시아노-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.12 g, 0.136 mmol)의 교반 용액에 1,4-디옥산 중 4N HCl (0.339 mL, 1.357 mmol)을 첨가하고, 혼합물을 2시간 동안 교반하였다. 반응 혼합물을 포화 수성 중탄산나트륨 (20 mL)으로 희석하고, 에틸 아세테이트 (30 mL)로 추출하였다. 유기 층을 분리하고, 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 정제용 HPLC (방법 A)에 의해 정제하여 (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(6-메틸피리미딘-4-일)벤조니트릴 (0.015 g, 0.045 mmol, 33% 수율)을 황색 고체로서 수득하였다. LCMS (ESI) m/e 325.2 [(M+H)+, 계산치 C19H25N4O 325.2]; LC/MS 체류시간 (방법 E): tR = 1.60분; LCMS 체류시간 (방법 F): tR = 1.92분. 1H NMR (400 MHz, 메탄올-d4): δ 9.04 (m, 1H), 8.48-8.52 (m, 2H), 7.92 (s, 1H), 7.38 (d, J = 9.20 Hz, 1H), 4.15 (s, 2H), 2.60 (s, 3H), 1.81-1.89 (m, 1H), 1.73-1.78 (m, 1H), 1.63-1.65 (m, 1H), 1.60 (s, 3H), 1.00-1.04 (m, 6H) ppm.
실시예 437
(S)-메틸 (6-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-클로로피리딘-3-일)피리미딘-4-일)카르바메이트
파트 A. 메틸 (6-(5-클로로-6-플루오로피리딘-3-일)피리미딘-4-일)카르바메이트
1,4-디옥산 (3 mL) 중 5-클로로-6-플루오로피리딘-3-일보론산 (0.037 g, 0.213 mmol), 메틸 (6-클로로피리미딘-4-일)카르바메이트 (실시예 432에 기재된 바와 같이 제조됨) (0.04 g, 0.213 mmol), PdCl2(dppf)-CH2Cl2 부가물 (0.017 g, 0.021 mmol) 및 Cs2CO3 (0.208 g, 0.640 mmol)의 혼합물을 80℃에서 3시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시키고, 염수로 희석하고, 에틸 아세테이트 (20 mL)로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 메틸 (6-(5-클로로-6-플루오로피리딘-3-일)피리미딘-4-일)카르바메이트 (0.03 g, 0.035 mmol, 17% 수율)를 회백색 고체로서 수득하였다. LCMS (ESI) m/e 281.0 [(M-H)-, 계산치 C11H7ClFN4O2 281.0]; LC/MS 체류시간 (방법 D): tR = 2.11분.
파트 B. (S)-메틸 (6-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-클로로피리딘-3-일)피리미딘-4-일)카르바메이트
DMF (5 mL) 중 메틸 (6-(5-클로로-6-플루오로피리딘-3-일)피리미딘-4-일)카르바메이트 (0.03 g, 0.035 mmol), (S)-2-아미노-2,4-디메틸펜탄-1-올 (4.63 mg, 0.035 mmol) 및 NaH (1.411 mg, 0.035 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 규조토 (셀라이트®)를 통해 여과하였다. 층을 에틸 아세테이트 (20 mL)로 세척하였다. 여과물을 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (석유 에테르 중 5% 에틸 아세테이트)에 의해 정제하여 (S)-메틸 (6-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-클로로피리딘-3-일)피리미딘-4-일)카르바메이트 (0.005 g, 0.013 mmol, 36% 수율)를 황색 고체로서 수득하였다. LCMS (ESI) m/e 394.2 [(M+H)+, 계산치 C18H25ClN5O3 394.2]; LC/MS 체류시간 (방법 E): tR = 1.74분; LCMS 체류시간 (방법 F): tR = 2.09분. 1H NMR (400 MHz, 메탄올-d4): δ 8.83 (t, J=1.51 Hz, 2H) 8.54 (d, J=2.01 Hz, 1H), 8.40 (d, J=1.51 Hz, 1H), 4.61 (d, J=4.52 Hz, 2H), 3.85 (s, 3H), 1.90 (d, J=9.54 Hz, 2H), 1.72 (s, 1H), 1.54 (s, 3H), 1.07 (m, 6H) ppm.
실시예 438
(S)-메틸 (6-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메틸피리딘-3-일)피리미딘-4-일)카르바메이트
파트 A. 메틸 (6-(6-플루오로-5-메틸피리딘-3-일)피리미딘-4-일)카르바메이트
1,4-디옥산 (3 mL) 중 2-플루오로-3-메틸피리딘-5-보론산 (0.033 g, 0.213 mmol), 메틸 (6-클로로피리미딘-4-일)카르바메이트 (실시예 432에 기재된 바와 같이 제조됨) (0.04 g, 0.213 mmol), PdCl2(dppf)-CH2Cl2 부가물 (0.017 g, 0.021 mmol) 및 Cs2CO3 (0.208 g, 0.640 mmol)의 혼합물을 80℃에서 3시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 규조토 (셀라이트®)를 통해 여과하였다. 층을 에틸 아세테이트로 세척하고, 여과물을 감압 하에 농축시켜 메틸 (6-(6-플루오로-5-메틸피리딘-3-일)피리미딘-4-일)카르바메이트 (0.03 g, 0.059 mmol, 28% 수율)를 회백색 고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 263.2 [(M+H)+, 계산치 C12H12FN4O2 263.1]; LC/MS 체류시간 (방법 H): tR = 2.00분.
파트 B. (S)-메틸 (6-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메틸피리딘-3-일)피리미딘-4-일)카르바메이트
DMF (2 mL) 중 메틸 (6-(6-플루오로-5-메틸피리딘-3-일)피리미딘-4-일)카르바메이트 (0.03 g, 0.063 mmol), (S)-2-아미노-2,4-디메틸펜탄-1-올 (8.26 mg, 0.063 mmol) 및 NaH (2.52 mg, 0.063 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 규조토 (셀라이트®)를 통해 여과하였다. 층을 에틸 아세테이트 (20 mL)로 세척하였다. 여과물을 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (석유 에테르 중 5% 에틸 아세테이트)에 의해 정제하여 (S)-메틸 (6-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메틸피리딘-3-일)피리미딘-4-일)카르바메이트 (0.008 g, 0.020 mmol, 31% 수율)를 황색 고체로서 수득하였다. LCMS (ESI) m/e 374.2 [(M+H)+, 계산치 C19H28N5O3 374.2]; LC/MS 체류시간 (방법 E): tR = 1.71분; LCMS 체류시간 (방법 F): tR = 1.91분. 1H NMR (400 MHz, 메탄올-d4): δ 8.76 - 8.81 (m, 1H), 8.69 (d, J=3.01 Hz, 1H), 8.32 - 8.39 (m, 1H), 8.17 - 8.23 (m, 1H), 4.27 (s, 2H), 3.85 (s, 3H), 2.36 (s, 3H), 1.81 - 1.92 (m, 1H), 1.58 (dd, J=14.06, 5.52 Hz, 2H), 1.29 (s, 3H), 1.02 (m, 6H) ppm.
실시예 439
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(6-메톡시피리미딘-4-일)벤조니트릴
파트 A. (S)-tert-부틸 (1-(4-(6-클로로피리미딘-4-일)-2-시아노페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (2 mL) 중 4,6-디클로로피리미딘 (0.05 g, 0.336 mmol), (S)-tert-부틸 (1-(2-시아노-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 86, 파트 A 및 B에 기재된 바와 같이 제조됨) (0.154 g, 0.336 mmol), PdCl2(dppf)-CH2Cl2 부가물 (0.027 g, 0.034 mmol) 및 Cs2CO3 (0.328 g, 1.007 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 규조토 (셀라이트®)를 통해 여과하였다. 층을 에틸 아세테이트 (20 mL)로 세척하였다. 여과물을 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (석유 에테르 중 20% 에틸 아세테이트)에 의해 정제하여 (S)-tert-부틸 (1-(4-(6-클로로피리미딘-4-일)-2-시아노페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.15 g, 0.246 mmol, 73% 수율)를 황색빛 반고체로서 수득하였다. LCMS (ESI) m/e 389.2 [(M+H- tBu) +, 계산치 C23H30ClN4O3 445.2]; LC/MS 체류시간 (방법 A1): tR = 2.89분.
파트 B. (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(6-메톡시피리미딘-4-일)벤조니트릴
0℃에서 MeOH (2 mL) 중 (S)-tert-부틸 (1-(4-(6-클로로피리미딘-4-일)-2-시아노페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.05 g, 0.112 mmol)의 교반 용액에 1,4-디옥산 중 4N HCl (0.281 mL, 1.124 mmol)을 첨가하였다. 혼합물을 실온으로 가온하고, 2시간 동안 교반하였다. 반응 혼합물을 포화 수성 중탄산나트륨 (20 mL)으로 희석하고, 에틸 아세테이트 (30 mL)로 추출하였다. 유기 층을 분리하고, 무수 황산나트륨 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 정제용 HPLC (방법 A)에 의해 정제하여 (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(6-메톡시피리미딘-4-일)벤조니트릴 (0.006 g, 0.018 mmol, 16% 수율)을 황색 고체로서 수득하였다. LCMS (ESI) m/e 341.2 [(M+H)+, 계산치 C19H25N4O2 341.2]; LCMS 체류시간 (방법 F): tR = 2.16분. 1H NMR (300 MHz, 메탄올-d4): δ 8.79 (d, J=0.76 Hz, 1H), 8.36 - 8.45 (m, 2H), 7.30 - 7.37 (m, 2H), 4.05 (s, 5H), 1.77 - 1.93 (m, 1H), 1.62 (dd, J=11.90, 5.48 Hz, 2H), 1.32 (s, 3H), 1.02 (m, 6H) ppm.
실시예 440
(S)-1-(4-(6-메톡시피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
파트 A. (S)-tert-부틸 (1-(4-(6-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (2 mL) 중 4,6-디클로로피리미딘 (0.1 g, 0.671 mmol), (S)-tert-부틸(2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (실시예 215에 기재된 바와 같이 제조됨) (0.337 g, 0.671 mmol), PdCl2(dppf)-CH2Cl2 부가물 (0.055 g, 0.067 mmol) 및 Cs2CO3 (0.656 g, 2.014 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시키고, 염수로 희석하고, 에틸 아세테이트 (20 mL)로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 (S)-tert-부틸 (1-(4-(6-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.25 g, 0.458 mmol, 68% 수율)를 황색빛 반고체로서 수득하였다. LCMS (ESI) m/e 432.2 [(M+H-tBu) +, 계산치 C23H30ClF3N3O3 488.2]; LC/MS 체류시간 (방법 A1): tR = 3.15분.
파트 B. (S)-1-(4-(6-메톡시피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
0℃에서 MeOH (2 mL) 중 (S)-tert-부틸 (1-(4-(6-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.05 g, 0.102 mmol)의 교반 용액에 1,4-디옥산 중 4N HCl (0.256 mL, 1.025 mmol)을 첨가하고, 혼합물을 실온으로 가온하고, 2시간 동안 교반하였다. 반응 혼합물을 포화 수성 중탄산나트륨 (20 mL)으로 희석하고, 에틸 아세테이트 (30 mL)로 추출하였다. 유기 층을 분리하고, 무수 황산나트륨 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 정제용 HPLC (방법 A)에 의해 정제하여 (S)-1-(4-(6-메톡시피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (0.006 g, 0.015 mmol, 15% 수율)을 황색 고체로서 수득하였다. LCMS (ESI) m/e 384.2 [(M+H)+, 계산치 C19H25F3N3O2 384.2]; LCMS 체류시간 (방법 F): tR = 2.66분. 1H NMR (300 MHz, 메탄올-d4): δ 8.79 (d, J=0.76 Hz, 1H), 8.41 (d, J=1.89 Hz, 1H), 8.30 - 8.37 (m, 1H), 7.30 - 7.37 (m, 2H), 4.00 - 4.12 (m, 5H), 1.78 - 1.91 (m, 1H), 1.61 (dd, J=12.65, 5.48 Hz, 2H), 1.33 (s, 3H), 1.00 (m, 6H), ppm.
실시예 441
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(6-클로로피리미딘-4-일)벤조니트릴
0℃에서 DCM (2 mL) 중 (S)-tert-부틸 (1-(4-(6-클로로피리미딘-4-일)-2-시아노페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 439에 기재된 바와 같이 제조됨) (0.05 g, 0.112 mmol)의 교반 용액에 TFA (0.087 mL, 1.124 mmol)를 첨가하고, 혼합물을 실온으로 가온하고, 2시간 동안 교반하였다. 반응 혼합물을 포화 수성 중탄산나트륨 (20 mL)으로 희석하고, 에틸 아세테이트 (30 mL)로 추출하였다. 유기 층을 분리하고, 무수 황산나트륨 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 정제용 HPLC (방법 A)에 의해 정제하여 (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(6-클로로피리미딘-4-일)벤조니트릴 (0.006 g, 0.017 mmol, 15% 수율)을 황색 고체로서 수득하였다. LCMS (ESI) m/e 345.2 [(M+H)+, 계산치 C18H22ClN4O 345.1]; LC/MS 체류시간 (방법 E): tR = 1.82분; LCMS 체류시간 (방법 F): tR = 2.31분. 1H NMR (400 MHz, 메탄올-d4): δ 9.00 (d, J=1.00 Hz, 1H), 8.56 (d, J=2.01 Hz, 1H), 8.49 - 8.53 (m, 1H), 8.13 (d, J=1.00 Hz, 1H), 7.37 (d, J=9.04 Hz, 1H), 4.06 (d, J=1.51 Hz, 2H), 1.86 (s, 1H), 1.54 - 1.70 (m, 2H), 1.31 (s, 3H), 1.02 (m, 6H), ppm.
실시예 442
(S)-1-(4-(6-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
0℃에서 DCM (2 mL) 중 (S)-tert-부틸 (1-(4-(6-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 440에 기재된 바와 같이 제조됨) (0.05 g, 0.102 mmol)의 교반 용액에 TFA (0.079 mL, 1.025 mmol)를 첨가하고, 혼합물을 실온으로 가온하고, 2시간 동안 교반하였다. 반응 혼합물을 포화 수성 중탄산나트륨 (20 mL)으로 희석하고, 에틸 아세테이트 (30 mL)로 추출하였다. 유기 층을 분리하고, 무수 황산나트륨 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 정제용 HPLC (방법 A)에 의해 정제하여 (S)-1-(4-(6-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (0.03 g, 0.077 mmol, 75% 수율)을 황색 고체로서 수득하였다. LCMS (ESI) m/e 388.2 [(M+H)+, 계산치 C18H22ClF3N3O 388.1]; LC/MS 체류시간 (방법 E): tR = 2.08분; LCMS 체류시간 (방법 F): tR = 2.83분. 1H NMR (400 MHz, 메탄올-d4): δ 9.00 (d, J=1.00 Hz, 1H), 8.53 (d, J=2.01 Hz, 1H), 8.45 (dd, J=8.78, 2.26 Hz, 1H), 8.14 (d, J=1.00 Hz, 1H), 7.36 (d, J=9.04 Hz, 1H), 3.97 - 4.06 (m, 2H), 1.84 (s, 1H), 1.57 (dd, J=10.54, 5.52 Hz, 2H), 1.28 (s, 3H), 0.96 - 1.04 (m, 6H) ppm.
실시예 443
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(6-에틸피리미딘-4-일)벤조니트릴
파트 A. (S)-tert-부틸 (1-(2-시아노-4-(6-에틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (5 mL) 중 (S)-tert-부틸 (1-(4-(6-클로로피리미딘-4-일)-2-시아노페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 439에 기재된 바와 같이 제조됨) (0.1 g, 0.225 mmol), 에틸보론산 (0.025 g, 0.337 mmol), PdCl2(dppf)-CH2Cl2 부가물 (9.18 mg, 0.011 mmol) 및 Cs2CO3 (0.220 g, 0.674 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시킨 다음, 층을 에틸 아세테이트 (100 mL)로 세척하면서 규조토 (셀라이트®)를 통해 여과하였다. 여과물을 감압 하에 농축시키고, 잔류물을 실리카 겔 크로마토그래피 (헥산 중 20% 에틸 아세테이트)에 의해 정제하여 (S)-tert-부틸 (1-(2-시아노-4-(6-에틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.11 g, 0.029 mmol, 13% 수율)를 황색빛 반고체로서 수득하였다. LCMS (ESI) m/e 439.2 [(M+H) +, 계산치 C25H35N4O3 439.2]; LC/MS 체류시간 (방법 A1): tR = 2.37분.
파트 B. (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(6-에틸피리미딘-4-일)벤조니트릴
0℃에서 DCM (2 mL) 중 (S)-tert-부틸 (1-(2-시아노-4-(6-에틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.1 g, 0.228 mmol)의 교반 용액에 TFA (0.176 mL, 2.280 mmol)를 첨가하고, 혼합물을 실온으로 가온하고, 2시간 동안 교반하였다. 반응 혼합물을 포화 수성 중탄산나트륨 (20 mL)으로 희석하고, 에틸 아세테이트 (30 mL)로 추출하였다. 유기 층을 분리하고, 무수 황산나트륨 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(6-에틸피리미딘-4-일)벤조니트릴 (0.005 g, 0.014 mmol, 6% 수율)을 황색 고체로서 수득하였다. LCMS (ESI) m/e 339.2 [(M+H)+, 계산치 C20H27N4O 339.2]; LC/MS 체류시간 (방법 E): tR = 1.77분. 1H NMR (400 MHz, CD3OD): δ 9.06-9.07 (m, 1H), 8.49-8.55 (m, 2H), 7.91 (d, J = 1.60 Hz, 1H), 7.39 (d, J = 8.80 Hz, 1H), 4.19-4.29 (m, 2H), 2.87 (q, J = 23.20 Hz, 2H), 1.00-1.04 (m, 6H), 1.38-1.43 (m, 6H), 1.62-1.67 (m, 1H), 1.77-1.88 (m, 2H), ppm.
실시예 444
(S)-1-(4-(6-에틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
파트 A. (S)-tert-부틸 (1-(4-(6-에틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (5 mL) 중 (S)-tert-부틸 (1-(4-(6-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 440에 기재된 바와 같이 제조됨) (0.1 g, 0.232 mmol), 에틸보론산 (0.026 g, 0.347 mmol), PdCl2(dppf)-CH2Cl2 부가물 (9.46 mg, 0.012 mmol) 및 Cs2CO3 (0.226 g, 0.695 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시킨 다음, 층을 에틸 아세테이트 (100 mL)로 세척하면서 규조토 (셀라이트®)를 통해 여과하였다. 여과물을 감압 하에 농축시키고, 잔류물을 실리카 겔 크로마토그래피 (헥산 중 20% 에틸 아세테이트)에 의해 정제하여 (S)-tert-부틸 (1-(4-(6-에틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.12 g, 0.075 mmol, 32% 수율)를 황색 반고체로서 수득하였다. LCMS (ESI) m/e 482.2 [(M+H)+, 계산치 C25H35F3N3O3 482.2]; LC/MS 체류시간 (방법 A1): tR = 2.78분.
파트 B. (S)-1-(4-(6-에틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
0℃에서 DCM (2 mL) 중 (S)-tert-부틸 (1-(4-(6-에틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.1 g, 0.208 mmol)의 교반 용액에 TFA (0.160 mL, 2.077 mmol)를 첨가하고, 혼합물을 실온으로 가온하고, 2시간 동안 교반하였다. 반응 혼합물을 포화 수성 중탄산나트륨 (20 mL)으로 희석하고, 에틸 아세테이트 (30 mL)로 추출하였다. 유기 층을 분리하고, 무수 황산나트륨 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-1-(4-(6-에틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민 (0.005 g, 0.013 mmol, 6% 수율)을 황색 고체로서 수득하였다. LCMS (ESI) m/e 382.2 [(M+H)+, 계산치 C20H27F3N3O 382.2]; LC/MS 체류시간 (방법 E): tR = 2.22분; LCMS 체류시간 (방법 F): tR = 2.78분. 1H NMR (400 MHz, CD3OD): δ 9.06 (d, J = 1.20 Hz, 1H), 8.43-8.50 (m, 2H), 7.91 (d, J = 1.20 Hz, 1H), 7.39 (d, J = 8.80 Hz, 1H), 4.13-4.18 (m, 2H), 2.85-2.91 (m, 2H), 1.82-1.87 (m, 1H), 1.74-1.79 (m, 1H), 1.62-1.67 (m, 1H), 1.29-1.43 (m, 6H), 0.98-1.05 (m, 6H) ppm.
실시예 445
(S)-1-((3-클로로-5-(6-메틸피리미딘-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A. 4-(5-클로로-6-플루오로피리딘-3-일)-6-메틸피리미딘
1,4-디옥산 (3 mL) 중 (5-클로로-6-플루오로피리딘-3-일)보론산 (0.055 g, 0.311 mmol), 4-클로로-6-메틸피리미딘 (0.04 g, 0.311 mmol), PdCl2(dppf)-CH2Cl2 부가물 (0.025 g, 0.031 mmol) 및 Cs2CO3 (0.304 g, 0.933 mmol)의 혼합물을 80℃에서 3시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시킨 다음, 층을 에틸 아세테이트 (100 mL)로 세척하면서 규조토 (셀라이트®)를 통해 여과하였다. 여과물을 감압 하에 농축시켜 4-(5-클로로-6-플루오로피리딘-3-일)-6-메틸피리미딘 (0.035 g, 0.090 mmol, 29% 수율)을 갈색 고체로서 수득하였다. LCMS (ESI) m/e 224.5 [(M+H) +, 계산치 C10H8ClFN3 224.0]; LC/MS 체류시간 (방법 B): tR = 0.86분.
파트 B. (S)-1-((3-클로로-5-(6-메틸피리미딘-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
테트라히드로푸란 (5 mL) 중 4-(5-클로로-6-플루오로피리딘-3-일)-6-메틸피리미딘 (0.035 g, 0.157 mmol), (S)-2-아미노-2,4-디메틸펜탄-1-올 (0.021 g, 0.157 mmol) 및 KOtBu (0.470 mL 0.470 mmol)의 혼합물을 실온에서 밤새 교반하였다. 반응 혼합물을 실온으로 냉각시킨 다음, 층을 에틸 아세테이트 (100 mL)로 세척하면서 규조토 (셀라이트®)를 통해 여과하였다. 여과물을 감압 하에 농축시켜 (S)-1-((3-클로로-5-(6-메틸피리미딘-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (0.008 g, 0.024 mmol, 15% 수율)을 황색 고체로서 수득하였다. LCMS (ESI) m/e 335.2 [(M+H)+, 계산치 C17H24ClN4O 335.2]; LC/MS 체류시간 (방법 E): tR = 1.88분; LCMS 체류시간 (방법 F): tR = 2.32분. 1H NMR (400 MHz, CD3OD): δ 9.07 (d, J = 1.20 Hz, 1H), 8.93 (d, J = 2.00 Hz, 1H), 8.64 (d, J = 2.40 Hz, 1H), 7.95 (d, J = 0.40 Hz, 1H), 4.60-4.64 (m, 2H), 2.62 (s, 3H), 1.88-1.93 (m, 2H), 1.69-1.75 (m, 1H), 1.54 (s, 3H), 1.08-1.07 (m, 6H) ppm.
실시예 446
(S)-2,4-디메틸-1-((3-메틸-5-(6-메틸피리미딘-4-일)피리딘-2-일)옥시)펜탄-2-아민
파트 A. 4-(6-플루오로-5-메틸피리딘-3-일)-6-메틸피리미딘
1,4-디옥산 (3 mL) 중 2-플루오로-3-메틸피리딘-5-보론산 (0.048 g, 0.311 mmol)의 용액에, 4-클로로-6-메틸피리미딘 (0.04 g, 0.311 mmol), PdCl2(dppf)-CH2Cl2 부가물 (0.025 g, 0.031 mmol) 및 Cs2CO3 (0.304 g, 0.933 mmol)을 첨가하였다. 반응 혼합물을 80℃에서 3시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시킨 다음, 층을 에틸 아세테이트 (100 mL)로 세척하면서 규조토 (셀라이트®)를 통해 여과하였다. 여과물을 감압 하에 농축시켜 4-(6-플루오로-5-메틸피리딘-3-일)-6-메틸피리미딘 (0.04 g, 0.160 mmol, 52% 수율)을 갈색 고체로서 수득하였다. LCMS (ESI) m/e 204.2 [(M+H) +, 계산치 C11H11FN3 204.1]; LC/MS 체류시간 (방법 A1): tR = 2.30분.
파트 B. (S)-2,4-디메틸-1-((3-메틸-5-(6-메틸피리미딘-4-일)피리딘-2-일)옥시)펜탄-2-아민
테트라히드로푸란 (5 mL) 중 4-(6-플루오로-5-메틸피리딘-3-일)-6-메틸피리미딘 (0.04 g, 0.197 mmol), KOtBu (0.591 mL, 0.591 mmol) 및 (S)-2-아미노-2,4-디메틸펜탄-1-올 (0.026 g, 0.197 mmol)의 혼합물을 실온에서 밤새 교반하였다. 반응 혼합물을 실온으로 냉각시킨 다음, 층을 에틸 아세테이트 (20 mL)로 세척하면서 규조토 (셀라이트®)를 통해 여과하였다. 여과물을 감압 하에 농축시키고, 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-2,4-디메틸-1-((3-메틸-5-(6-메틸피리미딘-4-일)피리딘-2-일)옥시)펜탄-2-아민 (0.049 g, 0.152 mmol, 77% 수율)을 황색 고체로서 수득하였다. LCMS (ESI) m/e 315.2 [(M+H)+, 계산치 C18H27N4O 315.2]; LC/MS 체류시간 (방법 E): tR = 1.81분; LCMS 체류시간 (방법 F): tR = 1.87분. 1H NMR (400 MHz, CD3OD): δ 9.03 (d, J = 1.20 Hz, 1H), 8.81-8.82 (m, 1H), 8.33-8.33 (m, 1H), 7.90 (d, J = 0.80 Hz, 1H), 4.46 (s, 2H), 2.61 (s, 3H), 2.29 (s, 3H), 1.88-1.93 (m, 1H), 1.77-1.82 (m, 1H), 1.63-1.68 (m, 1H), 1.45 (s, 3H), 1.03-1.08 (m, 6H) ppm.
실시예 447
(S)-1-((5-(6-에틸피리미딘-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A. 4-(6-플루오로-5-메틸피리딘-3-일)-6-비닐피리미딘
1,4-디옥산 (2 mL) 중 4-클로로-6-비닐피리미딘 (실시예 315, 파트 B에 기재된 절차를 사용하여 4,6-디클로로피리미딘으로부터 제조됨) (0.03 g, 0.213 mmol), 2-플루오로-3-메틸-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘 (0.051 g, 0.213 mmol), 및 PdCl2(dppf)-CH2Cl2 부가물 (0.017 g, 0.021 mmol) 및 Cs2CO3 (0.209 g, 0.640 mmol)의 혼합물을 80℃에서 밤새 가열하였다. 반응 혼합물을 실온으로 냉각시킨 다음, 층을 에틸 아세테이트 (100 mL)로 세척하면서 규조토 (셀라이트®)를 통해 여과하였다. 여과물을 감압 하에 농축시키고, 잔류물을 실리카 겔 크로마토그래피 (헥산 중 20% 에틸 아세테이트)에 의해 정제하여 4-(6-플루오로-5-메틸피리딘-3-일)-6-비닐피리미딘 (0.05 g, 0.151 mmol, 71% 수율)을 황색빛 반고체로서 수득하였다. LCMS (ESI) m/e 216.2 [(M+H)+, 계산치 C12H11FN3 216.1]; LC/MS 체류시간 (방법 A1): tR = 2.38분.
파트 B. 4-에틸-6-(6-플루오로-5-메틸피리딘-3-일)피리미딘
테트라히드로푸란 (5 mL) 중 4-(6-플루오로-5-메틸피리딘-3-일)-6-비닐피리미딘 (0.05 g, 0.232 mmol)의 용액에 탄소 상 팔라듐 (0.025 g, 0.023 mmol)을 첨가하고, 1 atm의 수소 기체 하에 실온에서 밤새 교반하였다. 반응 혼합물을 실온으로 냉각시킨 다음, 층을 에틸 아세테이트 (10 mL)로 세척하면서 규조토 (셀라이트®)를 통해 여과하였다. 여과물을 감압 하에 농축시켜 4-에틸-6-(6-플루오로-5-메틸피리딘-3-일)피리미딘 (0.04 g, 0.121 mmol, 52% 수율)을 황색빛 반고체로서 수득하였다. LCMS (ESI) m/e 218.2 [(M+H) +, 계산치 C12H13FN3 218.1]; LC/MS 체류시간 (방법 D): tR = 1.83분.
파트 C. (S)-1-((5-(6-에틸피리미딘-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민
테트라히드로푸란 (3 mL) 중 4-에틸-6-(6-플루오로-5-메틸피리딘-3-일)피리미딘 (0.04 g, 0.184 mmol), (S)-2-아미노-2,4-디메틸펜탄-1-올 (0.024 g, 0.184 mmol), 및 KOtBu (0.552 mL, 0.552 mmol)의 혼합물을 실온에서 밤새 교반하였다. 반응 혼합물을 실온으로 냉각시킨 다음, 층을 에틸 아세테이트 (20 mL)로 세척하면서 규조토 (셀라이트®)를 통해 여과하였다. 여과물을 감압 하에 농축시키고, 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-1-((5-(6-에틸피리미딘-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민 (0.008 g, 0.022 mmol, 12% 수율)을 황색 고체로서 수득하였다. LCMS (ESI) m/e 329.3 [(M+H)+, 계산치 C19H29N4O 329.2]; LC/MS 체류시간 (방법 E): tR = 1.11분; LCMS 체류시간 (방법 F): tR = 1.38분. 1H NMR (400 MHz, CD3OD): δ 9.05 (d, J = 1.20 Hz, 1H), 8.81-8.82 (m, 1H), 8.33-8.34 (m, 1H), 7.88 (d, J = 1.20 Hz, 1H), 4.53 (s, 2H), 2.87 (q, J = 22.80 Hz, 2H), 2.39 (s, 3H), 1.84-1.91 (m, 2H), 1.67-1.72 (m, 1H), 1.51 (s, 3H), 1.37 (s, 3H), 0.99-1.08 (m, 6H) ppm.
실시예 450
(S)-2,4-디메틸-1-((4-메틸-6-(6-메틸피리미딘-4-일)피리딘-3-일)옥시)펜탄-2-아민
파트 A. (S)-tert-부틸 (2,4-디메틸-1-((4-메틸-6-(6-메틸피리미딘-4-일)피리딘-3-일)옥시)펜탄-2-일)카르바메이트
1,4-디옥산 (3 mL) 중 4-클로로-6-메틸피리미딘 (0.1 g, 0.778 mmol), (S)-tert-부틸 (1-((6-클로로-4-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 226에 기재된 것과 유사한 방식으로 제조됨) (0.278 g, 0.778 mmol) 및 헥사메틸이주석 (0.242 mL, 1.167 mmol)을 질소로 10분 동안 플러싱하였다. Pd(Ph3P)4 4 (0.090 g, 0.078 mmol)를 첨가하고, 반응 혼합물을 질소로 5분 동안 플러싱하였다. 반응 혼합물을 마이크로웨이브에서 150℃에서 90분 동안 가열하였다. 이어서, 반응 혼합물을 규조토 (셀라이트®)를 통해 여과하고, 층을 에틸 아세테이트 (100 mL)로 세척하였다. 여과물을 감압 하에 농축시키고, 조 생성물을 실리카 겔 크로마토그래피 (헥산 중 20% 에틸 아세테이트)에 의해 정제하여 (S)-tert-부틸 (2,4-디메틸-1-((4-메틸-6-(6-메틸피리미딘-4-일)피리딘-3-일)옥시)펜탄-2-일)카르바메이트 (0.1 g, 0.190 mmol, 25% 수율)를 수득하였다. LCMS (ESI) m/e 415.2 [(M+H)+, 계산치 C23H35N4O3 415.2]; LC/MS 체류시간 (방법 G): tR = 3.83분.
파트 B. (S)-2,4-디메틸-1-((4-메틸-6-(6-메틸피리미딘-4-일)피리딘-3-일)옥시)펜탄-2-아민
메탄올 (2 mL) 중 (S)-tert-부틸 (2,4-디메틸-1-((4-메틸-6-(6-메틸피리미딘-4-일)피리딘-3-일)옥시)펜탄-2-일)카르바메이트 (0.08 g, 0.193 mmol)의 용액을 0℃로 냉각시키고, 1,4-디옥산 중 4M HCl (0.482 mL, 1.930 mmol)을 첨가하고, 혼합물을 실온에서 1시간 동안 교반하였다. 반응 혼합물을 포화 중탄산나트륨 용액 (20 mL)으로 희석하고, 에틸 아세테이트 (30 mL)로 추출하였다. 유기 층을 무수 Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 C)에 의해 정제하여 (S)-2,4-디메틸-1-((4-메틸-6-(6-메틸피리미딘-4-일)피리딘-3-일)옥시)펜탄-2-아민 (0.039 g, 0.120 mmol, 62% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 315.3 [(M+H)+, 계산치 C18H27N4O 315. 2]; LC/MS 체류시간 (방법 H): tR = 1.21분; LC/MS 체류시간 (방법 I): tR = 0.92분. 1H NMR(400 MHz, 메탄올-d4): δ 9.05 (d, J=1.00 Hz, 1 H), 8.39 (s, 1 H), 8.35 (s, 1 H), 8.23 (s, 1 H), 4.25 (d, J=10.54 Hz, 2 H), 2.62 (s, 3 H), 2.45 (s, 3 H), 1.81 - 1.91 (m, 2 H), 1.64 - 1.76 (m, 1 H), 1.49 (s, 3 H), 1.05 (m, 6 H) ppm.
실시예 451
(S)-1-((6-(2-클로로피리미딘-4-일)-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
파트 A. (S)-tert-부틸 (1-((6-(2-클로로피리미딘-4-일)-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (3 mL) 중 2,4-디클로로피리미딘 (0.1 g, 0.671 mmol), (S)-tert-부틸 (1-((6-아이오도-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (343에 대해서 기재된 것과 유사한 방식으로 제조됨) (0.301 g, 0.671 mmol) 및 헥사메틸이주석 (0.139 mL, 0.671 mmol)의 용액을 질소로 10분 동안 플러싱하였다. Pd(Ph3P)4 (0.039 g, 0.034 mmol)를 첨가하고, 반응 혼합물을 질소로 5분 동안 플러싱하였다. 반응 혼합물을 마이크로웨이브에서 150℃에서 90분 동안 가열하였다. 이어서, 반응 혼합물을 규조토 (셀라이트®)를 통해 여과하고, 층을 에틸 아세테이트 (100 mL)로 세척하였다. 여과물을 감압 하에 농축시키고, 조 생성물을 실리카 겔 크로마토그래피 (헥산 중 20% 에틸 아세테이트)에 의해 정제하여 (S)-tert-부틸 (1-((6-(2-클로로피리미딘-4-일)-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.02 g, 0.043 mmol, 7% 수율)를 수득하였다. LCMS (ESI) m/e 435.2 [(M+H)+, 계산치 C22H32ClN4O3 435.2]; LC/MS 체류시간 (방법 G): tR = 4.07분.
파트 B. (S)-1-((6-(2-클로로피리미딘-4-일)-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민
DCM (5 mL) 중 (S)-tert-부틸 (1-((6-(2-클로로피리미딘-4-일)-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.02 g, 0.046 mmol)의 용액을 0℃로 냉각시키고, TFA (3.54 μl, 0.046 mmol)를 첨가하였다. 반응 혼합물을 실온에서 4시간 동안 교반한 다음, 혼합물을 포화 중탄산나트륨 용액 (20 mL)으로 희석하고, 에틸 아세테이트 (30 mL)로 추출하였다. 유기 층을 무수 Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-1-((6-(2-클로로피리미딘-4-일)-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민 (0.008 g, 0.022 mmol, 49% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 335.3 [(M+H)+, 계산치 C17H24ClN4O, 335.2]; LC/MS 체류시간 (방법 H): tR = 1.53분; LC/MS 체류시간 (방법 I): tR = 1.19분. 1H NMR (400 MHz, 메탄올-d4): δ 8.71 - 8.77 (m, 1 H), 8.31 - 8.40 (m, 2 H), 7.49 - 7.60 (m, 1 H), 4.14 - 4.30 (m, 2 H), 2.64 (br. s., 3 H), 1.82 - 1.97 (m, 2 H), 1.69 - 1.81 (m, 1 H), 1.55 (s, 3 H), 1.00 - 1.15 (m, 6 H) ppm.
실시예 454
(S)-2,4-디메틸-1-((6-(2-메틸피리미딘-4-일)-2-(트리플루오로메틸)피리딘-3-일)옥시)펜탄-2-아민
파트 A. 6-브로모-2-(트리플루오로메틸)피리딘-3-올
0℃에서 DMF (5 mL) 중 2-(트리플루오로메틸)피리딘-3-올 (1.0 g, 6.13 mmol)의 용액에 NBS (1.091 g, 6.13 mmol)를 첨가하고, 혼합물을 실온으로 가온하고, 밤새 교반하였다. 반응 혼합물을 물 (50 mL)로 희석한 후, 디클로로메탄 (80 mL)으로 추출하였다. 유기 층을 염수로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 조 생성물을 실리카 겔 크로마토그래피 (석유 에테르 중 12% 에틸 아세테이트)에 의해 정제하여 6-브로모-2-(트리플루오로메틸)피리딘-3-올 (0.5 g, 1.984 mmol, 32% 수율)을 수득하였다. LCMS (ESI) m/e 241.8 [(M+H)+, 계산치 C6H4BrF3NO, 241.9]; LC/MS 체류시간 (방법 NA): tR = 1.99분.
파트 B. 6-(2-메틸피리미딘-4-일)-2-(트리플루오로메틸)피리딘-3-올
1,4-디옥산 (3 mL) 중 4-클로로-2-메틸피리미딘 (0.1 g, 0.778 mmol), 6-브로모-2-(트리플루오로메틸)피리딘-3-올 (0.207 g, 0.856 mmol), 및 헥사메틸이주석 (0.242 mL, 1.167 mmol)의 용액을 질소로 플러싱하였다. Pd(Ph3P)4 (0.045 g, 0.039 mmol)를 첨가하고, 혼합물을 질소로 추가로 5분 동안 플러싱하였다. 반응 혼합물을 마이크로웨이브에서 150℃에서 90분 동안 가열하였다. 이어서, 반응 혼합물을 에틸 아세테이트 (100 mL)로 세척하면서 규조토 (셀라이트®) 층을 통해 여과하였다. 여과물을 감압 하에 농축시키고, 조 생성물을 실리카 겔 크로마토그래피 (석유 에테르 중 20% 에틸 아세테이트)에 의해 정제하여 6-(2-메틸피리미딘-4-일)-2-(트리플루오로메틸)피리딘-3-올 (0.06 g, 0.207 mmol, 27% 수율)을 수득하였다. LCMS (ESI) m/e 256.0 [(M+H) +, 계산치 C11H9F3N3O 256.1 ]; LC/MS 체류시간 (방법 B): tR = 2.50분.
파트 C. (S)-tert-부틸 (2,4-디메틸-1-((6-(2-메틸피리미딘-4-일)-2-(트리플루오로메틸)피리딘-3-일)옥시)펜탄-2-일)카르바메이트
DMF (3 mL) 중 6-(2-메틸피리미딘-4-일)-2-(트리플루오로메틸)피리딘-3-올 (0.09 g, 0.166 mmol)의 용액에 NaH (0.020 g, 0.497 mmol) 및 (S)-tert-부틸 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (실시예 32, 파트 A-E에 기재된 바와 같이 제조됨) (0.049 g, 0.166 mmol)를 첨가하였다. 갈색 용액을 80℃에서 밤새 교반하였다. 반응 혼합물을 실온으로 냉각시키고, 규조토 (셀라이트®)를 통해 여과하였다. 층을 에틸 아세테이트 (20 mL)로 세척하고, 여과물을 감압 하에 농축시켰다. 조 생성물을 실리카 겔 칼럼 크로마토그래피 (석유 에테르 중 15% 에틸 아세테이트)에 의해 정제하여 (S)-tert-부틸 (2,4-디메틸-1-((6-(2-메틸피리미딘-4-일)-2-(트리플루오로메틸)피리딘-3-일)옥시)펜탄-2-일)카르바메이트 (0.1 g, 0.092 mmol, 55% 수율)를 수득하였다. LCMS (ESI) m/e 469.2 [(M+H)+, 계산치 C23H32F3N4O3, 469.2]; LC/MS 체류시간 (방법 G): tR = 1.35분.
파트 D. (S)-2,4-디메틸-1-((6-(2-메틸피리미딘-4-일)-2-(트리플루오로메틸)피리딘-3-일)옥시)펜탄-2-아민
0℃로 냉각시킨 DCM (5 mL) 중 (S)-tert-부틸 (2,4-디메틸-1-((6-(2-메틸피리미딘-4-일)-2-(트리플루오로메틸)피리딘-3-일)옥시)펜탄-2-일)카르바메이트 (0.1 g, 0.092 mmol)의 용액에 TFA (7.07 μl, 0.092 mmol)를 첨가하고, 반응 혼합물을 실온에서 1시간 동안 교반하였다. 반응 혼합물을 포화 중탄산나트륨 (20 mL)으로 희석하고, 에틸 아세테이트(30 mL)로 추출하였다. 에틸 아세테이트 층을 무수 Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-2,4-디메틸-1-((6-(2-메틸피리미딘-4-일)-2-(트리플루오로메틸)피리딘-3-일)옥시)펜탄-2-아민 (0.005 g, 0.013 mmol, 14% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 369.3 [(M+H)+, 계산치 C18H24F3N4O 369.2]; LC/MS 체류시간 (방법 H): tR = 1.76분; LC/MS 체류시간 (방법 I): tR = 1.16분. 1H NMR(400 MHz, 메탄올-d4): δ 8.75 - 8.82 (m, 2 H), 8.20 (d, J=5.02 Hz, 1 H), 7.88 (d, J=9.04 Hz, 1 H), 4.12 (d, J=4.02 Hz, 2 H), 2.78 (s, 3 H), 1.86 (s, 1 H), 1.63 (dd, J=16.06, 5.52 Hz, 2 H), 1.35 (s, 3 H), 1.02 (m, 6 H) ppm.
실시예 458
(S)-2-(2-아미노-2,4-디메틸펜틸옥시)-5-(2-메틸피리미딘-4-일) 벤조니트릴
파트 A: (S)-tert-부틸 (1-(2-시아노-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (10 mL) 중 4-클로로-2-메틸피리미딘 (0.05 g, 0.389 mmol), (S)-tert-부틸 (1-(2-시아노-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 86, 파트 A 및 B에 기재된 바와 같이 제조됨) (0.178 g, 0.389 mmol), 삼염기성 인산칼륨 (0.083 g, 0.389 mmol), 및 KBr (0.046 g, 0.389 mmol)의 용액을 질소 기체로 10분 동안 퍼징하였다. PdCl2 (dppf)-CH2Cl2 부가물 (0.032 g, 0.039 mmol)을 반응 혼합물에 첨가하고, 용액을 질소 기체로 다시 10분 동안 퍼징하였다. 반응 혼합물을 80℃에서 12시간 동안 가열하였다. 반응 혼합물을 감압 하에 농축시킨 다음, 에틸 아세테이트 (20 mL) 및 물 (20 mL) 중에 용해시켰다. 2상 혼합물을 규조토 (셀라이트®)를 통해 여과하였다. 층을 에틸 아세테이트 (25 mL)로 세척하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 (S)-tert-부틸 (1-(2-시아노-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.07 g, 0.122 mmol, 31% 수율)를 갈색 고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 425.2 [(M+H)+, 계산치 C24H32N4O3 425.2]; LC/MS 체류시간 (방법 A1): tR = 2.54분.
파트 B: (S)-2-(2-아미노-2,4-디메틸펜틸옥시)-5-(2-메틸피리미딘-4-일)벤조니트릴
0℃에서 DCM (2 mL) 중 (S)-tert-부틸 (1-(2-시아노-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (70 mg, 0.122 mmol)의 용액에 TFA (0.188 mL, 2.440 mmol)를 첨가하고, 혼합물을 0℃에서 5분 동안 교반하였다. 반응 혼합물을 실온에서 4시간 동안 교반되도록 한 다음, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 C)에 의해 정제하여 (S)-2-(2-아미노-2,4-디메틸펜틸옥시)-5-(2-메틸피리미딘-4-일) 벤조니트릴 (48 mg, 0.108 mmol, 89% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 325.0 [(M+H)+, 계산치 C19H25N4O 325.2]; LC/MS 체류시간 (방법 H): tR = 1.27분; LC/MS 체류시간 (방법 I): tR = 0.92분. 1H NMR(400 MHz, 메탄올-d4): δ 8.73 (d, J = 5.60 Hz, 1H), 8.53-8.60 (m, 2H), 7.85 (d, J = 5.60 Hz, 1H), 7.45 (d, J = 9.20 Hz, 1H), 4.32-4.38 (m, 2H), 2.78 (s, 3H), 1.89-2.00 (m, 2H), 1.72-1.77 (m, 1H), 1.57 (s, 3H), 1.06-1.11 (m, 6H) ppm.
실시예 462
(S)-1-(2-플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
파트 A: 4-(3-플루오로-4-메톡시페닐)-2-메틸피리미딘
1,4-디옥산 (5 mL) 및 물 (3 mL) 중 4-클로로-2-메틸피리미딘 (0.2 g, 1.556 mmol), (3-플루오로-4-메톡시페닐)보론산 (0.264 g, 1.556 mmol), 및 Cs2CO3 (1.014 g, 3.11 mmol)의 혼합물을 질소 기체로 30분 동안 퍼징하였다. 반응 혼합물에 PdCl2 (dppf)-CH2Cl2 부가물 (0.127 g, 0.156 mmol)을 첨가하고, 질소 기체로 10분 동안 다시 퍼징하였다. 반응 혼합물을 80℃에서 12시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각되도록 하고, 감압 하에 농축시켰다. 잔류물을 에틸 아세테이트 (50 mL) 및 물 (40 mL)에 녹인 다음, 2상 혼합물을 셀라이트를 통해 여과하였다. 셀라이트를 에틸 아세테이트 (50 mL)로 세척하였다. 수성 층을 분리하고, 유기 층을 무수 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 증발시켜 갈색 고체를 수득하였다. 조 고체를 실리카 겔 크로마토그래피 (석유 에테르 중 EtOAc)에 의해 정제하여 4-(3-플루오로-4-메톡시페닐)-2-메틸피리미딘 (0.128 g, 0.587 mmol, 38% 수율)을 담황색 고체로서 회백색 고체로서 수득하였다. LCMS (ESI) m/e 219.1 [(M+H)+, 계산치 C12H12FN2O 219.1]; LC/MS 체류시간 (방법 B): tR = 0.69분.
파트 B: 2-플루오로-4-(2-메틸피리미딘-4-일) 페놀
0℃에서 4-(3-플루오로-4-메톡시페닐)-2-메틸피리미딘 (0.128 g, 0.587 mmol)에 AcOH (34%) 중 HBr (5 mL, 92 mmol)을 첨가하고, 반응 혼합물을 실온으로 가온되도록 한 다음, 100℃에서 12시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각되도록 하고, 감압 하에 농축시켰다. 갈색 잔류물을 에틸 아세테이트 (5 mL) 및 석유 에테르 (10 mL)에 녹이고, 여과하고, 건조시켜 2-플루오로-4-(2-메틸피리미딘-4-일)페놀 (0.11 g, 0.269 mmol, 46% 수율)을 회백색 고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 205.2 [(M+H)+, 계산치 C11H10FN2O 205.1]; LC/MS 체류시간 (방법 A1): tR = 1.59분.
파트 C: (S)-tert-부틸(1-(2-플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
DMF (5 mL) 중 2-플루오로-4-(2-메틸피리미딘-4-일)페놀 (0.11 g, 0.269 mmol)의 교반 용액을 0℃로 냉각시켰다. K2CO3 (0.112 g, 0.808 mmol)을 반응 혼합물에 조금씩 첨가한 다음, DMF(1 mL) 중 (S)-tert-부틸 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (실시예 32, 파트 A-E에 기재된 바와 같이 제조됨) (0.095 g, 0.323 mmol)를 천천히 첨가하였다. 반응 혼합물을 천천히 실온으로 가온되도록 하고, 88℃에서 12시간 동안 교반하였다. 반응 혼합물을 0℃로 냉각시키고, 포화 수성 염화암모늄 용액 (10 mL)으로 켄칭하였다. 반응 혼합물을 에틸 아세테이트 (2x20 mL)로 추출하였다. 합한 유기 층을 물 (2x20 mL) 및 염수 (10 mL)로 세척하였다. 유기 층을 황산나트륨 상에서 건조시키고, 여과하고, 감압 하에 증발 건조시켜 (S)-tert-부틸 (1-(2-플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (조 수율) (0.08 g, 0.088 mmol, 33% 수율)를 갈색 반고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 418.2 [(M+H)+, 계산치 C23H33FN3O3 418.2]; LC/MS 체류시간 (방법 A1): tR = 2.66분.
파트 D: (S)-1-(3-플루오로-4-(2-메틸피리미딘-4-일) 페녹시)-2,4-디메틸펜탄-2-아민
DCM (2 mL) 중 (S)-tert-부틸 (1-(2-플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.08 g, 0.192 mmol)의 교반 용액을 0℃로 냉각시키고, TFA (0.295 mL, 3.83 mmol)를 첨가하고, 혼합물을 5분 동안 교반하였다. 반응 혼합물을 실온으로 가온되도록 하고, 4시간 동안 교반하였다. 반응 혼합물을 감압 하에 증발시켰다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-1-(3-플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민 (39.9 mg, 0.129 mmol, 61% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 318.0 [(M+H)+, 계산치 C18H25FN3O 318.2]; LC/MS 체류시간 (방법 H): tR = 1.27분. 1H NMR (400 MHz, 메탄올-d4): δ 8.64 (d, J = 5.60 Hz, 1H), 7.99-8.05 (m, 2H), 7.74 (d, J = 5.60 Hz, 1H), 7.30 (t, J = 17.20 Hz, 1H), 4.08-4.17 (m, 2H), 2.73 (s, 3H), 1.74-1.87 (m, 2H), 1.61-1.64 (m, 1H), 1.42 (s, 3H), 1.00-1.05 (m, 6H) ppm.
실시예 465
(S)-1-(2-클로로-4-(2-(트리플루오로메틸) 피리미딘-4-일) 페녹시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸(1-(2-클로로-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일) 카르바메이트
4-클로로-2-(트리플루오로메틸)피리미딘 (0.05 g, 0.274 mmol), (S)-tert-부틸 (1-(2-클로로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 285, 파트 A에 기재된 바와 같이 제조됨) (0.128 g, 0.274 mmol) 및 Cs2CO3 (0.179 g, 0.548 mmol)의 혼합물을 1,4-디옥산 (6 mL) 및 물 (1 mL)에 녹였다. 반응 혼합물을 질소 기체로 30분 동안 퍼징하고, PdCl2 (dppf)-CH2Cl2 부가물 (0.022 g, 0.027 mmol)을 첨가하였다. 반응 혼합물을 질소 기체로 추가로 10분 동안 다시 퍼징하고, 80℃에서 12시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시켰다. 잔류물을 물 (30 mL) 및 에틸 아세테이트 (30 mL)로 희석하였다. 2상 혼합물을 셀라이트를 통해 여과하였다. 셀라이트를 에틸 아세테이트 (50 mL)로 세척하였다. 에틸 아세테이트 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 (S)-tert-부틸 (1-(2-클로로-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.07 g, 0.143 mmol, 52% 수율)를 갈색 고체로서 수득하였다. LCMS (ESI) m/e 489.2 [(M+2H)+, 계산치 C23H31ClF3N3O3 489.2]; LC/MS 체류시간 (방법 C): tR = 2.65분.
파트 B: (S)-1-(2-클로로-4-(2-(트리플루오로메틸) 피리미딘-4-일) 페녹시)-2,4-디메틸펜탄-2-아민
0℃에서 디클로로메탄 (2 mL) 중 메틸 (S)-tert-부틸 (1-(2-클로로-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.08 g, 0.164 mmol)의 용액에 TFA (0.253 mL, 3.28 mmol)를 첨가하고, 혼합물을 0℃에서 5분 동안 교반하였다. 반응 혼합물을 실온에서 4시간 동안 교반되도록 한 다음, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-1-(2-클로로-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민 (46.5 mg, 0.12 mmol, 73% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 388.0 [(M+H)+, 계산치 C18H22ClF3N3O 388.1]; LC/MS 체류시간 (방법 H): tR = 1.93분; LC/MS 체류시간 (방법 I): tR = 1.45분. 1H NMR (400 MHz, DMSO-d6): δ 9.06 (d, J = 4.00 Hz, 1H), 8.36-8.41 (m, 2H), 8.25-8.27 (m, 1H), 7.35 (d, J = 8.80 Hz, 1H), 3.88-3.91 (m, 2H), 1.79-1.82 (m, 1H), 1.40-1.46 (m, 2H), 1.16 (s, 3H), 0.91-0.94 (m, 6H) ppm.
실시예 469
(S)-1-(2-클로로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-(2-클로로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (10 mL) 중 4-클로로-2-메틸피리미딘 (0.03 g, 0.233 mmol), (S)-tert-부틸 (1-(2-클로로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 285, 파트 A에 기재된 바와 같이 제조됨) (0.120 g, 0.257 mmol), Cs2CO3 (0.228 g, 0.700 mmol), 및 KBr (0.028 g, 0.233 mmol)의 혼합물을 질소 기체로 30분 동안 퍼징하였다. PdCl2 (dppf)-CH2Cl2 부가물 (0.019 g, 0.023 mmol)을 반응 혼합물에 첨가하고, 용액을 질소 기체로 추가로 10분 동안 다시 퍼징하였다. 반응 혼합물을 80℃에서 12시간 동안 가열하였다. 반응 혼합물을 농축시키고, 에틸 아세테이트 (20 mL) 및 물 (20 mL) 중에 용해시키고, 2상 혼합물을 규조토 (셀라이트®)를 통해 여과하였다. 패드를 에틸 아세테이트 (25 mL)로 세척하였다. 에틸 아세테이트 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 조 생성물 (S)-tert-부틸 (1-(2-클로로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (조 수율) (0.06 g, 0.138 mmol, 59% 수율)를 갈색 고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 434.2 [(M+H)+, 계산치 C23H33ClN3O3 434.2]; LC/MS 체류시간 (방법 B): tR = 2.34분.
파트 B: (S)-1-(2-클로로-4-(2-메틸피리미딘-4-일) 페녹시)-2,4-디메틸펜탄-2-아민
0℃에서 DCM (2 mL) 중 (S)-tert-부틸 (1-(2-클로로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.08 g, 0.184 mmol)의 용액에 TFA (0.284 mL, 3.69 mmol)를 첨가하고, 혼합물을 0℃에서 5분 동안 교반하였다. 반응 혼합물을 실온에서 4시간 동안 교반되도록 한 다음, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-1-(2-클로로-4-(2-메틸피리미딘-4-일) 페녹시)-2,4-디메틸펜탄-2-아민 (22.5, 0.067 mmol, 37% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 334.0 [(M+H)+, 계산치 C18H25ClN3O 334.2]; LC/MS 체류시간 (방법 H): tR = 1.48분; LC/MS 체류시간 (방법 I): tR = 1.10분. 1H NMR (400 MHz, 메탄올-d4): δ 8.68 (d, J = 5.60 Hz, 1H), 8.32 (d, J = 2.00 Hz, 1H), 8.15-8.18 (m, 1H), 7.77-7.79 (m, 1H), 7.32 (d, J = 8.80 Hz, 1H), 4.20-4.27 (m, 2H), 2.76 (s, 3H), 1.88-1.97 (m, 2H), 1.70-1.75 (m, 1H), 1.54 (s, 3H), 1.03-1.09 (m, 6H) ppm.
실시예 474
(S)-2-(2-아미노-2,4-디메틸펜틸옥시)-5-(2-(트리플루오로메틸)피리미딘-4-일)벤조니트릴
파트 A: (S)-tert-부틸 (1-(2-시아노-4-(2-(트리플루오로메틸) 피리미딘-4-일) 페녹시)-2,4-디메틸펜탄-2-일) 카르바메이트
1,4-디옥산 (6 mL) 및 물 (1 mL) 중 4-클로로-2-(트리플루오로메틸)피리미딘 (0.025 g, 0.137 mmol), (S)-tert-부틸 (1-(2-시아노-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 86, 파트 A 및 B에 기재된 바와 같이 제조됨) (0.063 g, 0.137 mmol), 및 Cs2CO3 (0.089 g, 0.274 mmol)의 혼합물을 질소 기체로 30분 동안 퍼징하였다. PdCl2(dppf)-CH2Cl2 부가물 (0.011 g, 0.014 mmol)을 첨가하였다. 반응 혼합물을 질소 기체로 10분 동안 다시 퍼징하고, 80℃에서 12시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시켰다. 잔류물을 물 (30 mL) 및 에틸 아세테이트 (30 mL)로 희석하였다. 2상 혼합물을 셀라이트를 통해 여과하였다. 셀라이트를 에틸 아세테이트 (50 mL)로 세척하였다. 에틸 아세테이트 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 (S)-tert-부틸 (1-(2-시아노-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.042 g, 0.088 mmol, 64% 수율)를 갈색 고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 479.3 [(M+H)+, 계산치 C24H30F3N4O3 479.2]; LC/MS 체류시간 (방법 B): tR = 1.19분.
파트 B: (S)-2-(2-아미노-2,4-디메틸펜틸옥시)-5-(2-(트리플루오로메틸)피리미딘-4-일)벤조니트릴
0℃에서 디클로로메탄 (2 mL) 중 (S)-tert-부틸 (1-(2-시아노-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.035 g, 0.073 mmol)의 용액에 TFA (0.113 mL, 1.463 mmol)를 첨가하고, 혼합물을 0℃에서 5분 동안 교반하였다. 반응 혼합물을 실온에서 4시간 동안 교반되도록 한 다음, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 C)에 의해 정제하여 (S)-2-(2-아미노-2,4-디메틸펜틸옥시)-5-(2-(트리플루오로메틸)피리미딘-4-일)벤조니트릴 (9 mg, 0.023 mmol, 32% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 379.0 [(M+H)+, 계산치 C19H22F3N4O 379.2]; LC/MS 체류시간 (방법 H): tR = 1.74분; LC/MS 체류시간 (방법 I): tR = 1.33분. 1H NMR(400 MHz, 메탄올-d4): δ 8.98 (d, J = 5.20 Hz, 1H), 8.58-8.61 (m, 2H), 8.20 (d, J = 5.60 Hz, 1H), 7.43 (d, J = 8.80 Hz, 1H), 4.18-4.23 (m, 2H), 1.77-1.90 (m, 2H), 1.62-1.67 (m, 1H), 1.42 (s, 3H), 1.04-1.06 (m, 6H) ppm.
실시예 479
(S)-1-(4-(2,6-디메틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-(4-(2,6-디메틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (10 mL) 중 4-클로로-2,6-디메틸피리미딘 (0.03 g, 0.210 mmol), (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2-(트리플루오로메틸)페녹시)펜탄-2-일)카르바메이트 (실시예 215, 파트 A 및 B에 기재된 바와 같이 제조됨) (0.116 g, 0.231 mmol), Cs2CO3 (0.206 g, 0.631 mmol), 및 KBr (0.025 g, 0.210 mmol)의 용액을 질소 기체로 30분 동안 퍼징하였다. PdCl2 (dppf)-CH2Cl2 부가물 (0.017 g, 0.021 mmol)을 반응 혼합물에 첨가하고, 용액을 질소 기체로 다시 10분 동안 퍼징하였다. 반응 혼합물을 마이크로웨이브에서 80℃에서 12시간 동안 가열하였다. 반응 혼합물을 농축시키고, 에틸 아세테이트 (20 mL) 및 물 (20 mL) 중에 용해시켰다. 2상 혼합물을 규조토 (셀라이트®)를 통해 여과하였다. 층을 에틸 아세테이트 (25 mL)로 세척하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켜 (S)-tert-부틸 (1-(4-(2,6-디메틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.04 g, 0.083 mmol, 40% 수율)를 갈색 반고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 482.2 [(M+H)+, 계산치 C25H35F3N3O3 482.2]; LC/MS 체류시간 (방법 A1): tR = 2.97분.
파트 B: (S)-1-(4-(2,6-디메틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민
0℃에서 DCM (2 mL) 중 (S)-tert-부틸 (1-(4-(2,6-디메틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (40 mg, 0.083 mmol)의 용액에 TFA (0.128 mL, 1.661 mmol)를 첨가하고, 혼합물을 0℃에서 5분 동안 교반하였다. 반응 혼합물을 실온에서 4시간 동안 교반되도록 한 다음, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 B)에 의해 정제하여 (S)-1-(4-(2,6-디메틸피리미딘-4-일)-2-(트리플루오로메틸) 페녹시)-2,4-디메틸펜탄-2-아민 (43 mg, 0.075 mmol, 91% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 382.3 [(M+H)+, 계산치 C20H27F3N3O 382.2]; LC/MS 체류시간 (방법 H): tR = 1.82분; LC/MS 체류시간 (방법 I): tR = 1.07분. 1H NMR(400 MHz, 메탄올-d4: δ 8.49-8.55 (m, 2H), 7.87 (s, 1H), 7.46 (d, J = 8.80 Hz, 1H), 4.27-4.35 (m, 2H), 2.78 (s, 3H), 2.63 (s, 3H), 1.87-1.93 (m, 2H), 1.72-1.77 (m, 1H), 1.55 (s, 3H), 1.02-1.09 (m, 6H) ppm.
실시예 480
(S)-1-(2-클로로-4-(2-이소프로필피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-(2-클로로-4-(2-이소프로필피리미딘-4-일) 페녹시)-2,4-디메틸펜탄-2-일) 카르바메이트
1,4-디옥산 (6 mL) 중 4-클로로-2-이소프로필피리미딘 (0.025 g, 0.160 mmol), (S)-tert-부틸 (1-(2-클로로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (실시예 285, 파트 A에 기재된 바와 같이 제조됨) (0.075 g, 0.160 mmol), Cs2CO3 (0.104 g, 0.319 mmol), 및 KBr (0.019 g, 0.160 mmol)의 용액을 질소 기체로 30분 동안 퍼징하였다. PdCl2 (dppf)-CH2Cl2 부가물 (0.013 g, 0.016 mmol)을 반응 혼합물에 첨가하고, 용액을 질소 기체로 다시 10분 동안 퍼징하였다. 반응 혼합물을 80℃에서 12시간 동안 가열하였다. 반응 혼합물을 농축시키고, 에틸 아세테이트 (30 mL) 및 물 (30 mL) 중에 용해시켰다. 2상 혼합물을 규조토 (셀라이트®)를 통해 여과하였다. 층을 에틸 아세테이트 (50 mL)로 세척하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켜 (S)-tert-부틸 (1-(2-클로로-4-(2-이소프로필피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (40 mg, 0.087 mmol, 54% 수율)를 갈색 고체로서 수득하였다. 고체를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 462.2 [(M+H)+, 계산치 C25H37ClN3O3 462.2]; LC/MS 체류시간 (방법 A1): tR = 3.39분.
파트 B: (S)-1-(2-클로로-4-(2-이소프로필피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
DCM (2 mL) 중 (S)-tert-부틸 (1-(2-클로로-4-(2-이소프로필피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (0.044 g, 0.095 mmol)의 용액을 0℃로 냉각시켰다. TFA (0.147 mL, 1.905 mmol)를 첨가하고, 0℃에서 5분 동안 교반하였다. 반응 혼합물을 실온에서 4시간 동안 교반하였다. 반응 혼합물을 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 B)에 의해 정제하여 (S)-1-(2-클로로-4-(2-이소프로필피리미딘-4-일) 페녹시)-2,4-디메틸펜탄-2-아민 (6 mg, 0.011 mmol, 12% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 362.2 [(M+H)+, 계산치 C20H29ClN3O 362.2]; LC/MS 체류시간 (방법 H): tR = 2.73분; LC/MS 체류시간 (방법 I): tR = 1.93분. 1H NMR(400 MHz, 메탄올-d4: δ 8.69 (d, J = 5.60 Hz, 1H), 8.31-8.34 (m, 1H), 8.18-8.21 (m, 1H), 7.77 (d, J = 5.60 Hz, 1H), 7.31 (d, J = 8.80 Hz, 1H), 4.19-4.27 (m, 2H), 3.23-3.30 (m, 1H), 1.84-1.91 (m, 2H), 1.69-1.74 (m, 1H), 1.53 (s, 3H), 1.34-1.41 (m, 6H), 1.01-1.08 (m, 6H) ppm.
실시예 484
(S)-2,4-디메틸-1-(2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일옥시)펜탄-2-아민
파트 A: 4-(5-플루오로-6-메틸피리딘-2-일)-2-메틸피리미딘
1,4-디옥산 (2 mL) 중 4-클로로-2-메틸피리미딘 (100 mg, 0.778 mmol), 6-브로모-3-플루오로-2-메틸피리딘 (148 mg, 0.778 mmol) 및 1,1,1,2,2,2-헥사메틸디스탄난 (255 mg, 0.778 mmol)의 용액을 질소 기체로 10분 동안 퍼징하였다. Pd (Ph3P)4 (90 mg, 0.078 mmol)를 반응 혼합물에 첨가하고, 용액을 질소 기체로 다시 10분 동안 퍼징하였다. 반응 혼합물을 마이크로웨이브에서 150℃에서 2시간 동안 가열하였다. 반응 혼합물을 농축시키고, 에틸 아세테이트 (20 mL) 및 물 (20 mL) 중에 용해시켰다. 2상 혼합물을 규조토 (셀라이트®)를 통해 여과하였다. 층을 에틸 아세테이트 (25 mL)로 세척하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켜 조 4-(5-플루오로-6-메틸피리딘-2-일)-2-메틸피리미딘을 갈색 고체로서 수득하였다. 고체를 실리카-겔 크로마토그래피 (석유 에테르 중 0-40% EtOAc)에 의해 정제하여 4-(5-플루오로-6-메틸피리딘-2-일)-2-메틸피리미딘 (50 mg, 0.246 mmol, 32% 수율)을 회백색 고체로서 수득하였다. LCMS (ESI) m/e 204.2 [(M+H)+, 계산치 C11H11FN3 204.1]; LC/MS 체류시간 (방법 A1): tR = 2.12분.
파트 B: (S)-2,4-디메틸-1-(2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일옥시)펜탄-2-아민
THF (4 mL) 중 (S)-2-아미노-2,4-디메틸펜탄-1-올 (19.37 mg, 0.148 mmol)의 용액을 0℃로 냉각시켰다. KOtBu (0.443 mL, 0.443 mmol)를 첨가하고, 이어서 (S)-2-아미노-2,4-디메틸펜탄-1-올 (19.37 mg, 0.148 mmol)을 천천히 첨가하였다. 반응 혼합물을 0℃에서 5분 동안 교반한 다음, 80℃에서 4시간 동안 교반되도록 하였다. 반응 혼합물을 물 (20 mL)로 켄칭하고, 에틸 아세테이트 (20 mL)로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 C)에 의해 정제하여 (S)-2,4-디메틸-1-(2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일옥시)펜탄-2-아민 (19 mg, 0.057 mmol, 39% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 315.3 [(M+H)+, 계산치 C18H27N4O 315.2]; LC/MS 체류시간 (방법 H): tR = 1.24분; LC/MS 체류시간 (방법 I): tR = 0.83분. 1H NMR(400 MHz, 메탄올-d4): δ 8.73 (d, J = 5.20 Hz, 1H), 8.39 (d, J = 8.80 Hz, 1H), 8.22 (d, J = 5.20 Hz, 1H), 7.53 (d, J = 8.80 Hz, 1H), 4.16-4.26 (m, 2H), 2.76 (s, 3H), 2.63 (s, 3H), 1.84-1.93 (m, 2H), 1.69-1.75 (m, 1H), 1.51 (s, 3H), 1.01-1.08 (m, 6H) ppm.
실시예 487
(S)-5-(2-아미노-2,4-디메틸펜틸옥시)-2-(2-메틸피리미딘-4-일)이소니코티노니트릴
파트 A: 2-브로모-5-플루오로이소니코틴알데히드 옥심
2-브로모-5-플루오로이소니코틴알데히드 (2 g, 9.80 mmol) 및 히드록실아민 히드로클로라이드 (1.022 g, 14.71 mmol)를 메탄올 (20 mL) 및 물 (20 mL) 중에 용해시켰다. 반응 혼합물을 60℃에서 5시간 동안 가열하였다. 반응 혼합물을 감압 하에 농축시켰다. 잔류물을 포화 수성 중탄산나트륨 용액으로 희석하고, 에틸 아세테이트로 추출하였다. 에틸 아세테이트 층을 황산마그네슘 상에서 건조시키고, 감압 하에 농축시켜 2-브로모-5-플루오로이소니코틴알데히드 옥심 (1.8 g, 8.22 mmol, 84% 수율)을 회백색 고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다. LCMS (ESI) m/e 219.0 [(M+H) +, 계산치 C6H5BrFN2O 219.0]; LC/MS 체류시간 (방법 A1): tR = 1.63분.
파트 B: 2-브로모-5-플루오로이소니코티노니트릴
2-브로모-5-플루오로이소니코틴알데히드 옥심 (1 g, 4.57 mmol)을 클로로포름 (20 mL)에 녹이고, 0℃로 냉각시켰다. POCl3 (2.128 mL, 22.83 mmol)을 반응 혼합물에 적가하고, 0℃에서 5분 동안 교반하였다. 반응 혼합물을 65℃에서 12시간 동안 가열하였다. 반응 혼합물을 감압 하에 농축시켜 갈색 잔류물을 수득하였다. 잔류물을 빙수로 희석하고, 포화 수성 탄산나트륨 용액을 사용하여 염기성화시키고, 에틸 아세테이트 (3 x25 mL)로 추출하였다. 에틸 아세테이트 층을 Na2SO4 상에서 건조시키고, 증발시켜 2-브로모-5-플루오로이소니코티노니트릴 (0.8 g, 3.98 mmol, 87% 수율)을 갈색 고체로서 수득하였으며, 이를 후속 단계에 추가 정제 없이 사용하였다. 1H NMR 400 MHz, DMSO-d6: δ 8.81 (d, J = 4.40 Hz, 1H), 8.41-8.43 (m, 1H) ppm.
파트 C: 5-플루오로-2-(2-메틸피리미딘-4-일) 이소니코티노니트릴
1,4-디옥산 (2 mL) 중 4-클로로-2-메틸피리미딘 (100 mg, 0.778 mmol), 2-브로모-5-플루오로이소니코티노니트릴 (156 mg, 0.778 mmol) 및 1,1,1,2,2,2-헥사메틸디스탄난 (255 mg, 0.778 mmol)의 용액을 질소 기체로 10분 동안 퍼징하였다. Pd(Ph3P)4 (90 mg, 0.078 mmol)를 반응 혼합물에 첨가하고, 용액을 질소 기체로 다시 10분 동안 퍼징하였다. 반응 혼합물을 마이크로웨이브에서 150℃에서 2시간 동안 가열하였다. 반응 혼합물을 감압 하에 농축시키고, 잔류물을 에틸 아세테이트 (20 mL) 및 물 (20 mL) 중에 용해시켰다. 2상 혼합물을 규조토 (셀라이트®)를 통해 여과하였다. 층을 에틸 아세테이트 (25 mL)로 세척하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 갈색 고체를 실리카 겔 크로마토그래피 (석유 에테르 중 0-40% EtOAc)에 의해 정제하여 5-플루오로-2-(2-메틸피리미딘-4-일) 이소니코티노니트릴 (40 mg, 0.187 mmol, 24% 수율)을 회백색 고체로서 수득하였다. LCMS (ESI) m/e 215.2 [(M+H)+, 계산치 C11H8FN4 215.2]; LC/MS 체류시간 (방법 A1): tR = 1.76분.
파트 D: (S)-5-(2-아미노-2,4-디메틸펜틸옥시)-2-(2-메틸피리미딘-4-일) 이소니코티노니트릴
DMF (4 mL) 중 (S)-2-아미노-2,4-디메틸펜탄-1-올 (15.31 mg, 0.117 mmol)의 용액을 0℃로 냉각시켰다. 5-플루오로-2-(2-메틸피리미딘-4-일)이소니코티노니트릴 (25 mg, 0.117 mmol)을 반응 혼합물에 첨가하고, 이어서 NaH (8.40 mg, 0.350 mmol)를 조금씩 첨가하고, 혼합물을 0℃에서 5분 동안 교반한 다음, 25℃에서 4시간 동안 교반하였다. 반응 혼합물을 0℃로 냉각시키고, 물 (20 mL)로 켄칭하고, 에틸 아세테이트 (20 mL)로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 B)에 의해 정제하여 (S)-5-(2-아미노-2,4-디메틸펜틸옥시)-2-(2-메틸피리미딘-4-일)이소니코티노니트릴 (4 mg, 9.10umol, 8% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 326.2 [(M+H)+, 계산치 C18H24N5O 326.2]; LC/MS 체류시간 (방법 H): tR = 2.40분; LC/MS 체류시간 (방법 I): tR = 2.01분. 1H NMR(400 MHz, 메탄올-d4): δ 8.68 (d, J = 5.20 Hz, 1H), 8.64 (d, J = 0.40 Hz, 1H), 8.50 (d, J = 0.40 Hz, 1H), 8.06 (d, J = 5.20 Hz, 1H), 3.57-3.81 (m, 2H), 2.74 (s, 3H), 1.79-1.90 (m, 3H), 1.50 (s, 3H), 0.98-1.02 (m, 6H) ppm.
실시예 491
1,1,1-트리플루오로-4-메틸-2-(((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)메틸)펜탄-2-아민
파트 A: 4-(5-플루오로-6-메틸피리딘-2-일)-2-메틸피리미딘
1,4-디옥산 (2 mL) 중 4-클로로-2-메틸피리미딘 (100 mg, 0.778 mmol), 6-브로모-3-플루오로-2-메틸피리딘 (148 mg, 0.778 mmol) 및 1,1,1,2,2,2-헥사메틸디스탄난 (255 mg, 0.778 mmol)의 용액을 질소 기체로 20분 동안 퍼징하였다. Pd(Ph3P)4 (90 mg, 0.078 mmol)를 반응 혼합물에 첨가하고, 용액을 질소 기체로 다시 10분 동안 퍼징하였다. 반응 혼합물을 마이크로웨이브에서 150℃에서 2시간 동안 가열하였다. 반응 혼합물을 농축시키고, 수득된 잔류물을 에틸 아세테이트 (20 mL) 및 물 (20 mL) 중에 용해시켰다. 2상 혼합물을 규조토 (셀라이트®)를 통해 여과하고, 층을 에틸 아세테이트 (25 mL)로 세척하였다. 에틸 아세테이트 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 갈색 고체를 수득하였으며, 이를 실리카 겔 크로마토그래피 (석유 에테르 중 0-40% EtOAc)에 의해 정제하여 4-(5-플루오로-6-메틸피리딘-2-일)-2-메틸피리미딘 (42 mg, 0.207 mmol, 27% 수율)을 회백색 반고체로서 수득하였다. LCMS (ESI) m/e 204.2 [(M+H) +, 계산치 C11H11FN3 204.1]; LC/MS 체류시간 (방법 A1): tR =2.41분.
파트 B: 4-메틸-N-(1,1,1-트리플루오로-4-메틸-2-(((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)메틸)펜탄-2-일)벤젠술폰아미드
DMF (4 mL) 중 4-메틸-N-(1,1,1-트리플루오로-2-(히드록시메틸)-4-메틸펜탄-2-일) 벤젠술폰아미드 (실시예 273에 기재된 바와 같이 제조됨) (66.8 mg, 0.197 mmol)의 용액을 0℃로 냉각시켰다. NaH (14.17 mg, 0.591 mmol)를 반응 혼합물에 첨가하고, 이어서 4-(5-플루오로-6-메틸피리딘-2-일)-2-메틸피리미딘 (40 mg, 0.197 mmol)을 천천히 첨가하고, 혼합물을 0℃에서 5분 동안 교반한 다음, 80℃에서 4시간 동안 교반하였다. 반응 혼합물을 실온으로 냉각되도록 하고, 물 (20 mL)로 켄칭하고, 에틸 아세테이트 (20 mL)로 추출하였다. 에틸 아세테이트 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 4-메틸-N-(1,1,1-트리플루오로-4-메틸-2-(((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)메틸)펜탄-2-일)벤젠술폰아미드 (60 mg, 0.115 mmol, 58% 수율)를 갈색 반고체로서 수득하였으며, 이를 후속 단계에 추가 정제 없이 사용하였다. LCMS (ESI) m/e 523.2 [(M+H) +, 계산치 C25H30F3N4O3S 523.2]; LC/MS 체류시간 (방법 A1): tR =2.20분.
파트 C: 1,1,1-트리플루오로-4-메틸-2-(((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)메틸)펜탄-2-아민
4-메틸-N-(1,1,1-트리플루오로-4-메틸-2-(((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)메틸)펜탄-2-일)벤젠술폰아미드 (88 mg, 0.168 mmol)를 0℃로 냉각시키고, 황산 (4 mL, 0.168 mmol)을 적가하고, 반응 혼합물을 0℃에서 2시간 동안 교반하였다. 반응 혼합물을 차가운 포화 수성 중탄산나트륨 용액 (pH~8-9)으로 염기성화시켰다. 반응 혼합물을 에틸 아세테이트 (3x20 mL)로 추출하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 1,1,1-트리플루오로-4-메틸-2-(((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)메틸)펜탄-2-아민, TFA (11 mg. 0.027 mmol, 16% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 369.3 [(M+H)+, 계산치 C18H24F3N4O 369.2]; LC/MS 체류시간 (방법 H): tR = 1.97분; LC/MS 체류시간 (방법 I): tR = 1.19분. 1H NMR(400 MHz, 메탄올-d4): δ 8.69 (d, J = 5.60 Hz, 1H), 8.36 (d, J = 8.40 Hz, 1H), 8.16 (d, J = 5.20 Hz, 1H), 7.49 (d, J = 8.80 Hz, 1H), 4.26-4.29 (m, 2H), 2.74 (s, 3H), 2.56 (s, 3H), 1.88-2.03 (m, 2H), 1.73-1.78 (m, 1H), 1.00-1.08 (m, 6H) ppm.
실시예 505
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)페닐)피리미딘-2-일)카르바메이트
파트 A: (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)펜탄-2-일)카르바메이트
1,4-디옥산 (20 ml) 중 (S)-tert-부틸 (1-(4-브로모페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (2.0 g, 3.47 mmol), 비스(피나콜레이토)디보론 (1.321 g, 5.20 mmol), 아세트산칼륨 (1.021 g, 10.41 mmol)의 현탁액을 질소로 5분 동안 퍼징하였다. PdCl2(dppf)-CH2Cl2 부가물 (0.283 g, 0.347 mmol)을 반응 혼합물에 아르곤 하에 첨가하고 80℃ (실리콘 오일 조)로 16시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각되도록 하였다. 이어서, 반응 혼합물을 에틸 아세테이트 (3 x 50 mL)로 추출하였다. 합한 유기 추출물을 물 (50 mL), 염수 (50 mL)로 세척하고, 황산나트륨 상에서 건조시키고, 감압 하에 농축시켰다. 유성 잔류물을 실리카 겔 크로마토그래피 (헥산 중 에틸 아세테이트의 0에서 15%)에 의해 정제하여 (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)펜탄-2-일)카르바메이트 (1.49 g, 3.44 mmol, 99% 수율)를 무색 오일로서 수득하였다. 1H NMR (300MHz, DMSO-d6) δ 7.59 (d, J=8.7 Hz, 2H), 6.91 (d, J=8.7 Hz, 2H), 6.54 (br. s., 1H), 4.10 (d, J=9.1 Hz, 2H), 3.89 (d, J=8.7 Hz, 2H), 1.82 - 1.67 (m, 2H), 1.49 - 1.40 (m, 1H), 1.34 (s, 6H), 1.27 (s, 9H), 1.24 (s, 3H), 1.17 (s, 6H), 0.91 (d, J=6.4 Hz, 6H), 0.89 (d, J=6.4 Hz, 6H).
파트 B: Boc-(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)페닐)피리미딘-2-일)카르바메이트
1,4-디옥산 (1 mL) 중 메틸 (4-클로로피리미딘-2-일)카르바메이트 (30 mg, 0.160 mmol), (S)-tert-부틸 (2,4-디메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)펜탄-2-일)카르바메이트 (69.3 mg, 0.160 mmol), 탄산세슘 (156 mg, 0.480 mmol) 및 PdCl2(dppf)-CH2Cl2 부가물 (6.53 mg, 8.00 μmol)의 혼합물을 100℃에서 16시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시키고, 염수로 희석하고, 에틸 아세테이트 (20 mL)로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 Boc-(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)페닐)피리미딘-2-일)카르바메이트 (40 mg, 0.087 mmol, 54% 수율)를 황색 반고체로서 수득하였다. LCMS (ESI) m/e 459.3[(M+H)+, 계산치 C24H35N4O5, 459.3]; LC/MS 체류시간 (방법 C): tR = 1.21분.
파트 B: (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)페닐)피리미딘-2-일)카르바메이트
실온에서 MeOH 중 Boc-(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)페닐)피리미딘-2-일)카르바메이트 (40 mg, 0.087 mmol)의 용액에 1,4-디옥산 중 HCl (436 μl, 1.745 mmol)을 첨가하고, 반응 혼합물을 6시간 동안 교반하였다. 반응 혼합물을 포화 중탄산나트륨 용액 (20 mL)으로 희석하고, 에틸 아세테이트 (30 mL)로 추출하였다. 유기 층을 무수 Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 A)에 의해 정제하여 (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)페닐)피리미딘-2-일)카르바메이트 (16 mg, 0.044 mmol, 51% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 359.3[(M+H)+, 계산치 C19H27N4O3, 359.2]; LC/MS 체류시간 (방법 D): tR = 1.02분 LC/MS 체류시간 (방법 E): tR = 0.87분. 1H NMR (400 MHz, 메탄올-d4): δ 8.42 (d, J = 5.60 Hz, 1H), 8.08 (d, J = 8.80 Hz, 2H), 7.44 (d, J = 5.20 Hz, 1H), 7.00 (d, J = 8.80 Hz, 2H), 3.77-3.84 (m, 2H), 3.71 (s, 3H), 1.73-1.79 (m, 1H), 1.43-1.50 (m, 2H), 1.18 (s, 3H), 0.87-0.91 (m, 6H) ppm.
실시예 506
(S)-1-(2,5-디플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
파트 A: (S)-tert-부틸 (1-(4-브로모-2,5-디플루오로페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
DMF (20 mL) 중 4-브로모-2,5-디플루오로페놀 (1.425 g, 6.82 mmol)의 교반 용액에 탄산세슘 (6.66 g, 20.45 mmol)을 첨가하고, 혼합물을 실온에서 10분 동안 교반하였다. (S)-tert-부틸 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드 (실시예 32, 파트 A-E에 기재된 바와 같이 제조됨) (2 g, 6.82 mmol)를 첨가하고, 반응 혼합물을 80℃에서 8시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 에틸 아세테이트 (100 mL)로 희석하였다. 에틸 아세테이트 층을 물 (50 mL)로 세척하고, 감압 하에 농축시켜 갈색 오일을 수득하였으며, 이를 실리카 겔 크로마토그래피 (헥산 중 5% EtOAc)에 의해 정제하여 (S)-tert-부틸 (1-(4-브로모-2,5-디플루오로페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (2 g, 3.79 mmol, 56% 수율)를 무색 오일로서 수득하였다. 1H NMR (300 MHz, CDCl3): δ 7.27 - 7.23 (m, 1H), 6.88 - 6.81 (m, 1H), 4.60 - 4.52 (m, 1H), 4.23 - 4.15 (m, 1H), 4.04 - 3.98 (m, 1H), 1.91 - 1.76 (m, 2H), 1.51-1.56 (m, 1H), 1.42 - 1.39 (m, 12H), 0.99 (dd, J=2.3, 6.4 Hz, 6H) ppm.
파트 B: (S)-tert-부틸 (1-(2,5-디플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
-78℃에서 THF (5 mL) 중 (S)-tert-부틸 (1-(4-브로모-2,5-디플루오로페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (300 mg, 0.710 mmol)의 교반 용액에 THF 중 1M 이소프로필마그네슘 클로라이드 (0.852 mL, 0.852 mmol)를 적가하였다. 반응 혼합물을 -78℃에서 1시간 동안 교반한 다음, 2-이소프로폭시-4,4,5,5-테트라메틸-1,3,2-디옥사보롤란 (145 mg, 0.781 mmol)을 첨가하였다. 혼합물을 -78℃에서 1시간 동안 교반한 다음, 실온에서 3시간 동안 교반하였다. 혼합물을 포화 NH4Cl 용액 (50 mL)으로 켄칭하고, 에틸 아세테이트 (50 mL)로 추출하였다. 유기 층을 분리하고, 황산나트륨 상에서 건조시키고, 감압 하에 농축시켜 (S)-tert-부틸 (1-(2,5-디플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (200 mg, 0.426 mmol, 60% 수율)를 황색 반고체로서 수득하였다. 수득된 조 생성물을 후속 단계에 추가 정제 없이 사용하였다.
파트 C: (S)-tert-부틸 (1-(2,5-디플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (1 mL)-물 (0.1 mL) 중 4-클로로-2-메틸피리미딘 (25 mg, 0.194 mmol), (S)-tert-부틸 (1-(2,5-디플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (91 mg, 0.194 mmol), 및 탄산세슘 (190 mg, 0.583 mmol)의 혼합물에 PdCl2(dppf)-CH2Cl2 부가물 (7.94 mg, 9.72 μmol)을 첨가하였다. 반응 혼합물을 100℃에서 16시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시키고, 염수로 희석하고, 에틸 아세테이트 (20 mL)로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 (S)-tert-부틸 (1-(2,5-디플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (50 mg, 0.100 mmol, 51% 수율)를 회백색 반고체로서 수득하였다. LCMS (ESI) m/e 436.3 [(M+H)+, 계산치 C23H32F2N3O3, 436.2]; LC/MS 체류시간 (방법 C): tR = 1.29분.
파트 D: (S)-1-(2,5-디플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
실온에서 MeOH (1 mL) 중 (S)-tert-부틸 (1-(2,5-디플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (50 mg, 0.100 mmol)의 용액에 1,4-디옥산 중 4M HCl (0.250 mL, 0.999 mmol)을 첨가하고, 반응 혼합물을 실온에서 6시간 동안 교반하였다. 반응 혼합물을 포화 중탄산나트륨 용액 (20 mL)으로 희석하고, 에틸 아세테이트 (30 mL)로 추출하였다. 유기 층을 무수 Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 C)에 의해 정제하여 (S)-1-(2,5-디플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민 (15 mg, 0.044 mmol, 44% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 336.2 [(M+H)+, 계산치 C18H24F2N3O, 336.2]; LC/MS 체류시간 (방법 D): tR = 2.17분: LC/MS 체류시간 (방법 E): tR = 1.70분. 1H NMR (400 MHz, 메탄올-d4): δ 8.68 (d, J = 5.60 Hz, 1H), 8.02-8.06 (m, 1H), 7.73-7.90 (m, 1H), 7.14-7.19 (m, 1H), 4.04-4.12 (m, 2H), 2.74 (s, 3H), 1.82-1.87 (m, 1H), 1.69-1.74 (m, 1H), 1.58-1.63 (m, 1H), 1.38 (s, 3H), 1.03-1.04 (m, 6H) ppm.
실시예 507
(S)-메틸 (6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-2,5-디플루오로페닐)피리미딘-4-일)카르바메이트
실시예 304에 기재된 것과 유사한 방식으로 (S)-메틸 (6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-2,5-디플루오로페닐)피리미딘-4-일)카르바메이트 (35 mg, 0.071 mmol)를 사용하여 제조하여 (S)-메틸 (6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-2,5-디플루오로페닐)피리미딘-4-일)카르바메이트 (13 mg, 0.033 mmol, 47% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 395.2 [(M+H)+, 계산치 C19H25F2N4O3, 395.2]; LC/MS 체류시간 (방법 D): tR = 2.11분. 1H NMR (400 MHz, 메탄올-d4): δ 8.82 (s, 1H), 8.48-8.49 (m, 1H), 7.91-7.95 (m, 1H), 7.13-7.18 (m, 1H), 3.98-4.04 (m, 2H), 3.84 (s, 3H), 1.85-1.88 (m, 1H), 1.54-1.68 (m, 2H), 1.33 (s, 3H), 1.01-1.05 (m, 6H) ppm.
실시예 508
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-2,5-디플루오로페닐)피리미딘-2-일)카르바메이트
실시예 304에 기재된 것과 유사한 방식으로 Boc-(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-2,5-디플루오로페닐)피리미딘-2-일)카르바메이트 (40 mg, 0.081 mmol)를 사용하여 제조하여 (S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-2,5-디플루오로페닐)피리미딘-2-일)카르바메이트 (8 mg, 0.020 mmol, 25% 수율)를 연황색 고체로서 수득하였다. LCMS (ESI) m/e 395.2 [(M+H)+, 계산치 C19H25F2N4O3, 395.4]; LC/MS 체류시간 (방법 D): tR = 2.00분. LC/MS 체류시간 (방법 E): tR = 1.70분. 1H NMR (400 MHz, 메탄올-d4): δ 8.59 (d, J = 5.20 Hz, 1H), 8.09-8.14 (m, 1H), 7.57-7.58 (m, 1H), 7.10-7.15 (m, 1H), 3.98-4.05 (m, 2H), 3.81 (s, 3H), 1.81-1.86 (m, 1H), 1.63-1.68 (m, 1H), 1.54-1.59 (m, 1H), 1.33 (s, 3H), 1.00-1.03 (m, 6H) ppm.
실시예 510
(S)-1-(4-(2-(디플루오로메틸)피리딘-4-일)-2,5-디플루오로페녹시)-2,4-디메틸펜탄-2-아민
실시예 506에 기재된 것과 유사한 방식으로 (S)-tert-부틸 (1-(4-(2-(디플루오로메틸)피리딘-4-일)-2,5-디플루오로페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (20 mg, 0.043 mmol)를 사용하여 제조하여 (S)-1-(4-(2-(디플루오로메틸)피리딘-4-일)-2,5-디플루오로페녹시)-2,4-디메틸펜탄-2-아민 (4 mg, 10.48 μmol, 25% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 371.2 [(M+H)+, 계산치 C19H23F4N2O, 371.2]; LC/MS 체류시간 (방법 D): tR = 2.46분: LC/MS 체류시간 (방법 E): tR = 2.11분. 1H NMR (400 MHz, 메탄올-d4): δ 8.68-8.93 (m, 1H), 7.87 (s, 1H), 7.73 (t, J = 5.20 Hz, 1H), 7.49-7.54 (m, 1H), 7.13-7.18 (m, 1H), 6.64-6.91 (m, 1H), 3.92-3.99 (m, 2H), 1.80-1.87 (m, 1H), 1.50-1.63 (m, 2H), 1.28 (s, 3H), 0.99-1.02 (m, 6H) ppm.
실시예 511
(S)-1-(2,3-디플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민
파트 A: 4-브로모-2,3-디플루오로페놀
-20℃에서 DCM (30 mL) 중 1-브로모-2,3-디플루오로-4-메톡시벤젠 (3 g, 13.45 mmol)의 교반 용액에 DCM 중 1M BBr3 (26.9 mL, 26.9 mmol)을 10분에 걸쳐 적가하였다. 냉각 조를 제거하고, 반응 혼합물을 실온에서 12시간 동안 교반하였다. 반응 혼합물을 10℃로 냉각시키고, 포화 수성 중탄산나트륨 용액 (100 mL)으로 켄칭하였다. 혼합물을 DCM (150 mL)으로 희석하였다. 유기 층을 분리하고, 황산나트륨 상에서 건조시키고, 감압 하에 농축시켜 4-브로모-2,3-디플루오로페놀 (2 g, 9.47 mmol, 70% 수율)을 암적색 오일로서 수득하였다. 1H NMR (400 MHz, 클로로포름-d): δ 7.15-7.21 (m, 1H), 6.69-6.76 (m, 1H), 5.30-5.31 (m, 1H) ppm.
파트 B: (S)-tert-부틸 (1-(4-브로모-2,3-디플루오로페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
DMF (10 mL) 중 4-브로모-2,3-디플루오로페놀 (50 mg, 0.239 mmol)의 용액에 탄산세슘 (78 mg, 0.239 mmol)을 첨가하고, 혼합물을 실온에서 10분 동안 교반하였다. (S)-tert-부틸 4-이소부틸-4-메틸-1,2,3-옥사티아졸리딘-3-카르복실레이트 2,2-디옥시드, 실시예 32, 파트 A-E에 기재된 바와 같이 제조됨 (70.2 mg, 0.239 mmol)를 첨가하고, 혼합물을 80℃로 8시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시켰다. 1.5N HCl (10 mL)을 잔류물에 첨가하고, 용액을 에틸 아세테이트 (20 mL)로 추출하였다. 유기 층을 분리하고, 황산나트륨 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (석유 에테르 중 0-15% EtOAc)에 의해 정제하여 (S)-tert-부틸 (1-(4-브로모-2,3-디플루오로페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (800 mg, 1.894 mmol, 57% 수율)를 회백색 반고체로서 수득하였다. 1H NMR (400 MHz, 클로로포름-d): δ 7.22 - 7.14 (m, 1H), 6.75 - 6.67 (m, 1H), 4.57 - 4.49 (m, 1H), 4.24 - 4.17 (m, 1H), 4.05 - 3.99 (m, 1H), 1.90 - 1.73 (m, 2H), 1.51 - 1.45 (m, 1H), 1.42 - 1.34 (m, 12H), 0.97 (dd, J=3.0, 6.5 Hz, 6H) ppm.
파트 C: (S)-tert-부틸 (1-(2,3-디플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (8 mL) 중 (S)-tert-부틸 (1-(4-브로모-2,3-디플루오로페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (500 mg, 1.184 mmol), 비스(피나콜레이토)디보론 (361 mg, 1.421 mmol) 및 아세트산칼륨 (290 mg, 2.96 mmol)의 용액에 PdCl2(dppf)-CH2Cl2 부가물 (48.3 mg, 0.059 mmol)을 첨가하고, 반응 혼합물을 80℃에서 12시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 감압 하에 농축시키고, 염수로 희석하고, 에틸 아세테이트 (20 mL)로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고 감압 하에 농축시켜 (S)-tert-부틸 (1-(2,3-디플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (160 mg, 0.341 mmol, 29% 수율)를 무색 반고체로서 수득하였다. 수득된 조 생성물을 후속 단계에 추가 정제 없이 사용하였다.
파트 D: (S)-tert-부틸 (1-(2,3-디플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트
1,4-디옥산 (1 mL) 중 4-클로로-2-메틸피리미딘 (25 mg, 0.194 mmol) 및 (S)-tert-부틸 (1-(2,3-디플루오로-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (91 mg, 0.194 mmol)의 용액에 물 (0.1 mL) 중 탄산세슘 (190 mg, 0.583 mmol)을 첨가하였다. 반응 혼합물을 아르곤으로 5분 동안 퍼징하였다. PdCl2(dppf)-CH2Cl2 부가물 (7.94 mg, 9.72 μmol)을 첨가하고, 반응 혼합물을 100℃로 16시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 에틸 아세테이트 (5 mL)로 희석하였다. 혼합물을 규조토 (셀라이트®)를 통해 여과하고, 층을 에틸 아세테이트 (5 mL)로 세척하였다. 여과물을 감압 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피 (석유 에테르 중 40% EtOAc)에 의해 정제하여 (S)-tert-부틸 (1-(2,3-디플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (20 mg, 0.046 mmol, 24% 수율)를 회백색 반고체로서 수득하였다. LCMS (ESI) m/e 436.5 [(M+H)+, 계산치 C23H32F2N3O3, 436.2]; LC/MS 체류시간 (방법 C): tR = 2.26분.
파트 E: (S)-1-(2,3-디플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민.
실온에서 DCM (0.5 mL) 중 (S)-tert-부틸 (1-(2,3-디플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-일)카르바메이트 (20 mg, 0.046 mmol)의 교반 용액에 1,4-디옥산 중 4M HCl (0.028 mL, 0.918 mmol)을 첨가하고, 반응 혼합물을 실온에서 4시간 동안 교반하였다. 혼합물을 감압 하에 농축시켰다. 조 물질을 정제용 LC/MS (방법 C)에 의해 정제하여 (S)-1-(2,3-디플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민 (13 mg, 0.038 mmol, 82% 수율)을 연황색 고체로서 수득하였다. LCMS (ESI) m/e 336.2 [(M+H)+, 계산치 C17H23ClN3O2, 336.3]; LC/MS 체류시간 (방법 D): tR = 2.28분: LC/MS 체류시간 (방법 E): tR = 1.01분. 1H NMR (400 MHz, 메탄올-d4): δ 8.72 (d, J = 5.60 Hz, 1H), 7.95-8.00 (m, 1H), 7.70-7.71 (m, 1H), 7.18-7.22 (m, 1H), 4.20-4.31 (m, 2H), 2.75 (s, 3H), 1.84-1.89 (m, 1H), 1.69-1.73 (m, 2H), 1.51 (s, 3H), 0.9 (m, 6H) ppm.
생물학적 데이터
방법
AAK1 키나제 검정
검정을 U-바닥 384-웰 플레이트에서 실행하였다. 검정 완충제 (10 mM 트리스-HCL pH 7.4, 10 mM MgCl2, 0.01% 트윈-20 및 1.0 mM DTT) 중 효소 및 기질 (플루오레세인화 펩티드 (5-FAM)-Aha-KEEQSQITSQVTGQIGWR-NH2 및 ATP) 및 시험 화합물의 15 μl 첨가로부터 제조된 최종 검정 부피는 30 μl였다. 박테리아 발현된 GST-Xa-hAAK1과 기질 및 시험 화합물의 조합에 의해 반응을 개시하였다. 반응물을 실온에서 3시간 동안 인큐베이션하고, 각각의 샘플에 35 mM EDTA 완충제 60 μl을 첨가함으로써 종결시켰다. 반응물을 형광 기질 및 인산화 생성물의 전기영동 분리에 의해 캘리퍼 랩칩(Caliper LabChip) 3000 (캘리퍼(Caliper), 홉킨턴, 매사추세츠주) 상에서 분석하였다. 100% 억제에 대한 EDTA 켄칭된 대조군 반응 및 0% 억제에 대한 비히클-단독 반응에 대해 비교하여 억제 데이터를 계산하였다. 검정에서 시약의 최종 농도는 ATP, 22 μM; (5-FAM)-Aha-KEEQSQITSQVTGQIGWR-NH2, 1.5 μM; GST-Xa-hAAK1, 3.5 nM; 및 DMSO, 1.6%였다. 용량 반응 곡선을 작성하여 키나제 활성의 50% 억제에 필요한 농도 (IC50)를 결정하였다. 화합물을 디메틸술폭시드 (DMSO) 중에 10 mM로 용해시키고, 11종의 농도에서 평가하였다. IC50 값을 비-선형 회귀 분석에 의해 도출하였다. 결과는 표 1에 제시된다.
표 1
AAK1 녹아웃 마우스
AAK1 유전자의 파괴를 위한 마우스 동형접합 (-/-)을 2종의 방법; 유전자 트랩핑 및 상동 재조합에 의해 제조하였다.
유전자 트랩핑은 리포터 또는 선택 마커 유전자를 코딩하는 DNA 단편을 돌연변이유발원으로서 사용하는 무작위 삽입 돌연변이유발 방법이다. 세포 스플라이싱 기구가 벡터 코딩된 엑손을 세포 mRNA로 스플라이싱하도록 하는 방식으로 인트론 또는 유전자에 통합되도록 유전자 트랩 벡터를 설계하였다. 통상적으로, 유전자 트랩 벡터는 강한 스플라이스 수용자 서열이 선행하고 프로모터는 선행하지 않는 선택 마커 서열을 함유한다. 따라서, 이러한 벡터가 유전자 내로 통합되는 경우에, 세포 스플라이싱 기구는 트랩핑된 유전자로부터의 엑손을 선택 마커 서열의 5' 말단 상에서 스플라이싱한다. 전형적으로, 이러한 선택 마커 유전자는 유전자를 코딩하는 벡터가 인트론에 통합된 경우에만 발현될 수 있다. 생성된 유전자 트랩 이벤트는 후속적으로 선택 배양에서 생존할 수 있는 세포를 선택함으로써 확인된다.
배아 줄기 세포 (뮤린 계통 A129로부터 유래된 Lex-1 세포)를 관심 유전자 내로 유전자 조작된 벡터 서열의 적어도 일부의 삽입을 수반하는 과정에 의해 돌연변이시키고, 돌연변이된 배아 줄기 세포를 배반포 내로 미세주사하고, 이를 후속적으로 가임신 암컷 숙주에 도입하고, 확립된 방법을 사용하여 수태시켰다. 예를 들어, 문헌 ["Mouse Mutagenesis", 1998, Zambrowicz et al., eds., Lexicon Press, The Woodlands, TX]을 참조한다. 생성된 키메라 동물을 후속적으로 번식시켜, 관심 유전자 내에 조작된 돌연변이를 함유하는 대립유전자의 배선 전달을 가능하게 하는 자손을 생산하였다.
AAK1-유전자 파괴된 마우스를 또한 상동 재조합에 의해 제조하였다. 이 경우에, 뮤린 AAK1 유전자 (진뱅크 수탁 번호 NM_177762 참조)의 제2 코딩 엑손을 관련 기술분야에 공지된 방법에 의해 제거하였다. 예를 들어, 미국 특허 번호 5,487,992, 5,627,059 및 5,789,215를 참조한다.
AAK1 유전자의 파괴에 대한 마우스 동형접합 (-/-)을 AAK1 유전자의 파괴에 대한 마우스 이형접합 (+/-) 및 야생형 (+/+) 한배 새끼와 함께 연구하였다. 이 분석 동안, 마우스를 포유동물 대상체의 주요 기관계의 기능을 평가하도록 설계된 통합된 한 묶음의 의료 진단 절차를 사용하여 의학적 정밀 검사에 적용하였다. 동형접합 (-/-) "녹아웃" 마우스를 그의 이형접합 (+/-) 및 야생형 (+/+) 한배 새끼와 함께 연구하였다. AAK1 유전자의 파괴를 서던(Southern) 분석에 의해 확인하였다. AAK1의 뮤린 상동체의 발현은 뮤린 뇌; 척수; 눈; 흉선; 비장; 폐; 신장; 간; 골격근; 골; 위, 소장 및 결장; 심장; 지방; 천식 폐; LPS 간; 혈액; 밴딩된 심장; 대동맥계; 전립선; 및 유선 (5주령 버진, 성숙한 버진, 12 DPC, 산후 3일 (수유중), 이유후 3일 (조기 퇴축) 및 이유후 7일 (후기 퇴축))에서 RT-PCR에 의해 검출하였다.
AAK1 동형접합 (-/-) 및 그의 야생형 (+/+) 한배새끼는 그의 급성 및 긴장성 침해수용성 반응을 평가하기 위해 포르말린 발 시험을 사용하여 시험하였다. 이들 시험을 위해, 자동 침해수용 분석기 (샌디에고 캘리포니아 대학교의 오자키(Ozaki) 실험실로부터 구입함)를 사용하였다. 금속 밴드를 시험 30분 전에 각각의 마우스의 좌측 뒷발 둘레에 놓았다. 30-분 순응 기간 후, 5% 포르말린 20 μl을 좌측 뒷발의 배측 표면에 피하로 주사하였다. 마우스를 원통형 챔버에 45분 동안 개별 하우징하였다. 새로운 5% 포르말린 용액을, 포름알데히드 (포름알드-프레시(formalde-fresh) 20%, 피셔 사이언티픽(Fisher Scientific)(뉴저지주 페어 론))를 증류수로 희석함으로써 제조하였다. 조사 화합물을 포르말린 주사 30분 전에 투여하였다.
컴퓨터는 전자기장을 통해, 분당 움찔함, I기 (급성기 = 처음 8분) 동안의 총 움찔함, 및 II기 (긴장기 = 20 - 40분 사이의 시간) 동안의 총 움찔함을 기록하였다. 문헌 [Yaksh TL, Ozaki G, McCumber D, Rathbun M, Svensson C, Malkmus S, Yaksh MC. An automated flinch detecting system for use in the formalin nociceptive bioassay. J Appl Physiol., 2001; 90:2386-402]을 참조한다. 도 1에 제시된 바와 같이, 1기 및 2기 데이터를 동형접합 (-/-) 마우스 암컷 (n = 16), 야생형 암컷 (n = 15), 동형접합 (-/-) 마우스 수컷 (n = 9) 및 야생형 수컷 (n = 18)을 사용하여 수득하였다. 모든 군에서 및 상기 기 둘 다에서, AAK1 동형접합 (-/-) 마우스는 그의 야생형 (+/+) 한배새끼보다 상당히 더 적게 기록된 발 움찔하기를 나타내었다.
본 개시내용이 상기 예시적인 실시예에 제한되지 않고, 그의 본질적인 속성으로부터 벗어나지 않으면서 다른 구체적 형태로도 구현될 수 있다는 것이 관련 기술분야의 통상의 기술자에게 명백할 것이다. 따라서, 실시예는 모든 측면에서 제한하는 것이 아니라 예시적인 것으로 고려되며, 상기 실시예보다는 첨부된 청구범위를 참조하고, 이에 따라 청구범위의 등가의 의미 및 범위 내에 있는 모든 변화가 그 안에 포괄되도록 의도되는 것이 바람직하다.
SEQUENCE LISTING
<110> BRISTOL-MYERS SQUIBB COMPANY
<120> BIARYL KINASE INHIBITORS
<130> 12587-WO-PCT
<150> Indian 3170/DEL/15
<151> 2015-10-01
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> fluoresceinated peptide
<400> 1
Lys Glu Glu Gln Ser Gln Ile Thr Ser Gln Val Thr Gly Gln Ile Gly
1 5 10 15
Trp Arg
Claims (7)
- 하기로부터 선택된 화합물, 또는 그의 제약상 허용되는 염.
(R)-2,4-디메틸-1-((3-메틸-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)펜탄-2-아민;
(S)-2,4-디메틸-1-((3-메틸-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)펜탄-2-아민;
메틸 5-(2-아미노-4-메틸-2-(트리플루오로메틸)펜틸옥시)-6-메틸-2,4'-비피리딘-2'-일카르바메이트;
1,1,1-트리플루오로-4-메틸-2-(((3-메틸-5-(2-메틸피리미딘-4-일)피리딘-2-일)옥시)메틸)펜탄-2-아민;
(S)-6-(4-((2-아미노-2, 4-디메틸펜틸) 옥시)-3-(트리플루오로메틸) 페닐) 피리미딘-4-아민;
(S)-1-((2-(플루오로메틸)-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민;
(S)-메틸 (5-((2-아미노-2,4-디메틸펜틸)옥시)-6-(플루오로메틸)-[2,4'-비피리딘]-2'-일)카르바메이트;
(S)-6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리미딘-4-아민;
(S)-2,4-디메틸-1-(4-(2-메틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민;
(S)-4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-아민;
(S)-2,4-디메틸-1-((5-(2-메틸피리미딘-4-일)-3-(옥사졸-5-일)피리딘-2-일)옥시)펜탄-2-아민;
(S)-2,4-디메틸-1-((6-(2-메틸피리미딘-4-일)-4-(옥사졸-5-일)피리딘-3-일)옥시)펜탄-2-아민;
(S)-메틸 (5-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리다진-3-일)카르바메이트;
(S)-메틸 (5-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리다진-3-일)카르바메이트;
(R)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-클로로피리딘-3-일)피리미딘-2-일)카르바메이트;
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-시아노페닐)피리미딘-2-일)카르바메이트;
(S)-메틸(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트;
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리미딘-2-일)카르바메이트;
(S)-1-(2-클로로-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-2,4-디메틸-1-(4-(6-메틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민;
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-플루오로페닐)피리미딘-2-일)카르바메이트;
(S)-이소프로필 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트;
(S)-메틸 (4-(5-((2-아미노-2,4 디메틸펜틸)옥시)-6-메틸피리딘-2-일)피리미딘-2-일)카르바메이트;
(S)-4-(5-((2-아미노-2,4-디메틸펜틸)옥시)-6-메틸피리딘-2-일)피리미딘-2-아민;
(S)-에틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-2-일)카르바메이트;
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-(디플루오로메틸)피리미딘-4-일)벤조니트릴;
(S)-1-(4-(2-메톡시피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3 (트리플루오로메틸)페닐)피리미딘-2-올;
(S)-1-((4-(디플루오로메틸)-6-(6-메틸피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민;
(S)-1-((2-(디플루오로메틸)-6-(2-(디플루오로메틸)피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민;
(S)-1-((6-(플루오로메틸)-2'-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민;
(S)-메틸 (4-(5-((2-아미노-2,4-디메틸펜틸)옥시)-6-(디플루오로메틸)피리딘-2-일)피리미딘-2-일)카르바메이트;
(S)-1-((2',6-비스(플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민;
(S)-1-((2'-(디플루오로메틸)-6-(플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민;
2',6-비스(디플루오로메틸)-5-((2-이소부틸아제티딘-2-일)메톡시)-2,4'-비피리딘;
(S)-2,4-디메틸-1-(4-(2-메틸-1H-피롤로[2,3-b]피리딘-4-일)-2- (트리플루오로메틸) 페녹시) 펜탄-2-아민;
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-메틸-1H-피롤로[2,3-b]피리딘-4-일)벤조니트릴;
(S)-2,4-디메틸-1-(2-메틸-4-(2-메틸피리미딘-4-일)페녹시)펜탄-2-아민;
(S)-2,4-디메틸-1-(2-메틸-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)펜탄-2-아민;
(S)-1-(2-플루오로-4-(2-(트리플루오로메틸)피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-1-(2-플루오로-4-(2-이소프로필피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-6-(5-((2-아미노-2,4-디메틸펜틸)옥시)-6-메틸피리딘-2-일)피리미딘-4-아민;
(S)-1-((2'-플루오로-4-메틸-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민;
(S)-2,4-디메틸-1-((6-메틸-2'-(트리플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)펜탄-2-아민;
(S)-2,4-디메틸-1-((4-메틸-2'-(트리플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)펜탄-2-아민;
(S)-1-(2-(디플루오로메틸)-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-1-(2-(플루오로메틸)-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민;
(R)-2,4-디메틸-1-((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)펜탄-2-아민;
(S)-1-((6-(디플루오로메틸)-2'-(플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민;
(S)-1-((6-(디플루오로메틸)-2'-(트리플루오로메틸)-[2,4'-비피리딘]-5-일)옥시)-2,4-디메틸펜탄-2-아민;
(S)-2,4-디메틸-1-(5-메틸-2-(피리딘-4-일)티아졸-4-일옥시)펜탄-2-아민;
1,1,1-트리플루오로-4-메틸-2-(((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)메틸)펜탄-2-아민;
(S)-1-(4-(2-클로로피리미딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-아민;
(S)-1-(4-(2-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민;
(R)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메틸피리딘-3-일)피리미딘-2-일)카르바메이트;
(R)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-플루오로피리딘-3-일)피리미딘-2-일)카르바메이트;
(S)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-4-메틸피리딘-3-일)피리미딘-2-일)카르바메이트;
(S)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-클로로피리딘-3-일)피리미딘-2-일)카르바메이트;
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-클로로피리미딘-4-일)벤조니트릴;
(S)-메틸 (4-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메틸피리딘-3-일)피리미딘-2-일)카르바메이트;
(S)-1-(2-클로로-4-(2-클로로피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-1-(2-(디플루오로메틸)-4-(2-메톡시피리딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-2,4-디메틸-1-(2-메틸-4-(6-메틸피리미딘-4-일)페녹시)펜탄-2-아민;
(S)-6-((2-아미노-2,4-디메틸펜틸)옥시)-2'-메톡시-[3,4'-비피리딘]-5-카르보니트릴;
(S)-1-(4-(2-메톡시피리딘-4-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-아민;
(S)-1-((2-(플루오로메틸)-6-(6-메틸피리미딘-4-일)피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민;
(S)-메틸 (4-(5-((2-아미노-2,4-디메틸펜틸)옥시)-6-(플루오로메틸)피리딘-2-일)피리미딘-2-일)카르바메이트;
(S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-일)-3-메틸부탄아미드;
N-(4-(4-(((S)-2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-일)-3-메틸펜탄아미드;
(S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-일)-4-메틸펜탄아미드;
(S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-일)-5-메틸이속사졸-3-카르복스아미드;
(S)-N-(4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리딘-2-일)-5-이소프로필-1H-피라졸-3-카르복스아미드;
(S)-4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)-N-(피리딘-3-일메틸)피리딘-2-아민;
(S)-4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)-N-(푸란-2-일메틸)피리딘-2-아민;
(S)-4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)-N-(벤조 [d][1,3]디옥솔-5-일)피리딘-2-아민;
(S)-4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-플루오로페닐)-6-메틸-6,7-디히드로-5H-피롤로[3,4-b]피리딘-5-온;
(S)-5-((2-아미노-2,4-디메틸펜틸)옥시)-6-메틸-[2,4'-비피리딘]-2'-아민;
(S)-6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리미딘-4-아민;
(S)-메틸 (6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-(트리플루오로메틸)페닐)피리미딘-4-일)카르바메이트;
(S)-메틸 (6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리미딘-4-일)카르바메이트;
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-메틸페닐)피리미딘-2-일)카르바메이트;
(S)-1-(2,5-디플루오로-4-(6-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(6-메틸피리미딘-4-일)벤조니트릴;
(S)-메틸 (6-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-클로로피리딘-3-일)피리미딘-4-일)카르바메이트;
(S)-메틸 (6-(6-((2-아미노-2,4-디메틸펜틸)옥시)-5-메틸피리딘-3-일)피리미딘-4-일)카르바메이트;
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(6-메톡시피리미딘-4-일)벤조니트릴;
(S)-1-(4-(6-메톡시피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(6-클로로피리미딘-4-일)벤조니트릴;
(S)-1-(4-(6-클로로피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(6-에틸피리미딘-4-일)벤조니트릴;
(S)-1-(4-(6-에틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-1-((3-클로로-5-(6-메틸피리미딘-4-일)피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민;
(S)-2,4-디메틸-1-((3-메틸-5-(6-메틸피리미딘-4-일)피리딘-2-일)옥시)펜탄-2-아민;
(S)-1-((5-(6-에틸피리미딘-4-일)-3-메틸피리딘-2-일)옥시)-2,4-디메틸펜탄-2-아민;
(S)-2,4-디메틸-1-((4-메틸-6-(6-메틸피리미딘-4-일)피리딘-3-일)옥시)펜탄-2-아민;
(S)-1-((6-(2-클로로피리미딘-4-일)-2-메틸피리딘-3-일)옥시)-2,4-디메틸펜탄-2-아민;
(S)-2,4-디메틸-1-((6-(2-메틸피리미딘-4-일)-2-(트리플루오로메틸)피리딘-3-일)옥시)펜탄-2-아민;
(S)-2-(2-아미노-2, 4-디메틸펜틸옥시)-5-(2-메틸피리미딘-4-일) 벤조니트릴;
(S)-1-(2-플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-1-(2-클로로-4-(2-(트리플루오로메틸) 피리미딘-4-일) 페녹시)-2, 4-디메틸펜탄-2-아민;
(S)-1-(2-클로로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-2-(2-아미노-2,4-디메틸펜틸옥시)-5-(2-(트리플루오로메틸)피리미딘-4-일)벤조니트릴;
(S)-1-(4-(2,6-디메틸피리미딘-4-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-1-(2-클로로-4-(2-이소프로필피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-2,4-디메틸-1-(4-(2-메틸티에노[2,3-d]피리미딘-4-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민;
(S)-1-(2-클로로-4-(2-시클로프로필피라졸로[1,5-a]피리미딘-7-일)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-1-(4-(2-시클로프로필피라졸로[1,5-a]피리미딘-7-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-2,4-디메틸-1-(2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일옥시)펜탄-2-아민;
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-(트리플루오로메틸)피라졸로[1,5-a]피리미딘-7-일)벤조니트릴;
(S)-5-((2-아미노-2,4-디메틸펜틸)옥시)-2-(피라졸로[1,5-a]피리미딘-7-일)이소니코티노니트릴;
(S)-5-(2-아미노-2,4-디메틸펜틸옥시)-2-(2-메틸피리미딘-4-일)이소니코티노니트릴;
(S)-2,4-디메틸-1-((2-메틸-6-(피라졸로[1,5-a]피리미딘-7-일)피리딘-3-일)옥시)펜탄-2-아민;
(S)-1-(2,5-디플루오로-4-(피라졸로[1,5-a]피리미딘-7-일)페녹시)-2,4-디메틸펜탄-2-아민;
1,1,1-트리플루오로-4-메틸-2-(((2-메틸-6-(피라졸로[1,5-a]피리미딘-7-일)피리딘-3-일)옥시)메틸)펜탄-2-아민;
1,1,1-트리플루오로-4-메틸-2-(((2-메틸-6-(2-메틸피리미딘-4-일)피리딘-3-일)옥시)메틸)펜탄-2-아민;
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-메틸이미다조[1,2-b]피리다진-8-일)벤조니트릴;
(S)-1-(4-(2-시클로프로필이미다조[1,2-b]피리다진-8-일)-2-플루오로페녹시)-2,4-디메틸펜탄-2-아민;
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(6-클로로-2-시클로프로필이미다조[1,2-b]피리다진-8-일)벤조니트릴;
(S)-1-(4-(6-클로로-2-메틸이미다조[1,2-b]피리다진-8-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-1-(4-(6-클로로-2-시클로프로필이미다조[1,2-b]피리다진-8-일)-2-(트리플루오로메틸)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-1-(2-플루오로-4-(2-메틸이미다조[1,2-b]피리다진-8-일)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-2,4-디메틸-1-(4-(2-메틸이미다조[1,2-b]피리다진-8-일)-2-(트리플루오로메틸)페녹시)펜탄-2-아민;
(S)-2-((2-아미노-2,4-디메틸펜틸)옥시)-5-(2-시클로프로필이미다조[1,2-b]피리다진-8-일)벤조니트릴;
(S)-2,4-디메틸-1-(2-메틸-4-(2-(트리플루오로메틸)이미다조[1,2-b]피리다진-8-일)페녹시)펜탄-2-아민;
(S)-2,4-디메틸-1-(4-(2-(트리플루오로메틸)이미다조[1,2-b]피리다진-8-일)페녹시)펜탄-2-아민;
(S)-1-(4-(이미다조[1,2-b]피리다진-3-일)-2-메틸페녹시)-2,4-디메틸펜탄-2-아민;
(S)-1-(2-클로로-4-(이미다조[1,2-b]피리다진-3-일)페녹시)-2,4-디메틸펜탄-2-아민;
(R)-2,4-디메틸-1-((3-메틸-5-(2-(트리플루오로메틸)이미다조[1,2-b]피리다진-8-일)피리딘-2-일)옥시)펜탄-2-아민;
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)페닐)피리미딘-2-일)카르바메이트;
(S)-1-(2,5-디플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민;
(S)-메틸 (6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-2,5-디플루오로페닐)피리미딘-4-일)카르바메이트;
(S)-메틸 (4-(4-((2-아미노-2,4-디메틸펜틸)옥시)-2,5-디플루오로페닐)피리미딘-2-일)카르바메이트;
(S)-6-(4-((2-아미노-2,4-디메틸펜틸)옥시)-3-클로로페닐)피리미딘-4(3H)-온;
(S)-1-(4-(2-(디플루오로메틸)피리딘-4-일)-2,5-디플루오로페녹시)-2,4-디메틸펜탄-2-아민; 및
(S)-1-(2,3-디플루오로-4-(2-메틸피리미딘-4-일)페녹시)-2,4-디메틸펜탄-2-아민. - 치료 유효량의 제1항의 화합물, 또는 그의 제약상 허용되는 염을 포함하는, 알츠하이머병, 양극성 장애, 통증, 파킨슨병 또는 정신분열증의 치료 또는 관리를 필요로 하는 환자에서 알츠하이머병, 양극성 장애, 통증, 파킨슨병 또는 정신분열증을 치료 또는 관리하기 위한 제약 조성물.
- 제2항에 있어서, 통증이 신경병증성 통증인 제약 조성물.
- 제3항에 있어서, 신경병증성 통증이 섬유근육통 또는 말초 신경병증인 제약 조성물.
- 삭제
- 삭제
- 삭제
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| IN3170/DEL/15 | 2015-10-01 | ||
| IN3170DE2015 | 2015-10-01 | ||
| PCT/US2016/054471 WO2017059085A1 (en) | 2015-10-01 | 2016-09-29 | Biaryl kinase inhibitors |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20180056765A KR20180056765A (ko) | 2018-05-29 |
| KR102704295B1 true KR102704295B1 (ko) | 2024-09-05 |
Family
ID=57190217
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187011874A KR102704295B1 (ko) | 2015-10-01 | 2016-09-29 | 비아릴 키나제 억제제 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US10544120B2 (ko) |
| EP (1) | EP3356340B1 (ko) |
| JP (1) | JP6785302B2 (ko) |
| KR (1) | KR102704295B1 (ko) |
| CN (2) | CN112142655A (ko) |
| ES (1) | ES2765730T3 (ko) |
| WO (1) | WO2017059085A1 (ko) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SG11201608195QA (en) | 2014-04-02 | 2016-10-28 | Bristol Myers Squibb Co | Biaryl kinase inhibitors |
| KR102704295B1 (ko) | 2015-10-01 | 2024-09-05 | 브리스톨-마이어스 스큅 컴퍼니 | 비아릴 키나제 억제제 |
| ES2767776T3 (es) | 2015-10-01 | 2020-06-18 | Bristol Myers Squibb Co | Inhibidores de biaril cinasa |
| US10633341B2 (en) | 2016-12-19 | 2020-04-28 | Novartis Ag | Picolinic acid derivatives and their use as intermediates |
| CN111995583A (zh) * | 2020-08-18 | 2020-11-27 | 上海毕得医药科技有限公司 | 一种1,5-二甲基嘧啶-2(1h)-酮的合成方法 |
| MX2024000807A (es) * | 2021-07-15 | 2024-02-06 | Xizang Haisco Pharmaceutical Co Ltd | Inhibidor de aak1 y uso de este. |
| AU2023228568A1 (en) * | 2022-03-01 | 2024-08-15 | Lexicon Pharmaceuticals, Inc. | Methods and compounds useful in the synthesis of an aak1 inhibitor |
| TW202423433A (zh) * | 2022-11-10 | 2024-06-16 | 大陸商西藏海思科製藥有限公司 | 含aak1抑制劑的藥物组合物 |
| WO2024153067A1 (zh) * | 2023-01-16 | 2024-07-25 | 上海海雁医药科技有限公司 | 杂环取代的含氮杂环衍生物、其药物组合物及应用与制备方法 |
| WO2024207945A1 (zh) * | 2023-04-07 | 2024-10-10 | 艾立康药业股份有限公司 | 作为aak1抑制剂的氮杂环类化合物 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013134036A1 (en) | 2012-03-09 | 2013-09-12 | Bristol-Myers Squibb Company | Aryl ether-base kinase inhibitors |
| WO2015153720A1 (en) | 2014-04-02 | 2015-10-08 | Bristol-Myers Squibb Company | Biaryl kinase inhibitors |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2507406A1 (en) | 2002-11-05 | 2004-05-21 | Vertex Pharmaceuticals Incorporated | Compounds useful as inhibitors of jak and other protein kinases |
| CN112244015B (zh) * | 2012-02-29 | 2022-05-17 | 株式会社Mmag | 包括新型亚氨基吡啶衍生物的有害物防治组合物 |
| AU2013230066A1 (en) | 2012-03-09 | 2014-09-25 | Lexicon Pharmaceuticals, Inc. | Inhibition of adaptor associated kinase 1 for the treatment of pain |
| US8901305B2 (en) * | 2012-07-31 | 2014-12-02 | Bristol-Myers Squibb Company | Aryl lactam kinase inhibitors |
| US9708337B2 (en) | 2013-02-22 | 2017-07-18 | Bristol-Myers Squibb Company | Aryl amide-based kinase inhibitors |
| EP3019475A1 (en) | 2013-07-08 | 2016-05-18 | Bristol-Myers Squibb Company | Aryl amide kinase inhibitors |
| JP6243539B2 (ja) | 2013-09-11 | 2017-12-06 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | アリールエーテルをベースとするキナーゼ阻害剤 |
| WO2015040116A1 (en) * | 2013-09-19 | 2015-03-26 | Basf Se | N-acylimino heterocyclic compounds |
| JP6276865B2 (ja) | 2014-01-29 | 2018-02-07 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | アリールラクタムキナーゼ阻害剤 |
| EA201691397A1 (ru) | 2014-01-31 | 2016-11-30 | Бристол-Майерс Сквибб Компани | Хинолиновые ингибиторы киназы |
| WO2016053794A1 (en) | 2014-09-30 | 2016-04-07 | Bristol-Myers Squibb Company | Quinazoline-based kinase inhibitors |
| WO2016164295A2 (en) | 2015-04-10 | 2016-10-13 | Bristol-Myers Squibb Company | Fused pyridines as kinase inhibitors |
| ES2767776T3 (es) | 2015-10-01 | 2020-06-18 | Bristol Myers Squibb Co | Inhibidores de biaril cinasa |
| KR102704295B1 (ko) | 2015-10-01 | 2024-09-05 | 브리스톨-마이어스 스큅 컴퍼니 | 비아릴 키나제 억제제 |
-
2016
- 2016-09-29 KR KR1020187011874A patent/KR102704295B1/ko active IP Right Grant
- 2016-09-29 CN CN202010986635.9A patent/CN112142655A/zh active Pending
- 2016-09-29 WO PCT/US2016/054471 patent/WO2017059085A1/en active Application Filing
- 2016-09-29 CN CN201680070440.1A patent/CN108368084B/zh active Active
- 2016-09-29 JP JP2018516713A patent/JP6785302B2/ja active Active
- 2016-09-29 US US15/763,280 patent/US10544120B2/en active Active
- 2016-09-29 ES ES16785279T patent/ES2765730T3/es active Active
- 2016-09-29 EP EP16785279.7A patent/EP3356340B1/en active Active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013134036A1 (en) | 2012-03-09 | 2013-09-12 | Bristol-Myers Squibb Company | Aryl ether-base kinase inhibitors |
| WO2015153720A1 (en) | 2014-04-02 | 2015-10-08 | Bristol-Myers Squibb Company | Biaryl kinase inhibitors |
Also Published As
| Publication number | Publication date |
|---|---|
| JP6785302B2 (ja) | 2020-11-18 |
| EP3356340B1 (en) | 2019-10-23 |
| US10544120B2 (en) | 2020-01-28 |
| KR20180056765A (ko) | 2018-05-29 |
| ES2765730T3 (es) | 2020-06-10 |
| JP2018537408A (ja) | 2018-12-20 |
| EP3356340A1 (en) | 2018-08-08 |
| US20180346440A1 (en) | 2018-12-06 |
| WO2017059085A1 (en) | 2017-04-06 |
| CN108368084A (zh) | 2018-08-03 |
| CN112142655A (zh) | 2020-12-29 |
| CN108368084B (zh) | 2020-10-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10981910B2 (en) | Biaryl kinase inhibitors | |
| KR102704295B1 (ko) | 비아릴 키나제 억제제 | |
| KR102707968B1 (ko) | 비아릴 키나제 억제제 | |
| US20140038999A1 (en) | Aryl Lactam Kinase Inhibitors | |
| US10174044B2 (en) | Fused pyridines as kinase inhibitors | |
| NZ725814B2 (en) | Biaryl kinase inhibitors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant |