KR102547298B1 - 복수 종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 - Google Patents
복수 종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 Download PDFInfo
- Publication number
- KR102547298B1 KR102547298B1 KR1020180020359A KR20180020359A KR102547298B1 KR 102547298 B1 KR102547298 B1 KR 102547298B1 KR 1020180020359 A KR1020180020359 A KR 1020180020359A KR 20180020359 A KR20180020359 A KR 20180020359A KR 102547298 B1 KR102547298 B1 KR 102547298B1
- Authority
- KR
- South Korea
- Prior art keywords
- substituted
- unsubstituted
- formula
- alkyl
- heteroaryl
- Prior art date
Links
- 239000000463 material Substances 0.000 title claims abstract description 56
- 150000001875 compounds Chemical class 0.000 claims abstract description 102
- 125000003118 aryl group Chemical group 0.000 claims description 53
- 125000001072 heteroaryl group Chemical group 0.000 claims description 48
- 125000000923 (C1-C30) alkyl group Chemical group 0.000 claims description 35
- 125000005104 aryl silyl group Chemical group 0.000 claims description 28
- 239000002019 doping agent Substances 0.000 claims description 25
- 125000004432 carbon atom Chemical group C* 0.000 claims description 23
- 125000001769 aryl amino group Chemical group 0.000 claims description 22
- 125000005842 heteroatom Chemical group 0.000 claims description 22
- 229910052757 nitrogen Inorganic materials 0.000 claims description 20
- 229910052717 sulfur Chemical group 0.000 claims description 19
- 229910052760 oxygen Inorganic materials 0.000 claims description 18
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 15
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 14
- 125000002950 monocyclic group Chemical group 0.000 claims description 14
- 125000001424 substituent group Chemical group 0.000 claims description 14
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 13
- 229910052739 hydrogen Inorganic materials 0.000 claims description 13
- 150000002431 hydrogen Chemical class 0.000 claims description 13
- 239000001257 hydrogen Substances 0.000 claims description 13
- 229910052736 halogen Inorganic materials 0.000 claims description 12
- 150000002367 halogens Chemical class 0.000 claims description 12
- 239000000126 substance Substances 0.000 claims description 12
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 claims description 11
- 125000002723 alicyclic group Chemical group 0.000 claims description 11
- 229910052805 deuterium Inorganic materials 0.000 claims description 11
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 claims description 10
- 125000003545 alkoxy group Chemical group 0.000 claims description 10
- 125000000732 arylene group Chemical group 0.000 claims description 10
- 239000011593 sulfur Chemical group 0.000 claims description 10
- 125000003282 alkyl amino group Chemical group 0.000 claims description 8
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 8
- 229910052796 boron Inorganic materials 0.000 claims description 8
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 claims description 8
- 239000001301 oxygen Chemical group 0.000 claims description 8
- 229910052710 silicon Inorganic materials 0.000 claims description 8
- 125000006822 tri(C1-C30) alkylsilyl group Chemical group 0.000 claims description 8
- 229910052698 phosphorus Inorganic materials 0.000 claims description 7
- 125000005549 heteroarylene group Chemical group 0.000 claims description 6
- 125000000304 alkynyl group Chemical group 0.000 claims description 5
- 238000000034 method Methods 0.000 claims description 5
- 125000000739 C2-C30 alkenyl group Chemical group 0.000 claims description 3
- 125000000217 alkyl group Chemical group 0.000 claims description 3
- 125000000592 heterocycloalkyl group Chemical group 0.000 claims description 3
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims description 2
- 125000004947 alkyl aryl amino group Chemical group 0.000 claims description 2
- 125000004448 alkyl carbonyl group Chemical group 0.000 claims description 2
- 125000005107 alkyl diaryl silyl group Chemical group 0.000 claims description 2
- 125000004414 alkyl thio group Chemical group 0.000 claims description 2
- 125000005129 aryl carbonyl group Chemical group 0.000 claims description 2
- 125000005110 aryl thio group Chemical group 0.000 claims description 2
- 125000004104 aryloxy group Chemical group 0.000 claims description 2
- 229910052799 carbon Inorganic materials 0.000 claims description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 2
- 125000005105 dialkylarylsilyl group Chemical group 0.000 claims description 2
- 125000005843 halogen group Chemical group 0.000 claims description 2
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 2
- 125000005415 substituted alkoxy group Chemical group 0.000 claims description 2
- 125000000547 substituted alkyl group Chemical group 0.000 claims description 2
- 125000003107 substituted aryl group Chemical group 0.000 claims description 2
- 125000005346 substituted cycloalkyl group Chemical group 0.000 claims description 2
- 125000004665 trialkylsilyl group Chemical group 0.000 claims description 2
- 125000005106 triarylsilyl group Chemical group 0.000 claims description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims 1
- 239000010410 layer Substances 0.000 description 106
- -1 benzofluorenyl Chemical group 0.000 description 26
- 238000002347 injection Methods 0.000 description 21
- 239000007924 injection Substances 0.000 description 21
- 102100039856 Histone H1.1 Human genes 0.000 description 13
- 101001035402 Homo sapiens Histone H1.1 Proteins 0.000 description 13
- 230000000052 comparative effect Effects 0.000 description 12
- 230000005525 hole transport Effects 0.000 description 12
- 230000000903 blocking effect Effects 0.000 description 11
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical class C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 11
- 238000004519 manufacturing process Methods 0.000 description 11
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 10
- 238000001771 vacuum deposition Methods 0.000 description 10
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 9
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 9
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 9
- 239000007787 solid Substances 0.000 description 9
- 125000004429 atom Chemical group 0.000 description 8
- 239000000203 mixture Substances 0.000 description 8
- 238000002360 preparation method Methods 0.000 description 8
- 238000006243 chemical reaction Methods 0.000 description 7
- 239000011368 organic material Substances 0.000 description 7
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 238000004768 lowest unoccupied molecular orbital Methods 0.000 description 6
- 229910052751 metal Inorganic materials 0.000 description 6
- 239000002184 metal Substances 0.000 description 6
- 125000001624 naphthyl group Chemical group 0.000 description 6
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 6
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 5
- 238000004440 column chromatography Methods 0.000 description 5
- 125000004122 cyclic group Chemical group 0.000 description 5
- 238000000151 deposition Methods 0.000 description 5
- 239000012153 distilled water Substances 0.000 description 5
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 5
- 238000004770 highest occupied molecular orbital Methods 0.000 description 5
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 5
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- 125000006736 (C6-C20) aryl group Chemical group 0.000 description 4
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical group CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 4
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 4
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 4
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 4
- 239000010949 copper Substances 0.000 description 4
- 230000005684 electric field Effects 0.000 description 4
- 238000001704 evaporation Methods 0.000 description 4
- 239000010408 film Substances 0.000 description 4
- 238000001953 recrystallisation Methods 0.000 description 4
- 125000003003 spiro group Chemical group 0.000 description 4
- 239000000758 substrate Substances 0.000 description 4
- YNPNZTXNASCQKK-UHFFFAOYSA-N Phenanthrene Natural products C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 description 3
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 3
- 235000010290 biphenyl Nutrition 0.000 description 3
- 239000004305 biphenyl Substances 0.000 description 3
- 150000004770 chalcogenides Chemical class 0.000 description 3
- 125000005509 dibenzothiophenyl group Chemical group 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 229910052741 iridium Inorganic materials 0.000 description 3
- GKOZUEZYRPOHIO-UHFFFAOYSA-N iridium atom Chemical compound [Ir] GKOZUEZYRPOHIO-UHFFFAOYSA-N 0.000 description 3
- 229910001507 metal halide Inorganic materials 0.000 description 3
- 150000005309 metal halides Chemical class 0.000 description 3
- 229910044991 metal oxide Inorganic materials 0.000 description 3
- 150000004706 metal oxides Chemical class 0.000 description 3
- 150000002739 metals Chemical class 0.000 description 3
- 125000001792 phenanthrenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C=CC12)* 0.000 description 3
- 125000005493 quinolyl group Chemical group 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 239000010409 thin film Substances 0.000 description 3
- 125000003837 (C1-C20) alkyl group Chemical group 0.000 description 2
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- JKHCVYDYGWHIFJ-UHFFFAOYSA-N Clc1nc(nc(n1)-c1ccc(cc1)-c1ccccc1)-c1ccccc1 Chemical compound Clc1nc(nc(n1)-c1ccc(cc1)-c1ccccc1)-c1ccccc1 JKHCVYDYGWHIFJ-UHFFFAOYSA-N 0.000 description 2
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 2
- 238000003775 Density Functional Theory Methods 0.000 description 2
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 2
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 2
- FBVBNCGJVKIEHH-UHFFFAOYSA-N [1]benzofuro[3,2-b]pyridine Chemical class C1=CN=C2C3=CC=CC=C3OC2=C1 FBVBNCGJVKIEHH-UHFFFAOYSA-N 0.000 description 2
- 125000003342 alkenyl group Chemical group 0.000 description 2
- 229910052782 aluminium Inorganic materials 0.000 description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 125000005874 benzothiadiazolyl group Chemical group 0.000 description 2
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 229910052802 copper Inorganic materials 0.000 description 2
- 230000005281 excited state Effects 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- 125000002883 imidazolyl group Chemical group 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 2
- 125000001041 indolyl group Chemical group 0.000 description 2
- 125000000904 isoindolyl group Chemical group C=1(NC=C2C=CC=CC12)* 0.000 description 2
- 229940078552 o-xylene Drugs 0.000 description 2
- 239000012044 organic layer Substances 0.000 description 2
- 229910052762 osmium Inorganic materials 0.000 description 2
- SYQBFIAQOQZEGI-UHFFFAOYSA-N osmium atom Chemical compound [Os] SYQBFIAQOQZEGI-UHFFFAOYSA-N 0.000 description 2
- 230000001590 oxidative effect Effects 0.000 description 2
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 2
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 2
- 125000004934 phenanthridinyl group Chemical group C1(=CC=CC2=NC=C3C=CC=CC3=C12)* 0.000 description 2
- 125000000843 phenylene group Chemical group C1(=C(C=CC=C1)*)* 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 125000003373 pyrazinyl group Chemical group 0.000 description 2
- 125000003226 pyrazolyl group Chemical group 0.000 description 2
- 125000002098 pyridazinyl group Chemical group 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- 125000000714 pyrimidinyl group Chemical group 0.000 description 2
- 125000000168 pyrrolyl group Chemical group 0.000 description 2
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 2
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 2
- 229910052761 rare earth metal Inorganic materials 0.000 description 2
- 150000002910 rare earth metals Chemical class 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 230000027756 respiratory electron transport chain Effects 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 229910000029 sodium carbonate Inorganic materials 0.000 description 2
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 2
- 239000002344 surface layer Substances 0.000 description 2
- 125000001935 tetracenyl group Chemical group C1(=CC=CC2=CC3=CC4=CC=CC=C4C=C3C=C12)* 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- 125000005247 tetrazinyl group Chemical group N1=NN=NC(=C1)* 0.000 description 2
- 125000003831 tetrazolyl group Chemical group 0.000 description 2
- 229910052723 transition metal Inorganic materials 0.000 description 2
- 150000003624 transition metals Chemical class 0.000 description 2
- 125000004306 triazinyl group Chemical group 0.000 description 2
- 125000001425 triazolyl group Chemical group 0.000 description 2
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 2
- BWHDROKFUHTORW-UHFFFAOYSA-N tritert-butylphosphane Chemical compound CC(C)(C)P(C(C)(C)C)C(C)(C)C BWHDROKFUHTORW-UHFFFAOYSA-N 0.000 description 2
- JWZZKOKVBUJMES-UHFFFAOYSA-N (+-)-Isoprenaline Chemical compound CC(C)NCC(O)C1=CC=C(O)C(O)=C1 JWZZKOKVBUJMES-UHFFFAOYSA-N 0.000 description 1
- 125000006749 (C6-C60) aryl group Chemical group 0.000 description 1
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical compound C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 description 1
- YJTKZCDBKVTVBY-UHFFFAOYSA-N 1,3-Diphenylbenzene Chemical group C1=CC=CC=C1C1=CC=CC(C=2C=CC=CC=2)=C1 YJTKZCDBKVTVBY-UHFFFAOYSA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical class C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 1
- 125000004973 1-butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000004972 1-butynyl group Chemical group [H]C([H])([H])C([H])([H])C#C* 0.000 description 1
- 125000006017 1-propenyl group Chemical group 0.000 description 1
- 125000000530 1-propynyl group Chemical group [H]C([H])([H])C#C* 0.000 description 1
- MYKQKWIPLZEVOW-UHFFFAOYSA-N 11h-benzo[a]carbazole Chemical compound C1=CC2=CC=CC=C2C2=C1C1=CC=CC=C1N2 MYKQKWIPLZEVOW-UHFFFAOYSA-N 0.000 description 1
- ZDPDDOIOIKNGEJ-UHFFFAOYSA-N 11h-indeno[1,2-h]quinoline Chemical class C1=CC=NC2=C3CC4=CC=CC=C4C3=CC=C21 ZDPDDOIOIKNGEJ-UHFFFAOYSA-N 0.000 description 1
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 1
- 125000004974 2-butenyl group Chemical group C(C=CC)* 0.000 description 1
- 125000000069 2-butynyl group Chemical group [H]C([H])([H])C#CC([H])([H])* 0.000 description 1
- JNGKNTZYAKKNLQ-UHFFFAOYSA-N 2-chloro-4,6-diphenyl-1h-triazine Chemical compound N=1N(Cl)NC(C=2C=CC=CC=2)=CC=1C1=CC=CC=C1 JNGKNTZYAKKNLQ-UHFFFAOYSA-N 0.000 description 1
- AYJJTPLDSZAGGA-UHFFFAOYSA-N 2-ethyl-7-methyl-5-(4-methylphenyl)-1,3,4,4a,5,9b-hexahydroindeno[1,2-c]pyridine Chemical class C1N(CC)CCC2C1C1=CC=C(C)C=C1C2C1=CC=C(C)C=C1 AYJJTPLDSZAGGA-UHFFFAOYSA-N 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- 125000004975 3-butenyl group Chemical group C(CC=C)* 0.000 description 1
- 125000000474 3-butynyl group Chemical group [H]C#CC([H])([H])C([H])([H])* 0.000 description 1
- 125000006163 5-membered heteroaryl group Chemical group 0.000 description 1
- RFTRFDMRINNTSI-UHFFFAOYSA-N 9,9-dimethyl-n-phenylfluoren-2-amine Chemical compound C1=C2C(C)(C)C3=CC=CC=C3C2=CC=C1NC1=CC=CC=C1 RFTRFDMRINNTSI-UHFFFAOYSA-N 0.000 description 1
- PFWJFKBTIBAASX-UHFFFAOYSA-N 9h-indeno[2,1-b]pyridine Chemical class C1=CN=C2CC3=CC=CC=C3C2=C1 PFWJFKBTIBAASX-UHFFFAOYSA-N 0.000 description 1
- 229910004261 CaF 2 Inorganic materials 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- 238000004057 DFT-B3LYP calculation Methods 0.000 description 1
- 101000687716 Drosophila melanogaster SWI/SNF-related matrix-associated actin-dependent regulator of chromatin subfamily A containing DEAD/H box 1 homolog Proteins 0.000 description 1
- 108091006149 Electron carriers Proteins 0.000 description 1
- KRHYYFGTRYWZRS-UHFFFAOYSA-M Fluoride anion Chemical compound [F-] KRHYYFGTRYWZRS-UHFFFAOYSA-M 0.000 description 1
- 239000002841 Lewis acid Substances 0.000 description 1
- 229910018068 Li 2 O Inorganic materials 0.000 description 1
- 101000687741 Mus musculus SWI/SNF-related matrix-associated actin-dependent regulator of chromatin subfamily A containing DEAD/H box 1 Proteins 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical group C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 1
- 229910003564 SiAlON Inorganic materials 0.000 description 1
- DHXVGJBLRPWPCS-UHFFFAOYSA-N Tetrahydropyran Chemical compound C1CCOCC1 DHXVGJBLRPWPCS-UHFFFAOYSA-N 0.000 description 1
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical group C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 1
- XDNADZYPWVQFRI-UHFFFAOYSA-N [1]benzofuro[2,3-h]quinoline Chemical class C1=CC=NC2=C3C4=CC=CC=C4OC3=CC=C21 XDNADZYPWVQFRI-UHFFFAOYSA-N 0.000 description 1
- CWDFYKZZCSEOPO-UHFFFAOYSA-N [1]benzothiolo[2,3-h]quinoline Chemical class C1=CC=NC2=C3C4=CC=CC=C4SC3=CC=C21 CWDFYKZZCSEOPO-UHFFFAOYSA-N 0.000 description 1
- WIUZHVZUGQDRHZ-UHFFFAOYSA-N [1]benzothiolo[3,2-b]pyridine Chemical class C1=CN=C2C3=CC=CC=C3SC2=C1 WIUZHVZUGQDRHZ-UHFFFAOYSA-N 0.000 description 1
- ABRVLXLNVJHDRQ-UHFFFAOYSA-N [2-pyridin-3-yl-6-(trifluoromethyl)pyridin-4-yl]methanamine Chemical compound FC(C1=CC(=CC(=N1)C=1C=NC=CC=1)CN)(F)F ABRVLXLNVJHDRQ-UHFFFAOYSA-N 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001339 alkali metal compounds Chemical class 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- SMWDFEZZVXVKRB-UHFFFAOYSA-N anhydrous quinoline Natural products N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- 150000004982 aromatic amines Chemical class 0.000 description 1
- 150000004984 aromatic diamines Chemical class 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 125000005605 benzo group Chemical group 0.000 description 1
- 125000002047 benzodioxolyl group Chemical group O1OC(C2=C1C=CC=C2)* 0.000 description 1
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000005878 benzonaphthofuranyl group Chemical group 0.000 description 1
- 125000005872 benzooxazolyl group Chemical group 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000000319 biphenyl-4-yl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 1
- 229910000024 caesium carbonate Inorganic materials 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 125000002676 chrysenyl group Chemical group C1(=CC=CC=2C3=CC=C4C=CC=CC4=C3C=CC12)* 0.000 description 1
- 125000000259 cinnolinyl group Chemical group N1=NC(=CC2=CC=CC=C12)* 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- SWXVUIWOUIDPGS-UHFFFAOYSA-N diacetone alcohol Natural products CC(=O)CC(C)(C)O SWXVUIWOUIDPGS-UHFFFAOYSA-N 0.000 description 1
- 125000005299 dibenzofluorenyl group Chemical group C1(=CC=CC2=C3C(=C4C=5C=CC=CC5CC4=C21)C=CC=C3)* 0.000 description 1
- 150000004826 dibenzofurans Chemical class 0.000 description 1
- 238000003618 dip coating Methods 0.000 description 1
- 230000005611 electricity Effects 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 125000003914 fluoranthenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC=C4C1=C23)* 0.000 description 1
- 150000002220 fluorenes Chemical class 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 125000003838 furazanyl group Chemical group 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 230000009477 glass transition Effects 0.000 description 1
- 230000005283 ground state Effects 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 1
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 1
- 238000007641 inkjet printing Methods 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 239000011229 interlayer Substances 0.000 description 1
- 125000002346 iodo group Chemical group I* 0.000 description 1
- 238000007733 ion plating Methods 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 125000001977 isobenzofuranyl group Chemical group C=1(OC=C2C=CC=CC12)* 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 229910052747 lanthanoid Inorganic materials 0.000 description 1
- 150000002602 lanthanoids Chemical class 0.000 description 1
- 150000007517 lewis acids Chemical class 0.000 description 1
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 1
- 235000019341 magnesium sulphate Nutrition 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- AFDFEVPHXYRVDH-UHFFFAOYSA-N n-(4-bromophenyl)-n,4-diphenylaniline Chemical compound C1=CC(Br)=CC=C1N(C=1C=CC(=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 AFDFEVPHXYRVDH-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- UWMISBRPSJFHIR-UHFFFAOYSA-N naphtho[2,3-b][1]benzothiole Chemical class C1=CC=C2C=C3C4=CC=CC=C4SC3=CC2=C1 UWMISBRPSJFHIR-UHFFFAOYSA-N 0.000 description 1
- NIHNNTQXNPWCJQ-UHFFFAOYSA-N o-biphenylenemethane Natural products C1=CC=C2CC3=CC=CC=C3C2=C1 NIHNNTQXNPWCJQ-UHFFFAOYSA-N 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 125000002080 perylenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC5=CC=CC(C1=C23)=C45)* 0.000 description 1
- 125000001644 phenoxazinyl group Chemical group C1(=CC=CC=2OC3=CC=CC=C3NC12)* 0.000 description 1
- 125000003367 polycyclic group Chemical group 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- 238000007639 printing Methods 0.000 description 1
- 125000001725 pyrenyl group Chemical group 0.000 description 1
- 229940083082 pyrimidine derivative acting on arteriolar smooth muscle Drugs 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- 125000002943 quinolinyl group Chemical class N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 229910052814 silicon oxide Inorganic materials 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- VNFWTIYUKDMAOP-UHFFFAOYSA-N sphos Chemical group COC1=CC=CC(OC)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 VNFWTIYUKDMAOP-UHFFFAOYSA-N 0.000 description 1
- 238000004528 spin coating Methods 0.000 description 1
- 238000004544 sputter deposition Methods 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- RAOIDOHSFRTOEL-UHFFFAOYSA-N tetrahydrothiophene Chemical compound C1CCSC1 RAOIDOHSFRTOEL-UHFFFAOYSA-N 0.000 description 1
- 238000005979 thermal decomposition reaction Methods 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- DBDCNCCRPKTRSD-UHFFFAOYSA-N thieno[3,2-b]pyridine Chemical compound C1=CC=C2SC=CC2=N1 DBDCNCCRPKTRSD-UHFFFAOYSA-N 0.000 description 1
- 229940125670 thienopyridine Drugs 0.000 description 1
- 239000002175 thienopyridine Substances 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 125000003960 triphenylenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C3=CC=CC=C3C12)* 0.000 description 1
- 238000002061 vacuum sublimation Methods 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D263/00—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings
- C07D263/52—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings condensed with carbocyclic rings or ring systems
- C07D263/54—Benzoxazoles; Hydrogenated benzoxazoles
- C07D263/56—Benzoxazoles; Hydrogenated benzoxazoles with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached in position 2
- C07D263/57—Aryl or substituted aryl radicals
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/656—Aromatic compounds comprising a hetero atom comprising two or more different heteroatoms per ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/60—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings condensed with carbocyclic rings or ring systems
- C07D277/62—Benzothiazoles
- C07D277/64—Benzothiazoles with only hydrocarbon or substituted hydrocarbon radicals attached in position 2
- C07D277/66—Benzothiazoles with only hydrocarbon or substituted hydrocarbon radicals attached in position 2 with aromatic rings or ring systems directly attached in position 2
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/10—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/10—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
- H10K50/12—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers comprising dopants
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/624—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing six or more rings
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/633—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising polycyclic condensed aromatic hydrocarbons as substituents on the nitrogen atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/654—Aromatic compounds comprising a hetero atom comprising only nitrogen as heteroatom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/10—Triplet emission
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/90—Multiple hosts in the emissive layer
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Optics & Photonics (AREA)
- Electroluminescent Light Sources (AREA)
Abstract
본 발명은 복수 종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자에 관한 것이다. 본 발명의 유기 전계 발광 소자는 특정 조합의 복수 종의 호스트 화합물을 포함함으로써 높은 발광 효율을 유지하면서 우수한 수명 특성을 나타낼 수 있다.
Description
본 발명은 복수종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자에 관한 것이다.
표시 소자 중, 전계 발광 소자(electroluminescent device: EL device)는 자체 발광형 표시 소자로서 시야각이 넓고 콘트라스트가 우수할 뿐만 아니라 응답속도가 빠르다는 장점을 가지고 있다. 1987년 이스트만 코닥(Eastman Kodak)사는 발광층 형성용 재료로서 저분자인 방향족 다이아민과 알루미늄 착물을 이용하는 유기 전계 발광 소자를 처음으로 개발하였다[참조: Appl. Phys. Lett. 51, 913, 1987].
유기 전계 발광 소자(organic electroluminescent device: OLED)는 유기 발광 재료에 전기를 가해 전기 에너지를 빛으로 바꾸는 소자로서, 통상 양극(애노드) 및 음극(캐소드)과 이들 사이에 유기물층을 포함하는 구조를 가진다. 유기 전계 발광 소자의 유기물층은 정공주입층, 정공전달층, 전자차단층, 발광층(호스트 및 도판트 재료 포함), 전자버퍼층, 정공차단층, 전자전달층, 전자주입층 등을 포함할 수 있다. 상기 유기물층에 사용되는 재료는 기능에 따라 정공주입 재료, 정공전달 재료, 전자차단 재료, 발광 재료, 전자버퍼 재료, 정공차단 재료, 전자전달 재료, 전자주입 재료 등으로 나뉜다. 이러한 유기 전계 발광 소자에서는 전압 인가에 의해 양극에서 정공이, 음극에서 전자가 발광층에 주입되고, 정공과 전자의 재결합에 의해 에너지가 높은 엑시톤이 형성된다. 이 에너지에 의해 유기 발광 화합물이 여기 상태로 되며, 유기 발광 화합물의 여기 상태가 기저 상태로 돌아가면서 에너지를 빛으로 방출하여 발광하게 된다.
유기 전계 발광 소자의 발광 재료는 소자의 발광 효율을 결정하는 가장 중요한 요인으로서, 발광 재료는 양자 효율이 높고 전자와 정공의 이동도가 커야 하고, 형성된 발광 재료층은 균일하고 안정해야 한다. 이러한 발광 재료는 발광색에 따라 청색, 녹색 또는 적색 발광 재료로 나뉘고, 추가로 황색 또는 주황색 발광 재료도 있다. 또한, 발광 재료는 기능적인 측면에서 호스트 재료와 도판트 재료로 구분될 수 있다. 최근에 고효율 및 장수명의 유기 전계 발광 소자의 개발이 시급한 과제로 대두되고 있는데, 특히 중대형 OLED 패널에서 요구하고 있는 EL 특성 수준을 고려해 볼 때 기존의 발광 재료에 비해 매우 우수한 재료의 개발이 시급한 실정이다. 이를 위하여 고체 상태의 용매 및 에너지 전달자 역할을 하는 호스트 물질의 바람직한 특성은 순도가 높아야 하며, 진공증착이 가능하도록 적당한 분자량을 가져야 한다. 또한 유리 전이온도와 열분해온도가 높아 열적 안정성을 확보해야 하며, 장수명화를 위해 높은 전기화학적 안정성이 요구되며, 무정형 박막을 형성하기 용이해야 하며, 인접한 다른 층의 재료들과는 접착력이 좋은 반면 층간 이동은 하지 않아야 한다.
발광 재료는 색순도, 발광 효율 및 안정성을 향상시키기 위해 호스트와 도판트를 혼합하여 사용할 수 있다. 일반적으로, EL 특성이 우수한 소자는 호스트에 도판트를 도핑하여 만들어진 발광층을 포함하는 구조이다. 이와 같은 도판트/호스트 재료 체계를 사용할 때, 호스트 재료는 발광 소자의 효율과 수명에 큰 영향을 미치므로, 그 선택이 중요하다.
일본공개특허공보 제2001-23777호는 페난트렌 골격의 중간 벤젠 고리에 질소를 함유하는 5원 헤테로아릴이 축합된 형태의 화합물을 호스트 재료로 사용하는 유기 전계 발광 소자를 개시하고 있다. 그러나, 상기 문헌에 개시된 화합물을 포함하는 유기 전계 발광 소자는 청색의 우수한 색 순도 특성은 나타내지만, 인광 발광층의 혼합 구조를 나타내지 못하며 구동 전압, 전류 효율 및 구동 수명에 대해서는 여전히 개선될 필요성을 갖고 있다.
본 발명의 목적은 높은 발광 효율을 유지하면서 장수명을 갖는 유기 전계 발광 소자를 제공하는 것이다.
상기의 기술적 과제를 해결하기 위해 예의 연구한 결과, 본 발명자들은 1종 이상의 제1 호스트 화합물 및 1종 이상의 제2 호스트 화합물을 포함하는 복수 종의 호스트 재료로서, 상기 제1 호스트 화합물은 하기 화학식 1 또는 2로 표시되고, 상기 제2 호스트 화합물은 하기 화학식 3으로 표시되는 것을 특징으로 하는 호스트 재료가 상술한 목적을 달성함을 발견하여 본 발명을 완성하였다.
[화학식 1] [화학식 2]
상기 화학식 1 또는 2에서,
X1 은 -N=, -NR7-, -O- 또는 -S-이고,
Y1 은 -N=, -NR8-, -O- 또는 -S-이되, X1이 -N= 인 경우 Y1은 -NR8-, -O- 또는 -S-이고, X1이 -NR7-인 경우 Y1은 -N=, -O- 또는 -S-이고,
R1 은 치환 또는 비치환된 (C6-C30)아릴, 또는 치환 또는 비치환된 (3-30원)헤테로아릴이고,
R2 내지 R8 은 각각 독립적으로 수소, 중수소, 할로겐, 시아노, 치환 또는 비치환된 (C1-C30)알킬, 치환 또는 비치환된 (C6-C30)아릴, 치환 또는 비치환된 (3-30원)헤테로아릴, 치환 또는 비치환된 (C3-C30)시클로알킬, 치환 또는 비치환된 (C1-C30)알콕시, 치환 또는 비치환된 트리(C1-C30)알킬실릴, 치환 또는 비치환된 디(C1-C30)알킬(C6-C30)아릴실릴, 치환 또는 비치환된 (C1-C30)알킬디(C6-C30)아릴실릴, 치환 또는 비치환된 트리(C6-C30)아릴실릴, 치환 또는 비치환된 모노- 또는 디-(C1-C30)알킬아미노, 치환 또는 비치환된 모노- 또는 디-(C6-C30)아릴아미노, 또는 치환 또는 비치환된 (C1-C30)알킬(C6-C30)아릴아미노이거나, 인접한 치환체와 연결되어 치환 또는 비치환된 (C3-C30) 단일환 또는 다환의 지환족 또는 방향족 고리를 형성할 수 있으며, 상기 형성된 지환족 또는 방향족 고리의 탄소 원자는 질소, 산소 및 황으로부터 선택되는 하나 이상의 헤테로원자로 대체될 수 있고,
L1 은 단일 결합, 치환 또는 비치환된 (C6-C30)아릴렌, 또는 치환 또는 비치환된 (3-30원)헤테로아릴렌이고,
a는 1이고, b 및 c는 각각 독립적으로 1 또는 2이고, d 및 e는 각각 독립적으로 1 내지 4 의 정수이고,
상기 헤테로아릴(렌)은 B, N, O, S, Si 및 P로부터 선택된 하나 이상의 헤테로원자를 포함하며;
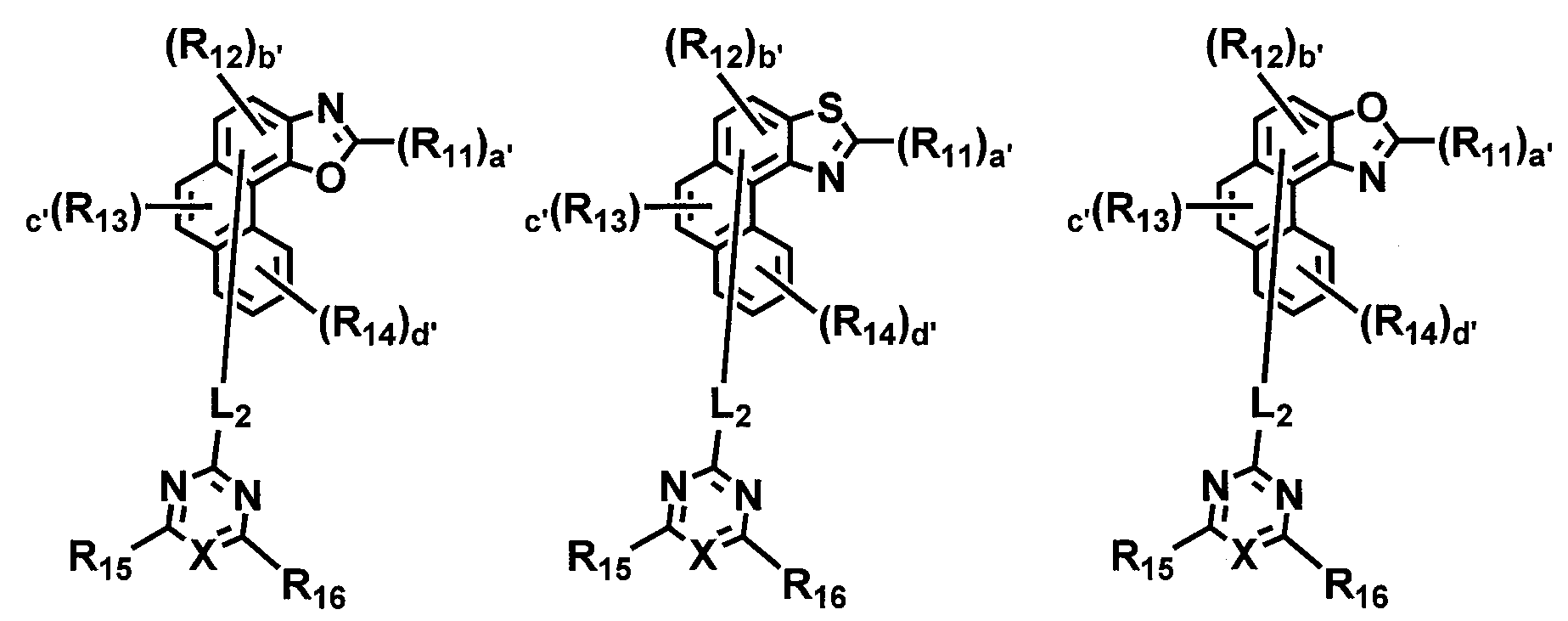
[화학식 3]
상기 화학식 3에서,
X11 은 -N=, -NR17-, -O- 또는 -S-이고,
Y11 은 -N=, -NR18-, -O- 또는 -S-이되, X11이 -N= 인 경우 Y11 은 -NR18-, -O- 또는 -S-이고, X11이 -NR17- 인 경우 Y11은 -N=, -O- 또는 -S-이고,
X는 N 또는 CH이고,
R11 은 치환 또는 비치환된 (C6-C30)아릴, 또는 치환 또는 비치환된 (3-30원)헤테로아릴이고,
R12 내지 R18 은 각각 독립적으로 수소, 중수소, 할로겐, 시아노, 치환 또는 비치환된 (C1-C30)알킬, 치환 또는 비치환된 (C6-C30)아릴, 치환 또는 비치환된 (3-30원)헤테로아릴, 치환 또는 비치환된 (C3-C30)시클로알킬, 치환 또는 비치환된 (C1-C30)알콕시, 치환 또는 비치환된 트리(C1-C30)알킬실릴, 치환 또는 비치환된 디(C1-C30)알킬(C6-C30)아릴실릴, 치환 또는 비치환된 (C1-C30)알킬디(C6-C30)아릴실릴, 치환 또는 비치환된 트리(C6-C30)아릴실릴, 치환 또는 비치환된 모노- 또는 디-(C1-C30)알킬아미노, 치환 또는 비치환된 모노- 또는 디-(C6-C30)아릴아미노, 또는 치환 또는 비치환된 (C1-C30)알킬(C6-C30)아릴아미노이거나, 인접한 치환체와 연결되어 치환 또는 비치환된 (C3-C30) 단일환 또는 다환의 지환족 또는 방향족 고리를 형성할 수 있으며, 상기 형성된 지환족 또는 방향족 고리의 탄소 원자는 질소, 산소 및 황으로부터 선택되는 하나 이상의 헤테로원자로 대체될 수 있고,
L2 는 단일 결합, 치환 또는 비치환된 (C6-C30)아릴렌, 또는 치환 또는 비치환된 (3-30원)헤테로아릴렌이고,
a'는 1이고, b' 및 c'는 각각 독립적으로 1 또는 2이고, d'는 1 내지 4 의 정수이고,
상기 헤테로아릴(렌)은 B, N, O, S, Si 및 P로부터 선택된 하나 이상의 헤테로원자를 포함한다.
본 발명에 따른 페난트로옥사졸계 및 페난트로티아졸계 화합물은 본래 전기음성도가 크며 전자가 풍부한 그룹을 가지고 있을 뿐만 아니라 페난트렌과 옥사졸, 또는 페난트렌과 티아졸 등의 그룹이 융합된 구조로서 휘지 않는(rigid) 특성을 가져 상호 분자간 전하 전달(intermolecular transition)이 용이해진다. 또한, 이러한 분자간 스태킹(stacking)이 강화되면 수평방향 분자배열(horizontal molecular orientation)의 구현이 쉬워지며, 이를 통해 빠른 전자 전류 특성 구현이 가능하다. 따라서 발광층의 재료로서 트리아진 및 피리미딘 유도체 등의 한정된 구조로 이용하여 전자 전달층과의 분자간 스태킹 효과를 유지함과 동시에 계면 특성 향상을 통하여 구동 전압이 비교적 낮고, 전류 효율 및 전력 효율과 같은 발광 효율이 우수하면서도, 순도 높은 색 구현이 가능한 유기 전계 발광 소자를 제공할 수 있다.
또한, 페난트로옥사졸계 및 페난트로티아졸계 화합물 재료를 정공 타입의 아민과 치환하여 제1 호스트로 이용하고, 제2 호스트로써 전자 타입의 아진 재료를 치환하여 발광층 재료로 혼합하여 사용하면, 빠른 구동전압과 함께 고효율 및 장수명의 유기 전계 인광 발광 소자를 구현하는 것이 가능하다. 본래, 인광 발광층 재료를 다른 치환체와 연결시 이면각이 큰 카바졸 형태의 유도체를 사용하면 특히 전자 전류를 방해하여 구동전압 증가와 효율이 감소되는 특성을 보일 수 있으나, 본 발명에 따른 발광 화합물을 사용하면 분자간 스태킹(intermolecular stacking) 및 상호작용(interaction) 특성에 의한 빠른 전류 주입 특성 및 계면 특성 향상을 통하여 구동 전압이 비교적 낮고, 전류 효율 및 전력 효율과 같은 발광 효율이 우수하면서도, 순도 높은 색 구현이 가능한 유기 전계 발광 소자를 제공할 수 있다.
도 1은 비교예 2와 소자 제조예 1에서 제조된 유기 전계 발광 소자의 휘도에 따른 전류 효율을 나타낸 것이다.
이하에서 본 발명을 더욱 상세히 설명하나, 이는 설명을 위한 것으로 본 발명의 범위를 제한하는 방법으로 해석되어서는 안 된다.
상기 화학식 1, 2 또는 3으로 표시되는 유기 전계 발광 화합물을 포함하는 유기 전계 발광 소자에 대해 보다 구체적으로 설명하면 다음과 같다.
상기 화학식 1 및 2에서, X1 은 -N=, -NR7-, -O- 또는 -S-이고, Y1은 -N=, -NR8-, -O- 또는 -S-이되, X1이 -N= 인 경우 Y1 은 -NR8-, -O- 또는 -S-이고, X1이 -NR7- 인 경우 Y1 은 -N=, -O- 또는 -S-이다. 본원의 일 양태에 따르면, X1 및 Y1 중 어느 하나는 -N=이고, 다른 하나는 -NR7-, -O- 또는 -S- 일 수 있다. 또한, 본원의 다른 일 양태에 따르면, X1 및 Y1 중 어느 하나는 -N=이고, 다른 하나는 -O- 또는 -S-일 수 있다. 여기서, X1 과 Y1이 모두 -O-인 경우, 모두 -S-인 경우, 및 X1 과 Y1 중 하나가 -O-이고, 다른 하나가 -S-인 경우는 제외될 수 있다. 예를 들면, X1 은 -N= 이고 Y1 은 -O-, X1 은 -O- 이고 Y1 은 -N=이거나, X1 은 -S- 이고 Y1 은 -N= 일 수 있다.
상기 화학식 1 및 2에서, R1 은 치환 또는 비치환된 (C6-C30)아릴, 또는 치환 또는 비치환된 (3-30원)헤테로아릴이고, 바람직하게는 치환 또는 비치환된 (C6-C30)아릴, 또는 치환된 (5-25원)헤테로아릴이며, 더욱 바람직하게는 치환 또는 비치환된 (C6-C30)아릴, 또는 치환된 (5-20원)헤테로아릴이며, 예를 들면, 비치환된 페닐, 비치환된 비페닐, 비치환된 나프틸, 메틸로 치환된 플루오레닐, 메틸로 치환된 벤조플루오레닐, 비치환된 디벤조푸라닐, 비치환된 디벤조티오페닐, 스피로[플루오렌-플루오렌]일, 또는 스피로[플루오렌-벤조플루오렌]일일 수 있다.
상기 화학식 1 및 2에서, R2 내지 R6 은 각각 독립적으로 수소, 중수소, 할로겐, 시아노, 치환 또는 비치환된 (C1-C30)알킬, 치환 또는 비치환된 (C6-C30)아릴, 치환 또는 비치환된 (3-30원)헤테로아릴, 치환 또는 비치환된 (C3-C30)시클로알킬, 치환 또는 비치환된 (C1-C30)알콕시, 치환 또는 비치환된 트리(C1-C30)알킬실릴, 치환 또는 비치환된 디(C1-C30)알킬(C6-C30)아릴실릴, 치환 또는 비치환된 (C1-C30)알킬디(C6-C30)아릴실릴, 치환 또는 비치환된 트리(C6-C30)아릴실릴, 치환 또는 비치환된 모노- 또는 디-(C1-C30)알킬아미노, 치환 또는 비치환된 모노- 또는 디-(C6-C30)아릴아미노, 또는 치환 또는 비치환된 (C1-C30)알킬(C6-C30)아릴아미노이거나, 인접한 치환체와 연결되어 치환 또는 비치환된 (C3-C30) 단일환 또는 다환의 지환족 또는 방향족 고리를 형성할 수 있으며, 상기 형성된 지환족 또는 방향족 고리의 탄소 원자는 질소, 산소 및 황으로부터 선택되는 하나 이상의 헤테로원자로 대체될 수 있고, 바람직하게는 각각 독립적으로 수소, 치환 또는 비치환된 (C6-C25)아릴, 치환 또는 비치환된 (3-25원)헤테로아릴, 치환 또는 비치환된 모노- 또는 디-(C6-C25)아릴아미노이거나, 인접한 치환체와 연결되어 치환 또는 비치환된 (C3-C25) 단일환 또는 다환의 지환족 또는 방향족 고리를 형성할 수 있으며, 상기 형성된 지환족 또는 방향족 고리의 탄소 원자는 질소, 산소 및 황으로부터 선택되는 하나 이상의 헤테로원자로 대체될 수 있으며, 더욱 바람직하게는 각각 독립적으로 수소, 치환 또는 비치환된 (C6-C20)아릴, 치환 또는 비치환된 (5-25원)헤테로아릴, 치환 또는 비치환된 디(C6-C18)아릴아미노이거나, 서로 연결되어 치환 또는 비치환된 (C3-C25) 단일환 또는 다환의 지환족 또는 방향족 고리를 형성할 수 있으며, 상기 형성된 지환족 또는 방향족 고리의 탄소 원자는 질소 및 황으로부터 선택되는 하나 이상의 헤테로원자로 대체될 수 있으며, 상기 헤테로아릴은 B, N, O, S, Si 및 P로부터 선택된 하나 이상의 헤테로원자를 포함할 수 있다. 예를 들면 R5 및 R6 은 각각 독립적으로, 치환 또는 비치환된 페닐, 치환 또는 비치환된 m-비페닐, 치환 또는 비치환된 p-비페닐, 치환 또는 비치환된 플루오렌일, 치환 또는 비치환된 나프틸, 치환 또는 비치환된 페난트레닐, 또는 치환 또는 비치환된 벤조플루오렌일 일 수 있다.
상기 화학식 1 및 2에서, a는 1 또는 2이고, 바람직하게는 1이며; b 및 c는 각각 독립적으로 1 또는 2이고, 바람직하게는 1이며; d 및 e는 각각 독립적으로 1 내지 4의 정수이고, 바람직하게는 1 또는 2이다.
상기 화학식 1 및 2에서, L1 은 단일 결합, 치환 또는 비치환된 (C6-C30)아릴렌, 또는 치환 또는 비치환된 (3-30원)헤테로아릴렌이고, 바람직하게는 단일 결합, 또는 치환 또는 비치환된 (C6-C18)아릴렌이며, 더욱 바람직하게는 단일 결합, 또는 비치환된 (C6-C12)아릴렌이고, 예를 들면, 단일 결합 또는 비치환된 페닐렌일 수 있다.
상기 화학식 1 또는 2로 표시되는 화합물은 하기 화학식 1-1 내지 1-5 중 어느 하나로 표시될 수 있다.
[화학식 1-1] [화학식 1-2] [화학식 1-3]
[화학식 1-4] [화학식 1-5]
상기 화학식 1-1 내지 1-5에서, R1 내지 R6, L1 및 a 내지 e는 화학식 1 및 2에서 정의된 것과 같다.
상기 화학식 3에서, X11은 -N=, -NR17-, -O- 또는 -S-이고, Y11은 -N=, -NR18-, -O- 또는 -S-이되, X11이 -N= 인 경우 Y11은 -NR18-, -O- 또는 -S-이고, X11이 -NR17-인 경우 Y11은 -N=, -O- 또는 -S-이다. 본원의 일 양태에 따르면, X11 및 Y11 중 어느 하나는 -N=이고, 다른 하나는 -NR17-, -O- 또는 -S-일 수 있다. 또한, 본원의 다른 일 양태에 따르면, X11 및 Y11 중 어느 하나는 -N=이고, 다른 하나는 -O- 또는 -S-일 수 있다. 여기서, X11 과 Y11이 모두 -O-인 경우, 모두 -S-인 경우, 및 X11 과 Y11 중 하나가 -O-이고, 다른 하나가 -S-인 경우는 제외될 수 있다.
상기 화학식 3에서, R11은 치환 또는 비치환된 (C6-C30)아릴, 또는 치환 또는 비치환된 (3-30원)헤테로아릴이고, 바람직하게는 치환 또는 비치환된 (C6-C30)아릴, 또는 치환된 (5-25원)헤테로아릴이며, 더욱 바람직하게는 치환 또는 비치환된 (C6-C30)아릴, 또는 치환된 (5-20원)헤테로아릴이며, 예를 들면, 비치환된 페닐, 비치환된 비페닐, 비치환된 나프틸, 메틸로 치환된 플루오레닐, 치환 또는 비치환된 카바졸릴, 메틸로 치환된 벤조플루오레닐, 비치환된 디벤조푸라닐, 비치환된 디벤조티오페닐, 비치환된 벤조나프토푸라닐, 스피로[플루오렌-플루오렌]일, 또는 스피로[플루오렌-벤조플루오렌]일일 수 있다.
상기 화학식 3에서, R12 내지 R18 은 각각 독립적으로 수소, 중수소, 할로겐, 시아노, 치환 또는 비치환된 (C1-C30)알킬, 치환 또는 비치환된 (C6-C30)아릴, 치환 또는 비치환된 (3-30원)헤테로아릴, 치환 또는 비치환된 (C3-C30)시클로알킬, 치환 또는 비치환된 (C1-C30)알콕시, 치환 또는 비치환된 트리(C1-C30)알킬실릴, 치환 또는 비치환된 디(C1-C30)알킬(C6-C30)아릴실릴, 치환 또는 비치환된 (C1-C30)알킬디(C6-C30)아릴실릴, 치환 또는 비치환된 트리(C6-C30)아릴실릴, 치환 또는 비치환된 모노- 또는 디-(C1-C30)알킬아미노, 치환 또는 비치환된 모노- 또는 디-(C6-C30)아릴아미노, 또는 치환 또는 비치환된 (C1-C30)알킬(C6-C30)아릴아미노이거나, 인접한 치환체와 연결되어 치환 또는 비치환된 (C3-C30) 단일환 또는 다환의 지환족 또는 방향족 고리를 형성할 수 있으며, 상기 형성된 지환족 또는 방향족 고리의 탄소 원자는 질소, 산소 및 황으로부터 선택되는 하나 이상의 헤테로원자로 대체될 수 있고, 바람직하게는 각각 독립적으로 수소, 치환 또는 비치환된 (C6-C25)아릴, 치환 또는 비치환된 (3-25원)헤테로아릴, 치환 또는 비치환된 모노- 또는 디-(C6-C25)아릴아미노이거나, 인접한 치환체와 연결되어 치환 또는 비치환된 (C3-C25) 단일환 또는 다환의 지환족 또는 방향족 고리를 형성할 수 있으며, 상기 형성된 지환족 또는 방향족 고리의 탄소 원자는 질소, 산소 및 황으로부터 선택되는 하나 이상의 헤테로원자로 대체될 수 있으며, 더욱 바람직하게는 각각 독립적으로 수소, 치환 또는 비치환된 (C6-C20)아릴, 치환 또는 비치환된 (5-25원)헤테로아릴, 치환 또는 비치환된 디(C6-C18)아릴아미노이거나, 서로 연결되어 치환 또는 비치환된 (C3-C25) 단일환 또는 다환의 지환족 또는 방향족 고리를 형성할 수 있으며, 상기 형성된 지환족 또는 방향족 고리의 탄소 원자는 질소 및 황으로부터 선택되는 하나 이상의 헤테로원자로 대체될 수 있으며, 상기 헤테로아릴은 B, N, O, S, Si 및 P로부터 선택된 하나 이상의 헤테로원자를 포함할 수 있다. 예를 들면, R15 및 R16은 각각 독립적으로, 치환 또는 비치환된 페닐, 치환 또는 비치환된 o-비페닐, 치환 또는 비치환된 m-비페닐, 치환 또는 비치환된 p-비페닐, 치환 또는 비치환된 나프틸, 치환 또는 비치환된 플루오레닐, 치환 또는 비치환된 카바졸릴, 치환 또는 비치환된 디벤조티오페닐, 치환 또는 비치환된 벤조플루오레닐, 치환 또는 비치환된 벤조카바졸 및 치환 또는 비치환된 벤조나프토티오펜으로 이루어진 군으로부터 선택될 수 있다.
상기 화학식 3에서, a'는 1 또는 2이고, 바람직하게는 1이며; b' 및 c'는 각각 독립적으로 1 또는 2이고, 바람직하게는 1이며; d'는 1 내지 4의 정수이고, 바람직하게는 1 또는 2이다.
상기 화학식 3에서, X는 N 또는 CH 이다.
상기 화학식 3에서, L2 는 단일 결합, 치환 또는 비치환된 (C6-C30)아릴렌, 또는 치환 또는 비치환된 (3-30원)헤테로아릴렌이고, 바람직하게는 단일 결합, 또는 치환 또는 비치환된 (C6-C18)아릴렌이며, 더욱 바람직하게는 단일 결합, 또는 비치환된 (C6-C12)아릴렌이고, 예를 들면, 단일 결합 또는 비치환된 페닐렌일 수 있다.
상기 화학식 3으로 표시되는 화합물은 하기 화학식 3-1 내지 3-6 중 어느 하나로 표시될 수 있다.
[화학식 3-1] [화학식 3-2] [화학식 3-3]
[화학식 3-4] [화학식 3-5] [화학식 3-6]
상기 화학식 3-1 내지 3-6에서, R11 내지 R18, L2, X 및 a' 내지 d'는 화학식 3에서 정의된 것과 같다.
본 발명에 기재되어 있는 “(C1-C30)알킬”은 쇄를 구성하는 탄소수가 1 내지 30개인 직쇄 또는 분지쇄 알킬을 의미하고, 여기에서 탄소수가 1 내지 20개인 것이 바람직하고, 1 내지 10개인 것이 더 바람직하다. 상기 알킬의 구체적인 예로서, 메틸, 에틸, n-프로필, 이소프로필, n-부틸, 이소부틸 및 tert-부틸 등이 있다. 본원에서 “(C2-C30)알케닐”은 쇄를 구성하는 탄소수가 2 내지 30개인 직쇄 또는 분지쇄 알케닐을 의미하고, 여기에서 탄소수가 2 내지 20개인 것이 바람직하고, 2 내지 10개인 것이 더 바람직하다. 상기 알케닐의 구체적인 예로서, 비닐, 1-프로페닐, 2-프로페닐, 1-부테닐, 2-부테닐, 3-부테닐, 2-메틸부트-2-에닐 등이 있다. 본원에서 “(C2-C30)알키닐”은 쇄를 구성하는 탄소수가 2 내지 30개인 직쇄 또는 분지쇄 알키닐을 의미하고, 여기에서 탄소수가 2 내지 20개 인 것이 바람직하고, 2 내지 10개인 것이 더 바람직하다. 상기 알키닐의 예로서, 에티닐, 1-프로피닐, 2-프로피닐, 1-부티닐, 2-부티닐, 3-부티닐, 1-메틸펜트-2-이닐 등이 있다. 본원에서 “(C3-C30)시클로알킬”은 환 골격 탄소수가 3 내지 30개인 단일환 또는 다환의 탄화수소를 의미하고, 여기에서 탄소수가 3 내지 20개인 것이 바람직하고, 3 내지 7개인 것이 더 바람직하다. 상기 시클로알킬의 예로서, 시클로프로필, 시클로부틸, 시클로펜틸, 시클로헥실 등이 있다. 본원에서 “(3-7원)헤테로시클로알킬”은 환 골격 원자수가 3 내지 7개, 바람직하게는 5 내지 7개이고, B, N, O, S, P(=O), Si 및 P로 이루어진 군에서 선택된 하나 이상의 헤테로원자, 바람직하게는 O, S 및 N에서 선택되는 하나 이상의 헤테로원자를 포함하는 시클로알킬을 의미하고, 예를 들어, 테트라히드로푸란, 피롤리딘, 티올란, 테트라히드로피란 등이 있다. 본원에서 “(C6-C60)아릴(렌)”은 환 골격 탄소수가 6 내지 60개인 방향족 탄화수소에서 유래된 단일환 또는 융합환계 라디칼을 의미하고, 여기에서 환 골격 탄소수가 6 내지 30개인 것이 바람직하고, 6 내지 20개인 것이 더 바람직하다. 상기 아릴의 예로서, 페닐, 비페닐, 터페닐, 나프틸, 비나프틸, 페닐나프틸, 나프틸페닐, 플루오레닐, 페닐플루오레닐, 벤조플루오레닐, 디벤조플루오레닐, 페난트레닐, 페닐페난트레닐, 안트라세닐, 인데닐, 트리페닐레닐, 피레닐, 테트라세닐, 페릴레닐, 크라이세닐, 나프타세닐, 플루오란테닐 등이 있다. 본원에서 “(3-30원)헤테로아릴(렌)”은 환 골격 원자수가 3 내지 30개이고, B, N, O, S, Si 및 P로 이루어진 군에서 선택된 하나 이상의 헤테로원자를 포함하는 아릴기를 의미한다. 헤테로원자수는 바람직하게는 1 내지 4개이고, 단일 환계이거나 하나 이상의 벤젠환과 축합된 융합환계일 수 있으며, 부분적으로 포화될 수도 있다. 또한, 본원에서 상기 헤테로아릴은 하나 이상의 헤테로아릴기 또는 아릴기가 단일 결합에 의해 헤테로아릴기와 연결된 형태도 포함한다. 상기 헤테로아릴의 예로서, 푸릴, 티오펜일, 피롤릴, 이미다졸릴, 피라졸릴, 티아졸릴, 티아디아졸릴, 이소티아졸릴, 이속사졸릴, 옥사졸릴, 옥사디아졸릴, 트리아진일, 테트라진일, 트리아졸릴, 테트라졸릴, 푸라잔일, 피리딜, 피라진일, 피리미딘일, 피리다진일 등의 단일 환계 헤테로아릴, 벤조푸란일, 벤조티오펜일, 이소벤조푸란일, 디벤조푸란일, 디벤조티오펜일, 벤조이미다졸릴, 벤조티아졸릴, 벤조이소티아졸릴, 벤조이속사졸릴, 벤조옥사졸릴, 이소인돌릴, 인돌릴, 벤조인돌릴, 인다졸릴, 벤조티아디아졸릴, 퀴놀릴, 이소퀴놀릴, 신놀리닐, 퀴나졸리닐, 퀴녹살리닐, 나프티리딜, 카바졸릴, 페녹사진일, 페난트리딘일, 벤조디옥솔릴 등의 융합 환계 헤테로아릴 등이 있다. 본원에서 “질소 함유 (5-30원)헤테로아릴”은 환 골격 원자수가 5 내지 30개이고 하나 이상의 헤테로원자 N을 포함하는 아릴기를 의미한다. 여기에서 환 골격 원자수가 5 내지 20개인 것이 바람직하고, 5 내지 15개인 것이 더 바람직하다. 헤테로원자수는 바람직하게는 1 내지 4개이고, 단일환계이거나 하나 이상의 벤젠환과 축합된 융합환계일 수 있으며, 부분적으로 포화될 수도 있다. 또한, 본원에서 상기 질소 함유 헤테로아릴은 하나 이상의 헤테로아릴기 또는 아릴기가 단일 결합에 의해 헤테로아릴기와 연결된 형태도 포함된다. 상기 질소 함유 헤테로아릴의 예로서, 피롤릴, 이미다졸릴, 피라졸릴, 트리아진일, 테트라진일, 트리아졸릴, 테트라졸릴, 피리딜, 피라진일, 피리미딘일, 피리다진일 등의 단일 환계 헤테로아릴, 벤조이미다졸릴, 이소인돌릴, 인돌릴, 인다졸릴, 벤조티아디아졸릴, 퀴놀릴, 이소퀴놀릴, 신놀리닐, 퀴나졸리닐, 퀴녹살리닐, 나프티리딜, 카바졸릴, 벤조카바졸릴, 디벤조카바졸릴, 페난트리딘일 등의 융합 환계 헤테로아릴 등이 있다. 본원에서 “할로겐”은 F, Cl, Br 및 I 원자를 포함한다.
또한 본 발명에 기재되어 있는 "치환 또는 비치환"에서 “치환”은 어떤 작용기에서 수소 원자가 다른 원자 또는 다른 작용기 (즉, 치환체)로 대체되는 것을 뜻한다. 화학식 1 내지 3의 상기 R1 내지 R8, R11 내지 R18, L1 및 L2에서 치환된 알킬, 치환된 알콕시, 치환된 시클로알킬, 치환된 아릴(렌), 치환된 헤테로아릴(렌), 치환된 트리알킬실릴, 치환된 트리아릴실릴, 치환된 디알킬아릴실릴, 치환된 알킬디아릴실릴, 치환된 모노- 또는 디- 알킬아미노, 치환된 모노- 또는 디- 아릴아미노, 치환된 알킬아릴아미노, 및 치환된 단일환 또는 다환의 지환족 또는 방향족 고리의 치환체는 각각 독립적으로 중수소; 할로겐; 시아노; 카르복실; 니트로; 히드록시; (C1-C30)알킬; 할로(C1-C30)알킬; (C2-C30)알케닐; (C2-C30)알키닐; (C1-C30)알콕시; (C1-C30)알킬티오; (C3-C30)시클로알킬; (3-7원)헤테로시클로알킬; (C6-C30)아릴옥시; (C6-C30)아릴티오; (C6-C30)아릴이나 디(C6-C30)아릴아미노로 치환되거나 비치환된 (3-30원)헤테로아릴; 시아노, (3-30원)헤테로아릴 또는 트리(C6-C30)아릴실릴로 치환되거나 비치환된 (C6-C30)아릴; 트리(C1-C30)알킬실릴; 트리(C6-C30)아릴실릴; 디(C1-C30)알킬(C6-C30)아릴실릴; (C1-C30)알킬디(C6-C30)아릴실릴; 아미노; 모노 또는 디(C1-C30)알킬아미노; 모노 또는 디(C6-C30)아릴아미노; (C1-C30)알킬(C6-C30)아릴아미노; (C1-C30)알킬카보닐; (C1-C30)알콕시카보닐; (C6-C30)아릴카보닐; 디(C6-C30)아릴보로닐; 디(C1-C30)알킬보로닐; (C1-C30)알킬(C6-C30)아릴보로닐; (C6-C30)아르(C1-C30)알킬; 및 (C1-C30)알킬(C6-C30)아릴로 이루어진 군으로부터 선택되는 하나 이상의 것을 의미하고, 바람직하게는 각각 독립적으로 (C1-C20)알킬; (C6-C18)아릴로 치환되거나 비치환된 (3-25원)헤테로아릴; 시아노, 트리(C6-C18)아릴실릴, (3-20원)헤테로아릴로 치환되거나 비치환된 (C6-C20)아릴; 트리(C6-C18)아릴실릴; 및 (C1-C20)알킬(C6-C20)아릴로 이루어진 군으로부터 선택되는 하나 이상의 것이 바람직하다.
상기 화학식 1 또는 2로 표시되는 화합물은 보다 구체적으로 하기의 화합물로서 예시될 수 있으나, 이들에 한정되는 것은 아니다.
상기 화학식 3으로 표시되는 화합물은 보다 구체적으로 하기의 화합물로서 예시될 수 있으나, 이들에 한정되는 것은 아니다.
본 발명에 따른 유기 전계 발광 소자는 양극; 음극; 및 상기 양극과 음극 사이에 개재되는 1층 이상의 유기물층을 포함하고, 상기 유기물층은 발광층을 포함하고, 상기 발광층은 호스트와 인광 도판트를 포함하고, 상기 호스트는 복수 종의 호스트 화합물로 구성되며, 상기 복수 종의 호스트 화합물 중 적어도 제1 호스트 화합물은 상기 화학식 1 또는 2로 표시되고, 제2 호스트 화합물은 상기 화학식 3으로 표시된다.
본 발명에서 발광층은 발광이 이루어지는 층으로서 단일층일 수 있으며, 또한 2개 이상의 층이 적층된 복수의 층일 수 있다. 상기 발광층의 호스트 화합물에 대한 도판트 화합물의 도핑 농도가 20 중량% 미만인 것이 바람직하다.
상기 유기물층은 발광층을 포함하고, 정공주입층, 정공전달층, 전자전달층, 전자주입층, 계면층(interlayer), 정공차단층 및 전자차단층에서 선택되는 1층 이상을 더 포함할 수 있다.
본 발명의 유기 전계 발광 소자에 있어서, 제1 호스트 화합물과 제2 호스트 화합물의 중량비는 1:99 내지 99:1 범위이다.
본 발명의 유기 전계 발광 소자에 포함되는 도판트로는 하나 이상의 인광 도판트가 바람직하다. 본 발명의 유기 전계 발광 소자에 적용되는 인광 도판트 재료는 특별히 제한되지는 않으나, 이리듐(Ir), 오스뮴(Os), 구리(Cu) 및 백금(Pt)으로부터 선택되는 금속 원자의 착체 화합물이 바람직하고, 이리듐(Ir), 오스뮴(Os), 구리(Cu) 및 백금(Pt)으로부터 선택되는 금속 원자의 오르토 메탈화 착체 화합물이 더욱 바람직하며, 오르토 메탈화 이리듐 착체 화합물이 더더욱 바람직하다.
본 발명의 유기 전계 발광 소자에 포함되는 도판트로 하기 화학식 101로 표시되는 화합물을 사용할 수 있으나, 이에 한정되는 것은 아니다.
[화학식 101]
상기 화학식 101 에서,
L은 하기 구조 1 또는 2에서 선택되고;
[구조1] [구조2]
R100 내지 R103은 각각 독립적으로 수소, 중수소, 할로겐, 할로겐으로 치환 또는 비치환된 (C1-C30)알킬, 치환 또는 비치환된 (C3-C30)시클로알킬, 치환 또는 비치환된 (C6-C30)아릴, 시아노, 치환 또는 비치환된 (3-30원) 헤테로아릴 또는 치환 또는 비치환된 (C1-C30)알콕시이고; R100 내지 R103은 인접 치환기가 서로 연결되어 치환 또는 비치환된 융합고리를 형성할 수 있고, 예를 들면 치환 또는 비치환된 퀴놀린, 치환 또는 비치환된 벤조푸로피리딘, 치환 또는 비치환된 벤조티에노피리딘, 치환 또는 비치환된 인데노피리딘, 치환 또는 비치환된 벤조푸로퀴놀린, 치환 또는 비치환된 벤조티에노퀴놀린 또는 치환 또는 비치환된 인데노퀴놀린 형성이 가능하며; R104 내지 R107은 각각 독립적으로 수소, 중수소, 할로겐, 할로겐으로 치환 또는 비치환된 (C1-C30)알킬, 치환 또는 비치환된 (C3-C30)시클로알킬, 치환 또는 비치환된 (C6-C30)아릴, 치환 또는 비치환된 (3-30원)헤테로아릴, 시아노, 또는 치환 또는 비치환된 (C1-C30)알콕시이고; R104 내지 R107은 인접 치환기가 서로 연결되어 치환 또는 비치환된 융합고리를 형성할 수 있고, 예를 들면 치환 또는 비치환된 나프틸, 치환 또는 비치환된 플루오렌, 치환 또는 비치환된 디벤조티오펜, 치환 또는 비치환된 디벤조푸란, 치환 또는 비치환된 인데노피리딘, 치환 또는 비치환된 벤조푸로피리딘 또는 치환 또는 비치환된 벤조티에노피리딘 형성이 가능하며; R201 내지 R211은 각각 독립적으로 수소, 중수소, 할로겐, 할로겐으로 치환 또는 비치환된 (C1-C30)알킬, 치환 또는 비치환된 (C3-C30)시클로알킬, 또는 치환 또는 비치환된 (C6-C30)아릴이고, 인접 치환기가 서로 연결되어 치환 또는 비치환된 융합고리를 형성할 수 있으며; n은 1 내지 3의 정수이다.
상기 도판드 재료의 구체적인 예는 다음과 같다.
본 발명의 유기 전계 발광 소자는 유기물층에 아릴아민계 화합물 및 스티릴아릴아민계 화합물로 이루어진 군으로부터 선택된 하나 이상의 화합물을 추가로 포함할 수도 있다.
또한, 본 발명의 유기 전계 발광 소자에 있어서, 유기물층에 1족, 2족, 4주기 전이금속, 5주기 전이금속, 란탄계열금속 및 d-전이원소의 유기금속으로 이루어진 군으로부터 선택되는 하나 이상의 금속, 또는 이러한 금속을 포함하는 하나 이상의 착체화합물을 추가로 포함할 수도 있다.
본 발명의 유기 전계 발광 소자에 있어서, 한 쌍의 전극의 적어도 한쪽의 내측표면에, 칼코제나이드(chalcogenide)층, 할로겐화 금속층 및 금속 산화물층으로부터 선택되는 하나 이상의 층(이하, 이들을 “표면층”이라고 지칭함)을 배치하는 것이 바람직하다. 구체적으로는, 발광 매체층 측의 양극 표면에 규소 및 알루미늄의 칼코제나이드(산화물을 포함한다)층을, 또한 발광 매체층 측의 음극 표면에 할로겐화 금속층 또는 금속 산화물층을 배치하는 것이 바람직하다. 상기 표면층에 의해 유기 전계 발광 소자의 구동 안정화를 얻을 수 있다. 상기 칼코제나이드의 바람직한 예로는 SiOX(1≤X≤2), AlOX(1≤X≤1.5), SiON 또는 SiAlON 등이 있고, 할로겐화 금속의 바람직한 예로는 LiF, MgF2, CaF2, 불화 희토류 금속 등이 있으며, 금속 산화물의 바람직한 예로는 Cs2O, Li2O, MgO, SrO, BaO, CaO 등이 있다.
양극과 발광층 사이에 정공 주입층, 정공 전달층, 또는 전자 차단층에서 선택되거나 이들의 조합으로 이루어진 층이 사용될 수 있다. 정공 주입층은 양극에서 정공 전달층 또는 전자 차단층으로의 정공 주입 장벽(또는 정공 주입 전압)을 낮출 목적으로 복수의 층이 사용될 수 있으며, 각 층은 2개의 화합물이 동시에 사용될 수 있다. 정공 전달층 또는 전자 차단층도 복수의 층이 사용될 수 있다.
발광층과 음극 사이에 전자 버퍼층, 정공 차단층, 전자 전달층, 또는 전자 주입층에서 선택되거나 이들의 조합으로 이루어진 층이 사용될 수 있다. 전자 버퍼층은 전자주입을 조절하고 발광층과 전자 주입층 사이의 계면 특성을 향상시킬 목적으로 복수의 층이 사용될 수 있으며, 각 층은 2개의 화합물이 동시에 사용될 수 있다. 정공 차단층 또는 전자 전달층도 복수의 층이 사용될 수 있고, 각 층에 복수의 화합물이 사용될 수 있다.
또한, 본 발명의 유기 전계 발광 소자에 있어서, 한 쌍의 전극의 적어도 한쪽의 표면에 전자 전달 화합물과 환원성 도판트의 혼합 영역 또는 정공 전달 화합물과 산화성 도판트의 혼합 영역을 배치하는 것도 바람직하다. 이러한 방식에 의해 전자 전달 화합물이 음이온으로 환원되므로 혼합 영역으로부터 발광 매체에 전자를 주입 및 전달하기 용이해진다. 또한, 정공 전달 화합물은 산화되어 양이온으로 되므로 혼합 영역으로부터 발광 매체에 정공을 주입 및 전달하기 용이해진다. 바람직한 산화성 도판트로서는 각종 루이스산 및 억셉터(acceptor) 화합물을 들 수 있고, 바람직한 환원성 도판트로는 알칼리 금속, 알칼리 금속 화합물, 알칼리 토류 금속, 희토류 금속 및 이들의 혼합물을 들 수 있다. 또한 환원성 도판트층을 전하생성층으로 사용하여 두 개 이상의 발광층을 가진 백색 유기 전계 발광소자를 제조할 수 있다.
본 발명의 유기 전계 발광 소자의 각 층의 형성은 진공 증착, 스퍼터링, 플라즈마, 이온 플레이팅 등의 건식 성막법이나 잉크 젯 프린팅(ink jet printing), 노즐 프린팅(nozzle printing), 슬롯 코팅(slot coating), 스핀 코팅, 침지 코팅(dip coating), 플로우 코팅 등의 습식 성막법 중의 어느 하나의 방법을 적용할 수 있다.
습식 성막법의 경우, 각 층을 형성하는 재료를 에탄올, 클로로포름, 테트라하이드로푸란, 디옥산 등의 적절한 용매에 용해 또는 분산시켜 박막을 형성하는데, 그 용매는 각 층을 형성하는 재료가 용해 또는 분산될 수 있고, 성막성에 문제가 없는 것이라면 어느 것이어도 된다.
또한, 본원 발명의 제1 및 제2 호스트 화합물은 공증착 또는 혼합증착 공정에 의해 성막될 수 있다.
또한, 본원 발명의 유기 전계 발광 소자를 이용하여 표시 장치 또는 조명 장치를 제조하는 것이 가능하다.
이하에서, 본원의 상세한 이해를 위하여 본원의 대표 화합물을 들어 본원에 따른 화합물, 이의 제조방법 및 이를 포함하는 유기 전계 발광 소자의 발광특성을 설명한다.
[
실시예
1] 화합물 H1-1의 제조
반응용기에 화합물 1-1 (4 g, 12 mmol), 비스(바이페닐-4-일)[4-(4,4,5,5-테트라메틸-[1,3,2]-다이옥사보로란-2-일)페닐]아민 (6.8 g, 13 mmol), 팔라듐(II) 아세테이트 (0.3 g, 1 mmol), 2-다이사이클로헥실 포스피노-2',6'-다이메톡시바이페닐 (0.9 g, 2 mmol), 탄산세슘 (11.5 g, 35 mmol), o-자일렌 60 mL, 에탄올 15 mL, 및 증류수 15 mL 를 넣고 3시간 환류교반하였다. 반응이 끝나면 증류수로 씻어주고 에틸 아세테이트로 추출한 뒤 유기층을 황산마그네슘으로 건조시킨 후 회전 증발기로 용매를 제거한 후 컬럼 크로마토그래피로 정제하여 화합물 H1-1 (2.2g, 수율: 27%)를 얻었다.
[
실시예
2] 화합물 H1-42의 제조
반응용기에 화합물 2-1 (4.8 g, 11.34 mmol), N-(4-브로모페닐)-N-페닐-[1,1'-바이페닐]-4-아민 (5 g, 12.47 mmol), 테트라키스(트라이페닐포스핀)팔라듐 (0.4 g, 0.34 mmol), 탄산나트륨 (3.0 g, 28.35 mmol), 톨루엔 57 mL, 에탄올 14 mL 및 증류수 14 mL를 첨가한 후 120℃에서 4시간 동안 교반하였다. 반응이 끝나면 혼합물을 메탄올에 적가하고, 생성된 고체를 여과하였다. 생성된 고체는 컬럼 크로마토그래피로 재결정으로 정제하여 화합물 H1-42 (1.4 g, 수율: 20.0 %)를 얻었다.
[
실시예
3] 화합물 H1-27의 제조
반응용기에 화합물 3-1 (4.5 g, 16.09 mmol), 9,9-다이메틸-N-페닐-9H-플로렌-2-아민(5.5 g, 19.31 mmol), 팔라듐(II) 아세테이트 (0.2 g, 0.80 mmol), 트라이-t-부틸 포스핀 (0.8 mL, 1.60 mmol), 소디움 tert-부톡사이드 (2.3 g, 24.14 mmol), 및 o-자일렌 80 mL를 넣고 120℃에서 2시간 동안 환류교반하였다. 반응이 끝나면 혼합물을 상온으로 식힌 후 생성된 고체를 여과하여 에틸아세테이트로 씻어 주었다. 여액을 감압증류하고 생성된 고체는 컬럼 크로마토그래피로 재결정으로 정제하여 화합물 H1-27 (2.4g, 수율: 28%)를 얻었다.
[
실시예
4] 화합물 H2-1의 제조
반응용기에 화합물 2-1 (10 g, 23.7 mmol), 2-클로로-4,6-다이페닐트라이아진 (CAS: 3842-55-5, 5.8 g, 21.6 mmol), 테트라키스(트라이페닐포스핀)팔라듐 (1.2 g, 1.0 mmol), 탄산칼륨 (7.5 g, 59 mmol), 톨루엔 90 mL, 에탄올 30 mL 및 증류수 30 mL를 첨가한 후, 120℃에서 4시간 동안 교반하였다. 반응이 끝나면 혼합물을 메탄올에 적가하고, 생성된 고체를 여과하였다. 생성된 고체는 컬럼 크로마토그래피로 재결정으로 정제하여 화합물 H2-1 (5.7 g, 수율: 50 %)를 얻었다.
[
실시예
5] 화합물 H2-2의 제조
반응용기에 화합물 2-1 (3.48 g, 8.3 mmol), 2-([1,1'-바이페닐]-4-일)-4-클로로-6-페닐-1,3,5-트리아진 (CAS: 1472062-94-4, 3.53 g, 9.1 mmol), 테트라키스(트라이페닐포스핀)팔라듐 (0.48 g, 0.41 mmol), 탄산나트륨 (2.2 g, 20.7 mmol), 톨루엔 28 mL, 에탄올 7 mL 및 증류수 7 mL를 첨가한 후, 120℃에서 5시간 동안 교반하였다. 반응이 끝나면 혼합물을 메탄올에 적가하고, 생성된 고체를 여과하였다. 생성된 고체는 컬럼 크로마토그래피로 재결정으로 정제하여 화합물 H2-2 (3.7 g, 수율: 74 %)를 얻었다.
상기 실시예 1 및 실시예 3에서 합성된 화합물 H1-1 및 H1-27의 LUMO (Lowest Unoccupied Molecular Orbital) 에너지, HOMO (Highest Occupied Molecular Orbital) 에너지, 및 삼중항 에너지를 B3LYP/6-31g(d) 수준에서 밀도함수이론(Density Functionaltheory, DFT) 계산을 수행하여 하기 표 1에 나타내었다.
이렇게 측정된 LUMO 에너지 및 HOMO 에너지 값은 본래 음수 값을 가지나, 편의상 그 절대값으로 나타낸다. 또한, LUMO/HOMO 에너지 값의 그 크기를 비교함에 있어서도 절대값을 기준으로 비교한다.
상기 표 1을 참조하면, 일 예에 따른 본원 제1 호스트 화합물, 즉 화학식 1로 표시되는 화합물 H1-1과 화학식 2로 표시되는 화합물 H1-27의 소자 특성을 비교ㆍ예상할 수 있다. 구체적으로, 화합물 H1-27의 HOMO 에너지 값은, 화합물 H1-1의 HOMO 에너지 값과 유사하고, LUMO 에너지 값은, 화합물 H1-1의 LUMO 에너지 값 보다 더 낮은 값을 보여 충분한 전자 캐리어 속박 효과를 보일 것으로 예상된다. 또한, 상기 H1-1 및 H1-27 호스트 화합물을 전자 전류 특성이 강한 호스트와 함께 조합시 엑시플렉스(exciplex) 생성에 문제가 없는 에너지 값을 가짐을 확인할 수 있다. 또한 삼중항 (Triplet) 에너지 값 또한 화합물 H1-1과 화합물 H1-27 각각 2.4 eV, 및 2.5 eV로, 도판트의 삼중항 에너지를 블록킹 하기에 충분한 에너지 값을 가지고 있는 것으로 나타났다. 즉, 일 예에 따른 제1 호스트 화합물로서, 화합물 H1-1 또는 화합물 H1-27를 사용한 경우, 이들을 포함하는 소자는 비슷한 소자 특성을 나타낼 것으로 예상할 수 있다.
이에, 하기 소자 제조예에서는 제1 호스트 화합물로서, 대표적으로 화학식 1로 표시되는 화합물인, 화합물 H1-1 및 H1-42만을 사용하여 유기 전계 발광 소자를 제조하고, 이의 소자 특성을 설명한다.
[
비교예
1] 본 발명에 따르지 않는 적색 발광 유기
전계
발광 소자의 제조
본 발명에 따르지 않는 OLED 소자를 제조하였다. 우선, OLED용 글래스 (지오마텍사 제조) 기판 상의 투명 전극 ITO 박막(10Ω/□)을 아세톤 및 이소프로필알코올을 순차적으로 사용하여 초음파 세척을 실시한 후, 이소프로판올에 넣어 보관한 후 사용하였다. 다음으로 진공 증착 장비의 기판 홀더에 ITO 기판을 장착한 후, 진공 증착 장비 내의 셀에 화합물 HI -1을 넣고 챔버 내의 진공도가 10-7 torr에 도달할 때까지 배기시킨 후, 셀에 전류를 인가하여 증발시켜 ITO 기판 위에 80 nm 두께의 제1 정공 주입층을 증착하였다. 이어서, 진공 증착 장비 내의 다른 셀에 화합물 HI-2를 넣고, 셀에 전류를 인가하여 증발시켜 제1 정공 주입층 위에 5 nm 두께의 제2 정공 주입층을 증착하였다. 이어서, 진공 증착 장비 내의 다른 셀에 화합물 HT-1을 넣고, 셀에 전류를 인가하여 증발시켜 제2 정공 주입층 위에 10 nm 두께의 제1 정공 전달층을 증착하였다. 이어서, 진공 증착 장비 내의 다른 셀에 화합물 HT-2를 넣고, 셀에 전류를 인가하여 증발시켜 제1 정공 전달층 위에 60 nm 두께의 제2 정공 전달층을 증착하였다. 정공 주입층과 정공 전달층을 형성시킨 후, 그 위에 발광층을 다음과 같이 증착시켰다. 진공 증착 장비 내의 한쪽 셀에 호스트로서 화합물 H1-1를 넣고, 또 다른 셀에는 도판트로서 화합물 D- 39을 각각 넣은 후, 두 물질을 다른 속도로 증발시켜 호스트와 도판트의 합계량에 대해 도판트를 3 중량%의 양으로 도핑함으로써 상기 제2 정공 전달층 위에 40 nm 두께의 발광층을 증착하였다. 이어서 상기 발광층 위에 전자 전달 재료로서 화합물 ETL - 1:EIL -1을 50:50 중량비로 증착하여 35 nm 두께의 전자 전달층을 형성하였다. 이어서 전자 주입층으로 화합물 EIL -1을 상기 전자 전달층 위에 2 nm의 두께로 증착한 후, 다른 진공 증착 장비를 이용하여 Al 음극을 상기 전자 주입층 위에 80 nm의 두께로 증착하여 OLED 소자를 제조하였다. 재료별로 각 화합물은 10-6 torr 하에서 진공 승화 정제하여 사용하였다.
[
비교예
2] 본 발명에 따르지 않는 적색 발광 유기
전계
발광 소자의 제조
발광층 재료로서 화합물 H1-1 대신에 화합물 H2-2를 사용한 것을 제외하고는, 비교예 1과 동일한 방법으로 OLED 소자를 제조하였다.
[
비교예
3] 본 발명에 따르지 않는 적색 발광 유기
전계
발광 소자의 제조
발광층 재료로서 화합물 H1-1 대신에 화합물 H2- 1를 사용한 것을 제외하고는, 비교예 1과 동일한 방법으로 OLED 소자를 제조하였다.
[소자
제조예
1 내지 3] 본 발명에 따른 적색 발광 유기
전계
발광 소자의 제조
소자 제조예 1 내지 3에서는, 발광층을 진공 증착 장비 내의 셀 두 군데에 호스트로서 하기 표 2에 기재된 각각의 제1 호스트 화합물 및 제2 호스트 화합물을 넣고, 또 다른 셀에는 D- 39을 넣은 후, 두 호스트 물질을 1:1의 속도로 증발시키고 동시에 도판트 물질을 다른 속도로 증발시켜 호스트와 도판트의 합계량에 대해 도판트를 3 중량%의 양으로 도핑함으로써 상기 정공 전달층 위에 40 nm 두께의 발광층을 증착한 것 외에는 비교예 1과 동일한 방법으로 OLED 소자를 제조하였다.
이상과 같이 제조된 비교예 1 내지 3 및 소자 제조예 1 내지 3의 유기 전계 발광 소자의 1,000 nits 휘도 기준의 구동 전압, 발광 효율, CIE 색좌표 및 5,000 nits 휘도 기준의 빛의 세기가 100%에서 90%로 떨어지는 데까지의 시간(수명; T90)을 하기 표 2에 나타내었다. 또한, 비교예 2 및 소자 제조예 1에서 제조된 유기 전계 발광 소자의 휘도에 따른 전류 효율을 도 1에 도시하였다.
상기 소자 제조예 1 내지 3으로부터, 본원의 화합물 조합은 비교예와 비슷한 구동전압을 유지하면서도, 효율 및 수명 특성을 크게 향상시킬 수 있음을 확인하였다. 특히 도1을 참조하면, 일 실시예에 따른 유기 전계 발광 소자와 같은 발광층 조합은 단독 발광층 조합인 비교예 대비 롤 오프 (Roll-off) 개선에도 큰 효과가 있음을 확인할 수 있다.
상기 비교예들 및 소자 제조예들에 사용된 화합물을 하기 표 3에 나타내었다.
Claims (7)
1종 이상의 제1 호스트 화합물 및 1종 이상의 제2 호스트 화합물을 포함하는 복수 종의 호스트 재료로서, 상기 제1 호스트 화합물은 하기 화학식 2로 표시되고, 상기 제2 호스트 화합물은 하기 화학식 3으로 표시되는 것인, 호스트 재료.
[화학식 2]
상기 화학식 2에서,
X1 은 -N=, -NR7-, -O- 또는 -S-이고,
Y1은 -N=, -NR8-, -O- 또는 -S-이되, X1이 -N= 인 경우 Y1은 -NR8-, -O- 또는 -S-이고, X1이 -NR7-인 경우 Y1은 -N=, -O- 또는 -S-이고,
R1 은 치환 또는 비치환된 (C6-C30)아릴, 또는 치환 또는 비치환된 (3-30원)헤테로아릴이고,
R2, R3, R5 내지 R8은 각각 독립적으로 수소, 중수소, 할로겐, 시아노, 치환 또는 비치환된 (C1-C30)알킬, 치환 또는 비치환된 (C6-C30)아릴, 치환 또는 비치환된 (3-30원)헤테로아릴, 치환 또는 비치환된 (C3-C30)시클로알킬, 치환 또는 비치환된 (C1-C30)알콕시, 치환 또는 비치환된 트리(C1-C30)알킬실릴, 치환 또는 비치환된 디(C1-C30)알킬(C6-C30)아릴실릴, 치환 또는 비치환된 (C1-C30)알킬디(C6-C30)아릴실릴, 치환 또는 비치환된 트리(C6-C30)아릴실릴, 치환 또는 비치환된 모노- 또는 디-(C1-C30)알킬아미노, 치환 또는 비치환된 모노- 또는 디-(C6-C30)아릴아미노, 또는 치환 또는 비치환된 (C1-C30)알킬(C6-C30)아릴아미노이거나, 인접한 치환체와 연결되어 치환 또는 비치환된 (C3-C30) 단일환 또는 다환의 지환족 또는 방향족 고리를 형성할 수 있으며, 상기 형성된 지환족 또는 방향족 고리의 탄소 원자는 질소, 산소 및 황으로부터 선택되는 하나 이상의 헤테로원자로 대체될 수 있고,
L1 은 단일 결합, 치환 또는 비치환된 (C6-C30)아릴렌, 또는 치환 또는 비치환된 (3-30원)헤테로아릴렌이고,
a는 1이고, b는 1 또는 2이고, e는 1 내지 4 의 정수이고,
상기 헤테로아릴(렌)은 B, N, O, S, Si 및 P로부터 선택된 하나 이상의 헤테로원자를 포함하며;
[화학식 3]
상기 화학식 3에서,
X11 은 -N=, -NR17-, -O- 또는 -S-이고,
Y11은 -N=, -NR18-, -O- 또는 -S-이되, X11이 -N= 인 경우 Y11은 -NR18-, -O- 또는 -S-이고, X11이 -NR17-인 경우 Y11은 -N=, -O- 또는 -S-이고,
X는 N 또는 CH이고,
R11 은 치환 또는 비치환된 (C6-C30)아릴, 또는 치환 또는 비치환된 (3-30원)헤테로아릴이고,
R12 내지 R18은 각각 독립적으로 수소, 중수소, 할로겐, 시아노, 치환 또는 비치환된 (C1-C30)알킬, 치환 또는 비치환된 (C6-C30)아릴, 치환 또는 비치환된 (3-30원)헤테로아릴, 치환 또는 비치환된 (C3-C30)시클로알킬, 치환 또는 비치환된 (C1-C30)알콕시, 치환 또는 비치환된 트리(C1-C30)알킬실릴, 치환 또는 비치환된 디(C1-C30)알킬(C6-C30)아릴실릴, 치환 또는 비치환된 (C1-C30)알킬디(C6-C30)아릴실릴, 치환 또는 비치환된 트리(C6-C30)아릴실릴, 치환 또는 비치환된 모노- 또는 디-(C1-C30)알킬아미노, 치환 또는 비치환된 모노- 또는 디-(C6-C30)아릴아미노, 또는 치환 또는 비치환된 (C1-C30)알킬(C6-C30)아릴아미노이거나, 인접한 치환체와 연결되어 치환 또는 비치환된 (C3-C30) 단일환 또는 다환의 지환족 또는 방향족 고리를 형성할 수 있으며, 상기 형성된 지환족 또는 방향족 고리의 탄소 원자는 질소, 산소 및 황으로부터 선택되는 하나 이상의 헤테로원자로 대체될 수 있고,
L2 는 단일 결합, 치환 또는 비치환된 (C6-C30)아릴렌, 또는 치환 또는 비치환된 (3-30원)헤테로아릴렌이고,
a'는 1이고, b' 및 c'는 각각 독립적으로 1 또는 2이고, d'는 1 내지 4의 정수이고,
상기 헤테로아릴(렌)은 B, N, O, S, Si 및 P로부터 선택된 하나 이상의 헤테로원자를 포함한다.
[화학식 2]
상기 화학식 2에서,
X1 은 -N=, -NR7-, -O- 또는 -S-이고,
Y1은 -N=, -NR8-, -O- 또는 -S-이되, X1이 -N= 인 경우 Y1은 -NR8-, -O- 또는 -S-이고, X1이 -NR7-인 경우 Y1은 -N=, -O- 또는 -S-이고,
R1 은 치환 또는 비치환된 (C6-C30)아릴, 또는 치환 또는 비치환된 (3-30원)헤테로아릴이고,
R2, R3, R5 내지 R8은 각각 독립적으로 수소, 중수소, 할로겐, 시아노, 치환 또는 비치환된 (C1-C30)알킬, 치환 또는 비치환된 (C6-C30)아릴, 치환 또는 비치환된 (3-30원)헤테로아릴, 치환 또는 비치환된 (C3-C30)시클로알킬, 치환 또는 비치환된 (C1-C30)알콕시, 치환 또는 비치환된 트리(C1-C30)알킬실릴, 치환 또는 비치환된 디(C1-C30)알킬(C6-C30)아릴실릴, 치환 또는 비치환된 (C1-C30)알킬디(C6-C30)아릴실릴, 치환 또는 비치환된 트리(C6-C30)아릴실릴, 치환 또는 비치환된 모노- 또는 디-(C1-C30)알킬아미노, 치환 또는 비치환된 모노- 또는 디-(C6-C30)아릴아미노, 또는 치환 또는 비치환된 (C1-C30)알킬(C6-C30)아릴아미노이거나, 인접한 치환체와 연결되어 치환 또는 비치환된 (C3-C30) 단일환 또는 다환의 지환족 또는 방향족 고리를 형성할 수 있으며, 상기 형성된 지환족 또는 방향족 고리의 탄소 원자는 질소, 산소 및 황으로부터 선택되는 하나 이상의 헤테로원자로 대체될 수 있고,
L1 은 단일 결합, 치환 또는 비치환된 (C6-C30)아릴렌, 또는 치환 또는 비치환된 (3-30원)헤테로아릴렌이고,
a는 1이고, b는 1 또는 2이고, e는 1 내지 4 의 정수이고,
상기 헤테로아릴(렌)은 B, N, O, S, Si 및 P로부터 선택된 하나 이상의 헤테로원자를 포함하며;
[화학식 3]
상기 화학식 3에서,
X11 은 -N=, -NR17-, -O- 또는 -S-이고,
Y11은 -N=, -NR18-, -O- 또는 -S-이되, X11이 -N= 인 경우 Y11은 -NR18-, -O- 또는 -S-이고, X11이 -NR17-인 경우 Y11은 -N=, -O- 또는 -S-이고,
X는 N 또는 CH이고,
R11 은 치환 또는 비치환된 (C6-C30)아릴, 또는 치환 또는 비치환된 (3-30원)헤테로아릴이고,
R12 내지 R18은 각각 독립적으로 수소, 중수소, 할로겐, 시아노, 치환 또는 비치환된 (C1-C30)알킬, 치환 또는 비치환된 (C6-C30)아릴, 치환 또는 비치환된 (3-30원)헤테로아릴, 치환 또는 비치환된 (C3-C30)시클로알킬, 치환 또는 비치환된 (C1-C30)알콕시, 치환 또는 비치환된 트리(C1-C30)알킬실릴, 치환 또는 비치환된 디(C1-C30)알킬(C6-C30)아릴실릴, 치환 또는 비치환된 (C1-C30)알킬디(C6-C30)아릴실릴, 치환 또는 비치환된 트리(C6-C30)아릴실릴, 치환 또는 비치환된 모노- 또는 디-(C1-C30)알킬아미노, 치환 또는 비치환된 모노- 또는 디-(C6-C30)아릴아미노, 또는 치환 또는 비치환된 (C1-C30)알킬(C6-C30)아릴아미노이거나, 인접한 치환체와 연결되어 치환 또는 비치환된 (C3-C30) 단일환 또는 다환의 지환족 또는 방향족 고리를 형성할 수 있으며, 상기 형성된 지환족 또는 방향족 고리의 탄소 원자는 질소, 산소 및 황으로부터 선택되는 하나 이상의 헤테로원자로 대체될 수 있고,
L2 는 단일 결합, 치환 또는 비치환된 (C6-C30)아릴렌, 또는 치환 또는 비치환된 (3-30원)헤테로아릴렌이고,
a'는 1이고, b' 및 c'는 각각 독립적으로 1 또는 2이고, d'는 1 내지 4의 정수이고,
상기 헤테로아릴(렌)은 B, N, O, S, Si 및 P로부터 선택된 하나 이상의 헤테로원자를 포함한다.
제1항에 있어서, 상기 R1 내지 R3, R5 내지 R8, R11 내지 R18, L1 및 L2 에서 치환된 알킬, 치환된 알콕시, 치환된 시클로알킬, 치환된 아릴(렌), 치환된 헤테로아릴(렌), 치환된 트리알킬실릴, 치환된 트리아릴실릴, 치환된 디알킬아릴실릴, 치환된 알킬디아릴실릴, 치환된 모노- 또는 디- 알킬아미노, 치환된 모노- 또는 디- 아릴아미노, 치환된 알킬아릴아미노, 및 치환된 단일환 또는 다환의 지환족 또는 방향족 고리의 치환체는 각각 독립적으로 중수소; 할로겐; 시아노; 카르복실; 니트로; 히드록시; (C1-C30)알킬; 할로(C1-C30)알킬; (C2-C30)알케닐; (C2-C30)알키닐; (C1-C30)알콕시; (C1-C30)알킬티오; (C3-C30)시클로알킬; (3-7원)헤테로시클로알킬; (C6-C30)아릴옥시; (C6-C30)아릴티오; (C6-C30)아릴이나 디(C6-C30)아릴아미노로 치환되거나 비치환된 (3-30원)헤테로아릴; 시아노, (3-30원)헤테로아릴 또는 트리(C6-C30)아릴실릴로 치환되거나 비치환된 (C6-C30)아릴; 트리(C1-C30)알킬실릴; 트리(C6-C30)아릴실릴; 디(C1-C30)알킬(C6-C30)아릴실릴; (C1-C30)알킬디(C6-C30)아릴실릴; 아미노; 모노 또는 디(C1-C30)알킬아미노; 모노 또는 디(C6-C30)아릴아미노; (C1-C30)알킬(C6-C30)아릴아미노; (C1-C30)알킬카보닐; (C1-C30)알콕시카보닐; (C6-C30)아릴카보닐; 디(C6-C30)아릴보로닐; 디(C1-C30)알킬보로닐; (C1-C30)알킬(C6-C30)아릴보로닐; (C6-C30)아르(C1-C30)알킬; 및 (C1-C30)알킬(C6-C30)아릴로 이루어진 군으로부터 선택되는 하나 이상의 것인, 호스트 재료.
양극, 음극, 및 양극과 음극 사이에 적어도 1층의 발광층을 포함하고, 상기 발광층은 호스트와 인광 도판트를 포함하고, 상기 호스트는 제1항에 기재된 호스트 재료를 포함하는, 유기 전계 발광 소자.
Priority Applications (8)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201880011342.XA CN110291075A (zh) | 2017-02-27 | 2018-02-23 | 多种主体材料和包含其的有机电致发光装置 |
| JP2019544070A JP2020510999A (ja) | 2017-02-27 | 2018-02-23 | 複数のホスト材料及びこれを含む有機エレクトロルミネセントデバイス |
| PCT/KR2018/002230 WO2018155942A1 (en) | 2017-02-27 | 2018-02-23 | A plurality of host materials and organic electroluminescent device comprising the same |
| US16/481,644 US20200028089A1 (en) | 2017-02-27 | 2018-02-23 | A plurality of host materials and organic electroluminescent device comprising the same |
| US17/670,572 US11737353B2 (en) | 2017-02-27 | 2022-02-14 | Plurality of host materials and organic electroluminescent device comprising the same |
| JP2022172306A JP2023011751A (ja) | 2017-02-27 | 2022-10-27 | 複数のホスト材料及びこれを含む有機エレクトロルミネセントデバイス |
| KR1020230078862A KR20230098747A (ko) | 2017-02-27 | 2023-06-20 | 복수 종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 |
| US18/344,288 US20240057472A1 (en) | 2017-02-27 | 2023-06-29 | Plurality of host materials and organic electroluminescent device comprising the same |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR20170025749 | 2017-02-27 | ||
| KR1020170025749 | 2017-02-27 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020230078862A Division KR20230098747A (ko) | 2017-02-27 | 2023-06-20 | 복수 종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20180099487A KR20180099487A (ko) | 2018-09-05 |
| KR102547298B1 true KR102547298B1 (ko) | 2023-06-26 |
Family
ID=63594497
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020180020359A KR102547298B1 (ko) | 2017-02-27 | 2018-02-21 | 복수 종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 |
| KR1020230078862A KR20230098747A (ko) | 2017-02-27 | 2023-06-20 | 복수 종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020230078862A KR20230098747A (ko) | 2017-02-27 | 2023-06-20 | 복수 종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 |
Country Status (4)
| Country | Link |
|---|---|
| US (3) | US20200028089A1 (ko) |
| JP (2) | JP2020510999A (ko) |
| KR (2) | KR102547298B1 (ko) |
| CN (1) | CN110291075A (ko) |
Families Citing this family (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11158831B2 (en) | 2019-02-22 | 2021-10-26 | Samsung Display Co., Ltd. | Organic light-emitting device |
| CN113614202A (zh) * | 2019-03-25 | 2021-11-05 | 日铁化学材料株式会社 | 有机电场发光元件用熔融混合物、及有机电场发光元件 |
| CN110734431B (zh) * | 2019-11-18 | 2022-04-15 | 烟台九目化学股份有限公司 | 一种含有三嗪结构的恶唑类化合物及其应用 |
| KR20210070738A (ko) * | 2019-12-05 | 2021-06-15 | 롬엔드하스전자재료코리아유한회사 | 복수 종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 |
| KR20210076837A (ko) | 2019-12-16 | 2021-06-24 | 롬엔드하스전자재료코리아유한회사 | 유기 전계 발광 화합물, 복수 종의 호스트 재료, 및 이를 포함하는 유기 전계 발광 소자 |
| KR20210082888A (ko) | 2019-12-26 | 2021-07-06 | 롬엔드하스전자재료코리아유한회사 | 복수 종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 |
| KR102511933B1 (ko) * | 2020-01-22 | 2023-03-20 | 주식회사 엘지화학 | 신규한 헤테로 고리 화합물 및 이를 이용한 유기발광 소자 |
| DE102021100597A1 (de) | 2020-01-31 | 2021-08-05 | Rohm And Haas Electronic Materials Korea Ltd. | Organische elektrolumineszierende verbindung, mehrere wirtsmaterialien und diese umfassende organische elektrolumineszierende vorrichtung |
| KR102541994B1 (ko) * | 2020-02-17 | 2023-06-12 | 주식회사 엘지화학 | 신규한 화합물 및 이를 이용한 유기 발광 소자 |
| KR102544125B1 (ko) * | 2020-02-17 | 2023-06-16 | 주식회사 엘지화학 | 신규한 화합물 및 이를 이용한 유기 발광 소자 |
| KR20210114601A (ko) * | 2020-03-10 | 2021-09-24 | 삼성디스플레이 주식회사 | 발광 소자 및 이를 포함하는 전자 장치 |
| CN113402508A (zh) * | 2020-03-17 | 2021-09-17 | 罗门哈斯电子材料韩国有限公司 | 有机电致发光化合物以及包含其的有机电致发光装置 |
| WO2021230681A1 (ko) * | 2020-05-13 | 2021-11-18 | 주식회사 엘지화학 | 신규한 화합물 및 이를 이용한 유기발광 소자 |
| CN113968847A (zh) * | 2020-07-24 | 2022-01-25 | 罗门哈斯电子材料韩国有限公司 | 有机电致发光化合物、多种主体材料及包含其的有机电致发光装置 |
| KR20220021651A (ko) | 2020-08-14 | 2022-02-22 | 롬엔드하스전자재료코리아유한회사 | 유기 전계 발광 화합물, 복수 종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 |
| US20220123223A1 (en) | 2020-10-19 | 2022-04-21 | Rohm And Haas Electronic Materials Korea Ltd. | Organic electroluminescent compound, a plurality of host materials and organic electroluminescent device comprising the same |
| US20220144856A1 (en) | 2020-11-10 | 2022-05-12 | Rohm And Haas Electronic Materials Korea Ltd. | Organic electroluminescent compound, a plurality of host materials, and organic electroluminescent device comprising the same |
| CN114075185B (zh) * | 2021-01-28 | 2023-09-22 | 陕西莱特光电材料股份有限公司 | 一种含氮化合物及包含其的电子元件和电子装置 |
| CN112939890A (zh) * | 2021-02-04 | 2021-06-11 | 吉林奥来德光电材料股份有限公司 | 一种杂环有机光电材料及其制备方法和有机电致发光器件 |
| KR20220121213A (ko) * | 2021-02-24 | 2022-08-31 | 주식회사 엘지화학 | 신규한 화합물 및 이를 이용한 유기 발광 소자 |
| EP4276924A4 (en) * | 2021-02-24 | 2024-07-24 | Lg Chemical Ltd | ORGANIC ELECTROLUMINESCENT DEVICE |
| US20240114776A1 (en) * | 2021-02-24 | 2024-04-04 | Lg Chem, Ltd. | Compound and organic light emitting device comprising the same |
| KR20220121218A (ko) * | 2021-02-24 | 2022-08-31 | 주식회사 엘지화학 | 유기 발광 소자 |
| CN113372289A (zh) * | 2021-05-25 | 2021-09-10 | 上海传勤新材料有限公司 | 一种含有菲并唑类化合物的有机电子材料及其制备方法和应用 |
| CN113528123B (zh) * | 2021-09-16 | 2022-02-18 | 浙江华显光电科技有限公司 | 主体材料和包含其的有机电致发光器件 |
| CN114057703B (zh) * | 2021-11-22 | 2024-02-02 | 烟台九目化学股份有限公司 | 一种含三嗪结构的䓛并呋喃类衍生物及其应用 |
| CN117343078A (zh) | 2021-11-25 | 2024-01-05 | 北京夏禾科技有限公司 | 有机电致发光材料和器件 |
| JP2024527855A (ja) * | 2022-01-07 | 2024-07-26 | エルジー・ケム・リミテッド | 有機発光素子 |
| US20230292610A1 (en) | 2022-03-08 | 2023-09-14 | Rohm And Haas Electronic Materials Korea Ltd. | Organic electroluminescent compound, a plurality of host materials and organic electroluminescent device comprising the same |
| CN117460719A (zh) * | 2022-04-15 | 2024-01-26 | 株式会社Lg化学 | 新型化合物及包含其的有机发光器件 |
| JP2024058639A (ja) | 2022-10-14 | 2024-04-25 | デュポン スペシャルティ マテリアルズ コリア リミテッド | 有機エレクトロルミネセント化合物、複数のホスト材料、及びそれらを含む有機エレクトロルミネセントデバイス |
| CN115974787A (zh) * | 2023-01-17 | 2023-04-18 | 吉林奥来德光电材料股份有限公司 | 一种化合物、其制备方法及应用 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008031743A1 (en) | 2006-09-14 | 2008-03-20 | Ciba Holding Inc. | Heterocyclic bridged biphenyls and their use in oleds |
| US20110240978A1 (en) | 2010-04-06 | 2011-10-06 | Samsung Mobile Display Co., Ltd | Heterocyclic compound and organic light-emitting device including the same |
| WO2017030283A1 (en) * | 2015-08-19 | 2017-02-23 | Rohm And Haas Electronic Materials Korea Ltd. | Organic electroluminescent compounds and organic electroluminescent device comprising the same |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001023777A (ja) | 1999-07-08 | 2001-01-26 | Toray Ind Inc | 発光素子 |
| TWI314947B (en) * | 2002-04-24 | 2009-09-21 | Eastman Kodak Compan | Organic light emitting diode devices with improved operational stability |
| JP2007110102A (ja) * | 2005-09-15 | 2007-04-26 | Fujifilm Corp | 有機電界発光素子 |
| JP2007200938A (ja) * | 2006-01-23 | 2007-08-09 | Fujifilm Corp | 有機電界発光素子 |
| JP2007221097A (ja) * | 2006-01-23 | 2007-08-30 | Fujifilm Corp | 有機電界発光素子 |
| WO2012143080A2 (de) * | 2011-04-18 | 2012-10-26 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| KR101777454B1 (ko) * | 2014-05-26 | 2017-09-12 | 주식회사 엘지화학 | 함질소 헤테로환 화합물 및 이를 이용한 유기 전자 소자 |
| KR102112786B1 (ko) * | 2015-08-19 | 2020-05-20 | 롬엔드하스전자재료코리아유한회사 | 유기 전계 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| US9559312B1 (en) * | 2016-01-07 | 2017-01-31 | E-Ray Optoelectronics Technology Co., Ltd. | Imidazole compound, material for electronic device, electroluminescent device, and electronic device thereof |
-
2018
- 2018-02-21 KR KR1020180020359A patent/KR102547298B1/ko active IP Right Grant
- 2018-02-23 CN CN201880011342.XA patent/CN110291075A/zh active Pending
- 2018-02-23 US US16/481,644 patent/US20200028089A1/en not_active Abandoned
- 2018-02-23 JP JP2019544070A patent/JP2020510999A/ja active Pending
-
2022
- 2022-02-14 US US17/670,572 patent/US11737353B2/en active Active
- 2022-10-27 JP JP2022172306A patent/JP2023011751A/ja active Pending
-
2023
- 2023-06-20 KR KR1020230078862A patent/KR20230098747A/ko not_active Application Discontinuation
- 2023-06-29 US US18/344,288 patent/US20240057472A1/en active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008031743A1 (en) | 2006-09-14 | 2008-03-20 | Ciba Holding Inc. | Heterocyclic bridged biphenyls and their use in oleds |
| US20110240978A1 (en) | 2010-04-06 | 2011-10-06 | Samsung Mobile Display Co., Ltd | Heterocyclic compound and organic light-emitting device including the same |
| WO2017030283A1 (en) * | 2015-08-19 | 2017-02-23 | Rohm And Haas Electronic Materials Korea Ltd. | Organic electroluminescent compounds and organic electroluminescent device comprising the same |
Also Published As
| Publication number | Publication date |
|---|---|
| US20220165956A1 (en) | 2022-05-26 |
| JP2023011751A (ja) | 2023-01-24 |
| US20240057472A1 (en) | 2024-02-15 |
| US20200028089A1 (en) | 2020-01-23 |
| KR20180099487A (ko) | 2018-09-05 |
| KR20230098747A (ko) | 2023-07-04 |
| CN110291075A (zh) | 2019-09-27 |
| US11737353B2 (en) | 2023-08-22 |
| JP2020510999A (ja) | 2020-04-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102547298B1 (ko) | 복수 종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 | |
| KR102660550B1 (ko) | 복수종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 | |
| KR102479135B1 (ko) | 복수 종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 | |
| KR102533792B1 (ko) | 유기 전계 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 | |
| KR102613166B1 (ko) | 복수 종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 | |
| KR102502306B1 (ko) | 유기 전계 발광 소자 | |
| KR102491209B1 (ko) | 복수종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 | |
| KR102214622B1 (ko) | 신규한 유기 전계 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 | |
| KR20240026971A (ko) | 복수종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 | |
| KR20230028739A (ko) | 복수종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 | |
| KR102182270B1 (ko) | 유기 전계 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 | |
| KR102646953B1 (ko) | 복수종의 호스트 재료와 이를 포함하는 유기 전계 발광 소자 | |
| KR102430648B1 (ko) | 정공 전달 재료 및 이를 포함하는 유기 전계 발광 소자 | |
| KR102397506B1 (ko) | 유기 전계 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 | |
| KR102419711B1 (ko) | 유기 전계 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 | |
| KR102667927B1 (ko) | 복수 종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 | |
| KR20160010373A (ko) | 유기 전계 발광 소자 | |
| KR20140035737A (ko) | 신규한 유기 전계 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 | |
| KR20130118059A (ko) | 신규한 유기 전계 발광 화합물 및 이를 사용하는 유기 전계 발광 소자 | |
| KR20160060569A (ko) | 복수종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 | |
| KR20140082486A (ko) | 신규한 유기 전계 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 | |
| KR20160136211A (ko) | 인광 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 | |
| KR102158472B1 (ko) | 유기 전계 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 | |
| KR20240132232A (ko) | 유기 전계 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 | |
| KR102420202B1 (ko) | 신규한 유기 전계 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant |