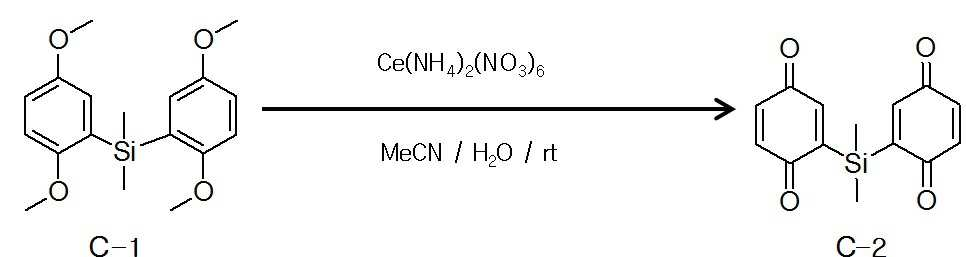KR102145425B1 - Organic compounds and organic light emitting diode device comprising the same - Google Patents
Organic compounds and organic light emitting diode device comprising the same Download PDFInfo
- Publication number
- KR102145425B1 KR102145425B1 KR1020130149384A KR20130149384A KR102145425B1 KR 102145425 B1 KR102145425 B1 KR 102145425B1 KR 1020130149384 A KR1020130149384 A KR 1020130149384A KR 20130149384 A KR20130149384 A KR 20130149384A KR 102145425 B1 KR102145425 B1 KR 102145425B1
- Authority
- KR
- South Korea
- Prior art keywords
- layer
- group
- organic
- organic compound
- hole
- Prior art date
Links
- 150000002894 organic compounds Chemical class 0.000 title claims abstract description 73
- 125000003118 aryl group Chemical group 0.000 claims abstract description 27
- 125000003277 amino group Chemical group 0.000 claims abstract description 25
- 125000000623 heterocyclic group Chemical group 0.000 claims abstract description 18
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 claims abstract description 9
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 claims abstract description 9
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims abstract description 9
- 125000004093 cyano group Chemical group *C#N 0.000 claims abstract description 9
- 229910052805 deuterium Inorganic materials 0.000 claims abstract description 9
- 229910052736 halogen Inorganic materials 0.000 claims abstract description 9
- 150000002367 halogens Chemical class 0.000 claims abstract description 9
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 9
- 150000002431 hydrogen Chemical class 0.000 claims abstract description 9
- 239000001257 hydrogen Substances 0.000 claims abstract description 9
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims abstract description 9
- 125000001424 substituent group Chemical group 0.000 claims abstract description 7
- 239000010410 layer Substances 0.000 claims description 262
- 238000002347 injection Methods 0.000 claims description 61
- 239000007924 injection Substances 0.000 claims description 61
- 230000005525 hole transport Effects 0.000 claims description 58
- 239000000463 material Substances 0.000 claims description 55
- 150000001875 compounds Chemical class 0.000 claims description 50
- 238000000034 method Methods 0.000 claims description 30
- 239000000872 buffer Substances 0.000 claims description 26
- 239000012044 organic layer Substances 0.000 claims description 10
- 229910052731 fluorine Inorganic materials 0.000 claims description 2
- 239000011737 fluorine Substances 0.000 claims description 2
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 claims 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims 1
- 239000000126 substance Substances 0.000 claims 1
- 125000003808 silyl group Chemical group [H][Si]([H])([H])[*] 0.000 abstract description 7
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 75
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 44
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 35
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 26
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 14
- 230000000052 comparative effect Effects 0.000 description 14
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 13
- 235000019341 magnesium sulphate Nutrition 0.000 description 13
- ZGEGCLOFRBLKSE-UHFFFAOYSA-N methylene hexane Natural products CCCCCC=C ZGEGCLOFRBLKSE-UHFFFAOYSA-N 0.000 description 13
- 238000002360 preparation method Methods 0.000 description 13
- 238000003756 stirring Methods 0.000 description 13
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 12
- 238000006243 chemical reaction Methods 0.000 description 12
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 10
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 10
- 238000000605 extraction Methods 0.000 description 9
- 239000000203 mixture Substances 0.000 description 8
- 238000004440 column chromatography Methods 0.000 description 7
- 239000002019 doping agent Substances 0.000 description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- 229910052782 aluminium Inorganic materials 0.000 description 6
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 6
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 6
- 239000002244 precipitate Substances 0.000 description 6
- 238000000926 separation method Methods 0.000 description 6
- 229910052757 nitrogen Inorganic materials 0.000 description 5
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 5
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 5
- XJDNKRIXUMDJCW-UHFFFAOYSA-J titanium tetrachloride Chemical compound Cl[Ti](Cl)(Cl)Cl XJDNKRIXUMDJCW-UHFFFAOYSA-J 0.000 description 5
- 239000007983 Tris buffer Substances 0.000 description 4
- 125000003545 alkoxy group Chemical group 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 239000011575 calcium Substances 0.000 description 4
- 229960004132 diethyl ether Drugs 0.000 description 4
- 230000001939 inductive effect Effects 0.000 description 4
- 239000011777 magnesium Substances 0.000 description 4
- 229920000767 polyaniline Polymers 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- 238000003786 synthesis reaction Methods 0.000 description 4
- TVIVIEFSHFOWTE-UHFFFAOYSA-K tri(quinolin-8-yloxy)alumane Chemical compound [Al+3].C1=CN=C2C([O-])=CC=CC2=C1.C1=CN=C2C([O-])=CC=CC2=C1.C1=CN=C2C([O-])=CC=CC2=C1 TVIVIEFSHFOWTE-UHFFFAOYSA-K 0.000 description 4
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- 229940126062 Compound A Drugs 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- NLDMNSXOCDLTTB-UHFFFAOYSA-N Heterophylliin A Natural products O1C2COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC2C(OC(=O)C=2C=C(O)C(O)=C(O)C=2)C(O)C1OC(=O)C1=CC(O)=C(O)C(O)=C1 NLDMNSXOCDLTTB-UHFFFAOYSA-N 0.000 description 3
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 3
- XLOMVQKBTHCTTD-UHFFFAOYSA-N Zinc monoxide Chemical compound [Zn]=O XLOMVQKBTHCTTD-UHFFFAOYSA-N 0.000 description 3
- 229910052791 calcium Inorganic materials 0.000 description 3
- 230000006866 deterioration Effects 0.000 description 3
- 229910052749 magnesium Inorganic materials 0.000 description 3
- 229910052751 metal Inorganic materials 0.000 description 3
- 239000002184 metal Substances 0.000 description 3
- 150000002736 metal compounds Chemical class 0.000 description 3
- IBHBKWKFFTZAHE-UHFFFAOYSA-N n-[4-[4-(n-naphthalen-1-ylanilino)phenyl]phenyl]-n-phenylnaphthalen-1-amine Chemical compound C1=CC=CC=C1N(C=1C2=CC=CC=C2C=CC=1)C1=CC=C(C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C3=CC=CC=C3C=CC=2)C=C1 IBHBKWKFFTZAHE-UHFFFAOYSA-N 0.000 description 3
- 239000011368 organic material Substances 0.000 description 3
- 229910000027 potassium carbonate Inorganic materials 0.000 description 3
- LVTJOONKWUXEFR-FZRMHRINSA-N protoneodioscin Natural products O(C[C@@H](CC[C@]1(O)[C@H](C)[C@@H]2[C@]3(C)[C@H]([C@H]4[C@@H]([C@]5(C)C(=CC4)C[C@@H](O[C@@H]4[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@@H](O)[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@H](CO)O4)CC5)CC3)C[C@@H]2O1)C)[C@H]1[C@H](O)[C@H](O)[C@H](O)[C@@H](CO)O1 LVTJOONKWUXEFR-FZRMHRINSA-N 0.000 description 3
- 229910052708 sodium Inorganic materials 0.000 description 3
- 239000011734 sodium Substances 0.000 description 3
- POILWHVDKZOXJZ-ARJAWSKDSA-M (z)-4-oxopent-2-en-2-olate Chemical compound C\C([O-])=C\C(C)=O POILWHVDKZOXJZ-ARJAWSKDSA-M 0.000 description 2
- OHBQPCCCRFSCAX-UHFFFAOYSA-N 1,4-Dimethoxybenzene Chemical compound COC1=CC=C(OC)C=C1 OHBQPCCCRFSCAX-UHFFFAOYSA-N 0.000 description 2
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- 229910052693 Europium Inorganic materials 0.000 description 2
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 2
- -1 SrF 2 Inorganic materials 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 229910052769 Ytterbium Inorganic materials 0.000 description 2
- CUJRVFIICFDLGR-UHFFFAOYSA-N acetylacetonate Chemical compound CC(=O)[CH-]C(C)=O CUJRVFIICFDLGR-UHFFFAOYSA-N 0.000 description 2
- 150000004984 aromatic diamines Chemical class 0.000 description 2
- UFVXQDWNSAGPHN-UHFFFAOYSA-K bis[(2-methylquinolin-8-yl)oxy]-(4-phenylphenoxy)alumane Chemical compound [Al+3].C1=CC=C([O-])C2=NC(C)=CC=C21.C1=CC=C([O-])C2=NC(C)=CC=C21.C1=CC([O-])=CC=C1C1=CC=CC=C1 UFVXQDWNSAGPHN-UHFFFAOYSA-K 0.000 description 2
- 230000000903 blocking effect Effects 0.000 description 2
- 239000012267 brine Substances 0.000 description 2
- 229910052792 caesium Inorganic materials 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- LIKFHECYJZWXFJ-UHFFFAOYSA-N dimethyldichlorosilane Chemical compound C[Si](C)(Cl)Cl LIKFHECYJZWXFJ-UHFFFAOYSA-N 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 229910052741 iridium Inorganic materials 0.000 description 2
- GKOZUEZYRPOHIO-UHFFFAOYSA-N iridium atom Chemical compound [Ir] GKOZUEZYRPOHIO-UHFFFAOYSA-N 0.000 description 2
- UEEXRMUCXBPYOV-UHFFFAOYSA-N iridium;2-phenylpyridine Chemical compound [Ir].C1=CC=CC=C1C1=CC=CC=N1.C1=CC=CC=C1C1=CC=CC=N1.C1=CC=CC=C1C1=CC=CC=N1 UEEXRMUCXBPYOV-UHFFFAOYSA-N 0.000 description 2
- 239000004973 liquid crystal related substance Substances 0.000 description 2
- CUONGYYJJVDODC-UHFFFAOYSA-N malononitrile Chemical compound N#CCC#N CUONGYYJJVDODC-UHFFFAOYSA-N 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- IEQIEDJGQAUEQZ-UHFFFAOYSA-N phthalocyanine Chemical compound N1C(N=C2C3=CC=CC=C3C(N=C3C4=CC=CC=C4C(=N4)N3)=N2)=C(C=CC=C2)C2=C1N=C1C2=CC=CC=C2C4=N1 IEQIEDJGQAUEQZ-UHFFFAOYSA-N 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- 229910052701 rubidium Inorganic materials 0.000 description 2
- 229910052709 silver Inorganic materials 0.000 description 2
- 239000004332 silver Substances 0.000 description 2
- 239000002356 single layer Substances 0.000 description 2
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 229910052712 strontium Inorganic materials 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 2
- RMGYQBHKEWWTOY-UHFFFAOYSA-N (3,4-difluorophenyl)boronic acid Chemical compound OB(O)C1=CC=C(F)C(F)=C1 RMGYQBHKEWWTOY-UHFFFAOYSA-N 0.000 description 1
- ZSYMVHGRKPBJCQ-UHFFFAOYSA-N 1,1'-biphenyl;9h-carbazole Chemical group C1=CC=CC=C1C1=CC=CC=C1.C1=CC=C2C3=CC=CC=C3NC2=C1 ZSYMVHGRKPBJCQ-UHFFFAOYSA-N 0.000 description 1
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical compound C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 description 1
- 150000004057 1,4-benzoquinones Chemical class 0.000 description 1
- VBQVHWHWZOUENI-UHFFFAOYSA-N 1-phenyl-2H-quinoline Chemical compound C1C=CC2=CC=CC=C2N1C1=CC=CC=C1 VBQVHWHWZOUENI-UHFFFAOYSA-N 0.000 description 1
- LPCWDYWZIWDTCV-UHFFFAOYSA-N 1-phenylisoquinoline Chemical compound C1=CC=CC=C1C1=NC=CC2=CC=CC=C12 LPCWDYWZIWDTCV-UHFFFAOYSA-N 0.000 description 1
- YXWJGZQOGXGSSC-UHFFFAOYSA-N 2,3,4,5,6-pentafluorobenzonitrile Chemical compound FC1=C(F)C(F)=C(C#N)C(F)=C1F YXWJGZQOGXGSSC-UHFFFAOYSA-N 0.000 description 1
- VFMUXPQZKOKPOF-UHFFFAOYSA-N 2,3,7,8,12,13,17,18-octaethyl-21,23-dihydroporphyrin platinum Chemical compound [Pt].CCc1c(CC)c2cc3[nH]c(cc4nc(cc5[nH]c(cc1n2)c(CC)c5CC)c(CC)c4CC)c(CC)c3CC VFMUXPQZKOKPOF-UHFFFAOYSA-N 0.000 description 1
- PYEQXZOIQJWYAH-UHFFFAOYSA-N 2-bromocyclohexa-2,5-diene-1,4-dione Chemical compound BrC1=CC(=O)C=CC1=O PYEQXZOIQJWYAH-UHFFFAOYSA-N 0.000 description 1
- JXPDNDHCMMOJPC-UHFFFAOYSA-N 2-hydroxybutanedinitrile Chemical compound N#CC(O)CC#N JXPDNDHCMMOJPC-UHFFFAOYSA-N 0.000 description 1
- HNWFFTUWRIGBNM-UHFFFAOYSA-N 2-methyl-9,10-dinaphthalen-2-ylanthracene Chemical compound C1=CC=CC2=CC(C3=C4C=CC=CC4=C(C=4C=C5C=CC=CC5=CC=4)C4=CC=C(C=C43)C)=CC=C21 HNWFFTUWRIGBNM-UHFFFAOYSA-N 0.000 description 1
- HONWGFNQCPRRFM-UHFFFAOYSA-N 2-n-(3-methylphenyl)-1-n,1-n,2-n-triphenylbenzene-1,2-diamine Chemical compound CC1=CC=CC(N(C=2C=CC=CC=2)C=2C(=CC=CC=2)N(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 HONWGFNQCPRRFM-UHFFFAOYSA-N 0.000 description 1
- OGGKVJMNFFSDEV-UHFFFAOYSA-N 3-methyl-n-[4-[4-(n-(3-methylphenyl)anilino)phenyl]phenyl]-n-phenylaniline Chemical compound CC1=CC=CC(N(C=2C=CC=CC=2)C=2C=CC(=CC=2)C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=C(C)C=CC=2)=C1 OGGKVJMNFFSDEV-UHFFFAOYSA-N 0.000 description 1
- VFUDMQLBKNMONU-UHFFFAOYSA-N 9-[4-(4-carbazol-9-ylphenyl)phenyl]carbazole Chemical group C12=CC=CC=C2C2=CC=CC=C2N1C1=CC=C(C=2C=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)C=C1 VFUDMQLBKNMONU-UHFFFAOYSA-N 0.000 description 1
- 229910016036 BaF 2 Inorganic materials 0.000 description 1
- 229910004261 CaF 2 Inorganic materials 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 229910052684 Cerium Inorganic materials 0.000 description 1
- 229910052692 Dysprosium Inorganic materials 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical class C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 1
- 239000002841 Lewis acid Substances 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- KWYHDKDOAIKMQN-UHFFFAOYSA-N N,N,N',N'-tetramethylethylenediamine Chemical compound CN(C)CCN(C)C KWYHDKDOAIKMQN-UHFFFAOYSA-N 0.000 description 1
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 1
- YNPNZTXNASCQKK-UHFFFAOYSA-N Phenanthrene Natural products C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 description 1
- 229910052772 Samarium Inorganic materials 0.000 description 1
- 229910052771 Terbium Inorganic materials 0.000 description 1
- DGEZNRSVGBDHLK-UHFFFAOYSA-N [1,10]phenanthroline Chemical compound C1=CN=C2C3=NC=CC=C3C=CC2=C1 DGEZNRSVGBDHLK-UHFFFAOYSA-N 0.000 description 1
- PJRJXFPRMUZBHQ-UHFFFAOYSA-N [Ir].C1C=CC2=CC=CC=C2N1C1=CC=CC=C1.C1C=CC2=CC=CC=C2N1C1=CC=CC=C1.C1C=CC2=CC=CC=C2N1C1=CC=CC=C1 Chemical compound [Ir].C1C=CC2=CC=CC=C2N1C1=CC=CC=C1.C1C=CC2=CC=CC=C2N1C1=CC=CC=C1.C1C=CC2=CC=CC=C2N1C1=CC=CC=C1 PJRJXFPRMUZBHQ-UHFFFAOYSA-N 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001339 alkali metal compounds Chemical class 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001341 alkaline earth metal compounds Chemical class 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 239000000956 alloy Substances 0.000 description 1
- 229910045601 alloy Inorganic materials 0.000 description 1
- 239000004411 aluminium Substances 0.000 description 1
- 125000000732 arylene group Chemical group 0.000 description 1
- PCCNIENXBRUYFK-UHFFFAOYSA-O azanium;cerium(4+);pentanitrate Chemical compound [NH4+].[Ce+4].[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O PCCNIENXBRUYFK-UHFFFAOYSA-O 0.000 description 1
- 229910052788 barium Inorganic materials 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 125000004556 carbazol-9-yl group Chemical group C1=CC=CC=2C3=CC=CC=C3N(C12)* 0.000 description 1
- XMPZTFVPEKAKFH-UHFFFAOYSA-P ceric ammonium nitrate Chemical compound [NH4+].[NH4+].[Ce+4].[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O XMPZTFVPEKAKFH-UHFFFAOYSA-P 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- JNGZXGGOCLZBFB-IVCQMTBJSA-N compound E Chemical compound N([C@@H](C)C(=O)N[C@@H]1C(N(C)C2=CC=CC=C2C(C=2C=CC=CC=2)=N1)=O)C(=O)CC1=CC(F)=CC(F)=C1 JNGZXGGOCLZBFB-IVCQMTBJSA-N 0.000 description 1
- LBJNMUFDOHXDFG-UHFFFAOYSA-N copper;hydrate Chemical compound O.[Cu].[Cu] LBJNMUFDOHXDFG-UHFFFAOYSA-N 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 238000000151 deposition Methods 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- DKHNGUNXLDCATP-UHFFFAOYSA-N dipyrazino[2,3-f:2',3'-h]quinoxaline-2,3,6,7,10,11-hexacarbonitrile Chemical compound C12=NC(C#N)=C(C#N)N=C2C2=NC(C#N)=C(C#N)N=C2C2=C1N=C(C#N)C(C#N)=N2 DKHNGUNXLDCATP-UHFFFAOYSA-N 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 230000005684 electric field Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- ZIUSEGSNTOUIPT-UHFFFAOYSA-N ethyl 2-cyanoacetate Chemical compound CCOC(=O)CC#N ZIUSEGSNTOUIPT-UHFFFAOYSA-N 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 231100001261 hazardous Toxicity 0.000 description 1
- 229940058961 hydroxyquinoline derivative for amoebiasis and other protozoal diseases Drugs 0.000 description 1
- AMGQUBHHOARCQH-UHFFFAOYSA-N indium;oxotin Chemical compound [In].[Sn]=O AMGQUBHHOARCQH-UHFFFAOYSA-N 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- 239000011147 inorganic material Substances 0.000 description 1
- 229910052746 lanthanum Inorganic materials 0.000 description 1
- 150000007517 lewis acids Chemical class 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- DLEDOFVPSDKWEF-UHFFFAOYSA-N lithium butane Chemical compound [Li+].CCC[CH2-] DLEDOFVPSDKWEF-UHFFFAOYSA-N 0.000 description 1
- 238000004768 lowest unoccupied molecular orbital Methods 0.000 description 1
- 239000007769 metal material Substances 0.000 description 1
- 229910044991 metal oxide Inorganic materials 0.000 description 1
- 150000004706 metal oxides Chemical class 0.000 description 1
- 239000011259 mixed solution Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- FGNGTWFJQFTFGN-UHFFFAOYSA-N n,n,n',n'-tetramethylethane-1,2-diamine Chemical compound CN(C)CCN(C)C.CN(C)CCN(C)C FGNGTWFJQFTFGN-UHFFFAOYSA-N 0.000 description 1
- MZRVEZGGRBJDDB-UHFFFAOYSA-N n-Butyllithium Substances [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 238000000059 patterning Methods 0.000 description 1
- 125000002080 perylenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC5=CC=CC(C1=C23)=C45)* 0.000 description 1
- CSHWQDPOILHKBI-UHFFFAOYSA-N peryrene Natural products C1=CC(C2=CC=CC=3C2=C2C=CC=3)=C3C2=CC=CC3=C1 CSHWQDPOILHKBI-UHFFFAOYSA-N 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- LISFMEBWQUVKPJ-UHFFFAOYSA-N quinolin-2-ol Chemical class C1=CC=C2NC(=O)C=CC2=C1 LISFMEBWQUVKPJ-UHFFFAOYSA-N 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 238000012827 research and development Methods 0.000 description 1
- 238000004904 shortening Methods 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 238000000859 sublimation Methods 0.000 description 1
- 230000008022 sublimation Effects 0.000 description 1
- NLSXASIDNWDYMI-UHFFFAOYSA-N triphenylsilanol Chemical compound C=1C=CC=CC=1[Si](C=1C=CC=CC=1)(O)C1=CC=CC=C1 NLSXASIDNWDYMI-UHFFFAOYSA-N 0.000 description 1
- 238000001771 vacuum deposition Methods 0.000 description 1
- YVTHLONGBIQYBO-UHFFFAOYSA-N zinc indium(3+) oxygen(2-) Chemical compound [O--].[Zn++].[In+3] YVTHLONGBIQYBO-UHFFFAOYSA-N 0.000 description 1
- 239000011787 zinc oxide Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic Table
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/0803—Compounds with Si-C or Si-Si linkages
- C07F7/081—Compounds with Si-C or Si-Si linkages comprising at least one atom selected from the elements N, O, halogen, S, Se or Te
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/40—Organosilicon compounds, e.g. TIPS pentacene
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1014—Carbocyclic compounds bridged by heteroatoms, e.g. N, P, Si or B
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Physics & Mathematics (AREA)
- Optics & Photonics (AREA)
- Electroluminescent Light Sources (AREA)
Abstract
본 발명의 일 실시예에 따른 유기 화합물은 하기 화학식 1로 표시되는 것을 특징으로 한다.
[화학식 1]
상기 화학식 1에서, R1, R2 및 R3 는 각각 독립적으로, 수소, 중수소, 할로겐, 시아노기, 트리플루오로메틸기, C1 내지 C20의 알킬기, 카르복실기, 카르보닐기, C1 내지 C20 의 알콕시기, C1내지 C20의 치환 또는 비치환된 실릴기, C6 이상의 치환 또는 비치환된 방향족 그룹, C5 이상의 치환 또는 비치환된 이형고리 그룹, C1 내지 C20의 치환 또는 비치환된 아민기, C6 이상의 방향족 그룹이 치환된 아민기, C5 이상의 이형고리 그룹이 치환된 아민기, 및 아릴기에서 선택된 어느 하나이며, X1 및 X2는 각각 독립적으로 하기 a 내지 f로 표시되는 치환기에서 선택된 어느 하나이다.
The organic compound according to an embodiment of the present invention is characterized by represented by the following formula (1).
[Formula 1]
In Formula 1, R 1 , R 2 and R 3 are each independently hydrogen, deuterium, halogen, cyano group, trifluoromethyl group, C1 to C20 alkyl group, carboxyl group, carbonyl group, C1 to C20 alkoxy group, C1 To C20 substituted or unsubstituted silyl group, C6 or more substituted or unsubstituted aromatic group, C5 or more substituted or unsubstituted heterocyclic group, C1 to C20 substituted or unsubstituted amine group, C6 or more aromatic group substituted Is any one selected from an amine group, an amine group in which a C5 or more heterocyclic group is substituted, and an aryl group, and X 1 and X 2 are each independently selected from substituents represented by a to f below.
Description
본 발명은 유기 화합물 및 이를 포함하는 유기전계발광소자에 관한 것으로, 보다 자세하게는, 유기전계발광소자의 발광효율을 향상시키고 구동전압을 낮출 수 있는 유기 화합물 및 이를 포함하는 유기전계발광소자에 관한 것이다.
The present invention relates to an organic compound and an organic electroluminescent device including the same, and more particularly, to an organic compound capable of improving the luminous efficiency of the organic electroluminescent device and lowering the driving voltage, and to an organic electroluminescent device including the same .
다양한 정보를 화면으로 구현해 주는 영상표시장치는 정보 통신 시대의 핵심 기술로 더 얇고 더 가볍고 휴대가 가능하면서도 고성능의 방향으로 발전하고 있다. 근래 정보화 사회의 발전과 더불어, 표시장치에 대한 다양한 형태의 요구가 증대되면서, LCD(Liquid Crystal Display), PDP(Plasma Display Panel), ELD(Electro Luminescent Display), FED(Field Emission Display), OLED(Organic Light Emitting Diode)등 평판표시장치에 대한 연구가 활발히 진행되고 있다.A video display device that embodies a variety of information on a screen is a core technology in the information and communication era, and is evolving toward a higher performance while being thinner, lighter, portable. With the recent development of the information society, as the demand for various types of display devices increases, LCD (Liquid Crystal Display), PDP (Plasma Display Panel), ELD (Electro Luminescent Display), FED (Field Emission Display), OLED ( Organic Light Emitting Diode) and other flat panel display devices are being actively researched.
이 중 유기전계발광소자는 양극과 음극 사이에 형성된 유기 발광층에 전하를 주입하면 전자와 정공이 쌍을 이룬 후 소멸하면서 빛을 내는 소자이다. 유기전계발광소자는 플라스틱 같은 플렉서블(flexible) 투명 기판 위에도 형성할 수 있을 뿐 아니라, 플라즈마 디스플레이 패널(Plasma Display Panel)이나 무기 전계발광(EL) 디스플레이에 비해 낮은 전압에서 구동이 가능하고 전력 소모가 비교적 적으며, 색감이 뛰어나다는 장점이 있다. 특히, 백색을 구현하는 유기전계발광소자는 조명뿐만 아니라 박형 광원, 액정표시장치의 백라이트 또는 컬러필터를 채용한 풀컬러 표시 장치에 쓰이는 등 여러 용도로 이용되고 있는 소자이다.Among them, the organic light emitting device is a device that emits light while electrons and holes form a pair and then disappear when charge is injected into the organic light emitting layer formed between the anode and the cathode. The organic light emitting device can be formed on a flexible transparent substrate such as plastic, and can be driven at a lower voltage compared to a plasma display panel or an inorganic electroluminescent (EL) display and consumes relatively little power. It is small and has the advantage of excellent color. In particular, an organic light emitting device that embodies white is a device that is used for various purposes, such as being used not only in lighting but also in a thin light source, a backlight of a liquid crystal display device, or a full-color display device employing a color filter.
백색 유기전계발광소자 개발에 있어서 고효율, 장수명은 물론이고, 색순도, 전류 및 전압의 변화에 따른 색안정성, 소자 제조의 용이성 등이 중요하기 때문에 각각의 방식에 따라 연구 개발이 진행 중에 있다. 백색 유기전계발광소자 구조에는 여러 가지가 있는데 크게는 단일층 발광 구조, 다층 발광 구조 등으로 나눌 수 있다. 이 중 장수명 백색의 소자를 위해 형광 청색 발광층과 인광 노란색 발광층을 적층(tandem)하는 다층 발광 구조가 주로 채택되고 있다.In the development of white organic electroluminescent devices, research and development are underway according to each method because of the high efficiency, long life, color purity, color stability according to changes in current and voltage, and ease of device manufacturing are important. There are various white organic light emitting device structures, and can be largely divided into a single-layer light-emitting structure and a multi-layer light-emitting structure. Among them, a multilayer light-emitting structure in which a fluorescent blue light-emitting layer and a phosphorescent yellow light-emitting layer are laminated (tandem) for a long-life white device is mainly adopted.
구체적으로, 청색(Blue) 형광 소자를 발광층으로 이용하는 제1 스택과, 노란색(yellow-Green) 인광 소자를 발광층으로 이용하는 제2 스택 구조가 적층된 형태의 인광 스택 구조가 이용되고 있다. 이러한, 백색 유기전계발광소자는 청색 형광 소자로부터 발광되는 청색광과 노랑색 인광 소자로부터 발광되는 노란색 광의 혼합 효과에 의해 백색광이 구현된다. 여기서, 제1 스택과 제2 스택 사이에는 발광층에서 발생하는 전류 효율을 배로 증가시키고, 전하 분배를 원활하게 해주는 전하 생성층(Charge generation layer)이 구비된다. 전하생성층은 내부에서 전하 즉, 전자 및 정공을 생성시키는 층으로서, 발광층에서 발생하는 전류 효율을 배로 증가시키고, 전하 분배를 원활하게 해주므로 구동 전압이 상승되는 것을 방지할 수 있다. Specifically, a phosphorescent stack structure in which a first stack using a blue fluorescent element as an emission layer and a second stack structure using a yellow-green phosphorescent element as an emission layer are stacked is used. In such a white organic light emitting diode, white light is realized by a mixing effect of blue light emitted from a blue fluorescent element and yellow light emitted from a yellow phosphorescent element. Here, a charge generation layer is provided between the first stack and the second stack, which doubles the current efficiency generated in the emission layer and facilitates charge distribution. The charge generation layer is a layer that generates charges, that is, electrons and holes inside, and doubles the current efficiency generated in the light-emitting layer and facilitates charge distribution, thereby preventing an increase in driving voltage.
또한, 유기전계발광소자에 구비되는 정공수송재료로 방향족 디아민 유도체가 많이 알려져 있다. 이들 방향족 디아민 유도체를 정공 수송 재료에 사용한 유기전계발광소자는 충분한 발광 휘도를 얻기 위해 인가 전압이 높아지기 때문에, 소자 수명의 저하 및 소비 전력이 커지는 문제점을 갖고 있다. 이를 해결하기 위해 정공주입층에 루이스산 등의 전자 수용성(electron acceptor)화합물을 도핑하거나 별도의 층을 형성하는 방법이 제안되어 있다. 그러나 이들에서 사용되고 있는 전자 수용성 화합물은 유기전계발광소자의 제조 공정에 있어서 취급상 불안정 하거나 또는 구동시에 있어서 내열성 등의 안정성이 부족하고, 수명이 저하된다는 등의 문제점이 있다. 또한 대표적인 전자 수용성 화합물인 F4TCNQ(테트라플루오로디시아노퀴노디메탄올)는 분자량이 작고 불소로 치환되어 있어 승화성이 높고, 진공 증착시, 장치 내에 확산되어 장치나 소자를 오염시킬 우려가 있다. 또 다른 대표적인 화합물인 HAT-CN은 결정화로 인해 증착 두께에 제약이 있으며 전류가 누설되는 문제가 있다.In addition, many aromatic diamine derivatives are known as hole transport materials provided in organic electroluminescent devices. The organic electroluminescent device using these aromatic diamine derivatives for the hole transport material has a problem in that the applied voltage is increased in order to obtain sufficient light emission luminance, and thus the device life is reduced and power consumption is increased. To solve this problem, a method of doping a hole injection layer with an electron acceptor compound such as Lewis acid or forming a separate layer has been proposed. However, the electron-accepting compounds used therein have problems such as unstable handling in the manufacturing process of organic electroluminescent devices, lack of stability such as heat resistance during driving, and shortening of lifespan. In addition, F 4 TCNQ (tetrafluorodicyanoquinodimethanol), a representative electron-accepting compound, has a low molecular weight and is substituted with fluorine, so it has high sublimation properties, and there is a concern that it diffuses into the device during vacuum deposition, contaminating the device or device . Another representative compound, HAT-CN, has a limitation in the deposition thickness due to crystallization and a problem of leakage of current.
특히, 일반적으로 전극은 금속 물질 또는 금속 산화물로 이루어져 있으므로, 이러한 무기 물질과 전하주입 물질로 사용되는 유기 물질 간의 계면이 안정되지 않으면, 외부로부터 가해지는 열이나 내부로부터 생성되는 열 또는 소자에 가해지는 전기장에 의하여 소자의 성능이 현격히 저하될 수 있다. 따라서 전극과의 안정적인 계면을 형성하며 높은 전하 수송 능력을 갖는 일정 이상의 분자량을 갖는 물질의 개발이 요구된다.
In particular, since the electrode is generally made of a metal material or metal oxide, if the interface between the inorganic material and the organic material used as the charge injection material is not stable, heat applied from the outside or heat generated from the inside or applied to the device The performance of the device can be significantly deteriorated by the electric field. Therefore, it is required to develop a material having a molecular weight of more than a certain amount that forms a stable interface with the electrode and has a high charge transport capability.
본 발명은 유기전계발광소자의 발광효율을 향상시키고 구동전압을 낮출 수 있는 유기 화합물 및 이를 포함하는 유기전계발광소자를 제공한다.
The present invention provides an organic compound capable of improving the luminous efficiency of the organic light emitting device and lowering a driving voltage, and an organic light emitting device including the same.
상기한 목적을 달성하기 위해, 본 발명의 일 실시예에 따른 유기 화합물은 하기 화학식 1로 표시되는 것을 특징으로 한다.In order to achieve the above object, the organic compound according to an embodiment of the present invention is characterized in that it is represented by the following formula (1).
[화학식 1][Formula 1]
상기 화학식 1에서, R1, R2 및 R3 는 각각 독립적으로, 수소, 중수소, 할로겐, 시아노기, 트리플루오로메틸기, C1 내지 C20의 알킬기, 카르복실기, 카르보닐기, C1 내지 C20 의 알콕시기, C1내지 C20의 치환 또는 비치환된 실릴기, C6 이상의 치환 또는 비치환된 방향족 그룹, C5 이상의 치환 또는 비치환된 이형고리 그룹, C1 내지 C20의 치환 또는 비치환된 아민기, C6 이상의 방향족 그룹이 치환된 아민기, C5 이상의 이형고리 그룹이 치환된 아민기, 및 아릴기에서 선택된 어느 하나이며, X1 및 X2는 각각 독립적으로 하기 a 내지 f로 표시되는 치환기에서 선택된 어느 하나이다.In Formula 1, R 1 , R 2 and R 3 are each independently hydrogen, deuterium, halogen, cyano group, trifluoromethyl group, C1 to C20 alkyl group, carboxyl group, carbonyl group, C1 to C20 alkoxy group, C1 To C20 substituted or unsubstituted silyl group, C6 or more substituted or unsubstituted aromatic group, C5 or more substituted or unsubstituted heterocyclic group, C1 to C20 substituted or unsubstituted amine group, C6 or more aromatic group substituted Is any one selected from an amine group, an amine group in which a C5 or more heterocyclic group is substituted, and an aryl group, and X 1 and X 2 are each independently selected from substituents represented by a to f below.
상기 유기 화합물은 하기 화학식 2로 표시되는 화합물에서 선택된 어느 하나인 것을 특징으로 한다.The organic compound is characterized in that any one selected from compounds represented by the following formula (2).
[화학식 2][Formula 2]
상기 유기 화합물은 하기 표시되는 화합물들에서 선택된 어느 하나인 것을 특징으로 한다.The organic compound is characterized in that any one selected from the compounds shown below.
상기 유기 화합물은 하기 화학식 3으로 표시되는 것을 특징으로 한다.The organic compound is characterized by represented by the following formula (3).
상기 화학식 2에서, X3 내지 X6은 각각 독립적으로, 하기 g 내지 l로 표시되는 치환기에서 선택된 어느 하나이며,In
Y1 및 Y2는 각각 독립적으로, 수소, 중수소, 할로겐, 시아노기, 트리플루오로메틸기, C1 내지 C20의 알킬기, 카르복실기, 카르보닐기, C1 내지 C20 의 치환 또는 비치환된 알콕시기, C1내지 C20의 치환 또는 비치환된 실릴기, C6 이상의 치환 또는 비치환된 방향족 그룹, C5 이상의 치환 또는 비치환된 이형고리 그룹, C1 내지 C20의 치환 또는 비치환된 아민기, C6 이상의 방향족 그룹이 치환된 아민기, C5 이상의 이형고리 그룹이 치환된 아민기, 및 아릴기에서 선택된 어느 하나이고, R4 내지 R9는 각각 독립적으로, 수소, 중수소, 할로겐, 시아노기, 트리플루오로메틸기, C1 내지 C20의 알킬기, 카르복실기, 카르보닐기, C1 내지 C20 의 치환 또는 비치환된 알콕시기, C1내지 C20의 치환 또는 비치환된 실릴기, C6 이상의 치환 또는 비치환된 방향족 그룹, C5 이상의 치환 또는 비치환된 이형고리 그룹, C1 내지 C20의 치환 또는 비치환된 아민기, C6 이상의 방향족 그룹이 치환된 아민기, C5 이상의 이형고리 그룹이 치환된 아민기, 및 아릴기에서 선택된 어느 하나이다. Y 1 and Y 2 are each independently hydrogen, deuterium, halogen, cyano group, trifluoromethyl group, C1 to C20 alkyl group, carboxyl group, carbonyl group, C1 to C20 substituted or unsubstituted alkoxy group, C1 to C20 Substituted or unsubstituted silyl group, C6 or more substituted or unsubstituted aromatic group, C5 or more substituted or unsubstituted heterocyclic group, C1 to C20 substituted or unsubstituted amine group, C6 or more aromatic group substituted amine group , C5 or more heterocyclic groups are any one selected from a substituted amine group, and an aryl group, and R 4 to R 9 are each independently hydrogen, deuterium, halogen, cyano group, trifluoromethyl group, C1 to C20 alkyl group , Carboxyl group, carbonyl group, C1 to C20 substituted or unsubstituted alkoxy group, C1 to C20 substituted or unsubstituted silyl group, C6 or more substituted or unsubstituted aromatic group, C5 or more substituted or unsubstituted heterocyclic group, C1 to C20 substituted or unsubstituted amine group, C6 or more aromatic group substituted amine group, C5 or more heterocyclic group substituted amine group, and any one selected from an aryl group.
상기 유기 화합물은 하기 화학식 4에 표시되는 화합물들에서 선택된 어느 하나인 것을 특징으로 한다.The organic compound is characterized in that any one selected from compounds represented by the following formula (4).
[화학식 4][Formula 4]
상기 유기 화합물은 하기 표시되는 화합물들에서 선택된 어느 하나인 것을 특징으로 한다.The organic compound is characterized in that any one selected from the compounds shown below.
또한, 본 발명의 일 실시예에 따른 유기전계발광소자는 양극과 음극 사이에 발광층을 포함하고, 상기 양극과 상기 발광층 사이에 적어도 하나의 유기막을 포함하는 유기전계발광소자에 있어서, 상기 유기막은 상기 유기 화합물을 포함하는 것을 특징으로 한다.In addition, in the organic light emitting device according to an embodiment of the present invention, in the organic light emitting device including an emission layer between an anode and a cathode, and at least one organic layer between the anode and the emission layer, the organic layer is It is characterized by containing an organic compound.
상기 유기막은 정공주입층, 정공수송층 및 정공버퍼층 중 선택된 어느 하나 이상인 것을 특징으로 한다.The organic layer is characterized in that at least one selected from a hole injection layer, a hole transport layer, and a hole buffer layer.
상기 정공주입층은 상기 유기 화합물로만 이루어진 것을 특징으로 한다.The hole injection layer is characterized in that it is made of only the organic compound.
상기 정공버퍼층은 상기 정공주입층과 상기 정공수송층 사이에 위치하며, 상기 양극에 접하는 것을 특징으로 한다.The hole buffer layer is positioned between the hole injection layer and the hole transport layer, and is in contact with the anode.
상기 정공버퍼층은 상기 정공주입층과 상기 정공수송층 사이에 위치하는 것을 특징으로 한다.The hole buffer layer is characterized in that it is located between the hole injection layer and the hole transport layer.
상기 정공버퍼층은 상기 유기 화합물로만 이루어지거나, 호스트 물질과 상기 유기 화합물로 이루어진 것을 특징으로 한다.The hole buffer layer may be made of only the organic compound or a host material and the organic compound.
상기 호스트 물질은 상기 정공수송층 물질인 것을 특징으로 한다.The host material is characterized in that the hole transport layer material.
상기 정공수송층은 상기 정공주입층 상에 위치하되, 상기 정공수송층 물질과 상기 유기 화합물로 이루어진 것을 특징으로 한다.The hole transport layer is located on the hole injection layer, and is made of the hole transport layer material and the organic compound.
또한, 본 발명의 일 실시예에 따른 유기전계발광소자는 양극과 음극 사이에 형성되며 각각 발광층을 포함하는 복수의 스택들을 포함하고, 상기 복수의 스택들은 적어도 제1 스택과 제2 스택을 포함하는 유기전계발광소자에 있어서, 제1 발광층을 포함하는 상기 제1 스택, 제2 발광층을 포함하는 상기 제2 스택, 및 상기 제1 스택과 상기 제2 스택 사이에 위치하는 전하생성층을 포함하고, 상기 전하생성층은 N형 전하생성층과 P형 전하생성층을 포함하되, 상기 P형 전하생성층은 상기 유기 화합물을 포함하는 것을 특징으로 한다.In addition, the organic light emitting diode according to an embodiment of the present invention includes a plurality of stacks formed between an anode and a cathode and each including an emission layer, and the plurality of stacks includes at least a first stack and a second stack. An organic light emitting diode device comprising: the first stack including a first emission layer, the second stack including a second emission layer, and a charge generation layer positioned between the first stack and the second stack, The charge generation layer includes an N-type charge generation layer and a P-type charge generation layer, and the P-type charge generation layer includes the organic compound.
상기 제1 스택은 상기 양극과 상기 제1 발광층 사이에 위치하는 적어도 하나의 유기막을 포함하되, 상기 유기막은 정공주입층, 제1 정공수송층 및 정공버퍼층 중 적어도 하나 이상인 것을 특징으로 한다.The first stack may include at least one organic layer disposed between the anode and the first emission layer, wherein the organic layer is at least one of a hole injection layer, a first hole transport layer, and a hole buffer layer.
상기 제1 스택은 제1 정공수송층을 포함하고, 상기 P형 전하생성층은 상기 유기 화합물로만 이루어지거나, 호스트 물질과 상기 유기 화합물로 이루어지는 것을 특징으로 한다.The first stack may include a first hole transport layer, and the P-type charge generation layer may be composed of only the organic compound or a host material and the organic compound.
상기 호스트 물질은 상기 정공수송층 물질인 것을 특징으로 한다.The host material is characterized in that the hole transport layer material.
상기 제2 스택은 상기 P형 전하생성층과 상기 제2 발광층 사이에 위치하는 제2 정공수송층을 포함하는 것을 특징으로 한다.The second stack may include a second hole transport layer positioned between the P-type charge generation layer and the second emission layer.
상기 P형 전하생성층은 상기 제2 발광층과 접하는 것을 특징으로 한다.The P-type charge generation layer is in contact with the second emission layer.
상기 정공주입층은 상기 유기 화합물로만 이루어진 것을 특징으로 한다.The hole injection layer is characterized in that it is made of only the organic compound.
상기 정공버퍼층은 상기 양극과 상기 제1 정공수송층 사이에 위치하되, 상기 양극에 접하는 것을 특징으로 한다.The hole buffer layer is located between the anode and the first hole transport layer, and is in contact with the anode.
상기 정공버퍼층은 상기 정공주입층과 상기 제1 정공수송층 사이에 위치하는 것을 특징으로 한다.The hole buffer layer is characterized in that it is located between the hole injection layer and the first hole transport layer.
상기 정공버퍼층은 상기 유기 화합물로만 이루어지거나, 호스트 물질과 상기 유기 화합물로 이루어진 것을 특징으로 한다.The hole buffer layer may be made of only the organic compound or a host material and the organic compound.
상기 호스트 물질은 상기 제1 정공수송층 물질인 것을 특징으로 한다.The host material is characterized in that the first hole transport layer material.
상기 제1 정공수송층은 상기 정공주입층 상에 위치하되, 상기 제1 정공수송층 물질과 상기 유기 화합물로 이루어진 것을 특징으로 한다.
The first hole transport layer is located on the hole injection layer, and is formed of the first hole transport layer material and the organic compound.
본 발명의 유기 화합물은 정공주입층, 정공수송층의 도핑, 정공버퍼층 및 P형 전하생성층에 적용함으로써, 전력효율의 상승을 유도하여 소비전력을 개선하고 구동전압을 낮출 수 있는 유기전계발광소자를 제공할 수 있는 이점이 있다.
The organic compound of the present invention is applied to a hole injection layer, a doping of a hole transport layer, a hole buffer layer, and a P-type charge generation layer, thereby inducing an increase in power efficiency to improve power consumption and lower the driving voltage. There is an advantage it can provide.
도 1 내지 도 3은 본 발명의 제1 실시예에 따른 유기전계발광소자를 나타낸 도면.
도 4 내지 도 6은 본 발명의 제2 실시예에 따른 유기전계발광소자를 나타낸 도면.
도 7은 본 발명의 실시예 1, 2 및 비교예에 따라 제조된 유기전계발광소자의 전압과 전류의 상관 관계를 나타낸 그래프.
도 8은 본 발명의 실시예 3 내지 6 및 비교예에 따라 제조된 유기전계발광소자의 전압과 전류의 상관 관계를 나타낸 그래프.1 to 3 are views showing an organic electroluminescent device according to a first embodiment of the present invention.
4 to 6 are views showing an organic light emitting diode according to a second embodiment of the present invention.
7 is a graph showing a correlation between voltage and current of organic light emitting devices manufactured according to Examples 1 and 2 and Comparative Examples of the present invention.
8 is a graph showing the correlation between voltage and current of organic light emitting devices manufactured according to Examples 3 to 6 and Comparative Examples of the present invention.
이하, 첨부된 도면을 참조하여 본 발명의 다양한 실시 예들을 자세하게 설명하면 다음과 같다.Hereinafter, various embodiments of the present invention will be described in detail with reference to the accompanying drawings.
도 1 내지 도 3은 본 발명의 제1 실시예에 따른 유기전계발광소자를 나타낸 도면이다.1 to 3 are views showing an organic light emitting diode according to a first embodiment of the present invention.
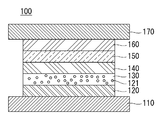
도 1을 참조하면, 본 발명의 제1 실시예에 따른 유기전계발광소자(100)는 양극(110), 정공주입층(120), 정공수송층(130), 발광층(140), 전자수송층(150), 전자주입층(160) 및 음극(170)을 포함할 수 있다.Referring to Figure 1, the organic
상기 양극(110)은 정공을 주입하는 전극으로 일함수가 높은 ITO(Indium Tin Oxide), IZO(Indium Zinc Oxide) 또는 ZnO(Zinc Oxide) 중 어느 하나일 수 있다. 또한, 상기 양극(110)이 반사 전극일 경우에 양극(110)은 ITO, IZO 또는 ZnO 중 어느 하나로 이루어진 층 하부에 알루미늄(Al), 은(Ag) 또는 니켈(Ni) 중 어느 하나로 이루어진 반사층을 더 포함할 수 있다.The
상기 정공주입층(120)은 양극(110)으로부터 발광층(140)으로 정공의 주입을 원활하게 하는 역할을 할 수 있다. 본 실시예의 정공주입층(120)은 하기 화학식 1로 표시되는 유기 화합물을 사용할 수 있다. The
[화학식 1][Formula 1]
상기 화학식 1에서, R1, R2 및 R3 는 각각 독립적으로, 수소, 중수소, 할로겐, 시아노기, 트리플루오로메틸기, C1 내지 C20의 알킬기, 카르복실기, 카르보닐기, C1 내지 C20 의 알콕시기, C1내지 C20의 치환 또는 비치환된 실릴기, C6 이상의 치환 또는 비치환된 방향족 그룹, C5 이상의 치환 또는 비치환된 이형고리 그룹, C1 내지 C20의 치환 또는 비치환된 아민기, C6 이상의 방향족 그룹이 치환된 아민기, C5 이상의 이형고리 그룹이 치환된 아민기, 및 아릴기에서 선택된 어느 하나로 이루어진다.In
또한, X1 및 X2는 각각 독립적으로 하기 a 내지 f로 표시되는 치환기에서 선택된 어느 하나로 이루어진다.In addition, X 1 and X 2 each independently consist of any one selected from substituents represented by a to f below.
상기 유기 화합물은 하기 화학식 2로 표시되는 화합물에서 선택된 어느 하나로 이루어진다.The organic compound is composed of any one selected from compounds represented by the following formula (2).
[화학식 2][Formula 2]
보다 자세하게, 유기 화합물은 하기 표시되는 화합물들에서 선택된 어느 하나로 이루어진다.In more detail, the organic compound consists of any one selected from the compounds shown below.
한편, 본 발명의 유기 화합물은 하기 화학식 3으로 표시될 수 있다.Meanwhile, the organic compound of the present invention may be represented by the following formula (3).
상기 화학식 2에서, X3 내지 X6은 각각 독립적으로, 하기 g 내지 l로 표시되는 치환기에서 선택된 어느 하나로 이루어진다.In
또한, Y1 및 Y2는 각각 독립적으로, 수소, 중수소, 할로겐, 시아노기, 트리플루오로메틸기, C1 내지 C20의 알킬기, 카르복실기, 카르보닐기, C1 내지 C20 의 치환 또는 비치환된 알콕시기, C1내지 C20의 치환 또는 비치환된 실릴기, C6 이상의 치환 또는 비치환된 방향족 그룹, C5 이상의 치환 또는 비치환된 이형고리 그룹, C1 내지 C20의 치환 또는 비치환된 아민기, C6 이상의 방향족 그룹이 치환된 아민기, C5 이상의 이형고리 그룹이 치환된 아민기, 및 아릴기에서 선택된 어느 하나로 이루어진다.In addition, Y 1 and Y 2 are each independently hydrogen, deuterium, halogen, cyano group, trifluoromethyl group, C1 to C20 alkyl group, carboxyl group, carbonyl group, C1 to C20 substituted or unsubstituted alkoxy group, C1 to C20 C20 substituted or unsubstituted silyl group, C6 or more substituted or unsubstituted aromatic group, C5 or more substituted or unsubstituted heterocyclic group, C1 to C20 substituted or unsubstituted amine group, C6 or more aromatic group substituted It consists of any one selected from an amine group, an amine group substituted with a C5 or more heterocyclic group, and an aryl group.
R4 내지 R9는 각각 독립적으로, 수소, 중수소, 할로겐, 시아노기, 트리플루오로메틸기, C1 내지 C20의 알킬기, 카르복실기, 카르보닐기, C1 내지 C20 의 치환 또는 비치환된 알콕시기, C1내지 C20의 치환 또는 비치환된 실릴기, C6 이상의 치환 또는 비치환된 방향족 그룹, C5 이상의 치환 또는 비치환된 이형고리 그룹, C1 내지 C20의 치환 또는 비치환된 아민기, C6 이상의 방향족 그룹이 치환된 아민기, C5 이상의 이형고리 그룹이 치환된 아민기, 및 아릴기에서 선택된 어느 하나로 이루어진다.R 4 to R 9 are each independently hydrogen, deuterium, halogen, cyano group, trifluoromethyl group, C1 to C20 alkyl group, carboxyl group, carbonyl group, C1 to C20 substituted or unsubstituted alkoxy group, C1 to C20 Substituted or unsubstituted silyl group, C6 or more substituted or unsubstituted aromatic group, C5 or more substituted or unsubstituted heterocyclic group, C1 to C20 substituted or unsubstituted amine group, C6 or more aromatic group substituted amine group , C5 or more heterocyclic groups are substituted with any one selected from an amine group, and an aryl group.
상기 유기 화합물은 하기 화학식 4에 표시되는 화합물들에서 선택된 어느 하나로 이루어진다.The organic compound is composed of any one selected from compounds represented by the following formula (4).
[화학식 4][Formula 4]
보다 자세하게, 본 발명의 유기 화합물은 하기 표시되는 화합물들에서 선택된 어느 하나로 이루어진다.In more detail, the organic compound of the present invention consists of any one selected from the compounds shown below.
전술한 본 발명의 유기 화합물은 벤조퀴논 유도체에 전자 수용 능력을 가진 치환기를 도입함으로써, 전자 수용 능력이 뛰어나 전력 효율의 상승을 유도하여 소비전력을 개선하고 구동 전압을 낮출 수 있는 유기전계발광소자를 제공할 수 있는 이점이 있다.The organic compound of the present invention described above is an organic light emitting device capable of improving power consumption and lowering the driving voltage by inducing an increase in power efficiency due to excellent electron-accepting capacity by introducing a substituent having an electron-accepting capacity to the benzoquinone derivative. There is an advantage it can provide.
정공주입층(120)의 두께는 1 내지 150nm일 수 있다. 여기서, 상기 정공주입층(120)의 두께가 1nm 이상이면, 정공 주입 특성이 저하되는 것을 방지할 수 있는 이점이 있고, 150nm 이하이면, 정공주입층(120)의 두께가 너무 두꺼워 정공의 이동을 향상시키기 위해 구동전압이 상승되는 것을 방지할 수 있는 이점이 있다.The thickness of the
상기 정공수송층(130)은 정공의 수송을 원활하게 하는 역할을 하며, NPD(N,N-dinaphthyl-N,N'-diphenyl benzidine), TPD(N,N'-bis-(3-methylphenyl)-N,N'-bis-(phenyl)-benzidine), s-TAD 및 MTDATA(4,4',4"-Tris(N-3-methylphenyl-N-phenyl-amino)-triphenylamine)로 이루어진 군에서 선택된 어느 하나 이상으로 이루어질 수 있으나 이에 한정되지 않는다. 상기 정공수송층(130)의 두께는 1 내지 150nm일 수 있다. 여기서, 상기 정공수송층(130)의 두께가 5nm 이상이면, 정공 수송 특성이 저하되는 것을 방지할 수 있는 이점이 있고, 150nm 이하이면, 정공수송층(130)의 두께가 너무 두꺼워 정공의 이동을 향상시키기 위해 구동전압이 상승되는 것을 방지할 수 있는 이점이 있다.The
상기 발광층(140)은 적색(R), 녹색(G) 및 청색(B)을 발광할 수 있으며, 인광 물질 또는 형광 물질로 이루어질 수 있다. The
발광층(140)이 적색인 경우, CBP(carbazole biphenyl) 또는 mCP(1,3-bis(carbazol-9-yl)를 포함하는 호스트 물질을 포함하며, PIQIr(acac)(bis(1-phenylisoquinoline)acetylacetonate iridium), PQIr(acac)(bis(1-phenylquinoline)acetylacetonate iridium), PQIr(tris(1-phenylquinoline)iridium) 및 PtOEP(octaethylporphyrin platinum)로 이루어진 군에서 선택된 어느 하나 이상을 포함하는 도펀트를 포함하는 인광물질로 이루어질 수 있고, 이와는 달리 PBD:Eu(DBM)3(Phen) 또는 Perylene을 포함하는 형광물질로 이루어질 수 있으나 이에 한정되지 않는다.When the
발광층(140)이 녹색인 경우, CBP 또는 mCP를 포함하는 호스트 물질을 포함하며, Ir(ppy)3(fac tris(2-phenylpyridine)iridium)을 포함하는 도펀트 물질을 포함하는 인광물질로 이루어질 수 있고, 이와는 달리, Alq3(tris(8-hydroxyquinolino)aluminum)을 포함하는 형광물질로 이루어질 수 있으나 이에 한정되지 않는다.When the
발광층(140)이 청색인 경우, CBP 또는 mCP를 포함하는 호스트 물질을 포함하며, (4,6-F2ppy)2Irpic을 포함하는 도펀트 물질을 포함하는 인광물질로 이루어질 수 있고, 이와는 달리, spiro-DPVBi, spiro-6P, 디스틸벤젠(DSB), 디스트릴아릴렌(DSA), PFO계 고분자 및 PPV계 고분자로 이루어진 군에서 선택된 어느 하나를 포함하는 형광물질로 이루어질 수 있으나 이에 한정되지 않는다.When the
상기 전자수송층(150)은 전자의 수송을 원활하게 하는 역할을 하며, Alq3(tris(8-hydroxyquinolino)aluminum), PBD, TAZ, spiro-PBD, BAlq 및 SAlq로 이루어진 군에서 선택된 어느 하나 이상으로 이루어질 수 있으나 이에 한정되지 않는다. 상기 전자수송층(150)의 두께는 1 내지 50nm일 수 있다. 여기서, 상기 전자수송층(150)의 두께가 1nm 이상이면, 전자 수송 특성이 저하되는 것을 방지할 수 있는 이점이 있고, 50nm 이하이면, 전자수송층(150)의 두께가 너무 두꺼워 전자의 이동을 향상시키기 위해 구동전압이 상승되는 것을 방지할 수 있는 이점이 있다.The
상기 전자주입층(160)은 전자의 주입을 원활하게 하는 역할을 하며, Alq3(tris(8-hydroxyquinolino)aluminum), PBD, TAZ, spiro-PBD, BAlq 또는 SAlq를 사용할 수 있으나 이에 한정되지 않는다. 반면, 전자주입층(160)은 금속화합물로 이루어질 수 있으며, 금속화합물은 예를 들어 LiQ, LiF, NaF, KF, RbF, CsF, FrF, BeF2, MgF2, CaF2, SrF2, BaF2 및 RaF2로 이루어진 군에서 선택된 어느 하나 이상일 수 있으나 이에 한정되지 않는다. 상기 전자주입층(160)의 두께는 1 내지 50nm일 수 있다. 여기서, 상기 전자주입층(160)의 두께가 1nm 이상이면, 전자 주입 특성이 저하되는 것을 방지할 수 있는 이점이 있고, 50nm 이하이면, 전자주입층(150)의 두께가 너무 두꺼워 전자의 이동을 향상시키기 위해 구동전압이 상승되는 것을 방지할 수 있는 이점이 있다.The
상기 음극(170)은 전자 주입 전극으로, 일함수가 낮은 마그네슘(Mg), 칼슘(Ca), 알루미늄(Al), 은(Ag) 또는 이들의 합금으로 이루어질 수 있다. 여기서, 음극(170)은 유기전계발광소자가 전면 또는 양면발광구조일 경우, 빛을 투과할 수 있을 정도로 얇은 두께로 형성할 수 있으며, 유기전계발광소자가 배면발광구조일 경우, 빛을 반사시킬 수 있을 정도로 두껍게 형성할 수 있다. The
전술한 도 1의 유기전계발광소자는 정공주입층이 본 발명의 유기 화합물로 이루어진 것을 도시하고 설명하였다. 반면, 도 2를 참조하면, 본 발명의 유기 화합물(121)은 정공수송층(130)에 도핑될 수 있다. 이때, 유기 화합물(121)은 정공수송층(130)에 대해 0.1 내지 50%의 도핑농도로 도핑된다. 정공주입층(120)은 CuPc(cupper phthalocyanine), PEDOT(poly(3,4)-ethylenedioxythiophene), PANI(polyaniline) 및 NPD(N,N-dinaphthyl-N,N'-diphenyl benzidine)로 이루어진 군에서 선택된 어느 하나 이상으로 이루어질 수 있으나 이에 한정되지 않는다. The organic electroluminescent device of FIG. 1 described above shows and describes that the hole injection layer is made of the organic compound of the present invention. On the other hand, referring to FIG. 2, the
또한, 도 3을 참조하면, 본 발명의 유기 화합물(121)은 정공주입층(120)과 정공수송층(130) 사이에 위치하는 정공버퍼층(125)에 포함될 수 있다. 정공버퍼층(125)은 유기 화합물(121)로만 이루어지거나, 호스트 물질에 유기 화합물(121)이 도핑되어 이루어질 수 있다. 이때, 정공버퍼층(125)의 호스트 물질은 정공 특성을 가진 물질들로 예를 들어 정공수송층 물질을 사용할 수 있으나 이에 한정되지 않는다. 이러한 정공버퍼층(125)은 정공주입층(120)과 정공수송층(130)에 위치하여 버퍼층(buffer layer)로 작용한다. 반면, 도시하지 않았지만 정공버퍼층(125)은 양극(110)과 정공수송층(130) 사이에서 양극(110)에 접하며, 정공주입층(120)이 생략된 구조로도 이루어질 수 있다.In addition, referring to FIG. 3, the
전술한 바와 같이, 본 발명의 유기 화합물은 정공주입층, 정공수송층의 도핑 및 정공버퍼층에 적용함으로써, 전자 수용 능력이 뛰어나 전력 효율의 상승을 유도하여 소비전력을 개선하고 구동 전압을 낮출 수 있는 유기전계발광소자를 제공할 수 있는 이점이 있다.As described above, by applying the organic compound of the present invention to the hole injection layer, the doping of the hole transport layer, and the hole buffer layer, the organic compound has excellent electron-accepting capacity and induces an increase in power efficiency, thereby improving power consumption and lowering the driving voltage. There is an advantage in that it can provide an electroluminescent device.
도 4 내지 도 6은 본 발명의 제2 실시예에 따른 유기전계발광소자를 나타낸 도면이다. 하기에서는 전술한 제1 실시예와 동일한 구성요소에 대해서는 그 설명을 생략하기로 한다.4 to 6 are diagrams showing an organic light emitting diode according to a second embodiment of the present invention. In the following, descriptions of the same components as those of the first embodiment will be omitted.
도 4를 참조하면, 본 발명의 유기전계발광소자(200)는 양극(210)과 음극(310) 사이에 위치하는 스택들(ST1, ST2) 및 스택들(ST1, ST2) 사이에 위치하는 전하생성층(260)을 포함한다. 본 실시예에서는 양극(210)과 음극(310) 사이에 2개의 스택들이 위치하는 것으로 도시하고 설명하였으나, 이에 한정되지 않으며 양극(210)과 음극(310) 사이에 3개, 4개 또는 그 이상의 스택들을 포함할 수도 있다. Referring to FIG. 4, the organic
보다 자세하게, 제1 스택(ST1)은 하나의 발광소자 단위를 이루는 것으로, 제1 발광층(240)을 포함한다. 제1 발광층(240)은 적색, 녹색 및 청색 중 어느 하나의 색을 발광할 수 있으며, 본 실시예에서는 청색을 발광하는 청색 발광층일 수 있다. 상기 제1 스택(ST1)은 양극(210)과 제1 발광층(240) 사이에 정공주입층(220), 제1 정공수송층(230)을 더 포함한다. 상기 정공주입층(220)은 양극(210)으로부터 제1 발광층(240)으로 정공의 주입을 원활하게 하는 역할을 할 수 있으며, CuPc(cupper phthalocyanine), PEDOT(poly(3,4)-ethylenedioxythiophene), PANI(polyaniline) 및 NPD(N,N-dinaphthyl-N,N'-diphenyl benzidine)로 이루어진 군에서 선택된 어느 하나 이상으로 이루어질 수 있으나 이에 한정되지 않는다. In more detail, the first stack ST1 constitutes one light emitting device unit and includes a first
상기 제1 정공수송층(230)은 전술한 제1 실시예의 정공수송층과 동일한 구성으로 이루어진다. 그리고, 제1 스택(ST1)은 제1 발광층(240) 상에 제1 전자수송층(250)을 더 포함한다. 제1 전자수송층(250)은 전술한 제1 실시예의 전자수송층과 동일한 구성으로 이루어진다. 따라서, 양극(210) 상에 정공주입층(220), 제1 정공수송층(230), 제1 발광층(240) 및 제1 전자수송층(250)을 포함하는 제1 스택(ST1)을 구성한다.The first
상기 제1 스택(ST1) 상에 전하생성층(Charge Generation Layer ; CGL)(260)이 위치한다. 전하생성층(260)은 N형 전하생성층(260N)과 P형 전하생성층(260P)이 접합된 PN접합 전하생성층일 수 있다. 이때, 상기 PN접합 전하생성층(260)은 전하를 생성하거나 정공 및 전자로 분리하여 상기 각 발광층에 전하를 주입한다. 즉, N형 전하생성층(260N)은 양극에 인접한 제1 발광층(240)에 전자를 공급하고, 상기 P형 전하생성층(260P)은 제2 스택(ST2)의 발광층에 정공을 공급함으로써, 다수의 발광층을 구비하는 유기전계발광소자의 발광 효율을 더욱 증대시킬수 있으며, 이와 더불어 구동 전압도 낮출수 있다.A charge generation layer (CGL) 260 is positioned on the first stack ST1. The
여기서, P형 전하생성층(260P)은 전술한 화학식 1 및 2로 표시되는 유기 화합물로 이루어진다. 유기 화합물은 전술한 제1 실시예와 동일한 물질로 그 설명은 생략하기로 한다. P형 전하생성층(260P)에 사용되는 유기 화합물은 전자 수용 능력이 뛰어나 전력 효율의 상승을 유도하여 소비전력을 개선하고 구동 전압을 낮출 수 있는 유기전계발광소자를 제공할 수 있는 이점이 있다.Here, the P-type
상기 N형 전하생성층(260N)은 금속 또는 N형이 도핑된 유기물질로 이루어질 수 있다. 여기서, 상기 금속은 Li, Na, K, Rb, Cs, Mg, Ca, Sr, Ba, La, Ce, Sm, Eu, Tb, Dy 및 Yb로 이루어진 군에서 선택된 하나의 물질일 수 있다. 또한, 상기 N형이 도핑된 유기물질에 사용되는 N형 도펀트와 호스트의 물질은 통상적으로 사용되는 물질을 이용할 수 있다. 예를 들면, 상기 N형 도펀트는 알칼리 금속, 알칼리 금속 화합물, 알칼리 토금속 또는 알칼리 토금속 화합물일 수 있다. 자세하게는 상기 N형 도펀트는 Cs, K, Rb, Mg, Na, Ca, Sr, Eu 및 Yb로 이루어진 군에서 선택된 하나일 수 있다. 상기 호스트 물질은 트리스(8-하이드록시퀴놀린)알루미늄, 트리아진, 하이드록시퀴놀린 유도체 및 벤즈아졸 유도체 및 실롤 유도체로 이루어진 군에서 선택된 하나의 물질일 수 있다.The N-type
한편, 상기 전하생성층(260) 상에 제2 발광층(290)을 포함하는 제2 스택(ST2)이 위치한다. 제2 발광층(290)은 적색, 녹색 및 청색 중 하나의 색을 발광할 수 있으며, 예를 들어 본 실시예에서는 노란색을 발광하는 노란색 발광층일 수 있다. 제2 발광층(290)은 옐로그린을 발광하는 발광층 또는 옐로그린 발광층과 그린을 발광하는 발광층의 다층 구조로 이루어질 수 있다. 본 실시예에서는 옐로그린을 발광하는 노란색 발광층의 단층 구조를 예로 설명한다. 제2 발광층(290)은 CBP(4,4'-N,N'-dicarbazolebiphenyl) 또는 Balq(Bis(2-methyl-8-quinlinolato-N1,O8)-(1,1'-Biphenyl-4-olato)aluminium) 중 선택된 적어도 하나의 호스트에 옐로그린을 발광하는 인광 옐로그린 도펀트로 이루어질 수 있다. Meanwhile, a second stack ST2 including a
상기 제2 스택(ST2)은 전하생성층(260)과 상기 제2 발광층(290) 사이에 제2 정공수송층(270)과 전자블록층(280)을 더 포함한다. 제2 정공수송층(270)은 전술한 제1 정공수송층(230)과 동일한 구성으로 이루어진다. 전자블록층(280)은 발광층에서 생성된 전자가 정공수송층으로 넘어오는 것을 방지하도록 정공수송층의 재료와 금속 또는 금속 화합물을 포함하여 이루어진다. 따라서, 전자블록층의 LUMO 레벨이 높아져 전자가 넘어올 수 없게 된다. The second stack ST2 further includes a second
또한, 제2 스택(ST2)은 제2 발광층(290) 상에 제2 전자수송층(300)을 더 포함하며, 제2 전자수송층(300)은 전술한 제1 스택(ST1)의 제1 전자수송층(250)과 동일한 구성으로 이루어진다. 따라서, 전하생성층(260) 상에 제2 정공수송층(270), 전자블록층(280), 제2 발광층(290) 및 제2 전자수송층(300)을 포함하는 제2 스택(ST2)을 구성한다. 제2 스택(ST2) 상에는 음극(310)이 구비되어 본 발명의 제2 실시예에 따른 유기전계발광소자를 구성한다.In addition, the second stack ST2 further includes a second
전술한 도 4의 유기전계발광소자는 P형 전하생성층(260P)이 본 발명의 유기 화합물로 이루어진 것을 도시하고 설명하였다. 반면, 도 5를 참조하면, 본 발명의 유기 화합물(121)은 호스트 물질로 이루어진 P형 전하생성층(260P)에 도핑될 수 있다. 즉, P형 전하생성층(260P)은 호스트 물질과 유기 화합물(121)로 이루어질 수 있다. 호스트 물질은 전술한 제1 실시예에서 설명하였으므로 생략한다. 이때, 유기 화합물(121)은 P형 전하생성층(260P)에 대해 0.1 내지 50%의 도핑농도로 도핑된다. 또한, 도 6을 참조하면, 본 발명의 유기 화합물(121)은 P형 전하생성층(260P)에 도핑되어 사용되되, 이때 P형 전하생성층(260P)과 제2 발광층(280) 사이에 정공수송층이 생략될 수 있다.The organic electroluminescent device of FIG. 4 described above shows and describes that the P-type
한편, 본 발명의 제2 실시예에서는 유기전계발광소자의 P형 전하생성층에 본 발명의 유기 화합물을 사용하는 것을 개시하였으나, 제2 실시예의 제1 스택에 형성된 정공주입층에 전술한 제1 실시예와 같이, 유기 화합물이 더 사용될 수도 있다. 즉, 본 발명의 제2 실시예에 전술한 제1 실시예의 구성이 적절히 혼합되어 사용될 수도 있다. On the other hand, in the second embodiment of the present invention, the use of the organic compound of the present invention in the P-type charge generation layer of the organic light emitting device is disclosed, but the above-described first embodiment is applied to the hole injection layer formed in the first stack of the second embodiment. As in the examples, organic compounds may be further used. That is, the configuration of the first embodiment described above may be appropriately mixed with the second embodiment of the present invention.
전술한 바와 같이, 본 발명의 유기 화합물은 P형 전하생성층에 적용함으로써, 전자 수용 능력이 뛰어나 전력 효율의 상승을 유도하여 소비전력을 개선하고 구동 전압을 낮출 수 있는 유기전계발광소자를 제공할 수 있는 이점이 있다.As described above, by applying the organic compound of the present invention to the P-type charge generation layer, it is possible to provide an organic light emitting device capable of improving power consumption and lowering the driving voltage by inducing an increase in power efficiency due to excellent electron-accepting capacity. There is an advantage to be able to.
이하, 본 발명의 유기 화합물의 합성예 및 이를 포함하는 유기전계발광소자에 관하여 하기 합성예 및 실시예에서 상술하기로 한다. 다만, 하기의 실시예는 본 발명을 예시하는 것일 뿐 본 발명이 하기 실시예에 한정되는 것은 아니다.Hereinafter, a synthesis example of the organic compound of the present invention and an organic electroluminescent device including the same will be described in detail in the following synthesis examples and examples. However, the following examples are only illustrative of the present invention, and the present invention is not limited to the following examples.
합성예Synthesis example
1) 화합물 A-1의 제조1) Preparation of compound A-1
2-브로모-1,4-벤조퀴논(2-Bromo-1,4-benzoquinone)(5.35mmol)과 트리페닐실라놀(triphenylsilanol)(5.88mmol), 테트라키스(트리페닐포스핀)팔라듐(0)Tetrakis(triphenylphosphine)palladium(0)(0.27mmol), 2M 의 탄산칼륨(potassium carbonate)을 1,4-다이옥산(1,4-dioxane)에 혼합하여 90℃까지 승온한다. 1시간 교반한 후, 물과 에틸 아세테이트(ethyl acetate)로 추출한다. 황산마그네슘(Magnesium sulfate)으로 수분 제거하여 농축한 후, 메틸렌 클로라이드(methylene chloride)와 헥산(hexane)으로 컬럼 크로마토그래프(column chromatography)를 통하여 분리하였다. 분리 후, 메틸렌 클로라이드와 헥산으로 침전물을 얻어 여과 후 건조하여 밝은 노란색 고체를 화합물 A-1(수율 34%)을 얻었다.2-Bromo-1,4-benzoquinone (5.35mmol) and triphenylsilanol (5.88mmol), tetrakis (triphenylphosphine) palladium (0 )Tetrakis(triphenylphosphine)palladium(0)(0.27mmol), 2M potassium carbonate was mixed with 1,4-dioxane and heated to 90℃. After stirring for 1 hour, extraction was performed with water and ethyl acetate. After concentrating by removing moisture with magnesium sulfate, it was separated through column chromatography with methylene chloride and hexane. After separation, a precipitate was obtained with methylene chloride and hexane, filtered, and dried to obtain a light yellow solid compound A-1 (yield 34%).
2) 화합물 A의 제조2) Preparation of compound A
화합물 A-1(1.91mmol)과 말라노니트릴(malononitrile)(19.1mmol)을 메틸렌 클로라이드에 혼합하여 질소 하에 교반한다. 아이스배쓰(Ice bath) 조건으로 0℃에서 티타늄 테트라클로라이드(titanium tetrachloride)(19.1mmol)을 천천히 투입한다. 0℃를 유지하며 피리딘(pyridine)(37.44mmol)을 천천히 투입하여 준 후, 메틸렌 클로라이드 환류 조건으로 교반하여 하룻밤 동안(overnight) 반응한다. 반응 완료 후 방냉하고 아이스배쓰 하에 물을 천천히 투입하여 준다. 메틸렌 클로라이드와 물로 추출한 후 황산마그네슘으로 수분을 제거하고 농축한다. 메틸렌 클로라이드와 헥산으로 컬럼 크로마토그래피를 통하여 분리하였다. 분리 후, 메틸렌 클로라이드와 헥산으로 침전물을 얻어 여과 후 건조하여 화합물 A(수율 25 %)를 얻었다.Compound A-1 (1.91 mmol) and malononitrile (19.1 mmol) were mixed with methylene chloride and stirred under nitrogen. Titanium tetrachloride (19.1 mmol) was slowly added at 0° C. under the conditions of an ice bath. Maintaining 0° C., pyridine (37.44 mmol) was slowly added thereto, followed by stirring under reflux conditions of methylene chloride and reacted overnight. After completion of the reaction, allow to cool and slowly add water under an ice bath. After extraction with methylene chloride and water, water is removed with magnesium sulfate and concentrated. It was separated by column chromatography with methylene chloride and hexane. After separation, a precipitate was obtained with methylene chloride and hexane, filtered, and dried to obtain compound A (yield 25%).
3) 화합물 B-1의 제조3) Preparation of compound B-1
펜타플루오로벤조니트릴(Pentafluorobenzonitrile)(51.79mmol)과 탄산칼륨(62.15mmol)을 디메틸하이드로퓨란(DMF) 용매에 혼합하여 교반한다. 에틸 시아노아세테이트(ethyl cyanoacetate)(51.79mmol)을 추가 투입한 후, 실온에서 48 시간 교반하였다. 반응 완료 후, 물을 추가하고 아세트산(acetic acid)(8.40mmol)을 투입하여 30분 교반한다. 클로로폼(Chloroform)과 물로 추출한 후, 황산마그네슘으로 수분제거 하고 농축하여 화합물 B-1을 얻되 추가 정제 없이 다음 반응을 진행하였다. Pentafluorobenzonitrile (51.79 mmol) and potassium carbonate (62.15 mmol) were mixed in a dimethylhydrofuran (DMF) solvent and stirred. After adding ethyl cyanoacetate (51.79 mmol), the mixture was stirred at room temperature for 48 hours. After completion of the reaction, water was added, acetic acid (8.40 mmol) was added, and the mixture was stirred for 30 minutes. After extraction with chloroform and water, water was removed with magnesium sulfate and concentrated to obtain compound B-1, but the next reaction was carried out without further purification.
4) 화합물 B-2의 제조4) Preparation of compound B-2
화합물 B-1(18.82mmol)과 50% 아세트산(21ml), 황산(1ml)를 일괄 투입한 후, 환류 및 교반하여 하룻밤 동안 반응하였다. 반응 완료 후, 방냉하고 물을 투입하여 30분 간 교반하였다. 클로로폼과 물로 추출하고 탄산수소나트륨(sodium bicatbonate)과 물로 2차 추출을 한 후, 황산마그네슘으로 수분제거 한 후 농축하였다. 진공 건조하여 노란색의 화합물 B-2(수율 86%)를 얻었다. Compound B-1 (18.82 mmol), 50% acetic acid (21 ml), and sulfuric acid (1 ml) were added in a batch, followed by refluxing and stirring to react overnight. After completion of the reaction, it was allowed to cool, and water was added thereto, followed by stirring for 30 minutes. After extraction with chloroform and water, secondary extraction was performed with sodium bicatbonate and water, water was removed with magnesium sulfate, and then concentrated. It dried in vacuo to give a yellow compound B-2 (yield 86%).
5) 화합물 A-2의 제조5) Preparation of compound A-2
화합물 A-1(1.91mmol)과 말라노니트릴(4.78mmol)을 메틸렌 클로라이드에 혼합하여 질소 하에 교반한다. 아이스배쓰 조건으로 0℃에서 티타늄 테트라클로라이드(4.78mmol)을 천천히 투입한다. 0℃를 유지하며 피리딘(9.55mmol)을 천천히 투입하여 준 후, 실온에서 교반하여 하룻밤 동안 반응한다. 반응 완료 후 방냉하고 아이스배쓰 하에 물을 천천히 투입하여 준다. 메틸렌 클로라이드와 물로 추출한 후 황산마그네슘으로 수분을 제거하고 농축한다. 메틸렌 클로라이드와 헥산으로 컬럼 크로마토그래피를 통하여 분리하였다. 분리 후, 메틸렌 클로라이드와 헥산으로 침전물을 얻어 여과 후 건조하여 화합물 A-2(수율 30%)를 얻었다.Compound A-1 (1.91 mmol) and malanonitrile (4.78 mmol) were mixed with methylene chloride and stirred under nitrogen. Titanium tetrachloride (4.78mmol) was slowly added at 0°C under ice bath conditions. Maintaining 0°C, pyridine (9.55mmol) was slowly added thereto, followed by stirring at room temperature to react overnight. After completion of the reaction, allow to cool and slowly add water under an ice bath. After extraction with methylene chloride and water, water is removed with magnesium sulfate and concentrated. It was separated by column chromatography with methylene chloride and hexane. After separation, a precipitate was obtained with methylene chloride and hexane, filtered, and dried to obtain compound A-2 (yield 30%).
6) 화합물 B의 제조6) Preparation of compound B
화합물 A-1(5.79mmol) 과 B-2(57.9mmol)을 메틸렌 클로라이드에 혼합하여 질소 하에 교반한다. 아이스배쓰 조건으로 0℃에서 티타늄 테트라클로라이드(57.9mmol)을 천천히 투입한다. 0℃를 유지하며 피리딘(113.48mmol)을 천천히 투입하여 준 후, 환류 교반하여 하룻밤 동안 반응한다. 반응 완료 후 방냉하고 아이스배쓰 하에 물을 천천히 투입하여 준다. 메틸렌 클로라이드와 물로 추출한 후 황산마그네슘으로 수분을 제거하고 농축한다. 메틸렌 클로라이드와 헥산으로 컬럼 크로마토그래피를 통하여 분리하였다. 분리 후, 메틸렌 클로라이드와 헥산으로 침전물을 얻어 여과 후 건조하여 화합물 B(수율 42%)를 얻었다.Compounds A-1 (5.79 mmol) and B-2 (57.9 mmol) were mixed with methylene chloride and stirred under nitrogen. Titanium tetrachloride (57.9 mmol) was slowly added at 0° C. under ice bath conditions. Maintaining 0° C., pyridine (113.48 mmol) was slowly added thereto, followed by reflux stirring and reacting overnight. After completion of the reaction, allow to cool and slowly add water under an ice bath. After extraction with methylene chloride and water, water is removed with magnesium sulfate and concentrated. It was separated by column chromatography with methylene chloride and hexane. After separation, a precipitate was obtained with methylene chloride and hexane, filtered, and dried to obtain compound B (yield 42%).
7) 화합물 C-1의 제조7) Preparation of compound C-1
1,4-디메톡시벤젠(1,4-dimethoxybenzene)(21.7mmol)과 N,N,N′,N′-테트라메틸에틸렌디아민(N,N,N′,N′-Tetramethylethylenediamine)(TMEDA, 22.6mmol)을 디에틸에테르(diethylether)(35ml)에 혼합하여 교반하였다. n-BuLi (1.51N, 21.7mmol)을 헥산(142ml)와 혼합하여 투입한 후, 실온에서 14시간 교반하였다. 디클로로디메틸실란(Dichlorodimethylsilane)(11.1mmol)과 디에틸에테르(1.5ml)의 혼합 용액을 투입한 다음 실온에서 6시간 교반한다. 반응 종료 후 물을 투입하여 수층을 헥산과 물, 브라인(brine)으로 추출한 후, 황산마그네슘으로 수분을 제거한 후 농축하였다. 클로로폼과 에탄올(ethanol)을 사용하여 재결정을 통해 화합물 C-1(수율 70%)을 얻었다.1,4-dimethoxybenzene (21.7 mmol) and N,N,N′,N′-tetramethylethylenediamine (N,N,N′,N′-Tetramethylethylenediamine) (TMEDA, 22.6 mmol) was mixed with diethylether (35ml) and stirred. After n-BuLi (1.51N, 21.7 mmol) was mixed with hexane (142ml) and added, the mixture was stirred at room temperature for 14 hours. A mixed solution of dichlorodimethylsilane (11.1 mmol) and diethyl ether (1.5 ml) was added, followed by stirring at room temperature for 6 hours. After the reaction was completed, water was added to extract the aqueous layer with hexane, water, and brine, and the water was removed with magnesium sulfate and then concentrated. Compound C-1 (yield 70%) was obtained through recrystallization using chloroform and ethanol.
8) 화합물 C-2의 제조8) Preparation of compound C-2
화합물 C-1(15.2mmol), 질산암모늄세륨(Ammonium cerium(Ⅳ)nitrate)(72.9mmol)을 아세토니트릴(acetonitrile)(200ml)과 물(150ml)에 혼합하여 실온에서 6시간 교반하였다. 반응 종료 후, 클로로폼과 물로 추출한 다음 황산마그네슘으로 수분 제거하여 농축한다. 클로로폼과 헥산으로 재결정하여 화합물 C-2(수율 50%)를 얻었다.Compound C-1 (15.2 mmol) and ammonium cerium (IV) nitrate (72.9 mmol) were mixed with acetonitrile (200 ml) and water (150 ml), followed by stirring at room temperature for 6 hours. After completion of the reaction, the mixture was extracted with chloroform and water, and then dried over magnesium sulfate and concentrated. Recrystallized from chloroform and hexane to obtain compound C-2 (yield 50%).
9) 화합물 C의 제조9) Preparation of compound C
화합물 C-2(1.91mmol)과 말로니트릴(19.1mmol)을 메틸렌 클로라이드에 혼합하여 질소 하에 교반한다. 아이스배쓰 조건으로 0℃에서 티타늄 테트라클로라이드(19.1mmol)을 천천히 투입한다. 0℃를 유지하며 피리딘(37.4mmol)을 천천히 투입하여 준 후, 실온에서 교반하여 하룻밤 동안 반응한다. 반응 완료 후 방냉하고 아이스배쓰 하에 물을 천천히 투입하여 준다. 메틸렌 클로라이드와 물로 추출한 후 황산마그네슘으로 수분을 제거하고 농축한다. 메틸렌 클로라이드와 헥산으로 컬럼 크로마토그래피를 통하여 분리하였다. 분리 후, 메틸렌 클로라이드와 헥산으로 침전물을 얻어 여과 후 건조하여 화합물 C(수율 43%)를 얻었다.Compound C-2 (1.91 mmol) and malonitrile (19.1 mmol) were mixed with methylene chloride and stirred under nitrogen. Titanium tetrachloride (19.1 mmol) was slowly added at 0° C. under ice bath conditions. Maintaining 0° C., pyridine (37.4 mmol) was slowly added thereto, followed by stirring at room temperature to react overnight. After completion of the reaction, allow to cool and slowly add water under an ice bath. After extraction with methylene chloride and water, water is removed with magnesium sulfate and concentrated. It was separated by column chromatography with methylene chloride and hexane. After separation, a precipitate was obtained with methylene chloride and hexane, filtered, and dried to obtain compound C (yield 43%).
10 ) 화합물 D-1의 제조10) Preparation of compound D-1
1,4-디아미노-2,5-디메톡시벤젠(1,4-diamino-2,5-dimethoxybenzene)(16.9mmol)과 디에틸에테르(70ml)를 교반 중 -78℃에서 1.55N의 n-BuLi(16.8mmol)을 11ml의 헥산에 혼합하여 추가 투입한다. 혼합물을 -78℃ 유지 하에 1.5 시간 동안 교반하였다. 디클로로디메틸실란(8.4mmol)과 디에틸에테르 2ml를 -78℃하에 추가 투입한 후 실온에서 하룻밤 동안 교반하였다. 이후 1.5 시간 동안 환류 및 교반하고 물을 투입하였다. 수층을 헥산과 물로 추출하고 물과 브라인으로 씻어준 후 황산마그네슘으로 수분을 제거해 준 후, 걸러주었다. 증류를 통하여 화합물 D-1(수율 45%)을 얻었다. 1,4-diamino-2,5-dimethoxybenzene (1,4-diamino-2,5-dimethoxybenzene) (16.9 mmol) and diethyl ether (70 ml) were stirred. 1.55 N n- BuLi (16.8 mmol) is mixed with 11 ml of hexane and added. The mixture was stirred for 1.5 hours while maintaining -78°C. Dichlorodimethylsilane (8.4 mmol) and 2 ml of diethyl ether were additionally added at -78°C, followed by stirring at room temperature overnight. After refluxing and stirring for 1.5 hours, water was added. The aqueous layer was extracted with hexane and water, washed with water and brine, dried with magnesium sulfate, and filtered. Compound D-1 (yield 45%) was obtained through distillation.
11) 화합물 D-2의 제조11) Preparation of compound D-2
화합물 D-1(7.6mmol), 질산암모늄세륨(36.7mmol)을 아세토니트릴(100ml)와 물(75ml)에 혼합하여 실온에서 6시간 교반하였다. 반응 종료 후, 클로로폼과 물로 추출한 다음 황산마그네슘으로 수분을 제거하여 농축한다. 클로로폼과 헥산으로 재결정하여 화합물 B-2(수율 55%)를 얻었다. Compound D-1 (7.6 mmol) and cerium ammonium nitrate (36.7 mmol) were mixed with acetonitrile (100 ml) and water (75 ml), followed by stirring at room temperature for 6 hours. After completion of the reaction, the mixture was extracted with chloroform and water, and then the moisture was removed with magnesium sulfate and concentrated. Recrystallized from chloroform and hexane to obtain compound B-2 (yield 55%).
12) 화합물 D-3의 제조12) Preparation of compound D-3
탄산칼륨(2M in water 35ml)에 화합물 D-2(4.6mmol)과 3,4-디플루오로페닐보로닉산(3,4-difluorophenylboronic acid)(10.2mmol) 및 테트라키스(트리페닐포스핀)팔라듐(0)(0.46mmol), 1,4-다이옥산(100ml)를 투입하고 90℃까지 승온하여 1 시간 동안 교반하였다. 반응 종료 후, 메틸렌 클로라이드와 물로 추출하고 황산마그네슘으로 수분제거 하여 농축한다. 메틸렌 클로라이드와 헥산에 컬럼 크로마토그래피를 통해 고체인 화합물 D-3(수율 34%)을 얻었다.Compound D-2 (4.6 mmol) and 3,4-difluorophenylboronic acid (10.2 mmol) and tetrakis (triphenylphosphine) in potassium carbonate (35 ml of 2M in water) Palladium (0) (0.46mmol) and 1,4-dioxane (100ml) were added, the temperature was raised to 90°C, and the mixture was stirred for 1 hour. After completion of the reaction, the mixture was extracted with methylene chloride and water, dried over magnesium sulfate, and concentrated. Compound D-3 (yield 34%) as a solid was obtained through column chromatography in methylene chloride and hexane.
13) 화합물 D의 제조13) Preparation of compound D
화합물 D-3(1.6mmol)과 말로노니트릴(15.7mmol)을 메틸렌 클로라이드에 혼합하여 질소 하에 교반한다. 아이스배쓰 조건으로 0℃에서 티타늄 테트라클로라이드(15.7mmol)을 천천히 투입한다. 0℃를 유지하며 피리딘(30.8mmol)을 천천히 투입하여 준 후, 실온에서 교반하여 하룻밤 동안 반응한다. 반응 완료 후 방냉하고 아이스배쓰 하에 물을 천천히 투입하여 준다. 메틸렌 클로라이드와 물로 추출한 후 황산마그네슘으로 수분을 제거하고 농축한다. 메틸렌 클로라이드와 헥산으로 컬럼 크로마토그래피를 통하여 분리하였다. 분리 후, 메틸렌 클로라이드와 헥산으로 침전물을 얻어 여과 후 건조하여 화합물 D(수율 38%)를 얻었다.Compound D-3 (1.6 mmol) and malononitrile (15.7 mmol) were mixed with methylene chloride and stirred under nitrogen. Titanium tetrachloride (15.7 mmol) was slowly added at 0° C. under ice bath conditions. Maintaining 0℃, pyridine (30.8mmol) was slowly added thereto, followed by stirring at room temperature to react overnight. After completion of the reaction, allow to cool and slowly add water under an ice bath. After extraction with methylene chloride and water, water is removed with magnesium sulfate and concentrated. It was separated by column chromatography with methylene chloride and hexane. After separation, a precipitate was obtained with methylene chloride and hexane, filtered, and dried to obtain compound D (yield 38%).
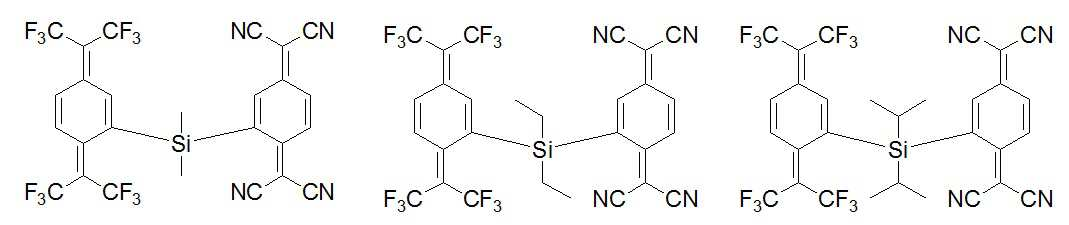
이하, 전술한 합성예에서 제조된 본 발명의 전하 수송성 화합물 A, B, C 및 D를 각각 정공주입층에 도핑하여 유기전계발광소자를 제작한 실시예를 개시한다. 또한, 하기 표시되는 화합물 E와 F도 각각 정공주입층에 도핑하여 유기전계발광소자를 제작하였다.Hereinafter, an embodiment in which an organic electroluminescent device is manufactured by doping the charge transport compounds A, B, C, and D of the present invention prepared in the above synthesis example into a hole injection layer, respectively, will be described. In addition, compounds E and F shown below were also doped into the hole injection layer, respectively, to fabricate an organic electroluminescent device.
<실시예 1><Example 1>
ITO glass의 발광 면적이 3mm × 3mm 크기가 되도록 패터닝한 후 세정하였다. 기판을 진공 챔버에 장착한 후 기본 압력이 1x10-6 torr가 되도록 한 후 양극인 ITO 상에 정공주입층으로 α-NPD를 100Å의 두께로 형성하되 화합물 A를 30%의 도핑농도로 도핑하였고, 정공수송층으로 α-NPD를 800Å의 두께로 형성하고, 발광층으로 호스트인 MADN에 도펀트인 BD-1을 3%의 도핑농도로 도핑하여 500Å의 두께로 형성하고, 전자수송층으로 Alq3를 350Å의 두께로 형성하고 전자주입층으로 LiF를 10Å의 두께로 형성하고, 음극으로 Al을 800Å의 두께로 순차적으로 형성하여 유기전계발광소자를 제작하였다. It was washed after patterning so that the light emitting area of the ITO glass was 3 mm × 3 mm in size. After mounting the substrate in a vacuum chamber, the base pressure was set to 1x10 -6 torr, and α-NPD was formed as a hole injection layer on the anode ITO to a thickness of 100Å, but compound A was doped with a doping concentration of 30%. As a hole transport layer, α-NPD is formed to a thickness of 800Å, and as a light emitting layer, the host MADN is doped with BD-1, a dopant, at a doping concentration of 3% to form 500Å, and Alq 3 is 350Å as an electron transport layer. And LiF as an electron injection layer to a thickness of 10Å, and Al as a cathode to a thickness of 800Å to fabricate an organic electroluminescent device.
<실시예 2><Example 2>
전술한 실시예 1과 동일한 공정 조건 하에, 화합물 B를 정공주입층에 도핑한 것만을 달리하여 유기전계발광소자를 제작하였다.Under the same process conditions as in Example 1 described above, an organic electroluminescent device was manufactured by differently only doping Compound B in the hole injection layer.
<실시예 3><Example 3>
전술한 실시예 1과 동일한 공정 조건 하에, 화합물 C를 정공주입층에 25%로 도핑한 것만을 달리하여 유기전계발광소자를 제작하였다.Under the same process conditions as in Example 1 described above, an organic electroluminescent device was manufactured by only differently doping Compound C to the hole injection layer at 25%.
<실시예 4><Example 4>
전술한 실시예 3과 동일한 공정 조건 하에, 화합물 D를 정공주입층에 도핑한 것만을 달리하여 유기전계발광소자를 제작하였다.Under the same process conditions as in Example 3 described above, an organic electroluminescent device was fabricated by only doping Compound D into the hole injection layer.
<실시예 5><Example 5>
전술한 실시예 3과 동일한 공정 조건 하에, 화합물 E를 정공주입층에 도핑한 것만을 달리하여 유기전계발광소자를 제작하였다.Under the same process conditions as in Example 3 described above, only the compound E was doped into the hole injection layer to fabricate an organic light emitting device.
<실시예 6><Example 6>
전술한 실시예 3과 동일한 공정 조건 하에, 화합물 F을 정공주입층에 도핑한 것만을 달리하여 유기전계발광소자를 제작하였다.Under the same process conditions as in Example 3 described above, only the compound F was doped into the hole injection layer to fabricate an organic light emitting device.
<비교예><Comparative Example>
전술한 실시예 1과 동일한 공정 조건 하에, 어떠한 도핑도 없이 α-NPB로 정공주입층을 형성한 것만을 달리하여 유기전계발광소자를 제작하였다.Under the same process conditions as in Example 1 described above, an organic electroluminescent device was manufactured by only differently forming the hole injection layer with α-NPB without any doping.
전술한 실시예 1, 2 및 비교예에 따라 제조된 유기전계발광소자의 구동전압, 발광효율 및 비교예 대비 구동전압 향상율을 측정하여 하기 표 1에 나타내었고, 실시예 3 내지 6 및 비교예에 따라 제조된 유기전계발광소자의 구동전압 및 및 비교예 대비 구동전압 향상율을 측정하여 하기 표 1에 나타내었다. 또한, 실시예 1, 2 및 비교예에 따라 제조된 유기전계발광소자의 전압과 전류의 상관 관계를 도 7에 나타내었고, 실시예 3 내지 6 및 비교예에 따라 제조된 유기전계발광소자의 전압과 전류의 상관 관계를 도 8에 나타내었다. (전류는 10mA/㎠로 실험한 결과 값이다.)The driving voltage, luminous efficiency, and driving voltage improvement rate compared to the comparative example of the organic electroluminescent device manufactured according to the above-described Examples 1 and 2 and Comparative Examples were measured and shown in Table 1 below, and Examples 3 to 6 and Comparative Examples The driving voltage of the organic electroluminescent device manufactured according to and the driving voltage improvement rate compared to the comparative example were measured and shown in Table 1 below. In addition, the correlation between the voltage and the current of the organic light emitting device manufactured according to Examples 1 and 2 and Comparative Example is shown in Figure 7, and the voltage of the organic light emitting device manufactured according to Examples 3 to 6 and Comparative Example The correlation between the overcurrent is shown in FIG. 8. (The current is the result of an experiment with 10mA/㎠.)
#
#
Driving voltage (V)
구동전압 향상율Compared to Comparative Example
Driving voltage improvement rate
(Cd/A)Current efficiency
(Cd/A)
(lm/W)Power efficiency
(lm/W)
상기 표 1, 도 7과 8을 참조하면, 본 발명의 실시예 1과 2는 비교예에 비해 발광효율이 향상되고 비교예 대비 구동전압이 40% 정도 향상되었다. 또한, 본 발명의 실시예 3 내지 6은 비교예 대비 구동전압이 18% 내지 38% 정도 향상되었다. Referring to Table 1 and FIGS. 7 and 8, in Examples 1 and 2 of the present invention, luminous efficiency was improved compared to the comparative example, and the driving voltage was improved by about 40% compared to the comparative example. In addition, in Examples 3 to 6 of the present invention, the driving voltage was improved by 18% to 38% compared to the comparative example.
이상 첨부된 도면을 참조하여 본 발명의 실시예를 설명하였지만, 상술한 본 발명의 기술적 구성은 본 발명이 속하는 기술 분야의 당업자가 본 발명의 그 기술적 사상이나 필수적 특징을 변경하지 않고서 다른 구체적인 형태로 실시될 수 있다는 것을 이해할 수 있을 것이다. 그러므로 이상에서 기술한 실시 예들은 모든 면에서 예시적인 것이며 한정적인 것이 아닌 것으로서 이해되어야 한다. 아울러, 본 발명의 범위는 상기 상세한 설명보다는 후술하는 특허청구범위에 의하여 나타내어진다. 또한, 특허청구범위의 의미 및 범위 그리고 그 등가 개념으로부터 도출되는 모든 변경 또는 변형된 형태가 본 발명의 범위에 포함되는 것으로 해석되어야 한다.Although the embodiments of the present invention have been described above with reference to the accompanying drawings, the technical configuration of the present invention described above is in other specific forms without changing the technical spirit or essential features of the present invention by those skilled in the art. It will be appreciated that it can be implemented. Therefore, the embodiments described above are illustrative in all respects and should be understood as non-limiting. In addition, the scope of the present invention is indicated by the claims to be described later rather than the detailed description. In addition, all changes or modifications derived from the meaning and scope of the claims and their equivalent concepts should be interpreted as being included in the scope of the present invention.
100 : 유기전계발광소자 110 : 양극
120 : 정공주입층 130 : 정공수송층
140 : 발광층 150 : 전자수송층
160 : 전자주입층 170 : 음극100: organic light emitting device 110: anode
120: hole injection layer 130: hole transport layer
140: light emitting layer 150: electron transport layer
160: electron injection layer 170: cathode
Claims (28)
An organic compound, characterized in that any one selected from the compounds shown below.
상기 화학식 3에서,
X3 내지 X6은 각각 독립적으로, 하기 g 내지 l로 표시되는 치환기에서 선택된 어느 하나이며,
Y1 및 Y2는 각각 독립적으로, 수소, 중수소, 할로겐, 시아노기, 트리플루오로메틸기, C1 내지 C20의 알킬기, 카르복실기, 카르보닐기, C1 내지 C20 의 알콕시기, C1내지 C20의 실릴기, C6 이상의 메틸 또는 불소로 치환 또는 비치환된 방향족 그룹, C5 이상의 이형고리 그룹, C1 내지 C20의 아민기, C6 이상의 방향족 그룹이 치환된 아민기, C5 이상의 이형고리 그룹이 치환된 아민기, 및 아릴기에서 선택된 어느 하나이고,
R4 내지 R9는 각각 독립적으로, 수소, 중수소, 할로겐, 시아노기, 트리플루오로메틸기, C1 내지 C20의 알킬기, 카르복실기, 카르보닐기, C1 내지 C20 의 알콕시기, C1내지 C20의 실릴기, C6 이상의 불소 치환 또는 비치환된 방향족 그룹, C5 이상의 이형고리 그룹, C1 내지 C20의 아민기, C6 이상의 방향족 그룹이 치환된 아민기, C5 이상의 이형고리 그룹이 치환된 아민기, 및 아릴기에서 선택된 어느 하나이다.
An organic compound, characterized in that represented by the following formula (3).
In Chemical Formula 3,
X 3 to X 6 are each independently any one selected from substituents represented by the following g to l,
Y 1 and Y 2 are each independently hydrogen, deuterium, halogen, cyano group, trifluoromethyl group, C1 to C20 alkyl group, carboxyl group, carbonyl group, C1 to C20 alkoxy group, C1 to C20 silyl group, C6 or more In an aromatic group substituted or unsubstituted with methyl or fluorine, a C5 or more heterocyclic group, a C1 to C20 amine group, an amine group substituted with a C6 or more aromatic group, an amine group substituted with a C5 or more heterocyclic group, and an aryl group Is any one selected,
R 4 to R 9 are each independently hydrogen, deuterium, halogen, cyano group, trifluoromethyl group, C1 to C20 alkyl group, carboxyl group, carbonyl group, C1 to C20 alkoxy group, C1 to C20 silyl group, C6 or more Fluorine-substituted or unsubstituted aromatic group, C5 or more heterocyclic group, C1 to C20 amine group, C6 or more aromatic group substituted amine group, C5 or more heterocyclic group substituted amine group, and an aryl group. .
상기 유기 화합물은 하기 화학식 4에 표시되는 화합물들에서 선택된 어느 하나인 것을 특징으로 하는 유기 화합물.
[화학식 4]
The method of claim 4,
The organic compound is an organic compound, characterized in that any one selected from the compounds represented by the following formula (4).
[Formula 4]
상기 유기 화합물은 하기 표시되는 화합물들에서 선택된 어느 하나인 것을 특징으로 하는 유기 화합물.
The method of claim 5,
The organic compound is an organic compound, characterized in that any one selected from the compounds shown below.
상기 유기막은 상기 제3 항 내지 제6 항 중 어느 한 항에 따른 유기 화합물을 포함하는 것을 특징으로 하는 유기전계발광소자.
In the organic electroluminescent device comprising a light emitting layer between an anode and a cathode, and comprising at least one organic layer between the anode and the light emitting layer,
The organic layer is an organic light emitting device comprising the organic compound according to any one of claims 3 to 6.
상기 유기막은 정공주입층, 정공수송층 및 정공버퍼층 중 선택된 어느 하나 이상인 것을 특징으로 하는 유기전계발광소자.
The method of claim 7,
The organic layer is an organic electroluminescent device, characterized in that at least one selected from a hole injection layer, a hole transport layer, and a hole buffer layer.
상기 정공주입층은 상기 유기 화합물로만 이루어진 것을 특징으로 하는 유기전계발광소자.
The method of claim 8,
The organic electroluminescent device, characterized in that the hole injection layer is made of only the organic compound.
상기 정공버퍼층은 상기 정공주입층과 상기 정공수송층 사이에 위치하며, 상기 양극에 접하는 것을 특징으로 하는 유기전계발광소자.
The method of claim 8,
The hole buffer layer is located between the hole injection layer and the hole transport layer, the organic electroluminescent device, characterized in that in contact with the anode.
상기 정공버퍼층은 상기 정공주입층과 상기 정공수송층 사이에 위치하는 것을 특징으로 하는 유기전계발광소자.
The method of claim 8,
The hole buffer layer is an organic electroluminescent device, characterized in that located between the hole injection layer and the hole transport layer.
상기 정공버퍼층은 상기 유기 화합물로만 이루어지거나, 호스트 물질과 상기 유기 화합물로 이루어진 것을 특징으로 하는 유기전계발광소자.
The method of claim 10,
The hole buffer layer is an organic electroluminescent device, characterized in that consisting of only the organic compound or a host material and the organic compound.
상기 호스트 물질은 상기 정공수송층 물질인 것을 특징으로 하는 유기전계발광소자.
The method of claim 12,
The host material is an organic light emitting device, characterized in that the hole transport layer material.
상기 정공수송층은 상기 정공주입층 상에 위치하되, 상기 정공수송층 물질과 상기 유기 화합물로 이루어진 것을 특징으로 하는 유기전계발광소자.
The method of claim 8,
The hole transport layer is located on the hole injection layer, and the organic electroluminescent device, characterized in that made of the hole transport layer material and the organic compound.
제1 발광층을 포함하는 상기 제1 스택, 제2 발광층을 포함하는 상기 제2 스택, 및 상기 제1 스택과 상기 제2 스택 사이에 위치하는 전하생성층을 포함하고,
상기 전하생성층은 N형 전하생성층과 P형 전하생성층을 포함하되,
상기 P형 전하생성층은 상기 제3 항 내지 제6 항 중 어느 한 항에 따른 유기 화합물을 포함하는 것을 특징으로 하는 유기전계발광소자.
In an organic light emitting diode device comprising a plurality of stacks formed between an anode and a cathode each including an emission layer, the plurality of stacks including at least a first stack and a second stack,
The first stack including a first emission layer, the second stack including a second emission layer, and a charge generation layer positioned between the first stack and the second stack,
The charge generation layer includes an N-type charge generation layer and a P-type charge generation layer,
The P-type charge generation layer is an organic electroluminescent device comprising the organic compound according to any one of claims 3 to 6.
상기 제1 스택은 상기 양극과 상기 제1 발광층 사이에 위치하는 적어도 하나의 유기막을 포함하되, 상기 유기막은 정공주입층, 제1 정공수송층 및 정공버퍼층 중 적어도 하나 이상인 것을 특징으로 하는 유기전계발광소자.
The method of claim 15,
The first stack includes at least one organic layer positioned between the anode and the first emission layer, wherein the organic layer is at least one of a hole injection layer, a first hole transport layer, and a hole buffer layer. .
상기 제1 스택은 제1 정공수송층을 포함하고, 상기 P형 전하생성층은 상기 유기 화합물로만 이루어지거나, 호스트 물질과 상기 유기 화합물로 이루어지는 것을 특징으로 하는 유기전계발광소자.
The method of claim 15,
The first stack includes a first hole transport layer, and the P-type charge generation layer is composed of only the organic compound or a host material and the organic compound.
상기 호스트 물질은 상기 정공수송층 물질인 것을 특징으로 하는 유기전계발광소자.
The method of claim 17,
The host material is an organic light emitting device, characterized in that the hole transport layer material.
상기 제2 스택은 상기 P형 전하생성층과 상기 제2 발광층 사이에 위치하는 제2 정공수송층을 포함하는 것을 특징으로 하는 유기전계발광소자.
The method of claim 17,
The second stack includes a second hole transport layer positioned between the P-type charge generation layer and the second emission layer.
상기 P형 전하생성층은 상기 제2 발광층과 접하는 것을 특징으로 하는 유기전계발광소자.
The method of claim 17,
The P-type charge generation layer is an organic light emitting device, characterized in that in contact with the second emission layer.
상기 정공주입층은 상기 유기 화합물로만 이루어진 것을 특징으로 하는 유기전계발광소자.
The method of claim 16,
The organic electroluminescent device, characterized in that the hole injection layer is made of only the organic compound.
상기 정공버퍼층은 상기 양극과 상기 제1 정공수송층 사이에 위치하되, 상기 양극에 접하는 것을 특징으로 하는 유기전계발광소자.
The method of claim 16,
The hole buffer layer is located between the anode and the first hole transport layer, the organic electroluminescent device, characterized in that in contact with the anode.
상기 정공버퍼층은 상기 정공주입층과 상기 제1 정공수송층 사이에 위치하는 것을 특징으로 하는 유기전계발광소자.
The method of claim 16,
The hole buffer layer is an organic electroluminescent device, characterized in that located between the hole injection layer and the first hole transport layer.
상기 정공버퍼층은 상기 유기 화합물로만 이루어지거나, 호스트 물질과 상기 유기 화합물로 이루어진 것을 특징으로 하는 유기전계발광소자.
The method of claim 22,
The hole buffer layer is an organic electroluminescent device, characterized in that consisting of only the organic compound or a host material and the organic compound.
상기 호스트 물질은 상기 제1 정공수송층 물질인 것을 특징으로 하는 유기전계발광소자.
The method of claim 24,
The host material is an organic electroluminescent device, characterized in that the first hole transport layer material.
상기 제1 정공수송층은 상기 정공주입층 상에 위치하되, 상기 제1 정공수송층 물질과 상기 유기 화합물로 이루어진 것을 특징으로 하는 유기전계발광소자.The method of claim 16,
The first hole transport layer is located on the hole injection layer, the organic electroluminescent device, characterized in that made of the first hole transport layer material and the organic compound.
상기 정공버퍼층은 상기 유기 화합물로만 이루어지거나, 호스트 물질과 상기 유기 화합물로 이루어진 것을 특징으로 하는 유기전계발광소자.
The method of claim 11,
The hole buffer layer is an organic electroluminescent device, characterized in that consisting of only the organic compound or a host material and the organic compound.
상기 정공버퍼층은 상기 유기 화합물로만 이루어지거나, 호스트 물질과 상기 유기 화합물로 이루어진 것을 특징으로 하는 유기전계발광소자.The method of claim 23,
The hole buffer layer is an organic electroluminescent device, characterized in that consisting of only the organic compound or a host material and the organic compound.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020130149384A KR102145425B1 (en) | 2013-12-03 | 2013-12-03 | Organic compounds and organic light emitting diode device comprising the same |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020130149384A KR102145425B1 (en) | 2013-12-03 | 2013-12-03 | Organic compounds and organic light emitting diode device comprising the same |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20150064794A KR20150064794A (en) | 2015-06-12 |
| KR102145425B1 true KR102145425B1 (en) | 2020-08-19 |
Family
ID=53503365
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020130149384A KR102145425B1 (en) | 2013-12-03 | 2013-12-03 | Organic compounds and organic light emitting diode device comprising the same |
Country Status (1)
| Country | Link |
|---|---|
| KR (1) | KR102145425B1 (en) |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011246395A (en) * | 2010-05-27 | 2011-12-08 | Sumitomo Chemical Co Ltd | Novel compound and light emitting element using the same |
-
2013
- 2013-12-03 KR KR1020130149384A patent/KR102145425B1/en active IP Right Grant
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011246395A (en) * | 2010-05-27 | 2011-12-08 | Sumitomo Chemical Co Ltd | Novel compound and light emitting element using the same |
Also Published As
| Publication number | Publication date |
|---|---|
| KR20150064794A (en) | 2015-06-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102679133B1 (en) | Organic Light Emitting Diode Device | |
| KR102174066B1 (en) | Organic compounds and organic light emitting diode device comprising the same | |
| KR102523099B1 (en) | Organic light emitting device | |
| KR102268119B1 (en) | Pyrene compound and organic light emitting diode device comprising the same | |
| EP2296204B1 (en) | Light-emitting element | |
| KR102644910B1 (en) | Organic Light Emitting Diode Device | |
| KR102525492B1 (en) | Organic light emitting device | |
| EP3176844B1 (en) | Organic light emitting display device | |
| WO2014087657A1 (en) | Aromatic amine derivative and organic electroluminescent element | |
| KR102169515B1 (en) | Quinone derivatives and organic light emitting diode device comprising the same | |
| KR102517937B1 (en) | Organic light emitting device | |
| KR102152013B1 (en) | Organic light emitting diode device comprising organic compounds | |
| JP5640460B2 (en) | Light emitting device and light emitting device material | |
| WO2014024750A1 (en) | Light emitting element material and light emitting element | |
| JP2020123477A (en) | Light-emitting element, display device and illumination apparatus | |
| KR102242870B1 (en) | Heterocyclic compounds and organic light emitting diode device comprising the same | |
| KR102181332B1 (en) | Heterocyclic compounds and organic light emitting diode device comprising the same | |
| KR102181311B1 (en) | Organic compounds and organic light emitting diode device comprising the same | |
| KR102175791B1 (en) | Organic compounds and organic light emitting diode device comprising the same | |
| KR102145425B1 (en) | Organic compounds and organic light emitting diode device comprising the same | |
| KR102228323B1 (en) | Compound and organic light emitting device comprising the same | |
| WO2014007022A1 (en) | Light emitting element material and light emitting element |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant |