KR102044676B1 - 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법 - Google Patents
생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법 Download PDFInfo
- Publication number
- KR102044676B1 KR102044676B1 KR1020190035355A KR20190035355A KR102044676B1 KR 102044676 B1 KR102044676 B1 KR 102044676B1 KR 1020190035355 A KR1020190035355 A KR 1020190035355A KR 20190035355 A KR20190035355 A KR 20190035355A KR 102044676 B1 KR102044676 B1 KR 102044676B1
- Authority
- KR
- South Korea
- Prior art keywords
- apixaban
- microspheres
- biocompatible polymer
- acid
- present
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1682—Processes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/437—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a five-membered ring having nitrogen as a ring hetero atom, e.g. indolizine, beta-carboline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/4545—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring hetero atom, e.g. pipamperone, anabasine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1617—Organic compounds, e.g. phospholipids, fats
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1641—Organic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, poloxamers
- A61K9/1647—Polyesters, e.g. poly(lactide-co-glycolide)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1682—Processes
- A61K9/1694—Processes resulting in granules or microspheres of the matrix type containing more than 5% of excipient
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Dermatology (AREA)
- Medicinal Preparation (AREA)
- Manufacturing Of Micro-Capsules (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Materials For Medical Uses (AREA)
Abstract
본 발명은 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법에 관한 것으로, 구체적으로 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법에 있어서 i) 지방산 또는 트리글리세라이드를 분산상에 첨가하는 단계; 및 ii) 미세유체법으로 미립구를 제조하는 단계를 포함하는 것인 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법에 관한 것이다.
본 발명의 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법은 고함량의 아픽사반이 안정적으로 봉입된 미립구 제조에 유용하게 이용될 수 있다.
본 발명의 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법은 고함량의 아픽사반이 안정적으로 봉입된 미립구 제조에 유용하게 이용될 수 있다.
Description
본 발명은 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법에 관한 것으로, 구체적으로 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법에 있어서, i) 지방산 또는 트리글리세라이드를 분산상에 첨가하는 단계; 및 ii) 미세유체법으로 아픽사반 함유 미립구를 제조하는 단계를 포함하는 것인 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법에 관한 것이다.
아픽사반(Apixaban)은 혈액응고단계에서 Xa 응고인자를 선택적으로 저해하여 혈전의 생성 및 혈액 응고를 방지하는 의약품으로써, 고관절 또는 슬관절 치환술을 받은 성인 환자에서 정맥혈전색전증의 예방, 비판막성 심방세동 환자에서 뇌졸중 및 전신 색전증의 위험 감소, 심재성 정맥혈전증 및 폐색전증의 치료 및 재발 위험 감소의 목적으로 경구 투여되고 있다.
그러나, 아픽사반을 경구 투여할 경우 아픽사반의 낮은 수용성에 의하여 체내 흡수가 저해되며, 이에 50% 정도의 생체이용률을 나타내는 것으로 알려져 있다. 또한, 경구로 투여되는 NOAC(Non-vitamin K antagonist oral anticoagulants)인 아픽사반의 경우, 1) 전신적 항응고 효과, 2) 국소적 항응고 효과, 3) 국소적 직접 부식성 작용, 4) 응고와 관련 없는 국소적 생물학적 작용 등의 기전이 복합되어서 위장관 출혈을 발생시키거나, 경구 섭취 후 아픽사반의 항응고 작용을 하는 활성 형태가 장관내에 존재하므로 장관내 다양한 병변에서 출혈을 일으킬 수 있다. 이에, 아픽사반의 낮은 생체이용율을 극복하고 위장관 출혈을 감소시키기 위한 새로운 투여경로의 모색이 필요한 실정이다.
기존 경구로 투여되는 의약품의 신규 투여 경로 모색과 관련하여, 생체적합성 고분자 기반의 미립구는 대표적인 근육 또는 피하 주사 제형으로써, 약물을 내부에 봉입할 수 있으며, 체내에 주입 후 서서히 완전 분해되어 약물을 100% 방출함으로써 체내 유효 약물 농도를 장기간 유지할 수 있도록 하는 장점을 가진다. 이에, 아픽사반을 상기 생체적합성 고분자 기반의 미립구로 제조하는 경우, 아픽사반의 투여 경로를 기존 경구 투여에서 근육 또는 피하 주사로 변경할 수 있으며, 낮은 생체이용율을 개선시킬 수 있을 것으로 기대된다.
미립구의 제조방법으로는 i) 용매증발법(Solvent evaporation method), ii) 분무건조법(Spray drying method), iii) 용매추출법(Solvent extraction method), iv) 미세유체법(Microfluidic method) 이 알려져 있으나(Biomaterials, 1989, 10(8) 557-563; Journal of microencapsulation, 2004, 21(2) 203-211; Journal of Controlled Release, 1997, 47(3) 233-245; Journal of Bioactive and Compatible Polymers, 2014, 29(4) 318-329), 현재까지 아픽사판은 상기 제조방법을 이용하여 미립구 제형으로 개발된 사례가 없으며, 아픽사반 함유 미립구의 제조방법에 대해서도 알려진 바가 없다.
이러한 배경하에, 본 발명자들은 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법을 개발하고자 예의 노력 연구한 결과, 지방산 또는 트리글리세라이드를 분산상에 첨가하고, 미세유체법으로 미립구를 제조하는 경우, 고함량의 아픽사반이 안정적으로 봉입된 미립구를 제조할 수 있음을 확인하여, 본 발명을 완성하였다.
본 발명의 하나의 목적은 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법에 있어서 i) 지방산 또는 트리글리세라이드를 분산상에 첨가하는 단계; 및 ii) 미세유체법으로 미립구를 제조하는 단계를 포함하는 것인 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법을 제공하는 것이다.
상기 목적을 달성하기 위하여, 본 발명의 하나의 양태는 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법에 있어서 i) 지방산 또는 트리글리세라이드를 분산상에 첨가하는 단계; 및 ii) 미세유체법으로 미립구를 제조하는 단계를 포함하는 것인 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법을 제공한다.
본 발명의 용어, "아픽사반(apixaban)"은 하기 화학식 1의 구조를 갖는 화합물을 의미한다. 아픽사반은 구조 내에 3개의 아미드를 가지고 있으며, 아미드 고유의 극성(dipole)구조를 갖는다. 따라서, 아픽사반은 N-H…O로 구성되는 분자간 수소결합을 형성할 수 있고, 이에 따라 양성자를 제공하는 물질(Proton donor)또는 양성자를 받는 물질(Proton accepter)이 존재할 경우 적절한 용매에서 공침전물을 형성할 수 있으며, 아픽사반 분자간 수소결합을 형성할 수도 있기 때문에 아픽사반만 용해하더라도 일정 시간이 경과하면 결정을 형성한다.
[화학식 1]
상기와 같은 약물 결정 현상은 미립구 내 약물의 함량을 현저하게 감소시킬 뿐만 아니라, 미립구 제조 과정 중 생성되는 약물 결정을 약물이 봉입된 미립구와 완벽히 분리하여 제거할 방법이 없으므로, 미립구 제조 시 약물의 결정 석출 현상을 방지할 필요가 있다.
아픽사반과 같은 소수성 약물은 일반적으로 미립구 제조 과정 중 석출되어 결정을 형성하는 경향을 나타내며, 이러한 경우 고농도/고점도의 고분자 용액을 이용하거나, 약물의 첨가량을 감소시키거나, 유기용매의 종류를 변경하거나, 용매의 휘발 온도를 감소시키는 방법으로 결정의 석출을 방지한다. 이러한 방법을 적용하는 것은 약물이 물과 접촉하는 확률을 줄이고 고분자가 경화되는 속도를 조절함으로써, 미립구 내 약물이 물리적으로 봉입되도록 하기 위함이다.
아픽사반의 1일 권장량 및 미립구로부터 약물의 총 방출 기간을 감안할 때, 미립구의 높은 약물 함량 기준은 아픽사반 서방출형 미립구 개발에 있어서 필수적으로 고려되어야 한다. 따라서, 미립구 내 약물 함량을 현저히 감소시키는, 약물의 첨가량을 감소시키거나, 고농도의 고분자 용액을 이용하는 방법은 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조에 적용하는데 어려움이 있다.
또한, 유기용매의 종류를 변경하거나, 용매의 휘발 온도를 감소시키는 방법은, 아픽사반이 대부분의 휘발성 비할로겐 유기용매에 대한 용해도가 극히 제한적이며, 용매의 완전 제거에 대한 잔류용매 문제가 있어 아픽사반 함유 미립구의 제조에 적용하기 적합하지 않다.
이에, 아픽사반은 지금까지 미립구로 개발된 사례가 없으며, 아픽사반 함유 미립구의 제조방법에 대해서도 알려진 바가 없으므로, 본 발명자들에 의해 최초로 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법이 개발되었다는 점에서 그 의의가 매우 크다고 할 수 있다.
본 발명에 있어서, 상기 아픽사반은 아픽사반의 약제학적으로 허용가능한 염을 포함한다.
본 발명의 용어, "약제학적으로 허용 가능한 염"은 양이온과 음이온이 정전기적 인력에 의해 결합하고 있는 물질인 염 중에서도 약제학적으로 사용될 수 있는 형태의 염을 의미하며, 통상적으로 금속염, 유기염기와의 염, 무기산과의 염, 유기산과의 염, 염기성 또는 산성 아미노산과의 염 등이 될 수 있다. 예를 들어, 금속염으로는 알칼리 금속염(나트륨염, 칼륨염 등), 알칼리 토금속염(칼슘염, 마그네슘염, 바륨염 등), 알루미늄염 등이 될 수 있고; 유기염기와의 염으로는 트리에틸아민, 피리딘, 피콜린, 2,6-루티딘, 에탄올아민, 디에탄올아민, 트리에탄올아민, 시클로헥실아민, 디시클로헥실아민, N,N-디벤질에틸렌디아민 등과의 염이 될 수 있으며; 무기산과의 염으로는 염산, 브롬화수소산, 질산, 황산, 인산 등과의 염이 될 수 있고; 유기산과의 염으로는 포름산, 아세트산, 트리플루오로아세트산, 프탈산, 푸마르산, 옥살산, 타르타르산, 말레인산, 시트르산, 숙신산, 메탄술폰산, 벤젠술폰산, p-톨루엔술폰산 등과의 염이 될 수 있으며; 염기성 아미노산과의 염으로는 아르기닌, 라이신, 오르니틴 등과의 염이 될 수 있고; 산성 아미노산과의 염으로는 아스파르트산, 글루탐산 등과의 염이 될 수 있다.
본 발명의 용어, "생체적합성 고분자 기반 아픽사반 함유 미립구"는 생체적합성 고분자를 이용하여 제조된 미립구 내에 아픽사반이 봉입된 것을 의미하며, 본 명세서에서 단순히 아픽사반 함유 미립구, 아픽사반 미립구 또는 미립구 등으로 지칭되기도 한다. 생체적합성 고분자를 이용하여 제조된 미립구 내에 아픽사반이 봉입된 것이라면, 이용한 생체적합성 고분자의 종류 등에 제한 없이 모두 본 발명의 범위에 속한다.
본 발명의 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법은 지방산 또는 트리글리세라이드를 분산상에 첨가하는 단계를 포함한다.
본 발명에서 상기 지방산 또는 트리글리세라이드는, 본 발명의 효과에 영향을 주지 않는 한 i) 의약학적으로 허용가능하고, ii) 아픽사반과 수소결합을 형성할 수 있는 작용기를 가지며, iii) 할로겐 유기용매에 대한 용해도가 높으면 그 제한 없이 사용될 수 있다.
본 발명의 용어, "지방산(fatty acid)"은 포화 또는 불포화 지방족 사슬 및 하나 이상의 카르복실기를 가지는 화합물을 의미한다. 지방산은 i) 의약학적으로 허용가능하고, ii) 아픽사반과 수소결합을 형성할 수 있는 카르복실기를 가지며, iii) 할로겐 유기용매에 대한 용해도가 높으므로, 본 발명에 사용될 수 있다. 구체적으로, 상기 지방산은 미립구 제조 시 유기용매를 휘발하기 위한 최저 온도인 35℃ 이상의 녹는점을 가지는, 하나 이상의 카르복실기를 가지는 탄소수 12 내지 18의 지방산일 수 있으며, 보다 구체적으로 스테아르산(stearic acid), 팔미트산(palmitic acid), 라우르산(lauric acid) 또는 이들의 조합일 수 있으며, 보다 더 구체적으로 스테아르산 또는 라우르산일 수 있으나, 이에 제한되는 것은 아니다.
본 발명의 용어, "트리글리세라이드(triglyceride)"는 지방산 3개가 글리세롤과 에스터(ester) 결합으로 형성된 화합물을 의미한다. 트리글리세라이드는 i) 의약학적으로 허용가능하고, ii) 아픽사반과 수소결합을 형성할 수 있는 에스터기를 가지며, iii) 할로겐 유기용매에 대한 용해도가 높으므로, 본 발명에 사용될 수 있다. 구체적으로, 상기 트리글리세라이드는 상온에서 고체 형태로 존재하는, 탄소수 10 이상의 지방산 3개와 글리세롤이 에스터 결합으로 형성된 것일 수 있으며, 보다 구체적으로 글리세릴트리데카노에이트(glyceryl tridecanoate), 글리세릴트리운데카노에이트(glyceryl triundecanoate), 글리세릴트리도데카노에이트(glyceryl tridodecanoate), 글리세릴트리미리스테이트(glyceryl trimyristate), 글리세릴트리팔미테이트(glyceryl tripalmitate) 또는 글리세릴트리스테아레이트(glyceryl tristearate)일 수 있으며, 보다 더 구체적으로 미립구 제조 시 유기용매를 휘발하기 위한 최저 온도인 35℃ 이상의 녹는점을 가지는 글리세릴트리도데카노에이트(glyceryl tridodecanoate)일 수 있으나, 이에 제한되지 않는다.
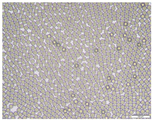
본 발명의 구체적인 일 실시예에서는, 지방산 또는 트리글리세라이드를 첨가하지 않은 일반적인 분산상을 이용하여 아픽사반을 포함하는 미립구를 제조하는 경우, 아픽사반이 빠르게 수상으로 석출되어 침상의 결정을 형성하여 미립구를 제조할 수 없음을 확인하였다(도 4 및 5).
본 발명의 용어, "분산상(dispersion phase)"은 유중수형(water in oil) 미립구의 경우, 내부 수상(Water phase)을 구성하기 위한 조성물, 수중유형(Oil in water) 미립구의 경우, 내부 유상(Oil phase)를 구성하기 위한 조성물, 수중유중수형(Water in oil in water) 미립구의 경우, 내부 1차 유중수상(Water in oil emulsion 또는 Primary emulsion)을 구성하기 위한 조성물로써, 미립구 제조용 조성물 중 외부상(Outer phase)을 제외한 내부상 (inner phase), 즉 약물과 고분자가 용해 또는 분산된 형태의 혼합물을 의미한다.
본 발명에 있어서, 상기 분산상은 생체적합성 고분자 및 할로겐 유기용매를 포함하는 것일 수 있다.
본 발명의 용어, "생체적합성 고분자(biocompatible polymer)"는 생체 내에 투여하였을 때 높은 세포독성 및 염증반응 등을 유발하지 않는 생체 내 안전성이 확보된 고분자를 의미하며, 본 명세서에서 단순히 고분자로 지칭되기도 한다.
본 발명에서 사용되는 생체적합성 고분자는 구체적으로 폴리에스터(Polyester)일 수 있으며, 보다 구체적으로 폴리에스터는 폴리락틱-코-글리코산(polylactic-co-glico acid; PLGA), 폴리락트산(polylactic acid; PLA) 및 폴리카프로락톤(polycaprolactone; PCL)으로 이루어진 군으로부터 선택된 어느 하나 이상일 수 있으나, 이에 제한되는 것은 아니다.
본 발명의 용어, "할로겐 유기용매"는 F, Cl, Br 또는 I와 같은 할로겐족 원소를 포함하는 유기용매를 의미한다. 아픽사반의 경우 다른 일반적인 소수성 약물과는 달리, 비할로겐 유기용매에 대한 용해도가 매우 낮아 비할로겐 유기용매는 아픽사반 함유 미립구의 제조에 사용할 수 없다.
본 발명에서 상기 할로겐 유기용매는 본 발명의 효과에 영향을 주지 않는 한 미립구 제조에 사용될 수 있으면 그 종류에 제한이 없다. 구체적으로, 상기 할로겐 유기용매는 디클로로메탄(CH2Cl2), 클로로폼(CHCl3), 카본 테트라클로라이드(CCl4)일 수 있으며, 보다 구체적으로 디클로로메탄일 수 있으나, 이에 제한되는 것은 아니다.
본 발명의 구체적인 일 실시예에서는, 아픽사반은 비할로겐 유기용매인 에틸아세테이트, 에틸포르메이트, 메틸프로피오네이트 및 에탄올에 용해되지 않아 아픽사반을 포함하는 미립구 제조에 비할로겐 유기용매는 사용할 수 없음을 확인하였으며(도 1), 할로겐 유기용매인 디클로로메탄에는 아픽사반이 일시적으로 용해되어 아픽사반 함유 미립구 제조에 할로겐 유기용매를 사용하여야 함을 확인하였다(도 2 및 3).
본 발명에 있어서, 상기 분산상은 아픽사반 또는 이의 약제학적으로 허용되는 염을 생체적합성 고분자 대비 10 내지 50 중량%로 포함하는 것일 수 있으나, 이에 제한되는 것은 아니다.
아픽사반 또는 이의 약제학적으로 허용되는 염을 생체적합성 고분자 대비 10 중량% 미만으로 포함하는 경우, 미립구 내 아픽사반 함량이 적어 임상적으로 사용하기 힘들며, 아픽사반 또는 이의 약제학적으로 허용되는 염을 생체적합성 고분자 대비 50 중량% 초과로 포함되는 경우, 미립구로부터 아픽사반의 초기 약물 방출을 억제하기 힘들다.
본 발명에 있어서, 상기 분산상은 지방산 또는 트리글리세라이드를 생체적합성 고분자 대비 50 중량% 이하로 포함하는 것일 수 있으나, 이에 제한되는 것은 아니다.
지방산 또는 트리글리세라이드를 생체적합성 고분자 대비 50 중량% 초과로 포함하는 경우, 미립구 제조 시 미립구의 경도가 저하되어 구형이 아닌 미립자가 제조될 수 있으며, 미립구의 경도 저하 및 형태 불균일성은 물리화학적 안정성 저하 및 용출율 변화 등의 품질 문제를 야기할 수 있다.
본 발명에 있어서, 상기 분산상은 생체적합성 고분자를 할로겐 유기용매 대비 5 내지 30w/v%로 포함하는 것일 수 있으나, 이에 제한되는 것은 아니다.
생체적합성 고분자를 할로겐 유기용매 대비 5 w/v% 미만으로 포함하며, 미립구 제조방법으로 미세유체법(Microfluidic method)를 이용하였을 경우, 동일양의 고분자를 이용하기 위한 조성물의 부피가 증가하여 주입시간이 길어지고, 점도가 떨어져 약물의 봉입이 효율적이지 않으며, 미립구의 경화(유기용매의 휘발)가 효율적이지 않다. 반면, 생체적합성 고분자를 할로겐 유기용매 대비 30 w/v% 초과로 포함하는 경우, 점도가 지나치게 높아져 미립구 제조에 한계가 있다.
본 발명의 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법은 미세유체법으로 미립구를 제조하는 단계를 포함한다.
본 발명자들은 기존에 알려진 미립구 제조방법인 용매증발법(Solvent evaporation method), 분무건조법(Spray drying method), 용매추출법(Solvent extraction method), 미세유체법(Microfluidic method)으로 아픽사반 함유 미립구의 제조가 가능한지 여부를 확인하였다.
본 발명의 구체적인 일 실시예에서는, 비할로겐 유기용매인 에틸아세테이트, 에틸포르메이트, 메틸프로피오네이트 및 에탄올에 대한 아픽사반의 용해도가 매우 낮은 반면(도 1), 할로겐 유기용매인 디클로로메탄에 대한 아픽사반의 용해도가 매우 높은 것을 확인하였다(도 2 및 3).
이로부터, 미립구 제조 시 주로 상기 4종의 비할로겐 유기용매를 사용하는 분무건조법과 용매추출법으로는 아픽사반 함유 미립구를 제조할 수 없으며, 미립구 제조 시 주로 상기 할로겐 유기용매를 사용하는 용매증발법 또는 미체유체법으로 아픽사반 함유 미립구를 제조하여야 함을 알 수 있었다.
본 발명의 구체적인 일 실시예에서는, 지방산 또는 트리글리세라이드를 첨가하지 않은 일반적인 분산상을 이용하여 아픽사반 함유 미립구를 제조하는 경우, 용매증발법과 미세유체법 모두에서 분산상(Dispersion phase)으로부터 형성된 액적(Oil phase)의 수상(Water phase) 분산을 시작함과 동시에 아픽사반이 빠르게 수상으로 석출되어 침상의 결정을 형성하는 것을 확인하였다(도 4 및 5).
이로부터, 일반적인 분산상과 용매증발법, 일반적인 분산상과 미세유체법으로는 생체적합성 고분자 기반 아픽사반 함유 미립구를 제조할 수 없음을 알 수 있었다.
본 발명의 구체적인 일 실시예에서는, 지방산 또는 트리글리세라이드를 첨가한 분산상을 이용하여 용매증발법으로 아픽사반 함유 미립구를 제조하는 경우, 분산을 시작함과 동시에 아픽사반이 빠르게 수상으로 석출되어 침상의 결정을 형성하는 것을 확인하였다(도 6).
이로부터, 분산상에 지방산 또는 트리글리세라이드를 첨가하더라도 용매증발법으로는 생체적합성 고분자 기반 아픽사반 함유 미립구를 제조할 수 없음을 알 수 있었다.
본 발명의 구체적인 일 실시예에서는, 지방산 또는 트리글리세라이드를 첨가한 분산상을 이용하여 미세유체법으로 아픽사반 함유 미립구를 제조하는 경우, 생체적합성 고분자 기반 아픽사반 함유 미립구를 수득할 수 있으며, 약물도 석출되지 않음을 확인하였다.
이로부터, 분산상에 지방산 또는 트리글리세라이드를 첨가하고 미세유체법으로 미립구를 제조하는 경우에만 생체적합성 고분자 기반 아픽사반 함유 미립구를 제조할 수 있음을 알 수 있었다.
본 발명의 생체적합성 고분자 기반 미립구는 5 내지 30 중량%의 아픽사반을 포함하는 것일 수 있다. 구체적으로, 5 내지 30 중량%, 8 내지 28 중량%, 10 내지 25 중량%, 12 내지 22 중량%, 보다 구체적으로 15 내지 20 중량%의 아픽사반을 포함하는 것일 수 있으나, 이에 제한되는 것은 아니다.
본 발명의 구체적인 일 실시예에서는, 본 발명이 제공하는 실시예 1 내지 6의 미립구가 15 내지 20 중량%, 고함량의 아픽사반을 포함하는 것을 확인하였다(표 2).
본 발명에 있어서, 상기 미세유체법의 구체적인 조건, 예를 들어 분산상 및 수상의 주입 유속, 교반 속도, 수상으로 사용되는 용액의 종류 등은 당업자가 적절히 선택할 수 있으며, 아픽사반을 포함하는 미립구를 제조할 수 있으면 구체적인 조건에 제한 없이 모두 본 발명의 범위에 포함된다.
본 발명의 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법은 미세유체법으로 미립구를 제조하는 단계 이후, 일반적인 미립구의 세척 공정 및 건조 공정을 추가로 포함할 수 있다. 구체적으로, 제조된 미립구를 여과하여 수득하고 물로 세척하는 단계, 세척된 미립구를 동결건조 또는 감압건조 하는 단계를 추가로 포함할 수 있으나, 이에 제한되는 것은 아니다.
본 발명의 다른 하나의 양태는 상기 제조방법으로 제조된 아픽사반 생체적합성 고분자 기반 아픽사반 함유 미립구를 제공한다.
본 발명의 생체적합성 고분자 기반 아픽사반함유 미립구의 제조방법은 고함량의 아픽사반이 안정적으로 봉입된 미립구 제조에 유용하게 이용될 수 있다.
도 1은 비할로겐 유기용매인 에틸아세테이트, 에틸포르메이트, 메틸프로피오네이트 및 에탄올에 아픽사반을 첨가하고 교반한 후를 디지털 카메라로 촬영한 사진이다.
도 2는 할로겐 유기용매인 디클로로메탄에 아픽사반 용해 후 즉시 및 12시간 경과 시를 디지털 카메라로 촬영한 사진이다.
도 3은 할로겐 유기용매인 디클로로메탄에 아픽사반 용해 후 12시간 경과 시 형성된 결정을 광학현미경으로 촬영한 사진이다.
도 4는 실험예 3-1에서 제조한 아픽사반 함유 미립구(비교예 1)를 광학현미경으로 촬영한 사진이다.
도 5는 실험예 3-2에서 제조한 아픽사반 함유 미립구(비교예 2)를 광학현미경으로 촬영한 사진이다.
도 6은 실험예 4에서 제조한 아픽사반 함유 미립구(비교예 3)를 광학현미경으로 촬영한 사진이다.
도 7은 실험예 5-1에서 제조한 아픽사반 함유 미립구(실시예 1)를 광학현미경으로 촬영한 사진이다.
도 8은 실험예 5-2에서 제조한 아픽사반 함유 미립구(실시예 2)를 광학현미경으로 촬영한 사진이다.
도 9은 실험예 5-3에서 제조한 아픽사반 함유 미립구(실시예 3)를 광학현미경으로 촬영한 사진이다.
도 10는 실험예 5-4에서 제조한 아픽사반 함유 미립구(실시예 4)를 광학현미경으로 촬영한 사진이다.
도 11은 실험예 5-5에서 제조한 아픽사반 함유 미립구(실시예 5)를 광학현미경으로 촬영한 사진이다.
도 12은 실험예 5-6에서 제조한 아픽사반 함유 미립구(실시예 6)를 광학현미경으로 촬영한 사진이다.
도 13은 실험예 5-7에서 제조한 아픽사반 함유 미립구(실시예 7)를 광학현미경으로 촬영한 사진이다.
도 2는 할로겐 유기용매인 디클로로메탄에 아픽사반 용해 후 즉시 및 12시간 경과 시를 디지털 카메라로 촬영한 사진이다.
도 3은 할로겐 유기용매인 디클로로메탄에 아픽사반 용해 후 12시간 경과 시 형성된 결정을 광학현미경으로 촬영한 사진이다.
도 4는 실험예 3-1에서 제조한 아픽사반 함유 미립구(비교예 1)를 광학현미경으로 촬영한 사진이다.
도 5는 실험예 3-2에서 제조한 아픽사반 함유 미립구(비교예 2)를 광학현미경으로 촬영한 사진이다.
도 6은 실험예 4에서 제조한 아픽사반 함유 미립구(비교예 3)를 광학현미경으로 촬영한 사진이다.
도 7은 실험예 5-1에서 제조한 아픽사반 함유 미립구(실시예 1)를 광학현미경으로 촬영한 사진이다.
도 8은 실험예 5-2에서 제조한 아픽사반 함유 미립구(실시예 2)를 광학현미경으로 촬영한 사진이다.
도 9은 실험예 5-3에서 제조한 아픽사반 함유 미립구(실시예 3)를 광학현미경으로 촬영한 사진이다.
도 10는 실험예 5-4에서 제조한 아픽사반 함유 미립구(실시예 4)를 광학현미경으로 촬영한 사진이다.
도 11은 실험예 5-5에서 제조한 아픽사반 함유 미립구(실시예 5)를 광학현미경으로 촬영한 사진이다.
도 12은 실험예 5-6에서 제조한 아픽사반 함유 미립구(실시예 6)를 광학현미경으로 촬영한 사진이다.
도 13은 실험예 5-7에서 제조한 아픽사반 함유 미립구(실시예 7)를 광학현미경으로 촬영한 사진이다.
이하, 하기 실시예에 의하여 본 발명을 더욱 상세하게 설명하고자 한다. 단, 하기 실시예는 본 발명을 예시하기 위한 것일 뿐 본 발명의 범위가 이들만으로 한정되는 것은 아니다.
실험예 1. 비할로겐 유기용매에서의 아픽사반 용해
에틸아세테이트, 에틸포르메이트, 메틸프로피오네이트 및 에탄올 각 1mL에 아픽사반 25mg을 넣고 교반하였다. 그 결과, 도 1에 나타낸 바와 같이, 아픽사반은 상기 4 종의 유기용매에 용해되지 않음을 확인하였다.
이로부터, 비할로겐 유기용매에 대한 아픽사반의 용해도가 매우 낮아, 미립구 제조 시 주로 상기 4종의 용매를 사용하는 분무건조법과 용매추출법으로는 아픽사반 함유 미립구를 제조할 수 없음을 알 수 있었다.
실험예 2. 할로겐 유기용매에서의 아픽사반 용해
25mg의 아픽사반을 1mL의 디클로로메탄에 용해하고 12시간 후에 사진 촬영하였다. 그 결과, 도 2에 나타낸 바와 같이, 아픽사반은 디클로로메탄에서 결정을 형성하는 것을 확인하였다.
또한, 상기 결정을 광학현미경으로 촬영한 결과, 도 3에 나타낸 바와 같이, 침상 구조를 형성하는 것을 관찰하였다.
이로부터, 아픽사반이 일시적으로 디클로로메탄에 용해되더라도 시간이 경과하면, 그 자체의 결정성이 높아 용매 내에서 재결정된다는 것을 알 수 있었다.
실험예 3. 일반적인 분산상을 이용한 아픽사반 함유 미립구의 제조
실험예 3-1. 용매증발법을 이용한 아픽사반 함유 미립구의 제조(비교예 1)
25mg의 아픽사반 및 100mg의 PLA R202H를 1mL의 디클로로메탄에 동시에 용해하여 분산상을 제조한 후 1,500rpm으로 교반되고 있는 High shear mixer (Silverson, L5M-A)를 이용하여 1% 폴리비닐알코올(poly vinyl alcohol; PVA) 용액에 분산하였다. 이때, 도 4에 나타낸 바와 같이, 분산을 시작함과 동시에 아픽사반은 빠르게 수상으로 석출되어 침상의 결정을 형성하였다.
이로부터, 일반적인 분산상 및 용매증발법을 이용할 경우 아픽사반 함유 미립구를 제조할 수 없음을 알 수 있었다.
실험예 3-2. 미세유체법을 이용한 아픽사반 함유 미립구의 제조(비교예 2)
25mg의 아픽사반과 100mg의 PLA R202H를 1mL의 디클로로메탄에 동시에 용해하여 분산상을 제조한 후 0.01mL/min의 유속으로 미세유체 칩(Microfluidic chip; Dolomite, 3D focusing hydrophilic chip)에 주입하였다. 이때, 수상은 1% PVA용액을 이용하였으며, 0.1mL/min의 유속으로 분산상과 동시에 주입하였고, 미세유체 칩(Microfluidic chip) 내부에서 형성된 액적을 150rpm으로 교반되고 있는 1% PVA 용액에 수득하였다. 수득된 미립구 액적을 광학현미경으로 관찰한 결과, 도 5에 나타낸 바와 같이, 다량의 침상 결정이 형성됨을 확인하였다.
이로부터, 일반적인 분산상 및 미세유체법을 이용할 경우 아픽사반 함유 미립구를 제조할 수 없음을 알 수 있었다.
상기 과정으로부터 얻어진 침상의 약물 결정 및 미립구의 혼합물로부터 75㎛ mesh sieve를 이용하여 3회 물로 세척하면서 최대한 약물 결정을 제거함으로써 상기 혼합물로부터 미립구를 최대한 분리하였으며, 분리된 미립구를 멤브레인 필터(membrane filter)를 이용하여 재수득하고 2일간 동결건조 하여 건조된 형태의 미립구를 수득하였다.
실험예 4. 용매증발법을 이용한 아픽사반 함유 미립구의 제조 (비교예 3)
25mg의 아픽사반, 100mg의 PLA R202H 및 25mg의 스테아르산을 1mL의 디클로로메탄에 동시에 용해하여 분산상을 제조한 후 1,500rpm으로 교반되고 있는 High shear mixer (Silverson, L5M-A)를 이용하여 1% 폴리비닐알코올(poly vinyl alcohol; PVA) 용액에 분산하였다. 이때, 도 6에 나타낸 바와 같이, 분산을 시작함과 동시에 아픽사반은 빠르게 수상으로 석출되어 침상의 결정을 형성하였다.
이로부터, 분산상에 지방산 또는 트리글리세라이드를 첨가하더라도 용매증발법을 이용할 경우 아픽사반 함유 미립구를 제조할 수 없음을 알 수 있었다.
실험예 5. 본 발명의 제조방법을 이용한 아픽사반 함유 미립구의 제조
실험예 5-1. 아픽사반 함유 미립구의 제조(실시예 1)
25mg의 아픽사반, 100mg의 PLA R202H 및 25mg의 스테아르산을 1mL의 디클로로메탄에 동시에 용해하여 분산상을 제조한 후 0.01mL/min의 유속으로 미세유체 칩(Microfluidic chip; Dolomite, 3D focusing hydrophilic chip)에 주입하였다. 이때, 수상은 1% PVA용액을 이용하였으며, 0.1mL/min의 유속으로 분산상과 동시에 주입하였고, 미세유체 칩 내부에서 형성된 액적을 150rpm으로 교반되고 있는 1% PVA 용액에 수득하였다. 수득된 미립구 액적을 광학현미경으로 관찰한 결과, 도 7에 나타낸 바와 같이, 미립구 액적으로부터 석출된 약물이 관찰되지 않았다.
상기 미립구 액적을 35℃의 조건에서 추가적으로 2시간 동안 교반하면서 유기용매를 휘발하였으며, 유기용매가 제거된 후 멤브레인 필터(membrane filter)를 이용하여 경화된 미립구를 수득하고 2일간 동결건조하여 건조된 형태의 미립구를 수득하였다.
실험예 5-2. 아픽사반 함유 미립구의 제조(실시예 2)
25mg의 아픽사반, 100mg의 PLGA RG753H 및 25mg의 스테아르산을 1mL의 디클로로메탄에 동시에 용해하여 분산상을 제조한 후 0.01mL/min의 유속으로 미세유체 칩(Microfluidic chip; Dolomite, 3D focusing hydrophilic chip)에 주입하였다. 이때, 수상은 1% PVA용액을 이용하였으며, 0.1mL/min의 유속으로 분산상과 동시에 주입하였고, 미세유체 칩 내부에서 형성된 액적을 150rpm으로 교반되고 있는 1% PVA 용액에 수득하였다. 수득된 미립구 액적을 광학현미경으로 관찰한 결과, 도 8에 나타낸 바와 같이, 미립구 액적으로부터 석출된 약물이 관찰되지 않았다.
상기 미립구 액적을 35℃의 조건에서 추가적으로 2시간 동안 교반하면서 유기용매를 휘발하였으며, 유기용매가 제거된 후 멤브레인 필터(membrane filter)를 이용하여 경화된 미립구를 수득하고 2일간 동결건조하여 건조된 형태의 미립구를 수득하였다.
실험예 5-3. 아픽사반 함유 미립구의 제조(실시예 3)
25mg의 아픽사반, 100mg의 PLGA RG503H 및25mg의 스테아르산을 1mL의 디클로로메탄에 동시에 용해하여 분산상을 제조한 후 0.01mL/min의 유속으로 미세유체 칩(Microfluidic chip; Dolomite, 3D focusing hydrophilic chip)에 주입하였다. 이때, 수상은 1% PVA용액을 이용하였으며, 0.1mL/min의 유속으로 분산상과 동시에 주입하였고, 미세유체 칩 내부에서 형성된 액적을 150rpm으로 교반되고 있는 1% PVA 용액에 수득하였다. 수득된 미립구 액적을 광학현미경으로 관찰한 결과, 도 9에 나타낸 바와 같이, 미립구 액적으로부터 석출된 약물이 관찰되지 않았다.
상기 미립구 액적을 35℃의 조건에서 추가적으로 2시간 동안 교반하면서 유기용매를 휘발하였으며, 유기용매가 제거된 후 멤브레인 필터(membrane filter)를 이용하여 경화된 미립구를 수득하고 2일간 동결건조하여 건조된 형태의 미립구를 수득하였다.
실험예 5-4. 아픽사반 함유 미립구의 제조(실시예 4)
25mg의 아픽사반, 100mg의 PLGA RG503H 및 25mg의 라우르산을 1mL의 디클로로메탄에 동시에 용해하여 분산상을 제조한 후 0.01mL/min의 유속으로 미세유체 칩(Microfluidic chip; Dolomite, 3D focusing hydrophilic chip)에 주입하였다. 이때, 수상은 1% PVA용액을 이용하였으며, 0.1mL/min의 유속으로 분산상과 동시에 주입하였고, 미세유체 칩 내부에서 형성된 액적을 150rpm으로 교반되고 있는 1% PVA 용액에 수득하였다. 수득된 미립구액적을 광학현미경으로 관찰한 결과, 도 10에 나타낸 바와 같이, 미립구 액적으로부터 석출된 약물이 관찰되지 않았다.
상기 미립구 액적을 35℃의 조건에서 추가적으로 2시간 동안 교반하면서 유기용매를 휘발하였으며, 유기용매가 제거된 후 멤브레인 필터(membrane filter)를 이용하여 경화된 미립구를 수득하고 2일간 동결건조하여 건조된 형태의 미립구를 수득하였다.
실험예 5-5. 아픽사반 함유 미립구의 제조(실시예 5)
25mg의 아픽사반, 90mg의 PLGA RG753H와 10mg의 PCL(평균 Mw 45,000g/mol) 및 25mg의 스테아르산을 1mL의 디클로로메탄에 동시에 용해하여 분산상을 제조한 후 0.01mL/min의 유속으로 미세유체 칩(Microfluidic chip; Dolomite, 3D focusing hydrophilic chip)에 주입하였다. 이때, 수상은 1% PVA용액을 이용하였으며, 0.1mL/min의 유속으로 분산상과 동시에 주입하였고, 미세유체 칩 내부에서 형성된 액적을 150rpm으로 교반되고 있는 1% PVA 용액에 수득하였다. 수득된 미립구 액적을 광학현미경으로 관찰한 결과, 도 11에 나타낸 바와 같이, 미립구 액적으로부터 석출된 약물이 관찰되지 않았다.
상기 미립구 액적을 35℃의 조건에서 추가적으로 2시간 동안 교반하면서 유기용매를 휘발하였으며, 유기용매가 제거된 후 멤브레인 필터(membrane filter)를 이용하여 경화된 미립구를 수득하고 2일간 동결건조하여 건조된 형태의 미립구를 수득하였다.
실험예 5-6. 아픽사반 함유 미립구의 제조(실시예 6)
25mg의 아픽사반, 90mg의 PLGA RG753H와 10mg의 PLA R202H 및 25mg의 스테아르산을 1mL의 디클로로메탄에 동시에 용해하여 분산상을 제조한 후 0.01mL/min의 유속으로 미세유체 칩(Microfluidic chip; Dolomite, 3D focusing hydrophilic chip)에 주입하였다. 이때, 수상은 1% PVA용액을 이용하였으며, 0.1mL/min의 유속으로 분산상과 동시에 주입하였고, 미세유체 칩 내부에서 형성된 액적을 150rpm으로 교반되고 있는 1% PVA 용액에 수득하였다. 수득된 미립구 액적을 광학현미경으로 관찰한 결과, 도 12에 나타낸 바와 같이, 미립구 액적으로부터 석출된 약물이 관찰되지 않았다.
상기 미립구 액적을 35℃의 조건에서 추가적으로 2시간 동안 교반하면서 유기용매를 휘발하였으며, 유기용매가 제거된 후 멤브레인 필터(membrane filter)를 이용하여 경화된 미립구를 수득하고 2일간 동결건조하여 건조된 형태의 미립구를 수득하였다.
실험예 5-7. 아픽사반 함유 미립구의 제조(실시예 7)
25mg의 아픽사반, 100mg의 PLGA RG503H와 10mg의 PLA R202H 및 18.7mg의 글리세릴트리도데카노에이트를 1mL의 디클로로메탄에 동시에 용해하여 분산상을 제조한 후 0.01mL/min의 유속으로 미세유체 칩(Microfluidic chip; Dolomite, 3D focusing hydrophilic chip)에 주입하였다. 이때, 수상은 1% PVA용액을 이용하였으며, 0.1mL/min의 유속으로 분산상과 동시에 주입하였고, 미세유체 칩 내부에서 형성된 액적을 150rpm으로 교반되고 있는 1% PVA 용액에 수득하였다. 수득된 미립구 액적을 광학현미경으로 관찰한 결과, 도 13에 나타낸 바와 같이, 미립구 액적으로부터 석출된 약물이 관찰되지 않았다.
상기 미립구 액적을 35℃의 조건에서 추가적으로 2시간 동안 교반하면서 유기용매를 휘발하였으며, 유기용매가 제거된 후 멤브레인 필터(membrane filter)를 이용하여 경화된 미립구를 수득하고 2일간 동결건조하여 건조된 형태의 미립구를 수득하였다.
이상으로부터, 지방산 또는 트리글리세라이드를 첨가한 분산상과 미세유체법으로 미립구를 제조하는 경우에만 아픽사반 함유 미립구를 제조할 수 있음을 알 수 있었다.
실험예 6. 아픽사반 함유 미립구 내 약물 함량 분석
상기 실험예 3에서 제조한 비교예 1 및 2, 상기 실험예 4에서 제조한 비교예 3, 및 상기 실험예 5에서 제조한 실시예 1내지 7에 해당하는 동결 건조된 미립구의 약물 함량을 측정하기 위하여, 최종 동결건조된 미립구 1mg을 1mL의 아세토니트릴에 용해한 후 0.45㎛ PVDF 실린지 필터(syringe filter)를 이용하여 여과하고 하기 표 1에 나타낸 조건에 따라 HPLC-UV 장비를 이용하여 정량 분석하였다.
| Mobile phase | Water : ACN (60:40) |
| Column | YMC-Triart C18 column, C18 (150 x 4.0mm ID), S-5㎛ |
| Flow rate | 1 mL/min |
| Column temperature | 20°C |
| Wavelength | 281nm |
| Injection volume | 20㎕ |
미립구에 봉입된 약물의 함량은 하기 식(1)에 의하여 계산하였다.
함량 = HPLC 분석된 약물의 농도 (mg/mL) ÷ 1 mg/mL X 100(%) - (1)
상기 식(1)에 의하여 분석된 미립구 내 아픽사반 함량 분석 결과는 표 2에 나타낸 바와 같다.
| 비교예1 | 비교예2 | 비교예3 | 실시예1 | 실시예2 | 실시예3 | 실시예4 | 실시예5 | 실시예6 | 실시예7 | |
| 약물 함량(%) |
측정 불가 |
0.57% | 측정 불가 |
18.40 | 17.61 | 18.36 | 20.41 | 18.60 | 18.65 | 18.92 |
구체적으로, 비교예 1 및 3의 경우 약물 결정이 너무 많아 약물 결정을 제거하기 어려워 미립구 내 아픽사반 함량 측정이 불가능하였으며, 비교예 2의 경우 75um mesh sieve를 이용하여 3회 물로 세척하면서 최대한 약물 결정을 제거하고 동결건조 하여 수득한 미립구를 이용하여 미립구 내 아픽사반 함량을 측정하였다.
그 결과, 본 발명이 제공하는 방법으로 제조한 실시예 1 내지 7의 미립구는 15 내지 20%, 고함량의 아픽사반을 포함할 수 있음을 확인하였다.
또한 이로부터, 본 발명이 제공하는 방법으로 제조한 미립구는 동결건조 후에도 아픽사반이 잘 봉입되어 있다는 것을 알 수 있었다.
이상의 설명으로부터, 본 발명이 속하는 기술분야의 당업자는 본 발명이 그 기술적 사상이나 필수적 특징을 변경하지 않고서 다른 구체적인 형태로 실시될 수 있다는 것을 이해할 수 있을 것이다. 이와 관련하여, 이상에서 기술한 실시예들은 모든 면에서 예시적인 것이며 한정적인 것이 아닌 것으로서 이해해야만 한다. 본 발명의 범위는 상기 상세한 설명보다는 후술하는 특허 청구범위의 의미 및 범위 그리고 그 등가 개념으로부터 도출되는 모든 변경 또는 변형된 형태가 본 발명의 범위에 포함되는 것으로 해석되어야 한다.
Claims (7)
- 생체적합성 고분자 기반 아픽사반 함유 서방형 주사제용 미립구(microsphere)의 제조방법에 있어서,
i) 아픽사반 결정 형성을 억제하는 지방산 또는 트리글리세라이드를 분산상에 첨가하는 단계; 및
ii) 미세유체법으로 미립구를 제조하는 단계를 포함하는 것인, 생체적합성 고분자 기반 아픽사반 함유 서방형 주사제용 미립구의 제조방법.
- 제1항에 있어서, 상기 지방산은 하나 이상의 카르복실기를 가지는 탄소수 12 내지 18의 지방산인 것인, 생체적합성 고분자 기반 아픽사반 함유 서방형 주사제용 미립구의 제조방법.
- 제1항에 있어서, 상기 지방산은 스테아르산(stearic acid) 또는 라우르산(lauric acid)인 것인, 생체적합성 고분자 기반 아픽사반 함유 서방형 주사제용 미립구의 제조방법.
- 제1항에 있어서, 상기 트리글리세라이드는 탄소수 10 이상의 지방산 3개와 글리세롤이 에스터 결합으로 형성된 것인, 생체적합성 고분자 기반 아픽사반 함유 서방형 주사제용 미립구의 제조방법.
- 제1항에 있어서, 상기 트리글리세라이드는 글리세릴트리도데카노에이트(glyceryl tridodecanoate)인 것인, 생체적합성 고분자 기반 아픽사반 함유 서방형 주사제용 미립구의 제조방법.
- 제1항에 있어서, 상기 분산상은 생체적합성 고분자 및 할로겐 유기용매를 포함하는 것인, 생체적합성 고분자 기반 아픽사반 함유 서방형 주사제용 미립구의 제조방법.
- 제1항에 있어서, 상기 아픽사반 함유 서방형 주사제용 미립구는 5 내지 30 중량%의 아픽사반을 포함하는 것인, 생체적합성 고분자 기반 아픽사반 함유 서방형 주사제용 미립구의 제조방법.
Priority Applications (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020190035355A KR102044676B1 (ko) | 2019-03-27 | 2019-03-27 | 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법 |
| EP20777186.6A EP3946272A4 (en) | 2019-03-27 | 2020-03-20 | PROCESS FOR THE PRODUCTION OF BIOCOMPATIBLE POLYMER-BASED APIXABAN-LOADED MICROBALLS |
| PCT/KR2020/003885 WO2020197190A1 (en) | 2019-03-27 | 2020-03-20 | Method for preparing biocompatible polymer-based apixaban-loaded microspheres |
| CN202080039719.XA CN113950322B (zh) | 2019-03-27 | 2020-03-20 | 制备基于生物相容性聚合物的负载阿哌沙班的微球的方法 |
| JP2021560188A JP7252375B2 (ja) | 2019-03-27 | 2020-03-20 | 生体適合性ポリマー系アピキサバン含有微粒球の製造方法 |
| US17/598,495 US20220183978A1 (en) | 2019-03-27 | 2020-03-20 | Method for preparing biocompatible polymer-based apixaban-loaded microspheres |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020190035355A KR102044676B1 (ko) | 2019-03-27 | 2019-03-27 | 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR102044676B1 true KR102044676B1 (ko) | 2019-11-14 |
Family
ID=68577801
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020190035355A KR102044676B1 (ko) | 2019-03-27 | 2019-03-27 | 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20220183978A1 (ko) |
| EP (1) | EP3946272A4 (ko) |
| JP (1) | JP7252375B2 (ko) |
| KR (1) | KR102044676B1 (ko) |
| CN (1) | CN113950322B (ko) |
| WO (1) | WO2020197190A1 (ko) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2020197185A1 (en) * | 2019-03-27 | 2020-10-01 | Mediforum Pharm | Compositions of dispersed phase for preparation of apixaban-loaded microspheres and biocompatible polymer-based apixaban-loaded microspheres prepared therefrom |
| WO2020197190A1 (en) * | 2019-03-27 | 2020-10-01 | Mediforum Pharm | Method for preparing biocompatible polymer-based apixaban-loaded microspheres |
| KR20230032772A (ko) | 2021-08-31 | 2023-03-07 | 에바바이오 주식회사 | 아픽사반을 함유하는 서방성 미립구 |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20220218608A1 (en) * | 2019-05-10 | 2022-07-14 | Fordoz Pharma Corp. | Injectable polymer nanoparticle compositions of antithrombotic agents and methods thereof |
| CN113786393A (zh) * | 2021-09-07 | 2021-12-14 | 浙江工业大学 | 一种利伐沙班微球及其制备方法与应用 |
| WO2024119376A1 (zh) * | 2022-12-06 | 2024-06-13 | 苏州大学 | 一种注射用阿哌沙班长效微球及其制备方法 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20120029428A (ko) * | 2009-06-16 | 2012-03-26 | 화이자 인코포레이티드 | 아픽사반의 투여 형태 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL193682C (nl) * | 1987-05-14 | 2000-07-04 | Glaxo Group Ltd | Beklede cefuroximaxetilsamenstelling. |
| US5250236A (en) * | 1991-08-05 | 1993-10-05 | Gasco Maria R | Method for producing solid lipid microspheres having a narrow size distribution |
| WO2015169957A1 (en) * | 2014-05-09 | 2015-11-12 | Sanovel Ilac Sanayi Ve Ticaret A.S. | Pharmaceutical combinations of rivaroxaban and h2-receptor antagonists |
| CN105310997B (zh) * | 2014-06-16 | 2020-01-31 | 重庆医药工业研究院有限责任公司 | 一种阿立哌唑缓释微球及其制备方法 |
| CN104523623A (zh) * | 2014-12-14 | 2015-04-22 | 天津市康瑞药业有限公司 | 阿哌沙班滴丸及其制备方法 |
| CA3032062A1 (en) * | 2016-08-30 | 2018-03-08 | Bracco Suisse Sa | Preparation of size-controlled microparticles |
| KR102044676B1 (ko) * | 2019-03-27 | 2019-11-14 | 주식회사 씨트리 | 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법 |
| KR102045721B1 (ko) * | 2019-03-27 | 2019-11-18 | 주식회사 씨트리 | 아픽사반 함유 미립구 제조용 분산상의 조성물 및 이로부터 제조되는 생체적합성 고분자 기반 아픽사반 함유 미립구 |
-
2019
- 2019-03-27 KR KR1020190035355A patent/KR102044676B1/ko active IP Right Grant
-
2020
- 2020-03-20 JP JP2021560188A patent/JP7252375B2/ja active Active
- 2020-03-20 WO PCT/KR2020/003885 patent/WO2020197190A1/en unknown
- 2020-03-20 CN CN202080039719.XA patent/CN113950322B/zh active Active
- 2020-03-20 EP EP20777186.6A patent/EP3946272A4/en active Pending
- 2020-03-20 US US17/598,495 patent/US20220183978A1/en active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20120029428A (ko) * | 2009-06-16 | 2012-03-26 | 화이자 인코포레이티드 | 아픽사반의 투여 형태 |
Non-Patent Citations (1)
| Title |
|---|
| Chem. Pharm. Bull., 55(4), 2008, pp.625-628* * |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2020197185A1 (en) * | 2019-03-27 | 2020-10-01 | Mediforum Pharm | Compositions of dispersed phase for preparation of apixaban-loaded microspheres and biocompatible polymer-based apixaban-loaded microspheres prepared therefrom |
| WO2020197190A1 (en) * | 2019-03-27 | 2020-10-01 | Mediforum Pharm | Method for preparing biocompatible polymer-based apixaban-loaded microspheres |
| CN113891705A (zh) * | 2019-03-27 | 2022-01-04 | Hlb制药有限责任公司 | 用于制备负载阿哌沙班的微球的分散相的组合物和由其制备的基于生物相容性聚合物的负载阿哌沙班的微球 |
| CN113891705B (zh) * | 2019-03-27 | 2024-04-09 | Hlb制药有限责任公司 | 用于制备负载阿哌沙班的微球的分散相的组合物和由其制备的基于生物相容性聚合物的负载阿哌沙班的微球 |
| KR20230032772A (ko) | 2021-08-31 | 2023-03-07 | 에바바이오 주식회사 | 아픽사반을 함유하는 서방성 미립구 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP7252375B2 (ja) | 2023-04-04 |
| US20220183978A1 (en) | 2022-06-16 |
| CN113950322A (zh) | 2022-01-18 |
| CN113950322B (zh) | 2023-05-12 |
| EP3946272A4 (en) | 2022-12-28 |
| EP3946272A1 (en) | 2022-02-09 |
| WO2020197190A1 (en) | 2020-10-01 |
| JP2022528452A (ja) | 2022-06-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102044676B1 (ko) | 생체적합성 고분자 기반 아픽사반 함유 미립구의 제조방법 | |
| KR102045721B1 (ko) | 아픽사반 함유 미립구 제조용 분산상의 조성물 및 이로부터 제조되는 생체적합성 고분자 기반 아픽사반 함유 미립구 | |
| DE69730093T2 (de) | Zubereitung mit verzögerter Freisetzung | |
| DE69824491T2 (de) | Mikrokapsel mit verzögerter Freigabe für wasserlösliche Arzneistoffe | |
| JP2012501321A (ja) | 溶媒交流蒸発法による徐放性マイクロスフェアの製造方法 | |
| KR20220112737A (ko) | 리바스티그민을 포함하는 장기지속형 제제 및 이의 제조방법 | |
| JP2016513721A (ja) | 高薬物含有ブプレノルフィンマイクロスフェア及びその製造方法 | |
| JP2012193212A (ja) | 優れた初期放出抑制特性を有する徐放性マイクロカプセルの製造方法及びこれにより製造されるマイクロカプセル | |
| JP2526589B2 (ja) | ペプチド含有マイクロカプセルおよびその製造法 | |
| KR20210100986A (ko) | 고밀도 서방출성 미립구의 제조방법 | |
| KR102237737B1 (ko) | 도네페질 함유 서방출성 plga 미립구의 제조방법 | |
| US20220226234A1 (en) | Injectable composition containing prodrug of caspase inhibitors, and preparation method therefor | |
| KR101738127B1 (ko) | 약물 함유 서방성 미립자의 제조 방법 | |
| KR102185348B1 (ko) | 데슬로렐린을 함유하는 서방형 주사제 및 그 제조방법 | |
| KR102235011B1 (ko) | 약물 함유 plga 미립구 및 그의 제조방법 | |
| DK171454B1 (da) | Fremgangsmåde til fremstilling af tørforarbejdede partikler, således opnåede tørforarbejdede partikler, og præparater indeholdende sådanne partikler | |
| WO2007024123A1 (en) | Pharmaceutical composition of pranlukast solid-dispersion with improved initial dissolution rate and the method of preparing the same | |
| KR102212717B1 (ko) | 지속 방출을 위한 마이크로스피어 및 이의 제조 방법 | |
| JP2023538901A (ja) | ケタミンを含むマイクロスフェア製剤ならびにその製造及び使用方法 | |
| KR20230032772A (ko) | 아픽사반을 함유하는 서방성 미립구 | |
| KR20230036886A (ko) | 생분해성 고분자를 이용한 서방형 미립구 및 이의 제조방법 | |
| JPS6341416A (ja) | 鎮痛性ペプチド含有マイクロカプセルの製造法 | |
| KR101985838B1 (ko) | N-desalkylquetiapine을 생리활성물질로 포함하는 서방성 약학 조성물 및 이의 제조방법 | |
| KR102451185B1 (ko) | 도네페질 함유 지속방출형 미립구 | |
| KR20240164192A (ko) | 사이클로스포린의 속효성 3d 프린트 정제의 조성 및 제조 방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant |