KR101881115B1 - 신규 2-치환된 테트라하이드로피란 또는 2-치환된 테트라하이드로퓨란 유도체 화합물, 이의 제조방법 및 이의 용도 - Google Patents
신규 2-치환된 테트라하이드로피란 또는 2-치환된 테트라하이드로퓨란 유도체 화합물, 이의 제조방법 및 이의 용도 Download PDFInfo
- Publication number
- KR101881115B1 KR101881115B1 KR1020150165740A KR20150165740A KR101881115B1 KR 101881115 B1 KR101881115 B1 KR 101881115B1 KR 1020150165740 A KR1020150165740 A KR 1020150165740A KR 20150165740 A KR20150165740 A KR 20150165740A KR 101881115 B1 KR101881115 B1 KR 101881115B1
- Authority
- KR
- South Korea
- Prior art keywords
- same
- phenyl
- bis
- different
- methoxyphenyl
- Prior art date
Links
- LCQFURWUXNWSAP-JPYDVTDNSA-N COc(cc1)ccc1N([C@@H]([C@@H]([C@H]1OCc2ccccc2)OCc2ccccc2)OC[C@@H]1OCc1ccccc1)c(cc1)ccc1OC Chemical compound COc(cc1)ccc1N([C@@H]([C@@H]([C@H]1OCc2ccccc2)OCc2ccccc2)OC[C@@H]1OCc1ccccc1)c(cc1)ccc1OC LCQFURWUXNWSAP-JPYDVTDNSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D309/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings
- C07D309/02—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings having no double bonds between ring members or between ring members and non-ring members
- C07D309/08—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D309/14—Nitrogen atoms not forming part of a nitro radical
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/34—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having five-membered rings with one oxygen as the only ring hetero atom, e.g. isosorbide
- A61K31/345—Nitrofurans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/02—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings
- C07D307/04—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having no double bonds between ring members or between ring members and non-ring members
- C07D307/06—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having no double bonds between ring members or between ring members and non-ring members with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, directly attached to ring carbon atoms
- C07D307/08—Preparation of tetrahydrofuran
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/02—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings
- C07D307/04—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having no double bonds between ring members or between ring members and non-ring members
- C07D307/10—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having no double bonds between ring members or between ring members and non-ring members with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D307/14—Radicals substituted by nitrogen atoms not forming part of a nitro radical
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
본 발명은 신규 2-치환된 테트라하이드로피란 또는 2-치환된 테트라하이드로퓨란 유도체 화합물, 이의 입체이성질체, 또는 이의 약학적으로 허용 가능한 염, 이의 제조방법, 및 이를 유효성분으로 포함하는 신경계 질환의 예방 또는 치료용 약학적 조성물에 관한 것이다. 화합물은 독성물질에 의해 유도된 미세아교세포 활성화에 대해 저해 기능을 나타내어 신경계 질환의 예방 및 치료용 약학적 조성물로 이용될 수 있다.
Description
본 발명은 신규 2-치환된 테트라하이드로피란 또는 2-치환된 테트라하이드로퓨란 유도체 화합물, 이의 제조방법 및 이의 용도에 관한 것으로, 상세하게는 신규 2-치환된 테트라하이드로피란 또는 2-치환된 테트라하이드로퓨란 유도체 화합물, 이의 입체이성질체, 또는 이의 약학적으로 허용 가능한 염, 이의 제조방법, 및 이를 유효성분으로 포함하는 신경계 질환의 예방 또는 치료용 약학적 조성물에 관한 것이다.
자연계에는 산소 함유 지방족(aliphatic) 고리 화합물이 다수 존재하며, 이 중 생체를 구성하거나 생리활성을 나타내는 내외인성 물질이 기 존재한다. 가장 대표적인 산소 함유 지방족(aliphatic) 고리 화합물이 당(sugar)이다. 그 예로서 ATP, GTP 같은 생체 내 삼인산화 뉴클레오사이드(nucleoside triphosphate)와 뉴클레오타이드는 5원 산소 함유 고리를 포함하고 있다. 지질이나 단백질의 당화는 생체내 인식의 특이성을 부여하며 감염, 전이, 염증, 분화, 생체 신호 조절 등 질병의 발현과 관련되는 생태병리 현상을 조절하는 핵심 역할을 하는 것으로 보고되고 있다(Hang et al., Acc. Chem. Res., 2001, 34(9): 727-736; Wong, Acc. Chem. Res., 1999, 32(4): 376-385). 산소 함유 지방족 고리 화합물의 용도는 탄수화물(carbohydrate)이나 당화 단백질, 당화 지질 및 뉴클레오타이드를 구성하는 당에만 국한되는 것은 아니다. 생합성 경로로 만들어지는 천연물이나 기 존재하는 의약품 혹은 알려진 생리 활성 화합물 중 테트라하이드로피란(tetrahydropyran)이나 테트라하이드로퓨란(tetrahydrofuran)을 포함하는 당 이외의 물질들이 존재한다. 그 한 예로 테트라하이드로피란 모핵을 갖는 면역억제제인 타크롤리무스(Tacrolimus, FK-506 혹은 fujimycin)와 테트라하이드로퓨란을 포함하는 항바이러스제인 암프레나비어암프레나비어(Amprenavir)가 있다. 그 외에도, 천연에 존재하는 당의 인공적인 변형 형태의 항바이러스제나 항암제 등이 존재한다(Ghosh et al., Future Med. Chem., 2011, 3(9): 1181-1197).
그동안 산소 함유 지방족 고리 화합물에 치환기를 도입하는 합성법이 연구되었다. 치환기 도입은 해당 고리 화합물 모핵을 다른 구조에 선택적으로 연결시키는 합성법(chemoselective ligation)이 주로 주목받았다. 당 펩타이드의 경우 당과 펩타이드를 연결하는 반응자리가 아노메릭(anomeric) 위치이다(Hang et al, Acc Chem Res. 2001 Sep;34(9):727-36). 즉, 화합물 연장방법으로 아노메릭(anomeric) 위치에 치환기를 도입하는 합성법이 개발되어 왔다. 당 유래의 의약품의 단백질 친화도를 높이는 방법으로 소수성기나 전하를 띤 치환기를 도입하는 것이 일반적이며, 이를 위한 다양한 합성 방법이 시도되어 왔다(Trejbalova et al., Nucleic Acids Res., 2011, 39(20): 8728-8739).
그러나, 기존 보고된 방법으로는 두 개의 방향족 치환기가 존재하는 2-아미노 테트라하이드로피란과 2-아미노 테트라하이드로퓨란 유도체를 합성하는 방법이 제한적이거나 비효율적이기 때문에 새로운 합성법의 개발이 요구되고 있는 실정이다.
이러한 배경 하에, 본 발명자들은 목적은 아노메릭 위치에 3차 아민이 도입된 신규 테트라하이드로피란 또는 테트라하이드로퓨란 유도체를 합성하는 하고자 예의 연구 노력한 결과, 산화적 고리화 방법에 의해 아노메릭 위치에 방향족 3차 아민을 효율적으로 도입하는 방법을 개발하여, 기존 방법으로는 보고되지 않았던, 2-치환된 테트라하이드로피란 또는 2-치환된 테트라하이드로퓨란 유도체를 효율적으로 합성할 수 있음을 확인하였고, 합성된 화합물들이 산업적 이용가능성의 한 예로서 LPS(lipid polysaccharide)에 의해 유도된 "미세아교세포 활성화(microglial activation)" 억제와 6-OHDA(6-hydroxydopamine)에 의한 세포 사멸(cell death) 억제 효과를 통해 신경계 질환의 예방 또는 치료에 있어서 유용성을 가짐을 확인하여 본 발명을 완성하기에 이르렀다.
본 발명의 하나의 목적은 신규 2-치환된 테트라하이드로피란 또는 2-치환된 테트라하이드로퓨란 유도체 화합물, 이의 입체이성질체, 또는 이의 약학적으로 허용 가능한 염을 제공하는 것이다.
본 발명의 다른 목적은 상기 2-치환된 테트라하이드로피란 또는 2-치환된 테트라하이드로퓨란 유도체 화합물, 이의 입체이성질체, 또는 이의 약학적으로 허용 가능한 염의 제조방법을 제공하는 것이다.
본 발명의 또다른 목적은 상기 2-치환된 테트라하이드로피란 또는 2-치환된 테트라하이드로퓨란 유도체 화합물, 이의 입체이성질체, 또는 이의 약학적으로 허용 가능한 염을 유효 성분으로 포함하는 신경계 질환의 예방 또는 치료용 약학적 조성물을 제공하는 것이다.
본 발명의 또 다른 목적은 상기 약학적 조성물을 이를 필요로 하는 개체에게 투여하는 단계를 포함하는, 개체에서 신경계 질환을 예방 또는 치료하는 방법을 제공하는 것이다.
상기의 목적을 달성하기 위하여, 본 발명은 하나의 양태로서 하기 화학식 1로 표시되는 화합물, 이의 입체이성질체 또는 이의 약학적으로 허용 가능한 염을 제공한다:
[화학식 1]
상기 식에서,
n은 0 또는 1이고;
R1 및 R2는 동일하거나 상이하며, 각각 독립적으로 C5-C14 아릴 또는 C5-C14 헤테로아릴이고, 상기 아릴 또는 헤테로아릴은 할로겐, C1-C6 알킬, C1-C6 알콕시, 및 -NR7R8로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고, 또는 R1과 R2가 서로 연결되어, 이들이 결합된 질소원자를 포함하여, 5원 내지 8원 헤테로사이클릭 고리를 형성하고, 상기 헤테로사이클릭 고리는 다른 C5-C14 아릴과 융합되거나, 할로겐 또는 C1-C6 알킬 로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고;
R3 및 R3'은 동일하거나 상이하며, 각각 독립적으로 수소, 히드록시, 할로겐, C5-14 아릴-C1-6 알콕시, 히드록시 C1-C6 알킬, 또는 트리(C1-C6 알킬)-실릴옥시-C1-C6 알킬(여기서, 트리(C1-C6 알킬)은 모두 동일하거나 2종 이상의 서로 상이한 (C1-C6 알킬)로 구성될 수 있음)이고;
R4 및 R4'은 동일하거나 상이하며, 각각 독립적으로 수소, 히드록시, 할로겐, C5-C14 아릴, 또는 C5-14 아릴-C1-6 알콕시이며;
R5 및 R5'은 동일하거나 상이하며, 각각 독립적으로 수소, 히드록시, 할로겐, 또는 C5-14 아릴-C1-6 알콕시이고;
R6 및 R6'은 동일하거나 상이하며, 각각 독립적으로 수소, 또는 C1-C6 알킬이며,
R7 및 R8은 동일하거나 상이하며, 각각 독립적으로 수소, 또는 C1-C6 알킬을 나타낸다.
구체적으로, 상기 화학식 1에서 R1 및 R2는 동일하거나 상이하며, 각각 독립적으로 페닐 또는 피리디닐을 나타내고, 상기 R1 및 R2는 플루오로, 메톡시, 디메틸아미노, 메틸, 및 브로모로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고, 또는 R1과 R2가 서로 연결되어 형성된, 메틸, 아이오도 또는 둘 모두로 치환된 인돌리닐을 나타내고;
R3 및 R3'는 동일하거나 상이하고, 각각 독립적으로 수소, 히드록시, 플루오로, 벤질옥시, 히드록시메틸, 또는 tert-부틸디메틸실릴옥시메틸이며;
R4 및 R4'는 동일하거나 상이하고, 각각 독립적으로 수소, 히드록시, 플루오로, 페닐, 또는 벤질옥시이며;
R5 및 R5'는 동일하거나 상이하고, 각각 독립적으로 수소, 히드록시, 플루오로, 또는 벤질옥시이며;
R6 및 R6'은 동일하거나 상이하며, 각각 독립적으로 수소, 또는 메틸일 수 있다.
더 구체적으로, R1 및 R2는 플루오로, 메톡시, 디메틸아미노, 메틸, 및 브로모로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않은 페닐, 또는 피리디닐; 또는 R1과 R2가 서로 연결되어 형성된 메틸 및 아이오도로 치환된 인돌리닐일 수 있다.
더욱 구체적으로, R1은 페닐, 메톡시페닐, 디메틸아미노페닐, 플루오로메틸페닐, 메틸페닐 또는 브로모페닐이고, R2는 페닐, 메톡시페닐, 플루오로페닐, 피리디닐 또는 디메틸아미노페닐일 수 있다. 또는, R1과 R2가 서로 연결되어 2-아이오도-2-메틸인돌리닐을 형성할 수 있다.
다른 양태로서 본 발명은 하기 화학식 1-1로 표시되는 화합물, 이의 입체이성질체 또는 이의 약학적으로 허용 가능한 염을 제공한다:
[화학식 1-1]
상기 식에서,
R1 및 R2는 동일하거나 상이하며, 각각 독립적으로 C5-C14 아릴 또는 C5-C14 헤테로아릴이고, 상기 아릴 또는 헤테로아릴은 할로겐, C1-C6 알킬, C1-C6 알콕시, 및 -NR7R8로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고, 또는 R1과 R2가 서로 연결되어, 이들이 결합된 질소원자를 포함하여, 5원 내지 8원 헤테로사이클릭 고리를 형성하고, 상기 헤테로사이클릭 고리는 다른 C5-C14 아릴과 융합되거나, 할로겐 또는 C1-C6 알킬 로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고;
R3 및 R3'은 동일하거나 상이하며, 각각 독립적으로 수소, 히드록시, 할로겐, C5-14 아릴-C1-6 알콕시, 히드록시 C1-C6 알킬, 또는 트리(C1-C6 알킬)-실릴옥시-C1-C6 알킬(여기서, 트리(C1-C6 알킬)은 모두 동일하거나 2종 이상의 서로 상이한 (C1-C6 알킬)로 구성될 수 있음)이고;
R4 및 R4'은 동일하거나 상이하며, 각각 독립적으로 수소, 히드록시, 할로겐, C5-C14 아릴, 또는 C5-14 아릴-C1-6 알콕시이며;
R5 및 R5'은 동일하거나 상이하며, 각각 독립적으로 수소, 히드록시, 할로겐, 또는 C5-14 아릴-C1-6 알콕시이고;
R6 및 R6'은 동일하거나 상이하며, 각각 독립적으로 수소, 또는 C1-C6 알킬이며,
R7 및 R8은 동일하거나 상이하며, 각각 독립적으로 수소, 또는 C1-C6 알킬을 나타낸다.
구체적으로, 상기 화학식 1-1에서, R1 및 R2는 동일하거나 상이하며, 각각 독립적으로 페닐 또는 피리디닐을 나타내고, 상기 R1 및 R2는 플루오로, 메톡시, 디메틸아미노, 메틸, 및 브로모로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고, 또는 R1과 R2가 서로 연결되어 형성된, 메틸, 아이오도 또는 둘 모두로 치환된 인돌리닐을 나타내고;
R3 및 R3'는 동일하거나 상이하고, 각각 독립적으로 수소, 히드록시, 플루오로, 벤질옥시, 히드록시메틸, 또는 tert-부틸디메틸실릴옥시메틸이며;
R4 및 R4'는 동일하거나 상이하고, 각각 독립적으로 수소, 히드록시, 플루오로, 페닐, 또는 벤질옥시이며;
R5 및 R5'는 동일하거나 상이하고, 각각 독립적으로 수소, 히드록시, 플루오로, 또는 벤질옥시이며;
R6 및 R6'은 동일하거나 상이하며, 각각 독립적으로 수소, 또는 메틸일 수 있다.
더 구체적으로, R1 및 R2는 플루오로, 메톡시, 디메틸아미노, 메틸, 및 브로모로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않은 페닐, 또는 피리디닐; 또는 R1과 R2가 서로 연결되어 형성된 메틸 및 아이오도로 치환된 인돌리닐일 수 있다.
더욱 구체적으로, R1은 페닐, 메톡시페닐, 디메틸아미노페닐, 플루오로메틸페닐, 메틸페닐 또는 브로모페닐이고, R2는 페닐, 메톡시페닐, 플루오로페닐, 피리디닐 또는 디메틸아미노페닐일 수 있다. 또는, R1과 R2가 서로 연결되어 2-아이오도-2-메틸인돌리닐을 형성할 수 있다.
또다른 양태로서, 본 발명은 하기 화학식 1-2로 표시되는 화합물, 이의 입체이성질체 또는 이의 약학적으로 허용 가능한 염을 제공한다:
[화학식 1-2]
상기 식에서,
R1 및 R2는 동일하거나 상이하며, 각각 독립적으로 하나 이상의 C1-C6 알콕시로 치환되거나 비치환된 C5-C14 아릴이다.
구체적으로, 상기 화학식 1-2에서, R1 및 R2는 동일하거나 상이하며, 각각 독립적으로 하나 이상의 C1-C6 알콕시로 치환되거나 비치환된 페닐일 수 있다.
더 구체적으로, R1 및 R2는 하나 이상의 메톡시기로 치환되거나 비치환된 페닐일 수 있다.
보다 더 구체적으로, 상기 화학식 1로 표시되는 화합물은 하기 화합물들로 이루어진 군에서 선택되는 화합물일 수 있다:
1) N,N-비스(4-메톡시페닐)테트라하이드로퓨란-2-아민[N,N-bis(4-methoxyphenyl)tetrahydrofuran-2-amine],
2) N,N-디페닐테트라하이드로퓨란-2-아민[N,N-diphenyltetrahydrofuran-2-amine],
3) N,N-비스(4-메톡시페닐)테트라하이드로-2H-피란-2-아민[N,N-bis(4-methoxyphenyl)tetrahydro-2H-pyran-2-amine],
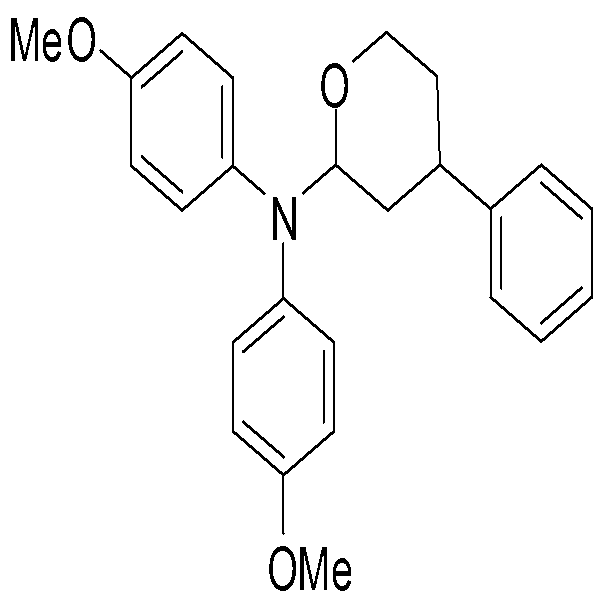
4) N,N-비스(4-메톡시페닐)-4-페닐테트라하이드로-2H-피란-2-아민[N,N-bis(4-methoxyphenyl)-4-phenyltetrahydro-2H-pyran-2-amine],
5) 3,3,4,4,5,5-헥사플루오로-N,N-비스(4-메톡시페닐)테트라하이드로-2H-피란-2-아민[3,3,4,4,5,5-hexafluoro-N,N-bis(4-methoxyphenyl)tetrahydro-2H-pyran-2-amine],
6) (2R,3S)-3-((tert-부틸디메틸실릴옥시)메틸)-N,N-비스(4-메톡시페닐)테트라하이드로-2H-피란-2-아민[(3S)-3-((tert-butyldimethylsilyloxy)methyl)-N,N-bis(4-methoxyphenyl)tetrahydro-2H-pyran-2-amine],
7) ((2R,3S)-2-(비스(4-메톡시페닐)아미노)테트라하이드로-2H-피란-3-일)메탄올[((3S)-2-(bis(4-methoxyphenyl)amino)tetrahydro-2H-pyran-3-yl)methanol],
8) (2R,3R,4S,5S)-3,4,5-트리스(벤질옥시)-N,N-비스(4-메톡시페닐)테트라하이드로-2H-피란-2-아민[(2R,3R,4S,5S)-3,4,5-tris(benzyloxy)-N,N-bis(4-methoxyphenyl)tetrahydro-2H-pyran-2-amine],
9) N1-(4-(디메틸아미노)페닐)-N4,N4-디메틸-N1-(테트라하이드로-2H-피란-2-일)벤젠-1,4-디아민[N1-(4-(dimethylamino)phenyl)-N4,N4-dimethyl-N1-(tetrahydro-2H-pyran-2-yl)benzene-1,4-diamine],
10) N-(4-메톡시페닐)-N-(테트라하이드로-2H-피란-2-일)피리딘-3-아민[N-(4-methoxyphenyl)-N-(tetrahydro-2H-pyran-2-yl)pyridin-3-amine],
11) N-(4-플루오로페닐)-N-페닐테트라하이드로-2H-피란-2-아민[N-(4-fluorophenyl)-N-phenyltetrahydro-2H-pyran-2-amine],
12) N-(2-플루오로-5-메틸페닐)-N-페닐테트라하이드로-2H-피란-2-아민[N-(2-fluoro-5-methylphenyl)-N-phenyltetrahydro-2H-pyran-2-amine],
13) N-페닐-N-m-톨릴테트라하이드로-2H-피란-2-아민[N-phenyl-N-m-tolyltetrahydro-2H-pyran-2-amine],
14) N-(4-브로모페닐)-N-페닐테트라하이드로-2H-피란-2-아민[N-(4-bromophenyl)-N-phenyltetrahydro-2H-pyran-2-amine],
15) N-(4-메톡시페닐)-N-p-톨릴테트라하이드로-2H-피란-2-아민[N-(4-methoxyphenyl)-N-p-tolyltetrahydro-2H-pyran-2-amine],
16) N,N-디p-톨릴테트라하이드로-2H-피란-2-아민[N,N-dip-tolyltetrahydro-2H-pyran-2-amine],
17) N,N-비스(4-메톡시페닐)-6-메틸테트라하이드로-2H-피란-2-아민[N,N-bis(4-methoxyphenyl)-6-methyltetrahydro-2H-pyran-2-amine],
18) 2-아이오도-2-메틸-1-(테트라하이드로-2H-피란-2-일)인돌린[2-iodo-2-methyl-1-(tetrahydro-2H-pyran-2-yl)indoline], 및
19) (2S,3S,4R,5R)-3,4,5-트리스(벤질옥시)-N,N-비스(4-메톡시페닐)테트라하이드로-2H-피란-2-아민[(2S,3S,4R,5R)-3,4,5-tris(benzyloxy)-N,N-bis(4-methoxyphenyl)tetrahydro-2H-pyran-2-amine].
본 발명의 구체적인 실시예에서는 상기 19종의 화합물을 합성하였다.
본 발명의 화합물은 염, 특히 약학적으로 허용가능한 염의 형태로 존재할 수 있다. 염으로는 약학적으로 허용 가능한 유리산(free acid)에 의해 형성된 산부가염과 같이, 당 업계에서 통상적으로 사용되는 염을 제한 없이 사용할 수 있다. 본 발명의 용어 "약학적으로 허용 가능한 염"이란 환자에게 비교적 비독성이고 무해한 유효작용을 갖는 농도로서 이 염에 기인한 부작용이 화학식 1로 표시되는 화합물의 이로운 효능을 저하시키지 않는 상기 화합물의 임의의 모든 유기 또는 무기부가염을 의미한다.
산부가염은 통상의 방법, 예를 들어 화합물을 과량의 산 수용액에 용해시키고, 이 염을 수혼화성 유기 용매, 예를 들어 메탄올, 에탄올, 아세톤 또는 아세토니트릴을 사용하여 침전시켜서 제조한다. 동 몰량의 화합물 및 물 중의 산 또는 알코올(예, 글리콜 모노메틸에테르)을 가열하고, 이어서 상기 혼합물을 증발시켜 건조시키거나, 또는 석출된 염을 흡인 여과시킬 수 있다.
이때, 유리산으로는 유기산과 무기산을 사용할 수 있으며, 무기산으로는 염산, 인산, 황산, 질산, 주석산 등을 사용할 수 있고 유기산으로는 메탄술폰산, p-톨루엔술폰산, 아세트산, 트리플루오로아세트산, 말레인산(maleic acid), 숙신산, 옥살산, 벤조산, 타르타르산, 푸마르산(fumaric acid), 만데르산, 프로피온산(propionic acid), 구연산(citric acid), 젖산(lactic acid), 글리콜산(glycollic acid), 글루콘산(gluconic acid), 갈락투론산, 글루탐산, 글루타르산(glutaric acid), 글루쿠론산(glucuronic acid), 아스파르트산, 아스코르브산, 카본산, 바닐릭산, 요오드화수소산(hydroiodic acid) 등을 사용할 수 있으며, 이들에 제한되지 않는다.
또한, 염기를 사용하여 약학적으로 허용 가능한 금속염을 만들 수 있다. 알칼리 금속염 또는 알칼리 토금속 염은, 예를 들어 화합물을 과량의 알칼리 금속 수산화물 또는 알칼리 토금속 수산화물 용액 중에 용해시키고, 비용해 화합물 염을 여과한 후 여액을 증발, 건조시켜 얻는다. 이때, 금속염으로는 특히 나트륨, 칼륨, 또는 칼슘염을 제조하는 것이 제약상 적합하나 이들에 제한되는 것은 아니다. 또한 이에 대응하는 은염은 알칼리 금속 또는 알칼리 토금속 염을 적당한 은염(예, 질산은)과 반응시켜 얻을 수 있다.
본 발명의 화합물의 약학적으로 허용 가능한 염은, 달리 지시되지 않는 한, 상기 화학식 1의 화합물에 존재할 수 있는 산성 또는 염기성 기의 염을 포함한다. 예를 들어, 약학적으로 허용 가능한 염으로는 히드록시기의 나트륨, 칼슘 및 칼륨염 등이 포함될 수 있고, 아미노기의 기타 약학적으로 허용 가능한 염으로는 히드로브롬화물, 황산염, 수소 황산염, 인산염, 수소 인산염, 이수소 인산염, 아세테이트, 숙시네이트, 시트레이트, 타르트레이트, 락테이트, 만델레이트, 메탄술포네이트(메실레이트) 및 p-톨루엔술포네이트(토실레이트) 염 등이 있으며, 당 업계에 알려진 염의 제조방법을 통하여 제조될 수 있다.
본 발명의 2-치환된 테트라하이드로피란 또는 2-치환된 테트라하이드로퓨란 유도체 화합물의 약학적으로 허용가능한 염으로는 2-치환된 테트라하이드로피란 또는 2-치환된 테트라하이드로퓨란 유도체 화합물과 동등한 신경계 질환의 치료 효과를 나타내는 화합물의 염이면 제한없이 모두 사용 가능하다.
또한, 본 발명에 따른 상기 화학식 1로 표시되는 화합물은, 이의 약학적으로 허용가능한 염뿐만 아니라 이로부터 제조될 수 있는 가능한 수화물 등의 용매화물을 제한없이 포함한다. 상기 화학식 1로 표시되는 화합물의 용매화물은 당업계에 공지된 방법을 사용하여 화학식 1로 표시되는 화합물로부터 제조할 수 있다.
아울러, 본 발명에 따른 상기 화학식 1로 표시되는 화합물은 결정 형태 또는 비결정 형태로 제조될 수 있으며, 결정 형태로 제조될 경우 임의로 수화되거나 용매화될 수 있다. 본 발명에서는 상기 화학식 1로 표시되는 화합물의 화학양론적 수화물뿐만 아니라 다양한 양의 물을 함유하는 화합물이 포함될 수 있다. 본 발명에 따른 상기 화학식 1로 표시되는 화합물의 용매화물은 화학양론적 용매화물 및 비화학양론적 용매화물 모두를 포함한다.
다른 하나의 양태로서, 본 발명은 하기 화학식 2의 화합물을 산화적 고리화 반응에 의해 화학식 1-1의 화합물로 전환시키는 단계를 포함하는, 화학식 1-1로 표시되는 화합물의 제조 방법을 제공한다:
[화학식 1-1]
[화학식 2]
상기 식에서,
R1 및 R2는 동일하거나 상이하며, 각각 독립적으로 C5-C14 아릴 또는 C5-C14 헤테로아릴이고, 상기 아릴 또는 헤테로아릴은 할로겐, C1-C6 알킬, C1-C6 알콕시, 및 -NR7R8로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고, 또는 R1과 R2가 서로 연결되어, 이들이 결합된 질소원자를 포함하여, 5원 내지 8원 헤테로사이클릭 고리를 형성하고, 상기 헤테로사이클릭 고리는 다른 C5-C14 아릴과 융합되거나, 할로겐 또는 C1-C6 알킬 로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고;
R3 및 R3'은 동일하거나 상이하며, 각각 독립적으로 수소, 히드록시, 할로겐, C5-14 아릴-C1-6 알콕시, 히드록시 C1-C6 알킬, 또는 트리(C1-C6 알킬)-실릴옥시-C1-C6 알킬(여기서, 트리(C1-C6 알킬)은 모두 동일하거나 2종 이상의 서로 상이한 (C1-C6 알킬)로 구성될 수 있음)이고;
R4 및 R4'은 동일하거나 상이하며, 각각 독립적으로 수소, 히드록시, 할로겐, C5-C14 아릴, 또는 C5-14 아릴-C1-6 알콕시이며;
R5 및 R5'은 동일하거나 상이하며, 각각 독립적으로 수소, 히드록시, 할로겐, 또는 C5-14 아릴-C1-6 알콕시이고;
R6 및 R6'은 동일하거나 상이하며, 각각 독립적으로 수소, 또는 C1-C6 알킬이며,
R7 및 R8은 동일하거나 상이하며, 각각 독립적으로 수소, 또는 C1-C6 알킬을 나타낸다.
상기 반응은 하기 반응식 1로 표시될 수 있다.
[반응식 1]
화학식 2 화학식 1-1
상기 방법에 있어서, 산화적 고리화 반응은 테트라하이드로피란 고리를 형성하기 위한 반응으로서, 촉매량의 라디칼 존재하에서 요오드 또는 과요오드화물(hypervalent iodine) 산화제를 사용하여 수행될 수 있다.
상기 고리화 반응에 있어서 촉매량으로 사용하는 라디칼은 TEMPO((2,2,6,6-tetramethylpiperidin-1-yl)oxidanyl) 또는 그 유도체일 수 있다. 상기 촉매량의 라디칼은 TEMPO 유도체에 한정되지 않으며, 그 실시예로서 트리스-4-브로모페닐 암모늄 헥사클로로안티몬염(TBPA; tris-4-bromophenyl ammonium hexachloroantimonate)이 있다.
과요오드화물 산화제로서, 바람직하게 BAIB(bis(acetoxy)iodobenzene) 또는 PIFA(phenyliodine bis(trifluoroacetate))이 사용될 수 있다.
용매로는 클로로포름을 사용할 수 있으나, 이에 제한되지 않는다.
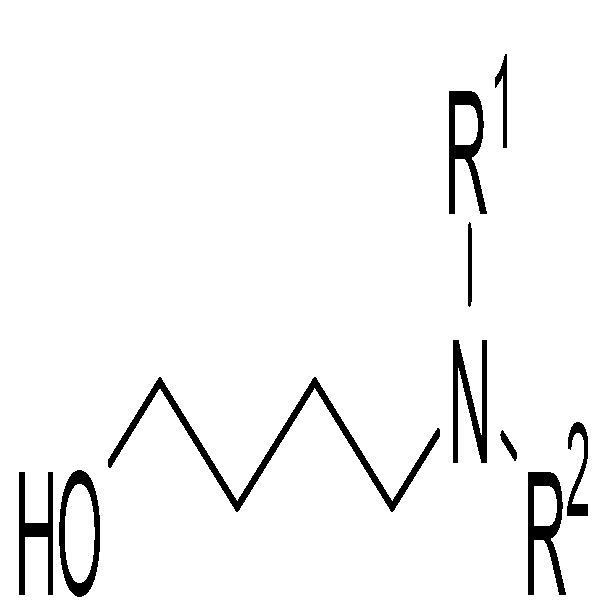
상기 화학식 2의 화합물은, 치환되거나 비치환된 글루타르산 모노 에스테르를 상업적으로 구매하거나 글루타르산 무수물(glutaric anhydride) 로부터 메톡시화 나트륨을 사용하여 수득한 글루타르산 모노 에스테르를 N,N-치환된 아민 유도체와 아실치환 반응하여 글루타르아미드 에스테르(glutaric amide ester)를 얻고 이를 LAH와 같은 환원제로 환원시켜 N,N-치환된-1,5-아미노알코올을 수득함으로써 제조할 수 있다.
대안적으로, 상기 화학식 2의 화합물은 문헌(Org. Lett., 2006, 8(15): 3307-3310)에 의거하여 2-히드록시테트라하이드로피란과 N,N-치환된 아민유도체의 환원 아미노화(reductive amination) 반응을 통해 합성한 입체선택적인 2-알킬 말론아미드 에스테르로부터 N,N-치환된-1,5-아미노알코올을 수득함으로써 제조할 수 있다.
또 다른 대안으로, 환원반응에 영향을 받는 치환기를 가지고 있는 경우, 상기 화학식 2의 화합물은 문헌(J. Am. Chem. Soc., 2015, 137: 6120-6123)에 의거하여 합성한 O-실릴 치환된 5-아이오도펜탄-1-올과 N,N-치환된 아민 유도체의 치환 반응 후 실릴 보호기를 제거하는 반응으로부터 N,N-치환된-1,5-아미노알코올을 수득함으로써 제조할 수 있다.
바람직하게는, 상기 본 발명의 제조 방법은 여과, 건조, 세척, 정제하는 단계 또는 이들의 조합을 추가로 포함할 수 있다. 상기 여과, 건조, 세척, 및 정제하는 단계는 당업계에서 공지된 방법을 제한 없이 이용하여 수행될 수 있다.
또 다른 양태로서, 본 발명은 하기 화학식 3의 화합물을 산화적 고리화 반응에 의해 화학식 1-2의 화합물로 전환시키는 단계를 포함하는, 화학식 1-2으로 표시되는 화합물의 제조 방법을 제공한다:
[화학식 1-2]
[화학식 3]
상기 식에서,
R1 및 R2는 동일하거나 상이하며, 각각 독립적으로 하나 이상의 C1-C6 알콕시로 치환되거나 비치환된 C5-C14 아릴이다.
상기 반응은 하기 반응식 2로 표시될 수 있다.
[반응식 2]
화학식 3 화학식 1-2
상기 방법에 있어서, 산화적 고리화 반응은 테트라하이드로퓨란 고리를 형성하기 위한 반응으로서, 촉매량의 라디칼 존재하에서 요오드 또는 과요오드화물(hypervalent iodine) 산화제를 사용하여 수행될 수 있다.
상기 고리화 반응에 있어서 촉매량으로 사용하는 라디칼은 TEMPO((2,2,6,6-tetramethylpiperidin-1-yl)oxidanyl) 또는 그 유도체일 수 있으나, 이에 한정되지 않는다.
과요오드화물 산화제로는, 바람직하게 BAIB(bis(acetoxy)iodobenzene) 또는 PIFA(phenyliodine bis(trifluoroacetate))이 사용될 수 있다.
용매로는 클로로포름을 사용할 수 있으나, 이에 제한되지 않는다.
상기 화학식 3의 화합물은, N,N-치환된 아민유도체와 할로겐화 석신산 에스테르(succinyl halide alkly ester), 예를 들어 에틸 4-클로로-4-옥소부타노에이트(ethyl 4-chloro-4-oxobutanoate)과 아실 치환반응하여 석신아미드 에스테르(succinamide ester)를 수득하고, 이를 LAH와 같은 환원제로 환원시켜 N,N-치환된-1,4-아미노알코올을 수득함으로써 제조할 수 있다.
바람직하게는, 상기 본 발명의 제조 방법은 여과, 건조, 세척, 정제하는 단계 또는 이들의 조합을 추가로 포함할 수 있다. 상기 여과, 건조, 세척, 및 정제하는 단계는 당업계에서 공지된 방법을 제한 없이 이용하여 수행될 수 있다.
또 다른 양태로서, 본 발명은 하기 화학식 4의 화합물을 산화적 고리화 반응에 의해 화학식 1-3의 화합물로 전환시키는 단계를 포함하는, 화학식 1-3으로 표시되는 화합물의 제조 방법을 제공한다:
[화학식 1-3]
[화학식 4]
상기 식에서,
R1 및 R2는 동일하거나 상이하며, 각각 독립적으로 C5-C14 아릴 또는 C5-C14 헤테로아릴이고, 상기 아릴 또는 헤테로아릴은 할로겐, C1-C6 알킬, C1-C6 알콕시, 및 -NR7R8로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고, 또는 R1과 R2가 서로 연결되어, 이들이 결합된 질소원자를 포함하여, 5원 내지 8원 헤테로사이클릭 고리를 형성하고, 상기 헤테로사이클릭 고리는 다른 C5-C14 아릴과 융합되거나, 할로겐 또는 C1-C6 알킬 로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고;
R5는 수소, 히드록시, 할로겐, 또는 C5-14 아릴-C1-6 알콕시이며;
R7 및 R8은 동일하거나 상이하며, 각각 독립적으로 수소 또는 C1-C6 알킬을 나타내고;
PG는 보호기(protecting group)를 의미한다.
상기 반응은 하기 반응식 3으로 표시될 수 있다.
[반응식 3]
화학식 4 화학식 1-3
상기 방법에 있어서, 산화적 고리화 반응은 테트라하이드로피란 고리를 형성하기 위한 반응으로서, 촉매량의 라디칼 존재하에서 요오드 또는 과요오드화물(hypervalent iodine) 산화제를 사용하여 수행될 수 있다.
상기 고리화 반응에 있어서 촉매량으로 사용하는 라디칼은 TEMPO((2,2,6,6-tetramethylpiperidin-1-yl)oxidanyl) 또는 그 유도체일 수 있으나, 이에 한정되지 않는다.
과요오드화물 산화제로는, 바람직하게 BAIB(bis(acetoxy)iodobenzene) 또는 PIFA(phenyliodine bis(trifluoroacetate))이 사용될 수 있다.
용매로는 클로로포름을 사용할 수 있으나, 이에 제한되지 않는다.
상기 화학식 1-3 및 화학식 4에서 PG는 보호기로서, tert-부틸디메틸실릴옥시메틸일 수 있으나, 이에 제한되지 않는다.
상기 화학식 4의 화합물은, 문헌(Chem. Comm., 2009, 782; Org. Lett., 2010, 12: 2826)에 의거하여 얻은 입체선택적인 말론아미드 에스테르를 환원하여 N,N-치환된-(2S)-알킬-1,3-아미노알코올을 합성하고, 히드록시기에 O-치환기 도입과 하이드로보레이션(hyrdoboration) 후 과산화수소 처리로 N,N-치환된-4-알킬-1,5-아미노알코올을 생성함으로써 제조할 수 있다.
바람직하게는, 상기 방법에서 탈보호 단계를 추가로 포함하여 화학식 1-3의 화합물로부터 화학식 1-6의 화합물을 수득할 수 있다:
[화학식 1-6]
상기 식에서,
R1 및 R2는 동일하거나 상이하며, 각각 독립적으로 C5-C14 아릴 또는 C5-C14 헤테로아릴이고, 상기 아릴 또는 헤테로아릴은 할로겐, C1-C6 알킬, C1-C6 알콕시, 및 -NR7R8로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고, 또는 R1과 R2가 서로 연결되어, 이들이 결합된 질소원자를 포함하여, 5원 내지 8원 헤테로사이클릭 고리를 형성하고, 상기 헤테로사이클릭 고리는 다른 C5-C14 아릴과 융합되거나, 할로겐 또는 C1-C6 알킬 로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고;
R5는 수소, 히드록시, 할로겐, 또는 C5-14 아릴-C1-6 알콕시이며;
R7 및 R8은 동일하거나 상이하며, 각각 독립적으로 수소 또는 C1-C6 알킬을 나타낸다.
한편, 히드록시기의 탈보호 반응은 공지된 방법중 보호기에 따라 적합한 방법을 선택하여 수행할 수 있다(참고: Protective Groups in Organic Synthesis, 4th Ed.).
바람직하게는, 상기 본 발명의 제조 방법은 여과, 건조, 세척, 정제하는 단계 또는 이들의 조합을 추가로 포함할 수 있다. 상기 여과, 건조, 세척, 및 정제하는 단계는 당업계에서 공지된 방법을 제한 없이 이용하여 수행될 수 있다.
다른 양태로서, 본 발명은 하기 화학식 5의 화합물을 산화적 고리화 반응에 의해 화학식 1-4의 화합물로 전환시키는 단계를 포함하는, 화학식 1-4로 표시되는 화합물의 제조 방법을 제공한다:
[화학식 1-4]
[화학식 5]
상기 식에서,
R1 및 R2는 동일하거나 상이하며, 각각 독립적으로 C5-C14 아릴 또는 C5-C14 헤테로아릴이고, 상기 아릴 또는 헤테로아릴은 할로겐, C1-C6 알킬, C1-C6 알콕시, 및 -NR7R8로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고, 또는 R1과 R2가 서로 연결되어, 이들이 결합된 질소원자를 포함하여, 5원 내지 8원 헤테로사이클릭 고리를 형성하고, 상기 헤테로사이클릭 고리는 다른 C5-C14 아릴과 융합되거나, 할로겐 또는 C1-C6 알킬 로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고;
R7 및 R8은 동일하거나 상이하며, 각각 독립적으로 수소 또는 C1-C6 알킬을 나타내며;
PG는 보호기를 의미한다.
상기 반응은 하기 반응식 4로 표시될 수 있다.
[반응식 4]
화학식 5 화학식 1-4
상기 방법에 있어서, 산화적 고리화 반응은 테트라하이드로피란 고리를 형성하기 위한 반응으로서, 촉매량의 라디칼 존재하에서 요오드 또는 과요오드화물(hypervalent iodine) 산화제를 사용하여 수행될 수 있다.
상기 고리화 반응에 있어서 촉매량으로 사용하는 라디칼은 TEMPO((2,2,6,6-tetramethylpiperidin-1-yl)oxidanyl) 또는 그 유도체일 수 있으나, 이에 한정되지 않는다.
과요오드화물 산화제로는, 바람직하게 BAIB(bis(acetoxy)iodobenzene) 또는 PIFA(phenyliodine bis(trifluoroacetate))이 사용될 수 있다.
용매로는 클로로포름을 사용할 수 있으나, 이에 제한되지 않는다.
상기 화학식 1-4 및 화학식 5에서 PG는 보호기로서, tert-부틸디메틸실릴옥시메틸일 수 있으나, 이에 제한되지 않는다.
상기 화학식 5의 화합물은, 문헌(European Journal of Organic Chemistry, 2012, 2012(29): 5818-5827)에 의거하여 얻은 2-알킬-1,3-디알코올을 선택적으로 O-치환기 도입 및 요오드화하여 요오드화물을 수득하고, N,N-치환된 아민유도체와 치환 반응을 통해 N,N-치환된-1,3-아미노알코올을 합성한 다음, 하이드로보레이션(hyrdoboration) 후 과산화수소 처리로 N,N-치환된-4-알킬-1,5-아미노알코올을 생성함으로써 제조할 수 있다.
바람직하게는, 상기 방법에서 탈보호 단계를 추가로 포함하여 화학식 1-4의 화합물로부터 화학식 1-7의 화합물을 수득할 수 있다:
[화학식 1-7]
상기 식에서,
R1 및 R2는 동일하거나 상이하며, 각각 독립적으로 C5-C14 아릴 또는 C5-C14 헤테로아릴이고, 상기 아릴 또는 헤테로아릴은 할로겐, C1-C6 알킬, C1-C6 알콕시, 및 -NR7R8로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고, 또는 R1과 R2가 서로 연결되어, 이들이 결합된 질소원자를 포함하여, 5원 내지 8원 헤테로사이클릭 고리를 형성하고, 상기 헤테로사이클릭 고리는 다른 C5-C14 아릴과 융합되거나, 할로겐 또는 C1-C6 알킬 로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고;
R7 및 R8은 동일하거나 상이하며, 각각 독립적으로 수소 또는 C1-C6 알킬을 나타낸다.
한편, 히드록시기의 탈보호 반응은 공지된 방법중 보호기에 따라 적합한 방법을 선택하여 수행할 수 있다[참고: Protective Groups in Organic Synthesis, 4th Ed.].
바람직하게는, 상기 본 발명의 제조 방법은 여과, 건조, 세척, 정제하는 단계 또는 이들의 조합을 추가로 포함할 수 있다. 상기 여과, 건조, 세척, 및 정제하는 단계는 당업계에서 공지된 방법을 제한 없이 이용하여 수행될 수 있다.
본 발명에 따른 화학식 1로 표시되는 화합물, 이의 입체이성질체 또는 이의 약학적으로 허용 가능한 염은 합성된 화합물들이 산업적 이용가능성의 한 예로서 LPS(lipid polysaccharide)에 의해 유도된 "미세아교세포 활성화(microglial activation)" 억제와 6-OHDA(6-hydroxydopamine)에 의한 도파민 세포 사멸(dopaminergic cell death) 억제 효과를 통해 신경계 질환의 예방 또는 치료에 있어서 유용하게 사용될 수 있다.
이에, 본 발명의 다른 구현예에 따르면, 본 발명은 상기 화학식 1의 화합물, 이의 입체이성질체 또는 이의 약학적으로 허용 가능한 염을 유효 성분으로 포함하는 신경계 질환의 예방 및 치료용 약학 조성물을 제공한다.
상기 신경계 질환은 미세아교세포 활성화를 억제시키는 치료를 필요로 하는 신경 질환을 의미하는 것일 수 있다. 또한, 상기 신경계 질환은 특히 뇌 신경계 및 중추 신경계 질환을 포함할 수 있다.
보다 구체적으로, 상기 신경계 질환은, 미세아교세포 활성화를 억제시키는 치료, 보다 바람직하게는 도파민 수용체에 작용하여 미세아교세포의 활성화를 억제시키는 치료를 필요로 하는 신경 질환으로, 그 예로는 허혈성 뇌질환, 퇴행성 뇌질환, 알츠하이머병, 파킨슨병, 헌팅턴병 등을 포함하나, 본 발명이 이에 한정되는 것은 아니다.
뇌 중엽에 분포하는 흑체(substantia nigra)에는 미세아교세포가 고농도로 분포하며, 미세아교세포 세포에 도파민 수용체중 D1 혹은 D2 서브타입이 특징적으로 존재하는 것으로 알려져 있다. 또한, 도파민은 D1 수용체에 결합하여 미세아교세포의 활성을 조절하여 NO의 발생양을 조절하는 것으로 알려져 있다. 미세아교세포의 과활성화는 도파민 뉴런의 파괴를 유발한다. 본 발명의 신규 2-치환된 테트라하이드로피란은 LPS(lipid polysaccharide)에 의해 유도된 "미세아교세포 활성화" 억제 지표인 NO의 발현 억제 효과가 있으며, 6-OHDA에 의한 도파민 세포사멸을 억제효과는 나타내는 것으로 확인되었으므로, 이러한 메커니즘에 의해 신경계 질환을 유용하게 치료할 수 있다. 그러나, 반드시 상기 메커니즘으로만 본 발명의 화합물의 효과가 한정되지는 않는다.
본 발명에 따른 화학식 1의 화합물, 이의 입체이성질체 또는 이의 약학적으로 허용 가능한 염, 수화물, 또는 용매화물은 그 자체로 세포보호 활성을 가지나, 체내에 흡수된 후 특수한 체내 환경에 의해 혹은 대사과정의 산물 등이 효능제로서 약리작용을 나타낼 가능성도 배제하지는 않는다.
이에 따라 본 발명에 따른 화학식 1의 화합물, 이의 입체이성질체 또는 약학적으로 허용가능한 염, 수화물, 또는 용매화물의 약학적 투여 형태는, 이들의 약학적으로 허용 가능한 염 또는 용매화물의 형태로도 사용될 수 있다.
본 발명에서 사용되는 용어, "예방"이란, 본 발명에 따른 약학적 조성물을 개체에 투여하여 신경계 질환의 발병을 억제하거나 지연시키는 모든 행위를 의미할 수 있다.
본 발명에서 사용되는 용어, "치료"란, 본 발명에 따른 약학적 조성물을 개체에 투여하여 신경계 질환의 증세가 호전되도록 하거나 이롭게 되도록 하는 모든 행위를 의미할 수 있다.
본 발명의 약학 조성물은 약학적으로 허용 가능한 담체, 부형제 또는 희석제를 추가로 포함할 수 있다.
본 발명에서 사용되는 용어, "약학적으로 허용 가능한 담체"란 생물체를 자극하지 않으면서, 주입되는 화합물의 생물학적 활성 및 특성을 저해하지 않는 담체 또는 희석제를 의미할 수 있다. 본 발명에 사용 가능한 상기 담체의 종류는 특별히 제한되지 아니하며 당해 기술 분야에서 통상적으로 사용되고 약학적으로 허용되는 담체라면 어느 것이든 사용할 수 있다. 상기 담체의 비제한적인 예로는, 식염수, 멸균수, 링거액, 완충 식염수, 알부민 주사 용액, 덱스트로즈 용액, 말토덱스트린 용액, 글리세롤, 에탄올 등을 들 수 있다. 이들은 단독으로 사용되거나 2 종 이상을 혼합하여 사용될 수 있다. 또한, 필요한 경우 항산화제, 완충액 및/또는 정균제 등 다른 통상의 첨가제를 첨가하여 사용할 수 있다.
상기 약학적 조성물은 정제, 환제, 산제, 과립제, 캡슐제, 현탁제, 내용액제, 유제, 시럽제, 멸균된 수용액, 비수성용제, 현탁제, 유제, 동결건조제제 및 좌제으로 이루어진 군으로부터 선택되는 어느 하나의 제형을 가질 수 있으며, 경구 또는 비경구의 여러 가지 제형일 수 있다. 제제화할 경우에는 보통 사용하는 충진제, 증량제, 결합제, 습윤제, 붕해제, 계면활성제 등의 희석제 또는 부형제를 사용하여 조제된다. 경구투여를 위한 고형제제에는 정제, 환제, 산제, 과립제, 캡슐제 등이 포함되며, 이러한 고형제제는 하나 이상의 화합물에 적어도 하나 이상의 부형제 예를 들면, 전분, 탄산칼슘, 수크로오스(sucrose) 또는 락토오스(lactose), 젤라틴 등을 섞어 조제된다. 또한 단순한 부형제 이외에 스테아린산 마그네슘, 탈크 등과 같은 윤활제들도 사용될 수 있다. 경구투여를 위한 액상제제로는 현탁제, 내용액제, 유제, 시럽제 등이 해당되는데 흔히 사용되는 단순 희석제인 물, 리퀴드 파라핀 이 외에 여러 가지 부형제, 예를 들면 습윤제, 감미제, 방향제, 보존제 등이 포함될 수 있다. 비경구투여를 위한 제제에는 멸균된 수용액, 비수성용제, 현탁제, 유제, 동결건조제제, 좌제가 포함된다. 비수성용제, 현탁용제로는 프로필렌글리콜(propylene glycol), 폴리에틸렌 글리콜, 올리브 오일과 같은 식물성 기름, 에틸올레이트와 같은 주사 가능한 에스테르 등이 사용될 수 있다. 좌제의 기제로는 위텝솔(witepsol), 마크로골, 트윈(tween) 61, 카카오지, 라우린지, 글리세로젤라틴 등이 사용될 수 있다.
본 발명의 약학적 조성물은 단일제제로도 사용할 수 있다. 또한 1 종류 이상의 다른 신경계 질환 치료제를 추가로 포함하여 복합제제로 제조하여 사용할 수 있다.
또 하나의 양태로서, 본 발명은 상기 약학적 조성물을 유효량으로 필요한 개체에 투여하는 단계를 포함하는 신경계 질환의 예방 또는 치료 방법을 제공한다. 상기 약학 조성물은 전술한 화학식 1의 화합물, 이의 입체이성질체, 또는 이의 약학적으로 허용가능한 염을 유효성분으로 포함하는, 신경계 질환의 예방 또는 치료용 약학적 조성물을 의미한다.
본 발명에서 사용된 용어, "투여"는 적절한 방법으로 개체에게 본 발명의 약학적 조성물을 도입하는 것을 의미하며, 본 발명의 약학적 조성물의 투여 경로는 목적 조직에 도달할 수 있는 한 어떠한 일반적인 경로를 통하여 투여될 수 있다. 복강내 투여, 정맥내 투여, 근육내 투여, 피하 투여, 피내 투여, 경구 투여, 국소 투여, 비내 투여, 폐내 투여, 직장내 투여, 자궁 내 경막 또는 뇌혈관(intracerbroventricular) 주사에 의해 투여될 수 있으나, 이에 제한되지는 않는다.
본 발명에서 사용된 용어, "개체"는 신경계 질환이 발병하였거나 발병할 수 있는 인간을 포함한 모든 동물을 의미한다. 본 발명의 약학적 조성물을 개체에게 투여하여 신경계 질환을 효과적으로 예방 또는 치료할 수 있다.
상기 용어, "유효량"은 약학적으로 유효한 양으로, 의학적 치료에 적용 가능한 합리적인 수혜/위험 비율로 질환을 치료하기에 충분하며 부작용을 일으키지 않을 정도의 양을 의미하며, 유효 용량 수준은 환자의 성별, 연령, 체중, 건강상태, 질병의 종류, 중증도, 약물의 활성, 약물에 대한 민감도, 투여 방법, 투여 시간, 투여 경로, 및 배출 비율, 치료기간, 배합 또는 동시에 사용되는 약물을 포함한 요소 및 기타 의학 분야에 잘 알려진 요소에 따라 당업자에 의해 용이하게 결정될 수 있다. 일반적으로, 유효 성분을 약 0.01 mg/kg/일 내지 1000 mg/kg/일의 용량으로 투여할 수 있다. 경구 투여하는 경우, 50 내지 500 mg/kg의 범위가 적합할 수 있으며, 1일 1회 이상 투여할 수 있다.
본 발명에 따른 신규 2-치환된 테트라하이드로피란 또는 2-치환된 테트라하이드로퓨란 유도체 화합물, 이의 입체이성질체, 또는 이의 약학적으로 허용 가능한 염은 산업적 이용가능성의 한 예로서 LPS(lipid polysaccharide)에 의해 유도된 "미세아교세포 활성화(microglial activation)" 억제와 6-OHDA(6-hydroxydopamine)에 의한 세포 사멸(cell death) 억제 효과를 통해 신경계 질환의 예방 또는 치료용 약학적 조성물로 유용하게 사용될 수 있다. 또한, 본 발명에 따른 제조방법은 2-치환된 테트라하이드로피란 또는 2-치환된 테트라하이드로퓨란 유도체를 효율적으로 합성할 수 있는 효과가 있다.
도 1은 본 발명의 실시예 화합물 6 및 7과 비교예 "6-shogaol" 화합물의, 신경 독성 물질(LPS)을 처리한 신경세포주(murine microglial BV-2 cells)에서 니트라이트(nitrite)의 생성 억제를 보여주는 도면이다.
도 2는 본 발명의 실시예 화합물들의 LPS에 의해 감소된 신경세포주(murine microglial BV-2 cells)에서 세포생존율에 대한 효과를 나타낸 도이다.
도 3은 본 발명의 실시예 화합물 6 와 비교예 "Ropinirole" 화합물에 의해, 신경 독성 물질(6-hydroxy dopamine)이 처리된 세포주(SH-SY5Y)의 생존율 증가를 보여주는 도면이다.
도 2는 본 발명의 실시예 화합물들의 LPS에 의해 감소된 신경세포주(murine microglial BV-2 cells)에서 세포생존율에 대한 효과를 나타낸 도이다.
도 3은 본 발명의 실시예 화합물 6 와 비교예 "Ropinirole" 화합물에 의해, 신경 독성 물질(6-hydroxy dopamine)이 처리된 세포주(SH-SY5Y)의 생존율 증가를 보여주는 도면이다.
본 발명은 다양한 변경을 가할 수 있고 여러 가지 형태를 가질 수 있는바, 특정 실시예들을 예시하고 하기에서 상세하게 설명하고자 한다. 그러나, 이는 본 발명을 특정한 개시 형태에 대해 한정하려는 것이 아니며, 본 발명의 사상 및 기술 범위에 포함되는 모든 변경, 균등물 내지 대체물을 포함하는 것으로 이해되어야 한다.
이하, 본 발명을 상세하게 설명한다.
실시예
1:
N,N
-
비스(4-메톡시페닐)테트라하이드로퓨란
-2-
아민의
합성
단계 1) 에틸 4-
비스
-4-
메톡시페닐아미노
-4-
옥소부타노에이트(
ethyl 4-bis(4-methoxyphenyl)amino-4-oxobutanoate:
3a
)의 제조
N,N'-디메톡시디페닐아민(4,4-dimethoxydiphenylamine: 2a ) 3 g을 메틸렌 클로라이드(CH2Cl2) 48 mL에 용해하고 얼음수조(ice-bath)에서 교반한 다음, 에틸 4-클로로-4-옥소부타노에이트(ethyl 4-chloro-4-oxobutanoate: 1) 2.56 mL을 서서히 적가하였다. TLC 상에서 생성물이 더이상 증가하지 않는 것을 확인한 후 얼음수조에서 증류수을 넣어 반응을 종료한 후, 반응 혼합물을 메틸렌클로라이드로 희석하고 물과, 포화 염화나트륨 수용액으로 세척하였다. 유기상은 황산 나트륨에서 건조하여 진공에서 농축하였다. 조 생성물은 Acetone: Hex(1:5)의 이동상을 이용하는 실리카 겔 상에서 컬럼 크로마토그래피(flash column chromatography)를 이용하여 정제하여 4.9 g의 에틸 4-비스-4-메톡시페닐아미노-4-옥소부타노에이트(ethyl 4-bis(4-methoxyphenyl)amino-4-oxobutanoate: 3a )를 수득하였다.
1H-NMR (600 MHz, CDCl3) δ 7.15~7.24 (m, 4H), 6.80~6.91 (m, 4H), 4.09~4.13 (m, 2H), 3.79 (s, 3H), 3.73 (s, 3H), 2.57~2.61 (m, 2H), 2.48~2.50 (m, 2H), 1.21~1.23 (m, 3H);
13C-NMR (600 MHz, CDCl3) δ 176.9, 173.1, 172.1 159.0, 157.5, 135.9, 135.7, 129.6, 127.4, 115.0, 114.1, 60.5, 55.5, 55.4, 30.0, 29.0, 14.2 ppm.
단계 2) 4-
비스
-4-
메톡시페닐
-
아미노부탄올(
4-bis-4-
methoxyphenyl
-aminobutan-1-ol:
4a
)의 제조
무수 진공상태의 리튬알루미늄하이드라이드(LiAlH4)에 무수 부틸에테르 를 적가한 다음, 아르곤 기류하에서 140℃로 환류, 가열 및 교반하였다. 140℃에서 에틸 4-비스-4-메톡시페닐아미노-4-옥소부타노에이트( 3a ) 2g을 무수 부틸에테르에 녹인 용액을 캐뉼러(cannular)로 옮긴 후, 30 여분간 동일한 온도에서 교반하였다. 반응액을 얼음수조에서 냉각하고 23 mL의 디에틸에테르와 증류수 1.7 mL을 넣어 반응을 종료한후, 15% 수산화나트륨 1.7 mL와 물 5.1 mL을 차례로 넣으며 교반한 후, 교반 후 생긴 슬러리에 황산 나트륨을 넣어 건조하고 필터한 후 진공에서 농축하였다. 조 생성물은 EtOAc: Hex(1:1)의 이동상을 이용하는 실리카 겔 상에서 컬럼 크로마토그래피를 이용하여 정제하여 4-비스-4-메톡시페닐-아미노부탄올(4-bis-4-methoxyphenyl-aminobutan-1-ol: 4a ) 1.2 g을 수득하였다.
1H-NMR (600 MHz, CDCl3) δ 6.88~6.89 (m, 4H), 6.81~6.87 (m, 4H), 3.78 (s, 6H), 3.63~3.65 (m, 2H), 3.59~3.61 (m, 2H), 1.67~1.72 (m, 2H), 1.60~1.65 (m, 2H);
13C-NMR (600 MHz, CDCl3) δ 154.3, 142.50, 122.2, 114.6, 62.7, 55.61, 52.72, 30.38, 24.08 ppm.
단계 3) 4-
비스
-4-
메톡시페닐
-테트라하이드로퓨란-2-
아민(
N,N
-
bis(4-methoxyphenyl)
tetrahydrofuran-2-amine)의 제조
4-비스-4-메톡시페닐-아미노부탄올( 4a )을 200 mg 을 클로로포름 6 mL에 용해하고 얼음수조에서 교반한 다음, 포화 중탄산나트륨 수용액 2 mL을 적가하고, 요오드(Iodine) 200 mg과 TEMPO(2,2,6,6-Tetramethylpiperidin-1-yl)oxyl 10 mg을 넣고 교반하였다. 반응액에서 더 이상 생성물의 증가가 관찰되지 않을 때, 포화 중탄산나트륨 수용액과 포화 중아황산나트륨(sodium bisulfite) 수용액으로 반응을 종결한 후, 반응 혼합물을 디에틸에테르로 희석하고 물과, 포화 염화나트륨 수용액으로 세척하였다. 유기상은 황산 나트륨에서 건조하여 진공에서 농축하였다. 조 생성물은 Acetone: Hex: NH4OH(aq)(1:10: 0.1)의 이동상을 이용하는 실리카 겔 상에서 컬럼 크로마토그래피를 이용하여 정제하여 90 mg의 실시예 화합물, 4-비스-4-메톡시페닐-테트라하이드로퓨란-2-아민(N,N-bis(4-methoxyphenyl)tetrahydrofuran-2-amine)을 수득하였다.
1H-NMR (600 MHz, CDCl3) δ 1.29~1.44 (m, 3H), 1.87~1.91 (m, 1H), 3.29 (s, 6H), 3.76~3.79 (m, 1H), 3.82~3.86 (m, 1H), 4.69~4.71 (m, 1H), 6.74~6.81 (m, 4H), 7.29~7.31 (m, 4H);
13C-NMR (600 MHz, CDCl3) δ 17.21, 33.97, 54.61, 66.06, 87.46, 95.47, 114.28, 125.89, 141.35, 156.04 ppm;
HRMS (ESI): calcd for C18H21NO3 [M]: 299.1521, found: 299.1521.
실시예
2:
N,N
-
디페닐테트라하이드로퓨란
-2-
아민의
합성
실시예 1의 단계 1에서 N,N'-디메톡시디페닐아민 대신 디페닐아민을 사용한 것을 제외하고는 상기 실시예 1과 동일한 방법으로 합성하였다.
1H-NMR (600 MHz, CDCl3) δ 6.8~7.3 (m, 10H), 4.63~4.65 (m, 1H), 3.68~3.80 (m, 2H), 2.04~2.05 (m, 2H), 1.76~1.85 (m, 2H) ppm
실시예
3:
N,N
-
비스(4-메톡시페닐)테트라하이드로
-2H-피란-2-
아민의
합성
단계 1)
메틸
5-
비스
-4-
메톡시페닐아미노
-5-
옥소펜타노에이트(methyl 5-(bis
(4-methoxyphenyl)amino)-5-oxopentanoate:
3c
)의 제조
N,N'-디메톡시디페닐아민(4,4-dimethoxydiphenylamine: 2a ) 5 g과 디메틸아미노피리딘(Dimethyl amino pyridine) 530 mg을 무수 메틸렌클로라이드 50 mL에 용해하고 교반하였다. 반응액을 얼음수조에서 교반한 다음, 5-메톡시-5-옥소펜탄산(5-methoxy-5-oxopentanoic acid) 5.5 mL을 적가하고, 동일한 온도에서 충분히 교반하였다. 교반 중인 반응액에 EDC(1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide) 8.4 g을 천천히 나누어 적가하였다(portionwise adding). TLC 상에서 생성물이 더 이상 증가하지 않는 것을 확인한 후 얼음수조에서 증류수을 넣어 반응을 종료한 후, 반응 혼합물을 메틸렌클로라이드로 희석하고 물과, 포화 염화나트륨 수용액으로 세척하였다. 유기상은 황산 나트륨에서 건조하여 진공에서 농축하였다. 조 생성물은 EtOAc: Hex(1:1)의 이동상을 이용하는 실리카 겔 상에서 컬럼 크로마토그래피를 이용하여 정제하여 3.1 g의 메틸 5-비스-4-메톡시페닐아미노-5-옥소펜타노에이트(methyl 5-(bis(4-methoxyphenyl)amino)-5-oxopentanoate)를 수득하였다.
1H-NMR (600 MHz, CDCl3) δ 7.16~7.17 (m, 4H), 6.82~6.90 (m, 4H), 3.79 (s, 3H), 3.74 (s, 3H), 3.6 (s, 3H), 2.34~2.36 (m, 2H), 2.27~2.39 (m, 2H), 1.93~1.97 (m, 2H) ppm.
단계 2) 및 단계 3)
N,N
-
비스(4-메톡시페닐)테트라하이드로
-2H-피란-2-
아민의
제조
상기 단계 1)에서 수득한 메틸 5-비스-4-메톡시페닐아미노-5-옥소펜타노에이트를 반응물로서 사용하는 것을 제외하고는 실시예 1의 단계 2) 및 단계 3)과 동일한 방법으로 상기 표제 화합물 N,N-비스(4-메톡시페닐)테트라하이드로-2H-피란-2-아민을 70%의 수율로 합성하였다.
1H-NMR (600 MHz, CDCl3) δ 1.20~1.30 (m, 2H), 1.34~1.41 (m, 2H), 1.52~1.54 (m, 2H), 3.30~3.36 (m, 7H), 3.91~3.93 (m, 1H), 4.88~4.90 (m, 1H), 6.83~6.85 (m, 4H), 7.15~7.18 (m, 4H);
13C-NMR (600 MHz, CDCl3) δ 24.03, 25.42, 31.44, 54.68, 66.66, 87.63, 114.23, 125.33, 140.80, 155.87ppm.
또는, 상기 단계 1 및 단계 2를 대신하여 다음의 경로를 통해 합성하였다.
상기 화학식 2의 화합물은 문헌(J. Am. Chem. Soc., 2015, 137: 6120-6123)에 의거하여 합성한 O-실릴 치환된 5-아이오도펜탄-1-올과 N,N-치환된 아민 유도체의 치환 반응 후 실릴 보호기를 제거하는 반응으로부터 N,N-치환된-1,5-아미노알코올을 수득함으로써 제조하였다.
실시예
4:
N,N
-
비스
(4-
메톡시페닐
)-4-
페닐테트라하이드로
-2H-피란-2-
아민의
합성
단계 1)에서 5-메톡시-5-옥소펜탄산 대신 3-페닐-5-메톡시-5-옥소펜탄산을 사용한 것을 제외하고는 실시예 3과 동일한 방법으로 표제 화합물 N,N-비스(4-메톡시페닐)-4-페닐테트라하이드로-2H-피란-2-아민을 89%의 수율로 합성하였다.
1H-NMR (600 MHz, CDCl3) δ 1.30~1.34 (m, 1H), 1.44~1.51 (m, 1H), 1.59~1.65 (m, 1H), 1.87~1.90 (m, 1H), 2.54~2.59 (m, 1H), 3.31 (s, 6H), 3.34~3.40 (m, 1H), 3.97~4.00 (m, 1H), 4.96~4.98 (m, 1H), 6.78~6.83 (m, 4H), 6.93~6.95 (m, 2H), 7.00~7.03 (m, 1H), 7.07~7.09 (m, 2H), 7.14~7.16 (m, 4H);
13C-NMR (600 MHz, CDCl3) δ 32.87, 39.15, 54.64, 65.99, 87.73, 114.27, 125.45, 126.25, 127.84, 127.97, 128.46, 140.79, 145.25, 155.96 ppm.
실시예
5:
3,3,4,4,5,5-
헥사플루오로
-
N,N
-
비스(4-메톡시페닐)테트라하이드로
-2H-피란-2-아민의 합성
단계 1)
메틸
5-
비스
-4-
메톡시페닐아미노
--2,2,3,3,4,4-
헥사플루오로
-5-
옥소펜타노에이트
(methyl 5-(
bis(4-methoxyphenyl)amino
)-2,2,3,3,4,4-
hexafluoro
-5-oxopentanoate:
3e
)의 제조
N,N '-디메톡시디페닐아민(4,4-dimethoxydiphenylamine: 2a ) 1.67 g 과 디메틸아미노피리딘 178 mg을 테트라하이드로퓨란 5 mL과 혼합하고, 얼음수조에서 교반하였다. 냉각된 반응액에 3,3,4,4,5,5-헥사플루오로디히드로-2H-피란-2,6(H)-디온(3,3,4,4,5,5-hexafluorodihydro-2H-pyran-2,6(3H)-dione) 1 mL을 천천하 적가하였다. 이어서, 혼합물의 온도를 약 10℃까지 승온하고, 혼합물을 동일한 온도에서 1시간 동안 교반하였다. 얻어진 반응물을 화합물 EDC(1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide) 1.4 g 및 메탄올 1 mL을 첨가하고, 실온에서 3시간 동안 교반하였다. TLC 상에서 생성물이 더이상 증가하지 않는 것을 확인한 후 얻어진 용액을 정치시키고, 에틸아세테이트를 충분히 가한 후 5% 염화수소 수용액을 이어서 적가한 후 분리하여 유기층을 회수하였다. 얻어진 유기상은 황산 나트륨에서 건조하여 진공에서 농축하였다. 조 생성물은 EtOAc: Hex(1:1)의 이동상을 이용하는 실리카 겔 상에서 컬럼 크로마토그래피를 이용하여 정제하여 1g의 메틸 5-비스-4-메톡시페닐아미노-2,2,3,3,4,4-헥사플루오로-5-옥소펜타노에이트(methyl 5-(bis(4-methoxyphenyl)amino)-2,2,3,3,4,4-hexafluoro-5-oxopentanoate: 3e )를 수득하였다.
단계 2) 및 단계 3) 3,3,4,4,5,5-
헥사플루오로
-
N,N
-
비스(4-메톡시페닐)테트라하이드로
-2H-피란-2-아민의 제조
상기 단계 1)에서 수득한 메틸 5-비스-4-메톡시페닐아미노-2,2,3,3,4,4-헥사플루오로-5-옥소펜타노에이트를 반응물로서 사용하는 것을 제외하고는 실시예 1의 단계 2) 및 단계 3)과 동일한 방법으로 상기 표제 화합물 3,3,4,4,5,5-헥사플루오로-N,N-비스(4-메톡시페닐)테트라하이드로-2H-피란-2-아민을 45%의 수율로 합성하였다.
1H-NMR (600 MHz, C6D6) δ 7.10 -7.13 (m, 4H), 6.69 -6.72 (m, 4H), 5.10 -5.14 (m, 1H), 3.49 -3.55 (m, 1H), 3.25 (s, 6H), 2.89 -2.97 (m, 1H);
13C-NMR (150MHz, C6D6) δ 157.7, 140.3 114.9, 88.0, 78.0, 70.7, 65.2, 63.6, 55.2, 34.4, 32.7, 29.7, 25.5, 23.5, 14.7 ppm;
HRMS (ESI+): calcd for C19H23NO3 + [M+H]+: 422.1191, found: 422.1195.
실시예
6:
(
2R,3S
)-3-((
tert
-
부틸디메틸실릴옥시
)
메틸
)-
N,N
-
비스(4-메톡시페닐)테트라하이드로
-2H-피란-2-아민의 합성
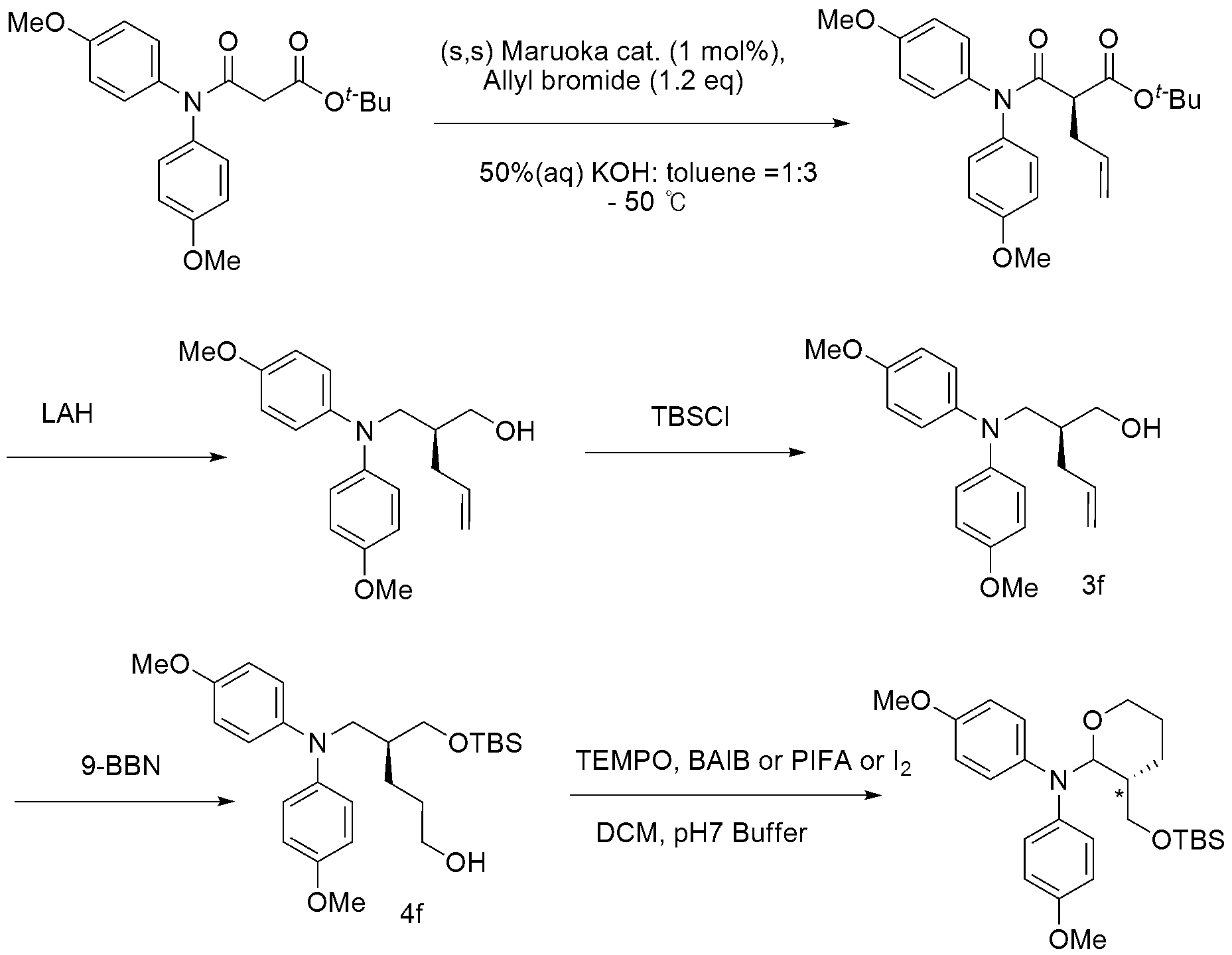
단계 1) (2S)-N-3차-
부틸다이메틸실릴옥시메틸
펜-4-텐-1-일-4-메톡시-N-4-메톡시페닐아닐린((S)-N-(2-(((tert-butyldimethylsilyl)oxy)methyl)pent-4-en-1-yl)-4-methoxy-N-(4-methoxyphenyl)aniline:
3f
)의 제조
문헌(Chem. Comm., 2009, 782)에 기재된 방법에 의해 화합물(2S)-비스-4-메톡시페닐아미노메틸펜-4-텐-1-올((2S)-bis-4-methoxyphenylaminomethylpent-4-en-1-ol) 1g을 합성하여 얻은 후, 3차부틸디메틸실릴 클로라이드(tert-Butyldimethylsilyl chloride) 460 mg 와 이미다졸 400 mg와 혼합하고, 무수 테트라하이드로피란을 적가하였다. 상온에서 교반하며 디이소프로필에틸아민 1 mL을 천천히 적가하고 교반하였다. TLC 상에서 생성물이 더이상 증가하지 않는 것을 확인한 후, 종결된 반응액을 EtOAc로 희석하고 소금물로 세척하였다. 유기층은 무수 황산 나트륨에서 건조하여 여과하고 감압 농축하였다. 조 생성물은 EtOAc: Hex(3:1)의 이동상을 이용하는 실리카 겔 상에서 컬럼 크로마토그래피를 이용하여 정제하여 1g의 (2S)-N-3차-부틸다이메틸실릴옥시메틸 펜-4-텐-1-일-4-메톡시-N-4-메톡시페닐아닐린((S)-N-(2-(((tert-butyldimethylsilyl)oxy)methyl)pent-4-en-1-yl)-4-methoxy-N-(4-methoxyphenyl)aniline: 3f )를 수득하였다.
1H-NMR (600 MHz, CDCl3) δ 6.93~6.94 (m, 4H), 6.79~6.80 (m, 4H), 5.71~5.78 (m, 1H), 4.98~5.01 (m, 2H), 3.77 (s, 6H), 3.67~3.73 (m, 2H), 3.47~3.53 (m, 2H), 2.13~2.15 (m, 2H), 1.92 (m, 1H), 0.91 (s, 9H), 0.02 (s, 6H);
3C-NMR (600 MHz, CDCl3) δ 154.4, 143.2, 137.0, 122.5, 116.5, 114.7, 62.5, 55.7, 54.3, 39.1, 33.9, 26.1, 18.4, -5.3, -5.4 ppm.
단계 2)
메틸
(
2S
)-5-
비스
-4-
메톡시페닐아미노
-4-
tert
-
부틸다이메틸실릴옥시메틸
펜탄-1-올 ((
S
)-5-
bis(4-methoxyphenyl)amino
-4-
tert
-butyldimethylsilyloxymethylpentan-1-ol:
4f
)의 제조
진공 처리된 9-BBN 590 mg을 무수 테트라하이드로피란에 용해한 후, 무수 테트라하이드로피란에 용해된 부틸다이메틸실릴옥시메틸 펜-4-텐-1-일-4-메톡시-N-4-메톡시페닐아닐린( 3f ) 1 g 용액을 상온에서 주의깊게 천천히 가한 뒤 하루 동안 교반하였다. 0℃에서 메탄올 20 mL, 30% 과산화수소 수용액 2.0 mL, 3몰 농도 수산화나트륨 수용액 3.0 mL를 순서대로 반응액에 조심스럽게 적가한 후, 충분히 교반하였다. 반응액을 에틸아세테이트로 희석한 후, 염수로 세척하고, 무수 황산 나트륨에서 건조 및 여과, 감압증류를 순서대로 수행하였다. 조 생성물은 EtOAc: Hex(1:1)의 이동상을 이용하는 실리카 겔 상에서 컬럼 크로마토그래피를 이용하여 정제하여 560 mg의 메틸 (2S)-5-비스-4-메톡시페닐아미노-4-tert-부틸다이메틸실릴옥시메틸 펜탄-1-올((S)-5-bis(4-methoxyphenyl)amino-4-tert-butyldimethylsilyloxymethylpentan-1-ol: 4f )을 수득하였다.
1H-NMR (600 MHz, CDCl3) δ 6.91~6.92 (m, 4H), 6.79~6.81 (m, 4H), 3.77 (s, 6H), 3.70~3.74 (m, 2H), 3.58~3.60 (m, 2H), 3.54~3.56 (m, 1H), 3.44~3.47 (m, 1H), 1.83 (m, 1H), 1.50~1.62 (m, 1H, shielding with water peaks), 1.41~1.44 (m, 2H), 0.90 (s, 9H), 0.03 (s, 6H);
13C-NMR (600 MHz, CDCl3) δ 154.3, 143.3, 122.5, 114.7, 63.4, 62.7, 55.8, 54.8, 39.1, 30.4, 26.1, 25.3, 18.4, -5.3, -5.4 ppm.
단계 3) (
2R,3S
)-3-((
tert
-
부틸디메틸실릴옥시
)
메틸
)-
N,N
-
비스(4-메톡시페닐)테트라하이드로
-2H-피란-2-아민의 제조
단계 2)에서 수득한 메틸 (2S)-5-비스-4-메톡시페닐아미노-4-tert-부틸다이메틸실릴옥시메틸 펜탄-1-올을 반응물로 사용한 것을 제외하고는 실시예 1의 단계 3과 동일한 방법으로 합성하였으나, 산화제로 요오드뿐 아니라, 비스아세톡시 요오드 벤젠(bisacetoxy-iodobenzene)이나 비스트리플로오르아세톡시 아이오도벤젠(bistrifluoroacetoxy-iodobenzene)을 산화제로 반응하여 수득할 수 있었다. 또한, 포화 중탄산나트륨 수용액 대신 포화 중아황산 나트륨, pH 7 인산 완충액 또는 이미다졸 조건에서도 표제 화합물 (3R)-3-tert-부틸디메틸실릴옥시메틸-N,N-비스-4-메톡시페닐테트라하이드로-2H-피란-2-아민((3R)-3-tert-butyldimethylsilyloxymethyl-N,N-bis(4-methoxyphenyl)tetrahydro-2H-pyran-2-amine)을 60%의 수율로 수득하였다.
1H-NMR (400 MHz, C6D6) δ 7.35~7.37 (m, 4H), 6.80~6.83 (m, 4H), 5.10 (d, J = 10 Hz, 1H), 3.88~3.92 (m, 1H), 3.79~3.83 (m, 1H), 3.49~3.52 (m, 1H), 3.31 (s, 6H), 3.18~3.25 (m, 1H), 1.90~1.94 (m, 1H), 1.80~1.83 (m, 1H), 1.54~1.65 (m, 1H), 1.42~1.47 (m, 1H), 1.21~1.24 (m, 1H), 0.99 (s, 9H), 0.07 (s, 3H), 0.02 (s, 3H);
13C-NMR (600 MHz, C6D6) δ 155.9, 126.0, 114.2, 91.0, 67.3, 63.7, 54.6, 39.9, 27.0, 26.0, 18.2, -5.6, -5.7 ppm.
실시예
7:
((
2R,3S
)-2-(
비스(4-메톡시페닐)아미노
)
테트라하이드로
-2H-피란-3-일)메탄올의 합성
20 mg의 실시예 6의 표제 화합물을 무수 테트라하이드로퓨란 1 mL에 용해하고, 1.0M 테트라부틸암모늄 플로라이드(Tetra butyl ammonium fluoride) 테트라하이드로퓨란 용액 20 uL를 적가하였다. TLC 상에서 기질이 모두 소멸되는 것을 관찰하고, 반응액에 물을 가하여 반응을 종결하였다. 종결된 반응액을 EtOAc로 희석하고 소금물로 세척하였다. 유기층은 무수 황산 나트륨에서 건조하여 여과하고 감압 농축하였다. 조 생성물은 EtOAc: Hex(2:1)에서 EtOAc로 바꾸는 gradient 이동상을 이용하는 실리카 겔 상에서 컬럼 크로마토그래피를 이용하여 정제하여 5 mg의 표제 화합물 (3R)-2-비스-4-메톡시페닐테트라하이드로-2H-2-피란-3-일 메탄올((3R)-2-bis(4-methoxyphenyl)tetrahydro-2H-pyran-3-yl)methanol)을 수득하였다.
1H-NMR (400 MHz, C6D6) δ 7.31~7.33 (m, 4H), 6.78~6.80 (m, 4H), 4.99 (d, J = 9.6 Hz, 1H), 3.84~3.86 (m, 1H), 3.53~3.55 (m, 1H), 3.39~3.42 (m, 1H), 3.31 (s, 6H), 3.10~3.14 (m, 1H), 1.87~1.93 (m, 1H), 1.59~1.62 (m, 1H), 1.35~1.38 (m, 1H), 1.25~1.28 (m, 1H), 1.15~1.20 (m, 1H);
13C-NMR (600 MHz, C6D6) δ 156.4, 126.5, 114.6, 92.5, 67.5, 64.4, 55.0, 39.8, 27.0, 26.0 ppm.
실시예
8:
(
2R,3R,4S,5S
)-3,4,5-
트리스
(
벤질옥시
)-
N,N
-
비스(4-메톡시페닐)테트라하이드로
-2H-피란-2-아민의 합성
단계 1) (2S,3R,4S)-2,3,4-트리스(벤질옥시)-5-(비스(4-메톡시페닐)아미노)펜탄-1-올(((2S,3R,4S)-2,3,4-tris(benzyloxy)-5-(bis(4-methoxyphenyl)amino)pentan-1-ol:
4g
)의 제조
2,3,4-트리스-O-(페닐메틸)-α-L-아라비노즈(2,3,4-tris-O-(phenylmethyl)-α-L-Arabinopyranose) 420 mg과 N,N'-디메톡시디페닐아민(4,4-dimethoxydiphenylamine: 2a) 230 mg 을 혼합하고, 에틸아세테이트 10 mL을 적가하였다. 반응액을 상온에서 교반하며 트리플로로아세트 산 0.15 mL을 적가하고, 테트라메틸암모니움트리아세톡시보로하이드라이드(tetramethylammonium triacetoxyborohydride) 320mg을 분획하여 천천히 넣은 뒤, 40℃에서 30 여분간 가온 및 교반한 뒤, 상온에서 교반하였다. TLC 상에서 생성물이 더 이상 증가하지 않는 것을 확인한 후, 종결된 반응액을 EtOAc로 희석하고 포화 중아황산 나트륨 수용액, 포화 중탄산 나트륨 수용액과 염수 순으로 세척하였다. 유기층은 무수 황산 나트륨에서 건조하여 필터하고 감압 농축하였다. 조 생성물은 EtOAc: Hex(2:1)의 이동상을 이용하는 실리카 겔 상에서 컬럼 크로마토그래피를 이용하여 정제하여 230 mg의 (2S,3R,4S)-2,3,4-트리스(벤질옥시)-5-(비스(4-메톡시페닐)아미노)펜탄-1-올(((2S,3R,4S)-2,3,4-tris(benzyloxy)-5-(bis(4-methoxyphenyl)amino)pentan-1-ol: 4g )을 수득하였다.
1H-NMR (600 MHz, CDCl3) δ 3.65~3.70 (m, 1H), 3.73~3.83 (m, 3H), 3.78 (s, 6H), 3.84~3.90 (m, 1H), 3.94~4.04 (m, 2H), 4.33~4.34 (m, 1H), 4.43~4.45 (m, 1H), 4.49~4.52 (m, 1H), 4.61~4.65 (m, 1H), 4.68~4.70 (m, 1H), 6.76~6.78 (m, 4H), 6.92~6.95 (m, 4H), 7.13~7.35 (m, 15H);
13C-NMR (600 MHz, CDCl3) δ 154.3, 142.5, 138.2, 128.3, 127.82, 122.37, 114.6, 79.40, 78.8, 76.14, 74.19, 73.40, 71.66, 60.85, 55.60, 54.38 ppm.
단계 2) (
2R,3R,4S,5S
)-3,4,5-
트리스
(
벤질옥시
)-
N,N
-
비스(4-메톡시페닐)테트라하이드로
-2H-피란-2-아민의 제조
상기 단계 1)에서 수득한 (2R,3R,4S,5S)-3,4,5-트리스벤질록시-5-비스-4-아미노펜탄-1-올을 반응물로서 사용하는 것을 제외하고는 실시예 1의 단계 3)과 동일한 방법으로 상기 표제 화합물 (3R,4S,5S)-3,4,5-트리스(벤질옥시)-N,N-비스(4-메톡시페닐)테트라하이드로-2H-피란-2-아민을 80%의 수율로 합성하였다.
1H-NMR (600 MHz, CDCl3) δ 3.20~3.22 (m, 1H), 3.60~3.63 (m, 1H), 3.70~3.78 (m, 1H), 3.76 (s, 6H), 4.28~4.31 (m, 1H), 4.35~4.37 (m, 1H), 4.56~4.58 (m, 1H), 4.65 (s, 2H), 4.72~4.74 (m, 1H), 4.80~4.89 (m, 2H), 6.67~6.78 (m, 4H), 7.16~7.22 (m, 4H), 7.26~7.47 (m, 15H);
13C-NMR (600 MHz, CDCl3) δ 55.30, 138.36, 128.10, 127.62, 125.21, 114.2, 93.57, 82.92, 75.16, 72.08, 70.76, 63.94, 55.46 ppm;
[α]D 20 = +0.17 (c 0.90, CHCl3); 97.5% ee [chiral HPLC analysis DAICEL ChiralPak AD-H, hexane:2-propanol = 70:30, flow rate = 1.0 mL/min, 23℃, λ = 254 nm, retention time, major 3.31 min, minor 4.62 min].
실시예
9:
N
1
-(4-(디메틸아미노)페닐)-
N
4
,N
4
-디메틸-N
1
-(
테트라하이드로
-2H-피란-2-일)벤젠-1,4-디아민의 합성
N,N'-디메톡시디페닐아민 대신 N,N'-(디메틸아미노)디페닐아민을 사용한 것을 제외하고는 실시예 3과 동일한 방법으로 표제 화합물 N1-(4-(디메틸아미노)페닐)-N4,N4-디메틸-N1-(테트라하이드로-2H-피란-2-일)벤젠-1,4-디아민을 합성하였다.
1H-NMR (600 MHz, C6D6) δ 6.69~7.2 (m, 8H), 4.98~5.2 (m, 1H), 3.95~3.98 (m, 1H), 3.37~3.34 (m, 1H), 2.53~2.56 (s, 12H), 1.04~1.64 (m, 6H).
실시예
10:
N-(4-
메톡시페닐
)-N-(
테트라하이드로
-2H-피란-2-일)피리딘-3-
아민의
합성
N,N'-디메톡시디페닐아민 대신 N-4-메톡시페닐-N'-2-피리딘아민을 사용한 것을 제외하고는 실시예 3과 동일한 방법으로 표제 화합물 N-4-메톡시페닐-N-(테트라하이드로-2H-피란-2-일)피리딘-3-아민을 합성하였다.
1H-NMR (600 MHz, CDCl3) δ 1.21~1.27 (m, 1H, sheided water), 1.43~1.49 (m, 2H), 1.56~1.63 (m, 2H), 1.83~1.86 (m, 1H), 3.60~3.67 (m, 1H), 3.83 (s, 3H), 4.05~4.08 (m, 1H), 4.97~4.99 (m, 1H), 6.91~6.93 (m, 2H), 6.95~6.98 (m, 1H), 7.04~7.06 (m, 2H), 7.11~7.13 (m, 2H), 8.04~8.05 (m, 1H), 8.11 (d, J = 2.4 Hz, 1H) ppm.
실시예
11:
N-(4-
플루오로페닐
)-N-
페닐테트라하이드로
-2H-피란-2-
아민의
합성
N,N'-디메톡시디페닐아민 대신 N-페닐-N'-4-플루오로페닐아민을 사용한 것을 제외하고는 실시예 3과 동일한 방법으로 표제 화합물 N-(4-플루오로페닐)-N-페닐테트라하이드로-2H-피란-2-아민을 99%의 수율로 합성하였다.
1H-NMR (600 MHz, C6D6) δ 6.7~7.2 (m, 9H), 4.77~4.79 (dd, 1H), 3.2~3.8 (m, 2H) , 0.9~1.45 (m, 6H);
13C-NMR (600 MHz, CDCl3) δ 160, 147.8, 141.48, 129, 121.47, 120.92, 115.4, 86.70, 66.69, 29.86, 25.21, 23.85 ppm.
실시예
12: N-(2-
플루오로
-5-
메틸페닐
)-N-
페닐테트라하이드로
-2H-피란-2-
아민의
합성
N,N'-디메톡시디페닐아민 대신 N-(2-플루오르-5-메틸페닐)-N-페닐아민을 사용한 것을 제외하고는 실시예 3과 동일한 방법으로 표제 화합물 N-(2-플루오로-5-메틸페닐)-N-페닐테트라하이드로-2H-피란-2-아민을 84%의 수율로 합성하였다.
1H-NMR (600 MHz, C6D6) δ 7.29~7.31 (m, 1H), 7.17~7.18 (m, 1H), 7.00~7.02 (m, 2H), 6.80~6.87 (m, 3H), 6.66~6.69 (m, 1H), 4.89~4.91 (m, 1H), 3.83~3.85 (m, 1H), 3.20~3.26 (m, 1H), 1.87 (s, 3H), 1.70~1.72 (d, 1H), 1.31~1.44 (m, 3H), 1.13~1.21 (m, 2H);
13C-NMR (600 MHz, C6D6) δ 157.2 (d, J = 241.5 Hz), 148.8, 134.2, 131.3, 129.0, 120.0, 119.0, 117.2, 115.8, 88.0, 66.9, 30.3, 25.5, 24.0, 20.3 ppm.
실시예
13:
N-페닐-N-m-
톨릴테트라하이드로
-2H-피란-2-
아민의
합성
N,N'-디메톡시디페닐아민 대신 N-페닐-N-m-톨릴아민을 사용한 것을 제외하고는 실시예 3과 동일한 방법으로 표제 화합물 N-페닐-N-m-톨릴테트라하이드로-2H-피란-2-아민을 95%의 수율로 합성하였다.
1H-NMR (600 MHz, C6D6) δ 7.14~7.86 (m, 2H), 7.02~7.13 (m, 5H), 6.90~6.93 (m, 1H), 6.80~6.82 (m, 1H), 4.92~4.94 (dd, 1H), 3.85~3.87 (m, 1H), 3.25~3.29 (m, 1H), 2.06 (s, 3H), 1.16~1.26 (m, 6H);
13C-NMR (150 MHz, C6D6) δ 147.6, 146.6, 138.8, 129.5, 129.1, 126.3, 124.6, 123.3, 122.7, 122.5, 118.1, 87.1, 67, 31.6, 25.5, 24.2, 24.1 ppm.
실시예
14:
N-(4-
브로모페닐
)-N-
페닐테트라하이드로
-2H-피란-2-
아민의
합성
N,N'-디메톡시디페닐아민 대신 N-(4-브로모페닐)-N-페닐아민을 사용한 것을 제외하고는 실시예 3과 동일한 방법으로 표제 화합물 N-(4-브로모페닐)-N-테트라하이드로-2H-피란-2-아민을 86%의 수율로 합성하였다.
1H-NMR (600 MHz, C6D6) δ 7.22~7.25 (m, 2H), 7.12~7.16 (m, 2H), 7.05~7.07 (m, 2H), 6.93~6.96 (m, 1H), 6.73~6.76 (m, 2H), 4.72~4.73 (dd, 1H), 3.77~3.80 (m, 1H), 3.15~3.19 (m, 1H), 1.39~1.42 (m, 1H), 1.29~1.31 (m, 1H), 1.06~1.18 (m, 3H), 0.94~0.96 (m, 1H);
13C-NMR (150 MHz, C6D6) δ 146.6, 145.8, 132.1, 129.3, 126, 124.3, 124.7, 115, 86.8, 67, 31.3, 25.4, 24 ppm.
실시예
15:
N-(4-
메톡시페닐
)-N-p-
톨릴테트라하이드로
-2H-피란-2-
아민의
합성
N,N'-디메톡시디페닐아민 대신 N-(4-메톡시페닐)-N-(p-톨릴)아민을 사용한 것을 제외하고는 실시예 3과 동일한 방법으로 표제 화합물 N-(4-메톡시페닐)-N-(p-톨릴)테트라하이드로-2H-피란-2-아민을 80%의 수율로 합성하였다.
1H-NMR (600 MHz, C6D6) δ 7.20~7.23 (m, 2H), 7.03 (s, 4H), 6.77~6.79 (m, 2H), 4.90~4.92 (m, 1H), 3.88~3.90 (m, 1H), 3.32~3.33 (m, 1H), 3.29~3.30 (s, 3H), 2.16 (s, 3H), 1.47~1.51 (m, 2H), 1.15~1.35 (m, 3H), 1.00~1.02 (m, 1H), 0.94~0.96 (m, 1H);
13C-NMR (150 MHz, C6D6) δ 157.6, 146.9, 138.6, 130, 129.8, 129.6, 121.5, 120, 114.9, 87.4, 66.9, 54.8, 53.2, 31.6, 25.7, 24.3, 20.6 ppm.
실시예
16:
N,N
-
디p
-
톨릴테트라하이드로
-2H-피란-2-
아민의
합성
N,N'-디메톡시디페닐아민 대신 N,N-디p-톨릴아민을 사용한 것을 제외하고는 실시예 3과 동일한 방법으로 표제 화합물 N,N-디p-톨릴테트라하이드로-2H-피란-2-아민을 85%의 수율로 합성하였다.
1H-NMR (600 MHz, C6D6) δ 7.11~7.13 (m, 4H), 7.00~7.01 (m, 4H), 4.92~4.94 (m, 1H), 3.86~3.88 (m, 1H), 3.26~3.31 (m, 1H), 2.13 (s, 6H), 1.47~1.49 (m, 2H), 1.30~1.37 (m, 1H), 1.14~1.26 (m, 2H), 0.98~1.00 (m, 1H);
13C-NMR (150 MHz, C6D6) δ 144.9, 132.1, 129.8, 124.4, 87.3, 67, 53.3, 31.6, 25.6, 24.3, 20.7 ppm.
실시예
17:
N,N
-
비스
(4-
메톡시페닐
)-6-
메틸테트라하이드로
-2H-피란-2-
아민의
합성
단계 1) 6-(
비스(4-메톡시페닐)아미노
)
헥산
-2-온의 제조
N,N'-디메톡시디페닐아민(4,4-dimethoxydiphenylamine: 2a ) 500 mg을 탄산칼륨 0.9 g과 요오드화칼륨 0.4 g과 함께 무수 아세토나이크릴 7 mL에 용해하고 교반하였다. 6-클로로헥사논을 넣고 가온하며 환류 교반한 다음, TLC 상에서 생성물이 더이상 증가하지 않는 것을 확인한 후 에틸아세테이트를 넣어 반응액을 희석한 후, 무기 고체를 여과하여 제거하고 진공에서 용매를 농축하였다. 조 생성물은 EtOAc: Hex(1:5->1:10)의 기울기 이동상을 이용하는 실리카 겔 상에서 컬럼 크로마토그래피를 이용하여 정제하여 114 mg의 6-(비스(4-메톡시페닐)아미노)헥산-2-온(6-(bis(4-methoxyphenyl)amino)hexan-2-one)을 수득하였다.
1H-NMR (600 MHz, CDCl3) δ 6.84~6.86 (m, 4H), 6.80~6.81 (m, 4H), 3.77 (s, 6H), 3.55~3.57 (m, 2H), 2.41~2.43 (m, 2H), 2.10 (s, 3H), 1.59~1.64 (m, 4H);
13C-NMR (150 MHz, CDCl3) δ 154.2, 142.4, 122, 114.6, 97.2, 61.3, 59.4, 55.5, 52.3, 43.5, 35.8, 29.8, 27.2, 21.2 ppm;
IR (FT-IR) 3840, 3725, 2916, 2850, 1507, 1240,1219, 772, 649 cm-1;
HRMS (ESI+): calcd for C20H25NO3 + [M+H]+: 328.1913, found: 328.1913
단계 2) 6-(
비스(4-메톡시페닐)아미노
)
헥산
-2-올의 제조
상기 단계 1)에서 수득한 6-(비스(4-메톡시페닐)아미노)헥산-2-온 100 mg을 메탄올 2 ml에 용해한 후, 얼음수조에서 소디움 보로하이드라이드(NaBH4) 36 mg을 천천히 나누어 가하고 교반하였다. 반응이 더이상 진행되지 않을 때, 용매를 농축하였다. 조 생성물은 EtOAc:Hex(1:5->1:2)의 기울기 이동상을 이용하는 실리카 겔 상에서 컬럼 크로마토그래피를 이용하여 정제하여 45 mg의 6-(비스(4-메톡시페닐)아미노)헥산-2-올(6-(bis(4-methoxyphenyl)amino)hexan-2-ol)을 수득하였다.
1H-NMR (600 MHz, CDCl3) δ 6.8~6.86 (m, 8 H), 3.77 (s, 6H), 3.56~3.65 (m, 3 H), 1.59~1.66 (m, 2H), 1.34~1.47 (m, 4H), 1.16~1.17 (d, 3H);
13C-NMR (150 MHz, CDCl3) δ 154.2, 142.5, 122.1, 14.6, 67.9, 55.6, 52.7, 39.0, 32.5, 23.3 ppm.
단계 3)
N,N
-
비스
(4-
메톡시페닐
)-6-
메틸테트라히드론
-2H-피란-2-
아민의
제조
상기 단계 2로부터 수득한 6-(비스(4-메톡시페닐)아미노)헥산-2-올을 반응물로 사용하여 실시예 3의 단계 3과 동일한 방법으로 표제 화합물 N,N-비스(4-메톡시페닐)-6-메틸테트라히드론-2H-피란-2-아민(N,N-bis(4-methoxyphenyl)-6-methyltetrahydro-2H-pyran-2-amine)을 80%의 수율로 합성하였다.
1H-NMR (600 MHz, C6D6) δ 7.12~7.14 (m, 4 H), 6.80~6.81 (m, 4 H), 4.93~4.95 (m, 1 H), 3.37~3.40 (m, 1 H), 3.33 (s, 6H), 1.45~1.56 (m, 2 H), 1.26~1.37 (m, 4H), 1.18~1.25 (d, 3H);
13C-NMR (150 MHz, C6D6) δ 155.8, 140.8, 119.5, 114.6, 114.2, 87.4, 72.3, 54.8, 32.6, 30.6, 23.8, 21.9 ppm.
실시예
18:
2-
아이오도
-2-
메틸
-1-(
테트라하이드로
-2H-피란-2-일)
인돌린의
합성
N,N'-디메톡시디페닐아민 대신 2-메틸인돌린을 사용한 것을 제외하고는 실시예 3과 동일한 방법으로 표제 화합물 2-아이오도-2-메틸-1-테트라하이드로-2H-피란-2-일)인돌린을 69%의 수율로 합성하였다.
1H-NMR (600 MHz, C6D6) δ 7.63~7.66 (m, 1H), 7.63~7.65 (m, 1H), 7.17~7.19 (m, 2H), 6.97~6.98 (m, 1H), 6.16~6.17 (m, 1H), 3.87~3.91 (m, 1H), 3.41~3.44 (m, 2H), 3.13~3.16 (m, 2H), 2.06 (s, 3H), 1.13~1.23 (m, 2H), 1.08~1.13 (m, 2H), 0.93~0.98 (m, 2H);
13C-NMR (600 MHz, C6D6) δ 137.1, 137.0, 130.8, 128.2, 122.1, 121.0, 120.6, 109.5, 77.6, 62.1, 58.6, 53.2, 44.1, 42.9, 33.4, 30, 23.2, 20.5, 13.0 ppm;
HRMS (ESI+): calcd for C14H18INO+ [M+H]+:344.0506, found: 344.0515.
실시예
19:
(
2S,3S,4R,5R
)-3,4,5-
트리스
(
벤질옥시
)-
N,N
-
비스(4-메톡시페닐)테트라하이드로
-2H-피란-2-아민의 합성
실시예 8의 출발물질 (3R,4S,5S)-3,4,5-트리스벤질옥시테트라하이드로-2H-피란-2-올((3R,4S,5S)-3,4,5-tris(benzyloxy)tetrahydro-2H-pyran-2-ol) 대신 (3S,4R,5R)-3,4,5-트리스벤질옥시테트라하이드로-2H-피란-2-올((3S,4R,5R)-3,4,5-tris(benzyloxy)tetrahydro-2H-pyran-2-ol)을 출발물질로 사용한 것을 제외하고는 실시예 8과 동일한 방법으로 합성하여 표제 화합물 (2S,3S,4R,5R)-3,4,5-트리스(벤질옥시)-N,N-비스(4-메톡시페닐)테트라하이드로-2H-피란-2-아민((2R,3R,4S,5S)-Trisbenzyloxy-N,N-bis-4-methoxyphenyl-tetrahydro-2H-pyran-2-amine)을 40%의 수율로 합성하였다.
실험예 1. 세포 기반 신경세포주 보호 활성의 측정
1-1) 세포 기반 활성 측정 방법
1) 세포 배양
인간 신경아세포종(neuroblastoma) SH-SY5Y 세포(American Type Culture Collection, 미국)와 마우스 뇌교세포(microglia) BV2 세포는 습도 95%, 5% CO2 인큐베이터내에서, 10% 열-불활성화된(heat-inactivated) 소 태아 혈청(Fetal Bovine Serum; Hyclone, 미국)이 보충된 Dulbecco's modified Eagle's medium(DMEM; Hyclone)에서, 37℃에서 배양되었다. 세포 손상 반응을 유도하기 위한 독성 물질로 "LPS(lipid polysaccahride)"와 "6-hydroxy dopamine"을 사용하였다. 즉, BV2 세포의 과활성화 유도를 위하여 자극물질로 'LPS'를 사용하였고, SH-SY5Y 세포에서 세포 손상 반응을 유도하기 위한 독성물질로 '6-hydroxy dopamine'을 사용하였다. BV2 세포에서의 비활성화 여부를 확인하기 위하여'6-shogaol'를, SH-SY5Y 세포에서는 세포 보호 활성 여부를 확인하기 위해서 'Ropinirole'을 양성 대조군으로 사용하였다. 세포가 면적의 70%-80%에 도달(confluence)한 후, 혈청이 없는 조건 하에서 화합물 및 비교예 화합물을 각 처리 농도로 처리한 뒤 30분 후에 자극 및 독성 물질을 처리하였다. 모든 처리 화학물질은 디메틸 설폭사이드(DMSO)에 용해하였으며 DMSO의 최종 농도는 0.2%이었다. 24시간 후, BV2 세포에서는 니트릭옥사이드(Nitric Oxide)와 MTT 측정을 하였으며, 48시간 후에는 SH-SY5Y 세포에서 MTT 측정을 실시하였다.
2)
LPS를
처리한
신경세포주의
니트라이트(nitrite)의 생성 정량
중추신경계에서의 염증반응은 퇴행성 뇌질환에 중요한 역할을 하는 것으로 알려져 있으며, 미세아교세포의 활성화는 생체내 보호기전이지만 미세아교세포의 과활성을 매개로한 염증반응은 신경세포의 사멸을 유도한다. 따라서 미세아교세포의 활성화를 억제하는 것은 퇴행성 뇌질환의 치료의 약물학적 타겟이 될 수 있다. 또한 파킨슨병이나 알츠하이머와 미세아교세포 활성화 사이의 연관 관계는 LPS 독성 물질 처리시 미세아교세포의 활성화가 일어나고 iNOS가 발현되어 니트로 옥사이드(NO)가 분비된다. 분비된 니트로 옥사이드의 양을 니트라이트(nitrite)의 양으로 정량할 수 있다. 정량된 니트라이트(nitrite)로 미세아교세포의 활성화가 어느 정도 억제되어 신경세포 보호 효과가 나타났는지를 가늠할 수 있다. 100 mg/ml의 LPS를 BV-2 신경세포주에 처리한 후, 0.01, 0.1, 1, 10 및 20 μM 농도로 실시예 화합물 6 및 7을 BV-2 세포주에 처리하였으며, 각 농도별 니트라이트의 생성량을 대조군과 비교하여 유의한 차이를 p<0.001(***)로 확인하였다. 추가적으로 100 mg/ml의 LPS를 BV-2 신경세포주에 처리한 후, 실시예 1 내지 10의 화합물을 BV-2 세포주에 처리하였으며, 각 농도별 니트라이트의 생성량을 대조군과 비교하여 IC50(μM)을 도출하였다. 이때 상층액을 제거한 후 남아있는 세포에서는 세포생존율을 측정하였다.
3) 6-hydroxy dopamine에 의해 유도된 신경세포주의 신경독성 억제 측정
25 μM 농도의 6-hydroxy dopamine을 처리하여 신경세포주(human neuroblastoma cells SH-SY5Y)에 대한 신경독성을 유발하고, 0.001, 0.01, 0.1, 1, 5, 10, 20 과 50 μM 농도로 실시예 화합물을 SH-SY5Y 세포주에 48시간 처리하였으며, 각 농도별 대조군과 대비 세포 생존율(%)을 측정하고, 분산 분석(one-way ANOVA followed by Tukey's multiple comparison test)을 통해 통계적 유의성을 *p<0.05 과 **p<0.01 로 검증하였다.
1-2) 실험 결과
본 발명의 실시예 화합물 6 및 7은 LPS를 처리한 신경세포주(murine microglial BV-2 cells)에서 니트라이트(nitrite)의 생성을 농도의존적으로 유의하게 억제하는 것으로 나타났다(도 1).
본 발명의 실시예 3, 실시예 5, 실시예 9 및 실시예 10은 LPS를 처리한 신경세포주(murine microglial BV-2 cells)에서 니트라이트(nitrite)의 생성을 μM 농도에서 유의하게 억제하는 것으로 나타났다(하기 표 1).
| 시료 | IC50(μg/ml) |
| 실시예 1 | >500 |
| 실시예 2 | >500 |
| 실시예 3 | 75.66 |
| 실시예 4 | >500 |
| 실시예 5 | 162.49 |
| 실시예 8 | >500 |
| 실시예 9 | 12.57 |
| 실시예 10 | 20.21 |
| 실시예 11 | >500 |
| 6-Shogaol | 5.59 |
본 발명의 실시예 1 내지 19의 화합물 중에서 실시예 1, 4 및 8의 화합물을 제외한 화합물이 LPS에 의해 감소된 신경세포주(murine microglial BV-2 cells)에서 세포생존율을 증가시킴을 확인하였다(도 1 및 2).
또한, 본 발명의 실시예 화합물 6은 6-hydroxy dopamine에 의해 유도된 신경세포주(human neuroblastoma cells SH-SY5Y)에 대한 신경독성을 농도의존적으로 유의하게 억제하는 것으로 확인되었다(도 3).
Claims (19)
- 하기 화학식 1로 표시되는 화합물, 이의 입체이성질체 또는 이의 약학적으로 허용 가능한 염:
[화학식 1]
상기 식에서,
n은 0 또는 1이고;
R1 및 R2는 동일하거나 상이하며, 각각 독립적으로 페닐 또는 피리디닐이고, 상기 페닐 또는 피리디닐은 할로겐, C1-C6 알킬, C1-C6 알콕시, 및 -NR7R8로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고, 또는 R1과 R2가 서로 연결되어, 이들이 결합된 질소원자를 포함하여, 피롤리딘 고리를 형성하고, 상기 피롤리딘 고리는 다른 페닐과 융합되며, 상기 피롤리딘 고리는 할로겐 또는 C1-C6 알킬 로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고;
R3 및 R3'은 동일하거나 상이하며, 각각 독립적으로 수소, 히드록시, 할로겐, 페닐-C1-6 알콕시, 히드록시 C1-C6 알킬, 또는 트리(C1-C6 알킬)-실릴옥시-C1-C6 알킬(여기서, 트리(C1-C6 알킬)은 모두 동일하거나 2종 이상의 서로 상이한 (C1-C6 알킬)로 구성될 수 있음)이고;
R4 및 R4'은 동일하거나 상이하며, 각각 독립적으로 수소, 히드록시, 할로겐, 페닐, 또는 페닐-C1-6 알콕시이며;
R5 및 R5'은 동일하거나 상이하며, 각각 독립적으로 수소, 히드록시, 할로겐, 또는 페닐-C1-6 알콕시이고;
R6 및 R6'은 동일하거나 상이하며, 각각 독립적으로 수소, 또는 C1-C6 알킬이며,
R7 및 R8은 동일하거나 상이하며, 각각 독립적으로 수소, 또는 C1-C6 알킬을 나타낸다.
- 제1항에 있어서,
R1 및 R2는 동일하거나 상이하며, 각각 독립적으로 페닐 또는 피리디닐을 나타내고, 상기 R1 및 R2는 플루오로, 메톡시, 디메틸아미노, 메틸, 및 브로모로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고, 또는 R1과 R2가 서로 연결되어 형성된, 메틸, 아이오도 또는 둘 모두로 치환된 인돌리닐을 나타내고;
R3 및 R3'는 동일하거나 상이하고, 각각 독립적으로 수소, 히드록시, 플루오로, 벤질옥시, 히드록시메틸, 또는 tert-부틸디메틸실릴옥시메틸이며;
R4 및 R4'는 동일하거나 상이하고, 각각 독립적으로 수소, 히드록시, 플루오로, 페닐, 또는 벤질옥시이며;
R5 및 R5'는 동일하거나 상이하고, 각각 독립적으로 수소, 히드록시, 플루오로, 또는 벤질옥시이며;
R5 및 R5'은 동일하거나 상이하며, 각각 독립적으로 수소, 또는 메틸인 것인 화합물, 이의 입체이성질체 또는 이의 약학적으로 허용 가능한 염.
- 제2항에 있어서,
R1 및 R2는 플루오로, 메톡시, 디메틸아미노, 메틸, 및 브로모로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않은 페닐, 또는 피리디닐; 또는 R1과 R2가 서로 연결되어 형성된 메틸 및 아이오도로 치환된 인돌리닐인 것인 화합물, 이의 입체이성질체 또는 이의 약학적으로 허용 가능한 염.
- 하기 화학식 1-1로 표시되는 화합물, 이의 입체이성질체 또는 이의 약학적으로 허용 가능한 염:
[화학식 1-1]
상기 식에서,
R1 및 R2는 동일하거나 상이하며, 각각 독립적으로 페닐 또는 피리디닐이고, 상기 페닐 또는 피리디닐은 할로겐, C1-C6 알킬, C1-C6 알콕시, 및 -NR7R8로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고, 또는 R1과 R2가 서로 연결되어, 이들이 결합된 질소원자를 포함하여, 피롤리딘 고리를 형성하고, 상기 피롤리딘 고리는 다른 페닐과 융합되며, 상기 피롤리딘 고리는 할로겐 또는 C1-C6 알킬 로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고;
R3 및 R3'은 동일하거나 상이하며, 각각 독립적으로 수소, 히드록시, 할로겐, 페닐-C1-6 알콕시, 히드록시 C1-C6 알킬, 또는 트리(C1-C6 알킬)-실릴옥시-C1-C6 알킬(여기서, 트리(C1-C6 알킬)은 모두 동일하거나 2종 이상의 서로 상이한 (C1-C6 알킬)로 구성될 수 있음)이고;
R4 및 R4'은 동일하거나 상이하며, 각각 독립적으로 수소, 히드록시, 할로겐, 페닐, 또는 페닐-C1-6 알콕시이며;
R5 및 R5'은 동일하거나 상이하며, 각각 독립적으로 수소, 히드록시, 할로겐, 또는 페닐-C1-6 알콕시이고;
R6 및 R6'은 동일하거나 상이하며, 각각 독립적으로 수소, 또는 C1-C6 알킬이며,
R7 및 R8은 동일하거나 상이하며, 각각 독립적으로 수소, 또는 C1-C6 알킬을 나타낸다.
- 제4항에 있어서,
R1 및 R2는 동일하거나 상이하며, 각각 독립적으로 페닐 또는 피리디닐을 나타내고, 상기 R1 및 R2는 플루오로, 메톡시, 디메틸아미노, 메틸, 및 브로모로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않을 수 있고, 또는 R1과 R2가 서로 연결되어 형성된, 메틸, 아이오도 또는 둘 모두로 치환된 인돌리닐을 나타내고;
R3 및 R3'는 동일하거나 상이하고, 각각 독립적으로 수소, 히드록시, 플루오로, 벤질옥시, 히드록시메틸, 또는 tert-부틸디메틸실릴옥시메틸이며;
R4 및 R4'는 동일하거나 상이하고, 각각 독립적으로 수소, 히드록시, 플루오로, 페닐, 또는 벤질옥시이며;
R5 및 R5'는 동일하거나 상이하고, 각각 독립적으로 수소, 히드록시, 플루오로, 또는 벤질옥시이며;
R5 및 R5'은 동일하거나 상이하며, 각각 독립적으로 수소, 또는 메틸인 것인 화합물, 이의 입체이성질체 또는 이의 약학적으로 허용 가능한 염.
- 제5항에 있어서,
R1 및 R2는 플루오로, 메톡시, 디메틸아미노, 메틸, 및 브로모로 구성된 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않은 페닐, 또는 피리디닐; 또는 R1과 R2가 서로 연결되어 형성된 메틸 및 아이오도로 치환된 인돌리닐인 것인 화합물, 이의 입체이성질체 또는 이의 약학적으로 허용 가능한 염.
- 삭제
- 제7항에 있어서,
R1 및 R2는 하나 이상의 메톡시기로 치환되거나 비치환된 페닐인 것인 화합물, 이의 입체이성질체 또는 이의 약학적으로 허용 가능한 염.
- 제1항에 있어서, 상기 화학식 1로 표시되는 화합물은 하기 화합물들로 이루어진 군에서 선택되는 것인 화합물, 이의 입체이성질체 또는 이의 약학적으로 허용 가능한 염:
1) N,N-비스(4-메톡시페닐)테트라하이드로퓨란-2-아민[N,N-bis(4-methoxyphenyl)tetrahydrofuran-2-amine],
2) N,N-디페닐테트라하이드로퓨란-2-아민[N,N-diphenyltetrahydrofuran-2-amine],
3) N,N-비스(4-메톡시페닐)테트라하이드로-2H-피란-2-아민[N,N-bis(4-methoxyphenyl)tetrahydro-2H-pyran-2-amine],
4) N,N-비스(4-메톡시페닐)-4-페닐테트라하이드로-2H-피란-2-아민[N,N-bis(4-methoxyphenyl)-4-phenyltetrahydro-2H-pyran-2-amine],
5) 3,3,4,4,5,5-헥사플루오로-N,N-비스(4-메톡시페닐)테트라하이드로-2H-피란-2-아민[3,3,4,4,5,5-hexafluoro-N,N-bis(4-methoxyphenyl)tetrahydro-2H-pyran-2-amine],
6) (2R,3S)-3-((tert-부틸디메틸실릴옥시)메틸)-N,N-비스(4-메톡시페닐)테트라하이드로-2H-피란-2-아민[(3S)-3-((tert-butyldimethylsilyloxy)methyl)-N,N-bis(4-methoxyphenyl)tetrahydro-2H-pyran-2-amine],
7) ((2R,3S)-2-(비스(4-메톡시페닐)아미노)테트라하이드로-2H-피란-3-일)메탄올[((2R,3S)-2-(bis(4-methoxyphenyl)amino)tetrahydro-2H-pyran-3-yl)methanol],
8) (2R,3R,4S,5S)-3,4,5-트리스(벤질옥시)-N,N-비스(4-메톡시페닐)테트라하이드로-2H-피란-2-아민[(2R,3R,4S,5S)-3,4,5-tris(benzyloxy)-N,N-bis(4-methoxyphenyl)tetrahydro-2H-pyran-2-amine],
9) N1-(4-(디메틸아미노)페닐)-N4,N4-디메틸-N1-(테트라하이드로-2H-피란-2-일)벤젠-1,4-디아민[N1-(4-(dimethylamino)phenyl)-N4,N4-dimethyl-N1-(tetrahydro-2H-pyran-2-yl)benzene-1,4-diamine],
10) N-(4-메톡시페닐)-N-(테트라하이드로-2H-피란-2-일)피리딘-3-아민[N-(4-methoxyphenyl)-N-(tetrahydro-2H-pyran-2-yl)pyridin-3-amine],
11) N-(4-플루오로페닐)-N-페닐테트라하이드로-2H-피란-2-아민[N-(4-fluorophenyl)-N-phenyltetrahydro-2H-pyran-2-amine],
12) N-(2-플루오로-5-메틸페닐)-N-페닐테트라하이드로-2H-피란-2-아민[N-(2-fluoro-5-methylphenyl)-N-phenyltetrahydro-2H-pyran-2-amine],
13) N-페닐-N-m-톨릴테트라하이드로-2H-피란-2-아민[N-phenyl-N-m-tolyltetrahydro-2H-pyran-2-amine],
14) N-(4-브로모페닐)-N-페닐테트라하이드로-2H-피란-2-아민[N-(4-bromophenyl)-N-phenyltetrahydro-2H-pyran-2-amine],
15) N-(4-메톡시페닐)-N-p-톨릴테트라하이드로-2H-피란-2-아민[N-(4-methoxyphenyl)-N-p-tolyltetrahydro-2H-pyran-2-amine],
16) N,N-디p-톨릴테트라하이드로-2H-피란-2-아민[N,N-dip-tolyltetrahydro-2H-pyran-2-amine],
17) N,N-비스(4-메톡시페닐)-6-메틸테트라하이드로-2H-피란-2-아민[N,N-bis(4-methoxyphenyl)-6-methyltetrahydro-2H-pyran-2-amine],
18) 2-아이오도-2-메틸-1-(테트라하이드로-2H-피란-2-일)인돌린[2-iodo-2-methyl-1-(tetrahydro-2H-pyran-2-yl)indoline], 및
19) (2S,3S,4R,5R)-3,4,5-트리스(벤질옥시)-N,N-비스(4-메톡시페닐)테트라하이드로-2H-피란-2-아민[(2S,3S,4R,5R)-3,4,5-tris(benzyloxy)-N,N-bis(4-methoxyphenyl)tetrahydro-2H-pyran-2-amine].
- 제1항 내지 제7항, 제9항, 제10항 중 어느 한 항의 화합물, 이의 입체이성질체, 또는 이의 약학적으로 허용 가능한 염을 유효성분으로 포함하는 신경계 질환의 예방 또는 치료용 약학적 조성물.
- 제11항에 있어서,
상기 신경계 질환은 뇌 신경 또는 중추 신경계 질환인 약학적 조성물.
- 제11항에 있어서,
상기 신경계 질환은 허혈성 뇌질환, 퇴행성 뇌질환, 알츠하이머병, 파킨슨병, 및 헌팅턴병으로 이루어진 군으로부터 선택되는 것인 약학적 조성물.
- 제11항에 있어서,
미세아교세포(microglia)의 과활성화를 억제하여 상기 신경계 질환을 예방 및 치료하는 것인 약학적 조성물.
- 제11항에 있어서,
LPS 혹은 6-OHDA에 의한 신경독성에 대한 세포보호 효과를 나타내어 상기 신경계 질환을 예방 및 치료하는 것인 약학적 조성물.
- 제16항 또는 제17항에 있어서, 산화적 고리화 반응이 TEMPO((2,2,6,6-tetramethylpiperidin-1-yl)oxidanyl)의 존재하에서 요오드 또는 과요오드화물(hypervalent iodine) 산화제를 사용하여 수행되는 것인 방법.
- 제18항에 있어서, 과요오드화물이 BAIB(bis(acetoxy)iodobenzene) 또는 PIFA(phenyliodine bis(trifluoroacetate))인 것인 방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020150090648 | 2015-06-25 | ||
| KR20150090648 | 2015-06-25 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20170001936A KR20170001936A (ko) | 2017-01-05 |
| KR101881115B1 true KR101881115B1 (ko) | 2018-08-20 |
Family
ID=57835684
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020150165740A KR101881115B1 (ko) | 2015-06-25 | 2015-11-25 | 신규 2-치환된 테트라하이드로피란 또는 2-치환된 테트라하이드로퓨란 유도체 화합물, 이의 제조방법 및 이의 용도 |
Country Status (1)
| Country | Link |
|---|---|
| KR (1) | KR101881115B1 (ko) |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4262006A (en) | 1978-12-12 | 1981-04-14 | Istituto Lusofarmaco D'italia S.P.A. | Substituted 2-phenylamino-imidazolines-(2) and pharmaceutical compositions containing them |
-
2015
- 2015-11-25 KR KR1020150165740A patent/KR101881115B1/ko active IP Right Grant
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4262006A (en) | 1978-12-12 | 1981-04-14 | Istituto Lusofarmaco D'italia S.P.A. | Substituted 2-phenylamino-imidazolines-(2) and pharmaceutical compositions containing them |
Also Published As
| Publication number | Publication date |
|---|---|
| KR20170001936A (ko) | 2017-01-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN109963844B (zh) | 一类抑制并降解酪氨酸蛋白激酶alk的化合物 | |
| CN109422752B (zh) | 一类具有抑制并降解布鲁顿酪氨酸蛋白激酶Btk活性的化合物 | |
| KR930011300B1 (ko) | 옥시인돌유도체 | |
| CA3113463A1 (en) | Nitroxoline prodrug and use thereof | |
| JPH0354952B2 (ko) | ||
| EP3590920A1 (en) | 2-(substituted benzene matrix) aromatic formate fto inhibitor, preparation method therefor, and applications thereof | |
| KR20150027217A (ko) | 항진균성 항생 암포테리신 b의 n-치환된 제2 세대 유도체, 및 이의 제조 및 응용 방법 | |
| US8258321B2 (en) | Beta-lactone compounds | |
| CN113698401A (zh) | β-榄香烯大环衍生物及其制备方法和应用 | |
| CN111662294A (zh) | 一类具有降解Btk活性的化合物 | |
| JP2020517585A (ja) | グアニジン誘導体 | |
| EP3638222B1 (en) | Enzyme-triggered carbon monoxide releasing molecules | |
| EP1938823A1 (en) | Agent for preventing or treating pancreas cancer, ovary cancer or liver cancer containing novel water-soluble prodrug | |
| KR101881115B1 (ko) | 신규 2-치환된 테트라하이드로피란 또는 2-치환된 테트라하이드로퓨란 유도체 화합물, 이의 제조방법 및 이의 용도 | |
| DE60125036T2 (de) | Hydroxyformamidin-derivate und diese enthaltende medikamente | |
| JP4310191B2 (ja) | タキサン誘導体結晶およびその製造方法 | |
| JP4769726B2 (ja) | コンセントリコリド及びその誘導体、それらを調製する工程、それを含む薬学的組成物並びにその使用 | |
| JP2006347942A (ja) | βアミロイド生成抑制剤 | |
| FI105270B (fi) | Menetelmä terapeuttisesti käyttökelpoisten oktahydro-1H-1-pyrindiini-4,5,6,7-terolien valmistamiseksi | |
| CN110305123B (zh) | 一种含有金刚烷的化合物及其在治疗癌症中的用途 | |
| JP4709387B2 (ja) | 4−デメチルペンクロメジンのアシル誘導体、その使用及び調製 | |
| KR100937738B1 (ko) | 퀴놀린 카복실산 아마이드 유도체 또는 이의 약학적으로허용가능한 염, 이의 제조방법 및 이를 유효성분으로함유하는 항균 조성물 | |
| CN111499619B (zh) | 一种治疗肝纤维化的药物及其制备方法 | |
| CN114149392B (zh) | 莪术烯含氮衍生物及其制备和应用 | |
| CN103450164B (zh) | 格尔德霉素衍生物及其制备方法和用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant |