KR101420564B1 - TGF-β2 발현을 억제하는 shRNA - Google Patents
TGF-β2 발현을 억제하는 shRNA Download PDFInfo
- Publication number
- KR101420564B1 KR101420564B1 KR1020130010233A KR20130010233A KR101420564B1 KR 101420564 B1 KR101420564 B1 KR 101420564B1 KR 1020130010233 A KR1020130010233 A KR 1020130010233A KR 20130010233 A KR20130010233 A KR 20130010233A KR 101420564 B1 KR101420564 B1 KR 101420564B1
- Authority
- KR
- South Korea
- Prior art keywords
- tgf
- shrna
- seq
- adenovirus
- expression
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1135—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against oncogenes or tumor suppressor genes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7105—Natural ribonucleic acids, i.e. containing only riboses attached to adenine, guanine, cytosine or uracil and having 3'-5' phosphodiester links
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/50—Physical structure
- C12N2310/53—Physical structure partially self-complementary or closed
- C12N2310/531—Stem-loop; Hairpin
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/10011—Adenoviridae
- C12N2710/10041—Use of virus, viral particle or viral elements as a vector
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Genetics & Genomics (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Biomedical Technology (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Biotechnology (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- Epidemiology (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Oncology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
본 발명은 TGF-β2 발현을 억제하는 shRNA에 관한 것이다.
본 발명에 따르면, TGF-β2 발현을 억제하는 shRNA를 이용한 항종양 조성물을 제공할 수 있다.
본 발명에 따르면, TGF-β2 발현을 억제하는 shRNA를 이용한 항종양 조성물을 제공할 수 있다.
Description
본 발명은 TGF-β2 발현을 억제하는 shRNA 및 이를 포함하는 항종양 조성물에 관한 것이다.
TGF-β2는 TGF-β1과 마찬가지로 세포독성 T 세포, 자연살해 세포, 그리고 마크로파아지 등의 증식과 분화를 억제하여 점점 자라나고 있는 종양에 대한 면역탐색을 저해. 뿐만 아니라 다기능의 분비단백질로 세포의 형태(type)와 시기에 따라 증식억제, 복제, 침윤, 전이, 세포사멸, 면역탐색, 그리고 혈관생성 등 다양한 역할을 수행뿐만 아니라 TGF-β1처럼 TGF-β2도 신호경로를 비활성화시키거나 혹은 세포주기의 비정상적 조절 등에 기인하여 TGF-β2에 의한 증식억제 작용에 저항성이 생기게 되는 종양이 진행(progression)되는 후기에 이르게 되면 TGF-β2는 종양을 더욱 발전시키는 역할을 하게 된다. 따라서 인체의 면역체계를 극복하고 증식한 종양세포들은 TGF-β2를 분비함으로써 면역감시로부터 자유로워지면서 동시에 증식과 침윤 전이 및 혈관생성에 플러스 요인으로 작용하게 된다. TGF-β2가 TGF-β1과 명백하게 다르게 작용하는 점은 다음과 같다. TGF-β2는 Foxp3를 유도하여 면역억제 유도를 현저히 진행시킨다는 점과, 종양의 전이, 신생혈관형성 그리고 증식 등에도 영향을 미쳐 악성으로의 종양 진행을 유도하는 점이다.
TGF-β2 관련 선행 연구로, 비특허문헌 1에는 인간 TGF-β2의 코딩 서열에 대한 합성 18-mer 포스포티오레이트 안티센스 올리고뉴클레오티드(phosphothioate antisense oligonucleotide)를 사용하고, 종양의 면역억제 제거, 종양 크기 감소, 림프절로의 전이 및 혈관형성 감소 등이 관찰되었으나, 그 효과는 미비하였다.
비특허문헌 2에는 murine의 TGF-β2에 대한 shRNA를 TGCTGTTGACAGTGAGCGCGGTGTATAAATCGAGACCAAATTAGTGTGAAGCCACAGATGTATTTGGTCTCGATTTATACACCTTGCCCCTACTGCCTCGGA(target)으로 제작하고, 또한, TGF-β2 shRNA 를 생성하는 렌티바이러스(lentivirus)를 제작하였으나, 렌티바이러스가 염색체에 인테그레이션(integration)되어 암이 소실된 이후에라도 정상세포에는 계속 전달되어 부작용이 큰 문제가 있다.
Schlingensiepen et al, Transforming growth factor-beta2 gene silencing with trabedersen (AP 12009) in pancreatic cancer, Cancer Sci 102: 1193-1200, 2011.
Chenyu Zhang et al, Transforming growth factor-β2 is a molecular determinant for site-specific melanoma metastasis in the brain, Cancer Res. 2009 February 1; 69(3): 828-35.
이에, 본 발명자들은 상기와 같은 문제점을 해결하기 위하여 연구 노력한 결과, 인간 TGF-β2 또는 마우스 TGF-β2의 침묵(silencing)을 효과적으로 유도하는 타겟을 선정하여 shRNA를 제작하고, 이를 아데노바이러스에 탑재시켜 기존 비바이러스성 제제에 의한 shRNA의 전달능력을 획기적으로 개선시킴으로써 본 발명을 완성하게 되었다.
따라서, 본 발명은 서열번호 1 또는 2로 표시되는 염기서열을 표적서열로 하고, TGF-β2 발현을 억제하는 shRNA을 제공하는데 그 목적이 있다.
본 발명은 또한, 상기 shRNA를 유효성분으로 함유하는 항종양 조성물을 제공하는데 다른 목적이 있다.
본 발명은 또한, 상기 shRNA 발현하는 재조합 발현벡터를 제공하는데 또 다른 목적이 있다.
본 발명은 또한, 상기 재조합 발현벡터를 유효성분으로 하는 항종양 조성물을 제공하는데 또 다른 목적이 있다.
본 발명은 또한, 상기 재조합 발현벡터가 도입된 아데노바이러스를 제공하는데 또 다른 목적이 있다.
본 발명은 상기 과제를 해결하기 위한 수단으로서,
서열번호 1 또는 2로 표시되는 염기서열을 표적서열로 하고, TGF-β2 발현을 억제하는 shRNA을 제공한다.
본 발명은 상기 과제를 해결하기 위한 다른 수단으로서,
상기 shRNA를 유효성분으로 함유하는 항종양 조성물을 제공한다.
본 발명은 상기 과제를 해결하기 위한 또 다른 수단으로서,
상기 shRNA 발현용 재조합 발현벡터를 제공한다.
본 발명은 상기 과제를 해결하기 위한 또 다른 수단으로서,
상기 재조합 발현벡터를 유효성분으로 포함하는 항종양 조성물을 제공한다.
본 발명은 상기 과제를 해결하기 위한 또 다른 수단으로서,
상기 재조합 발현벡터가 도입된 아데노바이러스를 제공한다.
본 발명은 TGF-β2 발현을 억제하는 새로운 shRNA을 제작하고, 유전자 전달체로 아데노바이러스를 사용하여 감염율을 증가시킴으로써 종래 기술에 비해 특이성, 전달능 및 발현억제능을 크게 향상시켰다.
즉, 본 발명에 의해 TGF-β2 발현을 억제하는 shRNA를 함유하는 항종양 조성물이 제공된다. 특히, 대부분의 암세포에서 전달효율성이 뛰어난 아데노바이러스에 표적성을 부여함으로써 모든 암에 적용 가능하다.
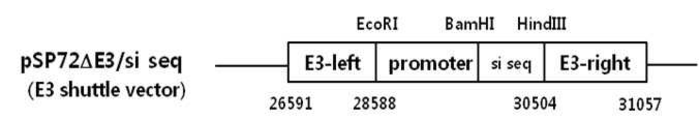
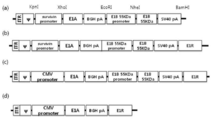
도 1은 E3 셔틀 벡터인 pSP72ΔE3/si-negative 벡터를 나타낸 것이다.
도 2는 TGF-β2 shRNA가 셔틀 벡터로 서브클로닝(subcloning)된 후 아데노바이러스 백본인 dl324와 상동 재조합하는 과정의 모식도이다.
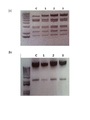
도 3은 실제로 재조합이 용이한 박테리아에서 상동 재조합된 콜로니의 선별을 위하여, (a)는 아데노바이러스의 E3 부위 PCR 결과를 나타낸 것이고, (b)는 아데노바이러스의 IX 유전자 부위 PCR 결과를 나타낸 것이며, (c)는 상동 재조합된 아데노바이러스 게놈(genomic) DNA의 트랜스펙션(transfection) 가능 여부를 확인하는 PacI 절단 후 단편(fragment) DNA가 출현하는 결과를 나타낸 것이다.
도 4는 HindⅢ 절단 패턴(digestion pattern)으로 최종 재조합된 콜로니를 선별 확인한 것이다.
도 5는 도 4의 선별된 콜로니가 shRNA hTGF-β2 염기서열을 가지고 있는지를 서열 분석으로 확인한 결과이다.
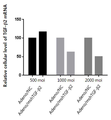
도 6은 실시예 2의 인간 TGF-β2 shRNA를 발현하는 아데노바이러스에 의한 TGF-β2 발현 억제능을 실시간-PCR로 확인한 것이다.
도 7은 실시예 2의 마우스 TGF-β2 shRNA를 발현하는 아데노바이러스에 의한 TGF-β2 발현 억제능을 실시간-PCR로 확인한 것이다.
도 8은 실시예 2의 마우스 TGF-β2 shRNA를 발현하는 셔틀 벡터에 의한 TGF-β2 발현 억제능을 실시간-PCR으로 확인한 것이다.
도 9는 실시예 2의 인간 TGF-β2 shRNA를 발현하는 아데노바이러스에 의한 TGF-β2 발현 억제능을 ELISA로 확인한 것이다.
도 10은 pBSKⅡ-3484 벡터(a), pCA14-3484 벡터(b), pCA14-CMV-3484 벡터(c)와 pCA14-CMV-3484-ΔE1B55 벡터(d)를 나타낸 것이다.
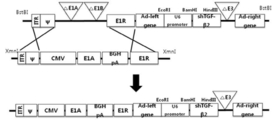
도 11은 dl324 아데노바이러스에서 dl324-CMV-3484-shTGF-β2 아데노바이러스를 제작하는 과정을 나타낸 모식도이다.
도 12는 마우스 shTGF-β2가 포함된 상동 재조합 과정을 나타낸 것으로, E3 스크리닝으로 상동 재조합된 콜로니를 선별 확인하고(a), HindⅢ 절단 패턴에 의한 상동 재조합이 된 클론(1, 2, 4)을 선별 확인하고(b), 상기 클론 1, 2, 4의 DNA를 PacI으로 잘라 보았을 때 클론1 만이 제대로 상동 재조합된 것을 확인(c)한 것이다[C: 대조군, dl324-△E3-sh-mTGFβ2], S: 셔틀 벡터 pCA14-CMV-3484-△E1B55, 1~6: 상동재조합된 콜로니].
도 13은 인간 shTGF-β2가 포함된 상동 재조합 과정을 나타낸 것으로, HindⅢ 절단 패턴(digestion pattern)으로 상동 재조합된 콜로니를 선별 확인(a), PacI 절단 후 상동 재조합된 콜로니를 최종 선별 확인(b)한 것이다[C: 대조군, dl324-△E3-sh-mTGFβ2], 1~3: 상동재조합된 콜로니].
도 14는 실시예 4의 종양선택적 복제 가능 아데노바이러스의 암세포에서 세포 용혈을 확인 것이다.
도 15는 인간 TGF-β2 shRNA를 발현하는 아데노바이러스와 인간 TGF-β1 shRNA를 발현하는 아데노바이러스에 의한 hTGF-β1,2,3 발현 억제능을 실시간-PCR 결과로 비교한 것이다
도 16은 인간 TGF-β2 shRNA를 발현하는 아데노바이러스와 인간 TGF-β1 shRNA를 발현하는 아데노바이러스에 의한 TGF-β1,2,3 발현 억제능을 ELISA 결과로 비교한 것이다
도 2는 TGF-β2 shRNA가 셔틀 벡터로 서브클로닝(subcloning)된 후 아데노바이러스 백본인 dl324와 상동 재조합하는 과정의 모식도이다.
도 3은 실제로 재조합이 용이한 박테리아에서 상동 재조합된 콜로니의 선별을 위하여, (a)는 아데노바이러스의 E3 부위 PCR 결과를 나타낸 것이고, (b)는 아데노바이러스의 IX 유전자 부위 PCR 결과를 나타낸 것이며, (c)는 상동 재조합된 아데노바이러스 게놈(genomic) DNA의 트랜스펙션(transfection) 가능 여부를 확인하는 PacI 절단 후 단편(fragment) DNA가 출현하는 결과를 나타낸 것이다.
도 4는 HindⅢ 절단 패턴(digestion pattern)으로 최종 재조합된 콜로니를 선별 확인한 것이다.
도 5는 도 4의 선별된 콜로니가 shRNA hTGF-β2 염기서열을 가지고 있는지를 서열 분석으로 확인한 결과이다.
도 6은 실시예 2의 인간 TGF-β2 shRNA를 발현하는 아데노바이러스에 의한 TGF-β2 발현 억제능을 실시간-PCR로 확인한 것이다.
도 7은 실시예 2의 마우스 TGF-β2 shRNA를 발현하는 아데노바이러스에 의한 TGF-β2 발현 억제능을 실시간-PCR로 확인한 것이다.
도 8은 실시예 2의 마우스 TGF-β2 shRNA를 발현하는 셔틀 벡터에 의한 TGF-β2 발현 억제능을 실시간-PCR으로 확인한 것이다.
도 9는 실시예 2의 인간 TGF-β2 shRNA를 발현하는 아데노바이러스에 의한 TGF-β2 발현 억제능을 ELISA로 확인한 것이다.
도 10은 pBSKⅡ-3484 벡터(a), pCA14-3484 벡터(b), pCA14-CMV-3484 벡터(c)와 pCA14-CMV-3484-ΔE1B55 벡터(d)를 나타낸 것이다.
도 11은 dl324 아데노바이러스에서 dl324-CMV-3484-shTGF-β2 아데노바이러스를 제작하는 과정을 나타낸 모식도이다.
도 12는 마우스 shTGF-β2가 포함된 상동 재조합 과정을 나타낸 것으로, E3 스크리닝으로 상동 재조합된 콜로니를 선별 확인하고(a), HindⅢ 절단 패턴에 의한 상동 재조합이 된 클론(1, 2, 4)을 선별 확인하고(b), 상기 클론 1, 2, 4의 DNA를 PacI으로 잘라 보았을 때 클론1 만이 제대로 상동 재조합된 것을 확인(c)한 것이다[C: 대조군, dl324-△E3-sh-mTGFβ2], S: 셔틀 벡터 pCA14-CMV-3484-△E1B55, 1~6: 상동재조합된 콜로니].
도 13은 인간 shTGF-β2가 포함된 상동 재조합 과정을 나타낸 것으로, HindⅢ 절단 패턴(digestion pattern)으로 상동 재조합된 콜로니를 선별 확인(a), PacI 절단 후 상동 재조합된 콜로니를 최종 선별 확인(b)한 것이다[C: 대조군, dl324-△E3-sh-mTGFβ2], 1~3: 상동재조합된 콜로니].
도 14는 실시예 4의 종양선택적 복제 가능 아데노바이러스의 암세포에서 세포 용혈을 확인 것이다.
도 15는 인간 TGF-β2 shRNA를 발현하는 아데노바이러스와 인간 TGF-β1 shRNA를 발현하는 아데노바이러스에 의한 hTGF-β1,2,3 발현 억제능을 실시간-PCR 결과로 비교한 것이다
도 16은 인간 TGF-β2 shRNA를 발현하는 아데노바이러스와 인간 TGF-β1 shRNA를 발현하는 아데노바이러스에 의한 TGF-β1,2,3 발현 억제능을 ELISA 결과로 비교한 것이다
RNA 간섭(RNA interference, RNAi)은 표적 유전자의 발현을 선택적으로 억제하는 천연의 매커니즘이다. 서열 특이적 mRNA 분해의 매개자는 보다 긴 ds RNA로부터 리보뉴클레아제 Ⅲ의 절단에 의해 생산된 19~23 뉴클레오타이드의 작은 간섭 RNA이다. 세포질의 RISC(RNA-induced silencing complex)는 siRNA에 결합하고 그 siRNA 중 한 가닥에 상보적인 서열을 포함하는 mRNA의 분해를 지시한다. 포유동물에서 RNA 간섭의 적용은 치료 유전자 침묵(silencing)의 효능을 가지고 있다. siRNA의 장점에도 불구하고 siRNA는 시험관 내에서 제조되어야 하고 녹다운 유전자를 통상적으로 6 내지 10일 동안 일시적 형질감염에 의해 전달되어야 한다는 점에서 임상에 적용하는데 제한을 가지고 있다. 본 발명의 shRNA(small-hairpin RNA) 발현 시스템이 전술된 단점을 해결할 수 있다.
shRNA는 1본쇄 RNA에서 부분적으로 회문상(回文狀)의 염기서열을 포함함으로써, 분자 내에서 2본쇄 구조를 가지고 헤어핀과 같은 구조가 되는 약 20염기 이상의 분자이다.
본 발명은 TGF-β2 발현을 억제하는 shRNA에 관한 것으로, 하기 서열을 표적서열로 하는 것을 특징으로 한다.
마우스 표적서열: 5'- GGATTGAACTGTATCAGATCCTTAA - 3' [서열번호 1]
인간 표적서열: 5'- GGATTGAGCTATATCAGATTCTCAA -3' [서열번호 2]
본 발명에서 TGF-β2 발현을 억제하는 shRNA는 TGF-β2 유전자의 일부에 상보적인 서열을 가지고, TGF-β2 유전자의 mRNA를 분해하거나, 번역을 억제할 수 있다. 상보성이 80-90%인 경우에는 mRNA의 번역을 억제할 수 있고, 100%인 경우에는 mRNA를 분해시킬 수 있다.
따라서, 본 발명에서 TGF-β2 발현을 억제하는 shRNA는 마우스 mRNA의 494~518번째 뉴클레오타이드에, 인간 mRNA의 578~602번째 뉴클레오타이드에 대한 상보적인 서열에 대하여 80% 이상, 바람직하게는 90% 이상, 보다 바람직하게는 100% 상동성을 갖는 염기서열을 포함할 수 있다.
한 양태로서, 마우스 shRNA는 서열번호 1(표적서열)에 나타낸 염기서열과 그의 상보적인 염기서열로 이루어지고, 인간 shRNA는 서열번호 2(표적서열)에 나타낸 염기서열과 그의 상보적인 염기서열로 이루어질 수 있다. 상기 각각의 염기서열과 그의 상보적인 염기서열은 4 내지 10 bp의 루프 영역에 의해 회문적으로(palindrom) 연결되어 헤어핀 구조를 형성하는 것일 수 있다.
본 발명의 shRNA의 구체적인 예로는 하기 서열을 포함할 수 있다:
서열번호 1의 마우스 표적서열으로 하는 shRNA: 5'-GGATTGAACTGTATCAGATCCTTAA tctc TTAAGGATCTGATACAGTTCAATCC-3' [서열번호 3]
서열번호 2의 인간 표적서열을 위한 shRNA: 5'- GGATTGAGCTATATCAGATTCTCAA tctc TTGAGAATCTGATATAGCTCAATCC-3' 서열번호 4].
RNAi에 의해 TGF-β2의 발현을 억제하는 물질로서는, 3'말단에 돌출부를 가지는 짧은 헤어핀 구조로 구성된 shRNA(short hairpin RNA)를 사용할 수도 있다.
RNAi에 의해 TGF-β2의 발현을 억제하는 물질은, 인공적으로 화학 합성하여도 좋고, 센스 가닥 및 안티센스 가닥의 DNA 서열을 역방향으로 연결한 헤어핀 구조의 DNA를 T7 RNA 폴리머라제에 의해 실험실 조건(in vitro)에서 RNA를 합성하여 제작하여도 무방하다. 실험실 조건에서 합성하는 경우, T7 RNA 폴리머라제 및 T7 프로모터를 이용하여, 주형 DNA로부터 안티센스 및 센스 RNA를 합성할 수 있다. 이들을 실험실 조건에서 어닐링한 후, 세포에 도입하면 RNAi가 유발되어, TGF-β2 mRNA의 분해를 유도한다. 세포에의 도입은 예를 들면, 인산칼슘법, 또는 각종 트랜스펙션 시약(예를 들면, oligofectamine, lipofectamine 및 lipofection 등)을 이용한 방법에 의해 행할 수 있다.
RNAi에 의해 TGF-β2의 발현을 억제하는 물질로서는, shRNA 또는 상기 DNA을 포함하는 발현벡터를 이용하여도 좋고, 상기 발현벡터를 함유하는 세포를 이용하여도 좋다. 상기 발현벡터나 세포의 종류는 특별히 한정되지 않으나, 이미 의약으로서 사용되고 있는 발현벡터나 세포가 바람직하다.
본 발명에서는 서열번호 1 또는 서열번호 2로 표시되는 염기서열을 표적서열로 하는 shRNA를 이용할 수 있다.
따라서, 본 발명은 상기 shRNA 발현용 재조합 발현벡터를 포함한다.
본 발명의 재조합 벡터는 당해 분야에 공지된 재조합 DNA 방법에 의해 구성될 수 있다.
본 발명에서 shRNA를 전달하기에 유용한 바이러스 (또는 바이러스 벡터)로는 아데노바이러스, 레트로바이러스, 렌티바이러스, 아데노부속바이러스 등이 있으며, 종양에서와 같이 한시적인 발현 유도가 필요한 이유로 아데노바이러스가 바람직하다.
아데노바이러스에 상기 shRNA를 도입하기 위하여, shRNA 서열을 근거로 하여 하기 DNA를 제작할 수 있다.
<마우스 표적서열에 대한 DNA>
탑 스트랜드: 5'- gatcc GGATTGAACTGTATCAGATCCTTAA tctc TTAAGGATCTGATACAGTTCAATCC tttt a - 3' [서열번호 5]
바텀 스트랜드: 5'- agctt aaaa GGATTGAACTGTATCAGATCCTTAA gaga TTAAGGATCTGATACAGTTCAATCC g - 3' [서열번호 6]
<인간 표적서열에 대한 DNA>
탑 스트랜드: 5'- gatcc GGATTGAGCTATATCAGATTCTCAA tctc TTGAGAATCTGATATAGCTCAATCC tttt a - 3' [서열번호 7]
바텀 스트랜드: 5'- agctt aaaa GGATTGAGCTATATCAGATTCTCAA gaga TTGAGAATCTGATATAGCTCAATCC g - 3' [서열번호 8]
또한, 본 발명에서 shRNA를 전달하기에 유용한 비바이러스 벡터로는 전술한 바이러스 벡터를 제외한 통상적으로 유전자 요법에 사용되는 모든 벡터를 의미하며, 그러한 예로는 진핵세포에서 발현 가능한 다양한 플라스미드 및 리포좀 등이 있다.
한편, 본 발명에서 TGF-β2 발현을 억제하는 shRNA는 전달된 세포에서 적절히 전사되기 위하여 적어도 프로모터에 작동 가능하게 연결되는 것이 바람직하다. 상기 프로모터는 진핵세포에서 기능할 수 있는 프로모터라면 어떤 것이든지 무방하나, U6 프로모터가 RNA 중합효소 Ⅲ로서 small size RNA를 생성하는데 유리한 이유로 특히 바람직하다. TGF-β2 발현을 억제하는 shRNA의 효율적인 전사를 위하여 필요에 따라 리더 서열, 폴리아데닐화 서열, 프로모터, 인핸서(enhancer), 업스트림(upstream) 활성화 서열, 시그날 펩타이드 서열 및 전사 종결인자를 비롯한 조절서열을 추가로 포함할 수 도 있다.
여기서, 이용된 용어 "작동 가능하게 연결된"이란 핵산 서열간의 결합이 기능적으로 연관되어 있는 것을 의미한다. 임의의 핵산서열이 작동 가능하게 연결된 경우는 임의의 핵산서열이 다른 핵산서열과 기능적으로 관련성을 가지도록 위치해 있는 경우이다. 본 발명에 있어서, 임의의 전사 조절서열이 shRNA의 전사에 영향을 미치는 경우, 상기 전사 조절서열이 상기 shRNA와 작동 가능하게 연결되어 있다고 말한다.
또한, 본 발명은 상기 서열번호 3 또는 4의 TGF-β2 발현을 억제하는 shRNA, 서열번호 5로 표시되는 탑 스트랜드(top strand)와, 서열번호 6으로 표시되는 바텀 스트랜드(bottom strand)를 포함하는 DNA 또는 서열번호 7로 표시되는 탑 스트랜드(top strand)와, 서열번호 8로 표시되는 바텀 스트랜드(bottom strand)를 포함하는 DNA 또는 이를 발현하는 재조합 발현벡터를 유효성분으로 포함하는 항종양 조성물에 관한 것이다.
본 발명의 항종양 조성물의 투여경로는 특별히 한정되지 않고, 경구 투여 또는 비경구 투여(예를 들면, 정맥내 투여, 근육내 투여, 피하 투여, 피내 투여, 점막 투여, 직장내 투여, 질내 투여, 환자에의 국소 투여, 피부투여 등)의 어느 하나의 투여경로에 의해 투여하여도 좋다. 경구 투여에 적당한 제제 형태로서는 고형 또는 액체의 형태가 가능하고, 비경구 투여의 적당한 제제 형태로서는 주사제, 점적제, 좌제, 외용제, 점안제, 점비제 등의 형태가 가능하다. 본 발명의 항종양 조성물은 그 제제형태에 의해, 필요에 따라 약학적으로 허용 가능한 첨가제를 함유하여도 좋다. 약학적으로 허용 가능한 첨가제의 구체적인 예로서는, 예를 들면, 부형제, 결합제, 붕해제, 활택제, 항산화제, 보존제, 안정화제, 등장화제, 착색제, 교미제, 희석제, 유화제, 현탁화제, 용매, 충진제, 증량제, 완충제, 송달 담체, 캐리어, 부형제 및/또는 약학적 어쥬번트 등을 들 수 있다.
경구용 고형제제 형태의 본 발명의 항종양 조성물로서는, 예를 들면, 유효성분에 부형제를 가하고, 아울러, 필요에 따라서, 결합제, 붕해제, 활택제, 착색제 또는 교미제 등의 제제용 첨가물을 가한 후, 통상의 방법에 따라, 정제, 과립제, 산제, 캡슐제로서 조제할 수 있다. 경구용 액체 제제형태의 본 발명의 항종양 조성물로서는, 유효성분에, 교미제, 안정화제, 또는 보존제 등의 제제용 첨가물 1종 또는 2종 이상을 가하고, 통상의 방법에 따라, 내복액제, 시럽제, 엘릭실제 등으로서 조제할 수 있다.
본 발명의 항종양 조성물을 액체 제제로서 처방하기 위하여 사용되는 용매로서는, 수성 또는 비수성의 어느 것도 무방하다. 액체제제는 당해 분야에 주지된 방법에 의해 조제할 수 있다. 예를 들면, 주사제는 생리식염수, PBS와 같은 완충액, 멸균수 등의 용제에 용해시킨 후, 여과지 등으로 여과멸균하고, 이어서 멸균용기(예를 들면, 앰플 등)에 충진하여 조제할 수 있다. 이 주사제에는 필요에 따라, 관용의 약학적 캐리어를 포함하여도 무방하다.
또한, 비침습적인 카테터를 이용하는 투여방법을 사용하여도 좋다. 본 발명에서 사용할 수 있는 캐리어로서는, 중성, 완충화 생리식염수, 또는 혈청알부민을 포함하는 생리식염수 등을 들 수 있다.
TGF-β2 발현을 억제하는 shRNA 발현벡터 등 유전자 송달에 관해서는, 적용되는 세포 내에서 TGF-β2 발현을 억제하는 shRNA 또는 shRNA 발현벡터를 발현시키는 한, 특별히 방법은 한정되지 않으나, 예를 들면, 바이러스 벡터, 리포좀을 이용한 유전자 도입을 이용하는 것이 가능하다. 바이러스 벡터로서는, 예를 들면, 레트로바이러스, 백시니아 바이러스, 아데노바이러스, 신린셈리키 바이러스 등의 동물바이러스를 들 수 있다.
RNAi에 의해 TGF-β2 발현을 억제하는 물질은 세포에 직접 주입하여도 무방하다.
본 발명의 항종양 조성물의 유효성분은 치료학적 유효량으로 사용하며, 상기 조성물의 투여량은 사용 목적, 질환의 중독도, 환자의 연령, 체중, 성별, 기왕력, 또는 유효성분으로서 사용되는 물질의 종류 등을 고려하여 당업자가 결정할 수 있다. 예를 들면, 유효성분으로서 성인 1 kg 당 약 1x1010 particles 내지 1x1012 particles 이다. 본 발명의 항종양 조성물의 투여빈도는, 예를 들면, 1일 1회 내지 수개월에 1회이면 좋다.
본 발명의 shRNA는 TGF-β2 발현을 억제하므로, 본 발명의 약제학적 조성물은 종양과 관련된 다양한 질병 또는 질환, 예컨대 암, 구체적으로 뇌암, 위암, 폐암, 유방암, 난소암, 간암, 기관지암, 비인두암, 후두암, 식도암, 췌장암, 방광암, 전립선암, 대장암, 결장암 및 자궁경부암 등의 예방 및 치료에 이용될 수 있다. 본 명세서에서 용어 "치료"는 (i) 종양 세포 형성의 예방; (ii) 종양 세포의 제거에 따른 종양과 관련된 질병 또는 질환의 억제; 및 (iii) 종양 세포의 제거에 따른 종양과 관련된 질병 또는 질환의 경감을 의미한다. 따라서, 본 명세서에서 용어 "치료학적 유효량"은 상기한 약리학적 효과를 달성하는 데 충분한 양을 의미한다.
이하, 본 발명에 따르는 실시예를 통하여 본 발명을 보다 상세히 설명하나, 본 발명의 범위가 하기 제시된 실시예에 의해 제한되는 것은 아니다.
실시예
1:
shRNA
제조-
TGF
-β2의 침묵(
silencing
)을 효과적으로 유도하는
타겟
선정
본 발명은 TGF-β2의 침묵(silencing)을 유도하기 위하여, 센스 25 mer/안티센스 25 mer(4 개 염기를 가지는 루프를 가운데에 포함)에 근거한 shRNA를 제작하고 아데노바이러스에서 발현시키기 위해 셔틀벡터에 도입하고 상동 재조합(homologous recombination) 바이러스를 제작하였다.
shRNA TGF-β2의 특이성 검증을 위하여, 스크램블드(scrambled) shRNA를 가지는 셔틀벡터도 동시에 제작하였다. 종래 방법에 비하여 특이성과 발현억제능이 크게 향상되었다.
이를 위해, TGF-β2의 shRNA 최소 10 nM에서 마우스의 TGF-β2 mRNA를 75% 이상 억제하는 효과가 있는 shRNA를 실시간 PCR 방법을 통해 확보하였다.
이를 위해 마우스용 shRNA는 피부암세포인 B16F10에 트랜스펙션시키고 24시간이 지난 후 감소되는 정도를 조사하였다.
실험방법은 다음과 같다.
실시간 RT-PCR로 여러 가지 종류의 후보 shRNA 10nM을 30% B16F10에 트랜스펙션하고 24시간 배양 후, 확인(validation)을 통하여 마우스 TGF-β2에 대해 5개의 shRNA 스크리닝 결과 타겟에 해당되는 shRNA에서 73.75% 침묵(silencing) 효과를 확인하였다.
실시간 RT-PCR을 위하여, 정방향 프라이머로는 5'-GTGAATGGCTCTCCTTCGAC-3' [서열번호 9]과 역방향 프라이머로는 5'-CCTCGAGCTCTTCGCTTTTA-3' [서열번호 10]이며, 반응조건은 다음과 같이 수행하였다.
1 단계: 역전사(42 ℃ 5 min, 95 ℃ 10 sec),
2 단계: PCR 반응 (95 ℃ 5 sec, 60 ℃ 20 sec) 50 cycles,
3 단계: 분리(60 ℃-> 95 ℃)로 수행하였다.
확인(validation) 실험 결과, 10개의 표적서열 후보 중 하기 표 1에 근거하여 하기 타겟을 선정하였다.
마우스 표적서열: 5'- GGATTGAACTGTATCAGATCCTTAA - 3' [서열번호 1]
주) ct: cycle threshold, saturation에 도달되는데 걸리는 cycle 수, 작을수록 원래 mRNA양이 많은 것임.
Δct: TGF-β2용 ct에서 actin용 ct를 뺀 값,
ΔΔct: TGF-β2 shRNA 처리 샘플의 Δct에서 대조군의 TGF-β2 Δct를 뺀 값.
2-ΔΔct: 2의 마이너스 지수 ΔΔct 값.
발현억제율: 2-ΔΔct를 백분율로 표시한 것임.
상기 표적서열에 대하여 25/25 +4 루프를 가지는 shRNA를 합성하고 이들의 표적서열에 대한 억제 효과를 실시간 PCR로 확인하였다.
마우스 표적서열(서열번호 1)으로 하는 shRNA: 5'- GGATTGAACTGTATCAGATCCTTAA tctc TTAAGGATCTGATACAGTTCAATCC-3' [서열번호 3]
앞서 설명한 실시간 PCR에 의해 선정된 서열번호 3의 염기서열을 아데노바이러스에서 발현시키기 위해 양 끝단에 BamHI과 HindⅢ 염기 사이트를 삽입하고 중간에 tctc의 4개의 염기를 가지는 루프(loop)를 가지게끔 제작하였다. 즉, 마우스 shRNA의 기본적인 구조는 5'-25 mer-루프(4 mer)-25mer-3'으로 구성되어 있다.
이에 근거하여 아데노바이러스에 도입시키기 위한 하기 2가닥의 DNA 스트랜드(strand)를 제작하여 shRNA 생성을 유도하였다.
탑 스트랜드: 5'- gatcc GGATTGAACTGTATCAGATCCTTAA tctc TTAAGGATCTGATACAGTTCAATCC tttt a - 3' [서열번호 5]
바텀 스트랜드: 5'- agctt aaaa GGATTGAACTGTATCAGATCCTTAA gaga TTAAGGATCTGATACAGTTCAATCC g - 3' [서열번호 6]
인간 TGF-β2 억제를 위한 실시간 PCR용 프라이머는 다음과 같다.
정방향 프라이머: 5'- GCTGCCTACGTCCACTTTACAT - 3' [서열번호 11]
역방향 프라이머: 5'- ATATAAGCTCAGGACCCTGCTG - 3' [서열번호 12]
반응조건은 1 단계: 역전사(42 ℃ 5 min, 95 ℃ 10 sec), 2 단계: PCR 반응 (95 ℃ 5 sec, 60 ℃ 20 sec) 50 cycles, 3 단계: 분리(60 ℃-> 95 ℃)로 수행하였다.
확인(validation) 실험 결과, 3개의 표적서열 후보 중 하기 표 2에 근거하여 하기 타겟을 선정하였다.
인간 표적서열: 5'- GGATTGAGCTATATCAGATTCTCAA -3' [서열번호 2]
상기 표적서열에 대하여 25/25 +4 루프를 가지는 shRNA를 합성하고 이들의 표적서열에 대한 억제 효과를 실시간 PCR로 확인하였다.
인간 표적서열(서열번호 2)을 위한 shRNA: 5'- GGATTGAGCTATATCAGATTCTCAA tctc TTGAGAATCTGATATAGCTCAATCC-3' [서열번호 4]
앞서 설명한 실시간 PCR에 의해 선정된 서열번호 4의 염기서열을 아데노바이러스에서 발현시키기 위해 양 끝단에 BamHI과 HindⅢ 염기사이트를 삽입하고 중간에 tctc의 4개의 염기를 가지는 루프를 가지게끔 제작하였다. 즉, 인간 shRNA의 기본 구조는 5'-25 mer-루프(4 mer)-25mer-3'으로 구성되어 있다.
이에 근거하여 아데노바이러스에 도입시키기 위한 하기 2가닥의 DNA를 제작하였다.
탑 스트랜드: 5'- gatcc GGATTGAGCTATATCAGATTCTCAA tctc TTGAGAATCTGATATAGCTCAATCC tttt a - 3' [서열번호 7]
바텀 스트랜드: 5'- agctt aaaa GGATTGAGCTATATCAGATTCTCAA gaga TTGAGAATCTGATATAGCTCAATCC g - 3' [서열번호 8]
실시예
2:
타겟
서열에 대한
shRNA
발현하는 복제 불능
아데노바이러스
벡터 제작
실시간 RT-PCR을 통하여 확인된 가장 효과적으로 발현을 억제하는 shRNA 염기서열을 센스와 안티센스 서열이 tctc 혹은 tctctc를 사이에 두고 위치하게 하고, 양 끝에 BamHI과 HindⅢ 제한효소 염기서열을 가진 염기로 구성된 올리고뉴클레오티드와 상보적인 올리고뉴클레오티드를 각각 합성하여 합체(annealing)시킨 뒤, E3 셔틀 벡터인 pSP72ΔE3/si-negative 벡터[도 1, pSP72 cloning 벡터(Promega)에 아데노바이러스 E3L(26591-28588)과 E3R(30504-31057)을 삽입하고 Ambion사의 psilencer 2.1-U6 hygro에서 -EcoRI-U6 promoter + -BamHI-nonsense shRNA 용 염기서열인 actaccgttgttataggtgttcaagagacacctataacaacggtagttttttggaa-HindⅢ가 들어간 형태의 pSP72ΔE3/si-negative (scrambled)]를 제작하였다.
인간 또는 마우스의 shRNA TGF-β2 도입을 위하여, 먼저 상기한 pSP72ΔE3/si-negative 플라스미드를 BamHI과 HindⅢ를 처리한 후, 인간 또는 마우스의 shRNA TGF-β2를 삽입시켜 pSP72ΔE3-sh-human TGF-β2 또는 pSP72ΔE3-sh-mouse TGF-β2를 제작하였다[도 2]. 음성 대조군 아데노바이러스로는 양끝에 BamHI과 HindⅢ를 가지게 하고 스크램블드(scrambled) 염기서열(actaccgttgttataggtg)과 loop(ttcaagaga) 제작하였다.
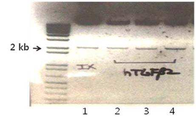
아데노바이러스의 E3 부위 PCR로 양성 클론(#1, 2, 5, 6, 7, 8, 9)만을 선별한 후[도 3의 (a): dl324/IX 아데노바이러스 백본(backbone) 게놈(genomic) DNA와 pSP72-sh-hTGF-β2 셔틀 벡터와의 상동 재조합 후 sh-hTGF-β2가 포함된 클론들을 선별하는 PCR 결과, 도 3의 (b): dl324/IX 아데노바이러스 백본 게놈 DNA와 pSP72-sh-hTGF-β2 셔틀 벡터와의 상동재조합 후 IX 유전자 유무를 통하여 도 3의 (a)에서 확인된 sh-hTGF-β2가 포함된 클론 중에서 게놈 DNA도 포함된 클론들을 재차 선별하는 PCR 결과], 도 3의 (c)에서 보듯이 HindⅢ 절단 패턴(digestion pattern)으로 최종 재조합체를 선별하였다[도 4].
도 3과 도 4를 구체적으로 설명하면 다음과 같다.
도 3의 (a)에서, dl324/IX 레인은 dl324 백본이고; 셔틀 레인은 pSP72-sh-hTGF-β2이다. 레인 1~10은 dl324 백본과 pSP72-sh-hTGF-β2 간의 상동 재조합 후 박테리아 클론(bacterial clone)으로부터 얻은 플라스미드를 E3 부위 증폭시킨 결과를 보여주는 것으로 약 2 kb에 해당하는 밴드가 나타나야 positive이다. E3 부분을 PCR을 하였을 때 E3 부분이 없는 dl324 백본에서는 2 kb에 해당하는 밴드가 나타나지 않지만, E3부분에 U6 프로모터와 sh-hTGF-β2의 sh 컨스트럭트(construct)가 삽입된 셔틀 벡터의 경우 PCR하면 2 kb의 산물(product)의 크기(size)가 나타나는 것을 통하여 상동 재조합되었는지 확인할 수 있다.
도 3의 (b)에서, dl324/IX 레인은 dl324 백본이고; 셔틀 벡터는 pSP72-hTGF-β2이다. 도 3의 (a)에서 확인된 sh-hTGF-β2가 포함된 클론 중(#1, 2, 5, 6, 7, 8, 9)에서 게놈 DNA도 포함된 클론들을 재차 선별하는 PCR 결과로 상동 재조합이 되었다는 것을 확인하는 도 3의 (a)에 이은 연속적인 선별 실험으로 양쪽에서 positive한 클론들이 상동 재조합이 되었음을 의미한다. IX 유전자 부분을 PCR을 하였을 때 IX 유전자를 가지고 있는 dl324 백본과 IX 유전자를 가지고 있지 않은 셔틀 벡터의 차이를 이용하여 상동 재조합이 되었는지를 확인하였다. 그 결과 #1, 2, 6, 7 만이 다시 선별되었다.
도 3의 (c)는, 백본과 샘플과의 HindⅢ로 컷팅(cutting)하였을 때 달라지는 패턴의 차이에 따라 상동 재조합되었는지를 최종적으로 확인한 것이다. 레인1~3은 상기 #1 클론 유래 DNA이고, 레인 4~6은 #2 클론, 레인 7~9는 #6 클론 에서 얻은 DNA를 DH5a라는 컴피턴트 셀(competent cell)에 재차 트랜스포메이션(transformation)하여 얻은 자손(progeny) 클론들로 각 모체(parental) 클론들에서 유래된 각각 3개의 DNA들 중 #1 클론만이 기존의 dl324-IX(맨 왼쪽 첫 번째 lane)과는 다른 HindⅢ 패턴을 보였다. 이는 백본 아데노바이러스 DNA가 셔틀 벡터와 상동 재조합을 이루었음을 의미하며, 따라서 본 발명은 #1 클론에 기초로 하고 있다.
도 4는, pPoly2라는 플라스미드에 PacI 부위에 삽입되어있는 Ad-dl324-IX-sh-hTGF-β2를 PacI으로 절단하여 pPoly2가 제대로 절단되는지 확인함으로써 바이러스 생산에 요구되는 최종 컨스트럭트(construct)를 결정하는 실험이다. 도 3의 (c)에서 확인한 #1 클론에 속하는 3개의 DNA들은 PacI으로 절단 시 전부 약 2 kb에 해당하는 pPoly2 백본 DNA가 모두 빠져나왔다. 이들이 각각 shRNA hTGF-β2 염기서열을 가지고 있는지를 서열 분석하여 확인한 결과 모든 클론들에서 동일한 shRNA hTGF-β2 염기서열을 가지고 있음을 확인하였다(도 5). 그런 다음, 이들을 PacI 절단 후 함께 293A 세포에 트랜스펙션(transfection)하여 아데노바이러스를 생산하였다.
즉, 상기의 방법으로 제작된 E3 셔틀 벡터들을 각각 XmnI 제한 효소로 처리하여 단일가닥으로 만든 다음, SpeI 제한효소를 처리하여 단일가닥이 된 복제 불능 아데노바이러스인 dl324와 함께 대장균 BJ5183에서 동시에 형질전환시켜 유전자 상동 재조합을 유도하였다. 상동 재조합된 플라스미드 DNA를 수득하여 HindⅢ 제한효소로 처리하여 DNA 패턴의 변화를 확인하고 최종적으로 서열 분석하여 상동 재조합 유무를 확인한 후, 확인된 플라스미드들을 PacI으로 절단한 뒤 293 세포주에 형질전환하여 shRNA TGF-β2를 발현하는 복제불능 아데노바이러스를 제작하였다. (복제 가능 아데노바이러스에 shRNA를 제작하는 경우에는 shRNA에 의한 억제 효과와 세포 라이시스(lysis) 효과가 혼재되어 있어 억제 효과만을 명확하게 확인하기 어렵기 때문에 복제 불능 아데노바이러스를 제작하였다). 이 아데노바이러스는 293 세포주에서 증식시켜 CsCl 변화도(gradient)로 농축하여 한계 희석배양법(limiting dilution) 또는 용균반검사(plaque assay)로 바이러스의 역가를 결정하였다.
최종 바이러스 역가(virus titer)는 한계 희석 적정법(limiting dilution titration)에 의해 2.5 × 109 pfu/ml 이였다.
실시에 3: 암세포에서의 효과 확인-
shRNA
발현하는
아데노바이러스에
의한
TGF
-β2 발현 억제 확인
1) 실시간 RT - PCR 로 확인
TGF-β2 발현 억제 확인은 인간의 경우, 인간 전립선암 세포인 DU-145에 실시예 2의 아데노바이러스 1 내지 100 moi로 감염시켜 2일 후, 트리졸(Trizol)로 세포를 라이시스(lysis)시키고, 클로로포름, 이소프로판올, 에탄올 등을 연속적으로 처리하여 RNA를 수확한 후 TGF-β2 mRNA 발현 억제 정도를 실시간 PCR로 확인하였다.
마우스인 경우, 마우스 흑색종세포인 B16F10에 실시예 2의 아데노바이러스 100, 500, 1000 moi로 감염시키고 그 이후의 과정은 인간과 동일하게 실시하였다.
인간 TGF-β2 억제를 위한 실시간 PCR용 프라이머는 정방향 프라이머: 5'-GCTGCCTACGTCCACTTTACAT-3' [서열번호 11]과 역방향 프라이머: 5'-ATATAAGCTCAGGACCCTGCTG-3' [서열번호 12]를 사용하였으며, AB powerSYBR Green RNA-to-Ct 1step kit를 사용하여 RT enzyme mix (125X) 0.2㎕, RT-PCR Mix(2x) 12.5 ㎕, Forward Primer(100 pM) 0.5 ㎕, reverse Primer(100 pM) 0.5 ㎕, RNA (10ng/㎕) 5 ㎕, Nuclease-free water 6.3 ㎕로 총 부피는 25 ㎕가 되게 하였고, 반응 조건은 다음 표 3과 같다.
마우스 TGF-β2 억제를 위한 실시간 PCR용 프라이머는 정방향 프라이머: 5'-GTGAATGGCTCTCCTTCGAC-3' [서열번호 9]과 역방향 프라이머: 5'-CCTCGAGCTCTTCGCTTTTA-3' [서열번호 10]를 사용하였으며, AB powerSYBR Green RNA-to-Ct 1step kit를 사용하여 RT enzyme mix (125X) 0.2㎕, RT-PCR Mix(2x) 12.5 ㎕, Forward Primer(100 pM) 0.5 ㎕, reverse Primer(100 pM) 0.5 ㎕, RNA (10ng/㎕) 5 ㎕, Nuclease-free water 6.3 ㎕로 총 부피는 25 ㎕가 되게 하였고, 반응 조건은 다음 표 3과 같다.
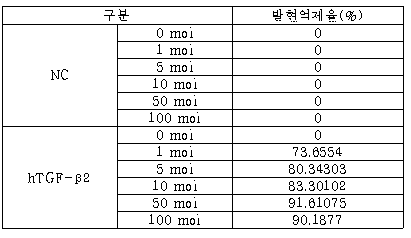
인간 TGF-β2의 shRNA 확인 결과, 1 moi의 아데노바이러스에서 73%의 침묵(silencing) 효과를 보이는 등, 50 moi의 아데노바이러스에서 90% 이상의 TGF-β2 발현 억제를 관찰하였다[표 4, 도 6].
주) NC: Scrambled shRNA sequence가 삽입된 아데노바이러스
마우스 TGF-β2의 shRNA 확인 결과, 1000 moi의 아데노바이러스에서 50 %의 침묵(silencing) 효과를 보였다[도 7]. 인간에 비해 상대적으로 낮은 억제율은 마우스세포에 대한 아데노바이러스의 낮은 감염율에 기인한 것으로 보인다. 이에 대한 확인은 마우스 shTGF-β2가 발현하는 플라스미드를 트랜스펙션(transfection)함으로써 발현된 shRNA가 효과적으로 TGF-β2 mRNA를 억제하는 것으로 확인하였다[도 8].
2) ELISA 로 확인
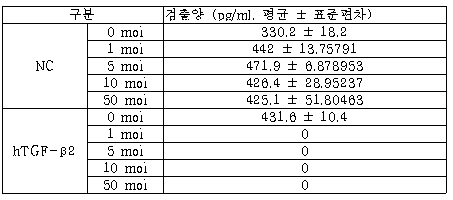
상기한 아데노바이러스 1, 5, 10, 50 moi 감염 후 2일 동안 인간 실시예 2의 전립선암세포에 배양하면서 마지막 24 시간은 무혈청 배지로 분비된 TGF-β2 양을 측정하였다.
TGF-β2의 shRNA를 발현하는 아데노바이러스를 1 moi만 감염되도 하루 동안 분비되는 TGF-β2는 거의 검출되지 않았다[표 5, 도 9]. 이는 TGF-β2의 shRNA가 매우 효과적으로 TGF-β2의 mRNA를 분해하고 있음을 의미한다.
실시예
4: 종양 선택적 살상
아데노바이러스
제작
복제 불능한 아데노바이러스에서 TGF-β2에 대한 shRNA의 효과를 확인한 후 이 shRNA를 발현하면서 종양 선택적으로 세포를 살상하는 아데노바이러스를 제작하였다. 종양 선택적 살상 복제 가능한 아데노바이러스를 만들기에 앞서 아데노바이러스의 E1A부분에 여러 유전자를 넣을 수 있는 셔틀벡터를 제작하고자 pBSKII 플라스미드[Stratagene, USA]에E1A와 E1B55kDa 유전자를 포함하며 다양한 효소 부위(Enzyme site)를 포함하는 pBSKⅡ-3484 합성 유전자를 제작하였다[도 10의 (a)]. 합성된 유전자를 상동 재조합 확인을 용이하게 하기 위한 pCA14 셔틀벡터에 도입하기 위한 형태로 바꾸기 위하여 pBSKⅡ-3484를 PCR하여 FspⅠ으로 제한효소를 처리한 뒤 블런팅(blunting) 효소로 블런트 엔드(blunt end)를 만들고 다시 BamHⅠ으로 처리하였다. pCA14[Microbix BiosystemsInc, Canada]는 SspⅠ으로 제한효소를 이용하여 자른 후 블런팅 효소를 이용하여 블런트 엔드를 만든 후, BglⅡ를 처리하여 동일전달제한효소(Isoschizomer)인 BamHⅠ과 BglⅡ 그리고 양끝의 블런트 엔드를 통해 합성된 유전자를 삽입하여 셔틀 벡터 pCA14-3484를 제작하였다[도 10의 (b)]. 그 후 CMV 프로모터 유전자를 KpnⅠ과 XhoⅠ으로 pCA14-3484에 삽입하여 pCA14-CMV-3484를 제작하였다[도 10의 (c)]. 그리고 pCA14-CMV-3484에서 EcoRI과 SalI 제한효소의 의해 E1B55kDa 부분을 자르고 블런팅(blunting)한 후 다시 연결(ligation)된 pCA14-CMV-3484-ΔE1B55를 얻었다[도 10의 (d)]. 제작된 셔틀 벡터 pCA14-CMV-3484-ΔE1B55를 XmnI으로 잘라 linearization시킨 후 IX 유전자가 없는 dl324-BstBⅠ-human shTGF-β2(또는 mouse shTGF-β2)를 BstBI으로 자른 후 대장균 BJ5183 에서 동시에 형질전환시켜 상동 재조합을 유도하였다. 상동 재조합된 플라스미드 DNA를 수득하여 HindⅢ 제한효소로 처리하여 DNA 패턴의 변화를 확인하고 최종적으로 서열 분석하여 상동 재조합 유무를 확인한 후, 확인된 플라스미드들을 PacI으로 절단한 뒤 293 세포주에 형질전환하여 종양을 선택적으로 살상하면서 인간(또는 마우스) TGF-β2의 발현을 억제하는 dl324-CMV-3484-shTGF-β2 아데노바이러스를 제작하였다[도 11].
도 12는 실제 마우스 shTGF-β2가 포함된 종양선택적 복제 가능 아데노바이러스 제작을 위한 상동 재조합 과정을 나타낸 것으로, E3 스크리닝 결과, 1, 2, 4, 5, 6 클론이 positive clone으로 1차 선별되었고(a), HindⅢ 절단 패턴(digestion pattern)으로 상동 재조합된 콜로니를 선별하고 1,2,4번 콜로니 모두 대조구와 패턴 비교한 결과 재조합된 것으로 확인하였고(b), PacI 절단 후 1, 2, 4 콜로니 중 1번만 PacI으로 절단되어 2kb 정도의 밴드를 확인함으로써 1번 콜로니의 DNA가 상동 재조합된 dl324-CMV-3484-△E1B55-△E3-sh-mTGF-β2의 DNA임을 확인할 수 있었다(c)
도 13은 인간 shTGF-β2가 포함된 종양선택적 복제 가능 아데노바이러스 제작을 위한 상동 재조합 과정을 나타낸 것으로, HindⅢ 절단 패턴에 의한 상동 재조합이 된 클론(1, 2, 3)이 선별되었으며(a), 상기 클론 1, 2, 3의 DNA를 PacI으로 잘라 보았을 때 클론 DNA 1,2,3 모두 절단되어 2 kb 정도의 밴드 확인하였으며, 이는 1,2,3 콜로니의 DNA가 상동 재조합된 dl324-CMV-3484-ΔE1B55-ΔE3-sh-hTGF-β2의 DNA 확인할 수 있었다(b).
실시예
5:
세포용혈
확인
복제 가능한 아데노바이러스의 세포 살상능을 확인하기 위하여 24 웰 플레이트(well plate)에 각 종류의 세포를 4×104에서 1×105까지 세포의 크기에 따라 세포수를 정한 뒤 분주하여 배양한 후 다음날 survivin promoter와 CMV 프로모터를 가진 복제 가능한 아데노바이러스를 MOI별로 감염시켜 양성 대조군인 293A 세포주에서 가장 낮은 MOI에서 세포가 바이러스에 의해 다 죽을 때 실험을 종료하여 각 플레이트에 죽지 않고 살아있던 세포를 Crystal violet으로 염색하였다. 3.7% 파라포름알데히드(Paraformaldehyde)로 세포를 5분간 상온에서 고정시킨 후 0.05% Crystal violet으로 상온에서 30분간 염색시킨 후 물로 세척하여 염색된 세포를 관찰하였다. 두 종류의 종양 살상 바이러스로 바이러스의 종양 살상 효과를 비교한 결과 프로모터에 따른 살상효과의 차이는 크지 않은 것으로 나타났으며 둘 다 종양 선택성이 뛰어남을 확인하였다.
도 14는 종양선택적 복제 가능 아데노바이러스(CMV promoter와 E1B 55KDa가 발현되지 못하는 dl324-CMV-3484과 surviving promoter에 의해 선택성을 부여하고 55KDa가 발현되는 dl324-hSurvivin-3484)들이 정상세포(BJ 세포)에서는 복제가 일어나지 않는데 반해 여러 종류의 인간암세포에서는 복제가 일어나 세포의 용혈이 일어나는 것을 보여준 것이다.
실시예
6: 암세포에서의 효과 확인
A375 멜라노마 세포주에서 인간 sh-TGF-β1 또는 sh-TGF-β2를 발현하는 실시예 2의 복제 불능 아데노바이러스를 1, 5, 10, 50, 100 moi로 감염시키고 나서 세포내에 존재하는 TGF-β1, TGF-β2, TGF-β3 mRNA의 수준을 실시간 PCR 방법으로 실행하였다.
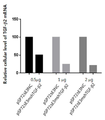
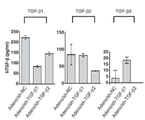
그 결과, TGF-β1의 shRNA를 발현하는 경우 세포내 TGF-β1 mRNA를 감소시키기는 하나 TGF-β2 mRNA나 TGF-β3 mRNA가 증가하는 경향으로 나타났다. 반면에 TGF-β2의 shRNA를 발현하는 경우 세포내 TGF-β2 mRNA를 효과적으로 감소시키면서 동시에 TGF-β2 mRNA나 TGF-β3 mRNA도 감소하는 경향으로 나타났다[도 15]. 이는 세포 내의 보상 효과 측면에 의한 효능 감소 우려가 적어도 TGF-β2의 shRNA를 발현하는 경우에는 이런 현상이 나타나지 않았을 뿐만 아니라 다른 TGF-β의 isotype도 억제시키는 부수 효과도 가질 수 있는 장점이 된다. 이와 비슷한 결과가 ELISA를 사용하여 TGF-β 단백질의 발현 감소 효과 패턴도 실시간 PCR에서와 유사하게 나타났다[도 16].
이는 TGF-β2에 대한 shRNA 발현하는 아데노바이러스가 TGF-β1에 대한 shRNA 발현하는 아데노바이러스 보다 발현 억제 효과가 상대적으로 우수함을 확인한 것이다.
<110> Industry-Academic Cooperation Foundation, Yonsei University
<120> The shRNA downregulating TGF-beta2 for treatment of tumor
<150> KR10-2012-0009811
<151> 2012-01-31
<160> 12
<170> KopatentIn 1.71
<210> 1
<211> 25
<212> DNA
<213> mouse target sequence
<400> 1
ggattgaact gtatcagatc cttaa 25
<210> 2
<211> 25
<212> DNA
<213> human target sequence
<400> 2
ggattgagct atatcagatt ctcaa 25
<210> 3
<211> 54
<212> DNA
<213> Artificial Sequence
<220>
<223> mouse shRNA
<400> 3
ggattgaact gtatcagatc cttaatctct taaggatctg atacagttca atcc 54
<210> 4
<211> 54
<212> DNA
<213> Artificial Sequence
<220>
<223> human shRNA
<400> 4
ggattgagct atatcagatt ctcaatctct tgagaatctg atatagctca atcc 54
<210> 5
<211> 64
<212> DNA
<213> Artificial Sequence
<220>
<223> top strand
<400> 5
gatccggatt gaactgtatc agatccttaa tctcttaagg atctgataca gttcaatcct 60
ttta 64
<210> 6
<211> 64
<212> DNA
<213> Artificial Sequence
<220>
<223> bottom strand
<400> 6
agcttaaaag gattgaactg tatcagatcc ttaagagatt aaggatctga tacagttcaa 60
tccg 64
<210> 7
<211> 64
<212> DNA
<213> Artificial Sequence
<220>
<223> top strand
<400> 7
gatccggatt gagctatatc agattctcaa tctcttgaga atctgatata gctcaatcct 60
ttta 64
<210> 8
<211> 64
<212> DNA
<213> Artificial Sequence
<220>
<223> bottom strand
<400> 8
agcttaaaag gattgagcta tatcagattc tcaagagatt gagaatctga tatagctcaa 60
tccg 64
<210> 9
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> forward primer
<400> 9
gtgaatggct ctccttcgac 20
<210> 10
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> reverse primer
<400> 10
cctcgagctc ttcgctttta 20
<210> 11
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> forward primer
<400> 11
gctgcctacg tccactttac at 22
<210> 12
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> reverse primer
<400> 12
atataagctc aggaccctgc tg 22
Claims (10)
- 서열번호 1 또는 2로 표시되는 염기서열을 표적서열로 하고, TGF-β2 발현을 억제하는 shRNA.
- 제 1 항에 있어서,
서열번호 3 또는 서열번호 4로 표시되는 shRNA.
- 제 1 항의 shRNA를 유효성분으로 함유하는 항종양 조성물.
- 제 1 항의 shRNA 발현하는 재조합 발현벡터.
- 제 4 항에 있어서,
서열번호 5로 표시되는 탑 스트랜드(top strand)와, 서열번호 6으로 표시되는 바텀 스트랜드(bottom strand)를 포함하는 DNA를 포함하는 재조합 발현벡터. - 제 4 항에 있어서,
서열번호 7로 표시되는 탑 스트랜드(top strand)와, 서열번호 8로 표시되는 바텀 스트랜드(bottom strand)를 포함하는 DNA를 포함하는 재조합 발현벡터.
- 제 4 항에 있어서,
U6 프로모터를 함유하는 벡터에 DNA를 재조합시켜 수득하는 재조합 발현벡터. - 제 4 항에 있어서,
pSP72△E3-sh-human TGF-β2 또는 pSP72△E3-sh-mouse TGF-β2인 재조합 발현벡터.
- 제 4 항의 재조합 발현벡터를 유효성분으로 하는 항종양 조성물.
- 제 4 항의 재조합 발현벡터를 도입한 아데노바이러스.
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PCT/KR2013/000791 WO2013115579A1 (ko) | 2012-01-31 | 2013-01-31 | TGF-β2 발현을 억제하는 shRNA |
| JP2014555484A JP2015506696A (ja) | 2012-01-31 | 2013-01-31 | TGF−β2発現を抑制するshRNA |
| CN201380007620.1A CN104245936B (zh) | 2012-01-31 | 2013-01-31 | 用于抑制TGF-β2表达的shRNA |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR20120009811 | 2012-01-31 | ||
| KR1020120009811 | 2012-01-31 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20130088792A KR20130088792A (ko) | 2013-08-08 |
| KR101420564B1 true KR101420564B1 (ko) | 2014-07-17 |
Family
ID=49215002
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020130010233A KR101420564B1 (ko) | 2012-01-31 | 2013-01-30 | TGF-β2 발현을 억제하는 shRNA |
Country Status (3)
| Country | Link |
|---|---|
| JP (1) | JP2015506696A (ko) |
| KR (1) | KR101420564B1 (ko) |
| CN (1) | CN104245936B (ko) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015152609A1 (ko) * | 2014-03-31 | 2015-10-08 | 연세대학교 산학협력단 | GM-CSF 유전자; 데코린 유전자; TGF-β2 발현을 억제하는 shRNA; 및 FoxP3 발현을 억제하는 shRNA를 포함하는 항종양 조성물 |
| KR101713407B1 (ko) * | 2014-03-31 | 2017-03-07 | 연세대학교 산학협력단 | 아데노바이러스 감염 및 복제가 가능한 흑색종 세포주 |
| WO2017099474A1 (ko) * | 2015-12-08 | 2017-06-15 | 연세대학교 산학협력단 | GM-CSF 유전자; FLT3L-TRAIL 융합 유전자; TGF-β 발현을 억제하는 shRNA; 및 HSP 발현을 억제하는 shRNA를 포함하는 항종양 조성물 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20120115923A1 (en) * | 2005-12-30 | 2012-05-10 | Intradigm Corporation | Sirna Compositions Promoting Scar-Free Wound Healing of Skin and Methods for Wound Treatment |
| US8936910B2 (en) * | 2010-06-11 | 2015-01-20 | Antisense Pharma Gmbh | Method for selective oligonucleotide modification |
| CN101974529B (zh) * | 2010-09-21 | 2013-04-03 | 南京大学(苏州)高新技术研究院 | 含自由三磷酸基团的TGF-β特异性siRNA及其应用 |
-
2013
- 2013-01-30 KR KR1020130010233A patent/KR101420564B1/ko active IP Right Grant
- 2013-01-31 JP JP2014555484A patent/JP2015506696A/ja active Pending
- 2013-01-31 CN CN201380007620.1A patent/CN104245936B/zh active Active
Non-Patent Citations (3)
| Title |
|---|
| Chenyu Zhang 등. Cancer Research. Vol. 69, No. 3, 페이지 828- 835 (2009.) * |
| GenBank Accession Number NM_001135599 (2010.12.19.) * |
| GenBank Accession Number NM_009367 (2010.12.29.) * |
Also Published As
| Publication number | Publication date |
|---|---|
| CN104245936A (zh) | 2014-12-24 |
| KR20130088792A (ko) | 2013-08-08 |
| CN104245936B (zh) | 2016-04-06 |
| JP2015506696A (ja) | 2015-03-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8389487B2 (en) | siRNA-mediated gene silencing of synuclein | |
| US7148342B2 (en) | Compositions and methods for sirna inhibition of angiogenesis | |
| US20100086526A1 (en) | Nucleic acid constructs and methods for specific silencing of h19 | |
| WO2009100955A1 (en) | Antisense rna targeting cxcr4 | |
| US9222090B2 (en) | RNA interference target for treating AIDS | |
| WO2016030501A1 (en) | Synthetic alu-retrotransposon vectors for gene therapy | |
| CN111876421A (zh) | 靶向KrasG12D突变转录本的gRNA序列、载体及其应用 | |
| US20230383275A1 (en) | Sgrna targeting aqp1 rna, and vector and use thereof | |
| KR101420564B1 (ko) | TGF-β2 발현을 억제하는 shRNA | |
| EP2766481A1 (en) | Targeting of mirna precursors | |
| KR101286053B1 (ko) | TGF-β1 발현을 억제하는 shRNA | |
| KR20180012255A (ko) | 이영양성 수포성 표피박리증 치료를 위한 안티센스 올리고뉴클레오타이드 | |
| JP2008048621A (ja) | キメラ型アデノウイルスとその作製方法並びにそれを用いた医薬 | |
| KR101374585B1 (ko) | HSP27 발현을 억제하는 shRNA | |
| KR101683964B1 (ko) | Daxx의 발현을 억제하는 핵산 분자, TRAIL 유전자 및 Bcl-xL 의 발현을 억제하는 핵산 분자를 포함하는 재조합 발현 벡터 | |
| EP2128261A1 (en) | A recombinant adenovirus comprising recombinant khp50 gene and preparation method and uses thereof | |
| US20090060889A1 (en) | Ii-RNAi involved Ii suppression in cancer immunotherapy | |
| WO2013115579A1 (ko) | TGF-β2 발현을 억제하는 shRNA | |
| WO2024078345A1 (zh) | snRNA核酸分子及其应用 | |
| WO2023134560A1 (zh) | 一种核苷酸及其应用 | |
| JP4505566B2 (ja) | 肺癌治療剤 | |
| KR100627377B1 (ko) | 뇌하수체 종양-형질전환 유전자 1 단백질의 합성을 차단할수 있는 작은 간섭 rna 및 이를 발현하는 벡터를 이용한 암의 유전자 치료 | |
| WO2023191631A1 (en) | Antisense nucleic acids for use in the treatment for lmna mutation carriers | |
| KR20240034143A (ko) | 신규한 유전체 세이프 하버 및 이의 용도 | |
| CN117778474A (zh) | 一种基于CRISPR-Cas13a靶向敲低癌基因的表达载体及其应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20180702 Year of fee payment: 5 |
|
| FPAY | Annual fee payment |
Payment date: 20190701 Year of fee payment: 6 |