KR101331573B1 - Photo-curable and thermo-curable resin composition and dry film solder resist - Google Patents
Photo-curable and thermo-curable resin composition and dry film solder resist Download PDFInfo
- Publication number
- KR101331573B1 KR101331573B1 KR1020130017683A KR20130017683A KR101331573B1 KR 101331573 B1 KR101331573 B1 KR 101331573B1 KR 1020130017683 A KR1020130017683 A KR 1020130017683A KR 20130017683 A KR20130017683 A KR 20130017683A KR 101331573 B1 KR101331573 B1 KR 101331573B1
- Authority
- KR
- South Korea
- Prior art keywords
- acid
- compound
- group
- resin composition
- thermosetting
- Prior art date
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L101/00—Compositions of unspecified macromolecular compounds
- C08L101/02—Compositions of unspecified macromolecular compounds characterised by the presence of specified groups, e.g. terminal or pendant functional groups
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F283/00—Macromolecular compounds obtained by polymerising monomers on to polymers provided for in subclass C08G
- C08F283/02—Macromolecular compounds obtained by polymerising monomers on to polymers provided for in subclass C08G on to polycarbonates or saturated polyesters
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L69/00—Compositions of polycarbonates; Compositions of derivatives of polycarbonates
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L77/00—Compositions of polyamides obtained by reactions forming a carboxylic amide link in the main chain; Compositions of derivatives of such polymers
- C08L77/12—Polyester-amides
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/027—Non-macromolecular photopolymerisable compounds having carbon-to-carbon double bonds, e.g. ethylenic compounds
- G03F7/028—Non-macromolecular photopolymerisable compounds having carbon-to-carbon double bonds, e.g. ethylenic compounds with photosensitivity-increasing substances, e.g. photoinitiators
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- Physics & Mathematics (AREA)
- General Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Materials For Photolithography (AREA)
Abstract
본 발명은 보다 높은 유리 전이 온도 및 향상된 내열 신뢰성을 갖는 드라이 필름 솔더 레지스트의 제공을 가능케 하는 광경화성 및 열경화성을 갖는 수지 조성물 및 드라이 필름 솔더 레지스트 에 관한 것이다. 상기 수지 조성물은 카르복시기(-COOH)와, 광경화 가능한 불포화 작용기를 갖는 이미노카보네이트계 화합물을 포함하는 산변성 올리고머; 3개 이상의 광경화 가능한 불포화 작용기를 갖는 광중합성 모노머; 열경화 가능한 작용기를 갖는 열경화성 바인더; 및 광개시제를 포함할 수 있다. The present invention relates to resin compositions and dry film solder resists having photocurable and thermoset properties that enable the provision of dry film solder resists having higher glass transition temperatures and improved heat resistance reliability. The resin composition may be an acid-modified oligomer comprising a carboxyl group (-COOH) and an iminocarbonate compound having a photocurable unsaturated functional group; Photopolymerizable monomers having three or more photocurable unsaturated functional groups; Thermosetting binders having thermosetting functional groups; And photoinitiators.
Description
본 발명은 광경화성 및 열경화성을 갖는 수지 조성물 및 드라이 필름 솔더 레지스트(DFSR: Dry Film Solder Resist; 이하, 같다.)에 관한 것이다. 보다 구체적으로, 본 발명은 보다 높은 유리 전이 온도 및 향상된 내열 신뢰성을 갖는 DFSR의 제공을 가능케 하는 광경화성 및 열경화성을 갖는 수지 조성물 및 DFSR에 관한 것이다. TECHNICAL FIELD The present invention relates to a resin composition having a photocurable and thermosetting property and a dry film solder resist (DFSR). More specifically, the present invention relates to resin compositions and DFSR having photocurable and thermosetting properties that enable the provision of DFSR with higher glass transition temperatures and improved heat resistance reliability.
각종 전자 기기의 소형화와 경량화에 따라, 인쇄회로기판, 반도체 패키지 기판, 플렉시블 회로기판 등에는 미세한 개구 패턴을 형성할 수 있는 감광성의 솔더 레지스트가 사용되고 있다.BACKGROUND ART With the miniaturization and light weight of various electronic devices, photosensitive solder resists capable of forming fine opening patterns are used for printed circuit boards, semiconductor package substrates, and flexible circuit boards.
반도체 패키지 제품은 에폭시 몰딩, 솔더 레지스트와 같은 부도체, 칩다이(Chip Die)와 같은 반도체, 기판 회로 패턴과 같은 도체로 구성된 복합 재료로 이를 제조하기 위해서는 가혹한 열충격 조건을 수반한 여러 공정을 거쳐야 한다. 하지만, 부도체, 반도체, 도체 각각의 열팽창계수(CTE, Coefficient of Thermal Expansion)가 서로 다름으로 인하여 부품의 치수 불안정, 휨(warpage) 현상이 문제로 나타난다. 이런 현상은 칩다이와 반도체 기판을 땜납볼이나 골드 와이어로 연결할 때 칩과 기판 사이의 위치 불일치 현상을 발생시키고, 또한 전단 응력으로 인해 제품의 균열 및 파단을 발생할 수 있으며 이는 제품의 수명에 영향을 줄 수 있다. 최근 기판의 두께가 점차 얇아짐에 따라 이러한 치수 불안정이나 휨 현상들이 더 큰 문제가 되고 있다. 이를 해결하기 위한 일환으로 소재 간 CTE 불일치(mismatch)를 최소화하는 방향으로 소재가 개발되고 있으며, 솔더 레지스트 또한 보다 낮은 열팽창계수를 가지는 솔더레지스트로의 개발이 지속적으로 요구되고 있다. Semiconductor packaged products are composite materials consisting of epoxy molding, insulators such as solder resists, semiconductors such as chip dies, and conductors such as substrate circuit patterns, which require a number of processes involving severe thermal shock conditions. However, due to the difference in the coefficient of thermal expansion (CTE) of each of the insulators, semiconductors, and conductors, dimensional instability and warpage of the component appear as problems. This phenomenon causes a mismatch between the chip and the substrate when soldering the chip die and the semiconductor substrate with solder balls or gold wires, and also causes the product to crack and break due to shear stress, which may affect the life of the product. Can be. Recently, as the thickness of the substrate becomes thinner, such dimensional instability and warpage are becoming more problematic. In order to solve this problem, materials are being developed to minimize CTE mismatch between materials, and solder resists are continuously required to be developed as solder resists having a lower coefficient of thermal expansion.
이전에 알려진 드라이 필름형 솔더 레지스트의 열팽창 계수는 α1(Tg 전의 열팽창계수)이 45 내지 70ppm이고 α2(Tg 후의 열팽창계수)는 140 내지 170ppm이다. The thermal expansion coefficient of the dry film type solder resist previously known is 45 to 70 ppm of α1 (coefficient of thermal expansion before Tg) and 140 to 170 ppm of α2 (coefficient of thermal expansion after Tg).
최근 기판 재료 중 코어의 경우 10ppm이하 또는 5ppm이하의 열팽창계수를 갖는 재료들이 개발되고 있는 것으로 알려져 있으나, 이와 함께 사용할 수 있는 솔더 레지스트의 재료는 개발은 아직까지 알려진 바 없다. Recently, materials having a thermal expansion coefficient of 10 ppm or less or 5 ppm or less have been developed in the case of the core of the substrate material, but the development of a solder resist material that can be used with it has not been known until now.
그리고, 사용되는 필러의 함량을 증가시킴으로써 솔더 레지시트의 열팽창계수를 낮추려는 시도가 있었으나, 필러의 함량을 일정 수준 이상 높이게 되면 필러의 응집으로 인하여 코팅 불량 현상이 나타날 수 있으며, 코팅 후 경화 전에 신장율이 감소하여 작업성이 저하되는 등의 문제가 나타날 수 있다. In addition, there have been attempts to lower the coefficient of thermal expansion of the solder resist sheet by increasing the content of the filler, but if the content of the filler is raised above a certain level, poor coating may occur due to the aggregation of the filler. This decrease may cause problems such as poor workability.
솔더 레지스트에 대해서는, 일반적으로 현상성, 고해상성, 절연성, 점착성, 납땜 내열성, 금 도금 내성 등의 특성이 요구된다. 특히, 반도체 패키지 기판용의 솔더 레지스트에 대해서는, 이러한 특성 이외에, 예를 들어, -65 ℃ 내지 150 ℃의 온도 사이클 시험(TCT)에 대한 내크랙성이나 미세 배선간으로의 HAST (Highly Accelerated Stress Test) 특성이 요구되고 있다.The solder resist generally requires characteristics such as developability, high resolution, insulation, adhesion, soldering heat resistance, gold plating resistance, and the like. In particular, for solder resists for semiconductor package substrates, in addition to these characteristics, for example, the crack resistance for the temperature cycle test (TCT) of -65 ° C to 150 ° C or the HAST (Highly Accelerated Stress Test between fine wirings). ) Characteristics are required.
근래에는, 솔더 레지스트로서, 막 두께의 균일성, 표면 평활성, 박막 형성성이 양호한 드라이 필름 타입의 솔더 레지스트가 주목받고 있다. 이와 같은 드라이 필름 타입의 솔더 레지스트는 상기 특성 이외에도, 레지스트 형성을 위한 공정의 간략화나 레지스트 형성시의 용제 배출량 절감이라는 장점을 가질 수 있다. In recent years, as a soldering resist, the dry-film type soldering resist which has favorable film thickness uniformity, surface smoothness, and thin film formability attracts attention. Such a dry film type solder resist may have advantages such as simplification of the process for forming the resist and reduction of solvent emissions during the resist formation in addition to the above characteristics.
종래에는 솔더 레지스트의 형성을 위해, 산변성 올리고머, 광개시제 및 열경화성 바인더와 함께, 다관능 아크릴레이트 등의 광중합성 모노머를 포함하여 광경화성 및 열경화성을 갖는 수지 조성물이 사용된 바 있다. 그러나, 이러한 수지 조성물로부터 형성된 솔더 레지스트는 유리 전이 온도가 그리 높지 않고 이에 따른 내열 신뢰성이 충분치 못하여, 반도체 소자의 패키지 기판 재료에 요구되는 PCT 내성, TCT 내열성 및 미세 배선간으로의 HAST 내성 등을 제대로 충족하지 못하는 단점이 있었다. Conventionally, in order to form a soldering resist, the resin composition which has photocurability and thermosetting, including photopolymerizable monomers, such as a polyfunctional acrylate, with an acid-modified oligomer, a photoinitiator, and a thermosetting binder, was used. However, the solder resist formed from such a resin composition does not have a high glass transition temperature and is not sufficient in heat resistance reliability, so that the PCT resistance, TCT heat resistance, and HAST resistance between the fine wirings required for the package substrate material of the semiconductor device are adequate. There was a disadvantage that could not be met.
본 발명은 보다 높은 유리 전이 온도 및 낮은 열팽창계수(CTE, Coefficient of Thermal Expansion)과 함께 향상된 내열 신뢰성을 갖는 DFSR을 제공할 수 있는 광경화성 및 열경화성을 갖는 수지 조성물을 제공하는 것이다. The present invention provides a resin composition having photocurability and thermosetting that can provide DFSR with improved heat resistance with higher glass transition temperature and low coefficient of thermal expansion (CTE).
본 발명은 또한, 보다 향상된 내열 신뢰성 등을 나타내는 DFSR을 제공하는 것이다. The present invention also provides a DFSR that exhibits improved heat resistance reliability and the like.
본 발명은 카르복시기(-COOH)와, 광경화 가능한 불포화 작용기를 갖는 이미노카보네이트계 화합물을 포함하는 산변성 올리고머; 3개 이상의 광경화 가능한 불포화 작용기를 갖는 광중합성 모노머; 열경화 가능한 작용기를 갖는 열경화성 바인더; 및 광개시제를 포함하는 광경화성 및 열경화성을 갖는 수지 조성물을 제공한다. The present invention provides an acid-modified oligomer comprising a carboxyl group (-COOH) and an iminocarbonate compound having a photocurable unsaturated functional group; Photopolymerizable monomers having three or more photocurable unsaturated functional groups; Thermosetting binders having thermosetting functional groups; And a photocurable and thermosetting resin composition comprising a photoinitiator.
상기 이미노카보네이트계 화합물은 시아네이트 에스테르계 화합물에 디카르복실산 화합물과, 광경화 가능한 불포화 작용기 및 히드록시기 또는 카르복시기를 갖는 화합물을 반응시켜 형성된 것 일 수 있다. The iminocarbonate-based compound may be formed by reacting a cyanate ester compound with a dicarboxylic acid compound, a compound having a photocurable unsaturated functional group and a hydroxyl group or a carboxyl group.
상기 디카르복실산 화합물로는 옥살산, 말론산, 석신산, 글루타르산, 아디프산, 프탈산, 이소프탈산, 테레프탈산, 노보넨 디카르복실산, 시클로헥센 디카르복실산(Cyclohexene dicarboxylic acid), 시클로헥세인 디카르복실산, 이미다졸 디카르복실산, 피리딘 디카르복실산 및 이들의 산 무수물로 이루어진 군에서 선택된 1종 이상의 화합물을 포함할 수 있다. Examples of the dicarboxylic acid compound include oxalic acid, malonic acid, succinic acid, glutaric acid, adipic acid, phthalic acid, isophthalic acid, terephthalic acid, norbornene dicarboxylic acid, cyclohexene dicarboxylic acid, It may include one or more compounds selected from the group consisting of cyclohexane dicarboxylic acid, imidazole dicarboxylic acid, pyridine dicarboxylic acid and acid anhydrides thereof.
상기 광경화 가능한 불포화 작용기 및 히드록시기 또는 카르복시기를 갖는 화합물은 아크릴산, 메타크릴산, 부텐산(butenoic acid), 헥센산(hexenoic acid), 신남산, 알릴페놀, 히드록시스티렌, 히드록시시클로헥센 또는 히드록시나프토퀴논으로 이루어진 군에서 선택된 1종 이상의 화합물을 포함할 수 있다. The compound having a photocurable unsaturated functional group and a hydroxyl group or a carboxyl group is acrylic acid, methacrylic acid, butenoic acid, hexenoic acid, cinnamic acid, allylphenol, hydroxystyrene, hydroxycyclohexene or hydroxy It may include one or more compounds selected from the group consisting of oxynaphthoquinone.
상기 시아네이트 에스테르계 화합물은 시아나이드기 (-OCN)를 갖는 비스페놀계 또는 노볼락계 화합물을 포함할 수 있다. The cyanate ester compound may include a bisphenol or novolac compound having a cyanide group (-OCN).
상기 디카르복실산 화합물과, 광경화 가능한 불포화 작용기 및 히드록시기 또는 카르복시기를 갖는 화합물은 2 : 8 내지 8 : 2의 몰 비로 사용되어 상기 시아네이트 에스테르계 화합물와 반응될 수 있다. The dicarboxylic acid compound and the compound having a photocurable unsaturated functional group and a hydroxyl group or a carboxyl group may be used in a molar ratio of 2: 8 to 8: 2 to react with the cyanate ester compound.
상기 산변성 올리고머는 하기 화학식 1의 이미노카보네이트계 화합물을 포함할 수 있다. The acid-modified oligomer may include an iminocarbonate-based compound of Formula 1 below.
[화학식 1][Formula 1]
상기 화학식 1에서, n은 1 내지 100의 정수이고, R1은 광경화 가능한 불포화 작용기 및 히드록시기 또는 카르복시기를 갖는 화합물에서 유래한 작용기이고, R2는 디카르복실산 화합물에서 유래한 작용기이다.In Formula 1, n is an integer of 1 to 100, R 1 is a functional group derived from a compound having a photocurable unsaturated functional group and a hydroxy group or a carboxy group, R 2 is a functional group derived from a dicarboxylic acid compound.
상기 산변성 올리고머는 수지 조성물의 전체 중량을 기준으로 15 내지 75 중량%로 포함될 수 있다. The acid-modified oligomer may be included in 15 to 75% by weight based on the total weight of the resin composition.
상기 광중합성 모노머는 3개 이상의 광경화 가능한 불포화 작용기를 갖는 아크릴레이트계 화합물을 포함할 수 있다. The photopolymerizable monomer may include an acrylate compound having three or more photocurable unsaturated functional groups.
상기 광중합성 모노머는 수산기 함유 아크릴레이트계 화합물, 수용성 아크릴레이트계 화합물, 폴리에스테르아크릴레이트계 화합물, 폴리우레탄아크릴레이트계 화합물, 에폭시아크릴레이트계 화합물 및 카프로락톤 변성 아크릴레이트계 화합물로 이루어진 군에서 선택된 1종 이상의 화합물을 포함할 수 있다.The photopolymerizable monomer is selected from the group consisting of a hydroxyl group-containing acrylate compound, a water-soluble acrylate compound, a polyester acrylate compound, a polyurethane acrylate compound, an epoxy acrylate compound, and a caprolactone-modified acrylate compound It may include one or more compounds.
상기 광중합성 모노머는 수지 조성물의 전체 중량을 기준으로 5 내지 30 중량%로 포함될 수 있다. The photopolymerizable monomer may be included in 5 to 30% by weight based on the total weight of the resin composition.
상기 광개시제는 벤조인과 그 알킬에테르류, 아세토페논류, 안트라퀴논류, 티오크산톤류, 케탈류, 벤조페논류, α-아미노아세토페논류, 아실포스핀옥사이드류 및 옥심에스테르류로 이루어진 군에서 선택된 1종 이상을 포함할 수 있다. The photoinitiator is a group consisting of benzoin and its alkyl ethers, acetophenones, anthraquinones, thioxanthones, ketals, benzophenones, α-aminoacetophenones, acylphosphine oxides and oxime esters. It may include one or more selected from.
상기 광개시제는 수지 조성물의 전체 중량을 기준으로 0.5 내지 20 중량%로 포함될 수 있다. The photoinitiator may be included in 0.5 to 20% by weight based on the total weight of the resin composition.
상기 열경화 가능한 작용기는 에폭시기, 옥세타닐기, 환상 에테르기 및 환상 티오 에테르기로 이루어진 군에서 선택된 1종 이상일 수 있다. The thermosetting functional group may be at least one selected from the group consisting of an epoxy group, an oxetanyl group, a cyclic ether group, and a cyclic thio ether group.
상기 열경화성 바인더는 상기 산변성 올리고머의 카르복시기 1 당량에 대하여 0.8 내지 2.0 당량에 대응하는 함량으로 포함될 수 있다. The thermosetting binder may be included in an amount corresponding to 0.8 to 2.0 equivalents based on 1 equivalent of the carboxyl group of the acid-modified oligomer.
상기 수지 조성물은, 용제; 및 열경화성 바인더 촉매, 필러, 안료 및 첨가제로 이루어진 군에서 선택된 1종 이상을 더 포함할 수 있다.
The said resin composition is a solvent; And one or more selected from the group consisting of a thermosetting binder catalyst, a filler, a pigment, and an additive.
또한, 본 발명은 카르복시기(-COOH)와, 광경화 가능한 불포화 작용기를 갖는 이미노카보네이트계 화합물을 포함하는 산변성 올리고머; 3개 이상의 광경화 가능한 불포화 작용기를 갖는 광중합성 모노머; 및 열경화 가능한 작용기를 갖는 열경화성 바인더의 경화물을 포함하는 드라이 필름 솔더 레지스트 (DFSR)를 제공한다. In addition, the present invention is an acid-modified oligomer comprising a carboxy group (-COOH) and an iminocarbonate compound having a photocurable unsaturated functional group; Photopolymerizable monomers having three or more photocurable unsaturated functional groups; And a cured product of a thermosetting binder having a thermosetting functional group.
이러한 DFSR에서, 상기 경화물은, 상기 이미노카보네이트계 화합물의 카르복시기와, 상기 열경화 가능한 작용기가 가교 결합된 가교 구조; 상기 이미노카보네이트계 화합물 및 광중합성 모노머의 불포화 작용기가 서로 가교 결합된 가교 구조; 및 상기 이미노카보네이트계 화합물에서 유래한 하기 화학식 2의 트리아진 가교 구조를 포함할 수 있다: In such DFSR, the cured product may include a crosslinked structure in which the carboxyl group of the iminocarbonate-based compound and the thermosetting functional group are crosslinked; A crosslinked structure in which the unsaturated functional groups of the iminocarbonate compound and the photopolymerizable monomer are crosslinked with each other; And a triazine crosslinked structure of Formula 2 derived from the iminocarbonate-based compound:
[화학식 2](2)
상기 화학식 2 등으로 표시되는 트리아진 가교 구조를 포함함에 따라, 상기 수지 조성물로부터 제공되는 드라이 필름 솔더 레지스트(DFSR)는 기존 노볼락(novolac) 구조를 기반으로 한 산변성 에폭시 아크릴레이트를 사용한 구조에 비하여 보다 높은 유리전이온도(Tg)를 가질 수 있으며, 상기 DFSR은 약 120 내지 200℃, 혹은 약 130 내지 170℃, 혹은 약 140℃의 보다 높은 유리 전이 온도(Tg)를 가질 수 있다. 이에 따라 보다 향상된 내열 신뢰성을 나타낼 수 있다. 따라서, 상기 DFSR은 반도체 소자의 패키지 기판 재료에 요구되는 PCT 내성, TCT 내열성 및 미세 배선간으로의 HAST 내성 등의 제반 물성을 충족할 수 있다. As the triazine crosslinked structure represented by Chemical Formula 2 and the like is included, the dry film solder resist (DFSR) provided from the resin composition may be used in a structure using an acid-modified epoxy acrylate based on an existing novolac structure. In comparison, it may have a higher glass transition temperature (Tg), and the DFSR may have a higher glass transition temperature (Tg) of about 120 to 200 ° C, or about 130 to 170 ° C, or about 140 ° C. Accordingly, it is possible to exhibit improved heat resistance reliability. Therefore, the DFSR can satisfy various physical properties such as PCT resistance, TCT heat resistance, and HAST resistance between fine interconnections required for the package substrate material of the semiconductor device.
상기 드라이 필름 솔더 레지스트는, 상기 경화물 내에 분산되어 있는 광개시제를 더 포함할 수 있다. The dry film solder resist may further include a photoinitiator dispersed in the cured product.
상기 드라이 필름 솔더 레지스트는, 반도체 소자의 패키지 기판의 제조에 사용될 수 있다. The dry film solder resist may be used to manufacture a package substrate of a semiconductor device.
본 발명의 수지 조성물은 특정한 산변성 올리고머를 포함함에 따라, DFSR을 이루는 수지 조성물의 경화물 내에 소정의 트리아진 가교 구조를 형성할 수 있다. 따라서, 상기 수지 조성물을 사용하여 보다 높은 유리전이 온도(Tg) 및 낮은 열팽창계수뿐만 아니라 향상된 내열 신뢰성을 나타내는 DFSR의 제공이 가능해진다. Since the resin composition of this invention contains a specific acid-modified oligomer, it can form a predetermined triazine crosslinked structure in the hardened | cured material of the resin composition which comprises DFSR. Thus, the resin composition can be used to provide DFSR which exhibits higher glass transition temperature (Tg) and low coefficient of thermal expansion as well as improved heat resistance reliability.
그러므로, 본 발명에 따라, 뛰어난 PCT 내성, TCT 내열성 및 미세 배선간으로의 HAST 내성 등의 제반 물성을 나타내는 DFSR의 제공이 가능해지며, 이러한 DFSR을 반도체 소자의 패키지 기판 제조 등을 위해 바람직하게 사용할 수 있다. Therefore, according to the present invention, it becomes possible to provide a DFSR exhibiting various physical properties such as excellent PCT resistance, TCT heat resistance, and HAST resistance between fine interconnects, and such DFSR can be preferably used for manufacturing a package substrate of a semiconductor device. have.
이하, 발명의 구현예에 따른 광경화성 및 열경화성을 갖는 수지 조성물과, DFSR에 대하여 보다 상세하게 설명한다.
Hereinafter, a photocurable and thermosetting resin composition and an DFSR according to an embodiment of the present invention will be described in more detail.
발명의 일 구현예에 따르면, 카르복시기(-COOH)와, 광경화 가능한 불포화 작용기를 갖는 이미노카보네이트계 화합물을 포함하는 산변성 올리고머; 3개 이상의 광경화 가능한 불포화 작용기를 갖는 광중합성 모노머; 열경화 가능한 작용기를 갖는 열경화성 바인더; 및 광개시제를 포함하는 광경화성 및 열경화성을 갖는 수지 조성물이 제공된다. According to one embodiment of the invention, an acid-modified oligomer comprising a carboxy group (-COOH) and an iminocarbonate compound having a photocurable unsaturated functional group; Photopolymerizable monomers having three or more photocurable unsaturated functional groups; Thermosetting binders having thermosetting functional groups; And a photocurable and thermosetting resin composition comprising a photoinitiator.
이러한 수지 조성물에는, 산변성 올리고머, 광중합성 모노머, 광개시제 및 열경화성 바인더가 포함되며, 특히, 카르복시기와, 광경화 가능한 불포화 작용기를 갖는 이미노카보네이트계 화합물이 산변성 올리고머로서 포함된다. Such resin compositions include acid-modified oligomers, photopolymerizable monomers, photoinitiators and thermosetting binders, and particularly include iminocarbonate-based compounds having a carboxyl group and a photocurable unsaturated functional group as acid-modified oligomers.
상기 일 구현예의 수지 조성물을 이용해 다음과 같은 과정을 거쳐 DFSR을 형성할 수 있다. 먼저, 수지 조성물로 필름을 형성하고 이러한 필름을 소정의 기판상에 라이네이션 한 후에, DFSR이 형성될 부분의 수지 조성물에 선택적으로 노광을 진행한다. 이러한 노광을 진행하면, 산변성 올리고머, 예를 들어, 이미노카보네이트계 화합물에 포함된 불포화 작용기와, 광중합성 모노머에 포함된 불포화 작용기가 광경화를 일으켜 서로 가교 결합을 형성할 수 있고, 그 결과 노광부에서 광경화에 의한 가교 구조가 형성될 수 있다. DFSR can be formed by the following process using the resin composition of one embodiment. First, after forming a film with a resin composition and laminating such a film on a predetermined board | substrate, it selectively exposes to the resin composition of the part in which DFSR is to be formed. When such exposure is carried out, the acid-modified oligomer, for example, the unsaturated functional group contained in the iminocarbonate-based compound and the unsaturated functional group contained in the photopolymerizable monomer may cause photocuring to form crosslinks with each other. In the exposed portion, a crosslinked structure by photocuring may be formed.
이후, 알칼리 현상액을 사용해 현상을 진행하게 되면, 가교 구조가 형성된 노광부의 수지 조성물을 그대로 기판 상에 남고, 나머지 비노광부의 수지 조성물이 현상액에 녹아 제거될 수 있다.Subsequently, when development is carried out using an alkali developer, the resin composition of the exposed part having the crosslinked structure is left on the substrate as it is, and the resin composition of the remaining non-exposed part may be dissolved in the developer and removed.
그리고 나서, 상기 기판 상에 남은 수지 조성물을 열처리하여 열경화를 진행하면, 상기 산변성 올리고머, 예를 들어, 이미노카보네이트계 화합물에 포함된 카르복시기가 열경화성 바인더의 열경화 가능한 작용기와 반응하여 가교 결합을 형성할 수 있고, 그 결과 열경화에 의한 가교 구조가 형성되면서 기판 상의 원하는 부분에 DFSR이 형성될 수 있다. Then, when the resin composition remaining on the substrate is thermally cured by heat treatment, the acid-modified oligomer, for example, a carboxy group contained in the iminocarbonate-based compound reacts with a thermosetting functional group of the thermosetting binder to crosslink. Can be formed, and as a result, a DFSR can be formed in a desired portion on the substrate while forming a crosslinked structure by thermal curing.
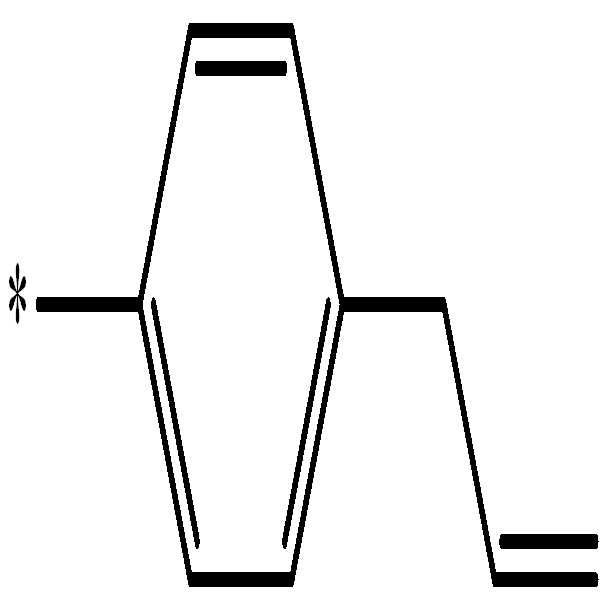
이때, 일 구현예의 수지 조성물이 상기 이미노카보네이트계 화합물을 산변성 올리고머로서 포함함에 따라, 열경화 과정에서 2차적인 가교 구조, 예를 들어, 하기 반응식 1의 화학식 2 등으로 표시되는 트리아진 가교 구조가 형성될 수 있다. 이는 이미노카보네이트계 화합물의 주쇄에 포함된 질소들이 열에 의해 서로 결합되어 트리아진 환을 이룸에 따라 형성되는 것이다: At this time, as the resin composition of one embodiment includes the imino carbonate-based compound as an acid-modified oligomer, the secondary cross-linking structure in the thermosetting process, for example, triazine cross-link represented by the formula (2) of Scheme 1 A structure can be formed. It is formed by the nitrogens in the main chain of the iminocarbonate compound to form a triazine ring by bonding to each other by heat:
[반응식 1][Reaction Scheme 1]
상기 반응식 1에서, R1은 광경화 가능한 불포화 작용기 및 히드록시기 또는 카르복시기를 갖는 화합물에서 유래한 작용기, 예를 들어, 아크릴산, 메타크릴산, 부텐산(butenoic acid), 헥센산(hexenoic acid), 신남산, 알릴페놀, 히드록시스티렌, 히드록시시클로헥센 또는 히드록시나프토퀴논의 화합물에서 유래한 작용기, 구체적인 예로서 아크릴산에서 유래한 또는 알릴페놀에서 유래한 등의 작용기로 될 수 있다. In Scheme 1, R 1 is a functional group derived from a compound having a photocurable unsaturated functional group and a hydroxyl group or a carboxyl group, for example acrylic acid, methacrylic acid, butenoic acid, hexenoic acid, shin Functional groups derived from compounds of namsan, allylphenol, hydroxystyrene, hydroxycyclohexene or hydroxynaphthoquinone, specific examples derived from acrylic acid Or derived from allylphenol It may be a functional group such as.
상기 R2는 디카르복실산 화합물에서 유래한 작용기, 예를 들어, 옥살산, 말론산, 석신산, 글루타르산, 아디프산, 프탈산, 이소프탈산, 테레프탈산, 노보넨 디카르복실산, 시클로헥센 디카르복실산(Cyclohexene dicarboxylic acid), 시클로헥세인 디카르복실산(Cyclohexane dicarboxylic acid), 이미다졸 디카르복실산, 피리딘 디카르복실산 및 이들의 산 무수물로 이루어진 군에서 선택된 디카르복실산 화합물에서 유래한 작용기, 구체적인 예로서, 프탈산에서 유래한 또는 시클로헥센 디카르복실산(Cyclohexene dicarboxylic acid)에서 유래한등의 작용기로 될 수 있다. 상기‘*'은 결합 지점을 의미한다.R 2 is a functional group derived from a dicarboxylic acid compound, for example, oxalic acid, malonic acid, succinic acid, glutaric acid, adipic acid, phthalic acid, isophthalic acid, terephthalic acid, norbornene dicarboxylic acid, cyclohexene Dicarboxylic acid compounds selected from the group consisting of dicycloacid (Cyclohexene dicarboxylic acid), cyclohexane dicarboxylic acid, imidazole dicarboxylic acid, pyridine dicarboxylic acid and acid anhydrides thereof Functional groups derived from, specific examples derived from phthalic acid Or derived from cyclohexene dicarboxylic acid It may be a functional group such as. '*' Means a point of attachment.
즉, 일 구현예의 수지 조성물을 사용하여 DFSR을 형성하는 경우, DFSR을 이루는 수지 조성물의 경화물에 기본적인 가교 구조(즉, 산변성 올리고머의 카르복시기와, 열경화성 바인더의 열경화 가능한 작용기에서 유래한 것) 외에도, 2차적인 트리아진 가교 구조가 포함됨에 따라, 상기 DFSR의 유리 전이 온도가 약 120 내지 200℃, 혹은 약 130 내지 170℃, 혹은 약 140 ℃로서 보다 높아질 수 있다. 이로 인해, 상기 DFSR의 내열 신뢰성이 보다 향상될 수 있고, 반도체 소자의 패키지 기판 재료 등에 요구되는 우수한 PCT 내성, TCT 내열성 및 미세 배선간으로의 HAST 내성 등의 제반 물성을 충족할 수 있다. That is, when DFSR is formed using the resin composition of one embodiment, the crosslinked structure (that is, derived from the carboxyl group of the acid-modified oligomer and the thermosetting functional group of the thermosetting binder) in the cured product of the resin composition constituting the DFSR. In addition, as the secondary triazine crosslinked structure is included, the glass transition temperature of the DFSR can be higher as about 120-200 ° C, or about 130-170 ° C, or about 140 ° C. As a result, the heat resistance reliability of the DFSR can be further improved, and various physical properties such as excellent PCT resistance, TCT heat resistance, and HAST resistance between fine wirings required for a package substrate material of a semiconductor device can be satisfied.
따라서, 일 구현예의 수지 조성물을 이용하여, 보다 높은 유리 전이 온도 및 향상된 내열 신뢰성을 나타내고, 반도체 소자의 패키지 기판 재료 등으로 바람직하게 사용 가능한 DFSR이 제공될 수 있다.
Therefore, using the resin composition of one embodiment, a DFSR which exhibits a higher glass transition temperature and improved heat resistance reliability, and which can be preferably used as a package substrate material of a semiconductor element, can be provided.
이하, 일 구현예에 따른 수지 조성물을 각 성분별로 보다 구체적으로 설명하기로 한다. Hereinafter, the resin composition according to one embodiment will be described in more detail for each component.
산변성Acid denaturation 올리고머Oligomer
상기 일 구현예의 수지 조성물은 카르복시기(-COOH)와, 광경화 가능한 불포화 작용기를 갖는 이미노카보네이트계 화합물을 산변성 올리고머로서 포함한다. 이러한 산변성 올리고머는 광경화에 의해 수지 조성물의 다른 성분, 즉, 광중합성 모노머 및/또는 열경화성 바인더와 가교 결합을 형성해 DFSR의 형성을 가능케 하며, 카르복시기를 포함하여 비노광부의 수지 조성물이 알칼리 현상성을 나타내게 한다. The resin composition of the embodiment includes a carboxyl group (-COOH) and an iminocarbonate-based compound having a photocurable unsaturated functional group as an acid-modified oligomer. Such acid-modified oligomers form crosslinks with other components of the resin composition by photocuring, that is, photopolymerizable monomers and / or thermosetting binders, thereby enabling the formation of DFSR, and the resin composition of the non-exposed portion, including the carboxyl group, is alkali developable. To indicate.
특히, 일 구현예의 수지 조성물은 상기 이미노카보네이트계 화합물을 산변성 올리고머로서 포함함에 따라, DFSR을 이루는 수지 조성물의 경화물 내에 상기 화학식 2 등으로 표시되는 트리아진 가교 구조를 형성시킬 수 있다. 따라서, 일 구현예의 수지 조성물은 보다 높은 유리 전이 온도 및 향상된 내열 신뢰성을 갖는 DFSR의 제조 및 제공을 가능케 한다. In particular, the resin composition of one embodiment may form a triazine crosslinked structure represented by Chemical Formula 2 in the cured product of the resin composition forming DFSR, as the iminocarbonate-based compound is included as an acid-modified oligomer. Thus, the resin composition of one embodiment enables the preparation and provision of DFSR with higher glass transition temperature and improved heat resistance reliability.
상기 이미노카보네이트계 화합물은 시아네이트 에스테르계 화합물에 디카르복실산 화합물과, 광경화 가능한 불포화 작용기 및 히드록시기 또는 카르복시기를 갖는 화합물을 반응시켜 형성된 화합물로 될 수 있다. 이러한 이미노카보네이트계 화합물을 사용함에 따라, 열경화 과정에서 상기 트리아진 가교 구조를 바람직하게 형성할 수 있고, 보다 우수한 내열 신뢰성 등을 나타내는 DFSR을 제공할 수 있게 된다. The imino carbonate compound may be a compound formed by reacting a cyanate ester compound with a dicarboxylic acid compound, a compound having a photocurable unsaturated functional group and a hydroxyl group or a carboxyl group. By using such an imino carbonate-based compound, it is possible to form the triazine crosslinked structure preferably in the heat curing process, it is possible to provide a DFSR showing more excellent heat resistance reliability and the like.
이때, 상기 시아네이트 에스테르계 화합물로는 시아나이드기 (-OCN)를 갖는 비스페놀계 또는 노볼락계 화합물, 예를 들어, 하기 화학식 1a의 화합물을 사용할 수 있다: In this case, as the cyanate ester compound, a bisphenol-based or novolak-based compound having a cyanide group (-OCN), for example, a compound of Formula 1a may be used:
[화학식 1a][Formula 1a]
상기 화학식 1a에서, n은 1 내지 100의 정수이다. In Formula 1a, n is an integer of 1 to 100.
또한, 이러한 시아네이트 에스테르계 화합물과 반응하는 상기 디카르복실산 화합물로는 옥살산, 말론산, 석신산, 글루타르산, 아디프산, 프탈산, 이소프탈산, 테레프탈산, 노보넨 디카르복실산, 시클로헥센 디카르복실산(Cyclohexene dicarboxylic acid), 시클로헥세인 디카르복실산, 이미다졸 디카르복실산, 피리딘 디카르복실산 및 이들의 산 무수물로 이루어진 군에서 선택된 화합물을 사용할 수 있으며, 상기 광경화 가능한 불포화 작용기 및 히드록시기 또는 카르복시기를 갖는 화합물로는 아크릴산, 메타크릴산, 부텐산(butenoic acid), 헥센산(hexenoic acid), 신남산, 알릴페놀, 히드록시스티렌, 히드록시시클로헥센 및 히드록시나프토퀴논으로 이루어진 군에서 선택된 1종 이상의 화합물을 포함할 수 있다. In addition, the dicarboxylic acid compound that reacts with the cyanate ester compound, oxalic acid, malonic acid, succinic acid, glutaric acid, adipic acid, phthalic acid, isophthalic acid, terephthalic acid, norbornene dicarboxylic acid, cyclo Compounds selected from the group consisting of hexene dicarboxylic acid, cyclohexane dicarboxylic acid, imidazole dicarboxylic acid, pyridine dicarboxylic acid and acid anhydrides thereof may be used. Possible compounds having unsaturated functional groups and hydroxyl or carboxyl groups include acrylic acid, methacrylic acid, butenoic acid, hexenoic acid, cinnamic acid, allylphenol, hydroxystyrene, hydroxycyclohexene and hydroxynaph It may include one or more compounds selected from the group consisting of toquinones.
상술한 시아네이트 에스테르계 화합물에, 상기 디카르복실산 화합물과, 광경화 가능한 불포화 작용기 및 히드록시기 또는 카르복시기를 갖는 화합물을 반응시킴에 따라, 카르복시기 및 광경화 가능한 불포화 작용기가 적절히 도입된 산변성 올리고머로서의 이미노카보네이트계 화합물이 바람직하게 얻어질 수 있다. 또한, 이렇게 얻어진 이미노카보네이트계 화합물은 열경화 과정에서 트리아진 가교 구조를 적절히 형성하여, 보다 향상된 내열 신뢰성을 나타내는 DFSR의 형성 및 제공을 가능케 한다. By reacting the dicarboxylic acid compound with a compound having a photocurable unsaturated functional group and a hydroxy group or a carboxyl group to the cyanate ester compound described above, an acid-modified oligomer to which a carboxyl group and a photocurable unsaturated functional group are appropriately introduced. Iminocarbonate type compounds can be obtained preferably. In addition, the iminocarbonate-based compound thus obtained properly forms a triazine crosslinked structure during the thermosetting process, thereby enabling the formation and provision of DFSR exhibiting improved heat resistance reliability.
상술한 이미노카보네이트계 화합물에 도입되는 카르복시기와, 불포화 작용기의 몰비는 상기 시아네이트 에스테르계 화합물과 반응하는 상기 디카르복실산 화합물과, 광경화 가능한 불포화 작용기 및 히드록시기 또는 카르복시기를 갖는 화합물의 몰비를 제어하여 조절할 수 있다. 상기 이미노카보네이트계 화합물이 산변성 올리고머로서 적절히 작용할 수 있도록 하기 위해, 상기 시아네이트 에스테르계 화합물과 반응하는 상기 디카르복실산 화합물과, 광경화 가능한 불포화 작용기 및 히드록시기 또는 카르복시기를 갖는 화합물의 몰비는 약 2 : 8 내지 8 : 2로 될 수 있다. 이로서 적절한 도입되는 카르복시기와, 불포화 작용기가 산변성 올리고머로서의 이미노카보네이트계 화합물에 도입되어, 비노광부의 수지 조성물이 우수한 알칼리 현상성을 나타내면서도, 산변성 올리고머가 광중합성 모노머 및 열경화성 바인더와 적절히 가교 구조를 형성하여 DFSR이 보다 우수한 내열성 및 기계적 물성 등을 나타낼 수 있다. The molar ratio of the carboxyl group introduced into the iminocarbonate-based compound and the unsaturated functional group is a molar ratio of the dicarboxylic acid compound reacting with the cyanate ester compound and the compound having a photocurable unsaturated functional group and a hydroxyl group or carboxyl group. It can be controlled and adjusted. In order for the imino carbonate-based compound to function properly as an acid-modified oligomer, the molar ratio of the dicarboxylic acid compound reacted with the cyanate ester-based compound and the compound having a photocurable unsaturated functional group and a hydroxyl group or a carboxyl group is About 2: 8 to 8: 2. The carboxyl group and the unsaturated functional group introduced therein are introduced into the iminocarbonate-based compound as the acid-modified oligomer, and the acid-modified oligomer is appropriately crosslinked with the photopolymerizable monomer and the thermosetting binder, while the resin composition of the non-exposed part exhibits excellent alkali developability. By forming the structure, the DFSR may exhibit more excellent heat resistance and mechanical properties.
한편, 보다 구체적인 예로서, 상기 산변성 올리고머, 특히, 상술한 시아네이트 에스테르계 화합물에 디카르복실산 화합물과, 광경화 가능한 불포화 작용기 및 히드록시기 또는 카르복시기를 갖는 화합물을 반응시켜 형성된 화합물은 하기 화학식 1의 이미노카보네이트계 화합물로 될 수 있다: On the other hand, as a more specific example, the compound formed by reacting the acid-modified oligomer, in particular, the cyanate ester-based compound with a dicarboxylic acid compound, a compound having a photocurable unsaturated functional group and a hydroxyl group or a carboxyl group is represented by the formula It may be an iminocarbonate-based compound of:
[화학식 1][Formula 1]
상기 화학식 1에서, n은 1 내지 100의 정수이고, R1은 광경화 가능한 불포화 작용기 및 히드록시기 또는 카르복시기를 갖는 화합물에서 유래한 작용기, 예를 들어, 아크릴산, 메타크릴산, 부텐산(butenoic acid), 헥센산(hexenoic acid), 신남산, 알릴페놀, 히드록시스티렌, 히드록시시클로헥센 또는 히드록시나프토퀴논의 화합물에서 유래한 작용기, 구체적인 예로서 아크릴산에서 유래한 또는 알릴페놀에서 유래한 등의 작용기로 될 수 있고, R2는 디카르복실산 화합물에서 유래한 작용기, 예를 들어, 옥살산, 말론산, 석신산, 글루타르산, 아디프산, 프탈산, 이소프탈산, 테레프탈산, 노보넨 디카르복실산, 시클로헥센 디카르복실산(Cyclohexene dicarboxylic acid), 시클로헥세인 디카르복실산(Cyclohexane dicarboxylic acid), 이미다졸 디카르복실산, 피리딘 디카르복실산 및 이들의 산 무수물로 이루어진 군에서 선택된 디카르복실산 화합물에서 유래한 작용기, 구체적인 예로서, 프탈산에서 유래한 또는 시클로헥센 디카르복실산(Cyclohexene dicarboxylic acid)에서 유래한 등의 작용기로 될 수 있다.In Formula 1, n is an integer of 1 to 100, R 1 is a functional group derived from a compound having a photocurable unsaturated functional group and a hydroxyl group or a carboxyl group, for example acrylic acid, methacrylic acid, butenoic acid , Functional groups derived from compounds of hexenoic acid, cinnamic acid, allylphenol, hydroxystyrene, hydroxycyclohexene or hydroxynaphthoquinone, specific examples derived from acrylic acid Or derived from allylphenol It may be a functional group such as, R 2 is a dicarboxylic one functional group, for example, oxalic acid, horses derived from acid compound acid, succinic acid, glutaric acid, adipic acid, phthalic acid, isophthalic acid, terephthalic acid, norbornene Group consisting of dicarboxylic acid, cyclohexene dicarboxylic acid, cyclohexane dicarboxylic acid, imidazole dicarboxylic acid, pyridine dicarboxylic acid and acid anhydrides thereof Functional groups derived from dicarboxylic acid compounds selected from, specific examples, derived from phthalic acid Or derived from cyclohexene dicarboxylic acid It may be a functional group such as.
이러한 화학식 1의 화합물은, 예를 들어, 화학식 1a의 화합물과, 프탈산 또는 시클로헥센 디카르복실산(Cyclohexene dicarboxylic acid) 등의 디카르복실산 화합물과, 아크릴산 또는 2-알릴페놀 등의 불포화 작용기 및 히드록시기 또는 카르복시기를 갖는 화합물을 반응시켜 얻어질 수 있으며, 산변성 올리고머로서 적절히 사용될 수 있으면서도, 트리아진 가교 구조를 효과적으로 형성하여 보다 우수한 내열 신뢰성을 갖는 DFSR 등의 형성 및 제공을 가능케 한다. Such a compound of Formula 1 may be, for example, a compound of Formula 1a, a dicarboxylic acid compound such as phthalic acid or cyclohexene dicarboxylic acid, an unsaturated functional group such as acrylic acid or 2-allylphenol, and It can be obtained by reacting a compound having a hydroxyl group or a carboxyl group, and can be suitably used as an acid-modified oligomer, while effectively forming a triazine crosslinked structure, thereby enabling the formation and provision of DFSR and the like having better heat resistance reliability.
한편, 일 구현예의 수지 조성물은 상술한 이미노카보네이트계 화합물 외에도, 통상적으로 알려진 산변성 올리고머를 추가적으로 포함할 수도 있다. 다만, 일 구현예에 따른 우수한 현상성 및 내열 신뢰성 등의 발현을 위해, 상기 이미노카보네이트계 화합물의 산변성 올리고머를 수지 조성물 전체 중량에 대해, 약 5 내지 25 중량%, 혹은 약 7 내지 20 중량%, 혹은 약 9 내지 15 중량%의 함량으로 포함할 수 있고, 후술하는 산변성 올리고머의 전체 함량 중 나머지 함량의 추가적 산변성 올리고머를 포함할 수 있다. On the other hand, the resin composition of one embodiment may further include a conventionally known acid-modified oligomer, in addition to the above-described iminocarbonate-based compound. However, in order to express excellent developability and heat resistance according to one embodiment, the acid-modified oligomer of the iminocarbonate-based compound is about 5 to 25% by weight, or about 7 to 20% by weight based on the total weight of the resin composition %, Or about 9 to 15% by weight, and may include additional acid-modified oligomer of the remaining content of the total content of the acid-modified oligomer described below.
이러한 추가적 산변성 올리고머로는 카르복시기와 광경화 가능한 작용기, 예를 들어, 아크릴레이트기나 불포화 이중 결합을 갖는 광경화 가능한 작용기와, 카르복시기를 분자 내에 갖는 올리고머로서, 이전부터 DFSR 형성용 수지 조성물에 사용 가능한 것으로 알려진 모든 성분을 별다른 제한없이 사용할 수 있다. 예를 들어, 이러한 추가적 산변성 올리고머의 주쇄는 노볼락 에폭시 또는 폴리우레탄 등으로 될 수 있고, 이러한 주쇄에 카르복시기와 아크릴레이트기 등이 도입된 성분을 추가적 산변성 올리고머로서 사용할 수 있다. 상기 광경화 가능한 작용기는 바람직하게는 아크릴레이트기로 될 수 있는데, 이때, 상기 산변성 올리고머는 카르복시기를 갖는 중합 가능한 모노머와, 아크릴레이트계 화합물 등을 포함한 모노머를 공중합하여 올리고머 형태로서 얻을 수 있다. Such additional acid-modified oligomers include carboxyl groups and photocurable functional groups, such as photocurable functional groups having acrylate groups or unsaturated double bonds, and oligomers having carboxyl groups in a molecule, which can be used in resin compositions for forming DFSR. All known ingredients can be used without limitation. For example, the main chain of such additional acid-modified oligomer may be a novolak epoxy or polyurethane, or the like. A component having a carboxyl group and an acrylate group introduced therein may be used as an additional acid-modified oligomer. The photocurable functional group may preferably be an acrylate group, wherein the acid-modified oligomer may be obtained as an oligomer form by copolymerizing a polymerizable monomer having a carboxyl group and a monomer including an acrylate compound.
보다 구체적으로, 상기 수지 조성물에 사용 가능한 추가적 산변성 올리고머의 구체적인 예로는 다음과 같은 성분들을 들 수 있다: More specifically, specific examples of additional acid-modified oligomers usable in the resin composition include the following components:
(1) (메트)아크릴산 등의 불포화 카르복실산 (a)과 스티렌, α-메틸스티렌, 저급 알킬(메트)아크릴레이트, 이소부틸렌 등의 불포화 이중 결합을 갖는 화합물 (b)을 공중합시킴으로서 얻어지는 카르복시기 함유 수지; (1) Obtained by copolymerizing unsaturated carboxylic acids (a) such as (meth) acrylic acid and compounds (b) having unsaturated double bonds such as styrene, α-methylstyrene, lower alkyl (meth) acrylate, and isobutylene Carboxyl group-containing resins;
(2) 불포화 카르복실산 (a)과 불포화 이중 결합을 갖는 화합물 (b)의 공중합체의 일부에 비닐기, 알릴기, (메트)아크릴로일기 등의 에틸렌성 불포화기와 에폭시기, 산클로라이드 등의 반응성기를 갖는 화합물, 예를 들어, 글리시딜(메트)아크릴레이트를 반응시키고, 에틸렌성 불포화기를 팬던트로서 부가시킴으로서 얻어지는 카르복시기 함유 감광성 수지; (2) ethylenically unsaturated groups such as vinyl groups, allyl groups, (meth) acryloyl groups, epoxy groups, acid chlorides, and the like, as part of the copolymer of the unsaturated carboxylic acid (a) and the compound (b) having an unsaturated double bond Carboxyl group-containing photosensitive resin obtained by making a compound which has a reactive group, for example, glycidyl (meth) acrylate react, and adding an ethylenically unsaturated group as a pendant;
(3) 글리시딜(메트)아크릴레이트, α-메틸글리시딜(메트)아크릴레이트 등의 에폭시기와 불포화 이중 결합을 갖는 화합물 (c)과 불포화 이중 결합을 갖는 화합물 (b)의 공중합체에 불포화 카르복실산 (a)을 반응시키고, 생성된 2급의 히드록시기에 무수프탈산, 테트라히드로무수프탈산, 헥사히드로무수프탈산 등의 포화 또는 불포화 다염기산 무수물 (d)을 반응시켜 얻어지는 카르복시기 함유 감광성 수지; (3) to a copolymer of a compound (c) having an unsaturated double bond with an epoxy group such as glycidyl (meth) acrylate and α-methylglycidyl (meth) acrylate and a compound (b) having an unsaturated double bond; Carboxyl group-containing photosensitive resin obtained by making unsaturated carboxylic acid (a) react, and making saturated or unsaturated polybasic acid anhydride (d), such as phthalic anhydride, tetrahydrophthalic anhydride, and hexahydrophthalic anhydride, react with the produced | generated secondary hydroxy group;
(4) 무수 말레산, 무수 이타콘산 등의 불포화 이중 결합을 갖는 산무수물 (e)과 불포화 이중 결합을 갖는 화합물 (b)의 공중합체에 히드록시알킬(메트)아크릴레이트 등의 1개의 히드록시기와 1개 이상의 에틸렌성 불포화 이중 결합을 갖는 화합물 (f)을 반응시켜 얻어지는 카르복시기 함유 감광성 수지; (4) One hydroxy group such as hydroxyalkyl (meth) acrylate in a copolymer of an acid anhydride (e) having an unsaturated double bond such as maleic anhydride and itaconic anhydride and a compound (b) having an unsaturated double bond Carboxyl group-containing photosensitive resin obtained by making compound (f) which has 1 or more ethylenically unsaturated double bond react;
(5) 후술하는 바와 같은 분자 중에 2개 이상의 에폭시기를 갖는 다관능 에폭시 화합물 (g) 또는 다관능 에폭시 화합물의 히드록시기를 추가로 에피클로로히드린으로 에폭시화한 다관능 에폭시 수지의 에폭시기와, (메트)아크릴산 등의 불포화 모노카르복실산 (h)의 카르복시기를 에스테르화 반응(전체 에스테르화 또는 부분 에스테르화, 바람직하게는 전체 에스테르화)시키고, 생성된 히드록시기에 추가로 포화 또는 불포화 다염기산 무수물 (d)을 반응시켜 얻어지는 카르복시기 함유 감광성 화합물; (5) The epoxy group of the polyfunctional epoxy compound (g) which has two or more epoxy groups in the molecule mentioned later, or the polyfunctional epoxy resin in which the hydroxy group of the polyfunctional epoxy compound was further epoxidized with epichlorohydrin, (meth The carboxyl group of unsaturated monocarboxylic acid (h) such as acrylic acid is subjected to esterification reaction (full esterification or partial esterification, preferably total esterification) and further saturated or unsaturated polybasic acid anhydride (d) Carboxyl group-containing photosensitive compound obtained by making it react;
(6) 불포화 이중 결합을 갖는 화합물 (b)과 글리시딜 (메트)아크릴레이트의 공중합체의 에폭시기에 탄소수 2 내지 17의 알킬카르복실산, 방향족기 함유 알킬카르복실산 등의 1 분자 중에 1개의 카르복시기를 갖고, 에틸렌성 불포화 결합을 갖지 않는 유기산 (i)을 반응시키고, 생성된 2급의 히드록시기에 포화 또는 불포화 다염기산 무수물 (d)을 반응시켜 얻어지는 카르복시기 함유 수지; (6) 1 in 1 molecule of an alkyl group having 2 to 17 carbon atoms, an aromatic group-containing alkyl carboxylic acid, etc., in the epoxy group of the copolymer of the compound (b) having an unsaturated double bond and glycidyl (meth) acrylate A carboxyl group-containing resin obtained by reacting an organic acid (i) having two carboxyl groups and not having an ethylenically unsaturated bond and reacting a saturated or unsaturated polybasic acid anhydride (d) with the resulting secondary hydroxy group;
(7) 지방족 디이소시아네이트, 분지 지방족 디이소시아네이트, 지환식 디이소시아네이트, 방향족 디이소시아네이트 등의 디이소시아네이트 (j)와, 디메틸올프로피온산, 디메틸올부탄산 등의 카르복시기 함유 디알코올 화합물(k), 및 폴리카르보네이트계 폴리올, 폴리에테르계 폴리올, 폴리에스테르계 폴리올, 폴리올레핀계 폴리올, 아크릴계 폴리올, 비스페놀 A계 알킬렌옥시드 부가체 디올, 페놀성 히드록실기 및 알코올성 히드록실기를 갖는 화합물 등의 디올 화합물 (m)의 중부가 반응에 의해 얻어지는 카르복시기 함유 우레탄 수지; (7) diisocyanates (j) such as aliphatic diisocyanates, branched aliphatic diisocyanates, alicyclic diisocyanates and aromatic diisocyanates; and carboxyl group-containing dialcohol compounds (k) such as dimethylolpropionic acid and dimethylolbutanoic acid, and polycarboxes; Diol compounds such as carbonate polyols, polyether polyols, polyester polyols, polyolefin polyols, acrylic polyols, bisphenol A alkylene oxide adducts, diols, phenolic hydroxyl groups and compounds having alcoholic hydroxyl groups ( carboxyl group-containing urethane resin obtained by the polyaddition reaction of m);
(8) 디이소시아네이트 (j)와, 비스페놀 A형 에폭시 수지, 수소 첨가 비스페놀 A형 에폭시 수지, 브롬화 비스페놀 A형 에폭시 수지, 비스페놀 F형 에폭시 수지, 비스페놀 S형 에폭시 수지, 비크실레놀형 에폭시 수지, 비페놀형 에폭시 수지 등의 2관능 에폭시 수지의(메트)아크릴레이트 또는 그의 부분산 무수물 변성물 (n), 카르복시기 함유 디알코올 화합물 (k), 및 디올 화합물 (m)의 중부가 반응에 의해 얻어지는 감광성의 카르복시기 함유 우레탄 수지; (8) diisocyanate (j), bisphenol A type epoxy resin, hydrogenated bisphenol A type epoxy resin, brominated bisphenol A type epoxy resin, bisphenol F type epoxy resin, bisphenol S type epoxy resin, bixylenol type epoxy resin, non Photosensitive properties obtained by polyaddition reaction of (meth) acrylate or partial acid anhydride modified product (n) of bifunctional epoxy resins, such as a phenol type epoxy resin, its carboxyl group-containing dialcohol compound (k), and a diol compound (m) Carboxyl group-containing urethane resin;
(9) 상기 (7) 또는 (8)의 수지의 합성 중에 히드록시알킬(메트)아크릴레이트 등의 1개의 히드록시기와 1개 이상의 에틸렌성 불포화 이중 결합을 갖는 화합물 (f)을 가하여, 말단에 불포화 이중 결합을 도입한 카르복시기 함유 우레탄 수지; (9) Compound (f) having one hydroxy group such as hydroxyalkyl (meth) acrylate and one or more ethylenically unsaturated double bonds is added during the synthesis of the resin of the above (7) or (8) and unsaturated at the terminal. Carboxyl group-containing urethane resin which introduce | transduced the double bond;
(10) 상기 (7) 또는 (8)의 수지의 합성 중에 이소포론디이소시아네이트와 펜타에리트리톨트리아크릴레이트의 등몰 반응물 등의 분자 내에 1개의 이소시아네이트기와 1개 이상의 (메트)아크릴로일기를 갖는 화합물을 가하고, 말단(메트)아크릴화한 카르복시기 함유 우레탄 수지; (10) A compound having one isocyanate group and one or more (meth) acryloyl groups in a molecule such as an equimolar reactant of isophorone diisocyanate and pentaerythritol triacrylate during the synthesis of the resin (7) or (8). Carboxyl group-containing urethane resin which was added and terminal (meth) acrylated;
(11) 후술하는 바와 같은 분자 중에 2개 이상의 옥세탄환을 갖는 다관능 옥세탄 화합물에 불포화 모노카르복실산 (h)을 반응시켜, 얻어진 변성 옥세탄 화합물 중의 1급 히드록시기에 대하여 포화 또는 불포화 다염기산 무수물 (d)을 반응시켜 얻어지는 카르복시기 함유 감광성 수지; (11) Saturated or unsaturated polybasic anhydrides with respect to the primary hydroxy group in the modified oxetane compound obtained by reacting unsaturated monocarboxylic acid (h) with a polyfunctional oxetane compound having two or more oxetane rings in a molecule as described later. carboxyl group-containing photosensitive resin obtained by making (d) react;
(12) 비스에폭시 화합물과 비스페놀류와의 반응 생성물에 불포화 이중 결합을 도입하고, 계속해서 포화 또는 불포화 다염기산 무수물 (d)을 반응시켜 얻어지는 카르복시기 함유 감광성 수지; (12) Carboxyl group-containing photosensitive resin obtained by introducing an unsaturated double bond into the reaction product of a bisepoxy compound and bisphenols, and then making a saturated or unsaturated polybasic acid anhydride (d) react;
(13) 노볼락형 페놀 수지와, 에틸렌옥시드, 프로필렌옥시드, 부틸렌옥시드, 트리메틸렌옥시드, 테트라히드로푸란, 테트라히드로피란 등의 알킬렌옥시드 및/또는 에틸렌카르보네이트, 프로필렌카르보네이트, 부틸렌카르보네이트, 2,3-카르보네이트프로필메타크릴레이트 등의 환상 카르보네이트와의 반응 생성물에 불포화 모노카르복실산 (h)을 반응시켜, 얻어진 반응 생성물에 포화 또는 불포화 다염기산 무수물 (d)을 반응시켜 얻어지는 카르복시기 함유 감광성 수지; (13) Novolak-type phenol resins, alkylene oxides such as ethylene oxide, propylene oxide, butylene oxide, trimethylene oxide, tetrahydrofuran, tetrahydropyran and / or ethylene carbonate, propylene carbon Unsaturated monocarboxylic acid (h) is reacted with a reaction product with cyclic carbonates such as carbonate, butylene carbonate, 2,3-carbonate propyl methacrylate, and saturated or unsaturated polybasic acid. Carboxyl group-containing photosensitive resin obtained by making anhydride (d) react;
상술한 성분들 중에서도, 상기 (7) 내지 (10)에서, 수지 합성에 이용되는 이소시아네이트기 함유 화합물이 벤젠환을 포함하지 않는 디이소시아네이트로 되는 경우와, 상기 (5) 및 (8) 에서, 수지 합성에 이용되는 다관능 및 2관능 에폭시 수지가 비스페놀 A 골격, 비스페놀 F 골격, 비페닐 골격 또는 비크실레놀 골격을 갖는 선상 구조의 화합물이나 그 수소 첨가 화합물로 되는 경우, DFSR의 가요성 등의 측면에서 산변성 올리고머로서 바람직하게 사용 가능한 성분이 얻어질 수 있다. 또한, 다른 측면에서, 상기 (7) 내지 (10)의 수지의 변성물은 주쇄에 우레탄 결합을 포함하여 휘어짐에 대해 바람직하다. Among the above-mentioned components, in the said (7)-(10), when the isocyanate group containing compound used for resin synthesis becomes diisocyanate which does not contain a benzene ring, and in said (5) and (8), When the polyfunctional and bifunctional epoxy resins used in the synthesis are linear compounds having bisphenol A skeleton, bisphenol F skeleton, biphenyl skeleton or bixylenol skeleton, or hydrogenated compounds thereof, the flexibility and the like of DFSR The component which can be preferably used as an acid-modified oligomer can be obtained. In addition, in another aspect, the modified product of the resins of the above (7) to (10) is preferable for the bending including the urethane bond in the main chain.
그리고, 상술한 추가적 산변성 올리고머로는 상업적으로 입수 가능한 성분을 사용할 수도 있는데, 이러한 성분의 구체적인 예로는 일본화약사의 ZAR-2000, CCR-1235, ZFR-1122 또는 CCR-1291H 등을 들 수 있다. In addition, commercially available components may be used as the above-mentioned additional acid-modified oligomer, and specific examples of such components include ZAR-2000, CCR-1235, ZFR-1122 or CCR-1291H, etc.
한편, 상술한 산변성 올리고머는 일 구현예의 수지 조성물의 전체 중량에 대하여 약 15 내지 75 중량%, 혹은 약 20 내지 50 중량%, 혹은 약 25 내지 45 중량%의 함량으로 포함될 수 있다. 상기 산변성 올리고머의 함량이 지나치게 작으면 수지 조성물의 현상성이 떨어지고 DFSR의 강도가 저하될 수 있다. 반대로, 산변성 올리고머의 함량이 지나치게 높아지면, 수지 조성물이 과도하게 현상될 뿐 아니라 코팅 시 균일성이 떨어질 수 있다. On the other hand, the acid-modified oligomer described above may be included in an amount of about 15 to 75% by weight, or about 20 to 50% by weight, or about 25 to 45% by weight relative to the total weight of the resin composition of one embodiment. When the content of the acid-modified oligomer is too small, the developability of the resin composition may be lowered and the strength of the DFSR may be lowered. On the contrary, when the content of the acid-modified oligomer is too high, not only the resin composition may be excessively developed, but also uniformity may be decreased during coating.
또, 산변성 올리고머의 산가는 약 40 내지 120 mgKOH/g, 혹은 약 50 내지 110 mgKOH/g, 혹은 약 60 내지 90 mgKOH/g로 될 수 있다. 산가가 지나치게 낮아지면, 알칼리 현상성이 저하될 수 있고, 반대로 지나치게 높아지면 현상액에 의해 광경화부, 예를 들어, 노광부까지 용해될 수 있으므로, DFSR의 정상적 패턴 형성이 어려워질 수 있다. In addition, the acid value of the acid-modified oligomer may be about 40 to 120 mgKOH / g, or about 50 to 110 mgKOH / g, or about 60 to 90 mgKOH / g. When the acid value is too low, alkali developability may be lowered. On the contrary, when the acid value is too high, it may be possible to dissolve the photocurable portion, for example, the exposed portion, by the developing solution, which makes it difficult to form a normal pattern of the DFSR.
광중합성Photopolymerization 모노머Monomer
한편, 일 구현예의 수지 조성물은 광중합성 모노머를 포함한다. 이러한 광중합성 모노머는, 예를 들어, 3개 이상의 다관능 비닐기 등 광경화 가능한 불포화 작용기를 갖는 화합물로 될 수 있으며, 상술한 산변성 올리고머의 불포화 작용기와 가교 결합을 형성하여 노광시 광경화에 의한 가교 구조를 형성할 수 있다. 이로서, DFSR이 형성될 부분에 대응하는 노광부의 수지 조성물이 알칼리 현상되지 않고 기판 상에 잔류하도록 할 수 있다. Meanwhile, the resin composition of one embodiment includes a photopolymerizable monomer. Such a photopolymerizable monomer may be, for example, a compound having a photocurable unsaturated functional group such as three or more polyfunctional vinyl groups, and may form a crosslink with the unsaturated functional group of the acid-modified oligomer described above to provide photocuring during exposure. Crosslinked structure can be formed. Thereby, the resin composition of the exposure part corresponding to the part where DFSR is to be formed can be left on the substrate without alkali development.
이러한 광중합성 모노머로는, 실온에서 액상인 것을 사용할 수 있고, 이에 따라 일 구현예의 수지 조성물의 점도를 도포 방법에 맞게 조절하거나, 비노광부의 알칼리 현상성을 보다 향상시키는 역할도 함께 할 수 있다. As the photopolymerizable monomer, a liquid phase may be used at room temperature, and accordingly, the viscosity of the resin composition of one embodiment may be adjusted according to the coating method, or the role of improving the alkali developability of the non-exposed part may also be combined.
상기 광중합성 모노머로는, 3개 이상의 광경화 가능한 불포화 작용기를 갖는 아크릴레이트계 화합물을 사용할 수 있고, 보다 구체적인 예로서, 2-히드록시에틸아크릴레이트, 2-히드록시프로필아크릴레이트, 펜타에리트리톨트리아크릴레이트, 또는 디펜타에리트리톨펜타아크릴레이트 등의 수산기 함유의 아크릴레이트계 화합물; 폴리에틸렌글리콜디아크릴레이트, 또는 폴리프로필렌글리콜디아크릴레이트 등의 수용성 아크릴레이트계 화합물; 트리메틸올프로판트리아크릴레이트, 펜타에리트리톨테트라아크릴레이트, 또는 디펜타에리트리톨헥사아크릴레이트 등의 다가 알코올의 다관능 폴리에스테르아크릴레이트계 화합물; 트리메틸올프로판, 또는 수소 첨가 비스페놀 A 등의 다관능 알코올 또는 비스페놀 A, 비페놀 등의 다가 페놀의 에틸렌옥시드 부가물 및/또는 프로필렌옥시드 부가물의 아크릴레이트계 화합물; 상기 수산기 함유 아크릴레이트의 이소시아네이트 변성물인 다관능 또는 단관능 폴리우레탄아크릴레이트계 화합물; 비스페놀 A 디글리시딜에테르, 수소 첨가 비스페놀 A 디글리시딜에테르 또는 페놀 노볼락 에폭시 수지의 (메트)아크릴산 부가물인 에폭시아크릴레이트계 화합물; 카프로락톤 변성 디트리메틸올프로판테트라아크릴레이트, ε-카프로락톤 변성 디펜타에리트리톨의 아크릴레이트, 또는 카프로락톤 변성 히드록시피발산네오펜틸글리콜에스테르디아크릴레이트 등의 카프로락톤 변성의 아크릴레이트계 화합물, 및 상술한 아크릴레이트계 화합물에 대응하는 메타크릴레이트계 화합물 등의 감광성(메트)아크릴레이트 화합물로 이루어진 군에서 선택된 1종 이상의 화합물을 사용할 수 있고, 이들을 단독 또는 2종 이상을 조합하여 사용할 수도 있다.As the photopolymerizable monomer, an acrylate compound having three or more photocurable unsaturated functional groups can be used. More specifically, 2-hydroxyethyl acrylate, 2-hydroxypropyl acrylate, pentaerythritol Hydroxyl group-containing acrylate compounds such as triacrylate or dipentaerythritol pentaacrylate; Water-soluble acrylate compounds such as polyethylene glycol diacrylate or polypropylene glycol diacrylate; Polyfunctional polyester acrylate compounds of polyhydric alcohols such as trimethylolpropane triacrylate, pentaerythritol tetraacrylate, or dipentaerythritol hexaacrylate; Acrylate compounds of ethylene oxide adducts and / or propylene oxide adducts of polyfunctional alcohols such as trimethylolpropane or hydrogenated bisphenol A or polyhydric phenols such as bisphenol A and biphenol; Polyfunctional or monofunctional polyurethane acrylate compounds which are isocyanate modified products of the hydroxyl group-containing acrylate; Epoxy acrylate compounds that are (meth) acrylic acid adducts of bisphenol A diglycidyl ether, hydrogenated bisphenol A diglycidyl ether, or phenol novolac epoxy resins; Caprolactone-modified acrylate compounds such as caprolactone-modified ditrimethylolpropane tetraacrylate, acrylate of ε-caprolactone-modified dipentaerythritol, or caprolactone-modified hydroxy pivalate neopentyl glycol ester diacrylate, And one or more compounds selected from the group consisting of photosensitive (meth) acrylate compounds such as methacrylate compounds corresponding to the acrylate compounds described above, and these may be used alone or in combination of two or more thereof. .
이들 중에서도, 상기 광중합성 모노머로는 1 분자 중에 2개 이상의 (메트)아크릴로일기를 갖는 다관능 (메트)아크릴레이트계 화합물을 바람직하게 사용할 수 있으며, 특히 펜타에리트리톨트리아크릴레이트, 트리메틸올프로판트리아크릴레이트, 디펜타에리트리톨헥사아크릴레이트, 또는 카프로락톤 변성 디트리메틸올프로판테트라아크릴레이트 등을 적절히 사용할 수 있다. 상업적으로 입수 가능한 광중합성 모노머의 예로는, 카야라드의 DPEA-12 등을 들 수 있다. Among these, as said photopolymerizable monomer, the polyfunctional (meth) acrylate type compound which has two or more (meth) acryloyl groups in 1 molecule can be used preferably, Especially pentaerythritol triacrylate and a trimethylol propane Triacrylate, dipentaerythritol hexaacrylate, caprolactone modified ditrimethylol propane tetraacrylate, etc. can be used suitably. As an example of a commercially available photopolymerizable monomer, Kaylarad DPEA-12 etc. are mentioned.
상술한 광중합성 모노머의 함량은 수지 조성물 전체 중량에 대하여 약 5 내지 30 중량%, 혹은 약 7 내지 20 중량%, 혹은 약 7 내지 15 중량%로 될 수 있다. 광중합성 모노머의 함량이 지나치게 작아지면, 광경화가 충분하지 않게 될 수 있고, 지나치게 커지면 DFSR의 건조성이 나빠지고 물성이 저하될 수 있다. The content of the photopolymerizable monomer described above may be about 5 to 30% by weight, about 7 to 20% by weight, or about 7 to 15% by weight based on the total weight of the resin composition. If the content of the photopolymerizable monomer is too small, the photocuring may not be sufficient, and if the content of the photopolymerizable monomer is too large, the drying property of the DFSR may deteriorate and the physical properties may be degraded.
광개시제Photoinitiator
일 구현예의 수지 조성물은 광개시제를 포함한다. 이러한 광개시제는, 예를 들어, 수지 조성물의 노광부에서 산변성 올리고머와, 광중합성 모노머 간에 라디칼 광경화를 개시하는 역할을 한다.The resin composition of one embodiment includes a photoinitiator. Such a photoinitiator, for example, serves to initiate radical photocuring between the acid-modified oligomer and the photopolymerizable monomer in the exposed portion of the resin composition.
광개시제로서는 공지의 것을 사용할 수 있고, 벤조인, 벤조인메틸에테르, 벤조인에틸에테르 등의 벤조인과 그 알킬에테르류; 아세토페논, 2,2-디메톡시-2-페닐아세토페논, 1,1-디클로로아세토페논, 4-(1-t-부틸디옥시-1-메틸에틸)아세토페논 등의 아세토페논류; 2-메틸안트라퀴논, 2-아밀안트라퀴논, 2-t-부틸안트라퀴논, 1-클로로안트라퀴논 등의 안트라퀴논류; 2,4-디메틸티오크산톤, 2,4-디이소프로필티오크산톤, 2-클로로티오크산톤 등의 티오크산톤류; 아세토페논디메틸케탈, 벤질디메틸케탈 등의 케탈류; 벤조페논, 4-(1-t-부틸디옥시-1-메틸에틸)벤조페논, 3,3',4,4'-테트라키스(t-부틸디옥시카르보닐)벤조페논 등의 벤조페논류와 같은 물질들을 사용할 수 있다. As a photoinitiator, a well-known thing can be used and benzoin, such as benzoin, benzoin methyl ether, and benzoin ethyl ether, and its alkyl ether; Acetophenones such as acetophenone, 2,2-dimethoxy-2-phenylacetophenone, 1,1-dichloroacetophenone and 4- (1-t-butyldioxy-1-methylethyl) acetophenone; Anthraquinones such as 2-methyl anthraquinone, 2-amylanthraquinone, 2-t-butyl anthraquinone and 1-chloro anthraquinone; Thioxanthones such as 2,4-dimethylthioxanthone, 2,4-diisopropylthioxanthone and 2-chlorothioxanthone; Ketal such as acetophenone dimethyl ketal and benzyl dimethyl ketal; Benzophenones such as benzophenone, 4- (1-t-butyldioxy-1-methylethyl) benzophenone, 3,3 ', 4,4'-tetrakis (t-butyldioxycarbonyl) benzophenone Materials such as these can be used.
또, 2-메틸-1-[4-(메틸티오)페닐]-2-모르폴리노프로파논-1,2-벤질-2-디메틸아미노-1-(4-몰포리노페닐)-부탄-1-온, 2-(디메틸아미노)-2-[(4-메틸페닐)메틸]-1-[4-(4-몰포리닐)페닐]-1-부타논, N,N-디메틸아미노아세토페논(시판품으로서는 치바스페셜리티케미컬사(현, 치바저팬사) 제품의 이루가큐어(등록상표) 907, 이루가큐어 369, 이루가큐어 379 등) 등의 α-아미노아세토페논류, 2,4,6-트리메틸벤조일디페닐호스핀옥사이트, 비스(2,4,6-트리메틸벤조일)-페닐포스핀옥사이드, 비스(2,6-디메톡시벤조일)-2,4,4-트리메틸-펜틸포스핀옥사이드(시판품으로서는, BASF사 제품 루실린(등록상표) TPO, 치바스페셜리티케미컬사 제품의 이루가큐어 819 등) 등의 아실포스핀옥사이드류가 바람직한 광개시제로서 언급될 수 있다.In addition, 2-methyl-1- [4- (methylthio) phenyl] -2-morpholinopropaneone-1,2-benzyl-2-dimethylamino-1- (4-morpholinophenyl) -butane-1 -One, 2- (dimethylamino) -2-[(4-methylphenyl) methyl] -1- [4- (4-morpholinyl) phenyl] -1-butanone, N, N-dimethylaminoacetophenone ( As commercially available products, α-aminoacetophenones such as Irugacure (registered trademark) 907, Irugacure 369, Irugacure 379, etc. of Chiba Specialty Chemical Co., Ltd. (currently Chiba Japan Co., Ltd.), 2,4,6- Trimethylbenzoyldiphenylhospinoxite, bis (2,4,6-trimethylbenzoyl) -phenylphosphine oxide, bis (2,6-dimethoxybenzoyl) -2,4,4-trimethyl-pentylphosphine oxide ( As a commercial item, acyl phosphine oxides, such as Rucillin (trademark) TPO by BASF Corporation and Irgacure 819 by Chivas Specialty Chemical Co., Ltd.), etc. can be mentioned as a preferable photoinitiator.
또, 바람직한 광개시제로서는, 옥심에스테르류를 들 수 있다. 옥심에스테르류의 구체예로서는 2-(아세틸옥시이미노메틸)티오크산텐-9-온, (1,2-옥탄디온, 1-[4-(페닐티오)페닐]-, 2-(O-벤조일옥심)), (에탄온, 1-[9-에틸-6-(2-메틸벤조일)-9H-카르바졸-3-일]-, 1-(O-아세틸옥심)) 등을 들 수 있다. 시판품으로서는 치바스페셜리티케미컬사 제품의 GGI-325, 이루가큐어 OXE01, 이루가큐어 OXE02, ADEKA사 제품 N-1919, 치바스페셜리티케미컬사의 Darocur TPO 등을 들 수 있다.Moreover, oxime ester is mentioned as a preferable photoinitiator. Specific examples of oxime esters include 2- (acetyloxyiminomethyl) thioxanthene-9-one, (1,2-octanedione, 1- [4- (phenylthio) phenyl]-, and 2- (O-benzoyloxime ), (Ethanone, 1- [9-ethyl-6- (2-methylbenzoyl) -9H-carbazol-3-yl]-, 1- (O-acetyloxime)), and the like. Commercially available products include GGI-325 from Chiba Specialty Chemical, Irugacure OXE01, Irugacure OXE02, ADEKA N-1919, Chiba Specialty Chemical's Darocur TPO, and the like.
광개시제의 함량은 수지 조성물 전체 중량에 대하여 약 0.5 내지 20 중량%, 혹은 약 1 내지 10 중량%, 혹은 약 1 내지 5 중량%로 될 수 있다. 광개시제의 함량이 지나치게 작으면, 광경화가 제대로 일어나지 않을 수 있고, 반대로 지나치게 커지면 수지 조성물의 해상도가 저하되거나 DFSR의 신뢰성이 충분하지 않을 수 있다.The content of the photoinitiator may be about 0.5 to 20% by weight, or about 1 to 10% by weight, or about 1 to 5% by weight based on the total weight of the resin composition. If the content of the photoinitiator is too small, photocuring may not occur properly, on the contrary, if the content of the photoinitiator is too large, the resolution of the resin composition may be lowered or the reliability of the DFSR may not be sufficient.
열경화성 바인더Thermosetting binder
일 구현예의 수지 조성물은 또한 열경화 가능한 작용기, 예를 들어, 에폭시기, 옥세타닐기, 환상 에테르기 및 환상 티오 에테르기 중에서 선택도니 1종 이상을 갖는 열경화성 바인더를 포함한다. 이러한 열경화성 바인더는 열경화에 의해 산변성 올리고머 등과 가교 결합을 형성해 DFSR의 내열성 또는 기계적 물성을 담보할 수 있다. The resin composition of one embodiment also includes a thermosetting binder having at least one selected from among thermosetting functional groups such as epoxy groups, oxetanyl groups, cyclic ether groups and cyclic thio ether groups. Such a thermosetting binder may form a crosslinking bond with an acid-modified oligomer and the like by thermosetting to secure heat resistance or mechanical properties of DFSR.
이러한 열경화성 바인더는 연화점이 약 70 내지 100℃로 될 수 있고, 이를 통해 라미네이션시 요철을 줄일 수 있다. 연화점이 낮을 경우 DFSR의 끈적임(Tackiness)이 증가하고, 높을 경우 흐름성이 악화될 수 있다. Such a thermosetting binder may have a softening point of about 70 to 100 ° C., thereby reducing unevenness during lamination. Low softening points increase the tackiness of the DFSR, and high flow rates may deteriorate.
상기 열경화성 바인더로는, 분자 중에 2개 이상의 환상 에테르기 및/또는 환상 티오에테르기(이하, 환상 (티오)에테르기라고 함)를 갖는 수지를 사용할 수 있고, 또 2관능성의 에폭시 수지를 사용할 수 있다. 기타 디이소시아네이트나 그의 2관능성 블록이소시아네이트도 사용할 수 있다.As the thermosetting binder, a resin having two or more cyclic ether groups and / or cyclic thioether groups (hereinafter referred to as cyclic (thio) ether groups) in a molecule can be used, and a bifunctional epoxy resin can be used. have. Other diisocyanates or their difunctional block isocyanates can also be used.
상기 분자 중에 2개 이상의 환상 (티오)에테르기를 갖는 열경화성 바인더는 분자 중에 3, 4 또는 5원환의 환상 에테르기, 또는 환상 티오에테르기 중 어느 한쪽 또는 2종의 기를 2개 이상 갖는 화합물로 될 수 있다. 또, 상기 열경화성 바인더는 분자 중에 적어도 2개 이상의 에폭시기를 갖는 다관능 에폭시 화합물, 분자 중에 적어도 2개 이상의 옥세타닐기를 갖는 다관능 옥세탄 화합물 또는 분자 중에 2개 이상의 티오에테르기를 갖는 에피술피드 수지 등으로 될 수 있다. The thermosetting binder having two or more cyclic (thio) ether groups in the molecule may be a compound having any one or two or more of three, four or five membered cyclic ether groups, or cyclic thioether groups in the molecule. have. The thermosetting binder may be a polyfunctional epoxy compound having at least two epoxy groups in a molecule, a polyfunctional oxetane compound having at least two oxetanyl groups in a molecule, or an episulfide resin having two or more thioether groups in a molecule And so on.
상기 다관능 에폭시 화합물의 구체예로서는, 예를 들면 비스페놀 A형 에폭시 수지, 수소 첨가 비스페놀 A형 에폭시 수지, 브롬화 비스페놀 A형 에폭시 수지, 비스페놀 F형 에폭시 수지, 비스페놀 S형 에폭시 수지, 노볼락형 에폭시 수지, 페놀 노볼락형 에폭시 수지, 크레졸 노볼락형 에폭시 수지, N-글리시딜형 에폭시 수지, 비스페놀 A의 노볼락형 에폭시 수지, 비크실레놀형 에폭시 수지, 비페놀형 에폭시 수지, 킬레이트형 에폭시 수지, 글리옥살형 에폭시 수지, 아미노기 함유 에폭시 수지, 고무 변성 에폭시 수지, 디시클로펜타디엔 페놀릭형 에폭시 수지, 디글리시딜프탈레이트 수지, 헤테로시클릭 에폭시 수지, 테트라글리시딜크실레노일에탄 수지, 실리콘 변성 에폭시 수지, ε-카프로락톤 변성 에폭시 수지 등을 들 수 있다. 또한, 난연성 부여를 위해, 인 등의 원자가 그 구조 중에 도입된 것을 사용할 수도 있다. 이들 에폭시 수지는 열경화함으로써, 경화 피막의 밀착성, 땜납 내열성, 무전해 도금 내성 등의 특성을 향상시킨다.As a specific example of the said polyfunctional epoxy compound, bisphenol-A epoxy resin, hydrogenated bisphenol-A epoxy resin, brominated bisphenol A-type epoxy resin, bisphenol F-type epoxy resin, bisphenol S-type epoxy resin, novolak-type epoxy resin, for example , Phenol novolak type epoxy resin, cresol novolak type epoxy resin, N-glycidyl type epoxy resin, bisphenol A novolak type epoxy resin, bixylenol type epoxy resin, biphenol type epoxy resin, chelate type epoxy resin, glyc Oxal type epoxy resin, amino group containing epoxy resin, rubber modified epoxy resin, dicyclopentadiene phenolic epoxy resin, diglycidyl phthalate resin, heterocyclic epoxy resin, tetraglycidyl xylenoyl ethane resin, silicone modified epoxy resin and (epsilon) -caprolactone modified epoxy resins. In addition, in order to impart flame retardancy, those in which atoms such as phosphorus are introduced into the structure may be used. These epoxy resins improve the properties such as adhesiveness of the cured film, solder heat resistance, and electroless plating resistance by thermosetting.
상기 다관능 옥세탄 화합물로서는 비스[(3-메틸-3-옥세타닐메톡시)메틸]에테르, 비스[(3-에틸-3-옥세타닐메톡시)메틸]에테르, 1,4-비스[(3-메틸-3-옥세타닐메톡시)메틸]벤젠, 1,4-비스[(3-에틸-3-옥세타닐메톡시)메틸]벤젠, (3-메틸-3-옥세타닐)메틸아크릴레이트, (3-에틸-3-옥세타닐)메틸아크릴레이트, (3-메틸-3-옥세타닐)메틸메타크릴레이트, (3-에틸-3-옥세타닐)메틸메타크릴레이트나 이들의 올리고머 또는 공중합체 등의 다관능 옥세탄류 이외에, 옥세탄 알코올과 노볼락 수지, 폴리(p-히드록시스티렌), 카르도형 비스페놀류, 카릭스아렌류, 카릭스레졸신아렌류, 또는 실세스퀴옥산 등의 히드록시기를 갖는 수지와의 에테르화물 등을 들 수 있다. 그 밖의, 옥세탄환을 갖는 불포화 모노머와 알킬(메트)아크릴레이트와의 공중합체 등도 들 수 있다.Examples of the polyfunctional oxetane compound include bis [(3-methyl-3-oxetanylmethoxy) methyl] ether, bis [(3-ethyl-3-oxetanylmethoxy) methyl] ether, 1,4-bis [( 3-methyl-3-oxetanylmethoxy) methyl] benzene, 1,4-bis [(3-ethyl-3-oxetanylmethoxy) methyl] benzene, (3-methyl-3-oxetanyl) methylacrylic Latex, (3-ethyl-3-oxetanyl) methyl acrylate, (3-methyl-3-oxetanyl) methyl methacrylate, (3-ethyl-3-oxetanyl) methyl methacrylate or these In addition to polyfunctional oxetanes such as oligomers and copolymers, oxetane alcohols and novolac resins, poly (p-hydroxystyrenes), cardo-type bisphenols, charixarenes, carlixresolecinarenes, or silses And etherates with resins having hydroxy groups such as quoxane. In addition, the copolymer etc. of the unsaturated monomer which has an oxetane ring, and an alkyl (meth) acrylate are mentioned.
상기 분자 중에 2개 이상의 환상 티오에테르기를 갖는 화합물로서는, 예를 들면 재팬 에폭시 레진사 제조의 비스페놀 A형 에피술피드 수지 YL7000 등을 들 수 있다. 또한, 노볼락형 에폭시 수지의 에폭시기의 산소 원자를 황 원자로 대체한 에피술피드 수지 등도 사용할 수 있다.Examples of the compound having two or more cyclic thioether groups in the molecule include a bisphenol A type episulfide resin YL7000 manufactured by Japan Epoxy Resin Co., An episulfide resin in which the oxygen atom of the epoxy group of the novolac epoxy resin is replaced with a sulfur atom can also be used.
또한, 시판되고 있는 것으로서, 국도화학사의 YDCN-500-80P 등을 사용할 수 있다.Moreover, as marketed, YDCN-500-80P etc. of Kukdo Chemical Co., Ltd. can be used.
열경화성 바인더는 상기 산변성 올리고머의 카르복시기 1 당량에 대하여 약 0.8 내지 2.0 당량에 대응하는 함량으로 포함될 수 있다. 열경화성 바인더의 함량이 지나치게 작아지면, 경화 후 DFSR에 카르복시기가 남아 내열성, 내알칼리성, 전기 절연성 등이 저하될 수 있다. 반대로, 함량이 지나치게 커지면, 저분자량의 환상 (티오)에테르기가 건조 도막에 잔존함으로써, 도막의 강도 등이 저하되기 때문에 바람직하지 않다.The thermosetting binder may be included in an amount corresponding to about 0.8 to 2.0 equivalents based on 1 equivalent of the carboxyl group of the acid-modified oligomer. When the content of the thermosetting binder is too small, carboxyl groups may remain in the DFSR after curing, thereby deteriorating heat resistance, alkali resistance, electrical insulation, and the like. On the contrary, when the content is too large, it is not preferable because the low molecular weight cyclic (thio) ether group remains in the dry coating film because the strength and the like of the coating film decrease.
상술한 각 성분 외에도, 일 구현예의 수지 조성물은 용제; 및 후술하는 열경화성 바인더 촉매, 필러, 안료 및 첨가제로 이루어진 군에서 선택된 1종 이상을 더 포함할 수도 있다. In addition to the above-mentioned components, the resin composition of one embodiment includes a solvent; And at least one selected from the group consisting of a thermosetting binder catalyst, a filler, a pigment, and an additive to be described later.
열경화성 바인더 촉매Thermosetting binder catalyst
열경화성 바인더 촉매는 열경화성 바인더의 열경화를 촉진시키는 역할을 한다.The thermosetting binder catalyst serves to promote thermosetting of the thermosetting binder.
이러한 열경화성 바인더 촉매로서는, 예를 들면 이미다졸, 2-메틸이미다졸, 2-에틸이미다졸, 2-에틸-4-메틸이미다졸, 2-페닐이미다졸, 4-페닐이미다졸, 1-시아노에틸-2-페닐이미다졸, 1-(2-시아노에틸)-2-에틸-4-메틸이미다졸 등의 이미다졸 유도체; 디시안디아미드, 벤질디메틸아민, 4-(디메틸아미노)-N,N-디메틸벤질아민, 4-메톡시-N,N-디메틸벤질아민, 4-메틸-N,N-디메틸벤질아민 등의 아민 화합물; 아디프산 디히드라지드, 세박산 디히드라지드 등의 히드라진 화합물; 트리페닐포스핀 등의 인 화합물 등을 들 수 있다. 또한, 시판되고 있는 것으로서는, 예를 들면 시코쿠 가세이 고교사 제조의 2MZ-A, 2MZ-OK, 2PHZ, 2P4BHZ, 2P4MHZ(모두 이미다졸계 화합물의 상품명), 산아프로사 제조의 U-CAT3503N, UCAT3502T(모두 디메틸아민의 블록이소시아네이트 화합물의 상품명), DBU, DBN, U-CATSA102, U-CAT5002(모두 이환식 아미딘 화합물 및 그의 염) 등을 들 수 있다. 특히 이들에 한정되는 것이 아니고, 에폭시 수지나 옥세탄 화합물의 열경화 촉매, 또는 에폭시기 및/또는 옥세타닐기와 카르복시기의 반응을 촉진하는 것일 수 있고, 단독으로 또는 2종 이상을 혼합하여 사용할 수도 있다. 또한, 구아나민, 아세토구아나민, 벤조구아나민, 멜라민, 2,4-디아미노-6-메타크릴로일옥시에틸-S-트리아진, 2-비닐-4,6-디아미노-S-트리아진, 2-비닐-4,6-디아미노-S-트리아진·이소시아누르산 부가물, 2,4-디아미노-6-메타크릴로일옥시에틸-S-트리아진·이소시아누르산 부가물 등의 S-트리아진 유도체를 이용할 수도 있고, 바람직하게는 이들 밀착성 부여제로서도 기능하는 화합물을 상기 열경화성 바인더 촉매와 병용할 수 있다. As such a thermosetting binder catalyst, for example, imidazole, 2-methylimidazole, 2-ethylimidazole, 2-ethyl-4-methylimidazole, 2-phenylimidazole, 4-phenylimidazole Imidazole derivatives such as 1-cyanoethyl-2-phenylimidazole and 1- (2-cyanoethyl) -2-ethyl-4-methylimidazole; Amines such as dicyandiamide, benzyldimethylamine, 4- (dimethylamino) -N, N-dimethylbenzylamine, 4-methoxy-N, N-dimethylbenzylamine, 4-methyl-N, N-dimethylbenzylamine compound; Hydrazine compounds such as adipic dihydrazide and sebacic acid dihydrazide; And phosphorus compounds such as triphenylphosphine. 2MZ-A, 2MZ-OK, 2PHZ, 2P4BHZ, 2P4MHZ (all trade names of imidazole-based compounds) manufactured by Shikoku Chemical Industry Co., Ltd., U-CAT 3503N and UCAT3502T DBU, DBN, U-CATSA102, and U-CAT5002 (all of bicyclic amidine compounds and salts thereof), and the like. It is not specifically limited to these, It may be the thing which accelerates reaction of the thermosetting catalyst of an epoxy resin or an oxetane compound, or an epoxy group and / or an oxetanyl group, and a carboxyl group, It can also be used individually or in mixture of 2 or more types. . Also, guanamine, acetoguanamine, benzoguanamine, melamine, 2,4-diamino-6-methacryloyloxyethyl-S-triazine, 2-vinyl-4,6-diamino-S-tri Azine, 2-vinyl-4,6-diamino-S-triazine isocyanuric acid adduct, 2,4-diamino-6-methacryloyloxyethyl-S-triazine isocyanuric acid S-triazine derivatives, such as an adduct, can also be used, Preferably, the compound which also functions as these adhesive imparting agents can be used together with the said thermosetting binder catalyst.
열경화성 바인더 촉매의 함량은 적절한 열경화성의 측면에서, 수지 조성물 전체 중량에 대하여 약 0.3 내지 15 중량%로 될 수 있다. The content of the thermosetting binder catalyst may be about 0.3 to 15% by weight based on the total weight of the resin composition in terms of suitable thermosetting.
필러filler
필러는 내열 안정성, 열에 의한 치수안정성, 수지 접착력을 향상시키는 역할을 한다. 또한, 색상을 보강함으로써 체질안료 역할도 한다.The filler plays a role of improving heat stability, dimensional stability by heat, and resin adhesion. In addition, it also serves as a constitution pigment by reinforcing the color.
필러로는 무기 또는 유기 충전제를 사용할 수가 있는데, 예를 들어 황산바륨, 티탄산바륨, 무정형 실리카, 결정성 실리카, 용융 실리카, 구형 실리카, 탈크, 클레이, 탄산마그네슘, 탄산칼슘, 산화알루미늄(알루미나), 수산화알루미늄, 마이카 등을 사용할 수 있다.As the filler, inorganic or organic fillers can be used, for example barium sulfate, barium titanate, amorphous silica, crystalline silica, fused silica, spherical silica, talc, clay, magnesium carbonate, calcium carbonate, aluminum oxide (alumina), Aluminum hydroxide, mica and the like can be used.
필러의 함량은 조성물 전체 중량에 대하여 약 5 내지 50 중량%인 것이 바람직하다. 50 중량%를 초과하여 사용할 경우에는 조성물의 점도가 높아져서 코팅성이 저하되거나 경화도가 떨어지게 되어 바람직하지 않다.The content of the filler is preferably about 5 to 50% by weight based on the total weight of the composition. In the case of using more than 50% by weight, the viscosity of the composition is increased, so that the coating property is lowered or the degree of curing is lowered.
안료Pigment
안료는 시인성, 은폐력을 발휘하여 회로선의 긁힘과 같은 결함을 숨기는 역할을 한다.Pigments exhibit visibility and hiding power to hide defects such as scratches on circuit lines.
안료로는 적색, 청색, 녹색, 황색, 흑색 안료 등을 사용할 수 있다. 청색 안료로는 프탈로시아닌 블루, 피그먼트 블루 15:1, 피그먼트 블루 15:2, 피그먼트 블루 15:3, 피그먼트 블루 15:4, 피그먼트 블루 15:6, 피그먼트 블루 60 등을 사용할 수 있다. 녹색 안료로는 피그먼트 그린 7, 피그먼트 그린 36, 솔벤트 그린 3, 솔벤트 그린 5, 솔벤트 그린 20, 솔벤트 그린 28 등을 사용할 수 있다. 황색 안료로는 안트라퀴논계, 이소인돌리논계, 축합 아조계, 벤즈이미다졸론계 등이 있으며, 예를 들어 피그먼트 옐로우 108, 피그먼트 옐로우 147, 피그먼트 옐로우 151, 피그먼트 옐로우 166, 피그먼트 옐로우 181, 피그먼트 옐로우 193 등을 사용할 수 있다.As the pigment, red, blue, green, yellow, black pigments and the like can be used. As the blue pigment, phthalocyanine blue, pigment blue 15: 1, pigment blue 15: 2, pigment blue 15: 3, pigment blue 15: 4, pigment blue 15: 6, pigment blue 60, and the like can be used. have. Pigment Green 7, Pigment Green 36, Solvent Green 3, Solvent Green 5, Solvent Green 20, Solvent Green 28, etc. may be used as the green pigment. Examples of the yellow pigments include anthraquinones, isoindolinones, condensed azos, and benzimidazolones. For example, Pigment Yellow 108, Pigment Yellow 147, Pigment Yellow 151, Pigment Yellow 166, Pigment. Pigment yellow 181, pigment yellow 193 and the like can be used.
안료의 함량은 수지 조성물 전체 중량에 대하여 약 0.5 내지 3 중량%로 사용하는 것이 바람직하다. 0.5 중량% 미만으로 사용할 경우에는 시인성, 은폐력이 떨어지게 되며, 3 중량%를 초과하여 사용할 경우에는 내열성이 떨어지게 된다.The content of the pigment is preferably used at about 0.5 to 3% by weight based on the total weight of the resin composition. When used in less than 0.5% by weight, visibility and hiding power is lowered, and when used in excess of 3% by weight is less heat resistance.
첨가제additive
첨가제는 수지 조성물의 기포를 제거하거나, 필름 코팅시 표면의 팝핑(Popping)이나 크레이터(Crater)를 제거, 난연성질 부여, 점도 조절, 촉매 등의 역할로 첨가될 수 있다.The additive may be added to remove bubbles in the resin composition or remove popping or craters from the surface of the film, impart flame retardancy, adjust viscosity, and catalyze the film.
구체적으로, 미분실리카, 유기 벤토나이트, 몬모릴로나이트 등의 공지 관용의 증점제; 실리콘계, 불소계, 고분자계 등의 소포제 및/또는 레벨링제; 이미다졸계, 티아졸계, 트리아졸계 등의 실란 커플링제; 인계 난연제, 안티몬계 난연제 등의 난연제 등과 같은 공지 관용의 첨가제류를 배합할 수 있다.Specifically, known conventional thickeners such as finely divided silica, organic bentonite and montmorillonite; Antifoaming agents and / or leveling agents such as silicone, fluorine, and polymers; Silane coupling agents such as imidazole series, thiazole series, and triazole series; Known and common additives such as flame retardants such as phosphorus flame retardants and antimony flame retardants can be blended.
이중에서 레벨링제는 필름 코팅시 표면의 팝핑이나 크레이터를 제거하는 역할을 하며, 예를 들어 BYK-Chemie GmbH의 BYK-380N, BYK-307, BYK-378, BYK-350 등을 사용할 수 있다.Among them, the leveling agent serves to remove the popping or craters of the surface when the film is coated, for example, BYK-380N, BYK-307, BYK-307, BYK-378, BYK-350, etc. of BYK-Chemie GmbH.
첨가제의 함량은 수지 조성물 전체 중량에 대하여 약 0.01 내지 10 중량%인 것이 바람직하다.The content of the additive is preferably about 0.01 to 10% by weight based on the total weight of the resin composition.
용제solvent
수지 조성물을 용해시키거나 적절한 점도를 부여하기 위해 1개 이상의 용제를 혼용하여 사용할 수 있다.One or more solvents may be used in combination to dissolve the resin composition or impart an appropriate viscosity.
용제로서는 메틸에틸케톤, 시클로헥사논 등의 케톤류; 톨루엔, 크실렌, 테트라메틸벤젠 등의 방향족 탄화수소류; 에틸렌글리콜모노에틸에테르, 에틸렌글리콜모노메틸에테르, 에틸렌글리콜모노부틸에테르, 디에틸렌글리콜모노에틸에테르, 디에틸렌글리콜모노메틸에테르, 디에틸렌글리콜모노부틸에테르, 프로필렌글리콜모노메틸에테르, 프로필렌글리콜모노에틸에테르, 디프로필렌글리콜디에틸에테르, 트리에틸렌글리콜모노에틸에테르 등의 글리콜에테르류(셀로솔브); 아세트산에틸, 아세트산부틸, 에틸렌글리콜모노에틸에테르아세테이트, 에틸렌글리콜모노부틸에테르아세테이트, 디에틸렌글리콜모노에틸에테르아세테이트, 디에틸렌글리콜모노부틸에테르아세테이트, 프로필렌글리콜모노메틸에테르아세테이트, 디프로필렌글리콜모노메틸에테르아세테이트 등의 아세트산에스테르류; 에탄올, 프로판올, 에틸렌글리콜, 프로필렌글리콜, 카르비톨 등의 알코올류; 옥탄, 데칸 등의 지방족 탄화수소; 석유에테르, 석유나프타, 수소 첨가 석유나프타, 용매나프타 등의 석유계 용제; 디메틸아세트아미드, 디메틸포름아미드(DMF) 등의 아미드류 등을 들 수 있다. 이들 용제는 단독으로 또는 2종 이상의 혼합물로서 사용할 수 있다.As a solvent, Ketones, such as methyl ethyl ketone and cyclohexanone; Aromatic hydrocarbons such as toluene, xylene, and tetramethylbenzene; Ethylene glycol monoethyl ether, ethylene glycol monomethyl ether, ethylene glycol monobutyl ether, diethylene glycol monoethyl ether, diethylene glycol monomethyl ether, diethylene glycol monobutyl ether, propylene glycol monomethyl ether, propylene glycol monoethyl ether , Glycol ethers (cellosolve) such as dipropylene glycol diethyl ether and triethylene glycol monoethyl ether; But are not limited to, ethyl acetate, butyl acetate, ethylene glycol monoethyl ether acetate, ethylene glycol monobutyl ether acetate, diethylene glycol monoethyl ether acetate, diethylene glycol monobutyl ether acetate, propylene glycol monomethyl ether acetate, dipropylene glycol monomethyl ether acetate And the like; Alcohols such as ethanol, propanol, ethylene glycol, propylene glycol and carbitol; Aliphatic hydrocarbons such as octane and decane; Petroleum solvents such as petroleum ether, petroleum naphtha, hydrogenated petroleum naphtha and solvent naphtha; Amides such as dimethylacetamide and dimethylformamide (DMF). These solvents can be used alone or as a mixture of two or more thereof.
용제의 함량은 수지 조성물 전체 중량에 대하여 약 10 내지 50 중량%로 될 수 있다. 10 중량% 미만인 경우에는 점도가 높아 코팅성이 떨어지고 50 중량%를 초과할 경우에는 건조가 잘 되지 않아 끈적임이 증가하게 된다.
The content of the solvent may be about 10 to 50% by weight based on the total weight of the resin composition. If it is less than 10% by weight, the viscosity is high, the coating is inferior, and if it exceeds 50% by weight, the drying is not good, the stickiness increases.
한편 발명의 다른 구현예에 따르면, 카르복시기(-COOH)와, 광경화 가능한 불포화 작용기를 갖는 이미노카보네이트계 화합물을 포함하는 산변성 올리고머; 3개 이상의 광경화 가능한 불포화 작용기를 갖는 광중합성 모노머; 및 열경화 가능한 작용기를 갖는 열경화성 바인더의 경화물을 포함하는 드라이 필름 솔더 레지스트 (DFSR)가 제공될 수 있다. Meanwhile, according to another embodiment of the present invention, an acid-modified oligomer including a carboxy group (-COOH) and an iminocarbonate-based compound having a photocurable unsaturated functional group; Photopolymerizable monomers having three or more photocurable unsaturated functional groups; And a cured product of a thermosetting binder having a thermosetting functional group, a dry film solder resist (DFSR) can be provided.
드라이 필름 Dry film 솔더Solder 레지스트Resist
먼저, 상기 일 구현예의 광경화성 및 열경화성을 갖는 수지 조성물을 이용하여 DFSR을 제조하는 과정을 개략적으로 설명하면 다음과 같다. First, the process of manufacturing the DFSR using the resin composition having the photocurable and thermosetting of the embodiment is as follows.
먼저, 캐리어 필름(Carrier Film)에 감광성 코팅 재료(Photosensitive Coating Materials)로서 상기 일 구현예의 수지 조성물을 콤마 코터, 블레이드 코터, 립 코터, 로드 코터, 스퀴즈 코터, 리버스 코터, 트랜스퍼 롤 코터, 그라비아 코터 또는 분무 코터 등으로 도포한 후, 50 내지 130℃ 온도의 오븐을 1 내지 30분간 통과시켜 건조시킨 다음, 이형 필름(Release Film)을 적층함으로써, 아래로부터 캐리어 필름, 감광성 필름(Photosensitive Film), 이형 필름으로 구성되는 드라이 필름을 제조할 수 있다. 상기 감광성 필름의 두께는 5 내지 100 ㎛ 정도로 될 수 있다. 이때, 캐리어 필름으로는 폴리에틸렌테레프탈레이트(PET), 폴리에스테르 필름, 폴리이미드 필름, 폴리아미드이미드 필름, 폴리프로필렌 필름, 폴리스티렌 필름 등의 플라스틱 필름을 사용할 수 있고, 이형 필름으로는 폴리에틸렌(PE), 폴리테트라플루오로에틸렌 필름, 폴리프로필렌 필름, 표면 처리한 종이 등을 사용할 수 있으며, 이형필름을 박리할 때 감광성 필름과 캐리어 필름의 접착력보다 감광성 필름과 이형 필름의 접착력이 낮은 것이 바람직하다.First, the resin composition of the above embodiment is used as a photosensitive coating material on a carrier film. After coating with a spray coater or the like, the oven was dried at a temperature of 50 to 130 ° C. for 1 to 30 minutes and dried, and then a release film was laminated to form a carrier film, a photosensitive film, and a release film from below. The dry film comprised by this can be manufactured. The photosensitive film may have a thickness of about 5 to 100 μm. In this case, a plastic film such as polyethylene terephthalate (PET), a polyester film, a polyimide film, a polyamideimide film, a polypropylene film, a polystyrene film may be used as the carrier film, and polyethylene (PE), A polytetrafluoroethylene film, a polypropylene film, a surface treated paper, or the like can be used, and when the release film is peeled off, it is preferable that the adhesive force of the photosensitive film and the release film is lower than that of the photosensitive film and the carrier film.
다음, 이형 필름을 벗긴 후, 회로가 형성된 기판 위에 감광성 필름층을 진공 라미네이터, 핫 롤 라미네이터, 진공 프레스 등을 이용하여 접합한다.Next, after peeling off a release film, the photosensitive film layer is bonded together on the board | substrate with a circuit using a vacuum laminator, a hot roll laminator, a vacuum press, etc.
다음, 기재를 일정한 파장대를 갖는 광선(UV 등)으로 노광(Exposure)한다. 노광은 포토 마스크로 선택적으로 노광하거나, 또는 레이저 다이렉트 노광기로 직접 패턴 노광할 수도 있다. 캐리어 필름은 노광 후에 박리한다. 노광량은 도막 두께에 따라 다르나, 0 내지 1,000 mJ/㎠가 바람직하다. 상기 노광을 진행하면, 예를 들어, 노광부에서는 광경화가 일어나 산변성 올리고머(예를 들어, 상술한 이미노카보네이트계 화합물)와, 광중합성 모노머 등에 포함된 불포화 작용기들 사이에 가교 결합이 형성될 수 있고, 그 결과 이후의 현상에 의해 제거되지 않는 상태로 될 수 있다. 이에 비해, 비노광부는 상기 가교 결합 및 이에 따른 가교 구조가 형성되지 않고 카르복시기가 유지되어, 알칼리 현상 가능한 상태로 될 수 있다. Next, the substrate is exposed to light (UV, etc.) having a constant wavelength band. The exposure may be selectively exposed with a photo mask or may be directly pattern exposed with a laser direct exposure machine. The carrier film peels off after exposure. Although exposure amount changes with coating film thickness, 0-1,000 mJ / cm <2> is preferable. When the exposure is performed, for example, in the exposure unit, photocuring occurs to form a crosslink between the acid-modified oligomer (for example, the iminocarbonate-based compound described above) and the unsaturated functional groups included in the photopolymerizable monomer. And as a result can be left unremoved by subsequent development. On the contrary, the non-exposed part may not be formed with the crosslinked structure and thus the crosslinked structure, and thus the carboxyl group may be maintained to be in an alkali developable state.
다음, 알칼리 용액 등을 이용하여 현상(Development)한다. 알칼리 용액은 수산화칼륨, 수산화나트륨, 탄산나트륨, 탄산칼륨, 인산나트륨, 규산나트륨, 암모니아, 아민류 등의 알칼리 수용액을 사용할 수 있다. 이러한 현상에 의해, 노광부의 필름만이 잔류할 수 있다. Next, development is carried out using an alkaline solution or the like. The alkaline solution may be an aqueous alkali solution such as potassium hydroxide, sodium hydroxide, sodium carbonate, potassium carbonate, sodium phosphate, sodium silicate, ammonia, amines and the like. By this phenomenon, only the film of the exposed portion may remain.
마지막으로, 가열 경화시킴으로써(Post Cure), 감광성 필름으로부터 형성되는 솔더 레지스트를 포함하는 인쇄회로기판을 완성한다. 가열 경화온도는 100℃ 이상이 적당하다. Finally, by heat curing (Post Cure), a printed circuit board including a solder resist formed from the photosensitive film is completed. The heat curing temperature is preferably at least 100 ° C.
상술한 방법 등을 통해, DFSR 및 이를 포함하는 인쇄회로기판이 제공될 수 있다. 상기 DFSR은 광경화 및 열경화를 거침에 따라, 카르복시기(-COOH)와, 광경화 가능한 불포화 작용기를 갖는 이미노카보네이트계 화합물을 포함하는 산변성 올리고머; 3개 이상의 광경화 가능한 불포화 작용기를 갖는 광중합성 모노머; 및 열경화 가능한 작용기를 갖는 열경화성 바인더의 경화물을 포함할 수 있다. Through the above-described method, a DFSR and a printed circuit board including the same may be provided. The DFSR is an acid-modified oligomer comprising an iminocarbonate-based compound having a carboxyl group (-COOH) and a photocurable unsaturated functional group through photocuring and thermosetting; Photopolymerizable monomers having three or more photocurable unsaturated functional groups; And a cured product of a thermosetting binder having a thermosetting functional group.
보다 구체적으로, 상기 경화물은, 상기 이미노카보네이트계 화합물의 카르복시기와, 상기 열경화 가능한 작용기가 열경화에 의해 가교 결합된 가교 구조; 상기 이미노카보네이트계 화합물 및 광중합성 모노머의 불포화 작용기가 서로 광경화에 의해 가교 결합된 가교 구조; 및 상기 이미노카보네이트계 화합물에서 유래한 상기 화학식 2의 트리아진 가교 구조를 포함할 수 있다. 특히, 상기 경화물이 이미노카보네이트계 화합물에서 유래한 트리아진 가교 구조를 포함함에 따라, 상기 DFSR은 약 130 내지 180℃, 예를 들어, 약 140 내지 170℃, 혹은 약 150℃의 보다 높은 유리 전이 온도를 가질 수 있고, 보다 향상된 내열 신뢰성을 나타낼 수 있다. 따라서, 상기 DFSR은 반도체 소자의 패키지 기판 재료 등에 요구되는 우수한 PCT 내성, TCT 내열성 및 미세 배선간으로의 HAST 내성 등의 제반 물성을 충족하여, 반도체 소자의 패키지 기판 재료 등으로 바람직하게 사용될 수 있다. More specifically, the cured product includes a crosslinked structure in which the carboxyl group of the iminocarbonate-based compound and the thermosetting functional group are crosslinked by thermosetting; A crosslinked structure in which the unsaturated functional groups of the iminocarbonate compound and the photopolymerizable monomer are crosslinked by photocuring with each other; And it may include a triazine cross-linked structure of the formula (2) derived from the imino carbonate-based compound. In particular, as the cured product comprises a triazine crosslinked structure derived from an iminocarbonate-based compound, the DFSR is higher glass of about 130 to 180 ° C., for example about 140 to 170 ° C., or about 150 ° C. It can have a transition temperature and can exhibit improved heat resistance reliability. Accordingly, the DFSR satisfies various physical properties such as excellent PCT resistance, TCT heat resistance, and HAST resistance between fine wirings required for the package substrate material of the semiconductor device, and can be preferably used as the package substrate material of the semiconductor device.
부가하여, 상기 DFSR은 광경화에 참여하고 남은 소량의 광개시제를 경화물 내에 분산된 상태로 더 포함할 수 있다.
In addition, the DFSR may further include a small amount of photoinitiator remaining in the cured product after participating in photocuring.
이하, 발명의 구체적인 실시예를 통해, 발명의 작용 및 효과를 보다 상술하기로 한다. 다만, 이러한 실시예는 발명의 예시로 제시된 것에 불과하며, 이에 의해 발명의 권리범위가 정해지는 것은 아니다.
Best Mode for Carrying Out the Invention Hereinafter, the function and effect of the present invention will be described in more detail through specific examples of the present invention. It is to be understood, however, that these embodiments are merely illustrative of the invention and are not intended to limit the scope of the invention.
[[ 실시예Example 및 And 비교예Comparative Example : 수지 조성물, 드라이 필름 및 인쇄회로기판의 제조]: Manufacture of Resin Composition, Dry Film and Printed Circuit Board]
실시예1Example 1
산변성 올리고머의 이미노카보네이트계 화합물은 Lonza사의 비스페놀계 시아네이트 에스테르 화합물 BA-230의 시아네이트기를 아크릴산 및 1,2,3,6- 테트라하이드로 프탈산(4-Cyclohexene-1,2-dicarboxylic acid)과 1:1의 몰비로 반응시켜 산변성 올리고머인 이미노카보네이트 화합물을 제조하였다. The iminocarbonate compound of the acid-modified oligomer is composed of acrylic acid and 1,2,3,6-tetrahydrophthalic acid (4-Cyclohexene-1,2-dicarboxylic acid). And an iminocarbonate compound, which is an acid-modified oligomer, by reacting with a molar ratio of 1: 1.
이러한 이미노카보네이트계 화합물을 10중량% 사용하고, 추가적인 산변성 올리고머로서 일본화약의 ZAR-2000 25중량%, 광중합성 모노모로 SK사이텍의 DPHA 5중량%, 광개시제로 TPO 2중량%, 열경화성 바인더로 일본 화약의 YDCN-500-80P 15중량%, 열경화성 바인더 촉매로서 2-PI 0.4 중량%, 필러 BaSO4 23중량%, 안료인 프탈로시아닌블루 0.3중량%, 첨가제 BYK-110 0.3중량%, 용매 DMF 19중량%를 혼합하여 수지 조성물을 제조하였다. 10 wt% of this iminocarbonate compound is used, and as an additional acid-modifying oligomer, 25 wt% of ZAR-2000 of Nippon Gunpowder, 5 wt% of DPHA of SK Cytec, photopolymerizable monomoro, 2 wt% of TPO as a photoinitiator, and a thermosetting binder 15% by weight of Japanese powder YDCN-500-80P, 2-PI 0.4% by weight as thermosetting binder catalyst, 23% by weight of filler BaSO 4 , 0.3% by weight of phthalocyanine blue as pigment, 0.3% by weight of additive BYK-110, 19% by weight of solvent DMF The resin composition was prepared by mixing%.
상기 제조된 수지 조성물을 캐리어 필름으로서 PET에 도포한 후, 75℃의 오븐을 통과시켜 건조시킨 다음, 이형 필름으로서 PE를 적층함으로써, 아래로부터 캐리어 필름, 감광성 필름(두께 20㎛), 이형 필름으로 구성되는 드라이 필름을 제조하였다.The resin composition prepared above was applied to PET as a carrier film, and then dried by passing through an oven at 75 ° C., and then laminated with PE as a release film to form a carrier film, a photosensitive film (thickness 20 μm), and a release film from below. The dry film which consists of was manufactured.
제조된 드라이 필름의 커버 필름을 벗긴 후, 회로가 형성된 기판 위에 감광성 필름층을 진공 적층하고, 회로 패턴에 대응하는 포토 마스크를 감광성 필름층에 올려놓고 UV로 노광하였다. 노광은 365nm 파장대의 UV를 350mJ/cm2의 노광량으로 진행하였다. 이후, PET 필름을 제거하고, 31℃의 Nα2CO3 1 중량% 알칼리 용액으로 일정 시간 동안 현상하여 불필요한 부분을 제거하여 원하는 패턴으로 형성하였다. 이어서, 1000mJ/cm2의 노광량으로 광경화를 진행하고, 마지막으로 160 내지 170℃에서 1 시간 동안 가열 경화를 진행하여 감광성 필름으로부터 형성되는 보호필름(솔더 레지스트)를 포함하는 인쇄회로기판을 완성하였다.
After removing the cover film of the manufactured dry film, the photosensitive film layer was vacuum-laminated on the board | substrate with a circuit, the photomask corresponding to the circuit pattern was put on the photosensitive film layer, and it exposed by UV. Exposure progressed UV of 365 nm wavelength band by the exposure amount of 350mJ / cm <2> . Thereafter, the PET film was removed, and developed with a Na 2 CO 3 1 wt% alkaline solution at 31 ° C. for a predetermined time to remove unnecessary portions, thereby forming a desired pattern. Subsequently, photocuring was performed at an exposure amount of 1000 mJ / cm 2 , and finally heat curing was performed at 160 to 170 ° C. for 1 hour to complete a printed circuit board including a protective film (solder resist) formed from the photosensitive film. .
실시예Example 2 내지 3 2 to 3
이미노카보네이트계 화합물 5 중량%(실시예2) 또는 15중량%(실시예3)으로 사용하고, 상기 이미노카보네이트계 화합물의 함량 증감에 따라 용매의 함량을 증감시켜 사용한 점을 제외하고는 실시예1과 동일한 방법으로 드라이 필름 및 인쇄회로기판을 제조하였다.
5 wt% (Example 2) or 15 wt% (Example 3) of the imino carbonate-based compound, except that the solvent content is increased or decreased according to the increase or decrease of the content of the imino-carbonate-based compound. A dry film and a printed circuit board were manufactured in the same manner as in Example 1.
실시예Example 4 내지 6 4 to 6
광중합성 모노머로 SK사이텍의 DPHA 5중량% 대신에 일본 화약의 T-1420(실시예4), 일본 화약의 DPCA-60(실시예 5), 일본 화약의 R-684(실시예 6)을 각각 5중량% 사용한 점을 제외하고, 실시예1과 동일한 방법으로 드라이 필름 및 인쇄회로기판을 제조하였다.
As a photopolymerizable monomer, T-1420 (Example 4) from Japan Gunpowder, DPCA-60 (Example 5) from Japan Gunpowder, and R-684 (Example 6) from Japan Gunpowder were used instead of 5% by weight of DPHA from SK Cytec. A dry film and a printed circuit board were manufactured in the same manner as in Example 1, except that 5 wt% was used.
상기 실시예 1 내지 6의 수지 조성물의 구체적 조성은 하기 표 1에 정리된 바와 같다.Specific compositions of the resin compositions of Examples 1 to 6 are as summarized in Table 1 below.
ingredient
(또는 제품명)Ingredients
(Or product name)
1Example
One
2Example
2
3Example
3
4Example
4
5Example
5
6Example
6
비교예Comparative Example 1 내지 3 1 to 3
이미노카보네이트 화합물을 사용하지 않고, 일본 화약의 ZAR-2000(비교예1), CCR-1235(비교예2), ZFR-1122(비교예3)을 산변성 올리고머로서 각각 35중량%의 함량으로 사용한 점을 제외하고, 실시예1과 동일한 방법으로 드라이 필름 및 인쇄회로기판을 제조하였다. ZAR-2000 (Comparative Example 1), CCR-1235 (Comparative Example 2), and ZFR-1122 (Comparative Example 3) from Nippon Gunpowder were used as acid-modifying oligomers in an amount of 35% by weight without using an iminocarbonate compound. A dry film and a printed circuit board were manufactured in the same manner as in Example 1 except for the use.
비교예4Comparative Example 4
광중합성 모노머로 SK사이텍의 DPHA를 사용하지 않은 점을 제외하고는, 실시예1과 동일한 방법으로 드라이 필름 및 인쇄회로기판을 제조하였다. A dry film and a printed circuit board were manufactured in the same manner as in Example 1, except that DPHA of SK Cytec was not used as the photopolymerizable monomer.
비교예5Comparative Example 5
열경화성 바인더를 사용하지 않은 점을 제외하고, 실시예1과 동일한 방법으로 드라이 필름 및 인쇄회로기판을 제조하였다.
A dry film and a printed circuit board were manufactured in the same manner as in Example 1, except that no thermosetting binder was used.
상기 비교예 1 내지 5의 수지 조성물의 구체적 조성은 하기 표 2에 정리된 바와 같다.Specific compositions of the resin compositions of Comparative Examples 1 to 5 are as summarized in Table 2 below.
ingredient
(또는 제품명)Ingredients
(Or product name)
1Comparative Example
One
2Comparative Example
2
3Comparative Example
3
4Comparative Example
4
5Comparative Example
5
<< 시험예Test Example > >
실시예 및 비교예에서 제조한 드라이 필름 및 인쇄회로기판의 물성을 다음과 같은 방법으로 측정하였다:
The physical properties of the dry film and the printed circuit board prepared in Examples and Comparative Examples were measured by the following method:
시험예1Test Example 1 : : PCTPCT 내열성 및 Heat resistance and 무전해Electroless 니켈 도금 내성 Nickel plating resistance
동박 적층판 두께: 0.1mm, 동박의 두께: 12㎛인 엘지화학 사제 LG-T-500GA의 동박 적층판을 가로 X 세로 = 5cm X 5cm 크기로 잘라, 화학적 에칭으로 동박 표면에 미세 조도를 형성하였다. 실시예 및 비교예에서 제조된 드라이 필름의 이형 필름을 제거한 후, 조도가 형성된 동박 적층판(기판) 위에 상기 필름층을 진공 라미네이터(메이끼 세이사꾸쇼사 제조 MV LP-500)로 진공 적층한 다음, 365nm 파장대의 UV를 350mJ/cm2의 노광량으로 노광하였다. 이후, PET 필름을 제거하고, 31℃의 Nα2CO3 1 중량% 알칼리 용액으로 일정 시간 동안 현상하고, 약 1000mJ/cm2의 노광량으로 광경화를 진행하였다. 마지막으로 약 170℃에서 1 시간 동안 가열 경화를 진행하여 시편을 제작하였다.A copper clad laminate of LG-T-500GA manufactured by LG Chemical Co., Ltd., having a thickness of 0.1 mm and a thickness of copper foil of 12 mm, was cut to a size of 5 cm x 5 cm in width X and a micro-roughness was formed on the surface of the copper foil by chemical etching. After the release films of the dry films prepared in Examples and Comparative Examples were removed, the film layers were vacuum laminated with a vacuum laminator (MV LP-500, manufactured by Meiki Seisakusho Co., Ltd.) on the illuminated copper clad laminate , And UV at a wavelength of 365 nm was exposed at an exposure dose of 350 mJ / cm 2 . Then, remove the PET film, which was in progress the photocurable at a predetermined time, and the developing, exposure dose of about 1000mJ / cm 2 during the Nα2CO 3 1% by weight of the alkaline solution 31 ℃. Finally, the specimen was heated and cured at about 170 ° C for 1 hour.
이 시편을 PCT 장치(에스펙 주식회사, HAST 시스템 TPC-412MD)를 사용하여, 온도 121℃, 습도 100% 포화, 압력 2 atm의 조건으로 192 시간 동안 처리하고, 도막의 상태를 관찰하였다. 관찰 결과를 다음과 같은 기준으로 평가하였다: This specimen was treated for 192 hours under conditions of a temperature of 121 캜, a humidity of 100% saturation and a pressure of 2 atm using a PCT apparatus (Espec Co., Ltd., HAST system TPC-412MD). The observations were evaluated based on the following criteria:
1: DFSR의 박리가 없고, 수포 및 변색이 없음;1: No peeling of DFSR, no blisters and discoloration;
2: DFSR의 박리, 수포 또는 변색이 발생하나, 하기 3 보다는 심하지 않음;2: DFSR peeling, blistering or discoloration occurs, but not less severe than in Example 3;
3: DFSR의 박리, 수포 및 변색이 심하게 발생함.
3: DFSR peeling, blistering and discoloration occur severely.
다음으로, 무전해 니켈 도금 내성은 위 시편을 무전해 니켈 도금 용액 (풍원화학, ELN-M, ELN-A)으로 85℃의 온도에서 30분간 처리한 후, 도막의 상태를 관찰하여 다음과 같은 기준으로 평가하였다: Next, the electroless nickel plating resistance is treated with an electroless nickel plating solution (Pungwon Chemical, ELN-M, ELN-A) for 30 minutes at a temperature of 85 ℃, and then observed the state of the coating film as follows. Criteria evaluated:
1: DFSR의 백화 발생이 없음;1: No occurrence of whitening of DFSR;
2: DFSR의 백화가 일부 발생하나, 하기 3 보다는 심하지 않음;2: some whitening of the DFSR occurred but not less severe than the following 3;
3: DFSR의 백화가 심하게 발생함.
3: DFSR whitening occurs severely.
시험예2Test Example 2 : : TgTg 및 열팽창 계수 And thermal expansion coefficient
미쓰이 금속의 3EC-M3-VLP 12㎛ 동박의 Shiny면 위에, PCT 내열성 등의 측정 시편 준비시와 마찬가지로 필름층을 적층하였다. 폭 5mm, 간격 5mm의 스트라이프 패턴이 있는 네가티브 타입 마스크를 시편 위에 놓고 노광한 것을 제외하고는, 상기 PCT 내열성 등의 측정 시편 준비시와 동일한 방법으로 가열 경화까지를 진행하여 DFSR 시편을 제작하였다. 최종적으로, 상기 시편으로부터 동박을 박리함으로써 TMA (thermal mechanical analysis, METTLER TOLEDO, TMA/SDTA 840) 평가용 5mm 스트라이프 형태의 시편을 제작하였다. On the Shiny surface of 3EC-M3-VLP 12 micrometer copper foil of Mitsui Metals, the film layer was laminated | stacked similarly to the preparation of the measurement specimens, such as PCT heat resistance. DFSR specimens were prepared by proceeding to the heat curing in the same manner as in the preparation of the test specimens such as PCT heat resistance, except that a negative type mask having a width of 5 mm and a spacing of 5 mm was placed on the specimen and exposed. Finally, the copper foil was peeled from the specimen to prepare a 5 mm striped test piece for evaluation of TMA (thermal mechanical analysis, METTLER TOLEDO, TMA / SDTA 840).
유리 전이 온도(Tg)는 다음의 방법으로 측정하였다. 먼저, 시편을 홀더에 거치하여 길이가 10mm가 되도록 하였으며, 0.05N으로 양단에 힘을 가하며 50℃에서 250℃까지 승온 속도 10℃/min의 조건으로 시편이 늘어난 길이를 측정하였다. 승온 구간에서 보여지는 변곡점을 Tg로 하고, Tg를 다음의 방법으로 평가하였다: The glass transition temperature (Tg) was measured by the following method. First, the specimen was mounted on a holder to have a length of 10 mm, a force was applied to both ends with 0.05 N, and the length of the specimen was measured at a heating rate of 10 ° C./min from 50 ° C. to 250 ° C. The inflection point seen in the temperature increase section was Tg, and Tg was evaluated by the following method:
1: Tg 150℃ 이상;1: Tg 150 ° C. or higher;
2: Tg 140℃ 이상 150℃ 미만;2: Tg 140 degreeC or more and less than 150 degreeC;
3: Tg 120℃ 이상 140℃ 미만;3: Tg 120 degreeC or more and less than 140 degreeC;
4: Tg 100℃ 이상 120℃ 미만;4: Tg 100 degreeC or more and less than 120 degreeC;
5: Tg 100℃ 미만.
5: Tg less than 100 ° C.
그리고, 상기 Tg 측정에 의해 동시에 요구되는 열팽창 계수(CTE)를 동시에 측정 및 비교하였다. 먼저, Tg 보다 낮은 온도에서의 열팽창 계수 α1은 50℃에서 80℃까지 늘어난 시편의 기울기로 산출하였고, Tg 보다 높은 온도에서의 열팽창 계수 α2는 170℃에서 210℃까지 늘어난 시편의 기울기로 산출하였다. 이러한 산출 결과를 다음의 기준 하에 평가하였다: And the coefficient of thermal expansion (CTE) simultaneously required by the Tg measurement was measured and compared at the same time. First, the coefficient of thermal expansion α1 at a temperature lower than Tg was calculated as the slope of the specimen increased from 50 ° C. to 80 ° C., and the coefficient of thermal expansion α2 at the temperature higher than Tg was calculated as the slope of the specimen increased from 170 ° C. to 210 ° C. The results of these calculations were evaluated under the following criteria:
(열팽창계수 α1)(Coefficient of Thermal Expansion α1)
1: α1 20ppm 미만;1: less than α1 20 ppm;
2: α1 20ppm 이상 30 ppm 미만;2: α1 20 ppm or more but less than 30 ppm;
3: α1 30ppm 이상 50 ppm 미만;3: α1 30 ppm or more but less than 50 ppm;
4: α1 50 ppm 이상.
4: at least 50 ppm α1.
(열팽창계수 α2)(Coefficient of Thermal Expansion α2)
1: α2 100ppm 미만;1: less than α2 100 ppm;
2: α2 100ppm 이상 120 ppm 미만;2: α2 100 ppm or more but less than 120 ppm;
3: α2 120 ppm 이상 150ppm 미만; 3: 120 ppm or more but less than 150 ppm of (alpha) 2;
3: α2 150 ppm 이상 200ppm 미만; 3: α2 150 ppm or more but less than 200 ppm;
4: α2 200 ppm 이상.
4: at least 200 ppm of a2.
실험예3Experimental Example 3 : : 현상성Developability 평가 evaluation
미쓰이 금속의 3EC-M3-VLP 12㎛의 동박 적층판을 가로 X 세로 = 5cm X 5cm 크기로 잘라, 화학적 에칭으로 동박 표면에 미세 조도를 형성하였다. 상기 실시예 및 비교예에서 제조된 드라이 필름의 이형 필름을 제거한 후, 조도가 형성된 동박 적층판(기판) 위에 상기 필름층을 진공 라미네이터(메이끼 세이사꾸쇼사 제조 MV LP-500)로 진공 적층하였다. The 3EC-M3-VLP 12 micrometer copper foil laminated board of Mitsui Metals was cut into the horizontal X length = 5 cm X 5 cm size, and fine roughness was formed in the copper foil surface by chemical etching. After removing the release film of the dry film manufactured by the said Example and the comparative example, the said film layer was vacuum laminated on the copper foil laminated board (board | substrate) in which roughness was formed by the vacuum laminator (MV LP-500 by Meisei Seisakusho Co., Ltd.). .
그리고, 직경 80㎛의 홀 형상을 갖는 네가티브 타입의 포토 마스크를 밀착시키고, 365nm 파장대의 UV를 350mJ/cm2의 노광량으로 노광하였다. 이후, PET 필름을 제거하고, 31℃의 Nα2CO3 1 중량% 알칼리 용액으로 일정 시간 동안 현상하고 패턴을 형성하였다. And the negative type photo mask which has a hole shape of 80 micrometers in diameter was made to adhere, and UV of 365 nm wavelength band was exposed by the exposure amount of 350mJ / cm <2> . Thereafter, the PET film was removed, and developed with a Na 2 CO 3 1 wt% alkaline solution at 31 ° C. for a period of time to form a pattern.
그리고, 상기 형성된 패턴의 형상을 SEM으로 관찰하여, 다음의 기준 하에 평가하였다. The shape of the formed pattern was observed by SEM, and evaluated under the following criteria.
1: 단면이 straight 형상이며, 바닥에 필름 잔사가 남아 있지 않음1: cross section is straight, no film residue on the bottom
2: 단면이 straight형상이 아니며, 홀 형상 내에 under cut 또는 overhang 존재2: The cross section is not straight and there is an under cut or overhang in the hole shape
3: 미현상 상태로 관찰3: Observe Undeveloped
4: 과현상으로 패턴 형성 불가
4: pattern cannot be formed due to overdevelopment
상기 실험예 1 내지 3에서 측정 및 평가된 PCT 내열성, 무전해 니켈 도금 내성, Tg, 열팽창 계수, 및 현상성을 하기 표 3에 정리하여 나타내었다.
PCT heat resistance, electroless nickel plating resistance, Tg, coefficient of thermal expansion, and developability measured and evaluated in Experimental Examples 1 to 3 are summarized in Table 3 below.
1Example
One
2Example
2
3Example
3
4Example
4
5Example
5
6Example
6
1Comparative Example
One
2Comparative Example
2
3Comparative Example
3
4Comparative Example
4
5Comparative Example
5
상기 표 3의 측정 및 평가 결과에 나타난 바와 같이, 실시예의 DFSR은 현상성 뿐만 아니라, PCT 내열성, 유리 전이 온도 및 열팽창 계수 등의 제반 물성에 있어서, 비교예의 DFSR에 비해 우수한 물성을 나타냄이 확인되었다. 따라서, 실시예는 고온 내열 신뢰성을 나타내는 DFSR의 형성에 적합함이 확인되었다. As shown in the measurement and evaluation results of Table 3, it was confirmed that the DFSR of the example exhibited superior physical properties in comparison with the DFSR of the comparative example in not only developability but also various physical properties such as PCT heat resistance, glass transition temperature and thermal expansion coefficient. . Therefore, it is confirmed that the embodiment is suitable for the formation of DFSR showing high temperature thermal reliability.
Claims (21)
3개 이상의 광경화 가능한 불포화 작용기를 갖는 아크릴레이트계 화합물을 포함하는 광중합성 모노머;
열경화 가능한 작용기를 갖는 열경화성 바인더; 및
광개시제를 포함하는 광경화성 및 열경화성을 갖는 수지 조성물.
Acid-modified oligomers containing an carboxyl group (-COOH) and an iminocarbonate compound having a photocurable unsaturated functional group;
A photopolymerizable monomer comprising an acrylate compound having three or more photocurable unsaturated functional groups;
Thermosetting binders having thermosetting functional groups; And
Resin composition which has photocurability and thermosetting containing photoinitiator.
According to claim 1, wherein the imino carbonate-based compound having a photocurable and thermosetting is formed by reacting a cyanate ester compound with a dicarboxylic acid compound, a compound having a photocurable unsaturated functional group and a hydroxyl group or a carboxyl group Resin composition.
The dicarboxylic acid compound according to claim 2, wherein the dicarboxylic acid compound is oxalic acid, malonic acid, succinic acid, glutaric acid, adipic acid, phthalic acid, isophthalic acid, terephthalic acid, norbornene dicarboxylic acid, cyclohexene dicarboxylic acid. Photocurable comprising at least one compound selected from the group consisting of (Cyclohexene dicarboxylic acid), cyclohexane dicarboxylic acid, imidazole dicarboxylic acid, pyridine dicarboxylic acid and acid anhydrides thereof And a resin composition having thermosetting property.
According to claim 2, wherein the compound having a photocurable unsaturated functional group and a hydroxyl group or carboxyl group is acrylic acid, methacrylic acid, butenoic acid (hexenoic acid), cinnamic acid, allylphenol, hydroxy styrene, A resin composition having a photocurable and thermoset comprising at least one compound selected from the group consisting of hydroxycyclohexene or hydroxynaphthoquinone.
3. The resin composition according to claim 2, wherein the cyanate ester compound comprises a bisphenol or novolac compound having a cyanide group (-OCN).
The photocurable according to claim 2, wherein the dicarboxylic acid compound and the compound having a photocurable unsaturated functional group and a hydroxy group or a carboxyl group are used in a molar ratio of 2: 8 to 8: 2 to react with the cyanate ester compound. A resin composition having thermosetting properties.
[화학식 1]
상기 화학식 1에서, n은 1 내지 100의 정수이고, R1은 광경화 가능한 불포화 작용기 및 히드록시기 또는 카르복시기를 갖는 화합물에서 유래한 작용기이고, R2는 디카르복실산 화합물에서 유래한 작용기이다.
The resin composition of claim 2, wherein the acid-modified oligomer has a photocurable and thermosetting composition comprising an iminocarbonate-based compound of Formula 1 below:
[Formula 1]
In Formula 1, n is an integer of 1 to 100, R 1 is a functional group derived from a compound having a photocurable unsaturated functional group and a hydroxy group or a carboxy group, R 2 is a functional group derived from a dicarboxylic acid compound.
The resin composition of claim 1, wherein the acid-modified oligomer is included in an amount of 15 to 75% by weight based on the total weight of the resin composition.
The photopolymerizable monomer of claim 1, wherein the photopolymerizable monomer is a hydroxyl group-containing acrylate compound, a water-soluble acrylate compound, a polyester acrylate compound, a polyurethane acrylate compound, an epoxy acrylate compound, and a caprolactone modified acrylate compound. A photocurable and thermosetting resin composition comprising at least one compound selected from the group consisting of compounds.
The resin composition of claim 1, wherein the photopolymerizable monomer is included in an amount of 5 to 30 wt% based on the total weight of the resin composition.
The photoinitiator of claim 1, wherein the photoinitiator is selected from benzoin, alkyl ethers, acetophenones, anthraquinones, thioxanthones, ketals, benzophenones, α-aminoacetophenones, acylphosphine oxides, and the like. Resin composition which has photocurability and thermosetting containing 1 or more types chosen from the group which consists of oxime esters.
The resin composition of claim 1, wherein the photoinitiator is included in an amount of 0.5 to 20 wt% based on the total weight of the resin composition.
The resin composition of claim 1, wherein the thermosetting functional group is at least one selected from the group consisting of an epoxy group, an oxetanyl group, a cyclic ether group, and a cyclic thio ether group.
The resin composition of claim 1, wherein the thermosetting binder is contained in an amount of 0.8 to 2.0 equivalents based on 1 equivalent of the carboxyl group of the acid-modified oligomer.
A solvent according to claim 1; And at least one selected from the group consisting of a thermosetting binder catalyst, a filler, a pigment, and an additive.
3개 이상의 광경화 가능한 불포화 작용기를 갖는 광중합성 모노머; 및
열경화 가능한 작용기를 갖는 열경화성 바인더의 경화물을 포함하는 드라이 필름 솔더 레지스트.
Acid-modified oligomers containing an carboxyl group (-COOH) and an iminocarbonate compound having a photocurable unsaturated functional group;
Photopolymerizable monomers having three or more photocurable unsaturated functional groups; And
A dry film solder resist comprising a cured product of a thermosetting binder having a thermosetting functional group.
상기 이미노카보네이트계 화합물 및 광중합성 모노머의 불포화 작용기가 서로 가교 결합된 가교 구조; 및
상기 이미노카보네이트계 화합물에서 유래한 하기 화학식 2의 트리아진 가교 구조를 포함하는 드라이 필름 솔더 레지스트:
[화학식 2]
.
18. The method of claim 17, wherein the cured product comprises: a crosslinked structure in which the carboxyl group of the iminocarbonate-based compound and the thermosetting functional group are crosslinked;
A crosslinked structure in which the unsaturated functional groups of the iminocarbonate compound and the photopolymerizable monomer are crosslinked with each other; And
A dry film solder resist comprising a triazine crosslinked structure of Formula 2 derived from the iminocarbonate-based compound:
(2)
.
18. The dry film solder resist of claim 17, further comprising a photoinitiator dispersed in said cured product.
18. The dry film solder resist according to claim 17, having a glass transition temperature (Tg) of 120 to 200 ° C.
18. The dry film solder resist according to claim 17, which is used for the manufacture of a package substrate of a semiconductor device.
Priority Applications (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US14/379,720 US9389504B2 (en) | 2012-02-20 | 2013-02-20 | Photo-curable and thermo-curable resin composition, and dry film solder resist |
| CN201380009949.1A CN104302708B (en) | 2012-02-20 | 2013-02-20 | Photocuring and the resin combination of heat cure and dry film solder mask |
| JP2014544685A JP5977361B2 (en) | 2012-02-20 | 2013-02-20 | Photocurable and thermosetting resin composition and dry film solder resist |
| PCT/KR2013/001339 WO2013125854A1 (en) | 2012-02-20 | 2013-02-20 | Radiation curable and thermosettable resin composition, and dry film solder resist |
| TW102105811A TWI489206B (en) | 2012-02-20 | 2013-02-20 | Photo-curable and thermo-curable resin composition, and dry film solder resist |
| US14/245,184 US9134609B2 (en) | 2012-02-20 | 2014-04-04 | Photo-curable and thermo-curable resin compostion, and dry film solder resist |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020120017125 | 2012-02-20 | ||
| KR20120017125 | 2012-02-20 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20130095683A KR20130095683A (en) | 2013-08-28 |
| KR101331573B1 true KR101331573B1 (en) | 2013-11-20 |
Family
ID=49218929
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020130017683A KR101331573B1 (en) | 2012-02-20 | 2013-02-19 | Photo-curable and thermo-curable resin composition and dry film solder resist |
Country Status (1)
| Country | Link |
|---|---|
| KR (1) | KR101331573B1 (en) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101734425B1 (en) * | 2013-09-24 | 2017-05-11 | 주식회사 엘지화학 | Preparation method for dry film solder resist and film laminate used therein |
| CN117431030B (en) * | 2023-11-15 | 2024-08-23 | 深圳市领航环宇科技有限公司 | Metallographic phase efficient mosaic glue and preparation process thereof |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001163972A (en) | 1999-12-03 | 2001-06-19 | Sumitomo Chem Co Ltd | Production method for cyanate prepolymer |
| JP3964326B2 (en) | 2000-09-20 | 2007-08-22 | 太陽インキ製造株式会社 | Carboxyl group-containing photosensitive resin, alkali-developable photocurable / thermosetting composition containing the same, and cured product thereof |
| JP2010260902A (en) | 2009-04-30 | 2010-11-18 | Pi R & D Co Ltd | Photosensitive modified polyimide resin composition and use thereof |
| KR20110106237A (en) * | 2010-03-22 | 2011-09-28 | 주식회사 엘지화학 | Photo-curable and thermo-curable resin composition, and dry film solder resist |
-
2013
- 2013-02-19 KR KR1020130017683A patent/KR101331573B1/en active IP Right Grant
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001163972A (en) | 1999-12-03 | 2001-06-19 | Sumitomo Chem Co Ltd | Production method for cyanate prepolymer |
| JP3964326B2 (en) | 2000-09-20 | 2007-08-22 | 太陽インキ製造株式会社 | Carboxyl group-containing photosensitive resin, alkali-developable photocurable / thermosetting composition containing the same, and cured product thereof |
| JP2010260902A (en) | 2009-04-30 | 2010-11-18 | Pi R & D Co Ltd | Photosensitive modified polyimide resin composition and use thereof |
| KR20110106237A (en) * | 2010-03-22 | 2011-09-28 | 주식회사 엘지화학 | Photo-curable and thermo-curable resin composition, and dry film solder resist |
Also Published As
| Publication number | Publication date |
|---|---|
| KR20130095683A (en) | 2013-08-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101361753B1 (en) | Photo-curable and thermo-curable resin composition, and dry film solder resist | |
| JP6047666B2 (en) | Method for producing dry film solder resist and film laminate used therefor | |
| KR101256553B1 (en) | Photo-sensitive resin composition, dry film solder resist, and circuit board | |
| JP6162775B2 (en) | Photocurable and thermosetting resin composition and dry film solder resist | |
| KR101799094B1 (en) | Photo-curable and thermo-curable resin composition and dry film solder resist | |
| JP5977361B2 (en) | Photocurable and thermosetting resin composition and dry film solder resist | |
| JP6702617B2 (en) | Photocurable and thermosetting resin composition and dry film solder resist | |
| KR101545724B1 (en) | Photo-curable and thermo-curable resin composition, and dry film solder resist | |
| KR101360968B1 (en) | Photo-curable and thermo-curable resin composition, and dry film solder resist | |
| KR101648555B1 (en) | Photo-curable and thermo-curable resin composition and dry film solder resist | |
| KR101331573B1 (en) | Photo-curable and thermo-curable resin composition and dry film solder resist | |
| KR101296851B1 (en) | Photo-curable and thermo-curable resin composition, and dry film solder resist | |
| KR101755018B1 (en) | Photo-curable and thermo-curable resin composition and dry film solder resist | |
| KR20140023717A (en) | Photo-curable and thermo-curable resin composition and dry film type solder resist manufactured using the same | |
| WO2014021590A1 (en) | Resin composition having photocurable property and thermosetting property, and dry film solder resist | |
| KR101785706B1 (en) | Photo-curable and thermo-curable resin composition, and dry film solder resist | |
| WO2013125854A1 (en) | Radiation curable and thermosettable resin composition, and dry film solder resist | |
| KR101629942B1 (en) | Thermo-curable resin composition, and dry film solder resist | |
| KR101799092B1 (en) | Photo-curable and thermo-curable resin composition and dry film solder resist | |
| KR20150122538A (en) | Photo-curable and thermo-curable resin composition, and dry film solder resist |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| A302 | Request for accelerated examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20160928 Year of fee payment: 4 |
|
| FPAY | Annual fee payment |
Payment date: 20170919 Year of fee payment: 5 |
|
| FPAY | Annual fee payment |
Payment date: 20181016 Year of fee payment: 6 |