JP7413999B2 - 抗体に対する親和性物質、切断性部分および反応性基を有する化合物またはその塩 - Google Patents
抗体に対する親和性物質、切断性部分および反応性基を有する化合物またはその塩 Download PDFInfo
- Publication number
- JP7413999B2 JP7413999B2 JP2020525702A JP2020525702A JP7413999B2 JP 7413999 B2 JP7413999 B2 JP 7413999B2 JP 2020525702 A JP2020525702 A JP 2020525702A JP 2020525702 A JP2020525702 A JP 2020525702A JP 7413999 B2 JP7413999 B2 JP 7413999B2
- Authority
- JP
- Japan
- Prior art keywords
- residue
- seq
- residues
- group
- antibody
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 150000003839 salts Chemical class 0.000 title claims description 307
- 150000001875 compounds Chemical class 0.000 title claims description 124
- 239000000126 substance Substances 0.000 claims description 509
- 125000000524 functional group Chemical group 0.000 claims description 390
- 125000000539 amino acid group Chemical group 0.000 claims description 186
- 238000006243 chemical reaction Methods 0.000 claims description 171
- 230000004048 modification Effects 0.000 claims description 143
- 238000012986 modification Methods 0.000 claims description 143
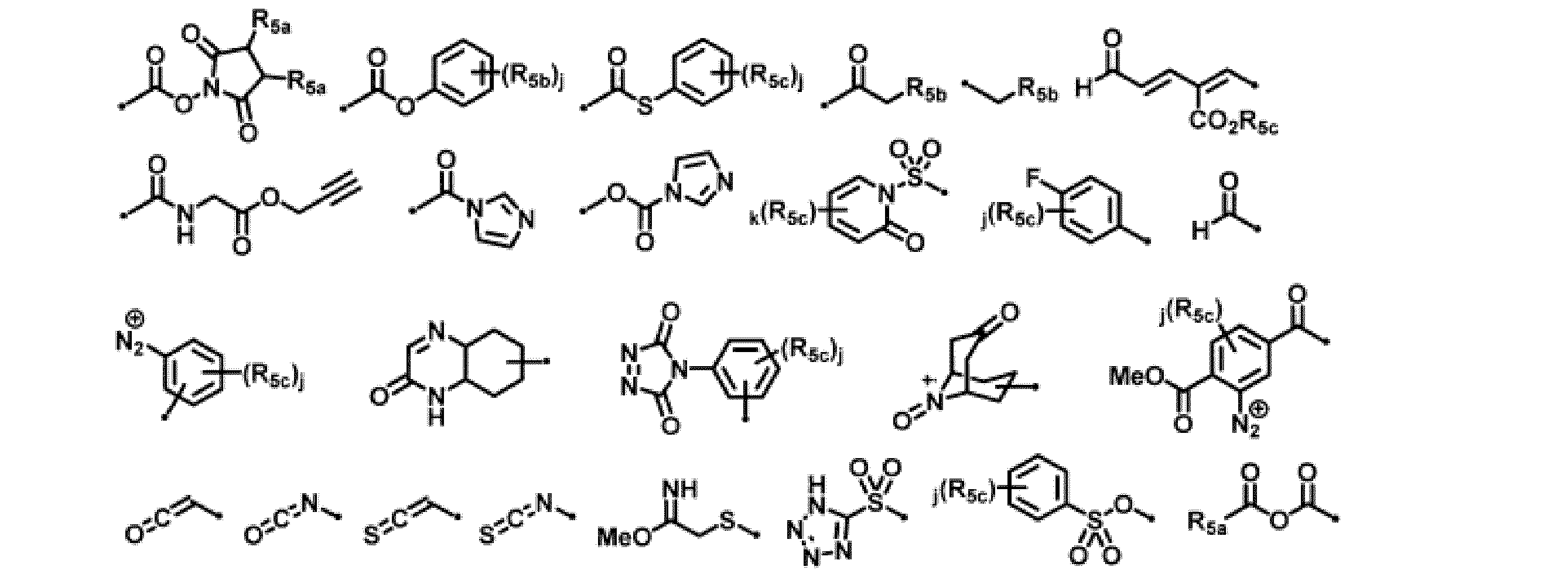
- -1 aconityl residues Chemical group 0.000 claims description 127
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 114
- 108090000623 proteins and genes Proteins 0.000 claims description 100
- 238000003776 cleavage reaction Methods 0.000 claims description 99
- 102000004169 proteins and genes Human genes 0.000 claims description 99
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 claims description 97
- 230000007017 scission Effects 0.000 claims description 97
- 235000018102 proteins Nutrition 0.000 claims description 94
- 230000036961 partial effect Effects 0.000 claims description 93
- 125000001424 substituent group Chemical group 0.000 claims description 91
- 125000004429 atom Chemical group 0.000 claims description 84
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 76
- 238000004519 manufacturing process Methods 0.000 claims description 62
- COLNVLDHVKWLRT-QMMMGPOBSA-N phenylalanine group Chemical group N[C@@H](CC1=CC=CC=C1)C(=O)O COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 claims description 61
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical group NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 claims description 60
- 125000003630 glycyl group Chemical group [H]N([H])C([H])([H])C(*)=O 0.000 claims description 58
- 150000001413 amino acids Chemical group 0.000 claims description 54
- 125000000487 histidyl group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C([H])=N1 0.000 claims description 50
- 238000000034 method Methods 0.000 claims description 46
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 claims description 45
- 239000004471 Glycine Substances 0.000 claims description 43
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 claims description 41
- 125000000430 tryptophan group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C2=C([H])C([H])=C([H])C([H])=C12 0.000 claims description 40
- 125000000613 asparagine group Chemical group N[C@@H](CC(N)=O)C(=O)* 0.000 claims description 36
- CKLJMWTZIZZHCS-REOHCLBHSA-N aspartic acid group Chemical group N[C@@H](CC(=O)O)C(=O)O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 claims description 35
- 125000000291 glutamic acid group Chemical group N[C@@H](CCC(O)=O)C(=O)* 0.000 claims description 33
- 150000003573 thiols Chemical group 0.000 claims description 33
- 230000027455 binding Effects 0.000 claims description 31
- 125000000623 heterocyclic group Chemical group 0.000 claims description 28
- 125000003118 aryl group Chemical group 0.000 claims description 27
- 150000002148 esters Chemical group 0.000 claims description 25
- 125000002228 disulfide group Chemical group 0.000 claims description 24
- 125000006575 electron-withdrawing group Chemical group 0.000 claims description 24
- 125000001500 prolyl group Chemical group [H]N1C([H])(C(=O)[*])C([H])([H])C([H])([H])C1([H])[H] 0.000 claims description 23
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 22
- 125000001909 leucine group Chemical group [H]N(*)C(C(*)=O)C([H])([H])C(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 22
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 claims description 21
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 claims description 21
- 125000000404 glutamine group Chemical group N[C@@H](CCC(N)=O)C(=O)* 0.000 claims description 21
- 125000002987 valine group Chemical group [H]N([H])C([H])(C(*)=O)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 21
- 239000003153 chemical reaction reagent Substances 0.000 claims description 20
- 125000003748 selenium group Chemical group *[Se]* 0.000 claims description 19
- 238000011282 treatment Methods 0.000 claims description 19
- 239000004473 Threonine Substances 0.000 claims description 18
- 229960002898 threonine Drugs 0.000 claims description 18
- 125000000341 threoninyl group Chemical group [H]OC([H])(C([H])([H])[H])C([H])(N([H])[H])C(*)=O 0.000 claims description 18
- 229960004441 tyrosine Drugs 0.000 claims description 18
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 claims description 17
- ZYGHJZDHTFUPRJ-UHFFFAOYSA-N coumarin Chemical compound C1=CC=C2OC(=O)C=CC2=C1 ZYGHJZDHTFUPRJ-UHFFFAOYSA-N 0.000 claims description 16
- 125000005843 halogen group Chemical group 0.000 claims description 14
- BLRPTPMANUNPDV-UHFFFAOYSA-N Silane Chemical group [SiH4] BLRPTPMANUNPDV-UHFFFAOYSA-N 0.000 claims description 13
- 230000002378 acidificating effect Effects 0.000 claims description 13
- 239000004475 Arginine Substances 0.000 claims description 12
- 239000000427 antigen Substances 0.000 claims description 12
- 108091007433 antigens Proteins 0.000 claims description 12
- 102000036639 antigens Human genes 0.000 claims description 12
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 claims description 12
- 235000009697 arginine Nutrition 0.000 claims description 12
- 229960003121 arginine Drugs 0.000 claims description 12
- 125000005620 boronic acid group Chemical group 0.000 claims description 12
- 150000002009 diols Chemical group 0.000 claims description 12
- 150000002466 imines Chemical group 0.000 claims description 12
- 150000001345 alkine derivatives Chemical group 0.000 claims description 11
- 125000004183 alkoxy alkyl group Chemical group 0.000 claims description 11
- IVRMZWNICZWHMI-UHFFFAOYSA-N azide group Chemical group [N-]=[N+]=[N-] IVRMZWNICZWHMI-UHFFFAOYSA-N 0.000 claims description 11
- OAKJQQAXSVQMHS-UHFFFAOYSA-N hydrazine group Chemical group NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 claims description 11
- AVXURJPOCDRRFD-UHFFFAOYSA-N hydroxylamine group Chemical group NO AVXURJPOCDRRFD-UHFFFAOYSA-N 0.000 claims description 11
- 125000005439 maleimidyl group Chemical group C1(C=CC(N1*)=O)=O 0.000 claims description 11
- 150000003457 sulfones Chemical class 0.000 claims description 11
- 125000000741 isoleucyl group Chemical group [H]N([H])C(C(C([H])([H])[H])C([H])([H])C([H])([H])[H])C(=O)O* 0.000 claims description 10
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 claims description 10
- UYHQUNLVWOAJQW-UHFFFAOYSA-N 1,3-benzothiazole-2-carbonitrile Chemical group C1=CC=C2SC(C#N)=NC2=C1 UYHQUNLVWOAJQW-UHFFFAOYSA-N 0.000 claims description 9
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 claims description 9
- DPOPAJRDYZGTIR-UHFFFAOYSA-N Tetrazine Chemical group C1=CN=NN=N1 DPOPAJRDYZGTIR-UHFFFAOYSA-N 0.000 claims description 9
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 claims description 9
- 125000003147 glycosyl group Chemical group 0.000 claims description 9
- SQDFHQJTAWCFIB-UHFFFAOYSA-N n-methylidenehydroxylamine Chemical group ON=C SQDFHQJTAWCFIB-UHFFFAOYSA-N 0.000 claims description 9
- 150000002825 nitriles Chemical group 0.000 claims description 9
- XYFCBTPGUUZFHI-UHFFFAOYSA-N phosphine group Chemical group P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 claims description 9
- 125000002221 trityl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C([*])(C1=C(C(=C(C(=C1[H])[H])[H])[H])[H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 claims description 9
- 235000001671 coumarin Nutrition 0.000 claims description 8
- 229960000956 coumarin Drugs 0.000 claims description 8
- 150000007857 hydrazones Chemical class 0.000 claims description 8
- PTMHPRAIXMAOOB-UHFFFAOYSA-N phosphoramidic acid Chemical group NP(O)(O)=O PTMHPRAIXMAOOB-UHFFFAOYSA-N 0.000 claims description 8
- 102000004190 Enzymes Human genes 0.000 claims description 7
- 108090000790 Enzymes Proteins 0.000 claims description 7
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 7
- 150000007970 thio esters Chemical group 0.000 claims description 7
- 239000003638 chemical reducing agent Substances 0.000 claims description 6
- 239000007800 oxidant agent Substances 0.000 claims description 6
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 5
- 230000001747 exhibiting effect Effects 0.000 claims description 5
- XFXPMWWXUTWYJX-UHFFFAOYSA-N isonitrile group Chemical group N#[C-] XFXPMWWXUTWYJX-UHFFFAOYSA-N 0.000 claims description 5
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 claims description 4
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 4
- 125000000542 sulfonic acid group Chemical group 0.000 claims description 4
- 239000012954 diazonium Substances 0.000 claims description 2
- AFOSIXZFDONLBT-UHFFFAOYSA-N divinyl sulfone Chemical class C=CS(=O)(=O)C=C AFOSIXZFDONLBT-UHFFFAOYSA-N 0.000 claims description 2
- IQPQWNKOIGAROB-UHFFFAOYSA-N isocyanate group Chemical class [N-]=C=O IQPQWNKOIGAROB-UHFFFAOYSA-N 0.000 claims description 2
- ZBKFYXZXZJPWNQ-UHFFFAOYSA-N isothiocyanate group Chemical class [N-]=C=S ZBKFYXZXZJPWNQ-UHFFFAOYSA-N 0.000 claims description 2
- 125000000468 ketone group Chemical group 0.000 claims description 2
- QAOWNCQODCNURD-UHFFFAOYSA-L sulfate group Chemical group S(=O)(=O)([O-])[O-] QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 claims description 2
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical class ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 claims description 2
- 125000001183 hydrocarbyl group Chemical group 0.000 claims 3
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 claims 2
- 125000002009 alkene group Chemical group 0.000 claims 1
- 230000002358 autolytic effect Effects 0.000 claims 1
- 229960000575 trastuzumab Drugs 0.000 description 137
- 238000004458 analytical method Methods 0.000 description 123
- 125000004432 carbon atom Chemical group C* 0.000 description 123
- 238000010586 diagram Methods 0.000 description 114
- 238000004704 ultra performance liquid chromatography Methods 0.000 description 93
- 238000001514 detection method Methods 0.000 description 92
- 125000005647 linker group Chemical group 0.000 description 91
- 125000003275 alpha amino acid group Chemical group 0.000 description 65
- 239000000047 product Substances 0.000 description 57
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 42
- 229940024606 amino acid Drugs 0.000 description 41
- 235000001014 amino acid Nutrition 0.000 description 41
- 239000003814 drug Substances 0.000 description 39
- 229940079593 drug Drugs 0.000 description 35
- 150000002430 hydrocarbons Chemical group 0.000 description 35
- 125000000217 alkyl group Chemical group 0.000 description 34
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 32
- 125000006615 aromatic heterocyclic group Chemical group 0.000 description 30
- 239000000243 solution Substances 0.000 description 28
- 238000012790 confirmation Methods 0.000 description 27
- 238000001269 time-of-flight mass spectrometry Methods 0.000 description 24
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 23
- 229940049595 antibody-drug conjugate Drugs 0.000 description 23
- 239000004472 Lysine Substances 0.000 description 22
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 21
- 235000018977 lysine Nutrition 0.000 description 21
- 229910052727 yttrium Inorganic materials 0.000 description 21
- 238000001228 spectrum Methods 0.000 description 20
- 239000007864 aqueous solution Substances 0.000 description 18
- 239000000872 buffer Substances 0.000 description 18
- 229910052799 carbon Inorganic materials 0.000 description 18
- 125000002947 alkylene group Chemical group 0.000 description 17
- 239000000611 antibody drug conjugate Substances 0.000 description 17
- 239000002994 raw material Substances 0.000 description 17
- 229910052757 nitrogen Inorganic materials 0.000 description 16
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 15
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical group C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 15
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 15
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 14
- 125000003545 alkoxy group Chemical group 0.000 description 14
- 238000004587 chromatography analysis Methods 0.000 description 14
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 14
- 125000004433 nitrogen atom Chemical group N* 0.000 description 14
- 125000000753 cycloalkyl group Chemical group 0.000 description 13
- 201000010099 disease Diseases 0.000 description 13
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 13
- 238000004949 mass spectrometry Methods 0.000 description 13
- 229960004799 tryptophan Drugs 0.000 description 13
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 13
- 235000002374 tyrosine Nutrition 0.000 description 13
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 12
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 12
- 108010033276 Peptide Fragments Proteins 0.000 description 12
- 102000007079 Peptide Fragments Human genes 0.000 description 12
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 12
- 229960003767 alanine Drugs 0.000 description 12
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 12
- PGLTVOMIXTUURA-UHFFFAOYSA-N iodoacetamide Chemical compound NC(=O)CI PGLTVOMIXTUURA-UHFFFAOYSA-N 0.000 description 12
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical group NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 11
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 11
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 11
- 235000004279 alanine Nutrition 0.000 description 11
- 125000004450 alkenylene group Chemical group 0.000 description 11
- 125000004419 alkynylene group Chemical group 0.000 description 11
- 125000000732 arylene group Chemical group 0.000 description 11
- 229960003136 leucine Drugs 0.000 description 11
- 125000004430 oxygen atom Chemical group O* 0.000 description 11
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 11
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 10
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 10
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 10
- 150000001299 aldehydes Chemical group 0.000 description 10
- 235000018417 cysteine Nutrition 0.000 description 10
- 229960002989 glutamic acid Drugs 0.000 description 10
- 229960002885 histidine Drugs 0.000 description 10
- 238000004191 hydrophobic interaction chromatography Methods 0.000 description 10
- 150000002500 ions Chemical class 0.000 description 10
- 150000002576 ketones Chemical group 0.000 description 10
- 229960004452 methionine Drugs 0.000 description 10
- 238000006467 substitution reaction Methods 0.000 description 10
- 235000000346 sugar Nutrition 0.000 description 10
- 229910052717 sulfur Inorganic materials 0.000 description 10
- 229910052720 vanadium Inorganic materials 0.000 description 10
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 9
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 9
- 108010026552 Proteome Proteins 0.000 description 9
- 108090000631 Trypsin Proteins 0.000 description 9
- 102000004142 Trypsin Human genes 0.000 description 9
- 125000003277 amino group Chemical group 0.000 description 9
- 229960005261 aspartic acid Drugs 0.000 description 9
- 229960002433 cysteine Drugs 0.000 description 9
- 235000013922 glutamic acid Nutrition 0.000 description 9
- 239000004220 glutamic acid Substances 0.000 description 9
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 9
- 235000014304 histidine Nutrition 0.000 description 9
- 229960000310 isoleucine Drugs 0.000 description 9
- 229930182817 methionine Natural products 0.000 description 9
- 125000004434 sulfur atom Chemical group 0.000 description 9
- 239000012588 trypsin Substances 0.000 description 9
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 8
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 8
- 239000004365 Protease Substances 0.000 description 8
- 150000001336 alkenes Chemical group 0.000 description 8
- 235000003704 aspartic acid Nutrition 0.000 description 8
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 8
- 238000001360 collision-induced dissociation Methods 0.000 description 8
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 8
- 230000029087 digestion Effects 0.000 description 8
- 238000004128 high performance liquid chromatography Methods 0.000 description 8
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 8
- 229960003646 lysine Drugs 0.000 description 8
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 8
- 239000000203 mixture Substances 0.000 description 8
- 229960005190 phenylalanine Drugs 0.000 description 8
- 102000004196 processed proteins & peptides Human genes 0.000 description 8
- 230000009257 reactivity Effects 0.000 description 8
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 7
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 7
- 102000035195 Peptidases Human genes 0.000 description 7
- 108091005804 Peptidases Proteins 0.000 description 7
- 150000001241 acetals Chemical group 0.000 description 7
- 125000003342 alkenyl group Chemical group 0.000 description 7
- 125000000304 alkynyl group Chemical group 0.000 description 7
- 125000005597 hydrazone group Chemical group 0.000 description 7
- 229930195733 hydrocarbon Natural products 0.000 description 7
- 239000012071 phase Substances 0.000 description 7
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 7
- 230000002285 radioactive effect Effects 0.000 description 7
- 230000002829 reductive effect Effects 0.000 description 7
- 229960001153 serine Drugs 0.000 description 7
- 229960004295 valine Drugs 0.000 description 7
- 244000099147 Ananas comosus Species 0.000 description 6
- 235000007119 Ananas comosus Nutrition 0.000 description 6
- 239000004215 Carbon black (E152) Substances 0.000 description 6
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 6
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 6
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 6
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 6
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 6
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 6
- 239000002246 antineoplastic agent Substances 0.000 description 6
- 229960001230 asparagine Drugs 0.000 description 6
- 150000001540 azides Chemical class 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 239000000470 constituent Substances 0.000 description 6
- 238000013270 controlled release Methods 0.000 description 6
- 125000004122 cyclic group Chemical group 0.000 description 6
- 125000000392 cycloalkenyl group Chemical group 0.000 description 6
- 125000002993 cycloalkylene group Chemical group 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- 238000001962 electrophoresis Methods 0.000 description 6
- 229940088598 enzyme Drugs 0.000 description 6
- 239000007850 fluorescent dye Substances 0.000 description 6
- 229910052731 fluorine Inorganic materials 0.000 description 6
- 229960002429 proline Drugs 0.000 description 6
- 238000010405 reoxidation reaction Methods 0.000 description 6
- 239000000523 sample Substances 0.000 description 6
- QAOWNCQODCNURD-UHFFFAOYSA-N sulfuric acid group Chemical group S(O)(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 6
- 238000003786 synthesis reaction Methods 0.000 description 6
- 239000004474 valine Substances 0.000 description 6
- WJQDJDVDXAAXSB-UHFFFAOYSA-N 5-sulfanylidenepyrrolidin-2-one Chemical group O=C1CCC(=S)N1 WJQDJDVDXAAXSB-UHFFFAOYSA-N 0.000 description 5
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 5
- 102100025475 Carcinoembryonic antigen-related cell adhesion molecule 5 Human genes 0.000 description 5
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 5
- 108010051815 Glutamyl endopeptidase Proteins 0.000 description 5
- 101000914324 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 5 Proteins 0.000 description 5
- 108050003558 Interleukin-17 Proteins 0.000 description 5
- 102000013691 Interleukin-17 Human genes 0.000 description 5
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 5
- 241000700605 Viruses Species 0.000 description 5
- 235000011054 acetic acid Nutrition 0.000 description 5
- 229960002964 adalimumab Drugs 0.000 description 5
- 125000002102 aryl alkyloxo group Chemical group 0.000 description 5
- 235000009582 asparagine Nutrition 0.000 description 5
- 210000004899 c-terminal region Anatomy 0.000 description 5
- 238000004440 column chromatography Methods 0.000 description 5
- 125000000000 cycloalkoxy group Chemical group 0.000 description 5
- 229960001251 denosumab Drugs 0.000 description 5
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 5
- 150000002367 halogens Chemical group 0.000 description 5
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 5
- 238000004255 ion exchange chromatography Methods 0.000 description 5
- 238000002372 labelling Methods 0.000 description 5
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 5
- 238000001294 liquid chromatography-tandem mass spectrometry Methods 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- 239000011259 mixed solution Substances 0.000 description 5
- 230000035772 mutation Effects 0.000 description 5
- 230000007935 neutral effect Effects 0.000 description 5
- 238000012856 packing Methods 0.000 description 5
- 239000008194 pharmaceutical composition Substances 0.000 description 5
- 238000004007 reversed phase HPLC Methods 0.000 description 5
- 230000028327 secretion Effects 0.000 description 5
- 239000000741 silica gel Substances 0.000 description 5
- 229910002027 silica gel Inorganic materials 0.000 description 5
- 150000003384 small molecules Chemical class 0.000 description 5
- 238000003756 stirring Methods 0.000 description 5
- 125000001425 triazolyl group Chemical group 0.000 description 5
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 4
- 102100034608 Angiopoietin-2 Human genes 0.000 description 4
- 102100037241 Endoglin Human genes 0.000 description 4
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 4
- 206010028980 Neoplasm Diseases 0.000 description 4
- 125000002723 alicyclic group Chemical group 0.000 description 4
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 description 4
- 239000002585 base Substances 0.000 description 4
- 229910052796 boron Inorganic materials 0.000 description 4
- 201000011510 cancer Diseases 0.000 description 4
- 235000015165 citric acid Nutrition 0.000 description 4
- 230000021615 conjugation Effects 0.000 description 4
- 239000003431 cross linking reagent Substances 0.000 description 4
- 238000005520 cutting process Methods 0.000 description 4
- 238000000354 decomposition reaction Methods 0.000 description 4
- 238000004925 denaturation Methods 0.000 description 4
- 230000036425 denaturation Effects 0.000 description 4
- 238000001212 derivatisation Methods 0.000 description 4
- 229950003468 dupilumab Drugs 0.000 description 4
- 238000001215 fluorescent labelling Methods 0.000 description 4
- 235000019253 formic acid Nutrition 0.000 description 4
- 229960002743 glutamine Drugs 0.000 description 4
- 125000005842 heteroatom Chemical group 0.000 description 4
- 239000000543 intermediate Substances 0.000 description 4
- 150000002527 isonitriles Chemical class 0.000 description 4
- 239000003446 ligand Substances 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- 239000000863 peptide conjugate Substances 0.000 description 4
- 238000012510 peptide mapping method Methods 0.000 description 4
- 235000011007 phosphoric acid Nutrition 0.000 description 4
- 125000004437 phosphorous atom Chemical group 0.000 description 4
- 125000006239 protecting group Chemical group 0.000 description 4
- 238000000746 purification Methods 0.000 description 4
- 102000005962 receptors Human genes 0.000 description 4
- 108020003175 receptors Proteins 0.000 description 4
- 239000003381 stabilizer Substances 0.000 description 4
- 229910052721 tungsten Inorganic materials 0.000 description 4
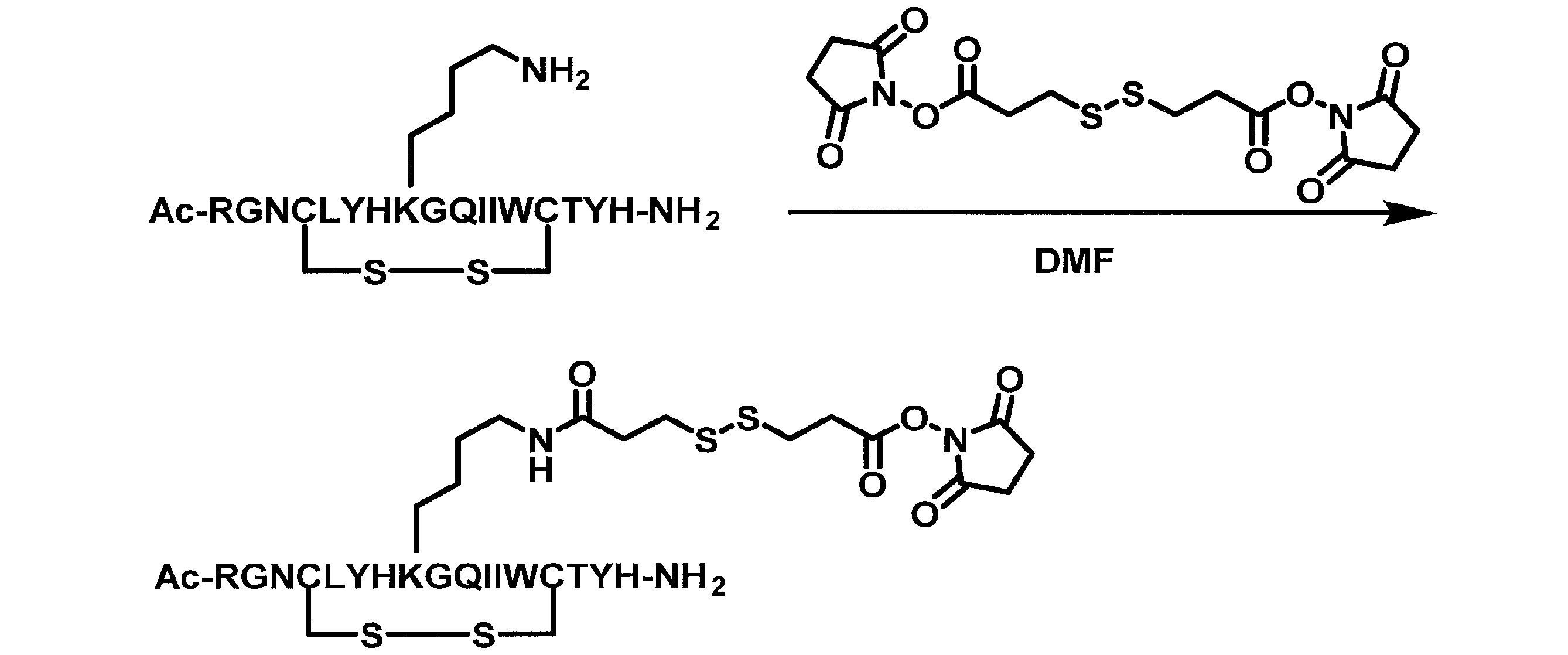
- FXYPGCIGRDZWNR-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-[[3-(2,5-dioxopyrrolidin-1-yl)oxy-3-oxopropyl]disulfanyl]propanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCSSCCC(=O)ON1C(=O)CCC1=O FXYPGCIGRDZWNR-UHFFFAOYSA-N 0.000 description 3
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 3
- 125000002373 5 membered heterocyclic group Chemical group 0.000 description 3
- 125000004070 6 membered heterocyclic group Chemical group 0.000 description 3
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 3
- 108010090849 Amyloid beta-Peptides Proteins 0.000 description 3
- 102000013455 Amyloid beta-Peptides Human genes 0.000 description 3
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 3
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 3
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 3
- 101150013553 CD40 gene Proteins 0.000 description 3
- 102100033553 Delta-like protein 4 Human genes 0.000 description 3
- 108010036395 Endoglin Proteins 0.000 description 3
- 102100023600 Fibroblast growth factor receptor 2 Human genes 0.000 description 3
- 101710182389 Fibroblast growth factor receptor 2 Proteins 0.000 description 3
- 101000924533 Homo sapiens Angiopoietin-2 Proteins 0.000 description 3
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 3
- 101000914321 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 7 Proteins 0.000 description 3
- 101000872077 Homo sapiens Delta-like protein 4 Proteins 0.000 description 3
- 101000777628 Homo sapiens Leukocyte antigen CD37 Proteins 0.000 description 3
- 101000617725 Homo sapiens Pregnancy-specific beta-1-glycoprotein 2 Proteins 0.000 description 3
- 101000801234 Homo sapiens Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 description 3
- 102100031586 Leukocyte antigen CD37 Human genes 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical group ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical group C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 229920002472 Starch Polymers 0.000 description 3
- 102100031294 Thymic stromal lymphopoietin Human genes 0.000 description 3
- 102100033728 Tumor necrosis factor receptor superfamily member 18 Human genes 0.000 description 3
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 3
- 239000004480 active ingredient Substances 0.000 description 3
- 125000002252 acyl group Chemical group 0.000 description 3
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 3
- 150000001408 amides Chemical class 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 230000033228 biological regulation Effects 0.000 description 3
- 239000007853 buffer solution Substances 0.000 description 3
- JRZBPELLUMBLQU-UHFFFAOYSA-N carbonazidic acid Chemical compound OC(=O)N=[N+]=[N-] JRZBPELLUMBLQU-UHFFFAOYSA-N 0.000 description 3
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 3
- 125000005724 cycloalkenylene group Chemical group 0.000 description 3
- 238000013480 data collection Methods 0.000 description 3
- UAOMVDZJSHZZME-UHFFFAOYSA-N diisopropylamine Chemical compound CC(C)NC(C)C UAOMVDZJSHZZME-UHFFFAOYSA-N 0.000 description 3
- 238000010828 elution Methods 0.000 description 3
- 238000001641 gel filtration chromatography Methods 0.000 description 3
- 230000014509 gene expression Effects 0.000 description 3
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 3
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 3
- 230000005847 immunogenicity Effects 0.000 description 3
- 125000001041 indolyl group Chemical group 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 150000002632 lipids Chemical class 0.000 description 3
- 230000014759 maintenance of location Effects 0.000 description 3
- 239000011159 matrix material Substances 0.000 description 3
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 3
- 230000003278 mimic effect Effects 0.000 description 3
- 150000007522 mineralic acids Chemical class 0.000 description 3
- 108020004707 nucleic acids Proteins 0.000 description 3
- 150000007523 nucleic acids Chemical class 0.000 description 3
- 102000039446 nucleic acids Human genes 0.000 description 3
- 150000007524 organic acids Chemical class 0.000 description 3
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N phenol group Chemical group C1(=CC=CC=C1)O ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 3
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 3
- 229910052698 phosphorus Inorganic materials 0.000 description 3
- 239000002504 physiological saline solution Substances 0.000 description 3
- 229920001184 polypeptide Polymers 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 239000003755 preservative agent Substances 0.000 description 3
- 235000019419 proteases Nutrition 0.000 description 3
- 230000035484 reaction time Effects 0.000 description 3
- 239000011347 resin Substances 0.000 description 3
- 229920005989 resin Polymers 0.000 description 3
- 235000019698 starch Nutrition 0.000 description 3
- 239000008107 starch Substances 0.000 description 3
- 150000008163 sugars Chemical class 0.000 description 3
- 108010029307 thymic stromal lymphopoietin Proteins 0.000 description 3
- 125000002088 tosyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1C([H])([H])[H])S(*)(=O)=O 0.000 description 3
- 239000003053 toxin Substances 0.000 description 3
- 231100000765 toxin Toxicity 0.000 description 3
- 108700012359 toxins Proteins 0.000 description 3
- 229960001612 trastuzumab emtansine Drugs 0.000 description 3
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 3
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 3
- 239000003643 water by type Substances 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 2
- TZCPCKNHXULUIY-RGULYWFUSA-N 1,2-distearoyl-sn-glycero-3-phosphoserine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCCCCCC TZCPCKNHXULUIY-RGULYWFUSA-N 0.000 description 2
- AYDAHOIUHVUJHQ-UHFFFAOYSA-N 1-(3',6'-dihydroxy-3-oxospiro[2-benzofuran-1,9'-xanthene]-5-yl)pyrrole-2,5-dione Chemical compound C=1C(O)=CC=C2C=1OC1=CC(O)=CC=C1C2(C1=CC=2)OC(=O)C1=CC=2N1C(=O)C=CC1=O AYDAHOIUHVUJHQ-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- BGFTWECWAICPDG-UHFFFAOYSA-N 2-[bis(4-chlorophenyl)methyl]-4-n-[3-[bis(4-chlorophenyl)methyl]-4-(dimethylamino)phenyl]-1-n,1-n-dimethylbenzene-1,4-diamine Chemical compound C1=C(C(C=2C=CC(Cl)=CC=2)C=2C=CC(Cl)=CC=2)C(N(C)C)=CC=C1NC(C=1)=CC=C(N(C)C)C=1C(C=1C=CC(Cl)=CC=1)C1=CC=C(Cl)C=C1 BGFTWECWAICPDG-UHFFFAOYSA-N 0.000 description 2
- 125000001731 2-cyanoethyl group Chemical group [H]C([H])(*)C([H])([H])C#N 0.000 description 2
- UYRPRYSDOVYCOU-UHFFFAOYSA-N 2-diphenylphosphanylbenzoic acid Chemical compound OC(=O)C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 UYRPRYSDOVYCOU-UHFFFAOYSA-N 0.000 description 2
- 125000003143 4-hydroxybenzyl group Chemical group [H]C([*])([H])C1=C([H])C([H])=C(O[H])C([H])=C1[H] 0.000 description 2
- 102100022464 5'-nucleotidase Human genes 0.000 description 2
- ATRRKUHOCOJYRX-UHFFFAOYSA-N Ammonium bicarbonate Chemical compound [NH4+].OC([O-])=O ATRRKUHOCOJYRX-UHFFFAOYSA-N 0.000 description 2
- 229910000013 Ammonium bicarbonate Inorganic materials 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 208000023275 Autoimmune disease Diseases 0.000 description 2
- 108010028006 B-Cell Activating Factor Proteins 0.000 description 2
- 108010008014 B-Cell Maturation Antigen Proteins 0.000 description 2
- 102000006942 B-Cell Maturation Antigen Human genes 0.000 description 2
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 description 2
- 108010074708 B7-H1 Antigen Proteins 0.000 description 2
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical group [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- 108010056102 CD100 antigen Proteins 0.000 description 2
- 102100038078 CD276 antigen Human genes 0.000 description 2
- 101710185679 CD276 antigen Proteins 0.000 description 2
- 102100025221 CD70 antigen Human genes 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- 108090000317 Chymotrypsin Proteins 0.000 description 2
- 208000035473 Communicable disease Diseases 0.000 description 2
- 108091035707 Consensus sequence Proteins 0.000 description 2
- 208000019736 Cranial nerve disease Diseases 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical group C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 2
- 239000005977 Ethylene Substances 0.000 description 2
- 102100037362 Fibronectin Human genes 0.000 description 2
- 108010067306 Fibronectins Proteins 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- ZWZWYGMENQVNFU-UHFFFAOYSA-N Glycerophosphorylserin Natural products OC(=O)C(N)COP(O)(=O)OCC(O)CO ZWZWYGMENQVNFU-UHFFFAOYSA-N 0.000 description 2
- 102000003886 Glycoproteins Human genes 0.000 description 2
- 108090000288 Glycoproteins Proteins 0.000 description 2
- 102100039939 Growth/differentiation factor 8 Human genes 0.000 description 2
- 102100030595 HLA class II histocompatibility antigen gamma chain Human genes 0.000 description 2
- 101000678236 Homo sapiens 5'-nucleotidase Proteins 0.000 description 2
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 description 2
- 101000934356 Homo sapiens CD70 antigen Proteins 0.000 description 2
- 101100334515 Homo sapiens FCGR3A gene Proteins 0.000 description 2
- 101001082627 Homo sapiens HLA class II histocompatibility antigen gamma chain Proteins 0.000 description 2
- 101000917824 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor II-b Proteins 0.000 description 2
- 101001024703 Homo sapiens Nck-associated protein 5 Proteins 0.000 description 2
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 2
- 101000610604 Homo sapiens Tumor necrosis factor receptor superfamily member 10B Proteins 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 2
- 208000026350 Inborn Genetic disease Diseases 0.000 description 2
- 108010001127 Insulin Receptor Proteins 0.000 description 2
- 102100036721 Insulin receptor Human genes 0.000 description 2
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 2
- 102000014429 Insulin-like growth factor Human genes 0.000 description 2
- 108090000176 Interleukin-13 Proteins 0.000 description 2
- 102000003816 Interleukin-13 Human genes 0.000 description 2
- 108010065637 Interleukin-23 Proteins 0.000 description 2
- 102000017578 LAG3 Human genes 0.000 description 2
- 101150030213 Lag3 gene Proteins 0.000 description 2
- 102100029205 Low affinity immunoglobulin gamma Fc region receptor II-b Human genes 0.000 description 2
- 102100029193 Low affinity immunoglobulin gamma Fc region receptor III-A Human genes 0.000 description 2
- 102100028198 Macrophage colony-stimulating factor 1 receptor Human genes 0.000 description 2
- 101710150918 Macrophage colony-stimulating factor 1 receptor Proteins 0.000 description 2
- WSMYVTOQOOLQHP-UHFFFAOYSA-N Malondialdehyde Chemical group O=CCC=O WSMYVTOQOOLQHP-UHFFFAOYSA-N 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 2
- 102100036946 Nck-associated protein 5 Human genes 0.000 description 2
- 101100280646 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) fal-1 gene Proteins 0.000 description 2
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 2
- 102000015636 Oligopeptides Human genes 0.000 description 2
- 108010038807 Oligopeptides Proteins 0.000 description 2
- 108091008606 PDGF receptors Proteins 0.000 description 2
- 102000011653 Platelet-Derived Growth Factor Receptors Human genes 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 241000288906 Primates Species 0.000 description 2
- 102100024216 Programmed cell death 1 ligand 1 Human genes 0.000 description 2
- 101710118538 Protease Proteins 0.000 description 2
- 208000035977 Rare disease Diseases 0.000 description 2
- 241000283984 Rodentia Species 0.000 description 2
- 102100027744 Semaphorin-4D Human genes 0.000 description 2
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical group [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 2
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 2
- 108010000499 Thromboplastin Proteins 0.000 description 2
- 102100030859 Tissue factor Human genes 0.000 description 2
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 2
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 2
- 102100036922 Tumor necrosis factor ligand superfamily member 13B Human genes 0.000 description 2
- 102100040112 Tumor necrosis factor receptor superfamily member 10B Human genes 0.000 description 2
- QYKIQEUNHZKYBP-UHFFFAOYSA-N Vinyl ether Chemical group C=COC=C QYKIQEUNHZKYBP-UHFFFAOYSA-N 0.000 description 2
- 239000012190 activator Substances 0.000 description 2
- 238000001042 affinity chromatography Methods 0.000 description 2
- 125000003172 aldehyde group Chemical group 0.000 description 2
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 2
- 125000004448 alkyl carbonyl group Chemical group 0.000 description 2
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 2
- 235000012538 ammonium bicarbonate Nutrition 0.000 description 2
- 239000001099 ammonium carbonate Substances 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 235000006708 antioxidants Nutrition 0.000 description 2
- LNQHREYHFRFJAU-UHFFFAOYSA-N bis(2,5-dioxopyrrolidin-1-yl) pentanedioate Chemical compound O=C1CCC(=O)N1OC(=O)CCCC(=O)ON1C(=O)CCC1=O LNQHREYHFRFJAU-UHFFFAOYSA-N 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 210000000988 bone and bone Anatomy 0.000 description 2
- 239000006227 byproduct Substances 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 235000011010 calcium phosphates Nutrition 0.000 description 2
- 238000007623 carbamidomethylation reaction Methods 0.000 description 2
- 239000003054 catalyst Substances 0.000 description 2
- 210000004027 cell Anatomy 0.000 description 2
- 210000000170 cell membrane Anatomy 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 229910052801 chlorine Inorganic materials 0.000 description 2
- 125000001309 chloro group Chemical group Cl* 0.000 description 2
- 229960002376 chymotrypsin Drugs 0.000 description 2
- 239000000562 conjugate Substances 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 150000001945 cysteines Chemical class 0.000 description 2
- 229940127089 cytotoxic agent Drugs 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 229940039227 diagnostic agent Drugs 0.000 description 2
- 239000000032 diagnostic agent Substances 0.000 description 2
- 102000038379 digestive enzymes Human genes 0.000 description 2
- 108091007734 digestive enzymes Proteins 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 125000000118 dimethyl group Chemical group [H]C([H])([H])* 0.000 description 2
- ILKCDNKCNSNFMP-UHFFFAOYSA-N dimethyl octanediimidate;hydron;dichloride Chemical compound Cl.Cl.COC(=N)CCCCCCC(=N)OC ILKCDNKCNSNFMP-UHFFFAOYSA-N 0.000 description 2
- 239000002612 dispersion medium Substances 0.000 description 2
- 239000012153 distilled water Substances 0.000 description 2
- ZWIBGKZDAWNIFC-UHFFFAOYSA-N disuccinimidyl suberate Chemical compound O=C1CCC(=O)N1OC(=O)CCCCCCC(=O)ON1C(=O)CCC1=O ZWIBGKZDAWNIFC-UHFFFAOYSA-N 0.000 description 2
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 2
- 125000003438 dodecyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 2
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 2
- 125000005677 ethinylene group Chemical group [*:2]C#C[*:1] 0.000 description 2
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 2
- 208000030533 eye disease Diseases 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 125000001153 fluoro group Chemical group F* 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 238000002523 gelfiltration Methods 0.000 description 2
- 208000016361 genetic disease Diseases 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 238000010353 genetic engineering Methods 0.000 description 2
- 229960002449 glycine Drugs 0.000 description 2
- 208000014951 hematologic disease Diseases 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 150000007529 inorganic bases Chemical class 0.000 description 2
- 108010024069 integrin alpha9 Proteins 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 102000006240 membrane receptors Human genes 0.000 description 2
- 108020004084 membrane receptors Proteins 0.000 description 2
- OKKJLVBELUTLKV-UHFFFAOYSA-N methanol Substances OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 2
- 229920000609 methyl cellulose Polymers 0.000 description 2
- 239000001923 methylcellulose Substances 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 125000002950 monocyclic group Chemical group 0.000 description 2
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 2
- 125000001624 naphthyl group Chemical group 0.000 description 2
- 229910017604 nitric acid Inorganic materials 0.000 description 2
- 239000012038 nucleophile Substances 0.000 description 2
- 239000002777 nucleoside Substances 0.000 description 2
- 125000003835 nucleoside group Chemical group 0.000 description 2
- 235000015205 orange juice Nutrition 0.000 description 2
- 235000005985 organic acids Nutrition 0.000 description 2
- 150000007530 organic bases Chemical class 0.000 description 2
- 150000002905 orthoesters Chemical group 0.000 description 2
- 230000000399 orthopedic effect Effects 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 150000004713 phosphodiesters Chemical group 0.000 description 2
- 125000003367 polycyclic group Chemical group 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 108091033319 polynucleotide Proteins 0.000 description 2
- 102000040430 polynucleotide Human genes 0.000 description 2
- 239000002157 polynucleotide Substances 0.000 description 2
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 239000002243 precursor Substances 0.000 description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 2
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 2
- YUOCYTRGANSSRY-UHFFFAOYSA-N pyrrolo[2,3-i][1,2]benzodiazepine Chemical compound C1=CN=NC2=C3C=CN=C3C=CC2=C1 YUOCYTRGANSSRY-UHFFFAOYSA-N 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 230000003248 secreting effect Effects 0.000 description 2
- 230000001568 sexual effect Effects 0.000 description 2
- 229910052710 silicon Inorganic materials 0.000 description 2
- 239000007974 sodium acetate buffer Substances 0.000 description 2
- JQWHASGSAFIOCM-UHFFFAOYSA-M sodium periodate Chemical compound [Na+].[O-]I(=O)(=O)=O JQWHASGSAFIOCM-UHFFFAOYSA-M 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 125000003107 substituted aryl group Chemical group 0.000 description 2
- 125000005717 substituted cycloalkylene group Chemical group 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 239000011593 sulfur Substances 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 102000013498 tau Proteins Human genes 0.000 description 2
- 108010026424 tau Proteins Proteins 0.000 description 2
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 125000000101 thioether group Chemical group 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- 210000004981 tumor-associated macrophage Anatomy 0.000 description 2
- 241000712461 unidentified influenza virus Species 0.000 description 2
- 229920002554 vinyl polymer Polymers 0.000 description 2
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical compound CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 1
- RCIVUMDLBQZEHP-UHFFFAOYSA-N (2-methylpropan-2-yl)oxycarbamic acid Chemical group CC(C)(C)ONC(O)=O RCIVUMDLBQZEHP-UHFFFAOYSA-N 0.000 description 1
- MFRNYXJJRJQHNW-DEMKXPNLSA-N (2s)-2-[[(2r,3r)-3-methoxy-3-[(2s)-1-[(3r,4s,5s)-3-methoxy-5-methyl-4-[methyl-[(2s)-3-methyl-2-[[(2s)-3-methyl-2-(methylamino)butanoyl]amino]butanoyl]amino]heptanoyl]pyrrolidin-2-yl]-2-methylpropanoyl]amino]-3-phenylpropanoic acid Chemical compound CN[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N(C)[C@@H]([C@@H](C)CC)[C@H](OC)CC(=O)N1CCC[C@H]1[C@H](OC)[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 MFRNYXJJRJQHNW-DEMKXPNLSA-N 0.000 description 1
- CHEANNSDVJOIBS-MHZLTWQESA-N (3s)-3-cyclopropyl-3-[3-[[3-(5,5-dimethylcyclopenten-1-yl)-4-(2-fluoro-5-methoxyphenyl)phenyl]methoxy]phenyl]propanoic acid Chemical compound COC1=CC=C(F)C(C=2C(=CC(COC=3C=C(C=CC=3)[C@@H](CC(O)=O)C3CC3)=CC=2)C=2C(CCC=2)(C)C)=C1 CHEANNSDVJOIBS-MHZLTWQESA-N 0.000 description 1
- IEUUDEWWMRQUDS-UHFFFAOYSA-N (6-azaniumylidene-1,6-dimethoxyhexylidene)azanium;dichloride Chemical compound Cl.Cl.COC(=N)CCCCC(=N)OC IEUUDEWWMRQUDS-UHFFFAOYSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- PJOHVEQSYPOERL-SHEAVXILSA-N (e)-n-[(4r,4as,7ar,12br)-3-(cyclopropylmethyl)-9-hydroxy-7-oxo-2,4,5,6,7a,13-hexahydro-1h-4,12-methanobenzofuro[3,2-e]isoquinoline-4a-yl]-3-(4-methylphenyl)prop-2-enamide Chemical compound C1=CC(C)=CC=C1\C=C\C(=O)N[C@]1(CCC(=O)[C@@H]2O3)[C@H]4CC5=CC=C(O)C3=C5[C@]12CCN4CC1CC1 PJOHVEQSYPOERL-SHEAVXILSA-N 0.000 description 1
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 1
- DHBXNPKRAUYBTH-UHFFFAOYSA-N 1,1-ethanedithiol Chemical compound CC(S)S DHBXNPKRAUYBTH-UHFFFAOYSA-N 0.000 description 1
- BJHCYTJNPVGSBZ-YXSASFKJSA-N 1-[4-[6-amino-5-[(Z)-methoxyiminomethyl]pyrimidin-4-yl]oxy-2-chlorophenyl]-3-ethylurea Chemical compound CCNC(=O)Nc1ccc(Oc2ncnc(N)c2\C=N/OC)cc1Cl BJHCYTJNPVGSBZ-YXSASFKJSA-N 0.000 description 1
- RZDHHDURUVIWSS-UHFFFAOYSA-N 2,3-dihydro-1h-pyrazin-6-one Chemical group O=C1NCCN=C1 RZDHHDURUVIWSS-UHFFFAOYSA-N 0.000 description 1
- BACYUWVYYTXETD-UHFFFAOYSA-M 2-[dodecanoyl(methyl)amino]acetate Chemical compound CCCCCCCCCCCC(=O)N(C)CC([O-])=O BACYUWVYYTXETD-UHFFFAOYSA-M 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 1
- DVLFYONBTKHTER-UHFFFAOYSA-N 3-(N-morpholino)propanesulfonic acid Chemical compound OS(=O)(=O)CCCN1CCOCC1 DVLFYONBTKHTER-UHFFFAOYSA-N 0.000 description 1
- GJXCLGKEGAGUQC-UHFFFAOYSA-N 3-[(3-amino-3-oxopropyl)disulfanyl]propanamide Chemical compound NC(=O)CCSSCCC(N)=O GJXCLGKEGAGUQC-UHFFFAOYSA-N 0.000 description 1
- PBVAJRFEEOIAGW-UHFFFAOYSA-N 3-[bis(2-carboxyethyl)phosphanyl]propanoic acid;hydrochloride Chemical compound Cl.OC(=O)CCP(CCC(O)=O)CCC(O)=O PBVAJRFEEOIAGW-UHFFFAOYSA-N 0.000 description 1
- 108010068327 4-hydroxyphenylpyruvate dioxygenase Proteins 0.000 description 1
- MJZJYWCQPMNPRM-UHFFFAOYSA-N 6,6-dimethyl-1-[3-(2,4,5-trichlorophenoxy)propoxy]-1,6-dihydro-1,3,5-triazine-2,4-diamine Chemical compound CC1(C)N=C(N)N=C(N)N1OCCCOC1=CC(Cl)=C(Cl)C=C1Cl MJZJYWCQPMNPRM-UHFFFAOYSA-N 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- 102100023990 60S ribosomal protein L17 Human genes 0.000 description 1
- AMZBXNVXJGUYMF-UHFFFAOYSA-N 9-$l^{1}-oxidanyl-9-azabicyclo[3.3.1]nonan-3-one Chemical group C1CCC2CC(=O)CC1N2[O] AMZBXNVXJGUYMF-UHFFFAOYSA-N 0.000 description 1
- 102100031585 ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Human genes 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 241000589291 Acinetobacter Species 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 239000000275 Adrenocorticotropic Hormone Substances 0.000 description 1
- 108010000239 Aequorin Proteins 0.000 description 1
- 229910002012 Aerosil® Inorganic materials 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 101710092462 Alpha-hemolysin Proteins 0.000 description 1
- 102100026882 Alpha-synuclein Human genes 0.000 description 1
- 101710197219 Alpha-toxin Proteins 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 1
- 239000005695 Ammonium acetate Substances 0.000 description 1
- 108010048036 Angiopoietin-2 Proteins 0.000 description 1
- 102100025668 Angiopoietin-related protein 3 Human genes 0.000 description 1
- 108091023037 Aptamer Proteins 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 102100027203 B-cell antigen receptor complex-associated protein beta chain Human genes 0.000 description 1
- 102100038080 B-cell receptor CD22 Human genes 0.000 description 1
- 208000035143 Bacterial infection Diseases 0.000 description 1
- 231100000699 Bacterial toxin Toxicity 0.000 description 1
- 102100026189 Beta-galactosidase Human genes 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 108010049974 Bone Morphogenetic Protein 6 Proteins 0.000 description 1
- 206010005949 Bone cancer Diseases 0.000 description 1
- 102100022525 Bone morphogenetic protein 6 Human genes 0.000 description 1
- 208000018084 Bone neoplasm Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 102100036848 C-C motif chemokine 20 Human genes 0.000 description 1
- 102100031650 C-X-C chemokine receptor type 4 Human genes 0.000 description 1
- 102100026094 C-type lectin domain family 12 member A Human genes 0.000 description 1
- GOXYVEMQUWNZPZ-UHFFFAOYSA-N C1=CC=C2C(=C1)C=CC(=N2)C3=CC=CC=C3S(=O)(=O)O Chemical group C1=CC=C2C(=C1)C=CC(=N2)C3=CC=CC=C3S(=O)(=O)O GOXYVEMQUWNZPZ-UHFFFAOYSA-N 0.000 description 1
- 108700012439 CA9 Proteins 0.000 description 1
- 102100024217 CAMPATH-1 antigen Human genes 0.000 description 1
- 102100024210 CD166 antigen Human genes 0.000 description 1
- 102100027207 CD27 antigen Human genes 0.000 description 1
- 108010065524 CD52 Antigen Proteins 0.000 description 1
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 1
- 229940045513 CTLA4 antagonist Drugs 0.000 description 1
- 102000000905 Cadherin Human genes 0.000 description 1
- 108050007957 Cadherin Proteins 0.000 description 1
- 102100024155 Cadherin-11 Human genes 0.000 description 1
- 102100038518 Calcitonin Human genes 0.000 description 1
- 108090000932 Calcitonin Gene-Related Peptide Proteins 0.000 description 1
- 108010078311 Calcitonin Gene-Related Peptide Receptors Proteins 0.000 description 1
- 102000014468 Calcitonin Gene-Related Peptide Receptors Human genes 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 102100033868 Cannabinoid receptor 1 Human genes 0.000 description 1
- 101710187010 Cannabinoid receptor 1 Proteins 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-N Carbamic acid Chemical group NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 1
- 102100036369 Carbonic anhydrase 6 Human genes 0.000 description 1
- 102100024423 Carbonic anhydrase 9 Human genes 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 108010076667 Caspases Proteins 0.000 description 1
- 102000011727 Caspases Human genes 0.000 description 1
- 108090000712 Cathepsin B Proteins 0.000 description 1
- 102000004225 Cathepsin B Human genes 0.000 description 1
- 102000003908 Cathepsin D Human genes 0.000 description 1
- 108090000258 Cathepsin D Proteins 0.000 description 1
- 108090000625 Cathepsin K Proteins 0.000 description 1
- 102000004171 Cathepsin K Human genes 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 102100023126 Cell surface glycoprotein MUC18 Human genes 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 108010082548 Chemokine CCL11 Proteins 0.000 description 1
- 101100385253 Chiloscyllium indicum GM1 gene Proteins 0.000 description 1
- 108700022831 Clostridium difficile toxB Proteins 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 102400000739 Corticotropin Human genes 0.000 description 1
- 101800000414 Corticotropin Proteins 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 102000001189 Cyclic Peptides Human genes 0.000 description 1
- 108010069514 Cyclic Peptides Proteins 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- CKLJMWTZIZZHCS-UHFFFAOYSA-N D-OH-Asp Natural products OC(=O)C(N)CC(O)=O CKLJMWTZIZZHCS-UHFFFAOYSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-UHFFFAOYSA-N D-alpha-Ala Natural products CC([NH3+])C([O-])=O QNAYBMKLOCPYGJ-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Natural products CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 1
- 239000012623 DNA damaging agent Substances 0.000 description 1
- 230000004568 DNA-binding Effects 0.000 description 1
- SBJKKFFYIZUCET-JLAZNSOCSA-N Dehydro-L-ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(=O)C1=O SBJKKFFYIZUCET-JLAZNSOCSA-N 0.000 description 1
- CYCGRDQQIOGCKX-UHFFFAOYSA-N Dehydro-luciferin Natural products OC(=O)C1=CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 CYCGRDQQIOGCKX-UHFFFAOYSA-N 0.000 description 1
- SBJKKFFYIZUCET-UHFFFAOYSA-N Dehydroascorbic acid Natural products OCC(O)C1OC(=O)C(=O)C1=O SBJKKFFYIZUCET-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- 102100030074 Dickkopf-related protein 1 Human genes 0.000 description 1
- 101710099518 Dickkopf-related protein 1 Proteins 0.000 description 1
- SHIBSTMRCDJXLN-UHFFFAOYSA-N Digoxigenin Natural products C1CC(C2C(C3(C)CCC(O)CC3CC2)CC2O)(O)C2(C)C1C1=CC(=O)OC1 SHIBSTMRCDJXLN-UHFFFAOYSA-N 0.000 description 1
- 102000016607 Diphtheria Toxin Human genes 0.000 description 1
- 108010053187 Diphtheria Toxin Proteins 0.000 description 1
- SNRUBQQJIBEYMU-UHFFFAOYSA-N Dodecane Natural products CCCCCCCCCCCC SNRUBQQJIBEYMU-UHFFFAOYSA-N 0.000 description 1
- 241001115402 Ebolavirus Species 0.000 description 1
- 102100029722 Ectonucleoside triphosphate diphosphohydrolase 1 Human genes 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 102100023688 Eotaxin Human genes 0.000 description 1
- 108010055196 EphA2 Receptor Proteins 0.000 description 1
- 108010055191 EphA3 Receptor Proteins 0.000 description 1
- 102100030322 Ephrin type-A receptor 1 Human genes 0.000 description 1
- 102100030340 Ephrin type-A receptor 2 Human genes 0.000 description 1
- 102100030324 Ephrin type-A receptor 3 Human genes 0.000 description 1
- 102100033942 Ephrin-A4 Human genes 0.000 description 1
- 108010066687 Epithelial Cell Adhesion Molecule Proteins 0.000 description 1
- 102000018651 Epithelial Cell Adhesion Molecule Human genes 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 101000740462 Escherichia coli Beta-lactamase TEM Proteins 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 101710089384 Extracellular protease Proteins 0.000 description 1
- 108010048049 Factor IXa Proteins 0.000 description 1
- 108010014173 Factor X Proteins 0.000 description 1
- 108091006020 Fc-tagged proteins Proteins 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 102100024802 Fibroblast growth factor 23 Human genes 0.000 description 1
- 102100027842 Fibroblast growth factor receptor 3 Human genes 0.000 description 1
- 101710182396 Fibroblast growth factor receptor 3 Proteins 0.000 description 1
- 102100027844 Fibroblast growth factor receptor 4 Human genes 0.000 description 1
- BJGNCJDXODQBOB-UHFFFAOYSA-N Fivefly Luciferin Natural products OC(=O)C1CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 BJGNCJDXODQBOB-UHFFFAOYSA-N 0.000 description 1
- 102000010451 Folate receptor alpha Human genes 0.000 description 1
- 108050001931 Folate receptor alpha Proteins 0.000 description 1
- 102100020997 Fractalkine Human genes 0.000 description 1
- 102000001002 Frizzled-7 Human genes 0.000 description 1
- 108050007985 Frizzled-7 Proteins 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 101710198884 GATA-type zinc finger protein 1 Proteins 0.000 description 1
- 102100025101 GATA-type zinc finger protein 1 Human genes 0.000 description 1
- 102100038904 GPI inositol-deacylase Human genes 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 101710088083 Glomulin Proteins 0.000 description 1
- DTHNMHAUYICORS-KTKZVXAJSA-N Glucagon-like peptide 1 Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(N)=O)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC=1N=CNC=1)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=CC=C1 DTHNMHAUYICORS-KTKZVXAJSA-N 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 102100041003 Glutamate carboxypeptidase 2 Human genes 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- 108010053070 Glutathione Disulfide Proteins 0.000 description 1
- 108010031186 Glycoside Hydrolases Proteins 0.000 description 1
- 102000005744 Glycoside Hydrolases Human genes 0.000 description 1
- 239000004378 Glycyrrhizin Substances 0.000 description 1
- 102000010956 Glypican Human genes 0.000 description 1
- 108050001154 Glypican Proteins 0.000 description 1
- 108050007237 Glypican-3 Proteins 0.000 description 1
- 101150112082 Gpnmb gene Proteins 0.000 description 1
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 1
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 1
- 102100034221 Growth-regulated alpha protein Human genes 0.000 description 1
- 102100040896 Growth/differentiation factor 15 Human genes 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- OWXMKDGYPWMGEB-UHFFFAOYSA-N HEPPS Chemical compound OCCN1CCN(CCCS(O)(=O)=O)CC1 OWXMKDGYPWMGEB-UHFFFAOYSA-N 0.000 description 1
- 102000006354 HLA-DR Antigens Human genes 0.000 description 1
- 108010058597 HLA-DR Antigens Proteins 0.000 description 1
- 102100034458 Hepatitis A virus cellular receptor 2 Human genes 0.000 description 1
- 101710083479 Hepatitis A virus cellular receptor 2 homolog Proteins 0.000 description 1
- 102100021866 Hepatocyte growth factor Human genes 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000777636 Homo sapiens ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Proteins 0.000 description 1
- 101000693085 Homo sapiens Angiopoietin-related protein 3 Proteins 0.000 description 1
- 101000914491 Homo sapiens B-cell antigen receptor complex-associated protein beta chain Proteins 0.000 description 1
- 101000884305 Homo sapiens B-cell receptor CD22 Proteins 0.000 description 1
- 101000713099 Homo sapiens C-C motif chemokine 20 Proteins 0.000 description 1
- 101000922348 Homo sapiens C-X-C chemokine receptor type 4 Proteins 0.000 description 1
- 101000912622 Homo sapiens C-type lectin domain family 12 member A Proteins 0.000 description 1
- 101000980840 Homo sapiens CD166 antigen Proteins 0.000 description 1
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 description 1
- 101000714525 Homo sapiens Carbonic anhydrase 6 Proteins 0.000 description 1
- 101000623903 Homo sapiens Cell surface glycoprotein MUC18 Proteins 0.000 description 1
- 101001012447 Homo sapiens Ectonucleoside triphosphate diphosphohydrolase 1 Proteins 0.000 description 1
- 101000881679 Homo sapiens Endoglin Proteins 0.000 description 1
- 101000938354 Homo sapiens Ephrin type-A receptor 1 Proteins 0.000 description 1
- 101000925259 Homo sapiens Ephrin-A4 Proteins 0.000 description 1
- 101001051973 Homo sapiens Fibroblast growth factor 23 Proteins 0.000 description 1
- 101000917134 Homo sapiens Fibroblast growth factor receptor 4 Proteins 0.000 description 1
- 101000854520 Homo sapiens Fractalkine Proteins 0.000 description 1
- 101001099051 Homo sapiens GPI inositol-deacylase Proteins 0.000 description 1
- 101000892862 Homo sapiens Glutamate carboxypeptidase 2 Proteins 0.000 description 1
- 101001069921 Homo sapiens Growth-regulated alpha protein Proteins 0.000 description 1
- 101000893549 Homo sapiens Growth/differentiation factor 15 Proteins 0.000 description 1
- 101000886562 Homo sapiens Growth/differentiation factor 8 Proteins 0.000 description 1
- 101000898034 Homo sapiens Hepatocyte growth factor Proteins 0.000 description 1
- 101001019455 Homo sapiens ICOS ligand Proteins 0.000 description 1
- 101000606465 Homo sapiens Inactive tyrosine-protein kinase 7 Proteins 0.000 description 1
- 101001103039 Homo sapiens Inactive tyrosine-protein kinase transmembrane receptor ROR1 Proteins 0.000 description 1
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 1
- 101000852965 Homo sapiens Interleukin-1 receptor-like 2 Proteins 0.000 description 1
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 1
- 101001076408 Homo sapiens Interleukin-6 Proteins 0.000 description 1
- 101001055222 Homo sapiens Interleukin-8 Proteins 0.000 description 1
- 101000945490 Homo sapiens Killer cell immunoglobulin-like receptor 3DL2 Proteins 0.000 description 1
- 101001133056 Homo sapiens Mucin-1 Proteins 0.000 description 1
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 description 1
- 101001103036 Homo sapiens Nuclear receptor ROR-alpha Proteins 0.000 description 1
- 101000589873 Homo sapiens Parathyroid hormone/parathyroid hormone-related peptide receptor Proteins 0.000 description 1
- 101001001487 Homo sapiens Phosphatidylinositol-glycan biosynthesis class F protein Proteins 0.000 description 1
- 101000595923 Homo sapiens Placenta growth factor Proteins 0.000 description 1
- 101000994669 Homo sapiens Potassium voltage-gated channel subfamily A member 3 Proteins 0.000 description 1
- 101001098868 Homo sapiens Proprotein convertase subtilisin/kexin type 9 Proteins 0.000 description 1
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 1
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 1
- 101000835984 Homo sapiens SLIT and NTRK-like protein 6 Proteins 0.000 description 1
- 101000709472 Homo sapiens Sialic acid-binding Ig-like lectin 15 Proteins 0.000 description 1
- 101000868152 Homo sapiens Son of sevenless homolog 1 Proteins 0.000 description 1
- 101000874179 Homo sapiens Syndecan-1 Proteins 0.000 description 1
- 101000946860 Homo sapiens T-cell surface glycoprotein CD3 epsilon chain Proteins 0.000 description 1
- 101000669447 Homo sapiens Toll-like receptor 4 Proteins 0.000 description 1
- 101000801433 Homo sapiens Trophoblast glycoprotein Proteins 0.000 description 1
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 description 1
- 101000685848 Homo sapiens Zinc transporter ZIP6 Proteins 0.000 description 1
- 241000725303 Human immunodeficiency virus Species 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 1
- 208000031226 Hyperlipidaemia Diseases 0.000 description 1
- 102100034980 ICOS ligand Human genes 0.000 description 1
- 101150088952 IGF1 gene Proteins 0.000 description 1
- 229940099539 IL-36 receptor antagonist Drugs 0.000 description 1
- 102100026120 IgG receptor FcRn large subunit p51 Human genes 0.000 description 1
- 101710177940 IgG receptor FcRn large subunit p51 Proteins 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 102100039813 Inactive tyrosine-protein kinase 7 Human genes 0.000 description 1
- 102100039615 Inactive tyrosine-protein kinase transmembrane receptor ROR1 Human genes 0.000 description 1
- 108010064593 Intercellular Adhesion Molecule-1 Proteins 0.000 description 1
- 102100037877 Intercellular adhesion molecule 1 Human genes 0.000 description 1
- 102100036697 Interleukin-1 receptor-like 2 Human genes 0.000 description 1
- 102000003812 Interleukin-15 Human genes 0.000 description 1
- 108090000172 Interleukin-15 Proteins 0.000 description 1
- 102100026878 Interleukin-2 receptor subunit alpha Human genes 0.000 description 1
- 102100030703 Interleukin-22 Human genes 0.000 description 1
- 102100033493 Interleukin-3 receptor subunit alpha Human genes 0.000 description 1
- 102000017761 Interleukin-33 Human genes 0.000 description 1
- 108010067003 Interleukin-33 Proteins 0.000 description 1
- 102000004388 Interleukin-4 Human genes 0.000 description 1
- 108090000978 Interleukin-4 Proteins 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 102100037792 Interleukin-6 receptor subunit alpha Human genes 0.000 description 1
- 102100026236 Interleukin-8 Human genes 0.000 description 1
- 102000036770 Islet Amyloid Polypeptide Human genes 0.000 description 1
- 108010041872 Islet Amyloid Polypeptide Proteins 0.000 description 1
- 108020003285 Isocitrate lyase Proteins 0.000 description 1
- 241000701460 JC polyomavirus Species 0.000 description 1
- 101150069255 KLRC1 gene Proteins 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- 102100034840 Killer cell immunoglobulin-like receptor 3DL2 Human genes 0.000 description 1
- 241000588748 Klebsiella Species 0.000 description 1
- 150000007649 L alpha amino acids Chemical group 0.000 description 1
- QNAYBMKLOCPYGJ-UWTATZPHSA-N L-Alanine Natural products C[C@@H](N)C(O)=O QNAYBMKLOCPYGJ-UWTATZPHSA-N 0.000 description 1
- CKLJMWTZIZZHCS-UWTATZPHSA-N L-Aspartic acid Natural products OC(=O)[C@H](N)CC(O)=O CKLJMWTZIZZHCS-UWTATZPHSA-N 0.000 description 1
- 235000019766 L-Lysine Nutrition 0.000 description 1
- FFEARJCKVFRZRR-UHFFFAOYSA-N L-Methionine Natural products CSCCC(N)C(O)=O FFEARJCKVFRZRR-UHFFFAOYSA-N 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-N L-arginine Chemical compound OC(=O)[C@@H](N)CCCN=C(N)N ODKSFYDXXFIFQN-BYPYZUCNSA-N 0.000 description 1
- 229930064664 L-arginine Natural products 0.000 description 1
- 235000014852 L-arginine Nutrition 0.000 description 1
- 239000004201 L-cysteine Substances 0.000 description 1
- 235000013878 L-cysteine Nutrition 0.000 description 1
- 229930182816 L-glutamine Natural products 0.000 description 1
- 229930182844 L-isoleucine Natural products 0.000 description 1
- 239000004395 L-leucine Substances 0.000 description 1
- 235000019454 L-leucine Nutrition 0.000 description 1
- 229930195722 L-methionine Natural products 0.000 description 1
- 229930182821 L-proline Natural products 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 102000004882 Lipase Human genes 0.000 description 1
- 108090001060 Lipase Proteins 0.000 description 1
- 239000004367 Lipase Substances 0.000 description 1
- 102000057248 Lipoprotein(a) Human genes 0.000 description 1
- 108010033266 Lipoprotein(a) Proteins 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- DDWFXDSYGUXRAY-UHFFFAOYSA-N Luciferin Natural products CCc1c(C)c(CC2NC(=O)C(=C2C=C)C)[nH]c1Cc3[nH]c4C(=C5/NC(CC(=O)O)C(C)C5CC(=O)O)CC(=O)c4c3C DDWFXDSYGUXRAY-UHFFFAOYSA-N 0.000 description 1
- 208000019693 Lung disease Diseases 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 102100033486 Lymphocyte antigen 75 Human genes 0.000 description 1
- 101710157884 Lymphocyte antigen 75 Proteins 0.000 description 1
- 101001018085 Lysobacter enzymogenes Lysyl endopeptidase Proteins 0.000 description 1
- 108010009254 Lysosomal-Associated Membrane Protein 1 Proteins 0.000 description 1
- 102100035133 Lysosome-associated membrane glycoprotein 1 Human genes 0.000 description 1
- 101100404845 Macaca mulatta NKG2A gene Proteins 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 229930126263 Maytansine Natural products 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 102000003735 Mesothelin Human genes 0.000 description 1
- 108090000015 Mesothelin Proteins 0.000 description 1
- 108010006035 Metalloproteases Proteins 0.000 description 1
- 102000005741 Metalloproteases Human genes 0.000 description 1
- 102100034256 Mucin-1 Human genes 0.000 description 1
- 101100262697 Mus musculus Axl gene Proteins 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 description 1
- 108010056852 Myostatin Proteins 0.000 description 1
- 125000001429 N-terminal alpha-amino-acid group Chemical group 0.000 description 1
- 102100022682 NKG2-A/NKG2-B type II integral membrane protein Human genes 0.000 description 1
- 102100035486 Nectin-4 Human genes 0.000 description 1
- 101710043865 Nectin-4 Proteins 0.000 description 1
- 102000015336 Nerve Growth Factor Human genes 0.000 description 1
- 108010025020 Nerve Growth Factor Proteins 0.000 description 1
- 102000001759 Notch1 Receptor Human genes 0.000 description 1
- 108010029755 Notch1 Receptor Proteins 0.000 description 1
- 102000001756 Notch2 Receptor Human genes 0.000 description 1
- 108010029751 Notch2 Receptor Proteins 0.000 description 1
- 102000001760 Notch3 Receptor Human genes 0.000 description 1
- 108010029756 Notch3 Receptor Proteins 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 108090000854 Oxidoreductases Proteins 0.000 description 1
- 102000004316 Oxidoreductases Human genes 0.000 description 1
- 241000282579 Pan Species 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- 108090000526 Papain Proteins 0.000 description 1
- 102100032256 Parathyroid hormone/parathyroid hormone-related peptide receptor Human genes 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 102100038551 Peptide-N(4)-(N-acetyl-beta-glucosaminyl)asparagine amidase Human genes 0.000 description 1
- 102000003992 Peroxidases Human genes 0.000 description 1
- 101710124951 Phospholipase C Proteins 0.000 description 1
- 102100035194 Placenta growth factor Human genes 0.000 description 1
- 231100000742 Plant toxin Toxicity 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 108010071690 Prealbumin Proteins 0.000 description 1
- 101710089372 Programmed cell death protein 1 Proteins 0.000 description 1
- 108010002519 Prolactin Receptors Proteins 0.000 description 1
- 102100029000 Prolactin receptor Human genes 0.000 description 1
- 102100023832 Prolyl endopeptidase FAP Human genes 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- 102100038955 Proprotein convertase subtilisin/kexin type 9 Human genes 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 102100036467 Protein delta homolog 1 Human genes 0.000 description 1
- 101710119301 Protein delta homolog 1 Proteins 0.000 description 1
- 206010037549 Purpura Diseases 0.000 description 1
- 241001672981 Purpura Species 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 101100437153 Rattus norvegicus Acvr2b gene Proteins 0.000 description 1
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 1
- 101710100969 Receptor tyrosine-protein kinase erbB-3 Proteins 0.000 description 1
- 102100029986 Receptor tyrosine-protein kinase erbB-3 Human genes 0.000 description 1
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- 241000725643 Respiratory syncytial virus Species 0.000 description 1
- 208000007014 Retinitis pigmentosa Diseases 0.000 description 1
- 108010039491 Ricin Proteins 0.000 description 1
- KJTLSVCANCCWHF-UHFFFAOYSA-N Ruthenium Chemical compound [Ru] KJTLSVCANCCWHF-UHFFFAOYSA-N 0.000 description 1
- 108091006976 SLC40A1 Proteins 0.000 description 1
- 102100025504 SLIT and NTRK-like protein 6 Human genes 0.000 description 1
- 229910052772 Samarium Inorganic materials 0.000 description 1
- 102100034201 Sclerostin Human genes 0.000 description 1
- 108050006698 Sclerostin Proteins 0.000 description 1
- 102100034361 Sialic acid-binding Ig-like lectin 15 Human genes 0.000 description 1
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 1
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 1
- 241000191967 Staphylococcus aureus Species 0.000 description 1
- 208000005718 Stomach Neoplasms Diseases 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- 101000874347 Streptococcus agalactiae IgA FC receptor Proteins 0.000 description 1
- 241000193998 Streptococcus pneumoniae Species 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 108010021188 Superoxide Dismutase-1 Proteins 0.000 description 1
- 102100038836 Superoxide dismutase [Cu-Zn] Human genes 0.000 description 1
- 241000725681 Swine influenza virus Species 0.000 description 1
- 102100035721 Syndecan-1 Human genes 0.000 description 1
- 229940126547 T-cell immunoglobulin mucin-3 Drugs 0.000 description 1
- 102100035794 T-cell surface glycoprotein CD3 epsilon chain Human genes 0.000 description 1
- 102100040347 TAR DNA-binding protein 43 Human genes 0.000 description 1
- 101710150875 TAR DNA-binding protein 43 Proteins 0.000 description 1
- PZBFGYYEXUXCOF-UHFFFAOYSA-N TCEP Chemical compound OC(=O)CCP(CCC(O)=O)CCC(O)=O PZBFGYYEXUXCOF-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 102000007000 Tenascin Human genes 0.000 description 1
- 108010008125 Tenascin Proteins 0.000 description 1
- WDLRUFUQRNWCPK-UHFFFAOYSA-N Tetraxetan Chemical group OC(=O)CN1CCN(CC(O)=O)CCN(CC(O)=O)CCN(CC(O)=O)CC1 WDLRUFUQRNWCPK-UHFFFAOYSA-N 0.000 description 1
- 108090000190 Thrombin Proteins 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- 102100030951 Tissue factor pathway inhibitor Human genes 0.000 description 1
- 102100039360 Toll-like receptor 4 Human genes 0.000 description 1
- 108010033576 Transferrin Receptors Proteins 0.000 description 1
- 102100026144 Transferrin receptor protein 1 Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 102100030742 Transforming growth factor beta-1 proprotein Human genes 0.000 description 1
- 102100029290 Transthyretin Human genes 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- RHQDFWAXVIIEBN-UHFFFAOYSA-N Trifluoroethanol Chemical compound OCC(F)(F)F RHQDFWAXVIIEBN-UHFFFAOYSA-N 0.000 description 1
- 102100033579 Trophoblast glycoprotein Human genes 0.000 description 1
- 102000004243 Tubulin Human genes 0.000 description 1
- 108090000704 Tubulin Proteins 0.000 description 1
- 102100029690 Tumor necrosis factor receptor superfamily member 13C Human genes 0.000 description 1
- 101710178300 Tumor necrosis factor receptor superfamily member 13C Proteins 0.000 description 1
- 101710187743 Tumor necrosis factor receptor superfamily member 1A Proteins 0.000 description 1
- 102100033732 Tumor necrosis factor receptor superfamily member 1A Human genes 0.000 description 1
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 description 1
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 1
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 208000002495 Uterine Neoplasms Diseases 0.000 description 1
- 102000009524 Vascular Endothelial Growth Factor A Human genes 0.000 description 1
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 1
- 108010053096 Vascular Endothelial Growth Factor Receptor-1 Proteins 0.000 description 1
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 description 1
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 1
- 102100039037 Vascular endothelial growth factor A Human genes 0.000 description 1
- 102100033178 Vascular endothelial growth factor receptor 1 Human genes 0.000 description 1
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- 102100023144 Zinc transporter ZIP6 Human genes 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- IEDXPSOJFSVCKU-HOKPPMCLSA-N [4-[[(2S)-5-(carbamoylamino)-2-[[(2S)-2-[6-(2,5-dioxopyrrolidin-1-yl)hexanoylamino]-3-methylbutanoyl]amino]pentanoyl]amino]phenyl]methyl N-[(2S)-1-[[(2S)-1-[[(3R,4S,5S)-1-[(2S)-2-[(1R,2R)-3-[[(1S,2R)-1-hydroxy-1-phenylpropan-2-yl]amino]-1-methoxy-2-methyl-3-oxopropyl]pyrrolidin-1-yl]-3-methoxy-5-methyl-1-oxoheptan-4-yl]-methylamino]-3-methyl-1-oxobutan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]-N-methylcarbamate Chemical compound CC[C@H](C)[C@@H]([C@@H](CC(=O)N1CCC[C@H]1[C@H](OC)[C@@H](C)C(=O)N[C@H](C)[C@@H](O)c1ccccc1)OC)N(C)C(=O)[C@@H](NC(=O)[C@H](C(C)C)N(C)C(=O)OCc1ccc(NC(=O)[C@H](CCCNC(N)=O)NC(=O)[C@@H](NC(=O)CCCCCN2C(=O)CCC2=O)C(C)C)cc1)C(C)C IEDXPSOJFSVCKU-HOKPPMCLSA-N 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 238000007792 addition Methods 0.000 description 1
- 206010064930 age-related macular degeneration Diseases 0.000 description 1
- 230000001476 alcoholic effect Effects 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 125000005907 alkyl ester group Chemical group 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 239000002776 alpha toxin Substances 0.000 description 1
- 108090000185 alpha-Synuclein Proteins 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- CEGOLXSVJUTHNZ-UHFFFAOYSA-K aluminium tristearate Chemical compound [Al+3].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CEGOLXSVJUTHNZ-UHFFFAOYSA-K 0.000 description 1
- 229940063655 aluminum stearate Drugs 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- PLOPBXQQPZYQFA-AXPWDRQUSA-N amlintide Chemical compound C([C@@H](C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H]1NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CCCCN)CSSC1)[C@@H](C)O)C(C)C)C1=CC=CC=C1 PLOPBXQQPZYQFA-AXPWDRQUSA-N 0.000 description 1
- 235000019257 ammonium acetate Nutrition 0.000 description 1
- 229940043376 ammonium acetate Drugs 0.000 description 1
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 1
- 125000004653 anthracenylene group Chemical group 0.000 description 1
- 229940045799 anthracyclines and related substance Drugs 0.000 description 1
- 230000000340 anti-metabolite Effects 0.000 description 1
- 229940100197 antimetabolite Drugs 0.000 description 1
- 239000002256 antimetabolite Substances 0.000 description 1
- 229940041181 antineoplastic drug Drugs 0.000 description 1
- 229940045985 antineoplastic platinum compound Drugs 0.000 description 1
- 150000007860 aryl ester derivatives Chemical class 0.000 description 1
- 125000005161 aryl oxy carbonyl group Chemical group 0.000 description 1
- 125000004104 aryloxy group Chemical group 0.000 description 1
- 229910052789 astatine Inorganic materials 0.000 description 1
- RYXHOMYVWAEKHL-UHFFFAOYSA-N astatine atom Chemical compound [At] RYXHOMYVWAEKHL-UHFFFAOYSA-N 0.000 description 1
- 229960003852 atezolizumab Drugs 0.000 description 1
- 108010044540 auristatin Proteins 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- 208000037979 autoimmune inflammatory disease Diseases 0.000 description 1
- 125000002393 azetidinyl group Chemical group 0.000 description 1
- 125000004069 aziridinyl group Chemical group 0.000 description 1
- 208000022362 bacterial infectious disease Diseases 0.000 description 1
- 239000000688 bacterial toxin Substances 0.000 description 1
- 239000000022 bacteriostatic agent Substances 0.000 description 1
- 229960004669 basiliximab Drugs 0.000 description 1
- 229960003270 belimumab Drugs 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- 125000000051 benzyloxy group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])O* 0.000 description 1
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- 229960000397 bevacizumab Drugs 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 229910052797 bismuth Inorganic materials 0.000 description 1
- JCXGWMGPZLAOME-UHFFFAOYSA-N bismuth atom Chemical compound [Bi] JCXGWMGPZLAOME-UHFFFAOYSA-N 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 239000004327 boric acid Substances 0.000 description 1
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 125000004106 butoxy group Chemical group [*]OC([H])([H])C([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- 125000004744 butyloxycarbonyl group Chemical group 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- FNAQSUUGMSOBHW-UHFFFAOYSA-H calcium citrate Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O.[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O FNAQSUUGMSOBHW-UHFFFAOYSA-H 0.000 description 1
- 239000001354 calcium citrate Substances 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- HXCHCVDVKSCDHU-LULTVBGHSA-N calicheamicin Chemical compound C1[C@H](OC)[C@@H](NCC)CO[C@H]1O[C@H]1[C@H](O[C@@H]2C\3=C(NC(=O)OC)C(=O)C[C@](C/3=C/CSSSC)(O)C#C\C=C/C#C2)O[C@H](C)[C@@H](NO[C@@H]2O[C@H](C)[C@@H](SC(=O)C=3C(=C(OC)C(O[C@H]4[C@@H]([C@H](OC)[C@@H](O)[C@H](C)O4)O)=C(I)C=3C)OC)[C@@H](O)C2)[C@@H]1O HXCHCVDVKSCDHU-LULTVBGHSA-N 0.000 description 1
- 229930195731 calicheamicin Natural products 0.000 description 1
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical class C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 description 1
- 229960001838 canakinumab Drugs 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- XYXGFHALMTXBQX-UHFFFAOYSA-N carboxyoxy hydrogen carbonate Chemical compound OC(=O)OOC(O)=O XYXGFHALMTXBQX-UHFFFAOYSA-N 0.000 description 1
- 230000022534 cell killing Effects 0.000 description 1
- 206010008118 cerebral infarction Diseases 0.000 description 1
- 208000026106 cerebrovascular disease Diseases 0.000 description 1
- 229960005395 cetuximab Drugs 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 229960004106 citric acid Drugs 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- IDLFZVILOHSSID-OVLDLUHVSA-N corticotropin Chemical compound C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)NC(=O)[C@@H](N)CO)C1=CC=C(O)C=C1 IDLFZVILOHSSID-OVLDLUHVSA-N 0.000 description 1
- 229960000258 corticotropin Drugs 0.000 description 1
- 125000000332 coumarinyl group Chemical group O1C(=O)C(=CC2=CC=CC=C12)* 0.000 description 1
- 125000001047 cyclobutenyl group Chemical group C1(=CCC1)* 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000002933 cyclohexyloxy group Chemical group C1(CCCCC1)O* 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000298 cyclopropenyl group Chemical group [H]C1=C([H])C1([H])* 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 229960002806 daclizumab Drugs 0.000 description 1
- 229960002204 daratumumab Drugs 0.000 description 1
- NDLOVDOICXITOK-UHFFFAOYSA-N dbco-acid Chemical compound OC(=O)CCC(=O)N1CC2=CC=CC=C2C#CC2=CC=CC=C12 NDLOVDOICXITOK-UHFFFAOYSA-N 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 235000020960 dehydroascorbic acid Nutrition 0.000 description 1
- 239000011615 dehydroascorbic acid Substances 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- LSXWFXONGKSEMY-UHFFFAOYSA-N di-tert-butyl peroxide Chemical compound CC(C)(C)OOC(C)(C)C LSXWFXONGKSEMY-UHFFFAOYSA-N 0.000 description 1
- 239000012969 di-tertiary-butyl peroxide Substances 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- IJGRMHOSHXDMSA-UHFFFAOYSA-O diazynium Chemical group [NH+]#N IJGRMHOSHXDMSA-UHFFFAOYSA-O 0.000 description 1
- RUHCATDGSSLXPZ-UHFFFAOYSA-N dicarboxyazaniumylideneazanide Chemical group OC(=O)[N+](=[N-])C(O)=O RUHCATDGSSLXPZ-UHFFFAOYSA-N 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 208000010643 digestive system disease Diseases 0.000 description 1
- QONQRTHLHBTMGP-UHFFFAOYSA-N digitoxigenin Natural products CC12CCC(C3(CCC(O)CC3CC3)C)C3C11OC1CC2C1=CC(=O)OC1 QONQRTHLHBTMGP-UHFFFAOYSA-N 0.000 description 1
- SHIBSTMRCDJXLN-KCZCNTNESA-N digoxigenin Chemical compound C1([C@@H]2[C@@]3([C@@](CC2)(O)[C@H]2[C@@H]([C@@]4(C)CC[C@H](O)C[C@H]4CC2)C[C@H]3O)C)=CC(=O)OC1 SHIBSTMRCDJXLN-KCZCNTNESA-N 0.000 description 1
- 125000004852 dihydrofuranyl group Chemical group O1C(CC=C1)* 0.000 description 1
- 125000005043 dihydropyranyl group Chemical group O1C(CCC=C1)* 0.000 description 1
- 125000005053 dihydropyrimidinyl group Chemical group N1(CN=CC=C1)* 0.000 description 1
- 229940043279 diisopropylamine Drugs 0.000 description 1
- LRHXBHUTQWIZTN-UHFFFAOYSA-N dimethyl heptanediimidate;dihydrochloride Chemical compound Cl.Cl.COC(=N)CCCCCC(=N)OC LRHXBHUTQWIZTN-UHFFFAOYSA-N 0.000 description 1
- LRPQMNYCTSPGCX-UHFFFAOYSA-N dimethyl pimelimidate Chemical compound COC(=N)CCCCCC(=N)OC LRPQMNYCTSPGCX-UHFFFAOYSA-N 0.000 description 1
- 229960004497 dinutuximab Drugs 0.000 description 1
- 125000005879 dioxolanyl group Chemical group 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000003534 dna topoisomerase inhibitor Substances 0.000 description 1
- MOTZDAYCYVMXPC-UHFFFAOYSA-N dodecyl hydrogen sulfate Chemical compound CCCCCCCCCCCCOS(O)(=O)=O MOTZDAYCYVMXPC-UHFFFAOYSA-N 0.000 description 1
- VQNATVDKACXKTF-XELLLNAOSA-N duocarmycin Chemical compound COC1=C(OC)C(OC)=C2NC(C(=O)N3C4=CC(=O)C5=C([C@@]64C[C@@H]6C3)C=C(N5)C(=O)OC)=CC2=C1 VQNATVDKACXKTF-XELLLNAOSA-N 0.000 description 1
- 229960005501 duocarmycin Drugs 0.000 description 1
- 229930184221 duocarmycin Natural products 0.000 description 1
- 229960002224 eculizumab Drugs 0.000 description 1
- 229960000284 efalizumab Drugs 0.000 description 1
- 239000012039 electrophile Substances 0.000 description 1
- 229960004137 elotuzumab Drugs 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 210000001163 endosome Anatomy 0.000 description 1
- 230000006862 enzymatic digestion Effects 0.000 description 1
- 239000002532 enzyme inhibitor Substances 0.000 description 1
- 108010087914 epidermal growth factor receptor VIII Proteins 0.000 description 1
- UFNVPOGXISZXJD-XJPMSQCNSA-N eribulin Chemical compound C([C@H]1CC[C@@H]2O[C@@H]3[C@H]4O[C@H]5C[C@](O[C@H]4[C@H]2O1)(O[C@@H]53)CC[C@@H]1O[C@H](C(C1)=C)CC1)C(=O)C[C@@H]2[C@@H](OC)[C@@H](C[C@H](O)CN)O[C@H]2C[C@@H]2C(=C)[C@H](C)C[C@H]1O2 UFNVPOGXISZXJD-XJPMSQCNSA-N 0.000 description 1
- 229960003649 eribulin Drugs 0.000 description 1
- 125000005448 ethoxyethyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])C([H])([H])* 0.000 description 1
- 125000005745 ethoxymethyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])* 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- CJXGPJZUDUOZDX-UHFFFAOYSA-N fluoromethanone Chemical group F[C]=O CJXGPJZUDUOZDX-UHFFFAOYSA-N 0.000 description 1
- 102000006815 folate receptor Human genes 0.000 description 1
- 108020005243 folate receptor Proteins 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 125000002446 fucosyl group Chemical group C1([C@@H](O)[C@H](O)[C@H](O)[C@@H](O1)C)* 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- 125000001634 furandiyl group Chemical group O1C(=C(C=C1)*)* 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 1
- YPZRWBKMTBYPTK-BJDJZHNGSA-N glutathione disulfide Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@H](C(=O)NCC(O)=O)CSSC[C@@H](C(=O)NCC(O)=O)NC(=O)CC[C@H](N)C(O)=O YPZRWBKMTBYPTK-BJDJZHNGSA-N 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- LPLVUJXQOOQHMX-UHFFFAOYSA-N glycyrrhetinic acid glycoside Natural products C1CC(C2C(C3(CCC4(C)CCC(C)(CC4C3=CC2=O)C(O)=O)C)(C)CC2)(C)C2C(C)(C)C1OC1OC(C(O)=O)C(O)C(O)C1OC1OC(C(O)=O)C(O)C(O)C1O LPLVUJXQOOQHMX-UHFFFAOYSA-N 0.000 description 1
- 229960004949 glycyrrhizic acid Drugs 0.000 description 1
- UYRUBYNTXSDKQT-UHFFFAOYSA-N glycyrrhizic acid Natural products CC1(C)C(CCC2(C)C1CCC3(C)C2C(=O)C=C4C5CC(C)(CCC5(C)CCC34C)C(=O)O)OC6OC(C(O)C(O)C6OC7OC(O)C(O)C(O)C7C(=O)O)C(=O)O UYRUBYNTXSDKQT-UHFFFAOYSA-N 0.000 description 1
- 235000019410 glycyrrhizin Nutrition 0.000 description 1
- 229960001743 golimumab Drugs 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 239000005090 green fluorescent protein Substances 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 208000009601 hereditary spherocytosis Diseases 0.000 description 1
- 150000002391 heterocyclic compounds Chemical class 0.000 description 1
- 125000004836 hexamethylene group Chemical group [H]C([H])([*:2])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[*:1] 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003707 hexyloxy group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])O* 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 229910000042 hydrogen bromide Inorganic materials 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 239000001341 hydroxy propyl starch Substances 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 1
- 235000013828 hydroxypropyl starch Nutrition 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 150000003949 imides Chemical class 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 229960000598 infliximab Drugs 0.000 description 1
- 208000037797 influenza A Diseases 0.000 description 1
- 208000037798 influenza B Diseases 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 108010021315 integrin beta7 Proteins 0.000 description 1
- 108010044426 integrins Proteins 0.000 description 1
- 102000006495 integrins Human genes 0.000 description 1
- 239000000138 intercalating agent Substances 0.000 description 1
- 108040006870 interleukin-10 receptor activity proteins Proteins 0.000 description 1
- 108040001304 interleukin-17 receptor activity proteins Proteins 0.000 description 1
- 102000053460 interleukin-17 receptor activity proteins Human genes 0.000 description 1
- 108010074108 interleukin-21 Proteins 0.000 description 1
- 108040006859 interleukin-5 receptor activity proteins Proteins 0.000 description 1
- 108040006858 interleukin-6 receptor activity proteins Proteins 0.000 description 1
- 108040006861 interleukin-7 receptor activity proteins Proteins 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 238000000752 ionisation method Methods 0.000 description 1
- 229960005386 ipilimumab Drugs 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 239000003350 kerosene Substances 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 208000017169 kidney disease Diseases 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 235000019421 lipase Nutrition 0.000 description 1
- 108010013555 lipoprotein-associated coagulation inhibitor Proteins 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000019423 liver disease Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- HWYHZTIRURJOHG-UHFFFAOYSA-N luminol Chemical compound O=C1NNC(=O)C2=C1C(N)=CC=C2 HWYHZTIRURJOHG-UHFFFAOYSA-N 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- 210000003712 lysosome Anatomy 0.000 description 1
- 230000001868 lysosomic effect Effects 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 208000002780 macular degeneration Diseases 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- WKPWGQKGSOKKOO-RSFHAFMBSA-N maytansine Chemical compound CO[C@@H]([C@@]1(O)C[C@](OC(=O)N1)([C@H]([C@@H]1O[C@@]1(C)[C@@H](OC(=O)[C@H](C)N(C)C(C)=O)CC(=O)N1C)C)[H])\C=C\C=C(C)\CC2=CC(OC)=C(Cl)C1=C2 WKPWGQKGSOKKOO-RSFHAFMBSA-N 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 229940041616 menthol Drugs 0.000 description 1
- 229960005108 mepolizumab Drugs 0.000 description 1
- 208000030159 metabolic disease Diseases 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 125000001360 methionine group Chemical group N[C@@H](CCSC)C(=O)* 0.000 description 1
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 1
- MBAXWTVHCRPVFW-UHFFFAOYSA-N methyl 3-[(3-imino-3-methoxypropyl)disulfanyl]propanimidate Chemical compound COC(=N)CCSSCCC(=N)OC MBAXWTVHCRPVFW-UHFFFAOYSA-N 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 239000010445 mica Substances 0.000 description 1
- 229910052618 mica group Inorganic materials 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 238000002715 modification method Methods 0.000 description 1
- 229950007699 mogamulizumab Drugs 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 229910000403 monosodium phosphate Inorganic materials 0.000 description 1
- 235000019799 monosodium phosphate Nutrition 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 125000004370 n-butenyl group Chemical group [H]\C([H])=C(/[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001298 n-hexoxy group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])O* 0.000 description 1
- 125000003935 n-pentoxy group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])O* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 238000005319 nano flow HPLC Methods 0.000 description 1
- 125000004957 naphthylene group Chemical group 0.000 description 1
- 125000004998 naphthylethyl group Chemical group C1(=CC=CC2=CC=CC=C12)CC* 0.000 description 1
- 125000004923 naphthylmethyl group Chemical group C1(=CC=CC2=CC=CC=C12)C* 0.000 description 1
- 229960005027 natalizumab Drugs 0.000 description 1
- 229960003301 nivolumab Drugs 0.000 description 1
- 208000001618 nondystrophic myotonia Diseases 0.000 description 1
- 125000001400 nonyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 229960003347 obinutuzumab Drugs 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 229960002450 ofatumumab Drugs 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 150000002482 oligosaccharides Chemical class 0.000 description 1
- 229960000470 omalizumab Drugs 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- 201000008482 osteoarthritis Diseases 0.000 description 1
- 108010000953 osteoblast cadherin Proteins 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 125000000160 oxazolidinyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000003566 oxetanyl group Chemical group 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- YPZRWBKMTBYPTK-UHFFFAOYSA-N oxidized gamma-L-glutamyl-L-cysteinylglycine Natural products OC(=O)C(N)CCC(=O)NC(C(=O)NCC(O)=O)CSSCC(C(=O)NCC(O)=O)NC(=O)CCC(N)C(O)=O YPZRWBKMTBYPTK-UHFFFAOYSA-N 0.000 description 1
- 125000000466 oxiranyl group Chemical group 0.000 description 1
- 125000001820 oxy group Chemical group [*:1]O[*:2] 0.000 description 1
- 125000005740 oxycarbonyl group Chemical group [*:1]OC([*:2])=O 0.000 description 1
- 229960000402 palivizumab Drugs 0.000 description 1
- 201000002528 pancreatic cancer Diseases 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- 229960001972 panitumumab Drugs 0.000 description 1
- 229940055729 papain Drugs 0.000 description 1
- 235000019834 papain Nutrition 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 230000006320 pegylation Effects 0.000 description 1
- 125000004115 pentoxy group Chemical group [*]OC([H])([H])C([H])([H])C([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 108010091748 peptide A Proteins 0.000 description 1
- 108040002068 peptide-N4-(N-acetyl-beta-glucosaminyl)asparagine amidase activity proteins Proteins 0.000 description 1
- 108040007629 peroxidase activity proteins Proteins 0.000 description 1
- 229960002087 pertuzumab Drugs 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- RXNXLAHQOVLMIE-UHFFFAOYSA-N phenyl 10-methylacridin-10-ium-9-carboxylate Chemical compound C12=CC=CC=C2[N+](C)=C2C=CC=CC2=C1C(=O)OC1=CC=CC=C1 RXNXLAHQOVLMIE-UHFFFAOYSA-N 0.000 description 1
- 125000000843 phenylene group Chemical group C1(=C(C=CC=C1)*)* 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 150000003016 phosphoric acids Chemical class 0.000 description 1
- 125000004592 phthalazinyl group Chemical group C1(=NN=CC2=CC=CC=C12)* 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- 239000003123 plant toxin Substances 0.000 description 1
- 150000003058 platinum compounds Chemical class 0.000 description 1
- 229920001481 poly(stearyl methacrylate) Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 235000011056 potassium acetate Nutrition 0.000 description 1
- 235000011118 potassium hydroxide Nutrition 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- MVCPDOUDYOUTKS-UHFFFAOYSA-N propanedithioic acid Chemical group CCC(S)=S MVCPDOUDYOUTKS-UHFFFAOYSA-N 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 125000002572 propoxy group Chemical group [*]OC([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- AOHJOMMDDJHIJH-UHFFFAOYSA-N propylenediamine Chemical compound CC(N)CN AOHJOMMDDJHIJH-UHFFFAOYSA-N 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 238000003506 protein modification method Methods 0.000 description 1
- 239000008213 purified water Substances 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000001422 pyrrolinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 229960002633 ramucirumab Drugs 0.000 description 1
- 229960004910 raxibacumab Drugs 0.000 description 1
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 1
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 1
- 108010054624 red fluorescent protein Proteins 0.000 description 1
- 238000006722 reduction reaction Methods 0.000 description 1
- 238000012827 research and development Methods 0.000 description 1
- 229960003254 reslizumab Drugs 0.000 description 1
- 229910052702 rhenium Inorganic materials 0.000 description 1
- WUAPFZMCVAUBPE-UHFFFAOYSA-N rhenium atom Chemical compound [Re] WUAPFZMCVAUBPE-UHFFFAOYSA-N 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 1
- 229960004641 rituximab Drugs 0.000 description 1
- 229910052707 ruthenium Inorganic materials 0.000 description 1
- KZUNJOHGWZRPMI-UHFFFAOYSA-N samarium atom Chemical compound [Sm] KZUNJOHGWZRPMI-UHFFFAOYSA-N 0.000 description 1
- 239000012488 sample solution Substances 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 229960003323 siltuximab Drugs 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 229940126586 small molecule drug Drugs 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- WXMKPNITSTVMEF-UHFFFAOYSA-M sodium benzoate Chemical compound [Na+].[O-]C(=O)C1=CC=CC=C1 WXMKPNITSTVMEF-UHFFFAOYSA-M 0.000 description 1
- 239000004299 sodium benzoate Substances 0.000 description 1
- 235000010234 sodium benzoate Nutrition 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 235000011083 sodium citrates Nutrition 0.000 description 1
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical compound [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 1
- 235000011121 sodium hydroxide Nutrition 0.000 description 1
- 229910052938 sodium sulfate Inorganic materials 0.000 description 1
- 229960003010 sodium sulfate Drugs 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- CIJQGPVMMRXSQW-UHFFFAOYSA-M sodium;2-aminoacetic acid;hydroxide Chemical compound O.[Na+].NCC([O-])=O CIJQGPVMMRXSQW-UHFFFAOYSA-M 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 238000010532 solid phase synthesis reaction Methods 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 230000003068 static effect Effects 0.000 description 1
- 201000011549 stomach cancer Diseases 0.000 description 1
- 229940031000 streptococcus pneumoniae Drugs 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- TYFQFVWCELRYAO-UHFFFAOYSA-L suberate(2-) Chemical compound [O-]C(=O)CCCCCCC([O-])=O TYFQFVWCELRYAO-UHFFFAOYSA-L 0.000 description 1
- 125000000565 sulfonamide group Chemical group 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 1
- 101150047061 tag-72 gene Proteins 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 229910052713 technetium Inorganic materials 0.000 description 1
- GKLVYJBZJHMRIY-UHFFFAOYSA-N technetium atom Chemical compound [Tc] GKLVYJBZJHMRIY-UHFFFAOYSA-N 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 1
- 125000003507 tetrahydrothiofenyl group Chemical group 0.000 description 1
- 125000004632 tetrahydrothiopyranyl group Chemical group S1C(CCCC1)* 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 125000002053 thietanyl group Chemical group 0.000 description 1
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 1
- 229960004072 thrombin Drugs 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- 229960003989 tocilizumab Drugs 0.000 description 1
- 229940044693 topoisomerase inhibitor Drugs 0.000 description 1
- ZGYICYBLPGRURT-UHFFFAOYSA-N tri(propan-2-yl)silicon Chemical compound CC(C)[Si](C(C)C)C(C)C ZGYICYBLPGRURT-UHFFFAOYSA-N 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 235000013337 tricalcium citrate Nutrition 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- XSQUKJJJFZCRTK-UHFFFAOYSA-N urea group Chemical group NC(=O)N XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 229960003824 ustekinumab Drugs 0.000 description 1
- 206010046766 uterine cancer Diseases 0.000 description 1
- UIYCHXAGWOYNNA-UHFFFAOYSA-N vinyl sulfide Chemical group C=CSC=C UIYCHXAGWOYNNA-UHFFFAOYSA-N 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 108010047303 von Willebrand Factor Proteins 0.000 description 1
- VWQVUPCCIRVNHF-UHFFFAOYSA-N yttrium atom Chemical compound [Y] VWQVUPCCIRVNHF-UHFFFAOYSA-N 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/08—Linear peptides containing only normal peptide links having 12 to 20 amino acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6807—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug or compound being a sugar, nucleoside, nucleotide, nucleic acid, e.g. RNA antisense
- A61K47/6809—Antibiotics, e.g. antitumor antibiotics anthracyclins, adriamycin, doxorubicin or daunomycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6849—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a receptor, a cell surface antigen or a cell surface determinant
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6889—Conjugates wherein the antibody being the modifying agent and wherein the linker, binder or spacer confers particular properties to the conjugates, e.g. peptidic enzyme-labile linkers or acid-labile linkers, providing for an acid-labile immuno conjugate wherein the drug may be released from its antibody conjugated part in an acidic, e.g. tumoural or environment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/524—CH2 domain
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Genetics & Genomics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Immunology (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Toxicology (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Cell Biology (AREA)
- Oncology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Peptides Or Proteins (AREA)
Description
〔1〕抗体に対する親和性物質、切断性部分および反応性基を有する化合物またはその塩であって、
前記化合物が、下記式(I):
A-L-B-R (I)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
Rは、前記抗体に対する反応性基である。〕で表されるものであり、かつ
抗体に対する親和性物質が、
式1-1:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-I-I-W-C-(X0-3)b(配列番号58)
式1-2:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-I-V-W-C-(X0-3)b(配列番号59)
式1-3:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-V-V-W-C-(X0-3)b(配列番号60)
式1-4:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-A-V-W-C-(X0-3)b(配列番号61)
式1-5:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-L-W-C-(X0-3)b(配列番号62)
式1-6:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-I-W-C-(X0-3)b(配列番号63)
式1-7:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-V-F-C-(X0-3)b(配列番号64)
式1-8:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-Q-V-W-C-(X0-3)b(配列番号65)
式1-9:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-E-V-W-C-(X0-3)b(配列番号66)
〔式中、
(X0-3)aは、なし、または1~3個の連続する同一または異なる任意のアミノ酸残基(リジン残基およびシステイン残基以外)であり、
(X0-3)bは、なし、または1~3個の連続する同一または異なる任意のアミノ酸残基(リジン残基およびシステイン残基以外)であり、
Xaa1は、アラニン残基、グリシン残基、ロイシン残基、プロリン残基、アルギニン残基、バリン残基、アスパラギン残基、グルタミン酸残基、またはフェニルアラニン残基であり、
Xaa2は、チロシン残基、トリプトファン残基、ヒスチジン残基、またはフェニルアラニン残基であり、
Xaa3は、ヒスチジン残基、フェニルアラニン残基、チロシン残基、トリプトファン残基、アルギニン残基、またはグリシン残基であり、
Xaa4は、リジン残基であり、
Xaa5は、グリシン残基、セリン残基、アスパラギン残基、グルタミン残基、アスパラギン酸残基、グルタミン酸残基、フェニルアラニン残基、チロシン残基、トリプトファン残基、ヒスチジン残基、スレオニン残基、ロイシン残基、アラニン残基、バリン残基、イソロイシン残基、またはアルギニン残基であり、
Xaa6は、グルタミン残基、グルタミン酸残基、アスパラギン残基、アスパラギン酸残基、プロリン残基、グリシン残基、アルギニン残基、フェニルアラニン残基、またはヒスチジン残基である。〕、あるいは
式2-1:(X0-3’)a-C-Xaa1’-Xaa2’-Xaa3’-Xaa4’-Xaa5’-Xaa6’-L-V-W-C-(X0-3’)b(配列番号67)
〔式中、
(X0-3’)aおよび(X0-3’)bはそれぞれ、前記(X0-3)aおよび(X0-3)bと同じであり、
Xaa1’、Xaa2’、Xaa3’、Xaa4’、Xaa5’、Xaa6’はそれぞれ、前記Xaa1、Xaa2、Xaa3、Xaa4、Xaa5、Xaa6と同じである。
但し、(X0-3’)aが1~3個の連続する同一または異なる任意のアミノ酸残基、(X0-3’)bが1~3個の連続する同一または異なる任意のアミノ酸残基、Xaa3’がヒスチジン残基、かつ、Xaa5’がグリシン残基の場合を除く。〕のいずれかのアミノ酸配列を含むペプチドである、化合物またはその塩。
〔2〕(X0-3)aは、なし、アルギニン残基-グリシン残基-アスパラギン残基、アスパラギン酸残基、またはアスパラギン残基であり、
(X0-3)bは、なし、スレオニン残基-チロシン残基-ヒスチジン残基、またはスレオニン残基であり、
Xaa1は、アラニン残基であり、
Xaa2は、チロシン残基、トリプトファン残基、またはヒスチジン残基であり、
Xaa6は、グルタミン残基、グルタミン酸残基、アスパラギン残基、またはアスパラギン酸残基である、〔1〕の化合物またはその塩。
〔3〕(X0-3)aは、グリシン残基-アスパラギン残基、グリシン残基、グリシン残基-グリシン残基、またはグリシン残基-グリシン残基-グリシン残基であり、
(X0-3)bは、スレオニン残基-チロシン残基、グリシン残基、グリシン残基-グリシン残基、またはグリシン残基-グリシン残基-グリシン残基であり、
Xaa1は、グリシン残基、ロイシン残基、プロリン残基、アルギニン残基、バリン残基、アスパラギン残基、グルタミン酸残基、またはフェニルアラニン残基であり、
Xaa2は、フェニルアラニン残基であり、
Xaa6は、プロリン残基、グリシン残基、アルギニン残基、フェニルアラニン残基、またはヒスチジン残基である、〔1〕の化合物またはその塩。
〔4〕抗体に対する親和性物質が、下記からなる群より選ばれるアミノ酸配列を含むペプチドである、〔1〕~〔3〕のいずれかの化合物またはその塩:
(1) RGNCAYHKGQIIWCTYH(配列番号5);
(2) RGNCAYHKGQIVWCTYH(配列番号8);
(3) RGNCAYHKGQVVWCTYH(配列番号9);
(4) RGNCAYHKGQAVWCTYH(配列番号10);
(5) RGNCAYHKGQLLWCTYH(配列番号11);
(6) RGNCAYHKGQLIWCTYH(配列番号12);
(7) DCAYHKGQIVWCT (配列番号13);
(8) DCAYHKGQVVWCT (配列番号14);
(9) DCAYHKGQAVWCT (配列番号15);
(10)RGNCAYHKSQIIWCTYH(配列番号16);
(11)RGNCAYHKNQIIWCTYH(配列番号17);
(12)RGNCAYHKDQIIWCTYH(配列番号18);
(13)RGNCAYHKQQIIWCTYH(配列番号19);
(14)RGNCAYHKEQIIWCTYH(配列番号20);
(15)RGNCAYHKFQIIWCTYH(配列番号21);
(16)RGNCAYHKYQIIWCTYH(配列番号22);
(17)RGNCAYHKWQIIWCTYH(配列番号23);
(18)RGNCAYHKHQIIWCTYH(配列番号24);
(19)RGNCAYHKTQIIWCTYH(配列番号25);
(20)RGNCAYHKLQIIWCTYH(配列番号26);
(21) CAYHKLQIVWC (配列番号27);
(22) CAYHKLQLIWC (配列番号28);
(23) CAYHKSQIVWC (配列番号29);
(24)RGNCAYHKGQLVFCTYH(配列番号30);
(25)RGNCAYHKGQQVWCTYH(配列番号31);
(26)RGNCAYHKGQEVWCTYH(配列番号32);
(27) CAYHKGQLVWC (配列番号33);
(28)RGNCAYHKAQLVWCTYH(配列番号34);
(29)RGNCAYHKVQLVWCTYH(配列番号35);
(30)RGNCAYHKLQLVWCTYH(配列番号36);
(31)RGNCAYHKIQLVWCTYH(配列番号37);
(32)RGNCAYHKSQLVWCTYH(配列番号38);
(33)RGNCAYHKTQLVWCTYH(配列番号39);
(34)RGNCAYHKNQLVWCTYH(配列番号40);
(35)RGNCAYHKDQLVWCTYH(配列番号41);
(36)RGNCAYHKQQLVWCTYH(配列番号42);
(37)RGNCAYHKEQLVWCTYH(配列番号43);
(38)RGNCAYHKFQLVWCTYH(配列番号44);
(39)RGNCAYHKRQLVWCTYH(配列番号45);
(40)RGNCAYHKHQLVWCTYH(配列番号46);
(41)RGNCAYHKWQLVWCTYH(配列番号47);
(42)RGNCAYHKYQLVWCTYH(配列番号48);
(43)RGNCAYFKGQLVWCTYH(配列番号49);
(44)RGNCAYYKGQLVWCTYH(配列番号50);
(45)RGNCAYWKGQLVWCTYH(配列番号51);
(46)RGNCAYRKGQLVWCTYH(配列番号52);
(47)RGNCAYGKGQLVWCTYH(配列番号53);
(48) DCAYHKGQLVWC (配列番号54);
(49) NCAYHKGQLVWC (配列番号55);
(50) CAYHKGQLVWCT (配列番号56);
(51) CAYHKSQLVWC (配列番号57);
(52)RGNCAWHKGQIIWCTYH(配列番号68);
(53)RGNCAFHKGQIIWCTYH(配列番号69);
(54)RGNCAHHKGQIIWCTYH(配列番号70);
(55)RGNCGYHKGQIIWCTYH(配列番号71);
(56)RGNCLYHKGQIIWCTYH(配列番号72);
(57)RGNCPYHKGQIIWCTYH(配列番号73);
(58)RGNCRYHKGQIIWCTYH(配列番号74);
(59)RGNCVYHKGQIIWCTYH(配列番号75);
(60)RGNCNYHKGQIIWCTYH(配列番号76);
(61)RGNCEYHKGQIIWCTYH(配列番号77);
(62)RGNCFYHKGQIIWCTYH(配列番号78);
(63)RGNCAYHKGEIIWCTYH(配列番号79);
(64)RGNCAYHKGNIIWCTYH(配列番号80);
(65)RGNCAYHKGPIIWCTYH(配列番号81);
(66)RGNCAYHKGGIIWCTYH(配列番号82);
(67)RGNCAYHKGDIIWCTYH(配列番号83);
(68)RGNCAYHKGRIIWCTYH(配列番号84);
(69)RGNCAYHKGFIIWCTYH(配列番号85);
(70)RGNCAYHKGHIIWCTYH(配列番号86);
(71) DCAYHKGQIIWCT(配列番号87);
(72) NCAYHKGQIIWCT(配列番号88);
(73) GNCAYHKGQIIWCTY(配列番号89);
(74) GCAYHKGQIIWCG(配列番号90);
(75) GGCAYHKGQIIWCGG(配列番号91);および
(76)GGGCAYHKGQIIWCGGG(配列番号92)。
〔5〕Lが、(i)切断により生体直交性官能基を反応性基側に生成する能力を有する切断性部分を含む2価の基である切断性リンカー、または(ii)切断により生体直交性官能基を反応性基側に生成する能力を有しない切断性部分を含む2価の基である切断性リンカーである、〔1〕~〔4〕のいずれかの化合物またはその塩。
〔6〕Lが前記(i)の切断性リンカーである、〔5〕の化合物またはその塩。
〔7〕Lが前記(i)の切断性リンカーであり、かつ、Bが前記(b)の2価の基である、〔5〕または〔6〕の化合物またはその塩。
〔8〕Lが前記(ii)の切断性リンカーであり、かつ、Bが前記(a)の2価の基である、〔5〕の化合物またはその塩。
〔9〕ペプチドが、モノクローナル抗体のFc領域に対する結合性ペプチドである、〔1〕~〔8〕のいずれかの化合物またはその塩。
〔10〕ペプチドが、IgGのFc領域に対する結合性ペプチドである、〔9〕の化合物またはその塩。
〔11〕前記親和性物質が、下記(A)~(C)からなる群より選ばれるいずれか一つのFc領域タンパク質を含み、かつ抗原結合能を有する抗体に対する親和性物質である、〔1〕~〔10〕のいずれかの化合物またはその塩:
(A)配列番号1のアミノ酸配列を含むFc領域タンパク質;
(B)配列番号1のアミノ酸配列において、1もしくは数個のアミノ酸残基が挿入、付加、欠失もしくは置換されたアミノ酸配列を含むFc領域タンパク質;または
(C)配列番号1のアミノ酸配列と90%以上の同一性を示すアミノ酸配列を含むFc領域タンパク質。
〔12〕ペプチドが、ヒトIgGと結合可能であることを特徴とする、〔1〕~〔11〕のいずれかの化合物またはその塩。
〔13〕切断性部分が、(a)酸性物質、塩基性物質、還元剤、酸化剤、酵素からなる群より選ばれる1種以上の物質による処理、(b)光からなる群より選ばれる物理化学的刺激による処理、または(c)自己分解性の切断性部分を含む切断性リンカーを用いた場合の放置のいずれかにより切断可能な部分である、〔1〕~〔12〕のいずれかの化合物またはその塩。
〔14〕前記切断性部分が、ジスルフィド残基、アセタール残基、ケタール残基、エステル残基、カルバモイル残基、アルコキシアルキル残基、イミン残基、三級アルキルオキシカルバメート残基、シラン残基、ヒドラゾン含有残基、フォスフォルアミデート残基、アコニチル残基、トリチル残基、アゾ残基、ビシナルジオール残基、セレン残基、電子吸引基を有する芳香族環含有残基、クマリン含有残基、スルホン含有残基、不飽和結合含有鎖残基、グリコシル残基からなる群より選ばれる、〔1〕~〔13〕のいずれかの化合物またはその塩。
〔15〕前記(i)の切断性部分が、ジスルフィド残基、エステル残基、アセタール残基、ケタール残基、イミン残基、ビシナルジオール残基からなる群より選ばれる、〔5〕~〔14〕のいずれかの化合物またはその塩。
〔16〕前記(ii)の切断性部分が、エステル残基、カルバモイル残基、アルコキシアルキル残基、イミン残基、三級アルキルオキシカルバメート残基、シラン残基、ヒドラゾン含有残基、フォスフォルアミデート残基、アコニチル残基、トリチル残基、アゾ残基、ビシナルジオール残基、セレン残基、電子吸引基を有する芳香族環含有残基、クマリン含有残基、スルホン含有残基、不飽和結合含有鎖残基、グリコシル残基からなる群より選ばれる、〔5〕~〔14〕のいずれかの化合物またはその塩。
〔17〕切断性部分が、下記:
複数のR2a、複数のR2b、および複数のR2cは、同一または異なって、
(i)水素原子、またはハロゲン原子;
(ii)1価の炭化水素基;
(iii)アラルキル;
(iv)1価の複素環基;
(v)Rc-O-、Rc-C(=O)-、Rc-O-C(=O)-、もしくはRc-C(=O)-O-(Rcは、水素原子、もしくは一価の炭化水素基を示す。);
(vi)NRdRe-、NRdRe-C(=O)-、NRdRe-C(=O)-O-、もしくはRd-C(=O)-NRe-(RdおよびReは、同一もしくは異なって、水素原子、もしくは一価の炭化水素基を示す。);または
(vii)ニトロ基、硫酸基、スルホン酸基、シアノ基、もしくはカルボキシル基
からなる群より選ばれ、
Jは、-CH2-、-O-、または-S-であり、
rは、1~4の任意の整数であり、
○(白丸)はAに対する結合を示し、●(黒丸)はBに対する結合を示す。
化学構造が、切断部位を中心にして非対称である場合、●がAに対する結合を示し、○がBに対する結合を示していてもよい。〕からなる群より選ばれるいずれか一つの化学構造に対応する、〔1〕~〔16〕のいずれかの化合物またはその塩。
〔18〕前記(i)の切断性部分が、以下:
R2aは、〔23〕と同じであり、
○(白丸)はAに対する結合を示し、●(黒丸)はBに対する結合を示す。
化学構造が、切断部位を中心にして非対称である場合、●がAに対する結合を示し、○がBに対する結合を示していてもよい。〕からなる群より選ばれるいずれか一つの化学構造に対応する、〔5〕~〔13〕、〔15〕、〔17〕のいずれかの化合物またはその塩。
〔19〕前記(ii)の切断性部分が、以下:
R2b、R2c、J、rは、〔23〕と同じであり、
○(白丸)はAに対する結合を示し、●(黒丸)はBに対する結合を示す。
化学構造が、切断部位を中心にして非対称である場合、●がAに対する結合を示し、○がBに対する結合を示していてもよい。〕からなる群より選ばれるいずれか一つの化学構造に対応する、〔5〕~〔13〕、〔16〕、〔17〕のいずれかの化合物またはその塩。
〔20〕Lが、下記式(L1)~(L3):
La-C-Lb (L1)
La-C (L2)
C-Lb (L3)
〔式中、
LaおよびLbは、それぞれ、2価の基であり、
Cは、切断性部分である。〕のいずれか一つで表される、〔1〕~〔19〕のいずれかの化合物またはその塩。
〔21〕前記LaおよびLbが、それぞれ、下記(La’)および(Lb’):
pおよびp’は、同一または異なって、0~10の任意の整数であり、
qおよびq’は、同一または異なって、0~10の任意の整数であり、
XおよびX’は、同一または異なって、炭素原子、窒素原子、または単結合(ここで、Xが窒素原子である場合、R1bは存在せず、X’が窒素原子である場合、R1b’は存在しない。Xが単結合である場合、R1aおよびR1bは存在せず、X’が単結合である場合、R1a’およびR1b’は存在しない)であり、
R1a、R1b、R1a’およびR1b’は、同一または異なって、前記(i)~(vii)からなる群より選ばれる原子または基である。〕で表される、〔20〕の化合物またはその塩。
〔22〕生体直交性官能基を含む2価の基が、アジド残基、アルデヒド残基、チオール残基、アルキン残基、アルケン残基、テトラジン残基、ニトロン残基、ヒドロキシルアミン残基、ニトリル残基、ヒドラジン残基、ケトン残基、ボロン酸残基、シアノベンゾチアゾール残基、アリル残基、ホスフィン残基、マレイミド残基、ジスルフィド残基、チオエステル残基、α-ハロカルボニル残基、イソニトリル残基、シドノン残基、セレン残基からなる群より選ばれる生体直交性官能基を主鎖に含む2価の基である、〔1〕~〔21〕のいずれかの化合物またはその塩。
〔23〕生体直交性官能基を含む2価の基が、アジド残基、アルデヒド残基、チオール残基、アルキン残基、アルケン残基、ハロゲン残基、テトラジン残基、ニトロン残基、ヒドロキシルアミン残基、ニトリル残基、ヒドラジン残基、ケトン残基、ボロン酸残基、シアノベンゾチアゾール残基、アリル残基、ホスフィン残基、マレイミド残基、ジスルフィド残基、α-ハロカルボニル残基、イソニトリル残基、シドノン残基、セレン残基からなる群より選ばれる生体直交性官能基を側鎖に含む2価の基である、〔1〕~〔21〕のいずれかの化合物またはその塩。
〔24〕生体直交性官能基が、下記:
R1f、単一もしくは複数のR1gおよび単一もしくは複数のR1hは、同一もしくは異なって、前記(i)~(vii)からなる群より選ばれる原子もしくは基、または電子吸引基であり、
・は、結合手である。)で表されるいずれか一つである、〔1〕~〔23〕のいずれかの化合物またはその塩。
〔25〕前記(b)の2価の基が、置換されていてもよいアルキレン、置換されていてもよいシクロアルキレン、置換されていてもよいアリール、置換されていてもよい2価の複素環基、-NRa-(Raは水素原子、または置換基を示す)、-O-、またはこれらの2以上の組み合わせからなる群より選ばれる、〔1〕~〔24〕のいずれかの化合物またはその塩。
〔26〕Bが、下記式(B-1):
Yは、-NH-、-O-、-CH2-、または下記式(B-2):
VおよびV’は、同一または異なって、-NH-、-O-、-CH2-、または単結合であり、
V1は、生体直交性官能基を含む2価の基であり、
sは、0~10の任意の整数であり、
式(B-2)における○および●は、それぞれ、式(B-1)における○および●と同じ配向である。)であり、
Zは、酸素原子、硫黄原子、または水素原子(Zが水素原子である場合、-C(=Z)-は、-CH2-を示す。)であり、
式(B-1)における○(白丸)は、L側の部分に対する結合を示し、●(黒丸)はR側の部分に対する結合を示す。〕で表される、〔1〕~〔25〕のいずれかの化合物またはその塩。
〔27〕反応性基が、リジン残基、チロシン残基、またはトリプトファン残基のいずれか一つの側鎖に対して特異的な反応性基である、〔1〕~〔26〕のいずれかの化合物またはその塩。
〔28〕反応性基が、リジン残基の側鎖に対して特異的な反応性基である、〔27〕の化合物またはその塩。
〔29〕反応性基が、下記:
R5aおよびR5cは、前記(i)~(vii)からなる群より選ばれる原子または基であり、
R5bは、電子吸引基であり、
jは、1~5の任意の整数であり、
kは、1~4の任意の整数である。〕からなる群より選ばれるいずれか一つの化学構造に対応する、〔1〕~〔28〕のいずれかの化合物またはその塩。
〔30〕AおよびRを連結する主鎖の原子数が4~20個である、〔1〕~〔29〕のいずれかの化合物またはその塩。
〔31〕AおよびRを連結する主鎖が環構造を含まない、〔1〕~〔30〕のいずれかの化合物またはその塩。
〔32〕L-Bで表される部分構造がペプチド部分を含まない、〔1〕~〔31〕のいずれかの化合物またはその塩。
〔33〕前記式(I)で表される化合物が、下記(I’):
A-B2-L’-B1-R (I’)
〔式中、
AおよびRは、前記式(I)のものと同じであり
L’は、切断性部分を含む2価の基である切断性リンカーであり、
B1およびB2は、同一または異なって、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
B1およびB2は、L’を中心にした対称構造を有していてもよい。〕で表される化合物である、〔1〕~〔32〕のいずれかの化合物またはその塩。
〔34〕前記式(I’)で表される化合物が、下記(I’’):
AおよびRは、〔1〕記載の式(I)のものと同じであり、
Cは、切断性部分であり、
p、p’、q、q’、X、X’、R1a、R1a’、R1b、およびR1b’は、〔19〕記載の式(La’)および(Lb’)のものと同じであり、
YおよびY’は、同一または異なって、〔24〕記載の式(B-1)のYと同じであり、
ZおよびZ’は、同一または異なって、前記式(B-1)のZと同じである。〕で表される、〔33〕の化合物またはその塩。
〔35〕抗体の位置選択的修飾試薬であって、
下記式(I):
A-L-B-R (I)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
Rは、前記抗体に対する反応性基である。〕で表される、抗体に対する親和性物質、切断性部分および反応性基を有する化合物またはその塩を含み、かつ
抗体に対する親和性物質が、上記式1-1~1-9、および式2-1のいずれかのアミノ酸配列を含むペプチド〔好ましくは、上記(1)~(76)からなる群より選ばれるアミノ酸配列を含むペプチド。以下同様〕である、試薬。
〔36〕抗体に対する親和性物質、切断性部分および反応性基を有する化合物またはその塩であって、
下記式(I):
A-L-B-R (I)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
Rは、リジン残基の側鎖に対して特異的な反応性基である。〕で表されるものであり、かつ
抗体に対する親和性物質が、上記式1-1~1-9、および式2-1のいずれかのアミノ酸配列を含むペプチドである、化合物またはその塩。
〔37〕抗体の位置選択的修飾試薬であって、
下記式(I):
A-L-B-R (I)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
Rは、リジン残基の側鎖に対して特異的な反応性基である。〕で表される、抗体に対する親和性物質、切断性部分および反応性基を有する化合物またはその塩を含み、かつ
抗体に対する親和性物質が、上記式1-1~1-9、および式2-1のいずれかのアミノ酸配列を含むペプチドである、試薬。
(抗体に対する親和性物質、および切断性部分を有する抗体またはその塩)
〔38〕抗体に対する親和性物質、および切断性部分を有する抗体またはその塩であって、
下記式(II):
A-L-B-R’-T (II)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表されるものであり、かつ
抗体に対する親和性物質が、上記式1-1~1-9、および式2-1のいずれかのアミノ酸配列を含むペプチドである、抗体またはその塩。
〔39〕抗体がモノクローナル抗体である、〔38〕の抗体またはその塩。
〔40〕抗体がIgG抗体である、〔38〕または〔39〕の抗体またはその塩。
〔41〕抗体がヒト由来である、〔38〕~〔40〕のいずれかの抗体またはその塩。
〔42〕抗体が、下記(A)~(C)からなる群より選ばれるいずれか一つのFc領域タンパク質を含み、かつ抗原結合能を有する抗体である、〔38〕~〔41〕のいずれかの抗体またはその塩:
(A)配列番号1のアミノ酸配列を含むFc領域タンパク質;
(B)配列番号1のアミノ酸配列において、1もしくは数個のアミノ酸残基が挿入、付加、欠失もしくは置換されたアミノ酸配列を含むFc領域タンパク質;または
(C)配列番号1のアミノ酸配列と90%以上の同一性を示すアミノ酸配列を含むFc領域タンパク質。
〔43〕抗体が、連続する1~50個のアミノ酸残基からなる標的領域中において特定のアミノ酸残基を1個以上含み、かつ、前記標的領域以外の非標的領域中において前記特定のアミノ酸残基を5個以上含み、
A-L-B-R’で表される構造単位が、前記標的領域中に含まれる1個以上の特定のアミノ酸残基に対して30%以上の位置選択性で結合している、〔38〕~〔42〕のいずれかの抗体またはその塩。
〔44〕前記標的領域が、連続する1~10個のアミノ酸残基からなる領域である、〔43〕の抗体またはその塩。
〔45〕前記標的領域が、連続する1~3個のアミノ酸残基からなる領域である、〔44〕の抗体またはその塩。
〔46〕前記標的領域が、ヒトIgG Fc領域における246~248位のアミノ酸残基からなる領域である、〔45〕の抗体またはその塩。
〔47〕前記位置選択性が50%以上である、〔43〕~〔46〕のいずれかの抗体またはその塩。
〔48〕前記位置選択性が70%以上である、〔47〕の抗体またはその塩。
〔49〕前記位置選択性が90%以上である、〔48〕の抗体またはその塩。
〔50〕前記特定のアミノ酸残基が、特定の位置に存在する特定のアミノ酸を中心としてそれぞれN末端側およびC末端側に対してa個(ここで、aは、1~10の任意の整数である)のアミノ酸残基の遠隔位置までの領域において、前記特定の位置に存在する特定のアミノ酸残基以外に、特定のアミノ酸残基と同種のアミノ酸残基を含まない、〔43〕~〔49〕のいずれかの抗体またはその塩。
〔51〕前記抗体が、複数個の重鎖を含む抗体であり、
Tが、複数個の重鎖中の対応する複数個の標的領域において、A-L-B-R’で表される構造単位を有する結果、前記抗体がA-L-B-R’で表される構造単位を複数個有する、〔38〕~〔50〕のいずれかの抗体またはその塩。
〔52〕重鎖の個数が2個である、〔51〕の抗体またはその塩。
〔53〕抗体と反応性基との間の反応により生成する部分が、リジン残基、チロシン残基、またはトリプトファン残基に対する、リジン残基、チロシン残基、またはトリプトファン残基のいずれか一つの側鎖に対して特異的な反応性基の反応により生成する部分である、〔38〕~〔52〕のいずれかの抗体またはその塩。
〔54〕抗体と反応性基との間の反応により生成する部分が、リジン残基と、リジン残基の側鎖に対して特異的な反応性基との間の反応により生成する部分である、〔38〕~〔53〕のいずれかの抗体またはその塩。
〔55〕前記反応により生成する部分が、下記:
〔56〕AおよびR’を連結する主鎖の原子数が4~20個である、〔38〕~〔55〕のいずれかの抗体またはその塩。
〔57〕AおよびRを連結する主鎖が環構造を含まない、〔38〕~〔56〕のいずれかの抗体またはその塩。
〔58〕L-Bで表される部分構造がペプチド部分を含まない、〔38〕~〔57〕のいずれかの抗体またはその塩。
〔59〕前記式(II)で表される化合物が、下記(II’):
A-B2-L’-B1-R’-T (II’)
〔式中、
A、R’およびTは、前記式(II)のものと同じであり
L’は、切断性部分を含む2価の基である切断性リンカーであり、
B1およびB2は、同一または異なって、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
B1およびB2は、L’を中心にした対称構造を有していてもよい。〕で表される化合物である、〔38〕~〔58〕のいずれかの抗体またはその塩。
〔60〕前記式(II’)で表される化合物が、下記(II’’):
A、R’およびTは、〔36〕記載の式(II)のものと同じであり、
Cは、切断性部分であり、
pおよびp’は、同一または異なって、0~10の任意の整数であり、
qおよびq’は、同一または異なって、0~10の任意の整数であり、
XおよびX’は、同一または異なって、炭素原子、窒素原子、または単結合(ここで、Xが窒素原子である場合、R1bは存在せず、X’が窒素原子である場合、R1b’は存在しない。Xが単結合である場合、R1aおよびR1bは存在せず、X’が単結合である場合、R1a’およびR1b’は存在しない)であり、
R1a、R1b、R1a’およびR1b’は、同一または異なって、
(i)水素原子、またはハロゲン原子;
(ii)1価の炭化水素基;
(iii)アラルキル;
(iv)1価の複素環基;
(v)Rc-O-、Rc-C(=O)-、Rc-O-C(=O)-、もしくはRc-C(=O)-O-(Rcは、水素原子、もしくは一価の炭化水素基を示す。);
(vi)NRdRe-、NRdRe-C(=O)-、NRdRe-C(=O)-O-、もしくはRd-C(=O)-NRe-(RdおよびReは、同一もしくは異なって、水素原子、もしくは一価の炭化水素基を示す。);または
(vii)ニトロ基、硫酸基、スルホン酸基、シアノ基、もしくはカルボキシル基
からなる群より選ばれ、
YおよびY’は、同一または異なって、〔24〕記載の式(B-1)のYと同じであり、
ZおよびZ’は、同一または異なって、前記式(B-1)のZと同じである。〕で表される、〔59〕の抗体またはその塩。
〔61〕抗体に対する親和性物質、および切断性部分を有する抗体またはその塩であって、
下記式(II):
A-L-B-R’-T (II)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
R’は、抗体と、リジン残基の側鎖に対して特異的な反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕表されるものであり、かつ
抗体に対する親和性物質が、上記式1-1~1-9、および式2-1のいずれかのアミノ酸配列を含むペプチドである、抗体またはその塩。
〔62〕抗体に対する親和性物質、および切断性部分を有する抗体またはその塩の製造方法であって、
下記式(I):
A-L-B-R (I)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
Rは、前記抗体に対する反応性基である。〕で表される、抗体に対する親和性物質、切断性部分および反応性基を有する化合物またはその塩を、抗体と反応させて、
下記式(II):
A-L-B-R’-T (II)
〔式中、
A、L、およびBは、前記式(I)のものと同じであり、
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表される、抗体に対する親和性物質、および切断性部分を有する抗体またはその塩を生成することを含み、かつ
抗体に対する親和性物質が、上記式1-1~1-9、および式2-1のいずれかのアミノ酸配列を含むペプチドである、方法。
〔63〕反応性基が、リジン残基の側鎖に対して特異的な反応性基である、〔62〕の方法。
(抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩)
〔64〕抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩であって、
下記式(III):
A-L-B’(-F)-R’-T (III)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
B’は、機能性物質と生体直交性官能基との間の反応により生成する部分を含む3価の基であり、
Fは、機能性物質であり、
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表されるものであり、かつ
抗体に対する親和性物質が、上記式1-1~1-9、および式2-1のいずれかのアミノ酸配列を含むペプチドである、複合体またはその塩。
〔65〕抗体がモノクローナル抗体である、〔64〕の複合体またはその塩。
〔66〕抗体がIgG抗体である、〔64〕または〔65〕の複合体またはその塩。
〔67〕抗体がヒト由来である、〔64〕~〔66〕のいずれかの複合体またはその塩。
〔68〕抗体が、下記(A)~(C)からなる群より選ばれるいずれか一つのFc領域タンパク質を含み、かつ抗原結合能を有する抗体である、〔64〕~〔67〕のいずれかの複合体またはその塩:
(A)配列番号1のアミノ酸配列を含むFc領域タンパク質;
(B)配列番号1のアミノ酸配列において、1もしくは数個のアミノ酸残基が挿入、付加、欠失もしくは置換されたアミノ酸配列を含むFc領域タンパク質;または
(C)配列番号1のアミノ酸配列と90%以上の同一性を示すアミノ酸配列を含むFc領域タンパク質。
〔69〕抗体が、連続する1~50個のアミノ酸残基からなる標的領域中において特定のアミノ酸残基を1個以上含み、かつ、前記標的領域以外の非標的領域中において前記特定のアミノ酸残基を5個以上含み、
A-L-B’(-F)-R’で表される構造単位が、前記標的領域中に含まれる1個以上の特定のアミノ酸残基に対して30%以上の位置選択性で結合している、〔64〕~〔68〕のいずれかの複合体またはその塩。
〔70〕前記特定のアミノ酸残基が、特定の位置に存在する特定のアミノ酸を中心としてそれぞれN末端側およびC末端側に対してa個(ここで、aは、1~10の任意の整数である)のアミノ酸残基の遠隔位置までの領域において、前記特定の位置に存在する特定のアミノ酸残基以外に、特定のアミノ酸残基と同種のアミノ酸残基を含まない、〔69〕の複合体またはその塩。
〔71〕前記抗体が、複数個の重鎖を含む抗体であり、
Tが、複数個の重鎖中の対応する複数個の標的領域において、A-L-B’(-F)-R’で表される構造単位を有する結果、前記抗体がA-L-B’(-F)-R’で表される構造単位を複数個有する、〔64〕~〔70〕のいずれかの複合体またはその塩。
〔72〕前記機能性物質が、生体直交性官能基と反応し易い官能基を有する場合、または、生体直交性官能基と反応し易い官能基を有するように誘導体化されている場合、前記生体直交性官能基と反応し易い官能基が、アジド残基、アルデヒド残基、チオール残基、アルキン残基、アルケン残基、ハロゲン残基、テトラジン残基、ニトロン残基、ヒドロキシルアミン残基、ニトリル残基、ヒドラジン残基、ケトン残基、ボロン酸残基、シアノベンゾチアゾール残基、アリル残基、ホスフィン残基、マレイミド残基、ジスルフィド残基、チオエステル残基、α-ハロカルボニル残基、イソニトリル残基、シドノン残基、セレン残基からなる群より選ばれる基である、〔64〕~〔71〕のいずれかの複合体またはその塩。
〔73〕前記機能性物質が、生体直交性官能基と反応し易い官能基を有する場合、または、生体直交性官能基と反応し易い官能基を有するように誘導体化されている場合、前記生体直交性官能基と反応し易い官能基が、下記:
R1f、単一もしくは複数のR1gおよび単一もしくは複数のR1hは、同一もしくは異なって、前記(i)~(vii)からなる群より選ばれる原子もしくは基、または電子吸引基であり、・は、機能性物質に対する結合手である。)で表される基からなる群より選ばれる基である、〔64〕~〔71〕のいずれかの複合体またはその塩。
〔74〕抗体と反応性基との間の反応により生成する部分が、リジン残基、チロシン残基、またはトリプトファン残基と、リジン残基、チロシン残基、またはトリプトファン残基のいずれか一つの側鎖に対して特異的な反応性基との間の反応により生成する部分である、〔64〕~〔73〕のいずれかの複合体またはその塩。
〔75〕抗体と反応性基との間の反応により生成する部分が、リジン残基と、リジン残基の側鎖に対して特異的な反応性基との間の反応により生成する部分である、〔64〕~〔74〕のいずれかの複合体またはその塩。
〔76〕前記反応により生成する部分が、下記:
〔77〕機能性物質が薬物または標識物質である、〔64〕~〔76〕のいずれかの複合体またはその塩。
〔78〕機能性物質が低分子化合物である、〔64〕~〔77〕のいずれかの複合体またはその塩。
〔79〕薬物が抗癌剤である、〔77〕または〔78〕の複合体またはその塩。
〔80〕AおよびR’を連結する主鎖の原子数が4~20個である、〔64〕~〔79〕のいずれかの複合体またはその塩。
〔81〕AおよびRを連結する主鎖が環構造を含まない、〔64〕~〔80〕のいずれかの複合体またはその塩。
〔82〕L-Bで表される部分構造がペプチド部分を含まない、〔64〕~〔81〕のいずれかの複合体またはその塩。
〔83〕前記式(III)で表される化合物が、下記式(III’):
A-B2’(-F2)-L’-B1’(-F1)-R’-T (III’)
〔式中、
A、R’およびTは、前記式(II)のものと同じであり、
L’は、切断性部分を含む2価の基である切断性リンカーであり、
B1’およびB2’は、同一または異なって、機能性物質と生体直交性官能基との間の反応により生成する部分を含む3価の基であり、
F1およびF2は、同一または異なって、機能性物質であり、
B1’(-F1)およびB2’(-F2)は、L’を中心にした対称構造を有していてもよい。〕で表される、〔64〕~〔82〕のいずれかの複合体またはその塩。
〔84〕前記式(III’)で表される化合物が、下記(III’’):
A、R’およびTは、〔62〕記載の式(III)のものと同じであり、
Cは、切断性部分であり、
pおよびp’は、同一または異なって、0~10の任意の整数であり、
qおよびq’は、同一または異なって、0~10の任意の整数であり、
XおよびX’は、同一または異なって、炭素原子、窒素原子、または単結合(ここで、Xが窒素原子である場合、R1bは存在せず、X’が窒素原子である場合、R1b’は存在しない。Xが単結合である場合、R1aおよびR1bは存在せず、X’が単結合である場合、R1a’およびR1b’は存在しない)であり、
R1a、R1b、R1a’およびR1b’は、同一または異なって、前記(i)~(vii)からなる群より選ばれ、
YおよびY’は、同一または異なって、前記式(B-1)のYから水素原子を一つ除いた残基であり、
ZおよびZ’は、同一または異なって、前記式(B-1)のZと同じであり、
FおよびF’は、同一または異なって、機能性物質である。〕で表される、〔83〕の複合体またはその塩。
〔85〕親和性物質、機能性物質および抗体を有する複合体またはその塩であって、
下記式(III):
A-L-B’(-F)-R’-T (III)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
B’は、機能性物質と生体直交性官能基との間の反応により生成する部分を含む3価の基であり、
Fは、機能性物質であり、
R’は、抗体と、リジン残基の側鎖に対して特異的な反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表されるものであり、かつ
抗体に対する親和性物質が、上記式1-1~1-9、および式2-1のいずれかのアミノ酸配列を含むペプチドである、複合体またはその塩。
〔86〕抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩の製造方法であって、
下記式(II):
A-L-B-R’-T (II)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基であり、
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表される、抗体に対する親和性物質、および切断性部分を有する抗体またはその塩を、機能性物質と反応させて、
下記式(III):
A-L-B’(-F)-R’-T (III)
〔式中、
A、L、R’およびTは、前記式(II)のものと同じであり、
B’は、機能性物質と生体直交性官能基との間の反応により生成する部分を含む3価の基であり、
Fは、機能性物質である。〕で表される、抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩を生成することを含み、かつ
抗体に対する親和性物質が、上記式1-1~1-9、および式2-1のいずれかのアミノ酸配列を含むペプチドである、方法。
〔87〕反応性基が、リジン残基の側鎖に対して特異的な反応性基である、〔86〕の方法。
〔88〕抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩の製造方法であって、
(A)下記式(I):
A-L-B-R (I)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基であり、
Rは、前記抗体に対する反応性基である。〕で表される化合物またはその塩を、抗体と反応させて、
下記式(II):
A-L-B-R’-T (II)
〔式中、
A、L、およびBは、前記式(I)のものと同じであり
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表される、抗体に対する親和性物質、および切断性部分を有する抗体またはその塩を生成すること、ならびに
(B)前記抗体に対する親和性物質、および切断性部分を有する抗体またはその塩を、機能性物質と反応させて、
下記式(III):
A-L-B’(-F)-R’-T (III)
〔式中、
AおよびLは、前記式(I)のものと同じであり、
R’およびTは、前記式(II)のものと同じであり、
B’は、機能性物質と生体直交性官能基との間の反応により生成する部分を含む3価の基であり、
Fは、機能性物質である。〕で表される、抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩を生成することを含み、かつ
抗体に対する親和性物質が、上記式1-1~1-9、および式2-1のいずれかのアミノ酸配列を含むペプチドである、方法。
〔89〕生体直交性官能基を有する抗体またはその塩の製造方法であって、
下記式(II):
A-L-B-R’-T (II)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表される、抗体に対する親和性物質、および切断性部分を有する抗体またはその塩の切断性部分を切断して、
下記式(IV):
L1-B-R’-T (IV)
〔式中、
B、R’およびTは、前記式(II)のものと同じであり、
L1は、(i’)生体直交性官能基を含む1価の基、または(ii’)生体直交性官能基を含まない1価の基である。〕で表される、生体直交性官能基を有する抗体またはその塩を生成することを含み、かつ
抗体に対する親和性物質が、上記式1-1~1-9、および式2-1のいずれかのアミノ酸配列を含むペプチドである、方法。
〔90〕Lが、(i)切断により生体直交性官能基を反応性基側に生成する能力を有する切断性部分を含む2価の基である切断性リンカー、または(ii)切断により生体直交性官能基を反応性基側に生成する能力を有しない切断性部分を含む2価の基である切断性リンカーである、〔89〕の方法。
〔91〕Lが前記(i)の切断性リンカーであり、
L1が、(i’)生体直交性官能基を含む1価の基であり、
Bが、前記(a)または(b)の2価の基である、〔89〕の方法。
〔92〕Lが前記(i)の切断性リンカーであり、
L1が(i’)生体直交性官能基を含む1価の基であり、
Bが前記(b)の2価の基である、〔90〕または〔91〕の方法。
〔93〕Lが前記(ii)の切断性リンカーであり、
L1が(i’)生体直交性官能基を含まない1価の基であり、
Bが前記(a)の2価の基である、〔90〕の方法。
〔94〕反応性基が、リジン残基の側鎖に対して特異的な反応性基である、〔89〕~〔93〕のいずれかの方法。
〔95〕生体直交性官能基を有する抗体またはその塩の製造方法であって、
(A)下記式(I):
A-L-B-R (I)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
Rは、前記抗体に対する反応性基である。〕で表される化合物またはその塩を、抗体と反応させて、
下記式(II):
A-L-B-R’-T (II)
〔式中、
A、L、およびBは、前記式(I)のものと同じであり
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表される、抗体に対する親和性物質、および切断性部分を有する抗体またはその塩を生成すること、ならびに
(B)前記抗体に対する親和性物質、および切断性部分を有する抗体またはその塩の切断性部分を切断して、
下記式(IV):
L1-B-R’-T (IV)
〔式中、
B、R’およびTは、前記式(II)のものと同じであり、
L1は、(i’)生体直交性官能基を含む1価の基、または(ii’)生体直交性官能基を含まない1価の基である。〕で表される、生体直交性官能基を有する抗体またはその塩を生成することを含み、かつ
抗体に対する親和性物質が、上記式1-1~1-9、および式2-1のいずれかのアミノ酸配列を含むペプチドである、方法。
〔96〕機能性物質を有する抗体またはその塩の製造方法であって、
下記式(III):
A-L-B’(-F)-R’-T (III)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
B’は、機能性物質と生体直交性官能基との間の反応により生成する部分を含む3価の基であり、
Fは、機能性物質であり、
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表される、抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩の切断性部分を切断して、
下記式(V):
F-(L1-B)’-R’-T (V)
〔式中、
L1は、(i’)生体直交性官能基を含む1価の基、または(ii’)生体直交性官能基を含まない1価の基であり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
(L1-B)’で表される構造単位は、機能性物質と、(i’)および(a)における生体直交性官能基のいずれか一方または双方との間の反応により生成する部分を含む2価の構造単位であり、
Fは、機能性物質であり、
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表される、機能性物質を有する抗体またはその塩を生成することを含み、かつ
抗体に対する親和性物質が、上記式1-1~1-9、および式2-1のいずれかのアミノ酸配列を含むペプチドである、方法。
〔97〕前記抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩の切断性部分を切断して、
下記式(V1):
L1-B’(-F)-R’-T (V1)
〔式中、
L1は、(i’)生体直交性官能基を含む1価の基、または(ii’)生体直交性官能基を含まない1価の基であり、
B’、F、R’およびTは、前記式(III)のものと同じである。〕で表される、機能性物質を有する抗体またはその塩を生成することを含む方法である、〔96〕の方法。
〔98〕前記生体直交性官能基を有する抗体またはその塩を、1種または2種の機能性物質と反応させて、
下記式(V2):
F-L1’-B-R’-T (V2)
〔式中、
B、R’およびTは、前記式(IV)のものと同じであり、
L1’は、機能性物質と、(i’)生体直交性官能基を含む1価の基との間の反応により生成する部分を含む2価の基であり、
Fは、機能性物質である。〕、または
下記式(V3):
Fa-L1’-B’(-Fb)-R’-T (V3)
〔式中、
R’およびTは、前記式(IV)のものと同じであり、
L1’は、前記式(V2)のものと同じであり、
B’は、機能性物質と生体直交性官能基との間の反応により生成する部分を含む3価の基であり、
FaおよびFbは、それぞれ、同一または異なる機能性物質である。〕で表される、機能性物質を有する抗体またはその塩を生成することを含む方法である、〔96〕の方法。
〔99〕反応性基が、リジン残基の側鎖に対して特異的な反応性基である、〔96〕~〔98〕のいずれかの方法。
〔100〕機能性物質を有する抗体またはその塩の製造方法であって、
(A)下記式(II):
A-L-B-R’-T (II)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基であり、
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表される、抗体に対する親和性物質、および切断性部分を有する抗体またはその塩を、機能性物質と反応させて、
下記式(III):
A-L-B’(-F)-R’-T (III)
〔式中、
A、L、R’およびTは、前記式(II)のものと同じであり、
B’は、機能性物質と生体直交性官能基との間の反応により生成する部分を含む3価の基であり、
Fは、機能性物質である。〕で表される、抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩を生成すること、ならびに
(B)前記抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩の切断性部分を切断して、
下記式(V1):
L1-B’(-F)-R’-T (V1)
〔式中、
L1は、(i’)生体直交性官能基を含む1価の基、または(ii’)生体直交性官能基を含まない1価の基であり、
B’、F、R’およびTは、前記式(III)のものと同じである。〕で表される、機能性物質を有する抗体またはその塩を生成することを含み、かつ
抗体に対する親和性物質が、上記式1-1~1-9、および式2-1のいずれかのアミノ酸配列を含むペプチドである、方法。
〔101〕機能性物質を有する抗体またはその塩の製造方法であって、
(A)下記式(I):
A-L-B-R (I)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基であり、
Rは、前記抗体に対する反応性基である。〕で表される、抗体に対する親和性物質、切断性部分および反応性基を有する化合物またはその塩を、抗体と反応させて、
下記式(II):
A-L-B-R’-T (II)
〔式中、
A、L、およびBは、前記式(I)のものと同じであり
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表される、抗体に対する親和性物質、および切断性部分を有する抗体またはその塩を生成すること、
(B)前記抗体に対する親和性物質、および切断性部分を有する抗体またはその塩を、機能性物質と反応させて、
下記式(III):
A-L-B’(-F)-R’-T (III)
〔式中、
AおよびLは、前記式(I)のものと同じであり、
R’およびTは、前記式(II)のものと同じであり、
B’は、機能性物質と生体直交性官能基との間の反応により生成する部分を含む3価の基であり、
Fは、機能性物質である。〕で表される、抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩を生成すること、ならびに
(C)前記抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩の切断性部分を切断して、
下記式(V1):
L1-B’(-F)-R’-T (V1)
〔式中、
L1は、(i’)生体直交性官能基を含む1価の基、または(ii’)生体直交性官能基を含まない1価の基であり、
B’、F、R’およびTは、前記式(III)のものと同じである。〕で表される、機能性物質を有する抗体またはその塩を生成することを含み、かつ
抗体に対する親和性物質が、上記式1-1~1-9、および式2-1のいずれかのアミノ酸配列を含むペプチドである、方法。
〔102〕機能性物質を有する抗体またはその塩の製造方法であって、
(A)下記式(II):
A-L-B-R’-T (II)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表される、抗体に対する親和性物質、および切断性部分を有する抗体またはその塩の切断性部分を切断して、
下記式(IV):
L1-B-R’-T (IV)
〔式中、
B、R’およびTは、前記式(II)のものと同じであり、
L1は、(i’)生体直交性官能基を含む1価の基、または(ii’)生体直交性官能基を含まない1価の基である。〕で表される、生体直交性官能基を有する抗体またはその塩を生成すること、ならびに
(B)前記生体直交性官能基を有する抗体またはその塩を、1種または2種以上の機能性物質と反応させて、
下記式(V2)
F-L1’-B-R’-T (V2)
〔式中、
B、R’およびTは、前記式(IV)のものと同じであり、
L1’は、機能性物質と、(i’)生体直交性官能基を含む1価の基との間の反応により生成する部分を含む2価の基であり、
Fは、機能性物質である。〕、または
下記式(V3):
Fa-L1’-B’(-Fb)-R’-T (V3)
〔式中、
R’およびTは、前記式(IV)のものと同じであり、
L1’は、前記式(V2)のものと同じであり、
B’は、機能性物質と生体直交性官能基との間の反応により生成する部分を含む3価の基であり、
FaおよびFbは、それぞれ、同一または異なる機能性物質である。〕で表される、機能性物質を有する抗体またはその塩を生成することを含み、かつ
抗体に対する親和性物質が、上記式1-1~1-9、および式2-1のいずれかのアミノ酸配列を含むペプチドである、方法。
〔103〕機能性物質を有する抗体またはその塩の製造方法であって、
(A)下記式(I):
A-L-B-R (I)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
Rは、前記抗体に対する反応性基である。〕で表される化合物またはその塩を、抗体と反応させて、
下記式(II):
A-L-B-R’-T (II)
〔式中、
A、L、およびBは、前記式(I)のものと同じであり
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表される、抗体に対する親和性物質、および切断性部分を有する抗体またはその塩を生成すること、
(B)前記抗体に対する親和性物質、および切断性部分を有する抗体またはその塩の切断性部分を切断して、
下記式(IV):
L1-B-R’-T (IV)
〔式中、
B、R’およびTは、前記式(II)のものと同じであり、
L1は、(i’)生体直交性官能基を含む1価の基、または(ii’)生体直交性官能基を含まない1価の基である。〕で表される、生体直交性官能基を有する抗体またはその塩を生成すること、ならびに
(C)前記生体直交性官能基を有する抗体またはその塩を、1種または2種以上の機能性物質と反応させて、
下記式(V2)
F-L1’-B-R’-T (V2)
〔式中、
B、R’およびTは、前記式(IV)のものと同じであり、
L1’は、機能性物質と、(i’)生体直交性官能基を含む1価の基との間の反応により生成する部分を含む2価の基であり、
Fは、機能性物質である。〕、または
下記式(V3):
Fa-L1’-B’(-Fb)-R’-T (V3)
〔式中、
R’およびTは、前記式(IV)のものと同じであり、
L1’は、前記式(V2)のものと同じであり、
B’は、機能性物質と生体直交性官能基との間の反応により生成する部分を含む3価の基であり、
FaおよびFbは、それぞれ、同一または異なる機能性物質である。〕で表される、機能性物質を有する抗体またはその塩を生成することを含み、かつ
抗体に対する親和性物質が、上記式1-1~1-9、および式2-1のいずれかのアミノ酸配列を含むペプチドである、方法。
(I)本発明の化合物またはその塩、(II)抗体に対する親和性物質、および切断性部分を(位置選択的に)有する本発明の抗体またはその塩、(III)抗体に対する親和性物質、切断性部分、機能性物質および抗体を(位置選択的に)有する本発明の複合体またはその塩は、例えば、生体直交性官能基を(位置選択的に)有する抗体またはその塩、および機能性物質を(位置選択的に)有する抗体またはその塩の調製のための中間体として有用である。機能性物質を(位置選択的に)有する抗体またはその塩は、例えば、医薬、または試薬(例、診断薬、研究用試薬)として有用である。生体直交性官能基を(位置選択的に)有する抗体またはその塩は、機能性物質を(位置選択的に)有する抗体またはその塩の調製のための中間体として有用である。したがって、(I)本発明の化合物またはその塩、(II)本発明の抗体またはその塩、および(III)本発明の複合体またはその塩は、例えば、医薬、または試薬の合成中間体として有用である。
1-1.概要
本発明は、式(I)で表される、抗体に対する親和性物質、切断性部分および反応性基を含む化合物またはその塩を提供する。
A-L-B-R (I)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
Rは、前記抗体に対する反応性基である。〕
式(I)において、Aは、抗体に対する親和性物質である。親和性物質とは、抗体に対して非共有結合による結合能を有する物質である。
(1)露出リジン残基
CH2ドメイン(246位、248位、274位、288位、290位、317位、320位、322位、338位)
CH3ドメイン(360位、414位、439位)
(2)露出チロシン残基
CH2ドメイン(278位、296位、300位)
CH3ドメイン(436位)
したがって、ヒトIgG1等のヒトIgGがリジン残基またはチロシン残基で修飾される場合、上記位置での修飾が好ましい。
(1’)露出リジン残基
CH2ドメイン(246位、248位、274位、288位、290位、317位、320位、322位)
CH3ドメイン(360位、414位、439位)
(2’)露出チロシン残基
CH2ドメイン(278位、296位、300位)
CH3ドメイン(436位)
したがって、ヒトIgG1等のヒトIgGがリジン残基またはチロシン残基で修飾される場合、上記位置での修飾がより好ましい。
(1)Lys248残基(以下、本明細書では単に「Lys248」とも表記し、ヒトIgG CH2領域(配列番号1)の18番目の残基に相当する)またはLys246残基(以下、本明細書では単に「Lys246」とも表記し、ヒトIgG CH2領域(配列番号1)の16番目の残基に相当する);
(2)Lys288残基(以下、本明細書では単に「Lys288」とも表記し、ヒトIgG CH2領域(配列番号1)の58番目の残基に相当する)またはLys290残基(以下、本明細書では単に「Lys290」とも表記し、ヒトIgG CH2領域(配列番号1)の60番目の残基に相当する);
(3)Lys317残基(以下、本明細書では単に「Lys317」とも表記し、ヒトIgG CH2領域(配列番号1)の87番目の残基に相当する)。
PD-L1、GD2、PDGFRα(血小板由来成長因子受容体)、CD22、HER2、ホスファチジルセリン(PS)、EpCAM、フィブロネクチン、PD-1、VEGFR-2、CD33、HGF、gpNMB、CD27、DEC-205、葉酸受容体、CD37、CD19、Trop2、CEACAM5、S1P、HER3、IGF-1R、DLL4、TNT-1/B、CPAAs、PSMA、CD20、CD105(エンドグリン)、ICAM-1、CD30、CD16A、CD38、MUC1、EGFR、KIR2DL1,2,、NKG2A、tenascin-C、IGF(Insulin-like growth factor)、CTLA-4、mesothelin、CD138、c-Met、Ang2、VEGF-A、CD79b、ENPD3、葉酸受容体α、TEM-1、GM2、グリピカン3、macrophage inhibitory factor、CD74、Notch1、Notch2、Notch3、CD37、TLR-2、CD3、CSF-1R、FGFR2b、HLA-DR、GM-CSF、EphA3、B7-H3、CD123、gpA33、Frizzled7受容体、DLL4、VEGF、RSPO、LIV-1、SLITRK6、Nectin-4、CD70、CD40、CD19、SEMA4D(CD100)、CD25、MET、Tissue Factor、IL-8、EGFR、cMet、KIR3DL2、Bst1(CD157)、P-カドヘリン、CEA、GITR、TAM(tumor associated macrophage)、CEA、DLL4、Ang2、CD73、FGFR2、CXCR4、LAG-3、GITR、Fucosyl GM1、IGF-1、Angiopoietin 2、CSF-1R、FGFR3、OX40、BCMA、ErbB3、CD137(4-1BB)、PTK7、EFNA4、FAP、DR5、CEA、Ly6E、CA6、CEACAM5、LAMP1、tissue factor、EPHA2、DR5、B7-H3、FGFR4、FGFR2、α2-PI、A33、GDF15、CAIX、CD166、ROR1、GITR、BCMA、TBA、LAG-3、EphA2、TIM-3、CD-200、EGFRvIII、CD16A、CD32B、PIGF、Axl、MICA/B、Thomsen-Friedenreich、CD39、CD37、CD73、CLEC12A、Lgr3、トランスフェリン受容体、TGFβ、IL-17、5T4、RTK、Immune Suppressor Protein、NaPi2b、ルイス血液型B抗原、A34、Lysil-Oxidase、DLK-1、TROP-2、α9インテグリン、TAG-72(CA72-4)、CD70
IL-17、IL-6R、IL-17R、INF-α、IL-5R、IL-13、IL-23、IL-6、ActRIIB、β7-Integrin、IL-4αR、HAS、Eotaxin-1、CD3、CD19、TNF-α、IL-15、CD3ε、Fibronectin、IL-1β、IL-1α、IL-17、TSLP(Thymic Stromal Lymphopoietin)、LAMP(Alpha4 Beta 7 Integrin)、IL-23、GM-CSFR、TSLP、CD28、CD40、TLR-3、BAFF-R、MAdCAM、IL-31R、IL-33、CD74、CD32B、CD79B、IgE(免疫グロブリンE)、IL-17A、IL-17F、C5、FcRn、CD28、TLR4、MCAM、B7RP1、CXCR1,2 Ligands、IL-21、Cadherin-11、CX3CL1、CCL20、IL-36R、IL-10R、CD86、TNF-α、IL-7R、Kv1.3、α9インテグリン、LIFHT
CGRP、CD20、βアミロイド、βアミロイドプロトフィブリン、Calcitonin Gene-Related Peptide Receptor、LINGO(Ig Domain Containing1)、αシヌクレイン、細胞外tau、CD52、インスリン受容体、tauタンパク、TDP-43、SOD1、TauC3、JCウイルス
Clostridium Difficile toxin B、サイトメガロウイルス、RSウイルス、LPS、S.Aureus Alpha-toxin、M2eタンパク、Psl、PcrV、S.Aureus toxin、インフルエンザA、Alginate、黄色ブドウ球菌、PD-L1、インフルエンザB、アシネトバクター、F-protein、Env、CD3、病原性大腸菌、クレブシエラ、肺炎球菌
アミロイドAL、SEMA4D(CD100)、インスリン受容体、ANGPTL3、IL4、IL13、FGF23、副腎皮質刺激ホルモン、トランスサイレチン、ハンチンチン
Factor D、IGF-1R、PGDFR、Ang2、VEGF-A、CD-105(Endoglin)、IGF-1R、βアミロイド
Sclerostin、Myostatin、Dickkopf-1、GDF8、RNAKL、HAS、Siglec-15
vWF、Factor IXa、Factor X、IFNγ、C5、BMP-6、Ferroportin、TFPI
BAFF(B cell activating factor)、IL-1β、PCSK9、NGF、CD45、TLR-2、GLP-1、TNFR1、C5、CD40、LPA、プロラクチン受容体、VEGFR-1、CB1、Endoglin、PTH1R、CXCL1、CXCL8、IL-1β、AT2-R、IAPP
(A)配列番号1のアミノ酸配列を含むFc領域タンパク質;
(B)配列番号1のアミノ酸配列において、1もしくは数個のアミノ酸残基が挿入、付加、欠失もしくは置換されたアミノ酸配列を含むFc領域タンパク質;または
(C)配列番号1のアミノ酸配列と90%以上の同一性を示すアミノ酸配列を含むFc領域タンパク質。
式1-1:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-I-I-W-C-(X0-3)b(配列番号58)
式1-2:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-I-V-W-C-(X0-3)b(配列番号59)
式1-3:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-V-V-W-C-(X0-3)b(配列番号60)
式1-4:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-A-V-W-C-(X0-3)b(配列番号61)
式1-5:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-L-W-C-(X0-3)b(配列番号62)
式1-6:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-I-W-C-(X0-3)b(配列番号63)
式1-7:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-V-F-C-(X0-3)b(配列番号64)
式1-8:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-Q-V-W-C-(X0-3)b(配列番号65)
式1-9:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-E-V-W-C-(X0-3)b(配列番号66)
〔式中、
(X0-3)aは、なし、または1~3個の連続する同一または異なる任意のアミノ酸残基(リジン残基およびシステイン残基以外)であり、
(X0-3)bは、なし、または1~3個の連続する同一または異なる任意のアミノ酸残基(リジン残基およびシステイン残基以外)であり、
Xaa1は、アラニン残基、グリシン残基、ロイシン残基、プロリン残基、アルギニン残基、バリン残基、アスパラギン残基、グルタミン酸残基、またはフェニルアラニン残基であり、
Xaa2は、チロシン残基、トリプトファン残基、ヒスチジン残基、またはフェニルアラニン残基であり、
Xaa3は、ヒスチジン残基、フェニルアラニン残基、チロシン残基、トリプトファン残基、アルギニン残基、またはグリシン残基であり、
Xaa4は、リジン残基であり、
Xaa5は、グリシン残基、セリン残基、アスパラギン残基、グルタミン残基、アスパラギン酸残基、グルタミン酸残基、フェニルアラニン残基、チロシン残基、トリプトファン残基、ヒスチジン残基、スレオニン残基、ロイシン残基、アラニン残基、バリン残基、イソロイシン残基、またはアルギニン残基であり、
Xaa6は、グルタミン残基、グルタミン酸残基、アスパラギン残基、アスパラギン酸残基、プロリン残基、グリシン残基、アルギニン残基、フェニルアラニン残基、またはヒスチジン残基である。〕、あるいは
式2-1:(X0-3’)a-C-Xaa1’-Xaa2’-Xaa3’-Xaa4’-Xaa5’-Xaa6’-L-V-W-C-(X0-3’)b(配列番号67)
〔式中、
(X0-3’)aおよび(X0-3’)bはそれぞれ、前記(X0-3)aおよび(X0-3)bと同じであり、
Xaa1’、Xaa2’、Xaa3’、Xaa4’、Xaa5’、Xaa6’はそれぞれ、前記Xaa1、Xaa2、Xaa3、Xaa4、Xaa5、Xaa6と同じである。
但し、(X0-3’)aが1~3のアミノ酸残基、(X0-3’)bが1~3のアミノ酸残基、Xaa3’がヒスチジン残基、かつ、Xaa5’がグリシン残基の場合を除く。〕のいずれかのアミノ酸配列を含むペプチドである。
(X0-3)aは、なし、アルギニン残基-グリシン残基-アスパラギン残基、アスパラギン酸残基、またはアスパラギン残基であり;
(X0-3)bは、なし、スレオニン残基-チロシン残基-ヒスチジン残基、またはスレオニン残基であり;
Xaa1は、アラニン残基であり;
Xaa2は、チロシン残基、トリプトファン残基、またはヒスチジン残基であり;
Xaa6は、グルタミン残基、グルタミン酸残基、アスパラギン残基、またはアスパラギン酸残基である。
(X0-3)aは、グリシン残基-アスパラギン残基、グリシン残基、グリシン残基-グリシン残基、またはグリシン残基-グリシン残基-グリシン残基であり、
(X0-3)bは、スレオニン残基-チロシン残基、グリシン残基、グリシン残基-グリシン残基、またはグリシン残基-グリシン残基-グリシン残基であり、
Xaa1は、グリシン残基、ロイシン残基、プロリン残基、アルギニン残基、バリン残基、アスパラギン残基、グルタミン酸残基、またはフェニルアラニン残基であり、
Xaa2は、フェニルアラニン残基であり、
Xaa6は、プロリン残基、グリシン残基、アルギニン残基、フェニルアラニン残基、またはヒスチジン残基である。
(1) RGNCAYHKGQIIWCTYH(配列番号5);
(2) RGNCAYHKGQIVWCTYH(配列番号8);
(3) RGNCAYHKGQVVWCTYH(配列番号9);
(4) RGNCAYHKGQAVWCTYH(配列番号10);
(5) RGNCAYHKGQLLWCTYH(配列番号11);
(6) RGNCAYHKGQLIWCTYH(配列番号12);
(7) DCAYHKGQIVWCT (配列番号13);
(8) DCAYHKGQVVWCT (配列番号14);
(9) DCAYHKGQAVWCT (配列番号15);
(10)RGNCAYHKSQIIWCTYH(配列番号16);
(11)RGNCAYHKNQIIWCTYH(配列番号17);
(12)RGNCAYHKDQIIWCTYH(配列番号18);
(13)RGNCAYHKQQIIWCTYH(配列番号19);
(14)RGNCAYHKEQIIWCTYH(配列番号20);
(15)RGNCAYHKFQIIWCTYH(配列番号21);
(16)RGNCAYHKYQIIWCTYH(配列番号22);
(17)RGNCAYHKWQIIWCTYH(配列番号23);
(18)RGNCAYHKHQIIWCTYH(配列番号24);
(19)RGNCAYHKTQIIWCTYH(配列番号25);
(20)RGNCAYHKLQIIWCTYH(配列番号26);
(21) CAYHKLQIVWC (配列番号27);
(22) CAYHKLQLIWC (配列番号28);
(23) CAYHKSQIVWC (配列番号29);
(24)RGNCAYHKGQLVFCTYH(配列番号30);
(25)RGNCAYHKGQQVWCTYH(配列番号31);
(26)RGNCAYHKGQEVWCTYH(配列番号32);
(27) CAYHKGQLVWC (配列番号33);
(28)RGNCAYHKAQLVWCTYH(配列番号34);
(29)RGNCAYHKVQLVWCTYH(配列番号35);
(30)RGNCAYHKLQLVWCTYH(配列番号36);
(31)RGNCAYHKIQLVWCTYH(配列番号37);
(32)RGNCAYHKSQLVWCTYH(配列番号38);
(33)RGNCAYHKTQLVWCTYH(配列番号39);
(34)RGNCAYHKNQLVWCTYH(配列番号40);
(35)RGNCAYHKDQLVWCTYH(配列番号41);
(36)RGNCAYHKQQLVWCTYH(配列番号42);
(37)RGNCAYHKEQLVWCTYH(配列番号43);
(38)RGNCAYHKFQLVWCTYH(配列番号44);
(39)RGNCAYHKRQLVWCTYH(配列番号45);
(40)RGNCAYHKHQLVWCTYH(配列番号46);
(41)RGNCAYHKWQLVWCTYH(配列番号47);
(42)RGNCAYHKYQLVWCTYH(配列番号48);
(43)RGNCAYFKGQLVWCTYH(配列番号49);
(44)RGNCAYYKGQLVWCTYH(配列番号50);
(45)RGNCAYWKGQLVWCTYH(配列番号51);
(46)RGNCAYRKGQLVWCTYH(配列番号52);
(47)RGNCAYGKGQLVWCTYH(配列番号53);
(48) DCAYHKGQLVWC (配列番号54);
(49) NCAYHKGQLVWC (配列番号55);
(50) CAYHKGQLVWCT (配列番号56);
(51) CAYHKSQLVWC (配列番号57);
(52)RGNCAWHKGQIIWCTYH(配列番号68);
(53)RGNCAFHKGQIIWCTYH(配列番号69);
(54)RGNCAHHKGQIIWCTYH(配列番号70);
(55)RGNCGYHKGQIIWCTYH(配列番号71);
(56)RGNCLYHKGQIIWCTYH(配列番号72);
(57)RGNCPYHKGQIIWCTYH(配列番号73);
(58)RGNCRYHKGQIIWCTYH(配列番号74);
(59)RGNCVYHKGQIIWCTYH(配列番号75);
(60)RGNCNYHKGQIIWCTYH(配列番号76);
(61)RGNCEYHKGQIIWCTYH(配列番号77);
(62)RGNCFYHKGQIIWCTYH(配列番号78);
(63)RGNCAYHKGEIIWCTYH(配列番号79);
(64)RGNCAYHKGNIIWCTYH(配列番号80);
(65)RGNCAYHKGPIIWCTYH(配列番号81);
(66)RGNCAYHKGGIIWCTYH(配列番号82);
(67)RGNCAYHKGDIIWCTYH(配列番号83);
(68)RGNCAYHKGRIIWCTYH(配列番号84);
(69)RGNCAYHKGFIIWCTYH(配列番号85);
(70)RGNCAYHKGHIIWCTYH(配列番号86);
(71) DCAYHKGQIIWCT(配列番号87);
(72) NCAYHKGQIIWCT(配列番号88);
(73) GNCAYHKGQIIWCTY(配列番号89);
(74) GCAYHKGQIIWCG(配列番号90);
(75) GGCAYHKGQIIWCGG(配列番号91);および
(76)GGGCAYHKGQIIWCGGG(配列番号92)。
式(I)において、Lは、切断性部分を含む2価の基である切断性リンカーである。
複数のR2a、複数のR2b、および複数のR2cは、同一または異なって、水素原子、または後述する置換基からなる群より選ばれ、
Jは、-CH2-、-O-、または-S-であり、
rは、1~4の任意の整数であり、
○(白丸)はA(または後述するLa)に対する結合を示し、●(黒丸)はB(または後述するLb)に対する結合を示す。
化学構造が、切断部位を中心にして非対称である場合、●がA(または後述するLa)に対する結合を示し、○がB(または後述するLb)に対する結合を示していてもよい。〕
複数のR2aは、同一または異なって、水素原子、または後述する置換基からなる群より選ばれ、
○(白丸)はA(または後述するLa)に対する結合を示し、●(黒丸)はB(または後述するLb)に対する結合を示す。
化学構造が、切断部位を中心にして非対称である場合、●がA(または後述するLa)に対する結合を示し、○がB(または後述するLb)に対する結合を示していてもよい。〕からなる群より選ばれるいずれか一つの化学構造に対応していてもよい。
複数のR2b、複数のR2c、J、rは、水素原子、または後述する置換基からなる群より選ばれ、
○(白丸)はA(または後述するLa)に対する結合を示し、●(黒丸)はB(または後述するLb)に対する結合を示す。
化学構造が、切断部位を中心にして非対称である場合、●がA(または後述するLa)に対する結合を示し、○がB(または後述するLb)に対する結合を示していてもよい。〕からなる群より選ばれるいずれか一つの化学構造に対応していてもよい。
La-C-Lb (L1)
La-C (L2)
C-Lb (L3)
〔式中、
LaおよびLbは、それぞれ、2価の基であり、
Cは、切断性部分である。〕
(i)ハロゲン原子;
(ii)1価の炭化水素基;
(iii)アラルキル;
(iv)1価の複素環基;
(v)Rc-O-、Rc-C(=O)-、Rc-O-C(=O)-、もしくはRc-C(=O)-O-(Rcは、水素原子、もしくは一価の炭化水素基を示す。);または
(vi)NRdRe-、NRdRe-C(=O)-、NRdRe-C(=O)-O-、もしくはRd-C(=O)-NRe-(RdおよびReは、同一もしくは異なって、水素原子、もしくは一価の炭化水素基を示す。);
(vii)ニトロ基、硫酸基、スルホン酸基、シアノ基、およびカルボキシル基。
(i’)ハロゲン原子;
(ii’)炭素原子数1~12のアルキル、フェニル、もしくはナフチル;
(iii’)炭素原子数3~15のアラルキル;
(iv’)5員または6員の複素環;
(v’)Rc-O-、Rc-C(=O)-、Rc-O-C(=O)-、もしくはRc-C(=O)-O-(Rcは、水素原子、もしくは炭素原子数1~12のアルキルを示す。);または
(vi’)NRdRe-、NRdRe-C(=O)-、NRdRe-C(=O)-O-、もしくはRd-C(=O)-NRe-(RdおよびReは、同一もしくは異なって、水素原子、もしくは炭素原子数1~12のアルキルを示す。);
(vii’)上記(vii)で列挙したものと同じ基。
(i’’)ハロゲン原子;
(ii’’)炭素原子数1~12のアルキル;
(iii’’)Rc-O-、Rc-C(=O)-、Rc-O-C(=O)-、もしくはRc-C(=O)-O-(Rcは、水素原子、もしくは炭素原子数1~12のアルキルを示す。);または
(iv’’)NRdRe-、NRdRe-C(=O)-、NRdRe-C(=O)-O-、もしくはRd-C(=O)-NRe-(RdおよびReは、同一もしくは異なって、水素原子、もしくは炭素原子数1~12のアルキルを示す。);
(v’’)上記(vii)で列挙したものと同じ基。
(i’’’)ハロゲン原子;
(ii’’’)炭素原子数1~6のアルキル;
(iii’’’)Rc-O-、Rc-C(=O)-、Rc-O-C(=O)-、もしくはRc-C(=O)-O-(Rcは、水素原子、もしくは炭素原子数1~6のアルキルを示す。);または
(iv’’’)NRdRe-、NRdRe-C(=O)-、NRdRe-C(=O)-O-、もしくはRd-C(=O)-NRe-(RdおよびReは、同一もしくは異なって、水素原子、もしくは炭素原子数1~6のアルキルを示す。);
(v’’’)上記(vii)で列挙したものと同じ基。
(i’’’’)ハロゲン原子;
(ii’’’’)炭素原子数1~4のアルキル;
(iii’’’’)Rc-O-、Rc-C(=O)-、Rc-O-C(=O)-、もしくはRc-C(=O)-O-(Rcは、水素原子、もしくは炭素原子数1~4のアルキルを示す。);または
(iv’’’’)NRdRe-、NRdRe-C(=O)-、NRdRe-C(=O)-O-、もしくはRd-C(=O)-NRe-(RdおよびReは、同一もしくは異なって、水素原子、もしくは炭素原子数1~4のアルキルを示す。);
(v’’’’)上記(vii)で列挙したものと同じ基。
pおよびp’は、同一または異なって、0~10の任意の整数であり、
qおよびq’は、同一または異なって、0~10の任意の整数であり、
XおよびX’は、同一または異なって、炭素原子、窒素原子、または単結合(ここで、Xが窒素原子である場合、R1bは存在せず、X’が窒素原子である場合、R1b’は存在しない。Xが単結合である場合、R1aおよびR1bは存在せず、X’が単結合である場合、R1a’およびR1b’は存在しない)であり、
R1a、R1b、R1a’およびR1b’は、同一または異なって、水素原子、または上述する置換基からなる群より選ばれる。〕で表されてもよい。
式(I)において、Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基である。
R1f、単一もしくは複数のR1gおよび単一もしくは複数のR1hは、同一もしくは異なって、前記(i)~(vii)からなる群より選ばれる原子もしくは基、または電子吸引基であり、
・は、結合手である。)
Yは、-NH-、-O-、-CH2-、または下記式(B-2):
VおよびV’は、同一または異なって、-NH-、-O-、-CH2-、または単結合であり、
V1は、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
sは、0~10の任意の整数であり、
式(B-2)における○および●は、それぞれ、式(B-1)における○および●と同じ配向である。)であり、
Zは、酸素原子、硫黄原子、または水素原子(Zが水素原子である場合、-C(=Z)-は、-CH2-を示す。)であり、
式(B-1)における○(白丸)は、L側の部分に対する結合を示し、●(黒丸)はR側の部分に対する結合を示す。〕で表されてもよい。
GおよびG’は、同一または異なって、-NH-、-O-、-CH2-、単結合、または下記式(B-4):
WおよびW’は、同一または異なって、-NH-、-O-、-CH2-、または単結合であり、
W1は、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
tは、0~10の任意の整数である。
式(B-4)における○(白丸)は、式(B-3)における結合手(・)の方向に対する結合を示し、●(黒丸)はb側の方向に対する結合を示す。)で表される基であり、
Hは、-CH2-、-C=O-、-C=S-、-NH-、または単結合であり、
Iは、2価の炭化水素基、2価の複素環、または単結合であり、
bは、下記:
R1f、単一もしくは複数のR1gおよび単一もしくは複数のR1hは、同一もしくは異なって、前記(i)~(vii)からなる群より選ばれる原子もしくは基、または電子吸引基であり、
・は、結合手である。)で表されるいずれか一つの基である。〕で表される基を側鎖として有する2価の基であってもよい。このような2価の基は、2価の炭化水素基、または2価の複素環基であり、好ましくは、置換されていてもよい2価の炭化水素基であり、より好ましくは、アルキレン、アルケニレン、アルキニレン、シクロアルキレン、シクロアルケニレン、シクロアルキニレン、またはアリーレンであり、さらより好ましくは、アルキレン、シクロアルキレン、またはアリーレンであり、特に好ましくはアルキレンである。これらの基の例および好ましい例は、上述したとおりである。これらの基は、上記側鎖以外の置換基で置換されていてもよい。このような置換基の数は、1~5個、好ましくは1~3個、より好ましくは1もしくは2個である。置換基の例および好ましい例は、上述したとおりである。
式(I)において、Rは、抗体に対する反応性基である。このような反応性基は、当該技術分野において技術常識である。
R5aおよびR5cは、水素原子、または上述した置換基であり、
R5bは、電子吸引基であり、
jは、1~5の任意の整数であり、
kは、1~4の任意の整数である。〕
1-6-1.AおよびRを連結する部分構造「L-B」中の主鎖の長さ
式(I)において、A(親和性物質)およびR(反応性基)を連結する主鎖(L-B中の直鎖部分)の長さは、抗体および親和性物質の種類、ならびに抗体における親和性物質の標的部位と、Rが反応して結合すべきである、上述したような標的領域(例、特定の位置)中の特定のアミノ酸残基の位置および数との関係などの種々の因子に応じて、適宜設計することができる。式(I)で表される化合物は、親和性物質が抗体に会合し、次いで、L-Bを介して親和性物質と共有結合している反応性基が、上記標的部位の近傍に存在する特定のアミノ酸残基の側鎖中の基(例、リジン残基の側鎖中のアミノ基)と反応することにより、抗体と共有結合することができる。このとき、Rが反応して結合すべきである特定のアミノ酸残基の近傍領域、上記標的部位の近傍領域、および当該特定のアミノ酸残基と上記標的部位との間の領域において当該特定のアミノ酸残基が他に存在しない場合、主鎖の長さを厳密に制御せずとも、反応性基は、当該特定のアミノ酸残基に対して位置選択的に結合することができる。勿論、このような領域において当該特定のアミノ酸残基が他に存在する場合であっても、主鎖の長さを制御することにより、反応性基は、当該特定のアミノ酸残基に対して位置選択的に結合することができる。
(a)の場合、最短経路は太字経路であるため、主鎖の原子数として数えられる2価の環構造中の原子数は、2である。
(b)の場合、最短経路は太字経路であるため、主鎖の原子数として数えられる2価の環構造中の原子数は、3である。
(c)の場合、いずれの経路も最短経路(等距離)であるため、主鎖の原子数として数えられる2価の環構造中の原子数は、4である。
(d)の場合、縮合部位の経路が最短経路であるため、主鎖の原子数として数えられる2価の環構造中の原子数は、4である。
上記式(I)において、LおよびBは、互いに連関し得る構造である。したがって、上記式(I)において、LおよびBは、「L-B」で表される部分構造として規定することができる。
A-B2-L’-B1-R (I’)
〔式中、
AおよびRは、前記式(I)のものと同じであり
L’は、切断性部分を含む2価の基である切断性リンカーであり、
B1およびB2は、同一または異なって、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
B1およびB2は、L’を中心にした対称構造を有していてもよい。〕
La’-C’-Lb’ (L1’)
La’-C’ (L2’)
C’-Lb’ (L3’)
〔式中、
La’およびLb’は、それぞれ、2価の基であり、
C’は、切断性部分である。〕
C、p、p’、q、q’、X、X’、R1a、R1a’、R1b、R1b’、Y、Y’、ZおよびZ’の定義、例および好ましい例は、上述したものと同じであり、
○(白丸)は、Aに対する結合を示し、●(黒丸)は、Rに対する結合を示す。〕
A、R、C、p、p’、q、q’、X、X’、R1a、R1b、R1a’、R1b’、Y、Y’、ZおよびZ’の定義、例および好ましい例は、上述したものと同じである。〕
抗体に対する親和性物質、切断性部分および反応性基を含む化合物またはその塩は、適宜調製することができる。抗体に対する親和性物質、切断性部分および反応性基を含む化合物は、式(I)、好ましくは式(I’)、より好ましくは式(I’’)で表される。
後述の発明〔例、式(II)~(v)およびその下位概念の式、ならびに部分構造式(例、(L1)~(L3)、(La’)、(Lb’)、(B-1)~(B-4))で表される発明〕では、任意の記号(例、A、L、B、R)、当該記号で表される用語、およびそれらの詳細(例えば、定義、例および好ましい例)は、上記式(I)で表される化合物またはその塩の発明と共通する。また、後述の発明を規定することができる特定の部分(例、切断性部分、切断により生体直交性官能基を反応性基側に生成する能力を有する部分)、特定の基(例、生体直交性官能基、2価の基、アルキル基、置換基、電子吸引基)、および特定の数値、ならびに塩等の任意の技術要素(例、定義、例および好ましい例)についても、上記で説明したものと共通にすることができる。したがって、これらの事項は、特に言及することなく、後述の発明において適宜援用することができる。同様に、後述の発明で述べた特定の発明の技術要素は、本発明および他の発明の技術要素として、適宜援用することができる。
2-1.概要
本発明は、式(II)で表される、抗体に対する親和性物質、および切断性部分を含む抗体またはその塩を提供する。
A-L-B-R’-T (II)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕
抗体と反応性基との間の反応により生成する部分において、抗体および反応性基の定義、例および好ましい例は、上述したとおりである。抗体と反応性基との間の反応により生成する部分は、当該技術分野において技術常識であり、抗体および反応性基の種類に応じて適宜決定することができる。
部分構造「L-B」の詳細は、上記「1-6.部分構造「L-B」」で述べたとおりである。
A-B2-L’-B1-R’-T (II’)
〔式中、
A、R’およびTは、前記式(II)のものと同じであり
L’は、切断性部分を含む2価の基である切断性リンカーであり、
B1およびB2は、同一または異なって、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
B1およびB2は、L’を中心にした対称構造を有していてもよい。〕
C、p、p’、q、q’、X、X’、R1a、R1a’、R1b、R1b’、Y、Y’、ZおよびZ’の定義、例および好ましい例は、上述したものと同じであり、
○(白丸)は、Aに対する結合を示し、●(黒丸)は、R’に対する結合を示す。〕
A、R’、T、C、p、p’、q、q’、X、X’、R1a、R1b、R1a’、R1b’、Y、Y’、ZおよびZ’の定義、例および好ましい例は、上述したものと同じである。〕
抗体以外の部分構造(例、A-L-B-R’)は、抗体(T)における上述したような標的領域に位置選択的に結合させることができる。
抗体(T)が保有する、抗体以外の部分構造(例、A-L-B-R’)の個数は、変動することができる。例えば、Tが複数の単量体タンパク質を含む多量体タンパク質である場合、Tは、複数個の単量体タンパク質中の対応する複数個の標的領域において、T以外の部分構造を有することができる。その結果、Tは、T以外の部分構造を複数個有することができる。したがって、式(II)、(II’)、または(II’’)で表される構造は、Tが、T以外の部分構造を1個または複数個有していてもよいことを示す。Tが有する、T以外の部分構造の個数は、抗体の種類、および抗体とそれに対して導入される構造単位との反応比率等の条件を適宜設定することで調節することができる。このような個数は、抗体の種類によっても異なるが、例えば1~8、好ましくは1~4、より好ましくは1または2であってもよい。
本発明は、以下を含む、抗体に対する親和性物質、および切断性部分を含む抗体またはその塩の製造方法を提供する:
(A1)抗体に対する親和性物質、切断性部分および反応性基を含む化合物またはその塩を抗体と反応させて、抗体に対する親和性物質、および切断性部分を含む抗体またはその塩を生成すること。
3-1.概要
本発明は、式(III)で表される、抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩を提供する。
A-L-B’(-F)-R’-T (III)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
B’は、機能性物質と生体直交性官能基との間の反応により生成する部分を含む3価の基であり、
Fは、機能性物質であり、
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表される、抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩。
機能性物質としては、抗体に任意の機能を付与する物質である限り特に限定されず、例えば、薬物、標識物質、安定化剤が挙げられるが、好ましくは薬物または標識物質である。機能性物質はまた、単一の機能性物質であってもよく、または2以上の機能性物質が連結された物質であってもよい。
B’は、(a)の生体直交性官能基が機能性物質と反応していることを除き、上述したBにおける(a)生体直交性官能基を含む2価の基と同様である。したがって、B’における3価の基および直交性官能基の定義、例および好ましい例は、(a)の生体直交性官能基が機能性物質と反応していることを除き、Bにおけるものと同様である。
○(白丸)はL側の部分に対する結合を示し、●(黒丸)はR’側の部分に対する結合を示す。
化学構造が、切断性部分を中心にして非対称である場合、●がL側の部分に対する結合を示し、○がR’側の部分に対する結合を示していてもよい。〕からなる群より選ばれるいずれか一つの化学構造に対応する残基を含む3価の基であってもよい。
部分構造「L-B’(-F)」の詳細は、BがB’(-F)に変更されていることを除き、上記「1-6.部分構造「L-B」」で述べたとおりである。
A-B2’(-F2)-L’-B1’(-F1)-R’-T (III’)
〔式中、
A、R’およびTは、前記式(III)のものと同じであり、
L’は、切断性部分を含む2価の基である切断性リンカーであり、
B1’およびB2’は、同一または異なって、機能性物質と生体直交性官能基との間の反応により生成する部分を含む3価の基であり、
F1およびF2は、同一または異なって、機能性物質であり、
B1’(-F1)およびB2’(-F2)は、L’を中心にした対称構造を有していてもよい。〕。
C、F1、F2、p、p’、q、q’、X、X’、R1a、R1a’、R1b、R1b’、ZおよびZ’の定義、例および好ましい例は、上述したものと同じであり、
YおよびY’は、同一または異なって、前記式(B-1)のYから水素原子を一つ除いた残基であり、
○(白丸)は、Aに対する結合を示し、●(黒丸)は、R’に対する結合を示す。〕
VおよびV’は、同一または異なって、-NH-、-O-、-CH2-、または単結合であり、
V1は、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
sは、0~10の任意の整数であり、
式(B-2’)における○および●は、それぞれ、式(B-1)における○および●と同じ配向である。)である。〕から水素原子を一つ除いた基である。式(B-2’)におけるsの定義、例および好ましい例は、式(B-2)のものと同様である。したがって、式(B-2’)では、VおよびV’の一方が、-N(-)-、または-CH(-)-であってもよい。あるいは、式(B-2’)では、V1は、上記(a)または(b)の2価の基から水素原子が一つ除かれた3価の基であってもよい。あるいは、式(B-2’)では、s個の-CH2-のうちの一つが-CH(-)-であってもよい。
A、R、C、F1、F2、p、p’、q、q’、X、X’、R1a、R1b、R1a’、R1b’、Y、Y’、ZおよびZ’の定義、例および好ましい例は、上述したものと同じである。〕
抗体以外の部分構造(例、A-L-B’(-F)-R’)は、抗体(T)における上述したような標的領域に位置選択的に結合させることができる。具体的には、Tが、連続する1~50個のアミノ酸残基からなる標的領域中において特定のアミノ酸残基を1個以上含み、かつ、前記標的領域以外の非標的領域中において前記特定のアミノ酸残基を5個以上含む場合、抗体以外の部分構造は、当該標的領域中に含まれる1個以上の特定のアミノ酸残基に対して30%以上の位置選択性で結合させることができる。標的領域および位置選択性の定義、例、および好ましい例は、上述したとおりである。
抗体(T)が保有する、抗体以外の部分構造(例、A-L-B’(-F)-R’)の個数は、変動することができる。例えば、Tが複数の単量体タンパク質を含む多量体タンパク質である場合、Tは、複数個の単量体タンパク質中の対応する複数個の標的領域において、T以外の部分構造を有することができる。その結果、Tは、T以外の部分構造を複数個有することができる。したがって、式(III)、(III’)、または(III’’)で表される構造は、Tが、T以外の部分構造を1個または複数個有していてもよいことを示す。Tが有する、T以外の部分構造の個数は、抗体の種類、および抗体とそれに対して導入される構造単位との反応比率等の条件を適宜設定することで調節することができる。このような個数は、抗体の種類によっても異なるが、例えば1~8、好ましくは1~4、より好ましくは1または2であってもよい。
本発明は、以下を含む、抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩の製造方法を提供する:
(B1)抗体に対する親和性物質、および切断性部分を含む抗体またはその塩を機能性物質と反応させて、抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩を生成すること。
(B2)抗体に対する親和性物質、切断性部分および反応性基を含む化合物またはその塩を抗体と反応させて、抗体に対する親和性物質、および切断性部分を含む抗体またはその塩を生成すること;および
(B3)抗体に対する親和性物質、および切断性部分を含む抗体またはその塩を機能性物質と反応させて、抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩を生成すること。
4-1.製造方法の概要
本発明は、式(IV)で表される、生体直交性官能基を有する抗体またはその塩の製造方法を提供する。
L1-B-R’-T (IV)
〔式中、
L1は、(i’)生体直交性官能基を含む1価の基、または(ii’)生体直交性官能基を含まない1価の基であり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕
式(IV)において、L1は、(i’)生体直交性官能基を含む1価の基、または(ii’)生体直交性官能基を含まない1価の基である。このような1価の基は、上述したような切断性部分を含む2価の基である切断性リンカーの切断により生成し得る1価の基である。したがって、L1は、上述したような切断性部分の残基または化学構造の切断により生成し得る1価の基であってもよい。より具体的には、(i’)生体直交性官能基を含む1価の基は、上述した(i)切断により生体直交性官能基を反応性基側に生成する能力を有する切断性部分を含む2価の基である切断性リンカーの切断により生成し得る1価の基であってもよく、(ii’)生体直交性官能基を含まない1価の基は、(ii)切断により生体直交性官能基を反応性基側に生成する能力を有しない切断性部分を含む2価の基である切断性リンカーの切断により生成し得る1価の基であってもよい。
C1-Lb (L1-1)
C1 (L1-2)
〔式中、
Lbは、2価の基であり、
C1は、生体直交性官能基、または生体直交性官能基以外の基である。〕
pは、0~10の任意の整数であり、
qは、0~10の任意の整数であり、
Xは、炭素原子、窒素原子、または単結合(ここで、Xが窒素原子である場合、R1bは存在しない。Xが単結合である場合、R1aおよびR1bは存在しない)であり、
R1a、およびR1bは、同一または異なって、水素原子、または上述する置換基からなる群より選ばれる。
○(白丸)は、C1に対する結合を示し、●(黒丸)はBに対する結合を示す。〕で表されてもよい。
4-3-1.L1末端部分およびR’を連結する部分構造「L1-B」の長さ
式(IV)において、切断により生成したL1末端部分(またはC1末端部分)およびR’を連結する部分構造(「L1-B」中の直鎖部分)の長さ(あるいは、式(IV)等の特定の式に限定されない、生体直交性官能基を位置選択的に有する抗体またはその塩における、生体直交性官能基および特定のアミノ酸残基の側鎖を連結する主鎖の原子数。以下同様)は、上記「1-6-1.AおよびRを連結する部分構造「L-B」中の主鎖の長さ」で述べたような種々の因子に応じて、適宜設計することができる。
上記式(IV)において、L1およびBは、互いに連関し得る構造である。したがって、上記式(IV)において、L1およびBは、「L1-B」で表される部分構造として規定することができる。
C1、p、q、X、R1a、R1b、Y、およびZの定義、例および好ましい例は、上述したものと同じであり、
●(黒丸)は、R’に対する結合を示す。〕
C1、p、q、X、R1a、R1b、Y、Z、R’、およびTの定義、例および好ましい例は、上述したものと同じである。〕
抗体以外の部分構造(例、L1-B-R’)は、抗体(T)における上述したような標的領域に位置選択的に結合させることができる。具体的には、Tが、連続する1~50個のアミノ酸残基からなる標的領域中において特定のアミノ酸残基を1個以上含み、かつ、前記標的領域以外の非標的領域中において前記特定のアミノ酸残基を5個以上含む場合、抗体以外の部分構造は、当該標的領域中に含まれる1個以上の特定のアミノ酸残基に対して30%以上の位置選択性で結合させることができる。標的領域および位置選択性の定義、例、および好ましい例は、上述したとおりである。
抗体(T)が保有する、抗体以外の部分構造(例、L1-B-R’)の個数は、変動することができる。例えば、Tが複数の単量体タンパク質を含む多量体タンパク質である場合、Tは、複数個の単量体タンパク質中の対応する複数個の標的領域において、T以外の部分構造を有することができる。その結果、Tは、T以外の部分構造を複数個有することができる。したがって、式(IVI)、(IV’)、またはIV’’)で表される構造は、Tが、T以外の部分構造を1個または複数個有していてもよいことを示す。Tが有する、T以外の部分構造の個数は、抗体の種類、および抗体とそれに対して導入される構造単位との反応比率等の条件を適宜設定することで調節することができる。このような個数は、抗体の種類によっても異なるが、例えば1~8、好ましくは1~4、より好ましくは1または2であってもよい。
本発明は、以下を含む、生体直交性官能基を有する抗体またはその塩の製造方法を提供する:
(C1)抗体に対する親和性物質、および切断性部分を含む抗体またはその塩の切断性部分を切断して、生体直交性官能基を有する抗体またはその塩を生成すること。
(C2)抗体に対する親和性物質、切断性部分および反応性基を含む化合物またはその塩を抗体と反応させて、抗体に対する親和性物質、および切断性部分を含む抗体またはその塩を生成すること;および
(C3)抗体に対する親和性物質、および切断性部分を含む抗体またはその塩の切断性部分を切断して、生体直交性官能基を有する抗体またはその塩を生成すること。
5-1.概要
本発明は、式(V)で表される、機能性物質を有する抗体またはその塩の製造方法を提供する。
F-(L1-B)’-R’-T (V)
〔式中、
L1は、(i’)生体直交性官能基を含む1価の基、または(ii’)生体直交性官能基を含まない1価の基であり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
(L1-B)’で表される構造単位は、機能性物質と、(i’)および(a)における生体直交性官能基のいずれか一方または双方との間の反応により生成する部分を含む2価の構造単位であり、
Fは、機能性物質であり、
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕
5-2-1.FおよびR’を連結する部分構造「L1-B」の長さ
式(V)において、FおよびR’を連結する部分構造「L1-B」(「L1-B」中の直鎖部分)の長さ(あるいは、式(V)等の特定の式に限定されない、機能性物質を位置選択的に有する抗体またはその塩における、機能性物質および特定のアミノ酸残基の側鎖を連結する主鎖の原子数、または機能性物質が生体直交性官能基を介して抗体に結合している場合には、生体直交性官能基および特定のアミノ酸残基の側鎖を連結する主鎖の原子数。以下同様)は、上記「1-6-1.AおよびRを連結する部分構造「L-B」中の主鎖の長さ」で述べたような種々の因子に応じて、適宜設計することができる。
式(V)において、F-(L1-B)’におけるL1およびBは、互いに連関し得る構造である。したがって、上記式(V)において、L1およびBは、「L1-B」で表される部分構造として規定することができる。
〔式中、
L1は、(i’)生体直交性官能基を含む1価の基、または(ii’)生体直交性官能基を含まない1価の基であり、
B’は、機能性物質と生体直交性官能基との間の反応により生成する部分を含む3価の基であり、
Fは、機能性物質であり、
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕
〔式中、
L1’は、機能性物質と、(i’)生体直交性官能基を含む1価の基との間の反応により生成する部分を含む2価の基であり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
Fは、機能性物質であり、
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕
〔式中、
L1’は、機能性物質と、(i’)生体直交性官能基を含む1価の基との間の反応により生成する部分を含む2価の基であり、
B’は、機能性物質と生体直交性官能基との間の反応により生成する部分を含む3価の基であり、
FaおよびFbは、それぞれ、同一または異なる機能性物質であり、
R’は、抗体と反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕
F、C1、p、q、X、R1a、R1b、およびZの定義、例および好ましい例は、上述したものと同じであり、
Y’は、前記式(B-1)のYから水素原子を一つ除いた残基であり、
●(黒丸)は、R’に対する結合を示す。〕
F、C1、p、q、X、R1a、R1b、Z、R’、およびTの定義、例および好ましい例は、上述したものと同じであり、
Y’は、前記式(B-1)のYから水素原子を一つ除いた残基である。〕
F、p、q、X、R1a、R1b、Y、およびZの定義、例および好ましい例は、上述したものと同じであり、
C1’は、機能性物質と生体直交性官能基との間の反応により生成する部分であり、
●(黒丸)は、R’に対する結合を示す。〕
F、p、q、X、R1a、R1b、Y、Z、R’、およびTの定義、例および好ましい例は、上述したものと同じであり、
C1’は、機能性物質と生体直交性官能基との間の反応により生成する部分である。〕
Fa、Fb、p、q、X、R1a、R1b、およびZの定義、例および好ましい例は、上述したものと同じであり、
C1’は、機能性物質と生体直交性官能基との間の反応により生成する部分であり、
Y’は、前記式(B-1)のYから水素原子を一つ除いた残基であり、
●(黒丸)は、R’に対する結合を示す。〕
Fa、Fb、p、q、X、R1a、R1b、Z、R’、およびTの定義、例および好ましい例は、上述したものと同じであり、
C1’は、機能性物質と生体直交性官能基との間の反応により生成する部分であり、
Y’は、前記式(B-1)のYから水素原子を一つ除いた残基である。〕
抗体以外の部分構造(例、F-(L1-B)’-R’)は、抗体(T)における上述したような標的領域に位置選択的に結合させることができる。具体的には、Tが、連続する1~50個のアミノ酸残基からなる標的領域中において特定のアミノ酸残基を1個以上含み、かつ、前記標的領域以外の非標的領域中において前記特定のアミノ酸残基を5個以上含む場合、抗体以外の部分構造は、当該標的領域中に含まれる1個以上の特定のアミノ酸残基に対して30%以上の位置選択性で結合させることができる。標的領域および位置選択性の定義、例、および好ましい例は、上述したとおりである。
抗体(T)が保有する、抗体以外の部分構造(例、F-(L1-B)’-R’)の個数は、変動することができる。例えば、Tが複数の単量体タンパク質を含む多量体タンパク質である場合、Tは、複数個の単量体タンパク質中の対応する複数個の標的領域において、T以外の部分構造を有することができる。その結果、Tは、T以外の部分構造を複数個有することができる。したがって、式(V)、(V1)、(V2)、(V3)、(V1’)、(V2’)、または(V3’)で表される構造は、Tが、T以外の部分構造を1個または複数個有していてもよいことを示す。Tが有する、T以外の部分構造の個数は、抗体の種類、および抗体とそれに対して導入される構造単位との反応比率等の条件を適宜設定することで調節することができる。このような個数は、抗体の種類によっても異なるが、例えば1~8、好ましくは1~4、より好ましくは1または2であってもよい。
本発明は、機能性物質を有する抗体またはその塩の製造方法を提供する。本製造方法は、(D)抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩を原料として使用する方法(図2の反応(3)を参照)、および(E)生体直交性官能基を有する抗体またはその塩を原料として使用する方法(図2の反応(5)を参照)に分類することができる。
(D1)抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩の切断性部分を切断して、機能性物質を有する抗体またはその塩を生成すること。
(D2)抗体に対する親和性物質、および切断性部分を含む抗体またはその塩を機能性物質と反応させて、抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩を生成すること;および
(D3)抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩の切断性部分を切断して、機能性物質を有する抗体またはその塩を生成すること。
(D4)抗体に対する親和性物質、切断性部分および反応性基を含む化合物またはその塩を抗体と反応させて、抗体に対する親和性物質、および切断性部分を含む抗体またはその塩を生成すること;
(D5)抗体に対する親和性物質、および切断性部分を含む抗体またはその塩を機能性物質と反応させて、抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩を生成すること;および
(D6)抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩の切断性部分を切断して、機能性物質を有する抗体またはその塩を生成すること。
(E1)生体直交性官能基を有する抗体またはその塩を機能性物質と反応させて、機能性物質を有する抗体またはその塩を生成すること。
(E2)抗体に対する親和性物質、および切断性部分を含む抗体またはその塩の切断性部分を切断して、生体直交性官能基を有する抗体またはその塩を生成すること;および
(E3)生体直交性官能基を有する抗体またはその塩を機能性物質と反応させて、機能性物質を有する抗体またはその塩を生成すること。
(E4)抗体に対する親和性物質、切断性部分および反応性基を含む化合物またはその塩を抗体と反応させて、抗体に対する親和性物質、および切断性部分を含む抗体またはその塩を生成すること;
(E5)抗体に対する親和性物質、および切断性部分を含む抗体またはその塩の切断性部分を切断して、生体直交性官能基を有する抗体またはその塩を生成すること;および
(E6)生体直交性官能基を有する抗体またはその塩を機能性物質と反応させて、機能性物質を有する抗体またはその塩を生成すること。
本発明において、塩としては、例えば、無機酸との塩、有機酸との塩、無機塩基との塩、有機塩基との塩、およびアミノ酸との塩が挙げられる。無機酸との塩としては、例えば、塩化水素、臭化水素、リン酸、硫酸、硝酸との塩が挙げられる。有機酸との塩としては、例えば、ギ酸、酢酸、トリフルオロ酢酸、乳酸、酒石酸、フマル酸、シュウ酸、マレイン酸、クエン酸、コハク酸、リンゴ酸、ベンゼンスルホン酸、p-トルエンスルホン酸との塩が挙げられる。無機塩基との塩としては、例えば、アルカリ金属(例、ナトリウム、カリウム)、アルカリ土類金属(例、カルシウム、マグネシウム)、および亜鉛、アルミニウム等の他の金属、ならびにアンモニウムとの塩が挙げられる。有機塩基との塩としては、例えば、トリメチルアミン、トリエチルアミン、プロピレンジアミン、エチレンジアミン、ピリジン、エタノールアミン、モノアルキルエタノールアミン、ジアルキルエタノールアミン、ジエタノールアミン、トリエタノールアミンとの塩が挙げられる。アミノ酸との塩としては、例えば、塩基性アミノ酸(例、アルギニン、ヒスチジン、リジン、オルニチン)、および酸性アミノ酸(例、アスパラギン酸、グルタミン酸)との塩が挙げられる。塩は、好ましくは、無機酸(例、塩化水素)との塩、または有機酸(例、トリフルオロ酢酸)との塩である。
抗体に対する親和性物質、切断性部分および反応性基を有する本発明の化合物またはその塩は、例えば、抗体の位置選択的な修飾に有用である。したがって、本発明は、抗体に対する親和性物質、切断性部分および反応性基を有する化合物またはその塩を含む、抗体の位置選択的修飾試薬を提供する。
(1-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKGQIIWCTYH-NH2(配列番号5)のペプチドをFmoc固相合成法により合成した。ペプチド合成装置はCEM社製Liberty Blueを使用した。試薬は全て渡辺化学工業製のものを使用した。ResinはFmoc-NH-SAL-PEG Resin,HL、アルギニン(R)、システイン(C)、ヒスチジン(H)はダブルカップリングを行った。Resinからの切り出しはトリフルオロ酢酸:水:トリイソプロピルシラン:エタンジチオール=94:2.5:1.0:2.5の溶液中3時間攪拌の条件で行った。切り出し後Resinをフィルトレーションにより除去し、トリフルオロ酢酸を除去した。生成した結晶中にジエチルエーテルを加えエーテル沈殿を行い、生成した白色結晶をフィルトレーションにより回収した。これを0.1%トリフルオロ酢酸水溶液に溶解し、オクタドデシル基化学結合型シリカゲルを充填剤とする逆相高速液体クロマトグラフィーに付し、トリフルオロ酢酸を0.1%含有する水とアセトニトリルの混合溶液で溶出し、各フラクションをLC-MSにより確認した。生成物が含まれるフラクションを回収し、減圧下濃縮することによりアセトニトリルのみ除去した後、凍結乾燥を行った。目的物(215mg,103μmol)を得た。
HPLC純度:79%
(1-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が152600にピークが確認された。
(1-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(1-5)で生成した糖鎖切断を行っていない抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料;
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
(2-1)トラスツズマブのチオール導入体の消化酵素による処理
実施例1の(1-3)で得られた抗体・ペプチド複合体をPNGaseF(New England BioLabs社製)により糖鎖切断を行った後、ペプチドマッピングを行った。1.5mL低吸着マイクロテストチューブにサンプル溶液を10μL、50mM炭酸水素アンモニウム緩衝液、40%トリフルオロエタノールに溶解した20mMのジチオスレイトール水溶液10μLを加えて65℃で1時間加温後、50mMのヨードアセトアミド水溶液10μLを添加し、遮光下室温で30分間300rpmで振盪し反応させた。反応後、50mM炭酸水素アンモニウム緩衝液を40μL加えて撹拌し、20ng/μLのトリプシン水溶液10μL、もしくは200ng/μLのGlu-Cプロテアーゼ水溶液12.5μLを添加して37℃で18時間酵素消化した。消化後、20%トリフルオロ酢酸水溶液をトリプシン消化サンプルには2μL、Glu-Cプロテアーゼ消化サンプルには2.12μL添加し反応を止め、LC-MS/MS測定を実施した。
(分析装置)
ナノHPLC:EASY-nLC 1000(サーモフィッシャーサイエンティフィック社)
質量分析計:トライブリッド質量分析計Orbitrap Fusion(サーモフィッシャーサイエンティフィック社)
トラップカラム:Acclaim PepMap(登録商標) 100,75μmx2cm(サーモフィッシャーサイエンティフィック社)
分析カラム:ESI-column(NTCC-360/75-3-125,75μm×12.5cm,3μm(日京テクノス株式会社))
移動相A:0.1%ギ酸水溶液
移動相B:0.1%ギ酸、アセトニトリル溶液
ローディング溶液:0.1%トリフルオロ酢酸水溶液
流速:300nL/min
サンプル注入量:1μL
グラジエント条件(B%):2%(0.0-0.5分)、2%→30%(0.5-23.5分)、30%→75%(23.5-25.5分)、75%(25.5-35.0分)
イオン化法:ESI, Positiveモード
スキャンタイプ:Data Dependent Aquisition
Activation Type:Collision Induced Dissociation(CID)
データの取得は付属ソフトであるXcalibur 3.0(サーモフィッシャーサイエンティフィック社)およびThermo Orbitrap Fusion Tune Application 2.0(サーモフィッシャーサイエンティフィック社)を用いて行った。
LC-MS/MS測定結果に対する修飾部位解析については、Proteome Discoverer version 1.4(サーモフィッシャーサイエンティフィック社)を用いて行った。
LC-MS/MSを用いた解析の結果、トラスツズマブのトリプシン消化によるリジン残基への修飾部位(ヨードアセトアミドによるCarbamidomethyl化を受けたチオール導入体(+145.019Da))を含むアミノ酸33残基からなるペプチド、THTCPPCPAPELLGGPSVFLFPPKPKDTLMISR(配列番号6)のペプチドフラグメントのMSスペクトル(実測値:m/z 1269.30717、理論値:1269.30273、3価)が観測され(図6)、CIDスペクトルより重鎖のEU numberingにおける248位のリジン残基の修飾を示す、2価のy9に相当するm/z 603.29(理論値:603.30)のプロダクトイオンが確認された(図7-1)。また、Proteome Discovererでの解析により、246位もしくは248位のリジン残基への修飾が高選択的に起こっていることが示された(図7-2)。
また、トラスツズマブのGlu-Cプロテアーゼ消化によるリジン残基への修飾部位(ヨードアセトアミドによるCarbamidomethyl化を受けたチオール導入体(+145.019Da))を含むアミノ酸16残基からなるペプチド、LLGGPSVFLFPPKPKD(配列番号7)のペプチドフラグメントのMSスペクトル(実測値:m/z 619.67299、理論値:619.67112、3価)が観測され(図8)、CIDスペクトルより重鎖のEU numberingにおける246位もしくは248位のリジン残基の修飾を示す、1価のy5に相当するm/z 729.49(理論値:729.36)のプロダクトイオンが確認された(図9-1)。また、Proteome Discovererでの解析により、246位もしくは248位のリジン残基への修飾が高選択的に起こっていることが示された(図9-2)。
この結果より、実施例1の(1-3)では抗体上、重鎖のEU numberingにおけるLys246およびLys248に位置選択的にコンジュゲーションが進行していることが分かった。
(3-1)トラスツズマブ・ペプチド複合体のリンカー切断と再酸化、およびそれらの生成物のESI-TOFMSによる解析
先ず、実施例1の(1-4)で合成したトラスツズマブ・ペプチド複合体1.9mgを60mMリン酸バッファー(pH7.0)に溶解し、18μMとした後、10mM トリス(2-カルボキシエチル)ホスフィン 51.4μL(トラスツズマブ・ペプチド複合体に対して40等量)を添加し室温で1時間攪拌して、リンカー中のジスルフィド結合を切断した。
(3-1)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
b:トラスツズマブ+リンカー切断、再酸化後サンプル;
(4-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKGQIVWCTYH-NH2(配列番号8)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(63.2mg,30.4μmol)を得た。
HPLC純度:89%
(4-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150314にピークが確認され、結合性ペプチドが二つ導入された生成物が152568にピークが確認された。
(4-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(4-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(4-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(5-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKGQVVWCTYH-NH2(配列番号9)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(69.3mg,33.6μmol)を得た。
HPLC純度:71%
(5-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150314にピークが確認され、結合性ペプチドが二つ導入された生成物が152568にピークが確認された。
(5-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50683、50845および、原料と同じ23439に軽鎖ピークが観測された。
(5-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(5-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(6-1)トラスツズマブのチオール導入体のトリプシン処理
実施例5の(5-3)で得られた抗体・ペプチド複合体をPNGaseF(New England BioLabs社製)により糖鎖切断を行った後、ペプチドマッピングを行った。1.5mL低吸着マイクロテストチューブにサンプル溶液を10μL、50mM炭酸水素アンモニウム緩衝液、40%トリフルオロエタノールに溶解した20mMのジチオスレイトール水溶液10μLを加えて65℃で1時間加温後、50mMのヨードアセトアミド水溶液10μLを添加し、遮光下室温で30分間300rpmで振盪し反応させた。反応後、50mM炭酸水素アンモニウム緩衝液を40μL加えて撹拌し、20ng/μLのトリプシン水溶液を10μL添加して37℃で18時間酵素消化した。消化後、20%トリフルオロ酢酸水溶液を2μL添加し反応を止め、LC-MS/MS測定を実施した。
(分析装置)
ナノHPLC:EASY-nLC 1000(サーモフィッシャーサイエンティフィック社)
質量分析計:トライブリッド質量分析計Orbitrap Fusion(サーモフィッシャーサイエンティフィック社)
トラップカラム:Acclaim PepMap(登録商標) 100,75μmx2cm(サーモフィッシャーサイエンティフィック社)
分析カラム:ESI-column(NTCC-360/75-3-125,75μm×12.5cm,3μm(日京テクノス株式会社))
移動相A:0.1%ギ酸水溶液
移動相B:0.1%ギ酸、アセトニトリル溶液
ローディング溶液:0.1%トリフルオロ酢酸水溶液
流速:300nL/min
サンプル注入量:1μL
グラジエント条件(B%):2%(0.0-0.5分)、2%→30%(0.5-23.5分)、30%→75%(23.5-25.5分)、75%(25.5-35.0分)
イオン化法:ESI, Positiveモード
スキャンタイプ:Data Dependent Aquisition
Activation Type:Collision Induced Dissociation(CID)
データの取得は付属ソフトであるXcalibur 3.0(サーモフィッシャーサイエンティフィック社)およびThermo Orbitrap Fusion Tune Application 2.0(サーモフィッシャーサイエンティフィック社)を用いて行った。
LC-MS/MS測定結果に対する修飾部位解析については、Proteome Discoverer version 1.4(サーモフィッシャーサイエンティフィック社)を用いて行った。
LC-MS/MSを用いた解析の結果、トラスツズマブのトリプシン消化によるリジン残基への修飾部位(ヨードアセトアミドによるCarbamidomethyl化を受けたチオール導入体(+145.019Da))を含むアミノ酸33残基からなるペプチド、THTCPPCPAPELLGGPSVFLFPPKPKDTLMISR(配列番号6)のペプチドフラグメントのMSスペクトル(実測値:m/z 952.23170、理論値:952.22900、4価)が観測され(図13)、CIDスペクトルより重鎖のEU numberingにおける246位もしくは248位のリジン残基の修飾を示す、2価のy20に相当するm/z 1166.88(理論値:1166.61)のプロダクトイオンが確認された(図14-1)。また、Proteome Discovererでの解析により、246位もしくは248位のリジン残基への修飾が高選択的に起こっていることが示された(図14-2)。この結果より、実施例5の(5-3)では抗体上、重鎖上EU numberingにおけるLys246およびLys248に位置選択的にコンジュゲーションが進行していることが分かった。
(7-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKGQAVWCTYH-NH2(配列番号10)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(73.1mg,35.9μmol)を得た。
HPLC純度:89%
(7-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150268にピークが確認され、結合性ペプチドが二つ導入された生成物が152630にピークが確認された。
(7-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50683、50844および、原料と同じ23439に軽鎖ピークが観測された。
(7-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(7-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(8-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKGQLLWCTYH-NH2(配列番号11)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(30.3mg,14.5μmol)を得た。
HPLC純度:75%
(8-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは148073にピークが観測され、結合性ペプチドが一つ導入された生成物が150495にピークが観測され、結合性ペプチドが二つ導入された生成物が152752にピークが確認された。
(8-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(8-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(8-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(9-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKGQLIWCTYH-NH2(配列番号12)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(40.0mg,19.1μmol)を得た。
HPLC純度:90%
(9-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が152758にピークが確認された。
(9-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(9-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(9-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(10-1)IgG1 Fc結合性ペプチドの合成
Ac-DCAYHKGQIVWCT-NH2(配列番号13)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(314mg,200μmol)を得た。
HPLC純度:90%
(10-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が152053にピークが確認された。
(10-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(10-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(10-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(11-1)IgG1 Fc結合性ペプチドの合成
Ac-DCAYHKGQVVWCT-NH2(配列番号14)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(180mg,116μmol)を得た。
HPLC純度:90%
(11-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が149220にピークが確認され、結合性ペプチドが二つ導入された生成物が151861にピークが確認された。
(11-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(11-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(11-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(12-1)IgG1 Fc結合性ペプチドの合成
Ac-DCAYHKGQAVWCT-NH2(配列番号15)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(158mg,104μmol)を得た。
HPLC純度:93%
(12-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が148897にピークが確認され、結合性ペプチドが二つ導入された生成物が151619にピークが確認された。
(12-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50684、50844および、原料と同じ23439に軽鎖ピークが観測された。
(12-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(12-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(13-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKSQIIWCTYH-NH2(配列番号16)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(20.0mg,9.43μmol)を得た。
HPLC純度:92%
(13-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が152864にピークが確認された。
(13-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(13-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(13-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(14-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKNQIIWCTYH-NH2(配列番号17)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(26.4mg,12.3μmol)を得た。
HPLC純度:100%
(14-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150549にピークが確認され、結合性ペプチドが二つ導入された生成物が152869にピークが確認された。
(14-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(14-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(14-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(15-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKDQIIWCTYH-NH2(配列番号18)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(37.2mg,17.3μmol)を得た。
HPLC純度:100%
(15-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が152864にピークが確認された。
(15-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(15-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(15-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(16-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKQQIIWCTYH-NH2(配列番号19)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(32.2mg,14.9μmol)を得た。
HPLC純度:89%
(16-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150212にピークが確認され、結合性ペプチドが二つ導入された生成物が152897にピークが確認された。
(16-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50686、50844および、原料と同じ23439に軽鎖ピークが観測された。
(16-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(16-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(17-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKEQIIWCTYH-NH2(配列番号20)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(38.0mg,17.6μmol)を得た。
HPLC純度:100%
(17-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が152900にピークが確認された。
(17-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50686、50844および、原料と同じ23439に軽鎖ピークが観測された。
(17-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(17-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(18-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKFQIIWCTYH-NH2(配列番号21)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(23.0mg,10.5μmol)を得た。
HPLC純度:93%
(18-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が153317にピークが確認された。
(18-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50686、50844および、原料と同じ23439に軽鎖ピークが観測された。
(18-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(18-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(19-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKYQIIWCTYH-NH2(配列番号22)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(30.8mg,14.0μmol)を得た。
HPLC純度:89%
(19-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が152965にピークが確認された。
(19-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50686、50844および、原料と同じ23439に軽鎖ピークが観測された。
(19-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(19-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(20-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKWQIIWCTYH-NH2(配列番号23)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(23.0mg,10.4μmol)を得た。
HPLC純度:93%
(20-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が153121にピークが確認された。
(20-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(20-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(20-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(21-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKHQIIWCTYH-NH2(配列番号24)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(68.7mg,31.6μmol)を得た。
HPLC純度:68%
(21-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が152909にピークが確認された。
(21-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50684、50844および、原料と同じ23439に軽鎖ピークが観測された。
(21-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(21-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(22-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKTQIIWCTYH-NH2(配列番号25)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(46.5mg,21.8μmol)を得た。
HPLC純度:89%
(22-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が152837にピークが確認された。
(19-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50686、50844および、原料と同じ23439に軽鎖ピークが観測された。
(22-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(22-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(23-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKLQIIWCTYH-NH2(配列番号26)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(32.2mg,15.0μmol)を得た。
HPLC純度:80%
(23-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が153053にピークが確認された。
(23-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(23-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(23-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(24-1)IgG1 Fc結合性ペプチドの合成
Ac-CAYHKLQIVWC-NH2(配列番号27)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(65.3mg,48.4μmol)を得た。
HPLC純度:85%
(24-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が149590にピークが確認され、結合性ペプチドが二つ導入された生成物が151270にピークが確認された。
(24-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(24-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(24-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(25-1)IgG1 Fc結合性ペプチドの合成
Ac-CAYHKLQLIWC-NH2(配列番号28)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(54.3mg,39.8μmol)を得た。
HPLC純度:88%
(25-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が149756にピークが確認され、結合性ペプチドが二つ導入された生成物が151131にピークが確認された。
(25-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(25-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(25-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(26-1)IgG1 Fc結合性ペプチドの合成
Ac-CAYHKSQIVWC-NH2(配列番号29)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(53.3mg,38.7μmol)を得た。
HPLC純度:92%
(26-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、合性ペプチドが一つ導入された生成物が149772にピークが確認され、結合性ペプチドが二つ導入された生成物が151323にピークが確認された。
(26-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(26-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(26-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(27-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKGQLVFCTYH-NH2(配列番号30)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(168mg,82.4μmol)を得た。
HPLC純度:89%
(27-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは148069にピークが観測され、結合性ペプチドが一つ導入された生成物が150279にピークが確認され、結合性ペプチドが二つ導入された生成物が152490にピークが確認された。
(27-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(27-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(27-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(28-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKGQQVWCTYH-NH2(配列番号31)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(51.3mg,24.5μmol)を得た。
HPLC純度:91%
(28-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは148057にピークが観測され、結合性ペプチドが一つ導入された生成物が150484にピークが確認され、結合性ペプチドが二つ導入された生成物が152587にピークが確認された。
(28-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(28-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(28-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(29-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKGQEVWCTYH-NH2(配列番号32)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(54.0mg,25.8μmol)を得た。
HPLC純度:92%
(29-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150036にピークが確認され、結合性ペプチドが二つ導入された生成物が152599にピークが確認された。
(29-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(29-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(29-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(30-1)IgG1 Fc結合性ペプチドの合成
Ac-CAYHKGQLVWC-NH2(配列番号33)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(171mg,118μmol)を得た。
HPLC純度:92%
(30-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が149591にピークが確認され、結合性ペプチドが二つ導入された生成物が151112にピークが確認された。
(30-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(30-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(30-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(31-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKAQLVWCTYH-NH2(配列番号34)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(58.8mg,28.1μmol)を得た。
HPLC純度:91%
(31-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは148057にピークが観測され、結合性ペプチドが一つ導入された生成物が150492にピークが確認され、結合性ペプチドが二つ導入された生成物が152755にピークが確認された。
(31-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(31-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(31-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(32-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKVQLVWCTYH-NH2(配列番号35)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(52.2mg,24.6μmol)を得た。
HPLC純度:82%
(32-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは148057にピークが観測され、原料のトラスツズマブは148062にピークが観測され、結合性ペプチドが一つ導入された生成物が150517にピークが確認され、結合性ペプチドが二つ導入された生成物が152998にピークが確認された。
(32-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(32-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(32-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(33-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKLQLVWCTYH-NH2(配列番号36)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(155mg,72.7μmol)を得た。
HPLC純度:89%
(33-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは148057にピークが観測され、結合性ペプチドが一つ導入された生成物が150899にピークが確認され、結合性ペプチドが二つ導入された生成物が153025にピークが確認された。
(33-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(33-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(33-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(34-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKIQLVWCTYH-NH2(配列番号37)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(153mg,71.7μmol)を得た。
HPLC純度:94%
(34-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150720にピークが確認され、結合性ペプチドが二つ導入された生成物が153210にピークが確認された。
(34-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(34-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(34-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(35-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKSQLVWCTYH-NH2(配列番号38)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(167mg,79.2μmol)を得た。
HPLC純度:92%
(35-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150505にピークが確認され、結合性ペプチドが二つ導入された生成物が152784にピークが確認された。
(35-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(35-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(35-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(36-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKTQLVWCTYH-NH2(配列番号39)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(164mg,77.3μmol)を得た。
HPLC純度:89%
(36-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が152814にピークが確認された。
(36-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(36-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(36-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(37-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKNQLVWCTYH-NH2(配列番号40)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(51.4mg,24.1μmol)を得た。
HPLC純度:93%
(37-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。結合性ペプチドが一つ導入された生成物が150370にピークが確認され、結合性ペプチドが二つ導入された生成物が152678にピークが確認された。
(37-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(37-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(37-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(38-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKDQLVWCTYH-NH2(配列番号41)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(50.8mg,23.7μmol)を得た。
HPLC純度:91%
(38-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。結合性ペプチドが一つ導入された生成物が150367にピークが確認され、結合性ペプチドが二つ導入された生成物が152831にピークが確認された。
(38-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(38-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(38-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(39-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKQQLVWCTYH-NH2(配列番号42)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(42.1mg,19.6μmol)を得た。
HPLC純度:91%
(39-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。結合性ペプチドが一つ導入された生成物が150540にピークが確認され、結合性ペプチドが二つ導入された生成物が152862にピークが確認された。
(39-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(39-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(39-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(40-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKEQLVWCTYH-NH2(配列番号43)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(38.3mg,17.8μmol)を得た。
HPLC純度:100%
(40-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150535にピークが確認され、結合性ペプチドが二つ導入された生成物が152865にピークが確認された。
(40-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(40-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(40-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(41-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKFQLVWCTYH-NH2(配列番号44)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(19.5mg,9.00μmol)を得た。
HPLC純度:90%
(41-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150972にピークが確認され、結合性ペプチドが二つ導入された生成物が153454にピークが確認された。
(41-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(41-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(41-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(42-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKRQLVWCTYH-NH2(配列番号45)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(46.2mg,21.2μmol)を得た。
HPLC純度:100%
(42-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150577にピークが確認され、結合性ペプチドが二つ導入された生成物が152923にピークが確認された。
(42-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(42-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(42-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(43-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKHQLVWCTYH-NH2(配列番号46)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(44.3mg,20.5μmol)を得た。
HPLC純度:69%
(43-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150549にピークが確認され、結合性ペプチドが二つ導入された生成物が152879にピークが確認された。
(43-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(43-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(43-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(44-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKWQLVWCTYH-NH2(配列番号47)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(29.0mg,13.1μmol)を得た。
HPLC純度:93%
(44-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が15.0595にピークが確認され、結合性ペプチドが二つ導入された生成物が15.3133にピークが確認された。
(44-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(44-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(44-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(45-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKYQLVWCTYH-NH2(配列番号48)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(25.5mg,11.7μmol)を得た。
HPLC純度:100%
(45-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150569にピークが確認され、結合性ペプチドが二つ導入された生成物が153086にピークが確認された。
(45-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(45-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(45-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(46-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYFKGQLVWCTYH-NH2(配列番号49)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(19.5mg,9.35μmol)を得た。
HPLC純度:75%
(46-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150661にピークが確認され、結合性ペプチドが二つ導入された生成物が153059にピークが確認された。
(46-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(46-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(46-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(47-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYYKGQLVWCTYH-NH2(配列番号50)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(29.6mg,14.1μmol)を得た。
HPLC純度:77%
(47-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150497にピークが確認され、結合性ペプチドが二つ導入された生成物が152779にピークが確認された。
(47-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(47-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(47-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(48-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYWKGQLVWCTYH-NH2(配列番号51)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(36.5mg,17.2μmol)を得た。
HPLC純度:97%
(48-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150529にピークが確認され、結合性ペプチドが二つ導入された生成物が152819にピークが確認された。
(48-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(48-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(48-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(49-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYRKGQLVWCTYH-NH2(配列番号52)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(46.6mg,22.2μmol)を得た。
HPLC純度:97%
(49-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは148222にピークが観測され、結合性ペプチドが一つ導入された生成物が150492にピークが確認され、結合性ペプチドが二つ導入された生成物が152761にピークが確認された。
(49-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(49-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(49-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(50-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYGKGQLVWCTYH-NH2(配列番号53)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(31.9mg,16.0μmol)を得た。
HPLC純度:94%
(50-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは148219にピークが観測され、結合性ペプチドが一つ導入された生成物が150402にピークが確認され、結合性ペプチドが二つ導入された生成物が152561にピークが確認された。
(50-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(50-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(50-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(51-1)IgG1 Fc結合性ペプチドの合成
Ac-DCAYHKGQLVWC-NH2(配列番号54)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(76.9mg,52.5μmol)を得た。
HPLC純度:89%
(51-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が151487にピークが確認された。
(51-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(51-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(51-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(52-1)IgG1 Fc結合性ペプチドの合成
Ac-NCAYHKGQLVWC-NH2(配列番号55)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(78.6mg,53.7μmol)を得た。
HPLC純度:93%
(52-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が151322にピークが確認された。
(52-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(52-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(52-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(53-1)IgG1 Fc結合性ペプチドの合成
Ac-CAYHKGQLVWCT-NH2(配列番号56)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(63.8mg,44.0μmol)を得た。
HPLC純度:77%
(53-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が151305にピークが確認された。
(53-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(53-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(53-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(54-1)IgG1 Fc結合性ペプチドの合成
Ac-CAYHKSQLVWC-NH2(配列番号57)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(68.3mg,49.5μmol)を得た。
HPLC純度:96%
(54-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液をNAP-5カラムに添加し、反応を停止させ20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が149771にピークが確認され、結合性ペプチドが二つ導入された生成物が151326にピークが確認された。
(54-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50844および、原料と同じ23439に軽鎖ピークが観測された。
(54-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(54-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(55-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAWHKGQIIWCTYH-NH2(配列番号68)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(58.4mg,27.6μmol)を得た。
HPLC純度:88%
(55-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150690にピークが観測され、結合性ペプチドが二つ導入された生成物が152796にピークが確認された。
(55-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(55-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(55-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(56-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAFHKGQIIWCTYH-NH2(配列番号69)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(78.2mg,37.7μmol)を得た。
HPLC純度:89%
(56-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150368にピークが観測され、結合性ペプチドが二つ導入された生成物が152717にピークが確認された。
(56-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50845および、原料と同じ23439に軽鎖ピークが観測された。
(56-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(56-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(57-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAHHKGQIIWCTYH-NH2(配列番号70)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(98.6mg,47.7μmol)を得た。
HPLC純度:60%
(57-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは148236にピークが観測され、結合性ペプチドが一つ導入された生成物が150466にピークが観測され、結合性ペプチドが二つ導入された生成物が152702にピークが確認された。
(57-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(57-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(57-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(58-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCGYHKGQIIWCTYH-NH2(配列番号71)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(88.7mg,42.7μmol)を得た。
HPLC純度:85%
(58-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは148229にピークが観測され、結合性ペプチドが一つ導入された生成物が150477にピークが観測され、結合性ペプチドが二つ導入された生成物が152892にピークが確認された。
(58-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50757に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50685、50845および、原料と同じ23439に軽鎖ピークが観測された。
(58-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(58-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(59-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCLYHKGQIIWCTYH-NH2(配列番号72)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(54.8mg,25.7μmol)を得た。
HPLC純度:84%
(59-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150691にピークが観測され、結合性ペプチドが二つ導入された生成物が152838にピークが確認された。
(59-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50757に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(59-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(59-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(60-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCPYHKGQIIWCTYH-NH2(配列番号73)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(83.0mg,39.2μmol)を得た。
HPLC純度:87%
(60-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは148225にピークが観測され、結合性ペプチドが一つ導入された生成物が150513にピークが観測され、結合性ペプチドが二つ導入された生成物が153398にピークが確認された。
(60-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50684、50845および、原料と同じ23439に軽鎖ピークが観測された。
(60-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(60-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(61-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCRYHKGQIIWCTYH-NH2(配列番号74)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(47.8mg,22.0μmol)を得た。
HPLC純度:74%
(61-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは148387にピークが観測され、結合性ペプチドが一つ導入された生成物が150730にピークが観測され、結合性ペプチドが二つ導入された生成物が153089にピークが確認された。
(61-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50757に重鎖ピーク、23440に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50845および、原料と同じ23439に軽鎖ピークが観測された。
(61-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(61-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(62-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCVYHKGQIIWCTYH-NH2(配列番号75)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(71.0mg,33.5μmol)を得た。
HPLC純度:88%
(62-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150358にピークが観測され、結合性ペプチドが二つ導入された生成物が152961にピークが確認された。
(62-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50684、50846および、原料と同じ23439に軽鎖ピークが観測された。
(62-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(62-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(63-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCNYHKGQIIWCTYH-NH2(配列番号76)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(102mg,47.7μmol)を得た。
HPLC純度:100%
(63-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150530にピークが観測され、結合性ペプチドが二つ導入された生成物が152839にピークが確認された。
(63-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50845および、原料と同じ23439に軽鎖ピークが観測された。
(63-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(63-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(64-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCEYHKGQIIWCTYH-NH2(配列番号77)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(77.7mg,36.1μmol)を得た。
HPLC純度:83%
(64-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは148073にピークが観測され、結合性ペプチドが一つ導入された生成物が150667にピークが観測され、結合性ペプチドが二つ導入された生成物が153031にピークが確認された。
(64-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(64-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(64-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(65-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCFYHKGQIIWCTYH-NH2(配列番号78)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(61.9mg,28.6μmol)を得た。
HPLC純度:78%
(65-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは148164にピークが観測され、結合性ペプチドが一つ導入された生成物が150725にピークが観測され、結合性ペプチドが二つ導入された生成物が153072にピークが確認された。
(65-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50678、50845および、原料と同じ23439に軽鎖ピークが観測された。
(65-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(65-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(66-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKGEIIWCTYH-NH2(配列番号79)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(82.3mg,39.3μmol)を得た。
HPLC純度:88%
(66-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が152753にピークが確認された。
(66-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(66-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(66-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(67-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKGNIIWCTYH-NH2(配列番号80)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(85.2mg,41.0μmol)を得た。
HPLC純度:89%
(67-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が152886にピークが確認された。
(67-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(67-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(67-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(68-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKGPIIWCTYH-NH2(配列番号81)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(86.8mg,42.1μmol)を得た。
HPLC純度:89%
(68-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは148394にピークが観測された。
(68-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は原料と同じく50594、50756に重鎖ピーク、23439に軽鎖ピークが観測された。
(68-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(68-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(69-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKGGIIWCTYH-NH2(配列番号82)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(68.9mg,34.1μmol)を得た。
HPLC純度:91%
(69-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150075にピークが観測され、結合性ペプチドが二つ導入された生成物が152612にピークが確認された。
(69-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50757に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50683、50845および、原料と同じ23439に軽鎖ピークが観測された。
(69-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(69-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(70-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKGDIIWCTYH-NH2(配列番号83)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(78.1mg,37.6μmol)を得た。
HPLC純度:88%
(70-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150682にピークが観測され、結合性ペプチドが二つ導入された生成物が153085にピークが確認された。
(70-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50757に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50845および、原料と同じ23439に軽鎖ピークが観測された。
(70-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(70-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(71-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKGRIIWCTYH-NH2(配列番号84)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(70.1mg,33.1μmol)を得た。
HPLC純度:81%
(71-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150674にピークが観測され、結合性ペプチドが二つ導入された生成物が153338にピークが確認された。
(71-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50757に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(71-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(71-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(72-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKGFIIWCTYH-NH2(配列番号85)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(61.2mg,29.0μmol)を得た。
HPLC純度:83%
(72-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150706にピークが観測され、結合性ペプチドが二つ導入された生成物が152979にピークが確認された。
(72-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50757に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50845および、原料と同じ23439に軽鎖ピークが観測された。
(72-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(72-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(73-1)IgG1 Fc結合性ペプチドの合成
Ac-RGNCAYHKGHIIWCTYH-NH2(配列番号86)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(94.0mg,44.8μmol)を得た。
HPLC純度:100%
(73-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が150686にピークが観測され、結合性ペプチドが二つ導入された生成物が152951にピークが確認された。
(73-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50757に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50845および、原料と同じ23439に軽鎖ピークが観測された。
(73-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(73-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(74-1)IgG1 Fc結合性ペプチドの合成
Ac-DCAYHKGQIIWCT-NH2(配列番号87)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(66.7mg,42.2μmol)を得た。
HPLC純度:92%
(74-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が149462にピークが観測され、結合性ペプチドが二つ導入された生成物が152084にピークが確認された。
(74-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50757に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50845および、原料と同じ23439に軽鎖ピークが観測された。
(74-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(74-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(75-1)IgG1 Fc結合性ペプチドの合成
Ac-NCAYHKGQIIWCT-NH2(配列番号88)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(75.1mg,47.6μmol)を得た。
HPLC純度:89%
(75-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが一つ導入された生成物が149662にピークが観測され、結合性ペプチドが二つ導入された生成物が152266にピークが確認された。
(75-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50757に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50845および、原料と同じ23439に軽鎖ピークが観測された。
(75-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(75-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(76-1)IgG1 Fc結合性ペプチドの合成
Ac-GNCAYHKGQIIWCTY-NH2(配列番号89)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(44.7mg,24.9μmol)を得た。
HPLC純度:95%
(76-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、結合性ペプチドが二つ導入された生成物が152165にピークが確認された。
(76-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50757に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(76-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(76-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(77-1)IgG1 Fc結合性ペプチドの合成
Ac-GCAYHKGQIIWCG-NH2(配列番号90)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(53.5mg,36.2μmol)を得た。
HPLC純度:85%
(77-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは148398にピークが観測され、結合性ペプチドが一つ導入された生成物が149874にピークが観測され、結合性ペプチドが二つ導入された生成物が151522にピークが確認された。
(77-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50757に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(77-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(77-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(78-1)IgG1 Fc結合性ペプチドの合成
Ac-GGCAYHKGQIIWCGG-NH2(配列番号91)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(16.5mg,10.4μmol)を得た。
HPLC純度:60%
(78-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは148790にピークが観測され、結合性ペプチドが一つ導入された生成物が150561にピークが観測され、結合性ペプチドが二つ導入された生成物が152305にピークが確認された。
(78-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(78-5)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(78-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(79-1)IgG1 Fc結合性ペプチドの合成
Ac-GGGCAYHKGQIIWCGGG-NH2(配列番号92)のペプチドを実施例1(1-1)と同様の方法で合成、精製を行い、目的物(69.9mg,41.0μmol)を得た。
HPLC純度:62%
(79-3)で合成したペプチドジスルフィドリンカー連結物-NHS活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは148225にピークが観測され、結合性ペプチドが一つ導入された生成物が150102にピークが観測され、結合性ペプチドが二つ導入された生成物が151977にピークが確認された。
(79-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50595、50757に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(79-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
実施例3の(3-1)記載の方法により、(79-4)で得られた抗体・ペプチド複合体のリンカー切断と再酸化を行えば、EU numberingにおけるLys246およびLys248に位置選択的にチオプロピオニル基が導入された抗体を得ることが可能である。
(80)切断性リンカーの合成とペプチドとの連結
(80-1)チオエステルリンカーの合成とペプチドとの連結
(80-1-1)チオエステルリンカーの合成
(80-3)で合成したペプチド-リンカー連結物-チオフェノール活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを50mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して10等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。
(80-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にペプチド-リンカー連結物が導入された52855、53017および、原料と同じ23439に軽鎖ピークが観測された(図88)。
(80-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチド-リンカー連結物-チオフェノール活性化体10等量;
(80-4)で得られたトラスツズマブ・ペプチド複合体(20mM PBSバッファー)をAmicon3Kにより、0.5Mヒドロキシルアミン、10mM EDTA(pH5.5)溶液へと置換し、室温で2時間静置した。2時間後、20mM PBSバッファー、10mM EDTA(pH7.4)へと置換し、トラスツズマブ・チオール導入体を得た。
(80-7)で生成したトラスツズマブ・チオール導入体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された(図90)。
(80-4)で生成したトラスツズマブ・チオール導入体とトラスツズマブ・ペプチド複合体の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ・ペプチド複合体
b:トラスツズマブ・チオール導入体;
(80-7)で得られたトラスツズマブ・チオール導入体(20mMPBSバッファー、10mM EDTA)に対して、フルオレセイン-5-マレイミド(10mM、DMSOに溶解)を5等量加えた。室温にて1時間静置後、20mMPBSバッファーに置換し、トラスツズマブ蛍光標識体(ADC mimic)を得た。
(80-10)で生成したトラスツズマブ蛍光標識体(ADC mimic)に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブ・チオール導入体は50682、50844に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にフルオレセインが導入された51110、51272および、原料と同じ23439に軽鎖ピークが観測された(図92)。
(80-7)で得られたトラスツズマブ・チオール導入体(20mM PBSバッファー、10mM EDTA)に対して、N-(4-アジドフェニル)-2-ヨード-アセトアミド(10mM、DMSOに溶解)を10等量加えた。室温にて1時間静置後、20mM PBSバッファーに置換し、ジベンゾシクロオクチン酸(DBCO-Acid、10mM、DMSOに溶解)を5等量加えてクリック反応を行い、ADC mimicを得た。
(80-12)で生成したADC mimicに7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブ・チオール導入体は50682、50844に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にクリック反応生成物が導入された51176、51338および、原料と同じ23439に軽鎖ピークが観測された(図93)。
トラスツズマブ、(80-5)、(80-8)、(80-10)、(80-12)の結果をまとめる(図94)。
(81)切断性リンカーの合成とペプチドとの連結
(81-1)チオエステルリンカーの合成とペプチドとの連結
(81-1-1)チオエステルリンカーの合成
(81-3)で合成したペプチド-リンカー連結物-チオフェノール活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 4.7)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。
(81-4)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にペプチド-リンカー連結物が導入された52855、53017および、原料と同じ23439に軽鎖ピークが観測された。
(81-4)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドジスルフィドリンカー連結物-NHS活性化体30等量;
(81-4)で得られたトラスツズマブ・ペプチド複合体(20mM PBSバッファー)をAmicon3Kにより、0.5Mヒドロキシルアミン、10mM EDTA(pH5.5)溶液へと置換し、室温で2時間静置した。2時間後、20mM PBSバッファー、10mM EDTA(pH7.4)へと置換し、トラスツズマブ・チオール導入体を得た。
(81-7)で生成したトラスツズマブ・チオール導入体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50682、50844および、原料と同じ23439に軽鎖ピークが観測された。
(81-3)で合成したペプチド-リンカー連結物-チオフェノール活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)500μgを60mM酢酸ナトリウムバッファー(pH 5.5)46.9μLに溶解させ、21.6mMのペプチド試薬を4.7μL(抗体に対して30等量)加えて、室温で1時間攪拌した。その後、0.5Mヒドロキシルアミン、10mM EDTA(pH5.5)溶液を酢酸ナトリウムと同量添加し、室温で2時間静置した。2時間後、20mM PBSバッファー、10mM EDTA(pH7.4)へと置換し、トラスツズマブ・チオール導入体を得た。
(81-9)で得られたトラスツズマブ・チオール導入体をPNGaseF(New England BioLabs社製)により糖鎖切断を行った後、ペプチドマッピングを行った。1.5mL低吸着マイクロテストチューブにサンプル溶液を10μL、50mM炭酸水素アンモニウム緩衝液、40%トリフルオロエタノールに溶解した20mMのジチオスレイトール水溶液10μLを加えて65℃で1時間加温後、50mMのヨードアセトアミド水溶液10μLを添加し、遮光下室温で30分間反応させた。反応後、50mM炭酸水素アンモニウム緩衝液を40μL加えて撹拌し、20ng/μLのトリプシン水溶液を10μL添加して37℃で16時間酵素消化した。消化後、20%トリフルオロ酢酸水溶液を2μL添加し反応を止め、LC-MS/MS測定を実施した。
(分析装置)
ナノHPLC:EASY-nLC 1000(サーモフィッシャーサイエンティフィック社)
質量分析計:トライブリッド質量分析計Orbitrap Fusion(サーモフィッシャーサイエンティフィック社)
トラップカラム:Acclaim PepMap(登録商標) 100,75μmx2cm(サーモフィッシャーサイエンティフィック社)
分析カラム:ESI-column(NTCC-360/75-3-125,75μm×12.5cm,3μm(日京テクノス株式会社))
移動相A:0.1%ギ酸水溶液
移動相B:0.1%ギ酸、アセトニトリル溶液
ローディング溶液:0.1%トリフルオロ酢酸水溶液
流速:300nL/min
サンプル注入量:1μL
グラジエント条件(B%):2%(0.0-0.5分)、2%→30%(0.5-23.5分)、30%→75%(23.5-25.5分)、75%(25.5-35.0分)
イオン化法:ESI, Positiveモード
スキャンタイプ:Data Dependent Aquisition
Activation Type:Collision Induced Dissociation(CID)
データの取得は付属ソフトであるXcalibur 3.0(サーモフィッシャーサイエンティフィック社)およびThermo Orbitrap Fusion Tune Application 2.0(サーモフィッシャーサイエンティフィック社)を用いて行った。
LC-MS/MS測定結果に対する修飾部位解析については、Proteome Discoverer version 1.4(サーモフィッシャーサイエンティフィック社)を用いて行った。
LC-MS/MSを用いた解析の結果、トラスツズマブのトリプシン消化によるリジン残基への修飾部位(ヨードアセトアミドによるCarbamidomethyl化を受けたチオール導入体(+145.019Da))を含むアミノ酸33残基からなるペプチド、THTCPPCPAPELLGGPSVFLFPPKPKDTLMISR(配列番号6)のペプチドフラグメントのMSスペクトル(実測値:m/z 1269.30359、理論値:1269.30273、3価)が観測され(図96)、CIDスペクトルより重鎖のEU numberingにおける246位もしくは248位のリジン残基の修飾を示す、1価のy9に相当するm/z 1205.86(理論値:1205.60)のプロダクトイオンが確認された(図97-1)。また、Proteome Discovererでの解析により、246位もしくは248位のリジン残基への修飾が高選択的に起こっていることが示された(図97-2)。
センス鎖:5’-6-FAM-A(M)C(M)AGC(M)AAAU(M)U(M)C(M)C(M)AU(M)C(M)GU(M)GU(M)-N(6)(配列番号93)
アンチセンス鎖:5’-p-AC(F)AC(F)GAU(F)GGAAU(F)U(F)U(F)GC(F)U(F)GU(F)UU(配列番号94)
・p:Phosphorylation、(F):2’-Fluoro、(M):2’-O-Me(methyl)、N(6):amino C6 linkerを3’末端に付加
を10等量加え、4℃にて40時間静置した。混合液をAmicon Ultra-0.5mL3kDa(メルクミリポア社製)を用いて精製した後、AKTApurifier(GEヘルスケア社製)を用いてさらに精製した。精製したコンジュゲートはSDS-PAGにより分析した。
カラム:Superdex 200 Increase10/300GL(GEヘルスケア社製)
バッファー:pH7.4のPBSバッファー
流速:0.4ml/min
検出器:215及び280nmの波長で検出した。
(82-1-2)で合成したコンジュゲートをSDS-PAGEにより分析した。スタンダードとしてプレシジョンPlusプロテインTMプレステインドスタンダード(BIO-RAD社製)を用い、染色はバレットCBBステイン ワン(ナカライテスク社製)で行った(図98)。
(83-1)トラスツズマブ・チオール導入体へのアジド基の導入とADC mimicの合成
(83-1-1)トラスツズマブ・チオール導入体へのアジド基の導入
(81-7)で得られたトラスツズマブ・チオール導入体(20mM PBSバッファー、10mM EDTA)に対して、N-[2-[2-(2-アジドエトキシ)エトキシ]エチル]-2-ヨード-アセトアミド(50mM、DMFに溶解)を50等量加えた。37℃にて3時間静置後、20mM PBSバッファーに置換し、トラスツズマブ・アジド導入体を得た。
(83-1-1)で生成したトラスツズマブ・アジド導入体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブ・チオール導入体は50682、50844に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にクリック反応生成物が導入された50895、51057および、原料と同じ23439に軽鎖ピークが観測された(図99)。
(83-1-1)で得られたトラスツズマブ・アジド導入体(20mM PBSバッファー、10mM EDTA)に、ジベンゾシクロオクチン酸(DBCO-Acid、10mM、DMFに溶解)を10等量加えてクリック反応を行い、ADC mimicを得た。
(83-1-3)で生成したADC mimicに7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブ・アジド導入体は50896、51058に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にクリック反応生成物が導入された51216、51378および、原料と同じ23439に軽鎖ピークが観測された(図100)。
(84)含アジド切断性リンカーの合成とペプチドとの連結
(84-1)含アジドチオエステルリンカーの合成とペプチドとの連結
(84-1-1)含アジドチオエステルリンカーの合成
MS(ESI)m/z:351[M+H]+
(84-1)で合成したペプチド-リンカー連結物-チオフェノール活性化体はN,N’-ジメチルホルムアミドに溶解し5.01mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)707μgを60mM酢酸ナトリウムバッファー(pH 5.5)220μLに溶解させ、5.01mMのペプチド試薬を19.1μL(抗体に対して10等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。
(84-2)で生成した抗体・ペプチド複合体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にペプチド-リンカー連結物が導入された52996、53158および、原料と同じ23439に軽鎖ピークが観測された(図101)。
(84-2)で生成した抗体・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ原料
b:トラスツズマブ+ペプチドアジドリンカー連結物-NHS活性化体10等量;
(84-2)で得られたトラスツズマブ・ペプチド複合体(20mM PBSバッファー)をAmicon10Kにより、0.5Mヒドロキシルアミン、10mM EDTA(pH6.0)溶液へと置換し、室温で2時間静置した。2時間後、20mM PBSバッファー、10mM EDTA(pH7.4)へと置換し、トラスツズマブ・チオール導入体を得た。
(84-5)で生成したトラスツズマブ・チオール導入体に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブは50594、50756に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にチオプロピオニル基が導入された50850、51012および、原料と同じ23439に軽鎖ピークが観測された(図103)。
(84-5)で生成した抗体・アジド導入体と原料の抗体・ペプチド複合体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ・ペプチド複合体
b:トラスツズマブ・アジド導入体;
(84-1)で合成したペプチド-リンカー連結物-チオフェノール活性化体をN,N’-ジメチルホルムアミドに溶解し21.1mMとした。抗HER2 IgG抗体トラスツズマブ(中外製薬)1.29mgを60mM酢酸ナトリウムバッファー(pH 5.5)123.8μLに溶解させ、21.1mMのペプチド試薬を10.8μL(抗体に対して15等量)加えて、室温で1時間攪拌した。その後、0.5Mヒドロキシルアミン、10mM EDTA(pH5.5)溶液を酢酸ナトリウムと同量添加し、室温で2時間静置した。2時間後、20mM PBSバッファー、10mM EDTA(pH7.4)へと置換し、トラスツズマブ・アジド導入体を得た。
(84-8)で得られたトラスツズマブ・アジド導入体を、上記(81-10)と同様に処理し、LC-MS/MS測定を実施した。
分析装置、HPLC分析条件、質量分析計分析条件は、上記(81-11)と同様である。
LC-MS/MS測定結果に対する修飾部位解析については、Dynamic Modificationsの設定を除き、上記(81-12)と同様である。Dynamic Modificationsについては、メチオニン残基の酸化(+15.995Da)およびリジン残基への修飾体(アジド導入体(+255.097Da)、アミン導入体(+229.106)、アジドカルボン酸導入体(+240.086)、アミンカルボン酸導入体(+214.095))を設定した。さらに、Peptide ConfidenceがHighのもののみとなるようフィルターをかけた。
LC-MS/MSを用いた解析の結果、トラスツズマブのトリプシン消化によるリジン残基への修飾部位(アジドカルボン酸導入体(+240.086))を含むアミノ酸33残基からなるペプチド、THTCPPCPAPELLGGPSVFLFPPKPKDTLMISR(配列番号6)のペプチドフラグメントのMSスペクトル(実測値:m/z 1300.99241、理論値:1300.99173、3価)が観測され(図105)、CIDスペクトルより重鎖のEU numberingにおける246位もしくは248位のリジン残基の修飾を示す、1価のy12に相当するm/z 1622.92(理論値:1622.87)のプロダクトイオンが確認された(図106-1)。また、Proteome Discovererでの解析により、246位もしくは248位のリジン残基への修飾が高選択的に起こっていることが示された(図106-2)。
(85-1)トラスツズマブ・アジド導入体への低分子導入
(84-5)で得られたトラスツズマブ・アジド導入体(20mM PBSバッファー、10mM EDTA)に対して、ジベンゾシクロオクチン酸(DBCO-Acid、10mM、DMFに溶解)を10等量加えてクリック反応を行い、ADC mimicを得た。
(85-1)で生成したADC mimicに7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料のトラスツズマブ・アジド導入体は50850、51012に重鎖ピーク、23439に軽鎖ピークが観測され、生成物は重鎖にクリック反応生成物が導入された51169、51330および、原料と同じ23439に軽鎖ピークが観測された(図107)。
(85-1)で生成した抗体・アジド導入体と原料の抗体・ペプチド複合体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:トラスツズマブ・アジド導入体
b:ADC mimic;
(85-1)で得られたADC mimicを、上記(81-10)と同様に処理し、LC-MS/MS測定を実施した。
分析装置、HPLC分析条件、質量分析計分析条件は、上記(81-11)と同様である。
LC-MS/MS測定結果に対する修飾部位解析については、Dynamic Modificationsの設定を除き、上記(81-12)と同様である。Dynamic Modificationsについては、メチオニン残基の酸化(+15.995Da)およびリジン残基への修飾体(DBCO-Acid導入体(+574.218)、DBCO-Acidカルボン酸導入体(+559.207)、アジド導入体(+255.097)、アジドカルボン酸導入体(+240.086))を設定した。さらに、Peptide ConfidenceがHighのもののみとなるようフィルターをかけた。
LC-MS/MSを用いた解析の結果、トラスツズマブのトリプシン消化によるリジン残基への修飾部位(DBCO-Acidカルボン酸導入体(+559.207))を含むアミノ酸33残基からなるペプチド、THTCPPCPAPELLGGPSVFLFPPKPKDTLMISR(配列番号6)のペプチドフラグメントのMSスペクトル(実測値:m/z 1055.77631、理論値:1055.77600、4価)が観測され(図109)、CIDスペクトルより重鎖のEU numberingにおける246位もしくは248位のリジン残基の修飾を示す、2価のy12に相当するm/z 971.71(理論値:971.50)のプロダクトイオンが確認された(図110-1)。また、Proteome Discovererでの解析により、246位もしくは248位のリジン残基への修飾が高選択的に起こっていることが示された(図110-2)。
(86-1)抗TNF-α IgG1抗体アダリムマブの特異的修飾とESI-TOFMSによる解析
(81-3)で合成したペプチド-リンカー連結物-チオフェノール活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗TNF-α IgG1抗体アダリムマブ(エーザイ)500μgを50mM酢酸ナトリウムバッファー(pH5.5)200μLに溶解させ、4mMのペプチド試薬を4.7μL(抗体に対して10等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のアダリムマブは148086にピークが観測され、反応物は結合性ペプチドが二つ導入された生成物が152605にピークが確認された(図111)。
(86-1)で生成したアダリムマブ・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:アダリムマブ原料
b:アダリムマブ+ペプチド-リンカー連結物-チオフェノール活性化体10等量;
(86-2)で得られたアダリムマブ・ペプチド複合体(20mM PBSバッファー)をAmicon3Kにより、0.5Mヒドロキシルアミン、10mM EDTA(pH5.5)溶液へと置換し、室温で2時間静置した。2時間後、20mM PBSバッファー、10mM EDTA(pH7.4)へと置換し、アダリムマブ・チオール導入体を得た。ESI-TOFMSにより質量を測定したところ、原料のアダリムマブ・ペプチド複合体は152606にピークが観測され、反応物のアダリムマブ・チオール導入体は148264にピークが確認された(図113)。
(863)で生成したアダリムマブ・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:アダリムマブ・ペプチド-リンカー連結物
b:アダリムマブ・チオール導入体;
(86-3)で得られたアダリムマブ・チオール導入体(20mMPBSバッファー、10mM EDTA)に対して、フルオレセイン-5-マレイミド(10mM、DMSOに溶解)を5等量加えた。室温にて1時間静置後、20mMPBSバッファーに置換し、アダリムマブ蛍光標識体(ADC mimic)を得た。
(86-5)で生成したアダリムマブ蛍光標識体(ADC mimic)に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料、生成物ともに軽鎖は同じピークが観測され、原料のアダリムマブは50730に重鎖ピークが観測され、生成物は重鎖にフルオレセインが導入された51156ピークが観測された(図115)。
(87-1)抗RANKL IgG2抗体デノスマブの特異的修飾とESI-TOFMSによる解析
(81-3)で合成したペプチド-リンカー連結物-チオフェノール活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗RANKL IgG2抗体デノスマブ(第一三共)500μgを50mM酢酸ナトリウムバッファー(pH5.5)200μLに溶解させ、4mMのペプチド試薬を4.7μL(抗体に対して10等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のデノスマブは147358.97にピークが観測され、反応物は結合性ペプチドが二つ導入された生成物が151878.61にピークが確認された(図116)。
(87-1)で生成したデノスマブ・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:デノスマブ原料
b:デノスマブ+ペプチド-リンカー連結物-チオフェノール活性化体10等量;
(87-2)で得られたデノスマブ・ペプチド複合体(20mM PBSバッファー)をAmicon3Kにより、0.5Mヒドロキシルアミン、10mM EDTA(pH5.5)溶液へと置換し、室温で2時間静置した。2時間後、20mM PBSバッファー、10mM EDTA(pH7.4)へと置換し、デノスマブ・チオール導入体を得た。ESI-TOFMSにより質量を測定したところ、原料のデノスマブ・ペプチド複合体は151878にピークが観測され、反応物のデノスマブ・チオール導入体は147535にピークが確認された(図118)。
(87-3)で生成したデノスマブ・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:デノスマブ・ペプチド-リンカー連結物
b:デノスマブ・チオール導入体;
(87-3)で得られたデノスマブ・チオール導入体(20mMPBSバッファー、10mM EDTA)に対して、フルオレセイン-5-マレイミド(10mM、DMSOに溶解)を5等量加えた。室温にて1時間静置後、20mMPBSバッファーに置換し、デノスマブ蛍光標識体(ADC mimic)を得た。
(87-5)で生成したデノスマブ蛍光標識体(ADC mimic)に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料、生成物ともに軽鎖は同じピークが観測され、原料のデノスマブは50292に重鎖ピークが観測され、生成物は重鎖にフルオレセインが導入された50717ピークが観測された(図120)。
(88-1)抗IL-4/13受容体 IgG4抗体デュピルマブの特異的修飾とESI-TOFMSによる解析
(81-3)で合成したペプチド-リンカー連結物-チオフェノール活性化体はN,N’-ジメチルホルムアミドに溶解し21.6mMとした。抗IL-4/13受容体 IgG4抗体デュピルマブ(Sanofi・Regeneron)500μgを50mM酢酸ナトリウムバッファー(pH5.5)200μLに溶解させ、4mMのペプチド試薬を4.7μL(抗体に対して10等量)加えて、室温で1時間攪拌した。反応液を100mMクエン酸ナトリウムバッファー(pH 2.9)に置換して反応を停止させ、さらに20mMPBSバッファーに置換した。ESI-TOFMSにより質量を測定したところ、原料のデュピルマブは149796にピークが観測され、反応物は結合性ペプチドが二つ導入された生成物が154315にピークが確認された(図121)。
(88-1)で生成したデュピルマブ・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:デュピルマブ原料
b:デュピルマブ+ペプチド-リンカー連結物-チオフェノール活性化体10等量;
(88-2)で得られたデュピルマブ・ペプチド複合体(20mM PBSバッファー)をAmicon3Kにより、0.5Mヒドロキシルアミン、10mM EDTA(pH5.5)溶液へと置換し、室温で2時間静置した。2時間後、20mM PBSバッファー、10mM EDTA(pH7.4)へと置換し、デュピルマブ・チオール導入体を得た。ESI-TOFMSにより質量を測定したところ、原料のデュピルマブ・ペプチド複合体は154315にピークが観測され、反応物のデュピルマブ・チオール導入体は149975にピークが確認された(図123)。
(88-3)で生成したデュピルマブ・ペプチド複合体と原料の抗体をHICにより解析した。カラムはProtein-Pak Hi Res HIC Column(Waters)4.6x100mm 2.5μmを使用した。A_Buffer:0.1M PiNa,2.3M(NH4)2SO4,pH7.0、B_Buffer:0.1M PiNa,pH7.0にて流速は0.6ml/min、グラジエントをA60% B40%→A0% B100%,16min(データ採取20min)、カラム温度は40℃、サーモスタット温度は40℃、検出器は280nmの波長で検出した。
a:デュピルマブ・ペプチド-リンカー連結物
b:デュピルマブ・チオール導入体;
(88-3)で得られたデュピルマブ・チオール導入体(20mMPBSバッファー、10mM EDTA)に対して、フルオレセイン-5-マレイミド(10mM、DMSOに溶解)を5等量加えた。室温にて1時間静置後、20mMPBSバッファーに置換し、デュピルマブ蛍光標識体(ADC mimic)を得た。
(88-5)で生成したデュピルマブ蛍光標識体(ADC mimic)に7mMトリス(2-カルボキシエチル)ホスフィン塩酸塩溶液5μL(抗体に対して等量)を加えて、室温で20分攪拌した。ESI-TOFMSにより質量を測定したところ、原料、生成物ともに軽鎖は同じピークが観測され、原料のデュピルマブ・チオール導入体は50973に重鎖ピークが観測され、生成物は重鎖にフルオレセインが導入された51399ピークが観測された(図125)。
以上の結果をまとめると、以下のとおりである。
A-L-B-R (I)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
Rは、前記抗体に対する反応性基である。〕
Lは、(i)切断により生体直交性官能基を反応性基側に生成する能力を有する切断性部分を含む2価の基である切断性リンカー、または(ii)切断により生体直交性官能基を反応性基側に生成する能力を有しない切断性部分を含む2価の基である切断性リンカーである。
Claims (31)
- 抗体に対する親和性物質、切断性部分および反応性基を有する化合物またはその塩であって、
前記化合物が、下記式(I):
A-L-B-R (I)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
Rは、リジン残基の側鎖に対して特異的な反応性基である。〕で表されるものであり、かつ
抗体に対する親和性物質が、
式1-1:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-I-I-W-C-(X0-3)b(配列番号58)
式1-2:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-I-V-W-C-(X0-3)b(配列番号59)
式1-3:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-V-V-W-C-(X0-3)b(配列番号60)
式1-4:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-A-V-W-C-(X0-3)b(配列番号61)
式1-5:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-L-W-C-(X0-3)b(配列番号62)
式1-6:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-I-W-C-(X0-3)b(配列番号63)
式1-7:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-V-F-C-(X0-3)b(配列番号64)
式1-8:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-Q-V-W-C-(X0-3)b(配列番号65)
式1-9:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-E-V-W-C-(X0-3)b(配列番号66)
〔式中、
(X0-3)aは、なし、または1~3個の連続する同一または異なる任意のアミノ酸残基(リジン残基およびシステイン残基以外)であり、
(X0-3)bは、なし、または1~3個の連続する同一または異なる任意のアミノ酸残基(リジン残基およびシステイン残基以外)であり、
Xaa1は、アラニン残基、グリシン残基、ロイシン残基、プロリン残基、アルギニン残基、バリン残基、アスパラギン残基、グルタミン酸残基、またはフェニルアラニン残基であり、
Xaa2は、チロシン残基、トリプトファン残基、ヒスチジン残基、またはフェニルアラニン残基であり、
Xaa3は、ヒスチジン残基、フェニルアラニン残基、チロシン残基、トリプトファン残基、アルギニン残基、またはグリシン残基であり、
Xaa4は、リジン残基であり、
Xaa5は、グリシン残基、セリン残基、アスパラギン残基、グルタミン残基、アスパラギン酸残基、グルタミン酸残基、フェニルアラニン残基、チロシン残基、トリプトファン残基、ヒスチジン残基、スレオニン残基、ロイシン残基、アラニン残基、バリン残基、イソロイシン残基、またはアルギニン残基であり、
Xaa6は、グルタミン残基、グルタミン酸残基、アスパラギン残基、アスパラギン酸残基、プロリン残基、グリシン残基、アルギニン残基、フェニルアラニン残基、またはヒスチジン残基である。〕、あるいは
式2-1:(X0-3’)a-C-Xaa1’-Xaa2’-Xaa3’-Xaa4’-Xaa5’-Xaa6’-L-V-W-C-(X0-3’)b(配列番号67)
〔式中、
(X0-3’)aおよび(X0-3’)bはそれぞれ、前記(X0-3)aおよび(X0-3)bと同じであり、
Xaa1’、Xaa2’、Xaa3’、Xaa4’、Xaa5’、Xaa6’はそれぞれ、前記Xaa1、Xaa2、Xaa3、Xaa4、Xaa5、Xaa6と同じである。
但し、(X0-3’)aが1~3個の連続する同一または異なる任意のアミノ酸残基、(X0-3’)bが1~3個の連続する同一または異なる任意のアミノ酸残基、Xaa3’がヒスチジン残基、かつ、Xaa5’がグリシン残基の場合を除く。〕のいずれかのアミノ酸配列を含むペプチドである、化合物またはその塩。 - (X0-3)aは、なし、アルギニン残基-グリシン残基-アスパラギン残基、アスパラギン酸残基、またはアスパラギン残基であり、
(X0-3)bは、なし、スレオニン残基-チロシン残基-ヒスチジン残基、またはスレオニン残基であり、
Xaa1は、アラニン残基であり、
Xaa2は、チロシン残基、トリプトファン残基、またはヒスチジン残基であり、
Xaa6は、グルタミン残基、グルタミン酸残基、アスパラギン残基、またはアスパラギン酸残基である、請求項1記載の化合物またはその塩。 - (X0-3)aは、グリシン残基-アスパラギン残基、グリシン残基、グリシン残基-グリシン残基、またはグリシン残基-グリシン残基-グリシン残基であり、
(X0-3)bは、スレオニン残基-チロシン残基、グリシン残基、グリシン残基-グリシン残基、またはグリシン残基-グリシン残基-グリシン残基であり、
Xaa1は、グリシン残基、ロイシン残基、プロリン残基、アルギニン残基、バリン残基、アスパラギン残基、グルタミン酸残基、またはフェニルアラニン残基であり、
Xaa2は、フェニルアラニン残基であり、
Xaa6は、プロリン残基、グリシン残基、アルギニン残基、フェニルアラニン残基、またはヒスチジン残基である、請求項1記載の化合物またはその塩。 - 抗体に対する親和性物質が、下記からなる群より選ばれるアミノ酸配列を含むペプチドである、請求項1~3のいずれか一項記載の化合物またはその塩:
(1) RGNCAYHKGQIIWCTYH(配列番号5);
(2) RGNCAYHKGQIVWCTYH(配列番号8);
(3) RGNCAYHKGQVVWCTYH(配列番号9);
(4) RGNCAYHKGQAVWCTYH(配列番号10);
(5) RGNCAYHKGQLLWCTYH(配列番号11);
(6) RGNCAYHKGQLIWCTYH(配列番号12);
(7) DCAYHKGQIVWCT (配列番号13);
(8) DCAYHKGQVVWCT (配列番号14);
(9) DCAYHKGQAVWCT (配列番号15);
(10)RGNCAYHKSQIIWCTYH(配列番号16);
(11)RGNCAYHKNQIIWCTYH(配列番号17);
(12)RGNCAYHKDQIIWCTYH(配列番号18);
(13)RGNCAYHKQQIIWCTYH(配列番号19);
(14)RGNCAYHKEQIIWCTYH(配列番号20);
(15)RGNCAYHKFQIIWCTYH(配列番号21);
(16)RGNCAYHKYQIIWCTYH(配列番号22);
(17)RGNCAYHKWQIIWCTYH(配列番号23);
(18)RGNCAYHKHQIIWCTYH(配列番号24);
(19)RGNCAYHKTQIIWCTYH(配列番号25);
(20)RGNCAYHKLQIIWCTYH(配列番号26);
(21) CAYHKLQIVWC (配列番号27);
(22) CAYHKLQLIWC (配列番号28);
(23) CAYHKSQIVWC (配列番号29);
(24)RGNCAYHKGQLVFCTYH(配列番号30);
(25)RGNCAYHKGQQVWCTYH(配列番号31);
(26)RGNCAYHKGQEVWCTYH(配列番号32);
(27) CAYHKGQLVWC (配列番号33);
(28)RGNCAYHKAQLVWCTYH(配列番号34);
(29)RGNCAYHKVQLVWCTYH(配列番号35);
(30)RGNCAYHKLQLVWCTYH(配列番号36);
(31)RGNCAYHKIQLVWCTYH(配列番号37);
(32)RGNCAYHKSQLVWCTYH(配列番号38);
(33)RGNCAYHKTQLVWCTYH(配列番号39);
(34)RGNCAYHKNQLVWCTYH(配列番号40);
(35)RGNCAYHKDQLVWCTYH(配列番号41);
(36)RGNCAYHKQQLVWCTYH(配列番号42);
(37)RGNCAYHKEQLVWCTYH(配列番号43);
(38)RGNCAYHKFQLVWCTYH(配列番号44);
(39)RGNCAYHKRQLVWCTYH(配列番号45);
(40)RGNCAYHKHQLVWCTYH(配列番号46);
(41)RGNCAYHKWQLVWCTYH(配列番号47);
(42)RGNCAYHKYQLVWCTYH(配列番号48);
(43)RGNCAYFKGQLVWCTYH(配列番号49);
(44)RGNCAYYKGQLVWCTYH(配列番号50);
(45)RGNCAYWKGQLVWCTYH(配列番号51);
(46)RGNCAYRKGQLVWCTYH(配列番号52);
(47)RGNCAYGKGQLVWCTYH(配列番号53);
(48) DCAYHKGQLVWC (配列番号54);
(49) NCAYHKGQLVWC (配列番号55);
(50) CAYHKGQLVWCT (配列番号56);
(51) CAYHKSQLVWC (配列番号57);
(52)RGNCAWHKGQIIWCTYH(配列番号68);
(53)RGNCAFHKGQIIWCTYH(配列番号69);
(54)RGNCAHHKGQIIWCTYH(配列番号70);
(55)RGNCGYHKGQIIWCTYH(配列番号71);
(56)RGNCLYHKGQIIWCTYH(配列番号72);
(57)RGNCPYHKGQIIWCTYH(配列番号73);
(58)RGNCRYHKGQIIWCTYH(配列番号74);
(59)RGNCVYHKGQIIWCTYH(配列番号75);
(60)RGNCNYHKGQIIWCTYH(配列番号76);
(61)RGNCEYHKGQIIWCTYH(配列番号77);
(62)RGNCFYHKGQIIWCTYH(配列番号78);
(63)RGNCAYHKGEIIWCTYH(配列番号79);
(64)RGNCAYHKGNIIWCTYH(配列番号80);
(65)RGNCAYHKGPIIWCTYH(配列番号81);
(66)RGNCAYHKGGIIWCTYH(配列番号82);
(67)RGNCAYHKGDIIWCTYH(配列番号83);
(68)RGNCAYHKGRIIWCTYH(配列番号84);
(69)RGNCAYHKGFIIWCTYH(配列番号85);
(70)RGNCAYHKGHIIWCTYH(配列番号86);
(71) DCAYHKGQIIWCT(配列番号87);
(72) NCAYHKGQIIWCT(配列番号88);
(73) GNCAYHKGQIIWCTY(配列番号89);
(74) GCAYHKGQIIWCG(配列番号90);
(75) GGCAYHKGQIIWCGG(配列番号91);および
(76)GGGCAYHKGQIIWCGGG(配列番号92)。 - Lが、(i)切断により生体直交性官能基を前記反応性基側に生成する能力を有する切断性部分を含む2価の基である切断性リンカー、または(ii)切断により生体直交性官能基を前記反応性基側に生成する能力を有しない切断性部分を含む2価の基である切断性リンカーである、請求項1~4のいずれか一項記載の化合物またはその塩。
- 前記切断性部分が、(a)酸性物質、塩基性物質、還元剤、酸化剤、酵素からなる群より選ばれる1種以上の物質による処理、(b)光からなる群より選ばれる物理化学的刺激による処理、または(c)自己分解性の切断性部分を含む切断性リンカーを用いた場合の放置のいずれかにより切断可能な部分である、請求項1~5のいずれか一項記載の化合物またはその塩。
- 前記切断性部分が、ジスルフィド残基、アセタール残基、ケタール残基、エステル残基、カルバモイル残基、アルコキシアルキル残基、イミン残基、三級アルキルオキシカルバメート残基、シラン残基、ヒドラゾン含有残基、フォスフォルアミデート残基、アコニチル残基、トリチル残基、アゾ残基、ビシナルジオール残基、セレン残基、電子吸引基を有する芳香族環含有残基、クマリン含有残基、スルホン含有残基、不飽和結合含有鎖残基、グリコシル残基からなる群より選ばれる、請求項1~6のいずれか一項記載の化合物またはその塩。
- 前記(i)の切断性部分が、ジスルフィド残基、エステル残基、アセタール残基、ケタール残基、イミン残基、ビシナルジオール残基からなる群より選ばれる、請求項5~7のいずれか一項記載の化合物またはその塩。
- 前記(ii)の切断性部分が、エステル残基、カルバモイル残基、アルコキシアルキル残基、イミン残基、三級アルキルオキシカルバメート残基、シラン残基、ヒドラゾン含有残基、フォスフォルアミデート残基、アコニチル残基、トリチル残基、アゾ残基、ビシナルジオール残基、セレン残基、電子吸引基を有する芳香族環含有残基、クマリン含有残基、スルホン含有残基、不飽和結合含有鎖残基、グリコシル残基からなる群より選ばれる、請求項5~7のいずれか一項記載の化合物またはその塩。
- 生体直交性官能基が、アジド残基、アルデヒド残基、チオール残基、アルキン残基、アルケン残基、ハロゲン残基、テトラジン残基、ニトロン残基、ヒドロキシルアミン残基、ニトリル残基、ヒドラジン残基、ケトン残基、ボロン酸残基、シアノベンゾチアゾール残基、アリル残基、ホスフィン残基、マレイミド残基、ジスルフィド残基、チオエステル残基、α-ハロカルボニル残基、イソニトリル残基、シドノン残基、およびセレン残基からなる群より選ばれる、請求項1~9のいずれか一項記載の化合物またはその塩。
- リジン残基の側鎖に対して特異的な反応性基が、活性化エステル残基、ビニルスルホン残基、スルホニルクロライド残基、イソシアネート残基、イソチオシアネート残基、アルデヒド残基、1,4,7,10-テトラアザシクロドデカン-1,4,7,10-テトラ酢酸残基、2-イミノ-2-メトキシエチル残基、またはジアゾニウムテレフタル酸残基である、請求項1~10のいずれか一項記載の化合物またはその塩。
- リジン残基の側鎖に対して特異的な反応性基が、下記からなる群より選ばれるいずれか一つの化学構造に対応する、請求項1~10のいずれか一項記載の化合物またはその塩:
R 5a およびR 5c は、水素原子、または下記:
(i)ハロゲン原子;
(ii)1価の炭化水素基;
(iii)アラルキル;
(iv)1価の複素環基;
(v)R c -O-、R c -C(=O)-、R c -O-C(=O)-、もしくはR c -C(=O)-O-(R c は、水素原子、もしくは一価の炭化水素基を示す。);または
(vi)NR d R e -、NR d R e -C(=O)-、NR d R e -C(=O)-O-、もしくはR d -C(=O)-NR e -(R d およびR e は、同一もしくは異なって、水素原子、もしくは一価の炭化水素基を示す。);
(vii)ニトロ基、硫酸基、スルホン酸基、シアノ基、もしくはカルボキシル基
のいずれかの置換基であり、
R 5b は、電子吸引基であり、
jは、1~5の任意の整数であり、
kは、1~4の任意の整数である。〕。 - 以下から選ばれる1以上の特徴を有する、請求項1~12のいずれか一項記載の化合物またはその塩:
(a)AおよびRを連結する主鎖の原子数が4~20個である;
(b)AおよびRを連結する主鎖が環構造を含まない;
(c)L-Bで表される部分構造がペプチド部分を含まない。 - 抗体の位置選択的修飾試薬であって、
下記式(I):
A-L-B-R (I)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
Rは、リジン残基の側鎖に対して特異的な反応性基である。〕で表される、抗体に対する親和性物質、切断性部分および反応性基を有する化合物またはその塩を含み、かつ
抗体に対する親和性物質が、
式1-1:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-I-I-W-C-(X0-3)b(配列番号58)
式1-2:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-I-V-W-C-(X0-3)b(配列番号59)
式1-3:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-V-V-W-C-(X0-3)b(配列番号60)
式1-4:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-A-V-W-C-(X0-3)b(配列番号61)
式1-5:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-L-W-C-(X0-3)b(配列番号62)
式1-6:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-I-W-C-(X0-3)b(配列番号63)
式1-7:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-V-F-C-(X0-3)b(配列番号64)
式1-8:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-Q-V-W-C-(X0-3)b(配列番号65)
式1-9:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-E-V-W-C-(X0-3)b(配列番号66)
〔式中、
(X0-3)aは、なし、または1~3個の連続する同一または異なる任意のアミノ酸残基(リジン残基およびシステイン残基以外)であり、
(X0-3)bは、なし、または1~3個の連続する同一または異なる任意のアミノ酸残基(リジン残基およびシステイン残基以外)であり、
Xaa1は、アラニン残基、グリシン残基、ロイシン残基、プロリン残基、アルギニン残基、バリン残基、アスパラギン残基、グルタミン酸残基、またはフェニルアラニン残基であり、
Xaa2は、チロシン残基、トリプトファン残基、ヒスチジン残基、またはフェニルアラニン残基であり、
Xaa3は、ヒスチジン残基、フェニルアラニン残基、チロシン残基、トリプトファン残基、アルギニン残基、またはグリシン残基であり、
Xaa4は、リジン残基であり、
Xaa5は、グリシン残基、セリン残基、アスパラギン残基、グルタミン残基、アスパラギン酸残基、グルタミン酸残基、フェニルアラニン残基、チロシン残基、トリプトファン残基、ヒスチジン残基、スレオニン残基、ロイシン残基、アラニン残基、バリン残基、イソロイシン残基、またはアルギニン残基であり、
Xaa6は、グルタミン残基、グルタミン酸残基、アスパラギン残基、アスパラギン酸残基、プロリン残基、グリシン残基、アルギニン残基、フェニルアラニン残基、またはヒスチジン残基である。〕、あるいは
式2-1:(X0-3’)a-C-Xaa1’-Xaa2’-Xaa3’-Xaa4’-Xaa5’-Xaa6’-L-V-W-C-(X0-3’)b(配列番号67)
〔式中、
(X0-3’)aおよび(X0-3’)bはそれぞれ、前記(X0-3)aおよび(X0-3)bと同じであり、
Xaa1’、Xaa2’、Xaa3’、Xaa4’、Xaa5’、Xaa6’はそれぞれ、前記Xaa1、Xaa2、Xaa3、Xaa4、Xaa5、Xaa6と同じである。
但し、(X0-3’)aが1~3個の連続する同一または異なる任意のアミノ酸残基、(X0-3’)bが1~3個の連続する同一または異なる任意のアミノ酸残基、Xaa3’がヒスチジン残基、かつ、Xaa5’がグリシン残基の場合を除く。〕のいずれかのアミノ酸配列を含むペプチドである、試薬。 - 抗体に対する親和性物質、および切断性部分を有する抗体またはその塩であって、
下記式(II):
A-L-B-R’-T (II)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
R’は、抗体とリジン残基の側鎖に対して特異的な反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表されるものであり、かつ
抗体に対する親和性物質が、
式1-1:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-I-I-W-C-(X0-3)b(配列番号58)
式1-2:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-I-V-W-C-(X0-3)b(配列番号59)
式1-3:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-V-V-W-C-(X0-3)b(配列番号60)
式1-4:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-A-V-W-C-(X0-3)b(配列番号61)
式1-5:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-L-W-C-(X0-3)b(配列番号62)
式1-6:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-I-W-C-(X0-3)b(配列番号63)
式1-7:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-V-F-C-(X0-3)b(配列番号64)
式1-8:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-Q-V-W-C-(X0-3)b(配列番号65)
式1-9:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-E-V-W-C-(X0-3)b(配列番号66)
〔式中、
(X0-3)aは、なし、または1~3個の連続する同一または異なる任意のアミノ酸残基(リジン残基およびシステイン残基以外)であり、
(X0-3)bは、なし、または1~3個の連続する同一または異なる任意のアミノ酸残基(リジン残基およびシステイン残基以外)であり、
Xaa1は、アラニン残基、グリシン残基、ロイシン残基、プロリン残基、アルギニン残基、バリン残基、アスパラギン残基、グルタミン酸残基、またはフェニルアラニン残基であり、
Xaa2は、チロシン残基、トリプトファン残基、ヒスチジン残基、またはフェニルアラニン残基であり、
Xaa3は、ヒスチジン残基、フェニルアラニン残基、チロシン残基、トリプトファン残基、アルギニン残基、またはグリシン残基であり、
Xaa4は、リジン残基であり、
Xaa5は、グリシン残基、セリン残基、アスパラギン残基、グルタミン残基、アスパラギン酸残基、グルタミン酸残基、フェニルアラニン残基、チロシン残基、トリプトファン残基、ヒスチジン残基、スレオニン残基、ロイシン残基、アラニン残基、バリン残基、イソロイシン残基、またはアルギニン残基であり、
Xaa6は、グルタミン残基、グルタミン酸残基、アスパラギン残基、アスパラギン酸残基、プロリン残基、グリシン残基、アルギニン残基、フェニルアラニン残基、またはヒスチジン残基である。〕、あるいは
式2-1:(X0-3’)a-C-Xaa1’-Xaa2’-Xaa3’-Xaa4’-Xaa5’-Xaa6’-L-V-W-C-(X0-3’)b(配列番号67)
〔式中、
(X0-3’)aおよび(X0-3’)bはそれぞれ、前記(X0-3)aおよび(X0-3)bと同じであり、
Xaa1’、Xaa2’、Xaa3’、Xaa4’、Xaa5’、Xaa6’はそれぞれ、前記Xaa1、Xaa2、Xaa3、Xaa4、Xaa5、Xaa6と同じである。
但し、(X0-3’)aが1~3個の連続する同一または異なる任意のアミノ酸残基、(X0-3’)bが1~3個の連続する同一または異なる任意のアミノ酸残基、Xaa3’がヒスチジン残基、かつ、Xaa5’がグリシン残基の場合を除く。〕のいずれかのアミノ酸配列を含むペプチドである、抗体またはその塩。 - 抗体がモノクローナル抗体である、請求項15記載の抗体またはその塩。
- 抗体がIgG抗体である、請求項15または16記載の抗体またはその塩。
- 抗体がヒト由来である、請求項15~17のいずれか一項記載の抗体またはその塩。
- 抗体が、下記(A)~(C)からなる群より選ばれるいずれか一つのFc領域タンパク質を含み、かつ抗原結合能を有する、請求項15~18のいずれか一項記載の抗体またはその塩:
(A)配列番号1のアミノ酸配列を含むFc領域タンパク質;
(B)配列番号1のアミノ酸配列において、1もしくは数個のアミノ酸残基が挿入、付加、欠失もしくは置換されたアミノ酸配列を含むFc領域タンパク質;または
(C)配列番号1のアミノ酸配列と90%以上の同一性を示すアミノ酸配列を含むFc領域タンパク質。 - 抗体が、連続する1~50個のアミノ酸残基からなる標的領域中において特定のアミノ酸残基を1個以上含み、かつ、前記標的領域以外の非標的領域中において前記特定のアミノ酸残基を5個以上含み、
A-L-B-R’で表される構造単位が、前記標的領域中に含まれる1個以上の特定のアミノ酸残基に対して30%以上の位置選択性で結合している、請求項15~19のいずれか一項記載の抗体またはその塩。 - 前記標的領域が、連続する1~10個のアミノ酸残基からなる領域である、請求項20記載の抗体またはその塩。
- 前記標的領域が、連続する1~3個のアミノ酸残基からなる領域である、請求項21記載の抗体またはその塩。
- 前記標的領域が、ヒトIgG Fc領域における246~248位のアミノ酸残基からなる領域である、請求項22記載の抗体またはその塩。
- 前記位置選択性が50%以上である、請求項20~23のいずれか一項記載の抗体またはその塩。
- 前記位置選択性が70%以上である、請求項24記載の抗体またはその塩。
- 前記位置選択性が90%以上である、請求項25記載の抗体またはその塩。
- 式(II)中の抗体が、A-L-B-R’で表される構造単位を複数有する、請求項15~26のいずれか一項記載の抗体またはその塩。
- 生体直交性官能基を有する抗体またはその塩の製造方法であって、
下記式(II):
A-L-B-R’-T (II)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
R’は、抗体とリジン残基の側鎖に対して特異的な反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表される、抗体に対する親和性物質、および切断性部分を有する抗体またはその塩の切断性部分を切断して、
下記式(IV):
L1-B-R’-T (IV)
〔式中、
B、R’およびTは、前記式(II)のものと同じであり、
L1は、(i’)生体直交性官能基を含む1価の基、または(ii’)生体直交性官能基を含まない1価の基である。〕で表される、生体直交性官能基を有する抗体またはその塩を生成することを含み、かつ
抗体に対する親和性物質が、
式1-1:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-I-I-W-C-(X0-3)b(配列番号58)
式1-2:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-I-V-W-C-(X0-3)b(配列番号59)
式1-3:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-V-V-W-C-(X0-3)b(配列番号60)
式1-4:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-A-V-W-C-(X0-3)b(配列番号61)
式1-5:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-L-W-C-(X0-3)b(配列番号62)
式1-6:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-I-W-C-(X0-3)b(配列番号63)
式1-7:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-V-F-C-(X0-3)b(配列番号64)
式1-8:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-Q-V-W-C-(X0-3)b(配列番号65)
式1-9:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-E-V-W-C-(X0-3)b(配列番号66)
〔式中、
(X0-3)aは、なし、または1~3個の連続する同一または異なる任意のアミノ酸残基(リジン残基およびシステイン残基以外)であり、
(X0-3)bは、なし、または1~3個の連続する同一または異なる任意のアミノ酸残基(リジン残基およびシステイン残基以外)であり、
Xaa1は、アラニン残基、グリシン残基、ロイシン残基、プロリン残基、アルギニン残基、バリン残基、アスパラギン残基、グルタミン酸残基、またはフェニルアラニン残基であり、
Xaa2は、チロシン残基、トリプトファン残基、ヒスチジン残基、またはフェニルアラニン残基であり、
Xaa3は、ヒスチジン残基、フェニルアラニン残基、チロシン残基、トリプトファン残基、アルギニン残基、またはグリシン残基であり、
Xaa4は、リジン残基であり、
Xaa5は、グリシン残基、セリン残基、アスパラギン残基、グルタミン残基、アスパラギン酸残基、グルタミン酸残基、フェニルアラニン残基、チロシン残基、トリプトファン残基、ヒスチジン残基、スレオニン残基、ロイシン残基、アラニン残基、バリン残基、イソロイシン残基、またはアルギニン残基であり、
Xaa6は、グルタミン残基、グルタミン酸残基、アスパラギン残基、アスパラギン酸残基、プロリン残基、グリシン残基、アルギニン残基、フェニルアラニン残基、またはヒスチジン残基である。〕、あるいは
式2-1:(X0-3’)a-C-Xaa1’-Xaa2’-Xaa3’-Xaa4’-Xaa5’-Xaa6’-L-V-W-C-(X0-3’)b(配列番号67)
〔式中、
(X0-3’)aおよび(X0-3’)bはそれぞれ、前記(X0-3)aおよび(X0-3)bと同じであり、
Xaa1’、Xaa2’、Xaa3’、Xaa4’、Xaa5’、Xaa6’はそれぞれ、前記Xaa1、Xaa2、Xaa3、Xaa4、Xaa5、Xaa6と同じである。
但し、(X0-3’)aが1~3個の連続する同一または異なる任意のアミノ酸残基、(X0-3’)bが1~3個の連続する同一または異なる任意のアミノ酸残基、Xaa3’がヒスチジン残基、かつ、Xaa5’がグリシン残基の場合を除く。〕のいずれかのアミノ酸配列を含むペプチドである、方法。 - 機能性物質を有する抗体またはその塩の製造方法であって、
下記式(III):
A-L-B’(-F)-R’-T (III)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
B’は、機能性物質と生体直交性官能基との間の反応により生成する部分を含む3価の基であり、
Fは、機能性物質であり、
R’は、抗体とリジン残基の側鎖に対して特異的な反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表される、抗体に対する親和性物質、切断性部分、機能性物質および抗体を有する複合体またはその塩の切断性部分を切断して、
下記式(V1):
L1-B’(-F)-R’-T (V1)
〔式中、
L1は、(i’)生体直交性官能基を含む1価の基、または(ii’)生体直交性官能基を含まない1価の基であり、
B’、F、R’およびTは、前記式(III)のものと同じである。〕で表される、機能性物質を有する抗体またはその塩を生成することを含み、かつ
抗体に対する親和性物質が、
式1-1:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-I-I-W-C-(X0-3)b(配列番号58)
式1-2:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-I-V-W-C-(X0-3)b(配列番号59)
式1-3:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-V-V-W-C-(X0-3)b(配列番号60)
式1-4:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-A-V-W-C-(X0-3)b(配列番号61)
式1-5:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-L-W-C-(X0-3)b(配列番号62)
式1-6:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-I-W-C-(X0-3)b(配列番号63)
式1-7:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-V-F-C-(X0-3)b(配列番号64)
式1-8:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-Q-V-W-C-(X0-3)b(配列番号65)
式1-9:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-E-V-W-C-(X0-3)b(配列番号66)
〔式中、
(X0-3)aは、なし、または1~3個の連続する同一または異なる任意のアミノ酸残基(リジン残基およびシステイン残基以外)であり、
(X0-3)bは、なし、または1~3個の連続する同一または異なる任意のアミノ酸残基(リジン残基およびシステイン残基以外)であり、
Xaa1は、アラニン残基、グリシン残基、ロイシン残基、プロリン残基、アルギニン残基、バリン残基、アスパラギン残基、グルタミン酸残基、またはフェニルアラニン残基であり、
Xaa2は、チロシン残基、トリプトファン残基、ヒスチジン残基、またはフェニルアラニン残基であり、
Xaa3は、ヒスチジン残基、フェニルアラニン残基、チロシン残基、トリプトファン残基、アルギニン残基、またはグリシン残基であり、
Xaa4は、リジン残基であり、
Xaa5は、グリシン残基、セリン残基、アスパラギン残基、グルタミン残基、アスパラギン酸残基、グルタミン酸残基、フェニルアラニン残基、チロシン残基、トリプトファン残基、ヒスチジン残基、スレオニン残基、ロイシン残基、アラニン残基、バリン残基、イソロイシン残基、またはアルギニン残基であり、
Xaa6は、グルタミン残基、グルタミン酸残基、アスパラギン残基、アスパラギン酸残基、プロリン残基、グリシン残基、アルギニン残基、フェニルアラニン残基、またはヒスチジン残基である。〕、あるいは
式2-1:(X0-3’)a-C-Xaa1’-Xaa2’-Xaa3’-Xaa4’-Xaa5’-Xaa6’-L-V-W-C-(X0-3’)b(配列番号67)
〔式中、
(X0-3’)aおよび(X0-3’)bはそれぞれ、前記(X0-3)aおよび(X0-3)bと同じであり、
Xaa1’、Xaa2’、Xaa3’、Xaa4’、Xaa5’、Xaa6’はそれぞれ、前記Xaa1、Xaa2、Xaa3、Xaa4、Xaa5、Xaa6と同じである。
但し、(X0-3’)aが1~3個の連続する同一または異なる任意のアミノ酸残基、(X0-3’)bが1~3個の連続する同一または異なる任意のアミノ酸残基、Xaa3’がヒスチジン残基、かつ、Xaa5’がグリシン残基の場合を除く。〕のいずれかのアミノ酸配列を含むペプチドである、方法。 - 式(III)中の抗体が、A-L-B’(-F)-R’で表される構造単位を複数有する、請求項29記載の方法。
- 機能性物質を有する抗体またはその塩の製造方法であって、
(A)下記式(II):
A-L-B-R’-T (II)
〔式中、
Aは、抗体に対する親和性物質であり、
Lは、切断性部分を含む2価の基である切断性リンカーであり、
Bは、(a)生体直交性官能基を含む2価の基、または(b)生体直交性官能基を含まない2価の基であり、
R’は、抗体とリジン残基の側鎖に対して特異的な反応性基との間の反応により生成する部分であり、
Tは、抗体である。〕で表される、抗体に対する親和性物質、および切断性部分を有する抗体またはその塩の切断性部分を切断して、
下記式(IV):
L1-B-R’-T (IV)
〔式中、
B、R’およびTは、前記式(II)のものと同じであり、
L1は、(i’)生体直交性官能基を含む1価の基、または(ii’)生体直交性官能基を含まない1価の基である。〕で表される、生体直交性官能基を有する抗体またはその塩を生成すること、ならびに
(B)前記生体直交性官能基を有する抗体またはその塩を、1種または2種以上の機能性物質と反応させて、
下記式(V2)
F-L1’-B-R’-T (V2)
〔式中、
B、R’およびTは、前記式(IV)のものと同じであり、
L1’は、機能性物質と、(i’)生体直交性官能基を含む1価の基との間の反応により生成する部分を含む2価の基であり、
Fは、機能性物質である。〕、または
下記式(V3):
Fa-L1’-B’(-Fb)-R’-T (V3)
〔式中、
R’およびTは、前記式(IV)のものと同じであり、
L1’は、前記式(V2)のものと同じであり、
B’は、機能性物質と生体直交性官能基との間の反応により生成する部分を含む3価の基であり、
FaおよびFbは、それぞれ、同一または異なる機能性物質である。〕で表される、機能性物質を有する抗体またはその塩を生成することを含み、かつ
抗体に対する親和性物質が、
式1-1:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-I-I-W-C-(X0-3)b(配列番号58)
式1-2:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-I-V-W-C-(X0-3)b(配列番号59)
式1-3:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-V-V-W-C-(X0-3)b(配列番号60)
式1-4:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-A-V-W-C-(X0-3)b(配列番号61)
式1-5:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-L-W-C-(X0-3)b(配列番号62)
式1-6:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-I-W-C-(X0-3)b(配列番号63)
式1-7:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-L-V-F-C-(X0-3)b(配列番号64)
式1-8:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-Q-V-W-C-(X0-3)b(配列番号65)
式1-9:(X0-3)a-C-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-E-V-W-C-(X0-3)b(配列番号66)
〔式中、
(X0-3)aは、なし、または1~3個の連続する同一または異なる任意のアミノ酸残基(リジン残基およびシステイン残基以外)であり、
(X0-3)bは、なし、または1~3個の連続する同一または異なる任意のアミノ酸残基(リジン残基およびシステイン残基以外)であり、
Xaa1は、アラニン残基、グリシン残基、ロイシン残基、プロリン残基、アルギニン残基、バリン残基、アスパラギン残基、グルタミン酸残基、またはフェニルアラニン残基であり、
Xaa2は、チロシン残基、トリプトファン残基、ヒスチジン残基、またはフェニルアラニン残基であり、
Xaa3は、ヒスチジン残基、フェニルアラニン残基、チロシン残基、トリプトファン残基、アルギニン残基、またはグリシン残基であり、
Xaa4は、リジン残基であり、
Xaa5は、グリシン残基、セリン残基、アスパラギン残基、グルタミン残基、アスパラギン酸残基、グルタミン酸残基、フェニルアラニン残基、チロシン残基、トリプトファン残基、ヒスチジン残基、スレオニン残基、ロイシン残基、アラニン残基、バリン残基、イソロイシン残基、またはアルギニン残基であり、
Xaa6は、グルタミン残基、グルタミン酸残基、アスパラギン残基、アスパラギン酸残基、プロリン残基、グリシン残基、アルギニン残基、フェニルアラニン残基、またはヒスチジン残基である。〕、あるいは
式2-1:(X0-3’)a-C-Xaa1’-Xaa2’-Xaa3’-Xaa4’-Xaa5’-Xaa6’-L-V-W-C-(X0-3’)b(配列番号67)
〔式中、
(X0-3’)aおよび(X0-3’)bはそれぞれ、前記(X0-3)aおよび(X0-3)bと同じであり、
Xaa1’、Xaa2’、Xaa3’、Xaa4’、Xaa5’、Xaa6’はそれぞれ、前記Xaa1、Xaa2、Xaa3、Xaa4、Xaa5、Xaa6と同じである。
但し、(X0-3’)aが1~3個の連続する同一または異なる任意のアミノ酸残基、(X0-3’)bが1~3個の連続する同一または異なる任意のアミノ酸残基、Xaa3’がヒスチジン残基、かつ、Xaa5’がグリシン残基の場合を除く。〕のいずれかのアミノ酸配列を含むペプチドである、方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2018113953 | 2018-06-14 | ||
| JP2018113953 | 2018-06-14 | ||
| JP2018205446 | 2018-10-31 | ||
| JP2018205446 | 2018-10-31 | ||
| PCT/JP2019/023778 WO2019240287A1 (ja) | 2018-06-14 | 2019-06-14 | 抗体に対する親和性物質、切断性部分および反応性基を有する化合物またはその塩 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPWO2019240287A1 JPWO2019240287A1 (ja) | 2021-07-01 |
| JP7413999B2 true JP7413999B2 (ja) | 2024-01-16 |
Family
ID=68842282
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020525702A Active JP7413999B2 (ja) | 2018-06-14 | 2019-06-14 | 抗体に対する親和性物質、切断性部分および反応性基を有する化合物またはその塩 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US20210139549A1 (ja) |
| EP (1) | EP3808760A4 (ja) |
| JP (1) | JP7413999B2 (ja) |
| KR (1) | KR20210020901A (ja) |
| CN (1) | CN112262152A (ja) |
| AU (1) | AU2019285353B2 (ja) |
| CA (1) | CA3103143A1 (ja) |
| WO (1) | WO2019240287A1 (ja) |
Families Citing this family (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2023504825A (ja) * | 2019-12-03 | 2023-02-07 | デビオファーム リサーチ アンド マニュファクチャリング ソシエテ アノニム | 反応性コンジュゲート |
| WO2022078566A1 (en) * | 2020-10-12 | 2022-04-21 | Debiopharm Research & Manufacturing S.A. | Reactive conjugates |
| AU2022208654A1 (en) | 2021-01-18 | 2023-08-03 | Ajinomoto Co., Inc. | Compound or salt thereof, and antibody produced using same |
| JPWO2022154127A1 (ja) | 2021-01-18 | 2022-07-21 | ||
| KR20230154853A (ko) | 2021-03-11 | 2023-11-09 | 아지노모토 가부시키가이샤 | 화합물 또는 이의 염, 및 이들에 의해 얻어지는 항체 |
| JPWO2022196675A1 (ja) | 2021-03-16 | 2022-09-22 | ||
| AU2022286137A1 (en) | 2021-06-01 | 2023-12-14 | Ajinomoto Co., Inc. | Conjugate of antibody and functional substance or salt of said conjugate, and compound for use in production of said conjugate or salt of said compound |
| US20230201365A1 (en) | 2021-07-09 | 2023-06-29 | Bright Peak Therapeutics Ag | Modified cd20 antibodies and uses thereof |
| WO2023281485A1 (en) * | 2021-07-09 | 2023-01-12 | Bright Peak Therapeutics Ag | Modified il-2 polypeptides for treatment of inflammatory and autoimmune diseases |
| AU2022307460A1 (en) | 2021-07-09 | 2024-01-04 | Bright Peak Therapeutics Ag | Checkpoint inhibitors conjugated to il-2, and uses thereof |
| KR20240041378A (ko) | 2021-07-09 | 2024-03-29 | 브라이트 피크 테라퓨틱스 아게 | 체크포인트 억제제와 il-2의 접합체 및 이의 용도 |
| CA3224147A1 (en) | 2021-07-09 | 2023-01-12 | Vijaya Raghavan PATTABIRAMAN | Antibody conjugates and manufacture thereof |
| WO2023038067A1 (ja) * | 2021-09-08 | 2023-03-16 | 味の素株式会社 | 位置選択的に修飾された抗体中間体、および生体直交性官能基または機能性物質を位置選択的に有する抗体誘導体の製造方法 |
| CA3234692A1 (en) | 2021-09-30 | 2023-04-06 | Ajinomoto Co., Inc. | Conjugate of antibody and functional substance or salt thereof, and antibody derivative and compound used in production of the same or salts thereof |
| KR20240073034A (ko) | 2021-09-30 | 2024-05-24 | 아지노모토 가부시키가이샤 | 항체 및 기능성 물질의 위치 선택적인 컨쥬게이트 또는 그 염, 및 그 제조에 사용되는 항체 유도체 및 화합물 또는 그것들의 염 |
| US20230355795A1 (en) | 2022-02-23 | 2023-11-09 | Bright Peak Therapeutics Ag | Immune antigen specific il-18 immunocytokines and uses thereof |
| CN116836235A (zh) * | 2022-03-25 | 2023-10-03 | 中国科学院上海药物研究所 | 亲和片段导向的可裂解片段,其设计、合成及在制备定点药物偶联物中的应用 |
| WO2023234416A1 (ja) * | 2022-06-02 | 2023-12-07 | 味の素株式会社 | 親和性物質、化合物、抗体およびそれらの塩 |
| CN115894837B (zh) * | 2022-11-24 | 2024-09-27 | 明月镜片股份有限公司 | 一种适用于精密热压成型的光学聚氨酯基复合材料及其制备方法和应用 |
| WO2024150158A1 (en) | 2023-01-11 | 2024-07-18 | Bright Peak Therapeutics Ag | Il-7 polypeptides, immunocytokines comprising same, and uses thereof |
| WO2024150174A1 (en) | 2023-01-11 | 2024-07-18 | Bright Peak Therapeutics Ag | Conditionally activated immunocytokines and methods of use |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016086206A1 (en) | 2014-11-25 | 2016-06-02 | Epiva Biosciences, Inc. | Probiotic compositions containing clostridials for inhibiting inflammation |
| WO2017191817A1 (ja) | 2016-05-02 | 2017-11-09 | 味の素株式会社 | アジド基含有Fcタンパク質 |
| WO2017217347A1 (ja) | 2016-06-13 | 2017-12-21 | 国立大学法人鹿児島大学 | IgG結合ペプチドによる部位特異的RI標識抗体 |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL89220A (en) | 1988-02-11 | 1994-02-27 | Bristol Myers Squibb Co | Immunoconjugates of anthracycline, their production and pharmaceutical preparations containing them |
| US5622929A (en) | 1992-01-23 | 1997-04-22 | Bristol-Myers Squibb Company | Thioether conjugates |
| US6214345B1 (en) | 1993-05-14 | 2001-04-10 | Bristol-Myers Squibb Co. | Lysosomal enzyme-cleavable antitumor drug conjugates |
| ES2195036T3 (es) | 1995-12-22 | 2003-12-01 | Bristol Myers Squibb Co | Conectores de hidrazona ramificados. |
| EP1243276A1 (en) | 2001-03-23 | 2002-09-25 | Franciscus Marinus Hendrikus De Groot | Elongated and multiple spacers containing activatible prodrugs |
| DK1545613T3 (da) | 2002-07-31 | 2011-11-14 | Seattle Genetics Inc | Auristatinkonjugater og deres anvendelse til behandling af cancer, en autoimmun sygdom eller en infektiøs sygdom |
| US7705045B2 (en) | 2002-11-14 | 2010-04-27 | Syntarga, B.V. | Prodrugs built as multiple self-elimination-release spacers |
| SI2489364T1 (sl) | 2003-11-06 | 2015-04-30 | Seattle Genetics, Inc. | Monometilvalinske spojine, konjugirane s protitelesi |
| JP4806680B2 (ja) | 2004-05-19 | 2011-11-02 | メダレックス インコーポレイテッド | 自己犠牲リンカー及び薬剤複合体 |
| AU2015274506C1 (en) * | 2014-06-12 | 2022-10-13 | CSPC Megalith Biopharmaceutical Co., Ltd. | Homogenous antibody drug conjugates via enzymatic methods |
| AU2015360621A1 (en) * | 2014-12-09 | 2017-06-29 | Abbvie Inc. | Bcl-xL inhibitory compounds and antibody drug conjugates including the same |
| JP5827769B1 (ja) | 2015-03-27 | 2015-12-02 | 義徳 川窪 | 掃除装置 |
| US10227383B2 (en) | 2015-05-20 | 2019-03-12 | Kagoshima University | Specific modification of antibody with IgG-binding peptide |
| CN108101825B (zh) * | 2016-11-25 | 2022-02-22 | 迈威(上海)生物科技股份有限公司 | 用于抗体-药物偶联的双取代马来酰胺类连接子及其制备方法和用途 |
| KR20200002858A (ko) * | 2017-04-28 | 2020-01-08 | 아지노모토 가부시키가이샤 | 가용성 단백질에 대한 친화성 물질, 절단성 부분 및 반응성기를 갖는 화합물 또는 이의 염 |
| CN107652219B (zh) * | 2017-08-14 | 2021-06-08 | 上海新理念生物医药科技有限公司 | 四马来酰亚胺型连接子及其应用 |
-
2019
- 2019-06-14 JP JP2020525702A patent/JP7413999B2/ja active Active
- 2019-06-14 EP EP19818738.7A patent/EP3808760A4/en active Pending
- 2019-06-14 CA CA3103143A patent/CA3103143A1/en active Pending
- 2019-06-14 KR KR1020207035639A patent/KR20210020901A/ko unknown
- 2019-06-14 WO PCT/JP2019/023778 patent/WO2019240287A1/ja active Application Filing
- 2019-06-14 CN CN201980038680.7A patent/CN112262152A/zh active Pending
- 2019-06-14 AU AU2019285353A patent/AU2019285353B2/en active Active
-
2020
- 2020-12-11 US US17/119,786 patent/US20210139549A1/en active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016086206A1 (en) | 2014-11-25 | 2016-06-02 | Epiva Biosciences, Inc. | Probiotic compositions containing clostridials for inhibiting inflammation |
| WO2017191817A1 (ja) | 2016-05-02 | 2017-11-09 | 味の素株式会社 | アジド基含有Fcタンパク質 |
| WO2017217347A1 (ja) | 2016-06-13 | 2017-12-21 | 国立大学法人鹿児島大学 | IgG結合ペプチドによる部位特異的RI標識抗体 |
Non-Patent Citations (1)
| Title |
|---|
| 伊東祐二 他,抗体部位特異的修飾法を用いた放射性医薬品の開発,Isotope News,2018年02月,2月号, No.755,p.22-24 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2019240287A1 (ja) | 2019-12-19 |
| AU2019285353A2 (en) | 2021-01-14 |
| US20210139549A1 (en) | 2021-05-13 |
| CA3103143A1 (en) | 2019-12-19 |
| EP3808760A1 (en) | 2021-04-21 |
| AU2019285353A1 (en) | 2021-01-07 |
| JPWO2019240287A1 (ja) | 2021-07-01 |
| EP3808760A4 (en) | 2022-10-05 |
| CN112262152A (zh) | 2021-01-22 |
| AU2019285353B2 (en) | 2024-08-22 |
| KR20210020901A (ko) | 2021-02-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7413999B2 (ja) | 抗体に対する親和性物質、切断性部分および反応性基を有する化合物またはその塩 | |
| JP7222347B2 (ja) | 可溶性タンパク質に対する親和性物質、切断性部分および反応性基を有する化合物またはその塩 | |
| US20210300972A1 (en) | Compound having affinity substance to antibody, cleavable portion, and reactive group, or salt thereof | |
| WO2019240288A1 (ja) | 抗体に対する親和性物質、および生体直交性官能基を有する化合物またはその塩 | |
| US20240000964A1 (en) | Compound or salt thereof, and antibody obtained by using the same | |
| EP4279500A1 (en) | Compound or salt thereof, and antibody produced using same | |
| WO2024210154A1 (ja) | 抗体および機能性物質のコンジュゲート、抗体誘導体ならびに化合物、またはそれらの塩 | |
| US20240115719A1 (en) | Compound or salt thereof, and antibody obtained by using the same | |
| WO2023054714A1 (ja) | 抗体および機能性物質の位置選択的なコンジュゲートまたはその塩、ならびにその製造に用いられる抗体誘導体および化合物またはそれらの塩 | |
| JP2024010532A (ja) | 化合物またはその塩 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201202 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20220525 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230516 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20230714 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230913 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20231128 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20231211 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7413999 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |