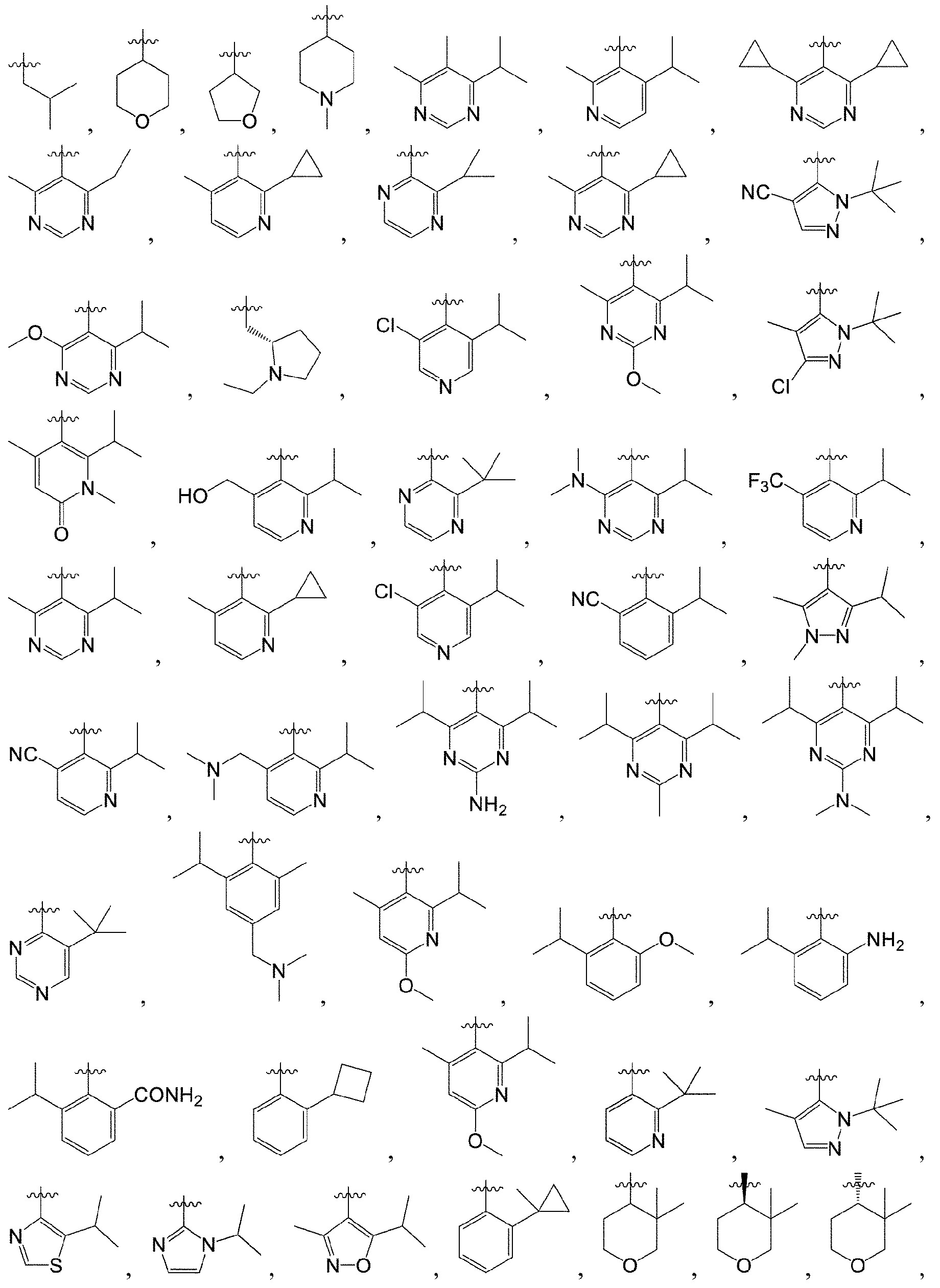
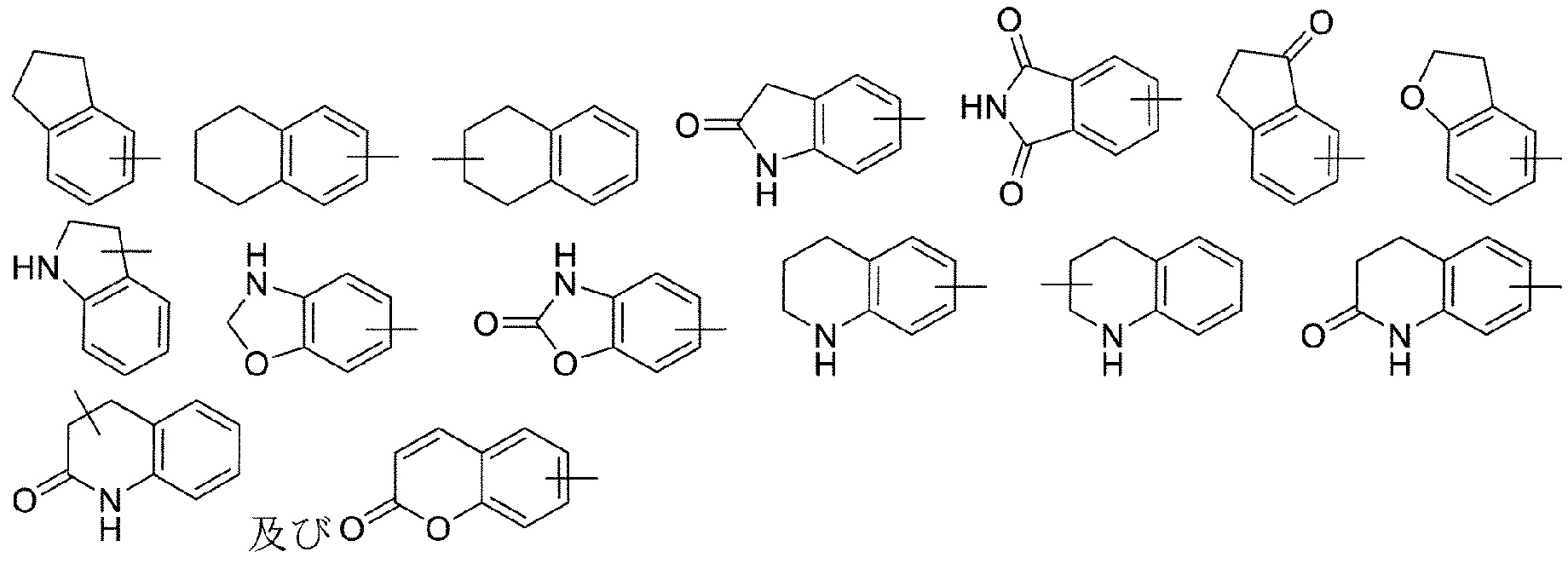
本発明の化合物は、以下に挙げる具体的な実施形態、以下に挙げるものを他の化学合成法と組み合わせて得られる実施形態、及び当業者によく知られている等価な代替方法を含む、当業者によく知られている様々な合成方法によって調製することができる。好ましい実施形態としては、本発明の実施例が挙げられるが、これに限定されない。
なお、下記実施例で分離される立体異性体の絶対配置は任意に特定される。分離方法はクロマトグラフィー分離であってよく、例えば、カラムクロマトグラフィー、薄層クロマトグラフィー、液体クロマトグラフィー等が挙げられるが、これらに限定されない。
本発明は、実施例によって詳細に説明されるが、これらに不利に限定されるものではない。本開示において、本発明を詳細に説明してきたが、その具体的な実施形態も開示されている。本発明の精神及び範囲から逸脱することなく、本発明の具体的な実施形態に様々な変更及び修正がなされ得ることは、当業者には明らかであろう。実施例において具体的な条件が示されていない場合は、従来の条件又は製造者が推奨する条件に従って実施される。製造者が示されていない試薬や器具は、いずれも市販される従来品である。
下記実施例で使用する試薬の略語は以下の通りである。CDIはN,N’-カルボニルジイミダゾールであり、DBUは1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エンであり、PyBopは1H-ベンゾトリアゾール-1-イルオキシトリピロリジニルヘキサフルオロホスフェートであり、SPhosは2-ジシクロヘキシルホスフィノ-2’,6’-ジメトキシビフェニルであり、SPhos-Pd-G2はクロロ(2-ジシクロヘキシルホスフィノ-2’,6’-ジメトキシ-1,1’-ビフェニル)[2-(2’-アミノ-1,1’-ビフェニル)]パラジウム(II)であり、LiHMDSはリチウムビス(トリメチルシリル)アミドであり、Selectfluorは1-クロロメチル-4-フルオロ-1,4-ジアゾニアビシクロ[2.2.2]オクタンビス(テトラフルオロボレート)であり、キサントホス-Pd-G2はクロロ[(4,5-ビス(ジフェニルホスフィノ)-9,9-ジメチルキサンテン)-2-(2’-アミノ-1,1’-ビフェニル)]パラジウム(II)であり、キサントホスは4,5-ビス(ジフェニルホスフィノ)-9,9-ジメチルキサンテンであり、Pd(dppf)Cl2は[1,1’-ビス(ジフェニルホスフィノ)フェロセン]パラジウム(II)ジクロライドであり、NCSはN-クロロスクシンイミドであり、NaHMDSはナトリウムビス(トリメチルシリル)アミドであり、T3Pは1-プロピルホスホン酸無水物であり、DIEAはN,N-ジイソプロピルエチルアミンである。
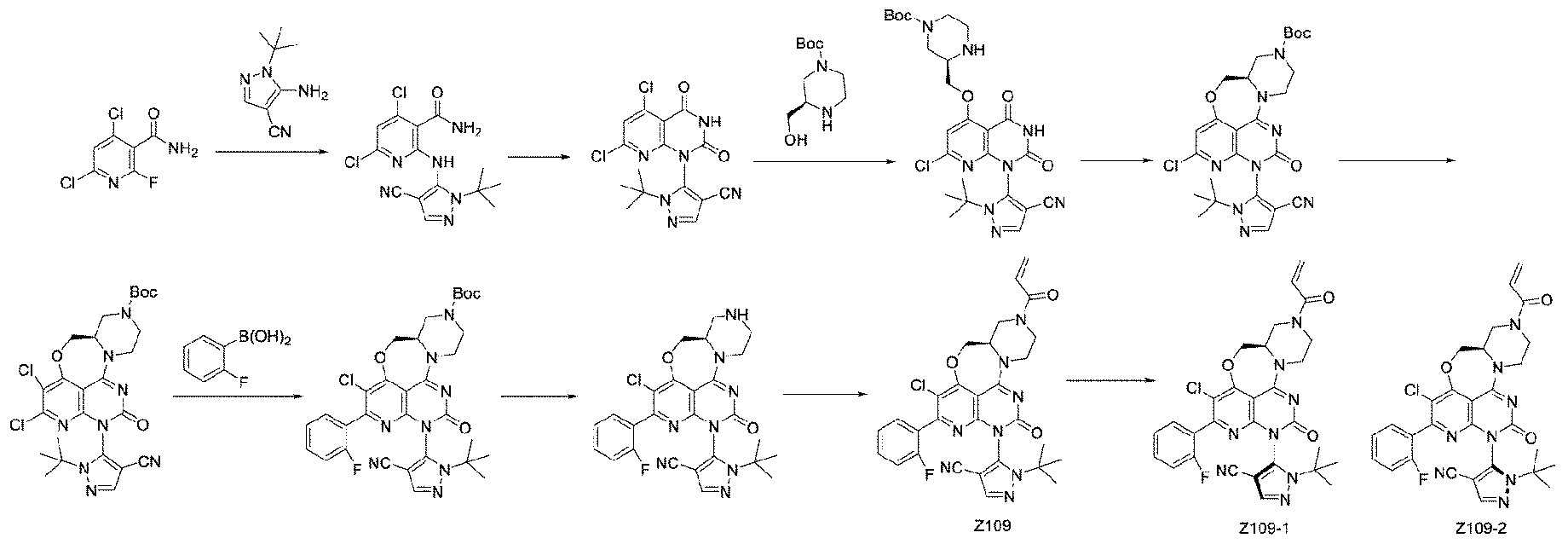
中間体aの調製
工程1:2-イソプロピル-4-メチルピリジン-3-アミン(50g、333.3mmol)をテトラヒドロフラン(500mL)に溶解した。反応溶液を-65℃に冷却した後、NaHMDS(333.3mL、2M、666.6mmol)をゆっくりと滴下した。滴下の間、反応溶液は-60℃より低い温度で保った。滴下終了後、-60℃で30分間反応させ、次に4-ブロモ-2,6-ジフルオロベンゾニトリルのテトラヒドロフラン(500mL)溶液を反応溶液にゆっくりと滴下した。滴下の間、反応溶液は-60℃より低い温度で保った。滴下終了後、反応溶液を室温に戻し、一晩反応させた。反応終了後、飽和塩化アンモニウム溶液を加えて反応を停止させた。反応溶液を酢酸エチルで抽出して有機相を食塩水で洗浄し、無水硫酸ナトリウムで乾燥し、減圧下で濃縮乾固させて4-ブロモ-2-フルオロ-6-((2-イソプロピル-4-メチルピリジン-3-イル)アミノ)ベンゾニトリルの粗生成物を得た(133g、収率100%)。ES-API:[M+H]+=348.1
工程2:4-ブロモ-2-フルオロ-6-((2-イソプロピル-4-メチルピリジン-3-イル)アミノ)ベンゾニトリル(133g、粗生成物、333.3mmol)をアセトニトリル(1400mL)に溶解し、NCS(89.1g、666.6mmol)を添加した。反応溶液を80℃に加熱して2時間反応させ、室温まで冷却し、水を加えて反応を停止させた。反応溶液を酢酸エチルで抽出して有機相を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥し、減圧下で濃縮乾固させ、カラム精製を行って4-ブロモ-3-クロロ-2-フルオロ-6-((2-イソプロピル-4-メチルピリジン-3-イル)アミノ)ベンゾニトリルを得た(13.91g、2工程の収率11%)。ES-API:[M+H]+=382.1
工程3:4-ブロモ-3-クロロ-2-フルオロ-6-((2-イソプロピル-4-メチルピリジン-3-イル)アミノ)ベンゾニトリル(13.91g、36.5mmol)をDMSO(130mL)に溶解し、次に炭酸カリウム(10.0g、73.2mmol)を添加し、過酸化水素(14.91g、131.41mmol)を氷浴下で滴下し、室温で2時間反応させた。反応終了後、10%亜硫酸ナトリウム溶液(100mL)を氷浴下でゆっくりと添加して反応を停止させた。反応溶液を酢酸エチルで抽出して有機相を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥し、減圧下で濃縮乾固させて生成物:4-ブロモ-3-クロロ-2-フルオロ-6-((2-イソプロピル-4-メチルピリジン-3-イル)アミノ)ベンズアミドを得た(12.5g、収率85.8%)。ES-API:[M+H]+=400.1
工程4:4-ブロモ-3-クロロ-2-フルオロ-6-((2-イソプロピル-4-メチルピリジン-3-イル)アミノ)ベンズアミド(12.5g、31.33mmol)のテトラヒドロフラン(150mL)溶液を、水素化ナトリウム(12.5g、156.66mmol)のテトラヒドロフラン(40mL)溶液にドライアイスエタノール浴下で滴下して温度を0℃未満に制御した。ドライアイスエタノール浴下で15分間反応させた後、カルボニルジイミダゾール(7.6g、47.1mmol)のテトラヒドロフラン(100mL)溶液を滴下した。滴下終了後、ドライアイスとエタノールを15分間反応させた。反応終了後、飽和塩化アンモニウム溶液を添加して反応を停止させた。反応溶液を酢酸エチルで抽出して有機相を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥し、減圧下で濃縮乾固させた。この粗生成物を石油エーテル/酢酸エチル=10:1でスラリー化して目的生成物:7-ブロモ-6-クロロ-5-フルオロ-1-(2-イソプロピル-4-メチルピリジン-3-イル)キナゾリン-2,4(1H,3H)-ジオンを得た(10.8g、収率81.1%)。ES-API:[M+H]+=426.1
工程5:(R)3-(ヒドロキシメチル)ピペラジン-1-カルボン酸tert-ブチル(3.0g、14.07mmol)を0℃でTHF(60mL)に溶解し、水素化ナトリウム(1.88g、46.9mmol)を数回に分けて添加した。0℃で30分間反応を続けた後、7-ブロモ-6-クロロ-5-フルオロ-4-ヒドロキシ-1-(2-イソプロピル-4-メチルピリジン-3-イル)キナゾリン-2-オン(4.0g、9.38mmol)を数回に分けて添加し、反応溶液を0℃~室温で1.5時間反応させた。反応終了後、反応溶液を酢酸エチル(100mL)で0℃で希釈し、続いて氷水を添加した。生成物を酢酸エチル(3×100mL)で抽出し、飽和食塩水(3×80mL)で洗浄し、無水硫酸ナトリウムで乾燥し、濃縮して粗生成物を得た。この粗生成物をシリカゲルカラムで精製して(R)-3-(((7-ブロモ-6-クロロ-4-ヒドロキシ-1-(2-イソプロピル-4-メチルピリジン-3-イル)-2-オキソ-1,2-ジヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-カルボン酸tert-ブチルを得た(褐色油、4.5g、収率77.59%)。ES-API:[M+H]+=622,624
工程6:(R)-3-(((7-ブロモ-6-クロロ-4-ヒドロキシ-1-(2-イソプロピル-4-メチルピリジン-3-イル)-2-オキソ-1,2-ジヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-カルボン酸tert-ブチル(4.0g、6.42mmol)を0℃でDMF(100mL)に溶解し、PyBOP(8.35g、16.05mmol)を数回に分けて添加した後、DBU(4.88g、32.10mmol)を滴下した。添加終了後、反応溶液を室温で2時間反応させた。反応終了後、反応溶液を酢酸エチル(100mL)で0℃で希釈し、続いて氷水を添加した。生成物を酢酸エチル(3×100mL)で抽出し、飽和食塩水(3×100mL)で洗浄し、無水硫酸ナトリウムで乾燥し、濃縮して粗生成物を得た。この粗生成物をシリカゲルカラムで精製して中間体aを得た(褐色油、3.6g、収率92.78%)。ES-API:[M+H]+=603,605
中間体bの調製
工程1:6-ブロモピリジン-2-オール(866mg、4.98mmol)を5mLのアセトニトリルに溶解し、炭酸カリウム(2.06g、14.93mmol)とヨウ化メチル(1.06g、7.47mmol)を添加し、60℃で2時間攪拌した。反応溶液を酢酸エチルで抽出し、減圧下で濃縮した。この粗生成物をカラムクロマトグラフィー(石油エーテル/酢酸エチル=1/1)で精製して6-ブロモ-1-メチルピリジン-2(1H)-オンを得た(白色固体、630mg、収率73%)。ES-API:[M+H]+=188.0
工程2:6-ブロモ-1-メチルピリジン-2(1H)-オン(2g、10.6mmol)をテトラヒドロフラン(20mL)に溶解し、窒素保護下で-78℃に冷却し、n-ブチルリチウム(5.1mL、12.7mmol、2.5Mテトラヒドロフラン溶液)を滴下した。攪拌下、-78℃で15分間反応させ、続いて塩化トリブチルスズ(5.19g、16.0mmol)を滴下し、反応物をゆっくりと室温まで上昇させた。反応溶液を飽和塩化アンモニウム溶液で急冷した後、酢酸エチルで抽出し、減圧下で濃縮した。この粗生成物をカラムクロマトグラフィー(石油エーテル/酢酸エチル=10/1-2/1)で精製して1-メチル-6-(トリブチルスタンニル)ピリジン-2(1H)-オンを得た(淡黄色液体、1.6g、収率38%)。ES-API:[M+H]+=400.2
中間体cの調製
工程1:2,4-ジクロロ-6-メチル-5-ニトロピリミジン(20g、97.08mmol)をジオキサン(400mL)に溶解し、イソプロペニルトリフルオロホウ酸カリウム(14.98g、101.9mmol)、ビス(トリフェニルホスフィン)パラジウムジクロライド(3.4g、4.85mmol)を順に添加した。そこに水100mLに溶解した炭酸ナトリウム(20g)を滴下した。添加終了後、窒素置換を3回行い、80℃で2時間反応させた。反応終了後、反応系を室温まで冷却し、500mLの氷水に添加し、酢酸エチルで3回抽出した。有機相を食塩水で1回洗浄し、無水硫酸ナトリウムで乾燥し、マニュアルカラムクロマトグラフィー(純石油エーテル)で精製して2-クロロ-4-メチル-5-ニトロ-6-(プロパ-1-エン-2-イル)ピリミジンを得た(8g、収率38%)。ES-API:[M+1]+=214.02
工程2:2-クロロ-4-メチル-5-ニトロ-6-(プロパ-1-エン-2-イル)ピリミジン(8g、37.55mmol)をメタノール(50mL)に溶解し、酢酸ナトリウム(6.15g、75.11mmol)及び800mgのパラジウム炭素を順に添加した。反応物を水素バルーンに連結して3回水素置換した。反応物を室温で24時間攪拌した。点板によって、原材料が消失し、生成物と、除去されていないClの副生成物とがあることがわかった。反応溶液をろ過し、このサンプルを混合してカラム器(120gカラム)に通して精製(石油エーテル/酢酸エチル=3/1)して4-イソプロピル-6-メチルピリミジン-5-アミンを得た(4g、収率71%)。ES-API:[M+1]+=152.1
実施例1:化合物Z1の調製
工程1:2-アミノ-4-ブロモ-6-フルオロ安息香酸メチル(2.6g、10.48mmol)及び50mLのイソプロパノールを250mL丸底フラスコに添加した。系温度を60℃まで上昇させた後、N-クロロスクシンイミド(1.7g、12.7mmol)を反応溶液に添加した。系温度を80℃に上昇させ、この温度で20分間反応させた。反応終了後、反応溶液を濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-8%)で精製して目的生成物:6-アミノ-4-ブロモ-3-クロロ-2-フルオロ安息香酸メチル1.2gを収率39%で得た。ES-API:[M+H]+=282.0;HNMR(400MHz,DMSO-d6):7.05(s,1H),6.87(s,2H),3.82(s,3H)
工程2:6-アミノ-4-ブロモ-3-クロロ-2-フルオロ安息香酸メチル(1.1g、3.89mmol)、1-ヨード-2-イソプロピルベンゼン(1.44g、5.84mmol)、Pd2(dba)3(0.36g、0.39mmol)、キサントホス(0.56g、0.97mmol)、炭酸セシウム(2.55g、7.78mmol)、及び20mLのジオキサンを100mL丸底フラスコに添加した。系内を3回窒素置換した後、窒素ボールで保護した。反応物を70℃で16時間攪拌した。反応の完了をLC-MSで検出した。30mLの水を反応物に添加した。反応溶液を30mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-5%)で精製して目的生成物:4-ブロモ-3-クロロ-2-フルオロ-6-((2-イソプロピルフェニル)アミノ)安息香酸メチル380mgを収率24%で得た。ES-API:[M+H]+=400.1
工程3:4-ブロモ-3-クロロ-2-フルオロ-6-((2-イソプロピルフェニル)アミノ)安息香酸メチル(380mg、0.95mmol)、水酸化ナトリウム(114mg、2.84mmol)、メタノール(5mL)、テトラヒドロフラン(10mL)、及び水(5mL)を100mL丸底フラスコに添加した。反応物を室温で3時間攪拌した。反応の完了をLC-MSで検出した。30mLの水を反応物に添加し、1M塩酸水溶液で反応物のpHを7に調整した。反応溶液を30mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮して粗生成物:4-ブロモ-3-クロロ-2-フルオロ-6-((2-イソプロピルフェニル)アミノ)安息香酸367mgを得た。ES-API:[M+H]+=386.1
工程4:4-ブロモ-3-クロロ-2-フルオロ-6-((2-イソプロピルフェニル)アミノ)安息香酸(280mg、0.72mmol)、塩化チオニル(862mg、7.2mmol)、及びトルエン(5mL)を100mL丸底フラスコに添加した。反応物を100℃で1時間攪拌した。反応溶液を濃縮乾固して黄色油を得た。この黄色油をテトラヒドロフランに溶解したものを28%アンモニア水(5mL)に滴下した。反応溶液を室温で1時間攪拌した。反応の完了をLC-MSで検出した。30mLの水を反応物に添加した。反応溶液を30mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-40%)で精製して目的生成物:4-ブロモ-3-クロロ-2-フルオロ-6-((2-イソプロピルフェニル)アミノ)ベンズアミド(300mg)を純度89%、収率96%で得た。ES-API:[M+H]+=385.3
工程5:60%NaH(146mg、3.65mmol)、テトラヒドロフラン(6mL)、及びDMF(2mL)を100mL丸底フラスコに添加した。反応物を0℃に冷却し、そこに4-ブロモ-3-クロロ-2-フルオロ-6-((2-イソプロピルフェニル)アミノ)ベンズアミド(280mg、0.73mmol)のテトラヒドロフラン(2mL)溶液を滴下した。反応物を0℃で5時間攪拌した後、N,N’-カルボニルジイミダゾール(141mg、0.87mmol)のテトラヒドロフラン(1mL)溶液を反応溶液に滴下した。滴下終了後、反応物を0℃で15分攪拌した。反応の完了をLC-MSで検出した。30mLの飽和NH4Cl水溶液を反応溶液に添加した。反応溶液を20mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-25%)で精製して目的生成物:7-ブロモ-6-クロロ-5-フルオロ-4-ヒドロキシ-1-(2-イソプロピルフェニル)キナゾリン-2(1H)-オン(150mg)を黄色固体として収率50%で得た。ES-API:[M+H]+=411.2
工程6:60%NaH(24mg、0.6mmol)、3-(ヒドロキシメチル)ピペラジン-1-カルボン酸tert-ブチル(67mg、0.31mmol)、テトラヒドロフラン(6mL)を100mL丸底フラスコに添加した。反応物を0℃まで冷却し、そこに7-ブロモ-6-クロロ-5-フルオロ-4-ヒドロキシ-1-(2-イソプロピルフェニル)キナゾリン-2(1H)-オン(100mg、0.24mmol)のテトラヒドロフラン(2mL)溶液を滴下した。反応物を0℃で5分攪拌した後、反応物を65℃油浴で1時間攪拌した。反応の完了をLC-MSで検出した。30mLの飽和NH4Cl水溶液を反応溶液に添加した。反応溶液を40mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(メタノール/ジクロロメタン:0-5%)で精製して目的生成物:3-(((7-ブロモ-6-クロロ-4-ヒドロキシ-1-(2-イソプロピルフェニル)-2-オキソ-1,2-ジヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-カルボン酸tert-ブチル(130mg)を黄色固体として純度84%、収率75%で得た。ES-API:[M+H]+=607.1
工程7:3-(((7-ブロモ-6-クロロ-4-ヒドロキシ-1-(2-イソプロピルフェニル)-2-オキソ-1,2-ジヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-カルボン酸tert-ブチル(100mg、0.16mmol)、N,N-ジメチルホルムアミド(1mL)、及び50%T3Pの酢酸エチル溶液(523mg、0.82mmol)を50mL丸底フラスコに添加した。DBU(146mg、0.96mmol)を攪拌しながら一度に添加した。反応物を室温で16時間攪拌した。反応の完了をLC-MSで検出した。反応物をC18逆相カラム(アセトニトリル/水(1%トリフルオロ酢酸):0-70%)で直接精製して目的生成物:10-ブロモ-11-クロロ-8-(2-イソプロピルフェニル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジン[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(50mg)を黄色固体として純度90%、収率53%で得た。ES-API:[M+H]+=589.1
工程8:10-ブロモ-11-クロロ-8-(2-イソプロピルフェニル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジン[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(40mg、0.068mmol)、(5-メチル-1H-インダゾール-4-イル)ボロン酸(18mg、0.1mmol)、SPhos(7mg、0.017mmol)、Pd2(dba)3(12mg、0.014mmol)、リン酸カリウム(43mg、0.2mmol)、2mLのジオキサン、及び0.2mLの水を10mLマイクロ波反応管に添加した。マイクロ波反応管を115℃のマイクロ波反応器に入れて1時間反応させ、反応を停止させた。20mLの水を反応溶液に添加した。反応溶液を20mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-100%)で精製して目的生成物:11-クロロ-8-(2-イソプロピルフェニル)-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジン[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(40mg)を黄色固体として純度70%、粗生成物収率64%で得た。ES-API:[M+H]+=641.2
工程9:11-クロロ-8-(2-イソプロピルフェニル)-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジン[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(40mg、0.062mmol)、2mLのジクロロメタン、及び2mLのトリフルオロ酢酸を25mL丸底フラスコに添加した。反応物を室温で0.5時間攪拌した。反応の完了をLC-MSで検出した。反応溶液を40℃で濃縮して粗生成物:11-クロロ-8-(2-イソプロピルフェニル)-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(39mg)を黄色固体として純度72%で得た。ES-API:[M+H]+=541.2
工程10:11-クロロ-8-(2-イソプロピルフェニル)-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(39mg、0.06mmol)、2mLのジクロロメタン、及びトリエチルアミン(30mg、0.3mmol)を25mL丸底フラスコに添加した。反応物を0℃まで冷却し、無水アクリル酸のジクロロメタン溶液(5mg、0.04mmol、0.5mL)を反応溶液に滴下した。反応物を0℃で20分攪拌した。10mLの飽和NaHCO3水溶液を反応溶液に添加し、10mLのジクロロメタンで3回抽出し、有機相を乾燥及び濃縮し、粗生成物を分取HPLCで精製して目的生成物:Z1(4.44mg)を白色固体として反応収率12%で得た。ES-API:[M+H]+=595.2;1HNMR(400MHz,CDCl3):7.52-7.34(m,4H),7.28-7.26(m,2H),7.11-7.09(m,1H),6.68-6.61(m,1H),6.44-6.40(m,1H),6.21-6.20(m,1H),5.83(d,J=10Hz,1H),5.05-5.01(m,1H),4.72-4.65(m,3H),4.08-3.98(m,2H),3.62-3.58(m,1H),3.21-3.12(m,2H),2.76-2.71(m,1H),2.12-2.10(m,3H),1.22-1.20(m,3H),1.05-1.01(m,3H)
実施例2~14
化合物Z2~Z14を化合物Z1と同様の方法を参照して調製した。各化合物の出発材料は、市販品や、当業者によく知られている既存の方法を参照して調製することができる。当業者には、中間体の同様の合成方法が既存の方法を参照して容易に入手可能である。
実施例15:化合物Z15、Z15-1、及びZ15-2の調製
工程1:2-イソプロピル-4-メチルピリジン-3-アミン(1.5g、9.99mmol)及び50mLのテトラヒドロフランを250mL丸底フラスコに添加した。系を0℃に冷却後、ナトリウムビス(トリメチルシリル)アミド(12.5mL、2.5Mテトラヒドロフラン溶液、25mmol)を反応溶液に滴下した。滴下終了後、反応物を-60℃で30分攪拌し、次に4-ブロモ-2,6-ジフルオロベンゾニトリル(2.39g、10.98mmol)のテトラヒドロフラン(50mL)溶液を反応溶液に滴下した。滴下終了後、反応物を0℃で一晩攪拌した。反応終了後、反応溶液を氷水に注ぎ入れ、酢酸エチルで抽出した。有機相を1M塩酸、飽和炭酸水素ナトリウム水溶液、及び飽和食塩水で洗浄した。有機相を無水硫酸ナトリウムで乾燥し、ろ過し、ろ液を濃縮乾固して生成物:4-ブロモ-2-フルオロ-6-(((2-イソプロピル-4-メチルピリジン-3-イル)アミノ)ベンゾニトリル(1.7g、49%)を黄色固体として得た。ES-API:[M+H]+=349.3
工程2:4-ブロモ-2-フルオロ-6-(((2-イソプロピル-4-メチルピリジン-3-イル)アミノ)ベンゾニトリル(1.7g、4.88mmol)及び50mLのジメチルスルホキシドを250mL三口丸底フラスコに添加し、氷浴下で0~5℃まで冷却し、炭酸カリウム(1.34g、9.76mmol)及び過酸化水素(6.57g、30%水溶液、58mmol)を添加した。この温度で一晩反応させた。反応の完了をLCMSで検出した。反応溶液を約150mLの氷水に注ぎ入れ、固体を沈殿させた。これをろ過してろ過ケーキを得た。ろ過ケーキを乾燥して4-ブロモ-2-フルオロ-6-(((2-イソプロピル-4-メチルピリジン-3-イル)アミノ)ベンズアミド(1.8g、粗生成物)を白色固体として得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=367.2
工程3:4-ブロモ-2-フルオロ-6-(((2-イソプロピル-4-メチルピリジン-3-イル)アミノ)ベンズアミド(1.8g、4.9mmol)及び80mLの乾燥テトラヒドロフランを250mL三口丸底フラスコに添加し、氷浴下で0~5℃まで冷却し、水素化ナトリウムを数回に分けて添加し(980mg、24.5mmol)、この温度で10分間反応させた。CDI(1.59g、9.8mmol)のテトラヒドロフラン(40mL)懸濁液を上記溶液に滴下した後、この温度で20分間反応させた。反応の完了をLCMSで検出した。反応溶液を約150mLの氷水に注ぎ入れ、pHを3M塩酸で約4に調整した。反応溶液を酢酸エチルで抽出した。有機相を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥し、ろ過した。ろ液を濃縮乾固して7-ブロモ-5-フルオロ-1-(2-イソプロピル-4-メチルピリジン-3-イル)キナゾリン-2,4(1H,3H)-ジオン(1.46g、76%)を黄色固体として得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=393.3
工程4:(S)-3-(ヒドロキシメチル)ピペラジン-1-カルボン酸tert-ブチル(1.04g、4.81mmol)を60%水素化ナトリウム(1.11g、18.5mmol)のテトラヒドロフラン(50mL)懸濁液に0℃で添加し、0℃で30分間反応させた。そこに7-ブロモ-5-フルオロ-1-(2-イソプロピル-4-メチルピリジン-3-イル)キナゾリン-2,4(1H,3H)-ジオン(1.46g、3.7mmol)のテトラヒドロフラン(20mL)溶液を滴下した。反応物を0℃で30分攪拌した。反応の完了をLC-MSで検出した。反応溶液を約100mLの氷水に注ぎ入れた。反応溶液を酢酸エチルで3回抽出した。有機相を乾燥及び濃縮し、粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:20-100%)で精製して(S)-3-((((7-ブロモ-1-(2-イソプロピル-4-メチルピリジン-3-イル)-2,4-ジオキソ-1,2,3,4-テトラヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-ギ酸tert-ブチル(1.34g、62%)を黄色固体として得た。ES-API:[M+H]+=589.1
工程5:(S)-3-((((7-ブロモ-1-(2-イソプロピル-4-メチルピリジン-3-イル)-2,4-ジオキソ-1,2,3,4-テトラヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-ギ酸tert-ブチル(1.34g、2.29mmol)、DBU(2.01g、13.74mmol)、PyBop(3.57g、6.87mmol)、ジクロロメタン(100mL)を丸底フラスコに添加した。反応物を室温で30分攪拌した。反応の完了をLC-MSで検出した。100mLのジクロロメタンを反応物に添加し、有機相を30mLの塩酸(1M)及び100mLの飽和炭酸水素ナトリウム水溶液で順に洗浄した。有機相を乾燥及び濃縮し、粗生成物を高速シリカゲルカラム(メタノール/ジクロロメタン:0-3%)で精製して(S)-10-ブロモ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(1.04g、80%)を得た。ES-API:[M+H]+=571.4
工程6:(S)-10-ブロモ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(1.04g、1.83mmol)、(2-フルオロ-6-ヒドロキシフェニル)ボロン酸(429mg、2.75mmol)、SPhos(73mg、0.18mmol)、SPhos-Pd-G2(129mg、0.18mmol)、リン酸カリウム(1.16g、5.49mmol)、60mLのジオキサン、及び12mLの水を100mL反応フラスコに添加した。反応物を窒素保護下で115℃で2時間攪拌し、反応を停止させた。50mLの水を反応溶液に添加した。反応溶液を50mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-100%)で精製して生成物:(S)-10-(2-フルオロ-6-ヒドロキシフェニル)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(560mg、51%)を黄色固体として得た。ES-API:[M+H]+=602.1
工程7:(S)-10-(2-フルオロ-6-ヒドロキシフェニル)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(560mg、0.93mmol)、3mLのトリフルオロ酢酸、及び6mLのジクロロメタンを丸底フラスコに添加した。反応物を室温で1時間攪拌した。反応の完了をLC-MSで検出した。反応溶液を濃縮して(S)-10-(2-フルオロ-6-ヒドロキシフェニル)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(582mg)を黄色固体として得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=502.1
工程8:(S)-10-(2-フルオロ-6-ヒドロキシフェニル)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(582mg、1.16mmol)、6mLのジクロロメタン、及びトリエチルアミン(1.17g、11.6mmol)を丸底フラスコに添加した。反応物を0℃まで冷却し、無水アクリル酸のジクロロメタン溶液(117mg、0.93mmol、1mL)を反応溶液に滴下した。反応物を0℃で10分攪拌した。40mLの飽和炭酸水素ナトリウム水溶液を反応溶液に添加し、反応溶液を20mLのジクロロメタンで3回抽出した。有機相を乾燥及び濃縮し、粗生成物を分取HPLCで精製して目的生成物:(S)-2-アクリロイル-10-(2-フルオロ-6-ヒドロキシフェニル)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オンZ15(257mg、40%)を得た。ES-API:[M+H]+=556.1;1H NMR(400MHz,DMSO-d6)δ10.08(d,J=1.8Hz,1H),8.50(d,J=5.0Hz,1H),7.28(d,J=5.0Hz,1H),7.16(dd,J=15.0,8.2Hz,1H),6.84(s,2H),6.72(d,J=8.2Hz,1H),6.69-6.60(m,1H),6.20(d,J=16.4Hz,1H),5.98(s,1H),5.76(s,1H),4.75(s,1H),4.61(s,2H),4.52-4.26(m,2H),4.17-3.97(m,2H),2.82-2.68(m,1H),1.95(d,J=3.4Hz,4H),1.24(s,3H),1.11-1.06(m,4H),1.05-1.00(m,4H)
工程9:化合物Z15(257mg、0.46mmol)をキラル分割(移動相:メタノール(0.2%アンモニア含有メタノール);カラムタイプ:Cellulose-SC(4.6×100×5μm);流量:1.8mL/分;カラム温度:40.2℃)して以下の化合物を得た。
化合物Z15-1(112mg、保持時間:1.6分、純度:100%、de値:99%):ES-API:[M+H]+=556.2、及び
化合物Z15-2(121mg、保持時間:2.81分、純度:100%、de値:99%):ES-API:[M+H]+=556.2
実施例16:化合物Z16の調製
工程1:水素化ナトリウム(0.81g、20.25mmol、60%)を15mLのテトラヒドロフラン溶液に懸濁して0℃まで冷却した。この溶液に7-ブロモ-5-フルオロ-1-(2-イソプロピル-4-メチルピリジン-3-イル)キナゾリン-2,4(1H,3H)-ジオン(1.44g、6.658mmol)、10mLのテトラヒドロフラン溶液をゆっくりと滴下した。5分攪拌した後、(R)-3-(ヒドロキシメチル)ピペラジン-1-カルボン酸tert-ブチル(1.8g、4.589mmol)、15mLのテトラヒドロフラン溶液を滴下した。65℃まで加熱後、反応物を1時間攪拌した。30mLの塩化アンモニウム溶液を反応溶液に添加した。反応溶液を50mLの酢酸エチルで2回抽出し、乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-35%)で精製して目的生成物:(R)-3-((((7-ブロモ-1-(2-イソプロピル-4-メチルピリジン-3-イル)-2,4-ジオキソ-1,2,3,4-テトラヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-カルボン酸tert-ブチル(1.5g、収率75%)を白色様固体として得た。ES-API:[M+H]+=588
工程2:(R)-3-((((7-ブロモ-1-(2-イソプロピル-4-メチルピリジン-3-イル)-2,4-ジオキソ-1,2,3,4-テトラヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-カルボン酸tert-ブチル(1.5g、2.55mmol)をN,N-ジメチルホルムアミド(50mL)に溶解し、ベンゾトリアゾール-1-イル-オキシトリピロリジノホスホニウムヘキサフルオロホスフェート(3.97g、7.64mmol)、1,8-ジアザビシクロウンデカ-7-エン(2.33g、15.29mmol)を順に添加した。反応物を室温で1時間攪拌した。150mLの酢酸エチルを反応溶液に添加し、反応溶液を飽和食塩水で3回洗浄し、乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-20%)で精製して目的生成物:(R)-10-ブロモ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(1.0g、収率69%)を淡黄色固体として得た。ES-API:[M+H]+=571
工程3:(R)-10-ブロモ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(200mg、0.35mmol)、(2-フルオロ-6-ヒドロキシフェニル)ボロン酸(82mg、0.526mmol)、クロロ(2-ジシクロヘキシルホスフィノ-2’,6’-ジメトキシ-1,1’-ビフェニル)(2’-アミノ-1,1’-ビフェニル-2-イル)パラジウム(II)(25.24mg、0.035mmol)、2-ジシクロヘキシルホスフィノ-2’,6’-ジメトキシ-ビフェニル(14.37mg、0.035mmol)、リン酸カリウム(223mg、0.105mmol)、5mLの1,4-ジオキサン、及び1mLの水を100mL三口丸底フラスコに添加した。系内を3回窒素置換した後、窒素ボールで保護した。反応物を110℃で1時間攪拌した。150mLの酢酸エチルを反応溶液に添加し、反応溶液を飽和食塩水で3回洗浄し、乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-50%)で精製して目的生成物:(R)-10-(2-フルオロ-6-ヒドロキシフェニル)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(160mg、収率76%)を淡黄色固体として得た。ES-API:[M+H]+=602
工程4:(R)-10-(2-フルオロ-6-ヒドロキシフェニル)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(160mg、0.266mmol)をジクロロメタン(5mL)に溶解し、トリフルオロ酢酸(2mL)を添加した。反応物を室温で2時間攪拌し、反応溶液を濃縮して目的生成物:(R)-10-(2-フルオロ-6-ヒドロキシフェニル)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(175mg)を得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=502
工程5:(R)-10-(2-フルオロ-6-ヒドロキシフェニル)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(175mg、0.266mmol)をジクロロメタン(15mL)に溶解し、トリエチルアミン(1.0mL、7.21mmol)を添加した。反応物を0℃まで冷却し、無水アクリル酸(26.83mg、0.213mmol)を反応溶液に滴下した。反応物を0℃で15分攪拌した。80mLのジクロロメタンを反応溶液に添加し、反応溶液を100mLの飽和NaHCO3水溶液、80mLの飽和食塩水で洗浄し、乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-60%)で精製して目的生成物:(R)-2-アクリロイル-10-(2-フルオロ-6-ヒドロキシフェニル)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オンZ16(60mg、収率67%)を黄色固体として得た。ES-API:[M+H]+=556;1H NMR(500MHz,DMSO-d6)δ10.05(d,J=92.9Hz,1H),8.50(d,J=4.9Hz,1H),7.35-7.24(m,1H),7.16(td,J=8.3,6.7Hz,1H),6.90(t,J=13.6Hz,1H),6.84(d,J=2.9Hz,1H),6.71(d,J=8.3Hz,1H),6.65(dd,J=9.9,8.4Hz,1H),6.20(d,J=16.7Hz,1H),5.98(dt,J=4.7,1.4Hz,1H),5.77(dd,J=10.4,2.4Hz,1H),4.76(d,J=18.0Hz,1H),4.67-4.54(m,2H),4.34(d,J=17.2Hz,1H),4.05(s,1H),3.51(dd,J=20.8,11.2Hz,1H),3.29-2.98(m,2H),2.76(dp,J=26.7,6.7Hz,1H),1.95(d,J=4.5Hz,3H),1.08(t,J=6.7Hz,3H),1.03(dd,J=6.7,4.2Hz,3H)
実施例17:化合物Z17、Z17-1、及びZ17-2の調製
工程1:4-ブロモ-2,6-ジフルオロベンゾニトリル(10g、45.87mmol)、40mLのイソプロパノール、及びシクロプロピルアミン(13g、229mmol)を密閉管に添加した。反応物を70℃油浴で2時間加熱した。反応の完了をLC-MSで検出した。反応溶液を濃縮した。この粗生成物を石油エーテルで洗浄して生成物:4-ブロモ-2-(シクロプロピルアミノ)-6-フルオロベンゾニトリル(11g、94%)を白色固体として得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=255.1
工程2:4-ブロモ-2-(シクロプロピルアミノ)-6-フルオロベンゾニトリル(10g、39.21mmol)、N-クロロスクシンイミド(5.7g、43.13mmol)、及びアセトニトリル(150mL)を丸底フラスコに添加した。反応物を65℃で0.5時間攪拌した。チオ硫酸ナトリウム水溶液を反応溶液に添加した。反応溶液を酢酸エチルで抽出した。有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-5%)で精製して4-ブロモ-3-クロロ-6-(シクロプロピルアミノ)-2-フルオロベンゾニトリル(3.97g、35%)を白色固体として得た。HNMR(400MHz,CDCl3)7.17(s,1H),5.13(s,1H),2.50-2.48(m,1H),0.92-0.90(m,2H),0.62-0.60(m,2H);ES-API:[M+H]+=289.1
工程3:4-ブロモ-3-クロロ-6-(シクロプロピルアミノ)-2-フルオロベンゾニトリル(5g、17.30mmol)、炭酸カリウム(4.77g、34.60mmol)、及びジメチルスルホキシド(30mL)を丸底フラスコに添加した。30%過酸化水素(3.47mL、34.60mmol)を攪拌しながら添加した。反応物を室温で3時間攪拌した。氷水を反応溶液に添加し、固体を沈殿させた。それをろ過し、ろ過ケーキを真空乾燥して4-ブロモ-3-クロロ-6-(シクロプロピルアミノ)-2-フルオロベンズアミド(4.7g、89%)を白色固体として得た。HNMR(400MHz,DMSO-d6)7.91(s,1H),7.85(s,1H),7.15(s,1H),6.96(s,1H),2.502-2.45(m,1H),0.80-0.75(m,2H),0.47-0.43(m,2H);ES-API:[M+H]+=306.9
工程4:4-ブロモ-3-クロロ-6-(シクロプロピルアミノ)-2-フルオロベンズアミド(4.7g、16.7mmol)及び80mLの乾燥テトラヒドロフランを丸底フラスコに添加して氷浴下で0~5℃まで冷却し、水素化ナトリウム(3.3g、83.5mmol)を数回に分けて添加し、この温度で5分間反応させた。CDI(3.2g、20.04mmol)のテトラヒドロフラン(40mL)懸濁液を上記溶液に滴下した後、この温度で15分間反応させた。反応の完了をLCMSで検出した。反応溶液を約150mLの氷水に注ぎ入れ、pHを3M塩酸で約3に調整した。反応溶液を酢酸エチルで抽出した。有機相を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥し、ろ過した。ろ液を濃縮乾固して7-ブロモ-6-クロロ-1-シクロプロピル-5-フルオロ-4-ヒドロキシキナゾリン-2(1H)-オン(3g、55%)を黄色固体として得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=333.1
工程5:60%NaH(180mg、4.5mmol)、(S)-3-(ヒドロキシメチル)ピペラジン-1-カルボン酸tert-ブチル(291mg、1.35mmol)、テトラヒドロフラン(12mL)を丸底フラスコに添加した。反応物を0℃まで冷却し、そこに7-ブロモ-6-クロロ-1-シクロプロピル-5-フルオロ-4-ヒドロキシキナゾリン-2(1H)-オン(300mg、0.90mmol)のテトラヒドロフラン(3mL)溶液を滴下した。反応物を0℃で5分攪拌した後、反応物を60℃油浴で1時間攪拌した。反応の完了をLC-MSで検出した。30mLの飽和NH4Cl水溶液を反応溶液に添加した。反応溶液を40mLの酢酸エチルで3回抽出した。有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(メタノール/ジクロロメタン:0-5%)で精製して目的生成物:(S)-3-((((7-ブロモ-6-クロロ-1-シクロプロピルメチル-4-ヒドロキシ-2-オキソ-1,2-ジヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-カルボン酸tert-ブチル(470mg)を黄色固体として収率98%で得た。ES-API:[M+H]+=529.1
工程6:(S)-3-((((7-ブロモ-6-クロロ-1-シクロプロピルメチル-4-ヒドロキシ-2-オキソ-1,2-ジヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-カルボン酸tert-ブチル(450mg、0.85mmol)、1H-ベンゾトリアゾール-1-イルオキシトリピロリジニルヘキサフルオロホスフェート(1.3g、2.55mmol)、N,N-ジメチルホルムアミド(8mL)を丸底フラスコに添加した。DBU(646mg、4.25mmol)を攪拌しながら添加した。反応物を室温で2時間攪拌した。反応の完了をLC-MSで検出した。20mLの水を反応溶液に添加した。反応溶液を20mLの酢酸エチルで3回抽出した。有機相を飽和食塩水で3回洗浄し、乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-100%)で精製して目的生成物:(S)-10-ブロモ-11-クロロ-8-シクロプロピル-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(420mg)を黄色固体として収率96%で得た。ES-API:[M+H]+=511.0
工程7:(S)-10-ブロモ-11-クロロ-8-シクロプロピル-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(370mg、0.72mmol)、(5-メチル-1H-インダゾール-4-イル)ボロン酸(190mg、1.08mmol)、SPhos(29mg、0.072mmol)、SPhos-Pd-G2(52mg、0.072mmol)、リン酸カリウム(457mg、2.16mmol)、8mLのジオキサン、及び2mLの水を丸底フラスコに添加した。丸底フラスコを105℃のマイクロ波反応器に入れて2時間反応させ、反応を停止させた。20mLの水を反応溶液に添加した。反応溶液を20mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(メタノール/ジクロロメタン:0-2%)で精製して目的生成物:(13aS)-11-クロロ-8-シクロプロピル-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(400mg)を黄色固体として純度60%、収率59%で得た。ES-API:[M+H]+=563.2
工程8:(13aS)-11-クロロ-8-シクロプロピル-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(400mg、0.44mmol)、3mLのジクロロメタン、及び3mLのトリフルオロ酢酸を丸底フラスコに添加した。反応物を室温で1時間攪拌した。反応の完了をLC-MSで検出した。反応溶液を濃縮して粗生成物:(13aS)-11-クロロ-8-シクロプロピル-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(203mg)を得た。これを直接次の工程で使用した。ES-API:[M+H]+=463.2
工程9:(13aS)-11-クロロ-8-シクロプロピル-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(203mg、0.44mmol)、5mLのジクロロメタン、及びトリエチルアミン(222mg、2.2mmol)を丸底フラスコに添加した。反応物を0℃まで冷却し、無水アクリル酸のジクロロメタン溶液(39mg、0.3mmol、0.5mL)を反応溶液に滴下した。反応物を0℃で10分攪拌した。10mLの飽和NaHCO3水溶液を反応溶液に添加し、反応溶液を10mLのジクロロメタンで3回抽出した。有機相を乾燥及び濃縮し、粗生成物を分取HPLCで精製して目的生成物:Z17(55.94mg、24%)を白色固体として得た。1HNMR(400MHz,CDCl3)7.62(s,1H),7.53-7.35(m,3H),6.60-6.56(m,1H),6.42-6.38(m,1H),5.83-5.80(m,1H),4.90-4.87(m,1H),4.60-4.55(m,3H),4.10-3.90(m,2H),3.56-3.26(m,3H),2.82-2.81(m,1H),2.26-2.25(m,3H),1.22-1.15(m,2H),0.88-0.80(m,2H);ES-API:[M+H]+=517.0
工程10:化合物Z17(0.3g)をキラル分割(カラムタイプ:Chiralpak IH 250mm×4.6mm×5μm;移動相:アセトニトリル:イソプロパノール:アンモニアメタノール=90:10:0.2;流量:1mL/分;カラム温度=30℃)して以下の化合物を得た。
化合物Z17-1(80mg、保持時間5.666分;ピーク1):白色固体;1HNMR(400MHz,CDCl3)7.68(s,1H),7.58(d,J=4Hz,1H),7.43-7.41(m,2H),6.62-6.56(m,1H),6.42-6.39(m,1H),5.82-5.80(m,1H),4.90-4.87(m,1H),4.60-4.51(m,3H),4.10-3.91(m,2H),3.60-3.29(m,3H),2.83-2.82(m,1H),2.26(s,3H),1.22-1.20(m,2H),0.90-0.82(m,2H);ES-API:[M+H]+=517.1、及び
化合物Z17-2(85mg、保持時間6.661分;ピーク2):白色固体;1HNMR(400MHz,CDCl3)7.74-7.41(m,4H),6.60-6.58(m,1H),6.42-6.39(m,1H),5.82-5.80(m,1H),4.89-4.88(m,1H),4.60-4.57(m,3H),4.06-3.96(m,2H),3.60-3.30(m,3H),2.83-2.82(m,1H),2.26(s,3H),1.20-1.16(m,2H),0.92-0.82(m,2H);ES-API:[M+H]+=517.1
実施例18:化合物Z18の調製
工程1:(S)-10-ブロモ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(500mg、0.9mmol)、(5-メチル-1H-インダゾール-4-イル)ボロン酸(238mg、1.35mmol)、SPhos(37mg、0.09mmol)、SPhos-Pd-G2(65mg、0.09mmol)、リン酸カリウム(600mg、2.25mmol)、60mLのジオキサン、及び12mLの水を100mL反応フラスコに添加した。反応物を窒素保護下で115℃で2時間攪拌し、反応を停止させた。50mLの水を反応溶液に添加した。反応溶液を50mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-100%)で精製して生成物:(R)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(346mg、62%)を黄色固体として得た。ES-API:[M+H]+=622.1
工程2:(R)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(346mg、0.56mmol)、3mLのトリフルオロ酢酸、及び6mLのジクロロメタンを丸底フラスコに添加した。反応物を室温で1時間攪拌した。反応の完了をLC-MSで検出した。反応溶液を濃縮して(R)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(361mg)を黄色固体として得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=522.1
工程3:(R)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(361mg、0.69mmol)、10mLのジクロロメタン、及びトリエチルアミン(700mg、6.9mmol)を丸底フラスコに添加した。反応物を0℃まで冷却し、無水アクリル酸のジクロロメタン溶液(69mg、0.55mmol、1mL)を反応溶液に滴下した。反応物を0℃で10分攪拌した。40mLの飽和炭酸水素ナトリウム水溶液を反応溶液に添加し、反応溶液を20mLのジクロロメタンで3回抽出した。有機相を乾燥及び濃縮し、粗生成物を分取HPLCで精製して目的生成物:(R)-2-アクリロイル-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オンZ18(134mg、35%)を得た。ES-API:[M+H]+=576.1;1H NMR(400MHz,DMSO-d6)δ13.12(s,1H),8.44(d,J=4.8Hz,1H),7.55-7.39(m,2H),7.25(dd,J=19.8,6.0Hz,2H),6.87(s,2H),6.22(d,J=16.6Hz,1H),5.85(s,1H),5.78(d,J=10.4Hz,1H),4.70(d,J=12.0Hz,3H),4.53-4.28(m,2H),4.13(s,2H),3.54(s,2H),2.93-2.72(m,1H),2.13(s,3H),2.01(d,J=5.6Hz,3H),1.08(d,J=6.1Hz,3H),0.97(dd,J=12.3,6.7Hz,4H)
実施例19:化合物Z19、Z19-1、及びZ19-2の調製
工程1:(S)-10-ブロモ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(500mg、0.9mmol)、(5-メチル-1H-インダゾール-4-イル)ボロン酸(238mg、1.35mmol)、SPhos(37mg、0.09mmol)、SPhos-Pd-G2(65mg、0.09mmol)、リン酸カリウム(600mg、2.25mmol)、60mLのジオキサン、及び12mLの水を100mL反応フラスコに添加した。反応物を窒素保護下で115℃で2時間攪拌し、反応を停止させた。50mLの水を反応溶液に添加した。反応溶液を50mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-100%)で精製して生成物:(S)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(381mg、68%)を黄色固体として得た。ES-API:[M+H]+=622.1
工程2:(S)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(381mg、0.61mmol)、3mLのトリフルオロ酢酸、及び6mLのジクロロメタンを丸底フラスコに添加した。反応物を室温で1時間攪拌した。反応の完了をLC-MSで検出した。反応溶液を濃縮して(S)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(401mg)を黄色固体として得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=522.1
工程3:(S)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(401mg、0.96mmol)、10mLのジクロロメタン、及びトリエチルアミン(971mg、9.6mmol)を丸底フラスコに添加した。反応物を0℃まで冷却し、無水アクリル酸のジクロロメタン溶液(97mg、0.77mmol、1mL)を反応溶液に滴下した。反応物を0℃で10分攪拌した。40mLの飽和炭酸水素ナトリウム水溶液を反応溶液に添加し、反応溶液を20mLのジクロロメタンで3回抽出した。有機相を乾燥及び濃縮し、粗生成物を分取HPLCで精製して目的生成物:(S)-2-アクリロイル-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オンZ19(248mg、45%)を得た。ES-API:[M+H]+=576.1
工程4:上記で得た化合物Z19(248mg、0.43mmol)をキラル分割(移動相:n-ヘキサン(0.1%アンモニア含有メタノール):エタノール(0.1%アンモニア含有メタノール)=50:50);カラムタイプ:AY-H(250×4.6mm×5μm);流量:1.0mL/分;カラム温度:30℃)して以下の化合物を得た。
化合物Z19-1(105mg、保持時間:8.821分、純度:99%、de値:99%):ES-API:[M+H]+=576.3、及び
化合物Z19-2(115mg、保持時間:11.79分、純度:99%、de値:99%):ES-API:[M+H]+=576.2;1H NMR(400MHz,DMSO-d6)δ13.12(s,1H),8.44(d,J=4.8Hz,1H),7.45(dd,J=16.7,6.5Hz,2H),7.27(d,J=3.2Hz,1H),7.22(d,J=8.6Hz,1H),6.88(t,J=10.8Hz,2H),6.21(d,J=16.3Hz,1H),5.84(d,J=1.7Hz,1H),5.78(dd,J=10.5,2.4Hz,1H),4.85-4.60(m,3H),4.53-4.29(m,2H),4.24-3.95(m,2H),2.79(ddd,J=20.1,13.5,6.8Hz,1H),2.12(s,3H),2.00(d,J=5.8Hz,4H),1.09-1.05(m,4H),0.99-0.91(dd,J=12.0,6.8Hz,3H)
実施例20:化合物Z20、Z20-1、Z20-2、Z20-3、及びZ20-4の調製
工程1:6-アミノ-4-ブロモ-3-クロロ-フルオロ安息香酸メチル(6.3g、22.35mmol)、(5-メチル-1-(テトラヒドロ-2H-ピラン-2-イル)-1H-インダゾール-4-イル)ボロン酸(9.3g、35.77mmol)、2-ビシクロヘキシルホスフィン-2’,6’-ジメトキシビフェニル(734mg、1.78mmol)、SPhos-Pd-G2(1.27g、1.78mmol)、リン酸カリウム(14.2g、67.05mmol)、100mLのジオキサン、及び20mLの水を反応フラスコに添加した。90℃油浴で窒素保護下、2時間反応させ、反応を停止させた。100mLの水を反応溶液に添加した。反応溶液を100mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-25%)で精製して目的生成物:6-アミノ-3-クロロ-2-フルオロ-4-(5-メチル-1-(テトラヒドロ-2H-ピラン-2-イル)-1H-インダゾール-4-イル)安息香酸メチル(6.7g)を黄色固体として純度58%で得た。ES-API:[M+H]+=418.0
工程2:6-アミノ-3-クロロ-2-フルオロ-4-(5-メチル-1-(テトラヒドロ-2H-ピラン-2-イル)-1H-インダゾール-4-イル)安息香酸メチル(6.2g、14.8mmol)、1-ヨード-2-イソプロピルベンゼン(5.4g、22.2mmol)、キサントホス-Pd-G2(0.92g、1.03mmol)、4,5-ビスジフェニルホスフィノ-9,9-ジメチルキサンテン(0.60g、1.03mmol)、炭酸セシウム(9.7g、29.6mmol)、及び120mLのトルエンを丸底フラスコに添加した。系内を3回窒素置換した後、窒素ボールで保護した。反応物を90℃で21時間攪拌した。反応の完了をLC-MSで検出した。水を反応溶液に添加した。反応溶液を酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-10%)で精製して目的生成物:3-クロロ-2-フルオロ-6-(((2-イソプロピルフェニル)アミノ)-4-(5-メチル-1-(テトラヒドロ-2H-ピラン-2-イル)-1H-インダゾール-4-イル)安息香酸メチル(5.55g)を収率70%で得た。ES-API:[M+H]+=536.1
工程3:3-クロロ-2-フルオロ-6-(((2-イソプロピルフェニル)アミノ)-4-(5-メチル-1-(テトラヒドロ-2H-ピラン-2-イル)-1H-インダゾール-4-イル)安息香酸メチル(6.5g、12.1mmol)、水酸化ナトリウム(1.5g、36.4mmol)、メタノール(50mL)、テトラヒドロフラン(50mL)、及び水(20mL)を丸底フラスコに添加した。反応物を45℃で1時間攪拌した。反応の完了をLC-MSで検出した。反応物のpHを6M塩酸で8に調整した後、有機相を濃縮して除去した。水を添加し、反応溶液を酢酸エチルで3回抽出した。有機相を乾燥及び濃縮して3-クロロ-2-フルオロ-6-((2-イソプロピルフェニル)アミノ)-4-(5-メチル-1-(テトラヒドロ-2H-ピラン-2-イル)-1H-インダゾール-4-イル)安息香酸(5.9g、94%)を得た。ES-API:[M+H]+=522.1
工程4:3-クロロ-2-フルオロ-6-((2-イソプロピルフェニル)アミノ)-4-(5-メチル-1-(テトラヒドロ-2H-ピラン-2-イル)-1H-インダゾール-4-イル)安息香酸(6.3g、12.1mmol)、塩化アンモニウム(1.9g、36.2mmol)、2-(7-アゾベンゾトリアゾール)-N,N,N’,N’-テトラメチルウレアヘキサフルオロホスフェート(6.9g、18.2mmol)、ジクロロメタン(40mL)、N,N-ジメチルホルムアミド(20mL)、及びトリエチルアミン(6.1g、60.5mmol)を順に0℃で丸底フラスコに添加した。反応物を室温で4時間攪拌した。水を反応溶液に添加した。反応溶液を酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を逆相カラム(アセトニトリル/水:20%-100%)で精製して目的生成物:3-クロロ-2-フルオロ-6-(((2-イソプロピルフェニル)アミノ)-4-(5-メチル-1-(テトラヒドロ-2H-ピラン-2-イル)-1H-インダゾール-4-イル)ベンズアミド(6.1g、95%)を黄色固体として得た。ES-API:[M+H]+=521.2
工程5:60%NaH(2.3g、58.5mmol)及びテトラヒドロフラン(60mL)を丸底フラスコに添加した。反応物を0℃まで冷却し、そこに3-クロロ-2-フルオロ-6-(((2-イソプロピルフェニル)アミノ)-4-(5-メチル-1-(テトラヒドロ-2H-ピラン-2-イル)-1H-インダゾール-4-イル)ベンズアミド(6.1g、11.7mmol)のテトラヒドロフラン(20mL)溶液を滴下した。反応物を0℃で5分攪拌した後、N,N’-カルボニルジイミダゾール(2.8g、17.5mmol)のテトラヒドロフラン(40mL)溶液を反応溶液に滴下した。滴下終了後、反応物を0℃で30分攪拌した。反応の完了をLC-MSで検出した。反応溶液を冷飽和炭酸水素ナトリウム水溶液に注ぎ入れた。反応溶液を酢酸エチルで3回抽出した。有機相を乾燥及び濃縮して目的生成物:6-クロロ-5-フルオロ-4-ヒドロキシ-1-(2-イソプロピルフェニル)-7-(5-メチル-1-(テトラヒドロ-2H-ピラン-2-イル)-1H-インダゾール-4-イル)キナゾリン-2(1H)-オン(6.2g、98%)を黄色固体として得た。ES-API:[M+H]+=547.2
工程6:60%NaH(2.3g、57.5mmol)、(S)-3-(ヒドロキシメチル)ピペラジン-1-カルボン酸tert-ブチル(4g、18.4mmol)、テトラヒドロフラン(100mL)を丸底フラスコに添加した。反応物を0℃まで冷却し、そこに6-クロロ-5-フルオロ-4-ヒドロキシ-1-(2-イソプロピルフェニル)-7-(5-メチル-1-(テトラヒドロ-2H-ピラン-2-イル)-1H-インダゾール-4-イル)キナゾリン-2(1H)-オン(6.3g、11.5mmol)のテトラヒドロフラン(20mL)溶液を滴下した。反応物を0℃で5分攪拌した後、反応物を65℃油浴で0.5時間攪拌した。反応の完了をLC-MSで検出した。反応溶液を冷飽和炭酸水素ナトリウム水溶液に注ぎ入れた。反応溶液を酢酸エチルで3回抽出した。有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(メタノール/ジクロロメタン:0-7%)で精製して目的生成物:(3S)-3-((((6-クロロ-4-ヒドロキシ-1-(2-イソプロピルフェニル)-7-(5-メチル-1-(テトラヒドロ-2H-ピラン-2-イル)-1H-インダゾール-4-イル)-2-オキソ-1,2-ジヒドロキナゾリン-5-イル)オキシ)メチルピペラジン-1-ギ酸tert-ブチル(6.7g、79%)を黄色固体として得た。ES-API:[M+H]+=743.2
工程7:(3S)-3-((((6-クロロ-4-ヒドロキシ-1-(2-イソプロピルフェニル)-7-(5-メチル-1-(テトラヒドロ-2H-ピラン-2-イル)-1H-インダゾール-4-イル)-2-オキソ-1,2-ジヒドロキナゾリン-5-イル)オキシ)メチルピペラジン-1-ギ酸tert-ブチル(6g、8.1mmol)、N,N-ジメチルホルムアミド(40mL)、及び1H-ベンゾトリアゾール-1-イルオキシトリピロリジニルヘキサフルオロホスフェート(10.5g、20.2mmol)を丸底フラスコに添加した。DBU(6.1g、40.4mmol)を攪拌しながら一度に添加した。反応物を室温で1時間攪拌した。反応の完了をLC-MSで検出した。反応物をC18逆相カラム(アセトニトリル/水(0.5%トリフルオロ酢酸):0-80%)で直接精製して目的生成物:(13aS)-11-クロロ-8-(2-イソプロピルフェニル)-10-(5-メチル-1-(テトラヒドロ-2H-ピラン-2-イル)-1H-インダゾール-4-イル)-7オキソ3,4,7,8,13,13aヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(4.1g、70%)を黄色固体として得た。ES-API:[M+H]+=589.1;ES-API:[M+H]+=725.2
工程8:(13aS)-11-クロロ-8-(2-イソプロピルフェニル)-10-(5-メチル-1-(テトラヒドロ-2H-ピラン-2-イル)-1H-インダゾール-4-イル)-7オキソ3,4,7,8,13,13aヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(4.1g、5.6mmol)、5mLのジクロロメタン、及び20mLのトリフルオロ酢酸を丸底フラスコに添加した。反応物を室温で2時間攪拌した。反応の完了をLC-MSで検出した。反応溶液40℃で濃縮して粗生成物:(13aS)-11-クロロ-8-(2-イソプロピルフェニル)-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(3g)を黄色固体として得た。これを直接次の工程で使用した。ES-API:[M+H]+=541.2
工程9:(13aS)-11-クロロ-8-(2-イソプロピルフェニル)-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(3g、5.6mmol)、20mLのジクロロメタン、及びトリエチルアミン(2.8g、28mmol)を丸底フラスコに添加した。反応物を0℃まで冷却し、無水アクリル酸(635mg、5.04mmol)を反応溶液に添加した。反応物を0℃で20分攪拌した。100mLの飽和NaHCO3水溶液を反応溶液に添加し、反応溶液をジクロロメタンで3回抽出した。有機相を乾燥及び濃縮し、粗生成物を分取HPLCで精製して目的生成物:Z20(1.1g、33%)を白色固体として得た。1HNMR(400MHz,CDCl3):7.50-7.30(m,4H),7.28-7.26(m,2H),7.11-7.09(m,1H),6.68-6.61(m,1H),6.44-6.40(m,1H),6.21-6.20(m,1H),5.84-5.81(m,1H),5.05-5.01(m,1H),4.72-4.65(m,3H),4.08-3.98(m,2H),3.62-3.58(m,1H),3.21-3.12(m,2H),2.76-2.70(m,1H),2.12-2.10(m,3H),1.22-1.20(m,3H),0.88-0.86(m,3H);ES-API:[M+H]+=595.2
工程10:化合物Z20(1.1g)をキラル分割(カラムタイプ:Chiralpak IA 250mm×4.6mm×5μm;移動相:n-ヘキサン:エタノール:アンモニアメタノール=50:50:0.2;流量:1mL/分;カラム温度=30℃)して以下の化合物を得た。
化合物Z20-1(151.17mg、保持時間6.439分;ピーク1):白色固体;1HNMR(400MHz,CDCl3)7.42-7.30(m,4H),7.22-7.16(m,2H),7.10-7.00(m,1H),6.56-6.53(m,1H),6.33-6.32(m,1H),6.06(s,1H),5.74-5.71(m,1H),4.94-4.91(m,1H),4.67-4.57(m,3H),4.00-3.92(m,2H),3.54-3.22(m,3H),2.66-2.63(m,1H),2.03(s,3H),0.94(d,J=4Hz,3H),0.88(d,J=4Hz,3H);ES-API:[M+H]+=595.2、
化合物Z20-2(110.33mg;ピーク4、保持時間:10.952分):白色固体;1HNMR(400MHz,CDCl3)7.38-7.21(m,4H),7.20-7.19(m,2H),7.10-7.00(m,1H),6.56-6.53(m,1H),6.33-6.32(m,1H),6.13(s,1H),5.74-5.71(m,1H),4.95-4.92(m,1H),4.67-4.57(m,3H),4.00-3.92(m,2H),3.54-3.22(m,3H),2.66-2.63(m,1H),2.03(s,3H),1.13(d,J=4Hz,3H),0.95(d,J=4Hz,3H);ES-API:[M+H]+=595.2、
化合物Z20-3(232.96mg;ピーク2、保持時間:7.026分):白色固体;1HNMR(400MHz,CDCl3)7.47-7.32(m,4H),7.20-7.19(m,2H),7.10-7.05(m,1H),6.66-6.60(m,1H),6.40-6.38(m,1H),6.20(s,1H),5.84-5.81(m,1H),5.00-4.90(m,1H),4.69-4.57(m,3H),4.00-3.92(m,2H),3.73-3.32(m,3H),2.71-2.68(m,1H),2.10(s,3H),1.22(d,J=4Hz,3H),1.01(d,J=4Hz,3H);ES-API:[M+H]+=595.2、及び
化合物Z20-4(196.33mg;ピーク3、保持時間:8.800分):白色固体;1HNMR(400MHz,CDCl3)7.64-7.24(m,6H),7.14-7.05(m,1H),6.66-6.62(m,1H),6.40-6.38(m,1H),6.21(s,1H),5.86-5.81(m,1H),5.03-4.92(m,1H),4.75-4.57(m,3H),4.10-4.00(m,2H),3.70-3.25(m,3H),2.71-2.68(m,1H),2.10(s,3H),1.22(d,J=4Hz,3H),1.05(d,J=4Hz,3H);ES-API:[M+H]+=595.2
実施例21:化合物Z21の調製
工程1:4-ブロモ-2,6-ジフルオロベンゾニトリル(50.0g、0.229mol)、シクロプロピルアミン(17.1g、1.146mol)、及び500mLのイソプロパノールを1000mL三口丸底フラスコに添加し、反応物を70℃で2時間攪拌した。反応終了後、反応溶液を室温まで冷却して固体を沈殿させ、ろ過して目的生成物:4-ブロモ-2-(シクロプロピルアミノ)-6-フルオロベンゾニトリル(53g、収率91%)を得た。ES-API:[M+H]+=255.0
工程2:4-ブロモ-2-(シクロプロピルアミノ)-6-フルオロベンゾニトリル(52.0g、0.204mol)、炭酸カリウム(55.5g、0.408mol)、及び500mLのジメチルスルホキシドを1000mL三口丸底フラスコに添加した。30%過酸化水素(93.0g、0.734mol)を室温でゆっくりと滴下した。反応溶液を室温で3時間攪拌した。500mLの水を反応溶液に添加して多量の固体を沈殿させ、ろ過して目的生成物:4-ブロモ-2-(シクロプロピルアミノ)-6-フルオロベンズアミド(55g、収率97%)を得た。ES-API:[M+H]+=273.0
工程3:4-ブロモ-2-(シクロプロピルアミノ)-6-フルオロベンゾニトリル(13.2g、0.048mol)及び150mLの無水テトラヒドロフランを500mL三口丸底フラスコに添加した。系内を3回窒素置換し後、窒素ボールで保護した。水素化ナトリウム(9.62g、0.240mol)を0℃で添加し、この温度を保ちながら0.5時間反応させ、N,N’-カルボニルジイミダゾールの無水テトラヒドロフラン溶液(1.44mol/L、50mL)を速やかに添加した。5分おいて反応を完了させた後、反応溶液を氷水に添加し、酢酸エチルで3回抽出し、有機相を無水硫酸ナトリウムで乾燥し、ろ過し、ろ液を濃縮して粗生成物を得た。この粗生成物を100mLのメチルtert-ブチルエーテルで一晩スラリー化してからろ過して目的生成物:7-ブロモ-1-シクロプロピル-5-フルオロ-4-ヒドロキシキノリン-2(1H)-オン(9g、収率63%)を得た。ES-API:[M+H]+=299.0s
工程4:3-(2-ヒドロキシエチル)ピペラジン-1-ギ酸tert-ブチル(6.1g、0.026mol)及び80mLの無水テトラヒドロフランを250mL三口丸底フラスコに添加し、系内を3回窒素置換した後、窒素ボールで保護した。水素化ナトリウム(4.5g、0.115mol)を0℃で添加し、この温度を保ちながら0.5時間反応させた。7-ブロモ-1-シクロプロピル-5-フルオロ-4-ヒドロキシキノリン-2(1H)-オンの無水テトラヒドロフラン溶液(1.12mol/L、20mL)を添加し、室温で1.5時間反応させた。反応の完了を質量分析で検出した。反応溶液を氷水に添加し、酢酸エチルで3回抽出し、有機相を無水硫酸ナトリウムで乾燥し、ろ過し、ろ液を濃縮して目的生成物:3-(2-(((7-ブロモ-1-シクロプロピル-4-ヒドロキシ-2-オキソ-1,2-ジヒドロキナゾリン-5-イル)オキシ)エチル)ピペラジン-1-ギ酸tert-ブチル(9g、収率78%)を得た。ES-API:[M+H]+=509.1
工程5:3-(2-(((7-ブロモ-1-シクロプロピル-4-ヒドロキシ-2-オキソ-1,2-ジヒドロキナゾリン-5-イル)オキシ)エチル)ピペラジン-1-ギ酸tert-ブチル(3.0g、0.006mol)、1H-ベンゾトリアゾール-1-イルオキシトリピロリジニルヘキサフルオロホスフェート(9.3g、0.018mol)、1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン(4.56g、0.03mol)、及び50mLのN,N-ジメチルホルムアミドを100mL三口丸底フラスコに添加し、室温で2時間攪拌した。80mLの酢酸エチルを反応溶液に添加し、反応溶液を80mLの飽和食塩水で3回洗浄した。酢酸エチル相を乾燥及び濃縮し、粗生成物を高速シリカゲルカラムで精製して目的生成物:10-ブロモ-8-シクロプロピル-7-オキソ-1,3,4,7,8,13,14,14a-オクタヒドロ-2H-ピラジノ[1’,2’:5,6][1,5]オキサゾリン[4,3,2-de]キナゾリン-2-カルボン酸tert-ブチル(0.65g、収率23%)を得た。ES-API:[M+H]+=490.3
工程6:10-ブロモ-8-シクロプロピル-7-オキソ-1,3,4,7,8,13,14,14a-オクタヒドロ-2H-ピラジノ[1’,2’:5,6][1,5]オキサゾリン[4,3,2-de]キナゾリン-2-カルボン酸tert-ブチル(0.49g、0.001mol)、(5-メチル-1H-インダゾール-4-イル)ボロン酸(0.260g、0.0015mol)、クロロ(2-ジシクロヘキシルホスフィノ-2’,6’-ジメトキシ-1,1’-ビフェニル)(2’-アミノ-1,1’-ビフェニル-2-イル)パラジウム(II)(0.072g、0.0001mol)、SPhos(0.041g、0.0001mol)、リン酸カリウム(0.64g、0.003mol)、10mLのジオキサン、及び2mLの水を100mL三口丸底フラスコに添加した。系内を3回窒素置換した後、窒素ボールで保護した。110℃で2時間反応させた。30mLの酢酸エチルを反応溶液に添加し、反応溶液を30mLの飽和食塩水で3回洗浄し、乾燥及び濃縮した。この粗生成物を高速シリカゲルカラムで精製して目的生成物:8-シクロプロピル-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-1,3,4,7,8,13,14,14a-オクタヒドロ-2H-ピラジノ[1’,2’:5,6][1,5]オキサゾリジン[4,3,2-de]キナゾリン-2-カルボン酸tert-ブチル(550mg、収率83%)を得た。ES-API:[M+H]+=543.3
工程7:8-シクロプロピル-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-1,3,4,7,8,13,14,14a-オクタヒドロ-2H-ピラジノ[1’,2’:5,6][1,5]オキサゾリジン[4,3,2-de]キナゾリン-2-カルボン酸tert-ブチル(550mg、0.001mol)をジクロロメタン(8mL)に溶解し、トリフルオロ酢酸(2mL)を添加した。反応物を室温で2時間攪拌し、反応溶液を濃縮して目的生成物:8-シクロプロピル-10-(5-メチル-1H-インダゾール-4-イル)-1,3,4,13,14,14a-ヘキサヒドロ-2H-ピラジノ[1’,2’:5,6][1,5]オキサゾリジン[4,3,2-de]キナゾリン-7(8H)-オン(500mg)を得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=443.3
工程8:8-シクロプロピル-10-(5-メチル-1H-インダゾール-4-イル)-1,3,4,13,14,14a-ヘキサヒドロ-2H-ピラジノ[1’,2’:5,6][1,5]オキサゾリジン[4,3,2-de]キナゾリン-7(8H)-オン(500mg、0.0011mol)をジクロロメタン(15mL)に溶解し、トリエチルアミン(0.034g、0.0003mol)を添加した。反応物を0℃まで冷却し、アクリル酸クロライド(138mg、0.0011mol)を反応溶液に滴下した。反応物を0℃で15分攪拌した。80mLのジクロロメタンを反応溶液に添加し、反応溶液を100mLの飽和NaHCO3水溶液、80mLの飽和食塩水で洗浄し、乾燥及び濃縮した。この粗生成物を高速シリカゲルカラムで精製して目的生成物:2-アクリロイル-8-シクロプロピル-10-(5-メチル-1H-インダゾール-4-イル)-1,3,4,13,14,14a-ヘキサヒドロ-2H-ピラジノ[1’,2’:5,6][1,5]オキサゾリジン[4,3,2-de]キナゾリン-7(8H)-オンZ21(80mg、収率14%)を得た。ES-API:[M+H]+=497.2;1H NMR(500MHz,DMSO-d6)δ13.13(s,1H),7.81(s,1H),7.50(d,J=8.3Hz,1H),7.28(s,2H),6.78(s,2H),6.19(t,J=14.8Hz,1H),5.75(d,J=8.9Hz,1H),4.85-4.58(m,1H),4.48-3.97(m,5H),3.60(d,J=13.2Hz,1H),3.05(s,2H),2.70(s,1H),2.37(s,3H),2.01(dd,J=81.0,33.5Hz,2H),1.06(d,J=56.8Hz,2H),0.67(d,J=72.2Hz,2H);ES-API:[M+H]+=497.2
実施例22:化合物Z22の調製
工程1:3-(2-ヒドロキシエチル)ピペラジン-1-ギ酸tert-ブチル(1.76g、7.65mmol)を水素化ナトリウム(404mg、10.20mmol)のテトラヒドロフラン(40mL)懸濁液に氷浴下で添加し、5分攪拌した。次に7-ブロモ-5-フルオロ-1-(2-イソプロピル-4-メチルピリジン-3-イル)キナゾリン-2,4(1H,3H)-ジオン(2g、5.10mmol)を反応溶液に添加し、60℃まで加熱し、2分攪拌した。室温まで冷却した後、反応溶液を飽和塩化アンモニウム溶液(40mL)で急冷し、酢酸エチル(50mL×3)で抽出し、有機相を合わせて乾燥及び濃縮し、高速シリカゲルカラム(0-10%メタノール/ジクロロメタン)で精製して3-(2-((7-ブロモ-1-(2-イソプロピル-4-メチルピリジン-3-イル)-2,4-ジオキソ-1,2,3,4-テトラヒドロキナゾリン-5-イル)オキシ)エチル)ピペラジン-1-カルボン酸tert-ブチルの白色固体を得た(1.5g、収率44%)。ES-API:[M+H]+=602.0
工程2:3-(2-((7-ブロモ-1-(2-イソプロピル-4-メチルピリジン-3-イル)-2,4-ジオキソ-1,2,3,4-テトラヒドロキナゾリン-5-イル)オキシ)エチル)ピペラジン-1-カルボン酸tert-ブチル(1.5g、2.49mmol)をN,N-ジメチルホルムアミド(50mL)に溶解し、1,8-ジアザビシクロウンデカ-7-エン(1.89g、12.45mmol)及び1H-ベンゾトリアゾール-1-イルオキシトリピロリジニルヘキサフルオロホスフェート(3.89g、7.47mmol)を順に添加し、室温で2時間攪拌した。反応溶液を飽和食塩水(50mL)に注ぎ入れ、酢酸エチル(50mL×3)で抽出し、有機相を合わせて乾燥及び濃縮し、順相カラム(0-100%アセトニトリル/水(1%トリフルオロ酢酸))で精製して10-ブロモ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-1,3,4,7,8,13,14,14a-オクタヒドロ-2H-ピラジノ[1’,2’:5,6][1,5]オキサゾリジン[4,3,2-de]キナゾリン-2-カルボン酸tert-ブチルの黄色油状化合物を得た(800mg、収率55%)。ES-API:[M+H]+=584.0
工程3:10-ブロモ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-1,3,4,7,8,13,14,14a-オクタヒドロ-2H-ピラジノ[1’,2’:5,6][1,5]オキサゾリジン[4,3,2-de]キナゾリン-2-カルボン酸tert-ブチル(200mg、0.34mmol)、(5-メチル-1H-インダゾール-4-イル)ボロン酸(90mg、0.51mmol)、クロロ(2-ジシクロヘキシルホスフィノ-2’,6’-ジメトキシ-1,1’-ビフェニル)(2’-アミノ-1,1’-ビフェニル-2-イル)パラジウム(II)(24mg、0.03mmol)、2-ビシクロヘキシルホスフィン-2’,6’-ジメトキシビフェニル(14mg、0.03mmol)、及びリン酸カリウム(218mg、1.03mmol)を1,4-ジオキサン(4mL)及び水(1mL)の混合物に加えたものを120℃で窒素保護下、1時間攪拌した。反応溶液を酢酸エチル(20mL)に溶解し、飽和食塩水(10mL×3)で洗浄し、得られた有機相を乾燥及び濃縮し、高速シリカカラム(0-10%メタノール/ジクロロメタン)で精製して8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-1,3,4,7,8,13,14,14a-オクタヒドロ-2H-ピラジノ[1’,2’:5,6][1,5]オキサゾリジノ[4,3,2-de]キナゾリン-2-カルボン酸tert-ブチルの白色固体を得た(120mg、純度:44%)。ES-API:[M+H]+=636.3
工程4:トリフルオロ酢酸(0.5mL)を8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-1,3,4,7,8,13,14,14a-オクタヒドロ-2H-ピラジノ[1’,2’:5,6][1,5]オキサゾリジノ[4,3,2-de]キナゾリン-2-カルボン酸tert-ブチル(120mg、0.19mmol)のジクロロメタン(2mL)溶液に氷浴下で添加し、室温で2時間攪拌し、濃縮して8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-1,3,4,13,14,14a-ヘキサヒドロ-2H-ピラジノ[1’,2’:5,6][1,5]オキサゾリジン[4,3,2-de]キナゾリン-7(8H)-オンの黄色油状化合物を得た。これを直接次の工程で使用した。ES-API:[M+H]+=536.2
工程5:氷浴下、トリエチルアミン(191mg、1.89mmol)を上記化合物8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-1,3,4,13,14,14a-ヘキサヒドロ-2H-ピラジノ[1’,2’:5,6][1,5]オキサゾリジン[4,3,2-de]キナゾリン-7(8H)-オンのジクロロメタン(2mL)溶液に添加した。反応溶液を清澄化してから、無水アクリル酸(22mg、0.18mmol)を滴下し、5分攪拌した。反応溶液を飽和炭酸水素ナトリウム溶液(5mL)で洗浄し、有機相を乾燥及び濃縮した後、分取HPLC(炭酸水素アンモニウム系)で精製してZ22の白色固体(43.39mg、純度:100%、収率39%)を得た。1H NMR(500MHz,DMSO-d6)δ13.10(s,1H),8.42(dd,J=11.3,4.8Hz,1H),7.50(s,1H),7.42(d,J=8.6Hz,1H),7.26(t,J=5.5Hz,1H),7.21(d,J=8.4Hz,1H),6.91-6.76(m,2H),6.26-6.17(m,1H),5.82-5.71(m,2H),4.94-4.76(m,1H),4.48(s,1H),4.42-4.29(m,1H),4.27-4.05(m,3H),3.84-3.67(m,1H),3.67-3.42(m,3H),2.96-2.82(m,1H),2.67-2.52(m,1H),2.14(d,J=2.5Hz,3H),2.08(s,1H),1.90(s,2H),1.07(d,J=6.6Hz,3H),1.02(d,J=6.6Hz,2H),0.85(d,J=6.7Hz,1H);ES-API:[M+H]+=590.3
実施例23:化合物Z23、Z23-1、及びZ23-2の調製
工程1:(R)-2,3-ジクロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(0.900mg、1.607mmol)、(2-フルオロ-6-ヒドロキシフェニル)ボロン酸(752mg、4.821mmol)、SPhos-Pd-G2(115.7mg、0.1607mmol)、SPhos(66.0mg、0.1607mmol)、リン酸カリウム(1.02g、4.821mmol)、ジオキサン(30mL)、及び水(5.0mL)を一口フラスコに添加し、3回窒素置換し、75℃で0.5~1時間反応させた。反応終了後、100mLの飽和食塩水を反応溶液に添加し、酢酸エチルで2回(100mL×2)抽出した。酢酸エチル相を無水硫酸ナトリウム乾燥し、ろ過及びスピン乾燥し、カラム[ジクロロメタン:メタノール=100:0-80:20(V/V)]精製して(5aR)-3-クロロ-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(0.660g、収率58.1%)を得た。API:[M+H]+=637.2
工程2:(5aR)-3-クロロ-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(0.660g、1.037mmol)及びメタノール(5mL)を100mL一口丸底フラスコに添加した後、ジオキサン塩酸溶液(3.0mL、4M、12.0mmol)を添加し、室温で2時間反応させた。反応終了後、溶媒を減圧下でスピン乾燥して粗生成物:(5aR)-3-クロロ-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(0.720g、粗生成物)を得た(API:[M+H]+=537.2)。この粗生成物を直接次の工程で使用した。
工程3:(5aR)-3-クロロ-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(0.720g、1.037mmol)をジクロロメタン(20mL)に溶解し、トリエチルアミン(1.04g、10.37mmol)を添加した。反応物を0℃まで冷却し、無水アクリル酸(117mg、0.933mmol)を反応溶液に滴下した。反応物を0℃で15分攪拌した。80mLのジクロロメタンを反応溶液に添加し、反応溶液を100mLの飽和NaHCO3水溶液、80mLの飽和食塩水で洗浄し、乾燥及び濃縮して調製して(5aR)-7-アクリロイル-3-クロロ-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オンZ23(395mg、収率65%)を得た。ES-API:[M+H]+=591.1;1H NMR(500MHz,DMSO-d6)δ10.05(t,J=13.1Hz,1H),9.60(s,1H),8.35(d,J=4.8Hz,1H),7.28-7.14(m,2H),6.94-6.75(m,1H),6.72-6.58(m,2H),6.21(dd,J=16.7,2.3Hz,1H),5.84-5.74(m,1H),4.87(dt,J=11.8,10.7Hz,2H),4.56(s,1H),4.42(d,J=51.3Hz,1H),4.28(s,1H),3.65(d,J=13.9Hz,2H),2.75(dd,J=25.2,18.5Hz,1H),1.92(dd,J=12.4,7.7Hz,3H),1.19(dd,J=13.7,7.1Hz,8H)
工程4:化合物Z23(395mg、0.6695mmol)を分割(カラムタイプ:IF,250mm×4.6mm×5μm、移動相:n-ヘキサン:エタノール=50:50、流量:1mL/分、カラム温度=30℃)して以下の化合物を得た。
化合物Z23-1(106mg、ピーク1、保持時間:6.792分、収率:27%):淡黄色固体;ES-API:[M+H]+=591.1;1H NMR(500MHz,DMSO-d6)δ10.03(s,1H),8.35(d,J=4.8Hz,1H),7.27-7.12(m,2H),6.95-6.77(m,1H),6.72-6.59(m,2H),6.21(dd,J=16.7,2.3Hz,1H),5.78(dd,J=10.4,2.2Hz,1H),4.87(t,J=20.3Hz,2H),4.42(dd,J=99.0,41.8Hz,3H),4.08(d,J=41.4Hz,1H),3.70(d,J=52.0Hz,2H),3.36(d,J=14.7Hz,1H),2.77(dt,J=13.3,6.7Hz,1H),1.91(d,J=9.3Hz,3H),1.07(d,J=6.9Hz,3H),0.93(dd,J=6.5,3.5Hz,3H)、及び
Z23-2(102.7mg、ピーク2、保持時間:11.512分、収率:26%):淡黄色固体;ES-API:[M+H]+=591.1;1H NMR(500MHz,DMSO-d6)δ10.02(d,J=30.9Hz,1H),8.35(d,J=4.7Hz,1H),7.28-7.11(m,2H),6.95-6.79(m,1H),6.66(ddd,J=24.8,12.3,5.9Hz,2H),6.21(dd,J=16.7,2.2Hz,1H),5.78(dd,J=10.4,2.2Hz,1H),4.94-4.83(m,2H),4.42(dd,J=102.4,44.1Hz,3H),4.04(s,1H),3.70(d,J=35.8Hz,2H),3.36(d,J=9.8Hz,1H),2.70(dt,J=13.6,6.8Hz,1H),1.93(d,J=5.8Hz,3H),1.07(d,J=6.9Hz,3H),0.93(dd,J=6.5,3.8Hz,3H)
実施例24:化合物Z24、Z24-1、及びZ24-2の調製
工程1:(S)-2-クロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(500mg、0.95mmol)、N-クロロスクシンイミド(255mg、1.9mmol)、及びアセトニトリル(50mL)を丸底フラスコに添加した。反応物を80℃で2時間攪拌した。チオ硫酸ナトリウム水溶液を反応溶液に添加した。反応溶液を酢酸エチルで抽出した。有機相を乾燥及び濃縮し、粗生成物を高速シリカゲルカラム(メタノール/ジクロロメタン:0-3%)で精製して生成物:(S)-2,3-ジクロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキサ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(533mg、粗生成物)を黄色固体として得た。ES-API:[M+H]+=562.2
工程2:(S)-2,3-ジクロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキサ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(533mg、0.95mmol)、(2-フルオロ-6-ヒドロキシフェニル)ボロン酸(222mg、1.43mmol)、テトラトリフェニルホスフィンパラジウム(109mg、0.095mmol)、炭酸ナトリウム(302mg、2.85mmol)、30mLのジオキサン、及び6mLの水を100mL反応フラスコに添加した。反応物を窒素保護下、90℃で2時間攪拌し、反応を停止させた。30mLの水を反応溶液に添加した。反応溶液を30mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-100%)で精製して生成物:(5aS)-3-クロロ-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキサ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(309mg、51%)を黄色固体として得た。ES-API:[M+H]+=638.2
工程3:(5aS)-3-クロロ-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキサ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(309mg、0.48mmol)、1mLのメタノール、及び3mLの塩酸/ジオキサン溶液(4M)を丸底フラスコに添加した。反応物を室温で1時間攪拌した。反応の完了をLC-MSで検出した。反応溶液を濃縮して(5aS)-3-クロロ-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(317mg)を黄色固体として得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=538.2
工程4:(5aS)-3-クロロ-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(317mg、0.59mmol)、10mLのジクロロメタン、及びトリエチルアミン(597mg、5.9mmol)を丸底フラスコに添加した。反応物を0℃まで冷却し、無水アクリル酸のジクロロメタン溶液(59mg、0.47mmol、0.5mL)を反応溶液に滴下した。反応物を0℃で10分攪拌した。40mLの飽和炭酸水素ナトリウム水溶液を反応溶液に添加し、反応溶液を20mLのジクロロメタンで3回抽出した。有機相を乾燥及び濃縮し、粗生成物を分取HPLCで精製して目的生成物:(5aS)-7-アクリロイル-3-クロロ-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オンZ24(108mg、40%)を得た。ES-API:[M+H]+=592.2
工程5:上記で得た化合物Z24(108mg、0.18mmol)をキラル分割(移動相:n-ヘキサン-エタノール=40-60);カラムタイプ:IC(250×4.6mm×5μm);流量:1.0mL/分;カラム温度:30℃)して以下の化合物を得た。
化合物Z24-1(45mg、保持時間:6.91分、純度:99%、de値:99%):ES-API:[M+H]+=592.3、及び
化合物Z24-2(55mg、保持時間:11.77分、純度:99%、de値:99%):ES-API:[M+H]+=592.2
実施例25:化合物Z25、Z25-1、及びZ25-2の調製
工程1:(R)-2-クロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(200mg、0.3800mmol)、(2-フルオロ-6-ヒドロキシフェニル)ボロン酸(90.0mg、0.5769mmol)、SPhos-Pd-G2(30mg、0.04167mmol)、SPhos(20mg、0.0487mmol)、リン酸カリウム(0.240g、01.132mmol)、ジオキサン(10mL)、及び水(2.0mL)を一口フラスコに添加し、3回窒素置換し、120℃で0.5~1時間反応させた。反応終了後、100mLの飽和食塩水を反応溶液に添加した。反応溶液を酢酸エチルで2回(100mL×2)抽出した。酢酸エチル相を無水硫酸ナトリウムで乾燥し、ろ過及びスピン乾燥し、カラム[ジクロロメタン:メタノール=100:0-80:20(V/V)]精製して(R)-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(0.210g、収率92%)を得た。API:[M+H]+=603.2
工程2:(R)-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(0.210g、0.3487mmol)及びメタノール(5mL)を100mL一口丸底フラスコに添加し、次にジオキサン塩酸溶液(3.0mL、4M、12.0mmol)を添加し、室温で2時間反応させた。反応終了後、溶媒を減圧下でスピン乾燥して粗生成物:(R)-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(0.234g、粗生成物)を得た(API:[M+H]+=503.2)。この粗生成物を直接次の工程で使用した。
工程3:(R)-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(0.234g、0.3487mmol)をジクロロメタン(15mL)に溶解し、トリエチルアミン(3.0mL、21.62mmol)を添加した。反応物を0℃まで冷却し、無水アクリル酸(39.5mg、0.3138mmol)を反応溶液に滴下した。反応物を0℃で15分攪拌した。80mLのジクロロメタンを反応溶液に添加し、反応溶液を100mLの飽和NaHCO3水溶液、80mLの飽和食塩水で洗浄し、乾燥及び濃縮して調製して(R)-7-アクリロイル-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オンZ25(152mg、収率78%)を得た。ES-API:[M+H]+=557.2
工程4:化合物Z25(152mg、0.2733mmol)をキラル分割(カラムタイプ:Chiralpak IC 250mm×4.6mm×5μm、移動相:アセトニトリル:イソプロパノール:アンモニアメタノール=60:40:0.2、流量:1mL/分、カラム温度=30℃)して以下の化合物を得た。
化合物Z25-1(21mg、収率13.8%):1H NMR(500MHz,DMSO-d6)δ11.72(s,1H),8.51(d,J=4.8Hz,1H),7.37-7.20(m,3H),6.95-6.81(m,1H),6.72(dd,J=11.9,8.4Hz,1H),6.60(d,J=8.3Hz,1H),6.21(dd,J=16.7,2.2Hz,1H),5.78(dd,J=10.4,2.2Hz,1H),4.91-4.69(m,2H),4.60(s,1H),4.48-4.33(m,1H),4.27(s,1H),4.04(s,1H),3.91-3.62(m,2H),3.40(d,J=10.6Hz,1H),2.80(dt,J=13.4,6.7Hz,1H),1.95(s,3H),1.09(d,J=6.7Hz,3H),0.96(d,J=6.7Hz,3H)、及び
化合物Z25-2(19mg、12.5%):1H NMR(500MHz,DMSO-d6)δ11.76(s,1H),8.52(d,J=4.9Hz,1H),7.35-7.21(m,3H),6.85(ddd,J=27.3,16.4,10.3Hz,1H),6.72(dd,J=12.2,8.2Hz,1H),6.60(d,J=8.4Hz,1H),6.21(dd,J=16.7,2.1Hz,1H),5.81-5.73(m,1H),4.86-4.71(m,2H),4.59(s,1H),4.39(dd,J=53.3,12.2Hz,1H),4.25(s,1H),4.14-3.98(m,1H),3.91-3.58(m,2H),3.45-3.37(m,2H),2.71(dt,J=13.3,6.6Hz,1H),1.99(s,3H),1.09(d,J=6.6Hz,3H),0.93(d,J=6.7Hz,3H)
実施例26:化合物Z26、Z26-1、Z26-2、Z26-2-1、及びZ26-2-2の調製
工程1:化合物4-ブロモ-2-フルオロ-6-(((2-イソプロピル-4-メチルピリジン-3-イル)アミノ)ベンゾニトリル(2.0g、5.6mmol)をアセトニトリル(20mL)に溶解した後、NCS(1.5g、2.0eq)を添加し、80℃で4時間反応させ、完了後に室温に戻し、水で洗浄し、酢酸エチルで抽出し、カラムクロマトグラフィー(PE:EA=10:1)で分離して生成物:4-ブロモ-3-クロロ-2-フルオロ-6-((2-イソプロピル-4-メチルピリジン-3-イル)アミノ)ベンゾニトリル(880mg、収率40%)を得た。ES-API:[M+H]+=383.2
工程2:4-ブロモ-3-クロロ-2-フルオロ-6-((2-イソプロピル-4-メチルピリジン-3-イル)アミノ)ベンゾニトリル(880mg、2.3mmol)及び50mLのジメチルスルホキシドを250mL三口丸底フラスコに添加し、氷浴下で0~5℃まで冷却し、炭酸カリウム(634mg、4.6mmol)及び過酸化水素(938mg、30%水溶液、8.28mmol)を添加し、この温度で一晩反応させた。反応の完了をLCMSで検出した。反応溶液を約15mLの氷水に注ぎ入れ、固体を沈殿させた。これをろ過してろ過ケーキを得た。ろ過ケーキを乾燥して4-ブロモ-3-クロロ-2-フルオロ-6-((2-イソプロピル-4-メチルピリジン-3-イル)アミノ)ベンズアミド(1.01g、粗生成物)を白色固体として得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=401.2
工程3:4-ブロモ-3-クロロ-2-フルオロ-6-((2-イソプロピル-4-メチルピリジン-3-イル)アミノ)ベンズアミド(1.01g、2.49mmol)及び20mLの乾燥テトラヒドロフランを250mL三口丸底フラスコに添加し、氷浴下で0~5℃まで冷却し、水素化ナトリウム(500mg、12.45mmol)を数回に分けて添加し、この温度で10分間反応させた。CDI(806mg、4.98mmol)のテトラヒドロフラン(20mL)懸濁液を上記溶液に滴下した後、この温度で20分間反応させた。反応の完了をLCMSで検出した。反応溶液を約50mLの氷水に注ぎ入れ、pHを3M塩酸で約4に調整した。反応溶液を酢酸エチルで抽出した。有機相を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥し、ろ過した。ろ液を濃縮乾固して7-ブロモ-6-クロロ-5-フルオロ-1-(2-イソプロピル-4-メチルピリジン-3-イル)キナゾリン-2,4(1H,3H)-ジオン(1.1g、粗生成物)を黄色固体として得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=427.3
工程4:(S)-3-(ヒドロキシメチル)ピペラジン-1-カルボン酸tert-ブチル(557mg、2.58mmol)を0℃で60%水素化ナトリウム(412mg、10.32mmol)のテトラヒドロフラン(50mL)懸濁液に添加し、0℃で30分間反応させ、そこに7-ブロモ-6-クロロ-5-フルオロ-1-(2-イソプロピル-4-メチルピリジン-3-イル)キナゾリン-2,4(1.1g、2.58mmol)のテトラヒドロフラン(20mL)溶液を滴下した。反応物を0℃で30分攪拌した。反応の完了をLC-MSで検出した。50mLの氷水を反応溶液に添加した。反応溶液を酢酸エチルで3回抽出した。有機相を乾燥及び濃縮し、粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:20-100%)で精製して(S)-3-((((7-ブロモ-6-クロロ-4-ヒドロキシ-1-(2-イソプロピル-4-メチルピリジン-3-イル)-2-オキソ-1,2-ジヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-カルボン酸tert-ブチル(1.04g、64%)を黄色固体として得た。ES-API:[M+H]+=623.3
工程5:(S)-3-((((7-ブロモ-6-クロロ-4-ヒドロキシ-1-(2-イソプロピル-4-メチルピリジン-3-イル)-2-オキソ-1,2-ジヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-カルボン酸tert-ブチル(1.04g、1.67mmol)、DBU(1.46g、10.02mmol)、PyBop(2.59g、6.87mmol)、ジクロロメタン(50mL)を丸底フラスコに添加した。反応物を室温で30分攪拌した。反応の完了をLC-MSで検出した。100mLのジクロロメタンを反応物に添加し、有機相を30mLの塩酸(1M)及び100mLの飽和炭酸水素ナトリウム水溶液で順に洗浄した。有機相を乾燥及び濃縮し、粗生成物を高速シリカゲルカラム(メタノール/ジクロロメタン:0-3%)で精製して(S)-10-ブロモ-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(806mg、80%)を得た。ES-API:[M+H]+=605.4
工程6:(S)-10-ブロモ-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(806mg、1.34mmol)、(5-メチル-1H-インダゾール-4-イル)ボロン酸(353mg、2.01mmol)、SPhos(55mg、0.134mmol)、SPhos-Pd-G2(96mg、0.134mmol)、リン酸カリウム(852mg、4.02mmol)、60mLのジオキサン、及び12mLの水を100mL反応フラスコに添加した。反応物を窒素保護下、115℃で2時間攪拌し、反応を停止させた。50mLの水を反応溶液に添加した。反応溶液を50mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-100%)で精製して生成物:(13aS)-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(395mg、45%)を黄色固体として得た。ES-API:[M+H]+=657.1
工程7:(13aS)-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(395mg、0.6mmol)、3mLのトリフルオロ酢酸、及び6mLのジクロロメタンを丸底フラスコに添加した。反応物を室温で1時間攪拌した。反応の完了をLC-MSで検出した。反応溶液を濃縮して(13aS)-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(401mg)を黄色固体として得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=557.1
工程8:(13aS)-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(401mg、0.71mmol)、6mLのジクロロメタン、及びトリエチルアミン(718mg、7.1mmol)を丸底フラスコに添加した。反応物を0℃まで冷却し、無水アクリル酸のジクロロメタン溶液(72mg、0.57mmol、1mL)を反応溶液に滴下した。反応物を0℃で10分攪拌した。40mLの飽和炭酸水素ナトリウム水溶液を反応溶液に添加し、反応溶液を20mLのジクロロメタンで3回抽出した。有機相を乾燥及び濃縮して化合物Z26を得た。
工程9:化合物Z26の粗生成物を分取HPLCで精製して化合物Z26-1(108mg、24%)(HPLC:保持時間:6.13/6.19分、ES-API:[M+H]+=611.2)及び化合物Z26-2(104mg、24%)(HPLC:保持時間:6.26/6.31分、ES-API:[M+H]+=611.2)を得た。
工程10:化合物Z26-2(106mg、0.18mmol)をキラル分割(移動相:n-ヘキサン-エタノール-40-60);カラムタイプ:IB(250mm×4.6mm×5μm);流量:1.0mL/分;カラム温度:30℃)して化合物Z26-2-1(35mg、保持時間:6.824分、純度:100%、de値:100%)(ES-API:[M+H]+=611.2)及び化合物Z26-2-2(31mg、保持時間:9.384分、純度:100%、de値:99%)(ES-API:[M+H]+=611.2)を得た。
実施例27:化合物Z27の調製
工程1:2,4,6-トリクロロニコチン酸(8g、35.5mmol)を150mLのジクロロメタンに溶解し、0℃まで冷却し、塩化オキサリル(9.3mL、106.6mmol)を添加した。30分かけて滴下を完了した後、DMF(0.5mL)を滴下し、反応物を室温まで上げ、1時間反応させた。反応終了後、反応溶液を濃縮し、150mLのジクロロメタンで希釈し、0℃まで冷却し、8mLのアンモニア水をゆっくりと滴下した。反応物を室温で2時間攪拌した。反応終了後、反応溶液を濃縮し、酢酸エチルでスラリー化し、ろ過して粗生成物:2,4,6-トリクロロニコチンアミド6g(6.5g、収率82%)を得た。ES-API:[M+H]+=224.9
工程2:2-イソプロピル-4-メチルピリジン-3-アミン(4.4g、29.1mmol)を80mLのテトラヒドロフランに溶解し、LiHMDS(106.4mL、1M)を窒素保護下、氷水浴で滴下し、30分攪拌した。2,4,6-トリクロロニコチンアミド(6.5g、29.1mmol)を20mLのテトラヒドロフランに溶解したものを上記反応溶液に添加し、温度をゆっくりと室温まで上げ、2時間反応させ、室温まで冷却し、希塩酸を滴下してpHを7~8に調整した。反応溶液液を酢酸エチルで抽出し、濃縮して灰色固体を得た。これを酢酸エチルでスラリー化し、ろ過して粗生成物:4,6-ジクロロ-2-((2-イソプロピル-4-メチルピリジン-3-イル)アミノ)ニコチンアミド(1.77g、収率18%)を得た。ES-API:[M+H]+=339.0
工程3:4,6-ジクロロ-2-((2-イソプロピル-4-メチルピリジン-3-イル)アミノ)ニコチンアミド(1.77g、5.24mmol)を30mLのテトラヒドロフランに溶解し、60%NaH(3g、15.72momL)を氷水浴下で添加し、15分攪拌した。CDI(0.63g、7.86mmol)を添加し、氷水浴下で1時間反応させると原材料が消失した。反応溶液を氷水に注ぎ入れ、希硫酸でpHを5~6に調整した。反応溶液を酢酸エチルで抽出し、水及び飽和食塩水で順に洗浄し、減圧下で濃縮して5,7-ジクロロ-1-(2-イソプロピル-4-メチルピリジン-3-イル)ピリジン[2,3-d]ピリミジン-2,4(1H,3H)-ジオン(1.72g、収率90%)を得た。ES-API:[M+H]+=365.0
工程4:(S)-3-(ヒドロキシメチル)ピペラジン-1-カルボン酸tert-ブチル(1.02g、4.72mmol)をテトラヒドロフランに溶解し、60%NaH(0.567g、14.2mmL)を氷水浴下で添加し、10分攪拌し、5,7-ジクロロ-1-(2-イソプロピル-4-メチルピリジン-3-イル)ピリジン[2,3-d]ピリミジン-2,4(1H,3H)-ジオン(1.72g、4.72mmol)を添加し、20分攪拌した。反応終了後、反応溶液を氷水に注ぎ入れ、酢酸エチルで3回抽出し、有機相を合わせて減圧下で乾燥及び濃縮し、カラムクロマトグラフィー(メタノール/ジクロロメタン:0~10%)で精製して(S)-3-((((7-クロロ-4-ヒドロキシ-1-(2-イソプロピル-4-メチルピリジン-3-イル)-2-オキソ-1,2-ジヒドロピリド[2,3-d]ピリミジン-5-イル)オキシ)メチル)ピペラジン-1-ギ酸tert-ブチル(1.93g、収率75%)を得た。ES-API:[M+H]+=545.2
工程5:(S)-3-((((7-クロロ-4-ヒドロキシ-1-(2-イソプロピル-4-メチルピリジン-3-イル)-2-オキソ-1,2-ジヒドロピリド[2,3-d]ピリミジン-5-イル)オキシ)メチル)ピペラジン-1-ギ酸tert-ブチル(1.93g、3.54mmol)をDMFに溶解し、PyBop(9.2g、17.7mmol)及びDBU(2.69g、17.7mmol)を氷水浴下で滴下し、室温で2時間反応させた。反応の完了を検出した。反応溶液を氷水に注ぎ入れ、酢酸エチルで3回抽出し、有機相を合わせて減圧下で乾燥及び濃縮し、カラムクロマトグラフィー(メタノール/ジクロロメタン:0~10%)で精製して(S)-2-クロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキサ-3,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(0.745g、収率40%)を得た。ES-API:[M+H]+=527.2
工程6:(S)-2-クロロ-12-(2-エチル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(0.745g、1.42mmol)、(5-メチル-1H-インダゾール-4-イル)ボロン酸(500mg、2.84mmol)、Pd(PPh3)4(164mg、0.142mmol)、及び炭酸カリウム(588mg、4.26mmol)を8mLのジオキサン及び2mLの水に溶解し、窒素置換し、120℃で1.5時間反応させ、室温まで冷却し、ろ過し、水及び飽和食塩水で洗浄し、濃縮し、カラムクロマトグラフィーを行って(S)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-2-(5-メチル-1H-インダゾール-4-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(371mg、収率42%)を得た。ES-API:[M+H]+=623.3
工程7:(S)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-2-(5-メチル-1H-インダゾール-4-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(371mg、0.6mmol)を10mLのジクロロメタンに溶解し、4mLのトリフルオロ酢酸を室温でゆっくりと滴下し、5時間反応させ、10mLのジクロロメタンを添加し、減圧下で濃縮して(S)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-2-(5-メチル-1H-インダゾール-4-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(313mg、粗生成物)を得た。これを直接次の工程で使用した。ES-API:[M+H]+=523.3
工程8:(S)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-2-(5-メチル-1H-インダゾール-4-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(313mg、0.6mmol)をジクロロメタンに溶解し、トリエチルアミン(303mg、3mmol)及び無水アクリル酸(60mg、0.48mmol)を氷水浴下で滴下し、氷浴下で10分攪拌した。反応終了後、反応溶液を室温で減圧下で濃縮し、分取HPLCで精製して化合物Z27(6.05mg、収率1.3%)を得た。ES-API:[M+H]+=577.2
実施例28:化合物Z28の調製
工程1:10-ブロモ-8-シクロプロピル-7-オキソ-1,3,4,7,8,13,14,14a-オクタヒドロ-2H-ピラジノ[1’,2’:5,6][1,5]オキサゾリジン[4,3,2-de]キナゾリン-2-カルボン酸tert-ブチル(100mg、0.2mmol)、(2-フルオロ-6-ヒドロキシフェニル)ボロン酸(48mg、0.3mmol)、クロロ(2-ジシクロヘキシルホスフィノ-2’,6’-ジメトキシ-1,1’-ビフェニル)(2’-アミノ-1,1’-ビフェニル-2-イル)パラジウム(II)(15mg、0.02mmol)、SPhos(8.4mg、0.02mmol)、リン酸カリウム(130mg、0.6mol)、10mLのジオキサン、及び2mLの水を100mL三口丸底フラスコに添加した。系内を3回窒素置換した後、窒素ボールで保護した。110℃で2時間反応させた。30mLの酢酸エチルを反応溶液に添加し、反応溶液を30mLの飽和食塩水で3回洗浄し、乾燥及び濃縮した。この粗生成物を高速シリカゲルカラムで精製して目的生成物:8-シクロプロピル-10-(2-フルオロ-6-ヒドロキシフェニル)-7-オキソ-1,3,4,7,8,13,14,14a-オクタヒドロ-2H-ピラジノ[1’,2’:5,6][1,5]オキサゾリジン[4,3,2-de]キナゾリン-2-カルボン酸tert-ブチル(100mg、収率93%)を得た。ES-API:[M+H]+=523.2
工程2:8-シクロプロピル-10-(2-フルオロ-6-ヒドロキシフェニル)-7-オキソ-1,3,4,7,8,13,14,14a-オクタヒドロ-2H-ピラジノ[1’,2’:5,6][1,5]オキサゾリジン[4,3,2-de]キナゾリン-2-カルボン酸tert-ブチル(100mg、0.19mol)をジクロロメタン(8mL)に溶解し、トリフルオロ酢酸(2mL)を添加した。反応物を室温で2時間攪拌した。反応溶液を濃縮して目的生成物:8-シクロプロピル-10-(2-フルオロ-6-ヒドロキシフェニル)-1,3,4,13,14,14a-ヘキサヒドロ-2H-ピラジノ[1’,2’:5,6][1,5]オキサゾリジン[4,3,2-de]キナゾリン-7(8H)-オン(70mg、粗生成物)を得た。これを直接次の工程で使用した。ES-API:[M+H]+=443.3
工程3:8-シクロプロピル-10-(2-フルオロ-6-ヒドロキシフェニル)-1,3,4,13,14,14a-ヘキサヒドロ-2H-ピラジノ[1’,2’:5,6][1,5]オキサゾリジン[4,3,2-de]キナゾリン-7(8H)-オン(70mg、0.165mmol)をジクロロメタン(15mL)に溶解し、トリエチルアミン(50mg、0.5mmol)を添加した。反応物を0℃まで冷却し、アクリル酸クロライド(21mg、0.016mol)を反応溶液に滴下した。反応物を0℃で15分攪拌した。40mLのジクロロメタンを反応溶液に添加し、反応溶液を50mLの飽和NaHCO3水溶液、40mLの飽和食塩水で洗浄し、乾燥及び濃縮した。この粗生成物を高速シリカゲルカラムで精製して目的生成物:Z28(30mg、収率38%)を得た。ES-API:[M+H]+=477.1;1H NMR(500MHz,DMSO-d6)δ10.07(s,1H),7.36-7.12(m,2H),6.98-6.63(m,4H),6.17(m,J=14.3Hz,1H),5.74(d,J=9.9Hz,1H),4.71(d,J=33.4Hz,1H),4.41-3.89(m,5H),3.57(d,J=13.6Hz,0.5H),3.31-3.19(m,2H),3.03(s,0.5H),2.64(s,1H),2.13-1.80(m,2H),1.18-0.99(m,2H),0.78-0.44(m,2H);ES-API:[M+H]+=477.1
実施例29:化合物Z29、Z29-1、Z29-2、Z29-3、及びZ29-4の調製
工程1:(R)-10-ブロモ-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(149mg、0.25mmol)、(2-フルオロ-6-ヒドロキシフェニル)ボロン酸(59mg、0.38mmol)、SPhos(10mg、0.025mmol)、SPhos-Pd-G2(18mg、0.025mmol)、リン酸カリウム(159mg、0.75mmol)、60mLのジオキサン、及び12mLの水を100mL反応フラスコに添加した。反応物を窒素保護下、115℃で2時間攪拌し、反応を停止させた。50mLの水を反応溶液に添加した。反応溶液を50mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-100%)で精製して生成物:(13aR)-11-クロロ-10-(2-フルオロ-6-ヒドロキシフェニル)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(111mg、70%)を黄色固体として得た。ES-API:[M+H]+=637.1
工程2:(13aR)-11-クロロ-10-(2-フルオロ-6-ヒドロキシフェニル)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(111mg、0.18mmol)、3mLのトリフルオロ酢酸、及び6mLのジクロロメタンを丸底フラスコに添加した。反応物を室温で1時間攪拌した。反応の完了をLC-MSで検出した。反応溶液を濃縮して(13aR)-11-クロロ-10-(2-フルオロ-6-ヒドロキシフェニル)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(121mg)を黄色固体として得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=537.1
工程3:(13aR)-11-クロロ-10-(2-フルオロ-6-ヒドロキシフェニル)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(121mg、0.21mmol)、6mLのジクロロメタン、及びトリエチルアミン(212mg、2.1mmol)を丸底フラスコに添加した。反応物を0℃まで冷却し、無水アクリル酸のジクロロメタン溶液(21mg、0.168mmol、1mL)を反応溶液に滴下した。反応物を0℃で10分攪拌した。40mLの飽和炭酸水素ナトリウム水溶液を反応溶液に添加し、反応溶液を20mLのジクロロメタンで3回抽出した。有機相を乾燥及び濃縮した。この粗生成物を分取HPLCで精製して目的生成物:Z29(28mg、23%)を得た。ES-API:[M+H]+=591.1
工程4:上記で得た化合物Z29(28mg、0.31mmol)をキラル分割(移動相:n-ヘキサン:エタノール:アンモニアメタノール=60:40:0.2;カラムタイプ:IE(250mm×4.6mm×5μm);流量:1mL/分;カラム温度:30℃)して以下の化合物を得た。
化合物Z29-1(6mg、保持時間:9.598分、純度:100%、de値:98%):ES-API:[M+H]+=591.1、
化合物Z29-2(5.5mg、保持時間:10.377分、純度:100.0%、de値:97.1%):ES-API:[M+H]+=591.1、
化合物Z29-3(4.3mg、保持時間:12.512分、純度:99.1%、de値:97.5%):ES-API:[M+H]+=591.1、
化合物Z29-4(4.2mg、保持時間:13.741分、純度:98.6%、de値:98.2%):ES-API:[M+H]+=591.1
実施例30:化合物Z30、Z30-1、Z30-2、Z30-2-1、及びZ30-2-2の調製
工程1:(R)-10-ブロモ-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(500mg、0.83mmol)、(5-メチル-1H-インダゾール-4-イル)ボロン酸(224mg、1.27mmol)、SPhos(34mg、0.084mmol)、SPhos-Pd-G2(60mg、0.084mmol)、リン酸カリウム(535mg、2.52mmol)、60mLのジオキサン、及び12mLの水を100mL反応フラスコに添加した。反応物を窒素保護下で115℃で2時間攪拌し、反応を停止させた。50mLの水を反応溶液に添加した。反応溶液を50mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-100%)で精製して生成物:(13aR)-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(418mg、76%)を黄色固体として得た。ES-API:[M+H]+=656.1
工程2:(13aR)-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(418mg、0.64mmol)、3mLのトリフルオロ酢酸、及び6mLのジクロロメタンを丸底フラスコに添加した。反応物を室温で1時間攪拌した。反応の完了をLC-MSで検出した。反応溶液を濃縮して(13aR)-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(501mg)を黄色固体として得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=556.1
工程3:(13aR)-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(501mg、0.9mmol)、6mLのジクロロメタン、及びトリエチルアミン(450mg、4.5mmol)を丸底フラスコに添加した。反応物を0℃まで冷却し、無水アクリル酸のジクロロメタン溶液(91mg、0.72mmol、1mL)を反応溶液に滴下した。反応物を0℃で5分攪拌した。40mLの飽和炭酸水素ナトリウム水溶液を反応溶液に添加し、反応溶液を20mLのジクロロメタンで3回抽出した。有機相を乾燥及び濃縮し、粗生成物を分取HPLCで精製して目的生成物:Z30(188mg、34%)を得た。ES-API:[M+H]+=611.2
工程4:化合物Z30を分取HPLCで精製して化合物Z30-1(188mg、34%)(HPLC:保持時間:7.36/7.41分、ES-API:[M+H]+=611.2)及び化合物Z30-2(88mg、16%)(HPLC:保持時間:7.45/7.51分、ES-API:[M+H]+=611.2)を得た。
工程5:化合物Z30-2(88mg、0.14mmol)をキラル分割(移動相:n-ヘプタン:エタノール(0.1%アンモニア含有メタノール)=70-30);カラムタイプ:AS-H(内径:0.46cm、長さ:15cm);流量:0.5mL/分;カラム温度:25℃)して化合物Z30-2-1(36mg、保持時間:4.612分、純度:100%、de値:98%)(ES-API:[M+H]+=611.2)及び化合物Z30-2-2(31mg、保持時間:4.861分、純度:100%、de値:98%)(ES-API:[M+H]+=611.2)を得た。
実施例31:化合物Z31の調製
化合物Z31を(S)-3-(ヒドロキシメチル)ピペラジン-1-カルボン酸tert-ブチルを原材料として実施例29の方法に従って調製した。ES-API:[M+H]+=591.1;1H NMR(500MHz,DMSO-d6),δ10.02(d,J=2.2Hz,1H),8.48(dd,J=4.8,2.5Hz,1H),7.30-7.26(m,1H),7.23-7.16(m,1H),6.97-6.81(m,1H),6.75-6.55(m,2H),6.21(d,J=16.1Hz,1H),5.83(dd,J=7.4,4.1Hz,1H),5.77(d,J=12.5Hz,1H),4.75(s,3H),4.55-4.00(m,3H),3.54(d,J=12.4Hz,1H),3.14(s,1H),2.88-2.65(m,1H),1.96(dd,J=14.7,8.8Hz,3H),1.14-0.90(m,6H)
実施例32:化合物Z32の調製
工程1:4-ブロモ-2,6-ジフルオロベンゾニトリル(10g、45.87mmol)をイソプロパノール(200mL)に添加し、次に2-メチルプロプ-1-アミン(5g、68.8mmol)を添加し、反応溶液を50℃まで加熱して2時間反応させた。反応の完了をLCMSで検出した。iPrOHをスピン乾燥し、100mLの水を添加した。反応溶液を酢酸エチル(100mL×3)で抽出し、抽出した有機相をスピン乾燥して粗生成物を得た。この粗生成物を高速カラム(120gシリカゲルカラム、酢酸エチル/石油エーテル=20/1~10/1)に通して生成物:4-ブロモ-2-フルオロ-6-(イソブチルアミノ)ベンゾニトリル(12.7g、収率96.7%)を得た。ES-API:[M+1]+=271.0,273.0
工程2:4-ブロモ-2-フルオロ-6-(イソブチルアミノ)ベンゾニトリル(10g、37mmol)をイソプロパノール(100mL)に溶解し、NCS(5.4g、40.7mmol)を添加し、反応溶液を50℃まで加熱して3時間反応させた。反応の完了をLCMSで検出した。iPrOHをスピン乾燥し、100mLの水を添加した。次に反応溶液を酢酸エチル(100mL×3)で抽出し、抽出した有機相をスピン乾燥して粗生成物を得た。この粗生成物を高速カラム(120gシリカゲルカラム、酢酸エチル/石油エーテル=20/1~10/1)に通して生成物:4-ブロモ-3-クロロ-2-フルオロ-6-(イソブチルアミノ)ベンゾニトリル(3.3g、収率33%)を得た。ES-API:[M+1]+=304.9,306.9
工程3:4-ブロモ-3-クロロ-2-フルオロ-6-(イソブチルアミノ)ベンゾニトリル(3.3g、10.8mmol)をDMSO(50mL)に溶解した後、炭酸カリウム(2.8g、20.4mmol)を添加した。過酸化水素(1.3g、37mmol)を室温でゆっくりと滴下し、反応溶液を室温で3時間攪拌した。反応の完了をLCMSで検出した。亜硫酸ナトリウム(5g、39.7mmol)を添加して30分攪拌した後、水(100mL)を添加した。反応溶液を酢酸エチル(100mL×3)で抽出し、抽出した有機相をスピン乾燥して粗生成物を得た。この粗生成物を高速カラム(40gシリカゲルカラム、酢酸エチル/石油エーテル=10/1~5/1)に通して生成物:4-ブロモ-3-クロロ-2-フルオロ-6-(イソブチルアミノ)ベンズアミド(3.3g、収率73%)を得た。ES-API:[M+1]+=322.9,324.9
工程4:NaH(1.6g、66mmol)をテトラヒドロフラン(40mL)に溶解し、0℃まで冷却した。次に4-ブロモ-3-クロロ-2-フルオロ-6-(イソブチルアミノ)ベンズアミド(2.1g、6.6mmol)を10mLのテトラヒドロフランに溶解したものを反応溶液にゆっくりと滴下し、0℃で1時間攪拌した。次にN,N’-カルボニルジイミダゾール(1.4g、8.58mmol)を10mLのテトラヒドロフランに溶解したものを0℃で反応溶液にゆっくりと滴下した後、自然に室温まで温め、30分攪拌した。LCMS検出から、生成物と原材料は約1/1であることが示された。更にLCMS検出から、30分後も目立った変化は無いことが示された。5mLの飽和塩化アンモニウム溶液を添加して過剰なNaHを急冷した後、20mLの水を添加した。反応溶液を酢酸エチル(50mL×3)で抽出し、抽出した有機相をスピン乾燥して粗生成物を得た。この粗生成物(酢酸エチル/石油エーテル=3/1)をスラリー化して生成物:7-ブロモ-6-クロロ-5-フルオロ-4-ヒドロキシ-1-イソブチルキナゾリン-2(1H)-オン(1.3g、収率92.5%)及び4-ブロモ-3-クロロ-2-フルオロ-6-(イソブチルアミノ)ベンズアミド(900mg)を得た。ES-API:[M+1]+=348.9,350.9
工程5:7-ブロモ-6-クロロ-5-フルオロ-4-ヒドロキシ-1-イソブチルキナゾリン-2(1H)-オン(1.2g、3.4mmol)、(S)-3-(ヒドロキシメチル)ピペラジン-1-カルボン酸tert-ブチル(1.1g、5.1mmol)をテトラヒドロフラン(20mL)に溶解した。次にNaH(410mg、17mmol)を反応溶液にゆっくりと添加し、室温で30分攪拌した。LC-MS検出から反応の完了が示された。5mLの飽和塩化アンモニウム溶液を添加して反応を停止させた後、20mLの水を添加し、酢酸エチル(30mL×3)で抽出し、抽出した有機相をスピン乾燥して粗生成物を得た。この粗生成物を高速カラム(20gシリカゲルカラム、ジクロロメタン/メタノール=100/1)に通して生成物:(S)-3-(((7-ブロモ-6-クロロ-4-ヒドロキシ-1-イソブチル-2-オキソ-1,2-ジヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-カルボン酸tert-ブチル(1.3g、収率72%)を得た。ES-API:[M+1]+=545.1,547.1
工程6:(S)-3-(((7-ブロモ-6-クロロ-4-ヒドロキシ-1-イソブチル-2-オキソ-1,2-ジヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-カルボン酸tert-ブチル(1.2g、2.2mmol)をN,N-ジメチルホルムアミド(20mL)に溶解した。1H-ベンゾトリアゾール-1-イルオキシトリピロリジニルヘキサフルオロホスフェート(3.45g、6.6mmol)を添加し、1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン(1.67g、11mmol)を氷浴下でゆっくりと滴下した後、室温まで加熱して2時間攪拌した。LC-MS検出から反応の完了が示された。30mLの水を添加し、酢酸エチル(30mL×3)で抽出し、抽出した有機相をスピン乾燥して粗生成物を得た。この粗生成物を高速カラム(20gシリカゲルカラム、ジクロロメタン/メタノール=20/1)に通して生成物:(S)-10-ブロモ-11-クロロ-8-イソブチル-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(1.2g、収率96.7%)を得た。ES-API:[M+1]+=527.1,529.1
工程7:(S)-10-ブロモ-11-クロロ-8-イソブチル-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(530mg、1.0mmol)、(2-フルオロ-6-ヒドロキシフェニル)ボロン酸(312mg、2.0mmol)、リン酸三カリウム(636mg、6.0mmol)、クロロ(2-ジシクロヘキシルホスフィノ-2’,6’-ジメトキシ-1,1’-ビフェニル)(2’-アミノ-1,1’-ビフェニル-2-イル)パラジウム(II)(72mg、0.1mmol)、2-ビシクロヘキシルホスフィン-2’,4’,6’-トリイソプロピルビフェニル(40mg、0.1mmol)をジオキサン(8mL)及び水(2mL)に順に添加した。3回窒素置換し、100℃まで加熱して16時間反応させた。室温まで冷却した後、反応溶液を酢酸エチル(30mL)に注ぎ入れ、食塩水で一回洗浄し、シリカゲルカラム(12gシリカゲルカラム、メタノール:ジクロロメタン=0~1:20)で精製して黄色発泡性固体:(13aS)-11-クロロ-10-(2-フルオロ-6-ヒドロキシフェニル)-8-イソブチル-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(370mg、収率60%)を得た。ES-API:[M+1]+=559.2
工程8:(13aS)-11-クロロ-10-(2-フルオロ-6-ヒドロキシフェニル)-8-イソブチル-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(370mg、0.67mmol)をジクロロメタン(5mL)に溶解し、トリフルオロ酢酸(2mL)を添加し、室温で1時間反応させ、スピン乾燥して黄色油状粗生成物:(13aS)-11-クロロ-10-(2-フルオロ-6-ヒドロキシフェニル)-8-イソブチル1,2,3,4,13,13aヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(300mg、収率100%)を得た。
工程9:(13aS)-11-クロロ-10-(2-フルオロ-6-ヒドロキシフェニル)-8-イソブチル1,2,3,4,13,13aヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(300mg、0.655mmol)及びトリエチルアミン(2mL)をジクロロメタン(5mL)に溶解し、0℃まで冷却した。無水アクリル酸(75mg、0.59mmol)を添加して0℃で0.5時間反応させた。反応溶液を20mLの水及びジクロロメタン(20mL×3)で抽出し、抽出した有機相をスピン乾燥して粗生成物を得た。粗生成物を調製及び精製(Ultimate XB-C18、50×250mm、10μm、アセトニトリル/水=10%/90%~90%/10%、40分)し、凍結乾燥して生成物:Z32(102mg、収率38%)を得た。ES-API:[M+1]+=513.1;1H NMR(400MHz,DMSO-d6)δ10.07(s,1H),7.26(d,J=8.1Hz,1H),7.05(s,1H),6.88-6.71(m,3H),6.17(d,J=16.6Hz,1H),5.73(d,J=10.5Hz,1H),4.60(s,2H),4.52-4.23(m,3H),4.10(d,J=12.4Hz,1H),3.94(s,3H),3.42(s,1H),3.16(s,1H),3.00(s,1H),2.03(s,1H),0.84(q,J=7.8Hz,6H)
実施例33:化合物Z33の調製
工程1:4-ブロモ-2,6-ジフルオロベンゾニトリル(10g、45.87mmol)及びテトラヒドロ-2H-ピラン-4-アミン(13.9g、137.6mmol)をi-PrOH(150mL)に溶解し、70℃で16時間反応させた。溶媒を濃縮して粗生成物を得た。この粗生成物を水(3×100mL)で洗浄して4-ブロモ-2-フルオロ-6-((テトラヒドロ-2H-ピラン-4-イル)アミノ)ベンゾニトリル(13g、43.48mmol、収率94.9%)を白色固体として得た。ES-API:[M+H]+=299.0
工程2:4-ブロモ-2-フルオロ-6-((テトラヒドロ-2H-ピラン-4-イル)アミノ)ベンゾニトリル(9g、30.1mmol)をDMF(80mL)に溶解し、1-クロロピロリジン-2,5-ジオン(4.82g、31.62mmol)を70℃で数回に分けて添加した。得られた混合物を80℃で1時間反応させた。室温まで冷却した後、水(50mL)を添加して固体を形成させた。固体を分離し、水(3×30mL)で洗浄して4-ブロモ-3-クロロ-2-フルオロ-6-((テトラヒドロ-2H-ピラン-4-イル)アミノ)ベンゾニトリル(7.05g、粗生成物)を白色固体として得た。ES-API:[M+H]+=333.1
工程3:4-ブロモ-3-クロロ-2-フルオロ-6-((テトラヒドロ-2H-ピラン-4-イル)アミノ)ベンゾニトリル(7g、20.99mmol)をDMSO(100mL)に溶解した後、炭酸カリウム(5.82g、42.2mmol)を添加し、最後に過酸化水素(8.61g、75.95mmol)を0℃で滴下した。その後、得られた混合物を室温で2時間攪拌した。混合物を氷水(50mL)に注ぎ入れ、酢酸エチル(3×200mL)で抽出した。有機層を食塩水(3×200mL)で洗浄し、無水硫酸ナトリウムで乾燥し、濃縮して粗生成物を得た。この粗生成物をシリカゲルカラム(石油エーテル/酢酸エチル=4:10)で精製して4-ブロモ-3-クロロ-2-フルオロ-6-((テトラヒドロ-2H-ピラン-4-イル)アミノ)ベンズアミド(3.6g、収率:48.78%)を白色固体として得た。ES-API:[M+H]+=351.0
工程4:4-ブロモ-3-クロロ-2-フルオロ-6-((テトラヒドロ-2H-ピラン-4-イル)アミノ)ベンズアミド(3.6g、10.24mmol)をテトラヒドロフラン(50mL)に溶解し、NaH(2.5g、61.44mmol)を0℃で数回に分けて添加し、0℃で0.5時間反応させた。次にCDI(2.5g、15.36mmol)のテトラヒドロフラン(10mL)溶液を0℃で滴下し、最後に得られた混合物を0℃で2時間攪拌した。酢酸エチル(100mL)を反応物に添加して希釈し、生成物を酢酸エチル(3×200mL)で抽出した。有機層を食塩水(2×100mL)で洗浄し、無水硫酸ナトリウムで乾燥し、濃縮して粗生成物を得た。この粗生成物を洗浄(石油エーテル/酢酸エチル=10:1)して7-ブロモ-6-クロロ-5-フルオロ-4-ヒドロキシ-1-(テトラヒドロ-2H-ピラン-4-イル)キナゾリン-2(1H)-オン(3.5g、収率90%)を白色固体として得た。ES-API:[M+H]+=377.0
工程5:NaH(1.8g、45mmol)を(S)-3-(ヒドロキシメチル)ピペラジン-1-ギ酸tert-ブチル(2.92g、13.5mmol)のTHF(60mL)溶液に0℃で数回に分けて添加し、得られた混合物を0℃で0.5時間攪拌した。次に7-ブロモ-6-クロロ-5-フルオロ-4-ヒドロキシ-1-(テトラヒドロ-2H-ピラン-4-イル)キナゾリン-2(1H)-オン(3.4g、9mmol)を0℃で添加し、得られた混合物を0℃~室温で2時間攪拌した。酢酸エチル(100mL)を反応物に添加し、生成物を酢酸エチル(3×200mL)で抽出した。有機層を食塩水(2×100mL)で洗浄し、無水硫酸ナトリウムで乾燥し、濃縮して粗生成物を得た。この粗生成物を洗浄(酢酸エチル/石油エーテル=1:3)して(S)-3-(((7-ブロモ-6-クロロ-4-ヒドロキシ-2-オキソ-1-(テトラヒドロ-2H-ピラン-4-イル)-1,2-ジヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-カルボン酸tert-ブチル(4.2g、収率=81%)を白色固体として得た。ES-API:[M+H]+=573.2
工程6:(S)-3-(((7-ブロモ-6-クロロ-4-ヒドロキシ-2-オキソ-1-(テトラヒドロ-2H-ピラン-4-イル)-1,2-ジヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-カルボン酸tert-ブチル(2g、3.48mmol)を(30mL)に溶解し、次にCarter縮合剤(3.86g、8.71mmol)を添加した。1,8-ジアザビシクロウンデカ-7-エン(2.65g、17.42mmol)を0℃で滴下し、得られた混合物を0℃~室温で2時間攪拌した。酢酸エチル(100mL)を反応物に添加し、生成物を酢酸エチル(3×100mL)で抽出した。有機層を食塩水(2×100mL)で洗浄し、無水硫酸ナトリウムで乾燥し、濃縮して粗生成物を得た。この粗生成物をシリカゲルカラム(酢酸エチル/石油エーテル=7:3)で精製して(S)-10-ブロモ-11-クロロ-7-オキソ-8-(テトラヒドロ-2H-ピラン-4-イル)-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(1.68g、収率86.6%)を白色固体として得た。ES-API:[M+H]+=555.0
工程7:(S)-10-ブロモ-11-クロロ-7-オキソ-8-(テトラヒドロ-2H-ピラン-4-イル)-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(1.3g、2.34mmol)、(2-フルオロ-6-ヒドロキシフェニル)ボロン酸(548mg、3.51mmol)、リン酸カリウム(1.5g、7.02mmol)、SPhos(192mg、0.468mmol)、及びSPhos-Pd-G2(166mg、0.234mmol)を窒素保護下でジオキサン/水(20mL、5:1)に溶解し、110℃で2時間反応させた。室温まで冷却した後、生成物を酢酸エチル(3×80mL)で抽出した。有機層を食塩水(3×30mL)で洗浄し、無水硫酸ナトリウムで乾燥し、濃縮して粗生成物を得た。この粗生成物を高速溶出(ジクロロメタン/メタノール=5:1)で精製して(13aS)-11-クロロ-10-(2-フルオロ-6-ヒドロキシフェニル)-7-オキソ-8-(テトラヒドロ-2H-ピラン-4-イル)-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(1.37g、収率99%)を白色固体として得た。ES-API:[M+H]+=587.2
工程8:(13aS)-11-クロロ-10-(2-フルオロ-6-ヒドロキシフェニル)-7-オキソ-8-(テトラヒドロ-2H-ピラン-4-イル)-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(500mg、0.85mmol)をジクロロメタン(6.0mL)及びトリフルオロ酢酸(2.0mL)に溶解し、室温で1時間反応させた。溶媒を濃縮して粗生成物(611mg、褐色油)を得た。これは更に精製せずに次の工程で使用することができる。ES-API:[M+H]+=487.1
工程9:(13aS)-11-クロロ-10-(2-フルオロ-6-ヒドロキシフェニル)-7-オキソ-8-(テトラヒドロ-2H-ピラン-4-イル)-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(414mg、0.85mmol)及びトリエチルアミン(430mg、4.25mmol)をジクロロメタン(10mL)に溶解した。無水アクリル酸(107mg、0.85mmol)のジクロロメタン(1mL)溶液を0℃で滴下した後、得られた混合物を0℃で0.5時間攪拌した。10mLの炭酸水素ナトリウムを添加し、生成物をジクロロメタン(3×30mL)で抽出した。有機層を炭酸水素ナトリウム(3×10mL)で洗浄し、無水硫酸ナトリウムで乾燥し、濃縮して粗生成物を得た。この粗生成物を逆相カラム(C18、球状、20~35μm、100A)で、アセトニトリル及び水での高速溶出(0-0,5分;0-45%,20分;45%-45%,7分)により精製して化合物Z33(127.4mg、収率27%)を白色固体として得た。ES-API:[M+H]+=541.0;1H NMR(400MHz,DMSO-d6)δ2.64-2.74(m,3H),3.11(s,1H),3.40-3.50(m,4H),3.85-4.04(m,4H),4.18-4.55(m,6H),5.73(d,J=10.2Hz,1H),6.16(d,J=16.6Hz,1H),6.69-6.83(m,3H),7.22-7.33(m,2H),10.06(s,1H)
実施例34:化合物Z34の調製
工程1:(S)-10-ブロモ-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(1.1g、1.82mmol)、3-(4,4,5,5-テトラメチル-1,3,2-ジオキサボラン-2-イル)ピリド-2-アミン(600mg、2.73mmol)、[1,1’-ビス(ジフェニルホスフィノ)フェロセン]パラジウム(II)ジクロライド(133mg、0.182mmol)、酢酸カリウム(535mg、5.46mmol)をジオキサン/水(15/3mL)に溶解し、100℃まで加熱し、窒素保護下で2時間反応させた。反応溶液を室温まで冷却し、水、酢酸エチルを添加して分離させた。有機相を食塩水で洗浄し、無水硫酸ナトリウムで乾燥し、スピン乾燥して粗生成物:(S)-10-(2-アミノピリジン-3-イル)-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサヘプチジン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(1.5g、収率100%)を得た。ES-API:[M+H]+=618.2
工程2:(S)-10-(2-アミノピリジン-3-イル)-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサヘプチジン[5,6,7-de]キナゾリン-2(1H)-カルボン酸-tertブチル(1.5g、1.82mmol)をジクロロメタン(10mL)に溶解し、トリフルオロ酢酸(5mL)を添加し、反応溶液を室温で0.5時間攪拌した。溶媒を減圧下で濃縮乾固して粗生成物:(S)-10-(2-アミノピリド-3-イル)-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(1.5g、収率100%)を得た。ES-API:[M+H]+=518.2
工程3:(S)-10-(2-アミノピリジン-3-イル)-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(1.5g、1.82mmol)をジクロロメタン(100mL)に溶解し、反応溶液を0℃に冷却し、トリエチルアミン(552mg、5.46mmol)を添加し、無水アクリル酸(183mg、1.46mmol)を滴下し、0℃で0.5時間反応させた。水を反応溶液に添加して反応を停止させた。有機相を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥し、スピン乾燥した。カラムクロマトグラフィー(クロマトグラフィーカラム:Ultimate XB-C18、50×250mm、10μm、移動相:アセトニトリル/水=10/90-90/10、40分)で調製及び精製して化合物Z34(218mg、収率21.0%)を得た。ES-API:[M+H]+=572.2;1H NMR(400MHz,DMSO-d6)δ8.46(d,J=4.7Hz,1H),7.90(s,1H),7.26(s,1H),6.87(s,1H),6.51(s,1H),6.19(d,J=17.1Hz,1H),5.76(d,J=11.8Hz,2H),5.60(s,1H),5.53(d,J=10.0Hz,1H),4.69(s,3H),4.55-4.24(m,1H),4.08(d,J=43.0Hz,1H),3.15(s,1H),2.76(s,1H),1.96(d,J=12.4Hz,3H),1.06(d,J=8.8Hz,3H),0.98(d,J=6.5Hz,3H)
実施例35:化合物Z35の調製
工程1:(S)-10-ブロモ-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(60mg、0.1mmol)、3-フルオロ-2-(トリブチルスタンニル)ピリジン(58mg、0.15mmol)、テトラ(トリフェニルホスフィン)パラジウム(12mg、0.01mmol)、塩化リチウム(13mg、0.3mmol)、ヨウ化第一銅(2mg、0.01mmol)をジオキサン(1.5mL)に溶解し、100℃まで加熱し、窒素保護下で5時間反応させた。反応溶液を室温まで冷却し、水、酢酸エチルを添加して分離させた。有機相を食塩水で洗浄し、無水硫酸ナトリウムで乾燥し、スピン乾燥した。薄層クロマトグラフィー(酢酸エチル:100%)で精製して(S)-11-クロロ-10-(3-フルオロピリジン-2-イル)-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(30mg、収率48.4%)を得た。ES-API:[M+H]+=621.2
工程2~3:化合物Z35を実施例34の対応する工程に従って調製した。ES-API:[M+H]+=575.2;1H NMR(400MHz,DMSO-d6)δ8.45(d,J=14.2Hz,2H),7.81(s,1H),7.54(s,1H),7.27(s,1H),6.86(s,0H),6.19(d,J=16.5Hz,1H),5.99(s,1H),5.75(d,J=10.7Hz,1H),4.74(s,2H),4.33(s,0H),4.12(s,1H),3.54(s,2H),3.14(s,1H),2.76(s,1H),1.95(d,J=10.5Hz,3H),1.05(d,J=6.6Hz,3H),0.99(s,3H)
実施例36:化合物Z36、Z36-1、及びZ36-2の調製
工程1:(S)-2-クロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(900mg、1.7mmol)、2-フルオロ-6-ヒドロキシフェニルボロン酸(400mg、2.6mmol)、SPhos(53mg、0.13mmol)、SPhos-Pd-G2(98mg、0.13mmol)、リン酸カリウム(1.1g、5.1mmol)、12mLのジオキサン、及び3mLの水を反応フラスコに添加した。反応物を窒素保護下、120℃油浴で1時間攪拌した。50mLの水を反応溶液に添加した。反応溶液を30mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(メタノール/ジクロロメタン:0-2%)で精製して(S)-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(1g、純度80%)を得た。ES-API:[M+H]+=603.2
工程2:(S)-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(1g、1.66mmol)、5mLのメタノール、及び5mLの塩酸/ジオキサン溶液(4M)を丸底フラスコに添加した。反応物を室温で1時間攪拌した。反応の完了をLC-MSで検出した。反応溶液を濃縮して粗生成物:(S)-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(835mg)を黄色固体として得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=503.2
工程3:(S)-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(835mg、1.66mmol)、15mLのジクロロメタン、及びトリエチルアミン(545mg、5.4mmol)を丸底フラスコに添加した。反応物を0℃まで冷却し、無水アクリル酸のジクロロメタン溶液(188mg、1.49mmol)を反応溶液に滴下した。反応物を0℃で10分攪拌した。40mLの飽和炭酸水素ナトリウム水溶液を反応溶液に添加し、反応溶液を30mLのジクロロメタンで2回抽出した。有機相を乾燥及び濃縮し、粗生成物を分取HPLCで精製してZ36(350mg、35%)を白色固体として得た。1H NMR(400MHz,DMSO-d6)δ11.88-11.85(m,1H),8.70(s,1H),7.58-7.57(m,1H),7.26-7.25(m,1H),7.18-7.17(m,1H),6.61-6.57(m,3H),6.46-6.42(m,1H),5.86-5.84(m,1H),5.07-5.05(m,1H),4.58-4.50(m,3H),4.11-3.40(m,5H),2.78-2.77(m,1H),2.16-2.15(m,3H),1.92-1.90(m,3H),1.13-1.08(m,6H);ES-API:[M+H]+=557.2
工程4:化合物Z36(350mg)をキラムカラムで分割(カラムタイプ:Chiralpak IB 250mm×4.6mm×5μm;移動相:n-ヘキサン:エタノール:アンモニアメタノール=50:50:0.2;流量:1mL/分;時間=20分)して以下の化合物を得た。
化合物Z36-1(121.5mg、保持時間:8.77分、ピーク1):白色固体;HNMR(400MHz,CDCl3)11.84(s,1H),8.72-8.71(m,1H),7.57(s,1H),7.27-7.20(m,2H),6.69-6.43(m,4H),5.87-5.84(m,1H),5.02-5.00(m,1H),4.57-4.50(m,3H),4.13-3.67(m,4H),3.40-3.38(m,1H),2.85-2.83(m,1H),2.16(s,3H),1.28-1.17(m,6H);ES-API:[M+H]+=557.2、及び
化合物Z36-2(130mg;保持時間:11.81分、ピーク2):白色固体;HNMR(400MHz,CDCl3)11.89(s,1H),8.70-8.69(m,1H),7.57(s,1H),7.27-7.20(m,2H),6.69-6.43(m,4H),5.87-5.84(m,1H),5.08-5.05(m,1H),4.57-4.50(m,3H),4.08-3.65(m,4H),3.40-3.39(m,1H),2.78-2.76(m,1H),2.15(s,3H),1.28-1.10(m,6H);ES-API:[M+H]+=557.2
実施例37:化合物Z37、Z37-1、及びZ37-2の調製
化合物Z37を2-シクロプロピルメチル-1-アミンを原材料として実施例32の方法に従って調製した。化合物Z37の粗生成物をシリカゲルカラム(溶離液は石油エーテル/酢酸エチル/メタノール=10/20/1~5/10/1)で分離し、まず極性の低い化合物Z37-1を回収した(TLC Rf値0.32(展開剤は石油エーテル/酢酸エチル/メタノール=5/10/1)、HPLC:保持時間9.686分、17mg、収率8%)。ES-API:[M+H]+=511.1;1H NMR(400MHz,DMSO-d6)δ10.08(s,1H),7.27(d,J=8.1Hz,1H),7.15(s,1H),6.92-6.67(m,3H),6.16(d,J=16.8Hz,1H),5.74(s,1H),4.61(s,2H),4.52-4.16(m,3H),4.16-3.73(m,4H),3.52-3.38(m,2H),1.13(d,J=18.8Hz,1H),0.38(d,J=7.4Hz,4H)
その後、極性の高い化合物Z37-2を回収した(TLC Rf値0.36(展開剤は石油エーテル/酢酸エチル/メタノール=5/10/1)、HPLC:保持時間9.767分、18mg、収率8%)。ES-API:[M+H]+=511.1;1H NMR(400MHz,DMSO-d6)δ10.08(s,1H),7.27(d,J=8.3Hz,1H),7.15(s,1H),6.93-6.68(m,3H),6.17(d,J=16.4Hz,1H),5.73(d,J=9.9Hz,1H),4.74-4.22(m,5H),4.18-3.92(m,4H),3.25-2.97(m,2H),1.10(s,1H),0.38(d,J=7.8Hz,4H)
実施例38:化合物Z38の調製
工程1:(S)-10-ブロモ-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(1.1g、1.82mmol)、(1-メチル-2-オキソ-1,2-ジヒドロピリジン-3-イル)ボロン酸(418g、2.73mmol)、[1,1’-ビス(ジフェニルホスフィノ)フェロセン]パラジウムジクロライド(133mg、0.182mmol)、酢酸カリウム(535mg、5.46mmol)をジオキサン/水(15/5mL)に溶解し、100℃まで加熱し、窒素保護下で2時間反応させた。反応溶液を室温まで冷却し、水、酢酸エチルを添加して分離させた。有機相を食塩水で洗浄し、無水硫酸ナトリウムで乾燥し、スピン乾燥して粗生成物:(S)-11-クロロ-8-(2-イソプロピル-4-メチルピリド-3-イル)-10-(1-メチル-2-オキソ-1,2-ジヒドロピリド-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(1.5g、収率100%)を得た。ES-API:[M+H]+=633.2
工程2~3:化合物Z38を実施例34の対応する工程に従って調製した。クロマトグラフィーカラム(Ultimate XB-C18、50×250mm、10μm、移動相:アセトニトリル/水=10/90-90/10、40分)を用いて精製した。ES-API:[M+H]+=587.2;1H NMR(400MHz,DMSO-d6)δ8.50(d,J=4.8Hz,1H),7.69(d,J=6.8Hz,1H),7.29(d,J=4.7Hz,1H),6.87(q,J=15.2Hz,1H),6.18(d,J=16.7Hz,1H),6.13-6.02(m,2H),5.81-5.71(m,2H),4.72(s,3H),4.34(s,1H),4.08(d,J=11.1Hz,1H),3.50(s,1H),3.37(s,3H),3.08(d,J=11.8Hz,2H),2.70(dt,J=31.2,6.9Hz,1H),1.96(d,J=9.0Hz,3H),1.12-0.90(m,6H)
実施例39:化合物Z39の調製
工程1:ナトリウムビス(トリメチルシリル)アミド(42mL)を、4-ブロモ-2,6-ジフオロベンゾニトリル(8.0g、36.70mmol)及び2-イソプロピルピリジン-3-アミン(5.0g、36.70mmol)のテトラヒドロフラン(50mL)混合液に-65℃で滴下し、-60℃で0.5時間保持した。温度が-50℃に上がった時点でテトラヒドロフラン(100mL)を添加した。次に混合物をゆっくりと室温まで上げ、3時間攪拌した。反応混合物を氷水(20mL)に注ぎ入れ、ジクロロメタン(3×100mL)で抽出した。有機相を合わせて飽和食塩水(3×50mL)で洗浄し、無水硫酸ナトリウムで乾燥した。溶媒をスピン蒸発させて除去した。残渣をシリカゲルを用いてフラッシュクロマトグラフィーで精製し、80gのシリカゲルカラム、石油エーテル/酢酸エチル=9%で溶出して4-ブロモ-2-フルオロ-6-((2-イソプロピルピリジン-3-イル)アミノ)ベンゾニトリル(8.0g、収率65.23%)を白色固体として得た。ES-API:[M+1]+=334.0
工程2:アセトニトリル(75mL)及び脱イオン水(225mL)を、4-ブロモ-2-フルオロ-6-((2-イソプロピルピリジン-3-イル)アミノ)ベンゾニトリル(10.0g、29.92mmol)、塩化ナトリウム(3.5g、59.85mmol)、ペルオキシ一スルホン酸カリウム(13.79g、22.44mmol)を入れた500mL丸底フラスコに添加した。反応混合物を大気中70℃まで一晩加熱し、ペルオキシ一スルホン酸カリウム(10.0g、16.27mmol)を更に添加した後、80℃まで加熱し、6時間反応を続けた。反応溶液をジクロロメタン(3×150mL)で抽出した。有機相を合わせて飽和食塩水(3×50mL)で洗浄し、無水硫酸ナトリウムで乾燥した。溶媒をスピン蒸発させて除去した。残渣をシリカゲルを用いてフラッシュクロマトグラフィーで精製し、120gのシリカゲルカラム、石油エーテル及び酢酸エチル(3%)で溶出して4-ブロモ-3-クロロ-2-フルオロ-6-((2-イソプロピルピリジン-3-イル)アミノ)ベンゾニトリル(2.0g、収率18.13%)を白色固体として得た。ES-API:[M+1]+=368.0
工程3:過酸化水素溶液(2.3g、ω=30%)を、4-ブロモ-3-クロロ-2-フルオロ-6-((2-イソプロピルピリジン-3-イル)アミノ)ベンゾニトリル(2.0g、5.43mmol)及び炭酸カリウム(1.5g、10.85mmol)のジメチルスルホキシド(20mL)混合液に0℃で滴下し、滴下終了後、室温で2時間反応させた。10%チオ硫酸ナトリウム溶液(35mL)を0℃で添加した後、混合物を氷水(200mL)に注ぎ入れ、吸引ろ過してろ過ケーキを得た。真空乾燥して4-ブロモ-3-クロロ-2-フルオロ-6-((2-イソプロピルピリジン-3-イル)アミノ)ベンズアミドの白色固体(1.5g、収率71.51%)を得た。ES-API:[M+1]+=386.0
工程4:水素化ナトリウム(0.685g、ω=60%)を、4-ブロモ-3-クロロ-2-フルオロ-6-((2-イソプロピルピリジン-3-イル)アミノ)ベンズアミド(1.325g、3.43mmol)のテトラヒドロフラン(10mL)混合液に0℃で添加した。添加終了後、0℃で1時間反応させた。カルボニルジイミダゾール(0.834g、5.14mmol)をテトラヒドロフラン(10mL)に溶解したものを上記混合物に滴下し、0℃で保持した。滴下終了後、反応混合物を室温まで上げ、2時間反応させた。混合物を氷水(150mL)に注ぎ入れ、ジクロロメタン(3×100mL)で抽出した。有機相を合わせて飽和塩化アンモニウム(3×50mL)及び飽和食塩水(3×50mL)で洗浄し、無水硫酸ナトリウムで乾燥した。溶媒をスピン蒸発させて除去した。残渣をシリカゲルを用いてフラッシュクロマトグラフィーで精製し、40gのシリカゲルカラム、ジクロロメタン、及びメタノール(3%)で溶出して7-ブロモ-6-クロロ-5-フルオロ-4-ヒドロキシ-1-(2-イソプロピルピリジン-3-イル)キナゾリン-2(1H)-オン(700mg、49.50%)を白色固体として得た。ES-API:[M+1]+=412.0
工程5:水素化ナトリウム(0.34g、ω=60%)を、7-ブロモ-6-クロロ-5-フルオロ-4-ヒドロキシ-1-(2-イソプロピルピリジン-3-イル)キナゾリン-2(1H)-オン(0.7g、1.7mmol)及び(S)-3-(ヒドロキシメチル)ピペラジン-1-カルボン酸tert-ブチル(0.4g、1.87mmol)のテトラヒドロフラン(10mL)混合液に0℃で添加し、添加終了後、0℃で1時間反応させた。混合物を氷水(100mL)に注ぎ入れ、ジクロロメタン(3×100mL)で抽出した。有機相を合わせて飽和塩化アンモニウム(3×30mL)及び飽和食塩水(3×50mL)で洗浄し、無水硫酸ナトリウムで乾燥した。溶媒をスピン蒸発させて除去した。残渣をシリカゲルを用いてフラッシュクロマトグラフィーで精製し、12gのシリカゲルカラム、ジクロロメタン、及びメタノール(3%)で溶出して(S)-3-(((7-ブロモ-6-クロロ-4-ヒドロキシ-1-(2-イソプロピルピリジン-3-イル)-2-オキソ-1,2-ジヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-カルボン酸tert-ブチル(0.75g、収率72.61%)を白色固体として得た。ES-API:[M+1]+=608.1
工程6:1H-ベンゾトリアゾール-1-イルオキシトリピロリジニルヘキサフルオロホスフェート(1.54g、2.96mmol)を、(S)-3-(((7-ブロモ-6-クロロ-4-ヒドロキシ-1-(2-イソプロピルピリジン-3-イル)-2-オキソ-1,2-ジヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-カルボン酸tert-ブチル(0.6g、0.985mmol)のN,N’-ジメチルホルムアミド(10mL)混合液に0℃で添加し、次に1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン(0.75g、4.93mmol)を滴下した。添加終了後、すぐに室温に移して1時間反応させた。混合物を氷水(100mL)に注ぎ入れ、酢酸エチル(3×30mL)で抽出した。有機相を合わせて飽和塩化アンモニウム(3×30mL)及び飽和食塩水(3×50mL)で洗浄し、無水硫酸ナトリウムで乾燥した。溶媒をスピン蒸発させて除去した。残渣をシリカゲルを用いてフラッシュクロマトグラフィーで精製し、12gのシリカゲルカラム、ジクロロメタン、及びメタノール(3%)で溶出して(S)-10-ブロモ-11-クロロ-8-(2-イソプロピルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(0.4g、収率68.70%)を白色固体として得た。ES-API:[M+1]+=590.1
工程7:テトラトリフェニルホスフィンパラジウム(0.051g、0.044mmol)を、(S)-10-ブロモ-11-クロロ-8-(2-イソプロピルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(0.26g、0.44mmol)、(5-メチル-1H-インダゾール-4-イル)ボロン酸(0.155g、0.88mmol)、及び炭酸ナトリウム(0.117g、1.1mmol)の1,4-ジオキサン(3mL)及び水(0.75mL)混合液に添加した。得られた混合物を110℃まで加熱し、アルゴン雰囲気下で1.5時間反応させた。室温まで冷却した後、反応混合物をジクロロメタン(3×150mL)で抽出した。有機相を合わせて水(1×50mL)及び飽和食塩水(3×50mL)で洗浄し、無水硫酸ナトリウムで乾燥した。溶媒をスピン蒸発させて除去した。残渣をシリカゲルを用いてフラッシュクロマトグラフィーで精製し、12gのシリカゲルカラム、ジクロロメタン、及び酢酸エチル(65%)で溶出して(13aS)-11-クロロ-8-(2-イソプロピルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(200mg、収率70.78%)を黄色油として得た。ES-API:[M+1]+=608.2
工程8:トリフルオロ酢酸(1mL)を、(13aS)-11-クロロ-8-(2-イソプロピルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(40mg、0.062mmol)のジクロロメタン(2mL)溶液に添加した。得られた混合物を室温で30分攪拌した。反応混合物のpHを1M炭酸水素ナトリウムで8に調整した。反応混合物をジクロロメタン(3×20mL)で抽出した。有機相を合わせて飽和食塩水(3×20mL)で洗浄し、無水硫酸ナトリウムで乾燥した。溶媒をスピン蒸発させて除去して(13aS)-11-クロロ-8-(2-イソプロピルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(30mg、収率88.85%)を黄色油として得た。これを更に精製せずに次の工程で直接使用した。ES-API:[M+1]+=508.1
工程9:トリエチルアミン(0.056g、0.55mmol)を(13aS)-11-クロロ-8-(2-イソプロピルピリジン-3-イル)-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(30mg、0.055mmol)のジクロロメタン(2mL)溶液に添加した。混合物を0℃まで冷却した。無水アクリル酸(6.98mg、0.055mmol)を0℃で添加し、2時間攪拌した。次に溶媒を減圧下で除去した。残渣をTLC板で精製して化合物Z39(2.8mg、収率22.71%)を白色固体として得た。ES-API:[M+1]+=561.0;1H NMR(400MHz,CDCl3)δ8.63(s,1H),7.45(d,J=8.8Hz,3H),6.63(t,J=13.9Hz,1H),6.42(d,J=16.9Hz,1H),6.12(s,1H),5.83(d,J=10.8Hz,1H),5.03(d,J=13.3Hz,1H),4.69(t,J=17.4Hz,4H),4.06(s,2H),3.66-3.20(m,2H),2.10(d,J=6.1Hz,3H),1.09(d,J=6.6Hz,6H)
実施例40:化合物Z40の調製
工程1:(R)-10-ブロモ-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(1.0g、1.65mmol)、(1-メチル-2-オキソ-1,2-ジヒドロピリジン-3-イル)ボロン酸(379mg、2.48mmol)、酢酸カリウム(485mg、4.95mmol)、及びPd(dppf)Cl2(121mg、0.165mmol)を1,4-ジオキサン/水(15mL、5:1)に溶解したものを順に100mL丸底フラスコに添加し、窒素保護下、110℃で1.5時間反応させた。生成物を酢酸エチル(3×50mL)で抽出し、飽和食塩水(2×20mL)で洗浄し、無水硫酸ナトリウムで乾燥し、濃縮して粗生成物を得た。この粗生成物をシリカゲルカラムで精製して(R)-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(1-メチル-2-オキソ-1,2-ジヒドロピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(褐色油、1.0g、収率94.34%)を得た。ES-API:[M+H]+=633,635
工程2:(R)-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(1-メチル-2-オキソ-1,2-ジヒドロピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(1.0g、1.58mmol)をジクロロメタン(12.0mL)に溶解してから、トリフルオロ酢酸(4.0mL)を添加し、室温で1時間反応させた。反応溶液を濃縮して(R)-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(1-メチル-2-オキソ-1,2-ジヒドロピリジン-3-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-1-オン(褐色油、921mg、粗生成物)を得た。ES-API:[M+H]+=533
工程3:(R)-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(1-メチル-2-オキソ-1,2-ジヒドロピリジン-3-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-1-オン(842mg、1.58mmol)をジクロロメタン(10mL)に溶解し、トリエチルアミン(479mg、4.74mmol)を0℃で添加した。2分攪拌した後、無水アクリル酸(199mg、1.58mmol、2.0mLのジクロロメタンに溶解)を滴下した。滴下後、0℃で1時間反応させた。飽和炭酸水素ナトリウム(10mL)を反応溶液に添加した。反応溶液をジクロロメタン(3×20mL)で抽出し、飽和炭酸水素ナトリウム(2×20mL)及び飽和食塩水(2×20mL)で洗浄し、無水硫酸ナトリウムで乾燥し、濃縮して粗生成物を得た。生成物Z40を逆相カラム(20G C18逆相カラム、アセトニトリル/水=36/100)で精製した(白色固体、122.5mg、収率13.21%)。ES-API:[M+H]+=587;1H NMR(400MHz,DMSO-d6)δ0.96-1.08(m,6H),1.96(d,J=9.0Hz,3H),2.70-2.78(m,1H),3.09(d,J=13.2Hz,1H),3.23(d,J=18.6Hz,1H),3.37(s,3H),3.50(s,1H),4.06-4.12(m,2H),4.34(d,J=12.9Hz,1H),4.45(d,J=13.3Hz,1H),4.71(s,3H),5.76(d,J=21.1Hz,2H),6.02-6.13(m,2H),6.19(d,J=16.6Hz,1H),6.79-6.90(m,1H),7.29(d,J=4.7Hz,1H),7.68(d,J=6.9Hz,1H),8.50(d,J=4.6Hz,1H)
実施例41:化合物Z41の調製
化合物Z41を中間体aを原材料として実施例34の方法に従って調製した。ES-API:[M+H]+=572;1H NMR(400MHz,DMSO-d6)δ1.02(dd,J=26.5,6.3Hz,6H),1.96(d,J=11.4Hz,3H),2.76(s,1H),3.17(s,1H),3.25(s,1H),3.39-3.49(m,2H),4.03(s,1H),4.14(s,1H),4.32-4.48(m,2H),4.69(s,3H),5.53(d,J=9.5Hz,1H),5.60(s,1H),5.74(d,J=10.9Hz,2H),6.19(d,J=16.7Hz,1H),6.51(t,J=6.0,6.0Hz,1H),6.87-7.00(m,1H),7.09(s,1H),7.26(s,1H),7.90(s,1H),8.46(d,J=4.5Hz,1H)
実施例42:化合物Z42の調製
化合物Z42をテトラヒドロフラン-3-アミンを原材料として実施例33の方法に従って調製した。ES-API:[M/2+1]
+=527.2;
1H NMR(400MHz,CDCl
3)δ7.43(s,1H),6.84(s,1H),6.75(s,1H),6.57(s,1H),6.42(d,J=16.3Hz,1H),5.95(s,1H),5.82(s,1H),4.73(s,1H),4.47(d,J=21.3Hz,4H),4.29(s,1H),4.08(s,1H),3.93(d,J=8.5Hz,3H),3.71(s,1H),3.61-3.15(m,3H),2.26(s,2H)
実施例43:化合物Z43の調製
工程1:(S)-10-ブロモ-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(800mg、1.32mmol)をトルエン(10mL)に溶解し、1-メチル-6-(トリブチルスタンニル)ピリジン-2(1H)-オン(631mg、1.59mmol)及びテトラ(トリフェニルホスフィン)パラジウム(114mg、0.132mmol)を添加し、窒素保護下、100℃で16時間反応させた。反応溶液を酢酸エチルで抽出し、減圧下で濃縮し、粗生成物をカラムクロマトグラフィー(ジクロロメタン/メタノール=20/1)で精製して(S)-11-クロロ-8-(2-イソプロピル-4-メチルピリジン-3-イル)-10-(1-メチル-6-オキソ-1,6-ジヒドロピリジン-2-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(褐色液体、630mg、収率75%)を得た。ES-API:[M+H]+=633.3
工程2~3:化合物Z43を実施例34の対応する工程に従って調製した。ES-API:[M+H]+=587.3;1H NMR(400MHz,DMSO-d6)δ8.48(d,J=4.7Hz,1H),7.47-7.19(m,2H),6.85(s,1H),6.40(d,J=9.2Hz,1H),6.19(d,J=16.7Hz,1H),6.07(d,J=6.1Hz,1H),5.93(d,J=52.9Hz,1H),5.75(d,J=10.5Hz,1H),4.74(s,3H),4.52-3.98(m,3H),3.52(d,J=15.5Hz,2H),3.25-3.11(m,1H),3.02(d,J=9.9Hz,3H),2.73(dd,J=25.7,17.4Hz,1H),1.96(dd,J=10.5,6.8Hz,3H),1.13-0.93(m,6H)
実施例44:化合物Z44の調製
化合物Z44を1-メチルピペリジン-4-アミンを原材料として実施例33の方法に従って調製した。ES-API:[M+1]+=554.2;1H NMR(400MHz,DMSO-d6)δ10.13(s,1H),7.27(d,J=7.5Hz,2H),6.91-6.68(m,3H),6.16(d,J=16.7Hz,1H),5.73(d,J=10.2Hz,1H),4.56(s,4H),4.28-3.93(m,3H),3.44(d,J=52.7Hz,3H),3.15-2.77(m,6H),2.56(s,3H),1.71(d,J=12.2Hz,2H)
実施例45:化合物Z45-1、Z45-2、Z45-3、及びZ45-4の調製
工程1:4-ブロモ-2,6-ジフルオロベンゾニトリル(540mg、2.48mmol)をテトラヒドロフラン(4mL)に溶解し、-70℃まで冷却した後、ナトリウムビス(トリメチルシリル)アミド(2.3mL、4.5mmol)を滴下した。-70℃で30分攪拌した後、4-イソプロピル-6-メチルピリミジン-5-アミンのテトラヒドロフラン(4mL)溶液を滴下した。反応溶液をゆっくりと室温まで上げ、一晩攪拌した。塩化アンモニウム水溶液で反応を停止させた。反応溶液を酢酸エチルで抽出し、有機相を乾燥及びスピン乾燥し、カラム装置(12gカラム)に通して精製(石油エーテル/酢酸エチル=3/1)して生成物(380mg、収率44%)を得た。ES-API:[M+1]+=349.0
工程2:4-ブロモ-2-フルオロ-6-((4-イソプロピル-6-メチルピリミジン-5-イル)アミノ)ベンゾニトリル(1.1g、3.15mmol)をアセトニトリル(20mL)に溶解し、NCS(419mg、3.15mmol)を添加し、80℃まで加熱し、3時間攪拌した。反応溶液を酢酸エチルで抽出し、有機相を乾燥及びスピン乾燥し、カラム装置(12gカラム)に通して精製(石油エーテル/酢酸エチル=4/1)して生成物(670mg、収率65%)を得た。ES-API:[M+1]+=385.0
工程3:4-ブロモ-3-クロロ-2-フルオロ-6-((4-イソプロピル-6-メチルピリミジン-5-イル)アミノ)ベンゾニトリル(620mg、1.61mmol)をジメチルスルホキシド(8mL)に溶解し、炭酸カリウム(1.1g、8.07mmol)を添加し、0℃まで冷却し、過酸化水素(659mg、5.81mmol)を滴下した。反応物を室温まで上げ、5時間攪拌した。反応溶液を亜硫酸ナトリウム水溶液で急冷した。反応溶液を酢酸エチルで抽出し、有機相を乾燥及びスピン乾燥し、カラム装置(12gカラム)に通して精製(石油エーテル/酢酸エチル=2/1)して生成物(400mg、収率55%)を得た。ES-API:[M+1]+=403.0
工程4:水素化ナトリウム(497mg、12.4mmol)をテトラヒドロフラン(5mL)に懸濁し、-10℃まで冷却した。4-ブロモ-3-クロロ-2-フルオロ-6-((4-イソプロピル-6-メチルピリミジン-5-イル)アミノ)ベンズアミド(500mg、1.24mmol)のテトラヒドロフラン(5mL)溶液を滴下し、20分攪拌した後、カルボニルジイミダゾールのテトラヒドロフラン(5mL)溶液を滴下した。反応溶液を-10℃で1時間攪拌した。反応溶液を-30℃まで冷却し、pHを0.5M塩酸溶液で2~3に調整した。反応溶液を酢酸エチルで抽出し、有機相を乾燥及びスピン乾燥し、逆相カラムクロマトグラフィー(40gカラム)(水/アセトニトリル=1/1)で精製して生成物(240mg、収率45%)を得た。ES-API:[M+1]+=429.0
工程5:7-ブロモ-6-クロロ-5-フルオロ-4-ヒドロキシ-1-(4-イソプロピル-6-メチルピリミジン-5-イル)キナゾリン-2(1H)-オン(240mg、0.56mmol)及び(S)-3-(ヒドロキシメチル)ピペラジン-1-カルボン酸tert-ブチル(182mg、0.84mmol)をテトラヒドロフラン(4mL)に溶解し、0℃まで冷却した。水素化ナトリウム(112mg、2.8mmol)を添加し、室温まで上げ、1時間攪拌した。反応溶液を水で急冷した。反応溶液を酢酸エチルで抽出し、有機相を乾燥及びスピン乾燥し、カラム装置(12gカラム)に通して精製(ジクロロメタン/メタノール=10/1)して生成物(260mg、収率74%)を得た。ES-API:[M+1]+=625.2
工程6:(S)-3-(((7-ブロモ-6-クロロ-4-ヒドロキシ-1-(4-イソプロピル-6-メチルピリミジン-5-イル)-2-オキソ-1,2-ジヒドロキナゾリン-5-イル)オキシ)メチル)ピペラジン-1-カルボン酸tert-ブチル(180mg、0.29mmol)をアセトニトリル(9mL)に溶解し、N,N-ジイソプロピルエチルアミン(112mg、0.86mmol)及びオキシ塩化リン(66mg、0.43mmol)を添加し、80℃まで加熱し、2時間攪拌した。反応溶液を炭酸水素ナトリウム水溶液で急冷した。反応溶液を酢酸エチルで抽出し、有機相を乾燥及びスピン乾燥し、カラム装置(12gカラム)(酢酸エチル)に通して生成物(80mg、収率45%)を得た。ES-API:[M+1]+=607.1
工程7:(S)-10-ブロモ-11-クロロ-8-(4-イソプロピル-6-メチルピリミジン-5-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチル(150mg、0.25mmol)をジオキサン(2mL)に溶解し、水(0.4mL)、(5-メチル-1H-インダゾール-4-イル)ボロン酸(87mg、0.49mmol)、2-ジシクロヘキシルホスフィノ-2’,6’-ジメトキシ-ビフェニル(10mg、0.025mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(23mg、0.025mmol)、及びリン酸カリウム(157mg、0.74mmol)を添加し、110℃マイクロ波下で1.33時間反応させた。反応溶液を酢酸エチルで抽出し、有機相を乾燥及びスピン乾燥し、カラムクロマトグラフィー(酢酸エチル/石油エーテル=0-100%、極性の低いものから高いものへの順)を行ってそれぞれ以下の生成物を得た。
(13aS)-11-クロロ-8-(4-イソプロピル-6-メチルピリミジン-5-イル)-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチルZ45-a(19mg):TLC Rf値:0.30(酢酸エチル);ES-API:[M+1]+=657.3、
(13aS)-11-クロロ-8-(4-イソプロピル-6-メチルピリミジン-5-イル)-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチルZ45-b(30mg):TLC Rf値:0.25(酢酸エチル);ES-API:[M+1]+=657.3、及び
(13aS)-11-クロロ-8-(4-イソプロピル-6-メチルピリミジン-5-イル)-10-(5-メチル-1H-インダゾール-4-イル)-7-オキソ-3,4,7,8,13,13a-ヘキサヒドロピラジノ[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-2(1H)-カルボン酸tert-ブチルZ45-c(20mg):TLC Rf値:0.10(酢酸エチル);ES-API:[M+1]+=657.3
工程8:化合物Z45-c(20mg、0.03mmol)をジクロロメタン(2mL)に溶解し、トリフルオロ酢酸(0.5mL)を添加し、室温で1時間反応させ、スピン乾燥して黄色油状粗生成物:(13aS)-11-クロロ-8-(4-イソプロピル-6-メチルピリミジン-5-イル)-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジン[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オンを粗生成物(17mg、収率100%)として得た。
工程9:(13aS)-11-クロロ-8-(4-イソプロピル-6-メチルピリミジン-5-イル)-10-(5-メチル-1H-インダゾール-4-イル)-1,2,3,4,13,13a-ヘキサヒドロピラジン[2’,1’:3,4][1,4]オキサゼピン[5,6,7-de]キナゾリン-7(8H)-オン(17mg、0.03mmol)及びトリエチルアミン(0.5mL)をジクロロメタン(2mL)に溶解し、0℃まで冷却し、無水アクリル酸(3mg、0.027mmol)を添加し、0℃で0.5時間反応させた。反応溶液を10mLの水及びジクロロメタン(10mL×3)で抽出し、抽出した有機相をスピン乾燥して粗生成物を得た。この粗生成物を調製及び精製(クロマトグラフィーカラム:Ultimate XB-C18、50×250mm、10μm;溶出系:アセトニトリル/水、10%から90%まで40分;モニタリング波長210nm;流量80mL/分)し、凍結乾燥して化合物Z45-1(4mg、収率20%)を得た。ES-API:[M+1]+=611.2;1H NMR(400MHz,CDCl3)δ9.01(s,1H),7.45(d,J=9.5Hz,1H),6.70-6.56(m,1H),6.42(d,J=16.6Hz,1H),6.04(s,1H),5.84(d,J=10.4Hz,1H),5.08(d,J=13.2Hz,1H),4.69(s,2H),4.12(d,J=7.2Hz,1H),3.69(d,J=43.3Hz,1H),3.51-3.28(m,2H),2.84-2.77(m,1H),2.31(s,3H),2.11(s,3H),2.04(s,1H),1.41(s,1H),1.33(s,2H),1.25(s,6H),1.06(d,J=6.7Hz,2H)
工程10~11:化合物Z45-bを原材料として用い、実施例45の工程8~9の方法を参照して最後にカラムクロマトグラフィー(メタノール/ジクロロメタン=0-10%)(極性の低いものから高いものへ)で精製して以下の化合物を得た。
化合物Z45-2(白色固体、3.8mg):LC-MS:保持時間:1.597分;ES-API:[M+1]+=611.2;1H NMR(400MHz,CDCl3)δ9.01(s,1H),7.45(d,J=9.5Hz,1H),6.70-6.56(m,1H),6.42(d,J=16.6Hz,1H),6.04(s,1H),5.84(d,J=10.4Hz,1H),5.08(d,J=13.2Hz,1H),4.69(s,2H),4.12(d,J=7.2Hz,1H),3.69(d,J=43.3Hz,1H),3.51-3.28(m,2H),2.84-2.77(m,1H),2.31(s,3H),2.11(s,3H),2.04(s,1H),1.41(s,1H),1.33(s,2H),1.25(s,6H),1.06(d,J=6.7Hz,2H)、及び
化合物Z45-3(白色固体、4.0mg):LC-MS:保持時間:1.648分;ES-API:[M+1]+=611.2;1H NMR(400MHz,CDCl3)δ9.01(s,1H),7.32(s,1H),6.64(dd,J=16.7,10.5Hz,1H),6.43(d,J=16.7Hz,1H),6.03(s,1H),5.84(d,J=10.4Hz,1H),5.08(d,J=13.1Hz,1H),4.69(d,J=14.7Hz,3H),4.08(s,2H),3.72-3.30(m,3H),2.87-2.76(m,1H),2.34(s,3H),2.09(s,3H),1.43-1.37(m,1H),1.26(d,J=8.1Hz,6H),1.05(d,J=6.6Hz,2H)
工程12~13:化合物Z45-aを原材料として用い、実施例45の工程8~9の方法を参照して化合物Z45-4(白色固体、4.2mg)を得た。ES-API:[M+1]+=611.2;1H NMR(400MHz,CDCl3)δ9.01(s,1H),7.45(d,J=9.5Hz,1H),6.70-6.56(m,1H),6.42(d,J=16.6Hz,1H),6.04(s,1H),5.84(d,J=10.4Hz,1H),5.08(d,J=13.2Hz,1H),4.69(s,2H),4.12(d,J=7.2Hz,1H),3.69(d,J=43.3Hz,1H),3.51-3.28(m,2H),2.84-2.77(m,1H),2.31(s,3H),2.11(s,3H),2.04(s,1H),1.41(s,1H),1.33(s,2H),1.25(s,6H),1.06(d,J=6.7Hz,2H)
実施例46:化合物Z46、Z46-1、及びZ46-2の調製
工程1:(S)-2,3-ジクロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5α,6,8,9,11,12ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(300mg、0.54mmol)、(2-フルオロフェニル)ボロン酸(227mg、1.62mmol)、テトラトリフェニルホスフィンパラジウム(62mg、0.054mmol)、炭酸ナトリウム(172mg、1.62mmol)、50mLのジオキサン、及び10mLの水を100mL反応フラスコに添加した。反応物を窒素保護下、65℃で3時間攪拌し、反応を停止させた。30mLの水を反応溶液に添加した。反応溶液を30mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-100%)で精製して生成物:(S)-3-クロロ-2-(2-フルオロフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(211mg、63%)を黄色固体として得た。ES-API:[M+H]+=622.3
工程2~3:化合物Z46を実施例34の対応する工程に従って調製した。ES-API:[M+H]+=576.2;1H NMR(500MHz,DMSO-d6)δ8.35(d,J=4.8Hz,1H),7.47(dd,J=13.4,6.2Hz,1H),7.31-7.21(m,2H),7.15(d,J=4.8Hz,2H),6.95-6.75(m,1H),6.21(dd,J=16.6,2.2Hz,1H),5.77(dd,J=10.4,2.2Hz,1H),4.98-4.78(m,2H),4.65-4.53(m,1H),4.51-4.32(m,1H),4.26(d,J=20.2Hz,1H),4.18-3.94(m,1H),3.82-3.56(m,2H),2.83-2.66(m,1H),1.94(d,J=11.5Hz,3H),1.06(d,J=6.8Hz,3H),0.93(d,J=6.6Hz,3H)
工程4:化合物Z46を調製及びキラル分割(カラムタイプ:IG、250mm×4.6mm×5μm、移動相:n-ヘキサン:エタノール=40:60、流量:1mL/分、カラム温度=30℃)して以下の化合物を得た。
化合物Z46-1(79.8mg、ピーク1、保持時間8.093分、収率:30.2%):白色固体;1H NMR(400MHz,DMSO-d6)δ8.36(d,J=4.8Hz,1H),7.48(ddd,J=15.6,5.4,1.8Hz,1H),7.35-7.07(m,4H),6.96-6.77(m,1H),6.00(ddd,J=13.5,12.7,2.3Hz,2H),5.01-4.79(m,2H),4.69-4.25(m,3H),4.07(d,J=31.0Hz,1H),3.82-3.57(m,2H),3.38(s,1H),2.78(dt,J=13.4,6.7Hz,1H),1.94(s,3H),1.06(d,J=6.7Hz,3H),0.93(d,J=6.7Hz,3H)、及び
化合物Z46-2(84.48mg、ピーク2、保持時間11.618分、収率:31.9%):白色固体;1H NMR(400MHz,DMSO-d6)δ8.36(d,J=4.8Hz,1H),7.48(dd,J=13.3,6.1Hz,1H),7.34-7.10(m,4H),6.95-6.77(m,1H),6.22(d,J=16.7Hz,1H),5.78(d,J=12.2Hz,1H),4.99-4.81(m,2H),4.68-4.22(m,3H),4.07(d,J=14.4Hz,1H),3.83-3.58(m,2H),3.37(s,1H),2.78-2.62(m,1H),1.96(s,3H),1.06(d,J=6.7Hz,3H),0.94(d,J=6.7Hz,3H)
実施例47:化合物Z47、Z47-1、及びZ47-2の調製
化合物Z47を(2,3-ジフルオロフェニル)ボロン酸を原材料として実施例46の方法に従って調製した(ES-API:[M+H]+=594.2)。化合物Z47をキラル分割(移動相:アセトニトリル:イソプロパノール=60:40;カラムタイプ:IC(250mm×4.6mm×5μm);流量:1.0mL/分;カラム温度:30℃)して以下の化合物を得た。
化合物Z47-1(23mg、保持時間:5.176分、純度:100%、de値:100%):ES-API:[M+H]+=594.2、及び
化合物Z47-2(29mg、保持時間:9.285分、純度:100%、de値:99%):ES-API:[M+H]+=594.2;1H NMR(500MHz,DMSO-d6)δ8.36(d,J=4.8Hz,1H),7.52(dd,J=18.0,8.6Hz,1H),7.26(dd,J=12.8,8.0Hz,1H),7.20-7.13(m,1H),6.99(d,J=6.4Hz,1H),6.94-6.75(m,1H),6.21(dd,J=16.8,2.0Hz,1H),5.78(dd,J=10.4,2.0Hz,1H),5.04-4.81(m,2H),4.56(s,1H),4.42(dd,J=53.8,12.1Hz,1H),4.30(s,1H),4.06(d,J=34.1Hz,1H),3.85-3.61(m,2H),3.41-3.30(m,1H),2.78-2.63(m,1H),1.94(d,J=12.3Hz,3H),1.06(d,J=6.8Hz,3H),0.94(d,J=6.6Hz,3H)
実施例48:化合物Z48の調製
化合物Z48を(3-フルオロフェニル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=576.2;1H NMR(500MHz,DMSO-d6)δ8.42(d,J=4.8Hz,1H),7.45(dd,J=14.0,8.0Hz,1H),7.40-7.27(m,2H),7.25-7.08(m,2H),7.00-6.72(m,1H),6.22(d,J=16.6Hz,1H),5.78(d,J=11.6Hz,1H),4.87(ddd,J=19.0,17.8,8.2Hz,2H),4.59(s,1H),4.52-4.34(m,1H),4.27(s,1H),4.08(d,J=40.8Hz,1H),3.71(d,J=44.8Hz,2H),3.40-3.25(m,1H),2.87-2.67(m,1H),1.95(d,J=10.1Hz,3H),1.08(d,J=6.8Hz,3H),0.95(d,J=6.4Hz,3H)
実施例49:化合物Z49、Z49-1、及びZ49-2の調製
化合物Z49を(2,4-ジフルオロフェニル)ボロン酸を原材料として実施例46の方法に従って調製した(ES-API:[M+H]+=594.2)。化合物Z49(75mg、0.12mmol)をキラル分割(移動相:アセトニトリル:イソプロパノール=60:40;カラムタイプ:IC(250mm×4.6mm×5μm);流量:1.0mL/分;カラム温度:30℃)して以下の化合物を得た。
Z49-1(27mg、保持時間:5.318分、純度:100%、de値:100%):ES-API:[M+H]+=594.1、及び
化合物Z49-2(28mg、保持時間:8.840分、純度:99%、de値:99%):ES-API:[M+H]+=594.1;1H NMR(500MHz,DMSO-d6)δ8.37(d,J=4.8Hz,1H),7.35(t,J=9.8Hz,1H),7.29-7.10(m,3H),6.98-6.73(m,1H),6.22(dd,J=16.8,2.2Hz,1H),5.78(dd,J=10.4,2.2Hz,1H),5.05-4.80(m,2H),4.57(s,1H),4.42(dd,J=54.5,12.0Hz,1H),4.29(s,1H),4.06(d,J=33.4Hz,1H),3.73(d,J=54.0Hz,2H),2.87-2.65(m,1H),1.94(d,J=12.0Hz,3H),1.07(d,J=6.8Hz,3H),0.93(d,J=6.8Hz,3H)
実施例50:化合物Z50の調製
化合物Z50を(4-フルオロフェニル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=576.2;1H NMR(500MHz,DMSO-d6)δ8.42(d,J=5.0Hz,1H),7.48(dd,J=8.8,5.6Hz,2H),7.24(t,J=8.8Hz,2H),7.20(t,J=4.2Hz,1H),6.86(m,1H),6.21(m,1H),5.78(d,J=12.0Hz,1H),4.87(m,2H),4.60(s,1H),4.43(dd,J=54.2,12.8Hz,1H),4.26(s,1H),4.09(d,J=43.2Hz,1H),3.70(d,J=52.2Hz,2H),2.74(m,1H),1.95(d,J=9.8Hz,3H),1.07(d,J=6.8Hz,3H),0.94(d,J=6.6Hz,3H)
実施例51:化合物Z51の調製
(5aS)-7-アクリロイル-3-クロロ-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキサ1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン11(12H)-オン(200mg、0.34mmol)、N-クロロスクシンイミド(137mg、1.02mmol)、及び酢酸(30mL)を丸底フラスコに添加した。反応物を75℃で2時間攪拌し、濃縮し、粗生成物を分取HPLCで分離して生成物:(5aS)-7-アクリロイル-3-クロロ-2-(3,5-ジクロロ-2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(176mg、56%)を黄色固体として得た。ES-API:[M+H]+=659.6;1H NMR(500MHz,DMSO-d6)δ10.25(dd,J=23.0,10.0Hz,1H),8.29(d,J=4.8Hz,1H),7.70(d,J=7.8Hz,1H),7.10(s,1H),6.78(s,1H),6.14(d,J=16.5Hz,1H),5.71(d,J=10.2Hz,1H),4.93-4.72(m,2H),4.59-4.35(m,2H),4.28-4.11(m,1H),4.10-3.89(m,1H),3.77-3.48(m,3H),2.81-2.56(m,1H),1.85(dd,J=19.6,12.4Hz,3H),0.99(d,J=6.2Hz,3H),0.89-0.81(m,3H)
実施例52:化合物Z52の調製
(5aS)-7-アクリロイル-3-クロロ-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(300mg、0.5085mmol)を30mLのアセトニトリルに添加し、最後にN-クロロスクシンイミド(135mg、1.0169mmol)を添加し、75℃で1時間反応させた。80mLの酢酸エチルを添加し、反応溶液を飽和食塩水で3回(3×60mL)洗浄した。有機相を無水硫酸ナトリウムで乾燥し、ろ過し、ろ液をスピン乾燥及び調製して(5aS)-7-アクリロイル-3-クロロ-2-(3-クロロ-6-フルオロ-2-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(9.2mg、収率3%)を得た。ES-API:[M+H]+=625.2
実施例53:化合物Z53の調製
工程1:(S)-2,3-ジクロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(200mg、0.36mmol)、(2,3-ジフルオロ-6-メトキシフェニル)ボロン酸(200mg、1.07mmol)、クロロ(2-ジシクロヘキシルホスフィノ-2’,6’-ジメトキシ-1,1’-ビフェニル)(2’-アミノ-1,1’-ビフェニル-2-イル)パラジウム(II)(28mg、0.04mmol)、2-ビシクロヘキシルホスフィン-2’,6’-ジメトキシビフェニル(16mg、0.04mmol)、リン酸カリウム(227mg、1.07mmol)の1,4-ジオキサン(2mL)及び水(0.4mL)混合液を100℃マイクロ波下、窒素保護下で1時間反応させた。反応溶液をろ過し、酢酸エチル(30mL)で洗浄した。ろ液を飽和食塩水(10mL×3)で洗浄し、得られた有機相を乾燥及び濃縮し、高速シリカカラム(0-10%メタノール/ジクロロメタン)で精製して黄色固体:(S)-3-クロロ-2-(2,3-ジフルオロ-6-メトキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(100mg、収率23%)を得た。ES-API:[M+H]+=669.1
工程2:17%三臭化ほう素のジクロロメタン溶液(2mL)を(S)-3-クロロ-2-(2,3-ジフルオロ-6-メトキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(100mg、0.15mmol)のジクロロメタン(2mL)溶液に氷浴下で添加し、室温で3時間攪拌した。反応溶液を飽和炭酸水素ナトリウム溶液(20mL)で急冷し、ジクロロメタンで抽出し、濃縮して黄色固体:(S)-3-クロロ-2-(2,3-ジフルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(83mg)を得た。ES-API:[M+H]+=555.1
工程3:N,N-ジイソプロピルエチルアミン(58mg、0.45mmol)を(S)-3-クロロ-2-(2,3-ジフルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(83mg、0.15mmol)のジクロロメタン(2mL)溶液に氷浴下で添加した。反応溶液を清澄化してから、無水アクリル酸(11mg、0.09mmol)を添加し、5分攪拌した。反応溶液を濃縮した後、分取HPLC(炭酸水素アンモニウム系)で精製して白色固体Z53(7.76mg、純度90%、収率9%)を得た。1H NMR(500MHz,DMSO-d6)δ10.04(t,J=15.7Hz,1H),8.37(d,J=4.7Hz,1H),7.32-7.23(m,1H),7.21-7.14(m,1H),6.92-6.78(m,1H),6.67-6.61(m,1H),6.21(dd,J=16.7,2.2Hz,1H),5.78(dd,J=10.5,2.1Hz,1H),4.96-4.82(m,2H),4.63-4.52(m,1H),4.49-4.34(m,1H),4.29(s,1H),4.11-3.99(m,1H),3.73-3.59(m,1H),3.56-3.47(m,1H),2.80-2.62(m,1H),1.93(d,J=12.2Hz,3H),1.08(d,J=6.7Hz,3H),0.94(d,J=4.7Hz,3H);ES-API:[M+H]+=609.1
実施例54:化合物Z54の調製
化合物Z54を(3,5-ジフルオロ-2-メトキシフェニル)ボロン酸を原材料として実施例53の方法に従って調製した。1H NMR(500MHz,DMSO-d6)δ9.83(d,J=5.1Hz,1H),8.37(d,J=4.8Hz,1H),7.35-7.24(m,1H),7.17(d,J=4.6Hz,1H),6.95-6.78(m,1H),6.61(d,J=8.5Hz,1H),6.22(d,J=16.6Hz,1H),5.78(d,J=12.2Hz,1H),4.99-4.81(m,2H),4.60(d,J=16.8Hz,1H),4.43(dd,J=55.1,12.0Hz,1H),4.27(s,1H),4.08(d,J=42.2Hz,1H),3.69(d,J=41.3Hz,2H),3.37(d,J=11.3Hz,1H),2.74(ddd,J=26.9,13.3,6.7Hz,1H),1.94(d,J=10.1Hz,3H),1.07(d,J=6.7Hz,3H),0.96(dd,J=6.6,1.7Hz,3H);ES-API:[M+H]+=609.1
実施例55:化合物Z55の調製
化合物Z55を(5-フルオロ-2-ヒドロキシフェニル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=591.1;1H NMR(500MHz,DMSO-d6)δ9.72(s,1H),8.37(d,J=4.8Hz,1H),7.17(d,J=3.8Hz,1H),7.05(td,J=8.7,3.2Hz,1H),6.86(ddd,J=13.7,12.7,7.5Hz,2H),6.75-6.66(m,1H),6.22(dd,J=16.7,2.1Hz,1H),5.78(dd,J=10.5,2.0Hz,1H),5.04-4.81(m,2H),4.58(s,1H),4.43(dd,J=56.0,12.8Hz,1H),4.25(s,1H),4.10(d,J=52.6Hz,1H),3.77-3.57(m,2H),3.38(s,1H),2.74(ddt,J=33.6,13.1,6.6Hz,1H),1.94(d,J=9.7Hz,3H),1.07(d,J=6.7Hz,3H),0.97(dd,J=6.7,3.5Hz,3H)
実施例56:化合物Z56の調製
化合物Z56を(2,4,6-トリフルオロフェニル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=612.2;1H NMR(500MHz,DMSO-d6)δ8.36(d,J=4.8Hz,1H),7.32(s,2H),7.16(d,J=4.8Hz,1H),6.96-6.69(m,1H),6.21(dd,J=16.8,2.2Hz,1H),5.77(dd,J=10.4,2.2Hz,1H),5.08-4.80(m,2H),4.63-4.27(m,3H),4.03(s,1H),3.91-3.58(m,2H),3.54-3.41(m,1H),2.83-2.67(m,1H),1.91(d,J=17.8Hz,3H),1.05(d,J=6.8Hz,3H),0.91(t,J=6.3Hz,3H)
実施例57:化合物Z57、Z57-1、及びZ57-2の調製
化合物Z57を(2-フルオロ-3-(トリフルオロメチル)フェニル)ボロン酸を原材料として実施例46の方法に従って調製した(ES-API:[M+H]+=644.2)。化合物Z57(40mg)をキラル分割(移動相:n-ヘキサン:エタノール=50:50;カラムタイプ:IG(250mm×4.6mm×5μm);流量:1.0mL/分;カラム温度:30℃)して以下の化合物を得た。
化合物Z57-1(16mg、保持時間:7.222分、純度:100%、de値:99.5%):ES-API:[M+H]+=644.2、及び
化合物Z57-2(12mg、保持時間:10.152分、純度:100%、de値:99.3%):ES-API:[M+H]+=644.2;1H NMR(500MHz,DMSO-d6)δ8.36(d,J=4.8Hz,1H),7.88(t,J=7.1Hz,1H),7.56-7.43(m,2H),7.16(d,J=2.9Hz,1H),6.95-6.74(m,1H),6.22(dd,J=16.7,2.2Hz,1H),5.78(dd,J=10.4,2.2Hz,1H),5.02-4.82(m,2H),4.64-4.54(m,1H),4.43(dd,J=52.2,12.1Hz,1H),4.31(s,1H),4.07(d,J=27.8Hz,1H),3.87-3.57(m,2H),2.83-2.66(m,1H),2.53-2.46(m,1H),1.95(d,J=11.2Hz,3H),1.07(d,J=6.8Hz,3H),0.94(d,J=6.6Hz,3H)
実施例58:化合物Z58の調製
化合物Z58を2-クロロフェニルボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=591.1;1H NMR(500MHz,DMSO-d6)δ8.34(d,J=4.8Hz,1H),7.50(d,J=7.9Hz,1H),7.43(td,J=7.7,1.8Hz,1H),7.41-7.36(m,1H),7.16(dd,J=13.4,3.5Hz,2H),6.86(m,1H),6.22(dd,J=16.7,2.4Hz,1H),5.78(dd,J=10.4,2.4Hz,1H),4.90(dd,J=26.6,14.0Hz,2H),4.57(d,J=28.2Hz,1H),4.42(dd,J=52.6,13.4Hz,1H),4.30(s,1H),4.07(d,J=30.3Hz,1H),3.67(s,2H),3.38(dd,J=10.2,5.2Hz,1H),2.84-2.63(m,1H),1.94(d,J=10.6Hz,3H),1.00(m,6.6Hz,6H)
実施例59:化合物Z59の調製
化合物Z59を(5-クロロ-2-フルオロフェニル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=609.0;1H NMR(500MHz,DMSO-d6)δ8.38(d,J=4.8Hz,1H),7.60-7.53(m,1H),7.41-7.33(m,1H),7.23(td,J=5.9,2.7Hz,1H),7.18(dd,J=5.0,2.1Hz,1H),6.94-6.78(m,1H),6.22(dd,J=16.6,2.4Hz,1H),5.78(dd,J=10.4,2.3Hz,1H),4.99-4.82(m,2H),4.59(s,1H),4.42(dd,J=52.5,13.2Hz,1H),4.29(s,1H),4.07(d,J=32.5Hz,1H),3.73(d,J=55.8Hz,2H),3.38(s,1H),2.82-2.68(m,1H),1.95(d,J=11.7Hz,3H),1.13-0.90(m,6H)
実施例60:化合物Z60の調製
化合物Z60を(2,5-ジフルオロフェニル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=593.2;1H NMR(500MHz,DMSO-d6)δ8.37(d,J=4.9Hz,1H),7.42-7.31(m,2H),7.18(dd,J=5.0,2.6Hz,1H),7.03(q,J=7.1Hz,1H),6.86(m,1H),6.22(m,1H),5.78(dd,J=10.4,2.4Hz,1H),5.02-4.80(m,2H),4.66-4.52(m,1H),4.43(m,H),4.29(s,1H),4.19-4.00(m,1H),3.74(d,J=60.6Hz,2H),3.37(s,1H),2.74(m,1H),1.95(d,J=12.1Hz,3H),1.00(dd,J=64.3,6.7Hz,6H)
実施例61:化合物Z61の調製
化合物Z61を(3-クロロ-2-フルオロフェニル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=609.1;1H NMR(500MHz,DMSO-d6)δ8.36(d,J=4.9Hz,1H),7.74-7.63(m,1H),7.29(t,J=7.9Hz,1H),7.20-7.11(m,2H),6.86(m,1H),6.22(dd,J=16.7,2.4Hz,1H),5.78(dd,J=10.3,2.4Hz,1H),5.02-4.79(m,2H),4.66-4.52(m,1H),4.50-4.34(m,1H),4.30(s,1H),4.07(d,J=32.6Hz,1H),3.74(d,J=56.3Hz,2H),3.39(s,1H),2.74(m,1H),1.95(d,J=12.1Hz,3H),1.01(dd,J=62.4,6.7Hz,6H)
実施例62:化合物Z62の調製
化合物Z62を2-イソプロピルベンゼンボロン酸を原材料として実施例46の方法に従って調製した。1H NMR(500MHz,DMSO-d6)δ8.32(d,J=4.2,1H),7.34(d,J=3.1Hz,2H),7.24-7.15(m,1H),7.15-7.08(m,1H),6.96-6.69(m,2H),6.22(dd,J=16.7,2.1Hz,1H),5.78(d,J=12.5Hz,1H),4.98-4.80(m,2H),4.67-4.52(m,1H),4.51-4.34(m,1H),4.29(s,1H),4.19-3.99(m,1H),3.88-3.62(m,2H),3.42-3.25(m,1H),2.79-2.64(m,1H),1.92(d,J=11.6Hz,3H),1.06(s,6H),0.96-0.86(m,3H),0.83-0.70(s,3H);ES-API:[M+H]+=599.2
実施例63:化合物Z63の調製
化合物Z63を3-イソプロピルベンゼンボロン酸を原材料として実施例46の方法に従って調製した。1H NMR(500MHz,DMSO-d6)δ8.41(dd,J=4.7,2.5Hz,1H),7.44(d,J=7.1Hz,1H),7.32-7.26(m,2H),7.24(s,1H),7.18(t,J=4.7Hz,1H),6.95-6.77(m,1H),6.22(d,J=17.0Hz,1H),5.78(d,J=11.7Hz,1H),4.95-4.81(m,2H),4.70-4.55(m,1H),4.50-4.35(m,1H),4.31-4.22(m,1H),4.17-4.00(m,1H),3.79-3.57(m,2H),3.37-3.28(m,1H),2.85-2.71(m,2H),1.94(d,J=7.5Hz,3H),1.12-1.05(m,9H),1.00(t,J=7.1Hz,3H);ES-API:[M+H]+=599.2
実施例64:化合物Z64の調製
化合物Z64を(2-(トリフルオロメトキシ)フェニル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=641.1;1H NMR(500MHz,DMSO-d6)δ8.34(d,J=4.8Hz,1H),7.59-7.54(m,1H),7.44(t,J=7.4Hz,2H),7.27-7.12(m,2H),6.87(d,J=10.2Hz,1H),6.22(dd,J=16.7,2.2Hz,1H),5.78(dd,J=10.4,2.2Hz,1H),4.88(d,J=21.2Hz,2H),4.37(dd,J=53.4,41.9Hz,3H),4.05(s,1H),3.69(s,2H),3.37(d,J=5.7Hz,1H),2.72(s,1H),2.05-1.83(m,3H),1.07(d,J=6.0Hz,3H),0.99-0.78(m,3H)
実施例65:化合物Z65の調製
化合物Z65を(4-クロロ-2-フルオロフェニル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=609.1;1H NMR(500MHz,DMSO-d6)δ8.37(d,J=4.8Hz,1H),7.55(d,J=9.8Hz,1H),7.36(d,J=8.2Hz,1H),7.25-7.12(m,2H),6.94-6.79(m,1H),6.22(dd,J=16.7,2.2Hz,1H),5.78(dd,J=10.4,2.1Hz,1H),4.99-4.82(m,2H),4.58(d,J=15.7Hz,1H),4.42(dd,J=54.0,13.6Hz,1H),4.29(s,1H),4.06(d,J=29.2Hz,1H),3.72(d,J=48.9Hz,2H),3.41-3.34(m,1H),2.74(ddd,J=30.8,13.4,6.7Hz,1H),1.94(d,J=12.5Hz,3H),1.07(d,J=6.7Hz,3H),0.93(d,J=6.6Hz,3H)
実施例66:化合物Z66の調製
化合物Z66を(2-(トリフルオロメチル)フェニル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=625.2;1H NMR(500MHz,DMSO-d6)δ8.31(d,J=4.6Hz,1H),7.75(dd,J=27.0,7.7Hz,2H),7.64(t,J=7.2Hz,1H),7.29(dd,J=24.8,7.5Hz,1H),7.16-7.11(m,1H),6.92-6.79(m,1H),6.22(dd,J=16.7,2.2Hz,1H),5.78(dd,J=10.4,2.2Hz,1H),4.97-4.78(m,2H),4.63-4.28(m,3H),4.05(s,1H),3.75(d,J=63.0Hz,2H),3.37(s,1H),2.78-2.66(m,1H),1.91(t,J=10.0Hz,3H),1.06(dd,J=11.8,5.4Hz,3H),0.96-0.84(m,3H)
実施例67:化合物Z67の調製
化合物Z67を2-クロロ-6-フルオロフェニルボロン酸を原材料として実施例46の方法に従って調製した。1H NMR(500MHz,DMSO-d6)δ8.35(d,J=5.0Hz,1H),7.55-7.47(m,1H),7.44-7.39(m,1H),7.37-7.29(m,1H),7.19-7.14(m,1H),6.93-6.77(m,1H),6.22(d,J=16.6Hz,1H),5.78(d,J=10.9Hz,1H),5.02-4.83(m,2H),4.65-4.38(m,2H),4.37-4.28(m,1H),4.14-3.99(m,1H),3.90-3.65(m,2H),2.81-2.62(m,2H),1.92(t,J=14.8Hz,3H),1.08(d,J=6.6Hz,3H),0.98-0.87(m,3H);ES-API:[M+H]+=609.1
実施例68:化合物Z68の調製
化合物Z68を(2,6-ジフルオロフェニル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=594.2;1H NMR(500MHz,DMSO-d6)δ8.35(d,J=4.8Hz,1H),7.60-7.49(m,1H),7.30-7.11(m,3H),6.96-6.73(m,1H),6.21(dd,J=16.7,2.2Hz,1H),5.78(dd,J=10.4,2.2Hz,1H),5.01-4.80(m,2H),4.66-4.24(m,3H),4.33-4.25(m,1H),4.15-3.95(m,1H),3.81-3.62(m,2H),3.42-3.16(m,1H),2.85-2.62(m,1H),1.92(d,J=16.8Hz,3H),1.07(d,J=6.8Hz,3H),0.92(t,J=6.0Hz,3H)
実施例69:化合物Z69の調製
化合物Z69を(3-フルオロピリド-4-イル)ボロン酸を原材料として実施例46の方法に従って調製した。1H NMR(500MHz,DMSO-d6)δ8.62(s,1H),8.44(d,J=4.8Hz,1H),8.29(d,J=4.9Hz,1H),7.24-7.05(m,2H),6.88-6.69(m,1H),6.14(dd,J=16.7,2.3Hz,1H),5.71(dd,J=10.4,2.3Hz,1H),4.95-4.83(m,2H),4.59-4.18(m,3H),3.98(d,J=28.4Hz,1H),3.67(d,J=56.4Hz,2H),3.30(s,1H),2.75-2.59(m,1H),1.88(d,J=13.2Hz,3H),0.99(d,J=6.7Hz,3H),0.86(d,J=6.7Hz,3H);ES-API:[M+H]+=643.1
実施例70:化合物Z70の調製
化合物Z70を(2-フルオロ-6-(トリフルオロメチル)フェニル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=643.1;1H NMR(500MHz,DMSO-d6)δ8.36(d,J=4.8Hz,1H),7.82(d,J=9.7Hz,1H),7.67(d,J=8.0Hz,1H),7.43(dd,J=14.0,7.0Hz,1H),7.17(s,1H),6.84(dd,J=25.9,14.1Hz,1H),6.22(dd,J=16.7,2.2Hz,1H),5.78(dd,J=10.5,2.2Hz,1H),5.01-4.82(m,2H),4.64-4.25(m,3H),4.07(d,J=29.3Hz,1H),3.74(d,J=56.6Hz,2H),3.37(s,1H),2.83-2.66(m,1H),1.95(d,J=12.1Hz,3H),1.07(d,J=6.7Hz,3H),0.94(d,J=6.6Hz,3H)
実施例71:化合物Z71の調製
化合物Z71を(2,6-ジメチルピリジン-4-イル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=586.2;1H NMR(500MHz,DMSO-d6)δ8.41(d,J=4.5Hz,1H),7.20(s,1H),7.00(s,2H),6.84(dd,J=27.0,14.4Hz,1H),6.22(d,J=16.8Hz,1H),5.78(d,J=10.3Hz,1H),5.01-4.77(m,2H),4.66-4.24(m,3H),4.07(d,J=33.5Hz,1H),3.72(d,J=53.7Hz,2H),3.37(s,1H),2.87-2.67(m,1H),2.38(s,6H),1.93(d,J=9.7Hz,3H),1.12-0.91(m,6H)
実施例72:化合物Z72の調製
工程1:(R)-2-クロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ5α,6,8,9,11,12ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(0.43g、0.82mmol)、N-ブロモスクシンイミド(292mg、1.64mmol)、及びアセトニトリル(5mL)を丸底フラスコに添加した。反応物を70℃で2時間攪拌した。チオ硫酸ナトリウム水溶液を反応溶液に添加した。反応溶液を酢酸エチルで抽出した。有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-50%)で精製して(R)-3-ブロモ-2-クロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(440mg)を収率88%で黄色固体として得た。ES-API:[M+H]+=605.2
工程2:(R)-3-ブロモ-2-クロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(180mg、0.30mmol)、2,4,6-トリメチル-1,3,5,2,4,6-トリオキシトリボラン(113mg、0.90mmol)、Pd(dppf)Cl2(22mg、0.03mmol)、リン酸カリウム(191mg、0.9mmol)、5mLのジオキサン、及び1mLの水を反応フラスコに添加した。反応物を70℃油浴で12時間攪拌し、反応を停止させた。20mLの水を反応溶液に添加した。反応溶液を20mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-60%)で精製して目的生成物:(R)-2-クロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-3-メチル-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(110mg、純度50%)を黄色固体として得た。ES-API:[M+H]+=541.2
工程3:(R)-2-クロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-3-メチル-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(110mg、0.20mmol)、2-フルオロ-6-ヒドロキシフェニルボロン酸(156mg、1.0mmol)、SPhos(8mg、0.02mmol)、SPhos-Pd-G2(14mg、0.02mmol)、リン酸カリウム(127mg、0.6mmol)、5mLのジオキサン、及び1mLの水を反応フラスコに添加した。反応物を80℃油浴で6時間攪拌し、反応を停止させた。20mLの水を反応溶液に添加した。反応溶液を20mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-60%)で精製して目的生成物:(5aR)-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-3-メチル-11-オキソ5α,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(55mg、2工程の収率30%)を黄色固体として得た。ES-API:[M+H]+=617.2
工程4:(5aR)-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-3-メチル-11-オキソ5α,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(55mg、0.089mmol)、1mLのメタノール、及び4M塩酸/ジオキサン溶液(3mL)を丸底フラスコに添加した。反応物を室温で1時間攪拌した。反応の完了をLC-MSで検出した。反応溶液を濃縮して(5aR)-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-3-メチル-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタン[1,2,3-de]ナフタレン-11(12H)-オン(46mg、粗生成物)を黄色固体として得た。ES-API:[M+H]+=517.2
工程5:(5aR)-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-3-メチル-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタン[1,2,3-de]ナフタレン-11(12H)-オン(46mg、0.089mmol)、3mLのジクロロメタン、及びトリエチルアミン(27mg、0.27mmol)を50mL丸底フラスコに添加した。反応物を0℃まで冷却し、無水アクリル酸のジクロロメタン溶液(31mg、0.25mmol、0.5mL)を反応溶液に滴下した。反応物を0℃で10分攪拌した。20mLの飽和炭酸水素ナトリウム水溶液を反応溶液に添加し、反応溶液を10mLのジクロロメタンで3回抽出した。有機相を乾燥及び濃縮した。この粗生成物を分取HPLCで精製してZ72(17.88mg、2工程の収率35%)を白色固体として得た。1H NMR(500MHz,CDCl3)8.69(brs,1H),8.50-8.49(m,1H),7.19-7.13(m,2H),6.61-6.53(m,3H),6.35-6.31(m,1H),5.78(d,J=8Hz,1H),5.01-4.51(m,4H),4.02-3.31(m,5H),2.78-2.76(m,1H),2.05-2.04(m,6H),1.22-1.20(m,3H),1.03-1.00(m,3H);ES-API:[M+H]+=571.2
実施例73:化合物Z73、Z73-1、及びZ73-2の調製
工程1:(R)-2-クロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ5α,6,8,9,11,12ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(1.1g、2.09mmol)、Selectfluor(3.69g、10.4mmol)、及び50mLのアセトニトリルを丸底フラスコに添加した。反応物を80℃で2時間攪拌した。反応溶液を氷水に注ぎ入れた。反応溶液を酢酸エチルで抽出した。有機相を硫酸ナトリウムで乾燥し、濃縮した。この粗生成物を高速シリカゲルカラム(メタノール/ジクロロメタン:0-3%)で精製して(R)-2-クロロ-3-フルオロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(0.6g、純度8%)を得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=545.2
工程2~4:化合物Z73を実施例72の工程3~5の方法に従って調製した。1H NMR(400MHz,DMSO-d6)δ10.25(s,1H),8.36(d,J=3.8Hz,1H),7.23-7.22(m,1H),7.15(d,J=3.8Hz,1H),6.82-6.70(m,1H),6.63-6.61(m,2H),6.22-6.17(m,1H),5.78-5.77(m,1H),4.88-4.80(m,2H),4.46-4.02(m,4H),3.82-3.72(m,2H),3.34-3.32(m,1H),2.77-2.66(m,1H),1.92-1.90(m,3H),1.07-1.06(m,3H),0.94-0.92(m,3H);ES-API:[M+H]+=575.2
工程5:化合物Z73(15mg)をキラル分割(移動相:n-ヘキサン:エタノール=60:40;カラムタイプ:IG(250mm×4.6mm×5μm);流量:1.0mL/分;カラム温度:30℃)して以下の化合物を得た。
化合物Z73-1(5.6mg、保持時間:10.149分、純度:100%、de値:100%):ES-API:[M+H]+=575.2、及び
化合物Z73-2(6.5mg、保持時間:13.445分、純度:100%、de値:99%):ES-API:[M+H]+=575.2
実施例74:化合物Z74の調製
工程1:(R)-2-クロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(1g、1.9mmol)、及びN-クロロスクシンイミド(507mg、3.8mmol)のアセトニトリル(20mL)溶液を窒素保護下、80℃で3時間攪拌した。反応溶液をろ過及び濃縮し、高速シリカゲルカラム(0-10%メタノール/ジクロロメタン)で精製して白色固体:(R)-2,3-ジクロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(1g、収率94%)を得た。ES-API:[M+H]+=561.1
工程2:(R)-2,3-ジクロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(300mg、0.53mmol)、2-フルオロ-6-メトキシフェニルボロン酸(270mg、1.60mmol)、[1,1’-ビス(ジフェニルホスフィノ)フェロセン]パラジウムジクロライド(39mg、0.05mmol)、並びに炭酸カリウム(220mg、1.60mmol)の1,4-ジオキサン(5mL)及び水(1mL)混合液を120℃マイクロ波下、窒素保護下で2時間反応させた。反応溶液をろ過し、酢酸エチル(30mL)で洗浄した。ろ液を飽和食塩水(10mL×3)で洗浄し、得られた有機相を乾燥及び濃縮し、高速シリカカラム(0-10%メタノール/ジクロロメタン)で精製して黄色固体:(5aR)-3-クロロ-2-(2-フルオロ-6-メトキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(220mg、純度63%)を得た。ES-API:[M+H]+=651.2
工程3:(5aR)-3-クロロ-2-(2-フルオロ-6-メトキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(200mg、0.3mmol)、ビニルトリフルオロホウ酸カリウム(120mg、0.9mmol)、クロロ(2-ジシクロヘキシルホスフィノ-2’,6’-ジメトキシ-1,1’-ビフェニル)(2’-アミノ-1,1’-ビフェニル-2-イル)パラジウム(II)(20mg、0.03mmol)、2-ビシクロヘキシルホスフィン-2’,6’-ジメトキシビフェニル(12mg、0.03mmol)、並びにリン酸カリウム(190mg、0.9mmol)の1,4-ジオキサン(2mL)及び水(0.4mL)混合液を150℃マイクロ波下、窒素保護下で2時間反応させた。反応溶液をろ過し、酢酸エチル(30mL)で洗浄した。ろ液を飽和食塩水(10mL×3)で洗浄し、得られた有機相を乾燥及び濃縮し、高速シリカカラム(0-10%メタノール/ジクロロメタン)で精製して黄色固体:(5aR)-2-(2-フルオロ-6-メトキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-3-ビニル-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(120mg、純度35%)を得た。ES-API:[M+H]+=643.3
工程4:17%三臭化ほう素のジクロロメタン溶液(2mL)を(5aR)-2-(2-フルオロ-6-メトキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-3-ビニル-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(120mg、0.19mmol)のジクロロメタン(2mL)溶液に氷浴下で添加し、室温で3時間攪拌した。反応溶液をメタノール(5mL)で急冷し、飽和炭酸水素ナトリウム溶液(20mL)に注ぎ入れ、ジクロロメタン(20mL×3)で抽出し、有機相を乾燥及び濃縮して黄色固体:(5aR)-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-3-ビニル-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(100mg)を得た。ES-API:[M+H]+=529.2
工程5:N,N-ジイソプロピルエチルアミン(74mg、0.57mmol)を(5aR)-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-3-ビニル-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(100mg、0.19mmol)のジクロロメタン(2mL)溶液に氷浴下で添加した。反応溶液を清澄化してから、無水アクリル酸(17mg、0.19mmol)を滴下して5分攪拌した。反応溶液を飽和炭酸水素ナトリウム溶液(5mL)で洗浄した。有機相を乾燥及び濃縮し、分取HPLC(炭酸水素アンモニウム系)で精製して白色固体Z74(2.4mg、純度94%、収率10%)を得た。ES-API:[M+H]+=583.2
実施例75:化合物Z75の調製
化合物Z75を実施例34の工程2~3の方法に従って調製した。ES-API:[M+H]+=605.2
実施例76:化合物Z76、Z76-1、及びZ76-2の調製
化合物Z76を(2,4-ジフルオロフェニル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=593.1
化合物Z76を調製及びキラル分割(カラムタイプ:IG、250mm×4.6mm×5μm、移動相:n-ヘキサン:エタノール=40:60、流量:1mL/分、カラム温度=30℃)して以下の化合物を得た。
化合物Z76-1(50.7mg、ピーク1、保持時間8.084分、収率:18%):白色固体;ES-API:[M+H]+=593.1;1H NMR(500MHz,DMSO-d6)δ8.37(d,J=4.8Hz,1H),7.35(td,J=10.1,2.4Hz,1H),7.28-7.11(m,3H),6.96-6.76(m,1H),6.22(dd,J=16.7,2.3Hz,1H),5.78(dd,J=10.4,2.2Hz,1H),4.97-4.82(m,2H),4.65-4.23(m,3H),4.07(d,J=20.5Hz,1H),3.71(dd,J=35.3,22.8Hz,2H),3.37(s,1H),2.70(dt,J=13.4,6.7Hz,1H),1.96(s,3H),1.06(d,J=6.7Hz,3H),0.93(d,J=6.7Hz,3H)、及び
化合物Z76-2(53.4mg、ピーク2、保持時間11.484分、収率:19%):白色固体;ES-API:[M+H]+=593.1;1H NMR(500MHz,DMSO-d6)δ8.37(d,J=4.8Hz,1H),7.35(td,J=10.2,2.4Hz,1H),7.16(dd,J=9.7,3.5Hz,3H),6.95-6.76(m,1H),6.22(dd,J=16.7,2.3Hz,1H),5.78(dd,J=10.4,2.3Hz,1H),5.00-4.79(m,2H),4.64-4.26(m,3H),4.07(d,J=31.9Hz,1H),3.70(dd,J=40.4,28.8Hz,2H),3.38(s,1H),2.77(dt,J=13.5,6.8Hz,1H),1.93(s,3H),1.06(d,J=6.7Hz,3H),0.93(d,J=6.7Hz,3H)
実施例77:化合物Z77、Z77-1、及びZ77-2の調製
化合物Z77を(2,3-ジフルオロフェニル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=593.1
化合物Z77を調製及びキラル分割(カラムタイプ:IG、250mm×4.6mm×5μm、移動相:n-ヘキサン:エタノール=40:60、流量:1mL/分、カラム温度=30℃)して以下の化合物を得た。
化合物Z77-1(45.3mg、ピーク1、保持時間7.568分、収率:24%):白色固体;1H NMR(500MHz,DMSO-d6)δ8.37(d,J=4.8Hz,1H),7.54(dt,J=17.2,5.6Hz,1H),7.27(dd,J=12.5,7.7Hz,1H),7.17(d,J=4.9Hz,1H),7.05-6.77(m,2H),6.24(s,1H),5.78(dd,J=10.4,2.2Hz,1H),4.90(d,J=4.6Hz,2H),4.65-4.26(m,3H),4.06(d,J=29.1Hz,1H),3.72(dd,J=36.9,24.2Hz,2H),3.41-3.36(m,1H),2.70(dt,J=13.4,6.6Hz,1H),1.96(s,3H),1.06(d,J=6.7Hz,3H),0.94(d,J=6.7Hz,3H)、及び
化合物Z77-2(37.8mg、ピーク2、保持時間9.781分、収率:20%):白色固体;1H NMR(500MHz,DMSO-d6)δ8.37(d,J=4.8Hz,1H),7.52(dd,J=17.1,8.3Hz,1H),7.17(d,J=5.2Hz,2H),7.07-6.75(m,2H),6.22(dd,J=16.7,2.3Hz,1H),5.85-5.72(m,1H),5.03-4.81(m,2H),4.69-4.26(m,3H),4.07(d,J=32.9Hz,1H),3.71(dd,J=40.6,28.9Hz,2H),3.36(d,J=10.8Hz,1H),2.78(dt,J=13.3,6.6Hz,1H),1.93(s,3H),1.06(d,J=6.7Hz,3H),0.93(d,J=6.7Hz,3H)
実施例78:化合物Z78の調製
化合物Z78を2-メチル-3-(4,4,5,5-テトラメチル-1,3,2-ジオキサボラン-2-イル)ピリジンを原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=572.2;1H NMR(500MHz,DMSO-d6)δ8.46(d,J=3.6Hz,1H),8.35(d,J=4.8Hz,1H),7.53-7.46(m,1H),7.27(dd,J=7.7,4.9Hz,1H),7.17(d,J=4.9Hz,1H),6.92-6.80(m,1H),6.22(dd,J=16.7,2.3Hz,1H),5.79(dd,J=10.4,2.3Hz,1H),4.99-4.79(m,2H),4.71-4.24(m,3H),4.08(d,J=32.5Hz,1H),3.88-3.62(m,2H),3.33-3.29(m,1H),2.78-2.65(m,1H),2.10(s,3H),1.95(d,J=12.3Hz,3H),1.10-1.00(m,3H),0.89(dd,J=6.6,3.6Hz,3H)
実施例79:化合物Z79の調製
化合物Z79を2-クロロ-フェニルボロン酸を原材料として実施例72の工程3~5の方法に従って調製した。ES-API:[M+H]+=576.3;1H NMR(500MHz,DMSO-d6)δ8.36(d,J=4.8Hz,1H),7.54(d,J=8.0Hz,1H),7.47(td,J=7.8,1.6Hz,1H),7.40(dd,J=7.5,6.6Hz,1H),7.27-7.21(m,1H),7.17(d,J=4.8Hz,1H),6.92-6.77(m,1H),6.22(dd,J=16.7,2.1Hz,1H),5.78(dd,J=10.4,2.3Hz,1H),4.97-4.79(m,2H),4.58(s,1H),4.51-4.26(m,2H),4.05(s,1H),3.93-3.66(m,2H),2.78(dt,J=13.6,6.8Hz,1H),2.73-2.60(m,1H),1.95(d,J=17.0Hz,3H),1.07(d,J=6.8Hz,3H),0.94(dd,J=6.4,4.8Hz,3H)
実施例80:化合物Z80の調製
化合物Z80を実施例46の方法に従って調製した。ES-API:[M+H]+=594.2;1H NMR(500MHz,DMSO-d6)δ8.35(d,J=4.8Hz,1H),7.62-7.47(m,1H),7.30-7.08(m,3H),6.94-6.75(m,1H),6.22(dd,J=16.7,2.3Hz,1H),5.78(dd,J=10.4,2.2Hz,1H),4.99-4.78(m,2H),4.49-4.43(m,2H),4.33-4.26(m,2H),4.16-3.95(m,1H),3.82-3.61(m,2H),2.88-2.63(m,1H),1.92(d,J=17.0Hz,3H),1.07(d,J=6.8Hz,3H),0.91(t,J=6.0Hz,3H)
実施例81:化合物Z81の調製
化合物Z81を4-メチル-3-(4,4,5,5-テトラメチル-1,3,2-ジオキサボラン-2-イル)ピリジンを原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=572.2
実施例82:化合物Z82、Z82-1、及びZ82-2の調製
化合物Z82を(3-クロロ-2-フルオロフェニル)ボロン酸を原材料として実施例46の方法に従って調製し、キラル分割(カラムタイプ:Chiralpak IG 250mm×4.6mm×5μm;移動相:n-ヘキサン:エタノール=50:50;流量:1mL/分;カラム温度=30℃)して以下の化合物を得た。
化合物Z82-1(13mg、保持時間:9.805分;ピーク1、収率4.1%):1H NMR(400MHz,DMSO-d6)δ8.37(d,J=4.8Hz,1H),7.68(t,J=6.8Hz,1H),7.28(d,J=8.2Hz,1H),7.16(dd,J=13.4,6.5Hz,2H),6.84(d,J=14.1Hz,1H),6.22(dd,J=16.4,2.1Hz,1H),5.80-5.77(m,1H),4.99-4.81(m,2H),4.65-4.25(m,3H),4.15-3.97(m,1H),3.75-3.48(m,2H),3.32(s,1H),2.82-2.75(m,1H),1.93(s,3H),,1.07(d,J=6.7Hz,3H),0.94(d,J=6.7Hz,3H)、及び
化合物Z82-2(8mg、保持時間:13.724分;ピーク2、収率2.5%)
実施例83:化合物Z83、Z83-1、及びZ83-2の調製
化合物Z83を(2-フルオロ-6-メトキシフェニル)ボロン酸を原材料として実施例72の工程3~5の方法に従って調製し、キラル分割(カラムタイプ:Chiralpak IC 250mm×4.6mm×5μm;移動相:アセトニトリル:イソプロパノール=60:40;流量:1mL/分;カラム温度=30℃)して化合物Z83-1(8mg、保持時間:5.005分;ピーク1、収率2.6%)及び化合物Z83-2(8mg、保持時間:6.658分;ピーク2、収率2.6%)を得た。
実施例84:化合物Z84の調製
化合物Z84を実施例72の工程3~5の方法に従って調製した。ES-API:[M+H]+=559.2
実施例85:化合物Z85の調製
化合物Z85を実施例72の工程3~5の方法に従って調製した。ES-API:[M+H]+=575.2;1H NMR(500MHz,DMSO-d6)δ10.16(s,1H),8.36(d,J=4.8Hz,1H),7.25(dd,J=15.4,8.2Hz,1H),7.16(d,J=4.9Hz,1H),6.99-6.78(m,1H),6.74-6.63(m,2H),6.21(dd,J=16.7,2.3Hz,1H),5.78(dd,J=10.4,2.3Hz,1H),4.96-4.77(m,2H),4.60(s,1H),4.39(dd,J=50.2,19.6Hz,2H),4.05(s,1H),3.75(dd,J=38.5,27.0Hz,2H),3.38(s,1H),2.83-2.63(m,1H),1.92(d,J=14.2Hz,3H),1.07(d,J=6.7Hz,3H),0.94(t,J=7.1Hz,3H)
実施例86:化合物Z86の調製
化合物Z86を(5-メチル-1H-インダゾール-4-イル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=611.2;1H NMR(400MHz,DMSO-d6)δ13.08(s,1H),8.28(t,J=4.5Hz,1H),7.45(t,J=7.8Hz,2H),7.25-7.01(m,2H),6.90(d,J=26.1Hz,1H),6.23(dd,J=16.7,2.1Hz,1H),5.79(dd,J=10.5,2.2Hz,1H),5.00-4.81(m,2H),4.67-4.29(m,3H),4.08(s,1H),3.71(s,2H),3.38(d,J=10.1Hz,1H),2.84-2.70(m,1H),1.96(dd,J=17.1,12.1Hz,6H),1.10-0.72(m,6H)
実施例87:化合物Z87、Z87-1、及びZ87-2の調製
化合物Z87を2-フルオロフェニルボロン酸を原材料として実施例46の方法に従って調製した(ES-API:[M+H]+=575.2)。290mgの化合物Z87をキラム分割(カラムタイプ:IG、250mm×4.6mm×5μm、移動相:n-ヘキサン:エタノール=40:60、流量:1mL/分、カラム温度=30℃)して以下の化合物を得た。
Z87-1(93.98mg、ピーク1、保持時間8.384分、収率:32.4%):白色固体;1H NMR(500MHz,DMSO-d6)δ8.36(d,J=4.9Hz,1H),7.70-7.42(m,2H),7.37-7.12(m,2H),7.05-6.76(m,2H),6.21(dd,J=16.6,2.4Hz,1H),5.77(dd,J=10.4,2.4Hz,1H),5.03-4.83(m,2H),4.69-4.22(m,3H),4.05(d,J=29.7Hz,1H),3.87-3.60(m,2H),3.39-3.34(m,1H),2.70(p,J=6.7Hz,1H),1.95(s,3H),1.06(d,J=6.7Hz,3H),0.94(d,J=6.7Hz,3H)、及び
化合物Z87-2(95.37mg、ピーク2、保持時間11.618分、収率:32.7%):白色固体;1H NMR(400MHz,DMSO-d6)δ8.29(d,J=4.8Hz,1H),7.46-7.35(m,1H),7.26-7.04(m,4H),6.89-6.69(m,1H),6.14(dd,J=16.7,2.3Hz,1H),5.71(dd,J=10.4,2.2Hz,1H),4.94-4.73(m,2H),4.60-4.15(m,3H),4.11-3.92(m,1H),3.76-3.50(m,2H),3.39-3.34(m,1H),2.71(dt,J=13.5,6.8Hz,1H),1.86(s,3H),1.06(d,J=6.7Hz,3H),0.93(d,J=6.7Hz,3H)
実施例88:化合物Z88、Z88-1、及びZ88-2の調製
化合物Z88を(2-フルオロ-6-ヒドロキシフェニル)ボロン酸を原材料として実施例46の方法に従って調製した(ES-API:[M+H]+=592.2)。化合物Z88を調製及びキラル分割(カラムタイプ:IG、250mm×4.6mm×5μm、移動相:n-ヘキサン:エタノール=65:35、流量:1mL/分、カラム温度=30℃)して化合物Z88-1(4.83mg、ピーク1、保持時間10.605分、収率:10.7%)を白色固体として、及び化合物Z88-2(13.64mg、ピーク2、保持時間14.649分、収率:30.3%)を白色固体として得た。
実施例89:化合物Z89の調製
工程1:モルホリン(17.4mg、0.2mmol)及び60%NaH(12mg、0.3mmol)を乾燥DMF(3mL)に氷水浴下で溶解し、10分攪拌した。(R)-2,3-ジクロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(56mg、0.1mmol)をゆっくりと添加し、反応物を室温まで上げ、1時間反応させた。反応溶液を氷水に注ぎ入れ、水及び飽和食塩水で洗浄し、濃縮した。カラムクロマトグラフィーで精製して(R)3-クロロ-2-(モルホリン)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(30mg、収率49%)を得た。ES-API:[M+H]+=612.3
工程2~3:化合物Z89を実施例34の対応する工程に従って調製した。ES-API:[M+H]+=566.2
実施例90:化合物Z90の調製
化合物Z90を(2-クロロフェニル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=592.2;1H NMR(500MHz,DMSO-d6)δ8.27(d,J=4.8Hz,1H),7.44(s,0H),7.41-7.26(m,2H),7.09(t,J=6.7Hz,2H),6.89-6.64(m,1H),6.14(dd,J=16.8,2.3Hz,1H),5.71(dd,J=10.4,2.3Hz,1H),4.83(dd,J=23.8,12.6Hz,2H),4.61-4.35(m,2H),4.33-4.13(m,1H),3.97(s,1H),3.59(s,2H),3.34-3.21(m,1H),2.67(d,J=31.0Hz,1H),1.87(d,J=10.4Hz,3H),1.00(d,J=6.6Hz,3H),0.86(d,J=6.4Hz,3H)
実施例91:化合物Z91、Z91-1、及びZ91-2の調製
化合物Z91を(3-クロロ-2-フルオロフェニル)ボロン酸を原材料として実施例46の方法に従って調製した(ES-API:[M+H]+=610.3)。化合物Z91(274mg、0.45mmol)をキラル分割(移動相:n-ヘキサン-エタノール-40-60;カラムタイプ:IG(250mm×4.6mm×5μm);流量:1.0mL/分;カラム温度:30℃)して以下の化合物を得た。
化合物Z91-1(103mg、保持時間:8.228分、純度:99%、de値:99%):ES-API:[M+H]+=610.3、及び
化合物Z91-2(109mg、保持時間:10.820分、純度:99%、de値:99%):ES-API:[M+H]+=610.3;1H NMR(500MHz,DMSO-d6)δ8.36(d,J=4.8Hz,1H),7.68(t,J=7.4Hz,1H),7.29(t,J=8.0Hz,1H),7.24-7.10(m,2H),7.06-6.71(m,1H),6.22(dd,J=16.8,2.0Hz,1H),5.78(dd,J=10.4,2.0Hz,1H),5.07-4.75(m,2H),4.70-4.22(m,3H),4.16-3.98(m,1H),3.84-3.57(m,2H),3.40-3.29(m,1H),2.89-2.63(m,1H),1.94(d,J=12.0Hz,3H),1.06(d,J=6.7Hz,3H),0.94(d,J=6.6Hz,3H)
実施例92:化合物Z92の調製
工程1:4-イソプロピル-2-メチルピリジン-3-アミン(1g、6.7mmol)及び30mLのテトラヒドロフランを250mL丸底フラスコに添加した。系を0℃に冷却した後、ナトリウムビス(トリメチルシリル)アミド(8.3mL、2Mテトラヒドロフラン溶液、16.5mmol)を反応溶液に滴下した。滴下終了後、反応物を0℃で10分攪拌した。次に4,6-ジクロロ-2-フルオロニコチンアミド(1.4g、6.7mmol)のテトラヒドロフラン(30mL)溶液を反応溶液に滴下した。滴下終了後、反応物を0℃で20分攪拌した。反応終了後、反応溶液を氷水に注ぎ入れた。反応溶液を酢酸エチルで抽出した。有機相を1M塩酸、飽和炭酸水素ナトリウム水溶液、及び飽和食塩水で洗浄した。有機相を無水硫酸ナトリウムで乾燥し、ろ過し、ろ液を濃縮乾固して生成物:4,6-ジクロロ-2-(((4-イソプロピル-2-メチルピリジン-3-イル)アミノ)ニコチンアミド(2.1g、90%)を黄色固体として得た。ES-API:[M+H]+=340.1
工程2:4,6-ジクロロ-2-(((4-イソプロピル-2-メチルピリジン-3-イル)アミノ)ニコチンアミド(2.1g、6.0mmol)及び80mLの乾燥テトラヒドロフランを250mL三口丸底フラスコに添加した。氷浴下で0~5℃まで冷却し、水素化ナトリウム(1.2g、30mmol)を数回に分けて添加し、この温度で10分間反応させた。CDI(1.9g、12mmol)のテトラヒドロフラン(40mL)懸濁液を上記溶液に滴下した後、この温度で20分間反応させた。反応の完了をLCMSで検出した。反応溶液を約150mLの氷水に注ぎ入れ、pHを3M塩酸で約4に調整した。反応溶液を酢酸エチルで抽出した。有機相を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥し、ろ過した。ろ液を濃縮乾固して5,7-ジクロロ-1-(4-イソプロピル-2-メチルピリジン-3-イル)ピリジン[2,3-d]ピリミジン-2,4(1H,3H)-ジオン(1.49g)を黄色固体として得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=366.2
工程3:(R)-3-(ヒドロキシメチル)ピペラジン-1-カルボン酸tert-ブチル(885mg、4.1mmol)を60%水素化ナトリウム(676mg、16.9mmol)のテトラヒドロフラン(20mL)懸濁液に0℃で添加した。そこに5,7-ジクロロ-1-(4-イソプロピル-2-メチルピリジン-3-イル)ピリジン[2,3-d]ピリミジン-2,4(1H,3H)-ジオン(1.49g、4.1mmol)のテトラヒドロフラン(20mL)溶液を滴下した。反応物を0℃で30分攪拌した。反応の完了をLC-MSで検出した。反応溶液を100mLの氷水に注ぎ入れた。反応溶液を酢酸エチルで3回抽出した。有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:20-100%)で精製して(S)-3-(((7-クロロ-1-(4-イソプロピル-2-メチルピリジン-3-イル)-2,4-ジオキソ-1,2,3,4-テトラヒドロピリド[2,3-d]ピリミジン-5-イル)オキシ)メチルピペラジン-1-ギ酸tert-ブチル(1.34g、60%)を黄色固体として得た。ES-API:[M+H]+=546.3
工程4:(S)-3-(((7-クロロ-1-(4-イソプロピル-2-メチルピリジン-3-イル)-2,4-ジオキソ-1,2,3,4-テトラヒドロピリド[2,3-d]ピリミジン-5-イル)オキシ)メチルピペラジン-1-ギ酸tert-ブチル(1.34g、2.45mmol)、ジイソプロピルエチルアミン(20mL)、ジクロロメタン(30mL)を丸底フラスコに添加した。そこにプロピルホスホン酸無水物溶液(20mL、50%w/w酢酸エチル溶液)を滴下した。反応物を室温で30分攪拌した。反応の完了をLC-MSで検出した。50mLのジクロロメタンを反応物に添加し、有機相を30mLの塩酸(1M)及び100mLの飽和炭酸水素ナトリウム水溶液で洗浄した。有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(メタノール/ジクロロメタン:0-3%)で精製して(R)-2-クロロ-12-(4-イソプロピル-2-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(903mg、70%)を得た。ES-API:[M+H]+=527.3
工程5~8:化合物Z92を実施例73の方法に従って調製した。ES-API:[M+H]+=575.2
実施例93:化合物Z93の調製
工程1:2,4-ジクロロ-6-フルオロ安息香酸(15g、71.4mmol)を200mLのジクロロメタンに溶解し、0℃まで冷却し、塩化オキサリル(12mL、142.9mmol)を添加した。30分かけて滴下を完了させた後、DMF(0.5mL)を滴下し、反応物を室温まで上げ、1時間反応させた。反応終了後、反応溶液を濃縮し、150mLのジクロロメタンで希釈し、0℃まで冷却し、20mLのアンモニア水にゆっくりと滴下し、2時間攪拌した。反応終了後、反応溶液を濃縮し、酢酸エチルでスラリー化し、ろ過して粗生成物:2,4-ジクロロ-6-フルオロベンズアミド(13.5g、収率90%)を得た。ES-API:[M+H]+=208.9
工程2:4,6-ジシクロプロピルピリミジン-5-アミン(3.56g、20.3mmol)を60mLのテトラヒドロフランに溶解し、LiHMDS(38.2mL、38.2mmol)を氷水浴下、窒素保護下で滴下し、30分攪拌した。2,4,6-ニコチンアミド(4g、19.1mmol)を30mLのテトラヒドロフランに溶解したものを上記反応溶液に添加し、ゆっくりと室温まで上げ、2時間反応させ、氷水浴下で冷却した。希塩酸を滴下してpHを7~8にした。反応溶液を酢酸エチルで抽出し、濃縮して灰色固体を得た。それを酢酸エチルでスラリー化し、ろ過して粗生成物:4,6-ジクロロ-2-(((4,6-ジシクロプロピルピリミジン-5-イル)アミノ)ニコチンアミド(6.5g、収率85%)を得た。ES-API:[M+H]+=364.0
工程3:4,6-ジクロロ-2-(((4,6-ジシクロプロピルピリミジン-5-イル)アミノ)ニコチンアミド(6.5g、17.9mmol)を120mLのテトラヒドロフランに溶解し、60%NaH(3.6g、89.5momL)氷水浴下で添加し、15分攪拌した。次にCDI(4.35g、26.6mmol)を添加し、氷水浴下で1時間反応させると、原材料が消失した。反応溶液を氷水に注ぎ入れ、pHを希塩酸で7~8に調整した。反応溶液を酢酸エチルで抽出し、水及び飽和食塩水で順に洗浄し、減圧下で濃縮して5,7-ジクロロ-1-(4,6-ジシクロプロピルピリミジン-5-イル)ピリド[2,3-d]ピリミジン-2,4(1H,3H)-ジオン(5.2g、収率74%)を得た。ES-API:[M+H]+=390.0
工程4:(R)-3-(ヒドロキシメチル)ピペラジン-1-カルボン酸tert-ブチル(2.83g、8.48mmol)をテトラヒドロフランに溶解し、60%NaH(1.02g、25.4mmL)を氷水浴下で添加し、10分攪拌した。5,7-ジクロロ-1-(4,6-ジシクロプロピルピリミジン-5-イル)ピリド[2,3-d]ピリミジン-2,4(1H,3H)-ジオン(4.3g、8.48mmol)を添加し、20分攪拌した。反応終了後、反応溶液を氷水に注ぎ入れ、酢酸エチルで3回抽出し、有機相を合わせて乾燥し、減圧下で濃縮した。カラムクロマトグラフィー(メタノール/ジクロロメタン:0~10%)で精製して(R)-3-((((7-クロロ-1-(4,6-ジシクロプロピルピリミジン-5-イル)-2,4-ジオキソ-1,2,3,4-テトラヒドロピリジン[2,3-d]ピリミジン-5-イル)オキシ)メチル)ピペラジン-1-ギ酸tert-ブチル(5.7g、収率92%)を得た。ES-API:[M+H]+=570.2
工程5:(R)-3-((((7-クロロ-1-(4,6-ジシクロプロピルピリミジン-5-イル)-2,4-ジオキソ-1,2,3,4-テトラヒドロピリジン[2,3-d]ピリミジン-5-イル)オキシ)メチル)ピペラジン-1-ギ酸tert-ブチル(5.7g、10.0mmol)をジクロロメタンに溶解し、ジイソプロピルエチルアミン(15.5g、120.0mmL)を室温で添加し、5分攪拌した。1-プロピルホスホン酸無水物(19g、30.0mmol)を添加し、20分攪拌した。反応終了後、反応溶液を氷水に注ぎ入れ、酢酸エチルで3回抽出し、有機相を合わせて飽和食塩水で洗浄し、乾燥し、減圧下で濃縮した。カラムクロマトグラフィー(メタノール/ジクロロメタン:0~10%)で精製して(R)2-クロロ-12-(4,6-ジシクロプロピルピリミジン-5-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(3.8g、収率69%)を得た。ES-API:[M+H]+=552.2
工程6:(R)-2-クロロ-12-(4,6-ジシクロプロピルピリミジン-5-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(550mg、1.0mmol)を10mLのアセトニトリルに溶解し、N-クロロスクシンイミド(266mg、2.0mmol)を添加し、80℃まで加熱し、1時間反応させ、室温まで冷却し、ろ過し、水及び飽和食塩水で洗浄し、濃縮した。カラムクロマトグラフィーで精製して(R)-2,3-ジクロロ-12-(4,6-ジシクロプロピルピリミジン-5-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(530mg、収率90%)を得た。ES-API:[M+H]+=586.2
工程7:(R)-2,3-ジクロロ-12-(4,6-ジシクロプロピルピリミジン-5-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(180mg、0.307mmol)、(2-フルオロフェニル)ボロン酸(215mg、1.54mmol)、SPhos-Pd-G2(82mg、0.114mmol)、及び炭酸カリウム(472mg、3.42mmol)を8mLのジオキサン及び2mLの水に溶解した。窒素置換し、80℃で1時間反応させた。室温まで冷却し、ろ過し、酢酸エチルで希釈し、水及び飽和食塩水で洗浄し、濃縮した。カラムクロマトグラフィーで精製して(R)3-クロロ-12-(4,6-ジシクロプロピルピリミジン-5-イル)-2-(2-フルオロフェニル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(120mg、収率60%)を得た。ES-API:[M+H]+=646.2
工程8:(R)-3-クロロ-12-(4,6-ジシクロプロピルピリミジン-5-イル)-2-(2-フルオロフェニル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(120mg、0.186mmol)を10mLのジクロロメタンに溶解し、5mLのトリフルオロ酢酸を室温でゆっくり滴下し、5時間反応させた後、10mLのジクロロメタンを添加した。反応溶液を減圧下で濃縮して(R)-3-クロロ-12-(4,6-ジシクロプロピルピリミジン-5-イル)-2-(2-フルオロフェニル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキサ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-1-オン(180mg、粗生成物)を得た。これを直接次の工程で使用した。ES-API:[M+H]+=546.2
工程9:(R)-3-クロロ-12-(4,6-ジシクロプロピルピリミジン-5-イル)-2-(2-フルオロフェニル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキサ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-1-オン(180mg、粗生成物)をジクロロメタンに溶解し、ジイソプロピルエチルアミン(255mg、1.98mmol)及び無水アクリル酸(83mg、0.66mmol)を氷水浴下で滴下し、氷浴下で10分間反応させた。反応終了後、反応溶液を室温で減圧下で濃縮し、分取HPLCで精製して化合物Z93(40mg、収率27%)を得た。ES-API:[M+H]+=600.2;1H NMR(500MHz,DMSO-d6)δ8.62(s,1H),7.48-7.41(m,1H),7.27-7.19(m,2H),7.16(m,1H),6.79(m,1H),6.14(dd,J=16.7,2.4Hz,1H),5.71(dd,J=10.4,2.3Hz,1H),4.85(t,J=13.3Hz,1H),4.77(dd,J=12.8,5.2Hz,1H),4.52(d,J=23.8Hz,1H),4.42(d,J=13.1Hz,1H),4.22(s,1H),3.99(d,J=31.2Hz,1H),3.78-3.62(m,1H),3.62-3.52(m,1H),3.25(d,J=5.8Hz,1H),1.73(m,1H),1.65(s,1H),1.05-0.65(m,8H)
実施例94:化合物Z94の調製
化合物Z94を(2-ヒドロキシ-6-フルオロフェニル)ボロン酸を原材料として実施例93の工程7~9の方法に従って調製した。ES-API:[M+H]+=617.1;1H NMR(500MHz,DMSO-d6)δ10.06(d,J=4.7Hz,1H),8.67(s,1H),7.25-7.21(m,1H),6.92-6.80(m,1H),6.71(dd,J=8.3,4.3Hz,1H),6.66(m,1H),6.21(dd,J=16.7,2.4Hz,1H),5.78(dd,J=10.3,2.4Hz,1H),4.96-4.80(m,2H),4.60(d,J=20.4Hz,1H),4.43(d,J=59.7Hz,1H),4.27(s,1H),4.04(s,1H),3.83-3.59(m,2H),3.33-3.31(m,1H),1.73(d,J=48.5Hz,2H),1.02-0.73(m,8H)
実施例95:化合物Z95、Z95-1、及びZ95-2の調製
工程1:4-イソプロピル-6-メチルピリミジン-5-アミン(2.8g、19.1mmol)及び45mLのテトラヒドロフランを250mL丸底フラスコに添加した。系を0℃に冷却した後、ナトリウムビス(トリメチルシリル)アミド(28.5mL、2Mテトラヒドロフラン溶液、57.3mmol)を反応溶液に滴下した。滴下終了後、反応物を0℃で10分攪拌した。次に4,6-ジクロロ-2-フルオロニコチンアミド(4g、19.1mmol)のテトラヒドロフラン(15mL)溶液を反応溶液に滴下した。滴下終了後、反応物を0℃で20分攪拌した。反応終了後、反応溶液を氷水に注ぎ入れた。反応溶液を酢酸エチルで抽出した。有機相を1M塩酸、飽和炭酸水素ナトリウム水溶液、及び飽和食塩水で洗浄した。有機相を無水硫酸ナトリウムで乾燥し、ろ過し、ろ液を濃縮乾固して生成物:4,6-ジクロロ-2-(((4-イソプロピル-6-メチルピリミジン-5-イル)アミノ)ニコチンアミド(5.7g、87%)を黄色固体として得た。ES-API:[M+H]+=340.1
工程2:4,6-ジクロロ-2-(((4-イソプロピル-6-メチルピリミジン-5-イル)アミノ)ニコチンアミド(5.7g、16.7mmol)及び80mLの乾燥テトラヒドロフランを250mL三口丸底フラスコに添加し、氷浴下で0~5℃まで冷却し、水素化ナトリウム(3g、75.1mmol)を数回に分けて添加し、この温度で5分間反応させた。CDI(4g、24.7mmol)のテトラヒドロフラン(40mL)懸濁液を上記溶液に滴下した後、この温度で10分間反応させた。反応の完了をLCMSで検出した。反応溶液を約150mLの氷水に注ぎ入れ、pHを3M塩酸で約4に調整した。反応溶液を酢酸エチルで抽出した。有機相を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥し、ろ過した。ろ液を濃縮乾固して5,7-ジクロロ-1-(4-イソプロピル-6-メチルピリミジン-5-イル)ピリド[2,3-d]ピリミジン-2,4(1H,3H)-ジオン(4.5g、純度70%)を黄色固体として得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=366.1
工程3:(R)-3-(ヒドロキシメチル)ピペラジン-1-カルボン酸tert-ブチル(3.2g、14.8mmol)を60%水素化ナトリウム(1.5g、36.9mmol)のテトラヒドロフラン(60mL)懸濁液に0℃で添加した。そこに5,7-ジクロロ-1-(4-イソプロピル-6-メチルピリミジン-5-イル)ピリド[2,3-d]ピリミジン-2,4(1H,3H)-ジオン(4.5g、12.3mmol)のテトラヒドロフラン(20mL)溶液を滴下した。反応物を0℃で30分攪拌した。反応の完了をLC-MSで検出した。反応溶液を100mLの氷水に注ぎ入れた。反応溶液を酢酸エチルで3回抽出した。有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:20-100%)で精製して(R)-3-((((7-クロロ-1-(4-イソプロピル-6-メチルピリミジン-5-イル)-2,4-ジオキソ-1,2,3,4-テトラヒドロピリジニル[2,3-d]ピリミジン-5-イル)オキシ)メチルピペラジン-1-ギ酸tert-ブチル(3g、44%)を黄色固体として得た。ES-API:[M+H]+=546.3
工程4:(R)-3-((((7-クロロ-1-(4-イソプロピル-6-メチルピリミジン-5-イル)-2,4-ジオキソ-1,2,3,4-テトラヒドロピリジニル[2,3-d]ピリミジン-5-イル)オキシ)メチルピペラジン-1-ギ酸tert-ブチル(3g、5.5mmol)、ジイソプロピルエチルアミン(10mL)、ジクロロメタン(30mL)を丸底フラスコに添加した。そこに1-プロピルホスホン酸無水物溶液(10mL、50%w/w酢酸エチル溶液)を滴下した。反応物を室温で30分攪拌した。反応の完了をLC-MSで検出した。反応物に50mLのジクロロメタンを添加し、有機相を30mLの塩酸(1M)及び100mLの飽和炭酸水素ナトリウム水溶液で洗浄した。有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(メタノール/ジクロロメタン:0-3%)で精製して(R)-2-クロロ-12-(4-イソプロピル-6-メチルピリミジン-5-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタン[1,2,3-de]-ナフタレン-7(5H)-カルボン酸tert-ブチル(2.3g、79%)を得た。ES-API:[M+H]+=528.3
工程5:(R)-2-クロロ-12-(4-イソプロピル-6-メチルピリミジン-5-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタン[1,2,3-de]-ナフタレン-7(5H)-カルボン酸tert-ブチル(500mg、0.9mmol)、N-クロロスクシンイミド(252mg、1.9mmol)、及びアセトニトリル(10mL)を丸底フラスコに添加した。反応物を80℃で2時間攪拌した。チオ硫酸ナトリウム水溶液を反応溶液に添加した。反応溶液を酢酸エチルで抽出した。有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(メタノール/ジクロロメタン:0-3%)で精製して生成物:(R)-2,3-ジクロロ-12-(4-イソプロピル-6-メチルピリミジン-5-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(470mg、88%)を黄色固体として得た。ES-API:[M+H]+=562.2
工程6:(R)-2,3-ジクロロ-12-(4-イソプロピル-6-メチルピリミジン-5-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(200mg、0.36mmol)、2-フルオロ-フェニルボロン酸(124mg、0.89mmol)、Pd(PPh3)4(42mg、0.036mmol)、炭酸ナトリウム(114mg、1.08mmol)、18mLのジオキサン、及び2mLの水を100mL反応フラスコに添加した。反応物を窒素保護下で80℃で2.5時間攪拌し、反応を停止させた。20mLの水を反応溶液に添加した。反応溶液を20mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-100%)で精製して生成物:(R)-3-クロロ-2-(2-フルオロフェニル)-12-(4-イソプロピル-6-メチルピリミジン-5-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(200mg、89%)を黄色固体として得た。ES-API:[M+H]+=622.2
工程7:(R)-3-クロロ-2-(2-フルオロフェニル)-12-(4-イソプロピル-6-メチルピリミジン-5-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(170mg、0.27mmol)、1mLのメタノール、及び3mLの塩酸/ジオキサン溶液(4M)を丸底フラスコに添加した。反応物を室温で1時間攪拌した。反応の完了をLC-MSで検出した。反応溶液を濃縮して(R)-3-クロロ-2-(2-フルオロフェニル)-12-(4-イソプロピル-6-メチルピリミジン-5-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタン[1,2,3-de]-ナフタレン-11(12H)-オン(167mg)を黄色固体として得た。この粗生成物を直接次の工程で使用した。ES-API:[M+H]+=522.2
工程8:(R)-3-クロロ-2-(2-フルオロフェニル)-12-(4-イソプロピル-6-メチルピリミジン-5-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタン[1,2,3-de]-ナフタレン-11(12H)-オン(167mg、0.32mmol)、3mLのジクロロメタン、及びトリエチルアミン(97mg、0.96mmol)を丸底フラスコに添加した。反応物を0℃まで冷却し、無水アクリル酸のジクロロメタン溶液(40mg、0.32mmol、0.5mL)を反応溶液に滴下した。反応物を0℃で10分攪拌した。反応溶液に40mLの飽和炭酸水素ナトリウム水溶液を添加し、反応溶液を20mLのジクロロメタンで3回抽出した。有機相を乾燥及び濃縮した。この粗生成物を分取HPLCで精製してラセミ体Z95を得た。
工程9:化合物Z95をキラル分割(カラムタイプ:Chiralpak IF 250mm×4.6mm×5μm;移動相:n-ヘキサン:エタノール=40:60;流量:1mL/分)して以下の化合物を得た。
化合物Z95-1(22.3mg、保持時間:12.6分;ピーク1):白色固体;ES-API:[M+H]+=576.2、及び
化合物Z95-2(31.2mg、保持時間:17.3分;ピーク2):白色固体;ES-API:[M+H]+=576.2;1HNMR(500MHz,DMSO-d6)8.93(s,1H),7.51-7.50(m,1H),7.48-7.17(m,3H),6.88-6.80(m,1H),6.23-6.20(m,1H),5.77(dd,J=10.5,2Hz,1H),4.87-4.84(m,2H),4.47-4.31(m,3H),4.05-4.02(m,1H),3.68-3.36(m,3H),2.82-2.80(m,1H),2.13(s,3H),1.08(d,J=6.5Hz,3H),0.95(d,J=6.5Hz,3H)
実施例96:化合物Z96、Z96-1、及びZ96-2の調製
化合物Z96を(2,3-ジフルオロフェニル)ボロン酸を原材料として実施例95の工程6~8の方法に従って調製し、キラル分割(カラムタイプ:Chiralpak IF 250mm×4.6mm×5μm;移動相:n-ヘキサン:エタノール=40:60;流量:1mL/分)して以下の化合物を得た。
化合物Z96-1(25mg、保持時間:12.02分;ピーク1):白色固体;ES-API:[M+H]+=594.1、及び
化合物Z96-2(37mg、保持時間:17.03分;ピーク2):白色固体;ES-API:[M+H]+=594.1;1HNMR(500MHz,DMSO-d6)8.94(s,1H),7.56-7.54(m,1H),7.53-7.52(m,1H),7.26-7.24(m,1H),6.86-6.80(m,1H),6.23-6.20(m,1H),5.79-5.77(m,1H),4.88-4.84(m,2H),4.47-4.32(m,3H),4.02-4.01(m,1H),3.72-3.66(m,2H),3.34-3.33(m,1H),2.82-2.80(m,1H),2.12(s,3H),1.07(d,J=6.5Hz,3H),0.95(d,J=6.5Hz,3H)
実施例97:化合物Z97の調製
工程1:(R)-2-クロロ-12-(4,6-ジイソプロピルピリミジン-5-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(450mg、0.81mmol)、及びN-クロロスクシンイミド(216mg、1.62mmol)のアセトニトリル(20mL)溶液を窒素保護下、80℃で2時間攪拌した。反応溶液を酢酸エチル(50mL)に溶解し、水(30mL×2)で洗浄した。有機相を乾燥及び濃縮し、高速シリカカラム(0-10%メタノール/ジクロロメタン)で精製して黄色固体:(R)-2,3-ジクロロ-12-(4,6-ジイソプロピルピリミジン-5-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(350mg、収率73%)を得た。ES-API:[M+H]+=590.2
工程2~4:化合物Z97を実施例46の方法に従って調製した。1H NMR(500MHz,DMSO-d6)δ10.04(s,1H),9.01(s,1H),7.21(dd,J=15.6,8.1Hz,1H),6.99-6.78(m,1H),6.68(dd,J=8.3,3.3Hz,1H),6.66-6.61(m,1H),6.22(dd,J=16.7,2.1Hz,1H),5.78(dd,J=10.5,2.2Hz,1H),4.96-4.85(m,2H),4.66-4.44(m,2H),4.41-4.25(m,2H),4.13-3.99(m,1H),3.84-3.65(m,2H),2.83-2.74(m,1H),2.73-2.63(m,1H),1.08(d,J=6.7Hz,6H),0.97-0.78(m,6H);ES-API:[M+H]+=620.2
実施例98:化合物Z98の調製
化合物Z98を4,6-ジイソプロピルピリミジン-5-アミンを原材料として実施例92の方法に従って調製した。1H NMR(500MHz,DMSO-d6)δ10.15(s,1H),9.02(s,1H),7.24(dd,J=15.3,8.2Hz,1H),6.94-6.76(m,1H),6.71(d,J=8.3Hz,1H),6.66(t,J=8.9Hz,1H),6.22(d,J=16.8Hz,1H),5.83-5.75(m,1H),4.91(t,J=11.0Hz,1H),4.84(dd,J=12.7,5.2Hz,1H),4.57(s,1H),4.49-4.28(m,2H),4.08-3.98(m,1H),3.94-3.66(m,2H),3.50-3.38(m,1H),2.78(dt,J=13.4,6.9Hz,1H),2.67(dd,J=13.4,6.6Hz,1H),1.11-1.05(m,6H),0.94(dd,J=18.8,6.7Hz,6H);ES-API:[M+H]+=604.2
実施例99:化合物Z99の調製
工程1:(R)2-クロロ-12-(4,6-ジシクロプロピルピリミジン-5-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(2.0g、3.63mmol)を100mLのアセトニトリルに溶解し、Selectfluor(6.64g、18.2mmol)を添加し、55℃まで加熱し、18時間反応させてから室温まで冷却し、ろ過し、水及び飽和食塩水で洗浄し、濃縮した。カラムクロマトグラフィーで精製して(R)-2,3-ジクロロ-12-(4,6-ジシクロプロピルピリミジン-5-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(2.0g、粗生成物)を得た。ES-API:[M+H]+=570.2
工程2~4:化合物Z99を実施例93の工程7~9の方法に従って調製した。ES-API:[M+H]+=600.1;1H NMR(500MHz,DMSO-d6)δ10.17(s,1H),8.69(s,1H),7.27(m,1H),6.85(m,1H),6.77-6.65(m,2H),6.21(dd,J=16.7,2.4Hz,1H),5.78(dd,J=10.3,2.4Hz,1H),4.89(t,J=12.2Hz,1H),4.82(dd,J=12.8,5.2Hz,1H),4.59(s,1H),4.41(dd,J=56.1,13.1Hz,1H),4.29(s,1H),4.02(s,1H),3.83(d,J=41.6Hz,1H),3.69(dd,J=25.9,13.6Hz,1H),3.42(d,J=12.9Hz,1H),1.77(m,1H),1.70-1.62(m,1H),1.04-0.84(m,6H),0.79(q,J=8.1Hz,2H)
実施例100:化合物Z100、Z100-1、及びZ100-2の調製
工程1:(R)-2-クロロ-3-フルオロ-12-(2-イソプロピル-4-メチルピリド-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(3.2g、5.87mmol)、(2-フルオロ-6-ヒドロキシフェニル)ボロン酸(5.5g、35.25mmol)、SPhos-pd-G2(1.0g、1.1mmol)、リン酸カリウム(2.5g、11.79mmol)、100mLのジオキサン、及び20mLの水を250mL三口丸底フラスコに添加した。系内を3回窒素置換した後、窒素ボールで保護した。120℃で3時間反応させた。100mLの酢酸エチルを反応溶液に添加し、反応溶液を飽和食塩水で3回洗浄し、乾燥及び濃縮した。この粗生成物を高速シリカゲルカラムで精製して目的生成物:(5aR)-3-フルオロ-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(350mg、収率3%)を得た。ES-API:[M+H]+=621.3
工程2:(5aR)-3-フルオロ-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(150mg、0.24mol)をアセトニトリル(8mL)に溶解し、重水素化ヨウ化メチル(300mg、2.11mmol)を添加し、80℃で1時間反応させた。反応溶液に30mLの酢酸エチルを添加し、反応溶液を30mLの飽和食塩水で3回洗浄し、乾燥及び濃縮した。この粗生成物を高速シリカゲルカラムで精製して目的生成物:(5aR)-3-フルオロ-2-(2-フルオロ-6-(メトキシ-d3)フェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(120mg、収率78%)を得た。ES-API:[M+H]+=638.3
工程3:(5aR)-3-フルオロ-2-(2-フルオロ-6-(メトキシ-d3)フェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチルをジクロロメタン(8mL)に溶解し、トリフルオロ酢酸(2mL)を添加した。反応物を室温で2時間攪拌した。反応溶液を濃縮して目的中間体を得た。
工程4:この中間体をジクロロメタン(15mL)に溶解し、トリエチルアミン(1g、10mmol)を添加した。反応物を0℃まで冷却し、無水アクリル酸(120mg、0.95mmol)を反応溶液に滴下した。反応物を0℃で15分攪拌した。反応溶液に40mLのジクロロメタンを添加し、反応溶液を50mLの飽和NaHCO3水溶液、40mLの飽和食塩水で洗浄し、乾燥及び濃縮した。この粗生成物を分取液体クロマトグラフィーで精製して目的生成物:Z100(55mg、収率48%)を得た。ES-API:[M+H]+=592.2
工程5:化合物Z100を調製及びキラル分割(カラムタイプ:IC、250mm×4.6mm×5μm、移動相:アセトニトリル:イソプロパノール=60:40、流量:1mL/分、カラム温度=30℃)して化合物Z100-1(13mg、ピーク1、保持時間5.065分、収率:23.6%)を白色固体として、及び化合物Z100-2(7mg、ピーク2、保持時間6.804分、収率:12.7%)を白色固体として得た。
実施例101:化合物Z101、Z101-1、及びZ101-2の調製
化合物Z101を実施例99の方法に従って調製し、キラル分割(カラムタイプ:Chiralpak IF 250mm×4.6mm×5μm;移動相:n-ヘキサン:エタノール=40:60;流量:1mL/分;カラム温度=30℃)して以下の化合物を得た。
化合物Z101-1(8.7mg、保持時間:7.10分;ピーク1):白色固体;ES-API:[M+H]+=576.2、及び
化合物Z101-2(15.2mg、保持時間:9.68分;ピーク2):白色固体;ES-API:[M+H]+=576.2
実施例102:化合物Z102、Z102-1、及びZ102-2の調製
化合物Z102を2-シクロプロピル-4-メチルピリジン-3-アミンを原材料として実施例95の方法に従って調製し、分取HPLC(炭酸水素アンモニウム系、カラムタイプ:Chiralpak IC 250mm×4.6mm×5μm;移動相:アセトニトリル:イソプロパノール=70:30;流量:1mL/分;カラム温度=30℃)で精製して以下の化合物を得た。
化合物Z102-1(85mg、保持時間:8.467分;ピーク1、収率:27%):1H NMR(500MHz,DMSO-d6)δ8.22(d,J=4.9Hz,1H),7.49(td,J=7.3,1.8Hz,1H),7.31-7.19(m,3H),7.09(d,J=5.0Hz,1H),6.93-6.79(m,1H),6.21(dd,J=16.7,2.3Hz,1H),5.78(dd,J=10.4,2.2Hz,1H),4.96-4.83(m,2H),4.66-4.54(m,1H),4.50-4.26(m,2H),4.07(d,J=40.0Hz,1H),3.79-3.62(m,2H),3.31(d,J=9.5Hz,1H),1.96(s,3H),1.75~1.68(m,1H),0.89~0.66(m,4H)、及び
化合物Z102-2(80mg、保持時間:9.990分;ピーク2、収率:25%):1H NMR(500MHz,DMSO-d6)δ8.21(d,J=4.9Hz,1H),7.50(dd,J=13.6,5.5Hz,1H),7.31-7.19(m,3H),7.08(d,J=4.9Hz,1H),6.93-6.79(m,1H),6.22(dd,J=16.7,2.2Hz,1H),5.78(dd,J=10.5,2.1Hz,1H),4.96-4.81(m,2H),4.58(d,J=13.5Hz,1H),4.49-4.23(m,2H),4.06(d,J=29.1Hz,1H),3.69(dd,J=41.5,29.9Hz,2H),3.32(s,1H),1.98(s,3H),1.65(s,1H),0.92(dd,J=11.5,5.9Hz,1H),0.77~0.67(m,3H)
実施例103:化合物Z103の調製
化合物Z103を(2-フルオロ-6-ヒドロキシフェニル)ボロン酸を原材料として実施例53の方法に従って調製した。ES-API:[M+H]+=590.2;1H NMR(500MHz,DMSO-d6)δ10.04(dd,J=12.5,4.9Hz,1H),8.68(s,1H),7.16(dd,J=15.4,7.3Hz,1H),6.80(dd,J=27.5,16.5Hz,1H),6.69-6.53(m,2H),6.14(dd,J=16.7,2.2Hz,1H),5.71(dd,J=10.5,2.1Hz,1H),4.96-4.73(m,2H),4.59-4.26(m,2H),4.21(s,1H),3.97(s,1H),3.57(s,2H),2.05(t,J=15.6Hz,3H),1.68(d,J=48.3Hz,1H),0.95-0.69(m,4H)
実施例104:化合物Z104、Z104-1、及びZ104-2の調製
化合物Z104を3-イソプロピルピラジン-2-アミンを原材料として実施例93の方法に従って調製した(ES-API:[M+H]+=562.2)。化合物Z104(191mg、0.34mmol)をキラル分割(移動相:n-ヘキサン-エタノール-40-60;カラムタイプ:IC(250mm×4.6mm×5μm);流量:1.0mL/分;カラム温度:30℃)して以下の化合物を得た。
化合物Z104-1(86mg、保持時間:8.554分、純度:99.2%、de値:99%):ES-API:[M+H]+=562.2、及び
化合物Z104-2(81mg、保持時間:15.317分、純度:100%、de値:99%):ES-API:[M+H]+=562.2
実施例105:化合物Z105、Z105-1、及びZ105-2の調製
化合物Z105を(2-フルオロ-6-ヒドロキシフェニル)ボロン酸を原材料として実施例104の工程6~8の方法に従って調製した(ES-API:[M+H]+=579.2)。化合物Z105(182mg、0.31mmol)をキラル分割(移動相:n-ヘキサン-エタノール-40-60);カラムタイプ:IC(250mm×4.6mm×5μm;流量:1.0mL/分;T:30℃)して以下の化合物を得た。
化合物Z105-1(78mg、保持時間9.559分、純度:99.5%、de値:99%):ES-API:[M+H]+=579.2、及び
化合物Z105-2(81mg、保持時間16.267分、純度:100%、de値:99%):ES-API:[M+H]+=579.2
実施例106:化合物Z106の調製
化合物Z106を(2,3-ジフルオロフェニル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=592.2;1H NMR(500MHz,DMSO-d6)δ8.77(s,1H),7.56(dd,J=17.7,8.8Hz,1H),7.31(dd,J=12.8,8.1Hz,1H),7.07(t,J=6.7Hz,1H),6.86(ddd,J=33.1,16.8,10.3Hz,1H),6.22(dd,J=16.7,2.2Hz,1H),5.78(dd,J=10.4,2.1Hz,1H),5.01-4.81(m,2H),4.67-4.37(m,2H),4.31(s,1H),4.05(d,J=27.3Hz,1H),3.89-3.62(m,2H),2.15(d,J=12.2Hz,3H),1.87-1.71(m,1H),1.08-0.76(m,4H)
実施例107:化合物Z107、Z107-1、及びZ107-2の調製
化合物Z107を実施例99の方法に従って調製した(ES-API:[M+H]+=562.1)。化合物Z107(207mg、0.37mmol)をキラル分割(移動相:n-ヘキサン-エタノール-40-60;カラムタイプ:IB(250mm×4.6mm×5μm;流量:1.0mL/分;カラム温度:30℃)して以下の化合物を得た。
化合物Z107-1(98mg、保持時間9.02分、純度:99.2%、de値:99%):ES-API:[M+H]+=562.1、及び
化合物Z107-2(95mg、保持時間14.76分、純度:100%、de値:99%):ES-API:[M+H]+=562.1
実施例108:化合物Z108の調製
化合物Z108を実施例99の方法に従って調製した。ES-API:[M+H]+=574.2;1H NMR(500MHz,DMSO-d6)δ10.21(s,1H),8.77(s,1H),7.27(dd,J=15.4,8.0Hz,1H),6.84(ddd,J=27.0,17.0,10.6Hz,1H),6.77-6.65(m,2H),6.21(dd,J=16.7,1.9Hz,1H),5.80-5.73(m,1H),4.85(ddd,J=18.0,15.2,5.7Hz,2H),4.57(s,1H),4.51-4.24(m,2H),4.02(s,1H),3.88(d,J=39.9Hz,1H),3.70(d,J=38.6Hz,1H),3.49-3.35(m,1H),2.12(d,J=18.0Hz,3H),1.83-1.67(m,1H),1.02-0.87(m,3H),0.86-0.76(m,1H)
実施例109:化合物Z109、Z109-1、及びZ109-2の調製
化合物Z109を5-アミノ-1-(tert-ブチル)-1H-ピラゾール-4-ニトリルを原材料として実施例93の方法に従って調製した(ES-API:[M+H]+=589.1)。それをキラル分割(カラムタイプ:Chiralpak IA 250mm×4.6mm×5μm;移動相:n-ヘキサン:エタノール=60:40;流量:1mL/分;カラム温度=30℃)して以下の化合物を得た。
化合物Z109-1(17mg、保持時間7.25分、ピーク1):黄色固体;ES-API:[M+H]+=589.1、及び
化合物Z109-2(17mg、保持時間9.22分、ピーク2):黄色固体;ES-API:[M+H]+=589.2;1HNMR(500MHz,DMSO-d6):7.87(s,1H),7.26-7.25(m,1H),7.20-7.23(m,2H),7.14-7.10(m,1H),6.62-6.59(m,1H),6.48-6.45(m,1H),5.89-5.87(m,1H),4.94-4.71(m,4H),4.15-4.12(m,1H),4.02-3.44(m,4H),1.31(s,9H)
実施例110:化合物Z110の調製
化合物Z110を4-イソプロピル-6-メトキシピリミジン-5-アミンを原材料として実施例93の方法に従って調製した。ES-API:[M+H]+=592.2;1H NMR(500MHz,DMSO-d6)δ8.72(s,1H),7.57-7.46(m,1H),7.37-7.23(m,2H),7.18(t,J=7.4Hz,1H),6.84(dd,J=30.7,13.7Hz,1H),6.21(d,J=16.7Hz,1H),5.78(d,J=12.2Hz,1H),5.01-4.80(m,2H),4.68-4.22(m,3H),4.06(d,J=32.5Hz,1H),3.68(s,5H),3.38(d,J=11.8Hz,1H),2.83(dd,J=27.6,21.0Hz,1H),1.13-0.88(m,7H)
実施例111:化合物Z111、Z111-1、及びZ111-2の調製
化合物Z111を実施例99の方法に従って調製した(ES-API:[M+H]+=592.2;1H NMR(500MHz,DMSO-d6)δ10.18(s,1H),8.71(s,1H),7.26(dd,J=15.3,8.2Hz,1H),6.95-6.77(m,1H),6.75-6.62(m,2H),6.21(d,J=15.5Hz,1H),5.84-5.69(m,1H),4.84(ddd,J=19.9,18.1,8.9Hz,2H),4.68-4.22(m,3H),4.02(s,1H),3.94-3.62(m,5H),2.79(ddd,J=45.6,13.2,6.6Hz,1H),1.11-0.95(m,6H))化合物Z111(75mg、0.1268mmol)をキラル分割(カラムタイプ:IF、250mm×4.6mm×5μm、移動相:n-ヘキサン:エタノール=50:50、流量:1mL/分、カラム温度=30℃)して以下の化合物を得た。
化合物Z111-1(25mg、ピーク1、保持時間:7.33分、収率:34%):淡黄色固体、及び
化合物Z111-2(26mg、ピーク2、保持時間:1.42分、収率:34.6%):淡黄色固体;ES-API:[M+H]+=592.2
実施例112:化合物Z112、Z112-1、及びZ112-2の調製
化合物Z112を2-シクロプロピル-4-メチルピリジン-3-アミンを原材料として実施例92の方法に従って調製し、分取HPLC(炭酸水素アンモニウム系、カラムタイプ:Chiralpak IC 250mm×4.6mm×5μm;移動相:アセトニトリル:イソプロパノール:アンモニアメタノール=85:15:0.2;流量:1mL/分;カラム温度=30℃)で精製して以下の化合物を得た。
黄色固体:化合物Z112-1(60mg、保持時間:9.201分;ピーク1、収率:22%):1H NMR(500MHz,DMSO-d6)δ8.22(d,J=4.9Hz,1H),7.23(dd,J=15.2,7.8Hz,1H),7.08(d,J=5.2Hz,1H),6.91-6.79(m,1H),6.73-6.59(m,2H),6.21(d,J=17.2Hz,1H),5.78(dd,J=10.4,2.3Hz,1H),4.91-4.80(m,2H),4.55(s,1H),4.47-4.34(m,1H),4.28(s,1H),4.03(d,J=29.0Hz,1H),3.74(dd,J=55.0,44.2Hz,4H),1.93(s,3H),1.70(td,J=8.1,4.1Hz,1H),0.82(d,J=4.0Hz,2H),0.77-0.71(m,1H),0.65(d,J=7.9Hz,1H)、及び
化合物Z112-2(12mg、保持時間:12.307分;ピーク2、収率:4.4%):1H NMR(500MHz,DMSO-d6)δ10.15(s,1H),8.21(d,J=4.9Hz,1H),7.25(dd,J=15.3,8.3Hz,1H),7.08(d,J=4.9Hz,1H),6.85(s,1H),6.73-6.65(m,2H),6.21(dd,J=16.7,2.3Hz,1H),5.77(dd,J=10.4,2.2Hz,1H),4.90-4.79(m,2H),4.59(s,1H),4.49-4.27(m,2H),4.02(s,1H),3.79-3.58(m,2H),3.30(s,1H),1.96(s,3H),1.61(d,J=4.6Hz,1H),0.84(s,1H),0.75(dd,J=15.9,7.2Hz,2H),0.61(d,J=8.3Hz,1H)
実施例113:化合物Z113の調製
工程1:4,6-ジクロロ-2-フルオロニコチンアミド(10.5g、50mmol)、(S)-(1-エチルピロリジン-2-イル)(7.68g、60mmol)、炭酸カリウム(20.7g、150mmol)、及び200mLのジメチルホルムアミドを500mL三口丸底フラスコに添加し、90℃で2時間反応させた。反応溶液に300mLの酢酸エチルを添加し、反応溶液を300mLの飽和食塩水で3回洗浄し、乾燥及び濃縮して目的粗生成物:(S)-4,6-ジクロロ-2-(((1-エチルピロリジン-2-イル)メチル)アミノ)ニコチンアミド(12.3g、収率77%)を得た。ES-API:[M+H]+=317.1
工程2:(S)-4,6-ジクロロ-2-(((1-エチルピロリジン-2-イル)メチル)アミノ)ニコチンアミド(5.5g、17.3mmol)及び100mLの無水ジメチルホルムアミドを250mL三口丸底フラスコに添加した。NaH(7.0g、17.5mmol)を氷水浴下で添加し、温度を保ったまま30分攪拌した。この溶液にN,N-カルボニルジイミダゾール(5.2g、32mmol)を添加した。5分後、(R)-3-(ヒドロキシメチル)ピペラジン-1-カルボン酸tert-ブチル(3.8g、17.6mmol)を氷水浴下で添加し、温度を保ったまま20分間反応させた。300mLの酢酸エチルを反応溶液に添加し、反応溶液を30mLの飽和食塩水で3回洗浄し、乾燥した。ろ液を濃縮し、カラムに通して目的生成物:(R)-3-(((7-クロロ-1-(((S)-1-エチルピロリジン-2-イル)メチル)-2,4-ジオキソ-1,2,3,4-テトラヒドロピリド[2,3-d]ピリミジン-5-イル)オキシ)メチルピペラジン-1-ギ酸tert-ブチル(4.5g、収率49%)を得た。ES-API:[M+H]+=523.3
工程3:(R)-3-(((7-クロロ-1-(((S)-1-エチルピロリジン-2-イル)メチル)-2,4-ジオキソ-1,2,3,4-テトラヒドロピリド[2,3-d]ピリミジン-5-イル)オキシ)メチルピペラジン-1-ギ酸tert-ブチル(5.2g、9.9mmol)、DIEA(23g、178mmol)、T3P(23g、36mmol)、及び50mLのジクロロメタンを100mL三口丸底フラスコに添加し、室温で2時間攪拌した。反応溶液に80mLの酢酸エチルを添加し、反応溶液を80mLの飽和食塩水で3回洗浄した。酢酸エチル相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラムで精製して目的生成物:(R)-2-クロロ-12-(((S)-1-エチルピロリジン-2-イル)メチル)-11-オキソ5α,6,8,9,11,12ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(750mg、収率14.7%)を得た。ES-API:[M+H]+=505.3
工程4:(R)-2-クロロ-12-(((S)-1-エチルピロリジン-2-イル)メチル)-11-オキソ5α,6,8,9,11,12ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(400mg、0.79mmol)、NCS(300mg、2.25mmol)を100mL三口丸底フラスコに添加し、80℃で2時間反応させた。反応溶液に30mLの酢酸エチルを添加し、反応溶液を30mLの飽和食塩水で3回洗浄し、乾燥及び濃縮した。この粗生成物を高速シリカゲルカラムで精製して目的生成物:(R)-2,3-ジクロロ-12-(((S)-1-エチルピロリジン-2-イル)メチル)-11-オキソ-5α,6,8,9,11,12ヘキサヒドロ4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(400mg、収率94%)を得た。ES-API:[M+H]+=539.2
工程5:(R)-2,3-ジクロロ-12-(((S)-1-エチルピロリジン-2-イル)メチル)-11-オキソ-5α,6,8,9,11,12ヘキサヒドロ4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(370mg、0.68mmol)、(2-フルオロフェニル)ボロン酸(380mg、2.7mmol)、テトラトリフェニルホスフィンパラジウム(150mg、0.13mmol)、炭酸ナトリウム(209mg、1.97mmol)、10mLのジオキサン、及び2mLの水を100mL三口丸底フラスコに添加した。系内を3回窒素置換した後、窒素ボールで保護した。120℃で1時間反応させた。反応溶液に30mLの酢酸エチルを添加し、反応溶液を30mLの飽和食塩水で3回洗浄し、乾燥及び濃縮した。この粗生成物を高速シリカゲルカラムで精製して目的生成物:(R)-3-クロロ-12-(((S)-1-エチルピロリジン-2-イル)メチル)-2-(2-フルオロフェニル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(199mg、収率96%)を得た。ES-API:[M+H]+=599.2
工程6:(R)-3-クロロ-12-(((S)-1-エチルピロリジン-2-イル)メチル)-2-(2-フルオロフェニル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(199mg、0.33mmol)をジクロロメタン(8mL)に溶解し、トリフルオロ酢酸(2mL)を添加した。反応物を室温で2時間攪拌した。反応溶液を濃縮して目的中間体を得た。この中間体をジクロロメタン(15mL)に溶解し、トリエチルアミン(1g、10mmol)を添加した。反応物を0℃まで冷却し、反応溶液に無水アクリル酸(50mg、0.39mmol)を滴下した。反応物を0℃で15分攪拌した。反応溶液に40mLのジクロロメタンを添加し、反応溶液を50mLの飽和NaHCO3水溶液、40mLの飽和食塩水で洗浄し、乾燥及び濃縮した。この粗生成物を分取液体クロマトグラフィーで精製して目的生成物:Z113(52mg、収率28%)を得た。ES-API:[M+H]+=553.2;1H NMR(500MHz,DMSO-d6)δ7.65-7.50(m,2H),7.38(dd,J=12.9,5.9Hz,2H),6.93-6.76(m,1H),6.28-6.16(m,1H),5.76(d,J=12.0Hz,1H),4.88-4.73(m,2H),4.53-3.98(m,6H),3.55(t,J=19.2Hz,2H),3.20(s,1H),2.99-2.71(m,3H),2.22-2.06(m,2H),1.75-1.52(m,4H),0.84(t,J=7.1Hz,3H)
実施例114:化合物Z114の調製
化合物Z114を3-クロロ-5-イソプロピルピリジン-4-アミンを原材料として実施例93の方法に従って調製した。1H NMR(500MHz,DMSO-d6)δ8.65(d,J=4.2Hz,1H),8.59(d,J=3.4Hz,1H),7.52-7.46(m,1H),7.30-7.23(m,2H),7.15(t,J=7.3Hz,1H),6.90-6.78(m,1H),6.21(d,J=16.5Hz,1H),5.80-5.75(m,1H),4.89(dd,J=19.2,13.8Hz,2H),4.51(d,J=32.0Hz,2H),4.32(d,J=28.9Hz,2H),4.03(s,1H),3.75(dd,J=41.6,27.4Hz,2H),3.36(s,1H),3.30(s,1H),2.78-2.65(m,1H),1.16(d,J=6.8Hz,3H),1.07-1.02(m,3H)
実施例115:化合物Z115の調製
化合物Z115を4-イソプロピル-2-メトキシ-6-メチルピリミジン-5-アミンを原材料として実施例92の方法に従って調製した。ES-API:[M+H]+=606.2;1H NMR(500MHz,DMSO-d6)δ10.19(d,J=4.2Hz,1H),7.27(dd,J=15.5,8.0Hz,1H),6.98-6.78(m,1H),6.76-6.56(m,2H),6.21(d,J=16.6Hz,1H),5.78(dd,J=10.4,2.2Hz,1H),4.98-4.74(m,2H),4.57(s,1H),4.46(d,J=12.8Hz,1H),4.33(d,J=4.4Hz,2H),4.04(s,1H),3.75(s,2H),2.86-2.57(m,1H),2.04(d,J=18.0Hz,3H),1.06(d,J=6.8Hz,3H),0.93(dd,J=10.0,6.8Hz,3H)
実施例116:化合物Z116の調製
化合物Z116を実施例93の工程6~9の方法に従って調製した。ES-API:[M+H]+=606.2;1H NMR(500MHz,DMSO-d6)δ7.51(dd,J=13.6,5.7Hz,1H),7.29(dd,J=18.2,9.0Hz,2H),7.25-7.17(m,1H),6.97-6.72(m,1H),6.21(dd,J=16.7,2.3Hz,1H),5.78(dd,J=10.4,2.2Hz,1H),4.88(ddd,J=19.6,17.8,8.6Hz,2H),4.68-4.52(m,1H),4.43(dd,J=54.5,13.2Hz,1H),4.30(s,1H),4.06(d,J=27.0Hz,1H),3.89(s,3H),3.84-3.58(m,2H),2.82-2.60(m,1H),2.06(d,J=13.0Hz,3H),1.06(d,J=6.8Hz,3H),0.93(d,J=6.8Hz,3H)
実施例117:化合物Z117の調製
化合物Z117を(1-メチル-1H-ピラゾール-4-イル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=561.2;1H NMR(500MHz,DMSO-d6)δ8.44(dd,J=69.0,4.5Hz,2H),7.34-7.19(m,2H),6.95-6.76(m,1H),6.21(d,J=16.6Hz,1H),5.77(d,J=10.4Hz,1H),4.83(s,2H),4.70-4.01(m,4H),3.83(s,3H),3.64(t,J=20.8Hz,2H),3.32(s,1H),2.82-2.63(m,1H),1.93(d,J=16.8Hz,3H),1.00(ddd,J=17.9,8.9,4.8Hz,6H)
実施例118:化合物Z118の調製
化合物Z118を(2-フルオロ-5-ヒドロキシフェニル)ボロン酸を原材料として実施例46の方法に従って調製した。ES-API:[M+H]+=591.2;1H NMR(500MHz,DMSO-d6)δ9.62(s,1H),8.37(d,J=4.8Hz,1H),7.20-7.01(m,2H),6.79(d,J=8.6Hz,2H),6.48-6.39(m,1H),6.21(dd,J=16.7,2.0Hz,1H),5.78(d,J=12.4Hz,1H),4.86(dd,J=20.3,9.2Hz,2H),4.28(s,3H),4.07(d,J=37.9Hz,1H),3.66(s,2H),3.34(s,1H),2.79-2.65(m,1H),1.93(d,J=12.4Hz,3H),1.00(dd,J=59.9,6.6Hz,6H)
実施例119:化合物Z119の調製
化合物Z119を3-クロロ-1-イソプロピル-4-メチル-1H-ピラゾール-5-アミン及び4,6-ジクロロ-2-フルオロニコチンアミドを原材料として実施例93の方法に従って調製した。
実施例120:化合物Z120の調製
工程1:(R)-12-(1-(tert-ブチル)-4-シアノ-1H-ピラゾール-5-イル)-2,3-ジクロロ-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(550mg、0.95mmol)、(2-フルオロ-6-ヒドロキシフェニル)ボロン酸(447mg、2.86mmol)、SPhos-Pd-G2(102mg、0.14mmol)、炭酸ナトリウム(304mg、2.87mmol)、10mLのジオキサン、及び2mLの水を100mL三口丸底フラスコに添加した。系内を3回窒素置換した後、窒素ボールで保護した。110℃で2時間反応させた。反応溶液に30mLの酢酸エチルを添加し、反応溶液を30mLの飽和食塩水で3回洗浄し、乾燥及び濃縮した。この粗生成物を高速シリカゲルカラムで精製して目的生成物:(5aR)-12-(1-(tert-ブチル)-4-シアノ-1H-ピラゾール-5-イル)-3-クロロ-2-(2-フルオロ-6-ヒドロキシフェニル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(350mg、収率56%)を得た。ES-API:[M+H]+=651.2
工程2:(5aR)-12-(1-(tert-ブチル)-4-シアノ-1H-ピラゾール-5-イル)-3-クロロ-2-(2-フルオロ-6-ヒドロキシフェニル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(350mg、0.53mmol)をジクロロメタン(8mL)に溶解し、トリフルオロ酢酸(2mL)を添加した。反応物を室温で2時間攪拌した。反応溶液を濃縮して目的中間体を得た。
工程3:この中間体をジクロロメタン(15mL)に溶解し、トリエチルアミン(1g、9.9mmol)を添加した。反応物を0℃まで冷却し、無水アクリル酸(14mg、0.11mmol)を反応溶液に滴下した。反応物を0℃で15分攪拌した。反応溶液に40mLのジクロロメタンを添加し、反応溶液を50mLの飽和NaHCO3水溶液、40mLの飽和食塩水で洗浄し、乾燥及び濃縮した。この粗生成物を分取液体クロマトグラフィーで精製して化合物Z120(64mg、収率44%)を得た。ES-API:[M+H]+=605.1;1H NMR(400MHz,DMSO-d6)δ10.17(s,1H),8.16-8.09(m,1H),7.26(d,J=7.2Hz,1H),6.90-6.66(m,3H),6.20(dd,J=16.7,2.2Hz,1H),5.77(dd,J=10.4,2.2Hz,1H),4.91(s,2H),4.63-4.27(m,4H),3.86(d,J=102.5Hz,3H),3.55-3.37(m,1H),1.40(dd,J=5.0,3.2Hz,9H)
実施例121:化合物Z121、Z121-1、及びZ121-2の調製
工程1:m-クロロペルオキシ安息香酸(2.78g、16.10mmol)を(R)-3-クロロ-2-(2-フルオロフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(5g、8.05mmol)のジクロロメタン(70mL)溶液に添加した。反応溶液を室温で一晩攪拌した。反応終了後、反応溶液をジクロロメタン(100mL)で希釈し、水(50mL×3)で洗浄した。有機相を乾燥及び濃縮し、高速シリカカラム(0-10%メタノール/ジクロロメタン)で精製して黄色固体:(R)-3-(7-(tert-ブトキシカルボニル)-3-クロロ-2-(2-フルオロフェニル)-11-オキソ-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-12(11H)-イル)-2-イソプロピル-4-メチルピリジン1-オキシド(2.5g、収率=49%)を得た。ES-API:[M+H]+=637.2
工程2:化合物:(R)-3-(7-(tert-ブトキシカルボニル)-3-クロロ-2-(2-フルオロフェニル)-11-オキソ-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-12(11H)-イル)-2-イソプロピル-4-メチルピリジン1-オキシド(2.5g、3.92mmol)の無水酢酸(25mL)溶液を80℃で1時間攪拌した。原材料が完全に中間体状態に変換されたら、真空下で濃縮して無水酢酸を除去し、メタノール(12mL)に再溶解し、炭酸カリウム(8g)を添加した。混合物を室温で30分攪拌した。濃縮してメタノールを除去した後、30mLの水及び30mLのジクロロメタンを添加して分離させた。有機相を乾燥及び濃縮して(R)-3-クロロ-2-(2-フルオロフェニル)-12-(2-イソプロピル-4-メチル-6-オキソ-1,6-ジヒドロピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル及び(R)-3-クロロ-2-(2-フルオロフェニル)-12-(4-(ヒドロキシメチル)-2-イソプロピルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチルの混合物(2.3g)を得た。ES-API:[M+H]+=637.2
工程3:ヨウ化メチル(5.12g、36.10mmol及び炭酸カリウム(1.50g、10.83mmol)を、(R)-3-クロロ-2-(2-フルオロフェニル)-12-(2-イソプロピル-4-メチル-6-オキソ-1,6-ジヒドロピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル及び(R)-3-クロロ-2-(2-フルオロフェニル)-12-(4-(ヒドロキシメチル)-2-イソプロピルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチルの混合物(2.3g、3.61mmol)のアセトニトリル(20mL)溶液に添加し、菅を封して65℃で6時間攪拌した。反応溶液を濃縮し、高速シリカカラム(0-5%メタノール/ジクロロメタン)で精製して2つの化合物:(R)-3-クロロ-2-(2-フルオロフェニル)-12-(2-イソプロピル-1,4-ジメチル-6-オキソ-1,6-ジヒドロピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(600mg、収率=15%)(ES-API:[M+H]+=651.2)及び(R)-3-クロロ-2-(2-フルオロフェニル)-12-(4-(ヒドロキシメチル)-2-イソプロピルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(750mg、収率=31%)(ES-API:[M+H]+=637.2)を得た。
工程4:(R)-3-クロロ-2-(2-フルオロフェニル)-12-(2-イソプロピル-1,4-ジメチル-6-オキソ-1,6-ジヒドロピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(600mg、0.92mmol)をジクロロメタン(8mL)に溶解し、トリフルオロ酢酸(2mL)を添加した。反応物を室温で1時間攪拌した。反応溶液を濃縮して粗生成物:(R)-3-クロロ-2-(2-フルオロフェニル)-12-(2-イソプロピル-1,4-ジメチル-6-オキソ-1,6-ジヒドロピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(508mg)を得た。これを直接次の工程で使用した。ES-API:[M+H]+=551.2
工程5:(R)-3-クロロ-2-(2-フルオロフェニル)-12-(2-イソプロピル-1,4-ジメチル-6-オキソ-1,6-ジヒドロピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(508mg、0.92mmol)をジクロロメタン(6mL)に溶解し、N,N-ジイソプロピルエチルアミン(596mg、4.61mmol)を添加した。反応溶液を0℃まで冷却し、アクリル酸クロライド(167mg、1.84mmol)を滴下した。反応溶液を0℃で10分攪拌し、濃縮し、粗生成物を分取HPLCで精製して化合物Z121(160mg、純度100%、収率29%)を白色固体として得た。1H NMR(500MHz,DMSO-d6)δ8.22(s,1H),7.53-7.44(m,1H),7.31-7.22(m,2H),7.18-7.11(m,1H),6.94-6.75(m,1H),6.21(dd,J=16.5,2.0Hz,1H),5.77(dd,J=10.5,2.0Hz,1H),4.94-4.83(m,2H),4.70-4.53(m,1H),4.50-4.33(m,1H),4.28(s,1H),4.13-4.01(m,1H),3.88(d,J=1.5Hz,3H),3.77-3.60(m,2H),3.29(s,1H),2.70-2.58(m,1H),1.78(d,J=13.5Hz,3H),1.04(d,J=6.5Hz,3H),0.95-0.90(m,3H);ES-API:[M+H]+=605.2
工程6:化合物Z121(160mg、0.26mmol)をキラルクロマトグラフィーカラムで分割(カラムタイプ:IC 250mm×4.6mm×5μm;移動相:アセトニトリル:イソプロパノール=70:30;流量:1mL/分;カラム温度30℃)して以下の化合物を得た。
化合物Z121-1(72mg、ピーク1、保持時間4.07分、純度:100%、de値:100%):1H NMR(500MHz,DMSO-d6)δ8.22(s,1H),7.53-7.44(m,1H),7.32-7.22(m,2H),7.17-7.12(m,1H),6.93-6.78(m,1H),6.21(dd,J=16.5,2.0Hz,1H),5.81-5.75(m,1H),4.95-4.84(m,2H),4.62-4.51(m,1H),4.42(dd,J=56.6,11.7Hz,1H),4.27(s,1H),4.05(d,J=23.5Hz,1H),3.88(s,3H),3.80-3.63(m,2H),3.33(s,1H),2.65-2.59(m,1H),1.80(s,3H),1.04(d,J=7.0Hz,3H),0.94(d,J=6.5Hz,3H);ES-API:[M+H]+=605.2、及び
化合物Z121-2(46mg、ピーク2、保持時間5.51分、純度:96%、de値:97.3%):1H NMR(500MHz,DMSO-d6)δ8.23(s,1H),7.53-7.45(m,1H),7.32-7.22(m,2H),7.19-7.13(m,1H),6.95-6.78(m,1H),6.21(dd,J=17.0,2.0Hz,1H),5.78(dd,J=10.5,2Hz,1H),4.94(t,J=12.0Hz,1H),4.88-4.81(m,1H),4.67-4.53(m,1H),4.52-4.34(m,1H),4.28(s,1H),4.18-4.00(m,1H),3.89(s,3H),3.77-3.59(m,2H),3.31(s,1H),2.75-2.66(m,1H),1.78(s,3H),1.06-1.02(m,3H),0.94(d,J=6.5Hz,3H);ES-API:[M+H]+=605.2
実施例122:化合物Z122、Z122-1、及びZ122-2の調製
工程1、工程2、及び工程3は、実施例121の工程1、工程2、及び工程3と同様である。
工程4:(R)-3-クロロ-2-(2-フルオロフェニル)-12-(4-(ヒドロキシメチル)-2-イソプロピルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(750mg、1.18mmol)をジクロロメタン(8mL)に溶解し、トリフルオロ酢酸(2mL)を添加した。反応物を室温で1時間攪拌した。反応溶液を濃縮して粗生成物:(R)-3-クロロ-2-(2-フルオロフェニル)-12-(4-(ヒドロキシメチル)-2-イソプロピルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(632mg)を得た。これを直接次の工程で使用した。ES-API:[M+H]+=537.2
工程5:(R)-3-クロロ-2-(2-フルオロフェニル)-12-(4-(ヒドロキシメチル)-2-イソプロピルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(632mg、1.18mmol)をジクロロメタン(6mL)に溶解し、N,N-ジイソプロピルエチルアミン(760mg、5.88mmol)を添加した。反応溶液を0℃まで冷却し、アクリル酸クロライド(85mg、0.94mmol)を滴下した。反応溶液を0℃で10分攪拌し、濃縮し、粗生成物を分取HPLCで精製して化合物Z122(470mg、純度100%、収率67%)を白色固体として得た。1H NMR(500MHz,DMSO-d6)δ8.49(d,J=5.0Hz,1H),7.53-7.43(m,1H),7.39-7.34(m,1H),7.30-7.20(m,2H),7.17-7.11(m,1H),6.96-6.76(m,1H),6.21(dd,J=16.5,2.5Hz,1H),5.78(dd,J=10.5,2.0Hz,1H),5.37-5.29(m,1H),4.97-4.80(m,2H),4.63-4.50(m,1H),4.49-4.34(m,1H),4.32-4.21(m,2H),4.18-3.99(m,2H),3.82-3.63(m,2H),3.29(s,1H),2.81-2.62(m,1H),1.06(d,J=6.5Hz,3H),0.95(dd,J=6.5,2.5Hz,3H);ES-API:[M+H]+=591.2
工程6:化合物Z122(470mg、0.79mmol)をキラルクロマトグラフィーカラムで分割(カラムタイプ:IC 250mm×4.6mm×5μm;移動相:アセトニトリル:イソプロパノール=70:30;流量:1mL/分;カラム温度=30℃)して以下の化合物を得た。
化合物Z122-1(177mg、ピーク1、保持時間4.34分、純度:100%、de値:100%):1H NMR(500MHz,DMSO-d6)δ8.50(d,J=5.0Hz,1H),7.51-7.44(m,1H),7.38(d,J=4.5Hz,1H),7.33-7.20(m,2H),7.18-7.11(m,1H),6.94-6.78(m,1H),6.21(dd,J=16.5,2.5Hz,1H),5.78(dd,J=10.5,2.0Hz,1H),5.35(s,1H),4.93(s,1H),4.84(dd,J=13.0,5.0Hz,1H),4.68-4.52(m,1H),4.51-4.33(m,1H),4.33-4.22(m,2H),4.16-3.99(m,2H),3.81-3.59(m,2H),3.33(s,1H),2.84-2.71(m,1H),1.07(d,J=6.5Hz,3H),0.95(d,J=6.5Hz,3H);ES-API:[M+H]+=591.2、及び
化合物Z122-2(266mg、ピーク2、保持時間7.32分、純度:97.55%、de値:100%):1H NMR(500MHz,DMSO-d6)δ8.50(d,J=5.0Hz,1H),7.51-7.44(m,1H),7.38(d,J=4.0Hz,1H),7.32-7.19(m,2H),7.16-7.11(m,1H),6.96-6.76(m,1H),6.21(dd,J=17.0,2.5Hz,1H),5.78(dd,J=10.5,2.5Hz,1H),5.36(s,1H),5.00-4.79(m,2H),4.63-4.50(m,1H),4.49-4.34(m,1H),4.32-4.21(m,2H),4.18-3.99(m,2H),3.82-3.63(m,2H),3.36(s,1H),2.75-2.65(m,1H),1.07(d,J=6.7Hz,3H),0.96(d,J=6.7Hz,3H);ES-API:[M+H]+=591.2
実施例123:化合物Z123の調製
化合物Z123を(2-(ジフルオロメチル)-6-フルオロフェニル)ボロン酸を原材料として実施例72の工程3~5の方法に従って調製した。ES-API:[M+H]+=607.2;1H NMR(500MHz,DMSO-d6)δ8.22(d,J=4.8Hz,1H),7.70(dd,J=13.6,8.0Hz,1H),7.55(dd,J=18.2,8.6Hz,2H),7.07(s,1H),6.92-6.60(m,1H),6.58(d,J=47.9Hz,1H),6.21(d,J=17.0Hz,1H),5.78(dd,J=10.4,2.1Hz,1H),4.71-4.03(m,2H),4.46(s,2H),4.35(s,2H),4.01(s,1H),3.73(s,1H),3.43(s,1H),1.94(s,3H),1.73(s,1H),1.02-0.78(m,4H)
実施例124:化合物Z124の調製
工程1:(R)-2-クロロ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタン[1,2,3-de]-ナフタレン-7(5H)-カルボン酸tert-ブチル(1.26g、2.4mmol)、ベンジルアルコール(2.6g、24.0mmol)、キサントホス-Pd-G2(192mg、0.22mmol)、キサントホス(127mg、0.22mmol)、炭酸セシウム(1.56g、4.8mmol)、及びジオキサン(10mL)をマイクロ波管に添加した。系内を5分間窒素バブリングした後、80℃マイクロ波下で3.5時間反応させた。反応終了後、ろ過し、ろ液を濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-100%)で精製して目的生成物:(R)-2-(ベンジルオキシ)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(866mg、59%)を黄色固体として得た。ES-API:[M+H]+=599.3
工程2:(R)-2-(ベンジルオキシ)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(2.6g、4.3mmol)、N-ヨードスクシンイミド(2.4g、10.8mmol)、及びアセトニトリル(30mL)を丸底フラスコに添加した。反応物を80℃で16時間攪拌した。チオ硫酸ナトリウム水溶液を反応溶液に添加した。反応溶液を酢酸エチルで抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-100%)で精製して(R)-2-(ベンジルオキシ)-3-ヨード-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキサ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(2.2g)を収率70%で得た。ES-API:[M+H]+=725.2
工程3:(R)-2-(ベンジルオキシ)-3-ヨード-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-5a,6,8,9,11,12-ヘキサヒドロ-4-オキサ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(1.9g、2.62mmol)、2,2-ジフルオロ-2-(フルオロスルホニル)酢酸メチル(1.5g、7.86mmol)、ヨウ化第一銅(1.5g、7.86mmol)、N,N-ジメチルホルムアミド(15mL)をマイクロ波管に添加した。系を密閉管内で90℃油浴下、2時間加熱した。水を反応溶液に添加した。反応溶液を酢酸エチルで抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-100%)で精製して生成物:(R)-2-(ベンジルオキシ)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-3-(トリフルオロメチル)-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ-[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(1g、57%)を黄色固体として得た。ES-API:[M+H]+=667.2
工程4:(R)-2-(ベンジルオキシ)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-3-(トリフルオロメチル)-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ-[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(1g、1.5mmol)、Pd/C(1g、純度10%)、及びメタノール(10mL)を丸底フラスコに添加した。反応物を室温で16時間攪拌した。反応の完了をLC-MSで検出した。反応物を珪藻土でろ過し、ろ液を濃縮して目的生成物:(R)-2-ヒドロキシ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-3-(トリフルオロメチル)-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(800mg、93%)を得た。ES-API:[M+H]+=577.2
工程5:(R)-2-ヒドロキシ-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-3-(トリフルオロメチル)-5a,6,8,9,11,12-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(800mg、1.4mmol)、トリエチルアミン(1.1g、11.2mmol)、及び10mLのジクロロメタンを反応フラスコに添加した。反応溶液を0℃まで冷却し、トリフルオロメタンスルホン酸無水物(1.56g、5.5mmol)を滴下した。反応物を0℃で10分攪拌した。飽和炭酸水素ナトリウム水溶液を反応溶液に添加し、反応溶液をジクロロメタンで3回抽出し、有機相を乾燥及び濃縮した。この粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-80%)で精製して目的生成物:(R)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-3-(トリフルオロメチル)-2-(((トリフルオロメチル)スルホニル)オキシ)-5a,6,8,9,11,12ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(500mg)を黄色固体として収率50%で得た。ES-API:[M+H]+=709.2
工程6:(R)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-3-(トリフルオロメチル)-2-(((トリフルオロメチル)スルホニル)オキシ)-5a,6,8,9,11,12ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-7(5H)-カルボン酸tert-ブチル(500mg、0.70mmol)、2-フルオロ-6-ヒドロキシフェニルボロン酸(330mg、2.11mmol)、テトラトリフェニルホスフィンパラジウム(81mg、0.07mmol)、リン酸ナトリウム(224mg、2.11mmol)、10mLのジオキサン、及び2mLの水を丸底フラスコに添加した。反応物を100℃油浴下、1時間攪拌し、反応を停止させた。反応溶液に50mLの水を添加した。反応溶液を50mLの酢酸エチルで3回抽出し、有機相を乾燥及び濃縮した。粗生成物を高速シリカゲルカラム(酢酸エチル/石油エーテル:0-100%)で精製して目的生成物:(5aR)-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-3-(トリフルオロメチル)-5a,6,8,9,11,12ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]-ナフタレン7(5H)-カルボン酸tert-ブチル(150mg)を黄色固体として収率31%で得た。ES-API:[M+H]+=671.2
工程7:(5aR)-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-11-オキソ-3-(トリフルオロメチル)-5a,6,8,9,11,12ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]-ナフタレン7(5H)-カルボン酸tert-ブチル(150mg、0.22mmol)、1mLのメタノール、及び4M塩酸/ジオキサン溶液(3mL)を丸底フラスコに添加した。反応物を室温で1時間攪拌した。反応の完了をLC-MSで検出した。反応溶液を濃縮して粗生成物:(5aR)-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-3-(トリフルオロメチル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(125mg)を黄色固体として得た。ES-API:[M+H]+=571.2
工程8:(5aR)-2-(2-フルオロ-6-ヒドロキシフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-3-(トリフルオロメチル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキソ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(125mg、0.22mmol)、5mLのジクロロメタン、及びトリエチルアミン(111mg、1.1mmol)を丸底フラスコに添加した。反応物を0℃まで冷却し、無水アクリル酸のジクロロメタン溶液(23mg、0.18mmol、0.5mL)を反応溶液に滴下した。反応物を0℃で10分攪拌した。反応溶液に20mLの飽和炭酸水素ナトリウム水溶液を添加し、反応溶液を20mLのジクロロメタンで3回抽出した。有機相を乾燥及び濃縮した。この粗生成物を分取HPLCで精製してZ124(46mg)を白色固体として2工程の収率33%で得た。1HNMR(500MHz,CDCl3)8.57-8.54(m,1H),8.53-8.41(m,1H),7.26-7.12(m,2H),6.61-6.55(m,3H),6.41-6.40(m,1H),5.86-5.84(m,1H),5.19-4.63(m,4H),4.29-3.29(m,5H),2.77-2.69(m,1H),2.05-2.01(m,3H),1.21-1.19(m,3H),0.94-0.88(m,3H);ES-API:[M+H]+=625.1
実施例125~実施例236
化合物Z125~236を上記実施例の合成方法に従って調製した。
実施例237:化合物Z237-1及びZ237-2の調製
工程1:N,N-ジイソプロピルエチルアミン(182mg、1.44mmol)を(R)-3-クロロ-2-(2-フルオロフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキサ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタン[1,2,3-ジナフタレン]11(12H)-オン(250mg、0.48mmol)のジクロロメタン(4mL)溶液に氷浴下で添加した後、(E)-4-ブロモブタ-2-エノイルクロライド(88mg、0.48mmol)を添加し、10分攪拌した。反応溶液を10mLの水に溶解し、10mLのジクロロメタンで抽出した。有機相を乾燥及び濃縮し、高速シリカカラム(0-10%メタノール/ジクロロメタン)で精製して白色固体:(R,E)-7-(4-ブロモブタ-2-エノイル)-3-クロロ-2-(2-フルオロフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキサ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(300mg)を収率93%で得た。
工程2:1Mジメチルアミンのテトラヒドロフラン溶液(1.35mL、1.35mmol)を(R,E)-7-(4-ブロモブタ-2-エノイル)-3-クロロ-2-(2-フルオロフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキサ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(300mg、0.45mmol)のテトラヒドロフラン溶液に氷浴下で滴下し、1時間攪拌した。反応溶液を濃縮し、分取HPLC(炭酸水素アンモニウム)で精製して(R,E)-3-クロロ-7-(4-(ジメチルアミノ)ブタ-2-エノイル)-2-(2-フルオロフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキサ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(120mg)を収率42%で得た。
工程3:上記で得た化合物:(R,E)-3-クロロ-7-(4-(ジメチルアミノ)ブタ-2-エノイル)-2-(2-フルオロフェニル)-12-(2-イソプロピル-4-メチルピリジン-3-イル)-5,5a,6,7,8,9-ヘキサヒドロ-4-オキサ-1,7,9a,10,12-ペンタアザベンゾ[4,5]シクロヘプタ[1,2,3-de]ナフタレン-11(12H)-オン(120mg、0.19mmol)をキラル分割(カラムタイプ:IG 250mm×4.6mm×5μm;移動相:n-ヘキサン:エタノール(0.2%アンモニア含有メタノール)=40:60;流量:1mL/分;カラム温度30℃)して以下の化合物を得た。
Z237-1(65mg、ピーク1、保持時間11.060分、純度:100%、de値:100%):1H NMR(500MHz,DMSO-d6)δ8.35(d,J=5Hz,1H),7.52-7.44(m,1H),7.30-7.21(m,2H),7.17-7.11(m,2H),6.75-6.58(m,2H),4.95-4.83(m,2H),4.64-4.51(m,1H),4.51-4.32(m,1H),4.32-4.23(m,1H),4.13-3.96(m,1H),3.84-3.58(m,2H),3.41-3.36(m,1H),3.07(d,J=4.9Hz,2H),2.75-2.63(m,1H),2.18(s,6H),1.95(s,3H),1.05(d,J=6.5Hz,3H),0.94(d,J=7.0Hz,3H);ES-API:[M+H]+=632.2、及び
Z237-2(45mg、ピーク2、保持時間14.48分、純度:100%、de値:99.68%):1H NMR(500MHz,DMSO-d6)δ8.35(d,J=5Hz,1H),7.51-7.44(m,1H),7.31-7.20(m,2H),7.18-7.12(m,2H),6.74-6.58(m,2H),4.98-4.80(m,2H),4.63-4.51(m,1H),4.50-4.33(m,1H),4.32-4.24(m,1H),4.14-3.97(m,1H),3.84-3.56(m,2H),3.41-3.36(m,1H),3.08(d,J=4.6Hz,2H),2.84-2.69(m,1H),2.18(s,6H),1.93(s,3H),1.06(d,J=6.7Hz,3H),0.93(d,J=6.7Hz,3H);ES-API:[M+H]+=632.2
試験例1.細胞増殖抑制実験
NCI-H358は、Kras G12C変異を有するヒト非小細胞肺癌細胞株であり、10%FBS RPMI-1640培地で培養した。A549は、Kras G12S変異を有するヒト肺腺癌細胞株であり、10%FBS F-12K培地で培養した。対数増殖期の細胞を採取し、トリプシンEDTAで消化し、回収してカウントした。H358は、2%FBS RPMI-1640培地を用いて細胞数1.8E4個/mLに調整し、A549は、2%FBS F-12K培地を用いて細胞数8.9E3個/mLに調整した。800個(45μl)のH358細胞又は400個(45μl)のA549細胞をそれぞれ384ウェル球形プレートに播種し、一晩培養して3D細胞モデルを構築した。DMSOを用いて1000×化合物の3.16倍勾配濃度ストック溶液を調製し、2%FBS培地を用いて100倍に希釈して10×化合物ストック溶液とした。細胞播種後2日目に、各細胞培養ウェルに5μlの10×化合物ストック溶液を加え、最終濃度を1×とし、DMSO含量を0.1%とした。実験対照(コントロール)としてDMSOを、ブランク対照(ブランク)として2%FBS培地を用いた。化合物及び細胞を加えて5日間培養した後、各ウェルに25μlのCellTiter-Glo使用液を加え、400rpmで混合し、30分間インキュベートした。室温で30分後、40μlの混合液を、底が不透明白色の384ウェルプレートに移し、luminescence化学発光値を読み取った。細胞増殖阻害率IR(%)=(RLUコントロール-RLU化合物)/(RLUコントロール-RLUブランク)×100%を算出し、Prism 6の4パラメータ法を用いて、化合物の勾配希釈濃度と対応する細胞増殖阻害率とをフィットさせ、IC50値を算出した。
この結果から、本発明の例示化合物は、Kras G12C変異体であるNCI-H358細胞に対する阻害活性が高く、IC50が500nM未満、又は100nM未満、又は10nM未満である一方、A549細胞に対する阻害活性は低く、いずれもIC50が1000nMを超え、明らかな選択的阻害活性を有していることがわかる。
表1から、本発明の例示化合物は、Kras G12C変異体であるNCI-H358細胞に対して高い阻害活性を示したが、A549細胞に対しては低い阻害活性を示し、明らかな選択的阻害活性を有することがわかる。
試験例2.細胞p-ERK検出実験
MIA PaCa2は、Kras G12C変異を有するヒト膵臓癌細胞株であり、10%FBS+2.5%ウマ血清DMEM培地で培養した。対数増殖期の細胞を採取し、酵素EDTAで消化し、回収してカウントした。2.5E4個の細胞を96ウェル細胞培養プレートに播種し、一晩培養した。DMSOを用いて1000×化合物の3.16倍勾配濃度ストック溶液を調製し、培地を用いて200倍に希釈して5×化合物ストック溶液とした。細胞播種後2日目に、各細胞培養ウェルに5×化合物ストック溶液を加え、最終濃度を1×とし、DMSO含量を0.1%とした。DMSOを実験対照(コントロール)として用いた。化合物を添加して2時間培養した後、残った培地を除去した。各ウェルに50μlの細胞溶解用緩衝液を加え、混合し、30分間インキュベートした。その後、16μlの混合液を、底が不透明白色の96ウェルプレートに移し、ブランクウェルに16μlの細胞溶解用緩衝液を加えた。移し終えた後、各ウェルに4μlのp-ERK HTRF抗体混合物を加え、4時間インキュベートし、蛍光値を読み取った。化合物阻害率IR(%)=(RLUコントロール-RLU化合物)/(RLUコントロール-RLUブランク)×100%を算出し、Prism 8の4パラメータ法を用いて、化合物の勾配希釈濃度と対応する細胞増殖阻害率とをフィットさせ、IC50値を算出した。この結果から、本発明の例示化合物は、Kras G12Cタンパク質変異を有する細胞経路下流のリン酸化ERKレベルに対して阻害活性が良好であり、IC50が10μM未満、又は1000nM未満、又は500nM未満、又は100nM未満であることがわかる。例示化合物の結果を下記表2に示す。
試験例3.細胞増殖抑制実験
MIA PaCa2は、Kras G12C変異を有するヒト膵臓癌細胞株であり、10%FBS+2.5%ウマ血清DMEM培地で培養した。A549は、Kras G12S変異を有するヒト肺腺癌細胞株であり、10%FBS F-12K培地で培養した。対数増殖期の細胞を採取し、酵素EDTAで消化し、回収してカウントした。200個のMIA PaCa-2細胞又は400個のA549細胞をそれぞれ384ウェル球形プレートに播種し、一晩培養して3D細胞モデルを構築した。DMSOを用いて1000×化合物の3.16倍勾配濃度ストック溶液を調製し、培地を用いて100倍に希釈して10×化合物ストック溶液とした。細胞播種後2日目に、各細胞培養ウェルに10×化合物ストック溶液を加え、最終濃度を1×とし、DMSO含量を0.1%とした。実験対照(コントロール)としてDMSOを、ブランク対照(ブランク)として培地を用いた。化合物及び細胞を加えて5日間培養した後、各ウェルに30μlのCellTiter-Glo使用液を加え、混合し、30分間インキュベートした。室温で30分後、40μlの混合液を、底が不透明白色の384ウェルプレートに移し、luminescence化学発光値を読み取った。細胞増殖阻害率IR(%)=(RLUコントロール-RLU化合物)/(RLUコントロール-RLUブランク)×100%を算出し、XLFitの4パラメータ法を用いて、化合物の勾配希釈濃度と対応する細胞増殖阻害率とをフィットさせ、IC50値を算出した。この結果から、本発明の例示化合物は、Kras G12C変異体であるMIA PaCa-2細胞に対する阻害活性が高く、IC50が1000nM未満、又は500nM未満、又は100nM未満、又は10nM未満であることがわかる。例示化合物の結果を下記表3に示す。
本発明で言及される全ての文書は、本出願において、各文書が個別に参考文献として引用されるように参考文献として引用される。また、本発明の上記教示内容を読んだ当業者は、本発明に様々な変更や修正を加えることができ、それら同等の形態も本出願の添付の請求項で定義された範囲内に包含されることを理解すべきである。