JP7072228B2 - 組織および細胞を処理するための方法および装置 - Google Patents
組織および細胞を処理するための方法および装置 Download PDFInfo
- Publication number
- JP7072228B2 JP7072228B2 JP2018563726A JP2018563726A JP7072228B2 JP 7072228 B2 JP7072228 B2 JP 7072228B2 JP 2018563726 A JP2018563726 A JP 2018563726A JP 2018563726 A JP2018563726 A JP 2018563726A JP 7072228 B2 JP7072228 B2 JP 7072228B2
- Authority
- JP
- Japan
- Prior art keywords
- sample
- microfluidic
- support plate
- carriage
- microfluidic chip
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000000034 method Methods 0.000 title description 55
- 239000000523 sample Substances 0.000 claims description 305
- 238000012545 processing Methods 0.000 claims description 59
- 239000012530 fluid Substances 0.000 claims description 26
- 230000006870 function Effects 0.000 claims description 10
- 230000033001 locomotion Effects 0.000 claims description 10
- 230000003993 interaction Effects 0.000 claims description 9
- 239000012472 biological sample Substances 0.000 claims description 7
- 238000004891 communication Methods 0.000 claims description 3
- 230000000149 penetrating effect Effects 0.000 claims description 2
- 230000002457 bidirectional effect Effects 0.000 claims 1
- 210000004027 cell Anatomy 0.000 description 65
- 210000001519 tissue Anatomy 0.000 description 45
- 238000011282 treatment Methods 0.000 description 36
- 210000000577 adipose tissue Anatomy 0.000 description 26
- 239000000463 material Substances 0.000 description 25
- 238000007443 liposuction Methods 0.000 description 21
- 230000008569 process Effects 0.000 description 19
- 210000002901 mesenchymal stem cell Anatomy 0.000 description 14
- 210000000130 stem cell Anatomy 0.000 description 14
- 102100031573 Hematopoietic progenitor cell antigen CD34 Human genes 0.000 description 10
- 101000777663 Homo sapiens Hematopoietic progenitor cell antigen CD34 Proteins 0.000 description 10
- 229910052751 metal Inorganic materials 0.000 description 10
- 206010028980 Neoplasm Diseases 0.000 description 9
- 239000002184 metal Substances 0.000 description 9
- 238000011144 upstream manufacturing Methods 0.000 description 9
- 230000000875 corresponding effect Effects 0.000 description 8
- 239000011347 resin Substances 0.000 description 8
- 229920005989 resin Polymers 0.000 description 8
- 102000029816 Collagenase Human genes 0.000 description 7
- 108060005980 Collagenase Proteins 0.000 description 7
- 238000013461 design Methods 0.000 description 7
- 238000004519 manufacturing process Methods 0.000 description 7
- 238000009423 ventilation Methods 0.000 description 7
- -1 CD31 Proteins 0.000 description 6
- 239000003153 chemical reaction reagent Substances 0.000 description 6
- 229960002424 collagenase Drugs 0.000 description 6
- 239000002609 medium Substances 0.000 description 6
- 238000002560 therapeutic procedure Methods 0.000 description 6
- 102000004190 Enzymes Human genes 0.000 description 5
- 108090000790 Enzymes Proteins 0.000 description 5
- 229910000831 Steel Inorganic materials 0.000 description 5
- 229910052782 aluminium Inorganic materials 0.000 description 5
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 5
- 239000012298 atmosphere Substances 0.000 description 5
- 206010012601 diabetes mellitus Diseases 0.000 description 5
- 229940088598 enzyme Drugs 0.000 description 5
- 230000003834 intracellular effect Effects 0.000 description 5
- 239000002245 particle Substances 0.000 description 5
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 5
- 229920000515 polycarbonate Polymers 0.000 description 5
- 239000004417 polycarbonate Substances 0.000 description 5
- 239000004926 polymethyl methacrylate Substances 0.000 description 5
- 238000009987 spinning Methods 0.000 description 5
- 239000010959 steel Substances 0.000 description 5
- 210000004881 tumor cell Anatomy 0.000 description 5
- 210000005167 vascular cell Anatomy 0.000 description 5
- 102100025680 Complement decay-accelerating factor Human genes 0.000 description 4
- 102100025012 Dipeptidyl peptidase 4 Human genes 0.000 description 4
- 101000856022 Homo sapiens Complement decay-accelerating factor Proteins 0.000 description 4
- 101000908391 Homo sapiens Dipeptidyl peptidase 4 Proteins 0.000 description 4
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 4
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 4
- 208000025865 Ulcer Diseases 0.000 description 4
- 208000027418 Wounds and injury Diseases 0.000 description 4
- 238000004140 cleaning Methods 0.000 description 4
- 239000002537 cosmetic Substances 0.000 description 4
- 238000005520 cutting process Methods 0.000 description 4
- 229940090124 dipeptidyl peptidase 4 (dpp-4) inhibitors for blood glucose lowering Drugs 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 239000007769 metal material Substances 0.000 description 4
- 229920003023 plastic Polymers 0.000 description 4
- 239000004033 plastic Substances 0.000 description 4
- 229920000642 polymer Polymers 0.000 description 4
- 239000002861 polymer material Substances 0.000 description 4
- 238000010008 shearing Methods 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 230000002966 stenotic effect Effects 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 231100000397 ulcer Toxicity 0.000 description 4
- 102100022464 5'-nucleotidase Human genes 0.000 description 3
- 102100023126 Cell surface glycoprotein MUC18 Human genes 0.000 description 3
- 101000678236 Homo sapiens 5'-nucleotidase Proteins 0.000 description 3
- 101000623903 Homo sapiens Cell surface glycoprotein MUC18 Proteins 0.000 description 3
- 208000031481 Pathologic Constriction Diseases 0.000 description 3
- 206010052428 Wound Diseases 0.000 description 3
- 230000000735 allogeneic effect Effects 0.000 description 3
- 238000013459 approach Methods 0.000 description 3
- 238000011109 contamination Methods 0.000 description 3
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 3
- 238000001746 injection moulding Methods 0.000 description 3
- 150000002739 metals Chemical class 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 239000002953 phosphate buffered saline Substances 0.000 description 3
- 238000007639 printing Methods 0.000 description 3
- 230000036262 stenosis Effects 0.000 description 3
- 208000037804 stenosis Diseases 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 230000035899 viability Effects 0.000 description 3
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- 206010056340 Diabetic ulcer Diseases 0.000 description 2
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 230000000712 assembly Effects 0.000 description 2
- 238000000429 assembly Methods 0.000 description 2
- 239000011324 bead Substances 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 210000004271 bone marrow stromal cell Anatomy 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 230000006037 cell lysis Effects 0.000 description 2
- 239000002771 cell marker Substances 0.000 description 2
- 230000003833 cell viability Effects 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 229910003460 diamond Inorganic materials 0.000 description 2
- 239000010432 diamond Substances 0.000 description 2
- 229940124568 digestive agent Drugs 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 230000003511 endothelial effect Effects 0.000 description 2
- 230000006862 enzymatic digestion Effects 0.000 description 2
- 230000002255 enzymatic effect Effects 0.000 description 2
- 210000003743 erythrocyte Anatomy 0.000 description 2
- 210000001808 exosome Anatomy 0.000 description 2
- 238000011049 filling Methods 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 230000035876 healing Effects 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 238000010329 laser etching Methods 0.000 description 2
- 238000011068 loading method Methods 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 238000003801 milling Methods 0.000 description 2
- 210000000822 natural killer cell Anatomy 0.000 description 2
- 210000003463 organelle Anatomy 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 239000008188 pellet Substances 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 230000002062 proliferating effect Effects 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 229910052761 rare earth metal Inorganic materials 0.000 description 2
- 150000002910 rare earth metals Chemical class 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 239000010935 stainless steel Substances 0.000 description 2
- 229910001220 stainless steel Inorganic materials 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 1
- 238000010146 3D printing Methods 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 108010081589 Becaplermin Proteins 0.000 description 1
- 208000010392 Bone Fractures Diseases 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 208000008960 Diabetic foot Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 102100024785 Fibroblast growth factor 2 Human genes 0.000 description 1
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 1
- 206010017076 Fracture Diseases 0.000 description 1
- 102100021866 Hepatocyte growth factor Human genes 0.000 description 1
- 102100031465 Hepatocyte growth factor activator Human genes 0.000 description 1
- 101710085796 Hepatocyte growth factor activator Proteins 0.000 description 1
- 101000898034 Homo sapiens Hepatocyte growth factor Proteins 0.000 description 1
- 101001076408 Homo sapiens Interleukin-6 Proteins 0.000 description 1
- 101000868152 Homo sapiens Son of sevenless homolog 1 Proteins 0.000 description 1
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 1
- 102000004218 Insulin-Like Growth Factor I Human genes 0.000 description 1
- 102100020880 Kit ligand Human genes 0.000 description 1
- 101710177504 Kit ligand Proteins 0.000 description 1
- 102100039648 Lactadherin Human genes 0.000 description 1
- 101710191666 Lactadherin Proteins 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 108700011259 MicroRNAs Proteins 0.000 description 1
- 108091028066 Mir-126 Proteins 0.000 description 1
- 108091062140 Mir-223 Proteins 0.000 description 1
- 229930040373 Paraformaldehyde Natural products 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 229920005372 Plexiglas® Polymers 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 101710088580 Stromal cell-derived factor 1 Proteins 0.000 description 1
- 102100021669 Stromal cell-derived factor 1 Human genes 0.000 description 1
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 1
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 1
- 239000006096 absorbing agent Substances 0.000 description 1
- 230000001133 acceleration Effects 0.000 description 1
- DPKHZNPWBDQZCN-UHFFFAOYSA-N acridine orange free base Chemical compound C1=CC(N(C)C)=CC2=NC3=CC(N(C)C)=CC=C3C=C21 DPKHZNPWBDQZCN-UHFFFAOYSA-N 0.000 description 1
- 239000004676 acrylonitrile butadiene styrene Substances 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 238000005273 aeration Methods 0.000 description 1
- 239000000956 alloy Substances 0.000 description 1
- 229910045601 alloy Inorganic materials 0.000 description 1
- 230000001668 ameliorated effect Effects 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 238000000071 blow moulding Methods 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 208000029028 brain injury Diseases 0.000 description 1
- 210000005013 brain tissue Anatomy 0.000 description 1
- 210000000845 cartilage Anatomy 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 238000003486 chemical etching Methods 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 238000002316 cosmetic surgery Methods 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 102000038379 digestive enzymes Human genes 0.000 description 1
- 108091007734 digestive enzymes Proteins 0.000 description 1
- 230000008034 disappearance Effects 0.000 description 1
- 238000007599 discharging Methods 0.000 description 1
- 108010007093 dispase Proteins 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 230000007515 enzymatic degradation Effects 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 230000003779 hair growth Effects 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 210000004153 islets of langerhan Anatomy 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 238000005304 joining Methods 0.000 description 1
- 238000011542 limb amputation Methods 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 238000003754 machining Methods 0.000 description 1
- 239000006249 magnetic particle Substances 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 210000005060 membrane bound organelle Anatomy 0.000 description 1
- 108091043612 miR-146b stem-loop Proteins 0.000 description 1
- 108091025686 miR-199a stem-loop Proteins 0.000 description 1
- 108091070501 miRNA Proteins 0.000 description 1
- 239000002679 microRNA Substances 0.000 description 1
- 238000001000 micrograph Methods 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 229940028444 muse Drugs 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 230000000926 neurological effect Effects 0.000 description 1
- 210000000948 non-nucleated cell Anatomy 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 238000005192 partition Methods 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 230000019612 pigmentation Effects 0.000 description 1
- 239000004626 polylactic acid Substances 0.000 description 1
- 229920006324 polyoxymethylene Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 229910000028 potassium bicarbonate Inorganic materials 0.000 description 1
- 235000015497 potassium bicarbonate Nutrition 0.000 description 1
- 239000011736 potassium bicarbonate Substances 0.000 description 1
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 description 1
- XJMOSONTPMZWPB-UHFFFAOYSA-M propidium iodide Chemical compound [I-].[I-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CCC[N+](C)(CC)CC)=C1C1=CC=CC=C1 XJMOSONTPMZWPB-UHFFFAOYSA-M 0.000 description 1
- 238000012342 propidium iodide staining Methods 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000001172 regenerating effect Effects 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 230000035939 shock Effects 0.000 description 1
- 210000004872 soft tissue Anatomy 0.000 description 1
- 208000020431 spinal cord injury Diseases 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 238000002660 stem cell treatment Methods 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 230000001502 supplementing effect Effects 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 239000010936 titanium Substances 0.000 description 1
- 229910052719 titanium Inorganic materials 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 238000003466 welding Methods 0.000 description 1
- 230000029663 wound healing Effects 0.000 description 1
- 230000037303 wrinkles Effects 0.000 description 1
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502715—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by interfacing components, e.g. fluidic, electrical, optical or mechanical interfaces
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N35/00—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502707—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by the manufacture of the container or its components
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/50273—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by the means or forces applied to move the fluids
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502753—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by bulk separation arrangements on lab-on-a-chip devices, e.g. for filtration or centrifugation
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502761—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip specially adapted for handling suspended solids or molecules independently from the bulk fluid flow, e.g. for trapping or sorting beads, for physically stretching molecules
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L9/00—Supporting devices; Holding devices
- B01L9/52—Supports specially adapted for flat sample carriers, e.g. for plates, slides, chips
- B01L9/527—Supports specially adapted for flat sample carriers, e.g. for plates, slides, chips for microfluidic devices, e.g. used for lab-on-a-chip
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B04—CENTRIFUGAL APPARATUS OR MACHINES FOR CARRYING-OUT PHYSICAL OR CHEMICAL PROCESSES
- B04B—CENTRIFUGES
- B04B5/00—Other centrifuges
- B04B5/04—Radial chamber apparatus for separating predominantly liquid mixtures, e.g. butyrometers
- B04B5/0407—Radial chamber apparatus for separating predominantly liquid mixtures, e.g. butyrometers for liquids contained in receptacles
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B04—CENTRIFUGAL APPARATUS OR MACHINES FOR CARRYING-OUT PHYSICAL OR CHEMICAL PROCESSES
- B04B—CENTRIFUGES
- B04B9/00—Drives specially designed for centrifuges; Arrangement or disposition of transmission gearing; Suspending or balancing rotary bowls
- B04B9/10—Control of the drive; Speed regulating
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N35/00—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor
- G01N35/02—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor using a plurality of sample containers moved by a conveyor system past one or more treatment or analysis stations
- G01N35/04—Details of the conveyor system
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0621—Control of the sequence of chambers filled or emptied
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0809—Geometry, shape and general structure rectangular shaped
- B01L2300/0816—Cards, e.g. flat sample carriers usually with flow in two horizontal directions
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0809—Geometry, shape and general structure rectangular shaped
- B01L2300/0819—Microarrays; Biochips
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0809—Geometry, shape and general structure rectangular shaped
- B01L2300/0829—Multi-well plates; Microtitration plates
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0861—Configuration of multiple channels and/or chambers in a single devices
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0861—Configuration of multiple channels and/or chambers in a single devices
- B01L2300/0864—Configuration of multiple channels and/or chambers in a single devices comprising only one inlet and multiple receiving wells, e.g. for separation, splitting
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0861—Configuration of multiple channels and/or chambers in a single devices
- B01L2300/0883—Serpentine channels
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/16—Surface properties and coatings
- B01L2300/161—Control and use of surface tension forces, e.g. hydrophobic, hydrophilic
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0403—Moving fluids with specific forces or mechanical means specific forces
- B01L2400/0409—Moving fluids with specific forces or mechanical means specific forces centrifugal forces
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N35/00—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor
- G01N35/00029—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor provided with flat sample substrates, e.g. slides
- G01N2035/00099—Characterised by type of test elements
- G01N2035/00158—Elements containing microarrays, i.e. "biochip"
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N35/00—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor
- G01N2035/00465—Separating and mixing arrangements
- G01N2035/00495—Centrifuges
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N35/00—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor
- G01N35/02—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor using a plurality of sample containers moved by a conveyor system past one or more treatment or analysis stations
- G01N35/04—Details of the conveyor system
- G01N2035/0439—Rotary sample carriers, i.e. carousels
- G01N2035/0446—Combinations of the above
- G01N2035/0449—Combinations of the above using centrifugal transport of liquid
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Analytical Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Clinical Laboratory Science (AREA)
- Dispersion Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Hematology (AREA)
- Physics & Mathematics (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biochemistry (AREA)
- General Physics & Mathematics (AREA)
- Immunology (AREA)
- Pathology (AREA)
- Fluid Mechanics (AREA)
- Molecular Biology (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Sampling And Sample Adjustment (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Physical Or Chemical Processes And Apparatus (AREA)
- Combined Means For Separation Of Solids (AREA)
- Separation Of Solids By Using Liquids Or Pneumatic Power (AREA)
- Filtration Of Liquid (AREA)
- Devices For Use In Laboratory Experiments (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Centrifugal Separators (AREA)
Description
[0001]
本出願は、2016年6月8日出願の米国仮特許出願番号第62/347,290号に優先権を主張するものであり、その全体が参照により本明細書に組み込まれる。35USC第119条およびその他の該当する法律に従って優先権が主張されている。
技術分野は、一般に、生細胞、および/または組織、試薬、粒子、および流体に剪断応力を加えるための装置および方法に関する。特に、技術分野は、生細胞、および/または組織、試薬、粒子、および流体に剪断応力を加えるためのマイクロ流体ベースの装置と組み合わせて回転力を利用することに関する。
組織を処理するために様々な技術および手順が利用されている。いくつかの用途では、化学物質や酵素が組織に添加されて、より大きな塊または組織の凝集体が、より小さな断片に粉砕される。例えば、コラゲナーゼ、トリプシン、またはディスパーゼなどの消化酵素が、脂肪組織などの組織を消化するために使用される。そのような酵素処理には、典型的には洗浄、それに続く酵素分解および遠心分離が含まれる。この酵素アプローチは、消化酵素の活性レベルが異なるために変異が生じる場合がある。さらに、これらの方法は、細菌に由来する高価な酵素を含む試薬の追加費用を必要とし、完了までにかなり時間がかかり、さらに酵素汚染の影響を最小限にするための追加の処理工程および/または洗浄工程を必要とする。
脂肪組織を含む組織を処理するための非酵素的アプローチも開発されている。例えば、脂肪組織から間質血管細胞群を単離するために、超音波キャビテーションが提案されている。参照によりその全体が本明細書に組み込まれる米国特許第8,440,440号を参照されたい。さらに他の方法は、参照によりその全体が本明細書に組み込まれる国際特許公開WO2014/036094号に開示されているものなど、脂肪組織を均質化するビーズの使用を含む。米国特許第9,580,678号(参照によりその全体が本明細書に組み込まれる)は、腫瘍組織を破壊するために用いられる拡張領域および狭窄領域を有する複数の連続配置されたチャネルまたはステージを使用するマイクロ流体腫瘍分離デバイスを開示する。シリンジポンプを使用して、腫瘍組織をマイクロ流体装置に前後に通している。
脂肪組織といった組織の処理は、脂肪組織が軟組織の欠陥を満たすためにある場所から別の場所に移される(すなわち、脂肪移植)形成外科や再生外科の分野において特に重要である。細胞補助リポトランスファー(CAL)は、脂肪移植片への間質血管細胞群(SVF)の添加を伴う技術であり、脂肪移植片の留置において有意な改善をもたらした。典型的には、SVFは、酵素コラゲナーゼを用いた短い消化ステップによって脂肪組織から採取される。より最近では、「ナノ脂肪グラフト」と呼ばれる技術が開発され、それは標準的な吸引脂肪を2つの連結されたシリンジの間を手動で素早く通過させることによって均質化し、その後に均質化した吸引脂肪を人間の患者に再注入して、外見上のしわ取りや色素沈着の修正を行うものである。ナノ脂肪処理方法は、SVFを機械的に解離させる手段として役立ち得ることもまた見出されたが、細胞にストレスをかけるので多型潜在性さらには多能性の集団も生成する。例えば、ナノ脂肪由来のSVFは、間葉系幹細胞(MSC)、脂肪由来幹細胞(ADSC)、内皮前駆細胞(EPC)、およびMuse細胞の割合が高いことが知られている。細胞に加えられるストレス量は幹様特性と直接相関すると仮定された。
例えば、MSCは、糖尿病性潰瘍の治療に利用することができる。同種移植片のような糖尿病性足部潰瘍の現在の治療は費用がかかり、そして患者の拒絶反応の可能性のせいで効果的でない場合がある。そのような潰瘍が治療されなかったら、患者は四肢切断しなければならず、それは以降のさらなる健康上の合併症をもたらす。これらの潰瘍を治療するための1つの革新的な解決策は、これらの潰瘍の直接治療のためにMSCを用いるものである。しかしながら、そのような細胞を得るための現在のアプローチは、長く、複雑で、そして細胞収率、量および再現性に関して変動的な結果をもたらす。処理組織を得るための迅速で費用対効果の高い方法が必要とされていた。
効率的、効果的かつ再現可能な方法で組織を処理するための装置、システム、および方法の必要性の観点から、そのような装置、方法、およびシステムの様々な実施形態、ならびに対象を治療または投与するための細胞の開発、生産またはその他の調製のためにそれらを使用することが本書に提供されている。
いくつかの実施形態では、受容要素を含む中央部分と、それぞれが複数のキャリッジと可逆的に相互作用するように構成された複数の相互作用領域を含む側方部分と、それぞれが支持プレートの側方部分に機能的に連結されるように構成された複数のキャリッジとを有する支持プレートを具える生体サンプル処理システムが提供される。
いくつかの実施形態では、受容要素はモータの駆動シャフトと可逆的に相互作用するように構成され、このモータは支持プレートに遠心運動を加えるように構成される。一実施形態では、中央部分はモータの駆動シャフトの回転軸に垂直な平面内にあり、側方部分は中央部分から半径方向に延び、少なくとも部分的に前記中央部分の平面に平行する平面内にある。
いくつかの実施形態では、複数のキャリッジのそれぞれは、第1端と第2端と、当該第1端と第2端との間に延びる基部と、処理のためにサンプルを受け取るように構成された少なくとも1つのサンプルチャンバに流体結合されたマイクロ流体チップと可逆的に相互作用するように構成される受入領域とを含む。いくつかの実施形態では、複数のキャリッジのそれぞれは、基部から実質的に直交して延在し、側方部分の複数の相互作用領域のうちの1つと相互作用する(例えば、接続する、取り付ける、または他の相互作用する)ように構成されたポスト、ロッド、シャフト、または他の伸長部を含む。いくつかの実施形態では、複数のキャリッジのそれぞれは、複数の軸のうちの1つの周りに同軸に配置され、動作中、各軸は、モータの駆動シャフトの回転軸と実質的に平行に延在し、複数のキャリッジはそれぞれ、複数の軸のうちの1つの軸の周りで少なくとも間欠的に回転可能である。実施形態によっては、キャリッジは様々な度合いで回転することができる。例えば、いくつかの実施形態では、キャリッジは、約180度の弧を通って回転するように案内される。
いくつかの実施形態において、システムは、システムに従ってサンプルを保持し処理するのに役立つ少なくとも1つのマイクロ流体チップをさらに含む。いくつかの実施形態において、各マイクロ流体チップは、第1端と第2端との間に位置する中央本体部分と、第1端と第2端との間に延びる少なくとも1つのマイクロ流体チャネルとを含み、この少なくとも1つのチャネルは、第1端から第2端までサンプルが通過可能なように構成された変化する寸法を有する。いくつかの実施形態では、第1端および第2端はそれぞれ、サンプルチャンバと流体的に相互作用するように構成されている。使用の便宜のために、個々のマイクロ流体チップはそれぞれ、対応するキャリッジ上の対応する受入領域内に収まるように寸法決めされている。いくつかの実施形態では、各マイクロ流体チップは、第1端および第2端のそれぞれでサンプルチャンバに可逆的に流体的に結合されている。
任意選択で、いくつかの実施形態は、通気口と、サンプルチャンバの内部に流体的に接続された通気路とを含むサンプルチャンバを具える。いくつかの実施形態では、各サンプルチャンバは、アダプタを介してマイクロ流体チップに可逆的に流体的に連結されている。
いくつかの実施形態では、各キャリッジは、当該キャリッジの第1端および第2端に捕捉要素を具え、当該捕捉要素は支持プレートの側方部分の解放要素と連通するように構成されており、前記捕捉要素と解放要素との間の連通により、複数のキャリッジの各々の間欠回転が可能となる。換言すれば、捕捉要素が解放要素との係合を解除するかそうでなくても解放要素との相互作用を停止させる信号(または力、またはその消失)があるまで、捕捉要素はキャリッジを所望の位置に保持するように作用し、その後はキャリッジが回転可能とし、続いてキャリッジの動きを停止させるために捕捉要素が再係合するようにする(いくつかの実施形態では、これにより、組織処理プロトコル内の所望の時間に180度の円弧を通してキャリッジを回転させることができる)。いくつかの実施形態では、捕捉要素は第1の極性の磁石を含み、解放要素は反対の極性の磁石を含む。
いくつかの実施形態では、支持プレートの側方部分は円板を有し、前記相互作用領域は円板の周囲に円周方向に間隔を置いて配置されている。いくつかのそのような実施形態では、側方部分および中央部分は一体構造であるが、他の実施形態では、支持プレートは使用前に接続または一体化される複数の部品を具える。
いくつかの実施形態では、支持プレートの側方部分は複数のアームを含み、各アームは対応する相互作用領域を有する。一実施形態では、アームおよび中央部分は一体構造である。さらなる実施形態では、アームと中央部分は互いに接合された別々の構造体である。いくつかの実施形態では、アームは中央部分に対してヒンジ結合されている。いくつかのそのような実施形態では、ヒンジは、動作中にアームがモータの駆動シャフトの回転軸と実質的に平行な軸の平面内で移動することを可能にする。いくつかの実施形態では、これにより、静かな起動および停止プロセスが可能になり、遠心力の急激な印加または消失によって細胞/組織サンプルが破壊されない。
いくつかの実施形態では、側方部分の相互作用領域は、対応するキャリッジからポスト(または他の構造体)を受け入れる貫通孔を有する。いくつかの実施形態では、この受入領域はキャリッジの基部の上面に配置されている。いくつかの実施形態では、ポストはキャリッジの基部の底面から延在する。そのような実施形態では、ポスト(または他の構造体)はキャリッジの底部から延在し、側方部分(例えばアーム)の貫通孔(受入領域)を通過して、例えばナット、ピン、クランプまたは他のそのような機構によって固定される(側方部分に対する回転は可能である)。いくつかの実施形態では、各キャリッジの間欠回転は、側方部分に配置された歯車と各キャリッジの回転を引き起こす固定歯との相互作用によって達成される。
いくつかの実施形態では、側方部分は少なくとも3つのアームを具え、3つのアームのそれぞれは、第1端および第2端を含む少なくとも3つのキャリッジのうちの1つと相互作用するように構成された相互作用領域を有し、各キャリッジは少なくとも3つのマイクロ流体チップのうちの1つと可逆的に相互作用するように構成されており、各チップが第1端、第2端、およびそれらの間の本体部を有し、マイクロ流体チップの各端部がサンプルチャンバに流体的に結合され、チップの本体部が前記第1端と第2端の間に延びる複数のマイクロ流体経路を有し、前記キャリッジは、前記第1端が前記中央部分の受容要素から第1の距離にある第1の場所に配置される第1の位置と、前記第1端が前記中央部分の受容要素から第2の距離にある第2の場所に配置される第2の位置との間で間欠的に回転するように構成され、前記第1の距離は第2の距離より大きい。
実施形態によっては、システムは任意選択的にエンクロージャを含むことができ、当該エンクロージャはシステムを外部環境から分離する。
実施形態によっては、前記システムは任意選択的に、前記駆動シャフトに動作可能に接続されたモータをさらに具える。いくつかの実施形態では、前記モータは、前記モータの回転速度の制御を実現するコントローラユニットによって制御され、前記コントローラユニットは、ユーザが組織を処理するためのプロトコルをプログラム(または事前プログラムから選択)できるようにするインターフェースを具える。
生物学的サンプルを処理するための方法もまた本明細書に提供される。例えば、いくつかの実施形態では、生物学的サンプルを処理する方法において、マイクロ流体チップと流体結合するように構成された第1のサンプルチャンバに生物学的サンプルを装填するステップを具え、当該チップは第1端と第2端との間に延在する中央本体部分を有し、前記第1端は前記第1のサンプルチャンバと流体結合し、前記第2端は第2のサンプルチャンバと流体結合しており、少なくとも1つのマイクロ流体チャネルが前記第1端と第2端との間に延在し、当該少なくとも1つのチャネルは、その寸法が変化し、前記第1端から第2端までサンプルを通過させるように構成され、マイクロ流体チップを遠心力装置の一部である複数のキャリッジのうちの1つの受入領域と可逆的に結合し、前記遠心力装置は、中央部分と側方部分とを有する支持プレートを具え、前記側方部分は前記中央部分から半径方向に延在し、前記中央部分の平面に平行な平面内に位置し、前記キャリッジはそれぞれ前記支持プレートの側方部分に動作可能に連結され、第1端と、第2端と、前記第1端および第2端の間に延びる基部とを具え、前記基部が前記受入領域を含み、各キャリッジは、前記中央部分の平面に対して実質的に垂直な軸の周りを回転可能に構成され、前記キャリッジは、前記第1端が前記支持プレートの中央部分から第1の距離に配置された第1の位置から開始し、前記第2端が前記支持プレートの中央部分から第1の距離に配置されるように前記第2端が配置された第2の位置へと回転可能であり、前記遠心力装置に回転力を加えることによって、サンプルを、マイクロ流体チップの第1端に連結された第1のサンプルチャンバから、前記第1端と第2端の間に延在する少なくとも1つのマイクロ流体チャネルを通り、前記第2のサンプルチャンバへと通過させ、前記第1端と第2端の間で前記キャリッジを回転可能とし、さらなる回転力を加えて、サンプルを、前記第2のサンプルチャンバから前記第2端と第1端の間に延在する少なくとも1つのマイクロ流体チャネルを介して前記第1のサンプルチャンバへ戻す。いくつかの実施形態では、生体サンプルは脂肪組織を含むが、本明細書に開示されるシステムおよび方法を用いて他の種類の組織を処理することもできる。例えば、脂肪組織、腫瘍組織、細胞調製物、脂肪吸引物、培養細胞などを容易に処理することができる。
さらに、いくつかの実施形態では、垂直に配向された回転チャックに結合されたモータと、支持プレートの周りに半径方向に配置された複数の回転可能キャリッジを含む支持プレートとを具えるサンプル処理システムが提供され、前記支持プレートは前記回転チャックに搭載されるか固定され、前記少なくとも1つのマイクロ流体チップは、前記回転可能キャリッジのうちの1つに配置され、前記少なくとも1つのマイクロ流体チップは、当該マイクロ流体チップの第1ポートから前記マイクロ流体チップの反対側の端部に配置された第2ポートまで延在する1またはそれ以上のマイクロ流体チャネルによって形成される流路を画定する。
いくつかの実施形態では、このようなシステムは、前記回転可能キャリッジ内に配置された第1のサンプル保持チャンバと第2のサンプル保持チャンバとを具え、前記第1のサンプル保持チャンバは、前記第1ポートを介して少なくとも1つのマイクロ流体チップに流体結合し、第2のサンプル保持チャンバは、前記第2ポートを介して少なくとも1つのマイクロ流体チップに流体的に結合されている。いくつかの実施形態において、第1のサンプル保持チャンバおよび第2のサンプル保持チャンバは、第1ポートと第1のサンプル保持チャンバとの間、および第2ポートと第2のサンプル保持チャンバとの間にそれぞれ挿入されたアダプタを介して少なくとも1つのマイクロ流体チップに流体結合される。いくつかの実施形態では、前記少なくとも1つのマイクロ流体チップは、前記少なくとも1つのマイクロ流体チップ内に配置された第1のサンプル保持チャンバと第2のサンプル保持チャンバとを具える。
いくつかの実施形態では、支持プレートは複数のアームを含み、複数のアームのそれぞれは1つの回転可能キャリッジを保持する。いくつかのそのような実施形態では、前記複数のアームは個別の中央ハブに固定されている。いくつかの実施形態では、前記支持プレートが、その内部またはその上に配置され、前記回転可能キャリッジの一端に隣接配置された第1の磁気要素を具える。
あるいは、いくつかの実施形態では、前記回転可能キャリッジは、前記支持プレートに搭載された歯車アセンブリ内に配置された歯車セットに結合され、前記歯車セットは前記歯車アセンブリの半径方向外側部分に露出した歯車を有する。いくつかの実施形態では、前記歯車アセンブリまたは前記支持プレートが、その中に配置された静止磁石をさらに具え、前記回転可能キャリッジが、その両端に配置された一対の磁気要素を具える。
いくつかの実施形態では、前記複数の回転可能キャリッジは、前記支持プレートの回転面と実質的に平行な面内で回転可能である。いくつかの実施形態では、前記複数の回転可能キャリッジは、前記支持プレートの回転面に対して実質的に直交する面内で回転可能である。
いくつかの実施形態では、システムがさらに、前記複数の回転可能キャリッジのそれぞれの下の支持プレートに配置された電磁石を具え、前記回転可能キャリッジは、前記支持プレートに形成された開口を通って延びる磁気ポスト要素を具える。
いくつかの実施形態では、前記マイクロ流体チップは、流路の中央領域において狭窄部で合流する一対のテーパ領域によって形成されたマイクロ流体チャネルを有する流路を具える。いくつかの実施形態では、前記テーパ領域は連続する複数のテーパ領域を含む。一実施形態では、前記テーパ領域は階段状の複数のテーパ領域を含む。さらなる実施形態では、流路は、チャネルの長さに沿って拡がった複数の拡張領域および狭窄領域を有するマイクロ流体チャネルを含む。いくつかの実施形態では、前記複数の拡張領域および狭窄領域は、前記マイクロ流体チャネル内の湾曲した壁によって画定される。いくつかの実施形態では、前記複数の拡張領域および狭窄領域は、前記マイクロ流体チャネル内の傾斜壁によって画定される。いくつかの実施形態では、流路は、前記マイクロ流体チャネルの長さに沿って配置された複数のフィン形状のポケットを有するマイクロ流体チャネルを含む。いくつかの実施形態では、流路は、寸法が拡大された複数の分岐チャネルと再結合する、寸法が縮小された複数の分岐チャネルを含む。一実施形態では、各分岐チャネルは分岐部を含む。さらなる実施形態では、各分岐部は鋭利な縁部を含む。
いくつかの実施形態では、前記第1のサンプル保持チャンバおよび第2のサンプル保持チャンバのうちの少なくとも一方はシリンジバレル、例えば標準の2mL、5mL、10mL、20mL、または60mLのシリンジバレルを具える。いくつかの実施形態では、少なくとも1つのマイクロ流体チップと前記第1のサンプル保持チャンバまたは第2のサンプル保持チャンバのうちの1つとの間に挿入されたフィルタをさらに具える。いくつかの実施形態では、前記フィルタは、マイクロ流体チップの上流または前に配置され、前記マイクロ流体チップの目詰まりを防ぐためにサンプルを濾過するように構成される。いくつかの実施例では、上流のフィルタは、組織または組織片を切断または微細化して、目詰まりすることなくサンプルがマイクロ流体チップを通過できるように構成されたメッシュを含むことができる。サンプルの切断または微細化は、前記マイクロ流体チップにおけるマイクロ流体剪断の目的のための巨視的凝集塊を生成するように構成される。いくつかの実施形態では、前記フィルタは、前記マイクロ流体チップの下流または後に配置されて、特定のサイズのサンプルのみを回収するために装置を通過させるようにする。
いくつかの実施形態では、システムはまた、回転可能キャリッジ内に配置され、前記マイクロ流体チップの第1ポートに結合されたサンプル保持チャンバと、前記マイクロ流体チップの第2ポートに結合されたシリンジとを具え、前記シリンジは前記マイクロ流体チップの回転面にほぼ直交するように搭載される。いくつかの実施形態では、本書記載のシステムは、前記シリンジのプランジャに連結され垂直方向に移動可能なプレートまたはリングを任意に含み得る。いくつかの実施形態では、前記垂直方向に移動可能なプレートまたはリングは、回転式のねじ付きロッドに取り付けられた雌ねじベアリングを具える。任意選択で、特定の実施形態は、前記ねじ付きロッドに結合された第2のモーターをさらに含む。
いくつかの実施形態では、前記システムの第1のサンプル保持チャンバおよび第2のサンプル保持チャンバの少なくとも一方は、内部に配置された一方向弁を有する入口を具える。
いくつかの実施形態では、本明細書に開示されるシステムを使用する方法が提供され、支持プレートを回転させて第1ポートを介して少なくとも1つのマイクロ流体チップの1つ以上のマイクロ流体チャネルにサンプルを移動させ、第2ポートから出すステップと、前記少なくとも1つのマイクロ流体チップを含む回転可能キャリッジを、約180°にわたって回転させるステップと、前記支持プレートを回転させて、第2ポートを介してサンプルを1つ以上のマイクロ流体チャネルに移動させ、第1ポートから出すステップと、少なくとも1つのマイクロ流体チップを含む回転可能キャリッジを、約180°にわたって回転させるステップと、サンプルが所望の程度に処理されるまで、これらのステップを複数回繰り返すステップとを具える。
いくつかのそのような方法では、サンプルは、第1ポートに流体結合された第1のサンプル保持チャンバと第2ポートに流体結合された第2のサンプル保持チャンバとの間を移動する。いくつかの実施形態では、前記第1のサンプル保持チャンバおよび第2のサンプル保持チャンバの少なくとも一方がシリンジバレルを具える。
いくつかの実施形態では、サンプルは腫瘍組織を含む。いくつかの態様において、サンプルは脂肪組織を含む。いくつかの実施形態では、サンプルは1またはそれ以上の試薬を含む流体を含む。いくつかの実施形態では、サンプルは粒子(例えば、ナノ粒子、磁性粒子、試薬または抗体で被覆された粒子など)を含む。いくつかの実施形態において、サンプルは細胞含有流体を含む。
いくつかの実施形態において、組織を処理した後、本明細書に開示される方法は、処理した組織(例えば脂肪組織)を対象に注入することをさらに含む。
上記のシステム、装置および方法を補足して、サンプルを処理するためのシステムも提供され、これは前記支持プレートから半径方向に延びる複数のアームを含む支持プレートと、前記支持プレートに結合され、前記支持プレートを回転させるように構成されたモータと、各々が支持プレート上の複数のアームのうちの1つに配置された複数のキャリッジとを具え、前記複数のキャリッジのそれぞれは、それぞれ前記キャリッジが配置されたアームから垂直に延在する複数の軸のうちの1つの周りに同軸に配置され、前記複数のキャリッジのそれぞれは、マイクロ流体チップと、処理のためにサンプルを受け取るための少なくとも1つのサンプルチャンバとを収容するように構成され、前記少なくとも1つのサンプルチャンバは、前記マイクロ流体チップに流体結合された開口を有し、前記複数のキャリッジのそれぞれは、前記複数の軸のうちの1つの周りで回転可能である。
いくつかの実施形態では、システムは、前記モータを駆動するように構成されたコントローラをさらに含み、前記コントローラは、前記モータの回転速度または毎分回転数(RPM)を調整するように構成されている。いくつかの実施形態では、前記コントローラは、所定のスピンプログラムまたは動作シーケンスで調整可能またはプログラム可能である。いくつかの実施形態において、前記コントローラは、前記モータの回転速度を、サンプルが前記マイクロ流体チップの第1端から前記マイクロ流体チップの第2端まで流れるようなRPM速度まで上昇させるように構成される(または構成可能である)。いくつかの実施形態では、前記コントローラは、前記複数のキャリッジのそれぞれが複数の軸のうちの1つの周りで回転するように、モータのRPMを加速または減速するように構成される。
いくつかの実施形態において、前記複数のキャリッジのそれぞれは、複数の軸のうちの1つの周りで180度回転するように構成される。さらに、いくつかの実施形態では、前記複数のキャリッジのそれぞれは、第1のサンプルチャンバおよび第2のサンプルチャンバを受容するように構成され、前記第1のサンプルチャンバはマイクロ流体チャンバの第1端に配置され、前記第2のサンプルチャンバはマイクロ流体チャンバの第2端に配置される。
いくつかの実施形態は、アダプタを使用して前記マイクロ流体チップの端部に取り付けられた少なくとも1つのサンプルチャンバを具える。前記アダプタは、ルアースリップ、スリップチップコネクタ、ルアーロック、および回転カラーのうちの1つを含み得る。前記アダプタは、実施形態によって、そしてまた前記マイクロ流体チップが使い捨てであるか再使用可能(例えば、滅菌可能)であるかに応じて、金属またはポリマー材料を含み得る。
いくつかの実施形態では、前記支持プレートはケースの内側に配置され、当該ケースはサンプルを処理するシステムからユーザを保護するように構成される。前記ケースは、プラスチック材料または金属のような任意の材料を含み、この材料は、低真空圧力、低温、熱変化、または前記支持プレートの遠心回転によって生じる破片によるケースの貫通または破裂を防ぐのに十分な厚さで提供される。いくつかの実施形態では、必要に応じて、前記ケースは、サンプルを入れる、サンプルを取り出す、または1つ以上のキャリッジを手動で回転させるために開閉されるように構成される。いくつかの実施形態では、前記ケースは光学的に透明であり、サンプルを処理するためのシステムの動作を観察できるように構成されている。
複数のアームを有する実施形態では、複数のアームのそれぞれが、第1の係合構造と、当該第1の係合構造から距離を置いて配置された第2の係合構造とをさらに具え、これら第1の係合構造と第2の係合構造はそれぞれ、前記キャリッジの第1端に配置された第1の構造と、前記キャリッジの第2端に配置された第2の構造とのうちの1つと係合するように構成される。いくつかのそのような実施形態において、第1および第2の係合構造は、前記キャリッジが前記複数の軸のうちの1つの周りの複数の配向間で移動可能に構成されるように、互換的に、前記第1の構造および第2の構造を解放および係合するように構成される。
いくつかの実施形態では、前記第1の係合構造および第2の係合構造は磁石であり、前記第1の構造および第2の構造は磁気応答材料を含む。いくつかの実施形態では、前記第1の係合構造および第2の係合構造は磁気応答材料を含み、前記第1の構造および第2の構造は磁石である。いくつかの実施形態では、前記第1の係合構造は、前記複数のアームのそれぞれの長さに沿って前記第2の係合構造から遠位に配置されている。前記キャリッジを移動させるために、いくつかの実施形態では、加速力または減速力が前記キャリッジを複数の配向間で移動させるように構成される。いくつかの実施形態では、前記キャリッジは歯車アセンブリを具え、当該歯車アセンブリは前記キャリッジを複数の配向間で移動させるように構成される。いくつかの実施形態では、前記キャリッジは求心性ラチェットを具え、当該求心性ラチェットは前記キャリッジを複数の配向間で移動させるように構成される。
マイクロ流体チップを通るサンプルの適切な流れを実現するために、いくつかの実施形態では、前記少なくとも1つのサンプルチャンバは、通気口と、サンプル流路の内部に流体接続された通気路とを具え、この通気路は(例えば、真空を防ぐことによって)サンプルチャンバを通る層流を提供するように構成される。いくつかの実施形態では、通気口は開口部としてサンプルチャンバの反対側の端部に配置されている。実施形態によっては、前記サンプルチャンバは、長方形、正方形、楕円形、円柱形、長円形、または他の多角形形状を含む任意の所望の形状とすることができる。一実施形態では、前記サンプルチャンバは長方形である。いくつかの代替実施形態では、前記サンプルチャンバはシリンジである。いくつかのそのような実施形態では、シリンジは、前記マイクロ流体チップに流体接続するように構成される開口部を有するアダプタ端部を有するチャンバと、前記チャンバ内に配置されたシールを含むプランジャと、前記プランジャの遠位端に取り付けられ、当該プランジャを前進および後退させるように構成されたデプレッサーとを具える。いくつかの実施形態では、前記シリンジは、チャンバの内部に流体接続された通気口および通気チャネルを含み、前記通気口は、シリンジを通る層流を提供するように構成される。さらに、いくつかの実施形態では、前記シリンジは、二次シリンジプランジャを任意で含むことができ、当該二次シリンジプランジャは前記通気チャネル内に配置され、前記通気チャネルを選択的に開閉するように構成される。そのような実施形態では、二次シリンジは、デプレッサーの動きがプランジャおよび二次プランジャの両方を前進および後退させるように構成されるように、任意でデプレッサーに連結される。いくつかの実施形態では、前記シリンジのアダプタ端部は針を受容するように構成される。いくつかの実施形態では、前記シリンジは前記マイクロ流体チップから取り外し可能であるように構成され、サンプルは注入部位に直接注入されるように構成される。
いくつかの実施形態では、前記複数のチャンバ(例えば、マイクロ流体チップを保持するためのチャンバ)のそれぞれは、前記複数のアームの各々の開口部内に保持され、前記複数のチャンバのそれぞれは、前記複数のアームのそれぞれの開口部を通って延在する。いくつかの実施形態では、前記複数のチャンバのそれぞれは、前記複数のアームのそれぞれの平面に沿って保持されている。いくつかの実施形態では、前記複数のチャンバのそれぞれは、前記複数のチャンバのそれぞれが面外回転できるように構成された少なくとも1つのピンで、前記複数のアームのそれぞれの開口部に保持される。いくつかの実施形態では、前記複数のチャンバのそれぞれの面外回転は、複数の配向間で複数のチャンバのそれぞれを動かすように構成される。いくつかの実施形態では、前記複数のチャンバのそれぞれは(面内であれ面外であれ)180°の回転の間で移動する。いくつかの実施形態では、前記複数のチャンバのそれぞれは、前記複数のチャンバのそれぞれが前記複数のアームのそれぞれの平面に沿って位置する向きの間で移動する。
いくつかの実施形態では、本明細書に開示されるシステムは、大きなサイズのサンプル成分がマイクロ流体チップに入り込み目詰まりさせるのを防ぐように構成された少なくとも1つのフィルタをさらに具える。いくつかの実施形態では、フィルタをサンプルチャンバに取り付けて、サンプルをマイクロ流体チップのマイクロ流体流路入り込む前にサンプルを濾過する。いくつかの実施形態では、フィルタは、前記マイクロ流体チップの上流または前に配置され、マイクロ流体チップの目詰まりを防ぐためにサンプルを濾過するように構成される。いくつかの実施例では、上流のフィルタは、組織または組織片を切断または微細化して、サンプルがマイクロ流体チップを目詰まりすることなく通過できるように構成されたメッシュを含むことができる。サンプルの切断または微細化は、マイクロ流体チップ内でマイクロ流体剪断の目的のための巨視的凝集塊を生成するように構成される。いくつかの実施形態では、前記フィルタは、前記マイクロ流体チップの下流または後に配置されて、特定のサイズのサンプルのみを回収するために装置を通過させるようにする。
さらなるシステムが本明細書に提供されている。例えば、サンプルを処理するためのシステムは、支持プレートと、当該支持プレートに結合され前記支持プレートを回転させるように構成されたモータと、前記支持プレート上に配置された少なくとも1つのキャリッジであって、マイクロ流体チップと、処理のためにサンプルを受け入れる少なくとも1つのサンプルチャンバとを受容するように構成され、前記支持プレートの平面に平行な平面内で回転するように構成された少なくとも1つのキャリッジとを具える。
さらに、支持プレートと、当該支持プレートに結合され前記支持プレートを回転させるように構成されたモータと、前記支持プレート上に配置された少なくとも1つのキャリッジとを具え、前記少なくとも1つのキャリッジは、前記支持プレートの平面と平行な平面内で回転するように構成され、マイクロ流体チップが前記少なくとも1つのキャリッジ内に収容されており、当該マイクロ流体チップは、ポートと、前記マイクロ流体チップの長さに沿って延びる少なくとも1つのマイクロ流体チャネルとを有し、処理のためにサンプルを受け取るための少なくとも1つのサンプルチャンバであって、前記マイクロ流体チップの第1ポートに流体接続され、サンプルが前記少なくとも1つのサンプルチャンバから前記マイクロ流体チップの長さに沿って流れることを可能にするように構成された少なくとも1つのサンプルチャンバを具えるサンプル処理システムが提供される。
いくつかの実施形態では、前記マイクロ流体チップは約10mm~100mmの間の長さを有する。いくつかの実施形態では、前記少なくとも1つのマイクロ流体チャネルの長さは、前記マイクロ流体チップの長さより短い(または等しい)。いくつかの実施形態では、前記マイクロ流体チャネルの幅および深さは、5μm~8mmの間の範囲内である。いくつかの実施形態では、前記マイクロ流体チップは取り外し可能であることを理解されたい。
マイクロ流体チャネルは、実施形態や処理される組織に応じて様々な構成を有することができる。例えば、一実施形態では、前記マイクロ流体チャネルは砂時計状の構成を有する。いくつかの実施形態では、前記少なくとも1つのマイクロ流体チャネルは、当該少なくとも1つのマイクロ流体チャネルの長さに沿って幅が徐々に減少する階段状テーパを含む第1の領域と、狭窄領域と、前記少なくとも1つのマイクロ流体チャネルの長さに沿って幅が徐々に増大する階段状テーパを含む第2の領域とを有する。さらなる実施例では、前記少なくとも1つのマイクロ流体チャネルは、幅が増大する一連の領域と、幅が減少する一連の領域とを有する。いくつかの実施形態では、前記少なくとも1つのマイクロ流体チャネルはダイヤモンドパターンを有する。いくつかの実施形態では、前記少なくとも1つのマイクロ流体チャネルは複数のポケットを具え、これらのポケットは任意でフィン形状である。いくつかの実施形態では、前記少なくとも1つのマイクロ流体チャネルは、一連の分岐部を含む第1の領域と、分岐したチャネル対が再結合される第2の領域とを含む。さらなる実施形態では、前記少なくとも1つのマイクロ流体チャネルは複数のウェルを含み、当該複数のウェルは所定のサイズのサンプルの部分をソートするように構成される。
さらに追加の方法が本明細書において提供され、例えば、サンプルチャンバ内のサンプルを含むサンプルの処理方法であって、複数のキャリッジのうちの少なくとも1つに前記サンプルチャンバを挿入するステップであって、前記サンプルチャンバは少なくとも1つのマイクロ流体チャネルを含むマイクロ流体チップに流体接続されており、前記複数のキャリッジのうちの1つが支持プレートに取り付けられ、当該支持プレートは第1の軸の周りを回転するように構成されており、前記複数のキャリッジのうちの少なくとも1つが第2の軸の周りを回転するように構成されており、前記第2の軸は前記第1の軸と平行である、ステップと、前記第1の軸の周りで前記支持プレートを回転させるステップであって、この回転が、前記少なくとも1つのマイクロ流体チャネルを通して前記サンプルチャンバからサンプルを遠ざかる第1の方向に駆動するように構成される、ステップとを具える。いくつかの実施形態では、この方法は、前記第2の軸の周りで前記複数のキャリッジのうちの少なくとも1つを第2の向きに回転させるステップをさらに含む。いくつかの実施形態では、この方法はさらに、前記支持プレートを前記第1の軸の周りに回転させるステップを含み、この回転が、前記少なくとも1つのマイクロ流体チャネルを通してサンプルチャンバに向かう第2の方向にサンプルを駆動するように構成される。さらに、この方法は任意で、前記サンプルチャンバを前記複数のキャリッジのうちの少なくとも1つから取り出すステップを含む。
さらなるシステムが提供され、これは支持プレートから半径方向に延在する複数のアームを有する支持プレートと、当該支持プレートに結合され前記支持プレートを回転させるように構成されたモータと、それぞれ前記支持プレート上の複数のアームのうちの1つに配置された複数のキャリッジとを具え、前記複数のキャリッジのそれぞれは、それぞれが前記キャリッジが配置されたアームから垂直に延びる複数の軸のうちの1つの周りに同軸に配置されており、前記複数のキャリッジのそれぞれは、マイクロ流体チップと、処理のためにサンプルを受け取るための少なくとも1つのサンプルチャンバとを受容するように構成され、前記複数のキャリッジのそれぞれは、前記複数の軸のうちの1つの周りで回転可能であり、前記支持プレートを収容するようにケースが構成されており、当該ケースはサンプルを処理するシステムからユーザを保護するように構成されるとともに、前記サンプルチャンバへのアクセスを提供するように構成されている。いくつかの実施形態では、前記少なくとも1つのサンプルチャンバは、通気口と、サンプル流路の内部に流体連通する通気路とを具え、前記通気口は、前記サンプルチャンバを通る層流を提供するように構成される。いくつかの実施形態において、前記少なくとも1つのサンプルチャンバは、前記マイクロ流体チップに流体接続されている開口部を有する。いくつかの実施形態では、前記少なくとも1つのサンプルチャンバは、処理のためにサンプルを前記少なくとも1つのサンプルチャンバに挿入または除去できるように構成された入口を具える。一実施形態では、前記入口は前記開口部の反対側に配置されるが、他の位置を任意に使用することができる。いくつかの実施形態では、前記少なくとも1つのサンプルチャンバは、処理中にサンプルがチャンバ内に確実に留まるように構成された一方向弁を具える。いくつかの実施形態では、前記サンプルチャンバの内部は、スロープ面、傾斜面、または入口に隣接する他の形状の表面を有し、この面は、処理後にサンプルの除去を容易にするためにサンプルが入口近くに集まるように構成されている。一実施形態では、前記通気口は開口部としてサンプルチャンバの反対側の端部に配置される。いくつかの実施形態では、入口はシリンジと係合するように構成され、このシリンジはサンプルを取り出してサンプルを標的部位に直接注射可能にするように構成される。
いくつかの実施形態では、前記複数のチャンバのそれぞれは、前記複数のアームのそれぞれの開口部に保持され、前記複数のチャンバのそれぞれは、前記複数のアームのそれぞれの開口部を通って延在する。そのような実施形態では、前記複数のチャンバのそれぞれは任意で前記複数のアームのそれぞれの平面に沿って保持される。いくつかの実施形態では、前記複数のチャンバのそれぞれは、前記複数のチャンバのそれぞれが面外回転できるように構成された少なくとも1つのピンを用いて、前記複数のアームのそれぞれの開口部に任意に保持される。いくつかのそのような実施形態では、前記複数のチャンバのそれぞれの面外回転は、複数のチャンバのそれぞれを複数の向きの間に動かすように構成される。いくつかの実施形態において、前記複数のチャンバの各々は、180度の回転の間(例えば、0~45度、45~90度、90~135度、135度~180度など)で動く。いくつかの実施形態では、前記複数のチャンバのそれぞれは、前記複数のチャンバのそれぞれが前記複数のアームのそれぞれの平面に沿って位置する複数の向きの間で移動する。いくつかの実施形態では、システムは、大きなサイズのサンプル成分がマイクロ流体チップに入り込んで目詰まりするのを防ぐように構成されたフィルタをさらに具える。一実施形態では、前記フィルタは前記サンプルチャンバに取り付けられる。いくつかの実施形態では、前記フィルタは、前記マイクロ流体チップの上流または前に配置され、前記マイクロ流体チップの目詰まりを防ぐためにサンプルを濾過するように構成される。いくつかの例では、上流のフィルタは、組織または組織片を切断または微細化して、サンプルが目詰まりすることなくマイクロ流体チップを通過できるようにするように構成されたメッシュを含むことができる。サンプルの切断または微細化は、前記マイクロ流体チップ内のマイクロ流体剪断の目的で巨視的な凝集塊を生成するように構成される。いくつかの実施形態では、前記フィルタは、前記マイクロ流体チップの下流または後に配置されて、特定のサイズのサンプルのみを回収するために装置から通過させることを可能にする。
いくつかの実施形態では、サンプルを処理するためのシステムが提供され、これは支持プレートから半径方向に延びる複数のアームを含む支持プレートと、当該支持プレートに結合され前記支持プレートを回転させるように構成されたモータと、それぞれが前記支持プレート上の複数のアームのうちの1つに配置された複数のキャリッジであって、当該複数のキャリッジのそれぞれは、複数の軸のうちの1つの周りに同軸配置され、各軸は前記キャリッジが配置されているアームから垂直に延在し、前記複数のキャリッジのそれぞれは、マイクロ流体チップと、処理のためにサンプルを受け取る少なくとも1つのサンプルチャンバとを受容するように構成され、前記複数のキャリッジはそれぞれ前記複数の軸のうちの1つの周りに回転可能である、複数のキャリッジと、本体部分とカバーとを含むケースであって、前記本体部分は処理システムを受けるように構成されており、前記カバーは前記本体部分の上に配置されるとともに、前記本体部分内に処理システムを密封し、サンプルを処理するためのシステムからユーザーを保護するように構成された、ケースと、モータを有するスピンスタンドと、前記モータに取り付けられた雄ねじロッドであって、前記モータの回転が前記雄ねじロッドを回転させる、雄ねじロッドと、シリンジを保持するための複数の係合構造を有するプレートであって、雌ねじを有するベアリングに取り付けられ、前記雌ねじは前記ロッドの雄ねじと係合するように構成され、前記モータの回転が前記プレートを垂直方向に上下させるように構成され、前記シリンジは、前記少なくとも1つのサンプルチャンバに流体接続するように構成された開口部を有するチャンバと、当該チャンバ内に配置されるプランジャとを具え、前記プランジャを前進、後退させると、処理のためにサンプルを排出、吸引し、前記プレートは前記プランジャの遠位端を保持し、前記プレートを垂直方向に動かすと、前記シリンジのチャンバ内の前記プランジャが上下して、処理のためにサンプルを排出、吸引する、プレートとを具える。
いくつかの実施形態では、回転モータは前記ケースのカバーに取り付けられるが、他の実施形態では、回転モータは前記ケースの外部に配置されている。いくつかの実施形態では、前記プレートは円形であるが、いくつかの実施形態では、前記プレートは複数のアームによって前記ベアリングに取り付けられたリングを具える。一実施形態では、前記プレートは中央の円形プレートと同軸リングとを具える。いくつかの実施形態では、係合構造はフック形状であり、プランジャの遠位端の挿入および取り外しが可能なように構成されている。いくつかの実施形態では、システムは、前記シリンジが前記マイクロ流体チャンバの第1端の少なくとも1つのサンプルチャンバに取り付けられるとき、または前記シリンジが前記マイクロ流体チャンバの第2端の少なくとも1つのサンプルチャンバに取り付けられるときに、当該シリンジを固定するための複数の離間係合構造を具える。いくつかの実施形態では、前記複数のアームのそれぞれは、前記複数のキャリッジのそれぞれに配置された対応する構造と係合して前記複数のキャリッジのそれぞれを第1の向きに保持するように構成された係合構造をさらに具える。いくつかの実施形態では、係合構造は、前記キャリッジが前記複数の軸のうちの1つの周りの複数の向きの間で移動するように構成されるように、対応する構造を解放・係合するように構成される。いくつかの実施形態では、前記係合構造は磁石を含み、前記対応する構造は磁気応答材料を含む。逆に、いくつかの実施形態では、前記係合構造が磁気応答材料を含み、前記対応する構造は磁石である。特定の実施形態では、加速力または減速力が、前記キャリッジを複数の配向間で動かすように構成される。いくつかの実施形態では、前記キャリッジは歯車アセンブリを含み、当該歯車アセンブリは前記キャリッジを複数の配向間で移動させるように構成される。いくつかの実施形態において、前記キャリッジは求心性ラチェットを具え、当該求心性ラチェットは前記キャリッジを複数の配向間で移動させるように構成される。
サンプルを処理する方法などの方法が提供され、この方法は、少なくとも1つのサンプルチャンバ内にサンプルを提供するステップと、当該サンプルチャンバを複数のキャリッジのうちの少なくとも1つに挿入するステップであって、前記サンプルチャンバは少なくとも1つのマイクロ流体チャネルを有するマイクロ流体チップに流体接続されており、前記複数のキャリッジのうちの1つが支持プレートに取り付けられ、前記支持プレートは第1の軸を中心に回転するように構成され、前記複数のキャリッジのうちの少なくとも1つは第2の軸を中心に回転するように構成されており、前記第2の軸は前記第1の軸と平行である、ステップと、前記サンプルチャンバにシリンジを固定するステップであって、前記シリンジの開口部は前記サンプルチャンバに流体接続され、前記シリンジのプランジャの遠位端はプレートに取り外し可能に取り付けられており、前記プレートはモータに取り付けられ、回転可能かつ垂直方向に移動可能であるように構成され、前記プレートの垂直方向の移動が前記プランジャを前記シリンジのバレル内で上下させて、前記サンプルチャンバ内で処理するためにサンプルを排出または吸引する、ステップと、前記第1の軸を中心に前記支持プレートを回転させるステップであって、この回転が、前記サンプルを前記サンプルチャンバから前記少なくとも1つのマイクロ流体チャネルを通って前記サンプルチャンバから離れる第1の方向へと駆動する、ステップとを具える。いくつかの実施形態では、この方法は、前記プランジャが前記シリンジのバレル内で下降して前記サンプルチャンバ内への処理のためにサンプルを排出するように前記プレートを垂直方向に下降させるステップをさらに含む。そのような方法では、処理のために前記サンプルチャンバからサンプルを取り出すために、前記プランジャが前記シリンジのバレル内で上昇するように前記プレートが垂直方向に持ち上げられるステップが任意である。いくつかの実施形態では、この方法はさらに、前記第2の軸の周りで前記複数のキャリッジのうちの少なくとも1つを第2の向きに回転させるステップをさらに含む。
さらなる実施形態では、病状の治療のために加工された組織サンプルの使用が提供される。いくつかの実施形態では、前記病状は糖尿病性潰瘍である。いくつかの実施形態では、前記病状は、幹細胞などの活性化細胞によって改善されるかそこから利益を得るものである。いくつかの実施形態において、疾患または病気を治療するための医薬の製造における使用のための、本明細書に開示される処理方法およびシステムから生じる脂肪組織由来の活性化幹細胞の使用が提供される。
図1は、一実施形態にかかるサンプル12を処理するためのシステム10を示す。システム10は、本明細書に記載されるようにサンプル12を処理するために使用される1またはそれ以上のマイクロ流体チップ14を具える。サンプル12は、一実施形態では、生物学的サンプルを含み得る。例えば、1つの特定の好ましい実施形態では、サンプル12は、脂肪または脂肪組織または腫瘍組織などの哺乳動物から得られた組織サンプルを含み得る。別の実施例では、サンプル12は、その後処理されるかまたはマイクロ流体チップ14にかけられる細胞を含み得る。サンプル12は、別の実施形態では、ビーズなどの粒子を含み得る。さらに別の実施形態では、サンプル12は、流体と1つ以上の流体試薬または反応物を含み得る。さらに別の実施形態では、サンプル12は水または水性サンプルを含み得る。
いくつかの実施形態では、マイクロ流体チップ14は、例えば図2に見られるように、基板18に形成された1またはそれ以上のマイクロ流体チャネル16を具える。マイクロ流体チップ14の長さ(最長辺に沿って)は、典型的には、約10mm~100mm、例えば約10~約20mm、約20~約30mm、約30~約40mm、約40~約50mm、約50~約60mm、約60~約70mm、約70~約80mm、約80~約90mm、約90~約100mm、および端点を含むそれらの間の任意の長さである。1またはそれ以上のマイクロ流体チャネル16は、実質的にマイクロ流体チップ14の長手方向(すなわち、長軸)に沿って延び、マイクロ流体チップ14の一方の端部から当該マイクロ流体チップ14の反対側の端部まで概ね横切っている。いくつかの実施形態では、マイクロ流体チャネル16の長さはマイクロ流体チップ14の全長よりも短い。マイクロ流体チャネル16の幅および深さは、実施形態に依存して、約5μm~約8mmの範囲内にあり得る。例えば、長さ(または幅)は、約5μm~約10μm、約10μm~約20μm、約20μm~約50μm、約50μm~約100μm、約100μm~約200μm、約200μm~約500μm、約500μm~約750μm、約750μm~約1000μm、約1mm~約2mm、約2mm~約3mm、約3mm~約4mm、約4mm~約5mm、約5mm~約6mm、約6mm~約7mm、約7mm~約8mm、および両端点を含むそれらの間の任意の寸法の範囲であり得る。さらなる実施形態では、マイクロ流体チャネルの長さと幅の比は、約1000:1、約750:1、約500:1、約250:1、約100:1、約50:1、約25:1、約10:1、約2:1、約1:1、約1:2、約1:10、約1:25、約1:50、約1:100、約1:250、約1:500、約1:750、約1:1000、およびこれら列挙されているものの間の任意の比率の範囲である。さらに、多くのマイクロ流体チップ14の設計において、幅および深さは、狭窄領域、拡張領域などの存在によって変化する。
図2に示す非限定的な一実施形態に見られるように、第1ポート20がマイクロ流体チップ14の一方の端部に配置されており、サンプル12のための入口(または本書で説明されるように出口)として機能する。第2ポート22がマイクロ流体チップ14の他方の反対側の端部に配置されている。本明細書で説明されるように、1またはそれ以上のマイクロ流体チャネル16は任意の数の構成で提供されてもよい。
マイクロ流体チップ14は、任意の数の材料から形成することができる。例えば、マイクロ流体チップ14は、ポリマーまたは樹脂材料(例えば、ポリカーボネート、ポリ(メチルメタクリレート)(PMMA)、ポリオキシメチレン、ポリ乳酸(PLA)またはアクリロニトリル-ブタジエン-スチレン(ABS)材料など)を用いて形成されてもよい。マイクロ流体チップ14は、金属(例えば、アルミニウム、スチール、チタン、合金など)のような他の材料を用いて形成してもよい。マイクロ流体チップ14は、貼り合わされて完全に包まれたマイクロ流体チップ14を形成する1またはそれ以上の層を用いて作製してもよい。したがって、マイクロ流体チップ14は、1またはそれ以上の層や基板18から形成された積層構造として作製することができる。例えば、マイクロ流体チップ14の第1の層は、ポリカーボネートまたはPMMAを用いて形成され、CNCミリングまたはレーザエッチング(または化学エッチング)を用いてマイクロ流体チャネル16を形成し、第1の層に第2の薄いカバーを貼り付けるか接着してマイクロ流体チップ14を完成することができる。両面加圧接着剤を使用して、2つの層を互いに接着することができる。接合は超音波溶接を用いて達成してもよい。あるいは、マイクロ流体チップ14はモノリシック基板18から作成されてもよい。マイクロ流体チップ14は、三次元(3D)印刷、射出成形、CNCミリングまたはレーザエッチングを含む任意の数の製造プロセスを使用して形成することができる。
図1に戻ると、システム10は支持プレート30を具え、これは好ましい実施形態では、当該支持プレート30の中央領域またはハブ31から外向きに延びる複数のアームまたはウィング32を有する。代替の実施形態では、支持プレートは、内側部分と側方部分とを有する単なる円板であり、この側方部分がアームの代わりとなる。いくつかの実施形態では、アームまたはウイング32は、1またはそれ以上の留め具(例えば、ねじ、ボルトなど)を使用してハブ31に固定された別々の構造体である。他の実施形態では、アームまたはウィング32は一体構造としてハブ31と一体化されている。中央領域またはハブ31は、アームまたはウィング32を形成するのと同じまたは異なる材料から作られてもよい。例えば、中央領域またはハブ31は、金属または金属材料(例えば、アルミニウム、ステンレス鋼、スチールなど)、または樹脂、ポリ(メチルメタクリレート)(PMMA)、ポリカーボネートなどのポリマー材料から形成することができる。アームまたはウィング32もまた、中央領域またはハブ31と共に使用可能な材料のような、金属、金属材料、またはポリマーを使用して形成することができる。
図1に示す支持プレートは、3つのアームまたはウィング32を具えているが、支持プレートは、単一のアーム32よりも多い(例えば、1~10本の間の)任意の数のアーム32を含み得ることを理解されたい。本発明の好ましい実施形態では、支持プレート30は、アーム32が支持プレート30の中央領域から半径方向に延び、支持プレート30の周りに対称的に配置されるように作られている。例えば、3本アームの構成では、各アーム32はそれぞれの隣接するアームから約120°に配向されている。いくつかの実施形態では、動作中にアームがアーチ形のパターンで動き、回転軸と直交するかほぼ直交する面内に配置されるように、ヒンジ結合されている。支持プレート30の中央領域は穴または開口部33を具え、これは穴または開口部33を貫通する回転チャック34を受容するように寸法決めされている。支持プレート30は、締結具36を用いてチャック34に固定される。例えば、チャック34にねじ切りして、締結具36が、支持プレート30をチャック34にしっかりと固定するためにチャック34のねじと螺号するねじ、ナット、クリップ、圧入、磁気係合などとしてもよい。あるいは、締結具36はピン、磁石などを含んでもよい。さらに、チャック34のシャフトは、2つの要素を一緒に固定するのを助けるために支持プレート30の穴または開口部33と一致または固定する幾何学的輪郭を有してもよい。もちろん、支持プレート30をチャック34に固定するために他の任意の種類の締結具またはロックを使用することができる。チャック34は、係止ピン、ねじ等(図示せず)を用いてモータ42の駆動シャフト40に固定的に保持されている。モータ42は、駆動シャフト40の回転速度を調整することができる任意の種類のモータを含むことができる。一例として、モータ42は、ブラシレスサーボモータ(例えば、ノースカロライナ州シャーロットのParker Hannifin CorporationのParkerモータSM232BE)を含むが、多種多様なモータ42を使用できることを理解されたい。他の代替実施形態では、支持プレート30およびアーム32はチャック34自体に組み込まれてもよい。すなわち、マイクロ流体チップ14を支持するアーム32が、チャック34上に配置される別個の支持プレート30とは対照的に、チャック34から延在してもよい。
図1に示すように、モータ42は固定具44に固定されており、駆動シャフト40とその中に取り付けられたチャック34とが実質的に垂直に配向される。この向きで、支持プレート30をチャック34の上に置き、締結具36を用いて固定することができる。この構成により、支持プレート30が実質的に水平面に配置される。モータ42が作動されて駆動シャフト40を回転させると、チャック34を用いてその上に取り付けられた支持プレート30が、駆動シャフト40の回転軸を中心にほぼ水平面内で回転する(回転は反時計回りまたは時計回りでもよく、交互パターンでは両方でもよい)。図3に示すように、搭載される支持プレート30(およびその上に載置されるマイクロ流体チップ14)は、任意で、ケース46内に配置されてもよい。ケース46は、システム10の使用時に起こり得る様々な危険または故障からオペレータを保護する。ケース46は、任意の厚い樹脂材料(例:ポリカーボネート、ポリ(メチルメタクリレート、例えばプレキシガラス)など)、さらには金属(例:スチール、アルミニウムなど)から作ることができる。ケース46は、支持プレート30などをチャック34に取り付けるためのアクセスを提供するために開閉することができる。システム10の動作を視覚的に監視できるように、1またはそれ以上の部分を光学的に透明にしてもよい。図1に示すような別個の固定具44を用いる代わりに、モータ42は、図3に示すように、ケース46の基部または他の構造支持部に取り付けてもよい。
図1に戻ると、モータ42は、1本以上のケーブル51を介してコントローラ50に接続されている。図示するように、一方のケーブル51はモータ42を駆動するために使用され、他方のケーブル51はフィードバックのために使用される。コントローラ50は、例えばステッパ/サーボコントローラ50であり、モータ42を駆動するために使用される。回転速度またはRPMが、コントローラ50を用いて調整またはプログラム可能である。好ましい実施形態では、コントローラ50は、所定の動作シーケンスで支持プレート30を回転させるスピンプログラムをプログラムまたはロードされてもよい。例えば、コントローラ50は、サンプル12がマイクロ流体チップ14の1またはそれ以上のマイクロ流体チャネル16を通過するようにモータ42の回転速度を所望のRPM速度まで上昇させ、次いで、一実施形態では、RPMを下げてマイクロ流体チップ14を半回転または180°回転させるようにしてもよい。マイクロ流体チップ14が反転または逆向きになった状態で、コントローラ50は次にRPMを所望のRPM速度まで再び上昇させて、マイクロ流体チップ14の1またはそれ以上のマイクロ流体チャネル16をサンプル12が逆方向に再度通過するように押すか力を加えることができる。このプロセスは、複数のサイクル(マイクロ流体チップ14の180°回転を10~30回、例えば、10~15、15~20、20~25、25~30回など)繰り返すことができる。例えば最初のサンプル粘度に応じて、より多いまたはより少ないサイクル数を利用できることを理解されたい。図4は、例えば、システム10の例示的な回転流プロファイルを示し、マイクロ流体チップ14の180°の複数のサイクルを示している。
一実施形態では、コントローラ50は、LabVIEW、Java(登録商標)、C、C++、Pythonなどのソフトウェアを使用してプログラムすることができる。コントローラ50は手動で制御してもよい。利用される実際の回転速度またはRPMは、マイクロ流体チップ14の構造および構成に依存し得る。典型的には、RPMの範囲は0~約10,000RPMである。RPMが高いと、マイクロ流体チップ14を通るサンプル12の流速が高くなる。マイクロ流体チップ14を通る流速は変動し得るが、一般的には約0mL/分~700mL/分の範囲内である。例えば、流速は、約0.2mL/分~約1mL/分、約1mL/分~約2mL/分、約2mL/分~約10mL/分、約10mL/分~約50mL/分、約50mL/分~約100mL/分、約100mL/分~約250mL/分、約250mL/分~約500mL/分、約500mL/分~約700mL/m分、およびこれらの間の任意の速度(両端点を含む)であり得る。モータ42を用いて得られる回転速度に応じて、流量の上限はさらに大きくなり得る。
図4は、一実施形態に従って使用される1つの例示的なフロープロファイルを示す。この実施形態では、RPM速度は、約1秒の期間で1,600RPMの最大回転速度まで上昇または加速される(たとえば、2,000RPM/秒)。1,600のRPM速度が数秒間(例えば、約8秒間)維持され、次いで急速に減速され(例えば、2,000RPM/秒)、それによってマイクロ流体チップ4が180°回転する。
図1と図5を参照すると、各マイクロ流体チップ14は回転可能キャリッジ60に保持され、そうでなくとも固定される。各回転可能キャリッジ60は支持プレート30のアーム32に回転可能に取り付けられている。回転可能キャリッジ60は、マイクロ流体チップ14をその中に受容するように寸法決めされた凹部62(図5に見られる)を具える。マイクロ流体チップ14は、摩擦嵌合、タブ、クリップ、デテントなどによってその中に保持される。一実施形態では、回転可能キャリッジ60は、それぞれのサンプルチャンバ70、72を保持するのに用いられる第1端64と第2端66をさらに具える。サンプルチャンバ70はキャリッジ60の第1端64に配置され、一方でサンプルチャンバ72は第2端66に配置されている。各サンプルチャンバ70、72は、例えば図2に見られるように、ポート20、22を介してマイクロ流体チップ14に流体結合されている。サンプルチャンバ70は、第1ポート20を介してマイクロ流体チップ14に流体結合されている。サンプルチャンバ72は、第2ポート22を介してマイクロ流体チップ14に流体結合されている。任意で、サンプルチャンバ70、72の一方または両方はアダプタ80を用いてマイクロ流体チップ14に結合してもよいことに留意されたい。このアダプタ80が、図2、図5、および図6に示されており、様々な数の設計および構成を含み得る。これらには、限定ではなく例示として、ルアースリップ(例えばスリップチップコネクタ)、ルアーロック(例えば回転カラー)などが含まれる。アダプタ80は、金属(例えば、アルミニウム、鋼、ステンレス鋼など)またはポリマー材料(例えば、プラスチック、ポリカーボネート、アクリレート、樹脂材料など)を含む様々な数の材料を使用して形成することができる。
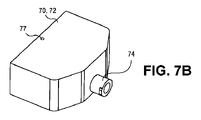
サンプルチャンバ70、72のうちの一方には、マイクロ流体チップ14を通して流されるサンプル12が装填されている。サンプルチャンバ70、72は、マイクロ流体チップ14を通して処理される一定量のサンプル12または他の材料を保持するように設計されている。サンプルチャンバ70、72の保持容量は、>0mlから約100mlまでの範囲とすることができ、チャンバ寸法の大きさを変えることによって変えることができる。例えば、いくつかの実施形態では、サンプルチャンバの容積は、約1ml~約3ml、約3ml~約5ml、約5ml~約10ml、約10ml~約25ml、約25ml~約50ml、約50ml~約75ml、約75ml~約100ml、または両端点を含む任意の容量であり得る。本発明の一実施形態では、サンプルチャンバ70、72に、マイクロ流体チップ14に通されるサンプル12または他の材料が充填される。図7A~図7Cを参照すると、サンプルチャンバ70、72は、ルアースリップ(例えば、スリップチップコネクタ)、ルアーロック(例えば、回転カラー)などの任意のタイプのシリンジアダプタヘッドであるアダプタヘッド74を用いて設計されている。サンプルチャンバ70、72もまた、図7Cに示すように通気路76を有するように設計され、これは直径0mm~約10mm(例えば、約1mm~約2mm、約2mm~約4mm、約4mm~約6mm、約6mm~約8mm、または約8mm~約10mm)の範囲であり、乱流ではなく、マイクロ流体チップ14を層流が通るようになっている。実施形態によっては、複数の通気口を使用することができる。通気路76は大気に通気しており、一実施形態では、通気口77(図7A~図7C)を介してサンプルチャンバ70、72の端部付近で出て、図7Cに見られるようにアダプタヘッド74付近でサンプルチャンバ70、72の内部に接続している。任意で、小さいフィルタを通気口77内に、そうでなければ通気口77と連通させて、汚染または漏れを防ぐことができる。サンプルチャンバ70、74は、樹脂材料、プラスチック、または金属などの複数の材料のうちの1つまたは複数から作ることができる。これらは、射出成形、樹脂プリント(例えば、3Dプリント)、ブロー成形、機械加工などの任意の数の一般的な製造方法によって製造することができる。一実施形態では、サンプルチャンバ70、72を満たすために、(針なしの)シリンジの端部または先端を、サンプルチャンバ70、72に位置するアダプタヘッド74に挿入し、シリンジプランジャを押し下げて、チャンバ容積がサンプル12またはシリンジのバレルに入っている材料で充填される。サンプルチャンバ70、72は、図5に見られるように、キャリッジ60の端部64、66から挿入および/または除去することができるモジュール要素であることが好ましい。例えば、チャンバ70は、装置またはシステム10の外部で充填され、その後にキャリッジ60の端部64に挿入されてもよい。
図8A~8Dに示すような別の実施形態では。シリンジ型チャンバ86がサンプルチャンバ70、72として使用され、キャリッジ60の一方または両方の端部64、66に配置することができる。端部64、66は、シリンジ型チャンバ86の長さを収容するように設計される。この実施形態は、医師が処理直後にシリンジ型チャンバ86を利用できるようになるので、特に有利である。例えば、脂肪または脂肪組織が本書記載のシステム10を用いて処理される場合、得られた処理済み組織は、システム10から容易に取り外すことができ対象の適用部位に処理済みの脂肪を直接注入するために使用可能なシリンジ型チャンバ86に充填される。これに関して、システム10は、サンプルチャンバ70、72の代わりに、1以上のシリンジ型チャンバ86を搭載する。処理が完了すると、シリンジ型チャンバ86が取り外され、針が端部に追加され、そして今処理されたサンプルが任意で対象に注入される。
シリンジ型チャンバ86は、サンプルを保持する三次元容積を画定するシリンジバレル88を含む。ゴムまたはポリマーシールを有する標準的なプランジャ90がバレル88内に配置され、これはプランジャ90を前進させるのに使用される近位デプレッサー92を有する。シリンジバレル88の端部は、マイクロ流体チップ14と接合するルアースリップ(例えば、スリップチップコネクタ)、ルアーロック(例えば、回転カラー)などを有するアダプタ端部94を具える。一実施形態では、シリンジ型チャンバ86は、バレル88の長さに沿って延在し、穴89を介してバレル88の内部と連通し、大気に解放されるベント穴98(図8Bに最もよく見られる)で終端する通気路96に結合されている。通気路96は通気を実現し、シリンジバレル88およびマイクロ流体チップ14に穏やかな層流が通るようにする。一実施形態では、ゴムまたはポリマーシールを具える小型の二次シリンジプランジャ100が通気路96内に配置され、その中で移動可能であり、通気路96を選択的に開閉する。具体的には、二次シリンジプランジャ100のシールが、図8Bのように通気穴98に対して近位に位置する場合に、通気路96が開放され、シリンジバレル88の内部が大気に通気することができる。しかしながら、二次シリンジプランジャ100のシールが通気口98に対して遠位に位置する場合、通気路96は閉じられ、シリンジ筒88の内部は通気されず、シリンジ型チャンバ86は標準的なシリンジとして機能する。二次シリンジプランジャ100は、同じ近位デプレッサー92に結合されていもよく、その結果、デプレッサー92の移動が、両方のプランジャ90、100の移動を引き起こす。シリンジ型チャンバ86およびデプレッサー92などの他の構成要素は、樹脂、プラスチックなどのポリマー材料を含む任意の数の材料から作製することができる。射出成形、樹脂プリントなどの従来の製造技術を使用することができる。シリンジ型チャンバ86はまた、金属または金属材料から形成されてもよい。
図5、6を参照すると、支持プレート30の特定の一実施形態が開示されている。この実施形態では、支持プレート30は、中央板104に固定された複数のアーム32を有する中央板104を使用して形成される。中心板104は、チャック34(図1参照)が入るように寸法決めされた穴または開口部106を具える。この実施形態における各アーム32は、下側プレート108と上側プレート110とを具える。下側プレート108および上側プレート110は、ねじ、ボルトなどの任意の数の固定具を使用して互いに固定することができる。プレート108、110は、キャリッジ60から延びるポスト114を収容するように位置合わせされ寸法決めされた、その中に形成された穴または開口112を具える。図6に最もよく示されているように、ポスト114は、下側プレート108および上側プレート110の穴112を通って延在し、アーム32の下にある距離だけ突出する。ポスト114は、当該ポスト114を貫通しキャリッジ60を(スピンまたは回転可能なまま)アーム32に固定するために使用されるピンまたはクリップ118を受ける穴116を具える。
この実施形態では、磁石または磁気要素120が、図5に示されるように中央プレート104を含み得る支持プレート30内に配置される。図5および図6に見られるように。2つの小さい磁石または磁気要素122がキャリッジ60の下面に配置され(またはキャリッジ60構造に組み込まれ)、これらは2つの180°構成のうちのキャリッジ60の縦軸がアーム32の半径方向長さに沿って整列する一方にキャリッジ60を一時的に保持するために使用される。例えば、キャリッジ60内に配置された磁気要素122は、実際の磁石(例えば、希土類磁石または他の種類)を含んでもよいし、磁気感受性のねじ、ボルト、または金属片を含んでもよい。本明細書で説明するように、キャリッジ60は、サンプル12がマイクロ流体チップ14を通って順方向または逆方向に流れることができるように、2つの180°の配向間で前後に切り替えることができる。本明細書で説明されるように、キャリッジ60をこれら2つの向きの間で切り替えるために、いくつかの異なる様式が使用されてもよい。これは、キャリッジ60の向きを切り替えるための減速力または加速力を用いることが含まれる。あるいは、アーム32内に配置された電磁石を使用して、キャリッジ60(およびマイクロ流体チップ14)をこれら2つの配向の間で切り替えることができる。さらに別の代替実施形態では、180°の向きの間でキャリッジ60を回転させることができるギア歯の半径方向セットとともに歯車アセンブリを用いてもよい。さらに別の代替実施形態は、支持プレート30のRPMの減少に基づいてキャリッジ60を異なる向きに機械的に回転させるために求心ラチェットを使用する。さらに別の代替実施形態は、ラチェットをピストンまたはショックアブソーバーのようなデバイスと置換してもよい。
図9は、マイクロ流体チップ14を中に有する回転可能キャリッジ60をそれぞれ含む3つの異なるアーム32を具える支持プレート30を概略的に示す。この上面図または平面図では、回転可能キャリッジ60はそれぞれ、アーム32の半径方向内側に位置する第1端(「1」)と、アーム32の半径方向外側に位置する第2端(「2」)とを有する。この構成では、支持プレート30の回転に応じて、サンプル12または他の材料がマイクロ流体チップ14を通って半径方向外向きに流れる。すなわち、サンプルチャンバ70で始まるサンプル12について、サンプル12はサンプルチャンバ70からマイクロ流体チップ14の中へと移動し、そしてサンプルチャンバ72の中へと進む。次に、それぞれのマイクロ流体チップ14とともにキャリッジ60を180°回転させて、図9の下側部分に見られるようにキャリッジ60およびそれらのマイクロ流体チップ14の向きを逆にする。この構成では、第1端(「1」)がアーム32の半径方向外側に位置し、第2端(「2」)がアーム32の半径方向内側に位置する。サンプルチャンバ72内にあったサンプル12はここでは半径方向内側に配置され、ここで支持プレート30の回転は、サンプル12をサンプルチャンバ72からマイクロ流体チップ14内へ移動させ、さらにサンプルチャンバ70内へと進める。このプロセスが、任意数のサイクルにわたって繰り返され得る。
図5、6の実施形態において、支持プレート30を減速するとキャリッジ60に力が加わり、これにより磁石120、122間の力が破壊され、キャリッジ60がポスト114を中心に回転し、キャリッジ60は180°向きを変え、これにより反対側の磁石122が他方の磁石120に引き寄せられ、キャリッジ60が新しい向きで固定される。次いで、支持プレート30を再び加速して、サンプル12をマイクロ流体チップ14を通して逆流方向に移動させ、それによって、キャリッジ60およびそれぞれのマイクロ流体チップ14をスピンさせるプロセスを再び実行することができる。
図10Aを参照すると、一代替実施形態では、下側プレート108に取り付けられた電磁石130を利用して、キャリッジ60を180°スピンまたは回転させる。電磁石130は、搭載電池またはシャフト40を通して供給される配線を用いて電力を供給され得る。この実施形態では、ポスト114は、ポスト114の両側に反対の磁極を形成する磁石115を具える。電磁石130はまた、図示のように2つの磁極を具え、作動すると、電磁石130のN極が磁石115のS極に近接するようにポスト114を回転させる。逆に言えば、電磁石130のS極が磁石115のN極に隣接する。キャリッジ60は、電磁石130の極性を反転させることによって回転する。
図10Bは、求心性ラチェットを使用してキャリッジ60をスピンまたは回転させるさらなる別の実施形態を示す。この実施形態では、下側プレート108が、ポスト114に固定されたラチェットギアまたはホイール134を具える。ラチェットギア134は、一端がばね138に接続されている一組のラチェット歯136と相互作用する。ばね138は反対側の端部で下側プレート108に固定されている。ラチェット歯136の反対側の端部は、おもり142に結合されたフィラメント、線、ケーブル、または紐140に接続されている。システム10の運用時、支持プレート30が回転すると、求心力によって重り142が下側プレート108上で半径方向外向きに移動し、それによってばね138がこの力に適応するように伸びる。このとき、ラチェット歯136はその歯の向きのために、動作中にラチェット歯車134を動かすことはない。支持プレート30が減速または停止すると、ばね138の引っ張り力がラチェット歯136(およびおもり142)を半径方向内側(矢印Aの方向)に引っ張り、それによってラチェット歯136がラチェットギア134と係合してポスト114の回転を引き起こす。ポスト114が回転すると、キャリッジ60が180°回転する。
図11は、中心孔または開口部31aを含む支持プレート30aの他の実施形態を示す。この実施形態では、マイクロ流体チップ14を支持プレート30の面にほぼ平行な水平面内で回転させるのではなく、支持プレート30の回転面に対して面外に(例えば、アームが延在する放射面に対して垂直に)マイクロ流体チップ14を反転させる。この実施形態では、マイクロ流体チップ14は、面外回転を可能にする支持プレート30に配置されたスロット146と係合するピン144を含み得る。この実施形態では、図5、6に示すマイクロ流体チップ14と同様に回転可能な、マイクロ流体チップ14を保持するキャリッジ60を設けてもよい。
図12Aは、支持プレート30bの他の実施形態を示す。この実施形態では、支持プレート30bは、本明細書で説明するように支持プレート30をチャック34に支持するのに用いられる中央開口部または穴33を有する。支持プレート30bは、図12Aに見られるようにいくつかの歯車ボックスまたは歯車アセンブリ150を支持しており、支持プレートのアーム32として効果的に機能する。この実施形態では、このような3つの歯車アセンブリ150があり、各歯車アセンブリ150は、図12Aに見られるように支持プレート30bの中央ハブ152に、アルミニウム製のネジ等(図示せず)を用いて固定される。歯車アセンブリ150は、2つの歯車154、156を保持する底部ハウジング153を具える。外側の歯車154は、底部ハウジング153内に設けられたポスト158を中心に回転し、歯車154の歯の一部が歯車アセンブリ150の半径方向縁部を越えて露出するように配置されている。これに関して、歯車154の歯は、この外側歯車154を回転させるために別の歯車またはギア付き面(図12Bに見られる)と噛合可能となっている。第2の内側の歯車156が外側歯車154に機械的に係合している。本明細書で説明されるように、この内側歯車156は、マイクロ流体チップ14’を含むキャリッジ60’を回転させるために使用される。
図12Aに見られるように、歯車アセンブリ150にはトップカバー160がある。トップカバー160は、キャリッジ60’に接続されたシャフトまたはポスト164が貫通して内側歯車156に機械的に接続するための開口部162を具える。トップカバー160には別の開口部166が形成され、これは磁石168(例えば、希土類磁石または他の種類)を受けるように寸法決めされている。磁石168は、この開口部166および支持プレート30に形成された部分的な凹部にしっかりと固定されている。磁石168は、キャリッジ60’の回転中に(マイクロ流体チップ14’が180°回転するまで)マイクロ流体チップ14’の向きを2つの向きのうちの一方に保持するために使用される。キャリッジ60’は、その上にマイクロ流体チップ14’を保持するように寸法形成されている。マイクロ流体チップ14’およびキャリッジ60’は、取り外し可能な留め具(例えば、ネジなど)を用いてマイクロ流体チップ14’をキャリッジ60’に固定できるように、角に穴170を有する。しかし、マイクロ流体チップ14’は、他の任意の種類の締結具を使用して固定されてもよい。さらに、キャリッジ60’の下面には、磁気ねじ172(例えばスチールねじ)を受ける2つの位置がある。これらのねじ172は、支持プレート30bの回転中に、キャリッジ60’(およびマイクロ流体チップ14’)を2つの向きのうちの一方に保持するために使用される。本実施形態のキャリッジ60’を回転させるためには、図12Bに示すように、支持プレート30’の回転中にギア歯を有する面180を外側歯車154に(矢印Aのように)接触させる(この動作のために支持プレート30’を減速して回転させてもよい)。支持プレート30’の回転により、歯車154が(例えば矢印Bの方向に)静止面を横切って移動し、ギア歯180が歯車154を回転させてキャリッジ60’を回転させる。図12Aおよび図12Bの実施形態では、マイクロ流体チップ14’は、マイクロ流体チップ14’の内部に直接形成されたサンプルチャンバ70’、72’を具える。この実施形態では、1またはそれ以上のマイクロ流体チャネル16’の端部にあるポート20、22’が、それぞれのオンチップ型サンプルチャンバ70’、72’に通じている。
図13は、本明細書に記載のシステム10に組み込むことができる任意のフィルタエレメント190を示す。フィルタエレメント190は、大きなサイズのサンプル成分がマイクロ流体チャネル16に入り込んでそれらを目詰まりさせないようにするために用いられる。フィルタエレメント190は、格子状のフィルタパターンまたはメッシュ193を用いている。一実施形態では、フィルタは、ルアースリップ(例えば、スリップチップコネクタ)、ルアーロック(例えば、回転カラー)などのような任意の種類のシリンジ型アタッチメントを有し得るエンドピース192(または頂部)に組み付けられる。中にメッシュ193を組み込んでいる他方のエンドピース194は、完全なフィルタエレメント190を形成するために反対側のエンドピース192に対して密封されている。エンドピース194もまた、ルアースリップ(例えばスリップチップコネクタ)、ルアーロック(例えば回転カラー)などのような任意の種類のシリンジ型アタッチメントを有してもよい。いくつかの実施形態では、フィルタエレメント190は、マイクロ流体チップ14、14’の上流または前に配置され、マイクロ流体チップ14、14’の目詰まりを防ぐためにサンプルを濾過するように構成される。いくつかの例では、上流のフィルタエレメント190は、組織または組織片を切断または微細化してサンプルが目詰まりすることなくマイクロ流体チップ14、14’を通過できるように構成されたメッシュを含んでもよい。サンプルの切断または微細化は、マイクロ流体チップ14、14’におけるマイクロ流体の剪断のための巨視的凝集体を生成するように構成される。いくつかの実施形態では、フィルタエレメント190は、マイクロ流体チップ14、14’の下流または後に配置されて、特定のサイズのサンプルのみを収集のために装置から通過させることを可能にする。
図14A~14Jは、マイクロ流体チャネル16の異なる構成を有するマイクロ流体チップ14のいくつかの異なる実施形態を示す。図14Aは、砂時計型のマイクロ流体チャネル16を有するマイクロ流体チップ14を示す。この実施形態では、マイクロ流体チャネル16は、マイクロ流体チップ14の長さに沿ってほぼ中央の小さな狭窄領域204に到達する緩やかにテーパする側面プロファイル200、202を有する。図14Aに示すように、マイクロ流体チップ14の第1段(左から右へ)は断面積(x)によって画定される入口206を有し、これがxより大きい断面積へと外側に向かってテーパ208している。次に、マイクロ流体チャネル16は、xよりも小さい断面積の狭窄領域204に向かって徐々にテーパする(200、202)。この設計は、サンプル12が狭窄領域204のより小さい断面積を通過するときにサンプル12の速度が徐々に増加することを意図している。代替実施例では、狭窄領域204へ徐々にテーパする(200、202)のではなく、マイクロ流体チャネル16は、図14Bに見られるように段階的なテーパ212を有してもよい。マイクロ流体チップ14の両側の最初の拡張部208も省略することができ、その場合、マイクロ流体チャネル16は、狭窄領域204まで断面積が徐々に減少することになる。特定の一実施形態では、狭窄領域204は、約1.5mmの幅と約1.5mmの深さを有する。いくつかの実施形態では、この長さまたは幅の範囲は、約0.1mm~約0.3mm、約0.3mm~約0.6mm、約0.6mm~約0.9mm、約0.9mm~約1.2mm、約1.2mm~約1.5mm、約1.5~約1.7mm、または約1.7mm~約2.0mm、または両端点を含む、列挙されたものの間の任意の値とすることができる。実施形態によっては、より大きな寸法を使用してもよい。入口(または出口)206は、例えば、約6mmの深さと約5mmの幅といったより大きな寸法を有してもよい。同様に、入口の長さ(または幅)は、実施形態に依存して、例えば、約2mm~約3mm、約3mm~約4mm、約4mm~約5mm、約5mm~約6mm、約6mm~約7mm、約7mm~約8mm、または両端点を含めてそれらの間の任意の値の範囲で変わり得る。マイクロ流体チャネルの狭窄領域204の長さは、yによって規定され、約1.5mm程度であり得る。他の寸法、例えば、約0.5~0.7mm、約0.7~約1.0mm、約1.0~約1.2mm、約1.2mm~約1.5mm、約1.5mm~約1.7mm、約1.7~約2.0mm、または両端点を含め記載されている値の間の任意の値の範囲の寸法を使用することができる。
図14Cは、一連の拡張領域220と狭窄領域222とを有する単一のマイクロ流体チャネル16を具えるマイクロ流体チップ14を示す。この設計では、マイクロ流体チャネル16は入口224で初期の断面積xを有し得る。次いで、チャネルは、拡張領域220においてxよりも大きい断面積へと外側に拡張する。拡張領域220は、約1mm~約5mmの範囲内の幅(最大幅で測定)を有し得る。例えば、拡張領域220の幅の一例は1.3mmである。他の実施形態は、約1mm~約1.2mm、約1.2mm~約1.4mm、約1.4mm~約1.7mm、約1.7mm~約2.0mm、約2.0mm~約2.5mm、約2.5mm~約3.0mm、約3.0mm~約4.0mm、4.0mm~約5.0mm、または両端点を含む列挙されたものの間の任意の値などの他の幅を用いてもよい。マイクロ流体チャネル16の拡張後は、マイクロ流体チャネル16は、狭窄領域222でx以下の断面積まで小さくなる。狭窄領域220は、約100μm~約3mmの範囲内の幅を有し得る。狭窄領域220の特定の例示的な幅は400μmである。他の実施形態は、例えば、約100μm~約150μm、約150μm~約200μm、約200μm~約250μm、約250μm~約500μm、約500μm~約750μm、約750μm~約1000μm、約1000μm~約1.5mm、約1.5mm~約2mm、約2mm~約2.5mm、約2.5mm~約3.0mm、および両端点を含むこれらの間の任意の値の幅を採用する。
図14Dは、マイクロ流体チャネル16が2つのより小さいマイクロ流体チャネルに分岐する一連の分岐部230を有するマイクロ流体チャネル16を具えるマイクロ流体チップ14を示す。図14Dに見られるように、複数段階の分岐を有することができる。より小さいマイクロ流体チャネル16が再結合した2つのマイクロ流体チャネルが1つに再結合する。このプロセスは、マイクロ流体チャネル16がマイクロ流体チップ14の反対側で単一のチャネルに組み合わされると完了する。この実施形態では、マイクロ流体チップ14は、入口(または出口)232において初期断面積xを有するように設計することができる。次いで、マイクロ流体チャネル16は、第1の領域234で拡張するか、収縮するか、入口断面積xと等しいままとなる。次いで、単一のマイクロ流体チャネル16が、2つのマイクロ流体チャネル236に分岐する。これらの分岐したマイクロ流体チャネル236は、ここで第1の領域234の初期断面積xよりも小さい。次に、分岐したマイクロ流体チャネル236が再び分岐して4つのマイクロ流体チャネル238を形成する。これらのマイクロ流体チャネル238の断面積は、初期断面積xよりさらに小さい。一般に、分岐チャネルの断面積は、xを初期断面積、yをそのセクション内で並行するチャネルの量とした場合に、x/y以下と決定することができる。マイクロ流体チャネル(236、238)の後続の各段階は、上流のマイクロ流体チャネルよりも小さくなる。この実施形態では、各分岐点において、エッジ240は鋭い先端として形成され、あるいは収束するマイクロ流体チャネルの徐々にテーパする壁の頂点に形成された点として形成される。これにより、脂肪やその他の組織が通るときにそれを切断するナイフエッジが形成される。
図14Eは、マイクロ流体チップ14の別の実施形態を示し、ここではマイクロ流体チャネル16がダイヤモンドパターンを有し、入口250が断面積xを有する。このチャネルは、断面積が初期断面積x以下となるように狭窄領域252へと急に狭くなる複数セクションを有する。狭窄領域252の後は、マイクロ流体チャネルは急に外側に拡張して、x以上の断面積を有する拡張領域254に達する。この実施形態は、複数の狭窄領域252および拡張領域254を有することができる。拡張領域254の幅(最大幅で測定)は、約1mm~約3mmとすることができ、例えば約1mm~約1.25mm、約1.25mm~約1.5mm、約1.5mm~1.75mm、約1.75mm~約2.0mm、約2.0mm~約2.2.5mm、約2.25mm~約2.5mm、約2.5mm~約2.75mm、約2.75mm~約3.0mm、および両端点を含むそれらの間の任意の値の範囲内である。狭窄領域252の幅は約100μm~約1mmでの範囲内であり、例えば、約100μm~約200μm、約200μm~約300μm、約300μm~約400μm、約400μm~約500μm、約500μm~約600μm、約600μm~約700μm、約700μm~約800μm、約800μm~約900μm、約900μm~約1000μm、および両端点を含むこれらの間の任意の値を含み得る。
図14Fは、マイクロ流体チップ14の他の実施形態を示し、これはマイクロ流体チャネル16の長さに沿って配置された複数のフィン形状のポケット260を有する単一のマイクロ流体チャネル16を用いている。フィン形状のポケット260は、マイクロ流体チップ14を通る流体の流れに乱流を引き起こし、サンプル12に高い剪断応力を与える。例えば、細胞や組織を含むサンプル12を、フィン形状のポケット260を有するマイクロ流体チャネル16を通過させると、これらの細胞を高い剪断応力環境に応じて分析することができる。フィン形状のポケット260は、それらの開口部において、入口262の断面積以下の最大断面積を有することができる。フィン形状のポケット260は、先端部へと先細になっている。
図14Gは、マイクロ流体チップ14の他の実施形態を示す。この実施形態では、マイクロ流体チップ14は、ナイフエッジ型の分岐部240、ならびに複数の拡張領域220および狭窄領域222の両方を組み込んでいる。図14Hはマイクロ流体チップ14の別の実施形態を示し、これは複数の拡張領域220および狭窄領域222と共に、ナイフエッジを全く有さない分岐部270を具える。図14Hに示すように、各分岐部270には丸められ、または鈍くされた角部が形成されている。特定の一例として、狭窄領域222は、約400μmの幅と約300μmの深さを有し得る。いくつかの実施形態では、狭窄領域の幅は約200μm~約500μmであり、これには約200μm~約250μm、約250μm~約300μm、約300μm~約350μm、約350μm~約400μm、約400μm~約450μm、約450μm~約500μm、および両端点を含むこれらの間の任意の幅の範囲が含まれる。同様に、狭窄領域は約200μm~約500μmの範囲の深さを有することができ、これには約200μm~約250μm、約250μm~約300μm、約300μm~約350μm、約350μm~約400μm、約400μm~約450μm、約450μm~約500μm、および両端点を含むこれらの間の任意の幅が含まれる。拡張領域220は、いくつかの実施形態では、約300μmの深さおよび約1.3mmの幅を有することができる。さらなる実施形態では、拡張領域の深さは約200μm~約500μmの範囲であり、これには約200μm~約250μm、約250μm~約300μm、約300μm~約350μm、約350μm~約400μm、約400μm~約450μm、約450μm~約500μm、および両端点を含むそれらの間の任意の深さが含まれる。その幅は、実施形態に依存して約0.5mm~約3mmの範囲とすることができ、これには約0.5mm~約0.75mm、約0.75mm~約1.0mm、約1.0mm~約1.1mm、約1.1~約1.2mm、約1.2mm~約1.3mm、約1.3mm~約1.4mm、約1.4mm~約1.5mm、約1.5mm~約2.0mm、約2.0mm~約2.5mm、約2.5mm~約3.0mm、および両端点を含むこれらの間の任意の幅が含まれる。一実施形態では、入口または出口におけるマイクロ流体チャネル16の最大深さは約6mmである。他の実施形態では約3~約7mmの範囲の深さを採用し、これには約3mm~約4mm、約4mm~約5mm、約5mm~約6mm、約6mm~約7mm、および両端点を含むそれらの間の任意の深さが含まれる。
図14Iはマイクロ流体チップ14の別の実施形態を示し、これは最も小さい分岐チャネル内に図14A、14Bと同様のナイフエッジ型分岐部240および砂時計部分280を具える。図14Jはマイクロ流体チップ14のさらに別の実施形態を示し、これはナイフエッジ型の分岐部240と、当該ナイフエッジ型分岐部240の直前または前に配置された砂時計部分280とを有する。
特定の一実施形態では、脂肪組織が、本明細書に記載のシステムを用いて処理される。最初に、医師または他のヘルスケア専門家が2cc~100ccの範囲の脂肪吸引術サンプル12を患者から採取し、これは用途に応じて、約2~約10cc、約10cc~約25cc、約25cc~約50cc、約50cc~約75cc、約75cc~約100cc、または両端点を含めてそれらの間の任意の体積を含み得る。次に、脂肪をリン酸緩衝食塩水(PBS)緩衝液(または他の許容される緩衝液)で複数回洗い流すことによって最初の処理を行う。この処理が終了すると、脂肪サンプル12はシリンジなどを使用してサンプルチャンバ70、72に充填され、サンプルチャンバがマイクロ流体チップ14、14’と共にキャリッジ60、60’に装填される。あるいは、脂肪サンプル12を個別のサンプルチャンバ70、72に充填する代わりに、シリンジの内容物(例えば、図8Aおよび図8Bのシリンジ型チャンバ86)をキャリッジ60、60’にマイクロ流体チップ14、14’と共に直接装填してもよい。このプロセスは、単一のマイクロ流体チップ14、14’に対して、または複数のマイクロ流体チップ14、14’に対して(例えば、多くのサンプル処理または異なる対象からのサンプルに対して)用いることができる。
サンプルチャンバ70、72(またはシリンジ型チャンバ86)およびマイクロ流体チップ14、14’がそれぞれのキャリッジ60、60’に装填された状態で、コントローラ50を用いてモータ50が作動され、運転が開始される。回転速度は最初に所望のRPM速度まで上昇し、その非限定的な一実施形態が図4に示されている。これにより、脂肪サンプル12がサンプルチャンバ70から(これが最も半径方向内側のサンプルチャンバであると仮定して)マイクロ流体チップ14内に移動し、そこでサンプルは1またはそれ以上のマイクロ流体チャネル16内で剪断力を受ける。サンプルは他方のサンプルチャンバ72へと移動し、そこで、ここに記載された方式(例えば、減速、電磁気、機械的歯車、求心性ラチェット、手動回転など)のいずれか1つを用いてキャリッジ60、60’およびマイクロ流体チップ14、14’が180°回転される。マイクロ流体チップ14、14’の回転、スピン、または反転の後、支持プレート30を回転させてサンプルがサンプルチャンバ72からマイクロ流体チップ14、14’に移動され、サンプルは1またはそれ以上のマイクロ流体チャネル16内でさらなる剪断力にかけられる。サンプルは、半径方向外向きにサンプルチャンバ70内へと移動し続ける。キャリッジ60、60’およびマイクロ流体チップ14、14’が再び180°回転され、このプロセスが所望のサイクル数だけ繰り返される。
脂肪サンプル12がマイクロ流体チップ14、14’を所望のサイクル数または回数だけ通過した後、処理された脂肪サンプル12がサンプルチャンバ70、72(またはシリンジ型チャンバ86)から取り出される。一実施形態では、処理された脂肪サンプル12は、次に、サンプルチャンバ70、72からヘッド74に取り付けられる別個のシリンジに移され、これにより処理されたサンプル21を取り出すことができる。処理済みのサンプル12は今やシリンジに入った状態であり、以降に任意でこれを対象に注入することができる。あるいは、シリンジ型チャンバ86がサンプルチャンバとして使用された場合、シリンジ型チャンバ86は、その中に含まれる脂肪サンプル12を被験体に直接注入するために使用される。
この設計はまた、いくつかの実施形態によれば、比較的短時間で、例えば10分未満で迅速に複数回の反復を行うことを可能にする。例えば、いくつかの実施形態では、4分間で20回の反復を行うことができ、20分間で100回の反復を行うことができる。このプラットフォームでは、0mL/分~700mL/分(またはそれ以上)の様々な流速、例えば、0mL/分~約10mL/分、約10mL/分~約25mL/分、約25mL/分~約50mL/分、約50mL/分~約75mL/分、約75mL/分~約100mL/分、約100mL/分~約200mL/分、200mL/分~約300mL/分、約300mL/分~約400mL/分、約400mL/分~約500mL/分、約500mL/分~約600mL/分、約600mL/分~約700mL/分、および両端点を含めてその間の任意の速度で行うことができる。従来のシリンジポンプベースの処理では、流体ポンプが実現する最大流量は約12.5mL/分であった。例えば、図15は、図11に示すタイプのシステム10を用いた場合のRPMの関数としてのマイクロ流体チップ14を通る平均流量のグラフを示す。さらに、本明細書に記載のシステム10は、高い剪断力を発生させることができ、これは図16に見られるように、シリンジポンプベースの処理を用いて生成される剪断力よりはるかに高い。この設計はまた、約10秒で単一の反復の処理を実行するという利点を有し、これは他のポンプベースの処理よりもはるかに高速である。
図17は、図5に示すシステム10を用いて処理された、RPMの関数として2つの異なるマイクロ流体チップ14を通る流速(mL/分)を示す実験的に得られたデータのグラフを示す。第1のマイクロ流体チップ14は、図14Gに示す種類のものであり(例えば、拡張および狭窄領域を有する分岐マイクロ流体チャネル)、200μmの深さおよび300μmの幅を有する。第2のマイクロ流体チップ14は、図14Gに示される種類のものであり(例えば、拡張および狭窄領域を有する分岐マイクロ流体チャネル)、1mmの深さおよび300μmの幅を有する。図17に示すように、1,500未満のRPMでも高い流量が達成可能である。図18は、より小さい寸法(例えば、200μmの深さおよび300μmの幅)を有するマイクロ流体チップ14について計算された剪断応力をRPMの関数として示すグラフである。剪断応力は以下の式を用いて計算された。
(式1) τ=6μQ/wh2
ここで、τは剪断応力、「6」は定数、μは流体粘度、Qは流速、wはチャネル幅、およびhはチャネルの深さを表す。図18に示すように、マイクロ流体チップ14を使用して、(マイクロ流体チップ14を通過する毎に)最大60,000ダイン/cm2の剪断力が得られた。もちろん、より高いRPMのモータ42を用いると、60,000ダイン/cm2を超える剪断力を達成することができる。いくつかの実施形態では、約10,000ダイン/cm2~約100,000ダイン/cm2の範囲の剪断力を達成することができ、これには約10,000ダイン/cm2~約20,000ダイン/cm2、20,000ダイン/cm2~約30,000ダイン/cm2、約30,000ダイン/cm2~約40,000ダイン/cm2、約40,000ダイン/cm2~約50,000ダイン/cm2、約50,000ダイン/cm2~約60,000ダイン/cm2、約60,000ダイン/cm2~約70,000ダイン/cm2、約70,000ダイン/cm2~約80,000ダイン/cm2、約80,000ダイン/cm2~約90,000ダイン/cm2、約90,000ダイン/cm2~約100,000ダイン/cm2、または両端点を含めてそれらの間の任意の力が含まれる。
システム10の1つの主な用途は、脂肪組織中に見られる幹細胞を解離し、濃縮し、活性化することである。本明細書で説明するように、マイクロ流体チップ14、14’のマイクロ流体チャネル16内に発生する剪断力は、脂肪組織、間充織幹細胞、および脂肪組織内に見られる他の細胞、を細かくするために使用される。本明細書に例示されている様々なマイクロ流体チップ14の設計(例えば、図14A~14J)は、サンプルに大きな剪断応力を加える。例えば、マイクロ流体チャネル16の狭窄部、テーパ部、および成形面が、脂肪組織を細かくし、その中にある細胞を活性化する。
システム10は他の用途にも使用することができる。例えば、このシステムは腫瘍細胞の単離に用いることができる。この意味で、サンプルが単一細胞または数個の細胞の集合体まで分解される一般的な細胞解離器または細胞分離器に用いることもできる。図19は、本明細書に記載のシステム10を用いてマイクロ流体チップ14を通過させた腫瘍細胞の顕微鏡写真を示す。図19に示すように、視野内に多数の単一細胞がある。これは、図20に見られるような未処理の腫瘍組織のコントロールとは対照的であり、図20では単一セルがはるかに少ない。システム10に使用できるさらなる組織の種類は、例えば、脳組織や骨髄を含む。細胞はまた、マイクロ流体チップ14、14’を通過させ細胞に剪断応力をかけて、それらを表現型または他の変化(例えば、間充織幹細胞)にかけることができる。別に、マイクロ流体チップ14、14’は、単一細胞の凝集体に剪断応力をかけて単離させることにより、細胞の凝集体を細かくする。その後に、これらの単一細胞を分類する(例えば、腫瘍型)か、細胞シグナルもしくは分泌物について分析することができる。
図21は、研究または診断での使用のために単一細胞を選別するため、またはサイズによって細胞を選別するために利用可能なマイクロ流体チップ14の一実施形態を示す。例えば、腫瘍細胞または膵島細胞を細かくした後、マイクロ流体チップ14を用いて、研究のために単一の腫瘍細胞を選別および捕捉することができる。マイクロ流体チップ14は、単一細胞または特定のサイズの任意の凝集体を分類できるように設計されている。マイクロ流体チップ14は、ある断面積(x)を有するサンプルが出入りする2つの入口または出口292を有する。次いで、サンプルは、入口/出口の断面積(x)よりも大きい、小さい、または等しい断面積の主流路294を通って流れる。サンプルが主流路294を通って流れる際に、マイクロ流体チップ14の底部および/または側面に形成された小さなリザーバ296を通る。これらのリザーバ296は、例えば直径約100ミクロン未満のサイズを有するウェルを含み得る。これらのリザーバ296は、主流路294の断面積より小さい。これらの小さなリザーバ296は、用途に応じて特定のサイズの単一細胞または凝集体に合わせることができる。効率および細胞の捕捉を向上するため、リザーバは、主チャネル294に対して垂直から0~90°(例えば、0°~10°、10°~30°、30°~45°、45°~60°、60°~90°など)の角度にすることができる。一実施形態では、捕捉された細胞は、以降の分析のためにマイクロ流体チップ14から洗い流すことができる。別の実施形態では、細胞はリザーバ296内に残り、チップ上で直接画像化または他の方法で分析されてもよい。
さらに、このシステム10は、様々な種類のマイクロ流体チップ14、14’を搭載することができ、したがって、殆どすべてのマイクロ流体デバイスへの汎用型にすることができる。このプラットホームは処理のためのあらゆるチップを統合できるので、将来の応用は、幹細胞治療、アルツハイマー病治療、関節炎治療、創傷治療、化粧品、脊髄損傷、骨折損傷、脳損傷、潰瘍治療、臓器治療、血液療法、再形成治療、免疫療法、栄養付与、育毛治療、視覚治療、神経学的治療、筋肉治療、および軟骨置換術を含む。
図22は、図23に示す実施形態のケース46’と共に使用できるサンプルチャンバ300の別の実施形態を示す。この実施形態では、サンプルチャンバ300は、入口304および出口306と流体連通する内部チャンバ302を具える。入口304は、内部チャンバ302にサンプルを充填するために使用され、その中に配置された一方向弁308を具える。一方向弁308は、任意の種類の機械的弁を含むことができ、解放可能な隔壁を含み得る。後述するように、入口304および一方向弁308は、サンプルを含むシリンジ320(図23)を入口304に挿入して、一方向弁308を開くことができるように寸法決めされ、これによりシリンジ320の内容物を内部チャンバ302内に充填し、内部チャンバ302から取り外すことができる。
チャンバ300の出口306は、例えばポート20、22を用いて、マイクロ流体チップ14と流体連通している。内部室302は傾斜した下面310を有する。傾斜した下面310は、処理済みのサンプルが抽出されたときにサンプル全体が回収されるように、チャンバ300の内容物を入口304の方へ押しやるように傾斜している。サンプルチャンバ300は、内部チャンバ302とサンプルチャンバ300外部との間を連通する(すなわち、大気に通気する)通気路312を有する。図22に見られるように、通気路312は、チャンバ300の前部(マイクロ流体チップ14に接続する側)の内側から、チャンバ300の後部にて大気に出る(後部は内部チャンバ302を充填するためのシリンジが取り付けられる場所である)。これにより、処理中に通気が可能になり、流体が均等に移動する。
図23は、図22に示すチャンバ300と共に使用されるケース46’の実施形態を示す。図23に示すように、マイクロ流体チップ14は、チャンバ300と共にキャリッジ60に搭載されている。この実施形態におけるケース46’は、処理中に不注意でこぼれるか放出されるサンプルを捕獲するために用いられるボウル48を具える。ケース46’は、当該ケース46’の側面に配置されたアクセスポート52をさらに含み、当該アクセスポート52は、サンプルをチャンバ300内に充填するか、処理後にチャンバ300から取り出すためにシリンジ320を通せる寸法である。図23は、アクセスポート52に通され、チャンバ300の入口304に挿入されたシリンジ320を示しており、それによって未処理のサンプルを内部チャンバ302に充填するか処理完了後にそこから取り出すことができる。
チャンバ300の充填または取出しのために、マイクロ流体チップ14をアクセスポート52と整列させ、次いでシリンジ320をアクセスポート52内および入口304内に挿入して一方向弁308を開く。完了すると、シリンジ320を取り外して、これにより一方向弁308が閉じて、サンプルの漏れが防止される。次に、サンプルがマイクロ流体チップ14を通って前後に通過するように、キャリッジ60およびそれらのマイクロ流体チップ14を複数回スピンまたは回転させることにより、マイクロ流体チップ14が本明細書に記載のように処理される。処理後、支持プレート30を回転させてマイクロ流体チップ14をアクセスポート52と整列させる。使用者は、シリンジ320をチャンバ300の入口304に取り付け、一方向弁308を開く。次いで処理済みのサンプルがシリンジ320内に抽出できるようになる。傾斜した下面310は、チャンバ300の内容物全体を排出するのを補助する。この抽出プロセスは、各マイクロ流体チップ14に対して行うことができる。
図24~26は、システム10の他の実施形態を示す。この実施形態では、システム10は、マイクロ流体チップ14に対して垂直に取り付けられる1またはそれ以上のシリンジ352と接合するトッププレートまたはリング350を具える。シリンジ352の出口は、シリンジ352の端部をマイクロ流体チップ14と流体的に結合するアダプタ80など(例えば、図2)を使用して、マイクロ流体チップ14のポート20に結合される。マイクロ流体チップ14の反対側の端部は、本明細書に開示されているようにサンプルチャンバ70、72に結合されている。シリンジ352のシリンジプランジャ354は、図25に見られるように、シリンジプランジャ354を保持するように寸法形成されたフックまたはクリップ356を用いてトッププレートまたはリング350を介して保持されている。好ましい実施形態では、図25に示すように、半径方向内側(すなわち内側)にある第1の組のフックまたはクリップ356と、半径方向外側(すなわち外側)にある第2の組のフックまたはクリップ356とがある。いくつかの実施例では、第1の組のフックまたはクリップ356および第2の組のフックまたはクリップ356は、シリンジプランジャ354の遠位端が各フックまたはクリップ356内に容易に固定され、そこから取り外せるように構成される。これらの異なるフックまたはスリップ356は、マイクロ流体チップ14および取り付けられたシリンジ352の「回転」状態に応じて、シリンジプランジャ354と係合する。以下により詳細に説明するように、キャリッジ60が回転すると、マイクロ流体チップ14に取り付けられたシリンジ352は、半径方向内側の位置から半径方向外側の位置へ回転することができる。キャリッジ60が回転すると、シリンジ352の遠位端が、半径方向内側にある第1のセットのフックまたはクリップ356から外れ、続いて半径方向外側に位置する第2のセットのフックまたはクリップ356に係合/固定される。
したがって、この実施形態では、1またはそれ以上のシリンジ352は、マイクロ流体チップ14の回転面に対してほぼ垂直に保持される。トッププレートまたはリング350は、内ねじが切られて回転モータ362に結合されたねじロッド360と係合するベアリング358に回転可能に取り付けられている。ベアリング358により、トッププレートまたはリング350が、マイクロ流体チップ14および取り付けられたシリンジ352と共に回転可能となる。回転モータ362を作動させると、ねじロッド360が回転し、トッププレートまたはリング350が垂直方向に移動する。一方向への回転によってトッププレートまたはリング350が矢印Aの方向に下方移動し、それによってシリンジプランジャ354をシリンジ352のバレル内に押し下げる。この方向へのモータ362の移動は、シリンジ352の内容物をマイクロ流体チップ14内に排出するために使用される。逆に、回転モータ362を反対方向に動かすと、ねじロッド360が反対方向に回転し、トッププレートまたはリング350を上方向に動かし(矢印Bに見られる)、それによってシリンジプランジャ354を引っ張ってシリンジ352のバレルから出す。この方向へのモータ362の動きは、マイクロ流体チップ14からシリンジ352内へサンプルを引き出すか排出するために使用される。回転モータ362は、図24に示すように、ケース46の頂部に固定することができる。
この実施形態では、マイクロ流体チップ14が支持プレート30上のキャリッジ60に取り付けられた状態で、シリンジ352は、一端(図24に見られるように半径方向内側の位置)においてアダプタ80などを介してマイクロ流体チップ14に取り付けられ、他端においてフックまたはクリップ356を介して取り付けられている。システム10は、ケース46に搭載され、運転パラメータ(例えば、RPMレート、運転時間、減速レート、サイクル数、サイクル時間など)をプログラムするために使用できるコントロールパネル370を具える。コントロールパネル370はまた、ディスプレイ372などを用いて特定の実行状態を監視するために使用することができる。ユーザがコントロールパネル370とインターフェースできるようにボタン374が設けられている。システム10は、本書に前述のとおりモータ42を用いた支持プレート30の回転により始動する。スピンプロセスの間、シリンジ352はマイクロ流体チップ14と共に回転する。回転モータ362を作動させてトッププレートまたはリング350を下方に進めてサンプルをシリンジ352からマイクロ流体装置14内に移動させる。支持プレート30を駆動するメインモータ42と回転モータ362との両方の回転が停止され、シリンジ352とともにマイクロ流体チップ14が180°回転される(例えば、減速が回転を引き起こすが、他の任意の回転様式を用いてもよい)。図26は、マイクロ流体チップ14と、半径方向外側の位置まで180°回転したシリンジ352とを示す。上述のように、キャリッジ60および取り付けられたマイクロ流体チップ14およびシリンジ352の回転は、様々な方法で実現することができる。シリンジ352を回転させると、プランジャ354が、当該プランジャ354の遠位端が取り付けられているフックまたはクリップ356から外れる。シリンジ352は次いで、異なる組のフックまたはクリップ356(すなわち、半径方向外側のフックまたはクリップ356)と係合することができる。次に、支持プレート30を駆動するメインモータ42および回転モータ362を(逆方向に)作動させ、それによってトッププレートまたはリング350がマイクロ流体チップ14から遠ざかり、マイクロ流体チップ14を通してサンプルが逆方向に吸い出される。このプロセスは、任意の回数またはサイクル数で繰り返すことができる。処理後、たった今処理されたサンプルを含むシリンジ352をシステム10から取り外し、患者または被験者に処理済みのサンプル(例えば脂肪組織)を注入するために直接使用することができる。
本明細書で説明されるように、システム10の1つの主な用途は、脂肪組織を処理して治療用途および/または美容用途を生成することである。1つの有利な態様は、追加の酵素や他の消化剤(例えばコラゲナーゼ)を必要とせずに処理が行われることである。例えば、創傷治癒用途のために処理済み組織の非化学的処理が行われ、それによって天然の細胞外マトリックス成分が保持される。もちろん、他の実施形態、例えばサンプルが実験室の環境で評価される状況では、コラゲナーゼなどの任意の消化剤や他の化学物質または化学剤を添加してもよい。これらの添加剤は、細胞および細胞内成分採取の効率を高めるために使用することができる。
マイクロ流体チップ14を使用して脂肪(または他の)組織の処理を記載したが、組織処理は、洗浄工程または濾過工程などの様々な追加の処理操作を伴ってもよいことを理解されたい。これらの追加の処理工程は、オンチップで(すなわちマイクロ流体チップ14上で)組み込まれてもよいし、オフチップで(すなわちマイクロ流体チップ14上でサンプルを処理した後に)行われてもよい。例えば、洗浄液をチャンバ70、72あるいはマイクロ流体チップ14内のサンプルを洗い流すために使用可能な他の別個の洗浄チャンバ(図示せず)に充填してもよい。同様に、図13に開示のものと同様のフィルタエレメント190を使用して、マイクロ流体チップを出る際にサンプルを濾過してもよい。複数のフィルターを用いて逐次的な濾過を行ってもよい。さらなる別の実施形態では、システム10を通過するサンプル12は細胞を含む。このシステム12は、細胞をマイクロ流体チップ14に通し、高い剪断力にかけることによって、細胞を破壊(すなわち溶解)するために使用することができる。細胞溶解により、1つ以上の細胞内小器官、細胞成分、膜結合小器官、細胞外小胞、タンパク質、核酸、パラクリン因子などを含み得る細胞の内容物が放出される。いくつかの実施形態において、これらの成分は細胞内に放出され、治療的および/または美容的効果を奏し得る。これらの放出された細胞内成分は治療的または美容的効力を有し得る。例えば、患者自身の細胞をシステム10に通し、破壊または溶解させて、細胞内の成分を放出させることができる。その後に細胞内成分を取り出して患者に使用する。これらは、いくつかの実施形態では処理後すぐに使用され、あるいは将来の使用のために収集し保存することができる。いくつかの実施形態において、抽出された細胞内成分は、同じ患者(すなわち自己由来)または異なる患者(すなわち同種異系)で使用することができる。さらなる実施形態では、処理済みの細胞は、必要に応じて、細胞増殖を促進するために、例えば適切な栄養素などを含むインビトロ培養培地中で培養される。いくつかの実施形態において、細胞によるセクレトーム産生を増大させるための条件が選択される。これは、セクレトーム産生を最適化するために、特定の増殖因子、培地濃度/pH、またはいくつかの実施形態では低酸素培養条件(例えば、約0.1%、約0.5%、約1%のO2)を含み得る。いくつかの実施形態では、細胞培養(後処理)により、培地から単離することができる1またはそれ以上の成分が分泌される。いくつかの実施形態において、細胞培養(後処理)により、細胞の溶解やそうでなくとも細胞の処理によっても単離することができる、内在性の膜または膜連結された1以上の因子が産生される。いくつかの実施形態では、これらの単離因子は、同種異系治療または自家治療のいずれかのために、保存して既製の治療薬として使用することができる。培養(後処理)した細胞から単離することができる成分の非限定的な例には、上記のように、様々なタンパク質、サイトカイン、エキソソームなどが含まれる。いくつかの実施形態において、これらの因子には、VEGF、HGF、IGF-1、SDF-1、PDGF-BB、NGF-β、SCF、bFGF、TNF-α、HGFA、MFG-E8およびそれらの組み合わせが含まれるが、これらに限定されない。いくつかの実施形態では、miRNAを含むエキソソームが単離され、これは例えば、miR-223、miR-146b、miR-126およびmiR-199aを単独で、互いにまたは他のマイクロRNAと組み合わせて含む。
図27A、27Bは、それぞれ、未処理の未加工脂肪組織(標準的な脂肪吸引物)とともに、図14Bに示す種類のマイクロ流体チップ14を使用する図5に示す組織処理システムを通過させた脂肪組織についての細胞数および細胞生存率の結果のグラフを示す。未処理の脂肪組織をそのまま処理しないもの(標準の脂肪吸引物)と、組織処理システムを用いて1600RPMで20サイクル(各サイクルはマイクロ流体チップ14を360°回転させた)で処理したものとした。その後、処理済みの各サンプルを0.1%コラゲナーゼと混合して間質血管細胞群を回収した。
簡単に説明すると、I型コラゲナーゼ(ミズーリ州セントルイス、Sigma-Aldrich社)をリン酸緩衝生理食塩水と混合することによって0.1%酵素消化溶液を調製し、次いでこれを0.22μm真空フィルタ(マサチューセッツ州ビルリカ、Millipore社)を用いて滅菌した。脂肪吸引物に対する1:1容量のコラゲナーゼ溶液を水浴中で37℃で30分間、断続的に撹拌しながら培養した。次いで、等容量の対照培地(ダルベッコ改変イーグル培地、10%ウシ胎児血清、500IUペニシリン、および500μgストレプトマイシン)を添加して酵素活性を中和し、混合物を少なくとも10分間分離させた。間質血管細胞群を含む液体浸潤物層を単離し、100μmセルストレーナ(ノースカロライナ州ダラム、Corning社)を通して濾過し、1800rpmで8分間遠心分離した。次いで、赤血球混入を最小限に抑えるために、各ペレットを赤血球溶解緩衝液(15.5mM塩化アンモニウム、1mM重炭酸カリウム、および0.01mMエチレンジアミン四酢酸)に5分間再懸濁した。5mlの対照培地を添加した後、懸濁液をもう一度遠心分離した。各遠心分離工程の後に、水性部分を吸引除去した。得られたペレットを次に対照培地に再懸濁し、染色および分析にかけた。
各サンプルから得られた新たに単離された間質血管細胞群(SVF)の一部をアクリジンオレンジ/ヨウ化プロピジウム染色(ヴァージニア州アナンデール、Logos Biosystems社)にかけ、生きている細胞と死んでいる細胞、および有核細胞と無核細胞を区別する二重蛍光自動細胞計数器を用いて計った。最後に、単細胞懸濁液をポリスチレンチューブに等分し、ヨウ化プロピジウムで染色した。生存率を評価するために、各チューブをフローサイトメータ(ドイツ、ベルギッシュ・グラートバッハ、MiltenyiBiotec社)の絶対細胞計数機能にかけた。図27Aは、標準的な脂肪吸引物および(図5の装置を使用して)処理された脂肪吸引物についての細胞数のグラフを示す。装置を使用して1600RPMでサンプルを処理すると、回収されたSVF細胞の数が約1/4に減少する。図27Bに見られるように、1600RPMで装置を使用して処理しても、回収された細胞の生存率に識別可能な差は生じない。一般に、加わる剪断速度が異なると、細胞に剪断力が累積するにつれて、細胞の破壊が増加することがわかった。
幹細胞サブタイプおよび幹細胞マーカーが、フローサイトメトリを用いて、標準的な脂肪吸引物および処理済みの脂肪吸引物の両方において分析された。最初に、間葉系幹細胞(MSC)集団が、生存細胞(前方散乱対側方散乱ウィンドウのX軸上の200ハッシュマークの右側のもの)をゲートして同定された。次に、CD45陰性であった生存細胞集団が排他的にゲートされた。最後に、CD31陰性およびCD45陽性である細胞が同定された。処理済みの脂肪吸引物は、標準の脂肪吸引物よりも多い割合のMSC(CD45-/CD31-/CD34+)を含有することが見出された。
図28は、標準的な脂肪吸引物対(図5の装置を用いて)処理済みの脂肪吸引物から得られた細胞のSVFから同定された幹細胞マーカーおよびサブタイプのグラフ表示を示す。CD34は、装置の処理後にほぼ3倍アップレギュレートされる共通の幹細胞マーカーである。同様に、MSC亜集団(CD45-/CD31-/CD34+)および糖尿病性創傷の治癒に重要なMSC亜集団(CD45-/CD31-/CD34+/DPP4+/CD55+)の両方が、処理後に濃縮されることが見出される。「*」で表されるグラフバーは、p<0.05を表す。
図5の装置を使用して処理された糖尿病性脂肪吸引物と、標準的な(未処理の)糖尿病性脂肪吸引物とを幹細胞マーカーおよびサブタイプについて分析した。図29は、処理済みの脂肪吸引液および標準の脂肪吸引液の両方についての幹細胞マーカー(CD45、CD31、CD34、CD73、CD146、MSC、DPP4/CD55)のグラフを示す。CD34は共通の幹細胞マーカーである。この特定の試験患者において、CD34は装置の処理後にほぼ2倍にアップレギュレートされた。同様に、他のMSCマーカー(CD73、CD146)ならびに内皮マーカー(CD31)も装置の処理後にアップレギュレートされた。最後に、MSC亜集団(CD45-/CD31-/CD34+)および糖尿病性創傷の治癒に重要なMSC亜集団(CD45-/CD31-/CD34+/DPP4+/CD55+)の両方が、糖尿病性組織の処理後に濃縮されることが見出された。
上記で開示された実施形態の特定の特徴および態様の様々な組み合わせまたはサブコンビネーションがなされてもよく、それでもなお1以上の本発明の範囲内に入ることが企図される。さらに、一実施形態に関連した任意の特定の構成、態様、方法、特性、特徴、品質、属性、要素などの本明細書における開示は、本明細書に記載の他のすべての実施形態において使用することができる。したがって、開示された実施形態の様々な特徴および態様は、開示された発明の様々な態様を形成するために互いに組み合わせることができ、または互いに置き換えることができることを理解されたい。したがって、本明細書に開示された本発明の範囲は、上記の特定の開示された実施形態によって限定されるべきではないことが意図されている。さらに、本発明は様々な修正形態および代替形態を受け入れることができるが、その特定の例が図面に示されており、本明細書で詳細に説明されている。しかしながら、本発明は開示された特定の形態または方法に限定されるべきではなく、反対に、本発明は、記載された様々な実施形態および添付の特許請求の範囲の精神および範囲内に含まれるすべての修正、均等物、および代替物を含む。本明細書に開示されたいかなる方法も列挙された順序で実行される必要はない。本明細書に開示された方法は、施術者によって取られる特定の行動を含むが、これらの行動に関する第三者からの指示を明示的または暗示的に含めることもできる。例えば、「増殖NK細胞の集団を投与する」などの行為は、「増殖NK細胞の集団の投与を指示すること」を含む。さらに、本開示の特徴または態様がマーカッシュ群として説明されている場合、当業者は、それによってマーカッシュ群の任意の個々の構成物または構成物のサブグループに関しても開示が説明されていることを認識するであろう。
本明細書に開示されている範囲は、ありとあらゆる重複、部分範囲、およびそれらの組み合わせも包含する。「~まで」、「少なくとも~」、「~より大きい」、「~未満」、「~の間」などの用語は、列挙された数字を含む。「約」または「およそ」などの用語が先行する数字は、列挙された数字を含む。例えば、「約10ナノメートル」は「10ナノメートル」を含む。
本発明の実施形態を図示し説明したが、本発明の範囲から逸脱することなく様々な修正を加えることができる。したがって、本発明は、添付の特許請求の範囲およびそれらの均等物を除いて限定されるべきではない。
Claims (17)
- 生物学的サンプルを処理するためのシステムにおいて、
支持プレートを具え、当該支持プレートが:
受容要素を具える中央部分であって、前記受容要素がモータの駆動シャフトと可逆的に相互作用し、前記モータは前記支持プレートに遠心運動を加えるように構成され、前記中央部分は、前記モータの駆動シャフトの回転軸に垂直な平面内にある、中央部分と;
前記中央部分から半径方向に延び、少なくとも部分的に前記中央部分と平行な平面内にある複数のアームと;を具え、
前記複数のアームが、対応するキャリッジと可逆的に相互作用する相互作用領域を含み、
前記相互作用領域が貫通孔を有し、
複数のキャリッジのそれぞれが、第1端と、第2端と、前記第1端と第2端の間に延びる基部とを有し、
複数のキャリッジのそれぞれが、前記基部から直交する方向に延びるポストであって、前記貫通孔を貫通するサイズで前記アームの底面を越えて突出するポストを有し、
前記ポストは、前記キャリッジをアームに固定するとともに、前記キャリッジが約180度の円弧を通って回転できるように機能し、
それぞれのキャリッジが、マイクロ流体チップと可逆的に相互作用するように構成された受入領域を有し、
前記複数のキャリッジのそれぞれは、複数の軸のうちの1つの周りに同軸配置され、動作中、各軸は、前記モータの駆動シャフトの回転軸とほぼ平行に延び、
前記複数のキャリッジのそれぞれは、前記複数の軸のうちの1つの周りで約180度の円弧まで間欠的に回転可能である、ことを特徴とするシステム。 - 請求項1のシステムにおいて、複数のマイクロ流体チップをさらに具え、各マイクロ流体チップは、
第1端と第2端との間に位置する中央本体であって、
前記第1端と第2端はそれぞれ、処理のためにサンプルを受け取るように構成されたサンプルチャンバと流体的に相互作用するように構成されている、中央本体と、
前記第1端と第2端との間に配置された少なくとも1つのマイクロ流体チャネルであって、変化する寸法を有し、前記第1端から第2端までサンプルの双方向の通過を可能にするように構成されたマイクロ流体チャネルとを具え、
前記複数のマイクロ流体チップのそれぞれが、対応するキャリッジ上の対応する受入領域内にフィットする寸法であることを特徴とするシステム。 - 請求項2のシステムにおいて、各マイクロ流体チップが、前記第1端および第2端のそれぞれにおいてサンプルチャンバに可逆的に流体的に結合されており、各サンプルチャンバが、サンプルチャンバの内部と流体的に接続された通気口および通気路を具え、各サンプルチャンバが、アダプタを介して前記マイクロ流体チップに可逆的に流体的に連結されることを特徴とするシステム。
- 請求項1のシステムにおいて、各キャリッジが前記第1端および第2端に捕捉要素を有し、前記捕捉要素は前記支持プレートの側方部分の解放要素と連絡するように構成されており、前記捕捉要素と解放要素との間の連絡により、前記複数のキャリッジの間欠的な回転が可能となることを特徴とするシステム。
- 請求項4のシステムにおいて、前記捕捉要素が第1の極性の磁石を有し、前記解放要素が反対の極性の磁石を有することを特徴とするシステム。
- 請求項1のシステムにおいて、前記支持プレートの側方部分はディスクを含み、前記相互作用領域は前記ディスクの周囲に円周方向に間隔を置いて配置されており、前記側方部分と中央部分が一体構造であることを特徴とするシステム。
- 請求項1のシステムにおいて、前記支持プレートの側方部分が複数のアームを含み、各アームが対応する相互作用領域を有し、前記アームと前記中央部分が一体構造であることを特徴とするシステム。
- 請求項1のシステムにおいて、前記支持プレートの側方部分が複数のアームを含み、前記アームと前記中央部分とが互いに接合された別々の構造体であり、前記アームが前記中央部分にヒンジで結合されており、前記ヒンジで結合されたアームは、動作中に前記アームが前記モータの駆動シャフトの回転軸と実質的に平行である軸の平面内に移動することを可能にすることを特徴とするシステム。
- 請求項1のシステムにおいて、前記受入領域は、前記キャリッジの基部の上面に配置されていることを特徴とするシステム。
- 請求項1のシステムにおいて、各キャリッジの間欠的な回転は、前記支持プレートの側方部分に配置された歯車と、各キャリッジの回転を引き起こす固定歯との相互作用を介して達成されることを特徴とするシステム。
- 請求項1乃至10のいずれかのシステムにおいて、エンクロージャをさらに具え、当該エンクロージャが前記システムを外部環境から分離することを特徴とするシステム。
- 請求項11のシステムにおいて、前記モータは、当該モータの回転速度の制御を可能にするコントローラユニットによって制御されることを特徴とするシステム。
- 請求項1のシステムにおいて、前記支持プレートの側方部分が少なくとも3つのアームを具え、前記3つのアームのそれぞれが、第1端および第2端を含む少なくとも3つのキャリッジのうちの1つと相互作用するように構成された相互作用領域を有し、各キャリッジは少なくとも3つのマイクロ流体チップと可逆的に相互作用するように構成され、各チップは第1端、第2端、およびそれらの間の本体部を有し、前記マイクロ流体チップの各端部はサンプルチャンバに流体的に結合され、前記チップの本体部は前記第1端および第2端の間に延在する複数のマイクロ流体流路を有し、前記キャリッジは前記第1端が前記中央部分の受容要素から第1の距離にある第1の位置に配置されている第1の位置と、前記第1端が前記中央部分の受容要素から第2の距離にある第2の位置に配置されている第2の位置との間で断続的に回転するように構成され、ここで前記第1の距離は前記第2の距離よりも大きいことを特徴とするシステム。
- サンプルを処理するためのシステムであって、
複数のアームを含む支持プレートであって、前記複数のアームが、前記支持プレートから半径方向に延在していて貫通孔を有する支持プレートと、
前記支持プレートに結合され、当該支持プレートを回転させるように構成されたモータと、
複数のキャリッジとを具え、
当該複数のキャリッジのそれぞれは、前記支持プレートの複数のアームのうちの1つに配置され、前記複数のキャリッジのそれぞれは、当該キャリッジが配置されているアームから垂直方向に伸びる複数の軸のうちの1つの周りに同軸に配置され、
前記複数のキャリッジのそれぞれは、マイクロ流体チップと、処理のためにサンプルを受け取るための少なくとも1つのサンプルチャンバとを受容するように構成され、前記少なくとも1つのサンプルチャンバは前記マイクロ流体チップに流体的に接続された開口部を有し、
前記複数のキャリッジのそれぞれは、前記キャリッジの基部から直交する方向に延びるポストであって、前記貫通孔を貫通するサイズで前記アームの底面を越えて突出するポストを有し、前記複数のキャリッジのそれぞれは、前記複数の軸のうちの1つの周りで回転可能であることをことを特徴とするサンプル処理システム。 - 請求項14のサンプル処理システムにおいて、前記モータを駆動するように構成されたコントローラをさらに具え、前記コントローラは、前記モータの回転速度または毎分回転数(RPM)を調整するように構成されていることを特徴とするサンプル処理システム。
- 請求項15のサンプル処理システムにおいて、前記コントローラが、予め特定された回転プログラムまたは動作シーケンスで調整可能またはプログラム可能であることを特徴とするサンプル処理システム。
- 請求項15または16のサンプル処理システムにおいて、前記コントローラは、前記モータの回転速度を、前記サンプルが前記マイクロ流体チップの第1端から第2端まで流れるように構成されるようなRPM速度まで上昇させるように構成されることを特徴とするサンプル処理システム。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2022072888A JP7368014B2 (ja) | 2016-06-08 | 2022-04-27 | 組織および細胞を処理するための方法および装置 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662347290P | 2016-06-08 | 2016-06-08 | |
| US62/347,290 | 2016-06-08 | ||
| PCT/US2017/036429 WO2017214323A1 (en) | 2016-06-08 | 2017-06-07 | Method and device for processing tissues and cells |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022072888A Division JP7368014B2 (ja) | 2016-06-08 | 2022-04-27 | 組織および細胞を処理するための方法および装置 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2019526036A JP2019526036A (ja) | 2019-09-12 |
| JP2019526036A5 JP2019526036A5 (ja) | 2020-02-13 |
| JP7072228B2 true JP7072228B2 (ja) | 2022-05-20 |
Family
ID=60578121
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018563726A Active JP7072228B2 (ja) | 2016-06-08 | 2017-06-07 | 組織および細胞を処理するための方法および装置 |
| JP2022072888A Active JP7368014B2 (ja) | 2016-06-08 | 2022-04-27 | 組織および細胞を処理するための方法および装置 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022072888A Active JP7368014B2 (ja) | 2016-06-08 | 2022-04-27 | 組織および細胞を処理するための方法および装置 |
Country Status (9)
| Country | Link |
|---|---|
| US (3) | US10589268B2 (ja) |
| EP (1) | EP3469374A4 (ja) |
| JP (2) | JP7072228B2 (ja) |
| KR (4) | KR20230136674A (ja) |
| CN (2) | CN109564231B (ja) |
| BR (1) | BR112018075194B1 (ja) |
| CA (1) | CA3051051A1 (ja) |
| IL (3) | IL295611B2 (ja) |
| WO (1) | WO2017214323A1 (ja) |
Families Citing this family (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP7370529B2 (ja) * | 2015-08-31 | 2023-10-30 | 剛士 田邊 | 多能性幹細胞製造システム、幹細胞の誘導方法、幹細胞の浮遊培養方法、幹細胞の浮遊培養器、人工多能性幹細胞の作製方法、及び動物細胞から特定の体細胞を作製する方法 |
| US11613759B2 (en) | 2015-09-04 | 2023-03-28 | Sqz Biotechnologies Company | Intracellular delivery of biomolecules to cells comprising a cell wall |
| US11291997B2 (en) * | 2018-08-02 | 2022-04-05 | Colorado State University Research Foundation | Rotary manifold for paper-based immunoassays |
| CN109174382A (zh) * | 2018-09-19 | 2019-01-11 | 北京新星靓京广医疗美容医院有限公司 | 一种点对点定向脂肪移植的装置 |
| EP3864391A4 (en) * | 2018-11-13 | 2022-08-24 | National Research Council of Canada | AUTOMATED WORLD-TO-CHIP INTERFACE FOR CENTRIFUGAL MICROFLUIDIC PLATFORMS |
| WO2020117610A1 (en) * | 2018-12-08 | 2020-06-11 | Min Wei | Apparatus for manufacturing cell therapy product |
| WO2020210162A1 (en) * | 2019-04-08 | 2020-10-15 | Sqz Biotechnologies Company | Cartridge for use in a system for delivery of a payload into a cell |
| CN110302851A (zh) * | 2019-04-24 | 2019-10-08 | 山东科技大学 | 基于微流体控制与贾敏效应观测的实验系统及其实验方法 |
| WO2020263858A1 (en) | 2019-06-24 | 2020-12-30 | The Regents Of The University Of California | Integrated system for mechanical processing of lipoaspirate |
| CN110243750B (zh) * | 2019-06-28 | 2024-05-03 | 佛山科学技术学院 | 一种采样器及应用该采样器的流式细胞仪 |
| US20210001344A1 (en) * | 2019-07-03 | 2021-01-07 | Shimadzu Corporation | Sample holding disc for centrifugation |
| KR102081615B1 (ko) * | 2019-10-07 | 2020-02-26 | 주식회사 미리메딕스 | 체외진단에 사용되는 비전기식 휴대용 시료 및 시약 혼합 장치 |
| KR102350660B1 (ko) * | 2020-01-21 | 2022-01-12 | (주)옵토레인 | 가변익 원심 주입 장치 |
| KR102404001B1 (ko) * | 2020-02-26 | 2022-05-31 | 주식회사 클리노믹스 | 원심력을 이용한 유체 제어 장치 |
| CN111298854B (zh) * | 2020-02-27 | 2021-08-06 | 西人马联合测控(泉州)科技有限公司 | 芯片的成型方法以及晶圆 |
| CN113462515B (zh) * | 2020-03-30 | 2024-05-24 | 礼德(上海)生物科技有限责任公司 | 一种组织分散芯片及方法 |
| KR102424845B1 (ko) * | 2020-07-30 | 2022-07-25 | 재단법인대구경북과학기술원 | 미세 유동 장치 |
| CA3198587A1 (en) * | 2020-10-12 | 2022-04-21 | The Regents Of The University Of California | Integrated microfluidic system for the processing of tissues into cellular suspensions |
| KR102561447B1 (ko) * | 2020-12-23 | 2023-08-01 | 성균관대학교산학협력단 | 유체다이오드 및 유체이송장치 |
| CN112791645B (zh) * | 2021-01-26 | 2022-05-13 | 驻马店职业技术学院 | 流体驱动控制阀 |
| CN112683631B (zh) * | 2021-01-27 | 2024-01-09 | 鄂尔多斯市路泰公路工程有限责任公司 | 一种沥青路面芯样分离器 |
| CN113484097B (zh) * | 2021-08-20 | 2023-03-21 | 太原学院 | 一种关于水环境工程检测用的污染物取样装置 |
| US20230081048A1 (en) * | 2021-09-10 | 2023-03-16 | Elephas Biosciences Corporation | Tissue cutting system and method |
| WO2023122296A1 (en) * | 2021-12-22 | 2023-06-29 | Somalogic Operating Co., Inc. | Method for conducting uniform reactions |
| US20230234049A1 (en) * | 2022-01-25 | 2023-07-27 | Brinter Oy | Fluidic device, apparatus comprising fluidic device and method of using same for fluidic manipulation |
| DE102022201938A1 (de) | 2022-02-24 | 2023-08-24 | Hahn-Schickard-Gesellschaft für angewandte Forschung e.V. | Flüssigkeitstransfer zwischen rotierenden Modulen |
| KR102711038B1 (ko) * | 2022-05-06 | 2024-09-27 | 충남대학교산학협력단 | 미세유체 시스템 |
| CN114949985B (zh) * | 2022-06-30 | 2023-06-20 | 山东和光智慧能源科技有限公司 | 一种可快速拆装π型除污器 |
| CN115322875B (zh) * | 2022-08-12 | 2023-06-30 | 中科院南昌高新技术产业协同创新研究院 | 干细胞预处理装置和方法 |
| WO2024085844A2 (en) * | 2022-10-20 | 2024-04-25 | Izmir Yuksek Teknoloji Enstitusu Rektorlugu | Closed-channel microfluidic platform working with centrifugal principle |
| CN118518454B (zh) * | 2024-07-23 | 2024-09-13 | 天津医科大学第二医院 | 一种适用于质谱检测的样本预处理装置 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20020142470A1 (en) | 2001-03-14 | 2002-10-03 | Clarke Mark S.F. | Directional acceleration vector-driven displacement of fluids (DAVD-DOF) |
| JP2006110523A (ja) | 2004-10-18 | 2006-04-27 | Hitachi Software Eng Co Ltd | 化学反応装置 |
| JP2008008875A (ja) | 2006-06-30 | 2008-01-17 | Ushio Inc | マイクロチップ検査装置 |
| JP2009510481A (ja) | 2005-10-04 | 2009-03-12 | マジック・テクノロジーズ・インク | 被分析物のマイクロ流体的検出 |
| JP2009075067A (ja) | 2007-08-31 | 2009-04-09 | Nsk Ltd | 遠心力付与装置及び検体液分析装置 |
Family Cites Families (140)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4883763A (en) * | 1984-05-03 | 1989-11-28 | Abbott Laboratories | Sample processor card for centrifuge |
| CN2062131U (zh) * | 1990-02-07 | 1990-09-12 | 肖志和 | 间歇式电磁推动旋转装置 |
| US5304487A (en) * | 1992-05-01 | 1994-04-19 | Trustees Of The University Of Pennsylvania | Fluid handling in mesoscale analytical devices |
| JP2002510530A (ja) | 1998-04-07 | 2002-04-09 | マクロポア インコーポレイテッド | 組織案内表面波形部付きのメンブレン |
| AU7866500A (en) | 1999-10-05 | 2001-05-10 | Macropore, Inc. | Heating pen, tack seating device, and tap and surgical implantation methods using same |
| US7090668B1 (en) | 1999-10-29 | 2006-08-15 | Cytori Therapeutics, Inc. | Time-released substance delivery device |
| ATE345868T1 (de) | 2000-05-15 | 2006-12-15 | Tecan Trading Ag | Zweirichtungs-durchfluss-zentrifugalmikrofluid- vorrichtungen |
| US6719795B1 (en) | 2001-04-25 | 2004-04-13 | Macropore Biosurgery, Inc. | Resorbable posterior spinal fusion system |
| US20030054331A1 (en) | 2001-09-14 | 2003-03-20 | Stemsource, Inc. | Preservation of non embryonic cells from non hematopoietic tissues |
| US9597395B2 (en) | 2001-12-07 | 2017-03-21 | Cytori Therapeutics, Inc. | Methods of using adipose tissue-derived cells in the treatment of cardiovascular conditions |
| US20060204556A1 (en) | 2001-12-07 | 2006-09-14 | Cytori Therapeutics, Inc. | Cell-loaded prostheses for regenerative intraluminal applications |
| US7651684B2 (en) | 2001-12-07 | 2010-01-26 | Cytori Therapeutics, Inc. | Methods of using adipose tissue-derived cells in augmenting autologous fat transfer |
| US8105580B2 (en) | 2001-12-07 | 2012-01-31 | Cytori Therapeutics, Inc. | Methods of using adipose derived stem cells to promote wound healing |
| US7771716B2 (en) | 2001-12-07 | 2010-08-10 | Cytori Therapeutics, Inc. | Methods of using regenerative cells in the treatment of musculoskeletal disorders |
| US20050095228A1 (en) | 2001-12-07 | 2005-05-05 | Fraser John K. | Methods of using regenerative cells in the treatment of peripheral vascular disease and related disorders |
| US8404229B2 (en) | 2001-12-07 | 2013-03-26 | Cytori Therapeutics, Inc. | Methods of using adipose derived stem cells to treat acute tubular necrosis |
| JP4653952B2 (ja) | 2001-12-07 | 2011-03-16 | サイトリ セラピューティクス インコーポレイテッド | 処理済み脂肪吸引細胞で患者を治療するためのシステムと方法 |
| US7585670B2 (en) | 2001-12-07 | 2009-09-08 | Cytori Therapeutics, Inc. | Automated methods for isolating and using clinically safe adipose derived regenerative cells |
| US7595043B2 (en) | 2001-12-07 | 2009-09-29 | Cytori Therapeutics, Inc. | Method for processing and using adipose-derived stem cells |
| US7514075B2 (en) | 2001-12-07 | 2009-04-07 | Cytori Therapeutics, Inc. | Systems and methods for separating and concentrating adipose derived stem cells from tissue |
| EP1467746A4 (en) | 2001-12-20 | 2006-10-04 | Macropore Inc | SYSTEMS AND METHODS FOR TREATING PATIENTS WITH COLLAGEN-RICH MATERIAL EXTRACTED FROM ADIPOSE TISSUES |
| US20050026301A1 (en) * | 2002-03-25 | 2005-02-03 | Henry Petithory | Method and apparatus for controlling fluid movement in a microfluidic system |
| US20040137607A1 (en) * | 2003-01-09 | 2004-07-15 | Yokogawa Electric Corporation | Biochip cartridge |
| KR20120038534A (ko) | 2003-02-20 | 2012-04-23 | 사이토리 테라퓨틱스, 인크. | 심혈관 증상의 치료에 지방조직-유래 세포를 사용하는 방법 |
| CA2529954A1 (en) | 2003-06-18 | 2005-02-10 | Macropore Biosurgery, Inc. | Methods of using adipose tissue-derived cells in augmenting autologous fat transfer |
| AU2004260937B2 (en) | 2003-06-25 | 2010-05-13 | Macropore Biosurgery Inc. | Systems and methods for separating and concentrating regenerative cells from tissue |
| KR20070017974A (ko) | 2003-09-17 | 2007-02-13 | 사이토리 테라퓨틱스, 인크. | 말초 혈관 질환 및 관련 장애의 치료에서의 재생 세포의이용 방법 |
| DK1670315T3 (en) | 2003-09-17 | 2017-08-07 | Cytori Therapeutics Inc | PROCEDURES FOR USING FAT FLATED REGENERATIVE CELLS IN THE TREATMENT OF PERFECT Vascular Disease |
| WO2005028635A2 (en) | 2003-09-19 | 2005-03-31 | Microfluidic Systems Inc. | Microfluidic differential extraction cartridge |
| CN1871343B (zh) | 2003-11-04 | 2013-06-26 | 株式会社宝玛斯特 | 从脂肪组织制备干细胞的方法和系统 |
| US7396677B2 (en) * | 2003-11-07 | 2008-07-08 | Nanosphere, Inc. | Method of preparing nucleic acids for detection |
| ES2602559T3 (es) | 2004-03-19 | 2017-02-21 | Cytori Therapeutics, Inc. | Soporte celular y dispositivos de contención de soporte celular que contienen células regenerativas |
| AT500319A1 (de) | 2004-05-13 | 2005-11-15 | Helmut Dipl Ing Habel | Scherfeste bodeneinbauleuchte für gepflasterte oberflächen |
| EP2980206A1 (en) | 2004-07-01 | 2016-02-03 | Cytori Therapeutics, Inc. | Methods of using regenerative cells in the treatment of musculoskeletal disorders |
| DE602004028876D1 (de) | 2004-07-01 | 2010-10-07 | Cytori Therapeutics Inc | Verfahren zur verwendung regenerativer zellen bei der behandlung von nierenkrankheiten und störungen |
| CN102204928B (zh) | 2004-07-01 | 2014-09-17 | 马克罗珀尔生物外科公司 | 再生细胞用于促进伤口愈合的应用 |
| WO2006022612A2 (en) | 2004-07-01 | 2006-03-02 | Macropore Biosurgery Inc. | Methods of using regenerative cells in the treatment of stroke and related diseases and disorders |
| ATE501247T1 (de) | 2004-07-01 | 2011-03-15 | Cytori Therapeutics Inc | Verfahren zur verwendung regenerativer zellen zur förderung der wundheilung |
| EP1765980A4 (en) | 2004-07-02 | 2007-12-12 | Cytori Therapeutics Inc | SYSTEMS AND METHOD FOR THE INSULATION AND USE OF CLINICALLY SAFE, FAT-GUN-GENERATING REGENERATIVE CELLS |
| EP1804776A2 (en) | 2004-09-30 | 2007-07-11 | Cytori Therapeutics, Inc. | Methods for making and using composites, polymer scaffolds, and composite scaffolds |
| DE202004019658U1 (de) | 2004-12-20 | 2005-02-17 | Basika Entwässerungen GmbH | Bodenablauf |
| WO2006069349A2 (en) | 2004-12-22 | 2006-06-29 | Cytori Therapeutics, Inc. | Cell-loaded prostheses for regenerative intraluminal applications |
| EP1844434A4 (en) | 2005-01-10 | 2013-11-13 | Cytori Therapeutics Inc | DEVICES AND METHODS FOR MONITORING, MANAGING AND SERVICING MEDICAL DEVICES |
| US7378043B2 (en) | 2005-01-12 | 2008-05-27 | Ansell Healthcare Products Llc | Latex gloves and articles with geometrically defined surface texture providing enhanced grip and method for in-line processing thereof |
| WO2006112941A2 (en) | 2005-02-16 | 2006-10-26 | Cytori Therapeutics, Inc. | Resorbable hollow devices for implantation and delivery of therapeutic agents |
| CA2599338A1 (en) | 2005-03-02 | 2006-09-08 | The Regents Of The University Of California | Flow switching on a multi-structured microfluidic cd (compact disc) using coriolis force |
| AU2013216683B2 (en) | 2005-05-25 | 2016-06-23 | Cytori Therapeutics, Inc. | Methods of using adipose tissue-derived cells in the treatment of cardiovascular conditions |
| CN101443023A (zh) | 2005-05-25 | 2009-05-27 | 再生医疗技术公司 | 使用脂肪组织来源的细胞治疗心血管病症的方法 |
| CN102861105A (zh) | 2005-05-25 | 2013-01-09 | 再生医疗技术公司 | 使用脂肪组织来源的细胞治疗心血管病症的方法 |
| JP2007033350A (ja) | 2005-07-29 | 2007-02-08 | Hitachi High-Technologies Corp | 化学分析装置 |
| EP1951358A1 (en) | 2005-10-14 | 2008-08-06 | Cytori Therapeutics, Inc. | Cell delivery catheters with distal tip high fidelity sensors |
| US20070224591A1 (en) | 2006-03-27 | 2007-09-27 | General Electric Company | Rotation-based microsampler, system and method of using the same |
| WO2007139551A1 (en) | 2006-05-30 | 2007-12-06 | Cytori Therapeutics, Inc. | Systems and methods for manipulation of regenerative cells from adipose tissue |
| US20100015104A1 (en) | 2006-07-26 | 2010-01-21 | Cytori Therapeutics, Inc | Generation of adipose tissue and adipocytes |
| EP1939629A3 (en) | 2006-08-11 | 2011-03-09 | Samsung Electronics Co., Ltd. | Centrifugal Force Based Magnet Position Control Device and Disk-Shaped Micro Fluidic System |
| WO2008060466A2 (en) | 2006-11-10 | 2008-05-22 | Cytori Therapeutics, Inc. | Individualized dosage determination for local administration of therapeutic particles |
| KR101228112B1 (ko) | 2006-12-06 | 2013-01-31 | 삼성전자주식회사 | 원심력과 펌프를 이용해 유체의 이동을 제어하는 미세유동장치 및 이를 포함하는 미세유동 시스템 |
| US8191715B2 (en) | 2007-04-02 | 2012-06-05 | Samsung Electronics Co., Ltd. | Centrifugal force-based microfluidic device and microfluidic system including the same |
| KR100858091B1 (ko) | 2007-04-24 | 2008-09-10 | 삼성전자주식회사 | 시료 분배 구조를 갖는 원심력 기반의 미세유동장치 및이를 포함하는 미세유동시스템 |
| JP2008278822A (ja) | 2007-05-11 | 2008-11-20 | Olympus Corp | 生体組織分解方法 |
| JP5190861B2 (ja) | 2007-05-11 | 2013-04-24 | オリンパス株式会社 | 生体組織分解方法 |
| US20090075801A1 (en) | 2007-09-19 | 2009-03-19 | Dalibor Hodko | Counter-centrifugal force device |
| WO2009055610A1 (en) | 2007-10-26 | 2009-04-30 | Cytori Therapeutics, Inc. | Syringe system for controlled delivery or removal of material |
| WO2009076548A1 (en) | 2007-12-13 | 2009-06-18 | Cytori Therapeutics, Inc. | Methods of inhibiting tumor development using adipose-derived regenerative cells |
| GB2457094A (en) * | 2008-02-04 | 2009-08-05 | Univ Dublin City | A cuvette assembly for holding milking samples |
| JP2009189281A (ja) | 2008-02-13 | 2009-08-27 | Olympus Corp | 細胞処理装置 |
| JP5078020B2 (ja) | 2008-02-13 | 2012-11-21 | オリンパス株式会社 | 遠心分離容器 |
| JP2009189280A (ja) | 2008-02-13 | 2009-08-27 | Olympus Corp | 遠心分離容器および遠心分離装置 |
| JP2010032444A (ja) | 2008-07-30 | 2010-02-12 | Olympus Corp | 生体組織処理装置 |
| JP2010043876A (ja) | 2008-08-08 | 2010-02-25 | Olympus Corp | 遠心分離容器 |
| WO2010021993A1 (en) | 2008-08-19 | 2010-02-25 | Cytori Therapeutics, Inc. | Methods of using adipose tissue-derived cells in the treatment of the lymphatic system and malignant disease |
| WO2010021931A2 (en) | 2008-08-22 | 2010-02-25 | Invista Technologies S.A.R.L. | Bulked continuous filaments with hexalobal cross-section and theree voids and spinneret plates for producing the filament |
| KR101563687B1 (ko) | 2008-09-02 | 2015-11-09 | 삼성전자주식회사 | 표적 분자 분리를 위한 미세유동 카트리지, 분리장치, 및 이를 이용한 표적 분자 분리 방법 |
| JP2010075066A (ja) | 2008-09-24 | 2010-04-08 | Olympus Corp | 遠心分離容器 |
| JP2010075114A (ja) | 2008-09-26 | 2010-04-08 | Olympus Corp | 生体組織処理装置および生体組織処理方法 |
| EP2169391B1 (de) * | 2008-09-30 | 2013-04-03 | ibidi GmbH | Probenkammerhalter zum Haltern einer Probenkammer und System bestehend aus der Probenkammer und dem Probenkammerhalter |
| JP2010127620A (ja) | 2008-11-25 | 2010-06-10 | Olympus Corp | 生体組織処理装置 |
| JP2010127708A (ja) | 2008-11-26 | 2010-06-10 | Olympus Corp | 遠心分離容器および遠心分離方法 |
| JP2010148450A (ja) | 2008-12-25 | 2010-07-08 | Olympus Corp | 細胞洗浄方法 |
| JP2010148451A (ja) | 2008-12-25 | 2010-07-08 | Olympus Corp | 細胞処理装置 |
| CN201389496Y (zh) * | 2009-04-01 | 2010-01-27 | 广州市第一人民医院 | 一种用在微流控复合芯片上的离心机 |
| WO2010124235A1 (en) | 2009-04-23 | 2010-10-28 | Cytori Therapeutics, Inc. | Use adipose tissue-derived regenerative cells in the modulation of inflammation in the pancreas and in the kidney |
| WO2010124325A1 (en) | 2009-04-27 | 2010-11-04 | Axxin Pty Ltd | A capillary flow test assembly |
| US9133431B2 (en) | 2009-05-01 | 2015-09-15 | Bimini Technologies Llc | Systems, methods and compositions for optimizing tissue and cell enriched grafts |
| EP2253958B1 (en) | 2009-05-18 | 2013-04-17 | F. Hoffmann-La Roche AG | Centrifugal force based microfluidic system and method for the automated analysis of samples |
| JP2011010616A (ja) | 2009-07-03 | 2011-01-20 | Olympus Corp | 脂肪組織処理容器 |
| JP2011010615A (ja) | 2009-07-03 | 2011-01-20 | Olympus Corp | 脂肪組織処理装置 |
| US20110085950A1 (en) * | 2009-10-08 | 2011-04-14 | Samsung Electronics Co., Ltd. | Centrifugal force based microfluidic system and bio cartridge for the microfluidic system |
| NO332016B1 (no) | 2009-12-29 | 2012-05-21 | Stiftelsen Sintef | Prøvebehandlingskassett og fremgangsmåte for å behandle og/eller analysere en prøve under sentrifugalkraft |
| IT1400069B1 (it) | 2010-05-20 | 2013-05-17 | Tremolada | Dispositivo e metodo per la preparazione di tessuto, in particolare tessuto adiposo per trapianto ottenuto da materiale adiposo lobulare estratto tramite liposuzione |
| CN104741157B (zh) | 2010-09-14 | 2017-04-12 | 加利福尼亚大学董事会 | 利用微流体截留涡流从异质溶液中分离细胞的装置 |
| US20130149724A1 (en) | 2010-10-08 | 2013-06-13 | Ashok Chander | Systems, devices and methods for microfluidic culturing, manipulation and analysis of tissues and cells |
| CN102002478B (zh) | 2010-12-01 | 2013-01-02 | 四川大学 | 一种脂肪干细胞的分离培养方法 |
| CA2823123A1 (en) | 2010-12-27 | 2012-07-05 | Intellicell Biosciences, Inc. | Ultrasonic cavitation derived stromal or mesenchymal vascular extracts and cells derived therefrom obtained from adipose tissue and use thereof |
| US9364082B2 (en) * | 2011-06-14 | 2016-06-14 | Rorze Corporation | Constant-temperature device provided with rotating specimen table |
| CA2847215C (en) | 2011-08-30 | 2020-10-20 | National Research Council Of Canada | Centrifugally-enhanced capture method and device |
| KR20130029277A (ko) | 2011-09-14 | 2013-03-22 | 삼성전자주식회사 | 미세유동장치 및 그 제어방법 |
| JP5628131B2 (ja) | 2011-10-19 | 2014-11-19 | サイトリ セラピューティクス インコーポレイテッド | 心血管状態の治療において脂肪組織由来細胞を使用する方法 |
| KR101915675B1 (ko) * | 2012-02-07 | 2018-11-06 | 주식회사 미코바이오메드 | 초고속 핵산 추출 장치, 및 이를 이용하는 핵산 추출 방법 |
| ITGE20120034A1 (it) | 2012-03-28 | 2013-09-29 | Carlo Tremolada | Preparato e metodo per la produzione di un preparato comprendente cellule staminali mesenchimali |
| US20140017806A1 (en) | 2012-07-11 | 2014-01-16 | Samsung Electronics Co., Ltd. | Microfluidic structure, microfluidic device having the same and method of controlling the microfluidic device |
| ITGE20120073A1 (it) | 2012-07-23 | 2014-01-24 | Carlo Tremolada | Metodo e dispositivo per la preparazione di cellule staminali non embrionali |
| WO2014036094A1 (en) | 2012-08-28 | 2014-03-06 | Intellicell Biosciences Inc. | Isolation of stromal vascular fraction from adipose tissue obtained using homogenization with beads |
| ITGE20120102A1 (it) | 2012-10-25 | 2014-04-26 | Lipogems Internat S R L | Procedimento di precondizionamento chimico di materiale cellulare per ottenere la riprogrammazione epigenetica chimica e l'espressione di pluripotenzialità |
| CN103852577A (zh) * | 2012-11-28 | 2014-06-11 | 三星电子株式会社 | 微流体装置和通过使用该微流体装置富集靶细胞的方法 |
| WO2014130391A1 (en) | 2013-02-25 | 2014-08-28 | Arkema Inc. | Unsaturated fatty acid ester-based plastic additives |
| KR20140142624A (ko) * | 2013-06-04 | 2014-12-12 | 삼성전자주식회사 | 미세유동장치 |
| US9580678B2 (en) * | 2013-06-21 | 2017-02-28 | The Regents Of The University Of California | Microfluidic tumor tissue dissociation device |
| US9440233B2 (en) | 2013-08-09 | 2016-09-13 | Shark Kabushiki Kaisha | Microfluidic device for serial fluidic operations |
| KR20150027939A (ko) | 2013-09-04 | 2015-03-13 | 삼성전자주식회사 | 미세유동장치 |
| JP6622189B2 (ja) | 2013-09-19 | 2019-12-18 | サイトリ・セラピューティクス株式会社 | 疼痛及び/又は線維症の調節において脂肪組織由来細胞を使用する方法 |
| KR102176587B1 (ko) | 2013-10-15 | 2020-11-10 | 삼성전자주식회사 | 시료분석장치, 시료분석방법, 및 밸브의 동적 작동 방법 |
| CN104657400B (zh) | 2013-11-19 | 2018-02-02 | 光宝科技股份有限公司 | 离心分析系统以及其分析方法 |
| EP3104708A4 (en) | 2014-02-10 | 2017-08-09 | Cytori Therapeutics, Inc. | Regenerative cell therapy for central nervous system (cns) disorders and ptsd |
| US10329533B2 (en) | 2014-02-19 | 2019-06-25 | Synova Life Sciences, Inc. | Regenerative cell and adipose-derived stem cell processing system and method |
| CA2941823C (en) | 2014-03-07 | 2023-01-17 | National Research Council Of Canada | Centrifugal microfluidic chip control |
| WO2015140737A1 (en) | 2014-03-19 | 2015-09-24 | Lipogems International S.P.A. | Device and method for preparing adipose tissue for transplantation |
| EP3142796A4 (en) | 2014-05-16 | 2017-12-20 | Qvella Corporation | Apparatus, system and method for performing automated centrifugal separation |
| AU2015265539B2 (en) | 2014-05-26 | 2020-01-16 | National Research Council Of Canada | Swivel mount for centrifugal microfluidic chip |
| KR101859860B1 (ko) | 2014-06-06 | 2018-05-18 | 에프. 호프만-라 로슈 아게 | 생물학적 샘플을 분석하기 위한 계측 챔버를 갖는 회전 가능한 카트리지 |
| US20160177250A1 (en) | 2014-06-25 | 2016-06-23 | Cytori Therapeutics, Inc. | Tissue transfer system |
| US10365661B2 (en) | 2014-06-30 | 2019-07-30 | Husqvarna Ab | Navigation for a robotic working tool |
| US20170205322A1 (en) | 2014-07-08 | 2017-07-20 | Cytori Therapeutics, Inc. | Centrifuge chamber |
| TWI550274B (zh) | 2014-08-20 | 2016-09-21 | 紹興普施康生物科技有限公司 | 微流體檢驗裝置及其運作方法 |
| EP3200843A4 (en) | 2014-10-03 | 2018-06-20 | Cytori Therapeutics, Inc. | Use of regenerative cells in mitigating burn progression and improving skin graft incorporation and healing |
| AU362084S (en) | 2014-11-03 | 2015-06-03 | Lipogems Int Spa | Medical apparatus |
| CN104630139A (zh) | 2015-01-31 | 2015-05-20 | 苏州大学 | 振动刺激在调控骨髓间充质干细胞体外成骨、成脂分化中的应用 |
| US10797567B2 (en) * | 2015-07-23 | 2020-10-06 | Life Technologies Corporation | Rotor assembly including a housing for a sensor array component and methods for using same |
| SG11201804220SA (en) | 2015-12-07 | 2018-06-28 | Univ Colorado State Res Found | Activated stem cells and systemic treatment methods for infected wounds |
| ITUB20159750A1 (it) | 2015-12-30 | 2017-06-30 | Alfredo Gorio | Metodo per la promozione ed il miglioramento delle proprieta? del tessuto adiposo, tessuto e cellule ottenute tramite detto metodo |
| WO2017125159A1 (en) | 2016-01-21 | 2017-07-27 | Universitat Politècnica De Catalunya | Method for conditioning stem cells |
| KR101835211B1 (ko) | 2016-04-07 | 2018-03-06 | 가톨릭대학교 산학협력단 | Lps 처리한 지방조직-유래 줄기세포 조정 배지의 제조 방법 및 이를 포함하는 약학 조성물 |
| KR101849841B1 (ko) | 2016-04-07 | 2018-04-18 | 가톨릭대학교 산학협력단 | 인간 지방조직-유래 줄기세포로부터의 저산소-조정 배지의 제조 방법 및 이를 포함하는 약학 조성물 |
| ITUA20163417A1 (it) | 2016-05-13 | 2017-11-13 | Lipogems Int Spa | Fat and medical uses thereof |
| JP2018030815A (ja) | 2016-08-25 | 2018-03-01 | ロート製薬株式会社 | 脂肪由来幹細胞賦活剤 |
| WO2018057959A2 (en) | 2016-09-23 | 2018-03-29 | ArcherDX, Inc. | Operation of a library preparation system to perform a protocol on a biological sample |
| EP3324189B1 (en) | 2016-11-16 | 2021-01-06 | Roche Diagnostics GmbH | Rotatable cartridge with multiple metering chambers |
| CN106434542A (zh) | 2016-11-17 | 2017-02-22 | 山东海斯福生物科技有限公司 | 一种增强脂肪干细胞增殖与移植后存活能力的方法 |
| US11224874B2 (en) | 2017-12-11 | 2022-01-18 | Autonomous Medical Devices Inc. | Apparatus for automatic sampling of biological species employing disk microfluidics system |
| US20190024033A1 (en) | 2017-07-19 | 2019-01-24 | Cellanyx Diagnostics, Llc | Systems, devices and methods for microfluidic culturing, manipulation and analysis of tissues and cells |
-
2017
- 2017-06-07 JP JP2018563726A patent/JP7072228B2/ja active Active
- 2017-06-07 IL IL295611A patent/IL295611B2/en unknown
- 2017-06-07 KR KR1020237031151A patent/KR20230136674A/ko not_active Application Discontinuation
- 2017-06-07 EP EP17810972.4A patent/EP3469374A4/en active Pending
- 2017-06-07 CA CA3051051A patent/CA3051051A1/en active Pending
- 2017-06-07 KR KR1020197034206A patent/KR102370343B1/ko active IP Right Grant
- 2017-06-07 IL IL263422A patent/IL263422B/en unknown
- 2017-06-07 CN CN201780047636.3A patent/CN109564231B/zh active Active
- 2017-06-07 KR KR1020197000183A patent/KR102049705B1/ko active IP Right Grant
- 2017-06-07 BR BR112018075194-4A patent/BR112018075194B1/pt active IP Right Grant
- 2017-06-07 WO PCT/US2017/036429 patent/WO2017214323A1/en unknown
- 2017-06-07 CN CN202211662126.6A patent/CN115993462A/zh active Pending
- 2017-06-07 KR KR1020227006655A patent/KR102579835B1/ko active IP Right Grant
- 2017-06-07 IL IL303399A patent/IL303399A/en unknown
-
2018
- 2018-08-10 US US16/101,254 patent/US10589268B2/en active Active - Reinstated
-
2020
- 2020-01-30 US US16/777,795 patent/US11130127B2/en active Active
-
2021
- 2021-08-26 US US17/412,841 patent/US20220097050A1/en active Pending
-
2022
- 2022-04-27 JP JP2022072888A patent/JP7368014B2/ja active Active
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20020142470A1 (en) | 2001-03-14 | 2002-10-03 | Clarke Mark S.F. | Directional acceleration vector-driven displacement of fluids (DAVD-DOF) |
| JP2006110523A (ja) | 2004-10-18 | 2006-04-27 | Hitachi Software Eng Co Ltd | 化学反応装置 |
| JP2009510481A (ja) | 2005-10-04 | 2009-03-12 | マジック・テクノロジーズ・インク | 被分析物のマイクロ流体的検出 |
| JP2008008875A (ja) | 2006-06-30 | 2008-01-17 | Ushio Inc | マイクロチップ検査装置 |
| JP2009075067A (ja) | 2007-08-31 | 2009-04-09 | Nsk Ltd | 遠心力付与装置及び検体液分析装置 |
Also Published As
| Publication number | Publication date |
|---|---|
| US11130127B2 (en) | 2021-09-28 |
| IL263422A (en) | 2018-12-31 |
| JP7368014B2 (ja) | 2023-10-24 |
| CN109564231A (zh) | 2019-04-02 |
| US10589268B2 (en) | 2020-03-17 |
| WO2017214323A1 (en) | 2017-12-14 |
| KR102579835B1 (ko) | 2023-09-15 |
| JP2022109993A (ja) | 2022-07-28 |
| CN109564231B (zh) | 2023-01-06 |
| US20180361382A1 (en) | 2018-12-20 |
| KR20230136674A (ko) | 2023-09-26 |
| IL303399A (en) | 2023-08-01 |
| KR102049705B1 (ko) | 2019-11-28 |
| US20200164374A1 (en) | 2020-05-28 |
| KR102370343B1 (ko) | 2022-03-03 |
| EP3469374A1 (en) | 2019-04-17 |
| KR20190004838A (ko) | 2019-01-14 |
| IL295611B1 (en) | 2023-07-01 |
| BR112018075194B1 (pt) | 2023-01-10 |
| IL295611B2 (en) | 2023-11-01 |
| BR112018075194A2 (pt) | 2019-03-19 |
| IL263422B (en) | 2022-09-01 |
| CA3051051A1 (en) | 2017-12-14 |
| EP3469374A4 (en) | 2019-12-04 |
| CN115993462A (zh) | 2023-04-21 |
| JP2019526036A (ja) | 2019-09-12 |
| US20220097050A1 (en) | 2022-03-31 |
| KR20220031753A (ko) | 2022-03-11 |
| IL295611A (en) | 2022-10-01 |
| KR20190133059A (ko) | 2019-11-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7072228B2 (ja) | 組織および細胞を処理するための方法および装置 | |
| US9840690B2 (en) | Systems and methods for autologous biological therapeutics | |
| US20050250204A1 (en) | Methods and apparatus for separation of particles | |
| CN107921182B (zh) | 用于分离基质血管部分的机械仪器和方法 | |
| CN111542350B (zh) | 用于制备脂肪来源干细胞的系统和方法 | |
| JP2014525260A (ja) | 脂肪組織から間質血管画分(svf)細胞を単離するためのシステムおよびその方法 | |
| KR102313628B1 (ko) | 충격파 또는 기계적 충격을 사용한 세포의 분리, 해리 및/또는 탈응집 | |
| US20210147788A1 (en) | Isolation device for adipose-derived stromal vascular fraction | |
| KR20240037389A (ko) | 면역 세포의 활성화 | |
| Nathan | Ultrasonic blood fractionation | |
| Tan et al. | Automated haematopoietic stem cells harvesting machine |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191223 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20191223 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20201016 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20201117 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210215 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210416 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210831 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211126 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20220405 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20220427 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7072228 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |