JP7021208B2 - PDE2阻害剤としての[1,2,4]トリアゾロ[1,5-a]ピリミジン化合物 - Google Patents
PDE2阻害剤としての[1,2,4]トリアゾロ[1,5-a]ピリミジン化合物 Download PDFInfo
- Publication number
- JP7021208B2 JP7021208B2 JP2019522863A JP2019522863A JP7021208B2 JP 7021208 B2 JP7021208 B2 JP 7021208B2 JP 2019522863 A JP2019522863 A JP 2019522863A JP 2019522863 A JP2019522863 A JP 2019522863A JP 7021208 B2 JP7021208 B2 JP 7021208B2
- Authority
- JP
- Japan
- Prior art keywords
- disorder
- disorders
- dementia
- compound
- disease
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- -1 [1,2,4] triazolo [1,5-a] pyrimidine compound Chemical class 0.000 title claims description 36
- 229940121828 Phosphodiesterase 2 inhibitor Drugs 0.000 title description 16
- 150000001875 compounds Chemical class 0.000 claims description 156
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 107
- 208000035475 disorder Diseases 0.000 claims description 82
- 238000000034 method Methods 0.000 claims description 61
- 206010012289 Dementia Diseases 0.000 claims description 57
- 150000003839 salts Chemical class 0.000 claims description 57
- 239000000203 mixture Substances 0.000 claims description 48
- 239000008194 pharmaceutical composition Substances 0.000 claims description 43
- 239000012453 solvate Substances 0.000 claims description 36
- 208000019901 Anxiety disease Diseases 0.000 claims description 28
- 239000003814 drug Substances 0.000 claims description 26
- 201000010099 disease Diseases 0.000 claims description 25
- 201000000980 schizophrenia Diseases 0.000 claims description 23
- 229940079593 drug Drugs 0.000 claims description 19
- 230000002265 prevention Effects 0.000 claims description 19
- 208000024827 Alzheimer disease Diseases 0.000 claims description 17
- 208000018737 Parkinson disease Diseases 0.000 claims description 17
- 208000010877 cognitive disease Diseases 0.000 claims description 17
- 208000020016 psychiatric disease Diseases 0.000 claims description 17
- 208000024891 symptom Diseases 0.000 claims description 17
- 208000012902 Nervous system disease Diseases 0.000 claims description 16
- 230000015654 memory Effects 0.000 claims description 16
- 208000020706 Autistic disease Diseases 0.000 claims description 14
- 208000028017 Psychotic disease Diseases 0.000 claims description 14
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 13
- 208000019022 Mood disease Diseases 0.000 claims description 13
- 208000011117 substance-related disease Diseases 0.000 claims description 13
- 208000015122 neurodegenerative disease Diseases 0.000 claims description 12
- 230000007170 pathology Effects 0.000 claims description 12
- 208000023105 Huntington disease Diseases 0.000 claims description 11
- 208000007271 Substance Withdrawal Syndrome Diseases 0.000 claims description 11
- 230000019771 cognition Effects 0.000 claims description 11
- 239000003937 drug carrier Substances 0.000 claims description 11
- 239000000126 substance Substances 0.000 claims description 11
- 125000003545 alkoxy group Chemical group 0.000 claims description 10
- 125000000217 alkyl group Chemical group 0.000 claims description 10
- 208000006096 Attention Deficit Disorder with Hyperactivity Diseases 0.000 claims description 9
- 208000015114 central nervous system disease Diseases 0.000 claims description 9
- 125000001424 substituent group Chemical group 0.000 claims description 9
- 230000001225 therapeutic effect Effects 0.000 claims description 9
- 208000016285 Movement disease Diseases 0.000 claims description 8
- ZPUCINDJVBIVPJ-LJISPDSOSA-N cocaine Chemical compound O([C@H]1C[C@@H]2CC[C@@H](N2C)[C@H]1C(=O)OC)C(=O)C1=CC=CC=C1 ZPUCINDJVBIVPJ-LJISPDSOSA-N 0.000 claims description 8
- 238000004519 manufacturing process Methods 0.000 claims description 8
- 206010065040 AIDS dementia complex Diseases 0.000 claims description 7
- 208000007848 Alcoholism Diseases 0.000 claims description 7
- 206010061216 Infarction Diseases 0.000 claims description 7
- 208000026139 Memory disease Diseases 0.000 claims description 7
- 230000007574 infarction Effects 0.000 claims description 7
- 230000001575 pathological effect Effects 0.000 claims description 7
- 208000028173 post-traumatic stress disease Diseases 0.000 claims description 7
- 201000009032 substance abuse Diseases 0.000 claims description 7
- 231100000736 substance abuse Toxicity 0.000 claims description 7
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 claims description 6
- 201000011240 Frontotemporal dementia Diseases 0.000 claims description 6
- 208000029650 alcohol withdrawal Diseases 0.000 claims description 6
- 208000024714 major depressive disease Diseases 0.000 claims description 6
- 208000022821 personality disease Diseases 0.000 claims description 6
- KWTSXDURSIMDCE-QMMMGPOBSA-N (S)-amphetamine Chemical compound C[C@H](N)CC1=CC=CC=C1 KWTSXDURSIMDCE-QMMMGPOBSA-N 0.000 claims description 5
- 208000011963 Substance-induced psychotic disease Diseases 0.000 claims description 5
- 208000030886 Traumatic Brain injury Diseases 0.000 claims description 5
- 229940025084 amphetamine Drugs 0.000 claims description 5
- 230000001149 cognitive effect Effects 0.000 claims description 5
- 238000009472 formulation Methods 0.000 claims description 5
- 230000008569 process Effects 0.000 claims description 5
- 208000036640 Asperger disease Diseases 0.000 claims description 4
- 201000006062 Asperger syndrome Diseases 0.000 claims description 4
- 208000024254 Delusional disease Diseases 0.000 claims description 4
- 208000012661 Dyskinesia Diseases 0.000 claims description 4
- 208000027534 Emotional disease Diseases 0.000 claims description 4
- 208000020358 Learning disease Diseases 0.000 claims description 4
- 208000026251 Opioid-Related disease Diseases 0.000 claims description 4
- 206010034912 Phobia Diseases 0.000 claims description 4
- 208000011962 Substance-induced mood disease Diseases 0.000 claims description 4
- 231100000395 Substance-induced mood disorder Toxicity 0.000 claims description 4
- 231100000393 Substance-induced psychotic disorder Toxicity 0.000 claims description 4
- 208000025569 Tobacco Use disease Diseases 0.000 claims description 4
- 208000028552 Treatment-Resistant Depressive disease Diseases 0.000 claims description 4
- 230000032683 aging Effects 0.000 claims description 4
- 229960003920 cocaine Drugs 0.000 claims description 4
- 208000026725 cyclothymic disease Diseases 0.000 claims description 4
- 230000007812 deficiency Effects 0.000 claims description 4
- 201000003723 learning disability Diseases 0.000 claims description 4
- 208000019906 panic disease Diseases 0.000 claims description 4
- 208000002851 paranoid schizophrenia Diseases 0.000 claims description 4
- 230000008447 perception Effects 0.000 claims description 4
- 230000002085 persistent effect Effects 0.000 claims description 4
- SNICXCGAKADSCV-JTQLQIEISA-N (-)-Nicotine Chemical compound CN1CCC[C@H]1C1=CC=CN=C1 SNICXCGAKADSCV-JTQLQIEISA-N 0.000 claims description 3
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 claims description 3
- 208000022497 Cocaine-Related disease Diseases 0.000 claims description 3
- 206010026749 Mania Diseases 0.000 claims description 3
- 208000036626 Mental retardation Diseases 0.000 claims description 3
- 206010028980 Neoplasm Diseases 0.000 claims description 3
- 206010057852 Nicotine dependence Diseases 0.000 claims description 3
- 206010033799 Paralysis Diseases 0.000 claims description 3
- 206010041250 Social phobia Diseases 0.000 claims description 3
- 208000031674 Traumatic Acute Stress disease Diseases 0.000 claims description 3
- 208000026345 acute stress disease Diseases 0.000 claims description 3
- 206010001584 alcohol abuse Diseases 0.000 claims description 3
- 201000007930 alcohol dependence Diseases 0.000 claims description 3
- 208000025746 alcohol use disease Diseases 0.000 claims description 3
- 230000001476 alcoholic effect Effects 0.000 claims description 3
- 208000028683 bipolar I disease Diseases 0.000 claims description 3
- 229910052799 carbon Inorganic materials 0.000 claims description 3
- 201000006145 cocaine dependence Diseases 0.000 claims description 3
- 206010013663 drug dependence Diseases 0.000 claims description 3
- 201000006517 essential tremor Diseases 0.000 claims description 3
- 238000007917 intracranial administration Methods 0.000 claims description 3
- 230000028252 learning or memory Effects 0.000 claims description 3
- 206010027175 memory impairment Diseases 0.000 claims description 3
- 125000005322 morpholin-1-yl group Chemical group 0.000 claims description 3
- 229960002715 nicotine Drugs 0.000 claims description 3
- SNICXCGAKADSCV-UHFFFAOYSA-N nicotine Natural products CN1CCCC1C1=CC=CN=C1 SNICXCGAKADSCV-UHFFFAOYSA-N 0.000 claims description 3
- 208000021090 palsy Diseases 0.000 claims description 3
- 239000000825 pharmaceutical preparation Substances 0.000 claims description 3
- 229940127557 pharmaceutical product Drugs 0.000 claims description 3
- 230000000750 progressive effect Effects 0.000 claims description 3
- 208000016686 tic disease Diseases 0.000 claims description 3
- 208000029197 Amphetamine-Related disease Diseases 0.000 claims description 2
- 201000004311 Gilles de la Tourette syndrome Diseases 0.000 claims description 2
- 208000005793 Restless legs syndrome Diseases 0.000 claims description 2
- 208000000323 Tourette Syndrome Diseases 0.000 claims description 2
- 208000016620 Tourette disease Diseases 0.000 claims description 2
- 208000022257 bipolar II disease Diseases 0.000 claims description 2
- 230000003920 cognitive function Effects 0.000 claims description 2
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 claims description 2
- 208000019899 phobic disease Diseases 0.000 claims description 2
- 201000001716 specific phobia Diseases 0.000 claims description 2
- 125000001475 halogen functional group Chemical group 0.000 claims 3
- 239000000543 intermediate Substances 0.000 description 94
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 78
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 76
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 37
- 238000006243 chemical reaction Methods 0.000 description 35
- 239000011541 reaction mixture Substances 0.000 description 35
- 239000000243 solution Substances 0.000 description 34
- 101001098814 Dictyostelium discoideum 3',5'-cyclic-nucleotide phosphodiesterase regA Proteins 0.000 description 31
- 239000012044 organic layer Substances 0.000 description 25
- 239000000047 product Substances 0.000 description 23
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 22
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 22
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 21
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 19
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 18
- 102000004190 Enzymes Human genes 0.000 description 17
- 108090000790 Enzymes Proteins 0.000 description 17
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 17
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 17
- 229940088598 enzyme Drugs 0.000 description 17
- 239000002904 solvent Substances 0.000 description 17
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 15
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 15
- 239000002253 acid Substances 0.000 description 14
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 13
- 238000011534 incubation Methods 0.000 description 13
- 102000004861 Phosphoric Diester Hydrolases Human genes 0.000 description 12
- 108090001050 Phosphoric Diester Hydrolases Proteins 0.000 description 12
- 239000000872 buffer Substances 0.000 description 12
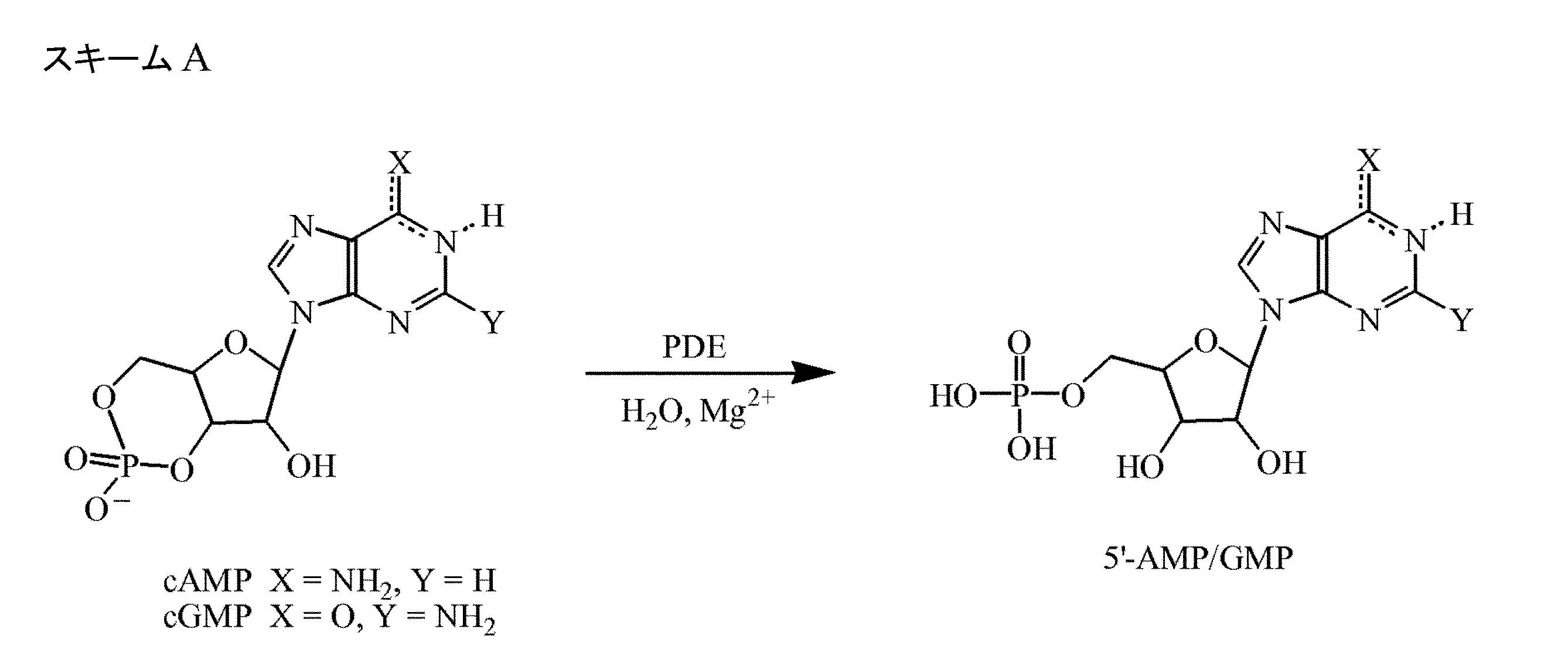
- ZOOGRGPOEVQQDX-UHFFFAOYSA-N cyclic GMP Natural products O1C2COP(O)(=O)OC2C(O)C1N1C=NC2=C1NC(N)=NC2=O ZOOGRGPOEVQQDX-UHFFFAOYSA-N 0.000 description 12
- 239000000741 silica gel Substances 0.000 description 12
- 229910002027 silica gel Inorganic materials 0.000 description 12
- ZOOGRGPOEVQQDX-UUOKFMHZSA-N 3',5'-cyclic GMP Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=C(NC2=O)N)=C2N=C1 ZOOGRGPOEVQQDX-UUOKFMHZSA-N 0.000 description 11
- 108010037527 Type 2 Cyclic Nucleotide Phosphodiesterases Proteins 0.000 description 11
- 239000002585 base Substances 0.000 description 11
- 210000004556 brain Anatomy 0.000 description 11
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 10
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 10
- 102100038953 cGMP-dependent 3',5'-cyclic phosphodiesterase Human genes 0.000 description 10
- 230000000694 effects Effects 0.000 description 10
- 235000019439 ethyl acetate Nutrition 0.000 description 10
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 9
- 241001465754 Metazoa Species 0.000 description 9
- 230000036506 anxiety Effects 0.000 description 9
- 210000004027 cell Anatomy 0.000 description 9
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 9
- 239000003480 eluent Substances 0.000 description 9
- 238000012360 testing method Methods 0.000 description 9
- 241000124008 Mammalia Species 0.000 description 8
- 208000025966 Neurological disease Diseases 0.000 description 8
- 238000002474 experimental method Methods 0.000 description 8
- 230000005764 inhibitory process Effects 0.000 description 8
- 230000000926 neurological effect Effects 0.000 description 8
- 208000020925 Bipolar disease Diseases 0.000 description 7
- 239000004480 active ingredient Substances 0.000 description 7
- 230000037396 body weight Effects 0.000 description 7
- 125000005843 halogen group Chemical group 0.000 description 7
- 230000027928 long-term synaptic potentiation Effects 0.000 description 7
- 230000002829 reductive effect Effects 0.000 description 7
- 239000011734 sodium Substances 0.000 description 7
- 239000007787 solid Substances 0.000 description 7
- 239000003826 tablet Substances 0.000 description 7
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 6
- 206010003805 Autism Diseases 0.000 description 6
- 241000282412 Homo Species 0.000 description 6
- 238000005481 NMR spectroscopy Methods 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 6
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- 239000011324 bead Substances 0.000 description 6
- 239000002775 capsule Substances 0.000 description 6
- 239000003795 chemical substances by application Substances 0.000 description 6
- 238000003776 cleavage reaction Methods 0.000 description 6
- 239000002552 dosage form Substances 0.000 description 6
- 230000004064 dysfunction Effects 0.000 description 6
- 238000010438 heat treatment Methods 0.000 description 6
- 239000012442 inert solvent Substances 0.000 description 6
- 239000003112 inhibitor Substances 0.000 description 6
- 230000014759 maintenance of location Effects 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 125000006239 protecting group Chemical group 0.000 description 6
- 108090000623 proteins and genes Proteins 0.000 description 6
- 238000002821 scintillation proximity assay Methods 0.000 description 6
- 230000007017 scission Effects 0.000 description 6
- 239000000758 substrate Substances 0.000 description 6
- DYHSDKLCOJIUFX-UHFFFAOYSA-N tert-butoxycarbonyl anhydride Chemical compound CC(C)(C)OC(=O)OC(=O)OC(C)(C)C DYHSDKLCOJIUFX-UHFFFAOYSA-N 0.000 description 6
- 210000001519 tissue Anatomy 0.000 description 6
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 5
- 208000036864 Attention deficit/hyperactivity disease Diseases 0.000 description 5
- 208000015802 attention deficit-hyperactivity disease Diseases 0.000 description 5
- 239000012267 brine Substances 0.000 description 5
- 238000005984 hydrogenation reaction Methods 0.000 description 5
- 239000010410 layer Substances 0.000 description 5
- 238000002844 melting Methods 0.000 description 5
- 230000008018 melting Effects 0.000 description 5
- 229910052751 metal Inorganic materials 0.000 description 5
- 239000002184 metal Substances 0.000 description 5
- 239000012071 phase Substances 0.000 description 5
- 238000000746 purification Methods 0.000 description 5
- 238000007127 saponification reaction Methods 0.000 description 5
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 5
- 238000003756 stirring Methods 0.000 description 5
- 238000001851 vibrational circular dichroism spectroscopy Methods 0.000 description 5
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 4
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 4
- 208000020401 Depressive disease Diseases 0.000 description 4
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 4
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 4
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 4
- 241000700159 Rattus Species 0.000 description 4
- 238000003556 assay Methods 0.000 description 4
- 230000009286 beneficial effect Effects 0.000 description 4
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
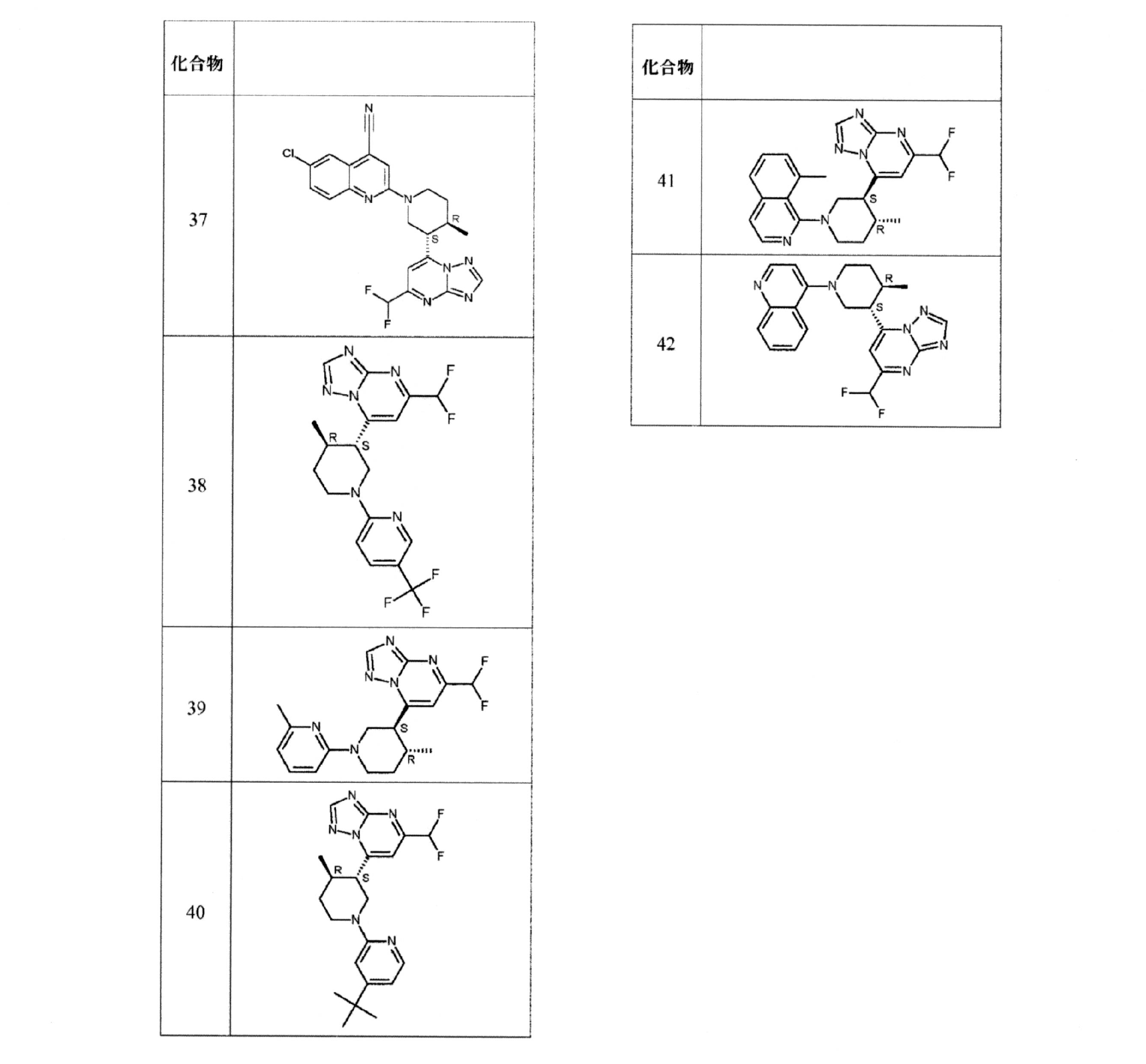
- 229940125904 compound 1 Drugs 0.000 description 4
- 239000013078 crystal Substances 0.000 description 4
- GHVNFZFCNZKVNT-UHFFFAOYSA-N decanoic acid Chemical compound CCCCCCCCCC(O)=O GHVNFZFCNZKVNT-UHFFFAOYSA-N 0.000 description 4
- 230000005684 electric field Effects 0.000 description 4
- 238000003818 flash chromatography Methods 0.000 description 4
- 229910052739 hydrogen Inorganic materials 0.000 description 4
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 4
- 230000006698 induction Effects 0.000 description 4
- 239000004615 ingredient Substances 0.000 description 4
- 230000002401 inhibitory effect Effects 0.000 description 4
- 235000018102 proteins Nutrition 0.000 description 4
- 102000004169 proteins and genes Human genes 0.000 description 4
- 102000005962 receptors Human genes 0.000 description 4
- 108020003175 receptors Proteins 0.000 description 4
- 230000004044 response Effects 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- 230000005062 synaptic transmission Effects 0.000 description 4
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 4
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 4
- 239000003039 volatile agent Substances 0.000 description 4
- FBZVZUSVGKOWHG-UHFFFAOYSA-N 1,1-dimethoxy-n,n-dimethylethanamine Chemical compound COC(C)(OC)N(C)C FBZVZUSVGKOWHG-UHFFFAOYSA-N 0.000 description 3
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 3
- 238000005160 1H NMR spectroscopy Methods 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N 1H-imidazole Chemical compound C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- NDMJUGGUJATEKY-UHFFFAOYSA-N 1h-1,2,4-triazol-5-amine;hydrochloride Chemical compound Cl.NC1=NC=NN1 NDMJUGGUJATEKY-UHFFFAOYSA-N 0.000 description 3
- 208000000044 Amnesia Diseases 0.000 description 3
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 3
- 101001072037 Homo sapiens cAMP and cAMP-inhibited cGMP 3',5'-cyclic phosphodiesterase 10A Proteins 0.000 description 3
- 208000019430 Motor disease Diseases 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- 229920002684 Sepharose Polymers 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- 239000007983 Tris buffer Substances 0.000 description 3
- 230000029936 alkylation Effects 0.000 description 3
- 238000005804 alkylation reaction Methods 0.000 description 3
- 208000029560 autism spectrum disease Diseases 0.000 description 3
- 102100036377 cAMP and cAMP-inhibited cGMP 3',5'-cyclic phosphodiesterase 10A Human genes 0.000 description 3
- 239000013522 chelant Substances 0.000 description 3
- 238000004587 chromatography analysis Methods 0.000 description 3
- 230000006735 deficit Effects 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 238000010790 dilution Methods 0.000 description 3
- 239000012895 dilution Substances 0.000 description 3
- DEFVIWRASFVYLL-UHFFFAOYSA-N ethylene glycol bis(2-aminoethyl)tetraacetic acid Chemical compound OC(=O)CN(CC(O)=O)CCOCCOCCN(CC(O)=O)CC(O)=O DEFVIWRASFVYLL-UHFFFAOYSA-N 0.000 description 3
- 239000000835 fiber Substances 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- 238000004128 high performance liquid chromatography Methods 0.000 description 3
- 210000001320 hippocampus Anatomy 0.000 description 3
- 238000000099 in vitro assay Methods 0.000 description 3
- 230000001965 increasing effect Effects 0.000 description 3
- 208000015181 infectious disease Diseases 0.000 description 3
- 230000003834 intracellular effect Effects 0.000 description 3
- 150000002500 ions Chemical class 0.000 description 3
- 230000013016 learning Effects 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- NXPHGHWWQRMDIA-UHFFFAOYSA-M magnesium;carbanide;bromide Chemical compound [CH3-].[Mg+2].[Br-] NXPHGHWWQRMDIA-UHFFFAOYSA-M 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 230000006984 memory degeneration Effects 0.000 description 3
- 208000023060 memory loss Diseases 0.000 description 3
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 210000002569 neuron Anatomy 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 239000003921 oil Substances 0.000 description 3
- 239000003208 petroleum Substances 0.000 description 3
- 239000000377 silicon dioxide Substances 0.000 description 3
- 230000000638 stimulation Effects 0.000 description 3
- 239000012258 stirred mixture Substances 0.000 description 3
- 239000012089 stop solution Substances 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 230000000946 synaptic effect Effects 0.000 description 3
- 241000701447 unidentified baculovirus Species 0.000 description 3
- ONBQEOIKXPHGMB-VBSBHUPXSA-N 1-[2-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]oxy-4,6-dihydroxyphenyl]-3-(4-hydroxyphenyl)propan-1-one Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1OC1=CC(O)=CC(O)=C1C(=O)CCC1=CC=C(O)C=C1 ONBQEOIKXPHGMB-VBSBHUPXSA-N 0.000 description 2
- WXTMDXOMEHJXQO-UHFFFAOYSA-N 2,5-dihydroxybenzoic acid Chemical compound OC(=O)C1=CC(O)=CC=C1O WXTMDXOMEHJXQO-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- UMSWWSIVPWVJOX-UHFFFAOYSA-N 7-bromo-1-chloroisoquinoline Chemical compound C1=C(Br)C=C2C(Cl)=NC=CC2=C1 UMSWWSIVPWVJOX-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- 102000013455 Amyloid beta-Peptides Human genes 0.000 description 2
- 108010090849 Amyloid beta-Peptides Proteins 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Natural products OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 239000005711 Benzoic acid Substances 0.000 description 2
- 241000218236 Cannabis Species 0.000 description 2
- 239000005632 Capric acid (CAS 334-48-5) Substances 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 208000028698 Cognitive impairment Diseases 0.000 description 2
- 102000008130 Cyclic AMP-Dependent Protein Kinases Human genes 0.000 description 2
- 108010049894 Cyclic AMP-Dependent Protein Kinases Proteins 0.000 description 2
- 102000004654 Cyclic GMP-Dependent Protein Kinases Human genes 0.000 description 2
- 108010003591 Cyclic GMP-Dependent Protein Kinases Proteins 0.000 description 2
- 238000004057 DFT-B3LYP calculation Methods 0.000 description 2
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 2
- 201000010374 Down Syndrome Diseases 0.000 description 2
- 206010013654 Drug abuse Diseases 0.000 description 2
- 230000005526 G1 to G0 transition Effects 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- 239000007821 HATU Substances 0.000 description 2
- 101001098818 Homo sapiens cGMP-inhibited 3',5'-cyclic phosphodiesterase A Proteins 0.000 description 2
- 108090000862 Ion Channels Proteins 0.000 description 2
- 102000004310 Ion Channels Human genes 0.000 description 2
- 108010044467 Isoenzymes Proteins 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 2
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 2
- 241000282372 Panthera onca Species 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 2
- LNUFLCYMSVYYNW-ZPJMAFJPSA-N [(2r,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[[(3s,5s,8r,9s,10s,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-3-yl]oxy]-4,5-disulfo Chemical compound O([C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1C[C@@H]2CC[C@H]3[C@@H]4CC[C@@H]([C@]4(CC[C@@H]3[C@@]2(C)CC1)C)[C@H](C)CCCC(C)C)[C@H]1O[C@H](COS(O)(=O)=O)[C@@H](OS(O)(=O)=O)[C@H](OS(O)(=O)=O)[C@H]1OS(O)(=O)=O LNUFLCYMSVYYNW-ZPJMAFJPSA-N 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- WNLRTRBMVRJNCN-UHFFFAOYSA-N adipic acid Chemical compound OC(=O)CCCCC(O)=O WNLRTRBMVRJNCN-UHFFFAOYSA-N 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 150000001408 amides Chemical class 0.000 description 2
- 210000004727 amygdala Anatomy 0.000 description 2
- 230000006907 apoptotic process Effects 0.000 description 2
- 229960005070 ascorbic acid Drugs 0.000 description 2
- 235000010323 ascorbic acid Nutrition 0.000 description 2
- 239000011668 ascorbic acid Substances 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- 210000004227 basal ganglia Anatomy 0.000 description 2
- 235000010233 benzoic acid Nutrition 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 125000001246 bromo group Chemical group Br* 0.000 description 2
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 2
- 102100037093 cGMP-inhibited 3',5'-cyclic phosphodiesterase A Human genes 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 239000003054 catalyst Substances 0.000 description 2
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 2
- 238000012822 chemical development Methods 0.000 description 2
- 125000001309 chloro group Chemical group Cl* 0.000 description 2
- 238000004440 column chromatography Methods 0.000 description 2
- 229940126142 compound 16 Drugs 0.000 description 2
- 230000001276 controlling effect Effects 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- JXTHNDFMNIQAHM-UHFFFAOYSA-N dichloroacetic acid Chemical compound OC(=O)C(Cl)Cl JXTHNDFMNIQAHM-UHFFFAOYSA-N 0.000 description 2
- WGLUMOCWFMKWIL-UHFFFAOYSA-N dichloromethane;methanol Chemical compound OC.ClCCl WGLUMOCWFMKWIL-UHFFFAOYSA-N 0.000 description 2
- 230000004069 differentiation Effects 0.000 description 2
- IJKVHSBPTUYDLN-UHFFFAOYSA-N dihydroxy(oxo)silane Chemical compound O[Si](O)=O IJKVHSBPTUYDLN-UHFFFAOYSA-N 0.000 description 2
- ADEBPBSSDYVVLD-UHFFFAOYSA-N donepezil Chemical compound O=C1C=2C=C(OC)C(OC)=CC=2CC1CC(CC1)CCN1CC1=CC=CC=C1 ADEBPBSSDYVVLD-UHFFFAOYSA-N 0.000 description 2
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 2
- 208000024732 dysthymic disease Diseases 0.000 description 2
- 230000002255 enzymatic effect Effects 0.000 description 2
- GZKHDVAKKLTJPO-UHFFFAOYSA-N ethyl 2,2-difluoroacetate Chemical compound CCOC(=O)C(F)F GZKHDVAKKLTJPO-UHFFFAOYSA-N 0.000 description 2
- 239000003889 eye drop Substances 0.000 description 2
- 229940012356 eye drops Drugs 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 239000001530 fumaric acid Substances 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- ASUTZQLVASHGKV-JDFRZJQESA-N galanthamine Chemical compound O1C(=C23)C(OC)=CC=C2CN(C)CC[C@]23[C@@H]1C[C@@H](O)C=C2 ASUTZQLVASHGKV-JDFRZJQESA-N 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 2
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 2
- 230000000971 hippocampal effect Effects 0.000 description 2
- 150000004677 hydrates Chemical class 0.000 description 2
- 239000001257 hydrogen Substances 0.000 description 2
- USZLCYNVCCDPLQ-UHFFFAOYSA-N hydron;n-methoxymethanamine;chloride Chemical compound Cl.CNOC USZLCYNVCCDPLQ-UHFFFAOYSA-N 0.000 description 2
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 2
- QWTDNUCVQCZILF-UHFFFAOYSA-N isopentane Chemical compound CCC(C)C QWTDNUCVQCZILF-UHFFFAOYSA-N 0.000 description 2
- 150000002576 ketones Chemical class 0.000 description 2
- HCZHHEIFKROPDY-UHFFFAOYSA-N kynurenic acid Chemical compound C1=CC=C2NC(C(=O)O)=CC(=O)C2=C1 HCZHHEIFKROPDY-UHFFFAOYSA-N 0.000 description 2
- TYQCGQRIZGCHNB-JLAZNSOCSA-N l-ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(O)=C(O)C1=O TYQCGQRIZGCHNB-JLAZNSOCSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- 239000011976 maleic acid Substances 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 230000000116 mitigating effect Effects 0.000 description 2
- KRKPYFLIYNGWTE-UHFFFAOYSA-N n,o-dimethylhydroxylamine Chemical compound CNOC KRKPYFLIYNGWTE-UHFFFAOYSA-N 0.000 description 2
- XTEGVFVZDVNBPF-UHFFFAOYSA-N naphthalene-1,5-disulfonic acid Chemical compound C1=CC=C2C(S(=O)(=O)O)=CC=CC2=C1S(O)(=O)=O XTEGVFVZDVNBPF-UHFFFAOYSA-N 0.000 description 2
- 239000007922 nasal spray Substances 0.000 description 2
- 229940097496 nasal spray Drugs 0.000 description 2
- 201000001119 neuropathy Diseases 0.000 description 2
- 230000007823 neuropathy Effects 0.000 description 2
- 230000009871 nonspecific binding Effects 0.000 description 2
- 230000036542 oxidative stress Effects 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 230000035515 penetration Effects 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 208000033808 peripheral neuropathy Diseases 0.000 description 2
- 230000002688 persistence Effects 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 230000001242 postsynaptic effect Effects 0.000 description 2
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 2
- 238000004007 reversed phase HPLC Methods 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 230000000698 schizophrenic effect Effects 0.000 description 2
- CXMXRPHRNRROMY-UHFFFAOYSA-N sebacic acid Chemical compound OC(=O)CCCCCCCCC(O)=O CXMXRPHRNRROMY-UHFFFAOYSA-N 0.000 description 2
- QZAYGJVTTNCVMB-UHFFFAOYSA-N serotonin Chemical compound C1=C(O)C=C2C(CCN)=CNC2=C1 QZAYGJVTTNCVMB-UHFFFAOYSA-N 0.000 description 2
- 239000002453 shampoo Substances 0.000 description 2
- BNRNXUUZRGQAQC-UHFFFAOYSA-N sildenafil Chemical compound CCCC1=NN(C)C(C(N2)=O)=C1N=C2C(C(=CC=1)OCC)=CC=1S(=O)(=O)N1CCN(C)CC1 BNRNXUUZRGQAQC-UHFFFAOYSA-N 0.000 description 2
- 238000010898 silica gel chromatography Methods 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 238000001228 spectrum Methods 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 238000013268 sustained release Methods 0.000 description 2
- 239000012730 sustained-release form Substances 0.000 description 2
- 230000003956 synaptic plasticity Effects 0.000 description 2
- 238000007910 systemic administration Methods 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 238000004809 thin layer chromatography Methods 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 238000011200 topical administration Methods 0.000 description 2
- 230000009529 traumatic brain injury Effects 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- 230000002792 vascular Effects 0.000 description 2
- GHYOCDFICYLMRF-UTIIJYGPSA-N (2S,3R)-N-[(2S)-3-(cyclopenten-1-yl)-1-[(2R)-2-methyloxiran-2-yl]-1-oxopropan-2-yl]-3-hydroxy-3-(4-methoxyphenyl)-2-[[(2S)-2-[(2-morpholin-4-ylacetyl)amino]propanoyl]amino]propanamide Chemical compound C1(=CCCC1)C[C@@H](C(=O)[C@@]1(OC1)C)NC([C@H]([C@@H](C1=CC=C(C=C1)OC)O)NC([C@H](C)NC(CN1CCOCC1)=O)=O)=O GHYOCDFICYLMRF-UTIIJYGPSA-N 0.000 description 1
- ZDOIEZAFQAGNKJ-BYPYZUCNSA-N (2s)-2-amino-3-oxopentanedioic acid Chemical compound OC(=O)[C@@H](N)C(=O)CC(O)=O ZDOIEZAFQAGNKJ-BYPYZUCNSA-N 0.000 description 1
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 description 1
- 125000006272 (C3-C7) cycloalkyl group Chemical group 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- MIOPJNTWMNEORI-GMSGAONNSA-N (S)-camphorsulfonic acid Chemical compound C1C[C@@]2(CS(O)(=O)=O)C(=O)C[C@@H]1C2(C)C MIOPJNTWMNEORI-GMSGAONNSA-N 0.000 description 1
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 1
- TUSDEZXZIZRFGC-UHFFFAOYSA-N 1-O-galloyl-3,6-(R)-HHDP-beta-D-glucose Natural products OC1C(O2)COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC1C(O)C2OC(=O)C1=CC(O)=C(O)C(O)=C1 TUSDEZXZIZRFGC-UHFFFAOYSA-N 0.000 description 1
- ZNPDAYJZIRPRFQ-UHFFFAOYSA-N 1-[4-[3-[4-(1h-benzimidazole-2-carbonyl)phenoxy]pyrazin-2-yl]piperidin-1-yl]ethanone Chemical compound C1CN(C(=O)C)CCC1C1=NC=CN=C1OC1=CC=C(C(=O)C=2NC3=CC=CC=C3N=2)C=C1 ZNPDAYJZIRPRFQ-UHFFFAOYSA-N 0.000 description 1
- SJJCQDRGABAVBB-UHFFFAOYSA-N 1-hydroxy-2-naphthoic acid Chemical compound C1=CC=CC2=C(O)C(C(=O)O)=CC=C21 SJJCQDRGABAVBB-UHFFFAOYSA-N 0.000 description 1
- PFJLHSIZFYNAHH-UHFFFAOYSA-N 2,2-difluoroethyl acetate Chemical compound CC(=O)OCC(F)F PFJLHSIZFYNAHH-UHFFFAOYSA-N 0.000 description 1
- IAWXTSMHXFRLQR-UHFFFAOYSA-N 2,3-bis($l^{1}-oxidanyl)-7-nitroquinoxaline-6-carbonitrile Chemical compound O=C1C(=O)N=C2C=C(C#N)C([N+](=O)[O-])=CC2=N1 IAWXTSMHXFRLQR-UHFFFAOYSA-N 0.000 description 1
- KKFDCBRMNNSAAW-UHFFFAOYSA-N 2-(morpholin-4-yl)ethanol Chemical compound OCCN1CCOCC1 KKFDCBRMNNSAAW-UHFFFAOYSA-N 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- BFSVOASYOCHEOV-UHFFFAOYSA-N 2-diethylaminoethanol Chemical compound CCN(CC)CCO BFSVOASYOCHEOV-UHFFFAOYSA-N 0.000 description 1
- CCZWSTFVHJPCEM-UHFFFAOYSA-N 2-iodopyridine Chemical compound IC1=CC=CC=N1 CCZWSTFVHJPCEM-UHFFFAOYSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- GSQZOLXWFQQJHJ-UHFFFAOYSA-N 3-bromo-4-methylpyridine Chemical compound CC1=CC=NC=C1Br GSQZOLXWFQQJHJ-UHFFFAOYSA-N 0.000 description 1
- UOQHWNPVNXSDDO-UHFFFAOYSA-N 3-bromoimidazo[1,2-a]pyridine-6-carbonitrile Chemical compound C1=CC(C#N)=CN2C(Br)=CN=C21 UOQHWNPVNXSDDO-UHFFFAOYSA-N 0.000 description 1
- FZFWPURYSWKIRT-UHFFFAOYSA-N 3-cyclopentyloxy-4-methoxybenzaldehyde Chemical compound COC1=CC=C(C=O)C=C1OC1CCCC1 FZFWPURYSWKIRT-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- WUBBRNOQWQTFEX-UHFFFAOYSA-N 4-aminosalicylic acid Chemical compound NC1=CC=C(C(O)=O)C(O)=C1 WUBBRNOQWQTFEX-UHFFFAOYSA-N 0.000 description 1
- ZKUZSTXNVMIDCY-UHFFFAOYSA-N 4-methylpyridine-3-carboxylic acid Chemical compound CC1=CC=NC=C1C(O)=O ZKUZSTXNVMIDCY-UHFFFAOYSA-N 0.000 description 1
- AWDJJMXJUOHGLC-UHFFFAOYSA-N 5-[5-[(2,4-dimethyl-1,3-thiazol-5-yl)methyl]-1,3,4-oxadiazol-2-yl]-1-ethyl-n-(oxan-4-yl)pyrazolo[3,4-b]pyridin-4-amine Chemical compound N=1N=C(CC2=C(N=C(C)S2)C)OC=1C1=CN=C2N(CC)N=CC2=C1NC1CCOCC1 AWDJJMXJUOHGLC-UHFFFAOYSA-N 0.000 description 1
- XDBHURGONHZNJF-UHFFFAOYSA-N 6-[2-(3,4-diethoxyphenyl)-1,3-thiazol-4-yl]pyridine-2-carboxylic acid Chemical compound C1=C(OCC)C(OCC)=CC=C1C1=NC(C=2N=C(C=CC=2)C(O)=O)=CS1 XDBHURGONHZNJF-UHFFFAOYSA-N 0.000 description 1
- JFHROPTYMMSOLG-UHFFFAOYSA-N 6-[3-(dimethylcarbamoyl)phenyl]sulfonyl-4-(3-methoxyanilino)-8-methylquinoline-3-carboxamide Chemical compound COC1=CC=CC(NC=2C3=CC(=CC(C)=C3N=CC=2C(N)=O)S(=O)(=O)C=2C=C(C=CC=2)C(=O)N(C)C)=C1 JFHROPTYMMSOLG-UHFFFAOYSA-N 0.000 description 1
- HTMSGWHMYLPXOK-UHFFFAOYSA-N 8-azabicyclo[3.2.1]octane-4,8-dicarboxylic acid Chemical compound OC(=O)C1CCC2CCC1N2C(O)=O HTMSGWHMYLPXOK-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- 125000003345 AMP group Chemical group 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 102000009346 Adenosine receptors Human genes 0.000 description 1
- 108050000203 Adenosine receptors Proteins 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- 206010002869 Anxiety symptoms Diseases 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 229940127291 Calcium channel antagonist Drugs 0.000 description 1
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 1
- 101710095468 Cyclase Proteins 0.000 description 1
- IVOMOUWHDPKRLL-KQYNXXCUSA-N Cyclic adenosine monophosphate Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=CN=C2N)=C2N=C1 IVOMOUWHDPKRLL-KQYNXXCUSA-N 0.000 description 1
- CKLJMWTZIZZHCS-UHFFFAOYSA-N D-OH-Asp Natural products OC(=O)C(N)CC(O)=O CKLJMWTZIZZHCS-UHFFFAOYSA-N 0.000 description 1
- YVECGMZCTULTIS-HSUXUTPPSA-N D-galactal Chemical compound OC[C@H]1OC=C[C@@H](O)[C@H]1O YVECGMZCTULTIS-HSUXUTPPSA-N 0.000 description 1
- RGHNJXZEOKUKBD-SQOUGZDYSA-N D-gluconic acid Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O RGHNJXZEOKUKBD-SQOUGZDYSA-N 0.000 description 1
- RGHNJXZEOKUKBD-UHFFFAOYSA-N D-gluconic acid Natural products OCC(O)C(O)C(O)C(O)C(O)=O RGHNJXZEOKUKBD-UHFFFAOYSA-N 0.000 description 1
- 206010012218 Delirium Diseases 0.000 description 1
- 206010012335 Dependence Diseases 0.000 description 1
- 101100296720 Dictyostelium discoideum Pde4 gene Proteins 0.000 description 1
- 101100189582 Dictyostelium discoideum pdeD gene Proteins 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 239000001263 FEMA 3042 Substances 0.000 description 1
- IAJILQKETJEXLJ-UHFFFAOYSA-N Galacturonsaeure Natural products O=CC(O)C(O)C(O)C(O)C(O)=O IAJILQKETJEXLJ-UHFFFAOYSA-N 0.000 description 1
- 238000003747 Grignard reaction Methods 0.000 description 1
- 208000031886 HIV Infections Diseases 0.000 description 1
- 208000037357 HIV infectious disease Diseases 0.000 description 1
- 229910004373 HOAc Inorganic materials 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 102000004157 Hydrolases Human genes 0.000 description 1
- 108090000604 Hydrolases Proteins 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- CKLJMWTZIZZHCS-UWTATZPHSA-N L-Aspartic acid Natural products OC(=O)[C@H](N)CC(O)=O CKLJMWTZIZZHCS-UWTATZPHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-N L-arginine Chemical compound OC(=O)[C@@H](N)CCCN=C(N)N ODKSFYDXXFIFQN-BYPYZUCNSA-N 0.000 description 1
- 229930064664 L-arginine Natural products 0.000 description 1
- 235000014852 L-arginine Nutrition 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-L L-tartrate(2-) Chemical compound [O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O FEWJPZIEWOKRBE-JCYAYHJZSA-L 0.000 description 1
- 208000009829 Lewy Body Disease Diseases 0.000 description 1
- 201000002832 Lewy body dementia Diseases 0.000 description 1
- 102000016193 Metabotropic glutamate receptors Human genes 0.000 description 1
- 108010010914 Metabotropic glutamate receptors Proteins 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 1
- UEEJHVSXFDXPFK-UHFFFAOYSA-N N-dimethylaminoethanol Chemical compound CN(C)CCO UEEJHVSXFDXPFK-UHFFFAOYSA-N 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- 229910017917 NH4 Cl Inorganic materials 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 239000012425 OXONE® Substances 0.000 description 1
- 208000021384 Obsessive-Compulsive disease Diseases 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 240000007594 Oryza sativa Species 0.000 description 1
- 235000007164 Oryza sativa Nutrition 0.000 description 1
- 101150098694 PDE5A gene Proteins 0.000 description 1
- 235000021314 Palmitic acid Nutrition 0.000 description 1
- 208000027099 Paranoid disease Diseases 0.000 description 1
- LRBQNJMCXXYXIU-PPKXGCFTSA-N Penta-digallate-beta-D-glucose Natural products OC1=C(O)C(O)=CC(C(=O)OC=2C(=C(O)C=C(C=2)C(=O)OC[C@@H]2[C@H]([C@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)O2)OC(=O)C=2C=C(OC(=O)C=3C=C(O)C(O)=C(O)C=3)C(O)=C(O)C=2)O)=C1 LRBQNJMCXXYXIU-PPKXGCFTSA-N 0.000 description 1
- 208000012202 Pervasive developmental disease Diseases 0.000 description 1
- 229940123932 Phosphodiesterase 4 inhibitor Drugs 0.000 description 1
- 229940123333 Phosphodiesterase 5 inhibitor Drugs 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 101100082610 Plasmodium falciparum (isolate 3D7) PDEdelta gene Proteins 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 208000024777 Prion disease Diseases 0.000 description 1
- 208000003251 Pruritus Diseases 0.000 description 1
- 241000700157 Rattus norvegicus Species 0.000 description 1
- 208000006289 Rett Syndrome Diseases 0.000 description 1
- 208000027674 Schizophrenia Spectrum and Other Psychotic disease Diseases 0.000 description 1
- 208000028810 Shared psychotic disease Diseases 0.000 description 1
- 206010041247 Social fear Diseases 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- LEHOTFFKMJEONL-UHFFFAOYSA-N Uric Acid Chemical compound N1C(=O)NC(=O)C2=C1NC(=O)N2 LEHOTFFKMJEONL-UHFFFAOYSA-N 0.000 description 1
- TVWHNULVHGKJHS-UHFFFAOYSA-N Uric acid Natural products N1C(=O)NC(=O)C2NC(=O)NC21 TVWHNULVHGKJHS-UHFFFAOYSA-N 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 239000001361 adipic acid Substances 0.000 description 1
- 235000011037 adipic acid Nutrition 0.000 description 1
- 229960000250 adipic acid Drugs 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001351 alkyl iodides Chemical class 0.000 description 1
- AEMOLEFTQBMNLQ-WAXACMCWSA-N alpha-D-glucuronic acid Chemical compound O[C@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O AEMOLEFTQBMNLQ-WAXACMCWSA-N 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 238000010640 amide synthesis reaction Methods 0.000 description 1
- 229940024606 amino acid Drugs 0.000 description 1
- 235000001014 amino acid Nutrition 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 229960004909 aminosalicylic acid Drugs 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 230000000949 anxiolytic effect Effects 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 229960005261 aspartic acid Drugs 0.000 description 1
- 201000007197 atypical autism Diseases 0.000 description 1
- WEAJZXNPAWBCOA-INIZCTEOSA-N avanafil Chemical compound C1=C(Cl)C(OC)=CC=C1CNC1=NC(N2[C@@H](CCC2)CO)=NC=C1C(=O)NCC1=NC=CC=N1 WEAJZXNPAWBCOA-INIZCTEOSA-N 0.000 description 1
- 229960000307 avanafil Drugs 0.000 description 1
- MYTWFJKBZGMYCS-NQIIRXRSSA-N bay 60-7550 Chemical compound C1=C(OC)C(OC)=CC=C1CC(NN12)=NC(=O)C1=C(C)N=C2[C@H]([C@@H](C)O)CCCC1=CC=CC=C1 MYTWFJKBZGMYCS-NQIIRXRSSA-N 0.000 description 1
- 230000003542 behavioural effect Effects 0.000 description 1
- JUHORIMYRDESRB-UHFFFAOYSA-N benzathine Chemical compound C=1C=CC=CC=1CNCCNCC1=CC=CC=C1 JUHORIMYRDESRB-UHFFFAOYSA-N 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 229960004365 benzoic acid Drugs 0.000 description 1
- 125000002619 bicyclic group Chemical group 0.000 description 1
- 230000027455 binding Effects 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 208000025307 bipolar depression Diseases 0.000 description 1
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 102100029175 cGMP-specific 3',5'-cyclic phosphodiesterase Human genes 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 239000000480 calcium channel blocker Substances 0.000 description 1
- AXCZMVOFGPJBDE-UHFFFAOYSA-L calcium dihydroxide Chemical compound [OH-].[OH-].[Ca+2] AXCZMVOFGPJBDE-UHFFFAOYSA-L 0.000 description 1
- 239000000920 calcium hydroxide Substances 0.000 description 1
- 229910001861 calcium hydroxide Inorganic materials 0.000 description 1
- 229940095643 calcium hydroxide Drugs 0.000 description 1
- RLDQYSHDFVSAPL-UHFFFAOYSA-L calcium;dithiocyanate Chemical compound [Ca+2].[S-]C#N.[S-]C#N RLDQYSHDFVSAPL-UHFFFAOYSA-L 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 229930003827 cannabinoid Natural products 0.000 description 1
- 239000003557 cannabinoid Substances 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 235000011089 carbon dioxide Nutrition 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical compound OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 1
- 239000012876 carrier material Substances 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 239000013592 cell lysate Substances 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 210000001638 cerebellum Anatomy 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 150000001793 charged compounds Chemical class 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- 239000000544 cholinesterase inhibitor Substances 0.000 description 1
- 230000007278 cognition impairment Effects 0.000 description 1
- 208000030251 communication disease Diseases 0.000 description 1
- 229940125797 compound 12 Drugs 0.000 description 1
- 238000002884 conformational search Methods 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- 239000000625 cyclamic acid and its Na and Ca salt Substances 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- HCAJEUSONLESMK-UHFFFAOYSA-N cyclohexylsulfamic acid Chemical compound OS(=O)(=O)NC1CCCCC1 HCAJEUSONLESMK-UHFFFAOYSA-N 0.000 description 1
- NXQGGXCHGDYOHB-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloropalladium;iron(2+) Chemical compound [Fe+2].Cl[Pd]Cl.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 NXQGGXCHGDYOHB-UHFFFAOYSA-L 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 229960002887 deanol Drugs 0.000 description 1
- 238000006114 decarboxylation reaction Methods 0.000 description 1
- 230000003412 degenerative effect Effects 0.000 description 1
- 210000001947 dentate gyrus Anatomy 0.000 description 1
- 230000003001 depressive effect Effects 0.000 description 1
- NIJJYAXOARWZEE-UHFFFAOYSA-N di-n-propyl-acetic acid Natural products CCCC(C(O)=O)CCC NIJJYAXOARWZEE-UHFFFAOYSA-N 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 1
- 108010037444 diisopropylglutathione ester Proteins 0.000 description 1
- 239000012972 dimethylethanolamine Substances 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 229960003530 donepezil Drugs 0.000 description 1
- 229960003638 dopamine Drugs 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 201000002545 drug psychosis Diseases 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 229950005081 elbimilast Drugs 0.000 description 1
- 230000008451 emotion Effects 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- XBRDBODLCHKXHI-UHFFFAOYSA-N epolamine Chemical compound OCCN1CCCC1 XBRDBODLCHKXHI-UHFFFAOYSA-N 0.000 description 1
- 238000011067 equilibration Methods 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- AFAXGSQYZLGZPG-UHFFFAOYSA-N ethanedisulfonic acid Chemical compound OS(=O)(=O)CCS(O)(=O)=O AFAXGSQYZLGZPG-UHFFFAOYSA-N 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- 125000001033 ether group Chemical group 0.000 description 1
- 125000004494 ethyl ester group Chemical group 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- XWRLQRLQUKZEEU-UHFFFAOYSA-N ethyl(hydroxy)silicon Chemical class CC[Si]O XWRLQRLQUKZEEU-UHFFFAOYSA-N 0.000 description 1
- 229920006227 ethylene-grafted-maleic anhydride Polymers 0.000 description 1
- 229940012017 ethylenediamine Drugs 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 238000013401 experimental design Methods 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 238000003682 fluorination reaction Methods 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 239000012458 free base Substances 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 229960003980 galantamine Drugs 0.000 description 1
- ASUTZQLVASHGKV-UHFFFAOYSA-N galanthamine hydrochloride Natural products O1C(=C23)C(OC)=CC=C2CN(C)CCC23C1CC(O)C=C2 ASUTZQLVASHGKV-UHFFFAOYSA-N 0.000 description 1
- LRBQNJMCXXYXIU-QWKBTXIPSA-N gallotannic acid Chemical compound OC1=C(O)C(O)=CC(C(=O)OC=2C(=C(O)C=C(C=2)C(=O)OC[C@H]2[C@@H]([C@@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)O2)OC(=O)C=2C=C(OC(=O)C=3C=C(O)C(O)=C(O)C=3)C(O)=C(O)C=2)O)=C1 LRBQNJMCXXYXIU-QWKBTXIPSA-N 0.000 description 1
- 229960005219 gentisic acid Drugs 0.000 description 1
- 230000004110 gluconeogenesis Effects 0.000 description 1
- 235000012208 gluconic acid Nutrition 0.000 description 1
- 229950006191 gluconic acid Drugs 0.000 description 1
- 229960002989 glutamic acid Drugs 0.000 description 1
- 230000004116 glycogenolysis Effects 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 238000011194 good manufacturing practice Methods 0.000 description 1
- 235000013928 guanylic acid Nutrition 0.000 description 1
- 210000001753 habenula Anatomy 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 210000000343 hippocampal mossy fiber Anatomy 0.000 description 1
- 239000003276 histone deacetylase inhibitor Substances 0.000 description 1
- 239000008240 homogeneous mixture Substances 0.000 description 1
- 208000033519 human immunodeficiency virus infectious disease Diseases 0.000 description 1
- XGIHQYAWBCFNPY-AZOCGYLKSA-N hydrabamine Chemical compound C([C@@H]12)CC3=CC(C(C)C)=CC=C3[C@@]2(C)CCC[C@@]1(C)CNCCNC[C@@]1(C)[C@@H]2CCC3=CC(C(C)C)=CC=C3[C@@]2(C)CCC1 XGIHQYAWBCFNPY-AZOCGYLKSA-N 0.000 description 1
- 150000002430 hydrocarbons Chemical group 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 230000003301 hydrolyzing effect Effects 0.000 description 1
- AKPUJVVHYUHGKY-UHFFFAOYSA-N hydron;propan-2-ol;chloride Chemical compound Cl.CC(C)O AKPUJVVHYUHGKY-UHFFFAOYSA-N 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 238000002329 infrared spectrum Methods 0.000 description 1
- 229940102223 injectable solution Drugs 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 239000013067 intermediate product Substances 0.000 description 1
- 230000007728 intracellular signaling mechanism Effects 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 1
- 229940099563 lactobionic acid Drugs 0.000 description 1
- 210000003715 limbic system Anatomy 0.000 description 1
- 238000012417 linear regression Methods 0.000 description 1
- 230000004132 lipogenesis Effects 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 1
- 239000012669 liquid formulation Substances 0.000 description 1
- YNESATAKKCNGOF-UHFFFAOYSA-N lithium bis(trimethylsilyl)amide Chemical compound [Li+].C[Si](C)(C)[N-][Si](C)(C)C YNESATAKKCNGOF-UHFFFAOYSA-N 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 229940098895 maleic acid Drugs 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N mandelic acid Chemical compound OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 230000003340 mental effect Effects 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- UKVIEHSSVKSQBA-UHFFFAOYSA-N methane;palladium Chemical compound C.[Pd] UKVIEHSSVKSQBA-UHFFFAOYSA-N 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- BBTFKAOFCSOZMB-UHFFFAOYSA-N methyl 4-[[3-[6,7-dimethoxy-2-(methylamino)quinazolin-4-yl]phenyl]carbamoyl]benzoate Chemical compound C=12C=C(OC)C(OC)=CC2=NC(NC)=NC=1C(C=1)=CC=CC=1NC(=O)C1=CC=C(C(=O)OC)C=C1 BBTFKAOFCSOZMB-UHFFFAOYSA-N 0.000 description 1
- OBWFJXLKRAFEDI-UHFFFAOYSA-N methyl cyanoformate Chemical compound COC(=O)C#N OBWFJXLKRAFEDI-UHFFFAOYSA-N 0.000 description 1
- 230000011987 methylation Effects 0.000 description 1
- 238000007069 methylation reaction Methods 0.000 description 1
- 208000027061 mild cognitive impairment Diseases 0.000 description 1
- 238000000324 molecular mechanic Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 230000036651 mood Effects 0.000 description 1
- 239000012452 mother liquor Substances 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- 230000003551 muscarinic effect Effects 0.000 description 1
- 230000004118 muscle contraction Effects 0.000 description 1
- CFRXVFRHMZLQBS-UHFFFAOYSA-N n-(3,5-dichloro-1-hydroxypyridin-4-ylidene)-6-(difluoromethoxy)-[1]benzofuro[3,2-c]pyridine-9-carboxamide Chemical compound ClC1=CN(O)C=C(Cl)C1=NC(=O)C1=CC=C(OC(F)F)C2=C1C1=CN=CC=C1O2 CFRXVFRHMZLQBS-UHFFFAOYSA-N 0.000 description 1
- JERXUPDBWDWFCF-UHFFFAOYSA-N n-(3,5-dichloropyridin-4-yl)-2-[1-[(4-fluorophenyl)methyl]pyrrolo[2,3-b]pyridin-3-yl]-2-oxoacetamide Chemical compound C1=CC(F)=CC=C1CN1C2=NC=CC=C2C(C(=O)C(=O)NC=2C(=CN=CC=2Cl)Cl)=C1 JERXUPDBWDWFCF-UHFFFAOYSA-N 0.000 description 1
- RLKHFSNWQCZBDC-UHFFFAOYSA-N n-(benzenesulfonyl)-n-fluorobenzenesulfonamide Chemical compound C=1C=CC=CC=1S(=O)(=O)N(F)S(=O)(=O)C1=CC=CC=C1 RLKHFSNWQCZBDC-UHFFFAOYSA-N 0.000 description 1
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- KVBGVZZKJNLNJU-UHFFFAOYSA-N naphthalene-2-sulfonic acid Chemical compound C1=CC=CC2=CC(S(=O)(=O)O)=CC=C21 KVBGVZZKJNLNJU-UHFFFAOYSA-N 0.000 description 1
- 210000001577 neostriatum Anatomy 0.000 description 1
- 230000007372 neural signaling Effects 0.000 description 1
- 230000007472 neurodevelopment Effects 0.000 description 1
- 230000001123 neurodevelopmental effect Effects 0.000 description 1
- 230000008906 neuronal response Effects 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 229960003512 nicotinic acid Drugs 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 238000001208 nuclear magnetic resonance pulse sequence Methods 0.000 description 1
- 210000001009 nucleus accumben Anatomy 0.000 description 1
- 208000030459 obsessive-compulsive personality disease Diseases 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 210000000956 olfactory bulb Anatomy 0.000 description 1
- 210000001010 olfactory tubercle Anatomy 0.000 description 1
- 238000012346 open field test Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 239000013110 organic ligand Substances 0.000 description 1
- 239000012074 organic phase Substances 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- AICOOMRHRUFYCM-ZRRPKQBOSA-N oxazine, 1 Chemical compound C([C@@H]1[C@H](C(C[C@]2(C)[C@@H]([C@H](C)N(C)C)[C@H](O)C[C@]21C)=O)CC1=CC2)C[C@H]1[C@@]1(C)[C@H]2N=C(C(C)C)OC1 AICOOMRHRUFYCM-ZRRPKQBOSA-N 0.000 description 1
- MUMZUERVLWJKNR-UHFFFAOYSA-N oxoplatinum Chemical compound [Pt]=O MUMZUERVLWJKNR-UHFFFAOYSA-N 0.000 description 1
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 1
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 1
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 1
- WLJNZVDCPSBLRP-UHFFFAOYSA-N pamoic acid Chemical compound C1=CC=C2C(CC=3C4=CC=CC=C4C=C(C=3O)C(=O)O)=C(O)C(C(O)=O)=CC2=C1 WLJNZVDCPSBLRP-UHFFFAOYSA-N 0.000 description 1
- FPOHNWQLNRZRFC-ZHACJKMWSA-N panobinostat Chemical compound CC=1NC2=CC=CC=C2C=1CCNCC1=CC=C(\C=C\C(=O)NO)C=C1 FPOHNWQLNRZRFC-ZHACJKMWSA-N 0.000 description 1
- 229960005184 panobinostat Drugs 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 208000024817 paranoid personality disease Diseases 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000003961 penetration enhancing agent Substances 0.000 description 1
- 230000009038 pharmacological inhibition Effects 0.000 description 1
- 239000002587 phosphodiesterase IV inhibitor Substances 0.000 description 1
- 239000002590 phosphodiesterase V inhibitor Substances 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 230000006461 physiological response Effects 0.000 description 1
- 229960005235 piperonyl butoxide Drugs 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 229910003446 platinum oxide Inorganic materials 0.000 description 1
- 230000010287 polarization Effects 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- CHKVPAROMQMJNQ-UHFFFAOYSA-M potassium bisulfate Chemical compound [K+].OS([O-])(=O)=O CHKVPAROMQMJNQ-UHFFFAOYSA-M 0.000 description 1
- 229910000343 potassium bisulfate Inorganic materials 0.000 description 1
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 1
- OKBMCNHOEMXPTM-UHFFFAOYSA-M potassium peroxymonosulfate Chemical compound [K+].OOS([O-])(=O)=O OKBMCNHOEMXPTM-UHFFFAOYSA-M 0.000 description 1
- 159000000001 potassium salts Chemical class 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- WSHYKIAQCMIPTB-UHFFFAOYSA-M potassium;2-oxo-3-(3-oxo-1-phenylbutyl)chromen-4-olate Chemical compound [K+].[O-]C=1C2=CC=CC=C2OC(=O)C=1C(CC(=O)C)C1=CC=CC=C1 WSHYKIAQCMIPTB-UHFFFAOYSA-M 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 210000002442 prefrontal cortex Anatomy 0.000 description 1
- 230000002028 premature Effects 0.000 description 1
- 238000002953 preparative HPLC Methods 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 230000000770 proinflammatory effect Effects 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 150000003242 quaternary ammonium salts Chemical class 0.000 description 1
- 239000002287 radioligand Substances 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 230000014786 regulation of synaptic transmission Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 239000013557 residual solvent Substances 0.000 description 1
- 229950010037 revamilast Drugs 0.000 description 1
- 235000009566 rice Nutrition 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 208000022610 schizoaffective disease Diseases 0.000 description 1
- 229940116353 sebacic acid Drugs 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 229940076279 serotonin Drugs 0.000 description 1
- 230000001568 sexual effect Effects 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 229960003310 sildenafil Drugs 0.000 description 1
- 210000003625 skull Anatomy 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- WBHQBSYUUJJSRZ-UHFFFAOYSA-M sodium bisulfate Chemical compound [Na+].OS([O-])(=O)=O WBHQBSYUUJJSRZ-UHFFFAOYSA-M 0.000 description 1
- 229910000342 sodium bisulfate Inorganic materials 0.000 description 1
- 229940083608 sodium hydroxide Drugs 0.000 description 1
- 238000007614 solvation Methods 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 239000004544 spot-on Substances 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 229960004274 stearic acid Drugs 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 239000011550 stock solution Substances 0.000 description 1
- 230000035882 stress Effects 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- WPLOVIFNBMNBPD-ATHMIXSHSA-N subtilin Chemical compound CC1SCC(NC2=O)C(=O)NC(CC(N)=O)C(=O)NC(C(=O)NC(CCCCN)C(=O)NC(C(C)CC)C(=O)NC(=C)C(=O)NC(CCCCN)C(O)=O)CSC(C)C2NC(=O)C(CC(C)C)NC(=O)C1NC(=O)C(CCC(N)=O)NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C1NC(=O)C(=C/C)/NC(=O)C(CCC(N)=O)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)CNC(=O)C(NC(=O)C(NC(=O)C2NC(=O)CNC(=O)C3CCCN3C(=O)C(NC(=O)C3NC(=O)C(CC(C)C)NC(=O)C(=C)NC(=O)C(CCC(O)=O)NC(=O)C(NC(=O)C(CCCCN)NC(=O)C(N)CC=4C5=CC=CC=C5NC=4)CSC3)C(C)SC2)C(C)C)C(C)SC1)CC1=CC=CC=C1 WPLOVIFNBMNBPD-ATHMIXSHSA-N 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 229940032330 sulfuric acid Drugs 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 230000009182 swimming Effects 0.000 description 1
- 210000000225 synapse Anatomy 0.000 description 1
- 230000001360 synchronised effect Effects 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 229940033123 tannic acid Drugs 0.000 description 1
- 235000015523 tannic acid Nutrition 0.000 description 1
- 229920002258 tannic acid Polymers 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- MENILFUADYEXNU-DTORHVGOSA-N tert-butyl (1r,5s)-3-oxo-8-azabicyclo[3.2.1]octane-8-carboxylate Chemical compound C1C(=O)C[C@H]2CC[C@@H]1N2C(=O)OC(C)(C)C MENILFUADYEXNU-DTORHVGOSA-N 0.000 description 1
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 229950002896 tetomilast Drugs 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- CZDYPVPMEAXLPK-UHFFFAOYSA-N tetramethylsilane Chemical compound C[Si](C)(C)C CZDYPVPMEAXLPK-UHFFFAOYSA-N 0.000 description 1
- 238000010257 thawing Methods 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-N triflic acid Chemical compound OS(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-N 0.000 description 1
- 229960004418 trolamine Drugs 0.000 description 1
- 229960000281 trometamol Drugs 0.000 description 1
- 229960000438 udenafil Drugs 0.000 description 1
- IYFNEFQTYQPVOC-UHFFFAOYSA-N udenafil Chemical compound C1=C(C=2NC=3C(CCC)=NN(C)C=3C(=O)N=2)C(OCCC)=CC=C1S(=O)(=O)NCCC1CCCN1C IYFNEFQTYQPVOC-UHFFFAOYSA-N 0.000 description 1
- 229940116269 uric acid Drugs 0.000 description 1
- MSRILKIQRXUYCT-UHFFFAOYSA-M valproate semisodium Chemical compound [Na+].CCCC(C(O)=O)CCC.CCCC(C([O-])=O)CCC MSRILKIQRXUYCT-UHFFFAOYSA-M 0.000 description 1
- 229960000604 valproic acid Drugs 0.000 description 1
- 210000005111 ventral hippocampus Anatomy 0.000 description 1
- 239000004563 wettable powder Substances 0.000 description 1
- 230000003936 working memory Effects 0.000 description 1
- UGZADUVQMDAIAO-UHFFFAOYSA-L zinc hydroxide Chemical compound [OH-].[OH-].[Zn+2] UGZADUVQMDAIAO-UHFFFAOYSA-L 0.000 description 1
- 229940007718 zinc hydroxide Drugs 0.000 description 1
- 229910021511 zinc hydroxide Inorganic materials 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5355—Non-condensed oxazines and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/22—Anxiolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/32—Alcohol-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/34—Tobacco-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/36—Opioid-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D451/00—Heterocyclic compounds containing 8-azabicyclo [3.2.1] octane, 9-azabicyclo [3.3.1] nonane, or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane or granatane alkaloids, scopolamine; Cyclic acetals thereof
- C07D451/02—Heterocyclic compounds containing 8-azabicyclo [3.2.1] octane, 9-azabicyclo [3.3.1] nonane, or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane or granatane alkaloids, scopolamine; Cyclic acetals thereof containing not further condensed 8-azabicyclo [3.2.1] octane or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane; Cyclic acetals thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D519/00—Heterocyclic compounds containing more than one system of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring system not provided for in groups C07D453/00 or C07D455/00
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Biomedical Technology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Psychiatry (AREA)
- Addiction (AREA)
- Epidemiology (AREA)
- Hospice & Palliative Care (AREA)
- Psychology (AREA)
- Pain & Pain Management (AREA)
- Anesthesiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Description
(式中、
R1は、CHF2またはCH3であり;
Aは、(a-1)および(a-2)
から選択される基であり、式中、
R2は、ハロ、OH、-CN;1つ、2つまたは3つの独立して選択されるハロ置換基で任意選択的に置換されたC1~4アルキル;1つ、2つまたは3つの独立して選択されるハロ置換基で任意選択的に置換されたC1~4アルキルオキシ;および1-モルホリニルからなる群からそれぞれ独立に選択される1つまたは2つの置換基でそれぞれ任意選択的に置換される2-ピリジル、1-イソキノリニル、4-キナゾリニル、1H-ピロロ[3,2-c]ピリジン-4-イルおよびフロ[3,2-c]ピリジン-4-イルから選択される)
の化合物およびその立体異性体型ならびにその薬学的に許容される塩および溶媒和物を対象とする。
「C1~4アルキル」は、単独でまたは別の基の一部として本明細書中で使用される場合、メチル、エチル、1-プロピル、1-メチル、ブチル、1-メチル-プロピル、2-メチル-1-プロピル、1,1-ジメチルエチルなど、1つ、2つ、3つまたは4つの炭素原子を有する直鎖状または分岐状の飽和炭化水素基を定義する。「C1~4アルキルオキシ」は、エーテル基を示すものとし、ここで、C1~4アルキルは、本明細書中で定義されるとおりである。「ハロ」は、フルオロ、クロロおよびブロモを示すものとする。「C3~7シクロアルキル」は、シクロプロピル、シクロブチル、シクロペンチル、シクロへキシルおよびシクロヘプチルを示すものとする。
実験手順1
本明細書では、それぞれ式(I-A)および式(I-B)(式中、RBは、式(a)または(b)の基である)の化合物と称される最終化合物は、好都合には、当技術分野で知られる手順に従ってハロゲン化物(III)との反応によって作製され得る(反応工程A)。前記変換は、好都合には、式(II-a)または(II-b)の中間体におけるピペリジン型官能基を、100~160℃に加熱するなどの熱的条件下、DCMまたはDMSOなどの好適な溶媒の存在下、DIPEAまたはK2CO3などの好適な塩基の存在下で(III)と共に処理することによって行われ得る。式(III)の試薬は、市販されているか、または当技術分野で知られる手順によって作製することができる。
B:N,N-ジメチルアセトアミドジメチルアセタールとの反応
C、F:1H-1,2,4-トリアゾール-3-アミン塩酸塩との反応
D:保護基切断
E:2,2,-ジフルオロ-酢酸エチルエステルとの反応
本発明による化合物は、PDE2、特にPDE2Aの酵素活性を阻害し、その結果、PDE2を発現する細胞内のcAMPまたはcGMPのレベルを上昇させる。したがって、PDE2の酵素活性の阻害は、細胞内のcAMPまたはcGMPの量が不足することにより引き起こされる疾患の治療に有用であり得る。PDE2阻害剤は、正常レベルを超えてcAMPまたはcGMPの量を上昇させることが治療効果をもたらす場合にも有益であり得る。PDE2の阻害剤は、神経障害および精神障害を治療するために使用され得る。
本発明は、神経障害および精神障害などのPDE2の阻害が有益である疾患を予防または治療するための組成物も提供する。前記組成物は、治療有効量の式(I)の化合物と、薬学的に許容される担体または希釈剤とを含む。
中間体1
手順a:4-メチル-3-ピリジンカルボン酸塩酸塩(1:1)(40g、230.4mmol)を硫酸(20mL)およびMeOH(400mL)の還流混合物に加えた。混合物を一晩還流させ、次にそれを蒸発させ、得られたスラリーを水(360mL)中のNaHCO3(64g)の冷溶液に加えた。生成物をDCMで抽出し、有機層をMgSO4で乾燥させ、濾過し、蒸発させて、中間体1を得た(28.70g、83%)。
手順a:水素化フラスコにAcOH(500mL)を充填し、次にPtO2(15.02g、66.2mmol)を加えた。中間体1(50g、330.8mmol)を加え、混合物を50℃で7日間水素化した。反応混合物をdicalite(登録商標)上で濾過し、濾液を蒸発させて、中間体2(52g)を得て、それをさらに精製せずに次の工程に使用した。
手順a:DCM(869mL)中の中間体2(52g、330.8mmol)の溶液にDIPEA(85.5g、661.5mmol)およびDMAP(4.04g、33.08mmol)を加えた。次に、二炭酸ジ-tert-ブチル(72.19g、330.8mmol)を少しずつこの溶液に加え、反応物を室温で1時間撹拌した。反応混合物を水および塩水で洗浄し、有機層をMgSO4で乾燥させ、濾過し、蒸発させた。生成物をカラムクロマトグラフ(シリカゲル、溶離剤:DCM、DCM中1%のMeOH、2%、4%)により精製した。所望の画分を蒸発させて、中間体3を得た(64.1g、75%)。
手順a:中間体3(64.1g、249.1mmol)をMeOH(500mL)中において室温で撹拌した。NaOH(2M、747.3mL)を加え、混合物を室温で2時間撹拌した。反応混合物を1NのHClで酸性化し、生成物をEt2Oで抽出した。有機層を塩水で洗浄し、MgSO4で乾燥させ、濾過し、蒸発させて、白色固体として中間体4を得た(59.70g)。
手順a:THF(800mL)中の中間体4(59.7g、0.25mol)の溶液にジ-1H-イミダゾール-1-イル-メタノン(54g、0.33mol)を加え、混合物を室温で1時間撹拌した。別のフラスコ中において、ACN(500mL)中のN-メトキシ-メタンアミン塩酸塩(1:1)(32.93g、0.34mol)の懸濁液にトリメチルアミン(35.75g、0.35mol)を加えた。両方の混合物を合わせて、監視しながら50℃で撹拌した。中間生成物が反応混合物から晶出し、これは、所望の生成物を形成するようにN-メトキシ-メタンアミンと反応しなかった。中間体が溶解されるまでDCMを加えた。反応物を80℃で1週間撹拌したままにした。溶媒を蒸発させた。残渣をDCMに溶解させ、水、20%のAcOH溶液および最後に飽和NaHCO3溶液で洗浄した。有機層をMgSO4で乾燥させ、濾過し、蒸発させた。生成物をカラムクロマトグラフィー(シリカゲル、溶離剤:DCM中2%のMeOH、4%)により精製した。純粋な画分を蒸発させて、中間体5を得た(70g、定量的)。
手順a:THF(250mL)中の中間体5(70g、244.4mmol)をN2下でフラスコに充填し、-15℃に冷却した。メチルマグネシウムブロミド(トルエン/THF 75/25中1.4M、206mL)を、温度が0℃を超えないように滴下して加えた。添加後、反応混合物を室温で1時間撹拌した。次に、反応混合物を20mLのAcOHと共に氷上に注いだ。生成物をEt2Oで抽出し、有機層を5%のNaHCO3溶液で洗浄した。有機層をMgSO4で乾燥させ、濾過し、蒸発させて、中間体6を得た(53.35g、90%)。
中間体6(53.35g、0.22mol)を、トルエン(1500mL)中においてN2下0℃で撹拌した。カリウムtert-ブトキシド(34.14g)を0~5℃で加え、2,2-ジフルオロ-酢酸エチルエステル(33.01g、0.27mol)を0~5℃で滴下して加えた。反応混合物を室温で2時間撹拌し、次に水中10%のH2SO4で洗浄し、有機層をMgSO4で乾燥させ、濾過し、蒸発させて、中間体7を得た(70.50g、定量的)。
中間体7(70.5g、220.8mmol)、1H-1,2,4-トリアゾール-5-アミン塩酸塩(1:1)(53.22g、441.52mmol)およびDMF(1500mL)を80℃で24時間撹拌した。Et3N(20g)および二炭酸ジ-tert-ブチル(20g)を加えた。混合物を30分間撹拌し、蒸発させ、次にEtOAcに溶解させ、水および塩水で洗浄した。有機層をMgSO4で乾燥させ、濾過し、蒸発させた。4つの異性体が観察された。第1の画分がEt2Oから結晶化された。結晶を濾別し、乾燥させて、中間体8を得た(24.60g、30%)。母液は、化合物の第2の画分を生じた。結晶を濾別し、乾燥させて、中間体8を得た(2.53g、3%)。
MeOH(350mL)中の中間体8(24.6g、67mmol)の溶液にHCl-iPrOH(350mL)を加え、反応混合物を室温で2時間撹拌した。反応混合物を蒸発させ、生成物がEtOHから結晶化された。結晶を濾別し、乾燥させ、20.33gの粗製物を得て、それに水、Na2CO3およびDCMを加えた。有機層をMgSO4で乾燥させ、濾過し、蒸発させて、12.80gの中間体9を得た。この遊離塩基を分取SFC(固定相:Chiralpak Diacel AD 30×250mm;移動相:CO2、(0.4%のiPrNH2と共に(MeOH-iPrOH 50/50))による精製によってエナンチオマー9aおよび9bへ分離して、中間体9a(5g、19%、保持時間=7.57分)および中間体9b(5.13g、19%、保持時間=9.36分)を得た。
N,N-ジメチルアセトアミドジメチルアセタール(20mL、0.91g/mL、0.14mol)中のI-6(7.3g、0.03mol)の撹拌混合物を100℃で4時間加熱した。反応混合物を真空中で濃縮し、トルエン(2×20mL)と共蒸発させて、茶色の残渣としてI-7(9.4g、収率100.1%)を得て、これを次の工程にそのまま使用した。
AcOH(50mL、1.05g/mL、1.75mol)中のI-10(9.4g、0.03mol)の混合物にHOAc(50mL、1.05g/mL、1.75mol)中の3-アミノ-1,2,4-トリアゾール(2.68g、0.03mol)の混合物を加え、結果として生じる反応混合物をDrysyn(登録商標)金属製ヒーティングブロックにおいて130℃で15分間加熱した。反応混合物を冷却し、真空中で濃縮し、DCM(0.2L)で希釈し、1 NaOHによりpH約8まで処理した。層を分離し、水層をDCM(2×50mL)で抽出した。合わせた有機層を乾燥させ(MgSO4)、濾過し、真空中で濃縮して、暗褐色の油を得て、これを、DCM中の0~3%の7N NH3/MeOHの勾配で溶離するRedisep(登録商標)120gフラッシュカラムを用いるシリカゲルクロマトグラフィーにより精製して、約1:4=シス:トランス混合物の黄褐色の油として中間体11を得た(2.15g、収率21.42%)。
MeOH(50mL、0.79g/mL、1.23mol)中のI-11(2.15g、0.0065mol)の撹拌混合物をHCl(iPrOH中の6M)(50mL、6M、0.3mol)で処理し、室温で16時間後、反応混合物を真空中で濃縮して、オフホワイトの固体を得た。これをEt2O(200mL)とACN(30mL)との混合物で16時間トリチュレートした。この固体を濾過により回収し、乾燥させて、オフホワイト固体のシス/トランス混合物(18%/82%)として中間体12を得た(1.7g、収率97.87%)。
MeOH(165mL)中のI-11(23g、0.0694mol)の撹拌混合物をHCl(iPrOH中の6M)(165mL、6M、0.986mol)で処理し、室温で16時間後、反応混合物を真空中で濃縮して、オフホワイトの固体を得た。これを水およびDCMで希釈し、Na2CO3で処理した。有機層をMgSO4で乾燥させ、濾過し、真空中で濃縮して残渣を得て、これをSCF(固定相:Chiralpak(登録商標)Diacel AD 20×250mm、移動相:CO2、MeOH-iPrOH(50-50)+0.4%iPrNH2)を用いて精製して、中間体12aおよび12bを得た。これをMeOH(100mL)中に溶解させ、HCl(iPrOH中の6M)(100mL)で0℃において2時間処理した。揮発物を減圧下で蒸発させ、得られた残渣をEt2O中において0℃で撹拌して、中間体12a(9.25g、43%)および中間体12b(8.8g、42%)を得た。これらをMeOH(100mL)中に溶解させ、HCl(iPrOH中の6M)(100mL)で0℃において2時間処理した。揮発物を減圧下で蒸発させ、得られた残渣をEt2O中において0℃で撹拌して、中間体12a(9.25g、43%、保持時間=3.54分、[α]20 D=-17.47°(c 0.54、DMF))および中間体12b(8.8g、42%、保持時間=3.24分、[α]20 D=+16.5°(c 0.52、DMF))を得た。
8-アザビシクロ[3.2.1]オクタン-2,8-ジカルボン酸,8-(1,1-ジメチルエチル)2-メチルエステル[1033820-28-8](4.77g、17.71mmol)をMeOH(41.608mL)中において室温で撹拌した。NaOH(106mL、1M、106mmol)を加え、混合物を室温で一晩撹拌した。MeOHを蒸発させた。反応混合物を1NのHClで酸性化し、生成物をクロロホルムで抽出した。有機層をMgSO4で乾燥させ、濾過し、蒸発させて、中間体13を得た(4.52g、100%)。
中間体13(4.52g、17.704mmol)をDCM(200mL)に溶解させた。次に、N,O-ジメチルヒドロキシルアミン塩酸塩(3.454g、35.407mmol)およびEt3N(5.37g、53.1mmol)を加えた。反応混合物を0℃に冷却した。次に、HATU(7.41g、19.5mmol)を加えた。反応混合物を室温で2時間撹拌した。反応混合物をNaHCO3水溶液(100mL)に注いだ。有機層を分離し、MgSO4で乾燥させ、溶媒を蒸発させた。残渣をシリカゲルのフラッシュカラムクロマトグラフィー(溶離液:DCMからDCM中の1%MeOH)により精製した。生成物画分を回収し、溶媒を蒸発させて、中間体14を得た(3.03g、57%)。
THF(50mL)中の中間体14(3.03g、10.2mmol)をN2下でフラスコに移し、-15℃に冷却した。メチルマグネシウムブロミド(12.7mL、1.4M、17.8mmol)を、温度が0℃を超えないように滴下して加えた。添加後、反応混合物を室温で1時間撹拌した。反応混合物をAcOH(20mL)と共に氷上に注いだ。生成物をEt2Oで抽出し、有機層を5%のNaHCO3溶液で洗浄した。有機層をMgSO4で乾燥させ、濾過し、蒸発させ、シリカゲル(溶離液:DCM)上で精製した。純粋な画分を蒸発させて、中間体15を得た(2.57g、100%)。
中間体15(2.57g、0.0101mol)をトルエン(150mL)中においてN2下0℃で撹拌した。カリウムtert.-ブトキシド(1.59g、14.2mmol)を0~5℃で加え、ジフルオロ酢酸エチル(1.52g、0.0122mol)を0~5℃で滴下して加えた。反応混合物を室温で2時間撹拌した。反応混合物を水中10%のH2SO4で洗浄し、有機層をMgSO4で乾燥させ、濾過し、蒸発させて、中間体16を得た(3.34g、99%)。
DMF(30mL)中の中間体16(3.34g、10.1mmol)および1H-1,2,4-トリアゾール-5-アミン塩酸塩(2.43g、20.2mmol)を80℃で16時間撹拌した。反応混合物を蒸発させ、DCMを加え、2gの(Boc)2OおよびEt3N(2mL)を加えた。混合物を30分間撹拌し、水で洗浄し、有機層をMgSO4で乾燥させ、濾過し、蒸発させた。生成物(4種の異性体)をシリカゲル(溶離液:DCMからDCM中の2%MeOH)で精製した。その画分を蒸発させて、3.07gの粗製物を得て、これを分取HPLC(固定相:Uptisphere(登録商標)C18 ODB-10μm、200g、内径5cm、移動相:水中の0.25%NH4HCO3溶液、MeOH)を介して精製して、中間体17を得た(1.07g、28%)。
MeOH(30mL)中の中間体17(1.07g、2.82mmol)にHCl(iPrOH中の6M 30mL、6M、179mmol)を加え、反応混合物を室温で一晩撹拌した。溶媒を蒸発させ、生成物がEtOHから結晶化された。結晶を濾別し、乾燥させて、塩酸塩として中間体18を得た(1.12g、112%)。
化合物1(213mg、0.45mmol)、ビス(ピナコラト)ジボラン[73183-34-3](120mg、0.47mmol)、KOAc[127-08-2](132.5mg、1.35mmol)および1,1’-ビス(ジフェニル-ホスフィノ)フェロセン-パラジウム(II)ジクロリドジクロロメタン錯体[95464-05-4](18mg、0.023mmol)を無水1,4-ジオキサン[123-91-1](4mL、1.033g/mL、46.898mmol)中に窒素雰囲気下で溶解させ、100℃で6時間加熱した。反応混合物を冷却し、EtOAcで希釈し、10%KHSO4水溶液で洗浄した。水層を酢酸エチルで2回抽出した。次に、有機相を合わせ、塩水で洗浄し、MgSO4で乾燥させ、濾過し、真空中で濃縮して中間体19(138mg)を得、これを次の工程にそのまま使用した。
化合物1
DIPEA[7087-68-5](4.26mL、24.7mmol)および7-ブロモ-1-クロロイソキノリン[215453-51-3](2.4g、9.88mmol)をn-ブタノール[71-36-3](8mL)中の中間体9b(1.5g、4.94mmol)の溶液に室温で加えた。次に、得られた混合物を160℃のマイクロ波照射下で4時間撹拌した。揮発物を真空中で除去し、得られた残渣をDCM中に溶解させ、NaHCO3飽和水溶液で洗浄した。有機層を分離し、MgSO4で乾燥させ、濾過し、減圧下で蒸発させた。得られた残渣を、溶離液としてDCM-MeOH(9:1、v/v)/DCM、0/100~5/95の勾配を用いてシリカゲルで精製した。生成物画分を回収し、真空中で濃縮した。得られた残渣がヘプタンから結晶化され、化合物1を得た(1.02g、43.6%)。
アセトン[67-64-1](6.3mL、0.786g/mL、84.93mmol)中の中間体19(138mg、0.26mmol)の溶液に水(1.255mL、0.998g/mL、69.53mmol)中のペルオキシ一硫酸カリウム[10058-23-8](318mg、2.09mmol)溶液を2分間にわたって滴下して加えた。反応混合物を10分間撹拌し、重硫酸ナトリウム水溶液で希釈し、さらに20分間撹拌し、次に揮発物を減圧下で除去した。得られた水性残渣を濾過し、濾液のpHを5に調整した。水相をDCMで3回抽出した。合わせた有機層をMgSO4で乾燥させ、濾過し、真空中で蒸発させた。得られた残渣を、溶離液としてDCMからDCM中の1.5%MeOHの勾配を用いてシリカゲルにより精製して、化合物18を得た(24mg、収率22%)。
融点
値は、ピーク値または融解範囲のいずれかであり、この分析方法に通常付随する実験上の不確実性を伴って得られる。
高速液体クロマトグラフィー(HPLC)測定は、それぞれの方法に明記したLCポンプ、ダイオードアレイ(DAD)またはUV検出器およびカラムを用いて行った。必要に応じて、追加の検出器を含めた(下の方法の表を参照されたい)。
400MHzで動作し、標準的なパルスシーケンスを有するBruker DPX-400分光計または360MHzで動作するBruker DPX-360のいずれかにおいて、溶媒としてDMSO-d6(重水素化DMSO、ジメチル-d6スルホキシド)を用いて1H NMRスペクトルを記録した。化学シフト(δ)は、内部標準として使用したテトラメチルシラン(TMS)に対する百万分率(ppm)で報告する。
本発明で提供される化合物は、PDE2、特にPDE2Aの阻害剤である。いくつかの薬理学的アッセイにおいて、化合物の試験結果が以下に示される。
組み換えrPDE10Aバキュロウイルス構築物を用いて、ヒト組み換えPDE2A(hPDE2A)をSf9細胞中で発現させた。感染の48時間後に細胞を採取し、hPDE2Aタンパク質をNi-セファロース6FFにおける金属キレートクロマトグラフィーによって精製した。試験される化合物を100%のDMSOに溶解させ、アッセイにおける最終濃度の100倍の濃度に希釈した。化合物の希釈物(0.4μl)を384ウェルプレート中で20μlのインキュベーション緩衝液(50mMのTris(pH7.8)、8.3mMのMgCl2、1.7mMのEGTA)に加えた。インキュベーション緩衝液中の10μlのhPDE2A酵素を加え、10μMのcGMPおよび0.01μCiの3H-cGMPの最終濃度まで10μlの基質を加えることにより、反応を開始させた。反応物を室温で45分間インキュベートした。インキュベーション後、200mMのZnCl2が補充された17.8mg/mlのPDE SPAシンチレーション近接アッセイ)ビーズからなる20μlの停止液を用いて、反応を停止させた。30分間ビーズを沈降させた後、Perkin Elmer Topcountシンチレーションカウンターにおいて放射能を測定し、結果をcpmとして表した。ブランク値のために酵素を反応から除外し、インキュベーション緩衝液で置き換えた。化合物の代わりに1%の最終濃度のDMSOを加えることにより、対照値を得た。最小平方和法により、化合物濃度に対するブランク値を差し引いた対照値の%のプロットに最良適合曲線を合わせて、この曲線から半数阻害濃度(IC50)値を導き出す。
ヒト組み換えPDE3A(hPDE3A)は、Scottish Biomedicalによって部分的に精製された昆虫細胞溶解物として供給され、それをヒト脳からクローン化し、Sf9細胞中で発現させた。試験される化合物を100%のDMSOに溶解させ、アッセイにおける最終濃度の100倍の濃度に希釈した。化合物の希釈物(0.4μl)を384ウェルプレート中で20μlのインキュベーション緩衝液(50mMのTris(pH7.8)、8.3mMのMgCl2、1.7mMのEGTA)に加えた。インキュベーション緩衝液中の10μlのhPDE3A酵素を加え、0.4μMのcAMPおよび2.4μCi/mlの[3H]-cAMPの最終濃度まで10μlの基質を加えることにより、反応を開始させた。反応物を室温で60分間インキュベートした。インキュベーション後、200mMのZnCl2が補充された17.8mg/mlのPDE SPA(シンチレーション近接アッセイ)ビーズからなる20μlの停止液を用いて、反応を停止させた。30分間ビーズを沈降させた後、Perkin Elmer Topcountシンチレーションカウンターにおいて放射能を測定し、結果をcpmとして表した。ブランク値のために酵素を反応から除外し、インキュベーション緩衝液で置き換えた。化合物の代わりに1%の最終濃度のDMSOを加えることにより、対照値を得た。最小平方和法により、化合物濃度に対するブランク値を差し引いた対照値の%のプロットに最良適合曲線を合わせて、この曲線から半数阻害濃度(IC50)値を導き出す。
組み換えrPDE10Aバキュロウイルス構築物を用いて、ラット組み換えPDE10A(rPDE10A2)をSf9細胞中で発現させた。感染の48時間後に細胞を採取し、rPDE10Aタンパク質をNi-セファロース6FFにおける金属キレートクロマトグラフィーによって精製した。試験される化合物を100%のDMSOに溶解させ、アッセイにおける最終濃度の100倍の濃度に希釈した。自社内で作製され、増幅された組み換えhPDE10Aバキュロウイルスを用いて、ヒト組み換えPDE10A(hPDE2A)をSf9細胞中で発現させた。感染の72時間後に細胞を採取し、hPDE10Aタンパク質をNi-セファロースにおける金属キレートクロマトグラフィーによって精製した。化合物の希釈物(0.4μl)を384ウェルプレート中で20μlのインキュベーション緩衝液(50mMのTris(pH7.8)、8.3mMのMgCl2、1.7mMのEGTA)に加えた。インキュベーション緩衝液中の10μlのhPDE10AまたはhPDE10A酵素を加え、60nMのcAMPおよび0.008μCi/mlの3H-cAMPの最終濃度まで10μlの基質を加えることにより、反応を開始させた。反応物を室温で60分間インキュベートした。インキュベーション後、17.8mg/mlのPDE SPA(シンチレーション近接アッセイ)ビーズからなる20μlの停止液を用いて、反応を停止させた。30分間ビーズを沈降させた後、Perkin Elmer Topcountシンチレーションカウンターにおいて放射能を測定し、結果をcpmとして表した。ブランク値のために酵素を反応から除外し、インキュベーション緩衝液で置き換えた。化合物の代わりに1%の最終濃度のDMSOを加えることにより、対照値を得た。最小平方和法により、化合物濃度に対するブランク値を差し引いた対照値の%のプロットに最良適合曲線を合わせて、この曲線から半数阻害濃度(IC50)値を導き出す。
方法
放射性リガンド(Buijnster et al.,(2014).Structure-Based Design of a Potent,Selective,and Brain Penetrating PDE2 Inhibitor with Demonstrated Target Engagement.ACS Med Chem Lett.5(9):1049-53における化合物12)として[3H]B-17a(国際公開第2013/000924号パンフレットに記載される)を用いて、エクスビボオートラジオグラフィーにより、PDE2Aの占有率を評価した。雄ウィスターラット(200~250g)を溶媒または漸増用量の[3H]B-17aの経口投与によって処理し、1時間後に殺処分した。脳を頭蓋骨から即座に取り出し、ドライアイスで冷却した2-メチルブタン(-40℃)中で急速に凍結させた。厚さ20μmの線条体切片を、Leica CM 3050 cryostat-microtome(van Hopplynus、Belgium)を用いて切り出し、顕微鏡スライド(SuperFrost Plus Slides、LaboNord、France)に解凍して固定し、使用するまで-20℃で保存した。
重要な試薬
スクロース解剖緩衝液は、(mM単位で)スクロース(150)、NaCl(40)、KCl(4)、NaH2PO4.H2O(0.3)、MgCl.6H2O(7)、NaHCO3(26)、CaCl2.2H2O(0.5)、D-グルコース(10)を含有しており、これを95%のO2および5%のCO2ガス混合物で平衡化した。平衡化および記録中に使用される人工脳脊髄液(ACSF)は、(mM単位で):NaCl(124)、KCl(2.7)、NaH2PO4.H2O(1.25)、MgSO4.7H2O(1.3)、NaHCO3(26)、CaCl2.2H2O(2)、D-グルコース(10)、アスコルビン酸(2)を含有しており、これを95%のO2および5%のCO2ガス混合物で平衡化した。CNQXおよびキヌレン酸をそれぞれ50μMおよび1mMの濃度においてACSF中で調製した。試験化合物を、ACSF中でおよび0.1%を超えない最終DMSO濃度を有する原液(DMSOを含む)から新たに調製した。全ての試薬は、特に示されない限り、Sigma-Aldrich製であった。
使用した動物は、Charles River Germanyによって提供される、145~200gの体重範囲の雄スプラーグドーリーラットであった。
標準的なプロトコルに従ってイソフルオランで麻酔した雄スプラーグドーリーラットの中間から腹側海馬から水平な脳切片(300μm)を得た。0.1mm/秒の速度において、低温(4℃)スクロース解剖緩衝液中で振動組織スライサー(Leica VT1200S)を用いて切片を切断した。切断後、切片を35℃で20分間平衡化し、次に人工脳脊髄液(ACSF)中において室温で少なくとも1時間回復させた。3~4つの切片を1つの脳から調製した。
全てのデータは、60チャネルA/Dカードに連結された4チャネル刺激発生器および60チャネル増幅器ヘッドステージから構成されるMultiChannel Systems MCS GmbH(Reutlingen、Germany)から市販されているMEA設備を用いて記録された。刺激、記録および分析のためのソフトウェアは、それぞれMulti Channel Systems:MC Stim(II 2.0.0リリース)およびMC Rack(3.8.1.0リリース)から市販されているものである。全ての実験は、100μm間隔を空けた60の先端形状および60μm高さの電極からなる3次元MEA(Ayanda Biosystems,S.A.、CH-1015 Lausanne、Switzerland)を用いて行った。MEA電極は、600kΩ<インピーダンス<900kΩを有する白金で作製されている。
シナプス伝達に対する試験化合物の効果を、海馬切片における細胞外電場電位を記録することによって調べた。シナプス伝達が、記録電極を囲むニューロンの集団における同期されたシナプス活性を反映する細胞外電場電位の偏位を生じ得ることは十分に確立されている。
本発明は、以下の態様を提供しうる。
[1]
式(I)
(式中、
R 1 は、CHF 2 またはCH 3 であり;
Aは、(a-1)および(a-2)
から選択される基であり、式中、
R 2 は、ハロ、OH、-CN;1つ、2つまたは3つの独立して選択されるハロ置換基で任意選択的に置換されたC 1~4 アルキル;1つ、2つまたは3つの独立して選択されるハロ置換基で任意選択的に置換されたC 1~4 アルキルオキシ;および1-モルホリニルからなる群からそれぞれ独立に選択される1つまたは2つの置換基でそれぞれ任意選択的に置換される2-ピリジル、1-イソキノリニル、4-キナゾリニル、1H-ピロロ[3,2-c]-ピリジン-4-イルおよびフロ[3,2-c]ピリジン-4-イルから選択される)
を有する化合物もしくはその立体異性体型またはその薬学的に許容される塩もしくは溶媒和物。
[2]
R 2 は、ハロ、OH、-CN;1つ、2つまたは3つの独立して選択されるハロ置換基で任意選択的に置換されたC 1~4 アルキル;および1つ、2つまたは3つの独立して選択されるハロ置換基で任意選択的に置換されたC 1~4 アルキルオキシからなる群からそれぞれ独立に選択される1つまたは2つの置換基でそれぞれ任意選択的に置換される2-ピリジルおよび1-イソキノリニルから選択される、上記[1]に記載の化合物。
[3]
R 2 は、ハロ、OH、-CN;1つ、2つまたは3つの独立して選択されるハロ置換基で任意選択的に置換されたC 1~4 アルキル;および1つ、2つまたは3つの独立して選択されるハロ置換基で任意選択的に置換されたC 1~4 アルキルオキシからなる群からそれぞれ独立に選択される1つまたは2つの置換基で任意選択的に置換された1-イソキノリニルである、上記[1]または[2]に記載の化合物。
[4]
R 2 は、1つまたは2つの独立して選択されるハロ置換基で任意選択的に置換された1-イソキノリニルである、上記[1]~[3]のいずれかに記載の化合物。
[5]
Aは、(a-1)である、上記[1]~[4]のいずれかに記載の化合物。
[6]
Aは、式(a-1a)
を有する基(a-1)である、上記[1]~[5]のいずれかに記載の化合物。
[7]
R 1 は、CHF 2 である、上記[1]~[6]のいずれかに記載の化合物。
[8]
治療有効量の上記[1]~[7]のいずれかに記載の化合物と、薬学的に許容される担体とを含む医薬組成物。
[9]
薬剤としての使用のための、上記[8]に記載の医薬組成物の、上記[1]~[7]のいずれかに記載の化合物。
[10]
精神病性障害および病態;不安障害;運動障害;薬物乱用;気分障害;神経変性障害;症状として注意および/または認知の不足を含む障害または病態;記憶の獲得および固定に関連する障害;脳卒中;ならびに自閉症性障害の群から選択される中枢神経系障害を治療または予防するのに使用するための、上記[1]~[7]のいずれかに記載の化合物または上記[8]に記載の医薬組成物。
[11]
前記精神病性障害は、統合失調症;統合失調症様障害;統合失調性感情障害;妄想性障害;物質誘発性精神病性障害;妄想性パーソナリティ障害;および統合失調症性パーソナリティ障害の群から選択され;
前記不安障害は、パニック障害;広場恐怖症;特定恐怖症;社交恐怖症;強迫性障害;心的外傷後ストレス障害;急性ストレス障害;および全般性不安障害の群から選択され;前記運動障害は、ハンチントン病およびジスキネジア;パーキンソン病;むずむず脚症候群および本態性振戦;トゥーレット症候群ならびに他のチック障害の群から選択され;物質関連障害は、アルコール乱用;アルコール依存症;アルコール離脱症状;アルコール離脱性せん妄;アルコール誘発性精神病性障害;アンフェタミン依存症;アンフェタミン離脱症状;コカイン依存症;コカイン離脱症状;ニコチン依存症;ニコチン離脱症状;オピオイド依存症およびオピオイド離脱症状の群から選択され;
前記気分障害は、鬱病;躁病;双極性I型障害、双極性II型障害;気分循環性障害;気分変調性障害;大鬱病性障害;治療抵抗性鬱病;および物質誘発性気分障害から選択され;
前記神経変性障害は、パーキンソン病;ハンチントン病;認知症;アルツハイマー病;多発梗塞性認知症;エイズ関連認知症または前頭側頭型認知症の群から選択され;
症状として注意および/または認知の不足を含む前記障害または病態は、アルツハイマー病に関連する認知症;多発梗塞性認知症;レビー小体病による認知症;アルコール性認知症または物質誘発性持続性認知症;頭蓋内腫瘍または脳外傷に関連する認知症;ハンチントン病に関連する認知症;パーキンソン病に関連する認知症;エイズ関連認知症;ピック病による認知症;クロイツフェルト・ヤコブ病による認知症;せん妄;健忘障害;心的外傷後ストレス障害;脳卒中;進行性核上麻痺;精神遅滞;学習障害;注意欠陥多動性障害(ADHD);軽度の認知機能障害;アスペルガー症候群;加齢による認知機能障害;および知覚、集中、学習または記憶に関連する認知機能障害の群から選択され;
記憶の獲得および固定に関連する前記障害は、記憶障害から選択される、上記[10]に記載の使用のための化合物または医薬組成物。
[12]
上記[8]に記載の医薬組成物を調製するためのプロセスにおいて、薬学的に許容される担体は、治療有効量の上記[1]~[7]のいずれかに記載の化合物と均質に混合されることを特徴とするプロセス。
[13]
上記[10]または[11]に記載の病態の治療または予防に使用するための、さらなる医薬品と組み合わされた上記[1]~[7]のいずれかに記載の化合物。
[14]
(a)上記[1]~[7]のいずれかに記載の化合物と、
(b)さらなる医薬品と
を含む、上記[10]または[11]に記載の病態の治療または予防における同時使用、別々の使用または逐次使用のための組み合わされた製剤としての製品。
[15]
精神病性障害および病態;不安障害;運動障害;薬物乱用;気分障害;神経変性障害;症状として注意および/または認知の不足を含む障害または病態;記憶の獲得および固定に関連する障害;脳卒中;および自閉性障害の群から選択される障害を治療する方法であって、それを必要とする対象に、治療有効量の上記[1]~[7]のいずれかに記載の化合物または治療量の上記[8]に記載の医薬組成物を投与することを含む方法。
Claims (16)
- 式(I)
(式中、
R1は、CHF2またはCH3であり;
Aは、(a-1)および(a-2)
から選択される基であり、式中、
R2は、ハロ、OH、-CN;1つ、2つまたは3つの独立して選択されるハロ置換基で任意選択的に置換されたC1~4アルキル;1つ、2つまたは3つの独立して選択されるハロ置換基で任意選択的に置換されたC1~4アルキルオキシ;および1-モルホリニルからなる群からそれぞれ独立に選択される1つまたは2つの置換基でそれぞれ任意選択的に置換される2-ピリジル、1-イソキノリニル、4-キナゾリニル、1H-ピロロ[3,2-c]-ピリジン-4-イルおよびフロ[3,2-c]ピリジン-4-イルから選択される)
を有する化合物もしくはその立体異性体型またはその薬学的に許容される塩もしくは溶媒和物。 - R2は、ハロ、OH、-CN;1つ、2つまたは3つの独立して選択されるハロ置換基で任意選択的に置換されたC1~4アルキル;および1つ、2つまたは3つの独立して選択されるハロ置換基で任意選択的に置換されたC1~4アルキルオキシからなる群からそれぞれ独立に選択される1つまたは2つの置換基でそれぞれ任意選択的に置換される2-ピリジルおよび1-イソキノリニルから選択される、請求項1に記載の化合物。
- R2は、ハロ、OH、-CN;1つ、2つまたは3つの独立して選択されるハロ置換基で任意選択的に置換されたC1~4アルキル;および1つ、2つまたは3つの独立して選択されるハロ置換基で任意選択的に置換されたC1~4アルキルオキシからなる群からそれぞれ独立に選択される1つまたは2つの置換基で任意選択的に置換された1-イソキノリニルである、請求項1または2に記載の化合物。
- R2は、1つまたは2つの独立して選択されるハロ置換基で任意選択的に置換された1-イソキノリニルである、請求項1~3のいずれか一項に記載の化合物。
- Aは、(a-1)である、請求項1~4のいずれか一項に記載の化合物。
- R1は、CHF2である、請求項1~6のいずれか一項に記載の化合物。
- 治療有効量の請求項1~7のいずれか一項に記載の化合物と、薬学的に許容される担体とを含む医薬組成物。
- 薬剤としての使用のための、請求項8に記載の医薬組成物または請求項1~7のいずれか一項に記載の化合物。
- 精神病性障害および病態;不安障害;運動障害;薬物乱用;気分障害;神経変性障害;症状として注意および/または認知の不足を含む障害または病態;記憶の獲得および固定に関連する障害;脳卒中;ならびに自閉症性障害の群から選択される中枢神経系障害を治療または予防するのに使用するための、請求項1~7のいずれか一項に記載の化合物または請求項8に記載の医薬組成物。
- 前記精神病性障害は、統合失調症;統合失調症様障害;統合失調性感情障害;妄想性障害;物質誘発性精神病性障害;妄想性パーソナリティ障害;および統合失調症性パーソナリティ障害の群から選択され;
前記不安障害は、パニック障害;広場恐怖症;特定恐怖症;社交恐怖症;強迫性障害;心的外傷後ストレス障害;急性ストレス障害;および全般性不安障害の群から選択され;
前記運動障害は、ハンチントン病およびジスキネジア;パーキンソン病;むずむず脚症候群および本態性振戦;トゥーレット症候群ならびに他のチック障害の群から選択され;
物質関連障害は、アルコール乱用;アルコール依存症;アルコール離脱症状;アルコール離脱性せん妄;アルコール誘発性精神病性障害;アンフェタミン依存症;アンフェタミン離脱症状;コカイン依存症;コカイン離脱症状;ニコチン依存症;ニコチン離脱症状;オピオイド依存症およびオピオイド離脱症状の群から選択され;
前記気分障害は、鬱病;躁病;双極性I型障害、双極性II型障害;気分循環性障害;気分変調性障害;大鬱病性障害;治療抵抗性鬱病;および物質誘発性気分障害から選択され;
前記神経変性障害は、パーキンソン病;ハンチントン病;認知症;アルツハイマー病;多発梗塞性認知症;エイズ関連認知症または前頭側頭型認知症の群から選択され;
症状として注意および/または認知の不足を含む前記障害または病態は、アルツハイマー病に関連する認知症;多発梗塞性認知症;レビー小体病による認知症;アルコール性認知症または物質誘発性持続性認知症;頭蓋内腫瘍または脳外傷に関連する認知症;ハンチントン病に関連する認知症;パーキンソン病に関連する認知症;エイズ関連認知症;ピック病による認知症;クロイツフェルト・ヤコブ病による認知症;せん妄;健忘障害;心的外傷後ストレス障害;脳卒中;進行性核上麻痺;精神遅滞;学習障害;注意欠陥多動性障害(ADHD);軽度の認知機能障害;アスペルガー症候群;加齢による認知機能障害;および知覚、集中、学習または記憶に関連する認知機能障害の群から選択され;
記憶の獲得および固定に関連する前記障害は、記憶障害から選択される、請求項10に記載の使用のための化合物または医薬組成物。 - 請求項8に記載の医薬組成物を調製するためのプロセスにおいて、薬学的に許容される担体は、治療有効量の請求項1~7のいずれか一項に記載の化合物と均質に混合されることを特徴とするプロセス。
- 請求項10または11に記載の病態の治療または予防に使用するための、さらなる医薬品と組み合わされた請求項1~7のいずれか一項に記載の化合物。
- (a)請求項1~7のいずれか一項に記載の化合物と、
(b)さらなる医薬品と
を含む、請求項10または11に記載の病態の治療または予防における同時使用、別々の使用または逐次使用のための組み合わされた製剤としての製品。 - 精神病性障害および病態;不安障害;運動障害;薬物乱用;気分障害;神経変性障害;症状として注意および/または認知の不足を含む障害または病態;記憶の獲得および固定に関連する障害;脳卒中;および自閉性障害の群から選択される障害を治療する方法に使用するための医薬組成物であって、
治療有効量の請求項1~7のいずれか一項に記載の化合物または治療量の請求項8に記載の医薬組成物を含み、
前記方法が、それを必要とする対象に、治療有効量の前記化合物または治療量の前記医薬組成物を投与することを含む、医薬組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP16196943 | 2016-11-02 | ||
| EP16196943.1 | 2016-11-02 | ||
| PCT/EP2017/077920 WO2018083103A1 (en) | 2016-11-02 | 2017-10-31 | [1,2,4]triazolo[1,5-a]pyrimidine compounds as pde2 inhibitors |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2019532983A JP2019532983A (ja) | 2019-11-14 |
| JP2019532983A5 JP2019532983A5 (ja) | 2020-12-24 |
| JP7021208B2 true JP7021208B2 (ja) | 2022-02-16 |
Family
ID=57223578
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019522863A Active JP7021208B2 (ja) | 2016-11-02 | 2017-10-31 | PDE2阻害剤としての[1,2,4]トリアゾロ[1,5-a]ピリミジン化合物 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US11053248B2 (ja) |
| EP (1) | EP3535269B1 (ja) |
| JP (1) | JP7021208B2 (ja) |
| KR (1) | KR20190071721A (ja) |
| CN (1) | CN109937202B (ja) |
| AU (1) | AU2017353315B2 (ja) |
| BR (1) | BR112019008163A2 (ja) |
| CA (1) | CA3038916A1 (ja) |
| EA (1) | EA039102B1 (ja) |
| ES (1) | ES2855032T3 (ja) |
| MX (1) | MX2019005115A (ja) |
| WO (1) | WO2018083103A1 (ja) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3371188B1 (en) | 2015-11-02 | 2019-10-23 | Janssen Pharmaceutica NV | [1,2,4]triazolo[1,5-a]pyrimidin-7-yl compound |
| BR112019008163A2 (pt) | 2016-11-02 | 2019-07-09 | Janssen Pharmaceutica Nv | compostos de [1,2,4]triazolo[1,5-a]pirimidina como inibidores de pde2 |
| ES2912264T3 (es) | 2016-11-02 | 2022-05-25 | Janssen Pharmaceutica Nv | Compuestos de [1,2,4]triazolo[1,5-a]pirimidina como inhibidores de PDE2 |
| US10947242B2 (en) | 2016-11-02 | 2021-03-16 | Janssen Pharmaceutica, Nv | [1,2,4]triazolo[1,5and#8208;A]pyrimidine compounds as PDE2 inhibitors |
| CA3150878A1 (en) * | 2019-09-12 | 2021-03-18 | Jonathan Bentley | Inhibitors of sarm1 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014518234A (ja) | 2011-06-27 | 2014-07-28 | ジヤンセン・フアーマシユーチカ・ナームローゼ・フエンノートシヤツプ | 1−アリール−4−メチル−[1,2,4]トリアゾロ[4,3−a]キノキサリン誘導体 |
| WO2015164508A1 (en) | 2014-04-23 | 2015-10-29 | Dart Neuroscience, Llc | Substituted [1,2,4] triazolo [1,5-a] pyrimidin-7-yl compounds as pde2 inhibitors |
| JP2019532990A (ja) | 2016-11-02 | 2019-11-14 | ヤンセン ファーマシューティカ エヌ.ベー. | PDE2阻害剤としての[1,2,4]トリアゾロ[1,5−a]ピリミジン化合物 |
| JP2019532985A (ja) | 2016-11-02 | 2019-11-14 | ヤンセン ファーマシューティカ エヌ.ベー. | PDE2阻害剤としての[1,2,4]トリアゾロ[1,5−a]ピリミジン誘導体 |
Family Cites Families (42)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4036840A (en) * | 1972-06-07 | 1977-07-19 | Icn Pharmaceuticals | 2-Substituted-s-triazolo[1,5a]pyrimidines |
| CA2111957A1 (en) | 1991-06-27 | 1993-01-07 | Richard A. Glennon | Sigma receptor ligands and the use thereof |
| PL342243A1 (en) | 1998-01-27 | 2001-06-04 | Aventis Pharm Prod Inc | Substituted oxoazaheterocyclic inhibitors of the factor xa |
| US6194410B1 (en) | 1998-03-11 | 2001-02-27 | Hoffman-La Roche Inc. | Pyrazolopyrimidine and pyrazolines and process for preparation thereof |
| US20040014744A1 (en) | 2002-04-05 | 2004-01-22 | Fortuna Haviv | Substituted pyridines having antiangiogenic activity |
| EP1546103B1 (en) | 2002-10-03 | 2009-03-18 | Vertex Pharmaceuticals Incorporated | Piperazine and piperidine derivatives for treatment of neurological diseases |
| WO2004108136A1 (en) | 2003-06-04 | 2004-12-16 | Vernalis (Cambridge) Limited | Triazolo `1 , 5-a!pyrimidines and their use in medicine |
| ES2317031T3 (es) | 2003-07-16 | 2009-04-16 | Janssen Pharmaceutica Nv | Derivados de triazolopirimidina como inhibidores de la glucogeno-sintasa-quinasa 3. |
| BRPI0418212A (pt) | 2003-12-29 | 2007-04-27 | Banyu Pharma Co Ltd | composto ou um sal deste farmaceuticamente aceitável, ativador da glicocinase, e, medicamentos para a terapia e/ou prevenção da diabete, e da obesidade |
| CN101083992A (zh) | 2004-09-20 | 2007-12-05 | 泽农医药公司 | 抑制人硬脂酰CoA去饱和酶的哒嗪衍生物 |
| TW200626154A (en) | 2004-09-20 | 2006-08-01 | Xenon Pharmaceuticals Inc | Heterocyclic derivatives and their use as therapeutic agents |
| JP2008516973A (ja) | 2004-10-15 | 2008-05-22 | タケダ サン ディエゴ インコーポレイテッド | キナーゼ阻害剤 |
| RU2007130893A (ru) * | 2005-01-14 | 2009-02-20 | Янссен Фармацевтика Н.В. (Be) | Производные триазолопиримидина |
| US7507842B2 (en) | 2005-08-12 | 2009-03-24 | Radiorx, Inc. | Cyclic nitro compounds, pharmaceutical compositions thereof and uses thereof |
| WO2007113136A1 (de) | 2006-03-30 | 2007-10-11 | Basf Aktiengesellschaft | Verwendung von substituierten riazolopyrimidinen zur bekämpfung von phyto pathogenen schadpilzen |
| JP2007332061A (ja) | 2006-06-14 | 2007-12-27 | Nippon Kayaku Co Ltd | 新規ピラゾロ[1,5−a]ピリミジン誘導体及びその用途 |
| US8153803B2 (en) | 2006-07-18 | 2012-04-10 | The General Hospital Corporation | Compositions and methods for modulating sirtuin activity |
| WO2008048914A1 (en) | 2006-10-17 | 2008-04-24 | Boehringer Ingelheim International Gmbh | Polycyclic compounds which modulate the cb2 receptor |
| UA99624C2 (uk) * | 2007-07-18 | 2012-09-10 | Янссен Фармацевтика Н.В. | Сульфонаміди як trpm8-модулятори |
| US8138168B1 (en) | 2007-09-26 | 2012-03-20 | Takeda Pharmaceutical Company Limited | Renin inhibitors |
| GB0719803D0 (en) | 2007-10-10 | 2007-11-21 | Cancer Rec Tech Ltd | Therapeutic compounds and their use |
| CN101560212B (zh) * | 2009-05-26 | 2011-03-16 | 华中师范大学 | 1,2,4-三唑并[1,5-a]嘧啶-2-乙基硫醚双取代衍生物的制备及其应用 |
| CA2818903C (en) | 2010-12-14 | 2021-03-23 | Electrophoretics Limited | 5-(1,3-benzoxazol-2-yl)-4-(pyridin-4-yl)pyrimidin-2-amine and its use as a casein kinase 1delta inhibitor |
| BR112013021366A2 (pt) | 2011-02-23 | 2016-09-13 | Pfizer | imidazo[5,1-f][1,2,4]triazinas para o tratamento de desordens neurológicas |
| AU2012311061B2 (en) | 2011-09-23 | 2016-08-18 | Advinus Therapeutics Limited | Amide compounds, compositions and applications thereof |
| CN103183675A (zh) * | 2011-12-27 | 2013-07-03 | 山东轩竹医药科技有限公司 | 磷酸二酯酶-4抑制剂 |
| US9034882B2 (en) | 2012-03-05 | 2015-05-19 | Bristol-Myers Squibb Company | Inhibitors of human immunodeficiency virus replication |
| NZ630721A (en) | 2012-03-09 | 2016-12-23 | Lexicon Pharmaceuticals Inc | Pyrazolo[1,5-a]pyrimidine-based compounds, compositions comprising them, and methods of their use |
| US9193736B2 (en) * | 2013-06-11 | 2015-11-24 | Janssen Pharmaceutica, Nv | PDE 10a inhibitors for the treatment of type II diabetes |
| US9328095B2 (en) * | 2013-10-15 | 2016-05-03 | Janssen Pharmaceutica Nv | Heteroaryl linked quinolinyl modulators of RORgammat |
| AU2015223049B2 (en) | 2014-02-27 | 2019-03-21 | Merck Patent Gmbh | Heterocyclic compounds as NaV channel inhibitors and uses thereof |
| ES2738416T3 (es) | 2014-03-19 | 2020-01-22 | Boehringer Ingelheim Int | Inhibidores heteroarílicos de SYK |
| CN105566321B (zh) | 2014-10-29 | 2020-04-21 | 广东东阳光药业有限公司 | 杂芳化合物及其在药物中的应用 |
| WO2016107602A1 (zh) | 2015-01-01 | 2016-07-07 | 成都贝斯凯瑞生物科技有限公司 | 一类取代氮杂环衍生物及其应用 |
| WO2016145614A1 (en) | 2015-03-17 | 2016-09-22 | Merck Sharp & Dohme Corp. | Triazolyl pyrimidinone compounds as pde2 inhibitors |
| WO2017000277A1 (en) | 2015-07-01 | 2017-01-05 | Merck Sharp & Dohme Corp. | Substituted triazolo bicycliccompounds as pde2 inhibitors |
| WO2017000276A1 (en) | 2015-07-01 | 2017-01-05 | Merck Sharp & Dohme Corp. | Bicyclic heterocyclic compounds as pde2 inhibitors |
| US20180305334A1 (en) | 2015-10-14 | 2018-10-25 | Aquinnah Pharmaceuticals, Inc. | Compounds, compositions and methods of use against stress granules |
| EP3371188B1 (en) | 2015-11-02 | 2019-10-23 | Janssen Pharmaceutica NV | [1,2,4]triazolo[1,5-a]pyrimidin-7-yl compound |
| WO2017157882A1 (en) | 2016-03-14 | 2017-09-21 | Université Catholique de Louvain | Serine biosynthetic pathway inhibitors |
| BR112019008163A2 (pt) | 2016-11-02 | 2019-07-09 | Janssen Pharmaceutica Nv | compostos de [1,2,4]triazolo[1,5-a]pirimidina como inibidores de pde2 |
| JP2020503300A (ja) | 2016-12-16 | 2020-01-30 | ヤンセン ファーマシューティカ エヌ.ベー. | 二環式oga阻害剤化合物 |
-
2017
- 2017-10-31 BR BR112019008163A patent/BR112019008163A2/pt active Search and Examination
- 2017-10-31 WO PCT/EP2017/077920 patent/WO2018083103A1/en unknown
- 2017-10-31 CN CN201780067815.3A patent/CN109937202B/zh not_active Expired - Fee Related
- 2017-10-31 EA EA201990973A patent/EA039102B1/ru unknown
- 2017-10-31 MX MX2019005115A patent/MX2019005115A/es unknown
- 2017-10-31 CA CA3038916A patent/CA3038916A1/en active Pending
- 2017-10-31 KR KR1020197011777A patent/KR20190071721A/ko active IP Right Grant
- 2017-10-31 ES ES17797898T patent/ES2855032T3/es active Active
- 2017-10-31 EP EP17797898.8A patent/EP3535269B1/en active Active
- 2017-10-31 JP JP2019522863A patent/JP7021208B2/ja active Active
- 2017-10-31 US US16/346,766 patent/US11053248B2/en active Active
- 2017-10-31 AU AU2017353315A patent/AU2017353315B2/en not_active Ceased
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014518234A (ja) | 2011-06-27 | 2014-07-28 | ジヤンセン・フアーマシユーチカ・ナームローゼ・フエンノートシヤツプ | 1−アリール−4−メチル−[1,2,4]トリアゾロ[4,3−a]キノキサリン誘導体 |
| WO2015164508A1 (en) | 2014-04-23 | 2015-10-29 | Dart Neuroscience, Llc | Substituted [1,2,4] triazolo [1,5-a] pyrimidin-7-yl compounds as pde2 inhibitors |
| JP2019532990A (ja) | 2016-11-02 | 2019-11-14 | ヤンセン ファーマシューティカ エヌ.ベー. | PDE2阻害剤としての[1,2,4]トリアゾロ[1,5−a]ピリミジン化合物 |
| JP2019532985A (ja) | 2016-11-02 | 2019-11-14 | ヤンセン ファーマシューティカ エヌ.ベー. | PDE2阻害剤としての[1,2,4]トリアゾロ[1,5−a]ピリミジン誘導体 |
Non-Patent Citations (1)
| Title |
|---|
| Bioorganic & Medicinal Chemistry Letters,2013年,Vol. 23, No. 24,pp. 6522-6527 |
Also Published As
| Publication number | Publication date |
|---|---|
| EA039102B1 (ru) | 2021-12-03 |
| BR112019008163A2 (pt) | 2019-07-09 |
| ES2855032T3 (es) | 2021-09-23 |
| JP2019532983A (ja) | 2019-11-14 |
| CA3038916A1 (en) | 2018-05-11 |
| AU2017353315B2 (en) | 2021-09-16 |
| CN109937202B (zh) | 2022-12-30 |
| EP3535269A1 (en) | 2019-09-11 |
| AU2017353315A1 (en) | 2019-05-02 |
| EP3535269B1 (en) | 2020-12-09 |
| US20200048260A1 (en) | 2020-02-13 |
| MX2019005115A (es) | 2019-06-20 |
| CN109937202A (zh) | 2019-06-25 |
| US11053248B2 (en) | 2021-07-06 |
| WO2018083103A1 (en) | 2018-05-11 |
| KR20190071721A (ko) | 2019-06-24 |
| EA201990973A1 (ru) | 2019-09-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7076441B2 (ja) | PDE2阻害剤としての[1,2,4]トリアゾロ[1,5-a]ピリミジン誘導体 | |
| JP6872541B2 (ja) | [1,2,4]トリアゾロ[1,5−a]ピリミジン−7−イル化合物 | |
| JP7021208B2 (ja) | PDE2阻害剤としての[1,2,4]トリアゾロ[1,5-a]ピリミジン化合物 | |
| JP7018944B2 (ja) | PDE2阻害剤としての[1,2,4]トリアゾロ[1,5-a]ピリミジン化合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201030 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20201030 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20201030 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210831 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20210902 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211130 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20220105 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20220203 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7021208 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |