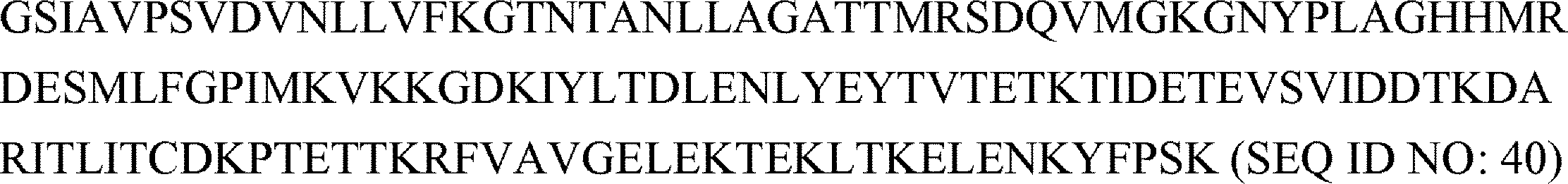JP6998862B2 - 可溶性ソルターゼa - Google Patents
可溶性ソルターゼa Download PDFInfo
- Publication number
- JP6998862B2 JP6998862B2 JP2018515482A JP2018515482A JP6998862B2 JP 6998862 B2 JP6998862 B2 JP 6998862B2 JP 2018515482 A JP2018515482 A JP 2018515482A JP 2018515482 A JP2018515482 A JP 2018515482A JP 6998862 B2 JP6998862 B2 JP 6998862B2
- Authority
- JP
- Japan
- Prior art keywords
- amino acid
- polypeptide
- sortase
- seq
- tag
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/52—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from bacteria or Archaea
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P21/00—Preparation of peptides or proteins
- C12P21/02—Preparation of peptides or proteins having a known sequence of two or more amino acids, e.g. glutathione
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/22—Cysteine endopeptidases (3.4.22)
- C12Y304/2207—Sortase A (3.4.22.70)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Genetics & Genomics (AREA)
- General Health & Medical Sciences (AREA)
- General Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Medicinal Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Peptides Or Proteins (AREA)
- Enzymes And Modification Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Description
ソルターゼA(SrtA)は、タンパク質を細菌細胞壁に共有結合で付着させる膜結合型酵素である。SrtA基質上の特異的な認識モチーフは、LPXTGであり、酵素は、残基トレオニンとグリシンとの間で切断する。ペプチドグリカン上の認識モチーフは、ペンタグリシンモチーフである。N末端のトリグリシンモチーフ、そしてジグリシンモチーフですら、SrtA反応を支持するのに十分であることが示されている(Clancy, K. W., et al., Peptide science 94(2010)385-396(非特許文献1))。その反応は、チオエステルアシル酵素中間体を通して進行し、それが、オリゴグリシンからのアミン求核剤の攻撃によって分離され、ペプチドグリカンがタンパク質基質に共有結合で連結され、SrtAが再生される。化学合成されたペプチドを組換え発現されたタンパク質に共有結合でコンジュゲートするため、SrtAを使用することが可能である。
(i)(任意で、C末端の100アミノ酸残基内に)アミノ酸配列LPXTG(SEQ ID NO:01、Xは任意のアミノ酸残基であり得る)またはLPXTA(SEQ ID NO:41、Xは任意のアミノ酸残基であり得る)を含む第1のポリペプチド、
(ii)(i)グリシニル化合物、アラニニル化合物、またはシステイニル化合物をN末端に含むか、あるいは(ii)オリゴグリシンまたはオリゴアラニンまたはシステインアミノ酸残基に続く1~3個のグリシンもしくはアラニンアミノ酸残基をN末端に含むか、あるいは(iii)リジンアミノ酸残基をN末端の5アミノ酸残基内に含む第2のポリペプチド、および
(iii)本明細書において報告されるポリペプチド
をインキュベートし、それによって、(融合)ポリペプチドを作製する工程
を含む、(融合)ポリペプチドの(酵素的)作製のための方法である。
[本発明1001]
SEQ ID NO:38のアミノ酸配列を有する1個のドメインおよび1個もしくは複数個のさらなるドメインを含むポリペプチドであって、SEQ ID NO:38のアミノ酸配列を有する該ドメインおよびいずれかの該さらなるドメインが、異なる生物に由来するポリペプチドであるかまたは合成/人工であり、両ドメインが、直接的にまたはペプチドリンカーを介して相互にコンジュゲートされている、ポリペプチド。
[本発明1002]
SEQ ID NO:38からなるポリペプチド。
[本発明1003]
ソルターゼモチーフを含むポリペプチドと、オリゴグリシンまたはオリゴアラニンまたはシステインアミノ酸残基に続く1~3個のグリシンもしくはアラニンアミノ酸残基をN末端に含むポリペプチドとのコンジュゲーションのための、本発明1001または1002のいずれかのポリペプチドの使用。
[本発明1004]
(i)アミノ酸配列LPXTG(SEQ ID NO:01、Xは任意のアミノ酸残基であり得る)またはLPXTA(SEQ ID NO:41、Xは任意のアミノ酸残基であり得る)を含む第1のポリペプチド、
(ii)(i)グリシニル化合物、アラニニル化合物、またはシステイニル化合物をN末端に含むか、あるいは(ii)オリゴグリシンまたはオリゴアラニンまたはシステインアミノ酸残基に続く1~3個のグリシンもしくはアラニンアミノ酸残基をN末端に含むか、あるいは(iii)リジンアミノ酸残基をN末端の5アミノ酸残基内に含む第2のポリペプチド、および
(iii)本発明1001または1002のいずれかのポリペプチド
をインキュベートし、それによって、ポリペプチドを作製する工程
を含む、ポリペプチドの酵素的作製のための方法。
[本発明1005]
2個のポリペプチドの酵素的コンジュゲーションのための、本発明1004の方法。
[本発明1006]
第2のポリペプチドがN末端にアミノ酸配列GGG、AAA、CGG、CAA、KGG、またはKAAを有する、本発明1004~1005のいずれかの方法。
[本発明1007]
第1のポリペプチドがアミノ酸配列LPXTG(SEQ ID NO:01、Xは任意のアミノ酸残基であり得る)またはLPXTA(SEQ ID NO:41、Xは任意のアミノ酸残基であり得る)をC末端に含む、本発明1004~1006のいずれかの方法。
[本発明1008]
第1のポリペプチドがアミノ酸配列LPETG(SEQ ID NO:04)またはLPETA(SEQ ID NO:42)をC末端に含む、本発明1004~1007のいずれかの方法。
[本発明1009]
第1のポリペプチドおよび第2のポリペプチドが相互に独立に、抗体可変ドメイン、抗体重鎖Fab断片、抗体Fc領域、タグ、ならびに、アミノ酸配列LPXTG(SEQ ID NO:01、Xは任意のアミノ酸残基であり得る)またはLPXTA(SEQ ID NO:41、Xは任意のアミノ酸残基であり得る)、リンカー、および非ソルターゼモチーフ部分を含むペプチドからなる群より選択される、本発明1004~1008のいずれかの方法。
本発明は、新規リステリア・モノサイトゲネスソルターゼAのN末端が短縮されたバリアントならびにN末端およびC末端が短縮されたバリアントが、酵素活性において予想外に異なるという所見に少なくとも一部分基づく。
「に由来する」という用語は、それぞれのアミノ酸配列が、同一のアミノ酸配列を含むか、またはアミノ酸配列の変化を含有しているか、または親アミノ酸配列の短縮バリアントもしくは融合バリアントであることを示す。
インビボでは共有結合で会合していない2種の要素を含む共有結合コンジュゲート(すなわち、融合ポリペプチド)を、酵素ソルターゼ、特に、ソルターゼAを使用することによって、インビトロで入手することができる。
新規リステリア・モノサイトゲネスソルターゼAの特異的にN末端が短縮された可溶性バリアントは、同一の新規リステリア・モノサイトゲネスソルターゼAの他のN末端またはC末端が短縮されたバリアントと比較して、増加した酵素活性を有することが見出された。
A:本明細書において報告されるリステリア・モノサイトゲネスソルターゼAバリアントA:
B:本明細書において報告されるリステリア・モノサイトゲネスソルターゼAバリアントB:
C:本明細書において報告されるリステリア・モノサイトゲネスソルターゼAバリアントC:
D:本明細書において報告されるリステリア・モノサイトゲネスソルターゼAバリアントD:
E:本明細書において報告されるリステリア・モノサイトゲネスソルターゼAバリアントE:
本明細書において報告される一つの局面は、
(i)アミノ酸配列LPXTG(SEQ ID NO:01、Xは任意のアミノ酸残基であり得る)またはLPXTA(SEQ ID NO:41、Xは任意のアミノ酸残基であり得る)を(任意で、C末端の100アミノ酸残基内に)含む第1のポリペプチド、
(ii)(i)グリシニル化合物、アラニニル化合物、またはシステイニル化合物をN末端に含むか、あるいは(ii)オリゴグリシンまたはオリゴアラニンまたはシステインアミノ酸残基に続く1~3個のグリシンもしくはアラニンアミノ酸残基をN末端に含むか、あるいは(iii)リジンアミノ酸残基をN末端の5アミノ酸残基内に含む第2のポリペプチド、および
(iii)本明細書において報告されるポリペプチド
をインキュベートし、それによって、ポリペプチドを作製する工程
を含む、ポリペプチドの酵素的作製のための方法である。
ソルターゼモチーフ(アミノ酸配列)は、これらの分子、治療剤(薬)、細胞傷害性薬剤(例えば、ドキソルビシンもしくは百日咳毒素のような毒素)、フルオレセインもしくはローダミンのような蛍光色素のようなフルオロフォア、イメージングもしくは放射線治療のための金属のキレート剤、ペプチド性もしくは非ペプチド性の標識、タグ、またはポリエチレングリコールの様々な異性体のようなクリアランス修飾剤、第3の成分に結合するペプチド、もう一つの炭水化物もしくは親油性薬剤、または、例えば、合成低分子(例えば、アセチルサリチル酸)のような低分子のうちの一つに直接含まれていない場合、コンジュゲートされてもよいしまたは組み入れられてもよい。モチーフがコンジュゲーションを介して組み入れられる場合、コンジュゲーションは、直接的であってもよいしまたは介在リンカーを介していてもよい。さらに、第1および/または第2のポリペプチドは、組換えによって作製されてもよいし、または合成であってもよいし、または半合成、即ち、組換えによって作製され、その後、化学的に修飾されたものであってもよい。
治療剤は、例えば、抗体、細胞傷害性もしくは細胞分裂阻害性の化合物のような、治療効果を有する任意の化合物、部分、または基であり得る。抗体は、全長のもしくは完全な抗体であってもよいしまたはそれらの抗原結合断片であってもよい。
非ソルターゼモチーフ部分は、標識であり得る。ソルターゼアミノ酸配列に共有結合で付着し得る任意の標識部分が使用され得る(例えば、Singh et al(2002)Anal.Biochem.304:147-15;Harlow E.and Lane,D.(1999)Using Antibodies:A Laboratory Manual,Cold Springs Harbor Laboratory Press,Cold Spring Harbor,N.Y.;Lundblad R.L.(1991)Chemical Reagents for Protein Modification,2nd ed.CRC Press,Boca Raton,Fla.を参照すること)。標識は、(i)検出可能なシグナルを提供するか;(ii)第1もしくは第2の標識によって提供される検出可能なシグナルを修飾するため、例えば、FRET(蛍光共鳴エネルギー転移)を与えるため、第2の標識と相互作用するか;(iii)電荷、疎水性、形、もしくはその他の物理的パラメータによって、移動度、例えば、電気泳動移動度もしくは細胞透過性に影響を与えるか、または(iv)例えば、イオン複合体化をモジュレートするため、キャプチャー部分を提供するよう、機能し得る。
(i)過酸化水素が色素前駆物質(例えば、オルトフェニレンジアミン(OPD)または3,3',5,5'-テトラメチルベンジジン塩酸塩(TMB))を酸化する、過酸化水素を基質として用いる西洋ワサビペルオキシダーゼ(HRP);
(ii)発色性基質としてパラニトロフェニルリン酸を用いるアルカリホスファターゼ(AP);および
(iii)発色性基質(例えば、p-ニトロフェニル-(3-D-ガラクトシダーゼ)または蛍光発生性基質4-メチルウンベリフェリル-(3-D-ガラクトシダーゼを用いる(3-D-ガラクトシダーゼ((3-D-Gal)。
「リンカー」という用語は、第1の部分を第2の部分とコンジュゲート(連結)するために使用され得る二官能性または多官能性の部分を意味する。2種の反応官能性を有するリンカーを使用して、連結されたコンジュゲートを便利に調製することができる。
例えばオリゴグリシンモチーフ(GG(SEQ ID NO: 28)、GGG(SEQ ID NO: 29)、GGGG(SEQ ID NO: 30)、GGGGG(SEQ ID NO: 31))などの求核性アミノ酸配列をN末端に含む任意のポリペプチドドメイン(例えば、scFv、scFab、もしくはdarpinのような単鎖抗原結合ポリペプチド、またはdsFvもしくはFabのような多鎖抗原結合ポリペプチド)を、発現させ、真核細胞(例えば、HEK293細胞、CHO細胞)の上清から精製することができる。ポリペプチドが、単離されたポリペプチドであるか、それとも多量体またはヘテロマーの要素に含まれているかは、重要でない。
Sambrook,J.et al.,Molecular cloning:A laboratory manual;Cold Spring Harbor Laboratory Press,Cold Spring Harbor,New York,1989に記載されているような標準的な方法を、DNAを操作するために使用した。分子生物学的試薬は、製造業者の説明書に従って使用された。
所望の遺伝子セグメントは、Geneart GmbH(Regensburg,Germany)において、化学合成によって調製された。合成された遺伝子断片を、増大/増幅のため、大腸菌プラスミドへクローニングした。サブクローニングされた遺伝子断片のDNA配列を、DNA配列決定によって確認した。あるいは、化学合成されたオリゴヌクレオチドのアニーリングによって、またはPCRによって、短い合成DNA断片を組み立てた。それぞれのオリゴヌクレオチドは、metabion GmbH(Planegg-Martinsried,Germany)によって調製された。
所望の遺伝子/タンパク質(例えば、全長抗体重鎖、全長抗体軽鎖、またはN末端にオリゴグリシンを含有しているFc鎖)の発現のため、以下の機能要素を含む転写単位を使用する:
-イントロンAを含むヒトサイトメガロウイルス(P-CMV)由来の前初期エンハンサーおよびプロモーター、
-ヒト重鎖免疫グロブリン5'非翻訳領域(5'UTR)、
-マウス免疫グロブリン重鎖シグナル配列、
-発現させるべき遺伝子/タンパク質(例えば、全長抗体重鎖)、ならびに
-ウシ成長ホルモンポリアデニル化配列(BGH pA)。
-大腸菌におけるこのプラスミドの複製を可能にするベクターpUC18由来の複製開始点、および
-大腸菌にアンピシリン耐性を付与するβラクタマーゼ遺伝子。
ポリペプチドのアミノ酸配列に基づき計算されたモル吸光係数を使用して、280nmにおける光学濃度(OD)を決定することによって、精製されたポリペプチドのタンパク質濃度を決定した。
可溶性ソルターゼAのための発現プラスミドの生成
黄色ブドウ球菌由来ソルターゼA
ソルターゼ遺伝子は、N末端が短縮された黄色ブドウ球菌ソルターゼA(60~206)分子(SEQ ID NO:05のアミノ酸配列)をコードする。
-T5プロモーター、
-精製タグ、
-N末端が短縮された黄色ブドウ球菌ソルターゼAをコードする核酸、ならびに
-Toおよびfdの終結配列。
-イントロンAを含むヒトサイトメガロウイルス(P-CMV)由来の最初期エンハンサーおよびプロモーター、
-ヒト重鎖免疫グロブリン5'非翻訳領域(5'UTR)、
-マウス免疫グロブリン重鎖シグナル配列、
-精製タグをコードする核酸、
-N末端が短縮された黄色ブドウ球菌ソルターゼAをコードする核酸、ならびに
-ウシ成長ホルモンポリアデニル化配列(BGH pA)。
ソルターゼ遺伝子は、N末端が短縮された化膿性連鎖球菌ソルターゼA分子(SEQ ID NO:06のアミノ酸配列)をコードする。
-T5プロモーター、
-精製タグ、
-N末端が短縮された化膿性連鎖球菌ソルターゼAをコードする核酸、ならびに
-Toおよびfdの終結配列。
-イントロンAを含むヒトサイトメガロウイルス(P-CMV)由来の最初期エンハンサーおよびプロモーター、
-ヒト重鎖免疫グロブリン5'非翻訳領域(5'UTR)、
-マウス免疫グロブリン重鎖シグナル配列、
-精製タグをコードする核酸、
-N末端が短縮された化膿性連鎖球菌ソルターゼAをコードする核酸、ならびに
-ウシ成長ホルモンポリアデニル化配列(BGH pA)。
N末端が短縮されたリステリア・モノサイトゲネスソルターゼA分子をコードする異なるソルターゼ遺伝子を発現させた:
A:本明細書において報告されるリステリア・モノサイトゲネスソルターゼAバリアントA:
B:本明細書において報告されるリステリア・モノサイトゲネスソルターゼAバリアントB:
C:本明細書において報告されるリステリア・モノサイトゲネスソルターゼAバリアントC:
D:本明細書において報告されるリステリア・モノサイトゲネスソルターゼAバリアントD:
E:本明細書において報告されるリステリア・モノサイトゲネスソルターゼAバリアントE:
-T5プロモーター、
-精製タグ、
-リステリア・モノサイトゲネスソルターゼAバリアントをコードする核酸、ならびに
-Toおよびfdの終結配列。
-イントロンAを含むヒトサイトメガロウイルス(P-CMV)由来の最初期エンハンサーおよびプロモーター、
-ヒト重鎖免疫グロブリン5'非翻訳領域(5'UTR)、
-マウス免疫グロブリン重鎖シグナル配列、
-精製タグをコードする核酸、
-L.モノサイトゲネスソルターゼAバリアントをコードする核酸、ならびに
-ウシ成長ホルモンポリアデニル化配列(BGH pA)。
一過性発現および分析的特徴決定
大腸菌:
それぞれのソルターゼ発現プラスミドによって形質転換された大腸菌細胞を37℃でおよそ0.9のOD578にまで増殖させること(予備培養)によって、ソルターゼの組換え作製を実施した。このおよそ0.9のOD578で、2mM IPTGを添加し、28℃においてさらに24時間細胞を増殖させることによって、タンパク質発現を誘導した。その後、細胞を遠心分離によって採集し、ホモジナイザーを使用して高圧を介して溶解した。細胞片を除去するため、細胞溶解物を遠心分離し、その後、精製まで、低温(例えば、-80℃)で細胞溶解物を保管した。可溶性ソルターゼを、Ni-NTAクロマトグラフィ後のサイズ排除クロマトグラフィを使用して精製した。内毒素の枯渇のため、陰イオン交換クロマトグラフィをフロースルーモードで実施した。アミノ酸配列に基づき計算されたモル吸光係数を使用して、280nmでの光学濃度(OD)を測定することによって、ソルターゼ調製物のタンパク質濃度を決定した。還元剤(5mM 1,4-ジチオスレイトール)の存在下および非存在下でのSDS-PAGEならびにクーマシーブリリアントブルーによる染色によって、ソルターゼの純度および完全性を決定した。
F17培地(Invitrogen Corp.)において培養されたHEK293細胞(ヒト胎児腎臓細胞株293由来)の一過性トランスフェクションによって、組換え作製を実施した。トランスフェクションのため、「293-Fectin」トランスフェクション試薬(Invitrogen)を使用した。製造業者の説明書に指定されたように、トランスフェクションを実施した。細胞培養上清をトランスフェクションの3~7日後に採集した。上清を低温(例えば、-80℃)で保管した。
活性アッセイ
40μlの各バリアントを80μlの基質溶液(50mMトリスpH7.5、200mM NaCl、10mM CaCl2、30μMグルコースデヒドロゲナーゼ(ソルターゼ反応の基質のうちの一つ(LPXTG)を含有)、およびビオチン(ソルターゼ反応の他の基質、GGGGを含有))と混合した。この反応混合物を37℃で2時間インキュベートした。その後、反応混合物を5000×gで10分間遠心分離した。上清(50μL)を、200mM NaCl、10mM CaCl2、およびストレプトアビジンによってコーティングされた磁気ビーズを含む100μLの50mMトリス緩衝液(pH7.5)に添加した。混合物を200rpmで30℃で30分間インキュベートした。その後、磁気ビーズを、磁石および真空ポンプを使用して、V底マイクロタイタープレートにおいて、各300μLの洗浄緩衝液(50mMトリス、pH7.5、200mM NaCl、10mM CaCl2、5mg/mL BSA、0.1%トリトンX-100)によって5回洗浄した。その後、ビーズを、100μLのクエン酸緩衝液に再懸濁させ、そのうちの10μLを新しいウェルに移した。それに、150μLの試験緩衝液(0.2Mクエン酸ナトリウム、pH5.8、0.3g/L 4-ニトロソアニリン、1mM CaCl2、30mMグルコース)を添加した。レポーター酵素の動力学を、620nmで5分間にわたり測定した。
動力学的アッセイ
酵素量
異なる濃度のソルターゼ(0.02mg/ml、0.17mg/ml、0.33mg/ml、0.67mg/ml、1.33mg/ml、2.00mg/ml、2.67mg/ml、3.33mg/ml)を、基質溶液(50mMトリスpH7.5、200mM NaCl、10mM CaCl2、92μMグルコースデヒドロゲナーゼ(ソルターゼ反応の基質のうちの一つ(LPKTA)を含有)、および7μMビオチン(ソルターゼ反応の他の基質AAAAを含有)、および7μMビオチン(ソルターゼ反応の他の基質GGGGを含有))と混合した。この反応混合物を37℃で2時間インキュベートした。20倍過剰の阻害緩衝液(50mMトリス、pH7.5、200mM NaCl、10mM CaCl2、5mMヨードアセトアミド)の添加によって、反応を停止させた。停止した反応混合物を、5000×gで10分間遠心分離した。上清(50μL)を、200mM NaCl、10mM CaCl2、およびストレプトアビジンによってコーティングされた磁気ビーズを含む、100μLの50mMトリス緩衝液(pH7.5)に添加した。混合物を、200rpmで30℃で30分間インキュベートした。その後、磁気ビーズを、磁石および真空ポンプを使用して、V底マルチウェルプレートにおいて各300μLの洗浄緩衝液(50mMトリス、pH7.5、200mM NaCl、10mM CaCl2、5mg/mL BSA、0.1%トリトンX-100)によって5回洗浄した。その後、ビーズを、100μLのクエン酸緩衝液に再懸濁させ、そのうちの10μLを新しいウェルに移した。それに、150μLの試験緩衝液(0.2Mクエン酸ナトリウム、pH5.8、0.3g/L 4-ニトロソアニリン、1mM CaCl2、30mMグルコース)を添加した。レポーター酵素の動力学を、620nmで5分間にわたり測定した。
固定された濃度のソルターゼ(0.67mg/ml)を、基質溶液(50mMトリスpH7.5、200mM NaCl、10mM CaCl2、92μMグルコースデヒドロゲナーゼ(ソルターゼ反応の基質のうちの一つ(LPKTA)を含有)および7μMビオチン(ソルターゼ反応の他の基質AAAAを含有)および7μMビオチン(ソルターゼ反応の他の基質GGGGを含有))と混合した。この反応混合物を、37℃で2時間、6.5時間、または18時間インキュベートした。20倍過剰の阻害緩衝液(50mMトリス、pH7.5、200mM NaCl、10mM CaCl2、5mMヨードアセトアミド)の添加によって、反応を停止させた。停止した反応混合物を、5000×gで10分間遠心分離した。上清(50μL)を、200mM NaCl、10mM CaCl2、およびストレプトアビジンによってコーティングされた磁気ビーズを含む、100μLの50mMトリス緩衝液(pH7.5)に添加した。混合物を、200rpmで30℃で30分間インキュベートした。その後、磁気ビーズを、磁石および真空ポンプを使用して、V底マルチウェルプレートにおいて各300μLの洗浄緩衝液(50mMトリス、pH7.5、200mM NaCl、10mM CaCl2、5mg/mL BSA、0.1%トリトンX-100)によって5回洗浄した。その後、ビーズを、100μLのクエン酸緩衝液に再懸濁させ、そのうちの10μLを新しいウェルに移した。それに、150μLの試験緩衝液(0.2Mクエン酸ナトリウム、pH5.8、0.3g/L 4-ニトロソアニリン、1mM CaCl2、30mMグルコース)を添加した。レポーター酵素の動力学を、620nmで5分間にわたり測定した。
固定された濃度のリステリア・モノサイトゲネスソルターゼバリアントC(1mg/ml)を、基質溶液(50mMトリスpH7.5、200mM NaCl、10mM CaCl2、2.5μM、5μM、10μM、20μM、40μM、80μM、160μM、325μM、650μM、1300μMグルコースデヒドロゲナーゼ(ソルターゼ反応の基質のうちの一つ(LPKTA)を含有)および14μMビオチン(ソルターゼ反応の他の基質GGGGを含有))と混合した。この反応混合物を37℃で2時間インキュベートした。20倍過剰の阻害緩衝液(50mMトリス、pH7.5、200mM NaCl、10mM CaCl2、5mMヨードアセトアミド)の添加によって反応を停止させた。停止した反応混合物を、5000×gで10分間遠心分離した。上清(50μL)を、200mM NaCl、10mM CaCl2、およびストレプトアビジンによってコーティングされた磁気ビーズを含む、100μLの50mMトリス緩衝液(pH7.5)に添加した。混合物を、200rpmで30℃で30分間インキュベートした。その後、磁気ビーズを、磁石および真空ポンプを使用して、V底マルチウェルプレートにおいて各300μLの洗浄緩衝液(50mMトリス、pH7.5、200mM NaCl、10mM CaCl2、5mg/mL BSA、0.1%トリトンX-100)によって5回洗浄した。その後、ビーズを、100μLクエン酸緩衝液に再懸濁させ、そのうちの40μLを新しいウェルに移した。それに、150μLの試験緩衝液(0.2Mクエン酸ナトリウム、pH5.8、0.3g/L 4-ニトロソアニリン、1mM CaCl2、30mMグルコース)を添加した。レポーター酵素の動力学を、620nmで5分間にわたり測定した。
固定された濃度の化膿性連鎖球菌ソルターゼ(3mg/ml)を、基質溶液(50mMトリスpH7.5、200mM NaCl、10mM CaCl2、2.5μM、5μM、10μM、20μM、40μM、80μM、160μM、325μM、650μM、1300μMグルコースデヒドロゲナーゼ(ソルターゼ反応の基質のうちの一つ(LPKTA)を含有)および14μMビオチン(ソルターゼ反応の他の基質GGGGを含有))と混合した。この反応混合物を37℃で2時間インキュベートした。20倍過剰の阻害緩衝液(50mMトリス、pH7.5、200mM NaCl、10mM CaCl2、5mMヨードアセトアミド)の添加によって、反応を停止させた。停止した反応混合物を、5000×gで10分間遠心分離した。上清(50μL)を、200mM NaCl、10mM CaCl2、およびストレプトアビジンによってコーティングされた磁気ビーズを含む、100μLの50mMトリス緩衝液(pH7.5)に添加した。混合物を、200rpmで30℃で30分間インキュベートした。その後、磁気ビーズを、磁石および真空ポンプを使用して、V底マルチウェルプレートにおいて各300μLの洗浄緩衝液(50mMトリス、pH7.5、200mM NaCl、10mM CaCl2、5mg/mL BSA、0.1%トリトンX-100)によって5回洗浄した。その後、ビーズを、100μLクエン酸緩衝液に再懸濁させ、そのうちの40μLを新しいウェルに移した。それに、150μLの試験緩衝液(0.2Mクエン酸ナトリウム、pH5.8、0.3g/L 4-ニトロソアニリン、1mM CaCl2、30mMグルコース)を添加した。レポーター酵素の動力学を、620nmで5分間にわたり測定した。
Claims (10)
- a) 配列番号38のアミノ酸配列、および
b) 配列番号38のアミノ酸配列のN末端またはC末端にあるアフィニティタグまたは精製タグ
からなるポリペプチドであって、該タグが、配列番号38のアミノ酸配列に直接的にまたは介在するリンカーを介してコンジュゲートされている、前記ポリペプチド。 - タグが、Argタグ、Hisタグ、Flagタグ、3×Flagタグ、Strepタグ、HAタグ、ナノタグ、SBPタグ、c-mycタグ、Sタグ、SNUTタグ、NusA、T7、チオレドキシン、カルモジュリン結合ペプチド、セルロース結合ドメイン、キチン結合ドメイン、GSTタグ、またはMBPタグより選択される、請求項1記載のポリペプチド。
- 配列番号38のアミノ酸配列からなるポリペプチド。
- ソルターゼモチーフを含むポリペプチドと、
a)オリゴグリシンをN末端に含むか、または
b)オリゴアラニンをN末端に含むか、または
c)1~3個のグリシンもしくはアラニンアミノ酸残基が後に続くシステインアミノ酸残基をN末端に含むポリペプチドとの、コンジュゲーションのための、請求項1~3のいずれか一項記載のポリペプチドの使用。 - (i)アミノ酸配列LPXTG(配列番号01、Xは任意のアミノ酸残基であり得る)またはLPXTA(配列番号41、Xは任意のアミノ酸残基であり得る)を含む第1のポリペプチド、
(ii)(a)グリシニル化合物、またはアラニニル化合物をN末端に含むか、あるいは(b)オリゴグリシンまたはオリゴアラニンをN末端に含むか、あるいは(c)1~3個のグリシンもしくはアラニンアミノ酸残基が後に続くシステインアミノ酸残基をN末端に含む第2のポリペプチド、および
(iii)請求項1~3のいずれか一項記載のポリペプチド
をインキュベートし、それによって、ポリペプチドを作製する工程
を含む、ポリペプチドの酵素的作製のための方法。 - 2個のポリペプチドの酵素的コンジュゲーションのための、請求項5記載の方法。
- 第2のポリペプチドがN末端にアミノ酸配列GGG、AAA、CGG、またはCAAを有する、請求項5~6のいずれか一項記載の方法。
- 第1のポリペプチドがアミノ酸配列LPXTG(配列番号01、Xは任意のアミノ酸残基であり得る)またはLPXTA(配列番号41、Xは任意のアミノ酸残基であり得る)をC末端に含む、請求項5~7のいずれか一項記載の方法。
- 第1のポリペプチドがアミノ酸配列LPETG(配列番号04)またはLPETA(配列番号42)をC末端に含む、請求項5~8のいずれか一項記載の方法。
- 第1のポリペプチドおよび第2のポリペプチドが相互に独立に、抗体可変ドメイン、抗体重鎖Fab断片、抗体Fc領域、タグ、ならびに、アミノ酸配列LPXTG(配列番号01、Xは任意のアミノ酸残基であり得る)またはLPXTA(配列番号41、Xは任意のアミノ酸残基であり得る)、リンカー、および非ソルターゼモチーフ部分を含むペプチドから選択される、請求項5~9のいずれか一項記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP15186951.8 | 2015-09-25 | ||
| EP15186951 | 2015-09-25 | ||
| PCT/EP2016/072502 WO2017050866A1 (en) | 2015-09-25 | 2016-09-22 | Novel soluble sortase a |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2018531006A JP2018531006A (ja) | 2018-10-25 |
| JP2018531006A6 JP2018531006A6 (ja) | 2018-12-13 |
| JP6998862B2 true JP6998862B2 (ja) | 2022-02-04 |
Family
ID=54207360
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018515482A Active JP6998862B2 (ja) | 2015-09-25 | 2016-09-22 | 可溶性ソルターゼa |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US11306302B2 (ja) |
| EP (1) | EP3353291B1 (ja) |
| JP (1) | JP6998862B2 (ja) |
| CN (1) | CN108138158B (ja) |
| HK (1) | HK1255457A1 (ja) |
| WO (1) | WO2017050866A1 (ja) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN116949004B (zh) * | 2023-07-13 | 2024-04-09 | 苏州源启生物科技有限公司 | 一种转肽酶Sortase A及其制备方法和应用 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014001324A1 (en) | 2012-06-27 | 2014-01-03 | Hoffmann-La Roche Ag | Method for selection and production of tailor-made highly selective and multi-specific targeting entities containing at least two different binding entities and uses thereof |
| WO2014001325A1 (en) | 2012-06-27 | 2014-01-03 | F. Hoffmann-La Roche Ag | Method for making antibody fc-region conjugates comprising at least one binding entity that specifically binds to a target and uses thereof |
| WO2014183066A2 (en) | 2013-05-10 | 2014-11-13 | Whitehead Institute For Biomedical Research | Protein modification of living cells using sortase |
Family Cites Families (52)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4150149A (en) | 1976-11-29 | 1979-04-17 | Professional Staff Association Of The Los Angeles County Harbor General Hospital | Method and means for the early detection and diagnosis of certain types of cancers |
| US4275149A (en) | 1978-11-24 | 1981-06-23 | Syva Company | Macromolecular environment control in specific receptor assays |
| US4318980A (en) | 1978-04-10 | 1982-03-09 | Miles Laboratories, Inc. | Heterogenous specific binding assay employing a cycling reactant as label |
| US4361544A (en) | 1980-03-03 | 1982-11-30 | Goldenberg Milton David | Tumor localization and therapy with labeled antibodies specific to intracellular tumor-associated markers |
| US4444744A (en) | 1980-03-03 | 1984-04-24 | Goldenberg Milton David | Tumor localization and therapy with labeled antibodies to cell surface antigens |
| US5342606A (en) | 1984-10-18 | 1994-08-30 | Board Of Regents, The University Of Texas System | Polyazamacrocyclic compounds for complexation of metal ions |
| US5316757A (en) | 1984-10-18 | 1994-05-31 | Board Of Regents, The University Of Texas System | Synthesis of polyazamacrocycles with more than one type of side-chain chelating groups |
| US4737456A (en) | 1985-05-09 | 1988-04-12 | Syntex (U.S.A.) Inc. | Reducing interference in ligand-receptor binding assays |
| US5143854A (en) | 1989-06-07 | 1992-09-01 | Affymax Technologies N.V. | Large scale photolithographic solid phase synthesis of polypeptides and receptor binding screening thereof |
| US5959177A (en) | 1989-10-27 | 1999-09-28 | The Scripps Research Institute | Transgenic plants expressing assembled secretory antibodies |
| EP0861893A3 (en) | 1991-09-19 | 1999-11-10 | Genentech, Inc. | High level expression of immunoglobulin polypeptides |
| US5739294A (en) | 1991-12-10 | 1998-04-14 | The Dow Chemical Company | Bicyclopol yazamacrocyclophosphonic acid complexes for use as contrast agents |
| US5428139A (en) | 1991-12-10 | 1995-06-27 | The Dow Chemical Company | Bicyclopolyazamacrocyclophosphonic acid complexes for use as radiopharmaceuticals |
| US5480990A (en) | 1991-12-10 | 1996-01-02 | The Dow Chemical Company | Bicyclopolyazamacrocyclocarboxylic acid complexes for use as contrast agents |
| ZA932522B (en) | 1992-04-10 | 1993-12-20 | Res Dev Foundation | Immunotoxins directed against c-erbB-2(HER/neu) related surface antigens |
| ES2152483T3 (es) | 1992-11-13 | 2001-02-01 | Idec Pharma Corp | Aplicacion terapeutica en anticuerpos quimericos y radiomarcados contra el antigeno de diferenciacion restringida de los linfocitos b humanos para el tratamiento del linfoma de celulas b. |
| US5385893A (en) | 1993-05-06 | 1995-01-31 | The Dow Chemical Company | Tricyclopolyazamacrocyclophosphonic acids, complexes and derivatives thereof, for use as contrast agents |
| US5462725A (en) | 1993-05-06 | 1995-10-31 | The Dow Chemical Company | 2-pyridylmethylenepolyazamacrocyclophosphonic acids, complexes and derivatives thereof, for use as contrast agents |
| US5789199A (en) | 1994-11-03 | 1998-08-04 | Genentech, Inc. | Process for bacterial production of polypeptides |
| US5840523A (en) | 1995-03-01 | 1998-11-24 | Genetech, Inc. | Methods and compositions for secretion of heterologous polypeptides |
| US5834456A (en) | 1996-02-23 | 1998-11-10 | The Dow Chemical Company | Polyazamacrocyclofluoromonoalkylphosphonic acids, and their complexes, for use as contrast agents |
| US6022688A (en) | 1996-05-13 | 2000-02-08 | Sequenom, Inc. | Method for dissociating biotin complexes |
| CN1173776C (zh) | 1996-06-28 | 2004-11-03 | 卡钳技术有限公司 | 在微规模流体性设备里的高通过量的筛选分析系统 |
| US6133436A (en) | 1996-11-06 | 2000-10-17 | Sequenom, Inc. | Beads bound to a solid support and to nucleic acids |
| US5900481A (en) | 1996-11-06 | 1999-05-04 | Sequenom, Inc. | Bead linkers for immobilizing nucleic acids to solid supports |
| US6447727B1 (en) | 1996-11-19 | 2002-09-10 | Caliper Technologies Corp. | Microfluidic systems |
| US6235471B1 (en) | 1997-04-04 | 2001-05-22 | Caliper Technologies Corp. | Closed-loop biochemical analyzers |
| US6040498A (en) | 1998-08-11 | 2000-03-21 | North Caroline State University | Genetically engineered duckweed |
| US6100541A (en) | 1998-02-24 | 2000-08-08 | Caliper Technologies Corporation | Microfluidic devices and systems incorporating integrated optical elements |
| US6528624B1 (en) | 1998-04-02 | 2003-03-04 | Genentech, Inc. | Polypeptide variants |
| CA2383186A1 (en) | 1999-09-03 | 2001-03-15 | Yale University | Method to identify gene function using small molecule probes |
| JP2003512821A (ja) | 1999-10-04 | 2003-04-08 | メディカゴ インコーポレイテッド | 外来性遺伝子の転写調節方法 |
| US7125978B1 (en) | 1999-10-04 | 2006-10-24 | Medicago Inc. | Promoter for regulating expression of foreign genes |
| AT410798B (de) | 2001-01-26 | 2003-07-25 | Cistem Biotechnologies Gmbh | Verfahren zur identifizierung, isolierung und herstellung von antigenen gegen ein spezifisches pathogen |
| US20100111856A1 (en) | 2004-09-23 | 2010-05-06 | Herman Gill | Zirconium-radiolabeled, cysteine engineered antibody conjugates |
| KR101328756B1 (ko) | 2006-05-30 | 2013-11-18 | 제넨테크, 인크. | 항체 및 면역접합체 및 이들의 용도 |
| US8247198B2 (en) | 2007-09-21 | 2012-08-21 | Friedrich Srienc | Enzymatic processing in deep eutectic solvents |
| US8940501B2 (en) | 2009-01-30 | 2015-01-27 | Whitehead Institute For Biomedical Research | Methods for ligation and uses thereof |
| US8648176B2 (en) | 2009-02-27 | 2014-02-11 | Massachusetts Institute Of Technology | Engineered proteins with high affinity for DOTA chelates |
| WO2012145522A2 (en) | 2011-04-19 | 2012-10-26 | Georgia Tech Research Corporation | Deep eutectic solvent systems and methods |
| AU2012275390A1 (en) | 2011-06-28 | 2014-01-16 | Whitehead Institute For Biomedical Research | Using sortases to install click chemistry handles for protein ligation |
| US9588110B2 (en) * | 2011-07-28 | 2017-03-07 | Cell Signaling Technology, Inc. | Multi component antibody based detection technology |
| EP2836638A1 (en) | 2012-04-12 | 2015-02-18 | Technische Universiteit Eindhoven | Pretreatment of lignocellulosic biomass and recovery of substituents using natural deep eutectic solvents/compound mixtures with low transition temperatures |
| WO2013177221A1 (en) | 2012-05-21 | 2013-11-28 | Massachusetts Institute Of Technology | Protein retrosplicing enabled by a double ligation reaction |
| US20140030697A1 (en) | 2012-06-14 | 2014-01-30 | Massachusetts Institute Of Technology | Sortase-mediated modification of viral surface proteins |
| US9267127B2 (en) | 2012-06-21 | 2016-02-23 | President And Fellows Of Harvard College | Evolution of bond-forming enzymes |
| WO2014055936A1 (en) | 2012-10-04 | 2014-04-10 | Integenx Inc. | Preservation of biological materials in non-aqueous fluid media |
| GB201303666D0 (en) | 2013-03-01 | 2013-04-17 | Goldsborough Andrew S | Sample fixation and stabilisation |
| EP2777714A1 (en) | 2013-03-15 | 2014-09-17 | NBE-Therapeutics LLC | Method of producing an immunoligand/payload conjugate by means of a sequence-specific transpeptidase enzyme |
| US9631218B2 (en) | 2013-03-15 | 2017-04-25 | The Trustees Of The University Of Pennsylvania | Sortase-mediated protein purification and ligation |
| KR101808223B1 (ko) | 2013-04-25 | 2017-12-13 | 주식회사 앱틀라스 | 자가 절단 카세트를 포함하는 단백질 정제 방법 및 이의 용도 |
| US20180104349A9 (en) | 2013-04-28 | 2018-04-19 | Gang Qin | Novel linker, preparation method, and application thereof |
-
2016
- 2016-09-22 JP JP2018515482A patent/JP6998862B2/ja active Active
- 2016-09-22 EP EP16775560.2A patent/EP3353291B1/en active Active
- 2016-09-22 WO PCT/EP2016/072502 patent/WO2017050866A1/en active Application Filing
- 2016-09-22 CN CN201680055734.7A patent/CN108138158B/zh active Active
-
2018
- 2018-03-23 US US15/933,705 patent/US11306302B2/en active Active
- 2018-11-15 HK HK18114630.7A patent/HK1255457A1/zh unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014001324A1 (en) | 2012-06-27 | 2014-01-03 | Hoffmann-La Roche Ag | Method for selection and production of tailor-made highly selective and multi-specific targeting entities containing at least two different binding entities and uses thereof |
| WO2014001325A1 (en) | 2012-06-27 | 2014-01-03 | F. Hoffmann-La Roche Ag | Method for making antibody fc-region conjugates comprising at least one binding entity that specifically binds to a target and uses thereof |
| WO2014183066A2 (en) | 2013-05-10 | 2014-11-13 | Whitehead Institute For Biomedical Research | Protein modification of living cells using sortase |
Non-Patent Citations (3)
| Title |
|---|
| Class A sortase,DATABASE uniport KB acsession no.A0A0B8RCN4,検索日2020年7月10日,2015年09月16日,https://www.uniprot.org/uniprot/A0A0B8RCN4.txt?version=6 |
| Nature Protocols,2013年,Vol.8, No.9,pp.1787-1799 |
| Putative cysteine protease ywpE,DATABASE Uniport KB accession no.A0A0E1R5I2,検索日2020年7月10日,2015年09月16日,https://www.uniprot.org/uniprot/A0A0E1R5I2.txt?version=4 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20180216091A1 (en) | 2018-08-02 |
| US11306302B2 (en) | 2022-04-19 |
| WO2017050866A1 (en) | 2017-03-30 |
| CN108138158B (zh) | 2021-11-09 |
| HK1255457A1 (zh) | 2019-08-16 |
| CN108138158A (zh) | 2018-06-08 |
| EP3353291B1 (en) | 2021-06-09 |
| JP2018531006A (ja) | 2018-10-25 |
| EP3353291A1 (en) | 2018-08-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11572552B2 (en) | Sortase | |
| JP2022025094A (ja) | 深共融溶媒におけるソルターゼaを利用したアミド基転移 | |
| JP6618539B2 (ja) | ソルターゼを使用した酵素媒介性のポリペプチドコンジュゲーションのための方法 | |
| JP7014725B2 (ja) | チオールベースの深共融溶媒 | |
| JP2018531009A6 (ja) | 深共融溶媒におけるソルターゼaを利用したアミド基転移 | |
| US11162088B2 (en) | Production of thioesters using sortase | |
| JP2018531008A6 (ja) | ソルターゼaを利用してチオエステルを作製するための方法 | |
| US11162127B2 (en) | Enzymatic one-pot reaction for double polypeptide conjugation in a single step | |
| JP6998862B2 (ja) | 可溶性ソルターゼa | |
| JP2018531006A6 (ja) | 可溶性ソルターゼa |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20190910 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20200625 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200720 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200929 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210118 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210310 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210526 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210825 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20211129 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20211221 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6998862 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |