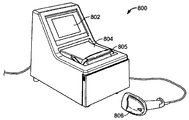
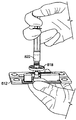
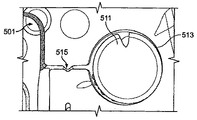
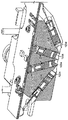
JP6265581B2 - Integrated system for processing microfluidic samples and methods of use thereof - Google Patents
Integrated system for processing microfluidic samples and methods of use thereof Download PDFInfo
- Publication number
- JP6265581B2 JP6265581B2 JP2011275368A JP2011275368A JP6265581B2 JP 6265581 B2 JP6265581 B2 JP 6265581B2 JP 2011275368 A JP2011275368 A JP 2011275368A JP 2011275368 A JP2011275368 A JP 2011275368A JP 6265581 B2 JP6265581 B2 JP 6265581B2
- Authority
- JP
- Japan
- Prior art keywords
- sample
- microfluidic
- cartridge
- polynucleotide
- liquid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000012545 processing Methods 0.000 title description 115
- 238000000034 method Methods 0.000 title description 82
- 108091033319 polynucleotide Proteins 0.000 claims description 343
- 102000040430 polynucleotide Human genes 0.000 claims description 343
- 239000002157 polynucleotide Substances 0.000 claims description 342
- 239000007788 liquid Substances 0.000 claims description 278
- 239000000463 material Substances 0.000 claims description 91
- 238000006243 chemical reaction Methods 0.000 claims description 48
- 239000012530 fluid Substances 0.000 claims description 39
- 239000000758 substrate Substances 0.000 claims description 28
- 230000033001 locomotion Effects 0.000 claims description 26
- 238000003753 real-time PCR Methods 0.000 claims description 17
- 238000000926 separation method Methods 0.000 claims description 5
- 230000000903 blocking effect Effects 0.000 claims description 2
- 230000005012 migration Effects 0.000 claims 1
- 238000013508 migration Methods 0.000 claims 1
- 239000000523 sample Substances 0.000 description 498
- 238000003752 polymerase chain reaction Methods 0.000 description 138
- 239000002245 particle Substances 0.000 description 127
- 239000003153 chemical reaction reagent Substances 0.000 description 118
- 241000193990 Streptococcus sp. 'group B' Species 0.000 description 97
- 108020004414 DNA Proteins 0.000 description 94
- 239000000243 solution Substances 0.000 description 90
- 239000011324 bead Substances 0.000 description 77
- 238000012360 testing method Methods 0.000 description 76
- 239000000872 buffer Substances 0.000 description 71
- 238000001514 detection method Methods 0.000 description 64
- 239000012472 biological sample Substances 0.000 description 57
- 239000007789 gas Substances 0.000 description 53
- 239000000203 mixture Substances 0.000 description 53
- 238000004458 analytical method Methods 0.000 description 52
- 230000009089 cytolysis Effects 0.000 description 52
- 239000003112 inhibitor Substances 0.000 description 51
- 238000010438 heat treatment Methods 0.000 description 49
- 239000012807 PCR reagent Substances 0.000 description 46
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 45
- 230000002209 hydrophobic effect Effects 0.000 description 41
- 239000013612 plasmid Substances 0.000 description 40
- 238000002156 mixing Methods 0.000 description 39
- 239000002699 waste material Substances 0.000 description 35
- 108091093088 Amplicon Proteins 0.000 description 33
- 210000004027 cell Anatomy 0.000 description 33
- 102000004190 Enzymes Human genes 0.000 description 32
- 108090000790 Enzymes Proteins 0.000 description 32
- 229940088598 enzyme Drugs 0.000 description 32
- 230000007246 mechanism Effects 0.000 description 29
- 102000005962 receptors Human genes 0.000 description 28
- 239000008188 pellet Substances 0.000 description 27
- 108090000623 proteins and genes Proteins 0.000 description 26
- 230000003321 amplification Effects 0.000 description 25
- 238000006386 neutralization reaction Methods 0.000 description 25
- 238000003199 nucleic acid amplification method Methods 0.000 description 25
- 229920000729 poly(L-lysine) polymer Polymers 0.000 description 25
- 238000004891 communication Methods 0.000 description 22
- 239000013642 negative control Substances 0.000 description 22
- 238000004090 dissolution Methods 0.000 description 21
- 238000002360 preparation method Methods 0.000 description 21
- 238000012546 transfer Methods 0.000 description 21
- 230000003472 neutralizing effect Effects 0.000 description 20
- 238000011144 upstream manufacturing Methods 0.000 description 20
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 20
- 241000894006 Bacteria Species 0.000 description 19
- 238000005516 engineering process Methods 0.000 description 19
- 230000014759 maintenance of location Effects 0.000 description 19
- 230000008569 process Effects 0.000 description 18
- KDXKERNSBIXSRK-RXMQYKEDSA-N D-lysine Chemical compound NCCCC[C@@H](N)C(O)=O KDXKERNSBIXSRK-RXMQYKEDSA-N 0.000 description 17
- 238000004140 cleaning Methods 0.000 description 17
- 238000011068 loading method Methods 0.000 description 17
- 239000013641 positive control Substances 0.000 description 17
- 230000000295 complement effect Effects 0.000 description 16
- 238000004590 computer program Methods 0.000 description 16
- 238000010586 diagram Methods 0.000 description 16
- 230000000717 retained effect Effects 0.000 description 16
- 239000011800 void material Substances 0.000 description 16
- 239000004952 Polyamide Substances 0.000 description 15
- 230000006870 function Effects 0.000 description 15
- 230000003287 optical effect Effects 0.000 description 15
- 229920002647 polyamide Polymers 0.000 description 15
- 229920000642 polymer Polymers 0.000 description 15
- 102000004169 proteins and genes Human genes 0.000 description 15
- 239000011534 wash buffer Substances 0.000 description 15
- 108010059712 Pronase Proteins 0.000 description 14
- 238000011109 contamination Methods 0.000 description 14
- 238000005382 thermal cycling Methods 0.000 description 14
- 210000004369 blood Anatomy 0.000 description 13
- 239000008280 blood Substances 0.000 description 13
- 239000007850 fluorescent dye Substances 0.000 description 13
- 239000001993 wax Substances 0.000 description 13
- 150000001875 compounds Chemical class 0.000 description 12
- 230000000994 depressogenic effect Effects 0.000 description 12
- 238000007689 inspection Methods 0.000 description 12
- 230000004044 response Effects 0.000 description 12
- 229920002873 Polyethylenimine Polymers 0.000 description 11
- 241000700605 Viruses Species 0.000 description 11
- 239000000975 dye Substances 0.000 description 11
- 239000012528 membrane Substances 0.000 description 11
- 239000002773 nucleotide Substances 0.000 description 11
- 125000003729 nucleotide group Chemical group 0.000 description 11
- 238000007789 sealing Methods 0.000 description 10
- 239000000126 substance Substances 0.000 description 10
- 241000588724 Escherichia coli Species 0.000 description 9
- 241000233866 Fungi Species 0.000 description 9
- 241000194017 Streptococcus Species 0.000 description 9
- 239000007853 buffer solution Substances 0.000 description 9
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 9
- 244000052769 pathogen Species 0.000 description 9
- 239000002683 reaction inhibitor Substances 0.000 description 9
- 230000007704 transition Effects 0.000 description 9
- 238000005406 washing Methods 0.000 description 9
- 241000194033 Enterococcus Species 0.000 description 8
- 241000282414 Homo sapiens Species 0.000 description 8
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 8
- 239000007983 Tris buffer Substances 0.000 description 8
- 238000001917 fluorescence detection Methods 0.000 description 8
- 230000000670 limiting effect Effects 0.000 description 8
- 238000004519 manufacturing process Methods 0.000 description 8
- 238000003860 storage Methods 0.000 description 8
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 8
- 239000002577 cryoprotective agent Substances 0.000 description 7
- 238000003745 diagnosis Methods 0.000 description 7
- 230000000694 effects Effects 0.000 description 7
- 229940094991 herring sperm dna Drugs 0.000 description 7
- 230000002934 lysing effect Effects 0.000 description 7
- 238000002844 melting Methods 0.000 description 7
- 230000008018 melting Effects 0.000 description 7
- 244000005700 microbiome Species 0.000 description 7
- 238000003908 quality control method Methods 0.000 description 7
- 239000002904 solvent Substances 0.000 description 7
- -1 stool complex Proteins 0.000 description 7
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 6
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 6
- 241000192125 Firmicutes Species 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 241001465754 Metazoa Species 0.000 description 6
- 241000607142 Salmonella Species 0.000 description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 6
- 239000000853 adhesive Substances 0.000 description 6
- 230000001070 adhesive effect Effects 0.000 description 6
- 239000003242 anti bacterial agent Substances 0.000 description 6
- 229940088710 antibiotic agent Drugs 0.000 description 6
- 238000002405 diagnostic procedure Methods 0.000 description 6
- 239000006166 lysate Substances 0.000 description 6
- 238000012163 sequencing technique Methods 0.000 description 6
- 239000004094 surface-active agent Substances 0.000 description 6
- 241000194032 Enterococcus faecalis Species 0.000 description 5
- 108010054147 Hemoglobins Proteins 0.000 description 5
- 102000001554 Hemoglobins Human genes 0.000 description 5
- 238000010222 PCR analysis Methods 0.000 description 5
- 241000191967 Staphylococcus aureus Species 0.000 description 5
- 241000193998 Streptococcus pneumoniae Species 0.000 description 5
- 238000009825 accumulation Methods 0.000 description 5
- 239000012634 fragment Substances 0.000 description 5
- 230000002452 interceptive effect Effects 0.000 description 5
- 229910052751 metal Inorganic materials 0.000 description 5
- 239000002184 metal Substances 0.000 description 5
- 238000012986 modification Methods 0.000 description 5
- 230000004048 modification Effects 0.000 description 5
- 230000001717 pathogenic effect Effects 0.000 description 5
- 239000011148 porous material Substances 0.000 description 5
- 238000003825 pressing Methods 0.000 description 5
- 230000002265 prevention Effects 0.000 description 5
- 230000002829 reductive effect Effects 0.000 description 5
- 239000012723 sample buffer Substances 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 210000002700 urine Anatomy 0.000 description 5
- 241000271566 Aves Species 0.000 description 4
- 241000222122 Candida albicans Species 0.000 description 4
- 102000052510 DNA-Binding Proteins Human genes 0.000 description 4
- 241000194031 Enterococcus faecium Species 0.000 description 4
- 108050001049 Extracellular proteins Proteins 0.000 description 4
- 108010039918 Polylysine Proteins 0.000 description 4
- 238000011529 RT qPCR Methods 0.000 description 4
- 241000191940 Staphylococcus Species 0.000 description 4
- 241000589884 Treponema pallidum Species 0.000 description 4
- 229920004890 Triton X-100 Polymers 0.000 description 4
- 230000003213 activating effect Effects 0.000 description 4
- 150000007942 carboxylates Chemical class 0.000 description 4
- 230000006037 cell lysis Effects 0.000 description 4
- 210000003756 cervix mucus Anatomy 0.000 description 4
- 239000003795 chemical substances by application Substances 0.000 description 4
- 239000002131 composite material Substances 0.000 description 4
- 230000006378 damage Effects 0.000 description 4
- 239000008367 deionised water Substances 0.000 description 4
- 229910021641 deionized water Inorganic materials 0.000 description 4
- 238000013461 design Methods 0.000 description 4
- 239000003599 detergent Substances 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 4
- 238000011049 filling Methods 0.000 description 4
- 239000011888 foil Substances 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 238000003780 insertion Methods 0.000 description 4
- 230000037431 insertion Effects 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- 244000144972 livestock Species 0.000 description 4
- 238000012423 maintenance Methods 0.000 description 4
- 239000011159 matrix material Substances 0.000 description 4
- 238000000465 moulding Methods 0.000 description 4
- 108010009719 mutanolysin Proteins 0.000 description 4
- 102000039446 nucleic acids Human genes 0.000 description 4
- 108020004707 nucleic acids Proteins 0.000 description 4
- 150000007523 nucleic acids Chemical class 0.000 description 4
- 230000002093 peripheral effect Effects 0.000 description 4
- 229920000656 polylysine Polymers 0.000 description 4
- 239000002861 polymer material Substances 0.000 description 4
- 230000007026 protein scission Effects 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- 210000001215 vagina Anatomy 0.000 description 4
- 238000009834 vaporization Methods 0.000 description 4
- 230000008016 vaporization Effects 0.000 description 4
- 238000012795 verification Methods 0.000 description 4
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 3
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 3
- 241000606161 Chlamydia Species 0.000 description 3
- 241000222290 Cladosporium Species 0.000 description 3
- 102000053602 DNA Human genes 0.000 description 3
- 101710096438 DNA-binding protein Proteins 0.000 description 3
- 241000520130 Enterococcus durans Species 0.000 description 3
- 241000588722 Escherichia Species 0.000 description 3
- 241000606768 Haemophilus influenzae Species 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 241000701074 Human alphaherpesvirus 2 Species 0.000 description 3
- 241000186779 Listeria monocytogenes Species 0.000 description 3
- 241000192041 Micrococcus Species 0.000 description 3
- 108091028043 Nucleic acid sequence Proteins 0.000 description 3
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 3
- 239000013504 Triton X-100 Substances 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 3
- 239000002518 antifoaming agent Substances 0.000 description 3
- 210000000436 anus Anatomy 0.000 description 3
- 239000012298 atmosphere Substances 0.000 description 3
- 230000001580 bacterial effect Effects 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 230000003115 biocidal effect Effects 0.000 description 3
- 239000007844 bleaching agent Substances 0.000 description 3
- 229940098773 bovine serum albumin Drugs 0.000 description 3
- 150000001720 carbohydrates Chemical class 0.000 description 3
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 3
- 230000006835 compression Effects 0.000 description 3
- 238000007906 compression Methods 0.000 description 3
- 238000013500 data storage Methods 0.000 description 3
- 230000007423 decrease Effects 0.000 description 3
- 230000002255 enzymatic effect Effects 0.000 description 3
- 210000003811 finger Anatomy 0.000 description 3
- 230000036541 health Effects 0.000 description 3
- 239000011261 inert gas Substances 0.000 description 3
- 238000001746 injection moulding Methods 0.000 description 3
- 238000009830 intercalation Methods 0.000 description 3
- 230000002687 intercalation Effects 0.000 description 3
- 239000004005 microsphere Substances 0.000 description 3
- 238000012544 monitoring process Methods 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 239000004033 plastic Substances 0.000 description 3
- 229920003023 plastic Polymers 0.000 description 3
- 108090000765 processed proteins & peptides Proteins 0.000 description 3
- 230000001681 protective effect Effects 0.000 description 3
- 238000005086 pumping Methods 0.000 description 3
- 230000002441 reversible effect Effects 0.000 description 3
- 230000035945 sensitivity Effects 0.000 description 3
- 229910000679 solder Inorganic materials 0.000 description 3
- 230000000087 stabilizing effect Effects 0.000 description 3
- 229940031000 streptococcus pneumoniae Drugs 0.000 description 3
- 235000000346 sugar Nutrition 0.000 description 3
- 150000005846 sugar alcohols Polymers 0.000 description 3
- 210000003813 thumb Anatomy 0.000 description 3
- 230000032258 transport Effects 0.000 description 3
- 229910052724 xenon Inorganic materials 0.000 description 3
- FHNFHKCVQCLJFQ-UHFFFAOYSA-N xenon atom Chemical compound [Xe] FHNFHKCVQCLJFQ-UHFFFAOYSA-N 0.000 description 3
- WYTZZXDRDKSJID-UHFFFAOYSA-N (3-aminopropyl)triethoxysilane Chemical compound CCO[Si](OCC)(OCC)CCCN WYTZZXDRDKSJID-UHFFFAOYSA-N 0.000 description 2
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 2
- 241000251468 Actinopterygii Species 0.000 description 2
- 240000005528 Arctium lappa Species 0.000 description 2
- 241000712891 Arenavirus Species 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- 235000014469 Bacillus subtilis Nutrition 0.000 description 2
- 241000217846 Bacteroides caccae Species 0.000 description 2
- 241000606124 Bacteroides fragilis Species 0.000 description 2
- 241001135228 Bacteroides ovatus Species 0.000 description 2
- 241001464894 Blautia producta Species 0.000 description 2
- 241000252203 Clupea harengus Species 0.000 description 2
- 238000007400 DNA extraction Methods 0.000 description 2
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 2
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 2
- AHCYMLUZIRLXAA-SHYZEUOFSA-N Deoxyuridine 5'-triphosphate Chemical compound O1[C@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)[C@@H](O)C[C@@H]1N1C(=O)NC(=O)C=C1 AHCYMLUZIRLXAA-SHYZEUOFSA-N 0.000 description 2
- 208000006825 Eastern Equine Encephalomyelitis Diseases 0.000 description 2
- 201000005804 Eastern equine encephalitis Diseases 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- 206010014587 Encephalitis eastern equine Diseases 0.000 description 2
- 108010067770 Endopeptidase K Proteins 0.000 description 2
- 241000283073 Equus caballus Species 0.000 description 2
- 241001333951 Escherichia coli O157 Species 0.000 description 2
- 241000701806 Human papillomavirus Species 0.000 description 2
- 241000186840 Lactobacillus fermentum Species 0.000 description 2
- 241000222740 Leishmania braziliensis Species 0.000 description 2
- 241000270322 Lepidosauria Species 0.000 description 2
- 241000186780 Listeria ivanovii Species 0.000 description 2
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 201000009906 Meningitis Diseases 0.000 description 2
- 241000588621 Moraxella Species 0.000 description 2
- 108010014251 Muramidase Proteins 0.000 description 2
- 102000016943 Muramidase Human genes 0.000 description 2
- 241000186367 Mycobacterium avium Species 0.000 description 2
- 241000187478 Mycobacterium chelonae Species 0.000 description 2
- 241000186365 Mycobacterium fortuitum Species 0.000 description 2
- 241001455333 Mycobacterium fortuitum complex Species 0.000 description 2
- 241000186362 Mycobacterium leprae Species 0.000 description 2
- 241000187494 Mycobacterium xenopi Species 0.000 description 2
- 241000204031 Mycoplasma Species 0.000 description 2
- 241001138504 Mycoplasma bovis Species 0.000 description 2
- 241000202952 Mycoplasma fermentans Species 0.000 description 2
- 108010062010 N-Acetylmuramoyl-L-alanine Amidase Proteins 0.000 description 2
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 2
- 241000588653 Neisseria Species 0.000 description 2
- 241000588652 Neisseria gonorrhoeae Species 0.000 description 2
- AHLPHDHHMVZTML-UHFFFAOYSA-N Ornithine Chemical compound NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 2
- 238000012408 PCR amplification Methods 0.000 description 2
- 229930182555 Penicillin Natural products 0.000 description 2
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 2
- 241000223960 Plasmodium falciparum Species 0.000 description 2
- 241000588769 Proteus <enterobacteria> Species 0.000 description 2
- 241000588770 Proteus mirabilis Species 0.000 description 2
- 241000589516 Pseudomonas Species 0.000 description 2
- 241000589540 Pseudomonas fluorescens Species 0.000 description 2
- 241000392514 Salmonella enterica subsp. enterica serovar Dublin Species 0.000 description 2
- 241000293871 Salmonella enterica subsp. enterica serovar Typhi Species 0.000 description 2
- 241000607149 Salmonella sp. Species 0.000 description 2
- 241000242687 Schistosoma intercalatum Species 0.000 description 2
- 241000607768 Shigella Species 0.000 description 2
- 241000607762 Shigella flexneri Species 0.000 description 2
- 241000700584 Simplexvirus Species 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 241000191963 Staphylococcus epidermidis Species 0.000 description 2
- 241001291896 Streptococcus constellatus Species 0.000 description 2
- 241000194049 Streptococcus equinus Species 0.000 description 2
- 241000960363 Streptococcus infantis Species 0.000 description 2
- 241000194019 Streptococcus mutans Species 0.000 description 2
- 241000193996 Streptococcus pyogenes Species 0.000 description 2
- 241000194024 Streptococcus salivarius Species 0.000 description 2
- 241000194005 Streptococcus sp. 'group G' Species 0.000 description 2
- 241001312524 Streptococcus viridans Species 0.000 description 2
- 241001489145 Trichuris trichiura Species 0.000 description 2
- 241000700647 Variola virus Species 0.000 description 2
- 241000607598 Vibrio Species 0.000 description 2
- 241000607272 Vibrio parahaemolyticus Species 0.000 description 2
- 241000607734 Yersinia <bacteria> Species 0.000 description 2
- 150000001336 alkenes Chemical class 0.000 description 2
- 230000000172 allergic effect Effects 0.000 description 2
- 210000004381 amniotic fluid Anatomy 0.000 description 2
- 239000012491 analyte Substances 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 208000010668 atopic eczema Diseases 0.000 description 2
- 229940095731 candida albicans Drugs 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 125000002091 cationic group Chemical group 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 235000013351 cheese Nutrition 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 239000012141 concentrate Substances 0.000 description 2
- 239000013068 control sample Substances 0.000 description 2
- 238000011217 control strategy Methods 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 238000012136 culture method Methods 0.000 description 2
- 230000001351 cycling effect Effects 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 230000001934 delay Effects 0.000 description 2
- 230000000881 depressing effect Effects 0.000 description 2
- 238000009792 diffusion process Methods 0.000 description 2
- 239000006185 dispersion Substances 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 229940032049 enterococcus faecalis Drugs 0.000 description 2
- 239000006023 eutectic alloy Substances 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 238000000855 fermentation Methods 0.000 description 2
- 230000004151 fermentation Effects 0.000 description 2
- 239000000945 filler Substances 0.000 description 2
- 235000019688 fish Nutrition 0.000 description 2
- 235000013305 food Nutrition 0.000 description 2
- 239000005350 fused silica glass Substances 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 239000000383 hazardous chemical Substances 0.000 description 2
- 235000019514 herring Nutrition 0.000 description 2
- 239000004021 humic acid Substances 0.000 description 2
- 230000005661 hydrophobic surface Effects 0.000 description 2
- 150000002466 imines Chemical class 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- NNPPMTNAJDCUHE-UHFFFAOYSA-N isobutane Chemical compound CC(C)C NNPPMTNAJDCUHE-UHFFFAOYSA-N 0.000 description 2
- QWTDNUCVQCZILF-UHFFFAOYSA-N isopentane Chemical compound CCC(C)C QWTDNUCVQCZILF-UHFFFAOYSA-N 0.000 description 2
- 229940012969 lactobacillus fermentum Drugs 0.000 description 2
- 229920000126 latex Polymers 0.000 description 2
- 239000004816 latex Substances 0.000 description 2
- 239000004973 liquid crystal related substance Substances 0.000 description 2
- 229960000274 lysozyme Drugs 0.000 description 2
- 235000010335 lysozyme Nutrition 0.000 description 2
- 239000004325 lysozyme Substances 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 210000001006 meconium Anatomy 0.000 description 2
- 239000000155 melt Substances 0.000 description 2
- 210000003470 mitochondria Anatomy 0.000 description 2
- 201000000626 mucocutaneous leishmaniasis Diseases 0.000 description 2
- 210000003097 mucus Anatomy 0.000 description 2
- 238000012015 optical character recognition Methods 0.000 description 2
- 239000012188 paraffin wax Substances 0.000 description 2
- 229940049954 penicillin Drugs 0.000 description 2
- 230000035699 permeability Effects 0.000 description 2
- 229920001281 polyalkylene Polymers 0.000 description 2
- 244000144977 poultry Species 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 230000002335 preservative effect Effects 0.000 description 2
- 238000007639 printing Methods 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 238000000275 quality assurance Methods 0.000 description 2
- 230000009257 reactivity Effects 0.000 description 2
- 210000000664 rectum Anatomy 0.000 description 2
- 238000005057 refrigeration Methods 0.000 description 2
- 229920002477 rna polymer Polymers 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 238000005070 sampling Methods 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- ATHGHQPFGPMSJY-UHFFFAOYSA-N spermidine Chemical compound NCCCCNCCCN ATHGHQPFGPMSJY-UHFFFAOYSA-N 0.000 description 2
- 150000008163 sugars Chemical class 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 238000003856 thermoforming Methods 0.000 description 2
- 201000008827 tuberculosis Diseases 0.000 description 2
- 206010046901 vaginal discharge Diseases 0.000 description 2
- 238000010626 work up procedure Methods 0.000 description 2
- OEPOKWHJYJXUGD-UHFFFAOYSA-N 2-(3-phenylmethoxyphenyl)-1,3-thiazole-4-carbaldehyde Chemical compound O=CC1=CSC(C=2C=C(OCC=3C=CC=CC=3)C=CC=2)=N1 OEPOKWHJYJXUGD-UHFFFAOYSA-N 0.000 description 1
- SXGZJKUKBWWHRA-UHFFFAOYSA-N 2-(N-morpholiniumyl)ethanesulfonate Chemical compound [O-]S(=O)(=O)CC[NH+]1CCOCC1 SXGZJKUKBWWHRA-UHFFFAOYSA-N 0.000 description 1
- VLEIUWBSEKKKFX-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;2-[2-[bis(carboxymethyl)amino]ethyl-(carboxymethyl)amino]acetic acid Chemical compound OCC(N)(CO)CO.OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O VLEIUWBSEKKKFX-UHFFFAOYSA-N 0.000 description 1
- QJZYHAIUNVAGQP-UHFFFAOYSA-N 3-nitrobicyclo[2.2.1]hept-5-ene-2,3-dicarboxylic acid Chemical compound C1C2C=CC1C(C(=O)O)C2(C(O)=O)[N+]([O-])=O QJZYHAIUNVAGQP-UHFFFAOYSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- 241000235389 Absidia Species 0.000 description 1
- 241000224422 Acanthamoeba Species 0.000 description 1
- 241000589291 Acinetobacter Species 0.000 description 1
- 241000588626 Acinetobacter baumannii Species 0.000 description 1
- 229920004439 Aclar® Polymers 0.000 description 1
- NLHHRLWOUZZQLW-UHFFFAOYSA-N Acrylonitrile Chemical compound C=CC#N NLHHRLWOUZZQLW-UHFFFAOYSA-N 0.000 description 1
- 241000186041 Actinomyces israelii Species 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 241000606828 Aggregatibacter aphrophilus Species 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 241000710929 Alphavirus Species 0.000 description 1
- 241000322976 Amazilia millerii Species 0.000 description 1
- 206010001935 American trypanosomiasis Diseases 0.000 description 1
- 241000244185 Ascaris lumbricoides Species 0.000 description 1
- 241000228212 Aspergillus Species 0.000 description 1
- 241000223836 Babesia Species 0.000 description 1
- 241000193830 Bacillus <bacterium> Species 0.000 description 1
- 241000193738 Bacillus anthracis Species 0.000 description 1
- 244000063299 Bacillus subtilis Species 0.000 description 1
- 241000193388 Bacillus thuringiensis Species 0.000 description 1
- 241000606125 Bacteroides Species 0.000 description 1
- 241001221145 Bacteroides pyogenes Species 0.000 description 1
- 241000606123 Bacteroides thetaiotaomicron Species 0.000 description 1
- 241000606215 Bacteroides vulgatus Species 0.000 description 1
- 241000235579 Basidiobolus Species 0.000 description 1
- 241000244181 Baylisascaris Species 0.000 description 1
- 241000244183 Baylisascaris procyonis Species 0.000 description 1
- 241001465178 Bipolaris Species 0.000 description 1
- 241000335423 Blastomyces Species 0.000 description 1
- 241000228405 Blastomyces dermatitidis Species 0.000 description 1
- 241000589968 Borrelia Species 0.000 description 1
- 241000589969 Borreliella burgdorferi Species 0.000 description 1
- 241000589562 Brucella Species 0.000 description 1
- 241000589567 Brucella abortus Species 0.000 description 1
- 241001148106 Brucella melitensis Species 0.000 description 1
- 241000244038 Brugia malayi Species 0.000 description 1
- 241000143302 Brugia timori Species 0.000 description 1
- 241001453380 Burkholderia Species 0.000 description 1
- 241000589513 Burkholderia cepacia Species 0.000 description 1
- 241000722910 Burkholderia mallei Species 0.000 description 1
- 241000191796 Calyptosphaeria tropica Species 0.000 description 1
- 241000589876 Campylobacter Species 0.000 description 1
- 241000589875 Campylobacter jejuni Species 0.000 description 1
- 241000222120 Candida <Saccharomycetales> Species 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- 240000001817 Cereus hexagonus Species 0.000 description 1
- 206010008631 Cholera Diseases 0.000 description 1
- 108020004638 Circular DNA Proteins 0.000 description 1
- 241001633123 Cladophialophora Species 0.000 description 1
- 241001112696 Clostridia Species 0.000 description 1
- 241000193163 Clostridioides difficile Species 0.000 description 1
- 241000193155 Clostridium botulinum Species 0.000 description 1
- 241000193468 Clostridium perfringens Species 0.000 description 1
- 241000193449 Clostridium tetani Species 0.000 description 1
- 241000223203 Coccidioides Species 0.000 description 1
- 241000223205 Coccidioides immitis Species 0.000 description 1
- 241001053477 Commiphora africana Species 0.000 description 1
- 241001087672 Cosenzaea myxofaciens Species 0.000 description 1
- 241001527609 Cryptococcus Species 0.000 description 1
- 241000221204 Cryptococcus neoformans Species 0.000 description 1
- 241000223935 Cryptosporidium Species 0.000 description 1
- 241000434322 Cryptus Species 0.000 description 1
- 241000016605 Cyclospora cayetanensis Species 0.000 description 1
- 241000205707 Cystoisospora belli Species 0.000 description 1
- 108010001237 Cytochrome P-450 CYP2D6 Proteins 0.000 description 1
- 102100021704 Cytochrome P450 2D6 Human genes 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 108700020911 DNA-Binding Proteins Proteins 0.000 description 1
- 229920004934 Dacron® Polymers 0.000 description 1
- 241001600125 Delftia acidovorans Species 0.000 description 1
- 241001123635 Dipodascus Species 0.000 description 1
- 241000243988 Dirofilaria immitis Species 0.000 description 1
- 235000003550 Dracunculus Nutrition 0.000 description 1
- 241000316827 Dracunculus <angiosperm> Species 0.000 description 1
- 229920001875 Ebonite Polymers 0.000 description 1
- 241000244160 Echinococcus Species 0.000 description 1
- 241000244170 Echinococcus granulosus Species 0.000 description 1
- 241000244163 Echinococcus multilocularis Species 0.000 description 1
- 241001466953 Echovirus Species 0.000 description 1
- 241001657508 Eggerthella lenta Species 0.000 description 1
- 206010014611 Encephalitis venezuelan equine Diseases 0.000 description 1
- 206010014612 Encephalitis viral Diseases 0.000 description 1
- 206010014614 Encephalitis western equine Diseases 0.000 description 1
- 241000224432 Entamoeba histolytica Species 0.000 description 1
- 241000588914 Enterobacter Species 0.000 description 1
- 101000925662 Enterobacteria phage PRD1 Endolysin Proteins 0.000 description 1
- 241000588921 Enterobacteriaceae Species 0.000 description 1
- 239000004593 Epoxy Substances 0.000 description 1
- 241000186811 Erysipelothrix Species 0.000 description 1
- 241000186810 Erysipelothrix rhusiopathiae Species 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- 240000005066 Euchiton japonicus Species 0.000 description 1
- 241000223682 Exophiala Species 0.000 description 1
- 241000242711 Fasciola hepatica Species 0.000 description 1
- 241001126302 Fasciolopsis buski Species 0.000 description 1
- 241000244009 Filarioidea Species 0.000 description 1
- 241000711950 Filoviridae Species 0.000 description 1
- 241000710831 Flavivirus Species 0.000 description 1
- 241000122862 Fonsecaea Species 0.000 description 1
- 241000589601 Francisella Species 0.000 description 1
- 241000589602 Francisella tularensis Species 0.000 description 1
- 241000605909 Fusobacterium Species 0.000 description 1
- 241000207201 Gardnerella vaginalis Species 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 241000224467 Giardia intestinalis Species 0.000 description 1
- 241000607259 Grimontia hollisae Species 0.000 description 1
- 241000606790 Haemophilus Species 0.000 description 1
- 241000606766 Haemophilus parainfluenzae Species 0.000 description 1
- 241001495142 Helicobacter heilmannii Species 0.000 description 1
- 241000590002 Helicobacter pylori Species 0.000 description 1
- 208000009889 Herpes Simplex Diseases 0.000 description 1
- 241000224421 Heterolobosea Species 0.000 description 1
- 241000228402 Histoplasma Species 0.000 description 1
- 241000228404 Histoplasma capsulatum Species 0.000 description 1
- 241000700588 Human alphaherpesvirus 1 Species 0.000 description 1
- 241000701085 Human alphaherpesvirus 3 Species 0.000 description 1
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 1
- 241000713340 Human immunodeficiency virus 2 Species 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 206010023076 Isosporiasis Diseases 0.000 description 1
- 241000588748 Klebsiella Species 0.000 description 1
- 241000588915 Klebsiella aerogenes Species 0.000 description 1
- 241000588749 Klebsiella oxytoca Species 0.000 description 1
- 241000588747 Klebsiella pneumoniae Species 0.000 description 1
- 241000186660 Lactobacillus Species 0.000 description 1
- 241000589248 Legionella Species 0.000 description 1
- 208000007764 Legionnaires' Disease Diseases 0.000 description 1
- 241000222722 Leishmania <genus> Species 0.000 description 1
- 241000222727 Leishmania donovani Species 0.000 description 1
- 208000004554 Leishmaniasis Diseases 0.000 description 1
- 241000589902 Leptospira Species 0.000 description 1
- 241000186781 Listeria Species 0.000 description 1
- 241000186807 Listeria seeligeri Species 0.000 description 1
- 241000255640 Loa loa Species 0.000 description 1
- 208000016604 Lyme disease Diseases 0.000 description 1
- 241001539803 Magnusiomyces capitatus Species 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 241001115401 Marburgvirus Species 0.000 description 1
- RJQXTJLFIWVMTO-TYNCELHUSA-N Methicillin Chemical compound COC1=CC=CC(OC)=C1C(=O)N[C@@H]1C(=O)N2[C@@H](C(O)=O)C(C)(C)S[C@@H]21 RJQXTJLFIWVMTO-TYNCELHUSA-N 0.000 description 1
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 1
- 108020005196 Mitochondrial DNA Proteins 0.000 description 1
- 241000588771 Morganella <proteobacterium> Species 0.000 description 1
- 241000588772 Morganella morganii Species 0.000 description 1
- MSFSPUZXLOGKHJ-UHFFFAOYSA-N Muraminsaeure Natural products OC(=O)C(C)OC1C(N)C(O)OC(CO)C1O MSFSPUZXLOGKHJ-UHFFFAOYSA-N 0.000 description 1
- 241000186359 Mycobacterium Species 0.000 description 1
- 241001467553 Mycobacterium africanum Species 0.000 description 1
- 241000187474 Mycobacterium asiaticum Species 0.000 description 1
- 241000187471 Mycobacterium fallax Species 0.000 description 1
- 241000186364 Mycobacterium intracellulare Species 0.000 description 1
- 241000187493 Mycobacterium malmoense Species 0.000 description 1
- 241000187492 Mycobacterium marinum Species 0.000 description 1
- 241001147832 Mycobacterium shimoidei Species 0.000 description 1
- 241000187489 Mycobacterium simiae Species 0.000 description 1
- 241000187496 Mycobacterium szulgai Species 0.000 description 1
- 241000187917 Mycobacterium ulcerans Species 0.000 description 1
- 241000204051 Mycoplasma genitalium Species 0.000 description 1
- 241000963347 Mycoplasma haemocanis Species 0.000 description 1
- 241000202894 Mycoplasma orale Species 0.000 description 1
- 241000202889 Mycoplasma salivarium Species 0.000 description 1
- 241000224436 Naegleria Species 0.000 description 1
- 241000498270 Necator americanus Species 0.000 description 1
- 206010061308 Neonatal infection Diseases 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 241000187654 Nocardia Species 0.000 description 1
- 241000331201 Nocardia pneumoniae Species 0.000 description 1
- 101710163270 Nuclease Proteins 0.000 description 1
- 244000020186 Nymphaea lutea Species 0.000 description 1
- 241000305424 Ochroconis Species 0.000 description 1
- 241000243985 Onchocerca volvulus Species 0.000 description 1
- 241000868013 Oocystidium ovale Species 0.000 description 1
- 241000242716 Opisthorchis Species 0.000 description 1
- 241000150452 Orthohantavirus Species 0.000 description 1
- 206010031252 Osteomyelitis Diseases 0.000 description 1
- 102000016979 Other receptors Human genes 0.000 description 1
- 241000606210 Parabacteroides distasonis Species 0.000 description 1
- 241000204306 Parabacteroides merdae Species 0.000 description 1
- 241001537205 Paracoccidioides Species 0.000 description 1
- 241000526686 Paracoccidioides brasiliensis Species 0.000 description 1
- 241001480233 Paragonimus Species 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 241000228143 Penicillium Species 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 108010013639 Peptidoglycan Proteins 0.000 description 1
- 241000191992 Peptostreptococcus Species 0.000 description 1
- 241000192035 Peptostreptococcus anaerobius Species 0.000 description 1
- 241000150350 Peribunyaviridae Species 0.000 description 1
- 241000222831 Phialophora <Chaetothyriales> Species 0.000 description 1
- 240000009188 Phyllostachys vivax Species 0.000 description 1
- 241000224016 Plasmodium Species 0.000 description 1
- 241000223821 Plasmodium malariae Species 0.000 description 1
- 206010035501 Plasmodium malariae infection Diseases 0.000 description 1
- 241001505293 Plasmodium ovale Species 0.000 description 1
- 206010035502 Plasmodium ovale infection Diseases 0.000 description 1
- 241000233872 Pneumocystis carinii Species 0.000 description 1
- 206010035664 Pneumonia Diseases 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 241000605861 Prevotella Species 0.000 description 1
- 241000588768 Providencia Species 0.000 description 1
- 241000576783 Providencia alcalifaciens Species 0.000 description 1
- 241000588777 Providencia rettgeri Species 0.000 description 1
- 241000588778 Providencia stuartii Species 0.000 description 1
- 240000002878 Prunus cerasus Species 0.000 description 1
- 241000589517 Pseudomonas aeruginosa Species 0.000 description 1
- 241000589776 Pseudomonas putida Species 0.000 description 1
- 241000228453 Pyrenophora Species 0.000 description 1
- MUPFEKGTMRGPLJ-RMMQSMQOSA-N Raffinose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 MUPFEKGTMRGPLJ-RMMQSMQOSA-N 0.000 description 1
- 241000702247 Reoviridae Species 0.000 description 1
- 241000223667 Rhinocladiella Species 0.000 description 1
- 241000235402 Rhizomucor Species 0.000 description 1
- 241000235527 Rhizopus Species 0.000 description 1
- 241000592155 Salmonella enterica subsp. enterica serovar Agona Species 0.000 description 1
- 241001354013 Salmonella enterica subsp. enterica serovar Enteritidis Species 0.000 description 1
- 241000607726 Salmonella enterica subsp. enterica serovar Heidelberg Species 0.000 description 1
- 241000210647 Salmonella enterica subsp. enterica serovar Montevideo Species 0.000 description 1
- 241001546666 Salmonella enterica subsp. enterica serovar Newport Species 0.000 description 1
- 241000293246 Salmonella enterica subsp. enterica serovar Saintpaul Species 0.000 description 1
- 241000293869 Salmonella enterica subsp. enterica serovar Typhimurium Species 0.000 description 1
- 241000242678 Schistosoma Species 0.000 description 1
- 241000242683 Schistosoma haematobium Species 0.000 description 1
- 241000242680 Schistosoma mansoni Species 0.000 description 1
- 241001520868 Schistosoma mekongi Species 0.000 description 1
- 241001524057 Scolecobasidium Species 0.000 description 1
- 241000405965 Scomberomorus brasiliensis Species 0.000 description 1
- 206010040047 Sepsis Diseases 0.000 description 1
- 241000607720 Serratia Species 0.000 description 1
- 241000607715 Serratia marcescens Species 0.000 description 1
- 241000607766 Shigella boydii Species 0.000 description 1
- 241000607764 Shigella dysenteriae Species 0.000 description 1
- 241000607760 Shigella sonnei Species 0.000 description 1
- 241000005436 Sisyrinchium minus Species 0.000 description 1
- 208000001203 Smallpox Diseases 0.000 description 1
- 239000005708 Sodium hypochlorite Substances 0.000 description 1
- 244000046101 Sophora japonica Species 0.000 description 1
- 241000736110 Sphingomonas paucimobilis Species 0.000 description 1
- 241000605008 Spirillum Species 0.000 description 1
- 241001149962 Sporothrix Species 0.000 description 1
- 241001149963 Sporothrix schenckii Species 0.000 description 1
- 241000122973 Stenotrophomonas maltophilia Species 0.000 description 1
- 241001478878 Streptobacillus Species 0.000 description 1
- 241001478880 Streptobacillus moniliformis Species 0.000 description 1
- 241000193985 Streptococcus agalactiae Species 0.000 description 1
- 241000194008 Streptococcus anginosus Species 0.000 description 1
- 241000194056 Streptococcus iniae Species 0.000 description 1
- 241000194023 Streptococcus sanguinis Species 0.000 description 1
- 241000244177 Strongyloides stercoralis Species 0.000 description 1
- 241000244155 Taenia Species 0.000 description 1
- 241000244159 Taenia saginata Species 0.000 description 1
- 241000244157 Taenia solium Species 0.000 description 1
- 241001523006 Talaromyces marneffei Species 0.000 description 1
- 108010006785 Taq Polymerase Proteins 0.000 description 1
- 241000710924 Togaviridae Species 0.000 description 1
- 241000244031 Toxocara Species 0.000 description 1
- 241000244030 Toxocara canis Species 0.000 description 1
- 241000244020 Toxocara cati Species 0.000 description 1
- 241000223996 Toxoplasma Species 0.000 description 1
- 241000223997 Toxoplasma gondii Species 0.000 description 1
- 241000589886 Treponema Species 0.000 description 1
- 241000243774 Trichinella Species 0.000 description 1
- 241000243777 Trichinella spiralis Species 0.000 description 1
- 241000224526 Trichomonas Species 0.000 description 1
- 241000224527 Trichomonas vaginalis Species 0.000 description 1
- 241000223230 Trichosporon Species 0.000 description 1
- 241000223231 Trichosporon beigelii Species 0.000 description 1
- 241000223109 Trypanosoma cruzi Species 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- MUPFEKGTMRGPLJ-UHFFFAOYSA-N UNPD196149 Natural products OC1C(O)C(CO)OC1(CO)OC1C(O)C(O)C(O)C(COC2C(C(O)C(O)C(CO)O2)O)O1 MUPFEKGTMRGPLJ-UHFFFAOYSA-N 0.000 description 1
- 241000202898 Ureaplasma Species 0.000 description 1
- 241000202921 Ureaplasma urealyticum Species 0.000 description 1
- 108010059993 Vancomycin Proteins 0.000 description 1
- 241000870995 Variola Species 0.000 description 1
- 208000002687 Venezuelan Equine Encephalomyelitis Diseases 0.000 description 1
- 201000009145 Venezuelan equine encephalitis Diseases 0.000 description 1
- 241000607594 Vibrio alginolyticus Species 0.000 description 1
- 241000607626 Vibrio cholerae Species 0.000 description 1
- 241000607253 Vibrio mimicus Species 0.000 description 1
- 241000607265 Vibrio vulnificus Species 0.000 description 1
- 208000028227 Viral hemorrhagic fever Diseases 0.000 description 1
- 241000080633 Viriola Species 0.000 description 1
- 206010047505 Visceral leishmaniasis Diseases 0.000 description 1
- 208000005466 Western Equine Encephalomyelitis Diseases 0.000 description 1
- 201000005806 Western equine encephalitis Diseases 0.000 description 1
- 241000244005 Wuchereria bancrofti Species 0.000 description 1
- 241000223673 Xylohypha Species 0.000 description 1
- 241000607447 Yersinia enterocolitica Species 0.000 description 1
- 241000607479 Yersinia pestis Species 0.000 description 1
- 241000222126 [Candida] glabrata Species 0.000 description 1
- 241000606834 [Haemophilus] ducreyi Species 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 230000001464 adherent effect Effects 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 210000003001 amoeba Anatomy 0.000 description 1
- 238000004873 anchoring Methods 0.000 description 1
- 239000006117 anti-reflective coating Substances 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 238000003491 array Methods 0.000 description 1
- 201000008680 babesiosis Diseases 0.000 description 1
- 244000052616 bacterial pathogen Species 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 238000005842 biochemical reaction Methods 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 229940074375 burkholderia mallei Drugs 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 208000032343 candida glabrata infection Diseases 0.000 description 1
- 150000001718 carbodiimides Chemical class 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 239000012459 cleaning agent Substances 0.000 description 1
- 238000003759 clinical diagnosis Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 238000012864 cross contamination Methods 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 238000007405 data analysis Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 239000002274 desiccant Substances 0.000 description 1
- 239000000645 desinfectant Substances 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 239000010432 diamond Substances 0.000 description 1
- 229910003460 diamond Inorganic materials 0.000 description 1
- AFABGHUZZDYHJO-UHFFFAOYSA-N dimethyl butane Natural products CCCC(C)C AFABGHUZZDYHJO-UHFFFAOYSA-N 0.000 description 1
- 229940099686 dirofilaria immitis Drugs 0.000 description 1
- 238000007599 discharging Methods 0.000 description 1
- 208000008576 dracunculiasis Diseases 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 238000000295 emission spectrum Methods 0.000 description 1
- 229940007078 entamoeba histolytica Drugs 0.000 description 1
- 229940092559 enterobacter aerogenes Drugs 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000004744 fabric Substances 0.000 description 1
- 210000003754 fetus Anatomy 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 229920005570 flexible polymer Polymers 0.000 description 1
- 238000001506 fluorescence spectroscopy Methods 0.000 description 1
- 238000002189 fluorescence spectrum Methods 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 238000013467 fragmentation Methods 0.000 description 1
- 238000006062 fragmentation reaction Methods 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 229940085435 giardia lamblia Drugs 0.000 description 1
- 230000004313 glare Effects 0.000 description 1
- 239000003365 glass fiber Substances 0.000 description 1
- 229940047650 haemophilus influenzae Drugs 0.000 description 1
- 239000013056 hazardous product Substances 0.000 description 1
- 229940037467 helicobacter pylori Drugs 0.000 description 1
- 230000002949 hemolytic effect Effects 0.000 description 1
- 229920001519 homopolymer Polymers 0.000 description 1
- 239000002663 humin Substances 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 230000036571 hydration Effects 0.000 description 1
- 238000006703 hydration reaction Methods 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 238000007373 indentation Methods 0.000 description 1
- 239000012678 infectious agent Substances 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 230000001788 irregular Effects 0.000 description 1
- 239000001282 iso-butane Substances 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 230000002101 lytic effect Effects 0.000 description 1
- 238000007403 mPCR Methods 0.000 description 1
- 229910001629 magnesium chloride Inorganic materials 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 230000013011 mating Effects 0.000 description 1
- QWIZNVHXZXRPDR-WSCXOGSTSA-N melezitose Chemical compound O([C@@]1(O[C@@H]([C@H]([C@@H]1O[C@@H]1[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O1)O)O)CO)CO)[C@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O QWIZNVHXZXRPDR-WSCXOGSTSA-N 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 238000001465 metallisation Methods 0.000 description 1
- 229960003085 meticillin Drugs 0.000 description 1
- 239000011325 microbead Substances 0.000 description 1
- 239000011259 mixed solution Substances 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- NJPPVKZQTLUDBO-UHFFFAOYSA-N novaluron Chemical compound C1=C(Cl)C(OC(F)(F)C(OC(F)(F)F)F)=CC=C1NC(=O)NC(=O)C1=C(F)C=CC=C1F NJPPVKZQTLUDBO-UHFFFAOYSA-N 0.000 description 1
- 238000011330 nucleic acid test Methods 0.000 description 1
- 230000000474 nursing effect Effects 0.000 description 1
- JRZJOMJEPLMPRA-UHFFFAOYSA-N olefin Natural products CCCCCCCC=C JRZJOMJEPLMPRA-UHFFFAOYSA-N 0.000 description 1
- 238000002515 oligonucleotide synthesis Methods 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000011860 particles by size Substances 0.000 description 1
- 239000013618 particulate matter Substances 0.000 description 1
- 229940074571 peptostreptococcus anaerobius Drugs 0.000 description 1
- 238000000206 photolithography Methods 0.000 description 1
- 210000002381 plasma Anatomy 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 229920000768 polyamine Polymers 0.000 description 1
- 229920005646 polycarboxylate Polymers 0.000 description 1
- 239000005023 polychlorotrifluoroethylene (PCTFE) polymer Substances 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 239000005020 polyethylene terephthalate Substances 0.000 description 1
- 229920006254 polymer film Polymers 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 239000004810 polytetrafluoroethylene Substances 0.000 description 1
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 1
- 230000001376 precipitating effect Effects 0.000 description 1
- 238000011045 prefiltration Methods 0.000 description 1
- 238000003672 processing method Methods 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 235000019833 protease Nutrition 0.000 description 1
- 238000012797 qualification Methods 0.000 description 1
- 239000010453 quartz Substances 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 230000000171 quenching effect Effects 0.000 description 1
- MUPFEKGTMRGPLJ-ZQSKZDJDSA-N raffinose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)O)O1 MUPFEKGTMRGPLJ-ZQSKZDJDSA-N 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 238000011897 real-time detection Methods 0.000 description 1
- 230000001172 regenerating effect Effects 0.000 description 1
- 230000002207 retinal effect Effects 0.000 description 1
- 239000011435 rock Substances 0.000 description 1
- 210000003296 saliva Anatomy 0.000 description 1
- 238000012284 sample analysis method Methods 0.000 description 1
- 239000012488 sample solution Substances 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 239000000565 sealant Substances 0.000 description 1
- 210000000582 semen Anatomy 0.000 description 1
- 239000004065 semiconductor Substances 0.000 description 1
- 230000009919 sequestration Effects 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- SUKJFIGYRHOWBL-UHFFFAOYSA-N sodium hypochlorite Chemical compound [Na+].Cl[O-] SUKJFIGYRHOWBL-UHFFFAOYSA-N 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 229940063673 spermidine Drugs 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 238000000859 sublimation Methods 0.000 description 1
- 230000008022 sublimation Effects 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- 238000012549 training Methods 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 241001529453 unidentified herpesvirus Species 0.000 description 1
- 241000712461 unidentified influenza virus Species 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 238000007666 vacuum forming Methods 0.000 description 1
- 238000010200 validation analysis Methods 0.000 description 1
- MYPYJXKWCTUITO-LYRMYLQWSA-N vancomycin Chemical compound O([C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1OC1=C2C=C3C=C1OC1=CC=C(C=C1Cl)[C@@H](O)[C@H](C(N[C@@H](CC(N)=O)C(=O)N[C@H]3C(=O)N[C@H]1C(=O)N[C@H](C(N[C@@H](C3=CC(O)=CC(O)=C3C=3C(O)=CC=C1C=3)C(O)=O)=O)[C@H](O)C1=CC=C(C(=C1)Cl)O2)=O)NC(=O)[C@@H](CC(C)C)NC)[C@H]1C[C@](C)(N)[C@H](O)[C@H](C)O1 MYPYJXKWCTUITO-LYRMYLQWSA-N 0.000 description 1
- 229960003165 vancomycin Drugs 0.000 description 1
- MYPYJXKWCTUITO-UHFFFAOYSA-N vancomycin Natural products O1C(C(=C2)Cl)=CC=C2C(O)C(C(NC(C2=CC(O)=CC(O)=C2C=2C(O)=CC=C3C=2)C(O)=O)=O)NC(=O)C3NC(=O)C2NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(CC(C)C)NC)C(O)C(C=C3Cl)=CC=C3OC3=CC2=CC1=C3OC1OC(CO)C(O)C(O)C1OC1CC(C)(N)C(O)C(C)O1 MYPYJXKWCTUITO-UHFFFAOYSA-N 0.000 description 1
- 238000013022 venting Methods 0.000 description 1
- 201000002498 viral encephalitis Diseases 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 230000036266 weeks of gestation Effects 0.000 description 1
- 238000004804 winding Methods 0.000 description 1
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502715—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by interfacing components, e.g. fluidic, electrical, optical or mechanical interfaces
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/50273—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by the means or forces applied to move the fluids
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502738—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by integrated valves
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L7/00—Heating or cooling apparatus; Heat insulating devices
- B01L7/52—Heating or cooling apparatus; Heat insulating devices with provision for submitting samples to a predetermined sequence of different temperatures, e.g. for treating nucleic acid samples
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L9/00—Supporting devices; Holding devices
- B01L9/52—Supports specially adapted for flat sample carriers, e.g. for plates, slides, chips
- B01L9/527—Supports specially adapted for flat sample carriers, e.g. for plates, slides, chips for microfluidic devices, e.g. used for lab-on-a-chip
-
- F—MECHANICAL ENGINEERING; LIGHTING; HEATING; WEAPONS; BLASTING
- F16—ENGINEERING ELEMENTS AND UNITS; GENERAL MEASURES FOR PRODUCING AND MAINTAINING EFFECTIVE FUNCTIONING OF MACHINES OR INSTALLATIONS; THERMAL INSULATION IN GENERAL
- F16K—VALVES; TAPS; COCKS; ACTUATING-FLOATS; DEVICES FOR VENTING OR AERATING
- F16K99/00—Subject matter not provided for in other groups of this subclass
- F16K99/0001—Microvalves
-
- F—MECHANICAL ENGINEERING; LIGHTING; HEATING; WEAPONS; BLASTING
- F16—ENGINEERING ELEMENTS AND UNITS; GENERAL MEASURES FOR PRODUCING AND MAINTAINING EFFECTIVE FUNCTIONING OF MACHINES OR INSTALLATIONS; THERMAL INSULATION IN GENERAL
- F16K—VALVES; TAPS; COCKS; ACTUATING-FLOATS; DEVICES FOR VENTING OR AERATING
- F16K99/00—Subject matter not provided for in other groups of this subclass
- F16K99/0001—Microvalves
- F16K99/0003—Constructional types of microvalves; Details of the cutting-off member
- F16K99/003—Valves for single use only
-
- F—MECHANICAL ENGINEERING; LIGHTING; HEATING; WEAPONS; BLASTING
- F16—ENGINEERING ELEMENTS AND UNITS; GENERAL MEASURES FOR PRODUCING AND MAINTAINING EFFECTIVE FUNCTIONING OF MACHINES OR INSTALLATIONS; THERMAL INSULATION IN GENERAL
- F16K—VALVES; TAPS; COCKS; ACTUATING-FLOATS; DEVICES FOR VENTING OR AERATING
- F16K99/00—Subject matter not provided for in other groups of this subclass
- F16K99/0001—Microvalves
- F16K99/0003—Constructional types of microvalves; Details of the cutting-off member
- F16K99/0032—Constructional types of microvalves; Details of the cutting-off member using phase transition or influencing viscosity
-
- F—MECHANICAL ENGINEERING; LIGHTING; HEATING; WEAPONS; BLASTING
- F16—ENGINEERING ELEMENTS AND UNITS; GENERAL MEASURES FOR PRODUCING AND MAINTAINING EFFECTIVE FUNCTIONING OF MACHINES OR INSTALLATIONS; THERMAL INSULATION IN GENERAL
- F16K—VALVES; TAPS; COCKS; ACTUATING-FLOATS; DEVICES FOR VENTING OR AERATING
- F16K99/00—Subject matter not provided for in other groups of this subclass
- F16K99/0001—Microvalves
- F16K99/0034—Operating means specially adapted for microvalves
- F16K99/0042—Electric operating means therefor
- F16K99/0044—Electric operating means therefor using thermo-electric means
-
- F—MECHANICAL ENGINEERING; LIGHTING; HEATING; WEAPONS; BLASTING
- F16—ENGINEERING ELEMENTS AND UNITS; GENERAL MEASURES FOR PRODUCING AND MAINTAINING EFFECTIVE FUNCTIONING OF MACHINES OR INSTALLATIONS; THERMAL INSULATION IN GENERAL
- F16K—VALVES; TAPS; COCKS; ACTUATING-FLOATS; DEVICES FOR VENTING OR AERATING
- F16K99/00—Subject matter not provided for in other groups of this subclass
- F16K99/0001—Microvalves
- F16K99/0034—Operating means specially adapted for microvalves
- F16K99/0055—Operating means specially adapted for microvalves actuated by fluids
- F16K99/0061—Operating means specially adapted for microvalves actuated by fluids actuated by an expanding gas or liquid volume
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/02—Adapting objects or devices to another
- B01L2200/026—Fluid interfacing between devices or objects, e.g. connectors, inlet details
- B01L2200/027—Fluid interfacing between devices or objects, e.g. connectors, inlet details for microfluidic devices
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/10—Integrating sample preparation and analysis in single entity, e.g. lab-on-a-chip concept
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/14—Process control and prevention of errors
- B01L2200/143—Quality control, feedback systems
- B01L2200/147—Employing temperature sensors
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/14—Process control and prevention of errors
- B01L2200/148—Specific details about calibrations
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/16—Reagents, handling or storing thereof
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/02—Identification, exchange or storage of information
- B01L2300/021—Identification, e.g. bar codes
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/06—Auxiliary integrated devices, integrated components
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/06—Auxiliary integrated devices, integrated components
- B01L2300/0681—Filter
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0809—Geometry, shape and general structure rectangular shaped
- B01L2300/0816—Cards, e.g. flat sample carriers usually with flow in two horizontal directions
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0861—Configuration of multiple channels and/or chambers in a single devices
- B01L2300/0867—Multiple inlets and one sample wells, e.g. mixing, dilution
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0861—Configuration of multiple channels and/or chambers in a single devices
- B01L2300/087—Multiple sequential chambers
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0887—Laminated structure
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/18—Means for temperature control
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/18—Means for temperature control
- B01L2300/1805—Conductive heating, heat from thermostatted solids is conducted to receptacles, e.g. heating plates, blocks
- B01L2300/1827—Conductive heating, heat from thermostatted solids is conducted to receptacles, e.g. heating plates, blocks using resistive heater
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/18—Means for temperature control
- B01L2300/1861—Means for temperature control using radiation
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0403—Moving fluids with specific forces or mechanical means specific forces
- B01L2400/0442—Moving fluids with specific forces or mechanical means specific forces thermal energy, e.g. vaporisation, bubble jet
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0475—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure
- B01L2400/0481—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure squeezing of channels or chambers
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0475—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure
- B01L2400/0487—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure fluid pressure, pneumatics
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/06—Valves, specific forms thereof
- B01L2400/0605—Valves, specific forms thereof check valves
- B01L2400/0611—Valves, specific forms thereof check valves duck bill valves
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/06—Valves, specific forms thereof
- B01L2400/0677—Valves, specific forms thereof phase change valves; Meltable, freezing, dissolvable plugs; Destructible barriers
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/06—Valves, specific forms thereof
- B01L2400/0677—Valves, specific forms thereof phase change valves; Meltable, freezing, dissolvable plugs; Destructible barriers
- B01L2400/0683—Valves, specific forms thereof phase change valves; Meltable, freezing, dissolvable plugs; Destructible barriers mechanically breaking a wall or membrane within a channel or chamber
-
- F—MECHANICAL ENGINEERING; LIGHTING; HEATING; WEAPONS; BLASTING
- F16—ENGINEERING ELEMENTS AND UNITS; GENERAL MEASURES FOR PRODUCING AND MAINTAINING EFFECTIVE FUNCTIONING OF MACHINES OR INSTALLATIONS; THERMAL INSULATION IN GENERAL
- F16K—VALVES; TAPS; COCKS; ACTUATING-FLOATS; DEVICES FOR VENTING OR AERATING
- F16K99/00—Subject matter not provided for in other groups of this subclass
- F16K2099/0082—Microvalves adapted for a particular use
- F16K2099/0084—Chemistry or biology, e.g. "lab-on-a-chip" technology
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N35/00—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor
- G01N35/00584—Control arrangements for automatic analysers
- G01N35/00722—Communications; Identification
- G01N35/00871—Communications between instruments or with remote terminals
- G01N2035/00881—Communications between instruments or with remote terminals network configurations
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A90/00—Technologies having an indirect contribution to adaptation to climate change
- Y02A90/10—Information and communication technologies [ICT] supporting adaptation to climate change, e.g. for weather forecasting or climate simulation
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Dispersion Chemistry (AREA)
- General Engineering & Computer Science (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Clinical Laboratory Science (AREA)
- General Health & Medical Sciences (AREA)
- Analytical Chemistry (AREA)
- Mechanical Engineering (AREA)
- Hematology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Automatic Analysis And Handling Materials Therefor (AREA)
- Micromachines (AREA)
- Physical Or Chemical Processes And Apparatus (AREA)
Description
本願は、35U.S.C.§119(e)に基づいて、2006年3月24日に出願した米国仮特許出願第60/786,007号、及び2006年11月14に出願した第60/859,284号の優先権を主張する。双方の内容は、ここで引用したことにより、全体が本願にも含まれるものとする。 The present application is 35U. S. C. Based on §119 (e), priority is given to US Provisional Patent Application No. 60 / 786,007 filed on March 24, 2006 and 60 / 859,284 filed on November 14, 2006. Insist. The contents of both are incorporated herein by reference in their entirety.
また、本願は、全て2006年3月27日に出願した米国意匠出願第29/257,028号、第29/257,029号、及び29/257,030号、並びに2006年10月11日に出願した米国特許出願第11/580,267号にも関係があり、その内容はここで引用したことにより本願にも含まれるものとする。 In addition, all of the present application is a US design application No. 29 / 257,028, 29 / 257,029 and 29 / 257,030 filed on Mar. 27, 2006, and Oct. 11, 2006. The application is also related to US patent application Ser. No. 11 / 580,267, the contents of which are incorporated herein by reference.
ここに記載する技術は、ポリヌクレオチド含有サンプルを処理し、これに対して診断検査を実行するための一体化装置に関する。更に特定すれば、本技術は、サンプルを受ける微小流体カートリッジを、ベンチ・トップ・システム(bench-top system)と共に用いて、生物サンプルに対する診断結果を得るための装置に関する。本技術の使用方法についてもここに記載する。 The techniques described herein relate to an integrated device for processing a polynucleotide-containing sample and performing a diagnostic test thereon. More particularly, the present technology relates to an apparatus for using a microfluidic cartridge that receives a sample in conjunction with a bench-top system to obtain diagnostic results for a biological sample. The use of this technology is also described here.
医療診断業界は、今日の健康管理インフラストラクチャの肝要な要素である。しかしながら、現在では、診断分析は、作業手順がどうであれ、患者の世話が隘路になっている。これには、いくつかの理由がある。第1に、大抵の場合、サンプルを収集し、診断結果を得るまでの間には、診断分析において数個のステップがあり、操作者には異なるレベルの技量が要求され、異なるレベルの機器の複雑さが必要となる。例えば、生物サンプルは、一旦被験者から抽出したならば、処理体制に適した形態にしておかなければならず、そのためには、通例、ポリメラーゼ連鎖反応(PCR)を用いて対象のヌクレオチドを増幅することを伴う。一旦増幅したなら、サンプル内における対象のヌクレオチドの存在を明確に判定する必要がある。サンプルの準備は、自動化し易いプロセスであるが、比較的日常的に殆どいずれの場所でも実行されている。対照的に、PCRのようなステップ及びヌクレオチド検出は、専門機器に接近することができる、特別に訓練された個人の領域に属するのが習慣的である。第2に、多くの診断分析は、高度に特殊な機器でなければ行うことができず、高価であると共に、訓練を受けた臨床家(clinician)でなければ操作することができない。このような機器は、少数の場所、多くの場合いずれの所与の都市区域においても僅かに一台しか置かれていない。これが意味するのは、殆どの病院はサンプルを分析のためにこれらの場所に送出しなければならず、これによって出荷コストや輸送遅延、そして恐らくはサンプルの紛失又は混合までをも誘発するということである。第3に、一部の特殊機器は、通例、「オンデマンド」では利用できず、代わりにバッチで作動するので、これによって多くのサンプルには処理時間の遅延が生ずる。何故なら、これらは、機械が充填するのを待ってからでないと、処理できないからである。 The medical diagnostics industry is a vital element of today's health care infrastructure. Today, however, diagnostic analysis has become a bottleneck for patient care, whatever the work procedure. There are several reasons for this. First, in most cases, there are several steps in the diagnostic analysis between collecting a sample and obtaining a diagnostic result, requiring different levels of skill for the operator, Complexity is required. For example, once a biological sample is extracted from a subject, it must be in a form suitable for the treatment regime, typically by amplifying the nucleotide of interest using polymerase chain reaction (PCR). Accompanied by. Once amplified, the presence of the nucleotide of interest in the sample must be clearly determined. Sample preparation is a process that is easy to automate, but is performed on a relatively routine basis almost everywhere. In contrast, PCR-like steps and nucleotide detection are customary to belong to a specially trained individual area that is accessible to specialized equipment. Second, many diagnostic analyzes can only be performed with highly specialized equipment, are expensive, and can only be operated by trained clinicians. There is only one such device in a few places, often in any given urban area. This means that most hospitals must deliver samples to these locations for analysis, which can lead to shipping costs, transportation delays, and possibly even sample loss or mixing. is there. Third, some specialized equipment is typically not available “on demand”, but instead operates in batches, which causes processing time delays for many samples. This is because they can only be processed after waiting for the machine to fill.
特定の診断を遂行するための生物サンプルの分析は、通例、サンプルの中にある1つ以上のポリヌクレオチドを検出することを含む。検出の一例に定性検出があり、例えば、ポリヌクレオチドの存在の判断、及び/又は、例えば、種類、サイズ、突然変異の有無、及び/又はポリヌクレオチドのシーケンスに関する情報の判断に関する。検出の別の一例には定量検出があり、例えば、存在するポリヌクレオチドの量の判断に関する。したがって、検出は一般に定性的及び定量的双方の面を含むと言える。ポリヌクレオチドを定性的に検出する場合、サンプルにおいて非常に少量の存在を確定することを含むことが多い。したがって、感度を高めるためには、問題のポリヌクレオチドの量を増幅することが多い。例えば、検出方法には、ポリメラーゼ連鎖反応(PCR)又は関係する増幅技法によるポリヌクレオチド増幅を含む場合がある。このような技法は、酵素、プローブ、及び標識付け剤の内1つ以上を含む、含有物質の混合物を用いる。したがって、ポリヌクレオチドの検出は、種々の異なる試薬の使用が必要となる可能性があり、その多くは、その保全性を、使用中及び経時的に維持するためには、要注意の扱いを必要とする。 Analysis of a biological sample to perform a particular diagnosis typically includes detecting one or more polynucleotides in the sample. An example of detection is qualitative detection, for example, relating to determining the presence of a polynucleotide and / or determining information relating to, for example, type, size, presence of a mutation, and / or polynucleotide sequence. Another example of detection is quantitative detection, for example, relating to determining the amount of polynucleotide present. Thus, detection can generally be said to include both qualitative and quantitative aspects. Qualitatively detecting a polynucleotide often involves determining the presence of a very small amount in the sample. Therefore, to increase sensitivity, the amount of the polynucleotide in question is often amplified. For example, detection methods may include polynucleotide amplification by polymerase chain reaction (PCR) or related amplification techniques. Such techniques use a mixture of containing materials, including one or more of enzymes, probes, and labeling agents. Thus, detection of polynucleotides may require the use of a variety of different reagents, many of which require careful handling in order to maintain their integrity during use and over time. And
サンプル・フローは、数個の主要なステップに別れることが分かっており、これらをできるだけ多く自動化し、望ましくはできるだけ多くを1つの機械で遂行し、オンデマンドで多くのユーザに利用可能にする方法を検討することが望ましいであろう。したがって、サンプル準備、PCR、及び生物サンプル上における検出を、実行する別個のステップをできるだけ少なくするような方法で実行する方法及び装置が求められている。 A sample flow has been found to break into several main steps, a method of automating these as much as possible, preferably performing as much as possible on one machine and making it available to many users on demand It would be desirable to consider. Accordingly, there is a need for a method and apparatus that performs sample preparation, PCR, and detection on a biological sample in such a way as to minimize the separate steps to be performed.
この技術に対する背景の論述は、技術のコンテキスト(context)を説明するために含まれている。これは、特許請求の範囲のいずれの優先日においても、引用する素材のいずれもが公開されている、公知であり、又は共通の一般的知識の一部であることの承認とは受け取らないこととする。 A background discussion of this technology is included to explain the context of the technology. This should not be taken as an acknowledgment that any of the materials cited are public, public or part of common general knowledge at any priority date of the claims. And
本明細書の説明及び特許請求の範囲全体を通じて、「備えている」(comprise)並びに"comprising"及び"comprises"のようなその変形は、他の追加の物、成分、完全体、又はステップを除外することは意図していない。 Throughout the description and claims of this specification, “comprise” and variations thereof such as “comprising” and “comprises” may include other additional items, ingredients, completeness, or steps. It is not intended to be excluded.
本装置は、挿入可能な微小流体カートリッジを収容するように構成されている受容ベイと、カートリッジに熱的に結合されており、カートリッジ上に保持してあるポリヌクレオチド含有生物サンプルの微小液滴を形成し、微小液滴を微小流体カートリッジの1つ以上の位置間で移動させ、細胞が生物サンプル内に存在する場合、当該細胞を溶解することにより、細胞からポリヌクレオチドを放出し、増幅のためにポリヌクレオチドの1つ以上を準備し、ポリヌクレオチドの1つ以上を増幅するために、1つ以上の選択した時点に、カートリッジにおいて選択した1つ以上の領域に熱を加えるように構成されている少なくとも1つの熱源と、1つ以上の増幅したポリヌクレオチドの存在を検出するように構成されている検出器と、検出器と少なくとも1つの熱源とに結合されているプロセッサであって、1つ以上の選択した時点に微小流体カートリッジの1つ以上の選択した領域に対して行う加熱を制御するように構成されている、プロセッサとを備えている。 The apparatus includes a receiving bay configured to receive an insertable microfluidic cartridge and a microdroplet of a polynucleotide-containing biological sample thermally coupled to the cartridge and retained on the cartridge. Forming and moving the microdroplet between one or more locations of the microfluidic cartridge, and releasing the polynucleotide from the cell by lysing the cell, if present in the biological sample, for amplification Preparing one or more of the polynucleotides and configured to apply heat to one or more selected regions in the cartridge at one or more selected time points to amplify one or more of the polynucleotides. At least one heat source, a detector configured to detect the presence of one or more amplified polynucleotides, A processor coupled to one heat source and configured to control heating to one or more selected areas of the microfluidic cartridge at one or more selected time points. And.
本システムは、更に、装置と相補的カートリッジとを備えており、装置及びカートリッジが共にカートリッジに注入されているサンプルを処理し、このサンプルに関する診断結果を与える一体型システムも備えている。 The system further includes an apparatus and a complementary cartridge, and also includes an integrated system that processes the sample in which the apparatus and cartridge are both injected into the cartridge and provides diagnostic results for the sample.
本装置の受容ベイは、この中で更に説明し添付図面において例示するように、微小流体カートリッジを選択的に収容するように構成されている。例えば、受容ベイ及び微小流体カートリッジは、形状を相補的とすることができ、微小流体カートリッジを、例えば、1つの向きで選択的に収容できるようになっている。微小流体カートリッジは、受容ベイの相補的機構にはまりこむ位置合わせ部材を有することができる。選択的にカートリッジを収容することにより、受容ベイは、装置がカートリッジに対して適正に動作することができるように、ユーザがカートリッジを配置するのを助けることができる。また、受容ベイは、微小流体カートリッジ上で動作する装置の種々の構成要素(ヒート・ポンプ、ペルティエ・クーラ、排熱電子エレメント、検出器、動力部材など)を、微小流体カートリッジ上で適正に動作するように位置付けることができるように、構成することもできる。例えば、接触熱源を受容ベイ内に配置し、選択的に受容ベイに収容することができる微小流体カートリッジの1つ以上の別個の位置にこの熱源を熱的に結合することができるようにする。 The receiving bay of the device is configured to selectively receive a microfluidic cartridge, as further described herein and illustrated in the accompanying drawings. For example, the receiving bay and the microfluidic cartridge can be complementary in shape, such that the microfluidic cartridge can be selectively accommodated, for example, in one orientation. The microfluidic cartridge can have an alignment member that fits into the complementary mechanism of the receiving bay. By selectively accommodating the cartridge, the receiving bay can assist the user in positioning the cartridge so that the device can operate properly with respect to the cartridge. In addition, the receiving bay operates the various components of the device operating on the microfluidic cartridge (heat pump, Peltier cooler, exhaust heat electronic element, detector, power member, etc.) properly operating on the microfluidic cartridge. It can also be configured to be positioned as such. For example, a contact heat source may be disposed within the receiving bay so that the heat source can be thermally coupled to one or more discrete locations of a microfluidic cartridge that can be selectively received in the receiving bay.
ヒート・ポンプは、例えば、抵抗器、液体充填熱転移回路又は熱電エレメントのような可逆的ヒート・ポンプ、キセノン・ランプのような放射熱源等のような、熱源とすることができる。ヒート・ポンプは、微小流体エレメントに熱を供給するためだけでなく、ある種の試薬の活動を抑え、微小チャネル内の液体を凍結してその相を液体から固体に変化させ、空気室の圧力を低下させて部分的な真空を発生する等のために用いることができる。 The heat pump can be a heat source such as, for example, a resistor, a reversible heat pump such as a liquid-filled heat transfer circuit or a thermoelectric element, a radiant heat source such as a xenon lamp, and the like. The heat pump not only supplies heat to the microfluidic element, but also suppresses the activity of certain reagents, freezes the liquid in the microchannel and changes its phase from liquid to solid, and the pressure in the air chamber Can be used to generate a partial vacuum.
本装置の種々の実施形態では、本装置は、更に、微小流体カートリッジに対して相補的な位置合わせ部材を含むことができ、これによって、受容ベイは微流体カートリッジを1つの向きで収容する。本装置は、更に、プロセッサに結合されているセンサを備えており、このセンサは、微小流体カートリッジが収容されているか否か検知するように構成されている。 In various embodiments of the apparatus, the apparatus can further include an alignment member that is complementary to the microfluidic cartridge, whereby the receiving bay accommodates the microfluidic cartridge in one orientation. The apparatus further includes a sensor coupled to the processor, the sensor configured to detect whether a microfluidic cartridge is contained.
プロセッサは、受容ベイ内に配置した微小流体カートリッジにおいてポリヌクレオチド又はそのプローブを検出するために、検出器を動作させるようにプログラム可能とすることができる。 The processor can be programmable to operate the detector to detect the polynucleotide or its probe in a microfluidic cartridge disposed in the receiving bay.
検出器は、例えば、光検出器とすることができる。例えば、検出器は、蛍光染料の吸収帯において光を放出する光源と、蛍光染料の発光帯において光を検出する光検出器とを含むことができ、蛍光染料は蛍光ポリヌクレオチド・プローブ又はその断片に対応する。例えば、光検出器は、選択的に蛍光染料の吸収帯において光を放出するバンドパス・フィルタ・ダイオードと、選択的に蛍光染料の発光帯において光を検出するバンドパス・フィルタ・フォトダイオードとを含むことができ、あるいは、例えば、光検出器は、異なる蛍光発光スペクトルを有する複数の蛍光染料を独立して検出するように構成することができ、各蛍光染料は、蛍光ポリヌクレオチド・プローブ又はその断片に対応し、あるいは、例えば、光検出器は、カートリッジ内の複数の異なる場所において複数の蛍光染料を独立して検出するように構成することができ、各蛍光染料は、蛍光ポリヌクレオチド・プローブ又はその断片に対応する。 The detector can be, for example, a photodetector. For example, the detector can include a light source that emits light in the absorption band of the fluorescent dye and a photodetector that detects light in the emission band of the fluorescent dye, the fluorescent dye being a fluorescent polynucleotide probe or fragment thereof. Corresponding to For example, a photodetector may include a bandpass filter diode that selectively emits light in the fluorescent dye absorption band and a bandpass filter photodiode that selectively detects light in the fluorescent dye emission band. Or, for example, the photodetector can be configured to independently detect a plurality of fluorescent dyes having different fluorescent emission spectra, each fluorescent dye comprising a fluorescent polynucleotide probe or its Or, for example, the photodetector can be configured to independently detect a plurality of fluorescent dyes at a plurality of different locations within the cartridge, each fluorescent dye being a fluorescent polynucleotide probe Or a fragment thereof.
プロセッサは、例えば、少なくとも1つのヒート・ポンプを動作させるようにプログラム可能とすることができる。 The processor can be programmable, for example, to operate at least one heat pump.
種々の実施形態において、少なくとも1つのヒート・ポンプは、抵抗性ヒータ、ラジエータ、流体熱交換機、及びペルティエ・デバイスから選択する接触熱源とすることができる。接触熱源は、前受容ベイにおいて、当該受容ベイに収容されている微小流体カートリッジの別個の場所に熱的に結合するように構成することができ、これによって、別個の場所を選択的に加熱することができる。少なくとも1つの追加の接触熱源を含むことができ、この場合、接触熱源は、各々、受容ベイにおいて、当該受容ベイに収容されている微小流体カートリッジの異なる別個の場所と独立して熱的に結合するように構成することができ、これによって別個の場所を独立して加熱することができる。接触熱源は、受容ベイに収容されている微小流体カートリッジの別個の場所と直接物理的に接触するように構成することができる。種々の実施形態では、各接触熱源ヒータは、二次元における(in 2 dimensions)平均直径が約1ミリメートル(mm)から約15mm(通例約1mmから約10mm)である別個の場所、又は約1mm2ために選択的とする及び約225mm2の間(通例、約1mm2及び約100mm2の間、又は実施形態によっては、約5mm2及び約50mm2の間)の表面積を有する別個の場所を加熱するように構成することができる。 In various embodiments, the at least one heat pump can be a contact heat source selected from resistive heaters, radiators, fluid heat exchangers, and Peltier devices. The contact heat source can be configured to thermally couple at a pre-receiving bay to a separate location of the microfluidic cartridge housed in the receiving bay, thereby selectively heating the separate location. be able to. At least one additional contact heat source can be included, where the contact heat sources are each thermally coupled in the receiving bay independently of different discrete locations of the microfluidic cartridge contained in the receiving bay. Can be configured so that separate locations can be heated independently. The contact heat source can be configured to be in direct physical contact with a separate location of the microfluidic cartridge contained in the receiving bay. In various embodiments, each contact heat source heater is a separate location with an average diameter in 2 dimensions of about 1 millimeter (mm) to about 15 mm (typically about 1 mm to about 10 mm), or about 1 mm 2. And heating a separate location having a surface area between about 225 mm 2 (typically between about 1 mm 2 and about 100 mm 2 , or in some embodiments, between about 5 mm 2 and about 50 mm 2 ). Can be configured to.
種々の実施形態では、本装置は、接触熱源において伸展層を含むことができ、この伸展層は、接触熱源を、受容ベイに収容されている微小流体カートリッジの少なくとも一部と熱的に結合するように構成されている。伸展層は、約0.05及び約2ミリメートルの間での厚さと、約25及び約100の間のショア硬度を有することができる。 In various embodiments, the apparatus can include an extension layer at the contact heat source that thermally couples the contact heat source with at least a portion of the microfluidic cartridge contained in the receiving bay. It is configured as follows. The stretch layer can have a thickness between about 0.05 and about 2 millimeters and a Shore hardness between about 25 and about 100.
種々の実施形態では、少なくとも1つのヒート・ポンプは、受容ベイに収容されている微小流体の別個の場所を直接加熱するように構成されている抵抗性熱源とすることができる。 In various embodiments, the at least one heat pump can be a resistive heat source configured to directly heat a discrete location of the microfluid contained in the receiving bay.
種々の実施形態では、1つ以上の動力部材は、受容ベイに収容されている微小流体カートリッジの少なくとも一部に力を加えるように構成されている。 In various embodiments, the one or more power members are configured to apply force to at least a portion of the microfluidic cartridge housed in the receiving bay.
種々の実施形態では、1つ以上の動力部材は、少なくとも1つのヒート・ポンプを微小流体カートリッジの少なくとも一部に熱的に結合するために力を加えるように構成することができる。1つ以上の動力部材は、微小流体カートリッジにおいて機械的部材を動作させるように構成することができ、穿孔可能リザーバ、弁(バルブ)、又はポンプから成る一群から機械的部材を選択する。 In various embodiments, the one or more power members can be configured to apply a force to thermally couple at least one heat pump to at least a portion of the microfluidic cartridge. The one or more power members can be configured to operate the mechanical member in the microfluidic cartridge, selecting the mechanical member from the group consisting of a pierceable reservoir, a valve (valve), or a pump.
種々の実施形態では、1つ以上の動力部材は、微小流体カートリッジにおける複数の場所に力を加えるように構成することができる。1つ以上の動力部材によって力を加えることにより、受容ベイの一部と微小流体カートリッジの一部との間の界面に、平均で約5キロパスカル及び約50キロパスカルの間の圧力を発生することができ、例えば、平均圧力は、少なくとも、約14キロパスカルとすることができる。少なくとも1つの動力部材を手動で動作させることができる。少なくとも1つの動力部材を受容ベイの蓋に機械的に結合することができ、これによって、蓋の動作で動力部材が動作することになる。 In various embodiments, the one or more power members can be configured to apply forces to multiple locations in the microfluidic cartridge. Applying force by one or more power members generates an average pressure between about 5 kilopascals and about 50 kilopascals at the interface between a portion of the receiving bay and a portion of the microfluidic cartridge. For example, the average pressure can be at least about 14 kilopascals. At least one power member can be manually operated. At least one power member can be mechanically coupled to the lid of the receiving bay, which causes the power member to operate in the movement of the lid.
種々の実施形態では、本装置は、更に、受容ベイにおいて蓋を含むことができ、この蓋は、受容ベイから少なくとも部分的に周囲光を除外するように動作可能である。蓋は、例えば、滑動扉とすることができる。蓋は、光検出器を含むことができる。光検出器又は受容ベイにおける蓋の主面は、約100マイクロメートル未満だけ、例えば、約25マイクロメータ未満だけ、平坦からばらつきがあることが可能である。蓋は、装置から取り外し可能に構成することができる。蓋は、係留部材を含むことができる。 In various embodiments, the apparatus can further include a lid in the receiving bay that is operable to at least partially exclude ambient light from the receiving bay. The lid can be, for example, a sliding door. The lid can include a photodetector. The main surface of the lid in the photodetector or receiving bay can vary from flat to less than about 100 micrometers, for example, less than about 25 micrometers. The lid can be configured to be removable from the device. The lid can include an anchoring member.
種々の実施形態では、本装置は、更に、プロセッサに結合されている少なくとも1つの入力デバイスを含むことができる。 In various embodiments, the apparatus can further include at least one input device coupled to the processor.
種々の実施形態では、本装置は、更に、装置から取り外し可能に構成されている加熱ステージを含むことができ、ヒート・ポンプの少なくとも1つを加熱ステージに配置することができる。 In various embodiments, the apparatus can further include a heating stage configured to be removable from the apparatus, and at least one of the heat pumps can be disposed on the heating stage.
種々の実施形態では、カートリッジは、更に分析ポートを含むことができる。分析ポートは、外部サンプル・システムが、微小流体カートリッジにおいてサンプルを分析することができるように構成することができ、例えば、分析ポートは、装置内の孔又は窓とすることができ、微小流体カートリッジにおいて現場でサンプルを分析することができる光検出プローブを受け入れることができる。 In various embodiments, the cartridge can further include an analysis port. The analysis port can be configured such that an external sample system can analyze the sample in the microfluidic cartridge, for example, the analysis port can be a hole or window in the device, and the microfluidic cartridge Can accept a light detection probe that can analyze the sample in situ.
実施形態によっては、分析ポートは、微小流体カートリッジから外部サンプル・システムにサンプルを送出するように構成することができる。例えば、分析ポートは、微小流体カートリッジと流体連通する導管を含むことができ、液体サンプルをクロマトグラフ装置、光学分光計、質量分光計等に送出することができる。 In some embodiments, the analysis port can be configured to deliver a sample from the microfluidic cartridge to an external sample system. For example, the analysis port can include a conduit in fluid communication with the microfluidic cartridge, and a liquid sample can be delivered to a chromatographic device, optical spectrometer, mass spectrometer, or the like.
実施形態によっては、本装置は、微小流体カートリッジを1つの向きで収容するように構成されている受容ベイと、受容ベイに熱的に結合されている少なくとも1つの放射熱源と、別個の場所に熱的に結合されるように受容ベイにおいて構成され、これによって別個の場所を選択的に加熱することができる少なくとも2つの接触熱源と、受容ベイに収容されている微小流体カートリッジの少なくとも一部に力を加えるように構成されている1つ以上の動力部材であって、1つ以上の動力部材の内少なくとも1つは接触熱源を別個の場所に熱的に結合するために力を加えるように構成することができ、1つ以上の動力部材の内少なくとも1つは微小流体カートリッジにおいて機械的部材を動作させるように構成することができ、穿孔可能リザーバから成る一群から機械的部材を選択する、動力部材と、受容ベイにおける蓋であって、受容ベイから周囲光を少なくとも部分的に除外するように動作可能であり、1つ以上の蛍光染料を独立して検出するように構成されており、任意に異なる蛍光発光スペクトルを有する光検出器を備えており、各蛍光染料が蛍光ポリヌクレオチド・プローブ又はその断片に対応する、蓋と、キーボード、接触感応面、マイクロフォン、及びマウスから成る一群から選択した少なくとも1つの入力デバイスと、ハード・ディスク・ドライブ、光ディスク・ドライブから成る一群から選択した少なくとも1つのデータ記憶媒体と、シリアル接続、パラレル接続、ワイヤレス・ネットワーク接続、及び有線ネットワーク接続から成る一群から選択した通信インターフェースと、光学式キャラクタ・リーダ、バーコード・リーダ、及び無線周波数タグ・リーダから選択したサンプル識別器と、ディスプレイ、プリンタ、スピーカから選択した少なくとも1つの出力と、検出器、センサ、熱源、入力、及び出力と結合されているプロセッサとを含むことができる。 In some embodiments, the apparatus includes a receiving bay configured to receive the microfluidic cartridge in one orientation, at least one radiant heat source thermally coupled to the receiving bay, and a separate location. At least two contact heat sources configured in the receiving bay to be thermally coupled, thereby selectively heating separate locations, and at least a portion of the microfluidic cartridge housed in the receiving bay One or more power members configured to apply force, wherein at least one of the one or more power members applies force to thermally couple the contact heat source to a separate location. And at least one of the one or more power members can be configured to operate the mechanical member in the microfluidic cartridge and the pierceable reservoir A power member selecting a mechanical member from the group consisting of: a lid in the receiving bay, operable to at least partially exclude ambient light from the receiving bay and independent of one or more fluorescent dyes With a photodetector, optionally with different fluorescence emission spectra, each fluorescent dye corresponding to a fluorescent polynucleotide probe or fragment thereof, a lid, keyboard, touch sensitive At least one input device selected from the group consisting of a plane, a microphone and a mouse; at least one data storage medium selected from the group consisting of a hard disk drive, an optical disk drive; a serial connection, a parallel connection, a wireless connection A communication interface selected from the group consisting of a network connection and a wired network connection A sample identifier selected from a face, an optical character reader, a barcode reader, and a radio frequency tag reader, at least one output selected from a display, printer, speaker, detector, sensor, heat source, input And a processor coupled to the output.
微小流体カートリッジは、微小流体ネットワークと、この微小流体ネットワークと流体連通する保持部材とを含むことができ、保持部材は、少なくとも1つのポリメラーゼ連鎖反応インヒビタに対して少なくとも1つのポリヌクレオチドのために選択的とする。実施形態によっては、微小流体カートリッジは、位置合わせ部材も含む。 The microfluidic cartridge can include a microfluidic network and a retaining member in fluid communication with the microfluidic network, wherein the retaining member is selected for at least one polynucleotide relative to at least one polymerase chain reaction inhibitor. Target. In some embodiments, the microfluidic cartridge also includes an alignment member.
微小流体カートリッジの種々の実施形態では、微小流体カートリッジは、更に、微小流体ネットワークと流体連通するサンプル入口弁を含むことができる。サンプル入口弁は、周囲圧力と比較して約20キロパスカル及び200キロパスカルの間、例えば、約70キロパスカル及び110キロパスカルの間の圧力差でサンプルを受け入れるように構成することができる。 In various embodiments of the microfluidic cartridge, the microfluidic cartridge can further include a sample inlet valve in fluid communication with the microfluidic network. The sample inlet valve can be configured to accept a sample with a pressure difference between about 20 kilopascals and 200 kilopascals, for example, about 70 kilopascals and 110 kilopascals, relative to ambient pressure.
種々の実施形態では、微小流体ネットワークは、サンプル入口弁と流体連通するフィルタを含むことができ、このフィルタは、サンプル入口において導入するサンプル混合物から少なくとも1つの成分を分離するように構成されている。 In various embodiments, the microfluidic network can include a filter in fluid communication with the sample inlet valve, the filter being configured to separate at least one component from the sample mixture introduced at the sample inlet. .
種々の実施形態では、微小流体ネットワークは、微小流体ネットワークと流体連通する少なくとも1つの熱作動ポンプを含むことができる。熱作動ポンプは、気体、25℃及び100℃の間の温度及び1気圧で気化することができる液体、及び膨張性ポリマから選択した熱膨張性材料を含むことができる。 In various embodiments, the microfluidic network can include at least one thermally actuated pump in fluid communication with the microfluidic network. The thermally operated pump can include a thermally expandable material selected from a gas, a liquid that can be vaporized at a temperature between 25 ° C. and 100 ° C. and 1 atmosphere, and an expandable polymer.
種々の実施形態では、微小流体ネットワークは、微小流体ネットワークと流体連通する少なくとも1つの熱作動弁を含むことができる。熱作動弁は、25℃及び100℃の間の温度及び1気圧において固相−液相遷移を有する材料を含むことができる。 In various embodiments, the microfluidic network can include at least one thermally actuated valve in fluid communication with the microfluidic network. Thermally actuated valves can include materials that have a solid-liquid transition at a temperature between 25 ° C. and 100 ° C. and 1 atmosphere.
種々の実施形態において、微小流体ネットワークは、試薬、緩衝液、又は溶剤を収容した少なくとも1つの封止リザーバを含むことができる。封止リザーバは、例えば、試薬、緩衝液、又は溶剤を微小流体ネットワークと流体連通させるように構成されている自己穿孔可能ブリスタ・パックとすることができる。 In various embodiments, the microfluidic network can include at least one sealed reservoir containing a reagent, buffer, or solvent. The sealed reservoir can be, for example, a self-pierceable blister pack that is configured to fluidly communicate a reagent, buffer, or solvent with the microfluidic network.
種々の実施形態では、微小流体ネットワークは、少なくとも少なくとも1つの疎水ベント(抜け孔)を含むことができる。 In various embodiments, the microfluidic network can include at least one hydrophobic vent.
種々の実施形態では、微小流体ネットワークは、細胞ごみのような流体及び/又は粒子物のような廃棄物を受け取り貯蔵するように構成されている少なくとも1つのリザーバを含むことができる。 In various embodiments, the microfluidic network can include at least one reservoir configured to receive and store fluids such as cellular debris and / or waste such as particulate matter.
種々の実施形態では、保持部材は、ポリアルキレン・イミン又はポリカチオニック・ポリアミド、例えば、ポリエチレン・イミン、ポリ−L−リシン、又はポリ−D−リシンを含むことができる。保持部材は1つ以上の粒子の形態とすることができる。保持部材は、微小流体カートリッジから取り出し可能とすることができる。 In various embodiments, the retaining member can comprise a polyalkylene imine or a polycationic polyamide, such as polyethylene imine, poly-L-lysine, or poly-D-lysine. The retaining member can be in the form of one or more particles. The holding member can be removable from the microfluidic cartridge.
種々の実施形態では、微小流体ネットワークは、溶解試薬を含むことができる。溶解試薬は、界面活性剤の1つ以上の凍結乾燥ペレットを含むことができ、微小流体ネットワークは、界面活性剤の凍結乾燥ペレットを、液体と接触させて、溶解試薬溶液を作成するように構成することができる。微小流体ネットワークは、サンプルを溶解試薬と接触させて、溶解サンプルを生成するように構成することができる。 In various embodiments, the microfluidic network can include a lysis reagent. The lysis reagent can include one or more lyophilized pellets of surfactant, and the microfluidic network is configured to contact the lyophilized pellet of surfactant with a liquid to create a lysis reagent solution. can do. The microfluidic network can be configured to contact the sample with a lysis reagent to produce a lysed sample.
種々の実施形態では、微小流体ネットワークは、外部熱源からの熱をサンプルに結合して、溶解サンプルを生成するように構成することができる。例えば、微小流体ネットワークは、保持部材及び溶解サンプルを接触させて、ポリヌクレオチド装填保持部材を作成するように構成することができる。 In various embodiments, the microfluidic network can be configured to couple heat from an external heat source to the sample to produce a lysed sample. For example, the microfluidic network can be configured to contact the retention member and the lysed sample to create a polynucleotide-loaded retention member.
種々の実施形態では、微小流体カートリッジは、更に、ポリヌクレオチド装填保持部材を液体から分離するように構成されているフィルタを含むことができる。 In various embodiments, the microfluidic cartridge can further include a filter configured to separate the polynucleotide load retaining member from the liquid.
種々の実施形態では、微小流体カートリッジは、更に、洗浄緩衝液を収容するリザーバを含むことができ、微小流体ネットワークは、ポリヌクレオチド装填保持部材を洗浄緩衝液と接触させるように構成することができ、例えば、洗浄緩衝液は、少なくとも約10のpHを有することができる。 In various embodiments, the microfluidic cartridge can further include a reservoir containing a wash buffer, and the microfluidic network can be configured to contact the polynucleotide load retaining member with the wash buffer. For example, the wash buffer can have a pH of at least about 10.
種々の実施形態では、微小流体カートリッジは、放出緩衝液を収容するリザーバを含むことができ、微小流体カートリッジは、ポリヌクレオチド装填保持部材を放出緩衝液と接触させて、放出ポリヌクレオチド・サンプルを作成するように構成することができる。 In various embodiments, the microfluidic cartridge can include a reservoir containing a release buffer, the microfluidic cartridge contacting the polynucleotide load retaining member with the release buffer to create a release polynucleotide sample. Can be configured to.
種々の実施形態では、微小流体ネットワークは、外部熱源からの熱をポリヌクレオチド装填保持部材に結合して、放出ポリヌクレオチド・サンプルを作成するように構成することができる。 In various embodiments, the microfluidic network can be configured to couple heat from an external heat source to the polynucleotide load retaining member to create a released polynucleotide sample.
種々の実施形態では、微小流体カートリッジは、中和緩衝液を収容するリザーバを含むことができ、微小流体ネットワークは、放出ポリヌクレオチド・サンプルを中和緩衝液と接触させて、中和ポリヌクレオチド・サンプルを作成するように構成することができる。 In various embodiments, the microfluidic cartridge can include a reservoir that contains a neutralization buffer, and the microfluidic network contacts the release polynucleotide sample with the neutralization buffer to neutralize the polynucleotide polynucleotide. Can be configured to create a sample.
種々の実施形態では、微小流体カートリッジは、ポリメラーゼ酵素及び複数のヌクレオチドを含むPCR試薬混合物を含むことができる。PCR試薬混合物は、1つ以上の凍結乾燥ペレットの形態とすることができ、微小流体ネットワークは、PCRペレットを液体と接触させて、PCR試薬混合溶液を作成するように構成することができる。 In various embodiments, the microfluidic cartridge can include a PCR reagent mixture comprising a polymerase enzyme and a plurality of nucleotides. The PCR reagent mixture can be in the form of one or more lyophilized pellets, and the microfluidic network can be configured to contact the PCR pellet with a liquid to create a PCR reagent mixed solution.
種々の実施形態では、微小流体ネットワークは、外部熱源からの熱をPCR試薬混合物及び中和ポリヌクレオチド・サンプルを、中和ポリヌクレオチド・サンプルからPCRアンプリコンを作成するのに適した熱サイクル条件の下で結合するように構成することができる。 In various embodiments, the microfluidic network is adapted for heat cycling conditions suitable for generating heat from an external heat source to create a PCR reagent mixture and a neutralizing polynucleotide sample, and a PCR amplicon from the neutralizing polynucleotide sample. Can be configured to combine below.
種々の実施形態では、PCR試薬混合物は、更に、陽性対照プラスミドと、プラスミドの少なくとも一部のために選択的とする蛍光原混成プローブとを含むことができる。 In various embodiments, the PCR reagent mixture can further include a positive control plasmid and a fluorogenic hybrid probe that is selective for at least a portion of the plasmid.
種々の実施形態では、微小流体カートリッジは、陰性対照ポリヌクレオチドを含むことができ、微小流体ネットワークは、中和ポリヌクレオチド・サンプルのPCRアンプリコン及び陰性対照ポリヌクレオチドのPCRアンプリコンを独立して作成するのに適した熱サイクル条件の下で、中和ポリヌクレオチド・サンプル及び陰性対照ポリヌクレオチドの各々をPCR試薬混合物と独立して接触させるように構成することができる。 In various embodiments, the microfluidic cartridge can include a negative control polynucleotide, and the microfluidic network independently creates a PCR amplicon for the neutralized polynucleotide sample and a PCR amplicon for the negative control polynucleotide. Each of the neutralized polynucleotide sample and the negative control polynucleotide can be configured to contact independently of the PCR reagent mixture under suitable thermal cycling conditions.
種々の実施形態では、微小流体カートリッジは、ポリヌクレオチド・シーケンスのために選択的とすることができる少なくとも1つのプローブを含むことができ、微小流体カートリッジは、中和ポリヌクレオチド・サンプル又はそのPCRアンプリコンをプローブと接触させるように構成することができる。プローブは、蛍光原混成プローブとすることができる。蛍光原混成プローブは、蛍光リポータ染料及び蛍光消光染料に結合されているポリヌクレオチド・シーケンスを含むことができる。PCR試薬混合物は、更に、陽性対照プラスミドと、プラスミドの少なくとも一部のために選択的なプラスミド蛍光原混成プローブとを含むことができ、微小流体カートリッジは、蛍光原混成プローブ及びプラスミド蛍光原混成プローブの独立した光学的検出を可能にするように構成することができる。 In various embodiments, the microfluidic cartridge can include at least one probe that can be selective for polynucleotide sequencing, wherein the microfluidic cartridge is a neutralized polynucleotide sample or a PCR amplifier thereof. The recon can be configured to contact the probe. The probe can be a fluorogenic hybrid probe. The fluorogenic hybrid probe can include a polynucleotide sequence that is coupled to a fluorescent reporter dye and a fluorescent quencher dye. The PCR reagent mixture can further include a positive control plasmid and a plasmid fluorogen hybrid probe selective for at least a portion of the plasmid, wherein the microfluidic cartridge comprises a fluorogen hybrid probe and a plasmid fluorogen hybrid probe. Can be configured to allow independent optical detection.
種々の実施形態では、プローブは、有機体を特徴付けることができるポリヌクレオチド・シーケンス、例えば、ディオキシリボ核酸又はリボ核酸ポリヌクレオチドを用いたあらゆる有機体のために選択的とすることができる。つまり、プローブは、いずれの有機体のためにも選択することができる。適した有機体は、ほ乳類(ヒトを含む)、鳥類、は虫類、両生類、魚類、家畜、飼育動物、野生動物、絶滅した有機体、バクテリア、菌類、ウィルス、植物等を含む。また、プローブは、それら自体のポリヌクレオチドを用いる有機体、例えば、ミトコンドリアの成分のために選択的とすることもできる。実施形態の中には、プローブは、微小有機体、例えば、食品生産に用いられる有機体(発酵製品において用いられるイースト、チーズに用いられるカビ又はバクテリア等)又は病原体(例えば、ヒト、家畜又は野生動物、家禽又は野生鳥類等の)に用いられる有機体のために選択的とすることができる場合もある。実施形態の中には、プローブが、グラム陽性バクテリア、グラム陰性バクテリア、イースト、菌類、原生動物、及びウィルスから成る一群から選択した有機体のために選択的とすることができる場合もある。 In various embodiments, the probe can be selective for any organism that uses a polynucleotide sequence that can characterize the organism, such as a dioxyribonucleic acid or a ribonucleic acid polynucleotide. That is, the probe can be selected for any organism. Suitable organisms include mammals (including humans), birds, reptiles, amphibians, fish, livestock, domestic animals, wild animals, extinct organisms, bacteria, fungi, viruses, plants, and the like. Probes can also be selective for organisms that use their own polynucleotides, eg, components of mitochondria. In some embodiments, the probe is a micro-organism, for example, an organism used in food production (such as yeast used in fermentation products, mold or bacteria used in cheese) or pathogen (eg, human, livestock or wild In some cases, it may be selective for organisms used in animals, poultry or wild birds). In some embodiments, the probe may be selective for an organism selected from the group consisting of gram positive bacteria, gram negative bacteria, yeast, fungi, protozoa, and viruses.
種々の実施形態では、プローブは、グループBストレプトコッカスの特徴を示すポリヌクレオチド・シーケンスのために選択的とすることができる。 In various embodiments, probes can be selective for polynucleotide sequences that exhibit Group B Streptococcus characteristics.
種々の実施形態では、微小流体カートリッジは、発光原混成プローブの光学的検出を可能にするように構成することができる。 In various embodiments, the microfluidic cartridge can be configured to allow optical detection of the luminescent hybrid probe.
種々の実施形態では、微小流体カートリッジは、更に、コンピュータ読み取り可能なラベルも含むことができる。例えば、ラベルは、バーコード、無線周波数タグ、又は1つ以上のコンピュータ読み取り可能キャラクタを含むことができる。ラベルは、機械的に伸展可能な材料で形成することができる。例えば、ラベルの機械的に伸展可能な材料は、約0.05及び約2ミリメートルの間の厚さと、約25及び約100の間のショア硬度とを有することができる。 In various embodiments, the microfluidic cartridge can further include a computer-readable label. For example, the label can include a barcode, a radio frequency tag, or one or more computer readable characters. The label can be formed of a mechanically extensible material. For example, the mechanically extensible material of the label can have a thickness between about 0.05 and about 2 millimeters and a Shore hardness between about 25 and about 100.
種々の実施形態では、取扱及び保管中、並びに室に挿入する前に、微小流体カートリッジを更に封止パウチで包囲することができる。微小流体カートリッジは、パウチの中に不活性ガスと共に封止することができる。封止パウチは、一塊の乾燥剤も収容することもできる。微小流体カートリッジは使い捨て型とすることができる。 In various embodiments, the microfluidic cartridge can be further surrounded by a sealing pouch during handling and storage and prior to insertion into the chamber. The microfluidic cartridge can be sealed with an inert gas in a pouch. The sealing pouch can also contain a mass of desiccant. The microfluidic cartridge can be disposable.
種々の実施形態では、微小流体カートリッジは、1つ以上のサンプル・レーンを内蔵することができる。例えば、サンプル・レーンは、熱作動型ポンプ、熱作動型弁、サンプル入口弁、フィルタ、及び少なくとも1つのリザーバを含むことができる。レーンは互いに独立であることができ、又は部分的に依存することもでき、例えば、レーンが、溶解試薬のような、1つ以上の試薬を共有することができる。 In various embodiments, the microfluidic cartridge can contain one or more sample lanes. For example, the sample lane can include a thermally activated pump, a thermally activated valve, a sample inlet valve, a filter, and at least one reservoir. Lanes can be independent of each other, or can be partially dependent, for example, lanes can share one or more reagents, such as lysis reagents.
実施形態によっては、微小流体カートリッジが位置合わせ部材及び微小流体ネットワークを含むことができる。微小流体ネットワークは、流体連通した状態で、少なくとも1つの熱作動型ポンプ、少なくとも1つの熱作動型弁、周囲圧力と比較して約70キロパスカル及び110キロパスカルの間の圧力差でサンプルを受け入れるように構成されているサンプル入口弁、少なくとも1つのポリメラーゼ連鎖反応よりも少なくとも1つのポリヌクレオチドのために選択した保持部材であって、ポリアルキレン・イミン又はポリカチオニック・ポリアミドで形成した複数の粒子の形態である、保持部材、ポリヌクレオチド装填保持部材を液体から分離するように構成されているフィルタ、複数のリザーバであって、少なくとも1つが封止されている自己穿孔可能ブリスタ・パック・リザーバである、リザーバを含むことができる。複数のリザーバは、とりわけ、リーシス試薬であって、微小流体ネットワークは、サンプル入口に導入されるサンプルを、リーシス試薬及び保持部材と接触させて、ポリヌクレオチド装填保持部材を作成するように構成されている、リーシス試薬と、洗浄緩衝液を収容するリザーバであって、微小流体ネットワークがポリヌクレオチド装填保持部材を洗浄緩衝液と接触させるように構成されている、リザーバと、放出緩衝液を収容するリザーバであって、微小流体ネットワークがポリヌクレオチド装填保持部材を放出緩衝液と接触させて放出ポリヌクレオチド・サンプルを作成するように構成されている、リザーバと、中和緩衝液であって、微小流体ネットワークが放出ポリヌクレオチド・サンプルを中和緩衝液と接触させて、中和ポリヌクレオチド・サンプルを作成する、中和緩衝液と、ポリメラーゼ酵素、陽性対照プラスミド、プラスミドの少なくとも一部及び複数のヌクレオチドのために選択した蛍光原混成プローブを備えているPCR試薬混合物と、ポリヌクレオチド・シーケンスのために選択的とすることができる少なくとも1つのプローブであって、微小流体ネットワークが中和ポリヌクレオチド・サンプル又はそのPCRアンプリコンをプローブと接触させるように構成することができる、プローブとを含むことができる。更に、微小流体ネットワークは、中和ポリヌクレオチド・サンプルからPCRアンプリコンを作成するのに適した熱サイクル条件の下で、外部熱源からの熱をPCR試薬混合物及び中和ポリヌクレオチド・サンプルに結合するように構成することができる。 In some embodiments, the microfluidic cartridge can include an alignment member and a microfluidic network. The microfluidic network accepts the sample in fluid communication with at least one thermally actuated pump, at least one thermally actuated valve, a pressure difference between about 70 kilopascals and 110 kilopascals compared to ambient pressure. A sample inlet valve configured to be a holding member selected for at least one polynucleotide rather than at least one polymerase chain reaction, wherein the particles are formed of polyalkylene imine or polycationic polyamide A holding member, a filter configured to separate the polynucleotide loading holding member from the liquid, a plurality of reservoirs, at least one of which is sealed with a self-pierceable blister pack reservoir A reservoir can be included. The plurality of reservoirs are, among other things, lysis reagents, and the microfluidic network is configured to contact a sample introduced into the sample inlet with the lysis reagent and the holding member to create a polynucleotide loading holding member. A reservoir containing a lysis reagent and a wash buffer, wherein the microfluidic network is configured to contact the polynucleotide load retaining member with the wash buffer, and a reservoir containing the release buffer A reservoir, a neutralization buffer, wherein the microfluidic network is configured to contact the polynucleotide load retaining member with the release buffer to create a release polynucleotide sample, the microfluidic network Contacting the release polynucleotide sample with a neutralization buffer to neutralize the polynucleotide. A neutralization buffer to create an otide sample; a PCR reagent mixture comprising a polymerase enzyme, a positive control plasmid, at least a portion of the plasmid and a fluorogenic hybrid probe selected for a plurality of nucleotides; At least one probe that can be selective for sequencing, wherein the microfluidic network can be configured to contact a neutralizing polynucleotide sample or its PCR amplicon with the probe; Can be included. In addition, the microfluidic network couples heat from an external heat source to the PCR reagent mixture and the neutralizing polynucleotide sample under thermal cycling conditions suitable for creating PCR amplicons from the neutralizing polynucleotide sample. It can be constituted as follows.
種々の実施形態では、ポリヌクレオチド分析システムは、微小流体カートリッジ及び、更にこの中で説明する、装置の双方を含むことができる。 In various embodiments, the polynucleotide analysis system can include both a microfluidic cartridge and the apparatus described further herein.
種々の実施形態では、ポリヌクレオチド・サンプル・キットは、微小流体ネットワークと、この微小流体ネットワークと流体連通する保持部材とを備えている微小流体カートリッジであって、少なくとも1つのポリメラーゼ連鎖反応インヒビタに対して少なくとも1つのポリヌクレオチドのために保持部材を選択する、微小流体カートリッジと、サンプル・コンテナと、シリンジのような液体転送部材とを含むことができる。 In various embodiments, the polynucleotide sample kit is a microfluidic cartridge comprising a microfluidic network and a retaining member in fluid communication with the microfluidic network, wherein the polynucleotide sample kit is for at least one polymerase chain reaction inhibitor. A microfluidic cartridge, a sample container, and a liquid transfer member, such as a syringe, for selecting a retention member for at least one polynucleotide.
種々の実施形態では、ポリヌクレオチド・サンプル・キットは、更に、サンプルをサンプル・コンテナから微小流体ネットワークに転送するために液体転送部材を用いる命令を含むことができる。 In various embodiments, the polynucleotide sample kit can further include instructions for using the liquid transfer member to transfer the sample from the sample container to the microfluidic network.
種々の実施形態では、ポリヌクレオチド・サンプル・キットは、更に、サンプルをサンプル・コンテナから送出し、ある体積の空気を微小流体ネットワークに送出するために液体転送部材を用いる命令を含むことができ、空気の体積は、約0.5mL及び約5mLの間である。 In various embodiments, the polynucleotide sample kit can further include instructions for using the liquid transfer member to deliver the sample from the sample container and deliver a volume of air to the microfluidic network; The volume of air is between about 0.5 mL and about 5 mL.
種々の実施形態では、ポリヌクレオチド・サンプル・キットは、更に、フィルタと、例えば、液体転送部材を用いてサンプルをサンプル・コンテナからフィルタを通じて微小流体ネットワークに送出する命令を含むことができる。 In various embodiments, the polynucleotide sample kit can further include a filter and instructions for delivering the sample from the sample container through the filter to the microfluidic network using, for example, a liquid transfer member.
種々の実施形態では、ポリヌクレオチド・サンプル・キットは、更に、サンプル・コンテナ上に少なくとも1つのコンピュータ読み取り可能ラベルを含むことができる。このラベルは、例えば、バーコード、無線周波数タグ、又は1つ以上のコンピュータ読み取り可能キャラクタを含むことができる。微小流体カートリッジは、不活性ガスと共にパウチの中に封止することができる。 In various embodiments, the polynucleotide sample kit can further include at least one computer readable label on the sample container. The label can include, for example, a barcode, a radio frequency tag, or one or more computer readable characters. The microfluidic cartridge can be sealed in a pouch with an inert gas.
種々の実施形態では、ポリヌクレオチド・サンプル・キットは、更に、採取部材、転送コンテナ、及び採取部材を生物サンプルに接触させ、採取部材を転送コンテナの中に置く命令を含むことができる。 In various embodiments, the polynucleotide sample kit can further include a collection member, a transfer container, and instructions for contacting the collection member with the biological sample and placing the collection member in the transfer container.
種々の実施形態では、ポリヌクレオチド・サンプル・キットは、更に、サンプル緩衝液、及び、例えば、採取部材及びサンプル緩衝液を接触させる命令を含むことができる。 In various embodiments, the polynucleotide sample kit can further include a sample buffer and instructions for contacting the collection member and the sample buffer, for example.
種々の実施形態では、ポリヌクレオチド・サンプル・キットは、更に、ポリヌクレオチド・シーケンス、例えば、グラム陽性バクテリア、グラム陰性バクテリア、イースト、菌類、原生動物、及びウィルスから成る一群から選択した病原体の特徴を示すポリヌクレオチド・シーケンスのために選択的とすることができる少なくとも1つのプローブをふうむことができる。 In various embodiments, the polynucleotide sample kit is further characterized by a polynucleotide sequence, eg, a pathogen selected from the group consisting of gram positive bacteria, gram negative bacteria, yeast, fungi, protozoa, and viruses. At least one probe can be included that can be selective for the polynucleotide sequence shown.
実施形態によっては、ポリヌクレオチド・サンプル・キットは、微小流体ネットワークと、この微小流体ネットワークと流体連通する保持部材とを備えている微小流体カートリッジと、蛍光原プローブとを備えている微小流体カートリッジであって、少なくとも1つのポリメラーゼ連鎖反応インヒビタに対して少なくとも1つのポリヌクレオチドのために保持部材を選択し、グラム陽性バクテリア、グラム陰性バクテリア、イースト、菌類、原生動物、及びウィルスから成る一群から選択した病原体の特徴を示すポリヌクレオチド・シーケンスのために蛍光原プローブを選択する、微小流体カートリッジと、サンプル・コンテナと、液体転送部材と、採取部材と、転送コンテナと、サンプル緩衝液と、命令とを含むことができる。命令は、サンプルをサンプル・コンテナから微小流体ネットワークに転送するために液体転送部材を用い、サンプルをサンプル・コンテナから送出し、ある体積の空気を微小流体ネットワークに送出するために液体転送部材を用い、空気の体積は、約0.5mL及び約5mLの間であり、サンプルをサンプル・コンテナからフィルタを通じて微小流体ネットワークに送出ために液体転送部材を用い、採取部材を生物サンプルに接触させ、採取部材を転送コンテナの中に置く命令を含むことができる。 In some embodiments, the polynucleotide sample kit is a microfluidic cartridge comprising a microfluidic network, a microfluidic cartridge comprising a holding member in fluid communication with the microfluidic network, and a fluorogenic probe. Selecting a retention member for at least one polynucleotide against at least one polymerase chain reaction inhibitor and selecting from a group consisting of gram positive bacteria, gram negative bacteria, yeast, fungi, protozoa, and viruses A microfluidic cartridge, a sample container, a liquid transfer member, a collection member, a transfer container, a sample buffer, and instructions for selecting a fluorogenic probe for a polynucleotide sequence that characterizes the pathogen Can be included. The instructions use a liquid transfer member to transfer the sample from the sample container to the microfluidic network, deliver the sample from the sample container, and use the liquid transfer member to deliver a volume of air to the microfluidic network. , The volume of air is between about 0.5 mL and about 5 mL, using a liquid transfer member to deliver the sample from the sample container through the filter to the microfluidic network, contacting the collection member with the biological sample, Can be included in the transfer container.
ポリヌクレオチドの採取方法は、微小流体カートリッジにおける保持部材を生物サンプルと接触させるステップであって、生物サンプルが少なくとも1つのポリヌクレオチドを含み、これによって微小流体カートリッジにおいてポリヌクレオチド装填保持部材を生成するステップと、生物サンプルの少なくとも一部をポリヌクレオチド装填保持部材から分離するステップと、ポリヌクレオチド装填保持部材からポリヌクレオチドの少なくとも一部を放出することにより、放出ポリヌクレオチド・サンプルを作成するステップとを含むことができる。 A method for collecting a polynucleotide comprises contacting a retention member in a microfluidic cartridge with a biological sample, the biological sample comprising at least one polynucleotide, thereby producing a polynucleotide-loaded retention member in the microfluidic cartridge. And separating at least a portion of the biological sample from the polynucleotide loading and holding member; and creating a released polynucleotide sample by releasing at least a portion of the polynucleotide from the polynucleotide loading and holding member. be able to.
種々の実施形態では、本方法は、更に、以下のステップの内1つ以上を含むことができる。微小流体カートリッジを前述の装置の受容ベイに入れるステップ、装置において動力部材を動作させて、受容ベイの一部と微小流体カートリッジの一部との間の界面に圧力を加えるステップ(例えば、約5キロパスカル及び約50キロパスカルの間の圧力、又は実施形態によっては少なくとも約14キロパスカルの圧力を発生させる)、動力部材を用いて微小流体カートリッジの中にある機械部材に力を加えるステップであって、この機械部材を、穿孔可能リザーバ、弁又はポンプから選択し、少なくとも1つの試薬、緩衝液、又は溶剤を微小流体チップの中にあるリザーバから放出するステップ、及び/又は蓋を閉鎖して動力部材を動作させ、動力部材を機械的に受容ベイにおける蓋と結合することができるステップ。 In various embodiments, the method can further include one or more of the following steps. Placing the microfluidic cartridge into a receiving bay of the aforementioned device, operating a power member in the device to apply pressure to an interface between a portion of the receiving bay and a portion of the microfluidic cartridge (eg, about 5 Generating a pressure between kilopascal and about 50 kilopascals, or in some embodiments at least about 14 kilopascals), using a power member to apply force to a mechanical member in a microfluidic cartridge. The mechanical member is selected from a pierceable reservoir, valve or pump to release at least one reagent, buffer or solvent from the reservoir in the microfluidic chip and / or to close the lid Operating the power member and mechanically coupling the power member with a lid in the receiving bay.
実施形態によっては、本方法は、更に、サンプル識別器を用いて、微小流体カートリッジ上のラベル、又は生物サンプル上のラベルを読み取るステップも含むことができる。 In some embodiments, the method can further include reading the label on the microfluidic cartridge or the label on the biological sample using a sample identifier.
実施形態によっては、本方法は、更に、生の生物サンプルを微小流体カートリッジに導入し、微小流体カートリッジの中で、例えば、カートリッジ内においてフィルタを用いて、生の生物サンプルから生物サンプルを分離するステップを含むことができ、あるいは生物サンプルを微小流体カートリッジに導入する前に、生物サンプルを生の生物サンプルから分離することもできる。 In some embodiments, the method further introduces the raw biological sample into the microfluidic cartridge and separates the biological sample from the raw biological sample within the microfluidic cartridge, eg, using a filter within the cartridge. Steps can be included, or the biological sample can be separated from the raw biological sample prior to introducing the biological sample into the microfluidic cartridge.
実施形態によっては、本方法は、更に、例えば、熱、溶解試薬等を用いて、生物サンプルを溶解するステップを含むこともできる。実施形態によっては、微小流体カートリッジが1つ以上の溶解試薬の凍結乾燥ペレットを備えている場合、本方法は、更に、液体によって界面活性剤の凍結乾燥ペレットを復元し、溶解試薬溶液を作成するステップを含むこともできる。 In some embodiments, the method can further include lysing the biological sample using, for example, heat, lysis reagents, and the like. In some embodiments, if the microfluidic cartridge comprises one or more lyophilized pellets of the lysis reagent, the method further reconstitutes the lyophilized pellet of surfactant with the liquid to create a lysis reagent solution. Steps can also be included.
種々の実施形態では、本方法は、更に、以下のステップの内1つ以上を含むことができる。微小流体カートリッジにおいて生物サンプルを加熱するステップ、微小流体カートリッジにおいて、周囲圧力と比較して約20キロパスカル及び200キロパスカルの間の差圧、又は、実施形態によっては、約70キロパスカル及び110キロパスカルの間の差圧で生物サンプルを加圧するステップ。 In various embodiments, the method can further include one or more of the following steps. Heating a biological sample in a microfluidic cartridge, in a microfluidic cartridge, a differential pressure between about 20 kilopascals and 200 kilopascals compared to ambient pressure, or in some embodiments, about 70 kilopascals and 110 kilos Pressurizing the biological sample with a differential pressure between Pascals.
実施形態によっては、ポリヌクレオチド装填保持部材から分離した生物サンプルの一部は、ヘモグロビン、ペプチド、糞便複合体、フミン酸、粘性複合体、DNA結合蛋白質、又はサッカリドから成る一群から選択した、少なくとも1つのポリメラーゼ連鎖反応インヒビタを含む可能性がある。実施形態によっては、本方法は、更に、生物サンプルにおけるポリメラーゼ連鎖反応インヒビタの実質的に全てからポリヌクレオチド装填保持部材を分離するステップを含むことができる。 In some embodiments, the portion of the biological sample separated from the polynucleotide load-carrying member is at least one selected from the group consisting of hemoglobin, peptide, stool complex, humic acid, viscous complex, DNA binding protein, or saccharide. It may contain two polymerase chain reaction inhibitors. In some embodiments, the method can further comprise separating the polynucleotide load retaining member from substantially all of the polymerase chain reaction inhibitor in the biological sample.
種々の実施形態では、本方法は、更に、以下のステップの内1つ以上を含むことができる。熱作動型ポンプ又は熱作動型弁を動作させることによって、微小流体カートリッジにおいて流体を送出するステップ、ポリヌクレオチド装填保持部材を洗浄緩衝液と接触させるステップ、ポリヌクレオチド装填保持部材を少なくとも約50℃(実施形態によっては、温度は100℃以下とすることができる)に加熱するステップ、約10分未満の間ポリヌクレオチド装填保持部材を加熱するステップ、ポリヌクレオチド装填保持部材を放出緩衝液と接触させて、放出ポリヌクレオチド・サンプル(例えば、実施形態によっては、放出緩衝液は、約50マイクロリットル未満の体積を有することができ、放出緩衝液は洗剤を含むことができ、及び/又は放出緩衝液は少なくとも約10のpHを有することができる)を作成するステップ、及び/又は放出ポリヌクレオチド・サンプルを中和緩衝液と接触させて、中和ポリヌクレオチド・サンプルを作成するステップ。 In various embodiments, the method can further include one or more of the following steps. Delivering a fluid in the microfluidic cartridge by operating a thermally actuated pump or a thermally actuated valve; contacting the polynucleotide load retaining member with a wash buffer; In some embodiments, the temperature can be 100 ° C. or less), heating the polynucleotide loading and retaining member for less than about 10 minutes, contacting the polynucleotide loading and holding member with a release buffer. A release polynucleotide sample (eg, in some embodiments, the release buffer can have a volume of less than about 50 microliters, the release buffer can comprise a detergent, and / or the release buffer can be And can have a pH of at least about 10. Step of contacting a neutralizing buffer release polynucleotide sample, to create a neutralized polynucleotide sample.
種々の実施形態では、本方法は、更に、以下のステップの内1つ以上を含むことができる。中和ポリヌクレオチド・サンプルを、ポリメラーゼ酵素及び複数のヌクレオチド(実施形態によっては、PCR試薬混合物は、更に、陽性対照プラスミド、及びプラスミドの少なくとも一部のために選択した蛍光原混成プローブを含むことができる)を含むPCR試薬と接触させるステップ。実施形態によっては、PCR試薬混合物は、1つ以上の凍結乾燥ペレットの形態とすることができ、本方法は、更に、PCRペレットを液体によって復元し、PCR試薬混合物溶液を作成するステップと、中和ポリヌクレオチド・サンプルからPCRアンプリコンを作成するのに適した熱サイクル条件の下で、PCR試薬混合物及び中和ポリヌクレオチド・サンプルを加熱するステップと、中和ポリヌクレオチド・サンプル又はそのPCRアンプリコンを、ポリヌクレオチド・シーケンスのために選択的とすることができる少なくとも1つのプローブと接触させるステップと、中和ポリヌクレオチド・サンプルのPCRアンプリコン及び陰性対照ポリヌクレオチドのPCRアンプリコンを独立して作成するのに適した熱サイクル条件の下で、中和ポリヌクレオチド・サンプル及び陰性対照ポリヌクレオチドの各々をPCR試薬混合物と独立して接触させるステップと、及び/又は中和ポリヌクレオチド・サンプル又はそのPCRアンプリコン、及び陰性対照ポリヌクレオチド又はそのPCRアンプリコンを、ポリヌクレオチド・シーケンスのために選択した少なくとも1つのプローブと接触させるステップ。 In various embodiments, the method can further include one or more of the following steps. The neutralized polynucleotide sample may comprise a polymerase enzyme and a plurality of nucleotides (in some embodiments, the PCR reagent mixture further comprises a positive control plasmid and a fluorogenic hybrid probe selected for at least a portion of the plasmid. Contacting with a PCR reagent. In some embodiments, the PCR reagent mixture can be in the form of one or more lyophilized pellets, and the method further comprises regenerating the PCR pellet with a liquid to create a PCR reagent mixture solution, and Heating the PCR reagent mixture and the neutralizing polynucleotide sample under thermal cycling conditions suitable for making a PCR amplicon from the sum polynucleotide sample, and the neutralizing polynucleotide sample or its PCR amplicon A PCR amplicon of a neutralizing polynucleotide sample and a PCR amplicon of a negative control polynucleotide independently of contacting with at least one probe that can be selective for polynucleotide sequencing Under thermal cycling conditions suitable for Contacting each of the sum polynucleotide sample and negative control polynucleotide independently with the PCR reagent mixture; and / or a neutralizing polynucleotide sample or PCR amplicon thereof; and a negative control polynucleotide or PCR amplicon thereof Contacting with at least one probe selected for polynucleotide sequencing.
種々の実施形態では、本方法は、更に、以下のステップの内1つ以上を含むことができる。生物サンプルにおけるポリヌクレオチド・シーケンスの存在を判定するステップであって、プローブが中和ポリヌクレオチド・サンプル又はそのPCRアンプリコンにおいて検出された場合、ポリヌクレオチド・シーケンスがプローブに対応する、ステップ、プローブが陰性対照ポリヌクレオチド又はそのPCRアンプリコンにおいて検出された場合、汚染結果を判定するステップ、及び/又は、実施形態によっては、PCR試薬混合物が更に陽性対照プラスミド及びプラスミドの少なくとも一部のために選択したプラスミド・プローブを備えている場合、本方法は、更に、プラスミド・プローブが検出された場合にPCR反応が発生したと判定するステップを含む。 In various embodiments, the method can further include one or more of the following steps. Determining the presence of a polynucleotide sequence in a biological sample, wherein if the probe is detected in a neutralizing polynucleotide sample or its PCR amplicon, the polynucleotide sequence corresponds to the probe; Determining contamination results when detected in a negative control polynucleotide or its PCR amplicon, and / or in some embodiments, a PCR reagent mixture was further selected for at least a portion of the positive control plasmid and plasmid. If equipped with a plasmid probe, the method further includes determining that a PCR reaction has occurred when a plasmid probe is detected.
種々の実施形態では、本方法は、更に、ポリヌクレオチド装填保持部材の遠心分離を含まない。 In various embodiments, the method further does not include centrifugation of the polynucleotide load retaining member.
実施形態によっては、ポリヌクレオチド採取方法は、微小流体カートリッジを装置の受容ベイに入れるステップと、装置において動力部材を動作させて、受容ベイの一部と微小流体カートリッジの一部との間の界面に圧力を加えるステップであって、力は、少なくとも1つの試薬、緩衝液、又は溶剤を微小流体カートリッジの中にあるリザーバから放出するように動作する、ステップと、微小流体カートリッジにおいて生物サンプルを溶解して、溶解生物サンプルを作成するステップと、微小流体カートリッジにおいて保持部材を溶解生物サンプルと接触させるステップであって、生物サンプルが少なくとも1つのポリヌクレオチドを含み、これによって、微小流体カートリッジにおいてポリヌクレオチド装填保持部材を生成し、保持部材が、ポリアルキレン・イミン又はポリカチオニック・ポリアミドで形成した複数の粒子の形態である、ステップと、ポリヌクレオチド装填保持部材を洗浄緩衝液と接触させるステップと、ポリヌクレオチド装填保持部材を少なくとも約50℃の温度に約10分未満の間加熱するステップと、ポリヌクレオチド装填保持部材を放出緩衝液と接触させて、放出ポリヌクレオチド・サンプルを作成するステップと、放出ポリヌクレオチド・サンプルを中和緩衝液と接触させて、中和ポリヌクレオチド・サンプルを作成するステップと、中和ポリヌクレオチド・サンプルからPCRアンプリコンを作成するのに適した熱サイクル条件の下で、中和ポリヌクレオチド・サンプルをPCR試薬混合物と接触させるステップであって、PCR試薬混合物が、ポリメラーゼ酵素、陽性対照プラスミド、プラスミドの少なくとも一部のために選択した蛍光原混成プローブ、及び複数のヌクレオチドを含む、ステップと、中和ポリヌクレオチド・サンプル又はそのPCRアンプリコンを、ポリヌクレオチド・シーケンスのために選択的とすることができる少なくとも1つの蛍光原プローブと接触させるステップであって、プローブは、グラム陽性バクテリア、グラム陰性バクテリア、イースト、菌類、原生動物、及びウィルスから成る一群から選択した有機体の特徴を示すポリヌクレオチド・シーケンスのために選択的とすることができ、1つの蛍光原プローブを選択することができる有機体の存在を判定するステップを含むことができる。 In some embodiments, the polynucleotide collection method includes placing a microfluidic cartridge in a receiving bay of the device and operating a power member in the device to interface between a portion of the receiving bay and a portion of the microfluidic cartridge. Pressure is applied, wherein the force operates to release at least one reagent, buffer, or solvent from a reservoir in the microfluidic cartridge, and lysing the biological sample in the microfluidic cartridge Creating a lysed biological sample and contacting the retaining member with the lysed biological sample in the microfluidic cartridge, wherein the biological sample comprises at least one polynucleotide, whereby the polynucleotide in the microfluidic cartridge Generating a load holding member, In the form of a plurality of particles formed of polyalkyleneimine or polycationic polyamide, contacting the polynucleotide load retaining member with a wash buffer, and bringing the polynucleotide load retaining member to at least about 50 ° C. Heating to a temperature for less than about 10 minutes; contacting the polynucleotide load retaining member with a release buffer to create a release polynucleotide sample; and contacting the release polynucleotide sample with a neutralization buffer A neutralizing polynucleotide sample and a PCR reagent mixture under thermal cycling conditions suitable for generating a PCR amplicon from the neutralizing polynucleotide sample. Contacting the PCR reagent mixture A step comprising a melase enzyme, a positive control plasmid, a fluorogenic hybrid probe selected for at least a portion of the plasmid, and a plurality of nucleotides, and a neutralizing polynucleotide sample or PCR amplicon thereof; Contacting with at least one fluorogenic probe, which can be selective for the probe, wherein the probe is selected from the group consisting of Gram positive bacteria, Gram negative bacteria, yeast, fungi, protozoa, and viruses. Determining the presence of an organism that can be selective for polynucleotide sequences exhibiting airframe characteristics and from which one fluorogenic probe can be selected.
種々の実施形態では、コンピュータ・プログラム生産物は、前述の装置を動作させるためのコンピュータ読み取り可能命令をその上に含む。 In various embodiments, the computer program product includes computer readable instructions thereon for operating the aforementioned device.
実施形態によっては、コンピュータ・プログラム生産物は、システムに放出ポリヌクレオチド・サンプルを生物サンプルから作成させるコンピュータ読み取り可能命令をその上に含む。コンピュータ読み取り可能命令は、ポリヌクレオチド装填保持部材を生成するのに適した条件の下で、保持部材を生物サンプルと接触させる命令と、生物サンプルの少なくとも一部をポリヌクレオチド装填保持部材から分離する命令と、ポリヌクレオチド装填保持部材からポリヌクレオチドの少なくとも一部を放出することによって、放出ポリヌクレオチド・サンプルを作成する命令とを含むことができる。 In some embodiments, the computer program product includes computer readable instructions thereon that cause the system to create a released polynucleotide sample from the biological sample. The computer readable instructions include instructions for contacting the holding member with the biological sample under conditions suitable for generating the polynucleotide loading and holding member, and instructions for separating at least a portion of the biological sample from the polynucleotide loading and holding member. And instructions for creating a release polynucleotide sample by releasing at least a portion of the polynucleotide from the polynucleotide load retaining member.
種々の実施形態では、コンピュータ・プログラム生産物は、システムに、受容ベイに微小流体カートリッジを入れたことの指示を出力させ、サンプル・ラベル又は微小流体カートリッジ・ラベルを読み取らせ、ユーザがサンプル識別子を入力する指令を出力させ、ユーザがサンプル転送部材に生物サンプルを装填する指令を出力させ、ユーザがフィルタをサンプル転送部材に適用する指令を出力させ、ユーザが生物サンプルを微小流体カートリッジに導入する指令を出力させ、ユーザに生物サンプルを微小流体カートリッジにおける溶解試薬と接触させる指令を出力させ、ユーザが微小流体カートリッジを受容ベイに入れる指令を出力させ、ユーザが装置において動力部材を動作させて、受容ベイの一部と微小流体カートリッジの一部との間の界面に圧力を加える指令を出力させ、ユーザが蓋を閉鎖して動力部材を動作させる指令を出力させ、及び/又はユーザが生物サンプルを約0.5mL及び約5mLの間の体積の空気と共に導入することによって、微小流体カートリッジの中で生物サンプルを加圧する指令を出力させる1つ以上の命令を含むことができる。 In various embodiments, the computer program product causes the system to output an indication that a microfluidic cartridge has been placed in the receiving bay, read the sample label or microfluidic cartridge label, and the user provides a sample identifier. An instruction to input, an instruction to load a biological sample to the sample transfer member, a user to output an instruction to apply the filter to the sample transfer member, and an instruction to introduce the biological sample to the microfluidic cartridge by the user To output a command to contact the biological sample with the lysis reagent in the microfluidic cartridge, to output a command for the user to place the microfluidic cartridge into the receiving bay, and for the user to operate the power member in the device to receive Between part of the bay and part of the microfluidic cartridge Command to apply pressure to the interface, user to command to close lid and operate power member, and / or user to introduce biological sample with volume of air between about 0.5 mL and about 5 mL By doing so, one or more instructions can be included that cause a command to pressurize the biological sample in the microfluidic cartridge.
種々の実施形態では、コンピュータ・プログラム生産物は、システムに、生物サンプルを溶解させ、生物サンプルを溶解試薬によって溶解させ、液体によって界面活性剤の凍結乾燥ペレットを復元させて、溶解試薬溶液を作成させ、生物サンプルを加熱させ、ポリヌクレオチド装填保持部材を生物サンプルの少なくとも一部から分離させ、生物サンプルにおけるポリメラーゼ連鎖反応インヒビタの実質的に全てからポリヌクレオチド装填保持部材を分離させ、熱作動型ポンプ又は熱作動型弁を動作させることによって、微小流体カートリッジにおいて流体を送出させ、ポリヌクレオチド装填保持部材を洗浄緩衝液と接触させ、ポリヌクレオチド装填保持部材を少なくとも約50℃(実施形態によっては、温度は100℃以下とすることができる)に加熱させ、約10分未満の間ポリヌクレオチド装填保持部材を加熱させ、ポリヌクレオチド装填保持部材を放出緩衝液と接触させて、放出ポリヌクレオチド・サンプルを作成させ、及び/又は放出ポリヌクレオチド・サンプルを中和緩衝液と接触させて、中和ポリヌクレオチド・サンプルを作成させる1つ以上の命令を含むことができる。 In various embodiments, the computer program product causes the system to lyse the biological sample, lyse the biological sample with the lysis reagent, and restore the lyophilized pellet of the surfactant with the liquid to create a lysis reagent solution. Heating the biological sample, separating the polynucleotide load retaining member from at least a portion of the biological sample, separating the polynucleotide load retaining member from substantially all of the polymerase chain reaction inhibitor in the biological sample, Alternatively, by operating a thermally actuated valve, fluid is delivered in the microfluidic cartridge, the polynucleotide load retaining member is contacted with a wash buffer, and the polynucleotide load retaining member is at least about 50 ° C. (in some embodiments a temperature Can be below 100 ° C Heating the polynucleotide load retaining member for less than about 10 minutes, contacting the polynucleotide load retaining member with a release buffer to produce a release polynucleotide sample, and / or release polynucleotide One or more instructions can be included that allow the sample to be contacted with a neutralization buffer to create a neutralizing polynucleotide sample.
種々の実施形態では、コンピュータ・プログラム生産物は、システムに、中和ポリヌクレオチド・サンプルを、ポリメラーゼ酵素及び複数のヌクレオチドを含むPCR試薬混合物と接触させ、中和ポリヌクレオチド・サンプルからPCRアンプリコンを作成するのに適した熱サイクル条件の下で、PCR試薬混合物及び中和ポリヌクレオチド・サンプルを加熱させ、中和ポリヌクレオチド・サンプル又はそのPCRアンプリコンを、ポリヌクレオチド・シーケンスのために選択的とすることができる少なくとも1つのプローブと接触させ、中和ポリヌクレオチド・サンプルのPCRアンプリコン及び陰性対照ポリヌクレオチドのPCRアンプリコンを独立して作成するのに適した熱サイクル条件の下で、中和ポリヌクレオチド・サンプル及び陰性対照ポリヌクレオチドの各々をPCR試薬混合物と独立して接触させ、中和ポリヌクレオチド・サンプル又はそのPCRアンプリコン、及び陰性対照ポリヌクレオチド又はそのPCRアンプリコンを、ポリヌクレオチド・シーケンスのために選択した少なくとも1つのプローブと接触させ、プローブが中和ポリヌクレオチド・サンプル又はそのPCRアンプリコンにおいて検出された場合、生物サンプルにおけるポリヌクレオチド・シーケンスの存在の判定を出力させ、ポリヌクレオチド・シーケンスがプローブに対応し、及び/又はプローブが陰性対照ポリヌクレオチド又はそのPCRアンプリコンにおいて検出された場合、汚染結果の判定を出力させる1つ以上の命令を含むことができる。 In various embodiments, the computer program product causes the system to contact a neutralized polynucleotide sample with a PCR reagent mixture comprising a polymerase enzyme and a plurality of nucleotides, and to generate a PCR amplicon from the neutralized polynucleotide sample. The PCR reagent mixture and the neutralized polynucleotide sample are heated under thermal cycling conditions suitable for generation, and the neutralized polynucleotide sample or its PCR amplicon is selectively selected for polynucleotide sequencing. Neutralizing under thermal cycling conditions suitable to independently generate PCR amplicons for neutralized polynucleotide samples and PCR amplicons for negative control polynucleotides in contact with at least one probe Polynucleotide samples and Each of the sex control polynucleotides was contacted independently with the PCR reagent mixture, and a neutralizing polynucleotide sample or its PCR amplicon and a negative control polynucleotide or its PCR amplicon were selected for the polynucleotide sequence. Contact with at least one probe and, if the probe is detected in a neutralized polynucleotide sample or its PCR amplicon, output a determination of the presence of the polynucleotide sequence in the biological sample and the polynucleotide sequence corresponds to the probe And / or if a probe is detected in the negative control polynucleotide or its PCR amplicon, it can include one or more instructions that output a determination of the contamination result.
種々の実施形態では、コンピュータ・プログラム生産物は、システムに前述の方法のステップの1つ以上を自動的に実行させる1つ以上の命令を含むことができる。 In various embodiments, the computer program product can include one or more instructions that cause the system to automatically perform one or more of the steps of the foregoing method.
種々の実施形態では、微小流体ネットワークが2つ以上のサンプル・レーンを含み、その各々が、熱作動型ポンプ、熱作動型弁、サンプル入口弁、フィルタ、及び少なくとも1つのリザーバを含み、コンピュータ読み取り可能命令は、システムにおける各レーンを独立して動作させるように構成することができる。 In various embodiments, the microfluidic network includes two or more sample lanes, each of which includes a thermally actuated pump, a thermally actuated valve, a sample inlet valve, a filter, and at least one reservoir, the computer readable The possible instructions can be configured to operate each lane in the system independently.
実施形態によっては、コンピュータ・プログラム生産物は、生物サンプルから放出ポリヌクレオチド・サンプルをシステムに作成させるコンピュータ読み取り可能命令をその上に含む。このシステムは、微小流体ネットワークと、この微小流体ネットワークと流体連通する保持部材であって、少なくとも1つのポリメラーゼ連鎖反応インヒビタに対して少なくとも1つのポリヌクレオチドのために選択した保持部材とを備えている微小流体カートリッジと、微小流体カートリッジを選択的に収容するように構成されている受容ベイと、受容ベイにおける微小流体カートリッジに熱的に結合するように構成されている少なくとも1つのヒート・ポンプと、検出器と、検出器及びヒート・ポンプと結合されているプラグラマブル・プロセッサとを備えている装置とを含むことができる。コンピュータ読み取り可能命令は、生物サンプルを溶解試薬と接触させることによって生物サンプルを溶解し、更に加熱して溶解サンプルを生成し、保持部材を生物サンプル及び/又は溶解サンプルと接触させて、ポリヌクレオチド装填保持部材を生成し、ポリヌクレオチド装填保持部材から生物サンプルの少なくとも一部を分離し、ポリヌクレオチド装填保持部材を洗浄緩衝液と接触させ、ポリヌクレオチド装填保持部材を放出緩衝液と接触させるか、又は加熱してポリヌクレオチドの少なくとも一部をポリヌクレオチド装填保持部材から放出することによって、放出ポリヌクレオチド・サンプルを作成し、放出ポリヌクレオチド・サンプルを中和緩衝液と接触させて、中和ポリヌクレオチド・サンプルを作成し、PCRアンプリコンを独立して作成するのに適した熱サイクル条件の下で、中和ポリヌクレオチド・サンプル及び陰性対照ポリヌクレオチドの各々をPCR試薬混合物と独立して接触させ、PCR試薬混合物が、ポリメラーゼ酵素、複数のヌクレオチド、陽性対照プラスミド、プラスミドの少なくとも一部のために選択したプラスミド・プローブを含み、プラスミド・プローブが検出された場合、PCR反応が発生したと判定し、中和ポリヌクレオチド・サンプル又はそのPCRアンプリコン、及び陰性対照ポリヌクレオチド又はそのPCRアンプリコンを、ポリヌクレオチド・シーケンスのために選択した少なくとも1つのプローブと接触させ、プローブが中和ポリヌクレオチド・サンプル又はそのPCRアンプリコンにおいて検出された場合、生物サンプルにおけるポリヌクレオチド・シーケンスの存在を判定し、ポリヌクレオチド・シーケンスがプローブに対応し、プローブが陰性対照ポリヌクレオチド又はそのPCRアンプリコンにおいて検出された場合、汚染結果の判定を出力させる1つ以上の命令を含むことができる。 In some embodiments, the computer program product includes computer readable instructions thereon that cause the system to create a released polynucleotide sample from the biological sample. The system comprises a microfluidic network and a retaining member in fluid communication with the microfluidic network, the retaining member selected for at least one polynucleotide relative to at least one polymerase chain reaction inhibitor. A microfluidic cartridge, a receiving bay configured to selectively receive the microfluidic cartridge, and at least one heat pump configured to thermally couple to the microfluidic cartridge in the receiving bay; And a device comprising a detector and a pluggable processor coupled to the detector and a heat pump. The computer readable instructions lyse the biological sample by contacting the biological sample with a lysis reagent, further heat to produce a lysed sample, and contact the retention member with the biological sample and / or lysed sample to load the polynucleotide. Generating a retaining member, separating at least a portion of the biological sample from the polynucleotide loading retaining member, contacting the polynucleotide loading retaining member with a wash buffer, contacting the polynucleotide loading retaining member with a release buffer, or A release polynucleotide sample is prepared by heating to release at least a portion of the polynucleotide from the polynucleotide load retaining member, and the release polynucleotide sample is contacted with a neutralization buffer to obtain a neutralization polynucleotide. Create a sample and use the PCR amplicon Each of the neutralized polynucleotide sample and the negative control polynucleotide is contacted independently with the PCR reagent mixture under thermal cycling conditions suitable for making the PCR reagent mixture, the polymerase enzyme, the plurality of nucleotides A positive control plasmid, a plasmid probe selected for at least a portion of the plasmid, and if a plasmid probe is detected, it is determined that a PCR reaction has occurred and a neutralized polynucleotide sample or its PCR amplicon And a negative control polynucleotide or its PCR amplicon is contacted with at least one probe selected for the polynucleotide sequence, and if a probe is detected in the neutralized polynucleotide sample or its PCR amplicon, Sample One or more instructions that determine the presence of a polynucleotide sequence that outputs a determination of a contamination result if the polynucleotide sequence corresponds to a probe and the probe is detected in a negative control polynucleotide or its PCR amplicon. Can be included.
本技術の1つ以上の実施形態の詳細は、添付図面及び以下の説明に明記されている。本技術のその他の特徴、目的、及び利点は、説明及び図面、並びに特許請求の範囲から明白であろう。種々の図面における同様の参照記号は、同様の要素を示すこととする。
これより、システム、微小流体カートリッジ、キット、方法、及びコンピュータ・プログラム生産物について更に説明する。
The details of one or more embodiments of the technology are set forth in the accompanying drawings and the description below. Other features, objects, and advantages of the technology will be apparent from the description and drawings, and from the claims. Like reference symbols in the various drawings indicate like elements.
The system, microfluidic cartridge, kit, method, and computer program product will now be further described.
生物サンプルの分析は、多くの場合、1つ以上のポリヌクレオチド(例えば、DNA、RNA、mRNA、又はrRNA)がサンプルの中に存在する可能性があるか否か判断することを含む。例えば、サンプルを分析して、特定の病原体(バクテリア又はビールスのような)を示すポリヌクレオチドが存在する可能性があるか否か判断する場合がある。ポリヌクレオチドは、ゲノムDNAのサンプルとすることができ、又はミトコンドリアDNAのサンプルとすることもできる。通例、生物サンプルは複合の混合物とすることができる。例えば、サンプルは、血液サンプル、組織サンプル(例えば、鼻、口、肛門、膣組織のスワブ)バイオプシ吸引液、溶菌液、菌類、又はバクテリアとして供給することができる。判断すべきポリヌクレオチドは、粒子の中に含有されていてもよい(例えば、細胞(例えば、白血球細胞及び/又は赤血球細胞)、組織断片、バクテリア(例えば、グラム陽性バクテリア及び/又はグラム陰性バクテリア)、菌類、胞子)。1つ以上の液体(例えば、水、緩衝液、血液、血液プラズマ、唾液、尿、髄液、又は有機溶剤)が、通例、サンプルの一部となることができ、及び/又は処理ステップの間にサンプルに添加することができる。 Analysis of a biological sample often involves determining whether one or more polynucleotides (eg, DNA, RNA, mRNA, or rRNA) can be present in the sample. For example, a sample may be analyzed to determine whether there may be a polynucleotide that is indicative of a particular pathogen (such as a bacterium or virus). The polynucleotide can be a sample of genomic DNA or it can be a sample of mitochondrial DNA. Typically, the biological sample can be a complex mixture. For example, the sample can be supplied as a blood sample, a tissue sample (eg, a swab of nose, mouth, anus, vaginal tissue) biopsy aspirate, lysate, fungus, or bacteria. The polynucleotide to be determined may be contained in particles (eg, cells (eg, white blood cells and / or red blood cells), tissue fragments, bacteria (eg, gram positive bacteria and / or gram negative bacteria). , Fungi, spores). One or more liquids (eg, water, buffer, blood, blood plasma, saliva, urine, spinal fluid, or organic solvent) can typically be part of the sample and / or during the processing step. Can be added to the sample.
生物サンプルの分析方法は、生物サンプル(例えば、スワブ)を用意し、サンプルの粒子(例えば、バクテリアのような細胞)からポリヌクレオチドを放出し、放出したポリヌクレオチドの1つ以上を増幅し(例えば、ポリメラーゼ連鎖反応(PCR)によって)、増幅ポリヌクレオチドの存在(又は不在)を判定する(例えば、蛍光検出によって)。しかしながら、生物サンプルは、通例、インヒビタ(例えば、粘液複合物、ヘモグロビン、糞便複合物、及びDNA結合蛋白質)を含み、これがサンプルにおけるポリヌクレオチドの存在を判定するのを妨げる可能性がある。例えば、このようなインヒビタは、PCR及びポリヌクレオチドの存在を判定するその他の酵素技法によるポリヌクレオチドの増幅効率を低下させる可能性がある。インヒビタの濃度が、判定すべきポリヌクレオチドに対して減少しない場合、分析が偽りの陰性結果を生成する可能性がある。ここでは、生物サンプル(例えば、判定すべき1つ以上のポリヌクレオチドを有するサンプル)を処理する本方法及び関係するシステムは、通例、インヒビタの濃度を判定すべきポリヌクレオチドの濃度に対して、ここで更に説明する方法によって低下させることができる。 Biological sample analysis methods prepare a biological sample (eg, a swab), release polynucleotides from the sample particles (eg, cells such as bacteria), and amplify one or more of the released polynucleotides (eg, , By polymerase chain reaction (PCR)) to determine the presence (or absence) of the amplified polynucleotide (eg, by fluorescence detection). However, biological samples typically contain inhibitors (eg, mucus complex, hemoglobin, stool complex, and DNA binding protein), which can prevent determining the presence of a polynucleotide in the sample. For example, such inhibitors may reduce the amplification efficiency of the polynucleotide by PCR and other enzymatic techniques that determine the presence of the polynucleotide. If the inhibitor concentration does not decrease relative to the polynucleotide to be determined, the analysis may produce a false negative result. Here, the present methods and related systems for processing biological samples (eg, samples having one or more polynucleotides to be determined) are typically used here for the concentration of the polynucleotide to be determined for the inhibitor concentration. Can be reduced by the method described further in FIG.
システム及び微小流体カートリッジの種々の態様について、ここで説明する。その種々の構成要素の追加の開示は、米国特許出願第11/580,267号、及び仮特許出願第60/859,284号において見出すことができ、その明細書はここで引用したことにより、本願にも含まれるものとする。 Various aspects of the system and microfluidic cartridge will now be described. Additional disclosure of its various components can be found in US patent application Ser. No. 11 / 580,267 and provisional patent application No. 60 / 859,284, the specification of which is hereby incorporated by reference: It shall be included in this application.
システムの全体像
ここに記載する分析を実行するシステム981の模式的な全体像を図1に示す。図1に示すシステム981の構成要素の幾何学的配置は、一例であり、限定することは意図していない。マイクロプロセッサのようなプロセッサ980は、図示のようなシステムの種々の構成要素の機能を制御するように構成されており、これによってこのような構成要素の各々と通信する。即ち、プロセッサ980は、分析すべきサンプルに関するデータを、例えば、サンプル・リーダ990からうけとるように構成されている。サンプル・リーダ990は、バーコード・リーダ、光学式キャラクタ・リーダ、又はRFIDスキャナ(無線周波数タグ・リーダ)とすればよい。例えば、サンプル識別器は、ハンドヘルド・バーコード・リーダとすることができる。プロセッサ980は、ユーザ命令や動作条件の選択を入力984から受け入れるように構成されており、このような命令は、サンプルの分析を開始する命令を含むことができる。また、プロセッサ980は、ディスプレイ982と通信するように構成されているので、例えば、分析の結果をディスプレイに送信する。加えて、プロセッサ980は、ディスプレイ982上に表示すべき1つ以上の質問を送信し、ユーザがそれに応答して入力を与えるように促すことができる。つまり、ある種の実施形態では、入力984及びディスプレイ982は、互いに一体化されている。任意に、プロセッサ986は更に分析の結果を、プリンタ、視覚ディスプレイ、又はスピーカ、あるいはその組み合わせのような出力デバイスに送信するように構成されている。任意に、プロセッサ980は更にネットワーク・インターフェースのような通信インターフェースを通じて、コンピュータ・ネットワーク988に接続されている。通信インターフェースは、シリアル接続、パラレル接続、ワイヤレス・ネットワーク接続、及び有線ネットワーク接続から成る一群から選択した1つ以上のインターフェースとすることができる。これによって、システムが相応しくネットワーク上でアドレスされているとき、遠隔ユーザはプロセッサにアクセスし、命令を送信し、データを入力し、データを読み出し、プロセッサと関連のあるメモリ(図示せず)、又はプロセッサと通信するその他の何らかのコンピュータ読み取り可能媒体に格納することができる。
System Overview A schematic overview of a
図1には示していないが、種々の実施形態では、入力984は、キーボード、接触感応面、マイクロフォン、トラック・パッド、網膜スキャナ、及びマウスから成る一群から選択した1つ以上の入力デバイスを含むことができる。
加えて、種々の実施形態では、本装置は、更に、プロセッサ、入力デバイス、及び通信インターフェースの1つ以上からデータを受け取るように構成されているデータ記憶媒体も備えることができ、データ記憶媒体は、ハード・ディスク・ドライブ、光ディスク・ドライブ、フラッシュ・カード、及びDC−Romから成る一群から選択した1つ以上の媒体である。
Although not shown in FIG. 1, in various embodiments,
In addition, in various embodiments, the apparatus can further comprise a data storage medium configured to receive data from one or more of the processor, the input device, and the communication interface, wherein the data storage medium is One or more media selected from the group consisting of: a hard disk drive, an optical disk drive, a flash card, and a DC-Rom.
更に、プロセッサ980は、全体像において以下に続き、この中で更に詳しく説明する、サンプル診断の種々の態様を制御するように構成されている。本システムは、微小流体カートリッジのような、相補的カートリッジ994と合わせて動作するように構成されている。カートリッジ自体は、この中で更に説明するが、生物サンプル996を、ワークアップ及び診断分析に適した形態で受け取るように構成されている。カートリッジは、システムの中にある受容ベイ992に収容される。受容ベイは、ヒータ998と連通しており、ヒータ998自体はカートリッジの特定の領域をサンプルワークアップ及び分析中の特定の時点に加熱するようにプロセッサ980によって制御される。また、プロセッサは、カートリッジ994からの診断の指示を受け取る検出器999を制御するように構成されている。前述のように、診断は、出力デバイス986及び/又はディスプレイ982に送信することができる。
Further, the
適したプロセッサ980は、当技術分野では周知の設計原理及び半導体処理方法によって、それぞれ、設計及び製造することができる。
A
図1に全体像を示したシステムは、ここに記載するその他の実施形態例と同様に、優位性がある。何故なら、これは試薬の蓄積に適した構成のシステム内部に場所を必要としないからである。本システムも、この中にあるその他の実施形態例も、例えば、ボトル、キャニスタ、又はリザーバのような外部蓄積容器から試薬を受け取るように構成されている入口や出口ポートを必要としない。したがって、図1におけるシステムは自己充足的であり、微小流体カートリッジと合わせて動作する。このカートリッジは、その内部に試薬蓄積専用の場所を有する。 The system shown in FIG. 1 is advantageous, as is the case with the other exemplary embodiments described herein. This is because no space is required inside the system, which is suitable for reagent accumulation. Neither the present system nor the other example embodiments therein require an inlet or outlet port configured to receive reagents from an external storage container such as, for example, a bottle, canister, or reservoir. Thus, the system in FIG. 1 is self-contained and works with a microfluidic cartridge. This cartridge has a dedicated location for reagent accumulation inside.
図1のシステムは、研究室のセッティングのような、1つの場所で動作を実行するように構成することができ、あるいは携行可能であってもよく、例えば、異なる場所の患者を訪問する場合がある、外科医又はその他の健康管理専門家に随伴することができる。本システムには、通例、電力コードが設けられているので、主電源又は発電機からAC電力を受け入れることができる。任意の変圧器(図示せず)をシステムに組み込むか、又は電力ソケットとシステムとの間で外部に配置すれば、AC入力電力をシステムが用いるためのDC出力に変圧する。また、本システムは、1つ以上のバッテリを用いることによって動作するように構成することもでき、したがって、通例、バッテリ再充電システムや、診断分析を信頼性高く開始又は完了するにはバッテリ電力が低くなり過ぎた場合にはユーザに警告する種々の警報デバイスも装備されている。 The system of FIG. 1 can be configured to perform operations at one location, such as a laboratory setting, or may be portable, for example when visiting patients at different locations. You can accompany a surgeon or other health care professional. The system is typically provided with a power cord so that AC power can be received from the main power source or generator. If an optional transformer (not shown) is incorporated into the system or placed externally between the power socket and the system, the AC input power is transformed into a DC output for use by the system. The system can also be configured to operate by using one or more batteries, so battery power is typically required to initiate or complete a battery recharge system or diagnostic analysis reliably. Various alarm devices are also provided to alert the user if it becomes too low.
図1のシステムは、更に、他の実施形態では、多重化サンプル分析に合わせて構成することもできる。このような構成の1つでは、図1に全体像を示したようなシステムの多数のインスタンス同士を一緒に動作させて、多数のカートリッジを受け入れて処理する。各カートリッジには、異なるサンプルが装填されている。図1に示す各構成要素は、したがって、サンプルの数だけあってもよいが、種々の構成要素は共通の筐体内に構成することができる。 The system of FIG. 1 may also be configured for multiplexed sample analysis in other embodiments. In one such configuration, multiple instances of a system, such as that illustrated in FIG. 1, are operated together to accept and process multiple cartridges. Each cartridge is loaded with a different sample. Each component shown in FIG. 1 may thus be the number of samples, but the various components can be configured in a common housing.
更に別の構成では、システムは、多数のカートリッジを受け入れて処理するように構成されているが、図1における1つ以上の構成要素は、多数のカートリッジに共通である。例えば、1つのデバイスに多数のカートリッジ受容ベイを構成することができるが、共通のプロセッサ及びユーザ・インターフェースを、種々のカートリッジの同時、連続、又は同時制御を可能にするのに適した構成とすることができる。更に、このような実施形態は、1つのサンプル・リーダ及び1つの出力デバイスを利用することも可能である。 In yet another configuration, the system is configured to accept and process multiple cartridges, but one or more components in FIG. 1 are common to multiple cartridges. For example, multiple cartridge receiving bays can be configured in one device, but the common processor and user interface are configured to allow simultaneous, sequential, or simultaneous control of various cartridges. be able to. Furthermore, such an embodiment may utilize one sample reader and one output device.
更に別の構成では、図1に示すシステムは、1つのカートリッジを受け入れるように構成されているが、1つのカートリッジは、1つよりも多い、例えば、2、3、4、5、又は6つのサンプルを並列に、互いに独立して、処理するように構成されている。多数のサンプルを取り扱うことができるカートリッジを作成する技術の例は、別の文献、例えば、米国特許出願第60/859,284号に記載されている。その内容は、ここで引用したことにより、本願にも含まれるものとする。 In yet another configuration, the system shown in FIG. 1 is configured to accept one cartridge, but one cartridge is more than one, eg, 2, 3, 4, 5, or 6 Samples are configured to be processed in parallel and independently of each other. An example of a technique for making a cartridge capable of handling a large number of samples is described in another document, eg, US Patent Application No. 60 / 859,284. The contents thereof are included in the present application by quoting here.
更に、カートリッジに、タグを付ける、例えば、サンプルを示す分子バーコードを付けることができ、サンプルの追跡をし易くし、サンプルの混合の危険性を極力抑えるようにすることも、本技術と調和する。このようなタグ付け方法は、例えば、米国特許出願公開第10/360,854号に記載されている。その内容は、ここで引用したことにより、本願にも含まれるものとする。 In addition, the cartridge can be tagged, for example, a molecular barcode indicating the sample, making it easier to track the sample and minimizing the risk of sample mixing. To do. Such a tagging method is described, for example, in US Patent Application Publication No. 10 / 360,854. The contents thereof are included in the present application by quoting here.
システム例
図2A〜図2Eは、本明細書中で更に説明するシステム例の種々の構成の外部斜視図を示す。図2Aは、微小流体カートリッジ(図示せず)を収容し、カートリッジに導入されたサンプルに種々の処理動作を行わせ、それらの動作を制御するシステム2000の斜視図を示す。システム2000のエレメントは、明示的に示すものに限定されるのではない。例えば、図示しないが、システム2000は、この中で更に説明するように、ハンドヘルド・バーコード・リーダに接続することもできる。
Example System FIGS. 2A-2E show external perspective views of various configurations of an example system further described herein. FIG. 2A shows a perspective view of a
システム2000は、筐体2002を備えており、筐体2002は金属又は硬化プラスチックで作ることができる。図2Aに示す筐体の形態は、様式的及び機能的特徴を具体化している。本発明のその他の実施形態は、構成要素の配列において、そして線の平滑さ、外部仕上げ、及び模様に関するそれらの全体的外観において、多少異なって見える場合もある。更に、システム2000は、1つ以上の安定化部材2004を備えている。図2Aに示すのは、安定脚であり、通常数個設けられており、システム2000の下側の種々の領域に配置されて、バランスを取り支持している。例えば、3本、4本、5本、6本、又は8本のこのような安定脚があってもよい。脚は、成型され、筐体2002と同じ材料で作るとよく、あるいは1つ以上の別個の材料で作り、システム2000の下側に取り付けてもよい。例えば、脚は、ゴムを含み、システム2000が設置されている面上で滑り難くし、更に表面を傷から保護することもできる。部材の安定化部材は、脚以外の形態、例えば、レール、ランナ、又は1つ以上のパッドの形態をなすこともできる。
The
更に、システム2000は、ディスプレイ2006を備えており、これはアクティブ・マトリクスのような液晶ディスプレイ、OLED、又はその他の何らかの適した形態とすればよい。これは、画像及びその他の情報をカラー又は白黒で呈示することができる。また、ディスプレイ2006は、接触感応ディスプレイとしてもよく、したがって、種々の表示プロンプトに応答してユーザからの入力を受け入れるように構成することもできる。ディスプレイ2006は、反射防止被膜をその上に有し、研究室設定において頭上光からのグレアや反射を低減するようにするとよい。また、ディスプレイ2006は、例えば、バックライトから照明し、暗い研究室において一層視認し易くするとよい。
Furthermore, the
図2Aに示すように、システム200は、ハンドル2008を有する可動蓋201も備えている。蓋2010は、前後に摺動することができる。図2Aでは、蓋は前方位置にあり、これによって「閉鎖」されている。図2Bでは、蓋は後方位置にあり、この場合蓋は「開放」しており、微小流体カートリッジを収容するように構成されている受容ベイ2014を露見させる。勿論、当業者は認めようが、ここに記載する技術は、摺動する蓋や、前後に摺動する蓋には限定されない。蓋がデバイスの前方に位置するときに「開放する」構成のように、横の移動も可能である。また、蓋が蝶番式の蓋であることや、完全に取り外し可能な蓋であることも可能である。
As shown in FIG. 2A, the
ハンドル2008は、ユーザが蓋2010を一方の位置から他方に移動させることを可能にする役割を果たし、更に、閉鎖位置にあるときに、蓋に対して下方に圧力を賭けさせ、圧力が受容ベイ2014の中にあるカートリッジに加えることができるようにする役割も果たす。図2Cでは、ハンドル2008は押下位置に示されており、これによって力が蓋2014に加えられ、このため、蓋の直下にある受容ベイに収容されているカートリッジに圧力が加えられる。
The
一実施形態では、ハンドル及び蓋の構造体には運動センサがはめ込まれており、受容ベイの中にカートリッジがないときには、ハンドルを押下させないようにする。別の実施形態では、ハンドル及び蓋の構造体には、機械的ラッチがはめ込まれており、分析が進行中のときにはハンドルを引き上げられないようにする。 In one embodiment, a motion sensor is fitted into the handle and lid structure to prevent the handle from being depressed when there is no cartridge in the receiving bay. In another embodiment, the handle and lid structure is fitted with a mechanical latch to prevent the handle from being raised when analysis is in progress.
システム2000の更に別の構成を図2Dに示す。この場合、扉2012が開放位置にある。扉2012は、図2A〜図2Cでは閉鎖位置に示されている。扉は、任意の構成要素であり、ユーザがヒータ・モジュール2020、そしてコンピュータ・読み取り可能媒体入力トレイ2022にも接近することができるようにする。システム2000は、ヒータ・モジュール2020及び媒体入力2022を覆う扉がなくても機能するが、このような扉が取り付けられていると便利なことがある。扉2012は底辺が蝶番式となって示されているが、その側辺、又はその上縁に蝶番が取り付けられていてもよい。あるいは、扉2012は、蝶番で取り付ける代わりに、取り外し可能なカバーであってもよい。例えば、ヒータ・モジュール及び/又はコンピュータ読み取り可能媒体入力への接近がシステムの異なる面上の方が望ましい場合、扉2012は、システム2000の背面又は側面に配置してもよい。また、ヒータ・モジュール、及びコンピュータ読み取り可能媒体入力には、デバイスの同じ又は異なる側面で別個の扉を介して到達することも、本システムと調和し、この場合、このような別個の扉は、独立して蝶番で取り付けられていても、取り外し可能でもよい。
ヒータ・モジュール2020は、好ましくは取り外し可能であり、以下で更に説明する。
Yet another configuration of
The
コンピュータ読み取り可能媒体入力2022は、種々の媒体の1つ以上を受け入れることができる。図2Dに示すのは、入力2022の一形態例であり、共通に用いられる読み取り可能、読み取り−書き込み可能、及び書き込み可能フォーマットのCD、DVD、又はミニ−CD、あるいはミニ−DVDを受け入れるCD−Romトレイである。また、フロッピ・ディスク、メモリ・スティックのようなフラッシュ・メモリ、コンパクト・フラッシュ、スマート・データ・カード、又はセキュア・データ・カード、ペン・ドライブ、可搬型USBドライブ、ジップ・ディスク、及びその他のような、他の形態の媒体も受け入れることができる入力も、この中の記載と調和する。また、このような入力は、様々な異なる形態の媒体も受け入れるように構成することができる。このような入力2022は、プロセッサと通信し(図2A〜図2Eには示さないが、図1に関連付けて説明した)、適正に入力に挿入されたときに、コンピュータ読み取り可能媒体からデータを読み取ることができる。
Computer
図2Eは、システム2000の背面の平面図を示す。図示するのは、分析の間余分な熱を逃がすためのエア・ベント2024である。通例、システム2000の内側には、エア・ベント2024を介してファンがあるが、図2Eには示されていない。図2Eに示すその他のポートは次の通りである。システム2000を電源に接続する電力コードを受け入れる電力ソケット2026、システム2000をローカル・エリア・ネットワークのようなコンピュータ・ネットワークにリンクするイーサネット(登録商標)接続2028、システム2000を電話ネットワークのような通信ネットワークにリンクするフォン・ジャック接続2032、システム2000を、プリンタ又はコンピュータ・ハード・ドライブのような1つ以上の周辺デバイスに接続する1つ以上のUSBポート2030、例えば、リモート・コントローラ(図示せず)と通信して、ユーザに、タッチ・スクリーン・インターフェースを用いずに、システムを制御させる、赤外線ポート。例えば、ユーザは離れたところからスケジューリング・コマンドをシステム2000に発行して、今後の特定の時刻に分析を開始させることもできる。
FIG. 2E shows a plan view of the back side of the
システム2000の背面上に示す機構は、種々の構成要素の内部構成に応じて、いずれの異なる様式にでも配置することができる。加えて、システム2000の背面にあるように示す機構は、設計の好みに応じて、任意にシステム2000の別の面に設けてもよい。図2Eに示すのは、接続の例である。尚、入力、出力、ソケット、及び接続を含むその他の機構がシステム2000の背面上に設けても、図示しないが、システム2000の別の面上に設けてもよいことは言うまでもない。
The mechanisms shown on the back of the
本装置の実施形態の一例の分解図を図3に示し、特に、装置2000の内部機構を示す。装置2000は、それと共に用いるカートリッジ上の動作を駆動し監視するために用いることができるハードウェア/ファームウェア、及びカートリッジ内で処理されるサンプルに対して実行される診断検査の結果を解釈し、伝達し、格納するソフトウェアが構成されているコンピュータ読み取り可能媒体を備えることができる。図3を参照すると、装置2000の典型的な構成要素が示されており、例えば、制御電子回路2005、着脱可能なヒータ/センサ・モジュール2020、携行検出モジュールのような検出器2009、表示画面又は任意に合体したディスプレイ及びユーザ・インターフェース2006(例えば、医療級接触感応液晶ディスプレイ(LCD))を含む。実施形態によっては、蓋2010、検出器2009、及びハンドル2008を纏めてスライダ・モジュール2007と呼ぶことができる場合もある。装置2000の更に別の構成要素には、種々のモジュール(例えば、ヒータ/センサ・モジュール2020及び/又はスライダ・モジュール2007)を位置合わせして保持し、構造的剛性を与えるためのフレーム2019のような、1つ以上の機械的固定具を含むことができる。検出器モジュール2009は、レールに配置すれば、装置2000におけるカートリッジ2060の開放及び配置がし易くなり、閉鎖するときに光学素子の位置合わせをし易くすることができる。ヒータ/センサ・モジュール2020は、容易に取り外し構造体に挿入するために、レール上に配置することもできる。
An exploded view of an example of an embodiment of the device is shown in FIG. The
また、装置2000の実施形態は、ソフトウェア(例えば、ユーザとインターフェースし、分析を行い、及び/又は検査結果を分析するため)、ファームウェア(例えば、カートリッジ812上での検査の間ハードウェアを制御するため)、及び周辺機器のための、2031で纏めて示す1つ以上の周辺通信インターフェース(例えば、コンパクト・ディスク又はハード・ディスクのようなストレージに接続するため、バーコード・リーダ及び/又はキーボードのような入力デバイスを接続するため、その他のコンピュータ又はストレージにネットワークを通じて接続するため等の、USB/シリアル/イーサネット(登録商標)のような通信ポート)も含む。
Embodiments of
制御電子回路840は、図4では模式的にブロック図で示されており、種々の実施形態において、例えば、主制御900、多重化902、表示制御904、検出器制御906等のための1つ以上の機能を含むことができる。主制御機能は、装置2000における制御電子回路840のハブとしての役割を果たせばよく、種々の電子機能の通信及び制御を管理することができる。また、主制御機能は、ユーザ又はプリンタ920のような出力デバイス、並びに任意の診断及び安全機能との電気的及び通信インターフェース908をサポートすることができる。主制御機能900と合わせて、マルチプレクサ機能902は、センサ・データ914及び出力電流916を制御し、ヒータ/センサ・モジュール2020を制御するのに役立つことができる。表示制御機能904は、タッチ・スクリーンLCD846への出力を制御し、そして該当するのであれば、これからの入力を解釈することができ、ある種の実施形態では、これによってグラフィカル・インターフェースをユーザに提供する。検出器機能906は、制御電子回路840内に実施することができ、典型的な制御及び処理回路を用いて、1つ以上の蛍光検出モジュールのような検出器2009からのデータの収集、ディジタル化、フィルタ処理、及び/又は送信する。
The
種々の実施形態では、蛍光検出モジュール2009は、微小化した、高感度蛍光検出システムとすることができ、例えば、図5に示すように、相応しく位置付けした微小流体カートリッジから発する蛍光信号のリアル・タイム分析を可能とすることができる。検出モジュール2009は、1つ以上の光源2850(例えば、発光ダイオード(LED))、1つ以上の検出器2852(例えば、フォトダイオード)、並びに1つ以上のフィルタ2851及び/又はレンズ2853を用いることができる。実施形態によっては、検出モジュール2009は多数(例えば、6つ)の検出エレメントを内蔵することができる場合もあり、各エレメントが1つ以上の蛍光プローブを検出することができる。
In various embodiments, the
種々の実施形態では、装置2000のスライダ・モジュール2007は、検出モジュール2009(例えば、光検出システム)及びスライダ・モジュール2007のハンドル2008を押下したときに微小流体カートリッジ2020を押下する機械的構造体/光学素子ジグ856を収容することができる。図6A及び図6Bは、種々の実施形態における、装置2000への挿入後の微小流体カートリッジ2060の場所を示す。光学素子ジグ(optics jig)856は、1箇所以上(例えば、4箇所)の点でスライダ・モジュール2007のケースから吊り下げることができる。スライダ・モジュール2007を閉鎖し、装置2000のハンドル2008を下に回すと、1つ以上の機械的アクチュエータ858(例えば、4つのカム)がプレート860を1つ以上(例えば、4つ)のばね862に対抗して押下することができる。圧縮時には、ばね862は力を検出器モジュール2009に伝達することができる。検出器モジュール2009の底面864は平坦に作ることができ(例えば、250ミクロン以内、典型的には100ミクロン以内、更に典型的には25ミクロン以内)、表面864はカートリッジ2060を押圧することができる。カートリッジ2060は、非圧縮時に厚さが0.1〜2.5mm、典型的には非圧縮時の厚さが約1.5mmの共形層868(例えば、ショア高度が約50から70)を有することができる。したがって、カートリッジ2060の圧縮は、平坦面864との組み合わせで、圧力、つまり熱接触を、微小流体カートリッジ2060全域にほぼ均一に発生することができる。スライダ・モジュール2007における1つ以上のばね862は力(例えば、5〜500N、典型的には約200〜250N)を伝達し、微小流体カートリッジ2060の底面全域に圧力(例えば、2psi)を発生することができる。また、図6Bは、スライダ・モジュール2007を閉鎖することができるときに、スライダ・モジュール2007の機械的機構863が微小流体カートリッジ2060の自己穿孔可能リザーバ866を押下して、リザーバの内容物(例えば、DI水、PCR試薬)を放出させることができる。
In various embodiments, the
着脱式ヒータ・モジュール
着脱式ヒータ・モジュール2020の一例を図7に示す。このモジュールは、局在化した熱を、受容ベイ2014の中に収容されているカートリッジの種々の選択領域に伝達するように構成されている。図7に示すのは、凹陥面2044を有するヒータ・モジュールであり、これが、受容ベイ2014の中にあるときカートリッジを支持するプラットフォームを設ける。一実施形態では、カートリッジは直接表面2044上に載る。表面2044は、図7では、凹陥して示されているが、そうである必要はない。
An example of the
区域2044は、1つの向きで微小流体カートリッジを受け入れるように構成されている。したがって、区域2044には、ユーザがカートリッジを受容ベイ2014に間違った構成で挿入することを防止する機械的なキーのような、位置合わせ部材を装備することができる。図7において機械的なキー2045として示すのは、区域2044の対角線に沿って切り欠いた角であり、この中に微小流体カートリッジの相補的に切り欠いた角をはめ込む(例えば、図9参照)。その他の位置合わせ部材も、ここに記載する装置と調和し、例えば、2つ以上のような数個の切欠角、図9のカートリッジの1つ以上の縁に切り込んだ1つ以上のノッチ、又は図9のカートリッジの1つ以上の縁に製作した1つ以上の突起を含むがこれらには限定されない、カートリッジの1つ以上の縁に設計する機構である。代わりの位置合わせ部材には、カートリッジの下側に設計され、表面2044における1つ以上の凹陥ソケット又は孔と相補的な1つ以上のラグ(lug)又はバンプ(bump)が含まれる。代わりの位置合わせ部材には、カートリッジの下側に設計され、表面2044における1つ以上の1つ以上のラグ又はバンプと相補的な1つ以上の凹陥ソケット又は孔が含まれる。一般に、機構のパターンは、カートリッジが少なくとも1つの非対称エレメントを所有し、1つの向きでしか受容ベイには挿入できないようになっている。
また、図7には、ハンド・グリップ2042も示されており、ユーザによるヒータ・モジュールの取り外し及び挿入をやり易くする。切欠2048によって、ユーザは、処理実行後カートリッジを受容ベイ2014から容易に取り外すことが可能になり、例えば、ユーザの親指は、カートリッジの上面を掴んでいるとき、切欠2048によって余裕のある空間が得られる。切欠2042及び2048の双方は、図7の実施形態では半円状の凹陥として示されているが、これらはその形状に限定されるのではないことは言うまでもない。つまり、矩形、正方形、三角形、楕円形、及びその他の形状の凹陥も、ここに記載するヒータ・モジュールと調和する。
Also shown in FIG. 7 is a
図7の実施形態は、図2A〜図2Eのシステムと互換性を有するように設計されており、ヒータ・モジュールの前面が図の左側にある。ヒータ・モジュール2020の背後には、RS−232接続のような電気接続2050があり、これによって、この中で更に説明するサンプル処理及び分析の間、区域2044の特定の領域に配置されているヒータに電気信号を送出することができる。つまり、区域2044の直下は、図7には示されていないが、抵抗性ヒータのような熱源のアレイとすることができ、受容ベイに適正に挿入された微小流体カートリッジの指定箇所と整合するように構成されている。表面2044は、周期的に浄化して、サンプル取り扱いの間に発生する可能性があるいずれの液体の漏出も、短絡を全く起こさないことを確保することができる。
The embodiment of FIG. 7 is designed to be compatible with the systems of FIGS. 2A-2E, with the front of the heater module on the left side of the figure. Behind the
ヒータ・モジュール2020には、他にも以下の必須でない機構がある。ヒータ・モジュール2020の1つ以上の側面(前面、背面、又はフランキング等)、又は表面(上面又は下面等)には、1つ以上のエア・ベント2052を設けることができ、受容ベイ2014の直下にあるヒータが動作しているときに、過剰の熱を逃がすことができる。図7におけるエア・ベントの構成は一例であり、他の数及び形状も、ヒータ・モジュールの慣例的な製作及び使用と調和することは言うまでもない。例えば、5つの正方形エア・ベントを示すが、1、2、3、4、6、8、又は10個というような他の数のエア・ベントを、ヒータ・モジュールの一方側に配列する、あるいは2つ以上の側面及び/又は面全体に分散させることもできる。更に別の実施形態では、エア・ベントは、円形、矩形、楕円形、三角形、多角形、とすることもでき、湾曲した又は直角の頂点、又は不規則な形状を含む、更に別の形状を有することもできる。
The
更に、ヒータ・モジュール2020は、1つ以上の案内部材2047も備えることができ、これらはヒータ・モジュールを装置に挿入し易くする。これについては、ヒータ・モジュール2020がユーザによって取り外すことができる実施形態で更に説明する。ヒータ・モジュールが取り外せることが利点であるのは、異なる位置合わせ部材及び/又は微小流体ネットワークを有する異なるカートリッジを、同じ又は異なる処理動作のシーケンスと共に採用するというように、異なる種類の分析のためにシステム2000の構成を容易に変更できるからである。別の実施形態では、ヒータ・モジュール2020は、固定とし、例えば、浄化、交換、又は保守のために、製造業者又は公認保守代理人によってのみ取り外すことができ、ユーザによって日常的に取り外すことはできないように設計されている。案内部材は、ヒータ・モジュールが正しく装置内で位置合わせされていることを確保すること、そしてサンプルの処理及び分析の間、又は装置の輸送の間、ヒータ・モジュールが密着し大きく移動しないことを保証することという1つ以上の役割を果たすことができる。図7の実施形態に示す案内部材は、受容ベイ2044のいずれかの側にあり、モジュール2020の全長の相当な部分に沿って広がっている。別の案内部材もこの中の使用と調和し、限定ではないが、1、3、4、5、6、又は8つというような、別の数の案内部材、そしてモジュール2020の区域2051内に配置することを含む、別の位置が含まれる。案内部材2047は、その長さに沿って一定でない厚さを有するように示されている。他の案内部材はその長さに沿って本質的に一定の厚さを有してもよいことは、本発明と調和する。
In addition, the
隣接する受容ベイ2014は、ランプのような、凹陥区域2053の中に設定した、非接触加熱エレメント2046である。凹陥区域2053には、反射板、又は反射被膜も設けて、非接触加熱エレメント2046からのできるだけ多くの熱及び光エネルギを受容ベイ2014に向けて外側に送出するように構成するとよい。エレメント2046は、ある種の実施形態では、熱ランプである。エレメント2046は、電気エネルギを受け、それによって電気抵抗の効果によって加熱するように構成されている。エレメント2046は、受容ベイ2014に収容されているカートリッジの隆起領域を加熱する方法を提供する。カートリッジの隆起領域(例えば、図9参照)は、溶解室を内蔵することができ、非接触加熱エレメント2046からの熱を加えることによって、溶解室内で細胞を溶解させる効果を有することができる。
また、図7には、ヒータ・モジュール2020の区域2051上にある、光学蛍光材2049のような、蛍光材の任意領域も示されている。蛍光材の領域は、この中で更に説明する検出システムによって検出されるように構成されている。領域2049は、サンプル処理及び分析に先だって、検出システムにおいて光学素子の状態を検証するために用いられ、したがって制御又は標準として作用する。例えば、一実施形態では、装置の蓋(例えば、図2A参照)が開いているとき、周囲の光が領域2049に到達することができ、これによって蛍光材が特性周波数又は光のスペクトルを放出することができ、これを検出器が、例えば、標準化又は較正の目的で測定することができる。別の実施形態では、周囲光を拠り所として蛍光材料に発光させる代わりに、1つ以上のLEDのような、検出システム自体からの光源を用いる。したがって、領域2049は、検出器の位置と整合するように位置付けられる。領域2049は、矩形であるように示されているが、正方形、円形、楕円形、三角形、多角形のようなその他の形状で、湾曲した又は直角の頂点を有するように構成することもできる。また、領域2049は、都合に応じて、そして展開する検出システムに対して相補的となるために、ヒータ・モジュール2020上の他の場所に配置してもいいことは言うまでもない。
Also shown in FIG. 7 is an optional area of fluorescent material, such as
また、ヒータ・モジュール2020は、区域2044の直下に配されているヒータのアレイも備えているが、図7には示されていない。更にここで説明するように、このようなヒータは、受信した電気信号にしたがって特定的にそして特定の時点に加熱するように構成されている、抵抗性ヒータとするとよい。
The
即ち、図7には示されていないが、ヒータ/センサ・モジュール2020は、例えば、多重化機能902を離散多重化回路ボード(MUXボード)に、1つ以上のヒータ(例えば、マイクロヒータ)、1つ以上の温度センサ(任意に、例えば、溶融シリカ基板上にフォトリソグラフィによって製作したような、1つ以上のそれぞれのマイクロヒータを有し、任意に合体して1つのヒータ/センサ・ユニットとなる)、及び非接触加熱エレメント2046を含むことができる。マイクロヒータ及び非接触加熱エレメントは、熱エネルギを供給することができ、この熱エネルギは、相応しく位置付けられている微小流体カートリッジ上にある種々の微小流体構成要素を作動させることができる。センサ(例えば、抵抗性温度検出器(RTD)のような)は、例えば、フィードバックに基づくメカニズムを通じて、マイクロヒータ及び非接触ヒータ2046のリアル・タイム監視を可能とし、温度制御に対処する。1つ以上のマクロヒータは、相応しく位置付けられた微小流体カートリッジ上で加熱する対応の微小流体構成要素(例えば、弁、ポンプ、ゲート、反応室)と位置合わせすることができる。マイクロヒータは、微小流体カートリッジ上の対応する微小流体構成要素よりも多少大きく設計することができるので、中心外れのように、カートリッジが多少ヒータからずれていても、個々の構成要素を効果的に加熱することができる。
That is, although not shown in FIG. 7, the heater /
また、非接触ヒータ2046は、相応しく位置付けられている微小流体カートリッジの少なくとも一区分を加熱する放射熱源としての役割を果たすこともできる。例えば、20Wのキセノン・ランプを、非接触加熱エレメント2046として用いることができる。種々の実施形態では、ヒータ/センサ・モジュール2020は、個々のカートリッジ設計に特定的とすることができ、装置800の前面パネルを通じて容易に交換可能とすることができる。ヒータ/センサ・モジュール2020は、普通の洗剤(例えば、10%漂白溶液)で加熱面2044を洗浄できるように構成することができる。
The
図8A及び図8Bを参照すると、循環的にPCR反応ゾーン1001を加熱するように構成されているヒータ集合の一例が示されている。尚、図8A及び図8Bに示すヒータを統御する原理と同様の原理にしたがって、他のゲート、弁、及びアクチュエータのような微小流体カートリッジの他の領域を作動させるためのヒータ構成を設計し展開することもできることは言うまでもない。PRC反応ゾーン1001の一例、通例、〜1.6μlの容積を有する室又はチャネルには、長辺と短辺とが設けられており、各々には、加熱エレメントが関連付けられている。PCR反応ゾーンは、ここでは、PCRリアクタとも呼ぶ場合もある。したがって、装置は、好ましくは、図8Aの実施形態例に示すように、所与のPCR反応ゾーンの辺に沿って配置されこれを加熱するように構成されている4つのヒータ、即ち、長い上側ヒータ1005、長い下側ヒータ1003、短い左側ヒータ1007、及び短い右側ヒータ1009を含む。長い上側ヒータ1005と長い下側ヒータ1003の間に小さい間隙があるため、無視し得る温度勾配(PCR反応ゾーンの長さに沿ったいずれの地点においてもPCRチャネルの幅を横切って1℃未満)が生じ、したがってPCR反応ゾーン全体に事実上均一な温度が得られる。PCRリアクタの短縁上のヒータは、2つの長ヒータによってリアクタの中心からリアクタの縁までに発生する勾配を相殺するための熱を供給する。
Referring to FIGS. 8A and 8B, an example of a heater assembly configured to heat the
尚、PCR反応ゾーンを中心に配置されている1つ以上のヒータの更に別の構成も、ここに記載する方法及び装置と調和することは、当業者には当然分かるはずである。例えば、反応ゾーンの「長い」辺は、2つ以上のヒータで加熱するように構成することができる。熱伝導性が低い基板上においても均一な加熱ゾーンを創作するために、特定的な方位及び構成のヒータを用いる。何故なら、ガラス又はクオーツ、あるいは溶融シリカ基板の低い熱伝導性は、弁のような種々の微小流体構成要素の独立した動作、及び種々のPCRレーンの独立した動作を促進するために利用されるからである。尚、PCR反応ゾーン周囲のヒータの構成の基礎となる原理は、アクチュエータ、弁、及びゲートのような、微小流体カートリッジのその他の構成要素に隣接するヒータの配列にも同様に適用可能であることも、当業者には当然分かるはずである。 It should be appreciated by those skilled in the art that further configurations of one or more heaters disposed around the PCR reaction zone are also consistent with the methods and apparatus described herein. For example, the “long” side of the reaction zone can be configured to be heated by more than one heater. In order to create a uniform heating zone even on a substrate with low thermal conductivity, a heater with a specific orientation and configuration is used. Because the low thermal conductivity of glass or quartz or fused silica substrates is utilized to facilitate the independent operation of various microfluidic components such as valves and the independent operation of various PCR lanes. Because. It should be noted that the principles underlying the heater configuration around the PCR reaction zone are equally applicable to heater arrays adjacent to other components of the microfluidic cartridge, such as actuators, valves, and gates. Of course, those skilled in the art should understand.
ある種の実施形態では、各ヒータには温度センサが関連付けられている。図8Aの実施形態では、双方の長ヒータに1つの温度センサ1011が用いられている。短い左側ヒータの温度センサ1013、及び短い右側ヒータの温度センサ1015も示されている。リアクタの中央にある温度センサは、フィードバックを与え、2つの長ヒータに供給する電力量を制御するために用いられ、一方短ヒータの各々は、それに隣接して配置されておりそれを制御するための専用の温度センサを有する。温度センサは、好ましくは、ヒータを加熱させる電流をヒータが受信していないようなときに、その近傍における温度に関する情報をプロセッサに送信するように構成されている。これは、電流サイクルのしかるべき制御によって達成することができる。
In certain embodiments, a temperature sensor is associated with each heater. In the embodiment of FIG. 8A, one
PCRヒータを制御するために必要なセンサ又はヒータ・エレメントの数を削減するために、熱を検知するためにもヒータを用いることによって、ヒータ毎に別個の専用センサを有する必要性をなくすことができる。別の実施形態では、4つのヒータの各々は、しかるべきワット数を有し、4つのヒータを直列又は並列に接続して、電気的に制御可能なエレメントの数を4から1に削減することによって、付随する電子回路への負担を低減するように設計することができる。 By reducing the number of sensors or heater elements required to control a PCR heater, the heater is also used to detect heat, thereby eliminating the need to have a separate dedicated sensor for each heater. it can. In another embodiment, each of the four heaters has an appropriate wattage, and the four heaters are connected in series or in parallel to reduce the number of electrically controllable elements from four to one. Can be designed to reduce the burden on the associated electronic circuit.
図8Bは、図8AのPCR反応ゾーンと共に用いるヒータ及び温度センサの拡大図を示す。温度センサ1001及び1013は、約200〜300オームの常温抵抗を有するように設計されている。この抵抗値は、堆積する金属層の厚さ(例えば、400ÅのTiW/3,000ÅのAu/400ÅのTiWの積層)を制御し、金属巻線をエッチングして約10〜25μmの幅及び20〜40mmの長さを有するようにすることによって決定する。この層に金属を用いることによって、約0.5〜20℃/Ω、好ましくは1.5〜3℃/Ωの範囲の抵抗率の温度係数がそれに与えられる。もっと高い温度で抵抗を測定すると、これらのセンサの場所の正確な温度の判定が可能となる。
FIG. 8B shows an enlarged view of the heater and temperature sensor used with the PCR reaction zone of FIG. 8A. The
図8Aに示す、1つのPCR反応ゾーンのための均一加熱構成は、多数の独立したPCR反応が起こるマルチ・レーンPCRカートリッジにも適用することができる。
各ヒータは、ここに記載する装置と共に用いるプロセッサ及び/又は制御回路によって独立して制御することができる。図8Cは、図8A及び図8Bにおけるように構成したヒータによって加熱した場合の、微小流体カートリッジの上面からの熱像を示す。このとき、各ヒータを次のように順番に活性化した。図8Cにおいて、(1)は長い上側のみ、(2)は長い下側のみ、(3)は短い左側のみ、(4)は短い右側のみ、及び(5)は4つのヒータ全てがオン下状態を示している。パネル(6)は、図8Cにおけるその他の画像パネルと同じメモリで、反応ゾーン及びヒータの図を示す。また、図8Cには、温度軸も示されている。
The uniform heating configuration for one PCR reaction zone shown in FIG. 8A can also be applied to multi-lane PCR cartridges where multiple independent PCR reactions occur.
Each heater can be independently controlled by a processor and / or control circuitry used with the devices described herein. FIG. 8C shows a thermal image from the top surface of the microfluidic cartridge when heated by the heater configured as in FIGS. 8A and 8B. At this time, each heater was activated in the following order. In FIG. 8C, (1) is the long upper side only, (2) is the long lower side only, (3) is the short left side only, (4) is the short right side only, and (5) is all four heaters in the down state. Is shown. Panel (6) shows the reaction zone and heater diagram in the same memory as the other image panels in FIG. 8C. FIG. 8C also shows the temperature axis.
微小流体カートリッジ
図9は、本明細書に記載するシステムと共に用いる微小流体カートリッジ2060の一例の外見の斜視図を示す。カートリッジ2060の中には、少なくとも1つの試薬パッケージ2062が含まれている。このような試薬カートリッジが4つ示されているが、限定ではなく、1、2、3、5、6、8、10、及び12個というような、その他の数のこのようなパッケージも、用途に応じて可能である。更に、カートリッジ2060は、試薬を収容し、ルアーのような入口2066にはめ込まれるタワー2064を備えている。入口2066を通じて、生物サンプルの一部を導入することができる。また、タワー2064は、バルク・溶解室2065及び廃棄物室2067のような、1つ以上の室も備えることができる。廃棄物室2067は、空気のような気体を放出するためのベント2069を有するとよい。
Microfluidic Cartridge FIG. 9 shows an external perspective view of one example of a
タワー2064以外では、カートリッジ2060は実質的に平坦であり、操作者が容易に取り扱うことができ、図1に示すような装置の相補的受容ベイに容易に沿わせることができるようになっている。
更に、カートリッジ2060は、ポート2068を備えており、これを通じて検出器が、処理又は増幅中に、信号を直接又は間接的にサンプル内の1つ以上のポリヌクレオチドから受け取り、ユーザにサンプルに対する診断結果を供給することができる。
更に、カートリッジ2060は、受信ベイにおける対応する位置合わせ部材に対して相補的な、機械的キーのような、位置合わせ部材も備えることができる。図9には、位置合わせ部材2071の一例として、カートリッジからの角切欠が示されている。
Other than the
In addition, the
In addition, the
ここに記載する一体化システムは、微小流体カートリッジを収容するように構成されている装置と、微小流体カートリッジとを備えている。微小流体カートリッジの多数の異なる構成、及びその目的が、相応しく構成された装置と互換性を有することは、ここに記載するシステムと調和する。つまり、例えば、1つのカートリッジが収集した生物サンプルを受け入れ、サンプルに一連の検査を行い、溶解細胞(lysing cell)を含ませてその中に含有するポリヌクレオチドを解放及び収集し、予備増幅準備ステップをポリヌクレオチドに適用し、ポリヌクレオチドを増幅し、増幅したポリヌクレオチドを検出させることができる場合の便益について述べるが、他の微小流体カートリッジを用いることができることも、この中の記載と調和する。このようなその他のカートリッジは、前述のステップよりも少ない、1つ以上のようなステップを実行するように構成することができ、対応して、それと共に用いる装置は、このような少ないステップを実行させるように構成される。したがって、この中で微小流体カートリッジの種々の構成例を紹介するときは、その種々の構成要素は、修正せずにでも、適宜幾何学的形状又はサイズの適した調節又は修正を伴ってでも、相互交換可能に用いることができることは言うまでもない(例えば、1つのカートリッジと関連付けて記載する弁の一例は、他のカートリッジと関連付けて記載するネットワークにおいて用いることもできる。) The integrated system described herein includes a device configured to receive a microfluidic cartridge and a microfluidic cartridge. It is consistent with the system described herein that a number of different configurations of the microfluidic cartridge, and its purpose, are compatible with properly configured devices. Thus, for example, a biological sample collected by one cartridge is received, the sample is subjected to a series of tests, lysing cells are included to release and collect the polynucleotide contained therein, and a preliminary amplification preparation step Is applied to the polynucleotide to amplify the polynucleotide and allow the amplified polynucleotide to be detected, but is consistent with the description herein that other microfluidic cartridges can be used. Such other cartridges can be configured to perform one or more steps that are fewer than those previously described, and correspondingly, devices used therewith perform such fewer steps. Configured to let Accordingly, when various configuration examples of the microfluidic cartridge are introduced herein, the various components may be modified without modification, with appropriate adjustment or modification of the geometric shape or size as appropriate. Needless to say, they can be used interchangeably (for example, an example of a valve described in association with one cartridge can also be used in a network described in association with another cartridge).
微小流体カートリッジの態様
したがって、本技術は、以下のような属性を有する微小流体カートリッジも備えている。つまり、本技術は、1つ以上のポリヌクレオチドを処理し、例えば、ポリヌクレオチドを終結させる及び/又はポリヌクレオチドの検出及び/又は増幅を妨げる虞れがあるインヒビタ複合体(例えば、ヘモグロビン、ペプチド、糞便複合体、フミン酸、粘性複合体、DNA結合蛋白質、サッカリド)からポリヌクレオチドを分離するように構成されている微小流体カートリッジを含む。
Accordingly, the present technology also includes a microfluidic cartridge having the following attributes. That is, the present technology treats one or more polynucleotides, eg, terminates the polynucleotide and / or interferes with the detection and / or amplification of the polynucleotide (eg, hemoglobin, peptide, Microfluidic cartridges configured to separate polynucleotides from stool complexes, humic acids, viscous complexes, DNA binding proteins, saccharides).
微小流体カートリッジは、ポリヌクレオチドと、インヒビタとは対照的にポリヌクレオチドと優先的に連合する(例えば、保持する)、比較的固定化した複合体とを接触させるように構成することができる。複合体の一例には、ポリカチオニック・ポリアミド(poly-cationic polyamide)(例えば、ポリ−L−リシン及び/又はポリ−D−リシン)又はポリエチレンイミン(PEI)があり、表面(例えば、1つ以上の粒子の表面)に結合することができる。複合体は、ポリヌクレオチドを保持し、複合体及び付随するポリヌクレオチドが結合される表面を洗浄する等によって、ポリヌクレオチド及びインヒビタを分離できるようにする。分離の再、ポリヌクレオチドと複合体との間の連合は破壊され、複合体及び表面からポリヌクレオチドを放出(例えば、分離)することができる。 The microfluidic cartridge can be configured to contact a polynucleotide and a relatively immobilized complex that preferentially associates (eg, retains) with the polynucleotide as opposed to an inhibitor. An example of a composite is a poly-cationic polyamide (eg, poly-L-lysine and / or poly-D-lysine) or polyethyleneimine (PEI) and a surface (eg, one The surface of the above particles). The complex retains the polynucleotide and allows the polynucleotide and the inhibitor to be separated, such as by washing the surface to which the complex and accompanying polynucleotide are bound. Re-separation, the association between the polynucleotide and the complex is broken, and the polynucleotide can be released (eg, separated) from the complex and the surface.
実施形態の中には、表面(例えば、1つ以上の粒子の表面)を、共有結合によって表面に結合することができる、ポリアミド又はPEIのようなポリカチオニック物質で改質することができる場合もある。ポリカチオニック・ポリアミドは、ポリ−L−リシン及びポリ−D−リシンの内少なくとも1つを含むとよい。実施形態に中には、ポリカチオン・ポリアミド(例えば、ポリ−L−リシン及びポリ−D−リシンの内少なくとも1つ)は、少なくとも約7500Daの平均分子重量を有する。ポリカチオン・ポリアミド(例えば、ポリ−L−リシン及びポリ−D−リシンの内少なくとも1つ)は、約35,000Da未満の平均分子重量を有するとよい(例えば、約30,000Da未満の平均分子重量(例えば、約25,000Daの平均分子重量))。ポリカチオン・ポリアミド(例えば、ポリ−L−リシン及びポリ−D−リシンの内少なくとも1つ)は、少なくとも約15,000Daの 中央分子重量を有するとよい。ポリカチオン・ポリアミド(例えば、ポリ−L−リシン及びポリ−D−リシンの内少なくとも1つ)は、約25,000Da未満の中央分子重量(例えば、約20,000Da未満の中央分子重量(例えば、約20,000Daの中央分子重量)を有するとよい。ポリカチオン材料がPEIである場合、その分子重量は、600〜800ダルトンの範囲であることが好ましい。 In some embodiments, the surface (eg, the surface of one or more particles) can be modified with a polycationic material such as polyamide or PEI that can be covalently bonded to the surface. There is also. The polycationic polyamide may include at least one of poly-L-lysine and poly-D-lysine. In some embodiments, the polycationic polyamide (eg, at least one of poly-L-lysine and poly-D-lysine) has an average molecular weight of at least about 7500 Da. The polycationic polyamide (eg, at least one of poly-L-lysine and poly-D-lysine) may have an average molecular weight of less than about 35,000 Da (eg, an average molecule of less than about 30,000 Da). Weight (eg, average molecular weight of about 25,000 Da)). The polycationic polyamide (eg, at least one of poly-L-lysine and poly-D-lysine) may have a median molecular weight of at least about 15,000 Da. A polycationic polyamide (eg, at least one of poly-L-lysine and poly-D-lysine) has a center molecular weight of less than about 25,000 Da (eg, a center molecular weight of less than about 20,000 Da (eg, If the polycationic material is PEI, the molecular weight is preferably in the range of 600-800 daltons.
他の実施形態では、微小流体カートリッジは、ポリカチオン・ポリアミド又はPEIが結合した表面と、表面を流体サンプルに接触させるための表面と連通するサンプル導入路とを含む。
実施形態の中には、本装置が、表面と接触する水溶液を少なくとも約65℃まで加熱するように構成されている熱源を含む場合もある。
実施形態の中には、カートリッジが少なくとも約10(例えば、約10.5以上)のpHを有する液体のリザーバを含む場合もある。カートリッジは、表面を液体と接触させるように構成することができる(例えば、圧力源を作動させて液体を移動させることによって)。
In other embodiments, the microfluidic cartridge includes a polycationic polyamide or PEI bound surface and a sample introduction channel in communication with the surface for contacting the surface with the fluid sample.
In some embodiments, the apparatus may include a heat source configured to heat the aqueous solution in contact with the surface to at least about 65 ° C.
In some embodiments, the cartridge includes a reservoir of liquid having a pH of at least about 10 (eg, about 10.5 or greater). The cartridge can be configured to bring the surface into contact with the liquid (eg, by activating a pressure source to move the liquid).
微小流体カートリッジの別の態様は、保持部材、例えば、結合PEI、又はポリリシン、例えば、ポリ−L−リシンを含むビーズのような複数の粒子、並びに関係する方法及びシステムに関する。サンプルを処理する方法の一例は、保持部材を、混合物と接触させることを含み、液体及びある量のポリヌクレオチドを含む混合物を供給することを含む。保持部材は、ポリメラーゼ連鎖反応インヒビタと比較して、ポリヌクレオチドを優先的に保持するように構成するとよい。混合物における液体の実質的に全てを、保持部材から除去することができる。ポリヌクレオチドは、保持部材から放出することができる。ポリヌクレオチドは、約7.5Mbp未満のサイズを有することが好ましい。 Another aspect of the microfluidic cartridge relates to a plurality of particles such as retaining members, eg, bound PEI, or beads comprising polylysine, eg, poly-L-lysine, and related methods and systems. One example of a method for processing a sample includes contacting a retaining member with a mixture and providing a mixture comprising a liquid and an amount of polynucleotide. The holding member may be configured to preferentially hold the polynucleotide as compared to the polymerase chain reaction inhibitor. Substantially all of the liquid in the mixture can be removed from the retaining member. The polynucleotide can be released from the holding member. The polynucleotide preferably has a size of less than about 7.5 Mbp.
液体は、第1液体であり、保持部材から液体の実質的に全てを除去する際、保持部材を第2液体と接触させることを含む。
保持部材を第2液体と接触させる際、熱作動式圧力源を作動させて、圧力を台2液体に加えることを含むことができる。保持部材を第2液体と接触させる際、熱作動式弁を開放して、第2液体を保持部材と連通させることを含むことができる。
第2液体は、約50マイクロリットル未満の体積を有し、洗剤(例えば、SDS)を含んでいる。
The liquid is a first liquid and includes bringing the holding member into contact with the second liquid when removing substantially all of the liquid from the holding member.
In contacting the holding member with the second liquid, a thermally actuated pressure source can be activated to apply pressure to the
The second liquid has a volume of less than about 50 microliters and includes a detergent (eg, SDS).
保持部材は、ポリヌクレオチドを優先的にポリメラーゼ連鎖反応インヒビタに結合するように構成されている複合体を有する表面を含むとよい(このようなインヒビタは、例えば、ヘモグロビン、ペプチド、糞便複合体、フミン酸、粘性複合体、DNA結合蛋白質、サッカリドを含む)。
表面は、ポリリシン(例えば、ポリ−L−リシン及び/又はポリ−D−リシン)又はPEIを含むとよい。
The retaining member may include a surface having a complex configured to preferentially bind the polynucleotide to the polymerase chain reaction inhibitor (such an inhibitor may include, for example, hemoglobin, peptide, stool complex, humin Acid, viscous complex, DNA binding protein, saccharide).
The surface may comprise polylysine (eg, poly-L-lysine and / or poly-D-lysine) or PEI.
ポリヌクレオチドを保持部材から放出する際、保持部材を少なくとも約50℃(例えば、約65℃)の温度に加熱することを含むとよい。温度は、加熱の間保持部材の存在下において液体を沸騰させるには不十分とするとよい。温度は、100℃以下とするとよい(例えば、100℃未満、約97℃以下)。温度は、約10分未満の間(例えば、約5分未満、約3分未満)維持するとよい。放出は、保持部材の遠心分離を伴わずに行うとよい。 When releasing the polynucleotide from the holding member, it may include heating the holding member to a temperature of at least about 50 ° C. (eg, about 65 ° C.). The temperature may be insufficient to boil the liquid in the presence of the holding member during heating. The temperature may be 100 ° C. or less (for example, less than 100 ° C., about 97 ° C. or less). The temperature may be maintained for less than about 10 minutes (eg, less than about 5 minutes, less than about 3 minutes). The discharge may be performed without centrifuging the holding member.
ある種の実施形態では、PCRインヒビタを臨床サンプルから迅速に除去して、PCRの準備ができたサンプルを作成することができる。したがって、本方法は、インヒビタを実質的に排除することができるポリヌクレオチド含有サンプルの調合を含むとよい。このようなサンプルは、例えば、熱、化学、超音波、機械、静電、及びその他の溶解技法から得られる、生のライセートから調合するとよい。サンプルは、遠心分離を伴わずに調合するとよい。サンプルは、他の微小流体デバイスを用いて、又は規模を大きくして調合してもよい。 In certain embodiments, PCR inhibitors can be rapidly removed from clinical samples to create PCR-ready samples. Thus, the method may include preparation of a polynucleotide-containing sample that can substantially eliminate the inhibitor. Such samples may be formulated from raw lysates obtained from, for example, thermal, chemical, ultrasonic, mechanical, electrostatic, and other dissolution techniques. Samples may be prepared without centrifugation. Samples may be formulated using other microfluidic devices or on a larger scale.
保持部材は、ポリメラーゼ連鎖反応による増幅のような、更に別の処理のためにポリヌクレオチド・サンプルを調合するために用いてもよい。ある種の実施形態では、90%よりも多いポリヌクレオチドがサンプル内に存在すると、保持部材に結合させ、放出し、回収することができる。
ある種の実施形態では、約10分未満(例えば、約7.5分未満、約5分未満、又は約3分未満)でポリヌクレオチドを保持部材に結合し、放出し、回収することができる。
The retaining member may be used to prepare a polynucleotide sample for further processing, such as amplification by polymerase chain reaction. In certain embodiments, if more than 90% of the polynucleotide is present in the sample, it can be bound, released, and collected by the retention member.
In certain embodiments, the polynucleotide can be bound to, released from, and recovered from the retention member in less than about 10 minutes (eg, less than about 7.5 minutes, less than about 5 minutes, or less than about 3 minutes). .
ポリヌクレオチド、保持部材、及び/又はインヒビタを遠心分離にかけなくても、ポリヌクレオチドを保持部材に結合し、放出し、回収することもできる。
ポリヌクレオチド及びインヒビタを分離するには、一般に、ポリヌクレオチド、インヒビタ、処理領域、及び/又は保持部材を沈殿(例えば、遠心分離)させることを除外する。
The polynucleotide can be bound to the retaining member, released and recovered without centrifuging the polynucleotide, retaining member, and / or inhibitor.
Separating polynucleotides and inhibitors generally excludes precipitating (eg, centrifuging) the polynucleotides, inhibitors, processing regions, and / or retaining members.
種々の実施形態では、微小流体カートリッジは、ポリメラーゼ酵素と複数のヌクレオチドとを含むPCR試薬混合物を含むことができる。PCR試薬混合物は、1つ以上の凍結乾燥ペレットの形態をなすことができ、微小流体ネットワークは、PCRペレットを液体と接触させてPCR試薬混合物溶液を作成するように構成することができる。 In various embodiments, the microfluidic cartridge can include a PCR reagent mixture that includes a polymerase enzyme and a plurality of nucleotides. The PCR reagent mixture can be in the form of one or more lyophilized pellets, and the microfluidic network can be configured to contact the PCR pellet with a liquid to create a PCR reagent mixture solution.
種々の実施形態では、微小流体カートリッジは、外部熱源からの熱をPCR試薬混合物及び中和したポリヌクレオチド・サンプルと、中和ポリヌクレオチド・サンプルからPCRアンプリコンを作成するのに適した熱サイクル条件の下で、結合するように構成することができる。
種々の実施形態では、PCR試薬混合物は、更に、陽性制御プラスミド(positive control plasmid)及びプラスミドの少なくとも一部のために選択した蛍光原混成プローブを含むことができる。
In various embodiments, the microfluidic cartridge includes heat cycling conditions suitable for creating a PCR amplicon from the PCR reagent mixture and neutralized polynucleotide sample and the neutralized polynucleotide sample with heat from an external heat source. Can be configured to combine.
In various embodiments, the PCR reagent mixture can further include a positive control plasmid and a fluorogenic hybrid probe selected for at least a portion of the plasmid.
種々の実施形態では、微小流体カートリッジは、陰性制御ポリヌクレオチドを含むことができ、微小流体ネットワークは、中和ポリヌクレオチド・サンプルのPCRアンプリコン及び陰性制御ポリヌクレオチドのPCRアンプリコンを独立して作成するのに適した熱サイクル条件の下で、中和ポリヌクレオチド・サンプル及び陰性制御ポリヌクレオチドの各々を独立してPCR試薬混合物と接触させるように構成することができる。 In various embodiments, the microfluidic cartridge can include a negative control polynucleotide, and the microfluidic network independently creates a PCR amplicon of the neutralizing polynucleotide sample and a PCR amplicon of the negative control polynucleotide. Each of the neutralizing polynucleotide sample and the negative control polynucleotide can be configured to contact the PCR reagent mixture independently under suitable thermal cycling conditions.
種々の実施形態では、微小流体カートリッジは、ポリヌクレオチド・シーケンスのために選択的とすることができる少なくとも1つのプローブを含むことができ、微小流体カートリッジは、中和ポリヌクレオチド・サンプル又はそのPCRアンプリコンをプローブと接触させるように構成することができる。プローブは、蛍光原混成プローブとすることができる。蛍光原混成プローブは、蛍光レポータ染料(fluorescent reporter dye)及び蛍光消光染料に結合されたポリヌクレオチド・シーケンスを含むことができる。PCR試薬混合物は、更に、陽性制御プラスミドと、プラスミドの少なくとも一部のために選択したプラスミド蛍光原混成プローブとを含むことができ、微量流体カートリッジは、蛍光原混成プローブ及びプラスミド蛍光原混成プローブの独立した光学的検出を可能にするように構成することができる。 In various embodiments, the microfluidic cartridge can include at least one probe that can be selective for polynucleotide sequencing, wherein the microfluidic cartridge is a neutralized polynucleotide sample or a PCR amplifier thereof. The recon can be configured to contact the probe. The probe can be a fluorogenic hybrid probe. The fluorogenic hybrid probe can comprise a polynucleotide sequence coupled to a fluorescent reporter dye and a fluorescent quencher dye. The PCR reagent mixture can further comprise a positive control plasmid and a plasmid fluorogen hybrid probe selected for at least a portion of the plasmid, wherein the microfluidic cartridge comprises a fluorogen hybrid probe and a plasmid fluorogen hybrid probe. It can be configured to allow independent optical detection.
種々の実施形態では、プローブは、有機体、例えば、ディオキシリボ核酸又はリボ核酸ポリヌクレオチドを用いるいずれの有機体の特徴をも示すことができるポリヌクレオチド・シーケンスのために選択的とすることができる。つまり、プローブはいずれの有機体にも選択することができる。適した有機体は、ほ乳類(ヒトを含む)、鳥類、は虫類、両生類、魚類、家畜、飼育動物、野生動物、絶滅した有機体、バクテリア、菌類、ウィルス、植物等を含む。また、プローブは、それら自体のポリヌクレオチドを用いる有機体、例えば、ミトコンドリアの成分のために選択的とすることもできる。実施形態の中には、プローブは、微小有機体、例えば、食品生産に用いられる有機体(発酵製品において用いられるイースト、チーズに用いられるカビ又はバクテリア等)又は病原体(例えば、ヒト、家畜又は野生動物、家禽又は野生鳥類等の)に用いられる有機体のために選択的とすることができる場合もある。実施形態の中には、プローブが、グラム陽性バクテリア、グラム陰性バクテリア、イースト、菌類、原生動物、及びウィルスから成る一群から選択した有機体のために選択的とすることができる場合もある。 In various embodiments, the probes can be selective for polynucleotide sequences that can exhibit characteristics of any organism using an organism, eg, a dioxyribonucleic acid or a ribonucleic acid polynucleotide. That is, the probe can be selected for any organism. Suitable organisms include mammals (including humans), birds, reptiles, amphibians, fish, livestock, domestic animals, wild animals, extinct organisms, bacteria, fungi, viruses, plants, and the like. Probes can also be selective for organisms that use their own polynucleotides, eg, components of mitochondria. In some embodiments, the probe is a micro-organism, for example, an organism used in food production (such as yeast used in fermentation products, mold or bacteria used in cheese) or pathogen (eg, human, livestock or wild In some cases, it may be selective for organisms used in animals, poultry or wild birds). In some embodiments, the probe may be selective for an organism selected from the group consisting of gram positive bacteria, gram negative bacteria, yeast, fungi, protozoa, and viruses.
種々の実施形態では、プローブは、Staphylococcus spp、例えば、S.エピダーミディス(S. epidermidis)、S.オーレウス(S. aureus)、耐メチシリン ・スタフィロコッカス・オーレウス (Methicillin-resistant Staphylococcus aureus (MRSA))、耐バンコミシン・スタフィロコッカス( Vancomycin-resistant Staphylococcus);S.ピオジーンズ(S. pyogenes)、S.アガラクティエ(S. agalactiae)のようなストレプトコッカス(Streptococcus) (例えば、α、β、又はガンマ−ヘモリティス、グループA、B、C、D又はG)(hemolytic. Group A, B, C, D or G) ;E.フェーカリス(E. faecalis)、E.デュランズ(E. durans)及びE.フェーシウム(E. faecium)(以前のS.フェーカリス( S. faecalis))、S.デュランズ(S. durans)、S.フェーシウム(S. faecium);ノネンテロコッカル・グループDストレプトコッチ(nonenterococcal group D streptococci)、例えば、S.ボビス(S. bovis)、及びS.エクインズ(S equines);ストレプトコッチ・ヴィリダンス(Streptococci viridans)、例えば、S.ミュータンス(S. mutans.)、S.サンギス(S. sanguis)、S.サリバリアス(S. salivarius)、S.ミチア(S. mitior)、A.ミレーリ(A. milleri)、S.コンステラタス(S. constellatus)、S.インターミディウス(S. intermedius)、及びS.アンギノスス(S. anginosus);S.イニエ(S. iniae);S.ニューモニエ(S. pneumoniae);ネイセリア(Neisseria)、例えば、N.メニンジタイズ(N. meningitides)、N.ゴノローエ(N. Gonorrhoeae)、サプロフィック・ネイセリアsp(saprophytic Neiseria sp);エリシペロスリクス(Erysipelothrix)、例えば、E.ルシオパティエ(E. rhusiopathiae);リステリアspp(Listeria spp)、例えば、L.モノシトジェン(L. monocytogenes)、希にL.イヴァノヴィイ(L. ivanovii)、及びL.シーリゲリ(L. seeligeri;);バシラス(Bacillus)、例えば、B.アンスラシス(B. anthracis)、B.セレウス(B. cereus)、B.サブティリス(B. subtilis)、B.サブティラス・ニガー(B. subtilus niger)、B.サリンジーシス(B. thuringiensis);ノカーディア・アステロイズ(Nocardia asteroids);レジオネラ(Legionella)、例えば、L.ニューモノフィリア(L. pneumonophilia)、ニューモシスティス(Pneiimocystis)、例えば、P.カリニイ(P. carinii);サルモネラ(Salmonella)、シゲーラ(Shigella)、エシェリキア(Escherichia )のようなエンテロバクテリアセエ(Enterobacteriaceae)(例えば、E.コリ(E. coli)、E.コリO157(E. coliO157):H7);クレブシーラ(Klebsiella)、エンテロバクター(Enterobacter)、セラティア(Serratia)、プロテウス(Proteus)、モルガネラ(Morganella)、プロビデンシア(Providencia)、エルシニア(Yersinia)等、例えば、サルモネラ(Salmonella)、例えば、S.ティフィ(S. typhi)、S.パラティフィA、B(S. paratyphi A, B)(S.ショットミューレリ(S. schottmuelleri))、及びC(S.ヒルシュフェルディ(S. hirschfeldii)、S.ダブリンSコレレースイス(S. dublin S choleraesuis)、S.エンテリティディス(S. enteritidis)、S.ティフィミュリアン(S. typhimurium)、S.ハイデルベルグ(S. heidelberg)、S.ニューポート(S. newport)、S.インファンティス(S. infantis)、S.アゴナ(S.agona)、S.モンテビデオ(S. montevideo)、及びS.サンポール(S. saint-paul);シゲーラ(Shigella)、例えば、S.フレックスネリ(S. flexneri)、S.ソネイ(S. sonnei)、S.ボイディイ(S. boydii)、S.ディセンテリエ(S. dysenteriae)のような、サブグループ:A、B、C、及びD;プロテウス(Proteus)(P.ミラビリス(P. mirabilis)、P.ブルガリス(P. vulgaris)、及びP.ミクソファシアンズ(P. myxofaciens)、モーガネラ(Morganella)(M.モーガニイM.morganii);プロビデンシア(Providencia)(P.レットゲリ(P. rettgeri)、P.アルカリファシエンス(P. alcalifaciens)、及びP.スチュアーティ(P. stuartii);イエルシニア(Yersinia)、例えば、Y.ペスティス(Y. pestis)、Y.エンテロコリチカ(Y. enterocolitica);ヘモフィラス(Haemophilus)、例えば、H.インフルエンゼ(H. influenzae)、H.パラインフルエンゼ(H. parainfluenzae)、H.アフロフィラス(H. aphrophilus)、H.デュクレイ(H. ducreyi);ブルセラ(Brucella)、例えば、B.アボータス( B. abortus)、B.メリテンシス( B. melitensis)、B.スイス(B. suis)、B.カニス(B. canis);フランシセラ(Francisella)、例えば、F.チュラレンシス(F. tularensis);シュードモナス(Pseudomonas)、例えば、P.エルギノサ(P. aeruginosa)、P.ポーシモビリス(P. paucimobilis)、P.ピュティダ(P. putida)、P.フルオレセンス(P. fluorescens)、P.アシドボランス(P. acidovorans)、バークホルデリア(シュードモナス)シュードマレイ(Burkholderia (Pseudomonas) pseudomallei)。バークホルデリア・マレイ(Burkholderia mallei)、バークホルデリア・セパシア(Burkholderia cepacia)、及びステノトロフォマナス・マルトフィリア(Stenotrophomonas maltophilia);カンピロバクタ(Campylobacter)、例えば、C.フェツス・フェツス(,C. fetus fetus)、C.ジェジュニ(C. jejuni)、C.ピロリ(C. pylori)(ヘリコバクタ・ピロリ(Helicobacter pylori));ビブリオ(Vibrio)、例えば、V.コレラ(V. cholerae)、V.パラヘモリティカス(V. parahaemolyticus)、V.ミニカス(V. mimicus)、V.アルギノリティカス(V. alginolyticus)、V.ホリセ(V. hollisae)、V.ヴルニフィカス(V. vulnificus)、及び凝着不可のビブリオ;クロストリディア(Clostridia)、例えば、C.パーフリンゲンス(C. perfringens)、C.テタニ(C. tetani)、C.ディフィシル(C. difficile)、C.ボツリヌス(C. botulinum);アンチノミセス(Actinomyces)、例えば、A.イスラエリ(A. israelii);バクテロイズ(Bacteroides)、例えば、B.フラジリス(B. firagilis)、B.テタイオタオミクロン(B. thetaiotaomicron)、B.ディスタサニス(B. distasonis)、B.ブルガツス(B. vulgatus)、B.オヴァテュス( B. ovatus)、B.カッケ(B. caccae)、及びB.マーデ(B. merdae);プレボトラ(Prevotella)、例えば、P.メラニノゲニカ(p. melaninogemca);ジーナス・フソバクテリウム(genus Fusobacterium);トレポネマ(Treponema)、例えば、T.パリダム・サブスペシーズ・エンデミカム(T. pallidumsubspecies endemicum)、T.パリダム・サブスペシーズ・パーテニュー(T. pallidum subspecies pertenue)、T.カラテウム(T. carateum)、及びT.パリダム・サブスペシーズ・パリダム(T. pallidum subspecies pallidum);ジーナス・ボレリア( genus Borrelia)、例えば、B.バーグドーフェリ( B. burgdorferi);ジーナス・レプトスピラ(genus Leptospira);ストレプトバシラス(Streptobacillus)、例えば、S.モニリフォーミス(S. moniliformis);スピリラム(Spirillum)、例えば、S.ミヌス(S. minus);ミコバクテリウム(Mycobacterium)、例えば、M.ツベルクロシス(M. tuberculosis)、M.ボビス(M. bovis)、M.アフリカヌム(M. africanum)、M.アヴィウス(M. avium)、M.イントラセルレア(M. intracellulare)、M.カンサシ(M.kansasii)、M.ゼノピ(M. xenopi)、M.マリヌム(M. marinum)、M.ウルセランス(M. ulcerans)、M.フォーテュイタム・コンプレックス(M. fortuitum complex)(M.フォーテュイタム(M. fortuitum)及びM.ケロネイ(M. chelonei))、M.レプラエ(M. leprae)、M.アシアティクム(M. asiaticum)、M.ケロネイ・スブスプ・アブセサス(M. chelonei ubsp. abscessus)、M.ファラックス(M. fallax)、M.フォーテュイタム(M. fortuitum)、M.マルモエンセ (M. malmoense)、M.シモイデイ(M. shimoidei)、M.シミエ(M. simiae)、M.スズルガイ(M. szulgai)、M.ゼノピ(M. xenopi);ミコプラズマ(Mycoplasma)、例えば、M.ホミニス(M. hominis)、M.オラレ(M. orale)、M.サリバリウム(M. salivarium)、M.ファーメンタンス(M. fermentans)、M.ニューモニエ(M. pneumoniae)、M.ボビス(M. bovis)、M.ツベルクロシス(M. tuberculosis)、M.アヴィウム(M. avium)、M.レプレ(M. leprae);ミコプラスマ(Mycoplasma)、例えば、M.ジェニタリウム(M. genitalium);ユレアプラスマ(Ureaplasma)、例えば、U.ユレアリティクム(U. urealyticum);トリコモナス(Trichomonas)、例えば、T.ヴァジナリス(T.vaginalis);クリプトコッカス(Cryptococcus)、例えば、C.ネオフォーマンス(C.neoformans);ヒストプラズマ(Histoplasma)、例えば、H.カプスラタム(H. capsulatum);カンディダ(Candida)、例えば、C.アルビカンス(C. albicans);アスパージルスsp( Aspergillus sp);コクシディオイデス(Coccidioides)、例えば、C.イミティス(C. immitis);ブラストミセス(Blastomyces)、例えば、B.ダーマティティディス(B. dermatitidis);パラコクシディオイデス(Paracoccidioides)、例えば、P.ブラジリエンシス(P. brasiliensis);ペニシリウム(Penicillium)、例えば、P.マーネフェイ(P. marneffei);スポロスリクス(Sporothrix)、例えば、S.シェンキー(S. schenckii);リゾプス( Rhizopus)、リゾムコア(Rhizomucor)、アブシディア(Absidia)、及びバシディオボルス(Basidiobolus);ビポラリス(Bipolaris)、クラドフィアロフォラ(Cladophialophora)、クラドスポリウム(Cladosporiium)、ドレシェラ( Drechslera)、エクゾフィリア(Exophiala)、フォンセカエ(Fonsecaea)、フィアロフォラ(Phialophora)、キシロヒファ(Xylohypha)、オクロコニス(Ochroconis)、リノクラディエラ(Rhinocladiella)、スコレコバシディウム(Scolecobasidium)、及びワンジーラ(Wangiella)によって生ずる病気;トリコスポロン(Trichosporon)、例えば、T.ベイジェリ(T.beigelii);ブラストシゾミセス(Blastoschizomyces)、例えば、B.カピタツス(B. capitatus);プラスモディウム(Plasmodium)、例えば、P.ファルシパルム(P.falciparum)、P.ヴィヴァックス(P. vivax)、P.オヴァレ(P. ovale)、及びP.マラリエ(P.malariae);バベシアsp(Babesia sp);ジーナス・トリパノソマアのプロトゾア(protozoa of the genus trypanosome)、例えば、T.クルジ(T. cruzi);レイシュマニア、例えば、L.ドノヴァニ(L. donovani)、L.メイジャL.トロピカ(L. major L. tropica)、L.メキシカナ(L. mexicana)、L.ブラジリエンシス(L. braziliensis)、L.ヴィアニア・ブラジリエンシス(L. viannia braziliensis);トクソプラズマ(Toxoplasma)、例えば、T.ゴンディイ(T. gondii);ジェネラ・ネグリエラ(genera Naegleria)又はアカンサモエバ(Acanthamoeba)のアモエバス(Amoebas);エンタモエバ・ヒストリティカ(Entamoeba histolytica);ジアルディア・ランブリア(Giardia lamblia);ジーナス・クリプトスポリディウム(genus Cryptosporidium)、例えば、C.パーヴム(C parvum);イソスポラ・ベッリ(Isospora belli);シクロスポラ・カイエタネシス(Cyclospora cayetanensis);アスカリス・ランブリコイズ(Ascaris lumbricoides);トリチュリス・トリチウラ(Trichuris trichiura);アンシロストマ・デュオデナェ(Ancylostoma duodenale)又はネケータ・アメリカヌス(Necator americanus);ストロンジロイデス・ステルコラリス・トクソカラ(Strongyloides stercoralis Toxocara)、例えば、T.カニス(T. canis)、T.カティス(T. cati);ベイリサスカリス(Baylisascaris)、例えば、B.プロシオニス(B.procyonis);トリチネラ(Trichinella)、例えば、T.スピラリス(T. spiralis);ドラクンクラス(Dracunculus)、例えば、D.メディネンシス(D. medinensis);ジーナス・フィラリオイデア(genus Filarioidea);ウッチェレリア・バンクロフティ(Wuchereria bancrofti);ブリンジア(Bnigia)、例えば、B.マライ(B. malayi)又はB.ティモリ(B. timori);オンコセルカ・ヴォルヴルス(Onchocerca volvulus);ロアロア(Loa loa);ディロフィアリア・インミティス(Dirofilaria immitis);ジーナス・シストソマ(genus Schis
tosoma)、例えば、S.ジャポニクム(S. japonicum)、S.マンソニ(S. mansoni)、
S.メコンジ(S. mekongi)、S.インターカラツム(S.intercalatum)、S.ヘモトビウム(S. haematobium);パラゴニムス(Paragonimus)、例えば、P.ウェスターマニ(P.Westermani)、P.スキリアビニ(P. Skriabini);クロノーチス・シネンシス(Clonorchis sinensis);ファシオラ・ヘパティカ(Fasciola hepatica);オピストホーチスsp(Opisthorchis sp);ファシオロプシス・バスキ(Fasciolopsis buski);ディフィロボツリウム・ラツム(Diphyllobothrium latum);テニア(Taenia)、例えば、T.サジナタ(T. saginata)、T.ソリウム(T. solium);エキノコッカス(Echinococcus)、例えば、
E.グラヌロスス(E. granulosus)、E.ムルチロクラリス(E. multilocularis);ピコマヴィルセス(Picomaviruses)、リノヴィルーセス・エコヴィルセス(rhinoviruses echoviruses)、コックサキエヴィルセス(coxsackievhuses)、インフルエンザ・ヴィルス(influenza virus);パラミクソヴィルセス(paramyxoviruses)、例えば、タイプ1、
2、3、及び4;アドノヴィムセス(adnovimses);ヘルペスヴィルセス(Herpesviruses)、例えば、HSV−1及びHSV−2;ヴァリセラ−ゾスタ・ヴィルス(varicella-zoster virus);ヒトT−リンファトロフィック・ヴィルス(human T-lymphotrophic virus)(タイプI及びタイプII);アーボヴァイラシス(Arboviruses)及びアレナヴィルセス(Arenaviruses);トガヴィリダエ(Togaviridae)、フラヴィヴィリダエ(Flaviridae)、ブニアヴィリダエ(Bunyaviridae)、レオヴィリダエ(Reoviridae);フラヴィヴィルス(Flavivirus);ハンタヴィルス(Hantavirus);ウィルス性脳炎(Viral encephalitis)(アルファヴィルセス(alphaviruses)、例えば、ヴェネズレラン・エクイン・エンセファリティス(Venezuelan equine encephalitis)、イースタン・エクイン・エンセファリティス(eastern equine encephalitis)、ウェスタン・エクイン・エンセファリティス(western equine encephalitis);ウィルス性出血熱(Viral hemorrhagic fevers )(フィロヴィルセス(filoviruses)、例えば、エボラ(Eboia)、マーバーグ(Marburg)、及びアレナヴィルセス(arenaviruses)、例えば、ラッサ(Lassa)、マチュポ(Machupo);天然痘(ヴィリオラ(variola));レトロウィルス(retroviruses)、例えば、ヒト免疫不全ウィルス1及び2;ヒト乳頭腫ウィルス(HPV)タイプ6、11、16、18、31、33、及び35から成る一群から選択した有機体の特徴を示すことができるポリヌクレオチド・シーケンスのために選択的とすることができる。
In various embodiments, the probe is a Staphylococcus spp, e.g. S. epidermidis, S. et al. S. aureus, Methicillin-resistant Staphylococcus aureus (MRSA), Vancomycin-resistant Staphylococcus; P. jeans (S. pyogenes), S. Streptococcus such as S. agalactiae (e.g., alpha, beta, or gamma-hemolitis, group A, B, C, D or G) (hemolytic. Group A, B, C, D or G) E. E. faecalis, E. E. durans and E. durans E. faecium (formerly S. faecalis), S. faecalis S. durans, S. S. faecium; nonenterococcal group D streptococci, for example, S. faecium; S. bovis and S. bovis S equines; Streptococci viridans, e.g. S. mutans, S. mutans. S. sanguis, S. S. salivarius, S. salivarius S. mitior, A.M. A. milleri, S.M. S. constellatus, S. constellatus S. intermedius, and S. intermedius S. anginosus; S. iniae; S. pneumoniae; Neisseria, for example N. pneumoniae; Meningitides, N. meningitides N. Gonorrhoeae, saprophytic Neiseria sp; Erysipelothrix, e.g. E. rhusiopathiae; Listeria spp, e.g. L. monocytogenes, rarely L. monocytogenes. L. ivanovii and L. ivanovii L. seeligeri ;; Bacillus, e.g. B. anthracis, B. B. cereus, B. B. subtilis, B. subtilis. B. subtilus niger B. thuringiensis; Nocardia asteroids; Legionella, e.g. L. pneumonophilia, Pneiimocystis, e.g. Enterobacteriaceae (eg, E. coli, E. coli O157 (E. coli O157), such as Salmonella, Shigella, Escherichia; P. carinii; ): H7); Klebsiella, Enterobacter, Serratia, Proteus, Morganella, Providencia, Yersinia, etc., for example, Salmonella, S. S. typhi, S. typhi. Paratyphi A, B (S. schottmuelleri), and C (S. hirschfeldii, S. dublin S. S. dublin S) choleraesuis), S. enteritidis, S. typhimurium, S. heidelberg, S. newport, S. infantis (S. infantis), S. agona, S. montevideo, and S. saint-paul; Shigella, eg, S. flexneri ( Subgroups: A, B, C, and D; Proteus, such as S. flexneri, S. sonnei, S. boydii, S. dysenteriae (P. mirabilis, P. vulgaris, and P. myxofaciens) ), Morganella (M. morganii); Providencia (P. rettgeri, P. alcalifaciens, and P. stuartii) Yersinia, such as Y. pestis, Y. enterocolitica; Haemophilus, such as H. influenzae, H. paline fluenze; (H. parainfluenzae), H. aphrophilus, H. ducreyi; Brucella, for example, B. abortus, B. melitensis, B. B. suis, B. canis; Francisella, such as F. tularensis, Pseudomonas, such as P. P. aeruginosa, P. aeruginosa P. paucimobilis, P. p. P. putida, P.P. P. fluorescens, P. fluorescens Acidborans (P. acidovorans), Burkholderia (Pseudomonas) pseudomallei. Burkholderia mallei, Burkholderia cepacia, and Stenotrophomonas maltophilia; Campylobacter, for example, C.I. F. Fetus fetus, C.I. C. jejuni, C.I. P. pylori (Helicobacter pylori); Vibrio, e.g. Cholera (V. cholerae), V. Parahemolyticus (V. parahaemolyticus), V. Minicus (V. mimicus), V. V. alginolyticus, V. V. hollisae, V. V. vulnificus and non-adherent vibrio; Clostridia, for example C. perfringens, C.I. C. tetani, C.I. C. difficile, C.I. C. botulinum; Antinomyces, for example, A. A. israelii; Bacteroides, e.g. B. firagilis, B. B. thetaiotaomicron, B. B. distasonis, B. B. vulgatus, B. Ovatus, B. ovatus B. caccae and B. caccae. B. merdae; Prevotella, e.g. P. Melaninogemca; genus Fusobacterium; Treponema, e.g. T. pallidum subspecies endemicum, T. pallidum subspecies endemicum T. pallidum subspecies pertenue, T. T. carateum and T. carateum T. pallidum subspecies pallidum; genus Borrelia, e.g. B. burgdorferi; genus Leptospira; Streptobacillus, e.g. S. moniliformis; Spirillum, e.g. S. minus; Mycobacterium, e.g. M. tuberculosis, M. M. bovis, M.B. Africanum, M. africanum M. avium, M.A. M. intracellulare, M. et al. Kansasii, M.M. M. xenopi, M.M. M. marinum, M.M. M. ulcerans, M. et al. M. fortuitum complex (M. fortuitum and M. chelonei), M. fortuitum complex. M. leprae, M. M. asiaticum, M.M. M. chelonei ubsp. Abscessus, M. et al. M. fallax, M.M. Fortuitum, M.C. M. malmoense, M.M. Shimoidei, M. M. simiae, M.M. M. szulgai, M. Xenopi; Mycoplasma, e.g. Hominis, M.M. Orale, M. M. salivarium, M. Fermentans, M. fermentans M. pneumoniae, M. et al. M. bovis, M.B. M. tuberculosis, M. M. avium, M.A. M. leprae; Mycoplasma, e.g. M. genitalium; Ureaplasma, e.g. U. urealyticum; Trichomonas, e.g. T. vaginalis; Cryptococcus, e.g. C. neoformans; Histoplasma, e.g. H. capsulatum; Candida, for example, C.I. C. albicans; Aspergillus sp; Coccidioides, for example, C. albicans; C. immitis; Blastomyces, e.g. B. dermatitidis; Paracoccidioides, e.g. P. brasiliensis; Penicillium, e.g. P. marneffei; Sporothrix, e.g. S. schenckii; Rhizopus, Rhizomucor, Absidia, and Basidiobolus; Bipolaris, Cladophialophora, Cladosporium, Cladosporium, Cladosporium (Drechslera), Exophiala, Fonsecaea, Phialophora, Xylohypha, Ochroconis, Rhinocladiella, Scolecobasidium and W Illness; Trichosporon, e.g. T. beigelii; Blastoschizomyces, e.g. B. capitatus; Plasmodium, e.g. P. falciparum, P. falciparum P. vivax, P.V. O. ovale and P. ovale P. malariae; Babesia sp; protozoa of the genus trypanosome, e.g. T. cruzi; Leishmania, e.g. L. donovani, L. Major L. L. major L. tropica, L. L. mexicana, L. L. braziliensis, L. L. viannia braziliensis; Toxoplasma, e.g. T. gondii; Genera Naegleria or Acanthamoeba Amoebas; Entamoeba histolytica; Giardia lamblia; Genus cryptus polydium Cryptosporidium), for example, C.I. C parvum; Isospora belli; Cyclospora cayetanensis; Ascaris lumbricoides; Trichuris trichiura; Trichuris trichiura; (Necator americanus); Strongyloides stercoralis Toxocara, e.g. T. canis, T. T. cati; Baylisascaris, e.g. B. procyonis; Trichinella, e.g. T. spiralis; Dracunculus, e.g. Medinensis; genus Filarioidea; Wuchereria bancrofti; Bnigia; B. malayi or B.I. B. timori; Onchocerca volvulus; Loa loa; Dirofilaria immitis; genus Schis
tosoma), e.g. Japonicum, S. japonicum S. mansoni,
S. S. mekongi, S. Intercalatum, S. intercalatum S. haematobium; Paragonimus, e.g. Westermani, P.W. P. Skriabini; Clonochis sinensis; Fasciola hepatica; Opisthorchis sp; Fasciolopsis buski; Difirobothium phy Taenia, e.g. T. saginata, T. T. solium; Echinococcus, for example
E. E. granulosus, E. E. multilocularis; Picomaviruses, rhinoviruses echoviruses, coxsackievhuses, influenza virus; paramyxoviruses, eg
2, 3, and 4; adnovimses; herpesviruses, eg, HSV-1 and HSV-2; varicella-zoster virus; human T-lymphortic virus human T-lymphotrophic virus (type I and type II); Arboviruses and Arenaviruses; Togaviridae, Flavividae, Bunyaviridae, Reoviridae Flavivirus; Hantavirus; Viral encephalitis (alphaviruses, eg, Venezuelan equine encephalitis, Eastern Equine encephalitis; Tis (eastern equine encephalitis), Western Equine Western equine encephalitis; Viral hemorrhagic fevers (filoviruses, eg, Eboia, Marburg, and arenaviruses, eg, Lassa ( Lassa), Machupo; smallpox (variola); retroviruses such as
種々の実施形態では、プローブは、シュードモナ・アエルジノサ(Pseudomonas aeruginosa)、プロテウス・ミラビリス( Proteus mirabilis)、クレブシエラ・オキシトカ(Klebsiella oxytoca)、クレブシエラ・ニューモニエ( Klebsiella pneumoniae)、エシェリチア・コリ( Escherichia coli)、アシネトバクテル・バウマンニ( Acinetobacter Baumannii)、セラティア・マルセセンス( Serratia marcescens)、エンテロバクタ・アエロジェネス(Enterobacter aerogenes)、エンテロコッカス・ファエシウム(Enterococcus faecium)、耐ヴァコミシン・エンテロコッカス(vacomycin-resistant enterococcus (VRE))、スタフィロコッカス・アウレウス(Staphylococcus aureus)、耐メセシリン・スタフィロコッカス・アウレウス( methecillin-resistant staphylococcus aureus (MRSA))、ストレプトコッカス・ヴィリダンス(Streptococcus viridans)、リステリア・モノシトジェネス(Listeria monocytogenes)、エンテロコッカスspp.(Enterococcus spp.)、ストレプトコッカス・グループB(Streptococcus Group B)、ストレプトコッカス・グループC(Streptococcus Group C)、ストレプトコッカス・グループ G(Streptococcus Group G)、ストレプトコッカス・グループF(Streptococcus Group F)、 エンテロコッカス・ファエカリス(Enterococcus Faecalis)、ストレプトコッカス・ニューモニエ(Streptococcus pneumoniae)、スタフィロコッカス・エピデルミディス(Staphylococcus epidermidis)、ガルデネララ・ヴァジナリス(Gardeneralla vaginalis)、ミクロコッカスsps.(Micrococcus sps.)、ハエモフィルス・インフルエンゼ(Haemophilus influenzae)、ネイセリア・ゴノルホエエ(Neisseria gonorrhoeee)、モラクセラ・カタラリス(Moraxella catarrahlis)、サルモネラsps.(Salmonella sps.)、クラミディア・トラコマティス(Chlamydia trachomathis)、ペプトストレプトコッカス生成物(Peptostreptococcus productus)、ペプトストレプトコッカス・アナエロビウス( Peptostreptococcus anaerobius)、ラクトバシルス・フェルメンツム(Lactobacillus fermentum)、ユーバクテリウム・レンテュム(Eubacterium lentum)、カンディダ・グラブラタ(Candida glabrata)、カンディダ・アルビカンス(Candida albicans)、クラミディアspp.(Chlamydia spp.)、カンプロバクタspp.(Camplobacter spp.)、サルモネラsp.( Salmonella sp.)、天然痘(smallpox)(ヴィリオラ・マジョール)(viriola major)、イエルシナ・ペスティス( Yersina Pestis)、ヘルペス・シンプレクス・ヴィルスI( Herpes Simplex Virus I )(HSV I)、及びヘルペス・シンプレクス・ヴィルスII(Herpes Simplex Virus II )(HSV II)から成る一群から選択した有機体を特徴付けるポリヌクレオチド・シーケンスのために選択的とすることができる。 In various embodiments, the probe comprises Pseudomonas aeruginosa, Proteus mirabilis, Klebsiella oxytoca, Klebsiella pneumoniae, Escherichia coli, Escherichia coli, Escherichia coli, Escherichia coli, Escherichia coli, Escherichia coli, Escherichia coli, Escherichia・ Baumannini (Acinetobacter Baumannii), Serratia marcescens, Enterobacter aerogenes, Enterococcus faecium, vacomycin-resistant enterococcus (V), vacomycin-resistant enterococcus (RE) Aureus (Staphylococcus aureus), Methecillin-resistant staphylococcus aureus (MRSA), Streptococcus viridans, Listeria Listeria monocytogenes, Enterococcus spp. (Enterococcus spp.), Streptococcus Group B, Streptococcus Group C, Streptococcus Group G, Streptococcus Group F, Enterococcus faecalis (F) Enterococcus Faecalis), Streptococcus pneumoniae, Staphylococcus epidermidis, Gardeneralla vaginalis, Micrococcus sps. (Micrococcus sps.), Haemophilus influenzae, Neisseria gonorrhoeee, Moraxella catarrahlis, Salmonella sps. (Salmonella sps.), Chlamydia trachomathis, Peptostreptococcus productus, Peptostreptococcus anaerobius, Lactobacillus fermentum, Lactobacillus fermentum lentum), Candida glabrata, Candida albicans, Chlamydia spp. (Chlamydia spp.), Camprobacter spp. (Camplobacter spp.), Salmonella sp. (Salmonella sp.), Smallpox (viriola major), Yersina Pestis, Herpes Simplex Virus I (HSV I), and herpes simplex Can be selective for polynucleotide sequences characterizing organisms selected from the group consisting of Herpes Simplex Virus II (HSV II).
種々の実施形態では、プローブを、グループBストレプトコッカスの特徴を示すポリヌクレオチド・シーケンスのために選択することができる。 In various embodiments, probes can be selected for polynucleotide sequences that exhibit Group B Streptococcus characteristics.
また、本技術は、流体の運動を抑制する構成要素を有する微小流体カートリッジも備えている。この構成要素は、チャネルと、チャネルの第1側に配置した第1熱応答物質(TRS)質量体と、チャネルの第1側とは逆になるチャネルの第2側に配置した第2TRS質量体と、第1TRS質量体と関連付けられている気体圧力源とを備えている。気体圧力源を作動させることにより、第1TRS質量体を第2TRS質量体に送り込み、チャネルを遮断する。 The present technology also includes a microfluidic cartridge having components that suppress fluid movement. This component includes a channel, a first thermally responsive material (TRS) mass disposed on the first side of the channel, and a second TRS mass disposed on the second side of the channel opposite to the first side of the channel. And a gas pressure source associated with the first TRS mass. By actuating the gas pressure source, the first TRS mass is fed into the second TRS mass and the channel is blocked.
微小流体カートリッジは、第2TRS質量体と関連付けられている第2気体圧力源を含むことができる。第2気体圧力源を作動させることによって、第2TRS質量体を第1TRS質量体に送り込む。第1及び第2TRS質量体の少なくとも一方(例えば、双方)は、ワックスとすることができる。 The microfluidic cartridge can include a second gas pressure source associated with the second TRS mass. Actuating the second gas pressure source feeds the second TRS mass into the first TRS mass. At least one (eg, both) of the first and second TRS masses can be a wax.
微小流体カートリッジの別の態様は、微小流体カートリッジのチャネルを遮断する構成要素を含む。TRSの質量体を加熱し、チャネルを横切って(例えば、気体圧力によって)第2TRS質量体に送り込むことができる。また、第2TRS質量体を第1TRS質量体に向けて送り込むことができる(例えば、気体圧力によって)。 Another aspect of the microfluidic cartridge includes a component that blocks a channel of the microfluidic cartridge. The TRS mass can be heated and fed into the second TRS mass across the channel (eg, by gas pressure). Also, the second TRS mass can be fed toward the first TRS mass (eg, by gas pressure).
微小流体カートリッジの別の態様は、アクチュエータである。このアクチュエータは、チャネルと、チャネルに接続されている室と、室内に配される封入液体の少なくとも1つのリザーバと、室内部においてリザーバを包囲する気体とを含む。室を加熱することによって、封入液体のリザーバが膨張し、気体を加圧する。通例、この液体の沸点は約90℃以下である。この液体は、約10個以下の炭素原子を有する炭化水素とするとよい。液体は、ポリマによって封入するとよい。 Another aspect of the microfluidic cartridge is an actuator. The actuator includes a channel, a chamber connected to the channel, at least one reservoir of enclosed liquid disposed in the chamber, and a gas surrounding the reservoir in the chamber. By heating the chamber, the reservoir of sealed liquid expands and pressurizes the gas. Typically, this liquid has a boiling point of about 90 ° C. or less. The liquid may be a hydrocarbon having about 10 or fewer carbon atoms. The liquid may be encapsulated with a polymer.
アクチュエータは、多数の封入液体のリザーバを含み、室内に配することができる。多数のリザーバは、固体(例えば、ワックス)の中に分散することができる。多数のリザーバは、可撓性エンクロージャ(例えば、可撓性の袋)の中に配することもできる。 The actuator includes a number of reservoirs of encapsulated liquid and can be disposed in the chamber. Multiple reservoirs can be dispersed in a solid (eg, wax). Multiple reservoirs can also be placed in a flexible enclosure (eg, a flexible bag).
微小流体カートリッジの別の態様は、デバイスの室内部において気体を加圧して、微小流体デバイスのチャネル内において液体を移動させるのに十分な気体圧力を発生させることを含む。通例、気体を加圧すると、室内部に配置されている少なくとも1つの封入気体のリザーバが膨張する。少なくとも1つのリザーバを膨張させるには、室を加熱することを含むことができる。気体を加圧するには、多数の封入液体のリザーバを膨張させることを含むことができる。 Another aspect of the microfluidic cartridge includes pressurizing a gas within the interior of the device to generate a gas pressure sufficient to move the liquid within the channel of the microfluidic device. Typically, when a gas is pressurized, at least one reservoir of enclosed gas disposed within the chamber expands. Inflating the at least one reservoir can include heating the chamber. Pressurizing the gas can include expanding a number of reservoirs of encapsulated liquid.
ここで用いるための微小流体カートリッジの別の態様は、第1及び第2液体体積を合体(例えば、混合)することを含む。本デバイスは、デバイスの第1及び第2チャネルを分離する、温度応答物質(TRS)の質量体(mass)を含む。デバイスは、第1チャネルに沿って第1液体を移動させて、第1液体の一部(例えば、中央部分)がTRSに隣接できるようにし、第2液体を第2チャネルに沿って移動させて、第2液体の一部(例えば、中央部分)がTRSに隣接できるように構成することができる。熱源を作動させてTRSを移動させる(例えば、溶解、分散、崩壊によって)ことができる。第1及び第2液体の中央部分は、通例、合体しており、気体界面によって分離されていない。通例、第1液体の部分集合及び第2液体の部分集合を合体させることができる。液体は、混合チャネルに沿って移動するときに混合する。液体合体すると、少なくとも2液滴長だけ移動し、層間挿入及び横断方向核酸(微小チャネルの長さに対して垂直)によって、適正な混合が得られ、混合のために長手方向の拡散のみを拠り所とする必要はない(例えば、"Mathematical modeling of drop mixing in a slit-type microchannel"(スリット型微小チャネルにおける滴下混合の数学的モデリング)、K Handique, et al., J. Micromech. Microeng., 11 548-554 (2001)も参照のこと。この内容はここで引用したことにより本願にも含まれるものとする)。混合液滴を一滴長ずつ移動させることによって、後端液滴の中央を先端液滴の先頭に移動させ、次いでチャネルの壁に向けて移動させる。液滴の後端では、液体が壁から液滴の中心に向かって移動する。この液滴の運動によって、2つの液体間に層間挿入が生ずる。本方法を余分な回数繰り返すことにより、更に多くの液滴長にわたってというように、より多くの層間挿入を達成することができる。 Another aspect of the microfluidic cartridge for use herein includes combining (eg, mixing) the first and second liquid volumes. The device includes a temperature responsive material (TRS) mass that separates the first and second channels of the device. The device moves the first liquid along the first channel to allow a portion of the first liquid (eg, the central portion) to be adjacent to the TRS, and moves the second liquid along the second channel. The second liquid can be configured such that a part (for example, a central part) of the second liquid can be adjacent to the TRS. A heat source can be activated to move the TRS (eg, by dissolution, dispersion, or decay). The central portions of the first and second liquids are typically united and not separated by a gas interface. Typically, a subset of the first liquid and a subset of the second liquid can be combined. The liquid mixes as it moves along the mixing channel. When combined, the liquid travels at least two droplets long, and intercalation and transverse nucleic acids (perpendicular to the length of the microchannel) provide proper mixing, relying only on longitudinal diffusion for mixing. (For example, “Mathematical modeling of drop mixing in a slit-type microchannel”), K Handique, et al., J. Micromech. Microeng., 11 548-554 (2001), the contents of which are hereby incorporated by reference). By moving the mixed droplets one by one, the center of the trailing droplet is moved to the beginning of the leading droplet and then moved toward the channel wall. At the trailing edge of the droplet, the liquid moves from the wall toward the center of the droplet. This droplet movement causes an intercalation between the two liquids. By repeating the method an extra number of times, more intercalation can be achieved, such as over more droplet lengths.
更に、微小流体カートリッジは、凍結乾燥試薬粒子も含む。実施形態によっては、凍結乾燥粒子は、多数の更に小さい粒子を含み、各々が、PCRインヒビタと比較してポリヌクレオチドと優先的に連合する複数の受容体を有する。また(あるいは)、凍結乾燥粒子は、細胞を溶解してポリヌクレオチドを放出するように構成されている溶解試薬(例えば、酵素)も含むことができる。また(あるいは)、凍結乾燥粒子は、蛋白質を劣化させる酵素(例えば、プロテーゼ)も含むことができる。 In addition, the microfluidic cartridge also includes lyophilized reagent particles. In some embodiments, the lyophilized particle comprises a number of smaller particles, each having a plurality of receptors preferentially associated with the polynucleotide as compared to a PCR inhibitor. Alternatively (or alternatively), the lyophilized particles can also include a lysis reagent (eg, an enzyme) configured to lyse the cells and release the polynucleotide. Alternatively (or alternatively), the lyophilized particles can also include an enzyme (eg, a prosthesis) that degrades the protein.
細胞は、例えば、微小流体液滴において、細胞の溶液を合体することによって溶解することができ、凍結乾燥粒子はこれによって粒子を再構成する。再構成した溶解試薬は、細胞を溶解する。ポリヌクレオチドは、更に小さい粒子の受容体と連合する。溶解の間、溶液を加熱するとよい(例えば、ヒート・ランプのようなランプを用いて放射的に、又は接触熱源によって)。
実施形態によっては、凍結乾燥粒子が、PCRを実行するために試薬(例えば、プライマ、制御プラスミド、ポリメラーゼ酵素)を含む場合もある。
Cells can be lysed, for example, in microfluidic droplets by coalescing a solution of cells, and lyophilized particles thereby reconstitute the particles. The reconstituted lysis reagent lyses the cells. Polynucleotides associate with smaller particle receptors. During dissolution, the solution may be heated (eg, radiatively using a lamp, such as a heat lamp, or by a contact heat source).
In some embodiments, the lyophilized particles may contain reagents (eg, primers, control plasmids, polymerase enzymes) to perform PCR.
微小流体カートリッジの別の態様は、液体(例えば、溶剤、緩衝液、試薬、又はその組み合わせ)を保持することができる液体リザーバを含む。一般に、リザーバは、国際出願公開第WO2006/079082号に更に記載されているような、以下の特徴の1つ以上を有することができる。
リザーバは、当該リザーバ内部の容積を減少させるように操作(例えば、押圧又は押下)することができる壁を含むことができる。例えば、リザーバは、液体を放出するためにリザーバの別の部分(例えば、壁の一部)を裂く穿孔部材(例えば、針状又はそれ以外の、先が尖った又は尖鋭な部材)を含むことができる。穿孔部材は、リザーバの内部にあり、穿孔部材がリザーバの内面(例えば、壁)から外に向かって壁を裂くようにすることができる。
Another aspect of the microfluidic cartridge includes a liquid reservoir that can hold a liquid (eg, a solvent, buffer, reagent, or combination thereof). In general, the reservoir may have one or more of the following features, as further described in International Publication No. WO 2006/079082.
The reservoir can include a wall that can be manipulated (eg, pressed or depressed) to reduce the volume inside the reservoir. For example, the reservoir includes a piercing member (eg, a needle or other pointed or pointed member) that tears another portion of the reservoir (eg, a portion of the wall) to release liquid. Can do. The piercing member can be internal to the reservoir such that the piercing member tears the wall outwardly from the inner surface (eg, wall) of the reservoir.
一般に、壁は液体又は蒸気の通過に抵抗する。実施形態によっては、壁が伸縮性に欠ける場合もある。壁は可撓性があるとよい。壁は、例えば、金属層、例えば、箔層、ポリマ、又はその組み合わせを含み積層体であるとよい。壁は、真空成形によって形成するとよい(例えば、真空及び熱を材料層に食わせて、成型面に対して層を引き延ばす)。成型面は、壁に全体的に凸状面を設けることができるように、凹状であるとよい。 In general, the wall resists the passage of liquid or vapor. In some embodiments, the wall may lack elasticity. The wall should be flexible. The wall may be a laminate including, for example, a metal layer, such as a foil layer, a polymer, or a combination thereof. The wall may be formed by vacuum forming (eg, applying a vacuum and heat to the material layer to stretch the layer against the molding surface). The molding surface is preferably concave so that the wall can be entirely provided with a convex surface.
リザーバが保持する液体の例には、水、及び1つ以上の塩(例えば、塩化マグネシウム、塩化ナトリウム、トリス緩衝液(Tris buffer)、又はその組み合わせ)を含む水溶液が含まれる。リザーバは、液体(例えば、実質的にその気化を生ずることなく)をある時間期間(例えば、少なくとも6カ月又は少なくとも1年)保管することができる。実施形態によっては、1年で10重量%未満(例えば、約5%未満)の液体が気化する。 Examples of liquids that the reservoir holds include water and an aqueous solution that includes one or more salts (eg, magnesium chloride, sodium chloride, Tris buffer, or combinations thereof). The reservoir can store liquid (eg, substantially without causing its vaporization) for a period of time (eg, at least 6 months or at least 1 year). In some embodiments, less than 10% (eg, less than about 5%) of liquid vaporizes in one year.
穿孔部材は、リザーバの壁の一体部分であってもよい。例えば、リザーバは、内部突起を有する壁を含むことができ、この内部突起がリザーバ内の液体と接触することができる。また、リザーバは、穿孔部材と対向する第2壁も含む。作動中、穿孔部材を駆動して第2壁を貫通し(例えば、内側から外側に向けて)、液体を放出することができる。 The piercing member may be an integral part of the reservoir wall. For example, the reservoir can include a wall having an internal protrusion that can contact the liquid in the reservoir. The reservoir also includes a second wall facing the piercing member. In operation, the piercing member can be driven to penetrate the second wall (eg, from the inside to the outside) to discharge the liquid.
実施形態によっては、リザーバが保管する液体の最大量を約1ml未満とすることができる。例えば、リザーバは、約500マイクロリットル(例えば、300マイクロリットル以下)を保持することができる。一般に、リザーバは、少なくとも約25マイクロリットル(例えば、少なくとも約50マイクロリットル)を保持する。リザーバは、意図する液体量の約10%以内(例えば、50±5μl)で導入することができる。 In some embodiments, the maximum amount of liquid stored in the reservoir can be less than about 1 ml. For example, the reservoir can hold about 500 microliters (eg, 300 microliters or less). Generally, the reservoir holds at least about 25 microliters (eg, at least about 50 microliters). The reservoir can be introduced within about 10% of the intended liquid volume (eg, 50 ± 5 μl).
リザーバは、実質的に空気がない(例えば、実質的に気体がない)ことが可能な所定量の液体を配出することができる。液体を導入するとき、実質的に空気及び/又は気体がない液体は、微小流体デバイス内にある液体の移動を妨害するような大きな気泡を殆ど又は全く生成しない。リザーバ内部に穿孔部材を用いることによって、リザーバが実質的に空気及び/又は気体がない液体を配出する能力を高めることができる。 The reservoir can dispense a predetermined amount of liquid that can be substantially free of air (eg, substantially free of gas). When introducing a liquid, a liquid that is substantially free of air and / or gas produces little or no large bubbles that interfere with the movement of the liquid within the microfluidic device. By using a piercing member within the reservoir, the ability of the reservoir to deliver liquid that is substantially free of air and / or gas can be enhanced.
実施形態によっては、押圧によって液体を開放するためにリザーバを作動させることができる場合がある(例えば、ヒトの指又は親指で、あるいは機械的圧力作動によって)。圧力はリザーバの壁に直接加えてもよく、又は穿孔部材を有するプランジャに加えてもよい。種々の実施形態では、リザーバを作動させるためには、最低限の圧力で済ますことができる。複数のリザーバを同時に又は順次作動させる(又は押下する)ために、自動化したシステムを用いることができる。 In some embodiments, the reservoir can be actuated to release liquid by pressing (eg, with a human finger or thumb, or by mechanical pressure actuation). The pressure may be applied directly to the reservoir wall or may be applied to a plunger having a piercing member. In various embodiments, minimal pressure may be required to operate the reservoir. An automated system can be used to activate (or depress) multiple reservoirs simultaneously or sequentially.
リザーバの作動には、穿孔部材を駆動してリザーバの壁を貫通させることを含むとよい。実施形態によっては、リザーバが穿孔部材を含まないこともある。代わりに、リザーバ内部で発生する内部圧力がリザーバの壁を裂いて、液体を微小流体デバイスに進入させる。 Actuation of the reservoir may include driving the piercing member to penetrate the wall of the reservoir. In some embodiments, the reservoir does not include a piercing member. Instead, internal pressure generated within the reservoir tears the reservoir wall and allows liquid to enter the microfluidic device.
リザーバを作動させて液体を微小流体デバイスに導入すると、液体は一般にはリザーバに引き返すことはない。例えば、作動時に、リザーバの容積がある最小値に減少する場合があるが、一般には液体をリザーバに引き戻すように増大することはない。例えば、リザーバは、作動時に、押しつぶされたままになっていると考えられる。このような実施形態では、可撓性がある壁は、可撓性があってもよいが、ヒステリシス、弾力性、又は伸展性はなくてもよい。あるいは又はそれと共に、リザーバは、液体を全く引き戻すことなく、ベントから空気を引き込んでもよい。 When the reservoir is activated to introduce liquid into the microfluidic device, the liquid generally does not pull back into the reservoir. For example, during operation, the volume of the reservoir may decrease to a certain minimum value, but generally does not increase to draw liquid back into the reservoir. For example, the reservoir may remain crushed when activated. In such embodiments, the flexible wall may be flexible but may not be hysteretic, elastic, or extensible. Alternatively or in conjunction therewith, the reservoir may draw air from the vent without drawing any liquid back.
リザーバは、その中にある試薬の反応性及び組成を保存する(例えば、リザーバの中にある化学薬品は、6カ月又は1年にわたって反応性の変化を殆ど又は全く呈しないことも可能である)。
リザーバの可撓壁は、化学薬品の侵出を制限又は防止することができる。リザーバは、微小流体カートリッジとは独立して組み立て、次いで微小流体カートリッジに固着することができる。
ポリヌクレオチドを処理するための微小流体カートリッジの例
The reservoir stores the reactivity and composition of the reagents in it (eg, chemicals in the reservoir may exhibit little or no change in reactivity over 6 months or 1 year). .
The flexible wall of the reservoir can limit or prevent chemical exudation. The reservoir can be assembled independently of the microfluidic cartridge and then secured to the microfluidic cartridge.
Example of a microfluidic cartridge for processing polynucleotides
図10を参照すると、ここに記載するシステムと共に用いるのに適した微小流体カートリッジ200の一例の一部は、微小流体ネットワーク201を定める第1、第2、及び第3層205、207、及び209を含む。微小流体ネットワーク201は、検出すべき1つ以上のポリヌクレオチドを含むサンプルを処理するように構成されている種々の構成要素を有する。カートリッジ200は、通例、サンプルを処理する際、とりわけ、判定すべきポリヌクレオチドの濃度を高める、及び/又は判定すべきポリヌクレオチドの濃度に対して、インヒビタの濃度を低下させる。カートリッジ200の種々の特徴は、無差別に組み込むこと、又は適した修正を加えて、種々のその他の動作と合わせてポリヌクレオチドの処理を実行するカートリッジの代わりの構成に組み込むこともできる。
Referring to FIG. 10, a portion of one example of a
カートリッジの製作
微小流体カートリッジ200は、所望通りに製作することができる。通例、層205、207、及び209は、ポリマ材で形成することができる。ネットワーク201の構成要素は、通例、層207、209を成型する(例えば、射出成型する)ことによって形成することができる。層205は、通例、ネットワーク201の構成要素を封止するために層207に固着する(例えば、接着及び/又は熱着)ことができる可撓性ポリマ材(例えば、積層体)とすることができる。層207及び209は、接着剤を用いて互いに接着することができる。本願に適したカートリッジ製作の別の方法が、2006年11月14日に出願した米国仮特許出願第60/859,284号において見出すことができる。その内容全体が、ここで引用したことにより、本願にも含まれるものとする。
Fabrication of Cartridge The
微小流量ネットワーク
ネットワーク201の構成要素の配列例は、米国特許出願公開第2006/0166233号に更に記載されているように、次の通りである。この出願の内容は、ここで引用したことにより、本願にも含まれるものとする。
An example arrangement of the components of the microflow network network 201 is as follows, as further described in US Patent Application Publication No. 2006/0166233. The contents of this application are hereby incorporated by reference herein.
ネットワーク201は、サンプル材料をネットワークに導入することができる入口202と、処理したサンプルをネットワーク201から取り出すことができる(例えば、ネットワークから放出又は抽出する)出口236とを含む。チャネル204が、入口202と合流点255との間を繋いでいる。弁206をチャネル204に沿って位置付けることができる。リザーバ・チャネル240が、合流点255とアクチュエータ244との間を繋いでいる。ゲート242及び246をチャネル240に沿って位置付けることができる。チャネル257が、合流点255と合流点259との間を繋いでいる。弁208をチャネル257に沿って位置付けることができる。リザーバ・チャネル246が、合流点259とアクチュエータ248との間を繋いでいる。ゲート250及び252をチャネル246に沿って位置付けることができる。チャネル261が、合流点259と合流点263との間を繋いでいる。弁210及び疎水性ベント212を、チャネル261に沿って位置付けることができる。チャネル256が、合流点263とアクチュエータ254との間を繋いでいる。ゲート258をチャネル256に沿って位置付けることができる。
The network 201 includes an inlet 202 through which sample material can be introduced into the network and an outlet 236 through which processed samples can be removed from the network 201 (eg, discharged or extracted from the network). A channel 204 connects between the inlet 202 and the junction 255. Valve 206 can be positioned along channel 204. A
チャネル214が、合流点263と処理室220との間を繋いでおり、処理室220は入口265及び出口267を有する。チャネル228が、処理室の出口267と廃棄物リザーバ232との間を繋いでいる。弁234をチャネル228に沿って位置付けることができる。チャネル230が、処理室の出口267と出口236との間を繋いでいる。
微小流体ネットワーク201の個々の構成要素について、以下のように更に説明する。
A
The individual components of the microfluidic network 201 are further described as follows.
処理室
図11も参照すると、処理室220は、第1条件集合(例えば、第1温度及び/又は第1pH)の下ではサンプルのポリヌクレオチドを保持し、第2条件集合(例えば、第2の高い温度、及び/又は第2のアルカリ側のpH)の下ではポリヌクレオチドを放出するように構成されている複数の粒子(例えば、ビーズ、微小球体)218を含む。通例、サンプル内に存在するかもしれないインヒビタと比較して、ポリヌクレオチドを優先的に保持することができる。粒子218は、保持部材216(例えば、カラム)として構成することができ、処理領域220の入口265及び出口267間で移動する場合、サンプル材料(例えば、ポリヌクレオチド)はここを通過しなければならない。
Processing Chamber Referring also to FIG. 11, the
フィルタ219が、粒子218が処理領域220の下流に流れることを防止する。チャネル287は、フィルタ219を出口267と接続する。フィルタ219は、入口265の断面積よりも大きくすることができる表面区域を処理領域220内部に有する。例えば、実施形態によっては、処理室220内部のフィルタ219の表面積の出口265の断面積(この断面積は、通例、チャネル214の断面積とほぼ同一である)に対する比率は、少なくとも約5(例えば、少なくとも約10、少なくとも約20、すくなくとも約30)とすることができる。実施形態によっては、処理領域220内部のフィルタ219の表面積は、少なくとも約1mm2(例えば、約2mm2、少なくとも約3mm2)とすることができる。実施形態によっては、入口265及び/又はチャネル214の断面積は、約0.25mm2以下(例えば、約0.2mm2以下、約0.15mm2以下、約0.1mm2以下)とすることができる。処理室220を通過する材料に対して、フィルタ219が示す表面積が大きい程、処理領域の目詰まりを防止するのに役立ちつつ、処理領域の無効容積(以下で説明する)の著しい増大を回避する。
粒子218は、ポリヌクレオチドを保持する(インヒビタと比較して優先的に)少なくとも1つの受容体によって改質することができる。通例、受容体は、約9.5以下のpH(例えば、約9.0以下、約8.75以下、約8.5以下)を有する液体からポリヌクレオチドを保持する。サンプル溶液が処理室220を通過すると、ポリヌクレオチドを保持することができつつ、液体及びその他の溶液成分(例えば、インヒビタ)を殆ど保持せず(例えば、全く保持せず)処理領域から排出することができる。一般に、受容体は、pHが約10以上(例えば、約10.5以上、約11.0以上)になることができると、ポリヌクレオチドを放出する。その結果、受容体改質粒子からポリヌクレオチドを、周囲の液体に放出することができる。
The
粒子218上の受容体の例には、例えば、ポリアミド(例えば、ポリ−L−リシン、ポリ−D−リシン、ポリ−DL−オルニシンのようなポリカチオン・ポリアミド)及びPEIが含まれる。他の受容体には、例えば、インターカレータ(intercalator)、ポリ−インターカレータ(poly-intercalator)、マイナ・グルーブ・ポリアミン(例えば、スペルミジン)、複数のアミノ酸を備えているホモポリマ及びコポリマ、並びにその組み合わせが含まれる。実施形態によっては、受容体の平均分子重量は、少なくとも約5,000Da(例えば、少なくとも約7,500Da、少なくとも約15,000Da)である。実施形態によっては、受容体は、アミド結合によって粒子表面に付着したポリリシン受容体とすることができる。
Examples of receptors on the
ある実施形態では、粒子218上の受容体は、ペプチド結合を切断するプロテーゼ酵素(例えば、プロナーゼ(pronase)のようなエンド−及びエクソ−プロテーゼの混合体)による劣化のような、酵素劣化に対して抵抗力を有することができる。耐プロテーゼ受容体の例には、例えば、ポリ−D−リシン、及び酵素攻撃を受けやすい受容体の鏡像体となることができるその他の受容耐が含まれる。
In certain embodiments, the receptor on
粒子218は、通例、受容体を連合させることができる材料で形成することができる。粒子218を形成することができる材料の例には、受容体を付着するように改質することができるポリマ材が含まれる。典型的なポリマ材は、受容体を付着するために利用可能なカルボキシル基及び/又はアミノ基を供給する、又は供給するように改質することができる。ポリマ材の例には、例えば、ポリスチレン、ラテックス・ポリマ(例えば、ポリカルボキシレート被覆ラテックス)、ポリアクリルアミド、酸化ポリエチレン、及びその派生物が含まれる。粒子218を形成するために用いることができるポリマ材は、Mathiowitz et al.,の米国特許第6,235,313号に記載されている。この特許の内容は、ここで引用したことにより、本願にも含まれるものとする。他の材料には、ガラス、シリカ、アガローズ、及びアミノ−プロピル−トリ−エトキシ−シラン(APES)改質材料が含まれる。
The
適した受容体で改質することができる粒子の例には、カルボキシル粒子(例えば、カルボキシレート改質磁気ビーズ(セラ−マグ磁気カルボキシレート改質ビーズ、Part#3008050250、セラダイン(Seradyn))、及びPolyscience, カタログ番号09850(catalog no. 09850)から入手可能なポリビーズ・カルボキシレート改質微小球体が含まれる。実施形態によっては、受容体がポリ−D−リシンを含み、ビーズがポリマ(例えば、ポリカルボキシレート被覆ラテックス)を備えている場合もある。別の実施形態では、受容体はPEIを含む。 Examples of particles that can be modified with a suitable receptor include carboxyl particles (eg, carboxylate modified magnetic beads (Cera-Magn magnetic carboxylate modified beads, Part # 3008050250, Seradyn)), and Included are polybead carboxylate modified microspheres available from Polyscience, catalog number 09850 (catalog no. 09850) In some embodiments, the receptor comprises poly-D-lysine and the beads comprise a polymer (eg, poly In another embodiment, the receptor comprises PEI.
一般に、粒子の質量の、当該粒子が保持するポリヌクレオチドの質量に対する比率は、約25以下又は以上(例えば、約20以下、約10以下)とすることができる。例えば、実施形態によっては、約1グラムの粒子が約100ミリグラムのポリヌクレオチドを保持する。 In general, the ratio of the mass of the particle to the mass of the polynucleotide that the particle holds can be about 25 or less (eg, about 20 or less, about 10 or less). For example, in some embodiments, about 1 gram of particles holds about 100 milligrams of polynucleotide.
通例、入口265とフィルタ219との間の処理室220(粒子218を含む)の全容積は、約15マイクロリットル以下(例えば、約10マイクロリットル以下、約5マイクロリットル以下、約2.5マイクロリットル以下、約2マイクロリットル以下)とすることができる。実施形態の一例では、処理領域220の全容積は、約2.3マイクロリットルとすることができる。実施形態によっては、粒子218が処理領域220の全容積の少なくとも約10パーセント(例えば、少なくとも約15パーセント)を占める場合がある。実施形態によっては、粒子218が処理室220の全容積の約75パーセット以下(例えば、約50パーセント以下、約35パーセント以下)を占める場合がある。
Typically, the total volume of processing chamber 220 (including particles 218) between
実施形態によっては、液体が自由に占めることができる処理室220の容積(例えば、粒子218間の隙間を含む処理室220の空隙容積(void volume))は、全容積から粒子が占める容積を減算した値にほぼ等しくすることができる。通例、処理領域220の空隙容積は、約10マイクロリットル以下(例えば、約7.5マイクロリットル以下、約5マイクロリットル以下、約2.5マイクロリットル以下、約2マイクロリットル以下)とすることができる。実施形態によっては、空隙容積は、約50ナノリットル以上(例えば、約100ナノリットル以上、約250ナノリットル以上)とすることができる。例えば、実施形態の一例では、処理室220の全容積は約2.3マイクロリットルとすることができ、粒子が占める容積は約0.3マイクロリットルとすることができ、液体が自由に占める容積(空隙容積)は、約2マイクロリットルとすることができる。
In some embodiments, the volume of the
粒子218は、通例、平均直径が約20ミクロン以下(例えば、約15ミクロン以下、約10ミクロン以下)である。実施形態によっては、粒子218の平均直径が少なくとも約4ミクロン(例えば、少なくとも約6ミクロン、少なくとも約8ミクロン)である場合もある。
実施形態によっては、フィルタ219と出口267との間にあるチャネル287の容積は、処理室220の空隙容積よりもかなり小さくすることができる。例えば、実施形態によっては、フィルタ219と出口267との間にあるチャネル287の容積は、空隙容積の約35%以下(例えば、約25%以下、約20%以下)とすることができる。実施形態の一例では、フィルタ219と出口267との間にあるチャネル287の容積は、約500ナノリットルとすることができる。
In some embodiments, the volume of
粒子密度は、通例、少なくともミリリットル当たり約108粒子(例えば、ミリリットル当たり約109粒子)とすることができる。例えば、全容積が約1マイクロリットルである処理領域では、約103個のビーズを含むことができる。
フィルタ219は、通例、粒子218の直径よりも直径が小さい孔を有する。実施形態の一例では、フィルタ219の孔は、平均約8ミクロンの幅を有し、粒子218の平均直径は約10ミクロンである。
The particle density can typically be at least about 10 8 particles per milliliter (eg, about 10 9 particles per milliliter). For example, a processing region with a total volume of about 1 microliter can contain about 10 3 beads.
実施形態によっては、粒子の少なくとも一部(例えば、全部)が磁性であることができる。代替実施形態では、粒子の殆ど(例えば、全部)が磁性でない。
実施形態によっては、粒子の少なくとも一部(例えば、全部)が固体であることができる。実施形態によっては、粒子の少なくとも一部(例えば全部)が多孔性であることができる(例えば、粒子は、その内部に少なくとも部分的に達するチャネルを有することができる)。
In some embodiments, at least some (eg, all) of the particles can be magnetic. In alternative embodiments, most (eg, all) of the particles are not magnetic.
In some embodiments, at least some (eg, all) of the particles can be solid. In some embodiments, at least a portion (eg, all) of the particle can be porous (eg, the particle can have a channel that reaches at least partially therein).
微小流体ネットワーク201において見出すことができるその他の構成要素は次の通りである。
チャネル
微小流体ネットワーク201のチャネルは、通例、少なくとも1つのミリメートル未満の断面寸法を有する。例えば、ネットワーク201のチャネルの幅及び/又は深さは、約1mm以下(例えば、750ミクロン以下、約500ミクロン以下、約250ミクロン以下)とすることができる。
弁
Other components that can be found in the microfluidic network 201 are as follows.
Channels The channels of the microfluidic network 201 typically have at least one cross-sectional dimension that is less than a millimeter. For example, the channel width and / or depth of the network 201 can be about 1 mm or less (eg, 750 microns or less, about 500 microns or less, about 250 microns or less).
valve
弁は、常時開放状態を有する構成要素であり、弁の一方側(例えば、弁の上流側)の位置から、弁の他方側(例えば、弁の下流側)の位置にチャネルに沿って材料が通過することを可能にする。作動時に、弁は閉鎖状態に遷移し、材料がチャネルに沿って弁の一方側から他方側に通過するのを妨げる。例えば、図10において、弁206は、熱応答物質(TRS)の質量体251を含み、TRSは、第1温度では比較的不動であり、第2温度では良く移動することができる(例えば、パラフィン・ワックス、はんだなどのような、通例、約60℃、約75℃、又は約90℃というように、融点が既知の、相遷移材料(PTM))。室253は、質量体251と気体連通することができる。室253内で気体(例えば、空気)を加熱し、TRSの質量体251を第2温度に加熱すると、室253内の気体圧力によって、質量体251がチャネル204の中に移動して、材料がそれに沿って通過するのを遮断する。ネットワーク201のその他の弁も、弁206と同様の構造を有し、同様に動作する。 A valve is a component that is always open, with material along the channel from a position on one side of the valve (eg, upstream of the valve) to a position on the other side of the valve (eg, downstream of the valve). Allows to pass through. In operation, the valve transitions to the closed state, preventing material from passing from one side of the valve to the other along the channel. For example, in FIG. 10, the valve 206 includes a thermally responsive material (TRS) mass 251 that is relatively immobile at a first temperature and can move well at a second temperature (eg, paraffin). Phase transition materials (PTMs) with known melting points, such as wax, solder, etc., typically about 60 ° C., about 75 ° C., or about 90 ° C. The chamber 253 can be in gas communication with the mass body 251. When a gas (eg, air) is heated in chamber 253 and TRS mass 251 is heated to a second temperature, the gas pressure in chamber 253 causes mass 251 to move into channel 204 and the material is Block it from passing along it. The other valves of the network 201 have the same structure as the valve 206 and operate in the same manner.
TRSの質量体は、本質的に、固体質量体、又は共同して通路を遮断する小さな粒子の集合体とすることができる。TRSの例には、共晶合金(例えば、はんだ)、ワックス(例えば、オレフィン)、ポリマ、プラスチック、及びその組み合わせが含まれる。第1及び第2温度は、カートリッジ200のポリマ層のような材料を損傷する程には高くない温度にすることができる。一般に、第2温度は約90℃未満とすることができ、第1温度は第2温度未満(例えば、約70℃以下)とすることができる。
The mass of the TRS can be essentially a solid mass or a collection of small particles that together block the passage. Examples of TRS include eutectic alloys (eg, solder), waxes (eg, olefins), polymers, plastics, and combinations thereof. The first and second temperatures can be temperatures that are not high enough to damage materials such as the polymer layer of the
ゲートは、当該ゲートの一方側の位置からゲートの他方側にチャネルを沿って材料を通過させない閉鎖状態と、当該ゲートの一方側の位置からゲートの他方側にチャネルを沿って材料を通過させる開放状態とを有することができる構成要素とすることができる。開放ゲートを作動させると、閉鎖状態にゲートを遷移させることができ、閉鎖状態では、ゲートの一方側(例えば、ゲートの上流側)からゲートの他方側(例えば、ゲートの下流側)に材料を通過させない。作動時に、閉鎖ゲートは、開放状態に遷移することができ、開放状態では、ゲートの一方側(例えば、ゲートの上流側)からゲートの他方側(例えば、ゲートの下流側)に材料を通過させる。例えば、図10におけるゲート242は、合流点255とチャネル240との間における材料の通過を妨害するように位置付けられたTRSの質量体271を含む。質量体271を第2温度に加熱すると、質量体は状態が変化し(例えば、溶融、分散、断片化、及び/又は溶解によって)、合流点255とチャネル240との間の材料の通過を許容する。
The gate is closed to prevent material from passing along the channel from one side of the gate to the other side of the gate, and open to pass material from the position on one side of the gate to the other side of the gate along the channel. The component can have a state. Activating an open gate can cause the gate to transition to a closed state where material is transferred from one side of the gate (eg, upstream of the gate) to the other side of the gate (eg, downstream of the gate). Do not pass. In operation, the closed gate can transition to an open state where material is passed from one side of the gate (eg, upstream of the gate) to the other side of the gate (eg, downstream of the gate). . For example, the gate 242 in FIG. 10 includes a
種々の実施形態では、微小流体ネットワーク201は、図12Aに示すような狭いゲート380を含むことができ、ワックス装填孔384からゲート合流点386までワックスを装填するために用いられるゲート装填チャネル382を狭くすることができる(例えば、幅が約150μm、深さが約100ミクロン)。ゲート合流部386の上流チャネル388及び下流チャネル390は、ワックスがゲート合流部386において確実に停止するのを補助するために、広く(例えば、500μmまで)そして深く(例えば、500μmまで)作ることができる。溶融しゲート合流部386から外部に移動するゲート材料の量は、ゲート380の最適な開口度を得るためには、最小限に抑えるとよい。カートリッジ外部のヒータを用いて、ゲート380において熱反応物質を溶融してもよいので、ヒータの位置がずれていると、ゲート装填チャネル382内にあるワックスも溶融する可能性がある。したがって、装填チャネルの寸法を狭くすることによって、ゲート開放の信頼性を高めることができる。ゲート合流部386及びゲート装填チャネル382において溶融するワックスの量が過剰な場合、ゲート合流部386に隣接する下流チャネル390の断面積を大きくすれば、ゲート380の開放の間、ワックスが下流チャネル390を未詰まりさせるのを防止することができる。ゲート合流部386における上流チャネル388の寸法は、ゲート製造中に正しいワックスの装填を確保するために、下流チャネル390と同様に作ることができる。
In various embodiments, the microfluidic network 201 can include a
種々の実施形態では、ゲートは、図12Bに示すようなベント・ゲート392のように、ネットワーク内部のゲートの有効面積即ちフットプリントを最小にするように構成することができる。ネットワーク内部のゲートの有効面積即ちフットプリントを最小にすることにより、所与の微小流体ネットワークの密度を高めることができ、これによって部品毎のコストを低減し、ネットワークの小型化を図り、ネットワークのチャネル長又は容積を最小に抑える等が可能となる。微小流体ネットワークの具体的なレイアウトに応じて、更に別の構成も可能であるが、図面には明示的には示さない。
In various embodiments, the gate can be configured to minimize the effective area or footprint of the gate inside the network, such as the
図10の微小流体カートリッジでは、ゲート242及び246間のチャネル240の一部が、液体(例えば、水、有機液体、又はその組み合わせ)を保持するように構成されている流体リザーバ279を形成する。保存の間、ゲート242及び246は流体リザーバ内における液体の気化を抑制する(例えば、防止する)。カートリッジ200の動作中、リザーバ279の液体は、粒子218(図11)と連合するポリヌクレオチドを残しながら、処理領域220からインヒビタを除去する洗浄液として用いることができる。通例、洗浄液は、1つ以上の追加成分(例えば、緩衝液、キレータ、界面活性剤、洗剤、塩基、酸、又はその組み合わせ)を有する溶液とすることができる。溶液の例には、例えば、pH8.0の10〜50mMトリス(Tris)、0.5〜2mMのEDTA、及び0.5%〜2%SDSの溶液、pH8.0の10〜50mMのトリス、0.5〜2mMのEDTA、及び0.5〜2%トリトン(Triton)X−100の溶液が含まれる。
In the microfluidic cartridge of FIG. 10, a portion of the
流体リザーバ281からゲート250及び252の間にあるチャネル247の一部は、気化を抑制又は防止して液体(例えば、溶液)を保持するリザーバ279のように構成されている。カートリッジ200の動作中、リザーバ281の液体は、通例、放出液(release liquid)として用いることができ、この中に、粒子218が保持していたポリヌクレオチドを放出することができる。放出液の一例は、例えば、濃度が約2mM水酸化物(例えば、約2mMのNaOH)及び約500mM水酸化物(例えば、約500mMのNaOH)水酸化溶液(例えば、HaOH溶液)とすることができる。実施形態によっては、リザーバ281内の液体は、濃度が約25mM以下の水酸化物溶液(例えば、濃度が約15mMの水酸化物)とすることができる。
A portion of the channel 247 between the fluid reservoir 281 and the
通例、リザーバ279、281は、各々、少なくとも約0.375マイクロリットルの液体(例えば、少なくとも約0.750マイクロリットル、少なくとも約1.25マイクロリットル、少なくとも約2.5マイクロリットル)を独立して保持する。実施形態によっては、リザーバ279、281は、各々、約7.5マイクロリットル以下の液体(例えば、約5マイクロリットル以下、約4マイクロリットル以下、約3マイクロリットル以下)を独立して保持する。 Typically, reservoirs 279, 281 each independently contain at least about 0.375 microliters of liquid (eg, at least about 0.750 microliters, at least about 1.25 microliters, at least about 2.5 microliters). Hold. In some embodiments, reservoirs 279, 281 each independently hold about 7.5 microliters or less of liquid (eg, about 5 microliters or less, about 4 microliters or less, about 3 microliters or less).
アクチュエータ
アクチュエータは、ネットワーク、例えば、ネットワーク201における1つの場所と他の場所との間で材料(例えば、サンプル材料及び/又は試薬材料)を移動させることができる気体圧力を供給する構成要素とすることができる。例えば、図13を参照すると、アクチュエータ244は、内部に熱膨張材料(TEM)の質量体273を有する室272を含む。加熱すると、TEMが膨張して、室272内部の自由容積が減少し、室272内部の質量体273を包囲する気体(例えば、空気)を加圧する。通例、ネットワーク201におけるゲート246及び242のようなゲートを、アクチュエータ244によって作動させることができる。その結果、加圧気体が流体リザーバ279内にある液体を合流部255に向けて送り出す。実施形態によっては、アクチュエータ244が約3psi(例えば、少なくとも約4psi、少なくとも約5psi)の圧力差を、アクチュエータと合流部255との間に発生することができる。
Actuators Actuators are components that provide a gas pressure that can move material (eg, sample material and / or reagent material) between one location and another location in a network, eg, network 201 Can do. For example, referring to FIG. 13, the
図13に示す一実施形態では、TEMは、キャリア277内に分散した複数の封止液体リザーバ(例えば、球体)275を含む。通例、液体は、容器(例えば、塩化ビニリデン、アクリロニトリル、及びメチルメタクリレートのようなモノマで形成したポリマ容器)内に封止された高蒸気圧液体(例えば、イソブタン及び/又はイソペンタン)とすることができる。キャリア277は、リザーバをチャネル240に沿って通過させずに、リザーバ275の膨張を許容するプロパティ(例えば、可撓性及び/又は高温における軟化(例えば、溶融)性)を有する。実施形態によっては、キャリア277はワックス(オレフィン)又は適したガラス繊維温度を有するポリマとすることができる。通例、リザーバは、少なくとも約25重量パーセント(例えば、少なくとも約35重量パーセント、少なくとも約50重量パーセント)のTEMを構成する。実施形態によっては、リザーバが約75重量パーセント以下(例えば、約65重量パーセント以下、約50重量パーセント以下)のTEMを構成する場合もある。適した封止液体リザーバは、Expancel(Akzo Nobel社)から入手することができる。
In one embodiment shown in FIG. 13, the TEM includes a plurality of sealed liquid reservoirs (eg, spheres) 275 dispersed within the
TEMを加熱することができる場合(例えば、少なくとも約50℃の温度まで(例えば、少なくとも約75℃又は少なくとも約90℃まで)、液体は気化し、各封止リザーバ及び質量体273の体積を増大させる。キャリア277は軟化して、質量体273を膨張させる。通例、TEMは、作動中に、約150℃未満(例えば、約125℃以下、約110℃以下、約100℃以下)の温度まで加熱することができる。実施形態によっては、TEMの体積は、少なくとも約5倍(例えば、少なくとも約10倍、少なくとも約20倍、少なくとも約30倍)に膨張する。
If the TEM can be heated (eg, to a temperature of at least about 50 ° C. (eg, to at least about 75 ° C. or at least about 90 ° C.), the liquid will vaporize and increase the volume of each sealed reservoir and
ベント
疎水ベント(例えば、ベント212)は、気体がチャネルから出ていくことを可能にしつつ、液体がチャネルから出ていくのを制限する(例えば、防止する)構造とすることができる。通例、疎水ベントは、チャネルの壁を定める多孔性疎水材(例えば、Osmonicsからの多孔性疎水メンブレーンのような、多孔性フィルタ)の層を含む。以下で説明するが、疎水ベントは、サンプルの微小液滴をネットワーク201内部の所望の場所に位置付けるために用いることができる。
Vent A hydrophobic vent (eg, vent 212) may be configured to restrict (eg, prevent) liquid from exiting the channel while allowing gas to exit the channel. Typically, a hydrophobic vent includes a layer of a porous hydrophobic material (eg, a porous filter, such as a porous hydrophobic membrane from Osmonics) that defines the walls of the channel. As will be described below, hydrophobic vents can be used to position sample microdroplets at desired locations within the network 201.
本技術の疎水ベントは、これらから逃げる空気の量を最大にしつつ、ベント面の下にあるチャネルの容積を最小にすることができるように構成することが好ましい。したがって、表面積が大きな疎水性メンブレーンと、ベント面の下に浅い断面の微小チャネルとを有するように、ベントを構成することができることが好ましい。 The hydrophobic vents of the present technology are preferably configured to minimize the volume of the channel below the vent surface while maximizing the amount of air escaping from them. Therefore, it is preferable that the vent can be configured to have a hydrophobic membrane having a large surface area and a microchannel having a shallow cross section under the vent surface.
疎水ベントは、通例、チャネルに沿って、少なくとも約2.5mm(例えば、少なくとも約5mm、少なくとも約7.5mm)の長さを有する。疎水ベントの長さは、通例、疎水ベント内部にあるチャネルの深さよりも少なくとも約5倍(例えば、少なくとも約10倍、少なくとも約20倍)大きくすることができる。例えば、実施形態によっては、疎水ベント内部のチャネルの深さは、約300ミクロン以下(例えば、約250ミクロン以下、約200ミクロン以下、約150ミクロン以下)とすることができる。 The hydrophobic vent typically has a length along the channel of at least about 2.5 mm (eg, at least about 5 mm, at least about 7.5 mm). The length of the hydrophobic vent can typically be at least about 5 times (eg, at least about 10 times, at least about 20 times) greater than the depth of the channel inside the hydrophobic vent. For example, in some embodiments, the depth of the channel inside the hydrophobic vent can be about 300 microns or less (eg, about 250 microns or less, about 200 microns or less, about 150 microns or less).
疎水ベント内部にあるチャネルの深さは、通例、疎水ベントの上流及び下流側にあるチャネルの深さの約75%以下(例えば、約65%以下、約60%以下)とすることができる。例えば、実施形態によっては、疎水ベント内部のチャネル深さは、約150ミクロンとすることができ、疎水ベントの上流及び下流側のチャネル深さは約250ミクロンとすることができる。 The depth of the channel inside the hydrophobic vent can typically be about 75% or less (eg, about 65% or less, about 60% or less) of the depth of the channel upstream and downstream of the hydrophobic vent. For example, in some embodiments, the channel depth inside the hydrophobic vent can be about 150 microns, and the channel depth upstream and downstream of the hydrophobic vent can be about 250 microns.
疎水ベント内部にあるチャネルの幅は、通例、当該ベントの上流側及び当該ベントの下流側にあるチャネルの幅よりも少なくとも約25%広く(例えば、少なくとも約50%広く)することができる。例えば、実施形態の一例では、疎水ベント内部にあるチャネルの幅は、約400ミクロンとすることができ、ベントから上流及び下流側の幅は、約250ミクロンとすることができる。 The width of the channel within the hydrophobic vent can typically be at least about 25% wider (eg, at least about 50% wider) than the width of the channel upstream of the vent and downstream of the vent. For example, in one example embodiment, the width of the channel inside the hydrophobic vent can be about 400 microns and the width upstream and downstream from the vent can be about 250 microns.
使用中、カートリッジ200は、通例、カートリッジの種々の構成要素(例えば、弁、ゲート、アクチュエータ、及び処理領域220)を動作させるように構成されている熱源のアレイと熱的に連動させることができる。実施形態によっては、熱源を、以下で更に説明するようなシステム内のプロセッサによって制御することができ、使用中にカートリッジを収容し監視するように動作する。プロセッサ(例えば、マイクロプロセッサ)は、所望のプロトコルに応じて、熱源を個々にそして異なる時点で作動させるように構成されている。ここで用いる又は修正するのに適した、微小流量カートリッジを動作させるように構成されているプロセッサは、2001年3月28日に出願した米国特許出願第09/819,105号(現在では、米国特許第7,010,391号)に記載されている。この特許の内容は、ここで引用したことにより、本願にも含まれるものとする。別の実施形態では、熱源はカートリッジ自体と一体化することができる。
In use, the
カートリッジ200は、以下のように動作させるとよい。ネットワーク201の弁は、開放状態で製作することができる。ネットワーク201のゲートは閉鎖状態で製作することができる。ここで更に説明するような生物サンプルのような、ポリヌクレオチドを含む流体サンプルを、入口202を通じてネットワーク201に導入することができる。例えば、サンプルは、ルアー取付具(Luer fitting)を有するシリンジを用いて導入することができる。シリンジは、圧力を供給しサンプルをまずネットワーク201内部に移動させる。サンプルは、チャネル204、257、261、及び214に沿って、処理領域220の入口265まで進む。サンプルは、処理領域220を通過し、出口267から排出し、チャネル228に沿って廃棄物室232まで進む。サンプルの後端縁(例えば、上流側液体−気体界面)が疎水ベント212に達したときに、導入デバイス(例えば、シリンジ)によって供給される圧力をネットワーク201から放出して、サンプルのそれ以上の運動を停止させることができる。
The
通例、導入するサンプル量は、約500マイクロリットル以下(例えば、約250マイクロリットル以下、約100マイクロリットル以下、約50マイクロリットル以下、約25マイクロリットル以下、約10マイクロリットル以下)とすることができる。実施形態によっては、サンプルの量は約2マイクロリットル以下(例えば、約0.5マイクロリットル以下)とすることもできる。 Typically, the amount of sample introduced is about 500 microliters or less (eg, about 250 microliters or less, about 100 microliters or less, about 50 microliters or less, about 25 microliters or less, about 10 microliters or less). it can. In some embodiments, the sample volume can be about 2 microliters or less (eg, about 0.5 microliters or less).
処理領域220に入ったポリヌクレオチドは、粒子218間の隙間を通り抜ける。サンプルのポリヌクレオチドは、保持部材216と接触し、サンプルの液体、及びある種のその他のサンプル成分(例えば、インヒビタ)と比較して優先的に保持することができる。通例、保持部材220は、処理領域220に入ったサンプルの中にあるポリヌクレオチドの内、少なくとも約50%のポリヌクレオチド(例えば、少なくとも約75%、少なくとも約85%、少なくとも約90%)を保持する。サンプルの液体及びサンプルの中にあるインヒビタは、出口267を通って処理領域220から出て、廃棄物室232に入る。処理領域220は、通例、サンプルの導入中は約50℃以下(例えば、約30℃以下)の温度とすることができる。
The polynucleotide that has entered the
処理は継続して、保持部材216をリザーバ279の液体で洗浄して、残留するインヒビタを、保持部材216が保持するポリヌクレオチドから分離する。保持部材216を洗浄するには、弁206を閉鎖することができ、第1リザーバ240のゲート242、246を開放することができる。アクチュエータ244を作動させて、リザーバ279内にある洗浄液をチャネル257、261、及び214に沿って移動させ、処理領域220を通過させ、廃棄物リザーバ232に入れる。洗浄液は、チャネル204、257、261、及び214の中に残留している可能性があるサンプルを、処理領域を通って、廃棄物室232の中まで移動させる。一旦洗浄液の後端縁がベント212に達したなら、アクチュエータ244が発生する気体圧力を発散させることができ、液体のそれ以上の運動を停止させることができる。
The process continues and the holding
アクチュエータ244によって処理領域220を通過して移動する洗浄液の体積は、通例、処理領域220の空隙容積の少なくとも約2倍(例えば、空隙容積の少なくとも約3倍)とすることができ、空隙容積の約10倍以下(例えば、空隙容積の約5倍以下)とすることができる。処理領域は、通例、洗浄中約50℃以下の温度(例えば、約30℃以下)とすることができる。洗浄液の例には、この中のリザーバ279及び281に関して記載した液体が含まれる。
The volume of cleaning liquid moved through the
処理は継続して、保持部材216からポリヌクレオチドを放出する。通例、ポリヌクレオチドを放出する前に、リザーバ279からの洗浄液をリザーバ281からの放出液(例えば、水酸化物溶液)と交換することができる。弁208を閉鎖することができ、ゲート250、252を開放することができる。アクチュエータ248を作動し、これによって、リザーバ281内部にある放出液をチャネル261、214に沿って処理領域220内にまで移動させ、保持部材216と接触させる。リザーバ281からの放出液の後端縁が疎水ベント212に達したときに、アクチュエータ248が発生する圧力を発散させて、液体のそれ以上の運動を停止させることができる。アクチュエータ248によって処理領域220を通過して移動させる液体の体積は、通例、少なくとも処理領域220の空隙容積とほぼ等しく(例えば、空隙容積の少なくとも約2倍)することができ、空隙容積の約10倍以下(例えば、空隙容積の約5倍以下)とすることができる。
Processing continues to release the polynucleotide from the retaining
一旦ポリヌクレオチドを保持した保持部材216がリザーバ281からの液体と接触すると、放出ステップを通例実行することができる。通例、放出は、処理領域216内にある放出液を加熱することを含む。一般に、液体は、保持部材が存在する液体を沸騰させるには不十分な温度まで加熱することができる。実施形態によっては、温度は100℃以下(例えば、100℃未満、約97℃以下)とすることができる。実施形態によっては、温度は約65℃以上(例えば、約75℃以上、約80℃以上、約90℃以上)とすることができる。実施形態によっては、温度を約1分以上(例えば、約2分以上、約5分以上、約10分以上)維持する。実施形態によっては、温度は約30分(例えば、約15分以下、約10分以下、約5分以下)維持する可能性もある。実施形態の一例では、処理領域220を約65及び90℃の間(例えば、約70℃まで)まで、約1及び7分(例えば、約2分間)の間加熱することができる。このような温度及び時間は、サンプルに応じて変化し、したがって当業者が選択することができる。
Once the holding
ポリヌクレオチドは、処理領域220内にある液体の中に放出することができる(例えば、ポリヌクレオチドは、通例、処理領域220の空隙容積とほぼ同じ体積を有する量の放出液に放出することができる)。通例、ポリヌクレオチドは、約10マイクロリットル以下(例えば、約5マイクロリットル以下、約2.5マイクロリットル以下)の液体に放出することができる。
The polynucleotide can be released into a liquid within the processing region 220 (eg, the polynucleotide can be released into an amount of release fluid that typically has approximately the same volume as the void volume of the
ある種の実施形態では、処理領域220を通して移動させた元のサンプルの体積の、ポリヌクレオチドを放出することができる液体の体積に対する比率は、少なくとも約10(例えば、少なくとも約50、少なくとも約100、少なくとも約250、少なくとも約500、少なくとも約1000)とすることができる。実施形態によっては、約2mlの体積を有するサンプルからのポリヌクレオチドを処理領域内に保持し、約4マイクロリットル以下(例えば、約3マイクロリットル以下、約2マイクロリットル以下、約1マイクロリットル以下)の液体に放出することができる。
In certain embodiments, the ratio of the volume of the original sample moved through the
ポリヌクレオチドを放出することができる液体は、通例、処理領域220に入ったサンプルの中にあるポリヌクレオチドの少なくとも約50%(例えば、少なくとも約75%、少なくとも約85%、少なくとも約90%)を含む。放出液の中にあるポリヌクレオチドの濃度は、元のサンプルにおけるよりも高い場合がある。何故なら、放出液の体積は、通例、処理領域を通じて移動させて元の液体サンプルの体積よりも少なくなっている可能性があるからである。例えば、放出液におけるポリヌクレオチドの濃度は、カートリッジ200に導入したサンプルにおけるポリヌクレオチドの濃度よりも、少なくとも約10倍大きい(例えば、少なくとも約25倍大きい、少なくとも約100倍大きい)場合もある。ポリヌクレオチドを放出することができる液体の中にあるインヒビタの濃度は、一般に、元の流体サンプルにおけるインヒビタの濃度よりも、ポリヌクレオチドに対する増幅効率を増大させるのに十分な量だけ少なくすることができる。
The liquid capable of releasing the polynucleotide typically provides at least about 50% (eg, at least about 75%, at least about 85%, at least about 90%) of the polynucleotide in the sample entering the
ポリヌクレオチド含有サンプルを処理領域220に導入してから、ポリヌクレオチドを放出液に放出するまでの時間間隔は、通例、約15分以下(例えば、約10分以下、約5分以下)とすることができる。
The time interval between the introduction of the polynucleotide-containing sample into the
放出したポリヌクレオチドを含む液体は、以下のように、処理領域220から除去するとよい。弁210及び234を閉鎖することができる。ゲート238及び258を開放することができる。アクチュエータ254を作動させて、圧力を発生することができる。この圧力が、液体及びポリヌクレオチドを処理領域220から、チャネル230の中へ、そして出口236に向けて移動させる。ポリヌクレオチドを含む液体は、例えば、シリンジ又は自動化したサンプリング・デバイスを用いて、除去することができる。ポリヌクレオチド放出の間に保持部材216と接触する液体に応じて、放出したポリヌクレオチドを含む溶液を、ある量の緩衝液(例えば、pH8.0の等しい体積の20〜50mMトリス−HCl緩衝剤)によって中和するとよい場合もある。
The liquid containing the released polynucleotide may be removed from the
ポリヌクレオチドの放出について、加熱ステップを含むように説明したが、ポリヌクレオチドは加熱しなくても放出することができる。例えば、実施形態によっては、リザーバ281の液体は、追加の加熱を必要とせずに、常温において保持部材からポリヌクレオチドを放出するイオン強度、pH、表面活性剤濃度、組成(composition)、又はその組み合わせを有する。 Although the release of the polynucleotide has been described as including a heating step, the polynucleotide can be released without heating. For example, in some embodiments, the liquid in the reservoir 281 is ionic strength, pH, surfactant concentration, composition, or combination thereof that releases the polynucleotide from the holding member at room temperature without requiring additional heating. Have
ポリヌクレオチドについて、処理領域220の中にある1種類の液体の体積の中に放出するように説明したが、別の構成を用いることもできる。例えば、ポリヌクレオチドは、流体の処理領域220への導入及び/又は通過と同時に(段階毎又は連続的)放出することもできる。このような実施形態では、ポリヌクレオチドは、処理領域220の空隙容積の約10倍以下(例えば、約7.5倍以下、約5倍以下、約2.5倍以下、約2倍以下)の体積を有する液体に放出することもできる。
Although the polynucleotide has been described as being released into one type of liquid volume within the
リザーバ279、281について、第1及び第2ゲートの間で液体を保持するように説明したが、別の構成を用いることもできる。例えば、リザーバ毎の液体を、全体的に透湿性のないメンブレーンによってネットワーク201から分離したパウチ(例えば、この中で更に説明するような、ブリスタ・パック(blister pack))の中に保持してもよい。パウチは、使用中にアクチュエータ244、248が液体を移動させることができるときに、ユーザがメンブレーンを裂いて、液体をリザーバ279、281の中に注入することができるように構成することができる。
Although the reservoirs 279 and 281 have been described as holding liquid between the first and second gates, other configurations may be used. For example, the liquid per reservoir is held in a pouch (eg, a blister pack, as further described herein) separated from the network 201 by a membrane that is totally impermeable to moisture. Also good. The pouch can be configured to allow the user to tear the membrane and inject the liquid into the reservoirs 279, 281 when the
処理領域について、マイクロリットル目盛りの寸法を有するように説明したが、他の寸法を用いることもできる。例えば、インヒビタに対してポリヌクレオチドを優先的に保持するように構成した表面(例えば、粒子)を有する処理領域が、大きな容積(例えば、数十マイクロリットル以上、少なくとも約1ミリリットル以上)を有してもよい。実施形態によっては、処理領域がベンチ・トップ目盛り(bench-top scale)を有する場合もある。 Although the processing region has been described as having microliter scale dimensions, other dimensions can be used. For example, a treatment region having a surface (eg, a particle) configured to preferentially hold a polynucleotide relative to an inhibitor has a large volume (eg, tens of microliters or more, at least about 1 milliliters or more). May be. In some embodiments, the processing region may have a bench-top scale.
処理領域220について、多数の表面改質粒子で形成した保持部材を有するように説明したが、別の構成を用いることもできる。例えば、実施形態によっては、処理領域220が、多数の開口(例えば、孔及び/又はチャネル)を有し、それをポリヌクレオチドが通過する多孔性部材(例えば、フィルタ、多孔性メンブレーン、又はゲル・マトリクス)として構成した保持部材を含む場合もある。ポリヌクレオチドを優先的に保持するように、多孔性部材の表面を改質することができる。例えば、Osmonicsから入手可能なフィルタ・メンブレーンは、表面改質し、処理領域220内部にポリヌクレオチドを保持するために用いることができるポリマで形成することができる。実施形態によっては、処理領域220は、複数の表面(壁又はバッフル)を有し、これをサンプルが通過するように構成した保持部材を含む場合もある。壁又はバッフルは、ポリヌクレオチドを優先的に保持するように改質することができる。
Although the
処理領域220について、微小流体ネットワークの構成要素として説明したが、別の構成を用いることもできる。例えば、実施形態によっては、保持部材を、処理のために、処理領域から別の場所に除去することができる。例えば、ある場所で保持部材を、ポリヌクレオチド及びインヒビタを含む混合物と接触させ、次いで別の場所に移動させて、ここでポリヌクレオチドを保持部材から除去することができる。
Although the
リザーバ275は、キャリア内に分散するように示したが、別の構成を用いてもよい。例えば、リザーバ275を可撓性のあるエンクロージャ(例えば、メンブレーン、例えば、袋のようなエンクロージャ)の中に密封することができる。実施形態によっては、リザーバは室272の中で固定されてないことも可能である。このような実施形態では、アクチュエータ244は、リザーバ275の通過を可能にするには小さすぎるが、気体が室272から出ていくことができる程に大きな孔を有する多孔性部材を含むとよい。
溶解室を有する微小流体カートリッジの例
Although the
Example of microfluidic cartridge with dissolution chamber
種々の構成要素を有する更に別の微小流体カートリッジが、Parunak, et al.,によって2004年3月17日に出願した米国仮特許出願第60/553,553号、及び米国特許出願公開第2005−0084424号に記載されている。これらの出願の内容は、ここで引用したことにより、本願にも含まれるものとする。 Additional microfluidic cartridges with various components are described in US Provisional Patent Application No. 60 / 553,553 filed March 17, 2004 by Parunak, et al., And US Patent Application Publication No. 2005-2005. No. 0084424. The contents of these applications are hereby incorporated herein by reference.
微小流体カートリッジについて、既に細胞から放出されたポリヌクレオチドを受け取るように構成されていると説明したが、ここで用いる微小流体カートリッジは、細胞からポリヌクレオチドを放出するように構成することもできる(例えば、セルを溶解することによって)。例えば、図14A、図14B、図15A、及び図15Bを参照すると、微小流体カートリッジ300は、サンプル溶解室302を含み、この中で細胞を溶解してポリヌクレオチドをその中で放出することができる。更に、微小流体カートリッジ300は、基板層L1〜L3、微小流体ネットワーク304(図14Aには、その一部のみが見られる)、及び液体試薬リザーバR1〜R4も含む。液体試薬リザーバR1〜R4は、液体試薬を保持し(例えば、サンプル材料を処理するために)、試薬ポートPR1〜PR4によってネットワーク304に接続することができる。したがって、微小流体カートリッジ300は、自己充足型環境とすることができ、軌道、細胞溶解、ポリヌクレオチド分離、増幅前処理、増幅、及びサンプル検出のステップを実行するために必要な試薬及び材料全てを備えている。実施形態によっては、1つ以上の必要な試薬が混合されているサンプルを導入する。その場合、残留する試薬をカートリッジ上に保管する。試薬及びその他の材料は、カートリッジ300上において、液体試薬リザーバR1〜R4、微小流体ネットワークの中にある微小流体チャネル又は室、及び/又は溶解室302に保管してもよい。
Although the microfluidic cartridge has been described as configured to receive a polynucleotide that has already been released from a cell, the microfluidic cartridge used herein can also be configured to release a polynucleotide from a cell (eg, By dissolving the cell). For example, referring to FIGS. 14A, 14B, 15A, and 15B, the
ネットワーク304は、実質的に層L2及びL3の間に定義することができるが、3つの層L1〜L3の全ての間にある部分に広がっている。微小流体ネットワーク304は、この中で更に説明するような種々の微小流体構成要素を含み、チャネルCi、弁Vi、二重弁V’i、ゲートGi、混合ゲートMGi、ベントHi、気体アクチュエータ(例えば、ポンプ)Pi、第1処理領域B1、第2処理領域B2、検出ゾーンDi、空気ベントAVi、及び廃棄物ゾーンWiを含む。
図15A、図15Bは、微小流体ネットワーク304の一例の2つの相補的な半分を示す。尚、ネットワークを2つの別個の半分に分割することは、任意であり、純粋に図示を容易にするために過ぎないことは、当業者には言外であろう。図15A、図15Bに示す構成要素の配列は一例であり、同じ構成要素の異なる幾何学的配列、又は異なる構成要素の異なる配列のような、別のこのような配列も、ここに説明するステップを遂行するために、当業者によって組み立てることができることは、当業者には言外であろう。
FIGS. 15A and 15B show two complementary halves of an
通例、ネットワーク304の構成要素は熱的に作動させることができる。図16に見られるように、熱源ネットワーク312の一例は、微小流体ネットワーク304の種々の熱作動構成要素に対応する場所を有する熱源(例えば、抵抗性熱源)を含む。例えば、熱源HPiの場所は、アクチュエータPiの場所に対応し、熱源HGiの場所はゲートGi及び混合ゲートMGiの場所に対応し、熱源HViの場所は、弁Vi及び二重弁V’iの場所に対応し、熱源HDiの場所は処理室Di、ネットワーク304の全ての場所に対応する。使用中、カートリッジ300の構成要素は、ネットワーク312の対応する熱源に熱的に接触して配置することができ、カートリッジ200について先に説明したように、通例、プロセッサを用いて動作させることができる。熱源ネットワーク312は、カートリッジ200について説明したように、カートリッジ300と一体であっても、別個であっても可能である。例えば、熱源ネットワーク312を、受容ベイ2014の直下等に、内部に配置されているカートリッジのネットワークと位置が合うように、加熱モジュール2020に一体化することができる。
Typically, the components of
微小流体カートリッジ300のその他の構成要素は、次の通りである。
空気ベント
空気ベントAViは、ネットワーク304内部における液体の移動によって変位した気体(例えば、空気)を発散させて、圧力の蓄積が液体の所望の移動を妨げないようにすることができる。例えば、空気ベントAV2は、ベントAV2を通過する液体の下流において気体を発散させることによって、液体をチャネルC14に沿ってチャネルC16の中まで移動させる。
弁
Other components of the
Air Vent Air Vent AVi can divert gas (eg, air) displaced by liquid movement within
valve
弁Viは、常時開放状態を有し、弁の一方側(例えば、弁の上流側)における位置から、弁の他方側(例えば、弁の下流側)における位置まで、チャネルに沿って材料を通過させることができる。弁Viは、微小流体カートリッジ200の弁と同様の構造を有することができ、この中において更に説明する。
The valve Vi is normally open and passes material along the channel from a position on one side of the valve (eg, upstream of the valve) to a position on the other side of the valve (eg, downstream of the valve). Can be made. The valve Vi can have a structure similar to that of the
図17及び図18に見られるように、二重弁V’iも常時開放状態を有し、弁の一方側(例えば、弁の上流側)における位置から、弁の他方側(例えば、弁の下流側)における位置まで、チャネルに沿って材料を通過させることができる。図17及び図18の二重弁V11’を例にあげると、二重弁Vi’はTRSの第1及び第2質量体314、316(例えば、共晶合金又はワックス)を含み、これらはチャネル(例えば、チャネルC14)のいずれかの側において互いに離間されている。通例、TRS質量体314、316は、互いにずらすことができる(例えば、TRS質量体の幅の約50%以下の距離だけ)。開放した弁を通って移動する材料は、第1及び第2TRS質量体314、316の間を通過する。各TRS質量体314、316は、それぞれの室318、320と関連付けることがで、室318、320は通例気体(例えば、空気)を含む。
As seen in FIGS. 17 and 18, the double valve V′i also has an open state at all times, from the position on one side of the valve (eg upstream of the valve) to the other side of the valve (eg downstream of the valve). The material can be passed along the channel to a position on the side). Taking the double valve V11 ′ of FIGS. 17 and 18 as an example, the double valve Vi ′ includes TRS first and
二重弁Vi’のTRS質量体314、316及び室318、320は、熱源ネットワーク312の対応する熱源HV11’と熱的に接触することができる。熱源HV11’を作動させると、TRS質量体314、316は更に移動可能な第2状態(例えば、部分的溶融状態)に遷移し、室318、320内における気体の圧力を高める。気体圧力は、チャネルC11を横切るようにTRS質量体314、316を進ませて、弁HV11’(図18)を閉鎖させる。通例、質量体314、316は少なくとも部分的に合体して質量体322を形成し、これがチャネルC11を遮断する。
The
図15A、図15Bに戻って、ゲートGiは常時閉鎖状態を有することができ、ゲートの一方側における位置からゲートの他方側にチャネルに沿って材料を通過させない。ゲートGiは、前述したカートリッジ200のゲートと同様の構造を有することができる。
Returning to FIGS. 15A and 15B, the gate Gi can have a normally closed state, and no material is passed along the channel from a position on one side of the gate to the other side of the gate. The gate Gi can have the same structure as the gate of the
微小流体ネットワークの一部の例について、図19Aから図19Dに見られるように、混合ゲートMGiは、液体の2つの体積をネットワーク304内部において合体(例えば、混合)させることができる。混合ゲートMGiについては、以下で更に説明する。
アクチュエータ
For some examples of microfluidic networks, as seen in FIGS. 19A-19D, the mixing gate MGi can merge (eg, mix) two volumes of liquid within the
Actuator
アクチュエータPiは、ネットワーク304の1つの場所と別の場所との間で材料(例えば、サンプル材料及び/又は試薬材料)を移動させる気体圧力を供給することができる。アクチュエータPiは、カートリッジ200のアクチュエータと形態が同様であることができる。例えば、各アクチュエータPiは、TEMの質量体273を有する室を含み、TEMの質量体273を加熱して室内部で気体を加圧することができる。各アクチュエータPiは、液体がアクチュエータの室に入るのを防止する、対応するゲートGi(例えば、アクチュエータP1のゲートG2)を含む。ゲートを作動させる(例えば、開放する)と、通例、アクチュエータの室内で発生した圧力を微小流体ネットワークに進入させることができる。
Actuator Pi may provide a gas pressure that moves material (eg, sample material and / or reagent material) between one location of
廃棄物室
廃棄物室Wiは、ネットワーク304内部における液体の操作(例えば、移動及び/又は混合)の結果生ずる無駄な(例えば、溢れた)液体を収容することができる。通例、各廃棄物室Wiには、空気ベントが付随しており、液体によって変位され室に入った気体を発散させる。
処理領域
Waste Chamber The waste chamber Wi can contain wasteful (eg, overflowed) liquid resulting from the manipulation (eg, movement and / or mixing) of the liquid within the
Processing area
ネットワーク304の第1処理領域B1は、ポリヌクレオチドを集中させ、サンプルのインヒビタから分離させる構成要素とすることができる。処理領域B1は、カートリッジ200の処理領域220のように構成し動作させることができる。実施形態によっては、第1処理領域B1が保持部材(例えば、多数の粒子(例えば、微小球体又はビーズ)、多孔性部材、多数の壁)を含む場合もあり、保持部材は、処理領域220について説明したように、1つ以上の受容体によって少なくとも1つの表面が改質されている。例えば、受容体は、1つ以上のポリアミド(例えば、ポリ−L−リシン、ポリ−D−リシン、ポリ−DL−オルニシンのようなポリカチオン・ポリアミド)、又はポリエチレン・イミンを含むことができる。実施形態によっては、保持部材の粒子を溶解室302内に配することができ、サンプル材料と共に処理領域B1に移動させることができる。
The first processing region B1 of the
第2処理領域B2は、1つ以上のポリヌクレオチドの存在を判定するために、材料(例えば、サンプル材料)を化合物(例えば、試薬)と合体させる構成要素とすることができる。実施形態によっては、化合物が1つ以上のPCR試薬(例えば、プライマ、制御プラスミド、及びポリメラーゼ酵素)を含む場合がある。 The second treatment region B2 can be a component that combines a material (eg, sample material) with a compound (eg, a reagent) to determine the presence of one or more polynucleotides. In some embodiments, the compound may include one or more PCR reagents (eg, a primer, a control plasmid, and a polymerase enzyme).
凍結乾燥粒子
実施形態によっては、1つ以上のポリヌクレオチドの存在を判定するために化合物は、1つ以上の凍結乾燥粒子(例えば、ペレット)として、B2のような処理領域内に蓄積することができる。粒子は、一般に、室温(例えば、約20℃)で少なくとも約6カ月(例えば、少なくとも約12カ月)の保管寿命を有する。第2処理領域B2に入った液体は、凍結乾燥化合物を溶解(例えば、復元)する。
Lyophilized particles In some embodiments, a compound can accumulate in a processing region such as B2 as one or more lyophilized particles (eg, pellets) to determine the presence of one or more polynucleotides. it can. The particles generally have a shelf life of at least about 6 months (eg, at least about 12 months) at room temperature (eg, about 20 ° C.). The liquid entering the second processing region B2 dissolves (for example, restores) the lyophilized compound.
通例、処理領域B2の凍結乾燥粒子は、平均体積が約5マイクロリットル以下(例えば、約4マイクロリットル以下、約3マイクロリットル以下、約2マイクロリットル以下)である。実施形態によっては、処理領域B2の凍結乾燥粒子は、平均直径が約4mm以下(例えば、約3mm以下、約2mm以下)である。実施形態の一例では、凍結乾燥粒子の平均体積は、約2マイクロリットルであり、平均直径は約1.35mmである。別の実施形態では、凍結乾燥粒子の直径は約5mm以下(例えば、約2.5mm以下、約1.75mm以下)である。 Typically, the lyophilized particles in processing region B2 have an average volume of about 5 microliters or less (eg, about 4 microliters or less, about 3 microliters or less, about 2 microliters or less). In some embodiments, the lyophilized particles in processing region B2 have an average diameter of about 4 mm or less (eg, about 3 mm or less, about 2 mm or less). In one example embodiment, the average volume of lyophilized particles is about 2 microliters and the average diameter is about 1.35 mm. In another embodiment, the lyophilized particle has a diameter of about 5 mm or less (eg, about 2.5 mm or less, about 1.75 mm or less).
1つ以上のポリヌクレオチドの存在を判定する凍結乾燥粒子は、通例、多数の化合物を含む。実施形態によっては、凍結乾燥粒子は、ポリヌクレオチドの存在を判定するため及び/又はポリヌクレオチドの濃度を高めるために反応において用いられる1つ以上の化合物を含む。例えば、凍結乾燥粒子は、PCRによる等で、ポリヌクレオチドを増幅する1つ以上の酵素を含むことができる。 A lyophilized particle that determines the presence of one or more polynucleotides typically contains a number of compounds. In some embodiments, the lyophilized particle comprises one or more compounds used in the reaction to determine the presence of the polynucleotide and / or to increase the concentration of the polynucleotide. For example, the lyophilized particle can include one or more enzymes that amplify the polynucleotide, such as by PCR.
凍結乾燥粒子の例には、グループBストレプトコッカス(GBS)バクテリアと関連のあるポリヌクレオチドの増幅のための試薬の例が含まれる。実施形態によっては、凍結乾燥粒子は、1つ以上のクリオプロテクタント、1つ以上の塩、1つ以上のプライマ(例えば、GBSプライマF及び/又はGBSプライマR)、1つ以上のプローブ(例えば、GBSプローブ−FAM)、1つ以上の内部制御プラスミド、1つ以上の特定性対照(specificity control)(例えば、GBSのPCRに対する対照のようなストレプトコッカス・ニューモニエDNA(Streptococcus pneumoniae DNA)、1つ以上のPCR試薬(例えば、dNTP及び/又はdUTP)、1つ以上の阻止(blocking)又は充填剤(例えば、非特定蛋白質(例えば、ボビン・セラム・アルブミン(BSA:bovine serum albumin)、RNAseA、又はゼラチン)、及びポリメラーゼ(例えば、グリセロールがないタク・ポリメラーゼ(Taq Polymerase))が含まれる。勿論、その他の成分(例えば、その他のプリマ及び/又は特定性対照)も、その他のポリヌクレオチドの増幅のために用いることができる。 Examples of lyophilized particles include examples of reagents for amplification of polynucleotides associated with Group B Streptococcus (GBS) bacteria. In some embodiments, the lyophilized particle comprises one or more cryoprotectants, one or more salts, one or more primers (eg, GBS primer F and / or GBS primer R), one or more probes (eg, GBS probe-FAM), one or more internal control plasmids, one or more specificity controls (eg, Streptococcus pneumoniae DNA, such as a control for GBS PCR), one or more PCR reagents (eg, dNTP and / or dUTP), one or more blocking or fillers (eg, non-specific proteins (eg, bovine serum albumin (BSA), RNAse A, or gelatin) ), And polymerases (eg, Taq Polymerase without glycerol) That. Of course, other components (e.g., other Prima and / or specificity control) can also be used for amplification of the other polynucleotide.
クリオプロテクタント(Cryoprotectant)は、一般に、凍結乾燥粒子の安定性を高めるのに役立ち、粒子の他の化合物に対する損傷を防止するのに役立つ(例えば、粒子の調合及び/又は保管中に酵素の変性を防止することによって)。実施形態によっては、クリオプロテクタントが1つ以上の糖(例えば、1つ以上のディサッカライド(dissacharides)(例えば、トレハローゼ(trehalose)、メリジトーゼ(melizitose)、ラフィノーゼ(raffinose))及び/又は1つ以上のポリ・アルコール(例えば、マニトール(mannitol)、ソルビトール(sorbitol)を含む場合がある。 Cryoprotectants generally help to increase the stability of lyophilized particles and help prevent damage to other compounds of the particles (eg, denaturation of enzymes during particle preparation and / or storage) By preventing). In some embodiments, the cryoprotectant has one or more sugars (eg, one or more dissaccharides (eg, trehalose, melizitose, raffinose) and / or one or more sugars. Other polyalcohols (eg, mannitol, sorbitol).
凍結乾燥粒子は、所望通りに調合することができる。凍結乾燥粒子を作る方法は、粒子及びクリオプロテクタント(例えば、糖又はポリ・アルコール)の試薬の溶液を形成することを含む。通例、凍結乾燥粒子の化合物を溶剤(例えば、水)と合体させて溶液を作ることができ、次いで、この溶液を冷却した疎水面(例えば、ダイアモンド膜又はポリテトラフルオルエチレン面)上に配することができる(例えば、1滴ずつ、ピペットによる等での離散分取(例えば、液滴))。一般に、表面の温度は、極低温剤の冷却槽を直下で使用する等によって、液体窒素の温度(例えば、約−150゜F以下、約−200゜F以下、約−275゜F以下)付近まで低下させることができる。溶液は、極低温剤に接触せずに分与することができる。溶液は、離散粒子のように凍結する。凍結粒子を、通例凍結したままで、ペレットから溶液を除去する(例えば、昇華によって)のに十分な圧力及び時間だけ、真空状態に置くことができる。このような方法は、国際特許出願公開第WO2006/119280号に更に記載されている。その内容は、ここで引用したことにより、本願にも含まれるものとする。 The lyophilized particles can be formulated as desired. A method of making lyophilized particles includes forming a solution of the particles and cryoprotectant (eg, sugar or polyalcohol) reagent. Typically, the lyophilized particle compound can be combined with a solvent (eg, water) to form a solution, which is then placed on a cooled hydrophobic surface (eg, a diamond membrane or polytetrafluoroethylene surface). (E.g., discrete dispensing (e.g., droplets), drop by drop, by pipette, etc.). Generally, the temperature of the surface is around the temperature of liquid nitrogen (for example, about −150 ° F. or less, about −200 ° F. or less, about −275 ° F. or less) by using a cryogenic agent cooling bath directly underneath. Can be lowered. The solution can be dispensed without contact with the cryogenic agent. The solution freezes like discrete particles. The frozen particles can be placed in a vacuum for a pressure and for a time sufficient to remove the solution from the pellet (eg, by sublimation) while typically frozen. Such a method is further described in International Patent Application Publication No. WO 2006/119280. The contents thereof are included in the present application by quoting here.
一般に、粒子を作る元の溶液における化合物の濃度は、微小流体カートリッジにおいて復元するときよりも高くすることができる。通例、溶液の濃度の復元した濃度に対する比率は、少なくとも約3(例えば、少なくとも約4.5)とすることができる。実施形態によっては、この比率が約6である可能性もある。 In general, the concentration of the compound in the original solution from which the particles are made can be higher than when reconstituted in a microfluidic cartridge. Typically, the ratio of solution concentration to reconstituted concentration can be at least about 3 (eg, at least about 4.5). In some embodiments, this ratio may be about 6.
GBSの存在を示すポリヌクレオチドの増幅に使用するための凍結乾燥ペレットを調合するための溶液の一例は、クリオプロテクタント(例えば、乾燥パウダのような120mgのトレハローゼ)、緩衝溶液(例えば、pH8.4の1Mトリス、2.5M KCl、及び200mGのMgCl2の溶液48マイクロリットル)、第1プライマ(例えば、1.92マイクロリットルの500マイクロモラーGBSプライマF(インヴィトロゲン(Invitrogen)))、第2プライマ(例えば、1.92マイクロリットルの500マイクロモラーGBSプライマR(インヴィトロゲン))、プローブ(例えば、1.92マイクロリットルの250マイクロモラーGBSプローブ−FAM(IDT/Biosearch Technologies(バイオサーチ・テクノロジ社))、対照プローブ(例えば、1.92マイクロリットルの250マイクロモラー・カル・オレンジ(Cal Orange)560(Biosearch Technologies(バイオサーチ・テクノロジ社))、テンプレート・プラスミド(例えば、0.6マイクロリットルのマイクロリットル当たり105コピーのプラスミドの溶液)、特定性対照(例えば、1.2マイクロリットルのマイクロリットル当たり10ナノグラムのストレプトコッカス・ニューモニエDNA(ATCC)の溶液(例えば、マイクロリットル当たり約5,000,000コピー))、PCR試薬(例えば、4.8マイクロリットルのdNTP(中心)の100ミリモラー溶液)及び4マイクロリットルのdUTP(中心)の20ミリモラー溶液、充填剤(例えば、24マイクロリットルのBSA(インヴィトロゲン)のミリリットル当たり50ミリグラムの溶液)、ポリメラーゼ(例えば、60マイクロリットルのグリセロールがないタク・ポリメラーゼ(インヴィトロゲン/エッペンドルフ)のマイクロリットル当たり5Uの溶液)、並びに約400マイクロリットルの溶液を作るための溶剤(例えば、水)を組み合わせることによって作ることができる。前述のように、この溶液の約2マイクロリットル毎の約200の標本を凍結し、脱溶媒して、200個のペレットを作ることができる。復元すると、200の粒子がPCR試薬溶液を作り、全体積は約2.4ミリリットルとなる。
An example of a solution for preparing a lyophilized pellet for use in amplifying a polynucleotide that indicates the presence of GBS is a cryoprotectant (eg, 120 mg trehalose such as dry powder), a buffer solution (eg,
試薬リザーバ
図14に見られるように、試薬リザーバRiは、使用する準備ができるまで、ネットワーク304から分離した液体試薬(例えば、水、緩衝溶液、水酸化溶液)を保持するように構成することができる。リザーバR1は、液体を保持するための封止空間330を規定するエンクロージャ329を含む。各空間330は、エンクロージャ329の下壁によって、試薬ポートRPi及びネットワーク304から分離することができる。キャッピング材341(例えば、積層体、接着剤、又はポリマ層)でエンクロージャの上壁を覆ってもよい。
Reagent Reservoir As seen in FIG. 14, the reagent reservoir Ri may be configured to hold a liquid reagent (eg, water, buffer solution, hydroxide solution) separated from the
エンクロージャ329の一部は、各エンクロージャの下壁333に向かって方向付けられた作動メカニズム(例えば、穿孔部材331)として形成することができる。カートリッジ300を用いることができるとき、穿孔部材331を押下することによって試薬リザーバRiを作動させて、壁333を穿刺することができる。穿孔部材331は、ユーザによって(例えば、親指で)、又はカートリッジ300を動作させるために用いられるオペレーティング・システムによって押下することができる。
A portion of the
壁333は、通例、切り裂く又は穿孔することができる低透湿率を有する材料(例えば、アクラー(Aclar)、メタライズ(例えば、アルミニウム)積層体、プラスチック、又は箔積層体)で形成することができる。例えば、リザーバは約200マイクロリットルまで保持することができる。穿孔部材331は、その体積の一部(例えば、約25%まで)を占めてもよい。塩基の水酸化ナトリウムのような腐食性試薬と接触する可能性があるブリスタ内部の積層体の材料は、6から12カ月の露出の後であっても、腐食してはならない。
一般に、リザーバRiは、所望通りに形成し充填することができる。例えば、エンクロージャの上壁を下壁333に封止することができる(例えば、接着及び/又は熱封止)。例えば、穿孔部材331の下端にある開口によって、液体をリザーバに導入することができる。充填の後、(例えば、局在的加熱による熱封止、又は封止材(例えば、キャッピング材料341)の被着によって開口を封止することができる)。
In general, the reservoir Ri can be formed and filled as desired. For example, the upper wall of the enclosure can be sealed to the lower wall 333 (eg, adhesive and / or heat sealed). For example, the liquid can be introduced into the reservoir through an opening at the lower end of the piercing
壁333を穿刺することができると、リザーバからの流体はネットワーク333に入る。例えば、図14及び図15に見られるように、リザーバR2からの液体は、ポートRP2を通ってネットワーク304に入り、チャネルC2に沿って進む。ゲートG3は、液体がチャネルC8に沿って通過するのを防止する。過剰な液体がチャネルC7に沿って通過して、廃棄物室W2に入る。リザーバR2からの液体の後端縁が疎水ベントH2を通過するときに、リザーバ内に発生した圧力を発散させて、液体のこれ以上の運動を停止させることができる。その結果、ネットワーク304は、合流点J1と合流点J2との間にあるチャネルC2の容積によって規定される体積を有する液体試薬の標本を受け取る。アクチュエータP1を作動させることができると、この試薬の標本をネットワーク304内部で更に移動させることができる。試薬リザーバR1、R3、及びR4を、対応するチャネル、疎水ベント、及びアクチュエータと関連付けることができる。
When
図示の構成では、試薬リザーバR1は、通例、処理領域B1内部に保持されているポリヌクレオチドを放出するために放出液(例えば、カートリッジ200について先に述べたような水酸化溶液)を保持する。試薬リザーバR2は、通例、ポリヌクレオチドを放出する前に、処理領域B1から保持しない化合物(例えば、インヒビタ)を除去するために洗浄液(例えば、カートリッジ200について先に述べたような緩衝溶液)を保持する。試薬リザーバR3は、通例、中和緩衝液(例えば、pH8.0の25〜50mMのトリス−HCl緩衝液)を保持する。試薬リザーバR4は、通例、脱イオン水を保持する。 In the illustrated configuration, the reagent reservoir R1 typically holds a release liquid (eg, a hydroxide solution as described above for the cartridge 200) to release the polynucleotide held within the processing region B1. Reagent reservoir R2 typically holds a wash solution (eg, a buffer solution as described above for cartridge 200) to remove non-retained compounds (eg, inhibitors) from processing region B1 before releasing the polynucleotide. To do. Reagent reservoir R3 typically holds a neutralization buffer (eg, 25-50 mM Tris-HCl buffer at pH 8.0). Reagent reservoir R4 typically holds deionized water.
リザーバは、当該リザーバの壁に穿孔部材が形成されているように示したが、別の構成も可能である。例えば、実施形態によっては、リザーバが針状の穿孔部材を含み、これがリザーバの上壁を貫通して、リザーバの下壁に向かって封止空間内に達することもある。リザーバの上壁は、針状穿孔部材において(例えば、接着剤、エポキシによって)封止することができる。使用中に、上壁を押下して、穿孔部材を押し進めて下壁を貫通させ、封止空間の中にある液体を微小流体ネットワークに進入させる。 Although the reservoir is shown as having a piercing member formed on the wall of the reservoir, other configurations are possible. For example, in some embodiments, the reservoir includes a needle-like piercing member that penetrates the upper wall of the reservoir and reaches the sealed space toward the lower wall of the reservoir. The upper wall of the reservoir can be sealed at the needle-like piercing member (eg, with an adhesive, epoxy). During use, the upper wall is pushed down to push the piercing member through the lower wall and allow the liquid in the sealed space to enter the microfluidic network.
リザーバは、作動メカニズム(例えば、穿孔部材)を含むように説明したが、別の構成も可能である。例えば、実施形態によっては、リザーバの封止空間の下壁は、微小流体ネットワークへの開口の上に被さる弱化部分を含むこともある。開口に被さる下壁の材料(例えば、積層体、ポリマ膜、又は箔)は、封止空間内部にある液体の逸失を防止する程度に厚いが、内部の液体に圧力を加えたときに避ける程度に薄くすることができる。通例、開口を覆う材料は、隣接する材料よりも薄くすることができる。あるいは、又は加えて、下壁の周りの材料と比較して、弱化した材料を比較的支持しないでおくことにより、この材料を形成することもできる。 Although the reservoir has been described as including an actuation mechanism (eg, a piercing member), other configurations are possible. For example, in some embodiments, the lower wall of the reservoir sealing space may include a weakened portion that overlies the opening to the microfluidic network. The material of the lower wall that covers the opening (for example, a laminate, polymer film, or foil) is thick enough to prevent loss of liquid inside the sealed space, but is avoided when pressure is applied to the liquid inside. Can be thinned. Typically, the material covering the opening can be thinner than the adjacent material. Alternatively, or in addition, this material can be formed by relatively unsupporting the weakened material as compared to the material around the lower wall.
リザーバは、封止空間の壁によって部分的に形成された封止空間を有するように説明したが、別の構成も可能である。例えば、図20Aを参照すると、リザーバは、プランジャ状の作動メカニズム(例えば、穿孔部材342)と、上層及び下層344、345をそれぞれ有する(例えば、上下積層体層)を有するガスケット状封止空間343を含む。液体は、上層と下層との間に封止することができる。封止空間は、支持構造346(例えば、ドーナツ状ガスケット)によって包囲することができ、支持構造は、その上下周面において封止空間を支持する。
Although the reservoir has been described as having a sealed space partially formed by the walls of the sealed space, other configurations are possible. For example, referring to FIG. 20A, the reservoir has a gasket-
図20Bを参照すると、穿孔部材342が示されており、穿孔部材342が上下層双方を穿孔し、液体を微小流体ネットワークと連通させるまで押下している。プランジャに隣接するベント346が、穿孔部材と封止空間の上層との間に取り込まれた気体を、微小流体ネットワークの中に押し込むことなく、逃がすことができる。
図20Cを参照すると、穿孔部材342を最大限作動させた場合が示されている。穿孔部材の一部が、液体の対応する体積を封止空間から変位させ、所定の体積の液体を微小流体カートリッジに導入する。
Referring to FIG. 20B, a piercing
Referring to FIG. 20C, the case where the piercing
リザーバは、穿孔部材に対して固定とすることができる封止空間を有するように説明したが、別の構成も可能である。例えば、図21Aは、封止空間347を有するリザーバを示す。封止空間347は、作動メカニズムに対して固着(例えば、これと一体化)することができる。作動メカニズムは、可動部材348(例えば、プランジャ)と、封止空間に対して固定とすることができる穿孔部材支持部350によって支持されている穿孔部材349とを有する。通例、封止空間は、可動部材内部の空洞と、封止空間内に液体を封止する下壁351とによって規定することができる。穿孔部材は、可動部材を押下することができるときに、下壁を裂くように構成することができる。穿孔部材支持部は、可動部材の空洞に対して全体的に相補的な形状を有する。穿孔部材支持部は、微小流体ネットワークに接続されているチャネル352を含み、密閉空間から放出した流体を、微小流体ネットワークに進入させる。
Although the reservoir has been described as having a sealed space that can be fixed relative to the piercing member, other configurations are possible. For example, FIG. 21A shows a reservoir having a sealed
図21Bを参照すると、可動部材が押下されており、穿孔部材が丁度封止空間の下層を裂いたところとなっている。図21Cを参照すると、リザーバは穿孔部材及び穿孔部材支持部上に最大に押下されている。リザーバから変位させられる流体の体積は、一般に、密閉空間に入る穿孔部材支持部の体積に対応する。チャネル353によって、可動部材が変位させた空気を排出させる。
Referring to FIG. 21B, the movable member is pressed, and the piercing member has just broken the lower layer of the sealed space. Referring to FIG. 21C, the reservoir is depressed to the maximum on the piercing member and the piercing member support. The volume of fluid displaced from the reservoir generally corresponds to the volume of the piercing member support that enters the enclosed space. The
リザーバは、当該リザーバの何らかの部分に対して固着することができる穿孔部材を有するように説明したが、別の構成も可能である。例えば、図22を参照すると、リザーバは、当該リザーバに対して固着しないことが可能な作動メカニズム354(例えば、針状穿孔部材のような穿孔部材)を含む。リザーバの封止空間355は、上壁356によって規定することができ、内部に微小流体ネットワークを規定することができる基板361の一部を貫通するチャネル357を含む。封止空間の下壁358が、封止空間を微小流体ネットワークのチャネル359から分離する。穿孔部材は、封止空間のチャネル357を占有し、穿孔部材の穿孔先端360が下壁358に対抗して留まるようになっている。リザーバの上壁356を押下すると、穿孔部材354が下壁を貫通し、封止空間内にある液体を微小流体ネットワークの中に押し込むことになる。
Although the reservoir has been described as having a piercing member that can be secured to some portion of the reservoir, other configurations are possible. For example, referring to FIG. 22, the reservoir includes an actuation mechanism 354 (eg, a piercing member such as a needle-like piercing member) that may not stick to the reservoir. The
別の例として、図23A及び図23Bは、作動メカニズム(例えば、穿孔部材)を含むリザーバを示す。この作動メカニズムは、初期状態ではリザーバの上壁の内部に固着することができるが、リザーバの作動時に上壁から少なくとも部分的に分離する。
更に別の例として、図24A及び図24Bは、穿孔部材364を含むリザーバを示す。穿孔部材364は、初期状態ではリザーバの上壁366の内部365に固着することができるが、リザーバの作動時に実質的に上壁から分離する(例えば、完全に分離する)。
As another example, FIGS. 23A and 23B show a reservoir that includes an actuation mechanism (eg, a piercing member). This actuation mechanism can be secured to the interior of the top wall of the reservoir in the initial state, but is at least partially separated from the top wall upon actuation of the reservoir.
As yet another example, FIGS. 24A and 24B show a reservoir that includes a piercing
リザーバについて、密閉空間を有し、これをリザーバの一部に固定又はそうでなければ一体化することができるように説明したが、別の構成も可能である。例えば、図25を参照すると、リザーバは、外壁368によって規定されたカプセル状密閉空間367を含む。外壁は、全体的に、低い透湿率を有する材料で形成することができる。また、リザーバは可動部材369を有する作動メカニズムも含む。可動部材369は穿孔部材370を有し、これが密閉空間を穿孔して中にある液体を放出する。液体はチャネル372に沿って通過し、微小流体ネットワークに至る。チャネル371は、他の場合では可動部材に取り込まれる気体(例えば、空気)を排出させる。
Although the reservoir has been described as having a sealed space that can be fixed or otherwise integrated into a portion of the reservoir, other configurations are possible. For example, referring to FIG. 25, the reservoir includes a capsule-like
リザーバについて、微小流体ネットワークへの入口を全体的に覆うように説明したが、別の構成も可能である。例えば、図26を参照すると、リザーバは、内部に液体を蓄積することができる密閉空間373と、微小流体ネットワークに入口376に接続されている接続部374とを含む。密閉空間373及び接続部374は、切り裂き可能なシール375(例えば、弱いシール)によって分離することができる。一般に、切り裂き可能なシール375は、液体又は蒸気が密閉空間から出るのを防止する。しかしながら、液体に圧力を加えるときに(例えば、密閉空間の壁377を押下することによって)、切り裂き可能シール375が裂けて、液体が弱いシールを通過して接続部に達し、更に微小流体ネットワーク378に入ることができる。
Although the reservoir has been described as generally covering the inlet to the microfluidic network, other configurations are possible. For example, referring to FIG. 26, the reservoir includes a sealed
穿孔部材を有するリザーバの更に別の実施形態を図27Aに示す。これは、外側シェル2703と、穿孔エレメント2704とを有するリザーバ2701を示し、双方とも同じ材料片で作ることができる。このような合体したシェル及び穿孔エレメントは、当業者には既知の多くのプロセスから形成することができる。特に好ましいプロセスは、真空熱形成及び射出成型とすることができる。穿孔エレメント2704は、全体的に円錐形状とすることができ、頂角がメンブレーン2702に隣接し、その頂角は0.040”を超過しないことが好ましい。外側シェルを押下することができるときに、穿孔エレメントは、メンブレーン2702を穿刺してリザーバ2701から液体を放出する。代表的な寸法を図27Aに示す。リザーバは、上面を水平にすることができ、平坦な保護片2705が穿孔部材2704の円錐形の底面を覆うように組み立てるとよい。
Yet another embodiment of a reservoir having a piercing member is shown in FIG. 27A. This shows a
穿孔部材を有するリザーバの更に別の実施形態を図27Bに示す。これは、単体外側シェル2712及び穿孔エレメント2714を有するリザーバ2711を示す。このような合体したシェル及び穿孔エレメントは、当業者には既知の多くのプロセスから形成することができる。特に好ましいプロセスは、真空熱形成及び射出成型とすることができる。穿孔エレメント2714は、全体的に円錐台形状とすることができ、その狭い辺がメンブレーン2713に隣接する。あるいは、穿孔エレメント2714は、数個の別個の穿孔エレメントを備え、円錐状空間内に配置することもできる。このような穿孔エレメントが4つあることができ、多数のエレメントがあることができることが好ましい。
Yet another embodiment of a reservoir having a piercing member is shown in FIG. 27B. This shows a reservoir 2711 having a unitary
尚、図27A及び図27Bにインチ単位の十進量で示すリザーバの寸法、穿孔エレメント、シェル、及び成型品は、一例であることは言うまでもない。特に、寸法は、シェルがそれ自体の重量で潰れることがなく、通例、カートリッジの動作中に必要となったときに、穿孔部材の押下を妨げる程強くはないようにすることができる。 It should be noted that the reservoir dimensions, perforated elements, shells, and molded articles shown in decimal units in inches in FIGS. 27A and 27B are examples. In particular, the dimensions can be such that the shell does not collapse under its own weight and is typically not strong enough to prevent pressing of the piercing member when needed during operation of the cartridge.
更に、種々の実施形態の材料も、カートリッジの保管寿命が約1年となるように選択することができる。これによって、種々の材料の厚さは、これらが、拡散のような手段によって、所望の保管寿命期間中にその内部に収容する液体体積の10%の消失を阻止するようにすることができる。 In addition, the materials of the various embodiments can also be selected such that the shelf life of the cartridge is about 1 year. This allows the thicknesses of the various materials to prevent them from losing 10% of the liquid volume contained therein during the desired shelf life by means such as diffusion.
好ましくは、リザーバの容積は、シェルを押下する前において、約150μlとすることができる。シェルを押下したときでは、容積は、その元の容積の約半分に変形できることが好ましい。 Preferably, the volume of the reservoir can be about 150 μl before pressing the shell. When the shell is depressed, the volume is preferably deformable to about half of its original volume.
尚、ブリスタ・パックに液体試薬を完全に充填し、気泡のための空間が残っていないと、ブリスタには、好ましいよりもかなり大きな力を加えることが必要となる。したがって、ブリスタは、通例、その容積の約80〜95%まで充填し、空気のために約5〜20%、通例では、10〜15%の容積を確保しておく。つまり、一実施形態では、全容積が200μlのブリスタに170mlの液体を充填する。 It should be noted that if the blister pack is completely filled with liquid reagent and there is no space left for the bubbles, it will be necessary to apply a much greater force than is preferred to the blister. Thus, blisters typically fill up to about 80-95% of their volume, and reserve a volume of about 5-20%, typically 10-15%, for air. That is, in one embodiment, a blister with a total volume of 200 μl is filled with 170 ml of liquid.
溶解室
図14A及び図14Bに示したような溶解室302の一例は、タワー型の外形で示されており、微小流体カートリッジ300の面から突出している。溶解室302は、主要溶解室306と廃棄物室308とに分割することができる。一実施形態では、主要溶解室及び廃棄物室306、308は、互いに分離されているので、材料はこれらの室の一方から他方の室に通り抜け、ネットワーク304の少なくとも一部を通過することはできない。主要溶解室306は、サンプルを室306に導入するサンプル入力ポートSP1、室306をネットワーク304に接続するサンプル出力ポートSP2、及びここに記載するように室306内部でサンプル材料と相互作用する凍結乾燥試薬LPを含む。ポートSP2は、図14Aでは、室302の底面にあるように示されている。図15Bは、微小流体ネットワーク304の残りに対するSP2の位置を示す。入力ポートSP1は、材料(例えば、サンプル材料及び気体)を室306に進入させるが材料がポートSP1を通って室308から出ることは制限する(例えば、防止する)一方向弁を含む。通例、ポートSP1は、気密封止を形成するためにサンプル入力デバイス(例えば、シリンジ)と嵌合するように構成されている取付具(例えば、ルアー取付具(Luer fitting))を含む。主要室306は、通例、約5ミリリットル以下(例えば、約4ミリリットル以下)の容積を有する。使用前に、主要室306は、通例、気体(例えば、空気)で充填することができる。
Dissolution chamber An example of the
廃棄物室308は、液体が室308にネットワーク304から入ることができる廃棄物部W6と、室308に入る液体によって変位する気体が出ていくことができるベント310とを含む。
The
溶解試薬粒子
溶解室302の乾燥凍結試薬粒子LPは、細胞からポリヌクレオチドを放出する(例えば、細胞を溶解することによって)ように構成されている1つ以上の化合物(例えば、試薬)を含む。例えば、粒子LPは、蛋白質(例えば、プロテイナーゼ、プロテーゼ(例えば、プロナーゼ)、トリプシン、プロテイナーゼK、ファージ・リティック酵素(例えば、PlyGBS)、リゾジーム(例えば、ReadyLyseのような改質リゾジーム)、細胞特定酵素(例えば、グループBストリプトコッチを溶解するためのミュタノリシン(mutanolysin))を減少させる(例えば、変性させる)ように構成されている1つ以上の酵素を含むことができる。
Lysis Reagent Particles Dry frozen reagent particles LP of
実施形態によっては、粒子LPは、代わりに又は加えて、インヒビタに比較してポリヌクレオチドを保持する成分を含むこともある。例えば、粒子LPは、カートリッジ200の処理室について先に述べたように、受容体で表面を改質した多数の粒子218を含むことができる。粒子LPは、表面改質粒子上の部位を結合するために、判定すべきポリヌクレオチドと競合する可能性があるポリヌクレオチドを減少させる酵素を含むことができる。例えば、判定すべきDNAと競合する可能性があるRNAを減少させるには、粒子LPはRNAase(例えば、RNAseA ISC BioExpress(Amresco))のような酵素を含むとよい。
In some embodiments, the particle LP may alternatively or additionally include a component that retains the polynucleotide relative to the inhibitor. For example, the particles LP can include a number of
実施形態の一例では、粒子LPは、クリオプロテカント、インヒビタと比較してポリヌクレオチドを保持するように受容体で改質した粒子、及び1つ以上の酵素を含む。
通例、粒子LPの平均体積は、約35マイクロリットル以下(例えば、約27.5マイクロリットル以下、約25マイクロリットル以下、約20マイクロリットル以下)である。実施形態によっては、粒子LPの平均直径が、約8mm以下(例えば、約5mm以下、約4mm以下)である場合もある。実施形態の一例では、凍結乾燥粒子はの平均体積は約20マイクロリットルであり、平均直径は約3.5mmである。
In one example embodiment, the particle LP comprises a cryoprotecanto, a particle modified with a receptor to retain a polynucleotide relative to an inhibitor, and one or more enzymes.
Typically, the average volume of the particles LP is about 35 microliters or less (eg, about 27.5 microliters or less, about 25 microliters or less, about 20 microliters or less). In some embodiments, the average diameter of the particles LP may be about 8 mm or less (eg, about 5 mm or less, about 4 mm or less). In one example embodiment, the lyophilized particles have an average volume of about 20 microliters and an average diameter of about 3.5 mm.
粒子LPは、所望通りに調合することができる。通例、他の試薬粒子について先に述べたように、クリオプロテクタント及び冷却した疎水面を用いて、粒子を調合する。例えば、粒子LPを調合するための溶液は、約20ミリリットル作るためには、クリオプロテクタント(例えば、6グラムのトレハローゼ)、受容体で改質した複数の粒子(例えば、約2ミリリットルのポリ−D−リシン受容体を有するカルボキシル改質粒子の懸濁液)、プロテーゼ(例えば、約400ミリグラムのプロナーゼ)、RNAase(例えば、約30ミリグラムのRNAseA(ミリグラム当たり120Uの活量)、ペプチドグリカンを消化する酵素(例えば、ReadyLyse(例えば、160マイクロリットルのReadyLyseのマイクロリットル当たり30,000Uの溶液))、細胞特定酵素(例えば、ミュタノリシン(例えば、200マイクロリットルのミュタノリシンのマイクロリットル当たり50Uの溶液)、及び溶剤(例えば、水)を組み合わせることによって調合することができる。この溶液の約20マイクロリットル毎の約1,000個の標本を、前述のように、凍結しそして脱溶剤して、1,000個のペレットを作る。復元したとき、ペレットは、通例、合計約200ミリリットルの溶液を作るために用いることができる。 The particles LP can be formulated as desired. Typically, the particles are formulated using a cryoprotectant and a cooled hydrophobic surface as described above for the other reagent particles. For example, to make about 20 milliliters of a solution to prepare particle LP, a cryoprotectant (eg, 6 grams of trehalose), a plurality of receptor modified particles (eg, about 2 milliliters of poly- Digests suspension of carboxyl-modified particles with D-lysine receptor), prosthesis (eg, about 400 milligrams of pronase), RNAase (eg, about 30 milligrams of RNAse A (activity of 120 U per milligram)), peptidoglycan Enzymes (eg, ReadyLyse (eg, 30,000 U solution per microliter of 160 microliters ReadyLyse)), cell specific enzymes (eg, mutanolysin (eg, 50 U solution per microliter of 200 microliters mutanolysin), and Solvent (eg water About 1,000 specimens of about 20 microliters of this solution are frozen and desolvated as described above to make 1,000 pellets. When reconstituted, the pellets can typically be used to make a total of about 200 milliliters of solution.
微小流体カートリッジの動作例
使用中、カートリッジ300の種々の構成要素は、次のように動作することができる。ネットワーク304の弁Vi及び弁Vi’は、開放状態に構成することができる。ネットワーク304のゲートGi及び混合ゲートMGiは、閉鎖状態に構成することができる。試薬ポートR1〜R4は、例えば、機械的な力を加えることによって押下して、先に説明したように、液体試薬をネットワーク304に導入することができる。サンプルは、ポートSP1を通じて溶解室302に導入し、主要溶解室306内において凍結乾燥粒子LPと合体することができる。通例、サンプルは、粒子(例えば、細胞)と緩衝溶液との組み合わせを含む。例えば、サンプルの一例は、約2部全血液(2 parts whole blood)から3約部緩衝溶液(3 about parts buffer solution)(例えば、pH8.0の20mMトリス、1mMのEDTA、及び1%SDSの溶液)を含む。別のサンプル例は、グループBストレプトコッチ及び緩衝溶液(例えば、pH8.0の20mMのトリス、1mMのEDTA、及び1%トリトン(Triton)X−100の溶液)を含む。
Example Operation of Microfluidic Cartridge In use, the various components of
一般に、導入するサンプルの体積は、主要溶解室306の全容積よりも小さくすることができる。例えば、サンプルの体積は、室306の全容積の約50%以下(例えば、約35%以下、約30%以下)とするとよい。典型的なサンプルは、体積が約3ミリリットル以下(例えば、約1.5ミリリットル以下)である。一般に、ある体積の気体(例えば、空気)が、サンプルと共に主要室306に導入される可能性がある。通例、導入される気体の体積は、室306の全容積の約50%以下(例えば、約35%以下、約30%以下)とすることができる。サンプル及び気体の体積が合わさって、室306の中に既に入っている気体を加圧する。ポートSP1の弁307は、気体が室306から出るのを防止する。ゲートG3、G4、G8、及びG10は閉鎖状態にあるので、加圧サンプルがポートSP2を通ってネットワーク304に入るのを防止することができる。
In general, the volume of sample introduced can be less than the total volume of the
サンプルは室306において粒子LPを溶解する。復元された溶解試薬(例えば、ReadyLyse、ミュタノリシン)がサンプルの細胞を溶解し始め、ポリヌクレオチドを放出する。その他の試薬(例えば、プロナーゼのようなプロテーゼ酵素)がサンプルの中にあるインヒビタ(例えば、蛋白質)を減少又は変性させ始める。サンプルからのポリヌクレオチドが、粒子LPから放出された粒子218の受容体と連合(例えば、結合)し始める。通例、室306内では、溶解が行われている間、サンプルをある時間期間(例えば、約15分以下、約10分以下、約7分以下)加熱する(例えば、少なくとも約50℃まで、少なくとも約60℃まで)ことができる。実施形態によっては、光エネルギを用いて、少なくとも部分的に、溶解室306の内容物を加熱することができる。例えば、カートリッジ300を動作させるために用いられる動作システムは、室306と熱的及び/又は光学的に接触するように配置した光源399(例えば、主に赤外線領域の光を放出するランプ)を含むことができる。このような光源は、ヒータ・モジュール2020、図7、参照番号2046と共に示したものとすることができる。室306は、室306の内部におけるサンプルの温度を監視するために用いる温度センサTSを含む。ランプ出力は、センサTSによって決定した温度に基づいて、増減することができる。
The sample dissolves the particles LP in the
カートリッジ300の動作を続けると、G2を作動させて(例えば、開放する)、主要溶解室306のポートSP2と溶解廃棄物室308のポートW6との間に経路を設ける。経路は、チャネルC9、チャネルC8に沿って延び、処理領域B1を貫通し、チャネルC11に至る。室306内の圧力が、溶解サンプル材料(ライセート、粒子218に結合したポリヌクレオチド、及びその他のサンプル成分を含有する)を通路に沿って送り出す。粒子218(ポリヌクレオチドを含む)を処理領域B1内に保持する(例えば、フィルタによって)ことができ、一方サンプルの液体及びその他の成分は廃棄物室308に流入する。ある時間期間の後(例えば、約2分及び約5分の間)、ゲートG1を開放することによって溶解室306内の圧力を発散させて、ポートSP2及びW6の間に第2経路を形成することができる。二重弁V1’及びV8’を閉鎖して、溶解室302をネットワーク304から分離することができる。
If the operation of the
カートリッジ300の動作は、続いて、ポンプP1を作動させ、ゲートG2、G3、及びG9を開放する。ポンプP1は、チャネルC2の中にある洗浄液を合流点J1の下流に処理領域B1を通って、廃棄物室W5まで送り込む。洗浄液は、インヒビタ、及び粒子218によって保持されないその他の化合物を、処理領域B1から除去する。洗浄液の後端縁(例えば、上流側界面)が疎水ベントH14を通過したときに、アクチュエータP1からの圧力がネットワーク304から発散し、液体のそれ以上の運動を停止させる。二重弁V2’及びV9’を閉鎖することができる。
The operation of the
動作は続いて、ポンプP2を作動させ、ゲートG6、G4、及びG8を開放して、放出液を試薬リザーバR1から処理領域B1に移動させ、粒子218と接触させる。空気ベントAV1は、放出液の移動に先だって、圧力を発散させる。疎水ベントH6は、放出液の後端縁の後で圧力を発散させ、放出液のそれ以上の運動を停止させる。二重弁V6’及びV10’を閉鎖することができる。
Operation continues by actuating pump P2, opening gates G6, G4, and G8 to move the release liquid from reagent reservoir R1 to processing region B1 and into contact with
動作は続いて、処理領域B1を加熱して(例えば、粒子218を加熱することによって)、粒子218からポリヌクレオチドを放出する。粒子は、カートリッジ200について先に説明したように、加熱することができる。通例、放出液は、約15mMの水酸化物(例えば、NaOH溶液)を含み、粒子を約70℃まで約2分加熱すると、粒子218からポリヌクレオチドを放出することができる。
The operation continues by heating the treatment region B1 (eg, by heating the particle 218) to release the polynucleotide from the
動作は続いて、ポンプP3を作動させ、ゲートG5及びG10を開放して、放出液を処理領域B1から下流に移動させる。空気ベントAV2が、放出液の下流側の気体圧力を発散し、液体がチャネルC16に流入できるようにする。疎水ベントH8は、放出液の上流から圧力を発散して、それ以上の移動を停止させる。二重弁V11’及び弁V14を閉鎖することができる。 The operation continues to operate the pump P3, open the gates G5 and G10, and move the discharged liquid downstream from the processing region B1. Air vent AV2 vents the gas pressure downstream of the discharge liquid and allows liquid to flow into channel C16. The hydrophobic vent H8 dissipates pressure from the upstream of the discharge liquid and stops further movement. The double valve V11 'and the valve V14 can be closed.
図19Aから図19Dを参照すると、粒子218から放出されたポリヌクレオチドを含む放出液の一部と、試薬リザーバR3からの中和緩衝液とを混合するために、混合ゲートMG11を用いることができる。図19Aは、試薬リザーバR3を押下して中和緩衝液をネットワーク304に導入する前における混合ゲートMG111領域を示す。図19Bは、中和緩衝液をチャネルC13及びC12に導入した後における混合ゲートMG11を示す。二重弁V13’を閉鎖すると、ネットワーク304を試薬リザーバR3から分離することができる。二重弁V12’を閉鎖すると、ネットワーク304を廃棄物室W3から分離することができる。中和緩衝液は、ゲートMG11のTRSの質量体324の一方側と接触する。
Referring to FIGS. 19A to 19D, a mixing gate MG11 can be used to mix a portion of the release liquid containing the polynucleotide released from the
図19Cは、放出液をチャネルC16内に移動させた後における混合ゲートMG11領域を示す。微小流体ネットワーク304の寸法(例えば、チャネルの寸法、及び疎水ベントH8の位置)は、チャネルC16及びC14の合流点J3及びJ4の間に位置する放出液の一部が、放出ステップの間粒子218と接触する液体の体積にほぼ対応するように構成することができる。実施形態によっては、合流点J3及びJ4の間に位置する液体の体積は、約5マイクロリットル未満(例えば、約4マイクロリットル以下、約2.5マイクロリットル以下)とすることができる。実施形態の一例では、合流点J3及びJ4の間にある放出液の体積は、約1.75マイクロリットルとすることができる。通例、合流点J3及びJ4の間にある液体は、処理領域B1に入ったサンプルの中にあるポリヌクレオチドの内、少なくとも約50%(少なくとも約75%、少なくとも約85%、少なくとも約90%)のポリヌクレオチドを含む。弁V14を閉鎖すると、ネットワーク304を空気ベントAV2から分離することができる。
FIG. 19C shows the mixed gate MG11 region after the release liquid has been moved into channel C16. The dimensions of the microfluidic network 304 (eg, the dimensions of the channel and the location of the hydrophobic vent H8) are such that a portion of the discharge liquid located between the confluences J3 and J4 of the channels C16 and C14 is a
混合ゲートMG11を作動させる前に、合流点J4における放出液、及びチャネルC13及びC12の間にある合流点J6における中和緩衝液を、TRSの質量体324によって分離することができる(例えば、液体は、通例、ある体積の気体によって離間されない)。放出液及び中和緩衝液を合体させるには、ポンプP4並びにゲートG12、G13、及びMG11を作動させることができる。ポンプP4は、合流点J5及びJ6の間にある中和液の体積、及び合流点J4及びJ3の間にある放出液の体積を混合チャネルC15(図19D)の中に送り込む。TRSの質量体324は、通例、散乱及び/又は溶融して、2つの液体が合体することが可能になる。合体した液体は、下流側界面335(合流点J3によって形成された)と、上流側界面(合流点J5によって形成された)とを含む。これらの界面があるために、界面がない場合よりも効率の高い混合が可能となる(例えば、混合液の再循環)。図19Dにおいて見られるように、混合は、通例、2つの液体の界面付近で開始する。混合チャネルC15は、通例、チャネル内部にある合体した液体の全長と少なくともほぼ同じ長さ(例えば、少なくとも約2倍長い)とすることができる。
Prior to activating the mixing gate MG11, the discharge at the junction J4 and the neutralization buffer at the junction J6 between the channels C13 and C12 can be separated by the TRS mass 324 (eg, liquid Are typically not separated by a volume of gas). Pump P4 and gates G12, G13, and MG11 can be activated to combine the release liquid and neutralization buffer. Pump P4 pumps the volume of neutralization liquid between junctions J5 and J6 and the volume of discharge liquid between junctions J4 and J3 into mixing channel C15 (FIG. 19D). The
放出液と合体する中和緩衝液の体積は、合流点J5及びJ6の間におけるチャネルの寸法によって決定することができる。通例、合体させる中和液の体積は、合体させる放出液の体積とほぼ同じとすることができる。実施形態によっては、合流点J5及びJ6間に位置する液体の体積は、約5マイクロリットル未満(例えば、約4マイクロリットル以下、約2.5マイクロリットル以下)である。実施形態の一例では、合流点J5及びJ6の間にある放出液の体積は、約2.25マイクロリットルとすることができる(例えば、放出液及び中和緩衝液の総体積は約4マイクロリットルとすることができる)。 The volume of the neutralization buffer that merges with the discharge can be determined by the size of the channel between the junctions J5 and J6. Typically, the volume of neutralizing liquid to be combined can be approximately the same as the volume of release liquid to be combined. In some embodiments, the volume of liquid located between the junctions J5 and J6 is less than about 5 microliters (eg, about 4 microliters or less, about 2.5 microliters or less). In one example embodiment, the volume of release liquid between junctions J5 and J6 can be about 2.25 microliters (eg, the total volume of release liquid and neutralization buffer is about 4 microliters). Can be).
図15A、15Bに戻り、合体した放出液及び中和緩衝液は、混合チャネルC15に沿って移動し、チャネルC32に流入する(空気ベントAV8によって下流側で脱気させる)。運動は、合体した液体の上流側界面が疎水ベントH11を通過するまで続く。疎水ベントH11は、アクチュエータP4からの圧力を発散させて、合体した液体のそれ以上の運動を停止させる。 Returning to FIGS. 15A and 15B, the combined release solution and neutralization buffer move along the mixing channel C15 and flow into the channel C32 (degassed downstream by the air vent AV8). The movement continues until the upstream interface of the combined liquid passes through the hydrophobic vent H11. Hydrophobic vent H11 dissipates the pressure from actuator P4 and stops further movement of the combined liquid.
カートリッジ300の動作を続けると、試薬リザーバR4からの、水中で第2処理領域B2にある凍結乾燥PCR粒子を溶解するために、アクチュエータP5並びにゲートG14、G15、及びG17を作動させることができる。疎水ベントH10は、水の上流側にあるアクチュエータP5からの圧力を発散させて、それ以上の運動を停止させる。PCR−試薬ペレットの溶解は、通例、約2分以下で(例えば、約1分以下で)行われる。弁V17を閉鎖することができる。
If the operation of the
カートリッジ300の動作を続けると、凍結乾燥粒子の溶解化合物を処理領域B2からチャネルC31に送り込むために、アクチュエータP6及びゲートG16を作動させることができ、溶解した試薬が混合して、均質に溶解した乾燥凍結粒子溶液を形成する。アクチュエータP6は、溶液をチャネルC35及びC33の中に移動させる(空気ベントAV5によって下流側で脱気させる)。疎水ベントH9は、溶液の上流側でアクチュエータP6が発生した圧力を発散させて、それ以上の運動を停止させる。弁V18、V19、V20’、及びV22’を閉鎖することができる。
Continuing the operation of
カートリッジ300の動作を続けると、ゲートMG20とゲートG22との間にあるチャネル32内にある中和放出液の一部と、ゲートG18及びMG20の間にあるチャネルC35内にある溶解凍結乾燥粒子溶液の一部とを合体(例えば、混合)するために、アクチュエータP7並びにゲートG18、MG20、及びG22を作動させることができる。合体した液体は、混合チャネルC37に沿って進み、検出領域D2に入る。空気ベントAV3が、混合液の下流側で気体圧力を発散させる。合体した液体の上流側界面が疎水ベントH13を通過するとき、アクチュエータP7からの圧力を発散させることができ、合体した液体は検出領域D2の中に位置することができる。
Continuing the operation of the
MG2とゲートG23との間にある試薬リザーバR4からの水の一部を、ゲートG19及びMG2の間にあるチャネルC33内にある溶解凍結乾燥粒子溶液の第2部分とを合体するために、アクチュエータP8並びにゲートMG2、G23、及びG19を作動させることができる。合体した液体は、混合チャネルC41に沿って進み、検出領域D1に入る。空気ベントAV4が、合体した液体の下流側で気体圧力を発散させる。合体した液体の上流側界面が疎水ベントH12を通過するとき、アクチュエータP8からの圧力を発散させることができ、合体した液体は検出領域D1の中に位置することができる。 Actuator to combine a portion of water from reagent reservoir R4 between MG2 and gate G23 with a second portion of the lyophilized particle solution in channel C33 between gates G19 and MG2. P8 and gates MG2, G23, and G19 can be activated. The combined liquid travels along the mixing channel C41 and enters the detection region D1. Air vent AV4 vents the gas pressure downstream of the combined liquid. When the upstream interface of the combined liquid passes through the hydrophobic vent H12, the pressure from the actuator P8 can be released and the combined liquid can be located in the detection region D1.
カートリッジ300の動作を続けると、検出領域D1をネットワーク304から分離するために、二重弁V26’及びV27’を閉鎖することができ、検出領域D2をネットワーク304から分離するために、二重弁V24’及びV25’を閉鎖することができる。各検出領域の内容物(検出領域D2内にあるサンプル・ポリヌクレオチドを含む中和放出液、溶解凍結乾燥粒子溶液からのPCR試薬、及び検出領域D1における溶解凍結乾燥粒子溶液からのPCR試薬を含み脱イオン水)に対して加熱及び冷却ステップを実施して、ポリヌクレオチド(検出領域D2にある場合)を増幅することができる。各検出領域の二重弁は、加熱の間、検出領域の内容物の気化を防止する。増幅したポリヌクレオチドは、通例、蛍光検出を用いて検出することができる。つまり、通例検出領域D1、D2の一方又は双方の上には、窓(例えば、図9におけるような)があり、検出器が窓の上に配置されたときに、反応混合における蛍光物質からの蛍光の検出が可能となる。
Continuing the operation of the
サンプルを処理する種々の段階を実行するカートリッジについて、ここでは全体的に平坦な外形を有するように示し説明したが、別の構成を用いることもでき、ここに記載する一体化システムと調和する。例えば、全体的に管状又は小瓶状の外形を有するカートリッジが、米国特許出願公開第2006−0166233号に記載されている。その内容は、ここで引用したことにより、本願にも含まれるものとする。 Although the cartridge performing the various stages of processing the sample has been shown and described herein as having a generally flat profile, other configurations can be used and are consistent with the integrated system described herein. For example, a cartridge having an overall tubular or vial-like profile is described in US Patent Application Publication No. 2006-0166233. The contents thereof are included in the present application by quoting here.
実施例
以下の実施例は、例示であり、限定することは意図していない。
実施例1:ポリヌクレオチド処理装置
この非限定的な実施例では、図28から図40に示すように、装置、システム、微小流体カートリッジ、キット、方法、及びコンピュータ・プログラム生産物の種々の実施形態例について説明する。
Examples The following examples are illustrative and not intended to be limiting.
Example 1: Polynucleotide Processing Apparatus In this non-limiting example, various embodiments of apparatus, system, microfluidic cartridge, kit, method, and computer program product, as shown in FIGS. An example will be described.
例えば、図28は、小型ベンチ・トップ・リアルタイム、ポリヌクレオチド分析システムとして動作することができる装置800の図である。このようなシステムは、ポリヌクレオチドに対して、例えば、1つ以上の感染症の徴候を見つけるために患者からの検査サンプルに対して種々の検査を実行することができる。本装置は、例えば、医療環境から離れる前に患者を検査し所持する際に臨床要員を補助するために、臨床診断市場において用いるための、リアルタイム・ポリヌクレオチド分析システムとして機能することができる。装置800は、例えば、表示出力802を有する筐体、ハンドル805を有する蓋804、及びバーコード・リーダ806を含むことができる。図28及び図36を参照すると、装置800は、受容ベイ807も含むことができ、これを蓋804によって覆うことができる。種々の実施形態では、装置800は、可搬型とすることができ、例えば、装置800は、重量を約10kgとすることができ、幅約25cm、奥行き約40cm、高さ約33cmの寸法を有することができる。
For example, FIG. 28 is a diagram of an
装置800は、図29に示すサンプル・キット810と共に用いることができる。サンプル・キット810は、例えば、任意のラベル813(例えば、バーコード・ラベル)を有する微小流体カートリッジ812、任意のラベル8159例えば、バーコード・ラベル)を有するサンプル・コンテナ814、任意のフィルタ818、任意のピペット先端820、及び任意のシリンジ82を含むことができる。図30を参照すると、サンプル・キット810の1つ以上の構成要素(例えば、微小流体カートリッジ812)を、例えば、任意にアルゴン又は窒素のような不活性ガスを気密封止することができる、封止パウチ824の中に収めることができる。
The
図31に示すように、微小流体カートリッジ812は、サンプル入口826、複数の自己穿孔可能なリザーバ828、リーシス・リザーバ830、廃棄物リザーバ832、任意のラベル813(例えば、バーコード)、及び位置合わせ部材836(例えば、面取りした角)を含むことができる。図31及び図36を参照すると、位置合わせ部材836は、装置800における受容ベイ807の相補位置合わせ部材機構809と一致することができ、装置800に挿入するときに、カートリッジ812の向きを決めやすくするために用いることができる。実施例によっては、微小流体カートリッジ812は、ヒータ/センサ・モジュール842におけるウェル807よりも多少小さくして(例えば、50〜300ミクロン、通例、200〜300ミクロン)、微小流体カートリッジ812の取付及び取り外しをし易くするように設計することができる。
As shown in FIG. 31, the
図32及び図33を参照すると、微小流体カートリッジ812及び/又はサンプル・コンテナ814上のラベル、例えば、バーコード813及び815を、通例検査を行う前に、例えば、手作業で又はバーコード・リーダ806を用いることによってラベル・コードを入力することによって、装置800によって記録することができる。
Referring to FIGS. 32 and 33, labels such as
サンプルを検査する準備において、キット810からのピペット先端820をシリンジ822に取り付けることができ、サンプル・コンテナ814からシリンジ822の中にサンプルを引き込むことができる。図34を参照すると、次に、サンプル入口826を通じて微小流体カートリッジ812のリーシス・リザーバ830にフィルタ818を取り付けることができ(例えば、サンプル入口826においてダックビル弁(duckbill valve)を有するルアー・ロックを用いて)、シリンジ822の内容物(例えば、サンプル/空気混合物)を、フィルタ818を通じて微小流体カートリッジ812に注入することができる。追加の空気(例えば、1〜3mL)をシリンジ822に引き込むことができ(図35に示すように)、微小流体カートリッジ812を加圧できるようにする(例えば、周囲圧力に対して平方インチ(psi)当たり5〜50ポンド、典型的には、周囲圧力に対して5〜25psiの間、更に典型的には10〜15psiの間)。微小流体カートリッジ812は、緩衝液、試薬などを、例えば、リーシス・リザーバ830に、液体、固体、凍結乾燥試薬ペレット等の形態で収容することができる。微小流体カートリッジ812を揺り動かして、注入したサンプルを緩衝液、試薬等と混合することができる。
In preparation for inspecting the sample, a
図35を参照すると、微小流体カートリッジ812を加圧するには、シリンジ822及びフィルタ818を、追加の空気と共に用いることができる。微小流体カートリッジ812は、図36に示すように、装置800の受容ベイ807の中に配置することができ、微小流体カートリッジ812上の位置合わせ部材836と受容ベイ807の中にある相補的な位置合わせ部材809との間における相互作用のために、装置800の受容ベイ807には1つの向きでなければ据え付けることができない。
Referring to FIG. 35, a
図37及び図38に示すように、装置800の蓋804を閉鎖すると、周囲の光をサンプル・ベイから遮断する役割を果たすことができる。加えて、蓋804を閉鎖すると、蓋の中に収容されている光学検出器を微小流体カートリッジ812に対して正しく位置付けることができる。また、装置の蓋804を閉鎖すると、圧力を微小流体カートリッジ812に加え、ウェル807における加熱/センサ・モジュール842との熱的接触を確保することができる。図39及び図40を参照すると、装置800の加熱/センサ・モジュール842は、洗浄、保守、又は特定の微小流体カートリッジ812のための特別な加熱段階との交換のために、着脱可能とすることができる。
As shown in FIGS. 37 and 38, closing the
実施例2:ポリヌクレオチド処理装置
この非限定的な実施例では、装置、システム、微小流体カートリッジ、キット、方法、及びコンピュータ・プログラム生産物の種々の実施形態例、特に、方法及びコンピュータ・プログラム生産物の態様例に関する、実施例1に記載した装置800を用いる種々の態様について説明する。
Example 2: Polynucleotide Processing Apparatus In this non-limiting example, various example embodiments of the apparatus, system, microfluidic cartridge, kit, method, and computer program product, particularly the method and computer program production. Various aspects using the
図28から図40を参照すると、装置800は、制御ソフトウェアの形態としてコンピュータ・プログラム生産物を含む、又はこれと共に構成することができる。このソフトウェアは、分析に用いられておらず、装置800を差し込んでユーザの入力を待つことができるときに、「レディ・モード」(READY MODE)(例えば、スタンバイ・モード)を装置に設けることができる。操作者は、ハンドル805を用いて蓋804を滑らせてその最大開放位置まで開くことができる。ソフトウェア及び装置800は、表示出力802上に、蓋804が開いており、装置800の準備ができていることを示すように構成することができる。ソフトウェア及び装置800は、ハードウェア及び/又はソフトウェア自己検査を実行するように構成するとよい。ソフトウェア及び装置800は、例えば、タッチ・スクリーン・インターフェースを用いることによって(例えば、表示出力802上の数字キーボードのキーに触れることによって)、バーコード・リーダ806によって、IDバッジ上に見られるような、ユーザを表すバーコードを走査入力すること等により、ユーザにログインさせるために、ユーザID及びパスワード画面の入力を要求するように構成するとよい。
Referring to FIGS. 28-40, the
次いで、ユーザは微小流体カートリッジ812及びサンプル・コンテナ814を封止パウチ824から取り出すことができる。ソフトウェア及び装置800は、いずれの検査を実行する前にも、図32及び図33におけるように、バーコード・リーダ806を用いて、微小流体カートリッジ812上のバーコード813及び/又はサンプル・コンテナ814上のバーコード815を走査入力することを要求するように構成するとよい。ソフトウェア及び装置800は、核酸検査を実行する前に、バーコードに基づいて、適格性検査を実行するように構成するとよい(例えば、微小流体カートリッジ812及びサンプル・コンテナ814が同じ封止パウチ824に入っていたか否か、キット810の有効期限が過ぎていないか、キット810を、ソフトウェア及び装置800等が行う特定の分析シーケンスと共に用いるように構成することができるか否か等を判定するため)。次に、表示出力802は、患者識別子のような、入力を要求する画面に進むことができる。また、装置800は、バーコード・リーダ806を用いて、バーコード(例えば、患者に割り当てられて医療IDブレスレット上にある)を走査することによって、患者情報を入力させてもよい。表示出力802は、例えば、既に実施した検査の結果、実施する検査についての選択肢等に関する情報を、ユーザに提供することができる。提供するとよい情報の例には、限定ではないが、検査判定(例えば、陽性/陰性結果)、内部制御結果(例えば、陽性及び/又は陰性)、及び/又は患者の結果(patient results)を含む。この実施例では、ユーザを促して、装置800に、検査データを用いて、データを記録しプリンタ、記憶装置、又はコンピュータ等に出力するというような、追加のタスクを実行させるようにしてもよい。
The user can then remove the
ソフトウェア及び装置800の種々の実施形態は、ユーザに1つ以上の任意の機能を実行させるように構成することができる(例えば、装置800又はソフトウェアに対する調節)。任意の機能には、限定ではないが、ユーザ設定値の修正、ログアウト設定値の修正、システム・クロックの設定、表示設定値の修正、QC要件の修正、報告の好みの設定、取り付けたプリンタの環境設定、ネットワーク接続の環境設定、ネットワーク接続を通じたデータ送出、データ分析プロトコルの選択又は適応化等が含まれる。
Various embodiments of software and
種々の実施形態では、ソフトウェアは、ユーザ・インターフェース及びデバイス・ファームウェアを含むことができる。ユーザ・インターフェース・ソフトウェアは、ユーザとの相互作用の側面に対処することができ、限定ではないが、患者/サンプル情報の入力、検査進展の監視、エラー警告、検査結果の印刷、結果のデータベースへのアップロード、ソフトウェアの更新等が含まれる。デバイス・ファームウェアは、分析検査中装置800を動作させることができ、検査とは関係ない包括部分と、実行する検査に特定的な部分を有することができる。検査特定部分(「プロトコル」)は、検査を遂行するために、微小流体動作及びその順序を指定することができる。図41Aは、リアル・タイム熱センサ・データを表示するインターフェースの一例から取り込んだ画面を示す。図41Bは、リアル・タイムの光学検出器のデータを表示するインターフェースの一例から取り込んだ画面を示す。
In various embodiments, the software can include a user interface and device firmware. User interface software can address aspects of user interaction, including but not limited to entering patient / sample information, monitoring test progress, error alerts, printing test results, and to a results database Uploads, software updates, etc. The device firmware can operate the
実施例3:ポリヌクレオチド処理装置
この非限定的な実施例では、特許請求する装置、システム、微小流体カートリッジ、キット、方法、及びコンピュータ・プログラム生産物の種々の実施形態例について説明する。一実施形態では、図28に示す装置800は、病原菌(例えば、出産前の女性におけるグループBストレプトコッカス(GBS))の迅速かつ正確な診断のための微小流体技術に基づく自己充足型、リアル・タイムPCRデバイスとすることができる。実施形態の一例では、微小流体カートリッジ812(図31)を設置することができる場合、装置800はカートリッジ上の動作を作動させること、PCR増幅の生成物を検出及び分析すること、及び/又は結果をグラフィカル・ユーザ・インターフェースに表示することができる。微小流体カートリッジ812は、複数の室及び/又はサブユニットを含み、ユーザによる介入を抑えて又は介入なしに、種々のタスクを実行することができる。図42は、微小流体カートリッジ812の一例における種々の室及び/又はサブユニットの模式図である。微小流体カートリッジ812は、サンプル入口826を通じて未処理の臨床サンプル(例えば、GBSの場合輸送緩衝液(transport buffer)内に浸漬した膣/直腸スワブ)を受け入れることができる。サンプル入口826は、ルアー型注入ポートとするとよい。ヒト及びバクテリアの細胞及びごみを含有する臨床スワブ・サンプルは、定期的に2mlの輸送緩衝液の中に収集することができる。しかしながら、微小流体デバイス上では、小さい体積(例えば、数マイクロリットル程度)であると、容易に処理することができる。マクロ及びミクロ動作間にインターフェースを組み込むことにより、微小流体技術の臨床診断に適応させることが可能になる。サンプルを注入するとき、カートリッジを装置800内に配すればよく、更に別の動作、例えば、サンプルの準備、試薬の計測/混合、及びPCR増幅/検出は、自動的に手を使わずに行うことができる。
Example 3: Polynucleotide Processing Apparatus This non-limiting example describes various example embodiments of the claimed apparatus, system, microfluidic cartridge, kit, method, and computer program product. In one embodiment, the
図43は、微小流体カートリッジ812の一例において実行することができるPCR及び検出に関係するステップの模式図である。種々の実施形態では、PCRに基づく病原菌(例えば、膣/直腸スワブからのGBS)の検出及び診断のためにサンプルを処理するステップは、DNAを放出するための溶解(例えば、ポリヌクレオチドを放出するためのGBSの溶解)、DNAの捕獲及び濃縮、並びにPCR互換性のためにDNAを浄化するためのインヒビタ及びコンペティタ(competitor)の最小化を含むとよい。臨床サンプルの中にインヒビタがあると、サンプルの浄化によってそれらの影響を軽減することができなければ、PCRに基づく診断検査に対して誤った陰性結果を生ずる危険性が高まる可能性がある。
FIG. 43 is a schematic diagram of the steps involved in PCR and detection that can be performed in an example of a
細胞の溶解は、当技術分野では周知の方法、例えば、熱及び/又は化学的活性化によって行うことができる。実施形態によっては、1.0+/−0.2mLのサンプルをサンプル入口826を通じてリーシス・リザーバ830に注入することができた後に、装置800は、サンプルを湿性試薬貯蔵部838からの溶解試薬と混合させ、リーシス・リザーバ830において加熱させることができる(例えば、7分間)。このプロトコルを用いると、90%よりも高い溶解効率が、GBS及びその他のバクテリア細胞に達成されている。また、溶解試薬は、カチオニック・ポリアミド改質ポリヌクレオチド−ポリスチレン・ラテックス・ビーズ系DNA親和性マトリクス(例えば、保持部材821)も組み込み、溶解プロセスの間に放出されることもある、負に荷電されたDNAを捕獲することもできる。親和性ビーズは、非常に高い親和性で、負に荷電されたDNAに結合することができ、一方潜在的なPCRインヒビタは、結合できなくなるか、又は後続の洗浄ステップの間に除去することができる。
Cell lysis can be accomplished by methods well known in the art, for example, heat and / or chemical activation. In some embodiments, after the 1.0 +/− 0.2 mL sample can be injected into the
実施形態の一例では、装置800は、「PCR対応」DNAを発生するために、生のサンプル・ライセート(例えば、GBSサンプル・ライセート)からのDNAの捕獲及び洗浄を自動化することもできる。リーシス・リザーバ830の内容物(例えば、1.0+/−0.2mLのサンプル及び試薬)をDNA処理室840に転送することができる。入力サンプルからのDNAが結合した親和性ビーズを、直列ビーズ・コラム(in-line bead column)(例えば、特定の孔の大きさを有するフィルタ)を用いて取り込むことができ、カートリッジ上のポンプを用いて親和性ビーズを洗浄し、緩衝液の交換を行うことにより、特定的に結合されていない半分(moiety)及び溶解可能なインヒビタを除去することができる。結合したDNAは、既知の方法で、例えば、親和性ビーズを加熱する(例えば80℃まで)ことにより、及び/又は放出緩衝液を用いることによって、放出することができる。この単一ステップの放出で、非常に小さい体積(3〜4μl)において無傷のDNAを復元することができ、これによって、元の目標DNAのかなりの濃縮を達成することができる。当技術分野では既知のその他の方法も、細胞溶解並びにDNA捕獲、洗浄、及び放出を遂行するために、本システムによって用いることができる。
In one example embodiment, the
ここに記載している実施例では、用いられるリアル・タイムPCR分析の基礎は、TaqMan(商標)分析であり、図44に模式的に動作を示す。しかしながら、当技術分野には既知の別の分析技法を用いてもよい(例えば、SYBR−緑I蛍光)。TaqMan(商標)PCR反応は、ある種のDNAポリメラーゼの5’ヌクアレーゼ活動(nuclease activity)を利用して、PCRの間にTaqMan(商標)プローブを割る。TaqMan(商標)プローブは、当該プローブの5’−端部にリポータ染料を、そして当該プローブの3’−端部に消光染料を含有する。反応の間、プローブの劈開(cleavage)がリポータ染料及び消光染料を分離することができ、その結果リポータの蛍光を増大させることができる。PCR生成物の蓄積は、リポータ染料の蛍光の増加を監視することによって、直接検出することができる。プローブが無傷の場合、レポータ染料が消光染料に近接すると、リポータが抑制される結果が得られる(蛍光放出は、フェルスタ型エネルギ転移によって生ずることができる)。PCRの間、対象のターゲットが存在することができれば、プローブは順及び逆プライマ部位(forward and reverse primer site)間でアニールすることができる。プローブがターゲットに混成する場合、DNAポリメラーゼは、通例、プローブをリポータと消光剤との間で裂くことができる。次いで、プローブの断片をターゲットから変位させることができ、ストランド(strand)のポリマ化は継続することができる。プローブの3’−端部を遮断して、PCRの間プローブの拡張を防止することができる。 In the example described here, the basis of the real-time PCR analysis used is TaqMan ™ analysis, which is schematically shown in FIG. However, other analytical techniques known in the art may be used (eg, SYBR-Green I fluorescence). The TaqMan ™ PCR reaction takes advantage of the 5 'nuclease activity of certain DNA polymerases to break the TaqMan ™ probe during PCR. The TaqMan ™ probe contains a reporter dye at the 5'-end of the probe and a quencher dye at the 3'-end of the probe. During the reaction, the cleavage of the probe can separate the reporter dye and quencher dye, thereby increasing the reporter fluorescence. The accumulation of PCR product can be detected directly by monitoring the increase in reporter dye fluorescence. When the probe is intact, the reporter dye is in close proximity to the quenching dye, resulting in suppression of the reporter (fluorescence emission can be caused by Förster energy transfer). During PCR, if the target of interest can be present, the probe can anneal between the forward and reverse primer sites. When the probe is hybridized to the target, the DNA polymerase can typically cleave the probe between the reporter and the quencher. The probe fragment can then be displaced from the target and strand polymerization can continue. The 3'-end of the probe can be blocked to prevent probe expansion during PCR.
このプロセスは、通例、例えば熱サイクル毎に行うことができ、生成物の指数的蓄積と干渉してはならない。蛍光信号の増大は、通例、ターゲット・シーケンスがプローブに対して相補的になることができ、PCRの間増幅することができれば、検出することができる。TaqMan(商標)分析は、2倍の厳格さを提供することができ(プライマは通例結合し、プローブは通例ターゲット・シーケンスに結合する)、したがって、いずれの非特定的な増幅の検出も低減又は解消することができる。 This process can typically be performed, for example, every thermal cycle and should not interfere with the exponential accumulation of product. An increase in fluorescence signal can typically be detected if the target sequence can be complementary to the probe and can be amplified during PCR. TaqMan ™ analysis can provide twice the stringency (primers typically bind and probes typically bind to the target sequence), thus reducing the detection of any non-specific amplification or Can be resolved.
GBS(ストレプトコッカス・アガラクティエ)に合わせたリアル・タイムPCRプライマ及びプローブのセットを、臨床サンプルを用いて設計し検査した。PCR試薬は、CAMP係数(CAMP factor)をエンコードする位置328及び451の間にあるcfb遺伝子の部分に特定的な1対の混成プリマを含むことができる(Christie, Atkins and Munch-Petersen、例えば、Boll Ist Sieroter Milan, (1955 Jul.-Aug.); 34(7-8):441-52を参照のこと)。CAMP係数は、拡散可能な細胞外蛋白質であり、GBSの大多数によって生成される。CAMP係数をエンコードする遺伝子、即ち、cfb遺伝子(GenBankアクセス番号:X72754)は、GBS分離株(isolate)に存在する可能性があり、GBSのPCRに基づく識別の発現(development)に用いられている(Danbing K., et al.,(2000), Clinical Chemistry, 46, 324-331)。更に、一例では、蛍光測定を用いることによってプライマ間で増幅されたシーケンスを認識し、リアル・タイムの検出を可能にするために、特定的なTaqMan(商標)型蛍光プローブも設計及び検査されている。 A set of real-time PCR primers and probes tailored to GBS (Streptococcus agalactier) was designed and tested with clinical samples. The PCR reagent can include a pair of hybrid primers specific for the portion of the cfb gene between positions 328 and 451 that encodes the CAMP factor (Christie, Atkins and Munch-Petersen, for example, Boll Ist Sieroter Milan, (1955 Jul.-Aug.); 34 (7-8): 441-52). The CAMP coefficient is a diffusible extracellular protein and is produced by the majority of GBS. The gene encoding the CAMP coefficient, ie, the cfb gene (GenBank accession number: X72754) may be present in GBS isolates and is used for the development of identification based on PCR of GBS. (Danbing K., et al., (2000), Clinical Chemistry, 46, 324-331). In addition, in one example, a specific TaqMan ™ type fluorescent probe has also been designed and tested to recognize sequences amplified between primers by using fluorescence measurements and to allow real-time detection. Yes.
DNA浄化プロセスを評価し、実行時における本プリマの性能を監視するために、陽性内部対照プラスミド(positive internal control plasmid)(例えば、図45に示す)を採用することができる。種々の実施形態では、以下のように内部対照プラスミドを組み立てるために特定のGBSプライマを採用した。特定のPCRプライマによって包囲した1片のランダムDNAシーケンスを、オリゴヌクレオチド合成によって発生した。このシーケンスと他のDNAシーケンス、特に、Genbankにおいて入手可能なStrep. agalactiae DNA(ストレプ.アガラクティエDNA)との間におけるいずれの可能な相同も慎重にチェックした。このシーケンスから発生するアンプリコンを認識するように蛍光原TaqMan(商標)型プローブを設計し、GBSターゲット・シーケンスDNA(FAM又は類似品)に用いたものとは異なる蛍光体(Cal Orange 560又は類似品)を、同時二重色蛍光検出に用いた。ある種の実施形態では、GBS特定増幅に重大な悪影響を及ぼすことなく内部対照生成物の増幅を可能にするために、PCR反応に含まれる内部対照プラスミドの量を最適化した。実施例によっては、以前に指定した相互反応性検査リストに含まれる病原体及びGBS DNAから純化したDNAを用いて、内部対照に対するプローブの特定性も検査し、PCRによって最適化した。 A positive internal control plasmid (eg, as shown in FIG. 45) can be employed to evaluate the DNA purification process and monitor the performance of the primer at run time. In various embodiments, specific GBS primers were employed to assemble the internal control plasmid as follows. A piece of random DNA sequence surrounded by specific PCR primers was generated by oligonucleotide synthesis. Any possible homology between this sequence and other DNA sequences, particularly Strep. Agalactiae DNA available at Genbank, was carefully checked. A fluorogen TaqMan (TM) type probe designed to recognize amplicons generated from this sequence, and a different phosphor (Cal Orange 560 or similar) from that used for GBS target sequence DNA (FAM or similar) Were used for simultaneous dual color fluorescence detection. In certain embodiments, the amount of internal control plasmid included in the PCR reaction was optimized to allow amplification of the internal control product without significant adverse effects on GBS specific amplification. In some examples, the specificity of the probe relative to the internal control was also tested using DNA purified from pathogens and GBS DNA included in the previously specified interaction test list and optimized by PCR.
実施形態の一例では、微小流体体積を用いて迅速な熱サイクルを実行するロバストなシステムを設計し、開発し、微小流体形式で実現した。収容することができる微小流体体積は、約0.01μlから約10μlまでの範囲を取り、下限に対する主な制限は、検出感度である。体積の例は、0.5〜4.5μlの範囲である。更に別の体積例は、2μlである。図41A及び図41Bは、装置800の出力例(例えば、接触感応LCD846上において見られる)の画面撮影を示す。図41Aは、迅速熱サイクルを受けている微小流体PCRモジュールを示し、図41Bは、リアル・タイムPCR分析を示す。このデータは、装置800のユーザに入手可能にすることができ、あるいは隠すこともできる。この場合、GBSカートリッジも、2つのPCR室を収容するように設計されており、基板上の陰性対照を組み込み、結果の忠実度を改善するために、サンプルを流出させることを考慮している。実施例によっては、化学薬品を最適化し、互換性のある検出システムを開発して、二色多重PCRを可能にすることによって、サンプル準備の効率及び関連する計装の適正な性能をチェックするための内部陽性対照の使用を容易にした。熱質量が非常に小さく、効率的なフィードバック制御に基づくアルゴリズムのために、超高速熱サイクルを実行し、典型的な50サイクルPCRを約20分で完了できるようにすることを可能にすることができる。熱サイクルに必要な熱は、ヒータ/センサ・モジュール842によって供給することができ、リアル・タイム多重化検出は、光学モジュール(例えば、蛍光検出モジュール844)によって実行することができる。
In one example embodiment, a robust system that performs rapid thermal cycling using a microfluidic volume was designed and developed and implemented in a microfluidic format. The microfluidic volume that can be accommodated ranges from about 0.01 μl to about 10 μl, with the main limitation on the lower limit being detection sensitivity. Examples of volumes are in the range of 0.5-4.5 μl. Yet another example volume is 2 μl. 41A and 41B show screen shots of an example output of device 800 (eg, as seen on touch sensitive LCD 846). FIG. 41A shows a microfluidic PCR module undergoing rapid thermal cycling, and FIG. 41B shows real-time PCR analysis. This data can be made available to the user of
種々の実施形態では、PCRを実行するために、いずれの数(例えば、0、1、2、又は全て)の試薬でも、凍結乾燥形式でカートリッジ上に組み込むことができる。使用時に、凍結乾燥PCR試薬を、例えば、脱イオン化水を用いて復元することができる。脱イオン化水は、ブリスタ形式で(例えば、自己穿孔可能リザーバ828に)微小流体カートリッジ812上に貯蔵することもできる。復元したPCR試薬は、例えば、2部分に分別することができる。種々の実施形態では、PCR対応DNA(サンプル準備モジュールの出力)を1つの標本に混合し、リアル・タイムPCR(サンプルPCR)のために第1PCRチャネルに送ることができる。非ターゲットDNAを含有するDI水を、PCR試薬の第2標本と混合することができ、陰性対照としての機能を果たすために、別のPCR室(陰性PCR)に送ることができる。
In various embodiments, any number (eg, 0, 1, 2, or all) of reagents can be incorporated on a cartridge in a lyophilized format to perform PCR. In use, the lyophilized PCR reagent can be reconstituted with, for example, deionized water. Deionized water can also be stored on the
実施例4:ポリヌクレオチド処理装置
種々の実施形態において、微小流体システム(例えば、微小流体カートリッジ812)は、液体液滴を移動/混合するための微小ポンプ、熱始動生物化学反応を行うための微小リアクタ、及び液体圧送動作の制御を可能とし、更に熱サイクルの間PCR室のようなカートリッジの領域を分離するための微小弁又は微小ゲートというような構成要素を含むことができる。
Example 4: Polynucleotide Processing Apparatus In various embodiments, a microfluidic system (eg, microfluidic cartridge 812) includes a micropump for moving / mixing liquid droplets, a micropump for performing a heat-started biochemical reaction. Reactors and components such as microvalves or microgates can be included to allow control of the liquid pumping operation and to isolate regions of the cartridge such as the PCR chamber during thermal cycling.
実施形態によっては、液体落滴(liquid drop)取扱システムを用いて、熱的に作動させるポンプ(例えば、熱−空気圧送)に基づく液体サンプルの注入及び運動を生成することができる。熱的に作動させるポンプは、機械的弁を用いずに、電子的に動作させてもよい。例えば、主要チャネルに接続することができる室の内側に取り込んだ空気を加熱することにより、熱−空気圧送のために大きな空気圧力を発生することができる。空気の温度を上昇させると、室内部の圧力を上昇させて、液滴を放出し(標本を測定する)、それを所望の場所まで移動させるのに十分に高い圧力までにすることができる。この技法は、カートリッジ上作動メカニズムとして実装することができ、例えば、成型室、チャネル、及びヒータを用いるとよい。通例、これは機械的移動部品を回避することができ、製作を容易にすることができる。図46は、前述の液滴取扱システムを用いて2つの流体(「A」−青、及び「B」−オレンジ色)の混合を示す実証の写真を示す。圧力ポンプP1及びP2を正確に制御して起動することができ、チャネルMに沿って交互回転離散液滴として、液体を移動させることができ、チャネルMにおいてこれらは混合し、最終的に室Cの中に入れることができ、ここでPCRを実施することができる。 In some embodiments, a liquid drop handling system can be used to generate liquid sample injection and motion based on a thermally activated pump (eg, thermo-pneumatic delivery). Thermally actuated pumps may be operated electronically without the use of mechanical valves. For example, a large air pressure can be generated for thermo-pneumatic delivery by heating air taken inside a chamber that can be connected to the main channel. Increasing the temperature of the air can increase the pressure inside the chamber to release droplets (measuring the specimen) and to a pressure high enough to move it to the desired location. This technique can be implemented as an on-cartridge actuation mechanism, such as using a molding chamber, channel, and heater. Typically, this can avoid mechanical moving parts and can facilitate fabrication. FIG. 46 shows a demonstration photograph showing mixing of two fluids (“A” -blue and “B” -orange) using the droplet handling system described above. The pressure pumps P1 and P2 can be precisely controlled and activated, and the liquid can be moved as alternating rotating discrete droplets along channel M, where they mix and eventually chamber C Where PCR can be performed.
実施形態によっては、気体、容易に気化可能な液体(例えば、1気圧では25℃及び100℃の間で気化可能)のような熱膨張材料、及び/又は熱膨張ポリマ(例えば、エクスパンセル(Expancel))を熱作動ポンプ(例えば、熱空気式空気室)に導入することもでき、5psiよりも大きな差圧を圧制するためのポンプ・サイズを最小に抑えることができる。これらの材料は、閾値温度に達することができるときには、例えば、100%以上に膨張することができ、部分的又は完全に熱空気室を充填し、更に空気の圧縮を生じさせる。 In some embodiments, a thermally expandable material such as a gas, a readily vaporizable liquid (eg, vaporizable between 25 ° C. and 100 ° C. at 1 atmosphere), and / or a thermally expanded polymer (eg, Expancel)) can be introduced into a thermally actuated pump (e.g., a hot air chamber), and the pump size to control differential pressures greater than 5 psi can be minimized. These materials can expand to, for example, 100% or more when they can reach a threshold temperature, partially or completely filling the hot air chamber and causing further air compression.
例えば、図47A及び図47Bは、相遷移材料(PTM)510(パラフィン・ワックス、はんだ、エクスパンセル等のような、融点が分かっているPTM(例えば、60℃/75℃/90℃))に基づく熱作動ポンプ500を、閉鎖(図47A)及び開放(図47B)構成にした場合を示す。PTM510は、特定の場所に制約することができる。この特定の場所は、PTM510(通例、約50〜100μl)を積層体上に配した封止室512とすることができる。ポンプを120℃よりも高い温度に加熱すると、PTM510は非可逆的に膨張し(その本来のサイズの40倍まで)、室512内部の空気を圧縮し、空気を室から変位させ、隣接するゲート514を開放させる。図47C及び図47Dは、ゲート515を動作させるために作動させることができるポンプ501の別の例を、室513内にあるエクスパンセル・ポリマ511と共に示す。
For example, FIGS. 47A and 47B show a phase transition material (PTM) 510 (PTM with a known melting point, such as paraffin wax, solder, expander, etc. (eg, 60 ° C./75° C./90° C.)) The heat-actuated
微小流体カートリッジ812に入力する臨床サンプルの一例は、約1ミリリットルの体積を有することができる。細胞の酵素/熱溶解の後、放出されたDNAを親和性マイクロビーズに結合することができる。これらのマイクロビームのサイズは、例えば、10ミクロン程度とすることができる。種々の実施形態では、全量が数百万個の範囲のビーズを、DNA濃縮のために、微小流体カートリッジ812毎に用いることができる。場合によっては、数分(例えば、3分)の内に数平方ミリメートル(孔サイズは8ミクロン)の直列フィルタ区域に対抗してビーズを濃縮するために、10psi(例えば、10psi,11psi、又は15psi)の最小圧力を用いてもよい。この圧力は、例えば、余分な空気(例えば、1〜3mL)を微小流体カートリッジ812のバルク・リーシス・室に注入することによって発生することができる。実施形態によっては、一方向ダックビル弁を、ルアー入口に用いると、空気圧力が入口を通って逃げるのを最小に抑えるか又は防止することができる。
An example of a clinical sample that enters the
計器の使用中に計器のスライダによって試薬ブリスタ・ドームを押下することによって、サンプルの準備及びPCR反応に用いることができる試薬を、微小流体ネットワーク内に圧送することができる。 By pressing the reagent blister dome with the instrument slider while the instrument is in use, reagents that can be used for sample preparation and PCR reactions can be pumped into the microfluidic network.
実施形態例では、細胞溶解、DNA捕獲、及びリアル・タイムPCRを実行するために通例用いられる酵素をペレットの中に凍結乾燥させ、カートリッジの異なる場所に貯蔵することができる。ペレットを微小流体カートリッジ812の中、例えば、窒素浄化室又は熱ゲートによって微小チャネルのいずれかの端部で封止したチャネル構造に格納することによって、空気の接触を最小に抑えることができる。サンプルの準備、試薬水和、及びPCRに通例用いられる干渉液は、密閉封止した試薬ブリスタ(例えば、自己穿孔可能なリザーバ828)に貯蔵することができる。試薬ブリスタを作るために用いられる材料は、高い水分蒸気障壁を有することができ、1年に及ぶカートリッジの保管の間に液体の逸失を最小に抑えることができる。燐送サンプル及び種々の洗浄緩衝液から生ずる廃棄物は、カートリッジ基板上の室及び微小チャネル(通例、漏れを防止することができる廃棄物リザーバ832)に貯蔵することができる。
In an example embodiment, enzymes commonly used to perform cell lysis, DNA capture, and real time PCR can be lyophilized into pellets and stored in different locations on the cartridge. By storing the pellet in a
実施例5:リアル・タイムPCRの態様
高精度のリアル・タイムPCRに基づく病原体(例えば、出産前の女性におけるグループBストレプトコッカス(GBS)定着)の診断に用いることができる複数のステップを、図48に示すような、単体の微小流体技術に基づく使い捨てカートリッジに統合した。このようなカートリッジにおいて「サンプル入力;結果出力」型動作で実行することができるステップの例には、一括溶解(bulk lysis)、DNA捕獲、洗浄、及び放出、並びにPCR準備及び実行が含まれる。このカートリッジの種々の実施形態では、サンプル及び試薬は、微小流体カートリッジ812(図31に示すような)自体に収容することができ、通例、例えば、サンプルをデバイスに注入する行為の間を除いて、手作業での動作との相互作用は不要である。処理の間に形成され取り込まれた空気を除去するために、最大限の効果が得られるように位置付けた疎水ベントを含ませることができ、分析に通例用いられる試薬は、カートリッジ内に凍結乾燥ビーズとして収めることができる。復元に必要な液体は、使用時に放出(release)するブリスタ・パウチに貯蔵することができる。
Example 5: Real-Time PCR Aspects The multiple steps that can be used to diagnose pathogens based on high-precision real-time PCR (eg, Group B Streptococcus (GBS) colonization in prenatal women) are shown in FIG. And integrated into a disposable cartridge based on a single microfluidic technology. Examples of steps that can be performed in such a cartridge in a “sample input; result output” type operation include bulk lysis, DNA capture, washing, and release, and PCR preparation and execution. In various embodiments of this cartridge, the sample and reagent can be contained in the microfluidic cartridge 812 (as shown in FIG. 31) itself, typically except during, for example, the act of injecting the sample into the device. No interaction with manual operation is required. Hydrophobic vents positioned for maximum effectiveness can be included to remove air that is formed and entrained during processing, and reagents commonly used for analysis are lyophilized beads in the cartridge. Can be stored as The liquid needed for reconstitution can be stored in a blister pouch that is released during use.
種々の実施形態では、シリンジを収容するためのルアー取付具を有することができるサンプル入口826を通って、サンプル(例えば、GBSサンプル)を導入することができる。サンプルからの生不純物の少なくとも一部を除去するために、プレフィルタ(例えば、シリンジに取り付ける)を用いることができ、実施形態によっては、加熱及び/又は溶解酵素を用いて、サンプル(例えば、1mL)を溶解室において溶解することができる。妨害蛋白質物及び競合RNA分子を除去するために、プロナーゼ、プロティナーゼK、及びRNAaseAのような酵素を(例えば、溶解ステップの間に)用いることができる。図49を参照すると、DNA捕獲ビーズも、マスタ・ミックス(master mix)に含めることができる。溶解液体サンプル(例えば、親和性ビーズに結合したBGS及び/又はその他のDNAを含有する)を、溶解室の出口から微小流体カートリッジに逆流させることができる。実施例によっては、望ましくないごみや過剰な液体を廃棄物室に送ることができる間、DNAを捕獲した親和性ビーズを直列フィルタによって保持することができる。このような実施形態では、用いるビーズは、非磁性体でも磁性体でもよく、フィルタは、粒子をサイズで判別するように選択する。別の実施形態では、ビーズは磁性体であり、磁力線を問題の場所に集中させるように構成した磁場を加えることによって、室又はチャネルのような、微小流体カートリッジの特定の場所に集中させる。用いる磁石は、サンプル分析の間の指定した時点にオン及びオフに切り換えるようにプロセッサによって制御するような、電磁石とするとよい。あるいは、磁石は、必要なときに適所に出入りさせるような、永久磁石としてもよい。
In various embodiments, a sample (eg, a GBS sample) can be introduced through a
実施形態によっては、廃棄物室にシメティコン(simeticone)のような発泡防止剤を装備する。液体は高速で廃棄物室に入り、廃棄物室内にある空気と混合すると発泡するので、廃棄物室では激しい気泡形成が生ずる可能性がある。泡が廃棄物室から溢れ出すと望ましくない。発泡防止剤があれば、この現象を軽減することができる。発泡防止剤は、パウダ、タブレット、ペレット、又は粒子形態で存在することができる。 In some embodiments, the waste chamber is equipped with an anti-foaming agent such as a simaticone. Since the liquid enters the waste chamber at high speed and foams when mixed with the air in the waste chamber, severe bubble formation can occur in the waste chamber. It is undesirable if bubbles overflow from the waste chamber. If there is an antifoaming agent, this phenomenon can be reduced. Antifoaming agents can be present in powder, tablet, pellet, or particle form.
実施形態によっては、ビーズを洗浄して、非結合及び非特定的結合物を除去することができ、浄化したDNAを小容積(〜3μl)の区分室内に放出し、濃縮する(例えば、約300倍に)ことができる。種々の実施形態では、濃縮したDNAは、次に、しかるべきPCR試薬と混合すること、及び/又はリアル・タイムPCRのためにPCRチャネルに送ることができる。内部対照プラスミド(その同系プローブと共に)も、第1PCRチャネルに含めてもよく、陽性対照として作用することができる。第2PCRチャネル(存在する場合)では、非ターゲットDNAを含有するDI水及び内部対照を、PCR試薬と共に混合し、陰性対照として作用することができる。 In some embodiments, the beads can be washed to remove unbound and unspecific binders, and the purified DNA is released into a small volume (˜3 μl) compartment and concentrated (eg, about 300 Can be doubled). In various embodiments, the concentrated DNA can then be mixed with the appropriate PCR reagents and / or sent to the PCR channel for real time PCR. An internal control plasmid (with its cognate probe) may also be included in the first PCR channel and can serve as a positive control. In the second PCR channel (if present), DI water containing non-target DNA and an internal control can be mixed with the PCR reagent to serve as a negative control.
ユーザは、サンプルを、一括溶解サンプルで、ルアー・ダックビル弁(例えば、サンプル入口826)を通じて導入し、軽く振ってリーシス試薬ペレットを溶解し、余分な量の空気(例えば、0.25〜0.75ml)を溶解室に導入し、溶解室を過剰に加圧する。次の式のように、室容積Vchamberを有する溶解室内に発生する絶対圧力(P)は、注入する液体サンプルの量Vsample、及び注入する余分な空気の量VextraAairと関係がある。
P=Patm(Vchamber - Vsample)/(Vchamber+ Vsample + VextraAair)
The user introduces the sample as a batch lysed sample through a luer duckbill valve (eg, sample inlet 826) and gently shakes to lyse the lysis reagent pellet, and an excess amount of air (eg, 0.25-0. 75 ml) is introduced into the dissolution chamber and the dissolution chamber is over-pressurized. As shown in the following equation, the absolute pressure (P) generated in the dissolution chamber having the chamber volume V chamber is related to the amount of liquid sample to be injected V sample and the amount of extra air to be injected V extraAair .
P = P atm (V chamber -V sample ) / (V chamber + V sample + V extraAair )
次いで、微小流体カートリッジ812を装置800の中に入れて、スライダ・モジュール848を閉鎖することができる。閉鎖するとき、スライダ・モジュール848は試薬ブリスタ(例えば、自己穿孔可能リザーバ828)を押圧し、これらを破裂させて試薬(例えば、洗浄緩衝液、放出緩衝液、中和緩衝液、及び水)を、試薬を含むチャネルに放出させる。
The
種々の実施形態では、装置800は、以下のステップのいずれか又は全てを実行することができる。次に、図50A〜図50Jを参照すると、種々のエレメントは、図15A及び図15Bにおける同じ参照符号によって発見することができる。図50Aを参照すると、4つの試薬を保持するチャネルのいずれかの側にある弁(V3、V4、V5、V7、V12、V13、V15、V16、V23)を閉鎖し、一括溶解ランプを活性化して、一括溶解室を、例えば、60℃に7分間(例えば、フィードバックのために図50Bにおける温度センサLを用いて)加熱することができる。図50Bを参照すると、ゲートG1を開放して、所定の時間量(例えば、サンプルの種類に応じて2〜5分)の間液体(ライセート、DNA親和性ビーズに結合したDNA等を含有する)を、ビーズ捕獲フィルタを通じて、廃棄物室に排出することができる。DNAビーズは、直列フィルタで捕らえることができるが、他の液体は廃棄物室まで流れていく。ゲートG7を開放すると、溶解室内の過剰な液体及び/又は圧力を、廃棄物室に発散させることができる。弁V1及びV8を閉鎖すると、溶解室及び廃棄物室をそれぞれ閉塞することができる。
In various embodiments, the
図50Cを参照すると、実施例によっては、ポンプE1を用いて洗浄緩衝液をビーズ・コラムを通して圧送し、ゲートG2、G3、及びG9を開放して、洗浄緩衝剤を疎水ベントH2の下流側に移すことによって、捕らえたビーズを洗浄するとよい。洗浄緩衝チャネル(例えば、V2)、及び洗浄緩衝廃棄物(例えば、V9)を分離する弁を閉鎖することができる。 Referring to FIG. 50C, in some embodiments, pump E1 is used to pump wash buffer through the bead column, gates G2, G3, and G9 are opened, and wash buffer is placed downstream of hydrophobic vent H2. The captured beads may be washed by transferring. The valve that separates the wash buffer channel (eg, V2) and the wash buffer waste (eg, V9) can be closed.
図50Dを参照すると、ポンプE2を用いることによって放出緩衝液を圧送し、ゲートG6、G4、及びG8を開放してビーズ・コラムを充填し、放出緩衝液を空気ベントH1の下流に移すことができる。放出緩衝液チャネル(例えば、V6)及びビーズ・コラムの下流側のチャネル(例えば、V10)を閉塞する弁を閉鎖し、ビーズを例えば70Cに2分間加熱することができ、これによってDNA親和性ビーズからDNAを放出することができる。 Referring to FIG. 50D, pumping the release buffer by using pump E2, opening gates G6, G4, and G8 to fill the bead column and transferring the release buffer downstream of air vent H1. it can. The valve that closes the release buffer channel (eg, V6) and the channel downstream of the bead column (eg, V10) can be closed, and the beads can be heated to, eg, 70 C for 2 minutes, thereby allowing DNA affinity beads DNA can be released from
図50Eを参照すると、ポンプE3を用いて、放出したDNAを圧送し、ゲートG5及びG10を開放して、疎水ベントH4の下流側に移すことができる。このとき、弁V11及びV14を閉鎖することができる。図50Fを参照すると、ポンプE4を用いゲートG12、G11、及びG13を開放することによって、放出したDNAの一部(合流点G11及びa1の間)、及び中和緩衝液の一部(G11及びa2の間)を混合することができる。a1及びa2間における複合液体プラグ(plug)の混合は、中和混合チャネルを通ってそれを圧送し、疎水ベントH4の下流側に移した後に行うとよい。G11は、ゼロ・デッド・ボリューム・ゲート(zero-dead volume gate)とするとよく、2つの液体プラグの融合中気泡を取り込むことなく、2つの液体チャネルを互いに接近させる。中和サンプルの端部にある2つの弁(V21及びV22)を閉鎖することができ、ここで図50Gを参照すると、ポンプE5を用いてDI水を圧送し、ゲートG14、G15、及びG17を開放して、PCR−試薬ペレットを溶解する。この液体は、疎水ベントH12を用いて配置することができる。凍結乾燥PCR試薬ペレットの完全な溶解に十分な長い時間期間(例えば、約1分)の後、弁V17を閉鎖することができる。 Referring to FIG. 50E, the pumped E3 can be used to pump the released DNA, open the gates G5 and G10, and move them downstream of the hydrophobic vent H4. At this time, the valves V11 and V14 can be closed. Referring to FIG. 50F, by opening gates G12, G11, and G13 using pump E4, part of the released DNA (between confluences G11 and a1) and part of neutralization buffer (G11 and a2) can be mixed. Mixing of the composite liquid plug between a1 and a2 may take place after pumping it through the neutralization mixing channel and moving it downstream of the hydrophobic vent H4. G11 may be a zero-dead volume gate and brings the two liquid channels closer together without entraining bubbles during the fusion of the two liquid plugs. The two valves (V21 and V22) at the end of the neutralized sample can be closed, and referring now to FIG. 50G, DI water is pumped using pump E5 and gates G14, G15, and G17 are turned on. Open and dissolve the PCR-reagent pellet. This liquid can be placed using a hydrophobic vent H12. After a long period of time (eg, about 1 minute) sufficient for complete lysis of the lyophilized PCR reagent pellet, valve V17 can be closed.
図50Hを参照すると、ポンプE6を用い、ゲートG16を開放することにより、溶解した酵素を、酵素混合チャネルを通して圧送することができ、更に疎水ベントH5を用いて、流体の配置をし易くすることができる。種々の実施形態では、混合した酵素を、多数の反応のために、サンプルPCR混合部及び陰性PCR混合部に(例えば、等しい2部分に)分配することができ、そのときに弁V18、V20、及びV19を閉鎖すればよい。 Referring to FIG. 50H, by using pump E6 and opening gate G16, the dissolved enzyme can be pumped through the enzyme mixing channel, and the hydrophobic vent H5 can be used to facilitate fluid placement. Can do. In various embodiments, the mixed enzyme can be distributed (eg, into two equal parts) for the sample PCR mix and negative PCR mix for multiple reactions, at which time valves V18, V20, And V19 may be closed.
種々の実施形態では、図50Iを参照すると、ポンプE7を用いゲートG18、G20、及びG22を開放することによって、中和したDNAの一部(合流点G20及びb1の間)、及び酵素の一部(G20及びb2の間)を混合することができる。a1及びa2間における複合液体プラグの混合は、中和混合チャネルを通って圧送し、疎水弁H6の下流側に移すことができた後に、行うことができる。ポンプE8を用いゲートG19、G21、及びG23を開放することによって、DI水の一部(合流点G21及びc1の間)及び酵素の一部(G21及びc2の間)を混合することができる。複合液体プラグの混合は、中和混合チャネルを通って圧送し、疎水弁H7の下流側に移すことができた後に、c1及びc3間において行うことができる。 In various embodiments, referring to FIG. 50I, by using pump E7 to open gates G18, G20, and G22, a portion of the neutralized DNA (between confluences G20 and b1) and one of the enzymes. Part (between G20 and b2) can be mixed. Mixing of the composite liquid plug between a1 and a2 can occur after being pumped through the neutralization mixing channel and transferred downstream of the hydrophobic valve H6. By opening the gates G19, G21, and G23 using the pump E8, a part of DI water (between the confluences G21 and c1) and a part of the enzyme (between G21 and c2) can be mixed. The mixing of the composite liquid plug can be performed between c1 and c3 after being pumped through the neutralization mixing channel and transferred downstream of the hydrophobic valve H7.
図50Jを参照すると、弁V24、25、26、27は、実施例によっては、サンプルPCR及び陰性対照PCRを実行するために、閉鎖することができる。種々の実施形態では、スライダにおいて光学系を用いて光(例えば、蛍光)を検出することができる。実施例によっては、蛍光データに基づいて、ソフトウェアがサンプル内におけるターゲット(例えば、GBS)の存在を判定することができ、結果を報告することもできる。 Referring to FIG. 50J, the valves V24, 25, 26, 27 can be closed to perform sample PCR and negative control PCR in some examples. In various embodiments, light (eg, fluorescence) can be detected using an optical system in the slider. In some examples, based on fluorescence data, the software can determine the presence of a target (eg, GBS) in the sample and can report the results.
実施例6:ポリヌクレオチド処理装置
この非限定的な例は、前述の装置、システム、微小流体カートリッジ、キット、方法、及びコンピュータ・プログラム生産物の種々の実施形態例のCAD図を示し、更に説明する。
Example 6: Polynucleotide Processing Apparatus This non-limiting example shows and further illustrates CAD diagrams of various exemplary embodiments of the aforementioned apparatus, system, microfluidic cartridge, kit, method, and computer program product. To do.
図51は、レバー1210、ギア・ユニット1212、及び動力部材1214を有するレバー・アセンブリ1200の側面図を示す。アセンブリ1200は、装置の蓋を閉鎖するため、そして(動力部材1214によって)受容ベイ1217の中にある微小流体カートリッジ1216に力を加えるために用いることができる。この切欠図には1つの動力部材しか見えないが、いずれの数、例えば、4つでも用いることができる。動力部材は、例えば、図示のような手動ばね装荷アクチュエータ、自動機械式アクチュエータ、十分な機械的伸展性及び剛性を備えた材料(例えば、硬質エラストマ・プラグ)等とすることができる。微小流体カートリッジ1216に力を加えると、少なくとも約0.7psiから約7psi(約5及び約50キロパスカルの間)の圧力が、微小流体カートリッジ1216の表面に生ずる可能性がある。実施形態によっては、約2psi(約14キロパスカル)の場合もある。
FIG. 51 shows a side view of a
図52は、微小流体カートリッジ1216が受容ベイ1217に入っている、レバー・アセンブリ1200の側面図を示す。ヒート・ポンプ1219(例えば、図示のようなキセノン・バルブ)が、サンプル入口リザーバ1218に向けた放射熱源として機能することができ、この熱がリザーバ1218において細胞を溶解することができる。熱伝導性で、機械的な伸展性がある層1222を、微小流体カートリッジ1216と熱ステージ(thermal stage)1224との間の界面に配することができる。通例、微小流体カートリッジ1216及び熱ステージ1224は、それぞれの界面上において平面であり、例えば、約100ミクロン以内、あるいは更に典型的には約25ミクロン以内で平面とすることができる。層1222は、微小流体カートリッジ1216と熱ステージ1224との間における熱結合を改善することができる。光検出エレメント1220は、微小流体カートリッジ1216の上面に向けることができる。
FIG. 52 shows a side view of
図53は、受容ベイ1217の至近図を示す。
図54は、微小流体カートリッジ1216、熱伝導性、機械的伸展性層1222、及び熱ステージ1224間の界面の至近図を示す。
図55は、アセンブリ1200の上面図を示す。機械的部材1214に加えて、案内部材1226も用いることができる。
図56は、図55の至近図を示す。
FIG. 53 shows a close-up view of the receiving
FIG. 54 shows a close-up view of the interface between the
FIG. 55 shows a top view of
FIG. 56 shows a close-up view of FIG.
図57から図59は、作動時のレバー1210の一連の画像である。加えて、ギア・アセンブリ1212の中に、カム1228も示すことができ、これは動力部材1214に結合されているプレート1230に、レバー1210が力を加えることを可能にする。
図60及び図61は、自己穿孔可能リザーバ1228と、自己穿孔可能リザーバを作動させる機械的部材1230とを含む微小流体カートリッジ1216の図を示す。
57 to 59 are a series of images of the
60 and 61 show a view of a
図62及び図63は、光検出エレメント1220のエレメントを示し、光源1232(例えば、発光ダイオード)、レンズ1234、光検出器1236(例えば、フォトダイオード)、及びフィルタ1238を含む。フィルタは、例えば、バンドパス・フィルタ、1つ以上の蛍光原プローブの吸収帯に対応する光源におけるフィルタ、及び蛍光原プローブの発光帯に対応する検出器におけるフィルタとすることができる。
62 and 63 show the elements of the
実施例7:保持部材の準備
濃度が約1011mL−1のカルボキシル表面磁気ビーズ(改質セラ−マグ磁気カルボキシレート、部品番号#3008050250、Seradyn)を、pH6.1の500mMの2−(N−モルフォリニオ)−エタネスルフォン酸(MES:2-(N-Morpholinio)-ethanesulfonic acid)緩衝溶液において、N−ヒドロキシルサクシニミド(NHS:N-hydroxylsuccinimide)及び1−エチル−3−(3−ヂメチルアミノプロピル)カルボジイミド(EDAC)を用いて30分活性化した。活性化したビーズを、3,000Da又は300,000Da平均分子重量のポリ−L−リシン(PLL)によって培養した。未結合PLLを除去するための2回の洗浄の後、ビーズは使用する準備ができた。
Example 7: Preparation of Holding Member A carboxyl surface magnetic bead (modified Sera-mag magnetic carboxylate, part number # 3008050250, Seradyn) with a concentration of about 10 11 mL −1 was added to 500 mM 2- (N -Morpholinio) -Etanesulphonic acid (MES: 2- (N-Morpholinio) -ethanesulfonic acid) buffer solution with N-hydroxylsuccinimide (NHS) and 1-ethyl-3- (3-diene) Activation was performed with methylaminopropyl) carbodiimide (EDAC) for 30 minutes. Activated beads were cultured with 3,000 Da or 300,000 Da average molecular weight poly-L-lysine (PLL). After two washes to remove unbound PLL, the beads were ready for use.
実施例8:微小流体カートリッジ
図64及び図65を参照すると、ポリヌクレオチドのインヒビタからの分離を実証するために微小流体カートリッジ300を製作した。カートリッジ300は、第1及び第2基板部302’、304’を備えており、これらは、それぞれ、第1及び第2層302a’、302b’及び304a’、304b’を備えている。第1及び第2層302a’、302b’は、入口310’及び出口312’を備えているチャネル306’を規定する。第1及び第2層304a’、304b’は、入口314’及び出口316’を備えているチャネル308’を規定する。接着剤324’を用いて、第1及び第2基板部302’、304’を填め合わせて、出口312’が入口314’と連通し、それらの間にフィルタ318’を位置付けるようにする。出口312’の一部に、先に準備した活性化ビーズを充填にて、保持部材(ビーズ)を備えた処理領域320’を設ける。接着剤326’によって固着したピペット322’(図66)によって、サンプルを導入し易くした。
Example 8: Microfluidic Cartridge With reference to FIGS. 64 and 65, a
使用中、入口310’を通って導入したサンプルは、チャネルに沿って進み処理領域320’を通過した。過剰なサンプル材料は、チャネル308’に沿って通過し、出口316’を通ってデバイス300’から排出した。ポリヌクレオチドは、インヒビタと比較して、優先的にビーズによって保持された。一旦サンプルを導入したなら、追加の液体、例えば、洗浄液及び/又は保持したポリヌクレオチドを放出する際に用いる液体を、入口326’を通じて導入した。 In use, the sample introduced through inlet 310 'traveled along the channel and passed through processing region 320'. Excess sample material passed along channel 308 'and exited from device 300' through outlet 316 '. The polynucleotide was preferentially retained by the beads compared to the inhibitor. Once the sample was introduced, additional liquid was introduced through inlet 326 ', such as liquid used in discharging the wash and / or retained polynucleotide.
実施例9:DNAの保持
約1000個のビーズを含む約1μLの容積を有する処理領域を備えている各デバイスを準備することによって、デバイス300’のポリ−L−リシン改質ビーズによるポリヌクレオチドの保持を実証した。約15,000及び30,000Daの間のポリ−L−リシンでビーズを改質した。各処理領域に、ニシン精子DNA(濃度が約20mg/mLのサンプル役20uL)で充填することによって、ビーズ及び液体を接触させた。10分間液体及びビーズが接触した後、液体を各処理領域から除去し、定量的リアル・タイムPCRを実行して、液体内にあるニシン精子DNAの量を判定した。
Example 9: Retention of DNA Polynucleotides by poly-L-lysine modified beads of
2種類の制御を実施した。第1に、別の同一処理領域に、非改質ビーズ、即ち、活性化及びポリ−L−リシン培養ステップを除いてポリ−L−リシン・ビーズと同一のビーズを充填した。ニシン精子DNAを含む液体をこれらのビーズと接触させ、10分間定在させ、除去し、定量的リアル・タイムPCRにかけた。第2に、ニシン精子DNAを含む液体(「未処理の液体」)を定量的リアル・タイムPCRにかけた。 Two types of control were performed. First, another identical treatment area was filled with unmodified beads, ie, the same beads as poly-L-lysine beads except for the activation and poly-L-lysine culture steps. A liquid containing herring sperm DNA was contacted with these beads, allowed to settle for 10 minutes, removed, and subjected to quantitative real-time PCR. Second, a liquid containing herring sperm DNA (“untreated liquid”) was subjected to quantitative real-time PCR.
図66を参照すると、第1及び第2制御は、本質的に同一の応答を呈し、非改質ビーズと接触させた液体及び未処理の液体においてニシン精子DNAの存在を示した。3,000個のポリ−L−リシン・ビーズと接触した液体の方が低い応答を呈し、改質ビーズがニシン精子DNAの実質的に全てを保持していたことを示す。300,000Daのポリ−L−リシン・ビーズと接触した液体のPCR応答は、3,000Daのビーズよりも少なくとも約50%大きい増幅応答を呈し、分子重量が小さい程、表面を改質すると、ニシン精子DNAを保持する効率が高いことを示した。 Referring to FIG. 66, the first and second controls exhibited essentially the same response, indicating the presence of herring sperm DNA in the liquid contacted with unmodified beads and untreated liquid. The liquid in contact with 3,000 poly-L-lysine beads exhibited a lower response, indicating that the modified beads retained substantially all of the herring sperm DNA. The PCR response of the liquid in contact with the 300,000 Da poly-L-lysine beads exhibits an amplification response that is at least about 50% greater than the 3000 Da beads, and the smaller the molecular weight, the better the herring It was shown that the efficiency of retaining sperm DNA is high.
実施例10:ポリ−L−リシン改質ビーズからのDNAの放出
処理領域を有するデバイスに、3,000Daのポリ−L−リシン改質ビーズを充填した。グループBストレプトコッチ(GBS)から得たポリヌクレオチドを含む液体をビーズと接触させ、ニシン精子DNAについて上述したように、10分間培養した。この液体は、10μlの20mMトリスpH8、1mMのEDTA、1%トリトンX−100緩衝液において、10,000のGBSバクテリアを97℃の熱溶解に3分間かけることによって得た。
Example 10: Release of DNA from poly-L-lysine modified beads Devices with treated regions were filled with 3,000 Da poly-L-lysine modified beads. A liquid containing a polynucleotide from Group B Streptococci (GBS) was contacted with the beads and incubated for 10 minutes as described above for herring sperm DNA. This liquid was obtained by subjecting 10,000 GBS bacteria to 97 ° C. heat lysis for 3 minutes in 10 μl of 20
10分後、処理領域に約10μlの洗浄溶液(1%トリトンX100を含むpH8.0のトリス−EDTA)を流すことによって、ビーズと接触した液体を除去した。その後、約1μlの5mM NaOH溶液を処理領域に追加した。このプロセスによって、処理領域には、ビーズと接触したNaOH溶液が充填した。ビーズと接触する溶液を95℃に加熱した。95℃の加熱の5分後、処理領域の空隙容積の3倍に等しい体積の溶液によって処理領域を溶離することによって、ビーズと接触する溶液を除去した。 After 10 minutes, about 10 μl of washing solution (pH 8.0 Tris-EDTA containing 1% Triton X100) was allowed to flow through the treatment area to remove the liquid in contact with the beads. Thereafter, approximately 1 μl of 5 mM NaOH solution was added to the treatment area. By this process, the treated area was filled with NaOH solution in contact with the beads. The solution in contact with the beads was heated to 95 ° C. After 5 minutes of heating at 95 ° C., the solution in contact with the beads was removed by eluting the treatment area with a volume of solution equal to three times the void volume of the treatment area.
図67を参照すると、溶液の標本5つに対して、定量的リアル・タイムPCR増幅を行った。標本E1、E2、及びE3は、各々、約1μlの液体を含有した。標本Lは、処理領域を通過した元のサンプルの液体に対応する。標本Wは、加熱しない洗浄溶液から得た液体であった。標本E1は、チャネル308の容積にほぼ等しい、デバイス300の死空間に対応する。つまり、標本E1の液体は、チャネル308の中にあり、加熱中ビーズと接触しなかった。この液体は、加熱前に処理領域を通過した。標本E2は、処理領域の中にあり、加熱中ビーズと接触した液体を含む。標本E3は、処理領域から標本E2を除去するために用いた液体を含む。
Referring to FIG. 67, quantitative real-time PCR amplification was performed on five specimens of the solution. Samples E1, E2, and E3 each contained about 1 μl of liquid. The specimen L corresponds to the liquid of the original sample that has passed through the processing region. Sample W was a liquid obtained from an unheated cleaning solution. Specimen E1 corresponds to the dead space of
図67に見られるように、初期サンプルにあったGBS DNAの65%超が、ビーズによって保持され、これらから放出された(標本E2)。また、標本E2は、ビーズによって保持されていたDNAの80%超の放出を実証した。GBS DNAの約18%未満が、捕獲されずに、処理領域を通過した。加熱しない洗浄溶液は、5%未満のGBS DNAを含んでいた(標本W)。 As seen in FIG. 67, more than 65% of the GBS DNA that was in the initial sample was retained by and released from the beads (specimen E2). Specimen E2 also demonstrated greater than 80% release of DNA retained by the beads. Less than about 18% of the GBS DNA passed through the treatment area without being captured. The unheated wash solution contained less than 5% GBS DNA (Sample W).
実施例11:ポリヌクレオチド及びインヒビタの分離
頬の裏層からの口腔細胞は、ヒトの遺伝子材料(DNA)源を提供し、単独ヌクレオチド多形性(SNP:single nucleotide polymorphism)検出に用いることができる。口腔細胞を含むサンプルに対して、熱溶解を行い、細胞内部からDNAを放出させた。デバイス300を用いて、前述のような随伴するインヒビタからDNAを分離した。図67の標本E2に対応する洗浄済みサンプルに対して、ポリメラーゼ連鎖反応を行った。熱溶解から得られた対照(control)又は生サンプルも増幅した。
Example 11 Separation of Polynucleotides and Inhibitors Oral cells from the cheek lining provide a source of human genetic material (DNA) and can be used for single nucleotide polymorphism (SNP) detection. . Samples containing oral cells were heat-dissolved to release DNA from the cells.
図68を参照すると、洗浄したサンプルは、対照サンプルよりも少ないサイクルでかなり高いPCR応答を呈した。例えば、洗浄サンプルは、32サイクル以内で20の応答を超過したが、一方対象サンプルは同じ応答を得るには約45サイクルを要した。 Referring to FIG. 68, the washed sample exhibited a much higher PCR response with fewer cycles than the control sample. For example, the washed sample exceeded 20 responses within 32 cycles, while the subject sample required about 45 cycles to obtain the same response.
血液は、感染症因子、癌マーカ、及びその他の遺伝子マーカの検出を含む種々の診断検査において、サンプル・マトリクスとして作用する。血液サンプルの中にあるヘモグロビンは、PCRの強力なインヒビタであり、文書に記載されている。2つの5ml血液サンプルを、20mMのpH8のトリス、1mMのEDTA、1%SDS緩衝液において溶解し、それぞれのデバイス300に導入した。デバイス300は、前述のように動作して、2つの洗浄サンプルを準備した。第3の5ml血液サンプルを溶解し、Gentra Systems社, MNの市販のDNA抽出方法Puregeneを用いて準備した。それぞれの洗浄済みサンプル、及び市販の抽出方法を実施したサンプルを、対立遺伝子判別分析(CYP2D6*4試薬、Applied Biosystems社, CA)に用いた。各サンプルは、約1mlの血液に対応する量のDNAを含有した。
Blood acts as a sample matrix in various diagnostic tests, including detection of infectious agents, cancer markers, and other genetic markers. Hemoglobin in the blood sample is a powerful inhibitor of PCR and is documented. Two 5 ml blood samples were lysed in 20
図69を参照すると、洗浄済みで市販の方法で抽出したサンプルは、同様のPCR応答を呈し、デバイス300’の処理領域は効率的にインヒビタを血液サンプルから除去したことを実証した。 Referring to FIG. 69, the washed and commercially extracted sample exhibited a similar PCR response, demonstrating that the processing region of device 300 'efficiently removed the inhibitor from the blood sample.
実施例12:耐プロテーゼ保持部材
更なる処理のためのポリヌクレオチド・サンプルの準備には、多くの場合、サンプルに対してプロテーゼ処置を施すことがふくまれ、その場合、プロテーゼがサンプル内の蛋白質のペプチド結合を裂いてしまう。プロテーゼの一例に、生体内及び生体外プロテーゼの混合物である、プロナーゼがある。プロナーゼは、殆どのペプチド結合を裂いてしまう。ポリ−L−リシンのような、ある種の受容体は、プロナーゼ及びその他のプロテーゼによる破壊を受けやすい可能性がある。つまり、結合する受容体がプロテーゼの影響を受けやすい場合、サンプルは、一般に、保持部材が存在する状態でプロテーゼ処置を受けない。
Example 12: Prosthesis Resistant Holding Member Preparation of a polynucleotide sample for further processing often involves subjecting the sample to prosthetic treatment, in which case the prosthesis is free of protein in the sample. It breaks the peptide bond. An example of a prosthesis is pronase, which is a mixture of in vivo and in vitro prostheses. Pronase cleaves most peptide bonds. Certain receptors, such as poly-L-lysine, may be susceptible to destruction by pronase and other prostheses. That is, if the receptor to be bound is susceptible to the prosthesis, the sample will generally not undergo prosthesis treatment in the presence of the retaining member.
ポリ−D−リシン、ポリ−リシンの右旋性エナンチオ異性体は、プロナーゼ及びその他のプロテーゼによる劈開に対して抵抗力がある。プロテーゼ処置を受ける場合における結合ポリ−D−リシンを含む保持部材のDNAを保持する能力について、研究した。 Poly-D-lysine, a dextrorotatory enantiomer of poly-lysine, is resistant to cleavage by pronase and other prostheses. The ability of retaining members containing bound poly-D-lysine to retain DNA when undergoing prosthetic treatment was studied.
8つのサンプルを準備した。4つのサンプルから成る第1グループは、10μlの緩衝液の中に1000GBSの細胞を含有した。4つのサンプルから成る第2グループは、10μl緩衝液の中に100GBSの細胞を含有した。8つのサンプルの各々を97℃で3分間加熱して、GBS細胞を溶解した。加熱したサンプルから、4つのサンプル集合を作成した。各サンプル集合は、第1及び第2グループの各々から1つのサンプルを含んだ。各サンプル集合のサンプルを以下のように処置した。 Eight samples were prepared. The first group of 4 samples contained 1000 GBS cells in 10 μl buffer. A second group of 4 samples contained 100 GBS cells in 10 μl buffer. Each of the eight samples was heated at 97 ° C. for 3 minutes to lyse the GBS cells. Four sample sets were made from the heated samples. Each sample set included one sample from each of the first and second groups. Samples from each sample set were treated as follows.
図70Aを参照すると、サンプル集合1のサンプルに対してプロナーゼ培養を行い、それぞれの蛋白質劈開サンプルを準備し、次いでこれらを加熱してプロテーゼを不活性化した。蛋白質劈開、加熱サンプルをそれぞれの保持部材と接触させた。保持部材は、各々、ポリ−L−リシン改質ビーズの集合体を備えている。5分後、それぞれのビーズ集合体を、5マイクロリットルの5mM NaOH溶液で洗浄して、インヒビタ及び蛋白質劈開の生成物を結合DNAから分離した。それぞれのビーズ集合体を、各々、NaOH溶液の第2標本と接触させ、80℃まで2分間加熱して、DNAを放出した。DNAが放出された溶液を、等しい体積の緩衝液で中和した。中和した溶液を分析して、DNA復元の効率を判定した。結果を平均化し、図70Bに示す。 Referring to FIG. 70A, pronase culture was performed on the samples of sample set 1 to prepare respective protein cleaved samples, which were then heated to inactivate the prosthesis. The protein cleaved and heated samples were brought into contact with the respective holding members. Each holding member includes an assembly of poly-L-lysine modified beads. After 5 minutes, each bead assembly was washed with 5 microliters of 5 mM NaOH solution to separate the inhibitor and protein cleavage products from the bound DNA. Each bead assembly was contacted with a second sample of NaOH solution and heated to 80 ° C. for 2 minutes to release the DNA. The solution from which the DNA was released was neutralized with an equal volume of buffer. The neutralized solution was analyzed to determine the efficiency of DNA restoration. The results are averaged and shown in FIG. 70B.
サンプル集合2のサンプルに対して、プロナーゼ培養を行い、それぞれの蛋白質劈開サンプルを準備し、次いでこれらを加熱してプロテーゼを不活性化した。蛋白質劈開、加熱サンプルを、それぞれの保持部材と接触させた。保持部材は、各々、ポリ−D−リシン改質ビーズの集合体を備えている。5分後、それぞれのビーズ集合体を、5マイクロリットルの5mM NaOH溶液で洗浄して、インヒビタ及び蛋白質劈開の生成物を結合DNAから分離した。それぞれのビーズ集合体を、各々、NaOH溶液の第2標本と接触させ、80℃まで2分間加熱して、DNAを放出した。DNAが放出された溶液を、等しい体積の緩衝液で中和した。中和した溶液を分析して、DNA復元の効率を判定した。結果を平均化し、図70Bに示す。 Pronase culture was performed on the samples of sample set 2 to prepare respective protein cleaved samples, which were then heated to inactivate the prosthesis. The protein cleaved and heated samples were brought into contact with the respective holding members. Each holding member includes an assembly of poly-D-lysine modified beads. After 5 minutes, each bead assembly was washed with 5 microliters of 5 mM NaOH solution to separate the inhibitor and protein cleavage products from the bound DNA. Each bead assembly was contacted with a second sample of NaOH solution and heated to 80 ° C. for 2 minutes to release the DNA. The solution from which the DNA was released was neutralized with an equal volume of buffer. The neutralized solution was analyzed to determine the efficiency of DNA restoration. The results are averaged and shown in FIG. 70B.
サンプル集合3のサンプルに対して、プロナーゼ培養を行い、それぞれの蛋白質劈開サンプルを準備した。プロテーゼは、熱的にも化学的にも不活性化しなかった。蛋白質劈開サンプルを、それぞれの保持部材と接触させた。保持部材は、各々、ポリ−L−リシン改質ビーズの集合体を備えている。5分後、それぞれのビーズ集合体を、5マイクロリットルの5mM NaOH溶液で洗浄して、インヒビタ及び蛋白質劈開の生成物を結合DNAから分離した。それぞれのビーズ集合体を、各々、NaOH溶液の第2標本と接触させ、80℃まで2分間加熱して、DNAを放出した。ポリヌクレオチドが放出された溶液を、各々、等しい体積の緩衝液で中和した。中和した溶液を分析して、DNA復元の効率を判定した。結果を平均化し、図70Bに示す。 Pronase culture was performed on the sample of sample set 3, and each protein cleaved sample was prepared. The prosthesis was not thermally or chemically inactivated. A protein cleaved sample was contacted with each holding member. Each holding member includes an assembly of poly-L-lysine modified beads. After 5 minutes, each bead assembly was washed with 5 microliters of 5 mM NaOH solution to separate the inhibitor and protein cleavage products from the bound DNA. Each bead assembly was contacted with a second sample of NaOH solution and heated to 80 ° C. for 2 minutes to release the DNA. Each solution from which the polynucleotide was released was neutralized with an equal volume of buffer. The neutralized solution was analyzed to determine the efficiency of DNA restoration. The results are averaged and shown in FIG. 70B.
サンプル集合4のサンプルに対して、プロナーゼ培養を行い、それぞれの蛋白質劈開サンプルを準備した。プロテーゼは、熱的にも化学的にも不活性化しなかった。蛋白質劈開サンプルを、それぞれの保持部材と接触させた。保持部材は、各々、ポリ−D−リシン改質ビーズの集合体を備えている。5分後、それぞれのビーズ集合体を、5マイクロリットルの5mM NaOH溶液で洗浄して、インヒビタ及び蛋白質劈開の生成物を結合DNAから分離した。それぞれのビーズ集合体を、各々、NaOH溶液の第2標本と接触させ、80℃まで2分間加熱して、DNAを放出した。ポリヌクレオチドが放出された溶液を、各々、等しい体積の緩衝液で中和した。中和した溶液を分析して、DNA復元の効率を判定した。結果を平均化し、図70Bに示す。 Pronase culture was performed on the sample of sample set 4, and each protein cleaved sample was prepared. The prosthesis was not thermally or chemically inactivated. A protein cleaved sample was contacted with each holding member. Each holding member includes an assembly of poly-D-lysine modified beads. After 5 minutes, each bead assembly was washed with 5 microliters of 5 mM NaOH solution to separate the inhibitor and protein cleavage products from the bound DNA. Each bead assembly was contacted with a second sample of NaOH solution and heated to 80 ° C. for 2 minutes to release the DNA. Each solution from which the polynucleotide was released was neutralized with an equal volume of buffer. The neutralized solution was analyzed to determine the efficiency of DNA restoration. The results are averaged and shown in FIG. 70B.
図70Bに見られるように、サンプル集合4を用いると、平均してGBS細胞からのDNAの80%超が復元されており、これらのサンプルは、ポリ−D−リシン改質ビーズと接触し、プロテーゼ不活性化を行わなかったビーズが存在する状態で、プロナーゼ培養が行われた。サンプル集合4の復元効率は、他のサンプルのいずれに対しても、2倍よりも高くなる可能性がある。具体的には、サンプル集合1、2、3、及び4の復元効率は、それぞれ、29%、32%、14%、及び81.5%であった。これらの効率は、DNAを保持する保持部材が存在する状態においてプロテーゼ培養を行ったサンプルについて、高い復元効率を得ることができることを実証している。 As seen in FIG. 70B, using sample set 4, on average, more than 80% of the DNA from GBS cells was restored and these samples contacted with poly-D-lysine modified beads, Pronase culture was performed in the presence of beads that had not undergone prosthesis inactivation. The restoration efficiency of sample set 4 can be higher than twice for any of the other samples. Specifically, the restoration efficiencies of sample sets 1, 2, 3, and 4 were 29%, 32%, 14%, and 81.5%, respectively. These efficiencies demonstrate that high restoration efficiencies can be obtained for samples that have been prosthetic cultured in the presence of a retention member that retains DNA.
実施例13:ポリヌクレオチド処理装置の操作者取扱書
この非限定的な実施例では、操作者の取扱書の形態で、特に、グループBストレプトコッカス(GBS)のような、微小有機体の定量的検出のための微小流体PCR分析を含む単体カートリッジ・システムを対象とする、特許請求する装置、微小流体カートリッジ、キット、方法、及びコンピュータ・プログラム生産物の種々の実施形態について説明する。GBS分析に関する更に詳しい説明は、実施例14において呈示する。
Example 13: Operator Manual for Polynucleotide Processing Equipment In this non-limiting example, in the form of an operator manual, in particular, quantitative detection of micro-organisms, such as Group B Streptococcus (GBS). Various embodiments of claimed devices, microfluidic cartridges, kits, methods, and computer program products are described that are directed to a single cartridge system that includes microfluidic PCR analysis. A more detailed explanation regarding GBS analysis is presented in Example 14.
以下のサンプル準備キットを含むことが好ましい。
緩衝液及び防腐剤を含有するサンプル小瓶
患者自身が収集するための指示書が付属する収集スワブ
多数の(例えば、25個)フィルタ付きシリンジ
緩衝液を収容した小瓶
収集小瓶用患者IDラベル
3ccシリンジ
この中で更に説明する微小流体カートリッジ
The following sample preparation kit is preferably included.
Sample vial containing buffer and preservative Collection swab with instructions for patient collection Multiple syringes with filters (eg, 25) Small vial containing buffer Patient ID label for collection vial 3cc syringe This Microfluidic cartridge further described in
以下の外部制御サンプル・キットを備えることが好ましい。
例えば、脱水形態のGBSバクテリアの検出サンプルの限度を含有する陽性対照スワブ被検物
小瓶上に陽性識別がある緩衝液を含有する小瓶
小瓶上に陰性識別がある緩衝液を含有する小瓶
シリンジ
Preferably, the following external control sample kit is provided.
For example, a positive control swab specimen containing a limit of detection sample of GBS bacteria in dehydrated form A vial containing a buffer with positive identification on the vial A vial containing a buffer with negative identification on the vial
機器:
バーコード・リーダを備えたシステムに、例えば、115V又は220Vの電源コードを差し込む。双方については、ここで更に説明する。
追加の任意選択機器
USB接続を有するプリンタ
病院ネットワーク接続
machine:
For example, a 115V or 220V power cord is plugged into a system equipped with a bar code reader. Both are further described here.
Additional optional equipment Printer with USB connection Hospital network connection
使用例及び使用の指示
この実施例における説明は、GBSの存在を調べるためのサンプル検査に適しており、その更に詳しい説明は、実施例14において提示する。
検査アプリケーションの説明
この中で更に説明するように、種々の病原体や微小有機体を検査するために、本装置及び材料を用いることができる。一例は、実施例14において更に説明するが、GBSを検査することである。検査は、実験室の手順にはさほど訓練されていない臨床家によって、患者の近くに設定して行うことができる。GBS検査のために継続して品質保証を行うためにシステムのユーザ・インターフェースにQCルーチンを組み込むことができる。また、検査を依頼した外科医が要求する時間枠以内にサンプル検査が行われるのであれば、検査は中央病院の「stat」実験室で行うこともできる。
Use Examples and Instructions of Use The description in this example is suitable for sample testing to check for the presence of GBS, a more detailed description of which is presented in Example 14.
Description of Test Application As described further herein, the apparatus and materials can be used to test various pathogens and micro-organisms. One example is to examine GBS, as further described in Example 14. The test can be set up close to the patient by a clinician who is not well trained in laboratory procedures. A QC routine can be incorporated into the system's user interface to provide continuous quality assurance for GBS inspection. The test can also be performed in the “stat” laboratory at the central hospital if the sample test is performed within the time frame required by the surgeon who requested the test.
警告及び注意の例
GBSに特定的なその他の警告及び注意を実施例14に呈示する。
・実施形態によっては、患者を現在抗生物質で処置している場合、検査は病状の信頼できる指標とはならない場合がある。
・通例、使用期限が切れたカートリッジ/サンプル・キットの使用を避ける。
・通例、以前に開封したカートリッジの使用を避ける。空気及び水分に晒すと、試薬が劣化する可能性がある。サンプルを注入する準備ができる後まで、カートリッジを開封するのを回避する。
・通例、サンプルの準備には新しいシリンジ材料を用いる。
・通例、検査キットの中に用意されているスワブ及び緩衝液を用いる。実施形態によっては、他のブランドの収集スワブでは、検査性能を損なう場合もある。
・被検物を保管しなければならない場合、4℃で24時間までの期間の冷蔵が指示されるのが通例である。
・通例、本システム及び被検物の成分を取り扱う間、保護服及び使い捨て手袋を用いる。
・通例、無菌技法を用いる。検査被検物又は検査材料の汚染を回避するために、新しい使い捨て手袋を用いることは、特に重要となる可能性がある。
・通例、サンプルを高圧で注入することを避ける。緩やかな注入が好ましい。
・通例、潜在的な感染被検物に対する安全病院手順にしたがって、統一予防策を用いて被検物を取り扱う。
・通例、システムを洗浄するときには、推奨された洗浄剤を用いる。
・通例、溢流が起きた場合、いずれの洗浄薬品で検査カートリッジを洗浄することも回避する。必要であれば、液体を除去するためには乾燥した実験室用ティッシュを用いる。
Warning and Caution Examples Other warnings and cautions specific to GBS are presented in Example 14.
In some embodiments, if the patient is currently being treated with antibiotics, the test may not be a reliable indicator of the condition.
• Typically, avoid using cartridges / sample kits that have expired.
• Typically, avoid using previously opened cartridges. Exposure to air and moisture can degrade reagents. Avoid opening the cartridge until after you are ready to inject the sample.
Typically, new syringe material is used for sample preparation.
・ Usually, swabs and buffers prepared in the test kit are used. In some embodiments, other branded collection swabs may impair test performance.
• If the specimen must be stored, it is customary to instruct refrigeration for up to 24 hours at 4 ° C.
Typically, use protective clothing and disposable gloves while handling the system and components of the specimen.
・ Usually use aseptic technique. The use of new disposable gloves can be particularly important in order to avoid contamination of the test specimen or test material.
• Typically, avoid injecting samples at high pressure. Slow injection is preferred.
• Typically, treat specimens using unified precautions according to safe hospital procedures for potentially infected specimens.
Typically, use recommended cleaning agents when cleaning the system.
• In general, if an overflow occurs, avoid cleaning the test cartridge with any cleaning chemical. If necessary, use a dry laboratory tissue to remove the liquid.
被検物収集の一例
注意:スワブのDacron(商標)端部に指で触るのを避ける。
容器からスワブを取り出す。
過剰な膣分泌物を拭い去る。
スワブを2cm膣(膣)に挿入する。
同じスワブを1cm肛門(直腸)に挿入する。
乾燥させて保管する場合、スワブを輸送用パッケージに入れる。
Example of specimen collection CAUTION: Avoid touching the Dacron ™ end of the swab with your finger.
Remove swab from container.
Wipe away excess vaginal discharge.
Insert the swab into the 2cm vagina (vagina).
The same swab is inserted into the 1 cm anus (rectum).
If stored dry, place swab in shipping package.
被検物準備の一例
検査材料及び被検物を取り扱うときは、無菌技法を用いる。
サンプル緩衝液が期限切れでないことを確認する。
1ccの緩衝液を収容する小瓶の中にスワブを20回勢い良く浸す。
スワブを取り出して破棄する。
臨床標準手順で要求されている場合、患者ID及び収集時刻を小瓶に記す。
注意:使用する準備ができるまで、カートリッジのパッケージを開封するのを避ける。内蔵試薬は、光及び水分に感応する可能性がある。
Example of specimen preparation Use aseptic technique when handling test materials and specimens.
Make sure the sample buffer is not expired.
Swab the swab vigorously 20 times in a vial containing 1 cc of buffer.
Remove swab and discard.
If required by clinical standard procedures, record patient ID and collection time in a vial.
Note: Avoid opening the cartridge package until you are ready to use it. Built-in reagents can be sensitive to light and moisture.
システム動作命令の一例
・システム・レディ画面を示すとよい。
・スクリーン・セーバを停止させるために、画面に触る。
・ハンドルを上げ、システムの蓋を開いて、開始する。
・一旦蓋を完全に開いて、「開放」インディケータがある場合、これがオンになると、システムの自己検査を開始することができる。
・以前の検査から残留しているいずれかの使用済みカートリッジがないか、システムを調べる。
・ユーザID及びパスワードを用いて、ログインする。
・サンプル収集小瓶のバーコードを走査する。
・検査カートリッジを開く。カートリッジ・バーコードを走査する。
・材料が期限切れの場合、及び/又は被検物小瓶及び検査材料が相応に一致しない場合、システムはエラー・メッセージを出すとよい。
・患者情報により、サンプルIDを確認する。
・必要であれば、患者ID及びその他の病院識別情報を入力する。
サンプルをカートリッジに転送する命令の一例
・新品の1対の手袋を着用する。
・サンプル小瓶をカウンタ上に置く。
・先端をシリンジに取り付ける。サンプル全体をシリンジに引き込む。加えて、2ccの空気をシリンジに引き込む。
・先端を取り外し、フィルタを取り付ける。
・シリンジを用いて、1ccのサンプル及び追加の2ccの空気をカートリッジに注入する。
・注意:サンプルからの跳ね返りを回避するために、サンプルに注入する際には弱い圧力を用いる。
・検査実行指示の一例は、次の通りである。
・ペレットが溶解するまで、カートリッジを前後にゆっくりと揺する。
・カートリッジをシステム上に置く。
・システムのカバーを閉じる。
・(検査は自動的に開始することができる。)
・結果。
・検査が完了したとき、表示又は印刷のために結果を利用可能とするとよい。
・材料の廃棄。使用したカートリッジ及び収集キットは、生物学的有害物質として取り扱うことができる。
An example of a system operation command • It is good to show the system ready screen.
・ Touch the screen to stop the screen saver.
• Raise the handle, open the system lid and start.
• Once the lid is fully opened and there is an “open” indicator, once it is turned on, the system can begin self-checking.
• Check the system for any used cartridges remaining from previous checks.
• Log in using your user ID and password.
-Scan the barcode on the sample collection vial.
・ Open the inspection cartridge. Scan cartridge barcode.
If the material has expired and / or if the specimen vial and the test material do not match accordingly, the system may issue an error message.
-Confirm sample ID by patient information.
・ If necessary, enter the patient ID and other hospital identification information.
An example of an instruction to transfer a sample to a cartridge • Wear a new pair of gloves.
• Place the sample vial on the counter.
・ Attach the tip to the syringe. Pull the entire sample into the syringe. In addition, 2 cc of air is drawn into the syringe.
・ Remove the tip and attach the filter.
Inject a 1 cc sample and an additional 2 cc of air into the cartridge using a syringe.
• Note: Use low pressure when injecting the sample to avoid bounce off the sample.
An example of the inspection execution instruction is as follows.
-Gently rock the cartridge back and forth until the pellet is dissolved.
-Place the cartridge on the system.
• Close the system cover.
・ (The inspection can be started automatically.)
·result.
• When inspection is complete, the results should be available for display or printing.
・ Disposal of materials. The cartridges and collection kits used can be handled as biological hazardous substances.
出荷のための材料の準備
通例、国際規格に記載されているように、カートリッジは生物学的有害物質保護材の中に包装しなければならない。
Preparation of materials for shipping Typically, cartridges must be packaged in a biological hazardous material protection material, as described in international standards.
システム洗浄手順の一例
10%漂白剤(0.5%次亜塩素酸ナトリウム)の溶液、続いて洗浄水濯ぎ洗いを用いて、消毒し、潜在的なDNA汚染を低減することができる。
DNA汚染は、通例、漂白剤又はDNA汚染を解消するのに適した材料で洗浄することによって、遂行することができる。Chemicon(商標)核酸リムーバも、通常の消毒剤での洗浄の後に用いることができる。
通例、アルコール又は通常の衛生布では、計器のDNA汚染は低減しない。
Example of System Washing Procedure A solution of 10% bleach (0.5% sodium hypochlorite) followed by a wash water rinse can be used to disinfect and reduce potential DNA contamination.
DNA contamination can typically be accomplished by washing with a bleach or a material suitable to eliminate DNA contamination. Chemicon ™ Nucleic Acid Remover can also be used after washing with conventional disinfectants.
Typically, alcohol or normal sanitary cloth does not reduce instrument DNA contamination.
試薬ロット検証の一例
目的−カートリッジ及びサンプル・キット・ロットの評価、並びにシステム性能全体の検証。
推奨:カートリッジ又はサンプル・キットの新しいロットを受け取ったとき、品質管理を実施して、例えば、試薬セットが(1)外部対照(external control)及び(1)陰性外部対照を含むか否か確認することができる。
Example of reagent lot verification Objective-Evaluation of cartridges and sample kit lots and verification of overall system performance.
Recommendation: When a new lot of cartridge or sample kit is received, perform quality control, for example, to check whether the reagent set includes (1) an external control and (1) a negative external control be able to.
品質管理ルーチンの一例
外部陽性対照は、被検物準備ステップの感度及び分析を監視し較正する役割を果たし、偽りの陰性結果の危険性を最小限に抑えるために用いることができる。検査が失敗した場合、そのカートリッジ群からの結果を無効にすればよく、供給業者に報告すべきである。
目的−サンプル取扱技法の評価を含むシステム性能全体の検証。検査は、ユーザが選択し予め設定した間隔で行うことができる。
推奨:検査を行うとき、(1)陽性外部対照及び(1)陰性外部対照を含むQCセットを実施し、QC検査で予期した結果が得られなかった場合、製造業者に連絡する。
Example Quality Control Routine An external positive control serves to monitor and calibrate the sensitivity and analysis of the specimen preparation step and can be used to minimize the risk of false negative results. If the test fails, the results from that cartridge group can be invalidated and should be reported to the supplier.
Objective-Verification of overall system performance, including evaluation of sample handling techniques. The inspection can be performed at intervals selected by the user and set in advance.
RECOMMENDED: When performing a test, perform a QC set that includes (1) a positive external control and (1) a negative external control and contact the manufacturer if the QC test does not provide the expected results.
品質管理ルーチン指令の例
・品質管理画面に移る。
・ユーザIDを入力する。
・画面上で指令される通りに、QC技法検証、新試薬ロット、規則的なQC実行サンプルを選択する。
Example of quality control routine command • Move to the quality control screen.
-Enter the user ID.
Select QC technique verification, new reagent lots, regular QC run samples as directed on the screen.
システムの自己検査
本システムは、電源を投入するときに、システム起動検査を実行することができる。各患者検査サンプル又はQCサンプルの開始ルーチンとして、システムは、自己検査を実行して、例えば、電子回路、光学系、ヒータ及び温度センサが、意図したように機能しているか否か判断することができる。
System self-test The system can perform a system start-up test when power is turned on. As the starting routine for each patient test sample or QC sample, the system may perform a self test to determine, for example, whether the electronics, optics, heaters, and temperature sensors are functioning as intended. it can.
内部対照の例(カートリッジ上)
分析に用いることができる試薬をカートリッジ上に含めれば、ユーザの取扱誤りや汚染の潜在的可能性を低減することができる。各微小流体カートリッジの中に、2種類のカートリッジ上陽性及び陰性対照方策(strategy)を組み込んで、個々のPCR分析性能を監視することができる。以下に2つの例を示す。
Example of internal control (on cartridge)
If a reagent that can be used for analysis is included on the cartridge, the handling error of the user and the potential for contamination can be reduced. Within each microfluidic cartridge, two different on-cartridge positive and negative control strategies can be incorporated to monitor individual PCR analysis performance. Two examples are shown below.
1)陽性内部対照プラスミド(ICP):内部対照プラスミドは、PCR分析試薬の完全性に対する対照を規定し、被検物の中にPCR妨害物質があることの指標となることができる。即ち、これは偽りの陰性結果に対する対照となることができる。熱サイクルの間、この領域を増幅すると、双方のPCRレーンに別個の蛍光原信号が発生する場合がある。陽性サンプルがない状態で、内部対照シーケンスを増幅し損ねることは、試薬混合の失敗、又は被検物におけるPCRインヒビタの存在の指示となることができる。これは、計器上のエラー・コードによって示されるように、検査結果を無効にすることができる。「IND」を表示して、中間結果を報告することができる。 1) Positive internal control plasmid (ICP): The internal control plasmid defines a control for the integrity of the PCR analysis reagents and can be an indicator of the presence of PCR interfering substances in the analyte. That is, this can serve as a control for false negative results. Amplification of this region during thermal cycling may generate separate fluorogenic signals in both PCR lanes. Failure to amplify the internal control sequence in the absence of a positive sample can be an indication of a reagent mix failure or the presence of a PCR inhibitor in the analyte. This can invalidate the test results as indicated by the error code on the instrument. “IND” can be displayed to report intermediate results.
2)陰性内部対照PCRレーン:サンプルが全くない同じ混合からの試薬を用いて第2PCRを実施するために、並列レーンを用いることができる。これは、試薬の汚染による偽りの陽性結果に対する対照を規定することができる。陰性対象レーンにおける失敗結果は、結果を無効化することができ、計器上のエラー・コードによって示すことができる。「IND」を表示して、中間結果を報告することができる。 2) Negative internal control PCR lane: A parallel lane can be used to perform a second PCR using reagents from the same mix without any sample. This can define a control for false positive results due to reagent contamination. Failure results in the negative target lane can invalidate the results and can be indicated by an error code on the instrument. “IND” can be displayed to report intermediate results.
GBS DNA検出のためのリアル・タイムPCRの一例
種々の実施形態では、検査は、臨床サンプルから復元したGBSのcfb遺伝子シーケンスの増幅、及び増幅したDNAの検出のための蛍光原ターゲット特定混成化に、リアル・タイム・ポリメラーゼ連鎖反応(PCR)を用いることができる。cfb遺伝子は、CAMP係数、即ち、典型的にGBS隔離集団に存在する拡散可能な細胞外蛋白質をエンコードする。グループBストレプトコッカス(GBS)検出検査を一体化し、原料−サンプル−結果型の核酸増幅分析とすることができる。TaqMan蛍光原プローブを用いて、PCRアンプリコンを検出することもできる。分析に用いられる試薬は、カートリッジに含ませると、ユーザの取扱謝りや汚染の潜在的可能性を低減することができる。
Example of Real Time PCR for GBS DNA Detection In various embodiments, the test is for amplification of GBS cfb gene sequences reconstructed from clinical samples, and for fluorogen target specific hybridization for detection of amplified DNA. Real time polymerase chain reaction (PCR) can be used. The cfb gene encodes the CAMP coefficient, a diffusible extracellular protein that is typically present in GBS sequestration populations. Group B Streptococcus (GBS) detection test can be integrated into a raw material-sample-result type nucleic acid amplification analysis. PCR amplicons can also be detected using TaqMan fluorogenic probes. Reagents used for analysis can be included in the cartridge to reduce user appreciation and the potential for contamination.
潜在的な注意の例
実施形態によっては、膣及び/又は直腸被検物以外の被検物における、GBS DNAのようなターゲットを特定する適格性がない場合がある。尿及び血液の被検物は適していない場合がある。
実施形態によっては、抗生物質の処置を受けている患者は、この診断検査又はその他の診断検査では正しい診断を得ることができない場合がある。
実施形態によっては、微生物学者によるバクテリアの直接的な識別に適したGBS培養が、本検査から得られない場合もある。実施形態によっては、ペニシリン・アレルギのヒトに対する処置を推奨するために必要な罹患性結果が、本検査からは得られない場合がある。
Examples of potential attention In some embodiments, it may not be eligible to identify a target, such as GBS DNA, in a subject other than a vaginal and / or rectal subject. Urine and blood specimens may not be suitable.
In some embodiments, patients undergoing antibiotic treatment may not obtain a correct diagnosis with this diagnostic test or other diagnostic tests.
In some embodiments, a GBS culture suitable for direct identification of bacteria by a microbiologist may not be obtained from this test. In some embodiments, the susceptibility results required to recommend treatment of a penicillin allergic human may not be obtained from this test.
潜在的な妨害物質の例
実施形態によっては、尿及び膣分泌物が大量に存在すると、検査を妨害する可能性がある。
通例、サンプルの血液、胎便、羊水汚染のような汚染物が検査を妨害する可能性はない。
通例、抗生物質以外の薬剤の妨害(膣及び直腸分泌物に存在するような)は、この時点では、PCRを妨害することは知られていない。
Examples of potential interfering substances In some embodiments, the presence of large amounts of urine and vaginal secretions can interfere with the test.
Typically, contaminants such as sample blood, meconium and amniotic fluid contamination cannot interfere with the test.
Typically, interference with drugs other than antibiotics (as present in vaginal and rectal secretions) is not known to interfere with PCR at this point.
性能特性及び解釈の例
図71のフロー・チャートは、結果を解釈するために計器における判断アルゴリズムが用いることができる判断基準集合の一例である。PCR反応(サンプル及び対照)は、問題のターゲットに対して、陽性又は陰性と解釈することができる。サンプルが決定的に陽性又は陰性か、あるいは不確定か判断するために、論理アルゴリズムを用いることができる。
Example of Performance Characteristics and Interpretation The flow chart of FIG. 71 is an example of a set of criteria that can be used by a judgment algorithm in the instrument to interpret the results. PCR reactions (samples and controls) can be interpreted as positive or negative for the target in question. A logic algorithm can be used to determine whether a sample is positively positive, negative, or indeterminate.
相互反応物質の例
以下の有機体から分離したゲノムDNAを用いて、リアル・タイムPCR(Taqman分析)によって、プライマ及びプローブの特定性を検査することができる。9つのGBSセロタイプ(セロタイプ1a、1b、1c、II、III、IV、V、VI及びVII、American Type Culture Collection and National Center for Streptococcus, Canada)、10個の臨床GBS隔離集団、60個の臨床サンプル、多種多様のグラム−陽性及びグラム−陰性バクテリア菌種、並びに2つのイースト菌種及びRSVタイプ1及び2。
Examples of interacting substances Using genomic DNA isolated from the following organisms, the specificity of primers and probes can be examined by real-time PCR (Taqman analysis). 9 GBS serotypes (cellotypes 1a, 1b, 1c, II, III, IV, V, VI and VII, American Type Culture Collection and National Center for Streptococcus, Canada), 10 clinical GBS isolated populations, 60 clinical samples A wide variety of gram-positive and gram-negative bacterial species, and two yeast species and
微小有機体の例
病原体 タイプ
シュードモナ・アエルジノサ(Pseudomones aeruginosa) グラム−バクテリア
プロテウス・ミラビリス( Proteus mirabilis) グラム−バクテリア
キーブシエラ・オキシトカ(Kiebsiella oxytoca) グラム−バクテリア
キーブシエラ・ニューモニエ(Kiebsiella pneumoniae) グラム−バクテリア
エシェリチア・コット( Escherichia cot)(臨床的隔離集団1)グラム−バクテリア
エシェリチア・コリ( Escherichia coli)(臨床的隔離集団2) グラム−バクテリア
アシネトバクテル・バウマンド( Acinetobacter Baumannd) グラム−バクテリア
セラ・マルセセンス(Serra. marcescens) グラム−バクテリア
エンテンバクタ・アエルジェネス(Entembacter aerugenes) グラム+バクテリア
エンテロコッカス・マックリーン(Enterococcus Maclean) グラム−バクテリア
スタフィロコッカス・アウレウス(Staphylococcus aureus)(臨床的隔離集団1)
グラム−バクテリア
スタフィロコッカス・アウレウス(Staphylococcus aureus)(臨床的隔離集団2)
グラム−バクテリア
ストレプトコッカス・ピオジーンズ(Streptococcus pyogenes) グラム−バクテリア
ストレプトコッカス・ヴィリダンス(Streptococcus viridans) グラム−バクテリア
リステナ・モノシトジェネス(Listena monocytogenes) グラム−バクテリア
エンテロコッカスsps.(Enterococcus sps.) グラム−バクテリア
センディダ・グラブラタ(Cendida glabrata) イースト
カンディダ・アルビカンス(Candida albicans) イースト
ストレプトコッカス・グループC(Streptococcus Group C) グラム+バクテリア
ストレプトコッカス・グループ G(Streptococcus Group G) グラム+バクテリア
ストレプトコッカス・グループF(Streptococcus Group F) グラム+バクテリア
エンテロコッカス・フィーカリス(Enterococcus Feecalis) グラム+バクテリア
ストレプトコッカス・ニューモニエ(Streptococcus pneumoniae)グラム+バクテリア
スタフィロコカス・エピダーニディス(C−)(Staphylococcus epiderrnidis (C-))
グラム+バクテリア
ガルデネレラ・ヴァジナリス(Gardenerella vaginalis) グラム+バクテリア
ミクロコカスsps.(Micrococcus sps.) グラム+バクテリア
ハエモフィルス・インフルエンザ゜(Haemophilus influenza゜) グラム−バクテリア
ネイセリア・ゴノルホエエ(Neisseria gonorrhoeae) グラム−バクテリア
モラクセラ・カタラリス(Moraxella catarrahlis) グラム−バクテリア
サルモネラsps.(Salmonella sps.) グラム−バクテリア
クラミサ・トレコマティス(Chlamytha trechomatis) グラム−バクテリア
ペプトストレプトコッカス生成物(Peptostreptococcus productus)
グラム+バクテリア
ペプトストレプトコッカス・アナエローベ(Peptostreptococcus anaerobe)
グラム+バクテリア
ラクトバシルス・レンネンタム (Lactobacillus lenmentum) グラム+バクテリア
ユーバクテリウム・レンテュム(Eubacterium lentum) グラム+バクテリア
ヘルペス・シンプレクス・ヴィルスI( Herpes Simplex Virus I )(HSV I)
ウィルス
ヘルペス・シンプレクス・ヴィルスII(Herpes Simplex Virus II )(HSV II)
ウィルス
Microorganism Examples (Escherichia cot) (Clinical isolate 1) Gram-Bacteria Escherichia coli (Clinical isolate 2) Gram-Bacteria Acinetobacter Baumannd Gram-Bacteria Serra marcescens Gram -Bacteria Entembacter aerugenes Gram + Bacteria Enterococcus Maclean Gram-Bacteria Staphylococcus a Reus (Staphylococcus aureus) (clinical isolates 1)
Gram-bacteria Staphylococcus aureus (clinical isolate 2)
Gram-bacteria Streptococcus pyogenes Gram-bacteria Streptococcus viridans Gram-bacteria Listena monocytogenes Gram-bacterial enterococcus sps. (Enterococcus sps.) Gram-bacteria Cendida glabrata East Candida albicans East Streptococcus Group C Gram + Bacteria Streptococcus Group G Group F (Streptococcus Group F) Gram + Bacteria Enterococcus Feecalis Gram + Bacteria Streptococcus pneumoniae Gram + Bacteria Staphylococcus epiderrnidis (C-)
Gram + Bacteria Gardnerella vaginalis Gram + Bacteria Micrococus sps. (Micrococcus sps.) Gram + bacteria Haemophilus influenza ° Gram-bacteria Neisseria gonorrhoeae Gram-bacteria Moraxella catarrahlis Gram-bacteria Salmonella sps. (Salmonella sps.) Gram-Bacteria Chlamytha trechomatis Gram-Bacteria Peptostreptococcus productus
Gram + bacteria Peptostreptococcus anaerobe
Gram + Bacteria Lactobacillus lenmentum Gram + Bacteria Eubacterium lentum Gram + Bacteria Herpes Simplex Virus I (HSV I)
Virus Herpes Simplex Virus II (HSV II)
virus
実施例14:ポリヌクレオチド処理装置の操作者説明書
この非限定的実施例では、ユーザ指示の形式で、特に、グループBストレプトコッカスのような微小有機体の定性的検出を含む微小流体PCR分析において用いる微小流体カートリッジを対象として、特許請求する装置、微小流体カートリッジ、キット、方法、及びコンピュータ・プログラム生産物の種々の実施形態について説明する。
Example 14: Operator Manual for Polynucleotide Processing Equipment This non-limiting example is used in a microfluidic PCR analysis involving qualitative detection of microorganisms such as group B Streptococcus, in the form of user instructions. Various embodiments of the claimed devices, microfluidic cartridges, kits, methods, and computer program products are described for a microfluidic cartridge.
グループBストレプトコッチ(GBS)の存在は、1990年代以来敗血症、誕生後の赤ん坊を冒す肺炎、及び骨髄炎の防止が大きく進歩したにも拘わらず、重大な新生児感染の最大の原因であり続けている。GBS検査システムは、膣/直腸サンプルにおけるグループBストレプトコッカス(GBS)DNAの迅速な定性的検出に用いることができる。 The presence of Group B Streptococci (GBS) continues to be the leading cause of serious neonatal infections despite significant advances in the prevention of sepsis, postpartum pneumonia and osteomyelitis since the 1990s. Yes. The GBS test system can be used for rapid qualitative detection of group B Streptococcus (GBS) DNA in vaginal / rectal samples.
使用例及び使用のための指示
種々の実施形態では、GBS検査システムは、膣/直腸サンプルにおけるグループBストレプトコッカス(GBS)DNAのような、臨床サンプルにおける微小有機体の迅速な定性的検出に用いることができる。
Use Cases and Instructions for Use In various embodiments, the GBS test system is used for rapid qualitative detection of micro-organisms in clinical samples, such as Group B Streptococcus (GBS) DNA in vaginal / rectal samples. Can do.
GBS検査に用いるための典型的な指示には、CDC指針(Centers for Disease Control and Prevention. Prevention of Prenatal Group B Streptococcal Disease: Revised Guideline from CDC. (疾病管理及び予防センタ、出産前グループBストレプトコッカス疾病の予防、CDCからの改訂指針) Morbidity and Mortality Weekly Report, August 16, 2002; 51 (No. RR-11); 1-24)に記載されているように陣痛中における抗生物質処置の必要性を判断するために、産科患者に対する出産前看護養生における迅速な選別(screening)検査が含まれる。この検査は、看護の時点、又は産科患者の分娩中及び分娩後段階における迅速なターンアラウンド・サービスを備えた中央検査室において迅速な結果を出すことができる。また、この検査は、GBS感染が疑われるいずれの被験者の膣又は直腸サンプルにおいてGBS DNAを検出するためにも用いることができる。A. Burns, Brian N. Johnson, Sundaresh N. Brahmasandra, Kalyan Handique, James R. Webster, Madhavi Krishnan, Timothy S. Sammarco, Piu M. Man, Darren Jones, Dylan Heldsinger, Carlos H. Mastrangelo, David T. Burke "An Integrated Nanoliter DNA Analysis Device" (一体化ナノリットルDNA分析装置)Science, Vol. 282, 16 October 1998も参照のこと。 Typical instructions for use in GBS testing include the CDC Guidelines (Centers for Disease Control and Prevention. Prevention of Prenatal Group B Streptococcal Disease: Revised Guideline from CDC. Prevention, revised guidelines from CDC) Determine the necessity of antibiotic treatment during labor as described in Morbidity and Mortality Weekly Report, August 16, 2002; 51 (No. RR-11); 1-24) To do this, a rapid screening test in prenatal care regimens for obstetric patients is included. This test can produce rapid results in a central laboratory with rapid turnaround services at the time of nursing or during the delivery and postpartum stages of obstetric patients. This test can also be used to detect GBS DNA in vaginal or rectal samples of any subject suspected of having GBS infection. A. Burns, Brian N. Johnson, Sundaresh N. Brahmasandra, Kalyan Handique, James R. Webster, Madhavi Krishnan, Timothy S. Sammarco, Piu M. Man, Darren Jones, Dylan Heldsinger, Carlos H. Mastrangelo, David T. Burke See also "An Integrated Nanoliter DNA Analysis Device" Science, Vol. 282, 16 October 1998.
検査アプリケーションの説明
疾病管理及び防止センタは、陣痛及び分娩中における予防用抗生物質の必要性を判断するために、妊娠期間35〜37週の全ての女性の膣/直腸GBS定着について全般的な出生前診査を推奨する。現在のCDC推奨は、培養に基づく検査方法(標準的培養方法)であり、通例、48〜72時間で結果が得られるが、それと比較して、本検査では約30分で済む。本検査は、CAMP係数をエンコードする、確立した特定シーケンスであるGBSゲノムにおけるcfb遺伝子を特定するために、自動化したサンプル準備及びリアル・タイムPCRを利用することができる。CAMP係数は、GBS分離菌内に通例存在する余分な細胞蛋白質である。CAMP係数は、培養方法による臨床サンプルにおけるGBSバクテリアの推定特定に用いることができる。この検査は、実験室の手順にはさほど訓練されていない臨床家によって、患者の近くに設定して行うことができる。GBS検査のために継続して品質保証を行うために、ユーザ・インターフェースにQCルーチンを組み込むことができる。また、産科が要求する時間枠以内にサンプル検査が行われるのであれば、検査は中央病院の「stat」実験室で行うこともできる。
Testing Application Description The Disease Management and Prevention Center is responsible for the general birth of vaginal / rectal GBS colonization in all women between 35 and 37 weeks of gestation to determine the need for prophylactic antibiotics during labor and delivery. Prior examination is recommended. The current CDC recommendation is a culture-based test method (standard culture method), which typically yields results in 48-72 hours, compared to approximately 30 minutes for this test. This test can utilize automated sample preparation and real-time PCR to identify the cfb gene in the GBS genome, an established specific sequence that encodes CAMP coefficients. The CAMP coefficient is an extra cellular protein that is typically present in GBS isolates. The CAMP coefficient can be used to estimate and identify GBS bacteria in clinical samples by culture methods. This test can be set up close to the patient by a clinician who is not well trained in laboratory procedures. A QC routine can be incorporated into the user interface to provide continuous quality assurance for GBS inspection. Also, if the sample test is performed within the time frame required by the obstetrics, the test can be performed in the “stat” laboratory at the central hospital.
可能性のある禁忌
GBS検査は、被検物収集スワブに含有するポリエステルに対してアレルギのあるヒトには、禁忌を示す場合がある。
Possible contraindications GBS tests may be contraindicated in humans who are allergic to the polyester contained in the specimen collection swab.
警告及び注意の例
ここの警告は、実施例13に示した一般的な応用のそれらに追加するとよい。
・GBS検査は、ペニシリンにアレルギがある女性に推奨される罹患性結果を与えない場合がある。
・IV抗生物質は通例分娩の少なくとも4時間前に開始する必要があり、そして分娩前GBSデータがない状態では、患者が病院の陣痛及び分娩区域に入ったら直ちにサンプルを収集して、GBS検査を開始することが重要となることがある。
・実施形態によっては、患者が現在抗生物質で治療を受けている場合、検査は疾病状態の指標にしては信頼性が低くなる場合もある。
・緩衝液は、防腐剤としてアジ化ナトリウムを含有する場合がある。摂取すると、健康被害が出る。
・通例、サンプリング及び緩衝液内の蓄積から、例えば、8時間以内に被検物を検査する。被検物を保管しなければならない状況では、4Cにおいて24時間までの期間での冷蔵を用いるとよい。
・通例、有効期限が切れた検査材料の使用を回避する。
・通例、サンプルを注入する準備ができた後まで、カートリッジの開封を回避する。通例、保護用メタライズ・バッグを開封した場合、カートリッジの使用を回避する。実施形態によっては、光、空気、及び水分に晒すと、試薬が劣化する可能性がある。
・通例、検査キットに備えられているスワブ、シリンジ、及び緩衝液を用いる。実施形態によっては、GBS収集スワブの別のブランドでは、検査性能が阻害される可能性がある。
・通例、材料の使用は1回に限る。材料を再利用すると、誤った結果が得られる場合がある。
・検査の準備ができるまで、カートリッジのパッケージを開封するのを回避する。内蔵試薬は、光及び水分に感応する可能性がある。パッケージの封止が破れており、箔パウチがもはや伸びない(膨れている)場合、使用を回避する。
Examples of warnings and cautions The warnings here may be added to those of the general application shown in Example 13.
• GBS testing may not give the recommended susceptibility results for women with allergies to penicillin.
IV antibiotics usually need to be started at least 4 hours before delivery, and in the absence of pre-delivery GBS data, samples should be collected as soon as the patient enters the hospital labor and delivery area and a GBS test is performed. It may be important to start.
In some embodiments, if the patient is currently being treated with antibiotics, the test may be less reliable as an indicator of disease state.
-The buffer may contain sodium azide as a preservative. Ingestion causes health damage.
Typically, test specimens within 8 hours of sampling and accumulation in buffer, for example. In situations where the specimen must be stored, refrigeration for up to 24 hours at 4C may be used.
• In general, avoid using test materials that have expired.
Typically, avoid opening the cartridge until after you are ready to inject the sample. Typically, avoid using cartridges when opening a protective metallization bag. In some embodiments, exposure to light, air, and moisture can degrade the reagent.
-Typically, swabs, syringes, and buffers provided in the test kit are used. In some embodiments, other brands of GBS collection swabs may hamper test performance.
・ Usually, the material is used only once. Reusing materials may give incorrect results.
• Avoid unpacking cartridge packages until ready for inspection. Built-in reagents can be sensitive to light and moisture. Avoid using if the package seal is broken and the foil pouch no longer stretches (swells).
サンプル収集キットの例
A.スワブ
B.サンプル収集緩衝液を収容するチューブ
C.カニューレ先端
D.シリンジ(例えば、3cc)
E.シリンジ・フィルタ
F.GBS微小流体カートリッジ
Example of Sample Collection Kit A. Swab C. Tube containing sample collection buffer. Cannula tip Syringe (eg 3cc)
E. Syringe filter F.F. GBS microfluidic cartridge
被検物収集及び緩衝液懸濁指令の例
・注意:通例、収集キットのみを用いる。スワブの端部に指で触れるのを避ける。
・容器からスワブを取り出す。
・過剰な膣分泌物を拭い去る。
・スワブを2cm膣(膣)に挿入する。
・同じスワブを1cm肛門(直腸)に挿入する。
・サンプル緩衝液(B)の小瓶が期限切れでないことを確認する。
・スワブ(A)を、緩衝液を収容した小瓶の中に浸漬して20回上下に激しく振る。
・スワブを取り出し破棄する。
・患者のID情報を小瓶に記す。
Sample collection and buffer suspension instructions • Caution: Typically, only the collection kit is used. Avoid touching the end of the swab with your finger.
・ Remove the swab from the container.
• Wipe away excess vaginal discharge.
-Insert the swab into the 2cm vagina (vagina).
Insert the same swab into the 1 cm anus (rectum).
Confirm that the vial of sample buffer (B) has not expired.
-Swab (A) is immersed in a small bottle containing a buffer solution and shaken vigorously up and down 20 times.
・ Remove the swab and discard it.
・ Put patient ID information in a small bottle.
検査用サンプル準備の例
・カニューレ先端(C)をシリンジ(D)に取り付けることができる。
・サンプルの一部又は全部をシリンジの中に引き込む。
・加えて、空気(例えば、2ml)も引き込んでもよい。
・カニューレ先端(C)をフィルタ(E)と交換してもよい。
・パッケージ上に印されている開封箇所から、カートリッジ・パッケージを開封することができる。
・サンプル小瓶(B)及びカートリッジ(F)のバーコードを、システム・スキャナによって走査することができる。材料が期限切れの場合、システムは警告するとよい。
・必要であれば、患者識別情報を入力することができる。
・カートリッジを平坦な表面に置くか、ルアーを用いて直立姿勢で平坦に保持する。通例、手順の間カートリッジのラベル側が上向きになっていることを確認する。
・シリンジ/フィルタ・アセンブリを用いてサンプル(過剰な空気を含む)をカートリッジに注入することができる。弱い注入圧力を用いると、サンプルからの跳ね返りを避けることができる。
・シリンジ/フィルタ・アセンブリをカートリッジから取り外すことができる。
・サンプル室内部にあるペレットが溶解し混合するまで、約10回カートリッジを横に軽く揺することができる。
・カートリッジをシステム上に置くことができる。
・システムのカバーを閉じ、ハンドルを下方位置で固定することができる(検査が自動的に開始してもよい)。
Example of sample preparation for inspection-Cannula tip (C) can be attached to syringe (D).
• Draw some or all of the sample into the syringe.
In addition, air (eg 2 ml) may be drawn in.
-The cannula tip (C) may be replaced with a filter (E).
-The cartridge package can be opened from the opening marked on the package.
The sample vial (B) and cartridge (F) barcodes can be scanned by the system scanner. The system should warn if the material has expired.
-Patient identification information can be entered if necessary.
• Place the cartridge on a flat surface or hold it flat in an upright position using a lure. As a rule, make sure that the label side of the cartridge is facing up during the procedure.
A sample (including excess air) can be injected into the cartridge using a syringe / filter assembly. If a weak injection pressure is used, rebound from the sample can be avoided.
The syringe / filter assembly can be removed from the cartridge.
-The cartridge can be shaken lightly about 10 times until the pellet in the sample chamber is dissolved and mixed.
A cartridge can be placed on the system.
• The system cover can be closed and the handle can be locked in the down position (testing may begin automatically).
結果
検査が完了したとき、結果を明確に表示するとよい。結果は、実験手順で決定した通りに、印刷又は格納することができる。
Results When inspection is complete, the results should be clearly displayed. Results can be printed or stored as determined by experimental procedures.
材料の処分例
カートリッジ及び収集キットは、生物的有害物質として扱わなければならない。
推奨する実験室品質管理ルーチンの例
Material disposal examples Cartridges and collection kits must be treated as biologically hazardous substances.
Recommended laboratory quality control routine examples
検査検証の例
1週間毎に、(1)陽性外部対照及び(1)陰性外部対照を実行することができる。QCを、システムの総合システム性能を確認するように設定する。この手順は、新たなユーザを訓練する場合にも推奨する。
Example of test validation Every week, (1) a positive external control and (1) a negative external control can be performed. Set QC to check the overall system performance of the system. This procedure is also recommended when training new users.
品質管理ルーチン指令の例
表示画面上で、指令通りに、サンプルを走らせる(run)ことができる。QC検査で、予期した結果を得ることができなかった場合、製造業者に連絡することができる。
外部陽性対照は、実行時にサンプル収集緩衝液によって復元したストレプトコッカス・アガラクチエ(GBS)細胞の凍結乾燥標本を含むことができる。外部陽性対照内にあるGBS細胞の数は、検査の最大検出可能限界(MDL)にほぼ等しくするとよい。
また、品質管理検査の例には、実施例14において説明した、システム自己検査QCも含む。
Example of quality control routine command You can run the sample as per the command on the display screen. If the QC test fails to achieve the expected result, the manufacturer can be contacted.
External positive controls can include lyophilized specimens of Streptococcus agalactie (GBS) cells reconstituted with sample collection buffer at run time. The number of GBS cells in the external positive control may be approximately equal to the maximum detectable limit (MDL) of the test.
The example of the quality control inspection includes the system self-inspection QC described in the fourteenth embodiment.
内部対照(カートリッジ上)の例
分析用の典型的な試薬は、ユーザの取扱謝りや汚染の潜在性を低減するために、カートリッジに含めるとよい。2種類のカートリッジ上陽性及び陰性対照方策を、各微小流体カートリッジ内に組み込み、個々のPCR分析実施過程を監視することができる。
GBS用陽性内部対照プラスミドの一例は、cfb遺伝子からの順方向及び逆方向シーケンスが側面に位置する(flank)一意の39bp人工DNAシーケンスから成る96bp領域を含有する二重鎖円形DNA分子であり、この一意のシーケンスに特定的な第2の別個の蛍光原プローブと共に、凍結乾燥マスタ・ミックス(master mix)に含めることができる。陽性GBSサンプルがない状態で、内部対照シーケンスを増幅できない場合、試薬混合の失敗又は被検物におけるPCRインヒビタの存在を示す可能性がある。
Example of Internal Control (On Cartridge) Typical reagents for analysis may be included in the cartridge to reduce user gratitude and potential for contamination. Two on-cartridge positive and negative control strategies can be incorporated into each microfluidic cartridge to monitor the individual PCR analysis performance.
An example of a positive internal control plasmid for GBS is a double stranded circular DNA molecule containing a 96 bp region consisting of a unique 39 bp artificial DNA sequence flanked by forward and reverse sequences from the cfb gene; Along with a second separate fluorogenic probe specific for this unique sequence, it can be included in the lyophilized master mix. Failure to amplify the internal control sequence in the absence of a positive GBS sample may indicate a reagent mix failure or the presence of a PCR inhibitor in the specimen.
GBS DNA検出のためのリアル・タイムPCRの例
この検査は、臨床サンプルから復元したBGSのcfb遺伝子シーケンスの増幅のために、リアル・タイム・ポリメラーゼ連鎖反応(PCR)を利用することができる。増幅したDNAの検出には、蛍光原特定Tacman(商標)プローブを用いることができる。cfb遺伝子は、CAMP係数をエンコードし、GBS分離菌の中に通例存在する拡散可能な細胞外蛋白質を分離する。グループBストレプトコッカス(GBS)検出検査は、核酸増幅分析の一体型の、原料−サンプル−結果型とするとよい。この分析のための典型的な試薬をカートリッジに含めれば、ユーザの取扱謝りや相互汚染の潜在性を低減することができる。
Example of Real Time PCR for GBS DNA Detection This test can utilize real time polymerase chain reaction (PCR) for amplification of BGS cfb gene sequences reconstructed from clinical samples. For detection of amplified DNA, a fluorogen specific Tacman ™ probe can be used. The cfb gene encodes a CAMP coefficient and isolates a diffusible extracellular protein that is typically present in GBS isolates. The Group B Streptococcus (GBS) detection test may be an integrated, raw material-sample-result type of nucleic acid amplification analysis. If typical reagents for this analysis are included in the cartridge, the user's appreciation and the potential for cross-contamination can be reduced.
可能な検査制限の例
実施形態によっては、検査システムは、膣及び/又は直腸被検物以外の被検物におけるGBS DNAを特定する適格性がない場合がある。例えば、実施形態によっては、尿及び血液の被検物は適していない場合がある。
実施形態によっては、抗生物質の治療を受けている患者は、正しいGBS診断が得られない場合もある。
実施形態によっては、微生物学者によるバクテリアの直接的な識別に適したGBS培養が、本検査から得られない場合もある。
Examples of possible test restrictions In some embodiments, a test system may not be eligible to identify GBS DNA in a subject other than a vaginal and / or rectal subject. For example, in some embodiments, urine and blood specimens may not be suitable.
In some embodiments, patients undergoing antibiotic treatment may not have a correct GBS diagnosis.
In some embodiments, a GBS culture suitable for direct identification of bacteria by a microbiologist may not be obtained from this test.
性能特性及び解釈の例
妊娠中の女性の10〜30%に、GBSが定着している(colonize)。GBS定着のカットオフ(cut-off)は、cfb遺伝子シーケンスの増幅によって判定したDNA/サンプルの約1000コピーであると定めれらている。結果の解釈のための判断基準例の適用について、ユーザは図71のフロー・チャートを参照すること。この場合、問題のターゲットはGBS及びICプラスミドである。
Examples of performance characteristics and interpretation GBS colonizes 10-30% of pregnant women. The cut-off of GBS colonization has been determined to be about 1000 copies of DNA / sample determined by amplification of the cfb gene sequence. Refer to the flow chart in FIG. 71 for the application of the example criteria for interpreting the results. In this case, the targets in question are GBS and IC plasmids.
可能な妨害物質の例
実施形態によっては、尿又は膣分泌物、あるいは粘液が大量に存在すると、検査を妨害する場合がある。
ある実施形態では、サンプルの血液、胎便、羊水汚染は、通例、検査を妨害する可能性はない。
ある実施形態では、抗生物質以外の薬剤の妨害(膣及び直腸分泌物に存在するような)は、この時点では、通例PCRを妨害することは知られていない。
Examples of possible interfering substances In some embodiments, the presence of large amounts of urine or vaginal secretions or mucus may interfere with the test.
In certain embodiments, sample blood, meconium, amniotic fluid contamination typically does not interfere with the test.
In certain embodiments, interference with drugs other than antibiotics (as present in vaginal and rectal secretions) is not known to interfere with PCR typically at this point.
結果の解釈及び期待値の例
妊娠中の女性の10〜30%に、GBSが定着している。GBS定着のカットオフ(cut-off)は、cfb遺伝子シーケンスの増幅によって判定したDNA/サンプルの約1000コピーであると定められている。
PCR反応は、GBS及び内部対照に対して陽性又は陰性として解釈することができる。サンプルが陽性又は陰性か、あるいは不確定か決定するために、論理アルゴリズムを用いてもよい。
Interpretation of results and example of expected values GBS are established in 10-30% of pregnant women. The cut-off of GBS colonization is defined as approximately 1000 copies of DNA / sample determined by amplification of the cfb gene sequence.
PCR reactions can be interpreted as positive or negative relative to GBS and internal controls. A logical algorithm may be used to determine whether a sample is positive or negative or indeterminate.
この中で引用した各引例は、引用したことによりその全体が本願にも含まれることとし、米国特許第6,057,149号、第6,048,734号、第6,130,098号、第6,271,021号、第6,911,183号、第CA2,294,819号、第6,575,188号、第6,692,700号、第6,852,287号、及びカナダ特許出願第CA2,294,819号を含む。 Each reference cited therein is incorporated herein by reference in its entirety, and U.S. Pat. Nos. 6,057,149, 6,048,734, 6,130,098, 6,271,021, 6,911,183, CA 2,294,819, 6,575,188, 6,692,700, 6,852,287, and Canada Including Patent Application No. CA2,294,819.
以上、本技術の多数の実施形態について説明した。しかしながら、本技術の主旨及び範囲から逸脱することなく、種々の修正が可能であることは言うまでもない。したがって、他の実施形態も、以下の特許請求の範囲に該当するものとする。 The numerous embodiments of the present technology have been described above. However, it will be appreciated that various modifications may be made without departing from the spirit and scope of the present technology. Accordingly, other embodiments are also within the scope of the following claims.
Claims (12)
第1のPCR反応室と、
第2のPCR反応室と、
基板上に第1のサンプルを受け取るための第1のサンプルポートであって、第1のPCR反応室との間で流体が移動可能な第1のサンプルポートと、
基板上に第2のサンプルを受け取るための第2のサンプルポートであって、第2のPCR反応室との間で流体が移動可能な第2のサンプルポートと、
第1のPCR反応室との間で流体が移動可能な第1の出口と、
第2のPCR反応室との間で流体が移動可能な第2の出口と、
第1のサンプルポート及び第1の出口と第1のPCR反応室とを分離するための微小流体用の第1の組のバルブと、
第2のサンプルポート及び第2の出口と第2のPCR反応室とを分離するための微小流体用の第2の組のバルブと
を備え、
第1及び第2の組のバルブによる分離によって、第1及び第2のPCR反応室から及びこれらPCR反応室への液体の移動を阻止し、
第1及び第2のPCR反応室、第1及び第2のサンプルポート、第1及び第2の出口、並びに、第1及び第2の組のバルブは、基板上に構成され、
第1の組のバルブは、第2の組のバルブと独立して動作する、
ことを特徴とする微小流体用のカートリッジ。 A microfluidic cartridge comprising a microfluidic substrate , the microfluidic substrate comprising :
A first PCR reaction chamber;
A second PCR reaction chamber;
A first sample port for receiving a first sample on the substrate, wherein the fluid is movable between the first sample reaction chamber and the first PCR reaction chamber;
A second sample port for receiving a second sample on the substrate, wherein the fluid is movable between the second sample reaction chamber and the second PCR reaction chamber;
A first outlet through which fluid can move between the first PCR reaction chamber;
A second outlet through which fluid can move to and from the second PCR reaction chamber;
A first set of valves for microfluidics for separating the first sample port and the first outlet from the first PCR reaction chamber;
A second set of valves for microfluidic for separating the second sample port and the second outlet from the second PCR reaction chamber;
The separation by the first and second sets of valves prevents liquid migration from and into the first and second PCR reaction chambers;
The first and second PCR reaction chambers, the first and second sample ports, the first and second outlets, and the first and second sets of valves are configured on the substrate,
The first set of valves operates independently of the second set of valves;
A cartridge for microfluids characterized by the above.
複数のサンプル・レーンであって、各々が相互に流体が移動可能なネットワークを構成している複数のサンプル・レーンを備え、サンプル・レーンの各々が、
基板上にサンプルを受け取るためのサンプルポートと、
出口孔と、
第1及び第2のバルブと、
サンプルポートから第1のバルブを介してPCR反応室に延びる第1のチャネルと、
PCR反応室から第2のバルブを介して出口孔に延びる第2のチャネルと
を備え、
第1及び第2のバルブは、PCR反応室への流体の移動又はPCR反応室からの流体の移動を阻止するように、サンプルポート及び出口孔とPCR反応室とを分離するよう構成され、
PCR反応室、第1及び第2のバルブ、サンプルポート、出口孔、第1及び第2のチャネルは、基板上に構成され、
第1のバルブは、第1のバルブ以外のバルブと独立して動作し、それにより、前記サンプル・レーンは、互いに独立である、
ことを特徴とする微小流体用のカートリッジ。 A microfluidic cartridge comprising a microfluidic substrate , the microfluidic substrate comprising :
A plurality of sample lanes, comprising a plurality of sample lanes, each of which constitutes a fluid which is movable network to each other, each sample lane,
A sample port for receiving the sample on the substrate;
An exit hole,
First and second valves;
A first channel extending from the sample port via a first valve to the PCR reaction chamber;
A second channel extending from the PCR reaction chamber through the second valve to the outlet hole,
The first and second valves are configured to separate the sample port and outlet hole and the PCR reaction chamber so as to prevent fluid movement to or from the PCR reaction chamber,
The PCR reaction chamber, the first and second valves, the sample port, the outlet hole, the first and second channels are configured on the substrate,
The first valve operates independently of valves other than the first valve, so that the sample lanes are independent of each other.
A cartridge for microfluids characterized by the above.
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US78600706P | 2006-03-24 | 2006-03-24 | |
| US60/786,007 | 2006-03-24 | ||
| US85928406P | 2006-11-14 | 2006-11-14 | |
| US60/859,284 | 2006-11-14 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009502930A Division JP5415253B2 (en) | 2006-03-24 | 2007-03-26 | Integrated system for processing microfluidic samples and methods of use thereof |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014043807A Division JP5981473B2 (en) | 2006-03-24 | 2014-03-06 | Integrated system for processing microfluidic samples and methods of use thereof |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2012055321A JP2012055321A (en) | 2012-03-22 |
| JP6265581B2 true JP6265581B2 (en) | 2018-01-24 |
Family
ID=38541746
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009502930A Active JP5415253B2 (en) | 2006-03-24 | 2007-03-26 | Integrated system for processing microfluidic samples and methods of use thereof |
| JP2011275368A Active JP6265581B2 (en) | 2006-03-24 | 2011-12-16 | Integrated system for processing microfluidic samples and methods of use thereof |
| JP2014043807A Active JP5981473B2 (en) | 2006-03-24 | 2014-03-06 | Integrated system for processing microfluidic samples and methods of use thereof |
| JP2016086245A Active JP6385387B2 (en) | 2006-03-24 | 2016-04-22 | Integrated system for processing microfluidic samples and methods of use thereof |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009502930A Active JP5415253B2 (en) | 2006-03-24 | 2007-03-26 | Integrated system for processing microfluidic samples and methods of use thereof |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014043807A Active JP5981473B2 (en) | 2006-03-24 | 2014-03-06 | Integrated system for processing microfluidic samples and methods of use thereof |
| JP2016086245A Active JP6385387B2 (en) | 2006-03-24 | 2016-04-22 | Integrated system for processing microfluidic samples and methods of use thereof |
Country Status (6)
| Country | Link |
|---|---|
| US (9) | US9040288B2 (en) |
| EP (2) | EP3088083B1 (en) |
| JP (4) | JP5415253B2 (en) |
| DK (2) | DK3088083T3 (en) |
| ES (2) | ES2692380T3 (en) |
| WO (1) | WO2007112114A2 (en) |
Families Citing this family (282)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6048734A (en) | 1995-09-15 | 2000-04-11 | The Regents Of The University Of Michigan | Thermal microvalves in a fluid flow method |
| US6692700B2 (en) | 2001-02-14 | 2004-02-17 | Handylab, Inc. | Heat-reduction methods and systems related to microfluidic devices |
| US6852287B2 (en) | 2001-09-12 | 2005-02-08 | Handylab, Inc. | Microfluidic devices having a reduced number of input and output connections |
| US7010391B2 (en) | 2001-03-28 | 2006-03-07 | Handylab, Inc. | Methods and systems for control of microfluidic devices |
| US7323140B2 (en) | 2001-03-28 | 2008-01-29 | Handylab, Inc. | Moving microdroplets in a microfluidic device |
| US8895311B1 (en) | 2001-03-28 | 2014-11-25 | Handylab, Inc. | Methods and systems for control of general purpose microfluidic devices |
| US7829025B2 (en) | 2001-03-28 | 2010-11-09 | Venture Lending & Leasing Iv, Inc. | Systems and methods for thermal actuation of microfluidic devices |
| EP1631496B1 (en) | 2003-04-28 | 2014-02-26 | Medical Instill Technologies, Inc. | Container with valve assembly for filling and dispensing substances, and apparatus and method for filling |
| JP4996248B2 (en) | 2003-07-31 | 2012-08-08 | ハンディーラブ インコーポレイテッド | Processing of particle-containing samples |
| EP1745153B1 (en) | 2004-05-03 | 2015-09-30 | Handylab, Inc. | Processing polynucleotide-containing samples |
| US8852862B2 (en) | 2004-05-03 | 2014-10-07 | Handylab, Inc. | Method for processing polynucleotide-containing samples |
| US20070137062A1 (en) * | 2005-07-05 | 2007-06-21 | Eck Gary A | Increased Negative Static Pressure Drying |
| KR20080096567A (en) | 2006-02-03 | 2008-10-30 | 마이크로칩 바이오테크놀로지스, 인크. | Microfluidic devices |
| ES2692380T3 (en) | 2006-03-24 | 2018-12-03 | Handylab, Inc. | Method to perform PCR with a cartridge with several tracks |
| US8883490B2 (en) | 2006-03-24 | 2014-11-11 | Handylab, Inc. | Fluorescence detector for microfluidic diagnostic system |
| US8088616B2 (en) | 2006-03-24 | 2012-01-03 | Handylab, Inc. | Heater unit for microfluidic diagnostic system |
| US11806718B2 (en) | 2006-03-24 | 2023-11-07 | Handylab, Inc. | Fluorescence detector for microfluidic diagnostic system |
| US7998708B2 (en) | 2006-03-24 | 2011-08-16 | Handylab, Inc. | Microfluidic system for amplifying and detecting polynucleotides in parallel |
| US10900066B2 (en) | 2006-03-24 | 2021-01-26 | Handylab, Inc. | Microfluidic system for amplifying and detecting polynucleotides in parallel |
| US7966746B2 (en) * | 2006-04-24 | 2011-06-28 | Medical Instill Technologies, LLC | Needle penetrable and laser resealable lyophilization method |
| WO2008061165A2 (en) | 2006-11-14 | 2008-05-22 | Handylab, Inc. | Microfluidic cartridge and method of making same |
| JP2008167722A (en) * | 2007-01-15 | 2008-07-24 | Konica Minolta Medical & Graphic Inc | Nucleic acid isolation method by heating on magnetic support |
| US20080212643A1 (en) * | 2007-03-02 | 2008-09-04 | Mcgahhey D David | Temperature monitoring device |
| WO2008109878A2 (en) * | 2007-03-07 | 2008-09-12 | California Institute Of Technology | Testing device |
| CN101678356B (en) | 2007-04-06 | 2014-04-16 | 加利福尼亚技术学院 | Microfluidic device |
| EP2175999B1 (en) | 2007-06-21 | 2017-01-04 | Gen-Probe Incorporated | Receptacles for use in performing processes |
| US8133671B2 (en) | 2007-07-13 | 2012-03-13 | Handylab, Inc. | Integrated apparatus for performing nucleic acid extraction and diagnostic testing on multiple biological samples |
| US8287820B2 (en) | 2007-07-13 | 2012-10-16 | Handylab, Inc. | Automated pipetting apparatus having a combined liquid pump and pipette head system |
| USD621060S1 (en) | 2008-07-14 | 2010-08-03 | Handylab, Inc. | Microfluidic cartridge |
| AU2008276211B2 (en) | 2007-07-13 | 2015-01-22 | Handylab, Inc. | Polynucleotide capture materials, and methods of using same |
| US20090136385A1 (en) | 2007-07-13 | 2009-05-28 | Handylab, Inc. | Reagent Tube |
| US9618139B2 (en) | 2007-07-13 | 2017-04-11 | Handylab, Inc. | Integrated heater and magnetic separator |
| US8182763B2 (en) | 2007-07-13 | 2012-05-22 | Handylab, Inc. | Rack for sample tubes and reagent holders |
| US9186677B2 (en) | 2007-07-13 | 2015-11-17 | Handylab, Inc. | Integrated apparatus for performing nucleic acid extraction and diagnostic testing on multiple biological samples |
| US8105783B2 (en) | 2007-07-13 | 2012-01-31 | Handylab, Inc. | Microfluidic cartridge |
| GB0715170D0 (en) * | 2007-08-03 | 2007-09-12 | Enigma Diagnostics Ltd | Reaction vessel |
| GB0715171D0 (en) * | 2007-08-03 | 2007-09-12 | Enigma Diagnostics Ltd | Sample processor |
| EP2178640A1 (en) * | 2007-08-03 | 2010-04-28 | Enigma Diagnostics Limited | Reaction vessel |
| CN104297507B (en) * | 2007-10-02 | 2017-10-10 | 赛拉诺斯股份有限公司 | Modular point-of-care devices and its application |
| GB2466398B (en) * | 2007-10-17 | 2012-09-05 | Agilent Technologies Inc | Measurement device with motion-triggered data exchange |
| US8021039B2 (en) * | 2007-11-07 | 2011-09-20 | Frank Amato | Quality control material monitor |
| JP5311801B2 (en) * | 2007-11-09 | 2013-10-09 | キヤノン株式会社 | Liquid feed drive mechanism using osmotic pressure pump and microchip having the liquid feed drive mechanism |
| US7847932B2 (en) * | 2007-12-28 | 2010-12-07 | Morpho Detection, Inc. | System and method for improved biodetection |
| US7852470B2 (en) * | 2007-12-28 | 2010-12-14 | Morpho Detection, Inc. | System and method for improved biodetection |
| US20090168592A1 (en) * | 2007-12-28 | 2009-07-02 | Michael Craig Burrell | Agitator for portable substance identification system and method |
| US8152494B2 (en) * | 2008-02-12 | 2012-04-10 | Gene Parunak | Methods and systems for fluid control |
| WO2009110473A1 (en) * | 2008-03-03 | 2009-09-11 | 学校法人 埼玉医科大学 | Method of distinguishing inflammatory pathogen causing acute respiratory infection |
| WO2010005444A1 (en) * | 2008-07-11 | 2010-01-14 | Handylab, Inc. | Polynucleotide capture materials, and methods of using same |
| USD618820S1 (en) | 2008-07-11 | 2010-06-29 | Handylab, Inc. | Reagent holder |
| USD787087S1 (en) | 2008-07-14 | 2017-05-16 | Handylab, Inc. | Housing |
| US11235323B2 (en) | 2008-08-27 | 2022-02-01 | Life Technologies Corporation | Apparatus for and method of processing biological samples |
| DK2331954T3 (en) * | 2008-08-27 | 2020-04-06 | Life Technologies Corp | APPARATUS AND PROCEDURE FOR PROCESSING BIOLOGICAL SAMPLES |
| EP2344620B1 (en) * | 2008-10-06 | 2014-05-28 | Mohr, Ulrich | Culture/exposure device for cell and/or bacteria cultures |
| US8247191B2 (en) * | 2008-11-13 | 2012-08-21 | Ritzen Kalle | Disposable cassette and method of use for blood analysis on blood analyzer |
| JP5245788B2 (en) * | 2008-12-12 | 2013-07-24 | 株式会社島津製作所 | Reaction processing equipment |
| US20100159498A1 (en) * | 2008-12-19 | 2010-06-24 | Ritzen Kalle | Blood analyzer with a blood cell sedimentation control mechanism and method of use |
| CA2750900C (en) * | 2009-01-30 | 2017-03-28 | Gen-Probe Incorporated | Systems and methods for detecting a signal and applying thermal energy to a signal transmission element |
| WO2010091246A2 (en) * | 2009-02-06 | 2010-08-12 | Northwestern University | Burstable liquid packaging and uses thereof |
| WO2010091400A2 (en) * | 2009-02-09 | 2010-08-12 | Frederic Zenhausern | Improvements in and relating to analysis |
| US9057064B1 (en) * | 2009-02-25 | 2015-06-16 | Ag-Defense Systems, Inc. | Method and apparatus for extracting DNA from a biological sample |
| CN101881782B (en) * | 2009-05-08 | 2016-02-24 | 深圳迈瑞生物医疗电子股份有限公司 | Samples in biochemical analyzer loading attachment and method |
| EP2437887B1 (en) | 2009-06-04 | 2016-05-11 | Lockheed Martin Corporation | Multiple-sample microfluidic chip for dna analysis |
| BRPI1010169A2 (en) | 2009-06-05 | 2016-03-29 | Integenx Inc | system that fits within a housing of no more than 10 ft3, cartridge, computer readable article, method, system configured to perform a method, optical system, instrument and device. |
| US8273300B2 (en) * | 2009-07-09 | 2012-09-25 | Siemens Medical Solutions Usa, Inc. | Modular system for radiosynthesis with multi-run capabilities and reduced risk of radiation exposure |
| US8435454B2 (en) * | 2009-07-09 | 2013-05-07 | Siemens Medical Solutions Usa, Inc. | Modular system for radiosynthesis with multi-run capabilities and reduced risk of radiation exposure |
| US9475049B2 (en) | 2009-07-31 | 2016-10-25 | Invisible Sentinel, Inc. | Analyte detection devices, multiplex and tabletop devices for detection of analyte, and uses thereof |
| AU2009352527B2 (en) * | 2009-09-12 | 2014-04-03 | Azure Vault Ltd. | Identifying transition points in chemical reactions |
| US8696991B1 (en) * | 2010-01-04 | 2014-04-15 | Harold W. Howe | Field deployable surface plasmon resonance based biosensor |
| US9329173B2 (en) * | 2010-01-07 | 2016-05-03 | Sensor-Kinesis Corporation | Method and apparatus for forming of an automated sampling device for the detection of Salmonella enterica utilizing an electrochemical aptamer biosensor |
| US9310363B2 (en) * | 2010-01-07 | 2016-04-12 | Sensor-Kinesis Corporation | Method and apparatus for forming of an automated sampling device for the detection of salmonella enterica utilizing an electrochemical aptamer biosensor |
| AU2011216253B2 (en) * | 2010-02-12 | 2015-07-02 | Northwestern University | Assay card for sample acquisition, treatment and reaction |
| EP2539719B1 (en) | 2010-02-23 | 2019-12-25 | Rheonix, Inc. | Self-contained biological assay apparatus, methods, and applications |
| AU2016200080B2 (en) * | 2010-03-09 | 2017-10-26 | Ande Corporation | Unitary biochip providing sample-in to results-out processing and methods of manufacture |
| US8720036B2 (en) | 2010-03-09 | 2014-05-13 | Netbio, Inc. | Unitary biochip providing sample-in to results-out processing and methods of manufacture |
| JP5815572B2 (en) * | 2010-03-09 | 2015-11-17 | ネットバイオ・インコーポレーテッドNetBio, Inc. | Single structure biochip and manufacturing method providing process from sample introduction to result output |
| KR101368463B1 (en) * | 2010-04-23 | 2014-03-03 | 나노바이오시스 주식회사 | Device for amplify nucleic acid comprising two heating block |
| EP2409765A1 (en) * | 2010-07-21 | 2012-01-25 | F. Hoffmann-La Roche AG | Microfluidic system and process for mixing liquid fluids |
| JP2013535193A (en) * | 2010-07-23 | 2013-09-12 | ベックマン コールター, インコーポレイテッド | System and method including an analyzer |
| WO2012018891A2 (en) | 2010-08-03 | 2012-02-09 | Drexel University | Materials for disinfection produced by non-thermal plasma |
| WO2012024658A2 (en) | 2010-08-20 | 2012-02-23 | IntegenX, Inc. | Integrated analysis system |
| GB201016014D0 (en) * | 2010-09-24 | 2010-11-10 | Epistem Ltd | Thermal cycler |
| CA2814720C (en) | 2010-10-15 | 2016-12-13 | Lockheed Martin Corporation | Micro fluidic optic design |
| GB2484735B (en) * | 2010-10-22 | 2014-12-31 | Fathy A A Hasan | Blood typing instrument and method |
| WO2012058420A1 (en) * | 2010-10-27 | 2012-05-03 | The Board Of Trustees Of The University Of Illinois | Health diagnostic compact disc |
| US8663974B2 (en) * | 2010-12-23 | 2014-03-04 | Claremont Biosolutions Llc | Compositions and methods for capture and elution of biological materials via particulates |
| JP6087293B2 (en) * | 2011-01-06 | 2017-03-01 | メソ スケール テクノロジーズ エルエルシー | Assay cartridge and method of using the same |
| TWI748368B (en) | 2011-01-21 | 2021-12-01 | 美商拉布拉多診斷有限責任公司 | Systems and methods for sample use maximization |
| US9469871B2 (en) * | 2011-04-14 | 2016-10-18 | Corporos Inc. | Methods and apparatus for point-of-care nucleic acid amplification and detection |
| AU2012242510B2 (en) | 2011-04-15 | 2015-05-14 | Becton, Dickinson And Company | Scanning real-time microfluidic thermocycler and methods for synchronized thermocycling and scanning optical detection |
| EP2527814A1 (en) * | 2011-04-27 | 2012-11-28 | Koninklijke Philips Electronics N.V. | Sensor system with an exchangeable cartridge and a reader |
| US9435765B2 (en) | 2011-07-22 | 2016-09-06 | Tecan Trading Ag | Cartridge and system for manipulating samples in liquid droplets |
| US8470153B2 (en) * | 2011-07-22 | 2013-06-25 | Tecan Trading Ag | Cartridge and system for manipulating samples in liquid droplets |
| US9857332B2 (en) | 2011-07-22 | 2018-01-02 | Tecan Trading Ag | System for manipulating samples in liquid droplets |
| US20140170735A1 (en) | 2011-09-25 | 2014-06-19 | Elizabeth A. Holmes | Systems and methods for multi-analysis |
| US8475739B2 (en) | 2011-09-25 | 2013-07-02 | Theranos, Inc. | Systems and methods for fluid handling |
| US9664702B2 (en) | 2011-09-25 | 2017-05-30 | Theranos, Inc. | Fluid handling apparatus and configurations |
| US9632102B2 (en) | 2011-09-25 | 2017-04-25 | Theranos, Inc. | Systems and methods for multi-purpose analysis |
| US9810704B2 (en) | 2013-02-18 | 2017-11-07 | Theranos, Inc. | Systems and methods for multi-analysis |
| US10012664B2 (en) | 2011-09-25 | 2018-07-03 | Theranos Ip Company, Llc | Systems and methods for fluid and component handling |
| DK3273253T3 (en) | 2011-09-30 | 2020-10-12 | Becton Dickinson Co | United reagent strip |
| WO2013049702A2 (en) | 2011-09-30 | 2013-04-04 | Life Technologies Corporation | Systems and methods for biological analysis |
| USD692162S1 (en) | 2011-09-30 | 2013-10-22 | Becton, Dickinson And Company | Single piece reagent holder |
| US10865440B2 (en) | 2011-10-21 | 2020-12-15 | IntegenX, Inc. | Sample preparation, processing and analysis systems |
| US20150136604A1 (en) | 2011-10-21 | 2015-05-21 | Integenx Inc. | Sample preparation, processing and analysis systems |
| WO2013067202A1 (en) | 2011-11-04 | 2013-05-10 | Handylab, Inc. | Polynucleotide sample preparation device |
| CN104145014A (en) | 2011-11-11 | 2014-11-12 | 爱库倍特公司 | Systems and methods for performing amplicon rescue multiplex polymerase chain reaction (PCR) |
| US9901928B2 (en) * | 2011-12-06 | 2018-02-27 | Edan Diagnostics | Calibration fluid cartridge for an in vitro medical diagnostic device |
| CN104204812B (en) | 2012-02-03 | 2018-01-05 | 贝克顿·迪金森公司 | The external file that compatibility determines between distributing and test for molecule diagnostic test |
| US10274487B2 (en) * | 2012-02-06 | 2019-04-30 | Nri R&D Patent Licensing, Llc | Microprocessor-controlled microfluidic platform for pathogen, toxin, biomarker, and chemical detection with removable updatable sensor array for food and water safety, medical, and laboratory applications |
| US11931740B2 (en) | 2012-02-13 | 2024-03-19 | Neumodx Molecular, Inc. | System and method for processing and detecting nucleic acids |
| US11485968B2 (en) | 2012-02-13 | 2022-11-01 | Neumodx Molecular, Inc. | Microfluidic cartridge for processing and detecting nucleic acids |
| US9637775B2 (en) | 2012-02-13 | 2017-05-02 | Neumodx Molecular, Inc. | System and method for processing biological samples |
| US9604213B2 (en) | 2012-02-13 | 2017-03-28 | Neumodx Molecular, Inc. | System and method for processing and detecting nucleic acids |
| CN114134029A (en) | 2012-02-13 | 2022-03-04 | 纽莫德克斯莫勒库拉尔公司 | Microfluidic cartridge for processing and detecting nucleic acids |
| WO2013123178A1 (en) * | 2012-02-14 | 2013-08-22 | Cornell University | Apparatus, methods, and applications for point of care multiplexed diagnostics |
| ITUD20120028A1 (en) * | 2012-02-21 | 2013-08-22 | Sedicidodici S R L | PERFUSION CHAMBER, RELATED EQUIPMENT USING THIS PERFUSION CHAMBER AND PROCEDURE FOR THE ANALYSIS OF THE THROMBOTIC-ISCHEMIC AND HEMORRHAGIC PATHOLOGY |
| US9322054B2 (en) | 2012-02-22 | 2016-04-26 | Lockheed Martin Corporation | Microfluidic cartridge |
| US9347938B2 (en) | 2012-03-09 | 2016-05-24 | Invisible Sentinel, Inc. | Methods for detecting multiple analytes with a single signal |
| US8804105B2 (en) * | 2012-03-27 | 2014-08-12 | E. I. Spectra, Llc | Combined optical imaging and electrical detection to characterize particles carried in a fluid |
| US11360076B2 (en) | 2012-03-30 | 2022-06-14 | Weavr Health Corp. | Methods and systems to collect a biological sample |
| US9354159B2 (en) | 2012-05-02 | 2016-05-31 | Nanoscopia (Cayman), Inc. | Opto-fluidic system with coated fluid channels |
| US9186670B2 (en) * | 2012-05-09 | 2015-11-17 | Wisconsin Alumni Research Foundation | Functionalized microfluidic device and method |
| US9213043B2 (en) | 2012-05-15 | 2015-12-15 | Wellstat Diagnostics, Llc | Clinical diagnostic system including instrument and cartridge |
| US9625465B2 (en) | 2012-05-15 | 2017-04-18 | Defined Diagnostics, Llc | Clinical diagnostic systems |
| US9075042B2 (en) | 2012-05-15 | 2015-07-07 | Wellstat Diagnostics, Llc | Diagnostic systems and cartridges |
| US8735853B2 (en) * | 2012-06-09 | 2014-05-27 | E.I. Spectra, Llc | Fluorescence flow cytometry |
| GB201210403D0 (en) * | 2012-06-13 | 2012-07-25 | Ffei Ltd | Mircoscope colour chart |
| EP2864781B1 (en) * | 2012-06-22 | 2017-12-13 | Scandinavian Micro Biodevices ApS | A method and a system for quantitative or qualitative determination of a target component |
| US20150259671A1 (en) * | 2012-07-31 | 2015-09-17 | General Electric Company | Devices and systems for isolating biomolecules and associated methods thereof |
| JP6332025B2 (en) * | 2012-08-03 | 2018-05-30 | ソニー株式会社 | Nucleic acid analyzer, nucleic acid analysis microchip, and microchip mounting method in the apparatus |
| CN104684645B (en) * | 2012-08-30 | 2017-03-08 | 生命技术公司 | Vertically grip device |
| CN104737024B (en) * | 2012-09-05 | 2018-01-09 | 塞弗德公司 | General Docking station and data gate in fluid analytical systems |
| AU2013334189B2 (en) * | 2012-10-24 | 2018-08-02 | Genmark Diagnostics, Inc. | Integrated multiplex target analysis |
| US20140322706A1 (en) | 2012-10-24 | 2014-10-30 | Jon Faiz Kayyem | Integrated multipelx target analysis |
| WO2014066376A1 (en) | 2012-10-25 | 2014-05-01 | Neumodx Molecular, Inc. | Method and materials for isolation of nucleic acid materials |
| US20140170678A1 (en) | 2012-12-17 | 2014-06-19 | Leukodx Ltd. | Kits, compositions and methods for detecting a biological condition |
| CN107941706A (en) | 2012-12-17 | 2018-04-20 | 伦珂德克斯有限公司 | system and method for measuring chemical state |
| US10610861B2 (en) | 2012-12-17 | 2020-04-07 | Accellix Ltd. | Systems, compositions and methods for detecting a biological condition |
| EP2943278B1 (en) * | 2013-01-09 | 2019-02-20 | Tecan Trading AG | Cartridge and system for manipulating samples in liquid droplets |
| EP3450984B1 (en) | 2013-01-31 | 2020-10-07 | Luminex Corporation | Fluid retention plates and analysis cartridges |
| CA2898477A1 (en) * | 2013-02-18 | 2014-08-21 | Theranos, Inc. | Systems and methods for multi-analysis |
| US9623409B2 (en) | 2013-03-11 | 2017-04-18 | Cue Inc. | Cartridges, kits, and methods for enhanced mixing for detection and quantification of analytes |
| US10545161B2 (en) | 2013-03-11 | 2020-01-28 | Cue Health Inc. | Systems and methods for detection and quantification of analytes |
| EP2861996B1 (en) | 2013-03-11 | 2019-03-06 | Cue Health Inc. | Sample analysis cartridge |
| AU2013202805B2 (en) * | 2013-03-14 | 2015-07-16 | Gen-Probe Incorporated | System and method for extending the capabilities of a diagnostic analyzer |
| US11865544B2 (en) | 2013-03-15 | 2024-01-09 | Becton, Dickinson And Company | Process tube and carrier tray |
| JP6387387B2 (en) | 2013-03-15 | 2018-09-05 | ベクトン・ディキンソン・アンド・カンパニーBecton, Dickinson And Company | Process tube and transfer tray |
| US9416776B2 (en) * | 2013-03-15 | 2016-08-16 | Siemens Healthcare Diagnostics Inc. | Microfluidic distributing device |
| US10220392B2 (en) | 2013-03-15 | 2019-03-05 | Becton, Dickinson And Company | Process tube and carrier tray |
| JP6351702B2 (en) | 2013-03-15 | 2018-07-04 | ジェンマーク ダイアグノスティクス, インコーポレイテッド | System, method and apparatus for operating a deformable fluid container |
| US10466236B2 (en) | 2013-03-29 | 2019-11-05 | Nima Labs, Inc. | System and method for detecting target substances |
| US9939431B2 (en) | 2013-03-29 | 2018-04-10 | Nima Labs, Inc. | Portable device for detection of harmful substances |
| US10254279B2 (en) | 2013-03-29 | 2019-04-09 | Nima Labs, Inc. | System and method for detection of target substances |
| EP2994761B1 (en) * | 2013-04-29 | 2019-08-07 | Becton, Dickinson and Company | Imaging cartridge, pipette, and method of use for direct sputum smear microscopy |
| US11358138B2 (en) | 2013-07-19 | 2022-06-14 | Boston Microfluidics Inc. | Fluid sample collection device |
| US10422806B1 (en) | 2013-07-25 | 2019-09-24 | Theranos Ip Company, Llc | Methods for improving assays of biological samples |
| US9347962B2 (en) | 2013-08-05 | 2016-05-24 | Nanoscopia (Cayman), Inc. | Handheld diagnostic system with chip-scale microscope and automated image capture mechanism |
| JP6427753B2 (en) | 2013-09-11 | 2018-11-28 | 国立大学法人大阪大学 | Thermal convection generating chip, thermal convection generating device, and thermal convection generating method |
| US10428374B2 (en) * | 2013-10-04 | 2019-10-01 | Kimantech, Llc | Liquid dispensing device |
| US10010882B2 (en) | 2013-10-22 | 2018-07-03 | Berkeley Lights, Inc. | Microfluidic devices having isolation pens and methods of testing biological micro-objects with same |
| US9498778B2 (en) | 2014-11-11 | 2016-11-22 | Genmark Diagnostics, Inc. | Instrument for processing cartridge for performing assays in a closed sample preparation and reaction system |
| USD881409S1 (en) | 2013-10-24 | 2020-04-14 | Genmark Diagnostics, Inc. | Biochip cartridge |
| WO2015073999A1 (en) * | 2013-11-18 | 2015-05-21 | Integenx Inc. | Cartridges and instruments for sample analysis |
| US20150166326A1 (en) * | 2013-12-18 | 2015-06-18 | Berkeley Lights, Inc. | Capturing Specific Nucleic Acid Materials From Individual Biological Cells In A Micro-Fluidic Device |
| US9243222B2 (en) * | 2014-01-06 | 2016-01-26 | Lawrence Livermore National Security, Llc | Compositions and methods for pathogen transport |
| US10559864B2 (en) | 2014-02-13 | 2020-02-11 | Birmingham Technologies, Inc. | Nanofluid contact potential difference battery |
| WO2015138343A1 (en) | 2014-03-10 | 2015-09-17 | Click Diagnostics, Inc. | Cartridge-based thermocycler |
| CA2944994C (en) | 2014-04-24 | 2021-01-19 | Diassess Inc. | Colorimetric detection of nucleic acid amplification |
| USD745423S1 (en) | 2014-05-12 | 2015-12-15 | Cue Inc. | Automated analyzer test cartridge and sample collection device for analyte detection |
| US10208332B2 (en) | 2014-05-21 | 2019-02-19 | Integenx Inc. | Fluidic cartridge with valve mechanism |
| EP2950076B1 (en) * | 2014-05-26 | 2017-06-28 | CSEM Centre Suisse d'Electronique et de Microtechnique SA - Recherche et Développement | Portable system for automated preparation of liquid and/or solid samples |
| DK3177920T3 (en) | 2014-08-05 | 2021-06-21 | Sanwa Biotech Ltd | On-site diagnostic system and procedure |
| US10141166B2 (en) * | 2014-08-15 | 2018-11-27 | Applied Materials, Inc. | Method of real time in-situ chamber condition monitoring using sensors and RF communication |
| EP3552690B1 (en) | 2014-10-22 | 2024-09-25 | IntegenX Inc. | Systems and methods for sample preparation, processing and analysis |
| US9598722B2 (en) | 2014-11-11 | 2017-03-21 | Genmark Diagnostics, Inc. | Cartridge for performing assays in a closed sample preparation and reaction system |
| US10005080B2 (en) | 2014-11-11 | 2018-06-26 | Genmark Diagnostics, Inc. | Instrument and cartridge for performing assays in a closed sample preparation and reaction system employing electrowetting fluid manipulation |
| JP2018502309A (en) * | 2014-11-11 | 2018-01-25 | ジェンマーク ダイアグノスティクス, インコーポレイテッド | Apparatus and cartridge for performing an assay in a closed sample preparation and reaction system |
| JP2016094238A (en) * | 2014-11-17 | 2016-05-26 | セイコーエプソン株式会社 | Container housing body |
| USD794819S1 (en) * | 2014-11-18 | 2017-08-15 | Illumina, Inc. | Analysis cartridge |
| USD794817S1 (en) * | 2014-11-18 | 2017-08-15 | Illumina, Inc. | Analysis cartridge |
| USD794818S1 (en) * | 2014-11-18 | 2017-08-15 | Illumina, Inc. | Analysis cartridge |
| EP3240906B1 (en) | 2014-12-31 | 2021-08-25 | Visby Medical, Inc. | Devices for molecular diagnostic testing |
| JP6384929B2 (en) * | 2015-01-22 | 2018-09-05 | Necソリューションイノベータ株式会社 | Target analysis tool and target analysis method |
| GB201501705D0 (en) | 2015-02-02 | 2015-03-18 | Atlas Genetics Ltd | Instrument for performing a diagnostic test on a fluidic cartridge |
| GB2531615B (en) * | 2015-02-02 | 2017-11-22 | Atlas Genetics Ltd | Instrument for performing a diagnostic test on a fluidic cartridge |
| WO2016172454A1 (en) | 2015-04-22 | 2016-10-27 | Berkeley Lights, Inc. | Microfluidic cell structure |
| US10233491B2 (en) | 2015-06-19 | 2019-03-19 | IntegenX, Inc. | Valved cartridge and system |
| CN108139387B (en) * | 2015-06-29 | 2020-12-11 | 源鉴定私人有限公司 | Method and apparatus for collecting test data from use of disposable test kits |
| AU2016294420B2 (en) | 2015-07-15 | 2019-04-18 | Hycor Biomedical, Llc | Customizable instrument |
| EP4434628A1 (en) | 2015-07-17 | 2024-09-25 | Cue Health Inc. | System for enhanced detection and quantification of analytes |
| EP3124118B1 (en) * | 2015-07-28 | 2018-02-28 | Panasonic Intellectual Property Management Co., Ltd. | Microchannel apparatus and pcr method |
| US10799865B2 (en) | 2015-10-27 | 2020-10-13 | Berkeley Lights, Inc. | Microfluidic apparatus having an optimized electrowetting surface and related systems and methods |
| CN115532189A (en) | 2015-11-23 | 2022-12-30 | 伯克利之光生命科技公司 | In-situ generated microfluidic isolation structure, kit and use method thereof |
| JP6964590B2 (en) | 2015-12-30 | 2021-11-10 | バークレー ライツ,インコーポレイテッド | Optically driven convection and displacement microfluidic devices, their kits and methods |
| WO2017127570A1 (en) * | 2016-01-20 | 2017-07-27 | Triv Tech, Llc | Point-of-care nucleic acid amplification and detection |
| EP3430378B1 (en) | 2016-03-14 | 2022-08-10 | Lucira Health, Inc. | Devices and methods for modifying optical properties |
| CA3240706A1 (en) | 2016-03-14 | 2017-09-21 | Pfizer Inc. | Systems and methods for performing biological assays |
| JP7073328B2 (en) * | 2016-03-14 | 2022-05-23 | ヘリックスバインド・インコーポレイテッド | Methods associated with integrated fluid devices |
| AU2017232344B2 (en) | 2016-03-14 | 2022-08-04 | Pfizer Inc. | Selectively vented biological assay devices and associated methods |
| AU2017232342B2 (en) | 2016-03-14 | 2022-04-21 | Pfizer Inc. | Devices and methods for biological assay sample preparation and delivery |
| FR3049060B1 (en) | 2016-03-21 | 2018-04-20 | Commissariat A L'energie Atomique Et Aux Energies Alternatives | DEVICE FOR PREPARING A BLOOD SAMPLE |
| WO2017197040A1 (en) | 2016-05-11 | 2017-11-16 | Click Diagnostics, Inc. | Devices and methods for nucleic acid extraction |
| WO2017201049A1 (en) | 2016-05-17 | 2017-11-23 | Integrated Nano-Technologies, Inc. | Flow control system for diagnostic assay system |
| CN109689213B (en) | 2016-05-26 | 2022-10-14 | 伯克利之光生命科技公司 | Covalently modified surface, kit, preparation method and application |
| WO2017210556A1 (en) * | 2016-06-02 | 2017-12-07 | Integrated Nano-Technologies, Inc. | System and method for optimizing heat transfer for target amplification within a diagnostic assay system |
| MX2018015889A (en) | 2016-06-29 | 2019-05-27 | Click Diagnostics Inc | Devices and methods for the detection of molecules using a flow cell. |
| GB201611442D0 (en) * | 2016-06-30 | 2016-08-17 | Lumiradx Tech Ltd | Fluid control |
| CN106047661B (en) * | 2016-07-06 | 2020-03-24 | 上海宏石医疗科技有限公司 | PCR detection reagent container and PCR pretreatment system |
| US11215587B2 (en) | 2016-08-31 | 2022-01-04 | Kyocera Corporation | Sensor device and detecting method employing same |
| JP6609530B2 (en) * | 2016-09-05 | 2019-11-20 | 株式会社日立製作所 | Single cell analysis system |
| CN109843437A (en) * | 2016-10-07 | 2019-06-04 | 勃林格殷格翰维特梅迪卡有限公司 | Method for controlling analytical equipment and analysis system |
| US10227633B2 (en) * | 2016-10-07 | 2019-03-12 | Bigtec Private Limited | Portable device for purifying biological sample and a method thereof |
| EP3548889A4 (en) * | 2016-12-01 | 2020-07-22 | Novel Microdevices, LLC | Automated point-of-care devices for complex sample processing and methods of use thereof |
| BR112019011569A2 (en) * | 2016-12-06 | 2019-10-22 | Nippon Sheet Glass Co Ltd | reaction processing device |
| US10427162B2 (en) * | 2016-12-21 | 2019-10-01 | Quandx Inc. | Systems and methods for molecular diagnostics |
| WO2018140540A1 (en) | 2017-01-25 | 2018-08-02 | Cue Health Inc. | Systems and methods for enhanced detection and quantification of analytes |
| WO2018138701A1 (en) * | 2017-01-30 | 2018-08-02 | Reza Kalantarinejad | An integrated patient monitor system |
| CN106680474A (en) * | 2017-02-04 | 2017-05-17 | 上海为然环保科技有限公司 | Instrument capable of quickly detecting escherichia coli on household tableware |
| US11080848B2 (en) | 2017-04-06 | 2021-08-03 | Lucira Health, Inc. | Image-based disease diagnostics using a mobile device |
| WO2018195107A1 (en) * | 2017-04-17 | 2018-10-25 | MedCision, Inc. | Systems, devices, and methods for automated large gauge sample thawing |
| EP3582893B1 (en) * | 2017-04-20 | 2021-03-31 | Hewlett-Packard Development Company, L.P. | Microfluidic reaction system |
| US10598637B2 (en) * | 2017-07-18 | 2020-03-24 | Perkinelmer Health Sciences, Inc. | Automated thermal desorption systems configured to determine sample tube orientation and/or cap presence, and related methods |
| WO2019018697A1 (en) | 2017-07-19 | 2019-01-24 | Evanostics, Llc | Cartridges for oral fluid analysis and methods of use |
| JP6904131B2 (en) * | 2017-07-21 | 2021-07-14 | 株式会社島津製作所 | Gene measuring device |
| US10549275B2 (en) | 2017-09-14 | 2020-02-04 | Lucira Health, Inc. | Multiplexed biological assay device with electronic readout |
| SG11202003744PA (en) | 2017-10-27 | 2020-05-28 | Boston Microfluidics Inc | Fluid sample collection device |
| CA3078976A1 (en) | 2017-11-09 | 2019-05-16 | Visby Medical, Inc. | Portable molecular diagnostic device and methods for the detection of target viruses |
| CA3086538A1 (en) | 2017-12-15 | 2019-06-20 | Evanostics Llc | Optical reader for analyte testing |
| AU2019226555A1 (en) * | 2018-03-02 | 2020-10-29 | Teleflex Medical Incorporated | Infection detection systems and methods |
| JP2021518158A (en) | 2018-03-15 | 2021-08-02 | クリプトス バイオテクノロジーズ,インコーポレイテッド | Methods and systems for conducting heat-assisted biochemical reactions |
| US10816516B2 (en) | 2018-03-28 | 2020-10-27 | Perkinelmer Health Sciences, Inc. | Autosamplers and gas chromatographic systems and methods including same |
| WO2019193004A1 (en) * | 2018-04-06 | 2019-10-10 | Boehringer Ingelheim Vetmedica Gmbh | Analysis device, cartridge, analysis system and method for testing a sample |
| KR102533782B1 (en) * | 2018-04-18 | 2023-05-17 | 엘지전자 주식회사 | Air conditioner |
| WO2019209290A1 (en) | 2018-04-25 | 2019-10-31 | Hewlett-Packard Development Company, L.P. | Selective release of material in thermally degradable capsule |
| US11484877B2 (en) | 2018-05-29 | 2022-11-01 | Weavr Health Corp. | Blood metering device with desiccant and support for storage media and inlay with flange |
| WO2019231837A1 (en) * | 2018-05-29 | 2019-12-05 | Boston Microfluidics, Inc. | Blood metering device with desiccant and support for storage media and inlay with flange |
| US20200041418A1 (en) * | 2018-07-31 | 2020-02-06 | The Texas A&M University System | Nanoplasmonic paper substrate for identification of fentanyl and fentanyl-related compounds |
| BR112021003395A2 (en) * | 2018-08-23 | 2021-05-18 | Sanwa Biotech Ltd | portable diagnostic device and its method |
| JP7475332B2 (en) * | 2018-08-27 | 2024-04-26 | ノベル マイクロデバイシズ,インク. | Sample-to-answer microfluidic system and method including vertical microfluidic device and automated actuation mechanism |
| US11772097B2 (en) | 2018-10-19 | 2023-10-03 | Renegadexbio, Pbc | Simultaneous spot test and storage of blood samples |
| WO2020086397A1 (en) | 2018-10-23 | 2020-04-30 | Boston Microfluidics, Inc. | Funnel with extension tube to augment blood collection device |
| CN111175481A (en) * | 2018-11-09 | 2020-05-19 | 广州万孚生物技术股份有限公司 | Blood gas biochemical test card, blood gas analyzer and control method of blood gas analyzer |
| US12066383B2 (en) | 2018-12-18 | 2024-08-20 | Aspida Dx Inc. | Optical analyte detection |
| USD910200S1 (en) | 2018-12-21 | 2021-02-09 | Lucira Health, Inc. | Test tube |
| US11358137B2 (en) | 2018-12-26 | 2022-06-14 | Industrial Technology Research Institute | Tubular structure for producing droplets and method for producing droplets |
| US11479748B2 (en) * | 2019-03-28 | 2022-10-25 | The Regents Of The University Of California | Methods and device for stimulating DNA repair |
| WO2020223555A1 (en) | 2019-04-30 | 2020-11-05 | Berkeley Lights, Inc. | Methods for encapsulating and assaying cells |
| TWI715997B (en) * | 2019-06-13 | 2021-01-11 | 新加坡商克雷多生物醫學私人有限公司 | Pcr apparatus for real-time detecting multiplex fluorescent signals |
| US11061014B2 (en) * | 2019-06-25 | 2021-07-13 | Hemex Health, Inc. | Malaria species detection |
| WO2021002941A1 (en) * | 2019-07-03 | 2021-01-07 | Siemens Healthcare Diagnostics Inc. | Multi-well tray for cell lysing and purification and method of use |
| US10820847B1 (en) | 2019-08-15 | 2020-11-03 | Talis Biomedical Corporation | Diagnostic system |
| WO2021046336A1 (en) * | 2019-09-06 | 2021-03-11 | Teleflex Medical Incorporated | Oligonucleotides for real-time determining the identification and antibiotic resistance of pathogenic microorganisms |
| DE102019124588A1 (en) * | 2019-09-12 | 2021-03-18 | Biometra GmbH | Temperature control device |
| WO2021066744A1 (en) | 2019-09-30 | 2021-04-08 | Illumina Singapore Pte. Ltd. | Test cartridge for analysis instruments |
| USD979092S1 (en) | 2019-10-02 | 2023-02-21 | Becton, Dickinson And Company | Microfluidic cartridge |
| WO2021138544A1 (en) | 2020-01-03 | 2021-07-08 | Visby Medical, Inc. | Devices and methods for antibiotic susceptibility testing |
| US10953404B1 (en) * | 2020-04-24 | 2021-03-23 | Pattern Bioscience, Inc. | Apparatuses for contactless loading and imaging of microfluidic chips and related methods |
| USD953561S1 (en) | 2020-05-05 | 2022-05-31 | Lucira Health, Inc. | Diagnostic device with LED display |
| USD962470S1 (en) | 2020-06-03 | 2022-08-30 | Lucira Health, Inc. | Assay device with LCD display |
| CN113773942A (en) * | 2020-06-10 | 2021-12-10 | 北京百康芯生物科技有限公司 | Nucleic acid detection card box |
| CN116057365A (en) * | 2020-09-11 | 2023-05-02 | 贝克顿·迪金森公司 | Device for testing environmental samples |
| JP2022058275A (en) * | 2020-09-30 | 2022-04-11 | 富佳生技股▲ふん▼有限公司 | Nucleic acid detection cassette and nucleic acid detection device |
| TWD218529S (en) * | 2020-09-30 | 2022-05-01 | 富佳生技股份有限公司 | Graphical user interface for nucleic acid detector |
| CN114317220A (en) * | 2020-09-30 | 2022-04-12 | 富佳生技股份有限公司 | Nucleic acid detecting cassette and nucleic acid detecting apparatus |
| US20220099624A1 (en) * | 2020-09-30 | 2022-03-31 | Icare Diagnostics International Co. Ltd. | Nucleic acid detection host and nucleic acid detection device |
| EP3978123A1 (en) * | 2020-09-30 | 2022-04-06 | iCare Diagnostics International Co. Ltd. | Nucleic acid detection kit and nucleic acid detection device |
| CN112629997B (en) * | 2020-12-15 | 2023-11-14 | 宁波爱基因科技有限公司 | Heating and heat-preserving system of microfluidic detector |
| US12115530B2 (en) * | 2021-03-19 | 2024-10-15 | Lost Arrow Bio | On-board reagent storage in a fluid processing device |
| US11891671B1 (en) * | 2021-03-24 | 2024-02-06 | A9.Com, Inc. | Virus detection system |
| GB2605956A (en) * | 2021-04-14 | 2022-10-26 | Univ Of South Eastern Norway | Systems, apparatus and methods for extracting and analysing cellular material |
| EP4326849A1 (en) * | 2021-04-22 | 2024-02-28 | Baebies, Inc. | Culture monitoring system and methods |
| MX2023015494A (en) * | 2021-07-30 | 2024-03-04 | Cue Health Inc | An analyte detection system cartridge with improved phase changeable valves. |
| CN113877239B (en) * | 2021-09-30 | 2023-07-25 | 浙江扬清芯片技术有限公司 | Micro-fluidic chip integrating ultrasonic textile extraction and detection |
| US20230113495A1 (en) * | 2021-10-12 | 2023-04-13 | Amazon Technologies, Inc. | Localized diagnostic testing module |
| EP4457029A1 (en) * | 2021-12-29 | 2024-11-06 | Memorial Sloan-Kettering Cancer Center | Vessels, devices, processes, and systems for tracking and managing items with circuitous custody chains |
| CN114308179A (en) * | 2022-01-06 | 2022-04-12 | 洛阳师范学院 | Digital product design teaching test bench |
| US20240058814A1 (en) * | 2022-01-24 | 2024-02-22 | Siphox, Inc. | Optical reader device for multiplexed diagnostic systems and methods of use |
| WO2023164613A2 (en) * | 2022-02-24 | 2023-08-31 | Denver Health and Hospital Authority | Methods for diagnosing and/or treating otitis media |
| KR20240018037A (en) * | 2022-08-02 | 2024-02-13 | 주식회사 아이젠텍 | All-in-one catridge and device for diagnozing disease |
| WO2024102748A1 (en) * | 2022-11-07 | 2024-05-16 | Kephera Diagnostics, Llc | Methods, diagnostic instruments, and kits for detecting diseases |
| EP4389887A1 (en) * | 2022-12-21 | 2024-06-26 | Mobidiag Oy | Isolating and lysing cells |
| CN117686670B (en) * | 2024-02-02 | 2024-05-03 | 内蒙古蒙牛乳业(集团)股份有限公司 | Sample automatic detection system and intelligent laboratory |
Family Cites Families (1049)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US1434314A (en) | 1921-08-04 | 1922-10-31 | Raich Anthony | Lunch pail |
| US1616419A (en) | 1925-04-03 | 1927-02-01 | Everlasting Valve Co | Automatic shut-off device for gas in case of fire |
| US1733401A (en) | 1928-03-29 | 1929-10-29 | Christman Matthias | Journal box |
| NL252802A (en) | 1959-11-20 | |||
| GB1095429A (en) | 1965-05-17 | |||
| US3528449A (en) | 1968-02-27 | 1970-09-15 | Trw Inc | Fluid flow control apparatus |
| US3813316A (en) * | 1972-06-07 | 1974-05-28 | Gen Electric | Microorganisms having multiple compatible degradative energy-generating plasmids and preparation thereof |
| US4038192A (en) | 1973-12-03 | 1977-07-26 | International Biomedical Laboratories, Inc. | Device for exchange between fluids suitable for treatment of blood |
| US3985649A (en) | 1974-11-25 | 1976-10-12 | Eddelman Roy T | Ferromagnetic separation process and material |
| JPS5255578A (en) * | 1975-10-31 | 1977-05-07 | Hitachi Ltd | Analyzing apparatus |
| US4018652A (en) | 1976-01-09 | 1977-04-19 | Mcdonnell Douglas Corporation | Process and apparatus for ascertaining the concentration of microorganism in a water specimen |
| US4018089A (en) | 1976-05-05 | 1977-04-19 | Beckman Instruments, Inc. | Fluid sampling apparatus |
| USD249706S (en) | 1976-12-17 | 1978-09-26 | Eastman Kodak Company | Sample cup tray for chemical analysis of biological fluids |
| USD252157S (en) | 1977-04-14 | 1979-06-19 | Warner-Lambert Company | Diagnostic device for measuring biochemical characteristics of microorganisms and the like |
| USD252341S (en) | 1977-05-12 | 1979-07-10 | Ryder International Corporation | Testing tray |
| JPS5416896A (en) | 1977-06-21 | 1979-02-07 | Asahi Medical Co | Blood dialyser |
| US4139005A (en) | 1977-09-01 | 1979-02-13 | Dickey Gilbert C | Safety release pipe cap |
| USD254687S (en) | 1979-01-25 | 1980-04-08 | Mcdonnell Douglas Corporation | Biochemical card for use with an automated microbial identification machine |
| USD261173S (en) | 1979-02-05 | 1981-10-06 | American Optical Corporation | Bilirubinometer |
| USD261033S (en) | 1979-02-05 | 1981-09-29 | American Optical Corporation | Bilirubin concentration analyzer |
| US4301412A (en) | 1979-10-29 | 1981-11-17 | United States Surgical Corporation | Liquid conductivity measuring system and sample cards therefor |
| JPS5766361A (en) | 1980-10-09 | 1982-04-22 | Olympus Optical Co Ltd | Plate-shaped apparatus for judging cohesion of particle |
| US4472357A (en) | 1981-11-18 | 1984-09-18 | Medical Laboratory Automation, Inc. | Blood bank cuvette cassette and label therefor |
| US4457329A (en) | 1981-12-04 | 1984-07-03 | Air Products And Chemicals, Inc. | Safety pressure regulator |
| JPS58212921A (en) | 1982-06-04 | 1983-12-10 | Aron Kasei Co Ltd | Molding method of plastic hollow product |
| USD279817S (en) | 1982-07-19 | 1985-07-23 | Daryl Laboratories, Inc. | Immunoassay test slide |
| US4504582A (en) | 1982-07-20 | 1985-03-12 | Genex Corporation | Vermiculite as a carrier support for immobilized biological materials |
| US4439526A (en) | 1982-07-26 | 1984-03-27 | Eastman Kodak Company | Clustered ingress apertures for capillary transport devices and method of use |
| EP0105194B1 (en) | 1982-09-02 | 1988-05-25 | Firma Andreas Hettich | Centrifugation chambers for the cytodiagnostic preparation of epithelial cells and their application |
| US4647432A (en) * | 1982-11-30 | 1987-03-03 | Japan Tectron Instruments Corporation Tokuyama Soda Kabushiki Kaisha | Automatic analysis apparatus |
| US4994373A (en) | 1983-01-27 | 1991-02-19 | Enzo Biochem, Inc. | Method and structures employing chemically-labelled polynucleotide probes |
| USD282208S (en) * | 1983-02-07 | 1986-01-14 | Data Packaging Corporation | Pipetter tip cartridge |
| US4698302A (en) | 1983-05-12 | 1987-10-06 | Advanced Magnetics, Inc. | Enzymatic reactions using magnetic particles |
| US4522786A (en) | 1983-08-10 | 1985-06-11 | E. I. Du Pont De Nemours And Company | Multilayered test device for detecting analytes in liquid test samples |
| US4673657A (en) | 1983-08-26 | 1987-06-16 | The Regents Of The University Of California | Multiple assay card and system |
| CA1220168A (en) | 1983-09-09 | 1987-04-07 | Henry J. Rahn | Magnetic separator for solid phase immunoassays |
| US4599315A (en) | 1983-09-13 | 1986-07-08 | University Of California Regents | Microdroplet test apparatus |
| USD292735S (en) | 1983-11-02 | 1987-11-10 | A/S Nunc | Tube for the immunological adsorption analysis |
| US4724207A (en) * | 1984-02-02 | 1988-02-09 | Cuno Incorporated | Modified siliceous chromatographic supports |
| US4654127A (en) | 1984-04-11 | 1987-03-31 | Sentech Medical Corporation | Self-calibrating single-use sensing device for clinical chemistry and method of use |
| JP2502961B2 (en) | 1984-04-26 | 1996-05-29 | 日本碍子株式会社 | Method for manufacturing electrochemical device |
| USD288478S (en) | 1984-06-21 | 1987-02-24 | Sentech Medical Corporation | Clinical chemistry analyzer |
| JPH06104118B2 (en) | 1985-03-13 | 1994-12-21 | バクスタ−、インターナショナル、インコ−ポレイテッド | Platelet collection system |
| US4683195A (en) | 1986-01-30 | 1987-07-28 | Cetus Corporation | Process for amplifying, detecting, and/or-cloning nucleic acid sequences |
| US4965188A (en) | 1986-08-22 | 1990-10-23 | Cetus Corporation | Process for amplifying, detecting, and/or cloning nucleic acid sequences using a thermostable enzyme |
| US4683202A (en) | 1985-03-28 | 1987-07-28 | Cetus Corporation | Process for amplifying nucleic acid sequences |
| US4612959A (en) | 1985-05-07 | 1986-09-23 | Mobil Oil Corporation | Valveless shut-off and transfer device |
| US4720374A (en) | 1985-07-22 | 1988-01-19 | E. I. Du Pont De Nemours And Company | Container having a sonication compartment |
| US4963498A (en) | 1985-08-05 | 1990-10-16 | Biotrack | Capillary flow device |
| US4795698A (en) | 1985-10-04 | 1989-01-03 | Immunicon Corporation | Magnetic-polymer particles |
| US4678752A (en) | 1985-11-18 | 1987-07-07 | Becton, Dickinson And Company | Automatic random access analyzer |
| US4871779A (en) | 1985-12-23 | 1989-10-03 | The Dow Chemical Company | Ion exchange/chelation resins containing dense star polymers having ion exchange or chelate capabilities |
| DE3614955C1 (en) | 1986-05-02 | 1987-08-06 | Schulz Peter | Sample distribution system |
| US4978622A (en) | 1986-06-23 | 1990-12-18 | Regents Of The University Of California | Cytophaga-derived immunopotentiator |
| US4889818A (en) | 1986-08-22 | 1989-12-26 | Cetus Corporation | Purified thermostable enzyme |
| US5763262A (en) | 1986-09-18 | 1998-06-09 | Quidel Corporation | Immunodiagnostic device |
| USD302294S (en) | 1986-10-03 | 1989-07-18 | Biotrack, Inc. | Reagent cartridge for blood analysis |
| US4935342A (en) | 1986-12-01 | 1990-06-19 | Syngene, Inc. | Method of isolating and purifying nucleic acids from biological samples |
| US4978502A (en) | 1987-01-05 | 1990-12-18 | Dole Associates, Inc. | Immunoassay or diagnostic device and method of manufacture |
| US5004583A (en) | 1987-01-29 | 1991-04-02 | Medtest Systems, Inc. | Universal sensor cartridge for use with a universal analyzer for sensing components in a multicomponent fluid |
| US4946562A (en) | 1987-01-29 | 1990-08-07 | Medtest Systems, Inc. | Apparatus and methods for sensing fluid components |
| US4997772A (en) | 1987-09-18 | 1991-03-05 | Eastman Kodak Company | Water-insoluble particle and immunoreactive reagent, analytical elements and methods of use |
| US5599667A (en) | 1987-03-02 | 1997-02-04 | Gen-Probe Incorporated | Polycationic supports and nucleic acid purification separation and hybridization |
| ES2054797T3 (en) | 1987-03-02 | 1994-08-16 | Gen Probe Inc | POLICATIONIC SUPPORTS TO PURIFY, SEPARATE AND HYBRID NUCLEIC ACIDS. |
| US4855110A (en) | 1987-05-06 | 1989-08-08 | Abbott Laboratories | Sample ring for clinical analyzer network |
| US5001417A (en) | 1987-06-01 | 1991-03-19 | Abbott Laboratories | Apparatus for measuring electrolytes utilizing optical signals related to the concentration of the electrolytes |
| US5192507A (en) | 1987-06-05 | 1993-03-09 | Arthur D. Little, Inc. | Receptor-based biosensors |
| EP0367795A4 (en) | 1987-07-16 | 1992-01-15 | E.I. Du Pont De Nemours And Company | Affinity separating using immobilized flocculating reagents |
| US4827944A (en) | 1987-07-22 | 1989-05-09 | Becton, Dickinson And Company | Body fluid sample collection tube composite |
| GB8720470D0 (en) | 1987-08-29 | 1987-10-07 | Emi Plc Thorn | Sensor arrangements |
| US4921809A (en) | 1987-09-29 | 1990-05-01 | Findley Adhesives, Inc. | Polymer coated solid matrices and use in immunoassays |
| USD312692S (en) | 1987-10-09 | 1990-12-04 | Bradley Marshall C | Pipette holder |
| US4914710A (en) | 1987-11-20 | 1990-04-03 | Storage Technology Corporation | MICR document smear test machine |
| US4902624A (en) | 1987-11-23 | 1990-02-20 | Eastman Kodak Company | Temperature cycling cuvette |
| USD310413S (en) | 1987-12-17 | 1990-09-04 | Miles Inc. | Sample processor |
| US4895650A (en) * | 1988-02-25 | 1990-01-23 | Gen-Probe Incorporated | Magnetic separation rack for diagnostic assays |
| JPH01219669A (en) | 1988-02-29 | 1989-09-01 | Shimadzu Corp | Detecting method of liquid sample vessel according to assortment |
| US5503803A (en) | 1988-03-28 | 1996-04-02 | Conception Technologies, Inc. | Miniaturized biological assembly |
| DE3811713A1 (en) | 1988-04-08 | 1989-10-19 | Bosch Gmbh Robert | PLANAR POLAROGRAPHIC PROBE FOR DETERMINING THE (LAMBDA) VALUE OF GAS MIXTURES |
| US5700637A (en) | 1988-05-03 | 1997-12-23 | Isis Innovation Limited | Apparatus and method for analyzing polynucleotide sequences and method of generating oligonucleotide arrays |
| US5060823A (en) | 1988-09-15 | 1991-10-29 | Brandeis University | Sterile transfer system |
| US6147198A (en) | 1988-09-15 | 2000-11-14 | New York University | Methods and compositions for the manipulation and characterization of individual nucleic acid molecules |
| US5096669A (en) | 1988-09-15 | 1992-03-17 | I-Stat Corporation | Disposable sensing device for real time fluid analysis |
| DE8813340U1 (en) | 1988-10-24 | 1988-12-08 | Laboratorium Prof. Dr. Rudolf Berthold, 7547 Wildbad | Sample rack for sample vessels |
| JPH0814337B2 (en) | 1988-11-11 | 1996-02-14 | 株式会社日立製作所 | Opening / closing control valve and opening / closing control method for flow path using phase change of fluid itself |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| US4919829A (en) | 1988-12-30 | 1990-04-24 | The United States Of America As Represented By The Secretary Of Commerce | Aluminum hydroxides as solid lubricants |
| US5229297A (en) | 1989-02-03 | 1993-07-20 | Eastman Kodak Company | Containment cuvette for PCR and method of use |
| US4948561A (en) | 1989-02-09 | 1990-08-14 | Eastman Kodak Company | Multiple level filter device and kit containing same |
| US5053199A (en) | 1989-02-21 | 1991-10-01 | Boehringer Mannheim Corporation | Electronically readable information carrier |
| US5416000A (en) * | 1989-03-16 | 1995-05-16 | Chemtrak, Inc. | Analyte immunoassay in self-contained apparatus |
| US5234809A (en) | 1989-03-23 | 1993-08-10 | Akzo N.V. | Process for isolating nucleic acid |
| US6610256B2 (en) | 1989-04-05 | 2003-08-26 | Wisconsin Alumni Research Foundation | Image processing and analysis of individual nucleic acid molecules |
| FI86229C (en) | 1989-04-10 | 1992-07-27 | Niilo Kaartinen | FOERFARANDE FOER FORMNING AV ETT UPPVAERMBART OCH NEDKYLBART ELEMENT VID ETT SYSTEM BEHANDLANDE SMAO VAETSKEMAENGDER SAMT ETT MEDELST FOERFARANDET FRAMSTAELLT ELEMENT. |
| US5334499A (en) | 1989-04-17 | 1994-08-02 | Eastman Kodak Company | Methods of extracting, amplifying and detecting a nucleic acid from whole blood or PBMC fraction |
| US4949742A (en) | 1989-04-26 | 1990-08-21 | Spectra-Physics, Inc. | Temperature operated gas valve |
| US5135872A (en) | 1989-04-28 | 1992-08-04 | Sangstat Medical Corporation | Matrix controlled method of delayed fluid delivery for assays |
| US5061336A (en) | 1989-05-01 | 1991-10-29 | Soane Technologies, Inc. | Gel casting method and apparatus |
| US5071531A (en) | 1989-05-01 | 1991-12-10 | Soane Technologies, Inc. | Casting of gradient gels |
| AU109440S (en) | 1989-05-03 | 1990-10-31 | Bayer Diagnostic G M B H | Diagnostic working station evaluation device |
| US5089233A (en) | 1989-06-12 | 1992-02-18 | Eastman Kodak Company | Processing apparatus for a chemical reaction pack |
| US5173269A (en) | 1989-06-15 | 1992-12-22 | At&T Bell Laboratories | Apparatus for reducing the reactivity of articles destined for disposal |
| USD325638S (en) * | 1989-07-10 | 1992-04-21 | Hach Company | Microtester or the like |
| USD328794S (en) | 1989-07-19 | 1992-08-18 | Pb Diagnostic Systems, Inc. | Diagnostic instrument or similar article |
| AU635314B2 (en) * | 1989-09-08 | 1993-03-18 | Terumo Kabushiki Kaisha | Measuring apparatus |
| ES2048440T3 (en) | 1989-09-29 | 1994-03-16 | Glory Kogyo Kk | PAPER SHEET PACKAGING APPARATUS. |
| US5275787A (en) * | 1989-10-04 | 1994-01-04 | Canon Kabushiki Kaisha | Apparatus for separating or measuring particles to be examined in a sample fluid |
| LU87601A1 (en) | 1989-10-05 | 1990-02-07 | Ceodeux Sa | TAP FOR GAS BOTTLE |
| US5231015A (en) | 1989-10-18 | 1993-07-27 | Eastman Kodak Company | Methods of extracting nucleic acids and pcr amplification without using a proteolytic enzyme |
| USD324426S (en) | 1989-10-20 | 1992-03-03 | Pacific Biotech, Inc. | Reaction unit for use in analyzing biological fluids |
| US4967950A (en) | 1989-10-31 | 1990-11-06 | International Business Machines Corporation | Soldering method |
| US5252743A (en) | 1989-11-13 | 1993-10-12 | Affymax Technologies N.V. | Spatially-addressable immobilization of anti-ligands on surfaces |
| US5091328A (en) | 1989-11-21 | 1992-02-25 | National Semiconductor Corporation | Method of late programming MOS devices |
| JP2731613B2 (en) | 1989-12-12 | 1998-03-25 | 株式会社クラレ | Cartridge for enzyme immunoassay, measuring method and measuring apparatus using the same |
| US5279936A (en) | 1989-12-22 | 1994-01-18 | Syntex (U.S.A.) Inc. | Method of separation employing magnetic particles and second medium |
| USD328135S (en) | 1990-01-12 | 1992-07-21 | Pacific Biotech, Inc. | Reaction unit for use in analyzing biological fluids |
| US5770029A (en) | 1996-07-30 | 1998-06-23 | Soane Biosciences | Integrated electrophoretic microdevices |
| US5126022A (en) | 1990-02-28 | 1992-06-30 | Soane Tecnologies, Inc. | Method and device for moving molecules by the application of a plurality of electrical fields |
| US6054034A (en) | 1990-02-28 | 2000-04-25 | Aclara Biosciences, Inc. | Acrylic microchannels and their use in electrophoretic applications |
| US5858188A (en) | 1990-02-28 | 1999-01-12 | Aclara Biosciences, Inc. | Acrylic microchannels and their use in electrophoretic applications |
| US5750015A (en) | 1990-02-28 | 1998-05-12 | Soane Biosciences | Method and device for moving molecules by the application of a plurality of electrical fields |
| US5935401A (en) | 1996-09-18 | 1999-08-10 | Aclara Biosciences | Surface modified electrophoretic chambers |
| GB9007791D0 (en) | 1990-04-06 | 1990-06-06 | Foss Richard C | High voltage boosted wordline supply charge pump and regulator for dram |
| WO1991016675A1 (en) | 1990-04-06 | 1991-10-31 | Applied Biosystems, Inc. | Automated molecular biology laboratory |
| AU639575B2 (en) | 1990-05-01 | 1993-07-29 | Enprotech Corporation | Integral biomolecule preparation device |
| US5667976A (en) | 1990-05-11 | 1997-09-16 | Becton Dickinson And Company | Solid supports for nucleic acid hybridization assays |
| US5935522A (en) | 1990-06-04 | 1999-08-10 | University Of Utah Research Foundation | On-line DNA analysis system with rapid thermal cycling |
| US5147777A (en) | 1990-06-18 | 1992-09-15 | Eastman Kodak Company | Biologically active reagents prepared from carboxy-containing polymer, analytical element and methods of use |
| US5155166A (en) | 1990-06-18 | 1992-10-13 | Eastman Kodak Company | Use of 1-(1-pyrrolidinylcarbonyl)pyridinium salts to attach compounds to carboxylated particles and a kit containing same |
| DE4023194A1 (en) | 1990-07-20 | 1992-01-23 | Kodak Ag | DEVICE WITH SEVERAL RECEIVER ARRANGEMENTS FOR LIQUID-FILLED CONTAINERS |
| US5208163A (en) | 1990-08-06 | 1993-05-04 | Miles Inc. | Self-metering fluid analysis device |
| US5147606A (en) | 1990-08-06 | 1992-09-15 | Miles Inc. | Self-metering fluid analysis device |
| JPH0734375Y2 (en) | 1990-09-11 | 1995-08-02 | 株式会社シノテスト | Instrument for measuring and measuring reaction of analyte |
| WO1992005443A1 (en) | 1990-09-15 | 1992-04-02 | Medical Research Council | Reagent separation |
| US5135627A (en) | 1990-10-15 | 1992-08-04 | Soane Technologies, Inc. | Mosaic microcolumns, slabs, and separation media for electrophoresis and chromatography |
| US5652141A (en) | 1990-10-26 | 1997-07-29 | Oiagen Gmbh | Device and process for isolating nucleic acids from cell suspension |
| US5141718A (en) | 1990-10-30 | 1992-08-25 | Millipore Corporation | Test plate apparatus |
| EP0484278B1 (en) | 1990-11-01 | 1995-04-12 | Ciba-Geigy Ag | Device for preparing liquid samples for chemical analysis |
| EP0488947B1 (en) * | 1990-11-26 | 1995-02-15 | Ciba-Geigy Ag | Detector cell |
| KR100236506B1 (en) | 1990-11-29 | 2000-01-15 | 퍼킨-엘머시터스인스트루먼츠 | Apparatus for polymerase chain reaction |
| US6703236B2 (en) | 1990-11-29 | 2004-03-09 | Applera Corporation | Thermal cycler for automatic performance of the polymerase chain reaction with close temperature control |
| US5273716A (en) | 1991-01-14 | 1993-12-28 | Electric Power Research Institute, Inc. | pH optrode |
| FR2672301A1 (en) | 1991-02-01 | 1992-08-07 | Larzul Daniel | Process and device for amplifying the number of a defined sequence of nucleic acid in a biological sample |
| US5466574A (en) | 1991-03-25 | 1995-11-14 | Immunivest Corporation | Apparatus and methods for magnetic separation featuring external magnetic means |
| US5384499A (en) | 1991-04-25 | 1995-01-24 | Altera Corporation | High-density erasable programmable logic device architecture using multiplexer interconnections |
| US5327038A (en) | 1991-05-09 | 1994-07-05 | Rockwell International Corporation | Walking expansion actuator |
| JPH05345900A (en) | 1991-07-08 | 1993-12-27 | Fuji Oil Co Ltd | Production of hard fat and oil |
| DE4123348A1 (en) * | 1991-07-15 | 1993-01-21 | Boehringer Mannheim Gmbh | ELECTROCHEMICAL ANALYSIS SYSTEM |
| USD333522S (en) | 1991-07-23 | 1993-02-23 | P B Diagnostic Systems, Inc. | Sample tube holder |
| IT1249433B (en) | 1991-08-06 | 1995-02-23 | Pompeo Moscetta | PROCEDURE FOR DOSING ANALYTES IN LIQUID SAMPLES AND RELATED EQUIPMENT. |
| US7297313B1 (en) | 1991-08-31 | 2007-11-20 | The Regents Of The University Of California | Microfabricated reactor, process for manufacturing the reactor, and method of amplification |
| US5474796A (en) | 1991-09-04 | 1995-12-12 | Protogene Laboratories, Inc. | Method and apparatus for conducting an array of chemical reactions on a support surface |
| US5256376A (en) | 1991-09-12 | 1993-10-26 | Medical Laboratory Automation, Inc. | Agglutination detection apparatus |
| WO1993006992A1 (en) | 1991-10-04 | 1993-04-15 | Alcan International Limited | Peelable laminated structures and process for production thereof |
| CA2074671A1 (en) | 1991-11-04 | 1993-05-05 | Thomas Bormann | Device and method for separating plasma from a biological fluid |
| USD347478S (en) | 1991-11-05 | 1994-05-31 | Hybaid Ltd. | Laboratory instrument for handling bimolecular samples |
| US5632957A (en) | 1993-11-01 | 1997-05-27 | Nanogen | Molecular biological diagnostic systems including electrodes |
| US5605662A (en) * | 1993-11-01 | 1997-02-25 | Nanogen, Inc. | Active programmable electronic devices for molecular biological analysis and diagnostics |
| US5787032A (en) | 1991-11-07 | 1998-07-28 | Nanogen | Deoxyribonucleic acid(DNA) optical storage using non-radiative energy transfer between a donor group, an acceptor group and a quencher group |
| US5849486A (en) | 1993-11-01 | 1998-12-15 | Nanogen, Inc. | Methods for hybridization analysis utilizing electrically controlled hybridization |
| DE69231853T2 (en) | 1991-11-07 | 2001-09-13 | Nanotronics, Inc. | HYBRIDIZING POLYNUCLEOTIDS CONJUGED WITH CHROMOPHORES AND FLUOROPHORS TO GENERATE A DONOR-TO-DONOR ENERGY TRANSFER SYSTEM |
| USD340289S (en) | 1992-01-30 | 1993-10-12 | Jan Gerber | Diagnostic testing material |
| US5559432A (en) | 1992-02-27 | 1996-09-24 | Logue; Delmar L. | Joystick generating a polar coordinates signal utilizing a rotating magnetic field within a hollow toroid core |
| US5217694A (en) | 1992-03-25 | 1993-06-08 | Gibler W Brian | Holder for evacuated test tubes |
| US5646049A (en) | 1992-03-27 | 1997-07-08 | Abbott Laboratories | Scheduling operation of an automated analytical system |
| CA2133643A1 (en) | 1992-04-06 | 1993-10-14 | Stanley R. Bouma | Method and device for detection of nucleic acid or analyte using total internal reflectance |
| US5223226A (en) | 1992-04-14 | 1993-06-29 | Millipore Corporation | Insulated needle for forming an electrospray |
| US6235313B1 (en) * | 1992-04-24 | 2001-05-22 | Brown University Research Foundation | Bioadhesive microspheres and their use as drug delivery and imaging systems |
| US5296375A (en) | 1992-05-01 | 1994-03-22 | Trustees Of The University Of Pennsylvania | Mesoscale sperm handling devices |
| US5587128A (en) | 1992-05-01 | 1996-12-24 | The Trustees Of The University Of Pennsylvania | Mesoscale polynucleotide amplification devices |
| US5304487A (en) | 1992-05-01 | 1994-04-19 | Trustees Of The University Of Pennsylvania | Fluid handling in mesoscale analytical devices |
| US5486335A (en) | 1992-05-01 | 1996-01-23 | Trustees Of The University Of Pennsylvania | Analysis based on flow restriction |
| US5637469A (en) | 1992-05-01 | 1997-06-10 | Trustees Of The University Of Pennsylvania | Methods and apparatus for the detection of an analyte utilizing mesoscale flow systems |
| US6953676B1 (en) | 1992-05-01 | 2005-10-11 | Trustees Of The University Of Pennsylvania | Mesoscale polynucleotide amplification device and method |
| US5744366A (en) | 1992-05-01 | 1998-04-28 | Trustees Of The University Of Pennsylvania | Mesoscale devices and methods for analysis of motile cells |
| US5498392A (en) | 1992-05-01 | 1996-03-12 | Trustees Of The University Of Pennsylvania | Mesoscale polynucleotide amplification device and method |
| US5726026A (en) | 1992-05-01 | 1998-03-10 | Trustees Of The University Of Pennsylvania | Mesoscale sample preparation device and systems for determination and processing of analytes |
| US5401465A (en) * | 1992-05-05 | 1995-03-28 | Chiron Corporation | Luminometer with reduced sample crosstalk |
| US5364591A (en) | 1992-06-01 | 1994-11-15 | Eastman Kodak Company | Device for moving a target-bearing solid through a liquid for detection while being contained |
| US5414245A (en) | 1992-08-03 | 1995-05-09 | Hewlett-Packard Corporation | Thermal-ink heater array using rectifying material |
| US5639423A (en) | 1992-08-31 | 1997-06-17 | The Regents Of The University Of Calfornia | Microfabricated reactor |
| DE4231966A1 (en) | 1992-09-24 | 1994-03-31 | Bosch Gmbh Robert | Planar polarographic probe for determining the lambda value of gas mixtures |
| US5338671A (en) | 1992-10-07 | 1994-08-16 | Eastman Kodak Company | DNA amplification with thermostable DNA polymerase and polymerase inhibiting antibody |
| US5422271A (en) | 1992-11-20 | 1995-06-06 | Eastman Kodak Company | Nucleic acid material amplification and detection without washing |
| US5885432A (en) | 1992-11-05 | 1999-03-23 | Soane Biosciences | Un-crosslinked polymeric media for electrophoresis |
| US5569364A (en) | 1992-11-05 | 1996-10-29 | Soane Biosciences, Inc. | Separation media for electrophoresis |
| GB9223334D0 (en) | 1992-11-06 | 1992-12-23 | Hybaid Ltd | Magnetic solid phase supports |
| US5500187A (en) | 1992-12-08 | 1996-03-19 | Westinghouse Electric Corporation | Disposable optical agglutination assay device and method for use |
| US5302348A (en) | 1992-12-10 | 1994-04-12 | Itc Corporation | Blood coagulation time test apparatus and method |
| US5311996A (en) | 1993-01-05 | 1994-05-17 | Duffy Thomas J | Edge protector |
| DE4334834A1 (en) | 1993-10-13 | 1995-04-20 | Andrzej Dr Ing Grzegorzewski | Biosensor for measuring changes in viscosity and / or density |
| FI932866A0 (en) | 1993-06-21 | 1993-06-21 | Labsystems Oy | Separeringsfoerfarande |
| JPH0664156U (en) | 1993-02-16 | 1994-09-09 | 株式会社ニッテク | Blood container holding structure |
| USD351913S (en) | 1993-02-25 | 1994-10-25 | Diametrics Medical, Inc. | Disposable electrochemical measurement cartridge for a portable medical analyzer |
| US5339486A (en) | 1993-03-10 | 1994-08-23 | Persic Jr William V | Golf ball cleaner |
| DE4316023A1 (en) | 1993-05-13 | 1994-11-17 | Basf Ag | Process for the preparation of low molecular weight polymers of 1-vinylimidazole |
| US5565171A (en) | 1993-05-28 | 1996-10-15 | Governors Of The University Of Alberta | Continuous biochemical reactor for analysis of sub-picomole quantities of complex organic molecules |
| US6203759B1 (en) | 1996-05-31 | 2001-03-20 | Packard Instrument Company | Microvolume liquid handling system |
| JP3339650B2 (en) | 1993-07-02 | 2002-10-28 | 和光純薬工業株式会社 | Liquid dispensing device |
| DE69429038T2 (en) | 1993-07-28 | 2002-03-21 | Pe Corporation (Ny), Norwalk | Device and method for nucleic acid amplification |
| USD356232S (en) * | 1993-08-20 | 1995-03-14 | Flair Communications Agency, Inc. | Dual vesselled beverage container |
| US5397709A (en) * | 1993-08-27 | 1995-03-14 | Becton Dickinson And Company | System for detecting bacterial growth in a plurality of culture vials |
| JP2948069B2 (en) | 1993-09-20 | 1999-09-13 | 株式会社日立製作所 | Chemical analyzer |
| US5374395A (en) | 1993-10-14 | 1994-12-20 | Amoco Corporation | Diagnostics instrument |
| US5645801A (en) | 1993-10-21 | 1997-07-08 | Abbott Laboratories | Device and method for amplifying and detecting target nucleic acids |
| US5415839A (en) | 1993-10-21 | 1995-05-16 | Abbott Laboratories | Apparatus and method for amplifying and detecting target nucleic acids |
| EP0653631B1 (en) | 1993-11-11 | 2003-05-14 | Aclara BioSciences, Inc. | Apparatus and method for the electrophoretical separation of mixtures of fluid substances |
| DE4343089A1 (en) | 1993-12-17 | 1995-06-29 | Bosch Gmbh Robert | Planar sensor element based on solid electrolyte |
| CA2178644A1 (en) | 1994-01-11 | 1995-07-13 | Thomas F. Zurek | Apparatus and method for thermal cycling nucleic acid assays |
| CA2143365A1 (en) | 1994-03-14 | 1995-09-15 | Hugh V. Cottingham | Nucleic acid amplification method and apparatus |
| DE4408361C2 (en) | 1994-03-14 | 1996-02-01 | Bosch Gmbh Robert | Electrochemical sensor for determining the oxygen concentration in gas mixtures |
| US5725831A (en) | 1994-03-14 | 1998-03-10 | Becton Dickinson And Company | Nucleic acid amplification apparatus |
| JPH09510614A (en) | 1994-03-24 | 1997-10-28 | ガメラ・バイオサイエンス・コーポレイション | DNA melt meter and method of using the same |
| US5580523A (en) | 1994-04-01 | 1996-12-03 | Bard; Allen J. | Integrated chemical synthesizers |
| US5475487A (en) | 1994-04-20 | 1995-12-12 | The Regents Of The University Of California | Aqueous carrier waveguide in a flow cytometer |
| USD366116S (en) | 1994-05-03 | 1996-01-09 | Thomas Biskupski | Electrical box for storing dental wax |
| EP0695941B1 (en) | 1994-06-08 | 2002-07-31 | Affymetrix, Inc. | Method and apparatus for packaging a chip |
| DE4420732A1 (en) | 1994-06-15 | 1995-12-21 | Boehringer Mannheim Gmbh | Device for the treatment of nucleic acids from a sample |
| US5514343A (en) | 1994-06-22 | 1996-05-07 | Nunc, As | Microtitration system |
| AU2907995A (en) | 1994-06-23 | 1996-01-19 | Dade International Inc. | Method for the rapid isolation of nucleic acid |
| FR2722294B1 (en) * | 1994-07-07 | 1996-10-04 | Lyon Ecole Centrale | PROCESS FOR THE QUALITATIVE AND / OR QUANTITATIVE ANALYSIS OF BIOLOGICAL SUBSTANCES PRESENT IN A CONDUCTIVE LIQUID MEDIUM AND BIOCHEMICAL AFFINITY SENSORS USED FOR THE IMPLEMENTATION OF THIS PROCESS |
| CN1069909C (en) | 1994-07-14 | 2001-08-22 | 特恩杰特有限公司 | Solid ink jet ink |
| US5639428A (en) | 1994-07-19 | 1997-06-17 | Becton Dickinson And Company | Method and apparatus for fully automated nucleic acid amplification, nucleic acid assay and immunoassay |
| US6001229A (en) | 1994-08-01 | 1999-12-14 | Lockheed Martin Energy Systems, Inc. | Apparatus and method for performing microfluidic manipulations for chemical analysis |
| CA2156226C (en) | 1994-08-25 | 1999-02-23 | Takayuki Taguchi | Biological fluid analyzing device and method |
| US5627041A (en) | 1994-09-02 | 1997-05-06 | Biometric Imaging, Inc. | Disposable cartridge for an assay of a biological sample |
| US5582988A (en) | 1994-09-15 | 1996-12-10 | Johnson & Johnson Clinical Diagnostics, Inc. | Methods for capture and selective release of nucleic acids using weakly basic polymer and amplification of same |
| JP3652424B2 (en) | 1994-10-27 | 2005-05-25 | 日本政策投資銀行 | Automatic analyzer and method |
| JP3403839B2 (en) | 1994-10-27 | 2003-05-06 | プレシジョン・システム・サイエンス株式会社 | Cartridge container |
| US5721136A (en) | 1994-11-09 | 1998-02-24 | Mj Research, Inc. | Sealing device for thermal cycling vessels |
| CA2204912C (en) | 1994-11-10 | 2005-01-04 | David Sarnoff Research Center, Inc. | Liquid distribution system |
| US5603351A (en) | 1995-06-07 | 1997-02-18 | David Sarnoff Research Center, Inc. | Method and system for inhibiting cross-contamination in fluids of combinatorial chemistry device |
| US5585069A (en) | 1994-11-10 | 1996-12-17 | David Sarnoff Research Center, Inc. | Partitioned microelectronic and fluidic device array for clinical diagnostics and chemical synthesis |
| US5632876A (en) | 1995-06-06 | 1997-05-27 | David Sarnoff Research Center, Inc. | Apparatus and methods for controlling fluid flow in microchannels |
| US5654141A (en) | 1994-11-18 | 1997-08-05 | Thomas Jefferson University | Amplification based detection of bacterial infection |
| GB9425138D0 (en) | 1994-12-12 | 1995-02-08 | Dynal As | Isolation of nucleic acid |
| US5731212A (en) | 1994-12-20 | 1998-03-24 | International Technidyne Corporation | Test apparatus and method for testing cuvette accommodated samples |
| US5846493A (en) | 1995-02-14 | 1998-12-08 | Promega Corporation | System for analyzing a substance from a solution following filtering of the substance from the solution |
| US6884357B2 (en) * | 1995-02-21 | 2005-04-26 | Iqbal Waheed Siddiqi | Apparatus and method for processing magnetic particles |
| US5683659A (en) | 1995-02-22 | 1997-11-04 | Hovatter; Kenneth R. | Integral assembly of microcentrifuge strip tubes and strip caps |
| US5579928A (en) | 1995-03-06 | 1996-12-03 | Anukwuem; Chidi I. | Test tube holder with lock down clamp |
| US6967088B1 (en) | 1995-03-16 | 2005-11-22 | Allergan, Inc. | Soluble recombinant botulinum toxin proteins |
| US5578270A (en) | 1995-03-24 | 1996-11-26 | Becton Dickinson And Company | System for nucleic acid based diagnostic assay |
| US5674394A (en) | 1995-03-24 | 1997-10-07 | Johnson & Johnson Medical, Inc. | Single use system for preparation of autologous plasma |
| DE19512368A1 (en) | 1995-04-01 | 1996-10-02 | Boehringer Mannheim Gmbh | Nucleic acid release and isolation system |
| US5700429A (en) | 1995-04-19 | 1997-12-23 | Roche Diagnostic Systems, Inc. | Vessel holder for automated analyzer |
| USD382346S (en) | 1995-04-19 | 1997-08-12 | Roche Diagnostic Systems, Inc. | Vessel holder |
| US5578818A (en) | 1995-05-10 | 1996-11-26 | Molecular Dynamics | LED point scanning system |
| US5771902A (en) | 1995-09-25 | 1998-06-30 | Regents Of The University Of California | Micromachined actuators/sensors for intratubular positioning/steering |
| DE19519015C1 (en) | 1995-05-24 | 1996-09-05 | Inst Physikalische Hochtech Ev | Miniaturised multi-chamber thermo-cycler for polymerase chain reaction |
| WO1996039547A2 (en) | 1995-06-01 | 1996-12-12 | The Regents Of The University Of California | Multiple source deposition of shape-memory alloy thin films |
| CA2222506C (en) | 1995-06-06 | 2007-07-24 | Quantic Biomedical Partners | Device and method for concentrating plasma |
| US5842106A (en) | 1995-06-06 | 1998-11-24 | Sarnoff Corporation | Method of producing micro-electrical conduits |
| US6228635B1 (en) * | 1995-06-07 | 2001-05-08 | Aastrom Bioscience, Inc. | Portable cell growth cassette for use in maintaining and growing biological cells |
| JP3554612B2 (en) | 1995-06-12 | 2004-08-18 | マツダ株式会社 | Roll curtain for vehicles |
| US6521181B1 (en) | 1995-06-20 | 2003-02-18 | The Regents Of The University Of Calfornia | Microfabricated electrochemiluminescence cell for chemical reaction detection |
| US5589136A (en) | 1995-06-20 | 1996-12-31 | Regents Of The University Of California | Silicon-based sleeve devices for chemical reactions |
| US6524532B1 (en) | 1995-06-20 | 2003-02-25 | The Regents Of The University Of California | Microfabricated sleeve devices for chemical reactions |
| US5968745A (en) | 1995-06-27 | 1999-10-19 | The University Of North Carolina At Chapel Hill | Polymer-electrodes for detecting nucleic acid hybridization and method of use thereof |
| US20020022261A1 (en) | 1995-06-29 | 2002-02-21 | Anderson Rolfe C. | Miniaturized genetic analysis systems and methods |
| US5856174A (en) | 1995-06-29 | 1999-01-05 | Affymetrix, Inc. | Integrated nucleic acid diagnostic device |
| US6168948B1 (en) | 1995-06-29 | 2001-01-02 | Affymetrix, Inc. | Miniaturized genetic analysis systems and methods |
| US6158269A (en) | 1995-07-13 | 2000-12-12 | Bayer Corporation | Method and apparatus for aspirating and dispensing sample fluids |
| US5872010A (en) | 1995-07-21 | 1999-02-16 | Northeastern University | Microscale fluid handling system |
| JP3923968B2 (en) | 1995-07-31 | 2007-06-06 | プレシジョン・システム・サイエンス株式会社 | Container usage |
| JP3927570B2 (en) | 1995-07-31 | 2007-06-13 | プレシジョン・システム・サイエンス株式会社 | container |
| EP0843176B1 (en) | 1995-07-31 | 2013-06-12 | Precision System Science Co., Ltd. | Analysis system comprising a container and a liquid sucking/discharging line |
| US5849208A (en) * | 1995-09-07 | 1998-12-15 | Microfab Technoologies, Inc. | Making apparatus for conducting biochemical analyses |
| WO1997010056A2 (en) | 1995-09-12 | 1997-03-20 | Becton Dickinson And Company | Device and method for dna amplification and assay |
| US6057149A (en) | 1995-09-15 | 2000-05-02 | The University Of Michigan | Microscale devices and reactions in microscale devices |
| US6130098A (en) | 1995-09-15 | 2000-10-10 | The Regents Of The University Of Michigan | Moving microdroplets |
| US6911183B1 (en) | 1995-09-15 | 2005-06-28 | The Regents Of The University Of Michigan | Moving microdroplets |
| US6048734A (en) | 1995-09-15 | 2000-04-11 | The Regents Of The University Of Michigan | Thermal microvalves in a fluid flow method |
| GB9519346D0 (en) | 1995-09-22 | 1995-11-22 | English Glass Company The Limi | Dispensing systems |
| US5658515A (en) | 1995-09-25 | 1997-08-19 | Lee; Abraham P. | Polymer micromold and fabrication process |
| US5628890A (en) * | 1995-09-27 | 1997-05-13 | Medisense, Inc. | Electrochemical sensor |
| US6132580A (en) | 1995-09-28 | 2000-10-17 | The Regents Of The University Of California | Miniature reaction chamber and devices incorporating same |
| US20020068357A1 (en) * | 1995-09-28 | 2002-06-06 | Mathies Richard A. | Miniaturized integrated nucleic acid processing and analysis device and method |
| EP0766256B1 (en) | 1995-09-29 | 1999-12-01 | STMicroelectronics S.r.l. | Voltage regulator for semiconductor non-volatile electrically programmable memory devices |
| US5651839A (en) | 1995-10-26 | 1997-07-29 | Queen's University At Kingston | Process for engineering coherent twin and coincident site lattice grain boundaries in polycrystalline materials |
| US5705813A (en) | 1995-11-01 | 1998-01-06 | Hewlett-Packard Company | Integrated planar liquid handling system for maldi-TOF MS |
| DE19540877C2 (en) | 1995-11-02 | 1998-02-26 | Byk Sangtec Diagnostica | Modular reagent cartridge |
| JP2000512434A (en) | 1995-11-03 | 2000-09-19 | サーノフ コーポレイション | Magnetite |
| CA2239613A1 (en) | 1995-12-05 | 1997-06-12 | Alec Mian | Devices and methods for using centripetal acceleration to drive fluid movement in a microfluidics system with on-board informatics |
| US20010055812A1 (en) | 1995-12-05 | 2001-12-27 | Alec Mian | Devices and method for using centripetal acceleration to drive fluid movement in a microfluidics system with on-board informatics |
| WO1997022825A1 (en) | 1995-12-18 | 1997-06-26 | Neukermans Armand P | Microfluidic valve and integrated microfluidic system |
| US6068751A (en) | 1995-12-18 | 2000-05-30 | Neukermans; Armand P. | Microfluidic valve and integrated microfluidic system |
| USD382647S (en) | 1996-01-17 | 1997-08-19 | Biomerieux Vitek, Inc. | Biochemical test card |
| US5631337A (en) | 1996-01-19 | 1997-05-20 | Soane Bioscience | Thermoreversible hydrogels comprising linear copolymers and their use in electrophoresis |
| US5883211A (en) | 1996-01-19 | 1999-03-16 | Aclara Biosciences, Inc. | Thermoreversible hydrogels comprising linear copolymers and their use in electrophoresis |
| US5863502A (en) | 1996-01-24 | 1999-01-26 | Sarnoff Corporation | Parallel reaction cassette and associated devices |
| US5726944A (en) | 1996-02-05 | 1998-03-10 | Motorola, Inc. | Voltage regulator for regulating an output voltage from a charge pump and method therefor |
| US5981735A (en) | 1996-02-12 | 1999-11-09 | Cobra Therapeutics Limited | Method of plasmid DNA production and purification |
| US5736102A (en) | 1996-02-21 | 1998-04-07 | Biomerieux Vitek, Inc. | Test sample positioning system |
| AU715627B2 (en) | 1996-02-21 | 2000-02-03 | Biomerieux Vitek, Inc. | Automatic sample testing machine |
| USD378782S (en) | 1996-03-01 | 1997-04-08 | Johnson & Johnson Clinical Diagnostics, Inc. | Processor for nucleic acid detection |
| US5849598A (en) | 1996-03-15 | 1998-12-15 | Washington University | Method for transferring micro quantities of liquid samples to discrete locations |
| CA2249235C (en) | 1996-03-25 | 2002-05-07 | Diasys Corporation | Apparatus and method for handling fluid samples of body materials |
| US6114122A (en) * | 1996-03-26 | 2000-09-05 | Affymetrix, Inc. | Fluidics station with a mounting system and method of using |
| US5844238A (en) | 1996-03-27 | 1998-12-01 | David Sarnoff Research Center, Inc. | Infrared imager using room temperature capacitance sensor |
| US7244622B2 (en) | 1996-04-03 | 2007-07-17 | Applera Corporation | Device and method for multiple analyte detection |
| US7235406B1 (en) | 1996-04-03 | 2007-06-26 | Applera Corporation | Nucleic acid analysis device |
| US5788814A (en) | 1996-04-09 | 1998-08-04 | David Sarnoff Research Center | Chucks and methods for positioning multiple objects on a substrate |
| US6399023B1 (en) | 1996-04-16 | 2002-06-04 | Caliper Technologies Corp. | Analytical system and method |
| US5942443A (en) | 1996-06-28 | 1999-08-24 | Caliper Technologies Corporation | High throughput screening assay systems in microscale fluidic devices |
| US5885470A (en) | 1997-04-14 | 1999-03-23 | Caliper Technologies Corporation | Controlled fluid transport in microfabricated polymeric substrates |
| US5671303A (en) | 1996-04-17 | 1997-09-23 | Motorola, Inc. | Molecular detection apparatus and method using optical waveguide detection |
| US5948363A (en) | 1996-04-22 | 1999-09-07 | Gaillard; Patrick | Micro-well strip with print tabs |
| US6001307A (en) | 1996-04-26 | 1999-12-14 | Kyoto Daiichi Kagaku Co., Ltd. | Device for analyzing a sample |
| US6221672B1 (en) | 1996-04-30 | 2001-04-24 | Medtronic, Inc. | Method for determining platelet inhibitor response |
| US6054277A (en) | 1996-05-08 | 2000-04-25 | Regents Of The University Of Minnesota | Integrated microchip genetic testing system |
| JPH09304385A (en) | 1996-05-14 | 1997-11-28 | Shionogi & Co Ltd | Magnetic particle separator and separating method for substance |
| US6180950B1 (en) * | 1996-05-14 | 2001-01-30 | Don Olsen | Micro heating apparatus for synthetic fibers |
| DE69638151D1 (en) * | 1996-05-20 | 2010-04-29 | Prec System Science Co Ltd | PROCESS AND APPARATUS FOR CONTROLLING MAGNETIC PARTICLES WITH THE HELP OF A PIPETTING MACHINE |
| US5726404A (en) | 1996-05-31 | 1998-03-10 | University Of Washington | Valveless liquid microswitch |
| US6083762A (en) | 1996-05-31 | 2000-07-04 | Packard Instruments Company | Microvolume liquid handling system |
| US5939291A (en) | 1996-06-14 | 1999-08-17 | Sarnoff Corporation | Microfluidic method for nucleic acid amplification |
| US5912124A (en) | 1996-06-14 | 1999-06-15 | Sarnoff Corporation | Padlock probe detection |
| US5914229A (en) | 1996-06-14 | 1999-06-22 | Sarnoff Corporation | Method for amplifying a polynucleotide |
| US5863801A (en) * | 1996-06-14 | 1999-01-26 | Sarnoff Corporation | Automated nucleic acid isolation |
| US5985651A (en) | 1996-06-17 | 1999-11-16 | The Board Of Trustees Of The Leland Stanford Junior University | Thermocycling apparatus and method |
| US5779868A (en) | 1996-06-28 | 1998-07-14 | Caliper Technologies Corporation | Electropipettor and compensation means for electrophoretic bias |
| BR9710052A (en) | 1996-06-28 | 2000-01-11 | Caliper Techn Corp | Microfluid system with compensation for electrophoretic polarization, electropipettor, processes for introducing materials from a series of sources into a microfluidic system, for controllably distributing a fluid stream and for transporting fluid samples, sampling system, use of a substrate , use of a microfluidic system, and substrate. |
| NZ333346A (en) | 1996-06-28 | 2000-03-27 | Caliper Techn Corp | High-throughput screening assay systems in microscale fluidic devices |
| US5800690A (en) | 1996-07-03 | 1998-09-01 | Caliper Technologies Corporation | Variable control of electroosmotic and/or electrophoretic forces within a fluid-containing structure via electrical forces |
| US5699157A (en) | 1996-07-16 | 1997-12-16 | Caliper Technologies Corp. | Fourier detection of species migrating in a microchannel |
| US6074827A (en) | 1996-07-30 | 2000-06-13 | Aclara Biosciences, Inc. | Microfluidic method for nucleic acid purification and processing |
| US20020053399A1 (en) * | 1996-07-30 | 2002-05-09 | Aclara Biosciences, Inc | Methods for fabricating enclosed microchannel structures |
| US5804436A (en) | 1996-08-02 | 1998-09-08 | Axiom Biotechnologies, Inc. | Apparatus and method for real-time measurement of cellular response |
| US6280967B1 (en) | 1996-08-02 | 2001-08-28 | Axiom Biotechnologies, Inc. | Cell flow apparatus and method for real-time of cellular responses |
| US6558916B2 (en) | 1996-08-02 | 2003-05-06 | Axiom Biotechnologies, Inc. | Cell flow apparatus and method for real-time measurements of patient cellular responses |
| US5858187A (en) | 1996-09-26 | 1999-01-12 | Lockheed Martin Energy Systems, Inc. | Apparatus and method for performing electrodynamic focusing on a microchip |
| US5872623A (en) * | 1996-09-26 | 1999-02-16 | Sarnoff Corporation | Massively parallel detection |
| US6110343A (en) | 1996-10-04 | 2000-08-29 | Lockheed Martin Energy Research Corporation | Material transport method and apparatus |
| WO1998016527A1 (en) | 1996-10-15 | 1998-04-23 | Fujisawa Pharmaceutical Co., Ltd. | Benzoxepine derivatives which promote release of growth hormone |
| US6500390B1 (en) | 1996-10-17 | 2002-12-31 | David A. Boulton | Method for sealing and venting a microplate assembly |
| US5874046A (en) | 1996-10-30 | 1999-02-23 | Raytheon Company | Biological warfare agent sensor system employing ruthenium-terminated oligonucleotides complementary to target live agent DNA sequences |
| US6133436A (en) | 1996-11-06 | 2000-10-17 | Sequenom, Inc. | Beads bound to a solid support and to nucleic acids |
| USD421653S (en) | 1996-11-18 | 2000-03-14 | Tekmar Company | Housing for a laboratory instrument |
| US6447727B1 (en) | 1996-11-19 | 2002-09-10 | Caliper Technologies Corp. | Microfluidic systems |
| DE19749011A1 (en) | 1996-11-19 | 1998-05-20 | Lang Volker | Micro=valve for one time use has opening closed by plug mounted on resistance plate |
| US6465257B1 (en) | 1996-11-19 | 2002-10-15 | Caliper Technologies Corp. | Microfluidic systems |
| US6379929B1 (en) | 1996-11-20 | 2002-04-30 | The Regents Of The University Of Michigan | Chip-based isothermal amplification devices and methods |
| US5772966A (en) | 1997-01-24 | 1998-06-30 | Maracas; George N. | Assay dispensing apparatus |
| USD399959S (en) | 1997-01-24 | 1998-10-20 | Abbott Laboratories | Housing for a device for measuring the concentration of an analyte in a sample of blood |
| USD414271S (en) | 1997-02-03 | 1999-09-21 | Eli Lilly And Company | Reaction vessel for combining chemicals |
| US5972694A (en) | 1997-02-11 | 1999-10-26 | Mathus; Gregory | Multi-well plate |
| DE19707226A1 (en) * | 1997-02-24 | 1998-08-27 | Bodenseewerk Perkin Elmer Co | Light scanner |
| US5882496A (en) | 1997-02-27 | 1999-03-16 | The Regents Of The University Of California | Porous silicon structures with high surface area/specific pore size |
| CA2574107C (en) | 1997-02-28 | 2011-08-16 | Cepheid | Heat exchanging, optically interrogated chemical reaction assembly |
| US5911737A (en) | 1997-02-28 | 1999-06-15 | The Regents Of The University Of California | Microfabricated therapeutic actuators |
| US5958349A (en) | 1997-02-28 | 1999-09-28 | Cepheid | Reaction vessel for heat-exchanging chemical processes |
| AU6343398A (en) | 1997-02-28 | 1998-09-18 | Cepheid | Heat exchanging, optically interrogated chemical reaction assembly |
| US8293064B2 (en) | 1998-03-02 | 2012-10-23 | Cepheid | Method for fabricating a reaction vessel |
| US5861563A (en) | 1997-03-20 | 1999-01-19 | Bayer Corporation | Automatic closed tube sampler |
| US5964997A (en) | 1997-03-21 | 1999-10-12 | Sarnoff Corporation | Balanced asymmetric electronic pulse patterns for operating electrode-based pumps |
| US5747666A (en) | 1997-03-26 | 1998-05-05 | Willis; John P. | Point-of-care analyzer module |
| US6391622B1 (en) | 1997-04-04 | 2002-05-21 | Caliper Technologies Corp. | Closed-loop biochemical analyzers |
| US6235471B1 (en) | 1997-04-04 | 2001-05-22 | Caliper Technologies Corp. | Closed-loop biochemical analyzers |
| US5964995A (en) | 1997-04-04 | 1999-10-12 | Caliper Technologies Corp. | Methods and systems for enhanced fluid transport |
| US5993750A (en) | 1997-04-11 | 1999-11-30 | Eastman Kodak Company | Integrated ceramic micro-chemical plant |
| DE19717085C2 (en) | 1997-04-23 | 1999-06-17 | Bruker Daltonik Gmbh | Processes and devices for extremely fast DNA multiplication using polymerase chain reactions (PCR) |
| EP0988529B1 (en) | 1997-04-25 | 2013-06-12 | Caliper Life Sciences, Inc. | Microfluidic devices incorporating improved channel geometries |
| US5976336A (en) | 1997-04-25 | 1999-11-02 | Caliper Technologies Corp. | Microfluidic devices incorporating improved channel geometries |
| US5997708A (en) | 1997-04-30 | 1999-12-07 | Hewlett-Packard Company | Multilayer integrated assembly having specialized intermediary substrate |
| DK1216754T3 (en) | 1997-05-02 | 2005-03-14 | Gen Probe Inc | Reactor Unit |
| AU7477398A (en) | 1997-05-09 | 1998-11-27 | Regents Of The University Of California, The | Peltier-assisted microfabricated reaction chambers for thermal cycling |
| US5944717A (en) | 1997-05-12 | 1999-08-31 | The Regents Of The University Of California | Micromachined electrical cauterizer |
| US5980719A (en) | 1997-05-13 | 1999-11-09 | Sarnoff Corporation | Electrohydrodynamic receptor |
| US6106685A (en) | 1997-05-13 | 2000-08-22 | Sarnoff Corporation | Electrode combinations for pumping fluids |
| JP3937107B2 (en) | 1997-05-23 | 2007-06-27 | 東拓工業株式会社 | Bell mouth for annular corrugated tube |
| JP3469585B2 (en) | 1997-05-23 | 2003-11-25 | ガメラ バイオサイエンス コーポレイション | Apparatus and method for using centripetal acceleration to drive flow motion in microfluidics systems |
| DE69831830T2 (en) * | 1997-06-09 | 2006-06-22 | F. Hoffmann-La Roche Ag | Disposable analyzer |
| US5869004A (en) | 1997-06-09 | 1999-02-09 | Caliper Technologies Corp. | Methods and apparatus for in situ concentration and/or dilution of materials in microfluidic systems |
| WO1998056956A1 (en) | 1997-06-09 | 1998-12-17 | Caliper Technologies Corporation | Apparatus and methods for correcting for variable velocity in microfluidic systems |
| US6190619B1 (en) | 1997-06-11 | 2001-02-20 | Argonaut Technologies, Inc. | Systems and methods for parallel synthesis of compounds |
| US5900130A (en) | 1997-06-18 | 1999-05-04 | Alcara Biosciences, Inc. | Method for sample injection in microchannel device |
| US5882465A (en) | 1997-06-18 | 1999-03-16 | Caliper Technologies Corp. | Method of manufacturing microfluidic devices |
| US6425972B1 (en) | 1997-06-18 | 2002-07-30 | Calipher Technologies Corp. | Methods of manufacturing microfabricated substrates |
| US5959291A (en) | 1997-06-27 | 1999-09-28 | Caliper Technologies Corporation | Method and apparatus for measuring low power signals |
| JP3191150B2 (en) | 1997-06-30 | 2001-07-23 | 株式会社アステックコーポレーション | Blood collection tube rack |
| US5928161A (en) | 1997-07-03 | 1999-07-27 | The Regents Of The University Of California | Microbiopsy/precision cutting devices |
| US6001231A (en) | 1997-07-15 | 1999-12-14 | Caliper Technologies Corp. | Methods and systems for monitoring and controlling fluid flow rates in microfluidic systems |
| US5985217A (en) | 1997-07-17 | 1999-11-16 | The Regents Of The University Of California | Microfabricated instrument for tissue biopsy and analysis |
| US5932799A (en) | 1997-07-21 | 1999-08-03 | Ysi Incorporated | Microfluidic analyzer module |
| US5827481A (en) | 1997-07-31 | 1998-10-27 | Hewlett-Packard Company | Cartridge system for effecting sample acquisition and introduction |
| US5876675A (en) | 1997-08-05 | 1999-03-02 | Caliper Technologies Corp. | Microfluidic devices and systems |
| US5919711A (en) | 1997-08-07 | 1999-07-06 | Careside, Inc. | Analytical cartridge |
| US5916522A (en) | 1997-08-07 | 1999-06-29 | Careside, Inc. | Electrochemical analytical cartridge |
| US6156199A (en) | 1997-08-11 | 2000-12-05 | Zuk, Jr.; Peter | Centrifugal filtration apparatus |
| US6368871B1 (en) | 1997-08-13 | 2002-04-09 | Cepheid | Non-planar microstructures for manipulation of fluid samples |
| WO1999033559A1 (en) | 1997-12-24 | 1999-07-08 | Cepheid | Integrated fluid manipulation cartridge |
| AU4437702A (en) | 1997-08-13 | 2002-07-11 | Cepheid | Microstructures for the manipulation of fluid samples |
| AU4437602A (en) | 1997-08-13 | 2002-07-11 | Cepheid | Microstructures for the manipulation of fluid samples |
| EP1003759A2 (en) | 1997-08-13 | 2000-05-31 | Cepheid | Microstructures for the manipulation of fluid samples |
| US5916776A (en) | 1997-08-27 | 1999-06-29 | Sarnoff Corporation | Amplification method for a polynucleotide |
| US5989402A (en) | 1997-08-29 | 1999-11-23 | Caliper Technologies Corp. | Controller/detector interfaces for microfluidic systems |
| US5965410A (en) | 1997-09-02 | 1999-10-12 | Caliper Technologies Corp. | Electrical current for controlling fluid parameters in microchannels |
| AU746098B2 (en) | 1997-09-02 | 2002-04-18 | Caliper Life Sciences, Inc. | Microfluidic system with electrofluidic and electrothermal controls |
| US6597450B1 (en) | 1997-09-15 | 2003-07-22 | Becton, Dickinson And Company | Automated Optical Reader for Nucleic Acid Assays |
| US6043880A (en) | 1997-09-15 | 2000-03-28 | Becton Dickinson And Company | Automated optical reader for nucleic acid assays |
| WO1999015876A1 (en) | 1997-09-19 | 1999-04-01 | Aclara Biosciences, Inc. | Apparatus and method for transferring liquids |
| US20020092767A1 (en) | 1997-09-19 | 2002-07-18 | Aclara Biosciences, Inc. | Multiple array microfluidic device units |
| US6902703B2 (en) | 1999-05-03 | 2005-06-07 | Ljl Biosystems, Inc. | Integrated sample-processing system |
| US5961925A (en) | 1997-09-22 | 1999-10-05 | Bristol-Myers Squibb Company | Apparatus for synthesis of multiple organic compounds with pinch valve block |
| US5993611A (en) | 1997-09-24 | 1999-11-30 | Sarnoff Corporation | Capacitive denaturation of nucleic acid |
| US6012902A (en) | 1997-09-25 | 2000-01-11 | Caliper Technologies Corp. | Micropump |
| DE69839294T2 (en) | 1997-09-29 | 2009-04-09 | F. Hoffmann-La Roche Ag | Apparatus for depositing magnetic particles |
| WO1999018438A1 (en) | 1997-10-02 | 1999-04-15 | Aclara Biosciences, Inc. | Capillary assays involving separation of free and bound species |
| US5842787A (en) | 1997-10-09 | 1998-12-01 | Caliper Technologies Corporation | Microfluidic systems incorporating varied channel dimensions |
| AU1517999A (en) | 1997-10-15 | 1999-05-03 | Aclara Biosciences, Inc. | Laminate microstructure device and method for making same |
| US5958694A (en) | 1997-10-16 | 1999-09-28 | Caliper Technologies Corp. | Apparatus and methods for sequencing nucleic acids in microfluidic systems |
| US6132684A (en) | 1997-10-31 | 2000-10-17 | Becton Dickinson And Company | Sample tube holder |
| JP4163382B2 (en) | 1997-11-14 | 2008-10-08 | ジェン−プローブ・インコーポレイテッド | Assay workstation |
| WO1999025816A1 (en) * | 1997-11-14 | 1999-05-27 | California Institute Of Technology | Cell lysis device |
| US5992820A (en) | 1997-11-19 | 1999-11-30 | Sarnoff Corporation | Flow control in microfluidics devices by controlled bubble formation |
| US6174675B1 (en) | 1997-11-25 | 2001-01-16 | Caliper Technologies Corp. | Electrical current for controlling fluid parameters in microchannels |
| USD413677S (en) | 1997-11-26 | 1999-09-07 | Bayer Corporation | Sample tube rack |
| US6123205A (en) | 1997-11-26 | 2000-09-26 | Bayer Corporation | Sample tube rack |
| US6197503B1 (en) | 1997-11-26 | 2001-03-06 | Ut-Battelle, Llc | Integrated circuit biochip microsystem containing lens |
| US6258264B1 (en) | 1998-04-10 | 2001-07-10 | Transgenomic, Inc. | Non-polar media for polynucleotide separations |
| US5922289A (en) | 1997-12-05 | 1999-07-13 | Evergreen Industries Inc. | Microtitration tray |
| US6914137B2 (en) | 1997-12-06 | 2005-07-05 | Dna Research Innovations Limited | Isolation of nucleic acids |
| DK1036082T3 (en) | 1997-12-06 | 2002-08-12 | Dna Res Innovations Ltd | Isolation of nucleic acids |
| US6074725A (en) | 1997-12-10 | 2000-06-13 | Caliper Technologies Corp. | Fabrication of microfluidic circuits by printing techniques |
| DE19755479A1 (en) | 1997-12-13 | 1999-06-17 | Wolfgang Prof Dr Ing Benecke | Micro-apparatus rapidly completing DNA amplification by polymerase-ketene reaction, useful for gene analysis |
| US5948227A (en) | 1997-12-17 | 1999-09-07 | Caliper Technologies Corp. | Methods and systems for performing electrophoretic molecular separations |
| EP1044370B1 (en) | 1997-12-30 | 2017-08-23 | Caliper Life Sciences, Inc. | Software for the display of chromatographic separation data |
| US6167910B1 (en) | 1998-01-20 | 2001-01-02 | Caliper Technologies Corp. | Multi-layer microfluidic devices |
| JP3551293B2 (en) | 1998-02-02 | 2004-08-04 | 東洋紡績株式会社 | Nucleic acid extraction device |
| USD413391S (en) | 1998-02-05 | 1999-08-31 | Bayer Corporation | Test tube sample rack |
| US6420143B1 (en) | 1998-02-13 | 2002-07-16 | Caliper Technologies Corp. | Methods and systems for performing superheated reactions in microscale fluidic systems |
| US6756019B1 (en) | 1998-02-24 | 2004-06-29 | Caliper Technologies Corp. | Microfluidic devices and systems incorporating cover layers |
| US6861035B2 (en) | 1998-02-24 | 2005-03-01 | Aurora Discovery, Inc. | Multi-well platforms, caddies, lids and combinations thereof |
| US6100541A (en) | 1998-02-24 | 2000-08-08 | Caliper Technologies Corporation | Microfluidic devices and systems incorporating integrated optical elements |
| US6251343B1 (en) | 1998-02-24 | 2001-06-26 | Caliper Technologies Corp. | Microfluidic devices and systems incorporating cover layers |
| US6537432B1 (en) | 1998-02-24 | 2003-03-25 | Target Discovery, Inc. | Protein separation via multidimensional electrophoresis |
| US6369893B1 (en) | 1998-05-19 | 2002-04-09 | Cepheid | Multi-channel optical detection system |
| USD417009S (en) | 1998-03-02 | 1999-11-23 | Bayer Corporation | Sample tube rack |
| USD428497S (en) | 1998-03-06 | 2000-07-18 | Bayer Corporation | Test tube sample rack |
| US6979424B2 (en) | 1998-03-17 | 2005-12-27 | Cepheid | Integrated sample analysis device |
| ATE250455T1 (en) | 1998-03-17 | 2003-10-15 | Cepheid | DEVICE FOR ANALYZING A SAMPLE |
| AU764319B2 (en) | 1998-03-17 | 2003-08-14 | Cepheid | Chemical processing device |
| US7188001B2 (en) | 1998-03-23 | 2007-03-06 | Cepheid | System and method for temperature control |
| AU1357102A (en) | 1998-03-23 | 2002-03-14 | Cepheid | Multi-site reactor system with dynamic independent control of indvidual reaction sites |
| JPH11295323A (en) * | 1998-04-13 | 1999-10-29 | Matsushita Electric Ind Co Ltd | Automatic dispenser and its method |
| US6024920A (en) * | 1998-04-21 | 2000-02-15 | Bio-Rad Laboratories, Inc. | Microplate scanning read head |
| US7078224B1 (en) | 1999-05-14 | 2006-07-18 | Promega Corporation | Cell concentration and lysate clearance using paramagnetic particles |
| CA2754182A1 (en) | 1998-05-01 | 1999-11-11 | Gen-Probe Incorporated | Automated diagnostic analyzer and method |
| JPH11316226A (en) | 1998-05-06 | 1999-11-16 | Olympus Optical Co Ltd | Cartridge for automatic measurement and automatic measuring method |
| US6123798A (en) | 1998-05-06 | 2000-09-26 | Caliper Technologies Corp. | Methods of fabricating polymeric structures incorporating microscale fluidic elements |
| WO1999060381A1 (en) | 1998-05-16 | 1999-11-25 | The Perkin-Elmer Corporation | Instrument for monitoring polymerase chain reaction of dna |
| US6818437B1 (en) | 1998-05-16 | 2004-11-16 | Applera Corporation | Instrument for monitoring polymerase chain reaction of DNA |
| CA2320296A1 (en) | 1998-05-18 | 1999-11-25 | University Of Washington | Liquid analysis cartridge |
| EP0964555A1 (en) | 1998-06-04 | 1999-12-15 | Siemens Aktiengesellschaft | Threshold control and adaptive filtering in CAP receivers |
| US6274089B1 (en) | 1998-06-08 | 2001-08-14 | Caliper Technologies Corp. | Microfluidic devices, systems and methods for performing integrated reactions and separations |
| US6306590B1 (en) | 1998-06-08 | 2001-10-23 | Caliper Technologies Corp. | Microfluidic matrix localization apparatus and methods |
| US6149882A (en) | 1998-06-09 | 2000-11-21 | Symyx Technologies, Inc. | Parallel fixed bed reactor and fluid contacting apparatus |
| USD421130S (en) | 1998-06-15 | 2000-02-22 | Bayer Corporation | Sample tube rack |
| US7799521B2 (en) | 1998-06-24 | 2010-09-21 | Chen & Chen, Llc | Thermal cycling |
| US6780617B2 (en) | 2000-12-29 | 2004-08-24 | Chen & Chen, Llc | Sample processing device and method |
| US6375901B1 (en) | 1998-06-29 | 2002-04-23 | Agilent Technologies, Inc. | Chemico-mechanical microvalve and devices comprising the same |
| US6787111B2 (en) | 1998-07-02 | 2004-09-07 | Amersham Biosciences (Sv) Corp. | Apparatus and method for filling and cleaning channels and inlet ports in microchips used for biological analysis |
| USD420747S (en) | 1998-07-10 | 2000-02-15 | Bayer Corporation | Sample tube rack |
| DE19833087A1 (en) | 1998-07-23 | 2000-01-27 | Bosch Gmbh Robert | Gas sensor for vehicle engine; has measuring electrode comprising platinum base with sintered porous layer and noble metal covering layer, applied in galvanic bath |
| DE19833293C1 (en) | 1998-07-24 | 2000-01-20 | Gunther Botsch | Continuous separation apparatus for solids and gases from liquids, e.g. removal of magnetizable particles and air from water or fuel systems |
| US6366924B1 (en) | 1998-07-27 | 2002-04-02 | Caliper Technologies Corp. | Distributed database for analytical instruments |
| DE59912484D1 (en) | 1998-07-31 | 2005-10-06 | Tecan Trading Ag Maennedorf | magnetic separator |
| US6540896B1 (en) | 1998-08-05 | 2003-04-01 | Caliper Technologies Corp. | Open-Field serial to parallel converter |
| US6236456B1 (en) * | 1998-08-18 | 2001-05-22 | Molecular Devices Corporation | Optical system for a scanning fluorometer |
| US6316774B1 (en) | 1998-08-18 | 2001-11-13 | Molecular Devices Corporation | Optical system for a scanning fluorometer |
| US6740518B1 (en) | 1998-09-17 | 2004-05-25 | Clinical Micro Sensors, Inc. | Signal detection techniques for the detection of analytes |
| USD439673S1 (en) * | 1998-10-06 | 2001-03-27 | Sorenson Bioscience | Multi-well microcentrifuge tube |
| US6958392B2 (en) | 1998-10-09 | 2005-10-25 | Whatman, Inc. | Methods for the isolation of nucleic acids and for quantitative DNA extraction and detection for leukocyte evaluation in blood products |
| US6572830B1 (en) | 1998-10-09 | 2003-06-03 | Motorola, Inc. | Integrated multilayered microfludic devices and methods for making the same |
| CA2347182C (en) | 1998-10-13 | 2004-06-15 | Biomicro Systems, Inc. | Fluid circuit components based upon passive fluid dynamics |
| US6149787A (en) | 1998-10-14 | 2000-11-21 | Caliper Technologies Corp. | External material accession systems and methods |
| US6498497B1 (en) | 1998-10-14 | 2002-12-24 | Caliper Technologies Corp. | Microfluidic controller and detector system with self-calibration |
| US6948843B2 (en) | 1998-10-28 | 2005-09-27 | Covaris, Inc. | Method and apparatus for acoustically controlling liquid solutions in microfluidic devices |
| US6086740A (en) | 1998-10-29 | 2000-07-11 | Caliper Technologies Corp. | Multiplexed microfluidic devices and systems |
| US5973138A (en) | 1998-10-30 | 1999-10-26 | Becton Dickinson And Company | Method for purification and manipulation of nucleic acids using paramagnetic particles |
| WO2000034521A1 (en) | 1998-12-08 | 2000-06-15 | Boston Probes, Inc. | Methods, kits and compositions for the identification of nucleic acids electrostatically bound to matrices |
| JP2000180455A (en) | 1998-12-15 | 2000-06-30 | Sanuki Kogyo Kk | Flow injection automatic analyzer |
| US6062261A (en) | 1998-12-16 | 2000-05-16 | Lockheed Martin Energy Research Corporation | MicrofluIdic circuit designs for performing electrokinetic manipulations that reduce the number of voltage sources and fluid reservoirs |
| US6261431B1 (en) | 1998-12-28 | 2001-07-17 | Affymetrix, Inc. | Process for microfabrication of an integrated PCR-CE device and products produced by the same |
| JP4454155B2 (en) | 1999-01-08 | 2010-04-21 | アプライド バイオシステムズ, エルエルシー | Fiber arrays for contacting chemical species and methods of using and making fiber arrays |
| US6150119A (en) | 1999-01-19 | 2000-11-21 | Caliper Technologies Corp. | Optimized high-throughput analytical system |
| IT1306964B1 (en) | 1999-01-19 | 2001-10-11 | St Microelectronics Srl | CAPACITIVE BOOSTING CIRCUIT FOR REGULATION OF LINE VOLTAGE READING IN NON-VOLATILE MEMORIES |
| US6416642B1 (en) | 1999-01-21 | 2002-07-09 | Caliper Technologies Corp. | Method and apparatus for continuous liquid flow in microscale channels using pressure injection, wicking, and electrokinetic injection |
| US20020019059A1 (en) | 1999-01-28 | 2002-02-14 | Calvin Y.H. Chow | Devices, systems and methods for time domain multiplexing of reagents |
| CN1296703C (en) | 1999-02-02 | 2007-01-24 | 卡钳生命科学股份有限公司 | Methods, devices and systems for characterizing proteins |
| US6294063B1 (en) | 1999-02-12 | 2001-09-25 | Board Of Regents, The University Of Texas System | Method and apparatus for programmable fluidic processing |
| AU3498900A (en) | 1999-02-23 | 2000-09-14 | Caliper Technologies Corporation | Sequencing by incorporation |
| US6143547A (en) | 1999-03-02 | 2000-11-07 | Academia Sinica | Cell line derived from Penaeus monodon and a method of growing virus using the same |
| US6749814B1 (en) | 1999-03-03 | 2004-06-15 | Symyx Technologies, Inc. | Chemical processing microsystems comprising parallel flow microreactors and methods for using same |
| US6558945B1 (en) | 1999-03-08 | 2003-05-06 | Aclara Biosciences, Inc. | Method and device for rapid color detection |
| US6326083B1 (en) | 1999-03-08 | 2001-12-04 | Calipher Technologies Corp. | Surface coating for microfluidic devices that incorporate a biopolymer resistant moiety |
| US6171850B1 (en) * | 1999-03-08 | 2001-01-09 | Caliper Technologies Corp. | Integrated devices and systems for performing temperature controlled reactions and analyses |
| US6148508A (en) | 1999-03-12 | 2000-11-21 | Caliper Technologies Corp. | Method of making a capillary for electrokinetic transport of materials |
| JP2000266760A (en) | 1999-03-17 | 2000-09-29 | Hitachi Ltd | Dispenser |
| EP1041386B1 (en) | 1999-03-25 | 2007-10-17 | Tosoh Corporation | Analyzer |
| JP3988306B2 (en) | 1999-03-25 | 2007-10-10 | 東ソー株式会社 | Automatic measuring device |
| US6783962B1 (en) | 1999-03-26 | 2004-08-31 | Upfront Chromatography | Particulate material for purification of bio-macromolecules |
| US6194563B1 (en) | 1999-03-26 | 2001-02-27 | Vysis, Inc. | Solid phase nucleic acid labeling by transamination |
| US6500323B1 (en) | 1999-03-26 | 2002-12-31 | Caliper Technologies Corp. | Methods and software for designing microfluidic devices |
| US6303343B1 (en) | 1999-04-06 | 2001-10-16 | Caliper Technologies Corp. | Inefficient fast PCR |
| US6306273B1 (en) | 1999-04-13 | 2001-10-23 | Aclara Biosciences, Inc. | Methods and compositions for conducting processes in microfluidic devices |
| US6322683B1 (en) | 1999-04-14 | 2001-11-27 | Caliper Technologies Corp. | Alignment of multicomponent microfabricated structures |
| US6605475B1 (en) | 1999-04-16 | 2003-08-12 | Perspective Biosystems, Inc. | Apparatus and method for sample delivery |
| US20040053290A1 (en) * | 2000-01-11 | 2004-03-18 | Terbrueggen Robert Henry | Devices and methods for biochip multiplexing |
| US6942771B1 (en) | 1999-04-21 | 2005-09-13 | Clinical Micro Sensors, Inc. | Microfluidic systems in the electrochemical detection of target analytes |
| CA2270106C (en) | 1999-04-23 | 2006-03-14 | Yousef Haj-Ahmad | Nucleic acid purification and process |
| US6773676B2 (en) | 1999-04-27 | 2004-08-10 | Agilent Technologies, Inc. | Devices for performing array hybridization assays and methods of using the same |
| EP1190252B1 (en) | 1999-04-28 | 2008-12-31 | Eidgenössische Technische Hochschule Zürich | Polyionic coatings in analytic and sensor devices |
| US7001725B2 (en) | 1999-04-30 | 2006-02-21 | Aclara Biosciences, Inc. | Kits employing generalized target-binding e-tag probes |
| WO2000066783A2 (en) | 1999-05-04 | 2000-11-09 | Ortho-Clinical Diagnostics, Inc. | Rapid and efficient capture of dna from sample without using cell lysing reagent |
| US6555389B1 (en) | 1999-05-11 | 2003-04-29 | Aclara Biosciences, Inc. | Sample evaporative control |
| US6458259B1 (en) | 1999-05-11 | 2002-10-01 | Caliper Technologies Corp. | Prevention of surface adsorption in microchannels by application of electric current during pressure-induced flow |
| CA2373537A1 (en) | 1999-05-12 | 2000-11-16 | Aclara Biosciences, Inc. | Multiplexed fluorescent detection in microfluidic devices |
| US6838680B2 (en) | 1999-05-12 | 2005-01-04 | Aclara Biosciences, Inc. | Multiplexed fluorescent detection in microfluidic devices |
| US6326147B1 (en) | 1999-05-13 | 2001-12-04 | The Perkin-Elmer Corporation | Methods, apparatus, articles of manufacture, and user interfaces for performing automated biological assay preparation and macromolecule purification |
| US6310199B1 (en) | 1999-05-14 | 2001-10-30 | Promega Corporation | pH dependent ion exchange matrix and method of use in the isolation of nucleic acids |
| WO2000070080A1 (en) | 1999-05-17 | 2000-11-23 | Caliper Technologies Corp. | Focusing of microparticles in microfluidic systems |
| US6592821B1 (en) | 1999-05-17 | 2003-07-15 | Caliper Technologies Corp. | Focusing of microparticles in microfluidic systems |
| US6287774B1 (en) | 1999-05-21 | 2001-09-11 | Caliper Technologies Corp. | Assay methods and system |
| US6472141B2 (en) | 1999-05-21 | 2002-10-29 | Caliper Technologies Corp. | Kinase assays using polycations |
| ATE401125T1 (en) | 1999-05-28 | 2008-08-15 | Bio Data Corp | METHOD AND DEVICE FOR DIRECT SAMPLING OF A FLUID FOR MICROFILTRATION |
| CA2374423C (en) | 1999-05-28 | 2013-04-09 | Cepheid | Apparatus and method for analyzing a liquid sample |
| US20040200909A1 (en) | 1999-05-28 | 2004-10-14 | Cepheid | Apparatus and method for cell disruption |
| JP4495866B2 (en) | 1999-05-28 | 2010-07-07 | セフィード | Cartridge for controlling chemical reactions |
| DE29909529U1 (en) | 1999-06-01 | 1999-08-12 | Festo AG & Co, 73734 Esslingen | Fluid control unit |
| US6649358B1 (en) | 1999-06-01 | 2003-11-18 | Caliper Technologies Corp. | Microscale assays and microfluidic devices for transporter, gradient induced, and binding activities |
| NZ515607A (en) | 1999-06-01 | 2003-07-25 | Univ California | Method of sterilizing |
| GB9913275D0 (en) | 1999-06-08 | 1999-08-04 | Dna Research Instr Limited | Sample processing device |
| FR2795426A1 (en) | 1999-06-22 | 2000-12-29 | Commissariat Energie Atomique | Support for genetic analysis comprising reservoir(s) for a medium to be analyzed connected by passage(s) having temperature control device(s) to a test strip with analysis sites having biological probes |
| DE60038883D1 (en) | 1999-06-22 | 2008-06-26 | Tecan Trading Ag | DEVICES FOR CARRYING OUT MINIATURIZED IN VITRO AMPLIFICATION ASSAYS |
| US6706519B1 (en) | 1999-06-22 | 2004-03-16 | Tecan Trading Ag | Devices and methods for the performance of miniaturized in vitro amplification assays |
| US6811668B1 (en) | 1999-06-22 | 2004-11-02 | Caliper Life Sciences, Inc. | Apparatus for the operation of a microfluidic device |
| US6878540B2 (en) | 1999-06-25 | 2005-04-12 | Cepheid | Device for lysing cells, spores, or microorganisms |
| EP1065378B1 (en) | 1999-06-28 | 2002-04-03 | California Institute of Technology | Microfabricated elastomeric valve and pump systems |
| US7306672B2 (en) * | 2001-04-06 | 2007-12-11 | California Institute Of Technology | Microfluidic free interface diffusion techniques |
| WO2001002850A1 (en) | 1999-07-06 | 2001-01-11 | Caliper Technologies Corp. | Microfluidic systems and methods for determining modulator kinetics |
| US6353475B1 (en) | 1999-07-12 | 2002-03-05 | Caliper Technologies Corp. | Light source power modulation for use with chemical and biochemical analysis |
| EP1202808B1 (en) | 1999-07-19 | 2008-10-15 | bioMerieux B.V. | Method for mixing magnetic particals with a fluid |
| USD438311S1 (en) | 1999-07-28 | 2001-02-27 | Matsushita Electric Industrial Co.,Ltd. | Strip for blood test |
| US6337435B1 (en) * | 1999-07-30 | 2002-01-08 | Bio-Rad Laboratories, Inc. | Temperature control for multi-vessel reaction apparatus |
| US6242188B1 (en) | 1999-07-30 | 2001-06-05 | Applied Gene Technologies, Inc. | Sample processing to release nucleic acids for direct detection |
| US6818060B2 (en) | 1999-08-02 | 2004-11-16 | Emerald Biostructures, Inc. | Robot for mixing crystallization trial matrices |
| US6524456B1 (en) | 1999-08-12 | 2003-02-25 | Ut-Battelle, Llc | Microfluidic devices for the controlled manipulation of small volumes |
| US6602206B1 (en) | 1999-08-18 | 2003-08-05 | Becton, Dickinson And Company | Stopper-shield assembly |
| US6495104B1 (en) | 1999-08-19 | 2002-12-17 | Caliper Technologies Corp. | Indicator components for microfluidic systems |
| WO2001014931A1 (en) | 1999-08-23 | 2001-03-01 | Mitsubishi Chemical Corporation | Photopolymerizable composition and photopolymerizable lithographic plate |
| US6858185B1 (en) | 1999-08-25 | 2005-02-22 | Caliper Life Sciences, Inc. | Dilutions in high throughput systems with a single vacuum source |
| US6613581B1 (en) | 1999-08-26 | 2003-09-02 | Caliper Technologies Corp. | Microfluidic analytic detection assays, devices, and integrated systems |
| US6613211B1 (en) | 1999-08-27 | 2003-09-02 | Aclara Biosciences, Inc. | Capillary electrokinesis based cellular assays |
| US6824663B1 (en) | 1999-08-27 | 2004-11-30 | Aclara Biosciences, Inc. | Efficient compound distribution in microfluidic devices |
| US6633785B1 (en) | 1999-08-31 | 2003-10-14 | Kabushiki Kaisha Toshiba | Thermal cycler and DNA amplifier method |
| WO2001017797A1 (en) | 1999-09-10 | 2001-03-15 | Caliper Technologies Corp. | Microfabrication methods and devices |
| USD466219S1 (en) | 1999-09-13 | 2002-11-26 | Micronic B.V. | Carrier for test-tubes |
| US6906797B1 (en) | 1999-09-13 | 2005-06-14 | Aclara Biosciences, Inc. | Side light activated microfluid channels |
| DE19945604A1 (en) | 1999-09-23 | 2003-08-07 | Aclara Biosciences Inc | Method of joining workpieces made of plastic and its use in microstructure and nanostructure technology |
| DE19948473A1 (en) | 1999-10-08 | 2001-04-12 | Nmi Univ Tuebingen | Method and device for measuring cells in a liquid environment |
| WO2001027253A1 (en) | 1999-10-08 | 2001-04-19 | Caliper Technologies Corp. | Use of nernstein voltage sensitive dyes in measuring transmembrane voltage |
| US6221600B1 (en) | 1999-10-08 | 2001-04-24 | Board Of Regents, The University Of Texas System | Combinatorial oligonucleotide PCR: a method for rapid, global expression analysis |
| US6287254B1 (en) | 1999-11-02 | 2001-09-11 | W. Jean Dodds | Animal health diagnosis |
| US6232072B1 (en) * | 1999-10-15 | 2001-05-15 | Agilent Technologies, Inc. | Biopolymer array inspection |
| US6272939B1 (en) | 1999-10-15 | 2001-08-14 | Applera Corporation | System and method for filling a substrate with a liquid sample |
| US6908594B1 (en) | 1999-10-22 | 2005-06-21 | Aclara Biosciences, Inc. | Efficient microfluidic sealing |
| USD461906S1 (en) | 1999-10-25 | 2002-08-20 | Tuan Hung Pham | Diagnostic test card |
| GB2355717A (en) | 1999-10-28 | 2001-05-02 | Amersham Pharm Biotech Uk Ltd | DNA isolation method |
| US6300124B1 (en) | 1999-11-02 | 2001-10-09 | Regents Of The University Of Minnesota | Device and method to directly control the temperature of microscope slides |
| US6875619B2 (en) | 1999-11-12 | 2005-04-05 | Motorola, Inc. | Microfluidic devices comprising biochannels |
| EP1237655A2 (en) | 1999-12-09 | 2002-09-11 | Motorola, Inc. | Multilayered microfluidic devices for analyte reactions |
| USD438632S1 (en) | 1999-12-21 | 2001-03-06 | Compucyte Corporation | Multi-well reagent cartridge for treating a sample |
| USD438633S1 (en) | 1999-12-21 | 2001-03-06 | Compucyte Corporation | Reagent cartridge for treating a sample |
| EP1242626B1 (en) | 1999-12-21 | 2009-06-10 | Ortho-Clinical Diagnostics, Inc. | Detection of nucleic acids |
| US6936414B2 (en) | 1999-12-22 | 2005-08-30 | Abbott Laboratories | Nucleic acid isolation method and kit |
| DE19963032A1 (en) | 1999-12-24 | 2001-06-28 | Roche Diagnostics Gmbh | System for processing samples in a multi-chamber arrangement |
| US6699713B2 (en) | 2000-01-04 | 2004-03-02 | The Regents Of The University Of California | Polymerase chain reaction system |
| ATE386815T1 (en) | 2000-01-06 | 2008-03-15 | Caliper Life Sciences Inc | METHODS AND SYSTEMS FOR MONITORING INTRACELLULAR BINDING REACTIONS |
| ATE340025T1 (en) | 2000-01-06 | 2006-10-15 | Caliper Life Sciences Inc | APPARATUS AND METHODS FOR HIGH-THROUGHPUT SAMPLING AND ANALYSIS |
| US6468761B2 (en) | 2000-01-07 | 2002-10-22 | Caliper Technologies, Corp. | Microfluidic in-line labeling method for continuous-flow protease inhibition analysis |
| ATE350160T1 (en) | 2000-01-11 | 2007-01-15 | Clinical Micro Sensors Inc | CARTRIDGE CONTAINING A BIOCHIP |
| AU2001232805A1 (en) | 2000-01-12 | 2001-07-24 | Ut-Battelle, Llc | A microfluidic device and method for focusing, segmenting, and dispensing of a fluid stream |
| US7037416B2 (en) | 2000-01-14 | 2006-05-02 | Caliper Life Sciences, Inc. | Method for monitoring flow rate using fluorescent markers |
| JP3397737B2 (en) | 2000-01-24 | 2003-04-21 | 倉敷紡績株式会社 | Nucleic acid extraction method |
| US6556923B2 (en) | 2000-01-26 | 2003-04-29 | Caliper Technologies Corp. | Software for high throughput microfluidic systems |
| US6589729B2 (en) | 2000-02-04 | 2003-07-08 | Caliper Technologies Corp. | Methods, devices, and systems for monitoring time dependent reactions |
| US6685813B2 (en) | 2000-02-11 | 2004-02-03 | Aclara Biosciences, Inc. | Tandem isotachophoresis/zone electrophoresis method and system |
| JP4753517B2 (en) | 2000-02-11 | 2011-08-24 | アクララ バイオサイエンシーズ, インコーポレイテッド | Microfluidic device and method with sample injector |
| JP3750460B2 (en) | 2000-02-18 | 2006-03-01 | 日立工機株式会社 | Dispensing device and dispensing method |
| AU2001238606A1 (en) | 2000-02-18 | 2001-08-27 | Board Of Trustees Of The Leland Stanford Junior University | Apparatus and methods for parallel processing of micro-volume liquid reactions |
| CN1261755C (en) | 2000-02-23 | 2006-06-28 | 卡钳技术有限公司 | Multi-reservoir pressure control system |
| US7040144B2 (en) | 2000-02-23 | 2006-05-09 | Caliper Life Sciences, Inc. | Microfluidic viscometer |
| US6681616B2 (en) | 2000-02-23 | 2004-01-27 | Caliper Technologies Corp. | Microfluidic viscometer |
| JP2003527616A (en) | 2000-03-17 | 2003-09-16 | アクララ バイオサイエンシーズ, インコーポレイテッド | Microfluidic devices and systems with additional peripheral channels |
| US20020012971A1 (en) | 2000-03-20 | 2002-01-31 | Mehta Tammy Burd | PCR compatible nucleic acid sieving medium |
| US6358387B1 (en) | 2000-03-27 | 2002-03-19 | Caliper Technologies Corporation | Ultra high throughput microfluidic analytical systems and methods |
| US6927851B2 (en) | 2000-03-31 | 2005-08-09 | Neogen Corporation | Methods and apparatus to improve the sensitivity and reproducibility of bioluminescent analytical methods |
| US7867763B2 (en) * | 2004-01-25 | 2011-01-11 | Fluidigm Corporation | Integrated chip carriers with thermocycler interfaces and methods of using the same |
| US6401552B1 (en) | 2000-04-17 | 2002-06-11 | Carlos D. Elkins | Centrifuge tube and method for collecting and dispensing mixed concentrated fluid samples |
| US6733645B1 (en) | 2000-04-18 | 2004-05-11 | Caliper Technologies Corp. | Total analyte quantitation |
| USD446306S1 (en) | 2000-04-26 | 2001-08-07 | Matsushita Electric Industrial Co., Ltd. | Medical information communication apparatus |
| US7160735B2 (en) | 2000-04-28 | 2007-01-09 | Monogram Biosciences, Inc. | Tagged microparticle compositions and methods |
| US6787016B2 (en) | 2000-05-01 | 2004-09-07 | Aclara Biosciences, Inc. | Dynamic coating with linear polymer mixture for electrophoresis |
| AU2001259355B2 (en) | 2000-05-03 | 2005-09-01 | Caliper Life Sciences, Inc. | Multi depth substrate fabrication processes |
| US7578976B1 (en) | 2000-05-10 | 2009-08-25 | Lawrence Livermore National Security, Llc | Sleeve reaction chamber system |
| AU6154101A (en) | 2000-05-11 | 2001-11-20 | Caliper Techn Corp | Microfluidic devices and methods to regulate hydrodynamic and electrical resistance utilizing bulk viscosity enhancers |
| DE60135912D1 (en) * | 2000-05-12 | 2008-11-06 | Caliper Life Sciences Inc | DETECTION OF HYBRIDIZATION OF NUCLEIC ACIDS BY FLUORESCENCE POLARIZATION |
| US6672458B2 (en) | 2000-05-19 | 2004-01-06 | Becton, Dickinson And Company | System and method for manipulating magnetically responsive particles fluid samples to collect DNA or RNA from a sample |
| DE60134849D1 (en) | 2000-05-19 | 2008-08-28 | Aclara Biosciences Inc | ORIENTATION OF AN OPTICAL DETECTION SYSTEM WITH A CAPILLARY CHANNEL IN A MICROFLUID LABORATORY CHIP |
| ES2319101T3 (en) | 2000-05-19 | 2009-05-04 | Becton Dickinson And Company | SYSTEM AND PROCEDURE FOR MAGNETICALLY SENSITIVE PARTICLE HANDLING IN FLUID SAMPLES TO EXTRACT DNA OR RNA FROM A SAMPLE. |
| EP1286761A2 (en) | 2000-05-24 | 2003-03-05 | Cellular Process Chemistry Inc. | Modular chemical production system incorporating a microreactor |
| WO2001092569A2 (en) | 2000-05-31 | 2001-12-06 | Tepnel Medical Limited | Formulation for polymerase chain reaction and vessel containing same |
| US6520197B2 (en) | 2000-06-02 | 2003-02-18 | The Regents Of The University Of California | Continuous laminar fluid mixing in micro-electromechanical systems |
| US7351376B1 (en) * | 2000-06-05 | 2008-04-01 | California Institute Of Technology | Integrated active flux microfluidic devices and methods |
| US6790330B2 (en) | 2000-06-14 | 2004-09-14 | Board Of Regents, The University Of Texas System | Systems and methods for cell subpopulation analysis |
| AU2001269929B2 (en) | 2000-06-19 | 2005-11-03 | Caliper Life Sciences, Inc. | Methods and devices for enhancing bonded substrate yields and regulating temperature |
| US7169618B2 (en) | 2000-06-28 | 2007-01-30 | Skold Technology | Magnetic particles and methods of producing coated magnetic particles |
| US6734401B2 (en) | 2000-06-28 | 2004-05-11 | 3M Innovative Properties Company | Enhanced sample processing devices, systems and methods |
| US6720187B2 (en) | 2000-06-28 | 2004-04-13 | 3M Innovative Properties Company | Multi-format sample processing devices |
| JP2004506179A (en) | 2000-07-19 | 2004-02-26 | ゲニスフィア・インコーポレイテッド | Methods for detecting and analyzing nucleic acid sequences |
| FR2812088B1 (en) | 2000-07-21 | 2003-01-24 | Abx Sa | DEVICE FOR PROCESSING SAMPLES OF BLOOD PRODUCTS |
| AU2001277075A1 (en) | 2000-07-21 | 2002-02-05 | Aclara Biosciences, Inc. | Method and devices for capillary electrophoresis with a norbornene based surface coating |
| US7004184B2 (en) * | 2000-07-24 | 2006-02-28 | The Reagents Of The University Of Michigan | Compositions and methods for liquid metering in microchannels |
| EP1314024A4 (en) | 2000-08-02 | 2007-04-11 | Caliper Life Sciences Inc | High throughput separations based analysis systems |
| US20020142618A1 (en) | 2000-08-04 | 2002-10-03 | Caliper Technologies Corp. | Control of operation conditions within fluidic systems |
| JP2004506183A (en) * | 2000-08-04 | 2004-02-26 | モレキュラー・センシング・パブリック・リミテッド・カンパニー | Equipment for diagnostic assays |
| FR2813207B1 (en) | 2000-08-28 | 2002-10-11 | Bio Merieux | REACTIONAL CARD AND USE OF SUCH A CARD |
| JP3993372B2 (en) | 2000-09-13 | 2007-10-17 | 独立行政法人理化学研究所 | Reactor manufacturing method |
| EP1317569B1 (en) | 2000-09-14 | 2009-11-18 | Caliper Life Sciences, Inc. | Microfluidic devices and methods for performing temperature mediated reactions |
| WO2002023163A1 (en) * | 2000-09-15 | 2002-03-21 | California Institute Of Technology | Microfabricated crossflow devices and methods |
| US6939451B2 (en) | 2000-09-19 | 2005-09-06 | Aclara Biosciences, Inc. | Microfluidic chip having integrated electrodes |
| ATE349011T1 (en) | 2000-10-03 | 2007-01-15 | Minerva Biotechnologies Corp | MAGNETIC IN SITU DILUTION PROCESS |
| EP1324828A1 (en) | 2000-10-06 | 2003-07-09 | Protasis Corporation | Fluid separation conduit cartridge with encryption capability |
| US6623860B2 (en) | 2000-10-10 | 2003-09-23 | Aclara Biosciences, Inc. | Multilevel flow structures |
| USD463031S1 (en) | 2000-10-11 | 2002-09-17 | Aclara Biosciences, Inc. | Microvolume sample plate |
| EP1325459A4 (en) | 2000-10-13 | 2010-09-01 | Irm Llc | High throughput processing system and method of using |
| US6375185B1 (en) * | 2000-10-20 | 2002-04-23 | Gamemax Corporation | Paper currency receiving control assembly for currency-coin exchange machine |
| US7514046B2 (en) | 2000-10-31 | 2009-04-07 | Caliper Life Sciences, Inc. | Methods and systems for processing microscale devices for reuse |
| AU2002220106A1 (en) | 2000-10-31 | 2002-05-15 | Caliper Technologies Corp. | Microfluidic methods, devices and systems for in situ material concentration |
| EP1331999A2 (en) | 2000-11-03 | 2003-08-06 | Clinical Micro Sensors, Inc. | Devices and methods for biochip multiplexing |
| US7105304B1 (en) | 2000-11-07 | 2006-09-12 | Caliper Life Sciences, Inc. | Pressure-based mobility shift assays |
| US20050202470A1 (en) | 2000-11-16 | 2005-09-15 | Caliper Life Sciences, Inc. | Binding assays using molecular melt curves |
| US6951632B2 (en) | 2000-11-16 | 2005-10-04 | Fluidigm Corporation | Microfluidic devices for introducing and dispensing fluids from microfluidic systems |
| US8900811B2 (en) | 2000-11-16 | 2014-12-02 | Caliper Life Sciences, Inc. | Method and apparatus for generating thermal melting curves in a microfluidic device |
| CH695544A5 (en) | 2000-11-17 | 2006-06-30 | Tecan Trading Ag | Apparatus for dispensing or aspirating / dispensing liquid samples. |
| USD468437S1 (en) | 2000-11-21 | 2003-01-07 | Acon Laboratories, Inc. | Test platform |
| US6521188B1 (en) | 2000-11-22 | 2003-02-18 | Industrial Technology Research Institute | Microfluidic actuator |
| SE0004296D0 (en) | 2000-11-23 | 2000-11-23 | Gyros Ab | Device and method for the controlled heating in micro channel systems |
| US20040043479A1 (en) | 2000-12-11 | 2004-03-04 | Briscoe Cynthia G. | Multilayerd microfluidic devices for analyte reactions |
| US7024281B1 (en) | 2000-12-11 | 2006-04-04 | Callper Life Sciences, Inc. | Software for the controlled sampling of arrayed materials |
| US6382254B1 (en) * | 2000-12-12 | 2002-05-07 | Eastman Kodak Company | Microfluidic valve and method for controlling the flow of a liquid |
| CA2430691A1 (en) | 2000-12-27 | 2002-07-04 | Dynavax Technologies Corporation | Immunomodulatory polynucleotides and methods of using the same |
| US6453928B1 (en) | 2001-01-08 | 2002-09-24 | Nanolab Ltd. | Apparatus, and method for propelling fluids |
| JP4505776B2 (en) | 2001-01-19 | 2010-07-21 | 凸版印刷株式会社 | Gene detection system, gene detection apparatus equipped with the same, detection method, and gene detection chip |
| JP3548858B2 (en) | 2001-01-22 | 2004-07-28 | 独立行政法人産業技術総合研究所 | Flow control method and microvalve used therefor |
| US6878755B2 (en) | 2001-01-22 | 2005-04-12 | Microgen Systems, Inc. | Automated microfabrication-based biodetector |
| WO2002060754A1 (en) | 2001-01-29 | 2002-08-08 | Caliper Technologies Corp. | Non-mechanical valves for fluidic systems |
| US6692700B2 (en) | 2001-02-14 | 2004-02-17 | Handylab, Inc. | Heat-reduction methods and systems related to microfluidic devices |
| US7670559B2 (en) | 2001-02-15 | 2010-03-02 | Caliper Life Sciences, Inc. | Microfluidic systems with enhanced detection systems |
| US6432695B1 (en) | 2001-02-16 | 2002-08-13 | Institute Of Microelectronics | Miniaturized thermal cycler |
| US6509186B1 (en) * | 2001-02-16 | 2003-01-21 | Institute Of Microelectronics | Miniaturized thermal cycler |
| US6720148B1 (en) | 2001-02-22 | 2004-04-13 | Caliper Life Sciences, Inc. | Methods and systems for identifying nucleotides by primer extension |
| US7867776B2 (en) | 2001-03-02 | 2011-01-11 | Caliper Life Sciences, Inc. | Priming module for microfluidic chips |
| WO2002072264A1 (en) | 2001-03-09 | 2002-09-19 | Biomicro Systems, Inc. | Method and system for microfluidic interfacing to arrays |
| US7150999B1 (en) | 2001-03-09 | 2006-12-19 | Califer Life Sciences, Inc. | Process for filling microfluidic channels |
| US6576459B2 (en) | 2001-03-23 | 2003-06-10 | The Regents Of The University Of California | Sample preparation and detection device for infectious agents |
| US7829025B2 (en) | 2001-03-28 | 2010-11-09 | Venture Lending & Leasing Iv, Inc. | Systems and methods for thermal actuation of microfluidic devices |
| US7010391B2 (en) | 2001-03-28 | 2006-03-07 | Handylab, Inc. | Methods and systems for control of microfluidic devices |
| US6575188B2 (en) | 2001-07-26 | 2003-06-10 | Handylab, Inc. | Methods and systems for fluid control in microfluidic devices |
| US7270786B2 (en) | 2001-03-28 | 2007-09-18 | Handylab, Inc. | Methods and systems for processing microfluidic samples of particle containing fluids |
| US8895311B1 (en) | 2001-03-28 | 2014-11-25 | Handylab, Inc. | Methods and systems for control of general purpose microfluidic devices |
| US6852287B2 (en) * | 2001-09-12 | 2005-02-08 | Handylab, Inc. | Microfluidic devices having a reduced number of input and output connections |
| US20140227710A1 (en) | 2001-03-28 | 2014-08-14 | Handylab, Inc. | Moving microdroplets in a microfluidic device |
| US7323140B2 (en) * | 2001-03-28 | 2008-01-29 | Handylab, Inc. | Moving microdroplets in a microfluidic device |
| US7192557B2 (en) | 2001-03-28 | 2007-03-20 | Handylab, Inc. | Methods and systems for releasing intracellular material from cells within microfluidic samples of fluids |
| US20020143297A1 (en) | 2001-03-30 | 2002-10-03 | Becton, Dickinson And Company | Adaptor for use with point-of-care testing cartridge |
| US6960437B2 (en) * | 2001-04-06 | 2005-11-01 | California Institute Of Technology | Nucleic acid amplification utilizing microfluidic devices |
| USD500142S1 (en) | 2001-04-10 | 2004-12-21 | Andrea Crisanti | Assay device |
| USD470595S1 (en) | 2001-04-10 | 2003-02-18 | Andrea Crisanti | Assay device |
| US7440684B2 (en) | 2001-04-12 | 2008-10-21 | Spaid Michael A | Method and apparatus for improved temperature control in microfluidic devices |
| US6588625B2 (en) | 2001-04-24 | 2003-07-08 | Abbott Laboratories | Sample handling system |
| US20020155010A1 (en) | 2001-04-24 | 2002-10-24 | Karp Christoph D. | Microfluidic valve with partially restrained element |
| JP4358521B2 (en) | 2001-05-18 | 2009-11-04 | サーナ・セラピューティクス・インコーポレイテッド | Conjugates and compositions for cellular delivery |
| USD495805S1 (en) | 2001-05-25 | 2004-09-07 | Umedik, Inc. | Assay device |
| US7723123B1 (en) | 2001-06-05 | 2010-05-25 | Caliper Life Sciences, Inc. | Western blot by incorporating an affinity purification zone |
| US20020187557A1 (en) | 2001-06-07 | 2002-12-12 | Hobbs Steven E. | Systems and methods for introducing samples into microfluidic devices |
| US7041068B2 (en) | 2001-06-12 | 2006-05-09 | Pelikan Technologies, Inc. | Sampling module device and method |
| US6977163B1 (en) | 2001-06-13 | 2005-12-20 | Caliper Life Sciences, Inc. | Methods and systems for performing multiple reactions by interfacial mixing |
| DE10128894A1 (en) | 2001-06-15 | 2002-12-19 | Basf Ag | Cationically surface-modified hydrophilic crosslinked polymer nanoparticles are used as an aqueous dispersion in stain-release treatment of textile or non-textile surfaces |
| US6859698B2 (en) | 2001-06-21 | 2005-02-22 | Snap-On Incorporated | Detachable cartridge unit and auxiliary unit for function expansion of a data processing system |
| US20030211517A1 (en) | 2001-06-22 | 2003-11-13 | Carulli John P. | Gp354 nucleic acids and polypeptides |
| US6709857B2 (en) * | 2001-06-26 | 2004-03-23 | Becton, Dickinson And Company | System and method for optically monitoring the concentration of a gas in a sample vial using photothermal spectroscopy to detect sample growth |
| US20030073110A1 (en) | 2001-07-03 | 2003-04-17 | Masaharu Aritomi | Method for isolating nucleic acid and a cartridge for chemical reaction and for nucleic acid isolation |
| US6514750B2 (en) | 2001-07-03 | 2003-02-04 | Pe Corporation (Ny) | PCR sample handling device |
| US6762049B2 (en) | 2001-07-05 | 2004-07-13 | Institute Of Microelectronics | Miniaturized multi-chamber thermal cycler for independent thermal multiplexing |
| WO2003006964A1 (en) | 2001-07-12 | 2003-01-23 | Aclara Biosciences, Inc. | Submersible light-directing member for material excitation in microfluidic devices |
| EP1952886B1 (en) * | 2001-07-16 | 2021-06-23 | BioFire Defense, LLC | Thermal cycling system and method of use |
| US7023007B2 (en) | 2001-07-17 | 2006-04-04 | Caliper Life Sciences, Inc. | Methods and systems for alignment of detection optics |
| CA2454570C (en) * | 2001-07-25 | 2016-12-20 | The Trustees Of Princeton University | Nanochannel arrays and their preparation and use for high throughput macromolecular analysis |
| US6766817B2 (en) | 2001-07-25 | 2004-07-27 | Tubarc Technologies, Llc | Fluid conduction utilizing a reversible unsaturated siphon with tubarc porosity action |
| US7270959B2 (en) * | 2001-07-25 | 2007-09-18 | Oakville Hong Kong Company Limited | Specimen collection container |
| EP1438567B1 (en) | 2001-07-26 | 2018-07-25 | Handylab, Inc. | Methods and systems for microfluidic processing |
| US20030064507A1 (en) * | 2001-07-26 | 2003-04-03 | Sean Gallagher | System and methods for mixing within a microfluidic device |
| US20060062696A1 (en) | 2001-07-27 | 2006-03-23 | Caliper Life Sciences, Inc. | Optimized high throughput analytical systems |
| US7060171B1 (en) | 2001-07-31 | 2006-06-13 | Caliper Life Sciences, Inc. | Methods and systems for reducing background signal in assays |
| JP2003047839A (en) | 2001-08-06 | 2003-02-18 | Yamatake Corp | Micro reactor |
| JP2003047840A (en) | 2001-08-06 | 2003-02-18 | Yamatake Corp | Micro reactor |
| US6640981B2 (en) | 2001-08-14 | 2003-11-04 | 3088081 Canada Inc. | Modular test tube rack |
| USD482796S1 (en) | 2001-09-11 | 2003-11-25 | Sysmex Corporation | Sample analyzer |
| USD512155S1 (en) | 2001-09-12 | 2005-11-29 | Techno Medica Co., Ltd. | Automatic blood sampling tube preparation apparatus |
| US20030059823A1 (en) | 2001-09-21 | 2003-03-27 | Juki Corporation | Hybridization apparatus and method for detecting nucleic acid in sample using the same |
| JP3996416B2 (en) | 2001-09-21 | 2007-10-24 | Juki株式会社 | B / F separation method in nucleic acid hybridization |
| USD467349S1 (en) | 2001-09-28 | 2002-12-17 | Orasure Technologies, Inc. | Analyzer |
| USD467348S1 (en) | 2001-10-15 | 2002-12-17 | Kimberly-Clark Worldwide, Inc. | Diagnostic test carrier |
| WO2003047712A2 (en) * | 2001-10-18 | 2003-06-12 | The Board Of Trustees Of The University Of Illinois | Hybrid microfluidic and nanofluidic system |
| EP1442131A4 (en) * | 2001-10-19 | 2006-06-07 | Univ West Virginia | Microfluidic system for proteome analysis |
| US20030156991A1 (en) | 2001-10-23 | 2003-08-21 | William Marsh Rice University | Optomechanically-responsive materials for use as light-activated actuators and valves |
| US7338760B2 (en) | 2001-10-26 | 2008-03-04 | Ntu Ventures Private Limited | Sample preparation integrated chip |
| US7584240B2 (en) | 2001-11-07 | 2009-09-01 | Genvault Corporation | Automated biological sample archive for storage, retrieval and analysis of large numbers of samples for remote clients |
| US6750661B2 (en) | 2001-11-13 | 2004-06-15 | Caliper Life Sciences, Inc. | Method and apparatus for controllably effecting samples using two signals |
| US7247274B1 (en) | 2001-11-13 | 2007-07-24 | Caliper Technologies Corp. | Prevention of precipitate blockage in microfluidic channels |
| US7069952B1 (en) | 2001-11-14 | 2006-07-04 | Caliper Life Sciences, Inc. | Microfluidic devices and methods of their manufacture |
| DE10156790A1 (en) | 2001-11-19 | 2003-06-18 | Chemagen Biopolymer Technologi | Device and method for treating magnetic particles |
| US20030099954A1 (en) * | 2001-11-26 | 2003-05-29 | Stefan Miltenyi | Apparatus and method for modification of magnetically immobilized biomolecules |
| US7635588B2 (en) | 2001-11-29 | 2009-12-22 | Applied Biosystems, Llc | Apparatus and method for differentiating multiple fluorescence signals by excitation wavelength |
| US7118910B2 (en) | 2001-11-30 | 2006-10-10 | Fluidigm Corporation | Microfluidic device and methods of using same |
| US6960235B2 (en) | 2001-12-05 | 2005-11-01 | The Regents Of The University Of California | Chemical microreactor and method thereof |
| JP2003185584A (en) | 2001-12-18 | 2003-07-03 | Fuji Photo Film Co Ltd | Scanner |
| JP2003180350A (en) * | 2001-12-21 | 2003-07-02 | Terumo Corp | Temperature control device |
| DE10163476A1 (en) | 2001-12-21 | 2003-10-30 | Siemens Ag | Arrangement for separating a component from a fluid |
| US20030127327A1 (en) | 2002-01-04 | 2003-07-10 | Kurnik Ronald T. | Microfluidic device and method for improved sample handling |
| US7410615B2 (en) * | 2002-01-24 | 2008-08-12 | Perkinelmer Las, Inc. | Precision liquid dispensing system |
| US7205154B2 (en) | 2002-01-31 | 2007-04-17 | Agilent Technologies, Inc. | Calibrating array scanners |
| US7288228B2 (en) | 2002-02-12 | 2007-10-30 | Gilson, Inc. | Sample injection system |
| US6819027B2 (en) | 2002-03-04 | 2004-11-16 | Cepheid | Method and apparatus for controlling ultrasonic transducer |
| US7101467B2 (en) | 2002-03-05 | 2006-09-05 | Caliper Life Sciences, Inc. | Mixed mode microfluidic systems |
| WO2003076052A1 (en) | 2002-03-05 | 2003-09-18 | Caliper Life Sciences, Inc. | Mixed mode microfluidic systems |
| US7303727B1 (en) | 2002-03-06 | 2007-12-04 | Caliper Life Sciences, Inc | Microfluidic sample delivery devices, systems, and methods |
| US7195986B1 (en) | 2002-03-08 | 2007-03-27 | Caliper Life Sciences, Inc. | Microfluidic device with controlled substrate conductivity |
| KR100450818B1 (en) | 2002-03-09 | 2004-10-01 | 삼성전자주식회사 | Multi chamber PCR chip |
| US7252928B1 (en) | 2002-03-12 | 2007-08-07 | Caliper Life Sciences, Inc. | Methods for prevention of surface adsorption of biological materials to capillary walls in microchannels |
| US7223371B2 (en) | 2002-03-14 | 2007-05-29 | Micronics, Inc. | Microfluidic channel network device |
| US7689022B2 (en) | 2002-03-15 | 2010-03-30 | Affymetrix, Inc. | System, method, and product for scanning of biological materials |
| DE10212761B4 (en) | 2002-03-22 | 2009-12-31 | Eppendorf Ag | microtiter plate |
| AU2003218806A1 (en) | 2002-03-27 | 2003-10-08 | Jae-Chern Yoo | Bio-disc, bio-driver apparatus, and assay method using the same |
| US7312085B2 (en) * | 2002-04-01 | 2007-12-25 | Fluidigm Corporation | Microfluidic particle-analysis systems |
| EP2442102B1 (en) | 2002-04-02 | 2019-06-26 | Caliper Life Sciences Inc. | Methods, systems and apparatus for separation and isolation of one or more sample components of a sample biological material |
| USD472324S1 (en) | 2002-04-05 | 2003-03-25 | Charles River Laboratories, Inc. | Cuvette |
| JP2003299485A (en) | 2002-04-10 | 2003-10-21 | Sekisui Chem Co Ltd | Temperature control-type microreactor and microreactor system |
| EP1492887A1 (en) | 2002-04-11 | 2005-01-05 | Sequenom, Inc. | Methods and devices for performing chemical reactions on a solid support |
| US8241883B2 (en) | 2002-04-24 | 2012-08-14 | Caliper Life Sciences, Inc. | High throughput mobility shift |
| US7718072B2 (en) | 2002-04-26 | 2010-05-18 | Abbott Laboratories | Structure and method for handling magnetic particles in biological assays |
| US6905612B2 (en) | 2003-03-21 | 2005-06-14 | Hanuman Llc | Plasma concentrate apparatus and method |
| JP3972189B2 (en) | 2002-05-10 | 2007-09-05 | 日本パルスモーター株式会社 | Dispensing device with detachable cartridge rack structure |
| JP3839349B2 (en) | 2002-05-15 | 2006-11-01 | 株式会社堀場製作所 | Chemiluminescent enzyme immunoassay device |
| USD474279S1 (en) | 2002-05-15 | 2003-05-06 | Monogen, Inc. | Specimen processing instrument |
| WO2003097240A2 (en) | 2002-05-17 | 2003-11-27 | Gen-Probe Incorporated | Sample carrier having sample tube blocking means and drip shield for use therewith |
| EP1506413B1 (en) * | 2002-05-17 | 2016-07-06 | Becton Dickinson and Company | Automated system for isolating, amplyifying and detecting a target nucleic acid sequence |
| US7132082B2 (en) | 2002-05-17 | 2006-11-07 | Gen-Probe Incorporated | Sample carrier having releasable locking mechanism |
| AU2003222704A1 (en) | 2002-05-24 | 2003-12-12 | Epr Labautomation Ag | Method and device for dosing small volumes of liquid |
| US7161356B1 (en) | 2002-06-05 | 2007-01-09 | Caliper Life Sciences, Inc. | Voltage/current testing equipment for microfluidic devices |
| USD480814S1 (en) | 2002-06-11 | 2003-10-14 | Diversa Corporation | Gigamatrix holding tray |
| US7208125B1 (en) | 2002-06-28 | 2007-04-24 | Caliper Life Sciences, Inc | Methods and apparatus for minimizing evaporation of sample materials from multiwell plates |
| AU2003249231A1 (en) | 2002-07-15 | 2004-02-02 | Phynexus, Inc. | Low dead volume extraction column devices |
| AU2003251996A1 (en) * | 2002-07-23 | 2004-02-09 | Protedyne Corporation | Liquid handling tool having hollow plunger |
| US7041258B2 (en) | 2002-07-26 | 2006-05-09 | Applera Corporation | Micro-channel design features that facilitate centripetal fluid transfer |
| US7214348B2 (en) | 2002-07-26 | 2007-05-08 | Applera Corporation | Microfluidic size-exclusion devices, systems, and methods |
| JP2005533652A (en) | 2002-07-26 | 2005-11-10 | アプレラ コーポレイション | Microfluidic size exclusion device, system, and method |
| DE10236029A1 (en) | 2002-08-02 | 2004-02-19 | Cybio Systems Gmbh | Device for dispensing and monitoring the luminescence of individual samples in multi-sample arrangements |
| US20040053315A1 (en) | 2002-08-12 | 2004-03-18 | Caliper Technologies Corp. | Methods and systems for monitoring molecular interactions |
| GB0219457D0 (en) | 2002-08-21 | 2002-09-25 | Amersham Biosciences Uk Ltd | Fluorescence reference plate |
| US7001853B1 (en) | 2002-08-30 | 2006-02-21 | Caliper Life Sciences, Inc. | Flow control of photo-polymerizable resin |
| USD516221S1 (en) | 2002-09-09 | 2006-02-28 | Meso Scale Technologies, Llc. | Diagnostic instrument |
| ITTO20020808A1 (en) | 2002-09-17 | 2004-03-18 | St Microelectronics Srl | INTEGRATED DNA ANALYSIS DEVICE. |
| JP3756477B2 (en) | 2002-09-17 | 2006-03-15 | 横河電機株式会社 | Method for extracting nucleic acid or protein with dendrimer and dendrimer composition |
| USD484989S1 (en) | 2002-09-20 | 2004-01-06 | Dade Behring Inc. | Multi-well liquid container |
| TW590982B (en) | 2002-09-27 | 2004-06-11 | Agnitio Science & Technology I | Micro-fluid driving device |
| US6730883B2 (en) | 2002-10-02 | 2004-05-04 | Stratagene | Flexible heating cover assembly for thermal cycling of samples of biological material |
| US7351303B2 (en) * | 2002-10-09 | 2008-04-01 | The Board Of Trustees Of The University Of Illinois | Microfluidic systems and components |
| US7217542B2 (en) * | 2002-10-31 | 2007-05-15 | Hewlett-Packard Development Company, L.P. | Microfluidic system for analyzing nucleic acids |
| US7932098B2 (en) * | 2002-10-31 | 2011-04-26 | Hewlett-Packard Development Company, L.P. | Microfluidic system utilizing thin-film layers to route fluid |
| US7122384B2 (en) | 2002-11-06 | 2006-10-17 | E. I. Du Pont De Nemours And Company | Resonant light scattering microparticle methods |
| WO2004044121A1 (en) | 2002-11-08 | 2004-05-27 | Irm, Llc | Apparatus and methods to process substrate surface features |
| JP2004170159A (en) | 2002-11-18 | 2004-06-17 | Hitachi Koki Co Ltd | Automatic dispenser |
| US20040204377A1 (en) | 2002-11-26 | 2004-10-14 | University Of Massachusetts | Delivery of siRNAs |
| USD491276S1 (en) | 2002-12-09 | 2004-06-08 | Babette Langille | Plastic diagnostic card |
| ATE508368T1 (en) | 2002-12-13 | 2011-05-15 | Dhr Finland Oy | ANALYZER, ANALYZING METHOD AND FLUID CARTRIDGE |
| WO2004055492A2 (en) | 2002-12-13 | 2004-07-01 | Aclara Biosciences, Inc. | Closed-loop control of electrokinetic processes in microfludic devices based on optical readings |
| USD491272S1 (en) | 2002-12-13 | 2004-06-08 | Immunivest Corporation | Autoprep instrument |
| USD491273S1 (en) | 2002-12-19 | 2004-06-08 | 3M Innovative Properties Company | Hybridization cartridge |
| SE0203781D0 (en) | 2002-12-19 | 2002-12-19 | Alphahelix Ab | Holder and method for cooling or heating samples |
| WO2004083443A1 (en) | 2002-12-20 | 2004-09-30 | Caliper Life Sciences, Inc. | Single molecule amplification and detection of dna |
| US20060094108A1 (en) * | 2002-12-20 | 2006-05-04 | Karl Yoder | Thermal cycler for microfluidic array assays |
| US7850912B2 (en) | 2003-05-14 | 2010-12-14 | Dako Denmark A/S | Method and apparatus for automated pre-treatment and processing of biological samples |
| US7648678B2 (en) | 2002-12-20 | 2010-01-19 | Dako Denmark A/S | Method and system for pretreatment of tissue slides |
| US20050042639A1 (en) | 2002-12-20 | 2005-02-24 | Caliper Life Sciences, Inc. | Single molecule amplification and detection of DNA length |
| US8676383B2 (en) | 2002-12-23 | 2014-03-18 | Applied Biosystems, Llc | Device for carrying out chemical or biological reactions |
| CN102620959B (en) | 2002-12-26 | 2015-12-16 | 梅索磅秤技术有限公司 | Assay cartridges and using method thereof |
| US20060113190A1 (en) | 2002-12-27 | 2006-06-01 | Kurnik Ronald T | Microfluidic device and method for improved sample handling |
| KR101216828B1 (en) | 2002-12-30 | 2013-01-04 | 더 리전트 오브 더 유니버시티 오브 캘리포니아 | Methods and apparatus for pathogen detection and analysis |
| US20070269891A9 (en) | 2003-01-13 | 2007-11-22 | Yasunobu Tanaka | Solid surface with immobilized degradable cationic polymer for transfecting eukaryotic cells |
| US7419638B2 (en) | 2003-01-14 | 2008-09-02 | Micronics, Inc. | Microfluidic devices for fluid manipulation and analysis |
| US6964747B2 (en) | 2003-01-21 | 2005-11-15 | Bioarray Solutions, Ltd. | Production of dyed polymer microparticles |
| US7049558B2 (en) | 2003-01-27 | 2006-05-23 | Arcturas Bioscience, Inc. | Apparatus and method for heating microfluidic volumes and moving fluids |
| US7338637B2 (en) | 2003-01-31 | 2008-03-04 | Hewlett-Packard Development Company, L.P. | Microfluidic device with thin-film electronic devices |
| JP4021335B2 (en) | 2003-01-31 | 2007-12-12 | ユニバーサル・バイオ・リサーチ株式会社 | Dispensing device with monitoring function and method for monitoring dispensing device |
| ES2604352T3 (en) | 2003-02-05 | 2017-03-06 | Iquum, Inc. | Sample Processing |
| US20040157220A1 (en) | 2003-02-10 | 2004-08-12 | Purnima Kurnool | Methods and apparatus for sample tracking |
| KR100959101B1 (en) | 2003-02-20 | 2010-05-25 | 삼성전자주식회사 | Polymerase chain reaction device and method for regulating opening or shutting of inlet and outlet of PCR device |
| US20050129580A1 (en) | 2003-02-26 | 2005-06-16 | Swinehart Philip R. | Microfluidic chemical reactor for the manufacture of chemically-produced nanoparticles |
| JP4129864B2 (en) | 2003-03-24 | 2008-08-06 | 農工大ティー・エル・オー株式会社 | Magnetic separation device for magnetic particles |
| JP2004305009A (en) * | 2003-04-02 | 2004-11-04 | Hitachi Ltd | Apparatus for amplifying nucleic acid and method for amplifying nucleic acid |
| AU2004229405A1 (en) | 2003-04-08 | 2004-10-28 | Irm, Llc | Material removal and dispensing devices, systems, and methods |
| ES2317016T3 (en) | 2003-04-14 | 2009-04-16 | Caliper Life Sciences, Inc. | REDUCTION OF INTERFERENCE IN A MIGRATION DISPLACEMENT TEST. |
| WO2004094986A2 (en) | 2003-04-16 | 2004-11-04 | Handylab, Inc. | System and method for electrochemical detection of biological compounds |
| GB2401237A (en) | 2003-04-28 | 2004-11-03 | Hewlett Packard Development Co | Data transfer arrangement for disaster recovery |
| US7148043B2 (en) | 2003-05-08 | 2006-12-12 | Bio-Rad Laboratories, Inc. | Systems and methods for fluorescence detection with a movable detection module |
| AU2004238846B2 (en) | 2003-05-09 | 2007-10-25 | Caliper Life Sciences, Inc. | Automated sample analysis |
| US7038472B1 (en) | 2003-05-12 | 2006-05-02 | Caliper Life Sciences, Inc. | Methods and systems for measuring internal dimensions of microscale structures |
| US7374949B2 (en) | 2003-05-29 | 2008-05-20 | Bayer Healthcare Llc | Diagnostic test strip for collecting and detecting an analyte in a fluid sample |
| US7055695B2 (en) | 2003-06-02 | 2006-06-06 | Caliper Life Sciencee, Inc. | Container providing a controlled hydrated environment |
| JP2005009870A (en) | 2003-06-16 | 2005-01-13 | Fuji Photo Film Co Ltd | Suction method of analyzer |
| JP4531698B2 (en) | 2003-07-17 | 2010-08-25 | 三菱化学メディエンス株式会社 | Automatic measuring cartridge and measuring apparatus using the same |
| US7381370B2 (en) * | 2003-07-18 | 2008-06-03 | Dade Behring Inc. | Automated multi-detector analyzer |
| US20060177376A1 (en) | 2003-07-21 | 2006-08-10 | Dendritic Nanotechnologies, Inc. | Stabilized and chemically functionalized nanoparticles |
| USD500363S1 (en) | 2003-07-24 | 2004-12-28 | Biomerieux Inc. | Sample holder |
| USD508999S1 (en) | 2003-07-24 | 2005-08-30 | Biomerieux, Inc. | Sample testing machine |
| JP4996248B2 (en) | 2003-07-31 | 2012-08-08 | ハンディーラブ インコーポレイテッド | Processing of particle-containing samples |
| US7744817B2 (en) * | 2003-08-11 | 2010-06-29 | Sakura Finetek U.S.A., Inc. | Manifold assembly |
| US7413712B2 (en) | 2003-08-11 | 2008-08-19 | California Institute Of Technology | Microfluidic rotary flow reactor matrix |
| US7347617B2 (en) * | 2003-08-19 | 2008-03-25 | Siemens Healthcare Diagnostics Inc. | Mixing in microfluidic devices |
| USD499813S1 (en) | 2003-08-22 | 2004-12-14 | As.Pire Bioresearch Inc. | Assay testing device |
| JP2005065607A (en) * | 2003-08-26 | 2005-03-17 | Hitachi Ltd | Gene treating chip and gene treating apparatus |
| USD515707S1 (en) | 2003-09-01 | 2006-02-21 | Matsushita Electric Industrial Co., Ltd. | Fluorescent reader |
| RU2006110931A (en) | 2003-09-05 | 2007-10-20 | Кайлипер Лайф Сайенсиз, Инк. (Us) | ANALYZED SUBSTANCE INJECTION SYSTEM |
| US7501094B2 (en) * | 2003-09-15 | 2009-03-10 | Syngenta Limited | Preparation and characterization of formulations in a high throughput mode |
| US20050220675A1 (en) | 2003-09-19 | 2005-10-06 | Reed Mark T | High density plate filler |
| US20070218459A1 (en) | 2003-09-19 | 2007-09-20 | Miller Benjamin L | Diagnostic System For Otolaryngologic Pathogens And Use Thereof |
| US20050069898A1 (en) | 2003-09-25 | 2005-03-31 | Cepheid | Lyophilized beads containing mannitol |
| DE10344700A1 (en) | 2003-09-26 | 2005-04-14 | Hirschmann Laborgeräte GmbH & Co. KG | Multichannel pipetting |
| JP2007506439A (en) | 2003-09-26 | 2007-03-22 | データスコープ・インベストメント・コーポレイション | Method for synthesizing a small amount of nucleic acid |
| WO2005031312A1 (en) | 2003-09-29 | 2005-04-07 | Vision Biosystems Limited | System and method for histological tissue specimen processing |
| USD528215S1 (en) | 2003-09-30 | 2006-09-12 | Biacore Ab | Chip carrier for biosensor |
| US7039527B2 (en) | 2003-10-01 | 2006-05-02 | Caliper Life Sciences, Inc. | Method for measuring diffusivities of compounds using microchips |
| NL1024578C2 (en) | 2003-10-21 | 2005-04-22 | Univ Delft Tech | Device for carrying out a reaction. |
| US7780639B2 (en) | 2003-11-12 | 2010-08-24 | Van Lue Stephen J | Magnetic devices and apparatus for medical/surgical procedures and methods for using same |
| US7754500B2 (en) | 2003-11-21 | 2010-07-13 | Anp Technologies, Inc. | Asymmetrically branched polymer conjugates and microarray assays |
| EP1541237A3 (en) * | 2003-12-10 | 2006-02-01 | Samsung Electronics Co., Ltd. | Polymerase chain reaction (pcr) module and multiple pcr system using the same |
| JP4595446B2 (en) | 2003-12-12 | 2010-12-08 | Dic株式会社 | Nucleic acid amplification method |
| JP2005176613A (en) | 2003-12-16 | 2005-07-07 | Yokogawa Electric Corp | Method for extracting dna and biochip utilizing dendrimer |
| US7122799B2 (en) | 2003-12-18 | 2006-10-17 | Palo Alto Research Center Incorporated | LED or laser enabled real-time PCR system and spectrophotometer |
| RU2006126664A (en) | 2003-12-23 | 2008-01-27 | Кайлипер Лайф Сайенсиз, Инк. (Us) | ANALYTES INPUT SYSTEM |
| JP4750412B2 (en) | 2003-12-25 | 2011-08-17 | モレックス インコーポレイテド | Biologically derived molecules, dioxins and endocrine disrupting substance detection apparatus and detection method using the apparatus |
| KR100750586B1 (en) | 2003-12-26 | 2007-08-20 | 한국전자통신연구원 | Micro-fluidic heating system |
| JP4732683B2 (en) | 2003-12-29 | 2011-07-27 | ユニバーサル・バイオ・リサーチ株式会社 | Target substance detection method |
| US7099778B2 (en) | 2003-12-30 | 2006-08-29 | Caliper Life Sciences, Inc. | Method for determining diffusivity and molecular weight in a microfluidic device |
| SG10201405756WA (en) | 2004-01-25 | 2014-11-27 | Fluidigm Corp | Crystal forming devices and systems and methods for making and using the same |
| JP2005224110A (en) * | 2004-02-10 | 2005-08-25 | Kawamura Inst Of Chem Res | Method for detecting polynucleotide or oligonucleotide and micro fluid device |
| CN1942590B (en) | 2004-02-18 | 2012-09-05 | 周小川 | Fluidic devices and methods for multiplex chemical and biochemical reactions |
| JP5297651B2 (en) | 2004-02-24 | 2013-09-25 | サーマル グラディエント | Heat cycle equipment |
| US20050196321A1 (en) | 2004-03-03 | 2005-09-08 | Zhili Huang | Fluidic programmable array devices and methods |
| USD517554S1 (en) | 2004-03-05 | 2006-03-21 | Seiko Epson Corporation | Film scanner |
| KR100552706B1 (en) * | 2004-03-12 | 2006-02-20 | 삼성전자주식회사 | Method and apparatus for nucleic acid amplification |
| US20050208676A1 (en) | 2004-03-19 | 2005-09-22 | Espir Kahatt | Device for aspirating, manipulating, mixing and dispensing nano-volumes of liquids |
| JP3858029B2 (en) | 2004-03-22 | 2006-12-13 | 株式会社アイディエス | Test tube detector |
| US8298832B2 (en) | 2004-03-23 | 2012-10-30 | Toray Industries, Inc. | Method of agitating solution |
| WO2005094981A1 (en) | 2004-03-29 | 2005-10-13 | Agilent Technologies, Inc. | Cyclic pcr system |
| JP2005291954A (en) | 2004-03-31 | 2005-10-20 | Olympus Corp | Disposable reagent pack and analyzer using the reagent pack |
| EP3167961A1 (en) | 2004-04-08 | 2017-05-17 | Biomatrica, Inc. | Integration of sample storage and sample management for life science |
| ZA200609269B (en) | 2004-04-09 | 2008-06-25 | Res Think Tank Inc | Devices and methods for collection, storage and transportation of biological specimens |
| US8852862B2 (en) | 2004-05-03 | 2014-10-07 | Handylab, Inc. | Method for processing polynucleotide-containing samples |
| EP1745153B1 (en) | 2004-05-03 | 2015-09-30 | Handylab, Inc. | Processing polynucleotide-containing samples |
| JP4784508B2 (en) | 2004-05-07 | 2011-10-05 | コニカミノルタエムジー株式会社 | Inspection microreactor, inspection apparatus, and inspection method |
| GB2414059B (en) | 2004-05-10 | 2008-06-11 | E2V Tech Uk Ltd | Microfluidic device |
| JP3952036B2 (en) | 2004-05-13 | 2007-08-01 | コニカミノルタセンシング株式会社 | Microfluidic device, test solution test method and test system |
| US8323564B2 (en) | 2004-05-14 | 2012-12-04 | Honeywell International Inc. | Portable sample analyzer system |
| AU2005246404A1 (en) | 2004-05-21 | 2005-12-01 | Caliper Life Sciences, Inc. | Automated system for handling microfluidic devices |
| US7553671B2 (en) | 2004-05-25 | 2009-06-30 | Vertex Pharmaceuticals, Inc. | Modular test tube rack |
| WO2005116202A1 (en) | 2004-05-27 | 2005-12-08 | Universal Bio Research Co., Ltd. | Reaction vessel, reaction measuring device, and liquid rotating treatment device |
| US7622296B2 (en) | 2004-05-28 | 2009-11-24 | Wafergen, Inc. | Apparatus and method for multiplex analysis |
| US7799553B2 (en) | 2004-06-01 | 2010-09-21 | The Regents Of The University Of California | Microfabricated integrated DNA analysis system |
| WO2005120710A2 (en) | 2004-06-07 | 2005-12-22 | Irm Llc | Dispensing systems, software, and related methods |
| JP2008504446A (en) | 2004-06-28 | 2008-02-14 | ボイス ステート ユニバーシティ | Electrochemical method using microdroplets of solution |
| US20060002817A1 (en) | 2004-06-30 | 2006-01-05 | Sebastian Bohm | Flow modulation devices |
| US7480042B1 (en) | 2004-06-30 | 2009-01-20 | Applied Biosystems Inc. | Luminescence reference standards |
| US8965710B2 (en) | 2004-07-02 | 2015-02-24 | The United States Of America, As Represented By The Secretary Of The Navy | Automated sample-to-microarray apparatus and method |
| JP4440020B2 (en) | 2004-07-09 | 2010-03-24 | 株式会社神戸製鋼所 | Microreactor and manufacturing method thereof |
| USD523153S1 (en) | 2004-07-23 | 2006-06-13 | Hitachi High-Technologies Corporation | Main part for immunity analysis machine |
| EP1621890A1 (en) | 2004-07-26 | 2006-02-01 | bioMerieux B.V. | Device and method for separating, mixing and concentrating magnetic particles with a fluid and use thereof in purification methods |
| US7585663B2 (en) | 2004-08-26 | 2009-09-08 | Applied Biosystems, Llc | Thermal device, system, and method, for fluid processing device |
| WO2006032044A2 (en) | 2004-09-15 | 2006-03-23 | Microchip Biotechnologies, Inc. | Microfluidic devices |
| KR100668304B1 (en) | 2004-09-16 | 2007-01-12 | 삼성전자주식회사 | A device for the injection of PCR solution into a PCR channel and a PCR chip unit comprising the device |
| CN101031801B (en) | 2004-09-30 | 2010-12-01 | 爱科来株式会社 | Thin film heater and analytical instrument |
| USD548841S1 (en) | 2004-10-15 | 2007-08-14 | Microsulis, Ltd | Electrical equipment for ablative treatment |
| WO2006043642A1 (en) | 2004-10-20 | 2006-04-27 | Ebara Corporation | Fluid reactor |
| US20060094004A1 (en) | 2004-10-28 | 2006-05-04 | Akihisa Nakajima | Micro-reactor, biological material inspection device, and microanalysis system |
| JP2006145458A (en) | 2004-11-24 | 2006-06-08 | Yaskawa Electric Corp | Dispensing device |
| US7727477B2 (en) | 2004-12-10 | 2010-06-01 | Bio-Rad Laboratories, Inc. | Apparatus for priming microfluidics devices with feedback control |
| JP4573243B2 (en) | 2004-12-15 | 2010-11-04 | 小林クリエイト株式会社 | Test tube tray |
| KR20130010036A (en) | 2004-12-17 | 2013-01-24 | 닛토덴코 가부시키가이샤 | Immobilized degradable cationic polymer for transfecting eukaryotic cells |
| US20060165558A1 (en) | 2004-12-21 | 2006-07-27 | Thomas Witty | Cartridge for diagnostic assays |
| US7315376B2 (en) | 2005-01-07 | 2008-01-01 | Advanced Molecular Systems, Llc | Fluorescence detection system |
| US7964380B2 (en) | 2005-01-21 | 2011-06-21 | Argylia Technologies | Nanoparticles for manipulation of biopolymers and methods of thereof |
| US20060183216A1 (en) | 2005-01-21 | 2006-08-17 | Kalyan Handique | Containers for liquid storage and delivery with application to microfluidic devices |
| DE102005004664B4 (en) | 2005-02-02 | 2007-06-21 | Chemagen Biopolymer-Technologie Aktiengesellschaft | Apparatus and method and use for separating magnetic or magnetizable particles from a liquid and their uses |
| WO2006089252A2 (en) * | 2005-02-16 | 2006-08-24 | Mcneely Michael R | Liquid valving using reactive or responsive materials |
| CA2598520A1 (en) | 2005-02-18 | 2006-08-24 | Canon U.S. Life Sciences, Inc. | Devices and methods for identifying genomic dna of organisms |
| USD535403S1 (en) | 2005-02-25 | 2007-01-16 | Fuji Photo Film Co., Ltd. | Component extractor for biochemistry |
| JP2008532048A (en) | 2005-03-07 | 2008-08-14 | ノブックス システムズ インコーポレーテッド | Automatic analyzer |
| ZA200707354B (en) | 2005-03-08 | 2009-04-29 | Authentix Inc | Microfluidic device for identification, quantification, and authentication of latent markers |
| CA2871777C (en) * | 2005-03-10 | 2015-07-28 | Matthew J. Hayes | System and methods for detecting multiple optical signals |
| US20060228734A1 (en) | 2005-03-18 | 2006-10-12 | Applera Corporation | Fluid processing device with captured reagent beads |
| JP4525427B2 (en) | 2005-04-01 | 2010-08-18 | パナソニック株式会社 | Analysis disk, and method for inspecting analysis disk and analyzer |
| US7507575B2 (en) | 2005-04-01 | 2009-03-24 | 3M Innovative Properties Company | Multiplex fluorescence detection device having removable optical modules |
| US9097723B2 (en) | 2005-04-01 | 2015-08-04 | Caliper Life Sciences, Inc. | Method and apparatus for performing peptide digestion on a microfluidic device |
| US20060246493A1 (en) | 2005-04-04 | 2006-11-02 | Caliper Life Sciences, Inc. | Method and apparatus for use in temperature controlled processing of microfluidic samples |
| CA112854S (en) | 2005-04-10 | 2007-03-27 | Akubio Ltd | Microbalance analyser cartridge |
| WO2006115863A2 (en) | 2005-04-12 | 2006-11-02 | Caliper Life Sciences, Inc. | Compact optical detection system for microfluidic devices |
| US20060234251A1 (en) | 2005-04-19 | 2006-10-19 | Lumigen, Inc. | Methods of enhancing isolation of RNA from biological samples |
| WO2006118420A1 (en) | 2005-04-30 | 2006-11-09 | Jae Chern Yoo | Bio-disc, bio-driver apparatus, and assay method using the same |
| US7300631B2 (en) | 2005-05-02 | 2007-11-27 | Bioscale, Inc. | Method and apparatus for detection of analyte using a flexural plate wave device and magnetic particles |
| US20070259348A1 (en) | 2005-05-03 | 2007-11-08 | Handylab, Inc. | Lyophilized pellets |
| USD566291S1 (en) * | 2005-05-03 | 2008-04-08 | Handylab, Inc. | Microfluidic cartridge |
| USD534280S1 (en) | 2005-05-04 | 2006-12-26 | Abbott Laboratories | Reagent carrier for use in an automated analyzer |
| WO2006121786A1 (en) | 2005-05-06 | 2006-11-16 | Caliper Life Sciences, Inc. | Microtitre plate with a relieved perimeter |
| WO2006122310A2 (en) | 2005-05-11 | 2006-11-16 | The Trustess Of The University Of Pennsylvania | System for testing |
| US8273294B2 (en) | 2005-07-01 | 2012-09-25 | Honeywell International Inc. | Molded cartridge with 3-D hydrodynamic focusing |
| US7527763B2 (en) | 2005-07-05 | 2009-05-05 | 3M Innovative Properties Company | Valve control system for a rotating multiplex fluorescence detection device |
| US20080226502A1 (en) | 2005-07-07 | 2008-09-18 | Jacques Jonsmann | Microfluidic Methods and Support Instruments |
| US20070020699A1 (en) | 2005-07-19 | 2007-01-25 | Idexx Laboratories, Inc. | Lateral flow assay and device using magnetic particles |
| JP4581128B2 (en) | 2005-07-20 | 2010-11-17 | 独立行政法人産業技術総合研究所 | Enzyme immunoassay method and enzyme immunosensor therefor |
| US20070020764A1 (en) | 2005-07-20 | 2007-01-25 | Miller Kerry L | Method for processing chemistry and coagulation test samples in a laboratory workcell |
| US20070068573A1 (en) | 2005-08-22 | 2007-03-29 | Applera Corporation | Device and method for microfluidic control of a first fluid in contact with a second fluid, wherein the first and second fluids are immiscible |
| JP2007074960A (en) | 2005-09-13 | 2007-03-29 | Shimadzu Corp | Method for amplifying gene |
| USD549827S1 (en) | 2005-09-16 | 2007-08-28 | Horiba, Ltd. | Blood analyzer |
| CN101273258A (en) | 2005-09-30 | 2008-09-24 | 卡钳生命科学股份有限公司 | Microfluidic device for purifying a biological component using magnetic beads |
| JP4827483B2 (en) | 2005-10-04 | 2011-11-30 | キヤノン株式会社 | Nucleic acid sample processing equipment |
| JP4630786B2 (en) | 2005-10-04 | 2011-02-09 | キヤノン株式会社 | Biochemical treatment apparatus, DNA amplification and purification apparatus, and DNA testing apparatus including the apparatus |
| JP4656646B2 (en) | 2005-10-04 | 2011-03-23 | キヤノン株式会社 | Display method, display device, and fully automatic inspection device provided with the display device |
| US20070199821A1 (en) | 2005-10-05 | 2007-08-30 | Chow Andrea W | Automated two-dimensional gel electrophoresis |
| US7727371B2 (en) | 2005-10-07 | 2010-06-01 | Caliper Life Sciences, Inc. | Electrode apparatus for use with a microfluidic device |
| WO2007044917A2 (en) | 2005-10-11 | 2007-04-19 | Handylab, Inc. | Polynucleotide sample preparation device |
| DE102005049920A1 (en) | 2005-10-17 | 2007-04-19 | Manz Automation Ag | robotic assembly |
| US20070092403A1 (en) | 2005-10-21 | 2007-04-26 | Alan Wirbisky | Compact apparatus, compositions and methods for purifying nucleic acids |
| USD537951S1 (en) | 2005-10-21 | 2007-03-06 | Sanyo Electric Co., Ltd. | Gene amplification apparatus |
| USD556914S1 (en) | 2005-10-21 | 2007-12-04 | Sanyo Electric Co., Ltd. | Gene amplification apparatus |
| DE102005051850A1 (en) | 2005-10-28 | 2007-05-03 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | Device for duplication and detection of nucleic acids |
| US20070104617A1 (en) | 2005-11-04 | 2007-05-10 | Advanced Biotechnologies Limited | Capped tubes |
| US20070116613A1 (en) | 2005-11-23 | 2007-05-24 | Donat Elsener | Sample tube and system for storing and providing nucleic acid samples |
| WO2007064117A1 (en) | 2005-11-30 | 2007-06-07 | Electronics And Telecommunications Research Institute | Affinity chromatography microdevice and method for manufacturing the same |
| EP2283923A2 (en) | 2005-11-30 | 2011-02-16 | F. Hoffmann-La Roche AG | Linear cuvette array without positioning means |
| JP3899360B2 (en) | 2005-12-19 | 2007-03-28 | オリンパス株式会社 | DNA amplification equipment |
| JP2007178328A (en) | 2005-12-28 | 2007-07-12 | Shimadzu Corp | Reaction container kit and reaction container treatment apparatus |
| EP1966585A2 (en) | 2005-12-30 | 2008-09-10 | Caliper Life Sciences, Inc. | Integrated dissolution processing and sample transfer system |
| US20070154895A1 (en) | 2005-12-30 | 2007-07-05 | Caliper Life Sciences, Inc. | Multi-assay microfluidic chips |
| SG134186A1 (en) | 2006-01-12 | 2007-08-29 | Nanyang Polytechnic | Smart nano-integrated system assembly |
| JP5006215B2 (en) | 2006-02-07 | 2012-08-22 | 古河電気工業株式会社 | Photodetector and measuring object reader |
| US8124033B2 (en) * | 2006-02-17 | 2012-02-28 | Agency, Science, Technology and Research | Apparatus for regulating the temperature of a biological and/or chemical sample and method of using the same |
| USD538436S1 (en) | 2006-03-06 | 2007-03-13 | Steris Inc. | Reprocessor for decontaminating medical, dental and veterinary instruments and articles |
| WO2007106580A2 (en) | 2006-03-15 | 2007-09-20 | Micronics, Inc. | Rapid magnetic flow assays |
| ES2692380T3 (en) | 2006-03-24 | 2018-12-03 | Handylab, Inc. | Method to perform PCR with a cartridge with several tracks |
| US11806718B2 (en) | 2006-03-24 | 2023-11-07 | Handylab, Inc. | Fluorescence detector for microfluidic diagnostic system |
| US7998708B2 (en) | 2006-03-24 | 2011-08-16 | Handylab, Inc. | Microfluidic system for amplifying and detecting polynucleotides in parallel |
| US8883490B2 (en) | 2006-03-24 | 2014-11-11 | Handylab, Inc. | Fluorescence detector for microfluidic diagnostic system |
| US8088616B2 (en) | 2006-03-24 | 2012-01-03 | Handylab, Inc. | Heater unit for microfluidic diagnostic system |
| US10900066B2 (en) | 2006-03-24 | 2021-01-26 | Handylab, Inc. | Microfluidic system for amplifying and detecting polynucleotides in parallel |
| USD559995S1 (en) * | 2006-03-27 | 2008-01-15 | Handylab, Inc. | Controller cartridge for a diagnostic instrument |
| USD569526S1 (en) | 2006-03-27 | 2008-05-20 | Handylab, Inc. | Molecular diagnostic instrument |
| EP1839756A1 (en) | 2006-03-31 | 2007-10-03 | F.Hoffmann-La Roche Ag | Apparatus for separating magnetic particles from liquids containing said particles, and an array of vessels suitable for use with such an apparatus |
| US8021531B2 (en) | 2006-04-14 | 2011-09-20 | Caliper Life Sciences, Inc. | Method for modifying the concentration of reactants in a microfluidic device |
| JP5054096B2 (en) | 2006-04-18 | 2012-10-24 | アドヴァンスト リキッド ロジック インコーポレイテッド | Biochemistry based on droplets |
| USD554070S1 (en) | 2006-05-03 | 2007-10-30 | Data I/O Corporation | Processing apparatus |
| USD554069S1 (en) | 2006-05-03 | 2007-10-30 | Data I/O Corporation | Processing apparatus |
| US8232091B2 (en) | 2006-05-17 | 2012-07-31 | California Institute Of Technology | Thermal cycling system |
| CN101522909A (en) | 2006-05-17 | 2009-09-02 | 加利福尼亚技术学院 | Thermal cycling system |
| BRPI0712655A2 (en) | 2006-06-08 | 2012-11-20 | Koninkl Philips Electronics Nv | microelectronic sensor device, method for investigating at least one biologically target substance, and, use of microelectronic sensor device |
| US7629124B2 (en) | 2006-06-30 | 2009-12-08 | Canon U.S. Life Sciences, Inc. | Real-time PCR in micro-channels |
| US7633606B2 (en) | 2006-08-24 | 2009-12-15 | Microfluidic Systems, Inc. | Integrated airborne substance collection and detection system |
| EP2064346B1 (en) * | 2006-09-06 | 2013-11-06 | Canon U.S. Life Sciences, Inc. | Chip and cartridge design configuration for performing micro-fluidic assays |
| US8097419B2 (en) | 2006-09-12 | 2012-01-17 | Longhorn Vaccines & Diagnostics Llc | Compositions and method for rapid, real-time detection of influenza A virus (H1N1) swine 2009 |
| US8246919B2 (en) * | 2006-09-21 | 2012-08-21 | Abbott Laboratories | Specimen sample rack |
| WO2008147382A1 (en) | 2006-09-27 | 2008-12-04 | Micronics, Inc. | Integrated microfluidic assay devices and methods |
| US20080095673A1 (en) * | 2006-10-20 | 2008-04-24 | Lin Xu | Microplate with fewer peripheral artifacts |
| WO2008061165A2 (en) | 2006-11-14 | 2008-05-22 | Handylab, Inc. | Microfluidic cartridge and method of making same |
| KR101422467B1 (en) | 2007-02-08 | 2014-07-24 | 삼성전자주식회사 | A system and a method for detecting fluorescence in microfluidic chip |
| US7985375B2 (en) | 2007-04-06 | 2011-07-26 | Qiagen Gaithersburg, Inc. | Sample preparation system and method for processing clinical specimens |
| JP2008267950A (en) | 2007-04-19 | 2008-11-06 | Enplas Corp | Fluid handling device |
| US20080257882A1 (en) | 2007-04-20 | 2008-10-23 | Bioinnovations Oy | Vessel for accurate analysis |
| WO2008134470A2 (en) | 2007-04-25 | 2008-11-06 | 3M Innovative Properties Company | Methods for nucleic acid amplification |
| WO2008149282A2 (en) | 2007-06-06 | 2008-12-11 | Koninklijke Philips Electronics N. V. | Microfluidic device and method of operating a microfluidic device |
| US8182763B2 (en) | 2007-07-13 | 2012-05-22 | Handylab, Inc. | Rack for sample tubes and reagent holders |
| US8133671B2 (en) | 2007-07-13 | 2012-03-13 | Handylab, Inc. | Integrated apparatus for performing nucleic acid extraction and diagnostic testing on multiple biological samples |
| AU2008276211B2 (en) | 2007-07-13 | 2015-01-22 | Handylab, Inc. | Polynucleotide capture materials, and methods of using same |
| US8287820B2 (en) | 2007-07-13 | 2012-10-16 | Handylab, Inc. | Automated pipetting apparatus having a combined liquid pump and pipette head system |
| USD621060S1 (en) | 2008-07-14 | 2010-08-03 | Handylab, Inc. | Microfluidic cartridge |
| US8105783B2 (en) | 2007-07-13 | 2012-01-31 | Handylab, Inc. | Microfluidic cartridge |
| US20090136385A1 (en) * | 2007-07-13 | 2009-05-28 | Handylab, Inc. | Reagent Tube |
| US9186677B2 (en) | 2007-07-13 | 2015-11-17 | Handylab, Inc. | Integrated apparatus for performing nucleic acid extraction and diagnostic testing on multiple biological samples |
| US9618139B2 (en) | 2007-07-13 | 2017-04-11 | Handylab, Inc. | Integrated heater and magnetic separator |
| GB0719193D0 (en) | 2007-10-02 | 2007-11-07 | Advanced Biotech Ltd | A Vessel |
| EP2209904B1 (en) * | 2007-10-10 | 2017-03-01 | Pocared Diagnostics Ltd. | System for conducting the identification of bacteria in urine |
| USD632799S1 (en) | 2008-05-15 | 2011-02-15 | The Automation Partnership | Cell dispenser |
| EP2285493A2 (en) | 2008-06-09 | 2011-02-23 | QIAGEN Gaithersburg, Inc. | Magnetic microplate assembly |
| USD596312S1 (en) | 2008-06-13 | 2009-07-14 | Csp Technologies, Inc. | Vial rack |
| USD595423S1 (en) | 2008-06-30 | 2009-06-30 | Ge Healthcare Bio-Sciences Ab | Magnetic rack |
| USD618820S1 (en) | 2008-07-11 | 2010-06-29 | Handylab, Inc. | Reagent holder |
| US20100009351A1 (en) * | 2008-07-11 | 2010-01-14 | Handylab, Inc. | Polynucleotide Capture Materials, and Method of Using Same |
| USD787087S1 (en) | 2008-07-14 | 2017-05-16 | Handylab, Inc. | Housing |
| USD598566S1 (en) | 2008-08-12 | 2009-08-18 | Diagenode Societe Anonyme | Medical instrument for laboratory use |
| DK2331954T3 (en) | 2008-08-27 | 2020-04-06 | Life Technologies Corp | APPARATUS AND PROCEDURE FOR PROCESSING BIOLOGICAL SAMPLES |
| CN102341710B (en) | 2009-04-15 | 2015-04-01 | 比奥卡尔齐什股份有限公司 | Optical detection system for monitoring rtpcr reaction |
| USD599234S1 (en) | 2009-04-28 | 2009-09-01 | Shiseido Co., Ltd. | Auto-sampler for chromatograph |
| GB2473868A (en) | 2009-09-28 | 2011-03-30 | Invitrogen Dynal As | Apparatus and method of automated processing of biological samples |
| USD638953S1 (en) | 2009-05-12 | 2011-05-31 | Invitrogen Dynal As | Laboratory apparatus |
| US8329117B2 (en) | 2009-05-14 | 2012-12-11 | Canon U.S. Life Sciences, Inc. | Microfluidic chip features for optical and thermal isolation |
| WO2010130310A1 (en) | 2009-05-15 | 2010-11-18 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | Pipette head with filter and flushing means |
| EP2263802A1 (en) | 2009-05-25 | 2010-12-22 | F. Hoffmann-La Roche AG | System and method for dispensing fluids |
| CN102597783B (en) | 2009-06-04 | 2014-08-13 | 环球生物研究株式会社 | Specimen testing device and method therefor |
| USD628305S1 (en) | 2009-07-14 | 2010-11-30 | Medical Research Council | Sitting-drop microwell plate for crystalization |
| EP2454381A1 (en) | 2009-07-16 | 2012-05-23 | Abbott Laboratories | A method for amplification of nucleic acids |
| JP4857373B2 (en) | 2009-09-09 | 2012-01-18 | 国立大学法人東京農工大学 | Dendrimer-coated magnetic fine particles, production method and use thereof |
| US8282895B2 (en) | 2009-09-15 | 2012-10-09 | Qiagen Gaithersburg, Inc. | Reagent cabinet system |
| US20110097493A1 (en) | 2009-10-27 | 2011-04-28 | Kerr Roger S | Fluid distribution manifold including non-parallel non-perpendicular slots |
| WO2011101467A1 (en) | 2010-02-22 | 2011-08-25 | 4Titude Ltd. | Multiwell strips |
| ES2583643T3 (en) | 2010-04-01 | 2016-09-21 | F. Hoffmann-La Roche Ag | Computer-implemented method to operate an automated sample work cell |
| US20110300033A1 (en) | 2010-06-07 | 2011-12-08 | Chemence Medical, Inc. | Pipette Holder and Applicator Apparatus |
| JP2013535193A (en) | 2010-07-23 | 2013-09-12 | ベックマン コールター, インコーポレイテッド | System and method including an analyzer |
| US20130183769A1 (en) | 2010-09-17 | 2013-07-18 | Universal Bio Research Co., Ltd. | Cartridge and automatic analysis device |
| AU2012242510B2 (en) * | 2011-04-15 | 2015-05-14 | Becton, Dickinson And Company | Scanning real-time microfluidic thermocycler and methods for synchronized thermocycling and scanning optical detection |
| DK3273253T3 (en) | 2011-09-30 | 2020-10-12 | Becton Dickinson Co | United reagent strip |
| USD692162S1 (en) | 2011-09-30 | 2013-10-22 | Becton, Dickinson And Company | Single piece reagent holder |
| CA2851356A1 (en) | 2011-10-14 | 2013-04-18 | Becton Dickinson And Company | Square wave thermal cycling |
| WO2013067202A1 (en) | 2011-11-04 | 2013-05-10 | Handylab, Inc. | Polynucleotide sample preparation device |
| CN104204812B (en) | 2012-02-03 | 2018-01-05 | 贝克顿·迪金森公司 | The external file that compatibility determines between distributing and test for molecule diagnostic test |
| CN114134029A (en) | 2012-02-13 | 2022-03-04 | 纽莫德克斯莫勒库拉尔公司 | Microfluidic cartridge for processing and detecting nucleic acids |
| CA2869717C (en) | 2012-04-13 | 2022-09-06 | Becton, Dickinson And Company | Reflex testing of samples using residual materials from a prior test |
| USD686749S1 (en) | 2012-04-20 | 2013-07-23 | Stratec Biomedical Ag | Rack for holding sheaths |
| USD702854S1 (en) | 2012-05-18 | 2014-04-15 | Yoko Nakahana | Micro tube array container |
| USD687567S1 (en) | 2012-10-22 | 2013-08-06 | Qiagen Gaithersburg, Inc. | Tube strip for automated processing systems |
| WO2014066376A1 (en) | 2012-10-25 | 2014-05-01 | Neumodx Molecular, Inc. | Method and materials for isolation of nucleic acid materials |
| USD710024S1 (en) | 2013-03-14 | 2014-07-29 | Bio-Rad Laboratories, Inc. | Microplate |
| JP6387387B2 (en) | 2013-03-15 | 2018-09-05 | ベクトン・ディキンソン・アンド・カンパニーBecton, Dickinson And Company | Process tube and transfer tray |
| CA2906345C (en) | 2013-03-16 | 2023-06-20 | Leslie Don ROBERTS | Self-contained modular analytical cartridge and programmable reagent delivery system |
| CA3091557C (en) | 2013-08-08 | 2022-10-18 | Illumina, Inc. | Fluidic system for reagent delivery to a flow cell |
| CH709054A1 (en) | 2013-12-20 | 2015-06-30 | Tecan Trading Ag | Spacer for stacked pipette tip support. |
| USD729404S1 (en) | 2014-06-02 | 2015-05-12 | Seahorse Bioscience | Carrier |
| CA3070637C (en) | 2016-05-23 | 2023-02-07 | Becton, Dickinson And Company | Liquid dispenser with manifold mount for modular independently-actuated pipette channels |
-
2007
- 2007-03-26 ES ES16174452.9T patent/ES2692380T3/en active Active
- 2007-03-26 EP EP16174452.9A patent/EP3088083B1/en active Active
- 2007-03-26 JP JP2009502930A patent/JP5415253B2/en active Active
- 2007-03-26 EP EP07754084.7A patent/EP2001990B1/en active Active
- 2007-03-26 ES ES07754084.7T patent/ES2587007T3/en active Active
- 2007-03-26 WO PCT/US2007/007513 patent/WO2007112114A2/en active Application Filing
- 2007-03-26 US US11/728,964 patent/US9040288B2/en active Active
- 2007-03-26 DK DK16174452.9T patent/DK3088083T3/en active
- 2007-03-26 DK DK07754084.7T patent/DK2001990T3/en active
-
2011
- 2011-12-16 JP JP2011275368A patent/JP6265581B2/en active Active
-
2014
- 2014-03-06 JP JP2014043807A patent/JP5981473B2/en active Active
-
2015
- 2015-05-22 US US14/719,692 patent/US20150328638A1/en not_active Abandoned
-
2016
- 2016-04-22 JP JP2016086245A patent/JP6385387B2/en active Active
-
2019
- 2019-12-30 US US16/730,671 patent/US10799862B2/en active Active
- 2019-12-30 US US16/730,688 patent/US10857535B2/en active Active
- 2019-12-30 US US16/730,763 patent/US10913061B2/en active Active
-
2020
- 2020-01-02 US US16/733,005 patent/US10843188B2/en active Active
- 2020-01-02 US US16/733,039 patent/US10821436B2/en active Active
- 2020-10-12 US US17/068,140 patent/US11666903B2/en active Active
-
2023
- 2023-06-01 US US18/327,799 patent/US20240139731A1/en active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6385387B2 (en) | Integrated system for processing microfluidic samples and methods of use thereof | |
| US20190338344A1 (en) | Method for processing polynucleotide-containing samples | |
| ES2553097T3 (en) | Processing of samples containing polynucleotides | |
| AU2018200698A1 (en) | Processing polynucleotide-containing samples |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20111216 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20121023 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20121025 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130123 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130128 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130225 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130228 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130322 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130327 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130425 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20131108 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140207 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140213 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140929 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20141226 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20150522 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150918 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20160119 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20160311 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170106 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170203 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170306 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170331 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170714 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170817 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170914 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20171013 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6265581 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |